Текст
ХИРУРГИЧЕСКИЕ
БОЛЕЗНИ
В двух томах
Под редакцией
B.C. Савельева, А.И. Кириенко
Учебник
с компакт-диском
Москва
Издательская группа «ГЭОТАР-Медиа»
2006
ХИРУРГИЧЕСКИЕ
БОЛЕЗНИ
Toм 1
Под редакцией
B.C. Савельева, А.И. Кириенко
Учебник
с компакт-диском
Рекомендовано УМО по медицинскому
и фармацевтическому образованию
вузов России в качестве учебника
для медицинских вузов
Москва
Издательская группа «ГЭОТАР-Медиа
200В
»
УДК 617.5(075.8)
ББК 54.5я73
Х50
Рецензенты:
Шойхет Я.Н. — зав. кафедрой факультетской хирургии с курсом хирургии
ФПК и ППС им. И.И. Неймарка ГОУ ВПО Алтайский государственный
медицинский университет, проф., чл.-кор. РАМН.
Луцевич Э.В. — профессор кафедры хирургических болезней и новых
эндохирургических технологий ГОУ ВПО Московский государственный
медико-стоматологический университет, чл.-кор. РАМН.
Х50 Хирургические болезни: учеб.: в 2 т. / под ред. B.C. Савельева,
А.И. Кириенко. - 2-е изд., испр. - М.: ГЭОТАР-Медиа, 2006. -Т 1.
- 608 с.: ил.
ISBN 5-9704-0152-8 (т. 1)
ISBN 5-9704-0I54-4 (общ.)
В учебнике, предназначенном для студентов медицинских вузов,
изложены вопросы этиологии, патогенеза, диагностики и лечения
распространенных хирургических заболеваний; отражены некоторые общие
вопросы хирургии, знание которых необходимо для восприятия курса
хирургических болезней. Для лучшего усвоения учебного материала
прилагается компакт-диск, содержащий краткий анатомический атлас,
контрольные тесты и задачи, схему написания истории болезни и вариант
программированного экзамена.
В томе I представлены исторические вехи развития хирургии,
методология постановки диагноза в хирургической клинике, наиболее важные
синдромы, которые встречаются в клинической практике, и принципы их
лечения, методы анестезиологического обеспечения операций и
послеоперационного ведения больных. В нем содержатся сведения о
хирургических заболеваниях органов брюшной полости.
УДК 617.5(075.8)
ББК 54.5я73
Права на данное издание принадлежат издательской группе «ГЭОТАР-Медиа».
Воспроизведение и распространение в каком бы то ни было виде части или целого
издания не могут быть осуществлены без письменного разрешения
издательской группы.
ISBN 5-9704-0152-8 (т. 1)
ISBN 5-9704-0154-4 (общ.)
© Коллектив авторов, 2005
© Иллюстрации. Воскресенский П.К., 2005
© Издательская группа «ГЭОТАР-Медиа». 2006
Абакумов Михаил Михайлович — д.м.н,, профессор, руководитель
отделения неотложной торако-абдоминальной хирургии Института
скорой помощи им. Н.В. Склифосовского.
Андрияшкин Вячеслав Валентинович — к.м.н., доцент кафедры
факультетской хирургии Российского государственного медицинского
университета (РГМУ).
Блеткин Александр Николаевич — к.м.н., научный сотрудник НИИ
Грудной хирургии ММА им. И.М. Сеченова.
Борисов Игорь Алексеевич — д.м.н., профессор НИИ Грудной
хирургии Московской медицинской академии (ММА) им. И.М.
Сеченова.
Бурневич Славомир Збигневич — к.м.н., доцент кафедры
факультетской хирургии РГМУ.
Владимиров Владимир Гаврилович — д.м.н., профессор, зав. кафедрой
оперативной хирургии и топографической анатомии РГМУ.
Воробьёв Геннадий Иванович — д.м.н., профессор, академик РАМН,
директор Государственного научного центра колопроктологии МЗ РФ.
Воскресенский Пётр Кириллович — к.м.н., старший научный
сотрудник института хирургии им. А.В. Вишневского РАМН.
Гельфанд Борис Романович — д.м.н., профессор, чл.-корр. РАМН,
зав. курсом анестезиологии, реаниматологии и антимикробной
химиотерапии ФУВ РГМУ.
Григорьев Евгений Георгиевич — д.м.н., профессор, член-корр.
РАМН, директор Научного центра реконструктивной и
восстановительной хирургии ВСНЦ СО РАМН, заведующий кафедрой
госпитальной хирургии Иркутского государственного медицинского
университета.
Григорян Рафаэль Азатович — д.м.н., профессор, заведующий
хирургическим отделением ГКБ № 1 им. Н.И. Пирогова г. Москвы.
Гудымович Виктор Григорьевич — к.м.н., сотрудник Национального
медико-хирургического центра им. Н.И. Пирогова.
6 О Хирургические болезни Ф Список авторов
Джубалиева Светлана Калиевна — к.м.н., научный сотрудник
Московского научно-исследовательского онкологического института им.
П.А. Герцена.
Евтягин Владимир Васильевич — к.м.н., научный сотрудник
Московского научно-исследовательского онкологического института им.
П.А. Герцена.
Егиев Валерий Николаевич — д.м.н., профессор, заведующий
кафедрой хирургии и онкологии ФПКМР Российского университета
дружбы народов.
Ермолов Александр Сергеевич — д.м.н., профессор, член-корр. РАМН,
директор Института скорой помощи им. Н.В. Склифосовского.
Ерюхин Игорь Александрович —д.м.н., профессор, член-корр. РАМН,
профессор кафедры военно-полевой хирургии Военно-медицинской
академии (ВМА) им. СМ. Кирова Министерства Обороны (МО) РФ.
Заринская Светлана Алексеевна — к.м.н., профессор кафедры
оперативной хирургии и топографической анатомии Института
социальной реабилитологии.
Затевахин Игорь Иванович — д.м.н., профессор, член-корр. РАМН,
заведующий кафедрой хирургических болезней педиатрического
факультета РГМУ.
Зверев Александр Андреевич — к.м.н., доцент кафедры общей
хирургии лечебного факультета РГМУ.
Золкин Владимир Николаевич — к.м.н., доцент кафедры
хирургических болезней педиатрического факультета РГМУ.
Кириенко Александр Иванович — д.м.н., член-корр. РАМН,
профессор кафедры факультетской хирургии РГМУ.
Кириенко Пётр Александрович — к.м.н., ассистент курса
анестезиологии, реаниматологии и антимикробной химиотерапии ФУВ РГМУ.
Кубышкин Валерий Алексеевич — д.м.н., профессор, член-корр.
РАМН, заведующий отделом абдоминальной хирургии института
хирургии им. А.В. Вишневского.
Кузнецов Максим Робертович — д.м.н., доцент кафедры
факультетской хирургии РГМУ.
Кузнецов Николай Алексеевич — д.м.н., профессор, заведующий
кафедрой обшей хирургии лечебного факультета РГМУ
Кучеренко Анатолий Дмитриевич — д.м.н., профессор кафедры
торакальной хирургии ВМА академии им. СМ. Кирова МО РФ.
Список авторов О 7
Матвеев Сергей Анатольевич — д.м.н., профессор, зам. по научной
работе исполнительного директора Национального
медико-хирургического центра им. Н.И. Пирогова.
Матюшенко Алексей Адамович — д.м.н., профессор кафедры
факультетской хирургии РГМУ.
Матюшкин Андрей Валерьевич — к.м.н., ассистент кафедры
хирургических болезней педиатрического факультета РГМУ.
Михалев Александр Иванович — к.м.н., доцент, заведующий
хирургическим отделением ГКБ №31 г. Москвы.
Мыльников Андрей Геннадиевич — к.м.н., доцент кафедры
госпитальной хирургии №2 РГМУ.
Нистратов Сергей Леонидович — к.м.н., доцент, заведующий
отделением анестезиологии и реанимации ГКБ №70 г. Москвы.
Пак Дингир Дмитриевич — д.м.н., руководитель хирургического
отделения Московского научно-исследовательского онкологического
института им. П.А. Герцена.
Панцырев Юрий Михайлович —д.м.н., член-корр. РАМН,
профессор кафедры госпитальной хирургии, заведующий лабораторией
клинической гастроэнтерологии РГМУ.
Петухов Виталий Анатольевич — д.м.н., профессор кафедры
факультетской хирургии РГМУ.
Проценко Денис Николаевич — к.м.н., ассистент курса
анестезиологии, реаниматологии и антимикробной химиотерапии ФУВ
РГМУ
Савельев Виктор Сергеевич — д.м.н., профессор, академик РАН и
РАМН, заведующий кафедрой факультетской хирургии РГМУ
Скворцов Моисей Борисович — д.м.н., профессор кафедры
госпитальной хирургии Иркутского государственного медицинского
университета.
Старцев Юрий Михайлович — ассистент кафедры хирургических
болезней №4 Ростовского Государственного медицинского
университета.
Трахтенберг Александр Харитонович — д.м.н., профессор,
руководитель отделения лёгочной онкологии Московского
научно-исследовательского онкологического института им. П.А. Герцена.
Фёдоров Владимир Дмитриевич —д.м.н., профессор, академик РАМН,
директор Института хирургии им. А.В. Вишневского РАМН.
8 О- Хирургические болезни О Список авторов
Филимонов Михаил Иванович — д.м.н., профессор кафедры
факультетской хирургии РГМУ
Цициашвили Михаил Шалвович — д.м.н., профессор кафедры
хирургических болезней педиатрического факультета РГМУ.
Чадаев Алексей Павлович — д.м.н., профессор, заведующий
кафедрой общей хирургии педиатрического факультета РГМУ.
Черкасов Владимир Аристархович — д.м.н., профессор, заведующий
кафедрой госпитальной хирургии, ректор Пермской государственной
медицинской академии.
Черкасов Михаил Фёдорович — д.м.н., профессор, заведующий
кафедрой госпитальной хирургии, проректор Ростовского
государственного медицинского университета.
Чиссов Валерий Иванович — д.м.н., профессор, академик РАМН,
директор Московского научно-исследовательского института
онкологии им. П.А. Герцена.
Шаповальянц Сергей Георгиевич — д.м.н., профессор, заведующий
кафедрой госпитальной хирургии №2 лечебного факультета РГМУ.
Шевченко Юрий Леонидович — д.м.н., профессор, академик РАМН,
заведующий кафедрой факультетской хирургии ММА им.
И.М.Сеченова, президент Национального медико-хирургического центра им.
Н.И. Пирогова.
Шляпников Сергей Алексеевич — д.м.н., профессор, заведующий
кафедрой хирургических инфекций Санкт-Петербургской
медицинской академии.
Шулутко Александр Михайлович — д.м.н., профессор, заведующий
кафедрой хирургических болезней №3 ММА им. И.М. Сеченова.
Юдин Олег Иванович — к.м.н., ассистент кафедры госпитальной
хирургии №2 РГМУ.
Аббревиатуры 11
Предисловие 12
ЧАСТЬ I. Обшие вопросы хирургии 13
Глава 1. Традиции и перспективы развития хирургии (B.C. Савельев) 13
Глава 2. Методология постановки диагноза
в хирургической клинике (Н.А. Кузнецов, А.И. Кириенко) 38
Глава 3. Важнейшие синдромы,
встречающиеся в хирургической практике 54
Шок(#.Л. Кузнецов) 54
Системная воспалительная реакция и сепсис
(Б.Р. Гелъфанд, Д.И. Проценко) 83
Нарушения метаболизма у хирургических больных (С.Л. Нистратов).... 110
Глава 4. Методы анестезии и обеспечения
безопасности больного во время хирургического
вмешательства (Б.Р. Гелъфанд, П.А. Кириенко) 133
Глава 5. Принципы лечения больных
в послеоперационном периоде (Б.Р. Гелъфанд, П.А. Кириенко) 147
ЧАСТЬ II. Абдоминальная хирургия 162
Глава 6. Острый аппендицит (B.C. Савельев, В.А. Петухов) 162
Глава 7. Острый холецистит (B.C. Савельев, М.И. Филимонов) 185
Глава 8. Острый панкреатит (М.И. Филимонов, С.З. Бурневич) 202
Глава 9. Осложнения язвенной болезни
(Ю.М. Панцырев, А.И. Михалев, О.И. Юдин) 222
Глава 10. Наружные брюшные грыжи
(А.И. Кириенко, В.В. Андрияшкин) 255
Глава 11. Острая кишечная непроходимость
(А.И. Кириенко, А.А. Матюшенко) 300
Глава 12. Острые нарушения мезентериального кровообращения
(B.C. Савельев, М.Р. Кузнецов) 324
Глава 13. Травма живота (А.С. Ермолов, М.М. Абакумов) 338
10 О Хирургические болезни ♦ Оглавление
Глава 14. Гнойный перитонит (И.А. Ерюхин, С.А. Шляпников) 370
Глава 15. Острый живот.
Дифференциальная диагностика (И.А. Ерюхин) 391
Глава 16. Желчнокаменная болезнь (A.M. Щулутко) 410
Глава 17. Опухоли панкреатодуоденальной зоны
(АД Федоров, В.А. Кубышкин) 430
Глава 18. Хронический панкреатит и кисты
поджелудочной железы (С.Г. Шаповальянц, А.Г. Мыльников) 446
Глава 19. Механическая желтуха (С,Г. Шаповальянц) 473
Глава 20. Рак желудка (АС. Савельев, Н.А. Кузнецов) 490
Глава 21. Рак толстой кишки (АД Федоров, Г.И. Воробьев) 519
Глава 22. Хронические воспалительные
заболевания кишечника (Г.И, Воробьев) 534
Глава 23. Неопухолевые заболевания
прямой кишки и перианальной области {Г.И. Воробьев) 561
Рекомендуемая литература 598
Предметный указатель 600
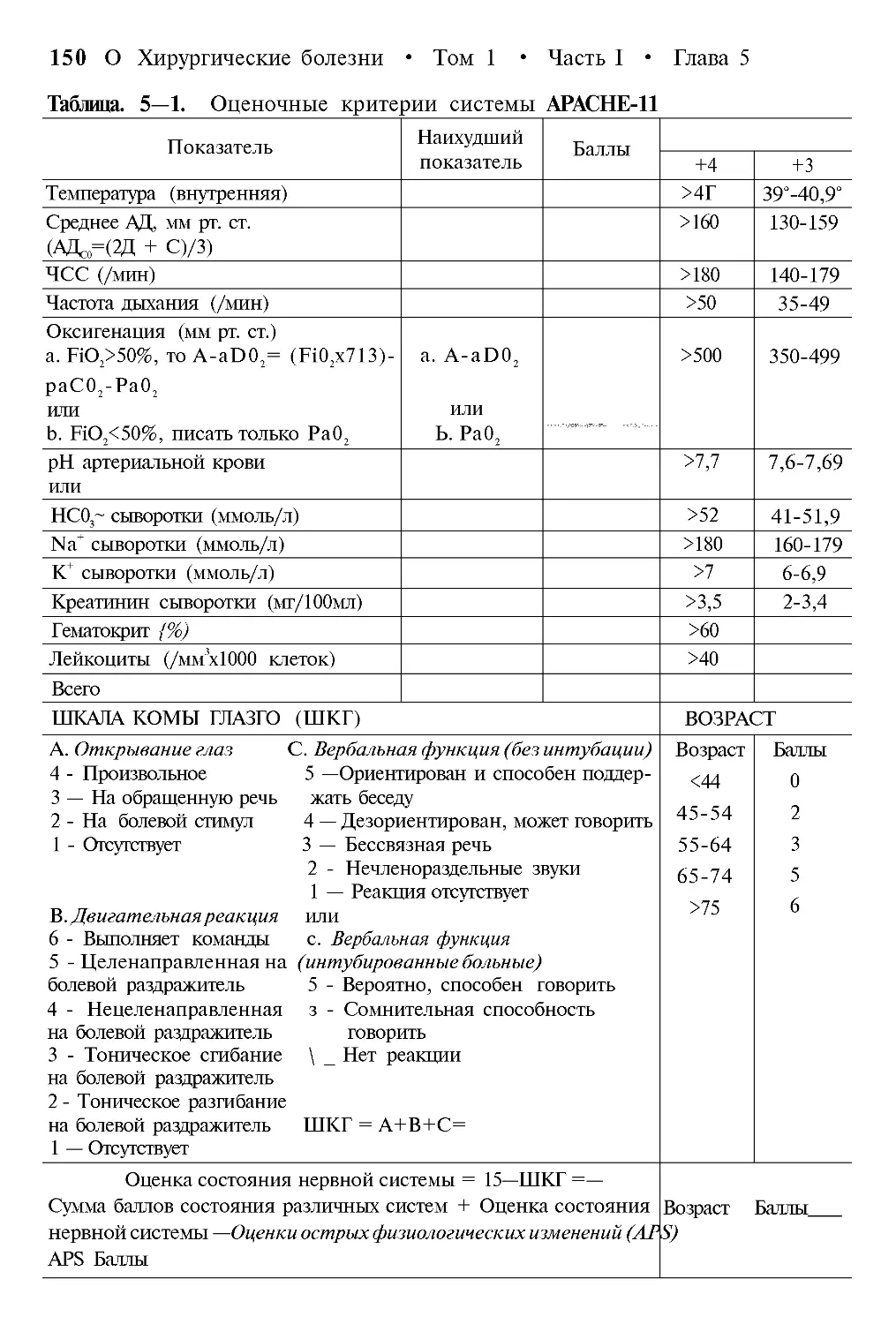
APACHE II (Acute Physiology and Chronic Health Evaluation) — оценка
острых и хронических изменений состояния здоровья
АВ — атриовентрикулярный
АД — артериальное давление
ВОЗ — Всемирная организация здравоохранения
ДВС — диссеминированное внутрисосудистое свёртывание
ДЗЛА — давление заклинивания в лёгочной артерии
ДНК — дезоксирибонуклеиновая кислота
ЕД — единица действия
ЖКБ — желчнокаменная болезнь
ЖКТ — желудочно-кишечный тракт
ИБС — ишемической болезни сердца
ИВЛ — искусственная вентиляция легких
ИЛ — интерлейкин
КТ — компьютерная томография
ME — международные единицы
МРТ — магнитно-резонансная томография
НПВС — нестероидные противовоспалительные средства
ОЦК — объём циркулирующей крови
РМЖ — рак молочной железы
СВ — сердечный выброс
СОЭ — скорость оседания эритроцитов
СПИД — синдром приобретённого иммунодефицита
ТТГ — тиреотропный гормон
ТЭЛА — тромбоэмболия лёгочной артерии
ФЭГДС — фиброэзофагогастродуоденоскопия
ХВН — хроническая венозная недостаточность
ЦВД — центральное венозное давление
ЦНС — центральная нервная система
ЧСС — частота сердечных сокращений
ЭКГ — электрокардиография
ЭРХПГ — эндоскопическая ретроградная холангиопанкреатикография
Учебник, который вы открыли, предназначен для студентов IV—
VI курсов медицинских институтов, университетов и академий,
изучающих клинические проявления, методы диагностики и лечения
основных хирургических заболеваний. Это не простое дело,
поскольку будущий врач, в какой бы области медицины ему не пришлось
работать, должен не только знать симптомы опасных болезней и
способы их лечения, при которых необходимо вмешательство хирурга, но
и уметь применить эти знания на практике, т.е. он обязан установить
диагноз, назначить необходимое обследование и решить вопросы
лечебной тактики.
Авторы постарались сделать учебник максимально компактным,
простым и доступным. Вместе с тем его изучение предполагает
знание студентами курса общей хирургии, основных её терминов,
понятий и принципов, которыми они овладевают на III курсе. Наряду с
изложением различных нозологических форм в книге представлены
важнейшие синдромы, которые чаще всего встречаются в
клинической практике. Кроме того, целый ряд учебных материалов —
необходимые сведения по анатомии и физиологии, краткий анатомический
атлас, контрольные тесты и задачи, вариант программированного
экзамена по хирургии и др. — вы найдёте на лазерном диске,
прилагаемом к учебнику. Полагаем, что использование компьютерных средств
обучения будет способствовать лучшему усвоению учебной программы.
Авторский коллектив, создавший учебник, уникален. В его
составе более 50 учёных, практикующих хирургов и преподавателей из
многих регионов России: от Санкт-Петербурга до Иркутска, от
Перми до Ростова-на-Дону. Надеемся, что содружество представителей
различных хирургических школ сделало возможным написание не
только полезной, но и интересной книги.
Авторы будут признательны всем читателям — студентам и
преподавателям за предложения и замечания, которые могут быть
учтены при переиздании учебника.
Изучив курс хирургических болезней, будущий врач должен
овладеть диагностикой и усвоить основные принципы лечения
наиболее распространённых заболеваний, с которыми сталкиваются
хирурги (впрочем, как и врачи других специальностей) в своей
повседневной деятельности. Эти знания накоплены в течение многих
веков, их передавали из поколения в поколение. Многие полагают,
что наиболее интересное в науке, в том числе и в медицине, — это
сегодняшние успехи и достижения. Между тем без осмысления
исторического опыта невозможно полноценное становление
специалиста любого профиля. Только тогда возникает возможность протянуть
нить от античных времён к современности и иметь научную основу
для суждений о будущем. Уже древним мудрецам было понятно, что
ничто не проистекает из ничего, и именно в прошлом берёт начало
всё, что есть и ещё будет. Связь времён, преемственность поколений,
бережная передача так трудно накапливаемых драгоценных знаний
от Учителя к ученику — непременное условие развития любой науки,
особенно хирургии.
Традиции, которыми столь богата современная хирургия,
сложились в результате напряжённого и самоотверженного труда
поколений хирургов, побед, поражений, отчаяния от собственного
бессилия, упорного научного поиска и вновь, пусть малого, но
поступательного движения к главной цели — спасению жизни больного.
Конечно, рамки учебника не позволяют осветить все вехи развития
хирургии, однако вспомнить основные этапы, выдающихся учёных и
врачей, стоящих у её истоков, чьими усилиями, талантом и
напряжённым трудом добыты все победы и достижения этой науки, просто
необходимо.
Хирургия — одна из древнейших наук, и родилась она, очевидно,
вместе с человечеством. Первые операции наши далёкие
предшественники выполняли в пещерах, с использованием кремниевого
ножа, при свете костров. Первобытные люди умели лечить раны и
переломы, вправлять вывихи, использовать целебные растения. Об
этом свидетельствуют многочисленные археологические находки, при
14 -О Хирургические болезни ♦ Том 1 О- Часть I ♦ Глава 1
которых в костных останках обнаруживают следы залеченных травм
и ранений.
В последующем, с развитием цивилизаций и государств, начался
активный процесс накопления знаний, совершенствования способов
и методов лечения, стал формироваться особый круг посвященных,
чьим основным занятием стало лечение заболеваний, ранений и травм.
Даже сейчас не могут не поражать знания и мастерство жрецов
древнего Египта, которые уже в III тысячелетии до н.э. умели
выполнять такие сложные операции, как ампутации, трепанации черепа,
удаление опухолей, катаракты, лечить переломы и вывихи. Об этом
свидетельствуют сохранившиеся изображения на памятниках, храмах
и гробницах, найденные хирургические инструменты, древние
медицинские папирусы. Знаменитый врачеватель Имхотеп, верховный
жрец и придворный врач фараона, живший в те годы, оставил одно
из древнейших медицинских сочинений. В нём предлагались
разумные и осмысленные меры при самых тяжёлых заболеваниях и
повреждениях, поскольку уже тогда хирургию можно было назвать «дитя
войны». Интересно, что такое широко используемое лечебное
средство, как заклинания, врачеватели прошлого использовали в
основном при лечении внутренних болезней. Хирургические
вмешательства, как более эффективные, они редко рекомендовали сопровождать
обращением к высшим силам и жертвами богам. Эта традиция —
всегда рассчитывать только на собственные силы, знания и опыт —
остаётся в хирургии уже много веков.
Врачам древнего Египта была хорошо знакома анатомия человека,
поскольку в стране существовала традиция бальзамирования трупов.
Эти знания, безусловно, помогали в распознавании и хирургическом
лечении болезней. Древнегреческий историк Геродот,
путешествовавший по Египту в V веке до н.э., отмечал, что уже тогда среди
древнеегипетских врачей существовала определённая специализация.
Достижения древнеегипетских хирургов стали в дальнейшем
известны во многих странах, прежде всего в Древней Греции, где в 460 г.
до н.э. на острове Кос в семье потомственных врачевателей,
возводивших свою родословную к Асклепию — богу медицины, родился
Гиппократ — величайший врач и мыслитель античного мира. В
течение своей жизни Гиппократ много путешествовал и учился, объездил
Грецию, Малую Азию, побывал в Ливии и Тавриде, после чего
основал на родине медицинскую школу. В своих трудах, вошедших в
так называемый «Гиппократов сборник» и основанных на
собственном опыте, он сформулировал свои взгляды на медицину. Именно
Традиции и перспективы развития хирургии О 15
Гиппократ стал основоположником принципа индивидуального
подхода к больному, оценки его душевного склада, темперамента,
телосложения и общего состояния. Ему принадлежат представления
об анамнезе, этиологии заболевания, прогнозе. В отличие от своих
предшественников Гиппократ полагал, что болезни не ниспосланы
богами, а обусловлены вполне объяснимыми причинами, например
воздействием окружающей среды.
Учение Гиппократа основано на нескольких основных
принципах — прежде всего, не навредить больному {Primum поп посеге!)<
противоположное лечить противоположным, помогать природе и
стимулировать естественные защитные силы человека. Гиппократ
прославился и как замечательный диагност. В своём учении о диагностике
и симптоматике болезней он рекомендовал основываться на данных
тщательного обследования больного, учитывать наличие характерных
симптомов и синдромов, многие из которых он описал впервые.
Гиппократ — философ и мыслитель — был хорошо знаком и с
реалиями окружающего мира, много занимался практической
медициной, лечением ран, переломов и вывихов, смело и искусно
производил различные хирургические операции. Во время Пелопонесской
войны Гиппократ был военным врачом. «Кто захочет упражняться в
этого рода хирургии, должен следовать за чужими войсками, ибо этим
способом он доставит себе опыт для такого упражнения», —
советовал Гиппократ.
« Чего не излечивает лекарство, излечивает железо. А чего железо не
излечивает, излечивает огонь. Л чего огонь не излечивает, то должно
считать неизлечимым», — утверждал Гиппократ в своих «Афоризмах».
Уже тысячелетия назад в медицине, и в хирургии в особенности,
огромное значение придавали взаимоотношениям врача и больного,
а также врачей между собой. Связано это с особой ответственностью
за жизнь пациента, поскольку хирургическое вмешательство может
как излечить болезнь, так и вызвать развитие опасных для жизни
осложнений. При этом овладеть настоящим мастерством, даже
прекрасно владея теорией, можно только на практике, в связи с чем особое
значение приобретают отношения доверия и преданности между
учеником и Учителем. С именем Гиппократа связано представление об
этическом кодексе врачей. Чтить наравне с родителями своего
Учителя, всегда и во всём помогать ему, вступать в каждый дом
единственно с целью всемерно помочь больному, хранить врачебную тайну,
исполнять свой долг самым честным образом, постоянно во благо
больного учиться у тех коллег, кто опытнее тебя, — вот тот нравствен-
16 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 1
ный фундамент, без которого просто нельзя заниматься
врачеванием, тем более хирургией. Знаменитая «Клятва врача» впоследствии
стала основой обязательств, принимавшихся врачами во многих
странах, в том числе и в России.
■ Труды Гиппократа в течение более чем 20 веков были
неисчерпаемым источником медицинских знаний для многих поколений
хирургов. Ещё в конце XIX века многие известные клиницисты вполне
серьёзно полагали, что современная им хирургия не прибавила к
хирургии Гиппократа ничего существенного. Его работы сохраняют
значение и для современной медицины, а советы и рекомендации
великого греческого врача, которые он давал хирургам (о
хирургической тактике, руках хирурга, поведении во время операции,
использовании инструментов), будут интересны и для врача, работающего в
■ клинике XXI века.
Высокий уровень хирургии был характерен и для древнейших
государств Азии — Индии и Китая. Одно из самых древних
медицинских сочинений, «Аюрведа» («Наука жизни»), позволяет судить о
знаниях и мастерстве хирургов того времени. Хирургия называется
«...первой и лучшей из всех медицинских наук, драгоценным
произведением неба и верным источником славы». Древнеиндийские врачи
выполняли пункции брюшной полости при асците, кесарево сечение,
ампутации и лапаротомии при кишечной непроходимости, удаляли
помутневший хрусталик. Они умели сшивать ткани льняными и
сухожильными нитями, конским волосом, накладывали кишечные швы.
Хирурги древней Индии стали основоположниками пластической
хирургии. Распространённое в те времена судебное наказание,
заключающееся в ампутации носа, привело к тому, что была изобретена
«индийская пластика», при которой дефекты лица исправляли с
помощью кожного лоскута на ножке, взятого с других частей тела.
Древнеиндийским хирургам было знакомо обезболивание, его
проводили с помощью опия, вина, белены, гашиша. Они
использовали разнообразные инструменты, среди которых были ножницы,
пилы, пинцеты, зонды, катетеры, зеркала, трепаны, шприцы для
орошения ран. Большинство из них было изготовлено из стали. При этом
справедливо считалось, что «самый лучший инструмент — рука».
Хирургия древнего Китая достигла расцвета в эпоху Хань (II—III
века н.э.), золотого века китайской культуры, когда жил
выдающийся хирург Хуа То. Достаточно сказать, что он проводил трепанации
черепа, кесарево сечение, удаление селезёнки, использовал при
проведении операций обезболивающие вещества. При сшивании ран он
Традиции и перспективы развития хирургии ♦ 17
применял шёлк, нити джута и конопли; Важной особенностью
древнекитайской хирургии было то, что болезни, лечившиеся
хирургическим путём, рассматривали как заболевание всего организма, и
наряду с операцией использовали акупунктуру, гимнастику и
лекарственные средства.
Значимый вклад в развитие хирургии внесли выдающиеся врачи
древнего Рима. Авл Корнелий Цельс придумал способы остановки
кровотечения. Ведь во времена Гиппократа не знали хирургических
методов борьбы с кровотечением и не отличали артерии от вен. Цельс
предложил использовать тампонаду с помощью губки, смоченной в
холодной воде или уксусе и прижатой рукой. Если тампонада не
помогала и кровотечение продолжалось, следовало наложить лигатуры
на сосуды: «Надо захватить вены, из которых льётся кровь,
перевязать в двух местах вокруг поражённого места...». Когда же не
удавалось наложить и лигатуры, рекомендовалось прибегнуть к
прижиганию. Описанная Цельсом методика прижиганий ран использовалась
затем в медицине на протяжении многих веков.
Имя другого выдающегося римлянина, Клавдия Галена, долгие
годы было символом врачебного искусства. Гален придерживался
взгляда о присущей природе органической целесообразности
строения и физиологических функций организма. Основными
причинами ошибок, от которых он предостерегал своих коллег, Гален считал
пренебрежение к анатомическим вскрытиям и незнание принципов
логического мышления. Хирург, стремящийся помочь больному, по
мнению Галена, не может быть простым ремесленником, он просто
обязан знать анатомию, физиологию и философию, быть
всесторонне образованным человеком.
Пришедшие на смену древним цивилизациям Запада и Востока
«тёмные века» Средневековья отбросили назад развитие культуры, в
том числе и медицины. С болезнями боролись посредством молитв и
заклинаний, они объявлялись наказанием божьим, которому нужно
покоряться без сопротивления; удачные же исцеления считались
делом рук дьявола. Религия — как христианство так и ислам —
фактически запретила операции на живом человеке и даже на его мёртвом
теле. Однако арабская медицина во многом смогла обогатить
врачебную практику Средневековья. Её выдающиеся представители
{Авиценна, Альбукакис) в своей практической работе и научных трудах
смогли обойти религиозные запреты и ограничения, совершенствуя
уже известные оперативные методы-лечения Лечение ран и переломов,
ампутации, перевязки артериий лапаро- и торакоцентез, грыжесечение
18 ♦ Хирургические болезни -О- Том 1 0> Часть I -О* Глава 1
(как оперативным путём, так и прижиганием), удаление катаракты,
камней из мочевого пузыря, обезболивание во время операций
(опиум, мандрагора) были знакомы и выполнялись арабскими
врачевателями. Они же впервые применили рассасывающиеся кишечные нити.
При всём своём незаурядном хирургическом мастерстве они
рекомендовали использовать оперативные методы осторожно,
тщательно взвешивая последствия их применения. «Не приступайте ни к нему
подобному, если не обладаете уверенными знаниями, которые считаете
достаточными, чтобы обеспечить пациенту благоприятный исход», —
советовал Альбукакис в «Руководстве для врача». В своих работах этот
выдающийся врачеватель, пользовавшийся огромным авторитетом,
анализировал свои ошибки и неудачи, что другие врачи делали
исключительно редко, поскольку в те далёкие времена (да и в
последующем) даже при очень тяжёлых заболеваниях врачей нередко
считали единственными виновниками трагического исхода.
Дальнейшее развитие медицины и хирургии в Европе было
связано с появлением больниц при монастырях и врачебных школ,
впоследствии превратившихся в университеты. В монастырских
госпиталях, которые постепенно стали играть всё большую роль в оказании
медицинской помощи, хирургия оказалась в руках у монахов,
выполнявших некоторые примитивные операции. Однако католическая
церковь, негативно относившаяся к любой науке, разрешив монахам
заниматься медициной, запрещала лечить больных «с помощью
прижиганий и ножа». Какое-то время этот запрет удавалось обходить,
однако созванный в 1215 г. 1УЛатеранский собор принял ещё одно и
на этот раз строжайшее решение — запретил духовным лицам
заниматься хирургией, поскольку «христианской церкви противно
пролитие крови». Эти запреты, способствовавшие искусственному
отделению хирургии от медицины, серьёзно задержали её развитие.
В эпоху Средневековья в Италии, Франции, Германии наряду с
монастырскими врачами работали и пользовались большим
авторитетом своеобразные, часто семейные врачебно-хирургические
школы, снискавшие уважение и известность. Гвидо Ланфранк, Гуго Бор-
гониони, Генри де Мондевиль, Ги де Шолиак — эти врачи, учёные и
педагоги сыграли огромную роль в подготовке практических врачей-
хирургов, передавая им свой огромный хирургический и жизненный
опыт. «Будь смел в верных случаях, боязлив в опасных, избегай
дурных методов или приёмов лечения, будь обходителен с больными,
приветлив с товарищами, мудр в своих предсказаниях, будь целомудрен,
воздержан, бескорыстен, не вымогай деньги, но принимай умеренную
Традиции и перспективы развития хирургии О 19
плату сообразно с трудом, состоянием больного, родом болезни и
исхода её и с собственным достоинством», — напутствовал Ги де Шолиак
молодого хирурга. Эти благородные слова сказаны в те годы, когда,
как порой считают, в Европе процветали только невежество и
религиозные догматы.
Всё большую роль в развитии медицины начинали играть
университеты, открывавшиеся в XII—XIV веках в разных странах Европы,
их медицинские факультеты, которым пусть и с трудом, но удавалось
преодолевать религиозные запреты. Так, университету в Солерно
(Италия) только в 1238 г. было разрешено один раз в пять лет производить
вскрытие человеческого трупа. Ещё через полтора века такое
разрешение получил университет во французском городе Монпелье. Между
тем развитие хирургии серьёзнейшим образом тормозили низкий
уровень знаний анатомии и физиологии, господство во всех без
исключения средневековых университетах схоластической медицины,
культивировавшей у студентов презрительное отношение к хирургии,
которая считалась «низкой» профессией. В результате практическую
хирургическую помощь, потребность в которой была особенно
высокой во время многочисленных войн, стали оказывать не врачи с
университетскими дипломами, а цирюльники. В войсках немецких
государств их называли фельдшерами («полевые ножницы»). Эти люди,
стоявшие едва ли не на самой низшей ступени официальной
медицины, честно и в меру своих представлений о пользе делали своё дело.
Даже эпоха Возрождения поначалу не изменила положение
хирургии среди медицинских специальностей. Среди хирургов было
много бродячих мастеров, которые переезжали из города в город и
производили свои операции на ярмарках и площадях, в присутствии
многочисленных зрителей. Университетский врачебный мир
по-прежнему не признавал, а зачастую открыто презирал и игнорировал
хирургов-ремесленников. Не оставались в долгу и те немногие
хирурги, допущенные к университетским кафедрам. Знаменитый
швейцарский врач Парацельс (Филипп Ауреол Теофраст Бомбаст фон
Хохенхайм), в знаниях которого не сомневались даже самые
высокомерные и чванливые университетские профессора, с гордостью
называвший себя «обеих медицин доктором», в отличие от
абсолютного большинства врачей того времени считал хирургию
неотъемлемой частью науки врачевания. «Хирургом быть невозможно, ежели не
быть враном, хирург из врача рождается. А ежели врач к тому же не
будет хирургом, то он окажется болваном, в коем нет ничего, и
размалёванной обезьяной», — писал он.
20 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I <$ Глава 1
Лишение хирургов учёных степеней не прекратило развитие этой
важнейшей составной части медицины. Самым выдающимся
реформатором хирургии стал бывший цирюльник, французский врач Амб-
руаз Паре. Со времени повсеместного распространения
огнестрельного оружия, т.е. с рубежа XIV и XV столетий, лучшим лекарством
для лечения огнестрельных ран считалось прижигание их
раскалённым железом или заливание кипящим маслом. Пулевые ранения
плохо поддавались лечению, во многих случаях эти раны становились
источником сепсиса, причину которого видели в специфическом для
огнестрельного оружия «отравлении». Поэтому у палатки военного
хирурга всегда горел костёр, на котором висел котелок с кипящим
маслом. Паре стал первым, кто заметил, что раны у солдат, которым
не хватило кипящего «бальзама», заживают скорее и легче, и
отказался от варварского прижигания.
Хирурги его времени останавливали сильное кровотечение при
ампутации, применяя раскалённые докрасна ножи. Для
состоятельных пациентов использовали инструменты из серебра и золота, но и
это помогало не всегда, и многие операции заканчивались смертью
пациента от кровопотери. Широко использовалось погружение
культи в кипящую смолу. Эта процедура сразу прекращала кровотечение,
но не всякий раненый мог её перенести. Паре применил новый
способ перевязки крупных сосудов лигатурой, наложенной несколько
выше зоны операции. Использовал он и лигирование сосуда с
прошиванием. Знаменитая нить Амбруаза Паре совершила переворот в
хирургической технике, избавив пациентов от кровотечений, и
применяется до наших дней. Амбруаз Паре получает титул «первого
хирурга и акушера короля». Король Франции Карл IX настолько
высоко ценил Паре, что, хотя тот и был гугенотом, спас ему жизнь во время
печально знаменитой «Варфоломеевской ночи».
В XVIII веке Европа вступила в «Век Просвещения». «...Имей
мужество пользоваться собственным умом!» — эти слова Иммануила
Канта стали девизом для учёных. В науке начинал главенствовать
метод эксперимента, исследования проводились с использованием
научных инструментов и измерительных приборов. Дальнейшее
развитие получило естествознание, зарождалась патологическая
анатомия, бурно развивалась физиология. Хирургия вступила в научный
период своего развития, становясь важнейшим разделом
клинической медицины. Официальное её признание как науки произошло в
1731 г. во Франции, где была основана Королевская Хирургическая
Академия, получившая те же права, что и университеты, и готовив-
Традиции и перспективы развития хирургии Ф- 21
шая настоящих врачей-хирургов. Интересно, что Великая
французская революция, упразднившая погрязшие в схоластике
университеты, не затронула Хирургическую Академию.
В эти годы во Франции жили, преподавали и своим упорным
трудом поднимали престиж хирургии такие талантливые врачи, как Жан-
Луи Пти, открывший новую эру в лечении рака молочной железы,
оперировавший на жёлчном пузыре и прямой кишке, удостоенный
чести стать первым из хирургов членом Парижской Академии наук
(«Академии бессмертных»); Пъер-Жозеф Дезо, много сделавший для
разработки лечения переломов и аневризм и всегда обучавший
студентов у постели больного; Франсуа Пейрони, делавший резекцию
кишки и оперировавший на мочевыводящих путях.
Во второй половине XVIII в. в Великобритании работал
выдающийся врач и исследователь Джон Хантер (Гунтер). Его имя носит
целый ряд анатомических образований (гунтеров канал и др.), он
разрабатывал новые операции на сосудах и нервах, при этом новые
оперативные методики проверял на животных. Хантер в своей
клинической практике выполнял пересадку кожи и именно ему
принадлежит термин «трансплантация». Если же экспериментальных
данных было недостаточно, этот самоотверженный учёный производил
эксперименты на себе.
Отечественная хирургия не была обособленной, изолированной
от других частью этой науки. Напротив, она стала неотъемлемой
частью общеевропейской и общемировой хирургии. Можно
по-разному относиться к реформам Петра I, но следует признать, что страсть
этого монарха к анатомии и хирургии способствовала
распространению медицинских знаний в России. При жизни Петра в стране было
создано 10 госпиталей и свыше 500 лазаретов. Учреждение
госпиталей преследовало целью не только лечение больных и увечных, но и
преподавание медицины и хирургии. Именно при госпиталях были
открыты первые медико-хирургические школы в России.
Николай Бидлоо, лейб-медик Петра I, ставший впоследствии
главным доктором Московского госпиталя и директором госпитальной
школы, обращал в первую очередь внимание на те науки, которые
призваны были сформировать у будущих медиков практические
навыки, клиническое мышление врача и хирурга. Отличительной
особенностью российских госпитальных школ было обучение
клиническим дисциплинам и практической хирургии непосредственно у
постели больного, это происходило параллельно с изучением
теоретических предметов. Хирургическим операциям в госпитальной шко-
22 <> Хирургические болезни ♦ Том 1 Ф Часть I v i лава
ле обучали как в анатомическом театре, так и в клинике. Этот
наиболее прогрессивный способ обучения хирургическому мастерству
используется и поныне.
Несмотря на развитие естествознания, прогресс анатомии и
физиологии, формирование научного подхода к оперативным методам
лечения, до середины XIX века хирургия оставалась царством
страданий, боли и крови. Даже сейчас пациенты с тревогой ждут
операции, страшась боли, связанной с вмешательством хирурга. Что уж
говорить о периоде зарождения современной хирургии. И люди
издавна искали средства обезболивания. Хирурги древней Ассирии
надевали больному на шею петлю, затягивая её до тех пор, пока
пациент не терял сознание. Когда он приходил в себя, петлю затягивали
опять, и так продолжали до конца операции. В средние века
применяли различные снадобья, рецепт которых хранили в строжайшей
тайне. Однако эти средства были крайне несовершенными: при
малых дозах пациенты пробуждались от боли во время операции, а при
больших — умирали от отравления. Французский хирург Вельпо
однажды сказал: «Нож хирурга и боль неотделимы друг от друга.
Безболезненная операция — мента, которая никогда не сбудется».
Но мечта сбылась. Современная анестезиология знает не только
год или месяц, но и день своего рождения: 16 октября 1846 г. В этот
день в Главной больнице Массачусетса зубной врач Вильям Мортон,
используя серный эфир, усыпил молодого человека, которому
известный американский хирург Джон Уоррен провёл удаление
опухоли верхней челюсти. В ходе операции больной был без сознания, не
реагировал на боль и лишь после окончания вмешательства начал
просыпаться. Тогда-то Уоррен и произнёс свою знаменитую фразу:
«Gentlemen, this is no humbug!» (Джентльмены, это не трюк!). С тех
пор этот день называют «The death of pain» (смертью боли).
Появление наркоза (а вслед за эфиром в хирургическую практику
вошли хлороформ и закись азота) повлекло за собой грандиозные
перемены. До этого оперативные вмешательства могли продолжаться
всего несколько минут, поскольку больные просто не могли
переносить боль в течение длительного времени. Хирурги были вынуждены
работать в лихорадочной спешке и были настоящими виртуозами.
Доминик Ларрэ, личный врач и любимец Наполеона, в 1812 г. во время
Бородинского сражения в полевых условиях провёл экзартикуляцию
нижней конечности в тазобедренном суставе за 4 мин и за сутки
произвёл 200 ампутаций, причём большинство раненых выжили. У
Николая Пирогова на удаление камня мочевого пузыря уходило 2 мин.
Традиции и перспективы развития хирургии -0- 23
С появлением обезболивания в операционных наконец-то
воцарилась тишина, и у хирургов появилась возможность вдумчивого
выбора оптимальных решений.
В истории хирургии, медицины, да и человеческой цивилизации
в целом, гений Пирогова занимает особое место. Во многом это
связано не только с его блестящими хирургическими способностями, но
и с талантом исследователя, новатора и организатора. В первой
половине XIX века в России работали многие замечательные хирурги,
которые вывели российскую хирургию на самые передовые рубежи в
мировой медицине. Илья Васильевич Буяльский, Ефрем Осипович
Мухин, Иван Филиппович Мойер, Николай Фёдорович Арендт, Иван
Фёдорович Буш — труды этих замечательных клиницистов, учёных и
педагогов, почитавших анатомию «основой хирургии», активных
сторонников строго научного анатомо-физиологического направления
были хорошо известны в Европе. Но именно Николая Ивановича
Пирогова история наградила титулом первого хирурга России.
Николай Иванович Пирогов родился в Москве в 1810 г. в большой
семье и был самым младшим из тринадцати детей. Благодаря
выдающимся способностям, поступив в Московский университет в
возрасте 14 лет, Пирогов уже в 26 лет был избран профессором хирургии
Дерптского (ныне Тартусский) университета, откуда через
несколько лет был приглашён в Петербург, где возглавил кафедру хирургии в
Медико-хирургической Академии. Одновременно он встал во главе
организованной им клиники госпитальной хирургии.
Пирогов представлял собой редчайшее сочетание гениального
учёного-теоретика и блистательного хирурга-практика. Феноменально
упорный и трудоспособный, огромное количество сил и времени он
посвятил изучению анатомии. «Нет медицины без хирургии и нет
хирургии без анатомии» — это выражение уже в юности стало девизом
Пирогова. Он фактически основал новую науку — топографическую
анатомию и оперативную хирургию. Выдающееся исследование
«Хирургическая анатомия артериальных стволов и фасций» стало
поистине фундаментом сосудистой хирургии. Разработка оригинального
метода «ледяной» анатомии, основанного на распилах во взаимно
перпендикулярных направлениях замороженных трупов, позволила
создать подробнейшие анатомические атласы, на которых было
представлено полное и точное взаиморасположение органов и тканей,
которое оказалось не таким, каким представлялось на вскрытиях, при
нарушении целостности герметически закрытых полостей. Нет
нужды говорить, как это было важно для хирургии.
24 О Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 1
Важнейшим условием разработки хирургической проблемы
Пирогов считал эксперимент на животных, который должен
предшествовать применению новых методов оперативных вмешательств в
клинике. Его работы по изучению развития коллатерального
кровообращения при перевязке брюшной аорты, о восстановлении
целостности ахиллова сухожилия носили
экспериментально-физиологический характер.
Для Николая Ивановича Пирогова, как и для подавляющего
большинства врачей-хирургов, составляющих гордость человечества, была
присуща высочайшая ответственность перед конкретным больным и
всем обществом за результаты выполненных исследований и плоды
своего труда. Гениальный хирург, прекрасно осознававший
перспективы, которые открывало появление общего обезболивания, он
провёл вначале ряд исследований, посвященных эфиру и хлороформу,
проверил их действие на себе, и лишь затем применил при лечении
больных и раненых.
Пирогов не был оторванным от жизни и своего народа
кабинетным учёным, увлечённым проведением только ему интересных
исследований. Во время Крымской войны он, профессор столичной
академии, считая своим долгом охранять здоровье русского солдата,
едет в действующую армию и в осаждённом Севастополе, под
пулями организовывает медицинскую помощь раненым и больным, сам
оперирует, насколько хватает сил. Огромный вклад, внесённый Пи-
роговым в развитие и практику военно-полевой хирургии,
исповедуемый им принцип сберегательного лечения стали той базой, которая
позволила советским хирургам век спустя, в годы Великой
Отечественной войны излечить и вернуть в строй более 70% раненых
бойцов. Авторитет Пирогова был столь высок, что его приглашали для
лечения национального героя Италии Джузеппе Гарибальди и
канцлера Германии Отто Бисмарка.
Самоотверженность, гуманизм, высокое чувство долга
выдающиеся хирурги демонстрировали не только за операционным столом.
Когда в России свирепствовала холера, профессор Андрей Иванович
Поль, знаменитый московский хирург, занимался борьбой с
эпидемией, организовывал лечение больных, карантины и временные
больницы. Французский хирург Ги де Шолиак боролся с чумой, причём
сам заразился бубонной её формой. Лечением азиатской холеры
занимался Пирогов, он же организовывал противоэпидемическую
службу в российской армии. Рискуя жизнью, борьбой с эпидемиями
и спасением тысяч людей занимались многие и многие хирурги.
Традиции и перспективы развития хирургии -0- 25
Другой основополагающей вехой, открывшей дорогу бурному
развитию хирургии, стала антисептика. К созданию метода, способного
спасти жизни больных от гнойно-септических осложнений,
стремились поколения хирургов. Не имея представления о микробиологии,
уже ранее наиболее наблюдательные хирурги использовали для
перевязок ран вино и морскую воду. Эти меры основывались, конечно
же, не на научном анализе, а на практическом опыте и интуиции, и
были, в сущности, замечательной догадкой.
Ещё в середине XIX столетия жизнь человека на операционном
столе зачастую подвергалась большей опасности, чем на поле брани.
В хирургических отделениях многих госпиталей смертность
достигала 60% оперируемых больных. «Если я оглянусь на кладбище, где
похоронены заражённые в госпиталях, — говорил Пирогов, — то я не знаю,
чему больше удивляться: стоицизму ли хирургов ... или доверию,
которым продолжают ещё пользоваться госпитали».
Причина столь трагической статистики заключалась в
господствовавшей в больницах эпидемии «послеоперационной горячки»,
которая очень часто заканчивалась смертью больного. Было замечено, что
болезнь эта встречается только в больницах и редко поражает
пациентов, оперируемых на дому. Поэтому данное заболевание получило
название «больничной горячки».
Следует отметить, что до середины XIX века больницы выглядели
совершенно иначе, чем теперь. В палатах, редко проветриваемых и
убираемых, царили грязь и смрад. Больные лежали на койках,
расставленных близко одна от другой, причём пациенты с высокой
температурой тела и гноящимися ранами лежали рядом с только что
перенёсшими операции или готовящимися к ним, выздоравливающие
лежали рядом с умирающими.
Не в лучшем сострянии были и операционные залы. В центре, как
правило, стоял обыкновенный стол, иногда из необструганных
досок; в углу на табурете стояла миска с водой, в которой врачи после
операции мыли окровавленные руки. Инструменты висели в
шкафчиках на стенах, откуда их брали без всякой стерилизации. Вместо
ваты употребляли корпию, т.е. клубки нитей, вырванных из старого
полотняного белья, иногда вообще не стиранного, а высушенного
после предыдущей операции.
Хирурги приходили в больницу всегда в одной и той же одежде, до
предела загрязнённой кровью и гнойными выделениями, что не
только никого не удивляло, но даже представляло предмет гордости,
потому что служило доказательством большого опыта, которым обла-
26 <» Хирургические болезни ♦ Том 1 О Часть I ♦ Глава 1
дал владелец грязного сюртука. Нет сомнения, что перегруженность
больниц, отсутствие какой-либо заботы об изоляции пациентов с
гнойными ранами от только что прооперированных, способствовали
распространению внутрибольничной инфекции.
Выдающийся венский хирург прошлого столетия Теодор Бильрот,
обладавший огромным опытом, пришёл к выводу, что главной
причиной «больничной горячки», губившей больных и результаты
работы самых искусных хирургов, является обычная грязь, царившая в
больницах. Он распорядился производить ежедневно тщательную
уборку всех помещений клиники. Один раз в неделю все палаты
поочередно освобождались от больных и коек, палаты проветривали,
тщательно убирали и мыли полы. Операционный зал после
операции убирали и мыли ежедневно.
Кроме того, Бильрот порвал с традицией грязных сюртуков.
После многочисленных ходатайств и не без борьбы он добился от
дирекции больницы белых кителей для врачей, притом в таком количестве,
какое было необходимо для ежедневной смены всеми без
исключения врачами. Распорядился, чтобы все хирурги перед операцией
обязательно мыли руки в хлорной воде. Таким образом, Теодор Бильрот
стал одним из основоположников наступательной борьбы с
инфекцией в хирургии, и именно ему обязаны современные врачи своими
белыми халатами, ставшими одним из символов профессии.
В 1847 г. Игнац Земмельвайс, молодой врач акушерской клиники
Венского университета, вменил в обязанность медицинскому
персоналу мытьё рук раствором хлорной извести. Эта мера дала отличные
результаты, случаи послеродовой горячки, а вместе с ними и
смертность среди родильниц резко снизились. Однако коллеги встретили
открытие Земмельвейса крайне отрицательно, оно не было по
достоинству оценено и признано. Антисептика появилась лишь в 1865 г.,
после гениальных открытий Луи Пастера и Джозефа Листера.
Вопреки тысячелетним представлениям хирургов о пользе
нагноения известный английский хирург Джозеф Листер, основываясь на
опытах Пастера, доказавшего присутствие в воздухе «особых низших
организмов», настойчиво искал такой способ обработки ран,
который бы воспрепятствовал попаданию в них «носящихся в воздухе
частиц». С этой целью Листер предложил использовать карболовую
кислоту для обработки рук хирургов, инструментов, повязок,
распыления в воздухе операционной. Свой антисептический метод Листер
стечением времени значительно усовершенствовал. Он впервые
предложил и начал использовать дренирование ран при помощи резино-
Традиции и перспективы развития хирургии Ф 27
вых трубок, обеспечивающих отток раневого отделяемого и крови.
И вскоре новым, открывающим огромные перспективы законом
хирургии стало положение, согласно которому при правильном лечении
раны должны заживать без нагноения, и его стали рассматривать как
осложнение, а не как обычное явление. «Никогда не было в хирургии
открытия, — утверждал российский хирург А.Д. Павловский, —
которое бы принесло столько счастья человечеству, как антисептика».
В гордом одиночестве антисептика просуществовала до 90-х
годов XIX столетия, когда на помощь ей в хирургию пришла асептика,
основанная на предварительном обеззараживании всего, что будет
соприкасаться с операционной раной. Были разработаны
совершенно новые правила работы в операционной — использование
стерильных инструментов, шовного материала, стерильного халата, маски,
резиновых перчаток и операционного белья. Эти правила действуют
и по нынешний день.
Появление методов обезболивания, асептики и антисептики
стало основой бурного прогресса хирургии, огромного расширения её
лечебных возможностей. Интенсивно развивалась хирургия желудка,
пищевода, печени и жёлчных путей, начали производить операции на
лёгких, гортани, головном и спинном мозге. Свой вклад в развитие
медицинской науки, формирование её современного облика внесли
представители разных стран. Немцы Теодор Бильрот, Иоганн фон Ми-
кулич-Радецкий, француз Жюль Пеан, швейцарец Жан Луи Реверден,
американец Уильям Холстед, российские хирурги Николай
Владимирович Экк, Николай Васильевич Склифосовский, Александр Алексеевич
Бобров, Пётр Иванович Дьяконов, Сергей Петрович Фёдоров и многие
другие разрабатывали новые эффективные операции и оперативные
методы, принёсшие им мировую известность. Ряд из них
используется без значительных изменений по настоящее время. Поистине
эпохальные достижения конца XIX века с полным правом можно
назвать плодом коллективных усилий. Интернационализация научных
исследований, объединение усилий хирургов и представителей
других естественных и точных наук с этого периода стали и традицией, и
условием дальнейшего прогресса хирургии. Из Золушки медицины
она окончательно превратилась в прекрасную юную волшебницу,
вызывающую восхищение и поклонение окружающих. В 1909 г.
Теодору Кохеру, первому из хирургов, за разработку методов лечения
заболеваний щитовидной железы была присуждена Нобелевская премия.
Огромные успехи, которых добилась хирургия в XIX веке,
стали прологом её невиданного прогресса в следующем, XX столетии.
28 А Хирургические болезни <> Том 1 ♦ Часть I ♦ Глава 1
Диагностические и лечебные возможности клинической медицины
и хирургии неуклонно росли, и в результате естественной
дифференциации из хирургии выделились гинекология, урология,
офтальмология, травматология, анестезиология и реаниматология, ставшие
самостоятельными дисциплинами. В высокоспециализированные
дисциплины превратились онкология, проктология, торакальная,
сердечно-сосудистая и детская хирургия, зародились и начали своё
активное развитие трансплантология, микрохирургия и рентгеноэн-
доваскулярная хирургия.
Во многих случаях новые достижения и победы были связаны со
становлением сосудистой хирургии. Разработанный в начале XX века
Алексисом Каррелем сосудистый шов открыл путь к хирургическому
лечению ишемической болезни сердца и инфаркта миокарда,
расстройств мозгового кровообращения, облитерирующего
атеросклероза, портальной гипертензии и многих других. В 1905 г. Каррель
первым выполнил трансплантацию сердца в эксперименте.
Созданный в 1920 г. Сергеем Сергеевичем Брюхоненко аппарат
искусственного кровообращения, названный им автожектором,
позволил другому выдающемуся родоначальнику мировой
трансплантологии Владимиру Петровичу Демихову в 1946 г. пересадить
дополнительное сердце собаке. В том же году он произвёл замену всего
сердечно-лёгочного комплекса — пёс прожил шесть суток. Это была
настоящая победа. Демихов начал эксперименты по пересадке
печени, впервые в эксперименте на собаках осуществлял коронарное
шунтирование. В 1954 г. он пересадил голову собаке, при этом в
пересаженной голове восстановилось кровообращение, она сохраняла свои
функции и все присущие рефлексы.
С помощью усовершенствованного аппарата искусственного
кровообращения в 1957 г. Александр Александрович Вишневский
произвёл первые в СССР операции на сердце, а южноафриканский хирург
Кристиан Барнард в 1967 г. впервые осуществил пересадку сердца
человеку.
Мировая и отечественная хирургия XX века дала много славных
имён замечательных учёных и клиницистов, достижения каждого из
которых достойны самой высокой оценки. Выдающимся русским
хирургом был Александр Васильевич Вишневский. Им разработан
оригинальный принцип местного обезболивания, не потерявший
значения и сейчас, предложены различные виды новокаиновой блокады и
методика их применения, масляно-бальзамическая эмульсия для
лечения ран и ожогов (мазь Вишневского).
Традиции и перспективы развития хирургии ♦ 29
Велик вклад в развитие современной медицины другого
замечательного хирурга — Сергея Ивановича Спасокукоцкого. Пожалуй, нет
ни одного раздела хирургии органов брюшной полости, лёгких,
общих вопросов специальности, в которых бы не проявлялся его
новаторский талант. Им создана одна из самых плодотворных
хирургических школ нашей страны.
Ученик Спасокукоцкого академик Александр Николаевич Бакулев
стал не только продолжателем дела своего учителя, но и приумножил
его славу. Им разработаны способы пластики пищевода,
нейрохирургические вмешательства при абсцессах мозга и черепно-мозговых
ранениях. Огромен вклад академика Бакулева в лёгочную и
сердечную хирургию. Им выполнены первые успешные операции в стране
по удалению опухоли средостения, лёгкого при хроническом
гнойном процессе, при слипчивом перикардите, митральном стенозе,
первая в стране перевязка боталлова протока. Под его руководством
разрабатывались методы диагностики заболеваний сердца,
электростимуляции при поперечных его блокадах, способы лечения
коронарной недостаточности. Он впервые предложил оперировать
больных с острым инфарктом миокарда. В 1955 г. по его инициативе был
создан Институт грудной хирургии, ныне — Центр
сердечно-сосудистой хирургии им. А.Н. Бакулева.
Велики заслуги наших учёных в развитии абдоминальной
хирургии. Ярким талантливым хирургом был Сергей Сергеевич Юдин. Он
так характеризовал свою профессию: «Одни умеют тонко наблюдать,
другие способны трезво рассуждать, третьи — спешно действовать.
Лишь очень редко все три качества встречаются в гармоничном
сочетании в одном лице. Обладая острой наблюдательностью и верным
суждением, можно быть отличным теоретиком и прекрасным
клиницистом. Но будучи лишённым умения смело и безошибочно действовать
сразу, нельзя стать хорошим хирургом...». Его заслуги особенно
велики в хирургии пищевода, желудка, двенадцатиперстной кишки.
Очень много сделали для развития сердечно-сосудистой хирургии
Пётр Андреевич Куприянов, Борис Алексеевич Королёв, Борис
Васильевич Петровский, Евгений Николаевич Мешалкин, Николай Михайлович
Амосов, разработавшие новые операции на сердце и крупных
кровеносных сосудах.
Велики заслуги в кардиохирургии Владимира Ивановича Бураковс-
кого, долгое время возглавлявшего Институт сердечно-сосудистой
хирургии им. А.Н. Бакулева и являвшегося не только выдающимся
хирургом и учёным, но и замечательным педагогом. Он писал, обра-
щаясь к своим ученикам: «Давно бытует определение нашей
профессии: хирургия — это наука, хирургия — это искусство, хирургия — это
ремесло. Я бы добавил: хирургия — ещё и философия, и образ жизни, и
призвание. Если ты все силы отдаешь избранному делу — ты хирург. Если
ты отдан ему наполовину, то ты хирург лишь наполовину».
В когорте выдающихся отечественных кардиохирургов видное
место принадлежит Александру Александровичу Вишневскому. Под его
руководством и при его непосредственном участии был разработан
ряд новых операций при врождённых пороках сердца,
отрабатывались в экспериментальных условиях принципы его пересадки. 4
ноября 1968 г. в Ленинграде на базе Военно-медицинской академии он
осуществил первую в СССР операцию по пересадке сердца человеку.
Говоря об онкологии, нельзя не упомянуть Николая Николаевича
Блохина — основателя и первого директора Всероссийского
научного онкологического центра, Александра Наумовича Рыжих и
Александра Михайловича Аминева — основоположников отечественной
проктологии, Андрея Григорьевича Савиных, создавшего первый в Сибири
онкологический институт. К сожалению, в рамках данного учебника
невозможно подробно остановиться на жизни и творчестве всех
выдающихся российских хирургов — это потребовало бы многотомного
издания. Каждый из них был личностью, многие создали свои
школы, развивающие отдельные направления отечественной хирургии.
Хирургия как наука и, тем более, как творчество и искусство
немыслима без постоянной и непосредственной передачи от Учителя к
ученику своих знаний, опыта, мировоззрения, больших и малых
«секретов» хирургического мастерства. Формирование
научно-практических школ стало ещё одной устоявшейся традицией современной
хирургии. Одному человеку, сколь бы талантлив и мудр он не был,
зачастую физически не под силу преодолеть в одиночку все те
сложные и многообразные проблемы, которые встают перед
исследователями и клиницистами на современной ступени развития общества и
медицины. Самые одарённые хирурги были и талантливыми
Учителями, поскольку такова уж особенность нашей профессии, что
обучить клиническому мышлению и оперативному мастерству можно
только на собственном примере при каждодневной практической
работе. Выдающиеся хирургические школы создали Николай
Иванович Пирогов, Николай Васильевич Склифосовский, Александр
Алексеевич Бобров, французский хирург Рене Лериш, американские хирурги
братья Уильям и Чарльз Мейо, Сергей Петрович Фёдоров, Александр
Васильевич Вишневский, Юстиан Юлианович Джанелидзе, Сергей
ралииии и перспективы развития хирур]
Иванович Спасокукоцкий, Николай Ни.ювич Бурденко, Александр
Николаевич Бакулеву Ефим Львович Березов, Виктор Иванович Стручков,
Борис Александрович Петров, Аркадий Тимофеевич Лидский, Борис
Васильевич Петровский, Евгений Антонович Вагнер, Генрих Ильич Луком-
ский, Михаил Ильич Кузин, Фёдор Григорьевич Уг,юв, Пётр Петрович
Коваленко, Михаил Израи^хевич Перельман, Агександр Алексеевич
Шалимов и многие другие талантливые и яркие учёные и исследователи,
блестяше владевшие практическим хирургическим мастерством.
Хирургия прошла трудный и славный путь. В борьбе за здоровье
человека не только со смертельно опасными болезнями, но и с
косностью, невежеством, религиозным фанатизмом, преодолев
огромные препятствия и разнообразные барьеры, она достигла своих
современных рубежей, которыми вправе гордиться. И это умение
побеждать, своим трудом, упорством, настойчивостью завоёвывать
ешё вчера, казалось бы, недостижимые высоты, стало ешё одной
бесценной традицией хирургии.
Сегодня мир, а вместе с ним и хирургия шагнули в III
тысячелетие, куда совсем недавно осмеливались заглядывать лишь писатели-
фантасты. Накоплен огромный багаж знаний, опыта, умения и
мастерства. Открывающиеся перспективы поистине безграничны. Но
претворятся в реальность они лишь тогда, когда мы сможем не
только оценить победы и достижения хирургов, но и осмыслить
проблемы, трудности и препятствия, как оставшиеся в наследство от
прошлого тысячелетия, так и те, которые создаёт быстро летящее время.
Определение основных путей их преодоления, своевременное
решение встающих перед хирургами новых, подчас неожиданных и
весьма сложных задач, обусловленных нелинейным развитием общества
и науки, являются теми условиями, без которых невозможен
дальнейший прогресс нашей специальности.
Современная хирургия достигла невиданных высот, и во многом
тому способствовала стремительная специализация. Не случайно
дучшие результаты сложнейших операций на сердце, сосудах, лёгких,
печени достигнуты в крупных высокоспециализированных центрах.
Между тем, общий уровень хирургии определяется не отдельными,
кс самыми значительными достижениями профильных
академических институтов, а качеством работы в районных и областных
больницах практических хирургов, которые были и остаются хирургами -
Iуниверсалами. Специализация не должна идти за счёт сужения
обшемелтшнекого клиническою кругозора, в противном случае не-
►ведение сё до абсурда.
32 ♦ Хирургические болезни ♦ Том 1 О- Часть I О Глава 1
Другая причина достигнутого прорыва в лечении сложнейших
заболеваний — активное повсеместное внедрение современных
технологий, стремительно меняющих лицо хирургии. Это касается как
диагностики, так и лечения больных. Революция в компьютерных
технологиях и конструкции видеосистем, произошедшая в последние
20 лет предыдущего века, позволили создать высокоинформативные
диагностические методы и принципиально усовершенствовать
технологию выполнения многих операций. В категорию рутинных
методик отошли стандартные рентгенологические, эндоскопические
исследования и УЗИ. На смену им пришли компьютерные
технологии, позволяющие получить объёмные, трёхмерные, так называемые
ЗО-изображения органов и тканей. Появилась возможность интрао-
перационной оптической биопсии ткани с разрешением, которое
приближается к гистологическому. Появление новых
диагностических методик идёт параллельно с интеграцией уже существующих, на
порядок увеличивая их информативность.
Чрезвычайно ценной является общая тенденция перехода к неин-
вазивным методам исследования. В первую очередь это относится к
ультразвуковой диагностике, с помощью которой можно обследовать
практически любые органы пациента в амбулаторных условиях. Если
ранее «золотым» стандартом в диагностике поражений сосудов
считалась ангиография, то в настоящее время это место прочно заняло
ультразвуковое ангиосканирование.
Современные ультразвуковые, эндоскопические, ангиографичес-
кие, радионуклидные методы диагностики, компьютерная (КТ) и
магнитно-резонансная (МРТ) томографии и другие самые
современные диагностические технологии нередко дают бесценную
информацию. Однако доверие к компьютерной технике, цифрам и графикам
не должно оттеснять клиническое мышление. Трудно спорить с
незабвенным Козьмой Прутковым, утверждавшим, что всякий узкий
специалист, даже самый блестящий, становится «подобный флюсу».
Только клиницист с широким кругозором, знающий сильные и
слабые стороны всех существующих диагностических методик, может
правильно оценить и интегрировать полученные данные.
Соединение сильных сторон специализации и интеграции в
медицине в целом и в хирургии в частности является одной из
первостепенных задач нашего времени, и её значимость будет только
возрастать с появлением новых диагностических технологий.
Кроме того, многие методы исследования, по крайней мере в
настоящее время, основаны на применении весьма дорогостоящих
Традиции и перспективы развития хирургии
аппаратов и оборудования, и ешё долго будут прерогативой
небольшого числа крупных хирургических центров. Поэтому и в
ближайшем будущем, и в далёкой перспективе необходима чёткая система
приоритетов в подготовке и практической деятельности как
хирургов, так и врачей иных специальностей: на первом месте —
клиническая картина, человек, больной, со всеми его физическими и
душевными особенностями, и лишь затем — даже самые ценные данные
инструментальных и лабораторных методов. В противном случае врач
неизбежно окажется погребён под Монбланом цифр и показателей,
которые закроют суть патологического процесса и перспективы
лечения.
Правильно и своевременно поставить больному диагноз —
важный, но всё же только первый этап работы хирурга. Главное,
безусловно, избавить человека от этого страдания. Последнее
десятилетие — период бурного внедрения новых технологий в лечении
больных. В первую очередь, это мини-инвазивная хирургия, позволившая
соединить то, о чём мечтали многие поколения хирургов: радикализм,
косметичность, низкую травматичность и быструю реабилитацию. Во
многих случаях именно доступ, а не объём вмешательства,
определяет общую переносимость операции, темпы выздоровления, срок
восстановления трудоспособности. Мини-инвазивная хирургия —
широкое понятие. Она объединяет эндоскопические вмешательства,
выполняемые через естественные анатомические отверстия, эндохи-
рургические — через проколы в грудной или брюшной стенке,
открытые операции — через малые хирургические доступы. Мини-инвазив-
ные вмешательства при опухолях лёгких, средостения, пищевода,
кишечника, на жёлчных путях, желудке, при грыжах выполняются
сегодня в сотнях клиник.
Преимущества подобных вмешательств перед традиционными во
многих случаях очевидны. Однако важнейшим вопросом остаётся
постановка показаний к эндохирургическим операциям. Опасно,
когда эндохирургический доступ становится самоцелью. Хирург не
должен исходить из приверженности к способам и следовать
веяниям моды. Выбор метода лечения, и это принципиально важно, всегда
должен быть адекватен имеющейся клинической ситуации.
Огромные перспективы у рентгеноэндоваскулярной хирургии. Уже
сейчас ей подвластны восстановление проходимости артерий и вен,
лечение пороков сердца, портальной гипертензии и аневризм,
остановка кровотечений, предотвращение лёгочной эмболии и многое
другое. В рентгеноэндоваскулярную хирургию пришли и активно ис-
34 -О Хирургические болезни ♦ Том 1 ♦ Часть I -*> Глава 1
пользуются лазеры. Возможности и доля эндовазальных
вмешательств, выполняемых «без разреза и наркоза», в будущем
значительно возрастёт.
Что же ожидается в недалёкой перспективе? Из сферы научной
фантастики в область экспериментального исполнения уже
переместилась так называемая интеллектуальная хирургия, в основе
которой лежит применение роботов, микророботов и телеоперационных
систем. Это обеспечивает возможность дистанционного выполнения
самых различных операций через минимальный оперативный доступ.
Хирургическое вмешательство прецизионно выполняется
микророботом, управляемым хирургом с помощью телеоперационной
системы, которая формирует компьютерное трёхмерное изображение,
позволяющее врачу ощущать себя внутри грудной или брюшной
полости. Многие операции с использованием робототехники уже
успешно сделаны в кардиохирургии, ортопедии, урологии. При этом
широчайшее расширение технологических возможностей столь же
значимо повышает значение интеллекта, знаний и опыта хирурга.
В более отдалённом будущем, по-видимому, облик хирургии и
многие хирургические операции совершенно изменятся, и
возникнет необходимость оборудовать операционные для тканевой
инженерии, генетических, биохимических вмешательств. Уже сейчас
экспериментально используют пересадку стволовых клеток, аутоло-
гичных скелетных миобластов в зону постинфарктного рубца для
улучшения функционального состояния этой зоны.
Как правило, наиболее передовые, революционные технологии
диагностики и лечения применяются при оказании плановой
хирургической помощи. Однако это не означает, что уменьшается роль
экстренной хирургии. Экстренная хирургия была и остаётся наиболее
сложным разделом нашей профессии. С острыми аппендицитами,
кишечной непроходимостью, ущемлёнными грыжами, травмами
хирургам придётся сталкиваться при любом уровне развития
общества, науки и технологий. В ургентной хирургии редко есть время
для сложных диагностических исследований, и наиболее
ответственные тактические решения приходится принимать в условиях
дефицита информации и времени. В то же время сложность «рядовых»
хирургических вмешательств при деструктивных процессах,
перитоните, кровотечении может значительно превышать технические
проблемы плановых реконструктивных операций. Выходить больного с
разлитым перитонитом нередко значительно сложнее, чем выполнить
протезирование аорты или пластику пищевода.
Традиции и перспективы развития хирургии ♦ 35
Что же может улучшить результаты лечения этой категории
больных? Судьба огромного числа пациентов находится в руках врачей
поликлиник. При своевременном выявлении и адекватном лечении
больных с опухолями, желчнокаменной (ЖКБ) и язвенной
болезнями, неосложнёнными грыжами значительно уменьшится число
запущенных форм и тяжёлых осложнений этих заболеваний. Чтобы
полноценно использовать этот резерв улучшения результатов
лечения, необходимо на новом уровне знаний, организации и
материального обеспечения вернуться к многократно ранее осмеянной за
формализм профилактике, плановым массовым медосмотрам, активной
пропаганде медицинских знаний и возможностей хирургии в
средствах массовой информации.
На рубеже тысячелетий возникла необходимость по-новому
взглянуть на такие общехирургические проблемы, как кровотечение,
инфекция, венозные тромбоэмболические осложнения,
онкологические заболевания. С чем это связано? Развитие человечества не идёт
строго в позитивном, поступательном направлении. Эпидемии
инфекционных болезней, угрожающие самому существованию жизни
на Земле, к сожалению, не остались в далёком прошлом. Более того,
появляются всё новые, доселе не известные и смертельно опасные
вирусные заболевания. Отличительной их особенностью является
возможность инфицирования через кровь. В связи с этим борьба с
такой базовой, родовой для хирургии проблемой, как кровотечение,
приобретает совсем иное направление. На сегодняшний день
переливание крови и её компонентов представляет огромную опасность
для больного, так как кровь может быть инфицирована вирусами
гепатита и иммунодефицита человека. Существующие тест-системы не
позволяют на ранних сроках заболевания выявить наличие вируса.
Сегодня мы знаем, что абсолютно безопасного переливания не
существует. Гемотрансфузия превращается в «русскую рулетку», когда
каждая доза плазмы или эритроцитарной массы может унести жизнь
человека. Даже переливание растворов желатина, традиционно
широко используемого в качестве коллоидного кровезаменителя, таит в
себе всё возрастающую угрозу распространения возбудителя
трансмиссивной спонгиоформной энцефалопатии, называемой в средствах
массовой информации «коровьим бешенством», не уничтожаемого
обычно используемыми режимами стерилизации.
В этих условиях резко возрастает потребность в создании
эффективных и безопасных кровезаменителей, обладающих
газотранспортной функцией и способных осуществлять иные функции крови. На-
36 О Хирургические болезни ♦ Том 1 ^ Часть I ♦ Глава 1
ряду с этим разрабатывается ряд альтернативных путей, связанных, в
частности, с использованием крови самого больного, созданием
индивидуальных банков крови. И, безусловно, в программах бескровной
хирургии огромная роль будет принадлежать эффективным
физическим методам остановки кровотечения (использованию
микроволнового и ультразвукового ножа, лазерного аргонового коагулятора), а
также современным локальным и системным гемостатическим средствам.
Требуют переосмысления и закономерности взаимосвязи
микроорганизм—человек, в первую очередь, решение концептуальных
вопросов, связанных с такой проблемой, как сепсис. Ещё великий
Н.И. Пирогов приложил огромные усилия для решения проблем
раневой инфекции и «заражения крови». Несмотря на все достижения
клиницистов и фармакологов, даже сейчас, в начале XXI века, при
значительном снижении общего числа раневых инфекционных
осложнений летальность при сепсисе составляет около 40%.
Причина этого — селекция чрезвычайно устойчивых микроорганизмов,
произошедшая под влиянием неконтролируемого назначения
антибиотиков, широкого применения инвазивных методов
диагностики и лечения, влияния различных факторов, вызывающих снижение
иммунитета. Увеличилась частота выделения микроорганизмов,
наименования которых ранее были вообще не известны клиницистам.
Ещё одна серьёзнейшая проблема, в равной степени тревожащая
наряду с хирургами травматологов, ортопедов, гинекологов,
урологов, — послеоперационные венозные тромбоэмболические
осложнения. Сейчас, когда мастерство хирургов возросло, на фоне общего
снижения послеоперационной летальности отмечается
угрожающий рост доли фатальных лёгочных эмболии. Всё более широкая
распространённость острых венозных тромбозов, являющихся их
источником, обусловлена общим увеличением возраста населения,
гиподинамией, ожирением, распространённостью предшествующих
хронических заболеваний вен, врождённых и приобретённых
нарушений свёртывающей системы крови, онкологических заболеваний,
растущей частотой сложных хирургических вмешательств.
Решение этой проблемы должно идти по пути первичной
профилактики, предотвращения тромботического поражения вен. Для этого,
наряду с профилактическим использованием современных
фармакологических средств, наиболее эффективными из которых являются
низкомолекулярные гепарины, обязательно следует настойчиво
применять неспецифические методы, в первую очередь эластическую
компрессию и раннюю активизацию больных.
Традиции и перспективы развития хирургии ♦ 37
Очень тревожит рост онкологической патологии, обусловленный
экологическими и демографическими проблемами. Лечение
опухолевого процесса имеет свои принципы, множество особенностей и
деталей. Между тем значительное число этих больных поступают в
экстренном порядке в непрофильные учреждения с тяжёлыми
осложнениями, на поздних стадиях заболевания. Знание базовых
принципов онкологии, умение правильно сориентироваться в клинической
ситуации необходимы сейчас хирургу любого профиля.
Нельзя остановить процесс специализации в медицине. Однако
большинство будущих врачей придут работать не в крупные
специализированные центры, а в скоропомощные и районные больницы,
где им придётся осваивать широкий круг вмешательств и
становиться хирургами-универсалами. Поэтому наряду с узкой
специализацией роль базового медицинского образования, широкого клинического
кругозора будет только возрастать. Для того чтобы помочь больному,
недостаточно одного лишь желания и самого искреннего
сострадания. В основе чутья и интуиции, мастерства и профессионализма
всегда лежат знания, добыть которые можно только упорным трудом.
Хирургия вступает в новое тысячелетие с ценнейшим багажом
знаний, опыта, мастерства и имеет огромный потенциал для развития.
Насколько этот потенциал будет реализован, зависит от нас с вами.
Установление диагноза — один из самых сложных и
ответственных моментов клинической практики, требующий от врача
значительных интеллектуальных усилий. Точность диагноза признаётся
главной составляющей успешного лечения. Как справедливо
гласит латинская пословица: «Что хорошо распознается, то хорошо
лечится {bene dignoscitur — bene curatur)»* В хирургии правильный
диагноз особенно важен, поскольку за ним, как правило, стоит
выбор агрессивного метода лечения, сопровождающегося
значительной травмой, возможными тяжёлыми осложнениями и даже
гибелью пациента.
Блестящий русский клиницист СП. Боткин в своё время писал:
«Я считаю себя неплохим диагностом, но всё же я был бы
удовлетворён, если бы 30% моих диагнозов были правильными». Тогда
объективные методы обследования больных были крайне скудными, и
диагностика почти полностью базировалась на тщательном анализе
клинических данных. С ростом технической оснащённости медицины
выявить болезнь становится всё проще. Современный врач
располагает многими высокоинформативными лабораторными и
инструментальными методами исследования, позволяющими в большинстве
случаев поставить точный диагноз. Тем не менее и сейчас
клиницисты часто испытывают значительные трудности в постановке
диагноза, и диагностические ошибки — самый частый вид врачебных
ошибок. В большинстве случаев их возникновение зависит не от дефицита
знаний, а от неумения ими пользоваться. Беспорядочный
диагностический поиск даже с использованием самых современных
специальных методов малопродуктивен.
В практике хирурга очень важна правильная методика
обследования больного. Весь диагностический процесс условно можно
разделить на несколько этапов.
• Оценка симптомов и данных физикального обследования.
• Постановка предварительного диагноза.
• Дифференциальная диагностика.
• Постановка клинического диагноза.
4
Методология постановки диагноза в хирургической... О- 39
Этап I. Оценка симптомов
и данных физикального обследования
Когда врач знакомится с новым пациентом, он всегда должен быть
готов к встрече с любыми проявлениями болезни. Первая беседа с
больным и его осмотр, ещё до применения инструментальных и
лабораторных методов исследования, дают грамотному врачу
уникальные данные, во многом определяющие его дальнейшие диагности-
еские и лечебные усилия.
Жалобы
Такие жалобы, как ухудшение самочувствия, недомогание и
снижение трудоспособности, встречаются при большинстве заболеваний
и не помогают в постановке диагноза. Необходимо активно выяснять
более специфичные для определения характера патологии
симптомы и затем максимально их детализировать. Примером могут
служить рвота кровью или «кофейной гущей» при желудочно-кишечном
кровотечении; схваткообразная боль в животе, его вздутие и
отсутствие стула при острой кишечной непроходимости; «перемежающаяся
хромота» при хронической артериальной недостаточности нижних
конечностей.
Чтобы сосредоточиться на конкретных проблемах больного и точ-
[0 определить их природу, врачи по сложившейся традиции
стараются выяснить тот ведущий симптом, который заставил
человека обратиться за медицинской помощью. Этот симптом называют
основной жалобой пациента. Подобных признаков может быть
несколько. В идеале формулировка основных признаков болезни
заостряет внимание врача и пациента на причинах и цели обращения
к врачу. Определению истинной причины обращения к врачу
часто помогает такой вопрос: «Почему именно теперь?». Почему
больной со сложным и запутанным анамнезом обратился к врачу
именно сейчас? Что изменилось? Что в настоящее время беспокоит
больного? Поняв «почему теперь», во многих случаях удаётся
установить истинную причину обращения к врачу и использовать
это как отправной пункт для детализации анамнеза. Хирург,
собирающий анамнез и в последующем записывающий его в историю
болезни, должен выяснить динамику развития заболевания, а не
историю скитания больного по врачам различного профиля,
поликлиникам и стационарам.
Определение времени появления симптомов и динамики их
развития позволяет клиницисту определить остроту болезни, а
выяснение ранее перенесённых болезней помогает оценить фон, на котором
протекает данное заболевание. Крайне важно выделение
угрожающих жизни ситуаций, требующих незамедлительной госпитализации
пациента в хирургический стационар и неотложных лечебных
мероприятий. В таких случаях невозможны подробный опрос больного
и детализация данных анамнеза, ему следует задавать предельно
краткие конкретные вопросы, на которые можно получить однозначный
ответ. Вслед за этим необходимо определить ведущие проявления
заболевания, такие как симптомы раздражения брюшины у пациента с
болями в животе.
Физикальное исследование
Физикальное исследование в целом ряде случаев позволяет
поставить правильный диагноз и решить вопрос о характере лечения. Если
диагноз остаётся неясен, то совокупность жалоб и анамнеза служит
основой для разработки плана дальнейшего обследования больного.
Ещё в стенах медицинского института врач должен приучить себя к
определённому порядку физикалъного исследования больного. Его
данные потом будут изложены в истории болезни: определение общего
состояния и особенностей телосложения, обследование органов
дыхания, кровообращения, пищеварения и неврологического статуса.
Для каждой из систем следует выяснить специфические жалобы,
провести наружный осмотр, пальпацию, перкуссию и аускулътацию. Вслед
за этим хирургу следует оценить местный статус при тех
заболеваниях, при которых это имеет решающее значение: заболевания
щитовидной и молочных желёз, наружные брюшные грыжи,
поражение сосудов конечностей, различные раны. Он должен также
выполнить пальцевое вагинальное и ректальное исследования (см. схему
написания истории болезни на прилагающемся к учебнику лазерном
диске). Методичное исследование всех органов и систем позволяет
избежать тяжёлых диагностических просчётов и выявить
сопутствующие заболевания, что может оказаться решающим в выборе
лечебной тактики. Тяжесть желудочного кровотечения, выраженность
интоксикации при перитоните, характер двигательных нарушений,
обусловленных острым нарушением артериального кровообращения
в конечностях лучше всего определяются именно при физикальном
исследовании.
Методология постановки диагноза в хирургической... ♦ 41
Выделение одного главного симптома может подтолкнуть врача к
принятию скоропалительных решений. Чтобы избежать этой
ловушки, врач должен рассмотреть как можно больше симптомов перед
тем, как начать составлять их патогенетические комбинации.
Определение ведущего синдрома позволяет значительно сузить круг
предполагаемой патологии. Например, при болях в животе,
сочетающихся с синдромом системной воспалительной реакции (повышение
температуры тела, тахикардия, лейкоцитоз), можно с определённой
уверенностью ограничить круг возможных заболеваний, исключив
из них нозологические формы, которые не имеют воспалительной
природы.
Последовательность процесса диагностики в классическом
варианте можно рассмотреть на следующем клиническом примере.
К врачу обратилась пациентка 52 лет по поводу приступов боли «в
правом боку», беспокоящих её в течение последних 2 мес. Обычно приступ
возникает после погрешностей в диете, особенно после приёма жирной пищи,
и сопровождается тошнотой и вздутием живота. Вне обострения
сохраняется тяжесть в правом подреберье и чувство горечи во рту. В последнее время
ухудшилось самочувствие и снизилась работоспособность. Результаты
фискального исследования в пределах нормы.
У нашей пациентки основная жалоба — боль в эпигастральной области и
правом подреберье. Она обратилась за помощью, потому что боли
повторяются и стали более интенсивными. Таким образом, выделение приступов
боли в качестве ведущего симптома позволяет врачу сконцентрироваться на
важном проявлении болезни, более всего тревожащем больную и
заставившем её обратиться за медицинской помощью.
У данной больной имеется вполне определённая клиническая
картина. В подобных случаях врачи действуют на редкость похоже (ход
рассуждений врача и его дальнейшие диагностические усилия будут
представлены ниже).
Вместе с тем бывают случаи, когда основная жалоба не подходи i
на роль ведущего симптома. Например, больного может беспокоить
гошнота, слабость или ухудшение самочувствия. На таких жалобах
почти невозможно основывать диагностический поиск, их нельзя
'очно охарактеризовать, поскольку наблюдаются они при множестве
болезней и могут быть обусловлены различными
патофизиологическими механизмами. Напротив, боль в эпигастральной области и
потеря массы тела — более определённые симптомы, они свойственны
ограниченному числу болезней, что облегчаем дифференциальную
диагностику.
42 О Хирургические болезни <г Том 1 <♦* Часть I О- Глава 2
Иногда характерных проявлений заболевания обнаружить
вообще не удаётся. Тогда, в силу обстоятельств, для постановки
предварительного диагноза и проведения дифференциальной диагностики
приходится брать за основу неспецифические симптомы. Если
главная жалоба — слабость, полезно сфокусировать внимание на
сопутствующей бледности кожного покрова и потемнении кала. Если
главная жалоба — тошнота, то для суждения о характере болезни следует
взять сопутствующее вздутие живота и задержку стула.
Выявление связей между отдельными проявлениями болезни
помогает разобраться во всей клинической картине и выделить ведущий
клинический синдром.
Этап II. Постановка предварительного диагноза
Предварительное суждение о характере заболевания — следующий
этап диагностического процесса. Подозрение на ту или иную болезнь
возникает естественным образом при сопоставлении её
хрестоматийных описаний с имеющимися симптомами. В процессе такого
сравнительного анализа у врача возникают догадки, зависящие от
степени соответствия симптомов тому описанию болезни, которое он
помнит. Часто подобное сопоставление позволяет быстро
сформулировать предварительный диагноз.
Обычно врачи, руководствуясь скорее интуицией, чем логикой,
мгновенно сопоставляют выявленные жалобы и симптомы с
клиническими проявлениями определённых заболеваний,
запечатленными в их памяти, и предполагают наличие той или иной болезни. Уже
в ходе сбора данных, переключая внимание с одного симптома на
другой или выделяя главный симптом либо клинический синдром,
врач не просто собирает информацию — он уже формулирует свои
первые предположения об имеющейся патологии. Процесс
постановки предварительного диагноза даёт возможность превратить вопрос
«что могло вызвать эти жалобы?» в другой вопрос, на который
ответить легче: «нет ли здесь болезни N?».
В случае с нашей пациенткой локализация боли и связь её с приёмом
жирной пищи заставят большинство врачей сразу заподозрить ЖКБ. При
этом заболевании боль обычно локализована в правом подреберье и
возникает после приёма жирной пиши. Таким образом, симптоматика
нашей больной вполне соответствует хрестоматийной картине ЖКБ. Теперь
перед врачом встаёт другой вопрос: действительно ли у больной это
заболевание?
Методология постановки диагноза в хирургической... <& 43
Этап III. Дифференциальная диагностика
В ходе дифференциальной диагностики перед нами встаёт иная,
чем при постановке предварительного диагноза, задача.
Формулируя предварительный диагноз, мы стремились определить одну
возможную болезнь. Проводя дифференциальную диагностику,
напротив, необходимо рассмотреть все сколько-нибудь вероятные в
данной ситуации болезни и выбрать из них наиболее схожие для
активной проверки. Сформулировав предварительный диагноз, врач
нередко сознаёт, что перед ним — целый набор альтернативных
версий. При использовании компьютерных систем диагностики
можно поразиться огромному количеству вариантов, которые
возникают на экране дисплея. Столкнувшись с длинным списком возможных
диагнозов, мы должны прежде всего ограничить их число наиболее
вероятными. Обдумывая ситуацию и подбирая возможные
варианты диагноза, врач может разделить болезни по категориям,
соответствующим механизмам патогенеза: воспаление, кровотечение,
опухоль, травма и т.д. Им соответствуют определённые клинические
синдромы.
Число синдромов, из которых, как из отдельных фрагментов,
складывается картина любого заболевания, не столь велико и вполне
доступно восприятию обычного врача. Зная, какие синдромы
определяют картину того или иного заболевания, врач проводит
целенаправленную дифференциальную диагностику и формулирует
показания к применению соответствующих лабораторных и
инструментальных методов исследования. Такой алгоритм действий хирурга
позволяет с наименьшей потерей времени и наибольшей
безопасностью для пациента поставить точный диагноз и приступить к
лечению больного.
Исключение маловероятных, но серьёзных болезней из
первоначального рассмотрения, скорее всего, необходимо, но одновременно
и опасно. Врачу не следует о них забывать. К этим версиям
приходится возвращаться, когда при рассмотрении распространённых
заболеваний уверенности в диагнозе нет. В подобной ситуации нужно
задуматься о возможности редкой болезни.
Выбор заболеваний, подлежащих дифференциальной
диагностике, должен учитывать следующие основные моменты:
• схожесть клинических проявлений;
• эпидемиологию болезни;
• «остроту» заболевания;
• опасность болезни для жизни больного;
• тяжесть общего состояния пациента и его возраст.
Включая ту или иную болезнь в список заболеваний, требующих
проведения дифференциальной диагностики, важно учитывать
частоту её наблюдения среди данной популяции людей. В первую очередь
следует принимать во внимание наиболее распространённые
заболевания. Старое шутливое правило гласит: «Частые болезни бывают
часто, редкие — редко». Это верно даже в тех случаях, когда широко
распространённые болезни проявляются не совсем обычными
симптомами. Методическая ошибка, известная как игнорирование
фонового уровня, заключается в том, что врачи склонны полагаться в
первую очередь на совпадение симптомов с известной им клинической
картиной, не учитывая эпидемиологические данные.
Исходную вероятность болезни легче всего учесть, если сразу же
задать себе вопрос, подходящий ли у больного образ жизни или тип
личности? Недостаточно знать, что острый панкреатит относится к
распространённым болезням; важно учитывать, что он особенно
часто бывает у женщин с избыточной массой тела и у лиц,
злоупотребляющих спиртными напитками. Имея дело с такими пациентами,
надо всегда проявлять настороженность в отношении этого
заболевания, даже если симптомы не вполне им соответствуют.
Определённую помощь в установлении круга заболеваний,
требующих проведения дифференциальной диагностики, может оказать
возраст пациента. У пожилых больных гораздо выше вероятность
сосудистых и онкологических заболеваний, в то время как острый
аппендицит чаще встречается у молодых и лиц среднего возраста.
Решая, в отношении каких болезней проводить
дифференциальную диагностику, врач должен учитывать также «остроту» болезни и
тяжесть состояния больного. Кроме того, обдумывая план
обследования больного, надо задавать себе вопрос, какая из подозреваемых
болезней представляет большую угрозу жизни пациента.
В нашем клиническом примере весьма вероятна ЖКБ. Широкая
распространённость этой болезни плюс классическая клиническая картина
говорят в пользу этой версии. Между тем, несмотря на очевидную
обоснованность подозрений на ЖКБ, нельзя сразу отвергнуть существование иных
возможных заболеваний. В первую очередь следует исключить гастрит,
язвенную болезнь и хронический панкреатит. Другая возможность — рак
желудка или поджелудочной железы. К ещё менее вероятным версиям
относится рак ободочной кишки. И совсем мала вероятность хронического
аппендицита. Поэтому у данной пациентки рак ободочной кишки и хрони-
Методология постановки диагноза в хирургической... > 45
ческий аппендицит можно, по крайней мере временно, исключить из
списка активно прорабатываемых версий. Такой вывод основан на том, что с
одной стороны, их проявления не имеют явной связи с погрешностями в
диете; с другой — эти заболевания обычно проявляются другими симптомами.
Обычно после сбора анамнеза, проведения физикального
исследования, постановки предварительного диагноза и составления
перечня диагностических версий, требующих проверки, врач
назначает дополнительное обследование. При этом часто возникает
искушение прибегнуть к расширенному использованию
инструментальных методов. Между тем, назначая тот или иной
диагностический тест, врач должен отдавать себе отчёт: «почему выбран именно этот
тест и зачем он нужен?». Лабораторное или инструментальное
исследование бывает необходимо, прежде всего, для подтверждения или
исключения конкретной болезни. Дополнительные диагностические
исследования назначают также для оценки нарушений, вызываемых
патологическим процессом, и определения степени тяжести
состояния пациента с тем, чтобы выработать оптимальную схему лечения
больного, оценить его результаты или выявить побочные эффекты
терапии. Если для диагностики конкретного заболевания может быть
использовано несколько различных методов, следует выбрать
наиболее информативный, доступный и легко переносимый.
Результаты диагностического теста могут быть
истинно-положительными (болезнь есть, и тест её подтверждает) или
истинно-отрицательными (болезни нет, и тест её исключает). Вместе с тем возможны
ложно-отрицательные заключения (болезнь есть, но тест её
исключает) и ложно-положительные (болезни нет, но тест на неё указывает).
Вероятность положительного результата диагностического теста в
присутствии болезни называется чувствительностью метода, а
частота отрицательного результата теста у здоровых лиц — его
специфичностью. Диагностический метод безупречен, если и его
чувствительность, и специфичность равны 100%. Диагностический тест, дающий
подобный идеальный результат, называют золотым стандартом, или
эталонным тестом. К сожалению, таких совершенных методов мало.
Они существуют лишь для некоторых болезней. Например,
ангиография используется в таком качестве для подтверждения или
исключения окклюзии сосуда, а биопсия —- в случае подозрения на
злокачественную опухоль того или иного органа. Использовать эталонный
тест в качестве первичного метода часто бывает слишком опасно или
дорого, а потому непрактично, поэтому в большинстве случаев
применяют менее совершенные методы. Чем ближе чувствительность и
46 ♦ Хирургические болезни О Том 1 ♦ Часть I О- Глава 2
специфичность метода к 100%, тем существеннее предварительная
информация о пациенте.
При сопоставлении положительных результатов нескольких
диагностических тестов естественно полагать, что точность диагноза
выше. В таком случае мы полагаемся на сумму доказательств. Это
имеет смысл только в том случае, если назначаемые тесты дают
независимые доказательства. Чтобы этого добиться, нужно исследовать
различные по своей природе феномены. Например, и гастроскопия,
и рентгенологическое исследование верхних отделов
желудочно-кишечного тракта (ЖКТ) направлены на поиск изменений в желудке.
Суммарный результат обоих тестов не намного значимее, чем
результат одного из них. Аналогичным образом использование УЗИ и КТ
органов брюшной полости для выявления опухоли поджелудочной
железы мало что добавит к данным одной лишь КТ. С другой стороны,
гастроскопия, отражающая состояние желудка, и УЗИ, позволяющее
судить о наличии изменений в других органах брюшной полости, дают
независимую информацию, суммируя которую мы повышаем
обоснованность диагностических выводов.
При таком подходе врач проводит или назначает диагностические
тесты не для того, чтобы охватить все возможные болезни, а лишь
для того, чтобы дифференцировать одну болезнь от другой. Если
результаты исследований подтверждают предварительный диагноз, это
свидетельствует о его правильности с высокой степенью вероятности.
Если при этом результаты тестов, назначаемых для исключения
альтернативных диагнозов, их действительно отвергают, то на этот
результат можно полностью положиться.
Постановка точного диагноза порой сопряжена с неоправданно
высоким риском некоторых диагностических тестов. Перед
назначением потенциально опасного метода исследования всегда
необходимо оценить вероятность, последствия и обратимость возможных
осложнений. Принимая решение о том, стоит ли проводить
определённое исследование, врач должен осознавать, как повлияет
точный диагноз на лечебную тактику. Так, назначая биопсию печени,
нужно быть очень уверенным в её пользе для дальнейшего
лечения. В целом ряде ситуаций лечение не зависит от точного
клинического диагноза. Едва ли есть необходимость в выявлении
локализации первичной опухоли с помощью дорогостоящих и инвазивных
методов при наличии множественных отдалённых метастазов у
больных, которым возможно проведение лишь симптоматической
терапии. Необосновано проведение сложного обследования у боль-
Методология постановки диагноза в хирургической... О 47
ных, которые не могут перенести хирургическое вмешательство
из-за наличия тяжёлых сопутствующих заболеваний. Другими
словами, прежде чем встать на путь широкомасштабного обследования,
нужно спросить себя, как повлияют его результаты на дальнейшее
лечение.
Проведение многочисленных, часто ненужных диагностических
тестов, помимо опасности получения ложных данных, чревато
информационной перегрузкой, хорошо знакомой многим
практикующим врачам. Избыточный объём данных ослабляет внимание и
приводит к игнорированию информации, независимо от её важности.
Этап IV. Постановка клинического диагноза
После постановки предварительного диагноза и составления
перечня требующих проверки альтернативных версий врач должен
сформулировать клинический диагноз. Для этого, используя
дифференциально-диагностический подход, врач из нескольких версий
выбирает одну-единственно правильную.
Альтернативные версии проверяют одну задругой, сравнивая
каждую с предварительным диагнозом и отбрасывая менее вероятную из
каждой пары болезней, пока не будет выбрана та, которая в
наибольшей степени соответствует собранным данным. Исследуя
альтернативные версии, врач опирается на принцип проверки гипотез. Этот
эвристический приём основан на том, что результаты проверки
служат для подтверждения диагноза, если они положительные, или для
его исключения, если они отрицательные. В идеальном случае
положительные результаты позволяют окончательно установить болезнь,
отрицательные — безоговорочно исключить её.
Последовательность приёмов при традиционном подходе к
диагностике может быть представлена в виде следующей схемы:
Проявления заболевания —> Основные симптомы —> Клинический
синдром —> Поражённый орган —> Причина синдрома —» Дифференциальный
анализ отдельных заболеваний -» Клинический диагноз.
По мере накопления знаний и опыта врач приобретает способность
быстро преодолевать все указанные этапы диагностического
процесса. Он не собирает сначала все данные, чтобы затем остановиться и
обдумать их. Напротив, он активно добывает информацию и
одновременно обрабатывает её. После короткого вступительного
периода, за который больной успевает изложить свои жалобы, опытный
48 О Хирургические болезни ♦ Том 1 О Часть I О- Глава 2
врач формулирует предварительный диагноз, продолжает собирать
анамнез и методично исследовать больного, исходя из
сложившегося у него впечатления. Перед постановкой клинического диагноза он
может заново пройти все этапы, собирая дополнительные данные,
проверяя достоверность полученных сведений, прикидывая, как всё
это согласуется между собой. Диагностический процесс в сознании
(и подсознании) врача идёт безостановочно, между тем попытка
вычленить главное на каждом этапе может оказаться полезной не только
студентам, но и опытным клиницистам. Понимание
закономерностей диагностического процесса позволяет врачу всегда действовать
по системе, логически переходя от одного этапа к другому.
Для проверки предварительного диагноза ЖКБ в нашем клиническом
наблюдении целесообразно провести УЗИ, которое при наличии
конкрементов в жёлчном пузыре практически всегда их выявляет. Для
исключения у нашей пациентки гастрита, язвенной болезни или рака желудка
лучше всего использовать гастроскопию, которая высокоспецифична для этих
заболеваний. Применение указанных дополнительных исследований,
подтверждающих ЖКБ и исключающих другие болезни, позволяет быстро и
уверенно поставить окончательный клинический диагноз — ЖКБ. В том
случае, если бы отсутствовали признаки поражения жёлчного пузыря,
желудка, двенадцатиперстной кишки и поджелудочной железы, возникла бы
необходимость обследования толстой кишки путём колоноскопии и ирри-
госкопии.
Предложенный подход к постановке клинического диагноза по
сути представляет собой набор эвристических правил, заведомо
упрощающий действительность, но предоставляющий логическую
схему диагностического процесса. Конечно, он не свободен от
недостатков, и для достижения успеха в сложных клинических ситуациях
необходим ещё целый ряд приёмов.
Особые диагностические приёмы
,
Тактический диагноз
Для начала лечения больного далеко не всегда необходим точный
клинический диагноз с определением нозологической формы
заболевания. Во многих ситуациях хирургу важно в первую очередь
определить тактику ведения пациента. При этом хирург располагает по
существу четырьмя вариантами.
Метолология постановки диагноза в хирургической... О 49
• Экстренная операция.
• Срочная операция после предоперационной подготовки.
• Плановая операция.
• Консервативное лечение.
Тактический диагноз с выделением ведущего синдрома
Тактический диагноз с выделением ведущего синдрома играет
особо важную роль в неотложной абдоминальной хирургии при острых
болях в животе. Выявление определённого синдрома даёт
информацию о протекающем в организме патологическом процессе и тем
самым позволяет, с одной стороны, направить в нужное русло
диагностический поиск, а с другой — начать патогенетическое лечение ещё
до установления точного клинического диагноза. Например, при
выявлении у пациента синдрома желудочной диспепсии и
дегидратации необходима немедленная инфузионная терапия для
восполнения потерь воды и электролитов.
В большинстве руководств приводится длинный список
возможных причин острых болей в животе, нередко насчитывающий 20-30
заболеваний, начиная с острого аппендицита и заканчивая такими
экзотическими причинами, как порфирия или укус паука «чёрная
вдова». Опытный хирург при осмотре больного с острой болью в
животе даже и не подумает перебирать в уме весь подобный список
«наиболее вероятных» причин абдоминального болевого синдрома.
Вместо этого он попытается свести множественные этиологические
факторы острых болей в животе к небольшому числу синдромов,
каждый из которых диктует определённый образ действий:
• боль в животе и признаки внутреннего кровотечения;
• перитонит;
• кишечная непроходимость;
• гинекологическое заболевание;
• урологическое заболевание;
• терапевтическое заболевание.
Каждому пациенту с острыми болями в животе срочно проводят
обзорную рентгенографию брюшной полости, анализ крови,
включающий подсчёт количества лейкоцитов, уровень гемоглобина и
сывороточной амилазы, а также общий анализ мочи. Эти рутинные
лабораторные тесты имеют определённое диагностическое значение,
быстро выполняются, не слишком дороги и часто делаются ещё до
осмотра больного хирургом.
50 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 2
Выявляющийся на обзорной рентгенограмме свободный газ в
брюшной полости в большинстве случаев свидетельствует о
перфорации гастродуоденальной язвы и значительно реже — о перфорации
толстой кишки. Наличие газа и уровней жидкости в кишечнике
свидетельствует о кишечной непроходимости.
УЗИ брюшной полости обладает незаменимой способностью
диагностики острого холецистита. Оно весьма демонстративно в
распознавании внутрибрюшной жидкости — будь это кровь, гной или
асцит. УЗИ также хорошо выявляет аневризму брюшной аорты,
повреждение паренхиматозных органов, патологию гениталий,
кишечную непроходимость, широко используется для обнаружения
расширения почечной лоханки при обтурации мочеточника камнем.
В трудных клинических ситуациях для уточнения диагноза при
острых болях в животе используют лапароскопию, которая может
обеспечить визуальный органоспецифический диагноз и тем самым
позволяет избежать напрасной лапаротомии.
Боль в животе и признаки внутреннего кровотечения
Это наиболее драматичные проявления «острого живота».
Пациенты, как правило, бледны и адинамичны, с сильной болью в животе
и снижением артериального давления (АД). Вызвать это состояние
могут три наиболее вероятных причины: разрыв паренхиматозного
органа при травме, разрыв аневризмы брюшной аорты и
прервавшаяся внематочная беременность. Единственно возможным вариантом
ведения больного в этом случае является немедленная операция, при
которой и уточняется клинический диагноз. В данной ситуации у
хирурга часто нет времени на дополнительное обследование и
подготовку к операции.
Перитонит
Клиническая картина распространённого перитонита
проявляется болями по всему животу и тяжёлой интоксикацией. Пациент
обычно малоподвижен, его живот доскообразно напряжён, отмечаются
значительное усиление болезненности и непроизвольная защитная
реакция на поверхностную пальпацию и сотрясение брюшной
стенки. При этом нет необходимости в определении симптома Щётки-
на—Блюмберга. Для выявления признаков раздражения брюшины
достаточно попросить больного покашлять или очень нежно
перкутировать его живот. Наиболее частые причины распространённого
Методология постановки диагноза в хирургической... ♦ 51
перитонита — перфоративная гастродуоденальная язва, прободной
аппендицит и перфорация толстой кишки. Больному, у которого при
физикальном исследовании выявляется чёткая картина
распространённого перитонита, не нужны дополнительные диагностические
исследования, так как ему всё равно показана лапаротомия после
кратковременной предоперационной подготовки.
Кишечная непроходимость
Кишечная непроходимость проявляется сильными
схваткообразными болями в центре живота, его вздутием, рвотой, задержкой
стула и газов. Рвота и схваткообразные боли более характерны для
тонкокишечной непроходимости, а резкое вздутие живота, задержка
стула и газов — для толстокишечной. Обзорная рентгенография и УЗИ
брюшной полости — лучшие методы диагностики этого синдрома.
Главная проблема при кишечной непроходимости заключается не
в установлении точного нозологического диагноза, а в выборе
соответствующей тактики лечения. Существует два пути ведения таких
пациентов: консервативное и оперативное (после предоперационной
подготовки). Если у пациента в анамнезе были хирургические
вмешательства на брюшной полости, то вполне правомочен
предварительный диагноз спаечной кишечной непроходимости.
Первоначально таким больным проводят консервативное лечение — инфузионную
терапию, введение назогастрального зонда с целью декомпрессии
верхних отделов ЖКТ, очистительную или сифонную клизму. При
безуспешности консервативной терапии в течение 2—3 ч выполняют
операцию. Появление признаков раздражения брюшины и
гипертермии, нарастание лейкоцитоза делают показания к лапаротомии
абсолютными.
При толстокишечной непроходимости диагноз не может быть
поставлен только с помощью обзорной рентгенографии брюшной
полости. Для уточнения диагноза обычно используют колоноскопию
или ирригоскопию. Как правило, механическая толстокишечная
непроходимость требует оперативного вмешательства после адекватной
предоперационной подготовки.
Терапевтические заболевания
Среди обширного круга нехирургических причин, которые могут
приводить к острым болям в животе (гастроэнтерит, колит,
дизентерия и др.), хирург должен постоянно иметь в виду абдоминальную
52 О- Хирургические болезни ♦ Том 1 О* Часть I ♦ Глава 2
форму инфаркта миокарда и диабетический кетоацидоз. Если
необоснованная лапаротомия при других заболеваниях может быть
досадной хирургической оплошностью, то необоснованная операция у
больного с нераспознанным инфарктом миокарда или
диабетической прекомой может стать фатальной ошибкой, избежать которую
надо стремиться любой ценой.
Динамическое наблюдение
В некоторых трудных клинических ситуациях часто лучший
диагностический тест — время. Наблюдение за состоянием пациента
помогает оценить динамику симптомов, уточнить диагноз и определить
тактику лечения. Вместе с тем динамическое наблюдение приносит
пользу только в том случае, если врач знает, на что следует обращать
внимание. К подобному диагностическому приёму обычно
прибегают при состояниях, непосредственно не угрожающих жизни
пациента и не требующих неотложных лечебных мероприятий, а также в тех
случаях, когда точный диагноз невозможно установить без
использования инвазивных, трудно переносимых пациентом исследований.
Пробное лечение
Иногда лучшее диагностическое средство — пробное лечение
(terapia exjuvantibus). В ряде случаев специфическую терапию можно
начинать, основываясь только на предварительном диагнозе, а
уточнение его отложить до того момента, когда станет ясна реакция
больного на такое лечение. Положительная клиническая динамика
является важным маркёром эффективности избранного лечебного подхода
и подтверждает предварительный диагноз. Такой диагностический
подход следует использовать осторожно и при активном участии
больного. Как и при динамическом наблюдении, больной должен быть
ориентирован, за какими особенностями своего состояния следить,
когда и что сообщать врачу.
Диагностическая операция
Хирургические заболевания почти всегда диагностируются с
использованием современной диагностической техники. Но
существуют ситуации, при которых операция остаётся единственным
средством подтвердить или исключить опасное для жизни больного
заболевание или его осложнение.
радииии и перспективы развития хирургии ♦ 53
Алгоритмы диагностики
Принимая во внимание несовершенство человеческой памяти и
способностей к анализу, предложены компьютерные варианты
диагностики и использование алгоритмов. Алгоритмы диагностики
разработаны для целого ряда наиболее распространённых симптомов и
синдромов.
Скрининговые исследования
В настоящее время врачи всё чаще пытаются выявить болезнь ещё
до появления симптомов (на доклинической стадии) с помощью
специальных тестов. Для доклинической диагностики разработаны
программы по направленному активному выявлению ряда заболеваний
у пациентов групп риска. Особенно часто этот приём используют
для выявления злокачественных образований, поскольку излечение
этих пациентов возможно лишь на ранних стадиях заболевания.
Примером может служить регулярное УЗИ или рентгеновская
маммография у женщин старше 35 лет. Таким путём можно выявить
опухоль молочной железы за 1—2 года до появления первых
клинических признаков.
Врач может прийти к одному и тому же диагнозу различными
путями, однако эффективнее и быстрее работает тот, кто тщательно
выбирает отправные точки в диагностике. Логический анализ всех
клинических проявлений болезни в их динамике, способность врача
увязать пёстрый набор клинических признаков страдания в единое
целое и рациональное использование специальных методов
исследования лежат в основе правильной и своевременной диагностики
большинства заболеваний. В сложных клинических случаях
диагностический процесс базируется не только на общих логических
принципах, использующих современные технологические достижения, но
и на интуитивных элементах хирургического мышления и часто
остаётся исключительной сферой интеллекта и рук хирурга.
-^ rAntin важнейшие синдромы,
^$ ГЛАВ!! ВСТРЕЧАЮЩИЕСЯ
В ХИРУРГИЧЕСКОЙ ПРАКТИКЕ
В этой главе будут рассмотрены три важнейших для клинической
практики синдрома: шок, системная воспалительная реакция,
включая сепсис, и метаболические расстройства, характерные для многих
хирургических заболеваний. От того, насколько врач
ориентирован в этих проблемах, может поставить правильный диагноз и
предпринять необходимые лечебные мероприятия, зависит не только
здоровье, но часто и жизнь больных. Особенно в условиях экстренной
хирургии. При дальнейшем изложении учебного материала авторы
старались избежать ненужных повторов. Если, читая главы
учебника, посвященные конкретной хирургической патологии, вы забыли
некоторые положения данного раздела, большую часть из которых
студенты изучают на курсе общей хирургии, не поленитесь
перелистать книгу назад и обратиться к этой главе.
Шок
До настоящего времени данный термин широко употребляется для
описания эмоционального состояния человека при воздействии на
него неожиданных, чрезвычайно сильных психических факторов, не
подразумевая под этим специфических повреждений органов или
физиологических нарушений. Применительно к клинической
медицине шок означает критическое состояние, которое характеризуется
резким снижением перфузии органов, гипоксией и нарушением
метаболизма. Этот синдром проявляется артериальной гипотензией,
ацидозом и быстро прогрессирующим ухудшением функций жизненно
важных систем организма. Без адекватного лечения шок быстро
приводит к смерти.
Острые кратковременные нарушения гемодинамики могут быть
преходящим эпизодом при нарушении сосудистого тонуса, рефлек-
торно вызванного внезапной болью, испугом, видом крови, духотой
или перегревом, а также при сердечной аритмии или ортостатичес-
кой гипотензии на фоне анемии или гипотонии. Такой эпизод носит
название коллапса и в большинстве случаев купируется самостоятель-
Важнейшие синдромы, встречающиеся в хирургической практике О- 55
но без лечения. Из-за преходящего снижения кровоснабжения мозга
может развиться обморок — кратковременная потеря сознания,
которой часто предшествуют нейро-вегетативные симптомы:
мышечная слабость, потливость, головокружение, тошнота, потемнение в
глазах и шум в ушах. Характерны бледность, низкое АД, бради- или
тахикардия. То же самое может развиться у здоровых людей при
высокой температуре окружающей среды, поскольку тепловой стресс
ведёт к значительному расширению кожных сосудов и снижению
диастолического АД.
Более продолжительные расстройства гемодинамики при шоке
всегда представляют опасность для организма.
Патогенез
В основе шока лежит генерализованное нарушение
кровообращения, приводящее к гипоксии органов и тканей и расстройствам
клеточного метаболизма. Системные нарушения кровообращения
являются следствием снижения сердечного выброса (СВ) и изменения
сосудистого сопротивления.
Первичными физиологическими нарушениями, уменьшающими
эффективную перфузию тканей, служат гиповолемия, сердечная
недостаточность, нарушение сосудистого тонуса и обструкция крупных
сосудов. При остром развитии этих состояний происходит
активация нейро-гуморальных систем с выбросом больших количеств
гормонов и биологически активных веществ, влияющих на тонус сосудов,
проницаемость сосудистой стенки и СВ. При этом резко нарушается
перфузия органов и тканей. Острые расстройства гемодинамики
тяжёлой степени, независимо от причин, вызвавших их, приводят к
однотипной патологической картине. Развиваются серьёзные
нарушения центральной гемодинамики, капиллярного кровообращения
и критическое нарушение тканевой перфузии с тканевой гипоксией,
повреждением клеток и органными дисфункциями.
Нарушения гемодинамики
Низкий СВ — ранняя особенность многих видов шока, кроме так
называемых перераспределительных (септического, неврогенного,
анафилактического, гипоадреналового), при которых в начальных
стадиях минутный объём сердца может быть даже увеличен. СВ
зависит от силы и частоты сокращений миокарда, венозного возврата
(преднагрузки) и периферического сосудистого сопротивления
(постнагрузки). Основными причинами снижения СВ при шоке бывают
гиповолемия, ухудшение насосной функции сердца и повышение
тонуса артериол. В ответ на снижение АД усиливается активация
адаптационных систем. Сначала происходит рефлекторная активация
симпатической нервной системы, а затем усиливается и синтез кате-
холаминов в надпочечниках. Содержание норадреналина в плазме
возрастает в 5—10 раз, а уровень адреналина повышается в 50—100 раз.
Это усиливает сократительную функцию миокарда, учащает
сердечные сокращения и вызывает селективное сужение периферического
и висцерального венозного и артериального русла. Последующая
активация ренин-ангиотензинового механизма приводит к ещё более
выраженной вазоконстрикции и выбросу альдостерона,
задерживающего соль и воду. Выделение антидиуретического гормона
уменьшает объём мочи и увеличивает её концентрацию.
При шоке периферический ангиоспазм развивается
неравномерно и особенно выражен в коже, органах брюшной полости и почках,
где происходит наибольшее снижение кровотока. Бледная и
прохладная кожа, наблюдаемая при осмотре, и побледнение кишки с
ослабленным пульсом в брыжеечных сосудах, видимое во время
операции, — явные признаки периферического ангиоспазма.
Сужение сосудов сердца и мозга происходит в гораздо меньшей
степени по сравнению с другими зонами, и эти органы дольше
других обеспечиваются кровью за счёт резкого ограничения
кровоснабжения остальных органов и тканей. Уровни метаболизма сердца и
мозга высоки, а их запасы энергетических субстратов крайне низки,
поэтому эти органы не переносят длительную ишемию. На
обеспечение немедленных потребностей жизненно важных органов — мозга и
сердца — и направлена в первую очередь нейроэндокринная
компенсация пациента при шоке. Нормальный кровоток в этих органах
поддерживается дополнительными ауторегуляторными механизмами до
тех пор, пока АД превышает 70 мм рт.ст.
Централизация кровообращения — биологически целесообразная
компенсаторная реакция. В начальный период она спасает жизнь
больному. Важно помнить, что первоначальные шоковые реакции —
это реакции адаптации организма, направленные на выживание в
критических условиях, но переходя определённый предел, они
начинают носить патологический характер, приводя к необратимым
повреждениям тканей и органов. Централизация кровообращения,
сохраняющаяся в течение нескольких часов, наряду с защитой мозга и
ике "Ф- J
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 57
сердца таит в себе смертельную опасность, хотя и более отдалённую.
Эта опасность заключается в ухудшении микроциркуляции, гипок-
ии и нарушении метаболизма в органах и тканях.
Коррекция нарушений центральной гемодинамики при шоке
включает в себя интенсивную инфузионную терапию, направленную
на увеличение объёма циркулирующей крови (ОЦК), использование
препаратов, влияющих на тонус сосудов и сократительную
способность миокарда. Лишь при кардиогенном шоке массивная инфузи-
онная терапия противопоказана.
Нарушения микроциркуляции и перфузии тканей
Микроциркуляторное русло (артериолы, капилляры и венулы)
является самым важным звеном системы кровообращения в
патофизиологии шока. Развивающийся спазм артериол и прекапилляр-
ных сфинктеров приводит к значительному уменьшению количества
функционирующих капилляров и замедлению скорости кровотока в
перфузируемых капиллярах, ишемии и гипоксии тканей.
Дальнейшее ухудшение перфузии тканей может быть связано с
вторичной капиллярной патологией. Накопление ионов водорода,
лактата и других продуктов анаэробного обмена веществ приводит к
снижению тонуса артериол и прекапиллярных сфинктеров и ещё
большему снижению системного АД. При этом венулы остаются
суженными. В данных условиях капилляры переполняются кровью, а
альбумин и жидкая часть крови интенсивно покидают сосудистое
русло через поры в стенках капилляров («синдром капиллярной
утечки»). Сгущение крови в микроциркуляторном русле приводит к
возрастанию вязкости крови, при этом увеличивается адгезия
активированных лейкоцитов к эндотелиальным клеткам, эритроциты и
другие форменные элементы крови слипаются между собой и
образуют крупные агрегаты, своеобразные пробки, которые ещё больше
ухудшают микроциркуляцию вплоть до развития сладж-синдрома.
Сосуды, блокированные скоплением форменных элементов
крови, выключаются из кровотока. Развивается так называемое
«патологическое депонирование», которое ещё больше снижает ОЦК и её
кислородную ёмкость, уменьшает венозный возврат крови к сердцу
и как следствие вызывает падение СВ и дальнейшее ухудшение
перфузии тканей. Ацидоз, кроме того, снижает чувствительность
сосудов к катехоламинам, препятствуя их сосудосуживающему действию,
и приводит к атонии венул. Таким образом, замыкается порочный
58 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 3
круг. Изменение соотношения тонуса прекапиллярных сфинктеров
и венул считают решающим фактором в развитии декомпенсирован-
ной фазы шока.
Неизбежным следствием замедления капиллярного кровотока
служит развитие гиперкоагуляционного синдрома. Это приводит к дис-
семинированному внутрисосудистому тромбообразованию, что не
только усиливает расстройства капиллярного кровоообращения, но
и вызывает развитие фокальных некрозов и полиорганной
недостаточности.
Клинические проявления нарушения тканевой перфузии —
холодная, влажная, бледно-цианотичная или мраморная кожа, удлинение
времени заполнения капилляров свыше 2 с, температурный градиент
более 3 °С, олигурия (мочеотделение менее 25 мл/ час).
Подобные нарушения микроциркуляции неспецифичны и
являются постоянным компонентом любого вида шока, а степень их
выраженности определяет его тяжесть и прогноз. Принципы лечения
нарушений микроциркуляции также неспецифичны и практически
не отличаются при всех видах шока: устранение вазоконстрикции,
гемодилюция, антикоагулянтная и дезагрегантная терапия.
Нарушения метаболизма
В условиях пониженной перфузии капиллярного русла не
обеспечивается адекватная доставка питательных веществ к тканям, что
приводит к нарушению метаболизма, дисфункции клеточных
мембран и повреждению клеток. Нарушаются углеводный, белковый и
жировой обмен, резко угнетается утилизация нормальных
источников энергии — глюкозы и жирных кислот. При этом возникает резко
выраженный катаболизм мышечного белка.
Важнейшие нарушения обмена веществ при шоке: разрушение
гликогена, уменьшение дефосфорилирования глюкозы в цитоплазме,
уменьшение продукции энергии в митохондриях, нарушение работы
натрий-калиевого насоса клеточной мембраны с развитем гиперка-
лиемии, которая может стать причиной аритмии и остановки сердца.
Развивающееся при шоке повышение в плазме уровня
адреналина, кортизола и глюкагона воздействует на обмен веществ в клетке
изменениями в использовании субстратов и белковом синтезе. Эти
эффекты включают увеличенный уровень метаболизма, возрастание
гликогенолиза и глюконеогенеза, снижение выделения инсулина
поджелудочной железой. Уменьшение утилизации глюкозы и аминокис-
Важнейшие синдромы, встречающиеся в хирургической практике О- 59
лот тканями почти всегда приводит к гипергликемии, которая по мере
истощения запасов гликогена сменяется гипогликемией. При шоке
в крови повышается уровень мочевины, уменьшается количество
сывороточного альбумина и фибриногена.
На фоне нарастающей гипоксии нарушаются процессы окисления
в тканях, их метаболизм протекает по анаэробному пути. При этом в
значительном количестве образуются кислые продукты обмена
веществ, и развивается метаболический ацидоз. Повышение
концентрации молочной кислоты в крови свыше 2 мЭкв/л служит
показателем усиления анаэробного клеточного метаболизма,
обусловленного гипоперфузией или клеточной метаболической недостаточностью.
Важная роль в патогенезе шока принадлежит нарушениям обмена
кальция, который интенсивно проникает в цитоплазму клеток.
Повышенный внутриклеточный уровень кальция увеличивает
воспалительный ответ, приводя к интенсивному синтезу мощных медиаторов
системной воспалительной реакции. Воспалительные медиаторы
играют значительную роль в клинических проявлениях и прогрессиро-
вании шока, а также и в развитии последующих осложнений.
Повышенное образование и системное распространение этих медиаторов
могут приводить к необратимым повреждениям клеток и высокой
летальности. Использование блокаторов кальциевого канала
повышает выживаемость пациентов с различными видами шока.
Действие провоспалительных цитокинов сопровождается
высвобождением лизосомальных ферментов и свободных перекисных
радикалов, которые вызывают дальнейшие повреждения — «синдром
больной клетки». Гипергликемия и повышение концентрации
растворимых продуктов гликолиза, липолиза и протеолиза приводят
к развитию гиперосмолярности интерстициальной жидкости, что
вызывает переход внутриклеточной жидкости в интерстициальное
пространство, обезвоживание клеток и дальнейшее ухудшение их
функционирования. Таким образом, дисфункция клеточной
мембраны может представлять общий патофизиологический путь
различных причин шока. И хотя точные механизмы дисфункции
клеточной мембраны неясны, лучший способ устранения
метаболических нарушений и предотвращения декомпенсации — быстрое
восстановление ОЦК.
Вырабатываемые при клеточном повреждении воспалительные
медиаторы способствуют дальнейшему нарушению перфузии,
которая ещё больше повреждает клетки в пределах микроциркуляторного
русла. Таким образом, замыкается порочный круг — нарушение пер-
60 ♦ Хирургические болезни ♦ Том 1 О- Часть I ♦ Глава 3
фузии приводит к повреждению клеток с развитием синдрома
системной воспалительной реакции, что в свою очередь ещё больше
ухудшает перфузию тканей и обмен веществ в клетках. Когда эти чрезмерные
системные ответы длительно сохраняются, становятся
автономными и не могут подвергнуться обратному развитию, развивается
синдром полиорганной недостаточности.
В развитии этих изменений ведущая роль принадлежит фактору
некроза опухоли, интерлейкинам (ИЛ-1, ИЛ-6, ИЛ-8), фактору
активации тромбоцитов, лейкотриенам (В4, С4, D4, Е4), тромбоксану
А2, простагландинам (Е2, Е12), простациклину, у-интерферону.
Одновременное и разнонаправленное действие этиологических
факторов и активированных медиаторов при шоке приводит к
повреждению эндотелия, нарушению сосудистого тонуса, проницаемости
сосудов и дисфункции органов.
Постоянство или прогрессирование шока может быть следствием
как продолжающихся нарушений перфузии, так и клеточного
повреждения или их сочетания. Поскольку кислород — наиболее лабильный
витальный субстрат, неадекватная его доставка системой
кровообращения составляет основу патогенеза шока, и своевременное
восстановление перфузии и оксигенации тканей часто полностью
останавливает прогрессирование шока.
Компенсаторные возможности и сила ответной защитной
реакции на чрезвычайное воздействие сугубо индивидуальны и зависят
от целого ряда факторов. Так, например, молодые исходно здоровые
пациенты обладают большими компенсаторными возможностями по
сравнению с людьми пожилого и старческого возрастов. Это
позволяет им легче адаптироваться к чрезвычайной ситуации и дольше
поддерживать удовлетворительные гемодинамические показатели.
Существенно снижают функциональные резервы организма
сопутствующие заболевания. И, прежде всего, патология тех органов и
систем, которые принимают непосредственное участие в адаптации
организма к стрессу. Среди них в первую очередь необходимо назвать
заболевания сердца, лёгких и почек.
Таким образом, в основе патогенеза шока лежат глубокие и
прогрессирующие расстройства гемодинамики, транспорта кислорода,
гуморальной регуляции и метаболизма. Взаимосвязь этих нарушений
может привести к формированию «порочного круга» с полным
истощением адаптационных возможностей организма. Предотвращение
его развития и является основной задачей интенсивной терапии
больных с шоком.
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 61
Стадии шока
Шок представляет собой динамический процесс, начинающийся
с момента действия фактора агрессии, который приводит к
системному нарушению кровообращения, и при прогрессировании
нарушений заканчивающийся необратимыми повреждениями органов
и смертью больного. Эффективность компенсаторных механизмов,
степень клинических проявлений и обратимость возникающих
изменений позволяют выделить в развитии шока ряд
последовательных стадий.
Стадия прешока
Шоку обычно предшествует умеренное снижение систолического
АД (не более чем на 40 мм рт.ст. от должного), которое стимулирует
барорецепторы каротидного синуса и дуги аорты и активирует
компенсаторные механизмы системы кровообращения. Перфузия тканей
существенно не страдает, и клеточный метаболизм остаётся
аэробным. Если при этом прекращается воздействие фактора агрессии, то
компенсаторные механизмы могут восстановить гомеостаз без каких-
либо лечебных мероприятий.
Ранняя (обратимая) стадия шока
Для этой стадии шока характерны уменьшение уровня
систолического АД ниже 90 мм рт.ст., выраженная тахикардия, одышка, оли-
гурия и холодная липкая кожа. В этой стадии компенсаторные
механизмы самостоятельно не способны поддерживать адекваный СВ и
удовлетворять потребности органов и тканей в кислороде.
Метаболизм становится анаэробным, развивается тканевой ацидоз,
появляются признаки дисфункции органов. Важный критерий этой фазы
шока — обратимость возникших изменений гемодинамики,
метаболизма и функций органов и достаточно быстрый регресс
развившихся нарушений под влиянием адекватной терапии.
Промежуточная (прогрессивная) стадия шока
Это жизнеугрожающая критическая ситуация с уровнем
систолического АД ниже 80 мм рт.ст. и выраженными, но обратимыми
нарушениями функций органов. Она требует немедленного
интенсивного лечения с проведением искусственной вентиляции лёгких (ИВЛ)
62 ♦ Хирургические болезни -О Том 1 ^0- Часть I О- Глава 3
и использованием адренергических лекарственных средств для
коррекции нарушений гемодинамики и устранения гипоксии органов.
Длительная глубокая гипотензия приводит к генерализованной
клеточной гипоксии и критическому нарушению биохимических
процессов, которые быстро становятся необратимыми. Именно от
эффективности терапии в течение первого так называемого «золотого
часа» зависит жизнь больного.
Рефрактерная (необратимая) стадия шока
Характерны выраженные расстройства центральной и
периферической гемодинамики, гибель клеток и полиорганная
недостаточность. Интенсивная терапия неэффективна, даже если устранены
этиологические причины и временно повышалось АД. Прогрессирующая
полиорганная дисфункция обычно ведёт к необратимому
повреждению органов и смерти.
Классификация шока
Вид шока
• Гиповолемический: кровотечение, обезвоживание.
• Перераспределительный: септический, анафилактический, нейро-
генный, гипоадреналовый.
• Кардиогенный: миопатический, механический, аритмический.
• Экстракардиальный обструктивный: тампонада сердца, массивная
тромбоэмболия лёгочной артерии (ТЭЛА).
Стадия
• Прешок.
• Ранний (обратимый).
• Промежуточный (прогрессивный).
• Рефрактерный (необратимый).
Нарушение функций органов при шоке
и принципы их лечения
Органы, больше всего страдающие при шоке от нарушения
перфузии, принято называть «шоковыми органами», или
органами-мишенями. В первую очередь это лёгкие и почки, повреждение которых
является наиболее характерной чертой любого шока.
Важнейшие синдромы, встречающиеся в хирургической практике
Почки
Почки одними из первых страдают при шоке. Вазоконстрикция
почечных сосудов развивается на ранних стадиях этого патологического
состояния, что приводит к резкому снижению почечной фильтрации и
мочевыделения вплоть до анурии. Развивается преренальная острая
почечная недостаточность. Ауторегуляторные механизмы в состоянии
поддерживать постоянный почечный кровоток лишь при уровне
системного АД выше 80 мм рт.ст. Продолжительное снижение почечной перфузии
ведёт к повреждению канальцевого эпителия, гибели части нефронов и
нарушению выделительной функции почек. При синдроме
длительного сдавления и гемотрансфузионном шоке к тому же происходит и об-
турация почечных канальцев выпадающими белковыми
преципитатами. В исходе развивается острая ренальная почечная недостаточность.
Возможность обратного развития почечных нарушений при
ликвидации шока сохраняется только в первые часы. Если снижение АД —
не кратковременный эпизод, а продолжается достаточно длительное
время, то даже нормализация гемодинамики не в состоянии
остановить цепь патологических изменений и предотвратить некроз
канальцевого эпителия. Дегенеративные изменения в почечных канальцах
чаще всего заканчиваются смертью больного.
Нарушение функций почек при шоке проявляется резким
снижением объёма выделяемой мочи вплоть до полной анурии,
увеличением концентрации креатинина, мочевины, калия в крови,
метаболическим ацидозом.
При лечении шока следует стремиться, чтобы почасовой диурез
составлял не менее 40 мл/ч. На фоне проводимой инфузионной
терапии и восстановленного ОЦК для стимуляции диуреза могут быть
использованы фуросемид и малые дозы допамина, улучшающие
почечное кровообращение и тем самым снижающие риск развития
почечной недостаточности. При отсутствии эффекта от диуретиков и
допамина применяют гемодиализ.
Лёгкие
Лёгкие всегда повреждаются при шоке. Дыхательная система
стандартно реагирует как на прямое повреждение лёгких (аспирация
желудочного содержимого, ушиб лёгкого, пневмоторакс, гемоторакс),
так и на шок и другие патологические факторы. Эндотоксины и ли-
посахариды оказывают прямой повреждающий эффект на лёгочные
эндотелиальные клетки, увеличивая их проницаемость. Другие ак-
64 4> Хирургические болезни -Ф- Том 1 ^ Часть I 4- Глава 3
тивные медиаторы, такие как фактор активации тромбоцитов,
фактор некроза опухоли, лейкотриены, тромбоксан А2, активированные
нейтрофилы, также патологически воздействуют на лёгкие.
Агрессивные метаболиты, медиаторы воспаления и агрегаты
клеток крови, образующиеся при шоке, поступают в системную
циркуляцию, повреждают альвеоло-капиллярную мембрану и приводят к
патологическому повышению проницаемости лёгочных капилляров. При
этом даже в отсутствие повышенного капиллярного гидростатического
или уменьшенного онкотического давления через стенку лёгочных
капилляров интенсивно проникает не только вода, но и плазменный
белок. Это приводит к переполнению интерстициального пространства
жидкостью, оседанию белка в эпителии альвеол и эндотелии
лёгочных капилляров. Изменения в лёгких особенно быстро
прогрессируют при проведении неадекватной инфузионно-трансфузионной
терапии. Эти нарушения приводят к некардиогенному отёку лёгких, потере
сурфактанта и спадению альвеол, развитию внутрилёгочного
шунтирования и перфузии плохо вентилируемых и невентилируемых
альвеол с последующей гипоксией. Лёгкие становятся «жёсткими» и плохо
растяжимыми. Эти патологические изменения не сразу и не всегда
определяются рентгенологически. Рентгенограммы лёгких
первоначально могут быть относительно нормальными, и часто рентгенологические
проявления отстают от истинных изменений в лёгких на 24 ч и более.
Подобные изменения в лёгких первоначально упоминались как
«шоковое лёгкое», а теперь обозначают терминами «синдром острого
повреждения лёгких» и «острый респираторный дистресс-синдром».
Между собой эти синдромы различаются лишь степенью
выраженности дыхательной недостаточности. В хирургической практике они чаще
всего развиваются у больных с септическим, травматическим и панк-
реатогенным шоком, а также при жировой эмболии, тяжёлых
пневмониях, после обширных хирургических вмешательств и массивных
гемотрансфузий, при аспирациях желудочного содержимого и
применении ингаляций концентрированного кислорода. Для острого
респираторного дистресс-синдрома характерны следующие признаки:
• выраженная дыхательная недостаточность с резкой гипоксеми-
ей даже при ингаляции смеси с высокой концентрацией кислорода
(ра02 ниже 50 мм рт.ст.);
• диффузные или очаговые инфильтраты без кардиомегалии и
усиления сосудистого рисунка на рентгенограмме грудной клетки*
• уменьшение податливости лёгких;
• экстракардиальный отёк лёгкого.
Важнейшие синдромы, встречающиеся в хирургической практике ♦
При острых респираторных синдромах необходимо выявлять и
лечить основное заболевание и проводить респираторную
поддержку, направленную на эффективную оксигенацию крови и
обеспечение тканей кислородом. Мочегонные средства и ограничение объёма
вводимой жидкости у больных с острым респираторным дистресс-
синдромом не оказывают никакого воздействия на
патофизиологические изменения в лёгких и не дают положительного эффекта.
В условиях патологической проницаемости лёгочных капилляров
введение таких коллоидных растворов, как альбумин, также не
приводит к эффективному уменьшению внесосудистой жидкости в лёгких.
Частота развития острых повреждений лёгких не изменилась и при
использовании противовоспалительных препаратов (ибупрофен) и
антицитокиновой терапии (антагонисты рецептора ИЛ-1 и монокло-
нальные антитела к фактору некроза опухоли).
Отёк лёгких можно уменьшить, если поддерживать минимальный
уровень лёгочно-капиллярного давления, достаточный лишь для
поддержания адекватного СВ, а ОЦК восполнять препаратами
крахмала, которые уменьшают «капиллярную утечку». При этом уровень
гемоглобина крови должен оставаться не ниже 100 г/л, чтобы
обеспечить требуемую доставку кислорода к тканям.
Искусственная вентиляция легких с умеренным положительным
давлением в конце выдоха позволяет поддерживать уровень ра02 выше
65 мм рт.ст. при концентрации кислорода во вдыхаемой смеси ниже 50%.
Ингаляция через эндотрахеальную трубку более высоких концентраций
кислорода может привести к вытеснению из альвеол азота и вызвать их
спадение и ателектазы. Она может вызывать токсическое воздействие
кислорода на лёгкие, ухудшать оксигенацию и приводить к
образованию диффузных лёгочных инфильтратов. Положительное давление на
выдохе предотвращает спадение бронхиол и альвеол и повышает
альвеолярную вентиляцию.
Летальность при остром респираторном дистресс-синдроме
крайне высока и превышает в среднем 60%, а при септическом шоке —
90%. При благоприятном исходе возможно как полное
выздоровление, так и формирование фиброза лёгких с развитием
прогрессирующей хронической лёгочной недостаточности. Если больным удаётся
выжить в остром периоде повреждения лёгких, для них серьёзной
угрозой становится вторичная лёгочная инфекция. У пациентов с
острым респираторным дистресс-синдромом трудно диагностировать
присоединившуюся пневмонию. Поэтому, если клинические и
рентгенологические данные позволяют предположить пневмонию,
показана активная антимикробная терапия.
66 -О Хирургические болезни -Ф- Том 1 ♦ Часть I ♦ Глава 3
Желудочно-кишечный тракт
Перераспределение кровотока, вызванное шоком, приводит
ишемии слизистой оболочки желудка и разрушению защитного
барьера, предохраняющего её от действия соляной кислоты. Обратная
диффузия ионов водорода в слизистую оболочку желудка приводит к
её изъязвлению и часто сопровождается вторичным желудочным
кровотечением. Для профилактики кровотечений необходимо остановить
разрушение защитного барьера слизистой оболочки, проводя
лечение шока и улучшая доставку кислорода к тканям. Кроме этого
следует увеличить рН содержимого желудка. Уровень этого показателя
выше 4 эффективно предотвращает желудочные кровотечения, а при
рН выше 5 они почти никогда не возникают. С этой целью назначают
НЛ-блокаторы внутривенно струйно или в виде инфузий. Цитопро-
текторы поддерживают целостность слизистой оболочки, не влияя на
кислотность содержимого желудка. Суспензию сукральфата (1 г
препарата растворяют в 10—20 мл стерильной воды) вводят в желудок
через назогастральный зонд каждые 6—8 ч. Сукральфат сопоставим
по эффективности с Н2-блокаторами и антацидами, в то же время
препарат не влияет на бактерицидную активность желудочного сока,
зависящую от величины рН. Большую роль в предотвращении
образования стресс-язв в желудке играет зондовое энтеральное питание,
особенно при введении препаратов непосредственно в кишечник.
Ишемия пищеварительного тракта ведёт к повреждению энтеро-
цитов и функциональной недостаточности кишечника. Следствием
угнетения моторики служат нарушения эвакуации и скопление в
просвете кишечника больших количеств жидкости и газов. Замедление
пассажа химуса сопровождается резким изменением состава
кишечной микрофлоры и интенсивным образованием токсических
продуктов. Перерастяжение кишечной стенки усугубляет нарушения,
вызванные ишемией энтероцитов, и сопровождается повышением
кишечной проницаемости, транслокацией бактерий и токсинов
через гликокаликс мембраны в кровь и лимфу. Кроме того,
депонирование жидкости в просвете кишечника ведёт к снижению ОЦК,
усугубляя нарушения гемодинамики, свойственные шоку. Тем самым
кишечник играет особо важную роль в патогенезе развития
полиорганной дисфункции и несостоятельности у больных с шоком.
Основная функция кишки — всасывание питательных веществ —
нарушается в тяжёлых случаях до полного отсутствия. В этих
условиях энтеральное питание не только не приводит к поступлению в кровь
необходимых веществ, но усугубляет перерастяжение кишечной стен-
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 67
ки и её гипоксию. Основные принципы лечения функциональной
недостаточности кишечника:
• нормализация водно-электролитного баланса;
• медикаментозная стимуляция моторики кишечника;
• энтеросорбция;
• парентеральное питание;
• при угрозе генерализации кишечной флоры — селективная де-
контаминация кишечника.
Печень
Ишемическое повреждение гепатоцитов при шоке приводит к
цитолизу, признаком которого является повышение активности
индикаторных ферментов лактатдегидрогеназы, аланинаминотрансфе-
разы, аспартатаминотрасферазы. Для септического шока характерно
также токсическое повреждение печёночных клеток. Нарушается
обмен билирубина, ухудшается функция детоксикации, снижается
синтез альбумина, церулоплазмина, холинэстеразы, факторов
свёртывания крови. Это приводит к желтухе, нарастанию интоксикации,
гипопротеинемии и коагулопатии. В результате действия токсинов,
не обезвреженных печенью, развивается энцефалопатия вплоть до
комы. Острая печёночная недостаточность при шоке чаще всего
развивается при наличии предшествовавших заболеваний печени, на
фоне которых ишемия быстро приводит к гибели гепатоцитов и
образованию очагов некроза в паренхиме печени. Основные принципы
лечения печёночной недостаточности:
• назначение гепатопротекторов и антиоксидантов;
• уменьшение всасывания из кишечника токсических продуктов —
эубиотики, лактулоза, селективная деконтаминация; при желудочно-
кишечных кровотечениях необходимо освобождение кишечника от
излившейся крови с помощью очистительной клизмы;
• использование фильтрационных методов детоксикации.
Кровь
Кровь как ткань также повреждается при шоке. Нарушаются её
транспортная, буферная и иммунная функции, страдают системы
свёртывания и фибринолиза. При шоке всегда развивается
гиперкоагуляция и происходит интенсивное формирование внутрисосудис-
тых кровяных сгустков, образующихся преимущественно в микроцир-
куляторном русле. При этом потребляется ряд факторов свёртывания
68 ♦ Хирургические болезни О Том 1 <>■ Часть I О- Глава 3
(тромбоциты, фибриноген, фактор V, фактор VIII, протромбин) и их
содержание в крови снижается, что приводит к значительному
замедлению свёртываемости крови. Одновременно с данным процессом в уже
образовавшихся сгустках начинается ферментативный процесс
распада фибриногена с образованием продуктов деградации фибриногена,
которые обладают мощным фибринолитическим действием. Кровь
совсем перестаёт свёртываться, что бывает причиной значительных
кровотечений из мест пункций, краёв раны и слизистой оболочки ЖКТ.
Важную роль в нарушениях гемокоагуляции играет снижение
концентрации антитромбина III и протеина С, поэтому целесообразна
коррекция их дефицита. Коагулопатию корригируют введением
свежезамороженной плазмы или отдельных факторов свёртывания.
Тромбоцитопения (менее 50x109 /л) требует переливания тромбоци-
тарной массы.
Прогрессирующее снижение содержания фибриногена и
тромбоцитов в сочетании с повышением уровня продуктов деградации
фибриногена и растворимых фибрин-мономеров, а также
соответствующей клинической симптоматикой должно быть основанием для
диагноза синдрома диссеминированного внутрисосудистого
свёртывания (ДВС) и начала специальной терапии. При лечении ДВС-син-
дрома к настоящему моменту вполне доказанными являются
следующие рекомендации:
• первоочередное удаление пускового фактора;
• воздействие на процесс гемокоагуляции с помощью прямых
антикоагулянтов;
• замещение потреблённых компонентов гемостаза введением
свежезамороженной плазмы или отдельных факторов свёртывания;
• ингибиция фибринолиза должна осуществляться только по
строгим показаниям.
ДВС-синдром устранить очень трудно, и более 50% больных
погибают от продолжающегося кровотечения. Высокая летальность от
данного феномена заставляет у больных с шоком проводить
профилактическую антикоагулянтную терапию.
Центральная нервая система (ЦНС)
У всех больных с тяжёлым шоком отмечают повреждение
функций ЦНС — нарушения сознания различной степени, повреждение
центра терморегуляции, дыхания, сосудодвигательного и других
вегетативных центров.
Важнейшие синдромы, встречающиеся в хирургической практике О 69
Сердце
При шоке сердце является одним из органов, на которые ложится
повышенная нагрузка по компенсации развивающихся нарушений.
Увеличение интенсивности сердечной деятельности требует
возрастания коронарного кровотока и доставки кислорода к самому
миокарду. Между тем длительная гипотензия и выраженная тахикардия
всегда приводят к ухудшению перфузии венечных артерий, это в
сочетании с метаболическим ацидозом и выделением специфических
кардиальных депрессантов ухудшает сократимость миокарда и
вызывает дальнейшее понижение насосной функции сердца и развитие
необратимого шока. Быстрее это развивается у больных с
сопутствующей ишемической болезнью сердца.
Синдром полиорганной недостаточности
Чаще всего при шоке происходит серьёзное нарушение функций
не одного «органа-мишени», а сразу нескольких. Синдром,
развивающийся при поражении двух и более жизненно важных органов, носит
название синдрома полиорганной недостаточности. Этим термином
обозначают нарушение функций жизненно важных органов, при
котором самостоятельное без медикаментозной поддержки
восстановление гомеостаза невозможно. Его клинико-лабораторные проявления
представлены сочетанием признаков повреждения отдельных органов,
описанных выше. Вместе с тем полиорганная недостаточность не
является простой суммой недостаточности различных органов.
Нарушения деятельности отдельных органов и систем усугубляют друг друга,
образуя новые «порочные круги» и ускоряя декомпенсацию.
Нарушения гомеостаза при полиорганной недостаточности очень быстро
принимают необратимый характер, поэтому развитие этого синдрома
всегда является признаком терминальной стадии любого вида шока.
Основные признаки полиорганной недостаточности: сопор,
необходимость оксигенотерапии или ИВЛ для поддержания
парциального давления кислорода выше 60 мм рт.ст.; гипербилирубинемия
свыше 34 мкмоль/л, увеличение активностей аспартатаминотрас-
феразы и аланинаминотрансферазы в 2 раза, а креатинина — выше
180 мкмоль/л; интенсивность мочевыделения менее 30 мл/час;
снижение АД ниже 90 мм рт.ст., требующее применения симпатомиме-
тиков; тромбоцитопения ниже 100x109 /л; динамическая кишечная
непроходимость, рефрактерная к медикаментозной терапии в
течение 8 ч и более.
70 0- Хирургические болезни <0> Том 1 О Часть I О- Глава 3
Диагностические исследования
и мониторинг при шоке
Мониторинг — система наблюдения за жизненно важными
функциями организма, способная быстро оповещать о возникновении
угрожающих ситуаций. Это позволяет вовремя начать лечение и не
допускать развития осложнений.
Шок не оставляет времени для упорядоченного сбора информа-
|ции и уточнения диагноза до начала лечения. Систолическое АД при
шоке чаще всего бывает ниже 80 мм рт.ст., но шок иногда
диагностируют и при более высоком систолическом АД, если имеются
клинические признаки резкого ухудшения перфузии органов: холодная
кожа, покрытая липким потом, изменение психического статуса от
спутанности сознания до комы, олиго- или анурия и недостаточное
■ наполнение капилляров кожи. Учащённое дыхание при шоке
обычно свидетельствует о гипоксии, метаболическом ацидозе и
гипертермии, а гиповентиляция — о депрессии дыхательного центра или
повышении внутричерепного давления.
Диагностические исследования при шоке включают клинический
анализ крови, определение содержания электролитов, креатинина,
показателей свёртываемости крови, группы крови и резус-фактора,
газов артериальной крови, электрокардиографию (ЭКГ), эхокарди-
ографию, рентгенографию грудной клетки. Только тщательно
собранные и корректно интерпретированные данные помогают принимать
(правильные решения.
Для контроля эффективности лечения показан мониторинг
гемодинамики, деятельности сердца, лёгких и почек. Число
контролируемых параметров должно быть разумным. Контроль за пациентом
в шоке должен обязательно включать регистрацию следующих
показателей.
• АД, используя при необходимости внутриартериальное измерение.
• Частота сердечных сокращений (ЧСС).
• Интенсивность и глубина дыхания.
• Центральное венозное давление (ЦВД).
• Давление заклинивания в лёгочной артерии (ДЗЛА) при тяжёлом
шоке и неясной причине шока.
• Диурез.
• Газы крови и электролиты плазмы.
Для ориентировочной оценки степени тяжести шока можно
рассчитывать индекс Алговера—Бурри, или, как его ещё называют ин-
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 71
деке шока — отношение частоты пульса в 1 мин к величине
систолического АД. И чем выше этот показатель, тем большая опасность
угрожает жизни пациента.
Центральное венозное давление
Измерение ЦВД с оценкой его ответа на малую нагрузку
жидкостью помогает выбрать режим инфузионной терапии и определить
целесообразность инотропной поддержки. Первоначально больному
в течение 10 мин вводят тест-дозу жидкости: 200 мл при исходном ЦВД
ниже 8 см водн.ст., 100 мл — при ЦВД в пределах 8—10 см водн.ст.,
50 мл — при ЦВД выше 10 см водн.ст. Реакцию оценивают, исходя из
правила «5 и 2 см водн.ст.»: если ЦВД увеличилось более чем на 5 см,
инфузию прекращают и решают вопрос о целесообразности
инотропной поддержки, поскольку такое повышение свидетельствует о
срыве механизма регуляции сократимости Франка—Старлинга и
указывает на сердечную недостаточность. Если повышение ЦВД меньше
2 см водн.ст., это указывает на гиповолемию и является показанием
для дальнейшей интенсивной инфузионной терапии без
необходимости инотропной терапии. Увеличение ЦВД в интервале 2 и 5 см
водн.ст. требует дальнейшего проведения инфузионной терапии под
контролем показателей гемодинамики.
Необходимо подчеркнуть, что ЦВД — ненадёжный индикатор
функций левого желудочка, поскольку зависит в первую очередь от
состояния правого желудочка, которое может отличаться от состояния
левого. Более объективную и широкую информацию о функциях
сердца и лёгких даёт мониторинг гемодинамики в малом круге
кровообращения. Без его использования более чем в трети случаев
неправильно оценивается гемодинамический профиль пациента с шоком.
Основным показанием для катетеризации лёгочной артерии при шоке
служит повышение ЦВД при проведении инфузионной терапии.
Мониторинг гемодинамики в малом круге кровообращения
Инвазивный мониторинг кровообращения в малом круге
производят с помощью катетера, установленного в лёгочной артерии. С этой
целью может быть использован катетер с плавающим баллончиком
на конце (Swan—Gans), который позволяет измерить ряд параметров:
• давление в правом предсердии, правом желудочке, лёгочной
артерии и ДЗЛА, отражающее давление наполнения левого желудочка;
72 ♦ Хирургические болезни ♦ Том 1 <> Часть I ♦ Глава 3
• СВ методом термодилюции;
• парциальное давление кислорода и насыщение гемоглобина
кислородом в смешанной венозной крови.
Определение этих параметров значительно расширяет
возможности мониторинга и оценки эффективности гемодинамической терапии.
1. Позволяют дифференцировать кардиогенный и некардиогенный
отёк лёгких, выявлять эмболию лёгочных артерий и разрыв створок
митрального клапана.
2. Позволяют оценить ОЦК и состояние сердечно-сосудистой
системы в случаях, когда эмпирическое лечение неэффективно или
сопряжено с повышенным риском.
3. Позволяют корректировать объём и скорость инфузии
жидкости, дозы инотропных и сосудорасширяющих препаратов, величину
положительного давления в конце выдоха при проведении ИВЛ.
Снижение насыщения кислородом смешанной венозной крови
всегда является ранним показателем неадекватности СВ.
Диурез
Уменьшение диуреза - - первый объективный признак снижения
ОЦК. Больным с шоком обязательно устанавливают постоянный
мочевой катетер для контроля за объёмом и темпом мочевыделения. При
проведении инфузионной терапии диурез должен быть не менее 50 мл/ч.
При алкогольном опьянении шок может протекать без олигурии,
поскольку этанол угнетает секрецию антидиуретического гормона.
Принципы лечения шока
Прямая угроза жизни при шоке любого генеза требует быстрых
организационных, диагностических и лечебных мер, направленных
на сохранение жизни и предупреждение необратимых изменений в
органах. Остальные задачи также важны, но они являются
проблемами второго плана.
При лечении шока рекомендуют поддерживать систолическое АД
не ниже ЮОммрт.ст., ЦВД — 5—8 см водн.ст, ДЗЛА— 12—15 ммрт.ст.,
насыщение кислородом смешанной венозной крови — выше 70%, ге-
матокрит — на уровне 0,30—0,35, гемоглобин — 80—100 г/л, диурез —
40—50 мл/ч, ра02 — выше 60 мм рт.ст., сатурацию крови — выше 90%,
уровень глюкозы — 4—6 ммоль/л, белка — выше 50 г/л, коллоидно-
осмотическое давление плазмы крови — в диапазоне 20—25 мм рт.ст.,
осмолярность плазмы — на уровне 280—300 мосм/л.
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 73
Основная цель терапии шока — оптимизация транспорта кислорода.
Это направление лечения реализуют с помощью гемодинамической и
респираторной поддержки. Лечение шока должно включать в себя
широкий комплекс интенсивных лечебных мероприятий, направленных на
коррекцию патофизиологических нарушений, лежащих в основе
развития шока: абсолютной или относительной гиповолемии,
расстройства насосной функции сердца, симпатоадренергической реакции и
гипоксии тканей. У всех пациентов следует применять меры,
направленные на предотвращение гипотермии и связанных с ней последствий.
Лечебные действия при шоке должны быть направлены на: • устранение причины шока;
• восстановление ОЦК;
• повышение сократимости миокарда и регуляцию сосудистого
тонуса;
• устранение гипоксии органов и тканей;
• коррекцию нарушенных обменных процессов;
• лечение различных осложнений.
При лечении шока в первую очередь необходимо выполнить
основные приёмы сердечно-лёгочной реанимации: обеспечить
проходимость дыхательных путей, адекватную вентиляцию лёгких и
кровообращение. Важная роль принадлежит и устранению причины
шока — остановке кровотечения, эффективному обезболиванию,
дренированию гнойного очага и т.д. Идеально, когда устранение
причины шока происходит одновременно с вмешательствами,
направленными на оптимизацию деятельности сердечно-сосудистой системы.
Фундамент лечения всех типов шока — увеличение СВ и
своевременное восстановление перфузии тканей, особенно в коронарном,
мозговом, почечном и брыжеечном сосудистом русле. Быстро улучшить
кровообращение мозга и сердца при резком снижении АД можно за
счёт перераспределения крови из нижних конечностей, сосуды
которых вмещают 15-20% общего объёма крови, в центральную
циркуляцию. Поэтому подъём на 30° нижних конечностей должен быть первым
и немедленным мероприятием, как только констатировано
снижение систолического АД ниже 80 мм рт.ст. Этот простой и полезный
приём позволяет быстро увеличить венозный возврат крови к сердцу
Инфузионная терапия
Центральное место в лечении шока занимает инфузионная
терапия. Она оказывает влияние на основные звенья патогенеза шока и
позволяет:
74 ♦ Хирургические болезни ♦ Том 1 -О- Часть I ♦ Глава 3
• поддерживать оптимальный уровень ОЦК и стабилизировать
гемодинамику;
• улучшить микроциркуляцию, доставку кислорода к клеткам и
уменьшить реперфузионные повреждения;
• восстановить нормальное распределение жидкости между
водными секторами, улучшить метаболизм в клетках и предотвратить
активацию каскадных систем.
Увеличение ОЦК — неотложное жизненно важное мероприятие
при всех формах «хирургического» шока. Только при этом условии
обеспечивается оптимальное кровенаполнение желудочков сердца,
адекватно увеличивается СВ, повышается АД, улучшается
доставка кислорода к тканям, восстанавливаются нарушенные обменные
процессы, и больной может быть выведен из критического состояния.
Восполнение ОЦК должно проводиться быстро через катетеры
большого диаметра, введённые в крупные периферические или
центральные вены. Если нет признаков застойной сердечной
недостаточности, первые 500 мл раствора вводят струйно. Затем инфузию
продолжают до тех пор, пока не будут достигнуты адекватные АД,
ЦВД, давление наполнения желудочков, ЧСС и мочеотделение.
Инфузионные растворы
Большинство современных специалистов при лечении шока
используют комбинацию кристаллоидных и коллоидных растворов. Это
позволяет быстро и эффективно восполнить ОЦК, устранить
дефицит внесосудистой жидкости и помогает поддерживать нормальные
онкотические градиенты между внутрисосудистыми и интерстици-
альными пространствами. Выбор соотношения кристаллоидных и
коллоидных растворов при проведении инфузионной терапии у
больного с шоком зависит от конкретной клинической ситуации, оценки
степени нарушений, чёткого понимания механизма действия
препарата и цели лечения.
К кристаллоидным (солевым) растворам относятся растворы Рин-
гера—Локка, Рингер-лактата, лактасол, физиологический раствор и др.
Эти растворы восполняют как внутрисосудистый объём крови, так и
объём и состав интерстициальной и внутриклеточной жидкостей.
Следует помнить, что три четверти объёма кристаллоидных растворов
быстро покидают сосудистое русло и увеличивают объём внеклеточной
жидкости. Эти потенциально вредные эффекты кристаллоидных
растворов далеко не всегда компенсируются увеличением лимфоотто-
ка и могут приводить к переполнению межклеточного пространства.
Важнейшие синдромы, встречающиеся в хирургической практике -О 75
Гемодинамическая стабильность, достигаемая с помошью
большого объёма инфузии кристаллоидных растворов, всегда будет
сопровождаться повышением экстравазации жидкости и формированием
отёка тканей. Особенно это выражено в условиях «капиллярной
утечки». Генерализованный отёк тканей ухудшает транспорт кислорода к
клеткам и усиливает органную дисфункцию. При этом более всего
страдают лёгкие, сердце и кишечник. Вот почему необходима
параллельная инфузия коллоидных средств.
К коллоидным растворам относятся инфузионные средства, в
которых большинство частиц растворённого вещества имеет молекулярную
массу более чем 30 000. В качестве коллоидных растворов используют
плазму, препараты альбумина, декстраны, желатин и гидроксиэти-
лированный крахмал. Кровь обычно в эту группу не включают.
Применение коллоидов сопряжено с меньшим риском
экстравазации и развития отёка тканей, они эффективно поддерживают
коллоидно-осмотическое давление плазмы и быстрее стабилизируют
гемодинамику по сравнению с кристаллоидными растворами. Поскольку
коллоиды более длительно циркулируют в сосудистом русле,
требуется меньший объём вводимой жидкости для стабилизации
гемодинамики по сравнению с объёмом кристаллоидных растворов. Это
значительно снижает опасность перегрузки организма жидкостью.
Вместе с тем коллоидные растворы дороже, могут связывать и
уменьшать ионизированную фракцию плазменного кальция, снижать
уровень циркулирующих иммуноглобулинов, уменьшать эндогенную
выработку белка и влиять на систему гемостаза. Инфузия коллоидных
растворов повышает онкотическое давление плазмы и может
приводить к перемещению внутритканевой жидкости в сосудистое русло.
При этом возникает потенциальный риск увеличения дефицита
объёма интерстициальной жидкости. Для профилактики подобных
нарушений и поддержания нормального онкотического градиента между
внутрисосудистым и интерстициальным пространствами
целесообразно одновременно вводить коллоидные и кристаллоидные растворы.
Не все коллоидные растворы в равной степени отвечают
современным требованиям лечения шока. Чрезмерное использование
препаратов альбумина в лечении шока должно быть ограничено.
Установлено, что увеличение коллоидно-осмотического давления плазмы
после введения альбумина носит кратковременный характер, а затем
происходит его экстравазация в интерстициальное пространство.
Разумной альтернативой препаратам альбумина служат растворы гид-
роксиэтилированного крахмала и декстраны.
76 ♦ Хирургические болезни -О- Том 1 ♦ Часть I ♦ Глава 3
Гидроксиэтилированный крахмал — искусственный коллоид,
получаемый из амилопектина, с коллоидными свойствами, подобными
таковым белка. Но это менее дорогой препарат, чем альбумин, имеет
большую молекулярную массу, в меньшей степени проходит через
стенку капилляра и дольше циркулирует в крови. Частицы крахмала
способствуют снижению активации эндотелиальных клеток и
уменьшают «капиллярную утечку».
Клинические результаты свидетельствуют, что препараты
крахмала при шоке имеют значительные преимущества по сравнению с
растворами альбумина:
• в меньшей степени увеличивают содержание жидкости в лёгких;
• в меньшей степени нарушают газообмен в лёгких;
• могут без особого риска использоваться у больных с
респираторным дистресс-синдромом;
• не нарушают сократимости миокарда;
• снижают отёк и повреждение тканей головного мозга
При анализе многолетнего клинического опыта выявлены особен
ности и преимущества коллоидных растворов на основе гидрокси-
этилированного крахмала, особенно их второго поколения. В первую
очередь это касается безопасности применения и исключительно
низкой частоты возникновения побочных реакций по сравнению с
другими коллоидными инфузионными растворами. Это обусловлено
структурным сходством гидроксиэтилированного крахмала с
гликогеном. Накопленный на сегодняшний день опыт применения колло-
лидных растворов позволяет рекомендовать использование растворов
гидроксиэтилированного крахмала второго поколения как
препаратов первого выбора при возмещении ОЦК у больных шоком.
Борьба с гипоксией
Главное при шоке устранить гипоксию тканей, поскольку это
является центральным звеном патогенеза данного патологического
состояния. Потребление кислорода зависит от метаболических
потребностей и с трудом поддаётся коррекции. Снизить потребности
организма в кислороде можно только устранив гипертермию или
исключив деятельность мышц, участвующих в дыхании, и возложив их
функцию на аппарат ИВЛ.
Доставка кислорода к тканям определяется главным образом
величиной СВ и кислородной ёмкостью крови. Оптимальный уровень
———
Важнейшие синдромы, встречающиеся в хирургической практике О- 77
можно поддерживать с помошью различных методов кислородной
терапии — ингаляции кислорода через лицевую маску или носовые
катетеры. Если при ингаляции кислорода сохраняется дыхательная
недостаточность, то следует проводить ИВЛ, которую можно
осуществлять через маску или интубационную трубку. Эндотрахеальная
интубация предпочтительна при обтурации и повреждении
дыхательных путей, а также при необходимости длительной ИВЛ. Показания
к применению ИВЛ: выраженное тахипноэ (частота дыханий более
35 в минуту), цианоз кожи и слизистых оболочек, участие в акте
дыхания вспомогательных мышц, изменение психического статуса
пациента, снижение напряжения кислорода в артериальной крови ниже
70 мм рт.ст. и повышение напряжения углекислоты выше 50 мм рт.ст.
при дыхании кислородом.
Повышение сократимости миокарда
и регуляция сосудистого тонуса
В основе стратегии лечения всех форм шока лежит регулирование
величины ОЦК, уровня общего сосудистого сопротивления и
сократимости миокарда. Первоначально обычно корригируют величину
ОЦК. При отсутствии положительного эффекта инфузионной
терапии необходимо немедленное применение адренергических средств.
Адренергические лекарственные препараты
Средства, влияющие на сосудистый тонус и сократимость
миокарда, отличаются различной степенью воздействия на а- и р-ад-
ренергические и допаминэргические рецепторы, обладают
различным хронотропным эффектом и влиянием на потребление кислорода
миокардом. К их числу относятся допамин, добутамин, эпинефрин,
норэпинефрин и др. Препаратом первого ряда при шоке является
допамин.
Допамин — эндогенный симпатический амин, является
биосинтетическим предшественником адреналина и действует как
центральный и периферический нейромедиатор. В низких дозах (1—3 мг/кг/
мин) стимулирует дофаминергические рецепторы и вызывает
избирательную дилатацию почечных и мезентериальных артериол. При
этом увеличиваются почечный кровоток, диурез и выделение натрия,
а также улучшается перфузия кишечника, устраняется его ишемия и
восстанавливается барьерная функция слизистой оболочки кишки.
В умеренных дозах (5 мг/кг/мин) происходит стимуляция кардиальных
78 О Хирургические болезни ♦ Том 1 ♦ Часть I О- Глава 3
(3-рецепторов, что приводит к увеличению сократимости миокарда и
повышению СВ. При этом ЧСС и АД изменяются мало. С
увеличением дозы (от 5 до 10 мг/кг/мин) (3-адренергические эффекты всё ещё
преобладают, но дальнейшее повышение СВ сопровождается
увеличением ЧСС и АД. При более высоких дозах (свыше 10 мг/кг/мин)
происходит преимущественная стимуляция а-адренорецепторов и
развивается выраженная периферическая вазоконстрикция, что
приводит к значительному увеличению сопротивления сосудов и АД.
Добутамин — синтетический катехоламин, который используется
в основном для Р-адренергических влияний. По сравнению с допа-
мином вызывает меньшую периферическую вазоконстрикцию и
более слабую хронотропную реакцию. Поэтому добутамин
предпочтительнее использовать в ситуациях, когда целью лечения является
увеличение СВ без значительного увеличения АД.
Норэпинефрин обладает преимущественно а-адренергическим
действием, ведущим к сужению периферических сосудов, и в меньшей
степени — положительным хроно- и инотропным действием на
миокард. Норэпинефрин повышает АД и улучшает функции почек без
применения низких доз допамина и фуросемида.
Эпинефрин, эндогенный катехоламин, выделяемый
надпочечниками в ответ на стресс, имеет широкий спектр отрицательных
системных эффектов, включающих сосудосуживающее действие на
почечные сосуды, аритмогенное воздействие на сердце и повышение
потребности миокарда в кислороде. Поэтому применение эпинеф-
рина ограничивается случаями полной рефрактерности к другим ка-
техоламинам и анафилактическим шоком.
Применение адренергических лекарственных средств с целью
увеличения АД показано при истинном кардиогенном и
анафилактическом шоках, а также при шоке, не восприимчивом к интенсивной ин-
фузионной терапии.
Сосудорасширяющие средства
Устранение спазма периферических сосудов значительно
снижает нагрузку на сердце, увеличивает СВ и улучшает перфузию тканей.
Но сосудорасширяющие препараты (нитропруссид натрия,
нитроглицерин и др.) можно вводить только после коррекции ОЦК и лечения
кардиальной депрессии, когда систолическое АД превышает 90 мм
рт.ст. Основное показание — длительная вазоконстрикция с олигу-
рией, высоким ЦВД или ДЗЛА и отёком лёгких. Необходимо
подчеркнуть, что сосудорасширяющие средства при шоке могут использо-
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 79
ваться только по строгим показаниям и с полным гемодинамичес-
ким контролем, потому что внезапная вазодилатация у пациентов с
гиповолемией или дегидратацией может сопровождаться
катастрофическим падением АД. Эти препараты нужно вводить только в
малых дозах внутривенно или в инфузиях и только до тех пор, пока не
нормализуется мочевыделение, конечности не станут тёплыми и
розовыми, а вены расширенными и хорошо заполненными.
Нитропруссид натрия — сбалансированное сосудорасширяющее
средство, которое действует непосредственно на гладкие мышцы
стенок и артерий, и вен. Снижение сопротивления изгнанию крови
приводит к увеличению СВ, а уменьшение венозного возврата крови к
сердцу снижает венозное давление в малом круге кровообращения и
ЦВД. Нитропруссид натрия действует быстро, но кратковременно.
Продолжительность его действия составляет от 1 до 3 мин, поэтому
необходима непрерывная дозированная инфузия препарата.
Поскольку в состав нитропруссида натрия входит цианид, то его
непрерывное применение более 72 ч при скоростях введения, превышающих
3 мг/кг/мин, может привести к интоксикации.
Нитроглицерин и связанные органические нитраты в отличие от
нитропруссида натрия действуют преимущественно на венозную
часть кровеносного русла, снижая возврат крови к сердцу, и тем
самым понижают нагрузку на миокард при сердечной недостаточности.
Коррекция нарушений метаболизма
При необходимости проводят экстренную коррекцию
электролитных нарушений, особенно уровня калия и кальция, а также
гипергликемии. Хотя метаболический ацидоз и уменьшает эффективность
вазопрессорных средств, но его коррекцию раствором
гидрокарбоната натрия следует проводить лишь при рН крови ниже 7,2.
Неоправданное назначение гидрокарбоната натрия ведёт к уменьшению
поступления кислорода в ткани и усиливает ацидоз в ЦНС.
При шоке часто возникает необходимость в лечении и других
патологических синдромов. Наиболее частыми следствиями шока
являются острая сердечная, почечная и печёночная недостаточность,
респираторный дистресс-синдром, ДВС-синдром и вторичные
желудочно-кишечные кровотечения из острых эрозий. Почти при всех
видах шока используют малые дозы глюкокортикоидов, а при
признаках надпочечниковой недостаточности и низком уровне кортизола их
применение обязательно. Антибиотики с широким спектром действия
80 О Хирургические болезни О Том 1 ♦ Часть I О- Глава 3
при шоке назначают эмпирически при открытых или потенциально
инфицированных ранах, множественных повреждениях органов
брюшной полости и в тех случаях, когда предполагают сепсис.
При неэффективности комплексной терапии шока должны быть
исключены продолжающееся кровотечение в грудную или брюшную
полость, гемопневмоторакс, прямое повреждение и тампонада сердца,
неадекватное восполнение ОЦК и прогрессирующий ДВС-синдром.
Особенности лечения гиповолемического шока
В хирургии гиповолемический шок среди различных типов шока
встречается чаще всего. Любой патологический процесс, который
вызывает снижение ОЦК, может приводить к гиповолемическому
шоку. Наиболее частой его причиной бывают массивные
кровотечения. Но гиповолемический шок может развиваться и в результате
значительной потери внутрисосудистой жидкости при рвоте и
депонировании в «третье пространство» при кишечной непроходимости,
панкреонекрозе и перитоните. При ожоге 25% поверхности тела и
более в результате быстрой потери плазмы из повреждённых тканей
уже в течение первых 24 ч могут развиться гиповолемия и шок.
В основе гемодинамических нарушений при гиповолемическом
шоке лежат низкий ОЦК, уменьшение венозного возврата крови к
сердцу и снижение СВ. При гиповолемии, как и при других формах
шока, основными последствиями пониженной перфузии являются
недостаточная поставка кислорода тканям, нарушенный метаболизм
и неэффективное удаление токсических продуктов обмена.
Компенсаторные механизмы при гиповолемическом шоке включают
увеличение симпатической активности, гипервентиляцию, сокращение
ёмкостных сосудов, выход крови из депо, выброс гормонов стресса,
увеличение внутрисосудистого объёма путём резорбции интерстици-
альной жидкости, мобилизации внутриклеточной жидкости и
сохранения жидкости и электролитов почками. Клинические проявления
гиповолемического шока бывают следствием интенсивного симпа-
то-адреналового ответа на низкий объём крови и зависят от скорости
кровопотери, объёма потерянной крови и адаптационных
механизмов организма.
Наиболее изученной формой гиповолемического шока является
геморрагический шок. При потере до 10—15% объёма крови (500-
750 мл) венозная вазоконстрикция перемещает кровь в артериальную
систему и тем самым компенсирует дефицит объёма. Общее состояние
ажнейшие синдромы, встречающиеся в хирургической практике -О 81
пациента при этом мало изменяется — лишь замедляется
кровенаполнение капилляров, подкожные вены становятся менее заметными,
поскольку они спадаются, и может появиться бледность. Потеря 20—
30% ОЦК (1000-1500 мл) приводит к выраженной периферической
вазоконстрикции, пациент становится беспокойным, развивается
умеренная тахикардия, но АД остаётся нормальным. Побледнение
кожи более заметно и сопровождается олигурией. Олигурия
отражает спазм почечных артерий в ответ на активацию адреналовой
системы и выброс гормонов стресса (вазопрессина и альдостерона). При
потере 30—40% объёма крови (1500—2000 мл) появляются
классические признаки геморрагического шока — снижается АД, развиваются
выраженная тахикардия, олигурия, возбуждение или спутанность
сознания, бледность и похолодание кожных покровов.
Тяжелое кровотечение с потерей 40% объёма крови и более (свыше
2000 мл) приводит к прогрессирующей тахикардии и глубокой гипо-
тензии даже у лежащих в полном покое пациентов. Психический
статус изменяется от возбуждения и беспокойства к апатии и сонливости
в результате значительного ухудшения кровоснабжения мозга. Причём
эти изменения развиваются достаточно быстро и могут привести к
смерти. Сонливость — зловещий клинический признак, требующий
незамедлительной остановки кровотечения и быстрого возмещения ОЦК.
Декомпенсация гомеостатических механизмов и неспособность
поддерживать систолическое АД выше 90 мм рт.ст. сопровождаются
летальностью, превышающей 50%. При остановке кровотечения и
быстром и адекватном восполнении ОЦК даже тяжёлый
геморрагический шок может быть устранён, но если гипотензия длительна, то
недостаточная тканевая перфузия ведёт к клеточному повреждению
и выработке воспалительных медиаторов, что способствует
дальнейшей недостаточной перфузии, дисфункции органов и необратимой
декомпенсации.
Диагноз гиповолемического шока при нестабильной
гемодинамике не представляет сложности в тех случаях, когда имеется
очевидный источник плазмо- и кровопотери при наружном кровотечении,
травме или обширном ожоге. Труднее диагноз ставится при скрытых
источниках снижения ОЦК — кровотечение в плевральную и
брюшную полости, в просвет ЖКТ и забрюшинное пространство,
скопление жидкости в брюшной полости и кишечнике при перитоните,
панкреатите и кишечной непроходимости.
Плазменные потери приводят к гемоконцентрации, а потеря
свободной воды — к сгущению крови и гипернатриемии. После острой
82 ♦ Хирургические болезни ♦• Том 1 *♦■ Часть I ♦ Глава 3
кровопотери гемоглобин и величина гематокрита не изменяются до
тех пор, пока не произошли компенсационные перемещения
жидкости из интерстициального пространства в сосудистое русло или не
проведена инфузионная терапия.
Обязательно проведение дифференцировки между гиповолемичес-
кой и кардиогенной формами шока, поскольку их терапия
принципиально отличается. Длительные сильные боли за грудиной,
набухание яремных вен, хрипы в лёгких, повышение ЦВД характерны для
кардиогенного шока и могут помочь в их различении.
■ Лечение гиповолемического шока направлено на прекращение
плазмо- и кровопотери, быстрое восстановление ОЦК, устранение
дефицита интерстициальной жидкости и коррекцию объёма
циркулирующих эритроцитов.
Быстрого восстановления ОЦК достигают инфузией коллоидных
растворов — препаратов крахмала и декстрана. Дефицит объёма
интерстициальной жидкости устраняют сбалансированными
электролитными растворами. Донорские эритроциты при геморрагическом
шоке применяют на втором этапе инфузионной терапии после
коррекции дефицита ОЦК с помощью плазмозаменителей. Решая
вопрос о показаниях к трансфузии эритроцитов, традиционно всегда
полагались на уровень гемоглобина в крови (как правило, ниже 80 г/л)
и гематокрита (менее 0,25). Между тем опираться на эти показатели
как единственные критерии для назначения гемотрансфузии
опасно. При выраженной тахикардии, низком содержании кислорода в
смешанной венозной крови и электрокардиографических признаках
ишемии миокарда такая степень гемодилюции является чрезмерной
и требует коррекции. К трансфузии эритроцитов прибегают также
сразу, как только выясняется, что продолжается массивное
кровотечение и тяжесть его такова, что трудно ожидать адекватного
возмещения ОЦК и оксигенации тканей от введения коллоидных растворов.
При геморрагическом шоке быстрого повышения кислородной
ёмкости крови можно добиться не только используя донорские
эритроциты, но и применяя препараты с газотранспортной функцией.
В последние два десятилетия появились кровезаменители —
переносчики кислорода, разработанные на основе эмульсии перфторуглеро-
дов — химически и физически инертных соединений, растворяющих
до 60 об.% кислорода и до 90 об.% углекислого газа. На их основе
разработан и создан первый отечественный препарат с
газотранспортной функцией — перфторан, а также японский препарат — флю-
озол. Эмульсии перфторана имеют голубой цвет, поэтому его ещё
ажнеишие синдромы, встречающиеся в хирургической практике О- 83
называют «голубая кровь». Эти препараты не только переносят
кислород, но и уменьшают вязкость крови и улучшают микроциркуляцию, а
также способны разрушать жировые эмболы. Перфторан циркулирует
в кровеносном русле достаточно долго: через 24 ч в кровотоке
обнаруживают около 30%, через 48 ч — 13%, а через 120 ч — 1% перфторана.
Восстановление утраченного объёма крови увеличивает венозный
приток крови к сердцу и восстанавливает наполнение желудочков.
В соответствии с законом Франка—Старлинга происходит
повышение сократимости миокарда, ударного объёма и СВ. При позднем
возмещении объёмных потерь, когда успевает развиться отёк миокарда,
может ухудшаться диастолическое расслабление желудочков сердца,
что требует дополнительного увеличения ОЦК для диастолического
растяжения желудочков и повышения силы сердечного сокращения.
При выраженной и длительной гиповолемии снижение
сократимости миокарда может потребовать дополнительной
медикаментозной инотропной поддержки. Но фармакологическая стимуляция
сократимости должна проводиться только после адекватного
возмещения ОЦК.
Быстрая инфузия плазмозамещающих растворов имеет не только
лечебное, но и диагностическое значение. Внутривенное введение 2—
3 л жидкости в течение первых 30 мин лечения в большинстве
случаев гиповолемического шока восстанавливает адекватное АД. Если же
этого добиться не удаётся, то следует предположить
продолжающееся кровотечение или наличие других причин нестабильности
гемодинамики, таких как тампонада сердца, напряжённый пневмоторакс
или сердечная недостаточность.
Особенности течения и терапии других видов шока — септического,
кардиогенного (возникающего при инфаркте миокарда), экстракарди-
ального обструктивного (вызванного тампонадой сердца или
массивной ТЭЛА) — будут изложены в соответствующих главах учебника.
Системная воспалительная реакция и сепсис
Этот раздел учебника посвящен двум важнейшим синдромам,
определяющим клиническую симптоматику, течение и лечебную
тактику при многих заболеваниях, в том числе хирургических.
Понятие «синдром системной воспалительной реакции» лишь
немногим более 10 лет используется в медицинской науке и практике
для обозначения общих изменений в организме, возникающих под
влиянием различных повреждающих факторов. Системная воспали-
84 -О- Хирургические болезни О- Том 1 ♦ Часть I ♦ Глава 3
тельная реакция — патогенетическая и клинико-физиологическая
основа различных патологических процессов и заболеваний
хирургического, инфекционного, онкологического, гематологического и
другого характера.
Термин «сепсис» в значении, близком к современному,
использовался ещё в VIII—VII веках до н.э. в «Илиаде» Гомера. Великий врач
древности Гиппократ словом «сепсис» описывал процесс распада
тканей, сопровождающихся гниением, болезнью и смертью.
Многовековое учение о сепсисе завершилось в последние
десятилетия пониманием, что в основе этого патологического процесса
лежит универсальный ответ организма на повреждение — системная
воспалительная реакция.
Синдром системной воспалительной реакции
Достижения фундаментальных наук и практической медицины
позволили прийти к заключению, что в основе реакции
макроорганизма на любые повреждающие факторы механической, химической
и биологической природы лежат активация и выброс различных
клеточных, внеклеточных и органных медиаторов. Эта реакция в
зависимости от интенсивности повреждающего действия может носить
генерализованный, системный характер.
Пусковую роль при этом играют гуморальные факторы и
медиаторы, определяющие развитие воспалительной реакции. Такой
генерализованный ответ макроорганизма на повреждение получил
название системной воспалительной реакции.
Концепция системной воспалительной реакции прочно вошла в
клиническую медицину для описания патофизиологических сдвигов
в ответ на повреждающее действие нижеследующих факторов:
• инфекция (бактериальная, вирусная, грибковая, паразитарная);
• травма, в том числе хирургическая;
• неадекватная анестезия;
• ожоги;
• ишемия;
• панкреатит;
• лекарственная реакция;
• аутоиммунные процессы;
• гипоксия.
Гуморальные факторы системной воспалительной реакции
включают практически все известные эндогенные биологически активные
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 85
субстанции — цитокины, ферменты, гормоны, продукты и
регуляторы метаболизма (всего более 200 биологически активных веществ).
Основные эндогенные медиаторы системной воспалительной реакции
• Про- и противовоспалительные
цитокины
- фактор некроза опухоли
(TNFa);
- интерлейкины (ИЛ) 1, 2, 4, 6,
8,Ю
• Фактор активации тромбоцитов
(PAF)
• Эйксаноиды:
- лейкотриены;
- тромбоксан;
- простагландины
• Интерферон-у
• Колониестимулирующий фактор
гранулоцитов-макрофагов
• Оксид азота
• Эндотелии
• Фрагменты комплемента СЗа,
С5а
• Продукты полиморфноядерных
клеток:
— токсические радикалы
кислорода
— протеолитические ферменты
• Молекулы адгезии
• Фактор проницаемости сосудов
• Кинины
• Факторы коагуляции
• Эндорфины
• Тканевые гормоны
• Основные регуляторные
гормоны
Гиперпродукция этих веществ, дисбаланс их активности на
регионарных и системных уровнях быстро приводят к повреждению
эндотелия и органной дисфункции, проявляющейся синдромом
полиорганной недостаточности.
Как известно, воспаление — комплексная сосудисто-тканевая
защитно-приспособительная реакция организма на действие
патогенного раздражителя (повреждающего фактора). В зависимости от
интенсивности действия повреждающего фактора и состояния
макроорганизма эта реакция может носить как локальный, так и
генерализованный характер.
Проявлениями местной воспалительной реакции являются 5
основных признаков, описанных ещё классиками древней медицины
А. Цельсом и К. Галеном, — краснота (rubor), припухлость (tumor),
боль (dolor), повышение температуры (calor) и нарушение функций
(function laesa). Древние говорили о воспалении как о местной
лихорадке, однако отмеченная ими характеристика этого процесса
распространяется и на системное, генерализованное воспаление.
Действительно, классические симптомы воспаления типичны и для
системной реакции. Краснота — распространённая гиперемия, свя-
86 ♦ Хирургические болезни ^ Том 1 Ф Часть I -$- Глава 3
занная с вазодилатацией, снижением сосудистого сопротивления и
повышением СВ, что характерно для септического шока —
воспалительной реакции под действием инфекта. Припухлость — отёк
тканей вследствие повышенной сосудистой проницаемости, приводя-
шей к синдрому «капиллярной утечки», в том числе отёку лёгочного
интерстиция и острому повреждению лёгких. Повышение
температуры — гипертермия, один из симптомов системной воспалительной
реакции, в основе которой лежит нарушение гуморальной регуляции
температуры тела, в частности под влиянием простагландинов. Боль
вполне соотносится с болевыми ощущениями и изменениями ЦНС,
характерными для системной воспалительной реакции
инфекционного генеза, т.е. для сепсиса. Нарушение функций, впервые
описанное Галеном, соответствует полиорганной дисфункции, столь
типичной для системной воспалительной реакции любой этиологии.
Системная воспалительная реакция полиэтиологична и может
возникать при введении высокотоксичных химиотерапевтических
средств и даже антибиотиков, отравлениях, панкреатической гипер-
ферментемии (стерильный панкреонекроз), применении
искусственного кровообращения и экстракорпоральных методов деток-
сикации. Во многих случаях эта реакция носит компенсаторный,
защитный характер, играя ведущую роль в саногенезе. Однако в
патологических ситуациях происходит дисрегуляция этой реакции,
образно говоря, «злокачественное системное воспаление», которое
ведёт к полиорганной дисфункции с необратимыми фатальными
нарушениями.
Начальной фазой системного воспаления является активация ци-
токинов и ферментов иммунокомпетентных клеток. Практически
одновременно активируются эндотелиальные клетки, полиморфно-
ядерные лейкоциты, моноциты и макрофаги.
Особую роль в системной воспалительной реакции играет
повреждение эндотелия. Эндотелий (площадь его составляет около 700 м2, а
масса — 1,5 кг) — не просто выстилка сосудов, это крайне важная
система, ключевые функции которой включают регуляцию
сосудистого тонуса, гемостаза, проницаемости сосудов, адгезии и
подвижности форменных элементов, в частности лейкоцитов.
В клетках эндотелия постоянно синтезируется в небольшом
количестве оксид азота (NO), который играет вазодилатирующую роль
и поддерживает сосуды в открытом состоянии. Активация эндотели-
альных клеток при системном воспалении ведёт, прежде всего, к
гиперпродукции оксида азота, что сопровождается чрезмерной вазоди-
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 87
латацией, повреждением стенки капилляров и повышением их
проницаемости («капиллярной утечке»).
Каскадные реакции, присущие системному воспалению,
перечислены ниже.
Нарушения, характерные для системной воспалительной реакции
(реакция повреждения)
• Активация комплемента
• Активация и повреждение эндотелия
• «Капиллярная утечка», формирование отёка тканей
• Активация и выброс адгезивных молекул, цитокинов
• Экстравазация полиморфноядерных клеток и моноцитов
• Активация фагоцитоза
• Активация коагуляции
• Подавление фибринолиза с последующим его усилением
• Лихорадка
• Гиперпродукция белков острой фазы
• Гиперпролиферация лейкоцитов
• Активация и пролиферация В- и Т-лимфоцитов
• Активация глюкокортикоидной функции надпочечников
• Активация симпатической нервной системы
• Угнетенияе функций щитовидной железы
• Гиперкатаболизм
Естественно, что возникновение воспалительной реакции
немедленно включает противовоспалительные механизмы,
способствующие подавлению этой реакции. Эти противовоспалительные
механизмы включают активацию и выброс цитокинов ИЛ-4, ИЛ-10, ИЛ-13,
рецепторов-антагонистов цитокина ИЛ-1, растворимых рецепторов
TNFa. Прямым противовоспалительным эффектом обладают глюко-
кортикоиды и катехоламины, которые подавляют продукцию TNFa
и ИЛ-1 и усиливают действие ключевого антивоспалительного
цитокина ИЛ-10.
Однако этих и других пока малоизученных механизмов
ограничения системной воспалительной реакции при чрезмерном действии
повреждающих факторов недостаточно для её устранения. Образно
говоря, медиаторный взрыв сжигает организм больного. Дисрегуля-
ция про- и противовоспалительных процессов ведёт к дальнейшей
деструкции эндотелиальных и других клеток, что является
патофизиологической основой полиорганных функциональных и морфоло-
88 -О- Хирургические болезни -0- Том 1 О- Часть I О- Глава 3
гических нарушении.
Клинико-лабораторные признаки системной воспалительной
реакции включают достаточно простые диагностические параметры: ги-
пер- или гипотермию тела, тахипноэ или гипокапнию, тахикардию,
лейкоцитоз или лейкопению. Однако причиной возникновения этих
симптомов являются глубокие «закулисные» процессы — выброс ци-
токинов, оксида азота, катехоламинов и других гуморальных
медиаторов, синтез простагландинов, повреждение эндотелия, нарушение
проницаемости капиллярных мембран и функций лёгких.
Эти клинические признаки неспецифичны, но несмотря на это,
их выявление и сохранение у хирургического больного в течение
достаточно продолжительного времени имеет большое
прогностическое значение, особенно в послеоперационном периоде. Они могут
быть предикторами (предсказателями) исхода лечения. Это
положение подтверждается весьма демонстративными клиническими
исследованиями. Так, при анализе результатов хирургического лечения
более 3000 больных установлено, что в группе больных, не имеющих
на 2-й день после операции ни одного из четырёх симптомов
(гипертермия, тахипноэ, тахикардия, лейкоцитоз) синдрома системной
воспалительной реакции, госпитальная летальность составила около 4%,
при наличии одного симптома — более 8%, двух — 18,5%, трёх
симптомов — 24%, а четырёх признаков системной воспалительной
реакции — 40%. Эти данные демонстрируют клиническую значимость
синдрома системной воспалительной реакции и подчёркивают
необходимость выяснения причины её развития в каждом случае.
По своей сути признаки системного воспаления — реакция
тревоги и для больного, и для клинициста, требующая должного
диагностического поиска, лежащего в основе своевременного и
адекватного лечения.
Дифференцировать характер и специфику системного воспаления
можно лишь на основании анализа клинической ситуации и оценки
вероятных этиологических факторов. В частности, септический
характер синдрома системной воспалительной реакции устанавливают
с помощью выявления очага инфекции,
экспресс-микробиологического обследования и определения
дифференциально-диагностических маркёров инфекционного процесса. Особое дифференциальное
значение имеет определение концентрации в плазме прокальцито-
нина или Ореактивного белка, существенное повышение которых
свидетельствует об инфекционной бактериальной этиологии
воспалительной реакции.
Важнейшие синдромы, встречающиеся в хирургической практике О 89
Сепсис
По современным воззрениям сепсис представляет собой
генерализованную (системную) реакцию организма на инфекцию любой
этиологии (бактериальную, вирусную, грибковую). Критерии
диагностики и классификация представлены в табл. 3-1.
Таблица 3-1. Классификация и критерии диагностики сепсиса
Патологический процесс
Клинико-лабораторные признаки
Синдром системной воспалительной
реакции — системная реакция
организма на воздействие различных
сильных раздражителей (инфекция,
травма, операция и др.)
Характеризуется двумя или более из
следующих признаков:
• температура тела >38 °С или <36 °С;
• ЧСС >90/мин;
• Частота дыхания >20/мин
или гипервентиляция
(раС02<32 мм рт.ст.);
• Лейкоциты крови > 12x109 /л или
<4-10 9/л, или незрелых форм >10%
Сепсис — синдром системной воспа
лительной реакции на инвазию мик
роорганизмов
Наличие очага инфекции и двух или
более признаков синдрома
системного воспалительного ответа
Тяжёлый сепсис
Сепсис, сочетающийся с органной
дисфункцией, артериальной гипо-
тензией, нарушениями тканевой
перфузии. Проявлениями последней, в
частности, являются повышение
концентрации лактата, олигурия, острое
нарушение сознания
Септический шок
Тяжёлый сепсис с признаками
тканевой и органной гипоперфузии, и
артериальной гипотензией, не
устраняющейся с помощью инфузионной
терапии и требующей назначения ка-
техоламинов
Дополнительные определения
Синдром полиорганной дисфункции
Дисфункция по двум системам и более
Рефрактерный септический шок
Сохраняющаяся артериальная гипо-
тензия, несмотря на адекватную ин-
фузию, применение инотропной и
вазопрессорной поддержки
90 <> Хирургические болезни О Том 1 ♦ Часть I О- Глава 3
Локальное воспаление, сепсис, тяжёлый сепсис и полиорганная
недостаточность — звенья одной цепи в реакции организма на
воспаление вследствие микробной инфекции. Тяжёлый сепсис и
септический шок составляют существенную часть синдрома системной
воспалительной реакции организма на инфекцию и являются
следствием прогрессирования системного воспаления с развитием
нарушения функций систем и органов.
Бактериемия и сепсис
Бактериемия — присутствие бактерий в системном кровотоке -
является одним из возможных, но не обязательных проявлений
сепсиса. Отсутствие бактериемии не должно влиять на постановку
диагноза при наличии обозначенных выше критериев сепсиса. Даже при
самом скрупулёзном соблюдении техники забора крови и
использовании современных технологий определения микроорганизмов у
самых тяжёлых больных частота положительных результатов, как
правило, не превышает 45%. Обнаружение микроорганизмов в кровотоке
у лиц без клинико-лабораторных подтверждений синдрома
системного воспаления следует расценивать как транзиторную бактериемию.
Клиническая значимость регистрации бактериемии может
заключаться в:
• подтверждении диагноза и определении этиологии
инфекционного процесса;
• доказательстве механизма развития сепсиса (например, катетер-
связанная инфекция);
• для некоторых ситуаций аргументации тяжести течения
патологического процесса (К. pneumoniae, P. aeruginosa);
• обосновании выбора схемы антибиотикотерапии;
• оценке эффективности терапии.
Оценка функциональной органно-системной состоятельности при
сепсисе может осуществляться по критериям органной дифункции
(табл. 3-2).
Наличие предполагаемого или подтверждённого инфекционного
процесса устанавливают на основании следующих признаков:
• обнаружение лейкоцитов в жидких средах организма, которые в
норме остаются стерильными;
• перфорация полого органа;
• рентгенографические признаки пневмонии с образованием
гнойной мокроты;
Важнейшие синдромы, встречающиеся в хирургической практике "О- 91
• клинические синдромы, при которых высока вероятность
наличия инфекционного процесса;
• наличие лабораторных маркёров системного воспаления.
Таблица 3-2. Критерии органной дисфункции при сепсисе
Система/орган
Сердечно-сосудистая
система
Мочевыделительная
система
Дыхательная система
Печень
Свёртывающая
система
Метаболическая
дисфункция
цнс
Клинико-лабораторные критерии
Систолическое АД <90 мм рт.ст. или среднее АД
<70 мм рт.ст. в течение 1 ч и более, несмотря на
коррекцию гиповолемии
Мочеотделение <0,5 мл/кг/ч при адекватном воле-
мическом восполнении или повышение уровня кре-
атинина в 2 раза больше нормального значения
pa02/Fi02 <250 или наличие билатеральных
инфильтратов на рентгенограмме, или необходимость
проведения ИВЛ
Увеличение содержания билирубина выше 20 мкмоль/л
в течение 2 дней или повышение активности транс-
аминаз в 2 раза и более
Количество тромбоцитов < 100х109/л, или его снижение
на 50% по отношению к наивысшему значению в
течение 3 дней
рН <7,3,
дефицит оснований >5,0 мЭкв/л,
лактат плазмы в 1,5 раза выше нормы
Менее 15 баллов по шкале Глазго
Особенности современной этиологии сепсиса
На сегодняшний день в большинстве крупных медицинских
центров частота грамположительного и грамотрицательного сепсиса
оказалась приблизительно равной. Это произошло в результате
увеличения роли в патологии таких бактерий, как Streptococcus spp.,
Staphylococcus и Enterococcus spp. Инвазивность лечения и рост
численности лиц со сниженной антиинфекционной защитой увеличили
долю инфекций, вызванных условно-патогенными
микроорганизмами, в особенности S. epidermidis. Среди популяции различных видов
стафилококка (возбудителей сепсиса) наблюдают неуклонное
увеличение метициллин(оксациллин)-резистентных штаммов.
92 О Хирургические болезни ^ Том 1 ♦ Часть I -О- Глава 3
Исчезновение доминирующей роли грамотрицательных
микроорганизмов сопровождается изменениями этиологической структуры
внутри этой группы. Выросла частота сепсиса, вызываемого нефер-
ментирующими грамотрицательными бактериями (Pseudomonas
aeruginosa и Acinetobacter spp), а также Klebsiella pneumonia, продуцентов
3-лактамаз расширенного спектра и Enterobacter cloacae. Как
правило, эти микроорганизмы выступают в роли возбудителей
госпитального сепсиса у пациентов отделения реанимации и интенсивной
терапии. Повышение их значимости в развитии тяжёлых инфекций
связано с увеличением пропорции больных, находящихся на
длительной ИВЛ, и излишне широким использованием в клинической
практике цефалоспоринов III поколения и гентамицина.
Увеличение продолжительности жизни лиц, перенёсших
критические состояния, популярность схем комбинированной антибио-
тикотерапии и новые препараты ультраширокого спектра действия
обусловили также появление прежде крайне редко встречающихся в
патологии микробов, таких как Enterococcusfaecium, Stenothrophomonas
maltophilia, Flavobacterium spp. и др.
Перестал быть исключением сепсис, вызываемый грибковой
флорой типа Candida. Риск его возникновения существенно
повышается у больных с высоким индексом тяжести общего состояния,
длительным пребыванием в отделении реанимации и
интенсивной терапии (>21 дня), находящихся на полном парентеральном
питании, получавших глюкокортикоиды, лиц с тяжёлой почечной
дисфункцией, потребовавшей проведения экстракорпоральной де-
токсикации.
Патогенез сепсиса
Развитие органно-системных повреждений при сепсисе, прежде
всего, связано с неконтролируемым распространением из
первичного очага инфекционного воспаления провоспалительных медиаторов
эндогенного происхождения. В последующем под их влиянием
происходит активация макрофагов, нейтрофилов, лимфоцитов и ряда
других клеток в других органах и тканях с вторичным выделением
аналогичных эндогенных субстанций, повреждением эндотелия и
снижением органной перфузии и доставки кислорода.
Диссеминация микроорганизмов может вообще отсутствовать или
быть кратковременной, трудноуловимой. Однако и этот «проскок»
способен запускать выброс провоспалительных цитокинов на дистан-
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 93
ции от очага. Экзо- и эндотоксины бактерий также могут
активировать их гиперпродукцию из макрофагов, лимфоцитов, эндотелия.
Суммарные эффекты, оказываемые медиаторами, формируют
синдром системной воспалительной реакции. В её развитии можно
выделить 3 основных этапа.
• I этап — локальная продукция цитокинов в ответ на инфекцию.
Особое место среди медиаторов воспаления занимает цитокиновая
сеть, которая контролирует процессы реализации иммунной и
воспалительной реактивности. Основными продуцентами цитокинов
являются Т-клетки и активированные макрофаги, а также в той или
иной степени другие виды лейкоцитов, эндотелиоциты
посткапиллярных венул, тромбоциты и различные типы стромальных клеток.
Цитокины приоритетно действуют в очаге воспаления и на
территории реагирующих лимфоидных органов, выполняя в итоге ряд
защитных функций, участвуя в процессах заживления ран и защиты
клеток организма от патогенных микроорганизмов.
• II этап — выброс малого количества цитокинов в системный
кровоток. Малые количества медиаторов способны активировать
макрофаги, тромбоциты, выброс из эндотелия молекул адгезии,
продукцию гормона роста. Развивающаяся острофазовая реакция
контролируется провоспалительными медиаторами (интерлейкина-
ми ИЛ-1, ИЛ-6, ИЛ-8; TNF и др.) и их эндогенными
антагонистами, такими как ИЛ-4, ИЛ-10, ИЛ-13, растворимые рецепторы к TNF
и другие, получившие название антивоспалительных медиаторов.
За счёт поддержания баланса и контролируемых взаимоотношений
между про- и антивоспалительными медиаторами в нормальных
условиях создаются предпосылки для заживления ран, уничтожения
патогенных микроорганизмов, поддержания гомеостаза. К
системным адаптационным изменениям при остром воспалении можно
отнести стрессорную реактивность нейроэндокринной системы,
лихорадку, выход нейтрофилов в циркуляцию из сосудистого и
костномозгового депо, усиление лейкоцитопоэза в костном мозге,
гиперпродукцию белков острой фазы в печени, развитие
генерализованных форм иммунного ответа.
• III этап — генерализация воспалительной реакции. При
выраженном воспалении или его системной несостоятельности некоторые
виды цитокинов (TNF-a, ИЛ-1, ИЛ-6, ИЛ-10, TGF-p, INF-y) при
вирусных инфекциях могут приникать в системную циркуляцию,
накапливаться там в количествах, достаточных для реализации своих
дистантных эффектов. В случае неспособности регулирующих сие-
94 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 3
тем к поддержанию гомеостаза деструктивные эффекты цитокинов
и других медиаторов начинают доминировать, что приводит к
нарушению проницаемости и функций эндотелия капилляров, запуску
синдрома ДВС, формированию отдалённых очагов системного
воспаления, развитию моно- и полиорганной дисфункции. В качестве
факторов системного повреждения, по-видимому, могут выступать и
любые нарушения гомеостаза, способные восприниматься иммун-
|ной системой как повреждающие или потенциально повреждающие.
На этой стадии синдрома системной воспалительной реакции с
позиций взаимодействия про- и антивоспалительных медиаторов
возможно условное выделение двух периодов. Первый, начальный —
период гипервоспаления, характеризующийся выбросом
сверхвысоких концентраций провоспалительных цитокинов, N0, что
сопровождается развитием шока и ранним формированием синдрома
полиорганной недостаточности. Однако уже в данный момент
происходит компенсаторное выделение антивоспалительных цитокинов,
скорость их секреции, концентрация в крови и тканях постепенно
нарастает с параллельным снижением содержания медиаторов
воспаления. Развивается компенсаторный антивоспалительный ответ,
сочетающийся со снижением функциональной активности иммун-
нокомпетентных клеток, — период «иммунного паралича». У
некоторых больных в силу генетической детерминации или изменённой
под действием факторов внешней среды реактивности сразу
регистрируется формирование устойчивой антивоспалительной реакции.
Грамположительные микроорганизмы не содержат в своей
клеточной оболочке эндотоксин и вызывают септические реакции через
другие механизмы. Запускающими септический ответ факторами
могут являться компоненты клеточной стенки, такие как пептидог-
ликан и тейхоевая кислота, стафилококковый протеин А и
стрептококковый протеин М, расположенные на поверхности клеток, гли-
кокаликс, экзотоксины. В этой связи комплекс реакций в ответ на
инвазию грамположительными микроорганизмами более сложен.
Ключевой провоспалительный медиатор — TNF. Его стержневая роль
в развитии сепсиса связана с его биологическими эффектами:
повышение прокоагулянтных свойств эндотелия, активация адгезии ней-
трофилов, индукция других цитокинов, стимуляция катаболизма,
лихорадки и синтеза белков острой фазы. Генерализация
повреждающих эффектов опосредована широкой распространённостью
рецепторов к TNF и способностью других цитокинов осуществлять его
высвобождение. С практической точки зрения чрезвычайно важно
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 95
отметить, что скорость реакций септического каскада резко
возрастает в условиях гипоксии из-за экспрессии цитокиновых рецепторов
а поверхности клеток.
В генезе острой сосудистой недостаточности, лежащей в основе
септического шокового синдрома, ведущую роль отводят оксиду азота
(N0), концентрация которого увеличивается в десятки раз в
результате стимуляции макрофагов TNF, ИЛ-1, IFN, а в дальнейшем его
секреция осуществляется и клетками гладкой мускулатуры сосудов,
и сами моноциты активируются под действием N0. В нормальных
условиях N0 выполняет роль нейротрансмиттера, участвует в вазо-
регуляции, фагоцитозе. Характерно, что нарушения
микроциркуляции при сепсисе носят неоднородный характер: зоны дилатации
сочетаются с участками вазоконстрикции.
В результате дисфункции печени, почек, кишечника
появляются новые, вторичные по отношению к цитокинам факторы
повреждающего воздействия. В роли таковых выступают промежуточные
и конечные продукты нормального обмена в высоких
концентрациях (лактат, мочевина, креатинин, билирубин), накопленные в
патологических концентрациях компоненты и эффекторы регуля-
торных систем (калликреин-кининовой, свёртывающей, фибрино-
литической, перекисного окисления липидов, нейромедиаторы),
продукты извращённого обмена (альдегиды, кетоны, высшие
спирты), вещества кишечного происхождения типа индола, скатола,
путресцина.
Интенсивная терапия сепсиса
Эффективная терапия сепсиса возможна только при условии
полноценной хирургической санации очага инфекции и адекватной
антимикробной терапии.
Неадекватная стартовая антимикробная терапия — независимый
фактор риска летального исхода у больных с сепсисом. Вместе с тем
поддержание жизни больного, предотвращение и устранение
органной дисфункции невозможны без проведения интенсивной терапии.
Основная цель этой терапии — оптимизация транспорта кислорода в
условиях его повышенного потребления, характерного для тяжёлого
сепсиса и септического шока. Это направление лечения реализуют с
помощью гемодинамической и респираторной поддержки. Важную
роль занимают другие аспекты интенсивной терапии: нутритивная
поддержка, иммунозаместительная терапия, коррекция нарушений
96 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 3
гемокоагуляции и предотвращение тромбоэмболических
осложнений, профилактика стресс-язв и возникновения
желудочно-кишечных кровотечений у больных с сепсисом.
Коррекция нарушений гемодинамики
Инфузионная терапия принадлежит к первоначальным
мероприятиям поддержания гемодинамики и, прежде всего, СВ. Основные
задачи инфузионной терапии у больных с сепсисом —
восстановление адекватной тканевой перфузии, коррекции расстройств гомео-
стаза, снижение концентрации медиаторов септического каскада и
токсических метаболитов.
Во многих случаях повышение преднагрузки под влиянием
инфузионной терапии при сохранении сократительной функции
миокарда способствует коррекции артериальной гипотензии, повышению СВ
и, как следствие, оптимизации доставки кислорода. При тяжёлом
сепсисе и септическом шоке возникает абсолютная или
относительная гиповолемия как следствие потерь жидкости, перераспределения
ОЦК с централизацией кровообращения и синдрома «капиллярной
утечки». Именно поэтому инфузионная терапия за счёт увеличения
ОЦК и преднагрузки быстро приводит к повышению СВ. При этом
необходимо стремиться к следующим показателям: ЦВД — 8—12 мм
рт.ст., АДср — более 65 мм рт.ст., диурез — 0,5 мл/кг/ч, гематокрит —
более 30%, сатурация смешанной венозной крови — не менее 70%.
Объём инфузионной терапии следует поддерживать так, чтобы ДЗЛА
не превышало коллоидно-онкотического давления плазмы во
избежание отёка лёгких.
Для инфузионной терапии в рамках целенаправленной
интенсивной терапии сепсиса и септического шока практически с
одинаковым результатом применяют кристаллоидные и коллоидные инфу-
зионные растворы. При выборе инфузионных сред в данной
клинической ситуации необходимо учитывать многофакторный характер
нарушений, вызванных септической системной воспалительной
реакцией. Вазодилатация, секвестрация циркулирующей крови,
синдром «капиллярной утечки» приводят к экстравазации не только
жидкости, но и коллоидной части плазмы, в частности альбумина, что
проявляется снижением венозного возврата и преднагрузки. Для
адекватной коррекции венозного возврата и преднагрузки требуются
значительно большие объёмы (в 2—4 раза больше) инфузии
кристаллоидов, чем коллоидов, что связано с особенностями
распределения растворов между различными секторами. Поэтому надо
Важнейшие синдромы, встречающиеся в хирургической практике -О- 97
учитывать, что инфузия кристаллоидов сопряжена с более высоким
риском отёка тканей, чем коллоидов.
При отсутствии положительного эффекта инфузионной терапии
в отношении стабилизации гемодинамических показателей
необходимо немедленное применение адренергических средств. Допамин и
норэпинефрин являются препаратами первоочередного выбора для
коррекции артериальной гипотензии у больных с септическим шоком.
Гемотрансфузия
Минимальная концентрация гемоглобина для больных с тяжёлым
сепсисом должна быть в пределах 80—100 г/л. Широкое
использование донорской эритроцитарной массы необходимо ограничить ввиду
высокого риска развития различных осложнений (острое повреждение
лёгких, анафилактические реакции, почечная недостаточность и пр.).
Глюкокортикоиды
В настоящее время доказано отрицательное влияние высоких доз
глюкокортикоидов при тяжёлом сепсисе и септическом шоке.
Между тем в последние годы получены новые данные о влиянии
глюкокортикоидов в малых дозах на течение и исход тяжёлого сепсиса и
септического шока: введение 100 мг гидрокортизона 3 раза в сутки
способствует стабилизации гемодинамики и отмене вазопрессорной
терапии, а также снижению летальности.
Респираторная терапия
Лёгкие очень рано становятся одним из первых органов-мишеней,
вовлекаемых в патологический процесс при сепсисе. Острая
дыхательная недостаточность — один из ведущих компонентов
полиорганной дисфункции. Клинико-лабораторные проявления острой
дыхательной недостаточности при сепсисе соответствуют синдрому
острого повреждения лёгких, а при прогрессировании
патологического процесса — острому респираторному дистресс-синдрому. В
клинической практике целесообразно использование следующих
критериев острого повреждения лёгких: острое начало, отношение
напряжения кислорода в артериальной крови (ра02) к фракции
кислорода во вдыхаемом воздухе (Fi02) <300 мм рт.ст., невзирая на
уровень положительного давления в конце вдоха, двусторонняя
инфильтрация лёгких на фронтальной рентгенограмме грудной клетки, ДЗЛА
<18 мм рт.ст. Острый респираторный дистресс-синдром — следую-
98 О- Хирургические болезни О* Том 1 О Часть I ♦ Глава 3
щая стадия прогрессирования острого повреждения лёгких, при
которой респираторный индекс падает ниже 200.
Показания к проведению ИВЛ при тяжёлом сепсисе
определяются развитием паренхиматозной дыхательной недостаточности (ост-
рого повреждения лёгких или острого респираторного
дистресс-синдрома): при снижении респираторного индекса ниже 200 показаны
интубация трахеи и начало респираторной поддержки. При
респираторном индексе выше 200 показания определяются в
индивидуальном порядке и зависят от нарушения ментального статуса,
клинической картины отёка головного мозга, гемодинамических нарушений,
слабости дыхательной мускулатуры и других «непаренхиматозных»
патофизиологических механизмов дыхательной недостаточности.
При отсутствии показаний к проведению ИВЛ оптимальный
уровень насыщения крови кислородом (~90%) можно поддерживать с
помощью различных методов кислородотерапии (лицевые маски,
носовые катетеры) при использовании нетоксичной концентрации
кислорода (Fi02 <0,6). Больным, которым показана респираторная
поддержка, применение неинвазивной респираторной поддержки
противопоказано.
При подборе параметров респираторной поддержки
придерживаются концепции безопасной ИВЛ с соблюдением следующих
условий: пиковое давление в дыхательных путях ниже 35 см водн.ст.,
фракция кислорода во вдыхаемой смеси ниже 60%, дыхательный объём
меньше 6 мл/кг, неинвертированное соотношение вдоха к выдоху.
Подбор параметров дыхательного цикла осуществляют до
достижения критериев адекватности ИВЛ: р О. — больше 60 мм рт.ст., SaO, —
больше 93%, pv02 — 35—45 мм рт.ст., Sv02 — больше 55%.
Нутритивная поддержка
Развитие синдрома полиорганной недостаточности при
сепсисе, как правило, сопровождается проявлениями гиперметаболизма.
В этой ситуации обеспечение энергетических потребностей
происходит за счёт деструкции собственных белковых структур (ауто-
каннибализма), что усугубляет имеющуюся органную дисфункцию
и усиливает эндотоксикоз. Поэтому проведение искусственной нут-
ритивной поддержки — крайне важный компонент лечения.
Включение энтерального питания в комплекс интенсивной терапии
предупреждает транслокацию микрофлоры из кишечника, развитие дис-
бактериоза, повышает функциональную активность энтероцитов и
защитные свойства слизистой оболочки, снижая степень эндоток-
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 99
сикоза и риск возникновения вторичных инфекционных
осложнений. При проведении нутритивной поддержки необходимо
руководствоваться следующими рекомендациями:
• энергетическая ценность питания — 25—30 ккал/кг/сут;
• белок — 1,3—2,0 г/кг/сут;
• глюкоза — 30-70% небелковых калорий с поддержанием уровня
гликемии ниже 6,1 ммоль/л;
• липиды — 15—20% небелковых калорий.
Контроль концентрации глюкозы в крови
и поддержание нормогликемии
Важный аспект комплексной интенсивной терапии тяжёлого
сепсиса — постоянный контроль уровня гликемии и инсулинотерапия.
При уровне гликемии более 6,1 ммоль/л проводят инфузию
инсулина (в дозе 0,5—1 ЕД/ч) для подержания нормогликемии (4,4-
6,1 ммоль/л). Определение концентрации глюкозы — каждые 1—4 ч в
зависимости от клинической ситуации.
Активированный протеин С (дротрекогин-альфа)
В настоящее время доказано, что введение этого препарата в дозе
24 мкг/кг/ч в течение 4 сут ведёт к снижению летальности при
тяжёлом сепсисе более чем на 6%, а у абдоминальных хирургических
больных — почти на 10%.
Иммунозаместительная терапия
Использование внутривенных иммуноглобулинов в рамках
терапии тяжёлого сепсиса и септического шока является в настоящее
время единственным реально доказанным методом иммунокоррекции.
Комбинация IgM с IgG (иммуноглобулин человеческий нормальный
[IgG + IgA + IgM]) — единственный препарат среди других препаратов
иммуноглобулинов, который способствует снижению летальности у
больных с сепсисом, что подтверждается данными доказательных
исследований.
Профилактика тромбоза глубоких вен
Профилактика тромбоза глубоких вен существенно влияет на
результаты лечения больных с сепсисом. С этой целью могут
использоваться как нефракционированный гепарин, так и препараты
низкомолекулярного гепарина. Главные преимущества низкомолекуляр-
100 ♦ Хирургические болезни ♦ Том 1 •♦• Часть I ♦ Глава 3
ного гепарина — меньшая частота геморрагических осложнений,
менее выраженное влияние на функции тромбоцитов,
пролонгированное действие, т,е. возможность однократного введения в сутки.
Профилактика образования стресс-язв ЖКТ
Профилактика образования стресс~язв ЖКТ играет существенную
роль в благоприятном исходе при ведении больных с тяжёлым
сепсисом и септическим шоком. Без неё летальность у септических
больных с кровотечениями из стресс-язв ЖКТ колеблется от 64 до 87%.
Профилактическое применение блокаторов Н2-рецепторов гистами-
на и ингибиторов протонной помпы в 2 раза и более снижают риск
осложнений. Основное направление профилактики и лечения —
поддержание рН в желудке выше 3,5 (до 6,0). При этом эффективность
ингибиторов протонной помпы выше, чем при применение Н2-бло-
каторов. Кроме того, большое значение имеет энтеральное питание.
Экстракорпоральная детоксикация
Возникающая при тяжёлом сепсисе почечная недостаточность
требует применения гемодиализа. При отсутствии так называемых
почечных показаний к экстракорпоральной детоксикации у больных
с сепсисом может быть эффективным использование гемоплазмо-
фильтрации, которая способствует выведению цитокинов и
снижает уровень эндотоксина, характерного для тяжёлого сепсиса. Вместе
с тем, решение вопроса о целесообразности проведения
детоксикации должно основываться на комплексной оценке состояния
больного с учётом полноценной хирургической санации
гнойно-воспалительного очага и адекватности антимикробной терапии возможных
осложнений.
Принципы хирургического лечения септических больных
В зависимости от характера, локализации и специфики гнойно-
воспалительного процесса, вызвавшего развитие сепсиса,
используют следующие типы санирующих хирургических вмешательств:
• дренирование гнойных полостей;
• удаление очагов инфицированного некроза;
• удаление внутренних источников контаминации - -
колонизированных имплантатов (искусственных клапанов сердца, сосудистых
или суставных протезов), инородных тел, временно с лечебной целью
внедрённых в ткани или внутренние среды организма (трубчатых
Важнейшие синдромы, встречающиеся в хирургической практике -0- 101
дренажей и катетеров), а также удаление или проксимальное
отключение (отведение) потока содержимого дефектов полых органов,
рассматриваемых в качестве источников инфицирования.
Принципы антимикробной
терапии хирургической инфекции
Задача антимикробной терапии в комплексном лечении больных
с хирургической инфекцией — предотвращение персистенции,
генерализации и рецидива инфекционного процесса. Основные её
принципы включают следующие положения.
1. Антибактериальная терапия, являясь обязательным компонентом
комплексной терапии хирургической инфекции, лишь дополняет
хирургическое лечение, но не заменяет его.
2. Она направлена на предотвращение продолжающегося после
операции реинфицирования в очаге поражения и, таким образом, на
профилактику рекуррентной инфекции.
3. Антибактериальная терапия служит основным методом лечения
госпитальных инфекций (нозокомиальная пневмония, уроинфек-
ция, катетерная инфекция) при условии устранения причины её
развития (санация трахеобронхиального дерева, гигиенические
мероприятия, регламентированные законами асептики и
антисептики, и т.д.).
4. В отличие от других видов лекарственного лечения,
антибактериальная терапия имеет определённую направленность —
специфическое действие против основных возбудителей хирургической
инфекции. В связи с этим действие антибактериального препарата
зависит от его адекватной пенетрирующей способности в
отношении инфицированных органов и тканей, т.е. от создания
оптимальной концентрации в очаге воспаления или деструкции, что
определяется фармакодинамической характеристикой антибиотика.
5. При проведении антибактериальной терапии хирургической
инфекции необходимо учитывать потенциальные побочные и
токсические реакции препарата, а также тяжесть основной и
сопутствующей патологии хирургического больного.
6. Она должна проводиться с учётом соотношения
стоимость/эффективность.
Решающую роль для результатов комплексного лечения больного
играет адекватная эмпирическая терапия, т.е. терапия до получения
микробиологических данных у конкретного больного.
102 <> Хирургические болезни ♦ Том 1 <С» Часть I О Глава 3
Выбор эмпирической антибактериальной терапии базируется на
следующих факторах:
• конкретная клиническая ситуация с учётом этиологии,
локализации и длительности патологического процесса, что позволяет с
определённой вероятностью определить микробиологическую
структуру инфекции;
• интраоперационные находки;
• наличие у больного факторов риска и сопутствующих
заболеваний, оценка полиорганной дисфункции;
• микробиологический «пейзаж» отделения и клиники;
• информация о резистентности возбудителей к антибиотикам.
Эти данные позволяют не только оценить влияние адекватного
эмпирического выбора антибиотиков на результаты лечения
хирургической инфекции, но и могут быть основой анализа соотношения
стоимость/эффективность проводимой терапии. Недорогой, но
неадекватный режим антибиотикотерапии может не только сказаться
на летальности больных, но и резко увеличить стоимость
госпитального лечения за счёт удлинения его продолжительности, повторных
операций и осложнений.
У пациентов в тяжёлом состоянии (оценённом с помощью
объективных шкальных систем) стратегия антибактериальной терапии
должна подчиняться закону двухэтапности с соблюдением принципа так
называемой деэскалации.
• Первый этап — максимально раннее начало лечения наиболее
эффективным антибиотиком или их комбинацией. Выбор
определяется не возможными микроэкологическими последствиями
(индукция резистентности бактерий) у конкретного пациента, а зависит
от тяжести его состояния, локализации инфекции и
предполагаемых возбудителей. Естественно, при отсутствии целесообразности не
следует использовать препараты группы карбапенемов, цефалоспо-
рины IV поколения, гликопептиды. Эти антибиотики должны
оставаться в резерве для лечения нозокомиальных инфекций или
больных после предшествующей антибактериальной терапии. Однако
в ряде клинических ситуаций — при перитоните, деструктивном
панкреатите, лёгочных нагноениях, некоторых формах инфекции
мягких тканей, которые определяют крайнюю тяжесть состояния
больного, — эти антимикробные средства необходимо назначать
в первоочередном режиме.
• Второй этап — деэскалация — начинается после получения
результатов бактериологического исследования и определения чувстви-
\ Важнейшие синдромы, встречающиеся в хирургической практике «О 103
тельности возбудителя. Этот этап важен как для больного, так и для
популяции в целом, поскольку имеет и экономическую, и
экологическую значимость. Например, если лечение стафилококковой
инфекции было начато дорогостоящим ванкомицином, а штамм
оказался чувствительным к карбоксипенициллинам, терапию можно
продолжить оксациллином. Целесообразность такого подхода
очевидна, поскольку позволяет сэкономить денежные средства и
уменьшить риск индукции ванкомицинрезистентности.
Хирургическая инфекция в плане антибактериальной терапии
представляет весьма сложную проблему вследствие полимикробного
характера, не всегда выявляемого при микробиологическом
исследовании, и быстрой смены приоритетных возбудителей (табл. 3-3).
Начало проведения антибактериальной терапии в первые часы после
установления диагноза «сепсис» должно основываться на следующих
принципах (см. с. 104).
Таблица 3-3. Рекомендации по антибактериальной терапии сепсиса
Условие
возникновения сепсиса
Сепсис,
манифестировавший во внебольнич-
ных условиях
Сепсис,
манифестировавший
в условиях стационара,
APACHE <15,
без полиорганной
недостаточности
Сепсис,
манифестировавший
в условиях стационара,
APACHE >15
и/или полиорганная
недостаточность
Средства
первого ряда
Цефотаксим +/—
метронидазол
Цефтриаксон +/—
метронидазол
Амоксициллин/клавула-
нат +/- аминогликозид
Ампициллин/сульбак-
там +/— аминогликозид
Цефепим +/—
метронидазол
Цефоперазон 4- сульбак-
там
Имипенем
Меропенем
Альтернативные
средства
Ципрофлоксацин +/—
метронидазол
Моксифлоксацин
Левофлоксацин +/—
метронидазол
Офлоксацин +/—
метронидазол
Пефлоксацин +/—
метронидазол
Имипенем
Меропенем
Цефтазидим +/—
метронидазол
Ципрофлоксацин +/-
метронидазол
Цефепим +/—
метронидазол
Цефоперазон + сульбак-
там
Ципрофлоксацин +/—
метронидазол
104 ^ Хирургические болезни <> Том 1 <г Часть I О- Глава 3
• Определение предполагаемых возбудителей в зависимости от
локализации первичного очага.
• Знание резистентности нозокомиальных возбудителей по данным
микробиологического мониторинга.
• Условия возникновения сепсиса — внебольничный или нозокоми-
альный.
• Тяжесть состояния больного, оценённая по наличию
полиорганной недостаточности или по шкале APACHE II (см. главу 5).
Оценку эффективности проводимой антибактериальной терапии
осуществляют через 48—72 ч.
Селективная деконтаминация ЖКТ
Метод селективной деконтаминации кишечника используют с
целью профилактики внутригоспитального и эндогенного
инфицирования больных при проведении обширных и травматичных
вмешательств, длительной ИВЛ, лечении крайне тяжёлых больных с
комбинированными повреждениями и полиорганными нарушениями в
отделении реанимации и интенсивной терапии различного профиля.
Основная идея селективной деконтаминации кишечника —
устранение энтерогенного источника инфицирования (реинфицирова-
ния) больных с учётом минимального воздействия на собственную
колонизационную резистентность организма, представленную
непатогенными анаэробами. Эти правила определяют основополагающую
направленность метода — профилактику распространения бактерий
и их токсинов из просвета ЖКТ с целью разрыва главных
звеньев патогенеза эндогенных инфекционных осложнений. Селективная
деконтаминация кишечника — метод антибактериальной
профилактики и лечения больных с интраабдоминальной инфекцией,
характеризующихся высоким риском инфицирования и колонизации
условно-патогенной микрофлорой.
Так как возбудителями практически всех гнойно-септических
осложнений у этой группы больных является большое количество
микроорганизмов аэробного спектра, то селективная элиминация этих
бактерий с помощью антибактериальных препаратов позволяет
сохранить собственную анаэробную микрофлору кишечника, которая
имеет низкий патогенный потенциал.
Основные факторы, определяющие эффективность
антибактериальных препаратов при селективной деконтаминации кишечника:
• низкое всасывание из просвета ЖКТ;
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 105
• преимущественное действие на весь спектр аэробной условно-
патогенной микрофлоры кишечника;
• бактерицидный механизм действия, низкая инактивация в ЖКТ.
В этой связи препаратами выбора является следующий комплекс:
тобрамицин — 320 мг/сут, полимиксин — 400 мг/сут, амфотерицин В —
2000 мг/сут. Альтернативой препаратам из группы аминогликозидов
может быть представитель группы фторхинолонов, а в качестве
противогрибкового препарата — флуконазол.
Деконтаминационный эффект в отношении «внегоспитальных»
микроорганизмов достигается, как правило, парентеральным
введением цефотаксима (3 г/сут) в течение 4—7 сут. Кроме того,
использование цефалоспоринов позволяет предупредить колонизацию или
инфицирование «госпитальными» микроорганизмами.
Энтерально препараты вводят 4—6 раз в сутки в назогастральный
или назоинтестинальный зонд. Ротоглотку и ротовую полость
обрабатывают гелями или пастами, содержащими комплекс препаратов.
Длительность селективной деконтаминации кишечника варьирует от
7 сут и более, что определяется индивидуально в соответствии с
тяжестью больного, длительностью интубации трахеи и результатами
микробиологических исследований в динамике заболевания.
Средством обязательного контроля лечения служит микробиологический
мониторинг не реже 2 раз в неделю.
В настоящее время установлено, что селективная деконтаминация
кишечника снижает уровни колонизации респираторного и мочевы-
делительного трактов за счёт преимущественной элиминации грамот-
рицательных возбудителей. При этом уменьшается риск
возникновения нозокомиальной пневмонии и уроинфекции и отмечается
тенденция к снижению летальности больных.
Применение селективной деконтаминации кишечника в
комбинации с системной антибактериальной терапией целесообразно при
следующих клинических ситуациях.
• Абдоминальный сепсис при распространённом перитоните.
• В качестве компонента профилактики и лечения
гнойно-септических осложнений панкреонекроза (инфицированный панкреонекроз,
панкреатогенные абсцессы и перитонит).
• Тяжёлый сепсис и полиорганная недостаточность любой
этиологии.
• Трансплантация печени и обширные операции в гепатобилиарной
зоне.
106 0- Хирургические болезни *0> Том 1 ♦ Часть 1 ♦ Глава 3
Оценка эффективности антибактериальной терапии
Клинико-лабораторные критерии эффективности
антибактериальной терапии у хирургических больных включают:
• снижение температуры тела;
• уменьшение лейкоцитоза и сдвига лейкоцитарной формулы влево;
• регресс других симптомов системной воспалительной реакции;
• улучшение показателей газового состава крови, возможность
«отлучения от ИВЛ»;
• регресс локальной симптоматики хирургического
инфекционного процесса;
• элиминацию возбудителей из очага инфекции.
Об окончательной эффективности антибактериальной терапии
хирургической инфекции можно судить лишь при полном
устранении всех исходных симптомов патологического процесса, что
крайне сложно в хирургической практике. Системная воспалительная
реакция в послеоперационном периоде может быть вызвана многими
факторами, связанными с продолжающимся гнойно-воспалительным
процессом, появлением вторичных очагов инфекции (нозокомиаль-
ной пневмонии, ангиогенного инфицирования, раневой инфекции),
воздействием различных лекарственных средств (инфузионных сред,
антибиотиков, других препаратов).
Только динамическое наблюдение за больным, комплексная
оценка всей клинической картины, врачебный опыт могут помочь
адекватно оценить эффективность антибактериальной терапии. При этом
всегда необходимо следовать закону «опережающей и
альтернативной настороженности» — на фоне компетентной и рациональной
антибактериальной терапии сохранение системной воспалительной
реакции должно побуждать не к смене режима назначения
антибиотиков (хотя и об этом следует думать!), а к поиску сохраняющегося
или вновь возникающего очага инфекции.
При отсутствии эффекта от проводимой терапии следует решить
следующие вопросы.
• Существует ли бактериальный источник инфекции?
• Правильно ли выбран антибактериальный препарат?
• Не присоединилась ли суперинфекция?
Параллельно необходимо вести активный поиск рецидивирующего
или альтернативного источника инфекции (нагноение раны,
пневмония, пролежни, тромбофлебит, катетерная инфекция, уроинфек-
ция и т.д.).
Важнейшие синдромы, встречающиеся в хирургической практике
При тяжёлом сепсисе, наличии одновременно нескольких
источников инфекции стойкий терапевтический эффект нередко
наблюдают при продолжительности антибактериальной терапии не менее
3-4 нед. Однако отсутствие каких-либо существенных изменений в
более ранние сроки может свидетельствовать как о неадекватном
хирургическом вмешательстве, так и о неадекватной
антибактериальной терапии.
Профилактика хирургической инфекции
Тщательное соблюдение асептики и антисептики и
профилактическое применение антибиотиков дают возможность уменьшить риск
послеоперационных раневых инфекционных осложнений. Вместе с
тем в ряде ситуаций необходима специфическая антимикробная
профилактика.
Принципы антибактериальной профилактики.
1. Антибиотик необходимо вводить до разреза кожи, т.е. до момента
бактериальной контаминации, с тем чтобы бактерицидная
концентрация поддерживалась в тканях в течение всего операционного
периода. Введение антибактериального средства через 3—4 ч после
контаминации не играет никакой профилактической роли в
отношении раневой инфекции.
2. При большинстве чистых и условно-чистых оперативных
вмешательств достаточно использования цефалоспоринов I, II поколения
(цефазолин или цефуроксим) или защищенных пенициллинов
(амоксициллин/клавуланат). Эти препараты имеют достаточный
спектр антимикробного действия, адекватные фармакокинетичес-
кие характеристики, низкую токсичность и невысокую стоимость.
Цефалоспорины III поколения не являются рутинным средством
профилактики, их применение должно быть резервировано для
случаев риска полимикробного инфицирования — при операциях на
толстой и прямой кишках, при проникающих ранениях брюшной
полости и аппендэктомии. Это не относится к резервному
использованию защищенных пенициллинов и комбинации аминоглико-
зида с метронидазолом.
3. Продолжительность профилактического применения
антибиотиков в большинстве случаев не превышает 24 ч. Более длительное
введение антибиотика носит терапевтический характер или
связано с другими факторами риска, не относящимися к раневой
инфекции.
108 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 3
4. При оперативных вмешательствах длительностью более 3 ч
необходимо повторное введение антибиотика (через интервал
времени, соответствующий периоду полувыведения лекарственного
препарата).
5. В случаях высокого риска инфицирования метициллин-резистен-
тными стафилококками и другими проблемными
микроорганизмами (их выявление входит в задачу службы профилактики и лечения
инфекций в хирургическом стационаре) для профилактики
оправдано применение антибиотиков резерва (в частности, ванкомицина).
В зависимости от риска развития послеоперационных
осложнений все хирургические вмешательства принято подразделять на
четыре категории.
• «Чистые» — операции, выполняемые в плановом порядке, не
затрагивающие ротоглотку, дыхательные пути, ЖКТ, мочеполовую
систему (мастэктомия, струмэктомия, грыжесечение, венэктомия у
больных без трофических нарушений, операции на аорте и
артериях конечностей, операции на сердце). Риск послеоперационных
инфекционных осложнений не превышает 5%.
• Условно-контаминированные — плановые операции на
ротоглотке, пищеварительном тракте, женских половых органах,
урологические и пульмонологические операции без признаков
сопутствующей инфекции, венэктомия при трофических нарушениях, но без
трофических язв, повторные операции доступом через «чистую»
рану в течение 7 дней, тупая травма живота без разрыва полых
органов, ургентные и неотложные операции, по другим критериям
входящие в группу «чистых». В эту группу входят и операции на сердце
с искусственным кровообращением. Риск инфекционных
осложнений 7-10%.
• Контаминированные — операции на жёлчных и мочеполовых
путях при наличии инфекции, на ЖКТ при высокой степени его
контаминации, операции при нарушении асептики или при наличии
воспалительного процесса (но не гнойного воспаления). Операции
при травматических повреждениях, обработанных в течение 4 ч.
Риск инфекционных осложнений 12—20%.
• «Грязные» — операции на заведомо инфицированных органах и
тканях при наличии сопутствующей или предшествующей инфекции,
раны или перфорации ЖКТ, прокто-гинекологические операции,
проникающие ранения, травматические раны, обработанные
позже 4 ч, венэктомия при трофических нарушениях и язвах, операции
к Важнейшие синдромы, встречающиеся в хирургической практике ♦ 109
при гнойном воспалении мягких тканей (мышцы), операции при
критической ишемии конечностей. Риск инфекционных
осложнений более 20%.
Антибиотикопрофилактика показана при всех условно-контами-
нированных и контаминированных операциях. При чистых
операциях профилактику проводят при наличии у больного факторов риска
развития послеоперационной инфекции.
Более чем тридцатилетний клинический опыт свидетельствует, что
профилактическое применение антибиотиков позволяет снизить
частоту раневых инфекционных осложнений на 80% при чистых
операциях и на 50% при контаминированных.
При оперативных вмешательствах на органах брюшной полости
опасность возникновения инфекционных осложнений резко
возрастает, особенно при вскрытии просвета полого органа, которое
приводит к контаминации нормальной микрофлорой ЖКТ. Раннее
назначение антибиотиков, обычно в течение 6 ч с момента перфорации
полого органа расценивают как профилактику, а в более поздние
сроки, когда развились признаки инфекции, — как лечение. К
дополнительным факторам риска в таких случаях следует отнести следующие
факторы.
• Длительная травматичная операция.
• Предшествующие воспалительные заболевания кишечника.
• Снижение питания, нарушения белкового обмена.
• Проведение гормональной, лучевой, цитостатической терапии.
• Обструктивные формы рака.
• Операции на неподготовленной толстой кишке.
• Сопутствующие воспалительные заболевания экстраабдоминальной
локализации.
Антибактериальный препарат следует вводить внутривенно за 10—
15 мин или внутримышечно за 30—60 мин до кожного разреза. Если
продолжительность операции вдвое превышает период
полувыведения антибиотика, то интраоперационно следует ввести дозу
повторно. В большинстве ситуаций достаточно однократного введения
антибактериального препарата. При высоком риске развития инфекции,
тяжести состояния больного, сложности операции допускается
продление антибиотикопрофилактики на срок не более 48—72 ч.
К антибактериальному препарату, используемому в качестве
основного профилактического средства, предъявляют следующие
требования.
ирургические болезни О- Том 1 О Часть I О- Глава 3
• Достаточная пенетрация в ткани зоны риска развития инфекции.
• Период полувыведения антибактериального препарата после
однократного введения должен быть достаточным для поддержания
бактерицидной концентрации в крови и тканях в течение всего
периода операции.
• Отсутствие токсичности и фармакокинетического взаимодействия
с препаратами для анестезии, особенно миорелаксантами.
• Оптимальное соотношение стоимость/эффективность.
Для профилактики раневой инфекции чаще всего назначают це-
фалоспорины I и II поколений (III поколение существенно дороже и
используется в основном для лечения) или защищенный
пенициллин — амоксициллин/клавуланат.
Рассмотренные режимы профилактики являются в определённой
степени ориентировочными и должны быть модифицированы в
зависимости от конкретной ситуации в хирургическом стационаре
(объём и характер оперативной деятельности, микробиологический
«пейзаж» операционных и отделений, доступность лекарственных
средств и т.д.).
Нарушения метаболизма у хирургических больных
У больных с различными хирургическими заболеваниями
нередко развиваются тяжёлые нарушения водно-электролитного баланса,
кислотно-щелочного равновесия и других звеньев метаболизма,
которые значительно утяжеляют течение основного патологического
процесса и могут привести к смерти. Причины этих нарушений
различны и заключаются в следующем:
• затруднение прохождения пищи из верхних отделов ЖКТ
(опухоли и стриктуры пищевода, стеноз привратника, кишечная
непроходимость);
• потери жидкости, богатой электролитами и белком, при
неукротимой рвоте, а также через кишечные свищи, желудочный и назоин-
тестинальный зонды;
• массивная экссудация при развитии асцита и тяжёлых гнойно-
некротических заболеваний (перитонита, эмпиемы плевры,
гнойного медиастинита, перикардита, флегмоны забрюшинной клетчатки
или мягких тканей конечностей);
• гормональные сдвиги (тиреотоксический зоб, удаление паращи-
товидных желёз, сахарный и несахарный диабет и пр.);
жнейшие синдромы, встречающиеся в хирургической практике
• недостаточность кровообращения, дыхательная и почечная
недостаточность;
• раковая интоксикация.
В ответ на возникновение тяжёлых осложнений, травму и
хирургическую агрессию организм реагирует повышением метаболической
активности. Хорошо известно, что в нормальных условиях
среднесуточная энергетическая потребность составляет 1800 ккал. После
обширных операций, тяжёлых травм, при развитии
гнойно-септических осложнений она значительно увеличивается и может достигать
4500 ккал/сут. Часть энергии образуется за счёт окисления глюкозы,
другая — при окислении жирных кислот, которые освобождаются
после расщепления жира. В основе этих метаболических сдвигов
лежит эндокринная регуляция, проявляющаяся увеличением
выделения гормонов и биологически активных субстанций.
Катехоламины (адреналин, норадреналин и дофамин)
выделяются в ответ на повреждение тканей, психическое возбуждение, страх.
В результате действия этих гормонов происходит распад гликогена в
печени, усиливаются глюконеогенез и липолиз. Уровень катехолами-
нов повышается тотчас после повреждения и снижается до
исходного уровня примерно через 2 сут.
В ответ на снижение ОЦК и дегидратацию происходит
дополнительный выброс антидиуретического гормона и альдостерона.
Антидиуретический гормон синтезируется гипофизом, а альдостерон —
надпочечниками. Под действием альдостерона в почечных
канальцах происходит реабсорбция воды, ионов натрия и хлора, но также и
потеря ионов калия. Антидиуретический гормон определяет
обратное поступление воды без электролитов.
Ренин-ангиотензиновая система локализуется в юкстагломеруляр-
ном аппарате почек. Она активизируется в ответ на адренергическую
стимуляцию и на уменьшение содержания воды в почечных
канальцах. Действие этой системы происходит следующим образом: ренин
превращается в печени в ангиотензин-I, который в лёгких
конвертируется в ангиотензин-П. Последний оказывает стимулирующее
действие на выделение альдостерона и задержку в организме воды и
натрия. Кроме того, в результате действия ангиотензина-П развивается
вазоконстрикция, которая проявляется повышением АД,
нарушениями микроциркуляции и централизацией кровообращения.
В ответ на травматическое повреждение и стресс происходит
увеличение концентрации в крови кортизола. При стрессе действие этого
гормона направлено, в первую очередь, на поддержание в крови нор-
Ва
мального уровня глюкозы за счет повышения доступности для
печени субстратов глюконеогенеза. Этот гормон также потенцирует
действие на печень адреналина и глюкагона. У больных с тяжёлым
сепсисом может развиться синдром острой надпочечниковой
недостаточности, который характеризуется лихорадкой, гипогликемией,
гипонатриемией, гиперкалиемий и шоком.
При уменьшении ОЦК, гипогликемии и снижении концентрации
жирных кислот происходит увеличение содержания в крови сомато-
статина. Действие этого гормона направлено на увеличение в
сосудистом русле концентрации глюкозы, жирных кислот и кетоновых тел.
Секреция поджелудочной железой инсулина и глюкагона связана
с активностью вегетативной нервной системы и действием других
гормонов. Инсулин выполняет функцию основного анаболического
гормона. Его действие направлено на накопление в клетках
углеводов, белков и жиров. У больных с хирургической патологией на
ранних стадиях заболевания отмечено снижение секреции инсулина.
Секреция же глюкагона, наоборот, увеличивается, так как этот
гормон является потенциальным стимулятором глюконеогенеза и гли-
когенолиза в печени.
Фазы развития метаболического ответа
Выделяют 4 фазы развития метаболического ответа на
хирургическую травму.
В первой фазе эндокринные и метаболические изменения связаны
с влиянием адренергических и адренокортикоидных гормонов. Под
действием повреждающего фактора в плазме существенно
возрастает концентрация свободного кортизола. Этот гормон активирует
надпочечники, увеличивает выброс в кровоток адреналина и норадрена-
лина. Они обеспечивают преобладание распада (катаболизма)
эндогенных белков, жиров и углеводов над их синтезом
(анаболизмом). Азотистый баланс в эту фазу отрицательный.
Параллельно указанным нарушениям метаболизма в результате
потерь жидкости и электролитов развивается дегидратация. В ответ
происходит увеличение содержания в крови антидиуретического
гормона, под действием которого увеличивается реабсорбция воды в
почечных канальцах. Этот же механизм запускается при увеличении
концентрации ионов натрия в плазме (гипернатриемии). При гипо-
волемии и снижении объёма циркулирующей плазмы происходит
выброс в кровоток минералокортикоид альдостерона. Действие этого
Важнейшие синдромы, встречающиеся в хирургической практике -0- 113
гормона направлено на увеличение реабсорбции ионов натрия и воды
и тем самым увеличение ОЦК.
Развитие артериальной гипотензии и снижение кровотока в
почках вызывает увеличение концентрации в крови ренина, который
запускает в действие ангиотензиновый механизм, в результате
повышается тонус периферических сосудов.
Вторая фаза — фаза гормонального разрешения — выявляется
между 3-м и 7-м днями заболевания и продолжается несколько дней.
В течение неё постепенно исчезают все гормональные сдвиги,
однако азотистый баланс всё ещё остаётся отрицательным.
Третья фаза характеризуется преобладанием анаболизма над
катаболизмом. Азотистый баланс становится положительным. В этот
период происходит восстановление мышечной массы.
Продолжительность этого периода составляет несколько недель.
Четвёртая фаза может продолжаться несколько месяцев,
основное её содержание — восстановление запасов жира в организме до
исходного уровня.
Нарушение метаболизма углеводов
Как уже было сказано выше, послеоперационный период у
многих больных, перенёсших различные оперативные вмешательства,
сопровождается полным или частичным голоданием. В этот период
основным источником энергии служит глюкоза, которая образуется в
результате распада гликогена, находящегося в печени и скелетной
мускулатуре. Между тем запасов гликогена для поддержания
энергетических потребностей хватает максимум на сутки. После истощения этого
депо включаются другие механизмы образования глюкозы, а именно:
из аминокислот, которые получаются после дезаминирования белков в
печени, мобилизованных жиров после их превращения в глицерол и
частично из молочной и пировиноградной кислот. Всё это
обеспечивает поддержание нормального уровня глюкозы в крови, даже если она
не поступает извне. Жировая ткань в отличие от печени не может
мгновенно освобождать триглицериды для использования их в метаболизме.
Для этого существует механизм медленного гидролиза триглицеридов в
глицерол и свободные кислоты, которые и являются источником
энергии в период полного или частичного голодания. Вместе с тем
включение в глюконеогенез глицерола сопровождается образованием
кетоновых тел: ацетона, ацетоуксусной и р-оксимасляной кислот.
Накапливаясь, эти кислоты могут привести к развитию кетоацидоза.
Метаболизм углеводов в значительной степени зависит от
наличия в тканях кислорода. Транспорт кислорода к органам и тканям
определяется его содержанием в крови, а также величиной СВ.
Поэтому в условиях гипоксии, а также при синдроме низкого СВ и
нарушениях микроциркуляции метаболизм глюкозы происходит по
анаэробному пути и сопровождается образованием большого
количества пирувата и лактата, что может привести к развитию
метаболического ацидоза.
Метаболизм белка и аминокислот
Для больных с различной хирургической патологией характерен
повышенный распад белков, т.е. преобладание катаболизма, который
проявляется отрицательным азотистым балансом. Общая потеря
белка в послеоперационном периоде может достигать значительных
величин. В частности, у больных, перенёсших резекцию желудка при
неосложнённом течении послеоперационного периода, без
проведения парентерального питания потеря белка может достигать 340 г/сут.
При развитии в послеоперационном периоде различных осложнений
(нозокомиальной пневмонии, несостоятельности швов анастомоза с
развитием разлитого фибринозного перитонита, пареза кишечника
и т.д.) эти потери существенно выше. Возникшая гипопротеинемия
представляет для больного большую опасность, поскольку на её фоне
нарушаются регенеративные процессы, ухудшается заживление
послеоперационных ран. Снижение коллоидно-осмотического давления
плазмы сопровождается развитием отёков.
Расстройства белкового обмена находятся в прямой зависимости
от нарушения обмена углеводов. При истощении их запасов распад
белка начинает преобладать над его синтезом. Если поступление белка
извне недостаточно, основным его источником становится
поперечно-полосатая мускулатура. Происходит интенсивный распад
мышечных белков до аминокислот, которые в свою очередь используются
печенью для глюконеогенеза. В печени происходит дезаминиро-
вание белка, полученный при этом азот идёт на синтез мочевины, а
карбоновые элементы — на синтез углеводов. Интенсивность этого
процесса зависит от тяжести состояния больного и длительности
заболевания.
Отрицательный азотистый баланс может усугубляться
дополнительной потерей белка через раневую поверхность,
желудочно-кишечные свищи, обширные раневые поверхности.
Важнейшие синдромы, встречающиеся в хирургической практике О 115
Метаболизм жира
Запасы жира покрывают до 80—90% энергетической потребности
организма больного с полиорганной недостаточностью, в условиях
отсутствия поступления энергетических субстратов извне (полное
голодание). В результате распада (гидролиза) жира в крови
увеличивается концентрация триглицеридов и глицерола. Основными липо-
литическими агентами являются адреналин, норадреналин и сома-
тотропный гормон. Под их влиянием в крови увеличивается уровень
свободных жирных кислот.
Катаболизм жира начинается уже в первые сутки
послеоперационного периода и составляет 1,5—2,0 кг в течение 5 дней. Обмен жира
тесным образом связан с метаболизмом углеводов, запасы которых
ограничены. У больных в отсутствие глюкозы происходит
избыточное образование кетоновых тел, накопление которых ведёт к
развитию кетоацидоза. Полный цикл включения в метаболизм жира
сложен и требует довольно длительного времени.
На основании изложенного становится ясно, что в
послеоперационном периоде для поддержания на должном уровне белкового и
энергетического баланса необходимо проведение полноценного
парентерального и (как можно раньше) энтерального питания.
Водно-электролитный баланс
Жидкость в организме распределяется в двух секторах:
внеклеточном и внутриклеточном. Объём внутриклеточной жидкости
составляет примерно две трети массы тела человека. Внеклеточная жидкость
находится внутри сосудистого русла и в интерстициальном
пространстве. Внутрисосудистый сектор представлен жидкостью,
циркулирующей внутри сосудов, он характеризуется ОЦК. У взрослого
человека ОЦК составляет приблизительно 5—6 л. В свою очередь ОЦК
подразделяется на объём циркулирующей плазмы, равный примерно
3 л, и объём циркулирующих эритроцитов, составляющий около 2—3 л.
Интерстициальная жидкость, в том числе и лимфа, находится в
пространстве, окружающем клетки. Её объём у взрослого человека
достигает 11 — 12 л. К внеклеточному сектору относится также жидкость,
находящаяся в полостях тела, так называемая трансцеллюлярная
жидкость. Это спинномозговая, перикардиальная, плевральная,
синовиальная и внутриглазная жидкости, а также жидкость, находящаяся в
просвете кишечника. Общий её объём составляет около 1 л.
16 ♦ Хирургические болез
Часть I
Каждый сектор отделён друг от друга полупроницаемой
мембраной, через которую и происходит перемещение жидкости и
электролитов. Перемещение жидкости через мембраны осуществляется
благодаря следующим механизмам: диффузии, фильтрации, активного
транспорта и осмоса. С помощью диффузии растворённые частицы
перемещаются по концентрационному градиенту, т.е. из области с
большей концентрацией в сторону меньшей. Под фильтрацией понимают
переход жидкости из области с большим гидростатическим давлением
в сторону меньшего давления. Активный транспорт позволяет
перемещать вещества из области низкой концентрации в область высокой.
С помощью этого механизма многие растворимые вещества (ионы
натрия, калия, водорода, аминокислоты) через клеточную мембрану
попадают в клетки. Осмос характеризуется движением жидкости через
полупроницаемую мембрану из области низкой осмоляльности в
область высокой. Следует запомнить, что при снижении
осмоляльности внеклеточной жидкости происходит перемещение жидкости из
внеклеточного пространства в клетки с развитием клеточного отёка.
Увеличение осмоляльности внеклеточной жидкости сопровождается
перемещением жидкости из внутриклеточного пространства во
внеклеточное. В результате развивается клеточная дегидратация.
Потеря жидкости
Потеря жидкости из верхних отделов ЖКТ происходит при
обильной, часто неукротимой рвоте, постоянной активной аспирации
содержимого желудка через желудочный зонд, свищах
двенадцатиперстной и начальных отделов тонкой кишки. При этом теряется
изотоническая жидкость, имеющая в своём составе ионы натрия,
калия, хлора и водорода. Содержимое нижних отделов кишечника также
в основном изотонично и содержит ионы натрия, калия и
бикарбонаты. Потери жидкости из этих отделов наблюдают при диарее,
через еюностому, кишечные свищи, при «запущенной» низкой
кишечной непроходимости, они могут достигать нескольких литров в сутки.
Нарушения водного баланса
Нарушения водного баланса вызываются внешними и
внутренними потерями жидкости и их патологическим перемещением внутри
жидкостных пространств организма. К внешним (видимым) относят
потерю жидкости при мочевыделении, рвоте, диарее, отток её нару-
Важнейшие синдромы, встречающиеся в хирургической практике -0- 117
жу по различным дренажам, желудочному или назоинтестинальному
зонду, свищам. Внутренние перемещения возможны при развитии
отёка травмированных и инфицированных областей, а также в
просвет ЖКТ. Ту область тела, куда временно перемещается и где
накапливается жидкость, называют третьим пространством. Примером
внутреннего перемещения служит накопление жидкости в брюшной
полости при перитоните, в плевральной — при плеврите и эмпиеме
плевры, в просвете кишечника — при его парезе, острой кишечной
непроходимости, мезентериальном тромбозе. Развивающиеся при
этом нарушения водного баланса сопровождаются выраженными
электролитными и белковыми нарушениями во всех жидкостных
пространствах организма.
Нарушение обмена жидкости в организме называют дисгидрией.
Различают синдром дефицита жидкости (дегидратацию) и избытка
жидкости (гипергидратацию), которые, в свою очередь,
подразделяются на вне- и внутриклеточную, а в зависимости от показателя осмо-
ляльности — на гипотоническую, изотоническую и гипертоническую.
Для описания процессов перемещения жидкости используют ещё
одно понятие: осмоляльность — величина осмотического давления,
которое образуется растворёнными ионами. Осмоляльность
внеклеточной жидкости зависит от концентрации ионов натрия, глюкозы и
мочевины и характеризуется числом мосмолей растворённого
вещества, содержащегося в 1 л растворителя. Чем концентрация
растворённых субстанций больше, тем выше осмоляльность. В организме
величина осмоляльности во всех жидкостях (внеклеточного и
внутриклеточного секторов) одинакова (закон изоосмоляльности) и
стремится поддерживаться на постоянном уровне. Поэтому при её
повышении или снижении в каком-либо пространстве жидкость всегда
будет перемещаться в сторону большей осмоляльности, стремясь
уменьшить её. В частности, при повышении осмоляльности плазмы
начнётся перемещение жидкости из интерстициального, а затем и
клеточного сектора (с развитием его дегидратации) в сосудистый. И,
наоборот, при снижении осмоляльности плазмы жидкость начнёт
выходить в интерстициальный, а затем и в клеточный сектор с
развитием клеточного отёка. Осмоляльность плазмы — величина
достаточно постоянная и колеблется от 285 до 295 мосмоль/кг. Снижение
осмоляльности внеклеточной жидкости сопровождается перемещением
воды через клеточную мембрану в клетки с развитием их отёка (ги-
поосмоляльный синдром), и наоборот, повышение осмоляльности
внеклеточной жидкости (гиперосмоляльный синдром) ведёт к пере-
118 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 3
мещению жидкости из клеток в интерстициальное пространство.
Развивается клеточная дегидратация.
В клинической практике величину осмоляльности определяют с
помощью специального прибора — осмометра, принцип работы
которого заключается в регистрации точки замерзания исследуемой
жидкости. Чем выше осмоляльность, тем ниже точка замерзания
раствора. Величину осмоляльности можно также рассчитать по
специальной формуле, согласно которой
Осмоляльность плазмы = 2 х Na (мэкв/л) +
+ глюкоза (мг%)/18 + мочевина (мг%)/2,8,
где: Na (мэкв/л) — концентрация ионов натрия в плазме;
глюкоза (мг%) — концентрация глюкозы в плазме;
мочевина (мг%) — концентрация мочевины в плазме;
Разность между измеренной и рассчитанной величинами
осмоляльности носит название дискриминанта осмоляльности,
увеличение которой указывает на наличие неучтённых осмотически
активных веществ и может указывать на нарастание эндотоксемии.
Коллоидно-осмотическое давление
Коллоидно-осмотическое давление зависит от концентрации
белка в плазме и в норме составляет 25—30 мм рт.ст. При гипопротеине-
мии коллоидно-осмотическое давление снижается. Причины гипоп-
ротеинемии у хирургических больных различны. Наиболее часто она
возникает в результате неполноценного парентерального или энте-
рального питания, когда поступающие аминокислоты идут на синтез
глюкозы, а также при их потерях. Величина
коллоидно-осмотического давления играет важную роль в транскапиллярном обмене
жидкости и влияет на распределение жидкости между плазмой и
межтканевой жидкостью.
Транскапиллярный обмен жидкости определяется разницей
между гидростатическим давлением в просвете капилляра и интерстици-
альном пространстве, с одной стороны, и коллоидно-осмотическим
давлением плазмы и интерстициальной жидкости, с другой, а также
проницаемостью капиллярной стенки. В артериальном конце
капилляра гидростатическое давление в сосуде преобладает над
коллоидно-осмотическим давлением плазмы. Жидкость и электролиты
фильтруются через непроницаемую для белка капиллярную мембрану в
интерстициальное пространство. При этом за счёт сгущения
происходит увеличение концентрации белка в плазме и, следовательно.
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 119
коллоидно-осмотическое давление плазмы. В венозном конце
капилляра происходит обратный процесс: жидкость и метаболиты
перемешаются из интерстициального пространства в просвет капилляра.
Таким образом, чем ниже концентрация белка, тем больше жидкости
накапливается во внесосудистом пространстве. Вот почему при
снижении коллоидно-осмотического давления ниже 20 мм рт.ст.
развиваются отёки мягких тканей нижних конечностей, ладоней, поясницы.
Клинические проявления дисгидрий
У больных хирургического профиля наиболее часто возникает
дегидратация. Чтобы выявить данное нарушение, необходимо обратить
особое внимание на жалобы больного, указывающие на повышенные
потери жидкости (неоднократная рвота, диарея, обильное
потоотделение, уменьшение массы тела и т.д). При этом, следует иметь в виду,
что в ряде случаев (например, кишечная непроходимость)
происходит накопление жидкости в «третьем пространстве». Масса тела при
этом не меняется.
Жажда характерна для дефицита жидкости, который
сопровождается увеличением осмоляльности. Сухость кожи в подмышечных
и паховых областях, содержащих большое количество потовых
желёз, указывает на дегидратацию. Этот симптом возникает при
дефиците жидкости в организме, как минимум, составляющем 1,5 л.
Снижение тургора кожи связано с недостатком жидкости в интер-
стициальном пространстве. Между тем, следует помнить, что с
возрастом тургор кожи снижается, а у тучных больных даже при
выраженной дегидратации кожа сохраняет свою эластичность достаточно
длительное время. Для определения тургора кожи на тыльной
стороне кисти кожу собирают в складку, а затем её отпускают. Если тургор
нормальный, складка тотчас расправляется, если снижен —
остаётся. В норме, осматривая язык, можно различить лишь одну
срединную полосу. При дегидратации появляются дополнительные
борозды, располагающиеся параллельно срединной. Тонус глазных яблок
зависит от содержания жидкости в организме. При дегидратации
глазные яблоки на ощупь мягкие, а при гипергидратации —
твёрдые. Видимые потери жидкости сопровождаются потерей массы тела
(при дегидратации, обусловленной накоплением жидкости в
«третьем пространстве», этот симптом отсутствует). Нарушения
гемодинамики (тахикардия, артериальная гипотензия, расстройства
микроциркуляции) развиваются при снижении ОЦК и указывают на
дефицит жидкости в интерстициальном секторе. Кроме того, целе-
120 -Ф- Хирургические болезни <>■ Том 1 ♦ Часть I ♦ Глава 3
сообразно учитывать степень наполнения наружной яремной
вены. У здорового человека в горизонтальном положении она
наполнена кровью и хорошо видна. При дегидратации и снижении ОЦК
в той же позиции наружная яремная вена находится в спавшемся
состоянии.
ЦВД — объективный показатель, помогающий выявить дефицит
ОЦК. Для измерения ЦВД необходима катетеризация подключичной
или внутренней яремной вены. Катетер устанавливают в верхней
полой вене, к нему подсоединяют специальный водный манометр,
заполненный физиологическим раствором, предварительно установив
нулевую отметку в точке проекции правого предсердия (передняя
подмышечная линия). Затем, попросив больного кратковременно
задержать дыхание на выдохе, открывают вышеуказанную
систему, и столбик раствора в зависимости от величины ЦВД начинает
либо падать, либо подниматься вверх. Нормальная величина ЦВД
колеблется от 60 до 120 мм вод.ст. Повышение ЦВД может быть
обусловлено не только гиперволемией, но и недостаточностью
сократительной функции правых отделов сердца (правожелудочковой
недостаточностью).
Методы контроля водного баланса
Методы контроля водного баланса необходимы при проведении
интенсивной инфузионной терапии. Водный баланс складывается
из объёма жидкости, который в течение суток получил больной
(внутривенная инфузия, введение через желудочный или назоин-
тестинальный зонд и дренажи, установленные в брюшной или
плевральной полости), и потерь с мочой, по дренажам, желудочному
зонду, со стулом. Не следует забывать о жидкости, которая
накапливается в «третьем пространстве», а также той, которая теряется
с перспирацией и потоотделением, однако точно учесть её объём
практически невозможно. Для регистрации водного баланса в
отделениях реанимации применяют специальную карту наблюдения за
состоянием больного, в которой медицинская сестра тщательно
фиксирует и суммирует весь объём введённой и потерянной
жидкости. Как правило, итог подводят вечером в 21 ч и на следующие
сутки в 8 ч утра.
Водный баланс может быть положительным, когда количество
введённой жидкости преобладает над количеством потерянной, и
отрицательным, если объём потерянной жидкости превышает
количество введённой. Тактика инфузионной терапии строится в
Важнейшие синдромы, встречающиеся в хирургической практике -О- 121
зависимости от вида дисгидрии. При дегидратации водный баланс
должен быть положительным, а при гипергидратации — отрицательным.
Нарушение баланса электролитов
Любые нарушения водного баланса часто сопровождаются
изменениями электролитного состава крови, наиболее важными из
которых являются содержание ионов калия, натрия, хлора и магния.
Нарушение содержания ионов натрия в плазме (гипернатриемия или
гипонатриемия) тесным образом связано с гиперосмоляльным или
гипоосмоляльным синдромом, это было рассмотрено выше.
Дефицит ионов калия
Дефицит ионов калия характеризуется снижением концентрации
этого иона в плазме (в норме его величина в плазме колеблется от 3,5
до 5,5 ммоль/л) при нормальном, сниженном или повышенном
содержании его в клетках. Причины дефицита ионов калия у больных с
хирургической патологией, как правило, связаны с его потерей при
рвоте (декомпенсированный стеноз привратника, высокая кишечная
непроходимость) и в результате применения слабительных средств.
Клинически дефицит ионов калия проявляется нарушением
сердечного ритма с развитием пароксизмальной предсердной тахикардии,
возникновением атонии кишечника и желудка.
Дефицит ионов калия целесообразно подтвердить несколькими
методами. Изучение анамнеза позволяет получить ценные данные о
причинах, которые могут привести к гипокалиемии. ЭКГ выявляет
следующие нарушения: снижение сегмента ST ниже изолинии,
уплощение зубца Г, появление зубца U. Для точности интерпретации
полученных данных необходим динамический контроль за изменениями ЭКГ.
При лабораторном исследовании выявляют снижение концентрации
ионов калия ниже нижней границы нормы. На дефицит ионов калия
также указывает метаболический алкалоз, при развитии которого
концентрация ионов калия в плазме уменьшается. Полиурия, стимуляция
мочевыделения фуросемидом также сопровождаются гипокалиемией.
Дефицит ионов калия корригируют с помощью внутривенной ин-
фузии калийсодержащих растворов. Их следует вводить в вену
медленно капельно, так как быстрое поступление ионов калия в
кровоток может привести к остановке сердца. Противопоказанием для
назначения калийсодержащих растворов являются анурия, гиперка-
лийурия, декомпенсированный ацидоз.
122 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 3
Гиперкалиемия
Гиперкалиемия характеризуется повышением уровня ионов калия
в плазме выше 5,5 мэкв/л. Концентрация ионов калия в плазме выше
6 мэкв/л опасна для жизни, а 11 — 12 мэкв/л смертельна. Причины
гиперкалиемии в хирургической клинике заключаются в избыточном
введении препаратов калия при недостаточном мочеотделении,
избыточном освобождении ионов калия из тканей при респираторном
или метаболическом ацидозе, ожоговой болезни, размозжениях
тканей, синдроме длительного раздавливания, дегидратации, гемолизе.
Первый сигнал, свидетельствующий о гиперкалиемии, —
появление желудочкового ритма, позже развивается мерцание желудочков
и происходит остановка сердца в диастоле. Со стороны ЖКТ она
проявляется спастическими болями в животе, рвотой и диареей. Диагноз
гиперкалиемии устанавливают на основании данных лабораторного
исследования (концентрация ионов калия в плазме выше 5,5 мэкв/л),
изменений ЭКГ (высокий узкий остроконечный зубец Т,
расширение комплекса QRS за счёт расширения зубца S, начало сегмента
ST ниже изолинии, атриовентрикулярный ритм, экстрасистолия).
Терапию гиперкалиемии следует начинать немедленно. При
выраженном увеличении концентрации ионов калия в плазме с
нарушением сердечного ритма внутривенно в качестве антагониста
вводят раствор глюконата или хлорида кальция. С целью перемещения
ионов калия в клетки начинают внутривенное введение
высококонцентрированного раствора глюкозы с инсулином. Развитие деком-
пенсированного метаболического ацидоза требует введения ощела-
чивающих растворов (гидрокарбонат натрия, трометамол). С целью
увеличения выведения ионов калия почками начинают стимуляцию
мочевыделения фуросемидом. При отсутствии эффекта от
проводимой терапии и нарастании концентрации ионов калия в плазме
следует прибегнуть к проведению гемодиализа.
Дефицит ионов кальция
Дефицит ионов кальция можно констатировать при снижении
его уровня ниже 2,2 мкмоль/л. Кальций представлен в
организме в виде трёх форм: ионизированной, связанной и комплексной.
В клинической практике особый интерес представляет
ионизированная форма.
Причины гипокальциемии различны. Наиболее часто она
связана с гипоальбуминемией. Снижение функций паращитовидных
Важнейшие синдромы, встречающиеся в хирургической практике О 123
желёз или их ошибочное удаление при оперативном вмешательстве
на щитовидной железе, дефицит витамина D, нарушение
всасывания ионов кальция после гастрэктомии и обширных резекций
кишечника, диарей, переливания большого количества цитратной крови
также ведут к гипокальциемии. Клинически этот синдром
представлен тоническими судорогами поперечно-полосатой мускулатуры и
проявляется в виде «руки акушера», «сардонической улыбки»,
«конской стопы», ларингоспазма, болей в животе, запоров. При физикаль-
ном обследовании отмечают положительный симптом Труссо,
который проверяют следующим образом: при наложении на руку манжеты
для определения АД и удерживании её в раздутом состоянии на
уровне систолического давления в течение 2—3 мин у больного
развивается индуцированный ишемией запястный спазм. Характерен также
положительный симптом Хвостека: сокращение лицевой мышцы и
мышцы века при раздражении лицевого нерва путём поколачивания
лица непосредственно перед ухом. Хроническая гипокальциемия
вызывает истончение кожи, поперечную исчерченность ногтей,
выраженный кариес.
Выявление гипокальциемии требует немедленного
внутривенного введения глюконата или хлорида кальция. При введении
препаратов кальция больному, получающему сердечные гликозиды,
необходимо помнить о повышении чувствительности миокарда к ионам
кальция и возможном возникновении желудочковой экстрасистолии,
фибрилляции желудочков и асистолии.
Гиперкальциемия
Гиперкальциемия чаще всего возникает при повышенной
продукции паратиреоидного гормона. Клинически гиперкальциемия
проявляется слабостью, анорексией, тошнотой, рвотой, летаргией,
снижением возбудимости нервно-мышечного аппарата, для
которой характерны гипотония поперечно-полосатой мускулатуры,
атония ЖКТ с мучительными запорами и метеоризмом. На ЭКГ
выявляют укорочение сегментов ST и QT. Гиперкальциемия
проявляется также отложением кальция в органах и тканях с образованием
кальцификатов (например, камней в почках). Умеренная,
протекающая бессимптомно гиперкальциемия не требует проведения терапии.
Тяжёлая гиперкальциемия требует немедленной коррекции,
которая заключается во внутривенном введении раствора глюкозы,
изотонического раствора хлорида натрия с последующей
стимуляцией диуреза.
124 О Хирургические болезни -О- Том 1 ♦ Часть I ♦ Глава 3
Гипомагниемия
Нормальное содержание магния в плазме составляет 0,75-1,6
ммоль/л. В хирургической практике снижение концентрации магния
(гипомагниемия) по отношению к нижней границы нормы — не
такая уж и редкость. Основные причины, ведущие к гипомагниемии,
связаны с повышенной потерей этого иона. В частности, потери
жидкости по свищам из верхних отделов ЖКТ, диарея, полиурия ведут к
снижению содержания ионов магния в плазме. Гипомагниемия
также возникает при нарушении всасываемости в кишечнике (синдром
мальабсорбции), у больных, страдающих хроническим алкоголизмом,
циррозом печени, острым панкреатитом. Клинические проявления
гипомагниемии довольно разнообразны. Наиболее характерные
симптомы связаны со спазмом гладкой мускулатуры и проявляются в виде
ларинго-, бронхо- или пилороспазма, спазма сфинктера Одди,
анального сфинктера, дискинезии жёлчных протоков. Отмечаются также
судороги мышц затылка, верхних и нижних конечностей,
жевательной мускулатуры. Диагноз гипомагниемии ставят на основании
лабораторных данных и клинической картины. Лечение заключается в
назначении и введении магнийсодержащих растворов. Больным с
почечной недостаточностью введение препаратов магния из-за
высокой опасности развития гипермагниемии противопоказано.
Гипермагниемия
Гипермагниемия характеризуется повышением концентрации
ионов магния в плазме выше 1,6 ммоль/л. Основные причины
гипермагниемии: почечная недостаточность, повышенный катаболизм
белка, избыточное введение магния. Клиническая симптоматика
гипермагниемии проявляется слабостью, снижением мышечного тонуса,
тошнотой, рвотой, болями в животе, снижением АД, сонливостью,
комой. При повышении концентрации ионов магния в плазме выше
7—8 ммоль/л развивается паралич дыхательной мускулатуры.
Терапия гипермагниемии заключается в прекращении введения
магнийсодержащих растворов и стимуляции мочевыделения.
Нарушение кислотно-основного равновесия
Среди физико-химических показателей организма важнейшее
место занимает кислотно-основное состояние. Хорошо известно, что
в процессе обмена вешеств в клетках образуется большое количество
Важнейшие синдромы, встречающиеся в хирургической практике ♦ 125
ионов водорода, накопление которых ведёт к изменению баланса
между кислотами и основаниями. При этом возникают нарушения
функций клеток и течения различных метаболических процессов.
Основным источником ионов водорода служит углекислый газ.
Вступая в реакцию с водой, он образует нестойкое соединение —
угольную кислоту (Н,С03), которая в свою очередь диссоциирует на
ион водорода и бикарбонат. Дополнительно ионы водорода
образуются в процессе метаболизма белков, образования лактата,
диссоциации органических кислот. В норме количество образовавшихся
ионов водорода соответствует количеству удалённых. Нарушение
этого равновесия сопровождается изменением показателей кислотно-
щелочного равновесия.
Для определения уровня ионов водорода используют величину рН,
которая в норме равна 7,4. При накоплении ионов водорода
происходит снижение рН ниже 7,35, т.е. развивается ацидоз. Снижение
концентрации ионов водорода или накопление ионов бикарбоната
ведёт к увеличению рН более 7,45, возникает алкалоз. Колебания
величины этого показателя незначительны, так как снижение рН до 6,9
и повышение до 7,7 несовместимы с жизнью. Для того чтобы
величина рН поддерживалась на нормальном уровне, существуют
специальные механизмы её регуляции. К ним относят буферность и
систему органов выделения.
Буферность
Буфер представляет собой слабую кислоту и её соль — сильное
основание. Можно представить себе буферное соединение как
своеобразную губку. При увеличении числа ионов водорода она
«впитывает» их избыток, при уменьшении может «отжиматься» с
выделением Н+ в раствор. Учитывая тот факт, что в процессе жизнедеятельности
организма образуется большое количество ионов водорода, в
буферной системе преобладает щелочной компонент, т.е. соотношение
между слабой кислотой и сильным основанием равно 1:20. Именно этим
соотношением и определяется величина рН.
Различают следующие буферные системы:
а) бикарбонатный H2C03/NaHC03 — самая мощная буферная
система организма, её мощность составляет 65%;
б) фосфатный NaH2P04/Na2HP04 — внутриклеточный буфер,
мощность этой системы невелика, она составляет всего 1%;
в) аммонийный, действие которого основано на связывании ионов
водорода аммиаком (NH ) с образованием иона аммония (NH4);
126 -О Хирургические болезни -0- Том 1 ♦ Часть I ■$ Глава 3
г) белковый, представленный в основном гемоглобином, его
мощность равна около 5%, в результате действия этого буфера
происходит связывание ионов водорода при их избытке гидроксильными
группами, что сопровождается повышением рН.
При увеличении или снижении концентрации ионов водорода
благодаря работе буферных систем величина рН достаточно
длительное время остаётся в пределах нормы. Однако их избыток приводит к
снижению рН крови с развитием ацидоза. Тогда к компенсации
подключаются органы выделения.
Органы выделения
Кроме буферных систем, удаление избытка ионов водорода или,
наоборот, их задержка происходит с помощью органов выделения.
К ним относятся лёгкие, почки и печень. При ацидозе вследствие
возбуждения дыхательного центра ионами водорода развивается
одышка. Избыток кислоты выделяется в виде углекислого газа. Вот почему
у больных с выраженным декомпенсированным метаболическим
ацидозом развивается тяжёлая, мучительная одышка. При алкалозе,
наоборот, дыхание редкое и глубокое. Углекислый газ задерживается в
организме и, вступая в реакцию с водой, образует угольную кислоту.
Почки регулируют рН с помощью задержки или, наоборот,
удаления избытка ионов НС03, а также с помощью синтеза в клетках
канальцев аммония (NH3+H+=NH4), причём этот путь компенсации
включается через несколько часов или даже суток. Печень участвует
в этом процессе с помощью синтеза хлористого аммония.
Стремление организма поддержать нормальную кислотность среды
называют законом поддержания постоянства рН.
В клинической практике кислотно-основное состояние
представлено в виде следующих параметров: рН, pC02, p02, HC03, BE, AB,
SB, Sat 02, ТСОг Для рассмотрения компонентов
кислотно-щелочного равновесия и правильной трактовки полученных результатов
необходимо знать определённую терминологию.
• рС02 — парциальное давление углекислого газа. Этот показатель
указывает на количество растворённой углекислоты и измеряется в
мм рт.ст. В норме в артериальной крови величина рС02 (раС02)
колеблется от 35 до 45 мм рт.ст., а в смешанной венозной (pvCO,) —
50—60 мм рт.ст. Увеличение рС02 в артериальной крови выше 45 мм
рт.ст указывает на избыточное содержание углекислого газа, или ги-
перкапнию, и, наоборот, снижение рСО, ниже 35 мм рт.ст. — на его
недостаток, или гипокапнию.
Важнейшие синдромы, встречающиеся в хирургической практике О- 127
• BE — избыток оснований. Этот показатель указывает на
количество бикарбоната, которое надо добавить или удалить из раствора,
чтобы его рН был 7,40 при рС02 40 мм рт.ст. и температуре 37 *С.
В норме эта величина колеблется от —2,4 до +2,4 ммоль/л. При
уменьшении BE ниже —2,4 говорят о дефиците оснований, а при
повышении более +2,4 — об избытке. На основании этого параметра
проводят метаболическую оценку показателей кислотно-основного
состояния. Отрицательная величина BE указывает на наличие
метаболического ацидоза, а положительная — метаболического алкалоза.
• НС03 — бикарбонат плазмы, который является главным
компонентом регуляции кислотно-основного состояния. Для поддержания
нормальной величины кислотно-основного состояния бикарбонат,
в зависимости от вида нарушения, задерживается или, наоборот,
выводится почками. В норме этот показатель равен 22—26 мэкв/л.
Снижение НС03 ниже этой величины указывает на метаболический
ацидоз, а увеличение — на метаболический алкалоз. Кроме того, этот
показатель характеризует ёмкость бикарбонатного буфера крови.
Бикарбонат плазмы представлен в виде двух показателей:
актуального и стандартного бикарбоната.
• АВ — истинный бикарбонат плазмы, указывает на истинное
содержание бикарбоната при истинном рС02 и р02, которое составляет
19—25 ммоль/л.
• SB — стандартный бикарбонат плазмы, величина бикарбоната,
рассчитанная при рС02 40 мм рт.ст., Sat02 100% и температуре 37 °С и
составляет 20—27 ммоль/л.
• ТС02 — общая концентрация углекислого газа, указывает на его
содержание в организме в виде трёх форм: газообразной,
растворённой в плазме и связанной с белками. В норме этот показатель
равен 24—33 ммоль/л.
Кроме вышеперечисленных параметров кислотно-основного со-
стония врача-клинициста интересуют показатели, отражающие
содержание кислорода в крови: р02 и насыщение гемоглобина
кислородом — SatOr
• р02 — парциальное давление кислорода. Эта величина указывает на
количество растворённого кислорода в крови. В норме при дыхании
атмосферным воздухом р02 артериальной крови (ра02) составляет
95-98 мм рт.ст., а в смешанной венозной (pv02) — 40—60 мм рт.ст.
• Sat02 — показатель, характеризующий насыщение гемоглобина
кислородом. Насытить гемоглобин выше 100% невозможно, поэтому мак-
128 ♦ Хирургические болезни О* Том 1 ^ Часть I ♦ Глава 3
симальное значение показателя составляет 100. В норме Sat02
артериальной крови составляет 97—98%, а смешанной венозной — 75-80%.
В зависимости от причины нарушений кислотно-основного со-
стония различают дыхательный (респираторный) ацидоз и алкалоз и
метаболический ацидоз и алкалоз, а по степени компенсации эти
изменения подразделяют на компенсированные и декомпенсирован-
ные. Метаболический ацидоз всегда сопровождается компенсаторным
снижением концентрации иона бикарбоната в плазме, а
метаболический алкалоз — его повышением. Несколько позже происходит
изменение парциального давления углекислого газа. При ацидозе этот
показатель снижается, а при алкалозе — повышается. При респираторном
ацидозе происходит увеличение рС02, а при респираторном алкалозе
этот показатель снижается. Вторично при респираторном ацидозе
происходит увеличение бикарбоната, а при алкалозе — его снижение.
Дыхательный (респираторный) ацидоз
Как известно, выделение углекислого газа из организма
полностью зависит от лёгочной вентиляции. При гиповентиляции
углекислота накапливается в организме, развивается гиперкапния, а при
гипервентиляции, наоборот, выводится с развитием гипокапнии. В свою
очередь углекислый газ, как уже было указано выше, при
соединении с водой образует угольную кислоту, которая диссоциирует на ион
водорода и НС03, причём эта реакция сдвигается вправо.
со2+н2о<->н2со3^н++нсо3"
Ионы водорода по своей сущности являются кислотой. В
результате задержка углекислоты в организме сопровождается развитием
ацидоза, а поскольку элиминация углекислого газа зависит от
дыхания, ацидоз получил название респираторного. При респираторном
ацидозе при исследовании параметров кислотно-основного
состояния отмечают снижение рН менее 7,35 и увеличение рС02 более
45 мм рт.ст. Остальные составляющие кислотно-основного
состояния, как правило, не изменены. Пример респираторного ацидоза:
рН - 7,10; рС02- 85; р02 - 90; НС03 - 26; BE -2,1.
Основные причины развития респираторного ацидоза:
• лёгочная патология (пневмония, респираторный
дистресс-синдром лёгких, пневмоторакс, гидроторакс);
• нарушение проходимости дыхательных путей (обструкция
верхних дыхательных путей, аспирация, бронхоспазм, ларингоспазм);
Важнейшие синдромы, встречающиеся в хирургической практике
• патология периферической нервной системы и ЦНС
(передозировка наркотических анальгетиков и средств для наркоза,
остаточные действия мышечных релаксантов);
• неисправность наркозно-дыхательной аппаратуры
(негерметичный контур респиратора, неисправный поглотитель углекислого газа
при работе по полузакрытому и закрытому контуру, увеличение
мёртвого пространства).
Терапия респираторного ацидоза заключается в выявлении и
устранении причины, приведшей к гиперкапнии, с последующим
контролем параметров кислотно-основного состояния. При
лапароскопических операциях, когда с целью наложения пневмоперитонеума
в брюшную полость вводят углекислый газ, необходимо помнить, что
ИВЛ надо проводить по полуоткрытому контуру с мониторингом
выдыхаемой концентрации углекислоты с помощью капнографа.
Респираторный алкалоз
Респираторный алкалоз является результатом излишнего
выведения углекислого газа с развитием гипокапнии. Основная причина этого
нарушения — альвеолярная гипервентиляция. Как правило, гипокап-
ния довольно часто развивается у больных, которым проводят ИВЛ.
Клинически данное нарушение у больных, получающих
респираторную поддержку, практически никак не проявляется и выявляется
только при исследовании кислотно-основного состояния или капногра-
фии. Пример респираторного алкалоза: рН — 7,50; рС02— 25; р02 —
98; НС03 — 20; BE +2,1. Лечение заключается в коррекции
параметров ИВЛ с последующим контролем кислотно-основного состояния.
Метаболический ацидоз
Метаболический ацидоз характеризуется накоплением в
организме в результате нарушения метаболизма избыточного количества
стойких (нелетучих) кислот.
Основные причины развития метаболического ацидоза.
• Повышенное образование кислот:
- кетокислот при сахарном диабете, длительном голодании и
алкогольном опьянении;
- молочной кислоты при шоке и гипоксии тканей;
- серной кислоты при усиленном катаболизме
(послеоперационный период, длительное голодание);
130 О Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 3
— повышенная абсорбция хлоридов у больных с уретерокишечным
анастомозом.
• Нарушение выведения кислот (уремический ацидоз):
— хронический гломерулонефрит;
— первично или вторично сморщенная почка;
— шоковая почка.
• Избыточная потеря гидрокарбоната:
— свищи двенадцатиперстной или тонкой кишки, жёлчного пузыря;
— диарея;
— язвенный колит.
• Избыточное введение хлорида натрия:
— ятрогенное нарушение, связанное с избыточной инфузией ряда
растворов.
Диагностика метаболического ацидоза основывается на
исследовании показателей кислотно-основного состояния. Лишь в далеко
зашедших случаях, особенно у больных с кетоацидозом,
значительное снижение рН проявляется одышкой (дыхание Куссмауля),
которая направлена на снижение концентрации углекислоты, и диагноз
нарушения кислотно-основного состояния можно поставить «на
расстоянии». При исследовании параметров кислотно-основного
состояния на метаболический ацидоз указывает снижение BE < -2,3 и
НСОЗ < 22 ммоль/м. Ниже приведены примеры компенсированного
и декомпенсированного метаболического ацидоза.
Компенсированный
метаболический ацидоз
РН
рС02
р02
BE
НС03
7,36
24 мм рт.ст.
94 мм рт.ст.
—8,4 ммоль/л
17 ммоль/л
Декомпенсированный
метаболический ацидоз
рН
Рсо2
р02
BE
НСО3
7,02
18 мм рт.ст.
90 мм рт.ст.
— 18,5 ммоль/л
10 ммоль/л
Терапия метаболического ацидоза
При компенсированном метаболическом ацидозе каких-либо
специальных лечебных мероприятий не требуется. При декомпенсации
с целью повышения рН плазмы необходимо введение щелочных
растворов. Гидрокарбонат натрия назначают с целью увеличения ёмко-
Важнейшие синдромы, встречающиеся в хирургической практике
сти гидрокарбонатного буфера плазмы. Необходимую дозу 1-моляль-
|ого раствора (8,4%) рассчитывают по формуле:
BE х масса тела х 0,3
Следует помнить, что введение гидрокарбоната натрия
сопровождается повышенным образованием углекислоты, для удаления
которой, если больному проводится ИВЛ, необходимо провести
коррекцию её параметров. Избыточное количество гидрокарбоната натрия
может привести к развитию ятрогенного алкалоза.
Для коррекции метаболического ацидоза также применяют тро-
метамол. Введение этого препарата связывает ионы водорода и
выводит их через почки. Часть препарата проникает через клеточную
мембрану в клетки, что позволяет проводить терапию
внутриклеточного ацидоза. Назначение этого средства возможно только при
нормальной функции почек. Помимо введения гидрокарбоната натрия
и трометамола, терапия метаболического ацидоза должна включать
коррекцию синдрома низкого СВ, оптимизацию доставки кислорода
к органам и тканям, коррекцию нарушений водно-электролитного
баланса, углеводного обмена, улучшение микроциркуляции,
проведение адекватной инфузионной терапии.
Метаболический алкалоз
Метаболический алкалоз характеризуется увеличением концент
рации бикарбоната крови. Основные факторы, которые ведут к раз
витию метаболического алкалоза, следующие.
• Потеря ионов водорода:
- неукротимая рвота желудочным содержимым;
^ высокая кишечная непроходимость;
потеря желудочного содержимого по желудочному зонду;
- гипокалиемия.
• Избыточное введение щелочных растворов:
— терапия метаболического ацидоза.
• Задержка гидрокарбоната:
- панкреатит;
— массивная гемотрансфузия.
При нарушении проходимости верхних отделов ЖКТ и рвоте орга
низм теряет ионы хлора и водорода. При этом начинается продукция
или задержка почками иона бикарбоната, направленная на
сохранение анионов, причём чем больше теряется хлор, тем больше его мес-
то занимает бикарбонат. Уменьшение объёма жидкости во
внеклеточном пространстве сопровождается повышением реабсорбции ионов
натрия и бикарбоната и увеличением рН крови. Одной из причин
развития метаболического алкалоза может быть гипокалиемия. Это
связано с тем, что при дефиците ионов калия в клетки
перемещаются ионы водорода. В данном случае метаболический алкалоз
сочетается с внутриклеточным ацидозом.
Клиническая картина метаболического алкалоза не имеет харак
терных признаков. При декомпенсации метаболического алкалоза
обращает на себя внимание гипопноэ, больные дышат с частотой
менее 6 дыхательных движений в минуту. Эта защитная реакция
направлена на задержку углекислого газа в организме и увеличение
содержания ионов водорода. При исследовании кислотно-основного
состояния на метаболический алкалоз указывает повышение BE
более +2,3 ммоль/л, а НС03 — выше 26 ммоль/л. Примеры
компенсированного и декомпенсированного метаболического алкалоза
представлены ниже.
Компенсированный
метаболический ацидоз
рН
Рсо2
р02
BE
НС03
7,44
60 мм рт.ст.
94 мм рт.ст.
+9,4 ммоль/л
34 ммоль/л
Декомпенсированный
метаболический ацидоз
рН
Рсо2
Ро2
BE
НСО3
7,59
60 мм рт.ст.
96 мм рт.ст.
+ 18,5 ммоль/л
40 ммоль/л
Терапия метаболического алкалоза заключается в назначении глю-
козо-инсулиново-калиевой смеси. Суточная доза калия не должна
превышать 2—3 мэкв/кг. При олигоурии или анурии введение
препаратов калия противопоказано.
Приведёнными данными далеко не исчерпываются
метаболические расстройства, возможные у хирургических больных. Вместе с тем,
знание основных нарушений помогает определить причину их
возникновения и наметить пути их устранения.
МЕТОДЫ АНЕСТЕЗИИ
At inflefl И ОБЕСПЕЧЕНИЯ БЕЗОПАСНОСТИ
БОЛЬНОГО ВО ВРЕМЯ
ХИРУРГИЧЕСКОГО ВМЕШАТЕЛЬСТВА
В клинической практике вопросы анестезиологического
пособия и обеспечения безопасности больного во время хирургической
операции в полной мере относятся к компетенции
врача-анестезиолога. Вместе с тем лечение хирургического больного — сложный,
многокомпонентный процесс, требующий участия различных
специалистов, без помощи которых невозможно успешное
выполнение оперативного вмешательства. Естественно, результат операции,
прежде всего, зависит от квалификации и таланта хирурга, который
должен ориентироваться в различных аспектах ведения больных —
предоперационной подготовке, методах анестезии,
высокотехнологичных способах защиты организма больного во время
хирургического вмешательства и методах профилактики
послеоперационных осложнений.
Предоперационный период и оценка
риска хирургического вмешательства
Хирург и анестезиолог обязаны детально ознакомиться с
состоянием больного и провести его подготовку, направленную, если не на
полную нормализацию всех функций, то хотя бы на устранение
наиболее опасных нарушений деятельности жизненно важных органов и
систем. Необходимо оценить симптомы имеющегося
хирургического заболевания, данные лабораторных анализов, начальное лечение
и ответ на него.
При сборе анамнеза важными с точки зрения
анестезиологического обеспечения являются указания на сопутствующие заболевания,
лекарственную терапию, время последнего приёма пищи,
аллергические реакции, проблемы и осложнения при предшествующих
операциях и анестезиях, алкоголизм и наркотическую зависимость.
Физикалъное обследование должно быть особенно тщательным.
Специальное внимание должно быть уделено обследованию
дыхательных путей, сердца, лёгких и нервной системы. Если планируется
использовать регионарную анестезию, то необходимо детальное
обследование конечностей и спины. Кроме того, следует внимательно
осмотреть ротовую полость больного (шатающиеся зубы, зубные
протезы), венозные сосуды конечностей (следует наметить вены для ин-
фузии во время операции). Нужно также оценить анатомические
соотношения в области шеи, чтобы быть готовым к трудностям при
интубации трахеи.
Лабораторные исследования. Минимум желательных исследований
составляют регистрация показателей кислотно-основного состояния,
общий анализ крови, содержание сахара и мочевины в крови.
Биохимический анализ крови, в частности определение содержания креа-
тинина, азота мочевины и билирубина в крови, особенно важен у
больных старше 65 лет с хроническими почечными,
сердечно-сосудистыми, печёночными заболеваниями, сахарным диабетом,
выраженным ожирением и т. д.
Количество тромбоцитов необходимо знать для выбора метода
анестезии. В случае тромбоцитопении центральные сегментарные
блокады не могут быть выполнены из-за риска развития эпидураль-
ной гематомы. Для оценки системы гемостаза определяют также тром-
биновое и активированное частичное тромбопластиновое время.
При наличии жалоб на боли в области сердца, хронической ише-
мической болезни сердца в анамнезе и у лиц старше 60 лет
необходима ЭКГ. Следует также определить групповую принадлежность
крови и резус-фактор. При имеющихся у больного бронхообст-
руктивном синдроме, ожирении проводят исследование функций
внешнего дыхания.
Операционный риск
Понятие «операционный риск» введено для суждения о степени
опасности операции. Результаты предоперационного обследования
определяют дальнейшую тактику хирурга и анестезиолога, делают
возможной общую оценку состояния больного и решения вопроса об
операционном риске.
В нашей стране наиболее широко используют модифицированную
классификацию операционного риска, которая предусматривает пять
градаций состояния больного. Поскольку следует учитывать и
характер предстоящей операции, объём которой обычно можно
предположить, она дополнена распределением больных по четырём группам
операций с учётом их объёма и тяжести.
134 ^ Хирургические болезни
Том 1 ♦ Часть I ♦ Глава 4
Принципы анестезии и обеспечения безопасности больного ... Ф 135
Оценка операционного риска в соответствии с физическим
состоянием больного и тяжестью оперативного вмешательства
физическое состояние больного
1. Больные, у которых нет органических заболеваний или у которых
заболевание локализовано и не вызывает системных расстройств.
2. Больные с лёгкими или умеренными системными расстройствами,
которые связаны или не связаны с хирургическим заболеванием и
которые только умеренно нарушают нормальную
жизнедеятельность и общее физиологическое равновесие.
3. Больные с тяжёлыми системными расстройствами, которые
связаны или не связаны с хирургическим заболеванием и которые
серьёзно нарушают нормальную жизнедеятельность.
4. Больные с крайней степенью системных расстройств, которые
связаны или не связаны с хирургическим заболеванием и которые резко
нарушают нормальную жизнедеятельность, становясь уже
опасными для жизни.
5. Отдельные больные, предоперационное состояние которых
настолько тяжело (moribundus), что можно ожидать их смерти в течение
24 ч даже без дополнительного воздействия операции.
Тяжесть оперативного вмешательства
A. Малые операции на поверхности тела и полостных органах.
Б. Операции средней тяжести на поверхности тела и полостных
органах.
B. Обширные хирургические вмешательства.
Г. Операции на сердце и крупных сосудах.
+ С (Экстренные оперативные вмешательства)
По этой системе наибольшую опасность представляет экстренное
оперативное вмешательство (+С) для больного, отнесённого к
группе 5 В-Г. При этом хирург должен минимизировать объём
оперативного вмешательства.
Методы анестезии
При решении вопросов о показаниях к тому или иному виду
анестезии врач сталкивается с необходимостью оценки ряда факторов,
существенно влияющих на его выбор. К ним относятся:
136 ^ Хирургические болезни ♦ Том 1 -0- Часть I ♦ Глава 4
• характер и объём предстоящего оперативного вмешательства;
• состояние больного;
• наличие тех или иных фармакологических средств и
аппаратуры;
• навыки и квалификация анестезиолога;
• опыт и оперативная техника хирурга.
При выборе обезболивания анестезиолог обязан также учитывать
пожелания хирурга и больного, но более важным является его
решение о том, что в данном конкретном случае будет более безопасным
и оптимальным. Старый принцип — «риск анестезии не должен
превышать риска оперативного вмешательства» — полностью сохраняет
своё значение и сегодня.
Абдоминальная хирургия
Общая анестезия
Наиболее часто используемая методика -- общая анестезия
(комбинированный эндотрахеальный наркоз). Её преимущества
включают защиту дыхательных путей, обеспечение адекватной лёгочной
вентиляции и быструю индукцию анестезии с контролируемой глубиной
и длительностью. К недостаткам относят потерю рефлексов верхних
дыхательных путей и возможные побочные реакции со стороны
сердечно-сосудистой системы на введение средств для наркоза.
Особенности общей анестезии
Премедикация должна включать атропин в дозе, соответствующей
пульсу больного. Обычно достаточно подкожного (за 45 мин до
анестезии) или внутримышечного (за 30 мин) введения 0,6 мг
атропина. Вполне уместно и предпочитаемое многими анестезиологами
внутривенное введение атропина в той же дозе на операционном
столе. В связи с тем, что у многих оперируемых больных наблюдается
выраженный болевой синдром, оправдано включение в премеди-
кацию наркотических анальгетиков — тримеперидина (30—40 мг)
или морфина (10—15 мг). Пожилым больным в состоянии кахексии
или резко выраженной интоксикации введение анальгетиков
следует ограничить, используя только небольшие дозы тримеперидина,
или вообще их не применять. При выборе в качестве метода
анестезии нейролептаналгезии премедикация может включать дропе-
ридол (1-2 мл).
ринципы анестезии и обеспечения безопасности больного ... О 13
Регионарная анестезия
Регионарные методики, применяемые при абдоминальных
вмешательствах, включают спинальную, эпидуральную, каудальную
анестезии и блок периферических нервов. Вмешательства на нижнем
этаже брюшной полости могут быть выполнены под теми регионарными
методиками, которые позволяют добиться сенсорного блока до
уровня Th Применяются эпидуральная анестезия, спинальная
анестезия с однократным введением анестетика, блоки периферических
нервов — билатеральная блокада Th8_|2 межрёберных нервов,
которая вызывает соматическую сенсорную анестезию, блок plexus cae-
liacus для висцеральной анестезии. Блокада пп. ilioinguinalis, iliohypo-
gastricus, genitofemoralis даёт удовлетворительное обезболивание для
проведения грыжесечения.
Вмешательства на верхнем этаже брюшной полости (выше пупка)
обычно не могут быть выполнены только под регионарной
анестезией. При спинальной и эпидуральной анестезии верхний уровень
сенсорного блока должен достигать уровня Th24, при этом развивается
паралич межрёберных мышц. Дыхательный и минутный объёмы
дыхания остаются прежними, так как зависят от функций диафрагмы, а
функциональная остаточная ёмкость и объём форсированного
выдоха уменьшаются пропорционально активности абдоминальных и
межрёберных мышц. У больных с хроническими обструктивными
заболеваниями лёгких при этом могут возникнуть нарушения вентиляции.
Особенности регионарной анестезии
Оперативные вмешательства по поводу неосложнённых
аппендицита, грыж, особенно у пациентов с низким операционно-анестези-
ологическим риском, можно с успехом выполнить в условиях суб-
арахноидальной или эпидуральной анестезии. Для субарахноидальной
анестезии используют раствор бупивакаина 0,5% изо- и
гипербарический. Для эпидуральной — 2% раствор лидокаина, 0,5% раствор
бупивакаина, 0,5-1% растворы ропивакаина.
При обширных оперативных вмешательствах на органах брюшной
полости имеет смысл использовать сочетанные методики анестезии.
Одной из таких методик является применение эпидуральной
анестезии в сочетании с внутривенным введением анестетиков, гипноти-
ков, миорелаксантов на фоне проведения ИВЛ. Такая комбинация
позволяет редуцировать дозы основных анестетиков и в то же время
добиться адекватной аналгезии, нейровегетативного торможения,
138 ♦ Хирургические болезни ♦ Том 1 ♦ Часть 1 ♦ Глава 4
миорелаксаиии и выключения сознания. Важной особенностью
такой методики является то, что по окончании операции происходит
быстрое восстановление сознания, спонтанного дыхания и имеется
возможность для продлённого послеоперационного обезболивания.
Проводя эпидуральную анестезию, следует помнить о том, что
нельзя применять местные анестетики эпидурально, пока полностью
не купированы явления шока и не нормализован О ЦК, но
применение наркотических анальгетиков в такой ситуации допустимо.
В тех ситуациях, когда предстоит неотложная операция по поводу
внутреннего кровотечения, в эпидуральное пространство вводят один
лишь фентанил (0,14-0,2 мкг/кг) либо морфин (0,1-0,15 мкг/кг),
разведённый на 10 мл физиологического раствора. Не дожидаясь
блокады болевой чувствительности, приступают к индукции анестезии
(2-4 мг/кг кетамина, миорелаксант), интубируют трахею.
Хирургической стадии анестезии добиваются введением кетамина в дозе 4-
6 мг/кг в час. После хирургической остановки кровотечения быстро
восполняют ОЦК, стабилизируют показатели гемодинамики. Затем
в эпидуральный катетер вводят местный анестетик [вначале
низкоконцентрированный (аналитическая концентрация) — 1% лидока-
ин, либо 0,25% бупивакаин, либо 0,2% ропивакаин]. Если спустя 30-
40 мин гемодинамика остаётся стабильной, то переходят к введению
анестетических концентраций местных анестетиков. От повторных
инъекций кетамина отказываются, так как развивается полноценная
сегментарная блокада. Если состояние больного позволяет, то по
окончании операции его экстубируют.
Преимущества этой методики в относительно быстром
пробуждении больного и восстановлении самостоятельного дыхания,
снижении негативных влияний общих анестетиков, миорелаксантов и
возможности продления аналгезии в послеоперационном периоде.
Торакальная хирургия
Операция, производимая на открытой грудной клетке, является
абсолютным показанием к проведению ИВЛ. При этом
предпочтение отдают комбинации общей анестезии с эпидуральной.
Проведение ряда вмешательств на органах грудной клетки (например,
резекция лёгкого) существенно облегчается обеспечением
неподвижного хирургического поля, чего достигают селективной однолёгочной
вентиляцией. Для этого используют двухпросветные эндобронхиаль-
ные трубки.
Принципы анестезии и обеспечения безопасности больного ... ♦ 139
После операций на трахее самостоятельное дыхание должно быть
возобновлено как можно ранее, чтобы минимизировать
травматические воздействия на швы, наложенные на трахею. В
послеоперационном периоде могут потребоваться частые бронхоскопии (их
проводят под местной анестезией) для удаления секрета из лёгких.
При оперативных вмешательствах на пищеводе применяют
комбинированную эндотрахеальную анестезию. Больные,
подвергающиеся хирургическим вмешательствам по поводу заболеваний
пищевода, как правило, имеют пониженное питание, гиповолемию. У них
имеется риск аспирации, следовательно, должны быть проведены
предоперационная профилактика и быстрая последовательная
индукция анестезии либо интубация больного в сознании.
Сосудистая хирургия
Во время оперативных вмешательств на сосудах нижних
конечностей (тромбэктомия из артерий и вен, бедренно-подколенное
шунтирование, флебэктомия и т.д.) часто применяют эпидуральную
анестезию на поясничном уровне. При вмешательствах на одной
конечности можно использовать комбинированную блокаду
поясничного сплетения и седалищного нерва. В случае невозможности
применения регионарной анестезии (например, в случае некорриги-
рованных нарушений свёртывающей системы) предпочтение отдают
общей анестезии.
Подвздошно-бедренное шунтирование также обычно
осуществляют в условиях спинальной и эпидуральной анестезии. При операциях
на брюшной части аорты и нижней полой вене комбинируют общую
и эпидуральную анестезию на среднегрудном уровне. После снятия
зажима с аорты возможна гипотензия, которая должна быть быстро
устранена с помощью инфузионной терапии и симпатомиметиков.
Операции на грудной части аорты требуют общей анестезии. В ряде
случаев эти хирургические вмешательства проводят с
использованием искусственного кровообращения.
Каротидная эндартерэктомия может быть выполнена в условиях
местной или регионарной анестезии (блокада поверхностной и
глубокой частей шейного сплетения) и под общей анестезией. При
наложении зажима на сонную артерию возможно раздражение синока-
ротидной зоны с вагусной реакцией в виде артериальной гипотензии
и брадикардии. Для профилактики этих осложнений необходимы
дополнительная местная анестезия и введение антихолинергических
140 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 4
средств. Снятие зажима с сонной артерии иногда сопровождается
вазодилатацией и брадикардией, требующих применения вазопрес-
соров для стабилизации гемодинамики.
Кардиохирургия
При так называемых закрытых операциях анестезиологическое
ведение пациента сходно с таковым при торакальной хирургии.
Операции на «открытом сердце» осуществляют при помощи
экстракорпорального насоса и газообменного блока. Кровь из венозного русла
поступает под действием гравитации в венозный резервуар, а затем в
оксигенатор, где происходит её обогащение кислородом и удаление
углекислого газа. Обогащенная кислородом кровь накачивается в
артериальное русло (обычно в восходящую аорту). Часто
необходимо использование холодовой и фармакологической кардиоплегии.
Таким образом сердце и лёгкие изолируются, и их функции
временно поддерживаются аппаратом искусственного кровообращения.
Для индукции анестезии применяют стандартные препараты —
гипнотик (барбитураты, бензодиазепины), опиоид, после введения
миорелаксанта осуществляют интубацию трахеи, начинают ИВЛ.
Анестезиологическое обеспечение в период перед началом
искусственного кровообращения направлено на поддержание стабильности
ЧСС и АД. Контролируют состав газов артериальной крови,
концентрацию калия в плазме, гематокрит и активированное время
свёртывания. Перед канюляцией в центральную вену вводят гепарин
(300 ЕД/кг). В период искусственного кровообращения анестезию
поддерживают болюсными дозами опиоидов и бензодиазепинов,
внутривенной инфузией пропофола. После полного перехода на ток
крови через оксигенатор, а также прекращения выброса из
желудочков вентиляцию приостанавливают. Тело больного охлаждают до 28-
32 °С, миокард — до 15—18 °С. Среднее АД должно быть не ниже
45 мм рт.ст. (зависит от характеристик насоса и системного
сосудистого сопротивления). Контролируют показатели коагуляции, доставку
кислорода, электролиты, кислотно-основного состояния.
По окончании операции, когда температура тела поднимается
выше 36 °С, нормализуются метаболические показатели,
появляются регулярные сердечные сокращения, осуществляют восстановление
спонтанного СВ. После возобновления лёгочной циркуляции
возобновляют механическую вентиляцию. При сохраняющемся низком СВ
к терапии подключают симпатомиметики.
Принципы анестезии и обеспечения безопасности больной
В послеоперационном периоде терапия направлена на
достижение вазодилатации, снижение постнагрузки и поддержание преднаг-
рузки, нормализацию кислотно-щелочного и электролитного баланса.
При необходимости проводят гемотрансфузию. Аналгезии
достигают системным введением опиоидов.
Хирургия эндокринных желёз
феохромоцитома
Во время операций по поводу феохромоцитомы, которая исходит
из мозгового слоя надпочечников, особенно при манипуляциях на
опухоли, наблюдаются резкие и весьма значительные колебания АД.
Методикой выбора является комбинированный эндотрахеальный
наркоз. Мониторинг ЭКГ, ЦВД и прямое измерение АД должны
начинаться перед индукцией анестезии. Подбор препаратов для
индукции и поддержания анестезии производят, исходя из необходимости
поддержания гемодинамической стабильности.
Для анестезии могут быть использованы тиопентал натрий, закись
азота, фентанил. Во время мобилизации опухоли часто происходит
высвобождение катехоламинов, так что для поддержания
приемлемого уровня АД требуется применение артериального вазодилата-
тора (нитропруссида натрия). После удаления опухоли АД может
снижаться. В послеоперационном периоде больной нуждается в
интенсивном наблюдении в течение 12—24 ч.
Операции на щитовидной железе
В ряде случаев зоб может вызывать обструкцию дыхательн
путей, загрудинный зоб иногда сопровождается окклюзией верхней
полой вены. Возможна компрессия трахеи или её смещение. В таких
случаях полезна предоперационная рентгенография шеи, входного
отдела грудной клетки, а также оценка тиреоидной функции.
Следует иметь наготове набор армированных трахеальных трубок
небольшого диаметра.
Плановая субтотальная тиреоидэктомия у пациентов с гиперти-
реозом может быть осуществлена в условиях р-адренергической
блокады или в сочетании такой блокады с назначением йодида калия.
Оперативные вмешательства у больных с токсическим зобом
сопряжены с достаточно высоким риском тиреотоксического криза,
поэтому они нуждаются в специальной подготовке (см. главу 40)
142 ♦ Хирургические болезни О Том 1 ♦ Часть I ♦ Глава 4
Упреждающая аналгезия
Для хирургических больных весьма важен профилактический
подход к защите пациента от действия оперативной травмы и
последующего развития послеоперационного болевого синдрома. Это
направление получило название упреждающей (pre-emptive) анал-
гезии.
В настоящее время применяют разные методики упреждающей
аналгезии.
• Нестероидные противовоспалительные средства (НПВС) за 30 мин
до индукции анестезии.
• Регионарный блок перед (после) индукции общей анестезии, но до
начала операции.
• Эпидуральное введение опиоида (+ местная анестезия) до начала
операции.
• Инфильтрационная местная анестезия зоны кожного разреза перед
(после) индукции анестезии, до разреза.
• Системное введение опиоида до операции.
• Введение малых доз кетамина до (во время) операции.
• Регионарный блок + опиоид.
• Регионарный блок + НПВС.
• НПВС + кетамин + клонидин + метоклопрамид.
Особенно целесообразно применение НПВС в варианте
предупреждающей аналгезии (когда НПВС вводят до начала
хирургического вмешательства и его применение продолжают в
послеоперационном периоде), а также различных регионарных блоков перед (или
после) индукции общей анестезии, но до начала операции.
Профилактика послеоперационных осложнений
Различные осложнения послеоперационного периода
существенно ухудшают состояние больных, пролонгируют период
госпитализации и могут быть непосредственной причиной летальности.
Следует обратить особое внимание на то, что предвидеть возможность
послеоперационных осложнений и предпринимать меры для их
предотвращения нужно уже во время самого хирургического
вмешательства и даже до его начала.
Принципы анестезии и обеспечения безопасности больного ... <> 143
Инфекционные осложнения
Инфекционные осложнения, их прогнозирование и профилактика
подробно рассматриваются в главе 3. Напомним лишь, что антибио-
тикопрофилактику гнойно-септических осложнений начинают
осуществлять на операционном столе ещё до кожного разреза.
Венозные тромбоэмболические осложнения
Венозные тромбоэмболические осложнения в значительном
проценте случаев возникают после различных хирургических
вмешательств. При подготовке больного к оперативному вмешательству
хирург вместе с анестезиологом в обязательном порядке должны
оценить возможную опасность развития в послеоперационном периоде
тромбоза глубоких вен нижних конечностей и связанной с ним ТЭЛА.
Для оценки риска развития в послеоперационном периоде
венозных тромбоэмболических осложнений следует использовать
приведённую ниже схему (табл. 4-1), предложенную экспертами и принятую
Таблица 4-1. Определение степени риска послеоперационных венозных
тромбоэмболических осложнений
Риск
1
Низкий
(IA)
Умеренный
(IB, 1С, НА, ИВ)
Факторы риска, связанные с:
операцией
2
I. Неосложнённые
вмешательства продолжительностью до
45 мин (например, аппендэк-
томия, грыжесечение, роды,
аборт, трансуретральная аде-
номэктомия и др.)
II. Большие вмешательства
(например, холецистэктомия,
резекция желудка или
кишечника, осложнённая аппендэк-
томия, кесарево сечение,
ампутация матки, артериальная
реконструкция, чреспузырная
аденомэктомия, остеосинтез
костей голени и др.)
состоянием больного
3
А. Отсутствуют
В. Возраст >40
Варикозные вены
Приём эстрогенов
Недостаточность
кровообращения
Постельный режим
более 4 дней
Инфекция
Ожирение
Послеродовый
период (6 нед)
144 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 4
Окончание табл. 4.1
1
Высокий
(ПС, II1A, ШВ, ШС)
2
III. Расширенные
вмешательства (например, гастрэктомия,
панкреатэктомия, колэктомия,
экстирпация матки, остеосин-
тез бедра, ампутация бедра,
протезирование суставов и др.)
3
С. Онкологические
заболевания
Тромбоз глубоких вен
и ТЭЛА в анамнезе
Паралич нижних
конечностей
Тромбофилии
в качестве алгоритма Всероссийским съездом хирургов (2000) и
Всероссийским съездом анестезиологов-реаниматологов (2000). Это
необходимо для выделения группы пациентов, которым показана
специфическая антикоагулянтная профилактика послеоперационных
венозных тромбозов.
Установив степень риска, следует определить необходимые в
данном случае профилактические меры. Существенное значение имеет
степень гидратации организма пациента. Предоперационная
подготовка должна предусматривать компенсацию нарушений водного
баланса и достижение оптимальной, с точки зрения реологии крови,
величины гематокрита. Использование нормоволемической гемоди-
люции (оптимальная величина Ht перед началом операции 27-29%)
уменьшает риск тромботических осложнений. С учётом
хирургической ситуации и риска послеоперационного тромбоза необходимо
выбрать оптимальный метод операционного обезболивания. По
возможности следует отдать предпочтение регионарной анестезии.
Дальнейшие мероприятия зависят от степени риска тромбоэмбо-
лических осложнений (табл. 4-2). Помимо неспецифических мер,
направленных на устранение застоя венозной крови в нижних
конечностях, используют обычный нефракционированный гепарин либо
низкомолекулярные гепарины.
Перед операцией нужно забинтовать эластическим бинтом
нижние конечности больного либо надеть специальные противотромбоз-
ные эластические чулки.
Профилактическое введение антикоагулянтов в ближайшем
послеоперационном периоде следует продолжать до полной
активизации пациента, минимально — 7 дней. В экстренной хирургии и
случаях высокой опасности интраоперационного кровотечения
допустимо назначение антикоагулянтов после завершения
хирургического вмешательства, но не позже чем через 12 ч.
Традиции и перспективы развития хирургии ♦ 145
Таблица 4-2. Способы профилактики венозных тромбоэмболических
осложнений
Риск
Низкий
Умеренный
Высокий
Особые случаи
Способы профилактики
• Ранняя активизация больных*
• Эластическая компрессия нижних конечностей*
• Низкомолекулярные гепарины; эноксапарин-натрий
20 мг либо далтепарин натрий 2500 ME, либо надропарин
кальций 0,3 мл 1 раз в день подкожно, или
• Нефракционированный гепарин 5000 ЕД 2-3 раза в день
подкожно или
• длительная прерывистая пневмокомпрессия ног
• Низкомолекулярные гепарины: эноксапарин-натрий
40 мг либо далтепарин натрий 5000 ME, либо надропарин
кальций 0,4—0,6 мл 1 раз в день подкожно или
• Нефракционированный гепарин 5000—7500 ЕД 3-4 раза
в день подкожно
+ Методы ускорения венозного кровотока
• Лечебные дозы низкомолекулярных гепаринов или не-
фракционированного гепарина
+ Парциальная окклюзия нижней полой вены
(имплантация фильтра, пликация нижней полой вены)
* Указанные мероприятия следует проводить всем без исключения
пациентам.
При наличии противопоказаний к антикоагулянтной терапии
(тяжёлая анемия, геморрагический синдром, тромбоцитопения и
др.) больным с высоким риском послеоперационных
тромбоэмболических осложнений следует проводить неспецифическую
профилактику (меры, направленные на ускорение венозного кровотока,
предпочтительно — прерывистая пневмокомпрессия нижних
конечностей). При подтверждённом эмболоопасном тромбозе глубоких
вен нижних конечностей (см. главу 37) следует рассмотреть вопрос
о целесообразности имплантации кава-фильтра для
профилактики ТЭЛА.
Эффективная мера предотвращения тромбоза глубоких вен
нижних конечностей — двигательная активность пациента, поэтому
хирург и анестезиолог должны приложить максимум усилий для
максимально ранней активизации больного после хирургического
вмешательства.
146 ♦ Хирургические болезни ♦• Том 1 <> Часть I ♦ Глава 1
Послеоперационные тошнота и рвота
Послеоперационные тошнота и рвота существенно ухудшают
течение послеоперационного периода и могут быть причиной
серьёзных осложнений, таких как аспирация, нарушения гемодинамики
вследствие повышения внутричерепного, внутрибрюшного или внут-
ригрудного давления, могут провоцировать кровотечение.
К основным факторам, вызывающим послеоперационные тошноту
и рвоту, относят ингаляционные и внутривенные анестетики,
наркотические анальгетики, центральные аналептики, антихолинэстераз-
ные препараты. Послеоперационные тошнота и рвота возможны и
при регионарной анестезии как следствие интраоперационной гипо-
тензии. Достаточно высок риск тошноты и рвоты у женщин, а также
в тех случаях, когда известно, что пациента укачивает в транспорте.
У курящих пациентов и пациентов пожилого возраста риск
возникновения послеоперационных тошноты и рвоты ниже.
Для профилактики послеоперационных тошноты и рвоты
используют селективные антагонисты серотониновых рецепторов.
Наиболее доступны трописетрон и ондансетрон. Применяемые в дозе 4 мг
в период индукции анестезии, эти препараты снижают частоту
послеоперационной рвоты до 3—5%, тошноты — до 10%. При отсутствии
антисеротониновых антиэметических препаратов возможно
использование небольших доз дроперидола (2,5 мг в составе премедикации
или во время индукции анестезии).
ПРИНЦИПЫ ЛЕЧЕНИЯ БОЛЬНЫХ
В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ
Лечебные меры, предпринимаемые в послеоперационном
периоде, можно условно подразделить на несколько основных
элементов:
1) интенсивное наблюдение;
2) поддержание функций основных систем организма и
интенсивная терапия различных синдромов;
3) послеоперационное обезболивание;
4) профилактика и лечение инфекционных осложнений;
5) нутритивная поддержка.
Борьба с инфекцией достаточно подробно представлена в главе
поэтому в данном разделе будут освещены остальные вопросы,
учитывающие основные принципы послеоперационной терапии:
интенсивное наблюдение, непрерывность лечения, замещение жизненно
важных функций организма.
Интенсивное наблюдение
Тщательное наблюдение за больным в послеоперационном
периоде необходимо для проведения грамотной и эффективной терапии,
раннего распознавания осложнений и своевременного их лечения.
Чем более критическим представляется состояние больного, тем
разностороннее и глубже должна быть информация о деятельности
основных систем организма.
Регистрацию всех необходимых показателей можно подразделить
на постоянную и периодическую.
• Постоянную информацию обеспечивают мониторные системы
(регистрирующие ЭКГ, пульс, параметры дыхания,
электроэнцефалографию, АД и ЦВД, иногда СВ, давление в лёгочной артерии и др.),
способные не только фиксировать величину показателя, но и дать
сигнал тревоги при её выходе за пределы безопасности.
• Периодическая информация включает как функциональные (ОЦК
и его компоненты, СВ, вентиляционно-перфузионные отношения
148 ♦ Хирургические болезни О Том 1 ♦ Часть I <0> Глава 5
в лёгких, диурез и другие показатели почек), так и биохимические
параметры (основные константы крови, кислотно-основное
состояние, водно-электролитный баланс, содержание билирубина,
мочевины, креатинина, глюкозы, индексы свёртывания крови, ос-
мо- и онкотическое давление и пр.). Периодическую информацию
собирают не реже 3 раз в сутки, а при необходимости и чаще,
контролируя как состояние больного, так и действенность
интенсивной терапии.
Для объективной оценки состояния больных и эффективности
проводимой терапии широко используют интегральные
системы-шкалы. Они позволяют определить степень дисфункции различных
органных систем и могут служить основой суждения о прогнозе. Наиболее
широкое практическое применение получила система APACHE II
(Acute Physiology and Chronic Health Evaluation — оценка острых и
хронических изменений состояния здоровья), включающая
определение температуры тела, показателей гемодинамики и функций
дыхания, электролитный и газовый состав крови, оценку функций ЦНС
с помощью шкалы Глазго. В шкале также учитывается влияние
возраста и сопутствующих хронических заболеваний (табл. 5-1).
Оценку физиологических функций осуществляют с помощью 12
показателей, полученных в первые 24 ч нахождения больного в
отделении реанимации и интенсивной терапии. Наибольшие отклонения
от нормы каждого показателя, выраженные в баллах, суммируют для
получения балльной оценки тяжести состояния пациента.
Значение возраста оценивают по 6-балльной шкале, а значение
сопутствующих заболеваний — по пяти дополнительным критериям
в зависимости от вовлечения основных систем организма.
Окончательный результат тестирования по системе APACHE II
определяется суммой баллов трёх составных её частей.
Сумма баллов ниже 11 соответствует средней тяжести
(прогнозируемая летальность около 10%), более 20 баллов — критическому
состоянию (при 22 баллах прогнозируемая летальность 50%), сумма
баллов более 39 связана практически со 100% летальностью.
Синдромный принцип интенсивной терапии
Объектом интенсивной терапии обычно является сочетание
различных синдромов, отражающих нарушения функций как отдельных
органов, так и целых систем.
Принципы лечения больных в послеоперационном периоде ^ 149
Неадекватность ОЦК
Один из важнейших синдромов, с которым приходится
сталкиваться у хирургических больных, — неадекватность ОЦК или его
компонентов. На её устранение направлена инфузионная терапия,
задачами которой являются: 1) восстановление и поддержание
нормального объёма и состава внутри- и внеклеточной жидкости, в том числе
циркулирующей крови; 2) улучшение реологических свойств крови;
3) профилактика и лечение нарушений функций печени, почек,
поджелудочной железы и кишечника; 4) дезинтоксикация; 5)
парентеральное питание.
Первоначальный объём инфузии зависит от выраженности гипо-
волемии и наиболее точно может быть определён на основании
исследования ОЦК. Если такой возможности нет, то ориентируются на
величину суточной потребности в жидкости [её легко определить по
формуле: суточная потребность в мл = (40 + масса тела в кг)х24].
Описанные в главе 3 критерии адекватности восполнения объёма
позволят скорректировать эту величину.
Состав вводимых растворов зависит от обнаруженных сдвигов
компонентов ОЦК, содержания электролитов, биохимических констант
крови, а также суточных потребностей в калориях (25—30 ккал/кг),
белках, жирах, углеводах, витаминах и основных электролитах.
В первую очередь необходимо устранить гиповолемию,
являющуюся одной из причин нестабильности гемодинамики. Потери
жидкости у больных с хирургической патологией (кишечная непроходимость,
гнойный перитонит, стеноз привратника и др.) могут составлять 3-5 л
(достигая в отдельных случаях 10—12 л). Поэтому инфузионную
терапию первоначально проводят в объёме предполагаемых потерь под
контролем АД, ЦВД, пульса, диуреза, величины Ht. В последующем
определению необходимого объёма помогает учёт потерь (с мочой,
калом, рвотой, перспирацией) и суточных потребностей. Инфузион-
ные среды включают альбумин, плазму, препараты декстрана (поли-
глюкин, реополиглюкин) и гидроксиэтилированного крахмала,
полиионные растворы с хлоридом калия, гипертонический раствор
хлорида натрия и др. В дальнейшем к ним необходимо добавить
средства парентерального питания: гидролизаты белков, растворы
аминокислот, жировые эмульсии, высококонцентрированную глюкозу
(10—20% растворы с добавлением инсулина). Следует иметь в виду, что
концентрированные растворы глюкозы можно вводить толькй в
центральные вены, а скорость вливания не должна превышать 0,5—1,0 г
глюкозы на 1 кг массы тела в течение 1 ч.
150 О Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 5
Таблица. 5—1. Оценочные критерии системы APACHE-11
Показатель
Температура (внутренняя)
Среднее АД, мм рт. ст.
(АДС0=(2Д + С)/3)
ЧСС (/мин)
Частота дыхания (/мин)
Оксигенация (мм рт. ст.)
a. FiO2>50%, то A-aD02= (Fi02x713)-
paC02-Pa02
или
b. FiO2<50%, писать только Ра02
рН артериальной крови
или
НС03~ сыворотки (ммоль/л)
Na+ сыворотки (ммоль/л)
К+ сыворотки (ммоль/л)
Креатинин сыворотки (мг/100мл)
Гематокрит {%)
Лейкоциты (/мм3х1000 клеток)
Всего
Наихудший
показатель
a. A-aD02
или
Ь. Ра02
Баллы
■■■■.^■/:оу-:-'-\У'-:-:У'-- ■<^.>„^--.-.-
ШКАЛА КОМЫ ГЛАЗГО (ШКГ)
A. Открывание глаз С. Вербальная функция (без интубации)
4 - Произвольное 5 —Ориентирован и способен поддер-
3 — На обращенную речь жать беседу
2 - На болевой стимул 4 — Дезориентирован, может говорить
1 - Отсутствует 3 — Бессвязная речь
2 - Нечленораздельные звуки
1 — Реакция отсутствует
B. Двигательная реакция или
6 - Выполняет команды с. Вербальная функция
5 - Целенаправленная на (интубированные больные)
болевой раздражитель 5 - Вероятно, способен говорить
4 - Нецеленаправленная з - Сомнительная способность
на болевой раздражитель говорить
3 - Тоническое сгибание \ _ Нет реакции
на болевой раздражитель
2 - Тоническое разгибание
на болевой раздражитель ШКГ = А+В+С=
1 — Отсутствует
Оценка состояния нервной системы = 15—ШКГ =—
Сумма баллов состояния различных систем + Оценка состояния
нервной системы —Оценки острых физиологических изменений (APS)
APS Баллы
+4
>4Г
>160
>180
>50
>500
>7,7
>52
>180
>7
>3,5
>60
>40
+3
39°-40,9°
130-159
140-179
35-49
350-499
7,6-7,69
41-51,9
160-179
6-6,9
2-3,4
ВОЗРАСТ
Возраст
<44
45-54
55-64
65-74
>75
Баллы
0
2
3
5
6
Возраст Баллы
Принципы лечения больных в послеоперационном периоде ♦ 151
Значение
+ 2
110-129
110-139
200-349
155-159
1,5-1,9
50-59,9
20-39,9
+ 1
38,5°-38,9°
25-34
7,5-7,59
32-40,9
150-154
5,5-5,9
46-49,9
15-19,9
0
36°-38,4°
70-109
70-109
12-24
<200
>70
7,33-7,49
22-31,9
130-149
3,5-5,4
0,6-1,4
30-45,9
3-14,9
+ 1
34°-35,9°
10-11
61-70
3-3,4
+2
32°-32,9°
50-69
55-69
6-9
7,25-7,32
18-21,9
120-129
2,5-2,9
<0,6
20-29,9
1-2,9
Имеет ли больной какое-либо из ниже перечисленных
заболеваний?
Печень - Цирроз с портальной гипертензией или
энцефалопатия?
Да?П □ Нет?
ССС - IV класс по Нью-йоркской классификации
Да?П □ Нет?
Легкие — хронические обструктивные или рестриктивные
заболевания или хроническая гипоксемия, гиперкапния или по-
лииитемия, легочная гипертензия , ЛАД > 40 мм рт.ст.
Да?П □ Нет?
Почки - хронический перитонеальный или гемодиализ
Да ? □ □ Нет ?
Иммунная система — иммунодефицитные состояния
Да?П □ Нет?
При любом положительном ответе к общему числу баллов
необходимо добавить:
А. 5 баллов для неоперированных больных и для больных
после экстренных операций;
Б. 2 балла для больных после плановых операций.
При всех отрицательных ответах прибавлять 0
ХРОНИЧЕСКИЕ ЗАБОЛЕВАНИЯ Баллы
+ 3
30е—31,9е
40-54
55-60
7,15-7,24
15-17,9
111-119
+4
<29,9°
<49
<39
<5
<55
<7,15
<15
<110
<2,5
<20
<1
ШКАЛА APACHE II
APS Баллы
ВОЗРАСТ Баллы
ХРОНИЧЕСКИЕ
ЗАБОЛЕВАНИЯ
Баллы
Всего
APACHE II
152 О Хирургические болезни -О- Том 1 -О- Часть I -0- Глава 5
Синдром миокардиальной недостаточности
Синдром миокардиальной недостаточности имеет достаточно
чёткие клинические проявления: одышка, цианоз, артериальная ги-
потензия или нестабильное АД, тенденция к повышению ЦВД,
тахикардия. Прогрессирование миокардиальной недостаточности
заставляет прибегнуть к введению стимуляторов адренорецепторов
(допамина, норэпинефрина, добутамина, а при их отсутствии — эпи-
нефрина) с нитратами (нитроглицерином, нитропруссидом натрия).
После кардиохирургических вмешательств, в случае, если кардио-
тоники оказываются неэффективными, применяют внутриаортальную
баллонную контрпульсацию или вспомогательное искусственное
кровообращение.
Синдром расстройств микроциркуляции
Синдром расстройств микроциркуляции характеризуют холодная
влажная кожа землистой или бледно-серой окраски с мраморным
рисунком, выраженное снижение температуры большого пальца
стопы и увеличение градиента при сравнении с температурой тела,
соответствующие биохимические изменения (накопление лактата,
метаболический ацидоз). В лечении синдрома большое значение имеет
нормализация ОЦК. При соблюдении этого условия на первый план
выступает применение реологически активных инфузионных
препаратов (реополиглюкин) в сочетании с метилксантинами.
Синдром дыхательной недостаточности
Синдром дыхательной недостаточности находит выражение в
широком спектре клинических проявлений — от незначительных
признаков в виде небольшой одышки и лёгкого снижения ра02 до
полной несостоятельности газообменной функции лёгких (синдром
шокового лёгкого). В соответствии с этим варьируют объём и
интенсивность терапии, которая начинается ещё в операционной, где
анестезиолог должен предпринять меры для профилактики
шокового лёгкого с помощью ИВЛ с положительным давлением в конце
выдоха, а также обеспечить хорошее расправление лёгких в конце
операции и тщательный туалет дыхательных путей.
Последующая тактика зависит от состояния больного, наличия или
отсутствия признаков дыхательной недостаточности. В ряде случаев
целесообразно прибегнуть к продлённой ИВЛ.
Принципы лечения больных в послеоперационном периоде О 153
Ранняя активность больного в сочетании с хорошей аналгезией в
немалой степени способствует нормализации функций лёгких.
Полезно проведение дыхательной гимнастики, оксигенотерапии,
раздувание резиновой детской игрушки или выдох через узкую трубку.
Важным элементом терапии, особенно при продуктивном процессе
в бронхах, является применение специальных методов массажа
грудной клетки (постукивание, поколачивание, вибромассаж) в
сочетании со стимуляцией кашля, бронхолитиками, муколитиками и
ингаляционной увлажняющей терапией. В более тяжёлых случаях массаж
грудной клетки сочетают с сеансами вспомогательной ИВЛ.
Нарушения функций почек
В послеоперационном периоде приходится встречаться с двумя
основными вариантами нарушений мочеотделительной функции.
Олигурия
Олигурия — снижение объёма мочеотделения менее 0,5 мл/кг/ч.
Наиболее частая её причина (при отсутствии сопутствующих
заболеваний почек и хронической почечной недостаточности) — гиповоле-
мия. В этих случаях целесообразно быстрое внутривенное введение
250-500 мл кристаллоидных растворов, что, кроме лечебной цели,
может служить и дифференциально-диагностическим тестом.
Введение диуретиков оправдано лишь при наличии у больных сердечной
или хронической почечной недостаточности. В других случаях
диуретики могут усиливать гипоперфузию почек и отрицательно
воздействовать на их функции.
При сохранении олигурии, несмотря на адекватное восполнение
ОЦК, необходим дальнейший диагностический поиск её причины.
• Преренальная олигурия связана со снижением перфузии почек.
Кроме гиповолемии, её причинами могут быть синдром малого СВ,
развитие в послеоперационном периоде тяжёлого сепсиса и
септического шока, синдром интраабдоминальной гипертензии.
• Ренальная олигурия в послеоперационном периоде, прежде всего,
обусловлена острым тубулярным некрозом, причиной которого
могут быть сепсис, действие нефротоксических лекарственных средств
(аминогликозидных антибиотиков, рентгеноконтрастных
препаратов), миоглобинурия.
• Постренальные причины олигурии включают обструкцию катетера
и травматические повреждения мочевыводящих путей.
154 ♦ Хирургические болезни ♦ Том 1 ♦ Часть! О Глава 5
Полиурия
Полиурия -- значительное увеличение мочеотделения в
послеоперационном периоде, встречается значительно реже. Она может иметь
несколько причин.
• Избыточная по объёму инфузионная терапия.
• Фармакологический диурез, связанный с введением лекарственных
средств.
• Быстрая ликвидация обструкции мочевыводящих путей.
• Полиурическая почечная недостаточность, возникающая в
ряде случаев в ранней фазе острого тубулярного некроза как
следствие снижения концентрационной функции канальцев.
Полиурия такого генеза может быть маркёром повреждения почек при
сепсисе.
• Осмотический диурез, вызываемый гипергликемией, алкогольной
интоксикацией, введением гипертонических растворов, в
частности препаратов для парентерального питания.
Замедленное пробуждение
в посленаркозном периоде — депрессия ЦНС
Основная причина этого синдрома — остаточное действие
препаратов для анестезии. Однако длительное сохранение депрессии ЦНС
в посленаркозном периоде заставляет думать и о других её причинах —
прежде всего о циркуляторной или дисметаболической
энцефалопатии. Её развитие в послеоперационном периоде чаще всего может
быть следствием вовлечения ЦНС в синдром полиорганной
дисфункции, связанный с сепсисом или тяжёлыми системными
метаболическими расстройствами, в частности, гипогликемией,
нарушениями электролитного или кислотно-основного баланса.
Послеоперационный делирий
Послеоперационный делирий нередко развивается у больных с
деструктивным панкреатитом и у хирургических больных с
лекарственной или алкогольной зависимостью. Ятрогенными причинами
делириозного состояния у хирургических больных может быть
применение ряда лекарственных средств, в частности кетамина, дропе-
ридола, опиоидов, бензодиазепинов, метоклопрамида, атропина,
больших доз блокаторов Н,-рецепторов гистамина.
Приниипы лечения больных в послеоперационном периоде ♦ 155
Делирий может быть проявлением гипоксии, ацидоза, нарушений
электролитного баланса (гипонатриемии), гипогликемии, сепсиса,
выраженного болевого синдрома. Лечебные мероприятия зависят от
причины делирия и, прежде всего, включают адекватную оксигена-
цию, коррекцию электролитных и метаболических расстройств, анал-
гезию. В качестве антипсихотических средств могут быть
использованы галоперидол, диазепам или лоразепам.
Принципы аналгезии
в послеоперационном периоде
Сами по себе болевые ощущения после операции составляют лишь
часть проблемы; следует помнить, что последствия некупированной
боли могут быть достаточно драматичными: существенно
увеличивается риск развития лёгочных, кардиальных, желудочно-кишечных,
тромбоэмболических и гнойно-септических осложнений. Адекватно
обезболенные пациенты в состоянии двигаться, довольно глубоко
дышать и эффективно откашливаться, что снижает риск развития
лёгочных и тромботических осложнений.
Методы послеоперационного обезболивания перечислены ниже.
• Парентеральное введение опиатов и опиоидов:
- внутримышечное введение (инъекции по требованию);
внутривенное болюсное введение;
длительная внутривенная инфузия;
- контролируемая пациентом аналгезия.
• Непарентеральное введение опиатов и опиоидов:
- щёчное/подъязычное;
пероральное;
трансдермальное;
- назальное;
- ингаляционное;
- внутрисуставное.
• Способы регионарной анестезии:
- эпидуральное введение местных анестетиков;
- эпидуральное введение опиатов и опиоидов.
• Назначение НПВС:
- внутримышечное;
внутривенное;
пероральное.
156 -0- Хирургические болезни ♦ Том 1 -О- Часть!
• Введение а2-адренергических агонистов:
— системное;
— эпидуральное.
• Нефармакологические методы:
— криотерапия;
— чрескожная электростимуляция нервов;
— психологические методы.
Лекарственные препараты, наиболее часто используемые для
послеоперационной аналгезии: НПВС, опиаты и опиоиды
(наркотические анальгетики), местные анестетики, центральные ос-адреноми-
метики (клонидини его аналоги), ингибиторы протеаз,
вспомогательные лекарственные средства (бензодиазепины, кофеин, фенитоин,
карбамазепин, фенотиазины, бутирофеноны).
Опиаты и опиоиды
Опиаты и опиоиды широко используют в целях обезболивания в
послеоперационном периоде.
Препараты
Морфин применяют обычно в дозе 10 мг внутримышечно, действие
его продолжается 3—5 ч. Высшие дозы для взрослых: разовая — 0,02 г,
суточная — 0,05 г. Наиболее важные побочные эффекты — угнетение
дыхания, тошнота и рвота. Хотя морфин имеет ряд нежелательных
побочных эффектов, он является отличным анальгетиком, в
сравнении с ним оценивается действие всех остальных опиоидов.
Тримеперидин применяют обычно в дозе 20 мг внутримышечно,
что вызывает 3—4-часовую аналгезию. По аналитической
активности он несколько слабее морфина, но значительно менее
токсичен, в меньшей степени угнетает дыхательный центр, реже
вызывает рвоту.
Морфин + Наркотин + Папаверин + Кодеин + Тебаин
представляет собой смесь гидрохлоридов алкалоидов опия, где на долю
морфина приходится около 50%, препарат применяют в дозе 20 мг. Высшие
дозы для взрослых: разовая — 0,03 г, суточная — 0,1 г. Препарат
обладает меньшей аналитической активностью, чем морфин и
тримеперидин, что обусловливает его меньшую популярность.
Бупренорфин по аналитической активности превосходит
морфин в 30—40 раз, его разовая доза составляет при внутримышечном
Принципы лечения больных в послеоперационном периоде ♦ 157
и внутривенном введениях 0,3-0,6 мг, при сублингвальном — 0,2-
0,4 мг. Важное преимущество препарата — возможность его
применения в различных формах — внутримышечное, внутривенное,
сублингвальное введения, а также в форме назального спрея.
Длительность действия препарата 6—8 ч. Отличительная особенность
бупренорфина — высокое сродство к ц-опиоидным рецепторам,
вследствие чего депрессия дыхания, вызванная бупренорфином, лишь
частично устраняется высокими дозами конкурентного
антагониста налоксона.
Трамадол используют в дозах 100—200 мг на 70 кг массы тела.
После внутривенного введения болеутоляющее действие развивается
через 5-10 мин, Т|/2 составляет около 6 ч. На фоне приёма трамадола
отмечают стабильность параметров кровообращения. Препарат
также используют для купирования мышечного тремора в ближайшем
постнаркозном и послеоперационном периодах.
Буторфанол применяют в дозе 2 мг (внутривенно или
внутримышечно), продолжительность действия 3—4 ч. Аналитическая
активность препарата в 5—7 раз выше морфина. Препарат оказывает
незначительное депрессивное влияние на функцию дыхания. Имеет
низкий наркогенный потенциал, не влияет на моторику ЖКТ и
тонус сфинктеров. Вместе с тем неблагоприятно воздействует на
гемодинамику, может вызвать дисфорию.
Налбуфин по аналитической активности эквивалентен морфину.
Обладает крайне низкой степенью развития привыкания и
минимальным влиянием на гемодинамику. Вызывает незначительное
угнетение дыхания, не имеющее клинического значения.
Способы введения наркотических анальгетиков
Внутримышечный способ
Наиболее часто используемый метод аналгезии в
послеоперационном периоде — традиционное внутримышечное введение опиоидов.
Как правило, для этого используют морфин, тримеперидин.
Достоинства традиционной аналгезии — лёгкость применения, дешевизна
метода, а также постепенное развитие побочных эффектов, что даёт
больше возможностей борьбы с ними. Между тем, эта методика
часто приводит к неадекватному обезболиванию: более 60% пациентов
отмечают неудовлетворительное качество послеоперационной
аналгезии. Причины этого кроются во введении фиксированных доз без
учёта фармакологической вариабельности, часто с большими пере-
Хирургические болезни ♦ Том 1 -0- Часть I ♦ Глава 5
рывами, т.е. когда уже произошёл «прорыв» боли. Немаловажным
моментом является также то, что при внутримышечном пути
введения начало обезболивания замедленное.
Внутривенный способ
Болюсное введение — наиболее быстрый способ достижения анал-
гезии. Этот метод применяют для аналгезии пациентов,
находящихся на ИВЛ. Угнетение дыхания в такой ситуации является не
недостатком, а преимуществом.
Контролируемое пациентом обезболивание — метод,
использующий быстрый аналитический эффект болюсного введения. Пациент
определяет скорость внутривенного введения препарата,
обеспечивая тем самым контроль с обратной связью. Прибор для
контролируемого пациентом обезболивания включает точный источник инфу-
зии и контролируемое устройство пациент-прибор. Для ограничения
устанавливаемой дозы и числа введений, а также интервала между
ними предусмотрено специальное устройство безопасности. При
контролируемом пациентом обезболивании устранение боли
обеспечивается значительно лучше, чем при обычном методе периодического
внутримышечного введения анальгетика.
Трансдермальный метод
Трансдермально применяют фентанил, который легко
проникает через кожу. Наклейки с фентанилом позволяют поддерживать
постоянную концентрацию препарата в крови с помощью
системы, которую заменяют каждые 3 сут. Трансдермальная система
высвобождает препарат со скоростью 25 мкг/ч. Максимальный
болеутоляющий эффект после наложения наклейки развивается в
течение 24—72 ч. Ввиду широкой фармакологической
вариабельности такого пути у разных пациентов этот метод мало пригоден
для контроля острой боли. Метод более применим для устранения
хронической боли при злокачественных заболеваниях в
терминальной стадии.
Ректальный способ
Ректальное введение опиоидов широко не применяют. Из прямой
кишки опиоиды быстро всасываются и попадают в систему нижней
полой вены, а затем, минуя печень, в системный кровоток. Имеется
значительная вариабельность достигаемой плазменной концентрации
риниипы лечения больных в послеоперационном периоде ♦ 159
препарата. Считают, что основное показание к ректальному
введению опиоидов — трудно контролируемая хроническая боль,
сопровождающаяся дисфагией.
Сублингвальный способ
Сублингвальное применение бупренорфина позволяет достичь
хорошего уровня аналгезии. Метод может быть использован в
период подготовки и проведения операции, а также в
послеоперационном периоде.
Послеоперационная регионарная аналгезия
Длительная эпидуральная аналгезия — эффективный метод
купирования острой боли после операции. Эта методика абсолютно
показана пациентам с высоким риском развития
сердечно-лёгочных осложнений после торакальных, ортопедических,
абдоминальных операций. В этом способе нуждаются 10% хирургических
больных.
В настоящее время в клинических условиях для эпидурального
обезболивания используют местные анестетики, адренергические
агонисты и опиоидные агонисты. Местные анестетики, такие как
лидокаин и бупивакаин, высокоэффективны для достижения и
поддержания адекватной аналгезии. Применение лидокаина
ограничено коротким периодом действия, высокой вероятностью развития
тахифилаксии и появления симптомов общей интоксикации,
выраженным моторным блоком. Отличительные особенности бупивака-
ина при эпидуральном введении — большая продолжительность
действия и относительно дифференцированное выключение сенсорных
волокон при сохранении моторной функции. Бупивакаин является
почти идеальным средством для эпидуральной аналгезии в
послеоперационном периоде, однако он не лишён побочных эффектов, в
частности высокой кардиотоксичности.
Ропивакаин обладает меньшей токсичностью и большей
продолжительностью действия, чем бупивакаин. Способность ропивакаи-
на вызывать дифференцированный блок определила его
клиническое преимущество над бупивакаином для эпидуральной инфузии
в послеоперационном периоде. Ропивакаин в концентрации 2 мг/мл,
вводимый со скоростью 8—12 мл/ч, позволяет обеспечить
оптимальный балланс между адекватной аналгезией и минимальным мотор-
; ным блоком.
160 0- Хирургические болезни ♦ Том 1 ♦ Часть I <г Глава 5
С целью улучшения качества послеоперационного обезболивания
без увеличения частоты побочных эффектов к местным анестетикам
добавляют опиатные и опиоидные аналгетики. Методики,
основанные на введении опиоидов в эпидуральное пространство,
представляют собой либо болюсное введение таких препаратов, как
морфин или продолжающуюся инфузию липофильных опиоидов, таких
как фентанил.
Кроме того, используют различные комбинации вышеуказанных
препаратов в малых дозах с целью достижения синергистического
аналитического эффекта. Наиболее часто комбинируют 0,125% бу-
пивакаин или 0,2% ропивакаин с морфином, фентанилом. Доказано,
что добавление к опиоидам а-адренопозитивных препаратов (клони-
дина) позволяет уменьшить их дозу.
Эпидуральный катетер, как правило, удаляют через 3—7 сут. Эпи-
дуральную аналгезию заменяют пероральным приёмом НПВС и
других препаратов.
Нестероидные противовоспалительные средства
НПВС следует рассматривать как одно из наиболее
перспективных и действенных патогенетических средств защиты
периферических болевых рецепторов. Механизм их действия связан с ин-
гибированием синтеза простагландинов, сенсибилизирующих эти
рецепторы.
За последние десятилетия были созданы новые препараты для
парентерального введения из группы НПВС (кеторолак, кетопрофен),
выделяющиеся своей аналитической активностью, которые наравне
с опиоидными аналгетиками могут применяться для купирования
послеоперационной боли. По сравнению с опиоидами их основные
преимущества — минимальное влияние на кровообращение и
дыхание, моторику ЖКТ и тонус сфинктеров, отсутствие наркогенного
потенциала.
Для послеоперационной аналгезии можно использовать
комбинацию средств, действующих на разные участки передачи боли: на
периферии, на соматические и симпатические нервы, на уровне
спинного и головного мозга. Преимущество такого подхода в том, что он
обеспечивает отличную аналгезию, а дозу каждого из препаратов
можно уменьшить. Передача боли может блокироваться путём подаате-
ния механизмов периферических болевых рецепторов с помощью
НПВС, блокадой афферентной нейронной передачи при регионар-
Принципы лечения больных в послеоперационном периоде О 161
ном блоке, а также воздействием опиоидов на уровне спинного
мозга (регионарное введение) и высших центров при системном
использовании.
Методика сбалансированной аналгезии показана при обширных
хирургических вмешательствах. Она не требуется после небольших
операций, когда достаточно предупреждающей аналгезии (см. главу
4) НПВС и использования того же НПВС в послеоперационном
периоде.
* * *
Заключая обзор интенсивной послеоперационной терапии,
следует особо выделить положение, являющееся основой клинической
медицины. Самая своевременная и рациональная интенсивная
терапия не будет эффективной без устранения основной причины
возникновения ухудшения состояния больного, будь то кровотечение,
острое развитие синдрома интраабдоминальной гипертензии,
пневмоторакс, очаг инфекции, продолжающийся перитонит и т.д. Крайнюю
опасность представляют несвоевременная диагностика и запоздалое
хирургическое лечение этих угрожающих жизни состояний.
ОСТРЫЙ АППЕНДИЦИТ
Острый аппендицит — воспаление червеобразного отростка
слепой кишки, одно из самых распространённых хирургических
заболеваний. Наиболее часто острый аппендицит встречают в возрасте от
20 до 40 лет, женщины болеют в 2 раза чаще мужчин. Летальность
составляет 0,1—0.3%, послеоперационные осложнения встречают в
5—9% случаев.
Этиология
Причины возникновения острого аппендицита до сих пор
окончательно не установлены. Определённую роль играет
алиментарный фактор. Пища, богатая животным белком, способствует
нарушению эвакуаторной функции кишечника, что следует считать
предрасполагающим фактором в развитии заболевания. В детском
возрасте некоторую роль в возникновении аппендицита играет
глистная инвазия.
Основной путь инфицирования стенки отростка энтерогенный.
Гематогенный и лимфогенный варианты инфицирования встречают
достаточно редко, они не играют решающей роли в генезе
заболевания. Непосредственными возбудителями воспаления становятся
разнообразные микроорганизмы (бактерии, вирусы, простейшие),
находящиеся в отростке. Среди бактерий чаще всего (до 90%)
обнаруживают анаэробную неспорообразующую флору (бактероиды и
анаэробные кокки). Аэробную флору встречают реже (6—8%), она
представлена кишечной палочкой, клебсиеллой, энтерококками и др.
Классификация
Клинико-морфологические формы аппендицита:
• катаральный;
• флегмонозный;
• гангренозный.
АБДОМИНАЛЬНАЯ
ХИРУРГИЯ
Острый аппендицит О 163
Осложнения:
• перфорация;
• разлитой перитонит;
• аппендикулярный инфильтрат;
• абсцессы брюшной полости (периаппендикулярный, тазовый,
поддиафрагмальный, межкишечный);
• забрюшинная флегмона;
• пилефлебит.
Формы острого аппендицита отражают степень (стадию) воспа
лительных изменений в червеобразном отростке. Каждая из них имеет
не только морфологические отличия, но и присущие ей клинические
проявления.
Патоморфология
и.
Острый катаральный аппендицит — начальная форма воспаления
червеобразного отростка. Макроскопически отросток утолщён, его
серозная оболочка тусклая, под ней видно множество наполненных
кровью мелких сосудов. На разрезе слизистая оболочка отростка
отёчна, серо-красного цвета, в подслизистом слое иногда видны пятна
кровоизлияний. В просвете червеобразного отростка нередко
содержится сукровичного вида жидкость. Микроскопически выявляют
небольшие дефекты слизистой оболочки, покрытые фибрином и
лейкоцитами, умеренную лейкоцитарную инфильтрацию подслизисто-
го слоя. Иногда в брюшной полости обнаруживают прозрачный
стерильный реактивный выпот.
При остром флегмонозном аппендиците отросток значительно
утолщён, серозная оболочка и брыжеечка отёчны, ярко гипереми-
рованы. Червеобразный отросток покрыт наложениями фибрина,
такие же наложения могут быть на куполе слепой кишки,
париетальной брюшине и прилегающих петлях тонкой кишки. В брюшной
полости почти всегда выявляют выпот, часто мутный из-за большого
количества лейкоцитов. Выпот может быть инфицированным. В
просвете червеобразного отростка, как правило, содержится жидкий,
серого или зелёного цвета гной. Слизистая оболочка
червеобразного отростка отёчна, легко ранима, нередко удаётся увидеть
множественные эрозии и свежие язвы. Микроскопически во всех слоях
червеобразного отростка наблюдают массивную лейкоцитарную
инфильтрацию.
164 ^ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 6
Эмпиема червеобразного отростка — разновидность флегмонозно-
го воспаления, при котором в результате рубцового процесса или
закупорки каловым камнем в просвете отростка образуется замкнутая
полость, заполненная гноем. Морфологическая особенность этой
формы аппендицита заключается в том, что воспалительный процесс
редко переходит на брюшинный покров. Червеобразный отросток при
эмпиеме колбовидно вздут и резко напряжён, содержит большое
количество зловонного гноя. Наряду с этим серозная оболочка
червеобразного отростка выглядит как при катаральной форме острого
аппендицита: тусклая, гиперемированная, но без наложений
фибрина. В брюшной полости может быть серозный стерильный выпот. При
вскрытии червеобразного отростка изливается большое количество
зловонного гноя. Микроскопически в слизистой оболочке и подсли-
зистом слое выявляют значительную лейкоцитарную инфильтрацию,
убывающую по направлению к серозной оболочке.
Гангренозный аппендицит характеризуется некротическими
изменениями в органе. Тотальный некроз встречают сравнительно редко,
в подавляющем большинстве случаев зона некроза охватывает
небольшую часть отростка. Некрозу способствуют располагающиеся в
просвете отростка каловые камни и инородные тела. Макроскопически
некротизированный участок грязно-зелёного цвета, рыхлый и легко
рвётся, остальная часть червеобразного отростка выглядит так же, как
при флегмонозном аппендиците. На органах и тканях, окружающих
воспалённый червеобразный отросток, видны фибринозные
наложения. В брюшной полости часто содержится гнойный выпот с каловым
запахом. Посев этого выпота даёт рост типичной толстокишечной
флоры. Микроскопически в участке деструкции слои
червеобразного отростка не удаётся дифференцировать, они имеют вид типичной
некротизированной ткани, в остальных отделах отростка наблюдают
картину флегмонозного воспаления.
Катаральная стадия острого аппендицита обычно длится 6—12 ч.
Флегмонозный аппендицит развивается через 12 ч от начала
заболевания, гангренозный — через 24—48 ч.
Клиническая картина
Острый аппендицит характеризуется определённым симптомоком-
плексом, претерпевающим соответствующие изменения по мере
развития воспалительного процесса. Вместе с тем, возможны различные
стрый аппендиц
варианты расположения червеобразного отростка (рис. 6-1) в
брюшной полости (высокое, низкое, или тазовое, подпечёночное, ретро-
цекальное и др.), наличие некоторых симптомов заболевания прямо
зависит от локализации отростка.
Катаральный аппендицит
Постоянный симптом начальных стадий острого аппендицита —
боли в животе, заставляющие больного обратиться к врачу. Боли
возникают чаще всего вечером, ночью или в предутренние часы, что
связывают с преобладающим влиянием блуждающего нерва в это время
суток. Даже при типичном расположении червеобразного отростка в
правой подвздошной области боли очень редко начинаются
непосредственно в этом месте. Они, как правило, возникают в эпигастраль-
ной области или имеют блуждающий характер (по всему животу без
какой-либо определённой локализации). В начальном периоде боли
неинтенсивные, тупые, постоянные и лишь иногда могут быть
схваткообразными.
Через 2—3 ч от начала заболевания боли, постепенно усиливаясь,
перемещаются в правую подвздошную область — зону локализации
червеобразного отростка. Такое смещение болей характерно для
острого аппендицита и носит название симптома Кохера—Волковына.
В дальнейшем после концентрации болей в правой подвздошной
области они остаются там постоянно.
Рис. 6-1. Варианты
расположения червеобразного отростка:
/ — типичное; 2 — позади
слепой кишки (ретроцекальное);
3 — ретроперитонеальное; 4 —
подпечёночное; 5 — в малом
тазу; 6 — медиальное (среди
петель тонкой кишки); 7 — в
правом латеральном канале.
166 <0- Хирургические болезни -0- Том 1 ♦ Часть II ♦ Глав£ 6
В первые часы заболевания у 30-40% пациентов может быть
однократная рвота, в этой стадии носяшая рефлекторный характер;
Общее состояние больного страдает мало, обращает на себя
внимание влажный, густо обложенный язык. При осмотре живот не вздут
и равномерно участвует в дыхании. Отмечают зону гиперестезии в
правой подвздошной области (положительный симптом Раздольско-
го). При глубокой пальпации даже в самые первые часы заболевания
здесь же удаётся определить явную, иногда довольно значительную
болезненность. В этот период можно выявить некоторые
специальные симптомы, характерные для острого аппендицита.
• Симптом Ровзинга: левой рукой сквозь брюшную стенку
прижимают сигмовидную кишку к крылу левой подвздошной кости,
перекрывая её просвет. Правой рукой выше этой зоны производят
толчкообразные движения передней брюшной стенки. При этом
возникает боль в правой подвздошной области, что связывают с
перемещением газов, находящихся в толстой кишке.
• Симптом Ситковского заключается в появлении или усилении
болей в правой подвздошной области при положении больного на
левом боку.
• Симптом Бартомье—Михельсона: усиление болезненности при
пальпации правой подвздошной области в положении больного на
левом боку.
Один из ранних объективных симптомов острого аппендицита —
повышение температуры тела до 37—37,5 °С и лейкоцитоз в пределах
10-12-109/л.
Флегмонозный аппендицит
Флегмонозный аппендицит — наиболее частая клиническая
форма, с которой больные поступают в хирургический стационар. Боли
при флегмонозном аппендиците довольно интенсивны и постоянны.
Они чётко локализуются в правой подвздошной области и нередко
носят пульсирующий характер. Рвота для этой формы острого
аппендицита не характерна, больные жалуются на постоянное чувство
тошноты. Из анамнеза выявляют характерное начало заболевания
(симптом смещения болей Кохера—Волковича).
Пульс учащён до 80—90 в минуту. Язык обложен. Наряду с
описанными симптомами острого аппендицита появляются признаки
воспаления брюшины. При осмотре живота отмечают умеренное отставание
при дыхании передней брюшной стенки в правой подвздошной области.
а при поверхностной пальпации здесь же, кроме гиперестезии,
определяют защитное напряжение мышц брюшной стенки и симптом Щёт-
кина-Блюмберга. При быстром отдёргивании руки после мягкого
надавливания на брюшную стенку больной ощущает внезапное
усиление боли вследствие сотрясения брюшной стенки в области
воспалительного очага. Симптом Воскресенского (симптом «рубашки», или
«скольжения»): через рубашку больного быстро производят
скользящее движение рукой вдоль передней брюшной стенки от реберной
дуги до паховой связки справа и слева от пупка. При этом отмечают
значительное усиление болезненности в правой подвздошной
области. Температура тела может достигать 38-38,5 °С, количество
лейкоцитов 12-20- 109/л.
Гангренозный аппендицит
Гангренозный аппендицит характеризуется уменьшением или даже
полным исчезновением спонтанных болевых ощущений вследствие
отмирания нервных окончаний в червеобразном отростке. Наряду с
этим всасывание из брюшной полости большого количества
бактериальных токсинов приводит к постепенному нарастанию
симптомов системной воспалительной реакции. При исследовании живота
напряжение брюшной стенки в правой подвздошной области
становится менее интенсивным, чем при флегмонозном аппендиците, но
попытка глубокой пальпации немедленно вызывает резкое усиление
болей. Живот чаще всего умеренно вздут, перистальтика ослаблена
или отсутствует. Выражены симптомы Щёткина—Блюмберга и
Воскресенского. Положительными также могут быть симптомы Ровзин-
га, Ситковского, Бартомье—Михельсона.
Температура тела при гангренозном аппендиците нередко бывает
или нормальной (ниже 37 °С), или даже пониженной (до 36 °С).
Количество лейкоцитов значительно снижается (10-12*109/л) или
находится в пределах нормы (6—8-109/л), но воспалительный сдвиг в
лейкоцитарной формуле крови может достигать значительной
степени (увеличение количества палочкоядерных и появление юных форм
нейтрофилов). Для гангренозного аппендицита характерны так
называемые «токсические ножницы» — несоответствие выраженной
тахикардии (100—120 в минуту) температуре тела на фоне явных
признаков тяжёлого воспалительного процесса.
У лиц преклонного возраста иногда развивается так называемый
первично-гангренозный аппендицит. Он бывает результатом первичного
168 О Хирургические болезни О Том 1 ♦ Часть II ^ Глава 6
нарушения кровотока по артерии червеобразного отростка вследствие
тромбоза, т.е. по существу возникает инфаркт червеобразного
отростка, непосредственно переходящий в гангрену отростка, минуя
катаральную и флегмонозную формы острого аппендицита. В
последующем подвергшийся тотальному некрозу червеобразный отросток
может полностью отторгнуться от слепой кишки (так называемая
самоампутация отростка) и лежать свободно в брюшной полости.
Особенности клинического проявления атипичных форм
Эмпиема червеобразного отростка морфологически похожа на
флегмонозный аппендицит, но в клиническом отношении имеет
существенные отличия. При эмпиеме боли в животе не имеют
характерного смещения (отрицательный симптом Кохера-Волковича), а
начинаются непосредственно в правой подвздошной области,
достигают максимума лишь к 3—5-му дню заболевания, принимают
пульсирующий характер, характерен озноб с повышением температуры
тела до 38-39 °С.
При объективном исследовании брюшная стенка не напряжена,
отсутствуют симптомы раздражения брюшины. Симптомы Ровзин-
га, Ситковского, Бартомье—Михельсона чаще всего положительны.
При глубокой пальпации в правой подвздошной области иногда
удаётся прощупать резко утолщённый, болезненный червеобразный
отросток. Количество лейкоцитов в первые сутки остаётся нормальным,
в последующем наблюдают быстрое его увеличение до 20 * 109/л и выше
с нарастанием сдвига лейкоцитарной формулы влево.
Ретроцекальный аппендицит начинается с болей в эпигастральной
области или по всему животу, которые в последующем локализуются
в зоне правого бокового канала или поясничной области.
Типичные симптомы аппендицита не выявляют. Симптомы
раздражения брюшины также не выражены. Устанавливают напряжение
мышц в треугольнике Пти и симптом Образцова (появление болей в
правой подвздошной области во время поднимания и последующего
опускания больным вытянутой правой ноги).
Тазовый аппендицит встречают у 16% мужчин и 30% женщин.
Боли начинаются в эпигастральной области или по всему животу, а
через несколько часов локализуются над лобком либо над паховой
связкой справа. В связи с близостью прямой кишки и мочевого
пузыря нередко возникают частые позывы на стул и дизурические
расстройства.
При тазовом аппендиците воспалительный процесс быстро
отграничивается окружающими органами, поэтому при исследовании
живота далеко не всегда удаётся отметить напряжение мышц передней
брюшной стенки и другие симптомы раздражения брюшины.
Симптомы Ровзинга, Ситковского, Бартомье—Михельсона нехарактерны.
В части случаев оказывается положительным симптом Коупа —
болезненное напряжение внутренней запирательной мышцы (в
положении больного лежа на спине сгибают правую ногу в колене и ротируют
бедро кнаружи, что приводит к появлению боли в глубине таза справа
и над лоном). При подозрении на тазовый аппендицит
исключительную ценность приобретают пальцевые вагинальное и ректальное
исследования, выявляющие болезненность в области дугласова
пространства, наличие выпота или воспалительного инфильтрата в полости
малого таза, а также позволяющие оценить состояние гениталий и др.
Подпечёночное расположение червеобразного отростка
существенно затрудняет диагностику острого аппендицита. Болезненность в
области правого подреберья, наличие здесь же напряжения мышц и
симптома Щёткина—Блюмберга заставляют думать об остром
холецистите. Типичный для приступа острого аппендицита анамнез служит
отправной точкой для установления правильного диагноза. При
остром холецистите пальпируют увеличенный жёлчный пузырь, при
остром аппендиците какое-либо патологическое образование в животе не
определяют (исключение составляет аппендикулярный инфильтрат).
Левосторонний острый аппендицит наблюдают при обратном
расположении внутренних органов (situs viscerum inversus) или в случае
мобильной слепой кишки, имеющей длинную брыжейку. Типичные
для аппендицита симптомы выявляют в левой подвздошной
области. В случае истинного обратного расположения внутренних органов
при аппендэктомии разрез проводят в левой подвздошной области.
Дифференциальная диагностика
Острый аппендицит приходится дифференцировать почти от всех
острых заболеваний органов брюшной полости и забрюшинного
пространства. Это гастроэнтерит, острый панкреатит, прободная язва
желудка или двенадцатиперстной кишки, острый холецистит,
правосторонняя почечная колика, правосторонний пиелит (пиелонефрит),
терминальный илеит (болезнь Крона) в начальной стадии, дивер-
тикулит (воспаление дивертикула Меккеля) и др. Большое подспо-
170 ♦ Хирургические болезни ♦ Том 1 ^ Часть II ♦ Глава 6
рье в затруднительных случаях дифференциальной диагностики при
острой патологии органов брюшной полости оказывают УЗИ и
лапароскопия.
Лечение
Лечебная тактика при остром аппендиците заключается в
возможно более раннем удалении воспалённого червеобразного отростка.
Аппендэктомию, как и любое другое полостное
вмешательство, предпочтительнее выполнять под общей анестезией. При
невозможности наркоза допустимо выполнение операции под местной
анестезией.
Типичную аппендэктомию обычно проводят с помощью косого
переменного доступа Волковича—Дьяконова в правой подвздошной
области: линию, соединяющую пупок и переднюю верхнюю ость
подвздошной кости, делят на три равные части, на границе наружной и
средней третей этой линии перпендикулярно к ней проводят
кожный разрез. При этом его третья часть должна находиться выше
указанной линии, а две трети — ниже неё.
Длина кожного разреза для аппендэктомии составляет обычно 10-
12 см. Апоневроз наружной косой мышцы надсекают скальпелем и
вскрывают ножницами по ходу волокон. Внутреннюю косую и
поперечную мышцы разводят по ходу волокон без их пересечения. После
этого рассекают брюшину.
Проникнув в брюшную полость, отыскивают слепую кишку. Она
в отличие от тонкой кишки имеет три хорошо выраженные
продольные мышечные ленты {taenia coli). Основание червеобразного
отростка и начало его брыжеечки находятся в месте слияния всех трёх лент
на куполе слепой кишки. В связи с этим чаще всего вместе с куполом
слепой кишки удаётся извлечь в рану и червеобразный отросток.
После выведения червеобразного отростка в рану перевязывают бры-
жеечку, следя за тем, чтобы собственная артерия червеобразного
отростка обязательно вошла в лигатуру. Перевязав брыжеечку,
отсекают её от отростка на всём протяжении. Вслед за этим пережимают
зажимом основание червеобразного отростка и перевязывают его
(рис. 6-2, а), используя тонкий кетгут, викрил либо другую быстро
рассасывающуюся нить. Червеобразный отросток отводят кверху и,
отступя 1 — 1,5 см от его основания, накладывают круговой (кисетный)
серозно-мышечный шов, для чего используют нерассасывающуюся
Принципы лечения больных в послеоперационном периоде О 171
нить на атравматической игле (рис. 6-2, б). Затем на червеобразный
отросток накладывают зажим на 0,3—0,5 см выше лигатуры и
отсекают его (рис. 6-2, в). Культю червеобразного отростка смазывают
5% спиртовым раствором йода и погружают внутрь кисетного шва
(рис. 6-2, г). Поверх кисетного шва аналогичной синтетической
нитью на атравматической игле накладывают Z-образный шов. После
этого купол слепой кишки погружают в брюшную полость.
Рис. 6-2. Этапы аппендэктомии: а — перевязка червеобразного отростка у
основания; б — наложение кисетного шва на слепую кишку вокруг
основания отростка; в — отсечение отростка; г — культя отростка инвагинирована,
кисетный шов завязан.
172 ♦ Хирургические болезни ♦ Том 1 ♦ Часть! ♦ Глава 5
После вправления выведенной для манипуляций слепой кишки
тщательно осушают брюшную полость от выпота. Проводят контроль
гемостаза. Рану передней брюшной стенки ушивают.
Ретроградную аппендэктомию выполняют при невозможности
выведения всего червеобразного отростка за пределы брюшной
полости. Под основание червеобразного отростка подводят толстую
лигатуру. Затем, используя образовавшееся в брыжеечке отверстие, на
основание червеобразного отростка накладывают два зажима, и между
ними пересекают отросток. Вскрытый просвет червеобразного
отростка смазывают с обеих сторон 5% спиртовым раствором йода. Под
наложенным зажимом перевязывают культю червеобразного отростка и
погружают её пинцетом в кисетный шов. Сверху дополнительно
накладывают Z-образный шов. Погрузив культю червеобразного
отростка, вправляют купол слепой кишки в брюшную полость. Затем,
поэтапно накладывая на брыжеечку зажимы, отсекают от неё и удаляют
червеобразный отросток. По мере выделения червеобразного
отростка рассекают также фиксирующие его сращения, особенно около вер-
|хушки. Взятые в зажимы пряди брыжеечки перевязывают, лучше всего
с прошиванием. Таким образом, брыжеечка оказывается
перевязанной не одной, а несколькими лигатурами. Дальнейший ход
оперативного вмешательства не отличается от антеградной аппендэктомии.
Ретроперитонеальная аппендэктомии. В редких случаях
червеобразный отросток или его дистальная часть бывает расположена забрю-
шинно. В связи с этим удаление забрюшинно расположенного
отростка — наиболее трудный вариант аппендэктомии. Расширяют
оперативный доступ за счёт максимального разведения внутренней
косой и поперечной мышц, а также путём надсечения края
влагалища прямой мышцы живота.
Затем под основание червеобразного отростка подводят лигатуру
и мобилизуют купол слепой кишки, рассекая париетальную брюши-
ну бокового канала и отодвигая слепую кишку медиально.
Проникнув таким путём в позадислепокишечную клетчатку, осторожно
выделяют из неё дистальную часть отростка. Особое внимание обращают
на гемостаз, так как лишённый серозного покрова червеобразный
отросток интимно сращён с окружающей клетчаткой. В этой же
клетчатке проходит и артерия червеобразного отростка, её обязательно
нужно отыскать и наложить на неё лигатуру. После выделения всего
червеобразного отростка и перевязки артерии выполняют
аппендэктомию. Вслед за этим ушивают непрерывным швом рассечённую
париетальную брюшину.
стрый аппендицит О 173
Особенности хирургического вмешательства
при различных формах острого аппендицита
Выполняя вмешательство по поводу катарального аппендицита,
всегда следует придерживаться следующего правила: нельзя удалять
червеобразный отросток, не убедившись в том, что изменения в нём
первичны, а не вызваны воспалительным процессом в
окружающих органах.
Ревизию начинают с осмотра подвздошной кишки. Поэтапно
выводя в рану, осматривают не менее 1 м подвздошной кишки, чтобы
убедиться в отсутствии терминального илеита, воспалённого
дивертикула Меккеля и более редких причин воспаления (массивный
аскаридоз, перфорация рыбьей костью и др). Затем осматривают
близлежащие отделы толстой кишки с целью исключения рака, язвенного
колита, дивертикулита или другого её поражения.
В случае воспаления дивертикула Меккеля в правой подвздошной
ямке также нередко находят воспалительный выпот и вторично
изменённый, гиперемированный червеобразный отросток. Проводя
ревизию подвздошной кишки, можно обнаружить дивертикул,
обычно расположенный на расстоянии 40—80 см от илеоцекального угла.
Обнаруженный рудимент подлежит удалению. При узком основании
дивертикула его перевязывают кетгутом и отсекают, культю
погружают в кисетный шов аналогично шву при аппендэктомии. При
широком основании выполняют клиновидную резекцию кишки, при
деструктивном воспалении дивертикула проводят более обширную
резекцию кишки с прилежащей брыжейкой.
У женщин наиболее часто вторичный аппендицит сопутствует
воспалению гениталий. Исходя из этого, в каждом случае катаральной
формы острого аппендицита у женщин необходимо проводить
ревизию внутренних половых органов. Пальпируют и осматривают матку
и её правый придаток. Убедившись в отсутствии основного
воспалительного очага в окружающих органах, приступают к аппендэктомии.
Флегмонозный аппендицит нередко сопровождается появлением
более или менее значительного выпота в правой подвздошной ямке.
В связи с этим во время операции необходимо, во-первых, взять
экссудат для посева на микрофлору, а во-вторых, тщательно осушить
правый боковой канал, подвздошную ямку и малый таз (дугласово
пространство) от скопившегося выпота. Обнаружение мутного выпота —
прямое показание к дренированию брюшной полости. Дренаж
оставляют на 3—4 дня для оттока экссудата и введения антисептиков.
174 ♦ Хирургические болезни <0- Том 1 ♦ Часть II ♦ Глава 6
При операции по поводу гангренозного аппендицита оперативный
доступ должен быть достаточно широким. После выведения купола
слепой кишки в рану осторожно отделяют дистальную часть
червеобразного отростка от окружающих органов. Выполняют аппендэктомию,
брюшную полость тщательно осушают от выпота. Оставление
дренажа в брюшной полости при гангренозном аппендиците обязательно.
Капиллярное кровотечение или неполное удаление некротизиро-
ванных тканей — показание для установки дренажа.
Антибактериальную терапию при гангренозном аппендиците назначают в
обязательном порядке.
Осложнения острого аппендицита
Перфорация
Перфорация червеобразного отростка приводит к попаданию в
брюшную полость содержимого отростка. Вследствие этого быстро
развивается местный перитонит, в последующем способный
отграничиться (формирование абсцесса) либо перейти в разлитой
перитонит. Макроскопически червеобразный отросток при прободении мало
отличается от такового при гангренозной форме острого
аппендицита. Участки некроза такого же грязно-зелёного цвета, в одном или
нескольких из них видны перфоративные отверстия, из которых
изливается зловонный гной. Окружающая брюшина покрыта
массивными фибринозными наложениями. В брюшной полости
содержится обильный гнойный выпот, иногда — выпавшие из червеобразного
отростка каловые камни.
Момент прободения стенки отростка проявляется
возникновением резчайшей боли в правой подвздошной области. При осмотре
больного обращают на себя внимание тахикардия и сухой обложенный
коричневатым налётом язык. Резко выражены все симптомы
раздражения брюшины. Живот постепенно становится всё более вздутым,
перистальтика отсутствует, что, несомненно, свидетельствует о
развивающемся разлитом гнойном перитоните.
Отмечают значительное повышение температуры тела (иногда
принимает гектический характер). Количество лейкоцитов в
периферической крови значительно повышено, выявляют резкий сдвиг
лейкоцитарной формулы крови влево.
Лечение прободного аппендицита по сути не отличается от
такового при разлитом перитоните.
стрый аппендицит О- 175
Разлитой гнойный перитонит
Разлитой гнойный перитонит осложняет течение острого
аппендицита в общей сложности не более чем в 1% случаев, однако среди
прободных аппендицитов частота этого осложнения возрастает до
8-10%. Перитонит — основная причина летальности при остром
аппендиците.
Диагностика разлитого перитонита при перфоративном
аппендиците не вызывает особых трудностей. Несколько иначе выглядит
клиническая картина при перитоните, развивающемся в
послеоперационном периоде на фоне медикаментозной терапии. В этих условиях
отсутствуют острые боли, соответствующие моменту прободения
червеобразного отростка. Боли носят постоянный характер, что до
известной степени можно связать с операционной травмой.
Генерализованное напряжение брюшной стенки также может отсутствовать,
часто живот остаётся умеренно вздутым за счёт пареза кишечника и
равномерно болезненным во всех отделах. Тем не менее симптом
Щёткина—Блюмберга обычно бывает выражен, как и другие
симптомы раздражения брюшины.
Помочь установлению правильного диагноза могут гектический
характер температурной кривой, гнойно-токсический сдвиг в
формуле крови и другие признаки системной воспалительной реакции.
При УЗИ выявляют дилатированные петли тонкой кишки с
ослабленной перистальтикой и свободную жидкость в брюшной полости.
Некоторую помощь может оказать и сопоставление развивающегося
неблагополучия со стороны живота со сроками, прошедшими с
момента операции. Симптомы послеоперационного перитонита
достигают максимума к 5—7-му дню после хирургического вмешательства.
При нормальном течении послеоперационного периода к этому
сроку исчезают все болезненные проявления, нормализуются
температура тела и ультразвуковая картина.
Разлитой гнойный перитонит — показание к незамедлительному
хирургическому вмешательству, проводимому после короткой (не
более 2—3 ч) предоперационной подготовки. Под наркозом
выполняют широкую срединную лапаротомию. При деструктивном
аппендиците проводят аппендэктомию. Тщательно санируют брюшную
полость многократным промыванием её большим количеством
жидкости. Обязательно следует промыть и осушить полость малого таза,
латеральные каналы и поддиафрагмальное пространство. При
уверенности в полном удалении гноя и некротизированных тканей полость
176 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 6
брюшины дренируют несколькими дренажами, выводя их через
контрапертуры. Операционную рану передней брюшной стенки
ушивают наглухо. Если полноценная санация брюшной полости во время
одного вмешательства невозможна, накладывают лапаростому,
позволяющую купировать явления «запущенного» перитонита путём
повторных санационных оперативных вмешательств (см. главу 14).
Аппендикулярный инфильтрат
Аппендикулярный инфильтрат — конгломерат рыхло спаянных
между собой органов и тканей, расположенных вокруг воспалённого
червеобразного отростка. В его образовании принимают участие
слепая кишка, большой сальник, петли тонкой кишки и париетальная
брюшина. Возникновение инфильтрата — следствие защитной
реакции, отграничивающей воспалительный процесс в брюшной полости.
Он чаще всего развивается при флегмонозно изменённом
червеобразном отростке, однако иногда в центре воспалительного
конгломерата находится отросток, подвергшийся полной деструкции.
Типичная картина аппендикулярного инфильтрата развивается,
как правило, через 3-5 дней от начала заболевания. Имевшиеся в
начале болезни самостоятельные боли в животе почти полностью
стихают, самочувствие больных улучшается, хотя температура тела
остаётся субфебрильной. При объективном исследовании живота не
удаётся выявить мышечного напряжения и других симптомов
раздражения брюшины. В правой подвздошной области, где чаще всего
локализуется инфильтрат, можно прощупать довольно плотное,
малоболезненное и малоподвижное опухолевидное образование. В
диагностике аппендикулярного инфильтрата исключительно важную
роль играет анамнез. Если появлению указанного образования в
правой подвздошной области предшествовал приступ болей в животе с
характерным для острого аппендицита симптомом Кохера—Волкови-
ча, однократной рвотой и умеренным повышением температуры тела,
то можно быть уверенным в правильной диагностике
аппендикулярного инфильтрата.
Аппендикулярный инфильтрат необходимо дифференцировать от
опухоли слепой кишки, особенно у лиц пожилого возраста. Для
новообразования характерен длительный анамнез с постепенным
развитием болевого синдрома без существенного повышения
температуры тела. Кроме того, опухоль слепой кишки часто сопровождается
анемией, может вызывать явления кишечной непроходимости, чего
Острый аппендицит -О 177
почти никогда не наблюдают при аппендикулярном инфильтрате.
Динамическое наблюдение за аппендикулярным инфильтратом
позволяет отметить уменьшение в размерах опухолевидного
образования, при новообразовании этого не бывает.
В диагностике аппендикулярного инфильтрата используют УЗИ,
даюшее возможность определения внутренней структуры
образования, динамики воспалительных изменений с течением времени и
под влиянием проводимого лечения, что позволяет уточнить
лечебную тактику.
Исходом аппендикулярного инфильтрата может быть либо его
полное рассасывание, либо абсцедирование. Это обусловливает
консервативно-выжидательную хирургическую тактику. Операция
противопоказана при спокойном течении аппендикулярного
инфильтрата, когда при динамическом наблюдении регрессирует воспаление
и есть явная тенденция к его рассасыванию. Этому способствуют ан-
тибиотикотерапия, ограничение физической активности пациента
и щадящая диета, предотвращающая чрезмерную перистальтику
кишечника. Поскольку перенесённое воспаление вызывает стойкую
деформацию червеобразного отростка и частичную облитерацию
просвета с нарушением дренажной функции, вероятность повторного
аппендицита очень высока. В связи с этим следует выполнить ап-
пендэктомию в «холодном» периоде — через 3—4 мес после
рассасывания инфильтрата.
Если в процессе наблюдения в стационаре у больного вновь
появляются боли в правой подвздошной области, развивается системная
воспалительная реакция (вновь нарастает лейкоцитоз, температура
тела принимает гектический характер), следует предположить абсце-
дирование аппендикулярного инфильтрата. При этом его размеры
могут увеличиваться, возрастает пальпаторная болезненность, в центре
иногда определяется размягчение. Развитие периаппендикулярного
абсцесса можно подтвердить с помощью УЗИ. Сформированный
абсцесс — полостное образование округлой формы с однородным гипо-
или анэхогенным содержимым и плотной пиогенной капсулой от 5
до 8 мм толщиной.
Периаппендикулярный абсцесс — показание к хирургическому
вмешательству. Вскрытие нагноившегося инфильтрата выполняют
под общей анестезией. Проводят разрез Волковича—Дьяконова.
Вскрывают полость гнойника, эвакуируют гной, промывают полость
раствором антисептика, устанавливают в ней один или два тампона и
трубчатый дренаж. Операционную рану ушивают до тампонов. При
178 ♦ Хирургические болезни О Том 1 ♦ Часть II ♦ Глава 6
латеральной локализации нагноившегося аппендикулярного
инфильтрата целесообразно опорожнить гнойник внебрюшинным доступом
Пирогова. При вскрытии нагноившегося аппендикулярного
инфильтрата не следует стремиться к одновременной аппендэктомии.
В послеоперационном периоде больным назначают дезинтокси-
кационную терапию и антибиотики широкого спектра действия. Во
избежание рецидива острого аппендицита больным настоятельно
рекомендуют плановую аппендэктомию через 3—4 мес после
выписки из стационара.
Абсцесс брюшной полости
Абсцессы брюшной полости различной локализации при остром
аппендиците бывают следствием осумкования инфицированного
выпота, нагноения гематом, несостоятельности швов культи
червеобразного отростка. Нередко они возникают при атипичном
расположении червеобразного отростка.
Наиболее часто встречают тазовый абсцесс. Это обусловлено,
прежде всего, анатомическими причинами, так как воспалительный
экссудат в первую очередь скапливается в полости малого таза —
самого нижнего отдела брюшной полости. Более того, если во время
аппендэктомии в брюшной полости обнаруживают выпот, то в
послеоперационном периоде больному в постели специально придают
положение с возвышенным головным концом (положение Фовлера),
поскольку выявить, вскрыть и санировать абсцесс малого таза легче,
чем гнойник любой другой локализации.
Тазовый абсцесс проявляется тупыми болями в нижних отделах
живота и промежности, дизурическими расстройствами и
учащёнными болезненными позывами к стулу (тенезмами), обычно
возникающими на 5—7-й день после операции на фоне вполне благополучного
течения. Эти жалобы сопровождаются повышением температуры
тела, лейкоцитозом с характерным нейтрофильным сдвигом
формулы крови, симптомами интоксикации (слабость, бледность кожных
покровов, сухость во рту, тахикардия).
При появлении подобных симптомов следует предпринять
пальцевые ректальное и вагинальное исследования, во время которых в
области заднего свода влагалища или передней стенки прямой
кишки обнаруживают малоподвижный болезненный инфильтрат.
Скопление большого количества гноя проявляется пальпаторно
определяемой флюктуацией.
Вскрытие аосцесса малого таза у женщин выполняют через
задний свод влагалища, а у мужчин — через переднюю стенку прямой
кишки. В послеоперационном периоде больному назначают
антибиотики и регулярно промывают полость абсцесса антисептиками
через дренаж, установленный во время хирургического вмешательства.
Системная терапия во всех подобных ситуациях заключается в
дезинтоксикации и назначении антибактериальных средств.
Полдиафрагмальный абсцесс встречают гораздо реже тазового. Для
него наряду с проявлениями системной воспалительной реакции
характерны тупые боли в нижних отделах грудной клетки справа,
усиливающиеся при глубоком вдохе, сухой кашель, вызванный
раздражением диафрагмы, отставание правой её половины при дыхании, в
поздних стадиях — выбухание нижних межреберий. В диагностике
поддиафрагмального абсцесса исключительная роль принадлежит
рентгенологическому исследованию, УЗИ и (особенно) КТ.
Для вскрытия поддиафрагмального абсцесса используют чресплев-
ральные и внеплевральные доступы. В настоящее время
предпочтение отдают чрескожному вскрытию и дренированию абсцесса под
контролем УЗИ или КТ.
Межкишечный абсцесс — довольно редкое осложнение
острого аппендицита. Для него характерен светлый промежуток,
продолжающийся 5—7 дней с момента аппендэктомии до первых его
симптомов — вялости, потери аппетита, гектической лихорадки, нейтро-
фильного сдвига формулы крови. При объективном исследовании
живота выявляют плотное, без чётких контуров опухолевидное
образование, аналогичное аппендикулярному инфильтрату, но
расположенное не в правой подвздошной области, а несколько медиаль-
нее её. Симптомы раздражения брюшины отсутствуют, возможен
парез кишечника. При отсутствии явных признаков абсцедирова-
ния инфильтрата допустима консервативно-выжидательная тактика:
покой, холод на область инфильтрата, антибиотики, динамическое
наблюдение за картиной крови и температурой тела,
ультразвуковой контроль.
Прогрессирование признаков системной воспалительной реакции
и обнаружение полости во время УЗИ указывают на необходимость
оперативного вмешательства. В проекции пальпируемого
инфильтрата делают разрез, вскрывают гнойник и эвакуируют гной. Полость
абсцесса промывают, и оставляют в ней тампон и дренаж для
введения антисептиков. Возможно «закрытое» (без тампонов) лечение
абсцесса, при этом в его полость устанавливают дренажную систему для
180 ^ Хирургические болезни ♦ Том 1 ♦ Часть II О- Глава 6
постоянного промывания и аспирации содержимого. Эту процедуру
продолжают не менее 5—6 дней, до полной санации абсцесса и
ликвидации его полости. Общее лечение аналогично описанному выше.
Пилефлебит
Пилефлебит (септический тромбофлебит воротной вены и её
притоков) — крайне редкое и самое тяжёлое осложнение острого
аппендицита. Достоверные случаи излечения пилефлебита до настоящего
времени неизвестны. Непосредственной причиной возникновения
пилефлебита обычно становится гангренозный аппендицит, при
котором воспалительный процесс переходит на брыжеечку
червеобразного отростка и её вены. После перехода гнойного тромбофлебита на
внутрипечёночные ветви воротной вены возникают абсцессы
печени и желтуха, прогрессирует печёночно-почечная недостаточность,
больные умирают через 7-10 дней от начала заболевания.
Профилактика пилефлебита состоит в ранней диагностике и своевременном
оперативном лечении острого аппендицита.
Особенности течения заболевания и лечебной
тактики у различных категорий больных
Острый аппендицит у беременных
Некоторые признаки аппендицита (боли в животе, тошнота,
рвота) присутствуют при обычном течении беременности, что
затрудняет диагностику заболевания.
Клинические проявления острого аппендицита в первой половине
беременности почти не отличаются от таковых вне беременности.
Существенные затруднения в диагностике возникают во второй
половине беременности. В этом случае болевой синдром, свойственный
аппендициту, иногда отождествляют с болями, часто возникающими во
второй половине беременности вследствие растяжения связочного
аппарата матки. Внимательный расспрос позволяет установить начало
болей в эпигастральной области и постепенное смещение их к месту
локализации червеобразного отростка (симптом Кохера—Волковича).
При обследовании живота необходимо учитывать локализацию
червеобразного отростка, смещаемого кверху по мере увеличения
сроков беременности. Локальная болезненность при остром
аппендиците во второй половине беременности определяется не в правой
стрый аппендицит ♦ 181
подвздошной области, а значительно выше. Вследствие растяжения
брюшной стенки увеличенной маткой локальное напряжение мышц
выражено слабо. На поздних сроках беременности, когда слепая
кишка и её отросток находятся позади увеличенной матки, могут быть
отрицательными и другие симптомы раздражения брюшины: Щёт-
кина-Блюмберга, Воскресенского. В этот период, как правило,
хорошо выражены симптомы Образцова и Бартомье—Михельсона,
выявляют также и обратный симптом Ситковского (усиление болей при
положении на правом боку из-за давления увеличенной матки на
воспалённый червеобразный отросток).
Температурная реакция выражена слабее, чем вне беременности.
Количество лейкоцитов умеренно повышается, но при этом
необходимо учитывать, что лейкоцитоз до 12109/л у беременных —
распространённое явление.
При любой форме острого аппендицита у беременных для
проведения аппендэктомии применяют общую анестезию. В качестве
оперативного доступа в первой половине беременности пользуются
разрезом Волковича—Дьяконова. Во второй половине беременности этот
доступ модифицируют по принципу: чем больше срок
беременности, тем выше разрез. В последние недели беременности разрез
проводят выше гребня подвздошной кости вследствие значительного
смещения слепой кишки и червеобразного отростка кверху.
Оперативная тактика при любой форме острого аппендицита у
беременных не отличается от общепринятых принципов его лечения.
В послеоперационном периоде, помимо обычной терапии,
необходимо назначить лечение, направленное на профилактику
преждевременного прерывания беременности.
Острый аппендицит у детей
Острый аппендицит у детей встречают значительно реже, чем у
взрослых. Это объясняется тем, что червеобразный отросток у них
имеет воронкообразную форму, способствующую хорошему его
опорожнению, а также тем, что лимфоидный аппарат органа в этот
период жизни недостаточно развит.
Острый аппендицит у детей протекает более бурно, чем у
взрослых, что обусловлено малой сопротивляемостью инфекции,
слабыми пластическими свойствами брюшины, недостаточным развитием
большого сальника, не доходящего до червеобразного отростка и
поэтому не участвующего в создании отграничивающего барьера.
182 <> Хирургические болезни ^ Том 1 ♦ Часть II ♦- Глава 6
Возникшие в животе боли нередко носят схваткообразный
характер и не имеют чёткой динамики, характерной для острого
аппендицита у взрослых. Дети до 10-летнего возраста не могут точно
локализовать боли, что затрудняет распознавание заболевания. Рвота у детей
чаще всего бывает многократной, стул не имеет тенденции к
задержке, а у детей младшего возраста даже учащён. Характерна поза
больного ребёнка. Он лежит на правом боку или спине, приведя ноги к
животу и положив руку на правую подвздошную область, защищает её от
осмотра врачом. При осторожной пальпации здесь нередко удаётся
выявить гиперестезию, напряжение мышц и зону наибольшей
болезненности. Даже в первые часы заболевания бывают выражены
симптомы Щёткина—Блюмберга, Воскресенского, Бартомье—Михельсона.
Температура тела с самого начала заболевания значительно
возрастает, нередко превышая 38 °С. Количество лейкоцитов в
периферической крови также увеличено наряду с имеющимся нейтрофильным
сдвигом формулы крови.
Острый аппендицит у детей дифференцируют с
функциональными расстройствами кишечника, острым гастроэнтеритом,
дизентерией, плевропневмонией, геморрагическим васкулитом (болезнью
Шёнляйна—Геноха). При затруднениях в дифференциальной
диагностике используют лапароскопию.
В связи с тем, что уже в течение первых суток заболевания у детей
происходит деструкция отростка, хирургическая тактика должна быть
более активной, чем у взрослых. Это в полной мере относится и к
аппендикулярному инфильтрату, который у детей нередко образуется
уже на 2-й день заболевания. Поскольку у детей червеобразный
отросток относительно длинный, а сальник короткий и брюшина не
обладает достаточными пластическими свойствами, образующийся
инфильтрат «непрочен» и не может служить надёжным
препятствием для распространения инфекции по брюшной полости. В связи с
этим операция показана даже при пальпируемом инфильтрате, тем
более что выделение червеобразного отростка из рыхло спаянных
органов не представляет особых трудностей.
Аппендэктомию детям всегда проводят под общей анестезией.
В качестве оперативного доступа используют разрез
Волковича—Дьяконова, за исключением случаев разлитого гнойного перитонита,
когда показана нижнесрединная лапаротомия.
В большинстве случаев аппендэктомия у детей технически
несложна ввиду отсутствия спаечного процесса и сращений червеобразного
отростка с окружающими органами. Порядок хирургических мани-
Острый аппендицит ♦ 18
пуляиий при этом остаётся тем же, что и у взрослых, за исключением
обработки культи отростка, которую у детей до 10-летнего возраста
не погружают ввиду опасности сквозного прокола тонкой кишечной
стенки при наложении кисетного шва. В связи с этим у детей первых
лет жизни применяют так называемый лигатурный (ампутационный)
способ аппендэктомии, при котором культю червеобразного
отростка перевязывают нерассасывающейся нитью, прижигают слизистую
оболочку электрокоагулятором и оставляют в таком виде в брюшной
полости. В связи с тем, что у детей отросток располагается в
брюшной полости более свободно, чем у взрослых, в детском возрасте
больше оснований для проведения лапароскопической аппендэктомии.
Острый аппендицит у больных
пожилого и старческого возрастов
У больных пожилого и старческого возрастов заболевание
характеризуется преобладанием деструктивных форм. Это обусловлено, с
одной стороны, сниженной реактивностью организма, а с другой —
атеросклеротическим поражением сосудов, что становится
непосредственной причиной быстрого нарушения кровоснабжения с
развитием некроза и гангрены червеобразного отростка. Именно у людей
старческого возраста возникает так называемый
первично-гангренозный аппендицит, который развивается сразу, минуя стадию
катарального и флегмонозного воспаления.
Симптомокомплекс острого аппендицита у больных этой группы
нередко имеет стёртую картину. Вследствие физиологического
повышения порога болевой чувствительности пациенты часто не
фиксируют внимания на эпигастральной фазе абдоминальных болей в
начале заболевания. Тошнота и рвота возникают чаще, задержка
стула не имеет решающего значения, поскольку в старческом возрасте
существует тенденция к замедленному опорожнению кишечника.
При исследовании живота выявляют лишь умеренную
болезненность в правой подвздошной области даже при деструктивных
формах аппендицита. Вследствие возрастной релаксации мышц
брюшной стенки мышечное напряжение в очаге поражения
незначительно, но симптом Щёткина—Блюмберга, как правило, выражен. Часто
оказываются положительными симптомы Воскресенского и Сит-
ковского.
Температура тела даже при деструктивном аппендиците
повышается умеренно или остаётся нормальной. Количество лейкоцитов
184 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 6
нормальное или повышено незначительно — в пределах 10—12-109/л,
нейтрофильный сдвиг формулы крови не выражен.
У лиц пожилого и старческого возрастов гораздо чаще возникает
аппендикулярный инфильтрат, характеризующийся медленным
развитием. Больные нередко замечают опухолевидное образование в
правой подвздошной области через несколько дней после приступа
неинтенсивных болей, что заставляет отнестись с особым
вниманием к дифференциальному диагнозу между аппендикулярным
инфильтратом и опухолью слепой кишки.
Своеобразие течения острого аппендицита у лиц преклонного
возраста приводит к тому, что точное распознавание той или иной
клинической формы острого аппендицита до операции затруднено. Это
говорит о необходимости активной хирургической тактики, тем
более что риск аппендэктомии в старческом возрасте нередко
преувеличен. При выборе метода обезболивания отдают предпочтение
местной анестезии, особенно у больных с сопутствующими
заболеваниями дыхательной и сердечно-сосудистой систем.
Ведение послеоперационного периода у больных пожилого
возраста — не менее ответственный этап, чем выполнение самой
операции. Необходим динамический контроль функционального
состояния важнейших систем организма. Основные мероприятия следует
направить на профилактику и лечение нарушений дыхания и
кровообращения, метаболических сдвигов и почечной недостаточности.
Следует обратить особое внимание на профилактику инфекционных
осложнений и ТЭЛА.
ОСТРЫЙ ХОЛЕЦИСТИТ
Срели острых заболеваний органов брюшной полости острый
холецистит занимает второе место после острого аппендицита и имеет
тенденцию к увеличению заболеваемости. В последние десятилетия
достигнуты значительные успехи в диагностике и
совершенствовании методов его лечения, что позволило снизить летальность до 2,5 %.
Вместе с тем, она остаётся высокой среди больных пожилого и
старческого возрастов.
Этиология и патогенез
Возникновение острого холецистита связано с действием
нескольких факторов, среди них ведущую роль играют инфекция и застой
жёлчи (жёлчная гипертензия). Лишь при их наличии создаются
необходимые условия для развития и дальнейшего прогрессирования
воспалительного процесса в жёлчном пузыре. В клинической
практике в подавляющем большинстве случаев холецистит развивается на
фоне ЖКБ. Ему обычно предшествует обтурация камнем шейки
жёлчного пузыря или пузырного протока. Внезапное повышение внут-
рипузырного давления и растяжение жёлчного пузыря приводят к
механическому сдавлению сосудов и нарушениям микроциркуляции
в его стенке. Степень сосудистых нарушений находится в прямой
зависимости от величины гипертензии. Длительное её сохранение
ведёт к ишемии стенки жёлчного пузыря, а возникающие при этом
изменения качественного состава жёлчи оказывают повреждающее
действие на слизистую оболочку. В этих условиях эндогенная
инфекция жёлчного пузыря становится вирулентной. Воспаление
жёлчного пузыря сопровождается экссудацией в его просвет, что
способствует дальнейшему возрастанию гипертензии и прогрессированию
повреждения пузырной стенки.
В жёлчный пузырь микробная флора попадает гематогенным,
лимфогенным или энтерогенным путём. В большинстве случаев
инфицирование жёлчного пузыря происходит гематогенным путём —
из общего круга кровообращения по системе общей печёночной
186 О- Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 7
артерии или из ЖКТ по воротной вене. Редко микробы попадают в
жёлчный пузырь восходящим путём — из двенадцатиперстной
кишки при зиянии сфинктера Одди и появлении дуодено-билиарного
рефлюкса. Обычно микробы обитают в стенке жёлчного пузыря, в
ходах Люшка, поэтому в пузырной жёлчи у здорового человека их не
обнаруживают.
Бактериальная основа острого холецистита — различные
микроорганизмы. Среди них преобладают грамотрицательные бактерии
(кишечная палочка, клебсиелла, псевдомонады), в трети случаев
обнаруживают их ассоциацию с грамположительными микроорганизмами
(бактероиды и анаэробные кокки).
Таким образом, первичным звеном в развитии воспаления
жёлчного пузыря становится остро возникающая жёлчная гипертен-
зия, а вторичным — инфекция. Прогрессированию патоморфоло-
гических изменений в жёлчном пузыре вплоть до некроза
способствуют сосудистые заболевания (атеросклероз, гипертоническая
болезнь), что часто наблюдают у больных пожилого и
старческого возрастов.
Классификация
Клинико-морфологические формы холецистита:
• катаральный;
• флегмонозный;
• гангренозный.
Осложнения:
• перфорация;
• разлитой перитонит;
• перипузырный инфильтрат и абсцесс;
• гнойный холангит;
• механическая желтуха;
• жёлчные свищи (наружные и внутренние).
Каждую из неосложнённых форм заболевания следует
рассматривать как закономерное развитие воспалительного процесса и
поэтапный переход от катарального воспаления к гангрене. Исключением
из этой закономерности считают первичный гангренозный
холецистит, развивающийся чаще всего вследствие атеротромбоза пузырной
артерии.
Острый холецистит О 187
Патоморфология
• Острый катаральный холецистит морфологически характеризуется
гиперемией и отёком жёлчного пузыря, появлением в его просвете
серозного экссудата. Микроскопически находят лейкоцитарную
инфильтрацию, главным образом слизистой оболочки и подслизи-
стого слоя, скопление макрофагов и серозное пропитывание.
• Флегмонозная форма сопровождается резкой гиперемией,
кровоизлияниями и отёком тканей жёлчного пузыря, вследствие этого
он становится напряжённым и приобретает багровый цвет. На
поверхности серозной оболочки появляется фибринозный налёт,
слизистая оболочка подвергается очаговому изъязвлению и некрозу.
В полости жёлчного пузыря скапливается гнойный или
гнойно-геморрагический экссудат. Микроскопическая картина
характеризуется лейкоцитарной инфильтрацией всех слоев стенки жёлчного
пузыря, иногда обнаруживают абсцессы.
• Деструктивные изменения в тканях жёлчного пузыря находят
также при гангренозном холецистите. Очаги некроза захватывают все
слои стенки жёлчного пузыря. Они приобретают
грязно-зеленоватый или грязно-серый цвет и бывают различной величины, в
просвете пузыря — гной.
В 5-10% случаев встречают бескаменный холецистит, в остальных —
заболевание носит калькулёзный характер. Независимо от факта
наличия или отсутствия камней клиническая картина заболевания и
лечебная тактика практически одинаковы. Относительно редко встречают
ферментативный холецистит, развивающийся в результате заброса
панкреатического секрета в жёлчные протоки, что может происходить
при наличии общей ампулы жёлчного и панкреатического протоков.
при наличии оощеи ампулы желчного и панкреатического протоков.
Клиническая картина
Острый холецистит развивается преимущественно у лиц старше
50 лет, больные пожилого и старческого возрастов составляют более
50% заболевших. Соотношение мужчин и женщин среди пациентов
составляет 1:5.
Острый холецистит возникает внезапно с появления интенсивных
болей в животе. Развитию острых воспалительных явлений в
жёлчном пузыре нередко предшествует приступ жёлчной колики. Боли
носят постоянный характер, по мере прогрессирования заболевания
188 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 7
их интенсивность нарастает. Они локализуются в правом подреберье
и эпигастральной области, иррадиируют в правую надключичную
область, плечо или лопатку. Иногда боли иррадиируют в область
сердца, что можно расценить как приступ стенокардии (холецистокар-
диальный синдром СП. Боткина).
Постоянные симптомы острого холецистита — тошнота и
повторная рвота, не приносящая облегчения больному. Повышение
температуры тела отмечают с первых дней заболевания, её характер
зависит от глубины патоморфологических изменений в жёлчном пузыре.
Для деструктивных форм характерен озноб.
Кожные покровы обычной окраски. Умеренная желтизна склер
может быть обусловлена переходом воспаления с жёлчного пузыря
на печень и развитием локального гепатита. Появление яркой
желтухи кожи и склер указывает на механический характер внепечёноч-
ного холестаза. Частота пульса колеблется от 80 до 120 в минуту и выше.
Частый пульс — грозный симптом, свидетельствующий о тяжёлых
воспалительных изменениях в жёлчном пузыре и брюшной полости.
Специфические симптомы заболевания:
• Ортнера — болезненность при поколачивании правой рёберной дуги
ребром кисти;
• Мерфи — непроизвольная задержка дыхания на вдохе при
пальпации правого подреберья;
• Кера — боль на высоте вдоха во время пальпации правого подреберья;
• Мюсси—Георгиевского (френикус-симптом) — болезненность при
надавливании пальцем между ножками правой грудино-ключично-
сосцевидной мышцы;
• Щёткина—Блюмберга — в случае вовлечения в воспалительный
процесс брюшины.
Частота выявления перечисленных симптомов неодинакова, она
зависит от характера морфологических изменений в жёлчном пузыре
и перехода воспаления на брюшину. Состояние больного может быть
различным, что определяется формой заболевания.
Катаральный холецистит
Катаральный холецистит — наиболее лёгкая форма заболевания,
характеризующаяся умеренной постоянной болью в правом
подреберье, тошнотой и однократной или двукратной рвотой. Общее
состояние больного страдает мало. Пульс может учащаться до 90 в
минуту. Язык влажный, обложен белым налётом, при пальпации живота
Острый холецистит ♦ 189
возникает нерезко выраженная боль в правом подреберье. Знаковые
признаки заболевания (симптомы Ортнера, Мерфи, Кера, Мюсси-
Георгиевского) выражены слабо или отсутствуют, симптом Щётки-
на-Блюмберга не определяется. Жёлчный пузырь не пальпируется,
но область его проекции болезненна. В анализе крови выявляют
умеренный лейкоцитоз (9— 11-Ю9/л).
Неярко выраженную клиническую картину катарального
холецистита можно ошибочно расценить как купировавшийся приступ
жёлчной колики, обусловленной холецистолитиазом. Для правильной
диагностики следует обращать внимание на признаки воспаления
(гипертермия, тахикардия, лейкоцитоз).
При стихании воспалительного процесса, если микробная флора
погибает, но сохраняется обтурация пузырного протока, развивается
водянка жёлчного пузыря. В этом случае в нём происходит всасывание
составных компонентов жёлчи, содержимое его становится бесцветным,
носит слизистый характер. При пальпации живота удаётся определить
дно увеличенного растянутого и безболезненного жёлчного пузыря.
Флегмонозный холецистит
Флегмонозный холецистит характеризуется более выраженной
клинической симптоматикой: боли носят интенсивный постоянный
характер, усиливаются при дыхании и перемене положения тела.
Больных беспокоят тошнота и многократная рвота. Резко выражены
слабость и недомогание, ознобы. Температура тела повышается до
37,8-38 °С и более, сохраняется в течение нескольких дней.
Состояние больных средней тяжести, пульс учащается до 100 в
минуту. Язык сухой, живот вздут, значительно болезнен в правом
подреберье, здесь же определяются выраженная мышечная защита и
положительный симптом Щёткина—Блюмберга. При нерезко
выраженном напряжении брюшной стенки удаётся пальпировать
воспалительный инфильтрат или увеличенный болезненный жёлчный
пузырь. Как правило, положительны симптомы острого холецистита:
Ортнера, Кера, Мерфи. Количество лейкоцитов в крови достигает 12—
15-109/л со сдвигом лейкоцитарной формулы влево, увеличена
скорость оседания эритроцитов (СОЭ).
Возможны различные варианты течения острого флегмонозно-
го холецистита. При своевременной госпитализации больного и
проведении рациональной консервативной терапии возможны сле-
шие исходы:
, дую
190 ♦ Хирургические болезни ♦ Том 1 ♦ Часть И ♦ Глава 7
• клиническое выздоровление;
• стихание воспалительного процесса в стенке жёлчного пузыря
и брюшной полости с последующим развитием эмпиемы жёлчного
пузыря;
• распространение воспалительного процесса на соседние органы.
Во втором случае пальпация живота выявляет увеличенный
плотный умеренно болезненный жёлчный пузырь, симптом Щёткина-
Блюмберга отрицательный. Наличие в полости «отключённого»
жёлчного пузыря микробной флоры и гнойного содержимого проявляется
периодическими ознобами, сопровождаемыми подъёмом
температуры тела до 39—40 °С. В клиническом анализе крови, взятом во время
лихорадки, определяют высокий лейкоцитоз с палочкоядерным
сдвигом лейкоцитарной формулы.
Третий вариант течения заболевания заключается в
распространении воспалительного процесса за пределы жёлчного пузыря на
соседние органы: желудок, двенадцатиперстную кишку, большой
сальник, поперечную ободочную кишку. Это приводит к плотному их
спаянию и образованию воспалительного инфильтрата. Перипузыр-
ный инфильтрат формируется на 4—5-й день заболевания. Пальпа-
торно он определяется в виде различных размеров плотного
неподвижного и болезненного образования в правом подреберье. В случае
стихания воспалительного процесса инфильтрат уменьшается в
размерах, исчезают боли в животе, нормализуются температура тела и
количество лейкоцитов в крови. Если не происходит отграничения
воспалительного процесса и спаяния окружающих органов с
жёлчным пузырём, развивается разлитой перитонит.
Гангренозный холецистит
Гангренозный холецистит в большинстве случаев бывает
результатом прогрессирования воспалительного процесса и расстройства
кровообращения в стенке жёлчного пузыря. Эту форму воспаления
чаще всего обнаруживают у больных пожилого и старческого
возрастов со снижением реактивности организма и у страдающих
атеросклерозом висцеральных ветвей брюшного отдела аорты.
В клинической картине заболевания на первый план выступают
симптомы выраженной системной воспалительной реакции, тогда как
болевые ощущения могут уменьшаться, что связано с гибелью
нервных окончаний в жёлчном пузыре. Состояние больных тяжёлое,
они вялы, заторможены или, напротив, возбуждены. Температура тела
Острый холецистит ♦ 191
повышается до 38-39 °С. Пульс учащается до 110-120 в минуту,
дыхание поверхностное и частое. Язык сухой. Живот становится
вздутым за счёт пареза кишечника, ограниченно участвует в акте
дыхания, перистальтика угнетена. Ярко выражены признаки раздражения
брюшины — защитное напряжение мышц передней брюшной стенки
и симптом Щёткина—Блюмберга. В анализе крови количество
лейкоцитов возрастает до 16—18109/л с резким сдвигом лейкоцитарной
формулы влево. Иногда можно наблюдать выраженную интоксикацию
и тахикардию в сочетании с нормальной температурой тела (симптом
«токсических ножниц»), что указывает на глубокие патоморфологи-
ческие изменения стенки жёлчного пузыря с образованием
участков некроза различной величины, вплоть до его тотальной гангрены.
Для первичного гангренозного холецистита, возникающего
вследствие тромбоза или эмболии пузырной артерии, с первых часов
заболевания характерно бурное течение. Оно проявляется симптомами
выраженной интоксикации и быстро прогрессирующими
признаками перитонита.
Некоторые особенности течения острого холецистита наблюдают
у больных пожилого и старческого возрастов, состояние которых
отягощено сопутствующими заболеваниями. У них нередко отсутствуют
интенсивные болевые ощущения, защитное напряжение мышц
передней брюшной стенки не выражено, в клиническом анализе крови
нет высокого лейкоцитоза, в связи с чем возникают затруднения в
диагностике заболевания и выборе метода лечения.
Прободной холецистит
Прободной холецистит развивается у больных с гангренозной
формой заболевания в случае неоказания им своевременной
хирургической помощи, а также может быть следствием пролежня стенки
жёлчного пузыря камнем.
Прободение жёлчного пузыря в свободную брюшную полость ведёт
к развитию разлитого перитонита. Клинически момент прободения
проявляется резчайшими болями в животе, повторной рвотой.
Больной покрывается холодным потом, кожные покровы становятся
бледными, происходит снижение пульса и АД. Пальпация живота
выявляет резкую болезненность во всех отделах и напряжение мышц передней
брюшной стенки, положительный симптом Щёткина—Блюмберга.
Прободение жёлчного пузыря при отграничении его
воспалительным инфильтратом протекает с менее выраженными клиническими
192 ♦ Хирургические болезни О- Том 1 ♦ Часть II ♦ Глава 7
проявлениями, так как гнойная жёлчь из пузыря скапливается в под-
печёночном пространстве и не поступает в свободную брюшную
полость. Нередко это заканчивается образованием подпечёночного
абсцесса, который в свою очередь может прорваться в брюшную
полость. В момент прободения у больных усиливается боль в правом
подреберье, постепенно нарастают симптомы системной
воспалительной реакции.
Гнойный холангит
Гнойный холангит, осложняющий течение деструктивного холе
цистита, чаще всего возникает при наличии камней в жёлчных про
токах или рубцовой стриктуры большого дуоденального сосочка.
Возможно развитие холангита в результате перехода воспаления с
жёлчного пузыря на внепечёночные жёлчные протоки.
Клинические признаки гнойного холангита появляются на 3-4-й
день от начала приступа. Для него характерны нарастающая желтуха
кожи и склер, фебрильная температура тела, сопровождающаяся
ознобами, и боли в правом подреберье (триада Шарко). Состояние
больных тяжёлое, они вялы и заторможены, пульс частый, АД снижено.
При пальпации живота наряду с симптомами острого холецистита
выявляют увеличение в размерах печени и селезёнки, выраженную
болезненность в правом подреберье. В анализе крови выявляют
высокий лейкоцитоз со сдвигом лейкоцитарной формулы влево, резкое
увеличение СОЭ, повышение содержания билирубина, активности
трансаминазы, щелочной фосфатазы и у-глутамилтрансферазы.
Прогрессирующее течение острого холангита приводит к развитию
печёночной и почечной недостаточности. Нередким осложнением
острого холангита бывают абсцессы печени и билиарный сепсис.
Летальность при гнойном обтурационном холангите достигает 40%.
Клинические проявления механической желтухи, способной
осложнять течение острого холецистита, описаны в соответствующей
главе учебника.
Диагностика
В типичных случаях диагностика острого холецистита не представ
ляется трудной. Вместе с тем со сходными клиническими
симптомами могут протекать прикрытая перфоративная язва желудка ил»
двенадцатиперстной кишки, острый панкреатит, острый аппендицит
при подпечёночном расположении червеобразного отростка,
правосторонняя плевропневмония, почечная колика и некоторые другие
острые заболевания органов брюшной полости. Правильная и
своевременная диагностика острого холецистита — необходимое условие
улучшения результатов лечения.
Для уточнения диагноза и принятия адекватной лечебной
тактики необходимо в течение первых 24 ч с момента госпитализации
больного использовать оптимальный набор лабораторных и
инструментальных исследований. Обязательные исследования: клинический
анализ крови и мочи, определение содержания билирубина в крови,
анализ мочи на диастазу, УЗИ органов брюшной полости,
рентгеноскопия органов грудной клетки, ЭКГ. Результаты этих исследований
позволяют не только исключить другие острые заболевания, но и
оценить тяжесть физического состояния больного, что очень важно
для выбора способа лечения.
УЗИ занимает центральное место в диагностике острого
холецистита. Значимость УЗИ определяется высокой информативностью
метода, неинвазивным характером, возможностью повторного
исследования и использования метода для проведения лечебных процедур.
Во избежание диагностических ошибок УЗИ необходимо проводить
каждому больному с подозрением на острый холецистит, независимо
от выраженности клинической симптоматики заболевания.
Ультразвуковые признаки острого холецистита: увеличение
размеров жёлчного пузыря, утолщение его стенок, неровность контуров
и наличие взвешенных мелких гиперструктур без акустической тени
в полости пузыря (рис. 7-1). Выявление жидкости в подпечёночном
пространстве и зоны повышенной эхогенности окружающих тканей
свидетельствует о выходе воспаления за пределы жёлчного пузыря,
перивезикальной воспалительной инфильтрации близлежащих
органов и тканей. Фиксированная эхоструктура с акустической тенью в
области шейки пузыря — признак вколоченного камня и обтураци-
онной формы острого холецистита. По результатам УЗИ судят и о
состоянии внепечёночных жёлчных протоков: диаметр общего
печёночного протока 9 мм и более указывает на жёлчную гипертензию,
которая может быть обусловлена камнем или стриктурой жёлчных
протоков. Повторное УЗИ проводят для оценки эффективности
проводимого консервативного лечения и выявления признаков прогрес-
сирования воспалительного процесса в стенке жёлчного пузыря и
брюшной полости.
Диагностировать острый холецистит позволяет лапароскопия, во
время которой по визуальным признакам судят о характере
воспаления жёлчного пузыря и распространённости перитонита. В
настоящее время лапароскопию проводят лишь при неясном диагнозе и
невозможности установить причину «острого живота» неинвазивны-
ми методами исследования.
При осложнении острого холецистита механической желтухой
проводят эндоскопическую ретроградную холангиопанкреатикогра-
фию (ЭРХПГ). Она позволяет установить причину внепечёночного
жёлчного стаза, локализацию окклюзии общего жёлчного протока, а
при наличии стриктуры дистального отдела жёлчного протока — её
протяжённость. Рентгеноэндоскопическое исследование
необходимо выполнять в каждом случае острого холецистита, осложнённого
внепечёночным холестазом, если тяжесть воспалительного процесса
в брюшной полости не требует срочного оперативного
вмешательства. Кроме того, проведение его целесообразно в тех случаях, когда
диагностический этап исследования может быть завершён
выполнением лечебной папиллотомии и назобилиарным дренированием для
ликвидации жёлчного стаза. В случае устранения причины
нарушения желчеоттока в кишечник путём эндоскопического
вмешательства в последующем представляется возможность сократить объём
операции, ограничивая её только выполнением холецистэктомии, что
положительно сказывается на результатах лечения. При срочном
выполнении операции у больных с острым холециститом и сопутству-
Рис. 7-1. Ультразвуковая скано-
грамма при остром флегмоноз-
ном калькулёзном холецистите.
Виден увеличенный жёлчный
пузырь с раздвоением контуров
и утолщением стенки, лоциру-
ется камень шейки пузыря (ука-
за„ сделкой,
194 О- Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 7
Острый холецистит О- 195
юшей механической желтухой причину последней устанавливают
в ходе самой операции с помощью холангиографии, по её
результатам определяют характер вмешательства на внепечёночных
жёлчных протоках.
Лечение
Больные острым холециститом подлежат срочной госпитализации
в хирургический стационар и должны находиться под постоянным
наблюдением хирурга.
Эффективное лечение острого холецистита предполагает
соблюдение принципа активной хирургической тактики. Деструктивный
холецистит с различными вариантами течения — показание к
хирургическому вмешательству в течение первых 24—48 ч пребывания
больного в стационаре. Консервативному лечению подлежат больные
с катаральным холециститом, при нём лечебные мероприятия в
большинстве случаев позволяют купировать воспалительный процесс.
При активной лечебной тактике показания к операции
определяют тотчас при постановке окончательного диагноза острого
деструктивного холецистита, протекающего как с явлениями перитонита, так
и без них. Экстренная операция, выполняемая в ближайшие 6 ч с
момента поступления в стационар, показана при всех формах
деструктивного холецистита (флегмонозный, гангренозный), осложнённого
местным или распространённым перитонитом. Показанием к
срочной операции, предпринимаемой в первые 24 ч с момента
госпитализации больного, считают флегмонозный холецистит, не
осложнённый перитонитом.
Как поступают, если течение острого холецистита осложняется
механической желтухой и обтурационным холангитом? В этом
случае хирургическая тактика зависит от двух факторов: выраженности
воспалительного процесса в жёлчном пузыре и брюшной полости,
а также тяжести состояния больного (степени операционно-анесте-
зиологического риска). При наличии показаний к экстренной
операции причину механической желтухи устанавливают путём
проведения интраоперационной холангиографии и в зависимости от
выявленной патологии проводят адекватное вмешательство на вне-
печёночных жёлчных протоках. Больным, не нуждающимся в
экстренной операции, первоначально выполняют эндоскопическую
ретроградную холангиографию и эндоскопическую папиллотомию.
196 ♦ Хирургические болезни
Глава 7
завершая её литоэкстракцией или назобилиарным дренированием для
устранения холестаза и холангита. Через 24—48 ч после
эндоскопического вмешательства прибегают ко второму этапу лечения —
операции холецистэктомии.
Важное место в программе активной лечебной тактики при
остром холецистите занимает консервативная терапия, в большинстве
случаев позволяющая купировать воспалительный процесс у
больных с катаральной формой холецистита и в то же время
играющая роль предоперационной подготовки у больных с деструктивным
холециститом. Комплекс консервативных мероприятий, основанный
на патогенетических принципах, включает следующие лечебные
мероприятия: голодание (разрешено щелочное питьё), локальная
гипотермия (пузырь со льдом на область правого подреберья), для
уменьшения болей и снятия спазма сфинктера Одди назначают
ненаркотические анальгетики и холинолитические спазмолитические
препараты (метамизолнатрий, метамизолнатрий + питофенон + фен-
пиверина бромид, дротаверин, мебеверин, платифиллин). Детокси-
кацию и парентеральное питание обеспечивают инфузионной
терапией в объёме 2,0—2,5 л в сутки. Критериями адекватного объёма
инфузионных сред, вводимых из расчёта 30—50 мл на 1 кг массы тела,
служат нормализация гематокрита, ЦВД и диуреза. При осложнении
острого холецистита механической желтухой или холангитом
дополнительно назначают гемодез, раствор аминокислот,
свежезамороженную плазму, витамины С, Ъ^ и В6.
Важный компонент консервативной терапии острого холецистита —
антибактериальные препараты, назначаемые с целью предотвращения
генерализации абдоминальной инфекции. К сожалению,
антибиотики не могут ограничить деструктивный процесс в жёлчном пузыре из-
за резкого снижения их накопления как в стенке пузыря вследствие
сосудистых нарушений, так и в жёлчи в связи с обтурацией камнем
шейки пузыря. Между тем, они играют важную роль, блокируя дис-
семинацию инфекции и развитие системной воспалительной
реакции. Кроме того, использование антибактериальных средств служит
средством профилактики послеоперационных гнойных осложнений.
Больным с неосложнённым деструктивным холециститом,
оперируемым в экстренном порядке, антимикробные средства вводят
внутривенно в максимальной одноразовой дозе за 30—40 мин до начала
операции. Для поддержания эффективной концентрации препарата
в тканях при длительности операции более 2 ч повторяют введение
половины разовой дозы этого антибактериального средства. В пос-
'стрый холецистит ♦ 197
леопераиионном периоде применение антибиотиков следует
продолжить при наличии у больных факторов риска развития
гнойно-септических осложнений.
Пациентам с осложнёнными формами деструктивного
холецистита показано применение антибиотиков в предоперационном
периоде и после операции в течение 5-7 дней. В таких случаях
препаратами выбора как для профилактического, так и для лечебного
использования служат цефалоспорины и фторхинолоны в сочетании
с метронидазолом или карбапенемы. Применение препаратов тетра-
циклинового ряда и гентамицина следует ограничить, так как они
обладают гепатонефротоксическими свойствами.
Для обезболивания при операциях по поводу острого холецистита
и его осложнений применяют многокомпонентный эндотрахеальный
наркоз. Местную анестезию используют только при выполнении хо-
лешстостомии.
Основные виды операций при неосложнённом остром
холецистите — холецистэктомия и холецистостомия. При сопутствующем
поражении внепечёночных жёлчных протоков (камни, стриктура)
холецистэктомию сочетают с вмешательствами на общем жёлчном
протоке и большом дуоденальном сосочке.
,
лецистэктомия
Холецистэктомия — радикальная операция, ведущая к полному
выздоровлению больного. Её выполняют открытым способом с
использованием традиционных доступов, из мини-лзпаротомного
доступа или с помощью видеолапароскопической техники. Открытую
холецистэктомию производят из широкого лапаротомного разреза в
правом подреберье (по Кохеру, Фёдорову), трансректального или
верхнесрединного разреза. Оптимальными представляются разрезы в
правом подреберье, обеспечивающие широкий доступ к жёлчному
пузырю, внепечёночным жёлчным протокам и двенадцатиперстной
кишке. Вместе с тем они вызывают существенную травму передней
брюшной стенки, парез кишечника, нарушение внешнего дыхания,
что затрудняет послеоперационную реабилитацию и удлиняет срок
нетрудоспособности. Верхнесрединный разрез целесообразно
использовать в случаях неясного диагноза, невозможности исключить
панкреонекроз или прободную язву.
Удаление жёлчного пузыря выполняют от шейки или от дна.
Преимущества имеет метод холецистэктомии от шейки: первоначально
198 ♦ Хирургические болезни ♦ Том 1
Часть II ♦ Глава 7
выделяют пузырную артерию и пузырный проток, их пересекают и
перевязывают (рис. 7-2).
Разобщение жёлчного пузыря с жёлчным протоком
предупреждает возможную миграцию камней в протоки, а предварительная
перевязка артерии обеспечивает бескровное выделение жёлчного пузыря
из ложа печени.
К удалению жёлчного пузыря от дна (рис. 7-3) прибегают при
наличии плотного воспалительного инфильтрата в области его шейки
и печёночно-двенадцатиперстной связки, поскольку он затрудняет
идентификацию важных анатомических элементов этой зоны.
Для выполнения холецистэктомии из мини-лапаротомного
доступа проводят трансректальный разрез длиной 4—5 см ниже
реберной дуги и на 3—4 см вправо от срединной линии. Операцию
осуществляют с помощью
инструментального комплекса «мини-ассистент» (см.
рис. 16-5). Удаление жёлчного пузыря из
мини-доступа при остром холецистите
выполняют в тех случаях, когда ещё не
сформировался плотный
воспалительный инфильтрат в подпечёночном
пространстве, обычно при длительности
заболевания не более 72 ч. Если инфильтрат
не позволяет идентифицировать
анатомические взаимоотношения элементов
гепатодуоденальной связки,
целесообразен переход на широкую лапаротомию.
Операция из мини-доступа отличается от
традиционной холецистэктомии малой
травматичностью, низкой частотой
развития ранних и поздних осложнений, а
также быстрым восстановлением
трудоспособности больного.
Видеолапароскопическую холецист-
эктомию при остром холецистите
проводят при сроке заболевания 48-72 ч. При
большей длительности заболевания
эндоскопическая операция часто обречена
на неудачу. Более того, она чревата
угрозой развития тяжёлых интраоперацион-
ных осложнений из-за воспалительного
Рис. 7-2. Холецистэктомия
от шейки. Пузырная
артерия перевязана, пузырный
проток пересечён у места
впадения в общий жёлчный
проток. Жёлчный пузырь
отделяют от печени с
помощью электрокоагулятора.
инфильтрата в подпеченочной области.
Применение лапароскопической
операции противопоказано при осложнённых
формах острого холецистита —
распространённом перитоните, механической
желтухе, обтурационном холангите. При
возникновении технических трудностей в
ходе эндоскопической операции и
угрозы развития ятрогенных повреждений
переходят на открытый способ операции.
При остром холецистите подобное
случается достаточно часто (до 20% случаев).
Холецистостомия
Холецистостомия — паллиативная
малотравматичная операция, позволяющая
достичь положительного лечебного
эффекта и снизить летальность. Её следует
считать стандартом хирургического
лечения больных острым холециститом, у
которых риск выполнения холецистэктомии чрезмерно велик в связи с
тяжёлыми соматическими заболеваниями. Патогенетическим
обоснованием целесообразности выполнения холецистостомии служат
снятие внутрипузырной гипертензии и отведение наружу
инфицированной жёлчи, что устраняет нарушения кровотока в стенке жёлчного
пузыря, предотвращая тем самым возникновение и прогрессирова-
ние в нём деструктивных изменений.
Холецистостомию выполняют путём чрескожного
дренирования жёлчного пузыря под ультразвуковым контролем,
лапароскопическим способом или путём открытой лапаротомии. Во всех случаях
применяют местное обезболивание при обязательном участии
анестезиолога.
Наиболее щадящий способ — пункция и последующее
дренирование жёлчного пузыря, проводимое чрескожно и транспечёночно под
УЗИ-контролем (рис. 7-4). В полость жёлчного пузыря
устанавливают дренаж, позволяющий отводить наружу гнойную жёлчь и активно
осуществлять его санацию. Воздерживаются от применения этого
метода при распространённом перитоните, гангрене жёлчного
пузыря и в случае заполнения всей его полости камнями.
Рис. 7-3. Холецистэктомия
от дна. Выделение
жёлчного пузыря из ложа в
печени до лигирования
пузырного протока и артерии.
Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава
Рис 7-4. Пункционная транс-
кутанная холецистостомия под
ультразвуковым контролем.
Лапароскопическую холецистостомию выполняют под контролем
видеоэндоскопии после визуальной оценки характера
воспалительного процесса в брюшной полости и при условии свободного от
сращений с соседними органами дна жёлчного пузыря. Из
многочисленных модификаций этого способа хорошо зарекомендовала себя
методика прямой пункции жёлчного пузыря троакар-катетером с
оставлением в его полости баллонного катетера, благодаря которому
обеспечивается герметичность стомы и формируется доступ в полость
жёлчного пузыря для его активной санации и удаления
конкрементов. Несмотря на малоинвазивный характер и эффективность
лапароскопической холецистостомии, применяют её редко, что связано с
необходимостью создания пневмоперитонеума и возможным
ухудшением состояния больного во время процедуры.
Открытую холецистостомию (рис. 7-5) выполняют под местным
обезболиванием из лапаротомного доступа в правом подреберье.
Формируют холецистостому подшиванием дна жёлчного пузыря к
париетальной брюшине, а в случае невозможности подшить жёлчный
Рис. 7-5. Открытая холецистостомия. В полости жёлчного пузыря
установлен баллонный катетер.
Острый холецистит ♦ 201
пузырь к брюшной стенке его отграничивают тампонами. При
открытой холеиистостомии образуется широкий канал для доступа в
полость жёлчного пузыря и его санации, что важно в профилактике
рецидива заболевания. Однако этот способ создания холеиистостомии
наиболее травматичен в связи с разрезом брюшной стенки.
При наружном дренировании жёлчного пузыря купирование
воспалительного процесса и его клинических признаков происходит к
8-10-му дню. Дальнейшая лечебная тактика зависит от тяжести
состояния больного и степени операционно-анестезиологического
риска. Если он крайне высок, холецистостомия становится основным и
окончательным методом лечения. При улучшении общего состояния
больного и снижении риска хирургического вмешательства
выполняют холецистэктомию с использованием малоинвазивных
технологий. Двухэтапное лечение подобных больных с острым
холециститом способствует резкому снижению частоты летального исхода.
Операции на жёлчном пузыре и жёлчных протоках, проводимые
при остром холецистите, заканчивают установкой в подпечёночном
пространстве контрольного дренажа. Дренаж в брюшной полости
необходим для оттока наружу жёлчи и крови, подтекающих из ложа
пузыря. В случае интенсивного крово- и желчеистечения дренаж
позволяет своевременно диагностировать несостоятельность лигатур
культи пузырной артерии или протока. При отсутствии отделяемого
по дренажу его удаляют на 3-й послеоперационный день.
Тампоны в брюшную полость при остром холецистите вводят
исключительно редко. Такая необходимость возникает при осложнении
заболевания подпечёночным абсцессом или невозможности
остановить кровотечение из ложа пузыря в печени. При абсцессе тампоны
подтягивают на 5-й день и удаляют на 9-й, гемостатический тампон
извлекают на 4—5-й день после операции.
В послеоперационном периоде продолжают терапию,
направленную на коррекцию метаболических нарушений, профилактику
инфекционных и тромбоэмболических осложнений. Инфузионную
терапию в объёме 2,0—2,5 л жидкости в сутки необходимо проводить
не менее 3 дней. Своевременное выполнение операции и
рациональная интенсивная терапия в послеоперационном периоде
обеспечивают благоприятный исход хирургического лечения больных острым
холециститом.
Острый панкреатит — острое асептическое воспаление
поджелудочной железы, основу которого составляют процессы аутофер-
ментативного некробиоза и некроза органа. Панкреатит относят к
наиболее частым хирургическим заболеваниям органов брюшной
полости. В России, странах Западной Европы и Северной Америки
заболеваемость острым панкреатитом варьирует от 40 до 80
человек на 100 000 населения. Некротические формы поражения подже-
(лудочной железы составляют 25—30%, летальность при их развитии
достигает 40%.
Анатомия, кровоснабжение и иннервация поджелудочной железы
изложены на приложенном к учебнику лазерном диске. Вместе с тем
необходимо отметить ряд особенностей анатомии панкреатодуоде-
нобилиарной зоны, определяющих этиологию, патогенез и патомор-
фологию острого панкреатита.
• Во-первых, в фатеров сосочек двенадцатиперстной кишки впадает
главный панкреатический (вирзунгов) проток после слияния с
общим жёлчным протоком, что объясняет частое развитие острого
билиарного панкреатита и сопутствующей механической желтухи
при ущемлении конкремента в терминальном отделе общего
жёлчного протока.
• Во-вторых, поджелудочная железа окружена рыхлой жировой клет-
чаткой, образующей парапанкреальное клетчаточное
пространство, анатомически связанное с передней паранефральной,
околоободочной клетчаткой (с обеих сторон) и левым поддиафрагмаль-
ным пространством. Эти топографо-анатомические обстоятельства
объясняют высокую частоту развития обширной некротической
флегмоны, включающей парапанкреальную, околотолстокишечные
и паранефральные области забрюшинной клетчатки при
распространённом панкреонекрозе.
• В-третьих, к переднему краю поджелудочной железы прикреплён
корень брыжейки поперечной ободочной кишки, что
обусловливает её воспалительно-некротические изменения и формирование
стойкого пареза кишки при деструктивном панкреатите. Для некро-
Острый панкреатит ♦ 203
за головки поджелудочной железы наиболее типично поражение
жировой околоободочной клетчатки восходящего отдела толстой
кишки и переднего паранефрия справа, тогда как деструкция тела и
хвоста органа чаще всего сопровождается развитием некротической
флегмоны в левых поддиафрагмальной, околотол сто кишечной и па-
ранефральной областях забрюшинного пространства.
Физиология. Поджелудочная железа — важнейший экзокринный
орган пищеварения и эндокринный орган регуляции углеводного
обмена.
Экзокринная функция. Поджелудочная железа секретирует
панкреатический сок, содержащий ферменты и бикарбонаты. За сутки
поджелудочная железа выделяет 1,5—3 л панкреатического сока с
основной реакцией среды (рН 8,4—8,8), содержащего ферменты (про-
теазы, липазы, амилазу). Панкреациты выделяют протеазы (трипси-
ноген, химотрипсиноген, прокарбоксипептидаза, эластаза), а также
фосфолипазы А2 и В в неактивном состоянии. В физиологических
условиях их активация происходит при поступлении в
двенадцатиперстную кишку под воздействием энтерокиназы. Образовавшийся
трипсин аутокаталитически активирует дальнейшие порции трип-
синогена. Амилаза, липаза, рибонуклеаза и дезоксирибонуклеаза
активируются по мере поступления секрета в протоковую систему.
Функции ферментов строго специфичны. Трипсин и химотрипсин
расщепляют до аминокислот пищевой белок, альфа-амилаза
катализирует расщепление полисахаридов, нуклеазы — нуклеиновые
кислоты, эластаза отщепляет от эластина пептид с переводом его в
растворимый эластин для дальнейшего его расщепления протеазами,
липаза осуществляет гидролиз несвязанных нейтральных жиров на
жирные кислоты и глицерин. Поскольку амилаза, кроме
поджелудочной железы, образуется в слюнных железах, печени и лёгочных
альвеолах, нормальная её активность в крови определяется суммой
синтезируемого во всём организме фермента.
В физиологических условиях присутствие внутриклеточных
(секреторного ингибитора трипсина) и плазменных (а,-антитрипсина
и а2-макроглобулина) ингибиторов протеаз обеспечивает
основные механизмы биологической защиты организма от
разрушительного действия ферментов. При развитии деструктивного
панкреатита протео- и липолитические ферменты поджелудочной железы,
лишённые естественных факторов физиологической защиты от ауто-
активации, оказывают мощное разрушительное действие не только
на ткани и структуры близлежащих с поджелудочной железой органов.
204 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 8
но и (поступая в кровеносное русло) на системы
экстраабдоминальной локализации.
Оптимальную среду для работы ферментов создают бикарбонаты,
секретируемые в поджелудочной железе. Кальций панкреатического
сока регулирует внутриклеточный синтез ферментов и их
поступление в протоки. Экзокринная функция поджелудочной железы
регулируется не только парасимпатической системой, но и гуморальной
функцией энтерогормонов.
Эндокринная функция поджелудочной железы реализуется в
островках Лангерханса, преимущественно локализованных в хвосте
органа. Инсулин (секретируется р-клетками), глюкагон (ос-клетками)
и липокаин регулируют функции углеводного и тканевого обмена.
Гастрин, панкреатический полипептид и соматостатин
(секретируется D-клетками островков Лангерханса) угнетают секрецию
ферментов поджелудочной железы, регулируют моторику желудка и
тонкой кишки.
Этиология и патогенез
Основной этиологический фактор развития острого
панкреатита — заболевания внепечёночных жёлчных путей, на их долю
приходится 45% наблюдений. Анатомическая и функциональная общность
панкреатобилиарной системы обусловливает частое развитие
острого панкреатита при ЖКБ, холедохолитиазе, стриктуре, спазме или
воспалении большого дуоденального сосочка, дискинезии жёлчных
путей различной природы. В этих условиях нарушается отток
панкреатического секрета по внепечёночным жёлчным путям и протоко-
вой системе поджелудочной железы, развивается билиарно-панк-
реатический или дуоденально-панкреатический рефлюкс, а также
внутрипротоковая гипертензия.
Второй по частоте предпосылкой развития острого панкреатита
бывает хронический алкоголизм, алкогольный эксцесс или приём
суррогатов алкоголя. Подобную причину заболевания выявляют в
среднем у 35% больных. Эти факторы ведут к нарушению дренажной
функции панкреатических и жёлчных протоков, поскольку
стимулированная алкоголем секреция приводит к увеличению вязкости
панкреатического секрета, повышению внутрипротокового давления.
Повреждения поджелудочной железы вследствие тупой травмы
живота, хирургического вмешательства либо эндоскопической рет-
Острый панкреатит ♦ 205
! роградной панкреатохолангиографии и папиллотомии также способ-
i ны вызвать развитие острого панкреатита.
При заболеваниях двенадцатиперстной кишки (пенетрации язвы
в головку поджелудочной железы, дуоденостазе, дуоденальных
дивертикулах, дуодените с папиллитом) нарушение эвакуации из кишки,
повышение внутриполостного давления, дискинезия сфинктерного
аппарата приводят к формированию дуоденально-панкреатического
рефлюкса и внутрипротоковой гипертензии с последующим
возникновением острого панкреатита.
С нарушениями нейро-гуморальных и висцеральных
взаимоотношений, системного метаболизма связано развитие острого
панкреатита при гиперлипидемии, сахарном диабете, вирусном гепатите,
СПИДе, васкулитах различной этиологии, заболеваниях печени, па-
рашитовидных желёз, различных видах шока. Среди широкого
спектра химических соединений, способных стать причиной острого
панкреатита, следует отметить следующие лекарственные препараты:
фуросемид, индометацин, салицилаты, эритромицин, тетрациклин
и некоторые другие антибиотики.
Основу патогенеза острого панкреатита составляют процессы
местного и системного воздействия панкреатических ферментов и ци-
токинов различной природы.
Комбинация нескольких пусковых факторов в рамках полиэтио-
логичности острого панкреатита приводит к повреждению ацинар-
ной клетки. При этом происходит слияние зимогенных гранул и
лизосомальных гидролаз, следствием чего становится активация
проферментов с последующим выходом протеаз в интерстиций
поджелудочной железы. В результате происходит её аутокаталитическое
переваривание. Активация трипсиногена и переход его в трипсин —
мощный активатор всех остальных проэнзимов с формированием
каскада тяжёлых патобиохимических реакций.
Активированные ферменты поджелудочной железы выступают в
качестве первичных факторов агрессии, оказывают местное действие,
а также поступают в забрюшинное пространство, брюшную полость,
по воротной вене — в печень, по лимфатическим коллекторам — в
системный кровоток. Фосфолипаза А2 разрушает мембраны клеток,
липаза гидролизует внутриклеточные триглицериды до жирных
кислот, которые, соединяясь с кальцием, образуют элементы структуры
жирового (липолитического) некроза в поджелудочной железе,
клетчатке забрюшинного пространства и на брюшине. Трипсин и химот-
рипсин осуществляют протеолиз белков тканей, эластаза разрушает
206 <> Хирургические болезни О Том 1 ♦ Часть II ^ Глава 8
стенку сосудов и межтканевые соединительнотканные структуры, что
приводит к развитию геморрагического (протеолитического)
некроза. Формирующиеся очаги некробиоза и некроза с перифокальной
демаркационной зоной воспаления в поджелудочной железе и заб-
рюшинной клетчатке первично асептичны.
Важное звено патогенеза острого панкреатита — активация
трипсином калликреин-кининовой системы с образованием вторичных
факторов агрессии — брадикинина, гистамина, серотонина, что
сопровождается увеличением сосудистой проницаемости,
нарушениями микроциркуляции, формированием отёка в зоне поджелудочной
железы и забрюшинном пространстве, повышенной экссудацией в
брюшную полость.
К факторам агрессии третьего порядка, участвующим в развитии
местной и системной воспалительной реакции, сердечной и
дыхательной недостаточности, нарушениях микроциркуляции и системной
гемодинамики, относят синтез мононуклеарными клетками,
макрофагами и нейтрофилами различных медиаторов воспаления (цито-
кинов): интерлейкинов 1, 6, 8 и 10, фактора некроза опухоли,
фактора активации тромбоцитов, непанкреатической формы фосфолипазы
А,, простагландинов, тромбоксана, лейкотриенов. В ранние сроки
некротического панкреатита концентрация всех медиаторов
воспаления резко увеличивается в поджелудочной железе, печени, лёгких,
селезёнке и системном кровотоке, а их дисбаланс определяет
механизмы развития локальной, органной и системной воспалительной
реакции и полиорганной недостаточности.
Ферменты, цитокины и метаболиты различной природы,
образующиеся в поджелудочной железе, беспрепятственно поступают в
воротную вену и/или по грудному лимфатическому протоку в
системный кровоток с развитием панкреатогенной токсинемии. Первыми
органами-мишенями на пути их транслокации из забрюшинного
пространства становятся печень, лёгкие, сердце, мозг и почки. Итогом
мошного цитотоксического повреждения этих органов в ранние
сроки заболевания бывают возникновение выраженных расстройств их
функций и развитие панкреатогенного шока.
В патогенезе системных нарушений ещё до развития
гнойно-септических осложнений важную роль играет токсинемия
бактериальной природы и, прежде всего, липополисахарид клеточной стенки
грамотрицательных бактерий. При остром панкреатите транслокация
эндогенной микрофлоры и эндотоксина грамотрицательных
бактерий кишечника происходит в условиях функциональной несостоя-
Острый панкреатит О 207
тельности барьерной функции ЖКТ, ретикулоэндотелиальной
системы печени и лёгких. Транслокация эндогенной микрофлоры из
ЖКТ в ткани поджелудочной железы и забрюшинного
пространства — ведущее звено патогенеза гнойно-септических осложнений
деструктивного панкреатита. Она составляет своеобразное связующее
звено между начальной (ранней, доинфекционной) и последующей
(поздней, инфекционной) фазами острого панкреатита.
В соответствии с эволюцией заболевания в патогенезе острого
панкреатита выделяют две основные фазы заболевания.
• Первая фаза заболевания обусловлена формированием системной
воспалительной реакции в течение первых суток от начала
заболевания, когда аутолиз, некробиоз и некроз поджелудочной железы и
забрюшинной клетчатки носят абактериальный характер. В эти
сроки заболевания в зависимости от степени выраженности патомор-
фологических нарушений возможно формирование интерстициаль-
ного (отёчного) панкреатита или стерильного панкреонекроза.
• При прогрессировании заболевания закономерен переход
патологического процесса во вторую фазу острого панкреатита, которая
характеризуется развитием поздних постнекротических
осложнений, связанных с инфицированием зон некроза различной
локализации на 2—3-й неделе заболевания. В этих условиях происходят
реактивация и репродукция аналогичных первой фазе воспалительных
медиаторов. Триггером процесса становятся токсины
микроорганизмов, колонизирующих зоны некроза.
Существует прямая зависимость между степенью
распространённости некротического поражения и вероятностью инфицирования.
Присоединение инфекции в условиях обширного некротического
процесса сопровождается развитием распространённого
инфицированного панкреонекроза, тогда как при ограниченном некрозе
формируется абсцесс.
Патоморфология
Основу патоморфологических изменений при остром
панкреатите составляет последовательная или синхронная в различных
анатомических зонах смена процессов воспаления, некробиоза, некроза и
инфицирования. Чаще возникают комбинированные поражения
отдельных частей поджелудочной железы. Варианты патоморфологии
варьируют от микроскопически выявленных очагов стеатонекроза и
ирургические болезни ♦ Том 1 О- Часть II ♦ Глава 8
интерстициального отёка поджелудочной железы до визуально
определяемых областей жирового и/или геморрагического панкреонек-
роза с вовлечением клетчатки забрюшинного пространства и
органов брюшной полости.
Отёчный (интерстициальный) панкреатит морфологически и
гистологически характеризуется отёком ткани поджелудочной железы, её
уплотнением, встречают отдельные микроучастки жирового некроза.
Жировой панкреонекроз характеризуется увеличением
поджелудочной железы, резким отёком с исчезновением дольчатости её
структуры, наличием очагов и зон стеатонекроза («стеариновых пятен»), а
также участков геморрагии в поджелудочной железе и забрюшинной
клетчатке. В брюшной полости выявляют серозный прозрачный
экссудат. При микроскопии отмечают чередование участков отёка,
кровоизлияний и жировых некрозов, лейкоцитарную инфильтрацию,
сосудистые микротромбозы.
Геморрагический панкреонекроз имеет наиболее яркие проявления.
В паренхиме поджелудочной железы и окружающих её тканях
определяют обширные участки кровоизлияний, геморрагической имбибиции,
зоны некроза чёрного и серого цветов. Эти изменения сочетаются с
наличием белых «стеариновых пятен» жирового некроза. В брюшной
полости содержится большое количество геморрагического выпота
с высокой активностью ферментов и токсических субстанций.
В асептическую фазу заболевания некротический процесс в
поджелудочной железе и различных отделах забрюшинного пространства
может носить распространённый и ограниченный характер.
• При распространённом панкреонекрозе зоны некроза
локализованы более чем в одном отделе поджелудочной железы с
обязательным вовлечением в патологический процесс клетчатки,
окружающей поджелудочную железу, а также клетчатки других областей
забрюшинного пространства.
• При ограниченном панкреонекрозе в поджелудочной железе
мелкие или крупные очаги некроза располагаются в пределах
какого-либо одного отдела поджелудочной железы и окружающей её
клетчатки.
Среди патоморфологических форм панкреатогенной инфекции
выделяют следующие:
• инфицированный панкреонекроз;
• панкреатогенный абсцесс;
• инфицированную псевдокисту.
Острый панкреатит -0- 209
Классификация
Основу клинико-морфологической классификации острого
панкреатита составляют следующие формы заболевания.
^L Отёчный (интерстициальный) панкреатит.
II. Стерильный панкреонекроз:
- по распространённости поражения: ограниченный и
распространённый;
- по характеру поражения; жировой, геморрагический,
смешанный.
III. Инфицированный панкреонекроз.
п
Отёчный панкреатит, как правило, имеет неосложнённое
(абортивное) течение, тогда как для панкреонекроза характерно развитие
местных и системных осложнений.
• Местные осложнения:
- в асептическую фазу панкреонекроза: парапанкреатический
инфильтрат, некротическая флегмона забрюшинной клетчатки,
ферментативный (абактериальный) перитонит, псевдокиста (позднее
осложнение);
— в фазу инфицированного панкреонекроза:
гнойно-некротическая флегмона забрюшинной клетчатки, абсцессы забрюшинных
клетчаточных пространств или брюшной полости, внутренние и
наружные панкреатические, желудочно-кишечные свищи, арро-
зивные кровотечения (внутрибрюшные и в ЖКТ).
• Внебрюшные осложнения: панкреатогенный (ферментативный)
шок, септический шок, полиорганная недостаточность.
Клиническая картина
Основные симптомы острого панкреатита — боль, рвота и
метеоризм (триада Мондора).
Боль появляется обычно внезапно, чаще в вечернее или ночное
время вскоре после погрешности в диете (например, употребление
жареных или жирных блюд, алкоголя). Как правило, она носит
интенсивный характер, без светлых промежутков. Наиболее типичная
её локализация — эпигастральная область, что соответствует
анатомическому положению поджелудочной железы. Эпицентр боли
ощущается по средней линии, но может располагаться преимуществен-
но справа или слева от срединной линии и даже распространяться по
всему животу. Обычно боли иррадиируют вдоль рёберного края по
направлению к спине, иногда в поясницу, грудь, плечи, левый рёбер-
но-позвоночный угол. Часто они носят опоясывающий характер и
создают впечатление затягивающегося пояса или обруча. При
преимущественном поражении головки поджелудочной железы
локализация боли может напоминать острый холецистит, при поражении её
тела — заболевания желудка, а при поражении хвоста — заболевания
сердца или левой почки. В ряде ситуаций резкий болевой синдром
может приводить к явлениям коллапса и шока: профузный пот,
снижение АД, тахикардия с ослаблением пульса.
Практически одновременно с болями возникает многократная,
мучительная и не приносящая облегчения рвота. Приём пищи или воды
её провоцирует. Несмотря на многократный характер рвоты, рвотные
массы никогда не имеют застойного (фекалоидного) характера.
Температура тела в начале заболевания чаще носит субфебриль-
ный характер, а при развитии инфицированных форм панкреатита
возникает гектическая лихорадка. Характерно поведение
пациентов — они беспокойны, просят обезболивающих средств. Важным и
ранним диагностическим признаком заболевания считают цианоз
лица и конечностей. Цианоз в виде фиолетовых пятен на лице
известен как симптом Мондора, пятна цианоза на боковых стенках
живота — симптом Грея Тернера, цианоз околопупочной области —
симптом Грюнвальда. В поздние сроки заболевания цианоз лица может
смениться яркой гиперемией кожных покровов, особенно лица —
«калликреиновое лицо». В основе перечисленных признаков лежат
быстро прогрессирующие гемодинамические и микроциркуляторные
расстройства, гиперферментемия.
При осмотре живота отмечают его вздутие, преимущественно в
верхних отделах. В тяжёлых случаях живот равномерно вздут, резко
чувствителен даже при поверхностной пальпации. При глубокой
пальпации боли резко усиливаются, порой носят нестерпимый
характер. Пальпация поясничной области, особенно в левом рёберно-
позвоночном углу, резко болезненна (симптом Мейо—Робсона). В зоне
повышенной чувствительности, обнаруживаемой при поверхностной
пальпации, выявляют ригидность мышц передней брюшной стенки.
Как правило, мышечное напряжение свидетельствует о наличии
выпота, богатого ферментами, и явлениях панкреатогенного
перитонита. Весьма часто наблюдают поперечную болезненную резистентность
передней брюшной стенки в проекции поджелудочной железы (сим-
Острый панкреатит О- 211
птом Керте). Один из признаков острого панкреатита —
невозможность определения пульсации брюшного отдела аорты вследствие
увеличения в размерах поджелудочной железы и отёка забрюшинной
клетчатки — симптом Воскресенского. В случаях, когда процесс
локализуется в сальниковой сумке, мышечное напряжение выявляют
преимущественно в надчревной зоне; когда процесс выходит за её
пределы (на клетчатку забрюшинного пространства и малого таза, а
также брюшину), появляются выраженное мышечное напряжение и
положительный симптом Щёткина—Блюмберга.
Необходимо помнить, что при локализации некрозов в хвостовой
части поджелудочной железы симптомы раздражения брюшины
могут быть слабо выраженными, что связано с преимущественно
забрюшинной локализацией процесса и отсутствием явлений
перитонита. Для поражения головки типично быстрое развитие желтухи и
гастродуоденального пареза. При тяжёлых формах острого
панкреатита можно обнаружить притупление в отлогих местах живота,
свидетельствующее о наличии выпота в брюшной полости. При аускуль-
тации живота выявляют ослабление или отсутствие кишечных шумов
вследствие пареза ЖКТ.
Многообразие клинических проявлений характерно для
различных форм некротического панкреатита и его осложнений.
• Парапанкреатический инфильтрат (оментобурсит) — один из
промежуточных вариантов эволюции патоморфологического
процесса в забрюшинной клетчатке. Клиническая картина представлена
длительным болевым синдромом, повышенной температурой тела
(37,5—38,0 °С), пальпируемым в верхних отделах брюшной полости
болезненным инфильтратом, явлениями гастродуоденальной
динамической непроходимости.
• Некротическая флегмона забрюшинной клетчатки проявляется
выраженной системной воспалительной реакцией, появлением
перитонеальных симптомов, стойким парезом кишечника, пан-
креатогенным или септическим шоком и полиорганной
недостаточностью.
• Инфицированный панкреонекроз, имеющий в большинстве
наблюдений распространённый характер, обычно формируется на 1—2-й
неделе заболевания. Для него характерны гектическая температура
тела, озноб, артериальная гилотензия и полиорганные нарушения.
• Панкреатогенный абсцесс (абсцесс поджелудочной железы,
сальниковой сумки, забрюшинной клетчатки) — типичное позднее ос-
212 О Хирургические болезни <? Том 1 ♦ Часть II ♦ Глава 8
ложнение ограниченного панкреонекроза, формирующееся на 3-
4-й неделе заболевания и даже позже. Появляются гектическая
лихорадка, озноб, пальпируемый болезненный инфильтрат, не
имеющий тенденции к уменьшению.
• Псевдокиста характеризуется длительным болевым синдромом в
эпигастральной области, симптомами дуоденальной
непроходимости и появлением в верхних отделах живота объёмного
пальпируемого округлого плотноэластического образования.
Диагностика
Лабораторная диагностика
В клинической практике наиболее распространено определение
активности панкреатических ферментов в крови — альфа-амилазы и
липазы. Увеличение сывороточной активности общей и
панкреатической амилазы в 4 раза и липазы в 2 раза по отношению к верхней
границе нормы свидетельствует о панкреостазе, что в совокупности
с клиническими симптомами заболевания подтверждает диагноз
острого панкреатита. Максимальные значения активности сывороточной
амилазы наблюдают в течение первых 2 сут от начала заболевания.
В более поздние сроки определение активности липазы в крови —
более значимый диагностический тест, поскольку её активность в
крови больного острым панкреатитом сохраняется длительное время.
Традиционно в клинической практике для диагностики острого
панкреатита используют определение активности амилазы в моче,
поскольку при высокой концентрации в крови она экскретируется
почками. В качестве дополнительного теста проводят определение
активности амилазы в перитонеальном экссудате, полученном во
время лапароскопии (лапароцентеза). При использовании метода Воль*
гемута (определение суммарной амилолитической активности мочи,
норма — 16—64 ед.) можно обнаружить различное повышение
активности — от 128 до 1024 ед. и более.
Среди других биохимических маркёров, характеризующих тяжесть
острого панкреатита, перспективно определение каталитической
активности фосфолипазы А2, трипсин-активированных пептидов, ин-
терлейкинов 6 и 8, TNF и эластазы нейтрофилов.
В пользу инфицированного панкреонекроза свидетельствует
увеличение количества лейкоцитов крови в динамике наблюдения и ле-
Острый панкреатит ♦ 213
чения. Чаще всего регистрируют лейкоцитоз 12—15-109/л, но при
обширном панкреонекрозе, особенно при развитии септических
осложнений, возможен значительный лейкоцитоз с увеличением
расчётного показателя лейкоцитарного индекса интоксикации.
Гемоконцентрация наиболее характерна для деструктивных форм
острого панкреатита: гематокрит более 47% на момент госпитализации
больного в стационар и отсутствие его снижения в течение 24 ч
интенсивной терапии. Стойкая гипергликемия свидетельствует в пользу
обширного некроза поджелудочной железы, а её содержание более
6,9 ммоль/л — неблагоприятный прогностический фактор. При би-
лиарном панкреатите вследствие холедохолитиаза, а также при
развитии преимущественного поражения головки поджелудочной
железы характерно формирование синдрома холестаза, что выражается в
гипербилирубинемии с преобладанием прямой (связанной) фракции
билирубина, высокой активности аспартатаминотрасферазы и
щелочной фосфатазы.
Дополнительный лабораторный метод, используемый в
комплексе диагностической программы у больных острым панкреатитом, —
определение в крови концентрации С-реактивного белка и прокаль-
цитонина. Содержание С-реактивного белка более 120 мг/л в
крови больного свидетельствует в пользу некротического поражения
поджелудочной железы, тогда как увеличение его концентрации в
динамике заболевания более чем на 30% исходного уровня в
совокупности с другими клинико-лабораторными данными
достоверно подтверждает развитие панкреатогенной инфекции.
Исследования последних лет показали, что увеличение концентрации
прокальцитонина (предшественника кальцитонина) в крови более
1,8 нг/мл в двух последовательных исследованиях — важный
лабораторный маркёр бактериального инфицирования очагов
некротической деструкции.
Инструментальная диагностика
Для диагностики острого панкреатита и его разнообразных форм
используют комплекс инструментальных методов: УЗИ,
лапароскопию, КТ, результаты чрескожных пункций зон некроза различной
локализации под контролем УЗИ и КТ, эндоскопическую
ретроградную панкреатохолангиографию. На основании результатов этих
методов обследования в динамике заболевания и лечения чётко
верифицируют клинико-морфологическую форму острого панкреатита.
214 О- Хирургические болезни ♦ Том 1 ♦ Часть II ^ Глава 8
Ультразвуковое исследование (УЗИ) используют в качестве
скрининг-метода при подозрении на острый панкреатит. Ведущие УЗИ-
признаки острого панкреатита: увеличение размеров головки, тела и
хвоста поджелудочной железы, неоднородность её эхо-структуры и
неровность контуров, визуализация жидкостных образований
различных размеров в парапанкреальной зоне и брюшной полости.
Лапароскопия при остром панкреатите показана в следующих
случаях:
• уточнение характера панкреонекроза — жировой,
геморрагический, смешанный;
• оценка распространённости и характера (абактериальный,
инфицированный) панкреатогенного перитонита;
• диагностика сопутствующего деструктивного холецистита;
• исключение других причин «острого живота» (перфорация
полого органа, острый холецистит, внутрибрюшное кровотечение,
инфаркт кишечника), требующего экстренного оперативного вмеша
тельства.
При осмотре брюшной полости во время лапароскопии
выявляют следующие признаки отёчного панкреатита: оттеснение желудка
и выбухание желудочно-ободочной связки, «стекловидный» отёк
околопанкреальных связочных образований, гиперемия брюшины
в верхнем этаже брюшной полости. Наличие «стеариновых пятен»
жирового некроза белесовато-жёлтого цвета, расположенных на
париетальной, висцеральной брюшине, сальнике, и серозный экссудат
соломенного цвета свидетельствуют о жировом панкреонекрозе. Для
геморрагического панкреонекроза характерны геморрагическая им-
бибиция малого и большого сальников, брыжейки поперечной
ободочной кишки, забрюшинной клетчатки латеральных каналов,
появление признаков пареза желудка, тонкой и толстой кишок,
значительное количество насыщенного геморрагического выпота («сок
чернослива») в брюшной полости.
Под лапароскопическим контролем при панкреонекрозе
выполняют декомпрессивные операции на жёлчном пузыре (холецисто-
стомию), при панкреатогенном перитоните — санацию и
дренирование брюшной полости.
Компьютерная томография (КТ) позволяет чётко
дифференцировать плотные некротические массы (некротическая флегмона) от
жидкостных образований (абсцесс, псевдокиста) различной локализации,
представить информацию об их взаиморасположении, вовлечении в
воспалительно-некротический процесс желчевыводящих путей, пред-
-
Острый панкреатит ♦ 21
лежащих сосудистых структур и отделов ЖКТ (рис. 8-1). Расширяет
диагностические возможности КТ с внутривенным контрастным
усилением. Для этого внутривенно вводят 100—120 мл
водорастворимого контрастного препарата. Отсутствие накопления контраста в
определённых отделах поджелудочной железы свидетельствует о её
некротическом поражении, что позволяет с высокой точностью
верифицировать локализацию панкреонекроза.
Методом ранней специальной диагностики инфицированных
постнекротических осложнений служит чрескожная пункция зон
некроза под контролем УЗ И или КТ с последующим бактериологическим
исследованием полученного материала, включающим немедленную
окраску по Граму, бактериологический посев для определения вида
микроорганизмов и их чувствительности к антибиотикам.
Эндоскопическая ретроградная панкреатохолангиография и
эндоскопическая папиллотомия показаны при наличии синдрома
механической желтухи и/или холангита с учётом визуализации при УЗИ
расширенного в диаметре общего жёлчного протока.
Рентгенологические диагностические методы не утратили своей
значимости в комплексе методов обследования больных с острым
панкреатитом и, в первую очередь, в дифференциации острого
панкреатита от перфорации полого органа и механической кишечной
непроходимости. При обзорной рентгенографии органов брюшной полости
неспецифическими симптомами острого панкреатита считают пнев-
матизацию поперечной ободочной кишки, наличие небольших по
размерам уровней жидкости в тонкой кишке. Рентгенография органов
L5
Рис. 8-1. Компьютерная
томограмма больного с
инфицированным панкреонекрозом,
осложнённым абсцессом
сальниковой сумки: / — полость абсцесса
с детритом; 2 — селезёнка; 3 —
желудок.
216 •$> Хирургические болезни ♦ Том 1 О Часть II ♦ Глава 8
грудной клетки позволяет выявить плевральный выпот и базальные
ателектазы лёгких, подъём купола диафрагмы, чаще всего синхронные
с поражением соответствующей области забрюшинной клетчатки.
Дифференциальная диагностика
Дифференциальная диагностика острого панкреатита
представляет сложную клиническую задачу, поскольку основные проявления
заболевания, особенно при развитии деструктивных форм, имеют
плюривисцеральный характер. По этим причинам острый
панкреатит довольно часто приходится дифференцировать с перфоративной
язвой желудка или двенадцатиперстной кишки, острой кишечной
непроходимостью, острым холециститом, острой окклюзией артерий
или вен мезентериального бассейна, разрывом аневризмы
брюшного отдела аорты, острым инфарктом миокарда.
Лечение
Консервативная терапия
Тактика лечения больных с острым панкреатитом определяется
формой заболевания в соответствии с фазой развития воспалительного
и некротического процесса и степенью тяжести состояния больного.
Лечение всех форм острого панкреатита построено на общих
принципах интенсивной консервативной терапии, включающей
следующие кардинальные моменты:
• подавление секреции поджелудочной железы, желудка и
двенадцатиперстной кишки;
• снижение ферментной токсинемии;
• ликвидация гиповолемии, водно-электролитных и
метаболических расстройств;
• устранение гипертензии в желчевыводящих и панкреатических
путях;
• улучшение реологических свойств крови и минимизация мик-
роциркуляторных расстройств;
• борьба с гипоксемией;
• лечение пареза ЖКТ;
• купирование болевого синдрома.
Адекватная инфузионная терапия — основа лечения панкреонек-
роза. Лечение начинают с переливания изотонических растворов и
Острый панкреатит О- 217
препаратов калия хлорида при гипокалиемии. Поскольку при остром
панкреатите возникает дефицит ОЦК за счёт потери плазменной
части крови, используют коллоидные растворы (препараты крахмала,
белки). Критериями адекватного объёма инфузии служат
нормализация ЦВД, гематокрита и объёма мочевыделения. Улучшения
реологических свойств крови достигают назначением
низкомолекулярных декстранов с пентоксифиллином.
Параллельно проводят мероприятия, направленные на
подавление функциональной активности поджелудочной железы, создание
«физиологического покоя», строгое ограничение приёма пищи в
течение 5—7 сут. Эффективного снижения панкреатической секреции
достигают аспирацией желудочного содержимого через назогаст-
ральный зонд, промыванием желудка холодной водой (локальная
гипотермия). С целью снижения кислотности желудочного секрета
назначают щелочное питьё и Н2-блокаторы желудочной секреции
(фамотидин, ранитидин) или препараты омепрозола. Для
подавления секреторной активности органов гастропанкреатодуоденальной
зоны в первые 3—5 сут активной гиперферментемии используют
синтетические аналоги соматостатина (октреотида ацетат, стиламин),
а для ликвидации энзимной токсинемии применяют ингибиторы
протеаз: апротинин (контрикал или гордокс) внутривенно капель-
но. С целью системной детоксикации целесообразно использование
экстракорпоральных методов детоксикации: плазмаферез,
ультрафильтрация крови.
Инфицированные осложнения панкреонекроза в поздней фазе
развития заболевания остаются основными причинами высокой
летальности. Поэтому проведение рациональной антибактериальной
профилактики и терапии инфекции при панкреонекрозе имеет
ведущее патогенетическое значение. Препараты выбора как для
профилактического, так и лечебного применения: карбапенемы, це-
фалоспорины III и IV поколений + метронидазол, фторхинолоны +
метронидазол. Отёчная форма панкреатита не требует назначения
антибактериальных препаратов.
Развитие метаболического дистресс-синдрома считают
основанием для длительного проведения полноценного парентерального
питания (растворы глюкозы, аминокислот). При восстановлении
функций ЖКТ целесообразно проведение энтерального питания
питательными смесями, которое осуществляют через назоеюнальный
зонд, установленный дистальнее связки Трейца эндоскопическим
путём либо во время хирургического вмешательства.
218 О Хирургические болезни <> Том 1 ♦ Часть II ♦ Глава 8
Хирургическое лечение
Принципы хирургического лечения больных панкреонекрозом
основаны на дифференцированном подходе к выбору оперативных
вмешательств в зависимости от фазы развития заболевания, клини-
ко-морфологической формы, степени тяжести состояния больного и
сроков заболевания.
Острый интерстициальный панкреатит и стерильные формы пан-
креонекроза, осложнённые развитием ферментативного
перитонита, — показания к лапароскопической санации и дренированию
брюшной полости. Если в этих условиях при УЗИ или КТ в забрюшинном
пространстве выявляют ограниченное скопление жидкости, её
удаляют путём чрескожной пункции или дренирования под контролем
этих визуализирующих методов.
Показанием к лапаротомному вмешательству при стерильном пан-
креонекрозе считают сохранение или прогрессирование полиорганной
недостаточности, несмотря на проведение интенсивной
консервативной терапии, лапароскопической санации и дренирования брюшной
полости и/или чрескожных операций, выполняемых под УЗИ- или
КТ-контролем. В доинфекционную фазу патологического процесса
лапаротомное вмешательство, предпринятое по этим показаниям,
направлено на удаление некротических тканей, эвакуацию богатого
ферментами и токсинами экссудата из забрюшинного пространства и
брюшной полости, их адекватное дренирование. Важнейший этап
оперативного вмешательства — устранение патологии жёлчных путей.
Наличие признаков билиарной гипертензии — показание к холецисто-
стомии. При деструктивном холецистите выполняют холецистэктомию
в сочетании с наружным дренированием общего жёлчного протока.
Инфицированные формы панкреонекроза, независимо от степени
полиорганных нарушений, требуют незамедлительного
хирургического вмешательства. В противном случае фатальный исход
заболевания неизбежен. При формировании инфицированного
панкреонекроза в сочетании с абсцессом на первом этапе хирургического лечения
используют малоинвазивные технологии чрескожного дренирования
гнойно-некротического очага под УЗИ- или КТ-контролем.
Подобная тактика позволяет выполнить лапаротомное вмешательство на 2-
3-й неделе заболевания, когда возможно разграничение зон некроза
и жизнеспособных тканей, что обеспечивает оптимальные условия
для одномоментной и полноценной некрэктомии и секвестрэктомии
с минимальной интраоперационной кровопотерей.
Острый панкреатит О- 219
Чрескожное дренирование панкреатогенного абсцесса или
инфицированной псевдокисты, выполняемое под УЗИ- или КТ-контролем,
представляется оптимальным способом их хирургического лечения в
тех ситуациях, когда объём некроза минимален, полость абсцесса или
псевдокисты не содержит крупных секвестров и замазкообразного
детрита, провоцирующих постоянную обтурацию трубчатых
дренажей. Эти методы малоинвазивной хирургии имеют несомненные
преимущества также в тех случаях, когда в забрюшинном пространстве
или брюшной полости формируются ограниченные жидкостные
образования в различные сроки после лапаротомных операций.
При распространённом инфицированном панкреонекрозе
выполняют лапаротомию, удаляют некротические ткани или секвестры,
проводят санацию зон поражения и широкое дренирование ретропе-
ритонеальной клетчатки (рис. 8-2). Невозможность
одномоментного устранения всех гнойно-некротических очагов в течение одной
операции обосновывает необходимость выполнения этапных
(программируемых) некр- и секвестрэктомий.
Выбор лапаротомного хирургического доступа зависит от
локализации и распространённости поражения поджелудочной железы и
различных отделов забрюшинной клетчатки. Основные оперативные
доступы:
• срединная лапаротомия;
• двухподрёберный доступ;
• люмботомия.
В зависимости от интраоперационной
картины при различных формах панкрео-
некроза используют резекционные
(удаление части некротизированной
поджелудочной железы) или органосохраняющие
(абдоминизация поджелудочной железы,
некр- и секвестрэктомия) виды операций.
Резекцию поджелудочной железы при
панкреонекрозе выполняют в случае
полного (на всю толщу органа) некроза в
области хвоста и/или тела поджелудочной
железы на фоне стабильного состояния
больного (отсутствие признаков шока).
Абдоминизация поджелудочной железы
направлена на декомпрессию парапанкре-
альной клетчатки, адекватную эвакуацию
Рис. 8-2. Дренирование па-
рапанкреальной клетчатки
при инфицированном
панкреонекрозе.
220 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 8
панкреатогенного и/или инфицированного высокотоксичного
выпота из забрюшинного пространства. С этой целью рассекают
брюшину по нижнему и верхнему краям в области тела и хвоста органа,
тупым путём выделяют железу из забрюшинной парапанкреальной
клетчатки (рис. 8-3). Некрэктомия предполагает удаление некроти-
зированных тканей в пределах кровоснабжаемых зон, связанных с
паренхимой органа, тогда как секвестрэктомия включает удаление
свободно лежащих некротических масс в пределах
нежизнеспособных тканей. Обязательный элемент каждой операции — промывание
всех поражённых зон забрюшинной локализации физиологическим
раствором или антисептиками.
При интерстициальном панкреатите летальность минимальна,
тогда как при развитии некротического панкреатита она варьирует
от 20 до 40%. Факторы неблагоприятного исхода острого панкреатита:
» обширный характер некроза поджелудочной железы и
различных отделов забрюшинной клетчатки;
• наличие панкреатогенной инфекции;
• выраженные полиорганные нарушения.
Распространённые инфицированные формы панкреонекроза,
которым в большинстве наблюдений сопутствует полиорганная
недостаточность, имеют фатальную эволюцию заболевания.
Рис. 8-3. Абдоминизация
поджелудочной железы в области тела
и хвоста (мобилизованная
поджелудочная железа взята на
держалку).
Острый панкреатит ♦ 221
В случае благоприятного исхода острого панкреатита основные
моменты, определяющие качество жизни пациентов, их физическую,
психоэмоциональную и социальную реабилитацию, следующие:
• степень утраты экзо- и эндокринной функций поджелудочной
железы;
• адекватность устранения этиологических факторов, приведших
к развитию заболевания.
Так, при полном устранении билиарной или алиментарной
причины, приведшей к развитию острого интерстициального
панкреатита, функции органа полностью восстанавливаются, качество жизни
пациентов существенно не страдает. Наиболее частым последствием
перенесённого распространённого панкреонекроза бывает развитие
псевдокист, панкреатических свищей, хронического
рецидивирующего панкреатита, обусловливающих формирование у пациента
синдрома нарушенного пищеварения, сахарного диабета и дислипопро-
еидемии.
Qi-дпкп ОСЛОЖНЕНИЯ
I WMMU ЯЗВЕННОЙ БОЛЕЗНИ
Язвенная болезнь желудка и двенадцатиперстной кишки широко
распространена во всём мире. Приводимые в специальной
литературе конца XX века статистические данные свидетельствуют о многих
миллионах больных в экономически развитых странах, подчёркивая
тенденцию к росту заболеваемости этим недугом. По мнению
ведущих гастроэнтерологов мира, язвенная болезнь — национальная
проблема многих стран.
Последнее десятилетие характеризовалось новыми достижениями
в лечении язвенной болезни, отразившимися на врачебном подходе
к этому заболеванию. Речь идёт об успехах фармакотерапии
(появлении принципиально новых классов антисекреторных препаратов), а
также об уточнении представления о патогенезе язвенной болезни
(роли Helicobacter pylori). Всё это вызвало у части врачей, в первую
очередь терапевтов, своего рода эйфорию. Казалось, что проблема
язвенной болезни разрешается исключительно терапевтическим
путём и хирургии не остаётся места в лечении этого заболевания.
Между тем летальность, обусловленная осложнениями язвенной
болезни, не претерпела столь заметных изменений. Поэтому ещё долгие
годы хирурги наряду с терапевтами будут призваны оказывать помощь
этому многочисленному контингенту больных.
Хирургия язвенной болезни в первую очередь — хирургия её
осложнений. Поэтому в данной главе учебника речь пойдёт только об
осложнённых формах заболевания. К ним относят перфорацию
язвы, профузное желудочно-кишечное кровотечение, пилородуоденаль-
ный стеноз, пенетрацию и малигнизацию. Последнее осложнение
в силу особенностей хирургической тактики будет рассмотрено в
главе, посвященной раку желудка. Пенетрация (проникновение язвы
в соседние анатомические структуры, чаще всего в головку
поджелудочной железы и печёночно-двенадцатиперстную связку)
становится частой причиной гастродуоденального кровотечения.
Поэтому своеобразные диагностические приёмы и хирургическая техника,
используемые при этом осложнении, будут описаны в рамках
кровоточащих язв.
Осложнения язвенной болезни О 223
Перфоративные гастродуоденальные язвы
Перфорация — тяжёлое, угрожающее жизни осложнение,
занимающее ведущие позиции в структуре летальности при язвенной
болезни. Снизившаяся к 50-м годам прошлого века летальность при этом
состоянии уже в течение многих лет составляет от 5 до 17,9%.
Определяющие летальность факторы — тяжёлое общее состояние
пациента, обусловленное развитием перитонита, нередко выраженной
сопутствующей патологией, а также время, прошедшее с момента
возникновения осложнения. Так, у больных, оперированных через
сутки после перфорации, летальность возрастает в 7—8 раз по
сравнению с пациентами, которым операцию провели в течение первых 6 ч.
Современная статистика последнего десятилетия подчёркивает
рост доли этого грозного осложнения, при этом перфорации язв
стали возникать гораздо чаще, чем стеноз, приближаясь к частоте
язвенных кровотечений. Количество операций по поводу перфоратив-
ной язвы стабильно держится на уровне 7,5—13,0 на 100 000 человек.
Как правило, осложнение возникает преимущественно у мужчин,
в основном молодого возраста, с кратким язвенным анамнезом (до
3 лет) и периодическими обострениями, чаще в весенний и осенний
периоды. У 25% больных жалоб в прошлом не было.
Перфоративные язвы чаще бывают локализованы в
двенадцатиперстной кишке (75%). Примерно в 10% случаев перфорация язвы
сопровождается кровотечением или стенозом.
Классификация
Этиология:
• перфорация хронической язвы;
• перфорация острой язвы (в том числе медикаментозной,
стрессовой, уремической и др.).
Локализация перфорации:
• язва желудка: малой кривизны, передней стенки, задней стенки;
• язва двенадцатиперстной кишки; передней стенки, задней стенки.
Клиническая форма перфорации:
• в свободную брюшную полость (в том числе прикрытая);
• атипичная: в сальниковую сумку, малый или большой сальник,
забрюшинную клетчатку, изолированную спайками полость;
• сочетание с желудочно-кишечным кровотечением;
• сочетание со стенозом выходного отдела желудка.
по
224 ♦ Хирургические болезни О- Том 1 О Часть II О- Глава 9
Фаза течения перитонита (клинический период):
• химический перитонит (период первичного шока);
• бактериальный перитонит (период мнимого благополучия);
• разлитой гнойный перитонит (период абдоминального сепсиса).
Основные черты патологии
Перфорация язвы приводит к поступлению гастродуоденального
содержимого в свободную брюшную полость, воздействуя на
брюшинный покров как химический, физический, а затем и
бактериальный раздражитель. Перитонит, возникающий при перфорации, —
один из факторов, влияющих на тактику хирургического лечения.
Следует отметить некоторые особенности перитонита при
перфорации. Начальная реакция организма на прободение язвы ярко
клинически окрашена в связи с воздействием кислого желудочного сока на
брюшину (по сути, её химическим ожогом). В дальнейшем
развивается серозно-фибринозный перитонит, а затем и гнойный. Как
правило, до 6—12 ч от момента перфорации в брюшной полости
выявляют прозрачный или мутный экссудат с нитями и хлопьями
фибрина, париетальная и висцеральная брюшина ярко гиперемирована.
Степень бактериальной контаминации при этом не превышает 103-
105 микробных тел в 1 мл экссудата. Микробный пейзаж в
большинстве случаев представлен грамположительными кокками, лактобацил-
лами, грибами рода Candida. Следует отметить, что в 30% случаев в
эти сроки бактериальное обсеменение отсутствует. Указанные
изменения позволяют выбрать радикальный способ оперативного
вмешательства у этой группы больных.
В более поздние сроки с момента перфорации в брюшной
полости появляются гноевидный экссудат, фиксированные наложения
фибрина, паралитическая кишечная непроходимость с увеличением
бактериальной контаминации. В период разлитого гнойного
перитонита следует избрать минимально травматичный способ
вмешательства, включающий санацию брюшной полости.
Диагностика
Симптоматика
Перфорация язвы развивается остро, хотя у 20% больных
удаётся выявить продромальный период — усиление болей за 3—4 дня,
появление тошноты, рвоты. Перфорация сопровождается класси-
Осложнения язвенной болезни ♦ 225
ческой триадой признаков: кинжальная боль (95%), доскообразное
напряжение мышц живота (92%), предшествующий язвенный
анамнез (80%).
Данные физикального обследования
В течение заболевания различают три фазы (шока, мнимого
улучшения и гнойного перитонита), имеющие свои характерные
клинические проявления.
В первой фазе перфорации (до 6 ч) при физикальном
обследовании выявляют шок. Обращает на себя внимание внешний вид больного:
он лежит неподвижно на спине или правом боку с приведёнными к
животу ногами, охватив руками живот, избегает перемены положения тела.
Лицо больного осунувшееся и бледное, с испуганным выражением.
Дыхание частое и поверхностное. Характерна начальная брадикардия:
пульс нередко падает до 50—60 в минуту (так называемый вагусный
пульс) вследствие ожога брюшины и нервных окончаний кислотой. АД
может быть снижено. Язык в первые часы после перфорации остаётся
влажным и чистым. Обращают на себя внимание резнайшая
перкуторная и пальпаторная болезненность живота, напряжение мышц передней
брюшной стенки сначала в верхних отделах, а затем и по всему животу.
Положителен симптом Щёткина—Блюмберга. Исчезает или
значительно уменьшается печёночная тупость — характерный симптом
появления свободного газа в брюшной полости. Вместе с тем, этот признак в
первые часы после перфорации, вследствие небольшого количества газа
в брюшной полости, может отсутствовать. Иногда отмечают
болезненность в правом боковом канале и правой подвздошной ямке (симптом
Кервена). Зачастую выявляют положительный френику с-симптом —
иррадиацию болей в надключичную область, правую лопатку. Как
правило, перистальтика кишечника не выслушивается. Уже в первые
часы заболевания удаётся обнаружить резкую болезненность тазовой
брюшины при пальцевом ректальном или вагинальном исследовании.
Описанная картина, характерная для фазы шока, через 6—12 ч
после перфорации «стирается». Наступает период мнимого благополучия.
Лицо больного приобретает нормальную окраску. Пульс и АД
нормализуются. Дыхание перестаёт быть поверхностным. Язык становится
сухим и обложенным. Напряжение мышц брюшной стенки
уменьшается, при пальпации сохраняются болезненность и
положительные симптомы раздражения брюшины. Перистальтика не
выслушивается, печёночная тупость отсутствует. При ректальном исследо-
226 О Хирургические болезни ♦ Том 1 ♦ Часть II -0- Глава 9
вании можно обнаружить нависание передней стенки прямой киш
ки и ее болезненность.
Затем, через 12—24 ч после перфорации состояние больных
начинает прогрессивно ухудшаться — наступает фаза гнойного
перитонита. Появляется рвота. Больной ведёт себя беспокойно. Температура
тела повышается. Учащается дыхание, падает пульсовое давление,
возникает вздутие живота, перистальтика отсутствует. Налицо
развернутая клиническая картина абдоминального сепсиса.
Диагностические методы
Обзорная рентгенография органов брюшной полости при
перфорации полого органа выявляет свободный газ под куполом
диафрагмы в 80% случаев. Точность рентгенологического метода находится в
прямой зависимости от количества газа, поступившего в свободную
брюшную полость. В сомнительных случаях следует прибегать к пнев-
могастрографии, повышающей достоверность метода до 95%.
Установив в желудок зонд, в его просвет с помощью шприца Жане вводят
150—200 мл воздуха и тотчас выполняют обзорную рентгенографию
брюшной полости. Тяжёлым больным целесообразно проводить
рентгенографию в положении на боку, при этом свободный газ
локализуется у места прикрепления диафрагмы к боковой стенке живота.
Эзофагогастродуоденоскопия позволяет уточнить диагноз в
сложных случаях, дать точную картину локализации язвы и её размеров,
обнаружить сочетанные осложнения (наличие второй язвы с
кровотечением или угрозой его развития, признаки стеноза).
Лапароскопия помогает уточнить диагноз и выбрать адекватный
план лечения при неясной клинической картине (в тех ситуациях,
когда другие вышеперечисленные методы не позволяют распознать
прикрытую или атипичную перфорацию), а в части случаев позволяет
убедиться в возможности проведения того или иного вида операции.
Лабораторное исследование крови констатирует быстро
нарастающий лейкоцитоз со сдвигом лейкоцитарной формулы влево. В
анализах мочи при перитоните отмечают появление форменных
элементов крови, белка и цилиндров.
Дифференциальная диагностика
го
Дифференциальный диагноз перфоративной язвы нередко
приходится проводить с острым аппендицитом, особенно если
больного осматривают через 6—7 ч после перфорации, когда желудочное
Осложнения язвенной болезни О 227
содержимое и экссудат скапливаются в правой подвздошной ямке,
вызывая симптомы, характерные для аппендицита. В части случаев
диагностические затруднения могут возникнуть при других острых
хирургических заболеваниях органов верхнего этажа брюшной
полости. Прежде всего, это острый холецистит, острый панкреатит,
почечная колика и острая кишечная непроходимость.
Нельзя также забывать о возникающих иногда чрезвычайных
трудностях диагностики терапевтических заболеваний, таких как инфаркт
миокарда, базальный плеврит, пневмония.
В заключение следует подчеркнуть, что вопросы точной
диагностики причины «острого живота» становятся непреодолимыми при уже
развившемся разлитом гнойном перитоните, тогда их решают при
экстренной срединной лапаротомии.
Лечение
Консервативный способ ведения больных с перфоративными
язвами (так называемый метод Тейлора) предполагает постоянную
аспирацию желудочного содержимого, голод, назначение больших доз
антибиотиков, а также придание телу больного положения Фовлера
(с приподнятым головным концом). Сегодня очевидно, что этот
метод несовершенен и поэтому применим только как вынужденная
мера — при предельно тяжёлом состоянии больного либо отсутствии
возможности проведения операции. Поэтому диагноз перфоратив-
ной язвы желудка или двенадцатиперстной кишки — абсолютное
показание к экстренной операции.
Хирургическая тактика
Характер и объём хирургического вмешательства определяют
строго индивидуально в зависимости от вида язвы, её локализации,
характера и распространённости перитонита, наличия сопутствующих
перфорации других осложнений язвенной болезни, а также с
учётом степени операционно-анестезиологического риска. Различают
радикальные операции, направленные не только на спасение
жизни больного, но и на профилактику дальнейших рецидивов
образования язв (резецирующие методы, ваготомия с иссечением язвы и пи-
лоропластикой), а также паллиативные — различные способы
ушивания перфорации, устраняющие только угрожающее жизни
осложнение болезни.
228 ♦ Хирургические болезни -О- Том 1 ♦ Часть II ♦ Глава 9
Ушивание дуоденальной или желудочной перфоративной язвы
остаётся спасительным методом лечения, особенно для больных с
распространённым «поздним» перитонитом или высокой степенью опе-
рационно-анестезиологического риска. На рис. 9-1 и 9-2
представлены наиболее распространённые способы ушивания перфоративной
дуоденальной язвы. Летальность зависит, прежде всего, от условий, в
которых выполняют вмешательство, распространённости и формы
перитонита; она составляет от 10 до 60%.
Лапароскопическое ушивание (или ушивание из абдоминального
доступа) показано также лицам молодой возрастной группы, когда
перфорируется так называемая «немая язва», в анамнезе отмечают
невыраженное или благоприятное течение заболевания, а
выполненная дооперационная диагностическая программа свидетельствует об
отсутствии других сочетанных осложнений язвенной болезни.
Рис. 9-1. Ушивание
перфоративной язвы
двенадцатиперстной кишки. Ряд швов проходит
в поперечном по отношению к
продольной оси кишки
направлении.
Рис. 9-2. Ушивание
перфоративной язвы по Оппелю-Поли-
карпову с использованием
пряди большого сальника.
Осложнения язвенной болезни ♦ 229
Стволовая ваготомия с иссечением язвы и пилоропластикой —
золотой стандарт хирургического лечения перфоративной дуоденальной
язвы, позволяющий ликвидировать другие осложнения заболевания,
сопутствующие перфорации, и создать условия профилактики
дальнейших рецидивов. На рис. 9-3 представлена стволовая ваготомия с
иссечением язвы и пилоропластикой по Джадду. Кроме того,
довольно часто выполняют пилоропластику по Финнею.
Послеоперационная летальность после этих операций составляет 1,8—2,5%.
Рис. 9-3. Стволовая ваготомия с
иссечением язвы и
пилоропластикой.
A. Рассечена париетальная
брюшина над абдоминальным
отделом пищевода. Выделен
передний блуждающий нерв.
Б. Иссекают перфоративную
язву в виде ромба.
B. Целостность органа
восстанавливают швами в поперечном
направлении, выполняя
пилоропластику по Джадду.
Ваготомию с антрумэктомией используют при перфорации, если
выявлены другие осложнения (поздняя стадия пилородуоденального
стеноза), а также при сочетанной форме язвенной болезни.
Резекцию желудка (гемигастрэктомию) проводят при прободной
желудочной язве больным с невысоким операционно-анестезиоло-
гическом риском, когда перфорирована длительно существующая
230 ♦ Хирургические болезни ♦ Том 1 О Часть II ♦ Глава 9
каллёзная язва или существуют сочетанные с перфорацией другие
осложнения (кровотечение, различной выраженности стеноз). Ле
тальность при этом достигает 4—9%.
Послеоперационный период
Ведение послеоперационного периода у больных, оперированных
по поводу прободных гастродуоденальных язв, необходимо
соотносить с характером проведённого вмешательства.
Так, при ушивании прободных язв, когда операция фактически не
влияет на патогенез заболевания, дальнейшее благополучие
больного зависит от противорецидивного лечения, начинаемого сразу
после операции. Оно должно быть комплексным, состоящим из
антисекреторных препаратов (блокаторы Н2-гистаминовых рецепторов,
блокаторы протонной помпы) и антихеликобактерной терапии
(препараты висмута в комбинации с антибиотиками — амоксициллином,
флемоксином). После выписки из стационара больной переходит под
наблюдение гастроэнтеролога для последующей поддерживающей и
противорецидивной терапии.
Хирургические операции, имеющие патофизиологическое
обоснование (ваготомия с пилоропластикой, ваготомия с антрумэктомией,
резекция желудка), по современным представлениям также должны
сопровождаться поддерживающей и противорецидивной терапией. Её
начинают также сразу в послеоперационном периоде.
После окончательной оценки непосредственного эффекта
противоязвенного лечения в условиях диспансерного наблюдения больных,
когда амбулаторно определяют состояние секреторной и эвакуатор-
ной функций оперированного желудка и эрадикацию Helicobacter
pylori, больные окончательно переходят под наблюдение
врача-гастроэнтеролога.
Прогноз
Показатели летальности были указаны в начале этого раздела.
Среди погибших после операций по поводу перфоративной язвы
превалируют пациенты с исходным предельно тяжёлым состоянием,
обусловленным либо сопутствующей патологией, либо терминальной
фазой перитонита. Неблагоприятный исход чаще всего становится
следствием поздней обращаемости больного за медицинской
помощью и несвоевременной диагностики.
Осложнения язвенной болезни ♦ 231
части больных возможно развитие хирургических
осложнений. Наиболее типичные из них — несостоятельность ушитой язвы или
сформированного анастомоза с развитием перитонита, абсцессы
различной локализации на фоне недостаточной санации брюшной
полости при первичной операции, паралитическая кишечная
непроходимость, послеоперационная спаечная кишечная непроходимость,
острый послеоперационный панкреатит.
Одна из особенностей состояния больных после операций с ва-
готомией — нарушение моторно-эвакуаторной функции желудка и
двенадцатиперстной кишки. Ниже, в разделе, посвященном
язвенному стенозу выходного отдела желудка, об этом будет сказано более
детально.
Одна из задач современной хирургической гастроэнтерологии —
не только обеспечение хороших непосредственных результатов, но и
создание условий для быстрейшей реабилитации пациентов в
раннем послеоперационном периоде и предотвращение рецидивов
язвенной болезни. В качестве неблагоприятных факторов в
отдалённом периоде рассматривают органические (рецидив язвы, дефект
сформированных ранее анастомозов) и функциональные (нарушение
желудочной эвакуации функциональной природы, ранний и
поздний демпинг-синдром, синдром приводящей петли, диарея и т.д.)
расстройства.
Очевидно, что органосохраняющие операции с ваготомией
имеют свои преимущества — в отдалённом послеоперационном периоде
у большинства пациентов (90%) отмечают хорошие результаты, а
качество жизни соответствует таковому у здорового человека. И всё же
следует иметь в виду, что количество рецидивов язвенной болезни
достигает 10%. Строгое определение группы больных, которым
показано ушивание прободной язвы (в том числе и лапароскопическое)
с последующей медикаментозной терапией, позволяет достичь
хорошего качества жизни у большинства больных язвенной болезнью при
достаточно низкой частоте рецидива язвы.
Язвенная болезнь, осложнённая кровотечением
Гастродуоденальные кровотечения язвенной природы
составляют около половины всех кровотечений из верхнего отдела ЖКТ.
Количество больных с язвенными гастродуоденальными
кровотечениями в последнее десятилетие увеличивается, и заболеваемость
232 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 9
составляет 90—103 на 100 000 взрослого населения в год. По данным
отечественной статистики, за последние годы количество
подобных больных возросло в 1,4—1,6 раза, что, очевидно, связано с
экономическими факторами, когда больные порой не в состоянии
обеспечить дорогостоящее курсовое противоязвенной лечение.
Важность знания врачами (не только хирургами!) способов диагностики
и лечения острых язвенных желудочно-кишечных кровотечений в
первую очередь определяется высоким уровнем летальности,
достигающей 50% в группе больных с тяжёлыми
желудочно-кишечными кровотечениями. Среди пациентов с кровотечением велика
доля людей пожилого и старческого возрастов (до 60%) с
выраженной возрастной и сопутствующей патологией, поэтому велика
доля послеоперационных осложнений. У мужчин
желудочно-кишечные кровотечения при язвенной болезни отмечают в 3 раза чаще
чем у женщин.
Классификация
Локализация источника кровотечения:
• язва желудка;
• язва двенадцатиперстной кишки;
• рецидивная язва после различных оперативных вмешательств
на желудке.
Степень тяжести кровопотери:
• лёгкая;
• средняя;
• тяжёлая.
Характер язвенного кровотечения (определяют эндоскопически):
• продолжающееся;
• остановившееся:
— высокая угроза рецидива;
— низкая угроза рецидива.
При оценке степени тяжести кровотечения учитывают как объём
перенесённой кровопотери, так и состояние больного. Данные
клинического обследования больного и лабораторные показатели
позволяют определить объём кровопотери, спланировать рациональную
инфузионно-трансфузионную терапию, адекватно оценить
состояние больного. В табл. 9-1 приведены наиболее важные показатели,
используемые в клинической практике.
Осложнения язвенной болезни О- 233
Таблица 9-1. Степень тяжести кровопотери
Показатели
Количество эритроцитов
Содержание гемоглобина, г/л
Пульс в минуту
Систолическое АД, мм рт.ст.
Гематокрит, %
Дефицит объёма циркулирующих
эритроцитов, в % должного
Степень кровопотери
лёгкая
>3,5-1012/л
>100
до 80
>110
>30
до 20
средняя
3,5-2,5-10|2/л
83-100
80-100
110-90
25-30
20-30
тяжёлая
<2,5-10в/л
<83
более 100
<90
<25
30 и более
Патофизиологические нарушения в организме
Реакция больного на кровопотерю, с одной стороны,
определяется интенсивностью и массивностью самого кровотечения (объёмом
потерянной крови и временем кровотечения), а с другой —
исходным состоянием и реакцией на кровопотерю основных систем
организма больного. Фактором, существенно повлиявшим на понимание
патофизиологических основ этого процесса и формирование
грамотной терапии, послужило учение о диссеминированном внутрисосу-
дистом свёртывании (ДВС), как универсальном механизме
реализации синдрома массивной кровопотери и пусковом механизме
синдрома полиорганной недостаточности. Следует подчеркнуть, что
гиперкоагуляционная фаза ДВС-синдрома и микроциркуляторные
нарушения, ведущие к ухудшению обеспеченности тканей
кислородом и питательными веществами, развиваются у каждого пациента с
клинически значимым желудочно-кишечным кровотечением.
Понятно, что существовавшие у пациента функциональные либо
органические расстройства со стороны сердечно-сосудистой, дыхательной
и выделительной систем (так называемые возрастные сопутствующие
заболевания) лишь усугубляют тяжесть состояния больного, требуют
соответствующей коррекции и учитываются при принятии решения
об оперативном лечении либо при подготовке к нему.
Считают, что быстрая кровопотери около 500 мл крови может
привести к коллапсу, причём проявления гемодинамических нарушений
будут более выраженными у пожилых больных с исходной
сердечнососудистой недостаточностью. Приблизительно такой же объём
излившейся в просвет пищеварительного тракта крови требуется для
234 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 9
появления характерных признаков желудочно-кишечных
кровотечений — рвоты кровью (hematemesis) и дегтеобразного стула {melena).
Наиболее яркие проявления наблюдают при острых массивных
кровотечениях, когда на протяжении короткого времени,
измеряемого минутами или часами, больной теряет более 1500 мл крови, или
около 25% ОЦК. В подобных обстоятельствах клиническая картина
соответствует геморрагическому (гиповолемическому) шоку, из
прямой кишки отмечают выделение красной малоизмененной крови
(hematochezia). Необходимо отметить, что у больного, если он лежит,
сначала может не быть сколько-нибудь выраженных изменений АД
(так называемая компенсированная гиповолемия), в то время как
феномен ортостатинеской гипотензии более точно отражает объём
кровопотери. Периферический спазм артерий, проявляющийся
бледностью кожных покровов, а также венозный спазм поддерживают
относительно стабильный уровень центрального кровообращения.
Диагностика
Врач, заподозривший кровотечение, должен ответить на
следующие вопросы.
• Есть ли желудочно-кишечное кровотечение?
• Что стало его источником?
• Продолжается ли кровотечение?
• Каковы темпы кровотечения?
• Какова тяжесть кровопотери?
Симптоматика
Клинические проявления острых, особенно массивных гастроду-
оденальных кровотечений достаточно ярки и складываются из общих
симптомов, характерных для кровопотери (резкая слабость,
головокружение, потеря сознания), и проявлений, характерных для
кровотечения в просвет ЖКТ (гематомезис, мелена или гематохезия). У
значительной доли больных кровотечение возникает на фоне обострения
язвенной болезни или в анамнезе удаётся отметить типичные
признаки этого заболевания с характерным «язвенным» болевым
синдромом и сезонностью обострений. У части больных можно встретить
указания на неэффективность проведённого ранее хирургического
лечения, когда вновь появившийся болевой синдром следует связать,
прежде всего, с образованием пептической язвы. Кровавая рвота и
Осложнения язвенной болезни ♦ 235
дегтеобразный стул — примерно одинаково частые признаки
кровотечения язвенной этиологии, хотя при локализации язвы в
двенадцатиперстной кишке чаще выявляют изолированную мелену.
Данные физикального обследования
Данные физикального обследования позволяют судить о степени
тяжести кровотечения и предположительно о его источнике.
Спутанное сознание, резкая бледность кожных покровов, частый пульс
слабого наполнения и напряжения, снижение АД и пульсового давления,
наличие в желудке большого количества крови и сгустков, а при
ректальном исследовании — чёрного жидкого либо с примесью крови
содержимого — признаки острого массивного кровотечения.
Фактически в таких случаях речь идёт о геморрагическом шоке (дефицит
глобулярного объёма крови, как правило, более 30%). При лёгкой
и средней степенях тяжести желудочно-кишечных кровотечений
(уменьшение объёма циркулирующих эритроцитов крови менее чем
на 30%) клинические проявления менее выражены. Общее
состояние больных, как правило, остаётся удовлетворительным либо
средней тяжести, гемодинамические показатели в пределах нормы или
изменяются умеренно, нет большого объёма крови в желудке. Рвота
и мелена редко бывают многократными.
Инструментальные методы
На сегодняшний день ведущим методом диагностики источника
типа, характера кровотечения и прогноза его рецидива, безусловно,
остаётся неотложная фиброэзофагогастродуоденоскопия (ФЭГДС). Она
играет чрезвычайно важную роль в определении лечебной тактики.
Основные показания к выполнению неотложного
эндоскопического исследования верхних отделов пищеварительного тракта —
наличие у больного признаков острого желудочно-кишечного
кровотечения либо подозрение на него и необходимость проведения
гемостаза через эндоскоп. Эффективность исследования тем выше, чем
раньше его проводят — в идеале в течение первого часа (максимум
2 ч) с момента поступления в стационар. ФЭГДС позволяет
обнаружить сочетанные осложнения заболевания — пилородуоденальный
стеноз и пенетрацию язвы.
Показанием к повторной (динамической) ФЭГДС считают
необходимость активного мониторинга источника кровотечения в связи
с сохраняющимся риском его рецидива (активная контрольная
236 4- Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 9
ФЭГДС), рецидив кровотечения, развившийся в стационаре у
больного предельного операционно-анестезиологического риска с
язвенным кровотечением.
Подготовка к исследованию верхних отделов пищеварительного
тракта заключается в возможно более полном опорожнении их
просвета, отмывании от крови и сгустков слизистой оболочки
пищевода, желудка и двенадцатиперстной кишки. Считают, что в
большинстве случаев решить эту задачу можно путём промывания желудка
«ледяной» водой через толстый желудочный зонд. Большой
внутренний диаметр зонда позволяет эвакуировать крупные сгустки, а
локальная гипотермия — достичь уменьшения интенсивности
кровотечения или его полной остановки.
Анестезиологическое обеспечение экстренных эндоскопических
вмешательств варьирует в широких пределах. Значительную часть
исследований можно выполнить под местной анестезией зева с
использованием премедикации. При беспокойном поведении
больного, затрудняющем адекватный осмотр или выполнение гемостаза,
применяют седативные средства внутривенно, а также внутривенный
или (при нестабильном состоянии пациента) эндотрахеальный наркоз.
Рентгенологическое исследование верхних отделов
пищеварительного тракта как метод экстренной диагностики
желудочно-кишечных кровотечений отошло на второй план. В основном его
применяют после остановки кровотечения в качестве метода получения
дополнительной информации об анатомическом состоянии и мотор-
но-эвакуаторной функции ЖКТ. Вместе с тем при отсутствии
условий для выполнения эндоскопического исследования и большом
практическом навыке врача рентгенологический метод позволяет
обнаружить язву в 80-85% случаев.
Ангиографический метод диагностики кровотечений всё ещё
имеет достаточно ограниченное использование. Его применяют в
специализированных учреждениях, обладающих необходимым
оборудованием. Хорошо разработанная техника катетеризации сосудов по
Сельдингеру сделала возможным проведение селективной или даже
суперселективной визуализации чревного ствола, верхней
брыжеечной артерии и их ветвей, а также венозных стволов. Ограниченность
метода применительно к условиям неотложной хирургии
объясняется не только его технической сложностью, но и сравнительно
небольшой информативностью: хорошее контрастирование экстравазатов
из источника кровотечения возможно только при артериальном
кровотечении достаточно большой интенсивности.
Осложнения язвенной болезни ♦ 237
Показания к селективной ангиографии могут возникнуть в
случаях повторных рецидивирующих кровотечений, когда источник
геморрагии не установлен ни эндоскопическим, ни рентгенологическим
методом исследования. Разумеется, диагностическую ангиографию
выполняют как первый этап лечебного эндоваскулярного
вмешательства, направленного на селективную инфузию сосудосуживающих
препаратов, эмболизацию кровоточащей артерии или вены либо
наложение трансъюгулярного интрапечёночного портосистемного
соустья при портальной гипертензии и массивном кровотечении из ва-
рикозно расширенных вен пищевода.
Накопленный опыт применения ангиографической диагностики
эзофагогастродуоденальных кровотечений свидетельствует о том, что
она может быть хорошим подспорьем в определении таких редких
заболеваний, приводящих к кровотечению, как разрывы аневризм
сосудов, сосудисто-кишечные фистулы, гемобилии, синдром
портальной гипертензии.
Лабораторные методы
Экстренный анализ крови предоставляет ценную
диагностическую информацию. Падение концентрации гемоглобина, уменьшение
количества эритроцитов, снижение гематокрита, лейкоцитоз,
несомненно, ориентируют в отношении тяжести кровопотери. Между тем,
в первые часы от начала острого кровотечения все эти показатели
могут меняться несущественно и, следовательно, имеют
относительное значение. Истинная выраженность анемии становится ясной лишь
по прошествии суток и более, когда уже разовьётся компенсаторная
гемодилюция за счёт внесосудистой жидкости, необходимой
организму для восстановления внутрисосудистого объёма крови.
Исследование ОЦК и его компонентов позволяет более точно
определять объём кровопотери. Среди существующих методов
наибольшее распространение получили красочный метод с краской Т-1824
(эванс синий) и изотопный метод с использованием меченых
эритроцитов. Для условий неотложной хирургии приемлемы простые
методы с использованием номограмм, например определение
глобулярного объёма по данным гематокрита и концентрации гемоглобина.
Наибольшее значение при остром кровотечении имеет снижение
глобулярного объёма, так как восстановление его дефицита происходит
медленно, в то время как снижение других показателей (объём
циркулирующей плазмы и ОЦК) относительно быстро нивелируется.
4*
238 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 9
Дифференциальная диагностика
У многих больных кровотечение возникает на фоне обострения
язвенной болезни или в анамнезе удаётся отметить типичные
признаки этого заболевания с характерным «язвенным» болевым
синдромом и сезонностью обострений. В части случаев можно встретить
указания на неэффективность проведённого ранее хирургического
лечения, когда вновь появившийся болевой синдром следует связать,
прежде всего, с образованием пептической язвы.
Кровотечение из разрывов слизистой оболочки области пище-
водно-желудочного перехода {синдром Мэллори—Вейса) следует
заподозрить, если у больных молодого возраста, злоупотребляющих
алкоголем, многократные приступы рвоты заканчиваются
появлением алой крови в рвотных массах. У пожилых больных
необходимо выявить или исключить факторы, предрасполагающие к
разрывам пищеводно-желудочного перехода (тяжёлые заболевания
сердечно-сосудистой системы и лёгких, грыжи пищеводного отверстия
диафрагмы).
Наличие неопределённых «желудочных» жалоб, похудание и
нарушение общего состояния больного (так называемый синдром
малых признаков) заставляют заподозрить опухоль желудка как
причину кровотечения. Рвотные массы в этих случаях чаще имеют характер
«кофейной гущи».
Для кровотечения из варикозно расширенных вен пищевода
характерна многократная рвота тёмной кровью. Дегтеобразный стул
появляется обычно через 1—2 сут. Из перенесённых заболеваний важно
отметить болезни печени и желчевыводящих путей (в первую очередь
цирроз печени), а также тяжёлые повторные приступы острого
панкреатита. Из клинической практики известно, что эти больные
нередко страдают алкоголизмом.
Данные анамнеза необходимо скрупулёзно уточнить, чтобы не
пропустить очень важных факторов, способных обусловить острое
желудочно-кишечное кровотечение. Необходимо выяснить наличие
тяжёлых терапевтических заболеваний с выраженными гемодинами-
ческими нарушениями (инфаркт миокарда, нарушение мозгового
кровообращения и др.), системных заболеваний (болезни крови,
уремия и др.), возможное лечение медикаментами, обладающими уль-
церогенным эффектом.
Дифференциальный диагноз в части случаев проводят с
кровотечением из верхних дыхательных путей, носоглотки и лёгких, когда заг-
Осложнения язвенной болезни О- 239
латываемая больным кровь может симулировать кровотечение из
пищеварительного тракта. Тщательно собранный анамнез и осмотр
больного позволяют заподозрить лёгочное кровотечение: характерен
ярко-красный цвет пенистой крови, выделяемой обычно при кашле
или отдельными плевками. Следует также помнить, что чёрная
окраска кала возможна после приёма некоторых медикаментов
(препаратов железа, викалина, карболена и др.).
Лечение
Общие вопросы лечебной тактики
Современные подходы к лечению острых язвенных желудочно-
кишечных кровотечений базируются на лечебной тактике,
сочетающей активный характер диагностических и лечебных
мероприятий с дифференцированным определением показаний к неотложной
операции.
Коллективный многолетний опыт показывает, что большинство
язвенных кровотечений (до 75%) останавливается под воздействием
консервативного лечения. И только 25% больных с язвенной
болезнью, осложнённой профузным желудочно-кишечным
кровотечением, подлежат неотложному оперативному вмешательству.
Возможности современной эндоскопии (не только диагностические, но и
лечебные) в сочетании с энергичной противоязвенной терапией ещё
более упрочили значение консервативного лечения этой группы
больных. Поэтому основа лечебной тактики при острых
желудочно-кишечных кровотечениях — консервативная терапия.
Решение важного вопроса лечебной тактики о показаниях к
неотложной операции почти всегда представляет большие сложности.
Правильно будет сказать, что операцию необходимо выполнить в
оптимальные сроки для больного, когда тщательно взвешены все «за»
и «против». Для этого нужно получить диагностические данные,
оценить эффективность проводимого лечения и взвесить имеющиеся
факторы риска.
Эндоскопическая остановка кровотечения
Лечебная эндоскопия при острых желудочно-кишечных
кровотечениях обладает достаточно высокой эффективностью и позволяет
осуществить временный гемостаз у подавляющего большинства
больных. Кроме того, она предоставляет возможность адекватно подго-
240 ■& Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 9
товить их к срочному оперативному вмешательству, если оно
показано. Последующая медикаментозная терапия даёт возможность
предотвратить рецидив кровотечения и перенести операцию на этап
плановой хирургии. Лечебная эндоскопия может стать единственным
оправданным методом лечения у группы больных с предельно
высоким операционным риском, когда выполнение неотложной
операции невозможно. Этим больным обеспечивают динамическую
ФЭГДС и повторный гемостаз.
Проведение эндоскопического гемостаза необходимо уже при
первичном осмотре в условиях продолжающегося в момент
эндоскопического исследования кровотечения. При язвенных геморрагиях
продолжающееся струйное аррозивное кровотечение встречают у 8-10%
больных. После его эндоскопической остановки возможный риск
потенциального рецидива кровотечения существует в 80-85% случаев.
Продолжающееся капиллярное кровотечение в виде диффузного
просачивания отмечают у 10—15% больных с риском рецидива
кровотечения до 5%.
Остановившееся на момент эндоскопического осмотра
кровотечение со следами недавно перенесённой геморрагии также считают
показанием к лечебной эндоскопии (профилактика рецидива).
Стигмами состоявшегося кровотечения служат обнаруживаемые в краях
и/или дне язвы мелкие тромбированные сосуды в виде
тёмно-коричневых или тёмно-красных пятен, плотно фиксированный к
язвенному кратеру тромб-сгусток или видимый крупный тромбированный
сосуд. При такой эндоскопической картине рецидив кровотечения
вероятен у 25% больных.
Показание для проведения эндоскопического гемостаза во время
динамической ФЭГДС (у больных с предельно высоким операци-
онно-анестезиологическим риском) — отрицательная динамика со
стороны источника кровотечения, когда сохраняются интактными
ранее обработанные сосудистые структуры, появляются новые
тромбированные сосуды либо развивается рецидив кровотечения.
Для воздействия на источник кровотечения через эндоскоп
применяют различные методы, отличающиеся по физическим свойствам
и механизму действия, но зачастую сходные по эффективности. В
арсенале эндоскопического гемостаза следующие методы: моно- и
биактивная диатермокоагуляция, термокаутеризация, аргоно-плаз-
менная коагуляция; инъекционные методы введения эпинефрина,
96% раствора этанола, а также специальных склерозантов, методы
эндоклипирования.
Осложнения язвенной болезни О- 241
Инфузионно-трансфузионная терапия
Инфузионно-трансфузионная терапия необходима для
восстановления основных параметров гомеостаза, нарушенных в результате
острого развившегося дефицита ОЦК. Хорошо известно, что
организм человека способен выдержать острую потерю 60—70% объёма
эритроцитов, но утрата 30% объёма плазмы не совместима с жизнью.
Первоочередные задачи — введение в сосудистое русло адекватного
количества коллоидных и кристаллоидных растворов для устранения
дефицита ОЦК, нормализация микроциркуляции и реологии крови,
коррекция водно-электролитного обмена. Особенности инфузион-
ной терапии при кровотечении рассмотрены в главе 3 (раздел «Шок»).
Критериями восстановления ОЦК служат симптомы,
указывающие на уменьшение степени гиповолемии: повышение АД,
уменьшение ЧСС, увеличение пульсового давления, потепление и
восстановление розовой окраски кожных покровов. Важными показателями
адекватности проводимой терапии считают почасовой диурез и ЦВД.
Лекарственная терапия язвенных кровотечений
Особое значение в лечении кровотечений язвенной этиологии
имеют антисекреторные препараты. Обоснованием к их применению
служат следующие положения:
• соляная кислота и пепсин препятствуют образованию тромба и
вызывают лизис уже сформированного сгустка;
• критический порог рН, при котором пепсин теряет свою
активность, составляет 6;
• агрегация тромбоцитов происходит при рН>6;
• для предотвращения рецидива кровотечения относительно
безопасный уровень концентрации водородных ионов рН= 4.
Внедрение в клиническую практику парентеральных форм
антагонистов Н2-гистаминовых рецепторов, а несколько позже и
ингибиторов протонной помпы, обладающих мощным антисекреторным
эффектом, даёт возможность создать в полости желудка
оптимальные условия для предотвращения рецидива кровотечения и
заживления язвы, позволяет отодвинуть операцию на этап плановой
хирургии либо вообще отказаться от неё. Особые надежды возлагают на
применение парентеральных форм ингибиторов протонной помпы.
Эффективность проводимой терапии антисекреторными средствами
целесообразно контролировать 24-часовой рН-метрией.
242 ♦ Хирургические болезни -0- Том 1 ♦ Часть II ♦ Глава 9
Аитихедикобактерные средства ускоряют регенеративные
процессы. Антациды и препараты, обладающие цитопротективным
действием (синтетические аналоги простагландинов), назначают в качестве
патогенетически обоснованных средств для скорейшего заживления
язвенных и эрозивных поражений, ставших источником кровотечения.
Питание больных с желудочно-кишечным кровотечением —
составная часть консервативной терапии. Вопросы энтерального и
парентерального питания у различных групп больных решают
неоднозначно, это зависит от избранной лечебной тактики.
• Пациентам, прооперированным в неотложном порядке, перораль-
ное питание следует назначить только после восстановления
перистальтики (как правило, с 3—4-х суток после операции). До этого
следует проводить полное парентеральное питание.
• Группе больных с высокой угрозой рецидива кровотечения после
эндоскопического гемостаза на фоне консервативного лечения
(динамические эндоскопические осмотры в сочетании с
медикаментозной терапией) до исчезновения риска кровотечения также
следует назначить парентеральное питание.
• Пациентам с невысокой угрозой рецидива кровотечения после
очищения кишечника от излившейся крови (как правило, в течение
суток) следует назначить диету Мейленграхта (частое дробное
питание; пищу, полноценную по составу, механически щадящую,
богатую молочными продуктами и витаминами).
Хирургическая тактика
Кровотечение из гастродуоденальных язв — показание к
неотложной операции:
• экстренной, если с помощью нехирургических методов его не
удаётся остановить;
• срочной, когда слишком велика угроза его рецидива.
Таким образом, в экстренном порядке оперируют следующих
пациентов:
• больных с профузным продолжающимся кровотечением,
геморрагическим шоком и клинико-анамнестическими данными,
свидетельствующими о кровотечении язвенной природы;
• больных с массивным кровотечением, если консервативные
мероприятия, включая эндоскопические методы, оказались
неэффективными;
• больных с рецидивом кровотечения в стационаре.
Осложнения язвенной болезни <> 243
Срочная операция показана больным с язвенным кровотечением,
остановка которого консервативными способами представляется
недостаточно надёжной, или есть указания на высокий риск рецидива
кровотечения. Больным этой группы хирургическое вмешательство,
как правило, проводят в течение 12—24 ч с момента поступления
(время, необходимое для подготовки больного к операции). Следует лишь
подчеркнуть, что доля таких больных по мере внедрения надёжных
средств неоперативного гемостаза постепенно сокращается, о чём уже
было сказано выше. Особые надежды возлагают на
комбинированный способ ведения таких больных, включающий адекватный
эндоскопический гемостаз и современную противоязвенную терапию,
включающую дозированное внутривенное введение блокатора
протонной помпы под контролем 24-часовой рН-метрии.
Прогноз рецидива кровотечения, остановленного эндоскопически,
основывают на учёте клинико-лабораторных данных, отражающих в
основном интенсивность кровотечения, и результатах
эндоскопического исследования. Клинико-лабораторные критерии высокой
угрозы рецидива кровотечения:
• клинические признаки геморрагического шока;
• обильная рвота кровью и/или массивная мелена;
• дефицит глобулярного объёма, соответствующий тяжёлой
степени кровопотери.
Эндоскопические критерии высокой угрозы возврата кровотечения:
• крупные тромбированные сосуды в язвенном кратере;
• язвенный дефект большого диаметра и глубины;
• локализация язвы в проекции крупных сосудов.
Наличие двух любых неблагоприятных факторов расценивают как
свидетельство существующей угрозы повторного кровотечения.
Если кровотечение остановлено консервативными методами и
риск его возобновления невелик, неотложное оперативное
вмешательство не показано, таких больных ведут консервативно.
В практической хирургии выделяют ещё одну группу больных, для
которых неотложная операция любого объёма неприемлема. Это
больные преклонного возраста с предельной степенью операцион-
но-анестезиологического риска, как правило, обусловленного
декомпенсацией сопутствующих заболеваний на фоне перенесённой
кровопотери. Таких больных, даже при указаниях на высокий риск
рецидива кровотечения, вынужденно ведут консервативно, как
указано выше, с динамическим эндоскопическим контролем.
Контрольные эндоскопические исследования носят в таких случаях лечеб-
244 ♦ Хирургические боле
Том 1 ♦ Часть II ♦ Глава
ный характер, их проводят ежедневно до исчезновения риска
рецидива кровотечения. Хирургическую операцию таким больным
проводят как сугубо вынужденную меру («операция отчаяния»).
Выбор метода хирургического вмешательства, прежде всего,
зависит от тяжести состояния больного, степени операционно-анестезио-
логического риска, а также локализации и характера кровоточащей
язвы. До сравнительно недавнего времени вопрос о выборе метода
операции при этом осложнении язвенной болезни решали
фактически однозначно — резекция желудка. Сейчас у хирурга в арсенале
существуют следующие средства хирургического лечения язвенных
желудочных кровотечений.
Органосохраняющие операции с ваготомией (как правило,
стволовой) применительно к запросам неотложной хирургии имеют особое
значение, так как отличаются технической простотой. Остановка
кровотечения из дуоденальной язвы заключается в пилородуодено-
томии, иссечении и/или прошивании источника кровотечения
отдельными швами (рис. 9-4), а при пенетрации — с выведением
язвенного кратера из просвета кишки (экстрадуоденизацией) и
последующей стволовой ваготомией с пилоропластикой. Летальность
после этой операции составляет 3—5%.
Рис. 9-4. Прошивание кровоточащей язвы. Выполнена продольная гастро
дуоденотомия. Края разреза разведены в поперечном направлении. На
задней стенке двенадцатиперстной кишки видна язва с сосудом, которую
прошивают 8-образным швом.
Осложнения язвенной болезни ♦ 245
Антрумэктомия с ваготомией при дуоденальной локализации
кровоточащей язвы показана больным со сравнительно невысокой
степенью операционного риска (молодой возраст, небольшая или
средняя степень кровопотери). Негативная сторона этой операции —
техническая сложность, вместе с тем она обеспечивает более
надёжную остановку кровотечения и большую радикальность лечения
язвенной болезни. Последнее обстоятельство немаловажно, когда
массивному кровотечению предшествует длительный анамнез с упорным
течением заболевания. Кроме того, такой вариант операции показан
пациентам с сочетанными осложнениями — кровотечением и поздней
стадией стеноза, а также при сочетанной форме язвенной болезни.
При проведении вмешательства хирург .должен быть готов к
закрытию «трудной» дуоденальной культи, когда речь идёт о язве, пенет-
рирующей в поджелудочную железу. Летальность после этой
операции составляет 5—10%.
Пилоропластику с иссечением или прошиванием язвы без ваготомии
выполняют вынужденно в связи с продолжающимся кровотечением,
которое невозможно остановить эндоскопическим способом, как
правило, у пациентов пожилого и старческого возрастов с крайне
высоким операционно-анестезиологическим риском.
Послеоперационная летальность у таких больных превышает 50%.
Резекция желудка (рис. 9-5) показана при кровоточащей
желудочной язве, если степень операционного риска сравнительно невысока.
Послеоперационная летальность после резекции составляет 2—7%.
Иссечение язвы (клиновидная резекция) или прошивание желудочной
язвы через гастротомический доступ можно предпринять у больных
с предельно высокой степенью операционного риска. Этим
технически несложным оперативным вмешательством можно остановить
кровотечение из язвы желудка. Такие операции носят характер
«вынужденных», когда другие средства гемостаза исчерпаны.
Послеоперационная летальность превышает 50%.
Послеоперационный период
Особенности ведения ближайшего послеоперационного периода
зависят от тяжести состояния больных (степень кровопотери,
пожилой возраст и сопутствующие заболевания), а также от характера
проведённого оперативного вмешательства. Послеоперационный период
у больных, перенёсших прошивание кровоточащей язвы и органосбе-
егающие операции с ваготомией, имеет особенности. В ближайшем
246 ♦ Хирургические болезни -0- Том 1 ♦ Часть II <? Глава 9
Рис. 9-5. Резекция желудка по Гофмейстеру—Финстереру (схема операции):
1 — культя двенадцатиперстной кишки; 2 — гастроэнтероанастомоз.
послеоперационном периоде больному проводят курс
противоязвенной терапии, включающий ингибиторы протонной помпы либо
последнее поколение Н2-блокаторов, а также комплекс антихеликобак-
терной терапии. Особенность послеоперационного периода у этих
больных — необходимость профилактики моторно-эвакуаторных
расстройств оперированного желудка.
Прогноз
Арсенал современных консервативных и оперативных методов
позволяет с удовлетворительными результатами решить сложный
вопрос об угрозе жизни больного с профузным язвенным
кровотечением. Многое зависит от своевременности и адекватности оказания
неотложной помощи.
После оценки ближайших результатов операций
(резецирующих, органосохраняющих с ваготомией) больные, находящиеся на
диспансерном наблюдении, должны быть через 2—3 мес переданы
врачу-гастроэнтерологу. Прогноз рецидива язвы зависит не только от
проведённого оперативного вмешательства (оно должно быть
патофизиологически обоснованным), но и от хорошо организованной
консервативной терапии (поддерживающая и противорецидивная
Осложнения язвенной болезни ♦ 247
антисекреторная терапия, антихеликобактерное лечение с
достижением эрадикации). Особое место занимают больные, перенёсшие
язвенные кровотечения из желудочной язвы. Им необходимо
пристальное внимание из-за возможности ракового перерождения
(малигнизации) хронической язвы желудка.
Язвенный пилородуоденальный стеноз
Около трети больных, оперированных по поводу осложнений
язвенной болезни, составляют пациенты с пилородуоденальным
стенозом. Мужчины страдают этой патологией чаще, чем женщины (5:1).
Обычно это больные среднего возраста. Отмечаемое снижение
частоты случаев, требующих хирургического лечения, можно связать с
активным внедрением в клиническую практику новых
медикаментозных средств.
Классификация
Существуют клинические, анатомические и функциональные
критерии выделения различных стадий пилородуоденального стеноза.
При этом их можно определить лишь при сопоставлении
клинических, рентгенологических, эндоскопических данных и результатов
специального исследования моторной функции желудка. В
клинической практике чаще всего выделяют три стадии этого
патологического процесса (табл. 9-2).
Сочетание рубцово-язвенного стеноза с другими осложнениями
язвенной болезни (перфорацией, кровотечением) не следует считать
большой редкостью. В части случаев пилородуоденальный стеноз
развивается после возникшего ранее осложнения (ушивание перфо-
ративной язвы или эпизод кровотечения, излеченный без операции).
Основные черты патологии
Деформация и сужение пилородуоденальной области развиваются
вследствие рубцевания многократно рецидивирующих язв, что
влечёт за собой ту или иную степень её непроходимости и замедление
эвакуации желудочного содержимого. Чтобы компенсировать
опорожнение желудка, происходят гипертрофия его мышечной
оболочки и усиление двигательной активности. С прогрессированием
стеноза желудок теряет свои компенсаторные возможности, растягивается,
248 О* Хирургические болезни О Том 1 ♦ Часть II ♦ Глава 9
Осложнения язвенной
увеличивается в размерах, ослабляется его перистальтика, что ещё в
большей степени усугубляет нарушения желудочной эвакуации.
Постепенно появляются признаки декомпенсации патологического
процесса, характеризующиеся рвотой застойным желудочным
содержимым, значительным замедлением эвакуации пищи из желудка,
нарушением питания и жизнедеятельности больного. Отмечают
также прогрессирующий метаболический алкалоз
(хлорид-чувствительный), нарушение водно-электролитного и белкового баланса
(подробности описаны в главе 3, раздел «Нарушения метаболизма»).
К этому следует добавить, что стеноз с выраженной дилатацией и
нарушениями моторно-эвакуаторной функции желудка приводит к
резкому истончению его стенки, потере компенсаторных
возможностей восстановления моторной активности и микробному
«загрязнению» слизистой оболочки вследствие гнилостного брожения
застоявшейся пищи.
Диагностика
Клиническая симптоматика
Наряду с «язвенными» болями в стадии компенсации стеноза
настойчиво возникает чувство переполнения в эпигастральной
области после приёма пищи. Эпизодически появляется рвота, на
некоторое время приносящая больному облегчение. При зондировании
желудка эвакуируют около 200—500 мл желудочного содержимого с
кислым неприятным запахом и примесью недавно принятых
пищевых масс. Общее состояние больного существенно не страдает.
При субкомпенсации больной ощущает постоянное чувство
тяжести и переполнения в эпигастральной области, сочетающееся с болью
и отрыжкой воздухом. При физикальном исследовании можно
отметить «шум плеска» в проекции желудка. Ежедневно, по несколько раз
в день бывает обильная рвота сразу или через 1-2 ч после еды только
что принятой и съеденной накануне пищей, без признаков
гнилостного брожения. Натощак в желудке при зондировании определяют
большое количество содержимого. В этой стадии стеноза больной
отмечает похудание.
Декомпенсированный стеноз характеризуется прогрессирующим
желудочным стазом, растяжением желудка. Состояние больного
значительно ухудшается, происходит резкое обезвоживание, снижение
количества отделяемой мочи. Характерна землистая окраска
потерявших тургор кожных покровов. Недомогание, апатия и вялость
250 ♦ Хирургические болезни ♦ Том 1 <> Часть II ♦ Глава 9
нивелируют другие симптомы болезни. Гипокалиемия проявляется
выраженной мышечной слабостью, нарушениями сердечного ритма
и проводимости. Гипохлоремия чревата возникновением судорожного
синдрома (так называемая хлоропривная тетания). Помимо общих
судорог (иногда принимаемых за эпилептический припадок),
возникает тризм (спазм жевательной мускулатуры). Определяются
симптомы Труссо («рука акушера») и Хвостека (подергивание мышц лица
при поколачивании в области лицевого нерва). Чувство распираний
в эпигастральной области заставляет больного самостоятельно
вызывать рвоту. Рвотные массы в огромном количестве содержат
зловонное разлагающееся содержимое с остатками многодневной пищи.
При осмотре обращает внимание сухость языка и кожных покровов.
При аускультации слышен «шум плеска» в проекции желудка. Зон-
довые пробы позволяют эвакуировать большое количество
застойного желудочного содержимого с признаками брожения и гниения.
Опорожнение желудка в стадиях субкомпенсации и декомпенсации
значительно облегчает самочувствие больных.
Инструментальные диагностические методы
Особую роль при этом осложнении язвенной болезни играет
рентгенологическое исследование. В стадии компенсации выявляют
некоторое увеличение размеров желудка, рубцово-язвенную
деформацию пилородуоденальной зоны. Отмечают замедление желудочной
эвакуации до 12 ч. При субкомпенсированном стенозе
обнаруживают признаки начинающейся декомпенсации моторики желудка —
увеличение его в размерах, ослабление перистальтической
активности. В этой стадии появляется симптом так называемого
«трёхслойного желудка» (трёхслойное содержимое — контрастное вещество,
слизь, воздух). Задержка эвакуации составляет более 12 ч. Стадия
декомпенсации характеризуется значительным увеличением размеров
желудка, снижением перистальтики, резким сужением пилородуоде-
нального канала и выраженными нарушениями желудочной
эвакуации. Бариевая взвесь остаётся в желудке более 24 ч.
ФЭГДС. В первой стадии отмечают выраженную рубцовую
деформацию пилородуоденального канала с сужением его просвета до
0,5—1 см. Можно обнаружить гипертрофию слизистой оболочки
желудка и усиленную перистальтику. Во второй стадии метод даёт
точные представления о значительном сужении пилородуоденального
канала, задержке эвакуации желудочного содержимого, увеличении
Осложнения язвенной болезни ♦ 251
размеров желудка. В третьей стадии выявляет резкое сужение пило-
родуоденального канала, истончение слизистой оболочки желудка,
отсутствие перистальтики желудочной стенки и чрезмерное
расширение просвета желудка.
Исследование моторной функции методом иономанометрии даёт
представление о тонусе, частоте, амплитуде сокращений желудка
натощак и после приёма пищевого раздражителя, позволяет определить
время задержки начальной эвакуации. Для компенсированного
стеноза характерен редкий ритм активных желудочных сокращений. При
субкомпенсированном моторная функция ослабляется. В стадии
декомпенсации выявляют резкое снижение тонуса и двигательной
активности желудка.
УЗИ. Выполнение УЗИ брюшной полости натощак в поздних
стадиях стеноза позволяет визуализировать наполненный жидкостью
желудок. Метод неточен в плане определения стадии стеноза, но
может быть полезным для экспресс-диагностики.
Лабораторная диагностика
При помощи лабораторной диагностики (при поздних стадиях
стеноза) определяют признаки метаболического
(хлор-чувствительного) алкалоза, эксикоза, гипогликемии, гипопротеинемии.
Дифференциальная диагностика
Дифференциальный диагноз необходимо проводить с опухолевым
поражением антрального отдела желудка, опухолью головки
поджелудочной железы с прорастанием в двенадцатиперстную кишку.
Лечение
Консервативная терапия
Консервативная терапия при пилородуоденальном стенозе
становится предоперационной подготовкой больных к плановому
хирургическому вмешательству. Она направлена, прежде всего, на
заживление активной язвы с применением современных антисекреторных
средств и антихеликобактерных препаратов. Кроме того, необходимо
обеспечить коррекцию нарушений водно-электролитного обмена,
белкового состава плазмы крови и восстановление массы тела. Этих
целей достигают парентеральным введением солевых и белковых
252 -Ф- Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 9
препаратов. В поздних стадиях стеноза одним из наиболее
эффективных способов подготовки больного к операции служит энтераль-
ное зондовое питание (зонд проводят с помощью эндоскопа за
уровень сужения в тощую кишку). В настоящее время существует много
питательных смесей для энтерального питания. В клинической
практике наибольшее распространение получили сбалансированные
пищевые смеси: Нутризон, Изокал, Эншур.
Большое внимание следует уделить восстановлению или
улучшению двигательной активности желудка, создав условия для
профилактики развития послеоперационных осложнений, включающих
моторно-эвакуаторные расстройства. С этой целью проводят
постоянную или фракционную аспирацию желудочного содержимого,
промывание желудка холодной водой, назначают современные про-
кинетические средства (см. ниже).
Хирургическая тактика
Процесс рубцевания пилородуоденальной зоны носит
необратимый и прогрессирующий характер. Поэтому лечение данного
осложнения может быть только оперативным, независимо от тяжести
клинических проявлений, степени расширения желудка, нарушений его
моторной и эвакуаторной функций. Пилородуоденальный стеноз —
показание к хирургическому лечению. При выборе метода
оперативного вмешательства следует учитывать стадию развития стеноза и
степень нарушений моторной функции желудка и двенадцатиперстной
кишки, а также особенности желудочной секреции и степень
операционного риска.
Стволовая ваготомия в сочетании с дренирующими желудок
операциями — наиболее частое вмешательство при этой патологии. Его
выполняют более чем у половины больных. Наиболее
аргументированы показания к этой операции при компенсированном пило-
родуоденальном стенозе. Её можно выполнить и в части случаев
субкомпенсированного стеноза, когда больным была проведена
адекватная предоперационная подготовка (восстановление
водно-электролитных нарушений, заживление активной язвы, нормализация
тонуса желудка и темпов желудочного опорожнения). Летальность при
такой операции, выполняемой в плановом порядке, близка к нулю.
Лапароскопическая стволовая ваготомия с пилоропластикой из
минидоступа — новое техническое направление малоинвазивной
хирургии. Её выполняют при компенсированном пилородуоденаль-
Осложнения язвенной болезни ♦ 253
ном стенозе. Летальность после таких операций также стремится к
нулевой отметке.
Стволовая ваготомия с антрумэктомией показана при пилородуо-
денальных стенозах с признаками субкомпенсации и декомпенсации,
а также при сочетанной форме язвенной болезни. Комбинация
резекции желудка со стволовой ваготомией позволяет уменьшить объём
удаляемой части органа, сохраняя при этом лечебный эффект
операции. Летальность при этих операциях составляет 0—2%.
Резекция желудка (гемыгастрэктомия) показана больным с деком-
пенсированным стенозом и сниженной кислотообразующей
функцией желудка. Летальность при этом составляет 1—4%.
Гастроэнтеростомия как окончательный способ лечения
показана пожилым больным, находящимся в тяжёлом состоянии, с
поздними стадиями стеноза, фактически при «отзвучавшей» язве. Этих
больных по ряду причин не удаётся подготовить к плановому
вмешательству, что обусловлено чаще всего крайне высоким опера-
ционно-анестезиологическим риском. Обычно при язвенном пило-
родуоденальном стенозе формируют задний позадиободочный гаст-
роэнтероанастомоз по Гакеру. В настоящее время такие операции
приходится выполнять довольно редко.
Послеоперационный период
Ведение послеоперационного периода у этой группы больных
имеет свои особенности. Следует принимать во внимание, что в
условиях язвенной болезни, осложнённой стенозом, существенно
страдает моторно-эвакуаторная функция желудка. Длительность
заболевания, частые обострения, активная язва на момент госпитализации,
нарушения координации работы смежных отделов желудка и
двенадцатиперстной кишки и другие факторы позволяют считать, что риск
развития моторно-эвакуаторных нарушений после операций с
ваготомией может быть крайне высоким. Именно поэтому в
предоперационном периоде назначают препараты, нормализующие моторику (ме-
токлопрамид, домперидон). В некоторых случаях необходимо и
проведение зондового энтерального питания. В ходе операции для
профилактики нарушений моторно-эвакуаторной функции
устанавливают двухканальный зонд. При этом один его канал открывается в
желудке и служит для декомпрессии последнего в
послеоперационном периоде, второй — в тощей кишке за связкой Трейтца, он
предназначен для энтерального кормления больных.
254 ♦ Хирургические болезни ♦ Том 1 О- Часть II ♦ Глава 9
Диагностировать развитие нарушений желудочной эвакуации
в послеоперационном периоде следует по клиническим и
инструментальным признакам. Жалобы могут быть выражены неярко, но в
условиях перенесённой ваготомии следует обращать внимание на
минимальные проявления. Такими признаками следует считать тяжесть
в желудке, возникающую вечером или после приёма пищи, отрыжку,
изжогу, икоту. Для диагностики нарушения желудочной эвакуации
наиболее простой способ — зондирование желудка с эвакуацией
содержимого. УЗИ поможет установить размеры желудка и примерное
содержание жидкости натощак. Окончательным методом
определения степени и вида нарушения желудочной эвакуации служит
рентгенологическое исследование с контрастным веществом.
Параллельно зондовому питанию в послеоперационном периоде
следует проводить медикаментозное и физиотерапевтическое
лечение, направленное на профилактику и ликвидацию развившегося
замедления желудочной эвакуации.
Нельзя забывать о проведении комплексного противоязвенного
лечения, состоящего из антисекреторного препарата (Н2-блокатор,
блокатор протонной помпы), препарата висмута в комбинации с
антибиотиками.
Прогноз
Основная причина летальных исходов у больных со стенозом —
выраженные нарушения гомеостаза, возникшие на фоне поздних
стадий стеноза, а также декомпенсация сопутствующей патологии у
пожилых больных.
НАРУЖНЫЕ
БРЮШНЫЕ ГРЫЖИ
Грыжей (hernia) живота называют выход внутренностей из
брюшной полости вместе с париетальным листком брюшины через
естественные или патологические отверстия под покровы тела или в
другую полость. Грыжа — одно из наиболее распространённых
хирургических заболеваний, им страдают 3—4% населения. В
клинической практике чаще всего встречают наружные брюшные грыжи. Они
представляют реальную опасность для жизни больного из-за
возможного развития осложнений (например, ущемление, воспаление), а при
неосложнённом течение значительно ограничивают
трудоспособность пациента и снижают качество его жизни.
Любая грыжа имеет следующие составные части: грыжевые
ворота, грыжевой мешок, грыжевое содержимое и оболочки грыжи
(рис. 10-1).
Грыжевые ворота — врождённые или приобретённые отверстия в
мышечно-апоневротическом слое брюшной стенки, через которые
под влиянием различных причин внутренние органы вместе с
париетальной брюшиной выходят из брюшной полости. Они могут
формироваться в изначально «слабых» участках брюшной стенки, таких как
пупочное кольцо, паховый и бедренный каналы, щели между апонев-
ротическими волокнами, образующими белую линию живота, и т.д.
Приобретённые дефекты возникают в результате травм брюшной
стенки, нагноения операционных ран, прорезывания швов апоневроза.
Размеры и форма грыжевых ворот могут быть самыми
разнообразными (круглые, овальные, треугольные, щелевидные и др.).
Наиболее опасны грыжи с узкими грыжевыми воротами, что
увеличивает риск ущемления. Послеоперационные и травматические грыжи
характеризуются неправильной формой грыжевых ворот и
значительными их размерами.
Грыжевой мешок формируется париетальной брюшиной,
вышедшей через грыжевые ворота и образовавшей своеобразный «карман».
♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 10
Рис. 10-1. Внешний вид (А) и составные элементы грыж (Б) передней брюш
ной стенки: 1 — послеоперационная вентральная грыжа; 2 — правосторон
няя паховая грыжа; 3 — оболочки грыжи; 4— грыжевой мешок; 5 — грыже
вые ворота; 6 — грыжевое содержимое — прядь большого сальника и петля
тонкой кишки.
Грыжевой мешок, как и сама грыжа, может быть врождённым и
приобретённым. Мешок при врождённой грыже представляет собой не-
заросший эмбриональный карман или остаток отростка брюшины.
Приобретённый грыжевой мешок представляет собой вновь
образованное выпячивание брюшины.
В грыжевом мешке различают устье, шейку, тело и дно.
• Устье — часть грыжевого мешка, граничащая с брюшной
полостью.
• Шейка — наиболее узкий его отдел, находящийся в толще брюшной
стенки (в грыжевых воротах).
• За шейкой идёт тело грыжевого мешка — как правило, самая
большая его часть.
• Дистальный отдел мешка называют дном.
Грыжевой мешок может быть однокамерным и многокамерны
При длительном существовании грыжи, особенно больших размеров,
в результате травматизации и асептического воспаления в грыжевом
мешке могут формироваться спайки и перегородки. Возможно ущем-
Наружные брюшные грыжи ♦ 257
ление содержимого грыжи в одной из полостей (камер) грыжевого
мешка. При полном отграничении одного из его участков возникает
киста грыжевого мешка.
Грыжевое выпячивание может сформироваться таким образом, что
одну из его стенок образует орган, частично покрытый брюшиной
(например, мочевой пузырь или восходящая ободочная кишка). Это
так называемая скользящая грыжа. Грыжевой мешок при увеличении
размеров грыжевого выпячивания вытягивает через грыжевые
ворота орган, расположенный мезоперитонеально, который «скользит» по
забрюшинной клетчатке. При вскрытии такого грыжевого мешка
легко можно повредить стенку полого органа.
Грыжевое содержимое представляет собой внутренние органы,
находящиеся в грыжевом мешке. Чаще всего грыжевым содержимым
бывают большой сальник и тонкая кишка, так как они расположены
интраперитонеально и наиболее подвижны. Внутренние органы в
результате длительной травматизации (например, ношения бандажа)
могут подпаяться к грыжевому мешку и перестать вправляться
(полностью или частично) в брюшную полость. Такие грыжи
называют невправимыми.
Оболочки грыжи. Грыжевое выпячивание покрыто снаружи
всеми тканями, расположенными в данной области между грыжевым
мешком (париетальной брюшиной) и кожей. Это фасциальные
листки, клетчатка, иногда истончённые мышечные волокна.
Различают наружные и внутренние грыжи живота.
• Наружные грыжи (грыжи брюшной стенки) характеризуются вы-
хождением внутренних органов через дефект в брюшной стенке в
подкожную клетчатку при сохранении кожных покровов.
• Внутренние грыжи формируются внутри брюшной полости в
результате проникновения органов в нормально существующие или
патологически образовавшиеся карманы и складки брюшины, в
которых при нормальных соотношениях они не содержатся.
Внутренние грыжи распознают, как правило, во время операции при
непроходимости кишечника. Диафрагмальные грыжи, проникающие в
грудную полость через естественные или приобретённые отверстия
и щели диафрагмы, также относят к внутренним брюшным грыжам.
Грыжу следует отличать от эвентрации и выпадения органа.
• При эвентрации выхождение внутренних органов из брюшной
полости возникает остро вследствие повреждения брюшной стенки
(ранения, разрыва, расхождения швов). Париетальный листок брю-
258 ♦ Хирургические болезни •♦■ Том
Часть II ♦ Глава 10
шины в этом случае утрачивает целостность и не формирует грыже
вой мешок. Внутренние органы через повреждённую брюшную
стенку выходят под кожу (подкожная эвентрация) или наружу
(наружная эвентрация).
• Выпадением называют выхождение наружу органа (или его части),
не покрытого брюшиной, через естественные отверстия
(выпадение прямой кишки, матки, мочевого пузыря).
Основное отличие грыжи от эвентрации и выпадения — наличие
грыжевого мешка.
.
Классификац!
Грыжи живота классифицируют по анатомическим, этиологичес
ким и клиническим признакам.
• Этиологическая характеристика:
- врождённые;
- приобретённые.
• Локализация:
- паховые;
- бедренные;
- пупочные;
- белой линии живота;
- редкие (спигелиевой линии, мечевидного отростка, поясничные,
седалищные, промежностные).
• Клиническое течение:
- неосложнённое (вправимая грыжа);
- осложнённое (ущемление, невправимость, воспаление, копро-
стаз);
- рецидивное.
По происхождению грыжи разделяют на врождённые и приобре
тённые.
• Врождённые грыжи могут проявиться как сразу после рождения
ребёнка, так и позже, поскольку до выхода грыжевого содержимого
в грыжевой мешок врождённую грыжу можно не обнаружить. Как
правило, врождённые грыжи бывают паховыми или пупочными.
• Приобретённые грыжи подразделяют в зависимости от причин,
приведших к возникновению дефекта брюшной стенки. Выделяют
грыжи «от усилия» (вследствие повышения внутрибрюшного
давления), «от слабости» (у пожилых людей, при атрофии мышц), пос-
Наружные брюшные грыжи О- 259
леоперационные, травматические, невропатологические. Последние
возникают при нарушениях иннервации мышц брюшной стенки.
По клиническому течению в зависимости от состояния входящих в
грыжу внутренних органов грыжи разделяют на вправимые (неослож-
нённые), невправимые, ущемлённые, грыжи с явлениями копроста-
за и воспаления, рецидивные (возникающие повторно после
операции по поводу грыжи).
Этиология и патогенез
Развитие грыжи — результат нарушения динамического
равновесия между внутрибрюшным давлением и способностью стенок
живота ему противодействовать. У здорового человека, несмотря
на наличие «слабых мест» брюшной стенки, мышечно-апоневро-
тический аппарат удерживает органы брюшной полости в их
естественном положении даже при значительных колебаниях внутри-
брюшного давления (роды, поднятие тяжестей, кашель, дефекация
и др.). Нарушения в системе взаимодействия стенок живота и внут-
рибрюшного давления наступают в результате комплекса местных и
общих факторов.
К местным факторам относят особенности топографо-анатоми-
ческого строения тех областей, через которые выходят грыжи. Эти
зоны изначально менее устойчивы к изменениям внутрибрюшного
давления. К ним относят паховый канал, через который у мужчин
проходит семенной канатик, бедренное кольцо, пупочное кольцо, щели
в белой линии живота и др.
Общие факторы образования грыж разделяют на
предрасполагающие и производящие.
К предрасполагающим относят особенности конституции человека
(астеническое телосложение, высокий рост), наследственную
слабость соединительной ткани (наряду с формированием грыж она
способствует развитию плоскостопия, варикозной болезни и
геморроя), пол (особенности строения таза и большие размеры
бедренного кольца у женщин, меньшая прочность паховой области у мужчин),
возраст (слабая брюшная стенка у детей первого года жизни,
атрофия брюшной стенки у пожилых людей); как ожирение, так и
быстрое похудание; частые роды (перерыв менее 3 лет), когда не
успевают восстановиться структура и тонус брюшной стенки;
послеоперационные рубцы; паралич нервов, иннервирующих брюшную
260 -О- Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 10
стенку. Перечисленные факторы способствуют ослаблению брюшной
стенки, однако их нельзя считать неизбежно определяющими
образование грыжи. Для этого необходимо их сочетание с
производящими факторами.
Производящими называют факторы, способствующие
значительному повышению внутрибрюшного давления или резким его
колебаниям. Это состояния, возникающие при частом плаче и крике ребёнка
в младенческом возрасте, длительном кашле (туберкулёз,
хронический бронхит, профессиональные пневмокониозы); тяжёлом
физическом труде, превышающем степень тренированности мышц
конкретного человека; затруднениях мочеиспускания (фимоз, аденома
предстательной железы, стриктура уретры), продолжительных
запорах, осложнённой беременности (многоводие) и трудных родах с
длительным потужным периодом.
Усилие, способствующее резкому повышению внутрибрюшного
давления, растяжению и разрыву апоневротического кольца и
возникновению грыжи, может быть единственным и внезапным
(поднятие тяжёлого груза, напряжение всего тела). Между тем, значительно
чаще грыжа формируется в результате умеренных, но
систематических его колебаний, «расшатывающих» слабые места брюшной стенки.
Для правильного выбора тактики лечения врач обязан выявить
предрасполагающие и производящие моменты формирования грыжи.
Повлиять на предрасполагающие факторы невозможно.
Производящие необходимо устранить или, по крайней мере, минимизировать
их влияние до операции и в ближайшие месяцы
послеоперационного периода, поскольку в противном случае неизбежен рецидив
заболевания.
Механизм образования грыж зависит от этиологии заболевания
(грыжа врождённая или приобретённая). Причиной образования
врождённой грыжи становится недоразвитие брюшной стенки во
внутриутробном периоде (эмбриональные пупочные грыжи) или незара-
шение брюшинно-пахового отростка. Грыжевые ворота и грыжевой
мешок к моменту рождения ребёнка уже сформированы, и лишь
затем (иногда через годы после рождения) в результате физического
усилия и повышения внутрибрюшного давления внутренние органы
проникают в грыжевой мешок.
При приобретённых грыжах органы брюшной полости выходят
через грыжевые ворота, продвигая перед собой париетальную
брюшину, и проникают далее, чаще всего по ходу сосудистого пучка или
существующего канала. Под влиянием повышенного внутрибрюш-
Наружные брюшные грыжи О- 261
ного давления формирующийся грыжевой мешок с грыжевым
содержимым раздвигает перед собой слои брюшной стенки. Грыжа
увеличивается посредством растяжения и прогрессивного
выпячивания париетальной брюшины, и в образующийся мешок проникает
всё большее количество грыжевого содержимого. В связи с этим
приобретённая грыжа клинически проявляет себя с самого начала
формирования.
Клиническая диагностика
Как правило, развитие грыжи происходит постепенно. В
начальной стадии заболевания больной ощущает незначительные тянущие
боли в области формирующейся грыжи, усиливающиеся при
повышении внутрибрюшного давления (при поднятии тяжестей, кашле,
акте дефекации и др.). Боли постепенно усиливаются, и через
определённый период времени в зоне их локализации больной (или врач)
обнаруживает небольшое опухолевидное образование круглой или
овальной формы, появляющееся при физическом напряжении и
исчезающее при принятии горизонтального положения. Болевые
ощущения в начальной стадии заболевания, когда происходит
растяжение интактной брюшины с формированием грыжевого мешка,
достаточно интенсивны, но не достигают остроты, характерной для
ущемления. По мере увеличения грыжевого выпячивания боли
становятся слабее и даже полностью исчезают. В последующем, при
длительном существовании грыжи и больших её размерах, при
скользящих и рецидивирующих грыжах они вновь становятся постоянным
симптомом и основной жалобой больных. Болевой синдром
возникает в момент выхождения грыжи и полностью проходит после её
вправления. Чем больше грыжевое выпячивание, тем более
значительные неудобства оно причиняет при ходьбе и физической работе,
резко ограничивает трудоспособность и создаёт не только физические,
но и психологические проблемы в повседневной жизни.
При сформировавшейся грыже основным симптомом заболевания
становится появление опухолевидного образования. Характерный
признак — изменение его размеров. Оно увеличивается в
вертикальном положении, при кашле и натуживании, а в горизонтальном
положении или при ручном вправлении уменьшается или даже совсем
перестаёт определяться. Это свойство быстрого изменения размеров
вплоть до полного исчезновения позволяет отличать грыжевое вы-
262 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 10
пячивание от иных опухолевидных образований, размеры которых во
время осмотра постоянны.
Больного с подозрением на грыжу обязательно осматривают в
вертикальной и горизонтальной позициях. В положении лёжа
грыжевое выпячивание может отсутствовать даже при натуживании,
поэтому осмотр больного необходимо начинать в положении стоя.
Это позволяет обнаружить появление ранее незаметных
опухолевидных образований, асимметрию в паховых областях и под паховыми
складками. При пахово-мошоночных и вентральных грыжах таким
образом сразу устанавливают их наибольший размер.
Пальпация неосложнённой (вправимой) грыжи безболезненна,
она позволяет определить образование мягко-эластической
консистенции. В горизонтальном положении грыжевое содержимое
обычно свободно вправляется в брюшную полость. При пальпации
скользящей грыжи, в состав грыжевого
мешка которой входит стенка мочевого
пузыря, может появляться позыв на
мочеиспускание. Обязательные
мероприятия — исследование грыжевых ворот и
выявление симптома кашлевого толчка.
Пальцами, введёнными в грыжевые
ворота после вправления грыжи, уточняют их
форму и размер. При покашливании
пациента пальцы врача ощущают толчки
органа, выходящего в грыжевой мешок.
Кашлевой толчок определяется при
любых формах грыж, за исключением
ущемлённых (рис. 10-2).
Перкуссия грыжевого выпячивания
определяет тимпанит при наличии в
грыжевом мешке кишки. Если его
содержимое составляет большой сальник или
другой орган, не содержащий газ, то
определяется притупление перкуторного
звука.
Аускультация позволяет выслушать
перистальтические шумы, если
содержимым грыжевого мешка стала петля кишки.
Из инструментальных методов
диагностики используют рентгеноконтрает-
Рис. 10-2. Методика
исследования пахового канала
при грыже: указательный
палец путём инвагинации
кожи мошонки вводят в
паховый канал. При кашле
выходящее грыжевое
содержимое ударяет в кончик
пальца — положительный
симптом кашлевого толчка.
Наружные брюшные грыжи -0- 263
ные исследования и УЗИ. Их выполняют при больших вентральных
грыжах для определения содержимого грыжевого мешка, подозрении
на скользящую грыжу и для исключения сочетанной патологии
органов брюшной полости.
Дифференциальная диагностика
Дифференцировать неосложнённую грыжу необходимо от
опухолевидных образований различной природы. Это могут быть
доброкачественные опухоли брюшной стенки (липомы, фибромы), метастазы
опухолей, увеличенные паховые лимфатические узлы при
инфекционных заболеваниях (включая сифилис и ВИЧ-инфекцию),
лейкозах, лимфадените. Пупочную грыжу легко спутать с кистой ураху-
са, паховую — с кистой круглой связки матки. Отличить грыжу от
этих заболеваний позволяет комплекс признаков, характерных
только для грыжи: грыжевое выпячивание во время осмотра способно
изменять свои размеры и даже полностью исчезать, вправившись в
брюшную полость; при вправлении грыжи всегда можно обнаружить
дефект брюшной стенки (грыжевые ворота), выявить симптом каш-
левого толчка.
Принципы лечения
Устранить грыжу и предотвратить возможные осложнения можно
только хирургическим путём. Операция при неосложнённой грыже
носит в значительной мере профилактический характер, её риск не
должен быть выше риска заболевания. Между тем у определённой
части больных это условие невыполнимо, тогда приходится
прибегать к консервативному лечению. Соматический статус многих
пациентов можно охарактеризовать рядом клинических признаков со
словом «очень»: очень пожилые, очень больные, очень полные.
Отказ от оперативного лечения в преклонном возрасте
определяется комплексом свойственных ему выраженных изменений
тканей, функций органов и систем. При этом следует учитывать
биологический, а не календарный возраст. Следующая позиция — не
поддающиеся коррекции декомпенсированные хронические
заболевания, онкологическая патология. Следует воздержаться от
планового грыжесечения и во время беременности. Выраженное
ожирение считают относительным противопоказанием не только по той
264 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 10
причине, что оно создаёт хирургу дополнительные технические
трудности, но и в связи с высоким риском нагноения раны и рецидива
заболевания.
Консервативное лечение
Консервативное лечение не преследует цель излечения
заболевания (это возможно только у детей первых недель жизни). Его
задача — устранить некоторые тягостные для больного симптомы,
предотвратить увеличение грыжи и её ущемление. Основу такого
лечения составляет ношение бандажа, препятствующего выхождению
внутренних органов в грыжевой мешок и возможному их ущемлению.
При невправимых грыжах бандаж противопоказан. Следует
подчеркнуть, что использование бандажа — сугубо паллиативное
мероприятие, и расширение показаний к его применению — тактическая
ошибка. Постоянное давление на ткани брюшной стенки
вызывает их атрофию, а длительная травматизация может способствовать
развитию спаек между органами брюшной полости и грыжевым
мешком. Это ведёт к превращению грыжи в невправимую и
невозможности дальнейшего применения бандажа. Таким образом, его
использование следует считать вынужденной (иногда временной) мерой, ни
в коем случае не заменяющей операцию.
В комплекс консервативных мероприятий входит подбор диеты, а
при необходимости и медикаментозных средств, направленных на
предупреждение запоров. Именно в туалете у пожилых пациентов
чаще всего происходит ущемление грыжи.
Оперативное лечение
Оперативное лечение неосложнённой грыжи проводят в
плановом порядке после выявления и коррекции факторов, спровоцировавших
повышение внутрибрюшного давления. Если причиной образования
грыжи стал тяжёлый физический труд, пациент должен быть заранее
предупреждён о необходимости изменения характера
производственной деятельности. При нарушении мочеиспускания его причину
необходимо устранить до грыжесечения. Наличие аденомы
предстательной железы легко установить с помощью исследования
остаточной мочи, количество которой в норме не должно превышать 30,0 мл.
Полностью избавить больного от хронического бронхита не всегда
реально, однако вполне возможно добиться стойкой ремиссии, про-
Наружные брюшные грыжи ♦ 265
ведя курс лечения. Это же касается и нарушений функций толстой
кишки, которые необходимо устранить с помощью специальной
диеты и назначения слабительных средств.
По доступам, применяемым для лечения грыж, все методы можно
разделить на две группы: открытые и закрытые (эндовидеохирурги-
ческие) вмешательства.
Операцию открытым доступом называют грыжесечением. Она
включает следующие этапы:
• рассечение тканей над грыжевым мешком;
• выделение грыжевого мешка до шейки;
• вскрытие грыжевого мешка и вправление содержимого в
брюшную полость;
• прошивание, перевязка грыжевого мешка у шейки и его отсечение;
• пластика грыжевых ворот местными тканями или аллопласти-
ческими материалами.
Современные синтетические протезы редко вызывают
выраженную реакцию асептического воспаления с образованием зон некроза
и последующим нагноением. Сетка протеза служит каркасом для
прорастания соединительной тканью, по прочности равной или
превосходящей прочность апоневроза. Наиболее широко используемые
синтетические материалы — полиэстер, политетрафторэтилен,
полипропилен. Нетканные пластины из пористого
политетрафторэтилена максимально инертны к тканям организма, их можно располагать
даже интраперитонеально без риска вызвать спаечный процесс.
Закрытие грыжевых ворот аллопластическим материалом называют
ненатяжной герниопластикой.
Эндовыдеохырургынескую герниопластыку выполняют при
небольших размерах грыжевых ворот (пупочные, паховые,
послеоперационные грыжи, грыжи белой линии живота) или при тех
локализациях грыж, когда грыжевые ворота сложно закрыть местными тканями,
например после люмботомии. Грыжи после лапароскопических
вмешательств также лучше оперировать видеоэндоскопически. После
введения троакаров в брюшную полость, её ревизии, разделения спаек
и идентификации дефекта апоневроза выполняют непосредственно
герниопластику. Помещённый в брюшную полость синтетический
протез, сетчатый или перфорированный, выкроенный с запасом не
менее 2—3 см по каждой из сторон грыжевых ворот, фиксируют
скобками с помощью специальных аппаратов — герниостеплеров.
Основным принципом оперативного лечения должен быть
индивидуальный, дифференцированный подход к выбору метода грыже-
266 О Хирургические болезни О Том 1 О Часть И О- Глава 10
сечения. Шаблонное использование одного типа вмешательства
неприемлемо для клинической практики. Например, хорошо
зарекомендовавшие себя с точки зрения отдалённых результатов методы
ненатяжной герниопластики не показаны детям, опасны при
ущемлённых грыжах из-за возможности инфицирования сеток, стоимость
операции вдвое выше, чем при традиционном грыжесечении.
Видеоэндоскопические операции требуют применения общего
обезболивания, соответствующего технического оснащения, специальной
подготовки операционной бригады, невозможны при ущемлённых и
рецидивных грыжах. Выбор метода может быть ограничен возрастом
и сопутствующими заболеваниями пациента, состоянием тканей
брюшной стенки и величиной грыжевого дефекта. Приоритет
следует отдать наиболее простому и наименее травматичному
вмешательству, с помощью которого можно надёжно ликвидировать дефект
брюшной стенки.
Осложнения
К осложнениям наружных грыж живота относят ущемление, не-
вправимость, копростаз и воспаление.
Ущемление
Ущемление — наиболее опасное осложнение грыжи, угрожающее
жизни больного и требующее немедленного хирургического
вмешательства. Под ущемлением понимают внезапное или постепенное
сдавление какого-либо органа брюшной полости (грыжевого
содержимого) в грыжевых воротах, приводящее к нарушению его
кровоснабжения и в конечном итоге к некрозу,
С точки зрения механизма возникновения этого осложнения
различают два принципиально различных типа ущемления:
эластическое и каловое.
Эластическое ущемление возникает в момент резкого повышения
внутрибрюшного давления при физической нагрузке, кашле или нату-
живании. При этом наступает перерастяжение грыжевых ворот, в
результате чего в грыжевой мешок выходит больше, чем обычно,
внутренних органов. После снижения давления в брюшной полости грыжевые
ворота за счёт эластичности тканей сокращаются и возвращаются к
первоначальным размерам. Вышедшие органы уже не могут самостоя-
Наружные брюшные грыжи ♦ 267
тельно вправиться обратно в брюшную полость, и происходит их
ущемление. Вследствие сдавления (странгуляции) в узком кольце
грыжевых ворот возникает ишемия ущемлённых органов, что
приводит к выраженному болевому синдрому. Он в свою очередь
вызывает стойкий спазм мышц передней брюшной стенки, усугубляющий
ущемление. Неликвидированное эластическое ущемление
приводит к быстрому (в течение нескольких часов) некрозу грыжевого
содержимого.
При каловом ущемлении сдавление грыжевого содержимого
возникает в результате резкого переполнения приводящего отдела
кишечной петли, находящейся в грыжевом мешке. Отводящий отдел
кишечника сдавливается в грыжевых воротах вместе с прилежащей
брыжейкой. В дальнейшем, вследствие переполнения каловыми
массами кишки, находящейся в грыжевом мешке, происходит
сдавление в грыжевых воротах всей петли кишки и её брыжейки, в
конечном итоге развивается картина странгуляции. Для развития некроза
кишки при каловом ущемлении характерен более длительный срок
(несколько суток).
Непременное условие возникновения эластического ущемления —
наличие узких грыжевых ворот, в то время как каловое ущемление
возникает, как правило, при широких грыжевых воротах. В случае
калового ущемления физическое усилие играет меньшую роль, чем
при эластической странгуляции; гораздо большее значение имеет
нарушение кишечной моторики (замедление перистальтики), что
часто встречают в пожилом и старческом возрастах. Существенную
роль играют перегибы, скручивание кишки, находящейся в грыже,
и её сращения со стенками грыжевого мешка. Каловое ущемление
обычно возникает как осложнение длительно существующей невпра-
вимой грыжи.
Ущемлению могут подвергаться различные органы, составляющие
грыжевое содержимое. Чаше всего ущемлённой оказывается тонкая
кишка или прядь большого сальника, реже — участок поперечной
ободочной или сигмовидной кишки. Крайне редко ущемляются
органы, расположенные мезоперитонеально: восходящая кишка,
мочевой пузырь, матка и её придатки и др. Наиболее опасно ущемление
кишки, поскольку оно чревато её некрозом, развитием тяжёлой стран-
гуляционной кишечной непроходимости и перитонита.
Первоначально в результате странгуляции сдавливаются вены
ущемлённого органа, приток артериальной крови бывает сохранён.
В кишке возникает венозный стаз, вызывающий вскоре отёк всех
268 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 10
слоев кишечной стенки. Происходит транссудация внеклеточной
части крови как внутрь просвета ущемлённой кишки, так и в полость
грыжевого мешка (при этом образуется так называемая грыжевая
вода). На этом этапе ущемлённая кишка ещё жизнеспособна. В
дальнейшем за счёт прогрессирования отёка стенки кишки происходит
сдавление артерий. Ущемлённая петля кишки подвергается некрозу,
начинающемуся со слизистой оболочки. Наибольшие изменения
развиваются в области странгуляционных борозд, которые возникают
в местах сдавления кишки либо другого органа ущемляющим
кольцом. Странгуляционные борозды хорошо заметны даже после
ликвидации ущемления.
Грыжевая вода сначала прозрачна и бесцветна (серозный
транссудат), однако по мере пропотевания форменных элементов она
приобретает розовую, а затем и красно-бурую окраску. Некротизирован-
ная стенка кишки перестаёт служить барьером для выхождения
микробной флоры за её пределы, вследствие этого экссудат в
конечном итоге инфицируется. Гнойное воспаление, развившееся в поздних
стадиях ущемления и распространяющееся на окружающие грыжу
ткани, получило укоренившееся, но не совсем точное название
флегмоны грыжевого мешка.
При ущемлении страдает не только часть кишки, находящаяся в
грыжевом мешке, но и её приводящий отдел, расположенный в
брюшной полости. В нём скапливается кишечное содержимое,
растягивающее кишку, что сопровождается явлениями кишечной
непроходимости (см. главу 11).
В качестве особых видов ущемления различают ретроградное
(А-образное) ущемление, пристеночное (рихтеровское) ущемление и
грыжу Литтре.
Ретроградное ущемление возникает, когда в грыжевом мешке
находится несколько (две и более) кишечных петель в относительно
благополучном состоянии, а наибольшие изменения претерпевают
соединяющие их отделы кишки, расположенные в брюшной
полости (рис. 10-3). Они находятся в худших условиях кровоснабжения,
поскольку брыжейка несколько раз перегибается, входя в грыжевой
мешок и выходя из него. Эти петли некротизируются в первую
очередь. В то же время кишечные петли, находящиеся в грыжевом
мешке, могут быть ещё жизнеспособны.
Ретроградное ущемление протекает значительно тяжелее, чем
обычное, так как основной патологический процесс развивается не в
замкнутом грыжевом мешке, а в свободной брюшной полости, и су-
Наружные брюшные грыжи ♦ 269
шествует значительно большая возможность для быстрого развития
перитонита.
Пристеночное ущемление (грыжа Рихтера) происходит в узких
грыжевых воротах (рис. 10-4), когда ущемляется только часть кишечной
стенки, обычно противоположная брыжеечному краю кишки.
Поскольку кишка сдавливается не на всю величину своего просвета, а лишь
частично, механической кишечной непроходимости не возникает.
Рис. 10-3. Схема ретроградного ущем
ления.
Рис. 10-4. Схема пристеночноп
(рихтеровского) ущемления.
Для этого вида ущемления характерны выраженные
расстройства кровообращения в ущемлённом участке кишки и быстрое
развитие некроза. Диагностировать подобное ущемление сложно из-за
отсутствия выраженных болей, поскольку не ущемляется брыжейка
кишки. Этот вид ущемления характерен для небольших грыж с
узкими грыжевыми воротами (бедренной, пупочной грыж, грыжи
белой линии живота) и никогда не встречается при грыжах большого
размера. Пристеночному ущемлению чаще подвергается тонкая
кишка, однако описаны случаи пристеночного ущемления желудка и
толстой кишки.
Грыжа Литтре — ущемление дивертикула Меккеля в паховой
грыже. Эту патологию можно приравнять к обычному пристеночному
ущемлению, но с той разницей, что в связи с худшими условиями
кровоснабжения дивертикул быстрее подвергается некрозу, чем обыч
ная стенка кишки.
270 ♦ Хирургические болезни ♦ Том 1 -0 Часть II «0- Глава 10
Клиническая картина
Для ущемления характерны четыре признака:
• резкая боль в области грыжи или по всему животу;
• невправимость грыжи;
• напряжение и болезненность грыжевого выпячивания;
• отсутствие передачи кашлевого толчка.
Боль — главный симптом ущемления. Она возникает, как
правило, в момент сильного физического напряжения и не стихает, даже
когда оно прекращается. Боль настолько сильна, что больному
трудно удержаться от стонов и крика. Поведение его беспокойно,
кожные покровы бледнеют, возможно развитие болевого шока с
тахикардией и снижением АД.
Боль остаётся очень сильной в течение нескольких часов, вплоть
до того момента, когда происходит некроз ущемлённого органа с
гибелью интрамуральных нервных элементов. Иногда боль может
принимать схваткообразный характер, что связано с развитием
кишечной непроходимости.
Невправимость грыжи — признак, имеющий значение только при
ущемлении свободной, ранее вправимой грыжи. В этом случае
больные отмечают, что грыжевое выпячивание, которое раньше свободно
вправлялось, с момента появления болей вправляться перестало.
Напряжение грыжевого выпячивания и некоторое увеличение его
размеров сопутствуют ущемлению как вправимой, так и невправи-
мой грыжи. В связи с этим данный признак имеет большее значение
для распознавания ущемления, чем сама по себе невправимость
грыжи. Обычно выпячивание становится не только напряжённым, но и
резко болезненным, что нередко отмечают сами больные при
ощупывании грыжи и попытке её вправить.
Отсутствие передачи кашлевого толчка в области грыжевого
выпячивания — наиболее важный признак ущемления. Он связан с тем,
что в момент ущемления грыжевой мешок полностью разобщается со
свободной брюшной полостью и становится как бы изолированным
образованием. В связи с этим повышение внутрибрюшного давления,
возникающее в момент кашля, не передаётся в полость грыжевого
мешка (отрицательный симптом кашлевого толчка). Этот симптом
трудно оценить при больших вентральных грыжах, в которых
содержится значительная часть органов брюшной полости. В таких
ситуациях при кашле сложно определить, передаётся кашлевой толчок или
грыжа сотрясается вместе со всем животом. Для правильной интер-
Наружные брюшные грыжи <>■ 271
претации данного симптома в подобных случаях нужно охватить
грыжевое выпячивание двумя руками. В случае положительного
симптома кашлевого толчка хирург ощущает увеличение грыжи.
Ущемление нередко сопровождается рвотой, носящей сначала
рефлекторный характер. В дальнейшем, по мере развития кишечной
непроходимости и гангрены кишки, она становится постоянной.
Рвотные массы приобретают зеленовато-бурый цвет с неприятным
запахом. Поскольку ущемление кишки (исключая грыжу Рихтера)
осложняется острой кишечной непроходимостью, оно
сопровождается всеми характерными для этого заболевания симптомами.
Частичное ущемление толстой кишки (например, слепой кишки в
скользящей паховой грыже) явлений непроходимости не вызывает, но вскоре
после ущемления наряду с болью появляются учащённые ложные
позывы к дефекации (тенезмы). Пристеночное ущемление мочевого
пузыря в скользящей грыже сопровождается дизурическими
расстройствами: учащённым болезненным мочеиспусканием, гематурией.
Длительное ущемление приводит к развитию флегмоны грыжевого
мешка. Клинически это проявляется синдромом тяжёлой системной
воспалительной реакции и характерными местными признаками:
отёком и гиперемией кожных покровов, резкой болезненностью в
области грыжевого выпячивания.
В конечном счёте, как правило, неликвидированное
хирургическим путём ущемление заканчивается развитием разлитого перитонита
либо вследствие перехода воспалительного процесса на брюшную
полость, либо за счёт перфорации резко растянутого и истончённого
приводящего отдела ущемлённой кишки.
Описанная симптоматика присуща, главным образом,
эластическому ущемлению. Каловое ущемление имеет те же закономерности
развития, но протекает менее бурно. В частности, при каловом
ущемлении не столь выражен болевой синдром, медленнее развиваются
явления интоксикации, позже наступает некроз ущемлённой
кишки. Тем не менее, каловое ущемление так же опасно, как и
эластическое, поскольку их конечный исход одинаков, поэтому лечебная
тактика при них едина.
Диагностика
Диагностика ущемлённой грыжи в типичных случаях несложна.
Однако необходимо учитывать, что начальная картина ущемления
имеет сходные черты с некоторыми другими острыми заболеваниями
272 ♦ Хирургические болезни О- Том 1 О Часть II -О- Глава 10
органов брюшной полости. В связи с этим при любых болях в животе
необходимо осмотреть все «слабые» места брюшной стенки,
способные стать грыжевыми воротами. Настоятельная необходимость
такого осмотра возникает, потому что иногда встречают так
называемые первично-ущемлённые грыжи. Этим термином обозначают грыжи,
ущемление которых происходит непосредственно в момент их
первоначального появления, без предшествующего грыжевого
анамнеза. Особенно часто первичному ущемлению подвергаются грыжи
редких локализаций: спигелиевой линии, поясничной области,
запирательного канала и др.
При осмотре ущемлённое грыжевое выпячивание обычно хорошо
заметно, оно не исчезает и не меняет очертаний при изменении
положения тела больного. Это образование резко напряжено и
болезненно, особенно в области грыжевых ворот. Передаточный кашле-
вой толчок отсутствует. Перкуссия грыжи в ранней стадии ущемления
кишки может выявить тимпанит, однако позже, вследствие
появления грыжевой воды, тимпанит сменяется тупым перкуторным звуком.
При аускультации над ущемлённой грыжей перистальтика не
выслушивается, а над брюшной полостью нередко можно выявить
усиленную перистальтику приводящего отдела ущемлённой кишки. При
осмотре живота иногда удаётся отметить «шум плеска», симптом Валя
и другие симптомы кишечной непроходимости. О её наличии в
случае ущемления грыжи также свидетельствуют уровни жидкости,
выявляемые на обзорной рентгенограмме органов брюшной полости.
Дифференциальная диагностика
Дифференциальную диагностику при ущемлении грыжи
приходится проводить с рядом патологических состояний как самого
грыжевого выпячивания, так и не имеющих непосредственного
отношения нему. Прежде всего, необходимо дифференцировать ущемлённую
грыжу от невправимой. Последняя, как правило, не напряжена, не
очень болезненна, хорошо передаёт кашлевой толчок. Кроме того,
полностью невправимые грыжи встречают редко, обычно часть
грыжевого содержимого всё же удаётся вправить. Особые трудности в
дифференциальном диагнозе могут возникнуть в случае
многокамерной грыжи, когда ущемление происходит в одной из камер. Тем не
менее, и в этом случае отмечают обязательные признаки ущемления:
боль, напряжение и отсутствие передачи кашлевого толчка.
В практической хирургии иногда возникает необходимость
дифференцировать ущемление грыжи от копростаза. Последнее состоя-
Наружные брюшные грыжи <?- 273
ние встречают главным образом при невправимых грыжах улиц
преклонного возраста с физиологическим замедлением перистальтики
и склонностью к запорам. Это приводит к застою содержимого в
петле кишки, находящейся в грыжевом мешке, но в отличие от калового
ущемления при копростазе никогда не бывает сдавления брыжейки
кишки. Клинически копростаз нарастает постепенно, без
предшествовавшего физического напряжения, с медленным развитием
болевого синдрома. Боли никогда не бывают интенсивными, на первое
место выступает задержка стула и газов, напряжение грыжевого
выпячивания не выражено, симптом кашлевого толчка положителен.
Ущемлённые паховую и бедренную грыжи необходимо
дифференцировать от пахового лимфаденита и острого орхоэпидидимита. В этих
случаях нет анамнестических указаний на предшествующую грыжу,
отсутствуют резко выраженный болевой синдром и рвота, появлению
болей обычно предшествует повышение температуры тела.
Постановке правильного диагноза помогает внимательный физикальный
осмотр, при котором удаётся определить неизменённое наружное
отверстие пахового канала, наличие ссадин, царапин и гнойников на
ногах, явления простатита, проктита или флебита геморроидальных
узлов, ставших причиной лимфаденита. В случаях орхоэпидидимита
всегда удаётся определить наличие увеличенного болезненного
яичка или его придатка.
Отличить тромбофлебит приустьевого отдела варикозно
изменённой большой подкожной вены от ущемлённой бедренной грыжи
помогает внимательный осмотр нижних конечностей, поскольку
тромбофлебит обычно носит восходящий характер.
В клинической практике встречают ситуации, обозначаемые
термином ложное ущемление. Это понятие включает симптомокомп-
лекс, напоминающий картину ущемления, но вызванный каким-либо
другим острым заболеванием органов брюшной полости. Грыжа —
распространённое заболевание, и её наличие не исключает
возможности развития иной острой патологии брюшной полости. При
возникновении перитонита воспалительный экссудат перемещается в
грыжевой мешок, больной в первую очередь начинает предъявлять
жалобы на боли в области грыжевого выпячивания. Сходная
симптоматика становится причиной ошибочного диагноза ущемления
грыжи, в то время как истинный характер заболевания остаётся
скрытым. Неверный диагноз приводит к неправильной хирургической
тактике, в частности к грыжесечению вместо необходимой широкой
лапаротомии.
274 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 10
Лечение
При ущемлении грыжи, даже в случаях её самопроизвольного
вправления, пациент подлежит экстренной госпитализации в
хирургический стационар. Ущемлённая грыжа — показание к
экстренному оперативному лечению вне зависимости от вида грыжи и срока
ущемления. Единственное противопоказание к операции — агональ-
ное состояние больного. Попытки вправления грыжи на
догоспитальном этапе или в стационаре недопустимы из-за опасности
перемещения в брюшную полость органа, подвергшегося необратимым
изменениям.
Введение перед операцией спазмолитических и обезболивающих
средств запрещается в связи с тем, что они могут спровоцировать
спонтанное вправление грыжи. Исключение может быть сделано
при операциях по поводу больших вентральных грыж, когда гернио-
лапаротомия позволяет выполнить полноценную ревизию органов
брюшной полости. Во всех остальных случаях анальгетики вводят
только после вскрытия грыжевого мешка и фиксации грыжевого
содержимого.
Особенности проведения хирургического вмешательства.
Экстренная операция при ущемлённой грыже имеет принципиальные
отличия от планового грыжесечения. Первоочередные задачи хирурга:
• возможно более быстрые обнажение и фиксация ущемлённого
органа во избежание ускользания его в брюшную полость при
последующих манипуляциях в области грыжевых ворот;
I* ликвидация ущемления;
• оценка жизнеспособности ущемлённого органа.
Разрез проводят непосредственно над грыжевым выпячиванием в
соответствии с локализацией грыжи. Рассекают кожу, подкожную
жировую клетчатку и, не выделяя полностью грыжевой мешок,
осторожно вскрывают его дно. Обычно при этом изливается грыжевая вода
желтоватого или тёмно-бурого цвета. Сразу же по вскрытии
грыжевого мешка ассистент берёт ущемлённый орган (наиболее часто
петлю тонкой кишки) и удерживает его в ране. После этого можно
продолжить операцию и рассечь ущемляющее кольцо, т.е. грыжевые
ворота. Делают это в наиболее безопасном по отношению к
окружающим органам и тканям направлении. При бедренных грыжах
ликвидация ущемления возможна лишь в медиальную сторону за счёт
рассечения лакунарной связки. При невозможности устранить
ущемление таким путём пересекают паховую связку.
Наружные брюшные грыжи О- 275
Освободив ущемлённую кишку, оценивают её жизнеспособность.
Если в грыжевом мешке находятся две петли кишки и более, то,
помня о возможности ретроградного ущемления, необходимо извлечь
и осмотреть соединяющую их петлю, расположенную в брюшной
полости. Жизнеспособная кишка имеет розовую окраску, отчётливо
перистальтирует, сосуды брыжейки, ранее вовлечённой в
странгуляцию, пульсируют. Если все указанные признаки налицо, кишку
можно признать жизнеспособной и погрузить в брюшную полость.
В сомнительных случаях в брыжейку кишки вводят 100—150 мл 0,25%
раствора прокаина и согревают ущемлённый участок в течение 10—
15 мин салфетками, смоченными тёплым изотоническим раствором
хлорида натрия. Если и после этого отсутствует хотя бы один из
перечисленных выше признаков и остаются сомнения в
жизнеспособности кишки, необходимо выполнить её резекцию в пределах
здоровых тканей.
Кроме явно нежизнеспособной ущемлённой петли (в пределах
странгуляционных борозд), подлежат удалению 30—40 см
приводящего отдела кишки и 15—20 см отводящего. Чем длительнее
ущемление, тем более обширной должна быть резекция. Это обусловлено тем,
что при ущемлении кишки приводящий отдел, находящийся выше
препятствия, в силу развития непроходимости страдает в гораздо
большей степени, чем отводящий. В связи с этим наложение
кишечного анастомоза около странгуляционной борозды связано с
опасностью его несостоятельности и развития перитонита.
Погрузив в брюшную полость жизнеспособный или
резецированный орган, подвергшийся ущемлению, полностью выделяют из
окружающей клетчатки грыжевой мешок, перевязывают его у шейки и
иссекают.
В дальнейшем в зависимости от разновидности грыжи
приступают к пластике грыжевых ворот. С этого момента операция
принципиально не отличается от планового грыжесечения, за исключением
того, что при ущемлённой грыже необходимо использовать наиболее
простые, малотравматичные способы герниопластики, существенно не
осложняющие и не утяжеляющие оперативное вмешательство.
Ненатяжные методы герниопластики с использованием различных аллот-
рансплантатов в условиях экстренной хирургической практики
применяют редко, обычно при грыжах с большими грыжевыми воротами.
Первичную пластику брюшной стенки нельзя проводить при
флегмоне грыжевого мешка и перитоните (из-за тяжести состояния
больных и опасности гнойных осложнений), больших вентральных грыжах,
276 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 10
существовавших у больных многие годы (возможно развитие
тяжёлой дыхательной недостаточности). В этих случаях грыжевой мешок
иссекают частично, пластику грыжевых ворот не выполняют,
накладывают швы на брюшину и кожу.
В случае флегмоны грыжевого мешка операцию проводят в два
этапа. Сначала под общей анестезией выполняют срединную лапарото-
мию. При этом осложнении ущемлённый орган настолько прочно
спаивается с грыжевыми воротами, что опасность ускользания его
в брюшную полость практически исключена. В то же время
наличие гнойного воспаления в области грыжи создаёт реальную
опасность инфицирования брюшной полости, если операцию начать
обычным способом со вскрытия грыжевого мешка. Произведя лапа-
ротомию, подходят к ущемлённому органу изнутри. Если
ущемлена кишка, её мобилизуют в указанных выше пределах. Отсекают и
концы ущемлённой части кишки, подлежащей удалению, оставляя
небольшие культи, ушиваемые наглухо. Между приводящим и
отводящим отделами жизнеспособной тонкой кишки накладывают
анастомоз. Вопрос о способе завершения резекции толстой кишки
решают индивидуально. Как правило, выполняют обструктивную
резекцию с наложением колостомы.
После формирования межкишечного анастомоза накладывают
кисетный шов на брюшину вокруг ущемлённого кольца
(предварительно кишечные культи погружают под брюшину), тем самым
отграничивая гнойник от брюшной полости. Затем ушивают лапаро-
томную рану и переходят ко второму этапу вмешательства
непосредственно в области грыжевого выпячивания. Рассекают кожу,
подкожную жировую клетчатку, вскрывают дно грыжевого мешка, а затем
надсекают грыжевые ворота ровно настолько, чтобы можно было
извлечь и удалить ущемлённый орган, включая слепые концы кишки,
оставленные вне брюшины. Вслед за тем удаляют некротизирован-
ную часть кишечника, дренируют и тампонируют полость гнойника.
Пластику грыжевых ворот в этих случаях не производят.
При флегмоне грыжевого мешка, возникшей в результате
ущемлённой пупочной грыжи, выполняют операцию Грекова. Суть этого
способа состоит в следующем: окаймляющий грыжевое выпячивание
разрез кожи продолжают через все слои брюшной стенки, включая
брюшину, и таким образом высекают грыжу единым блоком вместе с
ущемляющим кольцом в пределах здоровых тканей. Войдя в
брюшную полость, пересекают приводящий и отводящий отделы кишки,
отступив на необходимое расстояние от грыжевых ворот, и удаляют
Наружные брюшные грыжи ♦ 277
грыжу целиком, не освобождая содержимое грыжевого мешка.
Между приводящим и отводящим отделами кишки накладывают
анастомоз. Рану ушивают без формирования дупликатуры апоневроза.
Следует остановиться на хирургической тактике в случае
спонтанного вправления ущемлённой грыжи. Даже если оно произошло до
госпитализации (на дому, в машине «скорой помощи» по пути в
больницу или приёмном покое), больного всё равно необходимо
госпитализировать в хирургическое отделение, поскольку неизвестно
состояние ущемлённого органа.
При признаках перитонита или кишечной непроходимости
больного экстренно оперируют. Операция заключается в срединной ла-
паротомии и резекции изменённого органа в пределах
жизнеспособных тканей. Во всех остальных случаях спонтанного вправления
необходимо динамическое наблюдение за состоянием больного. В тех
ситуациях, когда состояние брюшной полости в ближайшие сутки
после ущемления не вызывает тревоги, нет болей и признаков
интоксикации, больного можно оставить в стационаре и после
необходимого обследования выполнить плановое грыжесечение.
Если в процессе наблюдения у больного повышается температура
тела, сохраняется болезненность в животе, появляются симптомы
раздражения брюшины, проводят экстренную срединную лапарото-
мию и резецируют орган, подвергшийся ущемлению и некрозу.
Невправимость
Невправимость характеризуется постоянным наличием грыжевого
содержимого в грыжевом мешке, при этом в отличие от ущемления их
связь с брюшной полостью сохраняется. Это самое распространённое
осложнение грыж. Под влиянием различных механических
раздражителей, микротравм в грыжевом мешке возникает асептическое
воспаление, приводящее к образованию спаек. Спайки фиксируют органы
брюшной полости к стенкам грыжевого мешка, что приводит сначала
к возникновению частично невправимой, а затем и полностью невпра-
вимой грыжи. При частично невправимой грыже часть внутренностей,
ещё сохранивших подвижность, можно вправить в брюшную полость.
При полной невправимости содержимое грыжевого мешка находится
в нём постоянно и ни самостоятельно, ни при надавливании не
перемещается в брюшную полость. Невправимость наиболее часто
отмечают при длительно существующих грыжах. В конечном итоге любая
своевременно не прооперированная грыжа становится невправимой.
278 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II О Глава 10
Грыжевое выпячивание в случае невправимой грыжи в положении
лёжа не исчезает и мало изменяет свою форму. При осторожной
попытке вправления грыжа не исчезает. Подобное грыжевое
выпячивание безболезненно и сохраняет мягко-эластическую консистенцию.
Характерная особенность невправимых грыж — положительный
симптом кашлевого толчка, что позволяет дифференцировать невправи-
мые грыжи от ущемлённых.
Лечение
При отсутствии противопоказаний в плановом порядке выполняют
грыжесечение. Операции при невправимых грыжах технически более
сложны из-за спаечного процесса в грыжевом мешке и Рубцовых
изменений тканей, обусловленных длительным существованием грыжи.
Копростаз в грыже
Это осложнение может развиться в тех случаях, когда содержимое
грыжевого мешка составляет толстая кишка. Копростаз возникает в
результате расстройства моторной функции кишечника, ослабления
перистальтики, понижения тонуса кишечной стенки, а также
деформации кишечной трубки в грыжевом мешке. Способствуют копроста-
зу невправимость грыжи, малоподвижный образ жизни, обильная еда,
отсутствие в пище растительной клетчатки. Его чаще выявляют у
тучных больных старческого возраста с пахово-мошоночными грыжами.
Копростаз в грыже проявляет себя ноющими болями в области
грыжевого выпячивания, запорами, тошнотой, редко рвотой. Общее
состояние больного страдает мало. Грыжевое выпячивание по мере
заполнения толстой кишки каловыми массами медленно
увеличивается в размерах, оно не очень болезненно, не напряжено,
тестообразной консистенции. Просвет кишки перекрыт не полностью,
сохраняется сообщение грыжевого мешка с брюшной полостью,
поэтому симптом кашлевого толчка положительный. Следует
учитывать, что длительно сохраняющийся копростаз может перейти в
каловую форму ущемление грыжи.
Лечение
При копростазе для освобождения толстой кишки от
содержимого применяют сифонные клизмы. Использование слабительных
средств может представлять определённую опасность, так как пере-
Наружные брюшные грыжи ♦ 279
полнение приводящей петли содержимым способно вызвать сдавле-
ние и странгуляцию отводящей петли кишки. Для предотвращения
копростаза (при невозможности выполнить грыжесечение)
рекомендуют подбор диеты, способствующей нормализации перистальтики
кишечника.
Воспаление грыжи
Воспаление грыжи возникает вследствие инфицирования
грыжевого мешка (воспаление изнутри) или оболочек грыжи (воспаление
снаружи). При инфицировании со стороны брюшной полости общее
состояние больных быстро ухудшается, прогрессируют признаки
перитонита, нарастает интоксикация. Грыжа увеличивается в размерах
в результате отёка и инфильтрации тканей, в последующем
появляется гиперемия кожи. Оболочки грыжи могут воспалиться в
результате первичного повреждения кожных покров (фурункулы,
ссадины, расчёсы). В таких случаях общее состояние больных страдает
незначительно.
Лечение
С помощью экстренной операции устраняют источник
перитонита и инфицирование грыжевого мешка. Пластику грыжевых ворот в
таких случаях не проводят. При наружном инфицировании
грыжесечение можно выполнить только после ликвидации воспалительных
процессов в коже.
Прогноз
Прогноз при наружных грыжах живота зависит от
своевременности выполнения операции. Плановое грыжесечение практически не
сопровождается летальностью, связанной с хирургическим
вмешательством. При развитии осложнений, в первую очередь ущемления
грыжи, опасность для жизни больного возрастает по мере увеличения
периода времени, прошедшего с момента ущемления до операции.
Летальность после операций, выполненных в первые 6 ч от момента
ущемления, составляет 1,0—1,5%. В случаях резекции ущемлённой
кишки летальность возрастает до 10—15%, а при флегмоне
грыжевого мешка превышает 25%.
280 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 10
Отдельные виды грыж
Пупочные грыжи
Пупочные грыжи наиболее часто выявляют в первые месяцы
жизни ребёнка. Второй пик заболеваемости приходится на возраст
около 40 лет. У женщин пупочную грыжу встречают значительно чаще,
чем у мужчин, что связано с растяжением пупочного кольца во время
беременности.
Пупочные грыжи у детей
Пупочные грыжи у детей возникают вследствие нарушения
формирования передней брюшной стенки. Верхний отдел пупочного
кольца, через который проходит пупочная вена, — наиболее слабое
место. При недоразвитии брюшной фасции она покрывает пупочное
кольцо только частично. Все факторы, способствующие повышению
внутрибрюшного давления, в таком случае могут привести к
образованию грыжи. Пупочные грыжи у детей обычно небольшого
размера, вправимые. Их диагностика не представляет трудностей.
Лечение
При пупочной грыже у детей по мере развития брюшного пресса
возможно самоизлечение. Закрытие грыжевых ворот рубцовой
тканью происходит обычно в первые месяцы жизни ребёнка. Поэтому,
если не происходит быстрого увеличения грыжи или её ущемления, в
течение первых 3 лет жизни применяют консервативное лечение. Для
предотвращения возможного ущемления внутренних органов на
пупочное кольцо после вправления грыжи накладывают упругую
пластинку (пелот), фиксируемую гипоаллергенным пластырем.
Назначают массаж и лечебную гимнастику, способствующие развитию и
укреплению передней брюшной стенки. Большое значение имеет
предупреждение запоров, простудных заболеваний, нарушений
мочеиспускания (фимоз), тщательный уход за областью пупка.
Ущемление пупочной грыжи у детей встречают редко, однако
родителей ребёнка следует информировать о признаках ущемления
грыжи и необходимости в таком случае экстренной госпитализации.
Если к 3 годам под влиянием консервативных мероприятий
пупочное кольцо не закрылось, самостоятельного излечения уже не
произойдёт. В этом случае показано оперативное лечение. Пластику
Наружные брюшные грыжи ♦ 281
грыжевых ворот у детей выполняют по способу Лексера. После
выделения, перевязки и удаления грыжевого мешка под контролем
введённого в грыжевые ворота пальца накладывают кисетный шов
вокруг отверстия прочной нерассасывающейся синтетической нитью.
При затягивании кисетного шва пупочное кольцо закрывается.
Пупочные грыжи у взрослых
Пупочные грыжи у взрослых обычно бывают приобретёнными и
могут иметь значительные размеры. Характерно существенное
преобладание размеров грыжевого выпячивания над диаметром
грыжевых ворот, в результате чего создаются предпосылки для ущемления
внутренних органов. Диагностика вправимой пупочной грыжи не
сложна, однако следует помнить, что за невправимую грыжу
небольших размеров можно принять метастаз рака желудка в пупок. Кроме
того, наличие пупочной грыжи (распространённого заболевания) не
исключает сочетанной патологии расположенных рядом органов
брюшной полости, которая и может быть причиной болевого
синдрома (например, язвенной болезни или рака желудка). Поэтому всем
больным с пупочной грыжей перед операцией необходимо проводить
гастродуоденоскопию и УЗИ органов брюшной полости, а в части
случаев и колоноскопию.
Лечение
В отличие от ребёнка избавить взрослого от пупочной грыжи
можно лишь оперативным путём. Грыжесечение выполняют по методу
Сапежко или по Мейо. Общий принцип обоих методов — закрытие
грыжевых ворот, проводимое после иссечения грыжевого мешка и
ушивания париетальной брюшины, дупликатурой апоневроза. По
Сапежко кожный разрез, рассечение грыжевых ворот и
формирование дупликатуры апоневроза выполняют в продольном направлении
(рис. 10-5), а по Мейо (обычно при небольших грыжевых воротах) —
в поперечном (рис. 10-6).
Серьёзная проблема — сохранение пупка, поскольку его удаление
относят к вмешательствам, изменяющим внешний облик человека,
что может стать причиной серьёзных психо-эмоциональных проблем,
особенно у детей и молодых женщин. Сохранить пупок можно,
выполняя разрез, окаймляющий пупок с одной стороны. Если же пупок
сильно растянут, деформирован, кожа дряблая и атрофичная, то
после иссечения собственного пупка необходимо сформировать новый
282 ♦ Хирургические болезни ♦• Том 1 ♦ Часть II ♦ Глава 10
Рис. 10-5. Пластика грыжевых ворот по Сапежко: а — грыжевые ворота
и апоневроз рассечены в продольном направлении, наложен первый ряд
П-образных швов; б — узловые швы формируют дубликатуру апоневроза.
а \ ф б
Рис. 10-6. Пластика грыжевых ворот по Мэйо; а — грыжевые ворота
рассечены в поперечном направлении, наложен первый ряд П-образных швов;
б — узловыми швами создается дубликатура апоневроза.
путём подшивания отдельными швами дермы к апоневрозу. В любом
случае о возможности удаления пупка больные (в первую очередь
женщины) должны быть предупреждены заранее.
Наружные брюшные грыжи ♦ 283
Грыжи белой линии живота
Белая линия живота проходит от мечевидного отростка до
лонного сочленения. С точки зрения хирургической практики значение
имеет её участок между мечевидным отростком и пупком, где
ширина этого анатомического образования достигает 2 см. Грыжи белой
линии живота чаще бывают эпигастральными и параумбиликальны-
ми. Гипогастральные грыжи встречают крайне редко.
Белая линия живота представляет собой соединительнотканную
пластинку, образованную косо направленными сухожильными
волокнами, перекрещивающимися по средней линии. При этом образуется
своеобразная сетка, в которой существуют различных размеров щеле-
видные промежутки, заполненные жировой клетчаткой.
Первопричиной грыж становится расширение белой линии живота. У мужчин оно
часто носит конституционный характер, бывает следствием
абдоминальной формы ожирения («пивной живот»), а у женщин —
результатом повторных беременностей. Предбрюшинная клетчатка проникает
в щель между сухожильными волокнами, и формируется так
называемая «предбрюшинная липома», способная ущемляться. В
последующем отверстие в белой линии живота под воздействием повышенного
внутрибрюшного давления постепенно увеличивается, образуется
дефект, в который пролабирует париетальный листок брюшины.
Содержимым грыжевого мешка чаще всего становится сальник.
Эпигастральные грыжи редко превышают в диаметре 4—5 см, у
тучных больных не всегда видны и могут быть множественными. Для
обнаружения грыжи пальпацию удобно проводить в горизонтальном
положении больного, лежащего, приподнявшись на локтях. Грыже
белой линии живота могут сопутствовать различные заболевания
ЖКТ, поэтому необходимо проведение дифференциальной
диагностики, включающей использование необходимых методов
инструментального исследования.
Лечение
Бессимптомно протекающие «предбрюшинные липомы» можно не
оперировать. Рекомендуют похудание, ношение бандажа. При
сформировавшейся грыже после проведения обследования органов
брюшной полости, расположенных рядом, показано хирургическое
лечение. На небольшой дефект в апоневрозе достаточно наложить в
продольном направлении узловые швы. Грыжи средних и больших
размеров чаще оперируют по Сапежко.
284 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 10
Послеоперационные грыжи
Послеоперационные грыжи выходят из брюшной полости в
области послеоперационного рубца и располагаются чаще на передней
брюшной стенке, реже — в поясничной области. Чаще всего они
возникают после экстренных лапаротомий по поводу воспалительных
заболеваний органов брюшной полости и ранений.
Основные причины возникновения послеоперационной грыжи —
перитонит, эвентрация и нагноение операционной раны. Эти
факторы становятся промежуточным звеном, а в качестве этиологических
моментов выступают все причины, их вызывающие: снижение
резистентности организма больного к инфекции, применение
нерациональных, травматичных операционных доступов, выведение через
рану тампонов и дренажей, небрежный гемостаз. Имеют значение
медленная регенерация тканей, гипопротеинемия, анемия,
гиповитаминоз, сахарный диабет, ожирение, раковое истощение.
Негативный вклад вносят парез кишечника, бронхопневмония,
бронхиальная астма, рвота любой этиологии, психоз, недостаточно надёжное
ушивание апоневроза, атрофия мышц брюшной стенки после
пересечения нервных стволов, беременность.
Послеоперационные грыжи часто бывают обширных и
гигантских размеров и иногда причиняют больным, среди которых много
молодых пациентов, не меньшие физические и душевные страдания,
чем те заболевания, по поводу которых их оперировали. Беспокоят
боли в животе, запоры, невозможность заниматься физическим
трудом, эстетический дискомфорт.
Диагностика этого вида грыж не представляет существенных
трудностей. Грыжевые ворота располагаются в области
послеоперационного рубца, они образованы разошедшимися, рубцово изменёнными
краями мышц и апоневроза. Наружные покровы послеоперационной
грыжи представлены рубцовой тканью, интимно сращённой с
грыжевым мешком и кожей. Они бывают настолько истончены, что
может быть видна перистальтика кишечника. Рубцы брюшной стенки
подвержены мацерации и изъязвлению.
Лечение
Выбор метода лечения должен основываться на взвешенном
анализе функциональных резервов организма, особенно при гигантских
грыжах у больных пожилого возраста. Многолетнее существование
грыжи вызывает глубокие анатомические и функциональные изме-
Наружные брюшные грыжи О- 285
нения органов брюшной и грудной полостей. Обязательно
исследование функциональных резервов внешнего дыхания, поскольку
после грыжесечения, вправления органов в брюшную полость и
пластики грыжевых ворот возможно резкое повышение внутрибрюшного
давления с развитием дыхательной недостаточности. При наличии
серьёзных противопоказаний к хирургическому лечению назначают
ношение поддерживающего пояса-бандажа.
Хирургическое вмешательство — единственный радикальный
метод лечения подобных грыж. Предоперационная подготовка при впра-
вимых грыжах, помимо общепринятых мероприятий, включает
обязательное ношение бандажа, чтобы выпавшие в грыжевой мешок
органы были вправлены в брюшную полость. Операция часто
сопряжена со значительными трудностями из-за сращения конгломерата
деформированных петель кишечника и сальника с грыжевым
мешком, а также наличия значительного дефекта брюшной стенки.
При небольших грыжах закрытие дефекта брюшной стенки возможно
за счёт дупликатуры апоневроза по Сапежко. При значительных
размерах грыжевых ворот используют нерассасывающиеся сетчатые
синтетические пластические материалы. Аллопластические способы
операций при послеоперационных грыжах в каждом конкретном случае
предусматривают максимально возможное использование собственных
тканей больного. Укрепление грыжевых ворот осуществляют
подшиванием трансплантата поверх аутопластики или изнутри, между
брюшиной и мышечно-апоневротическими слоями. Когда свести швами
края грыжевых ворот невозможно или опасно, трансплантат
подшивают к краям грыжевого дефекта по всей окружности в виде заплаты.
Эндовидеохирургические операции при срединной локализации
грыжевых ворот используют редко из-за выраженного спаечного процесса.
Паховые грыжи
Паховые грыжи составляют 75—80% общего количества грыж. Их
диагностируют преимущественно у мужчин (90%). Это связано с тем,
что паховый канал у женщин уже и длиннее, чем у мужчин, имеет
щелевидную форму, лучше укреплён мышечными и сухожильными
слоями. В хирургии детского возраста паховые грыжи встречают ещё
чаще, они составляют 95% всех вентральных грыж. Основные
разновидности представлены косыми и прямыми паховыми грыжами.
Встречают также косые грыжи с прямым каналом, предбрюшинные,
внутристеночные, околопаховые, надпузырные и др.
286 ♦ Хирургические болезни 0> Том 1 ♦ Часть II ♦ Глава 10
Сведения об эмбриологии и анатомии пахового канала
представлены на прилагаемом к учебнику лазерном диске. Для лучшего
понимания учебного материала здесь приведём лишь рисунок,
показывающий нижний отдел передней брюшной стенки изнутри (рис. 10-7)
Рис. 10-7. Вид нижней части передней брюшной стенки со стороны
брюшной полости: 1 — срединная лузырно-пупочная складка брюшины, в
которой проходит облитерированный урахус; 2 — медиальная пузырно-пу-
почная складка, в которой проходит облитерированная пупочная артерия;
3 — латеральная пупочная складка — нижние надчревные сосуды.
При осмотре передней брюшной стенки со стороны брюшной
полости можно увидеть пять складок брюшины.
• По средней линии расположена срединная складка, в ней проходит
облитерированный урахус.
• Латеральнее видны парные медиальные складки, в них находятся
облитерированные пупочные артерии.
• Ещё латеральнее проходят латеральные складки, где расположены
нижние надчревные артерии и вены.
Наружные брюшные грыжи <> 287
Между этими складками локализованы, соответственно, надпу-
зырные, медиальные и латеральные паховые ямки. Надпузырная ямка
находится позади прочной прямой мышцы живота и при её
сохранности не может быть местом выхода грыжи. Средняя паховая ямка
может стать местом выхода прямой паховой грыжи. Глубокое
(внутреннее) отверстие пахового канала соответствует латеральной
паховой ямке (оно проецируется на переднюю брюшную стенку
примерно над серединой паховой связки на 1,0—1,5 см выше неё). Эта
ямка — место выхода косой паховой грыжи, которая затем проходит
через паховый канал и в области его наружного отверстия
попадает под кожу.
Косые паховые грыжи
Косые паховые грыжи в зависимости от происхождения
грыжевого мешка бывают врождёнными и приобретёнными.
В основе развития врождённых паховых грыж лежит незаращение
влагалищного отростка брюшины, играющего роль
предуготовленного природой грыжевого мешка. Обычно они проявляются в
раннем детстве, но могут впервые обнаружить себя и в более позднем
возрасте. У взрослых врождённые паховые грыжи встречают в 10%
случаев.
Приобретённые паховые грыжи бывают косыми либо прямыми.
Основная причина образования паховых грыж — слабость задней
стенки пахового канала.
Косая паховая грыжа выходит через наружную паховую ямку, в
составе элементов семенного канатика, покрытых наружной семенной
фасцией, проходит паховый канал, выходит через наружное
отверстие пахового канала и может опускаться в мошонку, растягивая её.
Такую грыжу называют пахово-мошоночной.
Косая паховая грыжа чаще бывает односторонней. В начальной
стадии развития косой паховой грыжи (канальная грыжа) выпячивание
малозаметно. По мере увеличения грыжевого мешка и выхода его из
наружного отверстия пахового канала при натуживании или
покашливании определяется опухолевидное образование овальной формы.
Косое направление такая грыжа имеет только на начальных
стадиях заболевания. В последующем, по мере увеличения грыжи,
внутреннее отверстие пахового канала расширяется в медиальном направлении,
отодвигая надчревные сосуды и ещё сильнее разрушая заднюю стенку
пахового канала. Внутренняя косая и поперечная мышцы смещаются
288 <> Хирургические болезни <0> Том 1 ♦ Часть II ^ Глава 10
вверх, кремастер гипертрофируется. При длительно существующих
пахово-мошоночных грыжах паховый канал приобретает фактически
прямое направление (косая грыжа с выпрямленным ходом), его
наружное отверстие располагается почти на одном уровне с внутренним.
Мошонка при таких грыжах значительно увеличивается в размерах,
скрывая половой член. Грыжа перестаёт вправляться в брюшную
полость, и становится реальной угроза развития кишечной
непроходимости. В быту пожилые люди называют такую грыжу «кила».
Осматривая больного с паховой грыжей, необходимо выполнить
пальцевое исследование пахового канала (см. рис. 10-2). Его
проводят в горизонтальном положении больного после вправления
содержимого грыжевого мешка. Инвагинируя кожу мошонки,
указательным пальцем можно попасть в поверхностное отверстие пахового
канала, расположенное медиальнее и несколько выше лонного
бугорка. В норме поверхностное отверстие пахового канала у мужчин
пропускает кончик пальца. При сформировавшейся грыже можно
I завести кончик пальца за горизонтальную ветвь лонной кости.
Семенной канатик определяется кнутри от грыжи.
При покашливании больного находящийся в паховом канале
палец врача ощущает кашлевой толчок, направление которого в началь-
■ ной стадии формирования грыжи ощущается с латеральной
стороны, где находится внутреннее отверстие пахового канала. Обязательно
исследуют оба паховых канала и органы мошонки.
Грыжевой мешок во время операции по поводу приобретённой
косой паховой грыжи легко выделяется, так как связан рыхлой
соединительной тканью с элементами семенного канатика. После вскрытия
грыжевого мешка хирург имеет возможность ввести палец в
брюшную полость и ощупать заднюю поверхность передней брюшной
стенки. Пульсация нижней надчревной артерии при косой грыже
определяется кнутри от шейки грыжевого мешка. Если грыжа оказывается
врождённой, то на дне грыжевого мешка обнаруживают яичко.
Прямые паховые грыжи
Прямая паховая грыжа выходит из брюшной полости через
медиальную паховую ямку, растягивая поперечную фасцию. Прямая
грыжа никогда не бывает врождённой, чаще её встречают у пожилых
больных. Поскольку задняя стенка паховых каналов у этих
пациентов всегда ослаблена, грыжи часто бывают двусторонними и обычно
небольших размеров. Грыжевое выпячивание округлой или овальной
Наружные брюшные грыжи О 289
ормы, определяется у медиальной части паховой связки.
Поперечная фасция, даже изменённая, препятствует опусканию прямой
грыжи в мошонку, что случается исключительно редко.
Прямые грыжи нередко бывают скользящими и содержат стенку
мочевого пузыря. Кроме болей в области грыжи, чувства неудобства
при движении и опухолевидного образования, таких больных могут
беспокоить дизурические явления.
Прямая грыжа всегда лежит медиальнее семенного канатика,
который имеет нормальный размер, не связан с грыжей и только
прилежит к ней. Пульсация нижней надчревной артерии определяется
кнаружи от грыжевых ворот.
Дифференциальная диагностика
Ошибочный диагноз паховой грыжи может быть поставлен при
паховом крипторхизме (как одностороннем, так и двустороннем),
когда происходит задержка опускания яичка в мошонку. Таких
пациентов беспокоят боли и припухлость в паховой области. Правильный
диагноз несложно поставить после пальпации мошонки. Однако
необходимо помнить, что у 25% больных с крипторхизмом бывает
сопутствующая паховая грыжа.
Невправимая пахово-мошоночная грыжа имеет сходство с гидро-
целе (водянкой оболочек яичка), когда между листками собственной
оболочки яичка скапливается жидкость, в результате мошонка
значительно увеличивается в размерах. Отличие гидроцеле от грыжи
заключается в том, что при пальпации мошонки у больного с водянкой
нельзя отграничить пальпируемое образование от яичка и его
придатка. При диафаноскопии (просвечивании с помощью фонарика)
содержащаяся в мошонке прозрачная жидкость имеет красноватый
цвет, а в случае грыжи кишечные петли и сальник не пропускают
световые лучи. Диагноз несложно подтвердить при УЗИ мошонки.
С паховой грыжей имеет сходство расширение вен семенного
канатика (варикоцеле)-, при котором в вертикальном положении у
больного появляются распирающие боли и увеличивается мошонка.
В положении лёжа эти явления исчезают. При пальпации мошонки
определяются варикозно расширенные вены семенного канатика (как
правило, слева), легко спадающиеся при надавливании или
поднятии мошонки кверху.
Следует отметить, что врачи терапевтических специальностей
склонны практически любое опухолевидное образование в паховой
290 ♦ Хирургические болезни ♦ Том 1 О- Часть II ♦ Глава 10
области расценивать как грыжевое выпячивание, в то время как это
далеко не так. Тем не менее, даже исключив диагноз грыжи,
необходимо точно установить, что же за заболевание её симулировало, и
провести соответствующее лечение. Это может оказаться онкологической
патологией, в том числе и с поражением лимфатических узлов.
Паховый крипторхизм без лечения часто осложняется развитием семи-
номы, бурно растущей злокачественной опухоли яичка, поскольку
яичко, расположенное в паховом канале, значительно чаще
травмируется и подвергается перегреву, чем расположенное нормально, Ва-
рикоцеле может быть признаком сдавления яичковой вены опухолью
нижнего полюса почки.
Хирургическое лечение
К настоящему времени предложено более 600 операций и их
модификаций при паховых грыжах, но все они отличаются друг от
друга лишь завершающим этапом — пластикой пахового канала.
Остальные этапы операции выполняют однотипно.
1 этап — доступ к паховому каналу. Кожный разрез проводят
параллельно и на 2 см выше проекции паховой связки. Длина
стандартного разреза — от 5 до 8 см, в зависимости от выраженности
подкожной клетчатки. Рассекают апоневроз наружной косой мышцы по
ходу волокон. Верхний лоскут отделяют от внутренней косой и
поперечной мышц, нижний — от семенного канатика. Обнажают жёлоб
паховой связки до лонного бугорка.
2 этап — выделение из окружающих тканей и удаление грыжевого
мешка. При косой грыже его обнаруживают среди элементов
семенного канатика, выделяют до шейки, вскрывают и вправляют
грыжевое содержимое в брюшную полость. Прошивание грыжевого мешка
у шейки выполняют кисетным швом под контролем зрения.
Грыжевой мешок перевязывают и отсекают. При прямой грыже семенной
канатик берут на держалку, отводят в сторону и при ревизии задней
стенки пахового канала обнаруживают грыжевой мешок и дефект в
поперечной фасции. При небольших вправимых прямых паховых
грыжах грыжевой мешок можно не иссекать, а инвагинировать и
ушить над ним дефект в поперечной фасции.
Зэтап — ушивание глубокого пахового кольца до нормальных
размеров, укрепление задней стенки пахового канала.
4 этап — пластика пахового канала. В настоящее время на
основании анализа огромного клинического материала признано, что при
Наружные брюшные грыжи ♦ 291
всех видах паховых грыж (прямых, косых, с выпрямленным каналом,
скользящих, рецидивных и пр.) целесообразно проводить
укрепление задней стенки пахового канала. Современные пластики задней
стенки дают рецидивы не более чем в 1,5% случаев даже при
сложных формах заболевания.
Методы пластики задней стенки пахового канала
Пластика по Бассини. После высокого удаления грыжевого
мешка семенной канатик приподнимают на держалке, под ним
подшивают внутреннюю косую и поперечную мышцы вместе с поперечной
фасцией к паховой связке. Для разгрузки швов предварительно
рассекают глубокий листок влагалища прямой мышцы живота. В
медиальном углу подшивают край апоневроза влагалища прямой
мышцы живота к надкостнице лобковой кости в области лонного
бугорка. Швы между мышцами, поперечной фасцией и паховой
связкой полностью ликвидируют паховый промежуток (рис. 10-8). На
вновь образованную мышечную стенку укладывают семенной канатик.
292 ♦ Хирургические болезни ♦ Том 1 ♦ Часть И ♦ Глава 10
Для формирования внутреннего пахового кольца, которое должно
пропускать кончик мизинца, накладывают шов латеральнее
семенного канатика. Апоневроз наружной косой мышцы сшивают над
семенным канатиком край в край, реконструируя переднюю стенку
пахового канала и наружное паховое кольцо.
Существуют различные модификации классической операции
Бассини. Недостатком этой операции считают необходимость
сопоставления швами разнородных тканей. При высоком (более 4 см)
паховом промежутке сшивание мышц с паховой связкой происходит
с большим натяжением, поэтому надёжного срастания не происходит.
Пластика по Постемпскому. После выделения семенного
канатика и грыжесечения рассекают место прикрепления внутренней
косой и поперечной мышц к паховой связке в латеральную сторону от
глубокого отверстия пахового канала для того, чтобы переместить
семенной канатик в верхнелатеральный угол этого разреза. После
этого под семенным канатиком накладывают узловые швы между
верхним лоскутом апоневроза наружной косой мышцы живота,
внутренней косой, поперечной мышцей, поперечной фасцией и паховой
связкой. В первые два медиальных шва захватывают край апоневроза
прямой мышцы живота. Поверх подшивают нижний лоскут
апоневроза наружной косой мышцы и укладывают семенной канатик. При
этой пластике паховый канал ликвидируется, а семенной канатик
располагается в подкожной клетчатке.
Пластика по Кукуджанову предложена для сложных форм
паховых грыж. После вскрытия пахового канала и выделения задней
стенки продольно рассекают поперечную фасцию. Поперечную фасцию
отделяют от предбрюшинной клетчатки. Выделяют связку Купера
(плотная фиброзная структура, покрывающая сверху и сзади
верхнюю ветвь лобковой кости). После рассечения грыжевого мешка его
высоко перевязывают и отсекают. Иссекают ослабленную, разволок-
нённую часть поперечной фасции, после чего её ушивают. В
медиальном отделе пахового промежутка подшивают край глубокого
листка влагалища прямой мышцы живота и соединённое сухожилие
мышц к куперовой связке от лонного бугорка до фасциального
футляра, содержащего подвздошные сосуды. В латеральном отделе
пахового промежутка подшивают апоневроз поперечной мышцы вместе
с краем поперечной фасции к подвздошно-лобковому тяжу.
Последний шов накладывают у медиального края глубокого отверстия
пахового канала в виде кисета, захватывая сверху и снизу укреплённые
отделы поперечной фасции, снаружи — оболочки семенного канати-
Наружные брюшные грыжи ♦ 293
ка. Этим швом формируют внутреннее отверстие пахового канала. Для
снятия натяжения проводят послабляющий разрез влагалища прямой
мышцы живота. Поверх семенного канатика сшивают дупликатурой
апоневроз наружной косой мышцы живота.
Пластика по Шолдайсу позволяет оптимально сформировать
глубокое отверстие и укрепить заднюю стенку пахового канала, поэтому
она наиболее обоснована с анатомической точки зрения. Доступ в
паховый канал и обработку грыжевого мешка проводят стандартно.
Обязательный элемент операции — циркулярное иссечение
гипертрофированного кремастера от глубокого кольца до корня мошонки,
что позволяет точно определить диаметр глубокого кольца и
значительно уменьшить объём пахового канала. Поперечную фасцию
рассекают от глубокого до наружного отверстия с последующим
двойным непрерывным швом, позволяющим сформировать глубокое
кольцо нужных размеров. Дополнительного укрепления задней
стенки достигают наложением двойного непрерывного шва,
захватывающего с одной стороны соединённое сухожилие, а с другой — под-
вздошно-лонный тяж и глубокий отдел паховой связки. Семенной
канатик укладывают на вновь сформированную стенку, листки
рассечённого апоневроза наружной косой мышцы сшивают край в край,
формируют наружное отверстие.
Ненатяжная пластика по Лихтенштейну. Этот вид пластики
предполагает использование синтетического сетчатого протеза или
пластины из пористого политетрафторэтилена. После выделения и
обработки грыжевого мешка синтетический протез моделируют по форме
задней стенки пахового канала. В области латерального края
трансплантата формируют внутреннее отверстие пахового канала для
семенного канатика. Имплантат укладывают под семенным канатиком
и фиксируют швами к надкостнице лонной кости, паховой связке и
поперечной мышце (рис. 10-9). Разрез в латеральном участке сетки
ушивают П-образным швом позади семенного канатика так, чтобы
он пропускал только канатик и не мог в последующем расшириться.
В части случаев используют двухслойные трансплантаты из
нетканых материалов. Апоневроз наружной косой мышцы сшивают над
семенным канатиком край в край.
Методы пластики передней стенки пахового канала
Укрепление передней стенки пахового канала (как
технически наиболее простой метод) с обязательным ушиванием глубокого
пахового кольца до нормальных размеров в порядке исключения
можно применять у молодых пациентов при небольших косых
паховых грыжах.
Пластика по Мартынову. После типичного рассечения
апоневроза наружной косой мышцы живота, перевязки и удаления грыжевого
мешка накладывают не более четырёх швов между краем верхнего
лоскута апоневроза наружной косой мышцы живота и паховой
связкой. Для пластики используют монофиламентные нерассасываю-
щиеся нити. Нижний лоскут апоневроза наружной косой мышцы
накладывают поверх верхнего и фиксируют без натяжения несколькими
швами, чтобы не сузить поверхностное отверстие пахового канала.
Мышцы в шов не захватывают, что отличает этот способ от других
видов пластики пахового канала.
Пластика по Жирару—Спасокукоцкому. Над семенным канатиком
к паховой связке одновременно подшивают внутреннюю косую и
поперечные мышцы с верхним лоскутом апоневроза наружной
косой мышцы живота. Нижний лоскут фиксируют на верхнем,
создавая дупликатуру. Использование шва Кимбаровского позволяет
обеспечить соединение однородных тканей. С его помощью краем
верхнего лоскута апоневроза наружной косой мышцы укрывают края
внутренней косой и поперечной мышц. Иглу проводят через
верхний лоскут апоневроза на расстоянии 1 см от края, затем через
мышцы. После этого той же нитью снова прошивают верхний лоскут
апоневроза у самого края, затем поверх семенного канатика накладывают
Наружные брюшные грыжи ♦ 295
шов с паховой связкой. При этом края внутренней косой и
поперечной мышц оказываются как бы в желобке верхнего лоскута
апоневроза, и с паховой связкой сопоставляются однородные ткани.
Метод пластики избирают с учётом возраста больного,
топографии пахового канала, вида грыжи, размеров грыжевых ворот,
состояния тканей. В связи с этим невозможно стандартное использование
какого-либо одного способа операции.
Операция при врождённой паховой грыже у взрослых. Врождённая
паховая грыжа — всегда косая грыжа. В таких случаях на дне
грыжевого мешка лежит яичко, покрытое серозной оболочкой. Наиболее
трудный этап операции при врождённой грыже — выделение
грыжевого мешка, так как семенной канатик на всём протяжении интимно
сращён с его стенкой. В этом случае основная цель операции — не
удаление грыжевого мешка, а ликвидация его сообщения с брюшной
полостью.
После выделения грыжевого мешка его свободную стенку,
расположенную напротив семявыносящего протока и сосудов, продольно
вскрывают. На шейку грыжевого мешка изнутри накладывают
кисетный шов с таким расчётом, чтобы семенной канатик не захватить в
шов, а как бы «перешагнуть» швом, захватив брюшину с обеих
сторон от него. Отступив на 1,5 см дистальнее наложенного кисетного
шва, стенку мешка рассекают до семенного канатика, после чего
завязывают кисетный шов. Таким путём сообщение с брюшной
полостью ликвидируют. Грыжевой мешок до семенного канатика частично
иссекают, а оставленные полоски брюшины выворачивают и позади
канатика и яичка сшивают рассасывающейся нитью (операция Вин-
кельмана). Яичко погружают на дно мошонки. Пластику пахового
канала выполняют одним из описанных методов.
Особенности пахового грыжесечения у женщин. Апоневроз
наружной косой мышцы живота у женщин гораздо крепче. Паховый
промежуток выражен незначительно, чаще всего внутренняя косая и
поперечная мышцы живота тесно прилегают к паховой связке. Эти
особенности, а также отсутствие семенного канатика позволяют в
большинстве случаев добиться надёжного укрепления пахового
канала пластикой его передней стенки по способу Мартынова или
Жирара—Спасокукоцкого—Кимбаровского. В отличие от операции при
паховой грыже у мужчин, наружное отверстие пахового канала у
женщин закрывают наглухо, обеспечивая тем самым полное закрытие
пахового промежутка и устойчивость паховой области к
возникновению рецидива грыжи.
296 О- Хирургические болезни <> Том 1 ♦ Часть II О- Глава 10
Бедренные грыжи
Бедренные грыжи выходят через бедренный канал и
располагаются ниже проекции паховой связки. Они составляют 5% всех
наружных грыж живота. Бедренные грыжи значительно чаще встречают у
женщин, что обусловлено особенностями строения таза. Бедренные
грыжи чаще, чем паховые, представляют трудности для диагностики
и чаще ущемляются. У детей бедренные грыжи встречают
исключительно редко.
В процессе своего формирования бедренная грыжа проходит
три стадии:
• начальная — грыжевое выпячивание не выходит за пределы
внутреннего бедренного кольца;
• канальная — грыжевое выпячивание располагается около
сосудистого пучка, не выходит за пределы поверхностной фасции и
не проникает в подкожную жировую клетчатку скарповского
треугольника;
• полная — когда грыжа проходит весь бедренный канал, его
внутреннее и наружное отверстия и выходит в подкожную клетчатку
бедра; эту стадию грыжи обнаруживают чаще всего.
В начальной и канальной стадиях бедренная грыжа клинически
трудноразличима. Заподозрить такую грыжу можно на основании
жалоб на боли в паху, нижнем отделе живота, верхнем отделе бедра,
усиливающиеся при ходьбе и физической нагрузке. В узком,
ригидном внутреннем отверстии бедренного канала может возникать
ущемление (в том числе пристеночное), в части случаев оно бывает
первым клиническим проявлением грыжи. Для полной бедренной грыжи
характерно появление полусферического грыжевого выпячивания
небольшого размера, расположенного под паховой связкой, медиаль-
нее проекции бедренных сосудов.
Проведение дифференциального диагноза между паховой и
бедренной грыжами не вызывает затруднений при вправимой паховой
грыже, когда легко пальпируется наружное отверстие пахового
канала. У тучных больных, особенно женщин, это сделать гораздо
сложнее. Необходимо определить проекцию паховой связки, проведя
линию от передней верхней ости к лонному бугорку. Паховая грыжа
располагается выше паховой связки, бедренная — ниже. По
отношению к лонному бугорку паховая грыжа расположена выше и кнутри,
а бедренная — ниже и кнаружи. Бедренные грыжи в отличие от
паховых не достигают больших размеров, нередко бывают скользящими.
Наружные брюшные грыжи О- 297
Дифференциальная диагностика
За бедренную грыжу легко принять приустьевой узел большой
подкожной вены при варикозной болезни. В результате
несостоятельности клапана, расположенного у устья вены, узел обнаруживают в
положении больного стоя и при натуживании, а в горизонтальном
положении узел спадается. Определяемый при кашле ретроградный
ток крови из бедренной вены (кашлевой симптом Гаккенбруха)
можно расценить как движение грыжевого содержимого. Поставить
правильный диагноз позволяет полноценный осмотр раздетого
больного стоя, когда осматривают не только брюшную стенку, но и нижние
конечности.
Другое сосудистое заболевание, имитирующее бедренную гры
жу, — аневризма бедренной артерии. Обычно это ложная аневризма,
формирующаяся в силу различных причин после диагностических
или лечебных эндовазальных манипуляций, связанных с пункцией
бедренной артерии. Наряду с пульсацией опухолевидного
образования отличить аневризму позволяет систолический шум,
выслушиваемый при аускультации.
В редких случаях за бедренную грыжу можно принять натёчный
абсцесс, возникающий при туберкулёзном поражении
позвоночника, распространяющийся по ходу поясничной мышцы и
обусловливающий подкожное выбухание под паховой связкой. Главные
отличительные признаки: флюктуация и наличие данных, в том числе
рентгенологических, свидетельствующих о туберкулёзном поражении
позвоночника.
Хирургическое лечение
Операции при бедренной грыже (количество предложенных
способов и модификаций приближается к 200) в зависимости от дост]
па к грыжевым воротам можно разделить на две группы: бедренные
и паховые.
Операция Бассини. Используют доступ к бедренному каналу со
стороны его наружного отверстия. Кожный разрез проводят
параллельно и ниже проекции паховой связки. Этап поиска грыжевого мешка
у тучных больных может представлять существенные трудности. Его
легче обнаружить, если предложить больному потужиться или
покашлять. Тщательно освобождают грыжевой мешок от жировой
клетчатки и окружающих фасциальных оболочек. Грыжевой мешок
выделяют как можно выше, вскрывают, прошивают и отсекают. При
298 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 10
выделении грыжевого мешка следует помнить, что с медиальной
стороны может находиться мочевой пузырь, а латерально — бедренная
вена. Закрывают грыжевые ворота путём сшивания паховой и
лонной (куперовой) связок (рис. 10-10). Всего накладывают три-четыре
Рис. 10-10. Операция Бассини при бедренной грыже: а — проекция кожного
разреза; б — выделение грыжевого мешка в области овальной ямки (hiatus
saphenus)\ в —■ пластика грыжевых ворот путём подшивания паховой связки
к надкостнице лобковой кости (связка Купера); г — схема наложения швов в
сагиттальной проекции.
шва, контролируя, не сдавлена ли бедренная вена. Вторым рядом
швов между серповидным краем широкой фасции бедра и
гребенчатой фасцией ушивают бедренный канал.
В настоящее время отдают предпочтение паховым способам
лечения бедренных грыж, основными преимуществами которых
признаны высокая перевязка грыжевого мешка, удобное и надёжное
ушивание внутреннего отверстия бедренного канала. Этот доступ особенно
показан при ущемлении бедренной грыжи, когда может
потребоваться широкий доступ для проведения резекции кишечника.
Операция Руджи—Парлавеччио. Разрез кожи проводят
параллельно и выше паховой связки (как при паховой грыже). Вскрывают
апоневроз наружной косой мышцы (т.е. попадают в паховый канал).
Обнажают паховый промежуток. Рассекают поперечную фасцию в
продольном направлении. Отодвигая предбрюшинную клетчатку,
выделяют шейку грыжевого мешка. Грыжевой мешок выводят из
бедренного канала, вскрывают, прошивают у шейки и удаляют.
Грыжевые ворота закрывают путём сшивания внутренней косой, поперечной
мышц, верхнего края поперечной фасции с лонной и паховой
связками. При необходимости внутреннее отверстие пахового канала
ушивают до нормального размера, накладывая дополнительные швы
на поперечную фасцию. Семенной канатик (или круглую связку
матки) укладывают на мышцы. Рассечённый апоневроз наружной косой
мышцы живота сшивают с формированием дупликатуры.
ОСТРАЯ КИШЕЧНАЯ
НЕПРОХОДИМОСТЬ
Острая кишечная непроходимость характеризуется нарушением
пассажа кишечного содержимого по направлению от желудка к
заднему проходу. Она не представляет собой какую-то отдельную
нозологическую форму и бывает осложнением самых различных
заболеваний: наружных брюшных грыж, опухолей кишечника, ЖКБ и т.д.
Но, возникнув, это патологическое состояние протекает по единому
сценарию, вызывая интоксикацию и водно-электролитные
расстройства, сопровождается типичными клиническими проявлениями. В
связи с этим диагностическая и лечебная тактика во многом едина
при несхожей природе непроходимости. По летальным исходам в
абсолютных цифрах эта патология делит 1—2-е места среди всех острых
заболеваний органов брюшной полости.
Острая кишечная непроходимость может возникать во всех
возрастных группах. Наиболее часто встречают спаечную
непроходимость кишечника.
Классификация
Для острой кишечной непроходимости наиболее приемлема мор
фо-функциональная классификация.
• Динамическая (функциональная) непроходимость.
— Спастическая.
— Паралитическая.
• Механическая непроходимость.
— По механизму развития.
♦ Странгуляцыонная (ущемление, заворот, узлообразование).
♦ Обтурационная (обтурация опухолью, инородным телом, кало
вым или жёлчным камнем, фитобезоаром, клубком аскарид).
♦ Смешанная (инвагинационная, спаечная).
— По уровню препятствия.
♦ Высокая (тонкокишечная).
♦ Низкая (толстокишечная).
Острая кишечная непроходимость ♦ 301
Согласно этой классификации, принято выделять динамическую
(функциональную) и механическую кишечную непроходимость. При
динамической непроходимости нарушается двигательная функция
кишечной стенки без механического препятствия продвижению
кишечного содержимого. Различают два вида динамической
непроходимости: спастическую и паралитическую.
Механическая непроходимость характеризуется наличием
окклюзии кишечной трубки на каком-либо уровне, что и приводит к
нарушению кишечного транзита. При этом виде непроходимости
принципиально выделение странгуляции и обтурации кишки.
• При странгуляционной непроходимости первично страдает
кровообращение вовлечённого в патологический процесс участка кишки.
Это связано со сдавлением сосудов брыжейки за счёт ущемления,
заворота (рис. 11-1) или узлообразования (рис. 11-2), что вызывает
довольно быстрое (в течение нескольких часов) развитие гангрены
участка кишки.
• При обтурационной кишечной непроходимости кровообращение
расположенного выше препятствия (приводящего) участка кишки
нарушается вторично в связи с её чрезмерным растяжением кишечным
содержимым. Поэтому и при обтурации возможен некроз кишки,
но он развивается в течение нескольких суток. Обтурация может
быть вызвана злокачественными и доброкачественными опухолями,
каловыми и жёлчными камнями, инородными телами, аскаридами.
Рис. 11-1. Заворот тонкой кишки
(схема).
302 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 11
• К смешанным формам механической непроходимости относят
инвагинацию (рис. 11-3), при которой в инвагинат вовлекается
брыжейка кишечника, и спаечную непроходимость, которая может
протекать как по странгуляционному типу (сдавление штрангом кишки
вместе с брыжейкой) (рис. 11-4 а), так и по типу обтураиии
(перегиб кишки в виде «двустволки») (рис. 11-4 б).
Диагностическая и лечебная тактика во многом зависит от
локализации препятствия в кишечнике. В связи с этим по уровню
обструкции выделяют высокую (тонкокишечную) и низкую (толстокишечную)
непроходимость.
Этиология
В основе развития механической (особенно странгуляционной)
кишечной непроходимости лежат анатомические предпосылки
врождённого или приобретённого характера. Таким предрасполагающим
фактором может быть врождённое наличие долихосигмы,
подвижной слепой кишки, дополнительных карманов или складок брюшины.
Чаще предрасполагающие факторы носят приобретённый характер:
спаечный процесс в брюшной полости, удлинение сигмовидной
кишки в старческом возрасте, наружные и внутренние брюшные грыжи.
Спаечный процесс в брюшной полости развивается после
перенесённых ранее воспалительных заболеваний, травм и операций. Для
возникновения острой кишечной непроходимости наибольшее
значение имеют изолированные межкишечные, кишечно-париетальные,
а также париетально-сальниковые сращения, образующие в брюш-
Рис. 11-2. Узлообразование (схема)
Рис. 11-3. Илиоцекальная
инвагинация (схема).
Острая кишечная непроходимость ♦ 30:
Рис. 11-4. Спаечная кишечная непроходимость: а — с ущемлением петл]
кишки фиброзным штрангом (с первичным острым нарушением кровооб
ращения); б — с перегибом тонкой кишки и образованием «двустволки» (без
первичного нарушения кровообращения).
ной полости грубые тяжи и «окна», что может стать причиной
странгуляции (внутреннего ущемления) подвижных сегментов кишечника.
Не менее опасными в клиническом плане могут быть плоские
межкишечные, кишечно-париетальные и кишечно-сальниковые сращения
с образованием кишечных конгломератов, приводящих к обтура-
ционной непроходимости при функциональной перегрузке кишечника.
Ещё одна группа приобретённых факторов, способствующих
развитию кишечной непроходимости, — опухоли различных отделов
кишечника (в подавляющем большинстве случаев рак толстой кишки),
приводящие к обтурационной непроходимости. Обтурация может
возникнуть также вследствие сдавления кишечной трубки опухолью
извне, исходящей из соседних органов, а также сужения просвета
кишечника в результате перифокальной опухолевой или
воспалительной инфильтрации. Экзофитные опухоли (либо полипы) тонкой
кишки, а также дивертикул Меккеля могут обусловить инвагинацию.
При наличии указанных предпосылок непроходимость возникает
под влиянием производящих факторов. Для грыж таковым может
служить повышение внутрибрюшного давления. Для других видов
непроходимости в качестве провоцирующего фактора нередко выступают
нарушения моторики кишечника, связанные с изменением пищевого
304 ♦ Хирургические болезни 0> Том 1 <0 Часть I ♦ Глава 11
режима: употребление большого количества овощей и фруктов в
летне-осенний период, обильный приём пищи после длительного
голодания (может вызвать заворот тонкой кишки), переход с грудного
вскармливания на искусственное у детей первого года жизни (частая
причина илиоцекальной инвагинации).
Причины динамической кишечной непроходимости весьма
разнообразны. Чаще всего отмечают паралитическую непроходимость,
развивающуюся в результате травмы (в том числе операционной),
метаболических расстройств (гипокалиемии), перитонита. Все
острые хирургические заболевания органов брюшной полости,
потенциально способные привести к перитониту, протекают с явлениями
пареза кишечника. Снижение перистальтической активности ЖКТ
происходит при ограничении физической активности (постельный
режим) и в результате длительно не купирующейся жёлчной либо
почечной колики. Спастическую кишечную непроходимость
вызывают поражения головного или спинного мозга (метастазы
злокачественных опухолей, спинная сухотка и пр.), отравление солями
тяжёлых металлов (например, свинцовая колика), истерия.
Патогенез
Острая кишечная непроходимость вызывает в организме больных
выраженные нарушения, определяющие тяжесть течения этого
патологического состояния. В общем можно констатировать присущие
ему расстройства водно-электролитного баланса и
кислотно-основного состояния, потерю белка, эндотоксикоз, кишечную
недостаточность и болевой синдром.
Гуморальные нарушения связаны с потерей большого количества
воды, электролитов и белков. Жидкость теряется с рвотными
массами (безвозвратные потери). Также она депонируется в приводящем
отделе кишечника, скапливается в отёчной кишечной стенке и
брыжейке, содержится в брюшной полости в виде экссудата
(блокированный резерв). Если непроходимость будет устранена, по мере
нормализации процессов фильтрации и реабсорбции этот резерв воды
может вновь принять участие в обмене, В условиях
неликвидированной непроходимости потери жидкости в течение суток могут
достигать 4 л и более. Это ведёт к гиповолемии и дегидратации тканей,
гемоконцентрации, нарушениям микроциркуляции и тканевой
гипоксии. Указанные патофизиологические моменты напрямую отра-
Острая кишечная непроходимость О- 305
жаются на клинической картине — возникают сухость кожных
покровов, олигурия, артериальная гипотензия, высокий гематокрит и
относительный эритроцитоз.
Гиповолемия и дегидратация увеличивают синтез
антидиуретического гормона и альдостерона. Результатом этого становятся
снижение количества отделяемой мочи, реабсорбция натрия и
значительное выделение калия. На место трёх ионов калия в клетку входят два
иона натрия и один ион водорода. Калий выводится с мочой и
теряется с рвотными массами. Это обусловливает возникновение
внутриклеточного ацидоза, гипокалиемиы и метаболического внеклеточного
алкалоза. Низкое содержание калия в крови чревато снижением
мышечного тонуса, уменьшением сократительной способности
миокарда и угнетением перистальтической активности кишечника. В
дальнейшем в связи с деструкцией кишечной стеки, развитием перитонита
и олигурии возникают гиперкалиемия (что также далеко не
безразлично для организма, следует помнить о возможности калиевой
остановки сердечной деятельности) и метаболический ацидоз.
Наряду с жидкостью и электролитами теряется значительное
количество белков (до 300 г в сутки) за счёт голодания, рвоты, пропо-
тевания в просвет кишки и брюшную полость. Особенно значимы
потери альбумина плазмы. Гипопротеинемия усугубляется
превалированием процессов катаболизма.
Отсюда ясно, что для лечения больных с кишечной
непроходимостью необходимо не только переливание жидкости (до 5 л в первые
сутки терапии), но и введение электролитов, белковых препаратов,
нормализация кислотно-основного состояния.
Эндотоксикоз — важное звено патофизиологических процессов
при кишечной непроходимости. Жидкость в приводящем отделе
кишечника состоит из пищеварительных соков, пищевого химуса и
транссудата (он содержит белки плазмы, электролиты и форменные
элементы крови), поступающего в просвет кишечника вследствие
повышенной проницаемости сосудистой стенки. В условиях
нарушенного кишечного пассажа, снижения активности полостного и
пристеночного пищеварения и активизации микробного
ферментативного расщепления кишечное содержимое довольно быстро
разлагается и подвергается гниению. Этому способствует размножение
микрофлоры в застойном кишечном содержимом.
С приобретением доминирующей роли симбионтного
пищеварения в кишечном химусе увеличивается количество продуктов
неполного гидролиза белков — различных полипептидов, являющихся
306 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 11
представителями группы токсических молекул средней величины. В
нормальных условиях эти и подобные им соединения не
всасываются через кишечную стенку. В условиях же циркулярной гипоксии
стенка кишки утрачивает функцию биологического барьера, поэтому
значительная часть токсических продуктов поступает в общий кровоток,
что способствует нарастанию интоксикации.
Вместе с тем, главным моментом в генезе эндогенной
интоксикации следует признать микробный фактор. Застой содержимого
способствует бурному росту и размножению микроорганизмов и
колонизации тонкой кишки толстокишечной микрофлорой. Выделение
экзо- и эндотоксинов, нарушение барьерной функции кишечной
стенки приводят к транслокации бактерий в портальный кровоток,
лимфу и перитонеальный экссудат. Эти процессы лежат в основе
системной воспалительной реакции и абдоминального хирургического
сепсиса, характерных для острой кишечной непроходимости. Развитие
некроза кишки и гнойного перитонита становится вторым
источником эндотоксикоза. Апофеозом данного процесса служат
усугубление нарушений тканевого метаболизма и возникновение
полиорганной дисфункции и недостаточности, свойственных тяжёлому сепсису.
Специфичны для непроходимости нарушения моторной и секре-
торно-резорбтивной функций кишечника. Их вместе с некоторыми
другими патологическими проявлениями (нарушением барьерной
функции, подавлением местного иммунитета и др.) в настоящее вре
мя принято обозначать термином «кишечная недостаточность».
• В ранней стадии непроходимости перистальтика усиливается, при
этом кишечная петля своими сокращениями как бы стремится
преодолеть появившееся препятствие. На этом этапе
перистальтические движения в приводящей петле укорачиваются по
протяжённости, но становятся чаще. Возбуждение парасимпатической
нервной системы при сохранении препятствия может привести к
возникновению антиперистальтики.
• Затем в результате гипертонуса симпатической нервной системы
развивается фаза значительного угнетения моторной функции. Пе-
ристальтические волны становятся более редкими и слабыми, а в
поздних стадиях непроходимости развивается полный паралич
кишечника. В основе этого лежит нарастающая циркуляторная
гипоксия кишечной стенки, вследствие которой постепенно
утрачивается возможность передачи импульсов по интрамуральному аппарату.
Затем уже и сами мышечные клетки оказываются неспособными
воспринимать импульсы к сокращению в результате глубоких мета-
Острая кишечная непроходимость О- 307
болических расстройств и внутриклеточных электролитных
нарушений. Расстройства метаболизма кишечных клеток усугубляются
нарастающей эндогенной интоксикацией, последняя в свою очередь
увеличивает тканевую гипоксию.
Выраженный болевой синдром чаще развивается при странгу
ляционной кишечной непроходимости за счёт сдавления нервных
стволов брыжейки. Сильные схваткообразные боли сопровождают и
обтурационную непроходимость. Это поддерживает расстройства
центральной гемодинамики и микроциркуляции, что определяет
тяжёлое течение данного патологического состояния.
Патоморфология
Патологические изменения как в кишечнике, так и в брюшной
полости при острой кишечной непроходимости зависят от её вида.
При странгуляционной непроходимости первично
нарушается кровообращение участка кишки, поэтому ишемические и нек-
робиотические её изменения наступают значительно раньше и более
выражены.
Обтурационная непроходимость вызывает вторичные
расстройства кровотока в кишечной стенке за счёт чрезмерного растяжения
приводящего отдела содержимым. При остро развившейся обтурации
существенно повышается давление в кишечнике проксимальнее
уровня препятствия. Он раздувается от переполняющих его газов и
жидкого содержимого. Стенка кишки утолщается за счёт развития отёка,
а также венозного застоя и стаза, приобретает цианотичный оттенок.
В дальнейшем она подвергается перерастяжению и значительно
истончается. Повышение внутрикишечного давления до 10 мм рт. ст.
через 24 ч вызывает кровоизлияния и изъязвления в стенке кишки,
что отражает её ишемическое повреждение. Если давление
возрастает до 20 мм рт. ст., возникают необратимые некротические
изменения кишечной стенки.
Деструктивные изменения распространяются как вдоль слизистой
оболочки, так и вглубь стенки кишки вплоть до серозного покрова, в
связи с чем в её толще появляется воспалительная лейкоцитарная
инфильтрация. Под влиянием биологически активных аминов
присоединяется ишемический паралич прекапиллярных сфинктеров,
прогрессирует стаз в сосудах микроциркуляторного русла, увеличивается
агрегация форменных элементов крови. Высвобождающиеся тканевые
308 ♦ Хирургические болезни О- Том 1 О- Часть I ♦ Глава 11
кинины и гистамин нарушают проницаемость сосудистой стенки, что
способствует интерстициальному отёку кишки и её брыжейки и про-
потеванию жидкости сначала в просвет кишки, а затем и в брюшную
полость. При сохранении нарушений кровообращения происходит
расширение и углубление участков некробиоза, сливающихся в
обширные зоны некроза слизистой оболочки и подслизистых слоев.
Некротические изменения серозного покрова кишечной стенки
появляются в самую последнюю очередь и, как правило, бывают меньшими по
протяжённости, что нередко затрудняет точное интраоперационное
определение участков нежизнеспособности кишки. Это
обстоятельство обязательно необходимо учитывать во время оперативного
вмешательства при решении вопроса о границах резекции кишечника.
При прогрессировании некроза может произойти перфорация
кишечной стенки. Принципиально значимо, что при различных
формах странгуляцйонной непроходимости кишечника (ретроградное
ущемление, заворот, узлообразование) нарушения кровообращения
кишки нередко происходят в двух и более местах. При этом участок
кишечника, изолированный от приводящего и отводящего отделов,
как правило, претерпевает особенно глубокие и резко выраженные
патоморфологические изменения.
Клиническая картина
Ведущие симптомы острой кишечной непроходимости — боли в
животе, его вздутие, рвота, задержка стула и газов. Они имеют
различную степень выраженности, зависящую от вида непроходимости,
её уровня и длительности заболевания.
Боли обычно возникают внезапно, вне зависимости от приёма
пищи, в любое время суток, без каких-либо предвестников.
Характерен их схваткообразный характер, связанный с периодами
гиперперистальтики кишечника, без чёткой локализации в каком-либо
отделе брюшной полости.
• При обтурационной кишечной непроходимости вне схваткообраз-
Horo приступа они обычно полностью исчезают.
• Странгуляцйонной непроходимости свойственны постоянные
резкие боли, периодически усиливающиеся. При прогрессировании
заболевания острые боли, как правило, стихают на 2—3-й сутки,
когда перистальтическая активность кишечника прекращается, что слу-
——
та
Острая кишечная непроходимость ♦ 309
• Паралитическая кишечная непроходимость протекает с
постоянными тупыми распирающими болями в животе.
Рвота сначала носит рефлекторный характер, при
продолжающейся непроходимости рвотные массы представлены застойным
желудочным содержимым. В позднем периоде она становится
неукротимой, рвотные массы приобретают каловый вид и запах за счёт бурного
размножения кишечной палочки в верхних отделах
пищеварительного тракта. Каловая рвота — несомненный признак механической
кишечной непроходимости, но для уверенной диагностики этого
патологического состояния не стоит дожидаться данного
симптома, так как он часто указывает «на неизбежность летального исхода»
(Г. Мондор). Чем выше уровень непроходимости, тем сильнее
выражена рвота. В промежутках между ней больной испытывает
тошноту, его беспокоят отрыжка и икота. При низкой локализации
препятствия в кишечнике рвота возникает позже и протекает с
большими промежутками.
Задержка стула и газов — патогномоничный признак
непроходимости кишечника. Это ранний симптом низкой непроходимости. При
высоком её характере в начале заболевания, особенно под
влиянием лечебных мероприятий, может быть стул, иногда многократный
за счёт опорожнения отдела кишечника, расположенного ниже
препятствия. При инвагинации из заднего прохода иногда появляются
кровянистые выделения. Это может стать причиной
диагностической ошибки, когда острую кишечную непроходимость принимают
за дизентерию.
Анамнез имеет большое значение в успешной диагностике острой
кишечной непроходимости. Перенесённые операции на органах
брюшной полости, открытые и закрытые травмы живота,
воспалительные заболевания нередко бывают предпосылкой возникновения
спаечной кишечной непроходимости. Указание на периодические
боли в животе, его вздутие, урчание, расстройства стула (особенно
чередование запоров с диареей) может помочь в постановке
диагноза опухолевой обтурационной непроходимости.
Важно отметить тот факт, что клиническая картина высокой
кишечной непроходимости очень яркая, с ранним появлением
симптомов обезвоживания, выраженными расстройствами
кислотно-основного состояния и водно-электролитного обмена.
Общее состояние больного может быть средней тяжести или
тяжёлым, что зависит от формы, уровня и времени, прошедшего с
момента возникновения острой кишечной непроходимости. Температура
310 3> Хирургические болезни О Том 1 <& Часть I ♦ Глава 11
тела в начальном периоде заболевания не повышается. При странгу-
ляционной непроходимости, когда возникает коллапс, температура
тела может снижаться до 35 °С. В дальнейшем при развитии
системной воспалительной реакции и перитонита появляется гипертермия.
Пульс в начале заболевания не изменяется, нарастание явлений эн-
дотоксикоза и обезвоживания проявляется тахикардией. Обращает на
себя внимание явное расхождение между относительно низкой
температурой тела и частым пульсом (симптом «токсических ножниц»).
Язык становится сухим, покрывается грязным налётом.
Осмотр живота больного с подозрением на кишечную
непроходимость обязательно следует начинать с обследования всех возможных
мест выхожденыя грыж, чтобы исключить их ущемление как
причину возникновения этого опасного синдрома. Особое внимание
необходимо к бедренным грыжам у пожилых женщин. Ущемление
участка кишки без брыжейки в узких грыжевых воротах не сопровождается
выраженными локальными болевыми ощущениями, поэтому
больные далеко не всегда сами активно жалуются на появление
небольшого выпячивания ниже паховой связки, предшествующее
возникновению симптомов непроходимости.
Послеоперационные рубцы могут указывать на спаечный
характер непроходимости кишечника. К наиболее постоянным признакам
непроходимости относят вздутие живота. Его степень может быть
различной, что зависит от уровня окклюзии и длительности
заболевания. При высокой непроходимости оно может быть
незначительным и часто асимметричным, чем ниже уровень препятствия, тем
больше выражен этот симптом. Диффузный метеоризм характерен для
паралитической и обтурационной толстокишечной непроходимости.
Как правило, по мере увеличения сроков заболевания увеличивается
и вздутие живота.
Неправильная форма живота и его асимметрия более присущи
странгуляционной кишечной непроходимости. Иногда, особенно у
истощённых больных, через брюшную стенку удаётся увидеть одну или
несколько раздутых петель кишечника, периодически пери стал ьтиру-
ющих. Видимая перистальтика — признак механической
непроходимости кишечника. Он обычно определяется при медленно
развивающейся обтурационной опухолевой непроходимости, когда
успевает гипертрофироваться мускулатура приводящего отдела кишечника.
Локальное вздутие живота при пальпируемой в этой зоне
раздутой петле кишки, над которой определяется высокий тимпанит
(симптом Валя), — ранний симптом механической кишечной непроходи-
Острая кишечная непроходимость -0- 311
мости. При завороте сигмовидной кишки вздутие локализуется
ближе к правому подреберью, тогда как в левой подвздошной области,
т.е. там, где она обычно пальпируется, отмечают западение живота
(симптом Шимана).
Пальпация живота в межприступный период (во время отсутствия
схваткообразных болей, обусловленных гиперперистальтикой) до
развития перитонита, как правило, безболезненна. Напряжение
мышц передней брюшной стенки отсутствует, как и симптом Щёт-
кина—Блюмберга. При странгуляционной непроходимости на почве
заворота тонкой кишки бывает положительным симптом Тэвенара —
резкая болезненность при пальпации живота на 2-3 см ниже пупка
по срединой линии, т.е. там, где обычно проецируется корень её
брыжейки. Иногда при пальпации удаётся определить опухоль, тело ин-
вагината или воспалительный инфильтрат, послуживший причиной
непроходимости.
При сукуссии (лёгком сотрясении живота) можно услышать «шум
плеска» — симптом Склярова (см. рис. 15-4). Его выявлению
помогает аускультация живота с помощью фонендоскопа во время
нанесения рукой толчкообразных движений передней брюшной стенки в
проекции раздутой петли кишки. Обнаружение этого симптома
указывает на наличие перерастянутой паретичной петли кишки,
переполненной жидким и газообразным содержимым. Этот симптом с
большой долей вероятности указывает на механический характер
непроходимости.
Перкуссия позволяет определить ограниченные участки зон
притупления, что соответствует местоположению петель кишки,
наполненных жидкостью, непосредственно прилегающих к брюшной стенке.
Эти участки притупления не меняют своего положения при поворотах
больного, чем отличаются от притупления, обусловленного выпотом
в свободной брюшной полости. Притупление выявляют также над
опухолью, воспалительным инфильтратом или инвагинатом кишки.
Аускультация живота, по образному выражению Г. Мондора,
необходима для того, чтобы «услышать шум начала и тишину конца».
В начальном периоде кишечной непроходимости выслушивают
звонкую резонирующую перистальтику, что сопровождается появлением
или усилением болей в животе. Иногда можно уловить «шум
падающей капли» {симптом Спасокукоцкого—Вильмса) после звуков
переливания жидкости в растянутых петлях кишечника. Перистальтику
можно вызвать или усилить путём поколачивания брюшной стенки
или её пальпации. По мере развития непроходимости и нарастания
312 О Хирургические болезни О Том 1 ♦ Часть I О Глава 11
пареза кишечные шумы становятся короткими, редкими и более
высоких тонов. В позднем периоде все звуковые феномены постепенно
исчезают, им на смену приходит «мертвая (могильная, гробовая)
тишина» — несомненный зловещий признак непроходимости
кишечника. В этот период при резком вздутии живота над ним можно
выслушать не перистальтику, а дыхательные шумы и сердечные тоны,
которые в норме через живот не проводятся.
Обследование больного с острой кишечной непроходимостью
обязательно должно быть дополнено пальцевым ректальным
исследованием. При этом можно определить «каловый завал», опухоль прямой
кишки, головку инвагината и следы крови. Ценный
диагностический признак низкой толстокишечной непроходимости,
определяемый при ректальном исследовании, — атония анального жома и бал-
лонообразное вздутие пустой ампулы прямой кишки {симптом
Обуховской больницы, описанный И.И. Грековым). Этому виду
непроходимости присущ и симптом Цеге-Мантефейля, заключающийся в
малой вместимости дистального отдела кишечника при постановке
сифонной клизмы. При этом в прямую кишку удаётся ввести не
более 500 мл воды.
Клинические проявления непроходимости зависят не только от
её вида и уровня окклюзии кишечной трубки, но и от фазы (стадии)
течения этого патологического процесса. Принято выделять три
стадии острой кишечной непроходимости.
• Начальная — стадия местных проявлений острого нарушения
кишечного пассажа продолжительностью от 2 до 12 ч (время зависит
от формы непроходимости). В этом периоде доминируют болевой
синдром и местные симптомы со стороны живота.
• Промежуточная — стадия мнимого благополучия,
характеризующаяся развитием острой кишечной недостаточности,
водно-электролитных расстройств и эндотоксемии. Она обычно продолжается
от 12 до 36 ч. В этой фазе боль теряет схваткообразный характер,
становится постоянной и менее интенсивной. Живот сильно вздут,
перистальтика кишечника слабеет, выслушивается «шум плеска».
Задержка стула и газов полная.
• Поздняя — стадия перитонита и тяжёлого абдоминального сепсиса,
часто её называют терминальной стадией, что недалеко от истины.
Она наступает через 36 ч от начала заболевания. Для этого периода
характерны проявления тяжёлой системной воспалительной
реакции, возникновение полиорганной дисфункции и недостаточности,
выраженные интоксикация и обезвоживание, а также прогрессиру-
Острая кишечная непроходимость ♦ 313
юшие расстройства гемодинамики. Живот значительно вздут,
перистальтика не выслушивается, определяют перитонеальную
симптоматику.
Инструментальная диагностика
Применение инструментальных методов исследования при
подозрении на кишечную непроходимость предназначено как для
подтверждения диагноза, так и для уточнения уровня обтурации кишечной
трубки и причины развития этого патологического состояния.
Рентгенологическое исследование остаётся основным
специальным методом диагностики острой кишечной непроходимости. Оно
необходимо при малейшем подозрении на это состояние. Как правило,
сначала выполняют обзорную рентгеноскопию (-графию) органов
брюшной полости. При этом могут быть выявлены следующие признаки.
Кишечные арки (рис. 11-5) выявляют, если тонкая кишка раздута
газами. При этом в нижних коленах аркад видны горизонтальные
уровни жидкости, ширина которых уступает высоте газового столба.
Они характеризуют преобладание газа над жидким содержимым
кишечника и встречаются, как правило, в относительно более ранних
стадиях непроходимости.
Чаши Клойбера (рис. 11-6) — горизонтальные уровни жидкости с
куполообразным просветлением (газом) над ними, имеют вид
перевёрнутой вверх дном чаши. Если ширина уровня жидкости
превышает высоту газового пузыря, скорее всего, он локализуется в тонкой
Рис. 11-5. Обзорная
рентгенограмма органов брюшной
полости. Кишечные арки.
314 ♦ Хирургические болезни ♦ Том 1 ♦ Часть! ♦ Глава 11
Рис. 11-6. Обзорная
рентгенограмма органов брюшной
полости. Тонкокишечные уровни
жидкости — чаши Клойбера.
кишке. Преобладание вертикального размера чаши свидетельствует
о локализации уровня в толстой кишке. В условиях странгуляцион-
ной непроходимости этот симптом может появиться уже через 1 ч, а
при обтурационной непроходимости — через 3—5 ч с момента
заболевания. При тонкокишечной непроходимости количество чаш
бывает различным, иногда они могут наслаиваться одна на другую в виде
ступенчатой лестницы. Низкая толстокишечная непроходимость в
поздние сроки может проявляться как толстокишечными, так и
тонкокишечными уровнями. Расположение чаш Клойбера на одном
уровне в одной кишечной петле обычно свидетельствует о наличии
глубокого пареза кишечника и характерно для поздних стадий
острой механической или паралитической кишечной непроходимости.
Симптом перистости (поперечная исчерченность кишки в форме
растянутой пружины) встречается при высокой кишечной
непроходимости и связан с отёком и растяжением тощей кишки, имеющей
высокие циркулярные складки слизистой оболочки (рис. 11-7).
Рентгеноконтрастное исследование ЖКТ применяют при
затруднениях в диагностике кишечной непроходимости. В зависимости от
предполагаемого уровня окклюзии кишечника бариевую взвесь либо
дают per os (признаки высокой обтурационной непроходимости), либо
вводят с помощью клизмы (симптомы низкой непроходимости). Пе-
роральное использование рентгеноконтрастного препарата (в
объёме около 50 мл) предполагает повторное (динамическое) исследова-
Острая кишечная непроходимость •<> 315
ние пассажа бария. Задержка его более 6 ч в желудке и 12 ч в тонкой
кишке даёт основание заподозрить нарушение проходимости или
двигательной активности кишечника. При механической
непроходимости контрастная масса ниже препятствия не поступает.
Экстренная ирригоскопия позволяет выявить обтурацию толстой
кишки опухолью, а также обнаружить «симптом трезубца» —
признак илиоцекальной инвагинации.
Колоноскопия в настоящее время играет важную роль в
своевременной диагностике и лечении опухолевой толстокишечной
непроходимости. После клизм, выполненных с лечебной целью, дисталь-
ный (отводящий) участок кишки очищается от остатков каловых масс,
что позволяет предпринять полноценное эндоскопическое
исследование. Его проведение даёт возможность не только точно
локализовать патологический процесс, но и выполнить интубацию суженной
части кишки, разрешить тем самым явления острой непроходимости
и выполнить оперативное вмешательство по поводу
онкологического заболевания в более благоприятных условиях.
УЗИ брюшной полости обладает небольшими диагностическими
возможностями при острой кишечной непроходимости в связи с
выраженной пневматизацией кишечника, затрудняющей визуализацию
органов брюшной полости. Вместе с тем, в ряде случаев этот метод
позволяет обнаружить опухоль в толстой кишке, воспалительный
инфильтрат или головку инвагината.
Рис. 11-7. Обзорная
рентгенограмма органов брюшной
полости. Симптом перистос-
ти («растянутой пружины»).
316 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 11
Дифференциальная диагностика
Клинические признаки острой кишечной непроходимости могут
появляться при самых различных ургентных заболеваниях.
Принципы их диагностики представлены в соответствующих главах
настоящего учебника. Принципиально важно, что все острые хирургические
заболевания органов брюшной полости, способные привести к
развитию перитонита, протекают с явлениями паралитической кишечной
непроходимости. Если хирург диагностирует распространённый
перитонит, то до операции (она в данном случае обязательна) не столь
важно знать, вызван ли он механической кишечной
непроходимостью или сам стал причиной тяжёлой динамической непроходимости.
Это будет ясно во время интраоперационной ревизии брюшной
полости. Гораздо важнее для выработки адекватной диагностической и
лечебной тактики определить (естественно, до развития перитонита)
вид непроходимости.
1. Странгуляционная или обтурационная непроходимость? В первую
очередь при осмотре необходимо исключить ущемление наружных
брюшных грыж, способных стать причиной странгуляционной
непроходимости. Если ущемление обнаружено, необходимо
выполнить экстренное хирургическое вмешательство без проведения
какого-либо сложного инструментального обследования.
На странгуляционный характер непроходимости, вызванной
заворотом, узлообразованием или внутренним ущемлением,
указывают выраженные постоянные боли, которые могут временами
усиливаться, но полностью никогда не проходят. Для него характерна
рвота с самого начала заболевания и (довольно часто) асимметрия
живота. Состояние больных прогрессивно и быстро ухудшается,
отсутствуют «светлые» промежутки.
2. Высокая или низкая непроходимость? Ответ на этот вопрос важен
хотя бы потому, что от него зависит способ рентгеноконтрастного
исследования (динамическое наблюдение за пассажем бариевой
взвеси, или ирригоскопия). Высокая непроходимость
характеризуется ранней и частой рвотой, отхождением газов и наличием стула
в первые часы заболевания, быстрым обезвоживанием больного
(сухие кожные покровы со сниженным тургором, уменьшение
количества отделяемой мочи, низкое ЦВД, высокий гематокрит). Для
неё более типичны локальный метеоризм и симптом Валя. При
обзорной рентгеноскопии определяют тонкокишечные уровни (с
преобладанием горизонтального размера чаши Клойбера над вер-
Острая кишечная непроходимость О 317
тикальным). Низкая толстокишечная непроходимость
проявляется редкой рвотой, значительно менее выраженными признаками
дегидратации, положительными симптомами Цеге-Мантефейля и
Обуховской больницы. На обзорной рентгенограмме органов
брюшной полости видны толстокишечные уровни (они могут
сочетаться с тонкокишечными при длительной обтурации кишки).
3- Механическая или динамическая непроходимость? Решение этой
задачи не только сложно, но и крайне ответственно.
Динамическая непроходимость сама по себе обычно не требует
хирургического вмешательства. Более того, необоснованная операция может
её только усугубить. А при механической непроходимости, как
правило, показано оперативное лечение.
Отправными точками дифференциальной диагностики в этом
случае должны были бы служить особенности болевого синдрома. К
сожалению, динамическая непроходимость может проявляться как
схваткообразными (спастическая), так и тупыми распирающими
постоянными (парез кишечника) болями. Мало того, динамическая
непроходимость, сопровождающая, например, длительно не
купирующийся приступ почечной колики, из спастического вида
может перейти в паралитический. Конечно, рвота должна быть более
выражена при механической непроходимости, но тяжёлый парез
ЖКТ также сопровождается обильным количеством застойного
отделяемого по зонду из желудка, появлением кишечных уровней на
обзорной рентгенограмме органов брюшной полости. Это в первую
очередь относится к острому панкреатиту. Выраженный
длительный парез желудка и кишечника настолько присущ этому
заболеванию, что среди хирургов существует неписанное правило: во всех
случаях подозрения на кишечную непроходимость следует
исследовать мочу на диастазу. Этот простой тест часто бывает единственным
способом избежать ненужной лапаротомии. Локальный метеоризм,
симптомы Валя, Цеге-Мантефейля и Обуховской больницы
присущи только механической непроходимости. С другой стороны,
диффузный метеоризм и отсутствие указанных симптомов не
исключают её наличия.
Подобная диагностическая неопределённость (динамическая
или механическая непроходимость у больного) характерна для
данного патологического состояния. Вот почему во многих случаях
прибегают к консервативному лечению без окончательного
диагноза и без окончательного решения вопроса о показаниях к
экстренной операции.
318 ♦ Хирургические болезни О Том 1 ♦ Часть I ♦ Глава 11
Лечение
Поскольку непроходимость кишечника — осложнение различных
заболеваний, нет и не может быть единого способа её лечения.
Вместе с тем, принципы лечебных мероприятий при этом
патологическом состоянии достаточно единообразны.
1. Всех больных с подозрением на непроходимость кишечника
необходимо срочно госпитализировать в хирургический стационар.
Сроки поступления таких пациентов в лечебные учреждения во
многом предопределяют прогноз и исход заболевания. Чем позже
госпитализируются больные с острой кишечной непроходимостью,
тем выше уровень летальности.
2. Все виды странгуляционной кишечной непроходимости, как и
любые виды обтурациии кишечника, осложнённые перитонитом,
требуют неотложного хирургического вмешательства. В связи с
тяжёлым состоянием больных может быть оправдана только
кратковременная (не более 1,5—2 ч) интенсивная предоперационная
подготовка.
3. Динамическая кишечная непроходимость подлежит
консервативному лечению, так как хирургическое вмешательство само
по себе приводит к возникновению или усугублению пареза
кишечника.
4. Сомнения в диагнозе механической кишечной непроходимости при
отсутствии перитонеальной симптоматики указывают на
необходимость проведения консервативного лечения. Оно купирует
динамическую непроходимость, устраняет некоторые виды
механической, служит предоперационной подготовкой в тех случаях,
когда это патологическое состояние не разрешается под влиянием
терапевтических мероприятий.
5. Консервативное лечение не должно служить оправданием
необоснованной задержки хирургического вмешательства, если
необходимость его проведения уже назрела. Снижение летальности при
кишечной непроходимости может быть обеспечено, в первую
очередь, активной хирургической тактикой.
6. Хирургическое лечение механической кишечной непроходимости
предполагает настойчивую послеоперационную терапию водно-
электролитных расстройств, эндогенной интоксикации и пареза
ЖКТ, способных привести больного к гибели даже после
устранения препятствия для пассажа кишечного содержимого.
Острая кишечная непроходимость О- 319
Консервативное лечение
Консервативное лечение должно целенаправленно воздействовать
на звенья патогенеза кишечной непроходимости. Принципы его
заключаются в следующем.
Во-первых, следует обеспечить декомпрессию проксимальных
отделов ЖКТ путём аспирации содержимого через назогастральный или
назоинтестинальный (установленный во время оперативного
вмешательства) зонд. Постановка очистительной и сифонной клизм при их
эффективности («размывание» плотных каловых масс) позволяет
опорожнить толстую кишку, расположенную выше препятствия, и в
ряде случаев разрешить непроходимость. При опухолевой
толстокишечной непроходимости желательна интубация суженного участка
кишки для разгрузки приводящего отдела.
Во-вторых, необходимы коррекция водно-электролитных
нарушений и ликвидация гиповолемии. Общие правила подобной
терапии изложены в главе 5, здесь отметим лишь, что объём инфузии,
проводимой под контролем ЦВД и диуреза (желательна
катетеризация одной из центральных вен и наличие катетера в мочевом
пузыре), должен составлять не менее 3—4 л. Обязательно восполнение
дефицита калия, так как он способствует усугублению пареза
кишечника.
В-третьих, для устранения расстройств гемодинамики, помимо
адекватной регидратации, надлежит использовать реологически
активные средства — реополиглюкин, пентоксифиллин и др.
В-четвёртых, весьма желательна нормализация белкового
баланса с помощью переливания белковых гидролизатов, смеси
аминокислот, альбумина, протеина, а в тяжёлых случаях — плазмы крови.
В-пятых, следует воздействовать на перистальтическую активность
кишечника: при усиленной перистальтике и схваткообразных болях
в животе назначают спазмолитики (атропин, платифиллин, дротаве-
рин и др.), при парезе — средства, стимулирующие моторно-эвакуа-
ционную способность кишечной трубки: внутривенное введение
гипертонического раствора хлорида натрия, ганглиоблокаторы,
прозерин, убретид, многоатомные спирты, например сорбитол, токи
Бернара на переднюю брюшную стенку.
И, наконец, последнее (по порядку, но не по значению), жизненно
необходимы мероприятия, обеспечивающие детоксикацию и
профилактику гнойно-септических осложнений. С этой целью, помимо
переливания значительного количества жидкости, нужно использо
320 <0 Хирургические болезни ♦ Том 1 О- Часть! ♦ Глава 11
вать инфузию низкомолекулярных соединений (гемодез, сорбитол,
маннитол и др.) и антибактериальные средства.
Консервативная терапия, как правило, купирует динамическую
непроходимость (возможно разрешение некоторых видов
механической непроходимости: копростаза, инвагинации, заворота
сигмовидной кишки и т.д.). В этом заключается её роль диагностического и
лечебного средства. Если явления непроходимости не разрешаются,
проведённая терапия служит мерой предоперационной подготовки,
так необходимой при этом патологическом состоянии.
Оперативное лечение
Оперативное лечение острой кишечной непроходимости предпо
лагает хирургическое решение следующих лечебных задач.
• Устранение препятствия для пассажа кишечного содержимого.
• Ликвидация (по возможности) заболевания, приведшего к разви
тию этого патологического состояния.
• Выполнение резекции кишечника при выявлении нежизнеспособ
ности.
• Предупреждение нарастания эндотоксикоза в послеоперационном
периоде.
• Предотвращение рецидива непроходимости.
Основные моменты оперативного вмешательства при
непроходимости кишечника перечислены ниже.
• Анестезиологическое обеспечение.
• Хирургический доступ.
• Ревизия брюшной полости для обнаружения причины механичес
кой непроходимости.
• Восстановление пассажа кишечного содержимого или его
отведение наружу.
• Оценка жизнеспособности кишечника.
• Резекция кишечника по показаниям.
• Наложение межкишечного анастомоза.
• Назоинтестинальная интубация.
• Санация и дренирование брюшной полости.
• Закрытие операционной раны.
Оперативное лечение острой кишечной непроходимости
предполагает интубационный эндотрахеальный наркоз с миорелаксантами.
Осуществляют широкую срединную лапаротомию. Этот доступ
Острая кишечная непроходимость ^> 321
необходим в подавляющем большинстве случаев, так как помимо
ревизии всего кишечника во время вмешательства часто приходится
производить его обширную резекцию и интубацию, а также санацию
и дренирование брюшной полости.
Ревизия брюшной полости должна выявить точную локализацию
непроходимости кишечника и её причину. Ориентировочно о
расположении этой зоны судят по состоянию кишечника: выше
препятствия приводящая кишка раздута, переполнена газом и жидким
содержимым, стенка её обычно истончена и по цвету отличается от
других отделов (от багрово-цианотичной до грязно-чёрной окраски),
отводящая кишка находится в спавшемся состоянии, стенки её при
отсутствии перитонита не изменены. Важно помнить, что
препятствие, обусловившее развитие непроходимости, может находиться в
нескольких местах на разных уровнях, вот почему необходим
тщательный осмотр всего кишечника: от привратника до прямой кишки.
Назоинтестиналъная интубация (рис. 11-8) обеспечивает
опорожнение кишечника на операционном столе и в послеоперационном
периоде.
После выполнения назоинтестинальной интубации и
обнаружения препятствия приступают к устранению непроходимости:
пересекают спайки, разворачивают заворот или выполняют дезинвагина-
цию. Ликвидации обтурационной непроходимости в одних
случаях достигают путём энтеротомии, в
других — с помощью резекции кишки,
наложения обходного анастомоза или ко-
лостомы.
После устранения причины
непроходимости следует оценить
жизнеспособность кишки, что при острой кишечной
непроходимости бывает одной из самых
сложных задач, от правильного решения
которой может зависеть исход
заболевания. Степень выраженности изменений
поражённого участка определяют только
после ликвидации непроходимости и
декомпрессии кишки.
Основные признаки
жизнеспособности кишки: сохранённый розовый цвет,
наличие перистальтики и пульсации кра- рИс. 11-8. Схема назоинте-
евых сосудов брыжейки. При отсутствии стинальной интубации.
322 ♦ Хирургические болезни ♦ Том 1 О Часть I ♦ Глава 11
указанных признаков, за исключением случаев явной гангрены, в
брыжейку тонкой кишки вводят 150—200 мл 0,25% раствора прокаи-
на, её обкладывают салфетками, смоченными горячим
физиологическим раствором. Через 5—10 мин повторно осматривают
подозрительный участок. Исчезновение синюшной окраски кишечной
стенки, появление отчётливой пульсации краевых сосудов
брыжейки и возобновление активной перистальтики позволяют считать его
жизнеспособным.
Нежизнеспособная кишка должна быть резецирована в пределах
здоровых тканей. Учитывая, что некротические изменения появляются
сначала в слизистой оболочке, а серозные покровы поражаются в
последнюю очередь и могут быть мало изменены при обширном
некрозе слизистой оболочки кишечника, резекцию выполняют с
обязательным удалением не менее 30—40 см приводящей и 15—20 см
отводящей петель кишечника (от странгуляционных борозд, зоны
обтурации или границ явных гангренозных изменений). При
длительной непроходимости может потребоваться более обширная резекция,
но всегда удаляемый участок приводящего отдела должен быть вдвое
протяжённее отводящего. Любые сомнения в жизнеспособности
кишечника при непроходимости — показания к его резекции.
Важная роль в борьбе с эндотоксикозом принадлежит удалению
токсичного содержимого, которое скапливается в приводящем отделе
и петлях кишечника, подвергшихся странгуляции. Опорожнение
кишечника может быть достигнуто через назоинтестинальный зонд либо
путём сцеживания его содержимого в участок, подлежащий резекции.
Делать это через энтеротомическое отверстие нежелательно из-за
опасности инфицирования брюшной полости.
Операцию заканчивают тщательным промыванием и осушением
брюшной полости. При значительном количестве экссудата и
некротическом поражении кишечника (после его резекции) следует
дренировать через контрапертуры полость малого таза и зону максимально
выраженных изменений (например, боковые каналы). Рану передней
брюшной стенки тщательно послойно ушивают.
Послеоперационное ведение больных. Особенность ближайшего
послеоперационного периода при острой кишечной
непроходимости — сохранение пареза кишечника, водно-электролитных
расстройств, нарушений кислотно-основного состояния, тяжёлой
интоксикации. Поэтому все мероприятия, направленные на устранение
этих патогенетических моментов, начатые в предоперационном
периоде и проводимые во время хирургического вмешательства, в обя-
Острая кишечная непроходимость ♦ 323
тельном порядке должны быть продолжены и после операции.
Большое значение в профилактике и лечении пареза кишечника
принадлежит его декомпрессии. Этого эффективно достигают длительной
аспирацией кишечного содержимого через зонд Миллера—Эббота и
(в меньшей степени) аспирацией желудочного содержимого.
Аспирацию, сочетающуюся с промыванием и средствами селективной де-
контаминации кишечника, осуществляют в течение 3—4 сут, до
уменьшения интоксикации и появления активной перистальтики
кишечника. В течение этого времени больной находится на
парентеральном питании. Суточный объём инфузионных сред составляет не
менее 3—4 л.
Восстановлению функций кишечника способствует коррекция
водно-электролитных расстройств. Для стимуляции моторной
функции кишечника используют антихолинэстеразные препараты (про-
зерин, убретид), ганглиоблокаторы (диколин, димеколин),
гипертонический раствор хлористого натрия, токи Бернара, очистительные
и сифонные клизмы.
Более 75% всех осложнений, развивающихся в
послеоперационном периоде у больных, перенёсших операцию по поводу острой
кишечной непроходимости, связано с инфицированием (перитонит,
нагноение раны, пневмония). Поэтому обязательно проведение
антибактериальной терапии.
ОСТРЫЕ НАРУШЕНИЯ
МЕЗЕНТЕРИАЛЬНОГО
КРОВООБРАЩЕНИЯ
Острое нарушение мезентериального кровообращения —
патологическое состояние, обусловленное внезапным прекращением
кровотока по магистральным сосудам кишечника. Оно сопровождается
крайне тяжёлым течением и чрезвычайно высокой летальностью
(90%). Это связано с тяжёлыми фоновыми заболеваниями
сердечнососудистой системы, поздней госпитализацией, обусловленной
стёртой клинической картиной и запоздалым хирургическим
вмешательством в условиях необратимых некротических изменений кишечника,
системной воспалительной реакции и перитонита.
Основные черты патологии
Кровоснабжение кишечника осуществляется двумя непарными
ветвями брюшной аорты — верхней и нижней брыжеечными
артериями.
Верхняя брыжеечная артерия играет наиболее важную роль в
кровоснабжении кишечника. Она отходит под острым углом от передней
полуокружности абдоминального отдела аорты, на 1—2 см выше
устьев почечных артерий на уровне L — L2. В своём устье артерия имеет
диаметр 1,0-1,5 см, проходит позади тела поджелудочной железы,
пересекает спереди нижнюю горизонтальную (или восходящую) часть
двенадцатиперстной кишки справа от flexura duodenojejunalis,
входит в брыжейку тонкой кишки и отдаёт ветви к поджелудочной
железе, двенадцатиперстной кишке, всей тонкой и правой половине
толстой кишки.
Левая половина ободочной кишки получает кровь из нижней
брыжеечной артерии, которая отходит от передней поверхности аорты на
3—5 см выше её бифуркации на уровне Ц—L4, Она имеет хорошие
коллатеральные связи: с верхней брыжеечной артерией — через рио-
ланову дугу и маргинальную артерию, с подвздошными артериями —
через прямокишечные сосуды. Указанная особенность
кровоснабжения толстой кишки объясняет отсутствие в большинстве случаев её
Острые нарушения мезентериального кровообращения <> 325
ишемического повреждения при окклюзии устья нижней
брыжеечной артерии. Таким образом, говоря об остром нарушении
мезентериального кровоснабжения, чаше всего подразумевают окклюзию
верхней брыжеечной артерии.
Отток крови от тонкой и толстой кишок осуществляется по
одноимённым мезентериальным венам, вместе с селезёночной
формирующим воротную вену.
■ Вне зависимости от причины развития заболевания при
декомпенсации мезентериального кровообращения возникает
различный по протяжённости инфаркт кишечника. Инфаркт — ишемичес-
кий некроз тканей, его основная причина — сосудистый фактор.
При формировании артериального инфаркта, вследствие
нарушения притока крови и выраженного ангиоспазма, кровоток в
кишечной стенке почти полностью прекращается. В этот период
кишка становится бледной и спазмированной (анемический инфаркт),
токсические вещества почти не поступают в общий кровоток.
Затем ангиоспазм сменяется расширением коллатералей, кровоток
частично восстанавливается. Стенка кишки в связи с высокой
сосудистой проницаемостью пропитывается кровью, приобретая
красный цвет (геморрагический инфаркт). Кровь проникает в
просвет кишки и брюшную полость, где появляется геморрагический
выпот. Параллельно идёт процесс деструкции кишечной стенки.
Эти изменения сначала заметны лишь со стороны слизистой
оболочки (некроз, язвы), затем происходят распад тканей и
прободение кишки.
Интоксикация начинает развиваться с момента частичного
возобновления циркуляции и формирования геморрагического инфаркта
кишечника, усугубляясь с развитием перитонита. Полная ишемия
кишечной стенки, продолжающаяся более 4—6 ч, заканчивается
омертвением тканей даже после восстановления циркуляции крови
оперативным путём.
Время формирования венозного инфаркта кишечника отличается
и может составлять от 5—7 дней до 2—3 нед в связи с хорошо
развитым коллатеральным кровообращением. Процесс пропотевания
плазмы и форменных элементов крови начинается с момента
возникновения окклюзии магистральной вены. Развивается выраженный отёк
стенки кишки и её брыжейки, кишка приобретает
малиново-красный цвет. Гипоксия кишечной стенки выражена в меньшей степени,
поэтому признаки эндотоксикоза в первые дни заболевания бывают
не столь явными, как при артериальном инфаркте.
326 О- Хирургические болезни ♦ Том 1 <> Часть I ♦ Глава 12
Классификация
Механизм развития:
• Эмболия.
• Тромбоз артерий.
• Тромбоз вен.
• Окклюзия артерий в результате расслоения стенок аорты.
• Сдавление (прорастание) сосудов опухолями.
• Перевязка сосудов.
Стадии заболевания:
• Ишемия (геморрагическое пропитывание при венозном тром
бозе).
• Инфаркт кишечника.
• Перитонит.
Состояние кровообращения:
• Компенсация.
• Субкомпенсация.
• Декомпенсация (быстро или медленно прогрессирующая).
Среди основных причин развития острых нарушений мезенте-
риального кровообращения выделяют эмболию артерий, тромбоз
артерий и тромбоз вен. По стадиям заболевания принято
различать ишемию (геморрагическое пропитывание при венозном
тромбозе), инфаркт и перитонит. Первая стадия обратима, во второй
и третьей необходимо удаление нежизнеспособных отделов
кишечника.
По течению острые нарушения мезентериального
кровообращения могут протекать с компенсацией, субкомпенсацией и
декомпенсацией кровотока.
• При компенсации мезентериального кровотока происходит полное
восстановление всех функций кишечника без каких-либо
последствий. Выздоровление больных наступает спонтанно или под
воздействием консервативной терапии.
• Субкомпенсация мезентериального кровотока характеризуется
развитием в последующем хронической ишемии органов пищеварения
с клиникой «абдоминальной жабы», ишемических энтеритов и
колитов (нередко язвенных). В последующем у больных на этом фоне
могут возникать различные осложнения: кровотечение, перфорация,
флегмона кишечной стенки и др.
• Декомпенсация мезентериального кровообращения ведёт к
формированию инфаркта кишки, распространённого гнойного перитони-
Острые нарушения мезентериального кровообращения ♦ 327
та, тяжёлого абдоминального хирургического сепсиса. В
неотложной хирургии чаше всего приходится иметь дело именно с таким
течением заболевания.
Этиология и патогенез
Основной источник эмболии — тромбы в левых полостях сердца,
формирующиеся вследствие различных нарушений ритма (особенно
при мерцательной аритмии), врождённых и приобретённых
клапанных пороков, перенесённого инфаркта миокарда с развитием
аневризмы левого желудочка, инфекционного эндокардита. Изредка
встречают «парадоксальную» эмболию тромботическими массами из
правых отделов сердца через дефект межпредсердной или
межжелудочковой перегородки. Возможна эмболия атероматозными
массами или тромбами из вышележащих отделов аорты, особенно при
её аневризме.
Основная причина острого тромбоза — поражение стенки мезен-
териальных артерий вследствие атеросклероза или
неспецифического аорто-артериита.
Обширный инфаркт кишечника чаще всего развивается при
острой окклюзии устья либо ствола верхней брыжеечной артерии. Тром-
боэмболы обычно локализуются в местах анатомического сужения,
соответствующих отхождению артериальных ветвей. Тромбоз, как
правило, возникает при наличии атеросклеротической бляшки,
расположенной в устье или проксимальном отделе ствола верхней
брыжеечной артерии.
Локализация и протяжённость поражений кишечника зависят
от уровня окклюзии. Выделяют три сегмента ствола верхней
брыжеечной артерии (рис. 12-1), при окклюзии каждого из которых
наблюдают типичную локализацию и распространённость
поражения кишечника.
При эмболической или тромботической окклюзии I сегмента
артерии у большинства больных выявляют тотальное ишемическое
поражение тонкой кишки, причём более чем в половине случаев оно
захватывает слепую или всю правую половину толстой кишки.
Жизнеспособным остаётся лишь небольшой начальный отрезок тощей
кишки, протяжённость которого определяется сохранением
кровотока по первой ветви верхней брыжеечной артерии (нижней панк-
реатодуоденальной артерии) и наличием коллатералей с бассейном
чревного ствола, кровоснабжающего двенадцатиперстную кишку.
Наиболее глубокие деструктивные изменения развиваются в
терминальном отделе тонкой и в слепой кишок.
Окклюзия II сегмента ствола верхней брыжеечной артерии
ведёт к ишемии терминальной части тощей и всей подвздошной
кишки. Значительно реже при этом развивается некроз слепой и
восходящей толстой кишок. Жизнеспособным остаётся участок тощей
кишки длиной около 1-2 м, что вполне достаточно для функции пи-
■ щеварения.
При окклюзии III сегмента артерии кровообращение в кишечнике
склонно к компенсации, в случае развития инфаркта происходит
поражение только части подвздошной кишки.
Сочетание острой окклюзии I сегмента верхней брыжеечной
артерии с облитерацией устья нижней брыжеечной артерии приводит к
развитию тотального поражения тонкой и толстой кишок.
Нарушения мезентериального кровообращения в системе нижней
брыжеечной артерии по сравнению с верхней брыжеечной
встречают редко. Это объясняется тем, что обычно происходит
компенсация кровотока в левой половине ободочной кишки вследствие
хороших коллатеральных связей сосудов этого отдела кишечника с
системами верхней брыжеечной и внутренних подвздошных артерии.
Острые нарушения мезентериального кровообращения ♦ 329
Тромбоз воротной вены редко приводит к нарушениям
жизнеспособности кишечника, так как осуществляется компенсация оттока
крови через портокавальные анастомозы. Условия венозного кровотока
значительно ухудшаются, если блокированы пути оттока в нижнюю
полую вену. В худших условиях оказывается тонкая кишка, потому что она
имеет менее развитые коллатерали с другими венозными системами.
При первичном тромбозе интестинальных вен выявляют
ограниченные поражения тонкой кишки длиной не более 1 м. При
тромбозе основных венозных стволов наибольшие изменения отмечают в
подвздошной, слепой, сигмовидной кишках, в области печёночной
и селезёночной кривизны ободочной кишки.
линическая картина
Клиническая картина в первую очередь зависит от стадии
заболевания.
В стадии ишемии, продолжающейся 6—12 ч, основным и
наиболее ярким симптомом болезни бывают боли в животе. Они носят
крайне интенсивный характер, сравнимый с таковыми при завороте
тонкой кишки, и наиболее интенсивны в начале заболевания.
Характерно, что боли локализованы в эпигастральной области или по
всему животу, что связано с раздражением верхнебрыжеечного и
солнечного сплетений. Наркотические анальгетики боль не купируют,
отмечают некоторый обезболивающий эффект после введения
спазмолитических средств. Показательно чрезвычайно беспокойное
поведение больных: вследствие нестерпимых болей они кричат, не
находят себе места, подтягивают ноги к животу, принимают колен-
но-локтевое положение. Рефлекторно возникает рвота желудочным
содержимым, способная повторяться.
В ответ на острую ишемию возникает спастическое сокращение
кишечника. Происходит опорожнение сначала толстой, а затем и
тонкой кишки (ишеминеское опорожнение кишечника). У части больных в
этой стадии заболевания отмечают диарею.
При осмотре обращает на себя внимание резкая бледность
кожных покровов. Окклюзия ствола верхней брыжеечной артерии
приводит к развитию симптома Блинова, проявляющегося повышением
систолического АД на 60—80 мм рт. ст. Характерна брадикардия. Язык
на этой стадии заболевания остаётся влажным, живот — мягким, не
вздутым, совершенно безболезненным, конфигурация его не изме-
•■
ирургические болезни ♦ Том 1 <> Часть! ♦ Глава 12
нена, брюшная стенка участвует в акте дыхания. Характерно
отсутствие болезненности при глубокой пальпации живота. При аускульта-
ции выслушивают ослабленную перистальтику. Количество
лейкоцитов в крови повышается до 10—12-109/л.
В стадии инфаркта (обычно начинается через 6-12 ч от начала
заболевания и продолжается в течение 12—24 ч) интенсивность болей
уменьшается вследствие деструктивных изменений в стенке кишки
и некроза нервных окончаний. Они локализуются преимущественно
в зоне расположения поражённого участка кишки. Поведение
больных становится более спокойным. Диагностическое значение имеет
появление примеси крови в рвотных массах. Этот симптом выявляют
при всех видах острых нарушений мезентериального кровотока,
когда существует поражение тощей кишки.
Очень важный признак, возникающий в стадии инфаркта, —
появление крови в каловых массах, при этом выделения из прямой
кишки по виду напоминают «малиновое желе». В связи с этим большое
значение имеет пальцевое ректальное исследование.
В этой стадии у всех больных выявляют выраженную пальпатор-
ную болезненность, не соответствующую зоне локализации
спонтанных болей в животе. Появляется патогномоничный для этого
заболевания симптом Мондора: в месте инфаркта кишки пальпируют
инфильтрат мягкоэластической консистенции без чётких границ.
Наиболее часто его выявляют у пациентов с формирующимся
венозным инфарктом кишечника.
В связи с прогрессирующей интоксикацией появляется эйфория,
проявляющаяся в неадекватном поведении. АД нормализуется, бра-
дикардия сменяется тахикардией. Количество лейкоцитов в крови
повышается до 20—40109/л.
В стадии перитонита (наступает через 18—36 ч с момента
артериальной окклюзии) боли локализуются по всему животу, усиливаются
при малейшей перемене положения тела, кашле. Уже при
поверхностной пальпации определяют болезненность в сочетании с мышечным
напряжением и симптомом Щёткина—Блюмберга. Следует, однако,
отметить, что особенность клинического проявления перитонита при
острых нарушениях мезентериального кровообращения — более
позднее (по сравнению с другими формами перитонита) появление
мышечного напряжения и симптома Щёткина—Блюмберга.
Характерным признаком считают полное отсутствие кишечных
шумов в животе — симптом «гробовой тишины». При этом над
брюшной полостью выслушивают сердечные тоны.
Острые нарушения мезентериального кровообращения О 331
Состояние больных резко ухудшается в связи с выраженным эндо-
токсикозом, обезвоживанием, нарушениями электролитного баланса,
развитием метаболического ацидоза. Больные становятся адинамич-
ными, у некоторых появляется бред. Развивается задержка стула и газов.
Клиническая картина заболевания и скорость развития
деструктивных процессов в стенке кишки во многом зависят от причины
развития острого нарушения мезентериального кровообращения.
* Так, при эмболии клинические проявления более яркие, боли в
животе значительно интенсивнее, раньше происходит некроз
кишечной стенки. Это связано с внезапностью заболевания,
отсутствием достаточного компенсаторного коллатерального
кровообращения, а также рефлекторным ангиоспазмом.
• Напротив, для острого тромбоза верхней брыжеечной артерии,
обычно возникающего в месте атеросклеротического сужения,
характерны продромальные явления в виде хронической
абдоминальной ишемии («брюшной жабы», angina abdominalis). В анамнезе у
таких больных можно выявить боли в мезогастральной области,
возникающие после приёма пищи, неустойчивость стула, метеоризм.
Указанные явления зависят, как правило, не от качества пищи
(жирности, калорийности и др.)? а от её количества. Некоторые
пациенты вообще начинают принимать пищу малыми порциями из-за
боязни болевого синдрома. В связи с постепенным прогрессированием
заболевания и компенсаторным развитием коллатерального
кровотока в случае возникновения острого тромбоза верхней
брыжеечной артерии декомпенсация кровообращения кишечника
наступает значительно позже, патологические проявления менее выражены,
клиническая картина часто носит стёртый характер.
Диагностика
Клиническая диагностика острых нарушений мезентериального
кровообращения, несмотря на наличие казалось бы специфичных
симптомов, достаточно сложна. Особенно это касается начальных
проявлений заболевания (стадии ишемии), когда своевременное
сосудистое вмешательство способно сохранить жизнеспособность
кишечника. В связи с этим при малейших подозрениях на эту острую
абдоминальную хирургическую патологию проводят дополнительные
инструментальные исследования, позволяющие поставить
правильный диагноз.
332 ♦ Хирургические болезни ♦ Том 1 ♦ Часть
Инструментальная диагностика
Глава 12
Литографическое исследование — один из самых специфичных и
наиболее объективных методов диагностики этого патологического
состояния. Для получения максимально исчерпывающих сведений
аортографию выполняют в двух проекциях (прямой и боковой) с
последующей селективной мезентерикографией. Наличие дефектов
контрастирования и/или отсутствие заполнения ствола и ветвей
брыжеечных артерий подтверждают диагноз вне зависимости от стадии
заболевания (рис. 12-2).
Ультразвуковое ангиосканирование с ультразвуковой допплерогра-
фией и цветным допплеровским картированием основано на
визуализации просвета сосуда с регистрацией в нём потока крови. Движение
её по направлению к ультразвуковому датчику отображается синим
цветом, а от него — красным.
Преимущество этого метода заключается в неинва-
зивности и возможности динамического
наблюдения в виде повторных исследо
ваний при неясном диагнозе.
Лапароскопия — основной инстру
ментальный метод диагностики острого
нарушения мезентериального
кровообращения, поскольку может быть проведена
в большинстве хирургических
стационаров. Выявляемые с помощью эндоскопии
изменения кишки и брюшной полости
при этой патологии достаточно
специфичны и зависят от характера и глубины
поражения.
• В стадии ишемии париетальная и
висцеральная брюшина остаётся гладкой и
блестящей. Выпот отсутствует. Петли
кишок имеют бледно-розовый цвет с циа-
нотичным оттенком. Пульсация краевых
сосудов исчезает.
• В стадии инфаркта в малом тазу и
латеральных каналах появляется
значительное количество геморрагического выпота.
Стенка кишки красного цвета, отёчная,
отсутствует перистальтика.
Рис. 12-2. Прямая аортоар-
териография в боковой
проекции. Эмболия I сегмента
верхней брыжеечной
артерии: / — абдоминальный
отдел аорты; 2 — чревный
ствол; 3 — верхняя
брыжеечная артерия (контрастиру-
ется только в своем устье).
Острые нарушения мезентериального кровообращения ♦ 333
• В стадии гангрены кишки и перитонита в брюшной полости
выявляют большое количество мутного геморрагического выпота.
Брюшина тусклая, серого цвета, с наложениями фибрина. Петли
кишечника коричневого, чёрного или зелёного цвета.
Если ни один из дополнительных методов исследования не позво
ляет подтвердить диагноз, в качестве последнего этапа диагностики,
особенно при обоснованном подозрении на острое нарушение
мезентериального кровообращения, показана лапаротомия.
Дифференциальная диагностика
Острые нарушения мезентериального кровообращения
необходимо дифференцировать со многими заболеваниями органов брюшной
полости, в первую очередь, с острой кишечной непроходимостью,
острым панкреатитом, печёночной или почечной коликой, пищевой
токсикоинфекцией.
Отсутствие стула и прекращение отхождения газов заставляют
заподозрить острую кишечную непроходимость. Однако для кишечной
непроходимости характерны схваткообразные боли по всему животу
в первые часы заболевания, многократная рвота, часто с каловым
запахом, симптомы Валя, Цеге-Мантефейля, Обуховской больницы
и др. При спаечной кишечной непроходимости видны рубцы на
передней брюшной стенке после перенесённых ранее хирургических
вмешательств. Для низкой толстокишечной непроходимости,
обусловленной опухолевым процессом, патогномоничны длительно
существующие нарушения стула в виде чередования запоров и диареи,
а также симптомы малых признаков, свойственных
онкологическому процессу (похудание, снижение аппетита, анемия и др.).
Сильные некупирующиеся боли в животе в стадии ишемии при
остром нарушении мезентериального кровообращения могут
напоминать таковые при печёночной или почечной колике. Однако для этих
заболеваний характерно наличие в анамнезе подобных болей,
выявляемые при УЗИ конкременты жёлчного пузыря или почек, дизури-
ческие расстройства. Боли при колике носят волнообразный
характер, купируются спазмолитиками.
Постоянные тупые боли в животе, рефлекторная рвота
желудочным и дуоденальным содержимым могут наблюдаться при остром
панкреатите. Однако для него характерна связь с нарушениями
режима питания (приём жирной, жареной, острой пищи, алкоголя)
334 ♦ Хирургические болезни ♦ Том 1 О Часть I ♦ Глава 12
Боли преимущественно локализуются в эпигастральной области с
иррадиацией в спину, часто носят опоясывающий характер. Патого-
моничны симптомы Воскресенского, Мейо-Робсона. В крови и моче
отмечается достоверное повышение панкреатических ферментов.
Рвота желудочным содержимым и диарея, возникающие в стадии
ишемии при остром нарушении мезентериального кровообращения,
возможны и при различных инфекционных заболеваниях, в
частности при пищевой токсикоинфекции. В таком случае для
постановки диагноза большое значение имеет правильно собранный
эпидемиологический анамнез (качество съеденной пищи, одновременное
заболевание нескольких людей из одного коллектива и т.д.). Для
пищевой токсикоинфекции характерны быстрое появление
интоксикации с высокой температурой тела и такое же быстрое
самостоятельное её купирование в течение первых 1-2 сут. Диспептические
расстройства, как правило, преобладают над болевым
абдоминальным синдромом.
Лечение
Лечение острых нарушений мезентериального
кровообращения заключается в проведении экстренного хирургического
вмешательства, предпринимаемого незамедлительно после постановки
диагноза или возникновения обоснованного подозрения на это
заболевание.
Характер и объём хирургического вмешательства в каждом
конкретном случае зависят от нескольких факторов: механизма
нарушения мезентериального кровообращения, стадии заболевания,
локализации и протяжённости поражений кишечника, общего состояния
больного, хирургического оснащения и опыта хирурга. Диапазон
оперативного пособия может меняться от изолированных операций на
мезентериальных сосудах до сугубо резекционных вмешательств. В
большинстве случаев сочетают оба подхода. Восстановление
кровотока по брыжеечным артериям в течение 4—6 ч с момента окклюзии
(что удаётся достаточно редко) обычно приводит к предотвращению
гангрены кишечника и восстановлению его функций. При
необратимых изменениях более или менее протяжённого участка
кишечника, помимо его удаления, выполняют дополнительную операцию на
брыжеечных сосудах, что способствует восстановлению
кровоснабжения пока ещё жизнеспособных отделов.
Острые нарушения мезентериального кровообращения ♦ 335
Если выявляют тотальную гангрену тонкой кишки,
ограничиваются пробной (эксплоративной) лапаротомией. При обнаружении
ишемических расстройств тонкой и правой половины толстой
кишки без некротических изменений проводят ревизию ствола верхней
брыжеечной артерии. Ревизию нижней брыжеечной артерии
выполняют в случае ишемического повреждения сигмовидной кишки.
Кишку признают жизнеспособной при сохранении окраски её
стенки, перистальтики и пульсации сосудов брыжейки.
Способы восстановления мезентериального кровотока зависят от
характера сосудистой окклюзии. Эмболэктомию из верхней
брыжеечной артерии обычно выполняют с помощью баллонного катетера
Фогарти (рис. 12-3). При артериальном тромбозе проводят тромбин-
тимэктомию, обходное шунтирование, реимплантацию артерии в
аорту.
При тромботической окклюзии воротной вены с переходом на
верхнюю брыжеечную (нисходящий тромбоз) или окклюзии её ствола
при восходящем характере тромбоза выполняют тромбэктомию из
указанных вен.
Резекция кишечника при нарушениях мезентериального
кровообращения применяется как самостоятельное вмешательство или
вместе с сосудистыми операциями. В качестве самостоятельной
операции резекцию проводят при тромбозе и эмболии дистальных
ветвей верхней или нижней брыжеечной
артерии, ограниченном по протяжению
венозном тромбозе. При перечисленных
нарушениях протяжённость поражения
кишечника, как правило, бывает
незначительной, поэтому после резекции обычно
не наступает расстройств пищеварения.
В случаях поражения подвздошной,
слепой и восходящей ободочной кишок
выполняют правостороннюю гемиколэк-
томию с еюнотрансверзостомией.
Операцию при некрозе левой половины толстой
кишки заканчивают резекцией
сигмовидной кишки (при тромбозе ветвей нижней
брыжеечной артерии) либо левосторонней
гемиколэктомией (при окклюзии ствола
нижней брыжеечной артерии). В связи с
тяжёлым состоянием больных и высоким
Рис. 12-3. Эмболэктоми
из верхней брыжеечной
артерии с помощью баллон
ного катетера.
336 ♦ Хирургические болезни О Том 1 О Часть I ♦ Глава 12
риском несостоятельности первичного толстокишечного
анастомоза резекцию завершают наложением одноствольной колостомы.
Вмешательство на кишечнике завершают назоинтестинальной
интубацией, что необходимо для борьбы с послеоперационным
парезом и проведения селективной деконтаминации оставшейся части
кишечного тракта. Эта мера — необходимый компонент
купирования эндотоксикоза.
Результаты лечения больных с острыми нарушениями мезенте-
риального кровообращения во многом зависят от эффективного
проведения интенсивной терапии в пред- и послеоперационном
периодах, а также от адекватного анестезиологического пособия во
время хирургического вмешательства.
Предоперационная подготовка включает широкий круг
мероприятий, направленных на восстановление эффективного ОЦК и
улучшение тканевой перфузии, нормализацию сердечной деятельности,
коррекцию метаболических нарушений, снижение эндотоксикоза.
Объём предоперационной подготовки зависит от стадии процесса,
наличия и тяжести сопутствующих заболеваний.
В стадии ишемии и инфаркта кишечника для подготовки больных
используют мероприятия, направленные на уменьшение общего
периферического сосудистого сопротивления, восполнение ОЦК
и борьбу с метаболическими нарушениями. Интенсивная терапия
при глубоких деструктивных изменениях в кишечнике с
вовлечением в процесс брюшины не отличается от таковой при перитонитах
другой этиологии.
Быстрота развития необратимых изменений в кишечнике —
фактор, диктующий необходимость экстренного оперативного
вмешательства и ограничивающий время проведения интенсивной терапии
в предоперационном периоде (не более 1—2 ч). Её обязательно
продолжают во время операции.
В послеоперационном периоде лечение включает мероприятия,
направленные на улучшение системного и тканевого
кровообращения, поддержание адекватного газообмена и оксигенации,
коррекцию метаболических нарушений, борьбу с токсемией и бактериемией.
При благоприятном течении выраженная интоксикация
практически исчезает ко 2—3-му дню послеоперационного периода.
Стабилизируется гемодинамика, исчезают застойные явления в желудке и
кишечнике, восстанавливается перистальтика, начинают отходить
газы. Самочувствие больных заметно улучшается после
восстановления функций кишечника. Постепенно уменьшается лейкоцитоз и
Острые нарушения мезентериального кровообращения ♦ 337
снижается СОЭ, исчезает палочкоядерный сдвиг лейкоцитарной
формулы, содержание мочевины и жёлчных пигментов в крови мало
отличается от нормальных величин. Восстанавливается диурез,
уменьшаются протеинурия и цилиндрурия. При неосложнённом
послеоперационном периоде указанные показатели нормализуются к 7—
10-м суткам после хирургического вмешательства.
У ослабленных больных с тяжёлой сопутствующей патологией и
низкой резистентностью нередко развиваются различные
осложнения (абдоминальный хирургический сепсис, пневмония, ТЭЛА).
В тоже время, при прогрессировании заболевания в случае рецидива
сосудистой окклюзии немедленно переходят к активному
хирургическому вмешательству — релапаротомии.
Результаты лечения острых нарушений мезентериального
кровообращения зависят от своевременной госпитализации больных в
хирургические стационары, правильной диагностики этого тяжёлого
патологического состояния, активной хирургической тактики, а
также адекватной интенсивной и антибактериальной терапии. Именно
такой комплексный подход способен предотвратить
неблагоприятный исход заболевания.
1в ГА JIM ТРАВМА ЖИВОТА
Повреждения живота относят к специальному разделу
неотложной хирургии — хирургии повреждений. Во всём мире диагностикой
и лечением этой сложной патологии занимаются общие хирурги и
хирурги-травматологи. Развитие специальностей в нашей стране во
второй половине XX века происходило таким образом, что
травматология как специальность («травматология и ортопедия») и как
учебная дисциплина в настоящее время ограничивается только
проблемой повреждений опорно-двигательного аппарата, в то время как
повреждениями других областей тела человека (черепно-мозговой
травмой, травмой груди и живота) занимаются специалисты другого
профиля, хотя, строго говоря, всё это также относится к области
науки о повреждениях, т.е. к травматологии.
Как известно, во все времена наиболее опытными специалистами
в хирургии повреждений были и остаются военные хирурги. Однако
система оказания медицинской помощи в военно-полевых условиях
(искусственная раздробленность всего объёма помощи по времени
её оказания, многоэтапность) принципиально отличается от условий
работы гражданских хирургов.
Естественно, эти отличия обусловливают разные подходы к
диагностике и хирургической тактике, даже при одинаковых повреждениях.
Кроме того, гражданские хирурги нередко имеют дело с повреждениями,
практически не встречающимися в практике военно-полевых хирургов.
Конец XX и начало XXI века характеризуются резким ростом
травматизма с высокой летальностью за счёт, прежде всего, черепно-мозговой
травмы и травмы внутренних органов. Повреждения живота при этом
занимают одно из ведущих мест. Так, общая летальность пострадавших
с повреждениями живота при тяжёлой сочетанной травме достигает 60%.
Общая характеристика абдоминальной травмы
Все повреждения тела человека в результате воздействия
механической энергии делят на открытые (ранения) и закрытые. Эти виды
повреждений различаются этиологией, методами диагностики в ле-
Травма живота <*> 339
чения, тяжестью течения и исходами, поэтому их необходимо
рассматривать отдельно. Кроме того, следует различать такие понятия,
как изолированное и сочетанное повреждения.
Для определения объёма повреждений тело человека условно
разделено на пять анатомических зон. Повреждение каждой из них
требует специфических методов диагностики и лечения, чем и
занимаются врачи соответствующих специальностей:
1) голова, позвоночник и спинной мозг — нейрохирурги;
2) шея, 3) грудь, 4) живот — хирурги общего профиля;
5) опорно-двигательный аппарат (таз и конечности) —
травматологи-ортопеды.
Травма одной из этих анатомических зон носит название
изолированной, травма двух и более зон — сочетанной травмы. Если
повреждение было нанесено не только механической энергией, но ещё и
другим видом энергии (термической, химической, лучевой), в
отечественной медицине используют термин «комбинированная травма».
Абсолютный признак открытой травмы (ранения) — наличие раны
(нарушение целостности кожного покрова, наружных слизистых
оболочек). Ранение может быть нанесено холодным оружием (кинжалом,
ножом, «заточкой», употребляемой в криминальной среде) или
предметами быта, использованными в качестве холодного оружия
(шилом, отвёрткой, столовой вилкой, ножницами и т.д.). По внешнему
виду раны подразделяют на колотые, резаные и рубленые.
• Внешний вид колотых ран весьма обманчив, так как малые
размеры раны и отсутствие наружного кровотечения создают
впечатление лёгкого ранения. Однако при этом могут быть серьёзные
повреждения жизненно важных органов и крупных сосудов, поэтому
ранения такого рода заслуживают самого пристального внимания.
• Напротив, резаные раны, наносимые скользящим ударом, имеют
наиболее драматичный вид вследствие рассечения множества
подкожных сосудов и расхождения краёв. Однако они редко бывают
настолько глубокими, чтобы привести к повреждению внутренних
органов. Следует отметить, что наиболее часто хирург имеет дело с
ножевыми колото-резаными ранами, сочетающими признаки как
колотой, так и резаной ран.
• Рубленые раны (нанесённые топором) в настоящее время встреча-
I ют редко. Они сопровождаются значительным разрушением тканей,
характерны больше для ран головы, чем груди и живота.
Помимо холодного оружия, раны могут быть нанесены
металлическими конструкциями, стеклом (классический пример — автомобиль-
340 Ф Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 13
ная авария) и так называемыми вторичными снарядами —
летящими с большой скоростью обломками камней, кирпичей, осколками
стекла (например, при разрушении зданий во время землетрясения).
Такие раны называют рвано-ушибленными, их особенность понятна
из названия.
Наконец, особую разновидность представляют рваные раны,
нанесённые собаками, дикими животными.
Огнестрельные ранения наиболее опасны. В отличие от ранений
холодным оружием, при которых размеры раневого канала
(следовательно, и разрушение тканей на его протяжении) зависят от вида и
длины ранящего орудия, протяжённость раневого канала и степень
разрушения тканей при огнестрельном ранении зависят от
кинетической энергии ранящего снаряда (пули, дроби, осколка), т.е. от его
массы и скорости проникновения в тело человека.
Прямое действие огнестрельного снаряда (пули) и образующейся
перед ним волны сжатого воздуха вызывает разрушение живых
тканей по ходу раневого канала с частичным выбросом размозжённой
массы через входное и выходное отверстия. Лежащие на пути
снаряда кости раздробляются с большой силой и в виде вторичных
снарядов повреждают окружающие мягкие ткани.
Масштабы разрушения тканей при огнестрельном ранении во
много раз превосходят размеры снаряда и созданного им раневого канала.
Большая кинетическая энергия снаряда приводит к образованию в
тканях так называемой временной пульсирующей полости, давление в
которой настолько быстро и сильно повышается, что её возникновение
сравнивают с внутритканевым взрывом. Размеры этой полости резко
меняются в зависимости от плотности тканей, в среднем они
превышают калибр снаряда в 10 раз и более. В результате огнестрельного
ранения в тканях и органах различают три зоны повреждений: зону
раневого канала, зону первичного травматического некроза (контузии) и
зону вторичного травматического некроза (молекулярного сотрясения).
• Зона первичного травматического некроза, колеблется в широких
пределах и может занимать несколько сантиметров. Сразу после
ранения она имеет вид обширных кровоизлияний, в то время как
некроз тканей может произойти через несколько часов или даже суток.
Это обстоятельство намного затрудняет правильный выбор объёма
первичной хирургической обработки при огнестрельных ранениях
и, следовательно, затрудняет прогнозирование осложнений.
• Зону молекулярного сотрясения можно характеризовать как область
некробиоза. Она без резкой границы переходит в нормальные гка-
Травма живота ^> 341
ни, изменения в ней носят обратимый характер, но при
стечении неблагоприятных обстоятельств и в этой зоне происходит
некроз тканей.
Все огнестрельные ранения делят на пулевые, дробовые и
осколочные. Условно к ним можно отнести и ранения, нанесённые газовой
струей при выстреле из газового пистолета с близкого расстояния.
Пулевые ранения, нанесённые современным стрелковым оружием,
характеризуются наиболее обширными разрушениями органов и
тканей. Множественные ранения из автоматического оружия оставляют
пострадавшему мало шансов на жизнь.
Особая разновидность огнестрельной травмы — минно-взрывная
травма. Этот вид поражения встречают в практике хирургов в
последние годы при оказании помощи пострадавшим в результате
террористических актов. Разрушительная сила взрыва зависит от
мощности заряда. На открытом пространстве она убывает с каждым метром
от места взрыва, но в закрытом помещении даже небольшой заряд
вызывает огромные разрушения. Поражающими факторами при этом,
помимо осколков, становятся действия пламени (ожог) и взрывной
волны (баротравма). Таким образом, при взрыве мины возникает
комбинированная травма.
Все огнестрельные ранения делят на слепые и сквозные.
• Ранение считают слепым, когда есть только входное отверстие
(место вхождения ранящего снаряда), а сам ранящий снаряд
находится в тканях.
• При сквозном ранении ранящий снаряд образует не только
входное, но и выходное отверстие. Как правило, размеры входного
отверстия соответствуют размерам ранящего снаряда, в то время как
выходное отверстие, особенно при выстрелах с близкого
расстояния, намного больше входного, в его зоне больше разрушенных
тканей, более интенсивное наружное кровотечение. Эти
обстоятельства необходимо учитывать при оказании медицинской помощи на
месте происшествия.
Совместив локализацию входного и выходного отверстий по
прямой линии, можно с большой долей вероятности представить ход
раневого канала и возможные повреждения органов груди и живота.
Однако при использовании современного боевого оружия такой
закономерности может и не быть, особенно при использовании пуль
со смещённым центром тяжести.
Опасность любого ранения резко возрастает, если раневой
канал проникает в брюшную полость. Поэтому все ранения делят на
342 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 13
непроникающие и проникающие. Непроникающие ранения менее
опасны, однако это в большей степени относится к ранам передней
стенки живота. Ножевые ранения (в поясничной области), не говоря уже
об огнестрельных, не проникая в брюшную полость, могут приводить
к повреждениям почек, поджелудочной железы, двенадцатиперстной
кишки. Вместе с тем даже поверхностные, но обширные резаные раны
с повреждением множества подкожно расположенных кровеносных
сосудов могут привести к угрожающей жизни кровопотере, если
своевременно не оказать помощь.
Независимо от того, проникает или не проникает рана в серозную
полость, все ранения делят на две группы: без повреждения
внутренних органов и с повреждениями внутренних органов. Как показывает
опыт, в 15—20% случаев проникающих колото-резаных ранений
живота повреждений внутренних органов не выявляют, несмотря на то,
что имеется повреждение париетального листка брюшины, т.е.
может быть проникающее повреждение без повреждения внутренних
органов. При огнестрельных ранениях такие случаи возможны, но их
можно считать казуистикой.
Не проникающие в брюшную полость ранения также могут
сопровождаться повреждением внутренних органов: паренхиматозных
(печени, селезёнки, поджелудочной железы, почек), полых (ЖКТ,
жёлчного пузыря, мочевого пузыря) или сосудов (аорты, нижней полой
и воротной вен, сосудов брыжейки). Отдельное рассмотрение
ранений паренхиматозных и полых органов имеет принципиальное
значение не столько из-за морфологии повреждений, сколько из-за
различий в симптоматике, способах хирургического лечения,
возникновении и течении осложнений. При повреждении паренхиматозных
органов ведущим моментом патогенеза становится массивная кро-
вопотеря, при ранении полых органов пищеварительного тракта и
мочевого пузыря — фактор массивного инфицирования брюшной
полости и забрюшинного пространства.
Существует ощутимая разница в трудностях диагностики, лечения
и исходах травмы в зависимости от того, сколько органов
повреждено и сколько ран имеет тот или иной орган.
• Повреждение одного органа носит название одиночной травмы
(например, у пострадавшего выявлено колото-резаное ранение
живота с двумя ранами печени, гемоперитонеум, а других
повреждений нет).
• Если повреждённый орган имеет одну рану, такое повреждение
следует называть монофокальным, если существует несколько ран —
Травма живота ♦ 343
полифокальным. (В приведённом выше примере мы имеем дело с
одиночной полифокальной травмой, т.к. имеется несколько ран
печени).
• Повреждение нескольких органов носит название множественной
травмы (например, пулевое ранение желудка, селезёнки и левого
изгиба толстой кишки).
Среди сочетанных ранений груди и живота следует выделять то-
ракоабдоминальные, абдоминоторакальные ранения и
одновременные ранения груди и живота.
У пострадавших с закрытой травмой воздействие механической
энергии приводит к повреждению внутренних органов и тканей без
повреждения кожи. Именно поэтому в первой половине XX века в
медицинской литературе употребляли термин «подкожные
повреждения». Чтобы не была нарушена целостность кожи, повреждающий
агент не должен быть острым; в немецкой литературе принят термин
«тупая травма». Однако в мире в настоящее время наиболее
распространён термин «закрытая травма».
Так же, как и при ранениях, при закрытой травме живота
различают повреждения паренхиматозных, полых органов и крупных
кровеносных сосудов. Особо выделяют забрюшинную гематому.
Забрюшинная гематома (правильнее — забрюшинное
кровоизлияние) возникает при переломах костей таза, позвоночника, разрыве
органов и сосудов, расположенных забрюшинно. Возникает чаще
всего при падении с высоты и автомобильной травме. Различают
односторонние и двусторонние гематомы.
В зависимости от распространённости забрюшинные гематомы
могут вмещать от 500 до 3000 мл крови:
• если гематома ограничена полостью малого таза, её
предположительный объём составляет 500 мл;
• если она достигает с обеих сторон нижних полюсов почек - - не
менее 1,5 л;
• при достижении верхних полюсов — 2 л;
• при распространении на диафрагму — 3 л.
При кровоизлиянии более 2 л гематома распространяется на пред-
пузырное пространство и предбрюшинную клетчатку. В таких
случаях нередко часть крови (200—300 мл) пропотевает через листок
брюшины в свободную брюшную полость, что сопровождается
соответствующей клинической картиной и может стать причиной
необоснованной лапаротомии. В то же время следует помнить, что
встречаются случаи прорыва напряжённой забрюшинной гематомы
344 ♦ Хирургические болезни <> Том 1 ♦ Часть II ♦ Глава 13
в брюшную полость с продолжающимся кровотечением, что требует
немедленной лапаротомии.
Кроме того, при массивном кровоизлиянии кровь может
распространяться по межмышечным промежуткам и клетчаточным
пространствам на поясничную область, ягодицы, промежность и внутреннюю
поверхность бёдер. Понятно, что столь большой объём кровопотери
сам по себе может стать причиной смерти.
Кровь, излившаяся в забрюшинное пространство, пропитывает
клетчатку, раздражает большое количество нервных рецепторов
чревного и пояснично-кресцового сплетений, обусловливает длительное
течение травматического шока и стойкий парез ЖКТ. Через 5—6 дней
парез ЖКТ начинает разрешаться, но одновременно нарастает эндо-
токсикоз, обусловленный всасыванием продуктов распада
излившейся крови. Клинически это выражается в длительной желтухе,
способной привести к печёночно-почечной недостаточности.
,:■■■■■ ■■
Классификация
Открытая травма.
• Характер и вид ранения:
- холодным оружием: колотые, резаные, рубленые, рваные,
ушибленные;
- огнестрельные: пулевые, дробовые, осколочные.
• Соотношение раны с брюшной полостью:
- непроникающее;
- проникающее.
• Повреждения паренхиматозных органов:
- поверхностные раны капсулы органа;
- раны капсулы и паренхимы, не достигающие области сосудисто-
секреторной ножки;
- раны капсулы и паренхимы с повреждением
сосудисто-секреторной ножки;
- размозжение (огнестрельное ранение) либо отсечение части
органа.
• Повреждение полых органов:
- ранения серозной оболочки;
— проникающие в просвет органа ранения;
— сквозные ранения;
- размозжение или пересечение органа.
Травма живота ^> 345
\акрытая (тупая) травма.
• Локализация ушиба (повреждения):
- брюшная стенка;
- органы брюшной полости;
- забрюшинное пространство и его органы.
• Повреждение внутренних органов:
- внутрибрюшное;
- забрюшинное.
• Вид повреждённого органа:
- паренхиматозный;
- полый;
- кровеносный сосуд;
- забрюшинное кровоизлияние (гематома).
• Повреждения паренхиматозных органов:
- поверхностные разрывы глубиной не бодее 1 см (3 см для печени);
- центральные разрывы, проходящие через область ворот;
- подкапсульные гематомы (периферические и центральные);
- отрыв или размозжение органа или его части.
• Повреждение полых органов:
- надрыв (серозной или слизистой оболочки);
- разрыв;
- отрыв или размозжение.
Последствия абдоминальной травмы;
• образование гематомы;
• кровотечение: наружное или внутрибрюшное;
• перитонит;
• внутрибрюшные абсцессы;
• забрюшинная флегмона;
• свищи: кишечные, жёлчные, панкреатические, мочевые.
Клиническая картина и диагностика
Диагноз открытого повреждения не вызывает сомнений при
наличии раны на передней брюшной стенке. Труднее решить, проникает
ли рана в брюшную полость. Абсолютный и прямой признак
проникающего ранения — выпадение из раны внутренних органов (чаще
всего пряди большого сальника, реже петли тонкой кишки),
истечение из раны кишечного содержимого, жёлчи, мочи с
соответствующим окрашиванием повязки (белья) и запахом.
346 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 13
При отсутствии перечисленных выше признаков диагноз
проникающего ранения ставят на основании косвенных симптомов,
указывающих на наличие в брюшной полости патологического
содержимого (кровь, кишечное содержимое, моча). При этом присутствие
большого количества крови в брюшной полости сочетается с
признаками общей кровопотери, а содержимого ЖКТ и мочи — с
симптомами интоксикации и перитонита.
При отсутствии прямых признаков проникающего ранения
пострадавшего подвергают первичной хирургической обработке раны
брюшной стенки, окончательный диагноз в таких случаях
устанавливают в ходе этой хирургической операции.
При закрытых повреждениях самочувствие пострадавшего не
всегда соответствует истинной тяжести повреждений. Например, при
разрыве паренхиматозных органов или тонкой кишки в первые часы
после травмы больной может чувствовать себя удовлетворительно,
тогда как ушиб брюшной стенки без повреждения внутренних
органов в эти сроки может создать впечатление тяжёлой травмы.
Основной жалобой пострадавших бывает боль в животе разной
локализации, интенсивности и иррадиации. При повреждении печени боль
иррадиирует в надплечье справа, при травме селезёнки — слева.
Больные могут жаловаться на сухость языка, тошноту, рвоту, задержку
газов, отсутствие стула, затруднение при мочеиспускании.
При осмотре прежде всего следует обращать внимание на общие
признаки острой анемии вследствие внутреннего кровотечения —
бледность кожных покровов и видимых слизистых оболочек, холодный
пот, частое поверхностное дыхание, частый (более 100 в минуту) пульс
слабого наполнения, низкое (менее 100 мм рт.ст.) АД, при травме
полых органов часто отмечают сухость языка. Кровотечение,
обусловленное разрывом почки, может проявляться массивной гематурией.
При осмотре живота можно обнаружить ссадины, кровоподтёки и
кровоизлияния. В то же время их отсутствие не исключает наличия
тяжёлой травмы внутренних органов. Следует обращать внимание на
вздутие живота, его асимметрию вследствие различных выбуханий.
Важный признак повреждения внутренних органов — исчезновение
дыхательных экскурсий передней брюшной стенки. Диффузное
напряжение мышц передней брюшной стенки и её болезненность при
пальпации, особенно в области пупочного кольца, указывают на
повреждение внутренних органов.
Вздутие живота (без напряжения мышц) нельзя считать
достоверным признаком повреждения внутренних органов; резкое вздутие.
Травма живота ♦ 347
зникаюшее в первые 2 ч после травмы, характерно для забрюшин-
ной гематомы. Выраженное вздутие живота и напряжение брюшных
мышц наблюдают у пострадавших с распространённым гнойным
перитонитом, доставленных позднее 12 ч после травмы полых органов.
В таких случаях патогномоничный симптом, указывающий на
перитонит вследствие повреждения внутренних органов, — симптом Щёт-
кина-Блюмберга. При внутрибрюшном кровотечении можно выявить
симптом Куленкампфа (резкое усиление болей во время
отдергивания руки хирурга при мягкой передней брюшной стенке).
Укорочение перкуторного звука в боковых отделах живота
указывает на скопление в брюшной полости свободной жидкости (крови,
экссудата, кишечного содержимого, мочи, транссудата). В отличие
от забрюшинной гематомы, при которой также возникает
укорочение перкуторного звука, но границы этого укорочения не меняются
(симптом Джойса), при наличии свободной жидкости граница
укорочения перемещается при повороте пострадавшего на бок.
Появление тимпанита над областью печени свидетельствует о наличии
свободного газа в брюшной полости вследствие разрыва полого органа.
Однако этот признак встречают гораздо реже, чем, например, при
перфоративной язве.
Отсутствие перистальтических шумов, так же как и вздутие
живота, может быть как признаком перитонита вследствие разрыва полых
органов, так и проявлением большой забрюшинной гематомы без
повреждения органов. Следует помнить, что при забрюшинной
гематоме эти признаки появляются в первый час после травмы, а при
разрыве полых органов — только через 8-12 ч, когда развивается перитонит.
В случае сочетанной травмы ценность клинических симптомов при
открытых и закрытых повреждениях живота резко снижается.
Напряжение мышц передней брюшной стенки характерно для черепно-
мозговой травмы и переломов рёбер; у пострадавших, находящихся в
бессознательном состоянии, невозможно выявить боль в животе,
симптом Щёткина—Блюмберга и т.д. Нередко при переломах
позвоночника, нижних рёбер, костей таза, забрюшинных гематомах
наблюдают симптомы перитонизма (вздутие живота, угнетение перистальтики,
слабоположительные симптомы раздражения брюшины).
Поэтому при закрытой травме живота используют ряд
объективных методов исследования — как неинвазивных, так и инвазивных.
Наиболее распространён метод рентгенографии. Если позволяет
состояние пострадавшего, его обследуют стоя, затем — в положениях
лёжа на спине и на боку. При исследовании в вертикальном положе-
348 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 13
нии обращают внимание на наличие свободного газа под куполом
диафрагмы. Свободный газ лучше всего выявляется в положении на
левом боку при горизонтальном направлении рентгеновских лучей (ла-
терография).
Наличие свободной жидкости в брюшной полости
рентгенологически характеризуется появлением пристеночных лентовидных теней
в латеральных каналах и расширением межпетлевых промежутков,
особенно хорошо заметных на фоне пневматоза кишечника.
Обнаружение патологического содержимого в брюшной полости —
абсолютное показание к операции.
Забрюшинная гематома выглядит как диффузная тень, на фоне
которой исчезает тень подвздошно-поясничной мышцы (m. ileopsoas).
Забрюшинная гематома вызывает деформацию и смещение
мочевого пузыря, что хорошо видно на рентгенограмме. И всё же
рентгенологическое исследование продолжительно по времени, а его
диагностическая достоверность не превышает 70%.
УЗИ выявляет свободную жидкость в брюшной полости,
признаками которой является разобщение париетального и висцерального
листков брюшины в отлогих местах живота: чем больше жидкости
(крови) в брюшной полости, тем дальше отстоят друг от друга листки
брюшины (рис. 13-1). Отмечают также скопление жидкости между
петлями кишечника, особенно на фоне их пареза (рис. 13-2). Кроме
того, выявляют повреждения органов, которые ещё не привели к воз-
Рис. 13-1. Ультразвуковая сканограмма брюшной полости при наличии в ней
свободной жидкости: расширение межпетлевых промежутков.
Травма живота О 349
никновению внутрибрюшного кровотечения, в частности, подкап-
сульные и центральные гематомы печени, селезёнки (рис. 13-3), по
вреждения почек и поджелудочной железы.
Рис. 13-2. Ультразвуковая ска-
нограмма брюшной полости
при гемоперитонеуме. Видна
жидкость, «раздвигающая»
париетальный и висцеральный
листки брюшины.
Рис. 13-3, Ультразвуковая ска-
нограмма при подкапсульной
гематоме селезёнки.
350 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 13
КТ — объективный диагностический метод, наиболее точно
выявляющий характер повреждений паренхиматозных органов. При
этом на результаты исследования не влияет наличие пареза ЖКТ и
эмфиземы мягких тканей.
Ангиографию применяют для уточнения диагноза при
подозрении на повреждение внутриорганных кровеносных сосудов,
например при нарастающей центральной гематоме печени или гемоби-
лии (кровотечении по жёлчным путям в просвет
двенадцатиперстной кишки). В таких случаях селективная катетеризация печёночной
артерии с последующим контрастированием печёночного
артериального русла позволяет не только локализовать разрыв, но и
осуществить гемостаз путём эндоваскулярной эмболизации
повреждённого сосуда.
К сожалению, использование КТ и ангиографии возможно
только у пострадавших со стабильной гемодинамикой. Для выполнения
этих исследований необходимы сложное, дорогостоящее
оборудование и соответствующие специалисты. Каждое исследование
занимает от нескольких десятков минут до 1,5—2 ч. Всё это в значительной
степени ограничивает их применение при тяжёлой травме.
К инвазивным методам диагностики относят лапароцентез,
лапароскопию, а также уретроцистографию, используемую по
специальным показаниям.
Лапароцентез — достаточно простое, непродолжительное и
эффективное исследование, хотя для его безопасного проведения
необходим определённый опыт. При отсутствии такого опыта можно
травмировать подлежащую кишку либо (при неправильной методике)
получить ложный результат. Противопоказаниями к проведению ла-
пароцентеза считают резкое вздутие живота и наличие
множественных послеоперационных рубцов на передней брюшной стенке,
указывающих на существование спаечного процесса и фиксацию
кишечных петель.
Обнаружение примеси крови, кишечного содержимого, мочи или
мутного экссудата свидетельствует о повреждении внутренних
органов. Розовое окрашивание промывной жидкости, полученной из
боковых и нижних отделов живота, может быть связано с наличием
забрюшинной гематомы и пропотеванием крови через задний
листок брюшины. При сомнительных данных трубку троакара
извлекают, а катетер оставляют в брюшной полости. Наружный его
конец фиксируют ранее проведённой нитью-держалкой.
Накладывают стерильную повязку. Катетер может находиться в брюшной
Травма живота ♦ 351
полости до 2 сут, по нему можно осуществлять многократное
диагностическое промывание брюшной полости в течение 24 ч
после лапароцентеза. При сомнительных данных катетер можно
оставить для повторных промываний ещё на сутки. Полученную при
аспирации по катетеру жидкость при необходимости направляют
в лабораторию для оценки содержания эритроцитов,
лейкоцитов, амилазы.
Лапароскопию как инструментальный метод используют не
только в диагностических, но в отдельных случаях и в лечебных целях,
например для гемостаза при поверхностных повреждениях печени.
Лапароскопия позволяет визуально обследовать брюшную полость,
оценить степень повреждений и решить вопрос о необходимости ла-
паротомии.
В то же время, как и лапароцентез (первый и обязательный этап
лапароскопии), это исследование требует правильной техники
выполнения и интерпретации полученных данных, для чего необходим
опыт. Противопоказаниями к проведению лапароскопии также
считают резкое вздутие живота, наличие множественных рубцов на
передней брюшной стенке, а также крайне тяжёлое состояние
больного, обусловленное шоком, повреждением груди, головного мозга, т.к.
объём пневмоперитонеума существенно влияет не только на
функцию внешнего дыхания, но и на показатели гемодинамики.
Наложение большого пневмоперитонеума абсолютно противопоказано при
подозрении на разрыв диафрагмы, т.к. это быстро приведёт к напря
жённому пневмотораксу и гибели пострадавшего.
При подозрении на разрыв мочевого пузыря оценивают
результаты его катетеризации и по показаниям проводят рентгеноконт-
растную цистографию. Если при катетеризации получено более 1 л
кровянистой мочи, следует думать о внутрибрюшном разрыве
мочевого пузыря (поступление жидкости из брюшной полости). Но и
отсутствие этого признака не исключает разрыва. При неудачной
попытке проведения катетера в мочевой пузырь манипуляцию нужно
прекратить. Появление небольшого количества свежей крови при
этом свидетельствует о травме мочеиспускательного канала. В таких
случаях вместо цистографии проводят уретрографию. При урет-
рографии мочевой катетер проводят только до препятствия, затем
после введения 20 мл 20% раствора контрастного вещества делают
два снимка — в прямой и косой проекциях. Затекание контрастного
вещества за контуры мочеиспускательного канала свидетельствует
о травме уретры.
352 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦■ Глава 13
Лечение
Ранения живота, как проникающие, так и непроникающие,
подлежат хирургическому лечению. Исключение составляют
инфицированные поверхностные колото-резаные раны брюшной стенки
давностью более 24 ч. Такие раны не подвергают классической
первичной хирургической обработке, а обрабатывают раствором
антисептика, укрывают повязкой, за состоянием пострадавшего
активно наблюдают в течение ближайших 48 ч. Появление признаков
внутрибрюшного кровотечения или перитонита — показание к ла-
паротомии.
При закрытой травме живота тактика более дифференцирована.
Консервативному лечению подлежат пострадавшие с ушибами
брюшной стенки, внутриорганными гематомами паренхиматозных
органов, не имеющими тенденции к увеличению, небольшими и
стабильными субкапсулярными гематомами.
Пострадавших с повреждением почек при закрытой травме
живота в большинстве случаев также лечат консервативно. Исключение
составляют следующие больные:
|« с ясной клинической картиной внутреннего кровотечения;
• с массивной и длительной (более 24 ч) гематурией,
сопровождающейся нарастающей постгеморрагической анемией;
• с подтверждённым инструментальными методами (УЗИ, КТ,
ангиографией) тяжёлым повреждением почки вплоть до размозжения.
Комплекс консервативных мероприятий при закрытой травме
живота включает создание покоя, назначение дыхательных аналепти-
ков и терапию, направленную на профилактику и лечение органной
недостаточности. Большое значение имеют восполнение кровопоте-
ри, проведение противошоковых мероприятий, введение гемостати-
ческих средств, кардиотропных препаратов.
Забрюшинная гематома, возникшая вследствие переломов костей
таза или позвоночника, достигнув определённого объёма, обычно
далее не нарастает, кровотечение при этом останавливается. В таких
случаях показано консервативное лечение. Более того, вскрытие и
дренирование гематомы у этих больных может вновь спровоцировать
кровотечение. Консервативное лечение забрюшинной гематомы
направлено на коррекцию двух основных патологических комплексов:
раннего пареза ЖКТ, возникающего вследствие нейрорефлекторно-
го и механического воздействий на симпатическую и
парасимпатическую иннервацию корня брыжейки, а также эндогенной интокси-
Травма живота ♦ 353
кации вследствие всасывания продуктов распада элементов крови,
излившейся в забрюшинное пространство.
Лечение пареза ЖКТ включает постоянную декомпрессию и
эвакуацию содержимого ЖКТ (назогастральная и назоеюнальная
интубация с аспирацией, очистительные клизмы) на фоне
медикаментозной стимуляции и корригирующей инфузионной терапии.
При повышении содержания в плазме билирубина проводят де-
токсикационную терапию путём введения гемодеза, реополиглю-
кина и умеренных доз диуретиков (лазикс по 40—60 мг 2—3 раза
в сутки).
Наличие явных признаков внутрибрюшного кровотечения у
пострадавших с закрытой травмой живота служит абсолютным
показанием к немедленной операции вне зависимости от тяжести состояния
и показателей гемодинамики. Пострадавшего с клинической
картиной разрыва полого органа также необходимо незамедлительно
прооперировать. Однако в случае позднего поступления, при
развёрнутой клинической картине перитонита с интоксикацией,
электролитными нарушениями и нестабильной гемодинамикой необходима
кратковременная (не более 2-3 ч), но интенсивная
предоперационная подготовка, её основу составляет инфузионно-транфузион-
ная терапия.
Наконец, если у пострадавшего с тяжёлой сочетанной травмой,
находящегося в состоянии травматического шока, обнаружен разрыв
мочевого пузыря, операция по этому поводу может быть отложена до
выведения пациента из шока.
При явных признаках проникающего ранения живота операцию
начинают со срединной лапаротомии. Во всех остальных случаях
проводят первичную хирургическую обработку раны. Её задачи — не
только удаление нежизнеспособных тканей, гемостаз и наложение
швов, но и окончательное установление типа ранения (проникающее
или нет).
Наличие дефекта брюшины — показание к срединной
лапаротомии. С учётом того, что до окончания первичной
хирургической обработки нельзя сделать вывод о необходимости
лапаротомии, обработку ран следует проводить под эндотрахеальным
наркозом с миорелаксантами. Такая практика целесообразна по двум
причинам.
• Во-первых, в этих случаях снимается проблема расширения раны в
ходе первичной хирургической обработки (если необходимость в
этом возникает).
354 ♦ Хирургические болезни ♦ Том 1 О- Часть II О Глава 13
• Во-вторых, в случаях, когда показана лапаротомия, отпадает
необходимость в переходе от местной анестезии к общему
обезболиванию. Пострадавшим перед наркозом в обязательном порядке
вводят желудочный зонд, а после введения в наркоз
катетеризируют мочевой пузырь.
Принцип оперативного лечения повреждений живота — строгое
соблюдение этапов хирургического вмешательства. Отступление от
этого может стать причиной осложнений во время операции и после
её завершения, вплоть до гибели пострадавшего.
Этапы оперативного вмешательства при травме живота:
• обработка эвентрированных органов;
• выполнение доступа;
• временный гемостаз и эвакуация крови;
• ревизия органов брюшной полости;
• начало реинфузии крови;
• выполнение основного объёма операции на повреждённых
органах;
• санация и дренирование брюшной полости;
• ушивание лапаротомной раны.
Обработка эвентрированных органов
Выпавшие наружу петли кишки и рану под общим
обезболиванием обрабатывают тёплым изотоническим раствором хлорида натрия,
а затем раствором антисептика. Если кишка не повреждена, её
вправляют в брюшную полость, а рану временно тампонируют стерильной
салфеткой. Повреждённую петлю окутывают салфеткой и оставляют
временно на передней брюшной стенке. Выпавшую прядь сальника
в любом случае перевязывают и отсекают, не вправляя в брюшную
полость, рану прикрывают салфеткой.
Доступ
Во всех случаях выполняют срединную лапаротомию (обычно от
мечевидного отростка до точки на 4 см ниже пупка). Необходимость
столь широкого доступа обусловлена тем, что у пострадавших с про-
фузным внутрибрюшным кровотечением никогда нельзя определить
заранее объём и локализацию повреждений. Через небольшой
доступ невозможно осуществить полноценную ревизию и свободное
вмешательство на органах. В таких случаях хирургу приходится
тратить время на расширение доступа.
Временный гемостаз и эвакуация крови
В момент вскрытия брюшной полости кровотечение из
повреждённых сосудов за счёт снижения внутрибрюшного давления
усиливается. В связи с этим анестезиолог принимает меры по поддержанию
гемодинамики, хирург быстро осуществляет временную остановку
кровотечения, а ассистент проводит эвакуацию крови из брюшной
полости. При этом кровь необходимо собирать в стерильную ёмкость с тем,
чтобы в дальнейшем, после выяснения характера повреждений,
постараться вернуть её в кровеносное русло — выполнить реинфузию.
Наиболее простой приём временного гемостаза заключается в пережатии
кровоточащего сосуда пальцами. Временного гемостаза при
повреждениях печени и селезёнки достигают путём пережатия печёночно-две-
надцатиперстной связки или ножки селезёнки. Чтобы остановить
кровотечение из аорты, её забрюшинно расположенных висцеральных
ветвей, подвздошных артерий, а также нижней полой вены и её
ветвей, следует сначала прижать рану пальцем или всей ладонью к кости
(позвоночнику, костям таза и т.п.), а затем выделить сосуды прокси-
мальнее и дистальнее раны. Наложение на выделенные участки
крупного кровеносного сосуда турникетов из тесьмы и эластичных
пластиковых трубок надёжно останавливает кровотечение, и хирург в
спокойной обстановке продолжает операцию. Если все эти приёмы
недостаточно эффективны и кровотечение продолжается, следует
рукой придавить аорту к позвоночнику тотчас ниже диафрагмы.
Ревизия органов брюшной полости
Убедившись в достижении временного гемостаза и собрав кровь
из брюшной полости, приступают к тщательной ревизии органов. Её
лучше начинать с полых органов, поскольку обнаружение их
повреждений позволит, во-первых, осуществить изоляцию мест травмы, тем
самым прекратив постоянное инфицирование брюшной полости, а
во-вторых, решить вопрос о допустимости реинфузии крови,
собранной из брюшной полости.
Перед ревизией брюшной полости необходима новокаиновая
блокада корня брыжейки тонкой, поперечной ободочной и
сигмовидной кишок (200 мл 0,25% раствора прокаина). Ревизию начинают
с желудка. При любом повреждении передней стенки желудка,
двенадцатиперстной кишки или поджелудочной железы следует
широко рассечь желудочно-ободочную связку и осмотреть заднюю стенку
желудка, поджелудочную железу и двенадцатиперстную кишку.
356 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 13
Повреждение двенадцатиперстной кишки распознают по
жёлчному прокрашиванию забрюшинного пространства и присутствию в
нём пузырьков газа. Диагностику повреждения двенадцатиперстной
кишки можно облегчить интраоперационным введением через
желудочный зонд раствора метилтиониния хлорида. При наличии
повреждения двенадцатиперстной кишки её заднюю стенку нужно
внимательно осмотреть после мобилизации по Кохеру: в вертикальном
направлении вдоль латерального края двенадцатиперстной кишки
рассекают брюшину, высвобождают кишку из её ложа тупым путём с
помощью тупфера. При этом необходимо соблюдать осторожность,
чтобы не повредить нижнюю полую вену, расположенную
непосредственно за кишкой.
Ревизию тонкой кишки начинают с первой петли, находящейся у
корня брыжейки поперечной ободочной кишки несколько левее
позвоночника (область связки Трейтца). Затем петли тонкой кишки
последовательно извлекают, осматривают и погружают в брюшную
полость. При проведении операции в поздние сроки после травмы
(через 12-24 ч) обнаружить даже незначительные повреждения
тонкой кишки можно по наличию в этих зонах воспалительной
инфильтрации. Сгустки крови на стенке кишки могут прикрывать рану.
Большие субсерозные гематомы следует вскрывать с целью исключения
их сообщения с просветом кишки. С особенным вниманием нужно
осмотреть брыжеечный край кишки, где гематома часто маскирует
место перфорации.
Приступая к ревизии толстой кишки, сначала исследуют илеоце-
кальный угол. При подозрении на повреждение забрюшинного
отдела толстой кишки рассекают брюшину по наружному краю кишки на
протяжении 15—20 см. Показания к мобилизации фиксированных
отделов толстой кишки: обнаружение точечных кровоизлияний,
гематом, кровоподтёков на заднем листке брюшины, а также ранения,
если направление раневого канала говорит о возможности
повреждения забрюшинной части толстой кишки. К местам обнаруженных
повреждений временно подводят изолирующие тампоны.
Ревизию полых органов заканчивают осмотром прямой кишки и
мочевого пузыря. В ходе ревизии ушивать дефекты органов не
следует, поскольку может возникнуть необходимость в резекции какого-
либо из них.
Ревизию печени проводят визуально и пальпаторно. После паль-
паторной ревизии и определения локализации травмы для осмотра
диафрагмальной поверхности печени необходимо осуществить мо-
Травма живота О 357
билизацию органа. Для мобилизации левой доли печени её
оттесняют вниз и вправо, пересекают левую треугольную связку и часть
венечной связки. Поскольку в связках иногда проходят мелкие
жёлчные протоки, на них предварительно накладывают зажимы и
перевязывают кетгутом. Аналогичным образом, но оттягивая печень
вниз и влево за правую долю, пересекают правую треугольную связку
для мобилизации правой доли печени. Технически проще пересечь
серповидную связку, однако необходимо иметь в виду, что в случае
портальной гипертензии в ней могут проходить крупные сосуды.
Поэтому лигирование серповидной связки обязательно. При травме
нижнезадней поверхности печени необходимо пересечь печёночно-
почечную связку. Для этого печень поднимают кверху, связка при этом
натягивается, её рассекают. Сосудов она не содержит.
При тяжёлом кровотечении из печени, если пережатие печёноч-
но-двенадцатиперстной связки не дало эффекта, с целью полного
выключения печени из кровообращения временно пережимают
нижнюю полую вену. Её пережимают выше и ниже печени с помощью
турникетов. Для пережатия полой вены ниже печени
двенадцатиперстную кишку мобилизуют по Кохеру и отводят медиально, открывая
доступ к нижней полой вене выше почечных сосудов. Пережатие
нижней полой вены выше печени требует выполнения торакофренола-
паротомии. Взятые на держалки края диафрагмы широко разводят и,
отодвигая печень кпереди, с помощью диссектора подводят
турникет вокруг этого короткого участка нижней полой вены. Полное
выключение печени из кровообращения возможно не более чем на 20 мин.
Селезёнка. Отводят зеркалом влево брюшную стенку и при этом
подтягивая желудок вправо, визуально и пальпаторно исследуют
селезёнку. Наличие сгустков в области органа указывает на его
повреждение. Для обнажения сосудистой ножки вдоль желудочно-ободоч-
ной связки (ближе к поперечной ободочной кишке) раскрывают
дистальную часть сальниковой сумки, рассекая желудочно-ободоч-
ную связку. Вокруг сосудистой ножки с помощью диссектора
подводят турникет или на артерию и вену накладывают мягкий
сосудистый зажим, что обеспечивает остановку кровотока.
Поджелудочная железа. Для её обзора широко рассекают желудоч-
но-ободочную связку, перевязывая сосуды по её длиннику. Чтобы не
нарушить кровоснабжение желудка, рассечение выполняют между
желудочно-сальниковыми артериями и толстой кишкой.
Приподнимая желудок кверху и оттесняя книзу поперечную ободочную кишку,
обнажают поджелудочную железу на всём протяжении.
358 ♦ Хирургические болезни -О- Том 1 ♦ Часть II ♦ Глава 13
Забрюшинная гематома. Забрюшинная гематома подлежит
ревизии при любом ранении (холодным или огнестрельным оружием).
При закрытой травме живота забрюшинную гематому не вскрывают,
если пальпаторно целостность почек не вызывает сомнений,
гематома не нарастает на глазах и её причина очевидна — перелом костей
таза или позвоночника.
Быстрое нарастание гематомы, свидетельствующее о возможном
повреждении крупных сосудов, кровотечение из этой гематомы в
свободную брюшную полость, подозрение на разрыв нижней полой вены
или разрыв почки — показания к её ревизии. После тракции вверх
илеоцекального угла и смещения петель тонкой кишки над
гематомой рассекают задний листок брюшины, на обильно кровоточащие
(пульсирующей струёй) сосуды накладывают кровоостанавливающие
зажимы. Венозное и капиллярное кровотечение временно
останавливают тугой тампонадой.
Реинфузия крови
Показание к реинфузии крови — кровопотеря более 500 мл. Кровь,
излившаяся в брюшную полость, даже через 24 ч пригодна для
реинфузии по жизненным показаниям. Кровь собирают с помощью
специального аппарата для реинфузии либо отсосами в стандартные
флаконы для переливания крови.
Реинфузия крови по сравнению с переливанием донорской крови
и её компонентов имеет значительные преимущества. Её можно
быстро использовать, не определяя группу и индивидуальную
совместимость; в сосудистое русло возвращается собственная кровь,
участвующая в переносе кислорода и содержащая ферменты и иммунные
тела данного пострадавшего, что повышает сопротивляемость
организма в раннем послеоперационном периоде; исключён риск
перенесения вирусных заболеваний (в том числе СПИДа) и
индивидуальной непереносимости.
Противопоказания к реинфузии крови — сопутствующее
повреждение полых органов, длительный (более 24 ч) срок с момента
травмы и выраженный гемолиз. Если всё же произошла
непреднамеренная реинфузия контаминированной крови (например, при не
замеченном ранее повреждении полого органа), пострадавшему в
послеоперационном периоде назначают массивную антибактериальную
терапию, как правило, быстро устраняющую бактериемию, сепсис
при этом не развивается. В то же время попытки санации реинфузи-
руемой крови путём добавления непосредственно в нее антибиоти-
Травма живота О 359
в очень опасны, поскольку быстрая гибель микроорганизмов в
таком случае приведёт к массивному выбросу эндотоксинов и
развитию эндотоксического шока.
Операция на повреждённых органах
Печень. При небольших линейных ранах для гемостаза
применяют П-образные швы. Их следует накладывать в поперечном
направлении по отношению к сосудам и жёлчным протокам печени. Для
наложения швов на паренхиму необходимо применять викрил или
кетгут № 4 на атравматической игле. В случае отсутствия атравмати-
ческого материала можно использовать круглую иглу с нитью № 4
или №6. Применение нерассасывающегося шовного материала для
наложения швов на ткань вызывает длительную воспалительную
реакцию, нередко абсцедирование, что приводит к необходимости
повторной операции и удаления шовного материала, воспринимаемого
организмом как инородное тело.
В случае слепых огнестрельных ранений в ткани печени на
разной глубине находятся пули, их фрагменты, осколки, дробь и т.п.
Легко достижимые инородные тела лучше удалить, если же для этого
требуется очень травматичный доступ, их оставляют, при этом
удаляют все нежизнеспособные ткани и надёжно дренируют зону
повреждения.
У пострадавших с рваными и огнестрельными ранами печени
иссекают их края и удаляют нежизнеспособные участки, а затем на обе
стороны дефекта накладывают гемостатические П-образные швы,
отступя от края раны не менее чем на 0,5 см. По достижении гемо- и
желчестаза края дефекта сближают послойно накладываемыми
непрерывными или П-образными узловыми швами, заходя за линию
гемостатических швов (расстояние от края раны — не менее 1 см); их
используют для уменьшения нагрузки на рыхлую ткань печени. При
прорезывании гемостатических швов под них подкладывают
синтетические рассасывающиеся пленки. В случае невозможности
сближения краёв раны или прорезывании швов дефект ткани
тампонируют прядью сальника, узлы завязывают поверх неё. Дефект в области
серповидной связки можно укрыть ею же после её мобилизации.
Для закрытой травмы характерны самые разнообразные
повреждения печени — от небольших краевых разрывов до фрагментации
органа, причём фрагменты имеют различную степень
жизнеспособности. Наиболее часто, в 60—70% случаев, встречают неправильной
формы разрывы капсулы и паренхимы с истечением крови и жёлчи.
360 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 13
Размозжение нескольких сегментов, напротив, встречают всего в 1-
2% наблюдений. Нередко при закрытой травме живота встречают
большие подкапсульные гематомы, представляющие собой разрыв
паренхимы при сохранённой капсуле (15—20% случаев). Подкапсуль-
ная гематома выглядит как флюктуирующее плоское образование
тёмного цвета, расположенное под капсулой Глиссона. Ввиду высокой
вероятности двухэтапного разрыва такие гематомы следует
опорожнить, осуществляя гемостаз одним из указанных выше способов.
Особую форму закрытой травмы печени представляют внутрипечёноч-
ные гематомы (10-12% случаев). Их трудно диагностировать даже при
лапаротомии, поскольку внешне печень может быть не изменена.
Косвенным внешним признаком внутрипечёночной гематомы может
быть участок кровоизлияния тёмного цвета или небольшая
звёздчатая трещина капсулы. В любом случае внутрипечёночная гематома
подлежит консервативному лечению и динамическому наблюдению.
При наличии больших и глубоких трещин печени без
повреждений крупных сосудов необходимо использовать гепатопексию с
целью создания замкнутого изолированного пространства. Гепатопек-
сия по Киари-Алфёрову-Николаеву показана также при ранах или
разрывах на диафрагмальной либо нижнедорсальной поверхности
печени. Операция заключается в фиксации свободного края
соответствующей доли печени от круглой до треугольной связки к
диафрагме по линии её прикрепления к грудной стенке (при разрывах
диафрагмальной поверхности печени) или к заднему листку париетальной
брюшины (при травме на нижней поверхности). После такой
операции искусственно создаётся замкнутое щелевидное пространство
размером 15-25 см, при этом к линии швов в поддиафрагмальное или
подпечёночное пространство подводят двухпросветные дренажи для
оттока раневого отделяемого.
У пострадавших с разрывами печени, сопровождающимися профуз-
ным кровотечением, перечисленными выше приёмами не всегда
удаётся добиться полного гемостаза, особенно при значительном
разрушении её паренхимы и наличии гемобилии. В таких случаях, если
временное пережатие печёночно-двенадцатиперстной связки дало
достаточный гемостатический эффект, можно попытаться интраопера-
ционно выполнить эмболизацию. Если же такой возможности нет,
печёночную артерию перевязывают. Для этого диссектором по
верхнему краю печёночно-двенадцатиперстной связки выделяют общую и
собственную печёночные и пузырную артерии. Собственную
печёночную артерию перевязывают дистальнее места отхождения пузырной
Травма живота ♦ 361
артерии викрилом (во избежание некроза жёлчного пузыря с
необходимостью холецистэктомии). Особо подчеркнём, что перевязка
печёночной артерии сама по себе в 20—25% случаев заканчивается
летальным исходом ввиду развития множественных мелких сегментарных
некрозов, поэтому к ней можно прибегать только в крайних случаях.
При обширных разрывах в части случаев паренхима печени
представлена отдельными фрагментами, связанными друг с другом
только сосудисто-секреторными ножками. Удаление таких фрагментов
после раздельной перевязки сосудов и жёлчных протоков не
представляет сложности. Раневую поверхность печени прикрывают
прядью большого сальника, фиксируя его к капсуле печени
отдельными швами.
Травмированные участки печени с сомнительной
жизнеспособностью необходимо удалять, начиная из глубины разрыва. При этом
пальцами тупо разделяют участки ткани, ощущая натяжение
кровеносных сосудов и жёлчных протоков (этот приём называют дигитоклази-
ей), а затем прошивают и перевязывают викрилом сосуды и протоки.
Для достижения гемостаза при глубоких и кровоточащих
разрывах следует идти на частичное разделение печени по ходу портальных
щелей. Ассистент осторожно отводит край печени, а хирург
пальцами левой руки, идя по ходу сосудисто-секреторного пучка,
постепенно выделяет в паренхиме в зоне повреждения сосуды и жёлчные
протоки. После обнаружения источника кровотечения сосуд вместе с
прилежащим участком паренхимы печени прошивают обвивным вик-
риловым или кетгутовым швом на атравматической игле.
После окончательной остановки кровотечения постепенно
ослабляют турникет на печёночно-двенадцатиперстной связке, наблюдая
в течение 10-15 мин за изменением окраски печени. Появление
тёмно-багрового или серого цвета свидетельствует о нарушении
кровоснабжения и необходимости удаления соответствующего сегмента.
При большой кровопотере, нестабильной гемодинамике это
технически сложное и травматичное вмешательство следует отложить на
2-3 сут, пока не стабилизируется состояние пострадавшего или он
не будет доставлен в специализированный стационар. Необходимо
помнить, что при выполнении таких расширенных вмешательств
резко возрастает летальность (до 60—80%).
Если сосудисто-секреторные ножки выделить невозможно и
продолжается кровотечение, в виде исключения можно применить
тугую тампонаду раны с помощью пяти-шести марлевых тампонов,
выводимых через контрапертуру в правом подреберье.
362 О Хирургические болезни ♦ Том 1 О Часть II ♦ Глава 13
При тяжёлой травме обеих долей печени и профузном
кровотечении на фоне множественных и сочетанных повреждений также
применяют тугую тампонаду марлевыми тампонами. Во всех случаях
тяжёлой травмы печени, в том числе при тугой тампонаде, показаны
дренирование поддиафрагмального и подпечёночного пространств
двухпросветными силиконовыми трубками и обязательная
декомпрессия желчевыводящих путей наружным дренированием общего
жёлчного протока по Керу, или, в крайнем случае, путём наложения
холецистостомы.
Селезёнка. Небольшие (около 2 см в диаметре) гематомы не
требуют хирургического вмешательства, однако в зоне их расположения
необходимо на 5—6 дней оставить дренажи. Гематомы, занимающие
полюс селезёнки либо её тело, подлежат вскрытию и остановке
кровотечения, в случае неудачи прибегают к спленэктомии.
В настоящее время спленэктомию выполняют большинству
пострадавших. В то же время удаление селезёнки чревато развитием
значительных иммунных нарушений и опасностью возникновения по-
стспленэктомического сепсиса. Поэтому большое значение
имеет сохранение максимального количества ткани селезёнки при её
повреждении. С другой стороны, органосохраняющие операции на
селезёнке связаны с трудностями гемостаза, поэтому их
выполнение не должно быть самоцелью. Необходимо учитывать тяжесть
состояния пострадавшего и не подвергать его жизнь
дополнительному риску.
Наложение швов — надёжный гемостатический приём лишь при
небольших, поверхностных ранах селезёнки. Безуспешность
применения спленорафии при глубоких ранах привела к разработке
бесшовных способов гемостаза. Гемостатический эффект данных
методов обусловлен термическим воздействием на сосуды и
паренхиму селезёнки. К ним относят лазерную, плазменную,
инфракрасную, электрическую и криогенную коагуляции, а также горячий
воздух или горячие тампоны. Гемостатический эффект
расфокусированного лазерного луча обусловлен тромбированием сосудов в
зоне некротических изменений. Луч лазера вызывает в
биологических тканях вскипание и испарение жидкой части со сгоранием или
обугливанием плотных органических и неорганических субстанций.
Положительные стороны применения лазерного луча — его анти-
септичность и быстрота выполнения манипуляции. К недостаткам
следует отнести высокую стоимость аппаратуры, сложность в
обращении и трудность коагуляции ран задней поверхности селе-
Травма живота ♦ 363
зенки, отсутствие гемостатического эффекта при кровотечении из
крупных сосудов.
После спленэктомии осматривают ложе селезёнки, коагулируют
сосуды на поверхности диафрагмы. Небольшие кровоточащие
сосуды ушивают. В поддиафрагмальное пространство подводят дренаж,
выводимый на переднюю брюшную стенку в левом подреберье.
Поджелудочная железа. Несмотря на использование комплексных
методов обследования, повреждения поджелудочной железы до
операции выявляют редко, вследствие чего оперативное вмешательство
часто проводят на фоне воспалительных изменений. Даже во время
операции трудно оценить степень травматических изменений
железы в результате её контузии.
Небольшие субкапсулярные гематомы (до 2 см), не
распространяющиеся на паренхиму, не требуют специального лечения. При
больших гематомах (более 2 см), распространяющихся на паренхиму
железы в виде геморрагического пропитывания, для промывания зоны
травмы железы и удаления секвестров, а также для адекватного
оттока в случае образования панкреатического свища необходимо
выполнить дренирование сальниковой сумки. Дренажную трубку
укладывают вдоль ушибленной части железы в направлении от головки к
телу и хвосту и выводят справа на переднюю брюшную стенку. Для
свободного отхождения секвестров диаметр трубки должен
составлять не менее 10-12 мм.
При локализации процесса в области головки поджелудочной
железы показано наложение холецистостомы. Участки
нежизнеспособных тканей при позднем оперативном вмешательстве нужно
удалять.
При краевом повреждении поджелудочной железы на рану
накладывают узловые нерассасывающиеся швы (№3/0) атравматической
иглой. Ушивание глубоких разрывов поджелудочной железы чревато
нанесением дополнительной травмы. Нарушение кровоснабжения
железы и лигирование периферической протоковой системы
создают предпосылки для развития панкреонекроза. Поэтому при
наложении швов на поджелудочную железу дренирование сальниковой
сумки обязательно.
Наибольшую сложность представляет лечение разрывов железы с
повреждением панкреатического протока. При этом объём
хирургического вмешательства зависит от локализации повреждения. При
повреждении поджелудочной железы и её протоков в области тела и
хвоста проводят дистальную резекцию органа.
364 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 13
При резекции поджелудочной железы проксимальный отдел
панкреатического протока необходимо перевязывать нерассасывающим-
ся шовным материалом, а культю железы ушивать узловыми нерас-
сасывающимися швами на атравматической игле. Стремление
сохранить дистальную часть железы не всегда обосновано, если учесть
риск развития осложнений, нередко заканчивающихся летально.
Поэтому дистальная резекция поджелудочной железы при её травме
предпочтительнее дистальной панкреатоеюностомии, поскольку она
предупреждает возможность развития тяжёлого панкреатита в зоне
ушибленной части железы, секвестрации, развития флегмоны забрю-
шинной клетчатки и аррозионного кровотечения. Несмотря на
расширенное вмешательство в связи с удалением значительного
количества островков Лангерханса, дистальная резекция не влечёт за собой
эндокринной недостаточности.
При изолированном разрыве головки поджелудочной железы
вмешательство следует ограничить дренированием зоны повреждения и
ориентироваться на формирование наружного панкреатического
свища. В таких случаях, если свищ не закрылся самостоятельно, нередко
приходится выполнять реконструктивные оперативные вмешательства.
Наиболее сложны в плане тактики сочетанные повреждения
двенадцатиперстной кишки и поджелудочной железы, требующие
наряду с дренированием сальниковой сумки и забрюшинной
клетчатки наложения холецистостомы, выключения двенадцатиперстной
кишки с наложением гастроэнтероанастомоза и дистальной резекции
поджелудочной железы (при нарушении целостности
панкреатического протока). Полное размозжение двенадцатиперстной кишки и
головки поджелудочной железы — показание к панкреатодуоденаль-
ной резекции. Однако подобные вмешательства отличаются крайне
высокой летальностью (60—100%).
Почки. Удаление почки показано в случаях отрыва её ножки,
разрыва в нескольких местах. Ставя показания к нефрэктомии, следует
убедиться в функционировании второй почки. Для этого ножку
травмированной почки пережимают зажимом или турникетом, а затем
внутривенно вводят 5 мл раствора индигокармина. Появление из
установленного в мочевом пузыре катетера окрашенной мочи
свидетельствует о сохранности функций второй почки. При этом
необходимо помнить, что у пострадавшего с тяжёлой сочетанной травмой и
шоком при АД ниже 80 мм рт. ст. функции второй почки могут быть
резко снижены. В таких случаях приходится руководствоваться
результатами осмотра и пальпации второй почки.
Травма живота ♦ 365
При тяжёлом повреждении единственной почки нужно
стремиться её сохранить, перевязать сегментарные сосуды, наложить неф-
ростому и надёжно дренировать паранефральное пространство.
После удаления почки лапаротомным доступом задний листок
брюшины ушивают узловыми швами, при этом предварительно пара-
нефральную клетчатку дренируют через контрапертуру в
поясничной области.
Повреждение полых органов требует применения
дифференцированной тактики в зависимости от выраженности перитонита. Так,
если отсутствуют признаки распространённого гнойного
перитонита, показано наложение кишечного шва, в то время как при
запущенном гнойном или каловом перитоните необходимо выведение
повреждённой кишки наружу. При наложении швов на резко
изменённую стенку кишки в большинстве случаев развивается их несос
тоятельность, что приводит к гибели больного.
Желудок. При закрытой травме в пределах неповреждённых
тканей рассекают серозную и мышечную оболочки, путём обкалывания
лигируют сосуды под слизистого слоя, после чего рассекают
слизистую оболочку и удаляют нежизнеспособные ткани. Накладывают
двухрядный шов. Свежую резаную рану ушивают без иссечения, но
обязательным лигированием кровоточащих сосудов.
Двенадцатиперстная кишка. При её ранении необходимо ушить
рану двухрядным швом и дренировать забрюшинное пространство
широким дренажем, выведенным через контрапертуру. Обязательно
в просвете желудка оставляют зонд для постоянной аспирации с
целью устранения дуоденостаза.
Наличие обширной раны кишки диктует необходимость её
выключения из пассажа пищи и желудочного сока. Для этого можно
применить временное ушивание наглухо слизистой оболочки кишки
изнутри с наложением гастроеюноанастомоза. Когда ушивание раны
кишки невозможно, её пересекают в области привратника,
резецируют дистальную половину желудка (при сопутствующей язвенной
болезни двенадцатиперстной кишки следует резецировать не менее
двух третей желудка), культю желудка соединяют анастомозом с
тонкой кишкой. Если рана двенадцатиперстной кишки локализуется
не в самом начальном отделе, её культю ушивают как при обычной
резекции желудка, а в рану вводят силиконовый (лучше двухпрос-
ветный) дренаж, фиксируя швом к краю раны кишки. Зону
повреждения отгораживают от свободной брюшной полости марлевым
тампонами, которые вместе с дренажем выводят наружу через от
366 ♦ Хирургические болезни О Том 1 ♦ Часть II -♦• Глава 13
носительно узкую контрапертуру. Для утилизации
пищеварительных соков, которые в послеоперационном периоде получают по
дренажной трубке, находящейся в двенадцатиперстной кишке,
проводят назоеюнальную интубацию.
Тонкая кишка. Небольшие субсерозные гематомы после
рассечения погружают в стенку кишки серозно-мышечными узловыми
швами из нерассасывающегося материала в поперечном по отношению
к ходу кишки направлении. На лишённые серозной оболочки
участки накладывают такие же швы. На раны тонкой кишки после
экономного иссечения имбибированных кровью краёв накладывают в
поперечном направлении двухрядные швы. При наличии на одной
петле нескольких ран, отрыве кишки от брыжейки на протяжении
более 5 см, а также при её сомнительной жизнеспособности после
перевязки повреждённого сосуда необходима резекция петли с
наложением анастомоза. При резекции подвздошной кишки, если
терминальный (отводящий) её участок не превышает 5—8 см, анастомоз в
этом месте накладывать не следует во избежание нарушения
кровоснабжения. Оставшийся короткий отводящий конец ушивают
наглухо, а приводящий анастомозируют с восходящей ободочной кишкой
по типу «конец в бок».
В условиях гнойного перитонита кишку в месте повреждения
следует рассечь вместе с брыжейкой, затем оба её конца вывести наружу
через контрапертуры в передней брюшной стенке. При наличии на
одной петле нескольких ран в условиях гнойного перитонита или
отрыве тонкой кишки от брыжейки необходимо резецировать
повреждённый участок кишки, а оба её конца также вывести наружу.
Толстая кишка. Небольшие субсерозные гематомы погружают в
складку с помощью узловых серозно-мышечных швов. Десерозиро-
ванные участки ушивают такими же швами. Раны толстой кишки
ушивают по тем же принципам, что и тонкой, двухрядными швами.
Применение трёхрядного шва нецелесообразно ввиду ухудшения
кровоснабжения кишечной стенки.
При обширных повреждениях стенки кишки, наличии
нескольких близко расположенных ран, нарушении питания стенки кишки
её мобилизуют (после отграничения зоны ранения двумя
пережимающими кишку зажимами и введения в рану марлевой салфетки)
рассечением брюшины вдоль латерального края кишки от задней
брюшной стенки и резецируют. Резекцию восходящей ободочной кишки
заканчивают созданием илеотрансверзанастомоза. Эти операции
допустимы в ранние сроки (до 4 ч с момента травмы) и в относитель-
Травма живота ♦ 367
но чистой брюшной полости. В более поздние сроки и в условиях
загрязнения брюшной полости кровью и кишечным содержимым
участок повреждённой толстой кишки резецируют с выведением её
концов наружу.
В случае невозможности мобилизовать кишку нужно ушить рану,
изолировать зону повреждения тампонами с подведением широкой
дренажной трубки через широкую контрапертуру. Проксимальнее
повреждения накладывают полный кишечный свищ по типу
концевой стомы.
При повреждении прямой кишки следует по возможности ушить
дефект кишечной стенки, отграничить зону повреждения
тампонами, со стороны промежности дренировать параректальную клетчатку,
пересечь сигмовидную кишку и вывести её в виде концевой стомы.
Мочевой пузырь. При повреждении только забрюшинной части
мочевого пузыря его нужно вскрыть в области передней стенки
между двумя ранее наложенными держалками (этот разрез затем
используют для наложения эпицистостомы). Ревизию удобнее проводить
изнутри, поскольку околопузырная клетчатка со стороны разрыва
бывает резко инфильтрирована. После этого в области разрыва
широко вскрывают околопузырную клетчатку, удаляют некротические
ткани, на дефект пузыря накладывают двухрядный шов без
прошивания слизистой оболочки. Раны, расположенные низко (у
основания мочевого пузыря), удобнее ушивать изнутри.
Операцию заканчивают наложением эпицистостомы. С целью
дренирования околопузырной клетчатки при забрюшинных разрывах
выводят дренажную трубку через контрапертуру на передней
брюшной стенке — если есть возможность наладить постоянную
аспирацию. Если постоянной аспирации нет, дренировать околопузырную
клетчатку следует снизу через запирательное отверстие (по Буяльс-
кому-Мак Уортеру). При повреждении передней стенки показано
дренирование предпузырной клетчатки.
Дренирование брюшной полости
Дренирование брюшной полости следует осуществлять, исходя из
особенностей распространения инфицированной жидкости, её
вероятного скопления и руководствуясь анатомическим рельефом
брюшины. Для создания эффективной системы дренирования наружный
конец дренажа должен находиться на 30—40 см ниже уровня самой
нижней точки брюшной полости.
368 ♦ Хирургические болезни ♦ Том 1 <0 Часть II ♦ Глава 13
Ушивание лапаротомной раны
При обширном загрязнении мягких тканей брюшной стенки
кишечным содержимым следует наложить непрерывный шов на
брюшину, а затем тщательно промыть мягкие ткани раствором
антисептика, наложить швы на апоневроз и дренировать подкожную жировую
клетчатку трубкой с многочисленными боковыми отверстиями.
Наружный конец трубки соединяют с ёмкостью, в которой
поддерживают разрежение (дренирование по Редону). Инфицированный
экссудат, обрывки тканей и остатки крови, служащие, как известно,
прекрасной питательной средой для микроорганизмов, под
действием разрежения аспирируются в эту ёмкость, что предупреждает
нагноение тканей передней брюшной стенки.
Послеоперационный период
Ведение пострадавших, оперированных по поводу проникающих
повреждений живота, при неосложнённом течении не отличается от
ведения больных после любой лапаротомии. В то же время, в
ближайшем и отдалённом послеоперационных периодах могут
развиться различные осложнения: перитонит, непроходимость кишечника,
кишечные свищи, абсцессы брюшной полости и забрюшинного
пространства, послеоперационные грыжи. О возможности их
возникновения следует помнить и предпринимать необходимые меры для их
предотвращения.
Пострадавшие с непроникающими ранениями живота могут быть
выписаны на амбулаторное лечение через 2 сут. Лица, подвергшиеся
лапаротомии, при которой не было обнаружено повреждения
внутренних органов, после снятия швов могут быть выписаны на 7-10-е
сутки. При повреждении внутренних органов (если
послеоперационные осложнения отсутствуют) больных обычно выписывают на 14-
15-е сутки.
Пострадавших, перенёсших перитонит, с наружными кишечными
свищами необходимо наблюдать в условиях стационара в течение 3—
4 нед и более. Возникновение мочевых, панкреатических, жёлчных
свищей, а также глубоких гнойных свищей (параректальных, забрю-
шинных и т.д.) требует в ряде случаев более длительного
стационарного лечения. Наличие лигатурных поверхностных свищей не считают
противопоказанием для выписки больного на амбулаторное лечение.
При сочетанных повреждениях живота срок пребывания
пострадавших в стационаре зависит от вида и тяжести сочетанной травмы.
* * *
Травма живота ♦ 369
Благоприятные результаты лечения пострадавших с травмой
живота зависят от безошибочной диагностики, своевременно и
адекватно выполненного хирургического вмешательства, безукоризненно
проведённого послеоперационного периода. Кроме того,
необходимо проведение оптимальных лечебных мероприятий сочетанных
повреждений. Это возможно лишь при слаженной работе
представителей различных медицинских специальностей — хирургов,
травматологов-ортопедов, нейрохирургов, анестезиологов, реаниматологов,
терапевтов, специалистов лучевой диагностики.
\JL rrtflifl гнойный перитонит
Перитонит — воспаление брюшины. Это общее определение,
и следовательно, оно может иметь широкое толкование. Слово
«перитонит» известно не только в медицинской среде, но и на бытовом
уровне. В сознании больных и их родственников это слово нередко
обретает фатальный смысл, если употребляется как основа, главная
сущность диагноза. Вместе с тем, существуют и относительно
лёгкие, реактивные формы местного перитонита в ответ на
воспалительные заболевания или повреждения органов брюшной полости,
когда излечение больных достигается одной лишь своевременной
и адекватно выполненной операцией. В абсолютном своём
большинстве перитонит проявляется как вторичное патологическое
состояние, осложняющее течение первичного патологического процесса,
травмы либо заболевания, приведшего к образованию источника —
воспалительной или травматической деструкции органов брюшной
полости. Тяжесть перитонита в решающей мере определяется
характером источника и ещё в большей степени зависит от длительности
его существования. Наличие гнойного, тем более
распространённого перитонита всегда свидетельствует о запущенном,
неблагоприятном характере не только первичного страдания,
послужившего причиной возникновения источника, но и самого перитонита
как осложнения этого источника. От способности врача распознать
столь грозную ситуацию на раннем этапе, от сроков доставки
пациента в хирургический стационар и выполнения необходимого
оперативного вмешательства целиком и полностью зависит
судьба больного или раненого с перитонитом. Беспристрастная
статистика послеоперационной летальности при тяжёлых формах
перитонита, несмотря на прогресс, наблюдаемый в медицинской науке
практике, упорно удерживается на недопустимо высоких
показателях, достигающих 40% в течение столетия, когда в лечении
перитонита стала применяться лапаротомия. Отсюда — необходимость
для любого врача обретения и пополнения соответствующих
знаний и практических навыков диагностики этого патологического
состояния.
Гнойный перитонит ♦ 371
Основные черты патологии
Как и многие разделы большой клинической хирургии,
хирургия перитонита на ранних этапах своего развития определялась
главным образом задачами лечения боевых повреждений. При этом
довольно скоро сложилось суждение о приоритетном значении
устранения источника воспаления в брюшной полости. Особенно
отчётливо это проявилось после изобретения и распространения
огнестрельного оружия. Между тем, представление о возможном
источнике поначалу было не во всём адекватным. Долгое время
основным источником считался сам ранящий снаряд — пуля либо картечь.
Удаление ранящего снаряда полагалось основной целью лечебных
мероприятий. Главным методом удаления ранящего снаряда из живота,
а также из других частей тела, было зондирование раны, которое
проводилось в те времена без обезболивания. Образцы предназначенных
для этой цели зондов, крючков и «щупов» хранятся в запасниках
Эрмитажа. Приходится удивляться стойкости и мужеству раненых,
способных перенести подобные страдания, и упорству военных
хирургов, причинявших эти страдания в твёрдой уверенности, что делают
благое дело во имя спасения жизни людей.
Современная история перитонита начинается с конца XIX века,
когда стало возможным использовать широкую лапаротомию в
клинической практике. Несмотря на то, что прошло уже больше века с
тех пор и клиническая хирургия достигла чрезвычайно многого, в том
числе и в изучении перитонита, летальность от тяжёлого
распространённого (разлитого) перитонита продолжает оставаться стабильно
высокой.
Диагноз перитонита подразумевает любую форму и степень
выраженности воспаления брюшины. Воспалительно-деструктивные
заболевания органов брюшной полости являются наиболее
частой причиной (до 80%) различных форм перитонита,
представляющего собой, за редким исключением, осложнение местных,
органных инфекционно-воспалительных процессов в абдоминальном
отделе пищевода, желудке, двенадцатиперстной кишке, жёлчных
путях, различных отделах тонкой и толстой кишок, червеобразном
отростке, печени, поджелудочной железе, а также в органах малого
таза у женщин. При этом перфорация язвенных поражений
желудка и двенадцатиперстной кишки составляет приблизительно 30%,
деструктивный аппендицит — 22%, поражение толстой кишки —
21%, тонкой кишки — 13%. Особые группы составляют пациенты <
гезни -О» Том 1 ♦ Часть II ♦ Глава 14
372 ♦ Хирургические бол
последствиями повреждения органов живота при ранениях и
закрытых травмах, а также с послеоперационными осложнениями —
несостоятельностью анастомозов и ятрогенными повреждениями
полых органов.
В настоящее время принято наиболее тяжёлые формы
распространённого перитонита ассоциировать с клиническими
проявлениями абдоминального сепсиса. Сепсис — одно из наиболее
устоявшихся и получивших признание мирового профессионального
сообщества обозначений генерализованного инфекционного процесса.
Понятие об абдоминальном сепсисе выражает собой системную
воспалительную реакцию организма в ответ на развитие инфекцион-
но-воспалительного деструктивного процесса в брюшине, а также в
отдельных органах брюшной полости и/или забрюшинного
пространства. В такой постановке проблемы абдоминальный сепсис
становится достаточно широким понятием, отражающим не только тяжесть
общих клинических проявлений распространённых форм
перитонита. Имеется в виду, что он может являться следствием локальных ин-
фекционно-воспалительных процессов.
В абдоминальном сепсисе предлагают выделить четыре
разновидности: перитонеальный (т.е. обусловленный собственно
распространённым перитонитом, когда воспалённая и инфицированная
брюшина начинает играть роль основного источника сепсиса), хо-
лангиогенный, панкреатогенный, связанный с деструктивным
панкреатитом, и интестинальный (кишечный), связанный с теми или
иными воспалительными процессами, имеющими в качестве
источника просвет кишечника. Выделение названных форм
абдоминального сепсиса отражает отличительные особенности их развития,
диагностики и лечения. Эти особенности определяются несколькими
обстоятельствами:
• наличием, как правило, многофокусных и недостаточно
отграниченных очагов воспалительной деструкции, которые создают
трудности одномоментной санации;
• длительным существованием синхронных и метахронных инфек-
ционно-воспалительных очагов, средства для дренирования или
искусственного отграничения которых (катетеры, дренажи, тампоны)
служат источниками потенциального эндогенного и экзогенного
реинфицирования;
• сложностью дифференциальной диагностики абактериальных
(реактивных) форм воспаления (стерильного панкреонекроза, дис-
бактериоза, системных заболеваний, лекарственной болезни) и про-
Гнойный перитонит ♦ 373
грессированием инфекционно-воспалительной деструкции по мере
развёртывания клинической картины абдоминального сепсиса;
• быстрым развитием «фатальных» проявлений сепсиса:
системной полиорганной дисфункции, септического шока.
Классификация
• Этиологическая характеристика:
- первичный;
- вторичный;
- третичный.
• Распространённость:
- местный: отграниченный, неограниченный;
- распространённый (разлитой).
• Характер экссудата:
- серозно-фибринозный;
- фибринозно-гнойный;
- гнойный;
- каловый;
- жёлчный;
- геморрагический;
- химический.
• Фаза течения процесса:
- отсутствие сепсиса;
- сепсис;
- тяжёлый сепсис;
- септический (инфекционно-токсический) шок.
Основу классификации составляет выделение трёх
этиологических категорий первичного, вторичного, и третичного перитонита.
В качестве первичного перитонита (1—5%) рассматривают такие
формы заболевания, при которых воспалительный процесс
развивается без нарушения целостности полых органов, а перитонит
является результатом спонтанной гематогенной диссеминации
микроорганизмов в брюшинный покров или транслокации специфической
моноинфекции из других органов. В качестве разновидности
первичного перитонита выделяют спонтанный перитонит у детей,
спонтанный перитонит взрослых и туберкулёзный перитонит. Возбудители,
как правило, представлены моноинфекцией.
374 <0 Хирургические болезни -О* Том 1 *♦* Часть II ♦ Глава 14
• «Спонтанный» перитонит у детей возникает в периоде новорождён-
ности или в возрасте 4—5 лет. В последнем случае
предрасполагающим фактором может служить наличие системных заболеваний
(красная волчанка) или нефротического синдрома.
• Спонтанный перитонит взрослых нередко развивается после
дренирования асцита, обусловленного циррозом печени, а также при
длительном использовании катетера для перитонеального диализа.
К этой же форме относят перитонит, развивающийся у женщин
вследствие транслокации бактерий в брюшную полость из
влагалища через фаллопиевы трубы.
• Туберкулёзный перитонит является следствием гематогенного
инфицирования брюшины при специфических поражений кишечника,
а также при туберкулёзном сальпингите и туберкулёзном нефрите.
Вторичный перитонит — наиболее часто встречающаяся
категория, она объединяет несколько разновидностей перитонита.
• Перитонит, вызванный перфорацией и деструкцией органов
брюшной полости.
• Послеоперационный перитонит.
• Посттравматический перитонит:
- вследствие закрытой (тупой) травмы живота;
- вследствие проникающих ранений живота.
Послеоперационный перитонит рассматривают отдельно от
посттравматического перитонита, хотя операция также является травмой.
Дело в том, что в ходе операции степень негативных последствий
повреждения тканей существенно снижается посредством
совершенствования техники операций и инструментария, а реакция
организма на повреждение нивелируется многокомпонентным
анестезиологическим обеспечением.
Особую сложность для диагностики и лечения составляет
третичный перитонит. Под этим термином понимают воспаление
брюшины, носящее «рецидивирующий» характер, обозначаемое иногда как
«персистирующий», или «возвратный» перитонит. Обычно он
развивается в послеоперационном периоде у больных (или раненных,
пострадавших), переживших экстремальные, критические
ситуации, у которых имеется выраженное истощение механизмов про-
тивоинфекционной защиты. Течение такого перитонита отличается
стёртой клинической картиной, возможной полиорганной
дисфункцией и проявлением рефрактерного к проводимой терапии эндо-
токсикоза. В качестве основных факторов риска развития третич-
Гнойный перитонит О 375
ного перитонита принято рассматривать нарушения питания
(истощение) больного, снижение концентрации альбумина в плазме,
наличие проблемных возбудителей, как правило, резистентных к
большинству используемых антибиотиков, и развивающуюся
органную недостаточность.
Главное отличие вторичного перитонита от третичного
заключается в том, что клиническая картина вторичного перитонита
обусловлена защитной реакцией организма в виде высвобождения
большого количества провоспалительных цитокинов в ответ на попадание
инфекционного агента и развивающийся деструктивный процесс в
одном из отделов брюшной полости. В то время как третичный
перитонит, по мнению большинства авторов, рассматривают как
неспособность организма больного сформировать адекватную реакцию на
системном и локальном уровнях в результате превалирования
противовоспалительных цитокинов (как результат истощения провоспа-
лительного пула цитокинов) в ответ на развивающийся
инфекционный процесс в брюшной полости. При операции источник третичного
перитонита удаётся установить далеко не всегда.
Принципиально важным в практическом плане можно считать
разделение перитонита на местный и распространённый
(разлитой). При этом местный перитонит подразделяют на
отграниченный (воспалительный инфильтрат, абсцесс) и неограниченный,
когда процесс локализуется только в одном из карманов
брюшины. Если при местном перитоните, начиная с доступа, наряду с
устранением источника задача сводится к санации лишь области
поражения с проведением мероприятий, препятствующих
распространению процесса, то при распространённом перитоните требуется
обширная санация, нередко с многократным промыванием
брюшной полости.
Клиническое течение перитонита и соответствующая лечебная
тактика зависят от характера воспалительного экссудата и
патологических примесей, поступающих из полых органов живота.
Перечисленные в классификации характеристики экссудатов (серозно-фиб-
ринозный, фибринозно-гнойный, гнойный) охватывают основные
разновидности перитонита, используемые практическими
хирургами с ориентацией на данный классификационный принцип при
постановке послеоперационного диагноза.
Перечень характеристик в зависимости от патологических
примесей (каловый, жёлчный, геморрагический и химический
перитонит) также включает важные компоненты, определяющие качествен-
376 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II О- Глава 14
ные различия в клиническом течении перитонита и влияющие на
прогноз. Поэтому и их обычно указывают в послеоперационном
диагнозе. Диагноз калового перитонита выставляют при выраженном
загрязнении экссудата содержимым ободочной или подвздошной
кишки. Данная патологическая примесь предвещает тяжёлое
клиническое течение в связи с обильным поступлением анаэробной и гра-
мотрицательной микрофлоры в экссудат, представляющий собой
питательную белковую среду. Примесь неинфицированной жёлчи
способна вызвать кратковременное химическое раздражающее
действие на брюшину, после адаптации к которому воспалительный
процесс в брюшной полости может относительно долго (до нескольких
недель) не прогрессировать, пока не произойдёт вторичного
инфицирования экссудата. Геморрагический перитонит (когда к
экссудату примешивается излившаяся в брюшную полость кровь) сопряжён
с опасностью быстрой колонизации микрофлоры в условиях
обогащенной питательной среды (крови) и термостабильного режима,
свойственного внутренним средам организма. Наконец, о
химическом перитоните уместно говорить на ранних стадиях неинфициро-
ванного панкреонекроза или перфорации гастродуоденальных язв.
Агрессивные химические примеси способствуют ранней
клинической манифестации данной формы перитонита, следствием чего
становятся ранние операции (при перфоративных язвах) или удаление
экссудата во время лапароскопической ревизии (при деструктивном
перитоните), а это в свою очередь создаёт более благоприятные
условия для эффективного лечения.
После введения в последние годы в отечественную литературу
понятия «абдоминальный сепсис» стало возможным с достаточной
определённостью разграничивать фазы развития патологического
процесса при перитоните в зависимости от наличия признаков сепсиса
и его тяжести.
Помимо указанных характеристик перитонита, в клиническом
диагнозе на первом месте должна быть указана его нозологическая
причина (основное заболевание).
Патогенез распространённого перитонита
Перитонит начинается и развивается как воспаление. Строго
говоря, воспаление, даже если оно распространяется на большую часть
брюшинного покрова, является местным реактивным процессом,
поскольку соотносится с одной из полостей тела — животом. Имен-
дих
Гнойный перитонит ♦ 377
но в этом смысле перитониту присущи все патологические
механизмы острого местного воспаления.
• Сосудистая реакция, выражающаяся сначала в спазме прекапил-
лярных сфинктеров, а затем — в паралитическом расширении мик-
роваскулярного ложа.
• Экссудация — выход из сосудистого русла жидкой части крови в
результате изменения проницаемости микрососудов.
• Инфильтрация и клеточная пролиферация за счёт миграции из кро
ви в окружающую ткань форменных элементов.
• Фагоцитоз — захват и уничтожение чужеродных повреждающих
агентов активными форменными элементами.
• Регенерация и репарация повреждённых структур.
Все эти процессы последовательно регулируются сложной
системой биологических факторов — медиаторов воспаления.
В зависимости от силы и длительности воздействия
повреждающего агента, а также от реактивности организма воспаление
брюшины приобретает более или менее выраженные признаки
патологического процесса. Одновременно, в большей или меньшей степени, при
перитоните в пределах воспалительного ответа реализуются и
механизмы противоинфекционной защиты, выражающиеся в
отграничении и подавлении воспалительного процесса.
Инфекционный характер воспаления
Инфекционный характер воспаления, т.е. зависимость его от
патогенной микрофлоры, при вторичном перитоните проявляется по
мере формирования его источника. Чаще всего им служит
воспалительно-деструктивный процесс в одном из полых органов живота либо
повреждение полого органа. Условно-патогенная микрофлора полых
органов пищеварительного тракта — основной этиологический
фактор, определяющим микробиологическую природу вторичного
перитонита. Патоморфология источника, а ещё в большей степени —
длительность его существования в брюшной полости в решающей мере
определяют тяжесть клинического течения перитонита, а также его
исход. При неустранённом источнике позитивное влияние на
развитие и исход перитонита может оказать активность ограничительных
процессов, которая во многом определяется индивидуальными
возможностями пролиферативных тенденций местного воспаления.
В такой связи становятся понятными данные, приведённые ещё
Н.И. Пироговым в его «Началах общей военно-полевой хирургии»
378 О- Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 14
(1865), о том, что до 5% раненых в живот с повреждением полых
органов выживают с образованием кишечных свищей или без таковых.
Следует помнить, что речь идёт о том времени, когда лапаротомия
при проникающих ранениях живота ещё не применялась, а
использовалось лишь рассечение раны «для лучшего оттока гноя и
пищевой кашицы».
В отсутствии тенденции к отграничению воспалительного
процесса уже на начальном этапе иммуногенеза может сформироваться
порочный круг, способствующий не только интенсификации местного
воспаления, но и накоплению медиаторов воспаления в
кровеносном русле с соответствующим повышением напряжения
воспалительной реакции. Происходит своеобразная эндогенная
сенсибилизация организма, которая может проявиться бурным
распространением воспаления в брюшине в случае прорыва отграниченного
гнойника в свободную брюшную полость. Такая последовательность
развития событий нередко сопутствует естественному развитию местных
инфекционно-деструктивных воспалительных заболеваний органов
брюшной полости, в частности деструктивных форм острого
аппендицита, холецистита и панкреатита.
Обратная ситуация может возникнуть при тяжёлой сочетанной
шокогенной травме, одним из компонентов которой является
повреждение полых органов живота. В этом случае возникает несколько
очагов травматической деструкции тканей с образованием первичного и
вторичного некроза одновременно в нескольких анатомических
областях. Мёртвые и погибающие ткани в разных областях тела
становятся «чужими» для организма и индуцируют системную
воспалительную реакцию. На такую ситуацию организм отвечает
развитием компенсаторной противовоспалительной системной реакции,
физиологический смысл которой состоит в подавлении аутоимун-
ных механизмов повреждения тканей, переживающих критическое
состояние.
При обширных и тяжёлых повреждениях
противовоспалительная реакция может оказаться неконтролируемой. Это сказывается,
в частности, отсутствием местной воспалительной реакции на внут-
рибрюшные повреждения: к примеру, у пациентов, погибших на
2-е сутки после крайне тяжёлой сочетанной травмы с
повреждением полых органов живота, на секции не обнаруживают выраженных
признаков воспаления брюшины, несмотря на имевшееся
повреждение полых органов и наличие в брюшной полости кишечного
содержимого.
Гнойный перитонит <► 379
Энтеральная недостаточность
В комплексе висцеральных нарушений, обусловленных
распространённым перитонитом, особое место принадлежит энтеральной
недостаточности, которая служит одним из главных пусковых
механизмов эндотоксикоза. Прочие висцеральные нарушения уже
опосредованы эндотоксикозом и могут рассматриваться как его проявления.
Прежде всего, нарушается моторная функция кишечника. Ещё 15—
О лет назад двигательная функция пищеварительной системы
рассматривалась главным образом в связи с центральным нейротропным
тормозящим или стимулирующим влиянием, которое осуществляется
через симпатическую и парасимпатическую иннервацию
соответственно. С этих позиций обсуждались нейрорефлекторные
механизмы «голодной» перистальтики, раздражающее влияние на кишечник
поступления пищи в желудок, влияние страха на кишечную моторику.
В том же ракурсе парез кишечника, обусловленный перитонитом,
расценивался как следствие симпатического гипертонуса,
обусловленного реакцией вегетативной нервной системы на воспаление брюшины.
Принимались во внимание также изменения гормонального статуса
и в «местной эндокринной системе» тонкой кишки. Однако эта,
казалось бы, стройная концепция нарушилась, когда выяснилось, что
при тяжёлых формах распространённого перитонита
медикаментозная блокада симпатической иннервации не устраняет
развивающуюся паретическую непроходимость. Последняя постепенно
купируется лишь в результате пассивной декомпрессии кишечных петель.
Понимание сути паретической кишечной непроходимости при
перитоните обрело объективную основу после раскрытия роли
автономной, органной метасимпатической нервной системы: автономной
интрамуральной нервной структуры органов, в частности кишечной
стенки. В кишечнике эта автономная интрамуральная метасимпати-
ческая иннервация регулируется миотропным механизмом,
работающим в режиме осциллятора и имеющим собственный механизм
ритма, расположенный в двенадцатиперстной кишке. В нём возникает
импульс двигательной активности, получивший название
«мигрирующий миоэлектрический комплекс». В отличие от сердечного
автоматизма в кишечнике реализуется не каждый импульс, что создаёт
сложную и нестабильную осциллографическую картину.
В целом последовательность событий при прогрессирующем
перитоните может быть представлена следующим образом. Вначале под
влиянием воспаления париетальной и особенно висцеральной брю-
380 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 14
шины рефлекторно подавляется способность к проявлению
«пищеварительной» перистальтики, регулируемой центральными нейроэн-
докринными механизмами. При этом сохраняется функция
водителя ритма, но индукция мигрирующего миоэлектрического комплекса
подавляется. На данном этапе парез может быть купирован
включением в комплексное лечение перитонита различных блокад с
местными анестетиками — блокады корня брыжейки, сакроспинальной
или наиболее эффективной эпидуральной блокады. Однако при
естественном развитии патологического процесса паретическое
расширение кишечных петель и переполнение их содержимым приводят к
ишемии кишечной стенки и гипоксическому повреждению её инт-
рамурального метасимпатического нервного аппарата. Он
утрачивает способность передавать импульсы, а затем и сами мышечные
клетки становятся неспособными их воспринимать в связи с глубокими
нарушениями клеточного метаболизма.
Нарушение внутриполостной
микробиологической экосистемы
В условиях развившегося кишечного пареза включается ещё один
механизм — нарушение внутриполостной микробиологической
экосистемы. При этом микроорганизмы, мигрирующие в верхние
отделы тонкой кишки в условиях гипоксии и погибающие там от
скопления пищеварительных ферментов, выделяют эндотоксины и
экзотоксины. Последние вносят свой вклад в нарушение
сократительной способности кишечной мускулатуры, замыкая порочный круг
нарушений моторики пищеварительной системы при перитоните.
В условиях пареза гипоксия кишечной стенки приводит к
нарушению активной реабсорбции, что ведёт к переполнению кишечных
петель жидким содержимым. Однако по той же причине нарушается
другая пищеварительная функция кишечной стенки — барьерная,
обеспечивающая избирательную возможность проникновения
продуктов внутриполостного пищеварения через кишечную стенку.
Токсические продукты из просвета кишечника проникают во
внутренние среды, способствуя развитию каскада эндотоксикоза.
Гипоксия кишечной стенки сопряжена и с нарушениями в
диффузной кишечной эндокринной системе, играющей важную роль в
поддержании физиологического гормонального статуса организма.
Таким образом, многокомпонентные нарушения энтеральной
функции вносят весомый вклад в патогенетические механизмы распрос-
Гнойный перитонит <^ 381
транённого перитонита. Они усугубляют тяжесть клинических
проявлений и могут существенно снижать эффективность большинства
методов интенсивной терапии.
э,
ндогенная интоксикация
Эндогенная интоксикация (эндотоксикоз) представляет собой
единый аутокаталитический процесс, в котором сопряжены местные
воспалительно-деструктивные нарушения, последствия системной
полиорганной дисфункции, патологические преобразования
внутренних (для организма) биоценозов и постепенно нарастающие
системные нарушения тканевого метаболизма. Отличительная особенность
эндотоксикоза при перитоните — его инициальная зависимость от
источников интоксикации, которые подлежат хирургическому воз-
действию с целью удаления, отграничения или дренирования.
При распространённом (разлитом) перитоните источниками
эндотоксикоза могут быть очаги травматической или инфекционно-
воспалительной деструкции в органах живота, содержимое брюшной
полости, взаимодействующее с высокореактивным и богато крово-
снабжаемым полем брюшины, содержимое кишечника с его
биохимическим и бактериальным факторами.
Распространению и усугублению тяжести эндотоксикоза и
воспаления брюшины может также способствовать относительно недавно
установленный факт способности эндотелиоцитов посткапиллярных
венул брюшины (т.е. наиболее заполненного в условиях застоя крови
звена микроциркуляции) принять на себя функцию
«непрофессиональных» (т.е. необлигатных) антигенпрезентирующих клеток,
усиливающих провоспалительное действие медиаторов иммуногенеза.
Такова в кратком изложении сопряжённость патогенетических
механизмов вторичного распространённого тяжёлого перитонита.
Клиническая картина и диагностика
Клинические признаки перитонита определяются, во-первы
локализацией первичного источника процесса, а во-вторых,
местными и общими признаками непосредственно воспалительного
процесса в брюшине.
Как правило, больные предъявляют жалобы на резкие, сильные
боли в животе, усиливающиеся при перемене положения.
Характерным признаком является рвота, не приносящая облегчения, в раз-
вёрнутой стадии — застойным содержимым. Стул чаще отсутствует,
иногда могут быть тенезмы.
При осмотре обращают внимание на вынужденное положение
больного — на боку, с приведёнными к животу коленями. В
запущенных случаях выявляют fades Hyppocratica. При осмотре живота может
обнаруживаться асимметрия, в акте дыхания живот не участвует. При
пальпации живот напряжён, болезнен. Симптомы Щёткина—Блюм-
берга, Воскресенкого, Раздольского положительны.
Системные нарушения при перитоните определяются быстро
прогрессирующей дегидратацией, эндотоксикозом. В зависимости от
степени выраженности последнего, это могут быть классические
признаки системной воспалительной реакции, полиорганной
недостаточности, в крайней стадии — септического шока (см. главу 3).
Клиническая картина и диагностика местного перитонита не
требуют отдельного описания в настоящей главе, поскольку не могут
рассматриваться в отрыве от клинической картины и диагностики
обусловивших его заболеваний, которые изложены в
соответствующих разделах учебника.
Целесообразным представляется ограничиться обсуждением
наиболее сложных вопросов, связанных с диагностикой перитонита. Речь
идёт о своевременном распознавании так называемых «стёртых,
вялотекущих» форм разлитого перитонита, развивающихся, например,
в раннем послеоперационном периоде в условиях естественного после
любой лапаротомии временного угнетения кишечной моторики, или
возникающих в результате закрытых повреждений живота на фоне
сочетанной травмы и шока.
Трудности раннего распознавания послеоперационного
перитонита в значительной мере зависят от таких естественных проявлений в
первые 3—4 сут, как болезненность и умеренное напряжение живота,
учащение пульса, лейкоцитоз, отсутствие кишечных шумов. К тому же
дело осложняется применением обезболивающих средств и
антибиотиков, затушёвывающих остроту клинических проявлений. Особенно
сложна диагностика послеоперационного перитонита у больных
пожилого возраста, истощённых, с тяжёлым течением основного либо
сопутствующих заболеваний. Абсолютных признаков, позволяющих
распознать начало развития перитонита в послеоперационном периоде,
не существует. Поэтому многое зависит от правильной организации
динамического наблюдения за больными в послеоперационном
периоде с использованием клинических и лабораторных тестов,
позволяющих выявить прогрессирующее нарастание эндогенной интоксикации.
нойный перитонит ♦ 383
Одним из важных клинических признаков является тахикардия.
Увеличение частоты пульса у больных, подвергавшихся операции на
брюшной полости, до 120—140 ударов в минуту при отсутствии
выраженной гипертермии, не имеющее тенденции к снижению, несмотря
на рацио-нальную коррекцию ОЦК, водно-электролитных нарушений
и сердечно-лёгочной недостаточности, чаще всего свидетельствует о
нарастающей эндогенной интоксикации вследствие развивающегося
перитонита. Другим важным признаком послеоперационного перитонита
следует считать стойкий парез кишечника, который не удаётся
ликвидировать с помощью мероприятий, устраняющих гипертонус
симпатической нервной системы. Важный признак развития ранних
послеоперационных осложнений, способных обусловить перитонит, —
наличие так называемого «светлого промежутка», когда на фоне
относительно благоприятного раннего послеоперационного периода в
течение 3-4 дней наблюдают внезапное изменение состояния,
сопровождающееся появлением тахикардии, сухости языка, усилением пареза
кишечника и лабораторными признаками нарастания эндотоксикоза.
В сомнительных случаях помогает подключение дополнительных
лучевых методов исследования. Прежде всего, это относится к УЗИ-
диагностике, которая может быть использована повторно в
динамике и при наличии опытного специалиста оказывается весьма
информативной. Достаточно информативным исследованием является КТ.
В ходе этих исследований выявляют участки свободной жидкости и
газа в брюшной полости, которые могут быть признаками
несостоятельности анастомоза, перфорации полого органа, формирующегося
абсцесса. В некоторых случаях используют методику КТ с усилением
рентгенконтрастньши средствами, используемыми как перорально
(диагностика дефекта целостности стенки кишечника) так и
внутривенно (определение зоны некроза в паренхиматозных органах).
В случае несостоятельности неинвазивных методов диагностики
показана ранняя диагностическая релапаротомия. В зависимости от
показаний выделяют два вида таких релапаротомий:
запланированная (запрограммированная) и «по показаниям». Релапаротомию «по
показаниям» выполняют в любое время независимо от сроков.
Решение о релапаротомий по возникшим показаниям принимает
старший хирург с учётом данных динамического наблюдения и сведений
об особенностях первичной операции. К выполнению
релапаротомий также привлекается старший хирург, но с обязательным
участием врача, выполнявшего первую операцию и лучше других
представляющего её особенности.
384 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 14
Лечение
Лечение тяжёлых форм перитонита представляет собой сложную
задачу, требующую комплексного подхода. Хирургическая
операция — центральное звено лечебной программы при тяжёлых формах
перитонита. Она должна включать мероприятия, определяемые
особенностями реакции организма на местный воспалительный процесс,
а также наличием сопутствующих заболеваний. При перитонеальном
тяжёлом сепсисе, и, особенно, септическом шоке реализация
стройной системы последовательных, рассчитанных по времени лечебных
мероприятий начинается в отделении интенсивной терапии (а по
показаниям и в отделении реанимации), продолжается в ходе
анестезиологического обеспечения, оперативного вмешательства, а
затем — в послеоперационном периоде.
Предоперационная подготовка
Предоперационная подготовка наряду с общепринятыми
гигиеническими мерами включает, с учётом некоторых индивидуальных
различий в зависимости от возраста больных, массы тела (которая
определяется ориентировочно), наличия сопутствующих
заболеваний, следующие мероприятия:
• струйное (при наличии сердечно-лёгочной недостаточности —
капельное) внутривенное введение низкоконцентрированных
полиионных кристаллоидных растворов в количестве до 1000—1500 мл под
контролем ЦВД;
• введение 400—500 мл коллоидных растворов для восполнения ОЦК;
• внутривенное применение антибиотиков широкого спектра
действия за 30-40 мин до начала операции;
• коррекцию нарушений центральной и периферической
гемодинамики.
Необходимость внутривенного введения антибиотиков в
предоперационном периоде определяется неизбежным механическим
разрушением в ходе хирургического вмешательства биологических
барьеров, отграничивающих область инфекционного процесса и
естественный внутрикишечный биоценоз. Поэтому операцию при
перитоните следует выполнять на фоне создания в крови и тканях
лечебной концентрации антибактериальных препаратов.
Предоперационная подготовка начинается сразу после
установления диагноза и завершается в операционной, последовательно пе-
Гнойный перитонит О- 385
реходя в анестезиологическое обеспечение операции. Оперативное
вмешательство по поводу распространённого (разлитого) перитонита
всегда выполняют под многокомпонентной общей анестезией с ИВЛ.
Оперативное вмешательство
Оперативное вмешательство при распространённом (разлитом)
перитоните предусматривает выполнение следующих основных задач:
• устранение источника перитонита;
• интраоперационную санацию и рациональное дренирование
брюшной полости;
• создание условий для пролонгированной санации полости
брюшины в послеоперационном периоде;
• дренирование кишечника, находящегося в состоянии пареза;
• создание благоприятных условий для воздействия на основные
пути резорбции и транспорта токсинов (по специальным показаниям).
Доступ
Наиболее рациональный доступ при распространённом
перитоните — срединная лапаротомия, обеспечивающая возможность
полноценной ревизии и санации всех отделов брюшной полости.
Ревизия
После вскрытия брюшины по возможности полно удаляют патоло
гическое содержимое — гной, кровь, жёлчь, каловые массы и т.д.
Наиболее полноценно и менее травматично это можно выполнить с
помощью электрического отсоса, снабжённого специальным наконечником,
предотвращающим присасывание петель кишечника и большого
сальника. Особое внимание обращают на места скопления экссудата — под-
диафрагмальные пространства, боковые каналы, полость малого таза.
Затем производят тщательную ревизию органов брюшной
полости для выявления источника перитонита.
Устранение источника перитонита
Для устранения источника перитонита используют наиболее про
стой и быстрый способ. При этом необходимо соизмерять объём
вмешательства с тяжестью состояния больного и не расширять
операцию, стремясь во всех случаях к радикальному устранению основного
:
386 ♦ Хирургические болезни ♦ Том 1 ^ Часть II ♦ Глава 14
заболевания, вызвавшего перитонит. Операции типа обширных
резекций и экстирпарций органов в условиях перитонита следует
считать вынужденным исключением.
Санация брюшной полости
Необходимо обратить особое внимание на этот момент
вмешательства. Неполноценность его не может быть восполнена никакими
усилиями в послеоперационном периоде. В ряде ситуаций, когда у
хирурга нет уверенности в полноценной санации брюшной полости,
закономерным становится выполнение релапаротомии
(«программной» или «по требованию»). Уместно сказать, что от довольно
популярной в 80-х годах XX века лапаростомии отказались подавляющее
большинство хирургов в связи с большим количеством осложнений,
прежде всего, кишечных свищей.
Дренирование тонкой кишки
После санации решают вопрос о дренировании тонкой кишки. Оно
показано при выраженных признаках паралитической
непроходимости кишечника. Выявление во время операций резко растянутых
содержимым петель тонкой кишки с дряблыми синюшными стенками,
покрытыми фибрином, с тёмными пятнами субсерозных
кровоизлияний следует считать основанием для
дренирования кишечной трубки.
Дренирование брюшной полости
Заключительный этап
хирургического этапа — рациональное дренирование
брюшной полости (рис. 14-1).
Послеоперационный период
Рис. 14-1. Схема
дренирования брюшной полости
при разлитом перитоните.
В послеоперационном периоде
основное внимание должно быть направлено на
компенсацию всех жизненно важных
органов и систем, обеспечивающих
функционирование организма. Крайне важным
элементом является восстановление
перистальтики кишечника, что позволяет
переходить на полноценное энтеральное
Гнойный перитонит О 387
питание, существенно повышающее шансы на благоприятный исход
заболевания. Основное внимание хирурга должно быть направлено
на контроль за функционированием дренажей, установленных в
свободной брюшной полости. Как правило, через 3 сут после
постановки дренажи перестают адекватно функционировать и требуется
решение о их удалении или перестановке.
Основные принципы
антибактериальной терапии при перитоните
После адекватной хирургической санации очага перитонита
рациональное использование антибиотиков в комплексном лечении
абдоминального сепсиса выходит по значимости на первое место.
Считают, что неадекватная антибактериальная терапия определяет до
20% летальности при перитоните.
Ведущий фактор, диктующий выбор схемы антибактериальной
терапии, — тип перитонита, под которым понимают первичный,
вторичный или третичный его характеры. Каждому из них присущ свой
типичный набор микроорганизмов, знание которых позволяет
спланировать грамотную терапию. После получения результатов
микробиологического исследования может проводиться корректировка
схем антибактериальной терапии, но только в тех случаях, когда она
неэффективна.
Первичный перитонит
Основными возбудителями первичного перитонита являются
пневмококки и грамотрицательные палочки (табл 14-1). Как
правило, инфекционный процесс вызывается одним возбудителем, а не
полимикробной флорой. Возбудители попадают в брюшную полость
чаще всего гематогенным путём или за счёт транслокации через стенку
кишечника. Выбор антибиотика производят с учётом
чувствительности микрофлоры и токсичности препарата, а также фонового
заболевания (цирроз печени, хронической почечной недостаточности и т.д.).
Вторичный перитонит
Вторичный перитонит, наиболее часто встречающийся в клини
ческой практике, вызывается энтеральными грамотрицательными
возбудителями и облигатными анаэробами. На выбор антибиотик
существенное влияние оказывает ряд факторов.
ика
388 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 14
Таблица 14-1. Основные возбудители перитонита и используемые
антибактериальные препараты
Тип
перитонита
Первичный
Вторичный
Третичный
■
Этиология
Грамотрицательные
Грамположительные
Грамотрицательные
Грамположительные
Анаэробы
Грамотрицательные
Грамоложительныё
Грибы
Е. coli (40%)
К. pneumoniae (7%)
Pseudomonas sp. (5%)
Proteus sp. (5%)
Streptococcus sp. (15%)
Staphylococcus sp. (3%)
анаэробы (<5%)
E. coli
Enterobacter sp.
Klebsiella sp.
Proteus sp.
Streptococcus sp-
Enterococcus sp.
Bacteroides fragilis
Bacteroides sp.
Eubacterium sp.
Clostridium sp.
Анаэробные
Streptococcus
Enterobacter sp.
Pseudomonas sp.
Enterococcus sp.
Staphylococcus sp.
Candida sp.
Препараты*
АГ II—III,
ЦС III-IV
ЦС III-IV ±
антианаэробный
препарат,
ФХ с анти-
анаэробной
активностью,
карбапенемы
UCIV,
карбапенемы
Ванкомицин,
линезолид
Флюконазол,
итраконазол,
амфотерицин В
* Примечание. АГ — аминогликозиды; ЦС — цефалоспорины; ФХ — фтор-
хинолоны. Римскими цифрами обозначены поколения указанных средств.
• Локализация первичного очага. В зависимости от того, является ли
источником верхний отдел ЖКТ или нижний, желчевыводящие или
мочевые пути определяется преимущественная микрофлора, веге-
тирующая в этой зоне.
• Основные возбудители вторичного перитонита — внегоспитальные
штаммы микроорганизмов. Это означает, что в подавляющем боль-
Гнойный перитонит ♦ 389
шинстве они чувствительны к основным антибактериальным
препаратам и не требуют дополнительной микробиологической
оценки на антибиотикорезистентность.
Третичный перитонит
Одной из самых сложных задач, в том числе и для подбора
антибактериальной терапии, является лечение третичного (нозокомиаль-
ного) перитонита, который составляет около 10% всех перитонитов.
Возбудителями в этих ситуациях становятся госпитальные штаммы,
вегетируюшие в конкретных отделениях интенсивной терапии и
общехирургических отделениях. Реальную помощь в выборе
антибиотика здесь могут оказать данные эпидемиологического мониторинга
за микрофлорой и её резистентностью. Учитывая достаточно частое
участие метициллин-резистентного золотистого стафилококка,
препаратом выбора становится ванкомицин или тейкопланин (по
литературным данным, весьма перспективным представляется также
использование представителя новой группы антибиотиков оксазоли-
динонов, активного против этого возбудителя — линезолида). Гра-
мотрицательные микроорганизмы чаше всего перекрываются цефа-
лоспоринами IV поколения (цефепим), карбапенемами.
При лечении третичного перитонита необходимо всегда помнить
о риске развития системной грибковой инфекции, особенно часто —
системного кандидоза. Поэтому нужен тщательный контроль всех
возможных регионов локализации с периодическим
микробиологическим мониторингом. Широко распространённое мнение о профи-
лактической эффективности нистатина не соответствует
действительности в связи с его чрезвычайно низкой биодоступностью. Он
эффективен лишь при кандидозах слизистых оболочек полости рта и
верхних отделов ЖКТ.
Только при условии, что процесс выбора и назначения
антибактериальных препаратов основывается на глубоких знаниях и опыте,
можно рассчитывать на успех проводимой терапии при минимальной
опасности формирования резистентных штаммов микроорганизмов.
* * *
Заключая главу, приходится констатировать, что несмотря на
тенсивные усилия клиницистов и исследователей патогенеза
распространённых форм гнойного воспаления брюшины, перитонит
остаётся нерешённой хирургической, клинической и общепатологической
..
390 ♦ Хирургические болезни ♦ Том 1 -О- Часть II ♦ Глава 14
проблемой. Перспективным следует признать изучение проблемы
перитонита в аспекте широкомасштабного представления об
абдоминальном сепсисе. Это обосновывает потребность в её решении
новых медицинских технологий.
Обозначенный подход уже в ближайшее время может быть
реализован по нескольким основным направлениям. Первое из них —
внедрение малоинвазивных эндовидеохирургических методов повторной
санации брюшной полости, особенно труднодоступных её отделов.
Применение такой методики создаёт возможность не только
достижения санирующего эффекта, но также устранения вновь
обнаруженных дефектов стенки полых органов. В целях малоинвазивной
санации глубоких инфекционно-деструктивных очагов перспективно и
другое направление — так называемая «навигационная хирургия» на
основе интенсивной полипозиционной лучевой диагностики (УЗИ,
спиральная КТ, МРТ). Эти методы позволяют получить объёмное
изображение и разработать наиболее рациональный доступ к
инфекционному очагу, избегая опасного контакта с крупными сосудами и
другими важными анатомическими образованиями.
Актуальное направление, ориентированное на перспективу, —
разработка новых методов микробиологической экспресс-диагностики,
позволяющих рационализировать и повысить эффективность
антибактериальной терапии.
Таким образом, перспектива разрешения проблемы тяжёлых форм
распространённого перитонита не только сохраняется, но всё более
обретает конкретные очертания.
ОСТРЫЙ ЖИВОТ.
ДИФФЕРЕНЦИАЛЬНАЯ
ДИАГНОСТИКА
Определение понятия и его практический смысл
Словосочетание «острый живот» — не нозологический диагно;
а собирательное понятие, обозначающее формализованное
выражение тревоги, настороженности врача, обнаружившего при первичном
осмотре больного угрожающие признаки «брюшной катастрофы».
Именно такое образное сравнение использовал известный
французский хирург Генри (франц. Анри) Мондор в книге «Неотложная
диагностика. Живот», вызвавшей большой интерес российских
хирургов после публикации в переводе с французского в 1940 г. Из этой же
публикации в российскую медицинскую литературу перешло
обобщающее понятие «острый живот». Следует признать, что избранное
автором сопоставление с катастрофой вполне корректно. Согласно
сложившимся представлениям, под катастрофой в широком смысле
принято понимать событие чрезвычайной значимости, неизбежно
приводящее к несовместимым с жизнью многих людей или одного
человека последствиям при отсутствии надлежащей неотложной
помощи извне.
Спустя десятилетие после публикации перевода книги Мондора
термин острый живот закрепился в лексиконе отечественных
хирургов, получил широкое распространение и обрёл право на
официальное существование в качестве предварительного первичного
диагноза благодаря изданию, а затем — переизданию в дополненном
варианте в 1952 г. монографии Н.Н. Самарина «Диагностика острого
живота». Автор справедливо посвятил свою книгу сельскому врачу,
вынужденному работать в условиях, когда возможность
использования дополнительных аппаратных и лабораторных методов
диагностики резко ограничена. Однако вскоре оказалось, что
пропагандируемые Мондором и Самариным принципы неотложной диагностики
востребованы и в более благоприятных условиях работы. Сохраняют
они актуальность при оказании неотложной
лечебно-диагностической помощи и поныне. В значительной мере востребованность этих
принципов обусловлена двумя важными обстоятельствами.
392 <0> Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 15
Первое из них — объективная тенденция к подразделению обще
хирургии на более или менее самостоятельные частные разделы со
своими диагностическими и лечебными технологиями. Оборотная
сторона такой тенденции — узкая специализация хирургов, влекущая за
собой неизбежную утрату навыков общеклинической диагностики,
абсолютно необходимых в решении неотложных клинических задач.
Второе обстоятельство — создание в крупных городах и
отдельных регионах страны научно-исследовательских институтов или
многопрофильных больниц скорой помощи, выполняющих функции
методических центров неотложной хирургии, прежде всего
абдоминальной. В них концентрируются наиболее сложный контингент
больных с острыми хирургическими заболеваниями и травмами.
Таким образом, формируется организационная и методическая
основа совершенствования дифференцированного подхода к
данному виду медицинской помощи в крупных городах и
административных центрах. Вполне естественно, что обеспечение такого подхода
требует соответствующей подготовки медицинских кадров. При этом
следует иметь в виду, что методика постановки предварительного
диагноза на догоспитальном этапе и постановка нозологического
диагноза после доставки в стационар имеют существенные различия
в соответствии с различием практических задач.
На догоспитальном этапе главная цель состоит в том, чтобы на
основании индивидуального опыта, анамнестических данных и
ограниченного набора физикальных признаков определить, нуждается
ли пациент в срочной госпитализации в стационар, где ему может
быть оказана полноценная неотложная хирургическая помощь, или
после выполнения симптоматического пособия, устраняющего
остроту ситуации, он может быть направлен на плановое обследование
и лечение в больницу либо обследование в условиях поликлиники.
При этом постановка нозологического диагноза необязательна, если
такой диагноз не может быть подтверждён убедительными
объективными данными. В случае сохраняющихся обоснованных сомнений
относительно диагноза допустимо сформулировать его в
обобщающем предварительном варианте. Этим вариантом и служит «острый
живот». Если предварительный диагноз при сохраняющихся
сомнениях может быть выражен в виде более конкретного предположения
(допустим, предположения об остром аппендиците или перфоратив-
ной язве), он документируется в направлении на госпитализацию
после обобщающего диагноза под знаком вопроса, но с
обязательным последующим обозначением (также под вопросом) какого-либо
Острый живот. Дифференциальная диагностика <> 393
альтернативного предположения, с учётом которого, по мнению
принимающего решение врача, следует проводить дифференциальную
диагностику.
Такое поэтапное приближение к нозологическому диагнозу, уже
начиная с первичного осмотра, нередко оказывается полезным для
хирургов стационара, куда поступает больной, поскольку в более
поздние сроки после начала заболевания семиотика «острого живота»
может оказаться менее яркой либо видоизменённой. Выносить в
предварительный диагноз более двух альтернативных предположений
нецелесообразно, поскольку это может ещё более запутать и без того
непростую клиническую ситуацию.
На госпитальном этапе решают задачи иного уровня. Здесь от
полноты диагностической информации и конкретной формулировки
диагноза зависит не только суждение о выборе хирургической
тактики, но также объём предполагаемой операции, сроки и характер
предоперационной подготовки, выбор метода анестезиологического
пособия, т.е. решения, оказывающие влияние на исход лечения.
Получения требуемой диагностической информации достигают в ходе
реализации отработанных для каждой из основных нозологических
форм острого живота типовых алгоритмов, учитывающих
материальное оснащение и профессиональные возможности специалистов
конкретного хирургического стационара.
Диагностика острого живота
на догоспитальном этапе
Организационно-тактические принципы
Обычно первично диагностируют острый живот врачи линейных
бригад скорой помощи либо хирурги поликлиники при обращении
больных с острыми болями в животе. Эффективность диагностики в
том и в другом случае зависит от внимательности,
профессиональных навыков и опыта врача. Менее благоприятный вариант
догоспитальной диагностики применительно к острой хирургической
патологии складывается, когда первичный осмотр проводит на дому или
в поликлинике недостаточно подготовленный или излишне
осторожный, уклоняющийся от ответственных самостоятельных решений
врач общей практики, назначающий консультации специалистов —
хирургов, гинекологов, инфекционистов. В результате неоправдан-
394 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 15
но затягивается время и снижается эффективность необходимой
неотложной помощи. Ещё большую опасность представляют попытки
больных устранить беспокоящие их ощущения путём самолечения:
применения грелок на живот, спазмолитических, обезболивающих
препаратов или послабляющих средств.
По существу врач при первичном обследовании больного,
предъявляющего жалобы на боли в животе (рис. 15-1), рвоту и другие дис-
пептические расстройства, сопоставляет своё решение о
диагностической и лечебной тактике применительно к четырём группам
пациентов.
• Первая группа — больные, имеющие убедительные признаки острых
воспалительно-деструктивных заболеваний или закрытых
повреждений органов живота. В этом случае вопрос о необходимости срочной
госпитализации в хирургический стационар не вызывает сомнения.
• Вторую группу составляют больные, у которых без использования
дополнительных, лабораторных или аппаратных диагностических
методов (но не по причине нерешительности или профессиональ-
Рис. 15-1. Наиболее частые причины
острых болей в животе: 7 — инфаркт
миокарда; 2 — нижнедолевая
плевропневмония; 3 — печёночная
колика, острый холецистит; 4 —
прободная язва желудка; 5— прободная язва
двенадцатиперстной кишки; 6 —
острый панкреатит; 7—воспаление
дивертикула Меккеля; 8 — перфорация
опухоли толстой кишки; 9 —
терминальный илеит; 10 — кишечная
непроходимость; 77 — дивертикулит
или перфорация дивертикула толстой
кишки; 12 — острый аппендицит;
13 — апоплексия яичника, перекрут
или разрыв кисты яичника,острый
сальпингит; 14 — внематочная
беременность; 75 — гемоперитонеум при
травме живота.
Острый живот. Дифференциальная диагностика О- 395
ной некомпетентности врача!) исключить острые
воспалительно-деструктивные заболевания или закрытые повреждения внутренних
органов не представляется возможным. В таком случае вопрос о
необходимости срочной госпитализации также решается
положительно, а в качестве диагноза в направлении на госпитализацию может
быть использовано обобщающее понятие «острый живот»,
дополненное предположительными суждениями об одной или двух
нозологических формах со знаком вопроса либо без дополнений.
• Третья группа нередко вызывает значительные диагностические
затруднения. Речь идёт о больных с острыми или хроническими
заболеваниями терапевтического профиля (пневмонией, гастритом,
«абдоминальными кризами» при системных заболеваниях
гематологической или сосудистой природы), у которых наблюдают
проявления, не позволяющие исключить «брюшную катастрофу». Здесь
многое зависит от опыта врача, проводящего обследование, его
знаний, широты диапазона клинического мышления, однако
затягивать диагностический процесс на догоспитальном этапе даже в
трудной ситуации не следует. Кроме того, необходимо помнить, что для
части грозных острых заболеваний органов брюшной полости,
требующих хирургического лечения (например, перфоративных гаст-
родуоденальных язв и острой кишечной непроходимости),
характерен период мнимого благополучия, когда больной перестаёт
ощущать острую боль и даже отказывается от госпитализации.
Правильная форма поведения врача в подобном случае — терпеливое
убеждение с привлечением родственников, разъяснение возможных
опасных последствий отказа. При настойчивом категорическом
отказе больного от госпитализации, несмотря на убеждение, врач
обязан представить соответствующее сообщение о результатах вызова
на подстанцию скорой помощи для передачи в поликлинику по
месту жительства больного и организации контрольного осмотра
хирурга на дому. Таким же образом подобная ситуация разрешается и
в случае отказа больного от госпитализации после обследования в
приёмном отделении стационара.
• Четвёртая группа представлена больными с симптомами «острого
живота» и явными признаками острых инфекционных заболеваний,
прежде всего, кишечных инфекций. Организационные вопросы
дифференциальной диагностики применительно к этой группе
будут рассмотрены в одном из последующих разделов главы.
Завершая этот раздел, необходимо ещё раз напомнить, что
обозначение «острый живот» может служить лишь ориентировочным,
396 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 15
предварительным диагнозом и только на догоспитальном этапе. Этим
диагнозом не следует пользоваться излишне часто. Он предназначен
для отражения тревожной ситуации, настраивает на активную
хирургическую тактику и вместе с тем носит характер предположения,
неполной уверенности врача в своём заключении в связи с нечёткой
клинической картиной и ограниченными диагностическими
возможностями. Этот диагноз служит, прежде всего, основанием для
неотложного направления в хирургический стационар, где процесс
дифференциальной диагностики продолжается на более совершенном
уровне, начиная с приёмного отделения.
Семиотика острого живота, её патоморфологическая
и патофизиологическая природа
В клиническом смысле острый живот — синдром, но синдром
своеобразный. Обычно под синдромом (греч. syndrom — скопление)
понимают закономерное сочетание нескольких характерных признаков
(симптомов), связанных единством патогенеза. При этом характерные
признаки могут соотноситься с разными уровнями диагностического
процесса: жалобами на момент обследования, анамнестическими
данными о начальных признаках заболевания, данными объективного
осмотра или физикальными симптомами, а также результатами
лабораторного и рентгенологического исследований. Чем больше
характерных признаков удаётся выделить, тем большую определённость
обретает синдром и этим приближается к нозологической форме диагноза.
Но с синдромом острого живота всё обстоит иначе. Он
соотносится только с догоспитальным этапом диагностики, исключающим,
использование лабораторных, лучевых или иных специальных
дополнительных методов исследования. Он заведомо исходит из предположения
о нескольких нозологических формах заболевания, предполагает
также нестабильность, динамическую изменчивость отдельных
признаков в зависимости от истинной природы заболевания. Так, при пер-
форативных язвах желудка или двенадцатиперстной кишки боль в
животе изначально носит резкий «кинжальный» характер, затем,
утрачивая начальную остроту, становится разлитой и постоянной,
усиливающейся от изменения положения тела, а потом может вообще
проходить, что знаменует наступление периода мнимого
благополучия, когда у больного создаётся иллюзия завершения «приступа».
Сходным образом при развитии острой тонкокишечной
непроходимости боль сначала носит схваткообразный перемежающийся ха-
Острый живот. Дифференциальная диагностика ♦ 397
рактер. Интенсивность схваток может достигать силы симптома,
образно названного «илеусным криком», и сопровождается
выраженной перистальтикой приводящего отдела кишки, а затем по мере
функционального истощения и нарастания эндотоксикоза постепенно
утрачивает интенсивность, хотя патоморфологические изменения
нарастают. Развитие острого панкреатита также сопровождается
интенсивными болевыми проявлениями с характерной иррадиацией
(«опоясывающая» боль).
Данные объективного обследования при различных
заболеваниях, составляющих понятие о синдроме острого живота, также имеют
существенные различия и склонны к динамической изменчивости.
Наконец, главное, что отличает синдром острого живота от
других синдромов: его практическая ценность определяется не
количеством клинических признаков, соответствующих определённому
патологическому состоянию. Признаков острого живота описано
немало. Каждый, как правило, имеет своего автора (а то и нескольких).
Однако значимость каждого из них в распознавании синдрома
острого живота зависит главным образом от умения (своего рода
искусства) врача выявлять физикальные симптомы, раскрывающие
единый патогенетический механизм — раздражение рецепторов
брюшины как высокореактивной и высокочувствительной покровной
ткани агрессивным содержимым полых органов и развивающимся в
них воспалением. В определённом смысле справедливо говорить о
единой патогенетической природе синдрома острого живота.
Несмотря на различие инициальных механизмов при отдельных
нозологических формах, брюшина отвечает на раздражение однотипно:
сначала реактивным, а затем (по мере накопления экссудата и
транслокации в него микроорганизмов из внутренних микробиоценозов)
обретающим инфекционную природу воспалением.
Механизм развития опосредованных признаков раздражения
брюшины убедительно описал в своей книге Мондор. Согласно
изложенным им представлениям, этот механизм сводится к защитному
сокращению мышц передней брюшной стенки и диафрагмы. При этом
патофизиологическая подоплёка физикального эффекта —
непроизвольного местного уплотнения мышц передней брюшной стенки и
ограничения дыхательных экскурсий диафрагмы также за счёт
сокращения её мышечных структур — аналогична сокращению
поперечнополосатой мускулатуры в ответ на раздражение излившейся кровью,
реактивным выпотом или экссудатом синовиальной оболочки
сустава в случае его повреждения. Это непроизвольное сокращение при-
398 ♦ Хирургические болезни ♦ Том 1 -0- Часть II ♦ Глава 15
водит к фиксации сустава в функционально выгодном, так
называемом «физиологическом» положении, тем самым обеспечивая покой
повреждённому или воспалённому сегменту конечности. При
развитии перитонита возникает сходная ситуация. Она распознаётся при
умелой поверхностной пальпации живота, а ограничение
подвижности диафрагмы на стороне поражения внутренних органов легко
выявляется при перкуссии нижних отделов груди и особенно
отчётливо — во время рентгеноскопии.
О развитии воспаления какого-либо из органов брюшной
полости свидетельствует болезненность при пальпации живота в проекции
органа или при создании эффекта сотрясения брюшной стенки в тех
же отделах (симптомы Щёткина—Блюмберга, Раздольского и др.).
В случае развития распространённого перитонита защитное
напряжение мышц и болезненность при пальпации распространяются на
другие отделы живота.
Совершенно иначе реагируют гладкомышечные структуры стенки
полых органов на воспалительный процесс, переходящий с
висцерального брюшинного покрова. Смысл реакции тот же — создание
физиологического покоя воспалённому органу или органу, соседствующему
с очагом воспаления. Однако в отличие от сокращения
поперечнополосатой мускулатуры, гладкомышечные структуры, напротив,
расслабляются и растягиваются, поскольку для них достижение покоя
связано с прекращением перистальтической активности. Это различие также
получает опосредованное отражение в физикальных признаках,
свидетельствующих о местном парезе полых органов или их сегментов,
что выявляют во время перкуссии и аускультации, а также при
обзорной рентгеноскопии или рентгенографии органов брюшной полости.
Таким образом, феномен гиперчувствительности и повышенной
реактивности париетальной и висцеральной брюшины,
проявляющийся при наличии воспалительного либо
воспалительно-деструктивного очага в брюшной полости, определяет природу главных
опознавательных признаков синдрома острого живота.
Методика догоспитального обследования больных
на предмет распознавания синдрома острого живота
Как известно, любое обследование начинается с опроса больного
для выделения жалоб. Основными жалобами при синдроме острого
живота бывают: боль, рвота, расстройство стула. Однако характерис-
Острый живот. Дифференциальная диагностика ♦ 399
тика этих жалоб применительно к собирательному смыслу
рассматриваемого синдрома малоспецифична. Специфика в большей мере
соотносится с различными нозологическими формами острого живота,
но даже в этой связи не достигает патогномоничной значимости. Можно
говорить лишь об отдельных различиях, обусловленных спастическим
характером боли или болезненного состояния, возникающего,
например, вследствие нарушения опорожнения приводящего отдела кишки
при острой кишечной непроходимости. При той же кишечной
непроходимости характер рвоты меняется по мере развития процесса.
Сначала, в период «илеусного крика», рвота может носить рефлекторный
характер, обусловленный антиперистальтикой вследствие раздражения
брыжеечных и париетальных рецепторов ущемляющим механизмом.
По мере заполнения приводящего отдела в связи с неустранённым
препятствием для кишечного пассажа рвота обретает застойный характер,
при котором пусковым механизмом становится раздражение бароре-
цепторов. На этапе развития тяжёлого эндотоксикоза возникновение
рвоты связано с токсическим воздействием на подкорковые центры.
Нарушение стула при остром развитии синдрома тоже может
носить сначала рефлекторный характер. В этом же случае даже при
странгуляционной тонкокишечной непроходимости может наступить
императивное опорожнение нижних отделов кишечника, а затем уже
в связи с распространённым перитонитом может развиться стойкий
кишечный парез.
Учитывая недостаточную определённость субъективной
диагностической информации, её получению не следует уделять излишне
много времени. Регистрацию жалоб и анамнеза заболевания обычно
совмещают с объективным физикальным обследованием. При этом
условии достигают двойного эффекта: между врачом и пациентом
возникает атмосфера взаимного доверия, в свою очередь создающая
наилучшие условия для воспроизведения достаточно тонких по
ощущениям физикальных объективных симптомов.
Переходя к обсуждению приёмов и методов объективного
обследования в комплексной диагностике острого живота, следует ещё раз
напомнить, что именно участие в патологическом процессе
брюшинного покрова (париетального и брыжеечного) как
высокочувствительного и высокореактивного обширного рецепторного поля — главное
обстоятельство, объединяющее объективные и субъективные
клинические признаки в едином синдроме. Отсюда и особое внимание к
признакам, служащим прямым или косвенным свидетельством
включения брюшины в воспалительный процесс.
400 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ^ Глава 15
Уже при наружном осмотре пациента можно заметить, что
содружественное сокращение мышц передней брюшной стенки и
диафрагмы ограничивает амплитуду дыхательных движений. Этот эффект
особенно убедительно проявляется во время рентгеноскопического
исследования больных с перфорацией гастродуоденальных язв или
при поддиафрагмальных абсцессах любой этиологии. Он получает
также подтверждение в двух простых, легко выявляемых на
догоспитальном этапе симптомах.
• Для воспроизведения первого из них достаточно после обнажения
живота больного попросить его сделать несколько глубоких
вздохов. В этом случае при распространённом перитоните живот
вообще не принимает участия в дыхании, а при воспалении брюшины в
верхнем этаже брюшной полости отчётливо заметно ограничение
дыхательных движений в эпигастральной области.
• Другой симптом проявляется, если попросить больного покашлять.
При этом вместо резкого сокращения мышц брюшного пресса,
которое оттесняет диафрагму кверху и обычно сопутствует кашлю,
создавая повышенное давление в бронхах, способствующее от-
хождению секрета, у больных с распространённым перитонитом
возникает по выражению Мондора «абортивный»,
«^сформировавшийся» кашель, отличный от резкого болезненного кашля,
характерного для диафрагмального плеврита.
Если у больного симптомокомплекс острого живота выражен
нерезко и это сказывается в сохранении подвижности нижней половины
брюшной стенки, по совету Мондора, можно прибегнуть к проверке
ещё одного физикального признака, указывающего на сокращение
диафрагмальных мышц. Для этого, предупредив больного о цели
исследования, нужно положить ладонь на живот в поперечном
направлении непосредственно ниже пупка и путём периодически
усиливающегося надавливания оттеснять кишечные петли в направлении
диафрагмы, вызывая этим её раздражение и сокращение.
Положительный характер данного симптома фиксируют, когда каждый из таких
мягких толчков сопровождается более или менее болезненной икотой.
Главным определяющим симптомом острого живота, согласно
рекомендациям Мондора, Самарина, работам их современников и
предшественников, служит распознавание локального или
распространённого защитного непроизвольного напряжения мышц брюшной стенки.
При этом следует указать, что классические рекомендации прошлых
лет полностью сохранили значимость для диагностики острого
живота и сегодня, особенно на догоспитальном этапе.
Острый живот. Дифференциальная диагностика <> 401
Объективное обследование больного начинают уже во время
опроса по поводу жалоб и анамнеза заболевания. Для этого на
обнажённой поверхности живота врач легко и свободно располагает
руку, обязательно в стороне от той области, на боль в которой
жалуется пациент. Соблюдению деталей здесь придают особый смысл
и значимость, дабы обеспечить оптимальные условия для
восприятия искомой диагностической информации. Обращают внимание
даже на необходимость предварительного согревания рук врача в
зимнее время.
После того как врач убедился в полном спокойствии и доверии
пациента, следует начинать поверхностную пальпацию живота. Её
обязательно осуществляют всей ладонью и сомкнутыми пальцами с
периодическим сопоставлением полученных ощущений в
симметричных отделах правой и левой половин живота. Пальпацию проводят
не только по передней стенке, но также в боковых и даже заднебоко-
вых отделах живота, что даёт возможность распознать защитное
напряжение мышц не только при внутрибрюшном, но и в случае вне-
брюшинного расположения инфекционно-деструктивного очага.
Особую важность соблюдение представленных рекомендаций имеет
при осмотре больных с ожирением, нередко приводящим к
частичному жировому перерождению мышц передней брюшной стенки.
У таких пациентов выявление «главного» симптома острого
живота — непроизвольного мышечного сокращения (уплотнения, дефан-
са) — становится доступным лишь для опытного врача-клинициста,
обладающего «тактильным талантом» (выражение Мондора).
Существуют и дополнительные рекомендации, сводящиеся к
выявлению «внутренней» боли при распространённом вовлечении
брюшины в воспалительный процесс. Для этого необходимо во всех
случаях прибегать к осторожному пальцевому исследованию прямой
кишки (рис. 15-2).
• Палец в перчатке, смазанной вазелином, должен проникнуть в
ампулу кишки без насильственного преодоления сокращения мышц
сфинктера.
• После нескольких секунд адаптации больного к необычным
ощущениям необходимо произвести лёгкое надавливание концом
пальца на боковые стенки нижнеампулярного отдела.
• При этом можно выявить реакцию воспалённой брюшины, не
покрытой мышечным массивом брюшной стенки. Разлитая
болезненность за пределами точек давления свидетельствует о
распространённом воспалительном процессе в брюшной полости.
402 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 15
Рис. 15-2. Ректальное
исследование при перитоните
выявляет нависание передней
стенки прямой кишки и ее
резкую болезненность.
Особую значимость этот приём имеет у детей первых лет жизни,
если у них подозревают весьма редкий в таком возрасте острый
аппендицит. Дело в том, что вследствие естественного
(физиологического) висцероптоза в раннем детстве червеобразный отросток вместе
с кишечником опускается в малый таз, и распознавание его
воспаления при пальпации живота оказывается значительно менее
эффективным. Естественно, что у детей исследование прямой кишки
следует осуществлять с особой осторожностью, мизинцем, избегая
излишних манипуляций и наблюдая за реакцией ребёнка во время
надавливания на боковые стенки кишки, поскольку жалоб в словес-
ном выражении он воспроизводить не может.
Другое исследование, связанное с выявлением «внутренней боли»,
свойственной распространённому перитониту даже на ранних стадиях
его развития, используют при наличии начальных проявлений
пупочной грыжи (или грыжи брюшной стенки любой другой локализации).
При мягком пальцевом давлении удаётся легко вправить такую
грыжу, но при этом возникает разлитая болезненность за пределами
грыжевого дефекта. Вообще, следует постоянно помнить, что пальцевое
исследование прямой кишки и целенаправленная пальпация всех мест
типичного расположения грыж: брюшной стенки должны быть
непременным правилом при обследовании всех больных с подозрением на
синдром острого живота. Соблюдение этого правила способно уберечь от
грубых диагностических ошибок, когда, к примеру, больных с
выраженным ожирением при наличии у них пристеночного ущемления
грыжи брюшной стенки в течение многих часов наблюдают с диагнозом
«спаечная болезнь» или «частичная кишечная непроходимость».
Такие диагнозы вообще нельзя употреблять в неотложной хирургии,
поскольку они не содержат никакой информации для выбора
хирургической тактики.
Острый живот. Дифференциальная диагностика ♦ 403
Особое внимание к описанию симптомов раздражения брюшины
в диагностике острого живота вызвано тем, что умелое
воспроизведение этих симптомов с соблюдением деталей исследования служит
решающим аргументом диагностики. Вместе с тем, воспроизведение
с той же целью обширного набора симптомов, получивших широкую
известность по именам предложивших их авторов, но
воспроизводимых грубо, неточно и без понимания смысла связанной с ними
информации, способно запутать и без того сложную диагностическую
ситуацию. Это особенно отчётливо проявляется, когда при утреннем
обходе больных после ночного дежурства приходится видеть синяки
в правой подвздошной области. Это следы от пальцев, следы
неграмотного воспроизведения широко известного симптома Щёткина—
Блюмберга у больных с подозрением на острый аппендицит.
Дополнительную диагностическую информацию при физикальном
обследовании больных в связи с синдромом острого живота
привносит перкуссия. В зависимости от тембра (высоты) перкуторного звука
в диапазоне от тупости до высокого тимпанита, а также от локализации
выявленных изменений можно нередко получать весьма объективные
представления о внутрибрюшной патоморфологии. Так, наиболее
высокий тимпанит свидетельствует о скоплении газа в изолированной
петле тонкой кишки, что может быть признаком странгуляционной
кишечной непроходимости. Напротив, нечётко отграниченный
низкий тимпанит в проекции паренхиматозных органов (исчезновение
печёночной тупости) свидетельствует о пневмоперитонеуме (рис. 15-3),
Рис. 15-3. Перкуссия при перфорации гастродуоденальной язвы или
дивертикула толстой кишки выявляет исчезновение печёночной тупости, а при
скоплении крови или экссудата — притупление перкуторного звука в
отлогих местах живота.
404 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II -ф- Глава 15
который может быть с наибольшей вероятностью вызван перфорацией
гастродуоденальных язв или дивертикулов ободочной кишки и
служит в том и другом случае свидетельством распространённого
перитонита. Ограниченный тимпанит может свидетельствовать также о
местном парезе кишечных петель, располагающихся около очага
воспалительной деструкции. Так, наличие тимпанита в проекции
купола слепой кишки нередко служит признаком ретроцекального заб-
рюшинного деструктивного аппендицита. В этой связи следует ещё
раз напомнить, что в отличие от поперечнополосатой мускулатуры,
реагирующей на близость инфекционно-воспалительного очага
непроизвольным напряжением, гладкомышечные структуры кишечной
стенки отвечают на воспаление устойчивым парезом.
Проведение перкуссии живота с переменой положения тела
пациента позволяет по изменению границ тупости в соответствии с
перемещением жидкости в полости брюшины устанавливать скопление
крови или экссудата (см. рис. 15-3), начиная с 400—500 мл.
Полезную дополнительную информацию в диагностику острого
живота вносит аускультация. Она позволяет выявить усиленную
перистальтику приводящих кишечных петель при развитии острой
кишечной непроходимости, распознать пальпаторно
спровоцированный «шум плеска» в изолированной петле кишки при странгуляции
(рис. 15-4) или распространённый феномен «плеска» при глубоком
парезе, обусловленном тяжёлым
перитонитом или запущенной «низкой»
кишечной непроходимостью.
Начальный, догоспитальный этап
диагностики острого живота
завершается предварительным диагнозом. В
зависимости от выявленных признаков его
можно сформулировать достаточно
определённо или в обобщённой форме,
подтверждающей наличие синдрома
острого живота без указания конкретной
нозологической формы. Выставленный
после первичного осмотра диагноз
служит документальным аргументом для
направления больного в хирургический
стационар в целях дальнейшего
уточнения диагноза, определения и реализации
хирургической тактики либо для прове-
Рис. 15-4, Сукуссия
позволяет выслушать
характерный симптом острой
кишечной непроходимости —
шум плеска.
Острый живот. Дифференциальная диагностика О 405
дения лечебно-диагностического процесса в условиях поликлиники
или домашнего режима. Неустранённые сомнения в правомерности
диагноза острого живота также служат основанием для направления
в хирургический стационар, где есть условия для безотлагательного
уточнения диагноза и реализации решений об активной
хирургической тактике, если такое решение будет принято.
Организационно-тактические принципы дифференциальной
диагностики острого живота на госпитальном этапе
В условиях больницы или другого клинического учреждения
дифференциальную диагностику проводят, начиная с приёмного
отделения. Уже в ходе осмотра пациента дежурным хирургом диагноз
направления может быть отвергнут или уточнён на основании
воспроизведения тех же клинических симптомов, что и на
догоспитальном этапе, но в более поздние сроки и в исполнении более опытного
клинициста-хирурга. Здесь же, в приёмном покое, можно выполнить
элементарные лабораторные исследования (общий анализ крови и
мочи), а также обзорную рентгенографию или УЗИ органов живота.
С помощью последних даже в период мнимого благополучия
диагностируют признаки пневмоперитонеума, свидетельствующего о
перфорации гастродуоденальных язв или деструкции толстой кишки, а
также уровни жидкости в кишечных петлях — признак непроходимости.
Практика крупных стационаров показывает, что выполнение такого
элементарного набора исследований во время обследования больного
в приёмном отделении оказывается полезным. Однако расширять
объём догоспитальных исследований до направления больного в
лечебные подразделения нецелесообразно: в случае одновременного
поступления нескольких пациентов организация работы приёмного
отделения затрудняется, а эффективность диагностического
процесса снижается. Задержка больных в приёмном отделении тем более
нерациональна, если наличие признаков синдрома острого живота
при осмотре дежурным хирургом подтверждается, т.е.
соответственно подтверждается и необходимость активной хирургической
тактики. В зависимости от остроты клинической ситуации и, прежде
всего, от тяжести состояния больного дальнейшую дифференциальную
диагностику осуществляют в условиях госпитального отделения или
отделения реанимации, а в исключительных случаях (например, при
наличии признаков внутреннего кровотечения при внематочной
беременности) — в условиях операционной.
Если диагноз направления на госпитализацию сформулирован как
«острый живот» и не содержит предположений относительно возмож-
406 ♦ Хирургические болезни -0- Том 1 ♦ Часть II ♦ Глава 15
ных нозологических форм заболевания органов живота,
дифференциальную диагностику на госпитальном этапе следует начинать с
исключения патологических состояний, способных симулировать
симптомы острого живота. Отсутствие патогномоничных признаков
делает этот этап дифференциальной диагностики весьма
затруднительным, поскольку перечень возможных заболеваний и
повреждений, способных вызвать проявления синдрома, весьма обширен и
сопоставление отдельных патологических симптомов, свойственных
патологическим состояниям, относимым к различным
нозологическим формам, малопродуктивно. Поэтому, отчётливо сознавая, что
убедительно отвергнуть предварительный, неуточнённый синдром-
ный диагноз острого живота возможно лишь противопоставив ему
диагноз конкретного заболевания, не требующего хирургического
вмешательства на органах брюшной полости, в дифференциальной
диагностике острого живота с другими «нехирургическими»
патологическими состояниями приходится обращаться к синдромному
подходу. В этой связи можно пользоваться таблицей сопоставления
синдромов (табл. 15-1), предложенной Н.Н. Самариным (1952) и в
последующем рационально сокращённой и упрощённой АЛ.
Гринбергом (1988).
Когда синдромный диагноз острого живота подтверждён при
первичном осмотре в стационаре, задача дальнейшей
дифференциальной диагностики сводится к распознаванию конкретной
нозологической формы, скрывающейся за этим диагнозом. Обозначенная
постановка вопроса корректна при двух условиях:
• если такого рода уточнение диагноза может существенно
сказаться на выборе предпочтительной хирургической тактики;
• если по общесоматическому статусу больному показана
предоперационная подготовка в течение 1,5—2 ч, время которой можно
использовать также и для уточнения диагноза.
При наличии убедительных клинических признаков тяжёлого
распространённого перитонита подготовка к операции должна занимать
минимальное время, необходимое для стабилизации основных
жизненных функций больного. Задерживать операцию ради уточнения
нозологической формы диагноза при наличии перитонита недопустимо.
В более спокойной обстановке проведение рациональной
дифференциальной диагностики между отдельными нозологическими
формами острого живота оправдано, особенно если диагностические
мероприятия сочетаются с лечебными в виде инфузионной терапии,
- ———— -
Острый живот. Дифференциальная диагностика О 407
Таблица 15-1. Дифференциальная диагностика псевдоабдоминального
синдрома
Абдоминальный синдром Плевролёгочный синдром
Сердечный синдром
биотиков, опорожнения верхних отделов пищеварительного тракта
от застойного содержимого.
Выстраивание алгоритма дифференциальной.диагностики между
отдельными формами острого живота во многом определяется
характером изначально сложившихся предположений (если они
сложились) и зависит от оснащения конкретного стационара новыми
лечебно-диагностическими технологиями. В целом алгоритм должен
соответствовать логике диагностического процесса, а при его
реализации необходимо соблюдать следующие принципиальные
установочные положения.
• Во-первых, последовательность диагностических мероприятий
следует определять, исходя из принципа «от простого — к сложному»,
«от неинвазивных исследований — к инвазивным».
• Во-вторых, планируя инвазивное исследование, связанное с той или
иной степенью риска осложнений, вызванных самим его
проведением, необходимо взвешивать предполагаемую полезность ожидае-
Аодоминальныи синдром
Расстройство
пищеварения, боль в животе,
запор или диарея.
Острое начало, часто без
лихорадки
плевролегочныи синдром
Жалобы и анамнез
Озноб, возможность
заражения, простуда.
Острое начало, лихорадка
почти всегда. Боль
усиливается при дыхании
Объективное исследование
Лицо или нормальное,
или похоже на лицо
больного перитонитом.
Напряжение мышц
живота резко выражено, не
исчезает при пальпации.
Болезненность при
ощупывании усиливается от
давления на место
первичного очага
Яркий румянец на щеках.
Иногда движение крыльев
носа при каждом вдохе.
Напряжение мышц
живота ясно выражено, но
исчезает при пальпации.
Боль усиливается при
кашле и давлении на
межрёберные промежутки
Сердечный синдром
Анамнез сердечного
больного. Часто
жалобы на иррадиацию
боли в левую руку.
Редко внезапное, чаще
постепенное начало.
Рвота редко.
Иррадиация боли в левую руку
Выражение страха на
лице. Цианоз.
Напряжение резко
выражено, усиливается при
пальпации.
От давления боль не
изменяется
408 <> Хирургические болезни О Том 1 ♦ Часть II ♦ Глава 15
мой диагностической информации в сопоставлении с риском
дополнительных повреждений. В связи с этим вряд ли допустимо даже в
стационарах, обладающих возможностью круглосуточного
проведения эндовидеохирургических вмешательств, использовать этот
метод на этапе первичной диагностики, не испытав
предварительно диагностические возможности других, неинвазивных или менее
травматичных методов. По крайней мере, рекомендовать такой
подход в качестве общей рекомендации неправильно.
• В-третьих, применение инвазивного метода диагностики,
например лапароцентеза, предполагает использование всех связанных с
ним диагностических возможностей: лабораторного исследования
промывной жидкости после введения в брюшную полость
изотонического раствора в количестве 70 мл на 1 кг массы тела
(приблизительно 700—800 мл) с количественным определением форменных
элементов крови и содержания биохимических примесей. Так, при
микроскопическом исследовании промывной жидкости в случае
подозрения на продолжающееся кровотечение в брюшную полость
диагностически значимым считают наличие 100 000 эритроцитов в
1 мл, для диагностики развивающегося перитонита доказательным
считают наличие 10 000 лейкоцитов в 1 мл, а о развивающемся
остром панкреатите свидетельствует активность 128 ЕД амилазы в 1 мл.
• В-четвёртых, при обнаружении признаков острого живота нельзя
осуществлять лапаротомию заведомо в качестве лишь
диагностического акта («чтобы избежать ошибки в диагнозе»). Лапаротомия
всегда предполагает возможность выполнения лечебного
пособия. Иначе оперативное вмешательство, связанное пусть с
относительно небольшим, но всё же вполне реальным риском развития
обусловленных им осложнений, нельзя считать оправданным. В
определённой мере этот принцип соотносится также и с эндовидео-
хирургической лапароскопией. Несмотря на малую инвазивность,
в практике неотложной абдоминальной хирургии она вполне
сопоставима по риску осложнений с лапаротомией, а в отдельных
случаях (при наличии послеоперационных рубцов брюшной стенки,
свидетельствующих о вероятности спаечного процесса в полости
брюшины) превышает этот риск.
В последние годы более отчётливо проявилась необходимость
соблюдения и ещё одного принципа дифференциальной диагностики
при клинической картине острого живота. Такая необходимость
возникает, когда симптомы, указывающие на возможность внутрибрюш-
НОЙ катастрофы, сочетаются с объективными признаками инфекци-
Острый живот. Дифференциальная диагностика О 409
онных заболеваний, чаще всего кишечных инфекций. В этом случае
инфекционное заболевание вполне может оказаться не
диагностической альтернативой, а фоновым страданием, формирующим пато-
морфологический субстрат для развития синдрома острого живота.
Как показывает опыт работы в очагах эпидемий, угроза которых
возрастает в районах стихийных бедствий и длительных локальных
вооружённых конфликтов, применение антибиотиков широкого
спектра действия, способствующее нарушению естественного кишечного
микробиоценоза, нередко нарушает известную цикличность
классических инфекционных заболеваний, усиливая, например при
брюшном тифе, вероятность образования язвенных дефектов кишечной
стенки и их перфорации на всех этапах развития заболевания, в том
числе и повторных перфораций. Кроме того, в последние годы
доказана причастность некоторых возбудителей классических
инфекционных заболеваний (сальмонеллёза, иерсениоза, псевдотуберкулёза)
к этиологии деструктивных форм острого аппендицита и острого
холецистита, т.е. болезней, традиционно относимых к хирургическим
инфекциям. Отсюда необходимость настороженного отношения к
такого рода пациентам: признаки острого инфекционного
заболевания сами по себе не исключают необходимости неотложного
хирургического лечения, которое, естественно, необходимо осуществлять
в условиях хирургического стационара, но с соблюдением
противоэпидемического режима. К настоящему времени уже существуют
материалы, обобщающие позитивный опыт работы хирургических
отделений на базе крупных инфекционных больниц и некоторых
инфекционных госпиталей, обеспечивающих оказание медицинской
помощи в особых условиях. Апробированная организационная
форма подтверждает свою конструктивность.
Таковы организационно-тактические принципы
дифференциальной диагностики острого живота, сложившиеся к настоящему
времени. Если оценивать перспективу, то она в наибольшей мере связана
с широкомасштабным внедрением в практику
высокоинформативных методов лучевой диагностики, уже сегодня способных
обеспечить достоверное распознавание локализации и патоморфологичес-
кой характеристики многих инфекционно-деструктивных очагов,
составляющих объективную основу диагностики острого живота.
ЖЕЛЧНОКАМЕННАЯ
БОЛЕЗНЬ
В настоящее время желчнокаменной болезнью (ЖКБ), или холе-
литиазом, страдают каждая пятая женщина и каждый десятый
мужчина. Примерно четверть населения старше 60 лет имеют жёлчные
камни. У значительной части пациентов развиваются холедохолити-
аз, механическая желтуха, холецистит, холангит, стриктуры
большого дуоденального сосочка и другие, порой жизнеугрожающие
осложнения (рис. 16-1).
Рис. 16.1. Осложнения желчнокаменной болезни: а — обтурация пузырного
протока — причина острого холецистита, эмпиемы и водянки жёлчного
пузыря; б — холедохолитиаз, приводящий к механической желтухе и гнойному
холангиту; в — ущемлённый камень большого дуоденального сосочка,
вызывающий механическую желтуху и острый панкреатит; г — пролежень
стенки жёлчного пузыря, пузырно-кишечиый свищ.
Желчнокаменная болезнь -О 411
Ежегодно в мире выполняют более одного миллиона оперативных
вмешательств по поводу ЖКБ, а холецистэктомия является самой
частой абдоминальной операцией в общехирургической практике.
Таким образом, врач любой специальности, в особенности терапевт
и хирург, в своей практической деятельности весьма часто
встречается с этим заболеванием.
Проблема выявления, своевременного распознавания и лечения
этого заболевания требует от врача, с одной стороны, глубоких
знаний и владения методикой обследования больных, с другой - -
умения определять тактику лечения больного ЖКБ.
Этиология и патогенез холелитиаза
В патогенезе камнеобразования имеют значение три основных
фактора — перенасыщение жёлчи холестерином, усиленная нуклеа-
ция и снижение сократительной способности жёлчного пузыря.
Перенасыщение жёлчи холестерином
При ЖКБ наблюдают изменение нормального содержания в жёлчи
холестерина, лецитина, солей жёлчных кислот. Холестерин,
практически нерастворимый в воде, находится в растворённом состоянии в
жёлчи благодаря её мицеллярному строению и наличию жёлчных
солей и лецитина. В мицеллярных структурах всегда имеется
определённый предел растворимости холестерина. Состав жёлчи характеризуется
индексом литогенности, который определяется отношением
количества холестерина, находящегося в исследуемой крови, к его
количеству, которое может быть растворено при данном соотношении
жёлчных кислот, лецитина, холестерина. В норме индекс литогенности
равен единице. Если он выше единицы, холестерин выпадает в осадок.
Установлено, что в организме больных со значительной степенью
ожирения продуцируется жёлчь, перенасыщенная холестерином.
Секреция жёлчных кислот и фосфолипидов у больных с ожирением
больше, чем у здоровых лиц с нормальной массой тела, но концентрация
их все же недостаточна для удержания холестерина в растворённом
состоянии. Количество секретируемого холестерина прямо
пропорционально массе тела и её избытку, количество же жёлчных кислот
во многом зависит от состояния энтерогепатической циркуляции и
не зависит от массы тела. Следствием этой диспропорции и является
перенасыщение жёлчи холестерином у тучных людей.
412 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 16
Гиперхолестеринемию также наблюдают у больных сахарным
диабетом, атеросклерозом, ишемической болезнью сердца,
гипертонической болезнью, гипотиреозом, подагрой, циррозом печени, перенёсших
инфекционно-паразитарные заболевания и др. Повышает вероятность
возникновения холелитиаза приём пероральных контрацептивов.
Усиление нуклеации
Первым этапом образования камней в перенасыщенной
холестерином жёлчи является нуклеация — конденсационный и агрегаци-
онный процесс, при котором в жёлчи образуются всё
увеличивающиеся микроскопические кристаллы моногидрата холестерина. Один
из наиболее значимых пронуклеарных факторов — муцин-гликопро-
теиновый гель, который, плотно прилегая к слизистой оболочке
жёлчного пузыря, захватывает микрокристаллы холестерина и
слипшиеся везикулы, перенасыщенные холестерином, представляющие собой
суспензию жидких кристаллов. Со временем, при снижении
сократительной способности жёлчного пузыря, из везикул образуются
твёрдые кристаллы. Своеобразную цементирующую роль в этом
процессе играют соли кальция. Карбонат кальция, билирубинат кальция и
фосфат кальция могут также служить начальными ядрами
кристаллизации холестерина.
Снижение сократительной способности жёлчного пузыря
Наличие жёлчного пузыря с нарушенной сократительной
способностью («отстойника жёлчи») является предрасполагающим
фактором для застоя жёлчи и камнеобразования, поскольку небольшие
кристаллы холестерина могут свободно поступать с током жёлчи в
кишечник, до того как они трансформируются в конкременты.
Нарушение координированной работы сфинктеров вызывает
различные по характеру дискинезии. Выделяют гипертонические и
гипотонические (атонические) дискинезии желчевыводящих протоков и
жёлчного пузыря. При гипертонических дискинезиях происходит
повышение тонуса сфинктеров. Так, спазм общей части сфинктера Одди
вызывает гипертензию в протоках и жёлчном пузыре. Повышение
давления связано с поступлением в протоки и жёлчный пузырь жёлчи и
панкреатического сока, при этом последний может обусловливать
картину ферментативного холецистита. Возможен спазм сфинктера
пузырного протока, что также вызывает застойные явления в пузыре. При
Желчнокаменная болезнь ♦ 413
гипотонических (атонических) дискинезиях происходит расслабление
сфинктера Одди с последующим рефлюксом содержимого
двенадцатиперстной кишки в жёлчные протоки (возникает инфицирование
протоков). На фоне атонии и плохого опорожнения жёлчного
пузыря в нём развиваются застойные явления и воспалительный процесс.
Таким образом, нарушение эвакуации жёлчи из жёлчного пузыря
и протоков является необходимым фактором для камнеобразования
в концентрированной жёлчи.
Классификация
/. Характер конкрементов:
• холестериновые;
• пигментные (чёрные, коричневые);
• смешанные.
//. Формы клинического течения:
• латентная (камненосительство);
• диспептическая;
• болевая.
///. Осложнения:
• острый холецистит;
• холедохолитиаз;
• стриктура большого дуоденального сосочка;
• механическая желтуха;
• гнойный холангит;
• жёлчные свищи.
По составу принято различать холестериновые, коричневые и
чёрные пигментные камни. Холестериновые камни — наиболее частый
тип жёлчных камней, они состоят либо только из холестерина, либо
он является основной их составной частью. Камни, состоящие
только из холестерина, обычно крупных размеров, белого цвета или с
желтоватым оттенком, мягкие, достаточно легко крошатся, чаще имеют
слоистую структуру. Смешанные холестериновые камни содержат
более 50% холестерина и встречаются несколько чаще чисто
холестериновых. Они, как правило, меньших размеров и чаще бывают
множественными.
Пигментные камни составляют 10—25% всех жёлчных камней у
больных в Европе и США, но среди населения азиатских стран их
частота значительно выше. Они обычно малой величины, хрупкие,
414 ♦ Хирургические болезни О Том 1 ♦ Часть II ♦ Глава 16
чёрного или тёмно-коричневого цвета. Их частота увеличивается с
возрастом. Чёрные пигментные камни состоят либо из полимера
чёрного цвета — билирубината кальция, либо из полимероподобных
соединений кальция, меди и большого количества муцин-гликопро-
теинов, не содержат холестерина. Такие камни чаще выявляют у
больных циррозом печени, при хронических гемолитических состояниях
(наследственная сфероцитарная или серповидноклеточная анемия,
сосудистые протезы, искусственные клапаны сердца и др.). Они
составляют примерно 20—25% камней жёлчного пузыря, могут
мигрировать в жёлчные протоки.
Коричневые пигментные камни состоят преимущественно из
кальциевых солей неконъюгированного билирубина с включением
различного количества холестерина и протеина. Образование
коричневых пигментных камней связывают с наличием инфекции, и при
микроскопическом исследовании в них выявляют цитоскелетоны
бактерий. Камни могут образовываться как в жёлчном пузыре, так и
в протоках, причём в последних они образуются гораздо реже.
Клинические формы желчнокаменной болезни
Латентная форма (камненосительство)
Значительное число носителей жёлчных камней могут не
предъявлять никаких жалоб. До 60—80% людей с камнями в жёлчном пузыре
и 10-20% в общем жёлчном протоке не имеют никаких связанных
с этим расстройств. При этом камненосительство следует
рассматривать скорее как период течения ЖКБ, поскольку в срок от 10 до
15 лет после первичного обнаружения жёлчных «немых» камней у
30-50% больных развиваются другие клинические формы ЖКБ и её
осложнения.
Диспептическая форма ЖКБ
Жалобы больных связаны с функциональными расстройствами
деятельности ЖКТ. Больные отмечают чувство тяжести в надчревье,
метеоризм, неустойчивый стул, изжогу, горечь во рту Обычно эти
ощущения возникают периодически, но могут иметь и постоянный
характер. Чаще они возникают после еды, особенно если она
включала в себя жирные, жаренные, острые блюда, алкоголь или была
обильной. В чистом виде диспептическая форма встречается редко.
Желчнокаменная болезнь <0> 415
Болевая форма ЖКБ
Это наиболее частая клиническая форма симптомного холелити-
аза (75% больных). Она проявляется внезапно возникающими и
обычно периодически повторяющимися болевыми приступами печёночной
(жёлчной) колики. Механизм печёночной колики сложен и до конца
не изучен. Чаще всего приступ обусловлен нарушением оттока жёлчи
из жёлчного пузыря (спазм пузырного протока, обструкция его
камнем, комочком слизи) или нарушением отхождения жёлчи по общему
жёлчному протоку (спазм сфинктера Одди, обструкция его камнем,
комочком слизи, прохождением камня по общему жёлчному протоку).
Клиническая симптоматика печёночной колики
Приступ болей в правом подреберье может провоцировать
погрешность в диете или физическая нагрузка, однако у многих больных он
возникает спонтанно, даже во время сна.
Боль возникает внезапно, может длиться часами, редко более
суток. Боли носят острый, приступообразный характер, нечётко
локализованы в правом подреберье и надчревье (висцеральная боль).
Иррадиация болей в спину или лопатку обусловлена раздражением
окончаний ветвей спинномозговых нервов, принимающих участие в
иннервации печёночно-двенадцатиперстной связки по ходу жёлчных
протоков. Отмеченные симптомы могут быть связаны с наличием
холедохолитиаза, холангита, протоковой гипертензии.
Довольно часто возникают тошнота и рвота с примесью жёлчи,
приносящая временное облегчение.
В 1875 г. СП. Боткиным описан холецисто-кардиальный синдром,
при котором боли, возникающие при печёночной колике,
распространяются на область сердца, провоцируя приступ стенокардии.
Обычно после проведения холецистэктомии жалобы исчезают. В
противном случае пациенты долгое время находятся на лечении у кардиолога
или терапевта без желаемого результата.
Пульс может быть учащён, АД существенно не меняется.
Повышения температуры тела, озноба, лейкоцитоза не отмечают, так как нет
воспалительного процесса (в отличие от приступа острого
холецистита). Боль обычно нарастает в течение 15—60 мин, а затем остаётся
почти постоянной в течение от 1 до 6 ч. В дальнейшем происходит
постепенное стихание болей, однако возможно и внезапное их прекращение.
Приступ болей, продолжающийся более 6 ч, может свидетельствовать
416 ♦ Хирургические болезни -0- Том 1 ♦ Часть II ♦ Глава 16
о возможном развитии острого холецистита. Между приступами
колики больной чувствует себя вполне удовлетворительно. У 30%
больных повторных приступов не бывает в течение длительного времени.
При периодическом повторении приступов острых болей в
правом подреберье и надчревье (болевая торпидная форма ЖКБ)
каждый приступ следует рассматривать как острое состояние,
требующее активного лечения в условиях хирургического стационара.
Симптомы, выявляемые при печёночной (жёлчной) колике и
холецистите перечислены ниже.
• Симптом Ортнера-Грекова — появление или усиление болей
справа при сравнительном поколачивание краем ладони по правой и
левой рёберным дугам. В основе симптома лежит усиление болей
вследствие сотрясения воспалённой стенки или напряжённого
жёлчного пузыря.
• Симптом Мерфи — при надавливании на точку проекции жёлчного
пузыря больного просят резко сделать глубокий вдох. При
движении диафрагмы вниз дно жёлчного пузыря наталкивается на
пальцы обследующего — увеличивается гипертензия в жёлчном пузыре
(при условии нарушения оттока жёлчи, наличии воспаления),
происходит рефлекторный обрыв вдоха на его высоте из-за сильной боли.
• Симптом Мюсси—Георгиевского — сравнительное надавливание
между ножками грудино-ключично-сосцевидной мышцы справа и
слева. Иррадиация болей по правому диафрагмальному нерву
приводит к большей болезненности справа.
Инструментальная диагностика
Визуализирующие методы исследования в диагностике ЖКБ
представлены достаточно широко. Каждый из них имеет свои
преимущества и слабые стороны, они существенно различаются по стоимости,
доступности и риску для пациента. За исключением УЗИ, ни один из
инструментальных методов диагностики не должен быть
использован рутинно (без специальных показаний).
Ультразвуковое исследование
УЗИ с использованием современных ультразвуковых аппаратов с
цветным картированием и возможностью получения трёхмерного
изображения занимает лидирующее положение в диагностике ЖКБ.
Желчнокаменная болезнь ♦ 417
Чувствительность и специфичность метода при данной патологии
достигает 95% (рис. 16-2). Помимо отсутствия лучевой нагрузки на
больного и персонал и финансовой доступности, метод позволяет за
относительно короткий срок обследовать значительное количество
пациентов. При УЗИ можно определить наличие и локализацию
конкрементов в жёлчном пузыре, признаки воспаления (или деструкции)
стенки жёлчного пузыря, расширение внутри- и внепечёночных
жёлчных протоков, оценить состояние поджелудочной железы.
Информативность УЗИ значительно снижается при наличии большого
количества газа в кишечнике, выраженном ожирении.
Эндоскопическое УЗИ — более инвазивный и дорогостоящий
метод. Частными примерами эндо-УЗИ являются внутрипротоковое и
лапароскопическое интраоперационное УЗИ. Чувствительность и
специфичность приближается к 100%. Исследование выполняют при
эзофагогастродуоденоскопии и лапароскопических операциях
специальным датчиком.
Непрямая холецистохолангиография
Суть метода заключается в пероральном, внутривенном или ин-
фузионном введении йодсодержащих рентгенконтрастных веществ.
Эти методы диагностики называют непрямыми, так как они
основаны на способности клеток печени выделять с жёлчью контрастное
Рис. 16-2. Ультразвуковая
картина калькулёзного холецистита.
Стрелкой указан конкремент в
жёлчном пузыре.
418 О- Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 16
вещество, которое, попадая в желчные пути, позволяет получить их
изображение на рентгенограммах. По выявляемым дефектам
наполнения можно судить о наличии конкрементов в жёлчном пузыре или
желчевыводящих протоках, а также получить представление о
наличии стриктур общего жёлчного протока и большого дуоденального
сосочка. Отрицательные стороны этого метода исследования —
лучевая нагрузка на больного и персонал и относительная дороговизна
метода. Информативность метода 50-60%.
Прямая холангиография
Прямая холангиография основана на введении контрастного
вещества непосредственно в жёлчный пузырь или жёлчные протоки во
время операции либо после неё через дренажи, установленные там.
Метод применяют чаще при подозрении на механическую желтуху
(рис. 16-3).
Эндоскопическая ретроградная
холангиопанкреатикография
ЭРХПГ служит своего рода «золотым стандартом» в диагностике
холангиолитиаза. Суть метода состоит в эндоскопической канюляции
большого дуоденального сосочка с последующим введением во вне-
печёночные жёлчные протоки рентгеноконтрастного вещества.
Камни в просвете общего печёночного и общего жёлчного протоков
определяются как дефекты наполнения различного размера (рис. 16-4).
Рис. 16-3. Холецистохолан-
гиограмма через культю
пузырного протока. Видны
камни в общем жёлчном протоке.
Желчнокаменная болезнь О- 419
Рис. 16-4. Эндоскопическая
ретроградная холангиопанкреати-
кография (видны конкременты в
обшем жёлчном протоке).
Несмотря на лучевую нагрузку, метод, помимо диагностики,
позволяет выполнить и целый ряд лечебных мероприятий, таких как
эндоскопическая папиллосфинктеротомия, экстракция конкремента из
общего жёлчного протока, механическая литотрипсия. Эти
особенности метода в ряде ситуаций (холедохолитиаз, стриктура большого
дуоденального сосочка) позволяют избежать длительной и
травматичной операции на жёлчных протоках.
Билиосцинтиграфия
Метод контроля движения меченного 99тТс
радиофармпрепарата через клетки печени и желчевыводящие протоки с помощью
гамма-камеры. Дорогостоящий метод, требующий наличия специальной
аппаратуры. Информативность при ЖКБ ниже, чем у других методов
исследования, которые являются ещё и более доступными.
Компьютерная и магнитнорезонансная томографии
КТ и МРТ представляются высокоинформативными, но
дорогостоящими и доступными далеко не всем стационарам методами.
420 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 16
Дифференциальная диагностика
Основная задача дифференциальной диагностики при ЖКБ —
определение того факта, что жалобы пациента обусловлены ЖКБ, а
не каким-либо другим заболеванием, имеющим похожие
клинические проявления. В противном случае лечение окажется
неэффективным и пациент будет предъявлять прежние жалобы. Далеко не
полный перечень сходных по симптоматике болезней приведён ниже.
1. Заболевания жёлчного пузыря:
• бескаменный холецистит;
• лямблиоз, описторхоз, актиномиоз;
• холестероз;
• аденомы и аденомиоз;
• злокачественное новообразование.
2. Заболевания других органов:
• хронический гепатит;
• хронический панкреатит;
• хронический гастрит, дуоденит, язвенная болезнь желудка и
двенадцатиперстной кишки;
> рефлюкс-эзофагит;
• грыжа пищеводного отверстия диафрагмы;
• мочекаменная болезнь с правосторонней почечной коликой;
• опухоль правой половины толстой кишки.
Дифференциальная диагностика должна базироваться как на
анализе клинической симптоматики, так и на результатах
инструментальных методов.
В связи с этим, помимо УЗИ брюшной полости, пациенту
необходимо выполнять целый ряд дополнительных исследований, таких как
эзофагогастродуоденоскопия, колоноскопия, ЭКГ, рентгеноскопия
грудной и брюшной полостей и т.д.
Лечение
Лечение ЖКБ можно разделить на хирургическое и нехирургическое.
Нехирургическое лечение
Нехирургическое лечение заключается в лекарственном раство
рении жёлчных камней и экстракорпоральной ударно-волновой ли
тотрилсии.
.: !
Желчнокаменная болезнь О- 421
Лекарственное растворение камней (холестериновых)
С этой целью применяют препараты хенодезоксихолевой и урсо-
дезоксихолевой кислот, чаще используемые в режиме монотерапии.
Предпочтение отдают урсодезоксихолевой кислоте (выше
эффективность, меньше побочных эффектов). Основным механизмом действия
препаратов хенодезоксихолевой кислоты служит мицеллярное
растворение, тогда как формирование жидкой кристаллической фазы
играет важную роль при использовании препаратов
урсодезоксихолевой кислоты.
Скорость растворения камней во многом зависит от содержания
жирных кислот, отношения поверхности к объёму конкрементов
(поэтому мелкие камни растворяются быстрее) и скорости
опорожнения жёлчного пузыря. Эффективной литолитическую терапию
считают при полном растворении камней, что должно быть подтверждено
двумя последовательными УЗИ, проведёнными с интервалом в 1 мес.
При проведении данного вида лечения успех отмечают в 40-70%
в сроки от 3 до 24 мес (в среднем 12 мес). Вместе с тем, рецидивы
возникают у 50% больных в течение 5—7 лет после растворения, у
большинства — в первые 2 года. Необходимо отметить длительность
проводимого лечения и его высокую стоимость. Многие больные
самостоятельно прекращают приём препаратов по разным причинам.
Экстракорпоральная ударно-волновая литотрипсия
Метод используют по строгим показаниям в виде
самостоятельного способа лечения холецистолитиаза либо в сочетании с литоли-
тической терапией с целью повышения эффективности последней.
Образование ударной волны производят различными
физическими методами: с помощью электрогидравлического,
пьезоэлектрического или магнитнорестриктивного литотрипторов. При
использовании разных типов литотрипторов ударная волна генерируется под
водой и передаётся на тело больного посредством наполненного
водой мешка, плотно соприкасающегося с кожей, обработанной
специальным гелем. С целью повышения эффективности воздействия
на конкременты и снижения повреждающего действия на органы и
ткани пациента ударную волну фокусируют. Наибольшая
эффективность л итотрипсии отмечена при одиночных холестериновых камнях
до 2 см в диаметре.
Как любые другие методы, литотрипсия и лекарственное раст-
Прение камней имеют свои противопоказания (беременность во II
422 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ^ Глава 16
и III триместрах, различные коагулопатии и др.) и осложнения
(острый холецистит, панкреатит и др.).
Достаточно узкие показания, наличие определённого числа
осложнений и противопоказаний делают применение экстракорпоральной
волновой ударной литотрипсии весьма ограниченным. Нелишним
будет подчеркнуть, что при нехирургическом лечении ЖКБ усилия
специалистов оказываются направленными на устранение следствия
заболевания, а не на его причину, к тому же успешное дробление не
исключает повторного камнеобразования.
Хирургическое лечение
Хирургическое лечение заключается в удалении жёлчного
пузыря — холецистэктомии, которая является патогенетически
обоснованным методом лечения.
Показаниями к хирургическому лечению калькулёзного
холецистита считают безуспешность и бесперспективность консервативной
терапии, реальную вероятность развития осложнений, снижение
трудоспособности и качества жизни пациентов.
В арсенале хирургов на сегодняшний день имеются три основные
технологии:
1) традиционная холецистэктомия из срединного или косого ла-
паротомного доступа;
2) видеолапароскопическая холецистэктомия;
3) «открытая» лапароскопическая холецистэктомия из
мини-доступа с использованием комплекта инструментов «Мини-ассистент».
Два последних метода принято объединять под названием
«операции малых доступов», или «малоинвазивные операции».
Традиционная холецистэктомия
Традиционная холецистэктомия может выполняться из
верхнесрединного, косо-поперечного и косых подрёберных разрезов Кохера
или Фёдорова при любых формах ЖКБ, требующих хирургического
лечения. Этим обеспечивается широкий доступ к жёлчному пузырю,
внепечёночным жёлчным путям, печени, поджелудочной железе,
двенадцатиперстной кишке. Возможны осмотр и пальпация
практически всех органов брюшной полости и забрюшинного пространства.
Выполнима вся программа ревизии и вмешательств на внепечёноч-
ных жёлчных путях.
п
Желчнокаменная болезнь ♦ 423
Видеолапароскопическая холецистэктомия
Видеолапароскопическая холецистэктомия чаще выполняется при
неосложнённых формах ЖКБ. Более дорогостоящая и технически
зависимая операция, выполняемая в условиях пневмоперитонеума
(карбоксиперитонеума). При операции возможен осмотр всех
органов брюшной полости.
Наряду с очевидными преимуществами (минимальная травмати-
зация передней брюшной стенки, хороший обзор брюшной полости)
подобное вмешательство имеет негативные моменты, связанные с
реакцией организма на пневмоперитониум:
• ограничение экскурсии лёгких;
• рефлекторное угнетение двигательной активности диафрагмы в
послеоперационном периоде за счёт её перерастяжения;
• нарушение портального кровотока;
• тромботические осложнения — флеботромбозы нижних
конечностей с риском развития ТЭЛА как следствие повышенного внут-
рибрюшного давления, положения больного с поднятым головным
КОНЦОМ.
«Открытая» лапароскопическая
холецистэктомия из мини-доступа
«Открытую» лапароскопическую холецистэктомию из
мини-доступа выполняют с помощью комплекта инструментов
«Мини-ассистент», включающего в себя кольцевидный ранорасширитель,
комплекс крючков-зеркал и специальные хирургические инструменты.
Один из крючков снабжён источником света. Изменением угла
наклона зеркала, зафиксированного при помощи специального
механизма, можно при длине разреза брюшной стенки 3—5 см получить в
подпечёночном пространстве зону адекватного осмотра и
манипулирования, достаточную для выполнения холецистэктомии и
вмешательств на протоках.
Разрез передней брюшной стенки выполняют трансректально
вертикально в правом подреберье, отступя на 2—3 см от срединной
линии. При этом рассекают кожу, подкожную клетчатку, переднюю и
заднюю стенки влагалища прямой мышцы вместе с брюшиной,
волокна прямой мышцы расслаивают.
Основным этапом операции является установка системы крючков-
зеркал и системы освещения — «открытая» лапароскопия (рис. 16-5).
При правильной их установке операция технически не отличается
424 О Хирургические болезни О Том ] <0> Часть II ♦■ Глава 16
Рис. 16-5. Начальный этап «открытой» лапароскопической холецистэктомии:
а — проекция кожного разреза и положения кольца, на котором фиксируют
крючки-расширители и осветительную систему; б, в — расположение
комплекта «Мини-Ассистент» в операционной ране.
от традиционной, сохраняя при этом все достоинства малоинва-
зивных операций, и выполняется при любых формах ЖКБ и её
осложнений.
Прогноз
При выполнении своевременной операции до развития
возможных осложнений прогноз благоприятный.
Желчнокаменная болезнь ♦ 425
Осложнения ЖКБ
Холедохолитиаз
Частота холедохолитиаза при ЖКБ достигает 30—35% общего числа
больных, при этом около 20% из них имеют «немые» камни общего
печёночного или общего жёлчного протока, что обусловлено
неполной обструкцией их просвета.
Холедохолитиаз возникает путём проникновения камней из
жёлчного пузыря через пузырный проток (чаще) либо при первичном
образовании их в общем жёлчном протоке (реже). После холецистэкто-
мии или оперативных вмешательств на жёлчных протоках частота
резидуального (забытого) холедохолитиаза может достигать 25%,
рецидивного — 3—6%. Обструкция конкрементом общего жёлчного
протока может привести к механической желтухе, холангиту или
острому панкреатиту.
.
Клиническая картина
Клинические проявления холедохолитиаза включают боль в вер:
них отделах живота, больше справа, с иррадиацией в спину, тошноту,
рвоту, симптомы механической желтухи.
Лабораторные исследования
Обычно лабораторных исследований бывает недостаточно для
постановки диагноза. В период желтухи наблюдают повышение
концентрации билирубина (за счёт прямой фракции), активности транс-
аминаз и щелочной фосфатазы в биохимическом анализе крови,
увеличивается содержание жёлчных пигментов в моче. Может
отсутствовать стеркобилин в кале.
Инструментальная диагностика
Инструментальную диагностику можно подразделить на доопера
ционную, интраоперационную и послеоперационную.
кооперационная диагностика
• УЗИ — скриннинг-метод, чувствительность его на предмет
выявления расширения общего жёлчного протока составляет до 90%.
• Эндоскопическое УЗИ через двенадцатиперстную кишку —
эффективность 85-100%.
426 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 16
• МРТ — точность до 97%.
• ЭРХПГ — стандартный способ диагностики холедохолитиаза, в
руках опытного эндоскописта эффективен в 90—95% случаев. Этод
метод сопряжён с возможным развитием гиперамилаземии, холан-
гита, панкреатита, забрюшинной перфорации двенадцатиперстной
кишки, кровотечения. Поэтому профилактически перед
исследованием вводят антибиотики широкого спектра действия,
препараты соматостатина.
Интраоперационная диагностика
• Холангиография.
• Холедохоскопия через пузырный проток или холедохотомное
отверстие.
Послеоперационная диагностика
• Фистулохолангиография (в том числе через Т-образный дренаж
общего жёлчного протока).
• Холедохоскопия через дренаж.
• ЭРХПГ.
Как только при ЭРХПГ выявлен холедохолитиаз, исследование
перестаёт быть диагностическим и становится лечебным за счёт
выполнения эндоскопической папиллосфинктеротомии, литотрипсии, литоэк-
стракции. Мелкие камни могут быть удалены без повреждения большого
дуоденального сосочка, но в большинстве случаев необходима
эндоскопическая папиллосфинктеротомия перед тем как камни удалят или
они спонтанно отойдут. Камни диаметром менее 1 см, как правило,
отходят спонтанно в течение 48 ч. Если их размеры превышают
2 см, обычно требуется выполнение литотрипсии. При
невозможности эндоскопической коррекции показано оперативное вмешательство.
Хирургическое лечение холедохолитиаза
Оптимальное решение проблемы холедохолитиаза у больных ЖКБ
— его ликвидация путём эндоскопического пособия с последующим
выполнением холецистэктомии. Между тем, не всегда холедохолитиаз
поддаётся эндоскопической коррекции, тогда прибегают к прямому
оперативному вмешательству на внепечёночных жёлчных протоках.
Операция заключается в холедохотомии, извлечении камней из
просвета протока и завершается наружным (Т-образное дренирование
общего жёлчного протока) или внутренним (холедоходуоденостомия.
Желчнокаменная болезнь ♦ 427
холедохоеюностомия) дренированием. В определённых ситуациях
операцию можно завершить первичным швом общего жёлчного протока.
Альтернативой являются «открытые» лапароскопические
операции из мини-доступа с использованием комплекта инструментов
«Мини-Ассистент», которые позволяют выполнить весь объём
диагностических и оперативных вмешательств при холедохолитиазе.
Вместе с тем основным методом при холедохолитиазе всё же остаётся
традиционное вмешательство.
Холангит
Холангит — острое воспаление жёлчного дерева, как правило, на
фоне холедохолитиаза. Вследствие холестаза создаются все условия
для присоединения инфекции, которая по мере развития носит
восходящий характер и приводит к бактериемии в 25-40% случаев.
Наиболее часто встречающиеся при этом микроорганизмы — Е. coli,
Klebsiella, Enterobacter, Streptococcus. Инфицирование происходит
гематогенным, лимфогенным путями и через кишечник.
Лечение
• Инфузионная терапия. Антибиотикотерапия.
• ЭРХПГ, возможно, с устранением причины нарушения желчеоттока.
• Декомпрессия жёлчных путей.
По данным литературы 70-85% больных с лёгким и среднетяжё-
лым холангитом излечиваются консервативными методами. Около
15% требуют прямой операции или экстренного эндоскопического
пособия.
• Эндоскопическое дренирование снижает летальность с 30% до 10%.
• Консервативная терапия должна дополнять хирургическое или
эндоскопическое пособие.
Летальность
Летальность при холангите колеблется от 7 до 40%.
Рубцовые стриктуры
Рубцовые стриктуры большого дуоденального сосочка и желче-
выводящих путей возникают при повреждении слизистой
оболочки сосочка конкрементами, мигрирующими в просвет кишки, либо
428 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 16
воспалительным процессом. Стриктуры могут быть ограниченными
по протяжённости от нескольких миллиметров до 1,0—1,5 см и тубу-
лярными, при которых концентрическое сужение терминального
отдела общего жёлчного протока возникает на протяжении 2,0—2,5 см
и более. Рубцовые стриктуры, как правило, не имеют патогномонич-
ных симптомов. Выраженный стеноз терминального отдела общего
жёлчного протока с нарушением пассажа жёлчи проявляется
симптомами механической желтухи или холангита.
По уровню поражения стриктуры делят на высокие и низкие.
Высокими называют стриктуры в области бифуркации общего
печёночного протока. Низкие стриктуры локализуются в терминальной
части общего жёлчного протока. По степени сужения протока выделяют
полные и неполные стриктуры.
Высокие стриктуры желчевыводящих путей чаще всего
возникают при случайных повреждениях протока во время холецистэктомии.
При высоких стриктурах общего печёночного протока (возможно
правого или левого печёночного протоков) выполняют такие
операции, как гепатикодуоденостомия, гепатикоеюностомия или бигепа-
токоеюностомия.
Низкие стриктуры возникают после операций на терминальном
участке общего жёлчного протока, после папиллосфинктеротомии и
других операций на большом дуоденальном сосочке. Наиболее
частыми вмешательствами при таких стриктурах являются холедоходуо-
деностомия и холедохоеюностомия.
Внутренние жёлчные свищи
При длительном нахождении камня в желчевыводящих путях или
жёлчном пузыре образуются воспалительные инфильтраты.
Впоследствии между прилегающими органами при стихании воспаления
происходит образование соединительнотканных спаек. В дальнейшем в
результате некротических изменений в стенке жёлчного пузыря,
которые возникают под давлением камня, а также воспалительного
процесса может произойти перфорация стенки с образованием свища
между полыми органами.
Свищи желчнокаменного происхождения разделяют на билиоди-
гестивные (холецистогастральный, холецистодуоденальный и т.д.) и
билиобилиарные (холецистохоледохеальный, или синдром Миризи).
Клиническая картина внутренних жёлчных свищей часто
маскируется признаками основного заболевания, и патология может быть
Желчнокаменная болезнь <>> 429
случайной находкой при холангиографии или во время операции.
Одним из осложнений билиодигестивных свищей при ЖКБ бывает
кишечная непроходимость, обусловленная крупным жёлчным камнем.
При УЗИ отмечают признаки аэрохолии (наличие газа в жёлчных
протоках). Важную роль в диагностике билиодигестивных свищей
играют прямая холангиография и эндоскопические методы
исследования, в частности ретроградная холангиопанкреатикография.
ЖКБ, осложнённая формированием любого из внутренних
жёлчных свищей, с одной стороны, требует планового оперативного
лечения, с другой — значительно осложняет оперативное
вмешательство, особенно при синдроме Миризи.
Задача оперативного лечения — разобщение свища и создание
условий для адекватного оттока жёлчи. Следует подчеркнуть, что не
диагностированный до операции синдром Миризи является одной
из основных причин развития интраоперационных осложнений и
переходов от малоинвазивных операций к стандартной лапаротомии.
Наружные жёлчные свищи
Наружные жёлчные свищи по механизму своего развития
подразделяют на первичные и вторичные. К первичным относят свищи,
образовавшиеся в результате непосредственного, прямого
повреждения желчевыводящих путей; к вторичным — свищи, возникшие в
результате расплавления стенки жёлчного протока
гнойно-некротическим процессом.
Весьма важно подразделение наружных жёлчных свищей на
полные и неполные. При полных свищах вся жёлчь выделяется наружу,
не попадая в кишечник; при неполных свищах часть жёлчи
выделяется наружу, а остальная часть поступает в кишечник.
ОПУХОЛИ
ПАНКРЕАТОДУОДЕНАЛЬНОЙ ЗОНЫ
К опухолям панкреатодуоденальной зоны относят
новообразования поджелудочной железы, двенадцатиперстной кишки, большого
сосочка двенадцатиперстной кишки и терминального отдела общего
жёлчного протока. Тесная взаимосвязь указанных анатомических
образований и одно из наиболее частых клинических проявлений —
механическая желтуха объединяют эту группу опухолевых поражений.
Среди них 70% составляют опухоли поджелудочной железы.
Рак поджелудочной железы
Эта опухоль имеет наиболее важное клиническое значение, так как
в последние десятилетия среди онкологических заболеваний она по
частоте приобретает лидирующее положение у населения
большинства индустриально развитых стран. В нашей стране в структуре
заболеваемости рак поджелудочной железы занимает седьмое место.
Этиология и патогенез
Целостное представление о механизмах развития опухолевого про
цесса до настоящего времени отсутствует. Экспериментально
установлена важная роль в развитии рака поджелудочной железы и
лёгких присутствующих в табаке компонентов нитрозамина,
избыточного потребления животного протеина и углеводов. Это
находит подтверждение и при многолетних наблюдениях за
однородными группами населения.
Наблюдают прямую корреляцию частоты развития рака с работой
в некоторых областях химической промышленности. Повышенный
риск развития заболевания отмечают у лиц, страдающих
хроническими воспалительными процессами в поджелудочной железе,
которые приводят к усиленной пролиферации и дисплазии эпителия
протоков. В этом отношении показательно развитие рака большого
дуоденального сосочка, которое часто происходит на фоне
предшествующего папиллита, гиперпластического полипоза или аденомиоза.
„.
Опухоли панкреатодуоденальной зоны ^ 431
Вместе с тем исследования молекулярной биологии дают
основание отводить приоритетную роль в развитии рака повреждению
молекул ДНК и расстройству генетической регуляции
жизнедеятельности клетки. В частности, у подавляющего большинства больных раком
панкреатодуоденальной зоны обнаруживают снижение содержания
генов супрессии опухоли р16 и р53, мутацию в Kirsten-ras онкогене,
повышенную экспрессию HER2/new онкогена и др. Поэтому
совершенствование молекулярной-диагностики позволит диагностировать
опухоль до появления клинических признаков.
Классификация
В 95% случаев рак поджелудочной железы имеет эпителиальную
природу. Около 5% составляет экзокринный, или ацинарнокле-
точный рак, который протекает наиболее агрессивно и обычно
сопровождается отдалённым или регионарным метастазированием ещё
до появления клинических признаков и уверенной диагностики
заболевания.
По критериям TNM учитывают размер опухоли, вовлечение в
опухолевый процесс групп регионарных лимфатических узлов, наличие
отдалённого метастазирования.
Т (tumor) — характеристика опухоли:
Тх — недоступна оценке;
Т1 — размеры опухоли не более 2 см;
Т2 — размеры опухоли более 2 см;
ТЗ — вовлечение в опухолевый процесс двенадцатиперстной киш
ки, жёлчного протока, забрюшинных тканей, брыжейки
кишечника;
Т4 — распространение опухоли на окружающие органы и
магистральные сосуды.
N (nodulus) — характеристика регионарного метастазирования:
Nx — недоступно оценке;
N1 — метастазирование в регионарные лимфатические узлы;
Nla — наличие метастаза в один лимфатический узел;
Nib — множественные метастазы в регионарные лимфатические
узлы.
М (metastasis) — характеристика отдалённого метастазирования:
Мх — недоступно оценке;
Ml — наличие отдалённого метастазирования.
432 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 17
Стадии рака поджелудочной железы
Стадия
I
II
III
IVa
IVb
рака
Т
Tl-2
ТЗ
Tl-3
Tl-3
Т4
Tl-4
N
NO
NO
Nla
Nib
N0-1
N0-1
M
MO
MO
MO
MO
Ml
Как видно, стадия рака определяется не только размером
опухоли, который может быть минимальным даже в финале заболевания.
Рак поджелудочной железы, независимо от размеров опухоли,
имеет тенденцию к лимфогенному и периневральному
распространению. В опухолевый процесс вовлекаются регионарные
лимфатические коллекторы и узлы при метастазировании опухолевых клеток.
Прежде всего, рак этой локализации метастазирует в перипанкреа-
тические, ретродуоденальные и парааортальные лимфатические узлы,
а также в печень с развитием в ней обычно множественных
метастатических опухолевых очагов. Кроме того, рак тела и хвоста
поджелудочной железы часто метастазирует в лёгкие, кости и надключичные
лимфатические узлы слева (вирховская железа).
Прорастание опухоли за пределы анатомической структуры и
серозного покрова органа приводит к диссеминации опухолевых клеток
по париетальной и висцеральной брюшине с развитием карцинома-
тоза и асцита. Это может быть причиной вовлечения в опухолевый
процесс соседних органов и анатомических образований. Возможно
распространение на прилежащие отделы желудка,
двенадцатиперстную кишку, терминальный отдел общего жёлчного протока,
поперечную ободочную и начальный отдел тощей кишки и их брыжейки.
Нередко это затрудняет выявление первичной локализации
опухолевого процесса.
С хирургической точки зрения особенно важно раннее
прорастание таких опухолей в близлежащие магистральные сосуды —
воротную вену, верхние брыжеечные вену и артерию, чревный ствол и его
ветви, что в большинстве случаев исключает возможность удаления
новообразования без резекции и протезирования сосудов. Типичное
проявление периампулярного рака — обтурация общего жёлчного
протока с развитием у 60% больных механической желтухи, а также сдав-
лсние просвета или прорастание стенки двенадцатиперстной кишки.
Дипанкрег эй зоны О 433
Клинические проявления
Симптомы рака поджелудочной железы в течение хтительного
времени и. особенно, в начете заболевания неопределённы и слабо
выражены. Могут появляться психологическое угнетение,
нараставшая слабость и уменьшение физической активности, изменение
аппетита или вкусовых ощущений, а также снижение массы тета О
Подобные малые проявления болезни в ранние её сроки,
несмотря на неспецифичный характер, имеют огромное диагностическое
значение, но редко вызывают тревогу у больных и онкологическую
настороженность врачей, что является одной из причин
несвоевременного проведения обследования и диагностики рака лишь в по-
злней стадии.
С прогрессированием заболевания присоединяется постоянное
чувство дискомфорта в надчревье или правом подреберье, а позже боль с
иррадиацией в поясницу или правую лопатку, позвоночник. Болевой
синдром, как правило, свидетельствует о прорастании опухолью кап-
ы поджелудочной железы и периневральном её распространении.
Опухоли головки поджелудочной железы имеют свои
особенности клинических проявлений. Прогрессирующее нарушение
оттока секрета поджелудочной железы может быть причиной развития
сахарного диабета, появления склонности к диареям. Почти \
больных первым признаком болезни может быть приступ острого
панкреатита. Более чем в 60% случаев на фоне «синдрома малых
признаков» первым отчётливым проявлением заболевания оказывается
шническая желтуха, которая развивается исподволь, без
предшествующего приступа боли, характерного для ЖКБ. Появление т
Ричности склер и кожных покровов у пациента нередко обнаружива-
голько окружающие лица. Параллельно возникают интенсивная
0|фаска мочи и обесцвечивание кала.
Важно учитывать, что развитие механической желтухи при onj
лнх головки поджелудочной железы не свидетельствует о поадн
(^Рентабельной) стадии бластоматозного процесса и отражает
Иь анатомическую близость опухоли с обшим жёлчным протоком.
*Вой синдром при опухоли такой локализации возникает, как Щ
поздних стадиях процесса и отражает распространение его и
Рсделы поджелудочной железы.
Пальпация живота часто позволяет выявить симптом Кур
Увеличенный но безболезненный желчный пузыре " с*ш-
0М на фоне механической желгухи - натогномоничныи признак
434 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 17
опухолевой обтурации дистального отдела общего жёлчного протока
при раке головки железы. Скрытое течение заболевания и
единственный доминирующий её признак в виде желтухи часто дают
основание врачу вначале предполагать острый вирусный гепатит. Часто это
является причиной необоснованно длительного обследования
больных в инфекционных стационарах.
Опухоли, расположенные в теле или хвосте поджелудочной
железы, из-за большой продолжительности бессимптомного течения
более чем у 70% больных обнаруживают случайно, а после их выявления
более чем у 80% лиц оказываются нерезектабельными. Появление
типичного симптома опухоли тела или хвоста поджелудочной железы —
постоянной боли в спине, не связанной с изменением положения тела
или физической нагрузкой, отражает обычно позднюю стадию
заболевания с прорастанием опухолью капсулы железы и забрюшинных
нервных структур. Пальпация опухоли поджелудочной железы
возможна только при больших её размерах, что отражает обычно позднюю
стадию процесса, исключающую возможность радикального лечения.
Инструментальная диагностика
У подавляющего большинства больных раком поджелудочной
железы с механической желтухой или болевым синдромом способом
установления их причины (методом скрининга) должно быть УЗИ
органов брюшной полости. Опухоли головки и тела железы более
доступны ультразвуковой диагностике по сравнению с опухолями
хвоста этого органа. При проведении этого исследования обращают
внимание на размер и содержимое жёлчного пузыря, внутри- и вне-
печёночных жёлчных протоков, а также размеры и структуру самой
поджелудочной железы и её протока.
Увеличение размеров жёлчного пузыря, особенно в сочетании с
дилатацией жёлчных протоков, указывает, скорее всего, на
механическое препятствие в терминальном отделе общего жёлчного протока,
которое может быть обусловлено опухолью головки поджелудочной
железы или (реже) новообразованием большого сосочка
двенадцатиперстной кишки либо терминального отдела общего жёлчного
протока. Ультразвуковая семиотика опухоли поджелудочной железы
заключается в увеличении её размеров, нечётких границах, гипоэхогенной
структуре образования, расширении диаметра протока железы.
Диагностические возможности УЗИ повышаются при дуплексном
сканировании с использованием цветового допплеровского картиро-
Опухоли панкреатодуоденальной зоны О 435
вания для оценки кровоснабжения опухоли и состояния прилежащих
сосудистых магистралей. Злокачественные опухоли
характеризуются усиленным артериальным кровоснабжением наряду с изменением
анатомической позиции и просвета самих артерий. Важный признак
злокачественной опухоли — изменение просвета магистральных вен
(селезёночной, верхней брыжеечной и воротной) в результате сдав-
ления и появления в них тромбов.
Высокое диагностическое значение рака поджелудочной
железы имеют КТ и МРТ. При КТ с контрастированием сосудов на
опухоль указывает локальное увеличение размеров железы и
изменение денситометрических показателей (снижение). Эти методы
позволяют оценить и вовлечение в опухолевый процесс близлежащих
анатомических структур и магистральных сосудов, обнаружить
увеличение диаметра жёлчных путей и протока поджелудочной
железы, метастазы в печени и лимфатических узлах. МРТ (рис. 17-1),
помимо этого, даёт полную картину состояния желчевыводящих
протоков (диаметр, наличие в просвете конкрементов, сужений
или опухоли) и изменений вирзунгова протока. Выявление опухоли
в поджелудочной железе в сочетании с увеличением регионарных
лимфатических узлов (в гепатодуоденальная связке, окружности
головки поджелудочной железы либо двенадцатиперстной кишки,
вдоль аорты) или метастатических очагов в печени, а также
асцита характерно для злокачественного новообразования в последней
:го стадии.
Рис. 17-1. Магнитнорезонанс-
ная томограмма при раке голов-
:и поджелудочной железы
(указан стрелкой) дистальный отдел
общего жёлчного протока не
визуализируется из-за сдавле-
ния и прорастания опухолью.
436 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 17
Высокоинформативным способом диагностики рака
поджелудочной железы представляется чрездуоденальное эндоскопическое УЗИ,
которое позволяет обнаружить опухоли небольших размеров,
инвазию их в окружающие анатомические структуры, включая сосуды.
Существенно реже в диагностике рака поджелудочной железы
используют ретроградную холангиопанкреатикографию, при которой
можно обнаружить изменение контуров протока и стенозы, а также
провести забор сока для цитологического исследования. Возможно
использование чрескожной тонкоигольной биопсии, но ошибки
диагностики этого метода достигают 30%.
Важную роль в диагностике и оценке возможностей радикального
хирургического лечения рака поджелудочной железы играет
лапароскопия. Помимо визуального осмотра органов брюшной полости, могут
быть проведены интракорпоральное УЗИ, забор жидкости из
брюшной полости для цитологического исследования, биопсия
новообразования, лимфатических узлов или метастатических очагов в печени.
Большой диагностической чувствительностью обладают органоспе-
цифические онкомаркёры — СЕА (канцероэмбриональный), СА-19-9
и СА-125 (карбоангидратные) антигены. Повышение их уровня в крови
обычно свидетельствует о злокачественном новообразовании, а степень
повышения чаще всего коррелирует со стадией опухолевого процесса.
В диагностике рака поджелудочной железы недостаточно самого
факта обнаружения опухоли, хотя любая из них должна
рассматриваться как потенциально злокачественная. В процессе обследования
необходимо оценить возможность радикального удаления
новообразования. Помимо соматического состояния больных, такую
возможность определяет стадия опухоли, которую характеризуют её размер,
прорастание в соседние анатомические структуры, особенно в
магистральные сосуды (воротную, брыжеечные вену и артерию, чревный
ствол), вовлечение регионарных лимфатических узлов и отдалённое
метастазирование, так как радикальное оперативное лечение возмож-
нo только при I—II и реже III стадиях рака. Решение столь широких
иагностических задач требует привлечения комплекса методов об-
ледования.
Дифференциальная диагностика
Дифференциальная диагностика рака поджелудочной железы
сложна, потому что многочисленные доброкачественные её
новообразования, нейроэндокринные опухоли или псевдоопухолевые вое-
'пухоли панкреатодуоденальной зоны ^ 437
патительные изменения могут проявляться схожей клинической и
инструментальной семиотикой.
Для хронического панкреатита с изолированным или диффузным
увеличением размеров железы, напоминающим опухоль, в отличие
от рака более характерны продолжительный анамнез заболевания с
эпизодами острого панкреатита, превалирование болевого
синдрома, связанного с приёмом пищи или погрешностями в диете. При УЗИ
и КТ на хроническое воспаление могут указывать конкременты в
паренхиме или протоках железы, мелкие кистозные образования в
изменённой зоне железы.
В исходе острых и хронических воспалительных процессов в
поджелудочной железе часто развиваются псевдокисты, которые могут
иметь различную форму и содержимое. Достоверное различение ки-
стозных форм рака железы от доброкачественных кист по данным
лучевых методов исследования во многих случаях оказывается
сложной задачей. Воспалительные кистозные образования имеют ровные
контуры полости, а опухолевые — обычно с папиллярными
разрастаниями в просвете и толстой, плотной капсулой. Точный диагноз
можно установить только после биопсии стенки образования во
время операции.
Ряд особенностей имеет инструментальная семиотика нейроэндок-
ринных опухолей поджелудочной железы. Они могут иметь гипервас-
кулярную структуру и кальцинаты. При размерах более 3 см эти
опухоли всегда имеют гистологические признаки злокачественности, но
при этом относительно редко сопровождаются метастазированием в
лимфатические узлы и печень. Кроме того, их отличает, с одной
стороны, медленный рост, а с другой — редкое прорастание в соседние
анатомические структуры даже при значительных размерах опухоли.
В процессе инструментального обследования опухоли
поджелудочной железы нередко трудно отличить от неэпителиальных опухолей
желудка, кист и опухолей левого надпочечника или неорганных заб-
рюшинных новообразований. Обычно окончательный диагноз
удаётся установить только во время операции.
Доброкачественные новообразования выявляют чаще случайно,
при профилактическом обследовании. Поданным
инструментального обследования для них характерны отчётливые границы или даже
капсула, часто наличие полости распада в структуре образования.
В различении рака от других образований поджелудочной железы
большую роль играют онкомаркёры и тонкоигольная биопсия. К
сожалению, ни один метод не имеет абсолютной диагностической дос-
438 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 17
товерности в исключении ракового процесса. Часто диагноз удаётся
установить только после удаления опухолевого или
псевдоопухолевого образования. Это является важным аргументом в пользу
активной хирургической тактики.
Лечение
Опухоли любой морфологической структуры и локализации в
поджелудочной железе подлежат хирургическому лечению. Даже при
малых их размерах недопустимо динамическое наблюдение, так как
многие доброкачественные новообразования с полным основанием
рассматривают как факультативный или облигатный предрак.
В хирургии рака поджелудочной железы все операции
подразделяют на радикальные и паллиативные.
Радикальные хирургические вмешательства предусматривают
удаление опухоли с регионарными лимфатическими узлами. При
поражении головки железы выполняют панкреатодуоденальную резекцию
(рис. 17-2). Она предусматривает частичную резекцию желудка, хо-
лецистэктомию, удаление общего жёлчного протока, головки
поджелудочной железы с пересечением её по левому краю верхней
брыжеечной вены и всей двенадцатиперстной кишки с начальным
'пухоли панкреатодуоденальной зоны О 439
отрезком тощей кишки, а также регионарных лимфатических узлов.
В последние годы эту операцию стремятся производить без резекции
желудка, с сохранением привратника и 1-2 см начального отдела
двенадцатиперстной кишки.
После удаления панкреатодуоденального комплекса начальный
отдел тощей кишки последовательно анастомозируют с культёй
поджелудочной железы, общим печёночным протоком и желудком либо
начальным отрезком двенадцатиперстной кишки.
При раке тела и хвоста поджелудочной железы производят дис-
тальную панкреатэктомию со спленэктомией и иссечением
регионарных лимфатических узлов. Проксимальной границей пересечения
поджелудочной железы служит проекция правого края верхней
брыжеечной вены (рис. 17-3).
т
Рис. 17-3. Дистальная
резекция поджелудочной железы
(чёрным цветом обозначены
даляемые ткани).
В отдельных случаях, при диффузном опухолевом поражении
железы, производят тотальную панкреатэктомию, которая включает в
себя все элементы панкреатодуоденальной и дистальной резекции.
Вместе с тем, такая операция сопровождается труднокорригируемы-
ми нарушениями углеводного обмена и применяется редко.
Вследствие поздней диагностики опухоли (в Ш-IV стадиях) при
массивном метастазировании и прорастании опухолью близлежащих
органов и магистральных сосудов либо из-за тяжёлого
соматического состояния пациентов произвести радикальные операции удаётся
не чаще чем в 20% случаев. Поэтому в хирургии рака
панкреатодуоденальной зоны абсолютно преобладают по частоте паллиативные
операции, направленные лишь на облегчение состояния больных. Их
выполняют вынужденно для устранения таких осложнений, как
механическая желтуха, нарушение проходимости выходного отдела
440 -О Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 17
желудка или двенадцатиперстной кишки, а также некупируемого
болевого синдрома.
Для устранения механической желтухи выполняют обходные би-
лиодигестивные анастомозы (холецистоеюноанастомоз, холецисто-
гастроанастомоз, а при высоком распространении опухоли по
жёлчному протоку — гепатикоэнтероанастомоз). В ряде случаев удаётся
провести чреспечёночное бужирование и стентирование
сдавленного опухолью общего жёлчного протока. Для устранения
непроходимости выходного отдела желудка или двенадцатиперстной кишки при
обтурации их опухолью производят гастроеюностомию.
Неудалённый рак поджелудочной железы, распространяясь на заб-
рюшинные нервные сплетения, приводит к развитию тяжёлого, не
поддающегося медикаментозной терапии болевому синдрому. С
целью его устранения и улучшения качества жизни пациентов в таких
ситуациях может быть выполнена торакоскопическая грудная сплан-
хникосимпатэктомия (одно- или двусторонняя) либо установка
постоянного катетера в эпидуральное пространство грудного отдела
позвоночника для введения обезболивающих средств.
Химиотерапия и лучевая терапия рака поджелудочной железы в
качестве самостоятельных методов лечения неэффективны. После
радикальных операций назначение химиотерапевтических
препаратов (фторурацил, гемцитабин и др.), особенно в сочетании с лучевой
терапией, снижает частоту рецидивов заболевания и несколько
увеличивает продолжительность жизни.
Нейроэндокринные опухоли
Эта группа опухолей, называемых иногда карциноидами,
происходят из клеток диффузной нейроэндокринной системы,
включённых в процессе эмбриогенеза в различные органы и ткани
(поджелудочная железа, кишечник, бронхи, щитовидная железа и др.). Такие
опухоли чаще бывают изолированными, но иногда возможен
множественный эндокринный аденоматоз, при котором могут поражаться
гипофиз, щитовидные и паращитовидные железы, надпочечники,
поджелудочная железа и другие органы.
Подобные опухоли имеют особые клинические проявления,
отличающие их от аденокарциномы. При них редко возникает
развёрнутый синдром онкологического заболевания и мало изменяется
общее состояние больных. Но, в зависимости от уровня или структурной
Опухоли панкреатодуоденальной зоны ♦ 441
полноценности продуцируемых гормонов, эти опухоли могут иметь
как бессимптомное течение, так и разнообразные системные
проявления, соответствующие характеру гормонов.
Гормональнонеактивные опухоли даже больших размеров, при
которых незначительный уровень или неполноценность продуцируемых
ими гормонов не даёт клинических проявлений, обнаруживают
обычно случайно в процессе инструментального обследования. Для них
нехарактерно развитие механической желтухи или непроходимости
двенадцатиперстной кишки, даже при локализации в головке
поджелудочной железы. Такие опухоли нередко выявляют и сами больные
при пальпации живота. Большие размеры опухолей часто не
исключают возможности радикального удаления вследствие отсутствия
метастазов и прорастания в соседние органы. Нейроэндокринную природу
подобных новообразований устанавливают только при иммуногис-
тохимическом исследовании их ткани после биопсии или удаления.
Типичными разновидностями гормональноактивных нейроэндок-
ринных опухолей являются инсулинома, гастринома, випома
(вырабатывающая вазоактивные интенстинальные полипептиды), сомато-
статинома, глюкагонома и крайне редко — истинные карциноиды,
продуцирующие серотонин. Независимо от выраженности
клинических проявлений, при размерах более 2—3 см эти опухоли имеют
абсолютный риск малигнизации.
Инсулинома происходит из р-клеток Лангерханса. Она обычно
имеет диаметр 1—2 см, при больших размерах часто малигнизируется
и даёт гормональноактивные метастазы. Может локализоваться в
любом отделе поджелудочной железы, но чаще в её теле или хвосте.
Функциональная активность опухоли не зависит от размеров.
Основные симптомы гиперинсулинизма связаны с гипогликемией, которая
проявляется развитием резкой слабости, вплоть до потери сознания
или беспричинного возбуждения, галлюцинаций, нарушениями
зрения, дезориентацией, тремором конечностей и потливостью после
длительного голодания. Такое состояние часто возникает после
пробуждения от сна по утрам. При этом уровень глюкозы в крови может
составлять 1-2 ммоль/л. Самостоятельное употребление углеводов или
внутривенное введение глюкозы быстро нормализуют состояние
пациентов. Чтобы избежать развития такого состояния, больные
нередко вынуждены постоянно потреблять огромное количество
углеводов в чистом виде, что обычно приводит к выраженному ожирению.
Превалирование неврологической симптоматики во время
эпизодов гипогликемии часто вынуждает к бесплодному психиатрическому
442 ♦ Хирургические болезни ♦ Том 1 О- Часть II ф Глава 17
обследованию больных. Это связано и с тем, что при малых размерах
опухоли диагностика её любыми инструментальными методами
сложна. В выявлении инсулиномы важна проба с голоданием и
параллельным определением уровня глюкозы в крови. Наиболее
информативно определение в крови (особенно при одновременном селективном
заборе её из селезёночной вены и артерии) содержания иммунореак-
тивного инсулина и его предшественника С-пептида. Опухоли
размером более 1 см чаще выявляют при УЗИ или КТ.
Гастринома (ульцерогенная аденома) развивается из G1-клеток
поджелудочной железы и обычно локализуется в проксимальных её
отделах, но может располагаться и в стенке двенадцатиперстной
кишки, печени, надпочечнике, других органах. Часто малигнизируется
при размерах более 2-3 см. Продуцирует гастрин, стимулирующий
секрецию соляной кислоты в желудке, что лежит в основе синдрома
Золлингера-Эллисона.
Заболевание характеризуется частыми приступами коликообраз-
ных болей в животе, диареями и язвенным симптомокомплексом.
Нередко первым проявлением болезни служит тяжёлое желудочно-
кишечное кровотечение. Изъязвление двенадцатиперстной кишки
может сочетаться с язвой желудка, которые трудно, с
непродолжительным эффектом поддаются консервативной терапии. Резекция
желудка в таких случаях приводит к быстрым рецидивам язвенного
процесса, развитию пептических язв анастомоза и тяжёлым
повторным желудочным кровотечениям.
Диагностика гастриномы сложна. Определённое значение имеет
изучение характера желудочной секреции. Оно показывает
повышение более чем на 60% уровня стимулированной (гистамином или глю-
конатом кальция) секреции над базальной. Радиоиммунологическим
методом после стимуляции может быть выявлено повышение уровня
гастрина в крови. Наиболее информативны в выявлении опухоли УЗИ
и КТ с контрастным усилением. Нередко гастриномы удаётся
обнаружить только при интраоперационной ревизии поджелудочной
железы и других органов брюшной полости.
Лечение нейроэндокринных опухолей оперативное. Гормонально-
активные опухоли (инсулиномы, гастриномы и др.) при размерах
до 2 см в диаметре в большинстве случаев можно энуклеировать.
Более значительные размеры новообразований, отсутствие капсулы и
инвазивный рост делают необходимыми дистальную резекцию
железы или панкреатодуоденальную резекцию, в зависимости от их ло-
ализации.
Опухоли панкреатодуоденальной зоны ♦ 443
«Нефункшюнирующие» нейроэндокринные опухоли
поджелудочной железы, достигающие обычно больших размеров, подлежат
оперативному лечению по тем же принципам, что и при раке. В отличие
от аденокарциномы, после удаления нейроэндокринных опухолей
даже при наличии метастазов 5-летней выживаемости достигают 70%
пациентов.
Доброкачественные опухоли
Эти новообразования сравнительно редки и могут иметь
различный гистогенез — эпителиальный (аденомы и цистаденомы),
мышечный (лейомиомы), соединительнотканный (фибромы и липомы),
неврогенный (невриномы и ганглионевриномы) и ангиогенный (ге-
мангиомы, лимфангиомы). В поджелудочной железе среди
доброкачественных опухолей чаще встречаются серозная и муцинозная
цистаденома, а также внутрипротоковая папиллярно-муцинозная
аденома; в большом сосочке двенадцатиперстной кишки —
папиллярная аденома, а в двенадцатиперстной кишке — аденоматозный
полип, липома, миома и невринома. Доброкачественные
новообразования периампулярной зоны имеют различный прогноз. Так, для
аденом и муцинозных кист поджелудочной железы характерен высокий
потенциал малигнизации.
Доброкачественные периампулярные опухоли изредка
сопровождаются выраженными проявлениями: сдавлением общего жёлчного
протока с развитием механической желтухи или окклюзией
панкреатического протока, приводящей к острому панкреатиту и
выраженному болевому синдрому, а также возникновением кровотечения или
обтурации двенадцатипертной кишки с явлениями дуоденальной
непроходимости.
Диагностика подобных опухолей и выбор методов обследования
зависят от их характера и локализации, которые определяют ведущие
клинические проявления, но в целом они те же, что и при раке
поджелудочной железы.
Опухоли большого сосочка двенадцатиперстной кишки
проявляются, главным образом, симптомами холестаза, которые
выражаются в медленно нарастающей иктеричности склер, потемнении мочи,
обесцвечивании кала. При этом могут появляться боли или чувство
тяжести в правом подреберье. Реже на этом фоне возникают
симптомы острого панкреатита или признаки кишечного кровотечения.
444 ♦ Хирургические болезни ♦ Том 1 О- Часть II ♦• Глава 17
В отдельных случаях проявления механической желтухи могут быть
рецидивирующими вследствие распада опухоли. Физикальное
обследование не позволяет выявить каких-либо изменений со
стороны живота.
В диагностике опухолей большого дуоденального сосочка и самой
двенадцатиперстной кишки приоритетное значение принадлежит
эндоскопическому исследованию, при котором возможно не только
их визуальное обнаружение, но и проведение биопсии
новообразования с последующим гистологическим исследованием биоптатов.
Большие трудности возникают при дифференциации рака и аденом
большого дуоденального сосочка с высокой степенью дисплазии. В
таких случаях следует подходить к выбору метода лечения как при
раке. Для определения стадии и резектабельности опухоли
используют весь комплекс лучевой диагностики.
Опухоли двенадцатиперстной кишки, как правило, проявляются
симптомами кишечного кровотечения. Чаще оно бывает
незначительным по объёму, но рецидивирующим и проявляется в основном
общими расстройствами вследствие анемизации — головной болью,
нарушением сна, снижением физической активности. Реже такие
новообразования бывают причиной массивных кровотечений с
характерными для них рвотой типа «кофейной гущи», меленой и
соответствующими изменениями гемодинамики. Иногда эти опухоли
приводят к развитию дуоденальной непроходимости, которая проявляется
вначале периодической рвотой желудочным содержимым с
примесью жёлчи. Со временем рвота становится регулярной, после
каждого приёма пищи и даже натощак. У больных развивается постоянное
чувство тяжести и переполнения в эпигастральной области,
прогрессируют алиментарные расстройства. При физикальном исследовании
обычно не удаётся пальпировать опухоль, но можно выявить «шум
плеска» в эпигастральной области натощак.
При доброкачественных периампулярных опухолях в большинстве
случаев удаётся осуществить щадяшие, органосберегающие операции.
Так, опухоли малых размеров большого сосочка двенадцатиперстной
кишки, терминального отдела общего жёлчного протока или
двенадцатиперстной кишки удаётся удалить в процессе гастродуоденоскопии
путём электроэксцизии или с использованием энергии лазерного
излучения. Если размеры доброкачественного новообразования велики,
производят традиционную операцию дуоденотомии с иссечением опухоли.
Доброкачественные опухоли (главным образом аденомы и циста-
дсномы) поджелудочной железы удаляют только путём традицион-
Опухоли панкреатолуоленальной зоны ♦ 445
ного оперативного вмешательства. В большинстве случаев
оказывается возможной энуклеация опухоли, краевая или дистальная
резекция железы. Любой метод удаления опухолей должен обязательно
сопровождаться срочной морфологической их верификацией,
выявление рака вынуждает расширять объём операции.
Прогноз
Удаление доброкачественных периампулярных опухолей путём
оперативного вмешательства или при гастродуоденоскопии
полностью благоприятно для прогноза жизни, здоровья и социальной
реабилитации больных.
Прогноз жизни при злокачественных новообразованиях разной
локализации после однотипных оперативных вмешательств (панкре-
атодуоденальной резекции) даже с расширенной лимфаденэктомией
существенно различается. При протоковой аденокарциноме
поджелудочной железы любой локализации 5-летняя выживаемость не
превышает 20%, а медиана выживаемости колеблется от 12 до 20 мес. При
опухолях другой периампулярной локализации эти показатели
достигают 30-50% и 36-60 мес соответственно. Продолжительность
жизни больных с неудалённой опухолью редко превышает 6—12 мес.
Как правило, благоприятный прогноз характерен для больных с
нейроэндокринными опухолями поджелудочной железы, среди
которых 5-летняя выживаемость даже при наличии метастазов
достигает 50-70%.
ХРОНИЧЕСКИЙ
ПАНКРЕАТИТ И КИСТЫ
ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Хронический панкреатит
В основе заболевания лежит дегенеративное поражение поджелу
дочной железы, связанное с воспалительным процессом и фиброзом,
которые приводят к необратимым структурным нарушениям и
сопровождаются функциональной недостаточностью органа.
В настоящее время в течение года регистрируют 6—7 новых
случаев хронического панкреатита на 100000 населения, а общая частота
его составляет от 50 до 75 пациентов на 100000 населения в
зависимости от географического региона.
Основные черты патологии
Хронический панкреатит вне зависимости от причины
заболевания характеризуется прогрессирующими дегенеративными
изменениями поджелудочной железы, которые обусловлены хроническим
воспалительным процессом и связанным с ним фиброзом
железистой ткани. Существует несколько вариантов морфологических
изменений органа.
• Паренхиматозный хронический панкреатит, при котором основные
патологические изменения локализуются в ацинусах или междоль-
ковой соединительной ткани, между тем главный панкреатический
проток практически не изменён.
• Протоковый хронический панкреатит, когда вне зависимости от
изменений паренхимы железы определяется расширенный и
деформированный главный панкреатический проток (с вирзунголитиа-
зом или без него).
• Папиллодуоденопанкреатит, который характеризуется равномерным
расширением главного панкреатического протока на всём
протяжении.
Наиболее частыми хроническими неопухолевыми заболеваниями
поджелудочной железы являются хронический панкреатит,
панкреатические свищи и кисты.
Хронический панкреатит и кисты поджелудочной железы ♦ 447
С патогенетической и патогистологической точек зрения
хронический воспалительный процесс чаще всего начинается в головке
поджелудочной железы. Поражение этой части органа влияет на весь ход
болезни. Кроме того, именно оно, как правило, приводит к
развитию большинства осложнений панкреатита, таких как обструкция
главного панкреатического и общего жёлчного протоков,
двенадцатиперстной кишки, а иногда и верхней брыжеечной и/или воротной
вены. При выраженных хронических воспалительных изменениях
головки поджелудочной железы дистальные отделы органа нередко
остаются практически интактными. В увеличенной на фоне
хронического панкреатита головке поджелудочной железы (вертикальный
размер более 4 см) происходят специфические изменения
ультраструктуры её нервных волокон.
Одним из важнейших факторов развития болевых кризов считают
нарушение оттока панкреатического сока в двенадцатиперстную
кишку, реализующееся в повышении давления в системе
панкреатических протоков с их последующим расширением. Другой причиной
болевого синдрома могут служить воспалительные и рубцовые
изменения как в самой поджелудочной железе, так и в парапанкреатичес-
кой клетчатке, в которые вовлекаются нервные окончания, что в итоге
приводит к повреждению их периневральной оболочки. Обнажённые
афферентные волокна становятся подвержены постоянной
патологической стимуляции, приводящей к развитию стойкого болевого
синдрома. Среди прочих причин появления болей следует отметить
стеноз общего жёлчного протока с супрастенотическим
растяжением его стенок и стеноз двенадцатиперстной кишки.
Причины развития
Причины развития хронического панкреатита многообразны. В
большинстве случаев в качестве этиологического фактора выступает
хронический алкоголизм. Среди других следует отметить нарушения
липидного обмена и метаболизма кальция (последние чаще всего
обусловлены гиперфункцией паращитовидных желёз), хроническую
обструкцию протоков поджелудочной железы, которая может быть
вызвана разнообразными гиперпластическими процессами в
области большого дуоденального сосочка и стенки двенадцатиперстной
кишки вокруг него. Кроме того, факторами развития хронического
панкреатита могут служить осложнения ЖКБ (холедохолитиаз и па-
пиллостеноз), перенесённые ранее деструктивный панкреатит или
448 О- Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 18
травма поджелудочной железы, язвенная болезнь желудка или
двенадцатиперстной кишки, а также дисфункция сфинктера Одди.
Среди прочих причин необходимо упомянуть длительный приём ряда
лекарственных препаратов, генетическую предрасположенность
(«наследственный панкреатит»), аутоиммунные изменения; дефицит
белкового питания, вызывающий так называемый «тропический
панкреатит», при этом дополнительную роль может играть избыточное
употребление в пищу кассавы — растительного продукта, бедного
протеином и содержащего практически одни углеводы.
Несмотря на представленное многообразие причин развития
хронического панкреатита, наиболее часто заболевание развивается
вследствие злоупотребления алкоголем. Именно у этой группы больных
процессы дегенерации и фиброза поджелудочной железы идут значительно
быстрее, в связи с чем гораздо чаще возникают показания для
хирургического вмешательства, что дало повод для выделения
«алкогольного» и «неалкогольного» панкреатита. В настоящее время
рассматривают три теории развития хронического алкогольного панкреатита.
Первая предусматривает первичное влияние алкоголя на внешнюю
секрецию поджелудочной железы, вследствие чего образуются
белковые преципитаты, которые приводят к обструкции панкреатических
протоков и вторичному повреждению ацинарных клеток. Согласно
второй теории, прямое токсическое влияние метаболитов алкоголя на
ацинусы вызывает их жировую дегенерацию, приводящую к утрате
способности синтезировать ферменты и периацинарному фиброзу. И,
наконец, третья концепция свидетельствует о том, что под действием
алкоголя нарушается детоксикационная функция печени, что
приводит к образованию свободных радикалов кислорода, которые в свою
очередь обладают повреждающим эффектом на поджелудочную железу.
В последнее десятилетие отмечен значительный рост числа
больных хроническим панкреатитом. Заболевание возникает чаще всего
у мужчин трудоспособного возраста (30—40 лет) и в течение 12-
15 лет приводит их к инвалидности, а нередко и к смерти.
Классификация
Клинические формы заболевания.
• Хронический рецидивирующий панкреатит, для которого
характерны болевые кризы, вне которых состояние пациента остаётся
относительно благополучным (наиболее распространённая форма
заболевания).
Хронический панкреатит и кисты поджелудочной железы ♦ 449
• Хронический болевой панкреатит, протекающий с постоянным
болевым синдромом.
• Хронический латентный (безболевой) панкреатит, при котором на
первый план выступают нарушения внешней и внутренней
секреции поджелудочной железы.
• Псевдотуморозный хронический панкреатит с преимущественным
поражением головки поджелудочной железы.
Осложнения:
• протяжённый стеноз общего жёлчного протока, механическая
желтуха;
• вторичный сахарный диабет;
• дуоденальная непроходимость;
• сегментарная портальная гипертензия, желудочно-кишечное
кровотечение из варикозно расширенных вен;
• внутрипротоковое кровотечение;
• панкреатогенный асцит (плеврит).
Клиническая семиотика
Клинические проявления хронического панкреатита чрезвычай
но многообразны, вместе с тем можно выделить наиболее характер
ные для него синдромы.
Болевой синдром различной интенсивности — ведущее
клиническое проявление большинства случаев заболевания. Боли могут
носить характер рецидивирующих приступов или принимать постоянный
изнуряющий характер. Чаще всего они возникают в эпигастральной
области и правом (при преимущественном поражении головки
поджелудочной железы) либо левом (при поражениях дистальных
отделов органа) подреберье. Типична иррадиация болей в поясницу,
лопаточную область и плечо. Мучительные постоянные боли в ряде
случаев приводят к значительным изменениям личности пациентов,
побуждают их к приёму наркотиков, что еще более усугубляет тяжесть
их физического и психического состояния. Тяжёлые болевые
приступы иногда возникают не сразу после воздействия провоцирующего
фактора (приём алкоголя, жирной пищи), а спустя несколько часов,
а то и суток с момента нарушения диеты. Нередко боли вызывает
приём любой пищи.
Иногда болевой синдром оказывается невыраженным или
отсутствует вовсе. У некоторых больных с типичным алкогольным
панкреатитом, сопровождающимся выраженным болевым синдромом,
450 ♦ Хирургические болезни ♦ Том 1 О- Часть I ♦ Глава 18
через 15—20 лет от начала заболевания боли постепенно
уменьшаются, а затем и вовсе исчезают без специального лечения, что
связывают с полной атрофией ацинарной ткани поджелудочной железы и
прекращением внешнесекреторной активности органа.
Прогрессирующее снижение массы тела служит вторым по частоте
симптомом хронического панкреатита. Оно связано с нарушением
всасывания белков, жиров и витаминов, обусловленным снижением
экзокринной функции поджелудочной железы и развитием
внутрисекреторной недостаточности. Кроме того, из-за возникновения
болей после еды пациенты воздерживаются от приёма пищи.
Внешнесекреторную недостаточность поджелудочной железы
выявляют у большинства больных хроническим панкреатитом. Наиболее
распространёнными, хотя и неспецифическими симптомами
панкреатической недостаточности служат диспептические расстройства:
чувство тяжести в животе после приёма пищи, отрыжка, вздутие
живота. Эти явления усиливаются после нарушения диеты и несколько
стихают при соблюдении щадящего режима питания. Довольно рано
появляются расстройства стула: вначале упорные запоры, которые
в дальнейшем сменяются диареей, либо неустойчивый стул с
чередованием запоров и диареи. Характерен обильный «жирный» стул
светлой или серой окраски, часто в нём можно обнаружить кусочки
непереваренной пищи. Подобные нарушения пищеварения
свидетельствуют о далеко зашедших морфологических изменениях
поджелудочной железы.
При осмотре больных можно отметить сухость и шелушение кожи,
глоссит, стоматит и другие проявления дефицита витаминов в
организме.
Наступление и выраженность расстройств пищеварения зависят
от продолжительности заболевания и обусловлены прогрессирующей
атрофией и рубцеванием ткани железы. По времени их появление
примерно совпадает с развитием обызвествления поджелудочной
железы, которое обнаруживается спустя 5 лет от начала заболевания.
Этот срок короче для алкогольного панкреатита (в среднем 4 года),
при неалкогольной его природе процесс развития
внешнесекреторной недостаточности растягивается на 8-10 лет.
Внутрисекреторная недостаточность поджелудочной железы может
варьировать от скрытых признаков (нарушение толерантности к
глюкозе) до манифестирующего вторичного сахарного диабета. Степень
инсулиновой недостаточности обычно соответствует длительности
заболевания. Так, спустя 4 года после возникновения первых клини-
Хронический панкреатит и кисты поджелудочной железы О 451
ческих симптомов хронического панкреатита диабет находят у 40%
больных, а через 10—12 лет он регистрируется уже в 90% случаев.
Билиарная гипертензия (холестаз) встречается у 10% больных
хроническим панкреатитом. Она возникает вследствие компрессии
дистального отдела общего жёлчного протока отёчной головкой
поджелудочной железы при очередном обострении. В этом случае на
фоне приступа болей могут быть зафиксированы потемнение мочи и
иктеричность склер, которые быстро регрессируют после
медикаментозного лечения. Вовлечение общего жёлчного протока в
склеротический процесс приводит к формированию его протяжённого (тубу-
лярного) стеноза. Подобный вариант течения заболевания обусловлен
тяжёлыми морфологическими изменениями головки поджелудочной
железы, которые чаще всего развиваются при алкогольном
панкреатите. Желтуха, обусловленная обтурацией жёлчного протока, не
поддаётся лечению консервативными мероприятиями и может быть
ликвидирована только оперативным путём. При интенсивной длительной
желтухе могут присоединиться явления острой почечной
недостаточности и энцефалопатии, а также возникнуть наружные и внутренние
холемические кровотечения (носовое, желудочно-кишечное и др.).
Клинические проявления этого типа обструкции жёлчных протоков,
осложняющего течение хронического панкреатита, имеют
значительное сходство с клиническими проявлениями рака головки
поджелудочной железы.
Нарушение проходимости двенадцатиперстной кишки — нечастое
осложнение хронического панкреатита. В компенсированной стадии
дуоденальный стеноз проявляется чувством тяжести в верхних
отделах живота, отрыжкой, снижением аппетита. При декомпенсирован-
ном стенозе ведущим симптомом является рвота, часто неукротимая,
пишей, съеденной накануне, что приводит к развитию
водно-электролитных расстройств, в первую очередь — гемоконцентрации,
метаболическому алкалозу и гипокалиемии. В большинстве случаев
дуоденальная непроходимость на фоне панкреатита носит все черты
высокой кишечной непроходимости и при отсутствии
одновременной блокады жёлчных и панкреатических протоков сопровождается
потерей не только желудочного содержимого, но и всей жёлчи и
панкреатического секрета, что быстро приводит к труднообратимым
нарушениям гомеостаза.
Сегментарная портальная гипертензия часто выявляется у больных
во время операции по поводу хронического панкреатита. Её
признаками служат спленомегалия и расширение венозных сосудов боль-
452 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I -О- Глава 18
шого сальника, желудочно-ободочной связки и кардиального отдела
желудка. Клинические симптомы сегментарной портальной гипер-
тензии, обусловленной поражением поджелудочной железы,
определяются значительно реже. К их числу могут быть отнесены
желудочно-кишечные кровотечения из варикозно- расширенных
подслизистых вен желудка, увеличение селезёнки, которая становится
доступной пальпации, появление асцита. Развитие сегментарной ги-
пертензии в бассейне воротной вены является закономерным
следствием фиброзных изменений дистальных отделов поджелудочной
железы, которые могут привести к тромбозу или облитерации
просвета селезёночной вены.
Панкреатический асцит и плеврит являются проявлением
внутренних свищей поджелудочной железы (панкреато-абдоминального и
панкреато-плеврального). При этом на фоне длительно
существующего хронического панкреатита, сопровождающегося
панкреатической гипертензией, в стенке мелких, поверхностно расположенных
протоков или кист под влиянием повышенного давления образуется
дефект и панкреатический секрет в неактивной форме начинает
поступать в брюшную, реже — в плевральную полости, где вызывает
развитие хронического асептического воспалительного процесса,
который в свою очередь усиливает экссудацию жидкости.
Клинически у больных с панкреато-абдоминальным свищом начинает
постепенно увеличиваться в объёме живот в сочетании с
прогрессирующим общем истощением и появлением или усугублением
периферических отёков, что обусловлено большими потерями белка
из плазмы крови в асцитическую жидкость. При панкреато-плевраль-
ных свищах развивается картина гидроторакса, чаще
левостороннего, сопровождающаяся одышкой, снижением голосового дрожания,
притуплением перкуторного звука и ослаблением вплоть до полного
отсутствия дыхательных шумов при аускультации на стороне
поражения; симптомы гипопротеинемии также будут присутствовать.
Обычно экссудация жидкости у этой категории больных происходит
в большом объёме и требует проведения дифференциального
диагноза с другими, более распространёнными причинами асцита
(цирроз печени, канцероматоз брюшины) и плеврита (рак лёгкого).
Панкреатическое кровотечение. Довольно редко при хроническом
панкреатите может возникнуть кровотечение в панкреатические про- |
токи (hemosuccus pancreaticus). Это осложнение обычно развивается
при прорыве псевдоаневризмы одного из сосудов, окружающих
поджелудочную железу, в вирзунгов проток или его ветви. Заполнение
Хронический панкреатит и кисты поджелудочной железы ♦ 453
кровью протоков сопровождается выраженным болевым синдромом,
а после излитая её через большой дуоденальный сосочек в
двенадцатиперстную кишку появляется типичная картина
желудочно-кишечного кровотечения в виде рвоты кровью или «кофейной гущей»,
мелены либо (при высоком темпе кровопотери) гематохезии, слабости,
бледности кожных покровов, потери сознания, тахикардии и
артериальной гипотензии.
Диагностика
Диагноз хронического панкреатита складывается из оценки
клинической картины заболевания, данных лабораторного исследования
и результатов инструментальных методов. В результате
диагностического поиска врачу необходимо определить, есть ли у пациента
хронический панкреатит, установить степень его тяжести, выявить
осложнения и наметить план лечения.
Для того чтобы решить поставленные задачи, следует иметь
точное представление о состоянии внешней и внутренней секреции
поджелудочной железы, степени морфологических изменений её
протоков и паренхимы, а также о состоянии окружающих органов, тканей,
протоков и сосудов.
Лабораторные методы исследования
Неосложнённый хронический панкреатит не вызывает
выраженных изменений лабораторных показателей. Повышение активности
панкреатических ферментов (амилазы, липазы) в крови и моче
свидетельствует об обострении воспалительного процесса, при этом
также может быть выявлен лейкоцитоз с характерным сдвигом
лейкоцитарной формулы. При алиментарном истощении и на фоне
внутреннего панкреатического свища обнаруживают анемию, гипо-
и диспротеинемии. Первый признак нарушения желчеоттока при
формировании тубулярного стеноза общего жёлчного протока на до-
желтушной стадии — повышение активности щелочной фосфатазы
иу-глютамилтранспептидазы, при прогрессировании обструкции
повышается уровень обшего и прямого билирубина, в меньшей
степени аспартат- и аланинаминотрансфераз. Развитие панкреатогенного
дуоденального стеноза по мере его прогрессирования
сопровождается повышением содержания гемоглобина и гематокрита (признаки
гемоконцентрации); гипокалиемией; метаболическим алкалозом,
который характеризуется увеличением рН крови, появлением и на-
454 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 18
растанием избытка оснований; повышением уровней мочевины и кре-
атинина. При тромбозе селезёночной вены и развитии гиперсплениз-
ма наблюдают стойкое угнетение кроветворения в виде эритро-, лей-
ко- и тромбоцитопении. Наконец, панкреатическое кровотечение
сопровождается падением уровня гемоглобина и эритроцитов.
Асцит или плеврит, предполагаемой причиной которого является
внутренний панкреатический свищ, служит показанием к
выполнению лапаро- или торакоцентеза с исследованием полученной
жидкости на содержание панкреатических ферментов (амилазы, липазы).
В последнее время важную роль отводят изучению уровня опухо-
леассоциированных антигенов, которое проводят для
дифференциальной диагностики хронического панкреатита и рака
поджелудочной железы. Среди них наиболее информативен карбогидратный
антиген (СА19-9), повышение уровня которого оказалось наиболее
специфичным для рака поджелудочной железы.
Исследование внешней секреции поджелудочной железы
Исследование внешней секреции поджелудочной железы проводят
прямым и непрямым методами. При прямом исследовании секрет
получают в процессе дуоденального зондирования либо путём интубации
главного панкреатического протока через большой дуоденальный
сосочек под контролем эндоскопа; при наличии у пациента наружного
панкреатического свища собирают сок, истекающий по свищевому
ходу. В полученном одним из способов образце изучают его объём,
концентрацию бикарбонатов и основных ферментов поджелудочной
железы (амилазы, липазы, трипсина) как в состоянии функционального
покоя, т.е. натощак, так и после стимуляции. Её можно
осуществить, дав больному стандартный завтрак либо путём внутривенного
введения пищеварительных гормонов: вначале панкреозимина (холе-
цистокинина), затем — секретина. Характер изменений внешней
панкреатической секреции целиком зависит от стадии заболевания. В
начальной стадии хронического панкреатита происходит увеличение
объёма панкреатического сока при нормальной или несколько
сниженной концентрации бикарбонатов и уменьшение количества
ферментов; дальнейшее течение панкреатита ведёт к прогрессивному
снижению как общего объёма секреции поджелудочной железы, так
и концентрации бикарбонатов и ферментов.
К непрямым способам исследования панкреатической секреции
относят в первую очередь копрологическое исследование, которое при
Хронический панкреатит и кисты поджелудочной железы ♦ 455
простоте выполнения обладает весьма невысокой информативностью.
Более современной методикой считается РАВА — тест, основанный на
том, что принятая внутрь бензилтирозилпарааминобензойная
кислота расщепляется в кишечнике под воздействием химотрипсина. Одна
из частей её молекулы в виде парааминобензойной кислоты
всасывается в тонкой кишке и выводится с мочой, что позволяет
определить её концентрацию и на этом основании дать количественную
оценку экскреторной функции поджелудочной железы. Другим
достаточно точным непрямым методом является изучение
концентрации панкреатической эластазы-1 в кале. Этот фермент, входящий в
состав панкреатического сока, в течение транзита по кишечнику
остаётся в неизменённой форме, и содержание его в кале объективно
отражает состояние внешнесекреторной активности железы.
Исследование внутренней секреции поджелудочной железы
Для диагностики вторичного сахарного диабета используют
обычные в эндокринологии методики: при явном нарушении углеводного
обмена — изучение гликемического и глюкозурического профилей,
при скрытой эндокринной недостаточности — пероральный и
внутривенный тест толерантности к глюкозе.
Изучение состояния паренхимы и протоковой системы
поджелудочной железы и окружающих органов
Обзорная рентгенография
При обзорной рентгенографии брюшной полости иногда
обнаруживают кальцинаты в проекции поджелудочной железы, при
панкреато-плевральном свище рентгеноскопия грудной клетки
выявляет гидроторакс. При рентгеноскопии желудка и
двенадцатиперстной кишки (обычной или после создания искусственной
гипотонии) можно выявить косвенные признаки, свидетельствующие
лишь об увеличении всей поджелудочной железы или её отделов
(увеличение ретрогастрального пространства, расширение
подковы двенадцатиперстной кишки и пр.), но они не являются патог-
номоничными для хронического панкреатита. С другой стороны,
исследование высокоинформативно в выявлении панкреатогенно-
го дуоденального стеноза, сопутствующей панкреатиту язвенной
болезни, нарушений моторной функции желудка и
двенадцатиперстной кишки.
456 О Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 18
УЗИ
УЗИ (рис. 18-1) поджелудочной железы при хроническом
панкреатите позволяет обнаружить изменения размеров различных
отделов поджелудочной железы и её эхо-структуры. Между тем,
наиболее точными признаками служат расширение главного
панкреатического протока и наличие конкрементов в нём или паренхиме
органа. Кроме того, метод позволяет оценить состояние печени и
селезёнки, дать информацию о наличии камней в жёлчном пузыре
и протоках, выявить билиарную гипертензию при тубулярном
стенозе терминального отдела общего жёлчного протока.
Использование УЗИ даёт возможность обнаружить портальную гипертензию
и установить уровень препятствия кровотоку в системе воротной
вены и её притоков.
КТ
КТ (рис. 18-2) является в настоящее время, пожалуй,
единственным методом, позволяющим получить чёткое детализированное
изображение поджелудочной железы, оценить её форму, размеры,
структуру, взаимоотношение с окружающими органами и тканями. С её
помощью легко выявить кальцинаты в железе, а при расширении
главного панкреатического протока появляется возможность детально
проследить его ход и строение. Также возможно определение
состояния печени, селезёнки, жёлчных протоков, а после внутривенного
введения контрастного вещества — магистральных кровеносных
сосудов. Наконец, исследование позволяет дать заключение о состоя-
Рис. 18-1. Ультразвуковая ска-
нограмма при хроническом
панкреатите. Чёрной
стрелкой указан расширенный вир-
зунгов проток, белой —
камень в его просвете.
Хронический панкреатит и кисты поджелудочной железы О 457
Рис. 18-2. Компьютерная
томограмма при хроническом
панкреатите. Стрелкой указан
неравномерно расширенный вирзунгов
проток, вокруг которого в
паренхиме железы видны
множественные конкременты.
нии окружающей железу жировой клетчатки, что имеет значение в
определении степени выраженности воспалительного процесса в па-
рапанкреальной области.
Эндоскопическая ретроградная холангиопанкреатикография
ЭРХПГ (рис. 18-3) признана наиболее чувствительным способом
распознавания хронического панкреатита даже на ранних стадиях его
развития. Достоверными признаками заболевания считают
расширение главного и добавочного панкреатических протоков и их ветвей,
наличие по ходу протоков стриктур (нередко множественных), дефор-
Рис. 18-3. Эндоскопическая
ретроградная панкреатография.
Определяется резко расширенный
вирзунгов проток с протяжённой
стриктурой в головке железы.
458 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 18
мацию протоков, изъеденность их контуров и наличие в их просвете
камней. Помимо этого, методика даёт возможность достоверно
оценить состояние жёлчных путей, выявить наличие, степень и
протяжённость панкреатогенного стеноза общего жёлчного протока.
Ограничение для выполнения ЭРХПГ — рубцовая деформация и резкое сужение
устья жёлчного и/или главного панкреатического протока, что делает
невозможным введение катетера в протоковые системы и заполнение
их контрастным веществом. Наличие дуоденального стеноза также
затрудняет или делает невозможным подведение аппарата к области фа-
терова сосочка. Кроме того, исследование в достаточной степени ин-
вазивно и может сопровождаться развитием ряда тяжёлых осложнений.
Эндоскопическая ультрасонография
Эндоскопическая ультрасонография — относительно новый неин-
вазивный способ диагностики заболеваний поджелудочной железы и
жёлчных путей. Он способен предоставить высокую степень
разрешения при визуализации паренхимы поджелудочной железы и
панкреатических протоков посредством использования высокочастотного
(7,5-12 МГц) датчика, расположенного на рабочем участке гибкого
эндоскопа, который подводится достаточно близко к поверхности
поджелудочной железы, расположенной рядом со стенками желудка
и двенадцатиперстной кишки. Этот метод гораздо точнее обычного
УЗИ и сравним по информативности с КТ и ЭРХПГ, не сопровождаясь
при этом осложнениями и лучевой нагрузкой на пациента и
медицинский персонал. Особенно важна его роль в дифференциальной
диагностике хронического панкреатита и рака поджелудочной железы.
Магнитно-резонансная холангиопанкреатикография
Магнитно-резонансная холангиопанкреатикография делает
возможным получение изображения жёлчных и панкреатических
протоков без введения в них контрастного вещества, что выгодно
отличает методику от ЭРХПГ. Широкое применение метода, к сожалению,
ограничивает высокая стоимость оборудования.
Ангиография
Ангиография в настоящее время утратила своё диагностическое
значение в связи с внедрением других, значительно менее инвазив-
ных и в тоже время высокоточных лучевых методов визуализации
поджелудочной железы.
Хронический панкреатит и кисты поджелудочной железы ♦ 459
Пункционная биопсия
Пункционную биопсию поджелудочной железы проводят для
морфологической верификации изменений поджелудочной железы при
наличии очагового образования в её паренхиме, которое не
поддаётся идентификации менее инвазивными методами. Пункцию можно
проводить под контролем УЗИ, КТ (чрескожно) либо
эндоскопической ультрасонографии (из просвета желудка или
двенадцатиперстной кишки). Полученный материал подвергают цитологическому или
гистологическому исследованию. Информативность метода велика
при небольшом количестве осложнений, что даёт основание
рекомендовать его в качестве заключительного приёма в процессе
проведении дифференциального диагноза между хроническим
панкреатитом и раком поджелудочной железы.
Лечение
Каждое обострение хронического панкреатита следует
рассматривать как приступ острого панкреатита, который требует совершенно
определённого лечения (см. главу 8).
Консервативная терапия
Вне обострения целью консервативной терапии являются
устранение или смягчение болевого синдрома и коррекция внешне- и
внутрисекреторной недостаточности поджелудочной железы.
Борьба с болью при хроническом панкреатите нередко
представляет сложную задачу. Исходя из патогенеза болевого синдрома,
купировать его в ряде случаев можно путём снижения продукции
секрета поджелудочной железы, что приводит к уменьшению внут-
рипротокового давления. С этой целью назначают специальную
диету, исключающую приём жирной, острой, жареной пищи;
питание должно быть частым и дробным. Хороший болеутоляющий
эффект оказывает приём ферментных препаратов, тормозящий
внешнюю секрецию поджелудочной железы по принципу
«отрицательной обратной связи». Основанием для назначения антисекреторных
агентов является стимуляция поджелудочной железы кислым
желудочным соком посредством гиперпродукции соответствующих
гормонов в двенадцатиперстной кишке. Обязателен отказ от алкоголя.
И, наконец, применяют ненаркотические анальгетики в дозах,
зависящих от интенсивности болевого синдрома. Болевой синдром при
460 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 18
«головчатом» панкреатите не зависит от панкреатической гипертен-
зии и устранить или хотя бы смягчить его значительно сложнее, в этой
связи при данной форме заболевания чаще ставится вопрос о
хирургическом вмешательстве.
Для коррекции экзокринной недостаточности поджелудочной
железы рекомендуют заместительную терапию ферментными
препаратами (панкреатин и др.). Дозу их можно рассчитать на основании
изучения функций железы. Действующее начало препарата (сами
ферменты) должны быть защищены от повреждающего действия
желудочного сока специальной капсулой, и их должно быть достаточное
количество.
Что касается терапии внутрисекреторной недостаточности, то её
проводят по принципам лечения первичного сахарного диабета. В
начальных стадиях гипергликемию можно контролировать диетой,
затем — пероральными гипогликемическими средствами, в тяжёлых
случаях — введением инсулина. Необходимо помнить о том, что у
больных, получающих инсулин, повышен риск развития гипоглике-
мического состояния в связи с сопутствующим снижением секреции
глюкагона. С другой стороны, при вторичном сахарном диабете ке-
тоацидотическое состояние развивается крайне редко, даже при
выраженной гипергликемии.
Хирургическое лечение
Хирургическое лечение хронического панкреатита обычно не
способно устранить уже наступившие дегенеративные изменения
поджелудочной железы. В связи с этим большинство оперативных
вмешательств реально может быть направлено лишь на лечение осложнений
панкреатита и устранение болевого синдрома. В процессе выбора
метода операции следует предусмотреть максимально возможное
сохранение секреторной функции железы и её островкового аппарата.
Показания к хирургическому лечению хронического панкреатита:
• тубулярный стеноз терминального отдела общего жёлчного протока;
• стеноз двенадцатиперстной кишки;
• стеноз главного панкреатического протока;
• панкреатический асцит (плеврит);
• сегментарная портальная гипертензия;
• внутрипротоковое кровотечение;
• болевой синдром, не поддающийся консервативному лечению;
• подозрение на рак поджелудочной железы.
Хронический панкреатит и кисты поджелудочной
В арсенале хирургических вмешательств, выполняемых по поводу
хронического панкреатита, имеется довольно большое число
разнообразных операций как на самой поджелудочной железе, так и на
смежных с ней органах. Объём операции определяется характером,
локализацией и степенью выраженности морфологических
изменений поджелудочной железы и окружающих органов, при этом
часто возникает необходимость в сочетании нескольких оперативных
приёмов.
Изолированные операции на жёлчном пузыре и протоках, а также
на желудке выполняют при хроническом панкреатите, возникшем на
фоне ЖКБ либо язвенной болезни желудка или двенадцатиперстной
кишки при отсутствии грубых морфологических изменений
поджелудочной железы. Их проводят по принципам лечения первичного
заболевания и они включают в себя холецистэктомию,
вмешательства на жёлчных протоках (эндоскопические или хирургические),
резекцию желудка либо один из видов ваготомии.
При панкреатогенном стенозе общего жёлчного протока или
двенадцатиперстной кишки возникают показания к так называемым
шунтирующим вмешательствам: в первом случае предпочтение
отдают наложению гепатикоеюноанастомоза на петле по Ру в сочетании
с холецистэктомией, во втором неизбежно формирование гастроэн-
тероанастомоза.
Спленэктомию (обычно в сочетании с прошиванием варикозно
изменённых вен кардиального отдела желудка) выполняют при
хроническом панкреатите, который привёл к тромбозу селезёночной
вены и, как следствие, развитию сегментарной портальной гипертен-
зии, клинически проявляющейся рецидивирующими
желудочно-кишечными кровотечениями.
При расширении протоковой системы поджелудочной железы и,
в первую очередь, её главного протока по типу цепи озёр
преимущество отдают наложению продольного панкреатоеюноанастомоза. Суть
операции состоит в максимально широком рассечении главного
панкреатического протока через переднюю поверхность поджелудочной
железы, от её головки до хвоста, с последующим сшиванием протока
с изолированной по Ру петлёй тощей кишки (рис. 18-4).
В редких случаях хронического панкреатита с изолированным или
преимущественным поражением тела и хвоста органа операцией
выбора может служить дистальная резекция поджелудочной железы
соответствующего объёма — гемипанкреатэктомия, субтотальная
резекция органа. Не так однозначно решается вопрос о выборе метода
Рис. 18-4. Продольная панкреатоеюностомия (схема операции). После
широкого рассечения главного панкреатического протока его сшивают с
изолированной по Ру петлёй тощей кишки.
операции при так называемом «головчатом» панкреатите, в
особенности не сопровождающемся расширением протоковой системы
железы. В данной ситуации возможна панкреатодуоденальная резекция,
особенно если не исключается рак головки поджелудочной
железы (см. главу 17). В последние годы при «головчатом» панкреатите
стали применять изолированную резекцию головки поджелудочной
железы (рис. 18-5) с сохранением не только желудка, но и
двенадцатиперстной кишки. Несмотря на техническую сложность,
преимуществом этой операции является практически полное сохранение
функции пищеварения, что, несомненно, улучшает качество жизни
пациентов.
Объём хирургического пособия при внутренних свищах
поджелудочной железы, сопровождающихся асцитом или плевритом, зависит
от состояния панкреатической протоковой системы и локализации
дефекта. При свищах в области хвоста железы выполняют дистальную
резекцию органа с областью патологического соустья. Свищи,
исходящие из головки или тела поджелудочной железы и обычно
сопровождающиеся расширением её протоковой системы, требуют
обеспечения адекватного внутреннего дренажа протоков путём наложения
продольного панкреатоеюноанастомоза, при этом не обязательно
отыскивать и ушивать свищевое отверстие, оно закроется
самостоятельно после ликвидации интрапанкреатической гипертензии.
Хронический панкреатит и кисты поджелудочной железы О 463
Развитие эндоскопических методов лечения дало возможность
применять их и при отдельных формах хронического панкреатита.
Так. при изолированном стенозе устья главного панкреатического
протока возможно выполнение эндоскопической папиллосфинкте-
ротомии и вирзунготомии. При множественных стриктурах по ходу
протока достаточно эффективная мера по снижению интрапанкреа-
тической гипертензии — эндоскопическая установка пластикового
стента через фатеров сосочек в дистальные отделы вирзунгова
протока, т.е. панкреатодуоденальное протезирование; при наличии вир-
зунголитиаза вмешательство можно дополнить экстракорпоральной
ультразвуковой литотрипсией. Наличие внутреннего
панкреатического свища, проявляющегося асцитом или плевритом, также служит
показанием к применению эндопротезирования вирзунгова
протока, после чего свищи быстро закрываются. Положительной стороной
эндоскопических манипуляций является их малая травматичность.
Вместе с тем, при длительном стоянии протеза неизбежно наступает
его обструкция, приводящая к рецидиву заболевания, поэтому
рассчитывать на длительную ремиссию после протезирования не
приходится. Тем не менее, подобное эндоскопическое вмешательство
представляется крайне полезной процедурой в качестве временной
меры, направленной на подготовку тяжёлых больных к более
радикальному хирургическому вмешательству.
Рис. 18-5. Схема изолированной резекции головки поджелудочной железы
при хроническом панкреатите.
464 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I ♦ Глава 18
Для лечения стойкого болевого синдрома у больных с
хроническим панкреатитом и нерасширенной протоковой системой
поджелудочной железы при отсутствии осложнений со стороны окружающих
органов иногда используют хирургические вмешательства на
вегетативной нервной системе, направленные на прерывание
патологической болевой афферентной импульсации. Среди них наибольшее
распространение получили спланхникэктомия (одно- и двусторонняя)
и иссечение полулунного узла чревного сплетения. Эффективность
этих операций невысока в связи с неполным болеутоляющим
эффектом и временным его характером. В последние годы в качестве
паллиативных вмешательств стали применять эндоскопическую сплан-
хникэктомию, выполняемую через торакоскопический доступ, и так
называемую «химическую спланхникэктомию», которая
осуществляется путём введения спирта или фенола в зону чревного ствола либо
чрескожно под контролем КТ, либо из просвета желудка под
контролем эхоэндоскопа.
Кисты поджелудочной железы
Кисты поджелудочной железы представляют собой скопления
жидкости, окружённые капсулой, которые могут быть расположены
как в самой железе, так и в прилежащих отделах забрюшинной
клетчатки. Чаще всего (до 50% случаев) образование кист служит
отдалённым осложнением тяжёлых форм острого деструктивного
панкреатита; травма поджелудочной железы приводит к развитию кисты
у 20% пострадавших; они возникают не менее чем у 25% больных
хроническим панкреатитом. Наконец, примерно 5% всех случаев кис-
тозного поражения поджелудочной железы составляют «опухолевые
кисты» — цистаденомы и цистаденокарциномы.
Классификация
Характер кист:
• истинные, имеют эпителиальную выстилку:
— врождённые;
— приобретённые: ретенционные кисты (кистозное расширение
панкреатического протока любой этиологии), паразитарные,
опухолевые (доброкачественные и злокачественные);
• ложные (псевдокисты), имеют только фиброзную капсулу:
Хронический панкреатит и кисты поджелудочной железы О 465
- воспалительные (на почве острого или хронического панкреатита);
- посттравматические;
- илиопатические.
Локализация:
• органные: в головке, теле или хвосте поджелудочной железы, обычно
служат осложнением хронического панкреатита, имеют небольшие
размеры, нередко сообщаются с панкреатическими протоками;
• внеорганные: возникают на почве перенесённого панкреонекроза
или травмы поджелудочной железы, достигают значительных
размеров.
Осложнения:
• нагноение;
• перфорация в брюшную (реже плевральную) полость;
• стеноз выходного отдела желудка или двенадцатиперстной кишки;
• стеноз общего жёлчного протока;
• быстрый рост кисты с угрозой её разрыва;
• кровотечение в просвет кисты;
• сочетание нескольких осложнений.
Поскольку большинство кистозных поражений поджелудочной
железы составляют псевдокисты, являющиеся следствием
перенесённого острого или существующего у пациента хронического
панкреатита, основное внимание далее будет уделено именно им.
Клиническая симптоматика
Клинические проявления неосложнённых кист напрямую зависят
от их размеров и локализации, а также от характера сопутствующих
изменений поджелудочной железы.
Экстрапанкреатические постнекротические кисты обычно не
сопровождаются выраженным болевым синдромом. Постепенно
возникает и усиливается чувство тяжести в эпигастральной области и/
или левом, реже правом подреберье. Боли, если и присутствуют,
имеют характер тупых, ноюших, распирающих, с иррадиацией, зависящей
от локализации кисты. Нередко нарушается аппетит, больные
постепенно худеют. Развитие экскреторной недостаточности и сахарного
диабета обычно связано с обширностью перенесённого
панкреонекроза. Большие кисты нередко доступны пальпации. Они
малоболезненны, неподвижны, плотноэластической консистенции, округлой
или овоидной формы с гладкой поверхностью, расположены
обычно в эпигастральной области или левом, реже правом подреберье.
466 ♦ Хирургические болезни ♦ Том 1 ♦• Часть I ♦ Глава 18
Интрапанкреатические кисты относительно небольших размеров,
возникают на фоне хронического панкреатита, в связи с чем
клиническая картина в основном определяется тяжестью течения
воспалительного процесса в самой поджелудочной железе и степенью
вовлечения смежных органов. При локализации кисты в головке железы у
истощённых субъектов возможно пальпаторное выявление кисты, но
это бывает реже, чем при экстрапанкреатических образованиях.
Нагноение кисты сопровождается яркой клинической картиной
гнойного процесса, проявляющегося общим недомоганием, слабостью,
повышением температуры тела до гектических цифр. Киста
увеличивается в размерах, становится болезненной на ощупь. В лабораторных
показателях появляется лейкоцитоз со смещением лейкоцитарной
формулы влево, анемия, носящая интоксикационный характер.
Клиническая картина перфорации кисты в брюшную полость
сходна с клинической картиной перфоративной гастродуоденальной язвы:
внезапно возникают острые боли по всему животу, в течение
короткого промежутка времени развивается распространённый перитонит.
Киста (чаще всего экстрапанкреатическая), доступная пальпации до
перфорации, после её наступления перестаёт определяться вследствие
значительного уменьшения размеров. Перфорация в плевральную
полость проявляется острыми болями в грудной клетке на стороне
поражения, сопровождается одышкой, при физикальном обследовании
обнаруживают симптомы гидроторакса.
Стенозирование кистой выходного отдела желудка или
двенадцатиперстной кишки имеет симптоматику, сходную со стенозом,
причиной которого послужил хронический панкреатит: появляется
тошнота, затем может присоединиться рвота после приёма пищи или
натощак, постепенно нарастают водно-электролитные нарушения,
приводящие к гемоконцентрации, метаболическому алкалозу,
почечной недостаточности.
Стеноз общего жёлчного протока проявляется жёлчной гипертензи-
ей и механической желтухой. Выраженность её различна: от лёгкой ик-
теричности склер до тяжёлых нарушений функций печени, иногда
приводящих к развитию энцефалопатии и гепаторенального синдрома.
В случаях острой закупорки панкреатических протоков,
дренирующих кисту, при сохранённой секреторной активности
поджелудочной железы киста начинает быстро увеличиваться в размерах, что
может привести к появлению выраженного болевого синдрома,
купировать который часто не удаётся даже наркотическими
анальгетиками. При пальпации можно определить увеличение, иногда зна-
Хронический панкреатит и кисты поджелудочной железы О 467
чительное, размеров кисты.
Кровотечение в просвет кисты также сопровождается появлением
или внезапным резким усилением болей в животе и увеличением
диаметра образования в брюшной полости. При истечении крови через
фатеров сосочек или через спонтанное цистодигестивное соустье в
желудок или двенадцатиперстную кишку возникает клиническая
картина желудочно-кишечного кровотечения, сопровождающегося
рвотой «кофейной гущей» или кровью, меленой либо гематохезией и
общими симптомами кровопотери. При возникновении спонтанного
соустья кровоточащей кисты с ободочной кишкой пациент наряду с
общими симптомами острой анемии будет предъявлять жалобы на
примесь крови в стуле или наличие кала типа «малинового желе».
Диагностика
Инструментальная диагностика псевдокист не отличается по
существу от диагностического алгоритма при хроническом панкреатите.
Задачами неинвазивных лучевых методов визуализации (УЗИ, КТ
и пр.) являются установление факта существования кисты,
определение её размеров, формы и локализации, состояния стенки и
содержимого. Необычайно важной представляется оценка состояния
поджелудочной железы и окружающих органов (прежде всего жёлчных
протоков, желудка и двенадцатиперстной кишки), в особенности при
наличии хронического панкреатита (рис. 18-6).
Киста поджелудочной железы служит противопоказанием к
выполнению эндоскопической ретроградной панкреатографии, поскольку
Рис. 18-6. Компьютерная
томограмма больного с
постнекротической кистой
поджелудочной железы (указана
стрелкой).
468 ♦ Хирургические болезни ♦ Том 1 -О Часть I ♦ Глава 18
о
О
заполнение кисты контрастным веществом может с большой долей
вероятности привести к её инфицированию. Желудочно-кишечные
кровотечения служат показанием к неотложному эндоскопическому
исследованию ЖКТ; в зависимости от клинических данных необходимо
прибегнуть к гастродуодено- либо колоноскопии, при подтверждении
факта кровотечения из кисты очень полезна ангиография чревного
ствола и верхней брыжеечной артерии. Кроме точной топической
диагностики кровоточащего сосуда, в процессе ангиографии сущест-вует
возможность выполнения лечебной эмболизации. Перфорация
кисты в брюшную полость при стёртой клинической картине может
потребовать проведения лапароскопии для уточнения характера
процесса в брюшной полости, а при подозрении на перфорацию в
плевральную полость следует выполнить торакоцентез и исследовать
полученный экссудат на содержание панкреатических ферментов.
Лечение
В процессе принятия решения о необходимости оперативного
лечения клиницисту приходится принимать во внимание целый ряд
обстоятельств. В первую очередь необходимо определить, имеются
ли жизнеопасные осложнения кисты, при наличии которых
оперативное вмешательство должно носить экстренный характер. При
отсутствии осложнений большое значение имеют характеристики самой
кисты: причина её возникновения, наличие клинических
проявлений, срок существования, размеры, локализация, сформированность
стенки, топографо-анатомические взаимоотношения с
поджелудочной железой. Крайне важной представляется оценка состояния
паренхимы и протоковой системы поджелудочной железы, выражен-
ости в ней воспалительного процесса. Кроме того, анализу должно
одвергаться и состояние органов, непосредственно прилежащих к
железе: внепечёночных жёлчных протоков, желудка и
двенадцатиперстной кишки, магистральных сосудов портальной системы.
Не все кисты поджелудочной железы необходимо оперировать,
стрые панкреатические псевдокисты, возникшие на фоне
деструктивного панкреатита, в 30% случаев подвергаются спонтанному
разрешению в течение 2—4 мес после стихания приступа. В
противоположность этому, кистозные образования у больных с хроническим
панкреатитом крайне редко склонны к обратному развитию, за
исключением случаев спонтанного опорожнения кисты в протоковую
систему железы или ЖКТ. Исключительно важное значение для ус-
Хронический панкреатит и кисты поджелудочной железы О 469
тановления показаний к операции имеют и размеры кисты. На
сегодняшний день считают, что выполнение оперативного
вмешательства необходимо при диаметре кисты более 4—5 см. И, конечно,
подозрение на опухолевый характер кисты также является абсолютным
показанием к хирургическому вмешательству.
Дифференцированный подход к лечению постнекротических
псевдокист при отсутствии показаний к неотложной операции
определяется и «зрелостью» кисты, т.е. степенью сформированности её
стенок. Обычно для обеспечения безопасности операции внутреннего
дренирования должно пройти не менее 6 мес после завершения
лечения деструктивного панкреатита, к этому моменту стенка кисты
становится достаточно толстой и плотной, что сводит риск
несостоятельности швов в послеоперационном периоде к минимуму. Вместе с
тем, процесс формирования постнекротической кисты в
достаточной степени индивидуален, окончательное суждение о состоянии её
стенки принимают на основе данных инструментального
обследования пациента и результатов операционной ревизии.
Экстренная операция
Экстренную операцию производят при перфорации кисты в
брюшную, реже плевральную полость. В этом случае показано
наружное дренирование кисты и дренирование брюшной либо
плевральной полости, более радикальные операции производить не
следует. Недостатком наружного дренирования кисты является реальная
возможность возникновения после операции стойкого наружного
панкреатического свища. Кровотечение в просвет кисты, а затем в
ЖКТ (через фатеров сосок или спонтанное цистодигестивное соустье)
требует выполнения экстренной ангиографической эмболизации
кровоточащего сосуда, при его невозможности или неэффективности
возникает абсолютная необходимость в безотлагательном оперативном
вмешательстве. Объём операции может варьировать от прошивания
сосуда на протяжении или из просвета кисты с её тугим
тампонированием до резекции поражённого отдела поджелудочной железы с
кистой.
ср
очная операция
Срочная операция показана при нагноении кисты, ее
выполняют после кратковременной подготовки пациента. Объём операции
заключается в санации полости кисты и её наружном дренирова-
470 ♦ Хирургические болезни ♦ Том 1 ♦ Часть! ♦ Глава 18
нии, лучше двумя дренажами с целью активного промывания
полости в послеоперационном периоде. Альтернативным методом
служит чрескожное дренирование кисты под контролем УЗИ либо КТ.
Преимущество этого способа лечения заключается в отсутствии
необходимости прибегать к широкой лапаротомии, к недостаткам
можно отнести крайнюю сложность либо невозможность
эвакуации через дренажи относительно малого диаметра
секвестрированных тканей.
Сдавление кистой головки поджелудочной железы дистального
отдела жёлчного протока и/или двенадцатиперстной кишки, равно как
и быстрый рост её (определяемый клинически или посредством
лучевых методов диагностики) также заставляет предпринимать
срочные лечебные мероприятия. При тяжёлом общем состоянии
пациента, вызванном основным заболеванием или сопутствующими
страданиями, а также при явно малых сроках существования
псевдокисты преимущество следует отдавать чрескожным малоинвазивным
методам лечения в виде наружного дренирования кистозной
полости под контролем лучевых методов визуализации. Отсутствие
указанных неблагоприятных факторов позволяет выполнить
одномоментную, более радикальную хирургическую операцию, направленную на
внутреннее дренирование кисты.
Плановое хирургическое вмешательство
Плановое хирургическое вмешательство предпринимают при
наличии показаний и отсутствии осложнений со стороны кисты.
Операцией выбора в этом случае служит внутреннее дренирование кисты,
т.е. наложение цистодигестивного анастомоза. Возможно создание
соустья между кистой и желудком, двенадцатиперстной либо тощей
кишкой. Наложение цистогастроанастомоза (рис. 18-7) показано в
первую очередь при крупных, не полностью сформированных
постнекротических кистах поджелудочной железы с рыхлой стенкой, при
этом непременным условием является тесное сращение передней
стенки кисты с задней стенкой желудка. Привлекательная сторона
этой операции — простота её выполнения, однако постоянный
заброс желудочного содержимого в кисту может провоцировать
нагноение её полости и кровотечение из пептических язв, часто
образующихся по линии соустья.
В настоящее время при неосложнённой кисте поджелудочной
железы среди операций внутреннего дренирования наиболее широко
Хронический панкреатит и кисты поджелудочной железы ♦ 471
Рис. 18-7. Цистогастростомия: после рассечения передней стенки желудка
через заднюю его стенку электроножом вскрывают кисту, анастомоз
формируют путём сшивания стенок кисты и желудка.
применяют цистоеюностомию на петле по Ру. Суть её заключается в
формировании анастомоза между кистой и изолированной по Ру
петлёй тошей кишки. Цистоеюностомия при постнекротических кистах
поджелудочной железы сопровождается хорошими
непосредственными и отдалёнными результатами. В то же время, при кистах,
осложняющих течение хронического панкреатита, практически во всех
случаях их причиной служит панкреатическая гипертензия; в такой
ситуации во избежание рецидива кисты и с целью лечения
панкреатита цистоеюностомию следует обязательно сочетать с
наложением продольного панкреатоеюноанастомоза, т.е. сформировать цие-
топанкреатоеюноанастомоз. При наличии стеноза жёлчного протока
встаёт вопрос о необходимости одновременного наложения билмо-
дигестивного анастомоза, а при дуоденальном стенозе — гастроэнте-
роанастомоза.
При изолированных псевдокистах поджелудочной железы, не
сопровождающихся расширением её главного протока и другими
осложнениями самой кисты и хронического панкреатита, возмож-
472 ♦ Хирургические болезни ♦ Том 1 ♦ Часть I О Глава 18
но выполнение эндоскопической цистогастростомии. Для этого
под контролем эндоскопа через заднюю стенку желудка в полость
кисты вводят катетер специальной формы, который
обеспечивает декомпрессию кисты, препятствуя при этом рефлюксу в её
полость желудочного содержимого. После облитерации кисты дренаж
извлекают.
Резекция различных отделов железы с кистой показана при
единичной кисте дистальных отделов поджелудочной железы,
множественных кистах проксимального или дистального отдела
поджелудочной железы, подозрении на наличие кистозной опухоли
поджелудочной железы.
МЕХАНИЧЕСКАЯ
ЖЕЛТУХА
Желтуха — синдром, характеризующийся желтушным
окрашиванием кожных покровов, слизистых оболочек и склер, обусловленный
повышенным накоплением билирубина в сыворотке крови, а также в
других жидкостях и тканях организма.
Механическая желтуха — осложнение патологических процессов,
нарушающих отток жёлчи на различных уровнях желчевыводящих
протоков.
Причины развития желтухи
В течение суток печень выделяет в жёлчь до 250 мг жёлчного
пигмента — билирубина. Он образуется в клетках ретикуло-эндотели-
альной системы из освобождающегося гемоглобина зрелых
эритроцитов. Схема нормальных биохимических превращений билирубина
представлена на рис. 19-1.
Повышение содержания билирубина в сыворотке крови более
40 мкмоль/л вызывает желтушное окрашивание склер, слизистых
оболочек и кожных покровов. Билирубин проникает почти во все
жидкости и большую часть тканей организма, вызывая жёлтое
прокрашивание экссудатов и транссудатов, секретов различных желёз
(поджелудочной, слюнных, потовых и др.). У пациентов с анемией и
светлой кожей желтуху обнаруживают раньше, в то время как у
смуглых больных она дольше остаётся незамеченной.
В настоящее время известно множество разновидностей желтухи,
различающихся по этиологии, механизмам нарушения пигментного
обмена и в связи с этим требующих различных
лечебно-диагностических мероприятий (рис. 19-2). Повышение концентрации
билирубина может быть результатом трёх основных причин.
1. Ускоренный распад эритроцитов с избыточным образованием
и накоплением непрямого билирубина в сыворотке крови, когда
ферментные системы печени не способны обеспечить дальнейшее
превращение и выделение избыточного количества пигмента
(гемолитическая желтуха). Причиной подобных состояний могут быть
интоксикации, отравления, крупные гематомы и др.
474 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II А Глава 19
Рис. 19-2. Нарушения пигментного обмена при различных видах желтухи
Механическая желтуха <► 475
.
•
2. Поражение печёночных клеток, ведущее к нарушению
биохимических превращений билирубина (захват клетками печени и конъю-
гаиия) и проникновению его из крови в жёлчные капилляры
(паренхиматозная желтуха). Такие нарушения развиваются при острых и
хронических гепатитах, циррозах печени, гепатозах. Небольшую
группу составляют пациенты с различными вариантами наследственно
обусловленных нарушений пигментного обмена — так называемыми
доброкачественными гипербилирубинемиями (синдромы Жильбера,
Криглера-Найяра, Дабина-Джонсона и др.). Как правило,
нарушения конъюгации билирубина у этих больных связывают с
наследственной недостаточностью ферментов (глюкуронилтрансферазы).
Причиной некоторых форм приобретённой ферментопатии считают
использование гепатотоксичных препаратов (парацетамола,
экстракта мужского папоротника и др.). Подобные варианты желтухи чаще
возникают у лиц молодого возраста, чаще требуют наблюдения без
стационарного лечения, однако могут быть причиной
диагностических ошибок, обусловливающих неправильную лечебную тактику,
вплоть до напрасных лапаротомий.
3. Нарушение проходимости жёлчных путей, ведущее к попаданию
илирубина из жёлчных капилляров в кровеносные и
лимфатические сосуды (механическая желтуха).
Механическую желтуху могут вызывать следующие заболевания и
состояния.
Доброкачественные (80%):
- холедохолитиаз;
- стеноз большого дуоденального сосочка;
- холангит;
- острый папиллит, полипы большого дуоденального сосочка;
- острый и хронический панкреатит;
- рубцовая стриктура желчевыводящих протоков;
- прочие редкие причины (врождённые аномалии, перихоледохе
альный лимфаденит, паразитарные поражения и др.).
• Злокачественные поражения различной локализации (20%):
-рак большого дуоденального сосочка, поджелудочной железы, жёлч
ного пузыря или желчевыводящих протоков;
- первичный и метастатический рак печени.
Синдром механической желтухи следует рассматривать как слож-
ный патофизиологический комплекс, проявляющийся признаками
поражения всех органов и систем, преимущественно печени и почек.
Несмотря на разнообразие заболеваний, ведущих к развитию механи-
476 ♦ Хирургические болезни ♦ Том 1 ^> Часть II ♦ Глава 19
ческой желтухи, основные патофизиологические звенья синдрома
сходны, что позволяет руководствоваться единой
лечебно-диагностической тактикой как при доброкачественной, так и при
злокачественной его этиологии.
Механизмы развития различного вида желтухи, как правило,
сочетаются и редко встречаются в «чистом» виде. Например, при
гемолитической желтухе присоединяется механический компонент в связи
со сгущением жёлчи и обтурацией мелких жёлчных капилляров. При
длительной механической желтухе присоединяется поражение
печёночных клеток, и она приобретает некоторые черты желтухи,
свойственной гепатиту.
Диагностика
Диагноз механической желтухи включает два основополагающих
момента: подтверждение обтурационного характера желтухи и
определение конкретной причины нарушения проходимости желчевыво-
дящих путей.
Решение первой задачи крайне важно, поскольку на
догоспитальном этапе возникает до 20% диагностических ошибок, приводящих к
госпитализации пациентов в лечебные учреждения, не
соответствующие характеру заболевания. Больных с механической желтухой в
части случаев ошибочно госпитализируют в инфекционные
отделения, несколько реже пациенты с паренхиматозной желтухой
первоначально поступают в хирургические стационары. В обоих случаях
ошибочная госпитализация приводит к неверной тактике ведения —
затягиванию сроков декомпрессии жёлчных протоков, нарушениям
противоэпидемического режима и т.д. Кроме того, следует помнить,
что жёлтое прокрашивание кожи и других тканей организма может
происходить и в нормальных условиях при обильном приёме пищи,
содержащей красящие вещества, например моркови (каротин), или
некоторых лекарств (акрихина).
В табл. 19-1 представлены наиболее информативные клинико-
анамнестические и лабораторные данные, позволяющие
дифференцировать характер желтухи.
Механическая желтуха, обусловленная холедохолитиазом,
появляется через несколько часов или суток после выраженного болевого
приступа и характеризуется быстрым прогрессированием.
Возникновение желтухи сопровождается кожным зудом, вызывающим расчесы.
Механическая желтуха ♦ 477
критерии желтухи
Таблица 19-1, Дифференциально-диагностические
Тип желтухи
1
Гемолитическая
Паренхиматозная
Механическая
Показатели
Появление желтухи в детском
возрасте, подобные
заболевания у родственников
Контакт с больными
желтухой, инфекционные
заболевания, токсические воздействия
ЖКБ в анамнезе, операции
на жёлчных путях,
снижение массы тела
Анамнез
Лимонно-жёлтая (flavinicterus)
Жёлтая с оранжево-красным
оттенком {rubinicterus)
Жёлтая с зеленоватым
оттенком (verdinicterus)
Окраска
Умеренно выражена
Умеренно выражена
От умеренной до резко
выраженной, может быть ин-
термиттирующей
Интенсивность
желтухи
Отсутствует
Отсутствует
Выражен
Кожный зуд
Отсутствуют
Редкие, выражены слабо
Частые, носят интенсивный
характер
Боли
в правом подреберье
Отсутствует
Часто в начальный
период болезни
Нехарактерна
Тяжесть
в области печени
Не изменены
Увеличены
Не изменены
Размеры печени
Не изменены
Увеличены
Не изменены
Размеры селезёнки
Не изменён
Тёмный
Тёмный
Цвет мочи
Не изменён или тёмный
Обесцвечен
Обесцвечен
Цвет кала
Содержание резко повышено
Отсутствует в начальный
период болезни, затем
содержание может быть повышено
Отсутствует
(при полной обтурации)
Уробилин в моче
Концентрация повышена за
счёт непрямой фракции
Концентрация повышена за
счёт обеих фракций
Концентрация повышена за
счёт прямой фракции
Билирубин
Активность не изменена
Активность не изменена
Активность повышена
Щелочная фосфатаза
Активность не изменена
Активность высокая
Активность незначительно
повышена при длительных
сроках желтухи
аланин аминотран-
сфераза, аспартат
аминотрасфераза
478 ♦ Хирургические болезни ♦ Том 1 <>- Часть II ♦ Глава 19
преимущественно на передней брюшной стенке и разгибательных
поверхностях конечностей.
Для механической желтухи, вызванной опухолью головки
поджелудочной железы или большого дуоденального сосочка, характерны
отсутствие болей и постепенное развитие заболевания. Патогномо-
ничен синдром Курвуазъе, характеризующийся пальпируемым
увеличенным безболезненным жёлчным пузырем на фоне желтухи.
Основные клинические проявления, признанные характерными
спутниками желтухи, представлены на рис. 19-3. Как правило,
выраженность симптомов пропорциональна длительности течения
желтухи.
После оценки клинико-анамнестических и лабораторных данных
применяют инструментальные методы обследования. Наибольшее
распространение получили следующие способы диагностики:
Рис. 19-3. Основные клинические проявлении желтухи
Механическая желтуха ^ 479
• УЗИ;
• ЭРХПГ;
• чрескожная чреспечёночная холангиография;
• чреспузырная фистулография (после холецистостомии);
• КТ;
• магнитно-резонансная холангиопанкреатография;
• лапароскопия.
Выбор метода инструментальной диагностики определяется
предполагаемой причиной обтурации жёлчных протоков, возможностью
продолжения диагностического исследования в лечебное
вмешательство и техническим оснащением лечебного учреждения.
Важную роль в диагностике характера желтухи отводят УЗИ,
подтверждающему обтурационный характер заболевания путём выявления
дилатации жёлчных протоков, а в 75% наблюдений позволяющему
выявить непосредственную причину механической желтухи (рис. 19-4).
Важнейшие достоинства метода:
• скрининговый характер, неинвазивность, отсутствие осложнений;
• возможность использования при любой степени тяжести
состояния пациентов и во время беременности;
• одновременная оценка состояния жёлчных протоков и других
анатомических структур (печени, поджелудочной железы, забрюшин-
ного пространства и т.д.);
• возможность ультразвукового наведения при пункционных
методах декомпрессии и биопсии;
• объективный выбор метода декомпрессии желчевыводящих путей.
Рис. 19-4. УЗИ брюшной полос
ти при холедохолитиазе.
480 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 19
Несмотря на постоянное совершенствование ультразвуковой
диагностики, не всегда с её помощью удаётся получить полную
информацию о характере патологии жёлчных путей, достаточную для
решения вопроса о методе декомпрессии протоков. Для
прогнозирования эффективности вмешательств (в частности, эндоскопической
папиллосфинктеротомии) необходимы точные данные о размерах,
форме, количестве конкрементов, протяжённости и уровне стриктур
протоков и других важных деталях.
Наиболее точный способ определения причин механической
желтухи — прямое контрастирование жёлчных путей. Методом выбора
служит ЭРХПГ (рис. 19-5). Наряду с возможностью
контрастирования жёлчных протоков метод позволяет визуально оценить
состояние желудка и двенадцатиперстной кишки, большого дуоденального
сосочка и периампулярной области, а также констатировать факт
поступления жёлчи в просвет кишечника. У части больных желтухой
возможности эндоскопического ретроградного контрастирования
жёлчных протоков могут быть ограничены рядом обстоятельств,
такими как ранее перенесённые операции на желудке, расположение
большого дуоденального сосочка в полости крупных дивертикулов,
наличие непреодолимого препятствия в устье общего жёлчного
протока (стеноз, вклиненный конкремент, опухоль дистального отдела
протока). Подобные трудности встречают приблизительно у 10%
больных с обтурационной желтухой.
При неэффективности ретроградного контрастирования жёлчных
протоков используют чрескожную чреспечёночную холангиографию. Для
пункции внутрипечёночных жёлчных протоков применяются спе-
еханическая желтуха О-
р
циальные тонкие иглы, конструкция которых позволяет избежать
свойственных для этого исследования осложнений (крово- и желче-
истечения в брюшную полость). Если у больного расширены внутри-
печёночные жёлчные протоки, чрескожная чреспечёночная холанги-
ография позволяет получить информацию об их состоянии в 97%
случаев, при отсутствии расширения протоков — в 60% наблюдений.
В части случаев для получения целостного представления о жел-
чевыводящих путях выше и ниже участка сужения (например, при
Рубцовых или опухолевых стриктурах протоков) целесообразно со-
четанное ретро- и антеградное контрастное исследование билиарно-
го тракта. Это позволяет уточнить возможность и характер реконст-
уктивного хирургического вмешательства.
Один из распространённых способов контрастирования билиар-
ного дерева — использование холецистостомы, наложенной прямым
(хирургическим) путём либо пункционным под контролем УЗИ или
лапароскопии. Необходимое условие для выполнения подобного
исследования — проходимость пузырного протока. Об этом, как
правило, свидетельствует поступающая по дренажу жёлчь. Чаще всего
необходимость в наружном дренировании жёлчного пузыря
возникает при сочетании механической желтухи с острым деструктивным
холециститом или при опухолях головки поджелудочной железы
(листал ьного отдела протоков), когда крайне тяжёлое состояние
больных не позволяет выполнить паллиативное или радикальное
вмешательство традиционным хирургическим способом.
Высокую разрешающую способность имеет КТ, позволяющая
наряду с выявлением дилатации протоков и причины их обструкции
выполнить прицельную биопсию или декомпрессивное
вмешательство. В отличие от УЗИ диагностические возможности метода не
снижаются при метеоризме, асците, ожирении.
В последние годы широкое распространение приобретает магнит -
но-резонансная холангиопанкреатография, обладающая высокой
точностью в диагностике причин механической желтухи, особенно в
оценке характера и протяжённости стриктур жёлчных путей, а также
внутрипротоковых образований. Вместе с тем, этот метод лишён пун-
кционно-дренажных лечебных возможностей.
Лапароскопию при механической желтухе в настоящее время
применяют редко, в основном для подтверждения опухолевого процесса
(первичного или метастатического) в гепатодуоденальной области.
Цель исследования — определение операбельности
злокачественного заболевания и прицельная биопсия.
482 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 19
Лечение
Основная задача лечебных мероприятий при механической
желтухе — ликвидация холестаза и профилактика печёночно-почечной
недостаточности. Учитывая высокую летальность при операциях на
высоте желтухи, общепринят этапный лечебный подход.
На первом этапе используют комплексную консервативную
терапию и малоинвазивные методы, направленные на ликвидацию
холестаза. При неразрешающейся или нарастающей желтухе декомпрес-
сионные вмешательства необходимо выполнить в срочном порядке в
течение 2—3 сут с момента поступления больного в стационар.
Если малоинвазивные вмешательства не стали окончательными
способами лечения, на втором этапе по мере разрешения желтухи в более
благоприятных обстоятельствах проводят хирургические операции.
Все диагностические мероприятия с первых суток пребывания
больного в стационаре выполняют на фоне консервативной терапии,
главным образом направленной на профилактику печёночной и
почечной недостаточности. При оценке клинического течения и
определении тактики ведения пациентов с механической желтухой важнейшим
фактором считают степень печёночной недостаточности. По кли-
нико-лабораторным данным выделяют три степени её
выраженности (табл. 19-2).
При наличии в момент поступления печёночной недостаточности
III степени лечебный комплекс проводят в реанимационном
отделении. На фоне диеты (стол 5а), обогащенной углеводными и белковыми
продуктами, проводят массивную инфузионную терапию
(переливание глюкозы с инсулином, солевых растворов, гемодеза, реополи-
глюкина, белковых препаратов, кровезаменителей) и форсированный
диурез. Консервативная терапия включает также комплексную
витаминотерапию и препараты, улучшающие функции печени, — кокар-
боксилазу, сирепар, эссенциале.
Назначают также аминокислоты (глютаминовую кислоту и мети-
онин), стимуляторы метаболизма (метилурацил, пентоксил),
анаболические гормоны. Целесообразно назначение стероидных гормонов:
преднизолон по 60-120 мг/сут, в тяжёлых случаях внутрипечёночно-
го холестаза и холангита — до 1000 мг/сут.
Важный компонент лечения — профилактика эрозий, острых
изъязвлений и кровотечений из ЖКТ. Для этого назначают антацид-
ные и обволакивающие слизистую оболочку желудка препараты,
переливание свежезамороженной плазмы.
Механическая желтуха ♦ 483
Таблица 19-2. Оценочные критерии
точности
Критерии
Длительность
желтухи
Энцефалопатия
Гемодинамика
Диурез
Концентрация
билирубина,
мкмоль/л
Концентрация
мочевины
Альбумино-глобули-
новый коэффициент
Нарушение
тительно-выделительной функции
гепатоцитов (радио-
гепатография,
Т , мин)
max' /
Норма — до 25
Снижение
печёночного кровотока
степени тяжести печёночной недоста-
Степень печёночной недостаточности
I — легкая
До 7 дней
Нет
Стабильная
Достаточный
До 100
Не изменена
Более 1,2
До 50
На 25-30%
II — средняя III — тяжёлая
7-14 дней
Снижение аппетита,
адинамия,
бессонница
Стабильная
Достаточный
100-200
Не изменена
1,2-0,9
50-60
На 30-50%
Более 14 дней
Отсутствие
аппетита,
выраженная адинамия,
инверсия сна,
эйфория
Артериальная
гипотензия
Снижен
Более 200
Повышена
Менее 0,9
Более 60
Более 50%
В случаях тяжёлого эндотоксикоза используют методы
экстракорпоральной детоксикации (плазмаферез, гемодиализ и др.).
Важнейшей задачей ведения больных с механической желтухой
следует считать профилактику острого холангита — инфекционно-воспа-
лительного осложнения обтурации жёлчных путей. Замедление тока
жёлчи приводит к быстрому распространению микрофлоры на
магистральные и внутрипечёночные жёлчные ходы, что вызывает тяжёлую
системную воспалительную реакцию, внутрипечёночные абсцессы,
острую гепатоцеребральную и почечную недостаточность. Всё это обус-
484 ♦ Хирургические болезни ♦ Том 1 ♦ Часть И ♦ Глава 19
ловливает высокую летальность при остром холангите (до 30%). С целью
предотвращения этого осложнения используют антибиотики цефа-
лоспоринового ряда. При появлении клинико-лабораторных
признаков острого холангита декомпрессивные вмешательства и
комплексную консервативную терапию проводят в экстренном порядке.
Декомпрессия жёлчных протоков
Выбор способа декомпрессии желчевыводящих протоков зависит
от уровня и характера препятствия для оттока жёлчи. Арсенал этих
методов достаточно велик и продолжает расширяться. Наибольшее
распространение получили следующие мотоды:
• эндоскопическая папиллосфинктеротомия;
• чрескожная чреспечёночная холангиостомия;
• хирургическая холецистостомия;
• пункционная холецистостомия под контролем УЗИ или лапарос
копии;
• эндопротезирование жёлчных протоков;
• интраоперационные (прямые) методы декомпрессии жёлчных
протоков.
Для каждого из методов инструментальной декомпрессии
жёлчных протоков существуют показания и ограничения. Как правило,
методы декомпрессии становятся продолжением диагностических
процедур, что также следует считать одним из факторов,
определяющих целесообразность применения того или иного метода.
Инструментальные малоинвазивные
методы декомпрессии жёлчных путей
Среди малоинвазивных методов разрешения холестаза важнейшее
место занимает эндоскопическая папиллосфинктеротомия — метод
выбора устранения желтухи, обусловленной холедохолитиазом.
Показания к выполнению метода и прогнозирование его результативности
основываются на точном представлении о характере препятствия для
желчеоттока (размеры конкрементов, их расположение и количество,
состояние устья общего жёлчного протока и т.д.). Если размеры
конкрементов не превышают диаметра общего печёночного протока, их
можно удалить с помощью этой эндоскопической манипуляции и тем
самым восстановить пассаж жёлчи в двенадцатиперстную кишку.
Подобную ситуацию встречают более чем в 90% наблюдений, что обеспе
Механическая желтуха О- 485
чивает успешную санацию желчных протоков с помощью
эндоскопической папиллосфинктеротомии у большинства пациентов.
В случаях, когда размеры конкрементов велики и превышают
диаметр просвета нижележащих отделов жёлчных путей, не происходит
спонтанного отхождения конкрементов после эндоскопической
папиллосфинктеротомии. Тогда необходимо их насильственное извлечение
с предварительной литотрипсией. Плотная структура конкремента
делает подобное вмешательство весьма травматичным, что создаёт опасность
развития серьёзных осложнений (кровотечение, панкреонекроз, рет-
родуоденальная перфорация). Поэтому при наличии крупных
фиксированных конкрементов в магистральных жёлчных протоках, которые
можно выявить уже при УЗИ, не следует прибегать к ретроградному
контрастированию билиарного дерева и попыткам извлечения камней
путём эндоскопической папиллосфинктеротомии. В подобной ситуации
необходимо предпринять билиодуоденальное стентирование (катетер
проводят выше уровня конкремента) или антеградное чрескожное чрес-
печёночное дренирование. В последующем, по мере разрешения
желтухи, следует выполнить традиционное хирургическое вмешательство.
При наличии так называемого «высокого» блока жёлчных протоков
(опухоль, стриктура, реже конкремент) наряду с ретроградными
эндоскопическими методами декомпрессии можно использовать
антеградное чрескожное чреспечёночное дренирование жёлчных протоков.
В случаях, когда стент удаётся провести ниже места препятствия в
двенадцатиперстную кишку, осуществляют двойное
наружно-внутреннее дренирование жёлчных путей (рис. 19-6).
Рис. 19-6. Антеградное наружно
внутреннее дренирование жёлч
ных протоков.
486 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 19
Примерно в половине наблюдений при доброкачественной
природе обтурационной желтухи малоинвазивные инструментальные
методы позволяют устранить желтуху и ликвидировать патологию,
обусловившую её появление. Это исключает необходимость
традиционного хирургического вмешательства. В остальных случаях
после инструментальной декомпрессии жёлчных протоков по мере
разрешения механической желтухи и восстановления функций
важнейших органов и систем выполняют прямые операции. Сроки
проведения хирургических вмешательств зависят от исходной тяжести
печёночной недостаточности и составляют 1—4 нед. Как
правило, одним из основных ориентиров, свидетельствующих об
очевидной тенденции к разрешению холестаза и возможности
выполнения хирургического вмешательства, бывает снижение концентрации
общего билирубина ниже 50 мкмоль/л. Наряду с этим
нормализуются и другие параметры, характеризующие функциональное
состояние организма.
Прямые хирургические
вмешательства на жёлчных путях
Выбор метода операции основывается на результатах доопераци-
онной диагностики и данных интраоперационной ревизии жёлчных
протоков с учётом общего состояния больного.
Доступ. Наибольшее распространение при операциях на жёлчных
протоках получили косые разрезы в правом подреберье (Кохера,
Фёдорова). Реже применяют верхнесрединный доступ. При
необходимости обширных реконструктивных операций используют двухпод-
рёберный доступ. Вмешательства на жёлчных протоках у больных с
ЖКБ обычно выполняют после холецистэктомии (см. главу 16).
Идеальная холедохотомия — после удаления единичного
конкремента посредством холедохотомии при отсутствии признаков холан-
гита и хорошей проходимости дистального отдела общего жёлчного
протока отверстие в нём ушивают атравматическим монофиламент-
ным шовным материалом. Это позволяет снизить вероятность
формирования послеоперационного лигатурного холедохолитиаза.
Наружное дренирование общего жёлчного протока — наиболее час-
тый способ завершения холедохотомии. Необходимость во
временном наружном отведении жёлчи возникает при наличии холангита,
панкреатита, папиллита или других обратимых патологических со-
СТОЯНИЙ. Наружное дренирование протоков (рис. 19-7) проводят
Механическая желтуха ♦ 487
Т-образным дренажем (по Керу) или через культю пузырного
протока (по Холстеду—Пиковскому).
Холедоходуоденосгпомию (рис. 19-8) или холедохоэнтеростомию
применяют при необратимых препятствиях в дистальном отделе
общего жёлчного протока, которые невозможно устранить с помощью
б
Рис. 19-7. Наружное дренирование общего жёлчного протока: а — через
культю пузырного протока; б— Т-образный дренаж Кера, вводимый через холе-
дохотомию.
Рис. 19-8. Холедоходуоденостомия (схема операции)
488 О Хирургические болезни ♦ Том 1 О Часть II <> Глава 19
Рис. 19-9. Схема
реконструктивной операции на
жёлчных путях. Гепатико-
еюностомия с
использованием петли тонкой кишки,
выключенной по Ру,
дополнена наружным
дренированием жёлчных протоков.
эндоскопической папиллосфинктеро-
томии (протяжённый рубцовый стеноз,
индуративный панкреатит,
«неблагоприятное» расположение околососочковых
дивертикулов и т.д.).
При высоких рубцовых стриктурах
жёлчных протоков выполняют сложные
реконструктивные операции,
направленные на восстановление оттока жёлчи.
Среди них наибольшее распространение
получили билиодигестивные соустья на
различных уровнях жёлчных протоков с
петлёй тонкой кишки, выключенной по
Ру (рис. 19-9).
Операции при желтухе
опухолевой природы
Наиболее тяжёлую группу составляют
больные с обтурацией желчевыводящих
путей опухолевого происхождения.
После ликвидации желтухи малоинвазивным
путём выполняют радикальное или
паллиативное хирургическое вмешательство. Возможность выполнения
радикальных операций (они описаны в главе 17) у этих пациентов
отмечают не более чем в 15-20% случаев.
Паллиативные операции направлены на создание обходных били-
одигестивных соустий. В случае рака головки поджелудочной
железы (наиболее частой опухолевой причины механической желтухи)
операцией выбора считают холецистоэнтеростомию по Микуличу (рис.
19-10), Условие успешной декомпрессии жёлчных путей при этой
операции — проходимость пузырного протока.
При других локализациях опухоли формируют
билиодигестивные соустья либо применяют один из способов эндопротезирования:
антеградный чрескожный чреспечёночный или ретроградный
эндоскопический. В последние годы методы эндопротезирования
жёлчных протоков расценивают как предпочтительные паллиативные
вмешательства при опухолевых поражениях. Это обусловлено их меньшей
травматичностью и сходной продолжительностью жизни по
сравнению с результатами обходных билиодигестивных анастомозов.
Механическая желтуха ♦ 489
Прогноз
Летальность при механической желтухе зависит от причины обту-
рации жёлчных протоков, длительности заболевания и тяжести
состояния больных. Современные технические средства позволяют более
чем в 90% наблюдений устранить холестаз малоинвазивным путём и
оперировать больных, если это необходимо, в благоприятных
условиях после разрешения желтухи. При соблюдении подобного этапного
подхода летальность при доброкачественной природе обтурации
жёлчных путей не превышает 5%.
Наиболее сложную группу составляют больные, у которых с
помощью инструментальных методов не удаётся устранить билиарную ги-
пертензию, и прямое хирургическое вмешательство приходится
выполнять на высоте желтухи. В таких ситуациях проводят интенсивную
подготовку больных в течение суток в условиях отделения
реанимации, главным образом направленную на снижение интоксикации и
профилактику печёночно-почечной недостаточности. После
кратковременной подготовки выполняют минимальное по объёму
хирургическое вмешательство, направленное лишь на восстановление оттока
жёлчи. Вынужденные операции на фоне нарастающей механической
желтухи, холангита, печёночной недостаточности представляют
наибольшую опасность и сопровождаются высокой летальностью.
Рис. 19-10. Холецистоэнтеростомия
с межкишечным соустьем.
rrtfl&fl РАК ЖЕЛУДКА
Более 90% опухолей желудка — злокачественные. Аденокарцино-
ма желудка составляет 95% общего их количества. Ежегодно на
Земном шаре раком желудка заболевают около 1 млн человек. Уровень
заболеваемости в различных странах колеблется в достаточно
широких пределах. Наиболее высокие показатели регистрируются в
Японии, Китае, Белоруссии и России, а самые низкие — в США. В
подавляющем большинстве стран у мужчин эта злокачественная опухоль
возникает в 2 раза чаще, чем у женщин. В России летальность от рака
желудка в течение первого года после установления диагноза
достигает 55%, уступая по этому показателю лишь злокачественным
новообразованиям лёгкого и пищевода.
■ : ■.:;■:■ ::■■■.■.■■..:'-■:■■-■■ .... . ."■
Этиология
В настоящее время злокачественные опухоли рассматривают как
болезнь генома с множеством общих молекулярных путей развития.
Изменения в геноме определяются как врождённой патологией, так
и внешними воздействиями, среди которых можно выделить
физические, химические агенты и вирусы. Общей чертой этих факторов
является способность изменять ДНК. Злокачественная
трансформация нормальной клетки происходит при накоплении онкогенов,
кодирующих белки, которые участвуют в процессах клеточного
деления и дифференцировки, в сочетании с инактивацией генов-суп-
рессоров, ответственных за синтез белков, тромозящих клеточное
деление и индукцию апоптоза (процесс запрограммированной
гибели клетки, позволяющий организму избавляться от дефектных
структур). В клетках млекопитающих клеточный ответ на
повреждающие факторы выполняет ген р53, который называют «блюстителем
генома». Получив информацию о повреждении ДНК, он индуцирует
ре-парацию или, если повреждение существенно и необратимо,
направляет клетку по пути апоптоза, чтобы предотвратить
размножение клеток, имеющих протяжённую мутацию. Функциональная
инактивация ЭТОГО гена белками онковирусов в нормальных клетках вызы-
Рак желудка О- 491
вает нарушение контроля клеточного цикла и накопление
генетических аномалий, активирующих онкогены и инактивирующих ге-
ны-супрессоры опухолей. Приблизительно 50% первичных опухолей
человека несёт мутации гена р53. Эти опухоли клинически более
агрессивны.
В настоящее время невозможно выделить какую-либо одну
причину возникновения рака желудка. Злокачественный процесс
развивается под влиянием нескольких факторов. Определённую роль в
возникновении аденокарциномы желудка играет наследственность, хотя
её значение до конца не определено. Более сильным представляется
воздействие окружающей среды.
В конце 60-х годов XX века были обнаружены канцерогенные
свойства нитрозаминов. Ряд этих соединений, таких как диметилнитро-
замины, постоянно выявляются в воздухе предприятий резиновой,
кожевенной и других отраслей промышленности. Особенно
настораживают данные о спонтанном синтезе нитрозосоединений в
организме человека за счёт нитратов, которыми так богаты пищевые
продукты. Важную роль в развитии рака желудка играет потребление
консервов, копчёностей и консервированных пищевых продуктов.
Многие эмульгаторы, которые используются в качестве
консервантов продуктов, не просто вредны, но и обладают канцерогенным
действием. Потребление больших количеств соли также является
фактором риска, а наличие в рационе свежих фруктов и овощей оказывает
защитное действие. Витамин С и другие антиоксиданты,
содержащиеся в значительных количествах в «зелёных» овощах (салате,
капусте) и фруктах, препятствуют преобразованию нитритов в мутагенные
вещества. Наиболее наглядный пример роли диеты в развитии рака
желудка демонстрируют США, где за последние 70 лет пропаганда
рационального питания многократно снизила заболеваемость
населения раком желудка. Важно отметить, что при этом в 3 раза
уменьшилась заболеваемость раком желудка у эмигрантов первого
поколения из Японии, постоянно проживающих в США.
Колонизация ахлоргидрического желудка бактериями также
способствует преобразованию пищевых нитратов в нитриты и
превращению пищевых аминов в присутствии нитратов в канцерогенные нит-
розамины. В последнее время при определении причины
возникновения рака желудка огромное внимание уделяют роли Helicobacter pylori
(//. pilory), признанному ведущим в этиологии хронического
неиммунного антрального гастрита. В 1994 г. Международное агентство
по изучению рака включило этот микроорганизм в список явных
492 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 20
канцерогенов, который последовательно вызывает поверхностный
гастрит, атрофический гастрит, кишечную метаплазию, дисплазию,
карциному in situ и, в конечном счёте, инвазивную карциному.
Долю случаев рака желудка, связанную с наличием этой бактерии,
оценивают в 42%. Тяжёлая дисплазия указывает на неизбежный или
уже имеющийся рак желудка и должна служить показанием для
резекции желудка.
Рак желудка с повышенной частотой встречается при некоторых
заболеваниях желудка, которые рассматривают как фоновые. К ним
относят хронический атрофический гастрит, кишечную метаплазию
и гиперпластическую гастропатию.
Риск развития рака желудка повышен у пациентов, имеющих аде-
номатозные полипы желудка. В отличие от гиперпластических
полипов, содержащих разрастание гистологически нормального
желудочного эпителия (они составляют 80% общего их количества),
аденоматозные в 10-20% наблюдений трансформируются в рак.
Особенно часто злокачественному перерождению подвергаются
множественные аденоматозные полипы, а также те, диаметр которых
превышает 2 см.
У пациентов, страдающих пернициозной анемией свыше 5 лет,
риск развития рака желудка повышается в 2 раза.
Длительно существующая язва желудка увеличивает риск рака в
1,8 раза. Отмечено, что у пациентов, перенёсших резекцию желудка
по поводу доброкачественного заболевания, повышается риск
развития рака в культе органа. В течение 15 лет после такой операции
риск не увеличен, и лишь через 25 лет после резекции желудка он
повышается в 3 раза. В то же время язвенная болезнь
двенадцатиперстной кишки и ахлоргидрия, вызванная использованием
антагонистов Н2-рецепторов и ингибиторов желудочного протонного насоса,
не увеличивают частоту развития рака желудка.
Основные черты патологии
Рак (карцинома) желудка — злокачественная опухоль, исходящая
из клеток эпителия слизистой оболочки органа. Опухоль может
развиваться в любом отделе желудка, но чаще возникает в дистальной
его трети. В последнее время на фоне снижения заболеваемости
раком антрального отдела частота опухолей верхней трети и тела
желудка увеличилась.
Рак желудка ♦ 493
Макроскопическая картина
По макроскопической форме роста выделяют четыре формы рака
желудка.
1. Полипоидный рак, вдающийся в просвет желудка и хорошо
отграничений от здоровых тканей.
2. «Рак-язва» — изъязвлённый рак с приподнятыми и чётко
очерченными краями.
3. Рак в виде глубокого кратера, с выраженым инфильтративным
периферическим ростом без чёткого отграничения от здоровых тканей;
4. Диффузно-инфильтративный рак (скирр), захватывающий
значительный участок желудка, отождествляемый с пластическим линитом.
Последние две формы рака желудка протекают очень агрессивно,
рано дают метастазы и имеют чрезвычайно плохой прогноз.
Микроскопическая картина
Микроскопическая картина рака желудка довольно разнообразна,
что зависит от степени дифференцировки желёз, реакции стромы,
секреции муцина и направления роста опухоли. Принято разделять
карциному желудка на два главных гистологических типа: кишечный
и диффузный.
• Кишечный тип желудочного рака возникает в результате кишечной
метаплазии при замещении желудочного эпителия кубическими
клетками Панета. При кишечной форме желудочного рака
злокачественные клетки имеют хорошо дифференцированную железистую
структуру. Её обычно связывают с инфекцией Н. pylori, атрофичес-
ким хроническим гастритом, кишечной метаплазией и дисплазией.
Эта форма аденокарциномы чаще встречается в регионах с
высокой заболеваемостью раком желудка, у мужчин и пациентов
старших возрастных групп. Клинические исследования
свидетельствуют, что при этом типе чаще развиваются гематогенные метастазы.
• Диффузный тип не связан с кишечной метаплазией, а происходит
из мутаций единственной клетки в пределах нормальных
желудочных желёз и поражает верхние отделы желудка. Этот тип карциномы
чаще наблюдают у молодых женщин и в регионах с относительно
низкой заболеваемостью раком желудка. Диффузный тип рака
более агрессивен, быстро распространяется через подслизистое и под-
серозное лимфатические сплетения, рано проникает через
желудочную стенку и интенсивно распространяется по брюшной полости.
494 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 20
При одинаковой стадии заболевания диффузный тип имеет худший
прогноз, чем кишечный.
Международная гистологическая классификация рака желудка
выделяет следующие формы: аденокарцинома (папиллярная, тубуляр-
ная, муцинозная, перстневидноклеточная),
железисто-плоскоклеточный, плоскоклеточный, недифференцированный и неклассифици-
руемый рак.
Распространение
Рак желудка — биологически агрессивная опухоль, имеющая
большую склонность к раннему распространению как путём прямой
инвазии, так и метастазированием. Распространение первичной
опухоли происходит следующими путями:
• рост по стенке желудка с распространением на пищевод и,
значительно реже, на двенадцатиперстную кишку;
• прорастание стенки желудка с инвазией в окружающие органы и
ткани;
• лимфогенное метастазирование в регионарные и отдалённы
лимфатические узлы;
• отдалённое гематогенное метастазирование в органы и ткани
• имплантационное метастазирование по брюшной полости.
е
Распространение по желудочной стенке
Возникнув из клеток эпителия, опухоль недолго остаётся в самой
слизистой оболочке, а вскоре захватывает все слои стенки желудка.
Карцинома желудка растёт по всем направлениям, но всё же в
большей степени распространяется вверх по желудочной стенке
соответственно преимущественному току лимфы в сторону малой кривизны
желудка и желудочно-поджелудочной связки, где расположен
главный коллектор оттока лимфы от желудка. При инвазии опухоли в
лимфатические сосуды возможно образование отдельных раковых эмбо-
лов, которые вызывают появление так называемых внутристеночных
«пылевых» метастазов.
Внутристеночное распространение раковой опухоли происходит
по типу инфильтрации, главным образом в подслизистом слое. В связи
с л им макроскопическая и микроскопическая границы опухоли
помчи никогда не совпадают. При экзофитной опухоли раковые клетки
выявляются на расстоянии 2-3 см от определяемой на глаз границы
Рак желудка ♦ 495
опухоли. При инфильтративной и смешаной формах рака поражение
распространяется на 5—7 см и более и происходит преимущественно
в проксимальном направлении.
Распространение за пределы привратника на двенадцатиперстную
кишку происходит чаще по лимфатическим сосудам подслизистого и
мышечных слоев и существенно реже — по типу продолжающегося
роста. При этом раковая инфильтрация иногда поражает более 2 см
проксимальной части кишки. Переход рака верхней трети желудка на
пищевод идёт прямым путём, причём пищевод может быть вовлечён
в процесс на расстоянии от 2 до 7 см от края пальпируемой опухоли.
Для предупреждения местного рецидива рака эти особенности
всегда необходимо учитывать при определении границы резекции во
время операции. Единственным способом, позволяющим надёжно
контролировать истинные границы опухоли, является срочное
гистологическое исследование краёв резекции, что следует проводить при
всех хирургических вмешательствах по поводу рака желудка.
Распространение на соседние органы
Распространение на соседние органы и ткани происходит при
прорастании всех слоев стенки желудка. Этому способствует
сопутствующий воспалительный процесс, ведущий к укорочению и
деформации связочного аппарата желудка и сближению соседних органов.
Чаще всего поражаются поджелудочная железа, поперечная
ободочная кишка, печень и диафрагма. При этом может появиться
симптоматика, связанная с поражённым органом, — боли в спине, картина
толстокишечной непроходимости и желтуха.
Метастазирование
Рак желудка распространяется преимущественно по
лимфатическим путям, и метастазы появляются, прежде всего, в регионарных
лимфатических узлах. Возможно также гематогенное метастазирование
и распространение путём имплантации раковых клеток по брюшине.
Метастазы в регионарные лимфатические узлы появляются рано —
уже при прорастании опухоли в подслизистый слой. Учитывая данное
обстоятельство, для выбора адекватного объёма лимфодиссекции при
раке желудка необходимо знать особенности регионарного
лимфообращения и лимфоттока из этого органа.
Наиболее удобной для практики является схема лимфооттока,
предложенная Японской ассоциацией по раку желудка (1998). Детально
496 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 20
описаны 16 групп лимфатических узлов, воспринимающих лимфу от
различных отделов желудка и расположенных по ходу сосудов.
Согласно этой схеме выделяют три последовательных этапа метастази-
рования от различных отделов желудка.
• Первый этап (N1): перигастральные лимфатические коллекторы,
расположенные в связочном аппарате желудка, — правые и левые
паракардиальные (№1, 2), лимфатические узлы малой и большой
кривизны желудка (№3, 4s, 4d), над- и подпривратниковые
лимфатические узлы (№5, 6).
• Второй этап (N2): забрюшинные лимфатические узлы,
расположенные по ходу ветвей чревного ствола, — лимфатические узлы вдоль
левой желудочной артерии (№7), общей печёночной артерии
(№8а+р), чревного ствола (№9), в воротах селезёнки (№10), вдоль
селезёночной артерии (№llp+d).
• Третий этап (N3): лимфатические узлы гепатодуоденальной связки
(№12а+р+Ь), ретропанкреатодуоденальные (№13), лимфатические
узлы вдоль верхней брыжеечной артерии (№14a+v), в корне
брыжейки поперечной ободочной кишки по ходу средней ободочной
артерии (№15), парааортальные лимфатические узлы, расположенные на
различном уровне брюшной аорты (№16а1-а2, Ы-Ь2), а также хиа-
тальные и заднемедиастинальные лимфатические коллекторы для
рака проксимального отдела желудка с переходом на пищевод.
Отдалённые метастазы
Вовлечение лимфатических коллекторов N1—N2 рассматривают
как регионарное метастазирование, тогда как вовлечение
лимфатических узлов N3 — как отдалённое метастазирование.
Метастазирование при раке желудка в отдалённые
лимфатические узлы может развиваться как по обычному току лимфы, так и в
ретроградном направлении. По току лимфы чаще других
поражаются забрюшинные и медиастинальные лимфатические узлы.
Типичным для рака желудка является поражение через грудной
лимфатический проток лимфатических узлов в левой надключичной области.
Ретроградный ток лимфы возникает в случае блокады и закупорки
отводящих лимфатических путей метастазами. Классическим примером
таких метастазов при раке желудка являются двусторонние
метастазы в яичники. Другим примером ретроградных метастазов являются
метастазы в пупок, куда раковые клетки проникают по
лимфатическим сосудам круглой связки печени. При далеко зашедшей стадии
Рак желудка -О 497
заболевания можно обнаружить метастазы рака в подмышечных,
паховых и других отдалённых лимфатических узлах.
Помимо лимфатических узлов, наиболее частыми зонами
отдалённого метастазирования при раке желудка являются печень и
брюшина. Гораздо реже встречаются метастазы в лёгких, костях, почках,
головном мозге, коже и подкожной клетчатке.
Во внутренние органы метастазы рака попадают гематогенным
путём при прорастании опухоли в сосуды системы воротной вены или
лимфогематогенным путём через грудной лимфатический проток,
впадающий в венозное русло.
Имплантационные метастазы
Имплантапионные метастазы возникают при прорастании
опухолью всех слоев стенки желудка и контакте её с соседними органами, а
также при свободном перемещении отделившихся от первичной
опухоли раковых клеток по брюшной полости. В результате возникают
множественные имплантационные метастазы по брюшине в виде
мелкобугристых высыпаний — карциноматоз брюшины. Часто эти
свободные опухолевые клетки оседают также на поверхности большого
сальника или опускаются в малый таз, где образуют метастатические узлы.
Классификация
Распространённость опухолевого процесса выражают в стадиях
заболевания. Определение стадии включает оценку анатомических
размеров опухоли, степень поражения регионарных лимфатических узлов,
наличие или отсутствие отдалённых метастазов. Точное определение
стадии рака важно для выбора оптимального метода лечения, оценки
прогноза, сравнения эффективности различных лечебных программ
и результатов лечения в отдельных медицинских центрах.
По международной клинической классификации рака желудка
TNM местную и системную распространённость первичной опухоли
описывают заглавными индексами Т (tumor) — глубина инвазии
первичной опухолью стенки желудка; N (nodulus) — распространённость
лимфогенных метастазов по уровням лимфатических коллекторов; М
{metastasis) — наличие отдалённых органных метастазов.
Т — первичная опухоль.
ТХ — недостаточно данных для оценки первичной опухоли.
ТО — первичная опухоль не определяется.
498 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 20
Tis — карцинома in situ.
Tl — опухоль прорастает слизистую оболочку или подслизистый слой.
Т2 — опухоль прорастает мышечный или субсерозный слой.
В случае прорастания мышечного слоя и распространения
опухоли в желудочно-ободочную, желудочно-печёночную связки, большой
или малый сальник без прорастания их висцеральной брюшины,
случай классифицируют как Т2, при прорастании брюшины — ТЗ.
TЗ — опухоль прорастает серозный слой (висцеральную брюшину)
без прорастания в прилегающие структуры (селезёнку,
поперечно-ободочную кишку, печень, диафрагму, поджелудочную
железу, брюшную стенку, надпочечник, почку, тонкую кишку).
Т4 — опухоль прорастает в прилегающие структуры.
Интрамуральное прорастание в пищевод или двенадцатиперстную
кишку классифицируют по максимальной глубине инвазии в любом
из этих органов, включая желудок.
N — регионарные лимфатические узлы.
NX — недостаточно данных для оценки поражения регионарных лим
фатических узлов.
N0 — нет метастазов в регионарных лимфатических узлах.
N1 — метастазы в 1—6 регионарных лимфатических узлов.
N2 — метастазы в 7—15 регионарных лимфатических узлов
N3 — метастазы более чем в 15 регионарных лимфатических узлов.
М — отдалённые метастазы.
MX — нельзя установить наличие (отсутствие) отдалённых метастазов,
М0 — нет отдалённых метастазов.
Ml — имеются отдалённые метастазы.
Для удобства в клинической практике традиционно выделяют
четыре стадии рака. Группировка по стадиям карциномы желудка
приведена в табл. 20-1.
Наличие метастазов в органах, брюшине или поражение
лимфатических узлов N3 независимо от размеров первичной опухоли
классифицируют как IV стадию рака желудка.
В противоположность «количественному» принципу поражения
лимфатических узлов, лежащему в основе международной классификации,
Японская ассоциация по раку желудка (1998) предложила разделять
лимфатические коллекторы по «этапам метастазирования», что более
точно отражает распространённость процесса и позволяет выбрать
адекватный объём лимфодиссекции. Кроме этих стадий, японская
классификация ранний рак желудка выделяет в отдельную подгруппу — type О,
Рак желудка О- 499
Таблица 20-1. Группировка рака желудка по стадиям
Стадия 0
Стадия IA
Стадия IB
Стадия II
Стадия ША
Стадия ШВ
Стадия IV
Tis
Т1
Т1
Т2
Т1
Т2
ТЗ
Т2
ТЗ
Т4
ТЗ
Т1-3
Т4
Любая Т
N0
N0
N1
N0
N2
N1
N0
N2
N1
N0
N2
N3
N1-3
Любая N
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
МО
Ml
Ранний рак желудка
Концепция раннего рака впервые была разработана в Японии в
1963 г., когда была начата скрининговая программа выявления
злокачественных опухолей желудка на ранней стадии. В настоящее время
ранним раком считают опухоль, поражающую только слизистую
оболочку и не имеющую лимфогенных метастазов. По форме роста,
определяемой эндоскопически, ранний рак подразделяют на три типа:
• I — полиповидная опухоль, выступающая над уровнем слизисто]
оболочки более чем на 0,5 мм;
• II — поверхностная опухоль, выступающая над уровнем слизистой
оболочки менее 0,5 мм, либо расположенная ниже этого уровня
менее чем на 0,5 мм, также разделяемая на три подгруппы:
- Па — поверхностно-приподнятый тип;
- lib — поверхностно-плоский тип;
- Не — поверхностно-вдавленный тип.
• III — изъязвлённая опухоль.
Ранние раковые образования экзофитного типа (I и Па) хорошо
дифференцированы, а изъязвлённые — плохо дифференцированы.
Пятилетнее выживание для пациентов, когда рак ограничен
слизистой оболочкой, составляет 99%. Если он ограничен подслизистым ело-
500 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 20
ем — 93%, а в тех случаях, когда вовлекается хотя бы один
лимфатический узел, этот показатель резко понижается и составляет около 70%.
Ранний рак желудка в России выявляется редко, в США в 8-25%
случаев, а в Японии в 35—50% всех видов этой опухоли в связи с
проведением специальных программ с использованием массового фото-
флюороскопического и эндоскопического скрининга.
Клинические проявления
Клиническая картина карциномы желудка разнообразна и зависит
главным образом от стадии заболевания, а также от анатомической
формы опухоли, её локализации и наличия отдалённых метастазов.
В ранней стадии рак желудка протекает бессимптомно, и
пациенты достаточно долгое время чувствуют себя здоровыми.
Клинические проявления — снижение аппетита, похудание, боли в эпигаст-
ральной области и диспептические расстройства — появляются лишь
при прогрессировании заболевания. Желудочная диспепсия
проявляется такими симптомами, как ощущение тяжести и чувства
переполнения после еды, тошнота, отрыжка и срыгивание.
Все эти симптомы не специфичны для рака желудка и схожи с
признаками многих других гастродуоденальных заболеваний. Важно
обратить внимание на то, что антацидные препараты, антагонисты
Н2-рецепторов и ингибиторы желудочного протонного насоса у
части пациентов уменьшают эти признаки карциномы, поэтому прежде
чем начинать лечение желудочной диспепсии этими препаратами,
необходимо исключить опухоль желудка.
Явные симптомы рака желудка обычно появляются в поздних
стадиях заболевания, когда развивается обширное поражение стенки
желудка и прилежащих внутренних органов или возникают отдалённые
метастазы.
При локализации карциномы в антральном отделе желудка
характерно нарушение проходимости привратника. Вначале это
проявляется чувством переполнения желудка, иногда отрыжкой, изредка
рвотой съеденной только что пищей. С ростом опухоли эти симптомы
усиливаются, приобретая характер стойкой задержки эвакуации в
результате сужения выходного отдела желудка. Рвота принимает
постоянный характер, повторяясь ежедневно. Обильная рвота приносит
некоторое облегчение таким больным. При этом они резко худеют,
отмечаются симптомы обезвоживания, кожа становится сухой, теряет
эластичность и после собирания в складку долго не расправляется.
Рак желудка О 501
Рак проксимального отдела желудка и кардии длительное время
ничем не проявляется. Однако по мере сужения входа в желудок и
перехода процесса на пищевод появляются специфические симптомы
дисфагии — задержка пищи при переходе её из пищевода в желудок.
Больные отмечают эту задержку во время еды. Вначале она проходит
при покашливании или запивании водой твёрдой пищи, в
дальнейшем приобретает стойкий характер. Сужение может достичь резких
степеней, вплоть до непроходимости жидкой пищи. Помимо
затруднения глотания, появляется чувство давления и боли в грудной полости,
зависящее от расширения пищевода над опухолью и застоя в нём
пищи. Характерны усиленное слюнотечение, срыгивание пищей и икота
вследствие рефлекторного сокращения диафрагмы. Больные быстро
худеют и истощаются. Дисфагия — достаточно редкий симптом и
наблюдается лишь у 20% пациентов с проксимальным раком желудка.
Карцинома тела желудка в отличие от рака проксимального и
выходного отделов желудка долгое время протекает вообще без каких-
либо местных симптомов. Её относят к так называемым «немым»
формам опухоли. На первое место при этой локализации рака выступают
нарушения общего порядка: слабость, похудание, анемия, снижение
аппетита, депрессия, т.е. весьма поздние симптомы.
Также длительно бессимптомно может протекать рак дна
желудка, клинические проявления которого возникают при
распространении опухоли на диафрагму и плевру. При этом больных могут
беспокоить боли типа стенокардитических, что может приводить к
неправильной диагностике.
Наиболее частым осложнением прогрессирующей карциномы
желудка является стеноз привратника (точнее выходного отдела), реже
наблюдаются обтурация пищеводно-желудочного перехода,
кровотечение из распадающейся опухоли и воспаление. Однократные или
повторные желудочные кровотечения характерны для рака малой
кривизны желудка, т.е. той локализации, где проходят крупные ветви
левой желудочной артерии. Рвота цвета «кофейной гущи» и мелена —
важные признаки подобных карцином. Крайне редко (1%) в
результате распада опухоли наступает перфорация стенки желудка с развитием
картины разлитого перитонита.
А.И. Савицкий в 1945 г. предложил искать в клинической картине
прогрессирующего рака желудка не отдельные подозрительные
симптомы, а определённый симптомокомплекс, обусловленный не
грубыми анатомическими изменениями поражённого органа, а, прежде все-
о, нарушениями метаболизма, связанными с общим воздействием
502 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 20
опухоли на организм. Этот симптомокомплекс получил название
«синдром малых признаков» и заключается в следующем.
1. Изменение самочувствия пациента, выражающееся в появлении
беспричинной слабости, снижении трудоспособности, быстрой
утомляемости.
2. Немотивированно стойкое понижение аппетита, иногда полная его
потеря, вплоть до появления отвращения к пище.
3. Явления желудочного дискомфорта — потеря физиологического
удовлетворения от принятой пищи, ощущение переполнения
желудка, распирание его газами, чувство тяжести, иногда
болезненность в подложечной области, изредка тошнота и рвота.
4. Беспричинно прогрессирующее похудание, замечаемое больными
или окружающими, сопровождающееся бледностью кожных
покровов и другими признаками анемизации, необъяснимыми
нежелудочными расстройствами.
5. Психическая депрессия — потеря радости жизни, интереса к труду
и окружающему, апатия, отчуждённость.
Злокачественная опухоль значительно повышает тромбогенный
потенциал системы гемостаза. Помимо тканевого тромбопластина,
раковые клетки содержат раковый прокоагулянт А, который
обладает способностью непосредственно активировать фактор X. Поэтому
острый тромбофлебит подкожных вен (симптом Труссо) или острый
тромбоз глубоких вен может быть одним из первых симптомов
скрыто протекающего рака желудка.
Физикальное обследование у большинства пациентов с раком
желудка на начальных стадиях заболевания не выявляет никаких
отклонений от нормы. Патологические клинические признаки обычно
отражают поздние стадии заболевания. Кахексия, пальпаторное определение
опухоли в брюшной полости, гепатомегалия, асцит и надключичная аде-
нопатия обычно возникают лишь при запущенных формах заболевания.
Классическими клиническими признаками неизлечимого
злокачественного новообразования служат отдалённые метастазы,
характерные для рака желудка.
• Метастаз Вирхова (вирховская железа) в надключичные
лимфатические узлы, расположенные между ножками левой грудино-ключич-
но-сосцевидной мышцы. Увеличенный размер, форма и
специфически плотная консистенция лимфатических узлов данной группы
являются показанием к выполнению УЗИ шейно-надключпчиой
зоны с последующей пункционной биопсией.
Рак желудка -О- 503
• Метастаз Шницлера (имплантационный метастаз в дугласово
пространство, прорастающий в параректальную клетчатку). Данное
поражение выявляют при пальцевом ректальном исследовании. В
случае возникновения у клинициста подозрения на наличие метастаза
Шницлера необходимо выполнение трансректального УЗИ с
последующей пункционной морфологической верификацией.
• Метастазы Крукенберга (ретроградное лимфогенное либо имплан-
тационное метастазирование в яичники). Данное поражение
наиболее часто выявляют при влагалищном исследовнаии и УЗИ
брюшной полости. В случае выявления увеличенных яичников, либо при
прямом подозрении на их поражение пациенткам выполняют
лапароскопическое исследование с визуальной и морфологической
характеристикой процесса.
• Метастаз сестры Джозеф (метастаз опухоли в пупок) пальпаторно
определяется в виде плотного малоболезненного образования, не
вправимого в брюшную полость.
• Метастазы по париетальной брюшине могут приводить к
выраженному асциту. Их наличие подтверждают при лапароскопии или УЗИ.
• Метастазы в печень могут проявляться желтухой, портальной гипер-
тензией, асцитом и при пальпации давать картину увеличенной
бугристой печени. Лучевые методы исследования уточняют диагноз.
Диагностика
Диагноз рака желудка ставят на основании тщательного изучения
данных анамнеза, полного физикального обследования пациента и
применения лучевых, эндоскопических и морфологических методов
исследования. Специальных лабораторных методов диагностики рака
желудка до настоящего времени не существует.
Основные задачи обследования
1. Выявление первичной опухоли, определение её локализации,
границ в пределах желудка и анатомического типа роста опухоли.
Обязательным следует считать дооперационное морфологическое
исследование особенностей строения первичной опухоли, которое в
сочетании с характеристикой типа роста опухоли позволяет
прогнозировать течение заболевания и планировать адекватный объём
хирургического вмешательства.
2. Определение клинической стадии заболевания с целью выбора
метода лечения. Для этого необходимо обнаружить или исключить
наличие метастазов в печени, лимфатических узлах, париетальной
брюшине и прорастание опухоли в близлежащие органы.
3. Оценка общего состояния пациента и функциональной
переносимости хирургического вмешательства.
Алгоритм диагностики и лечения рака желудка представлен на
рис. 20-1. Тщательный анализ жалоб и анамнеза позволяет если не
установить диагноз, то, по крайней мере, заподозрить рак желудка.
А подозрение — «ключ» для распознавания рака желудка и показание
к инструментальному обследованию.
Наиболее важными методами диагностики рака желудка являются
гастроскопия и рентгенография. Оба метода имеют чувствительность
и специфичность выше 90%. Всем больным выполняют оба
исследования. Только их комбинация позволяет оценить характер опухолевой
инфильтрации стенок желудка с возможным переходом на пищевод
и двенадцатиперстную кишку, а также классифицировать тип
опухолевого роста.
Эндоскопическое исследование
Эндоскопическое исследование — один из наиболее
информативных методов диагностики рака желудка. Гастроскопия позволяет не
только визуально определить характер опухолевого поражения, его
локализацию, форму роста, распространённость по стенке желудка,
но и прицельно произвести биопсию для морфологической
верификации диагноза.
В начальных стадиях раковые образования желудка могут
выглядеть как плоские полиповидные бляшки или поверхностные язвы. По
мере прогрессирования заболевания раковые образования обычно
принимают изъязвлённый вид. Края подобной язвы подрытые, неровные,
а дно представлено некротическими тканями. Хотя все эти признаки
характерны для ракового поражения, всё же окончательно
дифференцировать злокачественную язву от доброкачественной возможно лишь
с помощью биопсии. При взятии биоптата из нескольких мест краёв
язвенного дефекта и окружающих зон точность диагноза может
достигать 95%. Ложноотрицательные результаты обычно обусловлены
погрешностями получения гистологического материала. Ложноположп-
тельные результаты редки. Диагностическая точность метода может
быть повышена за счёт проведения цитологического исследования,
Рак желудка ♦ 505
Рис. 20-1. Алгоритм диагностики и лечения рака желудка.
С целью более детального опредения границ опухолевой
инфильтрации, обнаружения синхронной опухоли и интрамуральных
пылевидных метастазов в стенке желудка на уровне подслизистого слоя
506 ♦ Хирургические болезни <> Том 1 ♦ Часть II ♦ Глава 20
производят хромоэндоскопическое исследование слизистой
оболочки органа. Для этого выполняют окраску слизистой оболочки 0,1%
раствором индигокармина либо метилтиониния хлорида.
Наиболее перспективно в комплексной диагностике интрамураль-
ной и лимфогенной распространённости опухолевого процесса
применение эндоскопического УЗИ. Для этих целей используют датчики
с частотами от 7,5 до 12 МГц. С их помощью стенка желудка
визуализируется как пятислойная структура с чередованием эхогенных и ги-
поэхогенных слоев. Акустического сцепления датчика со слизистой
оболочкой достигают заполнением желудка водой.
Данный метод позволяет определить глубину распространения
опухоли в стенку желудка, наличие метастатически изменённых
регионарных лимфатических узлов и помогает получить из них пункцион-
ный материал для морфологической верификации диагноза. Глубина
повреждения раком стенки желудка может быть точно определена в
80% случаев. Ранний рак, ограниченный слизистой оболочкой и под-
слизистым слоем, может быть дифференцирован от других стадий рака
более чем в 90% случаев. Этот метод исследования является
обязательным при проведении эндоскопических резекций слизистой
оболочки при раннем раке.
Эндоскопическое УЗИ весьма чувствительно в оценке подслизис-
тых образований в желудке. Лейомиомы обычно не вызывают эрозию
или образование язвы покрывающей слизистой оболочки и
выявляются как округлые гипоэхогенные массы с гладкими краями. Опухоль
при этом обычно связана с мышечным слоем желудка. Если размер
образования превышает 3 см, имеет неровные края, нарушает
слоистость стенки и имеет гипоэхогенные зоны, то следует предположить
злокачественное поражение.
Точность эндоскопического УЗИ в дифференцировке
доброкачественных и поражённых метастазами регионарных лимфатических
узлов составляет 50—80%.
Рентгенография желудка
Рентгенография желудка с сульфатом бария (отдельная или с
воздушным контрастированием) — основной метод определения локааи-
зации и протяжённости поражения стенки желудка (рис. 20-2).
Наиболее важными рентгенологическими признаками рака желудка являются:
• наличие дефекта наполнения или ниши в пределах тени желудка;
Рак желудка ♦ 507
Рис. 20-2. Рентгенограмма
желудка при раке. Определяется
дефект наполнения в антраль-
ном отделе с депо бария (указан
стрелкой).
• локальное отсутствие или уменьшение перистальтики в районе
опухоли;
• изменение рельефа слизистой оболочки в месте расположения
опухоли;
• изменение формы и размеров желудка.
Диагностические возможности рентгенографии желудка в
выявлении раннего рака ограничены, поскольку основные
рентгенологические признаки появляются при значительном поражении стенки
желудка. Рентгеновское исследование может быть расценено как
дополнительный метод, если подозревается скиррозный рак.
В процессе рутинного рентгенологического исследования
желудка, независимо от локализации первичной опухоли, чрезвычайно
важным представляется тщательное исследование всех остальных отделов
органа в связи с возможным мультицентрическим ростом карциномы
и наличием интрамуральных метастазов.
Экстракорпоральное ультразвуковое исследование
Экстракорпоральное УЗИ органов брюшной полости, забрюшин-
ного пространства и лимфатических коллекторов шейно-надключич-
ной области — обязательный метод обследования больных раком
желудка. У женщин в стандартное исследование необходимо включать
органы малого таза. УЗИ позволяет характеризовать поражение стенок
508 0* Хирургические болезни ♦ Том 1 ♦ Часть II О- Глава 20
желудка (при заполнении его жидкостью), оценить глубину инвазии,
определить распространение опухолевого процесса на париетальную
брюшину, другие органы и выявить асцит.
Компьютерная томография
КТ верхнего отдела живота с использованием внутривенного и внут-
рипросветного контрастирования желудка используют для
диагностики первичной опухоли и дооперационного определения стадии рака.
КТ может показать толщину и опухолевую инфильтрацию стенки
желудка, наличие язвы и метастазов в печени (рис. 20-3). Разрешающая
способность метода значительно повышается благодаря применению
современных спиральных томографов в сочетании с возможностью
построения трёхмерного изображения. Методика менее надёжна в
определении прорастания опухоли в близлежащие органы и
выявлении метастазов в регионарных лимфатических узлах. Из-за этих
ограничений КТ часто не исключает потребность в лапаротомии.
Лапароскопия
Лапароскопия не столько помогает в диагностике рака желудка
(что возможно лишь в поздних стадиях), сколько используется для
определения стадии заболевания и выявления мелких субкапсуляр-
ных метастазов в печени и на париетальной брюшине, не видимых
при УЗИ и КТ. Тем самым лапароскопия сводит до минимума число
эксплоративных лапаротомии.
Рис. 20-3. Компьютерная
томограмма верхней части живота. Рак
желудка (чёрная стрелка) и
метастаз в печени (белая стрелка).
Рак желудка ♦ 509
С целью повышения возможностей лапароскопической
диагностики применяют методику лапароскопической ультразвуковой
компьютерной диагностики. Благодаря применению УЗИ значительно
повышается разрешающая способность метода, особенно при
исследовании паренхимы печени и состояния лимфатических узлов забрю-
шинного пространства.
Несмотря на высокие разрешающие способности диагностических
процедур, отработку и оптимизацию методик исследования,
окончательное заключение об истинной распространённости процесса и
возможности выполнения радикальной операции зачастую удаётся
получить лишь при интраоперационном обследовании. С учётом характера
заболевания и современных аспектов тактики хирургического
лечения такое заключение возможно лишь при выполнении острой
ревизии, т.е. лишь после рассечения связочного аппарата и мобилизации
желудка либо вовлечённых структур с оценкой возможности
выполнения моноблочной комбинированной резекции.
Дифференциальная диагностика
Дифференциальную диагностику рака желудка следует проводить,
прежде всего, с гастритом, язвенной болезнью, полипами, лейомио-
мой, лимфомой и лейомиосаркомой желудка.
Дифференциация поздних стадий рака желудка от этих заболеваний
возможна на основании клинической картины, но имеет ограничен-
нное значение, поскольку практически не позволяет повлиять на
результаты лечения. Клиническая картина начальных излечимых стадий
рака желудка мало отличается от проявлений большинства
заболеваний системы пищеварения, поэтому первостепенное значение в
дифференциальной диагностике принадлежит эндоскопии с
гистологическим исследованием биоптата из стенки желудка. Следует проводить
гастроскопию при появлении любой умеренной диспепсии у
пациентов старше 40 лет и всем лицам вне зависимости от возраста с
постоянной диспепсией или любым другим настораживающим признаком.
Лечение
Основной и практически единственный метод радикального
лечения рака желудка в настоящее время — хирургическая
операция. Резекция желудка также обеспечивает и лучшее паллиативное
510 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 20
лечение. Лучевое воздействие и химиотерапия имеют
вспомогательное значение, их используют при паллиативном лечении.
Хирургическое лечение
Хирургические вмешательства при раке разделяются на:
• радикальные операции, которые обеспечивают отсутствие
остатков опухоли с высокой вероятностью полного излечения;
• условно-радикальные операции — отсутствие остатков опухоли,
но при вероятности наличия субклинических опухолевых очагов
(метастазов);
• паллиативные операции — наличие остатков опухоли.
Определяя план лечения конкретного больного раком желудка
необходимо ответить на главный вопрос — излечим ли пациент?
Критериями неизлечимости являются наличие отдалённых
множественных метастазов и обширное местное распространение опухоли на
близлежащие органы, которые нельзя удалить или резецировать.
В этих ситуациях радикальные хирургические операции не
выполняются, при наличии угрожающих жизни осложнений рака возможно
проведение паллиативных хирургических вмешательств. В тех
случаях, когда тщательное обследование не выявило отдалённых
метастазов или неизвестна истинная распространённость опухоли, следует
выполнить лапаротомию и после ревизии органов брюшной полости
выбрать объём операции.
Показания к радикальному хирургическому вмешательству.
1. Возможность полного удаления первичной опухоли.
2. Отсутствие отдалённых метастазов и диссеминации процесса по
брюшине.
3. Функциональная переносимость вмешательства.
При радикальной операции удаление первичной опухоли должно
быть выполнено единым блоком вместе с регионарными
лимфатическими коллекторами в пределах здоровых тканей, чтобы в краях
резекции не было раковых клеток. Впервые такой подход был
предложен более 100 лет назад Холстедом при хирургическом лечении рака
молочной железы. С тех пор это положение определяет стратегию всей
онкохирургии.
Выбор объёма радикального хирургического вмешательства в
первую очередь зависит от размеров, локализации и формы роста
первичной опухоли. При локализованных экзофитных формах карциномы
для достижения радикальности во время резекции необходимо отсту-
пить от края опухоли минимум на 3 см. При инфильтративных формах
рака отступать в проксимальном направлении (от визуально и пальпа-
торно определяемой границы опухоли) нужно не менее чем на 5 см.
Более надёжным критерием адекватности объёма операции служит
отсутствие раковых клеток в краях резицированного органа, что должно
быть установлено во время срочного гистологического исследования.
Наиболее распространёнными типичными радикальными
операциями при раке желудка являются дистальная субтотальная
резекция желудка, гастрэктомия и проксимальная субтотальная
резекция желудка с удалением регионарных лимфатических коллекторов.
В последнее время при раннем раке допускаются эндоскопические
вмешательства.
Эндоскопическая мукозэктомия
Эндоскопическую мукозэктомию выполняют лишь при
начальном неизъязвлённом раке, ограниченном пределами слизистой
оболочки желудка и не превышающем 1—2 см в диаметре. Эта
операция может быть радикальной, или её можно рассматривать как
тотальную биопсию.
Дистальная субтотальная резекция желудка
Дистальную субтотальную резекцию желудка выполняют при не-
инфильтративном типе опухоли нижней трети желудка и отсутствии
метастазов в лимфатические узлы паракардиальной области и по ходу
селезёночной артерии.
Субтотальная резекция желудка предполагает перевязку и
пересечение правой желудочной, правой желудочносальниковой и левой
желудочной артерий в самом их начале с удалением сопутствующих
лимфатических узлов и большого сальника. При этом иссекают
четыре пятых желудочной стенки, включая всю малую кривизну до уровня
пищеводно-желудочного перехода и 2—3 см проксимального отдела
двенадцатиперстной кишки. Непрерывность ЖКТ восстанавливают
путём гастроеюностомии (рис. 20-4). Предпочтение следует отдавать
формированию анастомоза между культёй желудка и выключенной по
методу Ру петлёй тощей кишки. При этом петля кишки,
предназначенная для формирования гастроэнтероанастомоза, должна быть
длиной не менее 40 см, чтобы избежать рефлюкса жёлчи в культю желудка
и пищевод. Другие методы реконструкции нужно ограничивать в
связи с худшими функциональными результатами.
512 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II О Глава 20
Проксимальная субтотальная резекция желудка
Проксимальную субтотальную резекцию желудка выполняют
редко. Подобный объём операции допустим лишь при экзофитных
опухолях размером менее 4 см, локализующихся в проксимальном
отделе, не прорастающих в серозную оболочку, и при отсутствии метастазов
в лимфатических узлах, располагающихся по правому краю большой
кривизны, а также супра- и субпилорических. Проксимальная
резекция включает удаление всей малой кривизны с пересечением
пищевода на расстоянии 5—6 см от края опухоли и завершается формиро-
1анием анастомоза между пищеводом и культёй желудка (рис. 20-5)
а 1-ч~~ б
Рис. 20-4. Дистальная субтотальная резекция желудка (схема): а — объём
удаляемой части желудка; б — завершение операции путём наложения гаст-
роэнтероанастомоза по Ру.
Рис. 20-5. Проксимальная субтотальная резекция желудка (схема): а — объём
резекции; б — завершение операции с помощью наложения эзофагогастроа-
настомоза.
Рак желудка О 513
Гастрэктомия
Гастрэктомия — основная операция при раке желудка,
выполняется при опухолях средней и верхней третей желудка, а также при
обширном распространении опухоли антрального отдела. Она включает
удаление всего желудка с регионарными лимфатическими
коллекторами. Наиболее функциональным и надёжным методом
восстановления непрерывности пищеварительного тракта после гастрэктомии
служит формирование инвагинационного эзофаго-энтероанастомоза с
отключённой по Ру петлёй тощей кишки (рис. 20-6), что позволяет
Рис. 20-6. Гастрэктомия при раке тела желудка (схема): а — объём удаления
органа; 6 — операция завершается эзрфагоэнтеростомией по Ру.
избежать рефлюкса жёлчи в пищевод и тем самым предотвратить
развитие рефлюкс-эзофагита. Ряд хирургов при реконструкции
используют петлевую пластику или интерпозицию сегментов тонкой или
ободочной кишки на сосудистой ножке с сохранением пассажа пищи
по двенадцатиперстной кишке.
Лимфодиссекция
Лимфодиссекция — обязательный элемент любого радикального
хирургического вмешательства при раке желудка, её выполняют по
принципиальным соображениям независимо от наличия или
отсутствия метастазов в регинарных лимфатических узлах. Термин
«лимфодиссекция» включает моноблочное удаление не только
лимфатических узлов, но и лимфатических сосудов с окружающей жировой
клетчаткой в пределах фасциальных футляров.
Вариант лимфодиссекции определяется объёмом удаляемых
тканей, классифицируется на основании последнего удаляемого этапа
514 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 20
■
и
метастазирования и обозначается символом D (dissection). Выделяют
следующие виды лимфодиссекции:
• D1 — удаление регионарных перигастральных лимфатических кол
лекторов (N1), расположенных в связочном аппарате желудка
сальнике;
• D2 — удаление как перигастральных, так и регионарных
лимфатических коллекторов второго этапа метастазирования (N2),
расположенных по ходу артериальных ветвей чревного ствола;
• D3 — удаление не только регионарных лимфатических коллекторов,
как в предыдущем объёме лимфодиссекции, но и лимфатических
узлов третьего этапа метастазирования (N3), расположенных вдоль
аорты и пищевода.
До недавнего времени обязательным стандартным объёмом
лимфодиссекции считалась D1. В настоящее время при радикальных
хирургических вмешательствах при раке желудка принято выполнять лимфо-
диссекцию в объёме D2. Этот объём не ухудшает непосредственных
результатов лечения и увеличивает 5-летнюю выживаемость, поэтому
лимфодиссекция D2 должна быть обязательным элементом
современного хирургического лечения локализованных стадий рака желудка.
Лишь при широком лимфогенном метастазировании с поражением заб-
рюшинных лимфатических коллекторов, большой площади выхода
процесса на серозную оболочку желудка и диффузно-инфильтративной
форме роста опухоли выполнение лимфодиссекции D2 не улучшает
отдалённые результаты лечения. Эти больные быстро погибают на фоне
прогрессирования и генерализации злокачественного процесса.
Дальнейшее расширение границ лимфодиссекции с иссечением
лимфатических узлов из печёночно-двенадцатиперстной связки, у
головки поджелудочной железы, корня брыжейки тонкой кишки и па-
рааортального пространства у ряда пациентов улучшает отдалённые
результаты лечения, но существенно увеличивает травматичность
хирургического вмешательства, риск осложнений и летального исхода.
На сегодняшний день расширение объёма лимфодиссекции до D3
рассматривают как исследовательское.
Комбинированные радикальные операции
Комбинированные радикальные операции с резекцией тела и
хвоста поджелудочной железы сопровождаются частыми осложнениями,
разви/ием инсулинзависимого сахарного диабета, высокой
летальное л>ю и редко улучшают отдалённые результаты лечения.
Рак желудка <> 515
Удаление метастазов
Удаление метастазов из печени в сочетании с устранением
первичной опухоли при раке желудка в отличие от подобных
вмешательств при раке ободочной кишки крайне редко улучшает результаты
лечения.
Паллиативные операции
Паллиативные операции чаще выполняют при раке желудка IV
стадии у пациентов со стенозом выходного отдела желудка,
кровотечением из раковой опухоли и перфорацией раковой язвы. Подобные
операции значительно не удлиняют жизни больных, но избавляют их
от тягостных симптомов. В ряде случаев эти операции могут быть
дополнены химиотерапией.
Лучшим видом паллиативного лечения в этих ситуациях служит
резекция желудка по Бальфуру. При этом лимфодиссекцию не
производят, операцию завершают формированием впередиободочного га-
строэнтероанастомоза на длинной петле с межкишечным соустьем
по Брауну. Средняя продолжительность жизни после паллиативной
резекции составляет 9 мес.
При невозможности выполнения паллиативной резекции
применяют операции меньшего объёма. Пациентам с раком, обтури-
рующим выходной отдел желудка, для восстановления
эвакуации пищи из желудка накладывают обходной гастроэнтероанасто-
моз. Это позволяет им прожить после операции в среднем 6 мес.
У больных раком кардиального отдела желудка и наличием дисфа-
гии для обеспечения энтерального питания выполняют стентирО-
вание, лазерную реканализацию опухоли, формируют гастростому
или еюностому.
При прободении опухоли и тяжёлом состоянии пациента или
наличии распространённого перитонита ограничиваются ушиванием
перфорации и дренированием брюшной полости. После
выведения больного из тяжёлого состояния и проведения соответствующей
подготовки следует стремиться оперировать повторно в возможно
короткий срок и выполнить резекцию желудка.
На выбор вида операции определённое значение оказывает и
функциональная переносимость хирургического вмешательства,
поскольку существует прямая связь между объёмом операции, уровнем
летальности и частотой осложнений. Так, резекция желудка даёт
хорошие непосредственные результаты, а гастрэктомия сопровождается
516 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 20
общей летальностью 5—8%. Основными причинами летальности слу
жат такие осложнения операции, как несостоятельность швов пи-
щеводно-кишечного анастомоза и панкреонекроз. Вследствие
использования сшивающих аппаратов частота несостоятельности швов
анастомоза снизилась до 5%. Тяжёлые формы панкреатита
развиваются значительно чаще при расширенных гастрэктомиях и лимфо-
диссекции D3.
Химиотерапия
Химиотерапия рака желудка до настоящего времени
малоэффективна в связи с низкой чувствительностью аденокарциномы ко всем
известным противоопухолевым препаратам. Ни одна из схем
комбинированной химиотерапии не способна излечивать больных раком
желудка и позволяет добиться лишь частичной ремиссии. При
неоперабельных формах рака желудка применение наиболее активных
современных противоопухолевых препаратов позволяет добиться
регрессии опухоли у 20—30% больных, однако эта регрессия обычно
частичная, и продолжительность жизни успешно леченных больных
составляет около 10 мес. Наиболее активным к настоящему времени из
всех комбинаций противоопухолевых препаратов считают сочетание
фторурацила, доксорубицина и митомицина.
На сегодняшний день не существует убедительных данных о пользе
проведения адъювантной (дополнительной) терапии у больных с
операбельным раком желудка, вопрос о её применении остаётся диску-
табельным. Результаты большинства рандомизированных
исследований не показали улучшения отдалённых результатов лечения при
проведении адъювантной химиотерапии при раке желудка.
При определении показаний к проведению химиотерапии следует
учитывать, что подобное лечение чревато серьёзными осложнениями,
обусловленными токсичностью самих противоопухолевых препаратов,
такими как нейтропения, сепсис, стоматит, энтероколит,
сопровождающийся тяжёлой диареей. Другая опасность при проведении
химиотерапии — кровотечение из неудалённой распадающейся
первичной опухоли желудка или её рецидива в зоне анастомоза.
Одним из перспективных направлений лечения местнораспро-
странённого и диссеминированного рака желудка можно
рассматривать комбинацию расширенных операций с последующей
гипертермической интраоперационной интраперитонеальыой
химиотерапией.
Рак желудка ♦ 517
Лучевая терапия
„
Лучевую терапию при раке желудка применяют преимуществен
о с палиативной целью. В связи с низкой чувствительностью
железистого рака к лучевой терапии и низкой толерантностью
окружающих желудок органов, подведение достаточных для подавления опу-
холе-вого роста доз ионизирующего излучения к органам верхнего
этажа брюшной полости посредством традиционных методов
лучевой терапии не представляется возможным. Лучевую терапию
иногда используют для уменьшения интенсивности болей при метастазах
рака желудка в кости.
Прогноз
Прогноз больных с операбельным раком желудка определяется
главным образом стадией заболевания и объёмом лимфодиссекции,
и в определённой степени формой роста и гистологической
структурой опухоли (рис. 20-7). При этом степень поражения регионарных
лимфатических узлов в наибольшей степени определяет 5-летнюю
выживаемость. Более 80% пациентов без метастазов в регионарные
лимфатические узлы выздоравливают после радикальных операций. А при
распространении рака на регионарные лимфатические узлы
излечиваются только 40-50% больных. Прогноз у больных с
неоперабельным раком желудка неблагоприятный. Большинство пациентов
умирают в течение первого года после установления диагноза.
5 годы
Рис. 20-7. Выживаемость больных при раке желудка.
5 18 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 20
В России у 75% первично выявленных пациентов заболевание
диагностируется лишь в III—IV стадии, более половины больных
раком желудка умирают на первом году с момента установления
диагноза. Популяционная 5-летняя выживаемость не превышает 30%.
Лучшие в мире отдалённые результаты лечения рака желудка
получены в Японии, где выживают более 50—60% пациентов. Это связано с
эффективной программой ранней диагностики и расширением
объёма лимфодиссекции при радикальных операциях.
Диспансеризация
Для ранней диагностики рака желудка большое значение имеет
диспансеризация лиц, имеющих повышенный риск развития этого
заболевания. В группу наблюдения должны быть включены больные
старше 40 лет, имеющие следующие заболевания:
• язвенная болезнь желудка;
• хронический атрофический гастрит с кишечной метаплазией;
• полипы желудка;
• неэпителиальные опухоли желудка;
• больные, перенёсшие резекцию желудка.
За этими пациентами необходимо вести активное наблюдение с
ежегодным эндоскопическим и рентгенологическим контролем и
исследованием кала на скрытую кровь каждые 6 мес.
РАК ТОЛСТОЙ КИШКИ
Рак толстой кишки — термин, объединяющий злокачественные
опухоли, локализующиеся в различных отделах этой части ЖКТ — от
слепой кишки до анального канала. Такое объединение обусловлено
общностью анатомии, практически сходной этиологией,
аналогичными механизмами канцерогенеза и одинаковыми методами диагностики.
В настоящее время во многих развитых странах рак толстой кишки
занимает по частоте одно из ведущих мест среди злокачественных
поражений. В России за последние 20 лет рак толстой кишки
переместился с шестого на четвёртое место, уступая лишь раку лёгкого,
предстательной железы и кожи.
Основные черты патологии
Частота локализации рака в различных отделах толстой кишки
неодинакова. Наиболее часто (до 65%) поражаются её дистальные
отделы (сигмовидная и прямая кишки), затем (15%) — правые отделы
ободочной кишки и слепая кишка. В поперечной ободочной и
нисходящей кишках опухоли возникают соответственно в 10—12% и 8—10%
случаев. Важной особенностью роста рака толстой кишки является
довольно частое (более 6%) синхронное возникновение нескольких
опухолей в одном или разных отделах толстой кишки. Возможно
также развитие новых опухолей в оперированной ранее кишке — мета-
хронный рак.
Микроскопическое строение рака толстой кишки достаточно
разнообразно. Согласно международной классификации, по
гистологическому строению выделяют следующие формы:
• аденокарцинома (высоко-, умеренно-, низкодифференциро-
ванная);
• муцинозная аденокарцинома (слизеобразующий, слизистый,
коллоидный рак);
• перстневидно-клеточный рак (мукоцеллюлярный);
• недифференцированный (солидный) рак;
• неклассифицируемый рак.
520 О Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 21
Кроме того, в прямой кишке и в анальном канале наблюдают:
• плоскоклеточный рак (ороговевающий и неороговевающий);
• железисто-плоскоклеточный рак;
• базально-клеточный (базалиоидный) рак — вариант
плоскоклеточного рака.
Самой распространённой гистологической формой является аде-
нокарцинома — более 80% всех раковых опухолей толстой кишки.
Опухоль сравнительно долго развивается в пределах кишечной
стенки, в частности в слизистой оболочке и в подслизистом слое.
Затем происходят постепенная инфильтрация других слоев и выход
за пределы кишечной стенки с прорастанием серозного покрова,
окружающих органов и тканей. Проникновение раковых комплексов в
лимфатическую и кровеносную системы может возникнуть на всех
этапах роста опухоли. Механизмы такого проникновения ещё до
конца не выяснены, но клиницисту важно знать, что у больных с очень
маленькой опухолью (менее 1 см) в самой кишке может наблюдаться
обширное лимфатическое и гематогенное распространение бласто-
матозного процесса. И наоборот, опухоль больших размеров даже с
прорастанием в соседние органы (например, в мочевой пузырь,
тонкую кишку и т.п.) иногда не сопровождается метастазами в
лимфатические узлы и, тем более, в другие органы.
Наиболее частым осложнением рака толстой кишки бывает
нарушение кишечной проходимости, которое хирурги нередко трактуют
как частичную кишечную непроходимость. Вторым по частоте
осложнением является обтурационная кишечная непроходимость, часто
требующая срочного оперативного вмешательства. Реже наблюдают
перфорацию опухоли или стенки кишки, профузное кишечное
кровотечение и абсцедирование опухоли. Описание этих осложнений
требует специального изложения, в данной главе речь пойдет лишь о
неосложнённом раке толстой кишки.
Этиология
Вероятнее всего, нет какой-либо одной причины возникновения
рака толстой кишки, злокачественный процесс развивается под
влиянием нескольких факторов. Среди них наибольшее воздействие
оказывают длительное применение малошлаковой диеты с высоким
содержанием животных жиров, нарушение режима питания, хронические
заболевания толстой кишки (дивертикулярная болезнь, язвенный
коли!, болезнь Крона), факторы внешней среды.
ак толстой кишки <> 521
Определённую роль в возникновении рака толстой кишки играет
наследственность. Некоторые генетически детерминированные
заболевания, такие как семейный аденоматоз толстой кишки, синдром
Гарднера, синдром Турко, сопровождаются высоким риском (30—100%)
развития рака толстой кишки.
Классификация
Характер роста опухоли:
• экзофитный (преимущественно в просвет кишки);
• эндофитный (распространяется в основном в толще стенки кишки);
• блюдцеобразный (сочетает элементы двух предыдущих форм в виде
опухоли-язвы).
Стадии развития (отечественная классификация):
• 1-я стадия — небольшая опухоль, локализующаяся в слизистой
оболочке или подслизистом слое. Метастазов в лимфатических узлах
нет.
• 2-я стадия.
А. Опухоль занимает не более полуокружности кишки, не выходит за
пределы кишечной стенки, метастазов в лимфатических узлах нет.
Б. Опухоль того же или меньшего размера с одиночными
метастазами в ближайших лимфатических узлах.
• 3-я стадия.
А. Опухоль занимает более полуокружности кишки, прорастает всю
её стенку или соседнюю брюшину, без регионарных метастазов.
Б. Опухоль любого размера при наличии множественных
метастазов в регионарные лимфатические узлы.
• 4-я стадия — обширная опухоль, прорастающая в соседние органы,
с множественными регионарными метастазами, а также любая
опухоль с отдалёнными метастазами.
Международная классификация по системе TNM (для рака
ободочной кишки).
Т — первичная опухоль:
• Tis — карцинома in situ или прорастание базальной мембраны без
инвазии в подслизистый слой;
• Т1 — опухоль прорастает в подслизистый слой;
• Т2 — опухоль прорастает в мышечный слой;
• ТЗ — опухоль прорастает в субсерозный слой либо прилегающие к
неперитонизированным отделам ткани;
ах
522 О- Хирургические болезни <^ Том 1 <? Часть II ♦ Глава 21
• Т4 — прямое прорастание опухоли в соседние органы либо
прорастание висцеральной брюшины. К этой категории относят также
случаи прорастания несмежных отделов толстой кишки (например,
прорастание опухоли сигмовидной кишки в слепую).
N — регионарные лимфатические узлы:
• N0 — метастазы в регионарные лимфатические узлы не выявлены;
• N1 — имеются метастазы в 1—3 регионарных лимфатических узлах;
• N2 — метастазы в 4 и более лимфатических узлах;
М — отдалённые метастазы:
• МО — отдалённых метастазов нет;
• Ml — имеются отдалённые метастазы.
Группировка по стадиям:
• Стадия 0: TisNOMO;
• Стадия I: T1-2N0M0;
• Стадия II: T3-4N0M0;
• Стадия III: T1-4N1-2M0;
• Стадия IV: T1-4N0-2M1.
Определение стадии заболевания должно основываться на
результатах дооперационного обследования, данных интраоперационной
ревизии, в том числе инструментальной, и морфологическом
изучении удалённого сегмента кишки с опухолью.
Клинические проявления
Клиническая картина рака толстой кишки не имеет каких-либо
специфических признаков. Наиболее характерными симптомами
являются примесь крови в кале; нарушение стула, чаще в виде запоров;
боли в различных отделах живота, в области прямой кишки или
анального канала. При локализации опухоли в дистальных отделах
сигмовидной кишки или в прямой кишке больные часто испытывают
ложные позывы на дефекацию (тенезмы).
Примесь крови в стуле, иногда микроскопическая, возникает
практически у всех больных раком толстой кишки, на чём и строятся
многие методики массового выявления (скрининга) этого
заболевания. Выделение алой крови типично для рака анального канала и
прямой кишки. Тёмная кровь характерна для рака левой половины
ободочной кишки. При этом кровь, смешанная с калом и слизью,
является более достоверным признаком. При раке правой половины
чаше наблюдают скрытые кровотечения, проявляющиеся анемией,
бледностью кожных покровов и общей слабостью.
Рак толстой кишки О- 523
Другим характерным (но всё же неспецифичным) симптомом рака
толстой кишки, наблюдаемым более чем у 70% больных, является то
или иное нарушение дефекации. Оно проявляется либо в виде
кратковременных периодических задержек стула и газов, либо в виде длительных
запоров. Иногда отмечают диарею или чередование запоров и диареи.
Нередко рак толстой кишки сразу манифестирует острой кишечной
непроходимостью, требующей экстренных лечебных мероприятий.
При раке прямой кишки больные часто жалуются на чувство
неполного опорожнения или ложные позывы на дефекацию,
сопровождающиеся выделением слизи.
Частым симптомом рака толстой кишки является боль в животе,
беспокоящая более чем 80% больных. Локализация боли непостоянна и
зависит от расположения опухоли. Боли в животе или в области прямой
кишки усиливаются при присоединении перифокального воспаления
или обтурации просвета кишки с нарушением кишечной проходимости.
Пальпируемая опухоль в животе не всегда является прямым
признаком рака толстой кишки, однако её выявление должно служить
существенным аргументом для исключения этого заболевания.
Как и любой злокачественный процесс, рак толстой кишки
сопровождается общими нарушениями, такими как общая слабость,
снижение аппетита, уменьшение массы тела, анемия и т.п. Но
расценивать их как ранние признаки нельзя, напротив, рак этой локализации
у большинства больных поздно приводит к подобным изменениям.
Диагностика
В настоящее время имеется возможность выявить рак толстой
кишки практически во всех случаях заболевания. Необходимо соблюдать
всего три условия.
• Помнить, что любое проявление кишечного дискомфорта может
быть проявлением этого заболевания
• При подозрении на рак толстой кишки следует выполнять
определённый алгоритм диагностических мероприятий.
• Должны быть полностью использованы возможности применяемых
методик обследования.
Для правильной ориентации врачей определена так называемая
группа риска по раку толстой кишки. Она характеризуется
следующими признаками:
• возраст старше 50 лет;
524 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 21
• наличие полипов толстой кишки (в том числе и в анамнезе);
• ворсинчатые образования;
• семейный аденоматоз толстой кишки и полипозные синдромы;
• неспецифический язвенный колит;
• болезнь Крона;
• дивертикулярная болезнь толстой кишки;
• перенесённые операции по поводу рака любой локализации;
• семейный анамнез по злокачественным новообразованиям.
Диагностический алгоритм для выявления рака толстой кишки
заключается в следующих мероприятиях:
• анализ жалоб и анамнеза (см. группу риска);
• клиническое обследование;
• пальцевое исследование прямой кишки;
• ректороманоскопия;
• анализ кала на скрытую кровь;
• колоноскопия;
• ирригоскопия (при сомнительных данных колоноскопии или их
отсутствии);
• УЗИ живота и малого таза;
• эндоректальное УЗИ при подозрении на опухоль прямой кишки;
• биопсия обнаруженной опухоли или любого подозрительного
участка кишки.
При проведении обследования необходимо добиваться
максимально полного использования диагностических возможностей применяемых
методов. Этому способствует правильная подготовка толстой кишки.
В настоящее время с этой целью с успехом используют слабительные
препараты, содержащие полиэтиленгликоль, например макрогол и другие.
Большинство опухолей толстой кишки (до 70%) локализуется в её
дистальных отделах (прямой и сигмовидной кишках), поэтому роль
таких общедоступных диагностических приёмов, как пальцевое
исследование прямой кишки и ректороманоскопия, очень важна.
Например, для выявления рака анального канала и нижнеампулярного
отдела прямой кишки вполне может быть достаточно одного
пальцевого исследования, а для большинства опухолей сигмовидной
кишки — ректороманоскопии. Разумеется, в том и другом случаях
клинические предположения должны быть подтверждены биопсией.
Одним из важнейших методов выявления рака ободочной кишки
является колоноскопия с биопсией. В то же время, при стенозирую-
щих формах рака колоноскоп может не пройти в вышележащие
отделы толстой кишки. В этих случаях необходимо использовать рентге-
Рак толстой кишки ♦ 525
нологическое исследование толстой кишки с помощью контрастной
клизмы (ирригоскопия). Колопроктологи рекомендуют использовать
оба метода у каждого больного, так как полученные с их помощью
данные помогают уточнить локализацию опухоли, её
распространение и связь с окружающими органами.
Важными методами уточняющей диагностики служат УЗИ, КТ и
МРТ. КТ и МРТ целесообразно использовать лишь в сложных
случаях прорастания опухоли в окружающие органы и ткани и редкого
отдалённого метастазирования (надпочечники).
Необходимым элементом диагностики, в том числе и
дифференциальной, является биопсия опухоли. При этом диагностическое
значение имеет лишь положительный результат обнаружения опухолевой
ткани. Отрицательный ответ (отсутствие признаков рака) не может
полностью отвергать наличие рака толстой кишки, так как участок
стенки кишки для биопсии берётся, как правило, из её поверхностных
слоев. Все сомнительные случаи должны расцениваться как наличие
злокачественной опухоли.
Лечение
В настоящее время лечение рака толстой кишки следует
рассматривать как совокупность мероприятий, адекватных локализации и
распространённости злокачественного процесса, характеру его клинического
течения, наличию и особенностям осложнений, общему состоянию
больных. Необходимо также учитывать сопутствующие заболевания и
возраст больных. В зависимости от перечисленных параметров должна
разрабатываться индивидуальная программа, в которой определяют:
• характер, объём и метод операции;
• необходимость и возможность проведения предоперационной
лучевой терапии;
• характер, метод и предпочтительность послеоперационного адъ-
ювантного (дополнительного) лечения (химиотерапия, лучевое
лечение, операции повторного осмотра и т.п.).
Общие принципы хирургического лечения
Общие принципы хирургического лечения рака толстой кишки
предусматривают радикализм, абластичность, асептичность и
обеспечение возможности беспрепятственного отхождения кишечного
содержимого, по возможности, естественным путём.
526 -О Хирургические болезни ♦ Том 1 ♦ Часть II ♦■ Глава 21
Успех хирургического лечения и возможность соблюдения
перечисленных принципов во многом определяются правильной
подготовкой толстой кишки. До настоящего времени в нашей стране
наиболее распространённым методом остаётся назначение бесшлаковой
диеты, слабительных препаратов и очистительных клизм за 3—5 дней
до операции. Современным, более эффективным и удобным методом
представляется антеградное промывание ЖКТ, так называемый лаваж,
с помощью специальных препаратов, принимаемых внутрь. К ним
относятся уже упоминавшиеся средства, содержащие в своей основе
полиэтиленгликоль, в качестве слабительного препарата. Подобная
подготовка заключается в приёме внутрь 2—3 л раствора накануне
операции (за 16—18 ч). Антибиотики следует назначать только при
наличии явных признаков перифокального воспаления.
По характеру операции при раке толстой кишки подразделяют на
экстренные, например при перфорации опухоли, срочные — при
кишечной непроходимости, плановые — при неосложнённом течении
заболевания.
По объёму оперативные вмешательства подразделяют на
типичные, комбинированные и расширенные.
Типичные операции подразумевают минимальный объём
резекции, необходимый при данной локализации и стадии опухоли. Так,
для рака средней трети сигмовидной кишки в I и II стадиях
типичной операцией будет сегментарная резекция сигмовидной кишки, но
для той же локализации в III стадии адекватной может быть только
левосторонняя гемиколэктомия.
Комбинированными называют операции, при которых из-за
распространения опухоли резецируют не только толстую кишку, но и
какой-либо другой орган.
Расширенные резекции — увеличение по сравнению с типичными
вмешательствами объёма резекции толстой кишки из-за
распространения опухоли или наличия синхронных опухолей. К ним относят
субтотальные резекции ободочной кишки при право- или
левосторонней локализации опухоли в ободочной кишке, гемиколэктомию
с резекцией прямой кишки при раке прямой кишки и др.
Хирургическое лечение рака ободочной кишки
При раке ободочной кишки объём резекции в зависимости от
локализации опухоли колеблется от дистальной резекции сигмовидной
кишки до колэктомии, т.е. удаления всей ободочной кишки. Наибо-
Рак толстой кишки <> 527
лее часто выполняют дистальную резекцию сигмовидной кишки,
сегментарную резекцию сигмовидной кишки, левостороннюю гемико-
лэктомию, резекцию поперечной ободочной кишки,
правостороннюю гемиколэктомию (рис. 21-1), субтотальную резекцию ободочной
кишки. Эти операции отличаются друг от друга объёмом резекции
ободочной кишки, анатомией пересекаемых сосудов и, в соответствии
с этим, удаляемой зоной лимфогенного метастазирования.
Рис. 21-1. Схема резекции толстого кишечника при раке различной
локализации: а — резекция сигмовидной кишки; б — левосторонняя гемиколэкто
мия; в — правосторонняя гемиколэктомия; г — резекция поперечной обо
домной кишки.
♦ Хит:
528 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 21
Дистальная резекция сигмовидной кишки заключается в резекции
дистальных двух третей сигмовидной кишки и верхней трети прямой
кишки с перевязкой сигмовидных и верхнепрямокишечных сосудов.
Восстановление толстой кишки осуществляют путём формирования
сигморектального анастомоза.
Сегментарная резекция сигмовидной кишки — резекция средней
части сигмовидной кишки с перевязкой сигмовидных сосудов и
формированием анастомоза.
Левосторонняя гемиколэктомия предусматривает удаление левой
половины ободочной кишки (сигмовидной, нисходящей и дисталь-
ной половины поперечной ободочной кишки) с перевязкой и
пересечением нижних брыжеечных сосудов и формированием трансвер-
зоректального анастомоза.
Резекция поперечной ободочной кишки предполагает перевязку и
пересечение средней ободочной артерии у её основания и
формирование анастомоза.
Правосторонняя гемиколэктомия заключается в удалении слепой
кишки с дистальной частью подвздошной кишки (10—15 см),
восходящей ободочной и проксимальной трети поперечной ободочной
кишки с перевязкой и пересечением подвздошно-ободочных
сосудов, правой ободочной артерии и правой ветви средней ободочной
артерии. Восстановление кишечной непрерывности осуществляют
путём формирования илео-трансверзоанастомоза.
Субтотальная резекция ободочной кишки — удаление всей
ободочной кишки, за исключением самой дистальной части сигмовидной
кишки, с формированием илео-сигмоидного анастомоза. При этом
пересекают все основные сосуды, питающие ободочную кишку.
При поражении лимфатических узлов следует выполнять
расширенные объёмы резекции. Так, при раке сигмовидной кишки любой
локализации в этих случаях показана левосторонняя гемиколэктомия
с перевязкой нижнебрыжеечных артерии и вен и формированием
трансверзоректального анастомоза. При раке нисходящего отдела или
левого изгиба показана дистальная субтотальная резекция ободочной
кишки с перевязкой ствола не только нижнебрыжеечных сосудов, но
и средней ободочной артерии с дальнейшим формированием асцен-
доректального анастомоза. При такой же ситуации, но при
правосторонней локализации опухоли показана проксимальная субтотальная
резекция ободочной кишки с перевязкой подвздошно-ободочной,
правой ободочной и средней ободочной артерии и формирование
илео-сигмоидного анастомоза. При локализации опухоли в средней
1И
Рак толстой кишки ♦ 529
трети поперечной ободочной кишки и наличии лимфогенных
метастазов объём резекции должен колебаться от субтотальной резекции
до колэктомии с илеоректальным анастомозом. Если опухоль
расположена в правом или левом изгибе ободочной кишки, выполняют
соответственно типичную право- или левостороннюю гемиколэк-
томию. При поражении лимфатических узлов показана
соответственно проксимальная или дистальная субтотальная резекция
ободочной кишки.
При прорастании опухоли ободочной кишки в соседние органы
(мочевой пузырь, тонкую кишку, желудок и т.д.) следует применять
комбинированные операции. Современная техника операции,
особенности анестезии и интенсивной терапии позволяют выполнять
одновременно резекции любого органа брюшной полости и забрю-
шинного пространства. Использование интраоперационного УЗИ
способствует лучшему дифференцированию истинного прорастания
опухоли от перифокального воспаления расположенных рядом органов.
В последние годы наряду с резекцией кишки всё шире применяют
удаление отдалённых метастазов, в частности различные по объёму и
технике резекции печени (так называемая полная циторедукция).
Паллиативные резекции (неполную циторедукцию) также следует
применять при отсутствии противопоказаний, стараясь по
возможности избегать симптоматического хирургического вмешательства
(формирования колостом или обходных анастомозов).
Резекции ободочной кишки следует заканчивать формированием
анастомоза с восстановлением естественного кишечного пассажа. Это
возможно при соблюдении следующих условий: хорошая подготовка
кишки, хорошее кровоснабжение анастомозируемых отделов,
отсутствие натяжения кишки в зоне предполагаемого анастомоза.
При формировании анастомоза наибольшее распространение
получил двухрядный узловой шов атравматической иглой. Возможно
также использование и других вариантов: механический скрепочный
шов, механический шов из рассасывающегося материала или
металлом с памятью формы, однорядный ручной шов и др. Если нет
уверенности в надёжности толстокишечного анастомоза, следует
формировать проксимальную колостому.
При осложнениях опухоли во время срочных операций на
неподготовленной кишке предпочтение следует отдавать многоэтапному
лечению. На первом этапе целесообразно не только устранить
возникшие осложнения, но и удалить саму опухоль, на втором — восстановить
естественный кишечный пассаж. К таким способам хирургического
О ♦ Хирургические болезни
Часть II ♦ Глава
'ис. 21-3. Брюшнопромежностная экстирпация прямой кишки с формиро
ванием плоской колостомы.
лечения относят операцию фон Микулич-Радецкого с
формированием двуствольной колостомы и операцию Гартмана —
формирование одноствольной колостомы и ушивание дистального отрезка
толстой кишки наглухо. Восстановление естественного кишечного пас
сажа производят через 2-6 мес по нормализации состояния больных
Рак толстой кишки О- 531
Хирургическое лечение рака прямой кишки
Характер операции определяется, главным образом,
локализацией опухоли (рис. 21-2). При расположении опухоли в нижнеампуляр-
ном отделе прямой кишки выполняют брюшно-промежностную
экстирпацию прямой кишки с выведением колостомы (рис. 21-3). При
этом полностью убирают параректальную клетчатку, пересекают
мышцу, поднимающую задний проход, и убирают клетчатку малого
таза. В левой подвздошной области формируют забрюшинную
плоскую колостому.
При расположении опухоли на расстоянии 7—10 см от края
заднего прохода целесообразна брюшно-анальная резекция прямой
кишки (рис. 21-4), которую выполняют двумя бригадами хирургов —
брюшной и промежностной (так же как и экстирпацию). Промежно-
стная бригада хирургов трансанальным доступом циркулярно
рассекает все слои кишечной стенки сразу за верхней границей анального
канала до соединения с абдоминальной бригадой хирургов.
Операцию заканчивают одним из трёх способов: 1) формированием колоа-
нального анастомоза ручным швом; 2) низведением ободочной
кишки в анальный канал с избытком и созданием бесшовного адгезивного
анастомоза; 3) отказом от низведения кишки с наложением
временной концевой колостомы. Выбор способа окончания брюшно-аналь-
ной резекции определяют состоянием больного, выраженностью пе-
Рис. 21-4, Брюшноанальная резекция прямой кишки с колоанальным анас
томозом.
532 ♦ Хирургические болезни ♦ Том 1 О Часть II ♦ Глава 21
рифокального воспаления, наличием осложнений опухоли,
например нарушением кишечной проходимости.
При расположении опухоли выше 10 см от наружного края
анального канала применяют переднюю резекцию прямой кишки с
формированием ручного или аппаратного сигморектального анастомоза.
Благодаря развитию хирургической техники и созданию нового
поколения сшивающих аппаратов, стало возможным выполнение
низких передних резекций при локализации опухоли ниже 10 см от
ануса. Эта сравнительно новая операция ещё недостаточно широко
внедрена в практическое здравоохранение, прежде всего из-за
сложности её выполнения.
При обнаружении небольших опухолей прямой кишки, не
прорастающих мышечные слои, можно использовать органосберегаюшие
операции. В частности, трансанальное эндомикрохирургическое
иссечение новообразований в случае расположения опухоли в стадии
Tis-T2N0M0, выше зубчатой линии до 10—12 см от края анального
отверстия. Операцию выполняют с помощью специального
операционного ректоскопа с оптической насадкой и микрохирургического
инструментария, позволяющего иссечь опухоль в пределах здоровых
тканей и восстановить целостность стенки кишки.
Трансанальная резекция нижнеампулярного отдела прямой кишки
позволяет не прибегать к абдоминальному доступу при наличии вы-
сокодифференцированного рака прямой кишки менее 3 см в
диаметре в стадии T1-2N0M0, располагающегося в пределах 3 см прокси-
мальнее зубчатой линии.
В случае высокодифференцированной аденокарциномы в стадии
T1-2N0M0 диаметром не более 3 см с расположением дистального
края выше зубчатой линии альтернативным подходом может
служить выполнение секторальной резекции прямой кишки и
анального канала.
При раке прямой кишки широкое распространение получают
расширенные и комбинированные операции вплоть до эвисцерации
таза. Задача колопроктологов состоит в разработке способов
восстановления уретрального мочеиспускания и промежностной
дефекации у подобных больных. Предложено несколько пластических
операций, но об их функциональных возможностях судить ещё рано.
Изложенные принципы хирургического лечения рака толстой
кишки должны обязательно соблюдаться и при применении новых
хирургических технологий. Прежде всего, имеются в виду
лапароскопические операции, внедрение новых методов рассечения тканой
Рак толстой кишки ♦ 533
(ультрасижен, лига-шу, куза, сонатом и т.п.), компьютерные
сшивающие аппараты, компьютерные удерживающие устройства и т.п.
Послеоперационное ведение и исход
В послеоперационном периоде крайне важно:
• осуществлять профилактику тромбоэмболических осложнений;
• быстро нормализовать пассаж по ЖКТ;
• обеспечить контроль заживления анастомоза (при
необходимости — рентгенологический);
• проводить профилактику воспалительных осложнений.
Исход операции во многом определяется адекватностью
анестезиологического обеспечения и интенсивной терапии в первые сутки
после хирургического вмешательства.
Дальнейшее лечение больного раком толстой кишки должно быть
согласовано с радиологом и химиотерапевтом.
ло-
ХРОНИЧЕСКИЕ
ВОСПАЛИТЕЛЬНЫЕ
ВАНИЯ КИШЕЧНИКА
В группу хронических воспалительных заболеваний входят
болезни кишечника, этиология которых не вполне ясна. Считают, что в их
развитии важная роль принадлежит аутоиммунной агрессии.
Наиболее распространены язвенный колит и болезнь Крона.
Неспецифический язвенный колит
Неспецифический язвенный колит — хроническое заболевание
толстой кишки, характеризующееся геморрагически-гнойным
воспалением слизистой оболочки и подслизистого слоя.
Эпидемиология
Наибольшее число случаев заболевания приходится на возраст 20-
40 лет и старшую возрастную группу — старше 60 лет.
Распространённость язвенного колита в различных странах отличается большим
разнообразием и колеблется от 28 до 117 на 100000 населения. Более
часто наблюдается в индустриально развитых странах, особенно в
США, а также в Норвегии и Дании. Для России достоверных
статистических данных пока нет, но клиническая практика указывает на
прогрессивное увеличение распространённости этого заболевания.
Этиология
Точная этиология язвенного колита к настоящему времени
неизвестна. Обсуждаются три основных концепции.
• Первая — воздействие некоторых экзогенных факторов окружающей
среды, которые пока не установлены. При наличии генетической
предрасположенности организма воздействие одного или
нескольких «пусковых» (триггерных) факторов запускает каскад
механизмов, направленных против собственных антигенов. Аналогичная
модель характерна для других аутоиммунных заболеваний.
• Вторая — заболевание обусловлено дисбалансом иммунной
системы ЖКТ. На этом фоне воздействие разнообразных неблагоприят-
ных факторов приводит к чрезмерному воспалительному ответу
вследствие наследственных или приобретённых нарушений в
механизмах регуляции иммунной системы.
• Третья — в качестве основной причины рассматривают инфекции,
главный агент которых пока также не установлен.
Патогенез
В развитии воспаления при язвенном колите задействованы
многочисленные механизмы тканевого и клеточного повреждения.
Бактериальные и тканевые антигены вызывают стимуляцию Т- и В-лим-
фоцитов. Дефицит иммуноглобулинов способствует проникновению
микробов и компенсаторной стимуляции В-клеток с образованием
иммуноглобулинов М и G. Усиленный их синтез сопровождается
образованием иммунных комплексов и активацией системы
комплемента, который обладает цитотоксическим действием, стимулирует
хемотаксис нейтрофилов и фагоцитов с последующим выделением
медиаторов воспаления, которые и вызывают деструкцию
эпителиальных клеток.
Важную роль в патогенезе язвенного колита отводят нарушению
барьерной функции слизистой оболочки кишечника и её
способности к восстановлению. Считают, что через дефекты слизистой
оболочки в более глубокие ткани кишки могут проникать разнообразные
пищевые и бактериальные агенты, запускающие каскад воспалительных
и иммунных реакций.
Патоморфология
Язвенный колит поражает всю толстую кишку. Интенсивность
воспаления в разных её сегментах может быть различной, постепенно
переходя в нормальную слизистую оболочку, без чёткой границы.
Вместе с тем, прямая кишка всегда вовлечена в патологический
процесс, имеющий диффузный непрерывный характер. В острой стадии
язвенного колита выявляют экссудативный отёк и полнокровие
слизистой оболочки с утолщением и сглаженностью складок. По мере
развития процесса или перехода его в хронический нарастает
деструкция слизистой оболочки и образуются изъязвления,
проникающие лишь до подслизистого или, реже, мышечного слоя. Мышечная
оболочка обычно не вовлекается в воспалительный процесс. При
тяжёлом хроническом течении язвенного колита кишка укорочена, просвет
536 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 22
её сужен, отсутствуют гаустры, характерно наличие псевдополипов
(воспалительной природы). Они представляют собой островки
слизистой оболочки, сохранившейся при её разрушении, или же
конгломерат, образовавшийся вследствие избыточной регенерации
железистого эпителия.
При гистологическом исследовании в фазе обострения
язвенного колита в слизистой оболочке находят расширение капилляров и
геморрагии, образование язв в результате некроза эпителия,
формирование крипт-абсцессов. Наблюдают уменьшение количества
бокаловидных клеток, инфильтрацию lamina propria лимфоцитами,
плазматическими клетками, нейтрофилами и эозинофилами. В подсли-
зистом слое изменения выражены незначительно.
Клинические проявления
Для язвенного колита характерны местные симптомы, главным
из которых являются кишечные кровотечения и диарея. К ним
присоединяются боли в животе, тенезмы и иногда запоры, а также
общие проявления токсемии — лихорадка, снижение массы тела,
тошнота, рвота, слабость и др. Интенсивность симптомов язвенного
колита коррелирует с протяжённостью патологического процесса по
кишке и тяжестью воспалительных изменений.
В клинической картине больных проктитом и проктосигмоиди-
том очень часто манифестирует не диарея, а запор и ложные позывы
к дефекации с выделением свежей крови, слизи и гноя, тенезмы. Если
через воспалённые дистальные отделы толстой кишки транзит
кишечного содержимого ускорен, то в проксимальных сегментах
наблюдается стаз. С этим патофизиологическим механизмом связывают
запор при дистальном колите. Пациенты могут длительное время не
замечать примеси крови в кале, общее состояние страдает мало,
трудоспособность сохраняется. Этот латентный период с момента
возникновения язвенного колита до установления диагноза может быть
очень длительным — иногда составляет несколько лет. При
обострении средней тяжести отмечаются учащённый стул (до 5—6 раз в
сутки) с постоянной примесью крови, схваткообразные боли в животе,
субфебрильная температура тела, быстрая утомляемость. У ряда
больных возникают внекишечные симптомы — артрит, узловатая
эритема, увеит и др. Для тяжёлого тотального поражения толстой кишки
характерны профузная диарея с примесью значительного количества
рови в каловых массах, иногда выделение крови сгустками; схват-
Хронические воспалительные заболевания кишечника ♦ 537
кообразные боли в животе перед актом дефекации, анемия,
симптомы интоксикации (лихорадка, уменьшение массы тела, выраженная
общая слабость). При этом варианте язвенного колита могут
развиваться осложнения, угрожающие жизни, — токсический мегаколон,
перфорация толстой кишки и массивное кишечное кровотечение.
Особенно неблагоприятное течение язвенного колита наблюдают у
больных с молниеносной формой язвенного колита. Среднетяжёлые
атаки язвенного колита в большинстве случаев успешно поддаются
консервативной терапии современными противовоспалительными
средствами, в первую очередь глюкокортикоидами. Летальность при
тяжёлой форме язвенного колита в течение первых 5 лет достигает
40%, половина этих случаев приходится на период первой атаки.
Классификация
Протяжённость поражения:
• дистальный колит (проктит или проктосигмоидит);
• левосторонний колит (поражение ободочной кишки до правого из
гиба);
• тотальный колит (поражение всей ободочной кишки, иногда с тер
минальным отделом подвздошной кишки).
Тяжесть течения заболевания:
• лёгкое;
• средней тяжести;
• тяжёлое.
Форма заболевания:
• острая (первая атака);
• молниеносная (как правило, с летальным исходом);
• хроническая рецидивирующая (с обострениями, чаще сезонного ха
рактера);
• непрерывная (обострение более 6 мес при адекватном лечении),
Фаза болезни:
• обострение;
• ремиссия.
Осложнения:
• острая токсическая дилатация толстой кишки;
• перфорация толстой кишки;
• массивное кишечное кровотечение;
• рак толстой кишки.
538 <> Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 22
Диагностика
Диагноз язвенного колита формулируют с учётом характера течения
(рецидивирования) заболевания, распространённости процесса,
степени тяжести заболевания и фазы болезни с указанием местных и
системных осложнений. Например: язвенный колит, тотальное
поражение, хроническое рецидивирующее течение средней степени тяжести.
К моменту установления диагноза приблизительно у 20%
пациентов выявляют тотальный колит, у 30—40% — левостороннее
поражение, у 40—50% — проктит или проктосигмоидит.
В настоящее время для оценки тяжести атаки язвенного колита
обычно пользуются критериями, представленными в табл. 22-1.
Таблица 22-1. Критерии тяжести язвенного колита
Показатель
Частота стула
в сутки
Примесь
крови в стуле
Температура, °С
Пульс
Уровень
гемоглобина
СОЭ, мм/ч
Результаты
рентгенологического
исследования
Клинические
симптомы
Лёгкая форма
<4
Периодически
Нормальная
Нормальный
Нормальный
<30
Специфичные
изменения
не выявляются
Не выражены
Тяжёлая форма
>6
Часто
>37,5
>90
<75% нормы
>30
Газ, отёчность
стенки,
«пальцевые вдавления»
Болезненность
при пальпации
живота
Молниеносная
форма
>10
Постоянно
>37,5
>100
<60% нормы
>30
Дилатация
Вздутие живота
и болезненность
Критерии обострения средней тяжести занимают промежуточное
положение между показателями, характеризующими тяжёлые и
лёгкие формы язвенного колита.
Осложнения
Осложнения язвенного колита можно условно разделить на два ви
да — местные и системные.
Хронические воспалительные заболевания кишечника ♦ 539
■ Местные осложнения
Местные осложнения включают острую токсическую дилатацию
толстой кишки (или токсический метаколон), перфорацию толстой
кишки, массивные кишечные кровотечения, рак толстой кишки.
Острая токсическая дилатация толстой кишки — одно из самых
опасных осложнений язвенного колита. Она развивается вследствие
тяжёлого язвенно-некротического процесса в стенке кишки и
связанного с ним токсикоза. Характеризуется расширением сегмента или
всей поражённой кишки во время тяжёлой атаки язвенного колита.
Больные с токсической дилатацией толстой кишки на начальных
стадиях нуждаются в интенсивной консервативной терапии. При её
неэффективности выполняют оперативное вмешательство.
Перфорация толстой кишки — наиболее частая причина смерти при
молниеносной форме язвенного колита, особенно при развитии
острой токсической дилатации. Вследствие обширного
язвенно-некротического процесса стенка толстой кишки истончается, теряет свои
барьерные функции и становится проницаемой для разнообразных
токсических продуктов, находящихся в просвете кишки. Помимо
растяжения кишечной стенки, решающую роль в возникновении
перфорации играют нарушения микроциркуляции и размножение
бактериальной флоры, особенно кишечной палочки с патогенными свойствами.
Массивные кишечные кровотечения встречаются сравнительно
редко. У большинства больных адекватная противовоспалительная и гемоста-
тическая терапия позволяет избежать операции. Хирургическое
вмешательство показано лишь при продолжающемся массивном кровотечении.
Риск развития рака толстой кишки резко возрастает при
длительности заболевания свыше 10 лет, а также в тех случаях, когда
язвенный колит начался в возрасте моложе 18 лет, особенно до 10 лет.
Системные осложнения
Системные осложнения язвенного колита иначе называют внеки-
шечными проявлениями. У больных могут встречаться поражения
печени, слизистой оболочки полости рта, кожи, суставов. Точный ге-
нез внекишечных проявлений до конца не изучен. В их формировании
участвуют чужеродные, в том числе токсические агенты,
поступающие в организм из просвета кишки, и иммунные механизмы.
Узловатая эритема встречается не только как реакция на приём
сульфасалазина, но наблюдается у 2—4% пациентов с язвенным
колитом и вне связи с приёмом препарата.
540 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 22
Гангренозная пиодермия — достаточно редкое осложнение возни
кает у 1-2% пациентов.
Эписклерит встречается у 5—8% больных с обострением неспеце-
фического язвенного колита, острая артропатия — у 10—15%. Артро-
патия проявляется асимметричным поражением крупных суставов.
Анкилозирующий спондилит выявляется у 1—2% пациентов.
Поражения печени наблюдают у 30% больных язвенным колитом
и болезнью Крона, они проявляются у большинства либо транзитор-
ным повышением активности трансаминаз в крови, либо гепатоме-
галией. Самым характерным серьёзным гепатобилиарным
заболеванием при язвенном колите является первичный склерозируюший
холангит, представляющий собой хроническое стенозирующее
воспаление внутри- и внепечёночных жёлчных протоков. Он
встречается приблизительно у 3% больных язвенным колитом.
•
иагностика
Диагноз язвенного колита устанавливают на основании оценки
клинической картины болезни, данных эндоскопического и рентге
нологического методов исследования.
Эндоскопическая картина
По эндоскопической картине выделяют четыре степени активно
сти воспаления.
• I степень (минимальная) характеризуется отёком слизистой
оболочки, гиперемией, отсутствием сосудистого рисунка, лёгкой
контактной кровоточивостью, мелкоточечными геморрагиями.
• И степень (умеренная) — наряду с отёком, гиперемией,
зернистостью, контактной кровоточивостью отмечают наличие эрозий,
сливных геморрагии, фибринозного налёта на стенках кишки.
• III степень (выраженная) характеризуется появлением
множественных сливающихся эрозий и язв на фоне вышеописанных
изменений в слизистой оболочке. В просвете кишки — гной и кровь.
• IV степень (резко выраженная) — кроме перечисленных,
изменений находят формирование псевдополипов и кровоточащих
грануляций.
В стадии ремиссии слизистая оболочка утолщена, сосудистый
рисунок восстановлен, но не полностью, и несколько перестроен. Могут
сохраняться зернистость слизистой оболочки, утолщённые складки,
Хронические воспалительные заболевания кишечника <>■ 541
Ирригография
При ирригографии для активной стадии процесса характерны
следующие рентгенологические признаки: отсутствие гаустр,
сглаженность контуров, изъязвления, отёк, зубчатость, двойной контур, псев-
дополипоз, перестройка по продольному типу складок слизистой
оболочки, наличие свободной слизи. При длительно текущем
язвенном колите из-за отёка может развиться утолщение слизистой и под-
слизистой оболочек. После опорожнения толстой кишки от
сульфата бария выявляют отсутствие гаустр, преимущественно продольные
и грубые поперечные складки, язвы и воспалительные полипы.
Рентгенологическое исследование имеет большое значение не
только в диагностике самого заболевания, но и его осложнений, в
частности острой токсической дилатации толстой кишки. С этой
целью выполняют обзорную рентгенографию брюшной полости.
Дифференциальная диагностика
Клиническая картина язвенного колита требует проведения
дифференциальной диагностики с большим числом заболеваний толстой
кишки инфекционной и неинфекционной этиологии. Первая атака
болезни может протекать под маской острой дизентерии.
Правильной диагностике помогают данные ректороманоскопии и
бактериологического исследования.
Сальмонеллёз нередко симулирует картину язвенного колита, так
как протекает с диареей и лихорадкой, но в отличие от него кровавая
диарея появляется только на 2-й неделе болезни. Из других форм
колита инфекционного генеза, требующих дифференциации от
язвенного колита, следует отметить гонорейный проктит, псевдомембра-
нозный энтероколит, вирусные заболевания. Наиболее сложна
дифференциальная диагностика между язвенным колитом, болезнью
Крона и ишемическим колитом. Ниже приводятся основные
отличительные признаки этих заболеваний (табл. 22-2).
Лечение
Лечебная тактика при неспецифическом язвенном колите
определяется локализацией патологического процесса в толстой кишке,
его протяжённостью, тяжестью атаки, наличием местных и/или
системных осложнений. Консервативная терапия язвенного колита
направлена на быстрое купирование атаки, предупреждение рецидива
542 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 22
Болезнь Крона
Язвенный колит
Ишемическая болезнь
толстой кишки
— ■——
Признаки
Постепенное
Часто постепенное
Острое
Начало
Меньше 5%
Меньше 10%
80%
Возраст 50 лет и старше
Нехарактерны
Регулярные
Единичные
Кровотечения
из прямой кишки
Характерно
Нехарактерно
Характерно
Формирование стриктур
Редки
Редки
Характерны
Сопутствующие
заболевания
сердечнососудистой системы
Хроническое
Хроническое, реже острое
Быстро меняющееся
Течение заболевания
Характерна
Нехарактерна
Характерна
Сегментарность
поражения
Терминальный илеит,
правая половина толстой
кишки, тотальный колит
Прямая кишка, в ряде
случаев поражение более
проксимальных сегментов
толстой кишки
Левый изгиб, нисходящая
кишка, сигмовидная кишка,
поперечная ободочная
кишка
Характерная
локализация
Нехарактерны
Очень редки
Характерны
«Пальцевые вдавливания»
на рентгенограммах
Саркоидные гранулёмы
Крипт-абсцессы
Макрофаги, содержащие
гемосидерин
Гистологические
проявления
Хронические воспалительные заболевания кишечника О- 543
заболевания и прогрессирования процесса. Дистальные формы
язвенного колита — проктит или проктосигмоидит — характеризуются
более лёгким течением, поэтому чаще всего лечатся амбулаторно.
Больных с левосторонним и тотальным поражением, как правило,
лечат в стационаре, так как течение заболевания у них отличается
выраженностью клинической симптоматики и большими
органическими изменениями.
Пища больных должна быть калорийной и включать продукты,
богатые белками, витаминами, с ограничением жиров животного
происхождения и исключением грубой растительной клетчатки. Из
рациона исключают сырые овощи и фрукты, поскольку они
способствуют развитию диареи. Нередко у больных отмечают лактазную
недостаточность, поэтому молочные продукты добавляют лишь при их
хорошей переносимости. Эти рекомендации соответствуют диетам
4, 4Б, 4В Института питания РАМН.
Лекарственная терапия
Базисная терапия язвенного колита включает противовоспали
тельные препараты, содержащие 5-аминосалициловую кислоту (суль-
фасалазин, месалазин); глюкокортикоиды и иммунодепрессанты.
Для того чтобы сохранить противовоспалительную активность,
присущую сульфасалазину, и в то же время избежать побочных эффектов,
связанных с сульфапиридиновым компонентом, в последние годы
разработаны препараты, содержащие «чистую» 5-аминосалициловую
кислоту. В качестве примера нового поколения аминосалицилатов можно
привести препарат месалазин. Препарат выпускается в трёх
лекарственных формах — таблетках, суппозиториях и микроклизмах. В таблетках
месалазин защищен от контакта с желудочным содержимым с
помощью специальной кислотоустойчивой полимерной оболочки, которая
растворяется при показателях рН выше 6,5. Именно такие лшчения
рН, как правило, регистрируются в просвете подвздошной кишки. В
подвздошной и толстой кишках после растворения оболочки создаётся
высокая концентрация активного противовоспалительного
компонента (месалазина). Выбор конкретной лекарственной формы месалазина
определяется протяжённостью зоны воспаления в толстой кишке. При
проктите целесообразно применение суппозиториев, при
левостороннем поражении — микроклизм, а при тотальном колите — таблеток.
Суточная доза аминосалицилатов определяется тяжестью атаки
язвенного колита и характером клинического ответа на приём пре-
544 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II -О- Глава 22
парата. Для купирования острой и среднетяжелой атак заболевания
обычно назначают 3—4 г сульфасалазина или 1,5—2 г месалазина в
сутки, разделённых на 3—4 приёма. При отсутствии хорошего
клинического ответа суточная доза месалазина может быть удвоена, однако
увеличить суточную дозу сульфасалазина свыше 4 г обычно не удаётся
из-за развития выраженных побочных эффектов.
Помимо лечебного воздействия, сульфасалазин блокирует
конъюгацию фолиевой кислоты в щёточной кайме тощей кишки,
тормозит транспорт этого витамина, угнетает активность связанных с ним
ферментативных систем в печени. Поэтому в лечебный комплекс
больных, получающих этот препарат, необходимо включать фолие-
вую кислоту в дозе 0,002 г 3 раза в сутки.
Для купирования атаки язвенного колита обычно требуется 3-
6 нед. После этого проводят противорецидивное лечение сульфаса-
лазином (2 г в сутки) или месалазином (1,5 г в сутки). При
использовании аминосалицилатов удаётся добиться ремиссии в 75-80%
случаев язвенного колита.
Наиболее эффективными противовоспалительными средствами в
лечении язвенного колита остаются стероидные гормоны, которые
при тяжёлых формах заболевания превосходят по активности ами-
носалицилаты. Глюкокортикоиды накапливаются в воспалительной
ткани и блокируют освобождение арахидоновой кислоты,
предотвращая образование простагландинов и лейкотриенов,
обусловливающих воспалительный процесс. Блокируя хемотаксис, стероидные
гормоны опосредованно проявляют иммуномодулирующее действие.
Влияние на тканевой фибринолиз приводит к уменьшению
кровоточивости. Показанием для проведения стероидной терапии являются
острые тяжёлые и среднетяжёлые формы заболевания, а также
наличие внекишечных осложнений.
При хорошей переносимости гормональных препаратов
назначенную дозу (гидрокортизон 250—500 мг/сут, преднизолон 1,0-
1,5 мг/кг/сут) рекомендуют принимать до получения стойкого
положительного результата — в течение 6—8 нед. После этого проводят
снижение по так называемой «быстрой ступенчатой» схеме: на 10 мг
каждые 3-5 дней. Начиная с 30—40 мг, рекомендуют однократный
приём преднизолона в утренние часы, что практически не вызывает
серьёзных осложнений. С этого момента в лечебную схему включают
месалазин или сульфасалазин, который следует принимать до
полной отмены гормонов. Начиная с 30 мг, отмену преднизолона
проводя! более медленно — по 5 мг в неделю в течение 2—2,5 мес. Таким
Хронические воспалительные заболевания кишечника О- 545
образом, полный курс гормональной терапии продолжается от 8 до 16
нед в зависимости от формы заболевания.
Проведение гормональной терапии сопряжено с развитием
побочных эффектов: задержка в тканях жидкости, хлоридов и натрия
(возможны отёки), артериальная гипертензия, гипокалиемия, потеря
кальция, остеопороз, различные вегетативные расстройства, нарушение
углеводного обмена, надпочечниковая недостаточность, язвы
желудка, желудочно-кишечное кровотечение. В этих случаях рекомендуют
назначение адекватной симтоматической терапии: гипотензивных
препаратов, диуретических средств, препаратов кальция, антацидных
средств. При нарушении углеводного обмена необходима диета с
ограничением углеводов, по показаниям назначают дробное введение
инсулина или пероральные противодиабетические лекарства. Для
профилактики развития тромбозов у больных с тяжёлыми формами
язвенного колита, получающих гормональное лечение, следует
проводить постоянный контроль свёртывающей системы крови и
одновременно назначать дезагреганты: дипиридамол и др.
Для лечения крайне тяжёлых форм заболевания, торпидных к
терапии глюкокортикоидами, в последнее время с успехом
применяют иммунодепрессант циклоспорин, который вводят внутривенно
(суточная доза 4 мг/кг). Широкое использование препарата
ограничивают его крайне высокая стоимость и значительное число
побочных эффектов.
При хроническом непрерывном течении язвенного колита и в
случаях гормональной зависимости целесообразно применение аза-
тиоприна (1,5—2,5 мг/кг/сут). Применение азатиоприна или мер-
каптопурина в этих клинических ситуациях позволяет добиться
положительного эффекта (наступление ремиссии, уменьшение дозы или
полная отмена глюкокортикоидов) почти у 60% пациентов.
Учитывая выраженные обменные нарушения и катаболическое
действие стероидных гормонов, целесообразно парентеральное
введение белковых препаратов: сывороточного альбумина, протеина плазмы,
незаменимых аминокислот. Для улучшения процессов
микроциркуляции и транскапиллярного обмена показано введение реополиглю-
кина, гемодеза. При анемии (гемоглобин 90 г/л и ниже), являющейся
признаком тяжёлой атаки язвенного колита, рекомендуют
проведение гемотрансфузии по 250 мл с интервалом в 3—4 дня. При
снижении уровня железа в сыворотке крови необходимо включение в
лечебный комплекс препаратов железа. Целесообразно рекомендовать
использование иммуномодуляторов в сочетании с базисным проти-
вовоспалительным лечением. Назначают витамины группы В, С, А,
D, К, которые также способствуют восстановлению эубиоза в
кишечнике. В лечебный комплекс включают психотропные средства в
обычных дозировках, ориентируясь на индивидуальную переносимость.
Стационарное лечение заканчивают при достижении клинико-
эндоскопической ремиссии, после чего больной подлежит
диспансерному наблюдению в поликлинике у гастроэнтеролога или коло-
проктолога.
Противорецидивное лечение
Вопрос о характере и длительности такого лечения пока остаётся
нерешённым. Согласно одной из точек зрения, противорецидивную
терапию следует проводить пожизненно, однако, учитывая высокую
стоимость препаратов и риск возникновения побочных эффектов при
их длительном применении, целесообразно придерживаться
следующей тактики. После купирования атаки язвенного колита
рекомендуют поддерживающую дозу аминосалицилатов (2 г сульфасалазина
или 1,5 г месалазина в сутки) на срок 6 мес. Если за этот период
времени не было отмечено клинических признаков обострения
заболевания, а при контрольном эндоскопическом исследовании через
полгода констатируется ремиссия, противорецидивное лечение можно
отменить. Если же во время курса противорецидивной терапии
состояние больного было нестабильным, что требовало увеличения дозы
аминосалицилатов для устранения симптомов обострения, а при
контрольной эндоскопии выявляются признаки активного воспаления,
противорецидивное лечение необходимо продлить ещё на полгода.
Больные с хроническим непрерывным течением заболевания
нуждаются в длительном непрерывном лечении, как правило, высокими
дозами аминосалицилатов, однако эта терапия не является в полном
смысле этого слова «противорецидивной». Это скорее сдерживающее
противовоспалительное лечение. У этой категории больных также
широко используют цитостатики (азатиоприн или меркаптопурин)
и интермиттирующие схемы приёма глюкокортикоидов.
Хирургическое лечение язвенного колита
Оперативные вмешательства при язвенном колите необходимы
лишь 10% пациентов. Хирургический метод может быть радикальным
В лечении язвенного колита, однако калечащий характер удаления
ТОЛСТОЙ кишки, а также успехи консервативной терапии заставляют
Хронические воспалительные заболевания кишечника ♦ 547
прибегать к операции по строгим показаниям, разделённым на три
основные группы: неэффективность консервативной терапии,
осложнения язвенного колита, рак на фоне язвенного колита.
Неэффективность консервативной терапии
У части больных прогрессирование воспалительных изменений не
удаётся предотвратить медикаментозными средствами, в том числе
гормональными (гормонорезистентная форма). Временным критерием
ожидания эффекта консервативной терапии являются 2—3 нед после
начала адекватной гормональной терапии. Выраженная интоксикация и
кровопотеря приводят к истощению больного, глубоким
метаболическим нарушениям, анемии, несут опасность развития септических
осложнений. В этом случае принимают решение о необходимости операции.
Гормональная зависимость, т.е. стабилизация состояния
больного только на высоких дозах стероидов и возникновение рецидива
заболевания при снижении их, влечёт развитие тяжёлых побочных
проявлений. Это обстоятельство также диктует необходимость операции,
которая позволяет отменить глюкокортикоиды.
Осложнения язвенного колита
Кровотечение. Потеря крови через прямую кишку при язвенном
колите обычно не бывает угрожающей. Однако в некоторых случаях
кровопотеря принимает жизнеопасный характер и вынуждает
принимать решение об операции, не дожидаясь эффекта от проводимой
консервативной терапии. В этом случае важно объективно оценить
количество крови, выделяемой больным с фекалиями, так как
визуальная оценка не только самого пациента, но и врача обычно бывает
неадекватна. Наиболее точным методом определения кровопотери
является радиоизотопное исследование, которое с помощью метки
эритроцитов больного изотопами хрома или технеция позволяет
ежедневно оценивать количество эритроцитов в каловых массах. При кро-
вопотере 100 мл в сутки и более показана срочная операция.
Токсическая дилатация толстой кишки возникает в результате
прекращения перистальтических сокращений кишечной стенки, что
приводит к накоплению в просвете кишечного содержимого и
расширению ободочной кишки до критического диаметра (11 — 15 см). Грозным
симптомом развития дилатации является внезапное урежение стула
на фоне диареи, вздутие живота, а также болевой синдром и
нарастание интоксикации. Простым, но информативным диагностическим
приёмом является динамическая обзорная рентгенография органов
брюшной полости, при которой отмечают увеличение пневматоза
ободочной кишки, расширение её до II (9-11 см) и III (11 —15 см) степеней.
При обнаружении I степени дилатации (6—9 см) проводят попытку
эндоскопической декомпрессии (эвакуация содержимого кишки через
колоноскоп). Сохранение 1 степени дилатации, а также её нарастание
являются показанием к экстренному оперативному вмешательству.
Перфорация толстой кишки обычно происходит на фоне
нарастающей токсической дилатации при отказе от своевременной
операции или на фоне некротических изменений стенки кишки при
тяжёлом трансмуральном поражении. Важно иметь в виду, что при
интенсивной гормональной терапии, введении антибиотиков,
спазмолитиков и анальгетиков у пациентов отсутствует классическая
картина «острого живота», поэтому своевременный диагноз поставить
бывает очень сложно. Вновь помогает рентгенологическое
обследование, при котором отмечают появление свободного газа в брюшной
полости. Успех операции напрямую зависит от своевременности
установления диагноза и длительности перитонита.
Рак на фоне язвенного колита
В популяции больных с язвенным колитом рак толстой кишки
встречается достоверно чаще, особенно при длительности
заболевания язвенным колитом более 10 лет. Неблагоприятными
особенностями подобного поражения являются злокачественные малодиффе-
ренцированные формы, множественное и быстрое метастазирование,
обширность поражения толстой кишки опухолью. При язвенном
колите встречается так называемая «тотальная» форма рака толстой
кишки, когда внутристеночный рост опухоли при гистологическом
исследовании находят во всех отделах, в то время как визуально кишка
может оставаться неизменённой. Основной метод вторичной
профилактики рака при язвенном колите — ежегодная диспансеризация
больных с множественной биопсией слизистой оболочки толстой
кишки, даже при отсутствии визуальных изменений.
вы бор хирургического вмешательства
Операцией выбора при хирургическом лечении язвенного колита
вляется субтотальная резекция ободочной кишки с формированием
илеостомы и сигмостомы (рис. 22-1). В этом случае проводят интенсив-
лечение сохранённого сегмента толстой кишки в послеоперацион-
Хронические воспалительные заболевания кишечника О 549
Рис. 22-1. Субтотальная
резекция ободочной кишки
(удаляемая часть кишки
заштрихована) с
формированием илио- и сигмостомы
при язвенном колите.
ном периоде — гормоны в микроклизмах
и свечах, месалазин местно, метронида-
зол, санация кишки антисептическими и
вяжущими растворами. Вариантом
резекции может быть колэктомия по типу
операции Гартмана, если, например,
перфорация произошла в дистальном отделе
сигмовидной кишки или сигмовидная
кишка явилась источником кровотечения.
В отдалённом послеоперационном
периоде в сроки от 6 мес до 2—3 лет решают
вопрос о втором этапе оперативного
лечения. При отсутствии рецидивов язвенного
колита в отключённой прямой кишке
выполняют формирование илеоректального
анастомоза. При развитии стриктуры
прямой кишки появляется необходимость в её
удалении — брюшно-анальной резекции
сохранённых отделов сигмовидной и
прямой кишок. Реконструктивный этап в этом случае может заключаться
либо в формировании резервуара из тонкой кишки либо в наложении
илеоанального анастомоза с превентивной илеостомой.
Превентивную илеостому закрывают после заживления анастомоза через 1-6 мес.
Одномоментную колэктомию с брюшно-анальной резекцией
прямой кишки применяют при массивном кишечном кровотечении,
когда источником кровопотери является прямая кишка.
Среднетяжёлое течение язвенного колита на фоне
удовлетворительного состояния больного также может быть поводом для
операции, если заболевание принимает гормонозависимую форму. В этом
случае возможно выполнение одномоментной операции с
реконструктивным этапом: колэктомия с формированием илеоректального
анастомоза либо колэктомия и брюшно-анальная резекция прямой
кишки с формированием илеорезервуара и наложением
илеоанального анастомоза с превентивной илеостомой.
При развитии рака ободочной кишки на фоне язвенного колита
также применяют колэктомию, комбинированную с
брюшно-анальной резекцией прямой кишки, а при локализации опухоли в прямой
кишке — колэктомию, комбинированную с брюшно-промежностной
экстирпацией прямой кишки. Операцию при раке обычно заверша
ют формированием постоянной одноствольной илеостомы.
550 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II -О Глава 22
Послеоперационные осложнения
Тяжёлое исходное состояние большинства больных перед
операцией сказывается на течении послеоперационного периода, развитии
послеоперационных осложнений (8-10%) и летальности (1,5-2%).
Осложнения (эвентрация, несостоятельность швов илеостомы)
часто связаны с плохой регенерацией тканей у ослабленных пациентов,
наблюдаются также серозный перитонит, экссудативный плеврит как
проявления полисерозита, абсцессы брюшной полости, дисфункция
илеостомы, пневмония. Особенно важна активная тактика хирурга
при осложнениях на фоне отсутствия резистентности у больного.
Прогноз после хирургического лечения
При своевременном выполнении операции, динамическом
наблюдении прогноз благоприятен. Необходимы ежегодный контроль в
случае сохранения прямой кишки, биопсия и мониторинг малигниза-
ции. Большинство пациентов длительно нетрудоспособны
(нуждаются в инвалидности).
■ ■ ■
Болезнь Крона
Болезнь Крона — хроническое рецидивирующее заболевание ЖКТ
неясной этиологии, характеризующееся трансмуральным
сегментарным распространением воспалительного процесса с развитием
местных и системных осложнений.
Эпидемиология
В последнее время в экономически развитых странах отмечается
рост заболеваемости болезнью Крона. Первично она выявляется у 2-
4 человек на 100000 жителей в год. Распространённость — 30—50
случаев на 100000 жителей.
Этиология и патогенез
В настоящее время нет единого взгляда на этиологию
заболевания. Продолжается дискуссия на тему — являются ли язвенный
колит и болезнь Кронадвумя самостоятельными нозологическими
формами или же это различные клинико-морфологическпс варианты
одного и того же заболевания. Большинство специалистов считают,
что язвенный колит и болезнь Крона обусловлены различными
этиологическими факторами, которые при воздействии на организм
человека «запускают» одни и те же универсальные патогенетические
механизмы аутоиммунного воспаления. Сторонники инфекционной
теории основную этиологическую роль при болезни Крона отводят
Mycobacterium paratuberculosis и вирусу кори. Сторонники вирусной
этиологии считают, что вирус кори способен вызывать сосудистые
нарушения в стенке кишечника, которые определяют своеобразие
клинической картины болезни Крона. Однако при болезни Крона с
помощью современных вирусологических исследований не удаётся
обнаружить вирус кори в тканях кишечника. Одним из аргументов в
пользу инфекционной этиологии заболевания является положитель
ный клинический эффект от терапии антибиотиками.
Патоморфология
Макроскопические изменения при болезни Крона любой
локализации имеют общий характер. При поражении толстой кишки её
длина изменяется не так заметно, как при язвенном колите.
Диаметр её не увеличен, а на отдельных участках можно обнаружить
сужение кишки. Серозная оболочка неравномерно полнокровная,
местами мутноватая, изредка в ней можно обнаружить мелкие округлые
бугорки (гранулёмы). В участках поражения локализуются
глубокие узкие язвы с ровными краями, напоминающие ножевые порезы.
Язвы обычно ориентированы вдоль и поперек оси кишки, имеют
ровные не подрытые края, сохранившиеся между ними участки отёчной
слизистой оболочки придают поверхности кишки сходство с
булыжной мостовой. Встречается сегментарное поражение толстой кишки
с сужением просвета протяжённостью от 5 до 15 см («чемоданная
ручка»), выше и ниже такого участка стенка кишки не изменена.
Иногда суженные участки имеют большую протяжённость и утолщённую
стенку, что придаёт им сходство со шлангом. Нередко такие участки
располагаются в тонкой кишке. Очень характерно наличие
нескольких участков поражения, разделённых неизменённой слизистой
оболочкой. В табл. 22-3 приведены
дифференциально-диагностические признаки макроскопических изменений при болезни Крона и
I язвенном колите.
Одним из существенных микроскопических отличий болезни
Крона от язвенного колита является распространение воспалительного
инфильтрата на все слои кишечной стенки (трансмуральный характер
552 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 22
Таблица 22-3. Макроскопические признаки болезни Крона и язвенного
колита
Язвенный колит
Поражение непрерывное
Прямая кишка поражена всегда
Анальные поражения в 25%
Тонкая кишка поражена в 10%
Крупные и мелкие язвы,
щелевидных язв нет
Полнокровие сосудов характерно
Серозная оболочка не изменена
Кишка укорочена, стриктуры
встречаются редко
Свищи отсутствуют
Воспалительные полипы
встречаются часто
Малигцизация наблюдается
при хроническом течении
Болезнь Крона
Поражение может прерываться
Прямая кишка поражена в 50% случаев
Анальные поражения в 75%
Тонкая кишка поражена в 30%
Язвы щелевидные, образуют
«булыжную мостовую»
Полнокровие сосудов нехарактерно
Серозит, спайки
Встречаются фиброзные стриктуры,
укорочение непостоянно
Кишечные или кожные свищи
в 10% случаев
Воспалительные полипы
встречаются редко
Малигнизация наблюдается редко
воспаления). При этом в большинстве случаев сохраняются
архитектоника крипт и обычное количество бокаловидных клеток.
Вместе с тем, в краях язв в слизистой оболочке строение крипт
нарушается, и бокаловидные клетки почти полностью исчезают, что придаёт
этим изменениям сходство с таковыми при язвенном колите. Другим
своеобразным отличительным признаком воспаления при болезни
Крона является неравномерная плотность инфильтрата собственной
пластинки слизистой оболочки: в окружности нескольких крипт
инфильтрат «густой», а рядом он отсутствует или выражен слабо. В
инфильтрате преобладают лимфоциты, в несколько меньшем количестве
определяются плазматические клетки, эозинофилы и сегментоядер-
ные лейкоциты единичные. Для болезни Крона характерно наличие
гранулём, однако они обнаруживаются при микроскопическом
исследовании сравнительно редко (даже в операционном материале менее
чем в 50% случаев). Гранулёмы при болезни Крона очень
напоминают гранулёмы при саркоидозе, поэтому их называют саркоидными.
Типичные гранулёмы располагаются изолированно и не образуют
Хронические воспалительные заболевания кишечника <0 553
крупных конгломератов. Они состоят из эпителиоидных и
гигантских клеток типа Пирогова—Лангханса, окружённых поясом из
лимфоцитов, не имеют чётких границ, вокруг них не образуется
фиброзный ободок, характерный для саркоидоза. В отличие от туберкулёзных
гранулём в них отсутствует творожистый некроз. При исследовании
биоптатов диагноз болезни Крона возможен лишь в 30% случаев, а
гранулёмы при этом обнаруживают только в 15%. Во многих случаях
обнаруживают лишь признаки неспецифического воспаления.
Клиническая симптоматика
Для болезни Крона характерно не только большое
морфологическое, но и клиническое разнообразие. Клинические проявления
широко варьируют в зависимости от локализации и протяжённости
поражения, стадии заболевания, наличия или отсутствия осложнений.
Это затрудняет создание классификации болезни Крона, основанной
на анализе клинических данных. Существующие классификации
характеризуют в основном локализацию воспалительного процесса в
ЖКТ, но не отражают многообразия клинического течения.
В России в повседневной клинической практике выделяют три
формы болезни Крона кишечника — энтерит, энтероколит и колит.
В большинстве случаев это даёт достаточное представление о
заболевании, облегчает выбор метода лечения и оценку прогноза.
Изолированное поражение тонкой кишки наблюдают в 25—30%
случаев болезни Крона, илеоколит — в 40—50%, изолированное
поражение толстой кишки — у 15—25% больных. При поражении
тонкой кишки терминальный отрезок подвздошной кишки вовлечён в
процесс почти у 90% больных. Почти у двух третей пациентов
отмечают вовлечение в процесс толстой кишки в той или иной степени.
Несмотря на то, что воспаление в прямой кишке выявляют не более
чем у 20% больных, аноректальные поражения (анальные трещины,
свищи, абсцессы и т.д.) встречаются гораздо чаще — до 40% случаев.
Чрезвычайно редко при болезни Крона поражаются пищевод,
желудок и двенадцатиперстная кишка — всего у 5% больных.
При болезни Крона могут поражаться любые участки ЖКТ — от
полости рта до ануса. Тем не менее, в подавляющем большинстве
случаев болезнь Крона вначале возникает в подвздошной кишке и затем
распространяется на другие отделы ЖКТ. Наиболее часто
поражается илеоцекальный отдел. Клиническая картина острых илеитов
имеет большое сходство с острым аппендицитом, в связи с чем больные
554 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 22
часто подвергаются лапаротомии. В клинической картине болезни
Крона можно выделить местные и общие симптомы, а также внеки
шечные проявления заболевания.
Местные симптомы
ни
;и-
Местные симптомы включают в себя боли в животе, диарею,
кровотечение и обусловлены поражением ЖКТ.
Боль в животе является классическим симптомом болезни Крона
и встречается у 90% больных. Так как чаще всего воспаление при
болезни Крона локализуется в терминальном отделе подвздошной
кишки, для этого заболевания характерна рецидивирующая боль в
нижнем правом квадранте живота, причём она может симулировать
картину острого аппендицита или непроходимости кишечника. В то
же время, у многих больных резкой боли может не быть, основным
проявлением болезни являются ощущение дискомфорта, тяжести в
животе, вздутия и умеренные по интенсивности схваткообразные
боли, усиливающиеся при нарушении диеты.
Диарея возникает у 90% больных, но обычно бывает менее
тяжёлой, чем при язвенном колите. При вовлечении в процесс только
тонкой кишки частота стула колеблется от 2 до 5 раз, а в случаях
энтероколитов — от 3 до 10 раз в сутки. Консистенция кала чаще
кашицеобразная, чем жидкая. Однако даже у тех больных, у которых
поражение ограничивается тонкой кишкой, стул может быть жидким
или водянистым. Тяжёлая диарея наблюдается у больных с
распространёнными поражениями, например при еюноилеитах.
Общие симптомы
Общие симптомы при болезни Крона возникают вследствие
воспалительного процесса в кишечнике или иммунопатологических
реакций. К ним относят лихорадку, общую слабость, уменьшение массы тела.
Повышение температуры тела при болезни Крона наблюдают
довольно часто и регистрируют при обострении заболевания у трети
больных. Лихорадка обычно связана с наличием гнойных процессов
(свищи, инфильтраты, абсцессы) или системных осложнений токси-
ко-аллергического характера.
Уменьшение массы тела при болезни Крона так же как при язвенном
колите, связано с недостаточным поступлением питательных веществ (и »-
за отсутствия аппетита и болей в животе), нарушением процесса их вса
сывания и усилением катаболизма. Основные нарушения обмена ве
Хронические воспалительные заболевания кишечника О- 555
ществ включают анемию, стеаторею, гипопротеинемию, гиповитаминоз,
гипокальциемию, гипомагниемию и дефицит других микроэлементов.
Поражение тонкой кишки приводит к развитию синдрома мальаб-
сорбции, иногда доминирующего в клинической картине болезни Крона.
Нарушение всасывания жёлчных солей в результате воспаления или
резекции сегмента тонкой кишки приводит к нарушениям в пуле жёлчных
кислот и формированию холестериновых конкрементов в жёлчном
пузыре. Жёлчные камни обнаруживают у 30% больных с локализацией
процесса в тонкой кишке. Стеаторея может способствовать повышенной
кишечной абсорбции оксалатов и приводить к образованию оксалатных
конкрементов в почках. Они выявляются у 10% больных с болезнью
Крона тонкой кишки. Нарушение всасывания витамина D и дефицит
кальция могут способствовать развитию остеопороза и остеомаляции.
Внекишечные проявления
Внекишечные проявления болезни Крона аналогичны таковым у
больных язвенным колитом. Атака болезни Крона может
сопровождаться развитием острой артропатии, сакроилеита, эписклерита и переднего
увеита, узловатой эритемы, гангренозной пиодермии. У 10% больных в
активной стадии болезни Крона в полости рта выявляют афтозные язвы.
Осложнения
Местные осложнения болезни Крона наблюдают довольно часто
в виде анальных и перианальных поражений (свищи прямой кишки,
абсцессы в параректальной клетчатке, анальные трещины), стриктур
различных отделов кишечника, инфильтратов и абсцессов в
брюшной полости, наружных и внутренних свищей. К осложнениям,
связанным с патологическим процессом в кишечнике, относят также
токсическую дилатацию толстой кишки, перфорацию, массивное
кишечное кровотечение и кишечную непроходимость. Осложнения
болезни Крона в основном обусловлены трансмуральным характером
поражения стенки кишки и анального канала.
Диагностика и дифференциальная диагностика
длч
Диагноз болезни Крона устанавливают на основании характерной
клинической картины заболевания, результатов эндоскопического,
рентгенологического и морфологического исследований.
556 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 22
Рентгенологическая диагностика
Рентгенологическая диагностика болезни Крона строится на на
личии прерывистого характера поражения кишечника, вовлечения в
процесс тонкой и толстой кишок, правосторонней локализации
процесса в ободочной кишке, образования глубоких язв-трещин,
внутренних свищей, ретроперитонеальных абсцессов с образованием
свищей и слепых синусов в случаях вовлечения в процесс тонкой кишки.
Ведущий рентгенологический симптом болезни Крона — сужение
поражённого участка кишки. Степень сужения прямо
пропорциональна давности заболевания. В отдельных случаях кишка суживается
неравномерно и эксцентрично. Гаустры в недалеко зашедших случаях
сглаживаются и принимают неправильную форму, при прогрессировании
процесса они исчезают совсем. Контуры поражённого участка кишки
чаще всего бывают мелко- или крупнозубчатые и лишь изредка ровные
и чёткие. Иногда на контуре кишки имеются весьма характерные для
болезни Крона остроконечные спикулоподобные выступы, которые
являются отражением поперечно расположенных и глубоко проникающих
в стенку кишки щелевидных изъязвлений — «фиссур». У некоторых
больных последние могут пенетрировать через серозный покров и
образовывать внутрибрюшные свищи. В ряде случаев язвы
распространяются в глубину стенки кишки и как бы «подмывают» её внутренний слой.
В рентгеновском изображении этот патологический процесс
обусловливает возникновение своеобразной картины в виде «шляпок гвоздей»,
располагающихся правильными рядами по контурам кишки. Кроме
сужения, наблюдают также укорочение отдельных отрезков толстой
кишки. При вовлечении в патологический процесс прямой кишки размеры
её значительно уменьшаются, изгибы сглаживаются, ретроректальное
пространство увеличивается. Весьма характерным для болезни Крона
считают чередование поражённых и нормальных фрагментов кишки.
Рентгенологические изменения слизистой оболочки при болезни
Крона характеризуются крупно- или мелкоячеистой структурой
внутренней поверхности кишки. На фоне перестроенного рельефа могут
обнаруживаться различные по величине стойкие контрастные
пятна — отражение язв и эрозий. При двойном контрастировании более
отчётливо определяются сужение поражённого участка кишки,
неровность его контуров, псевдодивертикулярные выпячивания,
ригидность стенок, резкая граница между поражёнными и нормальными
тканями. Если кишка раздувается умеренно, бывает отчётливо виден
рельеф внутренней её поверхности, который, как правило, имеет яме-
истую или пористую структуру. Большие псевдополипозные
разрастания на фоне воздуха дают картину пристеночно расположенных
дополнительных теней, иногда в виде цепочки.
Эндоскопическая картина
Эндоскопическая картина при болезни Крона характеризуется
наличием язв на фоне неизменённой слизистой оболочки. По мере про-
грессирования процесса язвы увеличиваются в размерах, принимают
линейную форму. Чередование островков сохранившейся слизистой
оболочки с глубокими продольными и поперечными
язвами-трещинами создаёт картину «булыжной мостовой».
Дифференциальная диагностика
Болезнь Крона приходится дифференцировать со многими забо
леваниями. Гранулематозное поражение тонкой кишки часто
диагностируют как аппендикулярный абсцесс или острый аппендицит, так
как дифференцировать их крайне трудно. Иногда невозможно
отличить болезнь Крона от воспаления дивертикула Меккеля и других
острых заболеваний брюшной полости. Болезнь Крона с локализацией
процесса в тонкой и правых отделах толстой кишок нелегко
отличить от туберкулёза кишечника, поскольку он может протекать без
поражения лёгких. Иногда злокачественная лимфома ошибочно
принимается за болезнь Крона. Не всегда можно быть уверенным в том,
что стриктуры тонкой кишки являются следствием только грануле-
матозных изменений. При локализации стриктуры в левом изгибе
ободочной кишки должно возникнуть подозрение на ишемический
характер поражения. Лихорадка, боли в суставах и даже узловатая
эритема могут доминировать в клинической картине воспалительного
заболевания кишечника и вызывать тем самым подозрение на коллаге-
новые болезни. Болезнь Уиппла, характеризующаяся лихорадкой,
болями в суставах, диареей, также требует дифференциации с
болезнью Крона. Если гранулематозный процесс локализуется только в
толстой кишке, его можно принять за туберкулёз слепой и
восходящей ободочной кишок, ишемическую стриктуру, рак и амебиаз.
Наиболее сложна дифференциальная диагностика болезни Крона
и язвенного колита, от которого она отличается отсутствием
поражения прямой кишки в половине случаев, более глубокими язвами
толстой кишки, асимметричностью и прерывистостью процесса и
тенденцией к формированию стриктур и свищей. К сожалению, в
558 <У Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 22
настоящее время нет клинических, эндоскопических или
гистологических критериев, которые бы однозначно указывали на наличие
язвенного колита или болезни Крона.
Лечение
До настоящего времени какого-либо специфического лечения
болезни Крона не разработано. Лечение сводится к подавлению активности
хронического воспалительного процесса с помощью антибиотиков,
иммуносупрессивных препаратов (глюкокортикоиды, азатиоприн, ме-
тотрексат), препаратов 5-аминосалициловой кислоты. В последние годы
при атаке болезни Крона успешно используют антибиотик ципрофлок-
сацин. По аналогии с метронидазолом его назначают длительно —
до 6 нед, в суточной дозе 1,0 г. Имеются сообщения о хорошем эффекте
сочетанного применения метронидазола (1,0 г) и ципрофлоксацина
(1,0 г) у больных с обострением болезни Крона. Эта комбинация более
эффективна в случаях колита и илеоколита, особенно осложнённых
формированием свищей различной локализации. При
изолированном поражении тонкой кишки она оказалась менее эффективной.
Характер и длительность поддерживающей противорецидивной
терапии при болезни Крона остаются до конца неясными, так как
клинические и эндоскопические признаки, свидетельствующие о
наличии активного воспалительного процесса в кишечнике, очень часто
не совпадают. Показана профилактическая эффективность
препаратов месалазина.
Хирургическое лечение болезни Крона
Хирургическое лечение болезни Крона в отличие от язвенного
колита не носит радикального характера, так как гранулематозное
воспаление может развиваться в любом отделе ЖКТ. Цель
хирургического лечения при болезни Крона — борьба с осложнениями, когда
этого невозможно достичь только медикаментозным лечением.
Более того, неоправданные повторные резекции кишки при болезни
Крона несут опасность развития синдрома «короткой кишки»,
нарушения процессов пищеварения.
Болезнь Крона тонкой кишки
Абсолютные показания к операции при болезни Крона тонкой
кишки — рубцовый стеноз и формирование наружных кишечных
свищей. Стеноз развивается вследствие воспаления сегмента гонкой
ой
кишки, трансформации воспаления в рубцовый процесс при
отсутствии эффекта от длительной медикаментозной терапии. Появление
супрастенотического расширения проксимальных отделов является
признаком декомпенсации сократительной способности кишечной
стенки и предвестником развития обтурационной тонкокишечной
непроходимости.
При болезни Крона тонкой кишки выполняют либо резекцию
поражённого отдела, либо стриктуропластику Применявшуюся ранее
операцию обходного анастомоза в настоящее время используют только при
стенозе двенадцатиперстной кишки. При резекции предпочтительны
анастомозы «конец в конец», а линия резекции может проходить в 2 см
от макроскопически определяемой границы поражения. Стриктуроп-
ластика ограниченных (до 3—4 см) Рубцовых поражений проводится без
вскрытия просвета тонкой кишки — рассечение рубца до слизистой
оболочки проводят в продольном направлении, а ушивание
образовавшегося дефекта — в поперечном. При более протяжённых стриктурах
выполняют рассечение всех слоев по одной из стенок кишки с наложением
в дальнейшем двухрядного шва по типу анастомоза в три четверти.
Наиболее распространённой формой болезни Крона тонкой кишки
является терминальный илеит, который часто развивается под маской
острого аппендицита и встречается хирургам экстренной помощи. При
выраженном воспалительном компоненте, местном перитоните, угрозе
перфорации, а также возможности развития кишечной
непроходимости выполняют резекцию поражённого сегмента тонкой кишки, а при
распространении очага поражения до баугиниевой заслонки —
резекцию илеоцекального отдела. Решение о возможности формирования
анастомоза принимают индивидуально на основании следующих
критериев: степени перифокального воспаления, выраженности
метаболических нарушений у больного, а также сведений о проведении
ранее иммуносупрессивной терапии, что отражается на регенерации
тканей в послеоперационном периоде. Сомнения должны склонить
хирурга в пользу формирования стом — илеостомы и асцендикостомы —
с последующей реконструктивной операцией в сроки от 2 до 6 мес.
Болезнь Крона толстой кишки
Болезнь Крона толстой кишки протекает в форме сегментарного
колита, тотального поражения (панколита), а также проктита с периа-
нальными поражениями (язвы, трещины, свищи, гнойные затёки).
Показанием к операции служит плохая переносимость или
неэффективность консервативной терапии с нарастанием интоксикации, раз-
560 О- Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 22
витием метаболических нарушений и септических осложнений.
Операция показана также при формировании свищей, абсцессов брюшной
полости, флегмон забрюшинного пространства вследствие разрушения
стенки толстой кишки на участке, расположенном соответственно инт-
раперитонеально, экстраперитонеально или при предлежании двух
сегментов кишки. Прогрессирование гнойных перианальных осложнений,
не поддающихся местной и системной медикаментозной терапии,
следует рассматривать как повод для хирургического вмешательства.
При неэффективности консервативной терапии, нарастании
интоксикации при панколите с перианальными поражениями
целесообразно первым этапом хирургического лечения наложить двуствольную
илеостому наиболее щадящим, лапароскопическим доступом. В
дальнейшем после стабилизации состояния больного возможна
сегментарная резекция либо колэктомия. В случае поражениия всей толстой
кишки производят колэктомию с брюшно-анальной резекцией прямой
кишки, если прямая кишка не вовлечена в процесс, её сохраняют, а
операцию заканчивают формированием илеоректального анастомоза.
При сегментарном поражении выполняют резекцию сегмента
толстой кишки по тем же правилам, что и резекцию тонкой кишки.
Наличие свищей и перифокального воспаления заставляет расчленять
оперативное лечение на два или более этапов, заканчивая первый
наложением стомы. Развитие перианальных осложнений и наличие
гнойных затёков диктуют необходимость наряду с вмешательством
со стороны промежности выполнить операцию отключения — сиг-
мостомию либо илеостомию, в зависимости от распространённости
поражения. Закрывают илео- или колостому, как правило, через 2-
12 мес. При перианальных осложнениях (свищах) без выраженного
воспалительного компонента с одновременной ремиссией процесса
в толстой кишке можно выполнить типичную операцию иссечения
свища без операции «отключения» при обязательном проведении
медикаментозной противорецидивной терапии.
При ограниченных сужениях толстой кишки обязательна интрао-
перационная биопсия с целью исключения злокачественного
поражения. Всё большее распространение при Рубцовых стенозах
получает стриктуропластика как органосохраняющая операция.
Необходимо отметить, что хирургическое лечение болезни Крона
представляет особенно трудную и нестандартную задачу, операции
часто проводятся в несколько этапов, а лечение занимает несколько
лет- Важным условием снижения частоты рецидивов после операции
является адекватная медикаментозная противорецидивная терапия.
НЕОПУХОЛЕВЫЕ
ЗАБОЛЕВАНИЯ ПРЯМОЙ КИШКИ
И ПЕРИАНАЛЬНОЙ ОБЛАСТИ
Геморрой
Геморрой — патологическое увеличение геморроидальных узлов,
расположенных в подслизистом слое дистальной части прямой
кишки. Геморроем страдают более 10% взрослого населения, а его
удельный вес среди болезней прямой кишки составляет около 40%.
Этиология
Геморроидальные узлы в норме представляют собой кавернозные
сосудистые образования, располагающиеся в подслизистом слое
прямой кишки над анальным каналом (внутренние геморроидальные
узлы). Наружные геморроидальные узлы, значительно меньшие по
размерам, располагаются в анальном канале над кожей промежности.
Причиной увеличения и последующего выпадения
геморроидальных узлов являются застой крови в геморроидальных кавернозных
сплетениях и ослабление связочного аппарата узлов,
удерживающего их в нормальной позиции (над аноректальной линией).
Нарушение кровообращения в геморроидальных узлах может быть
следствием ряда неблагоприятных факторов, таких как пожилой возраст,
малоподвижный образ жизни, длительные запоры, беременность,
злоупотребление алкоголем и др. Замедление кровообращения, в свою
очередь, может быть причиной дистрофических изменений
связочного аппарата узлов с нарастанием его слабости и потерей
удерживающей функции. Последнее обстоятельство и приводит к
необратимому выпадению геморроидальных узлов.
Клиническая симптоматика
Основным клиническим проявлением геморроя является
кровотечение из прямой кишки во время дефекации, отсюда и само название
заболевания. Второй важный симптом — выпадение
геморроидальных узлов, которое происходит сначала только при натуживании, а в
поздних стадиях заболевания — постоянно. Наряду с этим больные
562 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 23
нередко испытывают боли в заднем проходе, иногда внезапно прини
мающие острый характер.
Начавшись с малозначительных (по мнению заболевших)
предвестников — лёгкого зуда в заднем проходе, некоторого затруднения
при дефекации — заболевание постепенно принимает хронический
характер. Больные замечают, что в кале, особенно плотном, всё чаще
появляются прожилки алой крови, в некоторых случаях примесь алой
крови бывает довольно значительной. Выраженность и
периодичность кровотечений очень индивидуальна и зависит от многих
обстоятельств (особенностей питания, характера стула, степени
увеличения геморроидальных узлов и застоя в них крови и т.п.). В то же
время нередко приходится наблюдать больных геморроем с
выраженной хронической анемией. Боли при геморрое носят скорее характер
неприятных ощущений в заднем проходе, именно усиление их во
время дефекации нередко заставляет больных обращаться к врачам.
Хроническое течение заболевания, медленно, но неуклонно
прогрессируя, приводит ко всё более выраженной симптоматике. Всё
больше и чаще выпадают узлы, всё реже удаётся вправить их после
дефекации. Постепенно выпадение узлов происходит уже и без дефекации.
Наконец они перестают вправляться и мешают не только во время
дефекации, но и при ходьбе. Присоединяются постоянное мокнутие и
зуд в анальном канале. Могут учащаться кровотечения и воспаление.
В клиническом течении хронического геморроя принято
различать четыре стадии (рис. 23-1).
• I — периодическое выделение алой крови при дефекации без выпа
дения геморроидальных узлов.
• II — наряду с кровотечениями при дефекации выпадают геморрои
дальные узлы, самостоятельно вправляющиеся за анальный канал
• III — узлы выпадают всё чаще, самостоятельно не вправляются, для
их вправления требуется ручное пособие.
• IV — узлы не только не вправляются самостоятельно, но уже и
ручное пособие не помогает. Наряду с этим продолжаются
периодические кровотечения и обострения воспалительного процесса
Лечение
Лечение геморроя определяется стадией заболевания. В
начальный период показано консервативное лечение, направленное на
нормализацию функций пищеварительного тракта, прежде всего,
устранение запоров. С этой целью рекомендуют диету с повышенным
Рис. 23-1. Стадии хронического геморроя: а — I — узлы не выпадают;
б — II — выпавшие узлы самостоятельно вправляются в анальный канал;
в — III — выпавшие узлы требуют ручного вправления; г — IV — постоянное
выпадение узлов вместе со слизистой оболочкой, ручное вправление
невозможно.
содержанием клетчатки, регулярные физические упражнения,
различные слабительные препараты.
При повторяющихся кровотечениях необходимо, невзирая на
возраст больных, исключить какую-либо иную причину, прежде всего
опухоль. Лишь после этого следует назначать свечи с эпинефрином,
менадиона натрия бисульфит и другие гемостатические средства либо
использовать хирургические методы лечения.
При хроническом течении заболевания применяют так
называемые малоинвазивные хирургические методы лечения. К ним
относятся склеротерапия, инфракрасное облучение, электрокоагуляция
и др. Эффективный способ лечения геморроя — лигирование
геморроидальных узлов латексными кольцами. Этот вид лечения
используют при поздних стадиях заболевания. Методика данного
вмешательства заключается в том, что через аноскоп при помощи
вакуумного или механического лигатора набрасывают латексное
кольцо на внутренний геморроидальный узел, который затем отторгается
564 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 23
вместе с лигатурой на 10—12-й день. Все процедуры проводятся ам-
булаторно. В 90% случаев происходит полное купирование всех
симптомов заболевания.
Наиболее эффективным способом лечения геморроя остаётся
хирургическая операция — геморроидэктомия. Наибольшее
распространение получил метод Миллигана и Моргана (или его различные
модификации), заключающийся в полном иссечении
геморроидальных узлов. Несмотря на кажущуюся простоту, эти операции могут
приводить к серьёзным осложнениям (кровотечение, парапроктит,
стеноз, недостаточность анального жома и др.), поэтому они должны
выполняться специалистами.
В последние годы в нашей стране и за рубежом применяют в
основном три типа геморроидэктомии.
• Первый — закрытая геморроидэктомия с восстановлением
слизистой оболочки анального канала узловыми или непрерывными кет-
гутовыми швами (рис. 23-2). Этот вид оперативного вмешательства
применяют при геморрое 3—4-й стадии при отсутствии чётких
границ между наружными и внутренними геморроидальными узлами.
Рис. 23-2. Закрытая
геморроидэктомия (схема операции): а —
иссечение геморроидального узла с
последующей перевязкой
сосудистой ножки; б — ушивание раны
анального канала непрерывным
швом; в — вил анального канала
после завершения операции.
• Второй тип — открытая геморроидэктомия, при которой наружные
и внутренние геморроидальные узлы удаляют единым блоком с
перевязкой ножки узла кетгутовой нитью и оставлением открытой
раны анального канала. Эту операцию выполняют у пациентов с
теми же стадиями заболевания, но осложнённых анальной
трещиной или парапроктитом.
• Третьей методикой является под слизистая геморроидэктомия. Суть
этой операции заключается в том, что слизистую оболочку
анального канала не иссекают вместе с геморроидальным узлом, а
рассекают дугообразными разрезами, после чего из подслизистого слоя
острым путём при помощи коагулятора выделяют геморроидальный
узел, перевязывают его ножку, узел отсекают, оставляя культю
удалённого узла в подслизистом слое.
Наиболее частое осложнение геморроидэктомии — рефлекторная
задержка мочи. После закрытой геморроидэктомии это осложнение
возникает в 18% случаев, а после открытой подслизистой операции —
у 6% пациентов. Кровотечение из ран анального канала случается у
1,5% пациентов.
Осложнения
Основное осложнение обычного течения заболевания - - острый
геморрой, который чаще возникает в качестве обострения
хронического течения либо появляется сразу, внезапно, на фоне казалось бы
полного благополучия. В клинической картине острого геморроя
выделяются два основных компонента — тромбоз геморроидальных
узлов и их воспаление. В зависимости от выраженности того или иного
компонента различают три степени острого геморроя.
• I — тромбоз геморроидального узла с незначительными явлениями
воспаления. Узлы небольшой величины, тугоэластической
консистенции.
• И — к тромбозу присоединяется воспаление геморроидальных
узлов. Они становятся хорошо видны, багрово-синюшного цвета и
резко болезненны при пальпации.
• 111 — воспалительный процесс переходит на клетчатку и кожу пе-
рианальной области.
Для этого состояния характерно резкое усиление болей, которые
принимают постоянный характер, при этом становится
затруднительной не только дефекация, но и ходьба. Геморроидальные узлы значи-
566 <> Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 2
тельно увеличиваются, пальпация их вызывает резкую болезненность.
В последующем присоединяются явления системной
воспалительной реакции.
При остром геморрое I—II степени следует применять
консервативное лечение (местное применение обезболивающих и
противовоспалительных средств). Обычно назначают препараты, содержащие гепарин
(гепариновая мазь, гепарин натрий + декспантенол + аллантоин и др.),
в сочетании с противовоспалительными средствами (мази хлорамфени-
кол + метилурацил + сульфадиметоксин + тримекаин, хлорамфеникол
+ метилурацил и др.). Показано применение флеботонических
препаратов (рутозид, трибенозид, диосмин + гесперидин). Эти препараты
повышают резистентность капилляров, улучшают микроциркуляцию
в геморроидальных узлах, улучшают реологические свойства крови.
II и III степени острого геморроя являются показанием к
госпитализации. В некоторых случаях рекомендуется хирургическое лечение,
которое целесообразно применять до развития обширного воспаления.
Применение современных методик лечения геморроя,
выполняемых в колопроктологических отделениях, позволяет уменьшать
число пациентов с послеоперационным болевым синдромом и
осложнениями, сократить длительность их пребывания в стационаре до 6-7
дней. Дифференцированный подход к выбору способа лечения
геморроя в зависимости от его стадии и индивидуальных особенностей
течения заболевания позволяет достичь хороших результатов лечения
у 98-100% пациентов.
.
нальная трещина
Анальная трещина — спонтанно образующаяся язва слизистой
оболочки анального канала. Заболевание встречается довольно
часто, по обращаемости на проктологическом приёме занимает третье
место и составляет 20—25 случаев на 1000 взрослого населения.
Анальная трещина может возникнуть в любом возрасте, но чаще
наблюдается у молодых, практически одинаково часто у мужчин и женщин.
Этиология
Причины возникновения анальной трещины до сих пор
дискутируются. Среди них как наиболее вероятные рассматривают сосу-
истые нарушения, расстройства иннервации и длительный спазм
Неопухолевые заболевания прямой кишки ... ♦ 567
анального жома. Некоторые колопроктологи склонны связывать
возникновение трещин с патологией анальных крипт, другие — с
упорными запорами, рассматривая микротравмы слизистой
оболочки анального канала как возможную причину образования
хронической язвы.
Основные черты патологии
Различают острую и хроническую анальные трещины.
• Острая трещина имеет вид линейного щелевидного дефекта
слизистой оболочки анального канала, дном которого является
мышечная ткань сфинктера заднего прохода.
• Хроническая трещина отличается от острой разрастанием
грануляционной ткани в области её краёв и дна. Края такой трещины
уплотнены, а при длительном существовании развиваются избытки
ткани в области внутреннего и даже наружного края — так
называемые сторожевые бугорки. Такая трещина не имеет тенденции к
самостоятельному заживлению (рис. 23-3). У большинства больных
(до 80%) анальная трещина располагается по задней спайке
анального канала, нередко сочетаясь с геморроем.
Рис. 23-3. Хроническая анальная трещина: / — проксимальный
«сторожевой» бугорок; 2— анальная трещина; 3 — дистальный «сторожевой* бугорок
Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 23
Клиническое течение
Заболевание чаще начинается внезапно с появления сильных б<
лей в заднем проходе на фоне затруднения дефекации или при
прохождении твёрдого кала. Характерно одновременное появление алой
крови. Если возникновение трещины происходит на фоне геморроя,
то присоединяется выпадение узлов, а кровотечение принимает
обильный характер. В ответ на появление трещины возникает сильный спазм
анального жома, что ещё более увеличивает болевой синдром. В
остром периоде после дефекации боли в заднем проходе, как правило,
уменьшаются, а кровотечение останавливается. При хронической
трещине боли носят более длительный характер, усиливаются не только
во время дефекации, но и при изменении положения тела, кашле и т.п.
Диагностика
Для опытного проктолога достаточно внимательного расспроса
больного, чтобы заподозрить по характерным жалобам анальную
трещину. Всё же осмотр необходим, но именно осмотр анального
канала, а не пальцевое исследование и тем более не ректороманоскопия.
При раздвигании ягодиц можно увидеть линейный дефект
слизистой оболочки, расположенный, как уже указывалось, у большинства
больных на задней стенке анального канала. Чаще всего дефект
слизистой оболочки распространяется от кожно-слизистого перехода до
зубчатой (аноректальной) линии.
Больным с хронической трещиной следует выполнять пальцевое
исследование. При этом можно определить не только её точную
локализацию, но и состояние краёв (они обычно плотные,
приподнятые). Обращается внимание на наличие или отсутствие гнойного
отделяемого (дифференцирование с неполным внутренним свищом
прямой кишки) и, что очень важно, определяется степень спазма
сфинктера заднего прохода. Именно пальцевое исследование до
сфинктерометрии может дать представление о наличии спазма:
сфинктер при повышенном тонусе его мышц плотно охватывает палец,
продвигать который становится трудно, и манипуляция становится
очень болезненной. При отсутствии спазма палец свободно
проходит в прямую кишку, не вызывая излишней болезненности.
Наиболее типичные клинические признаки спазма анального
сфинктера — длительная интенсивная боль, возникающая после
дефекации, затруднённый акт дефекации и резкое повышение анального
рефлекса. Что касается методов диагностики, таких как аноскопия
или жёсткая ректороманоскопия, то у больных с анальной трещиной
с выраженным болевым синдромом и спазмом сфинктера они
должны проводиться обязательно с предварительным обезболиванием.
Д„фференЦиаль„ая диагностика
Анальную трещину следует дифференцировать, прежде всего, с
неполными внутренними свищами прямой кишки. При неполном
свище, как правило, спазм сфинктера не наблюдается, боли
значительно меньше, а на первый план выступают гнойные выделения из
заднего прохода. При пальцевом исследовании на дне
малоболезненной язвы определяется чёткое углубление — полость свища. При
хроническом течении заболевания трещину часто сопровождают
анальный зуд, проктит (сфинктерит) или проктосигмоидит.
Хронические трещины анального канала наблюдаются при целом
ряде заболеваний. Прежде всего, это болезнь Крона, туберкулёз,
сифилис, актиномикоз. Дифференциальную диагностику проводят
путём тщательного сбора анамнеза, морфологических, урологических
и других специальных методов.
Необходимо также помнить о возможном поражении анального
канала у больных синдромом приобретённого иммунодефицита.
Лечение
Лечение острой (или рецидивирующей хронической) трещины
начинают с нормализации стула. Во многих случаях только
регулирование транзита кишечного содержимого по толстой кишке,
изменение консистенции стула с помощью гидрофильных коллоидов и
пищевых добавок даёт стойкий эффект. Необходимо на период
лечения, курс которого длится в среднем 2 нед, из пищевого рациона
исключить солёные, кислые блюда и спиртные напитки.
В настоящее время выпускают много патентованных свечей
(например, гепарин натрий + декспантенол + аллантоин), применение
которых способствует уменьшению или снятию болевого синдрома.
Обезболивающие и санирующие препараты выдавливают в
заднепроходный канал примерно до 1 см столбика мази. После дефекации,
перед введением свечи нужно назначить тёплую (36—38 °С) сидячую
ванну. Такую же манипуляцию выполняют и на ночь. Антибиотики
не назначают.
570 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 23
В последнее время для устранения спазма анального сфинктера
используются препараты, содержащие нитроглицерин. Между тем,
эти препараты могут вызывать вазодилатирующее воздействие и
побочные эффекты в виде головной боли и слабости.
Консервативное лечение, как правило, приводит к
значительному улучшению самочувствия больных: снижается интенсивность
болей, уменьшается спазм сфинктера. Оперативное лечение анальных
трещин необходимо проводить при хроническом течении
заболевания, которое не поддаётся консервативной терапии в течение 2—3 нед.
Операция заключается в иссечении трещины в пределах здоровой
слизистой оболочки. В прямую кишку вводят ректальное зеркало,
трещину очерчивают по всему овалу скальпелем, а затем снаружи внутрь
иссекают ножницами на всём протяжении. Проводят гемостаз и
оставляют рану открытой в просвете прямой кишки. Рана обычно
легко и быстро (5—6 дней) заживает тонким рубцом. Больные, у
которых до операции спазм анального жома не определялся или был
выражен незначительно, могут быть стойко излечены путём только
иссечения трещины в пределах здоровой слизистой оболочки. Если
же спазм чётко выражен и является важным звеном патогенеза
заболевания, его необходимо снять (хотя бы временно), и в данной
ситуации показана боковая подслизистая сфинктеротомия. При этом
рассекают только внутренний сфинктер, так как доказано, что именно
его патологическое состояние является источником спазма и
болевого синдрома. Узкий (глазной) скальпель вкалывают в бороздку,
разграничивающую наружный и внутренний сфинктеры, поворачивают
лезвие скальпеля к просвету прямой кишки под контролем пальца
врача, введённого в задний проход. Затем одним движением руки
рассекают сбоку, вдали от рассечённой трещины, внутренний сфинктер
до слизистой оболочки анального канала. После операции в задний
проход вводят тонкую трубку-катетер и марлевую турунду,
пропитанную водорастворимой антисептической мазью хлорамфеникол + ме-
тилурацил + сульфадиметоксин + тримекаин.
В послеоперационном периоде, обычно проходящем в
амбулаторных условиях, необходимы лишь гигиенические мероприятия. В
течение одной недели следует принимать ежедневные сидячие ванны и
мазевые аппликации на рану анального канала. Пациенту
необходимо добиваться ежедневного мягкого стула не только в ближайшем
послеоперационном периоде, но и в дальнейший период жизни. Среди
редких осложнений после этой операции возможны нагноение,
кровотечение из раны и незначительная недостаточность анального
Неопухолевые заболевания прямой кишки ... О 571
сфинктера. При правильном уходе за раной и пациентом эти
осложнения легко купируются. Соблюдение гигиенического режима,
диеты с повышенным содержанием клетчатки, профилактика запоров
способствуют безрецедивному течению.
Острый парапроктит
Острый парапроктит представляет собой острое гнойное
воспаление околопрямокишечной клетчатки.
Этиология и патогенез
Возбудителем инфекции является в большинстве случаев
смешанная микрофлора. Чаше всего обнаруживают стафилококки и
стрептококки в сочетании с кишечной палочкой, протеем. Нередко
присутствие бактероидов, пептококков, фузобактерий, относящихся к
неспорообразующим анаэробам. Острый парапроктит, обусловленный
смешанной микрофлорой, обычно называют простым, банальным. В
1—2% случаев возникает специфическая инфекция (газовая,
туберкулёзная, актиномикотическая). При простом парапроктите
присутствуют все признаки острого воспаления: боль, отёк, гиперемия, гной. Если
парапроктит вызван ассоциацией микроорганизмов, но главную роль
при этом играют неспорообразующие анаэробы, возникает
гнилостный парапроктит, при котором поражается клетчатка на большом
протяжении. Может развиться и настоящий неклостридиальный
анаэробный парапроктит с поражением не только клетчатки, но и фасции, и
мышц. Такие парапроктиты характеризуются быстрым
распространением процесса с выраженной отёчностью тканей, некрозом, вместо
гноя выделяется зловонная жидкость с детритом. Иногда парапроктит
вызывается клостридиями — возбудителями газовой гангрены.
Факторы, предрасполагающие к возникновению гнойного процесса
в параректальной клетчатке, — ослабление местного и гуморального
иммунитета при истощении, алкоголизме, вследствие острой или
хронической инфекции (ангина, грипп, сепсис); сосудистые изменения при
сахарном диабете, атеросклерозе; функциональные нарушения (запоры,
диарея); наличие геморроя, трещин заднего прохода, криптита и др.
На уровне анатомической границы между прямой кишкой и
анальным каналом находятся морганиевы крипты — кармашки, дно которых
располагается примерно на границе верхней и средней третей
анального канала. На дне крипт открываются выводные протоки анальных
572 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 23
желёз, локализирующихся в толще внутреннего сфинктера. Анальные
железы имеют вил колбочек или гроздьев, размерами от 0,75 до 2,9 мм,
выводные протоки их очень тонкие, извитые. В каждой крипте
оказываются протоки нескольких желёз, причём в задних криптах более
десяти, немного меньше — в криптах по передней полуокружности, ещё
меньше — в криптах на боковых стенках. Анальные железы
представляют собой готовые каналы, в которые проникает инфекция из просвета
прямой кишки. Если происходит закупорка протока железы вследствие
отёка слизистой оболочки прямой кишки (при диарее), микротравмы,
Рубцовых изменений, криптита и т.д., может развиться острое
воспаление группы анальных желёз, открывающихся в крипту (крипты),
таким образом возникает микроабсцесс в стенке анального канала.
Микроабсцесс, возникший вследствие воспаления желёз,
сначала локализуется в области крипты и не выходит за пределы
внутреннего сфинктера. При благоприятном стечении обстоятельств он
может опорожниться через крипту. На этом этапе болезнь может быть
расценена как криптит. Но если абсцесс распространяется вглубь, т.е.
в межсфинктерное пространство, то возникает парапроктит.
Ещё один важный элемент в патогенетической цепи острого па-
рапроктита — гнойный ход, по которому гной из межсфинктерного
пространства попадает в более отдалённые зоны. Локализация этого
хода имеет решающее значение при выборе метода операции. Дело в
том, что гной из межмышечного пространства может попасть в
другое клетчаточное пространство, минуя наружный сфинктер заднего
прохода или проходя через него. Здесь могут быть такие варианты:
ход располагается кнутри от наружного жома, ход идёт через
подкожную порцию сфинктера, он может проходить и через более глубокие
слои — поверхностную и глубокую порции мышцы. А бывает так, что
гнойный ход огибает сфинктер с латеральной стороны, тогда говорят
об экстрасфинктерном гнойном ходе.
Классификация
Локализация гнойника:
• подкожный;
• подслизистый;
• межмышечный (располагается между внутренним и наружным
сфинктерами);
• седалишно-прямокишечный (ишиоректальный);
• тазово-прммокишечный (пельвиоректальный).
Локализация крипты, вовлечённой в процесс воспаления:
• задняя;
• передняя;
• боковая.
Локализация гнойного хода:
• чрезсфинктерный;
• внесфинктерный.
Клинические проявления
Заболевание, как правило, начинается остро. Вслед за коротким
продромальным периодом с недомоганием, слабостью, головными
болями появляется нарастающая боль в прямой кишке,
промежности или в тазу, сопровождающаяся повышением температуры тела и
ознобом. Степень выраженности симптомов острого парапроктита
зависит от локализации воспалительного процесса, его
распространённости, характера возбудителя, реактивности организма. При
локализации гнойника в подкожной клетчатке (подкожный парапроктит)
клинические проявления выражены более ярко и определённо:
болезненный инфильтрат в области заднего прохода, гиперемия кожи,
повышение температуры тела вынуждают, как правило, обратиться к
врачу вскоре после начала заболевания.
Ишиоректальный парапроктит в первые дни болезни проявляется
общими симптомами: познабливанием, плохим самочувствием,
тупыми болями в тазу и прямой кишке, усиливающимися при
дефекации. Характерны местные изменения: асимметрия ягодиц,
инфильтрация, гиперемия кожи, они появляются в более поздней стадии
(5—6-й день).
Наиболее тяжело протекает пельвиоректальный парапроктит, при
котором гнойник располагается глубоко в тазу. В первые дни
болезни преобладают общие симптомы воспаления: лихорадка, ознобы,
головная боль, боли в суставах. Боли локализуются в тазу, в низу
живота. Часто пациент обращается к хирургу или урологу, женщины — к
гинекологу. Нередко их лечат по поводу острых респираторных
заболеваний, гриппа. Продолжительность этого периода иногда
достигает 10—12 дней. В дальнейшем отмечаются усиление болей в тазу и
прямой кишке, задержка стула и мочи. Присутствуют симптомы тяжёлой
системной воспалительной реакции.
Если происходит гнойное расплавление стенки прямой кишки,
гной прорывается в её просвет, у женщин может быть прорыв гноя из
574 ♦ Хирургические болезни ♦ Том 1 О Часть II -0 Глава 23
пельвиоректального пространства во влагалище. Осложнённое
течение пельвиоректального парапроктита с опорожнением гнойника в
кишку или во влагалище часто смазывает картину заболевания, так
как уменьшаются боли и снижается температура тела.
Патологические выделения из прямой кишки или влагалища могут навести на
мысль о дизентерии, каких-то гинекологических заболеваниях и т.п.
Такие симптомы, как задержка стула, тенезмы, дизурические
расстройства, боли в низу живота, особенно часто бывают при
локализации гнойника в пельвиоректальном пространстве, но могут быть и
при любом другом виде парапроктита.
Самое грозное осложнение острого парапроктита —
распространение воспаления на клетчаточные пространства таза, гнойное
расплавление стенки прямой кишки выше уровня аноректальной линии.
В последнем случае кишечное содержимое попадает в параректаль-
ную клетчатку и открывается возможность широкого
распространения инфекции. Отмечены даже случаи гнойного расплавления
уретры. Учитывая непосредственное соседство с тазовой брюшиной и
сообщение тазовой клетчатки с забрюшинной, нельзя исключить
возможность прорыва гноя в брюшную полость и забрюшинное
пространство. Такие осложнения, как правило, возникают при
запоздалом обращении к врачу пожилых, ослабленных больных, при наличии
сахарного диабета, сосудистых расстройств. При позднем обращении
больных и несвоевременно выполненной операции возможно
развитие тяжёлого гнилостного процесса на фоне парапроктита,
начавшегося как банальное заболевание.
После спонтанного вскрытия гнойника или неадекватного
лечения, как правило, формируется свищ прямой кишки. Если свищ не
образовался, но при этом остался очаг воспаления в области
анальных желёз и межсфинктерного пространства, то через какое-то
время возникает рецидив острого парапроктита.
Диагностика
Первая и главная задача диагностики острого парапроктита — на
основании жалоб пациента, клинической картины и осмотра
распознать наличие и локализацию гнойника в клетчаточном пространстве,
окружающем прямую кишку.
Распознать подкожный парапроктит достаточно просто. Гнойник,
локализующийся в подкожной клетчатке перианальной зоны,
проявляется быстро и ярко: боли, гиперемия кожи на стороне поражения,
Неопухолевые заболевания прямой кишки ... О- 575
сглаженность складок перианальной кожи. При расположении
гнойника вблизи заднепроходного отверстия оно может приобретать ще-
левидную форму. Пальпация области воспаления резко болезненна,
но флюктуации вначале может и не быть. Несмотря на то, что
диагноз кажется несомненным уже при наружном осмотре и пальпации,
выполнять пальцевое исследование прямой кишки и анального
канала обязательно для того, чтобы установить связь гнойника с
кишкой, найти поражённую крипту. Аноскопию, ректороманоскопию,
сфинктерометрию и другие исследования обычно не проводят в
связи с тем, что инструментальные исследования при остром парапрок-
тите очень болезненны.
Ишиоректальный иарапроктит может давать изменения, видимые
глазом, в поздней стадии, когда появляются выраженная
асимметрия ягодиц, сглаживание перианальных складок. Поэтому, если
больной обратился по поводу познабливания, ухудшения самочувствия,
сна и при этом его беспокоят тупые постоянные боли в прямой
кишке и в тазу, усиливающиеся при дефекации, но нет видимых на глаз
изменений в области заднего прохода, необходимо произвести
пальцевое исследование прямой кишки. Уже в самые ранние сроки
заболевания можно выявить уплошение её стенки выше анального
канала, сглаженность складок слизистой оболочки на стороне поражения.
К концу первой недели заболевания инфильтрат выбухает в просвет
прямой кишки, отмечается повышение температуры в прямой
кишке. Воспалительный инфильтрат может распространиться на
предстательную железу и уретру, в этом случае их пальпация вызывает
болезненный позыв к мочеиспусканию.
Характерные признаки острого ишиоректального парапроктита —
наличие инфильтрата в анальном канале на уровне и выше анорек-
тальной линии (при этом пальцем удаётся достичь верхней границы
этого инфильтрата) и усиление болей при толчкообразном
исследовании со стороны промежности. Если диагноз ясен,
инструментальные методы исследования так же, как и при подкожном парапрокти-
те, не применяют.
Подслизистый парапроктит диагностируют при пальцевом
исследовании прямой кишки. Обычно выбухание гнойника в просвет кишки
бывает выраженным, гной может распространяться вниз в подкожное
клетчаточное пространство, может идти вверх, отслаивая слизистую
оболочку нижнеампулярного отдела прямой кишки. Подслизистый
парапроктит часто вскрывается самостоятельно в просвет кишки и, если
дренаж достаточный, может наступить самовыздоровление.
5
76 ♦ Хирургические болезни О- Том 1 ♦ Часть II ♦ Глава 23
Тазово-прямокишечный (пельвиоректальный) парапроктит протекает
наиболее тяжело и диагностируется поздно. Воспалительный процесс
локализуется глубоко в тазу. Верхняя граница пельвиоректального
пространства — тазовая брюшина, нижняя граница — мышца,
поднимающая задний проход. От кожи промежности до пельвиоректаль-
ной клетчатки два клетчаточных пространства — подкожное и иши-
оректальное, поэтому наружный осмотр промежности обычно не
позволяет диагностировать пельвиоректальный парапроктит.
Признаки пельвиоректального парапроктита, видимые при наружном
осмотре пациента, появляются только в том случае, если гнойный процесс
распространяется на ишиоректальную область и подкожную
клетчатку, т.е. в поздней стадии.
В начальной стадии пельвиоректального парапроктита при
пальцевом исследовании можно определить болезненность одной из
стенок средне- или верхнеампулярного отдела прямой кишки,
обнаружить тестоватость кишечной стенки или инфильтрат за её пределами.
В более поздней стадии стенка кишки утолщается, отмечается сдав-
ление её извне, а ещё позднее — выбухание в просвет кишки
эластичного опухолевидного образования, иногда определяется
флюктуация. Пельвиоректальный гнойник, как правило, можно распознать,
применив только пальцевое исследование прямой кишки. Но если
диагноз неясен, нужно использовать ректороманоскопию и УЗИ. УЗИ
позволяет установить локализацию, размеры гнойника, характер
изменений в окружающих тканях, помогает в топической диагностике
гнойного хода и поражённой крипты.
Дифференциальная диагностика
Острый парапроктит в основном приходится дифференцировать со
следующими заболеваниями: нагноившаяся тератома параректальной
клетчатки, абсцесс дугласова пространства, опухоли прямой кишки и
параректальной области. Как правило, такая необходимость возника-
т при ишиоректальных, пельвиоректальных парапроктитах, т.е. при
высоком расположении гнойника. При подкожном парапроктите
иногда возникает сомнение — не является ли этот гнойник абсцедирую-
шим фурункулом или нагноившейся атеромой. Если это парапроктит,
то в подкожной клетчатке определяется тяж, идущий к
заднепроходному отверстию, поскольку инфицирование идёт из просвета кишки.
Острый парапроктит иногда встречается как осложнение
распадающейся злокачественной опухоли прямой кишки. Распознать это,
Неопухолевые заболевания прямой кишки ... -Ф- 577
как правило, удаётся, применив пальцевое исследование прямой
кишки и цитологическое исследование.
Если воспалительный процесс в параректальной клетчатке носит
индуративный характер, обязательно нужно исключить
злокачественный процесс. Здесь уместно применить все необходимые методы
обследования: проктографию и рентгенографию крестца и копчика,
УЗИ, биопсию.
Лечение
Лечение острого парапроктита только хирургическое. Операция
должна быть выполнена тотчас после установления диагноза, она
относится к разряду неотложных вмешательств. Вид анестезиологического
пособия играет важную роль. Нужны полное обезболивание и хорошая
релаксация. Чаще всего применяют внутривенный наркоз, перидураль-
ную и сакральную анестезии, масочный наркоз. Местная анестезия при
операциях по поводу острого парапроктита противопоказана из-за
опасности распространения инфекции во время инъекции
анестетика, неадекватности обезболивания и усложнения ориентирования в
связи с инфильтрацией тканей анестезирующим раствором.
Основные задачи радикальной операции — обязательное вскрытие
гнойника и его дренирование. Поиск и нахождение поражённой крипты
и гнойного хода, ликвидация крипты и хода целесообразны только при
наличии опытного хирурга-колопроктолога. Если ликвидировать связь
с кишкой, можно рассчитывать на полное выздоровление пациента.
В условиях неспециализированных стационаров чаще всего
выполняют только вскрытие и дренирование гнойника. Стремление во
что бы то ни стало сразу выполнять радикальные вмешательства без
диагностических навыков и достаточных знаний анатомии
анального жома и параректальных клетчаточных пространств может
привести к тому, что вместе с гнойным ходом будет иссечена часть
наружного сфинктера и возникнет его недостаточность.
В ситуации, когда гнойный ход располагается экстрасфинктерно
или локализуется в толще мышцы наружного сфинктера и
рассечение его в просвет кишки опасно из-за возможности получить
недостаточность сфинктера, можно применить лигатурный метод. Смысл
использования лигатуры в том, что при поэтапном затягивании она
постепенно рассекает гнойный ход в просвет кишки.
Недостатки и опасности методик, описанных выше, привели
специалистов к мысли отказаться в некоторых случаях острого парапрак-
78 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 23
тита от экстренной радикальной операции и разделить лечение на два
этапа: в неотложном порядке вскрыть и дренировать абсцесс, а
спустя несколько дней после ликвидации гнойного процесса выполнить
отсроченную радикальную операцию.
При высоком расположении гнойного хода, что бывает обычно при
ишиоректальных и пельвиоректальных абсцессах, выбор способа
операции бывает затруднён и определяется не только сложностью
ситуации у конкретного больного, но и опытом и знаниями
оперирующего хирурга.
Прогноз
При своевременно и правильно выполненной операции при
остром парапроктите прогноз благоприятный. В то же время при
простом вскрытии гнойника без ликвидации первичного отверстия и
связи с прямой кишкой полного выздоровления, как правило, не
наступает.
Хронический парапроктит
Хронический парапроктит — хроническое воспаление парарек-
тальной клетчатки и анальной крипты с формированием свищевого
хода между просветом прямой кишки и кожей.
Этиология
Подавляющее большинство больных (до 95%) связывают
начало заболевания с перенесённым острым парапроктитом. Поданным
Государственного научного центра колопроктологии МЗ РФ, треть
больных острым парапроктитом обращаются к врачу после
спонтанного вскрытия гнойника, именно у них часто формируется свищ
прямой кишки. Около 30% больных вообще не обращаются за
медицинской помощью, пока у них после острого парапроктита не
появится свищ. Только 40% больных острым парапроктитом
обращаются к врачу своевременно, однако не все они, по разным причинам,
оперируются радикально. Примерно у половины из этой группы
больных производят вскрытие и дренирование абсцесса без
ликвидации ВХОДНЫХ ворот инфекции, что и приводит к формированию
свиша примой кишки.
Патоморфология
Наружное отверстие свища обычно открывается на коже
промежности, причём диаметр его часто не превышает 1 см. При
недостаточно хорошем дренировании в параректальной клетчатке могут
формироваться инфильтраты и полости.
При микроскопическом исследовании обнаруживается, что стенка
свищевого хода образована склерозированной соединительной тканью
с очаговыми скоплениями лимфоцитов или диффузной
инфильтрацией. Внутренняя поверхность свища представлена грануляционной
тканью разной степени зрелости. В отдельных случаях отмечается
частичная эпителизация просвета за счёт наползания многослойного
плоского эпителия с кожи в область наружного отверстия.
Классификация
...
В зависимости от расположения свищевого хода по отношению к
наружному сфинктеру заднего прохода выделяют интрасфинктерный,
транссфинктерный и экстрасфинктерный свищи прямой кишки.
• Примерно 25—30% всех случаев хронического парапроктита
составляют интрасфинктерные свищи. Их также называют подкожно-под-
слизистыми или краевыми. Свищевой ход, как правило, бывает
прямым, рубцовый процесс не выражен, давность заболевания обычно
небольшая. Наружное свищевое отверстие чаще всего локализуется
вблизи от ануса, внутреннее может быть в любой из крипт.
• Транссфинктерные свищи прямой кишки встречаются чаще (40—
45%). Причём отношение свищевого хода к наружному жому может
быть разным — ход может идти через подкожную порцию
сфинктера, через поверхностную, т.е. более глубоко, или ещё глубже — через
глубокую порцию. Чем выше по отношению к сфинктеру
расположен ход, тем чаще встречаются не прямые, а разветвлённые ходы,
чаще бывают гнойные полости в клетчатке, сильнее выражен
рубцовый процесс в тканях, окружающих ход, в том числе и в сфинктере.
• В 15-20% наблюдений встречаются экстрасфинктерные свищи, при
которых ход располагается высоко, он как бы огибает наружный
сфинктер, но внутреннее отверстие находится в области крипт, т.е.
ниже. Такие свищи образуются вследствие острого ишиоректально-
го, пельвиоректального или ретроректального парапроктита. Для них
характерно наличие длинного извилистого хода, часто
обнаруживаются затёки, рубцы. Нередко очередное обострение воспалительного
580 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 23
процесса приводит к образованию новых свищевых отверстий,
иногда воспалительный процесс переходит из клетчатого пространства
одной стороны на другую, возникает подковообразный свищ.
Клинические проявления
Заболевание протекает, как правило, волнообразно. На фоне
существования свища при закупорке наружного отверстия или
свищевого хода гнойно-некротическими массами или грануляционной
тканью происходит обострение воспалительного процесса. При этом
может возникнуть абсцесс, после вскрытия и опорожнения которого
острые воспалительные явления стихают, количество отделяемого из
раны уменьшается, исчезают боли, улучшатся общее состояние,
однако рана полностью не заживает, остаётся ранка не более 1 см в
диаметре, из которой продолжают поступать сукровично-гнойные
выделения, это — наружное отверстие свища. При коротком свищевом
ходе отделяемое обычно скудное, если выделения обильные,
гнойного характера, скорее всего, по ходу свища есть гнойная полость.
В периоды ремиссий общее состояние больных не страдает, боли
не беспокоят, выделений из свища или нет, или они очень
незначительны. При тщательном соблюдении гигиенических мероприятий
больные долгое время особых затруднений не испытывают. Но всё
меняется в период обострений — появляются боли, повышается
температура тела, ухудшается общее состояние. Возникновение новых
очагов воспаления, вовлечение в процесс сфинктера заднего
прохода приводят к появлению нового симптома — недержание газов.
Кроме того, беспокоят головные боли, плохой сон, снижение
работоспособности, отмечаются психические расстройства, снижается
половая потенция.
Наличие свища прямой кишки, особенно сложного, с
инфильтратами, частыми обострениями воспалительного процесса может
приводить к значительным нарушениям в организме больного. Кроме того,
могут возникнуть и местные рубцовые изменения, приводящие к
деформации анального канала и промежности, рубцовым изменениям
мышц, сжимающих задний проход, в результате чего может развиться
недостаточность анального сфинктера. Ещё одним осложнением
хронического парапроктита является пектеноз — рубцовые изменения в
стенке анального канала, приводящие к снижению эластичности и
рубиоиой структуре. При длительном существовании болезни (более 5
лет) в ряде случаем наблюдается озлокачествление свища.
Диагностика
Диагностика хронического парапроктита не столь уж сложна.
Обычно больные сами обращаются к врачу с жалобами на наличие свиша в
области промежности или гнойные выделения из области заднего
прохода. При осмотре, если это полный свищ прямой кишки, можно
увидеть наружное отверстие. При неполных внутренних свищах есть
только внутреннее отверстие со стороны просвета прямой кишки.
При осмотре обращают внимание на состояние кожных покровов
промежности и ягодиц, оценивают состояние наружного свищевого
отверстия, его локализацию по отношению к заднему проходу,
используя при этом принцип циферблата часов — расположение на 3,
5, 6, 11 часах и т.д.
Для свищей прямой кишки, возникших вследствие
перенесённого острого парапроктита, характерно наличие одного наружного
отверстия. При обнаружении отверстий справа и слева от анального
отверстия следует думать о подковообразном свище. Наличие
множественных наружных отверстий более характерно для какого-
либо специфического процесса (болезнь Крона, туберкулёз, актино-
микоз). При осмотре оценивают также количество и характер
выделений из свища. Обычный (банальный) парапроктит характеризуется
гноевидным отделяемым желтоватого цвета без запаха. Если при
надавливании на поражённую область гной выделяется обильно,
следовательно, по ходу свища есть полость (или полости).
Туберкулёзный процесс сопровождается обильными жидкими
выделениями из свища. При актиномикозе выделения скудные, иногда
крошковидные, свищевых отверстий, как правило, несколько.
Свищевые ходы могут быть длинными и хорошо пальпируемыми под
кожей промежности и ягодиц, кожа в окружности наружных отверстий
с синюшным оттенком. Достаточно редко бывает озлокачествление
свищей, при этом характер выделений из свища меняется, они
становятся кровянистыми с примесью слизи.
При наружном осмотре следует также обращать внимание на
наличие деформации промежности, рубцов. Отмечают, анус сомкнут
или зияет, есть или нет мацерация перианальной кожи, следы
расчёсов и пр. Если пациент жалуется на плохое держание газов и кала,
обязательна проверка рефлекса с перианальной кожи и кремастер-
ных рефлексов путём штрихового раздражения кожи с помощью зонда
или неострой иглы. Это нужно сделать до пальпации и пальцевого
исследования прямой кишки.
582 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 23
Пальцевое исследование прямой кишки полезно дополнить
пальпацией со стороны промежности, т.е. провести бимануальное
исследование. При этом исследовании можно выявить другие заболевания
прямой кишки и анального канала, предстательной железы.
Женщинам проводят вагинальное исследование. О наличии свищевого хода,
идущего во влагалище, о состоянии ректо-вагинальной перегородки
лучше всего судить при одновременном исследовании через прямую
кишку и влагалище.
У всех больных со свищами прямой кишки должна применяться
проба с красителем. Для этой цели чаще всего используют 1% раствор
метилтионина хлорида. Краска маркирует внутреннее отверстие
свища. Лучше всего видно окрашивание крипты при аноскопии.
Отсутствие окрашивания внутреннего отверстия даже при добавлении пе-
роксида водорода не всегда свидетельствует о том, что связи с кишкой
нет, ход может быть временно закрыт. Для уточнения диагноза
нужно проводить неоднократное промывание свища.
Ещё одно исследование проводят в обязательном порядке при
наличии свищевого отверстия на коже — зондирование свища. Оно даёт
возможность судить о направлении свищевого хода, ветвлении его в
тканях, наличии гнойных полостей, отношении хода к наружному
сфинктеру. Лучше пользоваться пуговчатым металлическим зондом. Его
осторожно вводят в наружное свищевое отверстие и далее продвигают
по ходу, контролируя с помощью указательного пальца свободной руки,
введённого в кишку. Грубые манипуляции неуместны, они не только
очень болезненны, но и опасны из-за возможности сделать ложный ход.
Диагностика интрасфинктерного свища достаточно проста:
пальпация перианальной области позволяет определить свищевой ход в
подслизистом и подкожном слоях, зонд, введённый в наружное
свищевое отверстие, обычно свободно проходит в просвет кишки через
внутреннее отверстие или проходит к нему в подслизистом слое.
Проба с краской у больных с такими свищами обычно бывает
положительной. Функции сфинктера сохранены. Фистулография и другие
дополнительные методы исследования обычно не требуются.
Для всех больных со свищами прямой кишки обязательна ректо-
романоскопия для выявления состояния слизистой оболочки прямой
кишки, наличия других заболеваний (новообразование,
неспецифические воспалительные заболевания и пр.).
Если при осмотре создалось впечатление, что у больного
имеется транссфинктерный или экстрасфинктерный свищ прямой
кишки, лучше дополнить обследование фистулографией. Рентгеновское
исследование методом бариевой клизмы (ирригоскопию) обычно
используют в диагностике свища прямой кишки как вспомогательное
при необходимости дифференцировать хронический парапроктит с
другими заболеваниями.
При транссфиктерных и экстрасфиктерных свищах прямой
кишки обследование больного необходимо дополнять ультрасонографи-
ей, а также определением функций сфинктера заднего прохода.
Дифференциальная диагностика
Свищи прямой кишки обычно приходится дифференцировать со
следующими заболеваниями: кисты параректальной клетчатки,
остеомиелит крестца и копчика, актиномикоз, туберкулёзные свищи,
свищи при болезни Крона, эпителиальный копчиковый ход.
При подозрении на озлокачествление свища надёжным методом
диагностики является цитологическое исследование соскоба из
свищевого хода, причём соскоб лучше делать из глубокой части хода, а
не из области наружного отверстия. В случае необходимости
подвергают гистологическому исследованию элементы самого хода.
Лечение
Единственный радикальный метод лечения свищей прямой
кишки — хирургический. Само по себе наличие свища служит
показанием к операции. Конечно, существуют и противопоказания к
радикальной операции, в основном, это тяжёлые сопутствующие заболевания
в стадии декомпенсации. В то же время, нецелесообразно
откладывать радикальное лечение надолго, потому что обострение часто
повторяется, воспалительный процесс с последующим рубцеванием
стенки анального канала, сфинктера и параректальной клетчатки
может привести к деформации анального канала и промежности и
развитию недостаточности анального жома.
При наличии инфильтратов по ходу свища проводят активную про-
тивоспалительную терапию: антибиотики, физиотерапия. Если же
процесс протекает без обострений, операцию проводят в плановом
порядке. В тех случаях, когда наступил период стойкой ремиссии,
операцию следует отложить, потому что в этих условиях нет чётких
ориентиров для выполнения радикального вмешательства. Операция
может оказаться не только неэффективной по отношению к свищу,
но и опасной из-за возможности повреждения тканей, не вовлечён-
♦ Хирургические болезни ^ Том 1 <ф>
584 ♦ Хирургические болезни ^ Том 1 -О Часть II ♦ Глава
ных на самом деле в патологический процесс. Операцию следует
выполнять, когда свищ вновь откроется.
Наиболее распространённые операции при свищах прямой кишки:
• рассечение свища в просвет прямой кишки;
• иссечение свища в просвет прямой кишки (операция Габриэля);
• иссечение свища в просвет прямой кишки со вскрытием и
дренированием затёков;
• иссечение свища в просвет прямой кишки с ушиванием дна раны;
• иссечение свища с проведением лигатуры;
• иссечение свища с перемещением слизистой оболочки дистального
отдела прямой кишки для ликвидации внутреннего свищевого отверстия.
Выбор метода операции определяется локализацией свищевого
хода и его отношением к наружному сфинктеру заднего прохода;
степенью развития рубцового процесса в стенках кишки, области
внутреннего отверстия и по ходу свища; наличием гнойных полостей и
инфильтратов в параректальной клетчатке.
Операцию рассечения свища в просвет прямой кишки обычно
выполняют при подслизистых и так называемых краевых свищах, когда
ход располагается внутри сфинктера и очень поверхностно. Свищ,
как правило, не окружён рубцами, поэтому рассечения свищевого
хода по всей длине с ликвидацией внутреннего отверстия достаточно
для излечения пациента.
При интрасфинктерных свищах чаще всего применяют операцию
иссечения свища в просвет прямой кишки. Суть операции заключается
в том, что производят рассечение свищевого хода с последующим
экономным иссечением его вместе с наружным и внутренним отверстиями
и приданием ране формы треугольника, вершина которого обращена в
просвет кишки, а основание располагается на перианальной коже. При
наличии затёков в параректальной клетчатке производят вскрытие их
по зонду и выскабливание стенок острой ложкой Фолькмана.
Операции по поводу транссфинктерных свищей прямой кишки
всегда сопровождаются рассечением сфинктера заднего прохода. Если
нет гнойников в параректальной клетчатке, рубцовый процесс по ходу
свиша выражен умеренно, обычно выполняют иссечение свища с
наружным и внутренним отверстиями, экономное иссечение кожно-сли-
зистых краёв раны с приданием ей формы треугольника с основанием
на коже и ушивание раны без захвата слизистой оболочки и кожи.
В случаях, когда свищ осложнён значительным Рубцовым
процессом и наличием гнойных полостей в параректальной клетчатке (часто
ГО бывает при рецидивирующем парапроктите), производит иссечение
это
Неопухолевые заболевания прямой кишки ... <0* 585
в просвет прямой кишки без ушивания раны (даже частичного),
вскрытие и дренирование затёков.
Экстрасфинктерные свищи с наличием гнойных затёков и
Рубцовыми изменениями стенки кишки и параректальной клетчатки чаще
всего лечат путём иссечения свища с проведением лигатуры
(лигатурный метод), особенно при локализации внутреннего отверстия по
задней полуокружности.
В арсенале хирургических методик при экстрасфинктерных
свищах прямой кишки есть пластические операции, предусматривающие
перемещение слизистой оболочки дистального отдела прямой кишки.
Их выполняют в нескольких вариантах. Отслоённый слизисто-мы-
шечный лоскут низводят вниз или смещают вправо или влево. В том и
другом случае ушитое отверстие в стенке кишки оказывается
прикрытым здоровой слизистой оболочкой. Основное достоинство такой пла-
сти-ки — ликвидируется внутреннее отверстие свища и при этом не
повреждается сфинктер заднего прохода. К сожалению, такие
операции не всегда выполнимы; основная причина отказа — рубцовый
процесс в стенке кишки, не позволяющий мобилизовать жизнеспособ
ный лоскут, и выраженный гнойно-воспалительный процесс.
Прогноз
Хирургическое лечение краевых, подслизистых свищей прямой
кишки, а также невысоких транссфиктерных приводит к стойкому
излечению и не сопровождается какими-то серьёзными осложнениями.
Свищи высокого уровня (глубокие транссфиктерные и
экстрасфинктерные) тоже могут быть излечены без функциональных нарушений.
При рецидивных свищах, длительно существующем воспалении,
наличии затёков и рубцовых изменений в стенке кишки, сфинктере и
параректальной клетчатке результаты значительно хуже.
Операции по поводу свищей прямой кишки требуют хороших
знаний анатомии, физиологии прямой кишки и анального канала и
достаточного клинического опыта. Поэтому плановое лечение больных
со свищами прямой кишки следует проводить только в специальных
стационарах, оперировать их должны специалисты колопроктологи.
Срочные операции при обострении хронического парапрок-
тита могут выполняться в общехирургических стационарах, но
после стихания воспаления радикальное лечение следует
проводить у специалистов. Слишком большой риск осложнений при этих
вмешательствах заставляет осторожно подходить к вопросам
хирургического лечения свищей прямой кишки.
586 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 23
Выпадение прямой кишки
Выпадение прямой кишки — выворачивание (выпадение) наружу
через задний проход всех слоев этого органа. Кроме наружного,
выделяют ещё так называемое внутреннее выпадение, в основе
которого лежит интраректальная инвагинация прямой кишки.
Этиология и патогенез
Выделяют предрасполагающие и производящие факторы
возникновения ректального пролапса.
• К предрасполагающим факторам относят наследственность,
особенности конституции организма и формирования связочного
аппарата тазовых органов и прямой кишки, глубокий тазовый
брюшинный карман, приобретённые изменения мышц тазового дна и
сфинктеров заднего прохода и др.
• Производящими факторами служат острые и хронические
заболевания ЖКТ, тяжёлые физические нагрузки, истощение, травмы,
тяжёлые роды и т.п.
Выделяют два основных варианта патогенеза выпадения прямой
кишки.
• Первый — развитие выпадения прямой кишки по типу скользящей
грыжи. В результате постоянного повышения внутрибрюшного
давления и ослабления (дистрофии) мышц тазового дна брюшинный
дугласов карман постепенно смещается вниз, захватывая за собой
переднюю стенку прямой кишки. Формирование глубокого дугла-
сова пространства сопровождается попаданием в него петель
тонкой кишки и расхождением мышц-леваторов, чему также
способствует повышение внутрибрюшного давления. При нарастании этих
неблагоприятных обстоятельств происходит постепенное пролаби-
рование передней стенки прямой кишки наружу через анальный
канал вместе с брюшиной дугласова пространства, как при
скользящей грыже. Со временем зона смещения стенки прямой кишки
увеличивается и становится циркулярной. Наступает клиническая
картина полного выпадения прямой кишки.
• Второй вариант — инвагинационный, когда чрезмерно подвижная
прямая кишка инвагинирует (сразу или постепенно) через
анальный канал. Возможно, промежуточным этапом является
внутреннее «выпадение», когда инвагинируют более проксимальные
отделы прямой кишки или дистальная часть сигмовидной кишки. Для
Неопухолевые заболевания прямой кишки ... ♦ 587
внутреннего выпадения характерно образование так называемой
солитарной язвы прямой кишки, которая чаще располагается на
передней ее стенке несколько выше аноректальной линии.
Клинические проявления
Заболевание протекает по двум основным вариантам.
• Первый вариант характеризуется внезапным началом, чаще всего,
после резкого повышения внутрибрюшного давления в результате
тяжёлой физический нагрузки, родов или при ослаблении мышц
тазового дна и анального сфинктера после резкого кашля, чиханья.
Во время подобного эпизода или сразу после него (иногда при
первой же дефекации) прямая кишка выпадает на значительном
протяжении (8—10 см и более). Нередко при этом возникают сильные
боли в животе, что связано с натяжением брюшины и брыжейки.
Боли могут быть настолько сильными, что иногда приводят
больных в состояние коллапса или даже шока.
• Более часто наблюдают второй вариант — заболевание начинается
постепенно, как бы исподволь. Сначала появляются всё
нарастающие затруднения при опорожении прямой кишки. Через тот или
иной промежуток времени во время дефекации начинает выпадать
небольшая часть её, которая затем после окончания дефекации
самостоятельно вправляется в анальный канал. Постепенно
выпадающая часть кишки увеличивается в размерах, а для её вправления
требуются дополнительные усилия, вплоть до ручного пособия. Со
временем кишка начинает выпадать уже и вне дефекации, при кашле,
чиханьи или даже при принятии вертикального положения.
Самостоятельное вправление выпавшей кишки становится неэффективным.
И при первом, и при втором вариантах возникновения
заболевания основной жалобой больных является именно выпадение кишки
из заднего прохода.
Вторым по частоте симптомом является недержание различных
компонентов кишечного содержимого, отмечающееся почти у 80%
больных. Особенно часто недержание газов и кала наблюдают при
втором варианте заболевания у женщин. Слабость сфинктеров
прямой кишки и недостаточность мышц тазового дна — составная часть
патогенеза заболевания.
Более чем у половины больных отмечают различные нарушения
функций толстой кишки, чаще в форме хронических запоров, что
приводит к необходимости постоянного применения слабительных
588 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 23
средств или очистительных клизм. Реже заболевание развивается на
фоне периодической диареи.
Болевой синдром у больных с выпадением прямой кишки, как
правило, не выражен. Он чаще возникает при внезапном выпадении
прямой кишки. Всё же примерно половина больных отмечают боли в низу
живота, усиливающиеся при дефекации, значительной физической
нагрузке и даже при ходьбе. При выпадении кишки боли либо
уменьшаются, либо проходят совсем.
Характерными жалобами являются патологические выделения из
заднего прохода, чаше в виде слизи, но могут быть и кровянистые
выделения, обусловленные травмированием мелких сосудов в
разрыхлённой и отёчной слизистой оболочке выпадающей части прямой
кишки. Этому способствует образование трещин заднего прохода при
частом выпадении кишки.
Нередко больные предъявляют жалобы на ощущение инородного
тела в прямой кишке и ложные позывы на дефекацию. При
длительном существовании выпадения прямой кишки, особенно
сочетающемся с выпадением матки, больные часто жалуются на различные
дизурические расстройства, например частые позывы или, наоборот,
прерывистое мочеиспускание.
Из осложнений заболевания следует в первую очередь отметить
ущемление выпавшей части прямой кишки. Оно может произойти
практически у каждого больного, если вовремя не вправить
выпавшую часть кишки или если попытка вправления была совершена
грубо. Быстро увеличивающийся отёк не только препятствует вправле
нию, но и ухудшает кровообращение кишки, что приводит к
возникновению некротических участков и язв.
Особенно опасно ущемление при одновременном выпадении
петель тонкой кишки в брюшинном кармане между стенками прямой
кишки. В этих случаях возможно развитие острой кишечной непро
ходимости и перитонита.
Классификация
Среди множества классификаций наибольший практический ин
терес представляют определение выраженности выпадения прямой
кишки, оценка степени компенсации мышц тазового дна и
состоянии анального жома.
• Степени выпадения прямой кишки:
- первая —■ ВЫПДДаетТОЛЬКО при дефекации.
Неопухолевые заболевания прямой кишки ... ♦ 589
— вторая — выпадение возникает не только при дефекации, но и при
физической нагрузке;
— третья — кишка выпадает при ходьбе или даже при принятии
вертикального положения.
• Возможность вправления выпавшей части кишки:
— вправляется самостоятельно;
— необходимо ручное вправление.
• Степень недостаточности анального жома:
— первая — недержание газов;
— вторая — недержание жидкого кала;
— третья — недержание твёрдого кала.
Важный клинический критерий — возможность
самостоятельного вправления выпавшей части кишки, что косвенно
свидетельствует о степени компенсации мышц тазового дна. Если кишка
самостоятельно вправляется, то мышцы тазового дна, прежде всего
мышцы-леваторы, находятся в стадии компенсации. Необходимость
ручного пособия для вправления прямой кишки свидетельствует о
декомпенсации мышц тазового дна. Следует также оценивать степень
недостаточности анального жома, характерную для большинства
больных выпадением прямой кишки.
Пример клинического диагноза: «Выпадение прямой кишки I
степени в стадии компенсации мышц тазового дна, недостаточность
анального жома I степени».
Диагностика
Кажущаяся лёгкость выявления выпадения прямой кишки, когда
больные сами приходят к врачу с «готовым» диагнозом, справедлива
лишь отчасти. Даже появление прямой кишки из заднего прохода при
лёгком натуживании или вертикальном положении — не окончание
диагностики, а лишь её начало. В тех случаях, когда больной
приходит с жалобами на ощущение инородного тела или тенезмы,
необходимо применить специальные методы осмотра, прежде всего в
положении «на корточках», при этом выявлению выпадения помогает
натуживание больного. Затем больного нужно поместить на
смотровое кресло и сделать пальцевое исследование прямой кишки.
Следует обратить внимание на состояние геморроидальных узлов, тонус и
волевые сокращения сфинктера, наличие каких-либо
патологических образований, например полипов. При осмотре выпадающей час
590 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 23
ти прямой кишки оценивают её форму и размеры, состояние
слизистой оболочки, наличие зубчатой (аноректальной) линии.
При выпадении прямой кишки обнаруживают циркулярное
пространство между стенкой прямой кишки и анальным каналом, это
пространство исчезает, если имеется выпадение не только прямой
кишки, но и анального канала. Большая длина выпавшей кишки
(более 12-15 см) свидетельствует о вовлечении в патологический
процесс сигмовидной кишки. В случае внутреннего выпадения прямой
кишки (инвагинации) большая роль в диагностике принадлежит
пальцевому исследованию и ректороманоскопии. При пальцевом
исследовании определяют патологическое образование гладкое,
эластической консистенции, легко смещаемое по отношению к стенкам прямой
кишки, которое может исчезать в коленно-локтевом положении и,
наоборот, увеличиваться при натуживании и кашле. Ректороманос-
копия в подобных случаях помогает определить характер
обнаруженного образования и выявить инвагинат. Кроме того, определяется
наличие солитарной язвы, располагающейся, как правило, на
передней стенке нижнеампулярного отдела прямой кишки.
Дальнейшее обследование больных должно быть направлено на
выявление причин и патогенеза выпадения прямой кишки. Для
выявления возможных опухолей, дивертикулёза и других
патологических образований толстой кишки необходимо эндоскопическое
обследование.
Важный элемент диагностики — рентгенологическое обследование
(включая дефектографию), с помощью которого определяют не
только наличие инвагината, петель тонкой кишки в выпавшем
брюшинном кармане, но и функциональные изменения (выраженность и
протяжённость колостаза, состояние компенсации мышц тазового дна).
Всем больным выпадением прямой кишки необходимо
выполнение физиологических исследований, направленных на оценку
функционального состояния замыкательного аппарата прямой кишки, мо-
торно-эвакуаторной способности толстой кишки и активности мышц
тазового дна.
Дифференциальная диагностика
Выпадение прямой кишки следует дифференцировать от
выпадения геморроидальных узлов. За выпадение прямой кишки иногда
принимаю! выпадение крупных полипов или ворсинчатых опухо [ей.
Существенные сложности возникают при налимий внутреннего вы-
Неопухолевые заболевания прямой кишки ... -О 591
падения и солитарной язвы. В этих случаях необходимо
дифференцировать его от эндофитных опухолей с помощью морфологических
методов (цитология, биопсия).
Лечение
Хирургическое лечение выпадения прямой кишки имеет большую
историю, уходящую в глубокую древность. Предложено более 200
различных вариантов операций, отличающихся друг от друга иногда
принципиально, но нередко лишь незначительными деталями. Все
способы хирургического лечения подразделяют по своим
принципиальным признакам на пять основных вариантов: воздействие на
выпавшую часть прямой кишки, пластика анального канала и тазового
дна, внутрибрюшные резекции толстой кишки, фиксация дисталь-
ных отделов толстой кишки, комбинированные способы.
Операция на выпавшей части прямой кишки
Резекцию выпавшей части кишки по определённым показани
применяют у ряда больных, особенно у пожилых при наличии
тяжёлых сопутствующих заболеваний. В настоящее время наибольшее
распространение получила операция Делорма — отсечение слизистой
оболочки выпавшей части прямой кишки с наложением сбориваю-
щих швов на мышечную стенку в виде валика, который затем
помещают над анальным каналом (рис. 23-4). Она технически проста по
выполнению, даёт наименьшее число послеоперационных осложне
ний и небольшой процент рецидивов выпадения.
Пластика анального канала и тазового дна
Типичная операция подобного рода — сужение заднего проход;
медной (серебряной) проволокой по Тиршу. Вместо проволоки был
предложены и другие материалы (серебряная и стальная цепочки,
шёлковая и лавсановая нити, различные полоски из аутопластичес-
ких и синтетических материалов и др.). Все эти предложения на
практике оказались несостоятельными из-за большого числа
послеоперационных осложнений и высокого процента рецидивов выпадения
прямой кишки.
Несмотря на большое число предложенных вариантов сужения
заднего прохода (более 40), все они страдают одним существенным
недостатком — слишком механистически и примитивно пытаются уст-
.
592 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 23
Рис. 23-4. Схема операции Делорма при выпадении прямой кишки: а —
рассечение выпавшей части кишки; б — наложение сборивающих швов и
отсечение наружного цилиндра прямой кишки; в — сборивание дистальной час
ти прямой кишки; г — формирование ректоанального анастомоза.
ранить сложный патологический процесс. Поэтому они заранее об
речены на неудачу, особенно у взрослых больных.
Пластика тазового дна путём сшивания краёв мышц-леваторов с
подшиванием или без подшивания к прямой кишке, напротив, даёт
хорошие результаты, но не в качестве самостоятельной операции, а
только тогда, когда она дополняет другие хирургические вмешатель
ства, направленные на устранение выпадения прямой кишки.
Внутренние резекции дистальных отделов толстой кишки
Внутренние резекции дистальных отделов толстой кишки, в том
числе и прямой кишки, — радикальное средство от её выпадения. Но
вряд ли ЭТО! метод лечения, т.е. удаление органа, является патогене
Неопухолевые заболевания прямой кишки ... ♦ 593
тически и физиологически оправданным у большинства больных.
Именно поэтому резекции сигмовидной и прямой кишок не нашли
распространения среди отечественных хирургов как средство лече
ния этого заболевания.
В то же время отказываться от выполнения подобных операци
не следует, так как у ряда больных «инертная» прямая кишка или до-
лихосигма может быть причиной выпадения. Применение в
подобных случаях других, например фиксирующих, операций может лишь
усугубить состояние больных, приводя не только к усилению
запоров, но и к полной потере самостоятельной дефекации. Возникший
хронический толстокишечный стаз, сопровождаемый постоянным
повышением внутрибрюшного давления, в свою очередь ведёт к
неизбежному рецидиву выпадения.
Таким образом, резекции сигмовидной и прямой кишок при
выпадении кишки должны быть патогенетически обоснованы, их следует
выполнять не в качестве самостоятельных операций, а в сочетании с
хирургическими пособиями (например, фиксацией), устраняющим
другие патогенетические звенья патологического процесса.
.
Фиксирующие операции
ими
Фиксирующие операции направлены на удержание прямой
кишки в нормальном анатомическом и физиологическом положении.
Наиболее логичные с точки зрения сути заболевания методы
устранения выпадения прямой кишки применяют уже более 100 лет.
Среди многочисленных методов, предложенных за этот период, в
настоящее время наибольшее распространение получили
следующие: способы Зеренина—Кюммеля — фиксация прямой кишки к
передней продольной связке позвоночника в области мыса
отдельными узловыми швами; Рипштейна — фиксация прямой кишки к
мысу крестца с помощью тефлоновой сетки и её модификация (задне-
петлевая фиксация прямой кишки к крестцу с помощью
синтетической сетки).
В последние годы всё большее распространение получает
лапароскопический метод хирургического лечения по типу заднепетлевой
фиксации прямой кишки с помощью тефлоновой сетки (рис. 23-5).
Этот метод наряду с надёжной фиксацией кишки обладает очень
важным качеством — малой травматичностью вмешательства, что
позволяет сократить стационарный послеоперационный период ;
4-5 дней.
594 ♦ Хирургические болезни ♦ Том 1 ♦ Часть II ♦ Глава 23
Комбинированные методы
Сложность патогенеза выпадения прямой кишки нередко
вынуждает хирургов прибегать к комбинированным методам
хирургического лечения. При этом сочетают различные способы фиксации,
пластики и даже резекции дистальных отделов толстой кишки. При
наличии у больных внутренней прямокишечной инвагинации
(внутреннего выпадения), сопровождающейся образованием солитарной
язвы, наиболее целесообразно выполнение резекции дистальных
отделов толстой кишки по типу передней и брюшно-анальной. У
больных пожилого и старческого возрастов с тяжёлыми сопутствующими
заболеваниями, препятствующими выполнению внутрибрюшных
операций, показана операция Делорма. Эту операцию рекомендуют
выполнять при длине выпадающего отрезка кишки не более 7—8 см.
Прогноз
При лечении выпадения прямой кишки необходим
дифференцированный выбор способа хирургической коррекции заболевания в
зависимости от возраста больных, длительности анамнеза, вида
ректального пролапса, характера кишечного транзита и других факторов.
Рис. 23-5. Заднепетлевая
фиксация прямой кишки с помо
щью тефлоновой сетки.
Неопухолевые заболевания прямой кишки ... *0> 595
При правильном выборе метода оперативного вмешательства прогноз
хирургического лечения, как правило, благоприятный. У 75%
оперированных больных удаётся ликвидировать ректальный пролапс и
улучшить эвакуаторную функцию толстой кишки.
Для получения стойкого эффекта хирургического лечения
необходимо не только соответствие его патогенезу заболевания, но и
правильное поведение больных в послеоперационном периоде. Следует
устранить факторы, способствующие заболеванию, прежде всего,
нормализовать работу ЖКТ и устранить тяжёлые физические нагрузки.
Эпителиальный копчиковый ход
Эпителиальный копчиковый ход — врождённая аномалия
развития каудального конца плода, при которой под кожей крестцово-
копчиковой области остаётся незаращённый ход, выстланный
эпителием. Эта аномалия встречается довольно часто, при
профилактических осмотрах её выявляют у 4—5% детей с соотношением мальчиков
и девочек 3:1.
Но есть и другая точка зрения на это заболевание, довольно часто
встречающаяся в зарубежной литературе. Это волосяная (пилонидаль-
ная) полость, киста, образующаяся в межъягодичной складке из-за
неправильного роста волос, когда они по неизвестным причинам
врастают в кожу с образованием полости (кисты). Копчиковый ход
(волосяная полость), как правило, небольших размеров — длиной 2—3
см, оканчивается слепо в подкожной клетчатке в области копчика,
но с самим копчиком никак не связан (рис. 23-6). Сам ход выстлан
кожным эпителием, содержащим волосы, волосяные луковицы,
потовые и сальные железы.
Клинические проявления
Небольшой кожный дефект в области копчика обычно никак
клинически не проявляется до полового созревания. С наступлением
половой зрелости начинают расти волосы, увеличиваются потовые и
сальные железы и малейшая травма, недостаточный гигиенический
уход могут быть причиной развития воспалительного процесса как в
самом ходе, так и вокруг него. Локализация вблизи заднего прохода
обусловливает обилие патогенной микрофлоры и быстрое развитие
местного инфекционного процесса.
С этого периода заболевание принимает острый характер
гнойного воспаления со всеми его признаками. Местно отмечается
припухлость межъягодичной складки, причём отёк может распространяться
и на обе ягодицы. Кожа в этой зоне резко гиперемирована и
болезненна. Болевой синдром довольно выражен. При пальпации
болезненность усиливается, иногда можно определить зону флюктуации.
■ Отмечается повышение температуры тела до 38—39 °С.
В остром воспалении эпителиального копчикового хода
различают две стадии — стадию инфильтрации и стадию абсцедирования с
последующим спонтанным прорывом гноя и образованием
вторичных гнойных ходов. После прорыва абсцесса температура тела
нормализуется, болезненность и отёк значительно уменьшаются, но
через сформировавшиеся ходы постоянно выделяется незначительное
гнойное отделяемое. В дальнейшем эти ходы могут периодически
закрываться с повторным образованием абсцессов. И так вплоть до
образования значительной рубцовой деформации не только
межъягодичной складки, но и самих ягодиц и промежности. Но и в этих
случаях остаётся воспалительный очаг, готовый в любой момент дать
очередное обострение. Таким образом, заболевание проходит
несколько стадий: бессимптомный период, острое воспаление
(инфильтрат, абсцесс), хроническое воспаление (гнойные свищи) с
периодически возникающими рецидивами абсцедирования.
В тяжёлых случаях заболевание завершается развитием свищевой
формы пиодермии, лечение которой представляет большую
сложность и сомнительные перспективы.
Неопухолевые заболевания прямой кишки ... ♦ 597
В бессимптомной стадии эпителиальный копчиковый ход можно
обнаружить при осмотре межягодичной складки, когда в коже
копчиковой зоны обнаруживают характерные углубления (первичные
отверстия). Когда же в этой зоне появляются признаки воспаления,
диагноз обычно не вызывает затруднений. Несмотря на очевидность
клинической картины, необходимо проводить пальцевое
исследование прямой кишки и ректороманоскопию для исключения какой-
либо иной причины воспалительного процесса (парапроктит,
остеомиелит, пресакральная тератома и др.).
Лечение
Лечение эпителиального копчикового хода на всех стадиях
развития заболевания может быть только хирургическим. Консервативные
мероприятия (местные и общие противовоспалительные средства)
носят лишь симптоматический характер. Задача операции —
ликвидация самого хода, всех вторичных гнойных ходов и возможных
скрытых полостей. Метод операции определяется стадией заболевания. В
неосложнённый воспалением период операция состоит в иссечении
эпителиального копчикового хода с ушиванием раны наглухо.
При остром воспалении в стадии инфильтрата, если он не
выходит за пределы межъягодичной складки, можно выполнить
радикальную операцию с иссечением хода и первичных отверстий. Однако в
этом случае ушивать рану наглухо не следует. Края кожной раны
подшивают к её дну. В случае развития небольшого абсцесса также
можно выполнить радикальную операцию. Рану при этом не ушивают.
При обширных абсцессах целесообразно хирургическое лечение
разделить на два этапа. На первом этапе производят вскрытие
абсцесса, его промывание и дренирование, на втором, после стихания
воспаления, эпителиальный ход с первичными и вторичными
отверстиями иссекают радикально в пределах здоровых тканей. Интервал
между этапами обычно составляет 5—6 дней. Второй этап можно
провести и в более поздние сроки. Отсроченные операции выполняют в
более «чистых» условиях, что позволяет производить кожную
пластику. Это более выгодно с косметических позиций.
Несмотря на кажущуюся простоту, хирургическое лечение
сопровождается большим числом осложнений (до 30—40%), главным
образом, воспалительного характера. Основная причина осложнений —
несоответствие техники операций имеющимся индивидуальным
особенностям воспалительного процесса.
1. Блохин Н.Н., Петерсон Б.Е. Клиническая онкология: т. 1—2. — М.:
Медицина, 1979.
2. Воробьев Г.И. Основы колопроктологии (учебное пособие). - Р.-на-Д.:
Феникс, 2001.
3. Гостищев В,К. Оперативная гнойная хирургия. - М.: Медицина, 1996.
4. Давыдовский И.В. Общая патология человека. - М.: Медицина, 1969.
5. Дадвани С.А., Ветшев П. С, Шулудко A.M., Прутков М.И.
Желчнокаменная болезнь. - М.: Видар, 2000.
6. Ееыев В.Н., Лядов К.В., Воскресенский П. К. Атлас оперативной
хирургии грыж. — М.: Медпрактика, 2003.
7. Ерюхин И.А., Гельфанд Б.Р., Шляпников С.А. Хирургические
инфекции. - СПб: Питер, 2003.
8. Ивашкин В. Т. Болезни пищевода (патологическая физиология, клини
ка, диагностика и лечение). — М.: Триада-Х, 2000.
9. Кригер А.Г., Федоров А.В., Воскресенский U.K., Дронов А.Ф. Острый ап
пендицит. - М.: Медпрактика, 2002.
10. Мартынов А.И., Мухин Н.А., Моисеев B.C. Внутренние болезни: т. 1-
2. - М.: ГЭОТАР-МЕД, 2002.
11. Мирский М.Б. Хирургия от древности до современности. — М.: Наука,
2000.
12 Мондор Г. Неотложная диагностика. Живот: т. 1-2. — СПб: Медбук, 1997.
13. Одарюк Т.С., Воробьев Г.И., Шелыгин Ю.А. Хирургия рака прямой киш
ки. - М.: Дедалус, 2005.
14. Панцырев ЮМ. Клиническая хирургия. - М.: Медицина, 1988.
15. Петров С.В, Общая хирургия. - СПб: Лань, 1999.
16. Петровский Б.В. Избранные лекции по клинической хирургии - М.:
Медицина, 1968.
17. Савельев B.C. 50 лекций по хирургии. - М.: Триада-Х, 2004.
18. Савельев ВС. Руководство по неотложной хирургии органов
брюшной полости. - М.: Триада-Х, 2004.
19. Трахтенберг А.Х., Чиссов В.И. Клиническая онкопульмонология. - М.:
I ><)\А\> М1.Д, 2000.
Рекомендуемая литература -Ф- 599
20. Федоров В Д., Воробьев Г.И., Ривкин В.Л. Клиническая оперативная
колопроктология. — М.: Медицина, 1994.
21. Федоров В.Д., Данилов М.В. Хирургия поджелудочной железы.
Руководство для врачей. — М.: Медицина, 1995.
22. Федоров В.Д., Емельянов СИ. Хирургические болезни (руководство для
интернов). — М.: МИА, 2005.
23. Черноусое А.Ф., Поликарпов С.А., Черноусое Ф.А. Хирургия рака же
лудка. - М.: ИздАТ, 2004.
24. Чиссов В.И., Дарьялова С.Л. Избранные лекции по клинической
онкологии. - М.: Фонд паллиативной медицины, 2000.
25. Шевченко Ю.Л. Частная хирургия: т. 1-2. - СПб, Специальная
литература, 1998.
26. Яицкий Н.А., Седов В.М., Морозов В.П. Язвы желудка и
двенадцатиперстной кишки. -М.: МЕДпресс-информ, 2002.
27. Яицкий Н.А., Седов В.М., Васильев СВ. Опухоли толстой кишки. -
М.: МЕДпресс-информ, 2002.
А
Абсцесс
брюшной полости 178
межкишечный 179
панкреатогенный 208, 211
поддиафрагмальный 179
тазовый 178
Алкалоз
метаболический 131
респираторный 129
Аналгезия упреждающая 142
Анестезия
общая 136
регионарная 137
Аппендицит
гангренозный 164, 167, 174
катаральный 163, 165
острый 162
ретроцекальный 168
тазовый 168
у беременных 180
у детей 181
у пожилых 183
флегмонозный 163, 166, 173
Алпендэктомия 170
ретроградная 172
ретроперитонеальная 172
типичная 170
Асцит панкреатический 452
Ацидоз
метаболический 129
респираторный 128
Б
Бактериемия 90
Болезнь
желчнокаменная 410
Крона 550
язвенная 222
Буфер 125
в
Ворота грыжевые 255
Выпадение прямой кишки 586
г
Гастринома 442
Геморрой 561
Гипергидратация 117
Гиперкалиемия 120, 122
Гиперкальциемия 123
Гипермагниемия 124
Гипертензия
билиарная 451
жёлчная 185
Гипокальциемия 122
Гипомагниемия 123, 124
Грыжа 255
живота 255
Литтре 269
Рихтера 269
Грыжи
бедренные 296
Предметный указатель <> 601
белой линии живота 283 Колит язвенный неспецифический
внутренние 257 534
наружные 257 Кровотечение
паховые 285 гастродуоденальное 231
послеоперационные 284 панкреатическое 452
пупочные 280
Лечение пробное 52
Дегидратация 117
Делирий послеоперационный 154 --
Детализация анамнеза 39
Диагноз Метастаз
дифференциальный 43 Вирхова 502
клинический 47 Крукенберга 503
предварительный 42 сестры Джозеф 503
тактический 48 Шницлера 503
Дивертикул Меккеля 173 Мешок грыжевой 255
Мондора триада 209
Ж
Жалоба основная 39 И
Желтуха 473
.-. Наблюдение динамическое 51, 52
гемолитическая 473 г
.-. Нарушение мезентериального
механическая 473 ^J
лпс кровообращения 324
паренхиматозная 475 тт
Нарушения метаболизма 109, ПО
■ - Недостаточность
энтеральная 379
Инсулинома 441 Непроходимость
Интоксикация эндогенная кишечная 300
379, 381
Инфильтрат аппендикулярный О
175, 176
Исследование физикальное 40 Оболочки грыжи 257
Олигурия 153
!• Оментобурсит 211
Операция диагностическая 52
Кисты поджелудочной железы 464 Опухоли
Колика большого сосочка
печёночная 415 двенадцатиперстной кишки 443
двенадцатиперстной
кишки 444
желудка 490
нейроэндокринные 438, 440
Острый живот 391
п
Панкреатит
интерстициальный 208
острый 202
отёчный 208
хронический 446
Панкреонекроз
геморрагический 208
жировой 208
инфицированный 208, 211
Парапроктит
ишиоректалъный 575
острый 571
пельвиоректальный 576
подкожный 574
подслизистый 575
хронический 577, 578
Перитонит 367, 370
вторичный 374
местный 174
первичный 373
разлитой 175
распространённый 375, 376
спонтанный 374
третичный 374
Перфорация язвы 223
Пилефлебит 180
Повреждения
живота 338
Полиурия 154
Псевдокиста
инфицированная 208
Р
Рак
желудка 490
поджелудочной железы 430
толстой кишки 519
Риск операционный 134
с
Свищи жёлчные
внутренние 428
наружные 429
Сепсис 89
Симптом
Бартомье-Михельсона 166
Воскресенского 167
кашлевого толчка 262
Кера 188
Кохера-Волковича 165
Мейо-Робсона 210
Мерфи 188
Мюсси-Георгиевского 188
Ортнера 188
Раздольского 166
Ровзинга 166
Ситковского 166
Щёткина-Блюмберга 167, 188
Синдром
дыхательной недостаточности
152
миокардиальной
недостаточности 149, 152
Мэллори-Вейса 238
полиорганной недостаточности 60
расстройств микроциркуляции 152
системной воспалительной
реакции 83, 84
холецистокардиальный 188
Содержимое грыжевое 257 острый 185
Стеноз прободной 191
пилородуоденальный 247 флегмонозный 187, 189
Холецистостомия 199
у лапароскопическая 200
открытая 200
Трешина анальная 566 Холецистэктомия 197
Установление диагноза 31, 34, 38 Централизация кровообращения 56
Ф ч
Флегмона некротическая 211 Чаши Клойбера 313
X Ш
Хирургия 13 Шарко триада 192
Ход копчиковый эпителиальный Шок 54
595 гиповолемический 80
Холангит гнойный 192
Холецистит ^
бескаменный 187
гангренозный 187, 190 Эмпиема червеобразного отростка
катаральный 187, 188 164
Подписано в печать 01.12.05. Формат 60х90У16.
Бумага офсетная. Печать офсетная. Объем 38 п.л.
Тираж 5000 экз. Заказ № 3015.
Издательская группа «ГЭОТАР-Медиа».
119828, Москва, ул. Малая Пироговская, 1а,
тел./факс: (095) 101-39-07,
info@geotar.ru, http://www.geotar.ru
Отпечатано в ОАО «Типография "Новости"».
105005, Москва, ул. Ф. Энгельса, 46.
ISBN 5-9704-0152-8
Учебное издание
ХИРУРГИЧЕСКИЕ
БОЛЕЗНИ
1том