Текст
Н.Я. Турова
Неорганическая химия в таблицах
высший химический колледэ/с Российской академии наук
Москва 1997
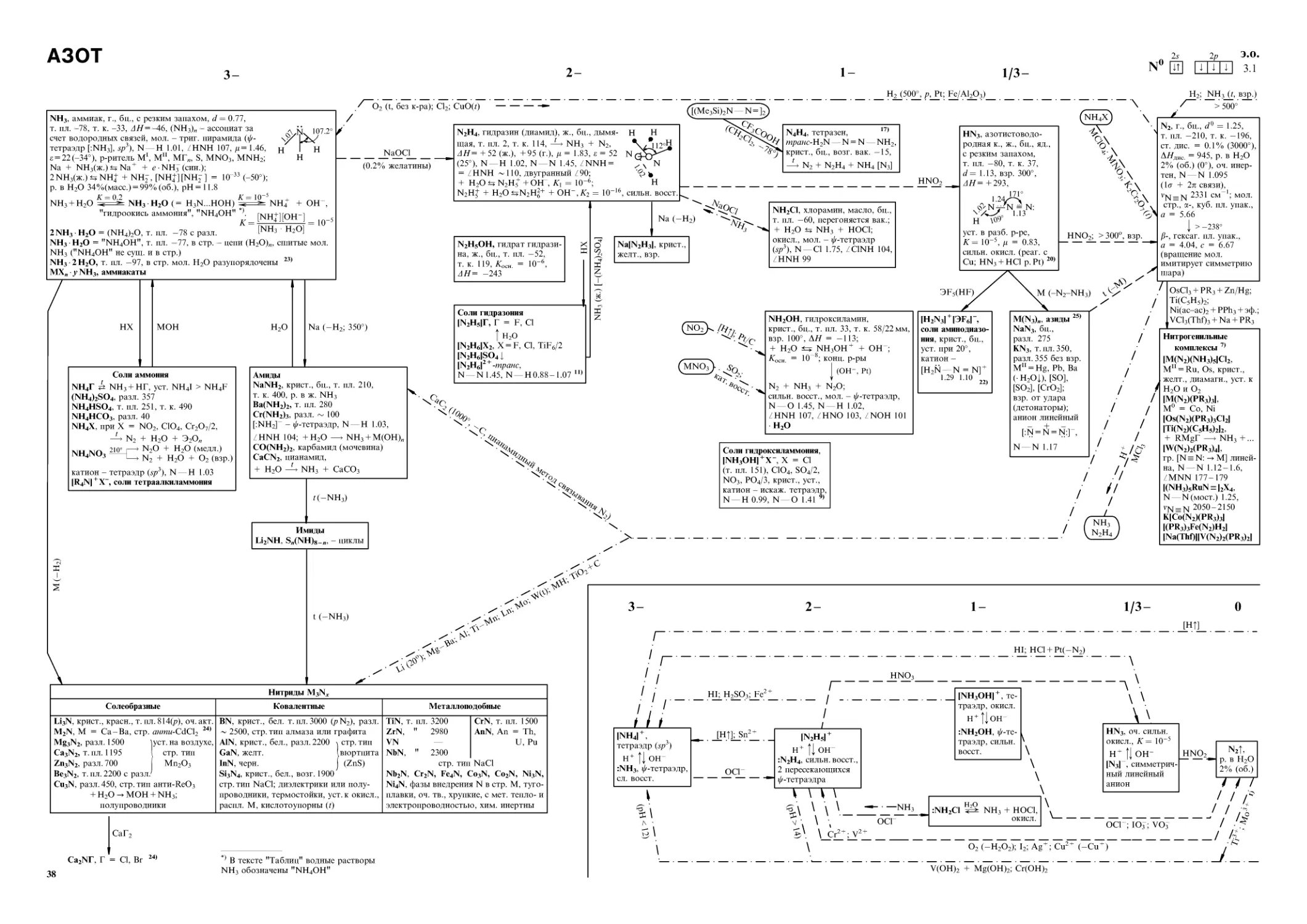
ГАЛОГЕНЫ, АСТАТ
1-
Фтор F°
Образование At при радиоактивном распаде:
238и ... 218р0 +031% 21|At ('’RaAt'’) __
“ ~2с
У U ... 28273Fr 21221Х0 2819 At ("AcAtl") ...2НРо 0-0005 >о ^/At ("АсАШ")
10“4 с
232Tb
90 1П
Г А 54 с
284Ро (Ш4% 2ЫА( (iiThAtn) Р 3 • 10-4 (
Синтез: 283Bi (а,2«) 2OAt 4 (Сегре, 1940);
7.2 ч. а(40%)
(отгоняется от Bi) 51)
*7997Au Clc, An) 28°55At 2У
------------------------25 мин--------------------
F
(HF)„, ассоциаты за счет водородных связей, в г. (п = 1 — 4), в ж. (п > 4), в стр. -зигзагообр. цепи:
3HF^.)«=>H2F+ + HFJ
K= KT10
Г алогеноводороды
d т. пл. т. к. ст. дис. при 1000° дя н—г М (г.) £ (ж.) р. в Н2О Конц, азеотропа сН2О, масс. % (<7 20) т. к. азеотропа ст. дис. 0.1 н. р-ра,% НГ лН2О HF г., бц., 0.92 -83 19.5 10 13 -271 1.00 1.91 84 (0°) р-ритель для Н2О, МГ, MNO3, M2SO4 40 плавиковая фтористо- 35 (1.12) 120 9 « = 0.25, 0.5 ( = [H3O] + [HF2D; 1 ( = [H3O] + F-) НС1 с резким запахе 1.64 -112 -84 10 2 -92 1.27 1.08 4.6 р-рите 35 соляная хлористо- 20 (1.10) НО 93 1, 2, 3, 6 ( = [Н14О6]2 + С- 12) 52) НВг эм 3.64 -84 -67 0.5 -34 1.41 0.79 6.3 (-80°) ли для Г2 55 броми-сто- 48 (1.50) 124 93 2, 3, 4 HI 5.79 -51 -35 Q,) 33 + 26 1.62 0.42 Q Г РГ 70 масс. % иодистово-дородная к. 57 (1.71) 127 95 2, 3, 4
SbF5
H2SO4
Хлор Cl°
Бром Br°
Иод 1°
2s
I 3s I 4s I 5s I 6s
У ОТ
Зр
У
5p
3d
Ad
5d
Э.0
4.1
3.0
2.8
2.2
ан. окисл.
6d
6p
Астат At
1.9
1
— H2(Pt);
H2S2O7 + SO3; AgX + Py(Agll)
o\
<rA_Hg0(CC14’ -Н§2ОС121), ryF/ Bi2O3(-BiOCll)
О
^\9
j'-t
Г2 С12 Вг2 I2 At
г., светло-желт. г., желто- ж., темно- крист., черн. мет., лету-
зел. красн. ч <
с резким запахом
<7(20°) 1.69 г/л 3.21 г/л 3.21 г/см3 4.94 г/см3
т. пл. —219 -101 —7 113.7 337
т. к. -188 -34 60 183 302
АЯДИС =158 243 192 150
312(ж.)Д
У +13
р. в Н2О, масс. % - 0.68 3.5
0.03
хор. ] э. в RH, RF, CS2, СС14
(фиол. р-ры);
в донорных
р-рителях
(кор.)
В угр. — мол. Г2; к. ч. Г 1 (= 8-7)
/Р, куб (изостр. О2) ромб.
а = 6.67 а = 6.29 6.74 7.26
т >-228° b = 4.50 4.55 4.79
а-, монокл., а = 5.60, с = 8.21 8.76 9.80
b = 3.28, с = 10.01, Стр. Г2
0 = 134.7 1
Г —Г 1.42 (г.) / 1.99 2.28 2.67
JMOH_(_MF)
C1+[SO3F] , ж., желт., т. пл. —84, т. к. 45 [ВгРу2]+Х-, [1Ру„]+Х-, п = 0; 1; 2; X = NO3, СЮ4, NCS, СН3СОО, HSO4, SO3F, HS2O7, IF6, I3 (= "I2-2Py"); I+- сип. ион, парамагн.
(p4, 2 неспар. эл.) 62)
р? -
of2 г., бц., яд. с запахом О3 т. пл. —224 т. к. —145 разл. 200 АЯ +24 р. в Н2О 6.5 + Н2О -U HF + О взр. д = 0.3 УГЛОВ1 О—Г 1.39 /ГОГ 104 ОЧ. СИЛ! С12О 53) г., желто-оранж. с запахом С12 -121 3.8 ж., взр., бур. Ж С12 + С1О2 + 80 99 об. % хор. р. в СС14 1.7 ле мол. 1.70 111 >н. окисл. 2Н2О т. пл. —36 Вг2О 39) ж., кор. — 17 с разл. -40 Н Г2 1.86 114 12О 4 Ру крист., оранж. + О2)
H2O
-H2o
|H2o
[TeF5]OBr
HOF НОС1 НОВг HOI
фторно- бц., летучее хлорно- конц. в насыщ. бромно- иодноватистая к.
в-во р-ре Г2 10“2 I03 10 5М
т. пл. —117 20° -У HF + О2; макс. конц. 20% (желт, р-ры) 30% оч. разб. р-ры (зеленоват.), стабилизир.
+ Н2О— HF + Н2_ neper, вак. 30° иодом
о2 + 1 —>13 + 0; угловь О Н -го 1.44 /ГОН ОЧ. СИЛЕ Хк = ю-8 ге мол. 0.96 1.69 103 а. окисл. 10“9 10-11 Косн = ю-10
MOH
H2CO3 (K, = 10~7)
МОГ, гипогалогениты
Галогениды
MF • HF = M[HF2], М = Na, К, NH4 анион линейный [F—Н ... F] 1.00 1.27 М[НС12], M = Cs, [NR4], разл. Н2О, М[С1(НС1)4] 50) [NR4][HBr2], оч. неуст. [NR4] [HI2]
гвию Н2О ионные стр. LiFJ. NaF KF NH4F CaF2 A1F3 T. ИЛ. 870 997 -HF 857 2H2O; «HI возг. 1419, "флюорит" 1040 NaCl КС1 NHiCl СаС12 T. ИЛ. 801,"галит" 776,"сильвин" 335, возг., "нашатырь" 782, иН2О, п = 1, 2, 6 NaBr КВг СаВг2 T. ПЛ. 755, 2H2O 735 760, лН2О « = 3,6 Nal KI T. ПЛ. 662 686
Уст. к дейт полимерные стр. UF3 игд uf5 1495 1036 287 (a), 348 (p) MgCl2 А1С13 VC12 VC13 714, -6Н2О, "бишофит" 180, возг., • 6Н2О 1350 500, разл., -6Н2О MgBr2 NbBr2 NbBr2,6 NbBr4 710, -6H2O разл. возг. 300, возг. Cal2 Mgl2 Sn I2 783 633, разл. 320
Р. в орг. р-рителях; + Н2О —> —НГ + Э(ОН)„ мол. стр. UF6 XeF6 OsF6 MoF6 SeF6 PF3 56, возг. Д крист., 49 Улету- 33 Зчие 17.5 ж. —47, возг. э -152 Jr. VC14 GeCU PC13 BC13 <-20) —50 У ж. -94 J — 107, г., т. к. 13 NbBr5 (AlBr3)2 PBr3 268 98 —40, ж. Snl4 (A1I3)2 PI3 145, возг. 191 61
п = 2, 3, 4 50)
Cs[(XeOF4)3F], в центре - тр-к [F*Xe3], F* Хе 2.63 50); МГ л МОН, М = Br, I 50)
о MOF
M = [NO], [SF5], [CF3], [TeF5]
Cl2 5.75 H2O (8:46) t. пл. 9.6 клатратные соединен стр. льда ("хозяина") 6 больших (Z> = 5.9/ (Z> = 5.2А) полости, чают С12, но не вмеш м it-. > Т. ПЛ. -ж—, гостя ). > Г2 Вг2 • 72/3Н2О (fX ♦ (Г^ । (6:46) 5 с разл. *1®! ия включения. В 1 zjrk Т /рЪ на 46 мол. Н2О - t XJ' 1 0 и 2 малых '+)*»1[ц Последние вклю- Т ают Вг2 (мол. 1 + Н2О<±НГ + НГО А А
LiOCl Н2О, уст NaOCl, взр. 70°, иН2О, п = 5, 2.5 (т. пл. 24 и 57) (р-р NaOCl + NaCl -"лабарракова вода") КОС1 (р-р КОС1 + КС1-"жавелева вода")
Са(ОС1)2, • 3 Н2О (т. пл. 86) 1/ЗСа(ОН)2 хН2О, "белильная известь" (—Хо2 + СаС12)
Ва(ОС1)2 2Н2О
NaOBr иН2О, п = 5, 7 КОВг ЗН2О, MOI изв.
крист., св.-желт. толь-
^Лмвг + МВг-о3 (др. соли не изв.) ко в р-рах
ОЧ. СИЛЕН. ОКИСЛ.
(C6H10O5)„ m I2, сип. канальное соединение включения (I2 входит в каналы амилозы)
C12O
Q
C1F
BrF3
AtBr Atl CsAtI2
r2 • иЬ, Г = Br, I; L = R2O, ROH, R2CO, R„NH3 „, R2S, C6H6 и др. донорные мол.
<5- <5+
[Г — Г <—:L], "комплексы с переносом заряда", линейные мол. (</<-триг. бипир.)
Pb(NO3)2 LiNO3 •
[NO2] of г., бц. т. пл. —175 т. к. —46 АЯ = -26 -U no2 + о2 + f2, 29) О —F 1.42 'TNO3" 36) [NO2] ОС1 ж., бц. -107 22 + 26 + NaOH -► NaNO3 + + NaOCl BrONO2 мол. плоская О о— / '0
6
3 +
/zv-УФ (—Cl2); О3
6 + (?) ИЛИ ”6 + ”
7 +
Фториды кислорода
O2F2
O3F2, "фторид озона"
O4F2, "фторид оксозона1
O5F2, O6F2
(см. Табл. "Кислород")
Вг2О3, желт., тв.
Г2
++>
СА
С1О2 53) г., желто-бур. <7= 1.64, т. пл. -59, ж., красн., АН +104 взр. димер в СС14и стр., ц = 0.78, хор. р. в Н2О, парамагн. СГ 118° ХО 6Н2О Вг2О4 2) крист., св.-желт., разл. 40, Вг2О + Вг2О5 + 54 в состав Вг2О4 входят: О2ВгОВгО (I форма), О2Вг — ВгО2 (II форма) i2o4= [IniO] + [ivo3]-крист., желт., -ЯЯ 12 + 12О5 (Ю2),„ в стр. - цепи -1П1—О —IVO2—О ..- 1ш —О 1.93, Iv—О 1.77-1.85, 14О9 (?) 6,37)
Вг2О5, ТВ., бц., полимер 45)
• 3 EtCN, т. пл. —20 5.3 +
Вг3О8 (?)
12О5 крист., бц., на свету темнеют, возг. с разл. 180 (—> 12 + О2), АЯ = -184
Яг н+ т(Г|(Ю сг Я)
Н2О (Тгг-В)
Н2о (-О2)
-Н2О (240°)
Н13О8; М13О8, М = К, Rb
-Н2О (110°)
НС1О2, хлористая к., быстро разл. в разб. р-ре (- HCI + НС1О3 + С1О2), К= 10“2, ОЧ. СИЛЕН, окисл.
•’ О
о
к
• о
• о
• О
о?.
» у
О
и ад
НС1О3
хлорно-
сущ. только макс. конц. 40% 40° взр.
СИЛЕН.
ОЧ. СИЛЕН, окисл.
-ЯЯ С1О2 +
НВгО3 бромно-в р-ре 50%
(НЮ3)„ йодноватая к., крист., бц., d = 4.63, т. пл. ПО с разл., К = 10“1, в р-ре п = 2 — 3, X I Zo
Хлориты
NaClO2, ЗН2О, т. пл. 37
Са(С1О2)2 4Н2О| Ва(С1О2)2
AgCIO2[, Pb(CIO2)2 .
желт., не окисл.;
-U MCI + MCIO3, взр., [:С1О2]“ - ^-тетраэдр, ZOC1O 108-111, С1—О 1.56 38)
Бромиты LiBrO2, • Н2О Ва(ВгО2)2, бел. порошки,
МВг„ + О2, + Н2О —МВг-
к.
О-Н
t (-О2)
U
МГО3, галогенаты
+ М(ВгО3)„, анион i//-tct-раэдр, Вг О 1,82,
/>•
[Ю]+х-
X = HSO4, SO4/2, HS2O7, SO3F, NO3, BF4, AsF6, "соли иодила", крист., желт., парамагн. (р2), в стр. - спирали (I О )то, I — O 1.97, I —OS 2.3-2.4, ZOIO 95, ZIOI 127 6)
т. пл.
NaClO3 262 с разл.
КС1О3 368, разл.400 "бертолетова" соль
Са(С1О3)2, 2Н2О у Ва(С1О3)2 414, Н2О/ AgClO3 230, разл.270 MCI +МС1О4 MCI + о2
т. пл.
381
343 с разл.
разл.
Ва(ВгО3)2 260 с разл., Н2О
NaBrO3 \KBrO3
AgBrO3
NaIO3 (в "селитре")
КЮ3 (изостр. MNO3)
МЮ3 иНЮ3 (КН12О6,
NaH2I3O9)
AgIO3[, бел.
Ва(Ю3)2 —> Ва5(Ю6)2 +
(МпО2)
ГО /ОГО
г Я?
1.45-1.50 106
Ln(IO3)3l, Zr(IO3)4 .
Th(IO3)4[, бел., не р. в
HNO3
окисл. - только в распл. [:ГО3] - ^-тетраэдр (sp3)
1.78
112
[Вг]3+Х3, 36) X = NO3 (крист., бц.), SO3F (крист., оранж., т. пл. 59), OSeF5
[Br(SO3F)2]
Х“
[1]3+Х3, 36)
X = NO3 (разл. >0), РО4/3, С1О4, OTeF5, SO3F, СН3СОО, SO4/2, крист., бц. или желт., + Н2О —> 12 +
+ НЮз + НХ
[I(SO3F)2]+X-
1.78-1.82
97 или искаж. окт., 3 связи I — O 2.58-2.77
С1О3, ж., красн., дымящая, т.пл. 3.5, т.к. 203, АН = +156, взр., 20°
С1О2 + О2, мономер, парамагн., в ж. и р-ре СС14 -димер, в стр. -[С1О2]+[С1О4Г; С1—О 1.41-1.47; + HF — C1O2F +
+ НС1О4;
+ МС12 —>
М(С1О4)2 +... M = Cu, Са, Ni 60)
V VII 56) 1гО6 = [Ю2][Ю4] крист., св.-желт., тигр., разл. > 100°, диамагн., + Н2О
НЮ3 + Н5Ю6
С12о7, масло, бц., т.пл. —90, т.к. 87, взр. 120, d = 1.86, (уст. >С1О3иС1О2), АЯ = +275, р. в СС14, ц = 0.72, мол. - 2 тетраэдра с общ. вершиной, окисл. ср.
Н2О (взр.)
Ю(ОЭГ5)3
1(ОЭГ5)5, Э = S, Se, Те, мол. - тетраг. пирамида ’
-Н2О (конц.
H2SO4, Z)
Н51О6 + НЮ3
Иодаты (VI) 57)
М2Ю4, крист., парамагн. (х1), + Н2О — N а I -
. ±.^1__________
ан. окисл.; F2 (ОН )
(1с1О2] + [М(С1О4)4]У
силы
Н2О (медл.)
-Н2О 63)
(Р2О5; олеум)
НС1О4
хлорная
эл-лиз (-30°)
НВгО4 2Н2О 55) иН2О,и= 1,2.5, 3 52)
ж., бц., дымящая подвижная, d = 1.77, т. пл. —101, т. к. 16/18 мм, ЗНСЮ4*±С12О7 + НзО[-С1О4] 100% (взр.) т. пл. 50 К = 38, окисл. в конц. р-ре
или при Z, азеотроп -
72% НС1О4, масло, т. к. ozSA'sO
111/20 мм U /' O
H.
Ю
I-63 ^106°
H2SO4 (конц.)
НЮ4 иН2О 56) бромная
макс. конц. 83%, уст.
<55%, летуча (вак. 100°) <НС1О4, окисл.
> НС1О4
H2SO4 (95%)
[I(OH)6] [HSO4] 3)
t (—Н2О, —О2)
O'v
М2О„ • /иГ2О7, пергалогенаты
4) т. ПЛ. 7 43) 5)
ЫС1О4 247 ЗН2О NaClO4 482 с разл. • Н2О KCIO4 610 с разл. МВгО4, М = Li-Cs, р. Li>Cs, NaH4IO6 • Н2О, разл.175^ = Na(H3O)[I(OH)3O3] Na2H3IO6
Ва(С1О4)2 505 ЗН2О AgClO4, разл. 486 М(С1О4)„, М = Al,Ga,Fe и др. ГС1О4, г = С1, Вг, I [Н14Э]С1О41, Э = Р, As. МС1О4 -Я МС1 + о2 Mg(ClO4)2 MgO + Cl2 + O2; уст. Li<Cs, ——> МВгО3 + + о2 уст. < МС1О4 M3H2IO6, М = Nal, Ва/2 Na2O2|| Н2О Na5IC>6, разл. 800 Ag5IO6l > К4Н212Ою; Ca2I2O9 KIO4I; NaIO4 MO2 If H2O ) орто- димезо- мета-
СИЛЕН, окисл. только в распл. и МЮ4 M3IO5 лН2О; Ag3IO5 , PbHIO5 Ag2HIO5 1, O2 + ... мезо-> перйодаты
[ГО4]“ - тетраэдр (sp3), Г — О ~ 1.44(d), -1.60 (Br), 1.79 (I); [IO6]3- - окт. (хр3^),
I — О 1.85; [Ю5р - тетраг. пирамида (sp3d), ] сетка окт. [Ю4(ОН)2]; [I2O i о]6 - 2 окт. с общ — О 1.78; в стр. M3IO5 • и . ребром, I — О 1.81-2.02 н2о-
7
ИНТЕРГАЛОГЕНИДЫ И ОКСОФТОРИДЫ ГАЛОГЕНОВ
\jn- 0 1/п +
1 +
3 +
C1F, г., бц.
т. пл. —156
т. к. —100
АЯ -50
/л 0.65
Г—F 1.63
BrF, ж., красн. 20°
—Br2 + BrF3
-33
20
—42
1.29
1.76
IF, порошок, красн. -14°
12 + if5
сильнейшие фторагенты
+ Н2О —> Г2 + О2 + HF
• Ру, уст. | • Ру, уст.
F2(t)
М+[Г„] , полигалогениды 30)
М+ = NH4, K-Cs, [R4N], [Ph4As], [PBr4], [Ln (капролактам)6] /3
|Me4X|CI3
RbBr3, разл. 140
CsBr3, т. пл. 180
[PBr4]Br3
CsBr5, крист., красн.
К13Н2О, крист., бур., т.пл. 38, разл. 225
Csl3, т. пл. 207
К15 2С(,Н(1: Са[15]2 7Н2О
Rbl7 4СбН6
Rbl9 4СбН6
Cs2I8, крист., фиол.
[Et4N] [I(I2)„], « = 2,3 4
[Н(теобромин)]4 [116] , анион центросимметричный (13 12 1з_)2
V г.
[Г3] , линейные анионы (</<-триг. бипир.)
т. пл. т. к. АЯдИС. Г—Г (г.) f2 -219 -188 158 1.42 С12 -101 -34 243 1.99 Вг2 -7.2 58.8 192 2.28 12 113.7 183 150 2.67
Г2
M[C1F2], M[BrF2], M[IF2],
M = K-Cs, разл. 230, ~ 64)
анионы - линейные ’
Br Br 2.5 (Rb)
2.4, 2.9 (PBr4)
Rb[I(BrCl)]
I—I 2.9 (M = Ph4As)
2.8, 3.0 (Cs)
2.8, 3.1 (NH4)
Cs[I(IBr)| (не сущ. аналогичных солей К и Rb) - используют для очистки Cs
[Cl—I—Br] , I — С1 2.38, I — Вг 2.50
Уст. МГГ^ возрастает по ряду Li<Cs<R4N, р. в Н2О падает;
СС14, эф., бзл. ускоряют распад MTTJ, —>МГ' + ГГ' (экстр. ГГ')
п»г
[С13]+Х- 7) |Вг„| + Х“,
п = 2, 3, 5; красн. [1„]+Х-, п = 2-5, черн.
[12С1] +Х , син. или красн.
|Вг2С1| + Х“, |I3CI2| ‘ X ,
X = А1С14, HSO4, SO3F,
Sb2F! 1, SbF6’,
Sb3F16, IF6 i3+, i? , Br2+, поликатионы, Г —Г в [Г2] + 2.13 (Br), 2.56 (I); [13]+- угловые, I —I 2.66, ZIII 102; [I4]2 + - прямоугольник,
I —I 2.57 и 3.26; W+=
I27I
сщ I Brl3 57)
Мол. - Т-образные (|//-триг. бипир.)
Cl—I 1.58, I Br—I 1.73,
1,70 |1,81
ВгС1 (*± Вг2 + С12) ст. дне. 40% (20°), г., желт. т. пл. —54 т. к. 5 с разл. АЯДИС. + 15 fi = 0.57 Г —Cl 2.14 + Н2О НС IC1, иглы красн. (а), кор. (fi) 27 (а), 14 (fi) 97 с разл. -33 0.65 2 IC1 (ж.) 1+ +1С12 2.32 в стр. - зигзагообразные цепи мол. 1 + г2 + нго3 хлор- и иодагент в орг. синтезе
H[ICI2], Я=10“3
Cs[BrCl2], M[IC12], M = K (разл. 215), крист, желт., Rb, Cs /т ид 238, разл. 290) Т. ПЛ. 205, гтл тут 1
разл. 150 [РуН1’ [РС141’ КРИСТ-’ оранж.
анионы [:ГС12] - линейные (|//-триг. бипир., sp3d), I—Cl 2.55 9)
[R4P][I(N3)2]; Na[I(CN)2] 2Н2О, анион линейный, I — С 2.31 10)
F(SO3F) - см. Табл. "Сера".
/ /С12
КС1О3; К!°3
I + НС1 (конп~)^
5 +
С120 (—C1F); IF5 (110°)
BrO2F
50°
—> BrF3 + Br2 + O2
бромил-ж., бц.
-9
АЯ = -247 17)
HX
[C1O2]+X“, X = AsF6, SbF6 (т. пл. 235) Sb2FH(58), SO2F(58), SO3F, PtF6, [A1(C1O4)4],
Cs[C1O2F2]
\г7
[BrO2]+X-
X = NO3, AsF6, SbF6 44)
io2f
иодилфторид крист., бц.
катионы угловые (</<-тр-к), С1 —О 1.31, ZOC1O 102 32) |________________________
[Ю2]+Х-58) X = AsF6, HSO4, SO3F, катион - полимер
ZFC1O 102 39,60)
BrK
of2 (-cif5)
cio2f
хлорил-г., бц., взр.
т. пл. —115
т. к. —6 оч. акт.
+ Н2О —>НСЮ3 + Н-
F
в ж. и стр. - мол. </<-тетраэдры [:ГО2Р],
С1—О 1.42, Cl—F 1.70, ZOC1O 115,
C1OF3
хлорозил-
ж., бц., т. пл. —42, т. к. 29, разл. 200, фторагент (Z)
F
BrOF3
бромозил-ж., бц., уст.
20°
KIO3
K[BrO2F2], крист., бц., разл. 87 41)
M[IO2F2], м = к Cs( • 1/3 Н2О); I F 2.00, 1—0 1.77, ZOIO 100, + Н2О МЮз + 2HF 40) р| О анионы - дисфеноиды (</<-триг. бипир.) 14)
при
IOF3
иодозилфторид крист., бц., АЯ= -552,
IF5 + I2O5 18)
мол. - </<-триг. бипир. [:FOF3] (дисфеноид) ' I—F 1.7-1.9, I О 1.82, ZFIO 98
[C1OF2]+X“, X = BF4, AsF6, NiF6/2, PtF6, соли дифтороксохлорония, катион -</<-тетраэдр [:C1F2O]+ 16)
(200°)
T. ПЛ.
C1F5 49)
г., бц.
-93
-13
35)
53)
HF (-MHF2)
мго3
разл.
АЯ
-238
|BrOF2| + X“
X = BF4, SbF6
16)
(200°)
BrF5
ж., бц.
-61
41
400
-460
1.51
“ Р, 3>F
M[C1OF4], M[BrOF4], /j U<7
M[IOF4], M = K-Cs, ани- F2—Tp 1/72 оны - </<-okt. [:FOF4] 16) I
(20 х воспл.)
MNO3 (-FNO2); MF + N2O5
IF5 31)
ж., бц. 9.4 104 400 -883 f г. 2.18 1 ж. 3.67 37.2
F
F
F
— 8
2ГР5(ж.) [ГР4]+ + [ГР6]-
в г. - мол. - тетраг. пирамида (</<-окт., spid1 ат. Г - ниже плоскости осн.
1.58
1.67 86
сильн фторагенты
Г — F (акс.) Г — F (экв.) ZFFF (акс.)
оч.
1.69
1.77
85
1.81
1.87
83 сл. фторагент
[C1F4]+X“, 42) I [BrF4] + X“, I [IF4]+X“,
X = AsF6, SbF6, Sb2Flb Sb4F21, PtF6 бц., летучие в-ва 20);
катионы - </<-триг. бипир. (дисфеноиды) [:ГР4] + , Г —Р(акс.) 1.91 (Br), 1.84 (I); Г —Р(экв.) 1.76 (Br), 1.77(1); ZFFF 160(акс.), 92(экв) 19)
| [Br3F14] + [Sb2F11]- |
M[BrF6]
M[I3F16], крист., бц.
1 Г <-2IF5)
M[IF6]
M = K-Cs, Xe” + , крист., бц., анион -ф-семивершинник [:IF6] (sp3d3) 21)
КСЮз
мго4
7 +
нго4
((NF4)(C1O4)
[IVOF3 IviiO2F3]2 15)
F2 (270°)
C1O3F, "перхлорилфторид", г., бц., т. пл. —148, т. к. —47, разл. 400, АН = —21, ц = 0.02, хим. инертен, окисл. (Z), мол. - тетраэдры, Г—О 1.40(С1), 1.58 (Вт), Г — F 1.62(С1), 1.71 (Вт),
/ОГО 115, ZFFO 101-103 35)____________________________________
BrO3F, крист., бц., летучи, АН = +138, акт. > CIO3F, не pear, с SbF5 22)
IO3F, крист., бц., разл. 90
[С1О3]* |О1-| = C1O4F 35’ 60) г., бц., т. пл. —164, т. к. —16, взр.
C1O2F3, г., бц., т. пл. —81, т. к. -22, C1O2F + F2, мол. - триг. бипир. (2 ат. О -экв.); + Н2О —> C1O2F + + HF (?) 23’24’35> (C1O2F3)„ IO2F3, иглы, желт., т. пл. 42.5, т.к. 147, оч. сильн. окисл., + СС14 СОС12, в стр. - цепи тетраг. бипир. [IOF3O2/2] 25’34) • SbF5, мол. - цикл. [Sb(F4)OI(F4)O]2 25)
[NO] [OF]
[C1O2F2]+X“, X = BF4, AsF6, PtF6, катион - тетраэдр, уст. > C1O2F3 24)
[IO2F2][SbF6], т. пл. 102 34’35)
ciof5
[C1F6]+X-,
X = AsF6, SbF6,
PtF6, крист., желт. 27)
<Р7
H[IO2F4], крист., бц., 7г 130° гл
т. пл. 36: -> О2, оч. сильн.
к. (~НС1О4); оч. сильн.
окисл.
+ Н2О —> HF + Н5Ю6
M[IO2F4], М = Cs, [Xe2F3], Хе/2, анионы - окт., цис- и транс-, Э.О. > 3.O.[OTeF5] 34)
CsIO4
юг5, ж., бц., т. пл. —15, мол. - окт., I—О 1.71 (акс.), I —F ~ 1.18 (экв.), 1.86 (акс.) 59)
.HSO3F
(ваз(Н2Ю6ъ)
IOF4(OF), крист., бц., т. пл. —33, уст. при 20°, мол. - окт. 35)
_КИ_2. (20")
[BrF6]+X“, X = AsF6, Sb2Fn, крист., бел., уст., оч. сильн. окисл., + О2 — [О2]+ + ... + Хе —> XeF+ 28) + Н2О —> ВгГз + О2 + ...
катионы - окт.
IIF61+X-,
X = AsF6, SbF6, AuF6, Sb2FH, сильнейший фторагент 48)
+о/
<97
|R4N||IOF6|, анион - пентаг. бипир., I — F 1.87 (5 ат. экв.), 1.82 (акс,), I —О 1,77 54)
Н2О; I2O5; SiO2; РОС13
IF7, г., бц., с затхлым запахом, т. пл. 6 (р), возг. 5, разл. 530, АН = —961, мол. - пентаг. бипир. (sp3d3), I — F 1.86(экв.), 1.79(акс.), ZFIF 72; сильн. фторагент (воспл. бзл.); + MNO3 — М F + FNO2 + +if5+o2 16)
M[IF8], M = Cs, [NO], [NO2]; +H2O^O2 35)
ГГ„' (Г' - более электроотрицательный галоген), п = 1,3, 5,7, оч. гигр. в-ва, диамагн., склонны к ассоциации, оч. сильн. окисл., реакц. способность падает в ряду: C1F3 > BrF5 > IF7 > C1F > BrF3 > IF5 > BrF, т.е. акт. FF„ растет с увеличением п, а при одном п акт. падает по ряду: Г = С1>Вг>1; + Н2О НГ' + НГО(„ + 1)/2
9
1/3-
0
1 +
3 +
5 +
7 +
(HF)„, к. средней силы н+ ' ОН
бц. ионы
[:ГО2]- - угловые ионы (^-тетраэдры)
[:ГО3]-, триг. пирамиды (^-тетраэдры)
[ГО4Гтетраэдрические ионы
HNO3; Н2О2; С12(-НС1)
НС1О; S2O| (/)
10
ИОНЫ МАРГАНЦА, ТЕХНЕЦИЯ И РЕНИЯ В ВОДНОМ РАСТВОРЕ
О 2 + 3+ 4+ 5 +
6 +
7 +
[ТсН9] , бц. ион, сущ. при pH >11
/
о2
Тс
2.5 +
[Тс2С18]
кат.
' В°сст
+ КаТ ----•
°ССТ. (+г.
' ^О2)
[ReH9]2“, бц. ион, триг. призма с центрированными гранями (d5sp3), сильн. восст., сущ. при рН>11
-----— Re
+ Н+(—Н2)
HNO3; ц. в.
[ReO4(H2O)2] - 20)
11
МАРГАНЕЦ
Ионы марганца в водном растворе см. с. 11
1+ (rf6)
2+ (</5)
3 + (rf4)
3d
45
Мп, мет., серебристый, тв., хрупкий, т. пл. 1245, т. к. 2080, р. в разб. к., Н2О (/), ^0Мп2 + /Мптв = “1-19, парамагн; а-, куб. (тип a-Fe), d = 7.43, а = 8.91
(МпО2 + Ес2С^)
-пт
Р-, куб. пл. упак., d = 7.29, а = 6.30,
Мп—Мп 2.6
| 1079°
у-, куб. (искаж. пл. упак.), d = 6.37, а = 3.86
| 1143°
д-, куб. (тип a-Fe), d = 6.28, а = 3.08
Ферромарганец: ^70% Мп, ~ 20 % Fe, 6-7 % С, < 2 % Si, > 0.35 % Р, 0.03 % Si
В системе Fe-Mn сущ. тв. р-р вычитания "Зеркальный чугун" содержит 15-20% Мп Марганцевистая сталь: 12-15% Мп, 1-2% С, износоустойчива
Мп-бронза: 95 % Си + 5 % Мп
НМп(СО)5, ж., бц., т. пл. —25, уст. при 25°, сл. к., К = 10“2, окт. мол., Мп—Н 1.4, Мп—С 1.83 М[Мп(СО)5], М = М1, [GeBr3] + , [SnCl3] + , [R3Sn], диамагн., Хе = 18, анион - триг. бипир., Мп—Мп 2.48 (Ge), 2.73 (Sn) НМп3(СО)10(ВН3)2 Н3Мп3(СО)12, «
Na3Mn(CO)4,
крист., желт., разл. 320°
(СО)4Со—Mn(CO)5
[Мп(СО)5]2, крист., золотисто-желт., т. ил. 154 (р), возг. 50/10“2, р. в орг. р-рителях, перегоняется с паром Н2О, мол. -- кластер, ц = 0.98 Мп4(СО)16 МпТс(СО)14 17)
Ph3PAu—Мп(СО)5, Au—Мп 2.52 Ph3PAuCu—Мп(СО)5, Си—Мп 2.56 (СО)4Ге[Мп(СО)5]2, гр. [Мп—Fe—Мп] линейна, Fe—Мп 2.8
Mn2 + |Mn7(Thf)6(CO)l2|2, в анионе - цикл [Мп6] с ат. Мп в центре 36)
э.о
4d
От
Г2; N2O4
60°
СО + A1R
Мп(ОН)2;, бел., стехиометрич. состава, Аосн.2 = 10“4, ХК1 = 10“19, ПР = 10“13, р. в присутствии NH.T; стр. тип Cdl2, Мп—О 2.30, "пирохроит"
[Мп(СО)5Х], крист., диамагн., X = Г (бц., летучесть С1 < Вг < I, д » 3.2),
__ NO3 (св.-желт., р. в Н2О), NCS (золотисто-желт.), Мп—С 1.8-1.9
[Mn(CO)4X]2, X = R, Г, NO3, мол. - 2 окт. с общ.
ребром [Х2], Мп—С 1.87, Мп—Мп 3.74 Мп(СО)4Х Ру
[Мп(СО)6] + [А1С14]-хор. р. в Н2О [Mn(CO)4(PR3)2]+X-X = А1С14, PF6 3)
СО + Mg(-C); Na; RMgF
МпСэОд
MnOj.0_j.j3, "закись", крист., серо-зел., т. пл. 1780, ХН = —384, р. в к., распл. КС1, полупроводник, стр. тип NaCl, Мп—О 2.22, "манганозит"
возд. (ОН ) (мгнов.)
Мп3О4 = Мп^п[МппО4], — крист., черно-кор., т. пл. 1705, АЯ=-1385, "гаусманит", стр. близка *_ шпинели
(MnIV,Si)Mn2O4,
браунит"
Манганаты (II) 24)
М4[Мп(ОН)6], М = Na, МП/2 Na2Mn(OH)4, крист., красн.
Naj4Mn2C>9, стр. - тетраэдры и триг. бипир., Мп—О 2.08-2.11
М2Мп2О3; ВаМпО2
О2(>500°)
940°;
Нг(230о)
Мп2О3, "окись", крист., бур., АЯ = -959,
__ в куб. стр. - окт. [MnOg] (Мп,Ее)2О3, " биксбиит"
VO
250°, вак. V
Mn2(CO)8(PEt3)2, мол. - стр. аналог Мп2(СО)ю, Мп—Мп 2.91, PR3 — акс.
Mn2(CO)7(MeNC)3 2)
Mn(CO)„(:NO)(PPh3)4_„, п = 2, 3; мол. -триг. бипир.
[(OC:)4Mn(:NO)], крист., красн., т. пл. — 1, диамагн.*
[(OC:)Mn(:NO)3|, крист., зел., т. пл. 27,
разл. на возд., диамагн., Хе = 18, мол. - тетраэдр, Мп—N 1.72, Мп—С 1.95, N = O 1.17 2)
(OC:)7Mn2(:NO)2, крист., красн., разл. 140
K3[Mn(CO)3(CN)3]
M5[Mn(CN)6], крист., бц.
И
Мп7С3, 18)
+ Н2О — н2 + сн4 + с„н2„ + ...
Мп23С6, Мп3С (т. ил. 1520)
MojN, Mn2N, Mn3N2
Мп2Р, МпР, Li7MnN4
MnSi
[Mn(PPh3)5]2, крист., бц., летучи, р. в орг. р-рителях, разл. щ.
* В связи с отсутствием данных о заряде на NO-rp. здесь и
в дальнейшем степень окисления центрального атома вычислена в предположении (NO)0.
Mn(CIO4)2, 2Н2О, 6Н2О = [Мп(Н2О)6](С1О4)2, Мп—О ~ 2.18 23) MnSO4, крист., бц., т. ил. 700, разл. 650,21) • иН2О, п = г1 ("маллардит"), 6, 5, 4("илезит"), 3, 2, 1 ("ссмикит"), роз.
• (NH4)2SO4 • 6Н2О, соль Туттона, красн.; • K2SO4 • 4Н2О
MnSO3 иН2О, п = 1, 3 21)
MnS2O6 6 Н2О, р. в Н2О; MnSeO3 2Н2О; MnSeO4 иН2О, п = 2, 5 Mn(SO3F)2
Mn(NO3)2, • иН2О, п = 6(т. ил. 26), 3(-^-> МпО + NO2)
Мп(Н2РО3)2 12); NaMn(H2PO3)3 Н2О; МпНРО2 3.6 Н2О; Cs2Mn(PO3)4 12)
МпНРО4 • ЗН2О, мало р. в Н2О; Мп(Н2РО4)2 • 2Н2О, роз., р. в Н2О Мп3(РО4)2 • иН2О, п = 4, 7; NaMnPO4, "натрофилит" 2)
Мп5(НРО4)2(РО4)2 4Н2О
NH4MnPO4 Н2О -U Мп2Р2О7, т. ил. 1196
Мп5(РО4)2(ОН)4 12); Mn3(AsO3)2 . "армантит"
> 100°
\ МпСО3], порошок, бел., ---> МпО + СО2
\ ПР = 1О“10, "родохрозит" (малиновый шпат), стр. аналог СаСО3 Мп(НСОО)2 • 2Н2О; Мп(СН3СОО)2; • яН2О, п = 2 и 4, содержат мол. [Мп3(ОАс)6(Н2О)4] 20); МпС2О4, • иН2О, п = 2, 3 Mn2[SiO4], "тефроит"; MnSiO3, "родонит" (пироксен)
Mn|SiF6| 6Н2О, оч. хор. р. в Н2О
М1[Мп(С1О4)з1; [NO2][Mn(ClO4)3] 19)
[Ph4As]2[Mn(NO3)4] 13) [NO][Mn(NO3)3],
(= "Mn(NO3)2 • N2O4,r крист., желт.
Ba2[Mn(AsO4)2], анион - окт., Мп—О 2.11-2.18 и 2.56 13)
Мп(ОН)С1; Мп2(ОН)3С1, "кемпинг1
К2[Мп(С2О4)2] 2Н2О, в стр. - окт.
[МпО4(Н2О)2],
Мп—О 2.15-2.25 5) р2 (250°); XeF2
22) стр. тип т. пл. т. к. АЯ • и Н2О, п =
МпЕ2, крист., роз. рутила 930 1640 -847 4
МпС12, роз., тигр., "скачкит" CdCl2 650 1231 -481 2 (= [МпС14/2(Н2О)2], Мп—С1 2.5, Мп—О 2.15); 4 (= [МпС12(Н2О)4], окт., т. ил. 58)
МпВг2, крист., роз. Cdl2 698 — -377 4, т. ил. 64
Мп12, крист., роз. В г. - линейные мо Cdl2 л., Мп— 638 F 1.81 — -306 4
МпГ2 PR3, (Г = C1-I)
КМпЕз
M2MnF4, крист., желто-зел., анион - тетраэдр (sp3)
NaMnCl3; M2MnCl4 Rb3Mn2Cl7
Na6MnCl8; Na2Mn3Cl8
ММщСЬ; K4MnCI6 ("хлороманганокалит"), все комплексы - окт., Мп—Cl 2.48-2.59 4)
Cs3MnBr5; Rb2MnBr4 9)
О2(680°)
Mn(CN)2]
KCN
2.5 +
Мп2Г5
Mn(NCS)2, крист., желт., -4Н2О, зел.. (!), в р-ре - [Mn(NCS)] + MnS-xH2O(., аморфный, телесного цв., ПР = 10“15, р. в НС1; + О2 —> МпО2 • п Н2О + S (медл.)
J, —Н2О (время, t)
MnS, крист., зел., т. пл. 1615, ХН = —205, стр. тип NaCl, "марганцевый блеск" ("алабандин"), /?-, красн., а-, стр. тип вюртцита
MnS2, "марганцевый колчедан" ("гауерит"), крист., черн., куб., стр. тип пирита
MnSe, MnSe2, МпТе2, стр. тип пирита
Мп(С5Н5)2, дициклоиентадиенилмарганец, т. пл. 173, крист., кор., окисляется возд., парамагн., стр. аналог ферроцена
K4[Mn(CN)6] ЗН2О, крист., сип., единственный низкоспиновый комплекс Мп11 (d3sp3, 1 неспаренный эл.) M3[Mn(CN)5(NO)| иН2О 25)
M4[Mn(NCS)6]
Ba2MnS3, в стр. - цепи окт.
МпО(ОН), "манганит", "гроутит1 | 100°
Мп2О3 хН2О|, бур.
Mn(OH)SO4 2Н2О 26) MnO(SO3Cl), бц.
Mn2(SO4)3, порошок, зел., аморфн., разл. 300
Манганаты (III) 15) Са3[Мп(ОН)6]2 Na5[MnO4|; К6Мп2Ов Na4Mn2O5; ММпО2, М = Zn/2 ("гетеро-локит"), Са/2 ("марколит"), красн., анионы -тетраэдры или окт. Мп—О 1.86-1.95
• H2SO4 • 4Н2О, крист., красн.
• Cs2SO4 • 24Н2О, квасцы, красн.
Mn(SO3F)3, зел. 34)
МпРО4 Н2О; МпНР2О7 34)
Мп2(С2О4)3 2Н2О [Mn3O2(AcO)5(AcOH)i.5] 34) [Мп3О(АсО)6(АсОН)2(Н2О)](ОАс)
K2[Mn(SO3F)5], кор.
М3[Мп(С2О4)3] 28)
2.87 +
Мп8ОюС13, оч. уст. (ср. МпС13) 27)
МпЕ3, крист., красн., АЯ = -996, 600° А, ----> MnF2 + F2, в стр. - слои окт.;
2Н2О;
+ Н2О —> МпО2 + + Мп2+ + HF
МпС13, крист., кор., разл. —40 (—> МпС12), р. в абс. си.
• Dipy, красн., полимер из окт. [MnN2Cl2Cl2/2], Мп—Cl 2.25 и 2.50 28)
ММпГ4, Н2О М2МпГ5, Н2О
M3MnF6, М = K-Cs, МП/2, красн. крист., анионы - окт., Мп—F 1.82-2.15
NaMn3F10
М2[МпС15], крист., красн.
M3MnCU, Rb[MnC14(H2O)2] 28)
F2 (500°)
M3[Mn(CN)6], крист., кор.;
• 6Н2О, крист., красн., единственный низкоспиновый окт. комплекс Мпш (d'-sp3, 2 неспаренных эл.), изостр. M3[Fe(CN)6] 10)
K2[Mn(CN)5(H2O)| • KCN (?), диамагн. 6)
12
4 + (d3)
5 + (rf2)
6 + (d1)
7 + (d°)
3.3 +
[Mn12O12(OAc)16(H2O)4] 2 AcOH 4 H2O /
35) /
13
ТЕХНЕЦИИ,РЕНИИ
Ионы Тс и Re в водном р-ре см. с. 11
з+ (</4)
4+ (<73)
4d
ТС° итпп]
5d
Re° 111X | i 14. | X ]
6s
и
5p 5d Э.О.
ГГП ГТТ 1.4
6p 6d
rm гтт i.5
Синтез Tc:
42Mo (2D + , 2n) 43Tc (Перье, Сегрэ, 1937 г.)
20 ч
ТсО2 ReO2 26)
крист., черн., р. в конц. НГ, HNO3, Н2О2
925U —> 43ТС* —> 43ТС (/1-излучатель), выход 6% (в реакторе) 2•105лет
возг. 1000,
АЯ = -435, монокл., искаж. стр. рутила
++m Re + Re2O7, АН = —446, а-, монокл., стр. близка рутилу; /?-, ромб., в стр. - цепи окт. с общ.
ребрами, Re—Re 2.61 4)
(NH4MO4)
-Н2О
K2|MH9], крист., бц., уст. при pH Z> 7
Na2[ReH9], разл. 245 Ba[ReH9], анион - триг. призма с центрированными гранями (d^sp3), Re—Н 1.68, ZHReH 94
H[Re(CO)5], ж., бц., т. пл. 13, р. в орг. р-рителях
Na
Na[M(CO)5], 20)
Na3Re(CO)4, кор. в-во
MRe(PF3)5 [H3Re(PR3)2]2 H4Re2(M-H)4(PR3)4 H5Re(PR3)3,
мол. - додекаэдр, Re—H 1.70, Re—P 2.38 16’20)
H7Re(AsR3)2 [H8Re(PR3)2]2 [H7Re(PR3)2]
гексаг. пл. упак.
а
М —М
2.76
4.46
2.76
2.73
4.40
2.73
Тс Re
мет., серебристо-бел., темнеют на возд.
2.5 +
[Тс2(СН3СОО)4]Г,
Г = Cl, Вг, Тс = Тс 2.12 13)
£°МО//МТВ +0-47
d 11.5
т. пл. ~ 2200
т. к. ~ 4600
p. в HNO3, ц. в.
?7
ReCl3(NO)+ 2Н2О
[М(СО)5Х], X = Г, NO3 п
Tc2CU(PR3)4 40)
О,Г
Re2O3 • яН2О|, черн., р. в НГ (Z); + О2 —> HReO4
Н2о (-Н2)
М(ОН)4. кор.-черн., р. в к. и щ.
Hg[ReMn(CO)10]
HRe2Mn(CO)14
\ О,
21.0 3190
~ 5900 H2SO4 (Z), HNO3, (H2O2 + NH4OH) + 0.37
[ReCl(CH3COO)2]2, крист., оранж., + O2 —>
[RevOCl(RCOO)2]2 [ReCl2(CH3COO)(H2O)|, кластер (Re = Re 2.24) из двух пересекающихся окт. [ReCl2O2(OH2)Re] [Rer2(CH3COO)]2 24)
ReOCl, + Н2О — Н2 + Re(II);
500° Re + ReCl3 + ReO3Cl м>
Sb2O3
[Тс(СО)5]2 [Re(CO)5]2
крист., бц., мало. р. в орг. р-рителях, уст.
возг. 50/10 2
т. пл. 160 (р)
на возд.
трудно летуч т. пл. 177 (р), разл. 250, р = 1.18
изостр. [Mn(CO)5]2, M —M 3.02
Те—С1.90(акс.)| 2.01
2.00(экв.) |
С—О 1.20 (акс.), 1.12 (экв.)
[Re(CO)6]+X-, X = [AICI4], [С1О4], уст. к гидрол.
[Re(CO)3F]4, [М(СО)4Г]2, [М(СО)51], [TcXCOJijFCOHh,4 [Re(CO)3ClPy2] 14)
[Мп(СО)5]2
\(CO)5Mn—Re(CO)5, крист., желт., Мп—Re 2.96
3.5 +
[Re2OCl3(EtCOO)2(PPh3)2] - 2 OKT.
[ReO2/2ClCl1/2P], Rc = Rc 2.51,
Re — Cl 2.36 (конц.), 2.40 (мост.),
Re —P 2.45, Re—ОС 2.11, Re—Омост. 1.91
Cs2[Re2(HPO4)4(H3PO4)2], Re=Re 2.24 37)
ReOF2 37)
F2 (500°)
ReT5
ReCl2 4Н2О, крист., сип.;
2НС1 2Н2О, крист., зел.
\| [ = ReBr2(PR3)2]2 23) Rel2, крист., черн., диамагн. кластер.
2.5 +
М3[Тс2С18],
M = К, NH4, крист., черн., анион - стр. аналог [Rc2CI8]2 , Тс—Тс 2.13
(1 неспаренный эл.) 22)
[R4N]2[Rer5(NO)+],
крист., зел.,
Мэфф = 2.32 3)
ReCl3, крист., темно-фиол., т. пл. 257, т. к. 327, р. в си., эф., Diox, АН = —264, в стр. и г. - кластер [Re3Cl9], Re = Re 2.48, Re + ReCi
H2O| | - Н2О
[Re3Cl9(H2O)3] лН2О
экстр, эф.,
2СН3СООН
ReBr3, крист.,красно-кор., '''• АН = —163, в стр. - цепи
кластеров [Re3Br9]
Rel3, черн., в стр. - цепь ’ \ из кластерных тр-ков
[(Re3I3)I4I4/2] 38)
M3[Re3r12], М = Rb, Cs, Г = Cl, Br, анион [Re3T9]_ + ЗГ-конц.
M2[Re3rn], M = Cs, [R4As], Г = Cl, Br, анион аналог Re3Cl9, но у 2 ат. Re no ЗГ-конц. и у 1 ат. Re — IT-конц., 1 ат. Г над центром тр-ка
M2[Re3Cl10], анион [Re3Cl9] + 2С1-МОСТ M2[Re2r8], Г = Cl, Br, диамагн. кластер - тетраг. пирамида [Rer4Re] (d~sp-
Н2о
ТсСЦ, крист., красн., па-рамагн., в стр. - линейные цепи окт. с общ. ребрами, Тс—Тс 3.62
Ренаты (IV) ("рениты") Na2ReO3; Ca2ReO4 Ca3ReO5, крист., кор.
K4[ReO2(CN)4], крист., черн., легко окисляются
M4[Re2OCl10], крист., желто-зел., парамагн., [Cl5Re—О— RcCI5]4 -2 окт. с общ. вершиной, Re—О 1.86, ZReORe 180, (ср. RuIV!)
HRe3(CO)14 H3Re3(CO)12,
Re — Re 3.03,
Re—H 3.17
M2[HRe3(CO)12]
M2[H3Re3(CO)10] M[H4Re3(CO)10], кластер - тр-к [Re3], Re = Re 2.82, Re —Re и 3.1 20)
Re2(CO)„(PR3)10_„
[Re(CO)2(NO)(PR3)2] 19)
K5[M(CN)6], М = Re, крист., зел.
Re(PF3)5Cl
Re(CO)(NO)(PR3)F2 Re(NO)2(PR3)2I2 19)
[ReF3(CO)3]
[ReCl3(PEt3)]2, мол. - кластер из 2-х пересекающихся тетраг. пирамид [ReCl3PRe], Re—Re 2.22, Re —Cl 2.29 и 2.35 (транс- к Р), Re—Р 2.45
ReF4, крист., желто-зел., т. пл. 125, т. к. и 735, возг. 300
ReCU, крист., черно-кор., уст. в атм. N2, р. в ац., Thf, -U ReCl3 + ReCl5;
в стр. - цепи из пар окт.
(с общ. с гранями), связанных общ. вершинами -[Re2Cl7Cl2/2], Re —Re 2.73 ReBr4, крист., темно-красн.
Rel4, крист., черн.;
550° D. 1 .
-----> Rel3 + 12
[ReCU(PR3)3]
3.25 +
M2[Re4Br15] =
= M2[Re3n Br9]°[RelvBr6
квн4
ReCl5
(kReO4) ------
И
K2MF6, M = Tc, Re, крист., зел., анион уст. даже при pH > 7 К2МС1б, крист., желто-зел., стр. тип. K2PtCl6, М —Cl 2.36 25)
| НВг
К2МВг6, крист., красн., М —Вг 2.50
К2М16
[Re(PF3)5]2, крист., бц., т. пл. 182, летучи, р. в орг. р-рителях, разл. щ.
[Tc(PF3)5]2, неуст., {Re[P(OR)3]5}2 21)
О х
\[Тс(СО)4]2, крист., кор.
K4[Re(CN)6] ЗН2О, крист., желт. M3[Re(CN)5(H2O)| K3[Re(CN)5(NO)] 2Н2О
{ReCl(N2)[(R2P)2]2}+X-
K3[Re(CN)3(OH)3], крист., гол.
K3[Re(CN)6] 3H2O, крист., зел.
K4[M(CN)7] h2o, желт., диамагн.
анион - пентаг. бипир., Re — С ~ 2.0 17)
MS2, крист, или аморфн. порошок, черн.
ReS2, возг. 1000 с разл., АН = —295, стр. тип MoS2, входит в состав "молибденита", к-p гидрирования
K2[Tc(CN)6], крист., красн., гидрол.
M2S7
M2Re4(CO)16, красн., Re — Re 2.96-3.02 M2[H2Re4(CO)12]; H4Re4(CO)13 , св.-желт., кластер [Re4] - тетраэдр, Re — Re 3.18, в вершинах - по 3 СО-конц., Н-мост. - вдоль ребер тетраэдра 20)
K6[Re(CN)6], желт.
Re(N2)XL4,
X = Cl, NH2, C5H5,
L = PR3, CO 2)
ReS, крист., черн., окисл. возд.
TeS /, не р. в разб.
НС1 (ср. MnS !)
р-ции NO—>N2O
S)
Re
(в отл. от Pt и Pd не отравляется S)
[Тс(С5Н5)2]2, крист., желт., т. пл. 155
ТсС, ТсС2, желт., т. пл. 2655,
+ Н2О С2Н2 + С2Н4 + н2 + ..., в стр. - ионы [С = С]2-, С—С 1.34
ReSi2; Re2P, ReP, ReP2, ReP3
ReSe2, искаж. стр. тип
CdCl2, Re—Se 2.38-2.45 (3 связи) и 2.60-2.66 (3 связи),
Re—Re 2.65-2.93
14
MReO4 + МОН (Z)
5+ (rf2)
Re2O5 (?), крист., гол., разл. 200;
+ Н2О —> ReO2; + HReO4
Re(Z)
ТсО3 | ReO3 26)
крист., красн., с мет. блеском (зел. в тонких
слоях), р. в конц. щ.,
т. пл. 160,
АН = -602, +44L. ReO2 + Re2O7;
+ NaOH —> ReO2 + NaReO4,
в стр. - каркас окт., Re—О 1.87
400°
ReO2F 37)
Ренаты (V) ("гипоренаты") NaReO3, мета-, крист., св.-желт.
M4Re2O7, пиро-, M3ReO4, орто-, + Н2О Re(OH)4; + MReO4
[МО2Ру4]Х 2Н2О X = С1, С1О4 28) ReO2(OR) PR3
[R4N][ReBr4O(H2O)|, Re = O 1.71,
1-2
(NH4)2[TcOC15]
О
ReO3 • En = [RevO2En2] [ReVIIO4]
5.85 + ,
Ho.isRe03J.,
крист., золотистые, р. в HNO3, проводник;
-U Н2О + ReO3 х 26)
Re (200°)
o2 (160°)
[RevO2] [ReVIIO4], СО; М "синь" ""
ел. парамагн.
( ReO2
BaTcO4, технат (VI)
ЙТсО4,
крист., красн., р-р обесцвечивается при разб.
7+ (</°)
Тс2О7 30) | Re2O7
крист., желт., летучие, тигр., не окисляют орг. в-ва (ср. Мп2О7 !), р. т. пл. 120, т. к. 311, , >1 Разл- 260’
ДЯ= -1127,
26,30)
Ренаты (VI) Li4ReO5, Li6ReO6, M2ReO4, M = Na, K, Ba/2;, крист., зел.;
+ H2O Re(OH)4; + + MReO4
h2o (+e)
TcOCI3, крист., кор., возг. 900, изостр. /LMoOCl3 ТсОВг3, крист., кор., возг. 400, изостр. NbOCl3 (а-МоОС13) ReOF3, крист., черн., нелетучи ReOCl3 [ReOCl(RCOO)2]2, крист., пурп. [ReOCl3(PPh3)2]-mpaHc, Re = O 1.60, Re —Cl 2.42 (цис- к О), 2.47 (транс-) ReOX3Dipy, X = Cl (зел. и фиол.), Вг (зел.), С1О4 (сии.) 15)
ан. окисл.
[Re2O(OMe)8]2, крист., — - ^qh' черн. ’
TcF5, т. пл. 50
т. пл. т. к.
ReF5, крист., желто-зел., стр. тип CrF5, -U MF4 + MF6 ReCl5, крист., кор., р. в СС14; -Ж ReCl3 + С12; стр тип UC Re — Cl 2.25 (конц.), 2.47 (мост ReBr5, крист., сине-зел.; —Re МГ5 + Н2О MIV + МО; НГ 4 48 260 возг. 150 5, ) Вг3 + Вг2; 221 360
[Re(OMe)5l2
K2[TcO(CN)5] 4H2O - желт. 17)
K3[MO2(CN)4], транс-, крист., оранж., диамагн. (<72!), анион - окт. (d3sp3' 6,17) M2[ReO(OH)(CN)4], крист., фиол.
|\ = ReI 2(PR3)2| к. ч. Re 5, Re—N 1.60, Re —F 2.38 (экв.), Re—Р(акс.) 2.45
|\ = ReCI2(PR3)3|. окт., Re—N 1.79, Re—Cl 2.56(транс- к N), 2.45, Re—Р(акс.) 2.46
K[ReOr4], Г = Cl, I, SCN, анион - тетраг. пирамида с О в вершине, Re = O 1.72 M2[ReOCl5], М = NH4, K-Cs, крист., желто-зел., анион - окт., Re = O 2.09, Re —Cl 2.3-2.4, Мэфф = 0-4 5)
[ReO2(RCOO)2]2
ReO2F2 (?), крист., бц., т. пл. 156
Re
TcOF4, т. пл. 134, мол. - циклич. тример [TcOF3F2/2]3-!/wc, Тс = О 1.66, Тс—F и 1.8 ТсОСЦ, т. пл. ~ 35, ^Хс12 + ТсОС13
т. пл. 108-
30
разл.
т. к. 172" 228 >80
ReOF4, крист., гол. 27) ReOCU, крист., зел.-кор. ReOBr4, крист., сии. р. в эф., бзл.;
+ Н2О Re(OH)4; + HReO4;
—U Re + ReO3r + Г2; в стр. - цепи окт. [ReOF3F2/2]-!/wc, Re = O 1.65, Re — F 1.86 (конц.), 1.94 (мост.),
в г. - мол., Re = O 1.66, Re — Cl 2.27, ZOReCl 105
M[ReOF5], 29)
М = K-Cs, крист., гол. или зел., р. в эф., ац.
M2[ReOCl6],
М = Rb, Cs;
+ Н2О
M2[ReIVCl6] +
+ MReO4
Г2
H2o
MTcF6
MReF6, M = Na-Cs, крист., бц., парамагн.
РГ3 (-РГ5, 20°)
в Н2О, си., эф., ац., Ру т. пл. 301, т. к. 362, разл. 600, ДЯ = -1234, R t
бц. < > желт. темный
-80°
в стр. - слои тетраэдров и окт. с общ. вершинами, Re—О 1.6-2.2; в г. - мол. - 2 тетрадра с общ. вершиной, Re—О 1.70 (конц.), 1.80(мост.), ZReORe 165;
• ЗРу, мол. - окт. и трит, бипир. с общ. вершиной
ReS2
(в MoS2 - "молибдените")
160'
H4Re2O9 = [O3Re—О—ReO3(-
Н2О)2],
крист., бц., в мол. стр. - тетраэдр и окт. с общ. вершиной, Re—О 1.74 (конц.), 2.10 (мост.), ZReORe 179
сильн. к., экстр. С5НцОН
H2Re2O8 • 3Diox, т. пл. 110 31)
HC1O4; H2SO4
Пертехнаты
M[TcO4], крист., бц.
rO ।
О I о
Перренаты 10)
Li5|ReO6|, анион - окт., Re—О ~ 1.88, Ca5Re2O12, в анионе — окт. [ReO6], Re—О 1.87 M[ReO4], крист., бц., р. в Н2О < МТсО4
р. в Н2О Li > Na > К +> Cs; М = [Ph4P] ;, [Ph4As] ;, Ag;, [C10H16N4H] ("нитрон");, Cs;, Ba/2(- 4H2O) KMO4, т. пл. 540, разл. 10001 т. пл. 555, т. к. 1370 анионы - тетраэдры, М—О 1.55-1.81
O2', Bi2O3
H2O
O2
оч.
ТсКристоло-тистые, т. пл. 37, т. к. 55
ТсС16, крист., зел., Ж ТсС14 + С12
ReNCl3, крист., черн., нелетучи, цэфф = 1.7 5 28)
TcO3F, ж., желт., т. пл. 18, т. к. 100 ТсО3С1, ж., бц., т. к. 25, экстр. СНС13 П)
>^|ReF6| + X , X = SbF6, Sb2F ReF5( = NF), оранж. 35)
ReOF5, крист., бц., т. пл. 41, т. к. 73, АН = —1229, мол. - окт., Re—О 1.64, Re—F 1.81 34)
_ . K2[Re(CN)8], пурп.
ReF6, крист., желт., т. пл. 19, т. к. 48, сильн. фторагент ReCl6, крист., зел., т. пл.22,уст. только в г. фазе
реакц.,
+ Н2О —> М(ОН)4 + НМО4 + НГ; мол. - окт., Re — F 1.83
M2[ReF8], крист., роз., анион - антипризма, Re —F 1.9 M[ReF7], крист., желт., неуст.
TcO2F3, крист., желт., т. пл. ~ 200, в стр. -цепи !/wc-[TcO2F2F2/2], Тс—F 1.83 (конц.), 2.08 (мост), Тс—О 1.65 39)
K3[Re(CN)8] Н2О, крист., кор., диамагн., к анион - додекаэдр (dAsp3) 8)
K2[N = Re(—NC-O4I Н2О, крист., роз., в стр - цепи тетраг. пирамид [Re(NC)4N2/2], Re = N 1.53, Re—NC 2.44, С—N 1.36 (в [CN]“ 1.16) ZReNC 136 (в MCN и 180)
Cs[Re(NCS)6]
ReS3 ---------------------
Н2
F2 (400°, p)
ReOjX, X = SO3F, NO3, RCOO, NR2, OR 36)
т. пл. т. к. Re—Г
ReOjF, крист., желт. 147 164 1.86
ReO3Cl, ж., бц. 5 132 2.23
ReO3Br, крист., бц. 40 163 —
мол. - тетраэдр, Re— О 1.70
ReO2(SO3F)3, крист., бц. ReO2(OTeF5)3, мол. -трит, бипир.
ReO2F3, крист., желт., т. пл. 90, т. к. 185
[ReOF4]+X“ 18) Z (—Re2O7)
ReF7, крист., желт., т. пл. 48, т. к. 72, АЯ = -1432, мол. - пентаг. бипир.,
Re—F 1.83 (экв.), 1.84 (акс.) 18)
---------(Re
M2S7;, черн., р. в , >
HNO3 (Н2О2 + МОН); ----------^\KReO4>
Tc2S7;, pH осаждения Г 42S (Н ) н+
Tc2S7 > Re2S7; —> MS2 + S -------------
МОН (z) j, | Н2О; СО2
M3ReO5, "мезоперренаты", оранж., тигр., анион - тетраг. пирамида, Re—О 1.75-1.82 9,33)
Ba5[ReOs]3r
M2ReO3F3 32)
M2ReO3Cl3, М = К, Cs, [R4N], крист., бц., анион - окт.
M[ReO3Cl2], M2|ReO3\|
|R4N||ReO2(OTeF5)4|-i/Mc 32) M[ReO2F4]
M[ReOF6], M = [NO], [NO2], крист., зел.
M[ReF8], M = K, [NO], [NO2], крист., желт., анион - антипризма Архимеда (сР’хр1) 12)
K2[Re(CN)8(OH)|
MIReO^^J, неуст. в р-ре
15
5000
р, Па I0 5
Лед VI
1000 Jr
0.0101-
о
ж.
0.005 _ Лед1
-50
2-
Н2О, вода, ж., бц., d® 0.9999, d2® 0.9982, т. пл. 0, т. к. 100, разл. 2000, тройная точка: 614 Па (= 4.6 мм), 0.0076°, АН = -286, 8 = 81, ц = 1.86, Н2О «=> Н+ + ОН , К = 10 Kw= [Н+][ОН ] = 0.86 • 10 14 (20°), pH = -lg[H+]; в г. фазе - угловые молекулы ((//-тетраэдры).
В стр. льда - ат. О в узлах гексаг. ячейки типа ZnS (вюртцита), а = 4.50, с = 7.34; искаж. тетраэдры [ОН4] -образуют "ледяные мол." (Н2О)8. Октамеры сохраняются при пл., при этом часть молекул мономера "проваливается1 в полости внутри октамеров (d41.0000 > d льда), в ж. сущ. (Н2О)„, п = 1-8
О 30
Диаграмма состояния Н2О
d льда
I - 0.92
II- 1.12
III- 1.03
V- 1.09
VI- 1.13
VII- 1.5 (>22 • 108 Па)
,-i6
Н 105о Н
'Ледяная мол.
радиолиз (—Н2 —О2)
1-
Н2О2, перекись водорода, ж., св.-гол., вязкая, d20 1.450, т. пл. —0.43 (склонна к переохл.), т. к. 150 (neper, в вак.), АН = —188, е = 73, ц = 2.1, диамагн., в ж. мол. ассоциированы (водородные связи), экстр, эф.
Н2О2 Н+ + НО2; К= 10 12; Н2О2 Н2О + О2 (быстро при pH > 7). Н2О2 высокой чистоты уст. в конц. р-рах (хранят в А1 сосудах); ингибиторы разл.: H2SO4, Н3РО4, Na4P2O7, ацетанилид; к-ры разл.: ОН , М” + , Pt, Си, фермент каталаза. Сильн. окисл. (при pH 1-13).
• 2Н2О = [Н3О] + [Н2О2(ОН)] , т. пл. -50
Na2CO3 • 1.5Н2О2 (СО/ образ. Н-связи с Н2О2); Li2O2 • Н2О2 • 2Н2О 4Na2SO4 • 2Н2О2 • NaCl, разл. 160, в стр. - [Н2О2] в каналах из ат. О 13)
Н2О (-Н„ЭОт)
МОН
н2о
МООН, гидроперекиси NH4OOH
Н2о
1/2-
1/3-
м2о,
М = Li-Cs, Са-Ва (20°), К Mg, Zn, Fe (0
Нх[Э(О2)„От], пероксокислоты (надкислоты)
ч ООН
V
д о
Н„ЭОт, кислоты
Соединения гидроксония 9) 1Н3О] + X , уст. при
X = AsF6, SbF6 (разл. 193 и 357), PtF6, BiF6; катион-(//-тетраэдр,
[(Н3О) иН2О]+Х-, п = 1([Н5О2] + ),2([Н7О3] + ; [Н14О6]2+), 3([Н9О4]+ -пирамида [О(Н- • ОН2)3], О—Н 1.09, О - Н 1.32, О- • -О 2.48-2.62, ZOOO 111-116); 5 ([Н13О6] + ).
М(ОН)„, амфотерные гидроокиси
М(ОН)„, основания.
В стр. [Me4N]OH Н2О-кластерные анионы [Н6О4]2 П)
гр. —ООН монодентатна HNO4, Н3РО5, H2SO5, Н4МО5 (М = Ti-Th)
о
—х/ан. окисл.
>m JK (-20°)
Т Н2О (—Н„ЭОт)
H2S2O8, Н4₽2О8,
пероксодисерная, \ -дифосфорная к.
-э—о—о—э-
|КдО|Х, R = Aik, соединения алкилоксония,
НХ R2O; НХ ROH
Пероксоанионы с бидентатной
ГР. [Ог] о
V|
0—0 1.45-1.55,
voО 870-890 см 1 12)
K2[Ti(o2)(SO4)2l; K4izr(o2)4]
K3[Nb(O2)4|; K3[Crv(O2)4]
K2[Mo(02)4], анионы - додекаэдры (середины гр. [О2] образ, тетраэдр)
Na4[UO2(O2)3], анион - гексаг. бипир., гр. [О2] - экв.
Перекиси
[О2]2-,М = Li-Cs, Mg-Ba/2, крист., бц., диамагн., О—О 1.50 (1а-связь);
• 8Н2О, М = Na, Mg-Ba/2;
+ Н2О (изб.) —> Н2О2 + МОН; сильн.
окисл. (в распл.): + Fe —> M2FeO4
(см. Табл. "Щелочные мет.")
Двухъядерные комплексы Со(Ш) 5,9) с гр.
о2 (р, t)
Н2О4, стекло, бц., диамагн., АЯ = -117; 30°
—> О2 + Н2О2 + + Н2о п
_Cs) .
„»л (-антрахинон); (НП;
антрахинол < и——
нДО) _. '
)Ог^ ’
Надперекиси
М+[О2]“, м = Na-Cs, [R4N], Ва/2, крист., желто-кор., парамагн. (1 неспаренный эл., см. схему мол. орбиталей), О—О 1.32-1.35 (1а + 0.5л-связи); оч. сильн. окисл.; + Н2О —> Н2О2 + О2 + МОН (см. Табл. "Щелочные мет.")
—Со—[О2]—Со о2 присоединен необратимо
/ \ / \ (см. Табл. "Кобальт")
{[(NH3)5Co]2(02)l5+Х5“, кор., парамагн. "надперекиси", О—О 1.31-1.45,
Vq___Q IIOOCM1
{[(NH3)5Co]2(02)2-}4 + X4-, зел., диамагн. "перекиси" WKCNbCoWO^-},
О—О 1.45-1.65, ZCoOO 118;
+ Н+ —> О2 (а не Н2О2!), не pear, с V2 + , Сг2+, Vq___q ~800 см 1
о2
(NH3)4CO\ Co(NH3)4 nh2
Na5{[(CN)5Co]2(02)}
4—
С,
сч с
-с
N=
С'
С—N
N—С
с-
Оз
—О2 (медл.)
Оз (фреон)
]2
Озониды
М[О3], М = Na-Cs, NH4, [R4P], [R4As], крист., красн., р. в Н2О (уст. при pH > 7), ж. NH3; парамагн. (1 неспаренный эл.), в стр. -слои анионов [О3] , О—О 1.34-1.42, ZOOO 101 2);
+ Н2О *—2 О2 + МОН
"Т
Комплексы с монодентатной гр. [О2]
(О2 присоединен обратимо) [R4N]3[Coni(CN)5(02)“] 5Н2О, ZCoOO 175, 0—0 1.13 3’10)
|Со(бзацен)Ру(02)-|.' парамагн. (1 неспаренный эл.), О—О 1.26, ZCoOO 126, vq____q ИЗО см 1
Гемоглобин, витамин В12 (кобаламин), хлорофилл содержат порфириновый цикл (с ат. Fe, Со и Mg соотв.). В гемоглобине [FeN5] -тетраг. пирамида, в осн. - 4 ат. N порфиринового цикла, в вершине - N гистидина, к VI вершине обратимо присоединяется О2
'Бзапен = OC(Ph)CHC(Me) = NC2H4NH2
Стр. координационного центра оксигемоглобина (по Полингу)
\/
N (гистидина)
\ 1 0 \l/l , Оксигенильные комплексы содержат бидентатную гр. [О2], М диамагн., vq q 830-860 см
(см. также Табл. "Рутений" - "Платина" 5’6) / 1 О
О2 присоединен необратимо (при разл. —> др. продукты восст. О2), О—О >1.45 H2O2 и O—O O2 присоединен обратимо, О—О 1.45 О—О
[(CuL3)2(O2)]X2, L = 1,2-Ме2-имидазол — [1гГ(СО)(РРЙ3)2(О2)]
[IrI(CO)(PR3)2(O2)] 1.51 Г = С1 ("комплекс Васка") 1.30
[Ir(Ph2P—СН2—)2(О2)| PF6 1.52 Вг 1.36
|RhT(PR3)2(Z-BuNC)(O2)| — [Rh(Ph2P—CH2-)2(O2)]PF6 1.42
[Pt(PPh3)2(O2)] L, L = 1.5C6H6, 1.45 [Rhr(PR3)2(H-CH3C6H4NC)(O2)] —
2CHC13 1.50 [Rh(PPh3)2Cl(O2)]2 (см. Табл. "Родий") 1.44
{Co[(Ph2PCH = )2]2(O2)}BF4 2C6H6 1.42 Диметилглиоксиматы Fen(Co, Ni) • и О2 —
[(PR3)3(CN)2Co—NC — Co(CN)(PR3)2(02)] 1.44 Комплексы Со с аминокислотами,
[M(O2)2(3R3)4] + X , M = Rh, Ir, Э = P, As «1.48 осн. Шиффа
окисл. акт. гр. [O2] > мол. O2: "оксигенильные" комплексы + NO —> NO2; + NO2 —> NO3;
+ SO2 SO4_; + PR3 OPR3; + RCH2OH RCOO ;
продукты окисл. становятся L: [Pt(PR3)2(O2)2] + NO —> [Pt(PR3)2(NO2)2];
к-ры окисл.: [Pt(PR3)2(O2)] + PR3 —> [Pt(PR3)3(O2)] —> Pt(PR3)2 + 2OPR3
16
КИСЛОРОД
”1/2 + ”
”2/3 + ”
”1 + ”
”2 + ”
2s
2р
э.о
КС1О3;КМпО?
KNO3 >
I (О
12.
ан. окисл.
(-50°, вак.)
О2, г., бц., d° = 1.429, т. пл. —219, т. к. —183 (>т. к. N2), разл. >2000, АЯДИС = +494; ж., гол.; крист., сии., парамагн. (2 неспар. эл.); р. в Н2О« 5%(об.), хор. р. в Pt-черни, акт. С; О—О 1.21 (1сг+ 1л-связь); мол. стр., у-, куб., а = 6.83, О2...О2 3.68 j. -229° Р-, ромбоэдрическая, а = 6.19, а = 99.1 j. -249° а-, ромб., а = 5.50, b = 3.82, с = 3.44 Pear, почти со всеми М (Z) тихий разряд; hv- УФ (<200 нм); радиолиз О3, озон, 7) г., гол. (при конц > 15%) с характерным запахом, яд, d= 2.144, т. пл. —193 (переохл. —250°), т. к. —ПО; ж., темно-син.; крист., черно-фиол.; \Н= + 144, разл. 250, взр. при ударе. К-ры разл.: NO, Cl2, Pt, CuO и т. д. Р. в Н2О ~ 45 % (об.), хор. р. в СС14, q фреонах (CC1„F4_„); диамагн., мол. угловая, ц = 0.53, О 117° 1.5-кратные связи (1п + 0.5л) (ср. SO2!) При 20° pear, со всеми М (кроме Pt и Au); орг. в-ва воспл.
[О2]+Х- X = [BF4], [MivF6] (М = Мп, Ni), [3VF6] (Э = P-Bi, Nb, Та, Au, Ru, Rh, Pt), [32Fn] (3 = Sb, Bi, Nb, Ta), соли оксигенила, крист., бц. (окрашены за счет аниона), уст. [O2][3F6] растет по ряду 3: Р (разл —80) + As > > Sb (разл. 13) + Pt (возг. 100);
Н2О —> О2 + F2 + 3F2; сильнейшие окисл.;
+ Хе, Rn » [XcF]-[3F6] + О2 (очистка атм. от Хе*, Rn*); [O2][PtF6] изостр. KPtvF6; парамагн. катион (1 неспаренный эл., см. схему мол. орбиталей), О—О 0.96-1.13 (1<т + 1.5л-связи), vq О 1825-1864 4)
PtF6; SbF5 + Ь2(/п’-УФ); М + F2(z, р, ИК)
\ F2 (разряд, вак.)
2-
1-
O6F2 (?), крист., красн., разл. —213 (—> Оз), взр. 14)
O4F2 = F — (О)4— F (?), "фторид оксозона", крист., красно-кор., т. пл. —199, взр. 14)
0
Число валентных эл. Число связей 0—0 VO—О’ см 1 Число неспаренных эл.
[О2]2- 14 1(TZ 1.50 880 0
[О2]- 13 lcrz + 0.5 тс = 1.5 1.33 1089 1
О2 12 1<tz+ 1 л = 2 1.21 1555 2
[О2] + 11 1<TZ+ 1.5 л = 2.5 1.13 1825-1864 1
"С А
2р
ИМ
АО О'
АО О"
МО о2
и
Схема мол. орбиталей О2
Е
"O3F2" = O4F2 + O2F2 (?), "фторид озона", ж., красн., т. пл. —189, т. к. х —179 (вак.), 14) разл. —160, \Н= +25, парамагн.
O2F2, крист., оранж., т. пл. —163, т. к. —57, т. разл —100, \Н= +21, мол. - стр. аналог Н2О2, О—F 1.58, 0—0 1.22
S (<7 + п = 2 связи), ZFOO ПО, двугранный Z87.5, сильнейший окисл. и фторагент 14)
OF2, г., бц., яд, т.пл. -224, т. к. —145, разл. 200, \Н= +25, угловая мол., F—О 1.40, L FOF 103, ц = 0.30, сильнейший окисл. и фторагент, р. в Н2О - 6.5 % (об.) при 0°, разл. щ.; + Н2О О3 + О2 + НР(взр.); + ОН Н2О + О2 + F ; + НГ —> Г2 + HF + Н2О ; + Хе —> XeF2 + XeOF2 14)
О
ан. окисл.
быстро
Окислы (типы структур)
Ионные Молекулярные Полимерные Металлоподобные
т. пл. Li2O 1570 К2О 740 стр. тип. анши-СаР2 СаО 2614 ВаО 1923 стр. тип. NaCl + Н2О^М(ОН)2 т. пл. т. к. С12О7 -90 87 Мп2О7 5.9 разл. мол. - 2 тетраэдра с общ. вершиной OsO4 39.5(a) 130 ХеО4 -36 — мол. - тетраэдр SeO3 121 возг. в стр. - циклы [SeO3]4(a) Р2О3 24 175 в стр. - мол. Р4О6 + Н2О —> Э2О„ • х Н2О т. пл. т. к. ВеО 2580 4260 Тип. вюртцита А12О3, 2072 -3500 тип. корунда (а) ТЮ2 1870 -3000 тип рутила. MnOi.o-i.i3, т. пл. 1780, полупроводник NbO0.94-i.04, с мет. блеском, проводник, искаж. тип NaCl, окт. кластер [Nb6], Nb —Nb 2.80 NbO2, полупроводник, т. пл. 2080., искаж. стр. рутила Wi8O49 - в стр. - слои кластеров [We]
Не реаг с Н2О
17
СЕРА
2-
Ijn—
3s
Зр
3d Э.О.
о.
1/4 +
2 +
Н2 (пемза, 600°); HI (г.!); С„Н2и+2(-С„Н2„)
H2S, сероводород, г., бц., яд, с характерным запахом, т. пл. —86, т. к. —60, разл. 300, АН = —20, ц = 0.93, s = 6, р-ритель орг. в-в; 2H2S (ж.) [H3S+] + [HS“], [H3S+][HS“] = 10 33; угловая мол., S—Н 1.33, ZHSH 92 (р2), р. в Н2О 75% (об.), сл. к., К{ = 10“7, Кг = 10“14 • 5.75 Н2О (8:46), клатрат, разл.0 S„C12 (-НС1)
%
H2S2
H2s3
H2s4
H2S5
т. пл. т. к.
-88 75 10“
-52 — —
-85 — 10“
-50 — 10“
H2S„, п < 35, полисульфаны, масла, тяжелые, желт., вязкость растет с п, сущ. при pH <? 7, а также в эф. и бзл. р-рах___________________________________
S„C12
S, крист., желт., d = 2.1, т. пл. 119, т. к. 445, П) хор. р. в CS2, скипидаре, р. в бзл., к. ч. S 2
H2s„)
\UQ
Ю7
10 6
а-, ромб., d = 2.07, т. пл. 113, а= 10.46, Ь= 12.86, с = 24.49;
в стр. - мол. S8 в форме короны, S —S2.06, ZSSS 108, диэдрический L 98.6
у-, перламутровая, метастаб., монокл., образ, при охл. бзл. р-ров, в стр. - S8
H2S2 - стр. аналог Н2О2, ц = 1.17, S — S 2.05, L HSS 92, двугранный Z 91, в мол. H2S„ - зигзагообразные цепи S„, оч. реакц.; + Н2О —> H2S + SJ, 44)
МОН
НС1 (конц.)
95'
[H3S] + [SbF6]-разл. 90, катион -ф-тетраэдр, Н—S 1.36, Z HSH 99 31)
Бисульфиды, крист., бц., хор. р. в Н2О, си., высаливают из р-ра эф.
LiHS, разл. 50
NaHS, т. пл. 350, • иН2О, п = 2, 3 (т. пл. 22) KHS, т. пл. 455
Ca(HS)2 6Н2О, разл. 15
Ba(HS)2 4Н2О
fi-, монокл., d = 1.96, т. пл. 119, a= 10.90, b= 10.96, c= 11.02, j5 = 83, в стр. - S8
Аморфная (пластическая) Л желт. переохл. ж., р. в CS2
кор. полимер (цепи S„), не р. в CS2
О
S„O, п = 6-10, желт., р. в CS2, разл. 34 (и = 6), 25 (п = 9, 10), т. пл. 55 (п = 7);
-_^MSO2 + S;^S„ + SO в стр. - цепи мол. - циклов S ("корона")
S2O (раньше "SO"), г., бц., уст., — -В—- SO2 + S, < —196° - оранж. крист., АН = —96, не pear, с О2, ц = 1.47, мол. - угловая,
S —S 1.88, S O 1.46, ZSSO 118 {Ir(S2O)[(Ph2P—СН2 —)2]2}Ю3, лиганд — S — S - бидентатный 27)
"S2O3" - см. соли [S8]2 +
S (тлеющий разряд)
fli2S( + H2O-много, р-ция Вакенродера)
M2S„, М = М1, Мп/2, п < 9, полисульфиды, крист., оч. гигр., с ростом п цв. от желт, к красн., уст. падает, хим, акт . растет, хор, р. в Н2О и си._________
Na2S2 т. пл. 480 480° < Na2S4 286 Na2S5 255 Na2S„ "серная печень"
K2S2 т. пл. 520 АН = -431 ЗН2О K2S3 292 -469 K2S4 159 -464 2H2O K2S5 211 -469 5H2O K2s6 196 -469 10)
Cs2S2 т. пл. 460 Cs2S3 217 Cs2S5 210 Cs2S6 185
BaS3 разл.554 BaS4 300
(NH4)2S„, "желт, сульфид аммония"
Ре[8г], "пирит"; Mn[S2], "марганцевый колчедан' [S,.,]2 - спиральные цепи (ср. гексаг. Se),
S — S 2.01-2.10 Z SSS «108, двугранный Z 98 '*
2.07
в анионах -циклы [MS„] 32)
M),|M(S„)„,I
M3[Cu(S4)„], п = 2, 3
M2[Pt(S5)3]
M3[Ag(S4)2] M2[Ag2(S6)2)l,
11
___________
Сульфиды M2SX
Солеобразные Ковалентные Металлоподобные фазы переменного состава
T. ПЛ. стр. тип т. пл. т. к. стр. тип
Li2S Na2S K2S Cu2Si Ag2Si Уст. 950 1180 840 ИЗО 842 к гидрол । анти-СаР г ., диэлектрики иН2О 9Н2О 5Н2О или SiS2 sb2s3r Bi2s3p P4S5 ai2s3 ZnSi CdSi + H2O 1090 548 685 с разл. 288 1120 (р) 1900(р)) стр 1475 J вю Э(ОН)„ + изо 990 514 этцита 42S, TiS TiS2 TiS3 Fei_xS CrSo.95-1.5 Уст. на возд., р NiAs Cdl2 NiAs NiAs в к., про-
полупроводники * уст. к H2O, остальные -мгнов. гидрол., диэлектрики водники (MS) или полупроводники (MS2 и MS3)
M2S„ + о2 M2SO4 -U М2О„ + SO2 + О2; + С М + CS2f
О2
М; MOR (ж. NH3) 26)
-80'
Л-, ж., желт., прозрачная, >159° - кор.; при 200° вязкость max, S8 S7 Sg s4
Пурпуровая, в стр. - парамагн. мол. S2 (эл. аналоги О2), S —S 1.89
445'
-180° (быстро)
Пар
s8 s7 оранж.
650° 900° 1500°
Sg S4 S2 S красн. желт.
Мол. S18
IAg(S8)2]+ [AsF6] “, крист., бц., корона S8 координирована в 1,3-положении Sio(CO)4, мол. -циклы
1288 I-
л н о о и п к
Циклы S„, крист., от оранж. (Se) до лимонножелт. (S2o), d= 2.02-2.09, т. пл. 39 (S7), 50 (S9), 148 (S12), 128 (S18), 124 (S2o); S10 разл. ~60, в стр. - неплоские циклы, S —S 1.99-2.18, ZSSS 102-106, двугранный Z 84-90
О О
S5
;s5
О О 33>
Диаграмма состояния S
P, Па -10
О 95 119 300
желт.
S8
кор.
/ S6-S4
О 100 200 400
Изменение вязкости распл. S с t
It
(1.7-3.3) +
H2S„O6, /7 = 20- 13, 6, 5, 4, 3, политионовые (сульфандисульфоновые) к., п растет с [H2S]: [SO2]; сущ. только в р-рах, сильн. к., уст. растет с п, 20°
S; + SO2 + Н28О4(медл.)
• 2Et2O, крист., бц. 24)
S8o =
[S4O6]
S —О 1.48, S —S 2.0-2.2
SbCl5
S7O2
Все соединения оранж.
H2s
о
о
о
НС1О4(-КС1ОД)
M2S„O6, политионаты, крист., бц., уст., в р-ре уст. падает с ростом п, анион - 2 тетраэдра [SO3S], соединенные зигзагообр. цепью (S)„_4 2.5 + K2s4o6 тетра-
K2s6o6 гекса-
K2s5o6 пента-
K2s3o6 тритионат
S„C12
H2S2O2, тио-сернистая к., >20°
-=^ H2S + S + + SO2 ...
(RO—S—)2
HSO3C1(-HC1)
О д
S2r2
о к
H2S2O3, тиосерная (серноватистая) к., ж., маслянистая, сильн. к., К = 10“2,
H2S + H2S3O6
—> ЗДоранж.) + H2SO3 + + H2SO4;
• 2Et2O, крист., бц., разл. —5
НОХ х.О НОХ s «_______» s
НОХ *S HS-" *О
HC1
H2S2O4, дитионистая (гидросернистая) к., сущ. в р-ре, К\ = 0.5, К2 = 10“3;
-=• Sj. + H2SO3
[S„]2+(AsF6)2, п = 16, 19, крист., красн., катион -[(цикло-87)285]2 +
[S8]2+X2, X = HS2O7, SO3F, А1С14, AsF6, Sb2Fn [S8][HS3O10]2 (раньше "S2O3"), крист., сип., гигр., р. в олеуме; —S + SO2 + + SO3; + Н2О —> S + + H2S„Of> + H2SO4;
в катионе - [S8]2 + , S — S 2.04, Z SSS 102(6 углов) и 93 (2 угла)
Тиосульфаты Na2S2O3,
• 5Н2О (т. пл. 48);
200°
Na2S5 + Na2SO4 K2S2O3, разл. 430, яН2О, п = 0.5; 1.67 (-Н2О, 180°)
BaS2O3 Н2О M3[Ag(S2O3)2], [SO3S]2 - тетраэдр,
S O 1.48, S —S 1.99
Дитиониты (гидросульфиты) Na2S2O4 2Н2О ZnS2O4; CoS204, анион [O2S — SO2]2 2 пересекающихся (//-тетраэдра, [SO2S], S O 1.15, S —S 2.39;
[S2O4]2 2SO2“,
сильн. восст.
- U
H2SO2, сульфоксиловая к.,
S(OH)2 но
H
| О2(мгнов.) [S4]2+X£, крист., желт., катион-квадрат, S — S 2.013)
Сульфоксилаты C0SO2 • ЗН2О, крист., бур. NaHSO2 НСНО 2Н2О, т. пл. 63, "ронгалит", восст. при крашении
18
4 +
5 +
6 +
SO2, г., бц., с резким запахом, т.пл. —75, т. к. -10, разл. 2500, АН = -297, р. в Н2О 98% (об.), е = 13; ж. SO2 р. N2, МГ„, орг. в-ва, р = 1.63, угловая мол. (</<-тр-к [:SO2], sp2); сильн. восст., сл. окисл.: + H(Pd) —> H2S;
• 7 2/3 Н2О (6: 46) - клатрат, т. пл. 12 Fe2(CO)8(:SO2)°; [Ru(NH3)4(:SO2)°Cl]Cl [NiPy3(SO2)°], разл. 150 [IrCl(CO)(SO2)°(PR3)2], S O 1.46, ZOSO 114 (см. Табл. "Рутений") 37)
° w °
NaHSO3 (сух.)
FeS2
О
__________О2 (-5^S^3)UI^£HNO3a)_
СО из доменных газов (А12О3); H2S (Н2О к-р)
SO3, крист., бел. шелковистые, т. пл.
17- 145 (разные формы); АН = —395 (г.);
—462 (/?)• В стр. - цикличические тримеры или цепи тетраэдров [SO4] (sp3)
о и
£
-12-
-°
M2S2O5, пиросульфиты ("метабисульфиты"), М = Na-Cs, 20° (медлэ sc>2 + Мг8Оз 4) Na2S2O5 • Н2О 2 NaHSO3
Сернистая к. ("H2SO3")
SO2 + H2O^SO2 hH2O Н+ +HSO3 2Н+ +SO2-,
[SO2]paBH. = [S02]o6nx -[HSO3~]-[SO32-]; восст.;
44 S „ - H2SO4___________________ _____________
О
— О д
От,
Г
М2СО3 (0°)
MHSO3, бисульфиты, M = Na, К (разл. 190), Cs (крист.); Li, Са/2 (сущ. только в р-ре), анион - </<-тетраэдр
,0 o—s^ чон
OK z°
>sz
HZ \)
Сульфиты
Li2SO3, разл. 455 33°
Na2SO3 7 н2О; K2SO3 2 Н2О
CaSO3 2Н2О;; BaSO3;
600> M2S + M2SO4, хор. р. в Н2О, [:SO3]2 - </<-тетраэдр, S — О 1.53, Z OSO 105 (sp3), сильн. восст.
HSO2F HF (ж.) + 8О2(ж.), фторосульфиновая к., т. пл. —84
S6>^
MSO2F, М = Na-Cs, Ж MF + SO^, мягкие фторагенты: + (PNC12)3^-(PNF2)3 + MCI + SO2
О
О
О2_(/Д>Ь_у2О5,_А§3уО4); О3
*------------->400° (-О2)
NO2 + H2O (-NO)
V'O
H2S2O6, дитионовая, сильн. к., сущ. в р-рах, уст. к окисл.
H2SO4
Дитионаты
M2S2O6 2Н2О,
М = Li, Na
K2s2o6
MnS2O6 яН2О,
Мп = Са, Sr (и = 4), Ва (п = 2), Мп все дитионаты р. в Н2О, анион -[O3S — so3]2--2 пересекающихся тетраэдра [SO3S], S —О -1.44, S —S 2.15
SO2
Тионилгалогениды т. пл. т. к. АН М
SOF2, г., бц. -129 -44 -711 1.62
SOFC1, г„ бц. -137 + 12 — —
SOCI2, ж., бц. -100 + 76 -247 1.44
SOBr2, ж., оранж. -52 138 -75 1.47
-U SO2 + 82Г2 + Г2; SO F2 медл с разл. . гидрол.; мол. [:S ОГ2]-
</<-тетраэдр, S — О 1.44, S — Г 1.59(F), 2.07(d), 2.27 (Вг),
ZOSF 107, ZFSF 93-96; + М2О„ МГ„ + SO2f; + МГ„ • хН2О МГ„ + SO2f + HFf
NH3
>O:
O'
C1F3
SO(NH), тионилимид, ж., бц., т. пл. —85, 20°
—> кор. полимер [—S(O)—NH—]х
SONC1; Hg(NSO)2
Na2S2O7; lFe2(SO4)3
H2SO4
Н2О
SO3
т. пл.
а-, 17
0-, 32
Г, 62(р)
Ь; 95(р)
В стр. (SO3)3, стекло изолированные цепи слои из цепей трехмерные сетки
+ В2О3 —> переохл. распл., т. к. 43, состоит из (SO3)3 + SO3.
В г. - мол. SO3 - плоский тр-к, S = O 1.41, ZOSO 120 (sp2); сильн. окисл.
иРу_________________________
H2S2O7, ди(пиро) серная к., крист., бц., тигр. т. пл. 35
H2SO4, серная к., масло, бц., оч. тигр, ("моногидрат"), т. пл. 10, т. к. 340 с разл., 2H2S04(100%)^[H3S04]+ + [HSO4] [Н3О]+ +[HS2. 07]-;
К = 10-4 А=10“5
s = 100(25°), р-ритель M2(SO4)„, сильн. окисл., в г. -мол. - искаж. тетраэдр (sp3);
Н2О, п= 1 —4, 6, 5(т. пл. -84), 8 (-110°);
т. к. азеотропа (98% H2SO4) 337;
H2SO4 [Н3О]+ + [HSO4]
т. пл. т. к.
S2O5F2, ж., бц. -48 51
S2O5FCI, ж., бц. -65 100
S2O5CI2, ж., бц. -37 —
и
03
S2O7, т. пл. 0, возг. 10
so2
О
____3Т°22____
H2S2O8, надсерная (nep-оксодисерная) к., крист.,
H2O
ан. окисл.;
Н2О2 (100%)
Пиросульфаты
Na2S2O7, т. пл. 405, разл. 460 K2S2O7, т. пл. 440; [3]2 + [HS2O7]2, Э = S, Se, Те, анион - 2 тетраэдра с общ. вершиной
M2S3Oio, трисульфаты, М = М1, Мп/2, [С1О2], [S8]/2, [NO2]
сильн. к., мало р. в эф., окисляет С„Н2„_2
о
о д
И
Сульфурилгало-гениды 38) т. пл. т. к. разл. АН м
SO2F2, г., бц., -137 -51 400 -856 1.11
SO2FC1, г„ бц., -125 + 7 — — —
SO2CI2, ж., бц., -54 69 300 -393 1.80
БОгГВг, ж., бц., -86 40 — — —
1.41, S—Г 1.59(F), 2.01(d),
мол. - тетраэдр, S — О
ZOSO 124, ZTST 96-100, Z OST 107; SO2F2 не pear, c H2O < 150°; SO2C12 мгнов. гидрол.; p. MCI,., и SO3, сильн. хлорагент
[SO2F] + [OF|- = "SO3F2", г., бц., т. пл. —158, т. к. —31
NH3 (CHC13)
SO2(NH2)2, сульфамид, крист., бц., т. пл. 92, р. в Н2О [SO2(NH)]6, сульфимид
SOF4, г„ бц., т. пл. -100, т. к. -49, Ж SF6+ SO2F2 7) мол. - триг. бипир., S — О 1.41, S — F 1.59(акс.), 1.53 (экв.), ZFSF 165 (акс.), 115(экв.), ZFSO 98 и 122
|SOF3| + |AsF6|’ ', катион - тетраэдр, S — О 1.35, S —F 1.44, ZFSF 102, ZOSF 116 8)
CsF
Cs + [SOF5]-210°
SF6 + o2 +
SO4, t. пл. 3 с разл., + H2O [O];
+ Mn2+ —> HMnO4
Ю4°Г s; ] НО V М
119‘
и
о и
2 [Н3О]+ + [SO4]2 , сильн. к. 34) = ю~2___________________________
Бисульфаты
NaHSO4 (т. пл. 186); • Н2О = Na[H3O][SO4]
KHSO4 (т. пл. 210, "меркаллит")
[H3O][HSO4] = "H2SO4 Н2О"
[NO][HSO4], "нитрозилсерная к.", MHSO4 -U M2S2O7 + H2O; [HSO4] - искаж. тетраэдр, S —ОН 1.56; S —О 1.43-1.46 25)
H2SO4 МОН
о
о
M2S4O14, надтетрасульфаты [O3S-OSO2-O-t, 4Ж о2;
+ H2O^H2O2 + K2SO4
M2S2O8, персульфаты, М = К (разл. 100), NH4, Ва/2 (• 4Н2О), -Ж M2S2O7 + О2;
+ Н2О M2SO4 + MHSO4 анион - из 2 тетраэдров
H2SO5, мононадсер-ная к. ("к. Каро"), крист., бц., тигр., т. пл. 7 с разл., в р-ре уст. > H2S2O8, К2 = Ю“10, р. в эф., + Н2О H2SO4 + + Н2О2 (метод получения Н2О2); оч. сильн. окисл., + бзл. —> взр.
о
Сульфаты
Na3SO4, т. пл. 884, т. к. 1430; • 10Н2О, "глауберова соль"
K2SO4, т. пл. 1076, т. к. >2000; MgSO4, разл. 1155 ("горькая соль")
CaSO4j,, т.пл. 1450; • 2Н2О, "гипс"; BaSO4j,, т. пл. 1580
CUSO4, разл. 650; • 5Н2О ("купорос");
M2(SO4)„ —М2О„ + SO3, М = Al, Fe, Си и др.; [SO4]2 - правильный тетраэдр (sp3), S — О 1.48; не окисл.; мол. M2SO4 (М = K-Cs) сущ. в г.
so3
HSO3CF3, оч. сильн. к.
HSO3F - оч. сильн. к., уст. (в отл. от др. HSO3F), фторагент
Галогеносульфоновые к.
HSO3F, ж., бц.
HSO3C1, ж., бц.
HSO3Br, ж., желт.
т. пл. т. к.
-87 169
-80 152 с разл.
—7 с разл. —
H[SbF2(SO3F)4], самая сильн. к.
MSO3F, хор. р„ М = Г+ (Cl, Вг, I), Г3+/3(Вг, I), XeF + , [Sb4]2+, NH4+, Li (т. пл. 360), К (т. пл. 311) Ba(SO3F)2, Ж- BaSO4 + SO2F2;
Cs[M(SO3F)„], М = Sbv, Au111, PtIV 12) MSO3C1, неуст.; Mn(SO3Cl)2, Mn = Ca-Ba, [8О3Г]- - тетраэдр, S —01.43, S —F1.55, S —Cl 2.03 12)
А§8ОзСГ3, p. бзл.
и о
и
SO3
80з-С\Л<?
VO-SO
S2O5F4, ж., бц., т. пл. —95, т. к. 35
о---о
f2os
sof2
—12—
H[SO3(NH2)], амидосульфоновая к., крист., бц., т. пл. 205, К = 10 1
M[SO3(NH2)], сульфаматы, S—N 1.65 12)
MHSO5, М = К( • Н2О), Rb, Cs
О2 + MHSO4, 39) анион - [SO4 — ОН] 1.46
SO3F2 = (FO)SO2F 39)
S2O2FK), ж., бц., т. пл. —95, т. к. 49, разл. 200, (F5 —S—O-)2,S—F1.56, S O 1.66, О—О 1.47
S2O6F2, ж., бц., т. пл. —55, т. к. 67, АН = —807, (FSO2 О— )2,
сильн. фторагент
SO3F, кор. в-во, разл. 200 23)
SO4F2, г., желто-зел., т. к. 0, разл. 50, мол. - FSO2OOF
SF5C1
bb^fsoT
19
ГАЛОГЕНИДЫ, НИТРИДЫ, ГАЛОГЕНО- И ОКСОНИТРИДЫ СЕРЫ 13)
1/л+ 1 +
2 +
Ст. окисл. S вычислена в предположении формальных ст. окисл. N 3— и Н 1 +
ИОНЫ СЕРЫ В ВОДНОМ РАСТВОРЕ
2- 2/w-
0
2.67 +
M + [S3N3]-
М = K-Cs, взр., анион. - 6-член-ный плоский цикл 30)
FeII[S4N4],
крист., черн., разл. 100, р.
в Ру, + Н2О
Fe(OH)3
/
/
/
2.66 +
\ s3n2ci2 /
% ./
'4 /
\ /
\/
6 +
Классификация катионов по растворимости сульфидов (M2S„)
М”+ npM2s„ р-ритель M2S„ Осадитель M2s„
Li-Cs Mg-Ba — H2o H2O (S2 HS ) —
Мп, Fe, Со, Ni, Zn IO-16 - IO-26 1 H. HC1 (S2 H2S) (NH4)2s
Ag, Cu, Cd, Hg, Sn11, Pb, Bi 10-28 - IO-72 HNO3; ц. в. (S2 SOD H2s
As, Sb, SnIV, Vv, Mo, W IQ-2» _ IQ-72 (NH4)2S; NaOH M2s„ [. + S2 — [MSx]m- M2S„ J. + OH —> [MSJm- + [MOJm- H2s
[HS]-
К2 = 10“14
восст., Ki = 10“7
н+ II он-
S2-, бц., сильн. —-----
восст.
H2s„, Ki IO-4
JI2O
о.
С;
О2; S
SO2
н
ОН-
s;
As111; Sb111; Sn11
VQ
(1.7-3.3) +
H2S„O6, п = 3-6, сильн. к., "ж. Вакенродера'
н2о
н+ II он-
h2s
К = 10 2, восст.
S; Си; Hg (z); HI; H2S
I2; MnO4; IO3
[s„]2-, желт. или красн. зигзагообразный ион
он
1.7+ 2+ 2.5+ 3.3 +
[S^Od2- IS5O6]2- |S4C)<,|2 [S3O6]2-
бц. анионы, 2 тетраэдра [SO3S], соединенные
цепью S„ 4; медл. —> SJ. + SO|
Н+ Ц ОН”
iS;O,i‘- L2A ihsoj-s°2 к =10-’
н+ II он-
H2SO4, 98 % - сильн. окисл. (/), > 75 % пасси-вир. Fe; ср. конц. - не окисл.
Н+ fl ОН“
[S2O3]2-, бц., анион - тетраэдр, сильн. восст.
|S2O4|2-, бц., ион - 2 пересекающихся незаверш. тетраэдра [SO2S], сильн. восст.
О2
Zn
[:SO3]2-, бц.,
</<-тетраэдр, — сильн. восст.
[S2O6]2-бц. анион, уст. к окисл. и восст., 2 пересекающихся тетраэдра
IHSO4]-, К= 10“2, искаж. тетраэдр
Н+ fl ОН-[SO4]2-, бц. ион, тетраэдр, не окисл.
+>Ю3
20
3 +
4 +
(-190°); Cl2 + NaF(-NaCl)
(20°)
6 +
SF,
-30'
[S2I4]2+(AsF6)2-,
катион - трит, призма, S—S 1.83, I—I 2.60, S—I 2.8 —3.2 35)
F
Py(HF)x; С12(ж)
F
F
SF4, г., бц., яд.
SCU, крист., бц.
т. пл.
-121
-34 с разл.
т. к.
-37
АЯ “769 -54
м
0A3
мол. - i/z-триг. бипир. (дисфеноиды);
SF4 - сильн. фторагент; + М2О„ —> MF„;
+ Н2О SO2 + НГ; SCU • SbCl5, возг. 125
BF3
Г2 + M2O,
г2 + эг,
S h ---------
[SF3] + [BF4]-
|SCI3| ' | AICI4|
[SBr3] + [Sbr6]-, желт., катионы - ^-тетраэдры, S —Г 1.52(F), 1.97(d), 2.14(Br), ZFSF 94(F), 101 (Cl) 5’22’45)
S2F10, ж., бц., оч. яд., т. пл. —53, т. к. 29, АЯ= —2134, S — S 2.21, S—F 1.56; не pear, с Н2О, щ., инертен при 20°, сильн. фторагент (Z) (^2SF5) f
H2(/zv-B)
Г2
т. пл. т. к. разл. АЯ м
SF6, г., бц. -50 (р) —64 (возг.) 800 -1226 0
SF5C1, г., бц. -64 -19 — — 1.58
SF5Br — -116 — — —
окт. мол. (sp3d2), S — F 1.57, S — С12.03; SF6 хим. инертен., не pear, с О2, к., щ.; + HI (г.) —> HF + H2S + 12;
SF5CI разл. щ.
SF6 • 17 Н2О, клатрат 21)
sf5oox,
X = h, so2f, COF, CF3, SF4OSF5 20)
M + [SF5]-, M = Cs, [R4N], анион - </<-окт. 6)
F
С? л
(SF5)2O, ж., бц., т. пл. —155, т. к. 31, мол. - 2 окт. с общ. вершиной, S —О 1.59, S —F ~ 1.57, ZSOS 142 9) Н2о H[OSF5], крист., возг. —65 M[OSF5], М = Cs, Хе/6, W/6, 1/5. 46)
(-80°)
(SN)X, политиазил, золотистые волокна (син. в тонких слоях), взр. ~ 240°, возг. вак. 135, не р. в Н2О и орг. р-рителях, медл. разл. щ., в стр. - зигзагообр. цепи, S—N 1.59 и 1.63; ZSNS 119.9, ZNSN 106.2; парамагн., проводник (делокализация л-эл. вдоль цепи) 28)
•иГ2 (п = 0.04 — 0.4) - канальные соед. включ., проводники
3.6 +
S5N6, крист., желт., взр., возг. 45 10 2; мол. - корзинка 55)
TV
О ✓
( SF4)
[SF5] + [OF]“ = "SOF6", г., бц., т. пл. -86, t. к. -35, S—F 1.53, S—О 1.64, О —F 1.43 9) [SF5][OC1]; [SF5][CF3], г., бц., т. пл. -87, т. к. -20, хим. инертен; (SF5)2SO4, т. к. 94
124-139'
S4N4, циклотетратиазил, тиазен, крист., золотист, (при —100° бц., > 100° красн.), d = 2.2, т. пл. ~ 180, возг. 130/0.1 мм, взр. 130°, \Н = +460, не р. в Н2О, р. в бзл., СС14, ц = 0.72; в мол. - квадрат N4, над и под плоскостью его - по 2 ат. S образ, искаж. тетраэдр;
+ Н2О -U NH3 + S3C>6 + S2o3 ; + HI — H2S + + NH3 + I2; m ЭГ„, Э = В, Sn, Sb, S, Se, Ti, Nb, W
50)
3.2 +
|S5X5| 'X“
3.5 +
|S4X4|2 1 Xf - соли тиазила; катионы -плоские, 10- или 8-членные циклы, S—N ~ 1.5
^C12(CC14)
СУ'.
|S4IXls| 1 X
N N^N
S S. S
4NZ ЧМ 56>
S(NSiMe3)2
(300° -80° вак., AgF2)
S2N2, крист., бц., летучи; р. в эф.; взр. 30°; 20° S---N
----> S4N4 + (SN)X, мол. - квадрат । 1
N—S 1.65 и 1.66 29) • SbCl5 n S
2.67 + K[S3N3] анион -плоский 29) ЦИКЛ ’
mHs2n3], крист., желт., взр.
Na[H2S2N3], крист., кор.
S2N3H3, HN = S = N—s—nh2, амидоимидонитрид, тв., красн., в ж. NH3 - одноосновная к., РЬ2+ —► PbN2S2 + S(NH)2
И z
H2O (быстро)
^Ag^(-Agn)_ _ Mn2+ —> MnO4
4^’
Ч*’
VI’,
H2S2O8, оч.
СИЛЬН. ОКИСЛ., медл. pear.
H
OH
[S2O8]2-, бц., анион из 2 тетраэдров, оч. сильн. окисл.
H2O(—O2); I2; H2O2
H2so5,
К2 = 1О“10
+ Н2О —------> H2SO4 + Н2О2
(медл.)
H
OH
[HSO5] , бц. ион, тетраэдр
(NSF)4, иглы, бц., т. пл. 153, мол. - 8-членный цикл т. пл.
(NSF)3, крист., бц., 74
(NSC1)3, желт. 163
(NSBr)3, красн., —
[N3S3F2]+X-
т. к. \$N
93 F—S<13.
18)
F
F
Т иазилгалогениды
NSF, г., бц., гигр., т. пл. —79, т. к. 5;
+ Н2О —> NH4F + SO2 (мгнов.), ц = 1.90 * 1245“ NSC1, г., желто-зел., оч. неуст. (полупродукт в синтезе S4N4), угловая мол., N—S 1.45, S — С1 2.16, ZNSC1 118; |Co(NSF)"||AsF6|2 53)
NSBr
AgF2
Cl2 + CsCl
NSF3, г., бц., т. к. —73, инертен, не гидрол.; + Н2О -U HF + HSO3NH2; ц = 1.91, мол. - тетраэдр, S = N 1.42, S—F 1.55, ZFSF 94
3.5 + M[S4N5], крист., желт., взр., N - на середине ребер тетраэдра [S4], S — N 1.63 52)
[S(NH)2]3, диимид NH
HN=S^ ^S=NH
HN. NH
NH
HgX(-HX) тт
Hgn[SN2]
с,О з 4N4
Оксонитриды 2.66 + s3n2o, ж., неуст., красн., O = S = (N = S)2 3.33 + s3N2o2, крист., желт., т. пл. 101, S = (N = S = O)2 4 + S4N4O2, мол. - цикл 51) 5.33 + 54) S3N2O5, крист., бц., возг., в мол. -6-членный цикл O[S(O)2N]2S
z--------\ KOR
(Me3SiN = SO
Me3SiCl
SOC12
so3
+ K[NSO], тионитрит (тиазат), крист., бц., взр., т. пл. 190 M[S3N3O], M[S3N3O2], сине.-фиол.
M[S4N5O], анионы - циклы
M3[ON(SO3)2], нитрозодисульфонат
57)
T. ПЛ. т. кип.
X = SI2CI — —
f2n-sf5 -110 -16
f2n-osf5 -139 -10
f2n-oso2f -129 —2
f2n-so2f -111 -18
ci2n-sf5 — разл. 80 —I p
cifn-sf4 — 25—1 2
HN(F)-SF5 -71 25\
FN = (SO2F)2 -80 -61 J KF
fn=sf4 -99 -13 47)
Галогениды суль (NSOF)3, ж., бц. KF f фанура, (NS т. пл. а- 17 р- 13 ОГ)3 т. к. 138 130 - °WN^° Га
(NSOC1)3, крист., бц. мол. - 6-членн а- 145 ЭФ- | р- 48 ый цикл (а-" кресло", /?-"в 39 <3 С1 1.9 anna") 49)
Hg[NSOF2]2 48)
Ag4[SO2N2], сульфамид, анион - [N—S(O)2 — N]‘
21
СЕЛЕН, ТЕЛЛУР, ПОЛОНИИ
2- 2/л- 2/п+ 1+ 2 +
4 +
Образование Ро при радиоактивном распаде:
2928U ... — 284SPo ("Ra A") 283 Bi
92 a a 84 ^305 mJ p,y p,y
284Po ("Ra C’") ... 2^ Bi
1.45- IO’4 c
284Po ("Ra F") ...
138.4 дн.
7 • 10“9 % в урановой руде
29325U^ ... 2|45Po ("Ac A") 2^Pb ...
1 Q 10-3 z-. r,/
... 20Bi
232Th
90 in
1.8-10-3c
284Po ("Ac C’") ...
5•IO”3 c
282iRn 2>6Po ("Th A")
0.158 c
2822Pb 283Bi тг-^Ро ("Th C ’")
a fi,y fi,y V / a
3-10 ' C
Синтез:
28°39Bi(n, y) 283°Bi -^... 284° Ро, отделяют от Bi перегонкой вак.
3•IQ-7
Se°
Те0
Ро°
45
1
55
65 и
4р
4d
Э.О.
2.4
5р
5d
2.1
6р
6d
1.8
ЭО2 )
РоС14 )
H SO4 с катодоми3_Э)
[НП Сэл-^2 --------------
H2Se г., би Н2Те -,яд Н2Ро выход + 0.1%
с неприятным запахом
т. пл. —65 т. к. —42 АН = + 84 разл. 280 р. в Н2О 75 Xi = 10“4 К2 = ю-11 -49 —2 + 100 >0 50%(об.) I03 10 5 -36 + 35 оч. неустой- чив
угловые мол. 3—Н 1.46 I 1.66 ZH3H 90.6 90.2
HF + SbF5
OiA?Si7
[H3Se] + [SbF6|-разл. -180 41)
M'
H
Селениды M^Se, крист., бц., гигр. M2Se, крист., бц., гигр. Cu2Se, "берцелианит" HgSe, "тиманит" Hg(Se,S) "онофрит" PbSe МЭ, М = Ge- As, Мп, Bi; 3 = полупроводник] тельные матери Теллуриды Na2Te, 9Н2О крист., бц. А12Те3 Ag2Te, "гессит" АиТе2, "калаверит" HgTe, "колорадоит" РЬТе, "алтаит" Bi2Te22S "тетрадимит" Pb, Zn-Hg, Se, Те, г, фоточувстви-алы, лазеры Полониды М2Ро, М = Na-Cs, стр. тип CaF2 МРо, М = Be-Ra, Zn-Hg, Ni, Pb, стр. тип NaCl, черн., летучи
Na4[SnSe4] 16Н2О, крист., красн. 26)
Se
порошок, аморфн., красн.
(--->черн.) или стекло, d = 4.3;
в стр. - перепутанные цепи.
1CS2 х
р-р оранж. с зел. отливом
Те 'аморфный",
порошок, кор. в стр. - цепи, АГе—Те 2.86,
/ТсТсТс 102
о а-, крист., красн., d = 4.5, монокл., а = 9.05, b = 9.07, л с = 11.61, р = 90°46', в стр. - циклы Se8, \ Se — Se 2.35, ZSeSeSe 102; ft-, крист., красн., d = 4.4;
т. пл. 180 (быстрый нагрев) г монокл., а = 12.85, b = 8.04, с = 9.31, р = 93°8', в стр. - Se8 "корона" ; 1зо°
"серый" Se (термодинамич. уст.), d = 4.81, т. пл. 217, >гт. к. 685
к. 990
р. в H2SO4, HNO3, ц. в., (щ. + Н2О2) Металлоподобные проводники обладает фотопроводимостью | хрупок (пластичен при высоких Z) гексаг. крист.
а 4.36 | 4.45
с 4.96 5.93
в стр. - спиральный цепи, к. ч. 6
3 —3 2.37 | 2.82
Z333 105 102
в г. фазе 4 мол.
с , с с с -т- Стр. гексаг. Se и Те
Se8 Se6 Se4 Se2 Те2, желт. к красн.
Э2 - эл. аналоги Ofc, парамагн.
Ро
мет., серебристо-бел., светится в темноте, d = 9.4, т. пл. 254, т. к. 962, р. в НО, конц. HNO3, распл. щ., £ор04+/р0та= +0.765 а-, куб., а = 3.34, /МММ 90, к. ч. 6
/?-, ромбоэдрич., к. ч. 6. Сущ. при 20° за счет выделения тепла при торможении а-частиц
Na2SO3
[Se„]2+X2- [Te„]2+X2-, X = HS2O7, S3O10/2
(раньше "3SO3"), A1C14, AsF6, NbCl6, NbOCl4, n = 4, 6, 8; 17) [Se4]2+ -желт.; [Те4]2+-красн.; [Э4]2+ - квадраты,
3 —3 2.28 (Se), 2.66 (Те) [Те6]4+, [Se6]2+- "ванна", [Se8]2+ - зел., 2 пятичленных цикла; [Se7]2+ - 2 цикла [Se7], связанные (/z-Sc)3 '*
серебристо-серый, d =
т. пл. 450, т. -
ДМ°.
6.24,
[Se6I]„+X„-[Se6I2]2+Xi 22)
2’ ^£°2 Г tr
Полиселениды M2Se„, п = 2-6 Rb2Se3, RbSe, RbnSe8, RbSe2, RbSe3, красн., стр. аналоги M2S„ Полителлуриды Na2Te„, п = 2-6; черн., крист., гигр. 25)
Se2C; (SeN)4
SeP4; Se3P2; Se5P2
TeC; Te3N4; Te3P2
Se3N2Cl2 C'Se4N2") = = [Se3N2]2 + Cl2, катион - цикл 42)
Te(PR3)2
Те2Г, Г = C1-I [= (Те2)2(Г)2] Те3С12
О2 (скорость окисл. M2S*<M2Se <М2~е)
Se4S4, крист., красн., т. пл. 113 Se2S6, крист., оранж., т. пл. 122 Se„S8_„; TeS7, мол. - циклы [3„S8„] 30)
I
I
70е
SeO2, иглы, гигр., бел., яд, d= 3.95, возг. 337, т. пл. ~ 350(р), АН = —239, р. в Н2О 69% (25°), си., ац., СН3СООН; "селенолит", в стр. - цепи; в г. (яд с запахом гнилой редьки) - мол. мономера, Se—О 1.61, ZOSeO 113, д = 2.7
Н2° 2’
Селено- и теллурополитионаты, 3’ 25) M2[Se„S2m(SO3)2] M2[SeS2(SO3)2] 1.5 Н2О, М = Na, Ва/2, анион -цепь - [S — S — Se — S—S] M2[Se2(SO3)2] M2[Se(SO3)2]
Na2[SeSO3], селеносульфат
Na2[SSeO3], тиоселенат
H2[SSeO3] 2Н2О K2[TeS2(SO3)2] 1.5 Н2О
K2[Se(SCN)3]2 Н2О K2[Se*(SeCN)3]2 Н2О, анионы - 2 квадрата с общ. ребром, Se—S « 2.3(конц.), 3.0 (мост.), Se*—Se 2.4(конц.), 3.2 (мост.) 21)
P0SO3, крист., красн.
SeCl2, мол. - угловая (^-тетраэдр), Se —Cl 2.16
Г2; C1F3(2O°)
HgSeF4 -w
Se(CN)2
Se(SCN)2
Se(SeCN)2 28)
t (-Br2)
H2SeO3, селенистая к., крист., бц., гигр. т. пл. 70, АЯ = -527; Кх = I О3, К2 = 10" восст.; в стр. - сетка из ^-тетраэдров [:SeO3], Se — ОН 1.74, Se = O 1.64 4)
[SeO]SO4
SeO(SO3F)2
[Se(OH)3]+ [С1О4] -', крист., бц., гигр., т. пл. 33, катион - ^-тетраэдр
МОН
Селениты, NaH7[SeO3]4 MH3(SeO3)2, М = Li-Cs Na2SeO3 5Н2О; Ag2SeO3l, ПР = 10 15; MnSeO3 • иН2О, п = 2, М = Си ("холькоменит"), РЬ ("керстенит"), Ni ("альфельдит");
п = 1, М = Мп, Со, Ni, Zn, Cd [:ScO3]2 - ^-тетраэдр, Se —О 1.70-1.76, ZOSeO 99-102 7)
Se2Cl2, масло, красн., т. пл. —85, т. к. 127, д = 2.1
Se2Br2, масло, красн., т. пл. 5, т. к. 225, зигзагообр. мол., Se —Se 2.24; АЯ = -31, —> Se + SeT4, + Н2О —> Sej. + + H2SeO3 + НГ Se2(CN)2; SeSCl2 27)
28)
T. ПЛ.
208
280
T, K, 328 340
ТеС12, зел.
ТеВг2, кор.
-U Те + ТеГ4;
мол. ТеГ2 - (//-тетраэдр. Те—Г 2.36(d), 2.51 (Вг), ZTTeT 97(d), 98 (Вг)
(R4N)2[Ter4|, анион - квадрат, Те —Г 2.61(d), 2.75 (Вг), 2.98(1)28)
Tel, p. в HI, а-триклин., 3 И в стр. а - плоские мол.
Те—Те-1—I
Те—Te^
I
[Те414], Те—Те 2.77-2.93, [Те12Те2] - квадрат и [Те1Те2] - триг. пирамиды;
в стр. Р - цепи, Те—Те 2.91 2)
РоС12, крист., красн., возг. 196
PoBr2, кор.
PoSl, черн., p. в конц. HC1, (NH4)2s, си., толуоле
[Se2I4][Sb2F11]2, Se —Se 2.84 22)
Селенилгалогениды 29’31) т. пл. т. к. м
SeOF2, ж., бц. 14.5 125 2.84
SeOCl2, ж., желт., р. S, Se, Вг2, 12, е = 46 И 179 с разл. 2.62
SeOBr2, крист., оранж. 42 217 с разл. —
мол. -тетраэдр [:SeOT2], Se = O 1.60,
Se—Г 1.70(F), 2.18(d), ZTSeF 92(F), 96(d), ZTSeO 105
Se(OR)4, крист., бц., тигр.
29) т. пл. т. к. АН
SeF4, ж. бц., д = 1.78, -10 108 -849
мол. - (/<-триг. бипир. [:SeF4], Se— F 1.77 (акс.), 1.68(экв.), ZFSeF 169, 100 SeCU, крист., бц., 305 (р) 196 -184
С12 + SeCl2(r.) в г. - мол. - тетраэдр(!), в стр - (SeCl4)4, аналоги (ТеС14)4, Se —С12.16 SeBr4, крист., желт. возг. 75
Sel4 (?) — — —
[:SeF3] + [Nb2F11]-, ZFSeF 94 22)
[:SeCl3]+Х“, X = А1С14, AsF6, катион-
-тетраэдр, Se — Cl 2.11 и еще 3 связи «3
[:SeBr3] + [AsF6]“, в стр. - каркас окт.
[SeBr3F3] и [AsF6], Se—Br 2.27, Se — F 2.8
[:SeI3] + [Asr6]“, Se—I 2.5, Se—As 2.9
Se
M[SeO2F], крист., бц., гигр., 43)
Zn[SeO2F2] 6Н2О
H2SeO2Cl2, ж., желт., т. к. 170 с разл.
|R4X|2|SeOCI4|
М[8еОГ3] = M2[(OT2Se)2(M-T)2] M[SeO(OMe)3], иглы, гигр., анион - |//-триг. бипир.
[:SeO4]
CsSeF5, [:SeF5]- - </<-okt. 5) M2SeF6
M2SeCl6, M = NH4, K-Cs, крист., желт.
Me2SeBr6, H2SeBr6, 8H2O
M2Se2Br10 32*
Cs2SeI6
Стр. M2SeT6 (Г = Cl-Br) типа K2PtCl(>, анион [:ScF6]2 -правильный окт.(!), Se —Г 2.41 (Cl), 2.54 (Br)
22
Те
’7
//з° Г/Ооро ^77
^нг) .:
4 +
”5 + ”
6 +
о
и
ТеО2, порошок, бел.; —> желт., т. пл. 733, т. к. 1260, возг. 450, летуч <SeO2, АН = —322, р. в конц. к. и щ., а - тетраг., стр. тип рутила,"теллурит"; ft - ромб., искаж. стр. тип брукита (TiO2); в стр. стекла - окт. [ТсО(>] с общ. ребрами, в г. - мономерные мол. -(/<-тр-ки, Те—О 1.83, ZOTeO ПО
Ро02±х, крист., красн. возг. 885, р. в НС1, щ.: куб., стр. тип CaF2
крист., желт., тетраг.
175° (-О2); MeNO2 (10°)
(\l2SeO4)
SO3 (—K2SO4)
О
И
ТеО2 • хН2О|, бел., аморф., р. в. к. и щ. Н2ТеО3 • Н2О, крист., бц., р. в Н2О 10 f
Кк = 10 3, Хосн. = 10 "
-Н2о (t)
РоО(ОН)2 , св.-желт., р. в к., щ., Косн > 10 1
Se2O5, крист., бц., возг. 145 (вак.), Ж SeO2 + р2; АН = -414 15);
в стр. - цепи тетраэдров и (/(-тетраэдров, Se—О 1.57-1.92 Se3O7 MeNO2 15)
Те4О9
(«"Те2О5") = = ТеО3 • 3 ТеО2, разл. 485 8)
SeO3, крист., бц., тигр., т. пл. 121, возг. вак., АН = —171, оч. сильн. окисл., неуст., взр. с орг. в-вами; + Р —> Р2О5; + НС1 —> С12 (0°) ; в стр. a-SeO3 - 8-членные циклы (SeO3)4, Se — О 1.56 (конц.), 1.80 (мост.), в стр. ft - цепи (Se03)oo, в г. - тр-ки SeO3, Se = O 1.69
нп ~ , 200°
ТеО3, а - аморфное в-во, желт., < > темнеет;
400° ТеО2 + О2, d = 5.1; р. в H2O(Z);
ft-, крист., серые, d = 6.2; не р. в к. и щ.; сл. окисл.;
+ НС1 -U С12
Н
NH4OH
-Н2О(Р2О5> 260°)
H4Se3On, т. пл. 25 с разл.
H2Se3O10, т. пл. 39 с разл.
H2SeS2O10
[NO2]2Se4O13
\7
Н2ТеО4, "аллотеллуровая" к., сиропообразная масса, К > 10“8, крист., монокл., в стр. -слои окт. [ТеО2(ОН)4/2], Те—О «1.90 13)
Н2О (медл.)
Po203(S04)
- Н20(>200°)
о и
Те2О3(С1О4)(ОН)
> [Te2O3(OH)]NO3 Te2O3(SO4) Те2О3(НРО4) Те4О5(РО4)2 35)
МОН
Теллуриты 7)
М2Те2О5; М2Те3О7; Na4Te4Ojo
М2Те4О9, М2ТеО3,
М = Li-Cs, Fe/З("эммонсит"), Cu/2 ("тейнеит"), анион - (^-тетраэдр или цепи триг. бипир.
(: - экв.), Те—О 1.84-2.50
Po(S04)2 иН2О, крист., бц. PoO„(N03)4_2„ Ро2(ОН)30(Р04)(
Полониты М2Ро03, сильно гидрол. SrPo03
Sr2Po04, разл. 980 37)
Н2Те2О6, в стр. - цепи окт. [TeVIO6] и триг. бипир. [TeIVO5], Те—О 1.8-2.1 9)
К2Те4О12 9)
M2Se3O10, М = К, NO, NO2 18)
M2II(Se2O5)3, М = Fe, Сг 18)
H2Se2O7, пироселеновая к., т. пл. 19
Н2о
-Н2о
M2Se2O7, М = К, NO
H2SeO4, крист., бц., т. пл. 62, H2SeO3 + О2, в стр. -гофрир. слои искаж. тетраэдров, Se—О 1.57-1.65 • иН2О, п = 1 (т. пл. 26); 2 (-24); 4 (= (H5O2)2SeO4) (—52); 6 (—68), сильн. к., Х2 = 10“2, сильнейший окисл.; р. Au(Z), (H2SeO4 + НС1) р. Pt
140° (—Н2О, в ампуле)
Н6ТеОб, крист., бц., т. пл. 136 (/?), р. в Н2О 25.3% (20°), Ki = 10“8, К2 = 10-11, К3 = 10“15, 70°
мол - окт., Те — О 1.92 (монокл.-> куб.)
• 4Н2О (< 10°) 14)
МОН
H2SeO5, крист., ^о2
Na2SeO5
Te2O3F2 Te2O(OH)2F4
ТеОС12; Те6ОцС12 ТеОВг2; Те6ОцВг2, в стр. - цепи ф-тет-раэдров, -триг. бипир. или -окт. 36)
M[TeO(OH)F2] M2[Te2O(OH)F7]
K[TeOF3|; M2[Te2O2F6]
H2Te2O3F4, анионы - мономеры или димеры из |//-триг. бипир., Те —O(F) 1.82-2.03 6) |R4N|2|TeOF4|, - анион (/(-окт. 12)
РоОС12, крист., желт.
KNO3 (t); Cl2
Селенаты 38)
Na5H3(SeO4)4 2Н2О
KHSeO4; Li2SeO4; Na2SeO4; 10Н2О, • «H2SeO4, п = 2/3; 1; 3/2; р. >M2SO4
BaSeCM, анион-тетраэдр, Se—О
Теллураты 16)
М2[ТеО2(ОН)4],
М = К( • 3 Н2О), [BiO2] ("монтанит"), К[ТеО3(ОН)| М6Те2О9 = М6[ТеО5][ТеО4]
М4ТеО5 М2ТеО4,
анионы - окт., цепи окт. с общими ребрами, триг.
бипир. и тетраэдры, Те—О 1.83-2.08
K8H2[TeNb12O38] 27Н2О
К2Н4ТеО7
К2Н4ТеО8
ТеГ .
т. пл. т. к. АН
TeF4, крист., бц. 130 — —
ТеС14, крист., бц., 224 390 -315
р. в бзл., ц = 2.54
ТеВг4, крист., оранж. 380 421 -178
Те14, крист., серые, 280(/0 — -35
ц = 2.54 разл. 100
В стр. TeF4 - цепи (/(-окт. ywc-[TeF3F2/2], Те—F 1.8 (конц.), 2.2 (мост.)., Z FaKCTeF3KB. = 75-87. Мол. [:ТеС14] (г.)-(/(-триг. бипир. (дисфеноид), (: - экв.), Те—С1 2.33, ZCITeCI 93 и 120,
в стр. - мол. [ТеС14]4, куб с 4 Те и 4 С1 в вершинах; в искаж. окт. [:ТеС16], Те—С1 2.3 (конц.) и 2.9 (мост.). В стр. ТеГ4 (Г = Вг, I) - мол. из 4 окт. с общ. ребрами (аналоги Ti(OR)4), Те—I ~ 2.7 (конц.), 3.11 и 2.23 (мост.) 24)
[TeF3][AsF6] [ТеС13]Х, X = А1С14, AsF6, AuC14, катион - (/(-тет- раэдр или тетраг. пирамида, Те—С1 2.28-2.45 21) [ТеВг3]Х, изостр. соед. Se 22) [TeI3]X, X = АП4, Те —I 2.70, 3.53 22)
TeCl„(OR)4_„
Te(OR)4, ортотеллуриты, крист.,
(R = Me, mpem-Bu) или ж. (R = Et, Рг), бц.
HSeO3F, фтороселеновая к., ж., вязкая, дымит на возд., оч. сильн. окисл.;
+ Н2О —> HF + H2SeO4
HSeO3Cl, крист., бц., т. пл. —46, разл. —10
K[SeO3(OMe)|
H2TeO2F4, цис- и транс-, т. пл. 160 и 118 20)
(PyH)[TeO(OH)F4|
(PyH)2[TeO2F4| 20)
HTeOF5, крист., бц., т. пл. 40, т. к. 60, разл. 320, оч. сильн. к., + Н2О — Н F + !/wc-TeF4(OH)2
MTeF5, разл. Н2О, анион - (/(-окт. [:TeF5], Те —F 1.81-1.93 [РС14][ТеС15], анион - цепь окт. цис- [ТсС14С12/2]
М2ТеС16,
М = NH4, K-Cs, Tl, крист., желт.
[Ph4As]2[Te2Cl10] [Ph3C][Te3Cl13]
М2ТеВг6, оранж.
МТе3Вг13
М2Те16, крист., черн.
НТе15, Стр. М2ТеГ6 (Г = C1-I) -искаж. типа K2PtCI(> (!), Те —Г 2.51(d), 2.62 (Вг), 2.92(1)
Н2Те16 8Н2О = [Н7О3]2[Те16] • 2 Н2О 8’24)
NaH[Te(OR)6]
PoF4 (?)
РоСЦ, крист., желт., т. пл. 300, т. к. 390, +NH3 —
РоС12 • NH3
РоВг4, крист., красн., т. пл. 360
Ро14, крист., черн., летучие, р.в си., ац.
МРоС15
М2РоС16,
М = K-Cs, NH4, крист., желт.
М2РоВг6
М2Ро16, крист., красн., стр. тип K2PtCI(> (!), Ро —Г 2.38 (С1), 2,61 (Вг)
SeO2F2, г., бц., оч. реакц., т. пл. —100, т. к. —8, мол. - тетраэдр,
Se—О 1.57, Se —F 1.68 10)
SeO2Cl2
SeO2(OR)2, ж., бц.
(Xe(SeOF5b>4^
В1Т5
Se)-------
MSeO3F, М = Li-Cs K[SeO3(OMe)|
M[TeOF5], тефлаты, 12)
М = Li-Cs, Те/6, XeF, Хе/п, крист., бц., тигр., Э. О. аниона >F , Те—О 1.81, Те —F 1,82-1,86
[SeOF4]2, мол. - 2 окт. с общ. ребром,
Se — О 1.78, Se—F 1.69 10)
(SeF5)2O, мол. - 2 окт. с общ. вершиной, Se—О 1.70, Se—F 1.68 (экв.), 1.66 (акс.) 39)
SeF6, г., бц., т. пл. — 35 (/?), возг. —46, АН = —1029, мол. - окт., Se — F 1.70 SeF5Cl, г., бц., т. пл. —19, т. к. 4 П)
[SeF5] + [ОГ]-, Г = F
( = "SeOF6", г., бц., т. пл. —54, т. к. -29), Cl, Вг, I 12)
HSeOF5, крист., бц., т. пл. 38, т. к. 47; + NaCl С12
MSeOF5,
М = Na-Cs, Хе/2, анион - окт., Se—О 1.53, Se—F 1.70 12)
(TeF5)2O, (ранее "TeF5"), ж., т. пл. —34, т. к. 54 (?), мол. - 2 окт. с общ.
вершиной, ZTeOTe 145, Те —O(F) -1.82 27)
Cs[B(TeOF5)4]
Ag2[Ti(TeOF5)6]
[R4N]2[TeOF6], анион -пентаг. бипир. 40)
TeF6, г., бц.,
т. пл. —38 (р), возг. —39, АН= -1318, 200° т .
----> TeF4, гидрол. (ср. SF6), мол. - окт., Те —F 1.82
MF (C6F*
M2[TeF8],
М = Rb, Cs, [R4N]
MTeF7, 17) анион - пентаг. бипир., Те — F 1.82-1.89 17)
72° [—Xe(OTeF5)2]
Se2O2F10 — (F5Se—О-)2, г., бц., т. пл. —76, т. к. —63 Te2O2F1023)
[TeF5] + X“, X = HSO4, SO4/2, SO3F, OR, Cl, OBr, BrO2 OF, катион - триг. бипир., Те —F - 1.83 19)
23
2-
0
2 +
4 +
6 +
_____________[НТ]_________________
кат. восст.; Sn2 + ; Ti3+; Си; Fe
HCI —
[НРоОзГ
н+ он ^[Ро03]2-, бц. ион
24
о
2 +
3 +
4 +
5 +
6 +
(-о2)
Q2 + Н+ 1Сг(О2)2О(Н2О)], СИН.,
•----------мол. - пентаг. пирамида,
(—Н2О) диамагн., быстро разл.
[Сг(Н2О)6Г+ + О2), экстр, эф.в виде
[Cr(O2)2O(Et2O)]
ОН
[Сг(О2)2О(ОН)|-
сине-фиол., диамагн. ион, неуст. 2)
Мо03_„(ОН)„, сини (колл, р-ры МоО„ • хН2О, п = 2 - 3)
cOV
Молибдаты бц. ИО1 i/mc-|Mo02F4|2- 7) W-IMo02Cl„(H20)4_„l(2’n) + окт. ионы ОН- If НС1(рН<1) [Н3Мо206]3+ [НМо03]+ [Н2Мо206]2+ || НС1О4 [Мо(ОН)5(Н20)] + , А' 20 [Н4Мо8026] . А' К) 2 ОН || н + [Мо8026]4-, окта-(мета-) ОН || н + |H21VIo7024|4— ю 1 1 он 1 н+ *1 д [НМ07О24]5- ~ ОН- || н + [MovO^]6-, пара-, сущ. при конц. > 0.1 М ОН- || Н+ (быстро) (pH > 7) [МоО(ОН)5] , окт. переходный комплекс ОН- || Н+ (pH > 7) [Мо04]2-, тетраэдр, сл. окисл. Вольфраматы ты 8) i/mc-|WO2F4|2 Н2О If F [WO2F3(H2O)1 Н2О || F" "h2wo4'4 ОН- || н + IW12O36(OH)10]10- II н+ [HW12O38(OH)2]5-, додека- li н + [W12O39]6-, мета- 11 Н+ (pH < 4) [H2W12O42]10-, п ара-14 2О || Н+ (медл.) [W10O32]4“, дека-Н2О || Н+ (быстро) [HW6O21]5-, гекса-[H3W6O21]3- (pH » 6) ОН- || Н+ (быстро) [WO4(H2O)„]2- (pH > 7) не окисл.
ОН J [ЭО4]" + Н+
[Э"+(М12О40)8 ](8 п)_, э уст. > изополианионов = Si, Р, As и т. д., М = Mo, W,
н2о2 [Мо2Оп]2-
[MoOJ2- [Мо05]2“ 10)
[MoO(02)2L2]"-L = Н2О, ООН, С2О4, F, желт, анионы, пентаг. бипир.
25
ХРОМ
1+ (<С)
2 + (rf4)
3+ (</'*) _______________________________
э.о.
1.6
Керметы, термостойкие материалы,
например, 72 % Сг, 28 % А12О3 или 83 % Сг2О3, 15 % Ni, 2 % WC
Na2[Cr(CO)5], крист., желт., мгнов. разл. на возд.
М[НСг(СО)5] 32)
КОН н&7со3)
КОН , | (-Н2-НСООК)
К2|Сг2(СО)6(ОН)3Н| < Na2[Cr2(CO)10], фИСТ., желт., анион - 2 окт. с общ. ребром М[НСг2(СО)10], гр. [Сг—Н—Сг] линейна, Сг —Сг 3.41
О
3d
45
4p
Ионы хрома в водном р-ре см. с. 25
0 (</°)
со
Сг(СО)3(СбН6), мол. - полу сэндвич, Сг —СО 1.88, Сг—цикл 2.19
Сг2(СН3СОО)4, крист., желт., Сг—Сг 2.29 (Сг(СН3СОО)2(Н2О)Ы, крист., красн., уст. к О2, диамагн., стр. аналог [Си(СН3СОО)2(Н2О)]2, Сг—Сг 2.36, Сг—О 1.97; Сг—ОН2 2.27 [Сг2(НСОО)4(Н2О)2]3 ЮН2О 33)
т. пл. с разл. 1900 Сг7С3, т. пл. 1680 Сг3С2, т. пл. 1520 СгС, оч. тв., кислотоупорны, уст. к окисл.
Cr(CO)2(C6H6)L,
L = N2H4, N2, ТГФ 23)
Сг(С1О4)2 6Н2О
CrSO4 иН2О, п = 7 ("гол. купорос", изостр.
FeSO4 • 7Н2О), 5, 4 (= [Cr(H2O)4SO4]), 3, 1 (бц.)
K2SO4 6Н2О, соль Туттона
СгНРО3 2Н,О 37)
Cr(CO)„(PF3)6_„; Cr(CO)2(AsR3)2 22)
Сг, мет., серо-стальной, пластичен (после перегонки в вак.), хим. инертен (из-за тончайшего слоя Сг2О3 на поверхности), d = 7.2, т. пл. 1890, т. к. 2680, р. в НС1, разб. H2SO4, пассивир. HNO3;
£0Сг2 + /Сгтв= “°-91’ £осгз + /Сгтв= “°-74’ куб. стр. (тип a-Fe), а = 2.88, Сг—Сг 2.54
Феррохром, 60-85% Сг, остальное - Fe. В системе Fe-Cr сущ. тв. р-р вычитания и FeCr (т. пл. 930)
Стали хромистые, 0.7-1.6 % Сг, 0.1-1 % С; хромоникелевые, 0.6-1.5 % Сг, 1-4 % Ni, 0.1-0.4 % С, оч. тв. пластичные, коррозионноустойчивы; нержавеющие, ^12 %; инструментальные, 12 % Сг, 0.8-1.5 % С [содержат карбиды (CrFe)7C3]; жаростойкие и жаропрочные, 15 % Сг + 1 % Si (уст. <800°), 25 %Сг (<950°)
Сг(СО)6, крист., бц., возг. 147, АЯ = —9 8 3 , 20) уст. к конц. к. и щ.,
• — окисляются возд., диамагн., мол. - окт., ’^) Сг—С 1.92, С —О 1.16
/ | NH3
Z [Cr(CO)3(NH3)3], [Cr(CO)5(NH3)|,
крист., желт., уст. на возд.
К2[Сг3(СО)14], черн.
Cr(CO)„(PR3)6
23)
Cr(CO)3(NO)2
М[Сг(СО)5Г], Г = C1-I, желт.
K2[Cr(CO)4(CN)2], крист., бц.
Cr(NO)4, крист., черно-кор., летучи, мол. -тетраэдр, Сг—N 1.76, N = O 1.17, 1,23) разл. на возд., диамагн. (2?е = 18), vn=o 1721 см 1
26
H2Cr[P(OMe)3]5 32)
Cr(PF3)6, крист., бц., т. пл. 193, возг. вак. 20, р. в орг. р-рителях, разл. щ.
[Cr(CNPh)6], уст. >Сг(СО)6
[CrDipy3], крист., черн., оч. неуст., мол. - окт. 22)
Сг(С6Н6)2, дибензолхром, крист., кор., т. пл. 284, р. в орг. р-рителях, диамагн., мол. - гексаг. призма (сэндвич), Сг—С 2.14
M6[Cr(CN)6], крист., зел.
K4[Cr(CN)5(NO)+], 2Н2О, крист., гол., диамагн.
M[Cr(CN)(CO)5] 23)
Нитриды Cr2N, т. пл. 1650 CrN, т. пл. 1500
Карбиды
Cr(CO)5I, крист., сип., уст. < —40, мол. - окт.
[CrDipy3]ClO4, крист., темно-син., неуст. на возд., р. в си., ац., Ру, катион -окт. 22)
[Сг(С6Н6)|+ [А1СЦ] -
СгО, крист., черн., хим. инертны; 700° Сг + Сг2О3
Сг(ОН)2[ , желт., р. в к., К\ • К2_ = ю-17
т. пл. АЯ • иН2О, п =
СгГД, крист., серые 894 -761
СгС12, иглы, бц., гигр. 824 -397 4, транс-[СгС12(Н2О)4] 2), 38° крист., СИН. > зел. изомер 1 51° (—Н2О) 3, крист., гол.
СгВг2, крист., бц. 842 -318 6
сп2, крист., красн. 795 -158 —
Монокл. стр. CrF2 и ромб. СгС12 - искаж.
тип рутила (TiO2), Сг— -С1 2.39 (4 связи);
2.90 (2 связи); в стр. монокл. Сг12 - цепи
окт., в г. фазе - Сг2С14, :'г С1 2.20 и 2.34 33)
•2N2H41, и • NН3, п Г = Cl, I, уст. к окисл. = 1-6
CrSJ., крист., черн., искаж. стр. тип NiAs
CrSe; CrTe
о2 (О
MCrF3 MCrCl3
М2СгСЦ; M3CrCl5 M2[CrBr4|; MCrBr3
M2[CrBr4(H2O)2] CsCrI3; анионы [CtT7] - цепи окт. с общ. гранями, высокоспиновые искаж. окт. комплексы, Мэфф = 4.9 {sp3d2) 3)
t (-I2)
[Cr(CO)2(AsR3)2r]r, к. ч. Сг 5 (!)
Сг(СО)4Г2, Г = С1, Вг, крист., желт., неуст.
[CrDipy3](ClO4)2, крист., черн., р-р красн., •, мгнов. окисляется
&— [CrDipy3]Br2 • 4Н2О, низкоспиновый комплекс (2 неспаренных эл.)
[CrDipy2(H2O)2]Cl2, высокоспиновый (4 неспаренных эл.)
[CrDipyr2] 22)
Mg
K3[Cr(CN)4]
Cr(CN)2, 2Н2О, Мэфф 2.73
CN
Сг(С5Н5)2, хромоцен, крист., красн., т. пл. 173, окисляется возд., низкоспиновый (2 неспаренных эл.), стр. аналог ферроцена,
Сг—С2.17, С —С 1.43
Cr7S8; Cr5S6 Cr3S4, стр. близка NiAs, Сг—S 2.44
K4[Cr(CN)6] 2Н2О, крист., сип., низкоспиновый {d4, 2 неспаренных эл.) окт. {d2sp3) комплекс, Мэфф 3.2 K3[Cr(CN)5(NO)], крист., св.-зел.
K4[Cr(NCS)6]
Na3[Cr(NCS)5(H2O)| 8Н2О, гол., Цэфф 4.5 [AmH][Cr(NCS)4]
Cr2F5, в стр. -правильные окт. [Сг11^] и вытянутые [CrnF6]
[Cr(NH3)3Cl2(H2O)]Cl, 3 изомера (красно-фиол., зел. и серый J.)
Cr(CN)3J.; Cr(NCS)3, хор. р., плохо крист.
Cr2S3(., листочки, черн., не образ, из р-ров в Н2О (ср. А1), но не р. в Н2О, р. в к.-окисл.; CrN, черн., не р. в к., щ., стр тип NaCl, —Cr2N
22)
Сг2О3, крист., темно-зел., т. пл. 2340 (р),
\Н = —1134, не р. в к., сплавляется со щ., M2S2O7, р. в NaBrO3 + Н2О (—> Na2Cr2O7 + Н2Сг2О7 + Вг2), стр. тип корунда (А12О3), "эсколаит"; Сг—О 1.96
430° (-Н2О)
СгО(ОН), крист., зел., стр. тип Cdl2
Сг(ОН)3 ЗН2О = [Сг2(ц-ОН)2(ОН)4(Н2О)4] • 2Н2О 36)
Сг(ОН)4, изостр. А1(ОН)3, "гидраргиллиту"
| —Н2О (медл.)
Сг2О3 • иН2О(., гель, серо-гол., К\ • /С • А3осн = 10 30;
Кк = 10 16, р. в к., щ., сл. р. в NH4OH, пептизуется СгС13
Cr2(SO4)3, крист., св.-роз., р. в Н2О в присутствии Сг2+
• иН2О {п = 18, 15) = [Cr(H2O)6]2(SO4)3 • {п— 12)Н2О, крист., фиол.;—.
• Miso4 • 24Н2О = [M(H2O)6] + [Cr(H2O)6]3 + (SO4)2, М = Na-Cs, \\ >
' фиол. квасцы, Сг—О 1.92, • nH2SO4 • /иН2О {п, т = 1, 14; 2, 18) 34)
X Cr2(Se2O5)3 34) \
Cr(NO3)3, порошок, зел., разл. 60, • яН2О, п = 9, 7.5, крист., красн., ' т. пл. 37 и 100
СгРО4-иН2О(., п = 6 (фиол.), 4 (зел.), 2 (фиол.); СгНР2О7 • 7 Н2О; Сг(РО3)335)
Сг(СН3СОО)3 6Н2О, иглы, сине-фиол.
[Cr3O*(RCOO)6(H2O)3]+X“ иН2О, X = СН3СОО, Cl, NO3; оксоацетаты, крист., зел., в катионе - тр-к [ОСг3], Сг—О 1.89 вдоль каждой стороны тр-ка - 2 СН3СОО (мост.), [СгО*О4(ОН2)] - окт., Сг—ОС и 2 4)
\ |Сг3(СН3СОО)6(ОН)2|С1 • 8Н2О 4); Сг2(С2О4)3 • и Н2О [, крист., фиол., неуст.
CrOCl
т. пл. Мэфф • иН2О, п =
CrF3, крист., зел. СгС13[, крист., фиол., + Cr2+, Sn2+ -р. в Н2О; разл. > 700 СгВг3[, крист., черно-зел., + Сг2+, - р. в Н2О Сг13, крист., черн. В стр. CrF3 - ромбоэдриче СгС13 (искаж. тип. ReO3) - CrBr3 типа FeCl3 //NH3 (и = 5, 6), • 3L; L = 1200 (возг.) 1150 (возг.) в токе С12 600 ской (изостр. слои окт., С ROH, Thf, С( 3.69 3.94 4.03 A1F3) г—Cl )(\112) -1113 -510 -402 -201 - сетка 2.38; ро 2, ОКТ. М( 3, 3.5, 4, 5, 6, 9 31) 10 (< 6°), 6, р. в Н2О, си., сущ. 3 изомера* 6 ** 9, черно-фиол. окт., в гексаг. стр. мбоэдрическая стр. эл. 31)
* [Сг(Н2О)б]С13, крист., серо-гол., не р. в ац., (эф. + [Сг(Н2О)5С1]С12 • Н2О, крист., св.-зел., р. в ац., (эф НС1) + НС1)
НС1 (эф., 0°) Т [Cr(H2O)5Cl]SO4 ЗН2О t
H2SO4 Т г/ис-[Сг(Н2О)4С12]С1 • 2Н2О, крист., темно-зел., катион окт., Сг —О 2.01, Сг —С1 2.28
эф. (-Н2О) J. цСг(Н2О)зС1з], аморфное в-во **[Сг(Н2О)4Вг2]Вг 2Н2О зел. кор., гигр., уст. в эф г [Сг(Н2О)б]Вг3, фиол р-ре
[СгАш6]Х3, Am = NH3, En/2, Dipy/2; X = Г, NCS, NO3, SO4/2, РО4/3, оранж. (лутеосоли) (ср. Со111)
[Cr(NH3)5X]X2, X = Cl, Br, SO4/2, красн. {пурпурен-)
[СгЕп2С12]С1 Н2О, красн.-фиол. {цис-) и зел. {транс-)
[Cr(NH3)3Cl3], сип.; [СгРу3С13], зел.
[(NH3)5Cr—ОН—Cr(NH3)5]Cl5, "нормальный родохлорид", красн.
н+ II ОН
[(NH3)5Cr—О — Cr(NH3)5]Cl4, "осн. родохлорид", сип., гр [Сг—О — Сг] 5)
I ОН- (медл.) линейна
[(NH3)5Cr—ОН—Cr(NH3)4(OH)]Cl4, цис- "осн. эритрохлорид", красн.
НС1 |
[(NH3)5Cr—ОН—Cr(NH3)5(H2O)]Cl5, • ЗН2О, "нормальный эритрохлорид", красн., Сг—О 1.91-1.97, Сг—N и 2.08, ZCrOCr и 150°
[Сг(С5Н5)2]+Х-', крист., зел.
HC1O4, HIO3; 02(<400°, p)
C(—Na2CO3—CO)
280°^'
[Cr(NH3)6](NO3)3)
Cr(NO3)3 • 9 H2O
Хроматы (III) ("хромиты") 21)
М3[Сг(ОН)6] ( = "М3СгО3 • ЗН2О"), М = М1, Ва/2
MCrO2, М = Li-Cs, св.-зел., изостр. MFeO2 Сг2О3 • МПО, Мп = Mg ("магнезиохромит"), Fe ("хромит", "хромистый железняк", изостр. Fe3O4), шпинели, в окт. Сг—О 1.9-2.11
b; Br2
"Cr2(SO4)3 иН2О", = Hm[Crz(SO4)1.5„(OH)x(H2O)J, п < 6, "зел. сульфаты" (не дают р-ций на Сг3+и SO4 Cr(OH)SO4 Н2О, в стр. - каркас окт.
[Сг(ОН)2О3(Н2О)] 34)
М3[Сг(С2О4)3] иН2О, крист, с плеохроизмом (от красн. до сине-зел.), сущ. 2 оптических изомера, анион - окт., Сг—О 1.96 30)
М„[Сг(С2О4)2Х2], X = Н2О, он, СН3СОО
M3[CrF6], анион - окт. Cr—F 1.90
Rb2CrF5, в стр. - цепи окт. !/wc-[CrF4F2/2],
Cr—F и 1.90 25)
M[CrF4]„, M = Na-Cs, Са, в стр. -конденсированные окт., Cr—F и 1.90; Sr5Cr3F19 М3[СгС1б], M = Li-Cs, крист., красн.
М3[Сг2С19], М = К -Cs, парамагн., дэфф = 3.77, в стр. - 2 окт. с общ. гранью (Сг—Сг 3.10, ср. W !), Cr—С1 2.35
М2[СгС15(Н2О)], М = Li-Cs, Tl, NH4, Mg/2, Ва/2, крист., красн.
М2[СгС12(Н2О)4]С13, крист., зел.
[РуН]2[СгС13(Н2О)3]С12
[pcuricrcur
Cs3[Cr2Br9], цЭфф = 3.81, Cr—Cr 3.32
M2[CrBr5(H2O)|, крист., фиол.
M2[CrBr2(H2O)4]Br3, М = Rb, Cs, крист., зел.
29)
CrO2, крист., черн., разл. 450, АН = —594, проводник, ферромагн., стр. тип рутила (TiO2),7) Cr—О 1.88 (2 связи), 1.92 (4 связи)
Н4Сг3О8 =
= [Crin(OH)2]2[CrIVO4] (?)
NaxCrO2, х = 0.5 - 0.7 19)
(СООН)2
*(“СО2)
280'
220'
6+(rf°)
4.8 +
. _ Сг5О12 =
Cr2n[CrVIO4]3
Сг2О5 » С?2П[СгГО7]3,
Сг2О3
Cr3O8
H2O2 (—CrO5 • Et2O)
4.5 +
н3сг2оа =
н2° <^дл2_ [Сгш(ОН)2]х x[HCrVIO4] (?), кор.
Хроматы (IV) 19)
Na2CrO3 (?), Na4CrO4, зел.
МпСгО3, М2СгО4, сине-черн., уст. на возд., в стр.-тетраэдры [СгО4]4 , Мэфф 2.8
Ва3СгО5, крист., зел. мУСгОб, Мп = Sr, Ва; + Н2О Сг(ш) + Cr(vi)
Cr
кф <5+ + 3’
О ^С]
(0°)
MCr3O8 = MCrin[CrVIO4]2
27)
Хроматы (V) ("гипохроматы")
М3СгО4, крист., зел., парамагн. (dx), цэфф= 1.60 М3'(СгО4)2, Мп = Са, Ва, черн., анион - тетраэдр, Сг—О 1.67-1.70;
+ Н+ — Сг3~ + Сг2О7“
[РуН][СгО2С12], неуст. 26)
СгО3, иглы, красн., яд, т. пл. 197, возг. АН = -577, р. в Н2О 62% (15°), в стр. -цепи тетраэдров, Сг—О 1.60 (конц.), 1.75 (мост.), ZCrOCr 143
яН2О, п = 1 — 4, оч. сильн. окисл., + EtOH —► СН3СООН + Сг3 +
H2SO4 (конц.)
H2O2 (0°)
Тетрахроматы, M2Cr4Oi3, М = K-Cs,
крист., кор., 210°
K2Cr4O13 К2Сг2О7 + СгО3;
анионы - цепи из 4 искаж. тетраэдров с общ. вершинами, Сг—О 1.6 (конц.), 1.7-1.8 (мост.), ZCrOCr 147, 139 и 120 12)
H
OH
СгО5 • L = [Cr(O2)2OL], L = Ме2О (взр. 30°), Ру, уст., к. ч. Сг 6, крист., СИН., р. в эф., бзл., диамагн.. мол. - пентаг. пирамида с О в вершине (искаж. окт.)
[Cr(O2)2(NH3)3], крист., кор., парамагн. (2 неспаренных эл.), мол. - пентаг. бипир., О—О 1.43, ZOCrO 45
CrF4, крист., темно-зел., гигр., т. пл. « 200, возг., АН = —1196, pear, со стеклом, не р. в орг. р-рителях, цэфф и 3 СгСЦ 1 CrBr4 / СУЩ' в г' MF M[CrF5], крист., СВ.-рОЗ., /^эфф 3.1 M2[CrF6], М = = K-Cs, парамагн., окт. комплексы
(BrF3)
-------------------(СгС13
MCI + Н2О + НС1 4-------'
CrOF3, в стр. - окт. [CrOFF4/2], Cr—О 1.54, Cr—F 1.74-2.18, цэфф= 1.82 •О.ЗГГ3, крист., красн.
СгОС13, крист., темно-красн., сущ. при /<0°, возг. вак.; + Н2О — Cr3 - + Cr(vi) 9)
CrF5, крист., малинового цв., оч. гигр., т. пл. 30, в стр. - цепи окт. i/wc-[CrF4F2/2], в г. - мол., триг. бипир., Сг—F и 1.70; + Н2О CrOF3; сильн. окисл.;
+ SO3 S2O6F2 + + Cr(SO3F)3 9)
M[CrOF4],
М = К, Ag, крист., пурп., оч. гигр.
М[СгОСЦ]
М2[СгОС15],
М = NH4, [R4N],
K-Cs, красн., .. = 1 7 26>
Дэфф 1 '
MCrF6, М = Cs, [NO2], [NF4], [NO], оч. гигр. 9)
и
и
и
и
Cr2o3
О
____ -7£^О;
ЖеО • Сг2О"'
^co.
Трихроматы, М2Сг3Ою,
М = Na( • Н2О), K-Cs, крист., красн.; 243°
К2Сг3О10 К2Сг2О7 + СгО3;
анион — цепь из 3 тетраэдров с общ. вершинами,
Сг—О « 1.6 (конц.), 1.7-1.8 (мост.), ZOCrO 103-113, ZCrOCr 136 13)
H
OH
MOH
Бихроматы, крист., оранж.
т. пл.
320
398
разл. р. в Н2О, % 52 —
400 62 (20°)
>500 13 —
200° Сг2О3 +
n2 + H2O
2H2O 2H2O
сгорает
= Са, Ва (• 2Н2О), РЬ
Li2Cr2O7
Na2Cr2O-
K2Cr2O7
(NH4)2Cr2O7 —
MnCr2O7, M1
("крокоит"), p. в H2O, оч. сильн. окисл.;
+ HC1 Cl2 + CrCl3, анион - 2 искаж.
тетраэдра с общ. вершиной, Сг—О 1.6 (конц.), 1.8-1.9(мост.), ZCrOCr 115-120
K3[Cr(CN)6], крист., желт., разл. 150, изостр. K3[Fe(CN)6], Сг—С « 2.07, высокоспиновый (d3, 3 неспаренных эл.) K3[Cr(NCS)6] 4Н2О, красно-фиол., оч. уст. (не дает р-ций на Сг3+)
M[Cr(NCS)4(NH3)2]-»ipaHc, М = NH4 ("соль Рейнеке"), Cu/2]., Hg/2J., Н ("к. Рейнеке"), крист., красн.
M3|Cr(NCO)6| 24)
EtOH + HCN + KCN --> »— • — • — • — • — • —(CrO3
[CrF4] + [Sb2F11]-, ж., красно-кор., —23° - стекло, т. к. 377 9)
X
(i2o^2^
С°2)
NaCrS2, крист., красн., р. в Н2О K2[Cr4O7], Fe[CrS2]2, "добреелит' MCr5S8, М = K-Cs 6)
Na2CO3 + S
(Z-BuO)2
K3[Cr(C2H)6], крист., оранж., неуст.
CrOCl3
Cr(NEt2)4
| ROH
Cr(OC4H9-Z)4, крист., гол., летучие, тигр., АН = —1276, чувствительные к О2, сильн. окисл., парамагн. (2 неспар. эл., d2), мол. - тетраэдр (d3s) 8)
СгО2Х2, X = С1О4, СН3СОО, SO3F, NO3, OR, Sb2Fn, SbF6 n)
СгО3
C1F; WF6
6\
OH
H
Хроматы, крист., желт. Li2CrO4, 2Н2О Na2CrO4 10Н2О К2СгО4 (NH4)2CrO4 т. пл. 792 20 968-980 разл. 200 р. в Н2О, % 60 46 39(20°)
СаСгО4, "хроматит", • 2Н2О, р. в Н2О ВаСгО4 : РЬСгО4 • Н2О . "иранит"; Ag2CrO4 . анион - тетраэдр (d3s), Сг—О 1.60-1.67 14)
Na4CrO5 • 13Н2О, ортохромат., крист., желт.; + ОН Na2CrO4
H2O2,
Пероксохроматы М[Сг(О2)2О(ОН)] Н2О,
М = К, NH4, Т1, крист., сине-фиол., медл. разл. 20°, взр. (Z), диамагн.
К3[Сг(О2)3О] (?) 17) M3[Cr(O2)4], М = Na (разл. 115, р. в Н2О -80% при 0°), К, NH4, крист., красно-кор., уст., взр. >170°, сл. р. в Н2О, парамагн. (1 неспареный эл.),
Ba5[CrvN4]N, крист., черн., анион -9) тетраэдр ’
НХ; С1О3 (-С1О2 -С12)
Хромилгалогениды 10) т. пл. т. к.
CrO2F2, крист., красно- J медл. Фиол- 30 возг. 9)
(CrO2F2)„, серый % 200 —
СгО2С12, ж., красн., -97 117
СгО2Вг2, крист. — —
гигр., р. в СС14, оч. сильн. окисл., взр. с орг. в-вами, мол. - искаж. тетраэдр, Сг—О 1.57, Сг—Г 1.74(F), 2.12 (С1); ZOCrO 105, ZTCrr 119(F), ИЗ (Cl)
M[CrO3(IO3)], М = М1, Mg/2, Со/2
M[CrO3F], М = Li(- 2Н2О), Na(- 2Н2О), K-Cs 18)
М[СгО3С1], оранж., уст. при pH + 7, М = K-Cs
К[СгОзВг], кор., К[СгО31], красн., + Н2О К2Сг2О7 + НГ; анион - тетраэдр, Сг—О 1.61, Сг—Г 1.78(F), 2.19 (С1) 16)
ню3
изостр. K3NbO8, анион - додекаэдр (середины 4-х граней [О2] образ, тетраэдр)
,, SO3(SO2C12)
CrO(SO4)2 I______
SiO2 (20°)
CrOF4, крист., красн., т. пл. 55; KrF2; SbF5 9)
Н2О
F2 (220°)
РГ5, НГ (г.); F2
M2[CrO2F4], М = К, Cs (т. пл. 340), Mg/2, Са/2 П)
M[CrO2F3], М = [NO2], [NO], крист., желт., разл. 130
Na2[CrO2F2(CF3COO)2] П)
[NO][CrOF5], крист., роз. 9)
CrO3
.• >-100° „ 9)
CrF6, крист., лимонно-желт.; -----> Сгг5 ’
М(СгГО6)„ тН2О, М = Li(m = 1), Na (1), К (0.5), Mg (6), Со (0);
-U М2Сг2О7 + 12О5Т 15)
27
МОЛИБДЕН, ВОЛЬФРАМ
47
55
$Р
э.о.
1.3
2 + (<Г)
3 + (</3)
5d
6s
6р
1.4
Мо
Н2О (800°)
Ионы Мо и W в водном р-ре см. с. 25
Мо мет., сероват d 10.2 т. пл. 2620 т. к. '--4630 р. в конц. H2SO4 пассивир. конц. HNO3 легко р. в распл. (КЬ £ом3+/Мтв “°-20 £0[МО4]2-/Мтв -1-05 куб. (тип а- а 3.14 М —М 2.80 W э-бел. 19.3 3420 5680 (HF + HNO3) оч. сл. р. в ц. в. О3 + NaOH) -0.15 -1.05 Fe) 3.16 2.80
Мо(ОН)3 1, черн., плохо р. в к.
Мо02 WO2
крист., кор., диамагн.,
возг. 1000 т. пл. « 1270
1 т. к. ~ 1700
Мо + МоО3 >1050 возг.
АЯ= -586 -590
р. в к.-окисл., конц. щ.,
искаж. стр. тип рутила
МоО(ОН)2 =
= Н2Мо5О7(ОН)8, оливково-зел., сл. р. в щ.
[МоО3]2-, зел.-гол. р-р) 26)
-н2
NH3; Н2
WH6 2PMe2Et, крист., бц., т. пл. 112 с разл., хор. р. в орг. р-рителях
/ Ферромолибден Ферровольфрам
1 > 55 % Мо, 65-80% W,
I 1-2% Si, 0.4-1 % Si,
+ 0.1-0.2 % С, 0.2-0.7 % Мп,
741 д . 0.1-0.2 % Р, S, 0.3 % Си, 0.5 % С,
остальное - Fe. 0.1 % S и Р,
В системе Mo-Fe остальное - Fe.
сущ. тв. р-р вычи- В системе Fe-W
тания, МобГе7 и сущ. тв. р-р вычи-
О I Mo2Fe3, (т. пл. тания, W6Fe7 и
1540 и 1480) WFe2 (т. пл. 1640 и
о 1 с 1 1046)
Металлоподобные фазы
(включение Э в стр. М) в системах Mo(W)-B (С, N, S) оч. тв., тугоплавки, хим. инертны, Мо2С (т. пл. 2690), WC (2600 с разл.), W2C (2800), d = 17.3; МоС (2700) 42) М2В; МВ; МВ2; М2В5
M2N; MN; МР4
M3Si; M3Si2; M5Si3; MSi2
K4[Mo2(S04)4], 2Н2О, крист., роз.
K2so4
-x (MoO3
+>-----
M02(SO3F)4
71)
О
<44
О,
Cs2[Mo2(hpo4)4(h2o)2],
крист., пурп., уст. на возд., Мо = Мо 2.22 45)
М3[М02(НРО4)41С1
M0(O2)(SO3F)4
Mg2Mo308 20)
[К^][НМ2(СО)10], в анионе - линейная гр. [М—Н—М] [R4N]2[W(CO)10] 33)
Инструментальные стали - быстрорежущие: 17.5-18.5 % W, а также Cr, V, С, Мп, Si.
"Победит", 80-87% W, 6-15% Со, 5-7% С.
[Mo(RCOO)2]2, иглы, желт., возг. 300 (R = Me), диамагн., стр. аналог [Cr(RCOO)2]2
СН3
2.5 +
K3[Mo2(S04)4] 2.5 H2O, крист., гол., цэфф = 1.69 3); + H2O [Mo2]4+ + Мо(ш)
О (</*)
Na2[M2(CO)10], крист., желт.
Na2[Mo3(CO)14], черн. 33)
М(СО)б крист., бц., возг. вак. 30-50, ^120,
АЯ = -979 (Мо), 961 (W) 22), р. в орг. р-рителях, не р. в к. и щ., мол. - окт., М —С 2.13 (Мо), 2.3 (W); С —О 1.15
N.a2?4_ т. к. 156 (Мо), 175 (W), разл.
СО
сн3
2.5 +
[Mo2(RCOO)4] + [I3]-[MoW(RCOO)4]I,
крист., кор., Мэфф = 1-67 43)
Na[Mo2P3Oi2], в каркасной стр. - окт. [МоО6], Мо—О ~ 1.33 Cs2[Mo304(C204)3(H20)3] 4Н2О • 0.5Н2С2О4, уст. в крист, и р-ре, в анионе кластер - тр-к [ОМо3], Мо—Мо 2.49, Мо —О 1.92-2.09 [R4N]4[Mo304(NCS)8(H20)] 46)
K4[MO2(CN)4] -транс, диамагн., анион - окт., Мо = О 1.83, Мо —С 2.20
К[М(СО)5Г] 45)
Мо(СО)„Еб_„, L = Ру, 3R3, ЭС13 (Э = Р-Sb), Snr4, MeCN, Dipy/2 °
K4[Mo(CN)5(NO)°], крист., фиол.
K3[MO(OH)(CN)4] иН2О K6[M2O3(CN)8] иН2О 47)
c
CH3
W(CH3COO)2
MoW(RCOO)4
MoCr(RCOO)4 32)
M(PF3)6, крист., бц., возг. вак. 40, т. пл. 196 (Мо), 214 (р, W), не р. в Н2О, разл. щ.
K2[W(CN)5(H2O)]
K[Mo(CN)5], диамагн. (42), анион - тетраг. пирамида (d4s)
H4[M(CN)8] 6Н2О
K4[M(CN)8] 2Н2О, крист., желт., диамагн (d2), анион - додекаэдр (d4sp3) в стр. и антипризма - в р-ре, Мо — С 2.16
W[P(OMe)3]6 2)
. ^<MoC14(PR3)])
|M(N2)2(PR3)4|-i/mc 2)
IM(N2)2[(R2P—СН2—)2]2,
цис- и транс-, крист., оранж., уст. на возд., мол. - окт., (N2)aKC, N = N 1.103;
+ EtOH + КОН —> NH3 + ...
+ z-PrOH —> N2H4 + ...
MH2C12(PR3)4
55^
K5[Mo(CN)7], диамагн., анион -пентаг. бипир.
K4[M(CN)6] K6[M(CN)8] 7)
NOC1
Moi2Si4; M09S11 Mo6S8, в стр. -колонки из тр-ков [Мо3]
K2[Mo(CN)5], красн.
K4[Mo(CN)7] 2Н2О, черн., Мэфф = 1.75, анион - пентаг. бипир., Мо — С 2.16
K5[Mo(CN)8] 7)
K3[M(NCS)6] иН2О, уст. к окисл., цэфф « 3.8
K2[Mo(NCS)6]
M5[W3O4(NCS)9] иН2О, пурп.
крист., стр. аналог
M5[Mo3O4F9], W—W 2.53 46)
S(Z)
Mo)------
(С5Н5)2МоН2, мол. -клинообразный сэндвич, Мо —С 2.22-2.41
М(С6Н6)2, мол. - сэндвич
Mo(C6H6)(PPh3)2
1 N2
|(С6Н(,)Мо(РР113)2Х = |2
(С6Н5)Мо(СО)3
(С5Н5)Мо(С(,Н6)
[(C5H5)M(CO)3X|,
X = H, Cl, R, мол. - трит, бипир.
MoS2)_, "молибденит", графитоподобные серые листочки, т. пл. « 2100, \Н = —248, р. в ц. в. В гексаг. слоистой стр. (и призмы [MoS6/3 WS2)_, "тунгстенит", р. в (HNO3 + HF) и распл. щ., полупроводник, стр. типа графита стр. аналог Cgo 72) скаж. тип. Cdl2) - трит. ; + О2 —> МО3
(NH4)2[Mo3S(S2)6] 0.5 Н2О 48), крист., красн., диамагн.
5+ (</*)
6+ (rf°)
5.5 +
5.6 +
5.75 +
5.78 +
Мо205, крист., черно-фиол., р. в к. (/)
5.44 +
W18O49, в стр. - слои кластеров [W6] 20)
Мо4Оц, Moi7047 сине-фиол. 20)
Mo5014
-U мо2 + мо3
Мо8023 гол.
Мо9026 черн.
5.80 + W2qO58, сине-фиол.
5.9 + W5oOi4(, W40Ou t, красно-фиол.
Мо308 • Н2О "ильземанит'
M(Z) Мо03, иглы, св.-зел. (—^ желт.), d = 4.69 WO3, крист., желт. оранж.
летучи с паром Н2О
т. пл. 795, т. к. 1155, возг. 650, \Н = —753, р. в щ., NH4OH и HF; в г. - В ромб. стр. - цепи тетраэдров [Мо—О 1.67 (конц.), 1.95(мост.)]; за счет еще 2-х связей (2.25-2.33) образ, трехмерная сетка окт.; "молибдит" • 1/3 NH3, в пустотах цепочечной стр. МоО3 68) т. пл. 1473 (р), возг. 850, \Н = —841, d '--7.2 циклич. тримеры Во всех модификациях (тетраг., ромб., монокл., трикл.) - искаж. тип ReO3, каркас окт. [WO6], W—О 1.72-2.16
‘/(-Н2О)
/------ч
f~N«+T^(NH4)2MO4) Г+О)у У
MoY3£% Н2о-
MoO(02)2LL', L и L' = = Н2О, Ру, OP(NR2)3, к.ч. Мо 7 (пентаг. бипир.), Мо = Оакс 1.67; Мо—ОО 1.92-1.98; О—О 1.47 19)
-н2о
(4-6) + Колл, р-ры гидратов окислов, Мо03_„(ОН)„, п = 2 — 0
4.4 + Мо507(ОН)8 МоО(ОН)3] кор., р. в к. п = 1 — 0, "молибденовые сини" | 15.67 + | 5.75 + Мо4О10(ОН)2 1 Мо4Оц • х Н201 Мо6017 • Н2О 1 Мо8023 • 8Н2О крист., сип., не разл. щ. и NH4OH, сл. восст.
SO2; H2S; HI; Zn; Mo; Sn2 + ; N2H4
М0ОРО4 2Н2О
73)
Се/ц
Мп(Мо03)2, Мп = Mg-Ba
Mo(NCS)5 • 2 Ме2СО, черн.
Mo2S5 иН2О1
(5.5-5.9) +
WO3_„(OH)„, « = 0.5 —0.1, "вольфрамовые сини", оч. сильн. восст.
"Бронзы" - вольфраматы и молибдаты М1 и Мп (5.67-5.74) +
К„Мо03, крист., п = 0.33 (красн.), 0.30 (гол.), 0.26 (красн.), полупроводники 50)
(5.1-5.7) +
Na„WO3, (0.3 + п + 0.9), крист., с мет. блеском и проводимостью; желт, (п = 0.9), красн. (0.6), сине-фиол. (0.3); в куб. стр. типа CaTiO3 - сетка окт. [WO(>] (ат. WVI и Wv эквивалентны)
а-, /?-К2Мо204Р207, крист., янтарного цв., Мо—Мо 2.56 73) a-K2Mo203(P04)2; KCsMo203(P04)2, крист., красн. 73)
M4[Mo204(NCS)6]
K3[WO2(C2O4)2]
К3(МоО)4(Р04)5, К+ - в туннелях, образ. [РО4] и [MoOg]
о о
Мо Мо
73)
Na2{[M0O(C2O4)2(H2O)]2O2}, диамагн., Мо—Мо 2.51
о
о
K4[M02O3(NCS)8] 4Н2О, II / II /
Мо — О 1.85 (мост.), 1.66 (конц.), —Мо—О—Мо—
Мо —N- 2.17 49) / \ / \
K2[MoO(NCS)5] 1 1 /
H3[M(CN)8] 6Н2О K3[M(CN)8] иН2О, п = 0, 2, желт. (Мо), сип. (W); анион -двухшапочная триг. призма, цЭфф = 1.61
KCN + КВН4(Н2О)
< /
(NH4)2[(S2)2Mo(S2)2Mo(S2)2] 2Н2О,
крист., диамагн., Мо—Мо 2.83, к.ч. Мо 9, Мо —S 2.39-2.50 52)
5.3 +
M2W3S9
M2W3OS8 2Н2О 53)
Мо03 1/3 Н2О Мо03 • Н2О], иглы, бц., образ, из горячих р-ров, разл. 115, в стр. а- трикл. - цепи окт. [МоОО4/2(Н2О)], Мо = О 1.69-2.28, Мо — ОН2 2.35 13); желт., монокл. | -Н2О (Н + , о Мо03 • 2Н2О], крист., желт., разл. 70, стр. аналог МоО3 • Н2О, II мол. Н2О - в пустотах решетки образ в стр. - слои окт. [MoOg] и [Н3О]+ 14) WO3 1/3 Н2О 51) H2WO4], крист., желт., не р. в Н2О и к., разл. 100; "тунгсит", в стр. - цепи окт. [WOO4/2(H2O)], W = O 1.69, W—ОН2 2.34 51) -н2о | (Н+, 0 H2WO4 • Н2О], бел., "гидротунгстит" при 20°
Н+ „ он-
Изополимолибдаты 17) Изополивольфраматы 17)
МОН
мета-
Na2[H18Moio04(J; М6|М0|9О33|
М2[Мою031] • лН2О
М^МоюО^] • иН2О
М4[Мо8026] /;Н2О
мета-("тетра"-)
М(,|Мо7О24| 4Н2О пара-, М = NH4, К, Rb
Cs2[Mo7022]
пара-
Н2О2
’(30%, 0°)
анионы - блоки из окт. с общ. ребрами, М — О
M2[Mo6019|; Cs2[Mo5016|; М2[Мо4013] лН2О, р. в Н2О
М2[Мо3Ою1; М2[Мо207], анионы - 2 тетраэдра с общ. вершинами или цепи из тетраэдров и окт.
М2[Мо04], М = Na (т. пл. 687), К (919), крист., бц., хор. р. в Н2О,
Ag] (желт.), анион - тетраэдр, Мо—О 1.77
МпМо04], Мп = Mg, Са ("повеллит"), Sr, Ba, РЬ ("вульфенит"), Cd, Mn-Zn и М3[Мо06], Мп = Mg-Ba, окт.
K4IM0O5], анион - триг. бипир.
M6[H2W12O40l лН2О, мета-, стр. аналоги гетеропо-лианионов; Na10[W12O41] 28Н2О, M10[W12O36(OH)10)l яН2О, пара-, анион из 4-х троек окт. с общ. вершинами, внутри тройки -общ. ребра
(NH4)6H6[W12O42] юн2о
[R4N]2[W6O19], анион - стр. аналог [Nb6Oi9]8 M8W4O16, анион - стр. аналог [Ti(OR)4]4
K2W3O10, каркас окт. с общ. ребрами
1.7 (конц.), 1.9-2.4 (мост.)
M2[W2O7], цепи из тетраэдров и окт. с общ. вершинами
M2[WO4], М = Na (т. пл. 692), К (921); • 2Н2О, крист., бц., оч. хор. р. в Н2О; Мп/2] = Са ("шеелит"), Sr-Ra, Pb ("штольцит"), анион - тетраэдр, W—О 1.79
Mn(WO4)„, М = Mg, Мп, Fe-Zn, )
(Мп, Fe) - ("вольфрамит"), Cd, Pb > анионы - окт. M6[WO6], М = Li, Mg-Ba/2 J
К2[М02О2(О2)4(ООН)2] М2[Мо(02)4], М = Na, К, [Zn(NH3)4]/2, крист., красн., взр., анион -искаж. додекаэдр, стр. аналог [Сг(О2)4]3-, Мо —О 1.97, О—О 1.51 20° | (-О2)
K„[MosOm(02)/)L 7 _ т _ 2/,|, L = Н2О, ООН, С2О4, ОН, F; крист., желт., взр. (/), анион - пентаг. бипир., Мо = О 1.66, Мо —ОО 1.95, О—О 1.44-1.47
K2WO„, п = 8 - 4 K2{[WO(O2)2(H2O)]2O}, W—О 1.66 (конц.), 1.94 (мост.), 1.8-1.9 (—ОО), ZWOW 139 19)
НтЭО4
МОН
Гетерополимолибдаты и гетерополивольфраматы 20)
I. [Эп+(М1204о)](8’п) = X; Э = В, Si, Ge, Ti, Zr, P, As
H8_„X, сильн. к., хор. p. в H2O, сп., эф., ац.; H4|Si(M0|2O49)| • 13Н2О; H3[P(Moi204o)| • 30Н2О
М8_„Х, М = Li-Na, Mg/2 (р. в Н2О); [R4N]], Csф, Rb], Ag], Ва/2], NH4, К (иногда не р. в Н2О); в анионе -кубооктаэдр [Moi2] или [W[2] (из 12 окт. [MVIO6]), в центре которого в тетраэдрической полости [О4] - ат. Э.
Вокруг каждого из 4-х ат. О - тетраэдр [ОЭМ]1] (стр. Кеггина).
(NH4)3[P(Mo12O40)| п Н2О : K4[Si(W12O40)];
II. (NH4)2H6[CeIV(Mo12042)| 12Н2О, в анионе - 6 гр. [Мо2О9]
(2 окт. с общ. гранью) размещены вокруг икосаэдра [СеО[2]
III. Na3H6[CrIII(Mo6024)|, окт. [СгО6] -в центре плоского кольца из 6 окт. [MoOg], связанных ребрами
" Мо02(С104)2, разл. 90
А , л H2SO4 (конц.)
(МоО3)——4V - Mo02(S04)
MoO(S04)2, разл. Н2О; WO(SO4)2 ^О.
wcQ—нс1°4
WO(C1O4)4 69)
MoO(S03F)4, масло, желт.
W(NCS)6 • 2Ме2СО, крист., черн.
Mo02S, MoOS2
MS3 • иН2О], кор., р. в щ., (NH4)2S и ц. в., образ, колл, р-ры; MS2
Cs[Mo02(C104)3|; Cs2[Mo02(C104)4] 69)
K4[Mo04(S04)|; K2[Mo206(S04)|
K2{[Mo02(C204)(H20)]20}, мост. гр. [Мо—О—Мо] линейна
(МоО2С12; WC1(?)
он-
S2 (медл.)
н
^МоО4]2-)
S2-
п = 1 — 4, крист., желт., разл. Н2О
S2- Ц ОН-(NHOJMS.J, тиосоли, крист., ярко-красн., р. в Н2О, анион - тетраэдр, М — S 2.18(Мо), 2.17 (W) 54)
29
Мо
(m(CO)6)
КГ
К[М(СО)5Г], Г = Cl-I, крист., желт.
[M(NO)2+C12L2]
30
1 + (<Z5)
Мо3С14(ОН)2 7Н2О =
= [(Мо6С18)(ОН)4(Н2О)2] • 12Н2О, крист., желт.
Мо3С15(ОН) Н2О =
= [(Мо6С18)С12(ОН)2(Н2О)2]
2 + (<Z4)
МоС12].(а,/Ц, крист., желт., р. в к., NH4OH, си., , 700° , , , , эф.; > Мо + МоС15 • иН2О, п = 8, 4/3 WC12, аморф. порошок, серый., неустойчив, + н2о н2/
МоВг2Ц крист., оранж., • 1/3 Н2О, р. в щ. WBr2, крист., сине-черн., разл. 400; + н2о н2/
Мо12, крист., черн., возг. 227, 800 > Мо + ... WI2J., крист., оранж., разл. Н2О (Z)
В стр. диамагн. МоГ2 и WF2 - слои из "больших" окт. [(М6Г8)Г2Г4/2] 21)
МоГ2 • 1/3 L = [(Мо6Г8)Г4Е2]; L = Н2О, Ру, Dipy, En; | = MoBr2(PR3)2|2: 23) WC12 2Thf
3+ (</’)
4 + (<Z2)
[M(CO)4I]2,
крист., диамагн., мол. - 2 окт. с общ. ребром [12], М —Мо 3.16 25)
Кластерная диамагн. гр. [(М6Г8)Х6|, X = Г, ОН, Н2О(ср. Nb6r8): окт. [М6] вписан в куб [Г8], расположенный внутри "большого" окт. [Х6], М—М 2.62-2.65, М —Г 2.4-2.5 (С1), 2.6(Вг), 2.8(1); уст. (W6r8) « (Мо6Г8).
M
= Mo, W
2.5 +
Мо2С15Еп4 20)
2.33 +
W6Br14 =
= [(W6Br8)Br6]
W6I14
2.5 +
W6I15
57)
Mol2.67 (« "Mo3I8") Mol2 87 (» "Mo8I23"), полупроводники 57)
Na2[(Mo6Cl8)(OR)6], крист., желт., диамагн. 6)
(R4N)[Mo(CO)4I3]
Мо(СО)4Г2,
Г = F-Br, крист., желт., неустойчивы 4)
Мо(СО)3Ы2,
L = (MeSCH2 —)2
K2[MoOF4] Н2О
(NH4)5[Mo304F9] иН2О
МоОГ 4Н2О, Г = F-Br
WOC1, крист., черн., не р. в к.; 431 > W + WO2C12 5 )
К2[МоС15(Н20)], красн.
MoOF2 МоОС12, крист., кор., не pear с НС1, в стр. -слои окт. шранс-[МоО2/2С14/2], Мо—О 1.89, Мо—Мо 2.93, Мо—С1 2.34-2.47 WOF2J., серый, не р. в щ., ц. в. WOC12, крист., золотистые, возг. 500, АЯ = -832 9) WOBr2 WOI2
Sb2O3
2.67 +
W6Br16 =
= [(W6Br8)Br6]Br2,
W—W 2.64,
W—Br 2.56-2.60
WC12
4^VC1„ (п = 4 - 6)
K4[W2OC110], красн., 31) rp. [WOW] - линейна, W—О 1.87, W—Cl 2.1
M2(NMe2)g
АЯ Дэфф
MoF3, крист., желт. -910 — WC13, крист., кор., не р. в к.
МоС13Ц крист., красн., р. в к., разл. 500 -393 0.7 550° WC12 + wci5
МоВг3Ц черно-зел. — 1.24 WBr3
Мо13, волокна, черн., т. пл. 900(?), 430° , т > Мо12 + 12 -113 1.4 WI3
МоГ3, нелетучи, легко окисляются; —МобГ[2 + MoF4t • 3L, L = NH3, Phen, Dipy, уст к окисл., парамагн., дэфф~ 3.7. MoF3 изостр. ReO3 (связи М — М отсутствуют), Мо—F 1.95; стр. a-МоСЦ близка А1С13, но окт. [МоСЦ] сближены попарно (Мо—Мо 2.76 и 3.71); ft - изостр. FeCl3; в стр. МоВг3 и Мо13 - цепи окт. с общ. гранями, Мо—Мо 3.03, Мо—Вг 2.57 59) В стр. WC13 и WBr3 - мол. [(ЧУ6Г12)Г6], окт. [W6] вписан в кубооктаэдр [С112], 6 ат. С1 над центрами его квадратных граней - образуют внешний окт. (ср. [Nb6Cl12] + ), W—W 2.92, W—С1куб 2.30, W—С1окт 2.52 59)
Cl2
Mo)- - - -;iooo)
и
Mo2(CH3COO)4)----------------
у И2О + HC1 + MC1
K3[MoF6], крист., кор., т. пл. 734, парамагн., анион - окт., Мо — F 2.00 К3[МоСЦ], крист., красн., неуст. зел.-гол. р-р; Мэфф ~ 3.8, окт. (d'-sp3), Мо—Cl 2.43-2.48 М2[МоС15(Н20)| К3[МоВг6] К3[Мо2Г9], Г = F-Br, Мэфф ~ 0-6 — 0.8, стр. аналоги K3[W2C19], Мо—Мо 2.65(d), 2.82 (Вг) М3[Мо2С18Н], М = Rb, Cs (раньше "М3[Мо2С18]"), в анионе - гр. [Мо—Н—Мо] 40) K5[W3C114], крист., зел. (красн. р-р) K3[W2r9], Г = С1, Вг, крист., желто-зел., Мэфф = 0.47 на 1 ат. W, анион - двуядерный кластер С1 С1 С1 CI-W^W-CI С1 V С1
M(OR)3, R = Me, Et, z-Pr, черн., нелетучие полимеры, парамагн.
M2(OR-t)6, крист., желто-зел., диамагн., Мо = Мо 2.22; обратимо связывают СО2 34)
[WC12(OR) 2ROH]2, крист., желто-зел., диамагн.
n Q
3.5 +
(R4N)2[W2Br9| 43)
^W(CO)6)
/ Ю) АЯ
MoF4, крист., зел., нелетучи, гигр. -1138 WF4, крист., красн., не гидрол., АЯ= —1210
МоСЦ, крист., кор.-красн., возг., разл. 130, не р. в орг. р-рителях -479 WCU серо-кор., нелетучи, гигр., диамагн., АЯ = -506; 500° wci2 + web WCl3Br, зел.
МоВг4, крист., черн., неуст., /1эфф = 1.28 -310 WBr4, диамагн.
Мо14, крист., черн., т. пл. « 400, неуст. — WI4, черн.
МоГ4 и Wr4 - сильн. восст., сильно гидрол. (кроме MF4); + Н2О —> Мош + Mov Мол. МоСЦ и МоВг4 в г. - тетраэдры (d3s), Мо—Г 2.23 (С1), 2.39 (Вг); слоистая стр. МоСЦ близка стр. FeCl3, Мо — С1 2.42, Мо—Мо 3.50; MoBr4, WC14 и WBr4 - изостр. NbCl4 • 2 Ру, парамагн.; • 2MeCN
Mo2F9,
MoF4 + MoF6
(Mo(CO)6)
M2MoF6, крист., кор., уст. к гидрол.
М2МоСЦ, А м = K-Cs
QP ТТ I
_ > СТО. ТИП
M2WC16, ( K2ptC1(5 11)
красн. J
M2WBr6, оливково-зел., слабо парамагн.;
+ Н2О MoOCl2 + ...
[WC12(OR)2(ROH)]2, зел., диамагн.
I F2 (-75°);
। MoF6 (20°)
\CX
w4(OR)16, крист., зел. (Me, Et), стр. аналоги [Ti(OR)4]4
[Mo(NO)2Cl2(PPh3)2] 8)
МоГ2(С5Н5)2, диамагн.
5 + (</’)
6 + (rf°)
Мо02С1 [Mo02ClDipy]2 [Mo203CUDipy2]
MF + HF _ (MoO(OH)J — (NH4)2[M02O4F4(H2O)2] K3[Mo204F5] (NH4)4[Mo204F6] М2[Мо204С14(Н20)2] иН2О, диамагн., анионы - 2 окт. с общ. ребром [О2], Мо = Мо 2.57, Мо —О 1.68-2.04 61)
(w°D
WC16
SnCl2
M3[Mo4012F3] 18)
МоОС13, крист., черно-кор.;
МоС13 + МоО2С12;
• 2OPR3, зел.; • Dipy; • и ROH, зел.
МоОВг3
WOC13, зел.
WOBr3
KC1
В тетраг. стр. а-МОГ3 (М = Mo, W; Г = С1, Вг) - цепи сдвоенных окт. [МГ2Г2/2О2/2] с общ. ребром [Г2];
в монокл. стр. /?-МОГ3 - цепи сдвоенных окт. [МГГ4/2О], ат. О - конц.
K2[MoOF5], н2о, анион - окт., Мо = О 1.66, Мо — F 1.8-1.9 (цис), 2.03 (транс)
Н2МоОС15, зел.
К2[МОГ5], Г = С1, Вг, крист., зел.,
Мэфф = 1-67; анион - окт., Мо = О 1.60(d), 1.86 (Вг), W = O 2.07, Мо—Г 2.40 (С1 цис), 2.59 (транс), 2.55 (Вг цис), 2.83 (транс), W—Cl 2.3-2.4
RblMOCU], анион - тетраг. пирамида, Мо = О 1.64, W = O 1.68, М —Cl 2.37,
Мэфф 1.76 1.86
К[МОГ4(Н2О)], г = С1, Вг, анион - окт., Мо = О 1.7, Мо — Г 2.3 (С1), 2.5 (Вг),
Мо—ОН2 2.3 65)
Mo
MoF5 10), крист., желт.
ж. SO2(-SOC12)
МоС15, крист., черн., гигр., p. в бзл., парамагн.
МоВг5
т. пл. т. к. Дэфф т. пл. т. к. АН
67 214 — WF5; WF4 + WF6 — — —
194 268 1.67 WC15, крист., черно-зел., Мэфф 1.67 253 288 -569
— 296 1.12 WBr5, крист., кор. 276 333 -364
В стр. MF5 - циклические мол. из 4-х окт. с линейными гр.
[М — F—М], Мо—F 1.66-1.89 (конц.), 2.05 (мост.), в г. - (MoF5)2.
В стр. МС15 - димеры (стр. тип UC15) - 2 окт. с общ. ребром, Мо —С1 2.25 (конц.), 2.53 (мост.), Мо —Мо 3.84, W—С1 2.24 и 2.52, W—W 3.81; в г. - мономеры - тетраг. пирамиды [Мо — С1 2.24(экв.) и 2.35 (акс.), W—С1 2.26], димеры и циклические тримеры (?) 10)
ROH
MoC13(OR)2, Dipy
МоС1(ОМе)4, черн.
[MoCl2(OR)3]2, R = Pr, Ph, крист., красн., цэфф = 0.42, мол. - 2 окт.
i/mc-[MoCI2(OR)2(OR)22],
Мо — Мо 2.8 67)
Wr3(OR)2, Г = С1, Вг, гол., парамагн.
[WC12(OR)3]2, красн., диамагн., уст. к гидрол. и окисл.
W(OR)5, R = Et, Ph, диамагн.
MoNBr2, крист., кор., гигр., разл. 420, цЭфф = 0.65,
Н2О 62) Mo2NCl7
[W(C5H5)2C12] + X-
oy
Na[MF6], анион - окт. (d2sp3), Мо —F 1.74
K3[MF8]
KWC16, зел.;
+ Н2О —> синь;
-4k2WC16 + WC16;
анион - искаж. окт., W—С1 2.33
K2WC17
KWBr6, зел.
£> •
66)
,O.
•с-
[R4N][M(OR)C15] [R4N][M(OR)2r4] 12) Na[W(OEt)6], желт., парамагн.
Mo02F2, крист., бц., возг. 270, АН = —1089 Мо02С12, желт., т. пл. 170, возг. 161; • Н2О, в стр. -цепи окт. [МоОС12(Н2О)О2/2]-транс, Мо — О 1.65 (конц.), 1.77 и 2.20 (мост.), Мо — С1 2.34, Мо—ОН2 2.26 (транс- к О) [Mo02X2(OPPh3)2], X = Cl, NO3 27) WO2F2 (?), крист., бц.; • L, L = Dipy, Phen WO2C12, крист., желт., т. пл. 497 с разл. WO2Br2, крист., красн., АН = —719 WO2I2 АН = -607 WO3 + WOr4; медл. гидрол. 35)
В г. фазе - мол. МоО2С12, тетраэдры, Мо—О 1.70, цепей окт. [МО4/2Г2], W—О 1.7 и 2.2, W—С1 2.31 MqO2(OR)2; • и Am 15) Мо—С1 2.26; в стр. МО2Г2 (Г = C1-I) - слои из WO2(OR)2, стекла; время> полимеры, не р. в ROH, /п’-УФ —> синеют 36)
MoOF4, крист., бц., т. пл. 97, т. к. 186
МоОС14, зел., возг. 104, оч. гигр., сильн. окисл. (+ КОН —> Mov)
т. пл. т. к. АН
WOF4, крист., бц. 110 186 -1489
WOC14, красн., летуч > WO2C12 211 233 -740
WOBr4, черн. 277 327 -582
В стр. - цепи окт. [MoOF3F2/2] и циклы из 4-х окт. [WO2/2F4], М = О 1.62 (Мо), 1.63 (W), Мо—F 1.82 (конц.), 1.93-2.31 (мост.), W—F 1.66 и 1.86 (конц.), 2.12 (мост.); [МОС14]2 -2 окт. с общ. ребром [С12], Мо = О 1.70, Мо—С1 2.32 (конц.), 2.90 (мост.)
В г. - тетраг. пирамиды МОГ4 (Г = С1, Вг), Мо = О 1.65, W = O 1.68, М — Г 1.85(F), 2.28 (С1), 2.45 (Вг), L OWE 104, L TWF 87 Ч
В стр. - линейные цепи окт. [WO2/2r4], W—О 1.8 и 2.2, W—С1 2.29, W—Вг 2.45
MoOF3(OR) L
MoOCl2(OR)2
MoO(OR)4, R = Et, Ph, ж., желт.
MoO(OTeF5)4 41)
WOF3(OR) • L, L = EtOH, MeCN 36)
WOCl3(OMe)
WOC12(OR)2
WO(OR)4, крист., бц., изостр. WOC14;
Л WO2(OR)2 + W(OR)6 36)
MO3
MCI (MeCN, -Cl2)
т. пл. т. к. АН
MoF6, ж., бц., d = 2.55, т. пл. 18, т. к. 35, АН = -1636 64) оч. гигр., реакц.; р. в орг. Г = F, С1 (типа UF6) - 01 WF6, г., бц. WF5C1, г., бц. WCl^J., крист., черно-фиол. 350° —-*WC15; р. в ROH, эф.,С82 WBr6J., крист., сине-черн., разл. H2O(Z); • ЗАш р-рителях, HF (ж); MoF6 - сильв ст. мол., Мо—F 1.77-1.86, W— 2 -30 281 . фторагет Г 1.883(F), 17 348 ; в г. и стр 2.24 (С1), 2/ -1761 -681 -385 мг6 15 (Вг) 70)
ROH
M
IN3
MoF2(OMe)4, тв., желт. MoF(OMe)5, ж., нелетуч 37) WF„(OR)6_„, п = 2 (цис), 4, 5, красн. W(OR)6, R = Me (крист., бц.), Et, и-Ви(ж.), оч. гигр., перегоняются в вак. 36), Ph (крист., красн., не гидрол.) 38) W(O3F5)6, Э = S, Se, Те 41)
[MoNCl3]4 4R2O, 39)
в мол. - квадрат [N4], 4 ат. Мо - на серединах сторон, Мо—N 1.65 и 2.15, Мо —С1 2.29
MoNBr3, кор. полимер;
MoNBr2; • РОС13
[WSr4]2, Г = Cl, Вг, мол. - 2 окт. с общ. ребром [Г2], W—S 2.10, W—С1 2.26 (конц.), 2.37 и 3.05 (мост), W—Вг 2.44 (конц.) WSeCl4, W = Se 2.20, W—Cl 2.28 63)
WNBr3, крист.,черн., гигр.
K[MO3F], цепи окт. с общими ребрами, Мо—O(F) 1.70-2.31
Cs2[MO3F2], в стр. - цепи окт. [MO2O2/2F2] (NH4)3[MO3F3], анион - окт., 3 ат. О цис-, сегнетоэлектрик
H2Mo03F2 • Н2О; Cs3|Mo206F3| [Ph4P] [Мо03С1]
29)
NH4[Mo02F3], анион - зигзагообразная цепь окт. [MoO2F2F2/2]
K2[MO2F4] -цис, Mo = O 1.68 (акс.), 1.73 (экв.),
Мо—F 1.99 (транс), 1.87 (цис)
K3[WO2F5]; K3[W2O4F7]; K6[W2O5F8]
К2[МО2С14], стр. тип K2PtCl6 (статистически распределены О и С1);
• 2Н2О = 2КС1 • [МоО2С12(Н2О)2]-гщс 5)
K[MOF5], анион - искаж. окт., Mo = O 1.66, Mo — F 2.03 (транс), 1.8-1.9 (цис), W = Q(¥) 1.82
NH4[MoOCl5]
NH4[MoOBr5]
28)
M^MFd, M1 = Rb, Cs, [NO], [NO2], Tl, [Cu(MeCN)5] 30)
K2[MF8]
[Ph4As][MoNCl4],
анион - тетраг. пирамида, Mo—N 1.66, Mo —Cl 2.34 39)
[Ph4P][WNBr4]
31
УРАН
5/
6d
Is
э.о. 3 + (f3 или ,Л/ ’)
4 + (f1 или у1^1)
Са
U, мет., серебристо-бел., оч. тв., ковкий, желтеет на возд., затем чернеет, мелкораздробленный -пирофорен, т. пл. 1134, т. к. ~4200, р. в к., (МОН + Н2О2), пассивир. конц. HNO3 £ou3 + /UTB= -1-80’ £ои4+/итв= “1Л7 а-, ромб, (искаж. гексаг. пл. упак.), d = 19.12, к. ч. 4 + 8
а = 2.85, b = 5.86, с = 4.95
. (UC14
fi-, тетраг., слоистая стр., d = 18.11, хрупок, а = 10.59, с = 5.63
у-, куб. (тип a-Fe), стабилизируется при 20° при сплавлении с Сг или Мо, d = 18.06, пластичен, а = 3.52, U—U 3.05
NaU2Cl9, крист, бронзового цв., проводник 36)
U(Dipy)„, п = 3,4, темно-зел. иглы, окисл. на возд., в стр. [UN8] - искаж. куб., U—N 2.48 19)
ин3
,
J Гисц
Радиоактивный ряд U—Ra (А = 4/? + 2)
238т т _ ЗЗ+рЦ __. 234р ___ 234т т _ 230 т-к
92 Г -> 901П 7=—> 91 * а ——> 92U --> 90 1П
а р ,у р ,у а
4.51 • 109 лет 2.48 • 105 лет
99.27 % в минералах 0.0056 %
Ряд Ас (А = 4п + 3)
29325U ("AcU") v23'Th...
7 • 108 лет
0.72 % в минералах,
ядерное горючее
1125'
НгЩ-Нг-иНз)^ UO2+x, крист., черно-кор., иногда пирофорны, т. пл. 2850, возг. 1400, АЯ = —1083, р. в к., хим. инертны, "уранинит", стр. тип CaF2 (к. ч. U 8), U—О 2.37 ( + ТйО2, "бреггерит"; + Ln2O3, "клевеит") О2 (220°)
4.5+ и4о9, крист., черн.
U(OH)4J., св.-зел., р. в к., восст.
ОН
4.66+ и3О7, метастаб. фазы (a, fi)
M[U(SO4)2] иН2О,
крист., кор.,
к. ч. и 9, U—0 2.4-2.6 м>
-834 .
Г* = 34-3.7 =>’ (|;o,ci.)+ (1,,-В)
U(OH)2SO4
UO(RCOO)2 иН2О, крист., зел. 26)
U(IO3)4
U(SO4)2 иН2О, п = 4, 8, крист., зел., в стр. -[UO4(H2O)4] - антипризма Архимеда, U—О 2.36
U(NO3)4, хор. р. в Н2О; U(PO3)4 26)
U(HCOO)4, Мэфф
U(CH3COO)4, нити, зел., в стр. - цепи двухшапочных антипризм (к. ч. U 10), U—О 2.52 и 2.80
и(С2О4)2 6Н2О
USiO4, "коффинит"
Уранаты (IV)
MnUO3, крист., чер-но-кор., М = Са-Ва
Н2 (500°)
EtOH + H2SO4(/zv-B)
(СООК)2
Cs2[U(NO3)6] K4[U(C2O4)4] 4Н2О, крист., темно-зел., к. ч. U 10,
U —0 2.37-2.58 29)
Ba2[U(C2O4)4] 8Н2О, крист., красно-фиол.
и •
^1
UOC1, АЯ = UOBr UOI U2(SO4)3 9Н2О
UPO4, крист., кор.
U(HCOO)3, крист., зел. 22)
VS ___,
диа4
О2
uof2 н2о
UOC12, АЯ = —1069, в стр. к. ч. U 7, 8 и 9 (додекаэдр без одной вершины, додекаэдр, трехшапочная призма), U — О 2.17-2.40, U —С1 2.66-3.15; цэфф = 2.73
UOBr2, крист., желт.; О2 + UF4 '*
UOI2
и°з
и2О2С15 30)
Na
т. пл. т. к. АЯ
UF3, крист., фиол., стр. тип LaF3 1495 2300 -1444
UC13, иглы, зел. или красн., гигр.; UC12 + UC14 + UC15; в гексаг. стр. - искаж. пл. упак. С1, к. ч. U 9 (триг. призма с центрированными гранями) 835 1780 -891
UBr3, крист., красн., стр. тип UC13 730 — -761
UI3, крист., черн., стр. тип PuBr3, U—I 3.16-3.24 17) 680 — 1750 -573
• 4 L, L = Thf, Ру, мол - пентаг. бипир. 17)
MUC14 4Н2О, м = к, nh4 к. ч. U 9 или 8, U —С1 2.93, и —О 2.55 25)
К2иа5
К3иС1^, фиол.
KU2C17, кор.; + Н2О— UIV;
Мэфф = 3.7 24)
Al; Н2 (z)
U(BH4)3, крист., красно-кор., нелетучи, взр. на возд.
100'
т. пл. т. к. АЯ
UF4J., крист., зел., ПР = 10 22, 1036 1450 г—1897
стр. тип ZrF4, в г. U — F 2.07; • Н2О (возг.) 1-1910
UCU, крист., зел., оч. гигр., р. в орг. р-рителях, в тетраг. ионной стр. - 2 пересекающихся тетраэдра [UC14], к. ч. U 4 + 4, U—С1 2.41 (конц.), 3.09 (мост.) (в г. - 2.53) 590 792 -1023
UBr4, крист., кор., в стр. - цепи пентаг. бипир. [иВгВг(>/2], сочлененных экв. ребрами, U — Вг 2.16 (акс.), 2.8-2.9 (экв.) (в г.-2.66) 15) 519 766 с разл. -899
UI4, крист., черн., цепи окт. U—I 2.92 (конц.), 3.10 (мост.) 27) разл. 520 — -527
(NH4)U3F13, к. ч. U 9 (трехшапочная триг. призма), U—F 2.18-2.48 ku2f9
(NH4)4[UF8|, анион - антипризма
M3[UF7], крист., зел., анион -пентаг. бипир., U — F 2.26
M2[UF6], крист., зел., в стр. -цепи искаж. додекаэдров, U — F 2.18-2.42 (К), триг. антипризма (Na)
LiUF5, в стр. - слои из [UF8/2F], U —F 2.2-3.4
Ba2[UCl8]
M2[UC16], анион - окт., U—С1 2.62
M2[UBr6], М = Rb, Cs, стр. тип K2PtCl6, U—Br 2.27 [R4N]2[UI6] 2)
4.25+ 4.5 + U4F17, u2f9, крист., черн., АЯ = -7610 и -3910
ей
.'и
стр. UH3
uos
U2S3; U3S5
о
32
U(O,N,C) (раньше "UO"), оксокарбонитрид, тв. р-р, металлоподобная фаза, сущ. на поверхности U
US2, крист., черн., т. пл. 1850, р. в к., у 425> fi 135°> а
US3, полисульфид, крист., черн., р. в конц. HNO3
US, крист., желт., т. пл. 2460, р. в к., АЯ = —377, стр. тип NaCl
USe2 23)
UN, порошок, серый, окисляется на возд., т. пл. 2850 (р), разл. > 1900, АЯ = -288, не р. в к., стр. тип NaCl, U—N 2.45; U3N4; U2N3, АЯ = -707 UN2, крист., черн., стр. тип CaF2
UP, т. пл. 2850, U3P4, U2P3, UP2, черн.
’C®
изоо
• — U(BH|)4, крист., темно-зел., возг., р. в эф, гидрол., • R2O28)
U(BH4)3(BH3CH3), крист., летучи
U(OR)4, R = Me, Et, крист., св.-зел.
| ROH
U(NEt2)4
1|Д1(ОРг-/)4|4. крист., зел., гигр., возг., т. к. 270
и(С5Н5)4, ураноцен, крист., красн., не гидрол., разл. 250
[U(C5H5)3]+ СГ', крист., темно-красн.
[R4N]4[U(NCS)8] 21)
6+
Na; Zn/Hg
UF6(100°); F2; Cl2(520°)
Q
[U(H2O)8]3+,
красно-кор. ион
H2O; O2(H + )
[Hf]
[U(H2O)8]4+,
• — зел. ион
IW ', СИН. ион, уст. к окисл.
[UO2(H2O)6]2 + , желт., диамагн. ион, гексаг. бипир., [UO2] - гантель (sf), не pear, с H2SO4 (ср. [NpO2]2+, [PuO2]2+)
- Н2О
Н2о<
H2O
о
F"
H
ОН2
^>ОН2
ОН2
UC, крист., фиол., т. пл. 2400, стр. тип NaCl, АЯ = —88
U2C3, АЯ = -205
UC2, крист., красн., гидрол., т. пл. 2350, АЯ = —163, стр. тип СаС2, С = С 1.34 USi2, т. пл. 1700; U3Si2, т. пл. 1665
UH3_X, крист., черн., хрупкие, разл. 330, АЯ= —125,
350°
проводник, воспл. на возд., разл. к.; +Н2О ----> UO2 + Н2;
fi-. куб., d = 10.9, в стр. - тетраэдры [UH4] и икосаэдры [UH12], U—Н 2.32, U —U 3.3 J <-100°
а-, куб., ферромагн., d = 11.11
[U(H2O)7(OH)]3 + ,
бур. ион (pH х 2)
H+(-H2)
H
IUO2] + , оч. неустойчив, сущ. при pH 2-4
5ио
[(UO2)2(OH)2|2 + [(UO2)3(OH)5|+ 16>
Я=10“6 я=10“16
и(он)4, св.-зел.
O2; I2; Fe
O2
UO2(OH)2 H2O . желт.
NH4OH
Na2U4Oi3J. + Na2Uj9O49J.
желт.
(nh4)2l'2o7[.
NaOH
H2O NaOH
Na2U2O7|., оранж.
5 + (fl или </*)
6+(/V)
иО2.б, метастаб. фаза, парамагн. (1 неспаренный эл.)
КНСОз ^Н2_О(/)
—K4[UO2(CO3)3]
4
UO2(NO3)2
(NH4)2U2O7
O2 (>200°)
Уранаты (V)
Li7UO6, крист., зел.
Li3UO4, крист., желт.
LiUO3, крист., фиол.
U13O34, U11O29, стаб. фазы
5.33 +
и3О8, крист., черно-зел., d = 8.3, разл. 1450,
АЯ= —3584,
+ HNO3 — U4- + [UO2]2 + , а-, в стр. - цепи пентаг.
о бипир.
$ U —0 2.07-2.23(6 ат.)
н- 2.44 и 2.71 (1 ат.)
Р-, 2 ат. U с к. ч. 7 и 1 окт.
U—О 1.89-2.40
ио2.9, метастаб. фаза
450'
О и
H2
Cs2U4O12 6)
Cs2U9O27
UO3, крист., оранж., 7 крист, форм и 1 аморф., АЯ = —1230. В стр.
a-UO3 - слои из [(иО2)Об], связаны цепями U — О—U-; U—О 1.8-2.4 32)
400'
H2o
Н2и2О7, крист., св.-желт. I
Т 160°
1О2(ОН)2. урановая к., крист., желт, или аморф. ос., ПР = 10 22; . , , .
слоя под Z70°, U = O 1.71, U — ОН 2.5; ft-, слои окт. [UO2(OH)4]
с общ. вершинами; у-, - с общ. ребрами (ОН)2, "янтинит" Т 100°
• Н2О, "шопит", "масюйит";
р. в к.; а-, слоистая стр., [UO2] наклонены к плоскости _ Н2О2
• 2/3 H2O "беккерелит1
(UO2(NO3)2^
/ Н2О2
' (рН~3)
UO2(O2) лн2о;, 33) желт., п = 4 ("штудтит"), 2 ("меташтудтит")
Уранаты (VI), М2О„ • т ЕО3[ 6)
M3UO6, оранж.; Li6UO6, анион - окт., U — О 2.09
Na4UO5, M^UOs, красн., мезоуранаты; M2UO4; MgUO4, желт., в стр. -цепи окт. [(UO2)O4/2] с общ. ребрами или вершинами, U = O 1.92, U —О 2.50
Na2U2O7, "кларкит", оранж.; (NH4)2U2O7, желт., U—О 2.0-2.3 K2U4Oi3; PbU4Oi3 • 5Н2О, "фурмарьерит"; Cs2U5Oi6.
K4U5O17; M2U6O19 • 11Н2О, М = К ("кампреньясит"), Ва/2 ("бильетит")
M2U7O22, крист., желт.; Pb3U8O27 • 4Н2О, "кюрит"
Cs2Ui5O46; Cs2Ui9O49
Н2О + МОН
Пероксоуранаты Na4[UO2(O2)3] 9Н2О,
U = O 1.86, и—ОО 2.28, О—О 1.5
К4ио6 6Н2О М4и2Ою ’ иН2О, крист., красн.
Na2U2O9 7 Н2О M4[UO2(O2)(CO3)2], гексаг. бипир. 35)
и5О12С1 3)
uo2f
UO2C1, дэфф = 1.36, -U UOC12 + С12
UO2Br, в стр. - слои пентаг. бипир., U—О 2.05-2.30, U—Вг 2.94 3)
UO2]
^5^о3
Соли уранила, [O = U = O]2 + , крист., желт., флуоресцирующие, U = O 1.61-1.93, U—О 2.3-2.4
[NO2][UO2(C1O4)3], UO2(C1O4)2 12)
H2[UO2(SO4)2] лН2О, п = 2; 6 12)
M2[UO2(SO4)2(H2O)2]; M4[UO2(SO4)3]; M2[UO2(SO3)2] лН2О 12)
АЯ
UOC13, крист., кор., р. в си., ац. -1188
UOBr3, крист., красно-кор. -988
UOI3 -853
UO(OR)3
[R4N]2[UOF5]
[PyH]2[UOCl5]
[R4N]2[UOBr5] 13)
(и; ио
5) UF5J., крист., бц. (окрашены за счет примесей) > > UF6 + U2F9 + U4F17, оч. реакц.; + Н2О UF4 + UO2F2; а-, тетраг., в стр. - линейные цепи окт. с общ. вершинами; /L, тетраг., трехмерная сетка восьмивершинников, т. к. 530, U — F 1.96-2.32 UC15, иглы, красно-кор., гигр., 120° UC14 + UC16; + Н2О UC14 + UO2C12; в монокл. и трикл. стр. - димерные мол. (2 окт. с общ. ребром), U—С1 2.43 (конц.), 2.70(мост.) UBr5, крист., черно-кор., —> UBr4 + Вг2; в стр. - димеры из 2-х окт., U — Вг 2.58-2.81 т. пл.
287 (р) 348 320 (р) -2030 -1041 -858
HF
[UvF4][UviOF5] (UO2)2C13 31)
M3[UF8|; M2[UF7]
Cs[UF6], крист., сии., анион -окт., U — F 2.06
HUF6 лН2О, п =2.5, 1.25, зел., уст. к окисл.;
+ Н2О UF4 + UO2F2
[R4N]3[UC18]
M[UC16], М = NO, [РС14] 4)
uf4
Q.
И
UF3(SO3F)2
UF2(SO3F)3, крист., зел., разл. 86, цэфф = 1
[UF4] + [SbF6] , к. ч. U 8 (додекаэдр), U — F 1.95 (конц.), 2.31-2.66 (мост.) 5)
U(OR)„r5_„, ж., зел. (Г = С1) или кор. (Г = Вг) | NaOR
U(OR)5, крист., кор. (R = Me) или ж. (R = Et), перегоняются в вак.
M[U(OR)6]„, M = Na, Ca, Al, крист., зел., возг. в вак.
(PhCH2O—)2
UO2(C1O4)2 2Z2! . 6Н2О, т. пл. 185
UO2(SO4) <175 • лН2О, п = 2.5, 3.5, в стр. - цепи пентаг. бипир. HzS°4-s
UO2(SeO4) 4Н2О 14)
UO2(NO3)2 6Н2О, т. пл. 60, р. в си., эф. (экстрагируется эф. из р-ров в HNO3), • 2Н2О, т. пл. 179, • л(С2Н5)2О, т. пл. 45 (п = 2); 2(п = 4)
2NO2
(UO2)3(PO4)2 4Н2О; (UO2)(H3O)PO4 ЗН2О
(UO2)(H2PO4)2 лН2О 20); (UO2)H(PO3)3
(UO2)3(AsO4)2 • 12Н2О, "трегерит"
UO2(CO3H, разл. 500, "резерфордин"
UO2(CH3COO)2, разл. 300 • 2Н2О
UO2(C2O4) ЗН2О
UO2F2, т. пл. 1303, в стр. - гексаг. бипир. [UO2F6];
мало дис., Ki = 10“4, К2 = 10“5, UF6 + U3O8 + О2 34)
UO2C12, т. пл. 578; • лН2О, п = 3, 1; • hNH3, п = 10.5-1 34)
UO2Br2
UO2(OR)2, R = Me, z-Pr, Ph (красн.)
UO2S(., кор., p. в CH3COOH; + О2 + Н2О UO2(OH)2
44 У
АЯ
-1636
-1255
-1159
UOF4, крист., оранж., гигр., > UF6 + UO2F2; + Н2О —> UO2F2
U(SO3)F4, оранж., разл. 90° 10); U(O3F5)6, Э = S, Se, Те
UF6, крист., бц., гигр., р. в С2Н4С12, эф., разл. си., мол. - искаж. окт.; U — F 1.98 (г. и стр. 14)); окисл.: + НВг —> Br2 + UF4 + HF UC16, крист., темно-зел., р. в СС14, в мол. стр. - искаж. гексаг. пл. упак. Cl, U - в окт. пустотах, U —С1 2.41-2.51 П) т. пл. т. к. АЯ
64 (р) возг. 56 177 с разл. 57 возг. -2180 -1068
NaOR|
U(OR)6, R = Et, z-Pr, ж., темно-красн., перегоняются в вак.
10)
K[UO3F]J., крист., оранж., -2CH3COOH, разл. 400
M[UO2(NO3)3|; Cs2[UO2(NO3)4] 20)
M[UO2(PO4)m] • лН2О, M = H, Li-K, Mg ("салеит"), Са ("отунит"),
Си ("торбернит"), Pb ("парсонсит") 20)
M[UO2(AsO4)„] z;/H2O: H2[(UO2)2(AsO4)2] 8H2O 20)
M2[(UO2)2(VO4)2] лН2О, M = К ("карнотит"), Ca/2 ("тюямунит") (NH4)4[X| 2H2O; Ca2[X] 10H2O, "ураноталлит"; Mg2X 18H2O; ----------------
X = [UO2(CO3)3], гексаг. бипир. 7)
Na[UO2(CH3COO)3], анион - гексаг. бипир.
NaMg[UO2(CH3COO)3]3 9Н2СЦ; MZn[UO2(CH3COO)3]3 6H2O. M = Li, Na
Na2[UO2(C2O4)2] 2H2O, в анионе - пентаг. бипир. [UO7]
(NH4)4[UO2(C2O4)3|, анион - гексаг. бипир., (H3O)2[Ca(UO2)2(SiO4)2| • 2Н2О, "уранофан" 7)
Cs2[(UO2)2F6(H2O)2], анион - 2 пентаг. бипир. с общ. ат. или ребром [F2] 8)
M3[(UO2)2F7|; M4[(UO2)2F8|; K5[(UO2)2F9], анион - 2 пентаг. бипир. [UO2F5] с общ. ат. F3KB
K2[(UO2)3F8(H2O)1 ЗН2О 8)
Cs2[UO2F4|; K3[UO2F5], анион - пентаг. бипир.
М2[иО2СЦ], анион - тетраг. бипир. с акс. [UO2], U—Cl «2.6;
Cs[(UO2)2Cl5], в стр. - каркас пентаг. бипир. 12)
M2[UO2Br4], М = Cs, [R4N], анион - сплющенный окт., U — Вг 2.8 9)
[R4N]2[UO2(OPh)4]
8)
О -13-
F, - III n*F
\---------F
F
F
> M[UOF5], М = NH4, K-Cs, анион - искаж. окт. (Cs) или цепи додекаэдров (К, Rb) 10)
(NH4)4[UF10]
Na3[UF9], крист., желт., гигр., разл. 300
M2[UF8], М = Na-Cs, анион - искаж. восьмивершинник
M[UF7], М = Na, [NO] + , [NO2] + , анион - пентаг. бипир., U—F 1.76 и 2.24 18)
33
э.о
Np 1.3
др. An 1.6
Нептуний '* 93NP [
Плутоний 94Ри°
Америций 95Ат° [
Кюрий 9бСт° [
Берклий 97Вк° [
Калифорний 9sCf°
Эйнштейний 99Es° [
Фермий looFm0 [
Менделевий wiMd0
Нобелий 102N00 [
Лоуренсий 103 кг0 [
5/
6d
PuF4, NpF4 AmF3, CmF3
' Li, La, Th
2 +
Ш1Ш1
шыш ТГ
шыш Т[Г
i цццц Т[Т
ицццц Т[Т
Т[Т
Т[Т
Т[Т
й]Т
Й1Й
ЙШ
и 1111
1111
1111
ц 1111
ц 1111
и 1111
1111
1111
1111
1111
и 1111
7s
И
И
И
И
и
и
И
И
И
И
Резерфордий 104^ Борий ю7ВЬ
Дубний iosDb Хассий iosHs
Сиборгий loeSg Мейтнерий io9Mt
*•* или 5/'57?
• Ca, Ba
Np £ Pu Am Cm Bk17> Cf 17) Es
Мет., d 20.4 т. пл. 637 т. к. 4082 £ом3 + /Мтв= -1-79 а-, ромб, (искаж. стр. тип a-Fe), к. ч. 4 (дисфеноид), а = 4.72, b = 4.88, с = 6.66 j. 280° fi-, тетраг., d = 19.4, а = 4.89, с = 3.38 j. 576° у-, куб. (тип a-Fe) d = 18.0, а = 3.43 серебристо-бел., мягкие, р. в 19.8 640 3352 -1.58 а-, монокл., а = 6.18, 6 = 4.82, с= 10.96, р = 101.79 j. 122° fi-, монокл., d = 17.8, а = 9.28, b = 10.46, с = 7.86, р = 92.13 j. 207° у-, ромб., d = 17.2, а = 3.16, b = 5.76, с = 10.16, к. ч. Pu 12 315° д-, куб. пл. упак., d = 15.9, а = 4.6 457° д'-, тетраг., d = 16.0, а = 3.31, с = 4.48 j. 472° £-, куб. (тип a-Fe), d = 16.5, НС1, не p. в 11.7 1292 2880 -2.07 a-, гек a = 3.47 с = 11.24 i P куб. (тип a-Fe) d = 13.1 a = 4.89 i P ромб, (тип a-U) a = 3.06 b = 5.97 c = 5.17 a = 3.63 конц. H? 13.5 1345 =3200 -2.06 саг. четь 3.49 11.33 d=\ i) 4O3, H2' 14.8 980 возг. -2.01 рехслой 3.42 11.07 /L, куб 3.25 a= 5,-06 >O4 900±30 возг. «1200/10 6 -1.93 ная пл. упак 3.38 11.04 (I форма) а = 4.00 с = 12.80 (II форма) | 600° пл. упак. 5.00 860 -2.00 4.94 725° куб. пл. упак. я= 5.-
AnO, пленки и порошки, черн., проводники, фазы внедрения О в куб. пл. упак. мет., стр. тип NaCl
AZ
АшГ2, Г = C1-I
ВкС12
CfT2, Г = Br, I
EsCl2 3)
Np2O3 Pu2O3; стр. тип La2O3 22) Ри5О8 Аш2О3, крист., оранж., АЯ= —1692 Ат6Оп Ст2О3, крист., бел. CmOi.5o_i.7i 22) Cf2O3, стр. тип Мп2О3 19) ES2O3, Мэф. 10.5 (5/10) 19)
Pu(O)H-PuO2_„ 22)
Np(OH)3;, красн. Ри(ОНЫ, гол. Аш(ОНЫ, I Ст(ОН)3 . роз. | бел. крист., изостр. гексаг. Ln(OH)3 20)
NH4OH
LiAmO2, изостр.
LiEuO2 20)
5)
An2O2(SO4), An = Am-Cf
Np(ClO4)3
Ри(С1О4)3 Ри(Ю3)4, Сш(Ю3Ы
кор. Pu2(SO4)3 Am2(SO4)3 Cm2(SO4)3
• 7 Н2О, фиол. Am(NO3)3, Cm(NO3)3,
РиРО4 9Н2О, крист., роз. крист., бц.
зел. Аш2(СО3)3 • СшРО4 • хН2О
2Н2О CmAsO4
Ри2(С2О4)3, Аш2(С2О4)3 • CmVO4 Cm2(C2O4)3
фиол. 10Н2О
Ри(СС13СОО)3, Аш(НСОО)3 Cm(HCOO)3 5)
красн. 0.2 Н2О 5)
Bk2(SO4)3
Синтез трансурановых элементов 30)
Открытие Получение важнейших изотопов Наиболее долгоживущий изотоп Открытие Наиболее долгоживущий ИЗОТОП
238т т / х 239т т у 2391\т— 92U (П, у) 92U 9jNp медл. р 2.3 сут. (Макмиллан, Эйблсон, 1940 г.) В ат. реакторе 29328и (п, 2п) 29327и -й 293Np (А 4/7 + 1) родоначальник ряда Np; в рудах - 2 • Ю“10% (ат.) от U 237Np 2.14-106 лет 29582Cf (*5°В, 5п) 8 с (Гиорсо, 1961 г.) 293Ат (Ч8О, 5п) fgfLr 35 с (Флёров, 1965 г.) 269Lr 3 мин.
29328U (2т7, 2«) 29338Np —> 29348Pu р 86.4 лет (Сиборг, 1941 г.) 2^Np -й 2^Рц (А = 4// + 3) 2.35 сут. 24390 лет 10’9% (ат.) от U; ядерное горючее (расщепляется под действием п) 244Pu 7.6 • 107 лет
294Pu (^Ne, 4n) 0.3 с (Флёров, 1964 г.) 299Bk (4N, Зтг) io4Rf 70 с (Гиорсо, 1969 г.) 261Rf 70 с
2941Ри у* 2^Ат 13 лет р 436 лет (Сиборг, Гиорсо, 1944 г.) 294iPu (П,р) 29453Ат 243Am 7370 лет
294Pu (а, п) 24|Ст (Сиборг, 163 сут. Джеймс, Гиорсо, 1944 г.) 29349Рц (п, у) 2944°Рц (п, у) i^Pu... 29443Pu ^^3Am(n,y) ^4Ат—* ^4Ст р 19лет 247Cm 1.64-107 лет
295Am(a,2n) 297Вк (Томи-4.5 час. сон, Гиорсо, Сиборг, 1949 г.) 244Ст (a,p) 297Вк - на ускорителе 247Bk 1380 лет >т (^Ne, 4n) ^Db (Друин, Флёров, 1971 г.) 29489Cf (‘М 4п) f^Db 9 с (Гиорсо, 1970 г.) 261Db 34 с
29бСт (а, п) 298Cf (Томпсон, 44 мин. Гиорсо, Сиборг, 1950 г.) 9б4Ст (п, у) . . . ^9Bk(n,y) --> 2957°Bk Г 2958°Cf(n, у) . \ . 29584Cf p 60 сут. 251Cf 890 лет
29328U( < 1 5щ bp) 29583Cf 29593Es р 20.03 сут. (при ат. взрыве, 1952 г.) 29582Cf (ц, у) ii3Cf —> 29593Es (n, y) 29594Es p 20 сут. 252Es 472 сут.
2828Pb (1^Сг, 2п) ?$Sg (Флёров, 1974 г.)
При ат. взрыве вместе с 29593Es-2ooFm (Гиорсо, 1952г.) 22 час. 29328U (ЧО, 4n) fggFm 30 мин. 257Fm 100.5 сут.
283Bi (24Сг, п) io2Bh (Мюнценберг, 1981 г.)
299Es (a, п) 2oiMd 77 мин. (Гиорсо, Сиборг, 1955 г.) 258Md 56 сут. 2828Pb (^Fe, п) fgfHs 1.8- 10“3 с (Мюнценберг, Оганесян, 1984 г.)
294Ри (Чо, 4//) fglNo 95 с (Флёров, 1958 г.) 29бСт (ЧС, 4//) 102N0 65 с (Гиорсо, Сиборг, 1958 г.) 294JPu (ЧО, 4n) fglNo 3 мин. 259No 58 мин.
2g39Bi (28Fe, n) 510-3 с (Мюнценберг, 1982 г.)
г2
K5Np(SO4)4 K5[Pu(SO4)4], крист., бц.
M[Pu(SO4)2] иН2О, M = Na-Cs крист., гол.
NpOI 31) РиОГ;, Г = F-I, зел., р. в к. Изостр. PbCIF, Ап—О 2.3( AmOCl AmOBr 5, Ап —Г =3.3 (Br), 3.40(1) CmOF CmOCl 31) СЮС1 EsOCl 31)
NpF3, крист., пурп. NpCl3, крист., бц. NpBr3, крист., зел. Npl3, крист., кор. 4Thf 40) Стр. AnF3 - типа L слои PufBrPuBr],.. т. пл. 1380 802 750 767 aF3 (к. Pu - » т. к. 2200 1500 ч. 11), лсжду АЯ -1506 -904 -774 -594 АпС13 -2 гр. [Bi PuF3, крист., пурп. РиС13, крист., зел. • иН2О, п = 1; 3; 6 PuBr3, крист., зел. 6Н2О Pul3, крист., зел. • 4L, L = Thf, Ру типа UC13 [к. ч. 9, Р 4] - прямоугольнике т. пл. 1426 760 780 40) Ц —С1 М И ИС т. к. 2300 1770 2.89 и каж. р АЯ -1569 -963 -832 -556 2.92]; А омбом 1 АшЕ3(.,роз. AmCl3, роз. AmBr3, бц. Aml3, желт. nBr3 и Anl3 -к. ч. Pu 8, Pu т. пл. 1430 850 680 - ромб Вг т. к. 2070 1750 стр. .08, С АЯ -1648 -1041 -912 гипа Pul m Br CmF3| CmCl3 CmBr3 *r3, 1.86-3.1 АЯ -1494 -949 -820 *) BkCl3 BkBr3 изостр. (Cf—Bi CfF3 CfCl3 CfBr3 cn3 A1C13, к 2.79 и : т. пл. 545 700 700 ч. 6 ..83) 6) 6) EsF3 EsCl3 EsBr3 Esl3
PuS, PuTe, CfS, стр.
тип NaCl
Cs2Xa|\pCI(,| 4)
An2O2S (Cf2O2S раньше "гексаг. Cf-мет.") 17)
Np2S3 х порошки, Pu2S3 \ черн., Pu3S4
Am2S3 J изостр. Sb2S3
NaPuF4
M3PuF6
M2PuF5
MPu2F7
Cs3PuCl6 2H2O, крист., зел. 2)
K2PuCl5
Na[AmF4]
Rb3[AmF6]
M2AmF5
MAm2F7
Cs2NaAmCI6 2)
An
Cs2Na[CmCl6] Cs2Xa|BkCI(,|
AnN (An = Np-Cf) Np3P4 AnP AnAs AnSb, AnBi 17) стр. тип NaCl NpC PuC NpC2 PuC2 Pu2C3 PuSi NpSi2 PuSi2 CmSi PuB Cm2Si3 PuB2 CmSi2 PuB4 PuB6
_________________________
Гидриды, порошки, черн. или серые АпН2, Ап = Np, Pu, Am, стр. тип CaF2 АпН3, крист., гексаг. (Np, Pu) AmH2.7±o.3, куб., хим. инертны
34
О
(An(NO3)4)
(Am(NO3h)
4 +
5 +
6 +
7 +
(Cm2(C2O4h)
\ Оз (650°)
3.43 +
Cf7o12 изостр. Tb7O12 24)
NpO2, крист., зел., т. пл. 2300, АЯ= -1159, р. в. конц. H2SO4 + КВгО3 1200° РиО2+„ РиО2, крист., черн., т. пл. 2100, АЯ=-1054 9) с АшО2, крист., кор., > 1000° разл., АЯ = -1004, + HNO3—>О2 +... гр. тип CaF2 9) СшО2, крист., черн., разл. 380 ВкО2, крист.,-желт., разл. 500
Np )---------
> LiClO4 (Z)
Np2O5, крист., кор., АЯ= -2148 770° NpO2 15) "*300
NpO2(OH)[, зел. или фиол.
NO2 (400°)
РиО3 • Н2О, крист., золотистые
АпО2
/S
NpO3(OH) /;Н2О
темно-зел. 23)
Np(OH)4 серо-зел., сл. осн., p. в к. 12) Ри(ОН)Д, зел., не окисл. при pH > 7 Ат(ОН)Д, черно-кор.
H2O2; Оз
Перекиси AnIV
Np(OH)2SO4 Np(IO3)4,
крист., кор.
Np(ReO4)4, 4H2O
Np(SO4)2, 4H2O
Np(TeO3)2
\p(HPO4)2
NpP2O7
Np(C2O4)2 6H2O
Np(HCOO)4, цэфф = 3.25 16)
Pu2(OH)2(SO4)3 4H2O
Pu(IO3)4, роз.
Pu2O(SO4)3 8H2O
Pu(SO4)2 • 4Н2О, роз., к. ч. Pu 8 (антипризма), Pu О 2.31-2.41
Pu(NO3)4 5Н2О Ри(НРО4)2 яН2О|, желто-зел.
Ри(С2О4)2 6Н2О 32) желто-зел.
Np2(O2)3 яН2О(, n = 2, 4, кор.
Pu4(O2)7 1.6 H2O;, крист., оранж.
NH4[Np(OH)5], 12) в стр. - слои анионов, к. ч. Np 9, Np —О 2.2-2.4 ВаРиО3, искаж. стр. перовскита, Pu—О 2.23
(NpO2)2SO4 иН2О, (AmO2)2SO4 • и Н2О (NpO2)(RCOO) Н2О (NpO2)HC2O4 2Н2О (NpO2)2C2O4 6Н2О
NpO2F 18)
Np3O8 = Np2 [NpVIO8], порошок, кор.
; НС1О4 [NpvO2]+ + [Np-
Плутоваты (V) (плутониты) M2Pu2O6 • 4Н2О, М = Na, К, NH4
— J^?co3 M (
"-3- ~Р.рг)
О
NpO2(OH)2;, кор.,
H2O
PuO2(OH)2;, p.
при pH > 5 27)
Актинаты (VI) М2АпОД, An = Np-Am M2Np2O7 Cs4NpsOi7 Li4AnO5, An = Am, Np, анион - окт., Np—О 2.1-2.2 Na6AmO6 35) ГапО2\^4/о _^CBr€)3^KC104_(400^_03_ _ —- • — • — • — • z
F2 (400°)
K4[Np(SO4)4] ЗН2О
K2[Np(NO3)6],
к. ч. Np 12, икосаэдр, Np—О ~1.5 16)
K4[Pu(SO4)4] иН2О, крист., зел.
K2[Pu(NO3)6], крист., зел.
NpOF3; PuOF3 34)
CmOF3 10)
AnO2
AnF3
О2
Cs[AmO2SO4] яН2О M[NpO2(SO4)2] 3H2O, M = [Co(NH3)6]3 +
K[AnO2(CO3)] К^-йАпО^СОзШ, n = 1-3
K3[AnO2(CO3)2] яН2О
Ba[NpO2(CH3COO)3] 2H2O
K[(AmO2)F2] Cs3[AnO2C14],
гр. [AnO2] - линейны, анионы - окт., Np = O 1.81
Cs[NpO2Cl2(H2O)], цепи пентаг. бипир. [NpO2Cl4/2(H2O)] 18)
[АпО2]Х2, соли нептунила, гр. АпО2 - линейна, крист. [AnO2]SO4, 2.5Н2О, [AnO2](NO3)2 6Н2О, красно-кор. [ А и - О2](СН3СОО)2 2Н2О |PiiO2|3|Ie(C\)(,|2. кор. [AnO2]F2 /;Н2О An = Np, Pu, крист., бц., р. в HF 34) •лутонила, америцила, , роз., сильн. окисл. K2[NpO2(SO4)2] 2Н2О Cs2[(NpO2)2(SO4)3] CsAmO2(NO3)3 M[AnO2PO4]m • и Н2О M[NpO2AsO4]m • и Н2О К4[АпО2(СО3)3] Na[AnO2(CH3COO)3] K3[NpO2F5] Cs2[AmO2Cl4] анионы - пентаг. бипир. и окт., Np = O 1.80 и 1.66, Np —Г 2.29(F), 2.5 -2.8 (С1) 18’28)
Н2О, SiO2
NpOF4; PuOF4, крист., кор., гигр., изостр. UOF4, -U AnF6 + AnO2F2 25)
Na4[NpO2(O2)3] 9H2O 18)
НГ
M?[Np(SO4)5]
M4[Np(CO3)5] • 4 Н2О 26)
«Н2О;, аморфн. масса, кор., оч. сильн. окисл.
NpO3F PuO3F 10)
F2 (400°)
NpF4, зел., стр. тип ZrF4 NpCU, кор., стр. тип UC14 NpBr4, кор. Npl4 (?), сущ. при рН<1 т. пл. 830 540 470 т. к. 1480 850 АН -1791 -992 -828 PuF4, крист., желт., т. пл. 1040, т. к. 1430, \Н = —1674, стр. тип ZrF4, образ, аномальные тв. р-ры с LaF3 • 2.5 Н2О РиС14 (?) РиВг4 (?), сущ. при рН<1 Pul4 (?), + Н2О Pul3 AmF4, крист., оранж. CmF4, крист., желт. ст BkF4 э. тип 2 CfF4, крист., зел. +Ь 4 8) EsF4 RfCU, 30) возг. 313 RfBr4, летуч
NpF4 • 1/3 H2O, к. 4. Np 7 и 8, Np — F 2.18-2.68, Np —О 2.43-2.54 7)
M4AnF8; МзАпГ7; M2AnF6, An = Np-Cm
MAnF5; M7An6F31; MAn2F9; MAn3F13 7)
M7Np6F3i
KrF2 (20°) NpF5, крист., бц. (?), роз. или гол., возг., -U NpF4 + NpF6 PuF5 25) AmF5 10) DbCl5, летуч 30)
K2PuF7
MPuF6
HF (ж.)
F2 (700° -180°)
• — /zv-В; t
AnO2
H2S (CS2)
M2NpCl6
M2NpBr6
M2[PuCl6], M = Cs, [R4N], PyH, крист., желт., анион - окт., Pu Cl 2.62
NpOS, порошок, черн., изостр. ВЮС1
AnS2, AnSe2, AnTe2 (An = Pu-Cf)
Np(OR)„Br4_„, п = 2, 3 Np(OR)4, R = Me, Et, крист., красно-кор., не p. в ROH, p. в CC14
Pu(OR)4, R = z-Pr, Z-Bu, Z-C7H15, крист., изумрудно-зел., возг.
NpBr(OEt)4, крист., зел., не р. в си.
Np(BH4)4, ж., зел., т. пл. 14, разл. 25, пирофорна 33)
Pu(BH4)4 33)
Br2
KrF2(HF),, Н2О
NpF6, крист., оранж. т. пл. 54 т. к. 55 АЯ= -1975 сильн. фторагент! М —F 1.98 уст. MF6 падает в U > Nj PuF6, крист., бц. (кор. из-за присутствия продуктов радиоактивного распада), г. - кор. 51 62 -1895 сл. парамагн. (хотя /2) >1, мол. — окт. 1.97 ряду: э > Pu
AmF6, CmF6
Нептунаты, плутоваты (VII) M5NpO6,
М = Li, Na, Ва/2 КзАиО5, Ап = Np (зел.), Pu (сине-черн.), уст. на возд. Pu>Np, термин, уст. Np > Pu, изостр. M3ReVIIO5 M3[NpO4(OH)2]
лН2О,
М = Na-Cs, Ва/2, [Co(NH3)6]3 + /3, крист., черн., р. в щ., анион -окт., Np = O 1.90, Np—ОН 2.32 MNpO4, М = Li-Cs, n Т i Ъ 29)
35
ИОНЫ ТРАНСУРАНОВЫХ ЭЛЕМЕНТОВ (Ап) В ВОДНОМ РАСТВОРЕ
О 1+ 2 + 3+ 4+ 5 +
6 +
7 +
рц2+ 36)
Np3+, сип. или пурп. ион
ОН I] н
Np(OH)3T, красн.
о2
о2
[НТ]
Np , желто-зел. ион, — .
уст. >U4+ \
Н
Np(OH)4|, серо-зел.
_h_(-_h2D
\\
Cf2 + Es2+ Fm2+
откристаллизуются c SmCl2 за счет истинного изоморфизма 13)
Pu3 h, сине-фиол., уст. >Np3 +
С12; МпО4
SO2 (1); N2H4
ОН I] н
Pu(OH)3T, гол. — __\
Аш3 + , роз. ион, уст. >Ри3+
OH If H+ Am(OH)2+ 37)
Аш(ОН)3Т, роз.
Сш3+, бц. ион, легко соосаждается с Ln3 +
Вк3+
[НТ] + SmCl3
Cf3+
Es3 +
Fm3 +
о2
Н2о (-О2)
СЮ ; S2O1 (ОН )
ВгО + HNO3; Ag(II); O3
H2O2; продукты радиолиза
BrO^O^J-S^Oi- НгЗОДконщ)
~-----------------H2SO3; N2n4 + Fe2+. J
. £N°3,- I2; Fe3
[NpO2] + , сине-зел. ион, уст. в разб. р-рах НС1, HNO3
С12; МпО4
Sn2+; NH2OH
Н
H2SO4; HNO3
[NpO2]2 + , роз. ион, уст.
>[РиО2]2 + ,рН~3
I(NpO2)2(OH)2]2 +
M2[NpO4] т
£3;_S_2Oij_BrO£; A_gO_(p_H >7);_XeF2
—------------H2O2
КОН (ЮМ)
[NpO3] + , кор. ион 23)
н
NpO3(OH)T, черн.
Н+ Ц ОН (pH 10)
[NpO4(OH)2]3-, зел., 23) не pear, с С2О4 , I
Pu , желто-кор. ион, уст. > U4+, сущ.
при pH < 7,
+ Н2О 2Ри3+ +
+ [PuviO2]2+ + Н+
[PuO2] + , бц. ион, сущ. при pH ~2-4
Н2о (-О2); I ; NH2OH
\ [РиО2]2+, желт, (в НС1) или оранж. (в HNO3) ион, уст. >[АтО2]2+
Х (pH 1-4)
Ри(ОН)Д, зел.
BrO3 (95°); Се4+; О3; MnO4; S2O1 (Ag+, Н + , t)
[(РнО2)2(ОН)2]2 + (РнО2)(ОН)2, pH~4-4.5 [(РнО2)4(ОН)7] + , рН~5 21’39)
N2H4 + Fe2 +
Н+ ]1 ОН
I ; Fe2+ (медл.) CIO"; S^ol";Bidr
[РиО4]2-св.-кор. ион
О3; ан. окисл.; ВгО (pH > 7)
Н2О2; N2H4; [Fe(CN)6]‘
[PuO5]3-', сип. ион (черн. при высоких конц.), разл. даже при pH > 7
[AmF8]4'', роз. ион, сильн. окисл.; Am (IV) 37)
HNO3; НС1О4
[Am111, AmIV](OH)„T, черн., не окисл.
[CmF„](n 4) , желт.
Ст4 , оч. сильн. окисл.
Вк4 + , осаждается РО4 или 1СД на носителях Се4+, Zr4+, уст. >Ст4+,тв. соединения не выделены 38)
[AmO2] + , желт, ион, оч. сильн. окисл.;
Am3+ + [AmO2]2+
О3; S2O| (Z); Се
I ; Fe2+ (быстро)
[АшО2]2 + , красн. ион, сильн. окисл.;
—> Am(V) + Am(VII) 21)
[АшО2(ОН)4]2-
Линейные ионы
МЕТОДЫ ВЫДЕЛЕНИЯ ТРАНСУРАНОВЫХ ЭЛЕМЕНТОВ
Облученный U
| HNO3
(M = U, Np, Pu) + продукты деления (Ва2+, Се4+, La3 + , Nbv, ZrIV, Ru) (р-р)
| SO2
[UO2]2+ +Np4+ +Pu3+ +Pu4+ + продукты деления
[МО2]2+
I. Na[UO2](CH3COO)31 + Np4+ + Pu" + Pu
| KBrO3
[NpO2]2+ + Pu4+ / (P-P)
CH3COONa
HF + La
Na[NpO2](CH3COO)3 T + Pu
III - экстр. [MO2](NO3)2 экстр, из 6M р-ров HNO3 трибутилфосфатом (ТБФ), М3+ - из 10-16М HNO3. В качестве экстрагентов используются Me(z-Bu)CO ("гексон"), эф. и т.д.
II. Лантан-фторидный цикл
LaF3 ( + PuF3, LnF3, NpF4)| + [UO2]2+ (p-p) носитель
| HNO3 + Al3+ (—[A1F6]3 )
M3+ + M4+ (p-p)
| KBrO3 + HF (20°)
[NpO2]2+ + Pul4
(P-P)
HNO
масц, откристаллизуется с CsCl, ПР = 10 14)
Md2+, откристаллизуется с SmCl2 14)
EuC13 Sxm2+
[HT]
Md3 +
IV - ионный обмен. Ln3+ и Ап3+ поглощаются в колонке катионитом, затем НС1 элюирует только An3 +, a H2SiF6 - только Ln3+. Далее Ап3+ снова поглощают катионитом и вымывают с помощью комплексообразователя (цитрата, лактата, оксибутирата и т.д.). Порядок вымывания Ап3+ - от более тяжелых к более легким, прочнее связанным и адсорбированным в верхней части колонки.
Ри4+
| КВгО3(95°) [РиО2]2+ + ...
36
3-
1/3-
2 +
3 +
5 +
Нитрилгалогениды 14)
О
( NH3
r2
(nh4ci)
NC13, "хлористый азот", масло, желт., с резким запахом, т. пл. —27, т.к. 71, взр. 90°, АЯ = + 230, р. в Н2О
NBr3, крист., красн., взр., р-ры в СН2С12 уст.;
+ NH3 —> NH2Br
NBr2I, крист., кор., разл. —20 19) NI3J., крист., темно-красн., разл. 78, возг., взр.
• nNH3J., крист., кор., взр. 20 и = 1, медно-красн. иглы, и = 3, уст.
+ Н2О —> NH3 + НОГ; Мол. - (^-тетраэдр [:NF3], N—Cl 1.76, ZC1NC1 108
1-
NH2F, фторамин
NH2C1, хлорамин
Ю7° ( N---Г
H
мол. - (^-тетраэдр, N—Г 1.43(F), 1.75(0), ZHNF 101(F), 103(0)
(cO(NH2)(NF2)}
12О
(-NH2COOH)
21)
Галогеназиды, взр.
FN3, г., желт.
—U n2 + n2f2 C1N3, г., бц.
BrN3, ж., красн. IN3, крист., желт.
<у\в/^°/1.25 O4^Nz
т.пл.
-139
-100
-45
KF (-KHF2)
т.к.
-30
-15
N=N
F N2F2, дифтордиазин, г., бц.
F цис-транс-
T. ПЛ
T. K.
АЯ
N—F
-106
-111
+ 67
+ 79
20)
N транс-форма
: —196
-172
20°
—> N2 + F2 (медл.);
[N2F]+X-, X = BF4, SbF6, AsF6, разл. —5, 100, 200 2)
NHF2, дифторамин, г., бц., т. пл. —116, т. к. —23, разл. 200, взр., АЯ = —67, р = 1.93, мол. - (^-тетраэдр,
N—F 1.40, N—Н 1.03, ZHNF 100, ZFNF 103
n2of,
т. пл. —166, т. к. —72
N2F4, тетрафторгидразин, г., т. пл. —162, т. к. —74, АЯ= —8, N2F4 2NF2
1.49
F
ZNNF
1.38
1.40
100°
114
106
NF3
F
Hg; С; А1С13; Fe(CO)5
'F
'F
KMnO4
двугранный Z64°, ц = 0.26, оч. акт. фторагент
уст.
радикал
1.14
N=yO
HSO3C1
'з; f2
Г
Г
N—Г
т. пл.
т. к.
т.разл.
Г2
NO
-133
-60
-63
1.51
Нитрозилгалогениды, -азид ’
АН
NOF, г., бц. hHF=[NO]-[F(HF)„] , и = 3,4; • и Н2О, клатрат NOC1, г., желт.
NOBr, г., кор.
NON3, ж., желт.
NOCF3, г., сии.
-60
-55
-57
-197
Галогенагенты, NOF + Si
с . су
> 150° —
. —• "с- NO’
NaOH
т. пл.
т. к.
т. разл.
АЯ
NO2F, г., бц.
NO2C1, г., бц.
мол. - тр-к, N—О 1.18(F), 1.2O(C1),N—Г 1.47(F),
1.84(0); ZONO 136(F), 131 (С1)
[NO2][Or] = "F(NO3)", см. Табл. "Галогены"
-166
-145
-72
-14
300
—79
0.47
0.42
NO2CF3, г., бц., т. к. —31 NO2CC13, "хлорпикрин", .. 1,57 с г ж'’ бц'’ т- пл- т- к- 02; --1- С—Г 1.33(F), 1.73 (С1)
NOF3, " окись трифторамина", г., бц., т. пл. —160, т. к. —80, разл. 300, АЯ= —134, ц = 0.04, мол. - тетраэдр, N—О 1.16, N—F 1.43, ZFNF 100, ZFNO 117;
t сильн. фторагент; + N2O4 —> NOF + NO2F; + С12 —> OF + NOF; не pear, c SiO2, и H2O 5)
-6
—2
-87
SiF4
>100
-20
-50
+ 50
+ 79
1.97
2.14
А*
3F5
хим. инертен
+ NO
OF2; POF3
[NOF2] + [3F6]-, 3 = As, Sb, оч. акт. окисл., катион - тр-к [NOCl2] + [SbCl6r, разл. 145, катион - тр-к, N—О 1.30, N—О -1.66 22)
O2NOOCF315)
[N2F3]+X-,
X = Sb2Fn, 3F6
(3 = As, Sb, Sn); сильнейший фторагент (+ Rn —> RnF„) 4)
NF3, фтористый азот, г., бц., яд, т. пл. —209, т. к. —129, разл. 600, АЯ = —125, хим. инертен даже при высоких t, ц = 0.21. Мол. - <//-тетраэдр, ZFNF 102, N—F 1.37, не является донором (ср. NH3 ); +Н2О —HF + NO + NO2 12) искра
[NF2] + X-, X = sf5, so2f, SO3F, г., бц., неуст.;
NF2CF3, т. пл. -122, т. к, -77
[NF] [SO2F]2
Г\
( nhf2)—
// f $
(NH4HF2(x.))
[NF4]+X , соли перфтораммония, 6)
X = HF2 BF4; ГО4, 3F6/h (Э = Si—Ti, As-Nb, Мп, Ni), разл. 100-300, катион - тетраэдр; + Н2О —> NF3 + О2 + HF + Н„ЭО4
NF2C1, хлордифторамин, т. пл. —190, т. к. -67, разл. 100 Н NF3), АЯ = + 17, мол. - (^-тетраэдр, N—F 1.38, N—С1 1.73, ZFNF 103, ZFNC1 105
N(CF3)3, г., бц., т. к. —70. мол - (^-тетраэдр, N—С 1.43, С—F 1.33, ZCNC 114
37
АЗОТ
з-
i-
1/3-
2s 2р Э.О.
№ [Тт] u u UI 3.i
/ O2 (t, без к-ра); Cl2; CuO(Z)
H2 (500°, p, Pt; Fe/Al2O3)
NH3, аммиак, г., бц., с резким запахом, d = 0.77, т. пл. -78, т. к. -33, АН=-46, (NH3)„ - ассоциат за счет водородных связей, мол. - триг. пирамида (1//-тетраэдр [:NH3], sp3), N—Н 1.01, ZHNH 107, д= 1.46, 8 = 22 (-34°), р-ритель М1, Мп, МГ„, S, MNO3, MNH2;
Na + Ь4Н3(ж.)±+№“ + e-NH3 (сии.);
2NH3^.)±*NHJ + NH2, [NH+][NHZ ] = 10“33 (-50°);
p. в H2O 34%(масс.) = 99% (об.), pH =11.8
X = 0.2 X=10“5 .
NH3 + H2O >- NH3 H2O (= H3N...HOH) -c >- NH4+ + OH ,
"гидроокись аммония", "NH4OH" *-*. [NH+][OH“]
2NH3 • H2O = (NH4)2O, t. пл. -78 с разл. tNHs ' H2°l
NH3 H2O = "NH4OH", t. пл. —77, в стр. - цепи (H2O)„, сшитые мол.
NH3 ("NH4OH" не сущ. и в стр.)
NH3-2H2O, т. пл. —97, в стр. мол. Н2О разупорядочены 23)
МХ„ • у NH3, аммиакаты
____NaOCl_ _
(0.2% желатины)
N2H4, гидразин (диамид), ж., бц., дымящая, т. пл. 2, т. к. 114, NH3 + N2, ДН= +52 (ж.), +95 (г.), д = 1.83, е = 52 (25°), N—Н 1.02, N—N 1.45, ZNNH = = ZHNH ~ 110, двугранный Z90; + Н2О N2H5+ + ОН , Ki = 10-6;
N2H]" + Н2О ±^N2Hg+ + ОН“,Х2 = 10“16, сильн. восст.
H
17)
nh2, крист., бц., возг. вак. —15, -U n2 + N2H4 + NH4 [N3]
)n N4H4, тетразен, inpaitc-H2N — N = N —
HX
MOH
H2o
Na (—H2; 350°)
z
N2H5OH, гидрат гидразина, ж., бц., т. пл. —52, т.к. 119, Хосн. = 10“6, ДН= -243
Соли гидразония [N2H5]r, Г = F, Cl
Na (-H2)
X к
О
z
z
Na[N2H3], крист., желт., взр.
no2
NH2C1, хлорамин, масло, бц., т. пл. —60, перегоняется вак.; + Н2О NH3 + НОС1; окисл., мол. - (^-тетраэдр (sp3), N —Cl 1.75, ZC1NH 104, ZHNH 99
hno2
(nh4xJ
HN3, азотистоводородная к., ж., бц., яд.,
с резким запахом, т. пл. —80, т. к. 37, \ %\
d = 1.13, взр. 300°,
АН= +293,
, 171° Q
1.24/->
^N-j-'N = N: с
v/^/o 1.13
уст. в разб. р-ре, К= 10-5, д = 0.83, _H_NO_2^>30(F, взр.
сильн. окисл. (pear, с Си; HN3 + HC1 p.Pt) 20)
Нг] ДНз_(£, взр.)
>500°
3F5(HF)
Соли аммония
NH4r «4 NH3 + HF, уст. NH4I > NH4F (NH4)2SO4, разл. 357 NH4HSO4, т. пл. 251, т. к. 490 NH4HCO3, разл. 40
NH4X, при X = NO2, С1О4, Сг2О7/2,
-Л n2 + Н2О + Э2О„ 1МЫ хо 210° [—> N2o + Н2О (медл.) NH4NO3 n2 + н2О + О2 (взр.) катион - тетраэдр (sp3), N—Н 1.03 |К4М' X , соли тетраалкиламмония
Амиды
NaNH2, крист., бц., т. пл. 210, т. к. 400, р. в ж. NH3
Ba(NH2)2, т. пл. 280
Cr(NH2)3, разл. ~ 100
[:NH2] - ^-тетраэдр, N—Н 1.03,
ZHNH 104; +Н2О —► NH3 + M(OH), CO(NH2)2, карбамид (мочевина)
CaCN2, цианамид, + Н2О -4 NH3 + СаСО3
[N2H6]X2, X = F, Cl, TiF6/2
|\2H(,|SO4
IN2h6]2 h -транс, N—N1.45, N—H0.88-l.07 n)
(mno J .
7|+А
/(-NH3)
Имиды
Li2NH, S„(NH)8 - циклы
t (-NH3)
C
3-
NH2OH, гидроксиламин, крист., бц., т. пл. 33, т. к. 58/22 мм, взр. 100°, АЯ = -113;
+ Н2О *=► NH3OH+ + ОН ;
Хосн. = Ю8; конц. р-ры | (ОН-, Pt)
N2 + NH3 + N2O;
сильн. восст., мол. - (^-тетраэдр,
N O 1.45, N—Н 1.02,
ZHNH 107, ZHNO 103, ZNOH 101
н2о
Соли гидроксиламмония, [NH3OH]+X“, X = Cl (т. ПЛ. 151), C1O4, SO4/2, NO3, PO4/3, крист., уст., катион - искаж. тетраэдр, N—Н 0.99, N O 1.41 ф)
2-
HNO3
[H2N3] + [3F6]-соли аминодиазо-ния, крист., бц., уст. при 20°, катион -[H2N—N = N] + 1.29 1.10 22)
1-
Нитриды M3NX
Солеобразные Ковалентные Металлоподобные
LisN, крист., красн., т. пл. 814(p), оч. акт. BN, крист., бел. т. пл. 3000 (pN2), разл. TiN, т. пл. 3200 CrN, т. пл. 1500
M2N, М = Са-Ва, стр. анти-С0С12 ~ 2500, стр. тип алмаза или графита ZrN, " 2980 AnN, An = Th,
Mg3N2, разл. 1500 ]уст. на воздухе, AIN, крист., бел., разл. 2200 \ стр. тип VN U, Pu
Ca3N2, т. пл. 1195 стр. тип GaN, желт. (вюртцита NbN, " 2300
Zn3N2, разл. 700 | Мп2О3 InN, черн. j (ZnS) стр. тип NaCl
Be3N2, т. пл. 2200 с разл/ Si3N4, крист., бел., возг. 1900 Nb2N, Cr2N, Fe4N, Co3N, Co2N, Ni3N,
Cu3N, разл. 450, стр. тип aHTn-ReO3 стр. тип NaCl; диэлектрики или полу- NL|N, фазы внедрения N в стр. M, туго-
+ H2O^MOH + NH3; проводники, термостойки, уст. к окисл., плавки, оч. тв., хрупкие, с мет. тепло- и
полупроводники распл. М, кислотоупорны (t) электропроводностью, хим. инертны
СаГ2
HI; H2SO3; Fe2 +
Ca2NF, Г = С1, Вт 24)
38
*•* В тексте "Таблиц" водные растворы NH3 обозначены "NH4OH"
INH41+, тетраэдр (sp3)
[НТ]; Sn2 +
IN2h5]
:NH3, </<-тетраэдр, сл. восст.
OC1
:N2H4, сильн. восст., 2 пересекающихся ^-тетраэдра
\ —-----NH3
осГ
.2+. v2 +
N2, г., бц., d® = 1.25, ' т. пл. —210, т. к. —196, ст. дис. = 0.1% (3000°), АЯдис. = 945, р. в Н2О 2% (об.) (0°), оч. инертен, N—N 1.095 (1а + 2л связи), VN = N 2331 см ’; мол. стр., а-, куб. пл. упак., ' а = 5.66 | >-238° /?-, гексаг. пл. упак., а = 4.04, с = 6.67 (вращение мол. имитирует симметрию шара)
7 i OsCl3 + PR3 + Zn/Hg; Ti(C5H5)2; Ni(ac-ac)2 + PPh3 + эф.; , VCl3(Thf)3 + Na + PR3
Нитрогенильные комплексы 7) [M(N2)(NH3)5]C12, Mn = Ru, Os, крист., желт., диамагн., уст. к / Н2О и О2 [M(N2)(PR3)3], М° = Со, Ni [Os(N2)(PR3)3Cl2] [Ti(N2)(C5H5)2]2, + RMgF —> NH3 +... [W(N2)2(PR3)4], rp. [N = N: -> M] линейна, N—N 1.12-1.6, ZMNN 177-179 [(NH3)5RuN = ]2X4, N—N(moct.) 1.25, VN = N 2050—2150 K[Co(N2)(PR3)3] l(PR3)3Fe(N2)H2] [Na(Thf)][V(N2)2(PR3)2]
M (-N2-NH3)
M(N3)„, азиды 25J NaN3, бц., разл. 275 KN3, т. пл. 350, разл. 355 без взр. Mn = Hg, Pb, Ba (•Н2О1), [SO], [SO2], [CrO2]; взр. от удара (детонаторы); анион линейный
[:N = N = N:]“, N—N 1.17
HI; HCl + Pt(—N2)
[NH3OH] + , тетраэдр, окисл.
:NH2OH, ^-тетраэдр, сильн. восст.
HN3, оч. сильн. окисл., К = IO-5 H+ J) OH-
|1N3| , симметричный линейный анион
[Hf]
hno2
0
N2T, р. в Н2О 2% (об.)
:NH2C1 Ш NH3 + НОС1, окисл.
OC1 ; IO3; VO3
о2 (-Н2о2); I2; Ag+; Cu2+ (-Cu+)
V(OH)2 + Mg(OH)2; Cr(OH)2
2 +
n2o, закись азота ("веселящий газ"), бц., т. пл. —91, т. к. —88, d = 1.98, АН = +81, р. в Н2О 56% (об.) (0°), ц = 0.17, линейная мол.
— + .. +
:N = N = O или :N = N—О: ;
**1.13 1.18**
не pear, с к., щ., О2, но поддерживает горение • 5.75 Н2О (8:46), клатрат
so2
О
NH3J О,
НС1 (эф.)
H2N2O2, азотноватистая к., крист., бц., взр., р. в Н2О, си., эф., Ki = 10“7, К2 = 10“12, оч. сл. окисл. и восст., + МпО4 —> NO-T;
+ [Н?] —> [NH3OH]+ 3)
\O2 (4000°, дуга); (Pt + оксиды Mn-Co)
NO, окись азота, г., бц., яд., т. пл. —164, т. к. —151, d = 1.34, АН = +90, парамагн., ц = 0.16, N—О 1.15, кратность связи = 2.5 (<т+ 1.5л), vn = O 1876; в бц. ж. и крист, (сии. из-за примеси следов N2O3) - диамагн. — — мол. !/wc-N2O2 - трапеции (N—N 2.18, О—О 2.62), р. в Н2О, к., не поддерживает горение. Лиганд (;NO) - донор 3-х эл. и образ, дативную связь M->(NO) + 1) Гр. [М — (N = O)+] линейна (sp), N—О 1.1-1.2, vN_o 1580-1940 Fe(;NO)4; Ru(;NO)5; Cr(iNO)4; Mn(JNO)3(:CO) Fe(;NO)2(:CO)2; Co(;NO)(:CO)3, диамагн., Se = 18 |Ru"(NO)X5|+", X = NH3, PR3, H2O, CN [M(NO)(CN)5]"-, M = Fe, Mn (n = 2), Mn, Cr, V (n = 3); |Fe'(NO)(H2O)5|2+, бур. ион 2) Гр. [M — ( N = O) ] угловая, Z MNO 120 (sp2), N—О 1.16, vN_o 1200-1040 [Irr(NO)(CO)(PR3)2][BF4]
K3[Coin(NO)(CN)5]; [Coin(NO)(NH3)5]X2 7)
O2 (мгнов.); NO2
о д
X д
• —H2; H2S (взр.)
116° ~
1.8бЛ/°
M2N2O2, гипонитриты, 3)
М = Na (разл. 335,
-1 Na2O + NaNO2 + N2),
Ag), (желт.), Ва/2
°K "I2-
L 120° J цис- и транс-конфигурации
(nh2oh)
\MeNO3 +
+ NaOMe
K3[N(SO3)2] Н2О, нитридосульфонат, анион -[O3S—N—SO3]3 , ZONO 121, N—S 1.61, S = O 1.47
M2[HN(SO3)2], имидосульфонаты 26)
HN(SO2r)2, Г = Cl, F, ИМИДО-сульфурилгалогениды 27)
M2N2O3, гипонитраты 3) (соли несуществующей азотноватой к.), М = Li-Cs, Са-Ва/2, Na( • Н2О) "соль Анжели", уст. при pH и 7; разл. 290-370; анион плоский + х6!2-
O__XS=XS<<_ чо
N = N 1.26, N—О 1.31-1.35 Na4N2O4T, соль гидро-азотистой к., порошок, желт., взр. > 100° или + Н2О
2 +
[Hf]
' CrO3; НМпО4; НОС1
n2ot (медл.) Р‘ в Н2О 1 ’ 56% (об.)
H2so3
NOT
H2SO3
1 ' “ р-р в Н2О 6% (об.)
HBr(Z); HI; Fe2 +
S-
1 он
n2 + n2o + no2
Fe2 +
[Ге^О)+(Н2О)5]2 + бур- Р-Р
К
hno2, оч. сильн. окисл. (в разб. р-ре), К= 10“3,
Н+ ОН |:NO2| , </<-тр-к (sp2), восст.
N2O3 no + no2 100% при 100° 90% при 25° азотистый ангидрид (окись-закись, трехокись); г. красно-бур., яд., d = 1.45, т. пл. — 101, АН = +84, ж. и крист, гол.; р. в Н2О с расслаиванием, в г. - плоские мол. ц = 2.12; в стр. - [NO] + [NO2]-, N—О 1.12 (в катионе), 1.21 (в анионе) 12)
о д
О2 (мгнов.);
" ~NO “" (600°, -О2)
hno2, азотистая к., q
НО—N = O Н—N^
ХО
Изв. только в р-ре (конц. - гол) и в
г. (плоские мол., транс-формы)
Н2О + NO+ HNO2 Н+ + NO2
косн = 10-7, Кк = 10-3;
+ Н + —> NO + HNO3 + Н2О
1.43°-^О
О
Соли нитрозония (нитрозилы), 10) крист., бц., оч. гигр.
[NO]HSO4, "нитрозилсерная к.",
т. пл. 73;
[NO]2S2O7, т. пл. 233, т. к. 360
[NO]2Se2O7; [NO]2Se3O10 8)
[NO]XF4, X = В, Вг
[NO]2[MC1J, М = Sn, Ti-Hf, Th, V 16)
[NOJAICU; [NO]MovF6; [NO]2XeF4
[NO][M(NO3)3], M = Cu, Mn [NO]m[M(NO3)4] = "M(NO3)m hN2O4"
Кратность связи [:N = О:]+ = 3 (о + 2л), N—О 1.06; v = 1860 - 2400 см 1
Na (NH3 ж.)
NONH2, крист., оранж., разл. -30 (^ N2 + NH4NO2)
H2O2(H+ ) [HOONOL
10-6
О.
NO2
I H2o HNO2 + HNO3, (окисл.)
O2
[Hf] (Al; Zn + OH -)
n2o4 четырех-бц.
99.8% (21°) АН = +10
О * /э О диамагн., ц = 0
2NO2 —58 кДж двуокись бур.
100% (140°) АН = +34
x^Q
парамагн., ц = 0.29
г., бур., яд, т. пл. -11, т. к. 21, ж. бур., крист, бц., электро-проводны в 103 раз > ж., ^О4(ж.) «=► NO+ + NOJ, RCN, RCOOH, HNO3 и др. доноры эл. усиливают дис.
[D:NO] + );
+ М—M(NO3)„ • т N2O4 + NO, М = Na, Си, Fe, Мп и др. 32)
H2o
.<4
Pb(NOj^)
O3(—78-
20° (-O2)
\As2O3; крахмал (C6Hi0O5)x; H2(Pd)/
H2O2- -
N2O5, азотный ангидрид, крист., бц., летучие, яд, т. пл. 41 (р), т. возг. 32,
-25°)
w т. к. 45, взр., d = 2.17,
.0
АН = —42, в стр. -[NO2] + [NO3]~ в г. — неионизированные мол., ц = 1.39 12,13)
О3(ж.)
H2o || -H2O(P2O5)
1.21
HNO3, азотная к., ж., бц.,
(^-^ no2? + Н2О + ОД), кор.
т. пл. —41, т. к. 84 (экстраполировано),
Н3О+ + NO3 + N2O5 3 HNO3 Н3О+ + NO2+ + 2NO , 100%
плоская мол., ц = 2.16
• иН2О, п = 3 (= [H7O3] + [NO3D; 1 (= [H3O] + [NO3D 18) у т.к. азеотропа с Н2О (68% HNO3) = 122, d = 1.40, '/ сильн к., К 20 (конц. р-ры)
X д
О д
о
H2O(-O2)
Нитриты, крист., бц. или св.-желт., летучи (500°, вак.) разл.
т. пл.
Н2О
220
284
438
422
398
NO
NO3, перекись азота, бел. неуст. в-во, р. в эф.
чб 1-50 , \?хт__о/ ,
HNO3 + HNO2 +
HNO4, 30) надазотная к., взр., 1.5 М р-р сущ. ~30 мин, + Н2О
—> hno2 + о2
LiNO2 NaNO2 KNO2 RbNO2 CsNO2 Ba(NO2)2
Ag-NO2i
NO2 +
[:NO2] - </<-тр-к (sp2),
N—О 1.1-1.2; ZONO 113-132, сильн. окисл. в распл.
iM2O (300°)
M3NO3 = [M3O][NO2], М = Na-Rb, мгнов. гидрол., в пустотах стр. [Na3O] (типа UHmw-ReO3) - гр. [NO2] 28)
H2O
NO
!2
6>
320
350
200
140
[NO2]+X“, соли нитрония 8) (нитрилы), X = PF6, AsF6, VF6, HSO4, HS2O7, SO3F, Se3Oi0/2, Se4O[3/2, MoF7, C1O4, крист., бц., оч. гигр., оч. сильн. окисл., линейный катион [О = N = О]+ (ср. изоэл. СО2 !), N—О 1.15, V[No2]+ = 2350-2320, 1400 см 1
t(-O2); C; Fe
NO2NH2, нитроамид, крист., бц., т. пл. 75 с разл., р. в Н2О, си., эф., Кк = 10“7, ц = 3.6, + ОН Н2О + N2,
уст. р-ры в MeCN
О Н
О4 '"Н двугранный Z52 29)
о СЛ д ni X
О
и о о
и
([NO2]BFj)
M[NO3(HNO3)2], М = K-Cs
M[H(NO3)2], М = K-Cs
18)
NH4NO4,
пероксонитрат, пяттт 5 3<9 pdJJl. э
HNO3, сильн. к., К = 20; 2-3% оч. слаб, окисл., (не pear, с Ш);
и 5% + Mg — Н2 Т (в начале р-ции); 30% -окисл., конц. (и 60%) -оч. сильн. окисл.
(+ ЗНС1 + Аи
H[AuC14] + NO + Н2О); Al, Cr, Fe - пассивир., Au, Pt, Rh, Ir - не pear.
Нитраты 31)
крист., бц. T. ПЛ.
LiNO3 261 3H2O
NaNO3 308 разл. 380
"чилийская селитра"
KNO3 334 разл. 400
RbNO3 310
CsNO3 414
Ca(NO3)2 561 4H2O
Ba(NO3)2 592
Pb(NO3)2 208 с разл.
AgNO3 210 разл. 300
H
OH
МС1„;
М(—NO)
[NO3] ', плоский тр-к (sp2), оч. сл. окисл. (в р-ре)
р. в ж. NH3; анион - плоский тр-к, ZONO 120 (sp2), N—О 1.18-1.25; окисл. только в распл.; в г. - мол. MJNO3, стр. аналоги HNO3;
M(NO3)„ • х Н2О -1—»М2О„ + Н2О + + NO2 + О2;
М'ХО3. Mii(NO3)2, М = Li-Cs, Са-Ва, Ni),
-U M(NO2)„ + o2 + no + no2 M(NO3)„, M = Cu, Be, Al, Mg, Fe, Co, Ni, Ti, SnIV, крист., летучи, p. в орг. р-рителях, гидрол.
| М^О (300°)
M3[NO4], ортонитраты, анион - тетраэдр, N—О 1.38 16)
39
ФОСФОР
з-*
i +
2 +
О'
РН3, фосфин, г., бц., яд, с запахом гнилой рыбы, т. пл. —134, т. к. —88, воспл. 150°, \Н= +5, оч. сильн. восст., р. в Н2О 20% (об.), и = 0.58; мол. -триг. пирамида, Р—Н 1.42, ZHPH 93 (р3у,
• 5.75 Н2О (8 : 46), клатрат
PHt +Н2О РН3 + Н2О Н3О+ +РН2
К= 10 29 К= 10 29
оч. сл. донор
PR3, сильн. доноры
[Ni(PH3)4|; [Co(N2)(PR3)3]
Р2Н4, дифосфин, ж., бц., т. пл. -99, т. к. 63, стр. аналог N2H4, Р—Р 2.22, Р—Н 1.45, ZHPH 94 и 99, двугранный Z 74 (транс- и гош- изомеры), воспл. при 20° (в виде примеси к РН3), не pear, с к.; • лН2О, клатрат 15)
н2о
Са3Р2)
Соли фосфония [РН4]Х
крист., бц.
[РН4]С1О4, взр.
РН4Г РН3 + НГ (г.)
т. возг.
РН4С1 -28
РН4Вг 38
РН41 80(т.к.), 18 (т. пл.) оч. сильн. восст.;
+ Н2О —> РН3 + НГ; катион - тетраэдр (sp3), Р—Н 1.42
О
£
Я
Н2О\\М(ж. NH3)
MPH2, дигидрофосфиды, крист., бц., самовоспламеняются
| 100° вак. (—РН3)
Na2PH
MAI(PH2)4; SiF3(PH2) 15)
Са2Р1; Са3Р13,
в стр. - вакансии катионов, окт. [СаР313] и [СаР214], Са—Р2.83, Са—I 3.41 и 3.27 12)
Солеобразные '*
Li3P; Na3P; Na2P5 (т. пл. 650)
К2Р5; Ва[Р5]2; Rb4[P6], в стр. - плоские циклы [Р5] и [Р6], Р—Р 2.20 Na3P23; Ва3[Р7]2, анион - кластер Вд; к5р4, анионы - цепочки Mg3P2; Са3Р2 Zn3P2; Cd3P2
Cu3Pl; CuP2J?, не p. в HNO3 (Z)
P(HgCI)3[ PH3 + HgCl2
+ О2 - воспл.,
+ Н2О —> РН3 + ...
(РН)„, тв. в-во, желт., не pear, с к. и щ.;
Р4 + РН3
3s
Зр
3d
э.о
2.1
Фосфиды М3Р
Ковалентные
BPJ., разл. >2000, не р. в к. и щ., стр. алмаза
А1Р, разл. 2000,
+ Н2О —> РН3 1иР[, разл. 1070 GaPJ., т. пл. 1467. AsP[, разл. 750
ScP; YP; LaP, стр. тип NaCl LnP + Н2О —> РН3 + ...
стр. сфалерита (ZnS)
О
/Л.
P4, бел., мягкий, воскообразный (желт, из-за примеси Ркрасн. и As), т. пл. 44, т. к. 257, р. в CS2, NH3, SO2, яд, воспл. 40°.
В стр. - мол. Р4 - тетраэдр, Р—Р 2.21, ZPPP 60, к. ч. Р 3. Напряжение в тетраэдре обуславливает хим. акт. Р. а-, куб., а= 18.51, d= 1.83
1 <-76.4°
Р-, трикл., а = 11.45, b = 5.50, с= 11.26, а = 71.8, £ = 90.4, у = 71.6, d= 1.94, в [Р4] Р—Р2.17
г* / ’
ct-
ад
Я
С
Металлоподобные
т. пл.
250°, /?> 5 - 107 Па (I2; Na; /гг-УФ, рентген)
1Р713’
Диэлектрики или полупроводники (М = Mg, Са, Zn, In, Ga, As)
KZnP, CaZn2P2, в стр. - слои тетраэдров [ZnP4/4], Zn—P 2.49 22)
* См. примечание к с. 58.
1580 с разл., стр. тип NaCl
1600
1200 с разл.
1356 — ферромагн.
Ti3P TiP Cr3P CrP Fe3P Fe2P FeP FeP2
UP; U3P4 Rh2P; Ir2P, стр. тип анти-СаР^-Проводники (TiP) или полупроводники (CrP); хим. инертны (акт. повышается с уменьшением содержания Р); р. в распл. Na2O2
Р„, красн., не р. в CS2, не яд, воспл. 240°, возг. 429, d = 2.2-2.4, мол.-цепи разной длины, к. ч. Р 3, Р —Р 2.24, ZPPP 102 450° j.
"фосфор Гитторфа",
6 модификаций (трикл., тетраг., куб), в стр.-цепи из гр. Р8, стр. аналогов As4S4, Р—Р 2.22, ZPPP 101
550'
Р„, черн., возг. 453, т. пл. « 1000718- 108 Па, <'/=2.69, термодинамически уст., не реакц., воспл. 400°, в ромб. стр. (а = 3.31, b = 4.38, с = 10.50)-гофрированные слои, Р—Р 2.18, Z РРР 99, графитоподобный полупроводник
| 83000-Ю5 Па
Р, мет., ромбоэдрический, стр. типа As, а = 3.52, а = 57.4, Р—Р 2.38, d = 3.56,
| 124000-105 Па куб., стр. аналог Ро, а = 2.38, d = 3.83
Фосфогенильные комплексы |МС1( Р4)( PR,)2|- М = Rh, It 2)
Р4О, полимер
(Са3(РО4)2)
|R4X||Rii4(C())i2(/(,-PO).
крист., уст. 38)
МОС1 + МОН
M6P6Oi2 • лН2О, M = Rb, Cs, Ba/2, гексаметафосфиты, анион - "кресло" 31)
S2O6F2 (HSO3F);
H2s2o7(-sq2-H2so*
ж., р.
охл.
280'
Р2О3, фосфористый ангидрид, крист., бел., т. пл. 24, р* т. к. 175, АЯ = —1640 (для P4Og), р. в орг. р-рителях. I В г., р-рах и одной из модификаций - димеры Р4О(>.
В мол. - 4 ^-тетраэдра [:РО3], связанные общ.
О вершинами, образ, "большой тетраэдр" [Р4]. В др. модификациях - полимеры из тетраэдров [РО4].
[P8]2+(HSO3F)2-[P4]2+(HSO4)2-бц. (изв. только в р-ре), [Р8]2 + , сии., [Р4]2 + , бц., диамагн. ионы
н2о
Н[ОРН(О)—РН2] 23)
Н4Р2О4 = Н2[Н2Р2О4]
о
£
MihHuPsO.s 4Н2О
MnH10P4Oi2 • Н2О
Мп3Н6Р4О12 1.5 Н2О 16)
H4P2O5 = Н2[Н2Р2О5], ди(пиро)фосфористая к., иглы, бц., т. пл. 38, разл. 130
Газ
P4 1000° P2 2000° P
[P = P], P—P 1.90, эл. аналог N2
Ва[Н2Р2О4] , Г О О Т
Н—Р—Р—н
О О
М2[Н2Р2О5], пирофосфиты Na2H2P2O5; ZnH2P2Os, анион - 2 тетраэдра с общ. вершиной
Г о
о
п)
-I2-
Н_Р_О —Р_н
РС13(—Н2О)
Н2О (Н+ t)
о
о
Н+ (катионит)
О
н—р—О
PC13(-P); Hg2+
я
Н3РО2 = Н[Н2РО2], фосфор-новатистая (гипофосфористая) к., крист., бц., гигр., т. пл. 27, К= 10-1, р. в си., эф.;
рн3 + н3ро3, оч. сильн. восст. (только в конц. р-ре, Z) 19)
О
М[Н2РО2] гипофосфиты NaH2PO2 Н2О 19) КН2РО2; NH4H2PO2 Mg(H2PO2)2 6Н2О Ва(Н2РО2)2 Н2О
Са(Н2РО2)2, хор. р. в Н2О [ср. СаНРО4 и Са3(РО4)2], анион -искаж. тетраэдр, Р—О 1.52
РВг3
О—Р—Р—О
О О
О Н
М3[НР2О5], дифосфиты Na3HP2O5 12Н2О
Н3РО3 = Н2[НРО3], фосфористая к., крист., бц., гигр., т. пл. 74, разл. 200, /7 = 10 2, К2 = 10 7, р. в Н2О, си.; мол. - искаж. тетраэдр;
Н3РО3 (крист.) —> РН3 + Н3РО4; сильн. восст.
( < Н3РО2; pear, медл., Z), при 20° не pear, с HNO3
Н2[НРО3] Р(ОН)3; о rjO, 154
P(°R)3 (RO)<R н^он ("перегруппировка Арбузова") ОН4
Н2о
( РС13 МН[НРО3], гидрофосфиты
4------7 NaH2PO3, 2.5 Н2О, т. пл. 4i
. j2rU3, • 2.5 Н2О, т. пл. 42, разл. 100 КН2РО3; Zn(H2PO3)2, анион - искаж. тетраэдр, Р—О 1.51 П)
О £
М2[НРО3], фосфиты 31)
Na2HPO3 • 5Н2О, т. пл. 53, разл. 120
К2НРО3; MgHPO3 6Н2О
Ag2HPO3 . бел.; СаНРО, : СгНРО3 2Н2О,
-U м3ро4 + рн3 + р + ...
[НРО3]2 - искаж. тетраэдр, Р—О 1.52, Р—Н 1.29
(ХН4),|Р(Мо6О2|)| 10Н2О . желт.
40
п
3.67 +
М3Р3О8 ООО
250°, вак. (—Р красн.) О2 (200°, медл.)
Р4О7 21) р4о8 крист., бц., возг. 180, не р. в орг. р-рителях; + Н2О—Н3РО3 + Н3РО4; Р4О9
стр. аналоги Р2О3 и Р2О5, но конц. ат. О
не у всех ат. Р, Р—О ~ 1.64 (мост.), 1.45 (конц.)
О^ О О.
/Р О
о< I
I I/O О. / Р\ ° О _31) М4Р4О10, м = Cs, Tl, Cu/2, Ni/2
М6Р4Оц
О О о
о
-16-
о—р—р—о—Р—Р—о
о о
О О
-1 5-
о —р—р—р—О
|_ ООО
Na5P3O8 14Н2О
Н2О (-НС1)
Н4Р2О6 = Н3[НР2О6], фосфористо-фосфорная к., крист., бц., уст. к восст.
(NaH2PO3 + Na2HPO^
180'
NajHPlOe, фосфито-фосфат (изогипофосфат), • 4Н2О
Н4Р2О6, фосфорноватая (гипофосфорная) к., крист., бц., т. пл. 73 с разл., • 2 Н2О, т. пл. 62, Ki>l(T2, К2 = 10~3, К3 = 10’8. Х4= 10 10;
(?,н )> Н3РО3 + Н3РО4
И
О и
7
НО/
о
11g II ОН о о
2-
Гипофосфаты Na2H2P2O6 6Н2О (NH4)2H2P2O6 Na4P2O6 10Н2О Са2Р2О6 2Н2О
ВагРгОб, все соли мало р. в Н2О, диамагн., анион - 2 пересекающихся тетраэдра
pt,Cu)
Р2О5, фосфорный ангидрид, порошок, бел., оч. гигр. ( сильнейший дегидратирующий агент. В г. и гексаг. ст над ребрами которого - 6 мост. ат. О; у каждого ат. i смесь аморфного и гсв ?. - димеры Р4Ою, обр ’ - 1 конц. ат. О, Р—( саг.), бурно pear, с Н2О; азованы тетраэдром [Р4], ) 1.40-1.49 (конц.), 1.56-1.65 (мост.) O<^P^124°J?P^ ° | О^р^О^|
а.-, гексаг. (ромбоэдрическая) мол. стр., d = 2.3, т. пл. 422(р), возг. 359 (летуч < Р2О3), АН = —2988 (для Р4Ою), оч. реакц. 450°, р_ 2 ч Т Р-, ромб (метастаб.), d = 2.7, т. пл. 506, возг. 605, в слоистой стр. - циклы из 10 тетраэдров [РО4] 500°, р 24 ч у-, ромб., d=2.9, т. пл. 580, в трехмерной стр. - циклы из 6 тетраэдров [РО4] ° II
422° О
ж., летучая, подвиж-ная (мол. Р4Ою) t ж., нелетучая, вязкая (из полимерных мол.) охл. I I —| стекла |
О2
-------*- из-за присутствия свобод-(Разряд)
Н2О (в недостатке, 0°)
(НРО3)„, п = 3, 4, 6, "метафосфорная к.", стекловидная масса, бц., тигр., т. пл. «40, возг., р. в Н2О, си., сильн. к., К3 = 10 2, К4 = 10 3, единственная из к. Р свертывает белок (большой заряд аниона), в стр. - неупорядоченное расположение циклических мол. - (НРО3)4 и др.
|Р(ОН)4| + Х“, соли фосфорила, Х = С1О4(т. пл. 47), HSO4, РО4/3 [в стр. новой формы К2(Н2РО4)2], в катионе Р—О 1.62 35)
о и
Н4Р2О7, ди(пиро)фосфорная к., стекло или крист., бц., т. пл. 61, Ki = 10 2, Х2= I03, /Д= 10 7, А4= 10 '°, р. в Н2О, сп„ эф.
МОН
Полифосфаты М’ + 2[Р„О3п + 1]
М^РяОзя-НОНН п = 20-70, образ, из р-ров, хор., но медл. р. в Н2О (с частичной олигомеризацией)
М7[Р5О16], пента-
М5[Р3Ою], триполифосфаты NaZn2[P3O10] 9.5 Н2О (NH4)5[P3O10] Н2О 10)
Р4Оц, крист., бц. (фиол.
ных радикалов), разл. 130
о и
о
и
я
о
:2РО4
о
к я
1(-Н2О)
£ 5?
М6[Р4О13], тетра-
Ма6| Р4О| 3|, стекло
(NHtUP^d 2Н2О 10)
Na5[P3O10] • 6Н2О NaPO3 + Na4P2O
(са5(РО4)3(ОН))
о
и
о и
[МРО3]„, М = Li-Cs, Ag, /7 + I04 и растет с t синтеза; соли Грэма (стекла), Мадрелла и Курроля (крист., пластинчатые или волокнистые); в неупорядоченной стр. - неразветвленные цепи или спирали из тетраэдров [РО4],
Р—О 1.59-1.63 (мост.), 1.46-1.49(конц.), ZOPO 123(конц.), ZOPO 99(мост.)
(RbPO,)x.
соль Курроля
(\аРО,)ч.
соль Мадрелла (/?)
H4P2O8. пероксодифос-форная к., крист., бц., = 2, К2=1(Г1, Х3=10~5,
К4 = 10"8;
+ Н2О —> Н3РО4 + Н3РО5
32)
Циклометафосфаты
[М(РО3)т]„, п = 3-6, 8, 10, 12, в стр. - неплоские циклические анионы [PO3]JJ из тетраэдров [РО4], Р—О 1.6-1.7(мост.), 1.4-1.5(конц.), ZOPO 100-119, ZPOP 103-139
тримета-, кресло
Ы3[Р3О9] ЗН2О
Na3[P3O9] иН2О,
Cd3[P3O9]2 14Н2О
тетрамета-, "кресло" и "ванна" Ы4[Р4О12] 6Н2О Na4[P4O12], 4Н2О Cu2[P4O12] А14[Р4О12]3
4)
гексамета-, l iJI’oOisI 5Н2О Na6[P6O18] 6Н2О Na2MiI[P6O18] Кб1РбО181 ЗН2О Li4(NH4)2[P6O18l 4Н2О
октамета-, K2Ga2[PsO24]
У льтрафосфаты М^-гРлОз»-!!, разветвленные конденсированные островные Mg^On]; Nd[P5O14] Cd2[P6O17]; Na3Fe[P8O23]
[Р8О23]
Ди(пиро)фосфаты
Na2H2P2O7, разл. 220, • 6Н2О; Na4P2O7, т. пл. 988, • 10Н2О; \g4P2O7, бел.; К4Р2О7 • ЗН2О, (——> Н2О,);
М2Р2ОД, Мп= Mg-Ва, Zn, -U М3(РО4)2 + Р2О5Т, анион - 2 тетраэдра с общ, вершиной, ZPOP 130-157
32,37)
'о
Пероксодифосфаты, М2Н2Р2О8; К4Р2О8, 340° т, „ „ , „ ,
анион - из 2 тетраэдров [РО4], в центре -гр, [ОО]
Н3РО5 =
= (НО)2Р(О)(ООН), пероксомонофосфор-ная к., Ki = IO"1, К2= 106.
Г. = I А 13
5)
Н3РО4, ортофосфорная к., крист., бц., тигр., не яд, т. пл. 42, К\ = 10 2, ХОН
К2= ю 7, К3 = 10 12, р. в сп„ s = 61 (25°), 2 Н3РО4 [Н4РО4]+ +[Н2РО4Г, сМ2рХ-ОН
мол. - искаж. тетраэдр, сл. окисл. (>350°), pear, с М, SiO2 X—
, ^осо/ ОН
'О^^МзНРО?)
, . Н3РО6 =
J хЬк =(НО)Р(О)(ООН)2,
J дипероксофосфор-ная к., уст. <0 5)
VX/'Y, ——-—— -- ——v ------,, , ---z
1/2H2O, t, пл. 30 (80% р-р H3PO4, вязкий сироп); продажный препарат -----------------------------------------------------------
Моно (орто) фосфаты
Однозамещенные (первичные) дигидрофосфаты, М[Н2РО4]„, р. в Н2О (при любых М) NaH2PO4, разл. 200; КН2РО4, т. пл. 253 с разл.; (NH4)H2PO4, т. пл. 190 Са(Н2РО4)2, "двойной суперфосфат" Са(Н2РО4)2 • H2O + CaSO4(., "простой" Ва(Н2РО4)2; AgH2PO4, М(Н2РО4),.А М(РО3)„ + Н2О. В стр. - цепи анионов с Н-связями, Р—ОН 1.52-1.58 Двузамещенные (вторичные) (гидро)фосфаты М2[НРО4]„, р. в Н2О только при М = М1 Na2HPO4, (разл. 300°), • иН2О п = 12 (разл. 35°), 7(48°), 2(95°); К2НРО4, (NH4)2HPO4; NaNH4HPO4, "фосфорная соль", -U NaPO3 + NH3 + Н2О СаНРО4, "монеит", • 2Н2О(., "брушит", ПР= 10 6, "преципитат", -U М4Р2О7 + Н2О Трехзамещенные (третичные), М3[РО4]„, р. в Н2О только при М = Na-Cs, NH4; Na3PO4, т. пл. 1340, • иН2О п = 10, 12 К3РО4, т. пл. 1340; Са3(РО4)2(., т. пл. 1670, ПР = 10 25; • 3-4.5Н2О, аморфн. Ca5(PO4)3(F, С1, ОН), "фтор-", "хлор-", "гидроксилапатиты"; Ag3PO4(., желт., т. пл. 849; ПР= 10 21 М3У[РО4]Д, MIV = Се, Th, Zr, U, Pu, не p. в HNO3, анион - правильный тетраэдр (sp3), л Р—0 1.46-1.55 А,
H3[P(W12O40)l иН2О, п = 6, 21, 29 (NH4)3[P(Mo12O40)1 нН2О.
фосфоромолибдат, желт.,
не р. в HNO3; в центре аниона -тетраэдр [РО4], каждый из 4-х ат. О - в центре тетраэдра [ОРМо3], 12 окт. [MoOg], связанные общ. ребрами и вершинами, образуют "оболочку" [Moi2O40], стр. Кеггина (см. Табл. "Молибден")
41
1 +
2 +
3 +
5 +
^7
A>.
(PF3)2O
г., бц., т. к. —18;
20°
PF3 + (POFX)
(PO2F)„, крист., бц.
РО2С1, масло, бц.
(PO2CF3)„
(POF2)2O, ж. т. пл. т. к.
0 72
(РОС12)2О, ж. -16 65
P2O5J
\NH4F; HF (40%)
----H2 (разряд)
т. пл.
-86 -28 126
т. к. ц
-6 —
180 — разл 0.45
HPOF2, мол. - искаж. тетраэдр, P—H 1.39, P—F 1.54, P—О 1.44, ZHPO = ZFPO 117, ZHPF = ZFPF 101
С12; вг2
-—-к (бурно)
•2^3)----------
o2(?l
P2F4, г., бц., неуст.
Р2С14, ж., бц.
Р214, крист., оранж.
мол. - Г2Р—РГ2, Р—Р 2.2-2.3,
Р —Г 1.59(F), 2.48(1), ZFPF 99(F), 102(1), ZTPP 94 18)
25)
PFBr2, г., бц., яд
РС13, ж., бц.
РВг3, ж., бц.
Р13, крист., красн.
PF3, г., бц., яд
PF2C1, г., бц., яд
PF2Br, г., бц., яд
PF2I, г., бц., яд
PFC12, г., бц., яд
т. пл. т. к. АЯ М Р—Г (г-) zrpr
-151 -101 -959 1.03 1.55 97
-165 -47 — — 1.57; 2.03 —
-134 -16 — — — —
-144 + 14 — — 1.55(F) 2.02 (С1) —
-115 78 — — — —
-90 75 -314 0.78 2.04 100
-40 173 -175 0.52 2.23 101
+ 61 разл. -46 0.34 2.46 102
H3PO3 + НГ;
Г2
HPF2, г., бц., т. пл. —124, т. к. —65, ц = 1.32, мол. - пирамида, Р—Н 1.41, Р—F 1.58, ZFPF 99, ZHPF 96;
+ Н2О —> Н2 + HPOF2 + HF + Н3РО2
гигр. в-ва, р. в CS2, СС14, эф., бзл.; + Н2О
мол. [:РГ3] - -тетраэдр, донор 2 эл., образ, дативную связь Р:«-М (за счет <7л-орбиталей Р), стабилизирует М°
[Cr(PF3)6]; KRe(PF3)5; [Pt(PF3)4]; [Ni(PCl3)4]
PC13 • я I ., L = Br2 (n = 2, 9); NH3 (n = 5); Me3N
PI2CF3
F3C
F3C
(CF3P)„, п = 4, 5, в мол. - циклы [Р„]
F
CF3
С;------F
1.32
н
h2pcf3
97°
F
"F
H'
H2PF3, т. пл. —47, т. к. +1, разл. при 20'
HF
H3PO2
[Р215] + [АП4]-', катион -[I3P—PI2] + ,P—Р2.22, Р—I 2.41
NH3 ж. (изб.)
P(NCS)3, ж.
HPF4, т. пл. —89, т. к. —36, неуст., мол. - триг. бипир., Р—F 1.55 (экв.), 1.59 (акс.), Р—Н 1.36,
ZHPF 90(акс.), 124(экв.)
|R4X||HPH5| 24)
Z
Оксогалогениды 7) т. пл. т. к. АЯ М Р—Г
POF3, г., бц. -39 (р) -40 (возг) -1218 1.77 1.52
POF2C1, г., бц. — — — — —
POFC12, г., бц. — — — — —
РОС13 ж., бц. + 1 107 -602 2.40 1.99
РОС12Вг, ж., бц. — 79 — —
РОВг3, крист., бц. 56 192 -460 — 2.17
РО13, крист., фиол. 50 — — — —
РОГ3, гигр., р. в орг. р-рителях; +Н2О —> Н3РО4 + НГ;
РОВг3 и РО13 разл. на свету; РОС13 (г ; = 14) - р-ритель МГ„,
мол. - искаж. тетраэдр (sp , , Р = О 1.45, zrpr -103, ZOPF 114
Lil
Р2О5
Ц-г2)
Г = Cl (100°);
Br(35°)
PO(NCS)3, ж.
т. пл т. к. \н
PF5, г., бц. -94 -85 -1594 —
PF4C1, г., бц. -132 -43 — —
PF3C12, г., бц. -125 + 7 — 0.68
PF2C13, г., бц. — — — 0
PF3Br2, ж. -20 разл. 15 — —
PC14F, ж., бц. -63 67 — 0.21
РС15, крист., бц. 160, возг. 159 (р) -433 13)
РВг5, крист., оранж. 106 с разл. — -231
Р15, крист., черн. 40 27) — —
P2(NH)3, имид
Л*
H3PO3
700° (-N2)
700° (-N2)
P = N, крист., желто-кор.; 800° п , хт
-----> Р4 + N2; не р. в к., щ.;
мол. PN сущ. в г., Р—N 1.49, ц = 2,75
H2[PO3F], ж., бц., d = 1.8, Ki « К2 « 10-5; + Н2О — НН + Н3РО4 M2[PO3F], М = М1, NH4, Са/2, уст. к Н2О, анион - искаж. тетраэдр, Р—О 1.51, Р—F 1.59 6)
H[PO2F2], ж., бц., d = 1.6, сильн. к.; +Н2О — НН + Н3РО4 30) M[PO2F2], анион - искаж. тетраэдр, Р—О 1.47, Р—F 1.58, ZOPO 122, ZFPF 97
Н[РО2С12], ж., бц., т. пл. —28, уст. при 20°; + Н2О —> НС1 + Н3РО4
М[РО2С12]
М[РО2Вг2]
PF2(O)OOCF3 14)
MPO3
70° (меД31)
O2F2; NOC1;
N2O4; XeF6
HPF6, масло, бц., • 6Н2О, т. пл. 32, сильн. к. M+[PF6]“, М = Na( H2O), K-Cs, Tl, Ag (p. как MC1O4), [O2], [NO], [NO2], [PC14], [PBr4], [Ir(O2)(PR3)4], [Xe2Fn]
|ЭС14| + |РС16|”, Э = P, As, анионы - окт. (sp3#), P—Г 1.59 (экв.), 1.73 (акс.) (F), 2.07 (Cl), [PH(>] уст. при pH > 7
РГ5 - оч. гигр. в-ва, р. в СС14, CS2, бенз.; мол. PF5, PF„C15 „, РС15(г.), -триг. бипир. (sp3d), Р—Г(экв.) 1.54(F), 2.02(С1), Р—Г(акс.) 1.58(F), 2.14 (С1). [РС14]+ [РС16]“, [PBr4]+ Вг образ, стр. типа CsCl
РС15 я L. L = NH3, N2O4, SeCl4, МоС14
[PF4] + [Sb3F16]- 9)
[PC14] + X-, X = F, [PC16], [PF6], [BC14], [IC12]
P2Cl9Br = [PCl4]3+[PCl3Br] + Br2 [PC16]2- 8)
[PBr4]+X , X = F-Br, [Cl3], [Br3] (= "PBr7"), [PF6], катионы -тетраэдры (sp3), P—Г 1.98 (Cl), 2.15 (Br)
[PI4] + [A1I4]-', катион - искаж. тетраэдр, P—I «2.4
PO(NH2)3, крист., бц., медл. гидрол., мол. - искаж. тетраэдр, Р—О 1.51, Р—N 1.66; PO(N2H3)3 [PO(NH2)(NH)]4, оксоамидоимид
! r(-NH3)
(PON)„, оксонитрид, порошок, бел., аморфный или крист., не р„ нелетуч., 1000°(вак-)> р2р5 + PN; + Nh3 P4ON6 26)
H2[PO3(NH2)], крист., бц., Ai = 10“3, K2 = 10 s, NH4PO3
Ag2IPO3(NH2)U
Na2[PO3(NH2)] Na4[(PO3)2NH] NaJ) PO3)3X|
амидофосфат 2 имидодифосфат 2 нитридотрифосфат
H[PO2(NH2)2], крист., бц., пятиосн. к., К\ = 10 5 NH
Н„|—PO2(NH)]„, п = 3-6, метафосфимовые ^P\qj_[
крист., бц., р. в Н2О, медл. гидрол. NH4PO3,
мол. - циклы, наиболее уст. при п = 4 Ч'Р^
M„[-PO2(NH)]„ м(ж- M2„[PO2N]„ Чон
N = P(NH2)2, амидонитрид, т. пл. 162; [N = РХ2]„, X = NCS (n = 3, 4), CF3; N = P(N3)2 = "PN7", азидонитрид
N = P = NH, имидонитрид ("фосфам"), порошок, бел., не р. в к., щ.
P4N6, крист., бц., не р. в к., щ., воспл. на возд.
| 400°, вак. (—NH3)
P3N5, нитрид
M[P(N3)6], азидофосфаты, M = [R4N], Cs
Li[PN2], крист., бц., уст. до 1000°, не р. в к., щ.
Mg2[PN3], анион - цепи тетраэдров., Р—N 1.76, Mg—N 2.09 28)
(NPX2)„, X = F, Cl, Br, SCN, NH2, R, n> 3, фосфонитрилгалогениды, -роданиды, -амиды, -алкилы, и т. д. (фосфазены) (NPC12)„, крист., бц., не смачиваются Н2О, уст. к к., щ., р. в эф., ц = 0.5
PC15
п т. пл. т. к.
3 114 256
4 123 328
5 41 224
6 90 262
7 -18 —
ОО — >250
г
Г
p<fl02°
при п = 3 - плоские циклы, Р—Г 1.52(F), 1.98 (С1); при п = 4 циклы - неплоские ], 250° (полимеризация)
прозрачная каучукоподобная масса (линейные полимеры)
], 350° (деполимеризация)
олигомеры
(XPC I,)„ /»!.. L = SO3 (m = 3); НС1О4 (m = 1, 2)______________________________
В молекуле 3 сопряженных двойных связи (не ароматическая система)
(NPF2)3 (NPF2)4 N4P4F„C18_„, т. ш т. пл. т. к. (NPBr2)3 (NPBr2)4 7), т. к. 301(п = 1), т. пл.
28 30 I. 63(п= 1 52 120 ), ~5(п = 192 202 П(п = 7)
42
СЕРНИСТЫЕ ПРОИЗВОДНЫЕ ФОСФОРА 29)
Полисульфиды (PS)„; (P2Sn)„; (P2S14)„, желт, в-ва, не р. в Н2О и орг. р-рителях, р. в щ., разл. 200
о
о
Сульфид] крист., жел гигр. (кром ы 17) г., летучие е P4S3) :, р. в С S2, бзл., нафталине ( распл.), воспл. на возд. (Z),
p4s2 P4S3 P4S4 P4S5 P4S„ p4s7 P4S9 P4S10
(PS)„ п = 5.5-6.7 (2 формы)
т. пл. 46 174 — 162 232 308 250 288
т. к. — 408 наиболее — с разл. с разл. 523 с разл. 514
В мол. всех при п > 6 S Р4О6 и Р4О уст. P4S„ - те -конц., Р 10 граэдр| — S2.1 Р4], Р-(мост.) -Р 2.2, S(moc 1.9 (конц.); ;т.) - на P4S6 и Р ребрах 4S10 — ст тетраэдра, р. аналоги
РдЗез, крист., оранж. т. пл. 247 33)
Оксосульфиды
3.5 + 4 + 5 +
P4O4S3; P4o7s 36); P4O4S6
p4o6s4,
т. пл. 102, т. к. 295
P4O7S3
5
Тиогалогениды 20)
PSF3, г., бц., воспл.
PSCI3, ж.
PSBr3, крист.
PSFCIBr
PSI3, крист.
T. ПЛ. т. K.
-149 -52 0.63
-36 125 1.41
37 206 —
— 98 —
47 — —
В тетрамерных мол. - тетраэдр [Р4], Р—Р 2.20, Р—S 1.86-2.19, Р—Г 2.19(Вг), 2.48(1), в г. -мономеры PST3 - искаж. тетраэдры P4S3I2, крист., оранж., т. пл. 121, 3 ат. S-moct. вдоль ребер, 2 ат. 1-конц., PS(NCS)3, ж,
Тиофосфаты 3 + M3[PS31 23) 5 + H3[PS41
4 + IR4N]2[H2P2S6] Zn4[P2S6]3 -
M4[P4s8], M'lPiSJ. = Zn4[Piv M3[PS41,
уст. к гидрол., м = Cd, Hg, S61 + H2O H2S + M3[PS„O4_„],
в анионе - Sn, Fe, IP2 S6]2 n = 0-3, анион - тетраэдр
квадрат [Р4] анион - 2 пересекающихся тетраэдра Ag7[PS6] Ag4[P2S7], анион изостр. [P2O7]4
Во всех анионах Р—S 1.99- 2.12, P—P 2.28
Оксотиофосфорные к. и оксотиофосфаты
s„r2 (эф., -20°) Н3[РОз8], К2= 10 6, К3= 10 11 Na3[PO„S4_„] • хН2О, п = 1, 2, 3 М3[Р3Оз86], М = Na, Т1, в анионе - цикл [Р3О3] \ H4p2s2o6, дитионадфосфорная, сильн. к., сущ. в р-ре; +он s2 +s+poi , стр. аналог Н4Р2О8 | НСЮ4 K2H2P2S2O(,
[(НОЪОР]^, п = 3, 10, быстро гидрол. Ba4[P2O6]S„, уст. %
Z \NaHSO4 QNa2HPOj- - HOSO2OPO(OH)2, пиросернофосфорная к., + Н2О —> H2SO4 + Н3РО4 Na3[PSO7] Ba3[PSO7]2, хор. р., уст.
з-
0
PS(NH2)3, крист., бц., медл. гидрол.
(SPN),
ИОНЫ ФОСФОРА В ВОДНОМ РАСТВОРЕ
HNO3 (30%); НС1О4
Г2; Ag+; Hg2 + ; О2 (I2); Н2О (-Н2, t)
Н2о (Н+, t)
[НТ]
—
[PH4] + , 1 Н3РО2 = Н[Н2РО2],
оч. сильн. восст., 1 К= 10 1, оч. сильн.
ион - тетраэдр I восст. (в конц. р-рах, /);
1 1 -U РНз + Н3РО4 + + PJ, + н2 + • • •
Ag+; Hg2~ Cu2+ (-CuHJ.)
Н3РОз = Н2[НРО3], Кх = 10-2, К2 = 10 сильн. восст., медл. pear., не восст.
HNO3
Н4Р2О6 (фосфорноватая к.), Кх > 10"2, К2 = 103, К3 = 10"8. К4 = 10 10, сл. восст. (< Н3РО3), pear, с HNO3 только в присутствии NO2
КМпО4
H3PO4, К,= 102. не окисл.
Н2о
(H+,Z)
Н4Р2О7, Кх = 10 2, К2=10~3
Н2о
н
Р, бел. Т —
yv
Н
ОН
он
ОН
н+ I ОН
Н2О2; МпО4
[Н2РО3Г
н+ I ОН
Н + , t
[Н2Р2О6]2’
н+ I он
[Н2РО4]-, v К2= 10-pH 4.6*
н+ I он
Гипотетические полифосфорные к., сильн. (для Н5Р3О10 к3 = 10 3, К4 = 10 7, К5 = 10 9, для Н6Р4О13 К3 = 10-2, К4 = Ю 3, А7= 10 7, К6 = 10 9), поэтому при pH <7 равновесие сдвигается в сторону более сл. к. - Н3РО4 и Н4Р2О7 (олигомеризация)
[НРОзк п = 3, 4, 6, сильн. к., К3 = 10 2 К4 = 10-\ свертывает белок
^4 H2o
H4P2O8, Kx = 2, K2 = io1, K3 = 10 5, K4 = 10 s. не pear, c KI
н+ I он
н
Н
ОН
[НРО4]2 , К3= 10’13. pH 8.9
н
ОН
[Н2Р2О7]2-, ^з = Ю 7, К4= 10-10. pH 4.2
[Н2Р„Оз„ + 1]"-, pH «7, спирали тетраэдров
н+ I он
н
ОН (-Н2О, 40°)
разрыв циклов
ОН
[Н2Р2О8]2
н+ I он
ан. окисл.
РНзТ, оч. сильн. восст., трит, пирамида
[Н2РО2]-
уст. к окисл. и восст.;
+ он —> н2 +
+ нро2 + ро4
|НРО3|2 21^ [Н2Р2О5]2-
Н2О искаж. тетраэдр
[Р2О6]4- (гипофосфат), уст. к окисл. и восст., 2 пересекающихся тетраэдра
[РО413“, тетраэдр (sp3), pH 12.1
Н2О '-Н2РО4
Il’iOd
pH 10.2
2‘'() 1Р3О1015-
- Н2РО4 pH 10
Цепи тетраэдров
Л?2- [Р4О13]6-- Н2РО4
Н2О2 (ОН )
О О
II ) II
ОР-/-ОРО
I t I
о о
4-
О
* Значения pH приводятся для 1 %-ных р-ров
О О II ) II ОР-/-ОР-О-РО
Ml I
о о о
5-
О
о
о о II) II ОР-/-ОР-О-Р-О-РО
Г I I I
о о о о
ФОСФАТЫ
6-
[РО3]"-, при pH 6.5 (п = 4), циклы из тетраэдров
<у? \
о
4—
[Р2О8]4-, сл. окисл., 2 тетраэдра [РО4]
О
О'
'О
н3РО5
А71 = IO"1, к2 = 106.
К3 = 10-13.
оч. сильн.
окисл.
( + Мп2+—>
НМпО4;
+ 1 12)
43
МЫШЬЯК, СУРЬМА, ВИСМУТ
(Na3SbC0
3-*
2-
2/п +
SnCl4 (эф.)
44
З’ОЛ У у ‘
AsH3, арсин | SbH3, стибин г., бц., оч. ядовиты, с запахом чеснока т. пл. —117 т. к. —62 разл. 300 АЯ +67
р. в Н2О р. в CS2 ц 0.22 мол. - трит, пирамиды
Э —Н 1.52 I 1.71
ZH9H 92 91 (р3)
не обладают донорной акт., сильн. восст.
5.75 Н2О (8:46), клатрат
BiH3, висмутин
As0
45 и
H2S
-94
-18
150, взр. 20 + 147
17% (об.)
99% (об.)
0.12
оч. неустойчив
медл. 20 + 231
M'AsH2, M = Li-К, крист., желт., разл. 0 (Li), 10 (Na), 80 (К) (^ H2 + MAs1) HAs(HgCI)2. крист., желт. KSbH2, уст. < KAsH2
AsR3, триалкиларсины, сильные доноры эл. [Pt(AsR3)4] [IrCl(CO)(AsR3)2]
[PluAsl + x-
X = C1O4, I, ОН, соли тетра-фениларсония
[R4Sb]+X“ оч. неуст.
As2H4
(AsH)„, красн., полимер, р. в HNO3
%
( AsCl,)
Sb°
Bi°
6s
И
4d
4р
55 и
|||ф| 1 1 1
5р 5d
I | I | [ 1 1
6р 6d
Э.О.
2.2
1.9
1.7
Ионы As, Sb, и Bi в водном р-ре см. с. 47
[Me2As-]2, какодил, ж., с отвратительным запахом, т. к. 170, воспл. на возд.
[AsMe2]+ X X = Cl, CN, S/2, соли какодила, O/2 (окись), ж., с отвратительным запахом
М(ж. NH3); HgCl2
НС1
С
Ал
U
М3Э„ 20)
Арсениды Антимониды (стибиды) Висмутиды стр. тип
Солеобразные M3As, М = Li-К M3Asn SrAs3; Sr3As4; Ba3[As7]2 Ca3As2; CaAs2 Mg3As2; Cu3As2 Zn3As2; ZnAs2 + HC1 ЭН4 + МС1; в CsSb; M2Sb; Li3Sb2 M3Sb, M = Li-К M4Sb7; M2Sb4; LiSb2 + H2O —> MOH + 9H3f Mg3Sb2; BaSb3 CanSb10; Ba3[Sb7]2; Ca16Sbn, фазы Цинтля ZnSb; CdSb стр. - кластеры [Э7], кольца M2Bi4; MBi МэВц M = Li-К, сине-фиол. CanBijo Mg3Bi2 цепи, Э—Э 2.53 (As] CuAu Na3As CuAu La2O3 ,2.84 (Sb)
Ковалентные AlAs, т. пл. 1740 GaAs; InAs, т. пл. 1238, 943, стр тип сфалерита, полупроводники; LnAs; + Н2О —> AsH3t + ... Ba|Zn2As2|, в стр. - слои тетраэдров [ZnAs4/4] AlSb GaSb InSb LnSb CsSnSb3, сущ. в г. Ca14AlSbn 30) LnBi NaCl
Металлоподобные TiAs; ZrAs NiAs, стр. тип NiAs, "красный Ni-колчедан" FeAs; CoAs VAs; CrAs, стр. тип MnP; V5As3 FeAs2, "леллингит" FeAsS, "мышьяковый колчедан" ("арсенопирит") Cu3As2], As(HgCl)4, кор. | HgCl2 Hg3As2]., черн. Ag39 • 3AgNO3 = [3Ag6 Ti4Sb TiSb; CoSb; NiSb ("брейтгауптит"), стр. тип. NiAs TiSb2; CoSb2; NiSb2, стр. тип FeS2 ("марказита") NiSbS, "ульманнит" Cu3Sb, Cu2Sb P-— 3 + (NO3)^, крист., желт. Ag, Zn, Cd, Pb, Sn, Fe-Ni не образ, висмутидов U3Bi4, PtBi2, Au2Bi - интерметаллиды ^>(эн3)
* См. примечание к с. 58
As I Sb
мет., серые, хрупкие
Bi
мет., серебристо-бел.
d
T. ПЛ.
T. K.
5.72 817/36 • 105 Па 615, возг.
6.62 630
1634
р. в к.-окисл.
9.80
271
1564
р. В щ. (0
> +0.30 |
гтв
мет. проводимость
а- гексаг. (ромбоэдрическая) стр., близкая черн. Р а а
£оэз+/э.
4.12
54.1
2.78
+ 0.24 I (растет от As к Bi)
+ 0.23
э—э
между слоями 3.33
4.50
I 57.1 к. ч. 3 (= 8-5)
3.18
3.36
1270 (As)
J. возг. в атм. Н2
Р-, порошки, черн. аморфн. или "зерка уст. на возд.
5.3
>-80°
(-SbH3)
у-, крист., желт., воскообразные, d= 1.97, разл. 358, р. в CS2, летучи с Н2О-паром, оч. реакц. (окисляются на возд.) в стр. - мол. As4 -тетраэдры, As—As 2.44
d
4.7-5.1
содержит «10% SbH;
!---<3^
(sbH3)^oN
Легкоплавкие сплавы Bi (эвтоники)
4.75
57.2
As(OH)SO4
As(HSO4)3
HAsO2 + Н2О H3AsO3. изв. только в р-ре, Хк1 = I О9, Хосн = 10 |4, pH « 5
H2SO4 (конц.); HNO3 (разб.)
HiVo z иЦ*ощп
3.64
ло" ж. As(p), Sb, Bi
|z
быст- г. э4 <4 2Э2 h 43 3 = As, Sb Bi2 2 Bi, эл. аналоги N2
рое охл.
Ч&о, ш
| Sb2O3[ крист., куб., бц.
т. пл. 278, АЯ = -665, р. в Н2О | АЯ = -707, р. в НС1, HNO3,
(«2%), "арсенолит" ("мышьяко- конц. H2SO4, щ., "сенармонтит", вый цвет"), d = 3.87 | d = 5.58
в узлах алмазной стр. - мол. Э4О6 [стр. аналоги Р4О6; Э—О 1.78 (As), 1.98 (Sb)]
I к. ч. 9 = 3 + 3 |А
570° || 360° 0О2)
ромб., "валентинит", ("сурьмяный цвет"), d = 5.75
т. пл. 656, возг. 1570
AS2O3, стекло или
221°
монокл., "клаудетит", d= 4.29
т. пл. 315, т. к. 465
в стр. - гофрированные слои ^-тетраэдров [:ЭО3/2], ZO3O 100(As), 90 (Sb), As—О 1.72-1.81, в г. - мол. Э4О6, Э—О 1.78(As), 2.00(Sb), Z3O3 129
J 1800°
Э2О3
Н2О
Д О
20° (—Н2О)
Sb2O3 • иН2ОЦ бел., р. в к. и щ.
SbO(OH)
Арсенаты [III] (арсениты) NaH2AsO3; NaAsO2 (ранее "Na2HAsO3"); K3AsO3 Ag-jAsO-?]., желт., ПР=10 17 CuHAsO3]., желт., [:AsO3] - (/(-тетраэдр, As—О 2.01 KH(AsO2)2 H2O MAsO2, M = Na, K, NH4 Pb(AsO2)2], желт., в стр. - цепи (^-тетраэдров [:AsOO2/2] (SbO)„X, оксосоли ("соли антимонила") 19) Sb4O5(OH)ClO4 1.5 Н2О [Sb(OH)SO4(H2O)]2 Sb4O4(OH)2(SO4), "клебельсбергит" Sb2O(SO4)2; Sb6O7(SO4)2 |Н5О2Г SIuOjIOHXSOjL н2о [(SbO)2(OH)(NO3)]2, в стр. -дисфеноид [:SbO4], (/(-тетраэдры [:SbO3] и окт., Sb—О 2.0-2.6 SbO(H2PO4) Н2О
Н2О (изб.)
H2SO4 (конц.)
МОН
Антимонаты (III) (антимониты) 21) M3|Sb(OH)6|, M[Sb(OH)4], анион - тетраэдр NaSbO2 3 Н2О BaSb3O5(OH) Na3SbO3; NaSb5O8 M2Sb6O10; M2Sb4O7, в стр. - (/(-тетраэдры и (/(-трит. бипир., Sb —О 1.82-2.18 Mn[Sb2O4],Mn = Mg, Zn, Mn-Ni, стр. аналоги РЬ3О4
Состав сплава, %
т. пл.
Bi Pb Sn Cd
69-89 (сплав Гутри) 47.4 19.4 19.9 13.3
69-75 (сплав Вуда) 50 25 12.5 12.5
92 50 30 20 —
48 36 28 6 30-Hg
пл. при трении 29 57 — 14-Hg
Типографский сплав
60 15 25-Sb
U| IAs8]2+, [As4]2+, |Sb4|4'.
сущ. в р-ре; бц. катионы, диамагн. (сии. из-за примеси [S8]2+) [Bi5l3+[A1C14|3, т. пл. 253
[Bi8]2 + [A1CU]2-
[Bi9]5+Bi+1 HfCI(,|2 , катионы-[Bi,Jт +, п = 3 - тр-к, п = 5 - трит, бипир., п = 8 - квадратная антипризма и п = 9 - трехшапочная трит, призма, Bi—Bi 3.1-3.9 '*
Sb(ClO4)3,
SbO(ClO4) 2)
Sb2(SO4)3, иглы, бц., н2о
Sb(NO3)3; Sb2(HPO3)3
SbPO4, уст. при 1200°
SbMO4, M = Ta, Nb, "стибиотанталит", колумбит"
M[Sb(ClO4)4] M[Sb(SO4)2] [H3O]2[Sb2(SO4)4] Ca[Sb4O4(OH)2(SO4)2], "перетаит"
Na3Sb(PO4)2, в стр. -цепи окт. [SbO6]
K2[Sb2(C4H2O6)2] 3H2O, "рвотный камень" (тартратоантимонат-Ш)
N+ I 4 сн
Os
2)
НС СН
I ^О. I
0/с\ /?< сЧо
Nr Nr
крист., бц., хор. р. в Н2О, сущ. 2 оптических изомера, [:SbO4] - дисфеноид, ZOSbO80
As4S3, AsS2
I 100°
As4S5, M2As4S6
Полианионы Цинтля [Na2L4]Bi4 [Na3L4]Sb7 [Na3L„]Asn,
L = En, криптанд 30)
(CO)3[CoAs3], мол. - трит, пирамида, As—As 2.37, Со—As 2.44
Bi[Co(CO)4]3
BiIr3(CO)9,
тетраэдрические кластеры,
Bi—1г 2.76 4)
As4S4, стекло или крист., оранж., т. пл. 320, т. к. 565, р. в M2S и NaHCO3, "реальгар", в стр. и г. - мол. As4S4, аналоги S4N4 (но ат. S и Э поменялись местами:
As4 - тетраэдр, S4 - квадрат);
+ КОН Asl + KAsO2 + K3AsS3
2.49
As2S31 , желт., ПР= 10 29, крист., золотистые, т. пл. 310, т. к. 723, АЯ = -96, р. в (NH4)2CO3, HNO3;
+ ОН — [3S„O2 ,J3 ; +S2 "аурипигмент",
в монокл. (изостр. As2O3)
Sb2S3J., оранж., ПР= 10 30, крист., серые т. пл. 560, т. к. 1160, \Н = —158, р. в конц. HC1(Z);
43SJ3 : +s/ -^[3VS4]7
'антимонит" ("сурьмяный блеск"), в ромб. стр.
ленты из ^-тетраэдров [:3S3]
и </<-окт. [:SbS5], Sb —S 2.46-3.14
Bi4S.
в г. - мол. As4S6, стр. аналоги Р4О6, As — S 2.25, ZAsSAs 100, ZSAsS 114______________________
As2Se3J., крист., кор., т. пл. 360
Сульфосоли 6)
M3AsS3, св.-желт., гигр.
Ag3AsS3, "прустит" Cu3AsS4, "энаргит"
TLAsS2, "лорандит" PbAs2S4, "сарторит" Cs2Sb8S13; RbSb3S5 Н2О
NaSbS2; K2Sb4S7 Н2О M^bS^; AsSbS3, "гетчеллит" Ag^^Sjs, "полиаргирит" CuSbS2, "халькостибит" PbSb2S4, "цинкенит" В стр. - тетраэдры и (/(-тетраэдры, Sb—S 2.4-2.8
”4 + ”
5 +
t (-о2)
Арсенаты (V), орто- ди (пиро-) Na2[AsO3(OH)| 12Н2О 90° 135° NaH2AsO4 п Н2О - , ’ > Na2H2As2O7 ( " „=1,4 (-н2°) НН Ba(H3As2O7)2 KH2AsO4, т. пл. 288 M2HAsO4 • иН2О, М = Na (п = 7, 12), К (п = 1) M?AsO4(OH), М = Си ("оливинит"), Zn ("адамит") CaHAsO4, 2Н2О, "фармаколит"; M3AsO4, М = Li, Na( • 12Н2О), К, NH4( - ЗН2О), Ba/2i, Pb/2i M3'|AsO4|2 8Н2О, М = Zn ("кеттигит"), Со ("эритрин", "аннабергит") Ca2Mg(AsO4)2 2Н2О, "беловит" Ag3AsO4j_, бур., ПР = КГ20 NHiMgAsCM -U Mg2As2O7 крист., бц. 39) три- мета- 2300 r Na3H2As3O10NaAsO3 )} IT Ас Г» (—Н2°) т. пл. 615 K5As3Oi0 Ba(AsO3)2j_, в стр. - цепи или циклы тетраэдров, As—О 1.62-1.81 (стр. аналоги фосфатов) Mn(AsO3)2, Мп = Са, Cd, Pb, Со, в стр. - каркас окт. [AsO(>] Na3H5As4O14, в стр. - каркас окт. [AsO(>] и тетраэдры [AsO4], As—О 1.77-1.88 и 1.64-1.73 НО ОН О—As—О н(к / / \ V ^О— ^As О О As -О'' \ \ / / ^он О—As—О но7 ^ОН [H6As4O14]2- BaH6As4Oi4
45
ГАЛОГЕНИДЫ И ОКСОГАЛОГЕНИДЫ МЫШЬЯКА, СУРЬМЫ И ВИСМУТА
п
5 +
Н2
Asoci;
НС1 (200°)
AS2I4, крист., темно-красн., т. пл. 136 с разл.;
+ Н2О —> As + Asl3
т. пл. т. к. АН As—Г (г-) М
AsF3, ж., бц. S' -6 63 -85 8 22) 1.71 2.81
AsCl3, ж., бцХ^ -16 130 -336 2.16 1.97
AsBr3, крист., бц. 33 221 -201 2.32 —
Asl3, крист., красн. 146 403 -67 2.56 —
мг
M[AsF4], М = K-Cs, [SC13], анион-</<-триг. бипир., As—F 1.72-1.88 KAs2F7 = K[AsF4][AsF3], As—F 1.73-1.9 1 22)
[SCl3] + [AsF3Cl]-
KAsCU
[AsF2] + [SbF6|-[AsCl2] + [SbCl6]-
AsF3 и Sbr3 гигр. в-ва, р. в эф., AsCl3 (е = 13) р. S, Р; распл. Sbr3 хор. р. МГ„; AsF3 + Н2О As(OH)3 + НГ (скорость гидрол.
F > Cl > Вг > I); Sbr3 + Н2О Sb(OH)„r3 „ + НГ SbOU; р. SbCl3 в Н2О ~80%; в стр. и г. - мол. [:ЭГ3] - ^-тетраэдры, /ГЭГ «100 (As), « 98(Sb); Э13 - слоистые полимеры, изостр. FeCl3, As—I 2.55-3.47
M2AsO3F; MAsO2F2
MAsOF4, M = K-Cs, анион [As2O2F8] - 2 окт. c общ. ребром [O2], As—(F,O) 1.81, As—As 2.66, ZAsOAs 95 9)
M2[(AsF5)2O], As—(F,O) 1.72
M[AsF5(OH)], анион - окт., As—(F,O) 1.76
M[AsF6], М = М1, [NF4], [AsC14], [SC13], [SeCl3], [TeCl3], [C1F4], [C1O2], [IO2], [IF6], [XeF], [Xe2F3], [Xe2Fn], [XeF5], анион - окт., As—F 1.63-1.70, уст. к H2O M2AsF7 M[AsCy, M = [PC14], [Et4N], крист., оранж.
Sb3O2F5; SbOF Sb3O4F
SbOCli; Sb4O5Cl2i; 8Ь8ОцГ2,
Sb4O5Br2i Г = Cl-I
Sb3O4I; Sb5O7I
В стр. - ^-тетраэдры, триг. бипир. и Г ,
Sb—О 1.9 - 2.5 25)
8ЬЭГ, Э = S-Te, Г = C1-I, полупроводники
SbF4 = [Sb2nF4]2 + [SbvF6]2
SbCl„, и^З, "взр. Sb", графитоподобная масса, взр. при трении, d= 5.8, в стр. -ат. Sb, [SbCl]2 + , [SbCl2] +, СГ
кат. восст.
т. пл. т. к. АН Sb — (г-)
SbF3, крист.,бц. 292 319, возг. -916 1.88
SbCl3, крист., бц. 73 233 -382 2.33
SbBr3, крист., бц. 97 289 -260 2.49
Sbl3, крист., красн., 171 401 -100 2.72
негигроскопичны
Sbr3 (Г = F-Br) изостр. YF3, Sbl3 - изостр. Р13,
МГ
г
Sb —Г 1.92(F), 2.34 (С1), 2.49 (Вг), 2.72(1), ZTSbr 87(F), 99(1). SbF3 р. в ROH, бзл, Diox; лЬ, L = Dipy, С6Н6, С10Н8 - л-комплексы.
M[SbF4|; Na2SbF5; KSb2F7; Li3Sb2F9 NaSb3F10; K[F(:SbF3)4]; K3Sb4F15
Na3Sb5F18; в анионах - </<-триг. бипир. (дисфеноид) или окт., Sb—F 1.96-2.06 M4Sb4F16, анион - цикл [:SbF3F2/2] M[SbCl4]; M2[SbCl5|; M3[SbClJ; Cs4SbCl7 Cs5SbCl8; M3Sb2Cl9; Cs5Sb2Cln; M7Sb3Cl16 Tl2Sb3Cln, в анионах - окт., </<-окт., Sb —Cl 2.4-3.2
RbSbBr4; K2Sb2Br9; M3SbBr6, анион - окт. (!), Sb —Вг 2.79
K2SbI5; Cs3Sb2I9, анион - окт., Sb—I 2.86-3.20
MSbI4, анион - окт. 3)
8ЬцГ43 — [Sb^nF13]5+[SbvF6]5-, в катионе - цепь из 2 завершенных и 3 ^-тетраэдров [:SbF3], Sb—F 1.7-1.9 (конц.), 2.06-2.2 (мост.)
(SbOF3)„; SbO2F
SbO2Cl
SbOCl3i,
желт, в-ва, гигр., не р. в орг. р-рителях;
+ Н2О —> Sb2O5 • п Н2О ],
Г2;
BrF5kS
MSbOF4
M2Sb2OF10
M[SbF5(OH)|, Sb—F 1.83-1.92 16)
Na[SbF4(OH)2]
H[SbF6_„(SO3F)„], n = 0-3
M2[SbvF6][(SbinF2)(SbvF6)2]
Sb2F4Cl5 8)
[SbCl4], кор. р.
т. пл. т. к. Sb —Г
(SbF5)„, масло, бц., 8.3 149 1.82 2.02
вязкое, сл. гигр. SbF3Cl2 — — конц. мост.
SbF2Cl3 — — — —
SbFCU — — экв. акс.
SbCl5, ж., бц. 3 102/вак. 2.29 2.34
SbBr5 (?) — — 2.31 2.43
BiOF; Bi7O9F3; Bi3O4F; Bi|3O|9F
BiOCl; Bi4O5Cl2; Bi3O4CI; Bij2Oi7Cl2; Bi^O^Cljo
BiOBr; Bii2Oi5Br9; Bi3O4Br; Bi|2O|7Br2; Bi2403iBrjo
BiOI; Bi5O7I, в стр. - колонки [Bii0Oi4]2” + , к. ч. Bi 7, 8 и 9, Bi—О 2.09-2.86.
В стр. др. оксогалогенидов - слои ГВЮВ1Г...(у ВЮГ) или [Bi12O15]6+ из ^-окт., Bi—О 2.0-2.7, Bi—Г 3.05-3.20(С1), 3.19 (Вг), 3.37(1), Bi—Bi 3.73 29)
BiSr, BiSer, Г = C1-I, к. ч. Bi 8, Bi—S 2.8-3.3,
Bi —Cl 2.7-3.5
M2SbCl6,
М = Rb, Cs, крист., черн., диамагн.;
+ Н2О — M3[SbCl6] + + M[SbCl6]
M2SbBr6,
крист., черн., диамагн., изостр.
K2PtCl(>, анионы -[Sbinr6] и [Sbvr6]
АН SbF5 = —439, р-ритель S, Se, Те; сильнейший акцептор F ; SbCl5 - сильный хлорагент. В ж. (SbF5)„ (п = 5 — 10) - цепи окт. [SbF4F2/2], в стр. - тетрамеры из окт. z/wc-[SbF4F2/2] П), в г. - циклы [SbF3F2/2]3.
Sbr5 -U :Sbr3 + Г2; + H2O SbOF3 + 2НГ экв. акс. экв. акс.
SbCl5 L, L = NOCI, POCI3, SO2, мол. - окт.
н
MBi3O4Cl2
LiBi2O3Cl
BaBiO2Cl
[SbF4] + [SO3F]-[Sbcurx-, X = SbF6, SO4/2, Г
[SbBr4]+X“
X = Sb(OTeF5)6 44)
SbF(NO3)4
SbF3(NO3)2
M[SbF6|; M[Sb2Fn], M = M1, [NF4], [AsC14], [SbCl4], [O2], [S8]/2, [S16]/2, [SF3], [H2F], [Cl3], [TF2], [TF4], [KrF], Хе/л, [XeF], [XeF3], [XeF5], [XeOF3], [Xe2Fn], анионы - окт. или 2 окт. с общ. вершиной, Sb — F 1.8-1.9 (конц.), 2.0-2.1 (мост.), ZSbFSb 150
M[Sb3F16], М = [PF4], [Вг2], анион - цепь из 3-х окт., в центре [SbF4F2/2]-mpaHc 16)
M2[SbF7|; H3[SbF8], к. ч. Sb 7 и 8; [BrF4] + [Sb7F36]-HSbC16-3H2O, крист., зел., гигр.; [H14O6][SbCl6]2 лН2О M[SbCl6], М = М1, [SC13], [NO], [IC12], [РуН], Sb —Cl «2.32 M[(SbCl5)2X], X = F, CN, N3
H[SbBr6] 3H2O; M[SbBr6], в окт. Sb—Вг 2.56
Cs[SbIJ 14)
I
Bi24Cl28 (« "BiCi") = [Bi9]riBinici5]i-[Biinci8]2-, крист., кор., гигр.,
т. пл. 163; ———* Bi 4- BiCl3;
Bi6Cl7
Bi24Br28, полупроводник
Bil, т. пл. 318 c разл.
Bi712; Bi9I2
Bi10I3, т. пл. 295
1)
H2o
31) т. пл. т. к. АН Bi—Г (г-)
BiF3j_, крист., серые 727 900 -899 —
BiCl3, крист., бел., 234 447 -379 2.48
темнеют на свету
BiBr3, крист., желт. 219 461 -260 2.63
BiI3J,, крист., кор., р. в при- 408 439 -109 —
сутствии I , S2O2 , AsO3 (возг.)
В г. - мол. [:Bir3] - </<-тетраэдры, ZFBiF «100, в ионной стр. BiF3 и BiCl3 (типа YF3), к. ч. Bi 8 + 1, в стр. BiBr3 (а- и [}-) - искаж. окт.; Bil3 изостр. FeCl3, Bi—Г 2.23-2.50(F), 2.50-2.34(Cl), 2.66-3.32 (Вг), 3.07(1)
BiCl3nL, L = NO, NO2, NOCI
MBiF4, в стр. - гр. [BiF9], Bi—F 2.19-2.86
K2BiF5; K3BiF9; KBi2F7; KBi3F|9
MBiCU; M2[BiCl5|; M3BiCI(1: Cs4BiCl7
Rb3Bi2Cl9; Rb7Bi3Cl16; M2Bi2Cl8, анион -
2 </<-окт. с общ. ребрами
M2BiBr5; M3BiBr6; Cs3Bi2Br9
M4[Bi2Brjo] • 4H2O; M7[BiBr9][Bi2Brio],
анионы - окт. или </<-окт., Bi—Г 2.6-2.9(С1), 2.7-3.0(Br)
KBiI4; HBiI4 4H2O; M3[Bi2I9]
Rb5I(I3)[BiI6], в анионах - окт., Bi—12.9-3.2 7)
46
3-
0
3 +
Ag+
ISbCld3’
СГ fl [R4N]C1
[SbCUP [Sb2Cl9]3’
[НП pH <2
Ag+-----
Cl" I H2O
[Sb(H2O)„]3+ (?)
zo; ^2— -z- '
hno3^2h52— —
ВЦ, черн.
[SbO(H2O)5]+ (?)
" антимонил-ион"
Sb2O3 »H2O
[Sb(OH)6]3“ [Sb(OH)4]-
сл. восст.
Bi(OH)3 . бел., сл. восст.
5 +
HNO3; MnO4 —. —
I2; [Ag(NH3)2] + ; OC1
HC1
. [Sb(OH)„Cl6_„r
cr || OH
H[Sb(OH)6H,
К = 10 5, сл. окисл.
[Ag(NH3)2] + ; ОСГ; H2O2 40)
[Sb(OH)6] , окт.
анион, не окисл.
47
ВАНАДИИ
Ионы V в водном растворе см. с. 52
2 + (<Z3)
у»
3d
45 И
э.о.
1.5
У8О; У4О; У2О1±Х 41)
VOi±„, п = 0.25, крист., черн. с мет. блеском, т. пл. 1830, АН = —412, р. в к. проводник (при выс. t - полупроводник), стр. тип NaCl, V—О 2.05, V—V 2.89 5)
V (1200°)
У2О3, крист., черн., т. пл. 1970, АН = —1239, р. в к., "карелианит", стр. тип корунда (А12О3), V—О 2.00
11 (-Н2О)
ГТ г- СО
NH4VO0
V(OH)2i, кор., р. в к.
УО(ОН), "монтрозеит", стр. аналог "диаспора" (А1ООН)
V(OH)3i, крист., кор.-зел., р. в к., сильн. восст.
м!
Феррованадий
30-80% V; 3.5% Si; >2% Al;
1% С; 0.1-0.2% Р и S;
70-10% Fe. В системе Fe-V сущ. тв. р-р вычитания и УГе, (т. пл. 1234).
Ванадиевые стали
(0.2% V) ковки, упруги, обладают значительной прочностью на истирание и сопротивлением на разрыв Сплавы Al-V уст. к коррозии
НУ(СО)6, неустойчив '*
z M[V(CO)6], М = Na, К, NH4, [R4N], крист, желт., уст., диамагн., анион - окт., Ее= 18
| PR3 (йт-УФ)
M[V(CO)4(PR3)2]
ч [R4N][V(CO)5(PR3)1
* М3У(СО)5
Na
Н3РО4
м
Li[VDipy3] 4Thf
K5[V(CN)5(NO)+]
Т?
V, мет., бел., тв., d= 6.1, т. пл. 1920, т. к. 3450, £ov2+/vtb= -1-17;
W+/v™= "°-86;
р. в HF, ц. в. (20°), HNO3, Н28О4-конц. (Z); куб. стр. (тип a-Fe), a = 3.03, V—V 2.68
V(C1O4)2 6Н2О, иглы, красно-фиол.
VSO4 • иН2О, п = 7 (фиол. "купорос", изостр. FeSO4 • 7Н2О), 6, 4, 1,
• M2SO4 • 6Н2О, соли Туттона
Г2
[V(H2O)d(CF3SO3)2, V—О 2.12 3)
о (<+)
V(CO)6, крист., сине-зел., возг. 40-50 вак., разл. 60, окисляется возд., оранж. р-ры в орг. р-рителях оч. неустойчивы; парамагн. (Ее = 17!), мол. - искаж. окт., V—С 2.01, С—О 1.14 35)
[V(Thf)4]2 + [V(CO)d2,
мол. - цепь из 3-х окт. 35)
V(:CO)5(ND), уст.: >V(CO)6, (Ее =18) (R3P)Au-V(CO)6
[V(CO)5(PR3)], крист., зел., т. пл. 104 35)
У[(— СН2—PR2)2]3
[VDipy3], окт. мол.
|V(C6H4I2 - 1.4)21, мол. - сэндвич
У(СбН6)2, дибензолванадий
K5[V(CN)5], крист., роз.
VN, V3N Li7VN4 VP, VP2, V3P2, V2P, V3P металлоподобные фазы внедре vc2, + H2O^C2H4 + C2H2+-- VC, т. пл. 2830, стр. тип NaCl V2C, гексаг. пл. упак. V3Si ния в стр. V УВ2, У3В4
Ж—
3)
АЯ
HF
[VDipy3] + X-, катион - окт.
(недо-^ статок)
УГ2, крист., св.-зел., стр. тип CaF2; 4Н2О, сине-фиол.
УС12, крист., св.-зел., т. пл. 1350, возг. 1000, стр. тип Cdl2; -4Н2О
УВг2, крист., кор., стр.
тип Cdl2; • 6Н2О
У12, а-крист., черн., возг. 800, Р-, красн., стр. тип Cdl2;
>1400° .
V т I2, Дэфф J
-451
-348
-264
УГ2 hNH3; УГ2 hL, L = Thf, С6Н5ОН, [V(M-Cl)3Thf6]+X 45)
v3s
У(С5Н5)(СО)4, крист., желт., т. пл. 138, диамагн. — С—
VSi+Д, п = 0.17-0.53, порошок, черн., р. в H2SO4 (Z), M2S, стр. тип NiAs V3S4 и У588, искаж. стр. NiAs, V—V х 2.9; V2S3 43)
У(С5Н5)2, ванадицен, крист., фиол., т. пл. 173, . . р. в эф. и С„Нт, окисляется возд., парамагн. (3 неспаренных эл.), стр. аналог ферроцена, V—С 2.28, С—С 1.43 36)
2.8 + Мпу10о15, в стр. -сетка окт. yll уIII 39)
MVF3, М = Na-Rb MVC13, M = К(т. пл. 946), NH4, Т1
К2УСЦ
Cs2VC14 2Н2О
МУВг3, роз-кор.
КУВг3 6Н2О, фиол. 4)
t (-Г2); Н2 (z)
K4[V(CN)6] ЗН2О, желт., анион - окт.
V—С 2.16, С—N 1.15, дэфф = 3.83 K4[V(CN)6(NO)], диамагн. M4[V(NCS)6] иН2О, дэфф = 3.8 40)
^nh4f
V(OH)(SO4) 2)
V2(SO4)3), крист., оранж. (монокл.), зел. (гексаг.), > SO2 + VOSO4 2)
• иН2О, п = 2, 4, 10
M2SO4 24Н2О, М = NH4, Rb, Cs, Tl, фиол. квасцы, уст. на возд.
У(Н2РО3)3), желто-зел. 26)
УРО4, кор.
[У(РО3)3]„, п = 4, со; желто-зел., в стр. - цепи окт. [VO6] и тетраэдров [РО4], Р—О 1.98 V4(P2O7)3, в стр. - пары окт. [V2O9], V—О 1.8-2.2
У(СН3СОО)3
[У3О(СН2С1СОО)6(Н2О)3]+Х- ЗН2О,
стр.аналог ацетата Сг (III) 2)
VOF
VOC1, порошок., кор.
УОВг, крист., фиол., разл. 480
VOI, уст. <УОВг<УОС1 37)
УГ3, крист., зел., возг. 800, изостр.
FeCl3 18)
УС13, крист., фиол., нелетучи, -Ж VC12 + VC14, изостр. FeCl3
VBr3, черно-зел.,
VBr2 + Вг2, изостр. FeCl3
VI3, черн., ^Ж- VI2 +12, изостр.
Bil3; Дэфф = 2.92
Все УГ3 сл. гигр., мало р. в Н2О,
в стр. VC13 • 6Н2О - катион [VC12(H2O)4] транс-[УС13(8Ме2)2], мол. - триг. бипир.
АН -1335 ЗН2О
-782 6Н2О
-452
-280
лучше - си.;
[V(NH2)(NH3)5]r2 (раньше "VF3-6NH3"), красн.
V(NH2)C12 V(NH)C1 -U vn
VCl2(OMe), крист., зел.
VCl(OMe)2 6)
V(OR)3, крист., зел., гигр., не р. в си., нелетучи
[V(C5H5)2]+X , соли ванадициния, красн.
230°
H[V(SO4)2] иН2О, п = 4, 6, крист., зел. 8)
M[V(SO4)2], крист., зел., • 6Н2О, фиол., в стр. - окт. [VO6], V—О ~ 1.98 26)
Na3V(SO4)3
Cs[VHP3O10], Rb[V(HPO4)2]
Cs[V2P5O16], в стр. - цепи тетраэдров
[РО4], связанных с окт. [VO6],
V—О 1.91-2.06
M3[V(C2O4)3], анион - окт.
26)
25)
К3УГ6, т. пл. 1020, V—F 1.93 (NH4)3VF6), т. пл. 1400, желто-зел. М2[УГ5(Н2О)1, крист., зел.
М[УГ4(Н2О)2]
М[УСЦ], анион - тетраэдр, • иН2О,
М = K-Cs, п = 0(фиол.), 1 (красн.), 4(зел.) Cs2[VCl2(H2O)4]Cl3 -транс, Cs3[VCl2(H2O)4]Cl4, V—О 1.97, V—C1 2.37
М2УС15, М3УС16, М3[У2С19], анионы - триг. бипир., окт., пары окт. с общ. гранью, V—С1 2.17-2.44
M[VBr4], Cs2[VBr2(H2O)4]Br3 -транс
t (-Cl2)
K3[V(CN)6] ЗН2О, крист., красн.
K4[V(CN)7] • 2Н2О, фиол., анион -пентаг. бипир., V—С 2.15
M3[V(NCS)6], М = Na ( • 12Н2О), К 10)
Li[VS2] П)
^50° ’
'5
48
4 + (/)
5+ (</")
<соо®+-
(3.5-3.75) +
V«O2„_!
V3O5, стр.
аналог Ti3O5 42*
УО2, крист., гигр., т. пл. 1545, т. к. ~ 2700, АН = —720, р. в к. и гц., искаж. стр. тип рутила (ТЮ2), "парамонтрозит"; • 2/3Н2О, "долоресит" 34)
4.33 +
V6Oi3, крист., сине-черн., разл. 650, в стр. окт., V — О 1.6-2.3 34) V4O9; V3O7 = VIV[V2O7]
.O'?
VO(OH)2], желт., р. в к. и щ., "дуттонит" 12)
4.66+ 4.8 +
V3O7 Н2О; У2О4 8 иН2О, и = 0.5, 3.5, черн., "корвусит" 30)
О'1'/
3.5 +
У2О2(ОН)3, "хеггит"
Соли ванадила (IV), О = УХ2 31) УО(С1О4)2 5Н2О VOSO4], крист., зел., • иН2О, п= 1-3, 5 ( = [VO(H2O)5]SO4(H2O)), 6 сип., хор., р. в Н2О, си.; • 0.5H2SO4; • hM2SO4, п = 1,2, крист., сип. VOSeO3, св. зел. (УО)3(РО4)2 9Н2О УО(НРО4) иН2О УО(Н2РО4)2, син. (УО)2Р2О7 46) УО(С2О4) иН2О, п = 2, 4 VO(RCOO)2 39) В стр. солей — окт. ион [УОХ5], У = О 1.58-1.67, V—О 2.0-2.2 МОН-
нх
Ванадаты (IV) ("ванадиты"), крист., желт, или кор.
Na(VO)2(OH)5; K2V3O7 2.66 Н2О
M4VO4 (орто-)
M3VO5; mVvO4; \l'VO3 (мета ) М2У2О5, (пиро-), из распл.
M2V4O9 • 7Н2О (тетра-, "гипована-даты"), крист., образ, из р-ров CaV4O9 • 5Н2О, "симплотит" H8[Mo3V3019]; M3[Mo2V4019H7], сии.
Ва[УО(РО4)]2 4Н2О 48)
К2[УО(Р2О7)], анион - тетраг. пирамида
Sr[VO(AsO4)]2, в стр. - цепи окт.,
У = О 1.63, V—О ~2.0;
Na14[V18O42(CO3)] 28Н2О 48)
(NH4)2[VO(C2O4)2] • 2Н2О, крист., гол.
44)
N У2О5, крист., оранж., т. пл. 680, разл. 700, АН = —1573, р. в Н2О « 0.04%, . р. вк. и щ., летучи с паром Н2О (^ Н4У2О7 г.), У2О5(ж.) VOl + VO3 ' (проводник), в стр. - двойные цепи тетраг. пирамид [VO5], V = О 1.58,
V-O 1.78-2.0 (4 связи); иН2О, п = 1 ("HVO3", "навахоит"), 2 ("H4V2O7"), 3 ("Н3УО4") - волокнистые крист. 28)
VOF2, крист., желт.
VOC12 крист., зел., возг., разл. 300; • 2.5Н2О
VOBr2, крист., желт., разл. 180
VOI2 • 2.5 Н2О, крист., кор.
УОГ2, гигр., хор. р. в Н2О, си.
VO(NH2)2, черн., -UvO(NH) -U (VO)3N2 VON
VO(OR)2, кор. порошки 13)
M3[VOF5]; Cs3[V2O2F7]; Cs[VOF3] 1/2H2O M2[VOF4|; K2[VOF4(H2O)], сип.
М2[УОСЦ]; Cs3[VOCl5],
в анионах - цепи окт., V—О 1.9-2.3, V = O 1.58-1.68, V—F 1.88-2.19
K3[VO(CN)5], анион - окт., V = O 1.64, V—С 2.31 (акс.), 2.14 (экв.)
M2[VO(NCS)4]
15)
АН V—Г
VF4, крист., гигр., желто-кор., -1412 Г 1.69
^(1(1 > VF3 + VF5t, в стр. - слои окт. УСЦ, ж., красн., оч. гигр., т. пл. -694 11.92 2.14
20, т. к. 154, медл. разл. 20 (^ VC13 + С12Т) VBr4, крист., красн. (образ, при охл. г. (550°—> —78°), разл. —23 (—> VBr3 + Вг2) мол. - тетраэдр 46) -393 2.28
M2VF6, анион — окт., V—F 1.61-2.29 16) M2VC16, М = К (кор.), Rb (роз.), Cs (фиол.) М[УС15], М = [РС14], (раньше "VC15", крист., кор., т. пл. 260 17)), [SC13] (крист., черн., т. пл. 32)
ch(200°)
VC1(NH2)3, кор.-зел.
VCI4(XO)
V2C17(NO), V2C18(NO)5, крист., возг.
| ROH
VC12(OR)2 ROH
V(OR)4, крист, или ж., кор., р. в эф., бзл., мол. - тетраэдр 13)
| ROH
V(NR2)4
V(S2)2, "патронит1 (C5H5)2VC12
NaOR
Тиованадаты (IV), р. в Н2О, + Н+ — VS], + S + ... BaVS3, в стр. - линейные цепи тетраэдров [VS4], V—V 2.81, проводник
NH4VO3)
[УюО28]6~
От
[VO2] + X, X = NO3, СЮ С1, крист., красн., сильн. окисл., сущ. при pH < 1 [VO2(RCOO)]4 19)
MOH
MXV2O5, М = Li-Cs, NH4, Си, Ag, 0<х "бронзы", в стр. - ат. V(IV) и (V), к. ч. 5 (тетраг. пирамида), V—О 1.53-1.98 18) М5[У15О36], М8[У19О41(ОН)9], анионы -кластеры, шар и эллипс, У(У) - V(IV) ~ 2.94
MN3(-N2)
N2O4(-NO)
V2O3(SO4)2 2Н2О, в стр. - окт. [VO6] и тетр. [SO4],
V—О 1.56 (конц.), 1.78 (мост.) 47)
o3; C1O3
Ванадаты (V)
М6У10О28 • яН2О, М = №(/? = 18), Са/2(17, "паскоит"), Ва/2 (19) крист., оранж. анион из 10 искаж. окт. [VOg] с общ. ребрами, V—О 1.68, 1.80, 1.90, V—V 3.04-3.32 K3V5O14; |R4X|3HV4Oi2; К5У3О10; МУ3О8 М4У2О7, М = Na (• Н2О), К (• 2Н2О), Ag]
МУО3, М = Na, К(т. пл. 520), Cs, NH4 (разл.30), Ag], Ва/2 (• Н2О), в стр. - конденсированные тетраэдры, триг. бипир., тетраг. пирамиды или окт., V — О 1.62-1.97
М3[УО4]„, М = Na(T. пл. 866), К( • 2Н2О), Ag], Sr, Ba, Al( • ЗН2О, "штейгерит"), Sc, Ln, Bi, Fe(III) ("ферванит"), Cu(II) ( • 3 H2O, "фольбортит");
в стр. - изолированные тетраэдры, V — О 1.75 [изостр. М3(РС>4)„]
РЬ5[УО4]3С1, "ванадинит", желто-красн., изостр. апатитам
K(UO2)[VO4] • 1.5 Н2О, "карнотит"
M„[VW12O40]; K4V2W8O3J; Mn|IA x\\ l2_ vO4(J: M^V^l; М6[Н3РУ14О42|, (NH4)5H3Mn3V12O40 15Н2О 29)
о
о
C2oi (-co2)
C1O3
УОХ3, желт. гигр. в-ва т. пл. т. к. АН
УО(С1О4)3, ж. 22 33.5 —
VO(NO3)3, ж. 2 68 —
УО(РО4) • 2Н2О, крист.*-* — — 21)
VO(SO3F)3 крист., красн. 120 разл. 190 —
VOF3, крист. 300 480 возг. >110 -1251
УОС13, ж., d = 1.829 УОВг3, ж. VOC12(N3), -77 128 130/вак. разл. 180 -740
-U VON + N2 + Cl2 — — —
VOr2(OR), ж. — — —
VOF(OR)2, ж. — — —
VO(OR)3, крист. (R = Me) или ж. (R = Е1-С5Нц). д = 1.1-1.2 * уст., р. в Н2О « 1% (фиол. р-р)
В стр. VOF3 - сетка окт. [VOFF4/2], V = O 1.57,
V—F 1.70 (конц.), 1.8-2.3 (мост.); УОГ3 (Г = в стр. и г. — тетраэдические мол., V = O 1.56, V—Cl 2.12, ZC1VC1 111 С1-Вг) 20)
VN) Q
21)
M[VO2(SO4)]
М3[УО2(С2О4)2]-цис, окт., V = O 1.63 и 1.64,
V—О 2.00 (цис- к О) и 2.23 (транс-)
M3[VO2F4], в стр. - линейные гр. [O = V = O]
M2[VO2F3], Cs3[(VO2)2F5]
M[VO2C12], M = K-Cs, V = O 1.56 и 1.60, V—Cl 2.23 22)
(NH4)4[V2O3(SO4)4] 22)
K[VO(SO4)2], в окт. [VO(>] V = O 1.52 (конц.), 1.82 (мост.) 47)
z
ЗС)
2°s уУгОз.
о
ЧО [УО3]+Х , соли пер-оксованади-ла(У), крист., красно-кор.
H
M[VOF4], крист., желто-зел., в стр. - цепь окт. [VF5OaKC], V сдвинут к О на 0.31 от экв. плоскости, У = О 1.57, V—F 1.79 (экв.), 2.33 (акс.) 23)
M2[VOF5]; Cs3(VO)2F9 [PyH][VOCl4]; M2[VOC15], М = K-Cs, NH4, зел. 32)
(OH )
V2O(SO4)4, желт., неуст.
VF5, крист., бц., оч. гигр., т. пл. 19, т. к. 48, АЯ= 1473, ж. VF]- + VFg; стр. аналог CrF5; в г. - мол., триг. бипир., V—F 1.71 (экв.), 1.73 (акс.); + Н2О У2О5] + HF (бурно); [VF4] + [SbF6] 38)
C13V = NC1, т. пл. 132, возг., в г. — мономеры 14) (V = N 1.65, N—Cl 1.60, V—Cl 2.14, ZC1VC1 ИЗ, ZVNC1 170), в стр. - димеры с 2 С1(мост.)
C13V = NF, Г = Br, I, мол. - триг. пирамида (NF - акс.)
V2S5], порошок, кор., р. в щ., M2S, разб. HNO3, легко окисляется возд.,
—V(S2)2 + V2S3 + ...
M2s
60° (N2)
M[VO2(O2)] 0.5 Н2О М2[У2О2(О2)4(Н2О)1 (NH4)4[V2Onl, желт., анион—
О—О о
° о—о
14-
К3[УО2(О2)2(Н2О)Ц, желт. К3[УО(О2)3]; К2[У(ОН)(О2)3]
М3[У(О2)4] п Н2О .
М = К (сине-фиол.), NH4(6p.) M„[VOm(O2)/,L7_m_2/)],
М = К, NH4; L = NH3, Dipy, С2О4, F, СО3, анион - пентаг. пирамида, ат. V сдвинут к О над экв. плоскостью, У = Оакс 1.61, V—ОО 1.9, 0—0 1.43-1.50 27)
M[VF6], M = NH4, К (разл. 330), Ag, [NO], [NO2], [Хе2Рц], крист., бц.
H2O
Ag[VF4(OH)2] -транс
M2[V(CN)7], k. 4. V = 7
M[VO2S] H2O; Na[VOS2] 2H2O
33)
(NH4)3[VS4], тиованадат, крист., фиол. (p-p
вишнево-красн.), анион - тетраэдр, V—S 2.15
( N H4VO3)
49
НИОБИИ,ТАНТАЛ, ПРОТАКТИНИИ
Nb; Н2 (Z)
з+ (<z2)
Ионы Nb, Та и Ра в водном растворе см. с. 52
Э.О.
1.2
1.3
1.1
K2NbOF5 + Nb2O5;
K2TaF7 + Та2О5
л
(мс15
ж
Na3[Ta(CO)5] M[Ta(CO)5(NH3)|
M^CCOJJ, М = Nb, Та, М1 = Na-Cs, [Ph3Sn]
Н3М(С5Н5)2 TaH(CO)2[(R2P—СН2 - )2]2, к. ч. Та 7 (одношапочный окт. с ат. Н над центром грани), Та—Р 2.51, Та —С 1.87 и 2.15 12)
<2/ ОУ
А/
NbO„, п = 0.94-1.04, крист., серые, с мет. блеском и проводимостью, т. пл. 1945, АЯ=-406, стр. тип NaCl, окт. кластер [Nb6], Nb—Nb 2.80 и 3.20 РаО, пленка на поверхности мет., стр. тип NaCl, Ра—О 2.48
Nb21S8; NbSj_x; Ta6S; Ta2S; Nb3S4, фазы с мет. проводимостью и связями М — М M1+xS3; MS2; M2Se3; MSe2; MTe2 3), порошки, черн., не р. в к. и щ.; стр. - типа CdCl2 или Cdl2 BaTaS3, полупроводник, Та—Та 2.87 NbN, т. пл. 2300; Nb2N, т. пл. 2420; Nb3N4; NbjNs; NbsN6; Nb4N5; TaN, т. пл. 3090; Ta2N; Ta3N5; PaN2, металлоподобные фазы, кислотоупорны, оч. тв. и термостойки; + O2(Z) М2О5 3) МР, МР2, темно-сер., р. в конц. H2SO4, HNO3 МС, крист., серые, с мет. блеском, возг. > 3000, т. пл. 3500 (Nb), 3900 (Та), стр. тип NaCl, окисляются > 800°
NbHj_x, х = 0-0.3; ТаН09, тв. р-ры внедрения, металлоподобные в-ва, не р. в ц. в., разл. >600°, стр. тип сфалерита Тв. р-ры предельного состава РаН3, крист., черн., куб., стр. тип UH3
Nb ТЗ Ра
мет., серые, тв , ковкие мет., блестящий, ковкий,
и тягучие, парамагн. тускнеет на возд.
d 8.6 16.6 15.4
т. пл. 2468 ЗОЮ «1570
т. к. 4927 5425 4500
р. в (HF + HNO3) р. в к., Еора5 + /ратв= -1.0,
и распл. щ. стр. - тетраг. объемно-
не р. в к.-окисл. и ц. в., центрированная (отличная
куб. (тип. a-Fe) от др. М)
а = 3.29 3.29 а = 3.92, с = 3.24, Ра—Ра
М —М 2.92 2.92 3.12(8 ат.) и 3.24(2 ат.) ("куб. Ра" - оксонитрид) 2)
"Феррониобий", 23-75% Nb и Та; 10-11.5% Si; 7% Ti; 7% Al; 0.15% Р; <0.5% S; 0.12% С; остальное - Fe, в системах Nb-Fe и Ta-Fe сущ. тв. р-ры вычитания, Nb2Fe3 (т. пл. 1660) и TaFe3
0(</5)
NbDipy3, крист., фиол.
Образование Ра при радиоактивном распаде 235т т 92 U
__. «тъ
.-► 90
238тт 92 U
92U ---> • ••
___. 231р ___ 227 д______, ___91”» а_______> 89АС _____> • ••
3.28-104 лет
— <»4Т11 д_ ----------> 934Ра’
234
Синтез Pa:
1.18 мин
и 6.75 ч (2 изомера)
2.5+ 32)
Nb4O5, в стр. -квадраты [NbO4]
NaNb10O18 32)
о2 (Z)-------------
NbO2, крист., сине-черн., т. пл. 2080, АЯ = —808, окисл. возд., диамагн., полупроводник, р. в конц. щ. (Z), , искаж. стр. рутила, кластер
(500°)
Та(ОН)31, зел.;
+ н2о Н2т
MNbO2, M = Li, Na, крист., сине-черн., стр. аналог MoS2, Nb —0 2.12 18)
3.5 +
NaNb10O18, в стр. -кластеры [Nb6Oi2] и окт. [NbvO«]
ОН
HC1 (800°)
NbBr2
Nbl2, черн.
2.33 +
М6г14 = 4)
= [МбГ1оГ2/2]Гз, М = Nb, Та, Г = C1-I, крист., темно-кор., уст. на возд.;
-U м + мг4, [М6Г12]Х2 8Н2О, X = Г (крист., зел.), ОН (черн.), уст. на возд., диамагн.
2.5 +
Nb2F5 = = [Nb6F12]F3, стр. тип ReO3 ([Nb6F12]3+ = = Re, F = О) Та2Г51,Г = Cl, Вг, крист., черн.
[Nb6Cl12f +, окт. кластер [Nb6] окружен кубооктаэдром из 12 ат. Cl, М—М 2.85 (Nb), 2.88 (Та), М —С1 2.41 (Nb), 2.44 (Та)
2.67 +
Nb3Cl8, крист., чер-но-зел., не р. в к., АЯ = -582
ХЬ3Вг8. крист., черн., разл. Н2О, возг. вак. 400, в стр. -кластер, тр-к [Nb3], Nb—Nb 2.81, образ, тв. р-ры с Nbr4 вплоть до состава
Nbr3.13 Nb3I8 ТаВг283 4)
NbF3l, 5) крист., сине-черн., р в HF и распл. щ., стр. тип ReO3
NbF3 j3 Nb2Cl6 иЁ, L = Me2S, PR3, Nb—Nb 2.70 Nbl3, крист., черн.
TaF3l, стр. тип ReO3
ТаС13±х, крист., зел., р. в Н2О, сильн. восст., А Я = - 5 4 4 , >440 ^
ТаС15
ТаВг3±х, серо-зел.
Та!3
+ Ta6Clj4 крист, 4)
[Ta6Cl12(OH)4(H2O)9] 10H2O
(У
(2.33-2.67) +
K„[(Nb6r12)F6], n = 2, 3, 4, Nb—Nb 2.97-3.02
М[(Та6С112)(Н2О)6]Г4 4)
(Me4N)2[Ta6Cl12(OH)6| 21H2O 5)
Nb(C5H5)2, сущ. в р-ре мономер, парамагн. (<73) '*
Nb(C5H5)2Cl, крист., диамагн.
K5[Nb(CN)8], анион - додекаэдр
3.7 +
K4[H5O2][Nb3O2(SO4)6(H2O)31 5Н2О,
кластер [Nb3] - тр-к, Nb—О ~2.13,
Nb—Nb 2.88 29)
3.3 +
NaNb3O5F 29)
Nb
/ Nb2O5 + NbCl5
NbOCl2, изостр. МоОС12
NbOI2, крист., черн., разл. 500, диамагн., в стр. - цепи окт., Nb—Nb 3.16, Nb—О 1.8-2.1, Nb—I ~2.8 29)
NbF4, крист., черн., + H2O NbO2F; 552° NbF5 + Nb2F5; искаж. стр. перовскита, Nb —F 1.85, 2.09
NbCU, иглы, черно-фиол., гигр., АЯ = —694;
NbCl3 + NbCl5;
+ Н2О —> син. р-р (восст.) NbBr4, крист., кор.
Nbl4, крист., серые
В стр. Nbr4 - цепи искаж. окт., крист, диамагн.
т. возг.
275
MnNbF6, цэфф= 1.15
K3NbF7, т. пл. 840, изостр. K3NbOF6, анион - пентаг. бипир. M2NbCl6, М = Na-Cs, неустойчивы 16)
Z (—Nbl5)
502
264
МГ4, диамагн., в стр. -кластеры [М2]
М2ТаС15,
М = K-Cs, красн.
[R4N]2[Nb(OR)Cl5],
крист., роз. или оранж.
[МГ4Ру2], Г = C1-I, крист., зел. или красн. (2 формы), парамагн. Nb2Cl4(OMe)4 • L2, L = МеОН, MeCN 25) Nb2Cl5(OEt)3(Dipy)2, крист., зел.
М(С5Н5)4, крист., син. (Nb), фиол. (Та); в мол. - 2 С5Н5-гр. образ, сэндвич, а 2 др-о-связи с М
M4[Nb(CN)8] иН2О,
М = Na-Cs, крист., оранж., уст., парамагн. (1 неспаренный эл.), изостр. K4[Mo(CN)8]
• 2 Н2О, анион - додекаэдр, в р-ре - антипризма, Nb —С 2.22 6’225
50
4 + (</’)
5 + (</")
Н2
02
ТаО2(?), крист., черно-кор.
РаО2±„, крист., сии., р. только в HF, стр. тип CaF2, АЯ= —1029
крист., красн., тетраг.
TaOCl2 TaOBr2
TaOI2, черн., крист., графитоподобны 30)
Nbj2O29
Nb22O54 Nb25Oe2, стаб. фазы
(4-5) + MxNbO3, "бронзы", М = Na-Ba
ВахТаО3
(NbCl5X^2
^Сф^^
4t%o-
РаОГ2, Г = C1-I, в стр. к. ч. Ра 7-9 31)
(ТаП
(Nb2O5)-------------
4---CBr4; Nb + I2
О
4)
ТаС14, крист., черно-зел., гигр., 300° 210°
возг. 300,
ТаС13 + ТаС15;
АЯ = -707;
320°
+ NbCl5 ТаС15 + NbCl4
ТаВг4, АЯ= -52.5
Та14, крист., черн., т. пл. 398, изостр. Nbl4 ТаС1212, в стр. - цепи окт. [Та14/2С12], Та —Та 3.15 и 4.34
РаГ4], крист., кор., т. пл. 1030, т. к. 1630, возг., не р. в (HNO3 + HF), стр. тип ZrF4, АЯ = —1996 РаСЦ, крист., желто-зел., возг. >400, т. пл. 680, т. к. 850, стр. тип UC14, АЯ=—1045 22) РаВг4, АЯ=-863 22)
M2TaCU, фиол.
РаО2
Nb2O5 „ 26) Та2О5 7) Ра2О5
n<0.54 крист., бц., диамагн., р. в конц HF
не восст. M АЯ= -1903 не восст. Н2 -2055 -2092
а-, ромб., к. ч. j. 830° Та 7 (пентаг. бипир.) | 1320°
/Тмонокл., т. пл. 1490, /Тмонокл., т. пл. 1872, куб,
в стр. - окт. и тетра- в стр. - слои окт. и т. пл.
эдры, Nb — О 1.98 и 1.83 пентаг. бипир., 1800
Та —О 1.71-2.38
-н2о '500°
Nb2O5 лН2О] бел., студенистые, р. в кони XK1 = 10~8nXOCH1 = 10~15 HNb3O8, изостр. Nb3O7F HNbO3 = [H3O]Nb3O8 Ta2O5 иН2О] . HF и щ. 10 10 и 10 13 НТа3О8 НТаО3 9) Ра(ОН)5], не pear, со щ., М2СО3
NbO2(ClO4) NbO(ClO4)3
Nb2O4(SO4); Nb2O3(SO4)2; Nb2O(SO4)4
NbO(NO3)3
NbO(PO4) = NbPO5, в стр. - блоки из
2 окт. [NbO(>] и тетраэдров [РОД Nb —О 1.86-2.04
Nb(ClO4)5; Nb3(PO4)5
Nb5OnCl3 4)
25)
Nb3O7Cl, крист., СИН.
NbO2r, Г = F-I (С1 - желт., I - красн.)
М2СО3
+ HNO3 (ионный обмен)
Rb[NbO(SO4)2], в стр. - слои окт. [О = Nb(SO4)5], Nb = O 1.73, Nb —О 1.96-2.26
M[Nb2(OH)2(PO4)3] иН2О M3[NbO(C2O4)3J; Cs[NbO(P2O7)] 17)
Cs[Nb(ClO4)6]
| CaNaNb2O6F, "пирохлор' K5(NbO3)4F; NaNbO2F2 ti-OF u Nb
F .
F
F
F
О
24)
F
NbOF3 350О
NbOCl3, крист., бц., возг. 335; -> NbCl5 + Nb2O5;
в стр. - цепи сдвоенных окт. [NbCl2Cl2/2O2/2] с общ.
ребром [Cl2], Nb—О 1.99, Nb—Cl 2.5з(мост.), 2.24 (конц.), ZONbO 170, Z CINbCl (конц.) 102
NbOBr3, крист., желт., возг., изостр. NbOCl3, разл. 320
NbOI3, крист., рубиново-красн., 150° —> NbOI2 + 12
NbO(NCS)3
М]_Н2
т. пл. т. к. АЯ
NbF5, крист., бц., склонны к переохлаж NbCUF, желт. 80 дению 235 -1812
NbCl5, бц., крист., 183° > желт. 205 254 -797
NbBr5, красн. Nbl5, бронзового цв. 268 362 -556
320 с разл. — -426
[NbF4] + [SbF6|-', крист., возг. 40, в стр. -зигзагообразные цепи окт. [NbF2/2F4] и изолированные окт. [SbF6] 8)
[R4N]6[Nb10O28] • иН2О, изостр. [V|0O28]6 , Nb —Nb 3.27-3.48
Rb4Taio027; K3Nb7Oi9
Ниобаты, танталаты (V) 13)
Na14Nb12O37; [R4N]8H4Nb12O36 • 28Н2О, р. в Н2О (рН«5!)
M8[M6O19] • иН2О, M = К (n = 12-16), Li], Na], в р-ре оч.
сильно гидрол., не олигомеризуются; анион - кластер, окт. [М6]
окружен большим окт. [О6] с 1 ат. О в центре и 12 ат. в серединах ребер
ВЬ4МбО17; К7[М5О16] • яН2О, п = 10 — 32; Cs3TasOi4; KTa3Oi3
СаТа4Оц; КМ3О8; NaNb3O8 • Н2О; Са2Та2О7
Sn(Nb,Ta)2O7, "торолит", (Y,Lf)(Nb,Ti)2Oe, "эвксенит"
КМО3 (мета-), стр. тип перовскита, сегнетоэлектрики
(ЕпМпп)[МО3]2, "колумбит" (М = Nb), "танталит" (М = Та)
(Na,Ce,Ca,Sr)[(Nb,Ti)O3], "лопарит" [Ta:Nb = 1: (12-20)]
CaNa(MO3)2F, М = Nb ("пирохлор"), Та ("микролит")
К3МО4 (орто-)
МшТаО4, Мш = Y ("форманит"), Sb ("стибиотанталит"),
Bi ("бисмутотанталит"), А1 ("симпсонит"); К5МО5; Li7NbO6
В стр. ниобатов и танталатов - конденсированные тетраг. пирамиды, окт., додекаэдры или пентаг. бипир., Nb — О 1.73-2.55, Та — О 1.84-2.49 K6[Nb6Si4O26]; K8[Nb14Si4O47]; K11[SbNb12O38] 14Н2О 14)
ТаО(С1О4)3; TaO(NO3)3; ТаО(РО4) Та(С1О4)5; Ta2(SO4)5; Ta(SO3F)5
Та(ТеОГ5)5; Ia3(PO4)5 20)
CsTaO(ClO4)4 20)
Cs2Ta(ClO4)7; CsTa(ClO4)6
CsTa(PO4)2; KTa(PO3)2(P2O7)
H[PaO2(SO4)|
H[PaO(SO4)2]
| 400°
H3[PaO(SO4)3]
H3[PaO(SeO4)3]
Н[МО4] иН2О, монопероксо-ниобиевая и -танталовая к., крист., желт. (Nb) или бц. (Та), разл. > 100;
+ H2SO4 Ж --> М2О5 ' Н2О j,
H2SO4 (разб.)
K3[MV(O2)4] • иН2О, П) крист., желт. (Nb) или бц. (Та);
[Nb(O2)4]3 - искаж. додекаэдр (Nb выведен из экв. плоскости)
M3[NbOF6]
M2[NbOF5] иН2О, М = К (р. в Н2О в 11 раз >K3TaF7, метод разделения Nb и Та по Мариньяку), анион -искаж. окт.
M[NbOF4], в стр. - цепи окт. лща//с-[ N ЬО2/2F4], Nb —О 1.81, 2.14, Nb — F 1.89, ат. Nb смещен из экв. плоскости на 0.23 M2[NbOCl5|; MfNbOCU], анион - тетраг. пирамида, Nb = O 1.70, Nb —Cl 2.36
Та3О7Г, Г = F, С1 20’30)
ТаО2Х, X = F-I, С1О4
TaOF3, АЯ= —1297 ТаОС13, аморфн. в-во, бел., оч. гигр., \Н = —891,
Та2О5 + ТаС15 ТаОВг3, крист., желт., АЯ= —853
ТаО13, АЯ = -723 | Га2О(ОРг-/)8 /-РгОН|2 33)
К2Та4О9Г4 23)
К3Та4О8Г7
КТаО2Г2
(»2К2ТаГ7 Та2О5), соль Мариньяка
М2ТаОГ5 К3[ТаОГ6], анион - одношапочный окт. (d5sp)
PaO(NO3)3 иН2О, п = 1 -4
РаОС13, крист., бц.
РаОВг3 к. ч. Ра 7 (пентаг.
бипир.), Ра — Вг 2.91 (экв.), 2.6(акс.), Ра—О 2.14-2.27 21)
Ра2ОГ8 = (F4Pa)2O, крист., бц., изостр.
U2F9, к. ч. Ра 9
| L + Н2О М^М^Ог)^-,»-^, М = K-Cs, [R4N], L = F, Cl, H2O, OH, C2O4, Phen, Dipy, Ph3AsO, к. 4. Nb и Ta 7 (пентаг. бипир.) (NH4)3[M(O2)2F4], анион - окт., [O2] - конц., M —О 1.94 (Nb), 2.07 (Та)
HF I Т Н2О
MPa(NO3)6, M = M1, H, крист., бц., неуст.
MNbF6, M = H, K-Cs, [BrF2], [O2] [SeF3] + [Nb2F11] , анион-2 окт. с общ. вершиной, Nb — F 1.8-2.0 M2NbF7], анион - одношапочная триг. призма (d5sp), Nb —F 1.8
K3NbF8; MNbCl6 4)
т. пл. т. к. АЯ
ТаГ5, бц. 97 230 -1903
ТаСЦГ 214 — —
ТаС15, бц. 217 239 -858
ТаВг5, желт. 266 349 -598
Та15, черн. 496 543 -489
возг.
[M(NCS)5]2, красно-кор.
M(OR)„r5_„
[M(OR)5]2, крист., бц., гигр. (R = Me) или ж. (R = Et), р.
в орг. р-рителях, легко летучи (возможно разделение Nb и Та) 33)
K[M(NCS)6], крист., темно-син. (Nb), оранж. (Та)
t NbO(NH2)3
NbON, стр. тип ZrO2 ("бадделеита"), семивершинники [NbO3N4], Nb—О 2.07, Nb—N 2.12 28)
MTaF6, М = К, 9) [О2], [XeF5], [Xe2Fn], Н( • /?Н2О) М2[ТаГ7|], М = Н, K-Cs К3[ТаГ8], т. пл. 780, анион - антипризма МТаСЦ,
М = Na-Cs, анион -окт., Та — С1 2.65
K|M(OR)6| 33’34) [BaNbO(OEt)5(EtOH)15]4
Li7MN4
т. пл. г. возг. АЯ 15)
РаГ5, бц. •2Н2О], р. в HF — 500 -2190
РаС15, желто-зел. 301 160 -1143
РаВг5, оранж. 317 — -863
Ра15, черн. 300 с разл. —
КРаГ6, к. ч. Ра 8 10) К2РаГ7], не р. в 5% HF, в стр. -цепи из гр. [PaF9], Ра — F 2.16 (конц.), 2.38 (мост.) М3РаГ8, анион - куб M4[PaF9], к. ч. Ра 9 МРаС16, желт.
М3РаС18, М = [NO], [R4N]
МГ5, крист., летучие, гигр., р. в эф., РОС13, ж. NH3; + Н2О —> М2О5 • хН2О (коллоидный р-р) 19); MF5 - стр. аналоги (MoF5)4; в стр. др. МГ5 - димеры (2 окт. с общ. ребром), Nb — Cl 2.30 (конц.), 2.55 (мост.), Nb—Nb 3.95, ZCINbCl 101, Nb — Br 2.4 (конц.), 2.7 (мост.); M — I 2.6-2.9; в г. - (MF5)3 - плоский цикл из окт., Nb — F 1.83 (конц.) 2.05 (мост.), МГ5 - триг. бипир. (d3sp),
Nb —Г 1.88(F), 2.34(акс.), 2.24(экв.) (С1); 2.46 (Вг); Та —Г 1.86(F), 2.37(акс.), 2.23 (экв.) (С1); 2.45 (Вг); в стр. РаС15 - цепи пентаг. бипир., РаВг5 - изостр. UC15. МГ5 L, L = NH3, Et2O, РОС13, NOCI, NO
51
Ра
2 +
3 +
4 +
5 +
[VC12(H2O)4] + , зел.
//л
[VF4(OH)2] (?)
|У(Н2О)6|2 + , фиол., парамагн.
(й?3, 3 неспаренных эл.), окт.
(d2sp3) ион (эл. аналог [Сг(Н2О)б]3 + ), сильнейший восст.
H2O (-H2)
[НТ]; кат. восст.
- [У(Н2О)6]3+, сине-зел.,
,т парамагн. (d2) OKT.(d2sp3) ион, оч. сильн. восст.
нсю4 II н2о
н+ I ОН
V(OH)2T, кор.
О2
O2
[НТ]; Sn'
— •> [О = У(Н2О)5]2 + , "ванадил-ион", сип., парамагн. (dv),
1 искаж. окт. (V = О + V—ОН2), наиболее уст. среди др. Vй+
HC1(-C12); H + (—H2O); H2O2(-O2)KpH
Pt; EtOH; [НТ]; С2О^ ; NH2OH; Sn2+; I
1 цис- [VO2(H2O)„] + , красн., сильнейший окисл.
[V(OH)(H2O)5]2+, кор. ион
н
х {О[У(Н2О)5]2}4 + , кор. ион
v(OH)4, зел.-кор.----------
HF + HNO3 (—NO -Н2О)
2.17 +
[Nb6Cl12] + , зел. ион, уст. в р-ре НС1, окт. кластер
[Та6С112] + , зел. ион, окт. кластер
Н+ (-Н2)
Кат. Восст.
HF + HNO3 (-NO -Н2О)
МпО4; Сг2О2 ; О2(рН>2.5)
1-3.5
Ог
[УО(ОН)(Н2О)4] + 3.5-6
он II н+ 4.66 +
УО(ОН)2Т, желт. —2—. УзО5(ОН)Д,
— черн.
[(УО)2(ОН)5|- ( = "[У4О9(Н2О)5]2-")
4)
желт. ’
3.66 +
[Nb6O3(SO4)12]8-
гол. ион, сущ. в р-ре
ТаС1з- иН2О (?), зел. р-р, оч. сильн. восст.
— — к
он
Та(ОН)3Т, зел.
т- л
Н2О (Z, —Н2)
6-8.5
(разб. р-ры)
8.5-11
8.5-13.5
13.5
Н2О (-Н + ) н
Н6УюО28, сильн. к. . [Н2У10О28]4-, К = 10 4 оранж. ионы, каркас из 10 искаж. окт. [VO(>] Н2О2 [УО(О2)з13-, [УО(О2)(Н2О)„] + ,
он- || Н+ [НУ10О28]5-, К = 10 6 с общ. ребрами ' (см. Табл. "Ванадий"), красно-кор. ионы, + н- — УО2+ + О2
ОН- || н + [V10o28]6- оч. сильн. окисл.
»н2от, оранж. |
[У3О<)(Н2О)„]3 , три- (мета-), циклы (?), бц. ион он- || Н2О (г) [У2Об(ОН)]3_, ди- (пиро-), бц. ион
(конц. р-ры) pH < 6.8
к. ч. V 5 (тетраг. пирамида или триг. бипир.)
Н2О2 [Н„УО2(О2)2](3-й)-,
— —► желт.
{НОУ(О2)2]2О}2- 5)
, н+,^=ю8 .
[УОз(ОН)]2-^==^[УО2(ОН)2П бц., диамагн. (d°)
ОН \
ОН-Пн2О;^10- XX
. ч I у С/ о J EL Cl НЫ
[VO4]3-, орто- '* '
Н2О2 [V(O2)4]3-сине-фиол.
[NbF6r", окт. ион
[NbOF5]2“ [NbOFJ3-
искаж. окт. одношапочный окт. бц. ионы
HF
Н2О
Nb2O5 • иН2ОТ, бел., Кк = I03, Кж„ = 10 15
Н+ 11 ОН“ lNb12O36]12-
А| (pH 5-6)
Н+ I ОН“
Я он я
[Nb6O19]8- [Nb4O12(OH)4]8-
(рН 8.8-14) (pH >14) 2)
[TaF8]3-’, антипризма
[TaOF6]3 , одношапочный окт.
PV
HF
ОН
Та2О5 • иН2ОТ, бел., Кк = 10 10, ^осн = 10 13
н
ОН
[TaeOl?]8 , бц. ион, не восстанавливается
<?О,
Ч [М(О2)„](2й-5)-
М = Nb (желт.), 4 Та (бц.)
52
1 +
2/п +
4 +
Дигалогенацетилены Г — с=с—г т. пл. т. к.
C2F2, г. С2С12, ж., взр. С2Вг2, ж., +О2 взр. С212, крист., бц. -64 -23 82 с разл. -76 32 76
Г ексагалогенбензолы т.пл. т.к.
C6F6, ж., бц. С6С16, крист., бц. С6Вг6, иглы, бц. С616, иглы, красно-кор. -И 231 316 350 с разл. 82 322 возг.
Т етрагалогенэтилены
Г
т. пл.
-142
—76
121 возг.
-22
187
600° (-НС1)
СО2
SiC)
Карбонилгалогениды т. пл. т. к. М с—г
COF2, г., бц. -114 -83 0.95 1.32
COFC1, г., бц. -138 -42 1.23 —
COFBr, г., бц. -120 -21 — —
COFI, г., бц. -90 -23 — —
СОС12, "фосген", г., бц., яд -128 + 8 1.17 1.74
СОВг2, ж., бц. — 65 с разл. — 1.92
гигр. в-ва; + Н2О —> Н2СО3 + НГ (скорость гидрол. F > мол. - тр.-ки, С = О 1.17, /ГСГ 108(F), 111 (Cl, Вг) (sp2) С1 > Вг),
Ъ'.
Г г
C2F4, г., бц., не р. в Н2О и орг. р-рителях 600° J
(C2F4)„, тефлон, тв. в-во, разл. 450, не pear, с Na, орг. р-рителями C2CI4, ж., бц.
С214, крист., желт.
Г ексагалогенэтаны Г3С—сг3 C2F6, г., бц. C2CU, крист., бц. С2Вг6, крист., бц. т. пл. т. к.
-101 189(A) 148 -78 186 возг. 210 с разл.
ад
т. пл. т. к. АЯ С —Г
CF4, г., бц. -184 -128 -223 1.32
СГ3Г, Г = Cl, Вг, I — — — —
CF2C12, г., бц., "фреон-12" -155 -30 — 11.34(F) 11.74(d)
CFC13 — — — f 1.36(F) 11.75(d)
CCI4, ж., бц., яд -23 77 -32 1.77
СВг4, крист., желт. 94 189 + 20 1.94
CI4, крист., красн.; С214 171 90, возг. + 73 2.12
CF4_„C1„, "фреоны", р-рители О3, жиров, смол; CF4 не р. в н2о,
не гидрол., хим. инертны, не горят, мол. - тетраэдры (sp3), уст. CF4 > СС14 > СВг4 > С14
[C6F6]+X- X = SbF6, Sb2FH, AsF6 (крист., оранж., т. пл. 61 с разл., уст. при — 15°, р. в ж. HF, Мэфф 1.3)
Соединения трифторметила 13)
[CF3]X, Х = I (-22)*, СЮ ( + 47, уст. при 100°), FO (-95), SF5 (-20), NO2(-31), NO (-87, син.), NF2(—77), PI2, PH2; O/2 (-61), S/2 (—22), O2/2 (—37), N/3 (—70), г., бц., хим. инертны (за искл.
FOCH3), в мол. - оч. уст. гр. CF3, сильнейший акцептор эл.,
С—F 1.33, ZFCF 108-110; CF3I + КОН KOI + CHF3
Н2ЭШО2СГ3, H23vO3CF3, Э = Р, As, оч. сильн. к. (в отл. от незамещенных на CF3)
HSO3CF3, самая сильн. к.
CF3COOH, ж., бц., т. пл. —15, т. к. 72, сильн. к., К = 1, е = 8.5
CF3COOM, яды; MOCF3, М — К—Cs
*В скобках указаны т. к.
Hg(CF3)2
[Ph4P] + [CBr5]-, в стр.
- цепи тетраэдров [СВг4] и Вг , С—Вг «1.96, Вг—Вг 3.19 23)
CF3OOX, X = Н, С1, — CF2OOCF3;
(CF3)2C(OH)(OOH) 16)
2 +
3 +
53
УГЛЕРОД
(2 + 2/w)- 2-
1-
2s 2p Э’0’
C° Ш l + l + l I 2.5
Углеводороды (гомологические ряды)
с„н2й+2 алканы, С —С 1.54 С„н2„ алкены, С—С 1.35 с„н2й2 алкины, С —С 1.21 С„н2й6 ароматические соединения, С—С 1.40
СН4, метан, г., бц., т. пл. —184, т. к. —161, АЯ = -75 С2Н6, этан, г., бц., т. пл. —183, т. к. —89, АЯ = 84.8, хим. инертны, мол. -тетраэдр и 2 тетраэдра с общ. вершиной (sp3), С—Н 1.09, С —С 1.54 СН2 = СН2, этилен, г., т. пл. —169, т. к. —104, АЯ = + 55, ZHCC = ZHCH = 120 (sp1), С—Н 1.09, С—С 1.40-1.47 //||\\ Л-KOMHJ /<^ Jbm/J кРатнь / оттягив 4 л*-орбг а— ^С1 K[PtCl3(C2H4)] СН = СН, ацетилен, г., т. пл. -81.8 (р), т. возг. -83.6, АЯ= +227, ТВ. и ж. взр., ZHCC = 180 (sp), С—Н 1.06, С—С 1.32 ексы е связи - доноры л - эл.; ания эл. с заполненных [тали L; M = Ag, Hg (II), Co2(CO)6(RC = CR) |Pt(PR3)2(PhC = )2| СбН6, бензол, ж., т. пл. 5.5, т. к. 80, АН =+49, \ ZCCC =ZHCC = 1 = 120 (sp1), С—Н 1.08, С—С 1.35-1.4 дативные связи образ, за сч 1 - орбиталей М на Со, Pt, Pd (II) и т. д. Сг(С6Н6)2, AgClO4 СбН6 3 ет
н2о н2о H2o
р, Па
Ю10
109
108
107
106
105
Алмаз
Графит
Пар
0 1000 2000 3000 4000 5000 °C
Диаграмма состояния С
Карбиды
Алмаз, крист., окт. или куб., бц., т.пл. >4000 (125 • 102 Па), d = 3.51, тв. 10, хрупок, диэлектрик, хим. инертен, куб. стр., а = 3.56, гранецентрированный куб с 4 ат. в центрах 4-х из 8 малых кубов, к. ч. 4, тетраэдр (sp3), С—С 1.54
Солеобразные (стехиометрического состава)
Метаниды и производные этана Производные этилена и аллена Ацетилиды
т. пл. т. пл. т. пл.
Ве2С 2150 А14С3 >2800 крист., бел., в стр. -изолированные анионы [С]4 (Ве2С - стр. тип awmw-CaF2); + н2о -U сн4 т ThC2 2655, желт. VC2 — UC2 2350 + Н2О -► С2Н4 + Н2 + + СН4 + СЙН„„ в искаж. стр. СаС2-ионы [С = С]4 , С —С 1.34 (ср. С2Н4!) NaHC2 — Na2C2 — стр. NaCl ВеС2 — ' MgC2 — стр. СаС2 2300 > тип ВаС2 > 1780 СаС2 ZnC2 — } МС3 = М2[С2]3, м = - А1, Се, крист., бц., + Н2О С2Н2 + • • •
Ри2С3, встр.-гр. [С2], С—С 1.54 (ср. С2Н6!) Mg2C3 (<-Mg + C5H12); + Н2О^СН3-С = С-н+ (аллилен) + сн2 = с=сн2 (аллен) В стр. - анионы [С = С = С]4 LnC2, желт., т. пл. «23( + Н2 + • • •; стр. тип Са проводники М2С3 = М4[С2]3, М = Li (50-70%) + С2Н4 + СН4 M2C2i,M = Cu-Au, стр. тип NaCl HgC2i, образ, из р-ра в Н2О; взр. в сухом состоянии. В стр. ацетилидов (тип CsCl) -ионы [С = С]2~, С—С 1.19-1.24 (ср. С2Н2!) )0; +Н2О С2Н2 + Сг, С—С 1.28, г, U; + Н2О С2Н2 + Н2; С—С 1.24-1.32
Ковалентные
SiC,"карборунд", крист., бц. (теми, из-за примесей), разл. > 2200, стр. близка алмазу
B4C = Bi2[C3], крист., черн., т. пл. 2450, т. к. > 3500, в стр. типа NaCl-икосаэдры [В12] и линейные гр. [С3], оч. тв., хим. инертны, жаростойки. Тв. сплавов в системе B-C-S > тв. SiC и В4С
54
Металлоподобные
(нестехиометрического состава)
1200'
p, t (Fe, Cr, Pt)
Z
Графит, крист., черн., d=2.22, тв. 1-5, возг. 3700, двухслойная гексаг. стр., а = 2.46, с = 6.69, С—С 1.41, к. ч. 3, ZCCC 120 (sp1). Межслоевые С—С 3.34 (/), электропроводность вдоль слоя обусловлена делокализацией л-связей. В минерале сущ. ромбоэдрический графит с трехслойной стр.
Аморфный углерод (сажа, древесный и животный уголь), мелкокрист. формы графита с дефектами в стр., d = 1.8-2.1, хим. наиболее акт., адсорбент ж. и г.
дуга (экстр, толуолом)
Сг3С2 т. пл. с разл. 1900 т. пл. Fe3C, "цементит" 1650 фазы внедрения ат. С в стр. М (гм > 1.3)
Сг7С3 1680 Ми3С 1520 MCj_x M2C
Ми7С3 — Со3С 1 метастаб. — T. ПЛ.
Сг23С6(я :"Сг4С") 1520 Ni3C J фазы — TiC 3250
Ми23Сб — крист., сер. или черн. ZrC 3735 \ T. ПЛ.
СгС — (Fe,Cr)3C, (Fe, Мо)3С, HfC 3890 стр. Hf2C — \
оч. тв., кислотоупор- оч. тв., придают тв. VC 2830 I тип V2c — гексаг.
ны, сталям; +Н+—>Н2 + NbC 3500 [ NaCl Nb2C — пл.
уст. к окисл. < 1000° + СН4 + СйНт TaC 3900 Ta2C — упак.
WC 2660 J W2C 2700 j
MoC — Mo2C 2690
Соединения с мет. связью, проводники, оч. тв. (9-10), но хрупки, жаропрочны
(т. пл. М + МС), кислотоупорны, р. только в (HF + HNO3) (Z) и (распл. щ. + О2):
—> Na2WO4 и т. д.
Триг. призмы [СМ6] образуют цепи C z, в искаж. стр. М, С—С к 1.65
Сродство к С (среди легирующих элементов) возрастает в ряду: Fe
Mn < Cr < W < Мо < Та
Zr < Ti < Nb
Fe3
+ Н2О
каталитическое ~ окисление
Фуллерены, С„, п = 60 ("бакминстерфуллерен"), 70, ..., темные порошки, возг. вак. >400, р. в бзл., сферические мол. С60, мол. типа "футбольного мяча", состоит из 12 пяти- и 20 шестичленных циклов, С—С 1.45 и 1.39, разл. > 1000, полупроводник
М„Сбо, М = К (п = 3, сверхпроводник), Rb (п = 3, 4, 6)
Сбо1М(РКз)21я, М = Pd, Pt, п = 1-6 (л-комплексы) С60 • 2L, L = Fe(C5H5)2, Р4 (с переносом заряда) C60[OsO4Py2]„, п = 1, 2; С60Вг24, разл. 700 п
Тубулены, Со,, полимерные цилиндры из графитовых сеток 3)
С,», линейные цепи (карбин, поликумулен -?)
пар, С2 при 3100°, С—С 1.31
Соединения графита (/ - расстояние между слоями)
"Графитиды" металлов, МС„, п + 60 14) Соединения включения 2) Графитовые соли 2)
LiC6, ВаС6 14) МХ_ХС8, М = K-Cs, крист., медно-красн., воспл. на возд., проводимость > графита; + Н2О —> Н2 + МОН + + графит. В однослойной стр. графита /=3.7 (Li), 5.4 (К), 5.6 (Rb), 5.9 (Cs), ат. М не на середине /; к. ч. М 12 (гексаг. призма) МС16, М = K-Cs; К6Сбо, диэлектрики '* М°С„, М = Мо, W, Mn-Ni, /= 5.6-5.9 С„ • L, L = А1Г3, SbF5, AsF5, GaBr3, FeCl3, LnCl3, CrCl3, FeS2, MoO3, XeF6, XeF4, KrF2 C21CrCl3, / = 12.80 C22_29CrCl3, / = 16.57 C6.3(Au2Cl6), / = 6.80 C33AlBr3, / = 20.10 C8 5IF5; C38UBr5; C13UF6 проводимость > графита С„+Г- • МСт, Г = С1, Вг, М = Be, Al, Ga, Fe, Hg, Pt, Au, W, U; I = 9-13 2) C„+X", X = NO3, C1O4, HF2, SO3F, AsF6, крист., спи., /%8 | НХ C24|HSO4| 2H2SO4, крист., гол., 1 к 8 Cs’Br-, в стр. графита (/=7.05) -анионы [Вг2] , Вг—Вг 2.1-2.2, проводимость > графита
LiAlH4; Na (ж. NH3)
Н2О (1000°, —Н2, "водяной г.")
2 +
3 +
с°г<
СН3СООН, уксусная к., масло ("ледяная к."), бц., т.пл. 17, т.к. 118, [СН3СООН2+ ][СН3СОО“] = 10“12 р. SO2, МГИ, M(NO3)„, 8 = 6, в г. - димеры, в р-ре Н2О -сл. к., К = 10“5, не восст.: уст. к МпО4 , Сг2О2“, ан. окисл.—> СО2 + С2Н6
С3о2, недокись, г., бц., с резким запахом, т. пл. —107, т. к. 7, \Н = —96, тв. красн.
полимер + С + СО2;
оч. реакц., мол. линейна: о=с=с=с=о, С—С 1.28, С—О 1.16
H2o
—H2O(P2O5)
СН2(СООН)2, малоновая к., крист., бц., т.пл. 135 с разл., К\ = 10“3, /О = Ю“6
СО, окись углерода, г., бц., яд, т.пл. —205, т.к. -191, АЯ= -110, р. в Н2О 3% (об.) (0°), не р. в к. и щ., хим. инертен., сильн. восст. (Z); + 12о5^0Д12 + СО2 (колич. опред. СО), в мол. стр. С = О 1.13, эл. аналог N2, ц = 0.12
М(р)
Z(-M)
М°(:СО)„, М = V-Ni, Mo-Pd, W-Pt, карбонилы, крист, или ж., яд, летучи, не р. в Н2О, р. в орг. р-рителях, Хе = 18 [кроме V(CO)6], в них сущ. дативные связи между d-эл. и свободными л*-орбиталями СО (см. схему МО); гр. [М — С—О (конц.)] почти линейные (ZMCO 171-178), С—О (конц.) 1.12-1.29
О2 [700°; MnO2 + СиО ("гопкалит"), 20°];
M2O„(Z, —М); Н2О (—Н2, 500°, Fe2O3)
• — с (>1000°)
-н2о
(конц. H2SO4)
Ацетаты
CH3COOLi 2Н2О CH3COONa, СН3СООК, CH3COONHi, М(СНзСОО),
МГСНзСОО), 1\/1Н И и <
• 3 Н2О, т. пл. 58
СНзСООН СНзСООН
НСООН, муравьиная к., ж., бц., с резким запахом, d = 1.23, т. пл. 8, т. к. 100, хор. р. в Н2О, ц = 1.35, 8 = 56, мол. -плоская, сильн. восст.
/ н\
гр —сС ;
\ ю/
азеотроп с Н2О 77 %, т. к. 107, К = 10“4;
бчдм, н2о + со2 (ZnO) СО2 + Н2
СО2, углекислый г., бц., возг. —78, т. к. 20/58 • 105 Па \Н = —393, р. в Н2О« 50% (об.), в гранецентриро ванной куб. стр. мол. СО2 в 3-х непересекающихся
—» направлениях, С—О 1.16, ZOCO 180 (sp)
Донор л-эл., в мол. [Rh(CO)(PR3)2(OH)(CO2)|
СО2 присоединен обратимо 12)
•5.75Н2О (8:46), клатрат, разл. —21
•/
Н2о
Угольная к.
(медл.) (мгнов.) , _ 2
СО2 + Н2О 2 * [Н2СО3] 2 * Н+ + НСО3 2 Н “ + СО2“
[Н+][НСО3] 7. [Н+][НСО3] 4.
к' = [Н2О][СО2] = 10 ’К' = [Н2СО3] =10 ’Kl=l° •
pH и 3.7 Мол. Н2СО3 сущ. в г.
"Н2СО3 R2O" = [R2OH] + [HCO3]“, крист., бц.,
R = Me (т.пл. —47), Et (разл. —10) 5)
т. пл.
70 324, 292, 114,
М = Zn-Hg, сл. диссоц.
М2О„ + СО2 + Н2О
М2' (СН3СОО)4, 2Н2О, Мп = Сг, Мо, Rh, Си, мол. - димерные кластеры (см. Табл. "Медь") со связью М — М, гр. СН3СОО“ бидентатны, каждая связана с 2 ат. М
Оксоацетаты
мУ О*(СН3СОО)6, Мп = Be, Zn, в мол. [О*М4] и [МО*О3]“ - тетраэдры (см. Табл. "Be, Al") |М',"О-(СН3СОО)(,|1 Х“. Мш = Сг, Fe, Al, Ru, Rh, в катионе - тр-к [О*М3] и окт.
[МО*О5], СН3СОО“ бидентатны и связаны
с 2 ат. М
н
(—СООН)2, щавелевая к., крист., бц., т. пл. 189 с разл., возг. 158, яд, хор. р. в Н2О, сп„ Ki = 10“', К2 = 10“5, мол. - плоская транс
(&0
ОН
• 2Н2О, т.пл. 10
•ДЮН
H2SO4
НОС = СОМ. М = Na-Cs, ацетилендиоляты [раньше - "соли гексаоксибензола (СОМ)6", "карбонилы"], крист., бц., гигр., пирофорные, стр. тип СаС2, С—С 1.20, С—О 1.37, -U М2СО3 + М2О + с 19)
Формиаты 18)
HCOOLi Н2О
НСООК, т. пл. 167
HCOONa, т. пл. 255;
-Ж. М2СО3 + М2С2О4 + + со + н2
HCOONHi, т. пл. 116, разл. 180
(НСОО)2Са^
(нсоо)2си н2о
(HCOO)2Zn; HCOOAg^
(НСОО)ИМ -U Н2О +
+ М2ОИ + СО ( — М + СО2)
400° (—Н2)
Оксалаты
ЫНС2О4 Н2О
NaHC2O4 • Н2О, мало р.
КНС2О4, яН2О, п= 1, 0.5
Н2С2О4 2Н2О
NH4HC2O4, Н2О
Li2C2O4, Na2C2O4
К2С2О4, Н2О (NH4)2C2O4 н2о
СаС2О4 Н2О , ВаС2ОД
ГеС2О4 2Н2О
М2[Ге(С2О4)2] иН2О
C^F“, крист., черн., разл 100, в , однослойной стр. графита / = 5.4 '
CF„, п 1.12, "фторид графита",^ крист., бц., разл. 800, хим. инертен, диэлектрик, в стр. - гофрированные слои, С — С 1.54, С — F 1.41, Z ССС 111, /= 5-8 (уменьшает- «f q ся с ростом п), термостойкая смазка, уст. к окисл., + f2 cf4 + с 3) (воспл.)
С„О, п 2, крист., бц. или желто-кор., диэлектрики, в стр. - гофрированные слои, к.ч. С 4, / и 7, после набухания в Н2О, ац., сп. и др. ж. Z < 19, в стр. -гр. сос, С = О, С ОН, С—ОО—С (?)
55
АЗОТНЫЕ И ФОСФОРНЫЕ ПРОИЗВОДНЫЕ УГЛЕРОДА
2 +
4 +
со
-— nA
NH3 (-Н2О, ThO2, 500°)
1.06 1.13 t 1.01 1.17
Н—С = Х «=> Н—N = C, циановодородная изоцианистая (синильная) к., ж., бц., оч. ядовита, изо-форма с запахом миндаля, летуча, ассоциир., d = 0.697; т. пл. —13, т.к. 26 (при 20° - 0.5% изо-формы), К = 10-9, ц = 2.96, s = 107 (25°), NH3 + НСООН + (СООН)2 + ..., горит фиол. пламенем; W(CO)5(CNH) 27)
О2 (Ag, z); С12 (акт. С);
NO2 (—NO -Н2О)
(HCN)3, "триазин", 6-членный цикл, т. пл. 86, легко гидрол.
н
С.
(—CN)2, дициан (нитрил щавелевой к.), г., бц., яд, т. пл. —28, т. к. —21, АЯ = +293, уст., р. в Н2О, мол. N = C — C = N линейна, С—N 1.13, С —С 1.37; хим. аналог Г2;
+ NaOH —> NaCN + NaOCN; + о2 —> со2 + n2 (Z + 4500°, красн. пламя), ^M°2CN* (С —N 1.17), уст. при оч. высоких Z
hv-B (медл).
860'
(coci
CO(NH2)2, карбамид (мочевина), крист., бц., т. пл. 133, возг. вак., хор. р. в Н2О, си., ж. NH3, SO2;
Н2О ,
[CO(NH2)(NH3)]+ + [CO(NH2)(NH)]-, Аосн = 10- 4; + Н2О (NH4)2CO3 (в почве);
+ НХ — [CO(NH2)(NH3)] + X-;, X = NO3, Н2РО4, НС2О4; + H2S2O7 NH2SO3H + СО2;
сл. восст. (уст. к МпО4, Н2О2); + ОСС —> N2, мол. - плоская
МС12 2(:NH2)2CO, М = Pd, Pt; МС1„ 2[:OC(NH2)2], М = Zn, Си11, Fe111, Сгш
L • [:OC(NH2)2], L = Н2О2(разл. 85), МеОН, CaSO4 • Н2О
CO(NH2)(NHNH2), семикарбазид, крист., бц., т. пл. 96, р. в си., Н2О
Z (—NH3)
СО2
NH4[NH2CO2], карбаминат, крист., бц., возг. 60;
+ Н2О 2NH+ + СО3
aNH2
:О=С 1119° 1-27 \/
NH2
|н2О (180°, 2107Па)
(NCO)2, оксоциан, крист., бц., т. пл. —12, неуст.
NC CN
,С=С (HCN)4, неуст.
h2nz xnh2
с,
ню Н 2
— — HCOONH4
-Н2О (Z, Р2О5)
с
С
А
Н+; KHS (Z)
СА ^с.
N ^N'
0.6 + C5N, 9) крист., уст. на возд., стр. графита (часть ат. С замещена на ат. N)
РН3 (дуга)
Цианиды
NaCN, т. пл. 564, т. к. 1497, стр. тип.
NaCl; 2Н2О
KCN, т. пл. 634
ХН4СХ. разл. 36 __'
Ca(CN)2, Hg(CN)2, хор. р. в Н2О, не диссоц.; яды только хор. дис. соли.
AgCN;,^. M[Ag(CN)2]
Fe(CN)2J. K4[Fe(CN)6]
M6[Cr°(CN)6], C N 1.14
M3O(CN), M = Na, К, бц., крист., стр.
тип awmw-CaTiO3 27)
[R—C = N:], нитрилы, МГ„ hiRCN
[R—N = C:], изонитрилы, доноры эл. > СО, способны к л-дативному взаимодействию с М° [Fe(CNR)6]2+; Ni°(CNR)4
НСР, метинофосфин, г., бц., уст. < —124°, воспл. на возд., -78° ---> черн. полимер, Аг = 0.39, Н—С = Р 1.07 1.54
HC(CN)3, трицианметан
M[C(CN)3]„, M = K, Ag, UO2
(CN)6, гексациан, крист., — N=C— бц., т. пл. 119, т. к. 262, мол. - циклическая
CN J3
+ 4Н2О
(NH4)2C2O4
О2 (Ni, z); PbO (Z)
Галогенцианы 15)
г., бц. г., бц. крист, крист.
т. пл.
~82
-7
51
146 (р)
Н
^N=C=O 1.21 1.17
изоциановая циановая к., ж., бц., с запахом уксусной к., т. пл. —87, т. к. 25, при 20° > 98% изо-формы, К = 10-4;
+ Н2О —> СО2 + NH3 —> CO(NH2)2
N = C —ОН
0°(конц. р-ры)
(HNCO)3, циануровая к., крист., бц., мол. - плоский цикл, мало р. в Н2О, Ki = 10“7, К2 = 10“12, К3 = 10“15
н
—.0
(HNCO)„, циамелид, линейный полимер K3(NCO)3, цианурат 20)
т. к.
46
13
61
140
ГС 1.26 1.63 1.79 2.00
= S-Те, N2, СО); P(CN)3.
1.68
2.9
3.7
FCN C1CN BrCN ICN
(N3)CN; X(CN)2, (X
Оч. яд. в-ва, возг., р. в Н2О (—> HCN + НГО), мол. линейны, С—N 1.16; [Fe(—NCBr)dX2
Z | время
(rCN)3, галогениды цианура,
мол. - циклы
(FCN)3, т.пл. —38, т. к. 74
(C1CN)3, т.пл. 146, т. к. 190 6)
HN(CN)2, дицианамид, сильная к.
о
£
Ъ И
NH3 (эф., -NH4CH)
N=C—’
Г J3
р
Q
M[N(CN)2]„,25)
М = М1, Tl, Ag, Hg.
[N = C—N—C = N]“
1.15 1.28
H2CN2, диазарин, уст. при 20° С 26)
ь (СС14, -Agl)
О и
О и
Цианаты /
700°
NaOCN, т. пл. 550; KOCN, ---> KCN + К2СО3 + N2 + СО /
NH4OCN, CO(NH2)2 (Велер, 1824); AgOCN (., бц., ПР= 10“7, + Н2О —> МНСО3 + NH3; K2[M(NCO)4], М = Mn-Zn, анион [N = C—О]- - линейный (не изв. по какому ат. - N или О -осуществляется связь)
Si(—NCO)4, т. пл. 26, т. к. 186 Р(—NCO)3, R—NCO, изоцианаты
Si(—ONC)4, т. пл. 35, т. к.245 М3[Мо(—OCN)J, цианаты
Н—C = N = О, гремучая к., ц = 3.06, Н С 1.03, С—N 1.16, N O 1.21
Фульминаты
AgCNOJ.; Hg(CNO)2J., детонатор, взр., —> Hg + CO + N2
M[Au(CNO)2], C—N 1.10, N O 1.25
150'
(NH2CN)3, меламин,
сильн. осн., мол.
- плоский цикл
—N=C—
L NH2 J 3
NH2CN, цианамид, крист., бц., гигр., т. пл. 46, хор. р. в Н2О, си., эф., м = 4.24, оч. сл. к.; + Н2О (Н+’ Otr)> CO(NH2); в орг. р-рителях - — HN = C = NH, карбодиимид
N-AC = N
Н
H2SO4, разб.
NH3
Цианамиды 17) ~
NaHCN2, K2CN2, KCN + К + N2; MCN2, М = Mg-Ba
CaCN2, возг. и 1200, ---> Ca(CN)2 + Са + N2 + CaC2; иН2О, n = 1 - 3;
>1000°
+ H2O CaCO3 + NH3 (удобрение); Pb(CN)2(
Ag2CN2)_, желт., ПР = IO-10, Г 1 23
анион - линейный, изоэлектронный СО2 ’N=C=N
(NH2)2CNH, гуанидин (диамидоимид), крист., бц., гигр.,
т. пл. 50 с разл., сильн. осн. < 2 » [(NH2)3C]+ + [(NH2)C(NH)2]“; (ОН-)
+ Н2О ------A CO(NH2)2 + NH3
[(NH2)3C]+X-,24)
соли гуанидиния
Ag[NH2C(NH)2]
^гТ8СгП^'
C3N4, нитрид, аморфная масса, желт., адсорбирует Н2О, не р. в Н2О и орг. р-рителях, ~ 700 > (CN)2 + N2
56
2 +
4 +
—S (дуга)
K2[CO2S]
HC(SO2F)3 сильная к.
Cs[C(SO2F)3]
HC(SO3F)3 29)
A
H2[COS2], дитиоугольная к.
K2[COS2]
s=c:
^SM
KSC(S)OEt, желт., разл. 200, р. в Н2О, си.
H2o
Ксантогенаты .OR
Кислые эфиры ^OR
(ксантогеновые к.) S^=C.
HNCS, роданистоводородная (тиоциановая) к., ж., бц., т. пл. —ПО, > —90° —> полимер, т. пл. 5 с разл., сильн. к., К = 0.5 (в разб. р-рах);
5 /о> H2C2N2S3 (ксантановый водород) + HCN; Н+ t
+ Н2О —COS + NH4; в г. - мономерные мол., ZHNC 135, ц = 1.72; + H2S CS2 + NH3
H.
0£n = C = S у 1.22 1.56
KHSO4 (вак.)
1.33 +
C3S2, ж., красн., с острым запахом, т. пл. —1, легко полимеризуется
CS, оч. неуст., стабилизируется в качестве L (тиокарбонильная гр.) [Rh(CS)Cl(PR3)2] [M(PPh3)2(CO)(CS)Cl2]PF4, М = Rh, Ir; С—S 1.54, ZRhCS 177 П)
-s
(разряд, <—100°)
's> CS2, сероуглерод, ж., бц., яд, взр. на возд., <720 = 1.2630,
т. пл. —108, т. к. 46, \Н = +63, не р. в Н2О, р-ритель жиров, смол,
— I2, S, Р; мол. - линейна, С—S 1.56; + Н2О > qq2 + h2S;
2.06 C 1.54
S
| (45 • 108 Па, 200°)
черн. полимер, d = 4.9, размягчается 70°, > с + S,
е = 4, полупроводник, в стр. - цепи: /
Донор л-эл.; CS2 в качестве L - угловая мол. I С $
[M(CS2)(PPh3)2]„, М = Pt, Pd
[Rh2Cl2(CO)(C2S4)(R3P)2]2
K2[C4s4],29) в анионе -квадрат [С4], С—С 1.45, С—S 1.68
K2[O2C — CS2] 29)
H2CS3, тритиоугольная к., масло, р. в Н2О, т. пл. —27, К\ = 10 3, К2 = 10“8, р. S, мол. - аналог. Н2СО3, С — S 1.69-1.77, ц = 2.13; > -27°
------> CS2 + H2S (медл.); уст. > Н2СО3, в стр. - цепи мол.,
S- • Н и 2.8 9)
CO(NH2)2 (110°, -CS2);
NH3 + Ca(OH)2 (—CaS I —H2O, 110°, p);
NaNCS KNCS \H4\CS
Ca(NCS)2 • ЗН2О, хор. р. в Н2О, си.
Ba(NCS)2 • ЗН2О, Ва—N 2.90,
Ва—S 3.39
AgSCNJ., бел., ПР = 10“13,--
анион линеен
Роданиды (изо- и тиоцианаты), не яды т. пл. 323, 177, 150,
Br2(CS2, —AgBr)
p. в H2O, cn. разл. 500 разл. 170
Hg(SCN)2(
M2[Hg(:SCN)4|; [Pt(:SCN)2(NH3)2], тио-
M2[Co(:NCS)4], изотиоцианат
H2CS4, тиомононадуголь-ная к., масло, красн., т. пл. —36, неуст., Ki = 10“4, К2 = 10“7
M
(SCN)2, диродан, крист., бц., т. пл. —2, уст. <0°, хор. р. в Н2О, —> HCN + HNCS +
' + H2SO4 (медл.);
+ KI «=► KNCS + 12; + KNCS K[NCS]3; аналог Г2; окисл. акт. Br2 > (SCN)2 > 12
| 20° (быстро) (SCN)„, паратиоциан, красн. полимер (SCN)2 2НГ; Н2О
HC1 (cn.)
Тиокарбонаты, M2[CS3] 10)
М = Na, К(- Н2О), NH4, [R4N] (• 4Н2О), крист., желт., гигр. (р-ры красн.), анион -тр-к, С—S 1.66, ZSCS 118
[Me4N]2C2S6 • 0.5 CS2, анион [C2Sg]2“ - из 2-х тр-ков под Z 87.1°, С—S 1.65 (конц.), 1.77 (мост.), S —S 2.03
M2[Ni(CS3)2], М = [Ph4As], [Ni(NH3)6]
S
• —M2SO3
Пертиокарбонаты, M2CS4 21)
М = Na (разл. 90), К, [Me4N] (разл. 125), [Ph4As],
крист., желт.; M2CS3 + S;
+ О2 + Н2О —> M2S2O3;
анион [S = SCS2]2- - не тетраэдр (!), S — S 2.03, С—S 1.66-1.74, С—SS 1.73, ZSCS 110-124, ZSSC 111
[Ph4As]2[Ni(CS4)2]
[RuCl2(CO)(CSe)(PR3)2], гр. (CSe) обладает трансвлиянием > гр. (СО), С—Se 1.67 28)
100°, (Р-Р в Diox)
SCSe, ж., желт., т. пл. —85, т. к. 84
SCTe, ж., красн., —54, неуст., ц = 0.17, мол. - линейна, С—Те 1.90
CSe(NH2)2, селеномочевина, крист., бц., т. пл. 200 с разл. Se(CN)2, т. пл. 134; (SeCN)2
H2CSe3, селеноугольная к., Ki = 10“2, Кг = 10“7, оч. неуст., сущ. в р-ре
HNCSe, селеноциановая к., неуст., сущ. в р-ре, сильн. к., К = 5
Селенокарбонаты K2CSe3, BaCSe3, крист., фиол., окисл. возд.
Изо- и селеноцианаты
KNCSe, крист., гигр., > KCN + Se AgSeCN, ПР = 10“16, линейный анион [N = C = Se], N—С 1.17, С—Se 1.83
M2[Fe(—NCSe)4], M2[Pt(—SeCN)4]
57
КРЕМНИИ
4- *
2- 1-
1 +
2 +
3 +
Силаны Si„H2n+2
г. или ж., бц., яды, с характерным запахом, воспл. на возд., уст. падает в гомолог, ряду, р. в орг. р-рителях, не р. в Н2О, гидрол. при pH >7, стр. аналоги С„Н2и + 2, Si—Н 1.48, Si—Si 2.32;
АН SiH4 = +33; сильн. восст., + Г2
4—
SiH4 моно-d 0.68 (-185°) т. пл. —185 т. к. —112
3-Si2H6 ди-0.68 (-25°) -132 -14
2.67—
Si3H8 три-0.743 (0°) -117 +53
(SiH2)„, полисилен, крист., кор., воспл. на возд., разл. 380
Sid
3s
Зр
3d
Э.О.
1.8
+
Si„H2„ + 2_xF-
2.5-
Si4H10 тетра-
0.825 (0°)
-84 + 107
(взр.)
2.25—
Si8Hj8 октасилан
Si5H10, Si6H12, ж., бц., воспл. на возд., стр. аналоги циклопентана и -гексана, Si—Si 2.34, Si—Н 1.48, ZSiSiSi 110 n
(SiH)„, сплин, желт., аморфн. в-во
CP
(SiO)„, порошок, кор., уст. в г. >1000°, АЯ = 769, медл. окисляется;
Si + SiO2 (при медл. возг.); +Н2О + МОН —> —> M2SiO3 + Н2
О
HC1 (-H2)
%
M2Si, M = Mg, Ca,
K[SiH3], крист., бц., стр. тип NaCl, разл. 200
Na (—Nal)
-H2 (780°)
Si, монокрист., серые или порошок, бур. ("аморфный Si"), d = 2.3, т. пл. 1415, т. к. ~3250, кислотоупорен, р. в щ., F’osio4-/Si = —1-86, полупроводник (< 150°) \d и электропроводность возрастают при т. пл.), стр. тип алмаза, а = 5.42, Si—Si 2.35.
Si высокой чистоты, порошок бел.; + Н2О —> Н2Т
| 2- 1010Па
Si мет., стр. аналог "бел." Sn, d = 2.55, f Si—Si 2.30 и 2.39 в искаж. тетраэдре , Si-гексаг., а = 4.04, с = 6.60, стр. тип вюртцита 4)
SiF4
(SiOOH),,. кремнещавелевая к., порошок, бел., взр. при трении,
+ NaOH —> Н2 + Na2SiO3
/ О
Положение ат. Si
[SiH3]X, производные радикала "силила", бц., гигр. в-ва, воспл. на возд., X = Г, SH, CN, NCS, N3, Me, РН2, О/2, S/2, Se/2, CN2/2, N/3, CH/3, P/3, As/3, Sb/3, тетраэдрические мол.
т. ПЛ. т. K. d Si—H Si—
(SiH3)2O, -144 -15 0.88 (-80°) 1.49 —
дисилоксан 1 н2о SiH3F (разл. 600) -88 1.46 1.59
SiH3Cl -118 -30 1.15 (—113°) 1.48 2.05
SiH3Br -94 + 2 1.53(0°) 1.48 2.21
SiH3I -57 45 2.03(15°) 1.48 2.44
[SiH3][PH2] — 13 — — —
(SiH3)3X -106 52 — — —
SiH3r Ж SiH2r2 + SiH4; ZHSiH 110, ZHSir 108, ZSiOSi 144, ZSiNSi 120 (cp. ZMeOMe 112, ZMeNMe 108 в MeO2 и Me3N)
Г
(Si„H2„ + i)2O, силоксаны, г. или ж., бц., быстро разл. щ., медл. — Н2О, стр. аналоги простых эфиров
(Н681бО3)„ силоксены, крист., бц., Н Н
Si------Si
HgSieOe, крист., фиол.
H—Si
Si—H
1
Силициды
О—Si----Si-O
H
О/
изолированные ат., стр. тип awmw-CaF2
Солеобразные, воспл. на возд., сильн. восст.
MSi, М = Са-Вщ гофрированные слои Sioo
MSi, М = Na-Cs, тетраэдры [Si4]4 (см. Табл.
"Щел. металлы")
MSi2, M = Ca-Ba,
слои Si(
Металлоподобные, кислотоупорны, p. в щ., термостойки (но т.пл. ниже, чем М), не оч. тв. (в отличие
от боридов и карбидов), парамагн.; MSi2, М = La, Сг, Мп, Fe, -полупров одники
V2S1 Kesi2, u3»i2 Mn5Sl3, Fe3Si3 MSi2, M = Cr, Mo, Ti ihSi2 MSi, M = li, Zr, | Mn, Fe
Пилижинии ат. Si Иэ V 4-LH.p UD ДИ . ат. Si rp. [by] Si» слои Sico тр^хккрная wTKa cjIqq
'Ферросилиций" содержит 9-15, 43-50 или 72-95% Si (низко-^С^едне-, высококремнистый)
H
сильн. восст.; +O2 —> люминес-цирует, разл. Н2О (Z);
+ Br2 —> H3Si6O3Br3;
+ HBr —> H5Si6O3Br (стр. аналог цеолитов);
+ I2 H5Si6O3I
(H2Si2O3)„, полисилоксаны, крист., бел., светочувствительны;
-Ж н2 + Si2o3 (?) H10Si10O15, в стр. -10-членные циклы 14)
U
И
H2o
т. пл. -122 -122 -70 -1
т. к.
-78
8
66
150
d
1.42 (-122°)
2.17 (0°)
2.73 (20°)
SiH2F2 SiH2Cl2
SiH2Br2 SiH2I2 г. или ж., бц., мол. - тетраэдр,
Si—Н 1.47, Si —Г 1.56(F), 2.02(d), ZHSiH 112(F), 114(d), ZrSir 108(F), 110(d)
Si(Dipy)3, крист., черн.
Si
* Несмотря на то, что значение Э.О. Si и ряда других неметаллических элементов - Ge (1.8), Sb (1.9), В и As (2.0), Р и Те (2.1) меньше или равны Э.О. водорода (2.1), ст. их окисл. в гидридах принимаются за отрицательную величину. В пользу такого рассмотрения свидетельствует, в частности, их синтез при гидролизе соответствующих М„Эт. Этот подход позволяет рассматривать ЭН„ перечисленных элементов в одном ряду с гидридами С, N, S и др. типичных неметаллов.
•Ъ
Q
58
SiC, карборунд, крист., бц., разл. 2830, стр. тип алмаза, полупроводник (< 1000°), оч. тв., р. только в (HF + HNO3);
+ NaOH + О2 -U Na2CO3 + Na2SiO3;
+ H2O siO2 + СН4; + С12 SiCl4 + С
О
И
т. пл. т. к. АН Si—Н Si —Г
SiHF3, г., бц. -110 -80 -1184 1.45 1.56
SiHCl3, ж., бц., силикохлороформ -126 33 -519 1.46 2.02
SiHBr3, ж., бц. -60 112 -327 1.49 2.16
SiHI3, ж., красн. + 8 220 - - -
мол. - тетраэдр, ZHSiF 111, ZFSiF 108
LiDipy
(Sir)
Г = C1-I, не р. в орг. р-рителях, разл. Н2О, стр. тип. BN
SiCl2 s
Cl2Si "'SiCl
Siiod18, масло вязкое
,SiCl2
ЖС12
Cl2Si^ ^SiCl ^SiCl2 Жс12 Жс12
SiF2, уст. в г. фазе, АЯ = -582, д = 1.23 (SiF2)„, каучукоподобная масса, разл. 300 (SiCl2)„, /7 = 5,6, циклы (SiBr2)l6, Ру (Sil2)„
(Sir2)„ Si + Sir4;
+ Н2О [Si(OH)2]„;
в г. - мономеры,
Si—Г 1.59(F), 2.08 (С1), 2.25 (Вг), ZrSir 101-103 5)
Si„r2„+2, ж. или крист., бц., стр. аналоги алканов, Si— Si —F 1.54, ZSiSiF 111 2); + H2O —> SiO2 • /г Н2О + НГ Si 2.34, + н2
2.5+ 6) 2.67 + т. пл. т. к.
2.33 + Si6ci14 т. пл. 318 Si4Fio т. пл. 67, т. к. 85 Si3F8 т. пл. —1, т. к. 42 Si2F6 -19 возг.
2.08 + Si25C152 ж., в 2.2 + SiioCl22 язкие само H-Si4r10 H-Si5r12 Г = Br, I воспламсн) 2.4 + SisBrj2 потея на вс Si2Cl6 Si2Br6 Si2I6 >здухе 3 90 неуст. 1 147 265
НС1
NH3 (ж.)
Si2P, крист., сии.
(SiS)„ иглы, желт.
сд(%Ж-
Si2(NH)3
SiP, иглы, желто-кор.
SiAs; SiAs2
Ca(SiN)2, аналог цианида
LiSi33,
Э = N, Р, As
| 500°
SiN, бел., аморфн.
в-во
4 +
SiOF2
(SiOCl2)„, п = 3-5
SiOS, крист., желт., неуст.
SiO2, крист, или стекло, бц., тугоплавки, р. в HF и щ., АЯ = —879 (а-кварц), в стр. - тетраэдры [SiO4], сочлененные всеми вершинами
12)
7)
т. пл.
-47
Si2OF6
Si2OCl6
Si2OBr6
+ Н2О —> SiO2 +
неуст.
НГ
Cl
т. к. -23
137
Cl
"/1-квар-ц", d = 2.65, гексаг., оптически 573° "а-кварц", т. пл. 1550, гексаг., пьезоэлектрик
867'
115'
"у-триди-
а - т р и д и -мит", d= 2.28-2.33,
|141 —163*
"/1-тридимит", ромб.
1470'
t, p
"а-кристоба-лит",
<7 = 2.32,
т. пл. 1728,
т. к. 2950,
,270"
"/L лит кристоба-н
"коэсит", d= 3.01, монокл., каркас тетраэдров;
"стишовит", d= 4.28, тетраг., стр. тип рутила (к. ч. Si 6), Si—О 1.75-1.81, не р. в HF
Волокнистый SiO2, изостр. SiS2 (образ, из газ. фазы).
В кварцевом стекле - неупорядоченное расположение тетраэдров [SiO4], d = 2.20
Стр. а-кристобалита, Si—О 1.63, LSiOSi 150
C1F5; XeF4
O2; B2O3(Z)
т. пл. т. к. d2(> АН Si—Г
SiF4, г., яд -77(р) -95 — -1615 1.55
возг.
SiF„Cl4_„ — — — — —
SiCl4, ж. -68 57 1.48 -685 2.02
SiCl„Br4_„ — — — — —
SiBr4, ж. 5 153 2.81 -460 2.15
SiBr2F2 — — — — х 1.54 /2.16
Sil4, крист., 122 290 — -210 2.43
г. воспл на возд.,
—> Si + 12
В-ва бц., гигр., в г. и стр. - мономерные мол. - тетраэдры
O(SiN)2, оксонитрид, в стр. -тетраэдры [SiON3], Si—N 1.71, Si—О 1.62, Z SiOSi 147
—»(SiCl3)3N, крист., бц., т. пл. 78 (Si2NCl5)n, в стр. - циклы
SiX4, X = СН3СОО(т. пл. 110), NCS, NCO, NO3( • 2 Ру), М3(взр.), РО4/3/, С1О4( • 2MeCN), крист., бц., р. в орг. р-рителях, тетраэдрические мол.
SiP2O7, т. пл. 1290, в стр. - каркас из р2О7] и окт. [SiO(>] 3)
SiS2, иглы, бц., гигр., т. пл. 1090, т. к. ИЗО, возг., \Н = —205, + Н2О SiO2 • xH2O + H2S; в стр. - цепи тетраэдров [SiS4/2]
Si(NH2)4 —► [Si(NH)2]„, порошок, бел., гигр. SiCl
SiSBr2, т. пл. 93
SiCl3(SH), ж., бц., т. к. 96; SiCl4 + (SiSCl2) + H2S (SiCl3)2S, ж., т. пл. —45, т. к. 187 с разл.
K2[Si(CH3COO)6] 10)
LiOSiN 9)
knh2
полимер [—N = Si(NH2)—],
Z(-H2-NH3)
K4[Si(NH)4]
K2[Si(NH)3]
M2SiS3, Ca2SiS4 Na4[Si4S10], крист., бц., гигр., в стр. -тетраэдры [SiS4] 9)
Cl2Si. ySiCl \ Z тг
ri Qi S1CI2
Cl3Si4 2
N N
Si3N4, порошок, бел., хим. инертен, возг. 1900, полупроводник, АН = —749; + NaOH (0 —> Na4SiO4 + NH3; + HF —> (NH4)2SiF6 + SiF4; в стр. каркас тетраэдров [SiN4] и тр-ков [NSi3] 8)
Si(OR)4, алкилортосиликаты
SiR4, алкилсиланы, ж. или крист., бц., термостойки
H2O
Полиорганосилоксаны, "силиконы", R R
линейные, циклические или трехмерные 1 /О\ 1 /
полимеры, уст. к окисл., термостойки, а/
обладают большой е. 1 1
В зависимости от мол. веса - ж. или R R
тв. в-ва, эластичные
H2SiF6, кремнефтористоводородная к., оч. сильн., сущ. только в р-ре (макс, конц. 61%), яд, летуча; • 2Н2О, т. пл. 19;
4Н2О (= [H5O2]2SiF6);
• 6Н2О (= [H5O2]2SiF6 • 2Н2О);
азеотроп с Н2О 13.3%.
M^iFe, М = Na ("малладрит"), К ("гиератит"), Rb, Ва/2, не р. в Н2О; М = Li, NH4 ("барарит"), Cs, Mg/2,
Zn/2, Al/3, p. в H2O; MF + SiF4f; стр. тип K2PtCI(>, анион - окт (sp 3d2), Si—F 1.70
MSiF5, M = Cs, [R4N], [Ph4As] (разл.
245, p. в орг. р-рителях)
K3SiF7 n)
Ca(SiN)2, аналог цианида
CaSiN2, аналог цианамида
-H2O(Z)
(si(OR)j
[SiO2 • х Н2О]„, х < 2, образ, золи и гели H4SiO4, сущ. в истинных р-рах, К\ = 10 10, Х2
Н2СО3 Т1 МГ; M2SO4(Z)
>12
M2O„ • m SiO2 • x H2O, силикаты,
- тетраэдр [SiO4], Si—О « 1.57 (конц.), 1.68 (мост.)
Листовые
[Si2O5l?r, димета-
Ленточные, амфиболы [SLOnl6
Цепочечные, пироксены |SiO3|?<, полимета-
СаАЫЗцОцЫОН),.
"тремолит"
Mg3[Si2O5]2(OH)2, "тальк"
KAl2[(Si3Al)O10](OH)2, "мусковит" (слюда)
Островные
[SiO4]4 , орто-
Be2[SiO4], "фенакит" Zr[SiO4], "циркон" M?Min[SiO4]3,
Mn = Mg, Ca, Fe, Mn; M111 = Al, Fe, Cr, гранаты (Mg-Al, "пироп")
[Si2O7]6 , диорто-
Sc2[Si2O7], "тортвейтит1
[Si3O9]6 , тримета-
BaTi[Si3O9], "бенитоит"
[Si4O12] 8 , тетрамета-
Ca2FenAl2(BO3)(OH)[Si4O12], "аксинит"
В стр. силикатов тетраэдры [SiO4] сочленяются только вершинами.
Na2O CaO 6SiO2, стекло, в его стр. [SiO4] и М+ расположены нерегулярно
M4[Si(W12O40)| vH2O; H4[Si(W12O40)] иН2О, n = 13, 16, p. в H2O и эф.
[Si6O18]12 , гексамета-
Be3AI2|Si6O|8|, "берилл1
ф M
В водном р-ре силикатов (им условно приписывают состав M2SiO3) сущ. равновесие полимеризации:
л 2Н+(-Н2О) , иН+(-п/2Н2О)
п [SiO4]4 ± п/2 [Si2O7]6 > [Si„O3„]2n
ОН" Н 3 н
/;|H3SiO4| -орто-
Н Н 4Н + и/2 [H4Si2O7]2 диорто-
ОН" I нН
r[H„Si„O3„]n-
п = 3-6, мета-(циклы)
Каркасные алюмосиликаты, в стр. - трехмерная сетка тетраэдров [(Si,А1)О4] K[(AlO2)(SiO2)3], полевые шпаты Nai2[(AlO2)i2(SiO2)i2], цеолиты
27H2O
В стр. - полости в форме кубооктаэдров диаметром 11.4 с отверстиями 4.2 и 2.0А ("мол. сита")
[Si7O21]14 , гептамета-, цикл из 7 тетраэдров
Ba7[Si7O21] • 10 BaCl2 13)
59
ГЕРМАНИИ, ОЛОВО, СВИНЕЦ
4- *
э.о
2 +
Ge„H2n+2, германы г., бц.
т. пл.
т. к.
GeH4
разл. 220, АН =+92
Ge2H6
Ge3Hs
Ge4H|9
GesHji
Ge9H29
+ НС1 —> GcH„CI4
+ HI —> Gel2 + Н2; стр.
аналоги С„Н2и+2, Ge—Н 1.53, Ge —Ge 2.41 18)
-166
-109
-106
-88
31 111 177 234
SnH4, станнан, г., яд, т. пл. —146, т. к. —52, разл. 20, (150° -быстро, к-p Sn), АН = +163, мол. -тетраэдр, Sn—Н 1.70 Sn2H6
РЬНд, плюмбан, г., бц., разл. при оч. низких Z; АН = +251
Полигерманы, тв. в-ва (GeH2)„; (GeH)„ 1) желт., оч. реакц. 2) бел., уст. только в р-рах ж. NH3
Ge°
Sn°
Pb°
4d
4p
ШШ Ш
5p 5d
ПЕП Ш
6d
45
2.0
1.8
GeO
1.5
GeO (?), порошок, темно-/ серый, возг. 700,
АН = —255, мало р. в к. и щ.
желт, форма
Ge(OH)4, бел., желт, или красн., р. в к. Кк < VK(CH3COOH), в щ. —» кор. золи
350° (N2)
SiH4;
(SiH3)3P;
i2(-hi)
Na(NH3 ж.)
^~Н2)
SnO, крист., темно-син. (красн. форма метастаб.), т. пл. 1040, т. к. 1425, АН = —284, окисляются на
возд., стр. тип а-РЬО; тв. SnO Sn + SnO2, но уст. в ж. и г.
120°(атм. N2)
SnO • иН2О(., бел., р. в к. и щ.
Sn6O4(OH)4 ("6 SnO • 2Н2О"), мол. - окт.
кластер [Sn6], над центрами граней - 8 ат. О 21)
M2O,
[GeH3]X, соединения "гермила"
GeH3F
GeH3Cl, ж., бц., т. пл. -52, т. к. 28, ц = 2.13
СеНзВг
GeH3I
Мол. - тетраэдр, L HGeH 111, Ge —Н 1.52, Ge —Г 1.73(F), 2.15 (Cl), 2.31 (Вт), в стр. - цепи Ge —Г... Ge
H3GeSiH3, т. пл. —120, т. к. +7
GeH3PH2
(GeH3)3P
NaMH3, M = Ge, Sn, натрийгерманил, -станнил, крист., бц.,
(1ХНз Na+ + [GeH3]"; уст. Ge + Sn,
> -33°
> NaGe + 3 H2
SnH3Br, мол. - тетраэдр, Sn—Н 1.76, Sn—Вт 2.47
О д
Ge2H5I, дигермилиодид, разл. « 0
Ge мет., серый, оч. тв., хрупкий, >550° пластичен, полупроводник, прозрачен для ИК-лучей, d 5.32 т. пл. 937 т. к. 2850 р. в (Н2О + щ.), HNO3 (медл.), H2SO4 и ц. в £ом2 + /Мтв~° куб. алмазная стр. а = 5.66, Ge —Ge 2.45 125° f| 12 -109 Па стр. тип бел. Sn, d = SAT, а = 4.88, с = 2.58 Sn а-, "серое", d = 5.75, стр. тип алмаза, а = 6.49, Sn-Sn 2.81, полупроводник >13.2° | /+, "белое", мет. ковкий 7.31 р. в конц. к. и щ. -0.136 тетраг. (искаж. алмазная) стр., а = 5.82, с = 3.17, Sn—Sn 3.17 и 3.02 | 161° у-, ромб., мет., хрупкий, d = 6.6, т. пл. 232, т. к. 2620 РЬ мет., мягкий, синевато-бел., не пропускает у- и рентгеновское излучение 11.3 327 1751 р. в HNO3 (разб.), H2SO4 (>80%) и (СН3СООН + О2) -0.126 куб. пл. упак., а = 4.94, Pb—РЬ 3.50
[Sn3O(OH)2]SO4 2)
[Sn3O(OH)]PO4, в катионе - тр-к [Sn3],
Sn—Sn 3.52, в гр. [:SnO3]
Sn—О 2.1-2.3 Sn2O(NO3)2, разл. 100 [Sn3(OH)4](NO3)2
OH
* См. примечание к с. 58
NaOH (0 3_]j22-______
~ __ -JijSO^ + Hcl
GeF2
Ge(CN)2, Ge(NCO)2, Ge(NCS)2, вязк. ж., p. в ац., Thf
SnSO4, крист., бц., разл. 360, в стр. - ^-тетраэдры [:SnO3];
2Н2О
Sn(NO3)2 • 20Н2О, крист., бц., оч. неустойчивы
Sn3(PO4)2, в стр. - ^-тетраэдры [:SnO3] и окт. [SnO6], Sn—0 2.1-3.2 2)
Станнаты (II) св.-желт. M4[Sn(OH)6], анион - окт.
Na[Sn(OH)3], Na2[Sn2O(OH)4] Na4[Sn4O(OH)10|; Ba[SnO(OH)2] M4SnO3; K2Sn2O3, K2SnO2, в стр. ^-тетраэдры [:SnO3], Sn—О 1.96-2.09 20)
Na2Sn(C2O4)2, анион -[:SnO4] - (//-тетраг. пирамида, Sn—О 2.25-2.36 23)
Германиды 8)
MGe, М = Na-Cs, крист., темные, в стр. тетраэдры [Ge4], Ge —Ge 2.58, -400° хт , „ -----> Na + Ge MGe4, M = K-Cs
M
\%>
H2O + CO2
Сн’Соон
Полианионные соли
Цинтля 19)
M4Ge17 = M4[Ge4]2[Ge9] Na„[39], Э = Ge, Sn, n = 2, 3, 4;
Na2[Sn4]; Na2[Pb5]; NaPb3 8) Na5[TlSn3], Na[GaSn5] Na8[SnSb4], в стр. - искаж. кубы [SnSb4Na4] Sr[Sn3Sb4], анион -30-членный цикл;
[М4] - тетраэдр, [М9] -триг. трехшапочные призмы
—L || L (NH3, Еп, криптанды) [Na4En5][Ge9]
[Na4En7][Sn9] [Na(NH3)9]4[Pb9] [KCrypt]3[Sn9]
Сплавы
Бронзы, Си + Sn
Баббиты (для подшипников), Pb + Sb + Си Типографские, 5-30% Sn, 10-20% Sb, 50-80% Pb
Мягкий припой, 30-70% Sn, остальное - Pb, т. пл. 181 (65% Sn)
GeSJ., крист., серые с мет. блеском, т. пл. 615, возг. 800, АН = -105, р. в (NH4)2S„, в стр. - слои. окт. [GcS(>], Ge—S 2.47-3.00 22) Cu3(Fe,Ge)S4, "германит"; + HNO3 + H2SO4 GcO2[ GeSe, крист., кор., т. пл. 667 GeTe
SnSJ., кор., ПР = 10 2S, р. в к.-окисл., конц. НС1, (NH4)2S„; не р. в (NH4)2S (IV аналитическая гр.), т. пл. 880, т. к. 1230, АН = —105
SnSej., серый, т. пл. 861
SnTej., порошок, серый, т. пл. 780
M2Sn2S8; M2Sn2S5
Cs5Sn2S6; Cs2SnS1410)
Ge[Fe(CO)4]4, в мол. - тетраэдр [GeFe4], Ge —Fe 2.40, Fe —Fe 2.82
{HSn[Mn(CO)5]2}2, кластер, Sn—Sn 2.89, [SnHMn2Sn] - искаж. тетраэдр, Sn—Mn 2.73 '*
GeH2Cl2
GeH2Br2 мол. - тетраэдры,
Ge—H 1.52-1.56, Ge —Г 2.13 (Cl), 2.27(Br)
60
”3 + ”
4 +
489°
РЬО, а-, красн., "глет", -----*
тетраг., в стр. - слои тетраг. пирамид [:РЬО4], РЬ—О 2.30, (7 = 9.36
-Н2О
РЬО • хН2О(, бел., р. в к. и щ., KXl = 10 12, К — 10-3 г- _ in-8
JVOCH.1 — iV •> JVOCH.2 — iV
| NaOH (t, p)
Pb6O4(OH)4, изостр. Sn-производному 21) Pb13O7(OH)12, крист, 26)
О2(500°)
/?-, желт., "массикот", ромб., т. пл. 886, т. к. 1580, d = 9.66; АЯ = -217, р. в Н2О в 2 р, < "глета"____________
МОН (разб.)
л (PbO2
Pb3O4 = Pb2IPbIVO4, крист., красн., сурик, "минимум", разл. 500, в стр. - цепи (/(-тетраэдров [:РЬПО3] и окт. [PbIVO6]; + HNO3 —> 2 PbNO3)2 + + PbO2i
РЬ(С1О4)2 ЗН2О, разл. 100
[РЬ4(ОН)4](С1О4)4 2Н2О, в катионе - тетраэдр [РЬ4], РЬ—РЬ 3.81, РЬ—ОН 2.41 5)
РЬ6О(ОН)6(С1О4)4 Н2О
РЬ(С1О2)2, взр. 126
РЬ(С1О3)2 Н2О, разл. ПО, оч. хор. р. в Н2О
РЬ(ВгО3)2 Н2О, разл. 180 /СГ\
РЬ(Ю3)4, разл. 300; PbHIO5i, разл. 130, • Н2О
PbSO4j., крист., бц., т. пл. 1170, ПР = 10 s, Г
Хдис = 10 4, р. в конц. к., СН3СООМ; "англезит", к. ч. РЬ 12 (РЬ — О 2.63-3.25);
• РЬО, ("ланаркит"); • 4 РЬО, в стр. - слои тетраэдров с общ. ребрами и вершинами, РЬ—О 2.19-2.4 5) Pb(HSO4)2 H2Oi; PbSO3i; PbS2O8 3H2O, хор.
р. в Н2О; PbS2O6 • 4Н2О, хор. р. в Н2О РЬСгОД, оранж., т. пл. 844, ПР = 10 |4, "хромовая желтая", р. в конц. HNO3 и щ. РЬ2Сг2О7, красн.; +Н2О —> РЬСгОД Pb(NO3)2, разл. 470, не р. в конц. HNO3;
• Н2О, к. ч. РЬ 9 и 10, РЬ —О 2.5-3.2 Pb(OH)„(NO3)2_„, п = 1, 1.45, 1.5, 1.7 28) РЬ3(РО4)2(, т. пл. 1014; РЬ5(РО4)3С1, "пироформит" РЬ2Р2О7; н2о;
РЬНАяОД; PbH4(AsO4)2(, разл. 140
Pb5(AsO4)3Cl, "миметезит"
РЬ(НСО3)2, хор. р. в Н2О
рьсо4, "белая свинцовая руда" ("церуссит"), разл. 300, к. ч. РЬ 9, РЬ—О 2.62-2.77 П) РЬ3(СО3)2(ОН)Д, "гидроцеруссит" ("свинцовые белила'"
РЬ(СН3СОО)2, т. пл. 280, ЗН2О ("свинцовый сахар");
• 10Н2О, т. пл. 22
PbSiO3, "аламозит"; Pb2SiO4, в стр. - ф-окт. [:РЬО5], РЬ—О 2.15-2.66 5)
Pb3Si2O7, "барисилит" (содержит Ва)
PbZn[SiO4], "ларсенит"
Pb(CN)4, p. в KCN
PbS)., черн., т. пл. 1120, t. k. 1281, \H = —92, ПР = 10 29, p. в разб. HNO3, не p. в (NH4)2S„ (в отл. от GeS и SnS) и в щ. (в отл. от РЬХ2(), "свинцовый блеск" ("галенит"), стр. тип NaCl, полупроводник
Pb[S2], разл. -20; + НС1 H2S2
PbSe, т. пл. 1065 |
РЬТе, т. пл. 924 J
полупроводники
Pb32S4, Э = As ("сарторит"), Sb ("цинкенит"), Bi ("галеновисмутит"); Pb(N3)2)_, взр. 350
Плюмбаты (II) 25) Na2[Pb(OH)4] Ва3РЬО4; М4[РЬО3] М4[РЬ2О4|; М2РЬ2О3, в анионах - (^-тетраэдр [:РЬО3], РЬ—О 2.1-2.2
Плюмбаты (II, IV) 32) КРЬО2, Rb2Pb4O7 М7РЬ2О7, в стр. РЬП -окт. или [:РЬО3], PbIV - тетраэдр, РЬ —О 2.1-2.7
H2[Pb(SO4)2]
M2[Pb(SO4)2],
M = К ("пальмерит")
2.3 +
Sn7(OH)12(SO4)2
О
О и
K2[Pb(NO3)(NO2)3] Н2О, 30) крист., оранж., к. ч. РЬ 9 (80+IN), РЬ—0 2.5-2.8, Pb—N 2.92
К[РЬ4(РО4)3], в стр. - [:РЬО6] и [РЬО9], РЬ—О 2.4 и 2.7
Na[Pb(CH3COO)3] ЗН2О
M2[Pb(SCN)4], гидрол.
Sn2(CH3COO)6, разл. 300
Sn2S3, в стр -цепи окт. [SnS€)], Sn(IV) — S 2.50-2.61 Sn(II) —S 2.64-2.74
33)
1000° (-Cl2)
2 +
F2 (HF ж.); SnF4
[Sn2F3]r; [Sn3F5]F; [Sn5F„]r10_„, Г = Cl-I 40)
Hci
2а’Хм^
SnF2, крист., бц.
SnCl2, крист., бц.
• 2Н2О, "оловянная соль",
Н2О
SnBr2, желт.
Snl2, красн., в р-ре сл. дис. и гидрол.
Н2О
3)
т.пл. т. к. АЯ Sn—Г(г.)
215 — -648 2.06
247 38 652 -352 2.43
232 638 -254 2.55
320 720 -152 2.78
SnCl2, < >• Sii4(OH)6C12i; Snr2 (Г = Cl-I) p. в opr. р-рителях. В стр. SnF2 - циклы [:SnFF2/2]4, Sn—F 2.05-2.18. В стр. SnCl2 - цепи ^-тетраэдров [:SnClCl2/2], Sn—Cl 2.67 и 2.78, ZCISnCl 80 и 150, в стр. Snl2 - 1/3 ат. Sn образ, цепи окт. с общ. ребрами, 2/3 - семивершинник, Sn—I 3.0-3.7; в г. - угловые мол. [:SnF2], ZTSnF 99 (Cl), 100 (Br), в стр. SnCl2 • /г Н2О - ^-тетраэдры [:SnCl„(H2O)3_„], Sn—Cl ~2.6, Sn—О -2.3
KSnF3 0.5 H2O, анион - цепь ^-тетраэдров, Sn—F 2.01 (конц.), 2.27 (мост.)
NaSn2F5, анион -[F2 = Sn—F — Sn = F2]-, Sn—F 2.07 (конц.), 2.22 (мост.)
MSn3F7
HSnCl3 3H2O, t. пл. -27
[H9O4]2[SnCl6] 2H2O
M[SnCl3] • H2O, анион -</<-тетраэдр [:SnCl3], Sn—Cl 2.51 [R4N][SnBr3], </<-тетраэдр, Sn—Br 2.72
[R4N]3[Cr(Snr3)6]
MSn2Br5, Sn—Br 2.7-3.1
MSnI3, MSn2I5, M3SnI5
Уст. [SnF4]2 падает по ряду Г:
F > Cl > Br > I 4)
иРЬС12 РЬ(ОН)Д, n = 1 "лаурионит", в стр. - квадратные антипризмы
[РЬО3С15]; 2 ("фидлерит"); 3 ("пенфильдит")
РЬС12иРЬО, п = 2 ("мендипид", т. пл. 693); 3 ("бликсит"); 6 ("лореттоит")
РЬ3О2Вг2, в стр - цепи тетраэдров [РЬО4], к. ч. 6 5)
РЬ12 2РЬО, в стр. к. ч. РЬ 6-8, РЬ —О 2Z2-2.4, Pb—I 3.2-4.0 5)
39) ПР т. пл. т. к. АЯ РЬ —Г
PbF2)_, крист., бц. 10 8 855 1292 -677 2.13
PbCIF), крист., бц., "матлокит" 10 9 — — — —
РЬСЬЦ, крист., бц., "котуннит" 10 5 501 954 -360 2.46
РЬВг2)_, крист., бц. (распл. - красн.) 10 6 373 916 -276 2.60
РЬ12(_, листочки, золотистые 10~9 412 954 -175 2.81
Стр. PbF2 при 20° и РЬС12 (высокотемпературная^ - типа CaF2;
РЬС12, PbF2 (высокотемпературная) и РЬВг - ромб, стр.,
к. ч. РЬ 9 (трехшапочная триг. призма); РЫ2 - стр. типа Cdl2;
в слоистой стр. PbCIF - к. ч. РЬ 9, в Pb—С1 2.44, 7ГРЬГ 98-99 (F-I). г. - угловые мол. РЬГ2,
\Г2
МРЬ2С15; М1П[РЬ4С111] МРЬС13; М2РЬС14
Т13РЬС15
МРЬ2Вг5; М2РЬВг4 Т13РЬВг5
НРЫ3 ЗН2О МРЫ3; Т13РЫ5
ТЦРЫб, крист., бц., анионы - окт. или одношапочные триг. призмы [:РЬГ7], РЬ —Г 2.7 (С1), 3.0 (Вг), 3.2(1) 38) Уст. [РЬГ4]2 растет по ряду:
F < Cl < Br < I
62
”3 + ”
4 +
GeOF2
GeOCl2(?), масло, бц., т. пл. —56; + Н2О —> Ge(OH)2 + О2 (?); t —> СеО(желт.) + С12
Ge2F6, 6) 42) т. пл. т. к. АЯ Ge —Г(г.)
A// = —1632
Ge2Cl6, крист., бц., GeF4, г., бц., с запахом -15(р) -37 -1188 1.67
т. пл. 41, летучи, чеснока; • 3 Н2О (возг.)
АЯ= —565 GeF3Cl -66 -20 — 11.68
GeF2Cl2 -52 —4 — 12.07
GeFCl3 -50 37 — —
GeCU, ж., бц., не р. в НС1, -50 86 -540 2.11
fGeP" р. в орг. р-рителях, SO2
GeBr4, ж., бц. 26 187 -348 2.29
GeCl3I — — — —
i2 (-hi) Gel4, крист., оранж., 146 377 -142 2.50
изостр. Snl4 с разл.
GeF4 • 2L, окт.
GeBr3[M(CO)5], М = Mn, Re
M[GeF5], М = [О2], XeF5, NO2 к. ч. Ge 5 или 6
K2GeF6, т. пл. 730, т. к. 835, хор. р. в Н2О, стр. тип K2PtCl6, Ge—F 1.76-1.84
M3GeF7
M2GeCI6, стр. тип K2PtCI(>, Ge—Cl 2.35 34)
7)
Sn7F16 = [Sn^F10]2+[SnIVF6]2-Sn3F8i = [SnnF4/2]2[SnIVF2F4/2], Sn—F 1.96-2.5
Sn2Fg
Sn2Cl6, Sn + SnCl4
SnOF2, SnO + SnF4
HF
36) т. пл. т. к. АЯ Sn—Г(г.)
SnF4, крист., бц. — 705(возг.) — —
SnCU, ж., бц. -34 114 — 2.27
5Н2О 56 — — —
SnCl3Br, ж., бц. -1 50 — —
SnClBr3, ж., желт. 1 73 — —
SnBr4, крист., бц. 31 205 -93 2.44
4Н2О — — — —
Snl4, крист., желт. 145 344 -215 2.64
(возг.)
В стр. SnF4 - слои окт. [SnF2F4/2]oo, Snr4 (Г = C1-I) -
тетраэдрические мол.; SnF 4 • 2L - окт.
Snr3[M(CO)5], M = Mn, Re, Г = Cl, Br, Sn-Mn 2.67
35)
[NF4]SnF5, анион - i/MC-[SnF4F2/2], M2[SnF6], H2O анион - окт.
(NH4)3[SnF6]F
M3HSnF8 = M3[HF2][SnF6]
H2SnCl6 6H2O, t. пл. 19
M2SnCl6, стр. тип K2PtCI(>, Sn—Cl 2.42
MSnCl5, анион - триг. бипир.
H2SnBr6, 8H2O
M2SnBr6, Sn—Br 2.59
M2SnI6, Sn—I 2,84
Sn
РЬОС12, крист., фиолет.
PbF4, иглы, бц., оч. гигр., т. пл. 600; \Н = —941; в стр. - слои окт. 36) РЬСЦ, ж., желт., дымящая, т. пл. —15, взр. 105°, АЯ = —331, в мол. стр. - тетраэдры, РЬ—С1 2.43; + н2о рьг2; + г2
M3[HPbF8|; M2PbF6, окт. анион,
SrPbF6 = Sr[PbF4F2/2]F
М2РЬС1б, крист., желт., стр. тип K2PtCl6, Pb —Cl 2.50
I Br2
M2PbBr6
M2PbI6
— H2O (-r2)
4-
0
2 +
4 +
63
ТИТАН, ЦИРКОНИИ, ГАФНИИ
Ti°
Zr°
Hf®
45
3d
ОУ
Ti Zr Hf
мет., серебристо-бел., ковки (хрупки в
присутствии следо в О, N, С, Н), уст. на возд.
d 4.5 6.5 13.1
т. пл. 1668 1855 2230
т. к. 3260 -4340 5197
£oTi2+/TiTB= “163 £0Ti3+/TiTB= -1-21 £ом4+/Мтв= -1-43 -1.57
р. в HF, НС1, конц. кислотоупорны,
H2SO4 и щ.; пассивируется HNO3 р. в (HF + HNO3), ц. в.
а-, ге ксаг. пл. упак.
а = 2.95 3.22 3.20
с = 4.68 5.13 5.08
J 882° J 862° | 1760°
Р-, куб. (стр. тип. a-Fe)
а = 3.32 3.61 3.54
Ферросплавы, тв., вязки., уст. к коррозии "Ферротитан", 15-25 или 40-50% Ti, 3-6% Si, 5-8% Al, 3% Си, и 0.1% C, S, Р; в системе Fe-Ti сущ. тв. р-р вычитания Ti2Fe, TiFe, TiFe2, и TiFe3 "Ферроцирконий", раскислитель в сталях; в системе Fe-Zr сущ. тв. р-р и Zr2Fe3 (т. пл. 1640)
0(W4)
Ti6O, Т13О, Ti2O, Zr3O
МГ4 (0
MCI, М = Zr, Hf, порошки, черн., графитоподобная слоистая стр. ММС1С1М...
ZrCl, ДЯ = -286 HfCl„, п = 0.92-0.99 ДЯ = -289 ZrBr, ДЯ= -193 HfBr, ДЯ = -204 Zrli.o-i.3, ДЯ=-142;
1 —М + МС14
А1С13 (200°)
TiO2 + Fe2O3 (из руды)
2 + (<Г)
TiOi±x, порошок, золотистый, т. пл. 1750, ДЯ = —519, р. в разб. к. (—>Н2Т), стр. тип. NaCl
Ti(OH)2 черн., мгнов. окисляется возд.
TiF2, разл. 354, стр. тип. CaF2 29) 2.29 +
Ti7Cl16, Ti7Br16, Ti7I16, крист., черн., воспл. на возд.;
ДЯ= -514(С1), -389 (Вг), —268 (I); р. в Н2О, си., ж. NH3; в стр. - ат. Ti(II) и Ti(IV), Ti —Ti 2.95
Ti(AlCl4)2, в стр. -окт. [Tide], Ti—Cl 2.56 29)
M2TiCU
CsTiCl3, черн., в стр. - цепи окт.,
Ti—Cl 2.51 18)
Na2Ti3Cl8, в стр. - кластеры [Ti3]6+ 18)
CsZr6I14
ZrF4
ZrF2,
Zr6Cl15
ZrBr2, уст. на возд. 14)
[Zrl2]6; Zrl2 4,
кластеры, Zr — Zr 3.20, крист., черн.;
t—>ZrCl + ZrCl4;
t —> Zr + Zrl4;
ДЯ = -963(F), -522 (Cl), -260(1)
Ti(C5H5)2, титаноцен, крист., темно-зел., т. пл. 173, окисл. возд., диамагн., стр. аналог ферроцена
[Ti(N2)(C5H5)2]2
Ti(C5H5)2(CO)2, крист., красн., т. пл. 90 с разл., воспл. на возд.
H2SO4 (разб.)
HfCl192_198 17)
HfBr2,
t —> HIT + HfT4
TiCL
М
A1R3
К
К
Ь
Н2; /(-МГ4Т)
о
2 +
Ti2O3, порошок, фиол., т. пл. 1830, ДЯ = -1518, р. в к.-окисл.;
TiO + TiO2; стр. тип корунда, Ti — О 2.05
Ti(OH)3 ], фиол., р. в к., сильн. восст., + NO3 —> NH3
Ti3O5,
крист., син., ДЯ = -2456
Ti4O7 2)
Ог (одновременно идет сопряженная р-ция:
(индуктор)
Н2О + О2 —> Н2О2) (акцептор) (актор)
МТЮ2, титанаты (ш),
М = Li, Na, Mg/2
3Ti2(SO4)3 H2SO4 25Н2О, крист., фиол.
Ti2(SO4)3 ] , порошок, зел., р. в к.
M2SO4 24Н2О, М = Rb, Cs, квасцы, красн.
TiOCl; TiOBr 30)
3) АЯ
TiF3, крист., пурп. или фиол.; 950° _ , > Ti + TiF4 -1490
TiCl3, крист., возг. 400, а-, изостр. FeCl3, фиол. | >200° Р-, цепь окт., коричн. • 6Н2О, крист., фиол. или зел. -719
TiBr3, крист., черн. • 6Н2О, т. пл. 115 -548
Til3, иглы, черн. -339
В стр. МГ3 (М =
M[Ti(SO4)2] 12Н2О, М = Rb, Cs, Н(- 4Н2О)
M[Ti3(SO4)5] иН2О
3)
MTiF4, М = Na—Cs, TI, NH4, крист., роз., в стр. — слои окт., Ti —F 1.88-2.04
M3TiF6, фиол., гол.; Na5Ti3F14
K3TiCl6; CsTi2Cl7
Cs3Ti2Cl9, дэфф = 1.3, стр. аналог [W2C19]3-, но Ti—Ti и 3.2
K2[TiCl5(H2O)|
Cs2|TiCI2(H2O)4|CI3-/n/>a7/c,
крист, с дихроизмом (бц.-фиол.), Ti—Cl 2.40, Ti —О ~ 2.04
K3TiBr6; K3Ti2Br9
•
NaTi2O4, в стр. - цепи окт. [TiO6] 2) Бронзы 2) NaxTiO2, х = 0.2-0.5, крист., черн., в стр. -слои окт. [TiOe], Ti —О 2.01, Ti—Ti 2.98 Naj^^Ou
17)
17)
M2[Zr(CO)6], 15) крист., фиол., светочувствительны Li[MDipy3], М = Ti, Zr, крист., черн.
Li2[TiDipy3] 6Thf, разл. 230
[MDipy3],
крист., фиол., р. в бзл., мол. - окт.
Ti(C6H6)2 K4Ti(CN)4,
Мэфф 2.17
K5Zr(CN)5 цэфф = 2.69 14)
МС14
Ю)
Zr9S2; Ti2S; Zr2S; Hf2S; TiS, стр. тип NiAs
ЛЭ; Ti233; Ti32, проводники
Zr233; Zr32, полупроводники, 3 = S-Te
Hf233; HfS2, диэлектрики
Все халькогениды уст. на возд., р. в конц. H2SO4, HNO3
HfOS; Zr2ON2; ZrO8\4: Zr7O95N3
BaMS3, M = Ti-Hf, стр. искаж. перовскита
MN, крист., бронзово-желт., оч. тв., т. пл. 3200 (Ti), 2950 (Zr),
2980 (Hf), р. в щ. (0, (HF + КМпО4), ц. в.; проводимость MN>M, стр. тип NaCl
Zr4N, Zr3N4, крист., кор.; Li5TiN3; M2TiS3; BaZrN2
стр. тип Cdl2
TiS3
Zr93
Hf93
64
MC, карбиды, крист., оч. тв., т. пл. 3250 (Ti), 3735 (Zr), 3890 (Hl), р. в HNO3, H2SO4, HF, проводники, стр. тип NaCl
HfC • 4ТаС, т. пл. 3990
ZrB12
TiHl 5_2 o, стр. тип CaF2, к-p гидрирования; ZrHi.3_2.o, стр. тип CaF2
АЯ
ZrCl3]., крист., —755 черно-зел., в стр. -цепи Zr — Zr —...
ZrBr3], крист., —727 черн.
ZrI2.64 - 3.4, —53 6
черно-фиол.
ZrT3 оч. сильн. восст.;
+ Н2О —> Н2 (мгнов.);
+ TiIV —► Ti2 + ;
+ К+ (ж. NH3) —> К
HfCl2.8_2.9, 420° HfCl2, АЯ= -758 НП3, крист., черн. АЯ = -473; диспропорцио-нируют и восстанавливаются труднее Zrl3
= Ti, Zr, Г = Cl—I) - пары окт. с общ. гранями; t —> M(II) + M(IV); Ti —Вг ~ 2.6, Ti —Ti 2.63, Zr—I ~ 2.9, Zr —Zr 3.17
Ti(C5H5)3. крист., зел., возг. •
Ti(C5H5)2Cl, крист.,
кор., т. пл. 283
[Ti(H2O)6]2+, бц. (?), парамагн. (d2), окт. (d2sp3)
Ti ±±СГ«Vf. у, V1X1.
\ ион, мгнов. разл. Н2О
Zr
Н
\ ц. в.; HF + HNO;
[н ?]
Н2О(-Н2)
K3[Ti(CN)6] — K5Ti(CN)8
K4[Ti(CN)7], крист., син. 6)
M3[Ti(NCS)6] 6Н2О
__ [Ti(H2O)6]3 + , фиол., пара-магн. (dx), окт. (d2sp3) ион -
[Zr(H2O)6]3+, оранж. окт. ион
[НТ]
О2; H2O(Pt)
__ TiIV, входит в состав диамагн. (Я0), окт. ионов
|Ti(OH)„(H2O)6_„|<4-", + , п + 4
[Ti(OH)2(HSO4)] +
[Ti(OH)„r6_„]2-, п > о
1(ТЮ)8(ОН)12]4+ 16)_________
I Н2О (0; NH4OH
TiO(OH)2 иН2О|, бел.
н202 [Ti(O2)(H2O)„]2+ ярко-желт, ион, оч. уст. при pH < 2, сильн. окисл.
н202
н20
[Ti(O2)2(H2O)„], бц.
Н2О2
+ ОН-
[Ti(O2)4]4-
красн. ион
[Zr3(OH)6Cl3]3 + ZrIV входит в состав 8-координационных
Cl- || Н2О |Zr4(OH)8(H2O)|6|8+ ионов, подвергающихся в водном р-ре гидрол. и полимеризации, равновесие к-рых устанавливается оч. медл.
н+ || ОН- ZrO2 • и Н2О | SO4- „ U [Zr18O10(OH)26(SO4)13]0 16)
Н2О || ОН- [Zr(OH)5(H2O)„r д [Zr(OH)6]2-,
сущ. в Юн. р-ре NaOH в 15н. р-ре NaOH
Стр. рутила
28)
TiO2, крист., бц., d = 3.6-4.3, т. пл. 1870, т. к. «3000, медл. р. в к.-окисл., сплавляется со щ. и NaHSO4, АН = —941, в тетраг. стр. "рутила" - сетка окт. [TiO6] с общ. вершинами и тр-ки [OTi3], Ti—О 1.96, Ti—Ti 2.96, в стр. "брукита" и "анатаза" - искаж. окт.;
анатаз -----> рутил-----> куб., изостр. CaF2
850° Z, р
(Т1о.67^Го.зз)02, "шриланкит" изостр. а-РЬО2 28)
—Н2О (Z, время)
4 + (</°)
мтр.
43п
ZrO2 I HfO2
порошки, бел., р. в HF, распл. щ.
2850
5.73
-1101
("бадделеит"), нерегулярная стр., к. ч. Zr и Hf 7
2900
9.68
-ИЗО
nh4oh
H2o (t)
^Ч1^Н2)
/4°^
О/
TiO(OH)2 • лН2О(., бел., аморфный, п < 1, "/^-титановая к.", р. в HF и конц. HNO3 (Z); на рентгенограмме - линии анатаза t —Н2О (Z, время)
п = 1-2, "а-титановая к.", свежеосажденная -р. в к. и конц. щ. П)
Н2О ОН он
H OH H о YH2 o
OH2q OH2 o
т. пл. d
АН
а.-, монокл.,
1000° || И
о 2300° -
р-, тетраг. ---> у-, куб.,
к. ч. Zr 8
стр. тип CaF2, стабилизируется при 20е У2О3, МПО и др.
'Ti
-Н2о
HJ° он2
Н2О н ОН2 ц
"оловый" комплекс
О । О он2 он2
оксоловый комплекс
| 1000е
/ТМО(ОН)2, порошки, бел., р. в к.
| 140°
а-МО2 иН2О|, желт., р. в к., М2СОз, пептизуются щ.
ан. окисл.
Стр. перовскита
Титанаты 13)
K9Ti2O7; M2Ti2O5; Na2Ti3O7; K2Ti4O9; Na4Ti5Oi2 K2Ti6O13, (волокнистые); Na2Ti7O15; Na2Ti9O19 M2TiO3 метатитанаты, MnTiO3,
Mn = Са ("перовскит"), Mg ("гейкилит"), Fe ("ильменит"), Mn ("пирофанит"), в стр. -цепи окт.; BaTiO3, сегнетоэлектрик; Ba4Ti1303o M4|TiO4|. Ba2[TiO4], орто-, анион - тетраэдр [TiO4], Ti—О 1.78
M4[Ti(Mo12O40)| • лН2О, в центре - тетраэдр [TiO4]
ZrCl4
Цирконаты, гафнаты 20)
Na2[Hf(OH)6]; K3Hf2O3(OH)5; K2Hf2O4(OH)2;
Na2Hf4O9 5H2O; Li8HfO6
K2MO3; CaMO3; PbMO3, сегнетоэлектрики M6Zr2O7; K4Zr5O|2, к. ч. Zr 6, Zr—О 1.96-2.31 Cs4ZrO4, тетраэдр, Zr — О ~ 1.97; 300° —> Cs2ZrO3 CaTi[Zr3O9], "кальциртит"; M4[Zr(Mo4204o)] • иН2О
Zr2(O2)3SO4 иН2О, 21) n = 8-10
Пероксокислоты HOOM(OH)3 , гели, кор. (Ti) или бел. (Zr, Hf);
+ H2SO4 —> H2O2; уст. Ti<Zr, Hf<Th
Н
Ti(ClO4)4, крист., бц., т. пл. 85, возг. вак. 70, разл. ПО, к. ч. Ti 8 (додекаэдр), Ti—О 2.06 7)
ТЮ(С1О4)2 • 6 Н2О, мало р. в Н2О, хор. р. в си., ац.
TiOSO4, крист., бц., разл. 500; Н2О 26)
Ti(SO4)2, крист., бц., гигр.; Ti(OTeF5)4
TiO(NO3)2 иН2О, гигр.
Ti(NO3)4, крист., бц., гигр., т. пл. 58, возг. вак. 40, воспл. орг. в-ва, к. ч. Ti 8 (додекаэдр [TiO4N4]) Ti(HPO4)2 • иН2О, п = 1,2; TiP2O7, изостр. SiP2O7 (TiO)2(P2O7)2; Ti(HAsO4)2 Н2О
Ba2Ti[SiO4]2, "фресноит"
BaTi[SiO3]3, "бенитоит"
M2Ti2[SiO4]2O, М = Na ("рамзаит"), Са/2 ("сфен", "титанит")
146°
TiOF2, желт., TiO2 + TiF4
TiOCl2, крист., желт., гигр., разл. 180
TiOI2, кор., разл. 105
H2SO4 (475°)
Н2о
Ti
Cs2[Ti(ClO4)6], анион - окт. 7) M2[Ti(IO3)6], M = Li-Cs, Н ( • 2Н2О) 8) H4[Ti(SO4)O3] = "TiOSO4-2H2O'4, "титанилсульфат"
K2[Ti(SO4)3|; K2[TiO(SO4)2] Cs2[Ti(OTeF5)6]
MTiOPO4; MTi2(PO4)3; Na5Ti(PO4)3 8)
K2[TiO(C2O4)2] я H2O
Ba[TiO(C2O4)2] 4.5 H2O, в окт. [TiO6]
Ti—О 1.80-2.13
Na2[TiO(SiO4)|, к. ч. Ti 5
K3H[Ti4O4(SiO4)3] 4H2O
8)
ZrO(ClO4)2 8Н2О, т. пл. 145
М(С1О4)4, крист., бц., летучи, т. пл. 96 (Zr), 105 (Hf), в мол. к. ч. М 8, Zr—О 2.19 7)
М(Ю3)Д, не р. в HNO3, анион - антипризма
M(OH)2SO4; 4Н2О, изостр. соединениям Ce(IV) M2O3(NO3)2 5Н2О, нитраты "дицирконила" и "дигафнила"
MO(NO3)2 • иН2О, п = 3.5-4.5, в стр. - [M(OH)2(NO3)2(H2O)4]
ZrO(OH)(NO3) иН2О, п = 2, 6
M(NO3)4, возг., гидрол. медл., <— л Х2О5; Zr(NO2)4
М(НРО4)2 иН2О, переменного состава, в отличие от др. М' (кроме Ра) выпадает при pH 7, р-р в H2SO4 + Н2О —> Hf(HPO4)2(. + ZrIV (в р-ре)
МО(С2О4) • яН2О|, р. в Н2С2О4, НС1
Zr(RCOO)4; ZrO(CH3COO)2
ZrSiO4(., "циркон", содержит > 1% HfO2
23)
В стр. солей "титанила", "цирконила" и "гафнила" - полимерные цепи —М — О—М—О— . . . связаны полидентатными анионами; окт. [TiO6] и восьмивершинники [ZrO8] и [HfO8] (антипризмы или додекаэдры) образуются ат. О аниона и Н2О. "Ильные" ионы [М = О]2+ не сущ. ни в стр., ни в р-ре
Н
27)
[Ti8O12(H2O)24]Cl8 НС1 7Н2О, в катионе - куб [Ti8]
TiCL
да
5) T. ПЛ. T. K. AH Ti—Г (г-)
TiF4, крист., бц. — 283 -1644 1.75
2H2O TiF3Cl, порошок, желт., — возг. — —
TiF4 + TiCl4 TiCU, ж., бц. -23 136 -803 2.17
TiBr4, крист., желт. 40 231 -619 2.34
TiCl„I4.„, n = l, 2, 3 — — — —
Til4, крист., бур., Ti + I2 155 377 -510 2.55
TiT4 + H2O TiO2 • иН2О( (pH 1.5); в стр. TiT4 и в г. -
МГ4 (M = Ti-Hf), мол. - тетраэдр (i/35), в стр. a -Til4 - цепи окт.
МГ4 • L, L = POC13, SC14; • 2L, L = NOCI, R2O, R2S, RCN и t. д.
K3HTiF8 = K3[HF2][TiF6]
H2TiF6, крист., бц.
M2TiF6 Н2О , анион - окт.,
Ti—F 1.85-1.91
[O2][TiF5]
K2TiCU, крист., желт., стр.
тип K2PtClg,Ti—Cl 2.35
MTiCl5, М = [R4N], [R4As], [PC14]
M[Ti2Cl9], M = [SC13], [PC14],
Ti—Cl 2.21 (конц.), 2.50(мост.) '* |R4X||liBr5|. моно- и димер 12)
K2TiBr6, крист., красн.
M2TiI6, крист., темно-красн.
Zr3F8O2; Zr2F6O, в стр. - антипризмы, Zr—O(F) 2.2 M2O3C12-5H2O(.; MOC12, крист., не p. в орг. р-рителях, • 8Н2О, в стр. - катионы [М4(ОН)8(Н2О)16]8+
НО ОН но он
н
N. TiO(NCS)2 • 2Н2О, крист., красн.
Ti(NH2)3Cl, порошок, красн., TiNCl, зел.
A)/ Z(-NH3)
Ti(NH2)4, кор., ——> Ti(NH)2, взр.
гк VTir„(OR)4_„, п = 1-3
^да
Ti(OR)4, алкил ортотитанаты, бц., гигр., крист.
(R = Me, Et) или ж. (R Рг), перегоняются вак., р. в орг. р-рителях, ассоциированы в р-ре и тв. фазе
Ti(C5H5)2X2, X = Cl, Вт (крист., красн., р. = 6.3), S„/2
Т1(л-С5Н5)2(а-С5Н5)2
MTi(OPr-05
BaTi4(OR)i8
BaTiO( О Pr-/)4 PrOH 31)
K2[TiO(NCS)4] X, крист., красн., X = NH3, Н2О, CH3CN
M2[Ti(NCS)6],
М = K-Cs, [R4N] 9)
Тетрамер в стр. Ti(OMe)4
25) возг. т. пл. АН м—Г возг. т. пл. АН
(р) (г-) (р)
ZrF4 903 912 -1911 1.89 HfF4J. 974 1025 -1929
ZrCU крист., 331 437 -979 2.32 HfCU 317 432 -988
ZrBr4 / бц., 357 450 -761 2.46 HfBr4 322 420 -837
Zrl4 гигр. 431 499 -485 2.66 НП4 392 — -586
+ Н2О — > мог2
В монокл. стр. MF4 - антипризмы [MF8], Zr—F 2.03-2.19. В стр.
ZrF4 • Н2О - каркас додекаэдров. В стр. MF4 • 3 Н2О - димерные мол. [(H2O)3F3Zr]2F2 и полимеры -Hf—F—Hf..., к. ч. М 8, Hf—F 2.0(конц.), 2.15 (мост.), Hf—О 2.2. В стр. МГ4 - цепи окт. [МГ2Г4/2], М — Г 2.48-3.0(С1), 2.7 —3.0 (I), в г. - мол. тетраэдры.
| NH3 (Z)
ZrNT; Zr(NH)2
M(OR)4, R = Me, Et, Bu 32)
|M(OI’r-/)4 t-PrOH]2, крист, или ж., бц. , гигр.
М(СН3СОСНСОСН3)4, ацетилацетонаты, иглы, бц., р. в Н2О, т. пл.
194 (Zr), 188 (Hf), возг. 82/10 3 (Zr)
Zr(C5H5)2r2,крист., бц., ц = 5.9
Ш(л-С5Н5)2(а-С5Н5)2 13>
Cs2[M(ClO4)6|; Cs[M(ClO4)5|; Cs3[Zr(ClO4)7] 7) "Zr(SO4)2 иН2О", п = 4, 5, 7, содержат анионы [Zr(SO4)4(H2O)4]4 . [Zr2(SO4)6(H2O)4]4 и др., антипризмы [МО8], Zr(Hf)—О 2.1-2.3 4) K2[M2(OH)4(SO4)3(H2O)„]
Cs2[M2(OH)2(SO4)4(H2O)„]
Na6[M2(OH)4(SO4)5]; Cs2[M(SO4)3(H2O)3] K4[M(SO4)4(H2O)2|; Na12[M2O(SO4)9(H2O)„]4)
Na6[M(SO4)5(H2O)„] [R4N]2[M(NO3)6]; [(NO2)(NO)3]4 + [Zr(NO3)5]4, к. 4. Zr 9 33)
KZrH(PO4)2; Na2Zr(PO4)2 иН2О; Na5Zr(PO4)3 LiHf2(PO4)3 19)
H4[MO(C2O4)3] 7H2O
Na4[M(C2O4)4] 3H2O, анион - додекаэдр
M2Zr[Si2O5]3, M = Na ("эльпидит"), К ("дэлиит") M2Zr[Si3O9], M = Na (• H2O, "катаплеит"), К ("вадеит")
Na5Zr2[Si6O18]Cl 2Н2О, "эвдиалит", роз.-красн., в стр. - окт. [ZrO(>], Zr—О 2.1
H2[MOF4] 2 H2O; K4Hf2OF10
K4TiO4 4 H2O2 2 H2O, бц.
K4M(O2)4 6H2O,
M = Zr, Hf, бц., не гидрол., сильн. окисл.
Н2О2
K2[M(O2)(SO4)2] 3H2O, крист., красн. (Ti), бц. (Zr, Hf)
M3[TiF5(O2)] лН2О 21)
K4[Ti2F8(O2)2], анионы -пентаг. бипир. или 2 бипир. с общ. ребром [F2], Ti—O(F) ~ 1.9; О—О 1.46
Pb5ZrF14; Pb3ZrF10; M2[Zr2F10(H2O)2] 22)
Li4[MF8], анион - додекаэдр или антипризма m3mf7, анион - пентаг. бипир., (Zr—F 2.00) или одношапочная триг. призма, (Zr—F 2.10) M2MF6(, анион - додекаэдр с 4 мост. F, антипризма, 2 одношапочные триг. призмы с общ. ребром (к. ч. Zr 7), 2 восьмивершинника с 3 F-мост. или окт.
H2ZrF6 • Н2О; MIZrF5, анион - цепь окт. или [ZrF6/2]F2; [H3O]ZrF5 Н2О
М2МС1б, анион - окт., Zr—Cl 2.45
MZr2Cl9; K3ZrCl7
Rb2[HfBr6]
[R4N]2[M(NCS)6], крист., фиол. (Zr) или роз. (Hf)
M[Zr2(OR)9], М = Li-К, [R4N]
BaZr4(OR)i8; K4Zr2O(OPr-t)10
BaZr2(OR)10, R = Et, LPr 31)
K3[Zr2(O2)2F7], H2O 21)
K3[Zr3F6(OH)(O2)4] 3H2O
65
ТОРИИ
2 + (rf2)
3 + (</*)
4 + (rf")
6d Is Ip Э.О.
Th0 5f ши । । । qt] rm i.i
"ThO" cm. РЦ 3ThOi.3Cl0.7
CP
Th, мет., серебристо-бел., пластичный, d = 11.7, т. пл. 1750, т. к. 4200, тускнеет на возд., порошок пирофорен, р. в (конц. НС1 + F"), Ц- в., пассивируется конц. HNO3, ^byh^/Th = —1-87, а-, куб. пл. упак., а = 5.08, Th—Th 3.59
p-, куб. (тип a-Fe), a = 4.11
—s сст,-
Радиоактивный ряд Th (А = 4п):
232 90Th 2|fRa ("MsTh,") — :
1.39-Ю1Олет Р
(100% в минералах)
2joTh ("RdTh")
1.9 лет
Применение Th:
“Th (n, Y)29303Th 29i₽a 29323U
ядерное горючее
i)
ThCl2 (?) ThBr2
Thl2 = Th4+(I-)2e2 (?), крист., золотистые, проводник, т. пл. 566, стр. тип. Cdl2;
880° . .
---> Th + Th 14/
Th(OH)2CrO4 Н2О, в стр. - цепи, аналогичные Th(OH)4
N2O5
Th(NO3)4, «---- 5Н2О, хор. р. в си., эфирах, кетонах (в отл.
от Ln(NO3)3), в р-ре гидрол., в стр. - [ThO8(H2O)3]
Th(PO3)4, крист, из распл. (из р-ра - ос. неопределенного состава), р. в к.; Th(HAsO4)2 • иН2О, п = 1-4 П)
ThO(CO3) 8 Н2О
Th(HCOO)4 5); [Th(HCOO)4(H2O)2] Н2О, к. ч. Th 10
Th(C2O4)2 6Н2ОЦ не р. в к. (в отл. от Zr)
ThSiO4, "оранжит" (оранж.), "торит" (черн.), "монацит" -изоморфная смесь ThSiO4 + LnPO4
ThOT2, Г = F-I, в стр. -цепи—Th—О—Th—
с центрированными гранями)
H2[Th2(SO4)5] 2Н2О; M8[Th(SO4)d
M[Th(NO3)5]; M2[Th(NO3)6], М = М1, Н
Mg[Th(NO3)6] • 8Н2О, к. ч. Th 12 (икосаэдр)
Na6[Th(CO3)5] 12Н2О, к. ч. Th 10,
Th—О «2.5
M2Th(CO3)3 иН2О; Na4Th(CO3)4 7Н2О 6)
(NH4)2[Th2(C2O4)5H
| с2о4
M4[Th(C2O4)4], М = К, NH4, хор. р. в Н2О (ср. Ln), к. ч. Th 10 (двухшапочная квадратная антипризма), Th—О 2.41-2.62 7)
ThCl3 (?) n
ThBr3
Thl3, a-, fi-, к. 4. Th 8 (куб и квадратная антипризма), Th—I 3.2-3.3, Th—Th 3.46
ThO2
ThEd, ПР = IO26, не p. в к. ThCI4, крист., бц., гигр. ThBr4, крист., бц., гигр. Thl4, крист., желт. Стр. ThF4 типа ZrF4, ТЬСЦ и В стр. ThF4 • 1/6 Н2О - триг. л призмы, Th—F 2.31-2.37 4), т. пл. т. к. АЯ •иН2О, п =
1100 770 678 4) 566 ThBr4 т вухшап г. Th— 1680 922 880 837 ипа UC очные -Г 2.14 -2096 -1192 -1012 -673 Л4 (к. ч. 8 тризмы и 1(F), 2.58 1/6, 2, 4 2-12, 8 4, 7, 8, 10, 12 10 )3). тетраг. анти-(С1), 2.72 (Вг)
Thr„(OR)4_„, n = 1-3
Th(OR)4, алкоголяты, крист., бц., гигр., в бзл. р-ре сущ. гекса-и гептамерные мол., перегоняются только при R-Z
Th(CH3COCHCOCH3)4, ацетилацетонат, крист., бц., возг. 160 (вак.), в мол. - додекаэдры [ThO8], Th—О 2.35 —2.43 12)
Th(BH4)4, крист., бц., гигр., возг. 40 (вак.), т. пл. 204, р. в эф.
K5ThF9 (к. ч. Th 8) 2)
Na4ThF8; M3ThF7, к. ч. Th 9 (тетраг. одношапочная призма), Th—F 2.36-2.40
M2ThF6; MThF5; RbTh3F13
M2ThCl6; [PyH]2[ThCl6]
M2ThBr6
K2ThI6; Li3ThI7, в стр. - тетраг. одношапочные призмы [Thl9]
[R4N]4[Th(NCS)8], анион - куб, Th—N 2.47 14)
(NH4)3[ThF5(O2)|
[Th(HSO4)(SO4)] +
H+ || H2O
66
°2 W’^a
В2О3, крист., бц., d = 2.56, т. пл., 450, т. к. 2250, АН = —1276, в стр. - плоские цепи тр-ков [ВО3]
(все ат. О мост.), аналогичные ЫВО2, соединенные вершинами в трехмерный каркас, В—О 1.33-1.40
| Н2О (5-10%, р, Z)
Стекло, гигр., размягчается «200°, АН = —1256, легко р. в Н2О, в стр. - неупорядоченное располо- q жение тр-ков [ВО3] с 3 общ. вершинами (sp2); в г. - угловые мол. 17)
Э2О5 (Z)
В2О3 • Э2О5, Э = Р, As, двойные окислы со стр. кристобалита (вместо Si - ат. В и Э) (раньше -"соли борила" [ВО]ЭО3), крист., негигроскопичные, р. в щ.
-Н2О (Z) П Н2О
в
3 s Й о & м
к
Н3ВО3, ортоборная к., "сассолин", крист., бц., пластинчатые, d = 1.43, т. пл. 171, перегоняется с паром Н2О, окрашивает пламя в зел. цв., р. в Н2О 4.3% (20°), си., слоистая стр.
ЛАЛА
70°
-ВД
[В(ОН)4]- = Х он
НО—В —ОН
ОН
НХ, К= 10’10
Н2О + н
Н‘
[В2О(ОН)6]2- = X
он он
Борные кислоты В2Оз • п Н2О и бораты М2ОИ • т В2Оз • х Н2О 8)
в тр-ке [ВО3] В — О 1.32-1.52, в тетраэдре [ВО4] 1.43-1.54
а-[НВО2]3 = = [В3Оз(ОН)3], триметаборная к., т. пл. 176, ромб., слоистая Н стр.
130'
ЯНВОгЬ, полиметаборная к., т. пл. 201, монокл., цепная стр.
,Н
140'
S;
HO. OH 3°)
V [B3O3(OH)4|- =x
HX - сильн. к.
KX лН2О н
Н2О + н
LiX 6Н2О
NaX, 2Н2О, т.пл. 57
a-CsX 2Н2О
МПХ2, 2Н2О, Мп = Са-Ва
CuClX, "бандилит"
НО—В—О —В—он
9)
MgAl[BO4], "сингалит", в стр. -тетраэдры [ВО4] и окт. [МО6]
ОСТРОВНЫЕ
НО. он
СГ О
ИСК 1 1 /ОН
/В,
нет \о^хон
[В3О3(ОН)6]3- = X Са3Х2 2Н2О 30)
ОН он
MgX, "пинноит"; Na2X • 5 Н2О
[В2О4(ОН)]3- = X
Mg2X(OH), "ашарит"
Са2Х(ОН), "сибирскит1
н
нок_ ,он Bz
в-"
он
[В3О3(ОН)5]2- = X
MgX, • лН2О, /? = 3,5 ("индерит", "курнаковит") СаХ • л Н2О, п = 1 ("майер-гофферит"); 2; 4 ("иньоит") CaMgX2 6Н2О; ZnX Н2О 10)
НС) .ОН в'
[В3О4(ОН)3]2- = СаХ Н2О, "колеманит" CaMgX2 ЗН2О, "гидроборацит"
[В3О5(ОН)|
СаХ, "фабианит-
НЦ_о' В
X
[В3О4(ОН)4]3-К3Х 2Н2О
= Х п)
БЕЗВОДНЫЕ БОРАТЫ
Ортобораты
М3Х„, М = Li, Na, Mg ("котоит"), л
Ва, Са, Cd, In, Sc, Ln, Ti111, V, Cr,
Mn, Ni, Co [BO3]3’ = X
Be2X(OH), "гамбергит" 28)
Пиробораты 29)
М?Х, Мп = Fe, С
Mg2x, "суанит"
Na4X
[В3О4(ОН)2]- = Х
Т1Х 0.5 Н2О П)
Цепочечные полиметабораты [МфОгШ,
М = Li, Mg-Ba, Pb, Cu, Mn, Fe, Co, в стр. - плоские цепи [В2О4]
КАРКАСНЫЕ
/?-ЫВО2, стр. тип
[Si02]oo - кристобалита
он
у-[НВ02]оо, полимета-борная к., т. пл. 236, оч. медл. р-ряется в Н2О, куб. каркасная стр.
н
.О.
•о^ ^сг
н
н
N/
[В4О5(ОН)4]2- = X, из 2-х
неплоских циклов [В3О3]
Li2X ЗН2О
Na2X 8Н2О = "Na2B4O7 10Н2О",
"бура", т. пл. 75
| 62°
Na2X ЗН2О = "Na2B4O7 5Н2О",
"тинкалконит" (ювелирная бура)
(NH|)2X 2Н2О
К2Х нН,О. п = 2, 3; Cs2X ЗН2О
[В4О6(ОН)2]2- = X
Na2X ЗН2О = = "Na2B4O7 4Н2О", "кернит"
Na2X = "Na2B4O7 Н2О" 31)
К2Х ЗН2О (NH4)2X ЗН2О
[В4О7]2- = Х М2Х„ M = Li, Mg, Zn, Cd 13)
[B5O6(OH)4]- = X,
2 плоских цикла в
перпендикулярных плоскостях
н\ /н MX ЗН2О,
"МВ5О8 5Н2О",
Г ¥ 1 м = Li, Na
("сборджит")
Н/ NI
MX 2Н2О = МВ5О8 4Н2О
М = K-Cs, nh4, ti
><
МВ5О8, М = К, Rb
[В5О7(ОН)4]3- = Х
-О-в-0 о-в—о—
[BS2]8, иглы, бц., разл. 115, мол - плоские циклы, аналоги порфирина 33)
ОН
ОН MgX лН2О, п = 2-4 15)
СаХ Н2О (?) Na6MgX4 ЮН2О, "ривадавит" 16)
B2S3, крист., бц.,
* т. пл. 310, АН = —239; возг. в токе H2S, гидрол., р. в РС13, & в стр. - плоские 6- и 4-член- g-z ные циклы B2S3 и B2S2,
f' В — S 1.81, в г. - угловые мол. 6NH3, желт.; B2Se3 33)
B2S3 • Р2. S5, крист., бц.
[В6О7(ОН)6]2- = Х
[В6О8(ОН)4]
СаХ2 ЗН2О "говерит1
он
ОН
[В6О9(ОН)2]2- = X
МПХ ЗН2О,
Мп = Са-Ва
В' 9F
‘S
[HBS2]3, иглы, бц., т. пл. 139, р. в бзл., гидрол.
MBS2, М = Na, К, т. пл. 580 и 550, гидрол. на возд.
(в(ОМе)з + МТОЯ
Тиопербораты MBS3, желт. M2B2S5, св.-желт. H2B2S5, крист., бц., т. пл. 376 33)
ВВг3
LiBO3 • Н2О
М2[В2(О2)2(ОН)4] л Н2О = "М-
ВО3лН2О",
М = Li-Cs; Sr, Ва/2, Na (л = 0, 2, 4, 6),
"пербораты" 14g
НО / С о—о он
. /1Й> — в
он
но
О—О
2-
NaCa2[B9O14(OH)4] 2Н2О
Na8[B12O20(OH)4]
Ag6[B12O18(OH)6] ЗН2О,
в стр. - цепи или слои
27)
из тр-ков и тетраэдров ’
-О'..^О.
-O'BN
гЛ А
Na2B4O7, т. пл. 741 или 711, медл. кристаллизуется из распл. или при отжиге 14) стекла ’
ОН ОН
NaCaX • ЗН2О, "пробертит"
Na2[B5O7(OH)3] • 2Н2О, "эзкурузит1
Равновесие полимеризации борат-ионов
при pH <7
ЗН[В(ОН)4] 4^ Н [В3О3(ОН)4Г + 5Н2О [В3О3(ОН)5]2- 20)
А=1О“10 н н
при pH 7 сущ. подвижное равновесие всех форм островных полианионов (содержащих 1, 2 или 3 шестичленных цикла [В3О3] из тр-ков [ВО3] и тетраэдров [ВО4]):
[В6О7(ОН)6]2- [В5О6(ОН)4|- [В4О5(ОН)4]2- [В3О3(ОН)5]2- [В(ОН)4|-
Состав боратов, кристаллизующихся из р-ров, зависит в основном от природы катиона: Li-Cs образ, моно-, тетра- и пентабораты, Mg и Са - три-и гексабораты (см. табл.) Наиболее легко кристаллизуются бораты, наименее р. по сравнению с др. тв. фазами данной системы: "LiBO2 • 8Н2О", "Na2B4O7 • 10 Н2О", "КВ5О8 • 4 Н2О", "Mg[B3O3(OH)5] • 5 Н2О ("индерит") и т. д.
О —
о—
М5[В5О10] 12)
[В6О12]б- = Х
ZaiOX 12)
[В5О8(ОН)2]3- = X
-о-в-0
о
О-В-о-\ О
[В2О5]4- = Х
Триметабораты
[М(ВО2)„]3, M = Na (т. пл. 966, т. к. 1400), К (т. пл. 947), Са (лН2О), Ва (мол. сущ. в г.)
1В3О6]3-
Си(ВО2)2 12)
мв3о5, М = Li, Cs
Mg3Cl[B7O13], "борацит'
МПВ4О7, М = Sr, Pb
Ва2[В8О14]
Li3X, Na3X Н2О 32)
В-О—
[В5О9]3- = Х
-О-в-0
О-в-О-
о
о
Na3X Н2О 32)
Растворимость щелочных боратов при 25° (в пересчете на % В2О3)
Моно- Тетра- Пентаборат
Li 6.9 15.0 15.0
Na 10.60 2.02 11.60
К 18.80 7.86 2.63
nh4 — «7 «7
Cs 7.3 «13 1.31
67
3- “
сплав MgB2 + Mg
В2О3 + Н2 (А1 + А1С13) ВС13 + Н2 (разряд, вак.) BF3 + LiH (—LiBF4)
H3PO4 (метод Штока)
ВН3 [:L]
L т. пл. т. к. + н2о
Ме2О Me2S MeCN SiH3CN СО NH3, неуст( NMe3, "боразан" n2h4 РН3 РМе3 PF3 P(NH2)3 AsMe3 P(NMe2)3; Мол. - тет] В —L 1.54( разл. —80 -83 -137 эйчив -> [Н 94 61 с разл. 103 -116 74 эаэдры, В— С), 1.56 (N) 38 -64 3nbh2nh3 171 -62 разл. 120 -Н 1.19-1.: 1.84 (Р) SiH4 + (BH2CN)x; СО + Н2 + Н3ВО3 + (ВН4)- не р. в к., перегоняется с паром Н2О 11, ZHBH 114,
L
£ Oj
а:
к
Я
я о
е
e
M
Бораны, г., ж. или крист., бц., с отвратительным запахом, разделяют перегонкой, разл. Н2О (—> Н3ВО3 + Н2), не pear, с конц. H2SO4, акт. падает в гомологических рядах; АЯ сгорания очень велики (—485 В2Н6, ракетное топливо). Мол. построены из тр-ков [В3], [В2Н], [ВН2] с мост. ат. В (к. ч. 4) и Н (к, ч, 2), В — В 1,68-1.95, В — Н 1,10-1,36(конц,, мост,); электронодефицитные мол, с многоцентровыми связями._ СН = СН (~Н2)
*< 3- В2н6 диборан, г. 1.8— В5Н9 пентаборан-9, ж. 1.67— ВбНю гексаборан-10, ж. 1.5— В8Н|2 октаборан-12, г. 1.4- /' BiqH14 декаборан-14, крист. 1.25- 1.22— В1бН20 в18н22 крист. крист.
т. пл. т. к. разл. АЯ В отношение к возд. отношение к Н2О Н I „Ж -165 -92 >25 + 35 0 воспл. мгнов. гидрол. 1 н -46 60 150 (медл.) + 114 3.37 (ж.) воспл. гидрол. при t Н Н н 'в^=^в' н( /В^ jn В —В Н ЧТ" Н С1у^ х -62 108 25 (медл.) + 84 уст. гидрол. при t н + к НСВЛ\ВХ / \ н н -20 -20 ? Н , В в В н( X Х1> Ч В<— н Н2 (тлеющий 100 213 250 -39 3.62 (бзл.) оч. уст. Н3О+ + B[0Hf3; сильн. к., медл. гидрол., р. в си., эф. Н Н H^z-B- Н-В-В^7 I J2B-B-H 99 180 (норм.) — 129 (из°) сильн. двухосновная к., к2 = io-8 мол. - два фрагмента икосаэдра с общ. ребром В — В —Н2 (350°, вак.)
п п п z 100- П эазряд) н 'Н
2-5- В4н1о тетраборан, г. / ' 2.2— В5НЦ пентаборан-11, ж. 2.0-В6Н12 гексаборан-12, ж. 1.7- В9н15 эннеаборан-15, ж. В|9Н|(, ~^i декаборан-16, крист. ""J 1.3- B2qH26 2,2'-би(нидо)-декаборанил
т. пл. т. к. разл. АЯ В отношение к возд. отношение к Н2О в и\\ -120 18 (с разл.) 25 + 68 0.56 (бзл.) уст. медл. гидрол. чн 1жр| 4 -122 63 25 (мгнов.>В1оН14) + 92 воспл. быстро гидрол. Н н Н н <Xd> н >-—чн н -82 80-90 25 уст. —> В4Н10 + Н3ВО3 + Н2 3 75 уст. н н Hz—В~>Н Н— в в—н И н /ВХ1 н( / С )н Хв——-в' н н н и .и н ув н Н Н мол. - 2 корзины [В10Н14] со связью В —В
60'
t (уротропин)
„ В„С2Н„ + 2, карбораны ' * (изоэлектронны боранам)
Ш3Н3С2Н2, (Se = 22 = Se В4Н10), т. пл. —126, т. к. —4
В10НюС2Н2, "карборан" (барен) (Se = 50 = Se [В,2Н ,2]2 ), крист., бц., р. в орг. р-рителях, не р. в к., щ. и окисл. Ат. Н легко замещаются (ароматические системы), мол. - икосаэдр [B[0C2], В —В 1.7-1.8
Изомеры: орто-, (С, С-1.2), т. пл. 320, ц = 4.53, С—С 1.64 | 475°
мета (нео)- (С, С-1.3), т. пл. 263, ц = 2.85, уст. > орто-, В — В = В — С 1.78
пара (изо)- (С, С-1.4), т. пл. 261, д = 0
0.8—
В20Н16, икосаборан-16, крист., бц., гигр., т. пл. 197, уст. на возд., р. в орг. р-рителях; + Н2О
Н[В20Н16(ОН)2]; мол. - из 2-х В10Н14 с 2 общ. гранями
Борогидриды
В4Н8СО, ж., бц., т. пл. - ПО, т. к. 60
МОН(-Н2-М3ВО3)
3- Na[B2H7], анион [Н3В- • Н- • ВН3] 2.3- NafBsHs], р. в эф., уст. к Н2О > NaBH4 2-м2[В2н6], M = Na, Cs 24)
В10Н8(СО)2
В12Н10(СО)2
НС—— сн
\О/
В10Н10
В4С, карбид, крист., черн., оч. тв., d = 2.5, т. пл. 2450, т. к. > 3500, АЯ = —71, хим. инертен < 1000°, стр. тип NaCl (икосаэдр [В12] = Na+, линейные гр. [С = С = С] = СГ)
f 1200° (-С)
ВС3, пленки с мет. блеском, стр. аналог графита, В — С 1.55
В13С2, B2Si, B4Si
26)
Солеобразные ывн4 NaBH4 КВН4 Mg(BH4)2 Са(ВН4)2 МВН4 иН2О т. разл. крист., бц., нелетучи, р. в Н2О (медл. -> Н2 Li > Na > К), ТГФ, ж. NH3, сильн. восст.; стр. тип NaCl, [ВН4] - тетраэдр, В —Н 1.26
278 400 500 280 320
Полимеры СиВН4 Zn(BH4)2, бц. Cd(BH4)2, бц. -12 85 25 неустойчивы, не р. в орг. р-рителях, гидрол.
О Ве(ВН4)24 А1(ВН4)3 /0Ц- возг. 91 летучи, р. в эф., С„Нт,
т. пл. —65, т. к. 45 мгнов. гидрол., в стр. -
я о я Sn(BH4)4, желт. Ti(BH4)4, зел. разл. разл. -65 25 мол. с мост. ат. Н
ей 03 Zr(BH4)4 } . Hf(BH4)4 Гц U(BH4)4, зел. т. пл. 29, т. к. 128 НХ /Н\ /НХ /Н
о т. пл. разл. 29, т. к. 118 70 ЗВ^ ЗВе2
%
| (диглим)
1.4- MlBsHd, M = Li-K 1.33- M = Li-K 1.2-MfBoHnl, м = [R4N] неуст.
М[В9Н14], М = Cs, [R4N], [R4P] н+ _
М[В1ОН13], м2[В10н14], М = K-Cs, уст. к гидрол., мол. - корзина
M[B10H15]
ОН
(Н2О)
В
О>В
(Et3N)
М[ВПН14]
МпО4; Сг2О2
* См. примечание к с. 58.
Ст. окисления ат. В. в анионных комплексах боранов вычислена в предположении образования их по реакции иМ + Н + В£/х-Н^
1.1-
М[ВПН13], анион уст. при pH > 7
0.9- М[В9Н9],
M = Rb, Cs
0.8-м2[В10н10], М = NH4, Cs (разл. 600), [r4n], Си1, Ag;, уст. к к., щ.;
+ МпО4 —> [В(ОН)4] (Н3О)2[В10Н10], оч.
сильн. к., анион -двухшапочная антипризма
м2[В12н12],
M = Cs (уст. 800°),
Ag),, не разл. к., щ. (t) и окисл.
Н2[В12Н12] иН2О, оч. сильн. к., анион - искаж. икосаэдр 24)
Na2[B20H18], анион из 2 гр. [B10H10]
Се4+; Fe3 + 21)
м3[В20н19] 21)
0.67—
М2[В6Н6], м = = Na, К, [R4N], Ag, анион - окт.
0.75— м2[В8н8], М = [Zn(NH3)4]
К4[В20Н18] 2Н2О; + Н2О—>Bi8H22
Состав М4В, М3В, М2В М3В2
М Mn, V, Сг Сг, Мо, W Nb, Та, Мп, Fe, Со, Ni, Be V, Nb
Положение ат. В Изолированные ат. В I стр. тип | анши-СаР2 гр- [В2]
Бориды переходных мет. нестехиометрического состава (особенно МВ2), оч. тв., жаропрочны (т. пл. TiB2 на 1000° > Ti), кислотоупорны, (ТаВ2 не р. в ц. в.); связь В—М - мет. (проводимость ZrB2 в 10 раз > Zr), "ферробор" (1.2% В, 3-5% А1, 3-4% Si, 0.1% С, 0.02% S, «80% Fe) - раскислитель при плавке легированных сталей
68
БОР
i +
2 +
3 +
2s
2р Э.О<
1*1 I I 2.0
В2О
(В2О3, борные кислоты и бораты см. с. 67)
В, порошок, аморфный, бц. (кор. из-за примесей) или крист., черн., т. пл. «2075, т. к. ~ 3700, тв. « алмазу, р. в HNO3, H2SO4, не р. в щ.; монокрист. - полупроводники; а-, тетраг., <7=2.37, а = 8.73, с = 5.03, в стр. - икосаэдры [В12], . В —В 1.60-1.80, к. ч. В 5 ( = 8-3), Р-, ромбоэдрический, <7=2.46, а = 10.92, с = 23.81, куб. пл. упак. [В12], В—В 1.71 стеклообразный В 36:
В2О 2)
В6о
В7О
В13О2
В2О3 (>1000°)
В3О3Н3, "бороксин", мол. - плоский цикл;
В3О3Х3, бороксолы, уст. падает по ряду X: R>NR2>OR>r>H
+ НС1 —> н2 + вог
н
н
В.
О О
о^^н
Н2В2О3, мол. - плоский цикл, ц = 0.95
-------------------Н2 (-НВг, 1300°)
B3S3R3, борсульфолы
(R = Me, т. пл. 28)
(ВО)Х, порошок, аморфный, бел., возг.
1500, оч. реакц.; +Н2О —> В2(ОН)4 + Н3ВО3 | быстрое охл.
в г. - линейные мол. О = В—В = О
- Н2О (250°, вак.)
Н
О из» о
НВ
1.36
В2(ОН)4, гипоборная к., крист., бц., р. в Н2О и си., сильн. восст.;
+ О2 + ОН [В(ОН)4] ;
+ Н2О Н2 + Н3ВО3
ВХ3, крист., бц., оч. гигр., неуст.
В(С1О4)з, разл. —5; B(HSO4)3; B(OTeF5)3
B(NO3)3, разл. 0; ВРО4 (т. пл. 1600)
BAsO4, искаж. стр. кристобалита (трехмерная сетка тетраэдров В, Р, As). Me В(СН3СОО)3, т. пл. 149 В2О(СН3СОО)4 19)
-с^о
[-B(OR)2]2
в^уЛ^Оо,
МсСОО—В — О —^в—ООСМе
(ВОГ)3, Г = Г—Вг, сущ. в г.;
в2о3 + вг3
М[В(С1О4)4], М = K-Cs
M[B(HSO4)4], М = Н, Na, К, Sr/2
M[B(SO4)2]
K[B(SO3r)4]
M[B(NO3)4], M = Rb, Cs, [R4N]
M[B(CH3COO)4], M = K-Cs, TI
Анионы - тетраэдры, В—О 1.46 5)
Na[B2O(CH3COO)5] 19)
Me
BF2(OH), мол. - тр-к, В — F 1.32, В—О 1.34, ZFBF 118, ZFBO 123 4)
|И4А|2„Ä.
Г = Cl, I М2[В10С110], М = Na—Cs, разл. >100° Cs2B12Cl12, р. в неполярных р-рителях, окрашен, уст. на возд. 23)
(ВГ)„, Г = Г(бел.), С1 С1(желт.), Вг (красн.), 1(черн.), п = 4, 7, 8-11 > В4СЦ, крист., желт., летучи, т. пл. 95, разл. 200, воспл. на возд., мол. - тетраэдр, (4 эл. пары ато- с мов В распределены по 6 связям В — В).
В8С18, крист., красн., мол. -антипризма [В8], В — В ~ 2 и ~ 1.76 В8Вг8, кор., возг.
В9С19; В9Вг9, мол. - трёхшапочная триг. призма В919, кор., т. к. 200/вак.
В10С110, оранж.; B10Cln
Cl
С1
B8Fi2 b3f5 37)
разряд (-г2)
3, 37)
M(z);
М2О„ + C(Z)
3-
2—
Бориды X'
МВ МзВ4 мв2 мв6 мв12
Ti, Zr, Hf, V, Nb, Та, Сг, Мо, W, Fe, Со, Ni Nb, Та, Сг, Мп Mg, Al, Ti, Zr, Hf, V, Nb, Ta, Cr, Mo, W, U, Fe Са, Sr, Ba, Ln, As, Th Al, U, Zr
стр. тип NaCl или простые цепи Вот Плоские ленты из 6-членных циклов Слои типа графита Трехме в куб стр. типа CsCl окт. [В6] = Cs, М = Cl рные сетки в куб. стр. типа NaCl кубооктаэдры [Bi2] = Na, М = Cl
H2B = NX2, боразены, ж. или тв. димеры
В,\3Н|2. крист., бц., разл. 150, р. в ж. NH3,
орг. р-рителях, не смачиваются Н2О
RFT
H2N^ \N н2
Н2В\ /ВН2
nh2
(bH3 N Н-f
Г2(-НГ)
НГ(-Н2);
МОН (тв.)
в2н6
4-h2)
37) т. пл. АН в—г
B2F4, г., бц. -56 — 1.32
В2СЦ, ж., бц. -93 -491 1.72
В2Вг4, ж., бц. + 1 — 1.90
В214, крист., желт. — — —
В2Н6;
Г
Г
+ Н2О —> ВГ3 +
+ NH3 —> NH4C1 + B2(NH)2;
+ [R4N]C1 [
0° (медл.) —> (ВГ)„ . J.
В стр. - плоские мол. В2Г4, ___ в г. Z между 2 гр. ВС12 90°
14С1 + В2(МН)2; \ /
[R4N]2[B2C16]; B-BJ (ВГ)„ + ВГ3. /1-72 у
г г
NaBH4 (диглим)
В2Оз
BF3, г., бц.
ВС13, г., бц.
ВВг3, ж., бц.
В13, крист., бц.
-127
-107
-46
50
</ ’------А
[R4N]2[B2Cld
U
д
й
(Ba[BF4]2)
т. пл. т. к. АН В-Г (г.)
1.31
1.73
1.89
2.12
-1138
-404
-243
-38
K[BF(OH)3]
H[BF2(OH)2], K[BF2(OH)2]
I H2O(-HF)
H[BF3(OH)] = "BF3 H2O", крист., бц., т. пл. 10, сильн. одноосновная к., сл. двухосновная [Н3О]+ [BF3(OH)| = "BF3 2Н2О", т. пл. 6, т. к. 60/133 Па, анион-тетраэдр, В—F 1.37, В—О 1.56
Н2О(-Н3ВО3)
HF
M[BF3(OH)] 7)
Н2О Ba[BF3O]
=1 о-з ^гидрол.
N2O.
(HBNH)3, боразол (боразин), "неорганический бзл.", ж., бц., с запахом бзл., т. пл. —56, т. к. 55, АН= — 548, уст. при 500°, ц = 0.5, мол. - цикл почти плоский, В — N полярны, Н
N НВ^ЧВН
• — склонны к р-циям присоединения, медл. гидрол.;
+ МОН —> Н2 + ] > + МВО2 + NH4OH;
200° (p, —H2)
2— т. пл. т. к.
В2Н5С1, г. -142 -И
B2HsBr, г. -104 + 10
В2Н51, ж. -110 —
+ Na/Hg В4Н10
(аналог р-ции Вюрца)
3-
М[ВН3(ОН)], М = К, Na, гипобораты, гигр.
НС1(-Н2)
мвн4
(BC1NH)3, трихлороборазин, крист., бц., возг. 80/15 мм, мол. -неплоский цикл
(мвн4)Х^г
ВГ3,
ВС1з
-100
13
90
210 разл.
с
Г = С1, Вг
Z(-HF)
NH3
BF3 + А1Г3
В стр. и г. - плоские тр-ки ВГ3 (sp2)',
+ НГ' ВГ'3 + НГ (HF вытесняет С1 из ВС13, HBr—I из BI3); BF3 + Н2О HBF4 + Н3ВО3; ВГ3 + Н2О —> Н3ВО3 + НГ (Г = C1-I); ВГ3 - оч. сильн. к. Льюиса, [ВГ3(:Ь)|, L = NR3, PR3, AsR R2O, R2S, R2CO, РГ3, PH3 и др.
[BF3(NH3)|, крист., бц., т. пл. 162(р),Н 125°
2^ BN + NH4BF4, хор. р. в Н2О;
Н2О [NH4]+ + [BF3OH] (медл.); HZ| мол. - 2 пересекающихся тетраэдра I [BC13(NH3)| 38)
VB(N3)3, взр.
B(NH2)3, неуст.
B(NMe2)3, т. пл. —16, т. к. 152, В—N 1.43 / B2(NH)3, крист., бел., не р. в ж. NH3
HN%/NH ; в
’ Е_Г
—конденсация циклов (аналоги нафталина и др.)
Н2В(ОН);
Н2 + (ВО).
. 1-
М[Н2В(ОН)2] /
Na[H2BF2]
BN, нитрид, "белый графит", d = 2.34, т. пл. 3000 (р N2), возг., разл. 1000, АН = —256, хим. инертен, р. в распл. щ., медл. гидрол., в гексаг. стр. графита В—N 1.45, ZNBN 120 (sp2)
НВ12
НВС12, г., бц.
HBBr2, nR2O
Na[HBF3]
(-ВС12—NH2)3, гексахлороборазин, цикл - кресло, В—N 1.57, В —С1 1.85 35)
О
1800°, 6 • 109 Па
"боразон", крист., цв. - от желт, до черн., т. пл. > 3200 (р), оч. тв., разл. 2000, куб., акт. < гексаг. формы, стр. тип алмаза, В—N 1.57 (sp3)
М[НВ(ОН)3],
B4N(,HS;
B4N8H6;
B24N36, стр. аналог фуллерена 35)
HBF4, сущ. только в р-ре, сильн. к., яд
M[BF4], М = Na (т. пл. 384, "ферручит"), К(т. пл. 570), КН4(возг. 350), Cs). ("авогадрит"), [R4N]]_, [NO], [NO2], [C1F2] (t. пл. 30), [C1O2], [NF4] (разл. 240;
+ H2O^O2),
[XeF5], [O2] (уст. <0), M”+-хор. p. в H2O; анион - тетраэдр, В — F 1.39-1.41 M[BC14], M = NH4, K-Cs, [R4N], [РуН], [PC14], крист., бц. ([NO] - оранж.), бурно гидрол.
М[ВГ3Х], Г = F, Cl, X = Cl, С1О4, NO3 22)
Li[B(NCS)4] nEt2O
M[B(N3)41, м = Li, Na
Li3BN2, т. пл. 870
М3'|В\2|2. Мп = Са-Ва;
+ Н2О —> NH3 + Н3ВО3 + М(ОН)2;
анион -
LnBN2
6)
>(в
ВР, крист., кор., т. пл. >2000 с разл., АН = —101, полу-^<7 Рт-’5 1180° ’
проводник, стр. тип алмаза, В—Р 1.96 -> В13Р2 + В
BAs
B(CN)3
B(NCS)3
В(С = СН)3
(BN)+(SO3F) , крист., син., проводник, стр. аналог С+Х 6)
69
БЕРИЛЛИИ, АЛЮМИНИИ
Ионы Be и А1 в водном р-ре см. с. 74
2s
2р
BeF2
А1°
3s
ПТ
Зр
э.о.
1.5
3d
Т 1.5
ВеС12 + NaCl, т. пл. 224
А1
мет., бел., блестящие (покрыты тончайшей пленкой окислов), легкие тв., хрупкий, прозрачен для рентгеновских лучей d т. пл. т. к.
Е0Мп+1М-
£о[М(ОН)4]«-/М.
Be
1.85
1287
2507
= -1.85
= -2.52
мягкий, ковкий
2.70
660 «2500 -1.70 -2.34
р. в разб. к., щ., пассивир. HNO3
р. в HF, NH4F
гексаг. пл. упак.
а = 2.28, с = 3.58
М —М 2.28
не р. в HF, Н3РО4, СН3СООН, мет. выс. чистоты р. в (НС1 4 + Си2+ + Н2О2) куб. пл. упак.
а = 4.04
М—М 2.86
<3%
НС1О4 (<220°, вак., —НС1)
Ве(СЮ4)2 10), • 4Н2О, крист., бц., хор. р. в Н2О
ВеС12
Си + ^6% Be = "бериллиевые бронзы", сплавы с высокой тв., механической прочностью и коррозионной уст.
о
Стали хромо-молибдено-алюминиевые, А1 повышает уст. к г. коррозии, стойкость к износу и истиранию.
Сплавы для магнитов, 12-15% А1
Дюралюминий, тв. сплав, 93-95% А1, 2.5-5.5% Си, 0.5-2.0% Mg, 0.5-1.2% Мп, 0.2-1.0% Si Силумин, 10-14% Si, 0.1% Na, остальное - Al
И
о
И О о и
и и
[Be(Dipy)2], парамагн., Мэфф = 2.1 (2 неспар. эл., хр3-?) 18) [Al(Dipy)3], Мэфф 2.32
о
И
ВеО порошки, хим. инертны после прокалива т. пл. 2580 (охл. —> стекло), т. к. 4260, АЯ = -611 п, в г. - мол. ВеО (Be—О 1.33) и (ВсО)„ - циклы | возг.; распл. + NaBO2 крист., стр. тип вюртцита (ZnS), к. ч. Be 4, "бромеллит", Be — О 1.64; летучи в токе О2 А12о3 ния, сплавляются со щ., K2S2O7 т. пл. 2072, т. к. ~3500, АЯ = —1670(a); d = 3.96; ж. (в распл. Na3AlF6) [А1О]+ + [А1О2] а-, ромбоэдрич., хим. инертен, "корунд", "рубин" ( + Сгш, красн.), "сапфир" ( + Ti, Fe11, гол.), оч. тв., в стр. - гексаг. пл. упак. ат. О, 2/3 окт. пустот заняты ат. Al, А1—О 1.86, 1.97 Р-, "гексаг." (~Na2O- ЮА12О3), тв. электролит 1' у-, куб. (А12 67О4), стр. тип шпинели, хим. акт.; + Н2О —> А1(ОН)3
Ве(ОН)2, крист., мало р. в щ., возг. 1200, изостр. s-Zn(OH)2
350°
АЮ(ОН), /Ь"диаспор" ^aQ|_| NaOH у-"бёмит" (в "бокситах") разл. 360, в стр. - слои октаэдров f 180-200°
А1(ОН)3, а-, "гидраргиллит" ("гиббсит"), монокл. (стаб); Р-, "байерит", гексаг.; у-, "нордстрандит", трикл., в стр. - слои окт., А1—О 1.74-2.06; р. в конц. щ.
| время, ОН
ВеО л Н2о; А12О3 л н2о;
бел., студенистые, р. в к., щ., не р. в NH3 и NH4X р. в EtNH2
А13 + + ЗОН ^А1(ОН)4 н+ + [А1(ОН)4] косн. = 10 33, Кк. = 10~8
р. в (NH4)2CO3
+ 2ОН ^Ве(ОНЫ ^S-2H+ + [Ве(ОН)4]2 зн. = 10 1510 22, Кк. = 10 25
МОН + сп
Ве4О(С1О4)б, крист., бц., гигр., т. пл. 165, возг. 100/133 Па 10)
. ХНТГ КрЯТОА. 12Н.О- ТЫТОА. 4 Н.П
' Be(IO4)2 8 Н2О; Ве3 (Ю5)2 12 Н2О; Ве(Ю3) 2 4 Н2О
-BeSO4, гигр., т. пл. 540, разл. 580, стр. тип кристобалита (SiO2), </u
• 2Н2О, — • 4Н2О (= [Be(H2O)4]SO4), изостр. CsCl; Be —О 1.62 10) • M2SO4 • 2Н2О, М = К, NH4 (не образ, квасцов, ср. А1 !) BeSeO4, 2Н2О 2^ 4Н2О; Ве4ТеО7 Be(NO3)2, Ж- 2N2O4, крист., желт., р. в сп.;
^возг. (т. пл. 60, разл. 160, —> NO2 + • • •),
Be4O(NO3)6, крист., бц., летучи, не р. в орг. р-рителях Ве(Н2РО4)2 Н2О; ВеНРО4 Н2ОФ: Ве3(РО4)2 6 Н2ОФ.
ПР = 10 3S, гидрол.
Be(NH4)PO4 Н2ОФ. ПР = 10 20; Ве2Р2О7
NaBelPCXJ, "бериллонит"; Ве2[РС>4](ОН) • 4Н2О, "мораэзит1 Ве(РО3)2[_, в стр. - сетка тетраэдров [РО4] и [ВеО4] 2
,Be(NH4)AsO4 1.5Н2О]_, Be2As2O7 + Be3(AsO4)2
ВеСО3 • 4Н2О]_, разл. 100, Ве(СО3)„(ОН)2_2Д,
(р)
р. в М2СО3 (ср. А1!)
[Ве(НСОО)2]„, не р. в орг. р-рителях, медл. гидрол.
|Ве(ОСОСН3)2|„, полимер, не р. в орг. р-рителях СН3СОО
г||(СН3СО)2О ( = АсО)
Бериллаты 5)
Na2Be(OH)2O; М2[Ве(ОН)4|; Na[Be(OH)3]
Na2BeO2; М2Ве2О3; NagBe2O3
Cs2Be3O4; К4Ве3О3
М4ВеО3; Na6Be8O| |, цепи тетраэдров и тр-ков [ВеО3], Be—О 1.45-1.75 А12[ВеС>4], "хризоберилл" (не изостр. шпинели)
M2[Be(NO3)4], М = [R4N], [NO] (= "Be(NO3)2 • N2O4":
20)
• иН2О, п = 2, 4 \6, 7
Be4O(OAc)6, оксоацетат, крист, куб. (стр. тип алмаза), т. пл. 285, возг. вак. >220, т. к. 331, не р. в Н2О, хор. р. в CHCI3, мало р.
в бзл., в центре мол. - тетраэдр [О*Ве4], связывающий
4 тетраэдра [ВеО О3]; СН3СОО - бидентатны;
L, L = 2SO2; 1.5N2O4, клатраты, разл. «20
1₽У + Н2О
Ве(ОАс)(ОН) Ру, 200°( ’’Т Ве7О2(ОАс)8(ОН)2, нелетуч, р.в бзл. > Ве4О(ОАс)6, мол. - 2 тетраэдра [О*Ве4] с общ. вершиной Ве6О2(ОАс)8, т. пл. 215, возг 130/1 Па, р. в бзл., С„Н2и + 2, мол. -2 тетраэдра [О*Ве4] с общ. ребром [Ве2] 3)
2 | >215°
д Ве5О2(ОАс)6, крист., летучи >200/1 Па, р. в бзл., СНС13,
5 мол. - 2 тетраэдра с общ. гранью [Ве3]
Т ВеС2О4 ЗН2О = [Ве(Н2О)4] [(С2О4 Н2О)2Ве] (?), хор. р. в Н2О (ср. др. МС2О4!), сл. дис.
Be2[SiO4], "фенакит"; Li2Be[SiO4], "либерит"
Be3Al2[Si6O18], "берилл" (прозрачный - "изумруд", + Сгш -
"аквамарин"), т. пл. 1650; Be4[Si2O7](OH)2, "бертрандит"
BeAl[SiO4](OH), "эвклаз"; Na2Be[Si2Og], "чкаловит"
Be
Be—О
Be
Be
NH4OH
МОН
Алюминаты 61
Na10[Al(OH)6]2(OH)4; Na9[Al(OH)6]2(OH)3 6Н2О;
М3[А1(ОН)6]2; Ва2[А12(ОН)10]; Ва2[А14(ОН)16], анионы - окт. с общ. ребрами [см. Ti4(OR)i6]; Li2[Al2O(OH)6] • (8-9)Н2О; К2[А12О(ОН)6] - 2 тетраэдра
Ва[А1О(ОН)2]2 - цепь тетраэдров; Na2[Al2O1.5(OH)5] Na3A103; Li5A104; Nai7[AI5O|g]; Nai4[A140i3], анионы - циклы SrAI4O- - конденсированью тетраэдры, Al—О 1.73-1.98 КЬЦАКХЖ МПО • А12О3, М = Mg ("шпинель", т. пл. 2115), Zn ("цинковая шпинель"), Fe ("герцинит"); куб. крист., в стр. (типа шпинели) - окт. [АЮ6], тетраэдры [МПО4] и [ОМПА13], пл. упак. атомов О.
М2[Ве(СО3)2] [Co(NH3)g]2[Be40(C03)6] 10 Н2ОФ. крист., оранж.
Alee
М2[Ве(С2О4)2], М = Na( Н2О), К, РуН, [Co(NH3)6]/3, Be—О 1.62 7)
А1(С1С>4)3, летуч, 10) • иН2О, п = 15, 12, 9, 6
А1(С1О3)3 иН2О, п = 9, 6, оч. хор. р. в Н2О
А1(ВгО3)3 • 9Н2О, т. пл. 62, разл. 100
А1(Ю3)3 лН2О, п = 6, 8
A12(SC>4)3, разл. 500; -9Н2О, <— • 18 Н2О ("алуноген"), разл. 86;
• M2SC>4 • 24Н2О, М = NH4, K-Cs, квасцы, крист., бц., АЯ р. < 0, в куб. стр. - окт. [М(Н2О)б] + , [Al(H2O)g]3+ и тетраэдры [SO4]2 (двойные соли)
• MnSO4 • 22Н2О, Мп = Mg ("пиккерингит"), Fe ("галотрихит")
A113(SO4)3(OH)33 • 46Н2О, стр. Кеггина(см. Табл. "Молибден") KA13(SO4)2(OH)6 Н2О, "алунит"; A12(SO4)(OH)4 7Н2О 8) А113(СгО4)14(ОН)11 л Н2О 8)
A1(NO3)3, возг. вак. 22)
f N2o5
•9Н2О, т. пл. 73, разл. 134 (—> NO2+ • • •), оч. хор. р. в Н2О
А16(РО4)4(ОН)6 5Н2О, "стёретит"; КА1Р2О7; NaAl3(PO4)2(OH)4 AIPO4I, т- пл. «1400, не р. в к., стр. тип кварца, А1—О 1.74, Р—О 1.52; не образ, стекол, "берлинит"; -2Н2О, "варисцит" 8) А1(Н2РО4)3
A1AsO4[., стр. тип кварца, —стр. рутила (TiO2);
• 2Н2О, "мансфилдит"
KA14(AsO4)3(OH)4 • 8Н2О, "алюмоформакосидерит"
AIVO4 • ЗН2О, "штайгерит"
А15(СО3)(ОН)13 • 5Н2О, "скарброит" 19)
MggAl2(CO3)(OH)16 • 4Н2О, "гибротальцит"
А1(СН3СОО)3; + Н2О (следы) [А13О(СН3СОО)6]+Х-, стр. аналоги ацетатов Сгш и Fe111, нелетучи, не р. в СНС13 (ср. Be!) А12[С6(СОО)6] 16Н2О, "меллит", анион - плоский цикл 22’ А12(С2О4)3 4Н2О, р. в Н2О
Al2[Si2O5](OH)4, "каолинит", в стр. - листы [SiO4] и колонки [AlOg] Al[Si2O5](OH) иН2О, "монтмориллонит", листовой силикат с лентами окт. [AlOg]
Al2SiO5, "андалузит" (в стр. - цепи окт. [А1О4О2/2], изолир. гр. [А1О5] и [SiO4]), "силлиманит", т. пл. 1860 (в стр. - колонки из окт. [А1О6] и цепи чередующихся тетраэдров [А1О4] и [SiO4]); "кринит" (колонки и слои окт. [AlOg])
Al2[SiO4](F,OH)2, "топаз", в стр. - окт. [A1O4F2]
MAl(SiO3)2, М = Na ("жадеит"), Li ("сподумен")
МА1(С1О4)4, м = K-Cs, [С1О2] . 'А1(С1О4)з • С12о6")
Li2[Al(ClO4)5] 10) (NH4)3[A1(C1O4)61
HA1(SO4)2 4Н2О
Na[Al13O4(OH)24(H2O)12|(SO4)4 «Н2О M[A1(NO3)4], М = [NO2], Rb, Cs (т. пл. 190); 2NO3 моно-, 2 - бидентатны, к. ч. А1 6 M2[A1(NO3)5], М = K-Cs, 4 гр. NO3 моно-, 1 - бидентатна, [AlOg] - искаж. окт., А1—О 1.91
M3[A1(NO3)6] 9)
A ?О* \V>
[Н3О][А13(Н2РО4)б(НРО4)21 4Н2О19)
КА1Р2О7, окт. [AlOg]
NH4[A12(OH)(H2O)(PO4)21 ЛН2О,
каркас тетраэдров,
А1—О 1.82-2.20 19)
М3[А1(С2О4)3] лН2О,
М = Na, Mg/2 ("жемчужниковит"), окт., А1—О 1.90 17)
Na[AlSiO4], "нефелин", в. стр. -сетка тетраэдров [SiO4] и [А1О4] (аналог SiO2, "тридимита") K[(AlO2)(SiO2)3], " ортоклаз" ("полевой шпат")
В стр. алюмосиликатов часть ат. А1 изоморфно замещает Si в тетраэдрических пустотах, а часть - образ, окт. [AlOg] Na12[(AlO2)12(SiO2)12], цеолиты 350°
(см. Табл. "Кремний"), <— -27Н2О
70
((NH4)2BeF4)
& X
Ве(ОН)С1 • 2 Н2О 24)
1,16) т. пл. т. к. АН Be—Г (г-) •иН2О, п =
BeF2, стекло или 801 >800 -1025 1.40 —
крист., изостр. SiO2 (возг.)
ВеС12, крист., бц. 425 520 -494 1.75 4
(возг.) (возг.) (т. пл. 96)
ВеВг2, крист., бц. 509 540 -369 1.91 4
Ве12, крист., бц. 480 530 -167 2.10 4
ВеО
"берилл" Ве3А1281бО18
1 +
2 +
HF (40%)
А1ОГ, Г = Cl-I, крист., бц., гигр.; A1(OH)2C1 • 4H2O, "кадваладерит"
В стр. ВеГ2 каркас (Г = F) или цепи (Г = C1-I) тетраэдров [ВеГ4] (стр. аналоги SiS2). Фазовые переходы BeF2 (аналог SiO2):
---> а-С----> /?-С (Q-кварце-, Т-тридимито-, т. пл. 820 С-кристобалитоподобные p,t---------модификации)
фаза, изостр. коэситу (к. ч. Be = 6 !)
В г. - линейные мол. ВеГ2 (sp)
или димеры Г — Вс^ /Вс—Г (sp2)
ВеГ2 - р. в Н2О, ROH, Et2O (с расслаиванием)
ВеГ2 hNH3, п = 12, 6, 4, 2 (С1); 13, 6 и 4 (I); hROH, п = 3, 4 [ВеГ2Ь2], Г = Cl-I; L = RCHO, R2CO, RNO2, RCN, Ру, R3N, H2S (Г = Br-I), R2O, Thf; мол. - искаж. тетраэдр
|ВеГ21.|. L = Dipy, Diox; ВеС12 3POC13
п 225° 450°
p-Q ----> a-Q ----> Т
| т, пл. 580 |
600° (к-p ZrF4)
MBeF3, анион - цепь тетраэдров [BeF2F2/2], Be—F 1.50 и 1.60; стр. аналоги Mg2[SiO3]2 M2[BeF4], анион - тетраэдр.
Be — F 1.55, стр. аналоги M2SiO4, M2SC>4; хор. р. в Н2О (ср. А1!)
MBe2F5, стр. аналоги листовых силикатов.
МзВе2Г7, анион - 2 тетраэдра с общ. вершиной, Be—F 1.52 М^ВеСЦ], М = Li-Cs, [R4N], Т1, Ва/2; полностью гидрол.
CsBeCl3
НВеС13 2 Ру, МВе2С15, М = NH4, K-Cs
i
4)
1НГ(1000°) I
AS2O3 (—AsF3)
14) т. пл. т. к. АН А1—Г • иН2О, п =
в. г. (тр-к) в стр.
конц. мост.
A1F4 1040 1279 -1510 1.63 1.77 1.83 1 ("флюел-лит"), 3, 5].
А1С13 193У) 180 (возг.) -704 2.06 2.04 2.24 6 ("хлороал-люминит")
А1Вг3 98 255 -514 — 2.21 2.40 6
АП3 А1Г3- 191 крист., 386 бц., гиг] -310 )., р. в! 2.44 12О, 2.48 2.65 6
ROH, Et2O (Г = C1-I 1, в бзл. cs2 (Вг) J® (Вт)
(Br, I). В г. А1Г3 (Г = C1-I), в стр. 115 А (А1)Г
А1Вг3 г АН3 и в р-рах в CS2 и бзл. - 87° 93М
димерные мол. - 2 искаж. тетраэдра с общим ребром; > 800° в г. - моно-
и димеры; стр. A1F3- искаж. типа ReO3, [A1F6] - триг. антипризма;
А1С13 - А1С13 искаж. 2NH3 = типа FeCl3; АН [A1C12(NH3)4]4 - цепи тетраэдров [АН4] [А1С14] , возг.
А1Г3 2L, L = Me2S(T. пл. 72), РОС13 (164), к. ч. А1 5 (?)
[А1Г3Е] , L = R2O, R2CO, Ру, R3N, NH3 (т. пл 125, т. к. 422), SO2,
H2S, NO, РН3, РГ314), SbBr3, РОС13 ( = С13РО: А1С13), HCN, РС15,
мол. - искаж. тетраэдр с большим ц; в р-рах L мономерные мол.
А1С13 • 6L = [A1L6]C13, L = Н2О (разл. 200, А1—О 1.88), NH3 (разл. 180), катион. - окт.
MA1F4J„ анион - тетраэдр (Al—F 1.69) или слои окт. с общ. вершинами [AlF4/2F2]0O [XeF5] + [Al2F7]“, разл. 130 (^ XeF6) M2AlF5i, анион - цепь окт. [AlF4F2/2]0O, М = Т11, К ( • Н2О), Ва/2 (H3O)2A1F5 ЗН2О
Na3AlF6j_, т. пл. 1012, "криолит", ж. 3Na+ + AIF4 + 2F , анион - окт., Al —F 1.70 и 1.89
H3AIF6 • иН2О, п = 3, 6
Ca2AlF7, в стр. - [CaF7][AlF6] и F 12)
М|А1С14|, М = Na (т. пл. 185), NH4(303), К (256), Cs(377), [SCI3], [SeCl3] (164), [ТеС13] (149), [NO] (180), [PC14](379), [BeCl(Et2O)3] (55), Mn/2 (V-Ni), [Bi„]/3 (n = 3, 5), [Te4]/2, [Se8]/2, [Hg3]/2; разл. H2O (за искл. M = [Re(COy), анион - тетраэдр, Al—Cl 2.09-2.84
НА1СЦ Diox; [Te4][Al2Cl7]2 n)
М[А1Вг4], анион - тетраэдр
MAl2Br7, анион - 2 тетраэдра с общ. вершиной, А1—Вг 2.26 (конц.), 2.43 (мост.), ZBrAlBr 113 (конц.), 104 (мост.) 13) М[АП4]; Li[Al2I7], т. пл. 220, в тетраэдре Al—I 2.50-2.58 13)
BeS, порошок, серый, уст. к Н2О, АН= -235, стр. тип сфалерита
Be(NMe2)2, мол. - тример, стр. аналог Be(OR)2
Be(NH2)2
Be[N(SiMe3)2]2, гр. [NBeN] линейна (sp), Be—N 1.57
Be(N3)2, крист., бел., не p. в эф., р. в Thf, не взр., гидрол.
M[Be(NH2)3]
M[Be(NH)(NH2)]
A1SC1
A12S3, иглы, бц., т. пл. 1120, АН = —651; + Н2О —> Al(OH)3j, + H2S, 26) неупорядоченная стр. типа сфалерита (а-, fi-) или корунда (у-)
Al2Se3, желт.; А12Те3, кор. (АН = —567 и —326)
ZnAl2S4, стр. тип шпинели
MAlSe2, желт.; МА1Те2, красн.
Ве3Р2, ВеР2, крист., красн., полупроводники 23)
BeAs2
Be(NCS)2, стекло; -2Et2O, т. пл. 38
1) BeR2 + L1AIH4 (эф.)
2) ВеС12 + LiHi (эф.)
3) BeR2(Z, -С„Н2„)
Be(NC)2, линейные мол., •0.5Et2O, не р. в эф., бзл. П)
(ВеН2)„, тв. бел. полимер, не р. в эф., нелетуч, на возд. мгнов. гидрол.; разл. 100 (получ. методом 1), 240 (получ. методом 3) АН = + 125; +Н2(р) —> крист., гексаг., в стр. - каркас тетраэдров, Be—Н 1.38-1.44
Ве(ВН4)2, возг. 91, разл. 123, в полимерной стр. - гр. [ВеН6], Be—Н 1.53-1.61 П)
M2[Be(NCS)4] 2L M[Be(NCS)3] hL, М = K-Cs, NH4 L = H2O, MeCN
LiBeH3
Li2BeH4 n)
Be(OR)2, крист., бц., гигр., R = Me, Et (не пл., не р. в орг. р-рителях), в полимерной стр. - тетраэдры [Bc(OR)4](.s'p5); R = Z-Bu, т. пл.112, возг. 100 (вак.), хор. р. в орг. р-рителях, мол. - тример:
OR OR
RO— Be<^^BeiC^^Be—OR
OR OR
R = CEt3
мол. - димер, (sp2)
OR
RO —ВеС^ЪВе —OR
ToglBe/HsBeRi)
R = CH(Bu-Z)2, мономер (sp)
CIBeOEt 2EtOH
21)
16)
co^
Be
Al[N(SiMe3)2]3, крист., бц., возг., р. в орг. р-рителях, [A1N3] - тр-к, А1—N 1.78
A1O(NH2)
A1(N3)3
M[A1(NH2)4], М = Li-Cs, крист., бел.,
NH3 27)
анион - тетраэдр., А1—N 1.80-1.89
Li[Al(3H2)4], Э = Р, As
Li3AlN2
Be(CH3COCHCOCH3)2, крист., бц., т. пл. 108, т. к. 270, р. в бзл., CS2, разл. к. и щ.
Ве(С5Н5)2, крист., бц., возг. вак. 25-45, ц = 2.46, стр. аналог ферроцена, но Be не в центре оси V порядка, Be - цикл 1.48 и 1.98
А1Р, AlAs, оранж., стр. тип сфалерита
A1(NCS)3 2Et2O 25)
A1(CN)3 Et2O
I НХ(эф.)
А1С13
Li3AlP2; Li3AlAs2, стр. тип CaF2
Li[Al(NCS)4]
Li[Al(CN)4]
(А1Н3)„ a F.LO. полимер, бел., гигр., не р. в эф.
А1Н3, мономер, разл. 105, в стр. - каркас окт., А1—Н 1.72
NH3 H2N-AIH2 HN = A1H AIN
• NMe3, т. пл. 76; • 2NMe3, т. пл. 95, возг. 40 (вак.), мол. -
триг. бипир., А1—Н 1.7 (экв.)
А1Н„Г3_„, оч. гигр., летучи, р. в эф.; А1Н12, т. пл. 80
А1Н21, т. пл. 35
АЦВНЖ, крист., бц., возг. >0, воспл. на возд.; • Me3N
(М + Al + Н
Jy^iCV V)
Г/
A1(OR)3, крист, или ж., бц., гигр., оч. реакц., R = Me, Et (полимеры, не р. в орг. р-рителях); R > Et (низкопл., летучи, в р-ре сущ. равновесие ассоциации - до тетрамера);
R = Z-Bu (димер); Al10O4(OEt)22 15)
P)
LiAlH4, крист., бц., разл. 125, p. в эф.,
• nEt2O, п = 1,2, 2.5, 3,
• и Thf, п = 1, 2, 3, 5,
+ Н2О —> Н2, мягкий восст.;
+ R2C = O R2CHOH; + ЭГ„ ЭН,
M|AIH4|,„ М = Na(T. пл. 178), К (не р. в эф., р. в Thf, уст. > LiAlH4), Mn11, Sn11, SnIV, Ti, Nb, уст. <0°, анион - тетраэдр, Al—Н 1.55 М3[А1Н6], М = Li (разл. 210), Na (т. пл. 260, не р. в Thf, стр. аналог Na3AlF6); К 28)
А1(СН3СОСНСОСН3)4, крист., бц., т. пл. 192, т. к. 315, возг. 140/10 мм, M[A1(OR)4], М = Li-K, Mg-Ba/2, р. в орг. р-рителях Co-Cu/2, U/4; Mg3[Al(OEt)6]2 1 >
71
ГАЛЛИИ, ИНДИИ, ТАЛЛИИ
Ga°
In0
Т1°
55 и
6s
И
45 и
Ga3 + (маточные р-ры после осаждения А1)
2+ и "2 +
Э.О
1.6
1.7
1.8
In2O (?), крист., черн., возг. 700, р. в НС1
Ga2O, крист., кор., возг.
500; Ga + Ga2O3;
АЯ = -343;
+ H2SO4 —> H2S + Ga3
4/
GaCl 2Dio-
t; Н2
оу
Ва(ОН)2
Ga In Т1
мет., с( уст. на d 5.9 d* 6.1 (!) т. пл. 29.8 (переохл. до —40°) т. к. 2403 р. в к., NH4OH, щ., плохо р. в HNO3 £ом3 + /Мтв= “°-56 а-, графитоподобная ромб, стр., а = 4.52, 6 = 7.65, с = 4.51, в стр. и распл. - мол. Ga2, Ga—Ga 2.48 1170° /?-, гранецентрирова (тип у- а = 2.81, с = 4.45, d = 6.6; к. ч. 4 + 8, Ga —Ga 2.81 и 2.99, у-, куб., а = 5.95, d = 6.59, к. ч. 8, Ga — Ga 2.78 4) зребристо-бел., оч. м возд. 7.3 157 2024 р. в к. -0.34 иная тетраг. стр. Мп) а = 4.60, с = 4.94, In—In 3.24 и 3.37 ягкие окисляется возд. 11.9 304 1475 р. в к.-окисл. и (Н2О + О2) Еот1+/Т1тв="0-34 а-, гексаг. пл. упак. а = 3.45, с = 5.51 ^235° /?-, куб. пл. упак. а = 3.87, TI—Т1 3.35 115° v 37 • 108Па у-, куб. (тип a-Fe), а = 4.85, т. пл. 650 (9 • 109 Па)
GaBr Gal, т. пл. 271
Т12О, порошок, черн. или желт., гигр. т. пл. 303, возг. 400, т. к. «1100; АЯ= —175, искаж. стр. типа анти-С<Н2, Т1—О 2.52-2.56, р. в си. 13)
i н2о
ТЮН, -2Н2О, крист., желт., р. в Н2О, си., сильн. осн., Косн = 0.33; АЯ = —239
Н2 (175°, медл.)
'^^00° л
Т1С1О4, крист., бц., т. пл. 501; Т1С1О3, иглы, бц.
ТПО3, к. ч. Т1 3, Т1—О 3.02-3.48 29)
^^T12SO4, т. пл. 645, изостр. K2SO4, ядохимикат
Min(SO4)3 24Н2О, квасцы; nH2SO4, п = 1/6, 1, 2
Т128Оз, светло-желт.; NaTI3(SO3)2, Т1282Оз; NaTlS2C>3 • Н2О
Tl2SeO4, т. пл. > 400; TlH3(SeO3)2; Т16ТеО6, оранж., т. пл. 650 29)
Т12СгО4)_, желт., т. пл. 633, ПР = I0 9
Т12Сг2О7)_, оранж., т. пл. 360
TINO3, т. пл. 206 (/?), 334 (а), т. к. 438
TINCM, желт. (ср. Ag !)
Т13РО41, бц., р. в к., к. ч. Т1 3, Т1—О « Т1Н5(РО4)2, в стр. - окт., Т1—О 2.9-3.3 Т14Р2О7, разл. 120, хор. р. в Н2О Т12СО3, т. пл. 273, разл. 300; хор. р. в Н2О, TICH3COO, иглы, т. пл. 131, р. В СП.
Т1НСОО, т. пл. 104, р. в Н2О «85%, d р-ров 3.3-4.7
Tl2SiF6 • 2Н2О, хор. р. в Н2О
2,53 29)
29)
GaO
Низкоплавкие сплавы: 82% Ga + 12% Sn + + 6% Zn, т. пл. 17; 24% In + 76% Ga, т. пл. 16
GafAlCU], т. пл. 175 HGaCl2, крист., бц., т. пл. 29, р. в бзл., эф., димер;
Н2 + Ga2Cl4
Кислотоупорные сплавы: 70% РЬ + 20% Sn + 10% Т1, не р. в H2SO4, НС1, HNO3
МТ1О, M = K-Cs, крист., красн., стр. близка Т12О
Na3TlO2, в стр. - тр-ки [МО3], Т1—О 2.32, Na —О 2.33;
+ О2 —> NaTlO2;
+ Н2О —> ТЮН + NaOH 28)
Т1Н2РО4
Т1НСО4
МЬ[Т15]72-[Т19]9-, крист., диамагн., анионы -кластеры - триг. бипир. и трехшапочная призма, TI—Т1 3.13-3.44 Na23K9Tl15 з, содержит анионы [TI5]7 , [Т14]8 , [Т13]7 , [Т1]5 33)
М[Со(СО)4]3, М = In, Т1, в мол. - тр-к [МСо3], М —Со 2.59 (In), 3.55 (Т1)
3)
InCl, а-, крист., желт., куб.
/?-, красн., ромб.
InBr, крист., оранж., ромб.
Ini, крист., красно-кор.
т. пл. т. к. АЯ In—Г (г-)
225 653 -186 2.40
285 662 -175 2.54
360 743 -117 2.86
В стр. InCi - куб. типа NaCl - тетраэдры [1п4], In—In 3.61, ромб. InCi, InBr и Ini изостр. желт. TH, In—Г 2.87-3.91 (Cl), 3.01-3.85(Br)
ПР т. пл. т. к. АЯ Т1—Г
(г-) (тв.)
T1F, крист., бц., оч. хор. р. 327 840 -310 2.08 2.25-3.90
Т1СЦ, бел. 10 4 431 818 -205 2.48 3.32
TIBr),, св.-желт. 10 6 461 816 -171 2.62 3.44
ТП), желт. | 168° красн. 10 8 442 825 -125 2.81 3.64
"T1I3" = ТН • 12, крист., черн., изостр. Rbl3; в р-ре Т1+ +13 Т13+ +317
Т1Г (Г = C1-I), р. в конц. H2SO4 HNO3 ; стр. T1F - ромб., искаж. типа
NaCl; Т1С1, TIBr и TH (красн.) - типа CsCl; TH (желт/ слоистая стр. (к. ч. Т1 и I 7), в г. - Т1Г и T12F2 - ромб.,
Ga4r6 = Ga^[Ga^r6] Г = Br, I, анион -кластер, Ga—Ga 2.39 9)
1П5Вг7 = Initln^BrdBr,
анион - кластер, In—In ~2.70, In—Вг 2.56-3.67
1п2Г3 = 1пМГ6]
1п2С13, т. пл. 323, т. к. 641
1п2Вг3, т. пл. 232, в анионе
In—In 2.70, In—Br ~2.52
1.75 +
In4Cl7, т. пл. 260, т. к. 710
In4Br7, т. пл. 201
In5Cl9 = In3[In2IICl9] 31)
27)
1пА1С14, т. пл. 268; + Et2O —> 1пСЦ + А1С13 • Et2O
[T16I6] M2+ [i4]2-, M = Ag, Au, TI, Pb/2, в каналах каркаса [T16I6] -гантели [M2]2+ 30)
CsTlBr2; Cs2TlBr3; Т1А1СЦ, т. пл. 308
T1CN; T1SCN, т. пл. 234
Tl2Sj., сине-черн., т. пл. 448, возг. >360, т. к. 1367, АЯ= —42; + О2 —> Т12О + T12S2O3, р. в к., стр. анти-Сс112
Tl2Se, крист., серые, т. пл. 398, АЯ = —58
TlCu3S2, "халькоталлит"; TlFeS2, "рагинит"
Т12Те, T1AsS2, "лорандит"
Т1:
M4T12S3, М = К, Rb 30)
Ga2S, крист., черн., разл. Н2О;
1000° „ , „ _
-----> Ga + Ga2S2
Ga4S5, разл. 1200
Ga2S2, крист., желт., т. пл. 970, в стр. - гр. [Ga—Ga]4+, Ga—Ga2.53 Ga2Se2, кор., т. пл. 960 Ga2Te2, черн., т. пл. 824
In2S, крист., черн. In2Se, черн., полупроводник
----\ kno2
T1NO3 ) Z кти 2
,___у (ж. NH3)
(1пН)„, разл. 340, не р. в орг. р-рителях;
+ Н2О —> In + In(OH)3 + Н2/
InC5H5, в стр. - цепи "сэндвичей", к. ч. In 10, In—цикл 3.19, в г. - мономер - "полусэндвич", In—цикл 2.41
TI3N, крист., черн.; + Н2О —> взр.
TIN3, крист., желт., т. пл. 334, взр. > 400; АЯ = —234
(Т1Н)„, порошок, кор., разл. 270, не р. в орг. р-рителях, гидрол. медл.
Т1[ЭН4], Э = В, А1
T1OR, крист. (R = Me, Рг...) или масло Т1 OR
(R = Et), бц., в стр. и р-ре - тетрамеры, т1'1
[Т14О4] - куб., к. ч. Т1 3 (пирамида), RO Т1
к. ч. О 4 (тетраэдр) 14) OR
С5Н6 (Н2О)
TlCsH5, крист., бц., изостр. 1пС5Н5
Ga2Cl4, крист., бц., т. пл. 176, т. к. 535; Ga + GaCl3; распл. электропроводен, легко переохлаждается; р. в бзл. (димер); ц = 8.9;
+ Н2О —> Н2 + Ga), +
+ GaCl(OH) 0.5 Н2СЦ, оранж.
Ga2Br4, крист., бц., т. пл. 153(a), 165 (/?)
Ga2I4, крист., желт., т. пл. 211 Ga2r4 = Ga^Ga111^], анион -тетраэдр; у Ga+ - трехшапочная триг. призма, Ga111 — Вг 2.32, Ga1 —Вг 3.18-4.28
2NMe3, Ga —Ga 2,42
1пГ2 = In^In111^], диамагн.; + Н2О —> In + 1пГ3 InF2, крист., бц., неуст.
1пС12, бц., т. пл. 240, т. к. 655, АЯ = -402 1пВг2, т. пл. 198 (распл. желт.), т. к. 638, АЯ = -ИЗ
Inl2, крист., кор., т. пл. 225, в стр. - анион тетраэдр, In—Г 2.49 (Вг), 2.71(1), к. ч. In1 8 (додекаэдр),
In—Вг 3.44 31)
9)
кА,
тюн
[R4N]2[Ga2r6],
Г = С1, Вг, анион - кластер, Ga—Ga «2.4 9)
Ga2Cl5
InS, крист, красн., т. пл. 692 In5S4, In6S7, In—In 2.76-2.80 InSe, т. пл. 660; 1щ8е3
InTe, In4Ie3 13)
72
Т1|[ПШО3] 26)
О2 (Z, сине-фиол. пламя) In
3 +
Ga2O3, крист., бел., т. пл. 1795, АН = —1089 (/?), а-, ромб., изостр. корунду (метастаб.), Ga—О в окт. 1.95; Р-, монокл., в стр. тетраэдры и окт., Ga—О 1.83 и 2.00; у-, стр. тип Мп2О3, р. в к. и щ. только а-форма
— Н2; С (800°)
GaOOH, стр. аналог A1OOH, "диаспора" 2) Ga2O3 • xH2O]_, бел., p. в к., щ. и конц. NH4OH (в отл. от А1 и In); К2 = 10-11, К3к = К3осн= 10 12
Ga(OH)3
In2O3, крист., желт., —> кор., т. пл. 1910 (р), т. к. —3300°, АН = —920, стр. тип Mn2O3, In—О 2.16, полупроводник
in(OH)4, бел., р. в к., сл. р. в конц. щ., куб. стр. близка ReO3, In—О 2.16 InO(OH), изостр. СгО(ОН)
24)
Т1
О3; О2(-Т12О)
Т12О3, крист., кор., т. пл. 716 (/?), АН = —390, 500° _
----> О2, сильн. окисл., + S —> взр., стр. тип Mn2O3, Т1—О 2.26 (Tl,Fe)2O3, " авиценнит"
T12O3 xH2Oi, кор., p. в к., пептизуется щ., осаждается при pH 1
GaCl3
Н2О || 15 н. МОН
М2О (+ О2)
T1SO4 = T1I[T1III(SO4)2] 17) 1.67 +
T13(NO3)5 = T|!,[TIIII(NO3)5]. крист., бц., т. пл. 150, темнеют во влажном возд.
Tl^Tl^CHjCOO)^, анион-додекаэдр
Ga(ClO4)3, в мол. - окт., • 6Н2О, р. в сп.
Ga5(IO6)3 ЗН2О
Ga2(SO4)3, 18Н2О
• M2SO4 • 24Н2О, М = K-Cs, квасцы Ga(NO3)3, возг. 140,
• 8Н2О, крист., бц., р. в сп.
GaPO4, т. пл. 1670, мол. сито, 2н2о;
Ga(H2PO4)3 Ga(PO3)3
GaAsO4, стр. тип а-кварца (каркас тетраэдров), Ga—О -1.78, As—О 1.72 15)
Г аллаты 35)
Na9[Ga(OH)6]2(OH)3 6Н2О;
Na10[Ga(OH)6]2(OH)4; M[Ga(OH)4];
NaGanO16(OH)2; K2[Ga2O(OH)6];
Ba[GaO(OH)2]2; MGaO2; M3GaO3; Ca3[Ga(OH)6]2; Ca3(GaO3)2, p. в H2O (в отличие от Al); CaGa4O7; M5GaO4, M = Li, Na; lVI8Ga2O7; LiGagOg;
M2Gai2Oi9, анион - изолированные или конденсированные тетраэдры или окт., Ga —О 1.78-1.90 или 2.00
Индаты 22)
M3[In(OH)6] 2Н2О, Rb2[In(OH)5(H2O)|
Ba3[In2(OH)12], анион - окт., In—О 2.09-2.27
Na5[InO4], анион - тетраэдр, In—О 2.09; Cs6[In2O6]
Ca[In2O4], анионы - тетраэдры
Li3InO3; MInO2; Rb2In4O7
13)
Таллаты
Na3|TI(OH)6|; Na8Tl2O7 ЗН2О
Rb3Tl3O6
М5[Т1О4], желт., анион - тетраэдр,
Т1—О 2.15-2.23,
-U М3Т1О3 -U МТ1О2,
М = Li-Rb; СаТ12О4; М?Т12О5,
в стр. - каркас окт.,
Т1—О 2.13-2.59
M[Ga(ClO4)4], М = Rb, Cs, [NO]
Li7[Ga(IO6)2] 4H2O
HGa(SO4)2 4H2O
M[Ga(NO3)4], M = Li, Na, [NO2]
Rb[Ga4(HPO4)(PO4)4] 0.5 H2O,
к.ч. Ga 4, 5 и 6
Cs2[Ga(H2PO4)(HPO4)] H3PO4 H2O
(NH4)3[Ga(C2O4)3] 2H2O 15)
T12F3 17)
тцга = TiirrFrd,
Г = Cl (желт., Т1ш —Cl 2.57,
TI1 —Cl 3.1-3.8, к. 4. TI1 7, 8, 9),
Br (красн.) -
ТЦСЦВгг, QT1C13
+ H2O — TlBr l + TlBr3 + . >7— ti4s3 = ti^tFS;,], d-
анион - тетраэдр '
4-
T1F2, изостр. CaF2
Т12г4 = tfrrFn],
Z Г = Cl, Вг, крист.,
СаОГ, крист., бц., уст. на возд. (кроме Г = I)
т. пл. т. к. АН
GaF3, крист., бц., лету- >1000 800 -1019
чие, (т) (возг.)
ЗН2О
GaCl3, иглы., бц., гигр. 78 201 -523
GaBr3, крист., бц. 122 279 -385
Gal3, крист., желт. 212 346 -213
В г. - димеры Ga2r6 [Ga— -Г(конц., мост.) 2.10,
2.30 (Cl); 2.24, 2.45 (Вг); 7ГСаГ(конц., мост.) 125, 88 (Cl); 128, 91 (Вг)] и мономеры - тр-ки GaF3, Ga — F 1.88 (крист, стр. см. 1пГ3)
СаГ3 • L, Г = C1-I, L = Н2О, ROH, R2O, NH3, NR3, РС13, AsCl3, РОГ3, PCI5, мол. - тетраэдры
1п(С1О4)3 • 8 Н2О, т. пл. 80, разл. 200
in(io3)4
In(OH)SO4 2Н2О, в. стр. - цепи окт. с общ. ребрами
In2(SO4)3, разл. 600; • иН2О, п = 5, 10
• M2SO4 • 24Н2О, М = NH4, Rb, Cs, квасцы In2(SeO3)3, 5Н2О, в стр. - окт., In—О 2.14 7) [InNO3(H2O)5](NO3)2, к. ч. In 7 InPO4 • 2Н2О]_, р. в изб. Н3РО4
InAsO4 н2сц
[In(OH)3_2„(CO3)„ + In(OH),L. р. в изб. СО)
1пВО3
[1п2(С2О4)3(Н2О)4] • 2Н2О, анион - пентаг.
бипир., In—О 2.15 (акс.), 2.23 (экв.) 25)
1п(ОН)„Г3_„]_; InOCl, изостр. BiOCl; InOBr;
InF2(OH), искаж. стр. типа ReO3
M[In(SO4)2] 4Н2О, М = K-Cs, (в стр. - слои окт. -шранс-[1пО4(Н2О)2], In—О 2.14), Н( = [Н5О2]+ [In(SO4)2(H2O)2]-) M3[In(SO4)3], окт., In—О 2.12
Na[In(SeO4)2] 6Н2О (NH4)2[In(NO3)5|
K6H[In(NO3)4(H2O)2]3(NO3)4
K[In(C2O4)2] • и Н2О П)
T1(OH)SO4 2Н2О, ядохимикат
Tl2(SeO4)3; -U Tl2SeO4
Т16ТеО12
T1(NO3)3 • ЗН2О, к. ч. Т1 9 (трехшапочная триг. призма), Т1—О 2.29-2.64
Т1РО4, 2Н2О
Т1(СН3СОО)3, в стр. - цепи [Т1О4О4/2], Т1—О 2.31-2.51 20)
TIOI\. крист., зел.
TIOBr 21)
7)
HT1(SO4)2 4Н2О MT1(SO4)2 иН2О, п = 5 (Li, Na), 4(K-Rb), 2 (Cs), в стр. - цепи окт. [T1(SO4)2(H2O)2],T1—0 2.24 M3[T1(SO4)3] (NH4)[T1(CH3COO)4]
Н[Т1(С2О4)2] ЗН2О М[Т1(С2О4)2]
М3[Т1(С2О4)3]
О
1.33 +
Т1618 = = Т1^[Т11П18], крист., черн.
бц., анион - искаж. тетраэдр, к. ч. Т11 8, TI —С1 2.48-3.90, изостр. МТ1С14, + Н2О —> Т14Вг6 + + Т1Вг3
Т12С12Вг2 Tis, TUS3
TISe, т. пл. 310
[R4N][GaF4] H2O; (NH4)3GaF6; Sr5Ga3F19; M2[GaF5(H2O)] MIGaCLd, M = NH4, [NO], K, [GaCl2Dipy2], анион - тетраэдр, Ga—Cl 2.17 5’13)
HGaCl4, экстрагируется MeCOOBu из 6 и. р-ров HC1 (в отличие от Al)
KGa2Cl7, анион - 2 тетраэдра с общ. вершиной
MGa3Br10; K[GaI4], G—I 2.54 16) [R^IGaT^'-J, Г, Г = Cl, Br, I, n = 1-4
18) т. пл. т. к. АН
InF3, крист., бц. 1172 >1200 -1029
1пС13, крист., бц. 586 (р) 617 (возг. 498) -537
1пВг3, крист., бц. (кор. распл.) 420 (р) 409 (возг.) -418
Inl3, крист., » 5° р-желт. ^:а-красн., ром- 570 боэдрический d = 4.72 d=5.32 (+ СНС13) Ini + I2 225 447 (с разл.) -229 (а) -224 ()?)
иН2О
4H2O
Ю)
Ga4[Fe(CN)6]3i, не р. в разб. к.
(в отличие от А1)
Ga(NCS)3 пЪ, L = Н2О(/г = 2), Dipy (1, 2),
Phen 8)
M[Ga(NCS)4]
M3[Ga(NCS)6] 8)
В стр. GaT3 и 1пГ3 (Г = Вг, I) - димеры, стр. аналоги А12Г6 (Zllnl 125, ZInlln 86); при высоких Z в г. - тр-ки МГ3; InF3 и GaF3 изостр. ReO3; 1пС13 изостр. А1С13;
в стр. InF3H2O - цепи окт. [InF2/2(H2O,F)4], In—(F,O) 2.07
in(CN)3;
GaN, крист., бел., т. пл. 1500, р. только в конц. щ. (Z), стр. тип вюртцита
M2S (Z)
Ga2S3, крист., желт., т. пл. 1250, АН= —510,--
разл. Н2О, неупорядоченная стр. типа \
вюртцита, или сфалерита \
Ga2Se3, черн., т. пл. 1020 \
Ga2Te3, черн., т. пл. 792, полупроводник \
MGaS2, в стр. - слои тетраэдров, Ga—S 2.3
CuGaS2, "галлит"
Ag9GaSe6; MGaSe2
MGaTe2 19)
Li3GaN2
M[Ga(NH2)4], анион -
тетраэдр, Ga—N 1.83-2.04
M2S3, М = Ga, In, Т1, в результате изоморфного замещения входят в состав Zn- Cd-сульфидных РУД
I H2S (Н2О)
In3S3j_, а-, куб., желт., р. в HNO3
/?-, крист., фиол., возг. 800, изостр. у-А12О3, т. пл. 1050, плохо р. в HNO3, АН = —426, полупроводник
Ga2H6, -2Me3N 32)
(GaH3)„, т. пл. —20, разл. —15
. • Et2O, разл. 35
Т BF3 (—BF3 • R3N)
• Ме^, т. пл. 70, возг., р. в эф.
• РМе3, мол. - тетраэдр
Ga[AlH4]3, разл. 0
£2ас/2
R3N • НС1
LiGaFLi, крист., бц., разл. 20, восст. акт. < LiAlH4, [GaH4] - тетраэдр, Ga—Н 1.97; Li3GaH6 + + Ga + Н2
т. пл. т. пл.
GaP 1467 InP 1058
GaAs 1245 InAs 942
GaSb 712 InSb 525
Крист., цв. от желт. до черн.,
полупроводники, стр. тип "сфалерита"
In2Se3; In2Te3, черн., т. к. 906 и 667, полупроводники,
АН = -343 (Se) и -191 (Те)
InN, крист., черн., т. пл. 1200, уст., разл. щ. и H2SO4, стр. тип вюртцита In(OR)3 14)
О/
Ga(OR)„r3_„, Г = Cl, Вг [Ga(OR)3]„, п = 2-4, крист, или ж.7 бц., гигр., р. в бзл., neper, вак.
MOR
M[Ga(OR)4], М = Li-K
Ga
(NH4)3InF6i, In—F 2.06
Sr2InF7 [R4N]2[InF5] иН2О; MIn2F7 Ba3In2F12; Rb2In3Fn, в стр. -окт. и пентаг. бипир.,
In—F 1.9-2.2
M4[InCl6]Cl; M3[InCl6]
Rb2[InCl5(H2O)|, анион - окт., In—Cl 2.47, In—О 2.28 (R4N)2InCl5; К1пСЦ, анионы -тетраг. пирамида и тетраэдр HInCU, неуст. и не экстр, эф. (в отличие от Ga)
M3InBr6; [R4N]2[InBr5] [R4N][InBr4], тетраэдр,
In—Вг 2.51
M4[InBr6]Br, In—Br 2.67 MInI4, M = [R4N], Cs HInI4, экстр, эф., циклогексаном 6’12’16)
|R4\|3|In(\CS)(,| 23)
MInS2, М = Li, Na( • Н2О) (желт.), К (роз.), Си/2 ("рокезит"), Fe/2 ("индит")
MInSe2
T1F3, крист., св.-зел., гигр., т. пл. 550 с разл., АН = —573, стр. тип YF3 Т1С13, крист., бц., разл. 40, р. в сп., эф., изостр. А1С13, АН = —352 Т1Вг3, крист., желт., неустойчивы
Т1С1„Вг3_„
Т1Г3 4Н2О =
= [Т1Г3(Н2О)2](Н2О)2, мол. - триг. бипир., Т1—Г 2.39(d), 2.51 (Вг), Т1—ОН2(акс.) -2.5 Т1Ы = Т1+[13]-
Т1Вг3 и Ру,
п = 2 (триг. бипир.), 3(окт.), TI—N -2.45, Т1—Вг 2.53 и 2.64 [TlBr2I(POR3)2] [TlClBrIL2], мол. - триг. бипир., Т1—Г 2.47 (С1),
M[T1F4], стр.тип CaF2
M3T1F6, Ba2TlF7
MT12F7, M = K-Cs, TI1
НТ1СЦ 3H2O (R4N)2T1C15, Куст = 1018
M2[T1C15(H2O)], TI—Cl -2.49
M3[T1C16] 2H2O
M3[T12C19], анион - 2 окт. с общей гранью
К1Т1СЦ], анион - тетраэдр, TI —С1 2.42
М[Т1Вг4(Н2О)2]
М[Т1Вг4], Т1—Вг -2.55, куст = ю24
Cs2TlBr5; Cs3Tl2Br9, в стр. -окт. [Т1Вг6]3 и тетраэдры [Т1Вг4Г
Rb3TlBr6 8/7 Н2О
М[ТП4], крист., темно-красн., анион - тетраэдр, TI—I 2.72-2.84, Куст=1032
12)
ГО
LiInH4 • 3 Et2O
Т1С1
T12S3, крист., черн.,
т. пл. 260, р. в HNO3,
АН= -116
T1J T12S5, красн. и черн.
формы
----
Т1Г )
M[T1(CN)4], Куст = 1035
LiTIH4
73
ИОНЫ БЕРИЛЛИЯ, АЛЮМИНИЯ, ГАЛЛИЯ, ИНДИЯ И ТАЛЛИЯ В ВОДНОМ РАСТВОРЕ
СКАНДИИ,АКТИНИИ
3 + (</")
3d
45
4Р Э.О.
6d
75
1р
Sc2O3, порошок, бел., d = 2.75, т. пл. 2489, р.
/ в конц. к. (/), АН = —1907, стр. тип Мп2О3 3)
f 460
M2OZ
Ac2O3, порошок, бел., АЯ = —2047, стр. тип La2O3
ScO(OH), стр. аналог AIO(OH)
Радиоактивный ряд Ас (А = 4п + 3);
а - 223l-„
----► 87fL>/ ' '
227 89АС- °
I 227 90Th("RdAc") • • •
235 92U("AcU")
231
)Th 23:1 91Ра
21.8 лет
(10 9% в U-рудах)
Sc2O3 • иН2О]_, гель, ОН Sc(OH)3j_, куб. стр.
бел., р. в к. и конц. щ. (/) (160°) близка ReO3, ZScOSc 143
Косн. А1(ОН)3 < Sc(OH)3 < Ln(OH)3
Ас(ОН)3]_, бел., р. в к., Косн > Ln(OH)3
Ряд Th (А = 4п):
232 228 -
901П ---> 88?
228 89Ас("№Ш’)
6.134 ч р ,У
228 -t-k
901П • • •
Синтез:
226 88Ra (п,у) 227 88Ra —> 227 89Ас, отделяется от др. продуктов распада
41 мин р экстракцией бзл. в виде теноилтрифторацето-ната (pH 5.5-6.0) или хроматографически
(ScF3, ScCl3)
5)
Sc | Ас
мет., серебристо-бел., мягкие светится в темноте 10.1 1050 3390 р. в Н2О, оч. реакц. (вследствие радиоактивности) -2.6
с желт, отливом
d 3.02
т. пл. 1541
т. к. ~2850
медл. pear, с Н2О, пассивируется (HF + HNO3)
£ом3 + /Мтв= “2-08 а-, гексаг. пл. упак., а = 3.31, с
= 5.27
а
М —М (сущ, при 20°)
Sc(Dipy)3
<2/
ScF3
Sc
4.53
3.26
/?-, куб. пл. упак.
0(rff)
5.31
3.76
6)
ScCl, '
Sc7Cl10,
Sc5Cl8,
Sc7Cl12, в стр. - цепи окт. [Sc(>] с общ. ребрами, Sc—Sc 3.15-3.41, Sc—Cl 2.44-3.31, Мэфф. .04
Li (THF)
Скандаты 4)
M3[Sc(OH)6], иН2О, Sc—О 2.12; M','Sc2(OH)l2
Na[Sc(OH)4]; NaScO2
M(ScO2)„, M = M1, в стр. - каркас окт. [ScOg], Мп, Ln
Ba3Sc4O9
Sc(ClO4)3 «
Sc(IO3)3, 2Н2О, «
Sc2(SO4)3, • иН2О, п = 5, 6;
• K2SO4 • иН2О, не р. в р-ре K2SO4;
Cs2SO4 24Н2О, квасцы (сущ. при 0°)
Sc2(SeO4)3, в стр. - каркас окт. [ScO6] и тетраэдров [SeO4], Sc—О 2.07-2.13; • 5Н2О, изостр. сульфату 2)
Sc2(TeO4)3 • 3 Н2О «
Sc2(CrO4)3 • 6Н2О, крист., оранж.; Sc(OH)(CrO4) • Н2О Sc(NO3)3; • иН2О, п = 2 (т. пл. 50), 3, 4, • 2 Dipy Sc(OH)(NO3)2 ЗН2О
ScHP2O7 ЗН2О]_; ScPO4 2H2O, "эгонит"
Sc(H2PO4)3; Sc(PO3)3 9)
Sc4(OH)12_„(CO3)„ vH2(\
Sc(RCOO)3, в стр. - цепи окт. П) Sc2(C2O4)3 • 5Н2О]_, не р. в к. (Sc,Y)2Si2O7, "тортвейтит"; Sc2Si2O7, "бефанамит" ScBO3, в стр. - окт. [ScO6] и тр-ки [ВО3], Sc—О 2.12 1 [Sc(M-OH)(H2O)5]2r4 2Н2О, Г = С1, Вг, к. ч. Sc 7 14) ^-ScOF, стр. типа ZrO2, к. ч. Sc 7, Sc—O(F) 2.07-2.27 14)
M[Sc(ClO4)4]
MSc3(OH)6(SO4)2 4Н2О 8)
M[Sc(SO4)2], М = Li, K-Cs 8)
M3[Sc(SO4)3], М = Н, Na-Cs
15)
13) т. пл. возг. АН Sc—Г (г-) иН2О п =
ScF3j_, крист., бц., негигр. 1530 — -1548 1.93 —
ScCl3, крист., гигр., р. в си. 940 (р) 965 -941 2.32 6
ScBr3, гигр., бц., 960 (р) 929 -752 2.47 6
Scl3 945 (p) 910 -552 2.68 6
В стр. ScF3 - каркас окт., связанных общ. вершинами, ScF3
(Г = Cl, Br, I) изостр. FeCl3, Sc—Cl 2. (Я 25) 51-2.53, в г. - тр- ки ScF3
col
c2o4 (0
M[Sc(CrO4)2] иН2О, M = Na-Cs
M2[Sc(NO3)5], M = K-Cs, [NO] (= "Sc(NO3)3 • 2N2O4,r
к. ч. Sc 9 (4 NO3 - бидентатны, 1 - моно),
Sc—О 2.17-2.28 10)
M3Sc2(PO4)3, M = Li, Na 9)
M5[Sc(CO3)4] иН2О; M[Sc(CO3)2] иН2О,
M = Na-Cs, NH4
M[Sc(C2O4)2]; M3[Sc(C2O4)3] 5H2O
MScF4, M2ScF5, M3ScF6, KSc2F7,
в стр. - цепи пентаг. бипир., Sc—F 2.07
Sr2ScF7 12)
K3ScCI6; Na3ScBr6, ионные проводники 12)
M[Sc(NCS)4] иН2О M3[Sc(NCS)d иН2О,
М = М1, [DipyH], экстр, эф.
„ Н2О; Н + (—Н2) оС--- -- -- -- --- —
Ас_____Hjoc-Hj)
Ac(NO3)3
асро4, о.5н2о;
Ас2(с2о4)3;
АсОГ, Г = С1, Вт
AcOF, стр. тип CaF2
AcF3)_, изостр. LaF3 АсС13, стр. тип UC13 АсВг3, стр. тип UC13 Ас13, возг. вак.
Sc(OH)(NCS)2 ин2о, крист., желт.
Sc(NCS)3 2 Dipy
Sc2S3, желт., разл. Н2О, полупроводник, черн. - проводник; Sc2O2S
ScN, т. пл. 2650, не р. в к. и щ., стр. тип NaCl
ScC; Sc4C3; ScH2, стр. тип CaF2
Sc(OMe)3, крист., бц., не р. в си.; Sc5O(OPr-/)l3, в мол. - тетраг. пирамида [Sc5] Sc(OR)3, р. в С„Н2„, мол. - тр-к, Sc—О ~ 1.86,14) R =
Sc(CsH7O2)3, ацетилацетонат, т. пл. 187, возг. 200 (вак.), не р. в Н2О (ср. Ln)
Ac2S3, черн., разл. Н2О, изостр. Ln2S3
[ScCl„](3-") + , п = 1, 2 неуст. [Sc(SO4)„](2"-3)-, п = 2, 3
[Sc(H2O)6]3+, окт. ион, склонен к гидрол. и полимеризации ("оловые комплексы"), усиливающейся с ростом pH, [Sc(OH)]2 + <± [Sc2(OH)2]4+ [Sc3(OH)5]4+ 7)
н
|Ac(H2O)„|3 н, гидрол. <Ln3+, экстр. ТБФ <Ln3+, вымывается из катиона после Ln'
AcH, стр. тип NaCl
AcH3, изостр. LnH3
75
ИТТРИИ, ЛАНТАН И ЛАНТА-
НИДЫ (Ln)
4/ 5d
/Лантан La0 1 1 1 1 1 1 1 1 1-1 1 1 1
Церий* Се° |1|1| I I I I | 1 1 1 1 1 1
сЗ е
е, Празеодим Рг° 1 Н Н Н 1 1 1 1 1 1 1 1 1 1
сЗ { Неодим Nd0 | | | | | | | | |
И \ К
Он 0) Прометий Pm° | Й Й Й Й Й | | [ | | | | |
Д
Самарий Sm° 1ЙЙЙЙЙЙ | | | | | | |
Европий Euu 1ЙЙЙЙЙЙЙ 1 1 1 1 1 1
2 +
*) и ли 4/’15<7'6.у2
**) или 4f*5d'6s2
6s Э.О.
Й] 1.08 f Гадолиний Gd° 1; 11 1 1111 1111
Й] 1.08 Тербий ** Tb° |и| и| 1 11111 1111
й] 1.07 Диспрозий Dy° |и| и| и 11111 1111
е е
й] 1.07 Гольмий Но0 |и| и| и |и| 1 1111
« /
й] 1.07 оЗ / « \ Эрбий Ег° |и| и| и I и| и 1111
й] 1.07 н Тулий Tin0 |и| и| и I и| и и| 1 |
S
й] 1.01 Иттербий Yb° |и| и| и I и| и и|и|
Лютеций Lu° |и| и| и |и|и| и|и|
1 Иттрий Y°
5d 6s Э’0, ш 1 1 1 1 Е] г"
1 1 1 1 1 1 Е1 1-ю 1 1 1 1 1 1 И 1-ю 1 1 1 1 1 1 Е] 1-ю 1 1 1 1 1 1 0 1-п Синтез Pm: *6oNd (Й>, n^fPm 18 лет (Пул, Квилл, 1938) 2925U (n) ‘^Prn + Pu +• • • 2.62 года (Маринский, Гленденин, 1947 г.) осколковый элемент в реакторах (0.7 г на 1 кг Pu)
1 1 1 1 1 1 EJ 1-п 1 1 1 1 1 1 Е] гое 14 1 1 1 1 ЕН 114 4d 5s |Й 1 1 1 1 [Й] 1.11
Nd2+ (f4), Sm2 + (f6), Eu2+ (f7), Ho2+ (fn), Tm2+ (f13), Yb2+ (f14)
SmCO3
KEu(CH3COO)3, в стр. - ат. Eu с к. ч. 8 и 9
Eu3(BO3)2; EuB2o4; Е112В2О5; Е11В4О7, стр. - аналоги боратов Sr
Ln4OCI6, Ln = Sm, Yb, ат. О в центре тетраэдра [Ln4], к. ч. Ln 9 + 1, Ln—Ln ~3.8, Ln—О 2.26, Ln—Cl 2.8-3.5 22)
Er3OBr4
^‘""""Мишметалл" (в основном Се, La)
La Се Рг Nd Pm Sm Ен Gd ть Dy Но Ег Tm Yb Lu Y
Мет., серебр исто - бел ., плас! гичные, тускне ют во вла жном возд , разл. Н2о (/) р. в к (за па <лючен нем Hf и Н3РО4) , парамап г.
^°М3+/МТВ -2.34 -2.35 -2.32 -2.29 -2.30 -1.99 -2.28 -2.31 -2.29 -2.32 -2.32 -2.32 -2.22 -2.30 -2.37
£ом2+/Мтв — — — — — -2.67 -2.80 -2.64 — -2.20 — — -2.3 -2.8 — —
р. в Н2О (20°) пирофо- р. в ж. ферро- ферромагн. р. в ж. горит
реи NH3 маги. NH3 >1000°
(сии. р-р)
d 6.17 7.3 6.8 7.0 7.26 7.5 5.3 7.9 8.3 8.5 8.8 9.0 9.3 7.0 9.8 4.58
т. пл. 920 804 935 1024 1180 1072 826 1312 1356 1407 1470 1522 1545 821 1663 1528
т. к. 3450 3450 3510 3080 -3000 1800 1440 3272 3073 2587 2707 2857 1947 1211 3412 3322
а-, гексаг. пл. упак. а-, ром- а-, гексаг. пл. упак. а-, куб. а-, гексаг. пл. упак.
боэдри-
ческая пл. упак.
а 3.77 3.68 3.67 3.66 3.65 а = 9.00 3.63 3.60 3.59 3.57 3.56 3.54 5.48 3.51 3.65
с 12.16 11.92 11.83 11.80 11.65 а = 23°13' 5.78 5.69 5.65 5.62 5.59 5.56 5.55 5.73
| 310° | 168° О
у-, куб. пл. упа к.
а 5.03 5.16 .. 798° .. 862° .. 917° .. 1264° .. 1317° .. 1400° .. 1367° .. 798° .. 1480°
| 868° | 725° I I I I I I I I I
Р-, куб. (тип a-Fe)
а 4.26 412 413 413 4.07 458 4.06 4.02 396 394 4.44 3.90 4.11
60 65 70 ат. №
Периодичность в изменении физических св-в и стр. Ln
NH4I (ж. NH3 -Н2Т)
YDipy3 3Thf
[Ln(H2O)8]3 + + H2O [Ln(H2O)7(OH)]2+ + H + , куб. ионы, Ln—OH2 2.48 (La), 2.41 (Tb), 2.40 (Dy), 2.37 (Er), 2.36 (Tm), 2.34 (Lu) 14) Ст. гидрол. растет от La к Lu по мере упрочнения связи Ln—ОН2;
в том же направлении изменяются радиусы [Ln(H2O)8]3+
(в противоположность свободным Ln3 + )
2 +
Окраска [Ln(H2O)8]3+
Yfe = 'l—n п Yfe = 'l + п
La, бц. (f0) 7 (f14) бц. Lu
Се, бц. (f1) 6 (f13) бц. Yb
Рг, желто-зел. (f2) 5 (f12) св.-зел. Tm
Nd, роз. (тв. -
фиол.) (/’3) 4 (f11) роз. Er
Pm, роз. (/’4) 3 (f10) св.-желт. Но
Sm, желт. (f5) 2 (/9) св.-зел. Dy
Eu, св.-желт. (/’6) 1 (f8) св.-роз.ТЬ
Gd бц. (f7)0
Y2r3, Г = Cl, Br, изостр. ZrCl, Y—Y 3.3-3.7, Y—Cl 2.7-2.8 Gd2Cl3 Tb6Br7
Ln7I12, Ln = Tb, Er, Lu
Lr7I|o, Er4I5
В стр. - цепи окт. кластеров [Ln6T 12], Ln—Ln 3.3-3.8 23)
LnF2j., Ln = La-Eu, Yb, крист., красн. (Eu -св.-желт.), стр. тип CaF2, Eu—F 2.51 LnFE, Г = Cl-I, изостр. PbFCl
13) NdCl2 SmCl2 EuCl2 НоС12 TmCl2 YbCl2
темно- кор. бц. желт. зел. желто-
зел. зел.
T. ИЛ. 841 859 738 527 720 723
АЯ -707 -798 -833 — -712 -709
Л Ln + LnCl3; Стр. LnCl2 типа PbCl2; LnCl2 • 2H2O, изостр. SrCl2-2H2O LnBr2, Ln = Sm, Eu (t. k. 2204, = —719), Tm, Dy, Yb, черн. Lnl2, Ln = Nd, Sm, Eu, Tm, стр. тип Cdl2; + H2O —> H2 + ...; H2O, в стр. - слои из пар окт., Yb—I 3.13-3.24, Yb—О 2.39 44) "Lnl2" = Ln3 + I2e“, Ln = La, Ce, Pr, Gd, Dy,
крист., с мет. проводимостью, в стр. Prl2 -кластеры [Рг4] и [I4], Pr—Pr 3.87 2)
Eu(C5H5)2
[Ln(OR)2]2 2Thf, Ln = Eu, Yb, R = C(Bu-Z)3, СбН2-2,4,6-К', крист., красн., p. в бзл. 43)
LnSJ., Ln = Sm, Eu, Yb, стр. тип NaCl [LaS, CeS = Ln3 + S2~e_, желт., проводники] Ln3S4(Ce,Sm); Ln2S3(., т. пл. x 2000, стр. (Lu-Yb) типа корунда (к.ч. 6); (Dy-Tm) к. ч. 6 и 7; (La-Sm, Gd-Dy) к. ч. 7 и 8; Се к. ч. 8 (додекаэдр)
Ln2S4; Ln2O2S; La[S2]
LnSe, LnTe, полупроводники; Ln3Se4 16)
KEu(NH2)3; Na2Eu3(NH2)8 26)
LnN, LnP, крист., черн., разл. H2O, стр. тип NaCl, проводники 26) ЬпЭ, Э = As, Sb, Bi, уст. к гидрол.
_________!__________________
La2Br5, черн.
Рг2Г5, Г = Br, I, к. 4. Pr 7 и 8 (одно- и двухшапочные триг. призмы), Рг—Рг 4.1-4.9, Рг—Вг 2.9-3.4
Nd3Cl7, стр. аналоги Nb6F 14
Nd4Br9; EU4CI9
SineBrn; Sm11Br24; 8т5Вгп, сверхструктура типа CaF2 24)
Vb4F4
CsLnCl3, Ln = Sm, Eu, Tm, Yb;
+ H2O H2t + • • •, стр. тип BaTiO3 MLn2Cl5, в стр. - цепи одношапочных призм [LnCl7] или [LnCl8], Yb—Cl 2.74 - 3.13 22)
LnC2, крист., желт., т. пл. «2300, стр. тип СаС2, С—С 1.28, проводники; + Н2О —> С2Н2 + Н2 + • • •
Ln2C3 (La-Но); Ln3C (Sm-Lu)
ЬпН^з (La-Pr), порошки, гигр., разл. 1000, самовоспл. на возд., куб. стр., к. ч. «11 (La-Nd), гексаг. стр., к. ч. Ln «6 (Sm, Gd-Lu) LnH2, металлоподобны, не pear, с Н2О, стр. тип CaF2
76
3 +
4 +
°-cY^00.
Ln
Ce(f °), Рг(/ '), Nd(f 2), Tb(/7), Dy(/8)
\О
Ln2O3, крист., тугоплавки, т. пл. 5:2000, т. к. «4300, цвет соответствует Ln3 + , АЯ= —1791 (Pm) - 1883 (Er); гексаг. слоистая стр. типа La2O3, к. ч. La 7 (одношапочный окт.) (La-Pm), La—О 2.55; монокл. типа /LSm2O3, к. ч. Sm 6 или 7 (Sm-Gd); куб. типа Мп2О3, к. ч. 6 (Pm-Lu, Y) 3)
LnO(OH), ионные стр., к. ч. Ln 7 (одношапочная триг. призма)
H2O(+Q, "гашение")
H2 (>1000°)
Се7О12 Се4О7, крист., син.
ТЬ7О12 ТЬ4О7, ТЬцО20, кор.
РГ7О12-Х РГ9О16+Х; РгбОц,
РГ10О18 черно-кор., стр. тип
Рг12О22 CaF2, разл. 520 18)
O2
H+ (-Ln3 + )
H2 (1000°)
СеО2, порошок, бел. (—> желт.), т. пл. 2700 (р), АЯ = —1087, р. только в конц. H2SO4(Z); + Н+ + Н2О2 —> Се3 + ;
(Се, Th)O2, "церианит"
РгО2, крист., черно-кор., разл. 400 (р О2 = 1 атм.);
АЯ= —1004; ТЬО2, корр., разл. 400; LnO2 - стр. тип CaF2
-v6\'450^
-Н2О (Nd 600, Sm 500, Но 300, Lu 100°)
\ Ln2O3 • xH2O]_, гели, цвет соотв. Ln3 + ; ------ > Ln(OH)3j_, стр. тип UC13
(к. ч. 9), Ln—О 2.43-2.54; Lu(OH)3 - искаж. стр. ReO3 (к. ч. 6), Lu—О 2.24; р. в к., сильн. осн., поглощают СО2; Хосн, т. разл., ПР падают от La к Lu
От
Ce2in(CeIVO3)3 vH2()t. крист., сине-фиол.
g'
Ce(ClO4)3, Д- • 8H2O 31); Ln(ClO3)3 • 3H2O, к. ч. (9)La, (8)Yb 31)
|Ln(H2O)9|(BrO3)3; Ln(IO3)3(. (Се-Lu), к. ч. Ln 8 (додекаэдр) минимально p. Gd HLa3(IO3)10 • 7 H2O; HPr(IO3)4; lnH2IO(,3 H2O: ' l nIO5, 4H2O 10) Ln2(SO4)3, порошки, гигр., разл. 780(La), 630(Ce), хор. p. в H2O(0°); • 8Н2О]_, р. падает с Z, Хдис [Ln(SO4)]+ = 10 4; • 9H2O(La, Се), в стр. - икосаэдры [LnO[2];
14Н2О(Се); Pr2O2(SO4), "техазит"; Ln2(SO3)3 6Н2О 33); La2(SeO4)3 5 Н2О Ln(NO3)3 • иН2О, п = 6(Pr-Nd)(= [Ln(NO3)3(H2O)4] • 2Н2О к. ч. Ln 10); (La, Се)(= [Ln(NO3)3(H2O)5] • Н2О, к. ч. Ln 11; Ln—О 2.54-2.71); п = 5, (Y, Eu, Er); п = l-6(Tb), п = 4(Tm-Lu); п = 3 (= [Yb(NO3)3(H2O)3], к. ч. Yb 9, Yb—О 2.32-2.43); п = 3.5 (= [Y(H2O)5(NO3)2][Y(H2O)2(NO3)4]) 43) —Е LnO(NO3), т. разл. падают от Се к Lu; La(OH)2(NO3), • Н2О, к. ч. La 9 32) Ln РОД (Er-Yb), стр. тип ZrSiO4, Ln—О 2.26-2.37 22) (Ce,La,Y,Th)PO4, "монацит"; YPO4, "ксенотим"; Nd[P5O14]
YAsO4, "черновит"
(Y,U)[Nb,Ti]2O6, "эвксенит"; (Na,Ca,LnM(Ti,Nb,Ta)2O6], "лопарит" Ln2(CO3)3 • л Н2О(, ПР«10 20 (минимально р. Gd)
La2(CO3)3 • 8Н2О, "лантанит"; Се(ОН)СО3; (Се,La . . .)FCO3, "бастнезит" Ln(C2O4)3 • 10Н2О]_, не р. в разб. к. и (NH4)2C2O4 (в отл. от Y и Th) Ln гр. Се р. < гр. Y, т. разл. (500-600), растет от Се к Lu
La(CH3COO)3 £а(он)и(сН3СОО)3_„)„ гель, синеет в присутствии 12
Be2Y2Fe[Si2O10], "гадолинит", "иттербит", содержат Sc, Eu-Lu
Y2[Si2O7], "таленит"
Лантанаты, Na[Nd(OH)4], MLnO2
Na4Ln(OH)7 лН2О, Ln = Yb, Lu, в стр. - окт. [Ln(OH)6] 4)
Cs[Ce(ClO4)4], Cs2[Ce(ClO4)5], Cs3[Ce(ClO4)6] 31)
M3[Ln(SO4)3], (Y, La)
M5[Ln(SO4)4], (La, Pr), к. ч. Ln 10, Ln —О 2.5-2.6
M4[Y2(SO4)5J; K8[Y2(SO4)7J; K6[Y4(SO4)9] 34'
K[Ln(SO4)2] • H2O, (La-Sm) плохо p., (Eu-Dy) средне p., (Tb —Lu, Y) xop. p.
M[Ln(SO4)2(H2O)3](H2O), (Pr, Sm), к. ч. Ln 9 20)
M2[Ln(NO3)5], M = M1, [NO], к.ч. Ln 10; Li3[Ln(NO3)5]NO3
M3[Ce(NO3)6], анион — икосаэдр; M3[Nd2(NO3)9] M2[Ln(NO3)5(H2O)2] • 2H2O, (La-Sm), к. ч. Ln 12 (икосаэдр), p. растет от La к Gd; K3Ce2(NO3)9
Mg3[Ln2(NO3)12] 24H2O; M2[Ln(NO3)5] H2O (Pr, Sm);
Cs[Ln(NO3)4(H2O)2] (Nd —Tm); MslNd^NO^n] H2O 17)
K3[Ln(NO2)6] 35)
M3Ln(PO4)2; MILn[P4Oi2], к. ч. Yb 7, Nd 8;
K2Nd[P5O15J; KLa2(PO3)7 10H2O
CsLn(PO3)4, к. 4. Ln 8 (антипризма)
M[Ln(CO3)2] лН2О, слои додекаэдров [Ln(CO3)5(H2O)3]
M3[Ln(CO3)3] 6 H2O; M5Ln(CO3)4 n H2O 37)
K3[Y(C2O4)3] 9H2O; [MZn(H2O)„](C2O4)2 H2O
LnOrj., стр. тип CaF2 или PbFCl; LnCl(OH)2, в стр. - слои из 8-мивершинников 39)
-Н2О + NH4r (z, вак.)
Lnl3
LnF3;
LnCl3
LnBr3
т. пл. La Lu т. к. La Lu -АЯ 40) La Lu Ln—Г (г.) La Lu • л Н2О, п =
1430-1184 2330-2230 1727-1702 2.22-2.04 4; 1 ]., не р. в ЗМ HNO3
862-925 1750-1480 1070-954 2.59-2.41 6; 7; 8; 9; 15 (Yb)
786-960 1780-1410 997-795 2.74-2.56 6 (Sm, Gd); 7 (La); 9 (Er, Y)
779-1048 1580-1210 700-556 2.98-2.77 9 (La-Ho); 8 (Er-Lu, Y); 6 (La-Lu)
LnT3, крист., гигр., р. в сп. (Г = C1-I). Стр. LnF3 (La-Ho) типа LaF3 ("тисони-та"): гексаг. слоистая, к. ч. La 11 (триг. призма с 5 шапками), La — F ~ 2.45(7 ат. F), 2.64(2 F) и 3.00(2 F); (Sm-Lu) - типа YF3, ромб., к. ч. Y 9 (трехшапочная призма), Y — F '--'2.3(8 F); 2.6(1 F), образ, аномальные тв. р-ры с CaF2; (Ca,Y,Ce)F„, п = 2-3, "иттрофлюорит"; LnCl3 (La-Gd) и LnBr3 (La-Pr) изостр. UC13 (к. ч. 9); LnCl3 (Dy-Lu, Y) изостр. A1C13 (к. ч. 6); LnBr3 (Nd, Sm) и Lnl3 (La-Nd) изостр. PuBr3 (к. ч. 8); (Sm-Lu) и LnBr3 (Dy-Ho) - изостр. Bil3. В г. - тр-ки или пирамиды, ZTLnT растет от Lu к La (110-114°) LnCl3 • 6Н2О = [LnCl2(H2O)6]Cl; LnCl3 • 7H2O = [Ln2Cl2(H2O)14]Cl4 ErCl3 7Thf = [ErCl2Thf5]+ [ErCl4Thf2E 21)
Lnl3 • (I2)„ • 6LJ., L = е-капролактам, n = 1-5, крист., кор., р. в ROH, ац., СНС13 9)
Ln(NCS)3 • 7Н2О, хор. р. в Н2О [Ln(OR)3]TO;, R = Me, Et, п-Pr ... l.n5O(OPr-/)l3. p. в орг. р-рителях, мол. - тетраг. пирамида, ат. О - в центре 42)
~~ ~(LnV " "
17)
36)
•— н2 (300°)
i(-f2)
M2LnF5, к. 4. Ln 7 5)
M3LnF6, анион - окт., (уст. Lu > La)
MLnF4, Ln = La-Tb, стр. тип. CaF2
RbLn2F7; BaLn2F8, в стр. -слои из антипризм [LnF8]
MLn3F10, M3Ln2F9, Ln = Dy-Lu, Y
(NHi)3Ln2F9 H2O
(NH4)2Ln3F11 H2O
K3LnCl6; Cs3LaCl6 4H2O, BaPrCl5
M3Ln2Cl9, M = Cs, PyH
Li3CeBr6, M3TmBr6, M3Tm2Br9 5)
Cs2[Nd(N3)5], к. 4. Nd 8, Nd—N 2.46-2.64 41)
M3|La(N Н2)6| NH3; M4[La(NH2)7] NH3; M[La2(NH2)7] Cs3[Ln2(NH2)9], (Ln = Ce-Sm), анион - 2 окт. с общ. гранью, Ln—Ln 3.7 - 3.6 38)
37)
K5Ce2(SO4)6 Н2О
H^Ce^SO^ •
72.2 Н2О
Ln = La-Tb, 29) крист., желт. ’
(Се(ОН)СОз)
fes
(40&
29)
СеО2иН2О;, гель, желто-кор., ПР = 10 50, р. в конц. к., оч. сл. в щ.
SI
Ln
гО-
Tbin(TbIVF5)3
Надперекиси 12) Ln(O2)3,
Ln = La, Pr, Nd, Dy Nd2O2(O2), в стр. -[NdO4(O2)2/2], Nd—О ~2.4, Nd—OO 2.50-2.65
Се(С1О4)4; СеНЮ6 ЗН2О 10)
Ce(SO4)2, порошок, желт., разл. 350, хор. р. в Н2О, не р. в конц. H2SO4;
• иН2О, п = 12, 8, 4, крист., оранж.; в стр. - антипризмы Архимеда [Ce(H2O)4(SO4)4/2], Се—О 2.29-2.39
х CeOSO4 Н2О; Ce2(OH)2(H2O)4(SO4)3 28)
Ce(OH)(NO3)3 • ЗН2О, крист., красн. 6) (р-р желт.)
[CePhen4](NO3)4
Се(НРО4)2]_, не р. в 4 н HNO3 (ср. Zr!) СеР2О7; Ce(HAsO4)2 • 2 Н2О
/ Се2(СО3)3(ОН)Д, красн.
.х Се(СН3СОО)4, крист., красн.
Се6О4(ОН)4(СН3СОО)12 30)
>о°
т. разл. 800 250 550
АЯ
-1962
-1705
» СеЕД, крист., бц.
PrF4 крист., бц.
TbF4, крист., желт.
t Стр. LnF4 типа ZrF4, в г. - тетраэдр, — Се —F 2.03;
ЕпЕД + Н2О -U LnF3 + HF + О2 П)
F2(p); XeF2
((NH4)2Ce(NO3)6)
Ce4O(OR)13 ROH
оранж.-кор. крист.30)
Ce(OR)4, крист., желт., тигр., разл. 200, возг.
/гт-В
•— • — (R = Z-Bu), ст.
ассоциации в бзл. 5-6
CeCl3(OPh) 30)
M2LnO3, Li8[LnO6], Ln = Ce, Pr, Tb Li6Tb2O7, M16Tb3O14, в стр. - цепи тетраг. пирамид [LnO5] или окт.
BaLnO3, стр. тип перовскита;
+ — Ln3+ + о2; 27)
Ln(OH)3 иН2О2 хН2О, Ln = La, Sm, Eu, Lu, уст. La > Lu 7) Ce(OH)3(OOH), крист., оранж.-красн. (качественная р-ция)
feco;
K8[Ce2(SO4)8] 4Н2Оф.
крист., оранж.
(NH4)6[Ce(SO4)5] 2Н2О, крист., красн.
M2[Ce(NO3)6], М = М1, Мп/2 (-8Н2О, крист., красн.); Н (экстр, из р-ров в HNO3-TE0>),
К2Се(РО4)2 Н2О
Na6[Ce(CO3)5], желт., • 12Н2О, к. ч. Се 10, все СО2- бидентатны (ср. Th!), Се—О ~2.4315)
Н2О2
LiCeF5, Li4CeF8, M2LnF9,
M7Ln6F31,
M = Na-Cs, Ln = Ce-Nd, Tb-Dy, Tm, бц., к. ч.
Ln = 7-9
Cs3LnF7, Ln = Nd, Tb, Dy;
90°
+ H2O o2 + ...
M2CeCl6, M = Rb, Cs, [R4N], оранж., анион - окт., Ce—Cl 2.59-2.62;
+ Н2О Се(Ш) + ОД ...
Н2СеС16 4 Diox, крист., оранж.
Се(ООН)4, оранж.
Се2(СО3)2(О2) 1, темно-красн.
М8[(СО3)3Се]2(О2)2 иН2О,
M = Na (и =18, 30), К (12), оранж., 2 гр. [О2] - мост., СО3 - бидентатны, к. ч.
Се 8, О—О 1.45, Се—ОО 2.35, Се—ОС 2.44 19)
МЕТОДЫ РАЗДЕЛЕНИЯ Ln
1. Ионообменная хроматография: сорбция Ln3 + на катионитах (в колонках) и элюирование р-рами комплексообразователей - оксикислот и комплексонов. Первым вымывается Lu, образующий наиболее крупный из [Ln(H2O)8]3 + , наименее прочно связанный с катионитом, La3+ вымывающийся последним, образует наименее прочный комплекс с элюентом.
2. Селективная экстракция Ln(NO3)3 из кислых р-ров трибутилфосфатом. Экстракционная способность растет от La к Lu. Предварительно Се отделяют от других Ln одним из следующих методов:
a) Ln3+ + ОН + О2 —> Се(ОН)4), + Ln(OH)3j,
| HNO3 (разб.)
Ln3+ + Се(ОН)4[. (р. в конц. HNO3)
б) Экстракция H2[CeIV(NO3)6] эф. или [ОР(ОВи)3] в керосине из р-ров в HNO3 (Ln3 + , не склонные к окисл., остаются в водной фазе).
77
Магний Mg° 3s И 1111 3d _I_L Э.0 1.2
Кальций Са° 45 ЕЗ J_L 1.0
Стронций Барий Sr° 5s И 1111 5d 1 1 1.0
Ва° 6s и 6р 1111 6d J_L 0.9
Радий Ra° 75 и LLU 7<Z J_L 0.9
Образование Ra при радиактивном распаде:
232 ..-гь __ 228 88Ra(MsThl) 228 > 228 224 ^(ThX)
6.7лет а’^ 3.64 сут. (ряд Th)
MgO CaO SrO BaO
крист., 6 ц., гигр.
"периклаз" "известь"
т. ПЛ. 2850 2614 2430 1923
т. K. 3600 2850 — «2000
АЯ -598 -636 -590 -556
RaO
-544
В стр. типа NaCl, М—О 2.11 (Mg), 2.40 (Са), 2.57 (Sr),
2.77(Ва); в г. - мол. МО, М — О 1.75(Mg), 1.94(Ва), р = 8.0 (Ва), 8.9 (Sr). MgO - хим. инертна после прокаливания;
Bai±xO, крист., красн.
600'
О2 (Ва < 600°, Н2О); (Sr, 125 • 108 Па)
M[O2], перекиси, крист., бц., диамагн., стр. тип СаС2,
О—О 1.49, сильн. окисл. SrO2 ВаО2
MgO2i(?) СаО2
разл. 20 380 (взр. 275) 480 750 (т. пл. 450)
АЯ -623 -652 -640 -632
8H2Oi 8H2Oi разл. «100 • и Н2О2 8Н2О
п = 0.5, 2 п= 1, 2 п = 1,2
O2 (p, t)
-o2
М[О2]2, надперекиси, М = Mg, Sr, Ва, крист., желто-зел., парамагн., разл. —30 (Mg); 50 (Ва);
+ Н2О —> Н2О2 + О2 + М(ОН)2 П)
---------------------------------
\ -70° (-О2)
М[О3]2, М = Sr, Ва, 3 11) озониды ’ ’
9oTh —>
238 тт ______
92 U ---->
235 тт ______
92 U
• 220 9oTh 22*’88Ra • • • (ряд U-Ra)
1617 лет
227 9gTh----> 222 88RafAcX) —> • • • (ряд Ас)
’ 11.3 сут.
Выделение 226Ra из U-руд ( «10 5%): 1) соосаждение с BaSO4i;
2) р, в комплексонах; 3) дробная кристаллизация или хроматографи-
MgO + CaO (из "доломита")
А1 [1200°, -М(А1О2)2]
^7
Mg Щелочноземельные металлы Ra
Са Sr Ва
бел. мет. бел., блестящие бел. | св.-желт. бел. мягкие бел.
окисляются возд., хим. акт. Ra > Mg
на поверхности тончайшая пленка MgO
4^7
' 47
светится в темноте
диамагн.
d 1.74 1.54 2.69 3.6
т. пл. 651 851 1000 10) 727
т. к. 1107 1482 1390 1860
£ом2 + /Мтв -2.34 -2.84 -2.89 -2.90
р. в разб. к. (кроме HF), NH4X(^H2 + NH3), RF(->RMgF)
pear, с Н2О, си., р. в а-, куб. пл. упак.
ж. NH3 (< М1)
5.56
а
М—М 3.94
6.05
4.30
Гексаг. пл. упак. (стр. тип Mg), ат. - в узлах гексаг. ячейки и в центрах 3-х из 6-ти триг. призм, к. (гексаг. аналог кубооктаэдра)
М—М = а 3.20
с 5.20
V-3.98 6.52
0-4.31 7.05
у-, куб (тип. a-Fe) а = 4.84
М—М4.19
5.02
4.44
парамагн.
«6
969
1536
-2.92
ч. 12
5.15
4.53
Легкие сплавы Mg:
[Mg + Al«10%) +Zn(^4%) + Mn«1.7%)]-
"’электрон"; [5-30% Mg + Al] - "магналий", тв. > Al
NH3
(г., Ж.)
[M(NH3)6], крист., золотистые, с мет. блеском, проводники, воспл. на возд., разл. 12 (Са), 4 (Sr), -З(Ва), уст. > [М>Н3)6]
[BaDipy4], разл. на возд.
H2O (кроме MgO)
Mg(OH)2i "брусит" т. пл. — разл. 350 ПР 10 11 Аосн.2 Ю3 Стр. т М —О 2.10 Са(ОН)21 "портлан-дит" 580 10 5 10 2 ип Cdl2 2.37 Sr(OH)2i 450 710 (?) 10Д иН2О п = 8, 1 10"1 В стр. Sr(OH)2 к. ч. Sr 7 (триг. одношапочная призма) В стр. М(ОН)2 • Ва(ОН)2 408 с разл. р. в Н2О • и Н2О, п = 8 (т. пл. 95, разл. 125), 3, 2(220), 1(375) 10"1 «Н2О к. ч. М 8 Ra(OH)2 р. > Ва(ОН)2 (антипризма), М — О
(MgCl2)
н2о
NaOH (65%) (100°)
Na2[Mg(OH)4|; Ba2[Mg(OH)6];
MgO • ЗК2О = "K6MgO4", двойной окисел, в стр. - тетраэдры [MgO4] 4)
Mg(ClO4)2, " ангидрон", т. пл. 246, разл. 382, хор р. в си., эф., 6Н2О, т. пл. 147; MI[Mg(ClO4)3] 15)
М(С1О4)2, М = Са, Sr( • Н2О), Ва (разл. 505), • иН2О, п = 3, крист., бц., оч. гигр. (сильн. осушители), хор. р. в Н2О, в стр. -икосаэдры [BaOi2], Ва—О 2.92 и 3.03; п = 1 15)
М(С1О3)2, разл. 120(Sr), т. пл. 414(Ва); иН2О, п = 6(Mg), 2(Са), 8 (Sr), 1 (Ва), оч. хор. р. в Н2О
Са(С1О)2; • ЗН2О; • 1/ЗСа(ОН)2 • хН2О, "белильная известь"
Ва(С1О2)2, разл. 235
М(ВгО3)2 • иН2О, п = 6(Mg), 1 (Са, Sr - хор р.; Bai), разл. > 200
Mg(IO3)2, иН2О, п = 4, 1, разл. 210, хор. р. в Н2О;
M(IO3)2i, крист., бц., ПР = 10 6 (Са. "лаутарит"), 10 12 (Sr),
10 9(Ва, лН2О, п = 1,2), 10’14(Ra)
Ba5(IO6)2; M2I2O9-nH2Oi, М = Са (п = 8); Ва (и = 3) 14)
MgSO4, т. пл. 1185 с разл. ("арканит"), <--- • иН2О, п = 1
("кизерит"), 2 ("сандерит"), 4, 5, 6 ("тетра-", "пента-", "гексагидрит"), 7, "горькая соль" ("эпсомит");
• K2SO4 • иН2О, п = 6 ("шенит"); 4 ("леонит") (NH4)2SO4 6Н2О = (NH4)2[Mg(H2O)6](SO4)2 24)
CaSO4i, т. пл. 1450, "ангидрит", • 0.5Н2О *2^ , т Н2О
"гипс", ПР = 10 5, К = 10 2
• M2SO4, М = Н, К ( • Н2О, "сингенит"), NH4, Na ("глауберит"), р. в Н2О
MSO4i, М = Sr [т. пл. 1500 (6 • 106 Па), разл. 1580, ПР = 10 7, "целестин"]; Ва[т. пл. 1580 с разл., ПР = 10 10, "барит" ("тяжелый шпат")]; Ra [ПР = 10 |2]; р. в ЭДТА (см. табл, ионов) MSO3 • HH2Oi, п = 6 (Mg), 2, 4(Са), 0(Sr, Ва) 16)
MS2O3 • иН2О, п = 6 и 3 (Mg, Са, хор. р. в Н2О);
5 и 1 (Sr, мало р.), 1 и 2 (Bai)
MS2O6 • иН2О, п = 4(Са, Sr), 2(Ва), хор. р. в Н2О
MSeO4 • иН2О, п = 6(Mg, хор. р.), 2(Са, р.), 0(Sri, Bai, Rai)
МТеОД, M = Са(т. пл. «1000); Ва, Ra
МСгО4 • иН2О, крист., желт., п = 7(Mg, оч. хор. р.), 2(Са, р.), 0(Sri, ПР = 10 5; Bai, Rai, ПР = 10 10)
МСг2О7 • иН2О, п = 3(Sr), 2(Ва), крист., красн., хор. р. в Н2О
2н2о;,
O3(фреон)
Co
Mg(NO3)2, разл. > 300, 7- • N2O4 5)
• иН2О, n = 6 т. пл. 95, разл. 100, р. в си., "нитромагнезит"), 2(т. пл. 129)
M(NO3)2, т. пл. 561 с разл. (Са), 570 (Sr), 592 (Ва, "нитробарит"), Ra(?); -7 M(NO2)2 + О2 —> NO2 + МО;
в стр. - кубооктаэдр (Sr, Ва), М — О 2.77 (Sr), 2.91 (Ва),
• иН2О, п = 4(Са, т. пл. 43, р. в си., ац., "нитрокальцит"; Sr, т. пл. 31 с разл.), 3(Са, т. пл. 51), 2(Ва, разл. 12), 1(Са-Ва, разл. «100)
M(NO2)2, разл. 240(Sr), 217 (Ва), Ra; • иН2О, р. в си., п = 4 (Са, разл. 44), 1 (Са, Sr, Ва, разл. > 100)
K2Ba(NO2)4, сегнетоэластик
MN2O2 нН2О;, п = 5 (Sr), 4(Ва)
K2[Ba(NO3)4], неуст. комплекс
М(НСО3)2, р. (М = Mg, Са обусловливают "временную" жесткость Н2О)
О д
Mg2(PO4)(OH) ЗН2О, "ковдорскит", в стр. - слои окт., Mg—О 1.99-2.23
М3(РО4)2)_, аморф., т. пл. 1357(Mg), 1670(Са), 1727(Ва);
• иН2О (Mg, п = 22, 8 "бобьерит", 4; Са, п = 4, 5);
ПР = 10 24(Mg), 10’26(Са), 10 28 (Sr), 10’22 (Ва)
M(NH4)PO4, иН2О, крист., бел., п = 6(Mg), 7(Са)
Ca5[PO4]3(F,Cl,OH), "апатит"; Са8Н2(РО4)6 5Н2О
МНРО4 • яН2О(, п = 3, 7 (Mg, "ньюберит", "фосфоррос-слерит"); 2 (Са, "брушит", ПР = 10 6); 0(Sr, 10 б,
Ва, 10 7)
М(Н2РО4)2, • иН2О, п = 6, 2 (Mg), 1 (Са, Ва), 0(Са, Ва)
(см. также Табл. "Фосфор")
М2Р2СМ, т. пл. 1383 (Mg), 1230 (Са),
• иН2О, п = 6, 3(Mg), 5(Са)
M3(AsO4)2 • иН2О, п = 8 (Mg, "хернезит"); 3(Са);
0 (Ва),, аморф., т. пл. 1605)
M(NH4)AsO4 • 6H2Oi, М = Mg, Са, крист.
MHAsO4 иН2О,
п = 7 (Mg, хор. р., "росслерит"); Ц (Sr, Ва) M(AsO3)2i, п = 4 (Sr), 0(Ва, разл. 500) M2As2O7, М = Sr, Ва (разл. 800)
7)
MgCO3i, "магнезит", разл. 350; • лН2О, п = 2("барринг-тонит"); 3 ("несквегонит"); 5 ("лансфордит"), + Н2О Mg2(OH)4_2„(CO3)„ mH2Oi, п = 1, т = 3, "артинит", ПР = 10 12, р. в NH4X
• М2СО3, М1 = К, NH4, Са/2 ("доломит") Mg5(CO3)4(OH)2 • 4Н2О, "гидромагнезит" CaCO3i, "кальцит" [т. пл. 1340 (108 Па)]; "арагонит"; различаются взаимным расположением М2+ и СО| , разл. 825, ПР = 10 9; • иН2О1, п = 6, 3, 1, 0.65 SrCO3i, "стронцианит", разл. 1350, т. пл. 1497 (р), ПР =10 9
BaCO3i, "витерит", разл. 1450, т.пл. 1740(р), ПР = I0 9 RaCO3i
"Магнезит" и "доломит" изостр. "кальциту"; "стронцианит", "витерит" и RaCO3 - "арагониту" М(СН3СОО)2, т. пл. 323 с разл. (Mg), 450 (Ва, в стр. -одношапочная квадратная антипризма [ВаО8],
Ва—О 2.7-3.2 и тетраэдры [Ва4]); • лН2О, п = 4(Mg, т. пл. 80); 1 и 2(Са), 0.5 (Sr), 3 и 1 (Ва), хор. р., сл. дис. SrH(CH3COO)3 • 2Н2О, додекаэдр, Sr—О «2.55 М(НСОО)2, • 2Н2О (М = Mg —Sr), р. в Н2О
МС2О4 • лН2СЦ, п = 2 (Mg), 3, 2 ("уэдделит") и 1 ("уэвел-лит")(Са), 1 (Sr), 0(Ва); ПР = 10"4(Mg), 10 9 (Са), 6-10-8(Sr), 10~7(Ва), К№С = 10~3
(М(ОН)2)
Mg2SiO4, "форстерит"; (Mg,Fe)2SiO4, "оливин", зел., в стр. - сетка тетраэдров [SiO4] и окт. [МО(>]
и Mg2SiO4 • Mg(F,OH)2, п = 1 ("норбергит"), 2 ("хондродит"), 3 ("гумит"),
4 ("клиногумит")
Mg2Si2O6, "энстатит" (пироксен)
Mg3Si4Oio(OH)2, "тальк"
CaMg(SiO3)2, "диопсид"
Ca2SiO4, "ларнит";
• и Н2О,"гиллебрандит"
CaSiO3 • иН2О, "соланит"
Ca3[Si2O7], "ранкинит"
Ca3[Si3O9], "волластонит" (пироксен)
Ca3[Si2O5]3 • и Н2О, п = 6 ("окенит")
2 ("трускотит")
BaSiO3, 6Н2О
RaSi2O5 5)
(NH4)2[Mg(C2O4)2]
M[SiF6], М = Mg(- 6Н2О, хор. р. в Н2О); Са(-2Н2ОП, Sr(-2H2Oi); Bai
78
Г алогениды, крист., бц., гигр.
НГ
MgE2 • nMg( ОН)2 8Н2О, п = 3, 5; I " = С1, Вг
Mg(OH)r, г = C1-I, стр. тип т. пл. т. к. Cdl2 АЯ Mg—Г (г-)
MgF2) "саллаит", стр. тип рутила 1396 2260 - -1121 1.77 ПР = 10 9, р. в. HNO3
MgCl2 "хлоромагнезит", стр. тип CdCl2 714 1418 -644 2.18 6Н2О ("бишофит")
MgBr2, тип Cdl2 710 1430 -519 2.34 6Н2О
Mgl2, 633 1014 тип Cdl2 с разл. Mg[I8]-2 6Н2О -360 2.52 8Н2О
СаС12 ЗСа(ОН)2 12Н2О
Са(ОН)С1, 0.5 Н2О
СаГД "флюорит"
СаС12
искаж. стр. рутила
т. пл. т. к. АЯ Са—
(г-)
1419 2500 -1222 2.10
782 2000 -799 2.51
760 810 -685 2.67
784 718 -536 2.88
г
ПР = 10
Sr(OH)Cl
СаВг2 искаж. стр. рутила Са12, стр. тип Cdl2
СаЕГ, Г = C1-I, изостр. PbCIF
Са[15]2 7Н2О
иН2О п = 1, 2, 6 ("фынфхрн-ицит")
иН2О п = 3, 6
6Н2О
SrF2i, стр. тип CaF2 SrCl2, стр. тип CaF2
SrBr2, искаж. стр. РЬС12, к. ч. Sr 7 12) Srl2, стр. тип РЬС12 SrFF, Г = C1-I
Sr|I(,|2 7Н2О
4Н2О т. пл. 1473 21) Sr—Г (г-) 2.20 ПР = 10 9
т. К. 2460 АЯ -1222
873 2030 -799 2.67 иН2О п = 1, 2, 6
643 — -685 2.82 иН2О п = 1, 2, 6
) 515 разл. -536 3.03 иН2О
п = 2, 6
Ва(ОН)С1 • 2 Н2О 20) Ва —Г (г-) 2.32 ПР = 10 6
ВаЕД, т. пл. 1353 Т. К. 2260 АЯ -1196
стр. тип CaF2
ВаГГ, Г = C1-I, — — — — —
изостр. PbCIF
ВаС12, стр. тип РЬС12 962 1830 -858 2.82 иН2О п = 1, 2
ВаВг2, стр. тип РЬС12 853 — -757 2.99 иН2О п = 1, 2
Ва12, стр. тип РЬС12 740 — -607 3.20 иН2О п = 2, 6
[Mg(NH3)6]X2, X = I, С1О4; + Н2О NH3 [M(NH3)6]I2, разл. 96 (Са), 62 (Sr), 20 (Ва)
[BaDipy4]I2
т. пл. Ra—Г 5) (г-)
ВаГД — 2.76 2Н2О
RaCl2 «900 — • иН2О, п = 2, 6
RaBr2* 728 возг. 900 —
Ral2 — —
* быстро желтеет
[Mg(H2O)6]2[CaCl6], "тахигидрит1
23)
KMgF3 (т. пл. 1070); K2MgF4 (разл. 846); NaMgF3 ("нейборит")
M4Mg3F10, М = Cs, Ва/2, в стр. - слои из гр. [Mg3F8F4/2] (3 окт. с общ.
гранями) связаны вершинами, Mg—F 1.89-2.10 8)
MMgCl3, • 6Н2О, М = К, МН4("карналлит"); KCIj. + MgCI2 • 6Н2О(ж.)
MJMgCLi], М = Na, [R4N], анион - тетраэдр, М = Li, стр. тип обратной шпинели
Na6MgCl8; Na2Mg3Cl8 9)
(M(NH3)6)Z
Стр. CaF2. Са - в узлах гранецентрированного куба, F - в центрах 8 малых кубов, к. ч. Са 8 (куб), F 4 (тетраэдр)
В расплаве ст. дис. МС12 = 43 (Са), 60 (Sr), 80% (Ва); в г. - линейные мол. MgF2, СаГ2 (Г = Cl-I), SrF2 (Br, I) и угловые CaF2, Srr2, (F, Cl) и ВаГ2
MgE2 • nL, L = NR3, R2O, R2C = O; n = 2, 6
В стр. Srr2 • 6H2O - [Sr(H2O)9]; • H2O, Sr—О 2.6, Sr—Г 2.99(d), 3.15 (Br); BaCl2 • 2H2O - одношапочная тетраг. антипризма [ВаС15(Н2О)4], Ва—О 2.86, Ва—С1 3.22 21)
K + NH3(p,Z)
M(CN)2, М = Mg, Са( + Н2О —> разл.); Ва(хор. р. в Н2О); Sr( • 4Н2О) в стр - цепи со связями М — С и М — N 22)
CaCN2, цианамид, возг. 1200°; +Н2О —> ИНД
M(NCS)2, иН2О, крист., гигр., хор. р. в Н2О, си., ац., М = Mg, в стр. -окт. [MgN2(H2O)4], Mg—N 2.10, Mg—О 2.09 22)
M(NH2)2, амиды, М = Mg (самовоспл.), Ва(т. пл. 290), крист., бел., не р. в ж. NH3; в стр. - тетраэдры [MgN4/2], Mg—N 2.08
| 400° (-NH3)
MNH, имиды, крист., желт.; MNK • 2NH3, разл. H2O
t If H2(-MH2)
12)
Z “
M2[Mg(NH2)4] 18)
KMn(NH2)3, Мп = Са, Sr в стр. — цепи окт. с общ. гранями, Са—N «2.5;
CaNH + KNH2 Na2Sr3(NH2)8
^7'
(CaSOQ
О
M(OR)2, M = Mg-Ba, крист., бц., изостр. Mg(OH)2 и Ca(OH)2, (стр. тип Cdl2)
М(ОМе)2 • иМеОН, п = 3.5 и 1 (Mg, Ва), О(Са)., Sr),)
M(OEt)2 • и EtOH, п = 4 и 2 (Са - Ва), 0 (МёД 6)
М(СО)2 = М2+[О—С = С—О]2 (?), бел. порошки, нелетучи, медл. гидрол.;
-U МСО3 + МО + С [ср. М2(СО)2!]
^7
О/
M3N2, нитриды, М = Mg (разл. 1500, АЯ=-477), Са(т. пл. 1195, АЯ=—439), Sr(> 1000, -389), Ва(1000, -364), крист., бц., + Н2О М(ОН)„ + NH3f; + СО — МО + N2 + С(М = Са, Sr), и —> ВаО + Ba(CN)2; в стр. - тетраэдры [MgN4], Mg—N 2.14
N2 |f t J, 500°(вак., —N2)
BaN2, пернитрид I M4N8, M = Sr, Ba, субнитриды,
M3N4, черно-кор., I черн., + H2O —> H2 + NH3 + M(OH)2
+ H+ «=> N2 + NH3 + M(OH)2
M(N3)2, азиды, M = Mg, Са, Ba (разл. 219, • 6H2O), Ra, p. в H2O и си., взр. <Pb(N3)2, в стр. - антипризмы (к. ч. Са, Sr 8); М = Са (• 2Н2О), к. ч. Са 8, Са—N 2.53, Са—О 2.54
М = N—М—Г, М = Sr, Ва, Г = C1-I, порошки, серые или красные (Са); т. пл. 965 (Ва)
И1Л
М)-----
K2lCa(N3)4(H2O)4],
Са—N 2.65, Са—О 2.45 19)
Гидриды
(MgH2)„, 1) порошок, бел., разл. «300, воспл. возд., бурно pear, с Н2О;
2) "неакт. форма", а-, медл. pear, с Н2О, уст. на возд., АН = —71, стр. тип рутила (TiO2); Р’ /?-, у-разл. 390°, в стр. к. ч. Mg 6 и 8 2)
R2Mg)
M(HS)2 • иН2О, п = 6 (Са, разл. 15), 0(Sr), 4(Ва, разл. 50), бц., хор. р. в Н2О MS)., крист., бел., т. пл. «2000° с разл.;
+ Н2О M(HS)2 + АЯ М(ОН)2; стр тип Na М —S □; д-BaS (г.) = 10.9
ТВ. г.
MgS -352 — — —
CaS -460 2.84 2.27 —
SrS -452 3.00 2.42 —
BaS -443 3.18 2.51 6Н2О
RaS — 3.29 — —
MgS4; MgS5 SrS4 • иН2О, n = 6, 4; SrS5, желт. BaS2, т. пл. 925 BaS3, зел., т. пл. 554; BaS4, красн., разл. 300, хор. р., • 2Н2О
Са3Р2, красн., т. пл. > 1600; СаР; + Н2О —> Са(ОН)2 + РН3
Sr3P2
Ва3Р2; ВаР2; ВаР3; Ca3As2; Ba3As2____________________________
Ва(С = СН)2 • 4NH3, крист., бц.
М[С2], карбиды (ацетилиды),
М = Са (т. пл. 2300, АЯ=-58), Sr, Ва(1780, —50); крист., бц., разл. «2000, стр. тип СаС2, тетраг. искаж.
стр. NaCl ([С2]2 = СГ);
+ Н2О —> М(ОН)2 + СгНД (ВаС2 с воспл.);
+ n2 —> mcn2
MgC2; Mg2C3 = Mg2[C = C = C];
z + H2O —> CH3C = CH + CH2 = C = CH2; АЯ = +88
Mg(C5H5)2, дицикл опентадиенилмагний, крист., бц., Г6(дГ” гигр., т. пл. 177, т. к. 221, разл. на возд., изостр.
Fe(C5H5)2, Mg — С 2,30 (ионная связь) 13)
0
АЯ
-188
-176
-170
d 1.90 3.27 4.21
крист., бц., d> dMeT., разл. «600 (уст.
Са > Sr > Ва), не р. в ж. NH3, стр. тип РЬС12 (к. ч. 9),
Са—Н 2.32(7 связей), 2.85 (2 связи);
+ Н2О —> Н2 (бурная реакция);
+ Э2О„ — Э + МО + Н2 (Э = Al, Ti, Nb, W);
+ ВС13 В2Н6 + МС12; МН2 + Н2 МН„, п <4,
М = Sr, Ва
CaH2
SrH2
BaH2
МН
(0
KMgH3 17)
K2MgH4 Li[MH3],
M = Ca-Ba Cs2CaH4, стр. тип K2NiF4
M[BH4]2, Ca[AlH4]2
2 +
Mg
M
Н + ; H2O + NH4+ .. 2+
-------------> [Mg(H2O)6] , бц., окт. ион
(-НД)
Н2_О ( Н2)_ [М(Н2О)й]2 + ,
уст. Ва < Sr < Са < Mg, не гидрол.
Hg If t (-Hgf)
M/Hg
v ЭДТА
М[ЭДТА]2 , окт. комплексы (хелаты), оч. уст. Куст. = 109 (Mg), 10п(Са), 109 (Sr), 108(Ва)
CH2COO
ооссн2
\(ch2)2n;
ооссн2 СН2СОО
-i4—
ЭДТА - этилендиаминтетраацетат-ион (комплексон III, трилон Б, динатриевая соль), гексадентатный лиганд.
79
ЦИНК, КАДМИИ
3d ..
7д? | ИIИIИI И| И~| [Й] 1111
45
4р
4Я
Э.О.
1.6
4J
Cd° |и|и|и|и|и~1 [й] 1111
5s
Sp
5d
1.5
ZnO, крист., бел. ( желт.), т. пл. 1969 (р), возг. 1725 с разл., кН = —348, "цинкит", стр. тип "вюртцита", каркас тетраэдров [ZnO4], Zn—О 1.95
250° (- Н2О)
Zn(OH)2;, бел., р. в к., щ., NH4X, Косн2 = 10 5, KXl = 10 12, Х1(, =10 13, старение осадка: а-, стр. тип Mg(OH)2 (окт. ZnO(>) —> ft-> у--> ... е- (тетраэдры [ZnO4]), Zn—О 1.96
/СР’’
—NH3
[Zn(NH3)4(H2O)2](-
Zn са
мет., бел., мягкие, блестящие
d 7.14 8.65
хрупкий ковкий
>150° - тягучий > 200° - хрупкий
т. пл. 419 321
т. к. 913 766
электропроводность
в 16 в 13 раз >Hg
р. в разб. к., щ., NH4OH р. в разб. к.
£ом2+/Мтв “°-76 -0.40
искаж. гексаг. пл. упак.
а 2.66 2.97
с 4.94 5.61
М—М 2.66 2.97
HX (H2O)
кат. восст.
чО
М
Zn(ClO4)2, • и Н2О, « = 2,4,6
Zn(ClO3)2 4Н2О; Zn(ClO2)2 2Н2О
Zn(BrO3)2 • 6Н2О, т. пл. 100, в стр. - [Zn(H2O)g]2 + г— Zn(IO3)2 • 2Н2СЦ, каркас окт., Zn—О 2.03-2.43 4)
23)
Сплавы
Zn + Cu - латуни;
Zn + Fe - в антикоррозионных покрытиях;
+ 0.1 % Mg - обладают высокой механической прочностью (типографские сплавы).
Легкоплавкие сплавы на основе Cd
Zn(MnO4)2 • 6H2O, черн., оч. хор. р. в Н2О
ZnSO4, разл. 620, "цинкозит", в стр. - окт. [ZnO6]; • иН2О, п = 7 (т. пл. 48, купорос, "госларит"), 6 ("бланкит"), 1; t —> Zn3O(SO4)2 8)
• (NH4)2SO4 • 6Н2О, соль Туттона; • 3Zn(OH)2
ZnSO3 • 2.5Н2О1; ZnS2O3, хор.р., К№С= I0 3
ZnS2C>6 • 6Н2О, хор. р. в Н2О; ZnSeO4 • 5Н2О; ZnCrO4l, желт.
ZnCr2O7 • ЗН2О, оранж., хор. р. в Н2О
Zn(NO3)2, летуч вак. 4^- • 2N2O4; • иН2О; п = 2.3 (т. пл. 45), 6 (т. пл. 36), 9; • nZn(OH)2 • /иН2О/, п = 4, т = 0; п = 2, т = 0; п = 1, т = 2 П) Zn(NO2)2, т. пл. 81
Zn3(PO4)2l, т. пл. 1060, • 4Н2О, "гопеит"; ZnHPO4 • иН2О, п = 1, 3 Zn(H2PO4)2 • яН2О, п = 1, 2, р. в Н2О; Zn2(PO4)(OH), "тарбуттит" Zn2P2O7l, т. пл. 1017; Zn(PO3)2[, т. пл. 872
Zn3(AsO4)2 • 8Н2О1, "кеттигит", разл. 100; Zn3(AsO3)2, "рейнерит" ZnCO3l, разл. 200, изостр. СаСО3, "смитсонит";
ZnCO3 nZn(OH)2 mH,O (п = 1 .5, т = 1, "гидроцинкит"; п = 1, т = 0), сущ.в виде оч. прочной пленки на поверхности мет. (в стр. - окт. [ZnO(>] и тетраэдры [ZnO4])
Zn(CH3COO)2, т. пл. 242; в стр. - каркас тетраэдров, Zn—О 1.93; 250°1 • 2Н2О, разл. 100. в стр. - окт. [ZnO(>], Хдис = 10 2 22)
Zn4O*(CH3COO)6, т. пл. 272, возг., р. в СНС13, изостр.
Ве4О(СН3СОО)б, но гидрол.; Zn—О* 1.96, Zn—ОС 1.98
ZnC2O4, 2Н2О;, ПР = 10 9, К№С = 10 5; Zn(HCOO)2 2Н2О Zn2[SiO4], т. пл. 1509, люминофор, "виллемит"; ZnSiO3, т. пл. 1437
Zn4O(BO2)e, т. пл. 980, стр. аналог Zn4O(CH3COO)g; Zn(BO2)2
[Zn2]2+[ZnCl4]2~ (сущ. в расплаве Zn + ZnCl2) 20)
Znr2 • nZn(OH)2 • /иН2О(, Г = Cl—I, п = 1, 4, в стр. - слои тетраэдров [F2/2Zn(OH)2/2] и окт., Zn—О 2.02 и 2.16, Zn—Cl 2.37 Zn(OH)G; Zn5(OH)8Cl2 H2O 25)
Н2О; ОН
21) т. пл. т. к. АЯ стр. тип Zn— (г-)
ZnF2). 875 1502 -765 рутила 1.81
ZnCl2 326(/1) 733 -414 — 2.07
315(a)
ZnBr2 394 670 -327 CdCl2 2.20
Znl2 446 624 -209 Cdl2 и 2.40
с разл. CdCl2
Г
• и Н2О,
4
4, 3, 2.5,
1.5 (т. пл. 25),
1
3,2
2
крист., бц., оч. гигр.
В г. - линейные мол. ZnF2; в стр. ZnCl2 (а- и ft-) - сетка искаж. тетраэдров, y-ZnCl2 изостр. Hgl2: в стр. ZnBr2, Znl2 - каркас тетраэдров, Zn—Г 2.41 (Вг), 2.63 (I); ZnBr2 • 2 Н2О = [Zn( H2O)6][Zn2Br6] - окт. и 2 тетраэдра с общ. ребром.
ZnF2 (Г = C1-I) оч. хор. р. в Н2О, сп., эф.
Ионы Zn и Cd в водном растворе см. с. 83
[ZnF2L2], L = NH3(t. пл. 211), Ру (в стр. - тетраэдические мол., Zn—Cl 2.2-2.35), N2H4 (в стр. - цепь окт. [ZnN4/2Cl2], Zn—Cl 2.58), RCN (Zn—Cl 2.17, Zn—N 2 15), R2O, ROH и т. д.
CdO, крист., кор.; ? красн.; возг. ~ 900 с частичным разл. (-^Я cd + о2), \Н = —260, р. в к., NH4X, стр. тип NaCl, Cd—О 2.35, "монтепонит"
МО2 «Н2О.
М = Zn, Cd, порошки, бел. или желт., взр. >200° 26)
M2O„(Z)
200° (- Н2О)
Cd(OH)2(., бел., ПР = 10 14, р. в к., NH4OH (Косн 2 = I03), в конц. щ. -оч. медл.; крист, стр. a-, ft- - стр. тип Cdl2, Cd — О 2.31; у- - в стр. - пары окт. с общ. гранями, Cd—О 2.15-2.40
27)
Цинкаты
Na2[Zn(OH)4] 2Н2О; Na[Zn(OH)3]
Ba2[Zn(OH)6], анион - окт., Zn—О 1.97-2.4
Ba[Zn2(OH)6] 5Н2О, анион - тетраэдр [ZnO2/2Oi/2O]
Sr[Zn(OH)4] Н2О, Zn—О 1.93-1.98
K4ZnO3, анион-тр-к (Zn-O 1.87-1.98), • ЗН2О
M2ZnO2l, в стр. - цепи тетраэдров [ZnO4/2] (М = К, Ва/2) или тетраэдров и тр-ков (Rb)
Nae[ZnO4], в стр. - тетраэдры [ZnO4], Zn—О «2.0
K2ZneO7
K2[Zn(S2O3)2] Н2О, хуст = ю5 M2[Zn(NO3)4], М = NO, R4N [NO][Zn(NO3)3]; M2[Zn(NO2)4] KZn2H(PO4)2; MZnPO4, в стр. -циклы тетраэдров [РО4] и [ZnO4], Zn—01.93-1.96
Rb3Zn4O(PO4)3 3.5 Н2О
K3Zn4O(AsO4)3 • 3 Н2О, фазы со св-вами цеолитов
M2[Zn(C2O4)2]
10)
MZ11F3; M2Z11F4,; K3Z112F7, анион - цепь окт., Zn—F 2.03 Sr4Zn3F14;
M2[ZnCl4], • иН2О, анион -тетраэдр, Zn—Cl 2.25
KZnG3 2Н2О, оч. неустойчив
MZn2Cl5, анион - 2 тетраэдра с общ. гранью [H3O]Zn2Cl5 Н2О
M3ZnCl5 = M3[ZnCl4]Cl Rb2ZnBr4, в тетраэдре Zn—Вг 2.38
KZnBr3 2Н2О
KZnI3 2Н2О, т. пл. 84
Li2[ZnI4], Zn—I 2.56-2.66
В стр. KZnF3 • 2Н2О (Г = C1-I) -тетраэдричские анионы [гпГ3(Н2О)Г 2)
1)
Cd'CI • nCdCl2, красно-черн. плав
| А1С13
Сй2[А1СЦ]2, крист., желт., р. в бзл.; + Н2О — Cd + Cd катион [Cd2] диамагн., уст. + [Hg2]
Cd(ClO4)2, • иН2О, п = 2, 6; Cd(ClO3)2 • 2Н2О, бц., гигр.
Cd(ClO2)2 2Н2О
Cd(BrO3)2 • 2Н2О, к. ч. Cd 7, Cd—О 2.30-2.54 32)
Cd(IO3)2, • иН2О, п = 1, 6, к. ч. Cd 7, Cd—О 2.26-2.51 32)
Cd(MnO4)2 • 6Н2О, фиол., хор. р. в Н2О
CdSO4, т. пл. 1135, • иН2О, п = 7, 4, 2.67 (в стр. -
окт. [CdO4(H2O)2]), 1.
• M2SO4 • 6Н2О, соли Туттона
Cd2(OH)2SO4, в стр. - слои окт. [Cd(OH)6], Cd—О «2.3 CdSO3, 2Н2О;; CdS2O3, К№С, = 10 4 CdS2O6 6Н2О; CdSeO4 Н2О, в окт. Cd—О 2.31 Cd(NO3)2, т. пл. 353, • иН2О, п = 2, 4 (т. пл. 59; в стр. додекаэдры [CdO4(H2O)4], Cd-O 2.3-2.5), 9
Cd3(PO4U, т. пл. 1500; Cd5H2(PO4)4 4Н2О 31) Cd(H2PO4)2; Cd2P2O7 2Н2О; CdHAsO4 Н2О CdCO3/., разл. 300, "отавит", изостр. СаСО3
| со2- (0
сасо3 иса(оны
Cd(CH3COO)2, т. пл. 256; . 2Н2О, Кдис = 10~2
j. 262° са4о(сн3соо)6, нелетуч (ср. Be, Zn!) 29) Cd(HCOO)2, к. ч. Cd 7, Cd—О 2.26-2.60, • Н2О CdC2O4, разл. 340, • ЗН2СЦ, Хдис = 10 4 Cd2SiO4, т. пл. 1252; CdSiO3, т. пл. 1242
Кадматы 6)
Na2[Cd(OH)4|; Ba2[Cd(OH)6], крист., бц. K2CdO2; K2Cd2O3; Csi4Cd9Oi6, желт., в стр. - конденсированные тетраэдры, Cd—О 2.16-2.33
M6CdO4, изостр. M6ZnO4
Nai4Cd2C>9, в стр. - тетраэдры и триг. бипир., Cd—О ~ 2.10
15)
33)
29)
Li[Cd(ClO4)3]; Na[Cd2(GO4)5]
K4[Cd(S2O3)3], А-уст = 107
M2[Cd(S2O3)2] 12)
M2[Cd(NO2)4],ycT. > Zn-комплекса,
KycT = 103
M2[Cd(C2O4)2]
Na[Cd(HCOO)3], анион - слои окт., Cd—О 2.28-2.32
Стр. Cdl2
С(1(ОН)Г Г = F-I; С(1Г2 3Cd(OH)2. в гексаг. стр. -слои окт. [Cd(OH)„r6 „] 30)
CdF2[
CdCl2 CdBr2
Cdl2
т. пл т. к. АН стр. тип Cd —Г (г-) иН2. о, п =
1072 1753 -698 CaF2 1.97 2
568 964 -389 CdCl2 2.21 1-4
567 863 -314 CdCl2 2.37 2,4
388 754 -201 Cdl2 2.55 —
крист., бц., Cdr2 p. в H2O < ZnF2, сл. электролиты, способные к автокомплексообразованию в р-ре: Cd2+ + 2[CdI3]“ 3Cdr2 «=> 3[CdF]+ + ЗГ", 2Cdr2 «=> Cd2+ + [Cdr4]2 ,
р. в сп., ац. В г. - линейные мол. Cdr2; в гексаг. слоистой стр. Cdl2 — [ICdl] [ICd.., III слой I повторяет I-й (гексаг. пл. упак. I , Cd2+ - в 1/2 окт. пустот); в ромбоэдрической стр. CdCl2 - др. взаимная ориентация тройных слоев [ClCdQClCd] [GCd... - IV слой СК повторяет I-й (куб. пл. упак. СК, Cd2+ - в 1/2 окт. пустот). В стр. Cdr2 • 4Н2О -
RbCdF3 13)
MCdCl3, М = Na-Cs, в стр. -колонки окт. с общ. гранями
KCdCl3 Н2О
M2CdCl4, в стр. - слои окт. с общ. вершинами, уст. > [ZnCI4]2 , Cd—Cl 2.51-2.71
M4[CdCl6], M = NH4, K-Cs, анион - окт., Cd — Cl 2.53-2.65
Na6CdCl8; Na2Cd3G8
CsCd5Cln; Rb3Cd2G7
RbCdBr3, изостр. MCdCl3;
Cd—Br 2.63-2.87
Rb4CdBr6, анион - окт.,
Cd—Br 2.80
RbCdI3H2O, анион - цепи тетраэдров, Cd—I 2.73-2.82
M2Cdr4; M4Cdr6, Г = Br, I
[Cdr2L2], L = NH3 5), Ру, в стр. - цепи окт. [CdF4/2N2]-/«pa//c, Cd —Г 2.35 и 3.04(G), 2.76(Br), Cd—N 2.46(G) и 2.12(Вг) Cdl2 10NH3; [CdG2(N2H4)2], мол. - окт.
80
Zn(CN)ii, бел., разл. 800
Zn(NCS)2, крист., бц., в стр. - слои тетраэдров [ZnN4] и [ZnS4] 19)
[Zn(NCS)2(N2H4)21, мол. - окт.
MCN
M2[Zn(CN)4], анион - тетраэдр, Zn—С 2.02,
Куст = Ю20
K[Zn(CN)3] 2.5 Н2О = K2Zn[Zn(CN)6] • 5 Н2О, в стр. - окт. [ZnC'e] и тетраэдры [ZnN4], в р-ре - [Zn(CN)J
K2[Zn(NCS)4] ЗН2О, в анионе - тетраэдр [ZnN4], Ауст= 103 7)
Cd(CN)2)_, крист., бц., разл. 200;
[Cd(CN)2]„ • /иН2О • »iR2O, п = 3, 8, клатраты 17)
Cd(SCN)2, крист., бц., в стр. - цепи 8-членных циклов [Cd2(SCN)2], в окт. [CdS4N2] Cd — S 2.7 - 2.8, Cd — N 2.25 17)
[Cd(SCN)2(N2H4)2], мол. - окт.
a-ZnS, "сфалерит" ("цинковая обманка"
АН = —205, в куб. стр. алмаза 1/2 узлов занята ат. одного сорта, 1/2 - др. сорта; [ZnS4] и [SZn4] -тетраэдры. + Си (следы) - фосфоресцирует;
+ MgS - светится при трении
ZnSJ., бел., аморфный, ПР = 10 24, не р.
в СН3СООН, р. в НС1, пептизуется в H2S; [ZnS + BaSO4] - "литопон", краситель, не темнеет от H2S
| H2S (сухой)
/?-ZnS, "вюртцит", т. пл. 1900 (р), возг. 1185, АН = —192, ат. одного сорта (Zn или S) образ.
гексаг. пл. упак., ат. др. сорта - на 6 вертикальных ребрах, в центре образуемого ими шестигранника и на центральных вертикалях 3-х триг. призм, [ZnS4] и [SZn4] - тетраэдры.
Na2ZnS2; Na6ZnS4 - изостр. цинкатам, Zn—S 2.34 16)
О
И
И
MnZnS2, Mn = Sr, Ba
Ba2ZnS3, в стр. - сдвоенная цепь тетраэдров
CdS)., желт. Н > красн., ПР = 10 27, р. в конц. НС1, пептизуется H2S; крист., красн., т. пл. 1475 (106 Па), АН = —150 а-, "гринокит", полупроводник, стр. тип вюртцита (ZnS);
Р-, "хоулиит", стр. тип сфалерита
120°
Zn[S2U, бел., ---> ZnS + S
ZnSe, крист.,желт., т. пл. 1575, возг. 2000, АН = —130, "стиллеит"
ZnTe, красн., т. пл. 1239, АН = —121; полупроводники
CdSe)., крист., красн., т. пл. 1250 (р), АН = —105, "кадмоселит", стр. тип вюртцита
CdTe)., крист., кор., т. пл. 1090, АН = —100
M2[Cd(CN)4], Ауст = 1018
M[Cd(CN)3]
M2[Cd(—SCN)4], анион - искаж. окт. [CdN2S4/2], Cd—S 2.67, Cd—N 2.45, Ауст = 103
M[Cd(SCN)3], M = Rb, Cs, в стр. - цепи из чередующихся окт. [CdS2N4] и [CdS4N2] (М = Rb) или [CdS6] и [CdN6] (М = Cs)
Ba2[Cd(—SCN)6] 7 Н2О, Cd — S 2.71 7)
Zn(NH2)2, порошок, бел., аморфный
| 200°
Zn3N2, черн., АЯ=-21; +Н2О Zn(OH)2 + NH3
Zn(N3)2, бц., взр., • 2.5Н2О, в стр. - окт. [ZnN4O2], Zn—N 2.14,
Zn—О 2.21 9)
Zn3P2, т. пл. 420, т. к. 1100; Zn3As2, т. пл. 1015
ZnC2, ацетилид, крист., бел., +H2O -> С2Н2 -*-----------
(ZnH2)„ (?), бел., гигр. полимер, не р. в эф.; Zn + Н2;
+ Н2О — Н2 + Zn(OH)4; • nEt2O, п = 0.1-0.3 9)
| В2Н6
Zn(BH4)2, крист., бел.; Zn + В + Н2
K2[Zn(NH2)4|; LiZnN
M2[Zn(N3)4], М = К, Cs (т. пл. 206 и 153); [R4N
Cs3[Zn2(N3)7]; Cs[Zn2(N3)5], т. пл. 171 и 210
K[Zn3(N3)7], т. пл. 186, в стр. - тетраэдры [ZnN4], Zn—N 1.88 и 2.17 14)
Cd(NH2)2, порошок, бел., темнеет на возд
| 120°
Cd(N3)2, желт., не взр., АН = + 163
Cd3N2, порошок, черн.
( CdCO3 K2[Cd(NH2)4]
^<4^ K[Cd(N3)3] H2O K2[Cd(N3)4] Tl8Cd3(N3)14, в окт. [CdN6] Cd—N 2.38 18)
C2H2(Z)
Cd3P2, сер.; CdP2, оранж.
Cd3As2, сер., т. пл. 721; CdAs2
CdSb, т. пл. 456
—►СйСЦ, ацетилид, + НС1 —> C2H2t
CdH2, порошок, бел., не р. в эф., разл.
-20
[Cd(NH3)6]X2, X = ОН, Г, SO4/2, ReO4
[Zn(NH3)„]X2, X = ОН, Cl, SO4/2, ReO4, п = 2, 4, 6
81
РТУТЬ
п
2 +
5d
6s
6р
6d
Э.О
1.4
(все соединения диамагнитны)
о,Д350".меЫ ;jT>4oo°
Hg, ж., мет., серебристо-бел., d = 13.55, т. пл. —38.86, т. к. 357, весьма летуч, эмульгируется конц. р-ром FeCl3, р. в Ш (—> Н2 + [Hgl4]2 ) и к.-окисл.;
£0[Нё]2+/2Н§ж = +0-79’ ^Н82-/Н8ж = +°
L С !
2102Hg2 + /[Hg]2+= +0.91, в ромбоэдрической \ стр. - искаж. куб. пл. упак., a = 3.00, a = 70°32', к. ч. 6 (= 8-2), Hg—Hg 3.00_________
M
Амальгамы
Химические соединения Hg образ, с элементами с заполненными ^-оболочками: М1, Мп, Си, Ag, Аи. В системе Na-Hg сущ. соединения: NajHg, Na3Hg2, NaHg (т. пл. 212), Na7Hg8 (222), NaHg2 (354), NaHg4 (156).
P. в Hg: Cd, Zn, Pb; не p.: Al, Ti, Zr, Bi, Nb, Ta, Mo, W, Re, Fe, Ni Rb5Hg16, T. пл. 157, в стр. -квадраты [Hg4] и кубы [Hg8] 17)
О
IHg4]2 + [AsF6]2 , катион -
[Н§2.57 - Н§2.70 - Н§ - Н-g]2 +
[Hg3]2+X2-, X = AICI4, PF6, [AsF6], [Sb2Fn], крист., желт., поликатионы линейны, диамагн.
[Hg-2Hg-Hg]2+
( Hg(NO3)2 У_____(400°,
Hg2SO4 Hg2(OH)2i
Hg4(OH)(NO3)3, Hg—О 2.05-2.31 19)
Hgi0(OH)4(NO3)6 = [(Hg2)5(OH)4(NO3)2](NO3)4 Hg4O(NO3)2 • HNO3 = [(Hg2)2O(NO3)]NO3 • HNO3 2Hg2Cl2 Hg2O, "эглестонит", в стр. - [Hg2]2 + окружены 8 Cl- (куб.) и 2 ат. О
Hg4O2(NO3)2 =
= [Hg2](OHgn)2(NO3)2 19)
Hg2Cl2 и HgO,
п = 1 ("эглестонит"),
2("терлингуаит")
| Н2О
Hg2(ClO4)2, разл. 230; • 4Н2О, хор. р. в Н2О
Hg2(ClO3)2, крист., бел., разл. 250
Hg2(BrO3)2, крист., бц.
Hg2(IO3)2l, порошок, желт.
Hg2SO4j_, крист., бц., ПР = 10 7
Hg2CrO4j_, иглы, красн., мало р. в HNO3
' Hg2(NO3)2 2Н2О, т. пл. 70 с разл., в стр. - катион
[Н2о—Hg -]Г; Hg2(NO3)2 • n2h4
[Hg2]3(PO4)2l, бел., р. в HNO3; M6[Hg2(P2O7)2]
Hg2HAsO4i. крист., желт.
Hg2CO3l, бел., ПР = 10 16, темнеет
(^ Hg) + HgO) + СО2)
Hg2(CH3COO)2, крист., бел., мало р.; Hg2(HCOO)2(
Hg2c2o4i
Hg2|SiF6| • 2Н2О, в стр. - линейный катион [Н2О—Hg-]2+ 14)
Hg
O*
HgOl, крист., желт, или красн., «=> черн. (различаются только размером частиц), летучи, разл. 400, АН = —92, р. в к.; + МГ HgF2 + МОН, в ромб. стр. - плоские зигзагообразные цепи, ZOHgO 179 (sp), "монтроидит1
П Н2о
Hg(OH)2 (?), ПР = 10-16, Косн1;2 = 10 22
Hg2O(OH)ClO4; Hg3O2(ClO4)2, разл. 430
HgSO4 • 2 Н2О( = [Hg(OHg)2]2 + (SO4)2+ крист., желт., "шуеттеит"
Hg3O2(NO3)2, в стр. - гофрированные слои [Hg3O2]
HgCO3 • иHgO),, п = 2(кор.), 3(желт.)
HgF(OH), в стр. - цепи окт., Hg—О 2.69, Hg—F 2.50
2HgCl2 • HgO = [O(HgCl)3]Cl, бц.; HgCl2 • иHgO, n = 1 (= Hg2O2Cl2, в стр. - тр-к [Hg3]), 2 (черн., = [Hg2(OHg)4Cl]Cl3), 3(желт.), 4 (красн. и черн.) Hgl2 • HgO • НС1О4 = [O(HgI)2(HgOH)] + (ClO4) , в стр. - линейные гр.
[HgO2] (sp) и тр-ки [Hg3O] ( sp2-O), Hg—О 1.9-2.1 (
Hg(CN)2 HgO),, крист., бел., в стр. - мол. O[HgCN]2
Cl
Hg
HgO; H2O
Н2О2 (-20°)
Hg< -^Hg 1
X'l
14)
О д
Hg(ClO4)2, т. пл. 170, гН^|<7>4 . иН2О, п = 2, 6, хор. р. в Н2О, оч. сл. гидрол.; в стр. - окт. [Hg(H2O)g]2 +, Hg—О 2.34 2) Hg(ClO3)2, иглы., бц., хор. р. в Н2О; Hg(ClO2)2j., крист., красн.; Hg(BrO3)2 • 2Н2О1, бц., разл. 130; Hg(IO3)2j_, порошок., бел.; Hg2HIO6, кор., Hg3(H2IO6)2, желт.; HgH3IO6, бц.; Hg3(IO5)2, черн.; Hg5(IO6)2 10)
HgSO4, крист., бц. (—> желт., красн.); 222^ Hg + SO2 + О2; в стр. - окт. [HgO6], Hg—О 2.10-2.17; • Н2О, в стр. -колонки окт., Hg—0 2.18-2.51; • 2Н2О, в стр. - графитоподобные слои из ат. Hg и О; 3HgSO4 • K2SO4 • 2Н2О 10)
HgSO3l; HgCrO4l, крист., красн.; HgSeO4 • Н2О, в стр. - тетраэдры [HgO3(OH)], Hg—О 2.26-2.50;
Hg2(SeO3)2 • Н2О, к.ч. Hg = 5 и 7, Hg—О 2.06-2.75 10)
Hg(NO3)2, крист., бц., гигр., т. пл. 79; • N2O4; • иН2О, п = 1, 0.5, хор. р. в Н2О, сильно дис., гидрол.
Hg(NO2)2, разл. 65 10)
Hg3(PO4)2j_, бел., р. в НС1, HNO3, в стр. - сетка тетрэдров [РО4] и гр. [О—Hg—О], ZOHgO 166 3); Hg3(AsO4)2j_, желт.; HgCO3 (?)1, желт.; Hg(CH3COO)2, крист., бц., разл. 180, светочувствительны, хор. р. в Н2О, К№С = 10 9, в стр. - цепи искаж. квадратов [HgO4], Hg—О 2.07 (конц.), 2.73 (мост.) 3); HgC2O4j,
14) ПР т. пл. АН Hg—Г
Hg2F2, крист., желт.; — 570 -485 2.14
+ Н2О — Hg + + НГ + HgOi Hg2Cl2i, "каломель", 10 18 400 -265 2.43
крист., бц., р. в HNO3 Hg2Br2)_, крист., бц. 10-23 разл. 340 -205 2.71
Hg2I2i, желто-зел., 10~28 возг. 290 -96 2.69
неуст.; + I” Hgi + [Hgl4] В стр. - линейные мол. 2 г—Hg- -Hg—Г,] Hg—нё: ..49-2.69
5) т. пл. т. к. АН Hg—Г (тв.)
HgF2J„ крист., бц.; + Н2О —> гидрол. 645 650 -397 2.43 2Н2О
HgCl2, крист., бц., "сулема", р. в Н2О, си., эф. 280 304 возг. -231 2.29
HgClIl, крист., красн. 153 315 — —
HgBr2, крист., бц., мало р. в Н2О 238 322 -175 2.48
HgBrI, крист., желт. 229 360 — —
Hgl2l, крист., красн. (тетраг.), ПР = 10 |2, — — — —
р. в бзл., эф., СНС13; желт, (ромб.) 259 354 -105 —
Стр. HgF2 типа CaF2 (к. ч. Hg 8); в стр. HgT2 (Г = Cl, Br, I желт.) - линейные мол.; в стр. Hgl2 -красн. - слои тетраэдров [HgI4/2]; в стр. HgF2 • Н2О - слои антипризм [HgO4F4].
В распл. 2HgT2 HgT+ + HgT^, K№C = 10 8(Br); p. в H2O HgF2 + Hgl2, оч. мало дис.; р в сп„ эф., ац. (Г = Cl-I); [HgT2 • L]2; HgT2 • 2L, L = R2S, R3P, R3As
Hg2(SCN)2),, бел., оч. неустойчивы; —> Hg + Hg(SCN)2), Hg2(N3)2),, крист., бел., светочувствительны, взр.
АММИНО-, АМИДО-, И НИТРИДОКОМПЛЕКСЫ Hg(ll)
[Hg(NH3)2r2]),, Г = С1 ("плавкий бел. преципитат", т. пл. 300), Вг(бел. т. пл. 180),
1(бел. или св.-желт.), в стр. - тетраэдрические мол., Hg—N 2.11
[HgNH2]r, Г = F-I 6)
[HgNHJCl),, хлорид амидортути ("неплавкий бел. преципитат"); —U Hg2Cl2 + NH3 + N2;
р. в разб. к., катион - зигзагообразная цепь, к. ч. Hg 2 (sp)
’ 712 HgO (желт.)
[Hg2N]OH иН2О, п = 2, 1, 0, " осн. Миллона", крист., желт., в стр. - трехмерная сетка тетра-эдров [NHg4/2], гр. [N—Hg—N] линейна (sp), Hg—N 2.07, Н2О и ОН - в пустотах
[Hg2N]X • яН2О), X = Cl ("мозезит"), (Cl, SO4) "клейнит", CN, NO3, SO4/2, CO3/2, крист., желт., I( • H2O), бур., т. пл. x 130, взр.
Hg3N2, крист., кор., взр.
NH4OH)
[Hgl]+X“, X = Г, NO3, BH4, [MF6]/2 (M = Ti, Zr, Sn) 5)
171° n~c,-^7c-N ’ /80°Х С—N N—С
в стр. - искаж. окт. 7)
Hg(CN)2, крист., бц., разл. 320, р. в Н2О 100 г/л, в р-ре не дис.
[M(CN)n), + Hg2+ —> Hg(CN)2 + М”+]; в стр. - линнейные мол.
|HgC \|1 X . X = NO3, [MF6]/2 (М = Ti, Zr, Sn) 5)
Hg(SCN)2)_, иглы, бц., разл. 165 co вспучиванием ("фараоновы змеи"),
Hg(SCN)T, Г = Cl, Вг, в стр. - искаж. окт. [HgT3SN2], Hg—S 2.31, Hg — Г 2.29 (Cl); 2.41 (Br); Hg—N 2.80
) N = C—S
, , 1 — Ul, D vip. — nvixazix. I . 3J1'I2J, J
Hg(CNO)2 • 1/2 H2O, фульминат ("гремучая ртуть", детонатор)
AH = -58, стр. тип сфалерита, в стр. - цепи, аналогичные HgO, Hg—S 2.53; р. в HI и ц. в.
С2Н?
ЫаОНО)
HgO
S —C = N
%
а-, гексаг., красн., "киноварь" ("циннабарит"), d = 8.1, возг. 559 П), в стр. - спирали Hg—S — Hg, Hg —S 2.36 и 3.1-3.3, ZSHgS 172
[HgL2]X2, L = HgO, Hgl2, AgBr, X = C1O4, SO4/2, SeO4/2, CrO4/2, катион - полимер 5)
[Hg(SHg)2]X2, X = SO4/2, F, Cl (бел.), Вг(желт.), NO3(6en.), I (оранж.), BF4, 3F6 (Э = Si-Sn, Ti, Zr, Nb, Sb); Hg[S]2, крист., бц., с сильн. двулучепреломлением; HgS + S HgSe, черн., т. пл. 799, АН = —46, "тимманит" HgTe, черн., т. пл. 667, АН = —13, "колорадоит"; р (15 • 106 Па) —> Hg + Те; стр. тип сфалерита Hg(N3)2l, крист., бц., оч. взр.
HgC2)_, ацетилид, взр. в сухом сост., стр. тип СаС2, Hg—С 1.17, С = С 1.19; + НС1 + Н2О —> HgCl2 + СН3СНО (ср. р-цию Кучерова) [(HOHg—)(OHg2 = )C—]2 (?), "осн. Гофмана"
| RCOOH
C(HgOCOR)4, R = Me, CF3, в мол. - тетраэдр [CHg4], ZCHgO 175, Hg — С 2.04, Hg—О 2.06 8)
hv-B ----> черн.
82
ИОНЫ ЦИНКА, КАДМИЯ И РТУТИ В ВОДНОМ РАСТВОРЕ
(все ионы бц.)
Перекись
HgO2, крист., оранж., взр. при
х (15%) УДаре
а-} в стр. цепи [-HgO—О-]от р-/ с линейными гр. [OHgO], Hg—О 2.10, 2.77-2.92,
0—0 1.47
.
НГ(_^2)_ —
[Znr4]2- - не сущ. в р-ре Н2О, т. к. Куст < 1
[Znr„(OH)m(H2O)6_„_m](n+m-2)
н2о || НГ
|Znr„(H2O)4„|(2-")+
Меркураты 20)
M2[HgO2], крист., бц., гигр.
Mn[HgO2], Мп = Sr, Ва, анион - гантель, Hg—О 1.95-2.00
K2[Hg(SO3)2] иН2О, уст. при pH >7, КуС1: = 1024
K6[Hg(S2O3)4], Куст = 1034
M2[Hg(NO3)4]
M2[Hg(NO2)4], Куст = 1013
K3[Hg(NO2)4](NO3), крист., желт.,
NO2 бидентатны, к. ч. Hg 8, Hg—О к 2.4
M2[Hg(C2O4)2]
M2[Hg(CH3COO)4] 15)
г 1 н
MHgF3, M = K-Cs, гидрол.
MHgCl3, в стр. - цепи искаж. тетраэдров [HgCl2Cl2/2], Hg—Cl 2.3 (конц.), 2.75 и 3.22 (мост.) 4)
H2|HgCI4| • ЗН2О; M2HgCU, в стр. - колонки искаж. окт. [HgCl2Cl4/2] с общ. ребрами,
Hg — Cl 2.29 и 2.9-3.1, Куст = 1015
Cs3[HgC14]Cl 4)
|R4N||HgBr3|. анион — тр-к, Hg—Вг 2.52
Cs3[HgBr4]Br, анион - тетраэдр
M2[HgBr4], Куст = 1022; M4[HgBr6]
М[Н§5ГП], Г = С1, Вг, в стр. - каркас сплющенных окт., Hg—Cl ~2.29 и ~3.2 4) CsHg2Br5 = Cs[HgBr3] • HgBr2, Hg—Br 2.46-3.23
Cs2[HgBr4], анион - искаж. тетраэдр,
Hg —Br 2.55-2.60
M[HgI3], M = K, [R4N], [R3S], крист., желт., анион - тр-к или цепь тетраэдров, Hg—I 2.6-2.9 4)
H[HgI3] 4Н2О
M2[Hgi4], М = К (• 2 Н2О, "реактив Несслера"),
Ва/2( • 5Н2О)_), Си1, Ag, крист., желт., анион-тетраэдр, Hg—I 2.78, Куст = 1О30
Cs2Hg3I8, в стр. - каркас искаж. тетраэдров [Hgl4], Hg—I 2.65-2.95
(NH4)4[HgI6|; Cs3HgI5 13)
[саг4]2-’, тетраэдры, Куст = 102(С1), 103(Вг), 105(1)
Г „Н2о
M[Hg(CN)2X]
Cs[Hg(CN)3], анион - цепи тр-ков [HgC3] 9) M2[Hg(CN)4], бц., анион - тетраэдр, Куст = 1041
M3[Hg(CN)5|; M4[Hg(CN)6]
M2[Hg(SCN)4], М = Н, К, Мп/2 (Со, Mg, Ni, Си, Zn, Са), крист., желт., анион - тетраэдр, Hg —S 2.56, Куст = 1022 12)
M[Hg(SCN)3], М = K-Cs, анион-2 тетраэдра [HgS4] с общ. ребром 9)
”1 + ”
K[Hg(— NCO)3], анион - 2 квадрата с общ. стороной, Hg—N 2.07, 2.47 M2[Hg3(NCO)8], М = K-Cs, в стр. -сплющенный окт., Hg—N 2.03 и ~3.0 16) K[HgS2] 5Н2О, неустойчив
Ba|Hg(C =C H)4| 2NH3, бц., взр.
изб. NH4X
(Х = С1О4, NOJ
|Hg(XH3)2|2 н, линейный ион
||nh3 (ж.)_________________
[Hg(NH3)4]2 +, тетраэдрический ион, Куст = 1019
83
ЩЕЛОЧНЫЕ МЕТАЛЛЫ, ФРАНЦИИ
2s Э.О.
Литий Li° ш 1.0
3s Зр 3d
Натрий Na° ш 1111 ш 1.0
45 4р 4d
Калий К0 ш 1111 LET 0.9
55 5р 5d
Рубидий Rb° ш 1111 LET 0.8
65 6т 6d
Цезий Cs° ш 1111 EZEI 0.8
75 2d
Франций Fr° ш ггп EZEI 0.8
( LiCl +
Са (800°, вак.)
• кат.
\восст.
Образование Fr при радиоактивном распаде:
235т т « 227 А (1-2%) 223т? /С
92 U > • • • 89АС —~> 87Г Г --->
21 мин.
Синтез:
29328и (р, 6р 21п) 2ЙГг
19.3 мин.
Fr+ соосаждается с Cs+ в виде
M3[P(W12O40)]-«H2O)
Субокислы 9)
Cs4O Cs7O CsnO3
разл. 10 ж., бц., крист., черн.,
d = 2.2, d = 6.21, т. ил. 52,
т. ил. —4 проводник
в стр. - кластеры [CsnO3],
Cs—Cs 3.3-4.3
RbtfO; RboO?; RlbCsnO^ RbCsnO^,
Rb—Rb 3.54-4.05
Rb
У’/ оу
а К
аса "
O2(U~-------------------------------------
( Li2co3
—> окраска усиливается; —> M2O2 + M;
в г. - линейные(?) мол. (Li—О 1.60); K[LiO]
Окислы, крист., гигр., возг. вак. (10 5мм). стр. тип анти-Сар2 (к. ч. М 4); стр. Cs2O - типа анти-СбС12 (к, ч, Cs 3)__________________________________
Ы2О Na2O к2о Rb2O Cs2O
бц. бц. желт. желт. оранж.
т. ил. 1570 — 740 — 495
т. к. 2600 — — — —
разл. >1000 400 — 400 300
АЯ -594 -418 -340 -331 -318
м
кат. восст.
Li Na К Rb Cs Fr
мет., Твердость 0.6 серебристо 0.4 -бел. мягкие 0.5 0.3 золотистый 0.2 —
(алмаз - 10) окисля d 0.54 ются возд. 0.97 с воспл. 0.86 1.52 1.90 2.46
т. ил. 180 97.8 64 39 28.7 23 (-90;
т. к. 1337 886 776 696 705 669
£ом+/Мтв “3-04 -2.71 -2.92 -2.92 -2.92 —
+ Н2О [M(NH3)6] [M(NH3)6] [Нф]; р. в ж. NH3 (гол. р-ры), + + [e(NH3)„] ("полярон"); —> MNH2 + Н2
(Na - медл., Cs - мгнов.) р. в RNH2, R3N 1 р. в Thf, диглиме ( < 10 4М, гол. р-ры)
а 3.50 М—М 3.10 ку а 4.41 в г. - одноатомные ь М—М 2.67 АЯ М2 -107 куб. с 4.28 3.80 | >-195° 5. ил. упак 5.34 юл. и М2 ( 3.08 красн. -72 тр. (тип а-5.33 4.70 < 5%) 3.93 фиол. -49 7е) 5.62 4.96 4.32 оранж. -45 6.08 5.34 4.55 -44
Щелочи, крист., бц., возг. ®400, р. в Н2О и сп. CsOH > LiOH, р. в ж. NH3, распл. pear, со стеклом, (Pt + О2); не р. Ag, Ni, Fe, летучи (кроме LiOH),
LiOH NaOH КОН RbOH CsOH
т. ил. 473 321 405 382 339
т. к. 925 1390 1320 — —
разл. 600 >2000 >2000 — —
АЯ -487 -428 -427 -414 -407
Н2О иН2О
п = 4, 2, 1
п = 3, 2,
1 (т. пл. 180, разл. 400), 0.5
n = 2(t. пл. 310), 1
п = 7, 4(т. пл. 7), 3.5(16), 2(13), 1(64)
3.4
Н2о (-Н2)
‘дис
1.5
5.1
В стр. LiOH (типа анти-РЪО) - слои пирамид [(OH)Li4/4], а-NaOH и а-КОН изостр. ТН-желт., к. ч. М и О 7; RbOH (4 формы) - слои тетраг. пирамид; CsOH -анти-Т\1. В г. - димеры, --------> МОН, линейные мол., М — О 2.18 (К), 2.30 (Rb),
2.40(Cs); окисл. (Z): + М —> Na„MOm + Н2 (М = Ti-Mn); + Na —> NaH + Na2O. В стр. LiOH • Н2О - цепи тетраэдров [Li(OH)2/2(H2O)2/2]; в стр. NaOH • 4Н2О -триг. бипир. [NaO5]; в стр. RbOH • Н2О - каркас кубов [RbOg], Rb—О 3.05
Hg( + Q)
Амальгамы тв. или пастообразные в-ва, сильн. восст. В системах М — Hg сущ. соединения со следующим соотношением M:Hg
Li Na К Rb Cs
6:1 и* 3:1 к 2:1 и 1:1 к 1:2 и 1:3 и * и - инко 3:1 и (35°) 5:2 и (66°) 3:2 и (119°) 1:1 к (212°) 7:8 и (222°) 1:2 к (345°) 1:4 и (136°) агруэнтное пл., к - 1:1 и 7:8 и 3:4 и 1:2 к 1:2 к 1:2 к 1:3 и 2:7 к 5:18 и 1:4 к 2:9 и 2:9 и 1:6 и 1:6 к 1:9 и 1:9 и 1:10 и конгруэнтное пл.
О
И
О
[Li(NH3)4]
[LiDipy]; [MDipy] 2.6 Thf, крист., темно-красн. (Na), св.-фиол. (К), окисл. на возд. INaPy2], крист., темно-зел.
MC1O4, M = Li (т. пл. 247, разл. 500, хор. p. в сп., эф.; • ЗН2О, т. пл. 95 с разл., р. в Н2О, сп., эф.; в стр. - ленты окт. [Li(H2O)g/2]), Na(T. пл. 482 с разл.; -Н2О, разл. 130, хор. р. в Н2О, сп.), К(т. пл. 610 с разл., р. в Н2О «1%), Rb), и Cs). (т. пл. % 700 с разл.), Fr) МС1О3, М = Li(T. пл. 129, разл. 270; • 0.5Н2О, т. пл. 65), Na (т. пл. 262), К ("бертолетова соль", т. пл. 368, разл. 400), Rb, р. в Н2О Li > Cs
MBrO3, М = Na(T. пл. 381), К (434, с разл.); Rb(T. пл. 430);
Cs(t. пл. 420), р. в Н2О Na Z> K-Cs
MIO3, М = Li, Na, К(т. пл. 560), Rb, Cs, мало p. в H2O; • иН1О3 МЮ4, М = Na (разл. 300, • ЗН2О), К) (т. пл. 582), Rb),, Cs) (см. также Табл. "Галогены")
MHSO4, М = Li(T. пл. 170), Na (186, • Н2О, т. пл. 58), К (210, "меркаллит"), Cs; • 0.5H2SO4, М = Li, в стр. - пары тетраэдров [Li2Og], Li—О 1.86-2.01 14), Na
• hH2SO4, (n = 1, M(H3O)(HSO4)2), n = 2, 3, M = Na, K, Cs 14) Li2SO4, т. ил. 860; • H2O, оч. хор. p. в H2O, АЯ р. > 0;
• M2SO4, М = Na, К, NH4; • 2M2SO4 • 9Н2О, М = Na, К Na2SO4, т. пл. 884, т. к. 1430, "теннардит", АЯ р.>0; • иН2О, п = 7 (метастаб.), 10 ("мирабилит", "глауберова соль"), АЯр. <0; разл. 32.4 (—ЮН2О) M2SO4, М = К(т. пл. 1076, т. к. >2000), Rb (т. пл. 1066), Cs(t. пл. 1019, возг. 900); летучесть Li>Na<K<Rb<Cs, в г. - мол. M2SO4 (М = K-Cs), АЯ р. <0
• MV'(SO4)3 • 24Н2О = [М^НгОб] • [Min(H2O)6](SO4)2, Мш = = Al, V-Co и т. д., "квасцы", крист., куб., АЯ р. < 0, р. К > Cs
MnSO4 6Н2О, М1 = Na-Cs, TI, NH4, Мп = Mg, Mn-Zn, Cd, соли Туттона ("шениты").
K2SO4 • MgSO4 • 2 CaSO4 • 2 H2O, "полигалит" M2SO3; M2S2O8; M2S„O6 и т. д. (см. Табл. "Сера") M2S2O7, М = Ы(т. ил. 205), Na (405), К (440), Rb(401), Cs(280)
12)
MCI )
13)
О2 (t, U-р)
Перекиси, крист., бц., гигр. (желт, из-за примеси МО2), диамагн., О—О 1.50-1.54 (la-связь) 2)
Li2O2 Na2O2 К2О2 Rb2O2 Cs2O2
т. ил. — разл. 342 АЯ -636 2Н2О Н2О2 • и Н2О, п = 1,2 В стр. К2О2 - ку +н2о —> Н2О2 596 675 -510 4Н2О2 4Н2О 2Н2. о2 8Н2О б. ил. упак. анион + МОН; сильн. 490 -494 4Н2О2 ов, К—О жисл.: + 567 -422 4Н2О2 2.68-2.71 Fe -U М2 597 650 -402 4Н2О2 FeO4;
EtOH
(<0°, —EtONa)
NaOOHi, порошок, бел., оч. сильн. окисл.; + СО2 NaHCO4
MNO3, М = Ы(т. пл. 261, разл. 475; • ЗН2О), Na (т. пл. 308, разл. 380, "чилийская селитра"), К(т. пл. 334, "калийная селитра"), Rb(T. пл. 313;
• л HNO3, п = 1; 2), Cs(t. пл. 414, разл. 585; • hHNO3, п = 1 и 2, т. пл. 104 и 39); р. в Н2О Li > Cs, р. в ж. NH3, в г. сущ. мол., стр. аналоги HNO3, Li—О 1.60, N—О 1.40 и 1.22; ZLiON 105, ZONO 134;
-U mno2 + o2
MNO2; M2N2O4, M2N2O3 и t. д. (cm. Табл. "Азот")
М3РО4, М = ЕЦ(т. пл. 837; • иН2О, п = 1/2, 12ф), Na (1340;
• иН2О, п = 10, 12), К (1340)
МН2РО4, М = Li (разл. 100), Na (разл. 200; • иН2О, п = 1,2),
К (т. ил. 253 с разл.); МН5(РО4)2, М = K-Cs П)
М2НРО4, М = Li(разл. 100), Na( • иН2О, п = 2, 7, 12), К
Li(Mn,Fe)PO4, "литиофилит", "трифилит"
LiAl[PO4](F,OH), " амблигонит"
МРО3; МН2РО2; М2НРО3; М4Р2О7; Rb2H2P2O7 1/2 Н2О 15)
и т. д. (см. Табл. "Фосфор");
М3[Р(Мо12О40)|, М = Li-Na (р. в Н2О), K-Cs)
M4[Si(W12O40)|, М = K-Cs) (используют для выделения Rb и Cs)
M[Sb(OH)6], М = Li, Na), К
M3Sbr6, Г = Cl, Br, M = Li, Na(p. в H2O), K-Fr)
MBiI4, M = K-Cs)
МНСО3, М = Li (разл. «0, сущ. в р-ре), Na (разл. 160, "нахколит"), К (разл. 100, "калицинит"), Rb (• Н2О), Сзфазл. 175), р. в Н2О Cs Z> Na
Na2CO3, т. пл. 854 ("сода кальцинированная"), • иН2О, п = 1 (разл. 107, "термонатрит"), 7 (разл. 32), 10 (т. пл. 34.5, "сода крист."), • 1.5Н2О2 • Н2О("персоль"), • иСаСО3, п = 1 (• 2Н2О, "пирссонит", 5Н2О, "гейлюссит"), 2 ("шортит")
М2СО3, крист., гигр., М = Li), (т. пл. 735, р. в присутствии др. М2СО3), К ("поташ", иН2О, п = 2, 1.5; • СаСО3, "ферчилдит"), Rb(T. пл. 873, разл. 900, • Н2О), Cs (разл. 610), р. в Н2О Cs Z> Li МНС4Н|О6, гидротартраты, М = Li, Na(p. в Н2О); NH4, K-Fr) (р. в к. и щ.); М2С4Н4Об, тартраты, хор. р. в Н2О MZn(UO2)3(CH3COO)9 6Н2О, М = Li), Na), крист., желто-зел. RCOOM, М2С2О4, MNCO, MNCS и т. д., см. Табл. "Углерод" RbH(CH3COO)2; Cs3[H5(CH3COO)8] 10)
^с°г
NaCl )
84
(МОН
О2 (стехиом., ж. NH3)
02^
М2О2 2 МО2 = "М2О3", М = Rb, Cs
O3(Cs)
O2 (p, t); O3 (фреон)
с%
М[О2], надперекиси, крист., гигр., разл. «550, АЯ~—270, парамагн., стр. тип СаС2 (K-Cs), стр. тип FeS2 (Na),
О—О 1.28-1.37 (1<т-+ 0.5л-связи) 8)___________________________
ЫО2 NaO2 4) ко2 RbO2 CsO2
желт., —35 разл. желт. (—80° —> бел.) оранж. кор. желт.
т. пл. — 152° а- £-, 505 — 412 450
оч. сильн. окисл. (со взр.); + Н2О —> О2 + Н2О2 + МОН;
[NaO2 + Na2O2] ("оксилит") + СО2 Na2C2O6
—> Na2CO3 + О2; + СО —> М2СО3 + О2
-O2
М[О3], озониды, М = Li( • 4NH3), Na (разл. -10) 4), К (60), Rb, Cs(53), _ крист., красн., р. в ж. NH3, парамагн., анион - тр-к, О—О 1.34-1.42, /ООО ИЗ, стр. тип CsCl (М = K-Cs), сильнейший окисл.;
+ Н2О —> О2 + МОН
Na3Or, Г = С1, Вг
К3ОС1, крист., оранж., искаж. стр. тип анти-перовскита, к. ч. К 8, К—О 2.60 Rb2(OH)I, в стр - каркас [Rb2(OH)]+ 16)
M2O(Z)
M2SiO3, М = LiJ., Na ("ж. стекло"), K-Cs (см. Табл. "Кремний")
LiAl[SiO3]2, "сподумен" ("пироксен")
KLi2Al[Si2O5]2(F,OH)2, "лепидолит" (слюда, содержит Rb и Cs) (Cs,Na)Al(SiO3)2 иН2О, "поллуцит" (единственный минерал Cs) KNaLi4A14Be3[B10O27], "родицит" (содержит Cs)
KLiFeAl[AlSi3Oio](F,OH)2, "циннвальдит" (содержит Rb)
Стр. NaCl
500 E
CI-
Bf
7001-
т. пл.
900
Cl
Br
I
F
АЯ
-- 600
I
400
-----1-----1------1------1200
Li Na К Rb Cs
Т. пл. и АЯ в ряду МГ
Галогениды
МГ, крист., бц. (у-, рентгеновские лучи окрашивают); МГ (М = Li-Rb) и CsF - стр. тип NaCl (к. ч. 6);
CsT (Г = Cl—I) - стр. тип CsCl (к. ч. 8); распл. МГ р. М., при охл. —> МГ (син.) + М; в г. сущ. мол. М2Г2 -плоские ромбы, Li—Г 2.23 (С1), 2.35 (Вг), 2.54(1), ZTLiT 108 (Cl), 110 (Br), 116(1); АЯ р. CsCl и RbCl > КС1 > NaCl «0; CsCl и RbCl хор. p. в конц. HC1 (в отличие от NaCl и КС1); р. в ж. NH3 (КВг и KI -хор., NaT - сл.); МГ (М = Li-K, Г = C1-I) р. в ROH; р. в EtOH RbCl и CsCl > КС1; LiBr и Lil p. в эф.
(K,Rb)Cl MgCl2 6H2O, "карналлит"[Cs- и Rb-карналлит p. < К и в отличие от К конгруэнтно] КС1 • MgSO4 • ЗН2О, "каинит";
КС1 • СаС12, "хлорокальцит";
Nal • 4NH3 = [Na(NH3)4] + I~, ж., т. пл. +3, разл. «25, катион - тетраэдр (См. также Табл. "Галогены")
24
^22 220 д18 116 ^14 л12
MF
MCI
S 8
MBr
MI
Растворимость МГ в Н2О (при 18°)
Стр. CsCl
т. пл. т. к. АЯ Li—Г ц(г.)
(г-) (тв.)
LiFi, р. в HF 870 1724 -611 1.56 2.01 6.33
LiCl, н2о LiBr, 614 1397 -406 2.02 2.56 7.13
550 1310 -352 2.17 2.75 6.19
2Н2О 44 — — — — —
Lil, 449 1190 -272 2.39 3.00 6.25
ЗН2О разл. 73 — — — — —
JlNa:
" / / фС1 т. пл. т. к. АЯ Na —Г
(г-) (тв.)
NaF, "виллиомит" 997 1785 -569 1.93 2.31
NaHF2 — — — — —
NaCl, "галит" 801 1465 -410 2.36 2.81
2Н2О разл. < 0° — — — —
NaBr 755 1392 -360 2.50 2.98
2Н2О — — — — —
Nal 662 1304 — 2.71 3.23
2Н2О — — — — —
т. пл. т. к. АЯ к—г ц(г.)
(г-) (тв.)
KF, "кароббиит" 857 1502 -565 2.17 2.67 8.62
2Н2О 41 — — — — —
khf2 239 — — — — —
КС1, "сильвин" 776 1407 -434 2.67 3.14 10.27
КВг 735 1383 -393 2.82 3.29 10.41
KI 686 1330 -327 3.05 3.53 11.05
К[13], син. 45 разл. 225 — — — —
A*
т. пл. т. к. Rb —Г
(г-) (тв.)
RbF, • лН2О, п = 3, 3/2, • и HF, п = 1,2,3 RbCl RbBr Rb[Br3] Rbl Rb[I3] Rb[I„], n = 7, 9, крист., бур. 798 726 682 140 разл. 642 190 1408 1395 1352 1304 2.27 2.79 2.94 3.18 2.82 3.27 3.43 3.66
T. ПЛ. т. K. АЯ Cs—Г ц(г.)
(г-) (тв.)
CsF, 684 1253 -531 2.34 3.00 7.88
• иН2О, — — — — —
п = 2/3 1/5 — — — — —
HF CsCl 646 1295 -431 2.91 3.56 10.42
CsBr 638 1297 -410 3.07 3.72 —
Cs[Br3] 180 — — — — —
CsI 622 1280 — 3.31 3.95 10.2
Cs[I3] 207 — — — — —
c?
о
MBiCU; M2BiCl5; M3BiCI6; Rb3Bi2C19; Cs4BiCl7, используются для разделения M1 и выделения Rb и Cs 5) M2[SiF6], М = Li ( • 2Н2О, разл. 100, хор. р. в Н2О, си.), Na], ("маллардит"), К), ("гиератит"), Rb),, NH4, Cs (оч. хор. р. в Н2О); MF + SiF4 M2[SnCl6], М = Li, Na (р. в Н2О), K-Csi
М2О • иВ2О3, см. Табл. "Бор"
M[BF4], М = Na (т. пл. 384, хор. р. в Н2О, "ферручит"), К ] (т. пл. 530),
(K,Cs)[BF4|, "авогадрит"
M|BPh4|, М = Li, Na (р. в Н2О), K-Csi M3[Co(N02)6], крист., желт., М = Li, Na (р. в Н2О), NHJ, K-Frj,
M2|PtCI6|, крист., желт., М = Li, Na(p. в Н2О), NH4, K-Fr (мало р. в Н2О, не р. в си.)
M2S, крист., бц., гигр., хор. р. в Н2О, си., сильно гидрол.; + о2 + Н2О —>
Li2S 950 -448
(К, Rb)Cl • MgCl2 • 6 Н2О ("карналлит")
т. пл.
АЯ
MHS, M2S„ (См. Табл. "Сера")
M2S2O3 +
MOH
стр. тип
Na2S K2S Rb2S
1180 840 (?) —
-373 -426 (?) -348
9H2O 5H2O 4H2O
т. пл. 50 60 разл. 200
azzmzz-CaF 2 6)
Cs2S
-339
4Н2О
CsAl(SiO3)2 (из "поллуцита")
Гидриды, крист., бел., гигр., не р. в ж. NH3 и орг. р-рителях, стр. тип NaCl
LiH NaH КН RbH CsH
т. пл. 691 «800 «400 «400 «400 (р Н2, Na-Cs)
АЯ -91 -56 -57 -54 -56
М —Н 2.04 2.44 2.85 3.02 3.19
M
+ Н , в г. - мол. МН (Li—Н 1.60), цин = 5.88, оч. сильн. восст.;
+ Н2О —> Н2 + МОН; + СО2 —> НСООМ; хим. акт. CsH > LiH
MN3, крист., бц., М (высокой чистоты) + N2 (без взр.); АЯ = +21 (Na), —1 (К), —10 (Cs), хор. р. в Н2О и си.;
+ CS2 KS(CSN3); + I2 — KI + N2
I (г, вак., -N2)
M3N, крист., рубиново-красн., М = Li (т. пл. 845, АЯ = —47), Na(разл. 200), K-Cs(взр.); + Н2О —> NH3 + МОН
Li2NH, имид, крист., бц., стр. тип azzmw-CaF2
MNH2, крист., бц. или св.-зел., т. пл. 390 (Li), 210 (Na), 338 (К), 309 (Rb), 261 (Cs), возг. х 400; р. в ж. NH3;
ж. «=> М+ + [NH2] ; +Н2О^МОН + NH3;
хим. акт. CsNH2 > LiNH2 (См. Табл. "Азот")
’ *•
МНС2, М = Na, К, гидроацетилиды
| 200° (-С2Н2)
М2С2, ацетилиды, М = Li (АЯ = —58), Na, К, крист., бц., хим. оч. акт., воспл. в атм. СО2, SO2; + Н2О —> МОН + QH^ (взр.)
Силициды
Li4Si, т. пл. 633 с разл., —> Li2Si, сине-фиол., т. пл. 752
'Х MSi, М = Na-Cs, крист., оч. гигр.; + Н2О —> взр.; —MSi8, М = K-Cs MOR, алкоголяты, крист., бц., оч. гигр., хор. р. в ROH (LiOR-Z р. в эф., бзл., С„Нт), в р-рах дис.;
+ Н2О MOR + ROH; стр. аналоги LiOH (М = Li, Na, R = Me, к. ч. 4) или а-КОН (K-Cs, Me, к. ч. 5)
• л ROH, п = 2 (Li, Me, Et), 5, 4, 3(Na, Me), 3, 2 (Na, Et, n-, z-Pr, n-, z-Bu);
5, 3, 1 (K, Me); 1 (K, Et), 7, 5, 2, 1 (Rb, Cs, Me), 1 (Cs, Et, Pr) 3’7) |MOBu-Z|4, M = K-Cs - кубаноподобные тетрамеры, к. ч. 3 (триг. пирамида); к-ры р-ций полимеризации, конденсации, восст. С = О "МСО" = (МОС = )2 (См. Табл. "Углерод")
85
МЕДЬ
3d
Си0 1111111111111 й]
45
4d
Э.О
1.8
(СиС12 ------
i+(</10)
Си, мет., желто-красн., ков-кий, с высокой тепло- и __. —
электропроводностью, •
d = 8.9, т. пл. 1085, т. к. 2540, р. в к.-окисл., NH4OH, KCN, окисляется на возд.,
£0Cu2+/CuTB=+0-34’ H2SO4 (200°)
£0Cu + /CuTB= +0-52’ диа’ маги.,
в стр. - гранецентрированный
куб ^у^^г, уттотл J
к. ч. 12 (кубооктаэдр), а = 3.6 и—Си
*
электролитическое рафинирование в р-ре CuSO4
10% Sn - бронза;
10% Zn - томпак;
40% Zn - латунь;
45% А1 + 5% Zn -
Сплавы 90% Си 90% Си 60% Си 50% Си
сплав Деварда (восст.);
95% Си + 4% Sn + 1% Zn-монетный сплав
RsAsCu—Мп(СО)5, Си—Мп 2.56
CuHl, крист., красно-кор., разл. 20, АН= +21, стр. тип вюртцита
------V------------------
\Н3РО2; NaBH4
(CuSO4)
2 + (<Z9)
Си2О1, "красн. окись", "куприт", т. пл. 1236, разл. 1800, АН = —167, к. ч. Си 2 (sp), Си—О 1.84, [ОСи4] - тетраэдр, ПР = 10 15, р. в NH4OH, НГ(конц.)> 4- H2SO4(pa36) > Си! 4- CuSO4
Си4О3 = Си2[Си2О3], "парамелаконит", к. ч. Си (II) 4 (квадрат), Си—О 1.87 и 1.93 22)
СиО, "черн. окись", "тенорит", т. пл. 1335 (р О2), разл. 1026, АН = —1565, в искаж. стр. типа PtS - квадраты [CuO4] (dsp2); Си—О 1.93
СиО1+х, полупроводник
н2 (370°)
M2SO3
оЛ7
О
циклы
MCN
MSCN
M[CuSO3[; хуст=108
CuCNl, призмы, бц., т. пл. 473, ПР = 10 20
CuSCNl, крист., бц.
Cu2SO4, крист., серые, т. пл. ~400;
+ Н2О —> Cui "I" CuSO4;
сильн. восст.: + NH2OH —> NH3;
в стр. - гантели [СиО2], Си—О 1.96; • 2NH3 25)
Cu2SO3 Н2О!, крист., бел.; _
-U Си2О + SO2
CU4N2O4 (?), порошок,
С\О\ кор., гигр.; + Н2О —> NO + ...
к СиСН3СОО1, иглы, бц., в стр. -v плоские цепи из 8-ми членных циклов, чв г- _ плоский димер, Си—Си 2.49, ZOCuO 172
О,
о\
%
СО
О-
•О’
Купраты (I) 14)
MCuO, М = Li-К, в стр. - квадрат [Си4О4]4 или цепи квадратов (М = Cs) M3Cu5O4, М = K-Cs, спирали из цепей М3[СпО2], крист., желт., во всех стр. -гантель [СиО2], Си—О 1.78-2.09; + Н2О Си! + Си11
M3[Cu(SO3)2[; M5[Cu(SO3)3] ю9 ю10
Cun[CuSO3]2 • 2Н2О!, крист., красн.
M[Cu(S2O3)[; M3[Cu(S2O3)2[; M5[Cu(S2O3)3[
= 1011 1012 1014
*7
/
Cu(OH)2l, сии., р. в к., NH4OH, в стр., близкой АЮ(ОН) - диаспору, слои искаж. окт. [СиО(>], Си—О 1.96, 2.36 и 2.91;
+ МОН (конц.) —> фиол. колл, р-р
| t (под р-ром)
30)
26) т. пл. т. к. АН ПР Си—Г (тв.)
178° СиСЦ, крист., бел.; —гол., "нантокит", • nNH3, п = 1/2, 3/2 450 1212 -136 10 7 2.34
CuBr!, крист., бел. 504 1345 -105 10 9 2.46
Cui!, крист., бел., "маршит" 605 1336 -68 10 12 2.62
СиГ р. в изб. NH3, MCN, M2S2O3.
Стр. СиГ типа сфалерита (к. ч. Си 4, sp3), в г. - 6-тичленные (СиГ)3, Си—Г 2.16 (С1), 2.44(1), ZCICuCI 150, ZCuCICu 90
[Сп2(СО)2(ц-С1)2] 4Н2О, крист., бц.
Сп(СО)С1, в стр. - тетраэдры [CuCi/2Cl3/3]
[Cu2(PR3)3(M-Br)2] 1.5С6Н6; [СпГ(PR3)]4, Г = C1-I, ядро мол. -
куб [СиГ]4, Си—Си 2.9-3.2
[Си! С5НП^4, в мол. - тетраэдр [Си4], внутри - тетраэдр [14], Си—Си ~2.6, в тетраэдре [CuI3N] Си—I 2.7, Си—N 2.05 27)
СиА1С14 • СбН6, к. ч. Си 4 = 3 С1 + (С = С), Си—С 2.15 и 2.30
Стр. CuFeS2
Cu2_xSl, серый, ПР = 10 50, "медный блеск", "халькозин", т. пл. ИЗО; АН = —79; + Fe2(SO4)3 —> —> FeSO4 + CuSO4 + S1 (гидрометаллургия) CuIFeIIIS2, "медный колчедан", "халькопирит", в стр.
Си2О; СиОЛ/' . CuF2 J
тетраэдры [CuJS4], [FeinS4], [SCu2Fe2], тип сфалерита Cu5FeinS4, "борнит", в стр. - тетраэдры [CuS4]
Cu3VS4, "сульванит", в стр. - тетраэдры, Си—S 2.28 CuAsinS2, "лаутит"; Cu3AsvS4, "энаргит"
CuSbniS2, "вольфсбергит"; Cu3SbvS4, "стибиоэнар-гит",
в стр. - тетраэдры [CuS4], Си—S 2.31
,CuBiS2, "эмплектит", Cu2Se, сии., т. пл. 1112; Си2Те, черн., т. пл. 855
Cu3N, крист., зел., разл. 300, АН = + 75, р. в к., стр. тип aHmw-ReO3
CuN3; Си + N2 Си3Р, т. пл. 1022; Cu3As; Cu3Sb; Cu2Sb
Си2С2, ацетилид, крист., красно-кор., • Н2О, в стр. - Си С = СН (л-комплекс)
НСиС12, иглы, перламутровые, анион -гантель, Си—С1 2.07
КСиС12; К2СиС13, анионы - цепи тетраэдров с общ. ребрами или вершинами, Си—С1 1.92
МСи2С13
M2CuBr3; |R4X|3|Cii2Br5|: |R4\|2|Cu2Br4|. в стр. - цепи тр-ков с общ. вершинами или сторонами, Си—Вг 2.3-2.4 [РуН]2[Си5Г7], Г = Br, I
М[Си213], цепи тетраэдров; M2[CuI3], тр-к, Си—I 2.47-2.96; Cs3Cu2I5
[NO] + [CuX2]“ = "СиХ2 NO", X = Г, CN, SCN, крист., черн., р. в ROH,
Хдис. = Ю 2 (в МеОН) - 10 5 (в н-ВиОН) |Cuii(NH3)4||CuiI2|2, крист., зел. 2)
M[Cu(CN)2], М = Na-Cs, крист., бц., Куст = 1024, полимер со спиральной стр., к. ч. Си 3 (sp2), Си—С 1.92, Си—N 2.05, ZCCuC 134 M3[Cu(CN)4], анион - тетраэдр
K[Cu2(CN)3] Н2О, анион - с графитоподобной стр., к. ч. Си =3 (sp2) Cs[Cu(SCN)2], Куст = 1011; K2[Cu(SCN)3]
Na3[Cu(SCN)4] 4Н2О
16)
(NHOIC^SJ, крист., гранатово-красн.
(NH4)[Cu7S4], черн., анион - каркас тетраэдров, Си—S 2.24-2.88
KCuS, анион - зигзагообразные цепи
KCu4S3, темно-син., полупроводник, в стр. -
слои тетраэдров [CuS4]
M4[Cui2S8], куб [S8], Си - в центрах ребер,
Си—Си 2.84, Си—S — 2.16
M3[Cu8S6], в - стр. тр-кп и тетраэдры,
Си—S -2.3 И2.2-2.8
M3[Cu3(S4)], в анионе - циклы [Cu3S3] и [CuS4] 16)
К2[Си2С2(СиС1)8]
[Cu(NH3)2]+)
Си
СиС1 • иС2Н2, п = 0.5, 0.166, крист., взр., образ, из си.
[Cu(MeC = N)4]+X-, X = NO2, С1О4 (т. пл. 175, взр. 205), BF4; + Н2О —Си)
+ Си2+
[Cu(PR3)4]C1O4
о
2!
И
О
И
Cu(CIO4)2f крист., желто-зел., разл. 130, летучи в вак., р. в Н2О, ROH и т. д.; • иН2О, п = 6 (в стр. - окт. [Си(Н2О)6]2 + ), Си—О 1.94-2.38, 2 7)
Си(С1О3)2 • 6Н2О; Си(ВгО3)2 • иН2О, п = 6, 2, крист., гол., хор. р. в Н2О 7)
Си(Ю3)2; СиО + 12 + О2; в стр. - слои окт. [Ю6] и [СиО6], Си—О 1.96-2.40 3)
• иН2О, п = 1,2/3 ("беллинджерит"), 2
Си(Ю3)(ОН), "салезит", в стр. - квадраты [CuO2(OH)2]; Си2НЮ6!, • иН2О!, п = 1,2 3)
CuSO4, крист., бц., разл. 550, в стр. - вытянутые окт. [СиО(>], "халькоцианит"; <- • иН2О,
/ п = 1 ("пойтевинит"), 3 ("бонаттит"), 5 ("халькантит", "купорос", крист., сии., в стр. - цепи
/ окт. [Cu(H2O)4(SO4)2/2]), 7 ("бутит"), • M2SO4 • 6Н2О, М = K-Cs, соли Туттона, в стр. -окт. [Си(Н2О)6]2+ [Си—О 1.94(акс.), 2.06-2.27(экв.)], М + , SOi 3)
Cu2O(SO4), в стр. - окт. и триг. бипир.; Cu4(OH)6(SO4) • 2Н2О, "лангит", в стр. - слои окт.,
Си—О 1.92-2.67 3); CuSeO4 5Н2О Си(ОН)2 3)
Cu(NO3)2, крист., сии., возг. 200 в вак., т. пл. 226, в стр. а - цепи,
Р - сетка квадратов [СиО4], Си—О 1.9-2.0, в г. - плоские мол. -
• иН2О, п = 9, 6 (т. пл. 26), 2.5 (т. пл. 115); 1 23);
ЗСи(ОН)2, "герхардтит" 23)
5Си(ОН)2 4Н2О, "ликазит", в стр. - вытянутые окт., Си—О 1.96 и 2.38 2
Cu(NO2)2, т. пл. 147 23)
Си3(РО4)2 • иН2О!, п = 1,3, крист., сии., р. в к.; СиНРО4 • иН2О; Си(Н2РО4)2
CU4H(PO4)3; Cu5(PO4)2(OH)4, в стр. - слои вытянутых окт., Си—О 1.95 и 2.70
Си2(РО4)(ОН), "либетенит", • Н2О, "тагилит" Na6Cii9(PO4)8
> Cu2(AsO4)(OH), "оливенит"; Cu3(AsO4)2 • ЗН2О, "эвхроит" иСиСО3 • Си(ОН)2!, "малахит" (п = 1, разл. 200), "азурит" (п = 2), \ в стр. - вытянутые окт. [CuO6]; + СО2(р, t) —> CuCO3! л Cu(CH3COO)2, крист., зел., р. в Н2О и орг. р-рителях
| ?(-Н2О)
1 [Си(СН3СОО)2(Н2О)]2, крист., темно-зел., кластер, Си—Си 2.64, диамагн.
СиС2О4 • Н2О!, крист., гол.; Си + СО2 + Н2О
Cu6[Si6O18] 6Н2О, "диоптаз" 12)
N—О
Мол. [Си(ОАс)2(Н2О)]2
СиГ2 • ЗСи(ОН)21, Г = С1 ("атакамит"), Вт; в стр. типа Cdl2 - слои окт. [Си(ОН)4Г2] или [Си(ОН)5Г], Си—ОН «2, Си—С1 2.75 Си2ОС12; Си(ОН)С1, в стр. - слои вытянутых окт.,
Си—О 1.99 И 2.70, Си—С1 2.29 (экв.) 12)
ОФ
т. пл. разл. АН Си—Г • иН2О, п =
акс. в вытяну экв. тых окт.
CuF2, крист., бц., 950 — -536 2.27 1.93 2, гол.
СиС12, крист., желто-кор. 596 1000 -216 2.95 2.30 2, гол., "эриохальцит"
CuBr2, крист., черн. — 290 -134 3.18 2.40 2, кор. 4, зел.
С1
С1
С1
СиГ2 (Г = С1, Вг), хор. р. в Н2О, р. в ROH, Ру, ац.; стр. CuF2 - искаж. тип рутила (окт. [CuF6]). В стр. СиС12 и CuBr2 (типа PdCl2) - ленты квадратов [СиГ4/2] (или вытянутых окт.), в стр. СиС12 • 2 Н2О - ленты сплющенных окт. [СиС14/2(Н2О)2], Си—О 2.01 (экв.), Си—С1 2.31 (экв.), 2.98 (акс.), в стр. СиС12 • 2 L (L = MeCN, С3Н7ОН) -ленты квадратов
СиГ2 + NO [CuF2(NO)]2, Г = С1, Вг 21)
Cu(CN)21, порошок, желто-кор.
20°
CuCN + (CN)2T; + Н2О CuCNl + О2(медл.)
Cu(SCN)2l, черн.; + SCN CuSCN!
Си
НС1
Си
Си
С1
Cl /« Cl
Cu2[Cun(CN)4[ 5Н2О
Мем
CuS!, черн., разл. 220, ПР = 10 38, р. в к.-окисл., M2S„, "ковеллин", сии., разл. 220, —
АН = —53, проводник, в стр. - тр-ки [CuS3], тетраэдры [CuS4] и гр. [S2],
Си—S 2.19 и 2.32; Cu2S + S
CuS3; Cu2S5; CuIIFe2IS3, "кубанит", стр. тип вюртцита (тетраэдры [CuS4] и
[FeS4])
CuSe; CuSe2
Cu(N3)2!, крист., кор., взр.
CuC2!, ацетилид
M2s,
86
3 + (rf8)
4 + (</7)
M[Cu(ClO4)3l, M = [NO2], [C1O2]; (NO2)2[Cu(C1O4)41; Na6[Cu(HIO6)2] 13H2O
5)
Ba2[Cu(TeO6)] 18); Na4H2[Cu(H2TeO6)2] 5, в анионах - квадрат [СиО4] [NO] + [Cu(NO3)3]“ (= "Cu(NO3)2 • N2O4"), крист., сине-зел., р. в орг.
р-рителях, анион - сетка из вытянутых окт., Си—О 1.97 (экв.) и
2.61 (акс.), все NO3-moct. бидентатны 6)
M4[Cu(NO2)6], анион - сплющенный окт.
K3[Cu(NO2)5], крист., черно-зел., т. пл. 163, к. ч. Си 5, Си—N 2.03
Rb4[Cu3(N02)io], в анионе связи Си—О и Си—N 13)
К2[Си(СО3)2], в стр. - сетка квадратов [СиО4], Ва2Си(РО4)2 13), Си—О 1.93 13)
• ЗН2О, крист., син., в стр. - квадратные пирамиды [СиО4(Н2О)] 13)
K2[Cu2(CH3COO)4][Cu(CH3COO)4] 32)
М2[Си(С2О4)2] 2Н2О, анион - вытянутый окт. транс-[СиО4(ОН2)2],
Си—О 1.94 (экв.), 2.58 и 2.74 (акс.) 17)
[R4N]4[Cu4OCl10] 12)
Галогенокупраты 8) Си—Г
экв. акс.
MCuF3, крист., бц., в стр. - каркас вытянутых окт. — —
M2CuF4, в стр. - слои вытянутых окт. 2.08 1.95
Cs4Cu3F10; Cs7Cu6F19; цепи окт. 2.25 1.85
НСиС13 • ЗН2О, иглы, красн. — —
CsCuCl3, цепь вытянутых окт. с общ. гранью 2.39 2.5-2.7
МСиС13, красн., анион [Си2С1(>] плоский - 2.2 2.3
2 квадрата с общ. стороной (М = К, NH4, Me2NH2); 2 сплющенных тетраэдра с общ. (конц.) (мост.)
ребром (М = [Ph4P]) (NH4)2CuC14, желто-кор., анион - цепь окт. 2.3 2.79
М2СиСЦ, М = Cs, [Me4N], оранж., анион -сплющенный тетраэдр 7) 2.23 —
M2[CuCl4(H2O)2], М = К ("митчерлихит") - Cs, крист., зел., анион - вытянутый окт. 2.28 2.89
[R4P][Cu2Cl5], анион - цепи квадратных пирамид -2.56
Rb3[Cu2Cl7], слои вытянутых окт. 2.30 2.87
[Cr(NH3)6][CuCl5], триг. бипир. 2.41 2.30
HCuBr3 • 10Н2О; MCuBr3, крист., черн. —
M2CuBr4, крист., красн. Cs2CuBr4, черн., анион - сплющенный тетраэдр — —
K2[Cu(CN)4], крист., бц., уст., из р-ров не осаждается CuS; + CN —> фиол. цианиды с более высоким к. ч. Си |Cui(NH3)2|2|Cuii(CN)4||, крист., зел.
M2[Cu(SCN)4], Кусу. = ю6
M[CuS4], М = NH4, K-Cs, крист., красн.
M[Cu(N3)3|; M2[Cu(N3)4|; M4[Cu(N3)6]; [Ph4P]2[Cu2(N3)6], анион -
2 квадрата с общ. стороной, Си—N 1.92-2.02 9)
Аммины Cu (II) крист., син.
[Cu(NH3)6]r2, катион - сплющенный окт.
[Cu(NH3)5]SO4, крист., сине-фиолет.
[Cu(NH3)4(H2O)2]X2, катион - вытянутый окт.
[Cu(NH3)4(H2O)]SO4, катион - тетраг.
пирамида (к. ч. Си 5)
[CuDipy2I]I, катион - триг. бипирамида (к. ч. 5)
[СиРу4]Х2, катион - квадрат (dsp2)
[Cu(NH3)4]X2, X = ОН (• 3 Н2О, реактив
Швейцера, обратимо р. целлюлозу), Г, NO3, SCN | 200° (—2NH3)
[Cu(NH3)2X2], X = Г, N3, в стр. - ленты окт.
[CuX4/2(NH3)2] с общ. ребрами
CuI2 nNH3, п = 5, 6, 10, 35
[Cu(NH3)2(CH3COO)2], в островной стр. -
вытянутые окт. [CuN2O4], Си—N 1.97 (экв.)
Си—О 2.0 (экв.), 2.7 (акс.)
[Cu(NH3)2](NO2)2, крист., пурп.; зел. 19)
CuXJ., X = Г, CN, SCN, SO3, бц.
Н2О
[СиХ2] , бц., диамагн. (<710) линейные (sp) ионы
X = CN SCN I
Хуст = Ю24 Ю11 Ю;
О2
2 +
[СиСЦ]2 , оранж., парамагн. (d9) ион, сплющенный тетраэдр (sp3), легко гидрол.
Н2О
[CuCl4(H2O)2]2 , зел., парамагн. ион, сплющенный окт. (sp2d2)
CuJ., красн.
Вг 106
С1 ю5
H2SO4; HNO3; НС1 + О2; СН3СООН + О2 — — Zn; Fe
Си2О желт, (гель), —> красн., ПР = 10 15, р. в NH4OH, НГ (конц.), KCN
4С .
Н
NH3
\ [Cu(NH3)2] + , бц., диамагн.
(d10) линейный (sp) ион, сущ. только в р-ре, КуСу = 1011
2а_
n2h?
S [Cu(H2O)6]2 h, гол., парамагн. (d9) катион, тетраг. / 1 искаж. (вытянутый) окт. (эффект Яна - Теллера)
[Си(Н2О)5(ОН)]+
(Хуст. = 107)
[Си2(ОН)]3+, (Хуст= 106) 20)
н
Си(ОН)2 , син., ПР = 10 20, р. в к., NH4OH, *2(оСн.) = 10~7; Х1к. = 10 10, Х2к. = 10-13
колл, р-р Си(ОН)2, фиол.
, он
[Си(ОН)4]2- &
Хуст. = 1015 Н2° син. ион, тетраэдр, парамагн. (d9)
[Си(ОН)6)|4-, гол. ион, окт. (sp 3<72), парамагн. (d9)
_ S2Oi_(OH2
Pq-.
?О
Си2О3[, красн.
[Си(ОН)4)|- красн., диамагн. (ds) ион, квадрат (dsp2)
IOi ; TeOg
. он [Cu(NH3)4(OH)]+ & [Cu(NH3)4(H2O)2]2 + , [Cu(NH3)5]2 + ,
темно-син. ион, NH3 хуст. = ю11
вытянутый окт., It к...
Cu—N 2.05, Си—О Н2О | NH3
2.59 и 3.37, Кусу. = Ю13 [(NH3)2Cu](M-OH)ir
[Cu(NH3)4]X2 20)
[Си(НЮ6)2]5-[Си(Н2ТеО6)2)]5-, кор., диамагн. (<78), квадратные (dsp2) ионы 24)
87
СЕРЕБРО
bd 5s 5р 5d Э.О.
Ag" |it|it|itntut| □ I I I I ГТТ 1.4
1 + (<Z10)
2 + (<Z9 ) или "2 + "
"4 + "
3 + (rf8) 5 + (rf6)
Ag3O, проводник, в стр. - окт. [Ag6], Ag—Ag 2.8, Ag—О 2.29
19)
Ag2O, крист., кор., разл. 300, АН = —29, ПР = 10 8, р. в к., NH4OH, KCN; + Н2О Ag+ + ОН (pH > 7), К = Ю 4; куб., изостр. Си2О (к. ч. Ag 2, sp)
ан. окисл. (ОН )
K2S2O8(90°); Оз (ОН )
O^OOP
AgOH
’ОХ/
.От’
AgO; = AgIAgIIIO2, крист., черн., куб., разл. 100(a), 178 (0); АН = -13, р. в HNO3, НС1О4;
+ H2SO4 —> Ag2SO4 + O2f;
+ КОН + KIO4 Ag2O + K5H2[Ag(IO6)2] + Н2О; полупроводник, диамагн., в стр. (a-формы) - гантели [Ag'O2] и квадраты [AginO4], Ag—О 2.0 и 2.05, в стр. (1 - тетраэдры [AgI,inO4], Ag—О 2.02-2.69 8,17)
20'
Ag3O4 = = Ag2inAgnO4, черн., в стр. -квадраты, Ag—0-2.01 17)
Ag2O3, крист., черн., разл. —20, изостр.
Аи2О3, Ag—О 1.96-2.03 17)
Ag, мет., бел., ковкий, с высокой электро- и теплопроводностью, d= 10.5, т. пл. 962, т. к. 2210, р. в к.-окисл., (KCN + O2), £oAg+/AgTB= °-8°; куб. пл. упак., а = 4.08, Ag — Ag 2.88 Колл. Ag, зел. или черн. листочки с мет. блеском ("колларгол"), порошки желто-кор. ("протаргол"), обладает стерилизующим действием.
-Znf (1250°)
Сплавы
90% Ag + 10% Си - серебряный, 90% Аи + 10% Ag-золотой, монетные сплавы Амальгама, легко образ., содержит Ag4Hg3, Ag5Hg8 (т. пл. 276 и 127). В системе Ag-Zn-Pb - расслаивание, > Ag р. в Zn-слое (верхи.)
?| 25
------
AgClO4, крист., бц., разл. 486, хор. р. в Н2О, PhMe,
Ру, PhNO2, PhCl, СН3СООН; • СбН6, в стр. - цепи -Ag —1|^ J— Ag+-•4PPh3 = [Ag(PPh3)4] + ClO4, катион - тетраэдр \s^J2.50 s
AgClO3, крист., бц., т. пл. 230, разл. 270; + Н+ —> АёСЦ + О2. 4>ZAgBrO3, мало р. в Н2О, уст. к Н > AgClOj / AgIO3;, ПР = 10 1 °, не р. в к. (t)
Ag2H3IO(1. крист., желт.; Ag5io6;, черн.
Ag2SO4;, крист., бц., т. пл. 660; 1000 > Ag + SO2 + О2;
^о^^ПР = 10 4, в стр. к. ч. Ag 6; + H2SO4 AgHSO4, • 4NH3 Ag2S2O3;, бел., + H2O —> Ag2s; + H2SO4 Ag2CrO4[, крист., красно-кор.; Ag2Cr2O7;, темно-красн.
AgNO3;, крист., бц., т. пл. 212, разл. 444, р. в Н2О, си., — Ру, MeCN, ж. NH3, свертывает белок
AgNO2;, [= AgONO + Ag—NO2], крист., св.-желт., разл 140, ПР = 10~3; NH3 = [Ag(NH3)2] + [Ag(NO2)2]-Agpo3;, крист., бц., т. пл. 482, р. в разб. к. Ag4P2O7. крист., бц., т. пл. 585 Ag3PO4. крист., желт., т. пл. 849, ПР = 10 19 Ag3AsO4;, крист., красн.; Ag3AsO3(, крист., желт. Ag2CO3;, крист., св.-желт., разл. 100; ПР = 10 ь в стр. - тетраэдры [AgO4], Ag—О 2.2-2.7 21) AgCH3COO, р. в воде «1%, К№С = 0.2 21)
Ag[BF4|; Ag[3F6], Э = Р, As, Sb, Nb, Та, хор. р. в PhMe, циклогексене; • 2 PhMe (л-комплекс)
Ag3BO3, в стр. - цепи гантелей [AgO2], Ag—О 2.11 22)
Ag[9H4], Э = В (бел.), А1(желт.), Ga (оранж.), разл. —30, —50, —75;
• nPR3, уст. > 100°
< О
AgF
Zn(i)
'черновой Pb"
Ag2F = Ag2+ F е , крист., бронзово-зел., АН = -50, проводник, уст. к hv-B; + Н2О Ag + AgF; слоистая стр. типа аниш-Сб12, Ag—F 2.46, Ag—Ag 2.86
О
О
о
s
в
и О
MNO2
§
Аргентаты 7)
K[Ag(OH)2], сущ. в р-ре M4[Ag4O4], М = Li-Cs, желт., анион - квадрат, Ag—О 2.06 M3[AgO2], анион - гантель, Na4Ag2O3; Na2Ag4O3
MAg3O2; + Н2О — Ag + O2+...
О
Si О.
т. пл. т. к. АН Ag Г (тв.) ПР Р-ритель
AgF, бц., уст. к hv-B 435 -201 2.46 Н2О«65%
яН2О, п = 1, 2, 4, • nHF, п = 1, 3
AgCi;, крист., бц. (распл. -оранж), "роговое серебро" "хлораргирит", 457 1554 -127 2.77 10 10 NH4OH, KCN, M2S2O3, ХдИС = 10~3
• nNH3, п = 1-3
AgBr;, бел. или желто-зел., "бромаргирит" 434 700 разл. -99 2.88 10 13 nh4oh, M2S2O3, А-дис=10-4
Agi;, св.-желт., "иодаргирит" Уст. к действию света Ag 560 разл. Br > Z ^gCI > -62 Agi 2.80 10 16 KCN, M2S2O3, не р. в NH4OH
Стр. AgF (Г = F-Br) типа NaCl (к. ч. Ag 6), Agi - типа сфалерита (к.ч. Ag 4,
sp3), менее уст. стр. Agi типа вюртцита; 3000 Па .т 137° г > стр. типа NaCl; > куб. стр.
со статистическим заполнением Ag и высокой проводимостью;
• PPh3, мол. - кубаноподобный тетрамер, в вершинах искаженного куба
чередуются ат. Ag и Г
AgCN;, крист., бел., уст. к hv-B, ПР = 10 14, в стр. - линейные цепи
—Ag — CN—Ag — CN..., Ag—С 1.98, C—N 1.15
AgSCN;, бел., ПР = 10 12, Ag—S 2.43, Ag—N 2.22, ZNAgS 165, ZAgSC 104
Ag2S;, крист., черн., т. пл. 827, ПР = 10 5 , р. в HNO3 (t), KCN; "серебряный блеск" ("аргентит" в Ag—Pb рудах); M2Ag4S3, MAg3S2 - двойные сульфиды 18) CuAg3S2, "ялпаит"; Ag8GeS6, "аргиродит"; Ag8SnS6, "канфильдит"
Ag3AsS3, "прустит"; Ag3SbS3, "пираргирит"; Ag4SSe, "агвиларит"; NaAgS2
Se, Те(Н2О) _Ag2SeJ„ черн., т. пл. 880, "науманит"; Ag2Te, син., т. пл. 959, "гессит"
Ag3N;, нитрид, "гремучее серебро", крист., кор., АН= +225, ПР = I0 9 20) AgN3;, азид., т. пл. 252, взр. 300°, —Ag—N = N+ = N —
С2Н2(Н+) Ag2C2;, бел., взр.
------—-----^AgNCO, цианат
AgCNO, фульминат, взр. (соль гремучей к.)
AgNO3 конц. р-р
NH3 (медл.)
Аё„э;; эн„(р
[TeAg8]6+(NO3)6; [3Ag6]3+(NO3)3, Э = As, Sb; [3Ag3]+NO3, Э = S, Se; [rAg3]2+(NO3)2- Г = Cl-I, CN, SCN, KycT = 1O5(C1), 108(Br), 1014(I), в стр. - каркас из искаж. триг. призм [IAg6/2], в пустотах его - NO3 1 '* |FAg2|+(NO3)“, Г = C1-I (т. пл. 160, 182, 94), Куст = 105(С1), 107(Br), 1011 (I) [Ag(NH3)2]OH, сущ. в р-ре, сильн. осн., линейный катион, Ag—N 1.88
ан. окисл. (Pt)
ВгР3 + 8Оз;
>6^
Ag7O8X, X = hf2, cio4, hso4, no3, bf4, крист., черн., с мет. блеском, проводники; + Н2О AgO; + О2 + AgNO8, в стр. - кубы [Ag'Os] и квадраты [AginO4], Ag—О 2.52 и 2.05 2)
( AgF )
Cs[Ag(SO3F)3],
Мэфф. 1.92
K2[Ag(SO3F)4] 14>
%
V
Na3[Ag(S2O3)2], KyCy = 1014
K[Ag(NO2)2], KyCy = 103
CS3Ba[Ag(NO2)6] 2H2O
K[Ag(CO3)], в стр. - цепь тетраэдров [AgO4], Ag—О 2.42
MnAgF3, Мп = Mg, Mn, Со, Ni '*
H[AgCl2]
M[AgCl2], анион - тетраэдр
M[AgBr2]
MAgI2, M2AgI3, M = Na K, T1 в стр. - цепи тетраэдров; KAg2I3 Н2О
KAg3I4 8Н2О; RbAg4I5 [R4N]2Ag13I15, крист, с ионной проводимостью, в стр. - каналы из тетраэдров [I4]; Ag+ могут мигрировать вдоль канала, Ag—Ag 1.3-2.2, Ag—I 2.7-3.1 (PyH)5Agl8I23, в стр. - слои тетраэдров [Agl4] '*
M[Ag(CN)2], М = Na-Cs, линейный ион, Ag—С2.13 9)
M[Ag(SCN)2] M2[Ag(SCN)3] M3[Ag(SCN)4], анион -тетраэдр (NH4)5[Ag(SCN)6] Na3[AgS2], анион -гантель, Ag—S 2.38 18) Cs[Ag(N3)2] 9)
Ag(SO3F)2, разл. 210; + Н2О —> О2 + ..., Мэфф 1.91
Ag[Pt(SO3F)6], Цэфф = 2.19 14) [AgPhen4]X2, X = С1О4, С1О3, NO3, HSO4, S2O8/2, крист., кор., парамагн. (d9) [AgDipy3](ClO4)2, крист., красн., катион -окт.
IAgPy4]X2, X = NO3, S2O8/2, крист., оранж., оч. сильн. окисл., катион - квадрат [AgN4] . AgCrO4 Z
M5[Ag(HIO6)2] лН2О
Na5[Ag(H2TeO6)2] 12.5 Н2О
крист., св.-желт., диамагн., анион - квадрат (dsp2), Ag — 0-1.98 15)
200° (-F2)
AgF2, крист., бц. (кор. за счет примесей), т. пл. 690, АН = —347, парамагн.
(<—110°), ферромагн., сильнейший фторагент; + Н2О —> Ag2O + О3 + HF, в стр. - квадраты [AgF4], Ag—F 2.07 4)
MF
MAgF3, M = K-Cs M2AgF4, M = K-Cs, Ca-Ba/2, Cd/2, Hg/2, анион - квадрат, Ag —F 2.05 3) Ba2AgF6, крист., гидрол., парамагн.
5)
(MAgO)
F2 (400°)
Ag[MIVF6], MIV = Ge-Pb, Ti-Hf, Rh, Pt, Pd, крист., окрашены, уст. до 600°, Мэфф 2.0
Ofe’^ •
Ag;,
Р-Р
Z
zF2
(Ag2SO4 + MnCO3)
Ag + , бц. ион, уст. к гидрол., обладает антибактериальным действием
ан. окисл.
н
ОН
Ag2O;, кор., ПР = 10 8, К = 10 4, pH > 7 + Н2О Ag+ + ОН , осн, средней силы______
н
ОН
[Ag(OH)2] , бц. линейный (sp) ион, сущ. при pH > 7, КуСу =10"
[Ag(NH3)2] + , Кусу = Ю7 [Ag(CN)2]-, Куст = 1021 [Ag(SCN)2]-, Куст = 108 [Agr2]-, KyCy = 1O5(C1), 8-107(Br), 1012 (I);
бц., линейные (sp) ионы
AgF3;,6) порошок, красно-ко-р., неуст., диамагн., изостр. AuF3, Ag—F 1.86 (конц.),
НР(ж.) + BF3 (—MHF2)
\ О
«А
(Ag
2 +
Н2О (—О2) (медл.)
О3 (ОН ); S2O|
н+ (-О2)
M[AgF4],
M = K-Cs, [O2], XeF5, крист., желт., оч. гигр., диамагн., анион - квадрат, изостр. MAuF4 и MBrF4 Ba[AgF5] 6)
Ag2+ (?), кор. р-ры, очень сильн. окисл.
(быстро)
и и
ОН |+ [ЭО6]' Ago;, черн., — очень сильн. окисл.;
1LO2 s2or
[AgAm4]2+, квадрат [AgAm6]2+, окт. (sp3d2), кор. или оранж., парамагн. (d9) ионы, очень сильн. окисл.
( AgF ) rCsF + F2 ♦ (Р)
Cs2[AgF6], в стр. типа K2PtCl6 -окт. [AgniF6], и
[AgvF6] d6(t62g) 16)
340° (-F2)
[Ag(IO6)2]7-[Ag(TeO6)2]9-
желт., диамагн.
(d8) анионы
2 — Ag2O3 (?);, черн., очень сильн. окисл.;
|он
[Ag(OH)4]- 13)
88
золото
1 + (<Z10)
"2 + "
3 + (rf8)
5 + (rf6) 7 + (rf4)
5d
Аи, мет., желт., наиболее тягучий и ковкий, d = 19.32, т. пл. 1064.4; т. к. 2947, летуч > 1000°, не pear, с О2, N2, С, S; р. в ц. в., (С12 + НС1), (H2SO4 + HNO3), (H2SO4 + HMnO4), H2SeO4(Z), (KCN + O2); ^°Au+/AuTB = 1-68, ^°Au3+/AuTB _ куб. пл. упак., a = 4.08, Au—Au 2.88
электродиспергирование
"Колл, золото", образ, в оч. разб. р-рах, с ростом размера частиц цв. изменяется по ряду: роз., красн. ("кассиев пурпур"), спи., фиол., черн.
Сплавы
Амальгама содержит
AuHg2, AuHg3, Au3Hg (т. пл. 124, 310, 421)
В системе Си—Аи непрерывный ряд твердых р-ров, < 400° в тв. фазе образ. Cu3Aui±„ и СиАи1±„ ("сверхструктуры")
-33
2.30
-18
2.62
Au—Г (тв.)
AuF, изв. только в г. АпСЦ, крист., св.-желт., неустойчивы AuBr), крист., желт. Aulj, крист., св.-желт.
В стр. АиГ - цепи, /АиГАи 94 (С1), 72(1), Аи—Аи 3.08
Г
Аи^ ^Аи
электролитическое рафинирование в р-ре НАиС14
Ап2О(?), порошок, серо-фиол.
AuO = Aui[AuiiiO2] (?), порошок, темно-зел.
Au2O3, порошок, кор., АЯ = —3, в стр. - сетка квадратов [AuOi/2O3/3], Au—О 1.93-2.07 5)
—H2O(P2O5)
Ап2О хН2О), темно-фиол.; + щ. —» спи, золь
AuO(OH)
I -Н2О(Р2О5)
MOH
Na2O2
Ауриты, М[Ап(ОН)2] (?), изв. только в р-ре Cs[AuO], крист., желт., в стр. - анионы [Аи4О4]4 Na5AuO2, в стр. - циклы [Na2Au2O4]4 с гантелями [АиО2] 6)
M3[Au(S2O3)2] Н2О, М = Na, Ва/2, Н, крист., бц., не окисляют Fe2 + , Sn2 + , (СООН)2; анион - линейный [S-Au-S], Au—S 2.27 9)
М[АиС12], крист., бц., уст. только в тв. фазе, Куст = 109,
M[AuBr2], Куст = 1013
M[AuI2] анионы - линейные, Аи—Г 2.26(d), 2,38 (Вг), 2,53(1) 10)
AuSO4 (?), крист., красн.
Au2O3 • 2Н2О), "золотая к.", желто-кор., р. в к. ищ., Кк = 10 12(1), 10~14(П), 10~16(Ш) >КОСН.
Аураты, К[Ап(ОН)4] • Н2О, желт. Мп[Ап(ОН)4]2, М = Са-Ва (-5Н2О, зел.), анион - квадрат, Au—О 1.98
NaAuO2
M6[Au2O6], М = Li, Na, анион - 2 квадрата с общ. стороной, Au—О 2.14 12)
у (2.0°
- А-
Au2(SO4)3 (?), сущ. в конц. р-ре
H2so4
[Au(SO3F)3]2, в мол. - 8-членные циклы [AuOSO]2, Аи—О 1.95 и 2.02 Au2(SeO4)3, крист., желт.
Au(TeOF5)3 14)
АиОСЦ, крист., красн., р. в конц.
НС1; Аи + С12 + О2;
в стр. - циклы [Аи(С1)О-]6, квадраты [Аи2О2] и [АиС13О], Аи—С1 2,24, Аи—О 2,03 8)
Na5[Au(HIO6)2] 3.5 Н2О 13)
Na5[Au(H2TeO6)2] 12Н2О
M[Au(SO4)2], крист., желт.
K5[Au(SO3)4] • 5Н2О, крист., бц. M[Au(SO3F)4|; Cs[Au(CF3SO3)4], желт., диамагн., анион - квадрат M[Au(NO3)4], м = к, nh4, Т1, крист., желт., анион - квадрат, Аи—О 2.00
H[Au(NO3)4] ЗН2О, желт., т. пл. 72
K2H[Au(NO3)6]
M[Au(CH3COO)4], М = М1, Мп/2
SbF5(—CsSbF6)
4V
о О° О С"А"
АиГ —U Аи + Г2;
+ Н2О ?’Av~B > Аи + [АиГ4]", уст.
AuI>AuCl; -nNH3(n = 1 — 12);
•иРН3(и = 1,2); СО; PR3
АиС1(СО), мол. - гантель, Аи—С1 2.26, Аи—С 1.93 17)
AuCl2, крист., красн., диамагн., в стр. -мол. [Au2nAu2Cl4], (кресло);
[Аи1ПС12С12/2] - квадрат, [Аи^г/г] - ган-тель, Au—С1 2,27 16)
М2Аи2Г6,
М = K-Cs, Г = C1-I, в стр. - гантели [Аи1 Г2] и квадраты [АишГ4] 16)
AuCl Д.с°Л SOC12
Aul3j, крист., темно-зел.
AuF3, крист., оранж., мгнов. гидрол.
АпС13, иглы, красн., оч. хор. р. в Н2О, р. в эф., т. пл. 288 (р) 7) AuBr3, порошок, кор., р. в эф.
разл. АЯ
500 -348
150 -117
100 -54
20 —
АиГ3 -А-> АиГ + Г2. В стр. AuF3 - спирали из квадратов [AuF2F2/2-!/wc], Au—F 1.91 (конц.), 2.04 (мост.). В стр. и г. - Аи2Г6 (Г = C1-I) - плоские димеры, Аи—Вг 3.59, Аи—Аи 2.38-2.47 8)
Г
Cu
Cu3Au
Au
AuCNJ., желт., изостр. AgCN AuSCN), разл. 140;
+ Н2О Au(SCN)3 + Н2
Ph3PAu—Х,Х = Мп(СО)5, Со(СО)4, W(CO)3(C5H5), Au—М 2.50-2.56
Au2S), серый или кор. порошок, 240° * , с
р. в ц. в.; -> Au + S
Au2S2), черно-кор.
Au2Te3, "монтбрейтит" (Au, Ag)Te2, "креннерит", "калаверит1
Au3N, нитрид, взр.; • NH3
AuN3, азид, крист., бц., р. в Н2О, АЯ = + 280, взр. даже в р-ре Аи2С2, крист., желт., взр. — AuX nPR3, оч. уст., X = I, CN, SCN, R 18) [Au(CH3CN)2]C1O4
M[Au(CN)2], линейный анион
H[Au(CN)2] -----------
M[Au(SCN)2], крист., бц., Куст = 1023 M[Au(CNO)2] 10) MAuS, М = Na (•4Н2О), К, крист., бц.
M3[AuS2], анион - гантель Au—S 2.30 10)
M4[Au12S8] 10) 1<|Аи(С= СН)2|
C2H4
^Оо-
Au2S3, черн., гидрол.; > Au + S
Au(NH2)2CH, воспл. при t
AuCNH^X^NH^U,
"гремучее золото”, желт-бур., взр.,
Au(CN)3 ЗН2О), крист., бц.-Au(SCN)3), красн., оч. неуст.
R2AuF
M[AuF4]„, М = Na, К, Ag, Mg, Ni, Pd, крист., св.-желт., р. в BrF3, гидрол., анион - вытянутый окт.
[BrF2][AuF4]
МАиСЦ, М = Li, Na ("золотая соль"), К( • 2Н2О), Cs),, [AsC14], крист., желт., р. в эф., анион - квадрат, Au—С1 -2.26
НАиСЦ • 4Н2О, "хлорид золота", св.-желт., гигр. иглы;
AuCl3 + Н2О + НС1 Н[Аи(ОН)С13], красно-кор. р-р, экстрагируется эф., CH3COOEt HAuBr4
KAuBr4 • 2Н2О, крист., пурп., анион -квадрат, Аи—Вг 2.43, Куст = 1031 К3АиВг6, крист., желт., образ, в р-ре CgH5NO2, анион - искаж. окт.
KAuI4, крист., черн.
HAuI4, оч. неустойчива 2)
M[Au(CN)2Cl2] -транс
K[Au(CN)4], 2"" Н2О, крист., бц.
анион - квадрат, Аи—С 1.97, ZAuCN 140 ’H[Au(CN)4]-3H2O, р. в сп., эф.; -^->Аи + ..
H[Au(SCN)4] • 2Н2О, крист., красн. K[Au(SCN)4], крист., оранж., Хуст = 1042
NaAuS2 • 4Н2О, крист., бц.
AuF5, крист., красно-кор., т. пл. 75, диамагн., АЯ = -473, изостр. RuF5, в г. - [AuF5]2 -2 окт., Au—F 1.82-2.03 3)
60'
(-Kr-F2);
(-O2-F2)
M[AuF6]„, М =
= K-Cs, Mg-Ва,
[XeF5], [Xe2Fn], [О2], [IF6], [KrF], желт., диамагн., анион - окт.
(d2sp3),
--------?---------
М'Ди. М = K-Cs M3OAu, изостр. M3OBr 19)
|Au4L4(/z-I2)|; Au5L4C1 = [AuI(Au°L)4]+ Cl ;
[Au6L8]X2; [Au8L7]X2 = [Aui(Au°L)7]X2;
[Au8L8]X2; [Au9L8]X3; [AunL7X3]; |AunL|0|I3;
[Au13L10C12]X3, L = PR3, кластеры - [Au,J;
n = 4 (тетраэдр), 6 (окт.), 9 (центрированная корона), 11 (центрированный 10-вершинник), 13 (центрированный икосаэдр),
Au—Au 2.65-2.90 П)
j^[Au(NH3)4]X3i, X = NO3, CrO4/2, 3 не р. в конц. к.
АиГ3-2Аш = [АиГ2Ат2]~Г , Ат = Ру, Phen, катион - квадрат
300'
HC1
SOC12
Г
Г
HCN
f CN-(-Cl-)
H2O
H2O
Au2O3 • n H2O j ,
C12
+ H2o-----
N2H4; H2O2; (COOH)2; Fe2 + ;
Au)., ос. или колл, р-р (отрицательный коллоид)
[АпС13(ОН)|-, красно-кор. ион,
[АпС12]-, бц., линейный (зр),
[Au(CN)2]-, бц., линей-
[Au(CN)4] , бц. ион, квадрат, Куст = 1056_________________
-уст = ю39
-^ДКВг_+н20.
[Au(CN)5I
[Au(NH3)2] + , бц., линейный ион, Куст = 1027
[Au(H2O)2]
AuF7, крист., желт., летучи; 100° AuF5;
+ Н2О—>Аи2О3
+ Au + ...4)
[Au(CN)6]3-
[AuCl4] ', св.-желт., диамагн. ион, квадрат, сильн. окисл., Куст = 1022
[Ап(ОН)4Г’, желт., диамагн. ион, квадрат (dsp1)
О
Z
д Z
д Z
[Au(NH3)4]3 + , бц. ион, Куст = Ю30
[Аи(Н2О)4]3+ 15)
89
ЖЕЛЕЗО
Ионы Fe в водном растворе см. с. 96
3d
О (<С)
4.S' Ар
4г/ Э.О.
Ферросплавы с высоким содержанием Э (Э = В, Si, Р, Сг, Мо, W, Mn, Ti, Zr, Nb), промежуточные материалы в производстве легированных сталей
-c±??oioco, в_домне. AJ (-Al2o3)
2+ (<Z6)
Диаграмма состояния системы Fe—С
Н2; СО(7); С (в домне)
’ Fej_xO, крист., черн., т. пл. 1368, AH = —268, иногда пирофорны; ___ 570°
---> Fe + Fe3O4 (медл. охл.); стр. тип NaCl, Fe—О 2.15, "вюстит"
-н2о
200'
Fe, мет., бел., d = 7.9, т. пл. 1539, т. к. « 3200, легко корродирует, р. в разб. к. (—> Fe2 + ) и конц. щ. (t) (—> [Fc(OH)6]4 ), пассивируется на холоду к.-окисл., EoFe2 + /FeTB= ЕЬре3 + /рет = -0.036, a-Fe, объемноцентрированный куб.,тк. ч. 8 (куб.), а = 2.86,ферромагн.
| 769° (точка Кюри)
Р-, изостр. a-Fe, а = 2.90
у-, куб. пл. упак., а = 3.56, Fe — Fe 2.58
парамагн.
8-, изостр. a-Fe, а = 2.94
£-, гексаг. пл. упак., d = 9.1
"Карбонильное железо", пирофорно
1539°
ж. + Fe3C
1140°
перлит +Fe3C
s
£
'аустенит + g РезС + + ледебурит | _|_ ледебурит
1650°
Fe(OH)2J., бел., ПР = IO16, AOCH. = 10“2, стр. тип Cdl2, Fe—OH 2.23 (Fe,Mg)(OH)2, "амакинит"
СО (200°, 2-107 Па)
130'
< 0.3% С - мягкие стали, <2 - стали, <4 - чугуны. Fe3C, карбид (цементит), уст. > 1100°, т. пл. 1650, АН = +25; + Н+ —> Н2 + С„Н2и + 2; ферромагн. (>214°). В стр. - триг. призмы [Fe6C], к. ч. Fe 2
H2Fe(CO)4, г., бц., т. пл. —70, разл. —10, воспл. на возд., р. в Н2О, К\ = 10“5, Кг = 10“14, диамагн., Хе = 18, в мол. - тетраэдр [FeC4], Fe — С 1.84 и 1.79, Fe — Н 1.1
>-10'
(-Н2)
V
н
он
Fe(CO)5, пентакарбонил, ж., желт. (< —196°, бц.), яд, d = 1.46, т. пл. —20, т. к. 103, АН = —733, не р. в Н2О, р. в бзл., эф., ж. NH3; +Н+ —> Fe2+ +СО + Н2 ; диамагн., Хе = 8 + (2 х 5) = 18; мол. - триг. бипир. (dsp3), Fe —С 1.80 (акс.), 1.84 (экв.), С—О 1.12
420° Nl 350° Nl
Fe4N ч---Fe3N ч----- Fe2N
MHFe(CO)4
M2[Fe(CO)4], М = Na (неустойчив, воспл. на возд.), NH4, Hg/2 ( желт., не р. в к.;
Hg + Fe + СО), SiH3
Sn[Fe(CO)4]4, крист., красн., в мол. - тетраэдр [SnFe4], Sn—Fe 2.54, Fe — Fe 2.87 [Mn(CO)5]2[Fe(CO)4], окт. кластер [Ре(СО)4Мп2]-транс, Fe—Mn 2.84 Na[Fe(:CO)3(:NO)], крист., желт., гигр., окисляются возд., диамагн., Хе = 18
[Fe(CO)4(NH3)|; [Fe(CO)3(SbCl3)2] [Fe(:CO)„(:PR3)5_„]; Fe(CO)3[P(OMe)3]2 "
[Fe(CO)5H]PF6
Fe(CO)„(C = N—R)5_„, и = 3,4, крист., св.-желт.
О
Fe + N2
[Fe(:NO)4], тетранитрозил, иглы, черн., оч. акт.; + Н+ [Fe(NO)(H2O)5] +
[Fe(:CO)2(:NO)2], крист., красн., летучи, т. пл. 19, окисл. на возд., р. в орг. р-рителях; диамагн., Хе = 8 + (2x2) + (2x3) = 18, мол. - тетраэдр, Fe —С 1.88, Fe—N 1.69, С—О 1.15, N—О 1.17 [Fe(:NO)2(:PF3)2], ж., красн., т. пл. —72, т. к. 97, летуча, разл. 118, диамагн. (Хе = 18)
Fe(NO)2(C = N—R)2, крист., красно-кор. 13)
H2O + H2SO4
О
U
M2Fe(PF3)4, М = Н (бц., т. пл. -80), К
M[Fe(PF3)3(NO)]
H2Fe(PR3)3(N2)
Na[FeDipy3], крист., черн.
[Fe(:PX3)5], X = F (крист., св.-желт., т.пл.45), ОМе (возг.
вак. 80), R, летучи, р. в орг. р-рителях, диамагн. (Хе = 18), [Fe(PEt3)4(N2)J; [Fe(PR3)3(H2)(N2)]
{I e|P(OMe)3|5H}PI (1: Fe[P(OMe)3]„(PF3)5_„
|Fe(C6Me6)2|, крист., кор., дэфф = 3.08, стр. аналог Сг(С6Н6)2
[FeDipy3], крист., черн.; + Н2О —> [FeDipy3]2+ + Н2| П)
H2Fe2(CO)8, крист., красн.
NaHFe2(CO)8
M2[Fe2(CO)8], крист., св.-кор., диамагн., кластер, Fe — Fe 2.88 (GeMe2)[Fe2(CO)„], п = 6,7
_moh_
(—M2CO3)
Fe2(CO)9, эннеакарбонил, крист., желт., гигр., нелетучи, не р. в эф., бзл., р. в Ру, ац.;
• — диамагн.; мол. - 2 окт. с
4 общ. гранью, кластер 5)
М2[Ге3(СО)ц], М = Н (ж., красн.), К, R4N, [Ni(NH3)6]/2, крист, красно-кор., диамагн., анион - стр. аналог Fe3(CO)i2 (без 1 СО-мост., Fe—Fe «2.7) или тр-к из 3-х гр. [Fe(CO)3]
’2
M2[Fe4(CO)13], М = [Сош(С5Н5)2], [FePy]/2, в анионе - тетраэдр [Fe4], Fe — Fe 2.58, 3 + (2х3) = 9 СО-конц., 3 СО - бидентатны, 1 СО (акс.) тридентатна MHFe4(CO)13
|1е'(ХО)1 (H2O)5|SO4. крист., красн., парамагн. (d7, 3 неспаренных эл.), vNO = 1745 см-1; M[Fe(NO) + Cl3] 23)
Fe(NO)3r, уст. I > Br > С1
[Fe(NO)2I]2, мол. - 2 тетраэдра с общ. ребром [12], Fe —Fe 3.05, Fe—I 2.58, Fe —N 1.67, N—О 1.15 [Fe(C6Me6)2]+X-
К. Руссена [(NO)2Fe(SH)]2 Н + Соли Руссена M2[Fe(NO)2S]2, красн. M[Fe4(NO)7S3], черн., диамагн. K2[Fe2(NO)4S2] 8Н2О 23) \
(NO)2Fe(PPh2)2Fe(NO)2, диамагн.
[Fe(C6Me6)2][PF6], крист., фиол.
Ге(С1О4)2 6Н2О, крист., бц.
FeSO4, крист., бц.; Fe2O3 + SO2 + SO3
/ f (t, H2)
' иН2О, n = 7 (зел., "железный купорос", "мелантерит", [Fe(H2O)g]SO4 • Н2О),
6 ("феррогексагидрат"), 5 ("сидеротил"), 4 ("розенит"), 1 ("ссмольнокит")
/ (NH4)2SO4 6Н2О, соль Мора; H2SO4 ЗН2О;
• 6NH3, разл. 100; + Н2О Fe(OH)2J. + (NH4)2SO4 + NH3
FeSO3 3H2O
Fe(NO3)2 • 6H2O, т. пл. 60.5 с разл.
Fe3(PO4)2 • яН2О|, п = 8 ("вивианит"), 4 ("лудламит"), 2 ("штренгит")
FeHPO4 2Н,ОФ: Fe4O(PO4)2
Fe(H2PO4)2 2Н2О, в стр. - слои окт., Fe—О «2.1 26)
Fe3(AsO4)2 8Н2О, "симплезит" (трикл.), "парасимплезит" (монокл.)
FeCO3)., "железный пшат" ("сидерит"), изостр. СаСО3; * Fe3O4 + СО + СО2;
СО2 + Н2О
с Fe(HCO3)2, сущ. в природных водах; + О2 —> Fe2O3 • /г Н2О| + СО2
Fe(CH3COO)2, 4Н2О; Fe(HCOO)2 2Н2О 26)
FeC2O4 • иН2О, п = 2, 5, крист., желт., "гумбольдин"; FeO + СО + СО2
(N2)
Fe3Al2[SiO4]3, "гранат"; Fe2SiO4, "фаялит"; FeSiO3, "клиноферросилит"
30)
Fe(OH)Cl; 3Fe(OH)2 • FeCl2 (ср. Табл. "Кобальт")
Fe(OR)2, бел., не р. в ROH, стр. типа Cdl2
"Fe(CN)2'4 = Fe2[Fe(CN)6], бел. в-во (ос. бур.), разл. 500 Fe(NCS)2 ЗН2О, крист., зел.
Fe(C5H5)2, ферроцен, крист., оранж., т. пл. 173, возг. 100, перегоняется с паром Н2О, уст. на возд. (ср. др. М(С5Н5)2!), диамагн., мол. -триг. антипризма, Fe — С 2.05 [Ге(СбМеб)2]Х2, крист., оранж.-красн.
Ре(СО)5Г2, Г = Cl (желт., разл. 0), I (красно-кор., разл. —35) Ре(СО)4Г2, крист., Г = С1 (желт., разл. 10), Вг (кор., разл. 55), I (черн., разл. 75); + Н2О —> РеГ2 + СО;
[Fe(CO)6]2+[Sb2F11]2, разл. 200 4)
Ре(СО)3Г2; Ге(СО)2Г2; Ге(РГ3)4Г2
FeF2, крист., бц. FeCl2, крист., бц., "лавренсит"
FeBr2, крист., св.-зел.
Fel2, крист., кор.
стр. тип т. пл. т. к. АН • и Н2О, п = Fe—Г (г-)
рутила 1100 — -661 8 (сине-зел.), 4 1.77 27)
CdCl2 674 1012 -343 4, 2 (в стр. - цепи окт. [Fc(H2O)2CI4/2]„) 2.16
Cdl2 684 — -247 z- 45 Л 6, 4 2.31
Cdl2 592 — -125 4 —
в г. - линейные мол.
"FeI2-3MeCN" = [Fe(MeCN)6] [Fel4]
[Fe(NH3)6]F2, сущ. только в тв. фазе, высокоспиновые (d6, 4 неспаренных эл.) окт. (sp3d2) комплексы
Fe2(CO)8I2, крист., бц., т. пл. —5, диамагн., в ж. и г. (красн.) -г парамагн. мономерные мол.
Fe2(CO)4(C5H5)2
Fe2(CO)4(NH2)2, крист., оранж., т. пл. 82, возг. вак., ц = 3.28, в мол. 2 NH2-moct. (Fe—N 1.98), Fe—Fe 2.40, ZFeNFe 74.4 все CO - конц.
Fe2(CO)6S2, в мол. 2 пересекающихся искаж. окт. [FeC3S2/2Fe], Fe—Fe 2.55, Fe—С 1.77, S —S 2.01, С—О 1.15
СО
СО
#СО Fe—СО
кС = СН
ОС
ОС--Fe
ОС
ОС
CN-; КОН [-Fe(OH)2j]
Fe2(CO)8(:SO2); Fe2(CO)8(-PMe2)2,
Fe—С 1.71 (акс.), 1.79(экв.), С—О 1.29(акс.), 1.16(экв.)
Fe3(CO)i2)_, тетракарбонил, крист., черно-зел., возг. вак. 60, разл. 140, окисл. на возд., не pear, ск., щ., диамагн., в мол. -кластер [Fe3], Fe — Fe 2.8 (M-H)2Fe3(CO)9(M3-PPh) Fe3(CO)„(PR3)12_„, n = 9, 11 14)
Fe3(CO)9S2; Fe3(CO)9Se2, мол. - тетраг. пирамида, Fe — Fe «2.6, Fe—С 1.7—1.8, к. ч. Ре(акс.)7; Ге3(СО)9(ц3-РРЬ)2
Fe4(CO)„(PR)2, п = 11, 12, мол. - квадрат; Li2Fe3(CO)9(/z3-P)2 14)
Fe5(CO)15C, крист., Fe(CO)3
черн., разл. ПО, р. в бзл., диамагн., мол. - кластер, / Fe—Fe 2.64, // и,, г1* 1 оо (л (COKFe/ /
и 1.96(1 связь), rrcn _ Fe—СО 1.75 (CO)3Fe ( -*Fe(CO)3
[R4N]2[Fe6(CO)16C] 14); [R^IFe^COM 31)
Fei_*S.|., крист., кор., т. пл. 1193, АН = —96, ПР = 10“19, р. в к.; + О2 — FeSO4; "пирротин", стр. тип NiAs
Fe(SH)2 S (500°) || >700°(-S)
Fe[S2], "пирит", "марказит", крист., золотистые, т. пл. 1171, АН = —175, стр. тип NaCl, ([S2]-2 = Cl"), Fe—S 2.26, S —S 2.17
Fe2S3, аморфн. или крист, (искаж. шпинель)
Fe3S4, "грейгит"; FeAsS, "арсенопирит"
‘2
90
O2 (мгнов.)
O2 (О
Fc\-__ Ч?О Си
6+(rf2)
H2(>570°)
FeO • и Fe2O3x Н2О темно-зел.
Fe3O4 = Fein(FenFeni)O4, крист., черн. с мет. блеском, ферромагн., т. пл. 1538 с разл., АЯ = —1116, не р. в к., полупроводник, "магнетит", в стр. обращенной шпинели -тетраэдры [FeinO4] и окт. [FenFeniO6]
воздух (z)
Fe2O3, крист., красн., —> серые, АЯ = —820, а-, гексаг., т. пл. 1562 с разл., парамагн., полупроводник, "красный железняк" ("гематит"), стр. тип корунда; у-, крист., кор., ферромагн., "маггемит", куб., стр. шпинели с частичным заполнением вакансий Fe, Fe — О 1.97 (а)
FeO(OH), а-, /L, у-, "бурый железняк" ("лимонит"), ("лапидокро-кит" + "гетит"), стр. аналоги АЮ(ОН) "бемита" 10), ферромагн.
H2O2+KOH
[-OFe(OH)(OOH)]2 (?),
порошок, красн., разл. О'
Ферраты (II) 7) Na2[Fe(OH)4] 2H2O, крист., серо-зел.
Ba2[Fe(OH)6] j, крист., св.-зел. Na4[FeO3]; Cs2K4[Fe2O5], крист., красн., в анионах — 1 и 2 тр-ка, к.ч. Fe 3 (d2s), Fe-0 «1.85-1.88
H2; CO (в домне)
NaFe2O3 - в стр. -слои окт., Fe — О ~2J LixFe3O4; LixFe2O3 28)
Fe2O3 • /1НД , бурый, p. в к. и конц. щ.; А1к = 10 13; А1осн = 10 10, = 4, 6, 2.5, Fe(OH)3, "берналит", стр. аналог CaTiO3 32)
[Ph4As]2[Fe(NO3)4l
M4[Fe(NO2)6]; [NO][Fe(NO3)4] 15)
K2[Fe(C2O4)2] 6H2O, крист., золотисто-желт., p. в H2O (в отличие от соединений Со и Ni)
FeIIFe2II(SO4)4 лН2О, п = 14 ("ремерит" = = [Fen(H2O)6][Feni(H2O)4(SO4)2]2--цис):. 22 ("биллинит") 2) FenFe4n(SO4)6(OH)2 20 Н2О, "копиапит"
Fe9O8(PO4); Na7Fe4(PO4)6 FeI1I6IFe|I(PO4)14(OH)24 [R4N][FenFein(C2O4)31 2)
MFeF3, М = K-Cs
M2[FeF4|; Ва2[Ее3Ею]; Cs7Fe4Fi5, в стр. - конденсированные окт.
MFeCl3, М = Rb, Cs, в стр. - окт. МЯГеСЦ], М = Li, К (-2Н2О, "дугласит"), крист., бц., высокоспиновый (4 неспаренных эл.), анион -тетраэдр (sp3), Fe — Cl 2.30 M3FeCl5, M = NH4, Т1 Na6FeCl8; Na2Fe3Cl8 С8зГеВг5
Fe2F5 • лН2О, n = 2 (красн.), 7 (желт.)
( = [Fen(H2O)6] [FeniF5(H2O)];
Ж FeF2 + FeF3 • H2O
Fe3F8 2H2O = 2 [FeniF6/2]x x[FenF4/2(H2O)2], Fe111—F 1.92, Fe11—F 2.11
Fe3I8 = 2FeI3 • Fel2;
+ K2CO3 KI + CO2 + Fe3O4], 17)
Ге(С1О4)з, крист., бц., • 10Н2О, крист., роз. Fe2(SO4)3, крист., бц., разл. «500; • иН2О, п = 10 9) ("квенштедтит"), 9 ("кокимбит"), 7 ("корнелит"), 6 ("лаузенит") M2SO4 24Н2О, квасцы, бц. (фиол. за счет следов Мп3+)
• 3Na2SO4 • ЗН2О, "ферринатрит"; • K2SO4 ("явапаит") Fe(SO4)(OH) • лН2О, п = 1.5, 2 ("бутлерит"), 5; FeO(SO2F) 9) Fe2(SeO3)3 • иН2О, п = 3 (в стр. - окт. [FeOe]), 6 16) Fe(NO3)3, 6) • 9Н2О, крист., монокл., разл. 50; • 6Н2О, т. пл. 40 Fe(H3O)(HPO4)2; 3) Fe4(PO4)3(OH)3 9); Fe(H2PO4)3, лН2О, п = 1, 0.5 Ге3(Н3О)(НРО4)2(Н2РО4)б 4Н2О 9) FePCL/, крист., желт., стр. типа кварца FeAsC>4 • 2 Н2О [, "скородит"; Fe(H2AsC>4)3 • 5Н2О 9) Fe3(AsC>4)2(OH)3 • 5Н2О, "формакосидерит" [Fe3O*(RCOO)6]+X ', крист., красн., в центре иона - тр-к [Fe3O*], Fe О* 1.89; FenO6(OH)6(RCOO)15 Fe4O2(RCOO)8(H2O)6, Fe—О 1.84-2.08 9) Fe2(C2O4)3 5H2O, крист., желт.; NaFe(SiO3)2, "эгирин"
FeOF, крист., черн., • яН2О|
FeOCl, красн., разл. 300, слоистая стр. типа Cdl2, отсутствуют 1/3 ат. М 20)
ля
• и Н2О, п =
8)
KxFeF3, х < 1, "бронзы"
H4[Fe(CN)6], железисто-синеродистая к., крист., бц., сильн. к., А3 = 10“2, К4 = 10“4; •лХ,Х = H2SO4, (С2н5)2о K4[Fe(CN)6] • ЗН2О, желт, кровяная соль, не ядовита, диамагн., анион - правильный окт., Fe —С 1.89, С—N 1.15 Ba2[Fe(CN)6H K2Ca|Fe(CN)6| [; Ca2[Fe(CN)6] — K2Fe[Fe(CN)6] ]., бел., стр. близка MFenFeni(CN)6 M„[Fen(CN)5X], X = NH3, SOj", NO0, NO , Ру, H2O, "пруссиды" Na2[Fen(CN)5(NO)+] • 2H2O, нитропруссид, крист., красн., p. в H2O и си. (наиболее уст. среди пруссидов), анион - искаж. окт., Fe —С 1.90, Fe —NO 1.63, N—О 1.13, С—N 1.14; ?n=o = 1940 см-1, реактив на S2- и SO2- (фиол. и красн. окраска) M2[Fe(NCS)4|; M4[Fe(NCS)6], Ауст = 102 Fe3 + Са(ОН)2 "Берлинская лазурь", "турнбулева синь", колл, р-ры MFenFeni(CN)6, М = Na-Rb, разл. щ., в стр. -сетка кубов из ат. Fe, на ребрах - CN, в 1/2 центров - М+; окт. [FenC6] и [FeniN6] распределены статистически Fe™ [Fen(CN)6]3 14-16Н2О . "пруссеновская лазурь", крист., син., в стр. - окт. [FenC6], [FeinN6], [FeniN2O4]; Fe—С 1.93, Fe—N 2.00, Fe—0 2.16, ферромагн.
BaFe2S3
FeF3, крист., св.-зел., возг. > 1000, изостр. ReO3, Fe —F 1.52
FeCl3, крист., темно-кор., т. пл. 308, т. к. 317, в стр. -трехмерная сетка окт.
[FeCl6], в г. - димерные мол., "молизит"
FeBr3, крист., кор., возг.;
FeBr2 + Вг2, изостр.
FeCl3
FeI3X Fel2 + I2,
Fe2 +
-994
-396
^!/s
+ Na2CO3 (800°) * KFe2S3, "расвулит", в стр. - цепи [FeS4/2], Fe —S 2.20-2.32 Na3Fe2S4 19)
4.5, 3
бц. или роз., p. в HF 20)
6, крист., желто-кор.,
т. пл. 37,
= [FeCl2(H2O)4]Cl(H2O)2, Fe —Cl 2.30, Fe —О 2.07;
2.5
6, красн.
-264
С1
123°
Fe(OR)3, красн., не р. в ROH, стр. типа А1(ОН)3
Fe10O4(OEt)22, Fe(OPr-t)3, р. в ROH 33)
"Fe(CN)3"J. = Fe[Fe(CN)6], крист., кор., стр. близка MFeFe[(CN)6]
Fe(NCS)3 3H2O, крист., темно-красн., p. в си., эф.
Ферраты (III) ("ферриты") 18)
Na4[Fe(OH)7] 2H2O; Na5[Fe(OH)8] 5H2O, крист., бц. M5FeO4; K6[Fe2O6]; M4Fe2O5; K14[Fe4O13]; Na14[Fe6O16], анионы - изолированные или конденсированные тетраэдры, стр. аналоги силикатов, Fe — О 1.82-1.91
LiFe5O8, Na3Fe5O9, Ва2Ге9Оц, M2Fe4O7, М = К, РЬ/2
MFeO2, крист., красн., стр. тип NaCl
Mn(FeO2)2 = Мп Feni[FeniO4], полупроводники со стр. обращенной шпинели, Мп = Mg ("магнезиоферрит"), Ni ("трево-рит"), Т1("ульвешпинель"); со стр. нормальной шпинели Мп = Zn ("франклинит"), Мп ("якобсит"),
[ClO2][Fe(ClO4)4]
M2[Fe(IO6)], М = Na, К (р. в Н2О), Li К/2[
HFe(SO4)2 4Н2О; M[Fe3(SO4)2(OH)6]
M3[Fe(SO4)3], М = NH4, Na( • 3H2O, "ферринатрит") 6)
RbFe(SeO4)2 16)
M[Fe(NO3)4]„, M = Cs, [R4N], [NO] ( = "Fe(NO3)3 • N2O4"), [(NO3) (NO)f]2- ( = "Fe(NO3)3 • 1.5N2O4"), анион-сплющенный тетраэдр, к. ч. Fe 8 (додекаэдр, sp3dA), NO3 бидентатны 3) (NO)[Fe(NO2)4| 15>
М[Ге3(Н2РО4)б(НРО4)2] 4Н2О; (NH4)Fe(HPO4)2 Li3Fe2(PO4)3 3); K3Fe3(PO4)4 Н2О; M2[Fe4O(PO4)41 3)
K[Fe4(AsO4)3(OH)4] • (6-7)Н2О, "фармакосидерит"
M3[Fe(C2O4)3], М = NH4( • ЗН2О), К( • ЗН2О "мингуццит"), Na (-5.5Н2О), (NaMg)(-9Н2О, "степановит");
hv (2 < 4900 А) —> M2[Fe(C2O4)2] + CO2t (количественно)
[NO][FeOCl2], M2[Fe2OCl6], Fe—О 1.75, Fe Cl 2.21, ZFeOFe 180 21)
[Fe(C5H5)2| +X ', соли феррициния, крист., син., парамагн. (1 неспаренный эл.), низкоспиновый, катион сущ. в р-ре Н2О
Fe2S3, крист., желто-зел.;
+ Н2О FeSJ. + SJ. + Fe2O3 • п Н2О^
M[FeS2], гол., • лН2О, крист., красно-фиол., анион - [FeS4/2]oo, Fe — S 2.22; Ba1+xFe2S4
Na3FeS3, анион - [Fe2S2/2S4] 29)
Н2О
Ферраты (IV) 7)
Li2FeO3; MnFeO3
Na4FeO4
M2IFeO4, Мп = Sr,
Ba, стр. шпинели
Ba3FeO5, крист., черн.
> 0" — Fe111 + Fev
Феррат (V)7,30) K3FeO4, крист., черн., парамагн., Мэфф. 3.88, анион - тетраэдр (sp3), Fe —О 1.71 LiLa2FeO6, стр. перовскита
Ферраты (VI) K2FeC>4, крист., красно-фиол., разл. 200,
ЭН изостр. К2СгО4
ВаГеО4, разл. 120, •Н2СЦ, крист., красн., парамагн., Цэфф. 3, анион - тетраэдр (d3s), Fe О 1.65
КОН
Го2)
MFeF4, М = Rb, Cs, [XeF5], крист., бц., дэфф. = 5.85, в стр. - слои окт. 25)
M2FeF5, в стр. - цепи окт., Fe — F 1.80-2.04; Cs3Fe2F9
M3[FeF6|; H3[FeF6] 3H2O, крист., св.-зел.
M2[FeF5(H2O)], высокоспиновые (5 неспаренных эл.), окт.
(sp3d2) комплексы, Fe — F 2.03
Н| IeCl4| 3Et2O
MfFeCU], M = M1, [PCI4], [AsRJ, высокоспиновые X тетраэдрические комплексы (sp3), Fe—Cl 2.17-2.22 I ГИд_
M2[FeCl5|; K^FeCl^O)], "эритросидерит" Z рОЛ
М3[ЕеС1б|; Cs3[Fe2Cl9], анионы - окт. I
M[FeBr4], M = Li-Cs, Tl, Ag, анионы - окт.; Cs[FeF4] 12)
—Z(-O2)
\9
FeF5 ЭГ5, Э = Sb, Pt Cs2FeF6 22)
H3[Fe(CN)6], железосинеродистая к., крист., кор., сильная к., неуст.
М3[Ге(СХ)б], М = К (красн. кровяная соль), Na( • 6Н2О), кор., порошок желт., яд, низкоспиновый (1 неспаренный эл.);
анион - искаж. окт. (z2g; d2sp3)
M„[Fein(CN)5X], "пруссиды", X = СО, NO, Ру, NH3, Н2О, NO2, NCS , N3 , SO2 , низкоспиновые комплексы
K3[Fe(NCS)6] 2Н2О, крист., темно-красн., анион - неустойчив;
+ Н2О [Fe(NCS)„(H2O)6_„](”-3)-, К,_з = 10 46; К,_6 = I0 3
K3[Fe(NCO)6] 3.3 Н2О 29)
91
КОБАЛЬТ
Ионы Со в водном растворе см. с. 96
3d 4^9 4б/ Э.О.
Со0 ЕШЕЕЕ И ГГП ГТТ
1+(</8)
2 + (</7)
--------Н2 (500°); С; А1
Coi_xO, крист., цв. - от зел. до черн., т. пл. 1935, разл. 2800, АЯ = —239, р. в к., конц. щ., антиферромагн., стр. тип NaCl, Со—О 2.15
| 170° (-Н2О) (N2)
Со(ОН)2)_, роз., ПР = 10 16, р. в к., щ., NH4OH, Аосн = 10 4, стр. тип Cdl2, Со—О 2.10
' [Co(NH3),(H2O)6 J"\ л продукты гидрометаллур-. гических технологий .
Co3N Ж Co2N Ж CoN
Со3С; Со2С
Со(СО)3(РРЬ3)Г, Г = Cl-I, крист., окисл. возд., р. в бзл., диамагн. = 18)
CoAs3(CO)3, мол. - тетраэдрический кластер [CoAs3], аналог мол. [As4], Со—As 2.44, As—As 2.37
Co(NO)2r, крист., черн., т. пл. 101 (Г = С1), 116 (Вг), 131 (I), возг. в токе N2, в ж. и в г. -димеры с 2 Г-мост.
(NO)2Co(PPh2)2Co(NO)2 [Co(NO)2(3R3)Cl], Э = P-Sb, крист., черн., диамагн., = 18
K3[Co(NO)2(S203)2], крист., св.-кор., р. в Н2О
{Co[P(OR)3]5}+X- п>
[Co(PR3)3r], Г = Cl—I, цЭфф = 3.1 (2 неспаренных эл.), мол. - тетраэдр
Co(PF3)4I, крист., кор.
[Co(MeCN)5]r, оч. уст., Со — С 1.87
[CoDipy3]C104
[Со(С6Ме6)2]+Х-
(CoCN),
K3[Co(CN)4], крист., св.-желт., > 20° - краснокор., окисл. возд., анион - квадрат K2[Co(CN)3(CO)]
Со(ОН)„Х2_„ /и Н2О(, гол., осн. соли
Д О
Со(СЮ4)2, разл. 210; • иН2О, п = 4, 6, крист., красн. 25)
CoS04, крист., роз., разл. 650; • иН2О, п = 7 ("биберит", "красн. купорос"), 6 ("мархаузеит"), 4 ("апловит"), 1
• M2SO4 • 6Н2О, соли Туттона, окт. [Со(Н2О)6], Со—О 2.02-2.13 9)
• 1.5Со(ОН)2 • 2.5Н2О)_, крист., фиол.; • ЗСо(ОН)2 • яН2О(, син.
CoS03 • иН2О)., крист., красн., п = 5, 3, 2.5, 2 7) /(n2o4)
Co(N03)2, крист., пурп.; • 6Н2О, крист., красн.
Со3(Р04)2, крист., красн., в стр. к. ч. Со 5, Со—О 2.06, 2.13; • яН2О(, п = 2, 8, р. в Н3РО4, NH4OH
Со5(Р04)2(ОН)4; Со(Н2Р04)2 ЗН3РО4; СоНР04 ЗН2О 12);
Co3(As04)2 8H2Oi, "эритрин",
СоС03, крист., красн., "сферокобальтит", изостр. СаСО3;
• 6Н2О)_, образ, в изб. СО2; • иСо(ОН)2 • »iH2O),, син.
Со(СН3СОО)2; -4Н2О, крист., красн.; + RNH2 + О2 —> [ — О — Co(RCOO)2(RNH2)3]2, диамагн., необратимо присоединяет О2 6)
Со3(СН3СОО)40; Со(НСОО)2 2Н2О 6)
СоС2Р4 2H2Oj, крист,, роз.; Со + 2СО2__________________
СоГ2 • 9Со(ОН)2 • 8Н2О)_, Г = С1, Вг, "зел. осн. галогениды", в двухслойной стр. - слои окт. [Со(ОН)6] и [Со(ОН)Г(Н2О)4]
СоГ2 ЗСо(ОН)2 Н2ОФ. "роз. осн. хлорид", "красн. осн.
бромид", однослойная стр. типа Cdl2; Со(ОН)С1 21)
[NO][Co(NO3)3]
450° [-(CN)2]
CoF2)_, крист., роз. СоС12, крист., гол. СоВг2, крист., зел. Со12, крист., черн. стр. тип т. пл. т. к. АЯ • и Н2О, п =
рутила Cdl2 Cdl2 Cdl2 Co(H2O)2CL мол., Co — 1200 740 678 520 /г] с об] -F 1.75 — 1740 1049 927 570 возг. ц. ребрак -661 -318 -213 -88 ш. 4,2 6 (роз.), 4 (красн.), 2(роз.-фиол.)*, 1 (сине-фиол.) 6 (красн.), 2 (пурп.) 6 (красн.) О
* в стр. - цепь окт. В г. фазе - линейны
CoCl2-6NH3, крист, красн.; -2NH3, а-, красно-фиол., т. пл. 273, в стр. -210°
цепи окт. [Co(NH3)2C14/2]; <--- /?-, спи., в стр. - тетраэдры [CoC12(NH3)2]
Co(CN)2, крист., спи., разл. 450; • 2.3 Н2О), = = Co2[Co(CN)6] • 7 Н2О, крист., роз., р. в NH4OH CN K3[Co(CN)5], зел. р-р
Co2(CO)4(PPh3)2As2, мол. - 2 пересекающихся искаж. окт. [CoC2PAs2/2Co], Со — Со 2.59, Со—As 2.35, As—As 2.27, ZCoAsCo 67 (стр. аналог Fe2(CO)6S2)
Co(NCS)2 • ЗН2О, крист., красно-фиол.; Со(—SCN)2(PR3)2
[Co(MeCN)6][CoI4]
Co3(CO)9S, парамагн., [Co3S] - тетраэдр, у 3 ат. Со по 3 СО-конц., Со—Со 2.64, Со—S 2.14 [Со3(СО)9С]2С = О, диамагн., мол. из 2-х фрагментов (стр. аналогов Co3(CO)9S), связанных СО-мост. (производное Ме2С = О) М2[Со6С(СО)15]; [Co6C(CO)12(S2)] 18)
CoS),, крист., черн., т. пл. 1116, а-, аморфн., р. в СН3СООН, ПР = 10 23, /?-, не р. в к., образ, колл, р-ры, ПР = 10 27, "джайнурит", стр. тип NiAs
CoS2)_, порошок, черн., "каттьерит", стр. тип FeS2
Co3S4, "кобальтовый колчедан", "линнеит", шпинель
CoAsS, "кобальтовый блеск", "кобальтин"; CoAs2, "смальтит"
CoAs3, "скуттерудит"; + О2 —> Со3О4
[Co(CNMe)4I2], крист., зел., в р-ре парамагн. мономер; тв. - парамагн. димер [Co(CNMe)5](C104)2, крист., гол., парамагн., неуст. (мономер); красн., диамагн.,
димер, уст., Со — Со 2.74, Со — С 1.88
[(C5H5)CoL|, L = NO, С5Н6;
(C5H5)CoL2, L = СО, PF3
[Co(NH3)6](C5H5)2
t i (-NH3)
Co(C5H5)2, кобальтоцен, крист., фиол., окисл. на возд., парамагн., (1 неспаренный эл.), стр. аналог ферроцена, Со—С 2.10 15) [Со(С6Ме6)2]Х2
92
4+ (rf5) 5+(rf4)
(Co(OH)2)
Jl2C1 ; H2°2<OH )
’ ’ “ C0O2 • лН2СЦ, черн. С <~'°з(~>4
X О,
________________________ Кобальтаты (IV) 3) KfjCojC^; LigCoOg М4С0О4, М = Li-Cs Ва2Со04; ВаСоОз, крист., красно-кор., анион - тетраэдр, Со—О х 1.8 (М1) или цепи окт. с общ. гранями, Со —Со 2.38, Со—О 1.87
(3.3-3.5) +
КхСо02, х = 0.5-0.67, "бронзы" 14)
Кобальтат (V)(?) К3С0О4, крист., сине-черн.
K3CoF7; Cs2CoF6, крист., желто-кор., анион - окт., цэфф = 2.9 (?), стр. типа K2PtCl6
3 +
[Co(NH3)2r2], а-, тетраэдрическая мол.; Р-, в стр. -цепь окт.
Амминокомплексы Со
Диаммины
[Co(NH3)2(N02)4r, транс-
Моноаммины [Co(NH3)(CN)5]2-
93
НИКЕЛЬ
Ионы Ni в водном растворе см. с. 96
3d
45
4р
4d Э’°
"Т 1-8
2 + (d8)
Ni, мет., блестящий, бел., d = 8.9, т. пл. 1455, т. к. х 2900, акт. < Fe и Со; р. в к. (пассивируется конц. HNO3) и [NH4OH + (NH4)2CO3]; ^°Ni2+/Ni = —0-25; ферромагн. (< 358°); а-, гексаг. пл. упак., а = 2.65, с = 4.32, Ni—Ni 2.48
Ni2H, стр. тип azzmw-CdI2 13)
о2(0
Н2(400°); С
Nij_xO, крист., черно-зел., т. пл. 1990, АЯ = —239, р. в к., "бунзенит", искаж. стр. тип NaCl, Ni—О 2.10
Ni(OH)2i, яблочно-зел., р. в к. и NH4OH; не р.
в конц. щ., ПР = 10 17, стр. тип Cdl2, Ni—О 2.11
HNi(N2)(PR3)2
H2Ni(CO)6, M2[Ni2(CO)6]
/?-, куб. пл. упак., а = 3.52 (уст. при 20°) "Скелетный Ni Ренея", порошок, черн., содержит р. Н2, к-p гидрирования
| конц. NaOH [—NaAl(OH)4] Сплав Ni-Al
Ni-сплавы: содержание 4-5% Ni повышает антикоррозионные св-ва сталей; "инвар" (36% Ni + 0.2% С + 64% Fe) имеет минимальный коэффициент линейного расширения; "магнитный сплав" содержит 11-14% А1, 22-34% Ni, остальное - Fe
O(rf10)
Ni(CO)4, ж., бц., яд, т. пл. —19, т. к. 43, разл. 180, АН = —146, взр. на возд., р. в орг. р-рителях, не р. в к. и щ.; диамагн., мол. -тетраэдр (sp3), Ni — С 1.84, Ni—О 1.15
[Ni(CO)„(PPh3)4_„], крист., св.-желт., мол. -тетраэдр 6)
[Ni(CO)„(PF3)4_„], мол. - тетраэдр., Ni—Р 2.10
[Ni(CO)(C = N—Ме)3]
[Ni(CO)(N = C—N = R2)]2, крист., оранж., неустойчивы на возд.
[Ni(PX3)4], X = F (ж., бц., т. пл. —55, т. к. 71), I Н, Cl, R, OR, OCN, мол. - тетраэдр —
[Ni(PR3)3(N2)] +
[Ni(PPh3)2(O2)]; + Н2О Н2О2 +...
Ni(PPh3)2(C2H4), мол. почти плоская,
Ni—Р 2.20, Ni—С 2.00, С—С 1.46,
ZPNiP 112, ZCNiC 43
[Ni(3R3)4], Э = As, Sb; [Ni(PR3)]2(M-CS2)2 «
сЯ-
Q Ni(acac)2
NiSJ., крист., черн., т. пл. 797, "желт. Ni-колчедан" ("миллерит"), а-, стр. тип NiAs, р. в к., ПР= 10 21 Р-, не р. в к., образ,
колл, р-ры, ПР= 10 26
Ni3S4, "полидимит"; Ni3S2, "хизлевудит" (Ni,Fe)9S8, "пентландит", в стр. - тетраэдры [MS4] с общ. ребрами
NiS2, "ваэсит", стр. тип FeS2 ("пирита")
Ni3N; Ni3N2, разл. 585'
NiAs, "красн. Ni-колчедан' ("никелин"), т. пл. 968, в стр. - ат. Ni - в узлах "двухэтажной" гексаг. ячейки, атомы As - в центрах триг. призм, по 3 в каждом "этаже", окт. [NiAs(>] и [AsNi6] NiSb, "брейтгауптит"
Ni
2
О
£
Ni3C, образ, при 900-2100°, пирофорен;
—Ni + С
Ni(CO)2(C5H5); 13°°( С°^ Ni3(CO)2(C5H5)3
H2[Ni3(CO)8], крист., темно-красн.
Li2[Ni3(CO)8]
M2[Ni3(CO)8]2, М = К, NH4, анион - триг. антипризма из 2-х плоских тр-ков (кластеров), Ni—Ni 2.38 (в плоскости), 2.77 (между плоскостями) 4
[Ni(C = N—R)4], крист., желт., гидрофобны,
уст. >Ni(CO)4; [Ni(CNR)3(O2)]
Ni4(CNR)„, п = 6, 7
[NiPy3(SO2)°], разл. 150, не окисл. 12)
[NiDipy2], крист., син., пирофорны Ni(C5H6)2, дициклопентадиенникель (0)
K„[Ni(CN)„(CO)4_„]
12)
H2Ni4(CO)9, крист., черно-фиол., К2 = 10 10
M2[Ni4(CO)9], М = Na, К, Mg/2, Cd/2, [Ni(NH3)2]/2, оч.
чувствительны к окисл., в анионе - тетраэдр [Ni4], 6 СО-мост., вдоль ребер, у 3 ат. Ni по 1 СО-конц., а у IV - свободная пара эл.
K4[Ni(CN)4], крист., желт., разл. на возд.; анион-тетраэдр (sp3); + Н2О —> K4[Ni2(CN)6] + Н2 + + KCN + КОН; HNi(PR3)3(CN)
K4|Ni(C = CH)4|. оч. неустойчиво
Li3NiPh3 3Thf
М2(СО)6(Р2СЦ), крист., желт., разл. 0
(СО)зМ(РЬ2Р—PPh2)Ni(CO)3 (PR3)2Ni(N2)Ni(PR3)2
M2Ni5(CO)12; M2Ni6(CO)12
M2Ni9(CO)18
M„H4_„Ni12(CO)21, n = 2, 3 10)
Ni4(CO)12(P4O6)
M2[Ni8(CO)16C]; M2[Ni9(CO)17C]
M2[Ni10(CO)16(C2)2]; M4|Ni|6(CO)23(C2)2| п>
Ni(ClO4)2, в стр. - окт., Ni—О 2.04; • иН2О, п = 4, 6, крист., сине-зел., т. пл. 149; • 6NH3 23)
Ni(ClO3)2 6Н2О, зел., разл. 80
Ni(IO3)2i. иглы, желт.; • 4Н2О; NiH3IO6 • 6Н2О 23)
NiSO4, крист., желт., разл. 640 3); • 7Н2О, "зел. купорос" ("мореназит");
• 6Н2О, крист., гол. или зел., "ретгерсит";
• M2SO4 • 6Н2О (соли Туттона) = M2[Ni(H2O)g](SO4)2 27); NiS2O3 • 6Н2О 7) NiSO3 6Н2ОФ: NiSeO4 6Н2О; NiSeO3 2Н2О, зел. или роз., "альфельдит" Ni(NO3)2, крист., св.-зел., разл. вак. 220, нелетучи; • 6Н2О, т. пл. 57, разл. 105
Ni(NO2)2, крист., св.-зел., разл. 220
NiHPO4 иН2О, п = 3, 3/2; Ni3(HP2O7)2 10Н2О; Ni(H3P2O7)2 2Н2О 25) Ni3(PO4)2 7 H2Oi, крист., зел.; Ni2P2O7 6 Н2ОФ. зел.; Ni(H2PO2)2 6Н2О Ni3(AsO4)2j_, желт., аморфн., "ксантосит", • 8Н2О, "аннабергит"
NiCO3)_, крист., желт, или зел., изостр. СаСО3 • 6Н2О)_, "хельерит'
I НСО3
3Ni(OH)2 2NiCO3 4Н2ОФ
Ni(CH3COO)2; 4H2O, крист., зел., в р-ре сильно гидрол., К2 = 10 3 26)
NiC2O4 2H2Oi, -U Ni + 2СО2; Ni(HCOO)2 2Н2О
NiSiF6 • 6Н2О, крист., зел., хор. р. в Н2О
Ni(CO)(CN)
[Ni(NO)(NO2)U, крист., гол., разл. 90, р.
в СНС13
[Ni(NO)(— PPh2)]4
[Ni(NO)F]4, Г = C1-I, крист., черно-зел., медл. гидрол., мол. - тетраэдр [Ni4], Г - в центрах граней
[Ni(NO)(PR3)I]2, диамагн.
[МГ(РРЙ3)2]2, Г = C1-I
[Ni(PR3)4][BPh4], катион - тетраэдр
NiX и Am, X = ВН4, BF4, PF6, Am = Dipy, Phen
[Ni(M-PR2)(CO2)]2
(NiCN)„l, оранж.
14)
Zn + 1450
K3[Ni(NO)2(S2O3)2], крист., син., р. в Н2О
K(,|Ni2(C = CH)8|. диамагн.
K3[Ni(CN)4], крист., красн., гигр., пара- г магн. (1 неспаренный эл.), оч. реакц.;
. _ + Н2О + О2 —> K2[Ni(CN)4] + КОН M4[Ni2(CN)6], крист., красн., уст. в р-ре при pH > 7, диамагн., кластер, Ni—Ni 2.3 2)
K4[Ni2(CN)6(CO)2], крист., желт., уст. при pH >7; + Н+ —> K2[Ni(CN)4] + + Ni(CO)4 + Н2
K4|Ni2(CN)6(NO)2|, крист., оранж., диамагн.
Л’-'
Ni(OH)Cl, стр. тип Cdl2; МГ2 • 3Ni(OH)2, Г = С1, Вг
т. пл. т. возг. АН • иН2О, п =
NiF2)_, крист., желт. 1160 — -657 3, 4, 6, зел.
NiCl2, крист., желт. 1001 970 -305 4, 6 (= mpawc-[NiCl2(H2O)4] • 2 Н2О)
NiBr2, крист., кор. 963 — -211 6(= [NiBr2(H2O)4] • 2Н2О)
Nil2, крист., черно-зел. 797 970 -96 6
Стр. NiF2 типа рутила (TiO2); Nir2 (Г = Cl—I) - типа CdCl2 в г. - NiF2 - линейная мол.
[Nir2(PR3)2], Г = Cl, Br, I; NiCl2 6H2O Dipy3, цэфф = 2.88 NiI2(PR3)3, мол. - триг. бипир., Ni—I 2.66, Ni—P 2.17 8) NiCl2(NO)°, порошок., зел., разл. 150, парамагн., 2 неспаренных эл. "NiI2-3MeCN" = [Ni(MeCN)6][NiI4]
Ni(CN)2, крист., желт., |||
420° N
Ni + N2 + С (взр.), в стр. - плоские слои:
4H2Oi, крист., зел.
C
-Ni—N=C—Ni—С=
N
C
С
N
—Ni—№C—Ni—СШ
C
N
Ni(OR)2, св.-зел. (R = Me), фиол. (Et-z-Pr), не р. в орг. р-рителях, нелетучи 28)
H3N
Ni
NH3 + C6H§
Ni(CN)2 • NH3 • С6Н6, клатратное соединение включения
CN
Ni(NCS)2 0.5 Н2О, крист., желт.; Ni(NCO)2 Н2О 17)
I KNH2 (ж. NH3)
Ni(NH2)2, красн., не р. в ж. NH3; разл. 120; + Н2О —► NH3 + Ni(OH)2
Ni[— ONC(CH3) — C(CH3)NOH]2 j, диметилглиоксимат, крист., красн., осаждаются из аммиачных или слабокислых р-ров Ni2+ (р-ция Чугаева), в стр. - столбики из плоских мол.
2.44
Ni(C5H5)2, никелецен, крист., ярко-зел., разл. 173, уст. на возд., парамагн. (2 неспаренных эл.), стр. аналог ферроцена, Ni — С 2.11 [Ni2(C5H5)3]+BF4, катион - трехпалубный сэндвич 17)
94
3+ (<Z7)
4+ (rf6)
6+ (<Z4)
95
ИОНЫ ЖЕЛЕЗА, КОБАЛЬТА И НИКЕЛЯ В ВОДНОМ РАСТВОРЕ
О 1+ 2 + 3+ 6+ О
2 +
3 +
4 +
[Fe(NH3)4]2 + , Куст = 104
[Fe(NCS)]2+, Куст = 102 3)
юГ
96
ИОНЫ РУТЕНИЯ И ОСМИЯ В ВОДНОМ РАСТВОРЕ
О 2 + 3+ 4 +
Ru
6+
8 +
O>
Ve • —
Osj., чернь
97
РУТЕНИИ
Ионы Ru в водном растворе см. с. 97
1 +(</7)
2+ (d6)
3 + (rf5)
K[RuH„(PR3)2], п = 3, 5 п
H2Ru(CO)(PR3)2 2)
H2Ru(N2)(PPh3)3
H2Ru(PPh3)4
H4Ru(PPh3)3
HRu(HCOO)(PPh3)3 2)
M2[Ru3(CO)n] MHRu3(CO)h HRu3(CO)10(NO) 36)
M2Ru4(CO)12 2)
M6Ru4(CO)11
M4Ru4(CO)12 H4Ru4(CO)„(PR3)12_
M2Ru4(CO)13, тетраэдрические кластеры [Ru4], Ru—Ru ~2.8
СО(180°, 2- 107 Па)
С<5 .
[Ru(NO)5], крист., красн. [Ru(NO)2(PR3)2] [Ru(PX3)5], X = F, OR Ru(NO) + C1(PR3)2
0(</8)
О
[RuDipy3]
Ru(CO)4
[Ru3(CO)i2, (раньше "Ru2(CO)9"), иглы, оранж., (CO)4Ru------------;Ru(CO)4
Ru3C(CO)12 5) [Ru5C(CO)15], стр. аналог [Fe5C(CO)15] 22)
(NH4)2Ru(SO4)2 6H2O, аналог соли Мора, Ru—0 2.12 23)
Ru2(RCOO)4; [Ru(RCOO)2(CO)(PR3)2] 23)
Ru, мет., серебристо-бел., тв., хрупкий, d = 12.6, т. пл. 2607, т. к. 4900, уст. к коррозии, р. в (НС1 + О2), (МОН + MNO3), М2О2 (/); гексаг. пл. упак., а = 2.70, с = 4.28, Ru—Ru 2.67 ' ‘ Перекристаллизация из Sn-распл.
черн. аморфный порошок, р. в (H2SO4 + МВгО3)
Ru(CO)5, ж., бц., т. пл. —22, р. в орг. р-рителях, мол. -триг. бипир. (dsp3);
АЯ = -1054
(OC)4Ru[Mn(CO)5]2 3)
Ru(CO)4(PR3)3
[Ru(CO)3(PR3)2]
[Ru(CO)2(PR3)3]
[Ru(CO)2(CS2)(PR3)2]
[Ru(CO)ClH(PR3)3]
[Ru(O2)(CO)2(PR3)2]
[Ru(O2)(CO)(PR3)2(CNR)] 16)
I rch2oh
[RuII(RCOO)(CO)(PR3)2(HCNR)]
н2
Ru(OH)4, кор.
Н2О|-Н2)
RuS2
Rul3 +.
EtOH + КОН
НС1------
Ru(CO)Br, крист., бц. Ru(CO)2(C5H5), крист., оранж., т. пл. 185
Ru(NO)+(OH)3 2Н2Оф. кор.
35)
Ru(OH)3 vH2(\. кор., р. в к.; 100° Ru + RuO2 + Н2О; 32) + О2 —> RuO2 • х Н2ОJ,
возг., разл. 150, мол. тр-к,
Ru—Ru 2.85,
Ru—C 1.93 (экв.), 1.89 (акс.),
С—О 1.14
Ru3(CO)„(PR3)12
i)
Ru(CO)2
СО
|(п“3)“, X = Cl, NO3, п = 0-5
K2[Ru(NO)+X5], X = F-I, CN K2[Ru(NO) + Cl5_2„(C2O4)„] /npa«c-M2[Ru(NO)+ (OH)(NO2)4] M2[Ru(NO)+F5] H2O
[Ru(NO)+X„(H2O)5_„f [Ru(NO)+(NH3)5]C13 H2O [Ru(NO)+(NH3)4X]F2, X = Г, OH [Ru(NO)+(NH3)2Cl3]-^Mc
[Ru(NO) + Cl3(PPh3)2]
красно-оранж., диамагн., окт. комплексы, оч. уст., гр. [Ru = N+ =О] -линейна, Ru—N 1.7-1.8, N—О 1.15, v[n = O]+ 1800-1935 см 1
[Ru(SO4)(SO2)°(PR3)2]2 PhMe, мол. - окт.
RuCl2(., крист., кор., не p. в к. и щ., стр. тип CdCl2;
• 2.5 PR3 = [Ru2C14(PR3)5], диамагн., мол. - 2 окт. [RuP3C13/2] и [RuP2C1C13/2], Ru—Cl 2.40 (конц.), 2.43—2.53 (мост.);
• 3PPh3 = [RuCl2(PPh3)3]-/npa//c, мол. - тетраг. пирамида, Ru—С1 2.39 6); 4PPh3 = [RuC12(PR3)4], окт.
• 3PEt2Ph = [Ru2CI3(PR3)(>]_[RuCI3(PR3)3] , катион - 2 окт.
с 3 Cl-мост., Ru—Cl 2.45-2.49
RuCl2(AsPh3)3; + О2 [RuCl2(AsPh3)3(O2)],
т. пл. 300 с разл., парамагн., Vq__q 880 см 1
[Ru(CO)Cl2(PR3)3]
Ru(CO)2r2, Г = Cl (крист., желт.), Вг (оранж., возг. 220),
’ I (оранж., разл. 200)
[Ru(CO)3Cl2]2 39)
[Ru(CO)2C12(PR3)2], цис- и транс-
[Ru(CO)2I2Py2], крист., оранж., диамагн.
[Ru(CO)3Br2|2, мол. - 2 окт. [Ru(CO)3BrBr2/2], Ru—Вг 2.54(конц.), 2.57(мост.), Ru—С 1.90-1.97 W-[Ru(CO)4I2], Ru—С 2.01, Ru—I 2.72, С—О 1.04
HC1 + HNO3; NO
M4[Ru(NO2)6],
в анионе - окт. [RuN6], Ru—N 2.05-2.10 19)
/§
PR3
/8
I
Cs2[Rur4(O2)] 15)
K2[Ru(CO)2I2(CN)2]
H4[Ru(CN)6] M4[Ru(CN)6] иН2О, крист., бц., изостр. M4[Fe(CN)6] • иН2О Fe4n[Ru(CN)6]3, изостр. пруссеновской лазури, полупроводники 1 )
’2
ОН“
[Ru3IIinO(CH3COO)6 (H2O)3]„, стр. аналоги ацетатов
Cr(III) и Fe(III) [Ru2(RCOO)4]+r , крист., парамагн., в стр. - цепи димерных мол. [аналогов Cu(RCOO)2], связанных Г-мост.,
Ru—Ru 2.28, Ru—Cl 2.59 17)
Ru(NO3)3 6Н2О, крист., желт. [Ru3O(CH3COO)6] + X , X = Cl, сн3соо 17-23)
Ru—Г
1.98
АН
Ru2IIinCl5(PBu3)4, парамагн. (1 неспаренный эл.), мол. - 2 окт. с общ. гранью [RuP2C1C13/2], Ru—Cl 2.3 (конц.), 2.4 (мост.), Ru—Ru 3.11
M6Ru6(CO)16 37)
M4Ru6(CO)17
MHRu6(CO)18
H2Ru6(CO)18 окт. кластер [Ru6], Ru—Ru 2.87
M2[Ru10H2(CO)25] M3[RunH(CO)27]
hv-B
i)
[КиССОШ,
в стр. - цепи из плоских мол.
[RuClH(PPh3)3] , мол. — искаж. триг. бипир., 2 гр. PR3 — акс.
[Ru(CH3COO)H(PPh3)]3,
мол. — искаж. окт.
(СН3СОО - бидентатна)
(CO)3Ru
(CO)3Ru
Ru(CO)2
Ruf CO)з
Ru(CO)3 RueC*(CO)i7, крист., красн. H2Ru6C(CO)16 M2[Ru6C(CO)16], окт. кластеры, Ru—Ru 2.90, в центре - С*, Ru—С* 2.05, к. ч. Ru 8 22)
RuF3j_, крист., кор., гигр., стр. близка ReO3
RuCl3, а-, чешуйки, черн., не р. в Н2О, си., стр. тип FeCl3 | 450° (С12)
Р-, порошок, кор., р. В СП., окисляется на возд., в стр. -цепи окт. с общими гранями;
Н2О
RuBr3, крист., темно-зел., в стр. - цепи окт. [RuBr6/2], Ru—Ru 2.73 и 3.12
Rul3i, крист., черн., разл. 300
2.40
2.30
-204
(R4N)2(H7O3)2|Ru3Cll2|.
крист., зел., анион - цепь из 3-х окт. с общ.
гранями, Ru—Ru 2.80 20)
Ru(BF4)2 6 Н2О N2(10 Па)> {[(H2O)5Ru]2N2}(BF4)4, крист., кор.
RuS2, RuSe2, RuTe2, стр. тип пирита
[Ru(NH3)6]Cl2, крист., оранж.
[RuDipy3]Cl2, крист., красн., разл. 300, хим. инертны
[Ru(NH3)5(N2)]X2, X = Cl-I, BF
PF6, N—N 1.12 7)
[(NH3)5Ru—(N = N)—Ru(NH3)5 ]BF4,
линейный катион, N—N 1.25, Ru—NH3 2.12, Ru—N 1.93 3)
транс- [Ru(NH3)4(L2)]Cl2, l = n2, o2 m/?aHC-[Ru(NH3)4(:SO2)0L]X„, L = H2O, Г, катион - окт., Ru—N 2.17, Ru—Cl 2.41, Ru—S 2.07, S —О 1.39 и 1.46
[Ru(NH3)4(HSO3)(H2O)] + транс-[Ru(NH3)4(SO3)(H2O)] 18)
H
[Ru(PR3)2(O2)°(NO)X2], X = Cl, ОН, CN, NCS, к-p окисления PR3 14)
Ru(C5H5)2, рутеноцен, крист., желт.,
т. пл. 196, возг., не pear, с к. и щ.,
мол. - триг. призма (ср. ферроцен), Ru—С 2.21
NO + НС1; N2H4; Mg; [Hf]; RNHNH2
[Ru(NH3)6]r3
[Ru(NH3)5X]F„,
X = Г, ОН, Н2О
[Ru(Dipy)3]X3
[Ru(Dipy)2Cl2]Cr
[Ru(Dipy)2(H2O)(OH)]X2
[Ru(NH3)4r2]r
[Ru(NH3)3r3], Ru—N 2.09,
Ru—О 2.01
[Rur3(PR3)3]
Na4[Ru(NH3)2(SO3)2(HSO3)2] 6H2O
2.46
2.52
-180
-158
крист., бц.
или св.-желт.
23)
{[(NH3)5Ruin]2(M-O)}X4 ^4 {[(NH3)5Ruiii iv]2(M-O)}X5 34)
33)
[(NH3)5Ruiii(S2)-Ruii(NH3)5]X4
[(NH3)5Ruin—L—Run(NH3)5]X5
Z К
Q
Z
К
[(NH3)5Ruin—O—Ruiv(NH3)4—O —Ruin(NH3)5]Cl6 3H2O, "рутениевая красная" (краска), диамагн., в катионе -линейная гр. [Ru—О — Ru—О — Ru], Ru—О 1.87;
—Н2О, р. в NH4OH, индикатор окисл.-восст.
титрования 34)
98
4 + (<Z4)
5+ (rf3)
6 + (rf2)
7 + (</’)
8 + (</")
02(700°); Оз (20°); NO2(275°)
Ruts: Д
RuO2, порошок, черн., нелетучий, 1300° г, ,, /л
не р. в к. и щ., ---> Ru + RuO4
I 960° (вак.)
крист., спи., d = 6.97, АН = —302, стр.
тип рутила, Ru—О 1.94-1,98_____________
RuO2 • х Н2О , черн., р. в к.
—Ог, взр. (108°, hv-B)
H2
RuO4, крист., яд, с запахом О3, уст. > 1000°, АЯ = -239, хор. р. в Н2О, СС14, взр. с орг. в-вами (хранят адсорбированным на А12Оз), диамагн., а-, желт., т. пл 25, т. возг 27, d = 3.29
^20)
/?-, кор., т. пл 27, возг., мол. - тетраэдр, Ru—О 1.71 26)
(3.75-3.97) + Na3_xRu4O9, 0 л0.9, "бронзы", крист., с гол. мет. блеском, в стр. - каркас окт. [RuO6], Ru—О 1.98, Ru—Ru 2.83
KRu4O8, крист., черн., разл. 1100, не р. в ц. в. П)
О
Д
Д
Cs2[Ru2(SO4)4(H2O)2] 32)
Mii[Ru2O(OCOCH3)6(H2O)3] K3[Ru(C2O4)3] 4.5 Н2О
H[Ru(C2O4)2] 2.5 Н2О, крист., зел., анион - окт., Ru—О 2.02 31)
K3[RuF6] M4[RuCl7]
M2[RuC15]
M3[RuCl6], Ru—Cl 2.37 z/z/c-M2|RuCI4(H2O)2| H2O, Ru—Cl 2.35 (цис-), 2.32 (транс-), Ru—H2O 2.12 M2[RuCl5(H2O)], M = K-Cs, крист., темно-красн., Ru—Cl 2.34, Ru—H2O 2.10 M2[RuBr5(H2O)|; M3Ru2Br9 28)
RuF4, крист., желт., гигр.; >280°
+ SiO2 -----> SiF4
"Ru(OH)Cl3", крист., красно-кор.
(содержат RUCI3 и [Ru*n’IV(OH)m(H2O)xCy)
RuCI4 5H2O, крист., / красн., гигр., разл. 100
EtOH
K2[Ru(C2O4)3], крист., черн.
MOC1
С\г
K4[Cl5Ru—О — RuCl5] H2O, крист., кор., диамагн., Ru—О 1.80, ZRuORu 180
Cs4[Ru2OBr10]
/32О
"4(0
i2(-if5)
О-Кг)
RuO(SO4)2, крист., кор., разл. 150;
+ Н2О —> RuO2 + ...
RuOF4, крист., бц, т. пл. 115 38)
[Ru(C5H5)2I]I3 10)
1 парамагн. (dy) анион M[RuF6], М = [О2],
- [Н3О], [KrF], [C1F2], Ru—F ~1.84
[KrF][Ru2Fn] 9) 4
Рутенаты (IV)
M2RuO3, М = Li, Na, Ва/2, в стр. - цепи окт. [RuO(>/2] с общ. гранями, Ru—О 1.99, Ru—Ru 2.55 (!)
Na4RuO4; Na2RaiO9
Na4Ru3O8 27)
M2[RuF6], крист., желт.
или роз. (М = Ва/2, спи.), ? низкоспиновый анион M2[RuCl6], крист., красно-кор., р-ры желт., низкоспиновый анион [R4N]3[RuCl7], к. ч. Ru 7 M2[RuBr6], крист., черн.
(R4\)3|Ru( NCS)6]
K3[Ru(NCS)„(— SCN)6_„] n = 1-4 29)
K3[Ru2NC18(H2O)2], анион - 2 окт.
/мра//с-[ RuCl4(H 2O) N j /2],
Ru—N 1.72,
Ru—Cl 2.36,
Ru—H2O 2.18
О2; Fe3 + (H+); ан. окисл.
[(NH3)5Ruiv— О—Runi(NH3)4— О—Ruiv(NH3)5]X7, X = NO3, SO4/2, крист., кор., парамагн. (1 неспаренный эл.), в катионе - линейная гр. [RU3OJ
{[(Dipy)2(OH)RuIIIIV]2O}X3 34)
ан. окисл.
Naj4Ru7O24 + x, крист., черн., в стр. - кластеры [Ru7O24]13 27)
PyreHaTbi(V)
Na3RuO4, порошок, гол., р. в Н2О, изостр. Na3NbO4, анион - тетрамер из 4-х окт. с общ. ребрами; Na4Ru2O7; Sr4Ru2O9, в стр. - колонки окт. с общ.
гранями, Ru—О 1.92 8)
Рутенаты (VI) 25) M2[RuO3(OH)2], М = К (раньше "K2RuO4 Н2О"), Cs, Ва/2, крист., зел. (красн. в тонких слоях, оранж. в р-ре), анион -триг. бипир., Ru = O 1.76 (экв.), Ru — ОН 2.03 (акс.), или тетраэдр, Ru-O~ 1.76
—- [(Dipy)2(O)RuIV-O-Ruv(O)(Dipy)2]X3 34>
OC1
200'
^7
K1-F2 (HF ж0_;
/н/ш//с-М (,| RuO2( HI O(,)2|, анион - окт.,
Ru = O 1.73, Ru—0 2.01
M6[RuO2(H2TeO6)2] 30)
RuO4 • NH3, разл. —20°
RuO4 • 2 Ру, уст. при 20' n RuO4 • PF3, n = 1,2
RuO4 2 NO
H2[RuO2C14] 3H2O M2[RuO2C14], M = Rb, Cs, крист., пурп.;
+ H2O —> RuO4 + RuO2
_ в. Перрутенаты K[RuO4]
— Na[RuO4] Н2О, крист., черн. (р-ры зел.), сл. р. в Н2О;
O2 + K2RuO4 анион - тетраэдр, Ru-O 1.79
RuF8(?) 24)
M2RuF8 (?), крист., бц.
K1RuF6], крист., гол. или роз.
f KF(0 |Brl2||RulJ. окт. (d2sp\
RuF6, крист., красно-кор., т. пл. 54;
RuF5 + F2;
+ Н2О —> RuO4 +
+ RuO2 + О2 + ... 38*
[PIuAsHRuNCU], анион -тетраг. пирамида,
Ru=N 1.57, Ru—Cl 2.31,
ZNRuCl 104.6, ZCIRuCI 86.4 и 150.8
Cs2[NRuF5], Г = Cl, Br 15)
99
осмии
Ионы Os в водном растворе см. с. 97
1 +(</7)
2 + (</6)
3 + (<Z5)
5d
6s
6р
6d Э.О
OsO, порошок, черн., р. в к.
О2; NO (в недостатке)
500°
__. OsO2, крист., черно-кор. -> Os + OsO4;
AH = —260, пирофорны (—> OsO4,), p. в к., стр. ’ тип рутила, Os—О 1.96(2 связи), 2.01 (4 связи)
H2Os(CO)4, крист., бц., т. пл. 149 Na2Os(CO)4, уст. на возд. '*
H2Os(CO)(PR3)3
H2Os2(CO)8, масло, бц. '*
H2Os3(CO)10, L, L = CO, PR3 H2Os3(CO)12 M2Os3(CO)n, оранж.
HOs3(CO)n(NO), кластер - тр-к, Os—Os -2.86 2)
H4Os4(CO)12 M2H2Os4(CO)12 MHOs4(CO)13,
анион - тетраэдрический кластер,
Os—Os 2.73-2.95 2’18)
H2Os5(CO)15
M2[Os5(CO)15], кластер - триг. бипир., Os—Os 2.71-2.87 30) V
H2Os6(CO)18 M2[Os6(CO)18] окт. кластер 30)
M2Os7(CO)20 .
M2Os8(CO)22 31) N
Os, мет., бел.-гол., тв., хрупкий, самый тяжелый, d = 22.6, т. пл. 3027, т. к. — 5000, окисляется на возд., р. в HNO3, гексаг. пл. упак., а = 2.73, с = 4,32, Os—Os 2,70
О (</8)
Os(CO)5, ж., бц., т. пл. —15, мол. - триг. бипир.
АЯ = -1033 5)
[Os(CO)3(PPh3)2], триг. бипир.
Os(CO)2(PR3)3
Os(CO)2(PR3)2(O2) 5) ^c-[Os(PR3)3H(CO)F], крист., бц., мол. - окт., Os—Р 2.34 и 2.56 (транс- к Н)
Os(PF3)5, крист., бц.
[Os(NH3)6], крист., кор., разл. 25
[Os(NH3)5(C6H6)|
[OsDipy3] 5)
Os2(CO)9, крист., оранж., т. пл. 64, разл. 20, в мол. - тр-к [Os2(CO)]
\ Os3(CO)12 (раньше ' ъ-.лттг-г
е
''Os2(CO)9"), крист., желт., т. пл 224, возг. 130, мол. - кластер [Os3], Os—Os 2.88, Os—С 1.95, С—О 1.14
Os3(CO)n Ру
Os7(CO)21, крист., оранж.,
200'
Os5(CO)„, крист., роз., п = 16-19
со (Z, р)
Os6(CO)18, крист., кор., мол. - двухшапочный
. тетраэдр [Os6]
> Os6(CO)20 4)
Os6(CO)12076-C6H6)2
Osl (?), крист., серые
[Os(NH3)6]Br, крист., желт.
[Os2(CO)8r2], Г = Br (крист., желт., возг. 100), I (крист., оранж.) Os2(CO)6(M-I)2, крист., оранж. 16)
Ог^-
н2
| —H2O(N2)
Os2O3 • х Н 2ОФ
Os(OH)4, черн.
Осматы (IV), Mn[Os(OH)6], MnOsO3, М = Са-Ва, РЬ, Cd, стр. тип. перовскита,
МО + Os + О2 6) (N2)
OsSO3)_, крист., черн.
M4[Os(SO3)3]
i^wc-[Os(NO)+(NH3)2Br2(OH)| 29)
[Os(RCOO)2(CO)(PR3)2] 17)
OsFBr 2” OsF2 + OsBr2 8) OsCI2j_, крист., кор., нелетучи, р. в сп., эф., стр. тип CdCl2
OsBr2
Osl2 (?), крист., черн.
со+нг
Os3(CO)12r2, Г = Br, I, кластер - тр-к, Os—Os -2.90 16)
Os5(CO)15C4, крист., красн. 3) [Os5(CO)15C], стр. аналог [Fe5(CO)i5C] 16)
M2[Os5(CO)14C] M2[Os10C(CO)24], анион - четырехшапочный окт.,
Os—Os 2.79-2.88 32)
Os6(M3-O)(CO)19 4)
[Os7] - одношапочный окт., Os—Os —2.83, все СО конц.
3)
[Os(CO)2(C5H5)]2, крист., желт., т. пл. 197
Os8(CO)23, оранж. 3)
Os(CO)„r2, Г = C1-I, п = 2, 3, 4 34) Os(CO)2(C5H5)Br, крист., желт., т. пл. 121 [OsF2Py4]-»ipaHc, Г = F-I 34) [OsDipy3]Cl2 • иН2О, крист., зел., оч. уст.
Нитрогенильные комплексы [Os(NH3)5(N2)]F2, крист., желт., диамагн., гидрол. медл., уст. к окисл., гр. [Os—N = N] линейна
I hno2 ^c-[Os(NH3)4(N2)2]F2 12)
[Os(NH3)4(N2)F]r [Os(PR3)3(N2)F2], крист., бц.
OsS2J., OsSe2, OsTe2, • -
крист., черн., стр. тип пирита
Os(C5H5)2, осмоцен, изостр. Ru(C5H5)2, Os—С 2.22
M2[Os(NO)+(OH)(NO2)4] (раньше "M2[Os(NO2)5]"), крист., желт.
K2[Os(NO)+F5] н2о (NO)2[Os(NO) + C15] (PR4)[Os(NO) + C14], гр. [Os(NO)] - линейна, Os—N 1.68,
Os—Г 1.95(F), 2.35 (Cl) 29)
со
.___KNO2 (изб.)
Os(SO3F)3, крист., зел., а-, /?-, т. пл. 30 и 140 [OsCl(CH3COO)2]2 28)
OsCl3, крист., кор., гигр., возг. 350, р. в Н2О, сп.; • ЗН2О, крист., темно-зел.
mer-[OsCl3Py3],
Os—N 2.09, Os—Cl 2.36 28) 325°
Osl3 Os + I2
M[Os(NO)+F5] 33)
(NH4)2[OsCl5] 1.5 Н2О
K3[OsCl6] ЗН2О, крист., красн.
M3[OsBr6|; Cs3Os2Br9
M2[Os2Br8], в анионе -
Os = Os
M2[Os4I14], анион - 2 гр.
[Os2Ig] с общ. ребром 28)
M2[OsF4(CO)2] П)
M[OsCl3(CO)3]
H4[Os(CN)6], крист., бц., р. в Н2О и сп. K4[Os(CN)6] ЗН2О, крист., бц., диамагн., изостр. K4[Fe(CN)6] FeYI[Os(CN)6]3, полупроводник, изостр.
Fe4n [Fen(CN)6] П)
H2S
Os(CO)2Br3, крист., желт.
K2[Os(CO)Cl5] Н2О П)
Os2OCl6
Os2OBr3 (ранее
"OsBr3") 27)
(OsF6)
-о>>
OsF4, крист., желт.Д т. пл 230, возг.; -2PF3
OsCU, иглы, кор., возг. 650, АН = —255, р. в к.-окисл.;
-U OsCl3
OsBr4j_, крист., черн., в стр. - цепи окт., Os—Вг 2.39-2.57;
-U OsBr4 „ 27)
(OsO4)
[OsDipy3]Cl3 [Os(NH3)6]F3, крист., бц.
[Os(NH3)5Br]Br2, крист., роз.
[Os(NH3)3(PR3)2C13]
[Os(PR3)r3]
ф
M2[Os(NH3)C15]
K8[Os2O2(SO4)6], диамагн., Os—Os 2.45 33)
M8[Os(SO3)6], крист., бц.
M6[Os(SO3)5(H2O)], крист., бц.
M6[Os(SO3)4X2],
X = Cl (желт.), ОН (фиол.)
— M4|F5Os O OsF5| Н2О, Г = С1, Вт (ср. Ru) 33)
(NH4)2[Os(OH)Cl5], крист., кор.
M2[OsF6], m = h, nh4,
Na—Cs, Ва/2, крист., бц., не гидрол.
M2[OsCl6], М = Н, Na (• 2 Н2О), Кф, NH4, крист., оранж. или кор. (р-ры - оранж. или зел.), низкоспиновые комплексы, стр.
тип K2[PtCl6], Os —Cl 2.36
(R4N)2[Os2C1101, анион - 2 окт.
/ с общ. ребром, Os—Cl 2.31 и 2.41 24)
' M2[OsBr6], М = Н, К, крист., кор. (р-ры пурп.), Os — Вг 2.51 M2[OsI6], крист., черн.
H2[OsI6] 2Н2О;
[R4As]2[OsCl5(NCS)| [R4As]2[OsC15(SCN)],
ZOsNC 166, ZOsSC 110,
Os—N 2.42, Os—S 2.37,
Os—Cl 2.32-2.35
[R4As]2[OsC12(NCS)2(SCN)2] [R4As]2[OsIC13(NCS)2] 35)
100
5 + (rf3)
6 + (rf2)
7 + (</’)
8+ (</“)
Os; орг. в-ва; H2(20°)
ВС13 (-196—20 )
101
РОДИИ
1 +(</8)
2 + (rf7)
4^7 55 Sp Sd Э»О»
Rh° |U|n|U| ИИ Ш I I I I ГТТ 1-5
Rh2O (?)
(-O2)
RhO (?) «.___________________________
1100°; H2
M[Rh(CO)4]
HRh(CO)4, крист., св.-желт., т. пл. —10 с разл., мол. -тетраэдр
Na[Rh(CO)2(PPh3)2] «
HRh(CO)(PR3)3
+o.
HRh(PF3)4, ж., бц., т. пл. -40, т. к. 90 с разл., мало р. в Н2О, р. в орг. р-рителях; мол -тетраэдр, Rh—Р 2.34, 2.39;
0.5С6Н6
K[Rh(PF3)4], крист., бц., уст. на возд.
HRh(PR3)4; H2RhCl(PR3)2
Rh(NO)+(PPh3)3 " [HRh(N2)(PR3)2] «
Rh, мет., бел., ковкий, d = 12.44, т. пл. 1963, т. к. ~3700, коррозионно-уст. > Pt, медленно р. в конц. H2SO4, (НВг + NaClO)(Z), не р. в ц. в.; парамагн.
Куб. пл. упак., а = 3.79, Rh—Rh 2.68
| распыление Rh-чернь, р. в к.-окисл., активнейший к-р гидрирования
[Rh(NH3)3Cl3];
[Rh(NH3)5Cl]Cl2
о (<C)
M[Rh5(CO)15], мол - триг. бипир.
i)
M2[Rh6(CO)15]
M4[Rh6(CO)14] 2)
оле"'1-
Rh(OH)4
СИН., сильн. восст.
|Rh2(H-SO4)2Py(,| • иН2О, п = 3, 6 [Rh2(M-H2PO4)4(H2O)2], кластеры, Rh—Rh 2.5-2.6 17)
[Rh(NO3)(PPh3)3]ClO4 29)
Rh2SO4 19), иН2О, п = 4, 12, 15
M4[Rh2(SO4)4(H2O)2] иН2О,
M = Na-Cs, [H3O], зел.,
Rh—Rh 2.45, все [SO4] - мост. 17)
Na2[Rh(SO3)2] 2H2O
M4[Rh2(CO3)4] иН2О,
M = Na, К (и = 2.5), Cs(/7 = 6.3; 7.5);
NH4 (n = 4.5), Ba/2, диамагн. кластеры 16)
[Me4N]3[Rh7(CO)16], кластер [Rh7] - одношапочный окт., Rh—Rh 2.71-2.88, Rh—С 1.86 (конц.), 2.01-2.48 (мост.) 8)
\Я
M3Rh9(CO)l3| 8)
M3[Rh11(CO)23] 8)
M2[Rh12(CO)30], анион - 2 гр.
[Rh6(CO)i5] [стр. аналоги Rh6(CO)ig] связаны 2 СО-мост., Rh—Rh 2.82, Rh—С 1.88 (конц.) и 2.00 (мост.) 8)
M2[H3Rh13(CO)24]
M4[Rh14(CO)„], n = 25, 26
M3[Rh15(CO)27]
M3[Rh17(CO)30] [R4N]4[Rh22(CO)37], анионы - кластеры, Rh—Rh 2.69-2.90 2’23)
Rh2(CO)8, крист., оранж., гигр., т. пл. 76 с разл. 12) [Rh2(PPh3)8], крист., св.-зел., диамагн.
[Rh2(PF3)8], крист., оранж., т. пл. 93
[Rh3(CO)„(PR3)3], п = 5, 7, Rh—Rh 3.12 12)
Rh4(CO)12, крист., красн., разл. 150, не pear, с Н2О, стр. аналог Co4(CO)i2, Rh—Rh «2.7, Rh—С 1.7-2.2 Rh4(CO)„(PR3)12„ 12)
Rh6(CO)16 (раньше "Rh4(CO)n"), крист., черн., разл. 220, не pear, с Н2О, мало р. в орг. р-ри-телях; мол. - окт. кластер [Rh6] (Rh—Rh 2.78), на 4-х гранях ц3-СО, в вершинах по 2 СО конц., к-ры разрыва Р—Св PR3 (—> RCHO + RCH2OH)
Rh6(CO)„Li6-„ M[Rh6(CO)15] M2[Rh6(CO)14(SCN)2] M2[Rh10S(CO)22] M3[Rh12Sb(CO)27]
2)
ад
О и
(Rh(CH3COOh)
С
M2[Rh6C(CO)„], n = 13, 15
К[ВЬ^(СО)15]
Cs2[Rh9P(CO)21], ат. C, N, P - в центрах кластеров -окт. или одношапочной антипризмы 21)
Li4RhH4
Li4RhH5 3)
[Rh(NH3)(PPh3)3]ClO4
[RhX(PPh3)3], X = Cl, NO3 29)
[RhDipy2]X, X = NO3 (парамагн. мономер),
C1O4 (диамагн. димер) -Г q2
’ 95s
^•yia)
RhCl
£/
RhCl3
?o
|Rh(RCOO)J2
(раньше "HRh'fRCOOh"), крист., зел., диамагн., стр. аналоги ацетатов Си11 и Сг11, кластер, к. ч. Rh 5
[Rh(CH3COO)2L]2, L = Н2О, ROH, PR3, NH3, Ру, крист., зел. или сии., диамагн. кластер, Rh—Rh 2.35-2.45, стр. аналоги [Cu(CH3COO)2L]2, Rh—О 1.99, Rh—Н2О 2.30
M2[Rh2(CH3COO)4r2],
Г = Cl, Br, Rh—Rh 2.47,
Rh—О 2.07,
Rh—Г 2.06 (Cl), 2.53 (Br) 27)
Qa
2.5 +
[Rh2(CH3COO)5]
4 [Rh2(CH3COO)4Cl] 22)
[RhX(CO)2]2, X = Г, NO3, SCN, SO4/2, RCOO, C5H5, крист., Г = Cl (оранж., т. пл. 123); Вг(кор., 118);
1(рубиново-красн., 114), р. в орг. р-рителях,
диамагн., мол - 2 квадрата с общ. стороной Г—Г, Rh—Rh 3.12
[RhCl(CO)L2], L = Ру, PR3, AsR3, мол. - квадрат (dsp1), к-p гидрирования
[RhCl(CO)L]2, L = C2H4, PR3, CO; Rh—Rh 2.81 9) [RhX(CO)(PR3)2], X = ОН, HCO3, обратимо
присоединяет CO2 15)
[RhCl(CS)(PPh3)2], тиокарбонил, мол. - квадрат 14)
[RhCl(NO)(AsR3)2]
[RF(NO)2]Д, Г = Cl, Br, I, крист., темно-кор.
[Rhr2(NO)(PR3)2]
RhF(PR3)2, крист., красн.,
[RhF(PR3)3], крист., красн., к-p гидрирования С = С
и С = С и синтеза альдегидов из С„Н2„. Н2 и СО
СН2
«7
/г
Rh
Cl
Cl
сн2
[RhCl(CH2 = СН2)2]2
Оксигенильные комплексы
[RhCl(PPh3)2(O2)]2, O2 присоединяется обратимо тряис-РЬСЦРССбНц^ЬЬ, L = O2 (крист., сии.), N2, P4, H2, CO, C2H4 (желт., диамагн.) 4)
RhF(PPh3)2(RNC)(O2), диамагн., O2 присоединен обратимо (R = и-СН3СбН4) или необратимо (R = mpem-Bu) 10)
{Rh(O2)[(Ph2PCH2—)2]2} + | PF6|", изостр.
Ir-комплексу, Rh—О 2.02, О—О 1.42;
O2 присоединен обратимо
P
>4Rh2OCl2(CO)3, иглы, красн., т. пл. 125
RhCl2, крист., красн., А Я = —163, окисл. возд., стр. тип CdCl2
{Rh[P(OMe)3]2} +|BPh4|. катион - угловой, ZPPhP 90, Rh—Р 2.18, в координационную сферу Rh входит Ph аниона
[Rh(CO)(PR3)4]2S; [Rh(CO)SP2], окт. и квадрат 25) (C5H5)Rh(C5H6); + Н+ Н2Т + [Rhni(C5H5)2]+
M2[Rh2r4(CO)2], сущ. в р-ре Н2О 13)
H[RhCl2(CO)(PR3)]
[R4N][Rhr2(CO)2] -цис, крист., желт.,
диамагн., уст. в р-ре НС1, анион - квадрат
\RhCl2(CO)(PR3)], крист., желт. 5)
Rh9S8 RhS2
RhSe2 RhTe2 стр. тип пирита
Rh2S5 Rh3S
Rh2Se5
Rh2Te3
Z(-S)
/° P
RhS ,Rh
'Об/ 1>
О-К^о С1
M2[HRh(CN)4(H2O)|
Rh2P, RhP2, RhP3
[RhPy6]r2, Г = Cl-I, крист., желт.
[RhPy5r]r, Г = Cl-I, крист., желт. [RhDipy2ClX]2, X = NO3, C1O4, крист., красно-фиол., диамагн.
[Rh(AsR3)4r2]; [Rh(AsR3)3r2]2
102
t, вак. (—O2)
M4[Sn(OH)6]
3 + (rf6)
Rh2O3, порошок, серый., АН = —356, не р. в к., щ., стр. тип корунда, Rh—О 2.03
RhO(OH), изостр. СгО(ОН) “ Rh(OH)3 иН2О;, п = 1, 2, 3, желт., р. в к. и конц. щ. 18)
Rh(NO3)3 )
Li2O (900°)
LiRhO2, в стр. - каркас окт., Rh—О 2.02 24)
O2 + H2O (OH , t, гидротермальный синтез)
o2 (OH )
RhO2 26)
и» RhO2 • иН2О)_, темно-зел., р. в щ., адсорбирует М(ОН),
5 + (rf4)
6 + (rf3)
Rh2(SO4)3 иН2О, п = 15 (желт.), 4 (красн.) • M2SO4 • 24Н2О, квасцы, оранж.
Rh3O(HSO4)5(SO4) 19); Rh(SO3F)3 п>
Rh2(— SO3)3 6Н2О, крист., бц.
Rh(NO3)3, крист., желт.; • 2Н2О;
ЗРу, крист., оранж.
RhPO4; RhAsO4, стр. тип рутила П) [Rh3O(CH3COO)6(H2O)3]ClO4 2Н2О, катион - стр. аналог ацетата Сг (III), Rh—Rh 3.32-3.35, Rh—О 1.92 П)
100° (-H2O)
и
RhF3i, крист., красн., не р. в к., щ., стр. близка ReO3, Rh—F 1.98
•иН2О, п = 6, 9, гидрол.
RhCl3i, крист., красн., возг. 900,
Ж Rh + С12; АН = -231, не р. в к.;
стр. слоя аналогична FeCl3
p. в воде форма
"Rh2(SO4)3 4Н2О", красн., содержит анион [Rh(SO4)„]’ M[Rh(SO4)2], М = Na-Cs, Tl, Ag M3[Rh(SO4)3|; K8H2[Rh2O(SO4)7]
K11[Rh3O(SO4)9] 11H2O
K3[Rh(— SO3)3(H2O)3]
M3[Rh(NO2)6], крист., бц., M = Li (-4H2O), Na-Cs 28)
K3[Rh(C2O4)3], крист., красн., сущ. оптические изомеры; -4.5Н2О
аморф. порошок, ](2и-3)-19)
19)
19)
&
H2o
О
Sr4RhO6; Sr2RhO4; BaRhO3, в каркасной стр. - пары окт. [РЬ2Оэ] с общ.
гранью, Rh—Rh 2.63, Rh—О 2.00 26)
Rh
'2
(700‘
0
яН2О, п = 3—4, аморфная масса, красн., тигр., р. в сп., к-p изомеризации и полимеризации С,.,Н2„
RhBr3, крист., темно-красн., АН = —209 Rhl3i, крист., черн.
M3[RhCl6], крист., диамагн.
(ср. [ColllF6]3 ’), гидрол.
M?RhF7, Мп = Pb, Sr, oKT.[RhF6] 13)
M3[RhCl6|; 12Н2О, М = Na, К, NH4, крист., красн.
K2[RhCl5(H2O)]
K3[RhCl„(NO2)6_„], п = 3 (крист., желт.), 5 (красн.)
Cs2[RhCl5(CO)|, анион сущ. в р-ре
Н2О 13)
BrF3 (300°)
Ce(NO3)4 + Cl2 + HNO3
RhF4, крист., гол. (красн.), возг. 700 (в атм. F2)
M2[RhF6], крист., желт., низкоспиновый комплекс, Rh—F 1.96 [BrF2]2[RhF6] -------
Cs2[RhCl6], крист., зел.;
+ Н2О С12
RhF5, крист., красн., изостр. (RuF5)4, Rh—F 1.99 (мост.), 1.82 (конц.) 6)
CsF (IF5)
Cs|RhF6|, крист., красно-кор., изостр. Cs[PtF6] M[RhF6], М = [О2], [KrF6] 7)
20° (-F2)
I
MRhBr4; M4RhBr7; M3Rh2Br9 M4Rh2Br10; M2[RhBr5(H2O)| 13) [R4N][RhI4(CO)|
0
2 +
Лк)
RhF6, крист., темно-красн., т. пл. 70;
+ Н2О —> о2, мол. - окт.
6 +
Rh(CN)3 • 3H2Oi, не р. в KCN -Rh(SCN)3 • 2Н2О, крист., оранж.
H2SO4
K3[Rh(CN)6], крист., бц.
K3[Rh(SCN)6], крист., красн.
[RhCl6]3-', роз., диамагн. (d6), окт. (d2sp3) ион, Куст = 1012
Ce
H2o (-Cl2)
[RhCl6]2 +, зел., " низкоспиновый (d5), окт. ион
Rh(HS)4, кор.
Rh2S3, крист., черн., не р. в ц. в., —> Rh3S4; в стр. - каркас окт.
Rh111 )
СГ
H2o
[RhCl„(H2O)6-„](n 3) , 11 = 3, 4, 5, красн. ионы
СГ
H2o
14• ——
[RhCl„(H2O)6 j(3 «)+ и = \ 2, желт, ионы
[Rh(NH3)6]X3, крист., бц. 20) [Rh(NH3)5X]F„, X = Г, ОН, Н2О, NO3, крист., желт.
[Rh(NH3)4Cl2]X, X = Г, NO3( H2O), крист., желт.
[Rh(NH3)3X3], X = Cl, NO2
[Rh(PR3)3Cl3], к-p гидрирования
[Rh(CO)2F3]2, крист., оранж., летучи
M2[Rh(NH3)3(SO3)2(SO3Na)|
K[Rh(NH3)2(NO2)4], крист., бц.
M2[Rh(NH3)X5], X = Cl (крист., красн.), NO2 (бц.)
Rhi, чернь
[Rh2(H2O)„]4+ 18)
Rh(OH)2i, син.
[Sn(OH)6]
СГ
H2O (HC1O4)
[Rh(H2O)6]3+ Жк [Rh(H2O)5(OH)]2 + , H
желт., окт., диамагн. ионы, уст. к окисл.
ОН
[Rh2(M-OH)2(H2O)8r
[Rh3(M-OH)4(H2O)10]5+ 18)
он
о2 (ОН )
Q,
Rh(OH)3H2O)_, желт.
RhO2 ин2о;, зел.
[H2RhO4] (?), фиол. р-р
[Rh(C5H5)2] + X , соли дициклопента-диенилродия (III), оч. уст., диамагн. (ср. Со111)
[Rh(NH3)5(H2O)]
|3 + , желт, ион
ОС/
н2о
[RhO4]2- (?), син. ион, изв. только в р-ре
^0/4 [Rh(NH3)6]
|3+, бц. ион
103
ИРИДИИ
2 + (<Z7)
3 + (rf6)
5d
6s
6p
6d Э.0
М[1г4(СО)пХ],
X = Cl, CN, SCN, RCOO 8)
[IrCl(X)°L2], X = Р4, N2, крист., диамагн.; + CSC12 [IrniCl3(CS)L2] + N2
IR4N]2Ir6(CO)16, крист., кор., анион - окт. кластер, Ir—Ir ~ 2.75 12)
[R4N][Ir8(CO)22]
[R4N][Ir8(CO)20] «
1г6(СО)16, крист., красн.
[Ir(CO)ClL2L2], Ц = Cl2, НС1, SO2, Н2; при Ц = SO2 мол. - тетраг. пирамида, в осн. - [1гСС1Р2]-шранс, SO2 - в вершине, 1г—S 2.49, S—О 1.46, ZOSO 114
(С5Н5)1г(С5Н6)--------
____(-HJ __
L = Ph3P, здесь и в дальнейшем
[Ir(NH3)6]X3
[Ir(NH3)5X]r„, X = Г, Н2О, NO2
[Ir(NH3)4X2]X
/и/>а7/с-| Ir Py4CI 2| Cl
[IrPy3Cl3], 2 желт, изомера
(мер- и фас-)
NH4[Ir(NH3)3(SO3)2] 25)
К[1гРу2С14], цис- и транс-
M2[Ir(NH3)Cl5], крист., темно-кор.
[Ir(PR3)3r3], крист., желт.
[1г(С5Н5)2] + Х, соли дициклопента-диенилиридия (III), оч. уст., диамагн., катион - стр. аналог Fe(C5H5)2
104
4 + (<Z5)
5 + (rf4)
6 + (rf3)
4 +
105
ПАЛЛАДИИ
2 + (<Z8)
4d
5s
Sp
5d
оЛ900р-2?’^2-
875O;H2<2°O>) + Q
Pd(OH)2 • лН2О)„ бурый, p. в к., щ. и NH4OH, сл. окисл.
________
Pd, мет., серебристо-бел., мягкий, d = 12.0, т. пл. 1554, т. к. 2940, р. в HNO3(Z), ц. в., парамагн., куб. пл. упак., а = 3.88, Pd—Pd 2.74;
р. > 1000 об. Н2 (до состава Pd3H4);
Pd +
[Н] Н+ + е
Губчатый Pd, во влажном состоянии р. 12000 об. Н2, акт. к-p гидрирования и дегидрирования
** Pd-чернь),, порошок, р. 870 об. Н2/1 об.
ОН
PdO, порошок, черн., разл. 200, АН = —121 8), р. в конц. НВг, не р. в ц. в., стр. тип PtS, Pd — О 2,01; "палладит"
K3PdH3
= K3H[PdH2] 21)
-Н2О Pd-колл., гель < > золь.;
Н2О
р. Н2 в 3-8 раз > крист. Pd
Pd(NO)Cl, крист., диамагн., кор. [Pd(NO)2Cl2]„
4qx
Pd2(CO)2Cl, крист., желт., диамагн., не р. в орг. р-рителях
С2Н4
Pd(ClO4)2 • 4H2O, крист., кор.
PdSO4-2H2O, крист., красно-кор., гигр.
Pd(SO3F)2, крист., пурп., ц = 3.39 12)
PdSeO4, крист., кор.; • (NH4)2SeO4; Pd[Pt(SO3F)6]
[Pd(NO3)2]„ <^2<~>5 • 2Н2О, призмы, желт., гигр.
[Pd(NO2)2(NH3)2], цис- и транс- 13)
[Pd4(NO2)8(PR3)4]
[Pd(CH3COO)2]3, крист., кор., р. в бзл., • 0.5С6Н6, в мол. -тр-к [Pd3], Pd—Pd 3.08-3.18, [PdO4] - квадрат, Pd—О 1.99 13)
Pd2OCl2, в стр. - ленты квадратов /?zpa//c-[PdO2/2CI2] 20) у
Палладаты (II)
M2[Pd(OH)4], крист., желт., р. в Н2О, М = Na, К, Ва/2 ( • Н2О), анион - квадрат, Pd—О « 2.02
M2PdO2, в стр. - цепи квадратов [PdO4] с общ. ребрами, диамагн.
MnPd3O4, М = Са-Ва, Cd, крист., черн., в стр. - колонки
квадратов, Pd—О 2.03, Pd—Pd «2.9
Na2Pd3O4
K6PdO4, оранж.
Nae[Pd(SO3)4] • 2Н2О, в стр. - квадраты [PdS4], Pd — S «2.33 M2[Pd(SO3)2] яН2О, квадраты - i/Mc-[PdS2/2O2/2], Pd — S 2.41, Pd—0 2.12 15)
K2[Pd(NO3)4], крист., оранж., гидрол.
M2[Pd(NO2)4], крист., желт., Ауст = Ю20 15)
M2[Pd(NO2)„Cl4_„], п = 1-3
PdF2, крист., св.-фиол., стр. тип рутила, Pd — F 2.15; АН + Н2О Pd(OH)2 + HF
PdCl2, крист., красн., гигр., т. пл. 680, возг. 600, в стр. a-PdCl2 - ленты квадратов [PdCl4/2], Pd — Cl 2.31, ft-, стр. аналог PtCl2; • 2Н2О, крист., красно-кор.
PdBr2)_, крист., кор., р. в НВг
Pdl2j_, крист., черн., разл. 350, (<—Pd2+ + I ,
качественная р-ция). В стр. PdBr2 и /?-Pd12 - гофрированные цепи квадратов, в стр. a-PdI2 - плоские цепи квадратов
-469
-163
-105
-63
CsF (SeF4)
[Pd(PPh3)2(n-CS2)|
[Pd(PR3)]„, п = 2, 3, 4, крист., желт., р. в бзл. n; + О2 [Pd(PPh3)2(O2)]
Pd[P(OPh)3]4, крист., бц., разл. 125 Pd(PF3)4, ж., бц., т. пл. —41, разл. Pd(AsR3)4, крист., бц., окисл. возд.
Pd(CNR)„, п = 2-4, крист., черн., не р. в орг. р-рителях;
+ Ру Pd/ + О2 [Pd(O2)(CNR)2]
EtOH .
[PdCl2(CO)]„, крист., желто-кор.; + Н2О —> Pd + С12 + СО
[PdCl2(3R„)]2, уст. Э = Р > As > S > Se > Те > Sb Cl Cl
/ ?&/ Pd/
ci ci
. — PdI2(CNR)2, крист., оранж.
[PdCl2(CH2 = CH2)]2
3R,
M2[Pd(C2O4)2] лН2О; H2[Pd(C2O4)2] 6Н2О, крист., желт.; в стр. -колонки квадратов, Pd—О 2.00, Pd—Pd 3.69
CsPd2F5, Rb3PdF5 (ранее "CsPdF3" и "Rb2PdF4"), оранж.; K2PdF4 5) ^-уст
H2[PdCl4], сущ. только в р-ре —
M2[PdCl4], крист., зел.-кор. (К, золотисто-желт.), анион -квадрат, Pd — Cl 2.30 ю15
K2[PdBr4], крист., красно-кор. ю13
K2[PdI4], крист., красн. ю25
[R4N]2[Pd2r6], Г = C1-I 3) —
HPdCl3(CO); M[PdCl3(CO)|
3R,
Na[Mn(CO)5]
—(-NaClT ’
SO2 (CH2C12)
K2[Pd(CN)2]
K4[Pd(CN)4], крист., желт.;
+ Н2О —> Н2/ + ...
[PR4][Pd(CN)(CO)| 7)
[Pd2(CH3COO)2(CO)2]2 2CH3COOH,
мол. - кластер, квадрат [Pd4], Pd—Pd 2.66 и 2.91 n)
[PdCl(CH2—CH—CH2)]2, хлорид л-аллилпалладия (л-аллил - бидентатный лиганд, донор 4 эл.)
3.46
СН2 1.35
сн
1.37
сн2
[Pdn(NH3)4][PdnCl4], "соль Вокелена", крист., красн., стр. аналог "соли Магнуса" [см. Pt(II)], Pd—Pd 3.25
C12
/ираис-{РйРу2[Мп(СО)5]2},
уст. на возд., р. в СНС13, СН2С12, гр. [MnPdMn] линейна 4)
Pd(CN)2j,, аморф., бел., разл. 210, АН = —348; стр. аналог
Ni(CN)2; 2PR3 13)
Pd(SCN)2, крист., красн., АН = —255
Pd(N3)2, крист., красно-кор., взр.
Pd3(PS4)2, в стр. - окт. [PdS6], Pd —S 2.34, 2.54 14)
Pd[MF6], M = Ge, Pt, крист., оранж.
K2[Pd(CN)4] • 3H2O, крист., бц., — H2O, в стр. - колонки квадратов (dsp2). Pd — С «2.0, Pd—Pd 3.74, Ауст = 1042
Ba[Pd(CN)4] • 4H2O, крист., зел., Pd —Pd 2.73
K2[Pd(SCN)4], иглы, красн., Pd — S 2.3 (в квадрате)
[Pd2(CO)2Dipy2] 4Н2О, крист., красн. 9)
[Pd3(CO)3(PPh3)| Pd(CO)3(PPh3)
Pd4(CO)5(PR3)4
Pd7(CO)7(PR3)7, одношапочный окт.,
Pd—Pd « 2.78, СО - в центрах граней.
Pd8(CO)8(PR3)7
Pd10(CO)18_„(PR3)„, п = 4, 6
| Me3NO
Pd23(CO)20(PR3)8
Pd4(SO2)3(PR3)4; Pd5(M-SO2)(M3-SO2)(PR3)5, мол. - кластеры, тетраэдр и триг. бипир. 9)
PdSi, черно-кор., АЯ = —77, не р. в НС1 и (NH4)2S; крист, синеватые, не р. в ц. в., стр. близка PtS, "брэггит" (+PtS +NiS) PdS2, крист., черн., р. в ц. в., искаж. стр. пирита
Pd[(CH3)2C2N2O2H]2i, диметилглиоксимат, желт., не р. в к., р. в щ., стр. аналог Ni-диметилглиоксимата, квадрат Pd достраивается до окт. за счет слабых связей Pd—Pd
K2lPd(N3)4]; K2[PdCl2(N3)2]
Pd2S
Pd2Se, Pd2Te, Pd9Te4 10)
Pd3As, "арсенопалладинит'
Pd3Sb, "стибиопалладинит'
PdSe; PdTe, стр. тип NiAs
PdSb
PdAs2, "сперрилит"; PdSb2, стр. тип пирита
106
"3 + " и 3 + (</7)
5 + (rf5)
Ряды транс-активности лигандов для Pd(II) и Pd(IV) аналогичны рядам Pt(II) и Pt(IV)
107
ПЛАТИНА
Sd 6л 6/? 6 б/ Э>0>
Pt° |U|U|U|U| + I Ш I I I I I I I 1-4
2 + (<Z8)
"3 + "
Q)
600°.
PtO, (?) порошок, черно-фиол., р. в ц. в., стр. тип PtS, Pt—О 2.02, р-р О2 в стр. Pt 27)
Pt, мет., серебристо-бел., не оч. тв., ковкий, d = 21.46, т. пл. 1769 22), т. к. -3900, р. в ц. в., Br2, М2О2(/).
Куб пл. упак., а = 3.92, Pt—Pt 2.78
Губчатая Pt, адсорбирует « 100 об. H2, O2 (на Pt-электродах)
Колл. Pt, к-p р-ций гидрирования, окисл., разл. Н2О2
Чернь Pt;, H2 максимально р-рим при O'
560°’
M^O2
Pt(OH2), Н2О + Pt + PtO2
Pt(OH)2 H2O. красн., p. в конц. к., щ., восст. (в сухом состоянии - черн.)
Pt3O4, искаж. стр. типа CaF2
Pt2O3, порошок, кор., p. в HC1-
| Pt2O3 • xH26T|
Платинаты (II)
Na2PtO2, порошок, серый; Pt + ...
MnPt3O4, крист., черн., разл. 800, в стр. -цепи или колонки квадратов [PtO4]
Na2[PtH4],
крист., диамагн., анион - квадрат, Pt—Н 1.64,
Na —Pt 3.12 24)
0 + (<Z10)
Pt(CO)„(PPh3)4_„, мол - тетраэдры, Pt—Р 2.35, Pt—С 1.85 5)
PtCl, крист., св.-зел.
PtBr
Pt(NO)2(PPh3)2, крист., желт., уст. на возд., т. пл. 125
Pt(NO)+(C5H5), крист., оранж., т. пл. 64
7И/>«77С-[ Н 2 Pt( Р Р113)2|, крист., бц., т. пл. 177 с разл., уст. на возд., р. в Ру, бзл., мол -квадрат, Pt—Р 2.28 /wpaHc-[H2Pt(AsR3)2] 25)
i2(-h2)
V-—CH2
Pt(PR3)„, п = 2, 3, 4, крист., желт.
(п = 3, мол. - тр-к, Pt—Р 2.26)
[Pt(PPh3)2(O2)], L, L = 1.5 С6Н6;
2СНС13; мол. плоская, О—О 1.45 и 1.50; к-p окисл. NO, NO2, PR3;
[Ptn(NO2)2(PPh3)2];
[Pt(NO3)2(PR3)2]; OPR3
[Pt(PPh3)2(n-CS2)], стр. аналог Pd-комплекса
. Pt(PPh3)3(SO2)] • 0.7 SO2, мол - тетраэдр
2 |Pt(PPh3)2(n-C2H4)|, Pt—С 2.1, Pt—P 2.27, С—C 1.43 (в C2H4 1.35)
[Pt(PPh3)2(PhC = CPh)|, С—C 1.32 Pt(Ph2PCH2—)2]2, крист., золотистые, т. пл., 255, уст. к окисл. 23)
Pt(PF3)4, ж., бц., т. пл. —15, разл. 90, диамагн., ->
мол. - тетраэдр, Pt—Р 2.23 П)
Pt[P(OR)3]4, крист., бц.; Pt(AsR3)4,
/H/4Z77c-HPtF(PR3)2, Г = Cl, Вг, крист., диамагн., р. в орг. р-рителях, мол. - квадрат, к-p гидрирования HPt(GeR3)(PR3)2; PtEn2, крист., роз.
О2(СНС13) -20°
Pt(C2H4)3; 21 > Pt(O2)(C2H4)2 (в р-ре); -----> Pt + PtO
K2|Pt( C CR)2|
M2[Pt„(CO)2„], п = 3, 6, 9, в стр. - колонки тр-ков кластеров [Pt3], с 3 СО (мост.) и 3 СО (конц.), Pt—Pt 2.66, Pt—С «1.8(конц.), 2.0(мост.)
| MCN(z)
M4[Pt19(CO)12(M-CO)10] 4)
[Pt(CO2)]„, крист., кор., неуст. на возд.
Pt3(CO)3(PPh3)4 8)
Pt3(CO)4(PR3)4
Pt4(CO)5(PPhMe2)4, мол. - кластер [Pt4], все СО-мост. - над центрами ребер, ат. Р - в вершинах
[Pt(NO3)2(PPh3)2]
[Pt(NO2)2(NH3)2|; [Pt(NH3)2(M-NO2)]„Xn [Pt2(NH3)4(M-HPO4)2]„, "синь", в стр. -линейная цепь Pt—Pt 2.65 и 2.80
[Pt(CO3)(PR3)2], мол. - квадрат, Pt—О 1.98, Pt—Р 2.24
[Pt(CH3COO)2]3
[Pt4(OAc)4En4]Cl4 • 4H2O; [Pt4] - квадрат
PtF2(?) Pt + PtF4
АЯ
-372
HC1
M6[Pt(SO3)4] лН2О; M2[Pt(SO3)2] лН2О
Na6[Pt(S2O3)4] ЮН2О, крист., желт. _________I___
M2[Pt(NO2)4] 2Н2О — —--------------------
K^PHNO^CU.,,], п = 1-3; K2[Pt(NO3)4] 0.5 Н2О 28)
K2[Pt(C2O4)2] 4Н2О, крист., фиол., [содержат « 10% Pt (IV)], в стр. - колонки квадратов, Pt—Pt 2.76 H2[Pt(C2O4)2] 2Н2О, крист., желт.
581° '
[Pt2(RCN)6]X2 '
26)
+ ... 23)
CH2
Бронзы 2)
M*Pt3O4, х = 0.25
CdPt2O4; K3Pt2O4
TlPt3O4, кластеры, Pt—Pt 2.84, Pt—О 2.06
K5[Pt4O3(NO2)9] K8[Pt7O6(NO2)12| 7Н2О, желт.
PtX(MeCONH)2, X = no2, no3, диамагн.
Pt2(CH3COO)6, крист., кор., диамагн. Pt4(CH3COO)10(OH)2, Pt—Pt 2.61 13)
OH
H[Pt(SO4)2] 5H2O, 10) крист., оранж.
K2[Pt2(SO4)4L3],
L = H2O, NH3, NR3 K4[Pt2(SO4)4X2],
X = ОН, Г, NO2, SCN, анионы - стр. аналоги Cu(CH3COO)2 • H2O, Pt—Pt 2.48
M6[Pt2(PO4)4(H2O)2]
PtCl2;, крист., св-кор., в стр. - окт. кластер [Pt(>] вписан в кубооктаэдр [С112], Pt—Pt 3.4, Pt—Cl 2.34 PtBr2;, крист., красно-кор. Pti2;, крист., черн., не р. в к., разл. 400, в стр. - слои квадратов, Pt—I 2.59 и 3.47 8)
-140
-79
-17
[Ptr2L2], L = AsR3, SbR3, крист.
(оранж.), PF3, РС13(бц.), CNRPa'cht.) [Ptr2(PR3)2], -цис и -транс, Г = Cl-I, Pt—P 2.26-2.32, M —Г «2.3 (Cl), 2.43 (Br), «2.6(1)
[PtPy(NH3)(NO2)Cl]
(—H2PtCl6 —Pt)
H2[PtCl4], р-р, темно-красн., Ауст = 1017; 20°
pt; + H2ptci6 + ptci2
MJPtCLd, M = Na( • 4H2O, хор. p. в H2O), K, крист., красн., анион - квадрат (dsp 2), Pt—Cl 2.34
M2[PtBr4], крист., кор., AycT = 1021
M2[PtI4], Ауст = IO30; [R4N]2[Pt2r6], Г = Cl-I 6)
M2[Ptr2(NO2)2], цис- и транс-
M2[PtClBrI(NO2)], 3 изомера
[PtCl4]2
Стр. K2PtCl4, Pt—Cl 2.34
[Pt(CNR)4]2+[PtCl4]2 , крист., красн.
[PtCl2(CO)2], крист., желт., т. пл. 142, р. в СС14, диамагн., ц = 4.85; + Н2О —> Pt + ...
[Pt2Cl4(CO)3]„, т. пл. 130, р. в СС14
[PtCl2(CO)]2, крист., желт., т. пл. 195, возг., р. в СС14; гидрол.;
Pt + СОС12
Cl Cl
H^'pt/PtS?2 Cl'
Cl
CH2
HC1
H[Pt(CO)Cl3], желт, р-р
(конц.) M[Pt(CO)Cl3]__________
Cl Cl
co
CO Cl Cl
[PtCl2(C2H4)]2, крист., оранж., гигр., разл. 200, р. в си., ац.
[PtCl2(C2H4)2], крис., желт., неуст.
HC1
(си., -KC1)
Pt(CN)2;, аморфное в-во, желт., воспл. на возд.
Pt(SCN)2;, кор.
I’Us 350° Ptl2;
в стр. - каркас квадратов Pt(II) и окт. Pt(IV) с общ. ребрами Pt—I 2.57-3.19
M2[PtH4], диамагн. (Я8), анион - квадрат (М = Na) или окт. (K-Cs); Pt—Н 1.64; M3PtH5 K2[Pt(NO) + Cl5]
K2|Pt(C = CR)4|
8)
PtF3, желт., АЯ = —202, в стр. -окт. [Ptn’IVF6], высокоспиновый комплекс Pt(II), цЭфф = 3.05 14) PtCl3, крист., темно-зел., АЯ = -129, р. в Н2О;
+ HCI—[Pt"CI4]2 + [Pt1 VC16]2 ;
435°
PtCl2
PtBr3, крист., черно-зел., АЯ = —125
’ PtI3L порошок, графитоподобный;
270°
—> I2 + Ptl2, диамагн., в стр. -цепи квадратов Pt(II) и окт. Pt(IV), Pt—I 2.61 и 2.70
310'
Cs2PtCl5, диамагн., квадраты
Pt(II) и окт. Pt(IV)
K2PtI5, цепи окт. [PtI4I2/2],
Pt—I 2.70 и 3.20
M4[Pt3I11]; M[PtI4] 30)
PtF3(CO)2, крист., желт., гигр., возг., /гт-В ----> разл.
"Ptr3(NH3)2" =
= /77pa//c-[Pt"(NH3)2r2] • 77z/?a77c-[PtIV(NH3)2r4],
Г = Cl, Вг, крист., черн., диамагн.,
Pt11 —Вг 3.03, PtIV—Br 2.50 (Ср. Pd!)
"PtCl3(EtNH2)4 2H2O" =
Стр. PtS
H2s
H2[Pt(CN)4)] 5Н2О, крист., красн., сильн к.,
Ауст = 1041
M2[Pt(CN)4)], М = Na, К( • ЗН2О, сине-желт.), 4<NH4 (бц. с дихроизмом), Мп/2, Ag, Hg/2, в стр. -
колонки из квадратов, Pt—Pt 2.8-3.7, Pt—С 2.01
Cl
Н2С
K[PtCl3(C2H4)] Н2О, "соль Цейзе", ц2С крист., желт., р. в Н2О, С—С 1.37,
Pt—С 2.12, Pt—Cl 2.34(транс-) и 2.30(гщс-) 9)
= [Ptn(EtNH2)4][PtIV(EtNH2)4Cl2]Cl4 • 2Н2О, "соль Вольфрама", крист., красн.
"Ptr(MeCONH—)2", Г = C1-I, диамагн. 13)
[PtEn2][Ptr2En2](ClO4)4 15)
[PtCl3En], мол. - тетраг. пирамида 13)
pts;, черн., серые иглы, АЯ = —50, не р. в ц. в., стр. близка сфалериту, [SPt4] - тетраэдр, [PtS4] - квадрат (dsp2), "куперит"
PtTe; PtSb; PtBi, крист., серебристые, стр. тип NiAs
Pt2S3, серый порошок; + О2 —> Pt + SO2
Pt32, Э = А8("спериллит"), 8Ь("геверсит"), Те ("мончеит")
Pt5Se4, 29)
M2PtS2, М = К, Rb, в стр. - цепи из прямоугольников с общ. ребрами, Pt—S 2.36
2.5+ H2Pt4S6
M2Pt4S6, серо-гол. M4Pt3S6, красн.
M2[Pt(SCN)4)|, M = K, [Pt(NH3)4]/2, крист., красн.
2.25 + M175[Pt(CN)4] 1.5 Н2О, М = K-Cs M2Pt(CN)4r03 3.2 Н2О, Г = С1, Вг, крист., желто-красн., проводники 30)
K2[Pt(CN)5] ЗН2О, в стр. - колонки квадратов [Pt(CN)4], Pt—Pt 2.92,
1 гр. CN неупорядоченно расположена между колонками
Pt
108
O2(—H2O, t)
PtO2, крист., черн.; Pt + О2, не р. в ц. в.; а-, гексаг.
слоистая стр., Pt—О 1.9; ---> /?-, ромб., искаж. тип рутила,
Pt—О 1.99-2.00, акт. к-p гидрирования С = С и С = О 17)
PtO2 • nH2OJ., п = 1 (черн.), 2(кор.), 3(желт.), 4(бел.) H2[Pt(OH)6], окт. анион, Pt—О 2.00, О—Н... О 2.59-2.66, р. в к. и щ., разл. 120 18)
Pt(SO3F)4, желт.
[PtPy(NH3)ClBrI(NO2)J
PtF4, крист., кор., возг. 300, диамагн., искаж. стр. типа UC14(k.4. Pt 8), АЯ = -740
___ PtCl4, крист., красно-кор., гигр., АН = —246, р. в ац.
• 5Н2О, св.-желт., разл. 38 PtBr4[, крист., черно-кор., 8 АН = —142, р. в сп., эф. PtI4J., крист., черно-кор., . .* 300° _ т
АН-----42; ---> Pt3I8;
•2Н2О = транс-[РН4(Н2О)2], крист., черн., Pt—I 2.65, Pt—О 2.1
В стр. Ptr4 (Г = C1-I) -цепи окт.
МОН
Платинаты (IV)
M2[Pt(OH)6] иН2О, М = М1, Са/2, Ва/2, крист., золотисто-желт., Pt—ОН 1.96
Na4PtO4; M8PtO6; M2PtO3, М = Na (красн.),
K-Rb/зел.), в стр. - слои окт., Pt—О 1.96-2.07
M4Pt3O8; MnPtO3; Ba3Pt2O7; М?РЮ4; М?РЮ6,
Л pt + о2 + м2о„ 3)
M2[Pt(IO3)6], М = K-Cs, NH4, разл. «300 7)
Cs[Pt(SO3F)d; Cs2[Pt(SO3F)6 7)
M2[Pt(SO3F)d, М = Cs, [С1О2], [BF2], Ва/2, желт.
K2[Pt(NO2)d, крист., желт., уст. к восст.
K2[Pt(NO2)„(r,r)6-d, п = 1-4
H2[PtF6] иН2О
M2[PtF6], крист., желт., диамагн., М = Na-Cs, Мп/2, Ln/3, Pdn/2, [FCO](= "PtF8(CO)2");
[BrF2] + , [SeF3] + , анион - окт., Pt—F 1.93 12)
[XeF] + [Pt2F9]- 12)
H2|PtCI6| • 4H2O = [H3O]2[PtCl6] • 2H2O, крист., желт.' (красн. в присутствии 12), гигр., р. в сп., эф., сильн. к. 16) M2[PtCl6], крист., желт., куб., р. Li( • 6Н2О)> >Na(-6H2O) > K>NH4 > Rb > Cs > Ag^;
Pt—Cl 2.32
H2[PtBr6] 9H2O, крист., красн.
M2[PtBr6], M = К (разл. 400, сл. p. в H2O),
Na( • 6Н2О), красн.
H2[PtI6] 9Н2О, крист., черн.
M2[PtI6], М = К, Na (• 6Н2О), крист., неустойчивы, светочувствительны
Ъ\
Pt
[Pt(NH3)Py(NO2)ClBrI], сущ. 15 изомеров
PtS2J., крист., серо-кор., оставляют штрих, АН = —88, р. в HNO3, M2S и ц. в., стр. тип Cdl2; Pt + ... PtSe2; PtTe2, крист., черн., р. в ц. в., стр. тип Cdl2
PtP2; PtAs2, "сперрилит1
PtSb2, стр. тип пирита
PtOF3, крист., кор., нелетучи, медл. гидрол.
PtF5, крист., красн., т. пл. 80; —PtF4 + PtFJ; сильн. окисл.;
+ BrF3 —> BrF5, изостр. (RuF5)4
( PtF4 )
[Ptci6]
Стр. K2PtCl6, тип awmw-CaF2 (Ca = [PtCl6], F = K)
M2[Pt(CN)„r6_„], п = 5, 4
H2[Pt(CN)d 2Н2О, крист., бц., сильн. к. K2[Pt(CN)6], крист., св.-желт., разл. 395, гр. [Pt—С—N] линейны
K2[Pt(NO)(CN)5]
M2[Pt(SCN)d, М = Н( • 2Н2О), K-Cs, Pb/2, крист., красн.
M2[Pt(SeCN)6], Pt-Se «2.7
(NH4)2[Pt(S5)3| 2Н2О, в анионе - 3 цикла [PtS5], Pt—S « 2.4
5 + (rf5)
6 + (rf4)
[Pt(OH)6]2 , желт., окт. ион, диамагн.
M + [PtF6] ', крист., M = K-Cs (желто-кор.), [O2] (оранж., возг. 100, т. пл. 219 (р), 2 неспаренных эл.), [Н3О], [IF4], [C1F6], [Xe2F3], Хе, Хе/2, XeF5, KrF, парамагн.
.' (d5, 1 неспаренный эл.), анион - окт. (d2sp3), ' 4 Pt—F 1.82-1.89 сильнейший окисл., / + Н2О PtO2 + [PtF6]2 + О2
' [M][Pt2Fn], М = [О2], [KrF] 20)
Xе’ О2 PtF6, крист., красн., т. пл. 61, т. к. 69;
Н2О
+ Н26 Pto2 + [PtF6]2 + О2;
оч. сильн. окисл., АН = —714 21)
2 +
и
C12
C2Oi ; N2H4
IPtCld2-, диамагн. (<76), окт. (d2sp3) ион
[Ptcm2 ', красн., диамагн. (ds) ион, / квадратур2), Куст=1017
0
cr-
.О/
[Pt(NH3)Cl3]", Cl Cl
оранж. ион, / Pt / Куст = 1024 ci NH3
Ch
•
[PtCl3(OH)3]2-
[PtCl5(H2O)r [PtCl5(OH)|2-H
ll’HJ2 мно-красн. ион 0 (качественная р-ция на PtIV)
NH3 If HC1
С2ОД
[Pt(NH3)Cl5] , желт., окт.
C12
««HPtfNHahCWOHhl, "оксоплатина" 33)
Cl
Г СА
7pzc-|Pt(NH3)2CI2|(, "соль Пейроне", крист., Cl NH3 ярко-желт., Pt—N 2.0, /р. / Pt—Cl 2.3, в стр. - колонки —т<гт_г квадратов, Pt—Pt 3.37 и 3.41
Cl 141 1-1 -
NH3
c2ot
ci Tnh
Cl
NH3 zzzzc-||>t(\H3)2CI4|.
"соль Клеве", крист., желт., 160°
----» зел., разл. 240
Pt
чернь, колл. Pt
п/раис-| Pt( \ Н3)2С12| (., "хлорид
Н N С1 Н основания Рейзе",
Ъ-----у крист., желто-зел.,
/ Pt / Куст= 1029, Pt—N 2.05,
Cl NH3 Pt—Cl 2.32, Pt—Pt 5.0
f HC1 (t)
[Pt(NH3)3Cl] +, св.-желт., H3N Cl
Куст = 1033 /Pt /
H3N NH3
f HC1 hjN NH3 [Pt(NH3)4]2+, бц.,
/ Pt / "I основание Рейзе", :уст = ю36
H3N NH3
[Pt(NH3)4][PtCl4], "соль Магнуса", крист., темно-зел., в стр. - колонки чередующихся квадратов катионов и анионов, Pt—Pt 3.25
Ch
Сг°*
C12
c2oi
Cl2; H2O2
------------------------------ С1 _______ /H/>a7/c-|Pt(NH3)2CI4|, H3N | Cl "соль Жерара", крист., у/pt / желто-зел., разл. 280 lNH3 ------------------------------ Cl —
ci
г%
NH3
ci Tnh nh3
<j6ac-[Pt(NH3)3Cl3]+, желт, ион
j/cp-[Pt(NH3)3Cl3]+, св.-желт, ион
Cl
H3N|___Cl
/ Pt /
H3N lNH3 Cl
С2°4 H3N I NH3 z/«c-|Pt(NH3)4X2|2+,
св.-желт. ион
NH3 в транс-положении к Cl более подвижен, чем в цис- (закономерность
[Pt(NH3)5Cl]3 + , бц. ион
[Pt(NH3)6]4+, бц. ион
трансвлияния И. И. Черняева) и первым вступает в р-ции замещения;
СК в транс-положении к NH3 более инертен, чем на координате С1—Pt — Cl
Ряды трансвлияния: Pt (II): NO2, I, SCN > Br > Cl > NH3, Py > H2O
Pt(IV): I > Br > Cl > OH > NH3, Py, NO2, NO3
(NH4)2CO3 + NH3
109
ИНЕРТНЫЕ ГАЗЫ
2 +
Гелий Не0 15 И э.о. 4.5
Неон Ne° 2s И | J-TIJ-TI J-Т I 4.0
Аргон Аг° 3s И Зр | J-ТIJ-ТIJ-ТI 2.9
Криптон Кг° 45 и | J-T I J-T I J-Т I [ 4d □ZE 2.6
Ксенон Хе° 55 и | J-T I J-T I J-Т I [ 5d □ZE 2.25
Радон Rn° 65 И | ИIИIИI [ 6d □ZE 2.0
Образование Rn при радиоактивном распаде:
232Т1т
90 АЙ
235т т 92 U
238т т 92 U
• • -286Rn ("Th Em", "торон") а—> • •• 54.5 с.
• • • 219 8бКп ("Ac Em", "актинон")
Kr[OTeF5]2, неуст. 18)
He(N2)n 16)
J
О
3.92 c.
• • -286Rn ("Ra Em") 3.82 сут.
• • -^fAt 2>n ("At Em") 0.019 c.
Образование Не и Аг в минералах U и К: 29328и ------> 8а + 6/? + 28°26РЬ;
), + 8с
8 2Не
Не Ne Аг Кг Хе Rn
г., бц., в разряде излучают
желт. оранж. красн. зел.-фиол. фиол. бел. свет
Содержание в атм. (%об. • 104) 5.24 18.2 9340 11.4 0.087 6 -10 14
т. пл. -269.7 -248.6 -189.4 -157.3 -111.9 -71.0
т. к. -268.9 -245.9 -185.8 -153.2 -108.1 -61.9
d (при т. к.) 0.126 1.20 1.40 2.60 3.06 4.40
р. в Н2О (% об.) при 0° 0.008 0.010 куб 0.034 . пл. упа к. 30 51 хор. р. в орг. р-рителях
а = 4.42 (р = 125-105) j, -258° 4.52 гекса 5.43 г. пл. уп 5.69 j, -247° 1К. 6.24 —
а = 3.47 3.14 — 4.00 4.34
с = 5.54 (р = 130-105) | -270° куб. (тип a-Fe) а = 4.11 (р = 30-Ю5) 5.14 6.53 7.09 13)
H2O; и-СбН4(ОН)2
Клатратные соединения включения
Рэ при синтезе (Па • 10 6) т. разл. (р = ю5)
Э • 5.75 Н2О (8: 46), Э = Ne Аг Кг Хе Rn Э Зл-С6Н4(ОН)2, Э = Аг, Кг, Хе (гидрохинон) 300 150 15 ~1 ~1 -42.8 -28 -4
£
PtF6 (Бартлетт, 1962 г.)
Xe[PtvF6] Xe[PtF6]18
порошок, красн., возг. вак.;
+ Н2О —> Хе + HF + PtO2 + О2
165'
KrF2, крист., бц., возг. < 0, взр., разл. «0, АН = + 22, окисл. акт. > XcF„ ( + NF3 -+ [NF4] + ), донорная акт. в отношении F-: XeF6 > XeF2 > KrF2»XeF4; р. в HF и BrF5; в стр. - слои линейных мол., Кг—F 1.89
• XeF6, т. пл. 40 с разл.; р. в BrF5 П)
[Kr2F3] + [3F6]“, Э = As, Sb, Nb, Ta, U, Np, Pu, Am, крист., бц. '*
| 25° (-Kr-F2)
[KrF] + [3F6]x, Э = As, Sb, Au, Rh, Ru, Pt, крист., уст.
[FKrL]+X“, L = MCN
14)
Xe(ClO4)2, Xe(IO2F4)2
Xe(SO3F)2, Xe(SeOF5)2, Xe(TeOF5)2, Xe(NO3)2 (разл. -70)
Xe(PO2F2)2, Xe[N(SO2F)2]2, Xe(CF3COO)2, уст. при 20;
гр. [ОХеО] - линейна, Хе—О 2.12
Xe[PtvF6]2, Xe[Pt2vF10], крист., желк^ Хе[ЭГ6]2, Э = P-Sb, Та, крист., желт.
19)
PdF4; RuF6; RhF6;
Xe[MF6], М = Pd, Ru, Rh, Sb Xe2[SiF6], разл. «20
(300°, 2-107 Па); hv
[Xe(OTeF5)]+X-, X = AsF6, Sb2Fn
[Xe(C6F5)]+X- 12)
(400°
Ofl (^oBJ
НХ
XeF2, крист., бц., т. пл. 136, т. к. 338, АН = -176, 350° — Хе + XeF4.
Р. в Н2О 0.15М (0°), хор.
р. в HF (не дис.); в стр. и г. -линейные мол. (</<-триг.
бипир), Хе — F 2.00, (ср. [1Вг2]"); оч. сильн. окисл. и фторагент:
+ Ag+ ——»Agn; Со11—>Сош;
NpV^Npvii 13)
Ч |XeF| + X“, X = С1О4, SO3F, [N(SO2F)2], OSeF5, OTeF5, NO3, VF6, CF3COO, SbF6, Sb2Fn, NbF6, TaF6, Ta2Fn, MoF7, WF7, PdF5, PtF6, Pt2Fn(rp. F—Xe — F линейна), Xe — F 1.87-2.12 2)
[Хе2Г3] + [ЭГ6]-,
Э = As, Sb, Та, Au, катион - угловой 14)
ХеС12, крист., бц., возг., разл. 80
\\.F
F
[RnF] + [SbF6]“ (?)
F2
CC14 (/гт-УФ)
XeF2 • XeF4, т. пл. 107 n)
Тв. продукты фторирования Rn RnF„ (?), n = 4 или 6, + H2O —> RnO3 (?) 3)
110
4 +
6 +
8 +
ВАЛЕНТНЫЕ СОСТОЯНИЯ (ТИПЫ ГИБРИДИЗАЦИИ) И КООРДИНАЦИОННЫЕ МНОГОГРАННИКИ ЦЕНТРАЛЬНОГО АТОМА
(Е - локализованная пара эл.)
Число эл. пар Валентное состояние, валентный угол Тип молекулы или иона к. ч. Пространственная конфигурация Примеры
2 sp, 180° 7«5/ 180° АХ2 2 2 линейная (гантель) о—•—о ВеГ2, Г = F-I(r.), СО,, N,O, [NO2] + dw: ZnCl, (r.). HgCl2, [Ag(NH3),] + . </": [UO2]2 + , [NpO2]2 + . [PuO,]2+
2 р2, 90° АХ2 2 угловая H2S, H2Se, [Ticy-
3 sp2, 120° d2s, 120° АХ3 3 плоский тр-к K[BeF3](r.), ВГ3> [BO3]3~, B2C14, [CO3]2~, C2H4> [NO3T, SO3(r.), [O(HgCl)3] + ; [Hgl3]~ d6: [FeO3]4~ </": ScF3(r.)
ах2е 2 угловая I ОД-тр-к) Snr2(r.), [NO2]-, N2F2, O3, SO2(r.), C1O2 +
3 р3, 90° АХ3 3 триг. пирамида PH3 AsF3(r.)
4 sp3, ^109° 28' ах4 4 тетраэдр [Be(H2O)4]2 +, [OBe4] в мол. Be4O(OAc)6; [BF4]“, [A1C14]“, CH4, [SiO4]4", NOF3, [SO4]2", [C1O4]“ <Z10: Ni(CO)4, [Cu(CN)4]3", [Zn(CN)4]2", [GaH4]", GeCl4, [AsO4]3-, [SeO4]2-, [BrO4]~, XeO4 d9: Co(CO)3(NO), Cs2[CuCl4] ds: [Fe(CO)2(NO)2], [Со(СО)4]", [NiCU]2" d7: [Mn(CO)(NO)3], [CoCl4]2" d6: [FeCl4]2"; d5: [MnCl4]2"; d3: [FeO4]3"
sp3, & 103° ах3е 3 триг. пирамида (1Д-тетраэдр) NH3, NF3, N2F4, [AsO3]3~, [H3O] + , SOC1,. [SO3]2[Se„], [SeO3]2~, [IO3]~, [BrO3]~, XeO3
sp3, & 103° АХ2Е2 2 угловая ) (1Д-тетраэдр) !—• H2O, OF2, [S„], SC12, ТеГ2, [C1F2] + , [C1O2]-, XeO2
d3s, 109° 28' ах4 4 тетраэдр d2: Cr(OC4H9-04, [MnO4]3-, [FeO4]2- d1: VC14, [CrO4]3", [MnO4]2", [RuO4]“ d°: TiCl4, [VO4]3", [CrO4]2", [MnO4]“, OsO4
dsp2, 90° ах4 4 квадрат ds: [Co(CN)4]3", [Ni(CN)4]2", [PtCl4]2", CuO, [Au(OH)4]-
Число эл. пар Валентное состояние, валентный угол Тип молекулы или иона к. ч. Пространственная конфигурация Примеры
5 sp3d, 120° (экв.), 90° (акс.) ах5 5 триг. бипир. А1Н3 • 2NR3, [SnCl5]-, PF5(r.), SOF4. [IO5]3 , C1O2F3
ах5 5 тетраг. пирамида [InCl5]2~
ах4е 4 дисфеноид Т Q "мр,,г [PBr4]", [SbF4]", SF4, TeCl4, [FO2F2]-, [FF4] + , rOF3, XeO2F2 (2F-aKc), XeO3F
AX3E2 3 Т-образная 1 (1Д-триг. бипир.) 0 I'’",’ C1F3, BrF3, [XeF3] + , XeOF2
АХ2Ез 2 линейная (1Д-триг. бипир.) * [IC12]-, [ГзГ, XeF2
dsp3, 120° (экв.), 90° (акс.) ах5 5 триг. бипир. zlv^ тетраг. пирамида (центральный ат. над центром квадрата) -А5 rfs: [Mn(CO)5]-, Fe(CO)5> [Co(CO)3(PR3)2]+, [Pt(SnCl3)5]3_, [CuCl5]3“ 13г/‘‘ 3ds4d') d1: Mn(CO)4(NO)(r.), [NiBr3(PEt3)2]
d2sp2, 90° ах5 5 d6. [RuC12(PR3)3] d4: [Et4N],[MnCl5]
d3sp ах5 5 триг. бипир. <Z°: NbCl5, УГ5
d4s, 90° ах5 5 тетраг. пирамида d2: VCl3(SMe2)2, [Mo(CN)5]", [ReOT4]"
6 sp3d2, 90° АХ6 6 окт. /ft. [Mg(H2O)6]2+, [A1F6]3[SiF6]2[Pb(OH)6]2~, [PCUT, SF6, [IO6]5[IF6] + , [IO2F4]-dw: AgCl, [Cd(OH)6]4-, [InF6]3-, [SnCU]2", [Sb(OH)6]~, TeF6. IOF5, [XeO6]4~ d9: K2[CuCl4] (искаж. окт.); d8: [AuBr,,]3 fd7. [Fe‘(NO) + (H2O)5]2 + , [Co(NH3)6]2 + высоко- 1 d6: [Fe(H2O)6]2 + , [СоГ(1] ' спиновые) d5: [Mn(H,O)6]2 +, [Fe(H,O)6]3 + '-rf4: [Cr(H,O)6]2 + , [Mn(C,O4)3]3~
ах5е 5 тетраг. пирамида Q (центральный ат. /н в центре или под центром квадрата) (1Д-окт.) [SbFs]2-, [SF5]-, ГЕ,, [EOFJ-, [Xeb,] +
ах4е2 4 квадрат (1Д-ОКТ.) хг [1С14]~, XeF4
112
Число эл. пар Валентное состояние, валентный угол Тип молекулы или иона к. ч. Пространственная конфигурация Примеры
6 d2sp3, 90° АХ6 6 окт. (<Г. [Os(NH3)6] + , [NiF6]3-d6: Сг(СО)6, [Mn(CN)6]5-. [Fe(CN)6]4-, низко- 1 [Co(NH3)6]3 + , [NiFJ2- спино- < d5: [Mn(CN),,]4 . [Fe(CN)(1] ‘ . вые [PtF6]“ d4: [TiDipy3], [Mo(CN)6]4-. \ [Mn(CN)6]3-, [OsCl6]2-, [IrF6]-, PtF6 d3. [V(H2O)J2 + ,[Cr(NH3)6]3 + . [MnCl6]2-. [OsFJ-. IrF6 d2: [V(H2O)6]3 +, [CrF6]2~, [ReOCy2-, [OsNr5]2“, RuF6 d'. [Ti(H2O)6]3 + . [VF6]2-. [MoF6]“, ReF6, OsOF5 rf°: [Sc(OH)6]3-, [TiF6]2-, [VF6]-, MoF6> [ReO3Cl3]2-, [OsO4(OH)2]2-
Лу, (?) ах5е 6 триг. призма (ту d2: MoS2, WS2
7 sir'd3, sP3d2f(?) ах7 7 пентаг. бипир. if7
АХ6Е 6 искаж. окт. (1Д-пентаг. бипир. или 1Д-одноша- т/* ионный окт.) [IF6]-, XeF6(r.), [XeOF5]-
ах5е2 5 плоский 5-угольник (1Д-пентаг. бипир.) [XeF5]-
d5sp, d4sp2, d3sp3 ах7 7 пентаг. бипир. d°: (NH4)3[ZrF7], OsF7 d1: OsF7 d2. [V(CN)7]4- d3: [Mo(CN)7]4" d4. [Re(CN)7]4"
7 одношапочный q/tTK окт. <Z°: [NbOF6]3-
7 одношапочная триг. призма <Z°: [NbF7]2", [TaF7]2", LnO(OH), YO(OH)
Число эл. пар Валентное состояние, валентный угол Тип молекулы или иона К. ч. Пространственная конфигурация Примеры
8 sp3d\ d4sp3 ах8 8 антипризма (томсоновский куб) (Z поворота 45° - о антипризма Архимеда) L [XeF8]2-, [Ва(Н2О)8]2 + , Zr[IO3]4> [TaF8]3-, [W(CN)8]2-, [Mo(CN)8]4-, [ReFs]2-. [Eu(H2O)6C12] +
куб ThO2, UO2, (NH3)4[U(C2O4)4]
додекаэдр \ Ti(NO j4 (NO8 - бидентатны), [ZrF8]4-, [Crv(O2)4]3-, [Mo(CN)8]2-, [Co(NO3)4]2-, [Fe(NO3)4]-, [Re(CN)8]3-
гексаг. бипир. //|\К [UO2(H2O)6]2 +
9 ах9 9 тетраг. одношапочная призма Li3ThI7
трехшапочная триг. призма РЬС12> ВаГ2, EuC12, [Nd(H2O)9]3 +, [Sc(H2O9]3 + , [Th(SO4)4]4~. K2[PaF7], UC13. [ReH9]2~. T1(NO3)3 3 H,O
sp3d5 ах8е 8 квадратная антипризма [XeF8]2~
10 АХ10 10 квадратная призма с 2 с центрированными гранями -4 [Th (трополонат)5]-
пентаг. бипир. [UO2(C2O4)2]2-
11 АХц 11 триг. призма с о^дсэ центрированными А • А основаниями и L J. ребрами LnF3, UF3, Th(NO3)4 • 5H2O
12 ах12 12 икосаэдр (кубооктаэдр и его гексаг. аналог встречаются в ионных крист.) La,(SO4)3 9H2O, [Ce(NO3)6]3~ [Th(NO3)6]2~, [UO2(C2O4)3]4~
113
важнейшие типы кристаллических структур
Формула Тип решетки К. Ч. и многогранник центрального атома К. Ч. и многогранник лиганда Страница
Си куб. пл. упак. 12, кубооктаэдр — 86
a-Fe куб. объемно-центрированная 8, куб — 90
Простые вещества Mg гексаг. пл. упак. 12, гексаг. аналог кубооктаэдра — 78
С (алмаз) куб. 4(= 8-4), тетраэдр — 54
С (графит) гексаг. 3, тр-к — 54
Р - бел. куб. 3 (= 8 -5), триг. пирамида, L РРР 60 — 40
Р - черн. ромб. 3, триг. пирамида — 40
s8 ромб. 2(= 8-6), ZSSS 108 — 18
Ъ ромб. 1(= 8-7) К.Ч. = 8-№гр. (правило Юм-Розери) — 6
NaCl куб. 6, окт. 6, окт. 85
CsCl куб. 8, куб 8, куб 85
ZnS (сфалерит) куб. 4, тетраэдр 4, тетраэдр 81
Соединения ZnS (вюртцит) = ZnO гексаг. 4, тетраэдр 4, тетраэдр 81
типа АХ NiAs гексаг. 6, окт. 6, окт. 94
BN гексаг. 3, тр-к 3, тр-к 69
PbO тетраг. 4, тетраг. пирамида 4, тетраэдр 61
PtS тетраг. 4, квадрат 4, тетраэдр 108
CaC2 тетраг. 10 и 2, тетраг. пирамиды, сближенные основаниями 5, тетраг. пирамида 79
FeS2 (пирит) куб. 6, окт. 4, тетраэдр 90
Соединения CaF2 (флюорит) PbCl2 куб. ромб. 8, куб 9, трехшапочная триг. призма 4, тетраэдр г 4, тетраэдр 15, пентаг. пирамида 79 62
типа АХ2 TiO2 (рутил) тетраг. 6, окт. 3, тр-к 65
Cdl2 гексаг. 6, окт. 3, триг. пирамида 80
CdCl2 ромбоэдрическая 6, окт. 3, триг. пирамида 80
SiO2 (кристобалит) куб. 4, тетраэдр 2, гантель 59
SiS2 ромб. 4, тетраэдр 2, угловая, L SiSSi « 100° 59
co2 куб. 2, гантель 1 55
Формула Тип решетки К. Ч. и многогранник центрального атома К. Ч. и многогранник лиганда Страница
FeCl3 ромбоэдрическая 6, окт. 3, триг. пирамида 91
ReO3 куб. 6, окт. 2, гантель 15
Соединения PuBr3 ромб. 8, искаж. восьмивершинник г 3, триг. пирамида 1 2, угол 34
типа АХ3 UC13 гексаг. 9, трехшапочная триг. призма 3, триг. пирамида 32
LaF3 гексаг. З(тр-к) + б(призма) + 2(акс.) = 11 г 4, тетраэдр t 3, тр-к 77
YF3 ромб. 9 = 8 + 1 — 77
Соединения типа АХ4 исц тетраг. 4 (искаж. тетраэдр) + + 4 (мост.) = 8 2, угол 32
ZrF4 монокл. 8, антипризма 2, угол 65
Соединения а-А12О3 (корунд) ромбоэдрическая 6, искаж. окт. 4, искаж. тетраэдр 70
типа А2О3 Mn2O3 куб. 6 (6 вершин куба) 4, тетраэдр 12
La2O3 гексаг. 7, одношапочный окт. 4(= 3 + 1) 77
MgAl2O4 (шпинель) куб. Mg - 4, тетраэдр А1 - 6, окт. 4, тетраэдр (= ЗА1+ IMg) 70
CaTiO3 ромб, (псевдоку- Са - 12, кубооктаэдр 2Ti + 4 Са (тетраг. 65
Тройные соединения (перовскит) бическая) (куб из 4 гр. [ТЮ3]) Ti - 6, окт. бипир.)
K2PtCl6 куб. (тип. анти- CaF2) К - 12, кубооктаэдр (тетраэдр из 4 гр. [PtCl6]) Pt - 6, окт. 2Pt + 4K (тетраг. бипир.) 109
K2NiF4 тетраг. К-9 Ni - 6, искаж. окт. 2 Ni 95
Гидраты газов 8Х 46Н2О, X = Cl2, H2S, n2o, СО2, СН4, Хе 6Х 46Н2О, X = Br2, SO2, соединения включения в стр. льда куб., а = 12 20 Н2О, пентагондодекаэдр 6
114
ЭФФЕКТИВНЫЕ ИОННЫЕ РАДИУСЫ (г)
Приведенные значения радиусов базируются на г О2- с К. Ч. 6, равном 1.40 А, например, в структурах окислов МПО. Эти величины используются в кристаллохимии при сравнении межатомных расстояний, объемов элементарных ячеек и т. д. В физике твердого тела (при описании диффузии, плотнейшей шаровой упаковке ионов и т. д.) чаще применяются т. н. ’'кристаллические” радиусы, значения которых на 0.14 А превышают приведенные в табл.; исключение составляют ионы Г-, Н + , N3-, N5 + , Э2- (Э = О, S, Se, Те) и ОН-, радиусы которых на 0.14 А меньше эффективных ионных (Shannon R.D., Acta Crystallogr., 1976, А32, 751).
ион К.Ч. г ион К.Ч. г ион К.Ч. г ион К.Ч. г ион К.Ч. г ион К.Ч. г ион К.Ч. г ион К.Ч. г ион К.Ч. г ион К.Ч. г ион К.Ч. г
Ас3+ 6 1.12 Bi3+ 8 1.17 Cm4+ 8 0.95 9 1.30 9 1.07 Mn4+ 4 0.39 Np2+ 6 1.10 Pd1+ 2 0.59 Ru4+ 6 0.62 Tb3+ 6 0.92 12 1.17
Ag1 + 2 0.67 Bi5+ 6 0.76 Co2+ 4 0.58 Eu2+ 10 1.35 Ho3+ 10 1.12 Mn4+ 6 0.53 Np3+ 6 1.01 Pd2+ 4 0.64 Ru5+ 6 0.56 7 0.98 U5+ 6 0.76
4 1.00 8 0.96 5 0.67 Eu3+ 6 0.95 I1’ 6 2.20 Mn5+ 4 0.33 Np4+ 6 0.87 Pd2+ 6 0.86 Ru7+ 4 0.38 8 1.04 7 0.84
5 1.09 Bk3+ 6 0.83 6 0.74 7 1.01 I5+ 3 0.44 Mn6+ 4 0.25 8 0.98 Pd3+ 6 0.76 Ru8+ 4 0.36 Tb3+ 9 1.09 U6+ 2 0.45
6 1.15 8 0.93 8 0.90 8 1.07 6 0.95 Mn7+ 4 0.25 Np5+ 6 0.75 Pd4+ 6 0.61 S2’ 6 1.84 Tb4+ 6 0.76 4 0.52
7 1.22 Br1’ 6 1.96 Co3+ 6 0.61 9 1.12 I7+ 4 0.42 6 0.46 Np6+ 6 0.72 Pm3+ 6 0.97 S4+ 6 0.37 8 0.88 6 0.73
8 1.28 Br3+ 4 0.59 Co4+ 4 0.40 F1’ 2 1.28 6 0.53 Mo3+ 6 0.69 Np7+ 6 0.71 8 1.09 S6+ 4 0.12 Tc4+ 6 0.64 7 0.81
Ag2+ 4 0.79 Br5+ 3 0.31 6 0.53 3 1.30 In3+ 4 0.62 Mo4+ 6 0.65 O2’ 2 1.35 9 1.14 6 0.29 Tc5+ 6 0.60 8 0.86
6 0.94 Br7+ 4 0.25 Cr2+ 6 0.73 4 1.31 6 0.80 Mo5+ 4 0.46 3 1.36 Po4+ 6 0.94 Sb3+ 4 0.76 Tc7+ 4 0.37 V2+ 6 0.79
Ag3+ 4 0.67 6 0.39 Cr3+ 6 0.61 6 1.33 8 0.92 6 0.61 4 1.38 8 1.08 5 0.80 6 0.56 V3+ 6 0.64
6 0.75 C4+ 3 0.08 Cr4+ 4 0.41 Fe2+ 4 0.63 Ir3+ 6 0.68 Mo6+ 4 0.41 6 1.40 Po6+ 6 0.67 6 0.76 Те2’ 6 2.21 V4+ 5 0.53
Al3+ 4 0.39 4 0.15 6 0.55 6 0.78 Ir4+ 6 0.62 5 0.50 8 1.42 Pr3+ 6 0.99 Sb5+ 6 0.60 Te4+ 3 0.52 6 0.58
5 0.48 6 0.16 Cr5+ 4 0.34 8 0.92 Ir5+ 6 0.57 6 0.59 OH1’ 2 1.32 8 1.13 Sc3+ 6 0.74 4 0.66 8 0.72
6 0.53 Ca2+ 6 1.00 6 0.49 Fe3+ 4 0.49 K1+ 4 1.37 7 0.73 3 1.34 9 1.18 8 0.87 6 0.97 V5+ 4 0.35
Аш2+ 7 1.21 7 1.06 8 0.57 5 0.58 6 1.38 N3’ 4 1.46 4 1.35 Pr4+ 6 0.85 Se2’ 6 1.98 Te6+ 4 0.43 5 0.46
8 1.26 8 1.12 Cr6+ 4 0.26 6 0.64 7 1.46 N3+ 6 0.16 6 1.37 8 0.96 Se4+ 6 0.50 6 0.56 6 0.54
9 1.31 9 1.18 6 0.44 8 0.78 8 1.51 N5+ 3 0.10 Os4+ 6 0.63 Pt2+ 4 0.60 Se6+ 4 0.28 Th4+ 6 0.94 W4+ 6 0.66
Аш3+ 6 0.97 10 1.23 Cs1+ 6 1.67 Fe4+ 6 0.58 9 1.55 6 0.13 Os5+ 6 0.57 6 0.80 6 0.42 8 1.05 W5+ 6 0.62
8 1.09 12 1.34 8 1.74 Fe6+ 4 0.25 10 1.59 Na1+ 4 0.99 Os6+ 5 0.49 Pt4+ 6 0.62 Si4+ 4 0.26 9 1.09 W6+ 4 0.42
Аш4+ 6 0.85 Cd2+ 4 0.78 9 1.78 Fr1+ 6 1.80 12 1.64 5 1.00 6 0.54 Pt5+ 6 0.57 6 0.40 10 1.13 5 0.51
8 0.95 5 0.87 10 1.81 Ga3+ 4 0.47 La3+ 6 1.03 6 1.02 Os7+ 6 0.52 Pu3+ 6 1.00 Sm2+ 7 1.22 11 1.18 6 0.60
As3+ 6 0.58 6 0.95 11 1.85 5 0.55 7 1.10 7 1.12 Os8 + 4 0.39 Pu4+ 6 0.86 8 1.27 12 1.21 Xe8+ 4 0.40
As5+ 4 0.33 7 1.03 12 1.88 6 0.62 8 1.16 8 1.18 P3+ 6 0.44 8 0.96 9 1.32 Ti2+ 6 0.86 6 0.48
6 0.46 8 1.10 Cu1 + 2 0.46 Gd3+ 6 0.94 9 1.22 9 1.24 P5+ 4 0.17 Pu5+ 6 0.74 Sm3+ 6 0.96 Ti3+ 6 0.67 Y3+ 6 0.90
At7+ 6 0.62 12 1.31 4 0.60 7 1.00 10 1.27 12 1.39 5 0.29 Pu6+ 6 0.71 7 1.02 Ti4+ 4 0.42 7 0.96
Au1+ 6 1.37 Ce3+ 6 1.01 6 0.77 8 1.05 12 1.36 Nb3+ 6 0.72 6 0.38 Ra2+ 8 1.48 8 1.08 5 0.51 8 1.02
Au3+ 4 0.68 7 1.07 Cu2+ 4 0.57 9 1.11 Li1+ 4 0.59 Nb4+ 6 0.68 Pa3+ 6 1.04 12 1.70 9 1.13 6 0.60 9 1.07
6 0.85 8 1.14 5 0.65 Ge2+ 6 0.73 6 0.76 8 0.79 Pa4+ 6 0.90 Rb1+ 6 1.52 12 1.24 8 0.74 Yb2+ 6 1.02
Au5+ 6 0.57 9 1.19 6 0.73 Ge4+ 4 0.39 8 0.92 Nb5+ 4 0.48 8 1.01 7 1.56 Sn4+ 4 0.55 Tl1+ 6 1.50 7 1.08
B3+ 3 0.01 10 1.25 Cu3+ 6 0.54 6 0.53 Lu3+ 6 0.86 6 0.64 Pa5+ 6 0.78 8 1.61 5 0.62 8 1.59 8 1.14
4 0.11 12 1.34 Dy2+ 6 1.07 H1+ 1 0.38 8 0.98 7 0.69 8 0.91 9 1.63 6 0.69 12 1.70 Yb3+ 6 0.87
6 0.27 Ce4+ 6 0.87 7 1.13 2 0.18 9 1.03 8 0.74 9 0.95 10 1.66 7 0.75 Tl3+ 4 0.75 7 0.92
Ba2+ 6 1.35 8 0.97 8 1.19 Hf4+ 4 0.58 Mg2+ 4 0.57 Nd2+ 8 1.29 Pb2+ 4 0.98 11 1.69 8 0.81 6 0.88 8 0.98
7 1.38 10 1.07 Dy3+ 6 0.91 6 0.71 5 0.66 9 1.35 6 1.19 12 1.72 Sr2+ 6 1.18 8 0.98 9 1.04
8 1.42 12 1.14 7 0.97 7 0.76 6 0.72 Nd3+ 6 0.98 7 1.23 14 1.83 7 1.21 Tm2+ 6 1.03 Zn2+ 4 0.60
9 1.47 Cf3+ 6 0.95 8 1.03 8 0.83 8 0.89 8 1.11 8 1.29 Re4+ 6 0.63 8 1.26 7 1.09 5 0.68
10 1.52 Cf4+ 6 0.82 9 1.08 Hg1+ 3 0.97 Mn2+ 4 0.66 9 1.16 9 1.35 Re5+ 6 0.58 9 1.31 Tm3+ 6 0.88 6 0.74
11 1.57 8 0.92 Er3+ 6 0.89 6 1.19 5 0.75 12 1.27 10 1.40 Re6+ 6 0.55 10 1.36 8 0.99 8 0.90
12 1.61 Cl1’ 6 1.81 7 0.94 Hg2+ 2 0.69 6 0.83 Ni2+ 4 0.55 11 1.45 Re7+ 4 0.38 12 1.44 9 1.05 Zr4+ 4 0.59
Be2+ 3 0.16 Cl5+ 3 0.12 8 1.00 4 0.96 7 0.90 5 0.63 12 1.49 6 0.53 Ta3+ 6 0.72 U3+ 6 1.02 5 0.66
4 0.27 Cl7+ 4 0.08 9 1.06 6 1.02 8 0.96 6 0.69 Pb4+ 4 0.65 Rh3+ 6 0.66 Ta4+ 6 0.68 U4+ 6 0.89 6 0.72
6 0.45 6 0.27 Eu2+ 6 1.17 8 1.14 Mn3+ 5 0.58 Ni3+ 6 0.56 5 0.73 Rh4+ 6 0.60 Ta5+ 6 0.64 7 0.95 7 0.78
Bi3+ 5 0.96 Cm3+ 6 0.97 7 1.20 Ho3+ 6 0.90 6 0.58 Ni4+ 6 0.48 6 0.77 Rh5+ 6 0.55 7 0.69 8 1.00 8 0.84
6 1.03 Cm4+ 6 0.85 8 1.25 8 1.01 0.64 No2+ 6 1.1 8 0.94 Ru3+ 6 0.68 8 0.74 9 1.05 9 0.89
115