Автор: Турова Н.Я.
Теги: физическая химия общая и неорганическая химия неорганическая химия схемы и таблицы
ISBN: 978-5-94057-451-4
Год: 2009
Текст
Н.Я.Турова
Таблицы-схемы по неорганической химии
Москва
МЦНМО
2009
ББК 24.1
УДК 544
Т88 Утверждено Ученым советом
Высшего химического колледжа Российской академии наук
Турова Н. Я.
Т88 Таблицы-схемы по неорганической химии. — М. МЦНМО, 2009. — 48 с.
ISBN 978-5-94057-451-4
Аннотация
Настоящее учебное и справочное пособие состоит из 23 таблиц-схем, посвящен¬
ных производным одного элемента или группы элементов-аналогов и их взаимным
превращениям. Оно включает основные элементы периодической системы, охватываю¬
щие школьную программу, а также некоторые 3<1-переходные металлы. Для отдельных
соединений приведены их физико-химические и структурные характеристики, а также
пути синтеза и дальнейших химических превращений. Положение каждого соединения
на поле таблицы однозначно определяется степенью окисления центрального атома и
природой лиганда. Это значительно облегчает поиск информации и помогает создать
общую картину химии данного элемента.
Пособие предназначено для школьников, изучающих углубленный курс неорганиче¬
ской химии, абитуриентов, поступающих в вузы химического профиля, а также
студентов нехимических специальностей.
ББК 24.1
Учебно-справочное издание
Верстка: Бобков А. В., Варванина Г. В.
Редактор: Кокуева Г. Н.
Подписано в печать 20.11.2008. Формат 90х60'/8. Бумага офсетная № 1.
Печать офсетная. Печ. л. 3. Тираж 3000 экз. Заказ № 12351.
Отпечатано по технологии CtP в ОАО «Печатный двор» им. А. М. Горького.
197110, Санкт-Петербург, Чкаловский пр., 15.
Книги издательства МЦНМО можно приобрести по адресу:
119002, Москва, Большой Власьевский пер., 11. Тел. (499) 241-72-85
ISBN 978-6-94067-461-4
Все права защищены. Никакая часть настоящего издания не
может быть воспроизведена, скопирована, размножена, передана
электронным или каким-либо иным способом для коммерческих
целей без получения предварительного письменного согласия
владельца авторских прав.
© Турова Н.Я., содержание, 2009 г.
© Высший химический колледж Российской
академии наук, компьютерный набор, 2009 г.
© МЦНМО, издание, 2009 г.
Содержание
Введение 4
Принятые сокращения 6
Г алогены 8
Ионы галогенов в водном растворе 10
Фториды галогенов 11
Марганец 12
Кислород 14
Сера 16
Хром 18
Азот 20
Фосфор 22
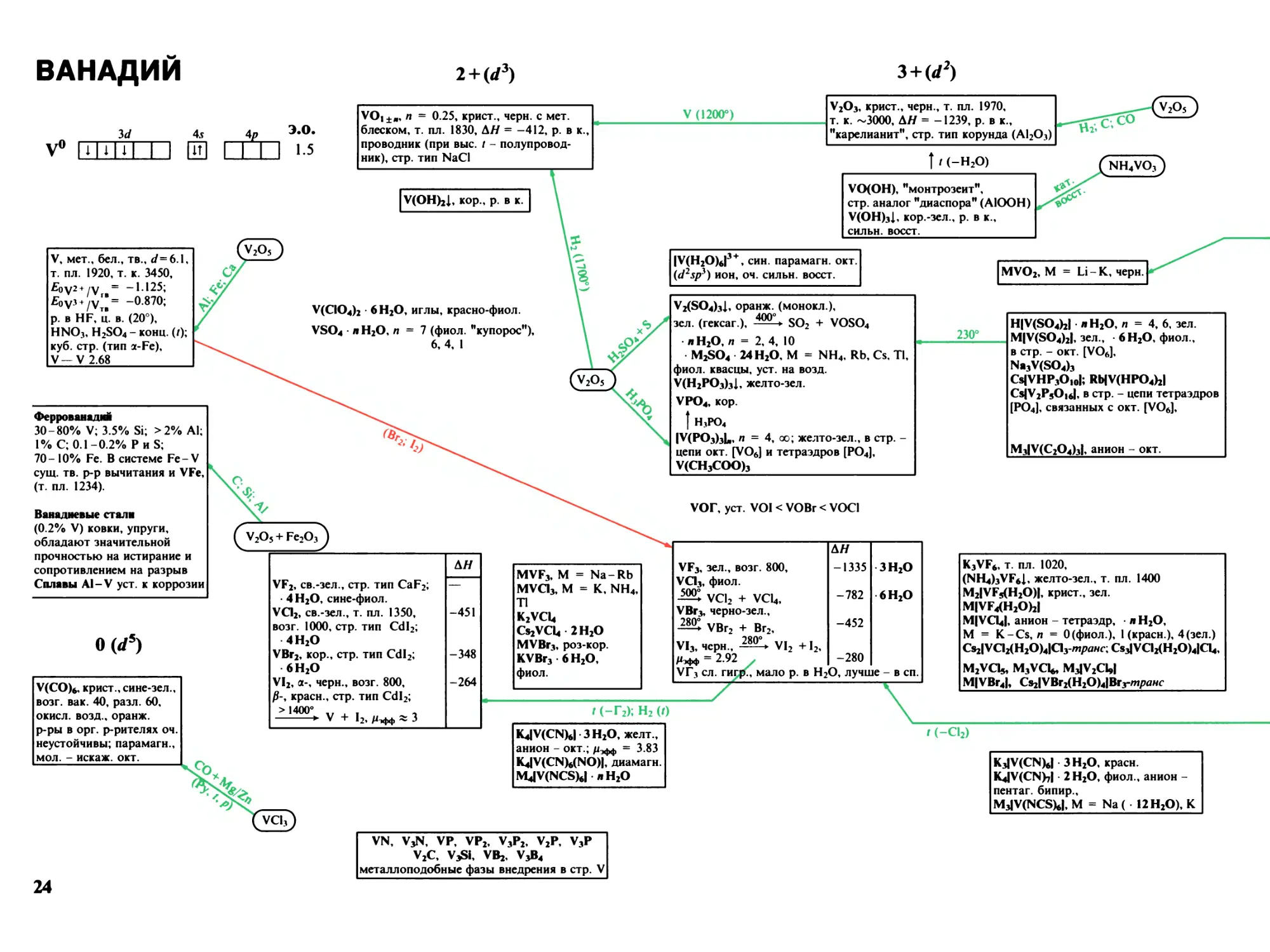
Ванадий 24
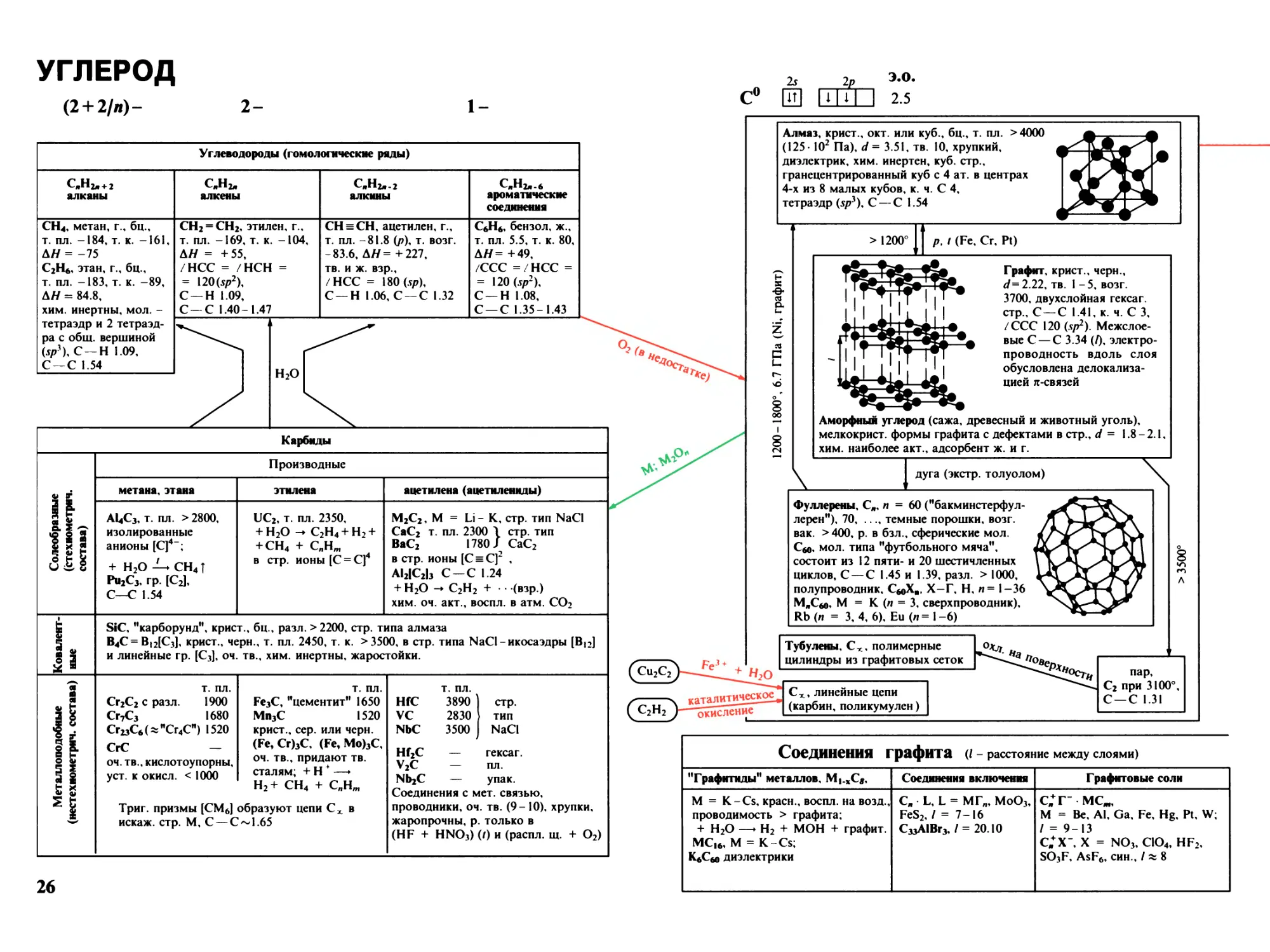
Углерод 26
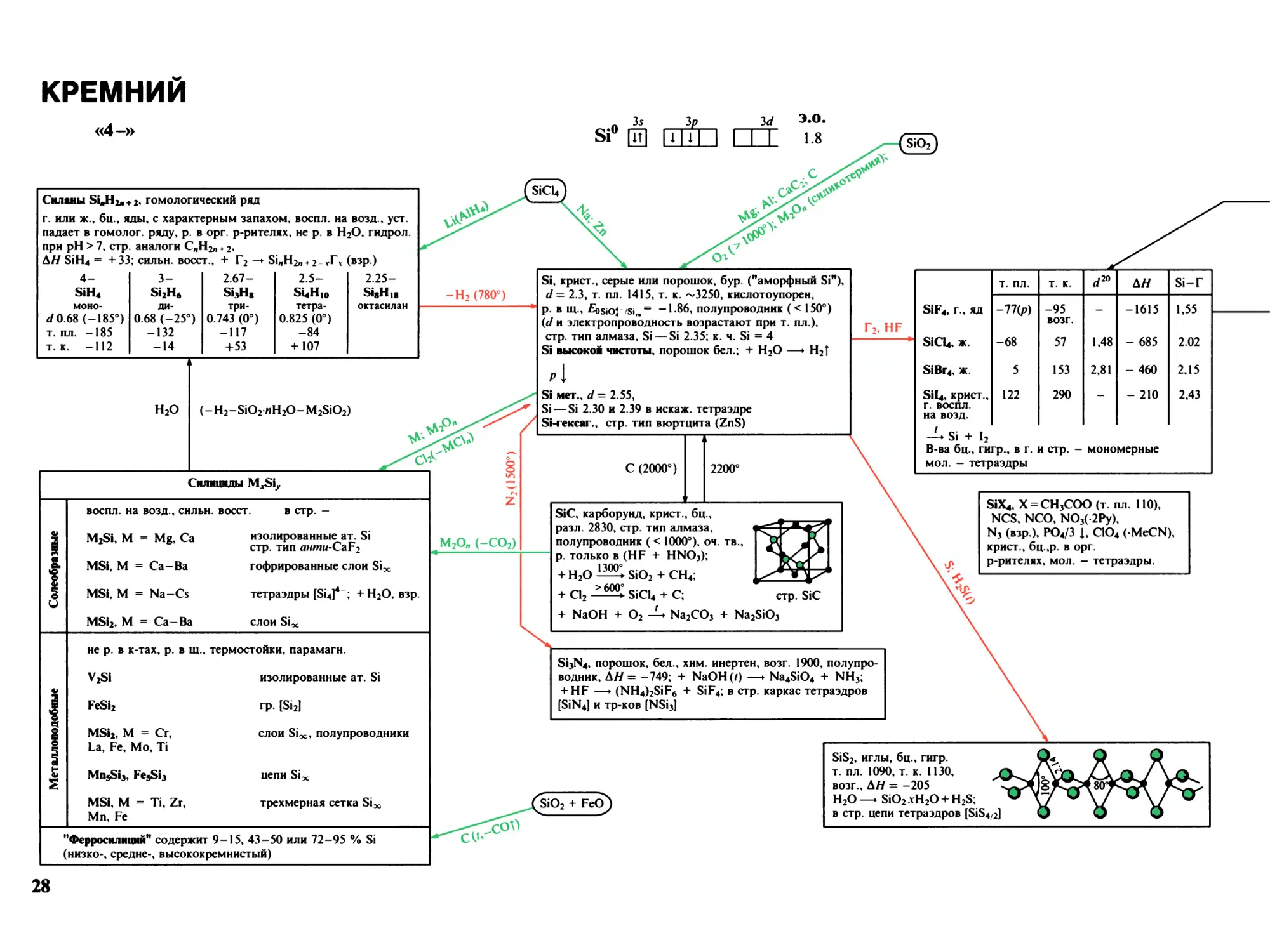
Кремний 28
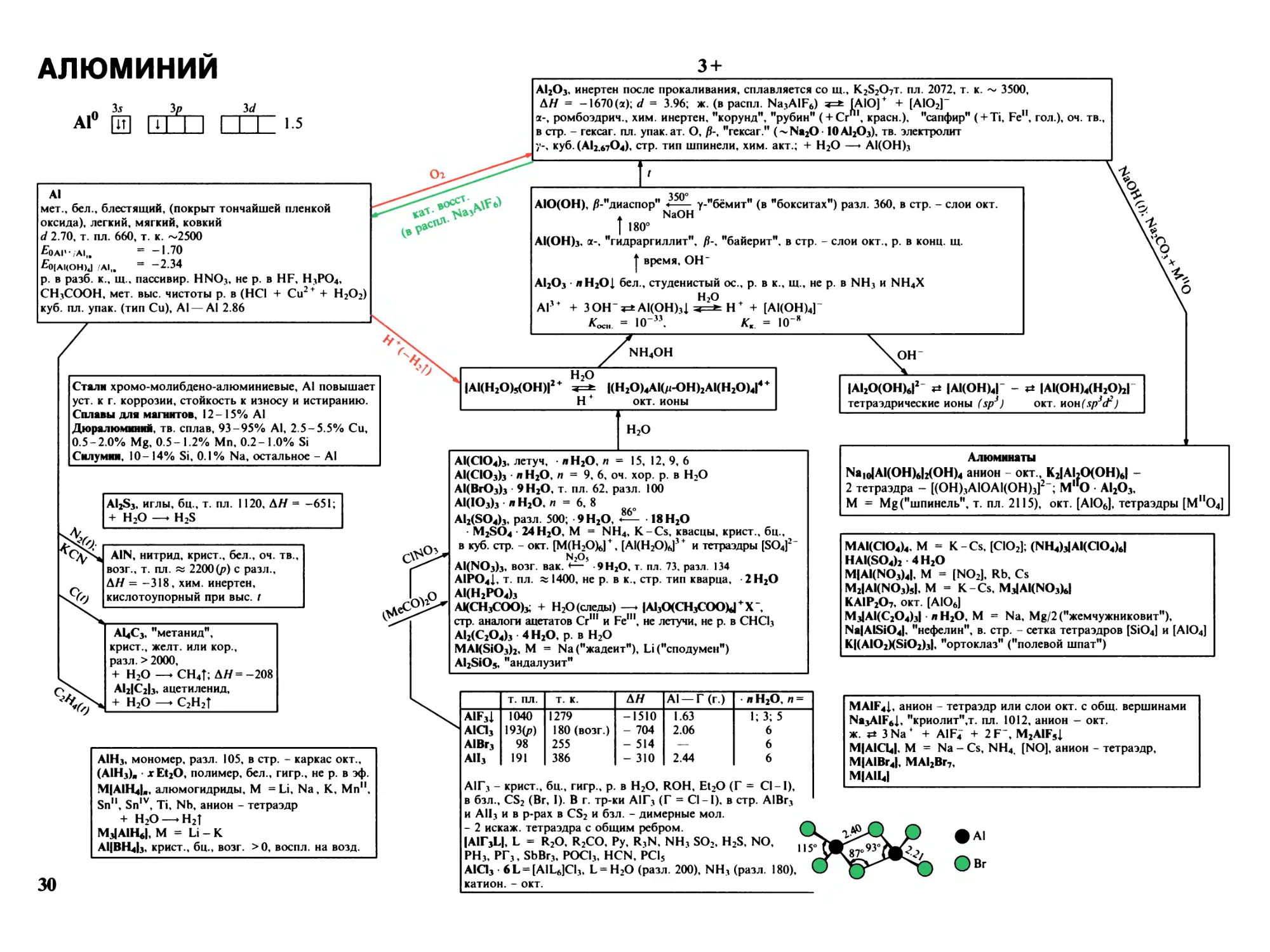
Алюминий 30
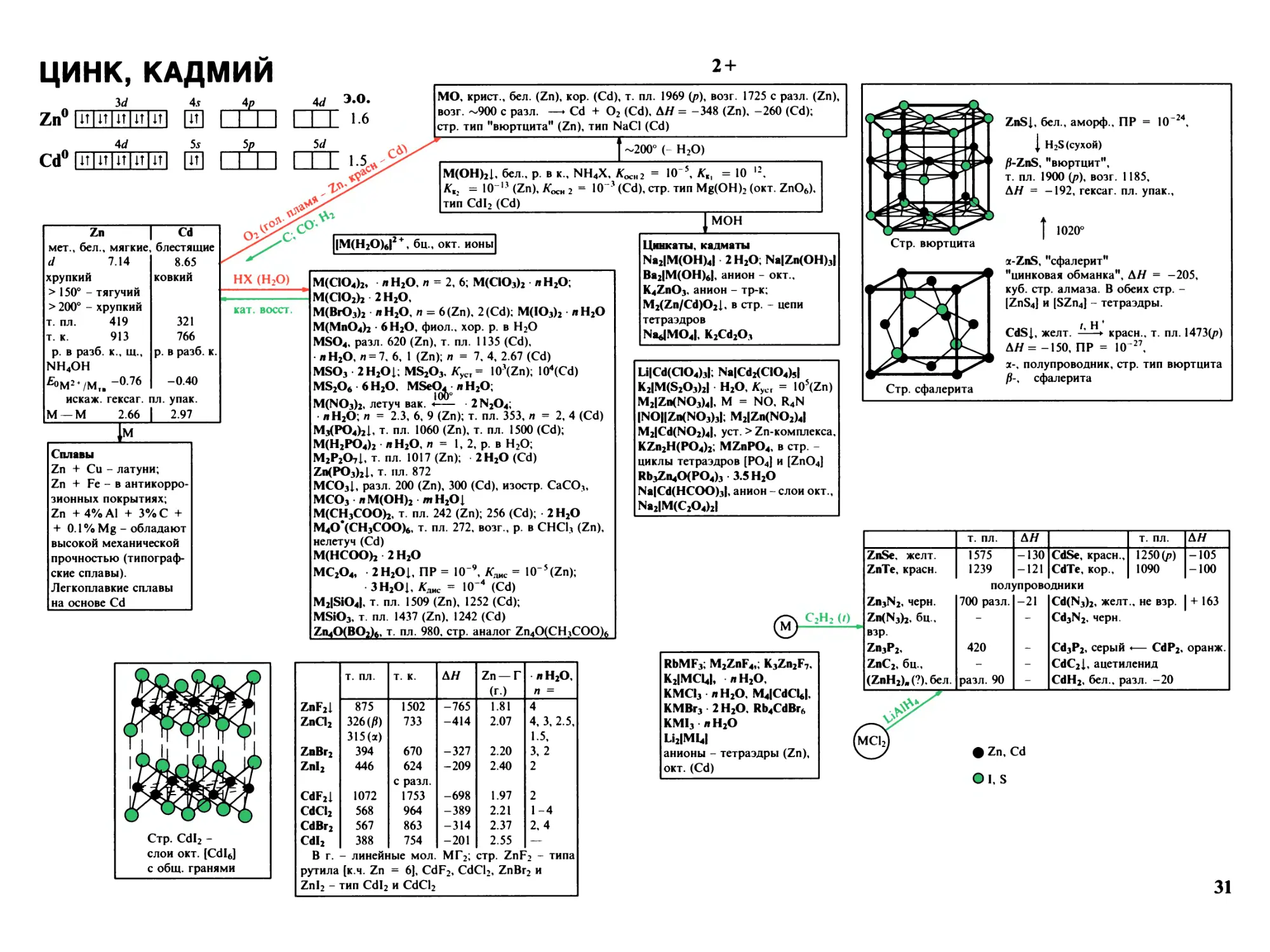
Цинк, кадмий 31
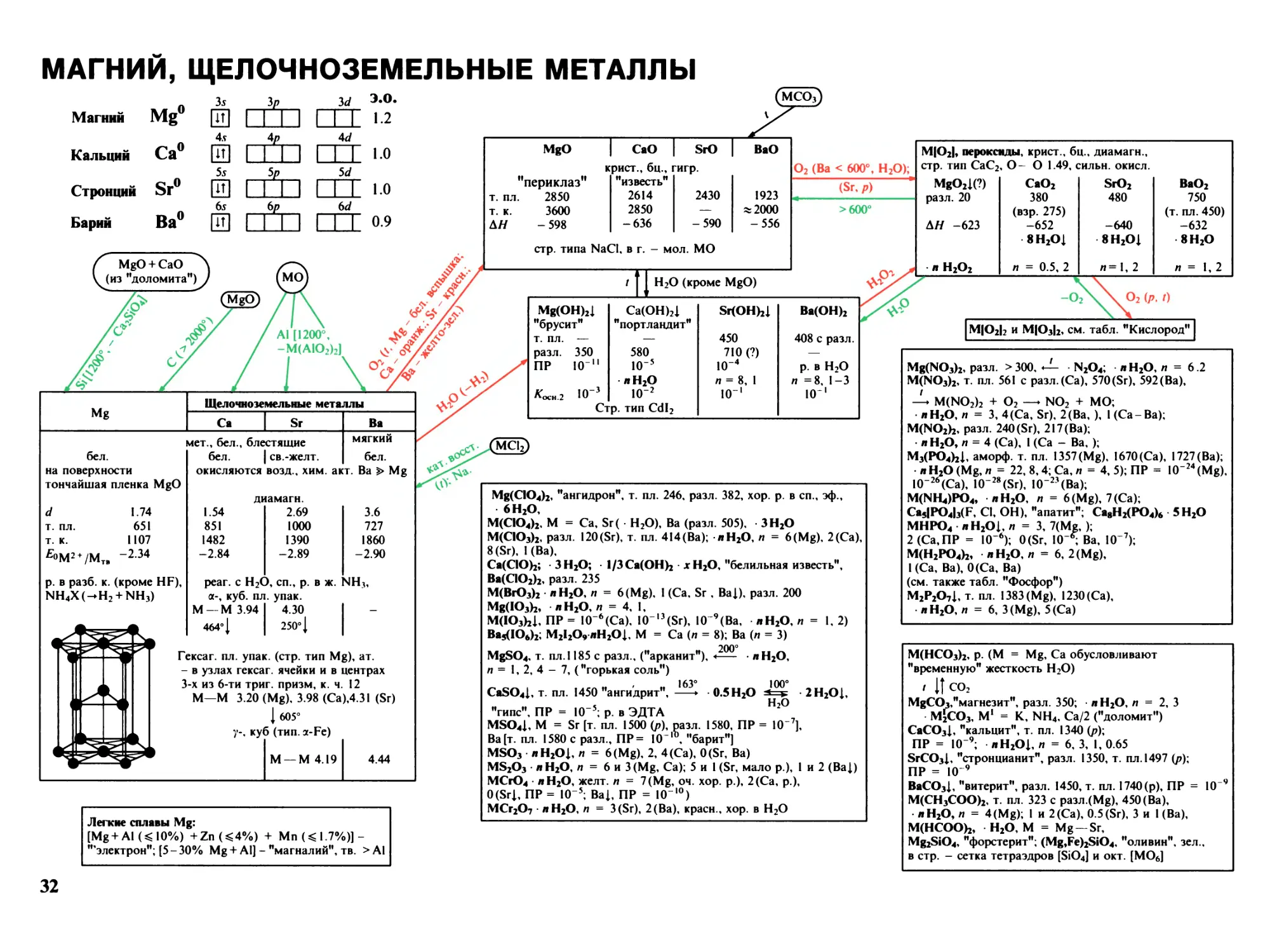
Магний, щелочноземельные металлы 32
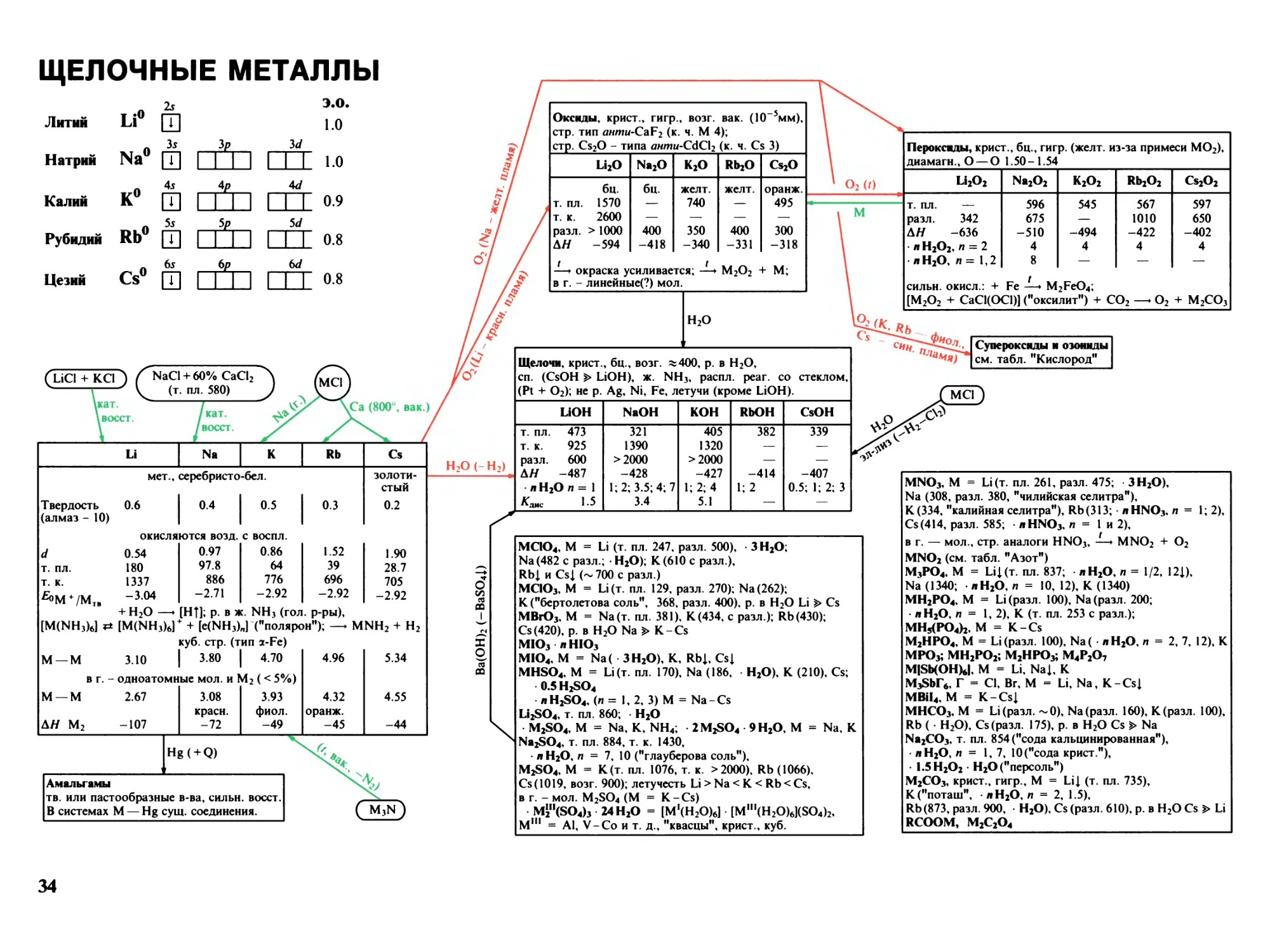
Щелочные металлы 34
Медь 36
Серебро 38
Золото 39
Железо 40
Кобальт 42
Никель 43
Фториды инертных газов 44
Валентные состояния
и координационные многогранники центрального атома. ... 45
Некоторые сведения о пространственном
строении (стереохимии) молекул и ионов 46
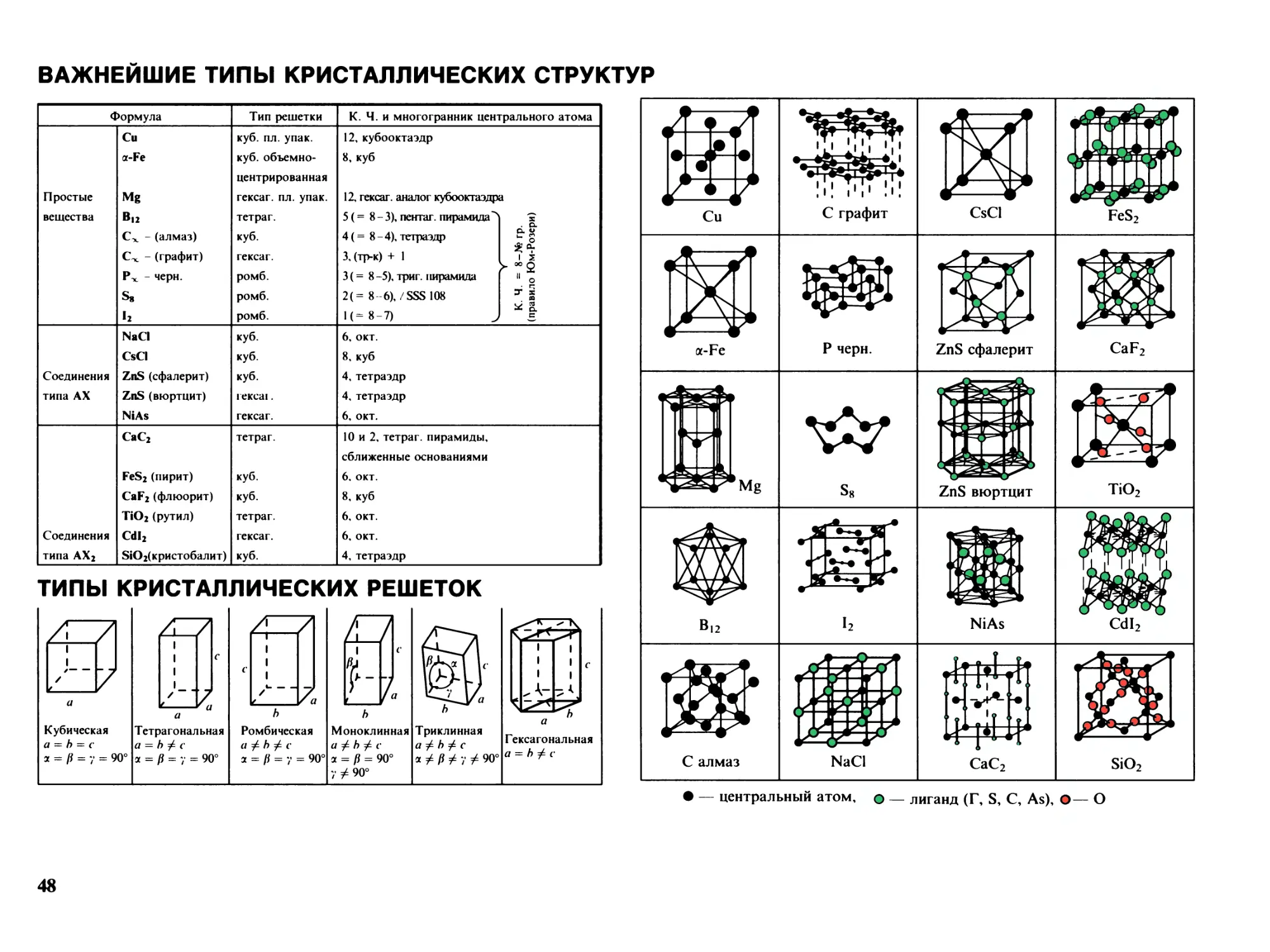
Важнейшие типы кристаллических структур 48
3
Введение
Есть ли логика в неорганической химии? На этот вопрос
большинство школьников, а иногда и студентов отвечают отрица¬
тельно. Принято считать, что эта описательная наука чем-то
напоминает ботанику или зоологию, только вместо огромного
числа растений или животных здесь приходится запоминать форму¬
лы неорганических соединений, методы их синтеза и свойства. Это
мнение может измениться, если открыть книгу (или скорее альбом)
"Таблицы-схемы по неорганической химии". Это оригинальное
издание сочетает в себе функции учебного пособия и справочника.
При этом оно может оказаться полезным как школьнику, начинаю¬
щего изучать химию (желательно с интересом), так и студенту
химического или нехимического вуза. Как построены "Таблицы"? В
основу их положена идея Jl.Полинга об описании химии каждого
элемента с помощью шкалы формальных степеней окисления. Они
состоят из отдельных таблиц-схем, каждая из которых посвящена
какому-либо одному элементу или группе элементов-аналогов.
Таблицы включают сведения о наиболее важных соединениях
данного элемента, кратко описаны их основные характеристики.
Для того, чтобы найти нужное соединение на поле таблицы,
необходимо прежде всего определить степень окисления элемента в
его составе. Соединения располагаются слева направо в порядке
возрастания степени окисления (она указана в верхней части листа).
Для данной положительной степени окисления вверху столбца
помещен оксид, под ним — продукт взаимодействия оксида с
водой — кислота или основание. Далее вниз по вертикали — соли
кислородных кислот (по мере уменьшения номера группы централь¬
ного атома аниона — галогенаты, сульфаты, нитраты, фосфаты,
карбонаты, карбоксилаты), затем следуют бинарные соединения
ЭXw — галогениды, сульфиды, некоторые типы координационных
соединений. Производные, в которых элемент входит в состав
катиона, расположены в левом столбце, анионные формы —
справа. Для соединений, в которых элемент имеет отрицательную
степень окисления, вверху страницы помещен гидрид, под ним его
катионные и анионные формы.
Таким образом, каждый лист представляет собой своеобразную
4
систему координат: по горизонтали — степень окисления, по
вертикали — заданный порядок расположения производных. По¬
ложение каждого соединения определено однозначно, что очень
облегчает поиск информации, касающейся его свойств, путей синтеза
и дальнейших превращений. Окислительные переходы обозначены
красными стрелками, восстановительные — зелеными, реакции,
происходящие без изменения степени окисления — черными. Такой
порядок позволяет наглядно представить окислительно-восстанови¬
тельные переходы, реакции диспропорционирования и т.д., предста¬
вляющие наибольшие трудности на начальном этапе изучения
неорганической химии. Над стрелками указан реагент и другие
условия проведения реакции — растворитель, катализатор, давление,
температура, облучение видимым (Ziv-B) или ультрафиолетовым (Av-
УФ) светом. Побочные продукты реакции обозначены в скобках со
знаком "минус".
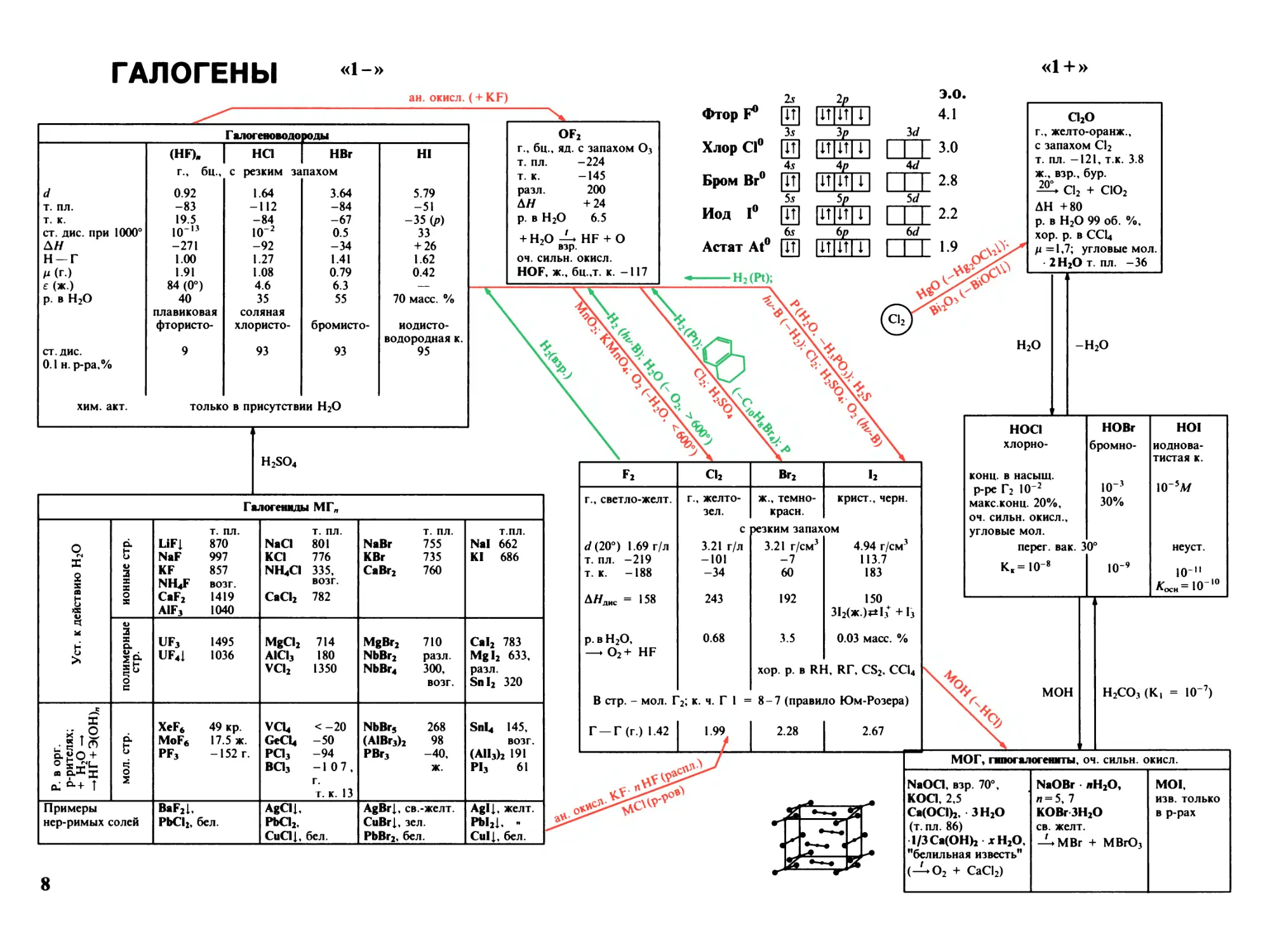
Описанный порядок можно проиллюстрировать на примере
таблицы "Галогены". С левого края таблицы помещены производ¬
ные в степени окисления «1-», т.е. галогеноводороды — HГ, под
ними — соли галогеноводородных кислот. Правее расположены
данные о свободных галогенах (в "нольвалентном" состоянии).
Следующий — правый столбец посвящен соединениям в степени
окисления «1 +». Вверху помещен единственный известный оксид —
СЬО, далее следуют три кислоты — хлорно-, бромно- и иодно-
ватистая НОГ (Г = Cl, Br, I), еще ниже их соли гипохлориты,
-бромиты, -иодиты. Двигаясь вправо, мы наблюдаем немногочи¬
сленные производные в степени окисления «3 + »: хлористую кислоту
— HClO2, ее соли — хлориты, а также бромиты (соответствующая
им кислота неизвестна). Далее следуют оксиды хлора и брома в
степени окисления «4 + ». Поскольку кислота, соответствующая
ClO2, не существует, его взаимодействие с водой сопровождается
диспропорционированием с образованием двух кислот со степенями
окисления «3 + » и «5 + ». Среди 5-тивалентных оксидов известен
только I2O5, хотя существуют кислоты — HTO3 — хлорно-, бромно-
и йодноватая и их соли — МГОз — галогенаты. Степень окисления
«6 + » реализуется лишь формально: в составе известных оксидов
СЮз и 12Об присутствуют атомы галогенов в двух степенях
окисления — «5 + » и «7 + ». Среди семивалентных соединений
известен только оксид хлора — О2О7, но три кислоты НГО4 —
хлорная, бромная и йодная, а также их соли — перхлораты,
-броматы и -иодаты.
Для характеристики отдельных соединений приводятся следую¬
щие данные:
- формула, иногда название (образцы применения номенклатуры
IUPAK — Международного Союза Чистой и Прикладной Химии —
содержатся в таблицах "Азот” и "Железо"), в остальных случаях —
только формулы соединений и иногда их тривиальные названия;
- внешний вид (агрегатное состояние, цвет);
- плотность — d (для жидкостей и твердых веществ — г/см3, для
газов — г/л);
- отношение к воде, кислотам, щелочам и органическим раствори¬
телям (соединения, нерастворимые в воде, обозначены как осадки);
- температуры плавления, кипения или возгонки, начала термиче¬
ского разложения — °С;
- стандартная энтальпия образования ЛЯ ( = Atf2^8, кДж/моль)
характеризует термодинамическую стабильность соединения: отри¬
цательные значения свидетельствуют об его устойчивости, положи¬
тельные — о нестабильности;
- константы диссоциации кислот и оснований (Ak и Koch)
„ [Н+ПХ-] „ [М+][ОН-]
характеризуют их силу: Kk = ; Kocit = [МОН]
^ ч ^ [МЦ_,][Ь]
- константы устойчивости комплексов (Куст): Куст = -—
[MLwJ
- произведение растворимости (ПР):
ПР(АГВ,) = IA+HBT
характеризует растворимость малорастворимых соединений
(концентрации ионов в насыщенном растворе — моль/л).
В отдельных случаях описаны магнитные и диэлектрические
свойства молекул, а также элементы их структуры:
- эффективный магнитный момент 0*эфф.) парамагнитных соедине¬
ний, обусловленный присутствием неспаренных электронов, измер¬
яется в магнетонах Бора (МВ). Он связан с числом неспаренных
электронов следующим соотношением: 1 эл. — 1.73, 2 эл. — 2.83,
3 эл. — 3.88, 4 эл. — 4.90, 5 эл. — 5.92 МВ;
- диэлектрическая проницаемость (е) показывает, во сколько раз
притяжение или отталкивание двух зарядов в данной среде меньше,
чем в вакууме (е = 1);
- дипольный момент (ц) характеризует полярность молекулы, он
равен произведению расстояния между полюсами на величину
заряда электрона: г ~ 10~8см = А; е = 4.8хЮ-10 эл.ст.ед.;
/х ~ IO-18 эл.ст.ед. см = D (1 дебай).
- тип кристаллической структуры, координационное число(к.ч.) и
многогранник центрального атома, тип гибридизации, величины
межатомных расстояний А — В (в А, I А = IO-8 см = IO-1 нм).
Значение электроотрицательности элемента по шкале Полинга
характеризует способность атома данного элемента оттягивать на
себя электронную плотность по сравнению с атомами других
элементов.
В приложении приводится сводная таблица (с комментариями к
ней), посвященная строению неорганических молекул и ионов. При
ее составлении использовались общие представления метода валент¬
ных связей о соответствии типа координационного многогранника
характеру гибридизации центрального атома. Отдельная таблица
посвящена важнейшим типам кристаллических структур молекул
или ионов, характерных для неорганических соединений.
Настоящее издание составлено на базе справочного и учебного
пособия "Неорганическая химия в таблицах”, неоднократно изда¬
вавшегося в нашей стране и Японии и предназначавшегося для
студентов, аспирантов, преподавателей вузов и химиков различных
специальностей. Опыт использования этого пособия за последние 30
лет показал, что во многих случаях оно успешно применялось также
школьниками, проходящими углубленный курс неорганической
химии, и абитуриентами. Однако большой объем книги, содержа¬
щей "избыточную" информацию, привел к необходимости подгото¬
вить новое издание, ориентированное на школьников. Помимо
элементов, входящих в школьный курс химии, казалось целесоо¬
бразным привести сведения об отдельных представителях
3^-металлов, а также о фторидах галогенов и инертных газов —
5
окислителях в синтезе соединений в высших степенях окисления.
Предполагается использование этого пособия в процессе обучения в трех
аспектах. На начальном этапе знакомства с химией данного элемента при
чтении материала учебника рекомендуется найти интересующее соединение
(как в «атласе») и постараться объяснить его свойства, исходя из положения
на поле таблицы. Затем объяснить пути его синтеза и превращений под
действием окислителей, восстановителей и т.д., написать уравнения реакций
(отсутствующие в тексте). На втором этапе при обобщении материала,
подготовке к экзаменам в школе и вступительным в вуз следует
рассмотреть все данные, приведенные в таблицах, в качестве «информа¬
ции к размышлению». Их можно использовать для установления законо¬
мерностей изменения свойств соединений данного элемента по степеням
окисления, группам элементов-аналогов, рядам и т.д., связи термодинами¬
ческих данных, геометрических параметров молекул и ионов с электронным
строением. Наконец, третья возможная область применения таблиц —
быстрый и удобный поиск справочных данных. Особенно это касается
химии элементов, не включаемых обычно в школьную программу, причем
для пользователя, освоившего работу с таблицами, получение этой
информации не потребует специальной подготовки.
Автор приносит искреннюю благодарность учителю химии ГОУ лицей
№ 13-03 Г.Н. Кокуевой за моральную поддержку, ценные советы и критиче¬
ские замечания, а также и доцентам Химического факультета МГУ
М.Е. Тамм, А.А. Дроздову, М.Г. Розовой, аспирантке Е.В. Сусловой,
студенту А. Гаврикову за дружескую помощь. Особой благодарности
заслуживают участники «Школы юного химика» при Химическом факульте¬
те МГУ В. Никитков, И. Тябликов, а также выпускница химического класса
школы № 57 М. Парнес, оценившие предложенный материал с точки зрения
его доступности и целесообразности использования в школах с углубленным
изучением химии. Автор весьма признателен заместителю председателя
Высшего химического колледжа РАН И.В. Свитанько, профессору Химиче¬
ского факультета МГУ Г.В. Лисичкину, З.П. Свитанько, интерес и инициати¬
ва которых обеспечили издание этого пособия, а также А.В. Бобкову и
Г.В. Варваниной за тщательное выполнение компьютерного набора.
Замечания и пожелания просьба направлять по адресу: 119992, ГСП 3,
Москва, Воробьевы Горы, Химический факультет МГУ, кафедра неорга¬
нической химии, е-таП: па1аПе@1пог§.сЬет.т8и.ги, тел. 939-33-39.
6
Принятые сокращения
акс. - аксиальный
акт. - активен, ~ность
аморф. - аморфный
ан. - анодный
ат. - атом
атм. - атмосфера (газа)
ац. - ацетон
бел. - белый
бзл. - бензол, ~ ьный
бц. - бесцветный
бипир. - бипирамида
бур. - бурый
вак. - вакуум
вал. - валентный
в-во - вещество
взр. - взрыв, ~ чатый
возг. - возгоняется
возд. - воздух
воспл. - воспламеняется
восст. - восстановитель, ~ ный
вязк. - вязкий, ~ость
г. - газ, ~ овый
Г - галоген
гексаг. - гексагональный
гигр. - гигроскопичный
гидрол. - гидролиз, дуется
гол. - голубой
гр. - группа
диамагн. - диамагнитный
дис. - диссоциация, ~ иирует
желт. - желтый
ж. - жидкость
зел. - зеленый
изб. - избыток
изв. - известен
изостр. - изоструктурен
искаж. - искаженный
к-р - катализатор
кат. - катодный
к. - кислота, ~ ный
колл. - коллоидный
К - константа
конц. - концентрация,
концентрированный
к.ч. - координационное число
кор. - коричневый
красн. - красный
крист. - кристаллы, ~ ический
куб. - кубический
мгнов. - мгновенно
медл. - медленно
M - металл
мет. - металл, ~ ический
мин. - минимум, минута
мол. - молекула, ~ ярный
монокл. - моноклинный
мост. - мостиковый
неспар. - неспаренный (эл-н)
образ. - образует, ~ся
общ. - общий
об. - объем, ~ ный
окисл. - окисление, ~ итель
окт. - октаэдр, ~ ический
оранж. - оранжевый
орг. - органический
ос. - осадок
осн. - основание, ~ный
охл. - охлаждение
пентаг. - пентагональный
пл. упак. - плотнейшая упаковка
ПР - произведение растворимости
пурп. - пурпурный
разб. - разбавленный
разл. - разлагается, ~ ожение
распл. - расплав
р-р - раствор
р. - растворим, ~ ость
р-ритель - растворитель
реаг. - реагирует
реакц. - реакционный
р-ция - реакция
роз. - розовый
ромб. - ромбический
св. - светло
св-ва - свойства
с. - секунда
сильн. - сильный
син. - синий
сл. - слабый
ст. - степень
стр. - структура, ~ ный
сущ. - существует
тв. - твердый
т. к. - температура кипения, cC
т. пл. - температура плавления, 0C
т. разл. - температура разложения, 0C
тетраг. - тетрагональный
тр-к - треугольник
триг. - тригональный
трикл. - триклинный
УФ - ультрафиолетовый
уст. - устойчив, ~ ость
ферромагн. - ферромагнитный
фиол. - фиолетовый
ц. в. - царская водка
(1 об. HNO3 н-3 об. HCl)
X - анион
цв. - цвет
ч. - час
черн. - черный
щ. - щелочь
экв. - экваториальный
экстр. - экстракция, ~ агируется
эл-лиз - электролиз
эл. - электрон, ~ ный
Э - элемент
Э. О. - электроотрицательность
эф. - эфир диэтиловый, Et2O
Условные обозначения
Ac - ацил, CH3CO
Am - амин
d - плотность, г/см3
е - электрон
E0 - нормальный электродный
потенциал, В
[Н|] - водород в момент выделения
Ziv-B - облучение видимым светом
Zjv-YO - облучение ультрафиолетовым
светом
р - давление
Py - пиридин, ^""^n
t - температура, 0C
е - диэлектрическая проницаемость
Atf - стандартная энтальпия
образования, кДж/моль
ц - дипольный момент, D
Итфф ~ магнитный момент, MB
ф - октаэдр (тетраэдр и т. д.) —
незавершенный координационный
многогранник, одну или
несколько вершин которого
занимают локализованные
электронные пары
7
ГАЛОГЕНЫ
«1-»
«1+»
ан. окисл. (+ KF)
Г алогеноводороды
год
(HF). "I HO I HBr
г., бц., с резким запахом
d
т. пл.
т. к.
ст. дис. при 1000°
АН
Н —Г
H (г.)
е(ж.)
р. в H2O
ст. дис.
0.1 н.р-ра,%
0.92
-83
19.5
IO'3
-271
1.00
1.91
84 (0°)
40
плавиковая
фтористо-
1.64
-112
-84
IO"2
-92
1.27
1.08
4.6
35
соляная
хлористо-
93
3.64
-84
-67
0.5
-34
1.41
0.79
6.3
55
бромисто-
93
HI
5.79
-51
-35 (р)
33
+ 26
1.62
0.42
70 масс. %
иодисто-
водородная к.
95
только в присутствии H2O
г., бц.
т. пл.
т. к.
разл.
АН
р. в H2O
OF2
яд. с запахом O3
-224
-145
200
+ 24
6.5
+ H2O -U HF+ О
взр.
04. сильн. окисл.
HOF, ж., 6ц.,т. к. -117
Ъ
И
35
Хлор Cl0 QT]
45
И
55
И
bs
Астат At0 [ТГ|
Фтор F0
Бром Br
Иод I0
UtTTf
к.
цт It
иж
ЕЖ
6р
ШЕ
H2(Pt);
H2SO4
Cl2O
г., желто-оранж.,
с запахом Cl2
т. пл. -121, т.к. 3.8
ж., взр., бур.
20°
ClO2
Cl2 +
АН +80
р. в H2O 99 об. %,
хор. р. в CCl4
/1=1,7; угловые мол.
2 H2O т. пл. -36
H2O
Галогенмды МГ„
Уст. к действию H2O
О.
В
V
2
X
X
о
X
т. пл.
LiFj 870
NaF 997
KF 857
NH4F возг.
CaF2 1419
AIF3 1040
т. пл.
NaCI 801
KCI 776
NH4CI 335,
возг.
CaCI2 782
т. пл.
NaBr 755
KBr 735
CaBr2 760
т.пл.
NaI 662
KI 686
U
2
X
о.
Se-
о
с
UF3 1495
UF4I 1036
MgCI2 714
AICI3 180
VCI2 1350
MgBr2 710
NbBr2 разл.
NbBr4 300,
возг.
CaI2 783
MgI2 633,
разл.
SnI2 320
е
X
KtS
о.«0 +
° X5TU
CQ Q.3- X
CU *• + T
CL
В
§
2
XeF6 49 кр.
MoF6 17.5 ж.
PF3 -152 г.
VCI4 < -20
GeCI4 -50
Pa3 -94
ва3 -Ю7,
г.
т. к. 13
NbBr9 268
(AIBr3)2 98
PBr3 -40,
ж.
SnI4 145,
возг.
(AII3)2 191
PI3 61
Примеры
нер-римых солей
BaF2I,
PbCI2, бел.
AgCIj,
рьа2,
Cuaj, бел.
AgBrj, св.-желт.
CuBrj, зел.
PbBr2, бел.
AgIj, желт.
PbI2I, -
CuIj, бел.
F2
Cl2
Br2
I2
г., светло-желт.
г., желто-
зел.
ж., темно-
красн.
крист., черн.
с
эезким запахом
</(20°) 1.69 г/л
т. пл. -219
т.к. -188
3.21 г/л
-101
-34
3.21 г/см3
-7
60
4.94 г/см3
113.7
183
АЯДИС = 158
243
192
150
312(ж.)*1з++1з
р. в H2O,
— O2+ HF
0.68
3.5
0.03 масс. %
хор. р. в RH, ЯГ, CS2, CCl4
В стр. - мол. Г
2; к. ч. Г 1 =
8-7 (правило Юм-Розера)
Г —Г (г.) 1.42
1.99
I 2.28
2.67
8
-H2O
HOCI
HOBr
HOI
хлорно-
бромно-
иоднова-
тистая к.
конц. в насыщ.
р-ре Г2 IO 2
IO"3
IO-sA/
макс.конц. 20%,
30%
оч. сильн. окисл.,
угловые мол.
перег. вак. 3
0°
неуст.
OO
I
о
II
ы
!О"9
0
1
Z о
о Il
—" I
мон
H2CO3 (К,
IO7)
МОГ, гшюгалогешпы, оч. сильн. окисл.
NaOa, взр. 70°,
KOa, 2,5
Ca(OCI)2, ЗН20
(т. пл. 86)
1/3 Ca(OH)2 х H2O,
"белильная известь”
(-^O2 + CaCl2)
NaOBr JiH2O,
п = 5, 7
KOBr зн2о
св. желт.
MBr + MBrO3
MOI.
ИЗВ. ТОЛЬКО
в р-рах
3 +
4 +
5 +
«6 + »
Лу-УФ (-Cl2); Oj
7 +
Z
CIO2
г., желто-бур.
</=1.64,
т. пл. -59,
ж., к рас н.,
ЛЯ = + 104
взр.
димер в CCU и
стр., /i = 0.78,
хор. р. в H2O,
парамагн.
Br2O4
крист.,
св.-желт.,
разл. 40
I2O4 =
[ImO] + PvO3]-
крист., желт.
I2O5
крист., бц., разл. 180
ЛЯ = -184
HCIO2,
хлористая к.,
быстро разл.
в разб. р-ре
(- HCl + НСЮ,+ ClO2)
K = IO"2,
оч. сильн. окисл.
-H2O
(240°)
H2SO4
Хлориты
NaCIO2, ЗН20
Ca(CIO2)2 4 H2O
Ba(CIO2)2
AgCIO2I, Pb(CIO2)2I,
желт., не окисл.;
MCl + MClO3,
взр.,
анионы -
- угловые [:Г02]_
Бромиты
LiBrO2, H2O
Ba(BrO2)2,
бел. порошки,
-!-> MBrn+ O2,
+ H2O-»МВг„ +
+ M(BrOj)n,
ф-тетраэдры
t (-O2)
H2SO4 (-BaSO41)
хлораты
т. пл.
NaCIO3 262 с разл.
KCIO3 368, разл.400
"бертолетова” соль
Ca(CIO3)2, 2 H2O
Ba(CIO3)2 414, H2O
яд
MrO3, галогенаты
броматы
т. пл.
NaBrO3 381
KBrO3 343 с разл.
AgBrO3 разл.
Ba(BrO3)2 260 с разл.,
H2O
сл. окисл.
X
CIO3, ж., красн.,
дымящая,
т. пл. 3.5, т. к. 203,
ЛЯ = +156, взр.,
^ ClO2 + Ok
в ж. и р-ре CCl4 -
димер, в стр. -
[ClO2] * [ClO4]
V Vll
I2O6 = [IOdPO4]
крист., св.-желт.
разл. > 100°
+ H2O —
—► HIO3 + H5IO6
/(-O2)
нао3
HBrO3
(HIO3)n
хлорно-
бромно-
йодноватая к.,
сущ. только в р-ре
крист., бц.,
макс. конц. 40%
50%
</=4.63, т. пл. 110
40° взр.
с разл., K= IO"1,
сильн. к.
в р-ре п = 2-3,
оч. сильн. окисл.
х
-Se. ClO2+ Cl2O7
иодаты
NaIO3 (в "селитре")
KIO3 (изостр. MNO3)
MIO3 п HIO3
(KHI2O6, NaH2I3O9)
AgIO3I, бел.
Ba(IO3)2 —► Ba5(IO6)2 +
+ I2 + O2
окисл. - только в распл.
[:Г03] - ^-тетраэдр (Spi)
t (-O2)
CI2O7, масло, бц.,
т.пл. -90, т.к. 87,
взр. 120, d = 1.86,
(уст. > ClO3 и ClO2),
ЛЯ = +275,
р. в CCl4, /i = 0.72,
окисл. ср. силы
•
г
О
о
о
H
локализованная
эл. пара
H2O (медл.)
-H2O
(P2O5; олеум)
HCIO4
хлорная
ж., бц., </=1.77,
т. пл. -101,
т. к. 16/18 мм,
ЗНСЮ4 *=± Cl2O7 +
+ H3OIClO4]
100% (взр.), т. пл. 50
К = 38, окисл.
в конц. р-ре или при t
HBrO4 2 H2O
бромная
оч. сильн. окисл.,
макс. конц. 83%,
уст. <55%,
окисл. > HClO4
HIO4 п H2O
йодные к., крист., бц.
HIO4,
t Iooo
H4I2O9,
T 80°
H5IO6,
т.пл. 122 с разл.,
Kx = IO"2, K2 = Ю"8,
Ki = IO"15,
мол.-триг. антипризма
ан. окисл.;
Cl2; S2O82 ; XeF2
H2SO4
M2Ofl • т Г207, пергалогенаты
перхлораты
т. пл.
LiQO4 247
NaCIO4 482 с разл.
KCIO4 610 с разл.
Ba(CIO4)2 505
AgCIO4, разл. 486
сильн. окисл.
только в распл.
-броматы
MBrO4,
M = Li-Cs,
р. L^Cs,
уст. L^Cs,
-!-.MBrO3 +
+ O2
сл. окисл.,
уст. < MClO4
и MIO4
K4H2I2Oi0; Ca2I2O9I-димс зо-
КЮ4|; NaIO4 - мета-
MO2 Il H2O
M3IOs л H2O- мезопериодаты
[Г041 - тетраэдр(sp^), [IO6]3" - окт. (sp3*/2);
[IO5] - тетраг. пирамида (sp^d),
Р2О10]6- - 2 окт. с общ. ребром
-иодаты
NaH4IO6 H2O, разл. 175
= Na(H3O)P(OH)3O3] -
Na2H3IO6
M3H2IO6, M = Nal, Ва/2
Na2O2 If H2O
Na5IO6
9
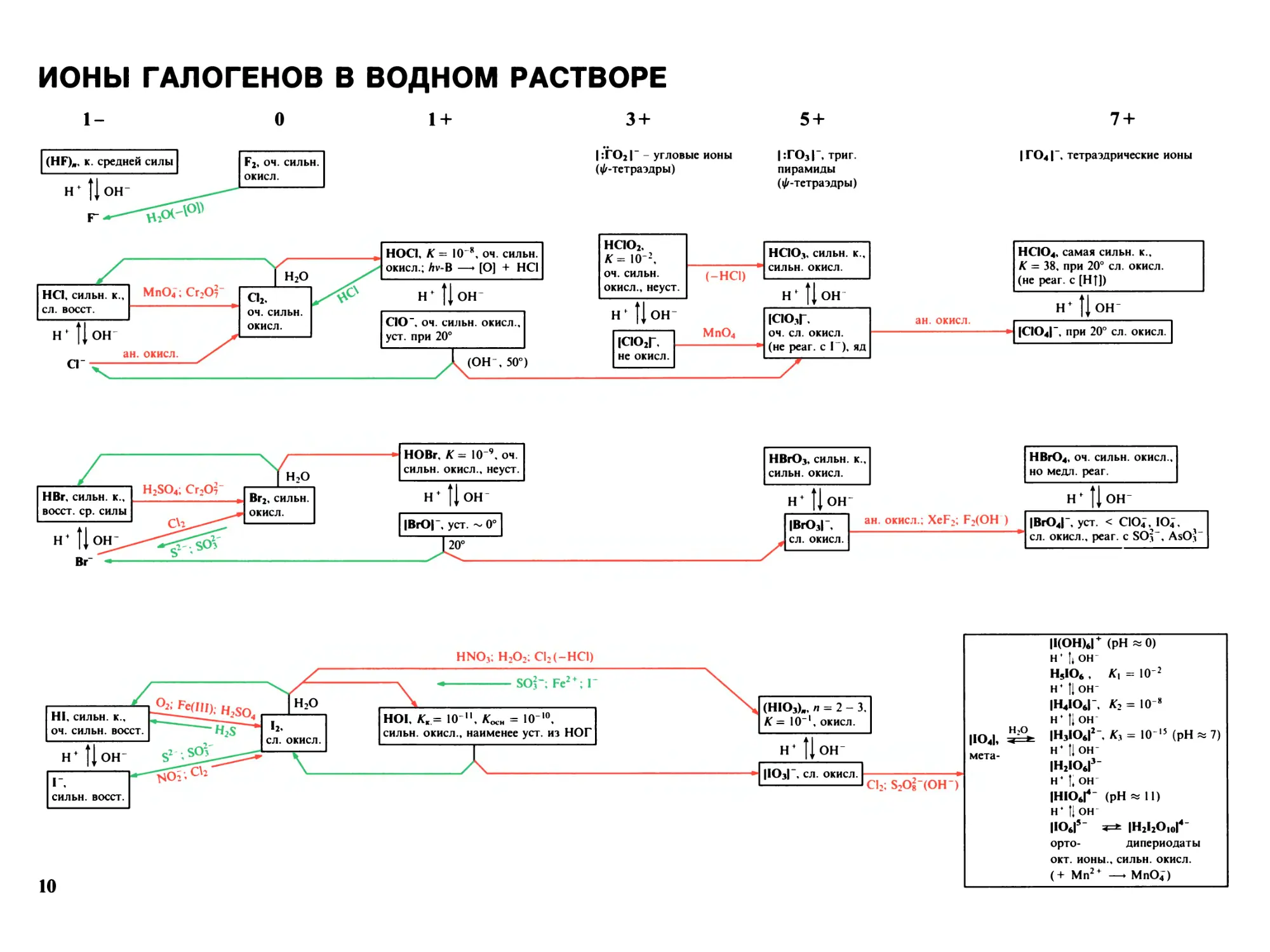
ИОНЫ ГАЛОГЕНОВ В ВОДНОМ РАСТВОРЕ
I-
о
1 +
3 +
|:Г02|" - угловые ионы
(^-тетраэдры)
5 +
|:Г03Г, триг.
пирамиды
(^-тетраэдры)
7 +
|го4| ', тетраэдрические ионы
(HF)., к. средней силы
H +
ОН“
Г
F2, оч. сильн.
окисл.
HCI, сильн. к.,
сл. восст.
Hf
ОН
сг
ан. окисл.
MnO4; Cr2O2
Cl2,
оч. сильн.
ОКИСЛ.
H2O
HOCI, K = IO 8, оч. сильн.
окисл.; Лу-В —► [О] + HCl
H +
ОН
CIO , ОЧ. СИЛЬН. окисл.,
уст. при 20°
(ОН", 50°)
HCIO2,
K = IO-2,
оч. сильн.
окисл., неуст.
Hf
он-
|СЮ2Г,
не окисл.
(-НС1)
MnO4
HCIO3, сильн. к.,
СИЛЬН. ОКИСЛ.
Hf
ОН
IClO3T
ОЧ. СЛ. ОКИСЛ.
(не реаг. с I-), яд
ан. окисл.
|СЮ4| , при 20° сл. окисл.
HCIO4, самая сильн. к.,
К = 38, при 20° сл. окисл.
(не реаг. с [HT])
H +
ОН
HBr, СИЛЬН. к.,
восст. ср. СИЛЫ
H +
ВГ
H2SO4; Cr2O2-
ОН~
H2O
Br2, сильн.
ОКИСЛ.
HOBr, K= IO 9, оч.
сильн. окисл., неуст.
H +
ОН
|ВЮГ, уст. ~ 0°
20°
HBrO3, сильн. к.,
СИЛЬН.ОКИСЛ.
H +
ОН"
ан. окисл.; XeF2; F2(OH )
IBrOJ-,
СЛ. ОКИСЛ.
HBrO4, оч. сильн. окисл.,
но медл. реаг.
Hf
OH"
|ВЮ4| , уст. < ClO4, IO4,
сл. окисл., реаг. с SO3-, AsO3-
|1(ОН)6| (pH * 0)
Hf Ii он
H5IO6 , Kx = 10 2
H^ Il OH-
|Н4Ю6Г, K2 = 10 8
Ht Ii он
IH3IOtIj-. К, = IO15 (pH « 7)
H4 Ц он-
IH2IOtI3-
H4 I* ОН
IHlOtI4- (pH «11)
H+ П ОН
IIOtI5- *=* IH2I2O10I4-
орто- дипериодаты
ОКТ. ИОНЫ., СИЛЬН. ОКИСЛ.
(+ Mn2+ — MnO4)
Н;0
IIO4I,
мета-
HNO3; H2O2: С12(-НС1)
SO3"; Fe2 + ; Г
HOI. К. = 10 ". Koch = IO-10,
сильн. окисл., наименее уст. из НОГ
H2O
HI, сильн. к.,
04. СИЛЬН. восст.
ь,
СЛ. ОКИСЛ.
г,
СИЛЬН. восст.
H +
OH-
H +
ОН
(НЮ,)., п = 2-3.
К = 10 окисл.
HO3I ', СЛ. ОКИСЛ.
Cl2; SiOllOH-)
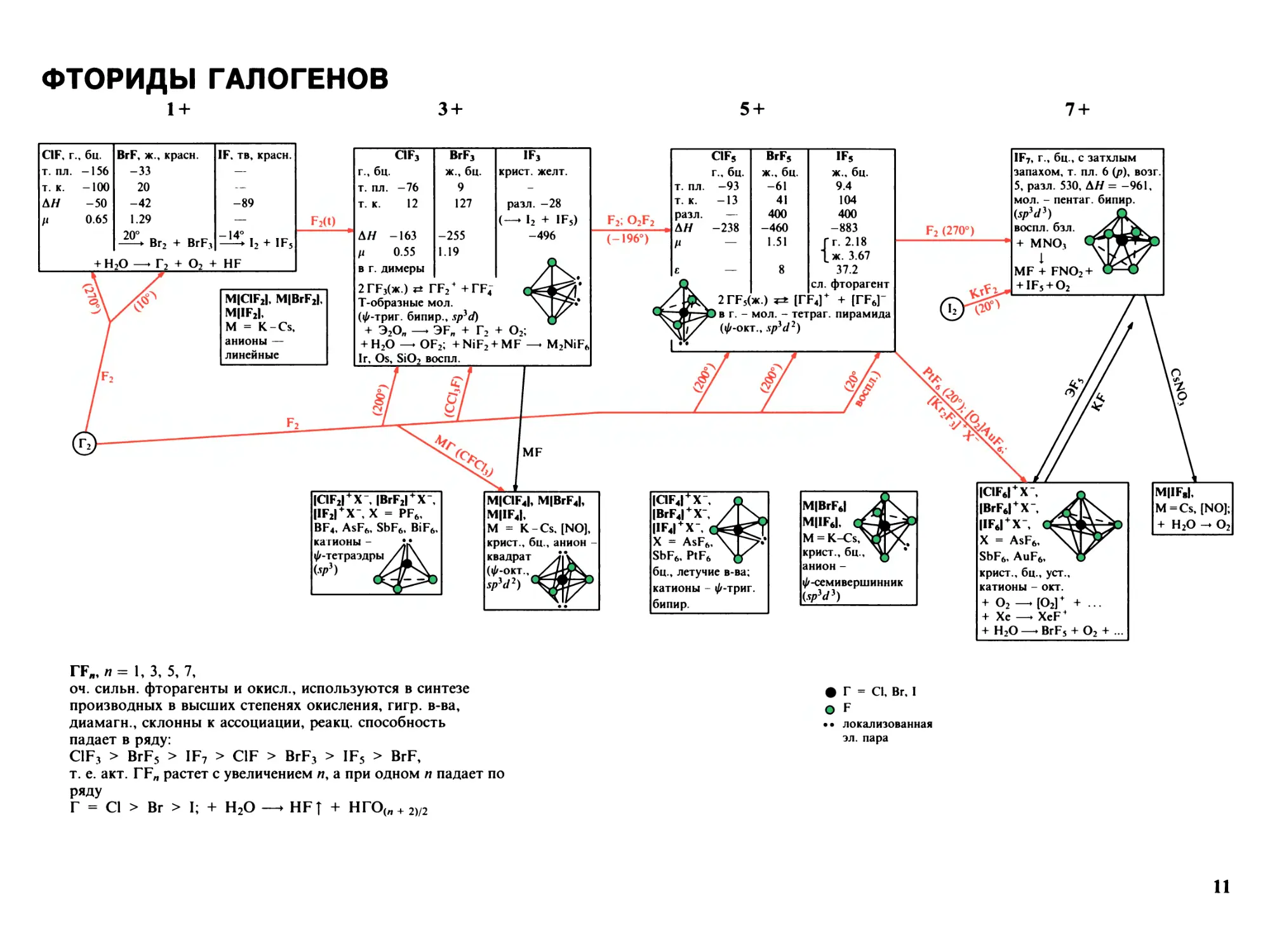
ФТОРИДЫ ГАЛОГЕНОВ
1+ 3 +
CIF, г., бц.
т. пл. -156
т. к. -100
Л// -50
/I 0.65
BrF, ж
-33
20
-42
1.29
20’
красн. IF, тв, красн.
-89
F2(I)
Br2 + BrF3
-14°
I2 + IF5
+ O2 + HF
MICIF2I, MIBrF2I,
MIIF2I,
M = K-Cs,
анионы —
линейные
г., бц.
т. пл.
т. к.
CIF3
-76
12
BrF3
ж., бц.
9
127
IF3
крист, желт.
разл. -28
— I2 + IF5)
-496
Л// -163 -255
ц 0.55 1.19
в г. димеры
2ГР3(ж.) TF2* +TF4
Т-образные мол.
(^-триг. бипир., Sph(I)
+ Э2Оя —► SFn + Г-) + O2;
+ H2O — OF2; + NiF2 + MF — M2NiF6
Ir, Os, SiO2 воспл.
ICIF2I + X", IBrF2I + X',
IIF2I + X', X = PF6,
BF4, AsF6, SbF6, BiF6,
MlClF4I, MfBrF4I,
MIIF4I,
M = K -Cs, [NO],
катионы - V
крист., бц., анион -
^-тетраэдры /71\
квадрат J
(ф-отт., XJj-
sPiJ2)
Z
ГГЯ, «=1,3, 5, 7,
оч. сильн. фторагенты и окисл., используются в синтезе
производных в высших степенях окисления, гигр. в-ва,
диамагн., склонны к ассоциации, реакц. способность
падает в ряду:
ClF3 > BrF5 > IF7 > ClF > BrF3 > IF5 > BrF,
т. е. акт. TFn растет с увеличением и, а при одном и падает по
ряду
Г = Cl > Br > I; + H2O —* HFT + НГО(п + 2)/2
5 +
7 +
F2; O2F2
(-196»)
CIF5
BrF5
IF5
г., бц.
ж., бц.
ж., бц.
т. пл.
-93
-61
9.4
т. к.
-13
41
104
разл.
—
400
400
АН
-238
-460
-883
И
—
1.51
Гг. 2.18
\ж. 3.67
E
—
8
37.2
сл. фторагент
2ГР5(ж.) IrF4I+ + [ГР6]-
в г. - мол. - тетраг. пирамида
(ф-окт., XpiJ2)
IQF4I + X-
IBrF4I + X-
IIF4I + X-,
X = AsFft
SbF6, PtF6
бц., летучие в-ва;
катионы - ^-триг.
бипир.
F2(270°)
IF7, г., бц., с затхлым
запахом, т. пл. 6 (р), возг.
5, разл. 530, AH = -961,
мол. - пентаг. бипир.
(Sp3Cli)
воспл. бзл.
+ MNO1
1
MF + FNO2 +
+ IF5 + O2
MIBrF6I
MIIF6I,
M = K-Cs,
крист., бц.,
анион -
^-семивершинник
(SP3J3)
ICIF6I + X', г
IBrF6I + X", У
ПК* I + Y- PL-U
|1Г6| А , Lral
X = AsF6, \Д
SbF6, AuF6, х
крист., бц., уст.,
катионы - окт.
+ O2-. [O2]+ +
+ Xe —► XeF4
+ H2O —♦ BrF5 +
O2 + ...
MIIF8I,
M=Cs,
[NO];
+ H2O
-O2
ф Г = Cl, Br, I
О F
•• локализованная
эл. пара
Ii
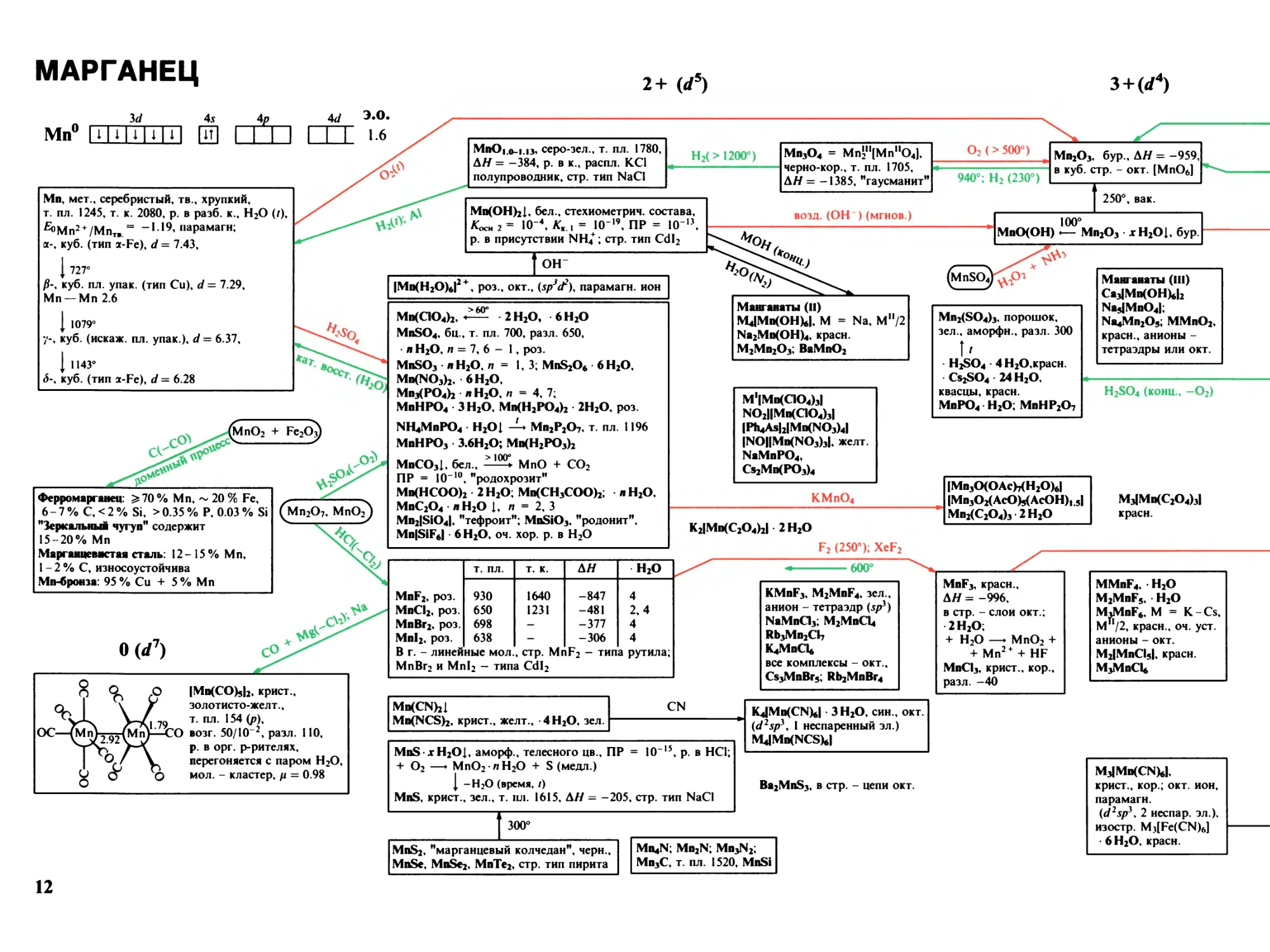
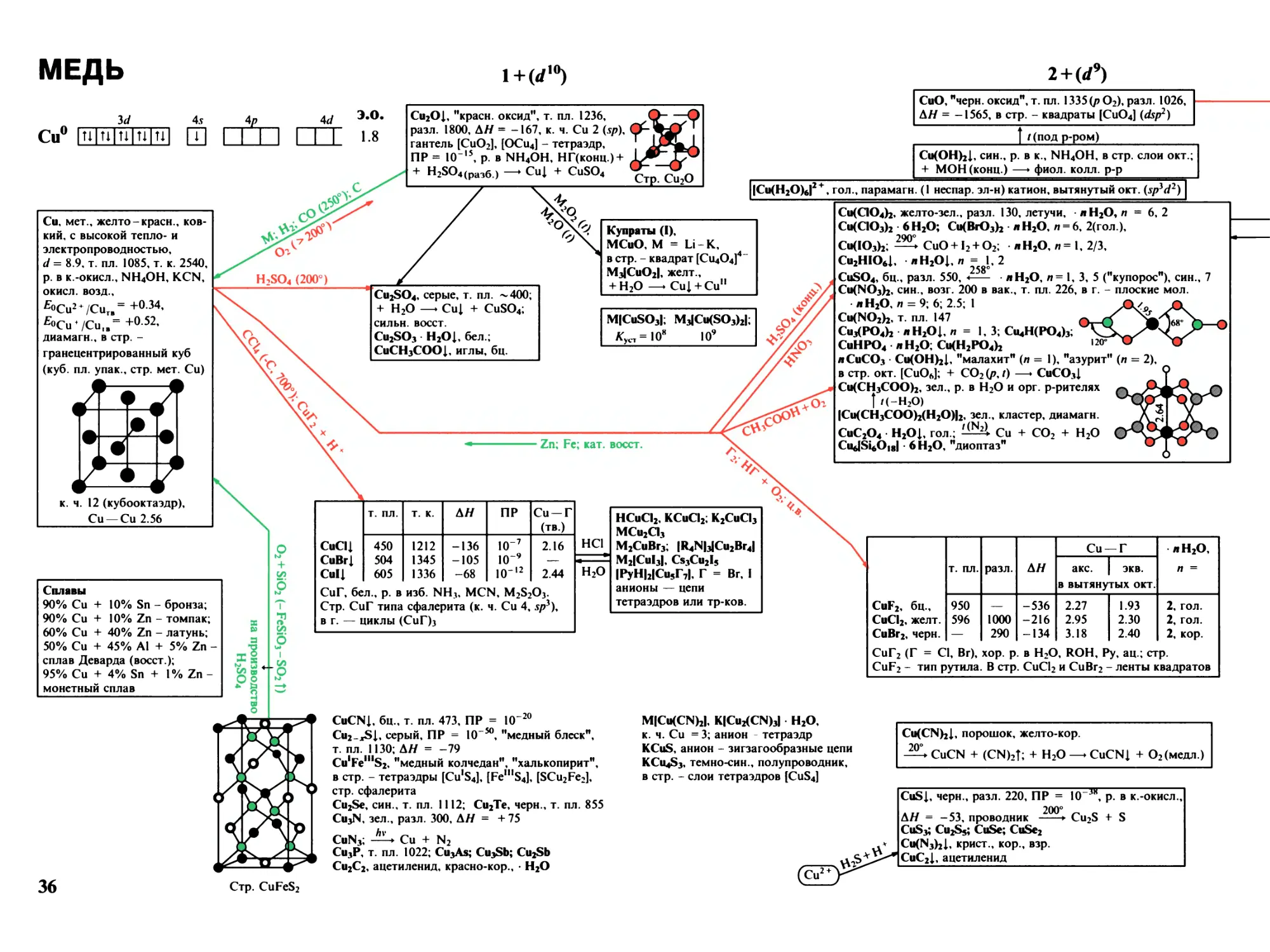
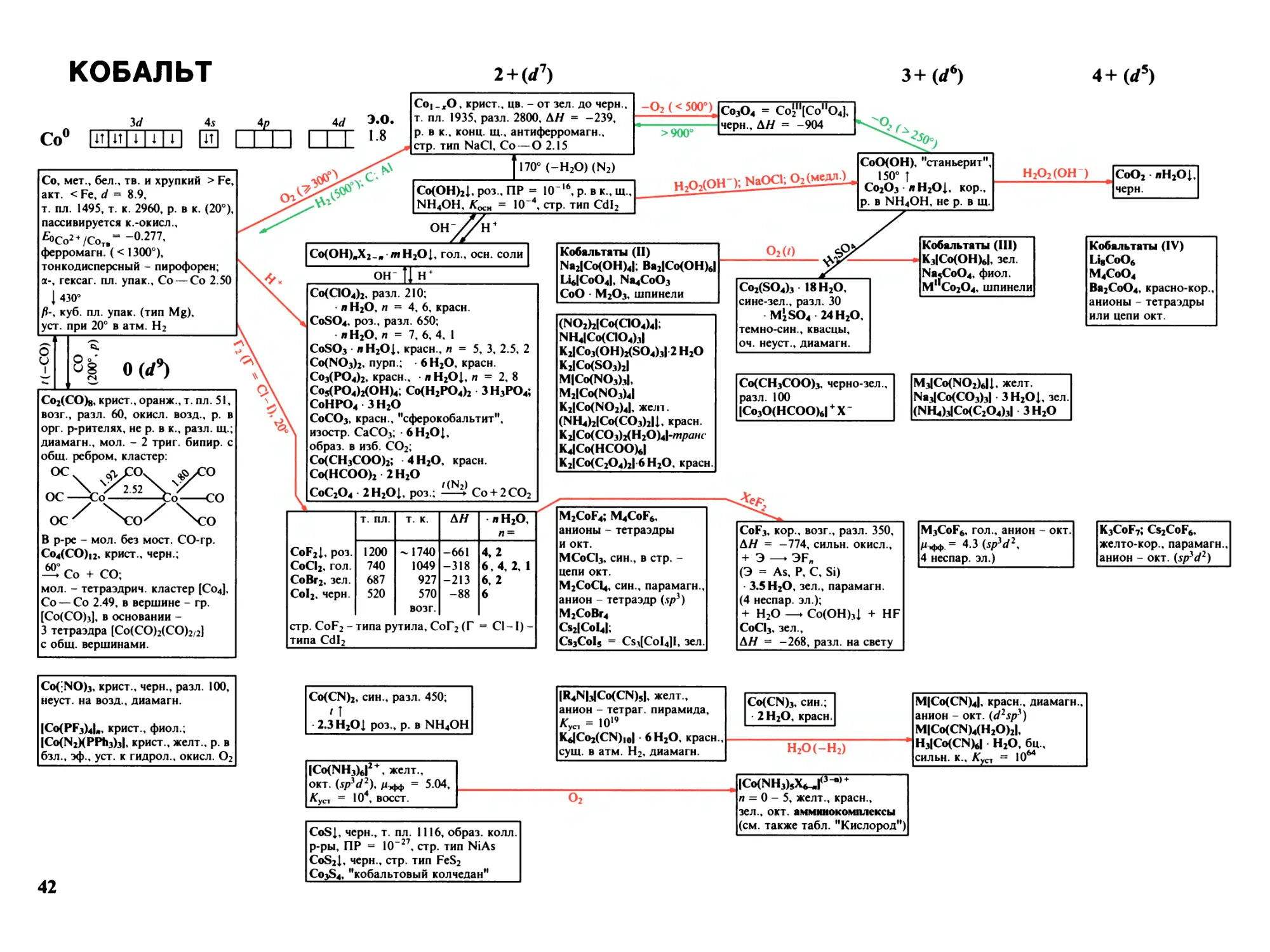
МАРГАНЕЦ
2+ (rf5)
з+(</4)
3</
4s
4р
Mn0 MMUUIH QH I I l I
Mn, мет., серебристый, тв., хрупкий,
т. пл. 1245, т. к. 2080, р. в разб. к., H2O (/),
fiOMn2 + ZMnr. = -119, парамагн;
а-, куб. (тип S-Fe), d = 7.43,
I пт
/?-, куб. пл. упак. (тип Cu), d = 7.29,
Mn — Mn 2.6
{ 1079°
у-, куб. (искаж. пл. упак.), d = 6.37,
I
1143°
<$-, куб. (тип Z-Fe), d -
6.28
MnOi .0-1.13» серо-зел., т. пл. 1780,
АН = -384, р. в к., рас пл. KCl
полупроводник, стр. тип NaCl
Нг( > 1200°)
Mn3O4 = MnV1(Mn11O4),
черно-кор., т. пл. 1705,
АН = -1385, "гаусманит"
O2 (> 500°)
Mn2O3, бур., АН = -959,
в куб. стр. - окт. [MnO6]
940°; H2 (230°)
Mn(OH)2I, бел., стехиометрии, состава,
Koch 2 = Ю-4, Kka = IO-19, ПР = !О'13,
р. в присутствии NH/; стр. тип CdI2
возд. (ОН ) (мгнов.)
Ферромарганец: ^70% Mn, ~ 20 % Fe,
6 - 7 % С, < 2 % Si, > 0.35 % Р, 0.03 % Si
"Зеркальный чугун" содержит
15-20% Mn
Марганцевнстая сталь: 12-15% Mn,
1 - 2 % С, износоустойчива
Мп-бронза: 95 % Cu + 5 % Mn
^Mn2O7, MnO2^
%
О (</7)
с®.
? ^
IMn(CO)5I2, крист.,
золотисто-желт.,
лл%
т. пл. 154 (р),
ОС—^Мп^ (Мл
X) возг. 50/Ю-2, разл. 110,
р. в орг. р-рителях,
ОС—
Pcg
перегоняется с паром H2O,
о
мол. - кластер, р = 0.98
он
IMn(H2O)tI2 + , роз., окт., (.Sp3Ct2), парамагн. ион
> АЛ°
Mn(QO4)2, • 2H2O, 6Н20
MnSO4, бц., т. пл. 700, разл. 650,
л H2O, п = 7, 6 - 1, роз.
MnSO3 лH2O, 1,3; MnS2O6 6Н20,
Mn(NO3)2, 6 H2O,
Mn3(PO4)2 л H2O, п = 4, 7;
MnHPO4 ЗН20, Mn(H2PO4)2 2Н20, роз.
NH4MnPO4 H2Ol Mn2P2O7, т. пл. 1196
MnHPO3 3.6Н20; Mn(H2PO3)2
MnCO3I, бел., MnO + CO2
ПР = IO10, "родохрозит"
Mn(HCOO)2 2 H2O; Mn(CH3COO)2; л H2O,
MnC2O4 л H2O 1, п = 2, 3
Mn2ISiO4I, "тефроит"; MniSiO3, "родонит",
MnISiF6I • 6 H2O, оч. хор. р. в H2O
Манганаты (II)
M4IMn(OH)6I, M = Na, Ми/2
Na2Mn(OH)4, красн.
M2Mn2O3; BaMnO2
M1IMn(QO4)3I
NO2HMn(QO4)3I
IPh4AsI2IMn(NO3)4I
INOHMn(NO3)3I, желт.
NaMnPO4,
Cs2Mn(PO3)4
KMnO4
K2IMn(C2O4)2I 2 H2O
F2 (250°); XeF2
т. пл.
т. к.
АН
H2O
MnF2, роз.
930
1640
-847
4
MnCl2, роз.
650
1231
-481
2,4
MnBr2, роз.
698
-
-377
4
MnI2, роз.
638
-
-306
4
В г. - линейные мол., стр. MnF2 - типа рутила;
MnBr2 и MnI2 - типа CdI2
•600°
KMnF3, M2MnF4, зел.,
анион - тетраэдр (sp*)
NaMnQ3; M2MnCl4
Rb3Mn2CI7
K4MnCI6
все комплексы - окт.,
Cs3MnBr5; Rb2MnBr4
MiKCNbl
Mn(NCJS)2, крист., желт., -4 H2O, зел.
CN
10
15
р. в HCl;
MnS * H2Ol, аморф., телесного цв., ПР =
+ O2 —► MnO2 п H2O + S (медл.)
I -H2O (время, /)
MnS, крист., зел., т. ил. 1615, АН = -205, стр. тип NaCl
300°
MnS2, "марганцевый колчедан", черн.,
MnSe, MnSe2, MnTe2, стр. тип пирита
Mn4N; Mn2N; Mn3N2;
Mn3C, т. пл. 1520, MnSi
250°, вак.
100°
MnO(OH) <— Mn2O3 XH2Ol, бур.
(MnSO4)^fn
Mn2(SO4)3, порошок,
зел., аморфн., разл. 300
I'
• H2SO4 • 4 H2O,красн.
Cs2SO4 24 H2O,
квасцы, красн.
MnPO4 H2O; MnHP2O7
IMn3O(OAc)7(H2O)6I
IMn3O2(AcO)5(AcOH)15I
Mn2(C2O4)3 2 H2O
MnF3, красн.,
АН = -996,
в стр. - слои окт.;
• 2 H2O;
+ H2O —► MnO2 +
+ Mn2+ + HF
MnCI3, крист., кор.,
разл. -40
K4IMn(CN)6I ЗН20, син., окт.
W2Spy, 1 неспаренный эл.)
M4IMn(NCS)6I
Ba2MnS3, в стр. - цепи окт.
Манганаты (III)
Ca3IMn(OH)6I2
Na5IMnO4I;
Na4Mn2O5; MMnO2,
красн., анионы -
тетраэдры или окт.
H2SO4 (конц., -O2)
M3IMn(C2O4)3I
красн.
MMnF4, H2O
M2MnF5, H2O
MoMnF6, M = K-Cs,
M /2, красн., оч. уст.
анионы - окт.
M2IMnCI5I, красн.
M3MnCI6
M3IMn(CN)6I,
крист., кор.; окт. ион,
парамагн.
W2Spi4 2 неспар. эл.).
изостр. M3(Fe(CN)6)
• 6 H2O, красн.
12
4 + (rf5)
5 + (d2)
6 + (</')
7 + (rf0)
MnO2-X. » черн.,
АН = -519, сильн. окисл., р. в к.
/?-, "пиролюзит”, стр. тип рутила
MnO2 • JH2Ol, бур.,
наименее р. среди гидратов
оксидов др. степеней окисл. Mn
+ O2
Манганаты (IV) ("манганиты”)
Li2MnO3, парамагн., = 3.82
M11O я MnO2,
M = Ca, BatZn, Pb (минералы)
Mn2O7, марганцевый ангидрид, масло, d = 2.79,
зел. (в отраженном свете), красн. (в проходящем),
с характ. запахом, т. пл. 5.9, перег. вак., разл. 55,
AH = -726, взр. 95, воспл. орг. в-ва, уст. в
р-рах CCl4, фреонов; в стр. - мол. - 2 тетраэдра
с общ. вершиной,
• 2 H2O, т. пл. -4, уст. к удару > Mn2O7
H2O
HMnO4, марганцевая к., крист., фиол., разл. 3; I
• 2 H2O, разл. 20 в р-ре (< 20%); ст. дис. 90%,
> 20% и ^ *
► MnO2 + O2I
MMnIO6, красн., уст.,
в стр. - окт.[Мп06] и [IO6],
Mn-O 1.87
М2|Мп(Ю3)6|, M
(2 H2OD
К, H
Манганаты (V)
M3MnO4,
■ л H2O, син.,
MV(MnO4KOH),
+ H2O —► MnO2J.
+ MnO^
Манганаты (VI)
M2MnO4,
M = Naf • IOH2O, т. пл. 17),
К (разл. >500),
Ва/2]., черн., парамагн.,
анион - тетраэдр (</3я),
+ H2O —► MnO2J. + MnO4
(медл.)
Солн "манганнла"
IMnO3IHSO4
MnO3F, ж.,
т. пл. -38, разл. О,
оч. сильн. окисл.;
Ii = 15;
мол. - тетраэдр,
MnO3CI, г., фиол.
взр., т. к. -30
H2SO4
(конц.)
In KrF2
/; 0Н(-02)
Cl2; ан. окисл.; S2OjS (Ag + )
Манганаты (VII)
Перманганаты,
крист., фиол.,
р. в H2O Li > Cs
LiMnO4 * 3 H2O, разл. 190
NaMnO4 H2O, разл. 170
KMnO4, разл. 250
CsMnO4I, разл. 320
Ca(MnO4)2 SH2O
Ba(MnO4)2I; AgMnO4I,
анион - тетраэдр, (Л)
диамаг., уст.при pH ^ 7,
оч. сильн. окисл. pH 11
—► M2MnO4 + M3MnO4 -
+ MnO2 + O2
H2SO4(K)Hn.) + MnSO4
MnF4, крист., гол.,
летучи; Atf = -1080;
/*эФФ. = 3.87,
в стр. - ленты окт.,
+ H2O —► O2 (взр.)
KMnF5, красн.
KfMnF5(H2O)I, роз.
K2IMnF6I, желт.; MIMn2F9I,
M = [O2], XeF, окт. анионы
(Mn(H2O)62+]
NOCl
K2IMn(CN)6I, желт.,
/1зфф. = 3.94, разл. на свету
K4IMn(CN)8I, красн.
13
"Ледяная мол."
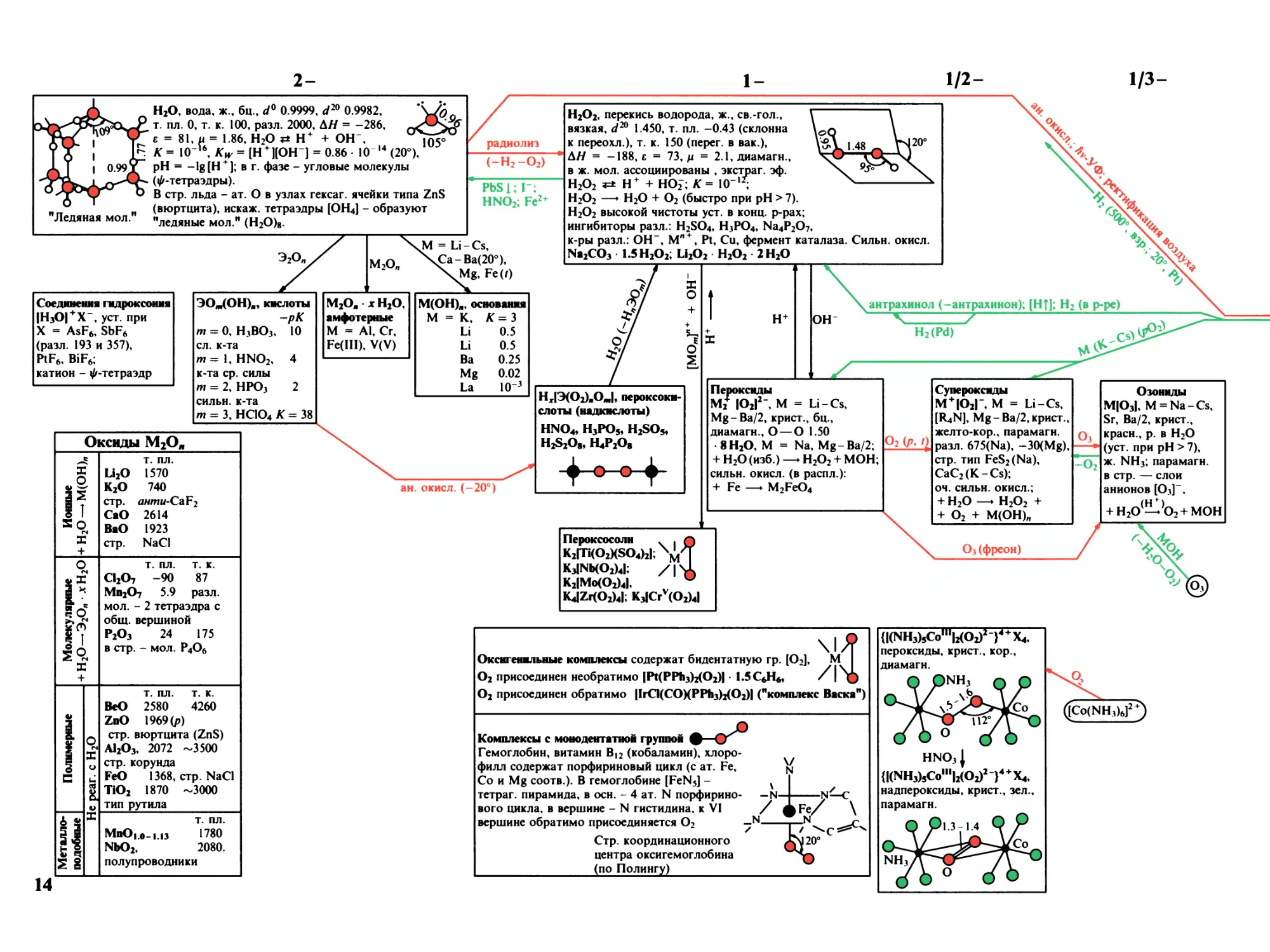
2-
H2O, вода, ж., бц., d0 0.9999, d20 0.9982,
т. пл. О, т. к. 100, разл. 2000, АН = -286,
с = 81, и = 1.86, H2O H+ + ОН",
K = IO"'6, А^ = [Н + ][ОН"] = 0.86- 10 14 (20°),
pH = -IgfH + ]; в г. фазе - угловые молекулы
(^-тетраэдры).
В стр. льда - ат. О в узлах гексаг. ячейки типа ZnS
(вюртцита), искаж. тетраэдры [OH4] - образуют
"ледяные мол." (H2O)8.
1-
1/2-
1/3-
Соединения гидроксоння
|Н30| + Х-, уст. при
X = AsF6, SbF6
(разл. 193 и 357),
PtF6, BiF6;
катион - ^-тетраэдр
(-H2-O2)
PbSj; Г;
HNO2; Fe2+
M2Ow
JVI = Li-Cs,
чСа-Ва(20°),
Mg, Fe(Z)
H2O2, перекись водорода, ж., св.-гол.,
вязкая, d20 1.450, т. пл. -0.43 (склонна
к переохл.), т. к. 150 (перег. в вак.),
АН = — 188, е = 73,^ = 2.1, диамагн.,
в ж. мол. ассоциированы , экстра г. эф.
H2O2 *=± H+ + HO2; K= 10
H2O2 —► H2O + O2 (быстро при pH > 7).
H2O2 высокой чистоты уст. в конц. р-рах;
ингибиторы разл.: H2SO4, H3PO4, Na4P2O7,
к-ры разл.: ОН-, Мп + , Pt, Си, фермент каталаза. Сильн. окисл.
Na2CO3 1.5 H2O2; Li2O2 H2O2 2 H2O
BOm(OH)ia, кислоты
-рК
т = О, H3BO3, 10
сл. к-та
W=IfHNO2, 4
к-та ср. силы
т = 2, HPO3 2
сильн. к-та
т = 3, HClO4 K= 38
M2Oia X H2O,
амфотерные
M = Al, Cr,
Fe(III), V(V)
M(OH)ia, основания
= к,
*
Il
Li
0.5
Li
0.5
Ba
0.25
Mg
0.02
La
IO"3
Оксиды M2Oj,
I
14
т. пл.
Li2O 1570
K2O 740
стр. AHmM-CaF2
CaO 2614
BaO 1923
стр. NaCl
т. пл. т. к.
CI2O7 -90 87
Mn2O7 5.9 разл.
мол. - 2 тетраэдра с
общ. вершиной
P2O3 24 175
в стр. - мол. P4O6
т. пл. т. к.
BeO 2580 4260
ZnO 1969 (р)
стр. вюртцита (ZnS)
AI2O3, 2072 ~3500
стр. корунда
FeO 1368, стр. NaCl
TiO2 1870 ~3000
тип рутила
т. пл.
МпО|.0-|.1з 1780
NbO2, 2080.
полупроводники
ан. окисл. (-20°)
HxIB(O2)iaOJ, пероксокн-
слоты (надкислоты)
HNO4, H3PO5, H2SO5,
H2S2Oe, H4P2Oe
+-0-0+
H+
антрахинол (-антрахинон); [Ht]; H2 (в р-ре)
—у у
H2(Pd)
Пероксиды
Mi IO2I2-, M = Li -Cs,
Mg-Ba^, крист., бц.,
диамагн., О — О 1.50
8 H2O, M = Na, Mg-Ba^;
+ H2O (изб.) —► H2O2 + МОН;
сильн. окисл. (в распл.):
+ Fe —► M2FeO4
O2 (р.
Супероксиды
M+IO2I-, M = Li-Cs,
[R4N], Mg-Ba^KpHCT.,
желто-кор., парамагн.
разл. 675(№), ^O(Mg),
стр. тип FeS2(Na),
CaC2(K-Cs);
оч. сильн. окисл.;
+ H2O —► H2O2 +
+ O2 + M(OH)n
O3
-O2
Озониды
М|03|, M = Na-Cs,
Sr, Ва/2, крист.,
красн., р. в H2O
(уст. при pH > 7),
ж. NH3; парамагн.
в стр. — слои
анионов [O3]",
+ H2O^tO2+ MOH
Пероксосоли . .
K2ITI(O2KSO4)2I;
K3INb(O2)4I;
K2IMo(O2)4I,
/I
KJZr(O2)4I; K3JCrv(O2)4I
O3 (фреон)
\\Я
Оксигеннльные комплексы содержат бидентатную гр. [O2], M
O2 присоединен необратимо IPt(PPh3)2(O2)I • LSC6H6,
O2 присоединен обратимо IlrCI(COXPPh3)2(O2)I ("комплекс Васка")
Комплексы с монодентатной группой
Гемоглобин, витамин В|2 (кобаламин), хлоро¬
филл содержат порфириновый цикл (с ат. Fe,
Со и Mg соотв.). В гемоглобине [FeN5] -
тетраг. пирамида, в осн. - 4 ат. N порфирино-
вого цикла, в вершине - N гистидина, к VI
вершине обратимо присоединяется O2
Стр. координационного
центра оксигемоглобина
(по Полингу)
\/
N
_1Ч_
/
-N-
/
20°
(I(NH3)5ComiI2(O2)2 I4+X4,
пероксиды, крист., кор.,
диамагн.
HNOjI
(I(NH3)JComI2(O1)2-)4+X4,
надпероксиды, крист., зел.,
парамагн.
([Co(NH3)6]2+)
КИСЛОРОД
2s 2р Э#0#
о0 QD цт| и 11 3.5
СЮз; KMnO4; л л
KNO,
(О
O2, г.. бц., d0 = 1.429,
т. пл. -219, т. к. -183
(> т. к. N2), разл. > 2000,
Atfдис = +494; ж., гол.; крист.,
син., парамагн. (2 неспар. эл.);
р. в Н20~5%(об.),
хор. р. в Pt-HepHH, акт. С;
мол. стр., у-, куб. (тип Си),
I -229°
/?-, ромбоэдрическая,
I -249°
а-, ромб.,
Реаг. почти со всеми M (г)
O1=1O
тихии
разряд;
Hv УФ
F-Mnrr
С
HClO4TN
HNO^y
ан. окисл.
(-50°, вак.)
O3, ОЗОН, г., гол. (при КОНЦ ^ 15%)
с характерным запахом, яд, </=2.144,
т. пл. -193, т. к. -110; ж., темно-син.;
крист., черно-фиол.; AH = + 144,
разл. 250, взр. при ударе.
К-ры разл.: NO, Cl2, Pt, CuO и т. д.
Р. в H2O ^ 45 % (об.), хор. р. в CCl4,
фреонах (CClnF4 „); мол. угловая,
диамагн.,// = 0.53, 1.5-кратные
связи (1а + 0.5 п)
При 20° реаг.
со всеми M
(кроме Pt и Au);
орг. в-ва воспл.
117°
SvPtF6; SbF5 + Г2(Ну-УФ)\ M + F2Q, л ИК),
F2 (разряд, вак.)
"1/2 + "
"2/3 + "
"1 + "
”2 + ”
• о
• М;Э
О H
15
IO2I + XT X = [BF4], [PF6], [PtF6]
соли оксигенила,
крист., бц.,
сильнейшие окисл.,
H2O-^O2 + F2 + ЭР„;
+ Xe, Rn PCeF] + PF6]- + O2
(очистка атм. от Xe*, Rn*).
"O3F2" = O4F2 + O2F2*?),
"фторид озона", ж.,
красн., т. пл. -189,
т. к. ~ -179 (вак.),
разл. -160, А#= +25,
парамагн.
O2F2, крист., оранж.,
т. пл. -163, т. к. -57,
т. разл. -100,
AH =+21, мол. - стр.
аналог H2O2,
сильнейший окисл. и
фторагент
OF2, г., бц., яд, т.пл. -224,
т. к. -145, разл. 200, AH= +25,
угловая мол., ц = 0.30,
сильнейший окисл. и
фторагент, р. в H2O - 6.5%(об.)
при 0°, разл. щ.;
+ H2O Оз + O2 + HF (взр );
+ ОН—► H2O + O2 + F-;
+ НГ —► Г2 + HF + H2O ;
+ Xe —► XeF2 + XeOF2
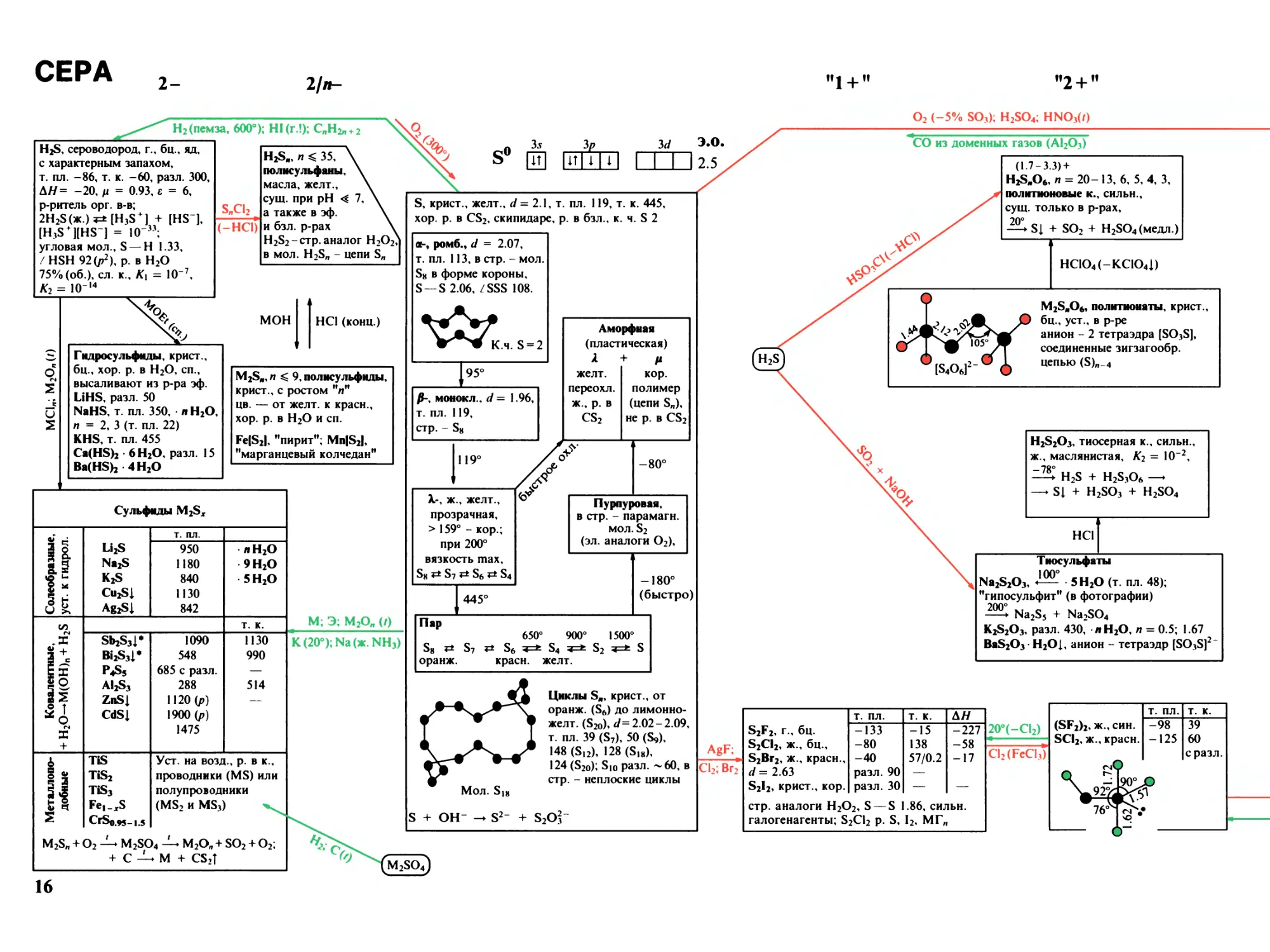
СЕРА
2-
Ijn-
ffI+11
"2 + "
H2 (пемза, 600°); HI (г.!); CnH2^2
H2S, сероводород, г., бц., яд,
с характерным запахом,
т. пл. -86, т. к. -60, разл. 300,
ЛЯ = -20, ц = 0.93, с = 6,
р-ритель орг. в-в;
2Н25(ж.) *=± [H3S + ] + [HS"],
[H3S + HHS-] = 10
угловая мол., S — H 1.33,
/HSH 92 (/т2), р. в H2O
75% (об.), сл. к., K1 = IO-7,
K2 = 10-14
SnCl2
(-НС1)
H2Sj,, п ^ 35,
полису льфаны.
масла, желт.,
сущ. при pH 4: 7,
а также в эф.
и бзл. р-рах
H2S2-CTp. аналог H2O2!
в мол. H2Sn - цепи Sn
O2 (-5% SO3); H2SO4; HNO3(Z)
MOH
Гидросульфиды, крист.,
бц., хор. р. в H2O, сп.,
высаливают из р-ра эф.
LiHS, разл. 50
NaHS, т. пл. 350, л H2O,
п = 2, 3 (т. пл. 22)
KHS, т. пл. 455
CaCHSb 6 H2O, разл. 15
BaCHSb 4 H2O
HCl (конц.)
M2Sjt, л ^ 9, полисульфиды,
крист., с ростом "п"
цв. — от желт, к красн.,
хор. р. в H2O и сп.
FcIS2I, "пирит"; MnIS2I,
"марганцевый колчедан"
Сульфиды M2Sx
Солеобразные,
уст. к г ид рол.
Li2S
Na2S
K2S
Cu2Sl
Ag2Sl
Т. ПЛ.
950
1180
840
1130
842
• л H2O
9 H2O
• 5 H2O
сл
гя
.X
а +
9 С
E ас
з!
й т
О
N
X
+
т. к.
Sb2S3I*
Bi2S3I*
P4S5
AI2S3
ZnSl
CdSl
1090
548
685 с разл.
288
1120 (р)
1900 (р)
1475
1130
990
514
а
I
s а
S
M2Sn+-
TiS
TiS2
TiS3
Fel^S
CrSfcM-1.5
O2 M2SC
+ С —
Уст. на возд., р. в к.,
проводники (MS) или
полупроводники
(MS2 и MS3)
)4 —► M2Off + SO2 + O2;
♦ M + CS2T
М; Э; M2On (/)
К (20°); Na (ж. NH3)
Зл
QD
к.
3 d
IT i i
S, крист., желт., d = 2.1, т. пл. 119, т. к. 445,
хор. р. в CS2, скипидаре, р. в бзл., к. ч. S 2
а-, ромб., d = 2.07,
т. пл. 113, в стр. - мол.
S8 в форме короны,
S-S 2.06, /SSS 108.
4Ar.
К.ч. 5 = 2
95°
/J-, монокл., d= 1.96,
т. пл. 119,
стр. - S8
119°
4*’
X-, ж., желт.,
прозрачная,
> 159° - кор.;
при 200°
вязкость шах,
S8 S7 S6 ** S4
-80°
Пурпуровая,
в стр. - парамагн.
мол. S2
(эл. аналоги O2),
445°
Э.О.
2.5
СО из доменных газов (Al2O3)
Аморфная
(пластическая)
к
+ V
желт.
кор.
переохл.
полимер
ж., р. в
(цепи Sn),
CS2
не р. в CS2
-180°
(быстро)
Пар
650° 900° 1500°
S8 S7 S6 S4 S2 S
оранж. красн. желт.
Циклы S11, крист., от
оранж. (S6) до лимонно¬
желт. (S20W= 2.02-2.09,
т. пл. 39 (S7), 50 (S9),
148 (S12), 128 (S18),
124 (S20); Si0 разл. ^ 60, в
стр. - неплоские циклы
S2Or
(1.7- 3.3) +
H2SwO6,/7 = 20-13, 6, 5, 4, 3,
политионовые к., сильн.,
/у
сущ. только в р-рах,
Sl + SO2 + H2SO4 (медл.)
НСЮ4(-КСЮ41)
M2S11O6, политионаты, крист.,
105 /
JD бц., уст., в р-ре
щ анион - 2 тетраэдра [SO3S],
T соединенные зигзагообр.
0IS4O6]2-0 (
JL цепью (5)л_4
H2S2O3, тиосерная к., сильн.,
ж., маслянистая, K2 = IO-2,
H2S + H2S3O6 —
— Sl + H2SO3 + H2SO4
HCl
Тиосульфаты
100°
Na2S2O3, 5 H2O (т. пл. 48);
"гипосульфит" (в фотографии)
700°
^ Na2S5 + Na2SO4
KiS2O3, разл. 430, л H2O, п = 0.5; 1.67
BaS2O3 - H2Ol, анион - тетраэдр [SO3S]2-
AgF;
Cl2; Br2
т. пл.
т. к.
ЛЯ
S2F2, г., бц.
-133
-15
-227
S2CI2, ж., бц.,
-80
138
58
S2Br2, ж., красн.,
-40
57/0.2
-17
d= 2.63
разл. 90
—
S2I2, крист., кор.
разл. 30
—
—
стр. аналоги H2O2, S — S 1.86, сильн.
галогенагенты; S2Cl2 р. S, I2, МГ„
г
16
4 +
6 +
SO2, г., бц., с резким запахом, т. пл. -75,
т. к. -10, разл. 2500, АН = -297,
р. в H2O 98% (об.), с = 13; ж. SO2 р. N2,
МГт орг. в-ва, /i = 1.63, угловая мол.
(^-тр-к IiSO2], sp2); сильн. восст.,
сл. окисл.: + H(Pd) —► H2
H2O
^ 120°
O2 (/; Pt, V2O5, Ag3VO4); О,
>400° (-O2)
Сернистая к. ("H2SO3")
SO2+ H2 O^SO2 л H2O я H++HSO3- я 2H + +SO3-,
,,-И»!
[SO2Jpaetl
[SO2Ipibh = [SO2Um -[HSOj]—[SO32 ]; восст.;
150°
Sl + H2SO4
SO3, крист., бел. шелковистые, т. пл.
17-145 (разные формы); АН = -395 (г.);
-462 (/?). В стр. - циклические тримеры
или цепи тетраэдров [SO4] (Spi)
В г. - мол. SO3 - плоский тр-к,
S = O 1.41, /OSO 120 (V);
сильный окислитель
1? 1?
Tb-Il4O
H2SO4
H2S2O7, ди(пиро)серная к., крист., бц., гигр. т. пл. 35
H2O
SO3
Пиросульфаты, M2S2O7
H2S2O8, надсерная к.,
сильн. к., крист.,
гигр., т. пл. 65 с разл.
M2CO3 (0°)
MHSO3, гидросульфиты, M = Na, К
(разл. 190), Cs (крист.); Li, Са/2 (сущ.
только в р-ре), анион - ^-тетраэдр
H2SO4, серная к., масло, бц., оч. гигр.
("моногидрат"), т. пл. 10, т. к. 340 с разл.,
2 H2SO4(100%)[H3SO4]+ + [HSO4]'*=* [H3O]+ +[HS2O7]-;
к =IO4 а: = IO5
е = 100(25°), р-ритель M2(SO4)m сильн. окисл.,
в г. - мол. - искаж. тетраэдр (sp3); 104°Г ф J119°
H1O, п = 1 - 4, 6, 5(т. пл. -84), 8(-110°); п-О^
т. к. азеотропа (98% H2SO4) 337;
H2SO4 [HjO]+ + [HSO4]- =S=S 2[H3O]+ +[SO4]2-,
(< 100%) СИЛЬН. к. *2 = IO"2
M2S2O8, персульфаты,
анион - из 2 тетраэдров
$
LvP 1
'V0"
T ионилгал огениды
т. пл.
т. к.
АН
SOF2, г., бц.
-129
-44
-711
SOFCI, г., бц.
-137
+ 12
—
SOCI2, ж., бц.
-100
+ 76
-247
SOBr2, ж., оранж.
-52
138
-75
с разл.
—► SO2 + S2F 2 + Г2;
мол. ^SOr2] - ф-тет¬
раэдр
POCl3
Сульфиты
Li2SO3, разл. 455
Na1SO3 ^ 7 H1O; K1SO3 2 H1O
CaSO3 2 H1Ol; BaSO3I
M2S + M2SO4, хор. р. в H2O,
[=SO3]2- - ^-тетраэдр
Галогеиосульфоиовые к.
т. пл.
т. к.
HSO3F, ж., бц.
-87
169
HSO3CI, ж., бц.
-80
152 с разл.
HSO3Br, ж., желт.
-7 с разл.
-
HSO3F - оч. сильн. к., уст.
Br2; I2; Fe3
Г идросульфаты
NaHSO4 (т. пл. 186); • H2O = №[Н30][Ю4]
KHSO4 (т. пл. 210, "меркаллит")
IH3OiIHSO4I - "H2SO4 H2O"
InOIIHSO4I, "нитрозилсерная к.",
MHSO4 M2S2O7+H2O
нг
H2SO4
Cl2 (ж.)
HF (газ)
-30°
Сульфурилгало-
геииды
SO2F2, г., бц.,
SO2FCI, г., бц.,
SO2CI2, ж., бц.,
SO2FBr, ж., бц.,
т. пл.
т. к.
разл.
АН
-137
-51
400
-856
-125
+ 7
—
—
-54
69
300
-393
-86
40
—
HISbF2(SO3F)4I, самая сильн. к.
MOH
Сульфаты
Na2SO^T.пл.884, т.к. 1430; • IOH2O, "глауберова соль"
K2SO4, т. пл. 1076, т. к. >2000
MgSO4, разл. 1155; • 7 H2O, "горькая соль"
CaSO4I, т.пл. 1450; ■ 2H2O, "гипс"; BaSO4I, т. пл. 1580
CuSO4, разл. 650; • 5 H2O ("купорос");
M2(SO4),, -L M2On+ SO3, M = Al, Fe, Cu и др.;
[SO4]2- - правильный тетраэдр (s/*3); S—О 1.48
т. пл.
т. к.
АН
Q SF4, г., бц., яд.
-121
-37
-769
S2Fi0, ж- бц., оч. яд.,
^ VQp SCI4, крист..
-34
—
-54
т. пл. -53, т. к. 29,
бц*
с разл.
AH= -2134, не реаг. с H2O,
мол. - ^-триг. бипир.
щ., сильн. фторагент (/)
•/Д1,54 SF4 - сильн. фторагент;
мол. - 2 тетраг. пирамиды
° + H2O — SO2 + НГ;
SF5-SF5, S - S 2.21
SOF4, г., бц., т. пл. -100,
мол. - триг. бипир.
-49,
H2 (Av-B)
SF6, г.,
бц., т.
пл. -50 (р), возг.
-64, разл. 800,
АН = -
-1226,;
окт. мол. (SpjJ2);
хим. инертен.
не реаг
с O2.,
к., щ.
• S
О О
О Г = Cl, F
О H
•• локализованная
эл. пара
17
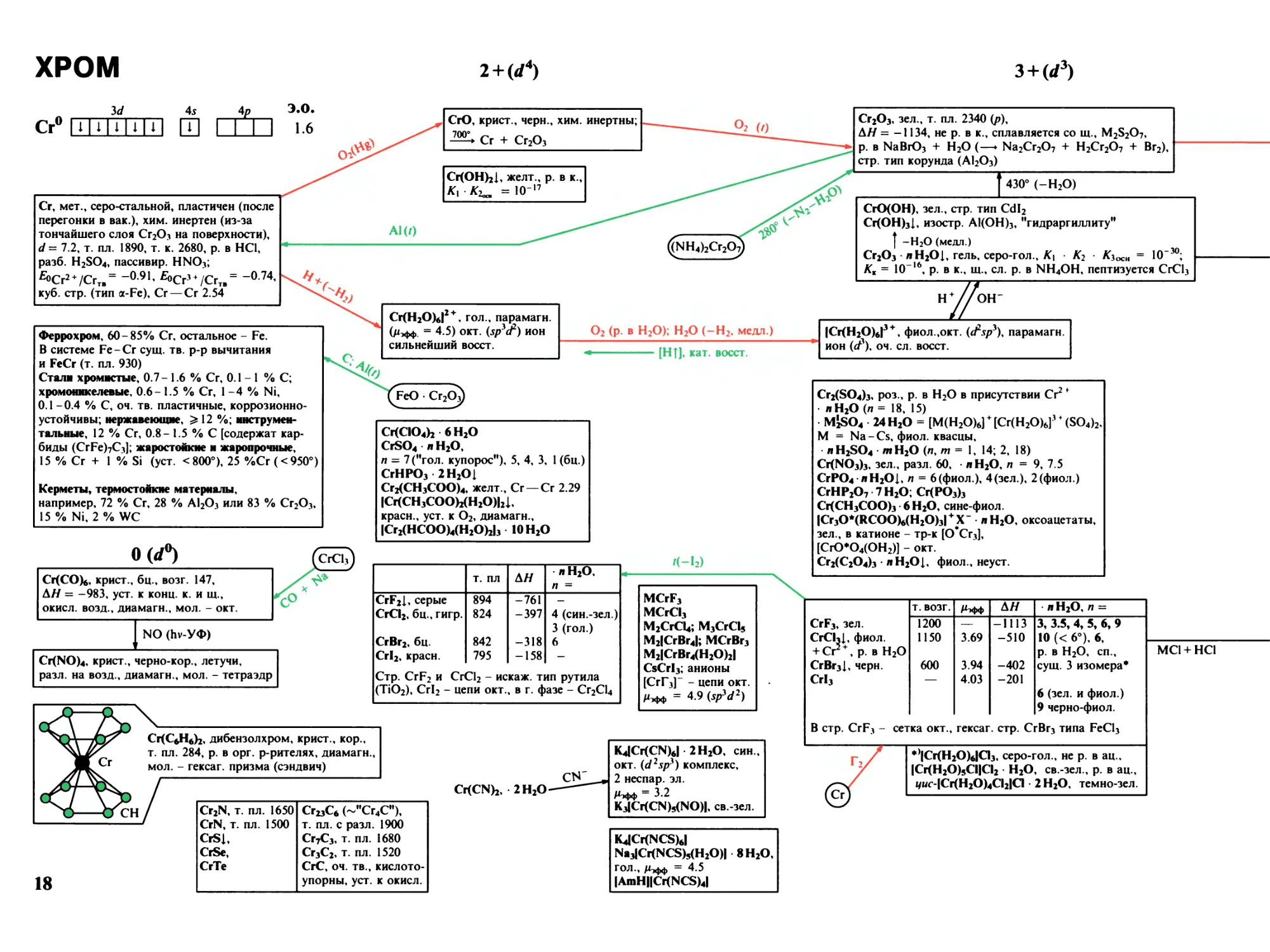
ХРОМ
2+ W4)
3 + (rf3)
3</ 45 4р
Cr0 U U IH 1111 □ LJ
Cr, мет., серо-стальной, пластичен (после
перегонки в вак.), хим. инертен (из-за
тончайшего слоя Cr2O3 на поверхности),
d = 7.2, т. пл. 1890, т. к. 2680, р. в HCl,
разб. H2SO4, пассивир. HNO3;
^0Cr2+ /Сгт»= _0-91' fOCr5 + /Cr1. = ~014'
куб. стр. (тип (X-Fe), Cr — Cr 2.54
Феррохром, 60-85% Cr, остальное - Fe.
В системе Fe-Cr сущ. тв. р-р вычитания
и FeCr (т. пл. 930)
Стали хромистые, 0.7 - 1.6 % Cr, 0.1 - 1 % С;
хромоникелевые, 0.6- 1.5 % Cr, 1-4 % Ni,
0.1 -0.4 % С, оч. тв. пластичные, коррозионно¬
устойчивы; нержавеющие, ^ 12 %; инструмен¬
тальные, 12 % Cr, 0.8- 1.5 % С [содержат кар¬
биды (CrFe)7C3]; жаростойкие и жаропрочные,
15 % Cr + 1 % Si (уст. <800°), 25 %Сг(<950°)
Керметы, термостойкие материалы,
например, 72 % Cr, 28 % Al2O3 или 83 % Cr2O3,
15 % Ni, 2 % WC
СЮ, крист., черн., хим. инертны;
^ Cr + Cr2O,
Cr(OH)2I, желт., р. в к
Kloat =IO-'7
Cr2O3, зел., т. пл. 2340 (/>),
AH = -1134, не р. в к., сплавляется со щ., M2S2O7,
р. в NaBrO3 + H2O (—► Na2Cr2O7 + H2Cr2O7 + Br2),
стр. тип корунда (Al2O3)
430° (-H2O)
Cr(H2O)6I ' * гол., парамагн.
(Яэфф. = 4.5) окт. [Sps(F) ион
сильнейший восст.
O2 (р. в H2O); H2O (-H2, медл.)
[Н|]. кат. восст.
FeO Cr2Oj)
Cr(CIO4)2 6 H2O
CrSO4 ■ л H2O,
л = 7 ("гол. купорос"), 5, 4, 3, 1 (бц.)
CrHPO3 2 H2Oj
Cr2(CH3COO)4, желт., Cr-Cr 2.29
ICr(CH3COO)2(H2O)I2I,
красн., уст. к O2, диамагн.,
ICr2(HCOO)4(H2O)2I3 IOH2O
OCrf0)
Cr(CO)6, крист., бц., возг. 147,
AH = -983, уст. к конц. к. и щ.,
окисл. возд., диамагн., мол. - окт.
NO (Ьу-УФ)
Cr(NO)4, крист., черно-кор., летучи,
разл. на возд., диамагн., мол. - тетраэдр
т. пл
A H
л H2O,
п =
CrF2I, серые
894
-761
-
CrCI2, бц., гигр.
824
-397
4 (син.-зел.)
3 (гол.)
CrBr2, бц.
842
-318
6
CrI2, красн.
795
-158
-
Стр. CrF2 и CrCl2 - искаж. тип рутила
(TiO2), Crl2 - цепи окт.
, в г. фазе - Cr2Cl4
К-\2)
MCrF3
MCrCI3
M2CrCI4; M3CrCI5
М2|СгВг4|; MCrBr3
M2ICrBr4(H2O)2I
CsCrI3; анионы
[СгГ3]~ - цепи окт.
Рэфф = 4.9 (sp^d1)
Cr(C6H6)2, дибензолхром, крист., кор.,
т. пл. 284, р. в орг. р-рителях, диамагн.,
мол. - гексаг. призма (сэндвич)
Cr(CN)2, 2 H2O-
Cr2N, т. пл. 1650
CrN, т. пл. 1500
CrSj,
CrSe,
CrTe
18
Cr23C4 (~"Сг4С"),
т. пл. с разл. 1900
Cr7C3, т. пл. 1680
Cr3C2, т. пл. 1520
СгС, оч. тв., кислото¬
упорны, уст. к окисл.
K4JCr(CN)6I • 2 H2O, син.,
окт. W2Sps) комплекс,
2 неспар. эл.
/Цфф 3.2
K3ICr(CN)5(NO)I, св.-зел.
K4JCr(NCS)6I
Na3ICr(NCS)5(H2O)I 8 H2O,
гол., /х,фф = 4.5
IAniHIICr(NCS)4I
CrO(OH), зел., стр. тип Cdl2
Cr(OH)3I, изостр. Al(OH)3, "гидраргиллиту"
I -H2O (медл.)
Cr2O3 лH2Oj, гель, серо-гол., К\ K2 Ksoch
10'
10 , р. в к., щ., сл. р. в NH4OH, пептизуется CrCl3
|Сг(Н20)6|3 + , фиол.,окт. (Лр3), парамагн.
ион ((P)4 оч. сл. восст.
Cr2(SO4)3, роз., р. в H2O в присутствии Cr2 f
• л H2O (п = 18, 15)
• MjSO4 24 H2O = [M(H2O)6] + [Cr(H2O)6]3 + (SO4)2,
M = Na-Cs, фиол. квасцы,
• AH2SO4 • тН20 (л, т = 1, 14; 2, 18)
Cr(NO3)3, зел., разл. 60, • л H2O, /1 = 9, 7.5
CrPO4 лH2Oj, п = 6(фиол.), 4(зел.), 2 (фиол.)
CrHP2O7 7 H2O; Cr(PO3)3
Cr(CH3COO)3 • 6 H2O, сине-фиол.
ICr3O^(RCOO)6(H2O)3I+ X " л H2O, оксоацетаты,
зел., в катионе - тр-к [0*Сг3],
[СЮ*04(0Н2)] - окт.
Cr2(C2O4)3 • л H2Oj, фиол., неуст.
т. возг.
/Н»Ф
A H
л H2O, п =
CrF3, зел.
1200
—
-1113
3, 3.5, 4, 5, 6, 9
CrChj, фиол.
+ Cr +, р. в H2O
1150
3.69
-510
10 (< 6°), 6,
р. в H2O, сп.,
CrBr3I, черн.
600
3.94
-402
сущ. 3 изомера*
CrI3
4.03
-201
6 (зел. и фиол.)
9 черно-фиол.
В стр. CrF3 - сетка окт.,
гексаг. стр. CrBr3 типа FeCl3
*^Cr(H2O)6ICI3, серо-гол., не р. в ац.,
ICr(H2O)5CIICI2 • H2O, св.-зел., р. в ац.,
|/ис-|Сг(Н20)4С12|С1 • 2 H2O, темно-зел.
MCl+ HCl
4+(</2)
5+0/')
СЮ3, иглы, красн., яд, т. пл. 197, возг.,
ЛЯ = -577, р. в H2O 62% (15°),
в стр. - цепи тетраэдров
•лH2O, п = 1 - 4, оч. сильн. окисл.,
+ C2H5OH —> CH3COOH + Cr3 +
(NHUbCr2O7
Тетрахроматы, M2Cr4Ot3, кор.,
M = K, разл. 210
Трнхроматы, M2Cr3Oi0, красн.,
M = K, разл 243
K2Cr2O7 + СЮ,
Бихроматы, оранж.
т. пл. разл.
Na2Cr2O7 320 400
K2Cr2O7 398 > 500
200°
р. в H2O, %
62 2 H2O
13 —
Cr2O3+ N2 + H2O
сгорает
M11Cr2O7, Mn = Ca, Ba ( 2 H2O), Pb
("крокоит"), р. в H2O, оч. сильн. окисл.;
+ HCl Cl2 + CrCl3, анионы - 2
тетраэдра с общ. вершиной
Хроматы, желт.
Na2CrO4 792 46 IOH2O
K2CrO4 968-980 39
(WH4)CrO4 разл. 200
CaCrO4, "хроматит", • 2 H2O, р. в H2O
BaCrO4],; PbCrO4 Н20|, "иранит";
Ag2CrO4J, анион - тетраэдр
НГ
CrO2X2, X = ClO4, CH3COO,
SO3F, NO3, OR, Sb2F11, SbF6
MICrO3F],
M = Lif 2 H2O), Na ( 2 H2O),
‘ М|СЮ3С1|, оранж., уст. при pH 4 7,
К|Сг03Вг|, кор., К|СЮ31|, красн.,
+ H2O *=* K2Cr2O7 + НГ;
HX; ClO3 (-ClO2-
Cl2)
Хромилгалогениды
т. пл.
т. к.
CrO2F2, крист., фиол.
CrO2CI2, ж., красн.,
CrO2Br2, крист.
гигр., р. В CCl4, ОЧ. СИЛ!
с орг. в-вами, мол. - иа
30
-97
>Н. OKHCj
каж. тет
возг.
117
п., взр.
раэдр
M2ICrO2F4I, M = K, Cs, желт.
MICrO2F3I, M = [NO2], [NO]
SiO2 (20°)
SO3(SO2Cl2)
CrO(SO4)2
CrOF4, крист., красн., т. пл. 55
INOIICrOF5], крист., роз.
CrF6, крист., лимонно-желт~|
19
HClO4, HIO3; O2(<400°, р)
Cr(NO3)3 • 9 H2O
CrO2, крист., черн.,
разл. 450, AH = -594,
проводник, ферромагн.,
стр. тип рутила (TiO2)
Хроматы (V)
MiCrO4, зел., парамагн.
Я,*ф= 1.60
MV(CrO4)2, Mn = Ca, Ba,
черн., анион - тетраэдр
+ H+ —. Сг,+ + Cr2O7"
Хроматы (IV)
Na4CrO4, зел. = 2.8
M11CrO3, Mi1CrO4,
черн., уст. на возд.
Ba3CrO5, зел.
Ml1CrOt, M11 = Sr, Ba;
+ H2O —► Cr(III) + Cr(Vi)
Хроматы (III)
M3ICr(OH)6I
MCrO2, M = Li -Cs, зел.,
CnO3 M11O,
M = М§("магнезиохромит"),
Fe ("хромит”, шпинели)
wCr2(SO4)3 • л H2O",
= H111 ICrz(SO4)K5w (OH)x(H2O)rI,
п ^ 6, "зел. сульфаты"
M3ICr(C2O4)3I л H2O
крист, с плеохроизмом
от красн. до сине-зел.
CrOF3,
CrOCI3, красн.,
разл. >0°, возг.
+ H2O — Cr3 * +
+ Cr(Vi)
MICrOF4I,
пурп.
MICrOCI4I
М2|СгОС15|,
/*эфф— 1-7
MCrF6,
M = Cs, [NF4],
[NO], [NO2]
CrF5, крист.,
малиновые,
т. пл. 30,
в стр. - цепи окт.
сильн. окисл.;
+ SO3 —► S2O6F2 +
+ Cr(SO3F)3
MICrF5I, роз.,
/Ьфф — 3.1
M2ICrF6I,
M = K-Cs,
парамагн.,
окт. анион
MF
(BrF3)
MF
CrF4, зел., возг.,
т. пл. 200,
A H = -1196,
реаг. со стеклом,
/*эфф ~ 3
ей ) СУЩ-в г-
MiJCrFtI, Rb2CrFs, MICrF4I,,
в стр. - изолир.
или консированые окт.
M3ICrCI6I, M3ICr2CI9I, красн.,
парамагн., 3.77
M2ICrCI5(H2O)I,
M2ICrCI2(H2O)4ICl3, крист., зел.
Cs3ICr2Br9I, Мтфф = 3.81
M2JCrBr5(H2O)I, крист., фиол.
M2JCrBr2(H2O)4IBr3,
M = Rb, Cs, зел.
K3ICr(CN)6I, крист., желт., разл. 150,
(</3, 3 неспаренных эл.)
K3ICr(NCS)6I • 4 H2O, красно-фиол.,
MlCr(NCS)4(NH3)2I-InzMwtc, M = NH4
("соль Рейнеке"), Си/2|, Щ/2|, H
("к. Рейнеке"), крист., красн.
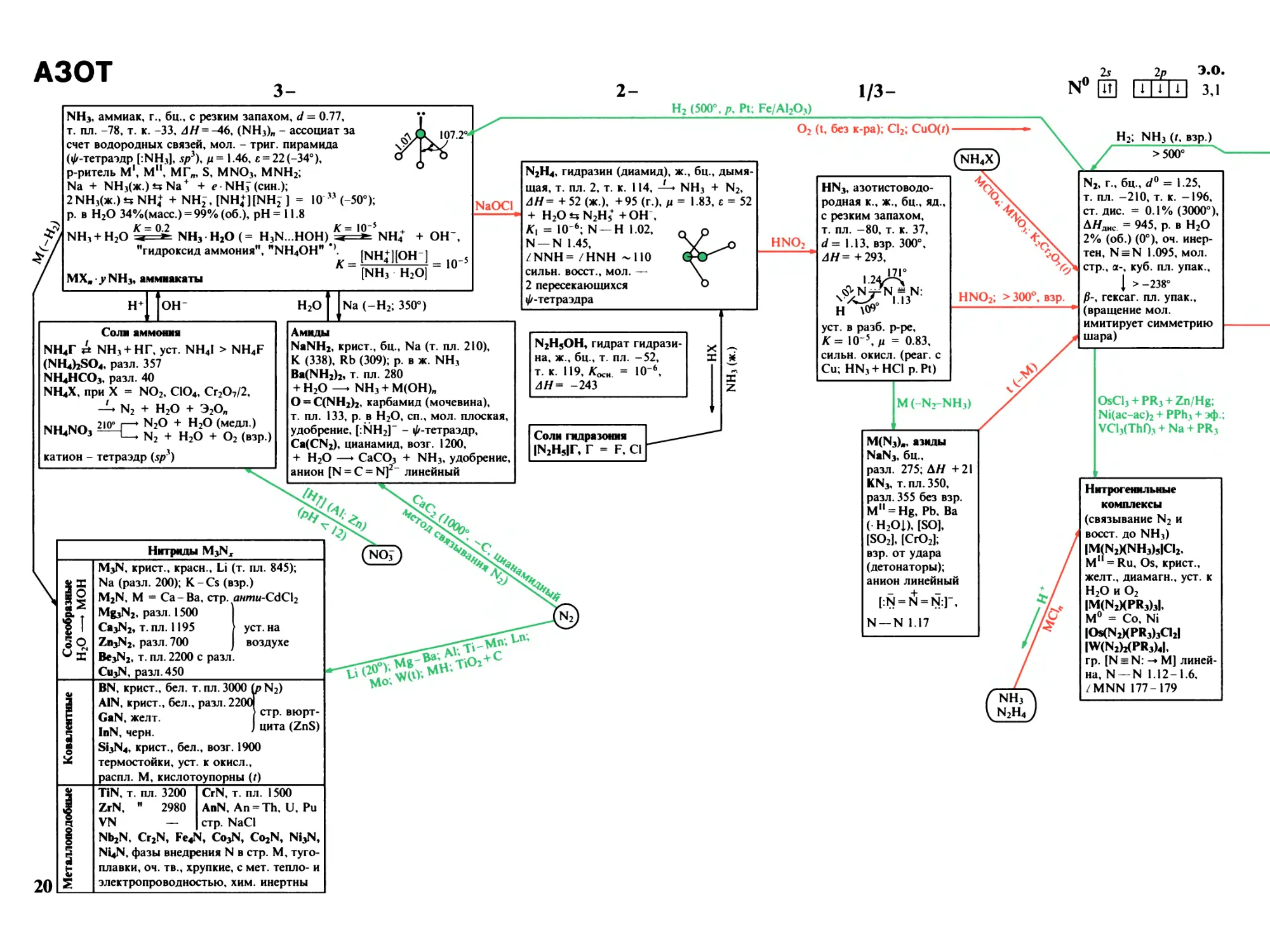
АЗОТ
з-
2-
NH3, аммиак, г., бц., с резким запахом, d = 0.77,
т. пл. -78, т. к. -33, АН = -46, (NH3)n - ассоциат за
счет водородных связей, мол. - триг. пирамида
(^-тетраэдр [INH3], Spi), ц = 1.46, г = 22 (-34°),
р-ритель M1, М", МГ„, S, MNOj, MNH2;
Na + №13(ж.)±*№ + + е NHJ (син.);
2 NH3(Xc) NHJ + NH2-, [NH4+][NHj ] = IO ” (-50°);
р. в H2O 34%(масс.) = 99% (об.), pH = 11.8
K = 0.2 K= IO5
NH3+ H2O ^ NH3 H2O (= H3N -HOH) * >»
NH4+ + ОН
"гидроксид аммония", "NH4OH"
K =
MXjt • у NH3, аммиакаты
[NH4IlOH-]
[NH3 H2O]
= 10"
Hh
он-
H2O
Соли аммония
NKtr Jt NH3 + НГ, уст. NH4I > NH4F
(NKibSO4, разл. 357
NH4HCO3, разл. 40
NH4X, при X = NO2, ClO4, Сг207/2,
N2 + H2O + Э2Оп
N2O + H2O (медл.)
NH4NO3
+ H2O + O2 (взр.)
катион - тетраэдр (Spi)
H2 (500°, рч Pt; FeZAl2O3)
1/3-
л
N0 03
м.
э.о.
Hihl зл
O2 (t, без к-ра); Cl2; CuO(Z) -
NaOCl
Na (-H2; 350°)
N2H4, гидразин (диамид), ж., бц., дымя¬
щая, т. пл. 2, т. к. 114, NH3 + N2,
AH = +52 (ж.), +95 (г.), р = 1.83, е = 52
+ H2Ot5N2Hs+ + ОН ,
K1 = IO 6; N-H 1.02,
N-N 1.45,
ZNNH= /HNH -110
СИЛЬН. ВОССТ., МОЛ. —
2 пересекающихся
ф-тетраэдра
Амиды
NaNH2, крист., бц., Na (т. пл. 210),
К (338), Rb (309); р. в ж. NH3
Ba(NH2)2, т. пл. 280
+ H2O — NH3+ M(OH)n
О = C(NH2)2, карбамид (мочевина),
т. пл. 133, р. в H2O, сп., мол. плоская,
удобрение, [:К|Н2]- - ф-тетраэдр,
Ca(CN2), цианамид, возг. 1200,
+ H2O —» CaCO3 + NH3, удобрение,
N2H5OH, гидрат гидрази¬
на, ж., бц., т. пл. -52,
т. к. 119, Koch. = IO-6,
AH= -243
Соли гидразония
IN2H5If, Г = F, Cl
HNO2
\
20
Нитриды M3Nx
1°
I2
I1
<51
I
M3N, крист., красн., Li (т. пл. 845);
Na (разл. 200); K-Cs (взр.)
M2N, M = Ca-Ba, стр. AwmM-CdCl2
Mg3N2, разл. 1500
Ca3N2, т. пл. 1195
Zn3N2, разл. 700
Be3N2, т. пл. 2200 с разл.
Cu3N, разл. 450
уст. на
воздухе
BN, крист., бел. т. пл. 3000 (р N2)
AlN, крист., бел., разл. 2200(
GaN, желт. ] ctP b^
InN, черн. > цита (2п5:)
Si3N4, крист., бел., возг. 1900
термостойки, уст. к окисл.,
распл. М, кислотоупорны (/)
TiN, т. пл. 3200 CrN, т. пл. 1500
ZrN, " 2980 AnN, An = Th, U, Pu
VN — стр. NaCl
Nb2N, Cr2N, Fe4N, Co3N, Co2N, Ni3N,
Ni4N, фазы внедрения N в стр. М, туго¬
плавки, оч. тв., хрупкие, с мет. тепло- и
электропроводностью, хим. инертны
HN3, азотистоводо¬
родная к., ж., бц., яд.,
с резким запахом,
т. пл. -80, т. к. 37,
d= 1.13, взр. 300°,
AH= +293,
IVzC
H \®°
уст. в разб. р-ре,
K= IO"5, ц = 0.83,
сильн. окисл. (реаг. с
Cu; HN3 + HCl p Pt)
HNO2; > 300°, взр.
M (-N2-NH3)
M(N3)11, азиды
NaN3, бц.,
разл. 275; АН +21
KN3, т. пл. 350,
разл. 355 без взр.
м" = Hg, Pb. Ba
( H2Oi), [SO],
[SO2], [CrO2];
взр. от удара
(детонаторы);
анион линейный
[!N = N = N:]",
N-N 1.17
Z
H2; NH3 (/, взр.)
>500°
N2, г., бц., d0= 1.25,
т. пл. -210, т. к. -196,
ст. дис. = 0.1% (3000°),
АЯднс = 945, р. в H2O
2% (об.) (0°), оч. инер¬
тен, N = N 1.095, мол.
стр., а-, куб. пл. упак.,
[ >-238°
/?-, гексаг. пл. упак.,
(вращение мол.
имитирует симметрию
шара)
OsCl3 + PR3 + ZnZHg;
№(ас-ас)2 + PPh3 + эф.;
VCl3(Thf)* + Na + PR3
Нитрогенильные
комплексы
(связывание N2 и
восст. до NH3)
IM(N2KNH3)5Id2,
M11 = Ru, Os, крист.,
желт., диамагн., уст. к
H2O и O2
IM(N2KPR3)3I,
M0 = Co, Ni
IOs(N2KPR3)3CI2I
IW(N2)2(PR3)4I,
гр. [N = N: -» М] линей¬
на, N-N 1.12-1.6,
/MNN 177-179
1 +
2 +
N2O, оксид азота (I),
("закись",
"веселящий газ"), бц.,
т. пл. -91, т. к. -88,
d = 1.98, АН =+81,
р. в H2O 56% (об.) (0°),
/i = 0.17, линейная мол.
JN = N = O или IN = N-O:
"1.13 1.18*'
не реаг. с к., щ., O2, но
поддерживает горение
SO-
O2 (4000°, дуга);
(Pt + оксиды Mn-Co)
NO, оксид азота (И), г.,
бц., яд., т. пл. -164,
т. к. -151, d = 1.34,
АН = +90, парамагн.,
/i = 0.16, N=O 1.15, в бц.
ж. и крист. - диамагн. мол.
цис- N2O2 — трапеция
(N-N 2.18,0 — 0 2.62),
мало р. в H2O, к.,
не поддерживает горение.
Fe(INO)4; Ru(INO)5; Cr(INO)4,
Гр. [M-(N = O)*]
линейна (sp), N — О 1.1 - 1.2
IFe1(NO)+(H1O)sI2 + , бур. р-р
Z
-H2; H2S (взр.)
H2N2O2, азотноватистая к.,
крист., бц., взр., р. в H2O,
сп., эф., К\ = 10 ,
K2 = IO-12, оч. сл.
окисл. и восст.,
+ MnO4 —► NO3";
+ [Htl — [NH3OH] +
O2
(мгнов.);
NO2
3 +
N2O3 ** NO + NO2
100% при 100'
4 +
(Pb(NO3)2)
90% при 25°
оксид азота (III),
(азотистый Л О
ангидрид); г. красно-бур., яд.,
d= 1.45, т. пл. -101,
АН = + 84, ж. и крист, гол.;
р. в H2O с расслаиванием,
в г. — плоские мол. ц = 2.12;
в стр. - [NO] + [NO2]',
N — О 1.12 (в катионе),
1.21 (в анионе)
(HNO3 (33%))
'О*
Oi (мгнов.);
~ NO
(600°, -O2)
HNO2, азотистая к., оч. сильн. окисл.
0 Изв. только в р-ре (конц. - гол.)
и в г. (плоские мол., транс-формы)
S H2O+ NO+TiHNO2^H ++NO2
Koch = IO-7, К. = IO-5;
+ H + —> NO + HNO3 + H2O
N2O4 ±5 2М>2-58кДж
оксид азота (IV)
бц. бур.
99.8% (21°) 100% (140°)
АН = +10 АН = +34
парамагн.,
/i = 0.29
г., бур., яд, т. пл. -11, т. к. 21,
ж. бур., крист, бц., электро-
проводны в IO3 раз > ж.,
N2O4 (ж.) NO+ + NO3.
RCN, RCOOH, HNO3 и др.
доноры эл. усиливают дис.
(—> [DiNO] + );
+ M-M(NO3)n т N2O4 + NO,
M = Na, Cu, Fe, Mn и др.
&
03(-78—> -25°)
20° (-O2)
5 +
N2O5, оксид азота (V)
азотный ангидрид,
крист., бц., летучие,
яд, т. пл. 41 (р),
возг. 32, т. к. 45,
взр., d = 2.17,
АН = -42, в стр. - [NO2]+ [NO3] ,
в г. — неионизированные мол.,
H = 1.39
к
H2O
Vh2SO4
SvAs2O3; крахмал (C6HiqO5)v; H2(Pd)
H2O2
(AgNO3
OV
H2O -H2O(P2O5)
HNO3, азотная, сильн. к.,
К = 20, ж., бц., с>
(JirJl NO2T + H2O + O2T), *
плоская мол., т. пл. —41,
т. к. 84 (экстраполировано),
H3O+ + NO3 + N2O5 3 HNO3 *±
ЯН30+ + NOz+ + 2 NO',
3% оч. слаб, окисл., 5% + Mg —► H2;
30% окисл., 60% оч. сильн. окисл.
(+ 3 HCl + Au — HfAuCl4] + NO + H2O
плоская мол., /i = 2.16
• IfH2O, л = 3 (= [H7O3] +[NO3]');
1 ( = [H3O] + INO3] ); т.к. азеотропа
с H2O (68% HNO3) = 122, d= 1.40
Соли нитрозония
(нитрозилы), INOI + X-
крист., бц., оч. гигр.
INOiHSO4, "нитрозилсерная к.",
т. пл. 73;
INOI2S2O7, т. пл. 233, т. к. 360
INOIXF4, X = В, Br
INOI2IMCUb M = Sn, Ti-Hf, Th, V
INOIIm(NO3)3I, M = Cu, Mn
Нитриты, крист., бц. или св.-
желт., летучи (500°, вак.)
т. пл. т. разл.
LiNO2 220 H2O
NaNO2 284 900
KNO2 438 350
Ba(NO2)2 - H2O 200
-U NO2 + NO + N2
IrNO2] - ф-тр-к (sp2),
сильн. окисл. в распл.
+ O2 +.
^H ZSO^-Na H SO4)
(метод Глаубера)
INO2I+ X , соли ннтрония
(нитрилы), X = PF6,
HSO4, HS2O7, MoF7, ClO4,
крист., бц., оч. гигр.,
оч. сильн. окисл.,
линейный катион
[O = N=OJ + ; N-O 1.15
г (-O2); С; Fe
О
О
О
N
О
H
Локализованная
электронная пара
MClrt;
Mf-NO)
Нитраты
крист., бц. т. пл.
UNO3 261
NaNO3 308
‘'чилийская селитра"
зн2о
разл.380
KNO3
Ca(NO3)2
Ba(NO3)2
Pb(NO3)2
AgNO3
334 разл. 400
561 • 4 H2O
592
208 с разл.
210 разл. 300
р. в ж. NH3; анион - тр-к,
ZONO 120 (Jp2)1 N-O 1.18-1.25;
окисл. только в распл.; в г. - мол.
M1NO3, стр. аналоги HNO3;
M(NO3)rt Jc H2O M2Ort + H2O +
+ NO2 + O2;
M1NO3, Mlf(NO3)2, M = Li -Cs,
Ca-Ba, Ni
M(NO2)rt + O2 + NO + NO2
M(NO3)e, M = Be, Al, Mg, Fe, Co, Ni,
Ti, Sniv, крист., летучи, р. в орг.
р-рителях, гидрол.
21
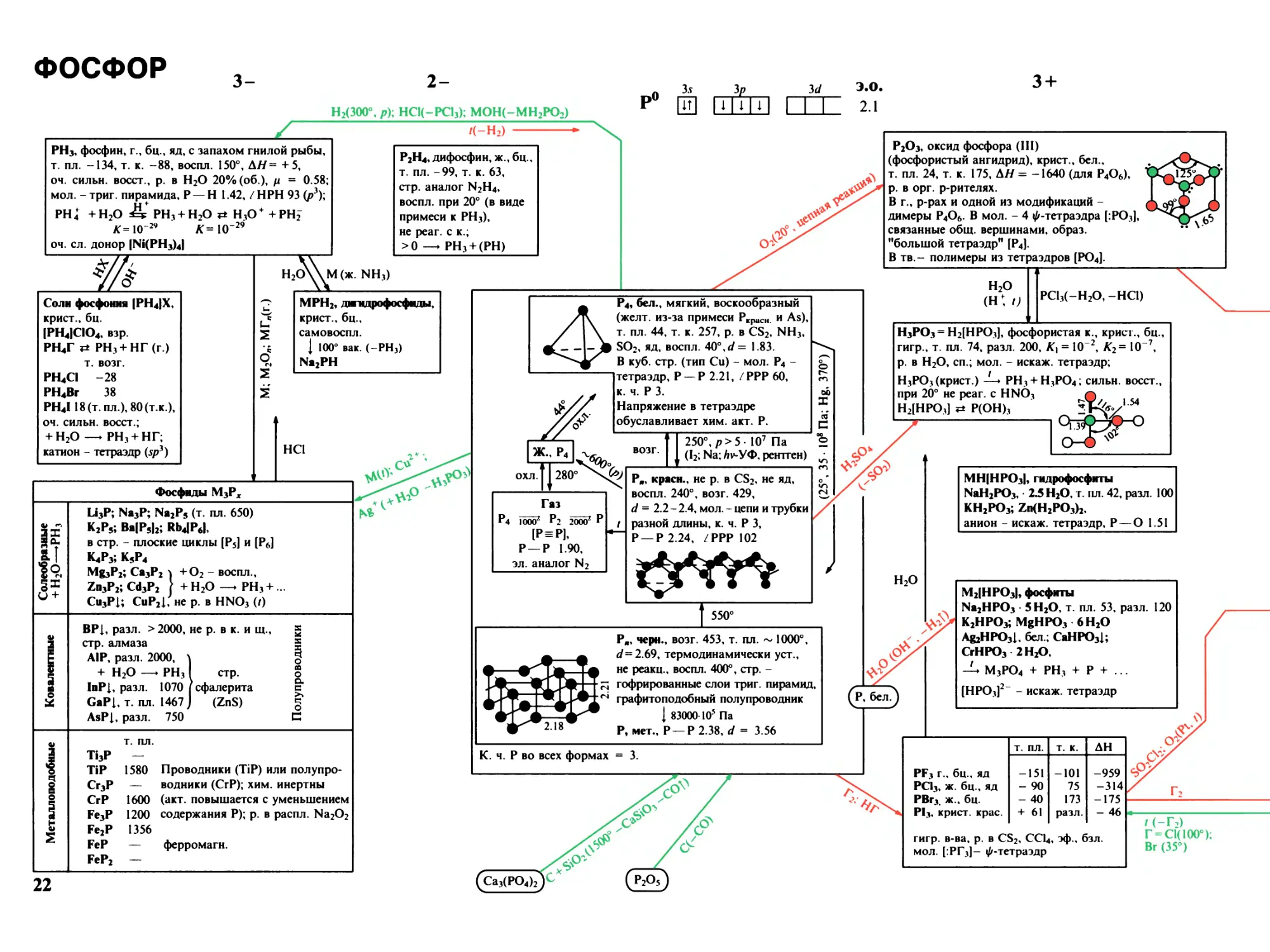
ФОСФОР
з-
JL
2-
Н2(300°, Р)\ НС1(-РС1з); М0Н(-МН2Р02)
3 J
QD
3P
ПК
3 d
э.о.
2.1
3 +
/(-H2)
PH3, фосфин, г., бц., яд, с запахом гнилой рыбы,
т. пл. -134, т. к. -88, воспл. 150°, AH = + 5,
оч. сильн. восст., р. в H2O 20% (об.), р = 0.58;
мол. - триг. пирамида, P— H 1.42, / HPH 93 (ръ)\
PH 4 +H2O Ш PH1 + H2O г* H1O+ +PHJ
Jf=IOw AT= IO-29
оч. сл. донор INi(PH3)4I
Соли фосфоння (PH4)X,
крист., бц.
IPH4ICIO4, взр.
РК|Г PH3-I-НГ (г.)
т. возг.
PH4CI -28
PH4Br 38
PH4118 (т. пл.), 80 (т.к.),
оч. сильн. восст.;
-I-H2O —♦ PH3-I-НГ;
катион - тетраэдр (sp3)
ж
P2H4, ди фосфин, ж., бц.,
т. пл. -99, т. к. 63,
стр. аналог N2H4,
воспл. при 20° (в виде
примеси к PH3),
не реаг. с к.;
>0 —♦ PH3-I-(PH)
M (ж. NH3)
MPH2, дшкдрофосфнды,
крист., бц.,
самовоспл.
{ 100° вак. (-PH3)
Na2PH
HCl
Фосфиды M3Px
If
19,
О +
Li3P; Na3P; Na2P5 (т. пл. 650)
K2P5; Ва|Р5|2; Rb4JP6I,
в стр. - плоские циклы [P5] и [P6]
K4P3; K5P4
Mg3P2; Ca3P2 ^ +O2 - воспл.,
Zn3P2; Cd3P2 ) + H2O —♦ PH3 +.
Cu3Pl; CuP2I, не р. в HNO3 (/)
BPl, разл. > 2000, не р. в к. и щ.,
стр. алмаза
AIP, разл. 2000, \
+ H2O —♦ PH31 стр.
InPl, разл. 1070 I сфалерита
GaPl, т. пл. 1467 J (ZnS)
AsPl, разл. 750
s
н
S
I
CQ
О
а
R
о
с
Ti3P
TiP
Cr3P
CrP
Fe3P
Fe2P
FeP
FeP2
1580 Проводники (TiP) или полупро-
— водники (СгР); хим. инертны
1600 (акт. повышается с уменьшением
1200 содержания Р); р. в распл. Na2O2
1356
— ферромагн.
P2O3, оксид фосфора (III)
(фосфористый ангидрид), крист., бел.,
т. пл. 24, т. к. 175, АН = -1640 (для P4O6),
р. в орг. р-рителях.
В г., р-рах и одной из модификаций -
димеры P4O6. В мол. - 4 ^-тетраэдра [:Р03],
связанные общ. вершинами, образ,
"большой тетраэдр" [P4].
В тв.- полимеры из тетраэдров [PO4].
?Г \>
^ I4, UcJl., MX
(желт, из-з;
/ I \ т. пл. 44, т.
-I-Ob SO2, яд, во
в кУб- стр.
P4, бел., мягкий, воскообразный
-за примеси Ркрасн и As),
к. 257, р. в CS2, NH3,
воспл. 40°,= 1.83.
(тип Си) - мол. P4 -
тетраэдр, P — P 2.21, /РРР 60,
к. ч. P 3.
Напряжение в тетраэдре
обуславливает хим. акт. Р.
H2O
(н: и
РС13(-Н20,-НС1)
возг.
Газ
4 IOOO^ P2 2000*
[P=PL
P-P 1.90,
эл. аналог N2
250°, р> 5- IO7 Па
(I2; Na; Hv- УФ, рентген)
P11, красн., не р. в CS2, не яд,
воспл. 240°, возг. 429,
d = 2.2 - 2.4, мол. - цепи и трубки
разной длины, к. ч. P 3,
P-P 2.24, ZPPP 102
550°
Pjl, черн., возг. 453, т. пл. ~ 1000°,
</=2.69, термодинамически уст.,
не реакц., воспл. 400°, стр. -
гофрированные слои триг. пирамид,
графитоподобный полупроводник
{ 83000 IO5 Па
Р, мет., P-P 2.38, d = 3.56
H3PO3 = Н2[НPO3], фосфористая к., крист., бц.,
гигр., т. пл. 74, разл. 200, К\ = IO-2, K2 = IO 7,
р. в H2O, сп.; мол. - искаж. тетраэдр;
H3PO3 (крист.) -!—* PH3 + H3PO4; сильн. восст.,
при 20° не реаг. с HNO3
H2JHPO3] *± P(OH)3
МН(НР03|, гидрофосфиты
NaH2PO3, • 2.5 H2O, г. пл. 42, разл. 100
KH2PO3; Zn(H2PO3)2,
анион - искаж. тетраэдр, P — О 1.51
M2IHPO3I, фосфиты
Na2HPO3 5 H2O, т пл. 53, разл. 120
K2HPO3; MgHPO3 6 H2O
Ag2HPO3I, бел.; CaHPO3I;
CrHPO3^H2O,
-U M3PO4 + PH3 + P + .
[HPO3]2- - искаж. тетраэдр
К. ч. P во всех формах = 3.
22
т. пл.
т. к.
АН
PF3 г., бц., яд
-151
-101
-959
PCI3, ж. бц., яд
- 90
75
-314
PBr3. ж., бц.
- 40
173
-175
PI3, крист, крас.
+ 61
разл.
- 46
гигр. в-ва, р. в CS2, CCl4, эф., бзл.
мол. [:РГз]— ^-тетраэдр
^Ca3(PO4)2
5 +
P2O5, фосфорный ангидрид, порошок, бел., оч. гигр. (смесь аморфного и гексаг.), бурно реаг. с H2O;
сильнейший дегидратирующий агент. В г. и гексаг. стр. - димеры P4Oi0, образованы тетраэдром [P4],
над ребрами которого - 6 мост. ат. О; у каждого ат. P - 1 конц. ат. О, P = О 1.40- 1.49 (конц.), P — О 1.56- 1.65 (мост.)
а-, гексаг. (ромбоэдрическая) мол. стр.,
d = 2.3, т. пл. 422 (р), возг. 359 (летуч
< P2O3), АН = -2988 (для Р4О|0), оч. реакц.
422°
ж., летучая, подвиж¬
ная (мол. Р4О10)
ж., нелетучая, вязкая
(из полимерных мол.)
P2O5
• р
OO
Ог
О H
•• локализ.
эл. пара
H2O (в недостатке, 0°)
(HPO3)*, п = 3, 4, 6, "метафосфорная к.”, стекловидная масса, бц., гигр., т. пл. «40, возг., р. в H2O, сп., сильн. к., Ki = 10 , K4 = 10 \
единственная из к. P свертывает белок (большой заряд аниона), в стр. - неупорядоченное расположение циклических мол. - (HPO3)4 и др.
Оксогалогениды
POF2 г. бц.
POCl3, ж. бц.
оч. токе.
POBr3. крист., бц.
POI3, крист, фиол
-39(р)
+ 1
56
50
-40
107
192
АН
-1218
- 602
-460
РОГ3, гигр., р. в орг. р-рителях;
+ H2O^H3PO4,
мол. — искаж. тетраэдр (луг*)
S
<ч
О
X
M2On(Z)
г (MH2PO4)TVh2O)
MOH
Полиметафосфаты
MilP-O3.-,(ОНЫ, п = 20-70, образ, из р-ров, хор., но медл. р. в H2O (с частичной олигомеризацией)
IVf5IP3OioI, триполифосфаты
NaZn2IP3O10I 9.5 H2O
(NH4)5IP3O10I H2O
M6IP4Oi3I, тетра-
Na6IP4Ol3I, стекло
MtIP5Oi6I, пента-
Цнклометафосфаты
IM(PO3)mIl, п = 3-6, 8, 10, 12, в стр. - неплоские циклические анионы [PO3E-
из тетраэдров [PO4], P — О 1.6-1.7(мост.), 1.4-1.5(конц.), ZOPO 100-11,
ZPOP 103-139
тетрамета-,
Li4IP4Oi2I 6 H2O
Na4IP4O12I, 4 H2O
тримета-,
Li3IP3O9I ЗН20
Na3JP3O9I я H2O,
гексамета
LUP6O18I
Na6IP6Ol8I
AvctA
SH2O
6Н20
H4P2O7, ди(пиро)фосфорная к., стекло или крист., бц., т. пл. 61,
K1 = 10~2, Kj = 10~3. AT3 = 10~7, K4= Ю~10, р. в H2O, СП., эф.
? ?
сю-#—о-
т. пл.
т. к.
АН
PF5 г., бц., яд
-94
-85
-1594
PCl5, крист., бц., яд
160 возг.
159(р)
- 433
PBr5. крист., оранж.
106
-
- 231
PI5, крист., черн.
40
-
-
РГ5, оч. гигр. в-ва, р. в CCl4, CS2, бенз.;
мол. PF5 , PCl5 (г.) - триг. бипир. (Sp3(I), /
в тв. - [PCU] + IPCl6]-, [PBr4]+Br- '
образ, стр. типа CsCl
43°
Дн(пмро)фосфаты
Na2H2P2O7, разл. 220, 6H2O; Na4P2O7, т. пл. 988, IOH2O; Ag4P2O7I, бел.; K4P2O7 ЗН20, (^ H2O,);
M21P2O7I, Mn= Mg-Ba, Zn, M3(PO4)2-I-P2O5I, анион - 2 тетраэдра с общ, вершиной, ZPOP 130- 157
H3PO4, ортофосфорная к., крист., бц., гигр., не яд, т. пл. 42, Ki = 10 ,
AT2= IO-7, AT1 = IO |2, р. в сп., е = 61 (25°), 2 H3PO4 *± [H4PO4]+ + [H2PO4]",
мол. - искаж. тетраэдр, сл. окисл. (>350°), реаг. с М, SiO2
• 1/2Н20, т. пл. 30 (80% р-р H3PO4, вязкий сироп); продажный препарат «85% Q-O
/ (-H2O)
H2SO4
Однозамоцетые (первичные) дигидрофос¬
фаты, MIH2PO4I11, р. в H2O (при любых М)
NaH2PO4, разл. 200; KH2PO4, т. пл. 253
с разл.; (NH4)H2PO4, т. пл. 190
Са(Н21Ю4)2, двойной суперфосфат”
Ca(H2PO4)2 H2O+ CaSO4I, "простой”
M(PO1)n+H2O.
В стр. - цепи анионов с Н-связями
Моно (орто) фосфаты
Двузамещемые (вторичные) гидрофосфаты
M2IHPO4I11, р. в H2O только при M1
Na2HPO4, (разл. 300°),
• IiH2O л = 12 (разл. 35°),7 (48°), 2(95°);
NaNH4HPO4, "фосфорная соль",
-U NaPO3 + NH3 + H2O;
С»НР04, 2 H2O 1, "бруцит"
ПР= 10 , "преципитат"
M4P2O7 + H2O
Трехзамещенные (третичные), M3IPO4Ijv,
р. в H2O только при M = Na-Cs, NH4;
Na3PO4, т. пл. 1340, • я H2O п = 10, 12
Ca3(PO4)2I, т. пл. 1670, ПР = IO'25;
Ce5(PO4)J(FlQlOH), "фтор-", "хлор-",
"гидроксила патиты";
анион - правильный тетраэдр (sp1)
23
ВАНАДИЙ
2 + (</ )
и
V0 ИМИ
45
Ш
*Е.
Э.О.
1.5
VOj ±я, п = 0.25, крист., черн, с мет.
блеском, т. пл. 1830, AH = -412, р. в к.,
проводник (при выс. t - полупровод¬
ник), стр. тип NaCl
V(OH)2I, кор., р. в к.
V, мет., бел., тв., </=6.1,
т. пл. 1920, т. к. 3450,
^0V2 + /V = —25;
Ео^+/у11= -°-87°;
р. в HF, ц. в. (20°),
HNO3, H2SO4-Kohu. (0;
куб. стр. (тип S-Fe),
V-V 2.68
V(CIO4)2 • 6 H2O, иглы, красно-фиол.
VSO4 • л H2O, л = 7 (фиол. "купорос”),
6, 4, 1
Феррованадий
30-80% V; 3.5% Si; >2% Al;
1% С; 0.1-0.2% P и S;
70- 10% Fe. В системе Fe-V
сущ. тв. р-р вычитания и VFe,
(т. пл. 1234).
Ванадиевые стали
(0.2% V) ковки, упруги,
обладают значительной
прочностью на истирание и
сопротивлением на разрыв
Сплавы Al-V уст. к коррозии
4Г-
^V2Os+ Fe2O3)
0(<п
V(CO)6, крист., сине-зел.,
возг. вак. 40, разл. 60,
окисл. возд., оранж.
р-ры в орг. р-рителях оч.
неустойчивы; парамагн.,
мол. - искаж. окт.
VF2, св.-зел., стр. тип CaF2;
• 4 H2O, сине-фиол.
VCI2, св.-зел., т. пл. 1350,
возг. 1000, стр. тип CdI2;
• 4Н20
VBr2, кор., стр. тип CdI2;
6Н20
VI2, а-, черн., возг. 800,
P-, красн., стр. тип CdI2;
> 1400° ж, ^ ,
► V + I2, /4тфф % 3
A H
-451
-348
-264
MVF3, M = Na-Rb
MVQ3, M = K, NH4,
Tl
K2VCI4
Cs2VCI4 2 H2O
MVBr3, роз-кор.
KVBr3 6 H2O,
фиол.
3 + (</2)
V (1200°)
V2O3, крист., черн., т. пл. 1970,
т. к. -3000, AH = -1239, р. в к.,
"карелианит", стр. тип корунда (Al2O3)
I / (-H2O)
VO(OH), "монтрозеит",
стр. аналог "диаспора" (AlOOH)
V(OH)3I, кор.-зел., р. в к.,
сильн. восст.
IV(H2O)6I3+, син. парамагн. окт.
((J2Spy) ион, оч. сильн. восст.
MVO2, M = Li-K, черн.
V2(SO4)3I, оранж. (монокл.),
зел. (гексаг.), 400 ► SO2 + VOSO4
• л H2O, п = 2,4, 10
M2SO4 24 H2O, M = NH4, Rb, Cs, Tl,
фиол. квасцы, уст. на возд.
V(H2PO3)3I, желто-зел.
VPO4, кор.
I H3PO4
IV(PO3)3L,, л = 4, оо; желто-зел., в стр. -
цепи окт. [VO6) и тетраэдров [PO4],
V(CH3COO)3
230°
HIV(SO4)2I л H2O, п = 4, 6, зел.
MIV(SO4)2I, зел., -6 H2O, фиол.,
в стр. - окт. [VO6],
Na3V(SO4)3
CsiVHP3OioI; RbIV(HPO4)2I
CslV2P5Oi6I, в стр. - цепи тетраэдров
[PO4], связанных с окт. [VO6],
M3IV(C2O4)3I, анион - окт.
VOr, уст. VOI < VOBr < VOCl
VF3, зел., возг. 800,
A H
-1335
зн2о
VCl3, фиол.
Vci2 + VCi4,
-782
6 H2O
VBr3, черно-зел.,
VBr2 + Br2,
-452
Vl,, черн., VI2 +12,
/1эфф — 2.92 у
-280
Vf3 сл. гир^г, мало р. в H2O, лучше - в сп.
K3VF6, т. пл. 1020,
(NH4)3VF6I, желто-зел., т. пл. 1400
M2IVF5(H2O)I, крист., зел.
MIVF4(H2O)2I
MIVCl4I, анион - тетраэдр, • л H2O,
M = K-Cs,/! = О (фиол.), 1 (красн.), 4 (зел.)
Cs2IV CI2(H2O)4ICl3-ZnpaMr; Cs3JV CI2(H2O)4ICI4,
M2VCI5, M3VCI6, M3IV2CI9I
MIVBr4I, Cs2IVBr2(H2O)4IBrrmpflwr
t (—Г2); H2 (О
K4JV(CN)6I 3 H2O, желт.,
анион - окт.; /i^ = 3.83
K4IV(CN)6(NO)I, диамагн.
M4JV(NCS)6I л H2O
/ (-Cl2)
K3IV(CN)6I ЗН20, красн.
K4IV(CN)7I • 2 H2O, фиол., анион -
пентаг. бипир.,
M3IV(NCS)6I, M = Na ( 12 H2O), К
VN,
V3P
V3N, VP, VP2, V3P2, V2P,
V2C, V3Si, VB2, V3B4
металлоподобные фазы внедрения в стр. V
24
4+ (</')
5+ (</")
VO2, син., гигр., т. пл. 1545, т. к. ~ 2700,
АН = -720, р. в к. и щ., искаж. стр. тип рутила
(TiO2), "парамонтрозит"; • 2/3 H2O
V2O3(Z); H2; NH3
(COOH)2;
VOiOH Ы, желт., р. в к. и щ.,
"дуттонит"
Соли ванадила (IV), (О = V)
VO(CIO4)2 5 H2O
VOSO4I, я H2O, п= 1-3 (зел ),
6 син., OcSH2SO4;
WM2SO4, п = 1,2, син.
(VO)3(PO4)2 • 9 H2O
VO(HPO4)^H2O
VO(H2PO4)2, син.
(VO)2P2O7
VO(C2O4)^H2O, л = 2,4
В стр. солей - окт. ион [VOX5].
MOH
HX
VOF2, желт.
VOCI2 зел., возг., разл. 300; • 2.5 H2O
VOBr2, желт., разл. 180
VOI2 2.5 H2O, кор.
VOf 2, гигр., хор. р. в H2O, сп.
H2O
АН
VF4, крист., гигр., желто-кор.,
-1412
VF3 +VF5T, в стр. - слои окт.
VCl4, ж., красн., оч. гигр., т. пл.
-694
^-20, т. к. 154, медл. разл. 20
(—> VCl3 + Cl2T)
VBr4, крист., красн., разл. -23
-393
(—► VBr3 + Br2) мол. - тетраэдр
VS1+Л, п = 0.14 -0.53, черн.,
р. в H2SO4 (/), M2S, стр. тип NiAs
V3S4 и V5S8f V(S2)2, "патронит”
Ванадаты (IV), желт, или кор.
Mlvo4. NafVOb(OH)5;
MpVO5; MfVO4; MiVO3
MiV2O5, K2V3O7
M2V4O9 7 H2O
2.66 H2O
BaIVO(PO4)I2 4 H2O
K2IVO(P2O7)I, анион - тетраг.
пирамида
(NH4)2IVO(C2O4)2I 2 H2O,
V2O5, оранж., т. пл. 680, разл. 700, АН = -1573, р. в H2O « 0.04%,
р. в к. и щ., летучи с паром H2O (±^ H4V2O7 г.), V2O5 (ж.) *=* VO2 +VOJ
(проводник), в стр. - двойные цепи тетраг. пирамид [VO5], • я H2O, п = 1, 2, 3
H4IlOH-
Ионы V(V) в водном растворе
!/Mc-IVO2(H2O)11I + , красн., сильнейший окисл.
H6Vi0O28, сильн. к.
|Н„У,о02*|<4~|',~
IV10OmI6-
Iv2O5 я H2OI, оранж.
оранж. ионы, анион
каркас из 10 искаж.
окт. [VO6] с общ.
ребрами
IV3O9(H2O)J3 , три- (мета-)
IV2O6(OH)I5-, ди- (пиро )
IVO3(OH)I1- ^ IVO2(OH)2I-
OH
IVO4I3-, орто-
бц., диа¬
магн. (d0)
тетраэдрич.
(J3S) ионы
MNjf-N2)
M3IVOF5I; Cs3IV2O2F7I; CsIVOF3I
M2IVOF4I; K2IVOF4(H2O)I, син.
M2IVOCI4I; Cs3IVOQ5I,
в анионах - цепи окт.
BrR
[VO2] + X, X = NO3, ClO4,
Cl, крист., красн., сильн.
окисл., сущ. при pH < 1
Jo,; СЮ,
Ванадаты (V)
M6V10O28 я H2O, M = Na, Са/2, Ва/2
K3V5O14; IR4NI3HV4O12; K5V3O10; MV3O8, M4V2O7
MVO3, в стр. - тетраэдры,
триг. бипир., тетраг. пирамиды или окт.
M3IVO4In, M = Na, К, Sc, Ba, Al, Fe (минералы),
в стр. - тетраэдры [VO4]
VOX3, желт. гигр. в-ва
т. пл.
т. к.
VO(ClO4)3, ж.
22
33.5
VO(NO3)3, ж.
2
68
VO(PO4) ^H2O, крист.
—
—
VOF3, крист.
300
480
возг. > 110
VOCl3, ж., d = 1.829
-77
128
VOBr3, ж.
—
130/вак.
В стр. и г. VOf 3
разл. 180
(Г = Cl - Br) — мол. — тетраэдры
MIVO2(SO4)I
MaIVO2(C2O4)2I-IZMc, окт.,
M2IVO2F3I, Cs3I(VO2)2F5I, M3IVO2F4I, MIVO2CI2I,
в стр. - линейные гр. [O = V = O]
KIVO(SO4)2I
MIVOF4I, M2IVOF5I; Cs3(VO)2F9
IPyHHVOCl4I; M2IVOCl5I, зел.
M2VF6, анион - окт.,
M2VCl6, M = K (кор.), Rb (роз.),
Cs (фиол.)
IPOiIVCI5
VF5, крист
., бц., оч. гигр., т. пл. 19, т. к. 48,
ЛЯ= 1473,
ж. *=*
VFJ + VF6;
в г. - мол.,
, триг.
бипир.,
+ H2O —►
V2O5I
+ HF
MIVF6I, M = NH4, К, Ag, [NO], [NO2], [Xe2F11],
крист., бц.
V2S5I, порошок, кор., р. в щ., M2S,
разб. HNO3, легко окисл. возд.,
Тиованадаты (IV), р. в H2O,
+ H+ —► VSj + S + ...
BaVS3, в стр. - линейные цепи
тетраэдров [VS4], проводник
V(S2)2 + V2S3 +
M2S
60° (N2)
(NH4)3IVS4I,
тиованадат, фиол.
( NH4VO,)
УГЛЕРОД
(2 + 2/я)- 2-
1-
Углеводороды (гомологические ряды)
CjtH2jt + 2
алканы
C11H2
ChH2m2
CwH2jl.6
ароматические
CH4, метан, г., бц.,
т. пл. -184, т. к. -161,
A H = -75
C2H6, этан, г., бц.,
т. пл. -183, т. к. -89,
A H = 84.8,
хим. инертны, мол. -
тетраэдр и 2 тетраэд¬
ра с общ. вершиной
(Spy), С —H 1.09,
C-C 1.54
CH2 = CH2, этилен, г.,
т. пл. -169, т. к. -104,
A H= + 55,
/НСС = /НСН =
= 120(^2),
C-H 1.09,
C-C 1.40-1.47
CH = CH, ацетилен, г.,
т. пл. -81.8 (/?), т. возг.
-83.6, AH= +227,
ТВ. и ж. взр.,
/НСС = 180 (sp),
C-H 1.06, C-C 1.32
C6H6, бензол, ж.,
т. пл. 5.5, т. к. 80,
A H= +49,
/ССС =ZHCC =
= 120 (л/г),
C-H 1.08,
C-C 1.35-1.43
H2O
Карбиды
ц
Hl
метана, этана
этилена
ацетилена (ацетилениды)
AI4C3, т. пл. > 2800,
изолированные
анионы [С]4-;
+ H2O CH4T
Pu2C3, гр. [C2],
C-C 1.54
UC2, т. пл. 2350,
+ H2O - C2H4+ H2 +
+ CH4 + CnHw
в стр. ионы [С = С]4
M2C2, M = Li-K, стр. тип NaCl
CaC2 т. пл. 2300 \ стр. тип
BaC2 1780/ CaC2
в стр. ионы [C = C]2 ,
А12[С2|3 С —С 1.24
+ H2O -* C2H2 + • • (взр.)
хим. оч. акт., воспл. в атм. CO2
Производные
Ii
SiC, "карборунд”, крист., бц., разл. > 2200, стр. типа алмаза
В4С=В|2[С3], крист., черн., т. пл. 2450, т. к. >3500, в стр. типа NaCl-икосаэдры [Bt2]
и линейные гр. [C3], оч. тв., хим. инертны, жаростойки.
т. пл.
Cr2C2 с разл. 1900
Cr7C3 1680
Cr23C6(^wCr4Cw) 1520
CrC —
оч. тв., кислотоупорны,
уст. к окисл. < 1000
т. пл.
Fe3C, "цементит” 1650
Mn3C 1520
крист., сер. или черн.
(Fe, Сг)3С, (Fe, Мо)3С,
оч. тв., придают тв.
сталям; +H + —►
H2+ CH4 + CnHw
Триг. призмы [CM6] образуют цепи Cx в
искаж. стр. М, С — С —1.65
HfC
т. пл.
3890
стр.
VC
2830
тип
NbC
3500
NaCl
Hf2C
—
гексаг.
V2C
—
пл.
Nb2C
—
упак.
Соединения с мет. связью,
проводники, оч. тв. (9-10), хрупки,
жаропрочны, р. только в
(HF + HNO3) (/) и (распл. щ. + O2)
26
C0 Qt] U I 11 I 2.5
Алмаз, крист., окт. или куб., бц., т. пл. >4000
(125- IO2 Па), d = 3.51, тв. 10, хрупкий,
диэлектрик, хим. инертен, куб. стр.,
гранецентрированный куб с 4 ат. в центрах
4-х из 8 малых кубов, к. ч. С 4,
тетраэдр (Spy), С — С 1.54
н
S
•е*
еа
о.
а
U
> 1200°
р, / (Fe, Cr, Pt)
Графит, крист., черн.,
</=2.22, тв. 1 -5, возг.
3700, двухслойная гексаг.
стр., C-C 1.41, к. ч. С 3,
/ССС 120 (sp1). Межслое-
вые С — С 3.34 (/), электро¬
проводность вдоль слоя
обусловлена делокализа¬
цией тс-связей
Аморфный углерод (сажа, древесный и животный уголь),
мелкокрист. формы графита с дефектами в стр., </ = 1.8 - 2.1,
хим. наиболее акт., адсорбент ж. и г.
X.
дуга (экстр, толуолом)
Фуллерены, Ся, п = 60 ("бакминстерфул-
лерен”), 70 темные порошки, возг.
вак. > 400, р. в бзл., сферические мол.
C6O, мол. типа "футбольного мяча",
состоит из 12 пяти- и 20 шестичленных
циклов, С — С 1.45 и 1.39, разл. > 1000,
полупроводник, C60Xa, Х-Г, Н, л = 1-36
MlfC60, M = К (п = 3, сверхпроводник),
Rb (п = 3, 4, 6), Eu (п = 1 -6)
Тубулены, Cx, полимерные
цилиндры из графитовых сеток
Cx, линейные цепи
(карбин, поликумулен)
СобДИНеНИЯ графита (/ - расстояние между слоями)
"Графитиды" металлов, MhxQ1
Соединения включения
Графнтовые соли
M = K-Cs, красн., воспл. на возд.,
проводимость > графита;
+ H2O —► H2 + MOH + графит.
МС|6, M = K-Cs;
K6C60 диэлектрики
Ch L, L = МГП, MoO3,
FeS2, I= 7-16
C33AlBr3, /= 20.10
с; г- мст,
M = Be, Al, Ga, Fe, Hg, Pt, W;
/ = 9-13
Cx-, X = NO3, ClO4, HF2,
SO3F, AsF6, син., / % 8
CO2 (>600°, "газификация топлива");
H2O (1000°, -H2. "водяной г.")
2 +
СО, оксид углерода (II), угарный газ, бц., яд,
т.пл. -205, т.к. -191, AH = -ПО,
р. в H2O 3% (об.) (0°), не р. в к. и щ.,
хим. инертен., сильн. восст. (/);
в мол. стр. C = O 1.13, эл. аналог N2, ц = 0.12
«3 + »
O2 [700°; MnO2 + CuO ;
М2Оя(/, -М); H2O (-H2, 500°)
О
<ч
X
CH3COOH, уксусная к.,
масло ("ледяная к.м),
бц., т. пл. 17, т. к. 118,
[CH3COOH2' ][СН3СОО ] = IO12,
р. SO2, МГ„, M(NO3)n, г = 6,
в г. - димеры, в р-ре H2O - сл. к.,
К — IO-5, не восст.:
уст. к MnO4, Cr2O2-,
ан. окисл.—► CO2 + C2H6
H +
М(р) /(-М)
М0(:СО)„, M = V-Ni, Mo-Pd, W-Pt,
карбонилы, крист, или ж., яд., летучи
не р. в H2O, р. в орг. р-рителях
гр. [М — С — О (конц.)] линейные
(/MCO 171-178)
НСООН, муравьиная к., ж., бц., с резким
запахом, d = 1.23, т. пл. 8, т. к. 100,
хор. р. в H2O, ц = 1.35, в = 56,
мол. плоская, сильн. восст.
к — IO-4
H2O + CO2
4 +
CO2, оксид углерода (IV), углекислый г., бц.,
возг. -78, т. к. 20/58 • IO5 Па, АН = -393,
р. в H2O «50% (об.),
в куб. стр. - мол. CO2 в 3-х непересекающихся
направлениях, С — О 1.16, ZOCO 180 (sp)
Донор 71-эл., в мол. [Rh(CO)(PR3)2(OH)(CO2)I
CO2 присоединен обратимо
H2O
Угольная к.
CO2 + H2O =S=S IH2CO3I
(мгнов.)
_ [н+ннсо,-) _ 7,
[Н20][С02]
■■ 3.7
H+ + HCOj S= 2Н* + CO^-
Мол. H2CO3 сущ. в г.
(Al2O3)
(ZnO)
CO2 + H2
ОН"
\
Ацетаты
т. пл.
CH3COOLi 2 H2O 70
CH3COONa, 324, ЗН20
CH3COOK, 292,
CH3COONH4, 114,
M(CH1COO)n -U M2On + CO2 + H2O
Оксоацетаты
Ml1 O4(CH3COO)t, м" = Be. Zn, в мол.
тетраэдр [О* M4]
IMj1Ot(CHjCOO)4I + X-, Mm = Cr1Fe1Al,
в катионе - тр-к [0*М3] и окт. [М0*05]
CH3COO- бидентатны
Формиаты
HCOOLi H2O
HCOONa, т. пл. 255; разл. 300
(HCOO)2Caj
-U H2O + +M2On+ со
I/
(-COOHfe, щавелевая к.,
крист., бц., т. пл. 189 с разл.,
возг. 158, яд, хор. р. в H2O,
сп., Ki = IO"1, K2 = IO 5
NH3
(-
(метод
+ NaCl
NH4Cl)
Сольвэ)
400° (-H2)
H-C-N
циановодородная (синильная) к.
ж., бц., оч. яд.
т. пл. -13, т. к. 26, К = IO-9
H2SO4
Оксалаты
LiHC2O4 H2O
NaHC2O4 H2O,
Li2C2O4, Na2C2O4
K2C2O4, H2O
BaC2O4I, CaC2O4I
HCl
(R2O, -35°)
Г идрокарбонаты
LiHCO3
NaHCO3, (сода питьевая), разл. 160
(60 в р-ре), мало р. в H2O;
• Na2CO3 • 2 H2O, "трона"
KHCO3, разл. 100, хор. р. в H2O
Ca(HCO3)2, сущ. в
природных водах;
анион - искаж. тр-к
NaCN, т. пл. 564, т. к. 1497
KCN, т. пл. 634
M(CN)2, M = Mg-Ba
яды только хор. дис. соли
HgCl2
(-CNb, дициан
(нитрил щавелевой к.),
г., бц., яд, т. пл. -28, т. к. -21
АН = +293, уст., р. в H2O
мол. N-C-C-N линейна
"Оксиды н к." графита
CJF", черн., разл 100, в
однослойной стр. графита / = 5.4
CF,,, п ^ 1.12,
бц., разл. 800, хим. инертен,
диэлектрик-термостойкая смазка
в стр. - гофрнров
CjlO, п ^ 2, бц.
или желто-кор.,
диэлектрики, / ~ 7,
после набухания в воде
сп. /< 19
а иные слои
CO(NH2)2 и CaCN2
см. табл. "Азот"
т. пл.
т. к.
АН
С—Г
COF2, г., бц.
-114
-83
_
1.32
COCI2, "фосген"
-118
+ 8
-
1.75
г., яд
COBr2, ж., бц.
65 с разл.
-
1.92
CF4, г., бц.
-184
-128
-223
1.32
CCI4, ж., бц., яд
- 23
77
- 32
1.77
CBr4, крист., желт.
94
189
+ 20
1.94
CI4, крист., красн.
171
90, возг.
+ 73
2.12
СГ4_ВС1В, "фреоны", р-рители O3, жиров, смол,
не гидрол., хим. инертны, не горят,
мол. - тетраэдры (.Vpi)
/(-H2O -CO2)
Карбонаты
р. только при M1 (кроме Li)
Na2CO3, т. пл. 854 ("сода кальцинированная");
• л H2O, п = 1, 7, 10 ("сода крист.")
K2CO3, т. пл. 901 ("поташ");
• п H2O, п = 2, 1.5,
M11CO3I, Mn = Mg ("магнезит"); Ca ("каль¬
цит", "арагонит"); Sr ("стронцианит"); Ba ("ви¬
терит"); Fe ("сидерит"); Mn ("родахрозит");
Pb ("церуссит"); [UO2] ("резерфордит")
CaMg(CO3)2, "доломит"
Cu2(CO3KOH)2, "малахит"
|ВЮ)2С03, "бисмутит"
M2(COj)n -U M2On + CO2,
[CO3]2' - правильный
тр-к (V)
^•*-о
о 129
• с
о о
27
КРЕМНИИ
«4-»
n
я” и
Силаны SillH2i.+2. гомологический ряд
г. или ж., бц., яды, с характерным запахом, воспл. на возд., уст.
падает в гомолог, ряду, р. в орг. р-рителях, не р. в H2O, гидрол.
при pH > 7, стр. аналоги CnH2,, + 2,
АН SiH4 = +33; сильн. восст., + Г2 —► SinH2n + ^ ХГХ (взр.)
2.25-
Si8H18
октасилан
4-
3-
2.67-
2.5-
SiH4
Si2H6
Si3H8
Si4Hi0
MOHO-
ди-
три-
тетра-
о
OO
7
OO
SO
О
0.68 (-25°)
0.743 (0°)
0.825 (0°)
т. пл. -185
-132
-117
-84
т.к. -112
-14
+53
+ 107
-H2 (780°)
H2O
(-H2-SiO2ZiH2O-M2SiO2)
Силициды MxSiy
воспл. на возд., сильн. восст. в стр. -
3
M2Si, M = Mg, Ca
изолированные ат. Si
I
стр. тип AHmw-CaF2
I
MSi, M = Ca-Ba
гофрированные слои Siac
и
MSi, M = Na-Cs
тетраэдры [Si4]4-; + H2O, взр.
MSi2, M = Ca-Ba
слои Sirtc
не р. в к-тах, р. в щ., термостойки, парамагн.
V2Si
изолированные ат. Si
I
FeSi2
гр. [Si2]
MSi2, M = Cr,
слои Si3c, полупроводники
1
La, Fe, Mo, Ti
I
Mn9Si3, Fe9Si3
цепи Siac
MSi, M = Ti, Zr,
трехмерная сетка Si30
Mn, Fe
Ii
'Ферросилиций" содержит 9-15, 43-50 или 72-95 % Si
(низко-, средне-, высококремнистый)
E
M2O11 (-CO2)
Si, крист., серые или порошок, бур. ("аморфный Si"),
d= 2.3, т. пл. 1415, т. к. —3250, кислотоупорен,
р. в щ., Eosio*-/Si,и= —1.86, полупроводник (< 150°)
(<d и электропроводность возрастают при т. пл.),
стр. тип алмаза, Si — Si 2.35; к. ч. Si = 4
Si высокой чистоты, порошок бел.; + H2O —► H2T
р\
Si мет., d — 2.55,
Si — Si 2.30 и 2.39 в искаж. тетраэдре
Si-TeKcar., стр. тип вюртцита (ZnS)
С (2000°)
Г2, HF
2200°
SiC, карборунд, крист., бц.,
разл. 2830, стр. тип алмаза,
полупроводник (< 1000°), оч. тв.,
р. только в (HF + HNO3);
+ H2O SiO2 + CH4;
+ Cl2 SiCI4 + С;
+ NaOH + O2 Na2CO3 + Na2SiO3
Si3N4, порошок, бел., хим. инертен, возг. 1900, полупро
водник, АН = -749; + NaOH(Z) —► Na4SiO,
+ HF —► (NH4)2SiF6 + SiF4; в стр. каркас тетраэдров
[SiN4] и тр-ков [NSi3]
т. пл.
т. к.
d20
АН
Si-F
SiF4, г., яд
-77 (р)
-95
возг.
-
-1615
1,55
SiCl4, ж.
-68
57
1,48
- 685
2.02
SiBr4, ж.
5
153
2,81
- 460
2,15
SiI4f крист.,
г. воспл.
на возд.
122
290
-
- 210
2,43
-L Si + I2
В-ва бц., гигр., в г. и стр. -
мол. - тетраэдры
мономерные
SiX4, X = CH3COO (т. пл. 110),
NCS, NCO, NO3( ^Py),
N3 (взр.), Р04/3 I, ClO4 ( MeCN),
крист., бц.,р. в орг.
р-рителях, мол. - тетраэдры.
SiO2 + FeO)
SiS2, иглы, бц., гигр.
7x5*
т. пл. 1090, т. к. 1130, >0^
возг., АН = -205
5VtT?
H2O — SiO2 VH2O + H2S; ^
в стр. цепи тетраэдров [SiS4Z2]
28
/
H2O
(-SiO2
4 +
SiOj, крист, или стекло, бц., тугоплавки, р. в HF и щ., АН = -879
(эс-кварц), в стр. - тетраэдры [SiO4], сочлененные всеми вершинами
Г2 + С
А1203(-AlCl3)
"0-кварц",
d =2.65,
гексаг.
573°
"а-кварц",
т. пл. 1550,
гексаг.
867°
"а-тридимит",
d= 2.28-2.33,
гексаг.
1470°
"а-кристобалит",
d =2.32,
т. пл. 1728,
т. к. 2950, куб.
UP
В кварцевом стекле - неупорядоченное
расположение тетраэдров [SiO4], d = 2.20
"коэсит", d = 3.01,
монокл., каркас
тетраэдров;
"епшювнт", J= 4.28,
тетраг., стр. тип
рутила (к. ч. Si 6),
Si-O 1.75-1.81,
не р. в HF
i
Стр. а-кристобалита
H2O)
H2SiF6, кремнефтористоводородная
к., оч. сильн., сущ. только в р-ре (макс.
конц. 61%), яд, летуча; 2 H2O, т. пл. 19;
• 4 H2O (= [H5O2J2SiF6);
6Н20(= [H5O2J2SiF6 • 2 H2O);
азеотроп с H2O 13.3%.
IVI2ISIFLi, M = Li-Cs, Mg-Ba, Zn, Al
400°
► MF + SiF4T;
анион - окт (SpiJ2),
-H2O(Z)
ISiO2 • х H2OLt, х < 2, образ, золи и гели
H4SiO4, сущ. в истинных р-рах, К\ = IO-10, K2 = Ky = IO-
H2CO3 MГ; M2SO4(Z)
МОН; M2CO3 (Z)
K2ISi(CH3COO)6I
M2SiS3, Ca2SiS4
Na4ISi4SioI, крист.,
бц., гигр., в стр. -
тетраэдры [SiS4J
M2Ow • ZnSiO2 • хH2O, силикаты, тетраэдр [SiO4], Si — O^ 1.57(конц.), 1.68(мост.)
В стр.силикатов тетраэдры [SiO4 ] сочленяются только вершинами.
Островные
ISiO4I4-, орто-
Be2ISiO4I, "фенакит”
Mg3AI2jISiO4I3, гранат
ISiiO7I6
диорто
Sc2ISi2O7I,
”тортвейтит”
Цепочечные, пироксены
ISiO3I^T, полимета-
ЖЖЖЖ CuISiO3I
Mg2ISiO3I1,
"энстатит”
Ca3ISiO3I3,
"волластонит”
ISi3O,!6
тримета-
BaTiISi3O9I,
”бенитоит”
ISUO12I*-,
тетрамета-
Ca2Fe11Al2(BO3KOH)
ISi4Oi2I, "аксинит"
Ленточные, амфиболы
Isuo11It
CaiMg5(Si4On)2(OH)2, "тремолит"
ISi6Oi8I , гексамета-
Be3AI2ISi6O18I
”берилл"
Листовые (Si2O5I^c, димета-
Mg3ISi2O5I2(OH)2,
”тальк”
KAI2I(Si3Al)O1Ol(OH)2,
"мусковит" (слюда)
В водном р-ре силикатов (им условно приписывают состав M2SiO3) сущ.
равновесие полимеризации:
. 2Н + (-Н20) а п H +(-п/2 HiO)
/IlSiO4I4- » п/2 ISbO-.! „ .» ISUO3.!2*
ОН |}зн* ОН" Il 4Н * ОН Il пН'
!.IH3SiO4I- , ^IH4Si2O7Ij-IHaSiaOjar-
орто- диорто- п = 3-6, мета-(циклы)
• Si
О о
О с, s
Na2O CaO eSiO2 - стекло,
в его стр. [SiO4J и M +
расположены нерегулярно
ф М"
Каркасные алюмосиликаты,
в стр. - трехмерная сетка
тетраэдров [(SuAl)O4J
KI(AIO2KSiO2)3I, полевые
шпаты лд, а
29
АЛЮМИНИЙ
3 +
n 35
Al0 Пт
*Е.
3 d
1.5
Al
мет., бел., блестящий, (покрыт тончайшей пленкой
оксида), легкий, мягкий, ковкий
d 2.70, т. пл. 660, т. к. -2500
^OAl' /Al1. = — 1 -70
^OIAI(OH)J /Al1. = -2.34
р. в разб. к., щ., пассивир. HNO3, не р. в HF, H3PO4,
CH3COOH, мет. выс. чистоты р. в (HCl + Cu2+ + H2O2)
куб. пл. упак. (тип Cu), Al — Al 2.86
« рЦсд
Стали хромо-молибдено-алюминиевые, Al повышает
уст. к г. коррозии, стойкость к износу и истиранию.
Сплавы для магнитов, 12- 15% Al
Дюралюминий, тв. сплав, 93-95% Al, 2.5-5.5% Си,
0.5-2.0% Mg, 0.5- 1.2% Mn, 0.2- 1.0% Si
Силумин, 10- 14% Si, 0.1% Na, остальное - Al
AI2S3, иглы, бц., т. пл. 1120, AH = -651;
+ H2O H2S
AIN, нитрид, крист., бел., оч. тв.,
возг., т. пл. и 2200(р) с разл.,
AH = -318, хим. инертен,
кислотоупорный при выс. t
ч-
Al4C3, "метанид”,
крист., желт, или кор.,
разл. > 2000,
+ H2O — CH4T; А// = —208
AI2IC2I3, ацетиленид,
+ H2O —► C2H2T
AIH3, мономер, разл. 105, в стр. - каркас окт.,
(AlH3)jl • XEt2O, полимер, бел., гигр., не р. в эф.
MIAIH4Iji, алюмогидриды, M = Li, Na, К, Mn11,
Sn11, Sniv, Ti, Nb, анион - тетраэдр
+ H2O-^H2T
M3IAlH6I, M = Li - К
AlIBH4I3, крист., бц., возг. >0, воспл. на возд.
AI2O3, инертен после прокаливания, сплавляется со щ., K2S2O7T. пл. 2072, т.
AH = -1670(я); d = 3.96; ж. (в распл. Na3AlF6) *=* [MO]+ + [AlO2]"
а-, ромбоэдрич., хим. инертен, "корунд", "рубин" ( + Cr , красн.), "сапфир"
в стр. - гексаг. пл. упак.ат. О, 0-, "гексаг." (^Na2O- IOAl2O3), тв. электролит
у-, куб. (А12.6704), стр. тип шпинели, хим. акт.; + H2O —> Al(OH)3
к. - 3500,
( + Ti, Fe11, гол.), оч. тв.,
t
AIO(OH), ^-"диаспор" у-"бёмит” (в ”бокситах”) разл. 360, в стр. - слои окт.
л NaOH
J 180°
AI(OH)3, а-, ”гидраргиллит”, /?-, ”байерит”, в стр. - слои окт., р. в конц. щ.
I время, ОН"
AI2O3 • л H2OI бел., студенистый ос., р. в к., щ., не р. в NH3 и NH4X
H2O
Al3+ + 3ОН"Al(OH)3I H+ + [Al(OH)4]-
ATocli. = IO33, Kk = IO8
NH4OH
,ОН
H2O
IAl(H2O)5(OH)Ij + I(H2O)4AIO1-OHbAI(H2O)4I44
H+ окт. ионы
IAl2O(OH)6I2 * IAI(OH)4I- - * IAI(OH)4(H2O)2I
тетраэдрические ионы (sp3) окт. ион (Sp3Cf)
H2O
AI(CIO4)3, летуч, • л H2O, п = 15, 12, 9, 6
AI(ClO3)3 • л H2O, п = 9, 6, оч. хор. р. в H2O
AI(BrO3)3 9 H2O, т. пл. 62, разл. 100
Al(IO3)3 л H2O, п = 6,8
Al2(SO4)3, разл. 500; 9 H2O, ISH2O
• M2SO4 • 24 H2O, M = NH4, K-Cs, квасцы, крист., бц.,
в куб. стр. - окт. [M(H2O)6] + , [Al(H2O)6]3+ и тетраэдры [SO4]2-
N2O5
AI(NO3)3, возг. вак. <— -9 H2O, т. пл. 73, разл. 134
AIPO4]., т. пл. % 1400, не р. в к., стр. тип кварца, 2 H2O
Al(H2PO4)3
AI(CH3COO)3; + H2O (следы) —► IAl3O(CH3COO)6I+X",
стр. аналоги ацетатов Сг,п и Fem, не летучи, не р. в CHCl3
Al2(C2O4)3 4 H2O, р. в H2O
MAl(SiO3)2, M = Na ("жадеит”), Li ("сподумен”)
AI2SiO5, ”андалузит”
Алюминаты
NaioIAI(OH)6I2(OH)4 анион - окт., К2|А1?0(0Н)6| -
2 тетраэдра - [(OH)3AiOAI(OH)3]2-; MlfO • AI2O3,
M = Mg ("шпинель", т. пл. 2115), окт. [AlO6], тетраэдры [M11O4]
MAl(CIO4)4, M = K -Cs, [ClO2Ii(NH4)3IAI(ClO4)6I
HAI(SO4)2 • 4 H2O
MIAI(NO3)4I, M = [NO2], Rb, Cs
M2IAI(NO3)5I, M = K -Cs, M3IAI(NO3)6I
KAIP2O7, окт. [AlO6]
M3IAI(C2O4)3I • л H2O, M = Na, Mg^ ("жемчужниковит"),
NaIAISiO4I, "нефелин", в. стр. - сетка тетраэдров [SiO4] и [AlO4]
KI(AIO2XSiO2)3I, "ортоклаз" ("полевой шпат")
30
т. пл.
т. к.
A H
Al-Г (г.)
• л H2O, п =
AlF3I
1040
1279
-1510
1.63
1; 3; 5
Aia3
193(р)
180 (возг.)
- 704
2.06
6
AlBr3
98
255
- 514
—
6
AII3
191
386
- 310
2.44
6
А1Г3 - крист., бц., гигр., р. в H2O, ROH, Et2O (Г = Cl-I),
в бзл., CS2 (Br, I). В г. тр-ки AlT3 (Г = Cl-I), в стр. AlBr3
и AlI3 и в р-рах в CS2 и бзл. - димерные мол.
- 2 искаж. тетраэдра с общим ребром.
IAir3LI, L = R2O, R2CO, Py, R3N, NH3 SO,, H2S, NO,
PH3, РГ3, SbBr3, POCl3, HCN, PCl5
Aia3 • 6 L = [AIL6JCi3, L = H2O (разл. 200), NH3 (разл. 180),
катион. - окт.
MAIF4J,, анион - тетраэдр или слои окт. с общ. вершинами
Na3AIF6],, "криолит",т. пл. 1012, анион - окт.
ж. 3 Na + + AlF4 + 2 F", M2AIF5I
MIAICUb M = Na - Cs, NH4 [NO], анион - тетраэдр,
М|А1Вг4|, MAI2Br7,
MIAIl4I
ЦИНК, КАДМИЙ
Ъс1_ 4.? 4р
Zn0 |1т|п|1тНтЦГ| Qt] [
4 d Ss 5р
Cd0UtiiTiiTiiTiui Qg Qn
Zn
Cd
мет., бел., мягкие, блестящие
d 7.14
8.65
хрупкий
ковкий
>150° - тягучий
> 200° - хрупкий
т. пл. 419
321
т. к. 913
766
р. в разб. к., щ.,
р. в разб. к.
NH4OH
5>м2</м„ -°-76
-0.40
искаж. гексаг. пл. упак.
M-M 2.66 I 2.97
бел. (Zn), кор. (Cd), т. пл. 1969 (/?), возг. 1725 с разл. (Zn),
ии с разл. — Cd + O2 (Cd), ЛЯ = -348 (Zn), -260 (Cd);
"вюртцита" (Zn), тип NaCl (Cd)
МО, крист
возг. ~900 с разл,
стр. тип
-200° (- H2O)
M(OH)2I, бел., р. в к., NH4X, Koch2 = IO"5, Ktl = 10 ,2,
Кж, = IO-13 (Zn), Koch 2 = IO"3 (Cd), стр. тип Mg(OH)2 (окт. ZnO6),
тип Cdl2 (Cd)
IM(H2O)6I , бц., окт. ионы
HX (H2O)
кат. восст.
IM
Сплавы
Zn + Cu - латуни;
Zn + Fe-B антикорро¬
зионных покрытиях;
Zn + 4% Al + 3%С +
+ 0.1 % Mg - обладают
высокой механической
прочностью (типограф¬
ские сплавы).
Легкоплавкие сплавы
на основе Cd
Стр. CdI2 -
слои окт. [CdI6]
с общ. гранями
M(ClO4)2, Л H2O, п = 2, 6; M(CIO3)2 я H2O;
M(ClO2)2 2 H2O,
M(BrO3)2 лH2O, п = 6(гп), 2(Cd); M(IO3)2 л H2O
M(MnO4)2 • 6 H2O, фиол., хор. р. в H2O
MSO4, разл. 620 (Zn), т. пл. 1135 (Cd),
• л H2O, л = 7, 6, I (Zn); п = 7, 4, 2.67 (Cd)
MSO3 2H2Ol; MS2O3, Zfycl= IO1(Zn); IO4(Cd)
MS2O6 6 H2O, MSeCVnH2O;
M(NO3)2, летуч вак. i 2 N2O4;
• л H2O; п = 2.3, 6, 9 (Zn); т. пл. 353, п = 2, 4 (Cd)
M3(PO4)2I, т. пл. 1060 (Zn), т. пл. 1500 (Cd);
M(H2PO4)2 л H2O, п = 1, 2, р. в H2O;
M2P2O7I, т. пл. 1017 (Zn); 2 H2O (Cd)
Zn(PO3)2I, т. пл. 872
MCO3I, разл. 200 (Zn), 300 (Cd), изостр. CaCO1,
MCO3 лM(OH)2 тН20|
M(CH3COO)2, т. пл. 242 (Zn); 256 (Cd); • 2 H2O
M4Oe(CH3COO)6, т. пл. 272, возг., р. в CHCl3 (Zn),
нелетуч (Cd)
M(HCOO)2 2 H2O
MC2O4, • 2Н201, ПР = IO 9, Kmc = 10“5(Zn);
• ЗН201, Kallc = IO-4 (Cd)
M2ISiO4I, т. пл. 1509 (Zn), 1252 (Cd);
MSiO3, т. пл. 1437 (Zn), 1242 (Cd)
Zn4O(BO2)6, т. пл. 980, стр. аналог Zn4O(CH3COO)6
т. пл.
т. к.
ЛЯ
Zn-T
(г.)
л H2O,
п =
ZnF2I
875
1502
-765
1.81
4
ZnCl2
326(P)
733
-414
2.07
4, 3, 2.5,
315(а)
1.5,
ZnBr2
394
670
-327
2.20
3, 2
ZnI2
446
624
-209
2.40
2
с разл.
CdF2I
1072
1753
-698
1.97
2
CdCI2
568
964
-389
2.21
1-4
CdBr2
567
863
-314
2.37
2,4
CdI2
388
754
-201
2.55
—
В г.
- линейные мол.
МГ2;
стр. ZnF2 - типа
рутила [к.ч. Zn
= 6], CdF2, CdCl2, ZnBr2 и
ZnI2 - тип CdI2
и CdCl2
MOH
Цинкаты, кадматы
Na2IM(OH)4I 2 H2O; NaIZn(OH)3I
Ва2|М(ОН)6|, анион - окт.,
K4ZnO3, анион - тр-к;
M2(ZnZCd)O2I, в стр. - цепи
тетраэдров
Na6IMO4I, K2Cd2O3
LiICd(QO4)3I; NaICd2(ClO4)5I
K2IM(S2O3)2I H2O, ATyct = IO5(Zn)
M2IZb(NO3)4I, M = NO, R4N
INOIIZd(NO3)3I; M2IZn(NO2)4I
M2ICd(NO2)4I, уст. > Zn-KOMruieKca,
KZn2H(PO4)2; MZnPO4, в стр. -
циклы тетраэдров [PO4] и [ZnO4]
Rb3Zn4O(PO4)3 3.5 H2O
NaICd(HCOO)3I, анион - слои окт.,
Na2IM(C2O4)2I
(B)
RbMF3; M2ZnF4,; K3Zn2F7,
K2IMCl4If л H2O,
KMCl3 л H2O, M4ICdCI6I,
KMBr3 2 H2O, Rb4CdBr6
KMI3 л H2O
Li2IMI4I
анионы - тетраэдры (Zn),
окт. (Cd)
Стр. сфалерита
ZnSj, бел., аморф., ПР = 10 2
J H2S(Cyxofi)
^-ZnS, "вюртцит",
т. пл. 1900 (/?), возг. 1185,
ЛЯ = -192, гексаг. пл. упак.,
I 1020°
Ot-ZnS, "сфалерит"
"цинковая обманка", ЛЯ = -205,
куб. стр. алмаза. В обеих стр. -
[ZnS4] и [SZn4] - тетраэдры.
I |_| ♦
CdSj, желт. ——► красн., т. пл. 1473(/?)
AH= -150, ПР = !О 27,
а-, полупроводник, стр. тип вюртцита
P-, сфалерита
C2H2 (/)
т. пл.
ЛЯ
т. пл.
ЛЯ
ZnSe, желт.
1575
-130
CdSe, красн.,
1250 (/?)
-105
ZnTe, красн.
1239
-121
CdTe, кор.,
1090
-100
полупроводники
Zn3N2, черн.
700 разл.
-21
Cd(N3)2, желт., не взр. I
+ 163
Zn(N3)2, бц.,
-
-
Cd3N2, черн.
взр.
Zn3P2,
420
-
Cd3P2, серый
<— CdP2, оранж.
ZnC2, бц.,
-
-
CdC2I, ацетиленид
(ZnH2)jl (?), бел.
разл. 90
-
CdH2, бел., разл. -20
# Zn, Cd
Ols
31
МАГНИЙ, ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
Магний
Mg0
35
QD
Ca0
As
Кальций
QD
55
Стронций
Sr0
QD
Ba0
6 S
Барий
IT
JlL
Ар
ГП
Je1
3 d Э.О.
Ш 1.2
Ad
Ш 1.о
Sd
0 СШ Ш 1.0
6P
ы
0.9
MgO I
I CaO I
I StO
I BaO
М|02|, пероксиды, крист., бц., диамагн.,
к
рист., бц., 1
'игр.
O2 (Ba < 600°, H2O);
стр. тип CaC2, 0-0 1.49, сильн. окисл.
нпериклазн
"известь"
(Sr, р)
MgO2K?)
CaO2
SrO2
BaO2
т. пл. 2850
2614
2430
1923
разл. 20
380
480
750
т. к. 3600
2850
—
*2000
>600°
(взр. 275)
(т. пл. 450)
AH - 598
-636
-590
-556
AH -623
-652
-640
-632
8 H2OI
8 H2OI
8 H2O
стр. типа INaci, в г. - мол. MU
л H2O2
п = 0.5, 2
п= I, 2
п = I, 2
бел.
на поверхности
тончайшая пленка MgO
мет., бел., блестящие мягкии
бел. I св.-желт. бел.
окисляются возд., хим. акт. Ba Mg
d
т. пл.
т. к.
fOM2 + /Mx
р. в разб. к. (кроме HF),
NH4X (-H2+ NH3)
диамагн.
1.74
1.54
2.69
651
851
1000
1107
1482
1390
-2.34
-2.84
-2.89
3.6
727
1860
-2.90
реаг. с H2O, сп., р. в ж. NH3
а-, куб. пл. упак.
M-M 3.94
464° \
4.30
250° \
Гексаг. пл. упак. (стр. тип Mg), ат.
- в узлах гексаг. ячейки и в центрах
3-х из 6-ти триг. призм, к. ч. 12
M-M 3.20 (Mg), 3.98 (Ca),4.31 (Sr)
J 605”
у-, куб (тип. Ot-Fe)
M-M 4.19
4.44
H2O (кроме MgO)
Mg(OH)2I
Ca(OH)2I
Sr(OH)2I
Ba(OH)2
"брусит"
"портландит"
т. пл. —
—
450
408 с разл.
разл. 350
580
710 (?)
—
ПР 10"
IO-5
IO-4
р. в H2O
л H2O
п = 8, 1
п =8, 1-3
Koch2 Ю"3
IO-2
IO-1
IO-1
Стр. тип CdI2
Легкие сплавы Mg:
[Mg + Al (^ 10%) +Zn (^4%) + Mn (^ 1.7%)] -
''электрон”; [5 - 30% Mg + Al] - "магналий”, тв. > Al
Mg(CIO4)2, ”ангидрон”, т. пл. 246, разл. 382, хор. р. в сп., эф.,
6Н20,
M(CIO4)2, M = Ca, Sr* H2O), Ba (разл. 505), • ЗН20
M(CIO3)2, разл. 120(Sr), т. пл. 414(Ва); лН20, п = 6^), 2(Са),
S(Sr), I(Ba),
Ca(CIO)2; • ЗН20; ■ !/JCa(OH)2 хН20, "белильная известь",
Ba(QO2)2, разл. 235
M(BrO3)2 • л H2O, п = 6 (Mg), I (Ca, Sr , Ва|), разл. 200
Mg(IO3)2, • лH2O, п = 4, I,
M(IO3)2!. ПР = IO 6(Ca). IO-13(Sr), IO 9(Ba, лН20, п = 1,2)
Ba5(IO6)2; М21209лН20|, M = Ca (п = 8); Ba (п = 3)
200°
MgSO4, т. пл. 1185 с разл., ("арканит”), < • л H2O,
п = 1, 2, 4 - 7, ("горькая соль")
CaSO4J, т. пл. 1450 "ангидрит", • 0.5 H2O • 2 H2Oj,
"гипс", ПР = IO'5; р. в ЭДТА Нг°
MSO4I, M = Sr [т. пл. 1500 (р), разл. 1580, ПР = IO"7].
Ba [т. пл. 1580 с разл., ПР= 10 , "барит"]
MSO3 • HH2Oi. п = 6 (Mg), 2, 4 (Ca), 0 (Sr, Ba)
MS2O3 • я H2O, п = 6 и 3 (Mg, Ca); 5 и I (Sr, мало р.), 1 и 2 (Bai)
MCrO4 я H2O, желт, п = 7 (Mg, оч. хор. р.), 2 (Ca, р.),
OfSri, ПР = IO-5; Bai, ПР = IO10)
MCr2O7 л H2O, п = 3(8г), 2(Ba), красн., хор. в H2O
-О
O2 (р. /)
MIO2I2 и MIO3I2, см. табл. "Кислород”
Mg(NO3)2, разл. >300, <— N2O4; лH2O, п = 6.2
M(NO3)2, т. пл. 561 с разл.(Ca), 570(8г), 592(Ва),
M(NO2)2 + O2- NO2 + МО;
• лH2O, п = 3, 4(Ca, Sr), 2(Ba, ), I (Ca-Ba);
M(NO2)2, разл. 240 (Sr), 217 (Ba);
• л H2O, п = A (Ca), I (Ca - Ba, );
M3(PO4)2I, аморф. т. пл. 1357 (Mg), 1670(Ca), 1727 (Ba);
л H2O (Mg, п = 22, 8, 4; Ca, л = 4, 5); ПР = IO^24(Mg),
IO- (Ca), IO-28(Sr), IO-23(Ba);
M(NH4)PO4, л H2O, п = 6 (Mg), 7 (Ca);
Са5|Р04|3(Р, Cl, ОН), ”апатит”; Ca8H2(PO4)6 5 H2O
MHPO4 л H2OI, п = 3, 7(Мв, );
2 (Ca,ПР = IO-6); OfSr, IO-* Ba, IO-7);
M(H2PO4)2, л H2O, п = 6, 2 (Mg),
I (Ca, Ba), О (Ca, Ba)
(см. также табл. ”Фосфор”)
M2P2O7I, т. пл. 1383 (Mg), 1230 (Ca),
•л H2O, п = 6, 3^), 5 (Ca)
M(HCO3)2, р. (М = Mg^a обусловливают
”временную” жесткость H2O)
' It CO2
MgCO3,^"магнезит”, разл. 350; • л H2O, п = 2, 3
MjCO3, M1 = К, NH4, Са/2 ("доломит”)
CaCO3I, "кальцит”, т. пл. 1340 (р)\
ПР = IO-9; л H2OI, п = 6, 3, 1, 0.65
SrCO3I, "стронцианит", разл. 1350, т. пл. 1497 (р);
ПР = IO-9
BaCO3I, "витерит”, разл. 1450, т. пл. 1740 (р), ПР = IO-
M(CH3COO)2, т. пл. 323 с разл.^), 450(Ba),
• л H2O, п = 4(Mg); 1 и 2 (Ca), O-S(Sr), 3 и I (Ba),
M(HCOO)2, H2O, M = Mg-Sr,
Mg2SiO4, "форстерит”; (MgfFe)2SiO4, "оливин", зел.,
в стр. - сетка тетраэдров [SiO4] и окт. [MO6]
32
Галогениды ®
т. пл.
т. к.
АН
Mg-T
(г.)
MgF2I, ”саллаит”,
стр. тип рутила
1396
2260
-1121
1.77
ПР = IO"9,
р. в HNO3
Mga2
"хлоромагнезит”,
стр. тип CdCl2
714
1418
- 644
2.18
6Н20
(”бишофит")
MgBr2,
тип CdI2
710
1430
-519
2.34
6 H2O
MgI2,
тип CdI2
633
с разл.
1014
-360
2.52
8 H2O
Mgr2 /iL, L
= NR3,
R2O, R2C — О; п :
= 2, 6
т. пл.
т. к.
АН
Ca-Г
(г.)
CaF2I
"флюорит"
1419
~ 2500
-1222
2.10
ПР = 1<г"
Caa2
искаж. стр.
рутила
782
~ 2000
-799
2.51
IfH2O
п = 1, 2, 6
(антарктицит)
CaBr2
искаж. стр.
рутила
760
1830
-685
2.67
л H2O
п = 3, 6
CaI2, стр.
тип CdI2
784
1760
-536
2.88
6 H2O
KMgF3 (т. пл. 1070); K2MgF4 (разл. 846); NaMgF3
M4Mg3Fi0, M = Cs, Ва/2,
MMgCI3, 6Н20, M = K, NН4("карналл ит"); КСЦ + MgCl2 6Н20(ж.)
M2IMgCI4I, M = Na, [R4N], анион - тетраэдр;
Na6MgCI8
В расплаве ст. дис. MCl2 = 43 (Ca), 60(Sr), 80% (Ba); в г.-линейные
мол. Mgf2, Caf2 (Г = Cl-I), Srf2 (Br, I) и угловые CaF2, Srf2 (F, Cl) и Baf2
Стр. CaF2. Са-в узлах гране-
центрированного куба, F-B
центрах 8 малых кубов, к. ч. Ca
8 (куб), F 4 (тетраэдр)
M(HS)2 • л H2O, п = 6 (Ca, разл. 15), O(Sr), 4 (Ba, разл. 50), бц., хор. р. в H2O
MSj, крист., бел., т. пл. ~2000° с разл.;
+ H2O M(HS)2 + M(OH)2; стр тип NaCl; /I-BaS (г.) = 10.9
M(NH2)2, M3N2, M(N3)2, M3P2 - см. табл. ”Азот”, "Фосфор”
• Ca
о F
[C2]
М|С2|, карбиды (ацетилениды)
M = Ca (т. пл. 2300, Atf = -58), Sr, Ba (1780, -50),
бц., разл. *2000, стр. тип CaC2, тетраг. искаж.
стр. NaCl ([C2]2- = СГ);
+ H2O —► M(OH)2 + C2H2T (BaC2 с воспл.);
+ N2 —MCN2
MgC26^ = Mg2IC = C = CI;
+ H2O —► CH3C = CH + CH2 = C = CH2
Стр. CaC2, в тетраг. ячейке гр. [C2] - в центрах ребер
т. пл.
т. к.
АН
Sr-F
(г.)
SrF2I,
стр. тип
CaF2
1473
2460
-1222
2.20
о»
I
О
II
CU
с
SrCI2, стр.
тип CaF2
873
2030
-799
2.67
л H2O
п= 1, 2, 6
SrBr2,
искаж. стр.
PbCl2
к.ч. Sr 7
643
-685
2.82
л H2O
п= 1, 2, 6
SrI2, стр.
тип PbCl2
515
разл.
-536
3.03
л H2O
п= 2, 6
т. пл.
т. к.
АН
Ba-Г
(г.)
BaF2I,
стр. тип
CaF2
1353
2260
-1196
2.32
<с
О
Il
CU
С
BaCI2,
стр. тип
PbCl2
962
1830
- 858
2.82
л H2O
п= 1, 2
BaBr2
стр. тип
PbCl2
853
- 757
2.99
л H2O
п= 1, 2
BaI2, стр.
тип PbCl2
740
"
- 607
3.03
л H2O
п= 2, 6
Гидриды
(MgH2)ll, 1) порошок, бел., разл. у ~300, воспл. возд.,
бурно реаг. с H2O;
2) ”неакт. форма” , медл. реаг. с H2O, уст. на возд.,
разл. 390°, стр. рутила (TiO2)
MH2, M = Ca-Ba, (1>с1м, разл. ~ 600, уст. Ca > Ba,
стр. тип PbCl2, бурно реаг. с H2O
М|ЭДТА|2 , окт. комплексы (хелаты), оч. уст.
Kycr. = IO9(Mg), IO11(Ca), IO9(Sr), IO8(Ba)
п 4—
OOCCH2 CH2COO
Nj(CH2)2N^
OOCCH2 CH2COO
ЭДТА - тгилендиаминтетраацетат-ион
(комплексен III, трилон Б),
гексадентатный лиганд. Р-ряет все MSO4I
(M2f
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
Литий
Li0
25
Ш
Натрий
Na0
35
ш
Калий
K0
45
Ш
Рубидий
Rb0
Ss
ш
Цезий
Cs0
65
ш
Э.О.
1.0
К
и
JEr
JEr
*Е
LLI 1.0
4d
Ш 0.9
Sd
QZ 0.8
bd
□И °-8
(Liat Ka ) Q
NaCl + 60% CaCl2
(т. пл. 580)
Li
Na
К
Rb
Cs
мет., серебристо-бел.
золоти¬
стый
Твердость
0.6 I
0.4
0.5
0.3
0.2
(алмаз - 10)
окисляются возд. с воспл.
d
0.54
0.97
0.86
1.52
1.90
т. пл.
180
97.8
64
39
28.7
т. к.
1337
886
776
696
705
fiHM + /M1.
-3.04
-2.71
-2.92
-2.92
-2.92
+ H2O —►
HT]; P- в ж. NH3 (гол. р-ры),
[M(NH3)6] * [M(NH3)6] + Ie(NH3)
„] ("полярон"); —► MNH2 + H2
куб. стр. (тип Ot-Fe)
M-M
3.10 I
I 3 80 I
I 4.70
4.96
5.34
в г. -
одноатомные мол. и M2 (< 5%)
M-M
2.67
3.08
3.93
4.32
4.55
красн.
фиол.
оранж.
AH M2
-107
-72
-49
-45
-44
Оксиды, крист., гигр., возг. вак. (10 5мм),
стр. тип AWWM-CaF2 (к. ч. M 4);
Li2O
Na2O
K2O
Rb2O
Cs2O
бц.
бц.
желт.
желт.
оранж.
т. пл. 1570
—
740
—
495
т. к. 2600
—
—
—
—
разл. > 1000
400
350
400
300
A H -594
-418
-340
-331
-318
—► окраска усиливается;
в г. - линейные(?) мол.
M2O2 + М;
O2 (/)
Пероксиды, крист., бц., гигр. (желт, из-за примеси MO2),
диамагн., О — О 1.50-1.54
Li2O2
Na2O2
K2O2
Rb2O2
Cs2O2
т. пл. —
разл. 342
A H -636
• л H2O2, п = 2
л H2O, л = 1,2
сильн. окисл.: +
[M2O2 + СаС1(0
596
675
-510
4
8
Fe -U M
Cl)] ("окси
545
-494
4
2Ре04;
лит") + С
567
1010
-422
4
O2-O2
597
650
-402
4
+ M2CO3
H2O
Щелочи, крист., бц., возг. %400, р. в H2O,
(CsOH P LiOH), ж. NH3, распл. реаг. со стеклом
LiOH
Hg (+ Q)
Амальгамы
тв. или пастообразные в-ва, сильн. восст.
В системах M — Hg сущ. соединения.
H2O ( H2)
т. пл. 473
т. к. 925
разл. 600
A H -487
л H2O п = 1
Km
1.5
NaOH
KOH
321
405
1390
1320
>2000
>2000
-428
-427
1; 2; 3.5; 4; 7
1; 2; 4
3.4
5.1
382
-414
1; 2
CsOH
339
-407
0.5; 1; 2; 3
Супероксиды и озониды
см. табл. "Кислород11
\
( M3N)
MClO4, M = Li (т. пл. 247, разл. 500), • ЗН20;
№(482 с разл.; H2O); К (610 с разл.),
Rbj и Csj (~ 700 с разл.)
МСЮз, M = LKt. пл. 129, разл. 270); №(262);
К ("бертолетова соль", 368, разл. 400), р. в H2O Li P Cs
MBrO3, M = NaCr. пл. 381), К (434, с разл.); Rb (430);
Cs(420), р. в H2O Na > K-Cs
MIO3 л HIO3
MIO4, M = Na(• ЗН20), К, Rbj, Csj
MHSO4, M = Li (т. пл. 170), Na (186, • H2O), К (210), Cs;
O^H2SO4
■ ZiH2SO4, (п = 1, 2, 3) M = Na-Cs
Li2SO4, т. пл. 860; • H2O
M2SO4, M = Na, К, NH4; IM2SO4 9 H2O, M = Na, К
Na2SO4, т. пл. 884, т. к. 1430,
л H2O, л = 7, 10 ("глауберова соль"),
M2SO4, M = К (т. пл. 1076, т. к. >2000), Rb (1066),
Cs (1019, возг. 900); летучесть Li > Na < К < Rb < Cs,
в г. - мол. M2SO4 (М = K-Cs)
• Mi11(SO4)3 24 H2O = [M1(H2O)6] • [Min(H2O)6I(SO4)2,
M111 = Al, V-Co и т. д., "квасцы", крист., куб.
MNO3, M = Li (т. пл. 261, разл. 475; ЗН20),
Na (308, разл. 380, "чилийская селитра"),
К (334, "калийная селитра"), Rb (313; • л HNO3, п = 1; 2),
Cs (414, разл. 585; • л HNO3, п = 1 и 2),
в г. — мол., стр. аналоги HNO3, —► MNO2 + O2
MNO2 (см. табл. "Азот")
M3PO4, M = LiKT. пл. 837; • л H2O, п = 1/2, 121),
Na (1340; лН20, п = 10, 12), К (1340)
MH2PO4, M = Li (разл. 100), Na (разл. 200;
• л H2O, п = 1, 2), К (т. пл. 253 с разл.);
MH5(PO4)2, M = K-Cs
M2HPO4, M = Li (разл. 100), Na* • л H2O, п = 2, 7, 12), К
MPO3; MH2PO2; M2HPO3; M4P2O7
MjSb(OH)6I, M = Li, Nal, К.
M3Sbr6, Г = Cl, Br, M = Li, Na, K-Csj
MBiI4, M = K-Csi
MHCO3, M = Li (разл. ~0), Na (разл. 160), К (разл. 100),
Rb (• H2O), Cs (разл. 175), р. в H2O Cs P Na
Na2CO3, т. пл. 854 ("сода кальцинированная"),
• л H2O, п = 1,7, 10 ("сода крист."),
• 1.5 H2O2 • H2O ("персоль")
M2CO3, крист., гигр., M = LiJr (т. пл. 735),
К ("поташ", л H2O, п = 2, 1.5),
Rb (873, разл. 900, • H2O), Cs (разл. 610), р. в H2O Cs P Li
RCOOM, M2C2O4
34
Г алогениды, крист., бц., гигр.
MГ (М = Li-Rb) и CsF - стр. тип NuCI
Csr (Г = Cl-I) - стр. тип CsCl (к. ч. 8);
в г. мол. М2Г2 — плоские ромбы
(K9Rb)Cl MgCI2 6 H2O, "карналли!"
т. пл.
г. к.
A H
К
-Г
(г.)
(ТВ.)
KF,
857
1502
-565
2.17
2.67
• 2 H2O
41
—
—
—
—
KHF2
239
—
—
—
—
KCI, "сильвин"
776
1430
-434
2.67
3.14
KBr
735
1383
-393
2.82
3.29
KI
686
1330
-327
3.05
3.53
т. пл.
т. к.
A H
Li-
-Г
(г.)
(ТВ.)
LiFi,
р. в HF
870
1724
-611
1.56
2.01
LiCI,
614
1397
-406
2.02
2.56
H2O
LiBr,
550
1310
-352
2.17
2.75
• 2 H2O
44
—
—
—
—
LiI,
469
1190
-272
2.39
3.00
зн2о
разл.
73
—
—
—
—
т. пл.
т. к.
Rb-
-Г
(г.)
(ТВ.)
RbF,
798
1430
2.27
2.82
я H2O, /7 = 3, 3/2,
—
—
—
—
IiHF,/7 = 1,2,3
—
—
—
RbCI
726
1395
2.79
3.27
RbBr
692
1352
2.94
3.43
RbI
656
1327
3.18
—
Li Na К Rb
Т. пл. и AH в ряду MГ
Li Na К Rb Cs
Растворимость MГ в H2O
(при 18°)
Стр. NaCl
NaF
NaHF2
NaCI, "галит”
• 2 H2O
NaBr
2 H2O
NaI
2 H2O
т. пл.
т. к.
A H
Na-
-Г
(г.)
(ТВ.)
997
1785
-569
1.93
2.31
801
1465
-410
2.36
2.81
разл. < O0
—
—
—
—
755
1392
-360
2.50
2.98
662
1304
—
2.71
3.23
т. пл.
т. к.
A H
Cs
-Г
(г.)
(ТВ.)
CsF,
684
1302
-531
2.34
3.00
• п H2O,
—
—
—
—
п = 2/3, 1/5
—
—
—
—
HF
Csa
646
1295
-431
2.91
3.56
CsBr
638
1297
-410
3.07
3.72
CsI
622
1280
—
3.31
3.95
Стр. CsCl
Гидриды, к
эист., бел., гигр., не р. в ж. NH3 и орг. р-рителях, стр. тип NaCl
LiH
NaH
KH
RbH
CsH
т. пл.
691
*800
*400
*400
%400 (р H2, Na
A H
-91
-56
-57
-54
-56
M-H
2.04
2.44
2.85
3.02
3.19
ж. M+ + H , в г. - мол. MH (Li — H 1.60), Нин = 5.88, оч. сильн. восст.;
+ H2O —* H2 + МОН; + CO2 — НСООМ; хим. акт. CsH > LiH
MN3, M3N и MNH2 см. Табл. ”Азот”
M2S см. Табл. "Сера"
MSi, см. Табл. "Кремний"
M2C2 см. Табл. "Углерод"
• M
QCI
35
МЕДЬ
2 + (</9)
Cu0 QT
3 d
Ti
Ti
Ti
Ti
Си, мет., желто-красн., ков¬
кий, с высокой тепло- и
электропроводностью,
d = 8.9, т. пл. 1085, т. к. 2540,
р. в к.-окисл., NH4OH, KCN,
окисл. возд.,
^0Cu2+/Cutb = +0-34-
eOCuVCui.= +0 52-
диамагн., в стр. -
гранецентрированный куб
(куб. пл. упак., стр. мет. Си)
к. ч. 12 (кубооктаэдр),
Си — Си 2.56
Сплавы
90% Cu -I- 10% Sn - бронза;
90% Cu -I- 10% Zn - томпак;
60% Cu -I- 40% Zn - латунь;
50% Си + 45% Al + 5% Zn
сплав Деварда (восст.);
95% Cu -I- 4% Sn -I- 1% Zn -
монетный сплав
Cu2Oi, "красн. оксид", т. пл. 1236,
разл. 1800, ЛЯ = -167, к. ч. Cu 2 (sp),
гантель [CuO2], [OCu4] - тетраэдр,
ПР = IO15, р. в NH4OH, НГ(конц.) +
+ H2SO4^pa3Q') ► Cul ^ CuSO4
Стр. Cu2O
CuO, "черн, оксид", т. пл. 1335 (/? O2), разл. 1026,
ЛЯ = -1565, в стр. - квадраты [CuO4] (dsp2)
\ t (под р-ром)
Cu(OH)2I, син., р. в к., NH4OH, в стр. слои окт.;
-I- MOH (конц.) —> фиол. колл, р-р
ICu(H2O)6I2 + , гол., парамагн. (1 неспар. эл-н) катион, вытянутый окт, (spid2)\
Cu2SO4, серые, т. пл. ^400;
-I- H2O —> Cui + CuSO4;
сильн. восст.
Cu2SO3 • H2Oi, бел.;
CuCH3COOi, иглы, бц.
Купраты (I),
MCuO, M = Li -K,
в стр. - квадрат [Cu4O4]4-
M3ICuO2I, желт.,
+ H2O —* Cui+ Cu"
• Zn; Fe; кат. восст.
т. пл.
т. к.
ЛЯ
ПР
Си-Г
(ТВ.)
CuCIi
450
1212
-136
IO7
2.16
CuBri
504
1345
-105
10~9
—
CuIi
605
1336
-68
IO'12
2.44
СиГ, бел., р. в изб. NH3, MCN, M2S2O3.
Стр. СиГ типа сфалерита (к. ч. Cu 4, sp3),
в г. — циклы (СиГ)3
HCl
H2O
HCuCI2, KCuCI2; K2CuCI3
MCu2CI3
M2CuBr3; IR4NI3ICu2Br4I
M2ICuI3I, Cs3Cu2I5
|РуН|2|Си5Г7|, Г = Br, I
анионы — цепи
тетраэдров или тр-ков.
CuCNi, бц., т. пл. 473, ПР = Ю“20
Cu2-JrSi, серый, ПР = IO-50, "медный блеск",
т. пл. ИЗО; ЛЯ = -79
Cu1Fe111S2, "медный колчедан", "халькопирит",
в стр. - тетраэдры [Cu1S4], [Fe111S4], [SCu2Fe2],
стр. сфалерита
Cu2Se, син., т. пл. 1112; Cu2Te, черн., т. пл. 855
Cu3N, зел., разл. 300, ЛЯ = -I- 75
CuN3; Cu + N2
Cu3P, т. пл. 1022; Cu3As; Cu3Sb; Cu2Sb
Cu2C2, ацетиленид, красно-кор., - H2O
Cu(CIO4)2, желто-зел., разл. 130, летучи, • л H2O, п = 6, 2
Cu(CIO3)2 6 H2O; Cu(BrO3)2 я H2O, п = 6, 2(гол ),
TQO0
Cu(IO3)2; CuO+ I2+ O2; я H2O, п= 1, 2/3,
Cu2HIO6I, • яН20|, п = 1,2
CuSO4, бц., разл. 550, • я H2O, л = 1, 3, 5 ("купорос"), син., 7
Cu(NO3)2, син., возг. 200 в вак., т. пл. 226, в г. - плоские мол.
• я H2O, л = 9; 6; 2.5; 1
Cu(NO2)2, т. пл. 147
Cu3(PO4)2 я H2Oi, п = 1,3; Cu4H(PO4)3;
CuHPO4 я H2O; Cu(H2PO4)2 120°
я CuCO3 CiKOHbi, "малахит" (п = 1), "азурит" (п = 2),
в стр. окт. [CuO6]; + CO2 (/?, /) —> CuCO3I
Cu(CH3COO)2, зел., р. в H2O и орг. р-рителях
I /(-H2O)
ICu(CH3COO)2(H2O)I2, зел., кластер, диамагн.
CuC2O4 H2Oi, гол.; Cu + CO2 + H2O
Cu6ISi6Oi8I • 6 H2O, "диоптаз"
Cu-
-Г
• л H2O,
т. пл.
разл.
ЛЯ
акс. I
I экв.
п =
в вытянутых окт.
CuF2, бц.,
CuCI2, желт.
CuBr2, черн.
950
596
1000
290
-536
-216
-134
2.27
2.95
3.18
1.93
2.30
2.40
2, гол.
2, гол.
2, кор.
СиГ2 (Г = Cl, Br), хор. р. в H2O, ROH, Py, ац.; стр.
CuF2 - тип рутила. В стр. CuCl2 и CuBr2 - ленты квадратов
MICiKCNbI, KICu2(CN)3I H2O,
к. ч. Cu = 3; анион - тетраэдр
KCuS, анион - зигзагообразные цепи
KCu4S3, темно-син., полупроводник,
в стр. - слои тетраэдров [CuS4]
Cu(CN)2I, порошок, желто-кор.
CuCN + (CN)2T; + H2O —> CuCNl + 02(медл.)
36
Стр. CuFeS2
CuSi, черн., разл. 220, ПР = 10 зк, р. в к.-окисл.
?оо°
ЛЯ = -53, проводник Cu2S + S
CuS3; Cu2S5; CuSe; CuSe2
Cu(N3)2I, крист., кор., взр.
СиС2|, ацетиленид
3+(</*)
4+(</’)
MOH
(конц.)
H2O
Купраты (II)
NafICii(OH)4I, син.; анион - тетраэдр (Spi)4 парамагн.
M2 ICu(OH)6I, Mn = Sr, Ba, гол.; окт. анионы (SpiCi2) или
квадраты (вытянутые окт.), Cu—О 1.95(экв.) и 2.8 (акс.)
MjCuO1, красн., Ca2CuO3
YBa2Cu3O7.,, высокотемпературные сверхпроводники
Cu2O3I, крист., гранатово-красн.;
400°
CuO + O2; + HCl — Cl2 + CuCl2
\ДОн
Купраты (III)
К|Си(ОН)4|, красн., разл. 20
MCuO2I, M = Na-Cs, черн, или син.,
диамагн., анион - ленты квадратов (dsp2)
Ba(CuO2)2I, красн., уст.
M6ICuO3I2, M = Li, Na, диамагн., анион -
2 квадрата с общ. стороной, полупроводник
М|Си(СЮ4)3|, (NO2)2ICu(QO4)4I
INOnCu(NO3)3I- (= wCu(NO3)2 N2O/),
сине-зел.
M4ICu(NO2)6I, анион - сплющенный окт.
K2ICu(CO3)2I, 3 H2O, син.
К2|Си2(СН3СОО)4||Си(СН3СОО)4|
M2ICu(C2O4)2I 2 H2O, анион - вытянутый окт.
О Fe
• Cu
О о
О N
О X, H2O
• С
MCuF3, бц., M2CuF4, в стр. -
каркас или слои вытянутых окт.
HCuQ3 • ЗН20, MCuQ3, красн.
Cs2CuCl4, оранж., анион -
сплющенный тетраэдр
M2ICuCI4(H2O)2I, M = К - Cs, зел.,
Cu — Cl 2.3 экв., 2.9 акс.
HCuBr3 • IO H2O; MCuBr3, черн.
M2CuBr4, красн.
CuF3, красн.
Рг(/М) + CsCl
НР(-60о)
K3CuF6, зел., парамагн., окт. (SpiCi2)
комплекс; + H2O —► F2 + ...
CsICuF4I, анион - квадрат, диамагн. (dsp2)
Cs2CuF6, оранж., бурно
реаг. с H2O, = 1.77
(1 неспар. эл.)
K2ICu(CN)4I, бц., уст.,
+ CN- —► фиол. цианиды с более высоким к. ч. Cu
MICuS4I, M = NH4, K-Cs, красн.
MICu(N3)3I; M2ICu(N3)4I; M4ICu(N3)6I
Ионы амминов Cu(II) в растворах
Tb. комплексы, крист., син.
ICu(NH3)6Ir2, катион - сплющенный окт.
ICu(NH3)5ISO4,
ICu(NH3)4(H2O)2IX2, катион -
вытянутый окт.
ICu(NH3)2(NO2)2I, крист., пурп.
ICu(NH3)2I + , бц., диамагн.
(d10) линейный (sp) ион, сущ.
только в р-ре, Kycj = 10м
O2
N2H4
ICu(NHjWH2O)2I2 + ,
темно-син. ион,
вытянутый окт.,
^ycl= IO1*
ICu(NHj)4IX2
NH3
H2O
ICu(NHj)5Ij*,
Кус. = 10"
Il NH5
I(NH3)2CuI(Zi-OH)If+
СЕРЕБРО
2 + (d9 ) или "2 + "
3 + (</8) 5 + (</6)
Agc
Ad
ЦтЦт|и[иЦТ1
Ag, мет., бел., ковкий,
с высокой электро- и
теплопроводностью,
d= 10.5, т. пл. 962,
т. к. 2210, р. в к.-окисл.,
(KCN + O2),
fioAgVAgx.= °-80;
куб. пл. упак.,
Ag - Ag 2.88
Колл. Ag, зел. или черн,
листочки с мет. блеском
("колларгол”), порошки
желто-кор. ("протар¬
гол"), обладает стерили-
зующим действием.
Ag2O, кор., разл. 300, AH= -29, ПР =
NH4OH, KCN; + H2O * Ag+ + ОН
К = IO-4; куб., изостр. Cu2O (к. ч. Ag
|-Н20(>-50°)
AgOH
IAg(NH3)2IOH, сущ. в р-ре, сильн. осн.,
линейный катион, Kycr = IO7
Ag + , бц. ион, уст. к гидрол.,
обладает антибактериальным действием
&
AgCIO4, бц., разл. 486, хор. р. в H2O,
AgCIO3, бц., т. пл. 230, разл. 270; +H + —► AgClj + O2
AgBrO3, мало р. в H2O, уст. кН+> AgClO1
AgIO3I. ПР = 10",0. не р. в к. (О
Ag2H3IO6I. желт.; Ag5IO6I, черн.
H2SO4 (конц.)
^Уо.
Ag + SO-) + O2;
AgHSO4
Сплавы, монетные —
90%Ag + 10%Cu-сереб¬
ряный, 90% Au + 10% Ag -
золотой
Амальгама,
содержит Ag4Hg3, Ag5Hg8
(т. пл. 276 и 127). В системе
Ag-Zn-Pb- расслаивание,
Ag р. в Zn-Cnoe (верхн.)
N
Ag2SO4I, бц., т. пл. 660; ►
ПР = IO 4, в стр. к. ч. Ag 6; + H2SO4
Ag2S2O3I, бел., + H2O —► Ag2Sj + H2SO4
Ag2CrO4I, красно-кор.; Ag2Cr2OTj, темно-красн.
‘ AgMXjj, бц., т. пл. 212, разл. 444, р. в H2O, сп.,
ж. NH3, свертывает белок
AgNO2L [= AgONO + Ag — N0-»], св.-желт., разл 140,
ПР = IOj; NH3 = (Ag(NH3)2] tIAg(NO2)2]-
AgPO3L бц., т. пл. 482, р. в разб. к.
Ag4P2OTj, бц., т. пл. 585
Ag3PO4L желт., т. пл. 849, ПР = IO-19
Ag3AsO4I, красн.; Ag3AsO3L желт.
Ag2COsj, св.-желт., разл. 100; ПР = IO-12,
в стр. - тетраэдры [AgO4],
AgCH3COO, р. в воде ~1%, Kjwc = 0.2
AgIBF4I; AgIBF6I, Э = Р, As, Sb, Nb, Та, хор. р. в PhMe,
Ag3BO3, стр. - цепи гантелей [AgO2Joc,
AgpH4I, Э = В (бел.), Al (желт.), Ga (оранж.)
Zn(Z)
"черновой Pb"
0O^
%
т. пл.
т. к.
A H
ПР
Р-ритель
AgF, бц.,
435
-201
_
H2O % 65%
• п H2O, п = 1,2,4,
• л HF, п = 1,3
AgCIi, бц.
457
1554
-127
IO-'0
NH4OH, KCN,
(распл. - оранж),
M2S2O3
"роговое серебро"
AgBri, бел. или
434
700
-99
IO"13
NH4OH, M2S2O3,
желто-зел.
разл.
IO"16
*дис=Ю-4
AgIi, св.-желт.
560
разл.
—
-62
KCN, M2S2O3,
не р. в NH4OH
Уст. к действию света AgBr
> AgCl > AgI. Стр. Agr (F = F- Br)
типа NaCl (к. ч. Ag 6), Agl
- типа сфалерита (к.ч. Ag 4, Spy)
IO-8, р. в к.,
"(pH >7),
2 ,V)
ан. окисл. (ОН )
K2S2O8(We);
O3 (ОН)
Аргентаты
KIAg(OH)2I, сущ.
при pH > 7
M4IAg4O4I, желт.,
анион - квадрат,
M3IAgO2I, гантель (sp),
Na4Ag2O3; Na2Ag4O3
MAg3O2;
+ H2O -» Ag + 02 + ..■
AgOj = Ag1Ag111O2, черн., куб.,
разл. 100 (а), 178(0); AH= -13,
р. в HNO3, HClO4; + H2SO4 —
—► Ag2SO4 +O2I; сильн. окисл.
полупроводник, диамагн., в стр.
а-формы - гантели [Ag1O2] и
квадраты [Ag111O4], в стр. р -
тетраэдры [AgunO4]
Ag2O3, черн.,
разл. -20,
изостр.
Au2O3
ан. окисл. (AgClO4)
Ag7O8X, X = HF2, ClO4, HSO4, NO3, BF4,
черн., с мет. блеском, проводники;
+ H2O AgOI + O2 + AgNO3,
в стр. - кубы [Ag1O8] и квадраты [Ag111O4]
ан. окисл. (Pt); SO2
12iAi
Na3IAg(S2O3)2I, Afycl = IO14
KIAg(NO2)2I, Afyct = Wi
Cs3BaIAg(NO2)6I 2 H2O
IAgPy4IX2, X = NO,. S2Olt/!,
оранж., оч. сильн. окисл.,
катион - квадрат [AgN4]
AgCrO4
Ag3(PO4)2, бц., хор. р. в воде
KIAg(CO3)I, в стр. - цепь
тетраэдров [AgO4]
(AgV^Sp^2
SOv1
Ag(SO3F)2, разл. 210;
+ H2O — O2 + ... ;
/*1ФФ — ^-91
CsIAg(SO3F)3I,
K2IAg(SO3F)4I
MF + F2
M5IAg(HIO6)2I я H2O
Na5IAg(H2TeO6)2I 12.5 H2O
св.-желт., диамагн. </8,
анион - квадрат (dsp2)
M11AgF3,
MfAgQ2I, анион -
тетраэдр, Kycr = IO6
MIAgBr2I, Kycx = IO6
MAgI2, M2AgI3, в
стр. - цепи
тетраэдров;
|А8Г2Г,^Уст =IO5(Cl),
8 • IO7 (Br), IO12 (1);
бц., линейные
(sp) ионы
AgF2, бц. т. пл. 690,
AH = -347, парамагн.
(< -110°), ферромагн.,
сильнейший фторагент;
+ ню —
—► Ag2O+ O3+ HF,
в стр. - квадраты [AgF4]
AglMlvF6I, Mlv =
= Ge - Pb, Ti - Hf. Rh.
Pt, Pd, уст. до 600°,
/М>Ф = 2.0
MAgF3,
M = K-Cs
M2AgF4, M
= K-Cs,
Ca-Ва/2,
С<1/2, Н8/2,
анион -
квадрат,
Ba2AgF6
AgF3L
порошок,
красно¬
кор.,
диамагн.,
изостр.
AuF3
MIAgF4I,
M = K-Cs,
[O2], желт.,
диамагн.,
анион -
квадрат,
изостр.
MAuF4
BaIAgF5I
Cs2IAgF6I,
в стр. типа
K2PtCl6 -
окт. [AgnlF6],
[AgvF6]
340° (-F2)/
F2 (400°)
(Ag2SO4 + M11CO3 ) (M4Ag4Oj)
38
^Ag2Si, черн., т. пл. 827, р. в HNO3 (/), KCN; ("аргентит" в Ag-Pb рудах);
AgCNi, крист., бел., уст. к Ziv-В, ПР = IO-14, в стр. - линейные цепи
AgSCNi, бел., ПР = IO"12
Ag3Ni, нитрид, "гремучее серебро", крист., кор., AH= +225, ПР = IO 9
AgN3L азид., т. пл. 252, взр. 300°, —Ag—N = N+ =N"—
AgCNO, фульминат, взр. (соль гремучей к.)
MIAg(CN)2I, линейный анион, Kycr= Ю21
MIAg(SCNb); M2IAg(SCN)3I;
M3IAg(SCN)4I, (NH4)5IAg(SCN)6I
KCN
ZnI-K2Zn(CN)4)
золото
«2+ «*
3 + (<Г)
Sd
Au0 UtlnUTUTliTl
Au2O3, порошок, кор., AH
в стр. - сетка квадратов
Au, мет., желт., наиболее
тягучий и ковкий,
d = 19.32, т. пл. 1064.4;
т. к. 2947, летуч > 1000°,
не реаг. с O2, N2, С, S;
р. в ц. в., (Cl2 + HCl),
(H2SO4 + HNOi),
(H2SO4 +HMnO4),
H2SeO4 (О, (KCN + O2);
fOAuVAut. = |68’
eOAu3 + /Aut. = |50;
куб. пл. упак., (тип Си);
Au — Au 2.88
электро-
диспергирование
"Колл, золото", образ,
в оч. разб. р-рах,
с ростом размера
частиц цв. изменяется
по ряду: роз., красн.,
син., фиол., черн.
Сплавы
Амальгама содержит
AuHg2, AuHg3, Au3Hg
(т. пл. 124, 310,421)
В системе Cu — Au
непрерывный ряд
твердых р-ров, < 400°
в тв. фазе образ.
Cu3Aui1, и CuAuit,
("сверхструктуры")
5+М6)
7 + (J4)
Аураты (III), К|Аи(ОН)4| • H2O, желт.;
M11IAu(OH)4I2. M = Ca-Ba (-5 H2O,
зел.), анион - квадрат, (dsp2), диамагн.
NaAuO2, M6IAu2O6I
MIAu(SO3F)4I;
MjAu(SO4)2I, желт.
MIAu(NO3)4I, желт.
М|Аи(СН3СОО)4|,
анион - квадрат
[F]
AuF7, желт.,
летуч, + H2O
—► Au2O3 + Au
A H
Au-Г
(TB.)
AuF, сущ. в г.
-
-
AuCIj, св.-желт.,
-33
2.30
неуст.
AuBrj, желт.
-18
-
AuIj, св.-желт.
+ 1
2.62
Г
/ V
В стр. АиГ - цепи, Au
АиГ -U Аи + Г2;
+ H2O Au+ [АиГ4]“,
уст. AuI > AuCl;
IiNH3 (л = 1-12);
AuCI(CO), мол. гантель
AuCI2, красн.,
диамагн.
MIAuCI2I, бц.,
М|АиВг2|,
MIAuI2I
анионы -
линейные, (sp)
+ H2O-^
—>Аи + [Auf4]-
М2Аи2Г6,
в стр. -
гантели
[Аи'П 2]
и квадраты
[АишГ4]
разл.
A H
AuF3, оранж.,
500
-348
AuCI3, красн.,
150
-117
т. пл. 288 (р)
AuBr3, кор.,
100
-54
Аи13|, зел.
20
—
Aufj -U АиГ + Г2.
В стр. AuF3 - спирали
из квадратов.
В стр. и г. - Аи2Г6
(Г = Cl-I) - плоские
димеры
HCl
SOCl2
MIAuF4Iji, св.-желт.,
анион - вытянутый окт.
HAuCI4 4 H2O,
"хлорид золота", св.-желт.,
гигр. иглы; Куст. = IO22
AuCI,+ H2O+ HCl;
MAuCl4, M = Na
("золотая соль")
К (• H2O), желт., диамагн.,
анион - квадрат,
сильн. окисл.
KAuBr4 • 2 H2O, пурп.,
анион - квадрат, Kyci = IO3
K3AuBr6, желт.,
анион - искаж. окт.
KAuI4, крист., черн.
AuCNI, желт., изостр. AgCN ^ HCl
AuSCNI, разл. 140;
+ H2O —* Au(SCN)3+ H2
Au2Sj, серый или кор. порошок,
р. в ц. в.; Au + S
Au2S2I, черно-кор.
Au3N, нитрид, взр., • NH3;
AuN3, азид, крист., бц., р. в H2O,
AH = + 280, взр. даже в р-ре;
Au2C2, желт., взр.
MIAu(CN)2I, бц.,
линейный анион;
Куст - Ю”;
MIAu(SCN)2I. 6ц..
П23
Au(CN)3-3 H2OI, крист., бц.
Au(SCN)3I, красн., оч. неуст.
KlAu(CN)4I. • H2O,
бц., анион - квадрат
KIAu(SCN)4I, оранж.
AuF5,
красно-кор.,
т. пл. 75,
диамагн.,
A H = -473
в стр. -
цикл [AuF5J4
MlAuF4I.,
желт.,
диамагн.,
анион - окт.
WV)
M3IAuS2I, бц.
MAuS
К|Аи(С = CHbI
Xtf^rAu2S3, черн., гидрол.; Au+ S NaAuS2 • 4 H2O, бц. разл. 30
(HAuCl4)--^H)
+ын!(»ъГ
IAu2O3 х NH3 + Au(NH2)aXm(NH)^Ii,
"гремучее золото", желт-бур., взр.,
р. в KCN
IAu(NH3)4IX3I, X
не р. в конц. к.
NO3, СЮ4/2,
39
AuO = Аи,[Аит02],зел.
AuO(OH)
Au2O3 • 2 Н20|, "золотая к.", желто-кор., р. в к.
и щ., Kk = IO12(I), IO14(II), IO16(III) > Koch,
Au2O • * H2Oj,
темно-фиол.;
+ щ. —» син. золь
Аураты (I)
С$|АиО|, желт., в стр. -
анионы [Au4O4]4-
Na3AuO2
электролитическое
(рафинирование
'в р-ре HAuCl4
M3IAu(S2O3)2I H2O, бц.,
анион - линейный [S-Au-S]
IAu(SO3F)3I2,
Au2(SeO4)3, желт.
Au(TeOF5)3
АиОС1|, красн., р. в конц. HCl;
Au + Cl2 + O2
ЖЕЛЕЗО
Fe0
it
0(0
з d
i 111111
45
IT
JLr
CE
4d
Э.О.
1.6
Fe, мет., бел., d = 7.9, т. пл. 1539, т. к. % 3200,
легко корродирует, р. в разб. к. (—► Fe2 + ) и
конц. щ. (г) (—► [Fe(OH)6]4-), пассивируется
-0.44,
'И
IМ" \ на холоду к.-окисл., ^оре2 + /ре
fOFejVFet.= -0036,
^x-Fe, объемноцентрированный куб.,
к. ч. 8 (куб.), ферромагн
J 769° (точка Кюри)
/?-, изостр. Ot-Fe
I 911°
у-, куб. пл. упак., Fe
1 1390°
<5-, изостр. Ot-Fe
е-, гексаг. пл. упак,
-Fe 2.58
парамагн
,d= 9.1
"Карбонильное железо", пирофорно
<0.3% С - мягкие стали, ^2 - стали, ^4 - чугуны
Fe3C, цементит, уст. > 1100°, т. пл. 1650, АН = -1-25
+ H + —► H2 + CnH2n + 2; ферромагн. (>214°),
в стр. - триг. призмы [FeC6], к.ч. Fe 2
Ферросплавы с высоким содержанием Э (Э = В,
Si, Р, Cr, Mo, W, Mn, Ti, Zr, Nb), промежуточные
материалы в производстве легированных сталей
Fe(CO)5, пентакарбонил, ж., желт., яд, d= 1.46,
т. пл. -20, т. к. 103, АН = -733, не р. в H2O,
р. в бзл., эф., ж. NH3; +H+ —► Fe2 * + СО + H2;
диамагн., мол. - триг. бипир. (dsp3)
I Ziv-B (-СО)
Fe2(CO)9, эннеакарбонил,
крист., желт., гигр., нелетучи,
не р. в эф., бзл., р. в Py, ац.;
диамагн.; мол. - 2 окт. с
общ. гранью, кластер
Fe3(CO)i2I, тетракарбонил,
крист., черно-зел., возг. вак. 60,
разл. 140, окисл. на возд., не
реаг. с к., щ., диамагн.,
в мол. кластер [Fe3]
H2; СО(/); С (в домне)
2+ (</*)
Fei-JrO, оксид железа (II), крист., черн., т. пл. 1368, АН = -268, иногда
пирофорны, _570^ рс + Pc3Q4 (медл рхл.); стр. тип NaCl.
-H2O T 200е
• H2 ( > 570°)
O2(J)
Fe(OH)2I, гидроксид железа (II), бел., ПР = 10 |6, Koal = IO'2, стр. тип CdI2
IFe(H2O)6I , зел., парамагн. (4 неспар. эл-на),
окт. ион (sp^d2)
н/он
Соли железа(Н)
Fe(CIO4)2 • 6 H2O, бц., разл. 100
700°
FeSO4, крист., бц.; Fe2O3 + SO2 + SO3 — (г, H2)
• л H2O, /1 = 7 (зел., "железный купорос"), 6-4, 1
(NH4)2SO4 6 H2O, соль Мора; H2SO4 3 H2O;
Fe(NO3)2 • 6 H2O, т. пл. 60.5 с разл.
Fe3(PO4)2 л H2Oj, п = 8; 4; 2
FeHPO4 IH2Oi; Fe4O(PO4)2
Fe(H2PO4)2 2 H2O, в стр. - слои окт.
400°
FeCO3L "железный шпат"; ► Fe3O4 + СО + CO2
Fe(HCO3)2, сущ. в природных водах;
+ O2 —► Fe2O3 • п H2Oi ^ CO2
Fe(CH3COO)2, 4 H2O; Fe(HCOO)2 2 H2O; FeSiO3; FeC2O4
Fe3Al2ISiO4I3, "гранат"; Fe2SiO4, "фаялит"; FeSiO3
CO2 + H2O
H2O
FeF2, бц.
FeCl2, бц.
FeBr2, зел.
FeI2, кор.
т. пл.
т. к.
АН
стр.
тип.
Fe-T
(г.)
л H2.
О, я =
1100
674
684 (р)
592
в
1026
927
827
г. - л
-661
-343
-247
-125
инейн!
рутила
CdI2
CdI2
CdI2
>1е мол.
1.77
2.16
2.31
8.4
4, 2
6.4
4
"Fe(CN)2"i = Fe2IFe(CN)6], бел. в-во (ос. бур.), разл. 500
Fe(NCS)2 • 3 H2O, крист., зел.
CN-
KOH [-Fe(OHbi)
Стр. пирита
Fei-JlSi, сульфид железа (II), крист., кор., т. пл. 1193,
АН = -96, ПР = IO19, р. в к.; + O2- FeSO4;
"пирротин", стр. тип NiAs
S(SOO0)If > 700°(-8)
FefS2), "пирит", "марказит", крист., золотистые,
т. пл. 1171, АН = -175, стр. тип NaCl,
([S2]"2 = Cl ), Fe-S 2.26, S-S 2.17
IFe(INO)J, тетранитрозил, иглы, черн., оч. акт.;
+ H+ —. [Fe(NO)(H2O)5] +
40
Fe(C5H5)2, ферроцен, крист., оранж.,
т. пл. 173, возг. 100, перегоняется
с паром H2O, уст. на возд., диамагн.,
мол. - триг. антипризма
MOH (конц.)
Ферраты (II)
Na2IFe(OH)4) • 2 H2O, серо-зел.
Ba2IFe(OH)6Ii, крист., св.-зел.
Na4IFeO3); Cs2K4IFe2O5I, крист.,
красн., в анионах — 1 и 2 тр-ка,
к.ч. Fe 3 (d^s)
IPh4AsI2IFe(NO3)4I
M4IFe(NO2)6I; INOHFe(NO3)4I
K2IFe(C2O4)2I • 6H2O1 крист.,
золотисто-желт., р. в H2O
Галогеноферраты (II)
MFeF3, M = K-Cs
M2JFeF4I; Ba2IFe3F10I
MFeCI3, M = Rb, Cs, в стр. - окт.
M2IFeCl4I, M = Li, К ( 2 H2O),
бц., анион - тетраэдр (Spi)
M3FeQ5, M = NH4, Tl
Cs3FeBr5
Гексацианоферраты (II)
H4IFe(CN)6I,
"железисто-синеродистая к.", крист.,
бц., сильн. к., Ky = IO"2, K4 = IO-4;
лХ, X = H2SO4, (C2H5)2O
K4 IFe(CN)6I • 3 H2O, "желт, кровяная
соль", разл. 87, не яд., диамагн. (d10),
анион
Ba2JFe(CN)6I
окт. W1Spi), Kycr = IO37
з+(</5)
Fe3O4 = Fe1 "(Fe11, Fe111KXl, черн.
с мет. блеском, ферромагн.,
т. пл. 1538 с разл., AH = -1116,
воздух
(/)
Fe2O3, оксид железа (III), крист., красн., серые, AH = -820, а-, гексаг.,
т. пл. 1562 с разл., парамагн., полупроводник, "красный железняк"
не р. в к., полупроводник, B Cl р.
тетраэдры [Fe O4] и
у-, крист., кор., ферромагн. FeO(OH), а-, /?-, у-, "бурый железняк"
>1400°
стр. аналоги AlO(OH) "бемита", ферромагн.
окт. [Fe11, Fe111O6], "магнетит"
T-H2O
4 + (</4) 5 + (</3)
6 + (</2)
KClO +KOH
O2 (мгнов.)
FeO ■ л Fe2O3X H2O
темно-зел.
Fe2O3 яH2Oj, бурый, р. в к. и конц. щ.; Kit =IO"13; Kloctt = \0~10,
л = 4, 6, 2.5, Fe(OH)3, "берналит"
(Fe(H2O)6) * бц., парамагн. (5 неспар.
эл-нов), окт. (Spid2) ион
H2^Mqh (конц.)
Соли железа (III)
Fe(CIO4)3, бц., • IOH2O, крист., роз.
Fe2(SO4)3, бц., разл. ~500;
• я H2O, л = 10,9,7,6
• M2SO4 • 24 H2O, квасцы, бц.
Fe(NO3)3, 9 H2O, разл. 50; -6 H2O, т. пл. 40
Fe(H2PO4)3, л H2O, л=1, 0.5; FePO4I
IFe3O^(RCOO)6I + X", красн., в центре
иона - тр-к [Fe3O*],
Fe2(C2O4)3 • 5 H2O, желт.; NaFe(SiO3)2
Ферраты (III) ("ферриты")
Na4IFe(OH)7I 2 H2O; Na5IFe(OH)8I 5Н20,бц.
M5FeO4; M4Fe2O5; M2Fe4O7; Na3Fe5O^
анионы - тетраэдры (sp3)
MFeO2, красн., стр. тип NaCl
IClO2IIFe(ClO4)4I
M2IFe(IO6)I, M = Na, К; M3IFe(SO4)3I,
MIFe(NO3)4I, M = Cs, [R4N], [NO]
анион - сплющенный тетраэдр, к. ч.
Fe 8 (додекаэдр, spV4), NOj бидентатны
K3Fe3(PO4)4 H2O; (WH4)Fe(HPO4)2
M3IFe(C2O4)3I, • ЗН20, зел.
Ферраты (IV)
Li2FeO3
Na4FeO4
Mi1FeO4
Ba3FeO5
черн.
Феррат(V)
K3FeO4,
черн.,
парамагн.,
Яэфф. = 3.88,
анион —
тетраэдр (3
неспар. эл-на)
KOH
Ферраты (VI)
K2FeO4,
красно-фиол.,
разл. 200,
BaFeO4,
разл. 120,
H2Ol, красн.,
анион - тетра¬
эдр ^iS)
(-O2)
Неуст.;
/, H2O —► Fe2O3 • лМ2Ол + O2
АН
• л H2O, л =
FeF3, св.-зел.,
-994
4.5,3
т. пл. 1027, т. к. 1327
бц. или роз., р. в HF
FeCI3, темно-кор.,
-396
6, 4, крист., желто-кор.,
т. пл. 308, т. к. 317, в
т. пл. 37,
стр. - сетка окт..
= [FeCl2(H2O)4Ia(H2O)2,
в г. - димерные мол.
Fe-Cl 2.30, Fe-0 2.07;
FeBr3, кор., возг.;
-264
6, красн.
FeBr2+ Br2,
FeI3I FeI2+ I2
QLV/ \ (Л
1234» Ac
MIFeF4], бц., /Ьфф. = 5.85,
M2FeF5, в стр. - цепи окт.,
M3IFeF6I; H3IFeF6I ЗН20, св.-зел.
MIFeCI4I, M2IFeCI5I; M3IFeCl6I
MIFeBr4I, анионы - окт.
(sp3d2, 5 неспар. эл-нов)
• Fe
О Г, S
OCO
Fe3 +
"Берлинская лазурь",
"турнбулева синь", колл,
р-ры MFe11Fe111(CN)6,
M = Na - Rb, разл. щ., в стр. -
сетка кубов из ат. Fe, на реб¬
рах - CN, в 1/2 центров -M + ;
окт. [Fe11C6] и [Fe111N6]
распределены статистически
Fe2 +
H3IFe(CN)6I, "железосинеродистая11 к.,
кор., сильная к., неуст.
M3IFe(CN)6I, M-K ("красн. кровяная соль"),
Naf • 6 H2O), кор., порошок желт., яд., анион -
искаж. окт. W2Spi), парамагн. (1 неспар. эл-н)
"Fe(CN)3"! = FeIFe(CN)6], кор.
K3IFe(NCS)6I • 2 H2O,
р. в СП., эф.
крист., неуст., темно-красн.
Fe2S3, желто-зел.;
+ H2O —♦ FeSj + Sj + Fe2O3 л H2Ol
K2S (/)
MIFeS2I, гол., • л H2O, крист., красно-фиол.
41
Fe2F5 • л H2O,
л = 2 (красн.), 7 (желт.)
(= (Fe (H2O)6] IFe111F5(H2O)];
Fe3I8 = 2 Fel3 Fel2
КОБАЛЬТ
2 + (d7)
3 + (</6)
4+ (d5)
Co0
з</
IT
IT 1 1
4 s
Il QD
Со, мет., бел., тв. и хрупкий > Fe,
акт. < Fe, d = 8.9,
т. пл. 1495, т. к. 2960, р. в к. (20°),
пассивируется к.-окисл.,
^0Co2 +/Со = —10.277,
ферромагн. (< 1300°),
тонкодисперсный - пирофорен;
а-, гексаг. пл. упак., Со — Со 2.50
I 430°
P-, куб. пл. упак. (тип Mg),
уст. при 20° в атм. H2
Со|_хО, крист., цв. - от зел. до черн.,
т. пл. 1935, разл. 2800, АН = -239,
р. в к., конц. щ., антиферромагн.,
стр. тип NaCl, Со — О 2.15
-O2 (< 500°)
>900°
Co3O4 = Со'"(Сом04),
черн., АН
-904
170° (-H2O) (N2)
Co(OH)2I, роз., ПР = 10 16, р. в к., щ.,
NH4OH, AToch = КГ4, стр. тип CdI2
».о,юн-у. Naoao^LL
он
О
»(</*)
Co2(CO)8, крист., оранж., т. пл. 51,
возг., разл. 60, окисл. возд., р. в
орг. р-рителях, не р. в к., разл. щ.;
диамагн., мол. - 2 триг. бипир. с
общ. ребром, кластер:
ОС к .COv уСО
OC^ 4ssCo/ 44sCO
В р-ре - мол. без мост. СО-гр.
Со4(СО)|2, крист., черн.;
H Со + СО;
мол. - тетраэдрич. кластер [Co4],
Со — Со 2.49, в вершине - гр.
[Co(CO)3], в основании -
3 тетраэдра [Со(СО)2(СО)2/2]
с общ. вершинами.
тН20|, гол., осн. соли
Co(CIO4)2, разл. 210;
• л H2O, п = 4, 6, красн.
CoSO4, роз., разл. 650;
• л H2O, п = 7, 6, 4, 1
CoSO3 • л H2Oj, красн., п = 5, 3, 2.5, 2
Co(NO3)2, пурп.; 6 H2O, красн.
Co3(PO4)2, красн., • лН20|, п = 2, 8
Co5(PO4)2(OH)4; Co(H2PO4)2 3 H3PO4;
CoHPO4 зн2о
CoCO3, красн., "сферокобальтит",
изостр. CaCO3; • 6 H2Oi,
образ, в изб. CO2;
Co(CH3COO)2; 4 H2O, красн.
Co(HCOO)2 2 H2O
CoC2O4 2 Н20|, роз.; Со+ 2 CO2
т. пл.
т. к.
АН
л H2O,
п =
CoF2L роз.
1200
-1740
-661
4,2
CoCI2, гол.
740
1049
-318
6,4, 2, 1
CoBr2, зел.
687
927
-213
6, 2
CoI2, черн.
520
570
возг.
-88
6
стр. CoF2 - типа рутила, СоГ2 (Г = Cl-I)
типа CdI2
Кобальтаты (II)
Na2ICo(OH)4I; Ва2|Со(ОН)6|
Li6ICoO4I, Na4CoO3
CoO • M2O3, шпинели
(NO2)2ICo(QO4)4I;
NH4ICo(QO4)3I
K2ICo3(OH)2(SO4)3I^H2O
K2ICo(SO3)2I
MICo(NO3)3I,
M2ICo(NO3)4I
K2ICo(NO2)4I, жел1.
(NH4)2ICo(CO3)2Ii, красн.
К2|Со(С03)2(Н20)4|-тра«г
K4ICo(HCOO)6I
К2|Со(С204)2|-6 H2O, красн.
M2CoF4; M4CoF6,
анионы - тетраэдры
и окт.
MCoCI3, син., в стр. -
цепи окт.
M2CoCI4, син., парамагн.,
анион - тетраэдр (л/?3)
M2CoBr4
Cs2ICoI4I;
Cs3CoI5 = С83[Со14]1, зел.
CoO(OH), "станьерит",
150° T
Co2O3 -л Н20|, кор.,
р. в NH4OH, не р. в щ.
H2O2 (ОН)
CoO2 • лН20|,
черн.
Co2(SO4)3 18 H2O,
сине-зел., разл. 30
NUSO4 24 H2O,
темно-син., квасцы,
оч. неуст., диамагн.
Co(CH3COO)3, черно-зел.,
разл. 100
|С03О(НСОО)6ГХ~
CoF3, кор., возг., разл. 350,
АН = -774, сильн. окисл.,
+ Э — OFn
(Э = As, Р, С, Si)
• 3.5 H2O, зел., парамагн.
(4 неспар. эл.);
+ H2O —► Co(OH)3 i + HF
CoCI3, зел.,
АН = -268, разл. на свету
Кобальтаты (III)
■ К3|Со(ОН)6|, зел.
Na^CoO4, фиол.
M Co2O4, шпинели
Кобальтаты (IV)
LigCoO6
M4CoO4
Ba2CoO4, красно-кор.
анионы - тетраэдры
или цепи окт.
M3ICo(NO2)6Ii, желт.
Na3ICo(CO3)3I SH2Oi, зел.
(NH4)3ICo(C2O4)3I ЗН20
M3CoF6, гол., анион
^фф.= 4.3 (Sp3Ci2,
4 неспар. эл.)
K3CoF7; Cs2CoF6,
желто-кор., парамагн.,
анион - окт. (sp3d2)
Co(^NO)3, крист., черн., разл. 100,
неуст. на возд., диамагн.
ICo(PF3)4Iji, крист., фиол.;
ICo(N2)(PPh3)3I, крист., желт., р. в
бзл., эф., уст. к гидрол., окисл. O2
42
Co(CN)2, син., разл. 450;
/Т
2.3 H2Oj роз., р. в NH4OH
IR4NI3ICo(CN)5I, желт.,
анион - тетраг. пирамида,
^yci = Ю19
K6ICo2(CN)IoI ■ 6 H2O, красн.,
сущ. в атм. H2, диамагн.
Co(CN)3, син.;
• 2 H2O, красн
Н20(-Н2)
ICo(NH3)6I2+, желт.,
окт. (Spi</2), /Лэфф = 5.04,
ICo(NH3)sXfrJc3^+
Куст = Ю4, восст.
O2
п = O - Sy желт., красн.,
зел., окт. амминокомплексы
(см. также табл. "Кислород")
CoSi, черн., т. пл. 1116, образ, колл,
р-ры, ПР = IO-27, стр. тип NiAs
CoS2I* черн., стр. тип FeS2
Co3S4, "кобальтовый колчедан"
MICo(CN)4I, красн., диамагн.,
анион - окт. W2Spi)
MICo(CN)4(H2O)2I,
H3ICo(CN)6I H2O, бц..
сильн. к.. К*
10е"
НИКЕЛЬ
Ni0
2 + (d )
3 + (</7)
4+ (</«)
ъа
IT IT IT 1 1
4.?
QD
JEr
П
Ni, мет., блестящий, бел., d= 8.9, т. пл. 1455,
т. к. ~ 2900, акт. < Fe и Со; р. в к. (пассивиру
ется конц. HNO3) и [NH4OH + (NH4)2CO3];
ZioNi2 + /Nirll = “0-234; ферромагн. ( < 358°);
а-, гексаг. пл. упак., Ni — Ni 2.48
\ 250°
0-, куб. пл. упак., (уст. при 20°)
"Скелетный Ni Ренея", порошок, черн.,
содержит р. H2, к-р гидрирования
Nii-JfO, крист., черно-зел., т. пл. 1990, АН
р. в к., "бунзенит", искаж. стр. тип NaCl
-239,
I 250°
Ni2O3 • л H2Ol, черн.,
H2O (-O2)
оч. сильн. окисл.
NiO2 л H2Ol1
черн.
Ni(OH)2I, яблочно-зел., р. в к. и NH4OH; не р.
в конц. щ., ПР = 10~17, стр. тип Cdl2
MO2; KClO3 + O2 (/)
I конц. NaOH I
Сплав Ni-Al
Кат. восст.
H +
-NaAl(OH)4]
Ni-CiuiaBbi: содержание 4-5% Ni повышает
антикоррозионные св-ва сталей; "инвар"
(36% Ni + 0.2% С + 64% Fe) имеет
минимальный коэффициент линейного
расширения; "магнитный сплав" содержит
11 - 14% Al, 22-34% Ni, остальное - Fe
о (</10)
Ni(CO)4, ж., бц., яд, т. пл. -19, т. к. 43,
разл. 180, АН = -146, взр. на возд.,
р. в орг. р-рителях, не р. в к. и щ.;
диамагн., мол. - тетраэдр (sp3)
NiSl, крист., черн., т. пл. 797, "желт.
М-колчедан", а-, стр. тип NiAs,
р. в к., ПР = IO-21 р.у не р. в к., образ.
колл, р-ры, ПР = IO-26
NiS2, "ваэсит", стр. тип FeS2 ("пирита")
M2INi(S4)2I, анион - квадрат
NiAs, "красн. М-колчедан*^
т. пл. 968, в стр. -
ат. Ni-B узлах
"двухэтажной" гексаг.
ячейки, атомы As -
в центрах триг. призм.,
по 3 в каждом "этаже",
окт. [NiAs6] и [AsNi6]
INi(H2O)6I2+, зел., парамагн. (2 неспар. эл-на),
окт. ион (sp^d2)
Ni(CIO4)2, • л H2O, п = 4, 6, сине-зел., т. пл. 149; ^NH3
Ni(ClO3)2 6 H2O, зел., разл. 80
Ni(IO3)2I, желт.; 4 H2O
NiSO4, желт., разл. 640; • 7 H2O, "зел. купорос",
• 6 H2O, гол. или зел.
Ni(NO3)2, св.-зел., разл. вак. 220, нелетучи; • 6 H2O
I /(-O2)
Ni(NO2)2, св.-зел., разл. 220
NiHPO4 л H2O, /; = 3, 3/2; Ni3(HP2O7)2 IOH2O;
Ni(H3P2O7)2 2 H2O;
Ni3(PO4)2 7 H2Ol, зел.; Ni2P2O7 6 H2Ol, зел.;
Ni(H2PO2)2 • 6 H2O
NiCO3I, желт, или зел., изостр. CaCO3 «*с°2 ^ • 6 H2Ol
I нсо,
3Ni(OH)2 2NiCOj 4 H2Ol
Ni(CH3COO)2; • 4H2O, зел., в р-ре гидрол., K2 = IO-3
NiC2O4 2 H2Ol, Ni + 2 CO2; Ni(HCOO)2 2 H2O
INi(NH3)6IX2, син., катион - окт., Kycr = 10
т. пл.
т. возг.
АН
л H2O,
п =
NiF2I, желт.
NiCl2, желт.
NiBr2, кор.
NiI2, черно-зел.
Стр. NiF2 типа
- типа CdCl2, в
1160
1001
963
797
рутила
г. - Ni!
1474
970
919
970
(TiO2); I
F2 - лин<
-657
-305
-211
-96
sIiT2 (Г
;йная !
3, 4,6
4,6
6
6
' = CI-I)
иол.
Ni(CN)2, крист., желт.,
420°
Ni + N2 + С (взр.)
• 4 H2O, зел.
Никелаты (II)
Na2INi(OH)4I
M2NiO2, от желто-зел.
до красн.
CsINi(ClO4)3I
(NO2)2INi(ClO4)4I
Никелаты (III)
MNiO2, M = Li, Na,
Ba2Ni2O5, черн.,
т. пл. 1200 (в атм. O2)
Na5NiO4, анион -
тетраэдр, парамагн.
+ H2SO4 -4 O2
/(-O2)
INOHNi2(NO3)5I
M2INi(NO3)4I; MINi(NO3)3I
M4INi(NO2)6I, H2O;
NaNi4(PO4)3
M2INi(CO3)2(H2O)4I
K2INi(CH3COO)4(H2O)2I(H2O)2
M2INi(C2O4)2I
MFn + F2; ClF3; (KrF2 + XeF6)
MINiF3I
M2INiF4I, в стр. слои окт. [NiF6]
M2INiCI4I; Cs3INiCI5I; KNiCl3,
анион - цепи окт.
M2INiBr4I, анион - тетраэдр
CsINiBr3I, в стр. - сетка окт.
•550°
M2INi(CN)4I, M = Na (желт.), К (оранж.),
диамагн., Kyci = IO31, в стр. -
столбики из квадратных анионов (dsp2)
M3INi(CN)5(H2O)I, красн.
Никелаты (IV)
M2NiO3, M = K, Ва/2,
черн., парамагн.
(Итфф = 2.1), в стр. -
колонки окт. с общ.
гранями,
+ H2O -
O2 + Ni(OH)2
M2S2O8-KM3H2IO6
M2NiF6, M = Na-Cs, Ва/2,
[O2], [XeF5], [NO], красн.,
диамагн., стр. тип K2PtCI6,
анион - окт. (</2.т>3), сильн.
фторагент ы
(+ Xe —► XeF2 + M3NiF6)
• Ni
О As
43
ФТОРИДЫ ИНЕРТНЫХ ГАЗОВ
2 +
6 +
KrF2 и XeF,, (п = 2, 4, 6) очень сильные окислители и фторагенты
(см. также табл. "Фторгиды галогенов”). Использование их,
как и TFn, в современном синтезе позволило получить новые классы
соединений в высших степенях окисления. Например:
XeF, + Ag+-. Ag"; + Со" — Со1"
+ BrO^ — BrOJ; XeF4 + Pt —> PtF4 + PtF6; + NH3 —. N2 + ... ;
Кислотность падает в ряду: XeF6 > XeF4 > XeF2
#Хе
О F
Локализованная
эл. пара
KrF2 (20°); F2 (-195°) изб.
XeF2, крист., бц., т. пл.
136, т. к. 338, АН = -176,
350° —+ Xe + XeF4.
Р. в H2O 0.15М (0°), хор.
р. в HFfae дис.); в стр. и г. -
линейные мол. (^-триг. бипир)
IXeFl + X', X = CIO4, NO,, CFjCOO,
SbF6, VF6, NbF6, TaF6, Ta2F11, MoF7,
PdF5, PtF6 (^-тетраэдр)
IXe2F3I + PFtI-,
Э = As, Sb, Ta, Au,
катион - угловой
F-
ч^Хе
ISOrTXes
F2 (300°, р)
XeF4, крист., бц., т. пл. 135, возг.,
АН = -251, р. в HF (не дис.),
мол. - квадрат (^-окт., Spi d2)
, />); (NiF2)J
IXeF3I + X', X = AsF6,
SbF6, [Sb2Fn], крист.,
желто-зел., катион -
Т-образный (^-триг.
бипир., Spi(I)
MIXeF5I, M = Na -Cs,
[NO], [R4N], анион - плоский
пятиугольник (^-пентаг.
бипир., Spi d1)
M2IXeF6I, M = Na-Cs, крист.,
бц., анион - окт.,
-U XeFn + MF + O2
XeF6, крист., бц., возг., т. пл. 49 (желт, ж.), т. к. 75 ,
АН = -338, взр.; + НР(ж.) —* [XeF5]+ + [HF2]';
Zjv —► XeF2 + XeF4 + ...; в г. - ^-семивершинник [!XeF6]
(sp^d*). В стр. - циклические тетрамеры и гексамеры
(в отношении 3:1), состоящие из [XeF5]+ и F-.
F5Xe+^!Ie^ XeFs4^ ^XeF5
Jp- + р-
I I
F5Xe+ +XeF5
/ ^F ^
F5Xe-F--XeF5
П| T t I
F5Xe^-F-XeF5
тетрамер
XeF5
гексамер +
IXeF5I + X-, IXe2F11I + X-,
X = BF4, Al2F7, GaF4,
ЭР6(Э = P-Sb, V-Ta
Pd, Pt); [:ХеР5]+ - ^-окт.,
[Xe2Fn]+ - 2 искаж. окт.
с общей вершиной
CsXeF7
M2XeF8, M = Na-Cs,
крист., желт., гигр., анион
квадратная антипризма
F2; BrF5; XeFjl (NiF2, NaF, к-ры) в р-ре BrF5
44
Tb. продукты
фторирования.
RnF., п = 4 или 6
IKr2F3I + PF6I ", Э = As, Sb, Nb,
Ta, U, Np, Pu, Au, Rh, Ru, Pt,
крист., бц.
1 25« (-Kr-F2)
IKrFI + PF6Ijr, крист., уст.
F2 (-188°, разряд; Лу-УФ)
H2O (^oI)
KrF2, крист., бц., возг. < 0, взр.,
разл. ~0, АН = + 22, окисл.
акт. > XeFn ( + NF3 - [NF4] + ),
р. в HF и BrF5; в стр. - слои
линейных мол.
ЭГп
ВАЛЕНТНЫЕ СОСТОЯНИЯ И КООРДИНАЦИОННЫЕ МНОГОГРАННИКИ ЦЕНТРАЛЬНОГО АТОМА
Число
эл.
пар
Валентное
состояние,
валентный
угол
К.Ч.
Пространственная
конфигурация
Примеры
Spy 180°
2
линейная
(гантель)
о—#—о
ВеГ2, Г = F-Hr.), CO2, N2O, [NO2] +
<1'° ZnCl2 (г.), HgCI2, [Ag(NH1)2] *
2
р\ 90°
2
угловая
H2S, H2Se
Sp1y 120°
120°
3
А
[СО,]2 , [NO,]-, SO,(г.), [FeO,]4
3
2
угловая
W-Tp-K)
• •
Ж
[NO2]', О,, SO2(г.), CIO2'
P3y 90°
3
триг.
пирамида
4Ьь
PH,. AsF,(г.)
sp**
^l 09° 28'
4
тетраэдр
А
CH4, [SiO4]4', [SO4]2', [CIO4] ,[AICI4] ,
Ni(CO)4, [Cu(CN)4]1'
Sp3y ^ 103°
3
триг.
пирамида
(^-тетраэдр)
• •
NH,, [H1O] + , SOCI2, [SO3]2\ [IO3]'
4
Sp3y « 103°
2
угловая
(^-тетраэдр)
H2O, OF2, SCI2, [CIF2]*, [ClO2]
Л, 109° 28'
4
тетраэдр
А
[VO4I1MCrO4]2-, [CrO4]' , [FeO4]2 ,
[MnO4]', [MnO4]2 , [MnO4]1'
dsp2, 90°
4
квадрат
Р<Г
CuO, [Ni(CN)4]2', [Au(OH)4]'
Число
эл.
пар
Валентное
состояние,
валентный
угол
к.ч.
Пространственная
конфигурация
Примеры
5
5/Л/,
120° (экв.),
90° (акс.)
5
триг. /
бипирамида
PF5 (г.), SOF4, [IO5]3
4
<
дисфеноид
(^-триг. бипир.) 0—4
(
<
)
[PBr4]", [SbF4]-, SF4, TeCl4, [FO2F2]",
IrF4]4, TOF3, XeO2F2 (2Р-акс), XeO3F
3
<
Т-образная
(^-триг. бипир.) 0—4
(
•
•
>
ClF3, BrF3, [XeF3]*
2
линейная « л
(^-триг. бипир.)
<
>
•
•
)
[ICl2IMr3]-, XeF2
6
Sp3J2, 90°
6
/Ж
октаэдр
[Mg(H2O)6I2t, [AIF6]1', [SiF6]2 , [PCI6] , SF6,
[IO6]5 ,[IF6]*,
[Mn(H2O)6]2*, [Fe(H2O)6]1*, [Cr(H2O)6]2*
[Fe(H2O)6]2 *, [CoF6]1', Fe(CO)5, [Co(NH1)6]21
5
тетраг. /JLk
пирамида Ч-
(ф-окт.)
[SF5] , TF5, [XeF5] *
4
квадрат
(ф-окт.)
[ICI4]*, XeF4
7
sp3/?
7
пентаг.
бипирамида СЬНР<^[
IF7
6
искаж. окт. Ли
(^-пентаг.
бипирамида)
[IF6]-, XeF6 (г.)
8
SP3S
8
антипризма
[XeF8]2-, [Ba(H2O)8]2*
45
Некоторые сведения о пространственном строении
(стереохимии) молекул и ионов.
В тексте таблиц при описании строения молекул и ионов
используется понятие гибридизации орбиталей (sp, sp2, sp3, SpiCi2 и
т.д.) Рассмотрим в качестве примеров молекулу CH4 и ион [NH4]+.
Из электронного строения следует, что в их образовании принимает
участие одна s- и три р-орбитали центральных атомов — ChN:
2 s
CH4, [NH4]+ Щ\
f — от 4 атомов H
(присутствие на схеме четырех электронов у атома N обусловлено
положительным зарядом на ионе аммония). Длина связи, образо¬
ванной с участием сферической в-орбитали должна отличаться от
трех других, осуществляемых с помощью эквивалентных рх, ру и
/>2-орбиталей, расположенных вдоль взаимно перпендикулярных
осей — х, у и Z. Между тем, экспериментально установлено, что в
обоих рассматриваемых примерах все 4 связи эквивалентны, как по
длине, так и по расположению в пространстве. Прямые, соединяю¬
щие 4 атома водорода (лиганда), образуют правильную треуголь¬
ную пирамиду — тетраэдр. Углы между отдельными связями С — H
или N — H (валентные углы С или N) составляют 109° 28'. Для
объяснения этого факта американский химик Jl. Полинг ввел понятие
гибридизации атомных орбиталей при образовании молекул или
ионов: приобретение 5-орбиталью частично р-харатера и наоборот. В
результате из одной s- и трех /7-атомных орбиталей образуются
четыре новых, идентичных по энергии, форме и расположению в
пространстве (максимально удаленных друг от друга), обозначаемых
как 5/?3-гибридные орбитали (см. рис.).
Аналогичным образом существование двух эквивалентных связей
под углом 180° в линейной молекуле MgCl2 (в газовой фазе)
свидетельствует о яр-гибридизации двух атомных орбиталей:
Is
MgCI2 Щ
45 f — от 2 атомов Cl
2P
Itl
2р
It It It
Для трех эквивалентных связей в треугольной молекуле ВС1з
реализуется зр2-гибридное состояние. При этом 3 атома Cl располо¬
жены в плоскости, а валентные углы центрального атома равны 120°:
25
BCl3 Щ
f — от 3 атомов Cl
Примерами двух последних типов гибридизации среди органи¬
ческих молекул могут служить углеводороды рядов ацетилена
RC = CR и этилена RHC = CHR.
В молекуле PFs 5 эквивалентных связей P—F, располагаясь
наиболее симметричным образом вокруг атома Р, образуют
тригональную бипирамиду. Углы F-P-F между тремя связями в
экваториальной плоскости составляют L FPF = 120°, а между каждой
из них и атомами F, расположенными на вертикальной оси
(аксиальными) составляют 90° (^/^/-гибридизация):
2р
It It
PF5
3 s
3P
3 d
Ifl IflIf
It
f — от 5 атомов F
Ионы [Mg(H2O)6]2 + или [SiF6]2- представляют собой правильные
четырехугольные (тетрагональные) бипирамиды — октаэдры, в
которых все 6 связей эквивалентны (з/Л^-гибридизация):
35 Ър 3 d
[Mg(H2O)6]2+
It It 1
It
It
Il — от 6 атомов О молекул H2O:
В образовании связей в соединениях переходных металлов
(^-элементов) участвуют внутренние ^-орбитали. Так, в октаэдри¬
ческом ионе [Cr(NH3)6]3+ связи Cr — NH3 образованы sp^d2-гибрид¬
ными орбиталями:
3 d 45 4р
[Cr(NH3)6]3 +
1
1
1
It
It
It It 1
If — от 6 атомов N молекул NH3
При этом три ^-электрона атома Cr остаются неспаренными, о
чем свидетельствует величина эффективного магнитного момента —
/*эфф. = 3.77 MB (магнетона Бора). Молекула IFv представляет собой
пятиугольную (пентагональную) бипирамиду, в которой осуществ¬
ляется я/Л^-гибридизация семи орбиталей:
35 3р Ъd
Щ
IF1
It It It
It
It
It
f — от 7 атомов F
Гибридизация орбиталей имеет место и в тех случаях, когда
максимальное координационное число центрального атома не
реализуются, а место отсутствующих лигандов занимают неподе-
ленные (локализованные) электронные пары, формально не участ¬
вующие в образовании связей. Примерами таких молекул могут
служить NH3, H2O:, TFn и XeFn (см. соответствующие таблицы).
Для описания строения этих соединений можно воспользоваться
"теорией взаимного отталкивания электронных пар", предложенной
канадским химиком Гиллеспи. Смысл ее состоит в том, что
поделенные и неподеленные пары электронов располагаются наибо¬
лее симметричным образом вокруг центрального атома таким
образом, чтобы их отталкивание было минимальным, т.е. на
максимальном удалении друг от друга.
В качестве примеров рассмотрим молекулы TF3 (Г = Cl, Br, I), они
содержат 7 электронов, принадлежавших центральным атомам, и по
одному от атомов F. Десять электронов образуют 5 пар, три из
которых относятся к связям Г—F, а два места в экваториальной
плоскости тригональной бипирамиды заняты неподеленными пара¬
ми. Таким образом образуется Т-образная молекула (незавершенная
тригональная бипирамида, \|/-бипирамида). Термин \|/- означает, что
часть вершин координационного многогранника занята неподелен¬
ными парами. Аналогичное рассмотрение молекул TFs, содержащих
7 + 5=12 валентных электронов, приводит к образованию тетраго¬
нальной пирамиды (^-октаэдру, одна из вершин которого занята
электронной парой). Ионы [FF2]+ (7 + 2 — 1 = 8) — угловые
(^-тетраэдр с двумя свободными парами), [FF4]- (7 + 4+1 = 12) —
квадрат (\|/-октаэдр с двумя свободными парами), [TF4]+
(7 + 4 - 1 = 10) — (\|/-тригональная бипирамида с одной свободной
парой), [TF6]- (7 + 6+1 = 14) — (\|/-семивершинник с одной свобод¬
ной парой).
Таким образом, рассматривая электронное строение центрально¬
го атома и лигандов и пользуясь представлениями о гибридизации
орбиталей, возможно во многих случаях предсказывать геометриче¬
ское строение молекул и ионов.
47
важнейшие типы кристаллических структур
Формула
Простые
вещества
Соединения
типа AX
Соединения
типа AX2
Cu
Ot-Fe
Mg
Bt2
Ctc - (алмаз)
Cnc - (графит)
Ptc - черн.
Se
I2
NaCI
CsCI
ZnS (сфалерит)
ZnS (вюртцит)
NiAs
CaC2
FeS2(пирит)
CaF2 (флюорит)
TiO2(рутил)
CdI2
8Ю2(кристобалит)
Тип решетки
куб. пл. упак.
куб. объемно-
центрированная
гексаг. пл. упак.
тетраг.
куб.
гексаг.
ромб.
ромб.
ромб.
куб.
куб.
куб.
гекса!.
гексаг.
тетраг.
куб.
куб.
тетраг.
гексаг.
куб.
К. Ч. и многогранник центрального атома
12, кубооктаэдр
8, куб
12, гексаг. аналог кубооктаэдра
5 (= 8-3), пентаг. пирамида
4 (= 8-4), тетраэдр
3, (тр-к) + 1
3 (= 8 -5), триг. пирамида
2( = 8 6),/SSSlOS
K= 8-7)
О. W
0 °
1 S
OO О
» о
• г;
ГГ Ж
ш
I/ л
SC CL
6, окт.
8, куб
4, тетраэдр
4, тетраэдр
6, окт.
10 и 2, тетраг. пирамиды,
сближенные основаниями
6, окт.
8, куб
6, окт.
6, окт.
4, тетраэдр
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК
Кубическая
а = Ь = с
л = р = у = 90°
Тетрагональная
а = b ф с
Oi = P = у = 90°
Ромбическая
афЬф с
X = Ii = У = 90'
Моноклинная
<* фЬф с
я = р = 90°
у ф 90°
Триклинная
а ф b ф с
*ф P фу ф 90°
Гексагональная
а = b ф с
Cu
Ot-Fe
»12
С алмаз
P черн.
NaCl
CsCl
ZnS сфалерит
ZnS вюртцит
NiAs
CaC2
FeS2
CaF2
TiO2
CdI2
SiO2
• — центральный атом, о — лиганд (Г, S, С, As), О— О
48