Текст
VSEVOLOD KARNOJITZKI
LES PEROXYDES
ORGANIQUES
II E R M ANN
e, RUE DI: I A SORBONNE, [’ARIS V
В. КАРНОЖИЦКИЙ
ОРГАНИЧЕСКИЕ
ПЕРЕКИСИ
Л-
Ch
ПЕРЕВОД С ФРАНЦУЗСКОГО
М. А, ВИНОГРАДОВОЙ
ПОД РЕДАКЦИЕЙ
АКАДЕМИКА
А. II. НЕСМЕЯНОВА
ИЗДАТЕЛЬСТВО ИНОСТРАННОЙ ЛИТЕРАТУРЫ
Москва 1961
В книге .собран материал по важнейшим орга-
ническим перекисям. Рассматриваются методы
синтеза перекисей, их физические и химические
свойства, а также применение в органическом
синтезе для инициирования различных свободно-
радикальных реакций, реакций окисления и др.
Книга представляет интерес для широкого
круга работников научно-исследовательских ин-
ститутов и промышленных предприятий.
Редакция литературы по химии
ПРЕДИСЛОВИЕ
Со времени классических исследований Баха органи-
ческие перекиси стали известны как важнейшие метабо-
литы. Перекиси различных типов находят все большее
промышленное применение как инициаторы полимери-
зации, как промежуточные продукты в синтезе фенолов
и ацетона, в вулканизации каучуков. Перекиси широко
используются в лабораторных исследованиях как веще-
ства, легко генерирующие свободные радикалы. Все это
иызывает в и а стоящее время усиленный интерес к этим
нестойким в подчас опасным в обращении вследствие
их взрывчатости веществам.
Посвященная перекисям монография Карножццкого
(Париж, 1958), несмотря на свои недостатки, будет по-
лезной для советского химика: она достаточно полно
охватывает предмет с точки зрения описания многочис-
ленных органических перекисей, их свойств, типов и
способов получения. Применение перекисей изложено
более поверхностно, скорее в плане их промышленного
использования. Многочисленные интереснейшие реакции
с участием перекисей, такие, например, как присоеди-
нение к олефинам бромистого водорода и меркаптанов
(работы Караша), как синтез ртутнооргагшческих со-
единений (работы Разуваева), как цис-транс-изомериза-
ции под действием следов перекиси и т. д., не нашли от-
ражения в дайной монографии. Что касается биохими-
ческих работ по перекисям, то автор лишь упоминает
о них. К недостаткам книги относятся многочисленные
небрежности, которые мы старались исправить в пере-
воде, частые повторения, излишне обильные иллюстра-
ции структурными формулами простейших реакций и
соединений, а также отсутствие в некоторых случаях
6
Предисловие
в тексте ссылок на литературу, приведенную в конце
каждой главы.
Тем не менее описание в одном труде всех многочис-
ленных типов органических перекисей вплоть до отдель-
ных представителей этого класса, их родственных свя-
зей, взаимопревращений и реакций, несомненно, создает
полную картину этих органических производных пере-
киси водорода,
А. Несмеянов
ГЛАВА I
ХИМИЧЕСКАЯ КЛАССИФИКАЦИЯ
ВВЕДЕНИЕ
Органические перекиси приобретают все большее зна-
чение в полимеризации — основной операции при произ-
водстве синтетических высокомолекулярных соединений.
С образованием перекисей равным образом связан
и. ряд других технологически очень важных проблем,
таких, как старение каучука, высыхание масляных кра-
сок, лаков, сиккативизация масел, осмоление топлива.
Наконец, с теоретической точки зрения образование
перекисей тесно переплетается с общим процессом авто-
окислспия.
Несмотря на то, что существует обширная библиогра-
фия, посвященная получению и свойствам очень боль-
шого числа органических перекисей, однако до на-
стоящего времени имеется очень мало обобщающих ста-
тей и монографий. Среди них упомянем:
Перекиси алкилов и озониды, Рихе (Дрезден, 1931).
Органические перекиси, т. 1, Губен —Вейль (Штут-
гарт, 1953).
Органические перекиси, Марк. Месробиэм и Тобаль-
ский (Нью-Йорк, 1954).
В обеих упомянутых выше работах немецких авто-
ров не обсуждается вопрос о разложении органических
перекисей па свободные радикалы и их образование не
связывается с общей теорией автоокнеления углеводо-
родов, между тем как в монографии американских авто-
ров подчеркивается главным образом их разложение на
свободные радикалы и механизм винильной полимериза-
ции. Вот почему не. будет, по-видимому, лишен интереса
обобщающий труд на французском языке, посвященный
органическим перекисям и их разнообразному примене-
нию, в котором также рассмотрен механизм их образо-
вания в процессе автоокисления углеводородов.
8
Органические перекиси
Перекисью называют любое химическое соединение,
молекула которого содержит два непосредственно свя-
занных между собой атома кислорода.
В настоящее время известно очень большое число
перекисей.
Это продукты твердые или жидкие, более или менее
взрывчатые при обычной температуре (кроме диметил-
нерекиси, которая газообразна), Способность к взрыву
отдельных перекисей иногда очень различается; так, пе-
рекись диметилкетена
нд\
ХС-С-О
H3CZ | |
0—0
взрывает уже при температуре —80°, в то время как
перекись гексафенилэтана плавится без разложения
при 185°.
Принимая во внимание большое количество переки-
сей и разнообразие их свойств, необходима классифика-
ция для их изучения,
В настоящей книге принята классификация переки-
сей по их химической функции.
ХИМИЧЕСКАЯ КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ
перекисей
Органические перекиси можно разделить на девять
групп.
I. Гидроперекиси алкилов с общей формулой ROOH,
которые можно рассматривать как производные пере-
киси водорода НООИ, один атом водорода которой за-
мешен па алкильную группу R.
2. Перекиси алкилов (диалкилперекисн) с общей фор-
мулой ROOR7, которые можно рассматривать как произ-
водные перекиси водорода НООН, полученные замеще-
нием двух атомов водорода па две одинаковые или раз-
ные алкильные группы; они могут также рассматриваться
как простые эфиры гидроперекиси ROOH и спирта
R'OH.
Химическая классификация
3. Г идроперекисн ацилов (надкислоты) с общей фор-
мулой
R—С—О—ОН
II
О
отличающиеся от кислот наличием дополнительного ато-
ма кислорода, расположенного между атомом углерода
и гидроксильной группой.
4. Эфиры гидроперекисей ацилов (перэфиры) с об-
щей формулой
R—С—О—OR'
II
О
которые можно рассматривать с точки зрения струк-
туры как сложные эфиры надкислот.
5. Перекисные производные одноосновных кислот
(или перекиси ацилов) с общей формулой
О
II
R-С—О
I
R— С—О
I
О
(с R одинаковым или отличным от R'), которые можно
рассматривать как смешанные ангидриды кислоты и гид-
роперекиси ацилов,
6. Перекисные производные двухосновных кислот,
разделяющиеся в свою очередь на две подгруппы:
а) пероксиди к и ел оты с общей формулой
О
II
НО - С-(СН2)„—С—О-О—С-4СНг)л — С—он
II I II
ООО
б) циклические перекиси с общей формулой
О—С—(СНХ—С—О
I I
О----—д-0
10
Органические перекиси
7, Перекисные производные альдегидов и кетонов,
включающие монооксигидроперокиси, монооксиперекиси,
диоксиперекиси, диперскиси и триперекиси.
8. Эндоперекиси, обладающие двумя атомами кисло-
рода, непосредственно связанными в цикле.
9. Озониды с общей формулой
которые можно рассматривать как внутренние простые
эфиры диоксппсрскиси.
ИЗОМЕРИЯ В РЯДУ ОРГАНИЧЕСКИХ ПЕРЕКИСЕЙ
Перекись, принадлежащая к некоторому данному
типу, может быть изомерной (не говоря об изомерии
положения и цепи между перекисями одного и того же
типа) перекиси другого типа или веществу, обладающе-
му иной функцией, чем функция перекиси.
Таким образом, гидроперекиси алкилов изомерны, с
одной стороны, перекисям алкилов и, с другой, — глико-
лям и их простым эфирам', изомерами гидроперекисей
ацилов являются эфиры этого класса и оксикислоты. Пе-
рекиси ацилов изомерны с двухосновными кислотами и
их сложными эфирами.
ГЛАВА II
ГИДРОПЕРЕКИСИ АЛКИЛОВ
ОЬЩИЕ МЕТОДЫ СИНТЕЗА
Замечание. Для выделения гидроперекисей алки-
лов часто используют их свойство образовывать с рас-
творами щелочей растворимые в воде щелочные соли.
Существует два основных способа синтеза гидропере-
кисей, в которых в качестве окислительных реагентов
используют соответственно перекись водорода и кисло-
род.
СПОСОБЫ С ИСПОЛЬЗОВАНИЕМ Н.О,
1. Действие 10—30 %-ной НаСЪ на диалкил сульфаты
в щелочной среде
Этот метод применим лишь к первым членам ряда
алифатических гидроперекисей; он непригоден для выс-
ших членов этого ряда (вследствие дегидратации образо-
вавшейся в реакционной смеси гидроперекиси алкила в
альдегид или кетон) так же, как и для гидроперекисей,
содержащих арильные группы (действие серной кислоты
па ароматический спирт не дает алкилсульфата, а при-
водит к дегидратации с образованием этиленового про-
изводного) .
Реакция протекает по уравнению
OR OR
o=i OR4-HOOH —> OH-t-ROOH
II ||
о о
Следует избегать избытка щелочи, которая способ-
ствует разложению гидроперекиси: щелочной раствор
(как правило, 40%-ный КОН) вливают по каплям
в смесь перекиси водорода и диалкил сульфата, сильно
12
Органические перекиси
перемешивая и строго следя за температурой реакционной
массы. Берут избыток П2ОИ (порядка 50%), чтобы умень-
шить образование перекисей алкила.
В случае гидроперекисей с третичным радикалом
можно исходить из кислого эфира серной кислоты и тре-
тичного спирта (который можно приготовить в ходе
опыта действием 70%-ной серной кислотой при темпера-
туре 0—5е* на соответствующий третичный! спирт).
2. Действие 30 %-ной Н2О2 на алкилметилсульфо-
наты [1]
Этот метод применяют, как правило, к алифатиче-
ским гидроперекисям, значительное число которых было
получено именно таким способом.
Он состоит в действии 30 %-ной Н2О2 при комнатной!
температуре на алкилмстилсульфонаты в среде водного
метилового спирта, согласно уравнению
НаС—SO3R + НООН —> Н3С—SO3H+ ROOH.
В свою очередь ал кил метил сульфонаты образуются
при действии метилсульфохлорида на спирт в присут-
ствии пиридина [1а]
О О
II II
1ЦС—S—CI + HOR —► Н3С—S-OR+HC1
Il II
О о
а) Синтез алкилметилсульфонатов (табл. 1). В охла-
жденную льдом и энергично перемешиваемую смесь
0,2 моля метилсульфохлорида и 0,2 моля спирта при-
бавляют по каплям 0,4 моля пиридина в течение 3—
5 час.
После введения всего пиридина перемешивание про-
должают еще 15 мин. Полученную таким образом смесь
вливают в 125 мл 10%-ной соляной кислоты, охлажден-
ной льдом.
Образовавшийся метилсульфонат извлекают 75 мл
эфира. Эфирный раствор промывают водой, затем рас-
твором NaHCOa. Высушивают над безводным поташом.
Гидроперекиси алкилов
!3
Таблица 7
Нормальные метилсульфонаты [1]
М ст ил су д1тф о к ат Т, кнгг,т ’•С/млс Т, пл., fc ПгйХад, %
Пропил 110/20 1,4228 83
Рутил 77—79/2 1,4265 82
Амил 67/1 1,4304 84
Гексил 78/1 1,4336 72
Гептил 02/1,5 1,4364 82
Октил 98/1,5 1,4392 81
Нонил 99/0,3 G—7 1,4403 67
Децил 120—122/0,5 16—17 1,4432 68
б) Синтез гидроперекисей (табл. 2). Смесь метанола,
50%-ного КОН, метилсульфоната и Н2О, выдерживают
при температуре 25 -27" в течение времени, зависящего
от молекулярного шта R: 20 час. для пропила и 40 час.
для бутила.
Таблица 2
Нормальные гидроперекиси [1J, получаемые действием НгО3
на алкнлметилсульфоцаты
Галропсрекись Т. Kttn., СС/.«4< Т. пл., °C Плотность Выход,
Бутил 40—42/8 0,907 1,4057 42
Л мил 41—42/4 0,897 1,4146 43
Гексил 42—43/2 0,891 1,4208 44
Гептил 46—47/0,5 — 37 0,884 1,4265 38
Октил 54—55/0,7 — 33 0.881 1,4311 38
Нонил 55—55/0,3 :1 ---20 0,878 1,4330 39
Децил 61-63/0,3 — 8 0,871 1,4378 45
а Так в подлиннике. — Прим. ред.
Образовавшуюся гидроперекись выделяют экстрак-
цией бензолом. Затем бензольные вытяжки обрабаты-
вают 20%-ным КОН (чтобы превратить гидроперекись
14
Органические перекиси
в калиевую соль). Потом снова нейтрализуют холод-
ной соляной кислотой (для выделения гидроперекиси).
Гидроперекись экстрагируют бензолом, который за-
тем удаляют перегонкой под уменьшенным давлением.
3. Синтез гидроперекисей действием 90 %-ной пере-
кисью водорода на третичные спирты [2а,б] (табл. 3)
Этот метод применим только к гидроперекисям
с третичным радикалом (независимо от характера ал-
кильной группы — алифатической или ароматической).
Сущность этого метода состоит в обработке соответ-
ствующего третичного спирта при температуре около 0°
небольшим избытком 90%-ной Н2О2 в присутствии 1%
(относительно Н2О2) концентрированной серной кислоты.
Продолжительность операции составляет примерно
24 часа.
Образовавшуюся гидроперекись извлекают из реак-
ционной смеси петролейным эфиром, который промывают
до нейтральной реакции раствором карбоната натрия и
удаляют затем под уменьшенным давлением.
Наличие арильных групп 'значительно упрощает окис-
ление третичного спирта в гидроперекись (возрастает
подвижность гидроксильной группы); так, ксантгидрол
образует гидроперекись при действии 30%-ной Н2О2
в отсутствие серной КИСЛОТЫ.
СПОСОБЫ С ИСПОЛЬЗОВАНИЕМ КИСЛОРОДА
1. Действие кислорода на углеводороды (табл. 4)
Этот способ используют главным образом для полу-
чения гидроперекисей, содержащих один или несколько
ароматических радикалов, наличие которых обеспечи-
вает большую подвижность водорода углеводорода и
облегчает окисление последнего.
Синтез. Окисление можно проводить либо в гомоген-
ной среде (углеводород как таковой пли растворенный
в органическом устойчивом к окислению растворителе),
либо в водной эмульсии в присутствии мыла; скорость
окисления возрастает с повышением температуры, так же
Таблица 3
Гидроперекиси с третичным радикалом [2а, 2б[, полученные
действием 90%-ной Н2О2 на третичные спирты
Гидроперекись Формула Т, лл>, °C Т, кип.»
Триэтилметил Н5СЙЧ^ НБС2—С—ООН Н8с/ 71—73/17
Пентаметилэтил сн3 Н3СХ | Н3С—С—С—ООН НзС/ 1 3 сн3 113—114
Тетрамстплттпл СНз )СН -С—ООН H3CZ 1 сна 51—58/12
Трифепилмстил CBHsx C3HS—С—ООН С6н/ 135
Ксантгпдрол ООН 123—124
I1 |! II 1 \/\/\^
1-Метилциклогс- ксенил Н3СХ/ООН 87—88/12
1-Этилциклогс- ксепил Н3С2х/ООН О1 100/12
16
Органические перекиси
Продолжение табл, 3
Гидроперекись Формула
Т. 1гл._ "С
Т. кип.,
° С/л.к
2, 5-Гидронерокси-
2,5-диметилгексил
СН3
НаС, !
>С—(СН2)2—С—ООН
I I
ООН СНз
104--105
2, 7-Гидропсроцси- СН:[
2,7-диметилоктил Н3СЧ I
>С-(СН2),—С—ООН
НаС/ I I
[ ООН CHj
как и при облучении (особенно ультрафиолетовыми
лучами). Гидроперекись выделяют из реакционной смеси
действием водных растворов щелочей,
2. Действие кислорода на магнийорганические
соединения [16] (табл. 5 и 6)
Эта реакция наиболее широкого значения приме-
няется для получения всех типов гидроперекисей.
Тем не менее для первых членов ряда выходы низки.
Медленное добавление при —75° магпийорганичс-
ского соединения RMgX к насыщенному кислородом
эфиру дает вещество ROOMgX, которое в результате
гидролиза образует гидроперекись ROOH.
Выход гидроперекиси зависит от:
а) природы галоида X (выход для хлорида больше,
чем для других галоидопроизводных);
б) характера алкильной группы R (выход повышается
с возрастанием молекулярного веса R);
в) температуры (выход увеличивается с понижением
температуры);
г) скорости прибавления (выход тем больше, чем
меньше скорость прибавления).
2 Зак. 19Й.
Продолжение табл. 4
Гидроперекись Формула Условия получения Основные свойства Лите- ратура
Тетралина Метилтетр а лип а Дигидроиндепа Флуорена Тетрагидрокарбазоаа ООН 1 z?\/\ . il i W\/ H3CX/OOH z?\/\ 1 II 1 \/\/ Z-Xj \/\/ 1 ООН /X /V. 1 II II 1 \/\/w 1 ООН ноо /\ 1 1 i \/\к/ н Ток воздуха в при- сутствии цинка при 70—80= Ток О2, 35—45" в те- чение 100 час. Ток О2, 70° в тече- ние 30 дней Ток О2 в бензольном растворе, 70° в те- чение 30 час. Охлаждение бензоль- ного раствора на воздухе Крупные кристаллы, т. пл. 53—54°. Взры- вает при повыше- нии температуры Бесцветное вязкое масло, плотность 1,11 Бесцветное масло, т. кип. 74—75"/0,04 мм, т. разл. 140° Желтые иголочки, т. пл, 93 Бесцветные пластин- ки. т. разл, 120° ба, б 7 8 9
Октагидроантрацена ООН ^\/\/\ II 1 \/\/\/ Ток Ог, 75° в тече- ние 12 час. Бесцветные пластин- ки, взрывает при 160’, т. пл. 88= 10
Дифепилэтана Фенилизобут апа С6нь< )С—сн3 свн/ 1 ООН снэ 1 НВС—СН2—С—ООН Ток О2, 65—70’ Ток О2, водная эмульсия Твердое вещество, т, пл. 82’ Т, кип. 5870,01 мм, п™ 1,5206 11 12
Циклогексена 1 c6Hs ООН 0 Ток О2, УФ, 30—35° в течение 14 час. Жидкость с резким запахом, плотность 1,058, т. кип. 51°/0,3 мм 13а, б, в
я-Гексена Н3С—(CHj)s—сн-сн 1 1! оонсн2 Ток О2 в течение 200 час, Т. кип. 35°/0,2 мм, df 0,9527; 1,459 14
2-Мет и л пентена С1-[э 1 Т. кип, 30—31"/0,б мм 14
НЭС—(СНг)2—с—сн-сн2 1
Тетрагпдрофурана ООН (J-OOH о Ток О2, 50’ в тече- ние 48 час. Жидкость, т. пл. —5°, т, кип. 53—5б’/1 мм, d® 1,118 15
26
Органические перекиси
Таблица 5
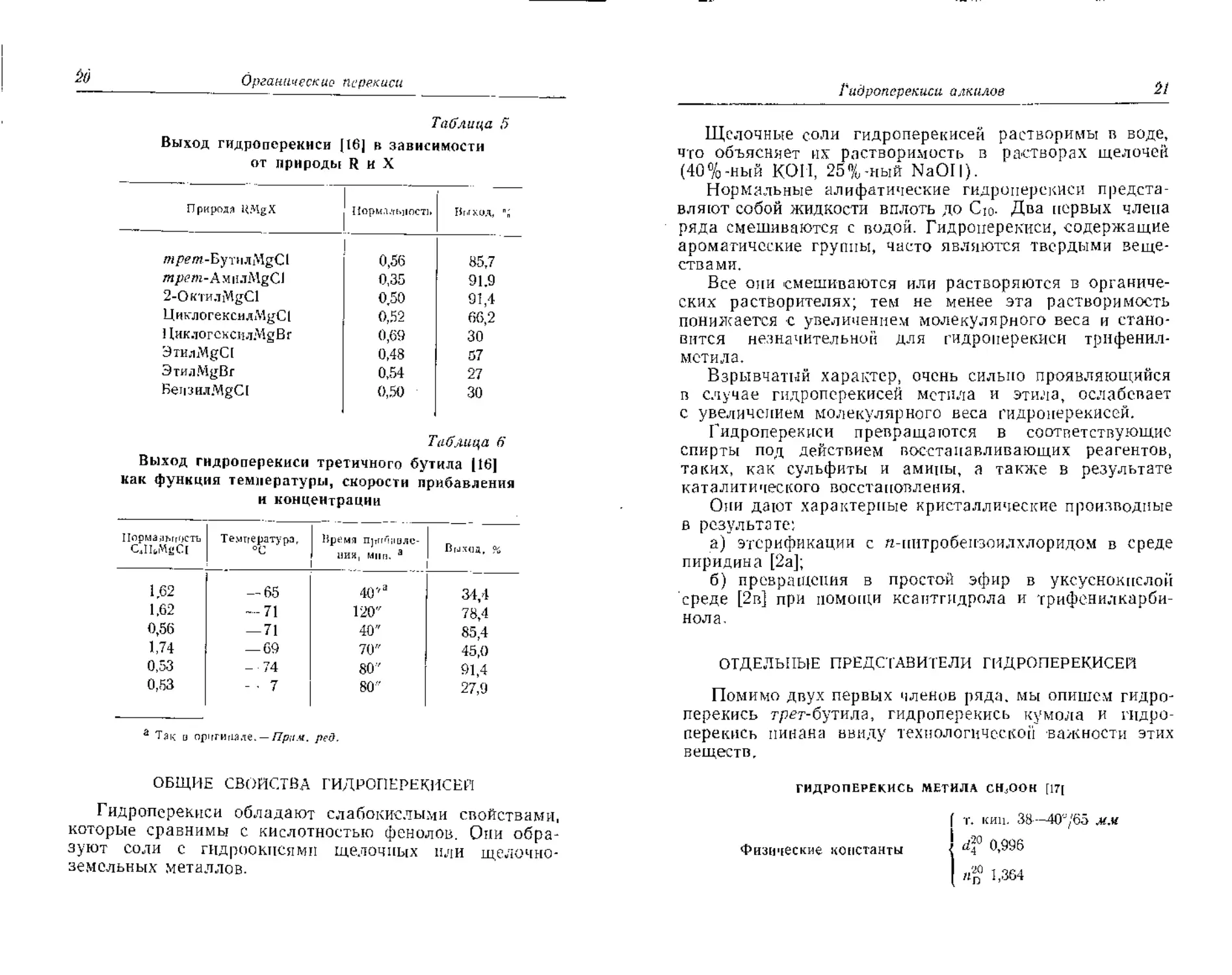
Выход гидроперекиси (16] в зависимости
от природы R и X
Природа UMgX liapM.Ufujincii» Ныхил, %
mpem-ByTiiaMgCl 0,56 85,7
m/wm-AMii.iMgC.l 0,35 91,9
2-ОктилМ£С1 0.50 91,4
ЦнклогексилМуС! 0,52 66,2
11ик.тогсксилМ§Вг 0,69 30
3TH.iMgC( 0,48 57
ЭтилМцВг 0,54 27
Беи 'Jiia.MgCl 0,50 30
Таблица б
Выход гидроперекиси третичного бутила |16]
как функция температуры, скорости прибавления
и концентрации
Нормальность С4ПьМйС[ Температура, °C Время пргтпиле- ния, МНИ, а Вых(]д, %
1,62 - 65 40',а 34,4
1,62 -71 120" 78,4
0,56 — 71 40" 85,4
1,74 — 69 70" 45,0
0,53 - 74 80" 91,4
0,53 - 7 80" 27,9
а Так u opi гги ал ле. — Прим. per).
ОБЩИЕ СВОЙСТВА ГИДРОПЕРЕКИСЕЙ
Гидроперекиси обладают слабокислыми свойствами,
которые сравнимы с кислотностью фенолов. Они обра-
зуют соли с гидроокисями щелочных или щелочно-
земельных металлов.
Гидроперекиси, алкилов
21
Щелочные соли гидроперекисей растворимы в воде,
что объясняет ид растворимость в растворах щелочей
(40%-ный КОИ, 25%-ный NaOIl).
Нормальные алифатические гидроперекиси предста-
вляют собой жидкости вплоть до Сю- Два первых члепа
ряда смешиваются с водой. Гидроперекиси, содержащие
ароматические группы, часто являются твердыми веще-
ствами.
Все они смешиваются или растворяются в органиче-
ских растворителях; тем не менее эта растворимость
понижается с увеличением молекулярного веса и стано-
вится незначительной для гидроперекиси трнфенил-
мстила.
Взрывчатый характер, очень сильно проявляющийся
в случае гидроперекисей метила и этила, ослабевает
с увеличением молекулярного веса гидроперекисей.
Гидроперекиси превращаются в соответствующие
спирты под действием восстанавливающих реагентов,
таких, как сульфиты и амины, а также в результате
каталитического восстановления.
Они дают характерные кристаллические производные
в результате:
а) этерификации с п-питробепзоилхлоридом в среде
пиридина [2а];
б) превращения в простой эфир в уксуснокислой
среде [2в] при помощи ксантгидрола и трифснилкарби-
нола.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ГИДРОПЕРЕКИСЕЙ
Помимо двух первых членов ряда, мы опишем гидро-
перекись трет-бутила, гидроперекись кумола и гидро-
перекись пинана ввиду технологической важности этих
веществ.
ГИДРОПЕРЕКИСЬ МЕТИЛА CHjOOH fl7[
Физические константы
т. кин. 38—40'765 мм
df 0,996
1,364
22
Органические перекиси
Синтез
К энергично перемешиваемой смеси 400 мл (1,32 мо-
ля) 10 %-ной Н2Оа и 100 г (0,795 моля) днметилсуль-
фата в течение 20 мин, прибавляют по каплям 210 г
40%-цого раствора КОН,
Поддерживая температуру массы 22—25°, нейтрали-
зуют ее 50 %-пой H2SO4, охлажденной до 0°. Гидропе-
рекись выделяют фракционированием под уменьшенным
давлением.
Свойства
Вещество очень взрывчато, чувствительно к толчкам
и особенно к нагреванию, смешивается с водой и с орга-
ническими растворителями. Его бариевая соль в сухом
виде также очень взрывчата.
ГИДРОПЕРЕКИСЬ ЭТИЛА П,ССН2ООН [IS]
Синтез
К энергично перемешиваемой смеси 100 г (2/3 моля)
диэтилсульфата и 340 г (1 моль) 10%-ной Н2О2 вли-
вают по каплям 345 г 42 % -кого раствора КОН в течение
2—3 час. Смесь осторожно нейтрализуют разбавленной
серной кислотой. Образовавшуюся гидроперекись извле-
кают из реакционной смеси выливанием в (NIL^SOi.
В чистом виде ее получают фракционированием под
уменьшенным давлением.
Свойства
Более устойчивая, чем гидроперекись метила, она
тем не менее сильно взрывает при нагревании. Смеши-
вается с водой и с органическими растворителями. Ее
бариевая соль (образующаяся действием гидроперекиси
па барит и удалением воды под уменьшенным дапле-
Гидроперекиси алкилов
23
пием) в сухом виде чувствительна к нагреванию и толч-
кам.
ГИДРОПЕРЕКИСЬ ТР£Г-БУТИЛА [|9]
Н3СЧ
Н3С—СО ОН
Нзс/
46е/30 мм
37е/18 мм
Т. кип. ____
35/17 мм
5г/2 мм
Физические константы 0,896
1,4013
. т. пл. — 4°, — 5
Ил многочисленных методов, пригодных для получе-
ния гидроперекиси трет-бутила, так же как и всех дру-
гих гидроперекисей этой группы (действие 90%-нои
1ЬОг па третичный бутиловый спирт и т. д.), изложим
подробно метод Майя аса и Сурджснора [19] ввиду его
удобства для работы в лабораторных условиях.
Этот способ включает три фазы:
а) синтез кислого трет-бутилового эфира серной
кислоты действием 70%-ной II2SO4 на (СН3)3СОН
О о
Н3СХ || Н3СХ ,|
Н3С—С—ОН+ НО— S-OI1 —> Н3С—С—О —S—OH-1-112О
н,с/ 1 н,с/ о
б) синтез гидроперекиси действием 30 %-ной на
кислый трет-бутиловый эфир серной кислоты
о о
f । 1II
Н,С—С —О — S—ОН -I I1OOH —> НЙС—С-ООН-г HO^S—он
Н3с/ Нас/ II
в) разделение гидроперекиси и перекиси трет-бутила
(последняя образуется одновременно) фракционирова-
нием иод уменьшенным давлением,
24
Органические перекиси
Синтез кислого трет-бутилового эфира серной кисло-
ты*. При энергичном перемешивании к 140 г (1 моль)
70%-ной H2SO4 прибавляют по каплям 74 г (1 моль)
трцт-бутилового спирта, поддерживая температуру мас-
сы 0—5° (чтобы не допустить дегидратации трет-бутило-
вого спирта в изобутилен).
Синтез смеси гидроперекиси и перекиси трет-бутила.
К полученному перед этим кислому трРг-бутилсульфату
прибавляют, перемешивая, 126 г (1 моль) 27 %-ной Н2С>2,
причем продолжительность прибавления составляет
примерно 30 мин.
Температура реакционной массы должна быть в пре-
делах от 0 до 5° (чтобы избежать разложения гидро-
перекиси) .
После прекращения охлаждения смеси дают постоять
при комнатной температуре в течение приблизительно
15 час.
Происходит разделение на два слоя.
Верхний слой (слой перекисей) снимают, промывают
несколько раз водой, а затем суспензией карбоната маг-
ния до полной нейтральности водного слоя. Совершенно
необходимо удалить даже следы серной кислоты (кото-
рая образуется при взаимодействии Н2О2 и трет-бутпл-
сульфата), иначе есть опасность разложения перекиси
при перетопке.
Выход сырого продукта составляет 70 г, содержащих
66% гидроперекиси трет-бутила и 33% перекиси трет-
бутила.
Фракционирование смеси. Фракционирование прово-
дят под уменьшенным давлением; перекись трет-бутила
перегоняется первой (т. кип. 12—13720 мм), а гидро-
перекись— при 53/2 мм и при 35718 мм.
Из осторожности не следует, чтобы температура бани
превышала 60ч
Свойства и применение. Жидкость с характерным
резким запахом, не смешивающаяся с водой, по смеши-
вающаяся с органическими растворителями. При комнат-
ной температуре не взрывчата,
* Рубрикация неправлена по сравнению с подлинником. — Прим,
ред.
Гидроперекиси алкиЛдв
25
Гидроперекись трет-бутила используется как
а) инициатор винилыюй полимеризации;
б) вещество, ускоряющее сгорание топлив в двига-
телях Дизеля.
ГИДРОПЕРЕКИСЬ КУМОЛА [20a, 6J
с6н5х
Н3С-С—ООН
н3с/
Физические константы
1 г. кип.
{ 4° 1,524
| d® 1,062
Г КГ/ОД мм
I 6070,2 мм
Синтез
Гидроперекись кумола получается прямым окисле-
нием изопропилбензола кислородом (который в свою
очередь образуется при действии пропилена на бензол).
Окисление протекает при 85° в водной эмульсии при
pH 8,5—10,5.
В качестве эмульгатора можно использовать стеа-
рат натрия или теепол, варьирование концентрации ко-
торых (стеарат натрия между 0,09 и 0,35%, теепол ме-
жду 0,2 и 2,5%) не оказало заметного изменения на
скорость окисления (она несколько выше для стеарата,
чем для теепола).
В начале реакции выход гидроперекиси количествен-
ный, считая на поглощенный кислород, по уже при до-
стижении концентрации гидроперекиси 20% выход со-
ставляет всего лишь 90%.
Отделение гидроперекиси от реакционной смеси про-
водят следующим образом.
1. Отделение органического слоя декантацией.
2. Повторные обработки 25%-иым NaOH для того,
чтобы выделить гидроперекись в виде щелочной соли,
растворимой в воде.
3. Снова декантация.
4. Выделение гидроперекиси током СО2.
5. Отделение органического слоя, промывание и
высушивание.
26
Органические перекиси
Свойства
Бесцветная жидкость, легко смешивающаяся с орга-
ническими растворителями. Устойчива при обычной
температуре, изрывает только при температуре
около 170°.
Употребление
Гидроперекись кумола широко используется при хо-
лодной полимеризации (редокс-система) и особенно при
полимеризации каучука CRS. Это также промежуточ-
ный продукт при изготовлении фенола и ацетона но
способу фирмы «Рон-пулен», исходя из бензола и про-
пилена.
ГИДРОПЕРЕКИСЬ ПИНАНА .21», б. в]
f df 1,019
Физические константы { 1,4395
Удельное вращение —21,8е
Синтез
Сущность получения этой гидроперекиси состоит
в окислении /-пинана кислородом при температуре 90—
110° и в удалении перегонкой исокислснного угле-
водорода.
/-Пинан получается каталитическим гидрированием
(3-пинена, который в свою очередь образуется ректифи-
кацией живицы американской сосны на колонне в сто
тарелок.
Гидроперекаси алкилов
27
Существуют два варианта этого синтеза.
Вариант 1. В 2-литровый сосуд, снабженный тер-
мометром и мощным обратным холодильником с насад-
кой Дина и Старка, вводят 1008 г (7,25 моля) /-пинана.
Температуру жидкости повышают до 120°, затем пропу-
скают кислород пузырьками так, чтобы температура ре-
акционной массы была примерно 110°. При этом реак-
ция продолжается 4,5 часа. Избыток пинана удаляют
перегонкой до тех пор, пока температура вверху ко-
лонки не достигнет 80°.
Выход составляет 72%.
Вариант 2. Окисляют 218 г (1,58 моля) /-пинана
током кислорода в течение 20 час. при 95°.
Полученный таким образом сырой продукт окисле-
ния весит 220 а и содержит 74% гидроперекиси. В ре-
зультате отгонки с водяным паром при 1 ,и,и при темпе-
ратуре, не превышающей 65°, получают остаток 122 г
в виде бесцветной жидкости, почти целиком состоящей
из чистой гидроперекиси (df 1,018, 1,4884). Для
получения гидроперекиси в совершенно чистом виде
необходимо перевести ее натриевую соль, а затем опять
в гидроперекись.
Свойства и применение
Гидроперекись пинана при обычной температуре
очень устойчива, опа начинает разлагаться только со
120° и бурно разлагается со 140°.
Как и гидроперекись кумола, она используется при
эмульсионной редокс-полимеризацип при низкой темпе-
ратуре.
Такое использование тем более интересно, что исход-
ное сырье доступно, а выход гидроперекиси высок.
ЛИТЕРАТУРА
I. Williams II., Mosher W.r J. Ahi. Chem. Soc., 76, 2984 (1954).
2 ') Cricgce R., Dietrich W., Ann. Sherri., 530, 130 (1948).
3. Davies A., Foster V., White. Й., J. Chcm. Soc., 1954, 2200.
!) Некоторые ця приводимых лиссратурщнк мсточинкоп не имеют соответ*
ггьующей ссылки в тексте и отц-осятся к глйею и целом. Прим. /.ч’д.
28
Органические перекиси
3. Hock Н., Lang S., Вег., 76, 169 (1943).
4. Hock Н., Lang S:, Вег.. 77, 257 (1944).
5. Helberger H., Fcttbach H., Вег., 72, 1643 (1939).
6а. Hock Н„ Susemihl W, Вег, 66, 61 (1933).
66. Hartmann М., Seibert М., Hclv. Chim. Acta, 15 1390
(1932). ’
7. Hock H., Depke E, Ber, 83, 238 (I960).
8. Hock IL, Lang S., Ber., 75, 1055 (1942),
9. Hock FL, Lang S., Ber., 83, 227 (1950).
10. Hock FL, Lang S., Ber., 76, 1131 (1943).
11. Юрченко T., T о л о п к о Д., Пущин В., ДАН, 74, 85 (1950),
12. Иванов К., Савина В., ДАН, 50. 493 (1948).
13а. Stephens Н., J. An;. С hem. Soc., 50, 568 (1928).
136. Criegee R., P i I г II.. Ber., 72, 1799 (1939).
13a. Farmer E., S u n d r a I i n g li a in A., J. Chem. Soc., 1942, 121.
14. Hock FL, Neuwirth A., Ber., 72, 1562 (1939).
15. Robertson A., Nature (London), 1948, 153.
16. Walling C., Buckler S., J. Am. Chem. Soc., 75, 4372 (1953).
17. Bayer A., V i 1 1 i g e г V., Ber., 62, 2458 (1929).
18. Bayer A, Vi Higer V, Ber., 34, 762 (1901).
19. Milas N., Surgcnor D„ J. Am. Client. Soc., 68, 205 (1946).
20a. Hock H., Lang S., Ber., 77, 257 (1944).
206. Armstrong С., H a [ [ R., Quin D., J. Sltem. Soc., 1950, 1666.
21a. F i s c It e r C., G о I d b 1 a 11 A., Ind. Eng. Chem., 43, 671 (1951).
216. Fischer C„ Stinson J,, Goldblatt A., J. Am. Chem,
Soc., 75, 3675 (1953).
21a. Schmidt C, Fischer C., J. Am. Chem. Soc., 76,5426 (1954).
21r. Sckera V., Marvel S., J. Am. Chem. Soc., 55, 345 (1933).
ГЛАВА III
ПЕРЕКИСИ АЛКИЛОВ
ОБЩИЕ МЕТОДЫ ПОЛУЧЕНИЯ
Существуют два общих- метода получения перекисей
алкилов.
1. Действие перекиси водорода на ди ал кил сульф ат
в щелочной среде
Этот способ применим только в алифатическом ряду.
Реакция Протекает по уравнению
О О
II
RO S -OR + НСОН+ RO— S- -OR —>
II ||
О О
О О
j1 II
RO—S-OH + ROOR+ НО—S— OR
Вместо избытка Н2О2, как в случае гидроперекисей
алкилов, используют лишь стехиомстрически необходи-
мое количество Н2О2 (чтобы свести к минимуму обра-
зование гидроперекисей).
Раствор щелочи вливают в энергично перемешивае-
мую смесь диалкнлеульфата и перекиси водорода, строго
контролируя температуру реакционной массы.
2. Этерификация гидроперекисей
Этот метод является общим; он позволяет, в частно-
сти, получать несимметричные перекиси алкилов ROOR'
(при R^ R')-
30
Органические перекиси
Эту этерификацию можно осуществить двумя спосо-
бами:
а) действием гидроперекиси на карбинол в присут-
ствии серной кислоты по уравнению
ROOH+HOR' —> ROOR'-j-H2O;
б) действием галоидного алкила R/X на щелочную
соль гидроперекиси по уравнению
R'X ф NaOOR —> R'OOR -ф NaX.
ОБЩИЕ СВОЙСТВА ПЕРЕКИСЕЙ АЛКИЛОВ
Первый член ряда газообразен, очень многие
члены — жидкости, некоторые представляют собой твер-
дые вещества при комнатной температуре.
Способность взрывать, исключительно резко выра-
женная для перекиси мстила, ослабевает с увеличением
молекулярного веса перекиси, становясь весьма незна-
чительной для перекиси гексафенилэтана *.
Первые члены ряда смешиваются с водой, почти все
растворимы в органических растворителях. Тем не ме-
нее эта растворимость может стать очень слабой для
перекисей с большим молекулярным весом; так, пере-
кись гексафенплэтапа практически нерастворима.
Перекиси алкилов, обладающие несколькими аро-
матическими группами (способными к перегруппи-
ровке), могут превращаться в простые эфиры гликолей
путем внутримолекулярной перегруппировки. Так, пере-
кись гексафенилэтана
СсНБ—coo с—свн5
Сен5
При нагревании в кипящем ксилоле переходит в дифени-
ловый эфир тетрафснилэтиленгликоля
С6НЕх ,C6HS
)С—с<
CsHj | | свнБ
ОС6Н5 ос6нб
Правильнее трифенцлметила. — Прим, ред.
Переписи алкилов
31
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПЕРЕКИСЕЙ АЛКИЛОВ
ПЕРЕКИСЬ МЕТИЛА НзСООСН3 [22[
Физические константы
т. кип. 13,57740 мм
плотность ОДО—0,85
Синтез
К сильно перемешиваемой смеси 7,5 а (0,0595 моля)
(CH3)2SO,( и 10 мл (0,0295 моля) НаО2 прибавляют по
каплям 25 г (0,179 моля) 40 %-кого КОН. Температура
не должна превышать 15°.
Реакцию необходимо проводить в атмосфере азота
ввиду исключительной воспламеняемости этой перекиси.
Свойства
Вещество в высшей степени взрывчато, очень чув-
ствительно к нагреванию и толчкам.
Растворимо в воде и в органических растворителях.
ПЕРЕКИСЬ МЕТИЛЭТИЛА НаСООСгН, [231
{т, кип. 40'7740 мм
dp 0,837
Синтез
Принцип получения этой перекиси состоит в действии
гидроперекиси этила па диметилсульфат в щелочной
среде и в атмосфере азота
О О
II II
C8HSOOH4-H3C—О—S—о—СН3 —> С2Н6ООСН3+НО—S—осп3
II II
о о
К сильно перемешиваемой и охлаждаемой смеси 7 г
С2Н5ООН и 15 a (CHshSOi прибавляют 30 г 15 %-него
КОН в течение 16 мин.
Перекись выделяют декантацией, промывают водой
до нейтральной реакции, а затем перегоняют под умень-
шенным давлением.
Выход 4 г.
32
Органические перекиси
Свойства
Эта перекись очень взрывчата, чувствительна к на-
греванию и толчкам; смешивается с водой и с органи-
ческими растворителями.
ПЕРЕКИСЬ ЭТИЛА CsHsOOCsH [24]
{т. кпп. 653
d11 0 827
Синтез
К сильно перемешиваемой смеси 210 г (CJI5)2SO,f
и 250 г 12%-ной НаО2 прибавляют 360 г 50 %-кого рас-
твора КОН. Температура реакционной массы не должна
превышать 20°. Операция продолжается 11 час. Смесь
осторожно нейтрализуют разбавленной H2SO^. Декан-
тируют, снимают органический слой, который промы-
вают до нейтральной реакции, и затем его фракциони-
руют под уменьшенным давлением.
Свойства
Бесцветная жидкость с запахом бромистого этила,
слабо растворимая в воде, легко смешивается с органи-
ческими растворителями, чувствительна к нагреванию,
но мало взрывчата при комнатной температуре.
ПЕРЕКИСИ, ВКЛЮЧАЮЩИЕ ТР^Г-БУТИЛЬНЫЙ радикал и другие
ТРЕТИЧНЫЕ РАДИКАЛЫ*
Перекиси этой группы соответствуют общей формуле
Н3С
Н3С—СООЙ
н3с/
Их получают действием калиевой соли гидропере-
киси трет-бутила в спиртовом растворе на диалкилсуль-
фат или галоидный алкил. Основные перекиси этой
группы приведены в табл. 7.
* В перепаде дано более широкое содержание этого раздела,
озаглавленного в оригинале «Перекиси алкилов — производные
гидроперекиси трет-бутила». В соответствии с этим несколько изме-
нен порядок подразделов на следующих двух страницах.— Прим.ред.
Перекиси алкилов
33
НзСх
Перекиси типа Н3С—COOR [25]
нас/
Таблица 7
К Т. пл,, с С Т, кип., сС/а«ас л20 "1)
Метил —102 23/119 0,311 1,3761
Этил — 83 35/84 0,809 1,3840
Изопропил 52/12,5 0,801 1,3864
я-Рутил 52/30 0,819 1,4001
8/ЯОр-И зобу ТИЛ — 68 53/150 0,809 1,3959
ffipcm-Изобутил — 40 70/197
111/760 0,794 1,3890
Аллил 55/75 0,826 1,4015
Среди перекисей алкилов упомянем следующие:
1. Перекись трет-амила
СН3 СН3
I I
П3ССН2—СО—ОС— СН8СН3
I I
снэ сн3
получаемая одновременно с гидроперекисью трет-амила
действием НзОа на ди-трет-амилсульфат и отделяемая от
смеси фракционированием под уменьшенным давлением.
Она обладает следующими константами: т. кип,
447Ю мм; 0,821; 1,4095,
2. Перекись кумила
насх СН3
Н3С—СООС—СН3
С6Н5/ ЧСеНс
получаемая действием гидроперекиси кумола на ди-
метилфеннлкарбинол при 95°, Она представляет собой
кристаллическое вещество, плавящееся при 39° и бурно
разлагающееся при 120°.
3 Зак. 1925.
34
Органические перекиси
Совсем недавно эта перекись была успешно исполь-
зована в качестве вулканизатора натурального каучука
и особенно в качестве вулканизатора пербунана.
ПЕРЕКИСИ, ВКЛЮЧАЮЩИЕ РАДИКАЛЫ ТРИФЕНИЛМЕТИЛА
И КСАНТГИДРИЛА [251
Эти типы перекисей представляют собой хорошо
выраженные кристаллы; их образование используется
для характеристики гидроперекисей. В табл. 8 приве-
дены темпер атурьг плавления этих перекисей с указа-
нием гидроперекисей, из которых они получаются.
Таблица 8
Перекиси, включающие радикалы трифенилметила
и ксантгидри.ча
Гидроперекись т. ил., ‘С
грифе пи л мети л ксантпгдрил
Н3СХ Н3С—СОО1! н3с/ 72,5—73 60—71
Н3С—СН!у Н3С—С—ООН Нзс/ Жидкость 41—42
Н3С—сн2—сн2 Н3С—СН2—С—ООН сн3 50-52 Жидкость
>сно—он H3CZ 85—86 84—86
>сн—ooh с6н/ 86-88 117
сан5х НаС—С—ООН Н3с/ 168—169 97—98
Перекиси алкилов
35
3. Перекись трифенилметила *
CcHsx ZC8HS
С9Н5—СООС—Cells
^CsHg
имеет некоторое теоретическое знамение, ибо ее получе-
ние связано с образованием первого известного свобод-
ного радикала трифенилметила
с5н5х
Cells-С •
Перекись трифенилметила получается окислением три-
фенилметила на воздухе. Перекись кристаллизуется из
сероуглерода в виде гексагональных призм, плавящихся
без разложения при 185—186s; очень мало растворима
в органических растворителях.
ЛИТЕРАТУРА
22. Riecli е А., Вег., 61, 901 (1928).
23. Rieclte А.. Вег., 62, 2458 (1929).
24. В aver A., Vi Higer V, Вег., 33, 3387 (1900).
25. R и s t F. Seo bold Н., V а и g h a a W., J. Am. Chem. Soc., 72,
338 (1950).
* Автор обозначает это вещество как перекись гексафенил-
этана. — Прим. ред.
3*
ГЛАВА [V
ГИДРОПЕРЕКИСИ АЦИЛОВ
(НАДКИСЛОТЫ)
ОБЩИЕ СВЕДЕНИЯ
Гидроперекиси ацилов можно разделить на две
группы.
1. Гидроперекиси- производные одноосновных кис-
лот с общей формулой
R—С—О—ОН
II
О
Интересно отмстить, что к этой группе относятся:
а) один представитель, содержащий этиленовую
связь (надкоричная кислота);
б) один представитель с фурановым ядром (над-
пирослизсвая кислота).
2. Гидроперекиси — производные двухосновных кис-
лот с общей формулой
НО-С—(СН2)„—С—О—ОН
|; и
о о
т. е. двухосновные кислоты с одной гидропсрекисной
функцией. Известен только один представитель с двумя
гидроперскиспыми функциями (находящимися в пара-
положении, а именно дппертерефталевая кислота).
ГИДРОПЕРЕКИСИ — ПРОИЗВОДНЫЕ ОДНООСНОВНЫХ
кислот
ОБЩИЕ МЕТОДЫ СИНТЕЗА
Существуют два основных способа получения этих
гидроперекисей ацилов: окисление и гидролиз.
Гидроперекиси ацилов
37
Окисление
а) Окисление альдегидов кислородом. Окисление со-
ответствующего альдегида проводят при низкой темпе-
ратуре (между —10 и —20°) струей сухого кислорода.
Скорость реакции значительно возрастает ври уль-
трафиолетовом облучении.
б) Окисление кислот или ангидридов 98 %-ной пере-
кисью водорода. Сущность этого метода состоит в том,
что стехиометрическую смесь кислоты и 98 %-ной пере-
киси водорода, к которой прибавляют 1% катализатора
(обычно H2SO,t), оставляют на 12—16 час, при комнат-
ной температуре и выделяют гидроперекись ацила из
реакционной смеси фракционированием •под уменьшен-
ным давлением.
Замечание. В процессе прибавления к кислоте
катализатора и перекиси водорода следует применять
энергичное охлаждение.
Г идролиз
Этот способ состоит в гидролизе * соответствующей
перекиси ацила при помощи алкоголята натрия по урав-
нению
О о
II II
R—О-о Na R—С—О—О—Na
1+0 —>
Натриевую соль образовавшейся гидроперекиси ацила
экстрагируют холодной водой, гидроперекись ацила вы-
деляют действием разбавленной минеральной кислоты,
а затем извлекают в свою очередь каким-нибудь орга-
ническим растворителем с низкой температурой кипе-
ния и не смешивающимся с водой (обычно хлорофор-
мом) .
Так в подлиннике. — Прим. ред.
38
Органические перекиси
ОБЩИЕ СВОЙСТВА
Гидроперекиси ацилов Ирл комнатной температуре
представляют собой жидкие или твердые вещества.
Три первых члена ряда смешиваются с водой, все
(кроме дипсртерефталевой кислоты) растворимы в ор-
ганических растворителях.
Взрывчатый характер резко выражен для гидро-
перекисей формила и ацетила.
Как правило, надкислоты обладают большой окисли-
тельной способностью по отношению к следующим со-
единениям.
1. Соединения с этиленовой связью
Действие гидроперекисей ацилов па соединения
с этиленовой связью приводят, как правило, к энокси-
соедииепням по уравнению
рС-С</ -р- R—Е—О—ОН
/ - |'
О
о
Эта реакция, открытая Прилежаевым [296], представляет
собой реакцию разложения гидроперекисей ацилов на
соответствующую кислоту с освобождением кислорода,
который фиксируется двойной этиленовой связью
Заметим, что эта реакция протекает также при на-
личии некоторых других восстанавливающих групп, та-
ких, как ОН спиртовой функции *; так, аллиловый спирт
Н2С-СН—СНгОН под действием гидроперекиси бен-
зоила превращается в эпоксиаллиловый спирт
Н,С--СП—СНгОН
2. Сульфиды
Действие гидроперекисей ацилов на сульфиды при-
водит к образованию сульфонов с высоким выходом.
* Так и подлиннике. С.:гед<1ва,!ю бы сказать СНОП и СН;ОН.—
Прим. ред.
Гидроперекиси ацилов
39
3. Амины
Действие гидроперекисей ацилов на амины может
привести к образованию азо-, азокси-, нитрозо- и нитро-
соединений иди окисей аминов.
4. Кетоны
Гидроперекиси нс действуют на алифатические моно-
кетоны, однако большинство циклических кетонов
окисляется.
С дикстопами и хинонами наблюдается разрыв цепи
с образованием кислот.
5. Альдегиды
Действие гидроперекисей ацилов на альдегиды при-
водит к образованию соответствующих кислот (за исклю-
чением, однако, фенол альдегидов вследствие простран-
ственных препятствий).
Наконец, гидроперекиси ацилов окисляют некоторые
широко применяемые органические материалы, такие,
как каучук и пробку, и обладают известными гермицид-
выми свойствами.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ГИДРОПЕРЕКИСЕЙ
АНИЛОВ {НАДКИСЛОТ)
НАДМУРАВЬИНАЯ КИСЛОТА (ГИДРОПЕРЕКИСЬ ФОРМИЛА) [2S, 271
И—С-О—он
II
о
Эта надкислота не получена в чистом виде. При
90%-пой концентрации это бесцветная жидкость с ха-
рактерным запахом, сильно раздражающим слизистые
оболочки, и вызывающая болезненные ожоги па коже.
Она смешивается с водой и с органическими раство-
рителями. Растворы нестойки. 90%-ная гидроперекись
теряет 25% своего активного кислорода за 24 часа
40
Органические перекиси
при 0°. Она бурно взрывает при 80° с образованием
СО2Н2О. Она может даже взрывать при комнатной тем-
пературе при прибавлении некоторых твердых ве-
ществ.
НАДУКСУСНАЯ КИСЛОТА (ГИДРОПЕРЕКИСЬ АЦЕТИЛА) [20, 27)
Н3С—С—О—ОН
Физические константы
( 2а /12 мм
т. кип. 1
I, 35—36' ’/29 мм
I. !1Л. 0,1°
dj3 1,226
Свойства
Бесцветная жидкость, смешивается с водой и с орга-
ническими растворителями. Бурно взрывает при 110°.
Разлагается па холоду под действием солей марганца
или платиновой черни. При отсутствии катализаторов
устойчива при комнатной температуре,
НАДПРОПИОНОВАЯ КИСЛОТА (ГИДРОПЕРЕКИСЬ ПРОП ИОН И ЛА) [26, 27)
Н3С—СН2—с—О—ОН
II
о
Эта гидроперекись значительно менее взрывчата,
че,м гидроперекись ацетила. Она плавится при — 13,5°.
НАДМАСЛЯНАЯ КИСЛОТА [26 , 27)
H3C-CHS—CHS—С—О—ОН
Эту гидроперекись в чистом виде получить не уда-
лось. При 90%-ной концентрации это жидкость, не сме-
шивающаяся с водой, взрывающая при 150°.
Физические константы
г. пл. — 10,5е
т. кип. 26—30712 мм
Гидроперекиси ацилов
41
НАДКАПРОНОВАЯ КИСЛОТА [28]
Н3С~(СНа)4—С—о—он
||
о
Синтез
К охлажденной льдом и энергично перемешиваемой
смеси 20 г капронового ангидрида и 6 а концентриро-
ванной серной кислоты прибавляют 6,8 г 93%-пой HsO2;
продолжительность операции составляет 1 час.
Реакционную смесь оставляют па 20 час. при ком-
натной температуре. Отделяют верхний слой (слой гидро-
перекиси ацила) декантацией, промывают водой до
нейтральной реакции, высушивают над безводным
Na2SO.i. Фракционируют под у меньше! ги ым давлением,
собирая фракцию, кипящую в пределах 62- -63°/!1 мм.
Температура кипения вещества 41 -4270,5 мм. Выход
порядка 50%.
Свойства
Белые кристаллы, плавящиеся при 15°; жидкая гидро-
перекись имеет резкий запах; слабо взрывает в пла-
мени.
НАДБЕНЗОИнАЯ КИСЛОТА
(ГИДРОПЕРЕКИСЬ БЕНЗОИЛА) [29а, С, в, г]
О
^-C-O-Ofl
V
Синтез
Гидроперекись бензоила можно получить большин-
ством тех способов, которые применимы к гидропере-
кисям ацилов, но наиболее интересным оказался спо-
соб гидролиза * перекиси бензоила метилатом натрия;
этот метод, использованный Байером и Виллиджером
(29а] и Прилежаевым [296], был усовершенствован Брау-
ном [29в] и Кольтгоффом [29г]. Ниже приведен уточнен-
ный способ работы [29в].
* Так в подлиннике. —Прим, ред.
Органические перекиси
1. Получение метилата натрия. Прибавление малень-
кими порциями 5 г натрия в 100 .ил абсолютного мети-
лового спирта (вполне сухая колба, снабженная обрат-
ным холодильником).
2. Гидролиз (с образованием натриевой соли гидро-
перекиси бензоила и бензойноэтилового эфира). Приба-
вление к раствору метилата натрия в метиловом спирте
раствора 50 г перекиси бензоила в 200 мл хлороформа.
Перемешивание в течение 5 мин., причем поддержи-
вается температура ниже 0°.
Появляется молочная муть (вадбепзоат натрия).
3. Экстракция пербензоата натрия холодной водой:
а) переливание в колбу для декантации;
б) промывание 500 мл НаО, содержащей толченый
лед, причем поддерживается температура ниже 0°;
в) декантация водного слоя и экстрагирование два-
жды 100 мл хлороформа (для удаления бснзойномсти-
лпвого эфира).
4. Выделение гидроперекиси бензоила. Медленное
прибавление 225 мл H2SO4 при охлаждении льдом, так
чтобы температура реакционной массы нс превы-
шала 5°.
5. Извлечение гидроперекиси бензоила. Трехкратное
экстрагирование 100 мл холодного хлороформа, высу-
шивание над безводным Al^SO-i, удаление хлороформа
в вакууме при комнатной температуре (барботиро-
вание СО2), высушивание бледно-желтого остатка
в течение нескольких часов при 30—35" в вакууме
при 10 .им.
Выход 20—23 г (75%) гидроперекиси бензоила.
Свойства и применение
Надбензойная кислота представляет собой белый
порошок, растворимый в органических растворителях
и слабо растворимый в воде. Плавится при 41°, кипит
при 97—Н0°/13—15 ЛЫ1. Устойчивая при обычной тем-
пературе, она разлагается с 80° па бензойную кислоту
и кислород. Используется в качестве реактива для по-
лучения эпоксисоединсннй и как аналитический реактив
для определения двойных связен.
Гидроперекиси арилов
43
НАДКОРИЧНАЯ КИСЛОТА [3Q]
о
—CH-CH—С—О—ОН
О
Синтез
Сущность метода состоит в расщеплении перекиси
циннамила этилатом натрия.
Методика работы
В охлажденный до 0° раствор 10 г перекиси циана-
мида и 250 мл хлороформа вливают 20 мл спиртового
раствора, содержащего 0,8 г натрия. Через 30 мил. ре-
акционную смесь обрабатывают водой. Водный слой
дважды промывают хлороформом.
Подкисляют II2SO4 и гидроперекись извлекают хло-
роформом.
Хлороформный раствор промывают водным раство-
ром карбоната натрия (для удаления коричной кис-
лоты). Хлороформ удаляют под уменьшенным давле-
нием. Выход 80%.
Свойства
Эта гидроперекись относительно устойчива. Пла-
вится при 67—68°.
надпирослизевая кислота
(ГИДРОПЕРЕКИСЬ ФУРОИЛА) [31]
о
U-c-°-0H
Синтез
Сущность метода состоит в действии метилата на-
трия на перекись фуроила. К раствору 10 г перекиси
фуроила в 300 мл безводного эфира, охлажденному до
—5°, медленно прибавляют при энергичном перемепшва-
44
Органический перекиси
нии 40 мл метилового спирта, содержащего 1,100 г на-
трия.
Реакционную смесь выливают в 100 мл ледяной
воды, отделяют декантацией органический слой и вод-
ный слой (содержащий натриевую соль гидроперекиси
фуроила).
Водный слой промывают дважды 100 мл СНС|3 (для
удаления всей перекиси).
Водный слой подкисляют 20%-пой II0SO4 при темпе-
ратуре около 0° (для выделения гидроперекиси фуроила
из се натриевой соли).
Дважды экстрагируют 100 мл СПС1;!.
Удаляют хлороформ под уменьшенным давлением.
Выход сырого продукта 88%.
Перекристаллизовывают из СС14.
Свойства
Гидроперекись фуроила представляет собой бесцвет-
ные иголочки, плавящиеся (с разложением) при 60°.
Она прекрасно растворима в воде (которая гидроли-
зует ее в пирослизевую кислоту и в перекись водорода).
Она также растворима в органических растворите-
лях (кроме петролейного эфира).
Будучи довольно устойчивой при 0°, она быстро раз-
лагается при 30—40° с выделением кислорода и дву-
окиси углерода. Хлороформный раствор вполне устойчив
при 0° и может быть и сп о львов ап для определения сте-
пени ненасыщенности в многочисленных органических
соединениях. Тем не менее некоторые вещества не всту-
пают в реакцию с гидроперекисью фуроила в отличие
от других гидроперекисей,
ГИДРОПЕРЕКИСИ — ПРОИЗВОДНЫЕ ДВУХОСНОВНЫХ
кислот
МЕТОДЫ СИНТЕЗА
Для получения надкислот этого ряда обычно исполь-
зуют окисление кислот или их ангидридов перекисью
водорода.
Гадроперекиси ацилов
45
Но вместо 98%-пой Н2О2, как в случае однооснов-
ных кислот, используют только 30%-ную Н2О2 (присут-
ствие одной карбоксильной группы благоприятствует
окислению другой).
Реакцию проводят в щелочной среде; гидроперекись
выделяют из ее щелочной соли обработкой кислоты
с последующим возможным извлечением органическим
растворителем (эфиром, хлороформом).
Свойства
Надкислоты двухосновных кислот, как правило, рас-
творимы в воде и в органических растворителях; устой-
чивы при комнатной температуре, более или менее
взрывчаты при повышенной температуре.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
МОНОПЕРФТАЛЁВАЯ КИСЛОТА |32а, б, в]
О
^рС-О-ОН
О
Синтез
Сущность метода состоит в действии 30%-ной Н2О2
на фталевый ангидрид в щелочной среде и в осаждении
моноперфталевой кислоты при помощи 20%-ной H2SO4.
Чтобы увеличить выход, можно дополнительно из-
влечь моиоперфталевую кислоту из маточного раствора
эфиром.
Методика работы
К энергично перемешиваемой и охлаждаемой от 0
до 5° смеси 55 г 15%-ного NaOII и 23 а 30%-пой Н2О2
прибавляют 15 г фталевого ангидрида.
46
Органические перекиси
Нейтрализуют 20%-ной H2SO4. Отсасывают и про-
мывают холодной водой до нейтральной реакции. До-
полнительно извлекая моноперфта левую кислоту’ из
фильтрата эфиром, получают выход 65—70% [326].
Свойства
Белый порошок, растворимый в воде и эфире, мало
растворимый в бензоле и хлороформе, более устойчи-
вый, чем гидроперекись бензоила.
ДИПЕРТЕРЕФТАЛЕВАЯ КИСЛОТА [32J
О
-С—О-ОН
о
Синтез
Сущность метода состоит в действии хлористого те-
рефталила в эфирном растворе на 30%-ную Н3О2 в ще-
лочной среде. Промежуточно образуется мопонагриевая
соль, очень мало растворимая в воде.
Методика работы
К энергично перемешиваемой и охлаждаемой смеси
27 мл 3,2%-поп Н3О3 и 8,5 мл 15%-пого NaOH приба-
вляют 2 г хлористого терефталила в эфирном растворе.
Образуется твердое вещество, растворяющееся при
прибавлении воды. Действием СО2 получают моиона-
трпевую соль, очень плохо растворимую в воде, которую
можно изолировать в чистом виде фильтрованием и
промыванием водой. Действуют на монопатриевую соль
точно рассчитанным количеством NaOH, чтобы перевести
се в двупатриевую соль, растворимую в воде, и выделяют
днпертерефталевую кислоту действием 20%-ной H2SO4.
Гидроперекиси ацилов
47
Свойства
Белый порошок, очень плохо растворимый в воде,
взрывающий от толчков и нагревания.
МОНОПЕРЯПТАРНАЯ КИСЛОТА [S3]
НО—С—CIi2—сн2—с—о— он
|| II
о о
Синтез
Ее получают гидролизом пероксидияптарной кислоты.
10 г этой перекиси вводят в стакан с. 75 лм воды и
непрестанно перемешивают приблизительно в течение
4 час., поддерживая температуру 30°. Остаток от выпа-
ривания этого раствора в вакууме состоит из смеси ян-
тарной кислоты и соответствующей моногидроперекиси.
Последнюю выделяют из смеси растворением в хлоро-
форме, в котором она более растворима, чем кислота.
Свойства
Она плавится при 107° (с разложением) и медленно
разлагается при хранении при комнатной температуре,
хотя она и не менее устойчива, чем гидроперекись бен-
зоила.
Растворима в спирте и ацетоне, мало растворима
в эфире и хлороформе.
При нагревании в атмосфере инертного газа она раз-
лагается на р-оксипропионовую кислоту, образуя затем
акриловую кислоту по уравнению
НО-С—СН2-СН2—С—О—ОН —> НО—С—СНа—СН2ОН + СО2
II II |1
О О о
н он
I I
НО—С—СН—СН2 —> но—С—СН-СН, + Н2О
II ||
О о
48
Op
ганические перекиси
МОНОПЕРКЛМФОРНАЯ КИСЛОТА [И, 35]
Синтез
Сущность метода состоит в окислении ангидрида
перекисью натрия в эфирной среде.
К энергично перемешиваемому и охлаждаемому до
0° раствору 4,300 г Na2O2 в 200 мл H2O прибавляют
раствор 10 е камфорного ангидрида в 400 мл эфира.
После окончания прибавления перемешивание продол-
жают еше 1 час.
Смесь подкисляют 20%-ной H2SO4 при температуре
около 0° (для выделения перекиси из ее натриевой
соли). Декантацией отделяют эфирный слой. Промывают
водным раствором (NH^aSOj. Высушивают над безвод-
ным Na2SO4. Эфир удаляют иод уменьшенным давле-
нием. Выход 6 г.
Кислоту получают в чистом виде в результате кри-
сталлизации из петролейного эфира.
Свойства
Твердое вещество, плавится при 49—50°. Растворимо
в воде (с гидролизом в камфорную кислоту и Н2О2) и
в органических растворителях (мало растворимо в ис-
тролейном эфире).
Устойчива при 0° и в сухой атмосфере в течение не-
скольких недель, медленно разлагается при комнатной
температуре на кислород и камфорную кислоту. Реак-
ция сопровождается взрывом при 80—100°.
Гидропсрекиеи ацилов
49
ЛИТЕРАТУРА
•1“ 26. Swern D., Chem. Rev., 45, 1 (1949).
27. D'ans J., Prey W., Ber.. 45, 1845 (1912).
28. Pich ter F., Zumbrunii R., Helv. Chem. Acta, 10, 869(1927).
л 29a. Bayer A.. Villager V„ Ber., 33, 858 (1900).
296. P г r 1 e j a e v N., Ber., 42, 4811 (1909).
29b. Braun Ci„ Org. Synlh., 1, 431 (1941).
29r. Kolthoff I, J. Pol. sc., 2, 290 (1947).
30. Bodendorf K., Ber., 66, 165 (1933).
* 31. Milas N., A 1 c v у A., J. Am. Chcrn. Soc., 56, 1219 (1934).
32a. Bayer A.. Vi i liger V., Ber., 34, 762 (1901).
326. В oh me H., Ber., 70, 379 (1937).
32в. Арбузов Б., Ber., 68, 1430 (1935).
I 33a. Clover M., Haughton C„ Am. Chem. .1., 32, 43 (1904).
I 34, Mil as N., A levy A., J. Am. Chcrn. Soc., 55, 349 (1933).
35. Milas N., Cliff !., J. Am. Chem. Soc., 55, 354 (1933).
4 Sait. 1925.
ГЛАВА V
ПЕРЭФИРЫ (ЭФИРЫ ГИДРОПЕРЕКИСЕЙ
АЦИЛОВ) [36—40]
Е?_С—О—OR
6
СИНТЕЗ
Общий метод получения состоит в действии хлор ан-
гидрида кислоты на щелочную соль соответствующей -
гидроперекиси по уравнению
R—С—Cl (-NaOOR' —> R—С—О—О—R' + NaCl
II II
О О
В энергично перемешиваемую гидроперекись приба-
вляют одновременно стехиометрические количества хлор-
ангпдрида кислоты и щелочи, поддерживая темпера-
туру реакционной массы около 10°. По окончании доба-
вления перемешивание продолжают еще в течение при-
близительно 16 час.
Промывают 5%-ным раствором Ха^СОз (для удале-
ния следов непрореагировавшего хлор ангидрида кис-
лоты), затем водой до нейтральной реакции. Высуши-
вают над безводным Na»SO.i.
Перегоняют (если возможно) перэфир под умень-
шенным давлением. (Если перэфир устойчив при ком-
натной температуре, то в реакционную смесь добавляют
какой-нибудь летучий органический растворитель, ко-
торый затем удаляют под уменьшенным давлением при
комнатной температуре.)
ОБЩИЕ СВЕДЕНИЯ
Хотя с точки зрения структуры рассматриваемый
класс соединений является эфирами гидроперекисей
ацилов, эти вещества нельзя приготовить этсрефикацией
последних.
Перэфиры
51
Подобный же случай имеет место для нитрилов
R—С ss N, которые не могут быть получены этерефика-
цией спиртов синильной кислотой.
Известны эфиры моноперкислот и диперкислот. Это
вещества при комнатной температуре твердые или жид-
кие, нс растворимые в воде, растворимые в органиче-
ских растворителях, устойчивые при комнатной темпе-
ратуре, более или менее взрывчатые при нагревании.
В табл. 9 приведены известные перэфиры. трет-Ъу-
/СНз
C6HS—С—О—О—C--CFI,
тилпербензоат и ди-трет-бутилперфтадат широко ис-
пользуются в полимеризации виниловых мономеров.
Таблица 9
Основные перэфиры
Перэфир T. кип. Т. вл., аС dJI 20 "D Лите- ратура
трст-Еутилпербеп- 75—ТГ'12 мм 1,013 1,5007 36
зоат
г/;д.?»г-Бутилперфу- 40— 49°а/2,5 мм 1,092 1,4747 36
роат tnpem-Бу тнлперстеа- 186'70,3 (JL а 14—16,5 30
рат /гср?/тг-Бутилперкро- 3672 мм 0,954 1,4414 36
тонат
Ди-м/^ги-бутилпср- 53—54 36
сукцинат Ди-т/^т-бутилпер- 57—57,5 36
фталат Диэтилпсртерефталат 37 37
Диизопропилпертерс- 59 38
фталат
а Давление и этой графе приведено в микронах ртутного столба, а темпе-
ратура соответствует температуре» баки при молек}т,тярцой перегешке на хплмапн-
довской установке. — Прим. ред.
4*
52
Органические1 перекиси
«-ПИТР0ПЕРБЕН30ЛТЫ [2а]
Эти типы перэфиров имеют хорошо выраженную
кристаллическую форму, их образование используют
для характеристики гидроперекисей.
Этерификация протекает при действии п-нитробензо-
илхлорида на гидроперекись в среде пиридина.
В табл. 10 приведены температуры плавления основ-
ных перэфиров этого типа, а также природа характе-
ризуемой гидроперекиси.
Таблица 10
Гидроперекись Т, л л. пср- эфнра, "С Кристаллическая форма перэфира
трет- Бутил 78 Желтые пластинки
Три эти л 59 Бесцветные пластинки
1.1, 2, 2-Тетрамстнлэти.1 57-58
М е тилцн к л о ге к с ил 76—78 Желтоватые иголочки
Этилциклогексил 68—69 > а
2,7-0 нс-Диметилоктан 66 Ромбоэдры
Бломквист и Берштейн [39] синтезировали несколько
трет-бутилпербензоатов, замещенных в бензольном ядре,
общим методом действия соответствующего хлорангид-
рида кислоты на гидроперекись трет-бутил а.
В табл. 11 приведены замещенные в бензольном
ядре пербензоаты, а также некоторые их физические
константы.
Таблица 11
Заместитель Т, ил., РС «20 Степень чистоты, Внхсд, ?;
л-Мстокси 18-19 1,5157 1,103 97,8 85
п-Метил 1,5022 1,027 97,6 78
л-Хлор 49 98,5
л-Нитро 79 [00 77
Перэфиры
АЛКИЛПЕРКАРБОНЛТЫ [40]
АЛКИЛМОНОПЕРКАРБОН АТЫ
,О-Й
о-с<
\O-O-R'
Эфиры этого типа получают действием гидропере-
киси на хлорформиат в щелочной среде при низкой
температуре (между —5 и 0°) по уравнению
R'OOH -р Cl—С—OR —> R'O—О—С—OR + НО
li .1
О о
Наиболее известным представителем является
-OCjlls ptj
у''^п3
'ЧО-О—С-СНЭ
ЧСН3
получаемый действием этилхлорформиата на гидро-
перекись т/л?т-бутила. Он обладает следующими физиче-
скими константами: т. кип. 52—5571 мм; 1,4050;
0,966.
АЛКИЛДИПЕРКАРВОНАТЫ [40]
O-O-R
О-С<
ЧО—О—R'
Их получают действием фосгена на соответствующую
гидроперекись в пиридипово-эфнрной среде при низкой
температуре (3—5°)
,С1 HOOR .OOR
О-С< -[- —> О-С( +2НС1
-Cl HOOR' XOOR'
Наиболее известным представителем этого типа
соединений является ди-т/?ег-бутилпсркарбонат
СН3
''СНз
54
Органические перекиси
Алкилмоно- и алкилдиперкарбонаты при комнатной
температуре довольно устойчивы.
Эти два типа соединений являются активными ката-
лизаторами полимеризации некоторых виниловых мо-
номеров.
Алкилмоноцсркарбонаты — активные катализаторы
полимеризации аллильных эфиров, алкилдиперкарбо-
наты в этом случае менее эффективны.
ЛИТЕРАТУРА
36. Milas N., Surgcnor D., J. Am. Chem. Soc., 68, 642 (1946).
37. Bayer A., V i 1 1 i g e г V., Ber., 34, 738 (1901).
38. Медведев С., Алексеева E., Bcr., 65, 131 (1932).
39. В 1 о m q u i s t A., Berstein I., J, Am. Chem. Soc., 73, 5546
(1951).
40. Strain F., Rudoff H., J. Am. Cltem Soc., 72, 1254 (1950).
ГЛАВА VI
ПЕРЕКИСИ —ПРОИЗВОДНЫЕ КИСЛОТ
А. ПЕРЕКИСИ —ПРОИЗВОДНЫЕ ОДНООСНОВНЫХ
КИСЛОТ ИЛИ ПЕРЕКИСИ АЦИЛОВ
Общие методы синтеза
Существуют три метода получения этого типа пере-
кисей.
t. Действие 30%-ной перекиси водорода
на ангидриды кислот
Этот метод применим особенно к первым членам
ряда, которые при обычной температуре жидкие веще-
ства. Он основан на реакции [33]
О
II
О—Н R—с—о—он
о—н R—С—ОН
II
о
R—С—О
II I ' +
О он
о
II
С—R
О—С—R
II
О
о
II
НО-С—R
О
II
\i R—С—О—О—С—R
II
О
Перекись водорода вливают в охлажденный до —10°
и энергично перемешиваемый эфирный раствор уксус-
ного ангидрида. Промывают 10%-ным раствором едкого
натра (для отделения гидроперекиси ацетила, которая
также образуется при этой реакции, и избытка не-
прореагировавшего уксусного ангидрида). Отделяют
56
Органические перекиси
эфирный слой декантацией и удаляют эфир иод умень-
шенным давлением.
Перекись водорода можно заменить перекисью ще-
лочного металла, например Na2O2'8H2O, или перекисью
щелочноземельного металла, например ВаОа 8Н2О.
2. Действие 10%-ной перекиси водорода на соответ-
ствующий хлорангидрид кислоты в щелочной среде
Этот метод применим главным образом для получе-
ния перекисей, твердых при комнатной температуре.
Реакция протекает по уравнению
О О О
?i II 'i
2R—С—Cl % Н2О2 —> R С-О-О-С-В+ 2НС1
Хлорангидрид кислоты вливают в энергично переме-
шиваемую и охлаждаемую до 0—5° смесь 10%-ной пе-
рекиси водорода (взятой в небольшом избытке по срав-
нению с хлорангидридом) и едкого натра (в стехиоме-
трическом количестве по отношению к хлорангидриду).
Перемешивание продолжают некоторое время и
после прибавления всего хлорангидрида до исчезнове-
ния его запаха.
Образовавшуюся перекись отсасывают, промывают
водой до нейтральной реакции и перекристаллизовы-
вают из подходящею растворителя.
Перекись должна быть полностью освобождена от
хлорангидрида, так как последний в контакте с влагой
воздуха даст соляную кислоту, а она прореагирует с пе-
рекисью с выделением хлора, обусловливая местные по-
желтения (явление, часто констатируемое на примере
плохо очищенной продажной перекиси бензоила).
3. Действие хлорангидрида кислоты на натриевую
соль надкислоты (гидроперекиси ацила)
Эту реакцию используют исключительно с целью по-
лучения асимметричных перекисей ацилов
О О
1 ||
R—С—О-О—С—R'
Перекиси — производные кислот 57
где R и R' - разные. Реакция выражается уравнением
О 0 0
9 II II
R—С—Cl-j-NaO—О—С—R' —> R—C-O-O-C-R' + NaCl
il
О
Стехиометрическое количество натриевой соли надкис-
лоты в водном растворе добавляют к раствору хлоран-
гидрида кислоты в органическом растворителе (обычно
в хлороформе). Органический слой отделяют деканта-
цией, несколько раз промывают водой до полного удале-
ния NaCl. Органический растворитель удаляют в вакууме.
ОБЩИЕ СВОЙСТВА ПЕРЕКИСЕЙ АЦИЛОВ
При обычной температуре это жидкости или твердые
вещества.
Перекись ацетила крайне взрывчата при комнатной
температуре. (Заметим, что перекиси формила не суще-
ствует, так же как и ангидрида муравьиной кислоты.)
Эта способность взрывать уменьшается с увеличением
молекулярного веса.
Существуют перекиси непредельных ацилов (произ-
водные кислот этиленового ряда), такие, как перекись
кротонила и циннамила. Известны и перекиси ацилов
с гетероциклическим ядром — перекиси фуроила и ни-
котниила.
Растворимость в органических растворителях умень-
шается с возрастанием молекулярного веса и становится
слабой для замещенных перекисей бензоила.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
ПЕРЕКИСЬ АЦЕТИЛА [41а, 6J
О
II
СН3—С—О
I
СН3—С-0
II
о
Физические консганты: т. пл. 26—27°, т. кип. 63721 л.ч.
ж
Органические перекиси
Синтез
а) Метод Нефа [41а]. 19,200 г 30 %-ной перекиси во-
дорода прибавляют по каплям к 116 а уксусного ангид-
рида, интенсивно перемешивая и поддерживая темпера-
туру реакционной смеси —10°. Разбавляют в 5 раз эфи-
ром, затем промывают 10%-ным раствором едкого
натра (для удаления уксусной и надуксусной кислот),
органический слон сушат над хлористым кальцием н
под уменьшенным давлением удаляют эфир. При всех
операциях температура не должна превышать 30° из-за
вероятности сильного взрыва.
б) Метод Гамбаряна [416]. К энергично перемеши-
ваемой смеси 20 г уксусного ангидрида и 100 мл эфира
добавляют небольшими порциями 10 г Nasth-8Н2О,
поддерживая температуру реакционной массы —15°.
Эфирный слой отделяют декантацией и эфир уда-
ляют под уменьшенным давлением.
Выход 60%.
Свойства
Вещество очень взрывчато, способно детонировать
при комнатной температуре при встряхивании, перели-
вании из сосуда в сосуд или в результате трения ме-
шалки.
При хранении неустойчиво. Так, 20 г перекиси аце-
тила при хранении в закрытом сосуде в течение 4 меся-
цев полностью разложилось, образовав смесь уксусного
ангидрида и уксусной кислоты [41а]. Поэтому вещество
следует использовать в течение 24 час. после пригото-
вления,
ХЛОрСОДЕрЖАЩЦЕ ПЕРЕКИСИ АЦЕТИЛА [42]
Перекись мо я о хл о р а ц е т и л а
О О
il 11
С1СН2—С-О—О-С-СН2С1
Получена действием хлористого хлорацетила на
двойной избыток 3%-ной перекиси водорода в нейтраль-
Перекиси — производные кислот
59
ной среде. (Следует избегать щелочной среды, чтобы
нс гидролизовать хлористый хлорацстил.)
Перекись представляет собой прекрасно образован-
ные иголочки, растворимые в органических растворите-
лях. Разлагается уже при обычной температуре и взры-
вает при нагревании и толчках.
Перекись трихлорацетила
О О
С II |!
1| С13С—С—О—О—С—СС[Э
<1 Получена так же, как и перекись монохлорацетила.
4 Очень неустойчива.
ПЕРЕКИСЬ ФЕНИЛАЦРЛМЛА [32г]
Подучена действием хлорангпдрида фснилуксусной
кислоты на водный раствор перекиси натрия ХагОг-
8Н2О.
Она представляет собой большие блестящие пла-
стинки, плавящиеся при 4 Г, растворимые в органиче-
ских растворителях. Эта перекись мало взрывчата при
обычной температуре, по своей устойчивости опа похожа
на перекись бензоила.
Несколько известных высших гомологов перекиси
ацетила были получены действием соответствующих
ангидридов на перекись бария ВаОа-ВНгО.
В табл. 12 приведены их главнейшие свойства,
СМЕШАННАЯ ПЕРЕКИСЬ БЕНЗОИЛА —АЦЕТИЛА [41а]
О О
II II
Сен5—С-О-О-С—сн3
Синтез
Смесь 125 г бензальдегида и 250 г уксусного ангид-
рида оставляют на рассеянном свету в течение 43 дней.
Добавляют эфир, промывают 10%-ным раствором соды
(для удаления уксусной и бензойной кислот, также об-
разующихся в этой реакции). Отделяют декантацией
эфирный слой и эфир удаляют отгонкой под уменьшен-
ным давлением.
Таблица 12
£-1
со
Г U
Л г
Формула о l-U и — О 1 о 1 О- <3 т 1 о [ о О--
о 1 О- 1 - о о =
о 1'1 Н3С—СНз- с- 1 СЧ м г и т о г
Перекись Пропионила Бутирила
Капроила Н3С— (СН2),— С— О—О—С—(СН2)+—СН3 Бесцветное масло. Разла-
гается начиная с 85е с
выделением газа
Перекиси. — производные кислот
61
Свойства
S
й
з
Си
й
Плавится при 37—38°.
Бурно разглагастся начиная с 85 °.
ПЕРЕКИСЬ БЕНЗОИЛА [11а, 45]
О О
II !!
С6Но-С-О—О-С-С6Н5
Синтез
К энергично перемешиваемой смеси 100 мл 10%-ной
перекиси водорода и стехиометрического количества
4 н. едкого натра, температуру которой поддерживают
О—15°, приливают по каплям стехиометрическое коли-
чество хлористого бензоила. Перемешивание продол-
жают до исчезновения запаха последнего.
Перекись отсасывают, промывают водой до ней-
тральной реакции, затем кристаллизуют из этилового
спирта с небольшой добавкой воды.
Свойства
Устойчива при комнатной температуре. Плавится при
100е с разложением. Малорастворима на холоду в таких
растворителях, как сероуглерод, спирт, лигроин, устой-
чива к действию концентрированной соды и разбавлен-
ной серной кислоты.
ЗАМЕЩЕННЫЕ ПЕРЕКИСИ БЕНЗОИЛА [42, 46, 47]
Бензольное ядро перекиси бензоила может иметь
различные заместители — электроположительные или
электроотрицательные — в орто-, мета- и пара-положе-
I НИЯХ.
I Замещенные перекиси бензоила можно разделить на
I две большие группы:
62
Органические перекиси
Таблица 13
Основные симметричные замещенные перекиси бензоила
Электрд0г|.1ИЦ|]'- тельный заместитель Т. ил., "С Эле ктро поло ?г( иге л тт| г ы й зиме ститиль Т, пл., °C
о-Фтор 66—67 о-Метил 54
.м-Фтор 87—88 я-Этил 58—59
л-Фтор 93
о-Хлор
М-Хлор 122-123 п-Ивонропил 98
п -Хлор 140-141 -
2,3, 4, 5-Тетра- 154 я-т/?ет-Бутил 142-143
хлор
о-Бром (Взрывает при 114е)
л-Бром 132 3,5-Диметил 118—120
л-Бром (Взрывает при 150°)
я-Циан 175 3,4-Диметокси 97
О-Нитро
.м-Нитро 139
я-Нитро 151 я-Этокси 131-132
п-Фе пил 171
1. Симметричные перекиси (табл. 13), в которых оба
ядра замещены (обычно один и тот же заместитель за-
нимает одинаковое положение).
Перекиси этого типа получают действием соответ-
ствующего хлорангидрида кислоты на перекись водорода
или натрия
О
'I
2Х-<^ ^>-С—С[-ЬНООН—>
о
о
/-Ч И
.-> X—\_С—
—С-,^ Ч-Х4-2НС!
Перекиси — производные кислот
63
2, Несимметричные перекиси (табл. 14), в которых
только одно бензольное ядро имеет заместитель.
Таблица 14
Несимметричные перекиси
бензоила
Заместитель т, пл.,
п-Хлор .«-Нитро п-Нитро л-Метокси 85 101 93—94 178—180
Эти перекиси синтезируют действием хлорангидрида
кислоты, имеющей заместитель, на пербепзоат натрия
С5Н5—С—ООХ'а-р Cl—С—Ч—X—>
I! li Х==/
О о
—> С6Н5-С-О—О—С—Ч Ч—X + NaCi
Il II Ч=/
О о
ПЕРЕКИСЬ КРОТОНИЛА [«[
о о
II !1
СН3СН=СН—С—О—О-С-СН=СНСН3
Синтез
Энергично перемешивают 300 ч. кротонового ангид-
рида с 60 ч, 30%-ной перекиси водорода до получения
эмульсии. Продолжая перемешивание, медленно доба-
вляют 20%-ный раствор едкого натра. Температуру под-
держивают 0°. Через 30 мин, выделяется кристалличе-
ский порошок, который отсасывают, промывают водой
и сушат на воздухе. Выход 94%.
64
Органические перекиси
Свойства
Белый кристаллический порошок, плавящийся при
температуре 40—41°.
ПЕРЕКИСЬ ЦИННАМИЛА [30[
о о
II II
С6П5СН=СП-С—О—О-С-СН=СНСвН5
Перекись получена по общему методу действием
хлорангидрида коричной кислоты па 10%-ную перекись
водорода в щелочной среде.
Это красивые бесцветные иголочки, кристаллизую-
щиеся из смеси спирта и ацетона. Устойчива при обыч-
ной температуре, разлагается при 133°.
ПЕРЕКИСИ АЦИЛОВ С ГЕТЕРОЦИКЛИЧЕСКИМ ЯДРОМ
Известны две перекиси этой группы:
а) перекись ликотинила [49] (с ядром пиридина),
плавящаяся при 88 -89°
б) перекись фуроила [50] (с ядром фурана), плавя-
щаяся при 86°
О О
II—С—О—O-C-II II
хсг Чу
представляет собой красивые белые иголочки, быстро
желтеющие на воздухе и легко взрывающие при трении
и нагревании.
Перекиси — производные кислот
65
Б, ПЕРЕКИСИ - ПРОИЗВОДНЫЕ ДВУХОСНОВНЫХ
КИСЛОТ
Перекиси — производные двухосновных кислот можно
разделить на две группы:
1. Пераксидикислоты общей формулы
НО—С—(СН2) -С-О—О—(СН2)0/—с—он
il р И Р !!
0 0 о
(р и р' могут быть равны или не равны). Эти вещества
можно рассматривать как смешанные ангидриды двух-
основной дикарбоповой кислоты и двухосновной гидро-
пероксикарбоновой кислоты.
2. Циклические перекиси общей формулы
О О
II II
С-(СН2)„-С
! I
О_—-—о
которые можно рассматривать как внутренние ангид-
риды двухосновной кислоты с одной функцией пер-
кислоты.
ПЕРОКСИДИКИСЛОТЫ [33]
Общие сведения
Этот тип кислот получают действием перекиси водо-
рода в щелочном или нейтральном растворе на соответ-
ствующий ангидрид.
Реакция протекает в две стадии.
Сначала происходит образование моноперкислоты,
которая, реагируя с избытком ангидрида, дает уже
пероксидпкислоту.
В зависимости от взятых соотношений перекиси водо-
рода и ангидрида получают тот или другой тип соедине-
ния. Так, пер оке иди фталевую, пероксиянтарную и
пероксиглутаровую кислоты можно получить при приме-
нении избытка соответствующего ангидрида.
5 Зак. 1925
66
Органические перекиси
ПЕРОКСИДИФТАЛЕВАЯ КИСЛОТА [33а]
НООС о О СООН
Синтез
К охлажденной во льду и энергично перемешиваемой
смеси 60 мл 3 %-ной перекиси водорода и 30 мл 10%-ного
едкого натра малыми порциями добавляют 9 г фтале-
вого ангидрида. После нейтрализации разбавленной сер-
ной кислотой промывают водой до нейтральной реакции
и сушат в вакууме при комнатной температуре.
Свойства
Белое вещество, кристаллизующееся в виде игл, с
т. пл. 156°. Очень пдохо растворимо в органических рас-
творителях, растворяется в концентрированном растворе
соды.
Устойчиво при обычной температуре. Взрывает при
нагревании или действии восстановителей, таких, как
анилин и фенилгидразин.
ПЕРОКСИДИЯНТАРНАЯ КИСЛОТА [33]
НО-С—СН2-СН2—С. О -О—С—СН2—СН2—С—ОН
II il II II
О о о о
Синтез
10 г янтарного ангидрида добавляют малыми пор-
циями к 25 мл 7,5%-ной перекиси водорода при энергич-
ном перемешивании. Примерно через 35 мин. темпе-
ратура перестает повышаться, что свидетельствует
Перекиси — производные кислот
67
о растворении всего ангидрида. Твердый осадок филь-
труют, промывают несколько раз водой и сушат в ва-
кууме до постоянного веса.
Свойства
Вещество представляет собой неправильные кристал-
лические пластинки, съеживающиеся при 115° и
плавящиеся при 128° (с разложением), взрывающие
в пламени, но мало чувствительные к толчкам и трению.
Довольно хорошо растворимо в воде, спирте и ацетоне,
мало — в эфире.
Реагирует е йодистым калием энергичнее, чем другие
перекиси этого типа.
ПЕРОКСИДИГЛУТАРОВАЯ КИСЛОТА [33]
МО—С-(СН2)3—С—О—О—С—(СН2)3—С—он
II 'I II II
0 0 0 0
Синтез
3 г глутарового ангидрида растворяют в б мл 8 %-ной
перекиси водорода. По охлаждении выкристаллизовы-
вается пероксидпкислота.
Свойства
Плавится при 108*’ с разложением.
Растворима в спирте и ацетоне, умеренно — в эфире,
плохо —в бензоле и хлороформе.
СМЕШАННАЯ ЯНТАРНОГЛУТАРОВАЯ ПЕРОКСИДИКИСЛОТА [33]
НО - С (С[]2)з С -0-0 С-(СНг)г-С—он
II I,- 1 II
0 0 0 0
Получена действием моноперянтарной кислоты па
глутаровый ангидрид. Спекается при 155°, плавится при
167°. Растворима в спирте и ацетоне, умеренно —
в эфире.
5*
68
Органические перекиси
АЛКИЛ ПЕРОКСИД НКАрБОН АТЫ [40]
RQ—С—О—О—С—OR'
I! II
О О
Эти соединения приготовляют действием хлор-
муравьиного эфира на перекись натрия в водной среде
при низкой температуре.
Реакция протекает по уравнению
О О
II и
C1-G -OR О—С—OR
На2О2 -J- —> | -|-2NaC[
Cl -C-OR' O-C—OR'
II II
О о
Это вещества очень легко взрывающие от толчка и
нагревания и спонтанно разлагающиеся при комнатной
температуре.
Они растворимы в органических растворителях и
слабо растворимы в воде.
ЦИКЛИЧЕСКИЕ ПЕРЕКИСИ
О О
II II
С-(СН2)р-С
I I
О---------о
Это аморфные порошки, часто неплавкие, мало
растворимые в органических растворителях, способные
более или менее сильно взрывать при механических
воздействиях (толчок, трение) и при действии восстано-
вителей — анилина, фенилгидразина.
Их получают, как и перекиси ацилов, действием хлор-
ангидрида двухосновной кислоты на перекись водорода
в щелочной среде (или на водный раствор перекиси
натрия).
Перекиси — производные кислот
•69
ПЕРЕКИСЬ СУКЦИНИЛА [32г]
О
II
Н2С—с о
I I
HjC-C-0
II
о
Белое кристаллическое вещество, не растворимое
в обычных органических растворителях.
Перекись довольно устойчива при обычной темпера-
туре, но сильно взрывает при температуре около 100°,
а также при толчке и трении как очень сильное бризант-
ное вещество. Перекись также сильно взрывает при
действии анилина и фенилгидразина.
ПЕРЕКИСЬ ФТАЛИЛА [45]
Бесцветный порошок, не растворимый в органических
растворителях, плавящийся при 135° (с разложением),
взрывает при нагревании ц особенно при толчке.
ПЕРЕКИСЬ КАМФОРИЛА [Зга]
СН3
Эта перекись малорастворима в спирте и эфире. Пла-
вится при 42°. Слабо взрывчата.
70
Органические перекиси
ПЕРЕКИСЬ ЦИКЛО ПРОПАН-1,2-ДИ КАРБОНОВОЙ КИСЛОТЫ [З’д]
О
II
СН—С—О
сн/1 I
хсн—с—о
II
о
Малорастворима в органических растворителях. Пла-
вится при 93° (с разложением). Быстро нагретая, она
взрывает при 63° Чувствительна к толчкам.
ПЕРЕКИСЬ ФУМАРИЛА [Sir]
о
I
си-с--о
' I
СН—С О
I
О
Это белый не растворимый ли в одном из органиче-
ских растворителей порошок, лишь слегка взрывающий
при 80°. Таким образом, он менее взрывчат, чем перекись
сукцинила. Тем не менее с крепкой серной кислотой и
с фенилгидразипом перекись фумарнла реагирует ана-
логично перекиси сукцинила.
ЛИТЕРАТУРА
32а. В з у с г A., V i I 1 i g е г V., Вег., 34, 7С2 (1901).
326. Vanino [I., Thiele Е., Вег., 29, 1724 (1896).
32в. F i с h е г F., S р i е 1 b е г g Н., He]v. Chiin. Acta, 12, 1152 (1929).
41a. Net F., Ann. Cheni., 298, 287 (1897).
416. Gainbarj an S.r Ber., 42, 4003 (1909).
42. V a n i n о I.., Uhl folder E., Ber , 33, 1043 (1909).
43. Clover M., These doctoral Ann Arbor (1914).
44. Fichter F., Zumbrunn, Helv. Chim. Acla, 10, 869 (1927).
45. Pecliman H., Vanino L., Ber., 27, 1510 (1894).
46. С 1 а г k e T., The Massachusetts first. Tech., Cambridge (1948).
47. Swain G., Slock ma у er W., Clarke J., J. Am. Cheni. Soc.,
72, 5426 (1950).
48. Пат. США 2379390, 26/VI, 1945.
49. M i I a s M., Panagiotakos P., J. Am. Cliem. Soc. 62, ] 878
(1940).
fjO. Milas N., A levy A.. J. Am. Cheni. Soc., 56, 1219 (1934),
f Л А В Л viJ
ПЕРЕКИСИ — ПРОИЗВОДНЫЕ
АЛЬДЕГИДОВ И КЕТОНОВ
ОБЩИЕ СВЕДЕНИЯ
Действие перекиси водорода на альдегиды и кетоны
Альдегиды и кетоны могут присоединять перекись во-
дорода, образуя сначала а-оксигидроперекиси
ОН ОН
I I
R—С—О—ОН или Rf—С—О - ОН
I I
Н R2
Они в свою очередь могут:
I. Реагировать с избытком альдегида или кетона,
образуя диоксиперекись
ОН ОН ОН
I 1 I
R—С—O-OH-f-O^C-R —> R—С—О—О—С --R ,
I 111
И Н НН
а последняя в результате последующей дегидратации
в присутствии обезвоживающего вещества, подобного
Р2О5, может образовать диозонид
R—СП О- -O-CH-R
1 ОН 1 он R—СП- О—О—CH-R 1 1 О о
он i он 1 1 1 R—СН-О- 0—CH—R
R СП -О—О—СП -R
72
Органические перекиси
2. Претерпеть внутримолекулярные конденсации, при-
водящие последовательно к
а) оксигидроперекиси
ОН ноо он ноо
I [ I I
R—С—ООН Н- НО—С—R —> R—С- -о—О—C-R
I I ! I
Н НИН
б) диперекиси
ОН НОО
1 I ,0-0.
R—С—O-O-C-R —> R—С< ;С—R
I [ [хо-о/I
Н II н н
в) циклической триперекпсн
,0Н
R—СН-;
ООН
НОО.
)CHR
но
НО. /°011
хсн
г) полимерной перекиси с
нами в качестве концевых
окси- и гидропероксигруп-
Н н Н
I I I
ноо—с—он-рноо—с—oit-j-ноо—с—он —>
I I I
R I? R
н н н
I I I
—> НОО—С—О—О—С-О—О—С—он
I i I
R R R
3. Отщепить воду за счет обеих функций окси- и
гидроперокси, стоящих у одного атома углерода, и
Перекиси — производные альдегидов и кетонов
73
таким путем образовать внутреннюю неустойчивую пере-
кись
,О Ri .О
R—С( | или /С/ |
| ХО Rs/ ХО
Н
которая претерпевает изомеризации и внутренние окис-
ления.
В действительности, внутренняя перекись
является изомером каждого из эфиров
R1—С—ОЙ2 Rs—С—OR1
II и |)
О О
I и соответствующего оксикетона. Например, перекись
изомерна метилацетату и ацетолу
НОСН2-С—СН3
О
Равным образом, внутренняя перекись
,О
R—СИ/ |
'о
изомерна кислоте
R_С—ОН
11
О
и соответствующему оксиальдегиду.
74
Органические перекиси
Действие гидроперекисей на альдегиды и кетоны
Конденсируя в среде абсолютного эфира альдегиды
и гидроперекиси, получают монооксиперекисн
Н Н
I I
R1—С—О+НОО—R2 —> К'-С-О—О—R3
I
ОН
С кетонами такая реакция приводит к диперекисям
R2 R2
1 I
R1—C-O-OR3 —► R1—С—О—OR3
I I
ОН -I- О—OR3
HOOR3
ПЕРЕКИСИ — ПРОИЗВОДНЫЕ АЛЬДЕГИДОВ
Среди перекисей— производных альдегидов — из-
вестны следующие.
I. Несколько мопооксигидроперекисей.
2. Некоторое количество монокси- и диокси пере-
кисей.
3. Несколько диперскисей (димерных перекисей).
4. Одна триперекись (гримерная перекись).
МОНООКСИГИДРОПЕРЕКИСИ
/ОН
R—С-О—он
н
Эти соединения получают действием перекиси водо-
рода на альдегиды пои комнатной температуре в среде
абсолютного эфира. Первые члены ряда получаются
трудно, так как реакция заходит дальше с образованием
диокси-бнс-перекиссй.
Оксигидропсрскись метана
Н /ОН
Hz ZOOH
11 ерекиси — производные альдегидов и кетонов 75
получена действием безводного формальдегида на пере-
кись водорода. Взрывает в пламени. Члены ряда Ст—С)2
легко получаются в кристаллическом состоянии. Несмо-
тря на разницу молекулярных весов, их температуры
плавления очень близки: для С? 46° и для Cia 67°.
Моно-а-оксигидроперскиси способны путем элимини-
рования воды превращаться в кислоты (по механизму,
рассмотренному ниже). Так, при выдерживании в состоя-
нии расплава или будучи нагреты в ледяной уксусной
кислоте в присутствии Р2О5 они образуют заметные ко-
личества кислот.
Это явление представляет большой интерес с точки
зрения гидролитического разложения озонидов, для ко-
торых мопо-а-оксигидроперекиси — промежуточные про-
дукты синтеза.
ДИОКСИПЕРЕКИСИ
R R'
1 I
НО—С—О -О--С—ОН
I 1
н н
Перекиси этого типа образуются при действии пере-
киси водорода на альдегиды в присутствии избытка
последних.
Первые члены ряда взрывчаты. Симметричные диокси-
перекиси (R = R'), в которых R от СтН^ до Ci2H25
тверды и не взрывчаты. При нагревании с водой они ре-
генерируют Исходный альдегид и'перекись водорода. Эта
реакция катализируется как кислотами, так и разбавлен-
ными щелочами.
Обработанные сильными обезвоживающими веще-
ствами, подобными фосфорному ангидриду, они обра-
зуют озониды и диозониды (аналогично первый этап
гидролиза озонидов есть образование диоксипере.-
кисей).
Рассмотрим следующие отдельные представители
этого класса.
а) Диоксиперекись формальдегида HOCHsOOCHaOH
[51а, 6} Эго вещество образуется при медленном его-
76
Органические перекиси
рании эфира. Оно растворимо в воде и в органических
растворителях. Устойчивое ио отношению к кислотам,
оно неустойчиво к щелочам. Плавится при 51°, взрывает
при толчке и нагревании.
6) Диоксиперекись ацетальдегида [52а]. Ее получают
действием 10%-ной перекиси водорода на ацетальдегид
в присутствии серной кислоты. Выделяется масло, которое
по охлаждении застывает в кристаллы, плавящиеся
при 100°, Сильно взрывает при толчке и нагревании.
в) Диоксиперекись хлораля [526]
СС13 cci3
i I
НО—СН—О—О—СН— он
Это вещество получают, окисляя хлораль персульфатом
калия в серной кислоте. К смеси 5 г хлораля и 10 г
персульфата калия, охлажденной во льду, добавляют
50 г H2SO4. Кристаллизация начинается мгновенно и за-
вершается через 3 часа. Обрабатывают эфиром и высу-
шивают в вакууме. Всшество можно перекристаллизо-
вать из бензола или хлороформа. Оно представляет со-
бой гексагональные таблички с т. пл. 122°. Очень плохо
растворимо в спирте, эфире и эфирах уксусной кислоты;
растворимо в бензоле и хлороформе.
т) Диоксиперекись бензальдегида [526]
CSH5—СН—О—О—СН—С6Н6
I I
он он
Синтез
2—3 г 30%-ной перекиси водорода медленно доба-
вляют к 10 г бензальдегида. Температура массы должна
быть около 5°, По окончании прибавления перекиси во-
дорода смесь оставляют на 1 час при комнатной темпе-
ратуре (не выше 30°). Смесь обрабатывают холодным
эфиром, отсасывают кристаллы, промывая эфиром до
полного удаления бензальдегида.
Перекиси — производные альдегидов и кетонов
11
Свойства
Вещество плавится при 60—62°, нерастворимо в воде,
холодном эфире и лигроине. Может быть перекристалли-
зовано из бензола. Разлагается при 70°.
МО1ГО-«-ОКСИПЕРЕКИСИ [Ш]
Синтез
Этот тип перекисей получают действием альдегидов
па гидроперекиси. Стехиометрическую смесь альдегида
и гидроперекиси в виде 5%-ного эфирного раствора оста-
вляют при комнатной температуре на сутки. После
удаления эфира в вакууме при комнатной температуре
фракционированной перегонкой также в вакууме выде-
ляют монооксиперскпсь из смеси.
Свойства
Монооксиперскиси имеют большую плотность и менее
взрывчаты, чем перекиси алкилов. Напротив, они очень
чувствительны к щелочам, при действии которых обра-
зуются соответствующие кислоты и спирты по уравнению
R1—СЛ—-О—О—R2NaOU —> R1—С—ONa 4-R2OHHSO
I II
ОН о
Главнейшие моно-а-окси перекиси и их константы приве-
дены в табл. 15.
ДИПЕРЕКИСИ
Перекись этил идеи а, или димерная
перекись ацетальдегида [54а]
,О—Сд
снэ—d>[ сн-снз
\о—о/
Синтез
Эту перекись синтезируют действием перекиси водо-
рода на ацетальдегид в присутствии обезвоживающих
средств.
Переписи — производные альдегидов и кетонов 79
5
Монооксиперекнси алкилов [556]
Смесь 1 моля перекиси водорода, 2 молей ацеталь-
дегида и безводного сернокислого натрия оставляют на
двое суток. Фильтруют, добавляют па каждые 200 мл
20 г фосфорного ангидрида и оставляют стоять 15 дней
при 0°. Перегоняют в вакууме. Образующийся одновре-
менно озонид бутена-2
СН3 -CH--0 -О-СН-СНЯ
I I
О о
I 1
СНЭ—СН—О—О—СИ—сн3
перегоняется при 40—45'715 мм. Маслянистый остаток по
охлаждении закристаллизовывается.
Свойства
Плавящееся при 63° это вещество исключительно
взрывчато, очень сильно детонирует при нагревании и
обладает сильными бризантными свойствами.
Димерная перекись бензальдегида [52в]
/0-0
CSH6-CIJ< )сн-с6н6
ХО—о/
Синтез
Эту перекись можно получить действием перекиси
водорода па бензальдегид в присутствии серной кислоты.
К охлажденной смеси 50 а 2,6 %-ной перекиси водо-
рода, 50 г спирта и 200 г серной кислоты добавляют
7,5 г бензальдегида.
Сначала появляется муть, затем выделяются кри-
сталлы перекиси. Очищают кристаллизацией из спирта.
Свойства
Эта перекись легко растворима в теплых хлороформе,
ледяной уксусной кислоте, спирте, эфире, из которых она
перекристаллизовывается в призмах или иглах с
д. ПЛ. 202°,
80
Органические перекиси
ТРИМЕРНАЯ ПЕРЕКИСЬ ПРОПНЛИДЕНА ИЛИ ПРОПАНАЛЯ [556]
/О--------0
СН,—СН2—CH CH-CHj—сн3
\> О'7
ХО с/
\'к
I
сн2
I
сн,
Синтез
Эту перекись можно приготовить действием перекиси
водорода на пропионовый альдегид в эфирном растворе
в присутствии обезвоживающих средств.
Стехиометрическую смесь перекиси водорода, эфир-
ного раствора пропаналя с 20 г фосфорного ангидрида
на каждые 200 ял оставляют на леднике в течение
8 дней. Эфир отгоняют под уменьшенным давлением
при 20°, а затем перегоняют при 15 мм: 1 час при
60—70° и 2 часа при 90—95° для удаления диозонида
пропилена, также образующегося при этой реакции.
Свойства
Эта перекись представляет собой вязкое масло кон-
систенции глицерина. Она в высшей степени взрывчата,
будучи крайне чувствительна, к толчкам и трению.
ПЕРЕКИСИ — ПРОИЗВОДНЫЕ КЕТОНОВ
Общие сведения
Среди перекисей — производных жирных кетонов —
более тщательно изучены первые члены ряда—димер-
ные и тримерные перекиси. В противоположность альде-
гидам неизвестны диоксиперекиси — производные ке-
тонов.
Перекиси. — производные альдегидов и кетонов
81
Перекиси — производные ароматических кетонов —
трудно получаются нормальным путем, так как вслед-
ствие подвижности ароматических групп эти вещества
способны к изомеризации.
Напротив, известно большое число перекисей цикла-
нонов, например циклогексанона.
Подводя итог изучению окисления кетонов перекисью
водорода в кислой среде, Пастюро [56] пришел к сле-
дующим выводам:
1. Алифатические монокетоны образуют всегда пере-
кись и а-оксикетон.
2. Алифатические дикетоны дают высокополимерные
перекиси в виде стеклообразной массы, очень взрывчатые.
3. Мопокетоны, имеющие ароматическое ядро в со-
седстве с карбонильной группой, образуют оксикетон
и ароматическую кислоту, по дают лишь следы перекиси
или вовсе ее не дают.
Так, ацетофенон CgHsCOCHs образует а-окси ацето-
фенон СН5СОСНзОН и бензойную кислоту.
ПЕРЕКИСИ --ПРОИЗВОДНЫЕ АЛИФАТИЧЕСКИХ
КЕТОНОВ
ДИПЕРЕКИСЬ АЦЕТОНА [Й7а, б, в, г}
СН3 /О-О. /СН3
)С< )С<
СНв/ Х'О—0-' чсн,
Синтез
Принцип метода состоит в окислении ацетона пере-
кисью водорода или персульфатом щелочного металла
в присутствии дегидратирующего средства, подобного
серной кислоте или уксусному ангидриду.
Метод Пастюро [57в]. К энергично перемешиваемой
и охлаждаемой льдом смеси 50 мл чистой серной кис-
лоты и 10 объемов перекиси водорода добавляют по
каплям 25 мл ацетона. Через 3—5 мин. образуется твер-
дый осадок диперекиси ацетона, которую отсасывают,
промывают холодной дистиллированной водой до нейт-
ральной реакции и сушат в вакууме при комнатной
температуре. Вещество можно очистить возгонкой
при 70°.
6 Зак. 1925.
82
Органические перекиси
При этой реакции образуется также в соответ-
ствии с объясненным выше механизмом оксиацетон
НОСНгСОСНз и продукт его дальнейшего окисления —
пировиноградная кислота СН3—СО—СООН. Побочные
продукты идентифицируют следующим образом: нейтра-
лизуют фильтрат содой; удаляют ацетон отгонкой при
температуре бани 60—80°; отгоняют оксиацетон с во-
дяным паром; выделяют пировинограднокислый натрий
из остатка от выпаривания досуха на водяной бане.
Из 100 г ацетона получается 21 г диперекиси ацетона,
33 г оксиацетона и 75 а пировиноградной кислоты.
Метод Дильтея [57г]. К сильно охлажденной и пере-
мешиваемой смеси 25 г 30 %-ной перекиси водорода, 20 г
96% -ной серной кислоты и 50 г уксусного ангидрида
добавляют по каплям смесь 20 г ацетона и 20 а ледяной
уксусной кислоты, не допуская подъема температуры
выше 15°. Выделяются бесцветные кристаллы, которые
можно перекристаллизовать из уксусноэтиловот эфира.
Получают 10 г перекиси.
Метод Байера и Виллиджера [57а]. Эти авторы полу-
чили диперекись ацетона действием кислоты Каро на
смесь ацетона и эфира.
Свойства
Белый кристаллический порошок, плавящийся при
132°, не растворимый в воде, мало растворимый в орга-
нических растворителях, сильно взрывающий при толчке
и нагревании.
ТРИПЕРЕКИСЬ АЦЕТОНА [58J
Перекиси — производные альдегидов и кетонов 83
Синтез
Смесь ацетона с 10%-ной перекисью водорода оста-
вляют при комнатной температуре на несколько дней.
Перекись выделяется в твердом виде. Можно ускорить
ее образование, работая при низкой температуре (—15°,
—20°) в присутствии небольшого количества НС1.
Свойства
Вещество представляет собою белый кристаллический
порошок, плавящийся при 97°. Нерастворим в воде,
слабо растворим в органических растворителях (бензол,
ацетон, эфир). Вещество чрезвычайно взрывчато. Оно
очень чувствительно к толчку, трению и обладает боль-
шой бризантной силой..
ДИПЕРЕКИСЬ МЕТИЛЭТИЛКЕТОНA [57r, 5В]
Синтез
Метод Пастюро. К энергично перемешиваемой и
охлаждаемой смеси 800 мл перекиси водорода (10 объе-
мов) и 400 мл серной кислоты добавляют 40 мл метил-
этилкетона. Перекись собирается в виде верхнего масля-
нистого бесцветного слоя; после декантации и промы-
вания до нейтральной реакции ее перегоняют с паром и
сушат в вакууме при 100°.
Метод Дильтея. К сильно охлаждаемой смеси 50 г
30%-ной перекиси водорода, 40 г 95%-пой серной кис-
лоты и 30 г уксусного ангидрида прибавляют по каплям
29 г мстилэтнлкетона, растворенного в 20 мл ледяной
уксусной кислоты. Оставляют на ночь при комнатной
температуре. Отделяется маслянистый слой, который
промывают до нейтральной реакции и сушат. Непрореа-
гировавший метилэтилкетон удаляют отгонкой в вакууме
(20 мм, температура <50°).
6*
84
Органические перекиси
Свойства
Перекись метилэтилкетона— бесцветная маслянистая
жидкость приятного janaxa с плотностью 1,042 при 15°,
устойчивая при комнатной температуре, но очень взрыв-
чатая выше 100°.
Она широко используется при винильных полимери-
зациях, особенно при получении полиэфиров, в виде пре-
парата луперсоль, который представляет собой раствор
этой перекиси в дибугилфталате.
Диперскиси пропиткетона (т. пл. 47—48’) и бензил-
ацетона (т. пл. 102°) были получены действием соответ-
ствующих кетонов на смесь перекиси водорода, уксус-
ного ангидрида и серюй кислоты.
КОНДЕНСАЦИЯ К1ГОПОВ С ГИДРОПЕРЕКИСЯМИ [61}
Конденсация кетонов с гидроперекисями приводит
к диперекисям обшей формулы
.O-OR3
)С(
I17 ХО OR3
(где R1 и R2 — алкилиныс радикалы кетона, a R3 — ал-
кильный радикал гидроперекиси).
Особой известностью пользуются диперекиси — про-
изводные гидроперекиси трет-бутила.
В большинстве случаев это жидкости приятного за-
паха. Их используют 1 качестве инициаторов полимери-
зации.
В табл. 16 приведет главные дпперекиси этого типа
и их показатели прелсмления.
ПЕРЕКИСИ — ПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ КЕТОНОВ
Как мы уже видели, действие перекиси водорода на
ароматические кетоны дает не соответствующие пере-
киси, а только продукты их изомеризации (в частности,
сложные эфиры).
Все же Марвел и Никольс [63] сумели получить,
впрочем с очень малывд выходами (не превышающими
в лучшем случае 10% ), несколько перекисей этого типа.
Перекиси—производные кетонов и гидроперекиси трет-бутила
Органические перекиси
Это было достигнуто следующим путем:
а) действием перегнем водорода на хлориды тина
Лг\с/С1
Аг/ ЧС1
б) действием озона на арилированныс олефины
Аг.
^C^CHR
В последнем случае образовывался озонид
Ai\ .0—0.
>С< ;CHR
Аг' \ /
4 О7
разлагавшийся или на радикал
/0-0—
Аг/ 4
и альдегид R—СН = С, млн па два радикала
Радикалы спаивались в перекись
Полученные таким путем диперекиси значительно бо-
лее стабильны, -чем соответствующие алифатические ди-
перекиси. К их числу относятся следующие диперекиси.
Диперекись бензофенона, плавящаяся между 205 и
215° в зависимости от растворителя, из которого она
перекристаллизована.
Диперекись толилфенилкетона с т. пл. 186—187°.
Диперекись .w-толилфенилкетона, кипящая при
134—13975 мм.
Перекиси—производные альдегидов и кетонов
87
ПЕРЕКИСИ--ПРОИЗВОЛНЫЕ АЛИЦИКЛИЧЕСКИХ КЕТОНОВ
Общие сведения
Среди перекисей этого типа наиболее изучены произ-
водные циклогексанона [62а, б, в, г]. Известно несколько
последних (гримерная, димерная перекиси, диоксипере-
кись, оксигидронероксиперски'сь). Это твердые, не рас-
творимые в воде продукты, растворимые в органических
растворителях, в общем мало взрывчатые.
Продажный продукт состоит из смеси нескольких
перекисей, разделение которой на составные части свя-
зано с трудностями.
Ниже приведены способы получения известных пере-
кисей циклогексанона.
Оксигидропероксиперекись циклогексила
^0—0,^
\„/"'ООН НО/\_/
Т. пл. 78°
Принцип ее получения состоит в действии перекиси
водорода на циклогексанон в эфирном растворе.
10 мл циклогексанона смешивают с 9 мл 30%-ной
перекиси водорода. Мгновенно происходит повышение
температуры до 40°, и при этом образуется гомогенный
раствор. После охлаждения до 25° добавляют 2 мл 2 ц.
соляной кислоты. Появляется и отделяется маслянистый
слой. Через 30 мин, начинается кристаллизация, завер-
шающаяся через 1 час. Через 2 часа перекись отсасы-
вают и промывают 50%-ной уксусной кислотой.
Выход 6,3 г, т. пл. 76°. После высушивания в тече-
ние 7 час. при 45° т, пл. 78°.
бис-Гидропероксиперекись циклогексила
/~\/°----------------------°\/—\
Ч-/ЧООН ноо/4—/
Т. пл. 82—83°
5 мл циклогексанона смешивают с 40 мл 10%-ного
эфирного раствора перекиси водорода, поддерживая
температуру 12°,
88
Органические перекиси
После долгого стояния эфир удаляют и маслянистый
остаток выдерживают при 30° в течение 2 час. Обра-
батывают холодным метиловым спиртом и перекристал-
лизовывают из ледяной уксусной кислоты. Получают
2,8 г перекиси.
Триперекись циклогексанона
О---------_С\
~х~"' \Q o/v_/
'о с/
Q
Т. пл. 83°
10 мл циклогексанона перемешивают с перекисью
водорода до получения гомогенного раствора. Затем
без охлаждения добавляют 5 мл соляной кислоты. Тем-
пература поднимается до 50э, выделяется маслянистый
слой, который собирают после стояния в течение 16 час.
Добавляют 10 мл метанола. Через неделю вещество ва-
кристаллпзовывается. Отсасывают, промывают 80%-ной
уксусной кислотой. Получают вещество, плавящееся ме-
жду 85 и 90°; после нескольких перекристаллизаций
т. пл. 93°. Выход 6 г.
Выделение разных перекисей циклогексанона, ис-
ходя из продажного продукта. [62в]. Продажная пере-
кись циклогексанона — твердое вещество с растянутой
температурой плавления, содержащее смесь разных пе-
рекисей. Наличие подвижного равновесия различных
форм мешает их разделению обычными методами. Вес
же можно достигнуть качественного разделения, приме-
няя описанный ниже прием.
Быстрое добавление воды к метилово-спиртовому
раствору продажного продукта вызывает, судя по тем-
пературе плавления, осаждение оксигидроиероксипере-
киси циклогоксила с выходом 63%,
ч^/ООН НО^/_
\-/\о-------о/\~/
Переписи — производные альдегидов и кетонов
89
Если этот продукт не отфильтровать немедленно,
то он полностью растворяется снова и уже не осаждает-
ся при новом добавлении воды. В водном растворе про-
дажная перекись циклогексанона образует в результате
диссоциации простые формы вплоть до самого циклоге-
ксанона. Диссоциация до перекисей, растворимых в воде,
протекает тем быстрее и полнее, чем выше диэлектри-
ческая константа растворителя.
; В присутствии кислот и щелочей диссоциация проис-
ходит очень быстро.
Купер и Дейвисон [62г], исследуя диссоциацию окси-
гидропероксиперскиси
/--^/ООН НОХ/-^
о/4"- /
в растворе хлороформа и четыреххлористого углерода,
пришли к выводу о существовании равновесия гипоте-
тической 1,1-дигидроиерекиси
х—/чоон
с циклогексаноном; подобным образом обстоит дело
с диоксиперекисью циклогсксила
/"\/0И Н0\/ \
''-о. О/ /
Получение оксигидропероксиперекиси циклогексила
из продажного продукта. К раствору 10 г продажной пе-
рекиси в 100 г метанола добавляют насколько возможно
быстро 60 мл воды, тотчас же фильтруют и сушат под
давлением 1 мм при комнатной температуре в течение
1 часа. Получают твердый продукт с т. пл. 73°.
ЛИТЕРАТУРА
51а. Legler L. Анн. СЬегп., 217, 381 (1882—1883).
516. Legler L.’, Вег., 18, 3343 (1885).
52а. Bayer A., Vi II i ger V., Ber., 33, 2484 (1900).
526. Bayer A., Vi 1 1 i ger V., Ber., 33, 2481 (1900).
52b. Bayer A., V i 1 1 i g e г V., Ber., 33, 2485 (1900).
53. Ncf V„ Anri- Clicm., 298, 292 (1897).
Органические перекиси
54а. Rieche A., Meister R., Вег., 72, 1937 (1939).
546. Rieche A., Meister R, Вег., 72, [940 (1939),
55а. Rieche A, Meister R, Вег. 66, 7)8 (1933).
556. Rieche А., Вег., 63, 2642 (1930).
56. Pastureau J., Bui]. Soc. Chim France, 5, 227 (1909).
57a. Bayer A., V i 11 i g e г V., Ber, 32, 3628 (1899).
576. В a yer'A., ViHiger V, Ber., 33, 124 (1900).
57b. Rastureau J., C. R, Paris, 140, [591 (1905).
57г. Di [they W, J. Prakt. Chem, 154, 219 (1939—1940).
58. Wolf enstein K, Ber, 28, 2265 (1895).
59. Pastureau J„ C. R, Paris, 144, 90 (1907).
60. Pastureau J, C. R., Paris, 143, 967 (1906).
61. D t с к e у F, Rust F, Vaughan W., J. Am. Chem. Soc, 71,
1432 (1949).
62a. Harris S., P a n a gi о t a к os P, J. Am. Cheni. Soc, 71,
2430 (1949).
626. Criegee ]?,, Ami. Chem, 560, 138 (1948).
62b. Northrop B, J. Am. Chem. S:ic, 77, 1/56 (1955).
62r. Cooper W, Davison E, J. Chem. Soc, 1180 (1952).
63. Marvel C, Nichol s V, J. Am. Cheni. Soc, 60, 1455 (1938),
ГЛАВА VIII
ТРАНСАННУЛЯРНЫЕ ПЕРЕКИСИ [64]
ОБЩИЕ СВЕДЕНИЯ
Эндоперекисями, или трансаннулярными перекисями,
называют соединения с перекисным мостом внутри
цикла.
Обычно это бензольный или циклогексеновый цикл
(до настоящего времени известно лишь одно исключе-
ние: эидоиерекись ментана, содержащая насыщенный
цикл).
Эндоперекиси образуются при действии кислорода на
циклические углеводороды, обладающие двумя сопря-
женными двойными связями. Можно допустить, что мо-
лекула кислорода фиксируется сначала одной двойной
связью и затем следует молекулярная перегруппировка
по схеме
Эндоперекиси обнаруживают ряд характерных реак-
ций.
I. Каталитическое гидрирование
В результате каталитического гидрирования эндо-
псрскиси превращаются в диолы, природа которых за-
висит от примененного катализатора. Можно осуществить
гидрирование:
а) только перекисного моста (в этом случае обра-
зуется циклогскссновый диол);
б) моста и двойной связи (при этом получается цик-
лановый диол),
92
Органические перекиси
2. Действие нагревания и различных катализаторов
Под действием нагревания или некоторых катализа-
торов эндоперекиси претерпевают различные изомери-
зации.
Сначала происходит превращение перекисного моста
в окисный *, причем освобождающийся кислород может
фиксироваться двойной связью кольца с образованием
эпоксисоединения, в свою очередь способного изомери-
зоваться в кетон
Наконец, известное количество трансаннулярных пе-
рекисей, как, например, некоторые перекиси антрацено-
вого и нафтаценового ряда (перекись рубена), способно
к обратимой термической диссоциации **.
Эндоперекиси можно разделить на две большие
группы.
1, Эндоперекиси терпенов (например, аскаридол).
2. Эндоперекиси многоядерные, в свою очередь раз-
деляемые на следующие группы:
а) эндоперекиси с фенантреновым ядром, относя-
щиеся к стеринам (например, перекиси холестадисна,
эргостерина);
б) эндоперекиси с антраценовым ядром;
в) эндоперекиси с нафтаценовым ядром (перекись
рубена).
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
ВНУТРЕННЯЯ ПЕРЕКИСЬ ЦИКЛОГЕКСЕНА [65]
* Правильнее— простои эфирный. — Прим. ред.
** Т. е. на молекулярный кислород и неходкий углеводород. —
Прим. ред.
Трансаннулярные перекиси
93
Следы ее получают окислением циклогексадиена то-
ком кислорода при комнатной температуре. Затем про-
изводят перегонку в вакууме при 0,3 мм. Перекись пред-
ставляет собой желтые кристаллы с т. пл. 82—83°.
Основная часть продукта окисления состоит из непере-
гоняющейся полимерной перекиси.
АСКАРИДОЛ, ИЛИ ЭНДОПЕРЕКИСЬ «-ТЕРПИНЕНА [64, 6fla, б, в]
Аскаридол—главная составная часть (вместе с «-ци-
молом) глистогонного масла chenopodium, из которого
это вещество можно выделить фракционированной пере-
гонкой в вакууме. Это маслянистая жидкость с неприят-
ным запахом, кипящая при 83°/4—5 льщ бурно разла-
гающаяся при 130°. Нагретый в инертном растворителе
аскаридол превращается в эпоксисосдиненне
Н3С сн3
Его строение, установленное В аллахом [666] и Нел-
соном [66в], следует из природы продуктов его катали-
тического гидрирования.
94
Органические перекиси
1. В присутствии коллоидального палладия в ре-
зультате гидрирования и перекисного моста и двойной
связи получается /?-мептандиол-1,4
СН3
J—ОН
f !
ch
н3с сн3
2, В присутствии палладия, насыщенного водородом,
гидрируется только перекисный мост с образованием
м-ментендиола-1, 4
СН3
L ОН
и
Y ОН
сн
н3с сн3
3. В присутствии окиси платины гидрируется только
двойная связь, перекисный мост остается нетронутым,
и образуется дигидроаскаридол — эндоперекись л-мен-
тана
Н3С СН,
Трансаннулярные перекиси
95
Интересно отметить, что а-терпинен можно окислить
в аскаридол только на солнечном свету в присутствии
хлорофилла, тогда как прямое окисление приводит
к получению только полимерной перекиси.
ЭНДОПЕРЕКИСИ С ФЕНАНТРЕНОВЫМ ЯДРОМ
Изолирование этих эндоперекисей тесно связано с ис-
следованиями по получению витамина D из эргостерина.
В ходе этих исследований были выделены эидопере-
киси эргостерина, дегидроэргостерина, дегидрохолесте-
рина и холестадиена. Это твердые вещества, легко кри-
сталлизующиеся, достаточно устойчивые при нагревании,
легко изомеризующиеся в эпоксисоединения и в кетоны.
ЭНДОПЕРЕКИСЬ ЭРГОСТЕРИНА [67]
Синтез
Принцип метода состоит в окислении спиртового
раствора эргостерина в присутствии эозина при нагре-
вании и освещении.
4 г эргостерина растворяют в 1200 мл 95%-ного спир-
та, добавляют 6 мг эозина, пропускают медленный ток
кислорода, поддерживая температуру 60° и освещая лам-
пой в 200 вт. Окисление завершается за 3 часа, Концен-
трируют до малого объема в вакууме. Фильтруют и не-
сколько раз перекристаллизовывают из спирта до т. пл.
178°,
Выход 70%.
96
Органические перекиси
Свойства
Эидоперекись эргостерина умеренно растворима
в эфире, ацетоне и спирте. Кристаллизуется из спирта и
ацетона в виде очень крупных призм. Раствор в хлоро-
форме окрашивается в фиолетовый цвет при действии
AsCl3, в бур о-фиолетовый при действии SbCl3 и в вин-
но-красный при действии SnClj.
Перекись устойчива до 170°, при температуре 185—
190° протекает изомеризация в изомер, не имеющий
свойств перекиси. Очевидно, происходит разрыв пере-
кисного моста и присоединение атома кислорода по
двойной связи.
ЭИДОПЕРЕКИСЬ ДЕГИДРОЭРГОСТЕРИНА [08]
Эта перекись, полученная способом, аналогичным
описанному для эргостерина, представляет собой кри-
сталлы, плавящиеся при 158° (дегидроэргостерин полу-
чается из эргостерина дегидрогенизацией при помощи
ацетата ртути),
ЭИДОПЕРЕКИСЬ ДЕГИДРОХОЛЕСТЕРИНА [6»[
Трансаннулярные перекиси
97
Синтез
В раствор 450 лгг дегпдрохолестерина, 0,5 л г эози-
на в 400 мл спирта пропускают ток кислорода при сол-
нечном освещении. По испарении спирта при 40° кри-
сталлизуется перекись, плавящаяся при (52э.
Свойства
Хорошо растворима в бензоле, эфире и спирте, кри-
сталлизуется из спирта в прекрасных кристаллах с
т. пл. 152°.
ЭИДОПЕРЕКИСЬ ХОЛЕСТАДИЕНА [84]
Окисление холестадиепа (полученного дегидратацией
холестерина над AhOj имеет интересные особенности.
В действительности, если окисление происходит при
облучении светом электрической лампы (лампа .Мазда
200 вг), то получается эидоперекись с т. пл. ИЗ—114е,
тогда как на солнечном свету образуется изомерный ей
кетон с т. пл, 1725,
Равным образом эидоперекись при облучении солнеч-
ным светом превращается в тот же кетон (эта изомери-
зация идет через промежуточную стадию образования
эпоксисосдипсния).
ЭНДОПЕРЕКИСИ АНТРАЦЕНОВОГО РЯДА [70а, б, I, г]
Следующие антраценовые перекиси получены фото-
окпсление.м соответствующих углеводородов и отвечают
приведенным ниже формулам;
7 Зак. 1925.
se
Органические переписи
Перекись антра-
цена
[70а1
Перекись мезо-
дцфенилантраиеиа
I7O6I
С6н5 (ХН,
Перекись димет-
окси-1,4-мезоди-
фешыантрацена
!70в1
Перекись
! 1 - д и а нт рила
Что касается склонности к фотоокислению п терми-
ческой устойчивости различных относящихся к этому
классу перекисей, то они зависят от заместителей и
в первую очередь от лезо-заместителей. Значительно
меньше влияние заместителей, расположенных во внеш-
них бензольных ядрах.
Так, наличие антранидьного заместителя в /н<?зо-
положении полностью исключает фотоокисленис антра-
цена, но если ядра антрацена связаны в положении 1,1,
то фотоокисление происходит нормально с образованием
бис-перекиси. Что касается термической диссоциации
полученной перекиси, то наиболее благоприятны арома-
тические заместители. Заместители алкильные, алифа-
тические или гпдроароматические в л-i езо-поло жен ни
Трансаннулярные перекиси
.99
совершенно не благоприятствуют отщеплению кисло-
рода.
Заметим, что перекись диметокси-1,4-дифенилантра-
цена начинает диссоциировать уже при комнатной тем-
пературе.
До настоящего времени не получены фотоперекиси
фенантрена, нафталина и акридина.
ПЕРЕКИСИ НАФТАЦЕНОВОГО РЯДА
Перекись рубена или
тетрафенил нафтацена [70г, 71 а ,б]
Эта перекись образуется фотоокислением (свет есте-
ственный или искусственный) раствора рубена. Темпе-
ратура плавления кристаллической перекиси зависит от
природы растворителя. Устойчивая при обычной темпе-
ратуре, она диссоциирует на исходный углеводород и
кислород при нагревании до температуры 100—200°. Од-
нако реакция не полностью обратима. Можно регенери-
ровать лишь до 80% абсорбированного кислорода. Под
действием эфирного раствора йодистого магния эта пе-
рекись в результате необратимой экзотермической изо-
меризации превращается в изомерную окись (оба кис-
лорода уже не связаны друг с другом), очень стабиль-
ную даже при высокой температуре, соответствующую
формуле Нг.се С.фй
100
Срганичео; tie перекиси
Под влиянием сильных кислот перекись превращается
в псевдоокситетрафенилнафтацеп. плавящийся при 205",
обладающий следующим строением:
Хотя эндоперекиси, за исключением аскаридола, при-
меняемого в фармации н как глистогонное средство, не
нашли практического применения, их значение все же
велико. Они, по-гадимому, служат промежуточными про-
дуктами в многочисленных процессах биологического
окисления, приводящих к образованию терпеновых спир-
тов и кетонов, исходя из соответствующих углеводоро-
дов. Кроме того, ряд перекисей, как, например, пере-
кись рубепа и п=которые перекиси антраценового ряда,
обнаруживают явление обратимой термической диссо-
циации и представляют собой интересный пример со-
единений с лабильной связью кислород — углерод.
ЛИТЕРАТУРА
64. В ergma пи V\. АТ а с. L с а n М.. Chem. Rev. 28, 367 (1941).
65. Hock Н., Depke F„ Вег., 6, 349 (1951).
66a. Bollendorf K., Arch. pilar. Ber., 271, 1 (1933).
666. Wallach O., Ann. Chem., 59, 392 (1912).
66b. Nelson E, J. Am. Chem. Soc., 33, 1404 (1911).
67. W i n d h a us 4, В r n nken J. Ann. Chem., 460, 225 (1928).
68. Windhans A. Li ns erf O„ Ann. Chem.. 465, 157 (1928)1
69. Schenk G., B?r., 69, 2696 (1936).
70a. Dulraisse C. Gerard M. C. R., Paris 201, 428 (1935).
706. Du f f r ai sse C.. Ve I lu z L., C. R., Paris, 208. 1823 (1939).
70b. D u f f r a i s s e C., Velluz L.. C, R., Paris, 201, 280 (1935).
70r. Etienne A., Grignard, 17, 1299 (Masson, 1939).
71a. Dulraisse C., Dull. Soc. Chim. France, 53, 789 (1933).
716. Dulfraisse C., Bull. Soc. Clrim. France, 6, 422 (1939).
ГЛАВА IX
ПОЛИМЕРНЫЕ ПЕРЕКИСИ
Хотя с точки зрения функции эти перекиси относятся
к перекисям алкилов, им посвящена отдельная глава
вследствие особенностей их образования и слишком вы-
сокого молекулярного веса.
Эти вещества представляют собой вязкие жидкости
или твердые вещества, мало растворимые в органических
растворителях и реагирующие с главнейшими реакти-
вами на перекиси (такими, как йодистый калий) очень
неполно. Перекиси эти имеют структуру, отвечающую
общей формуле
I I I I
-О—С —О—О—С—О—О—С—О—О—С—О—
I ' 1 ! I
Имеется три пути получения этих перекисей.
1. Действие перекиси водорода (или кислоты Каро)
на кетоны
Этот способ образования полимерных перекисей уже
был рассмотрен в главе, посвященной перекисным про-
изводным альдегидов и кетонов.
Взят патент на получение смешанной перекиси аце-
тона и этил метил кетон а [72]
СН5--СН3 сн,
I I
---О—С—О—О—С—о------
сн3 сн3
8 Зак. 1925.
102
Органические перекиси
2. Окисление производных моноолефинов общей
формулы
X.
:-С-СН„
или
Х>
>с-сыа
Х2/
(где X — электроотрицательная группа).
а) Бернс и Колсон [73а] получили полимерные пере-
киси общей формулы
X Н X л
II II
---О—С—С—О—О—С—С—О—
II II
Н 1! НН
из виниловых мономеров стирола, винилацетата и ,ме-
тилметакрилата при окислении их кислородом воздуха
ниже 50° и непрерывном удалении избытка мономера
отгонкой в вакууме при 1 льн (выходы очень низки, по-
рядка 0,5 %). Это вещества более или менее смолистые,
сильно взрывающие в пламени. Их строение подтвер-
ждается природой продуктов деструктивной перегонки
и каталитического гидрирования.
Так, полимерная перекись метилметакрилата при де-
структивной перегонке образует формальдегид и мети-
ловый эфир пировиноградной кислоты.
О О—
l! I
сн3—о—с—с—сн3
о о
.1 II
—> СН3—9-С—С—СН3 + СН2О
СН;—О —
При каталитическом гидрировании та же перекись
дает метиловый эфир а, [5-диоксиизомасляиой кислоты
О О— О ОН
I । II
СН5—О—С—С—СН5 СН3—о—с-с—сн3
I I
СНа—о— сн.2он
Иолилгерные перекиси
103
Полимерная перекись стирола дает формальдегид и
бензальдегид при деструктивной перегонке
CSH5 С6Н5
I I
—О—С—СН2—О------> О-С + СН2О
I I
н н
и фснилэтиленгликоль при гидрировании
СВН5 CSH3
J н 1
—О—С—СН2—О— _2Д-> но—с—сн2он
I I
н н
б) Штаудингер [74], окисляя 1, 1-дифепилэтилен
(СбН5)2С = СН2 при комнатной температуре на свету,
получил полимерную перекись
С^Нз С6Н5
I I
—О—С—СНг—О--О—С—сн2—о—о— -
! I
С6н5 СВНВ
Проводя то же окисление при 100—150°, он полу-
чил только продукты разложения перекиси — бензо-
фенон и форм альдегид [66 а, 75].
3. Окисление диеновых углеводородов [66а, 75а, б]
Диеновые углеводороды с сопряженными двойными
связями, подобные 2,3-диметил бутадиену-1,3
СН2=С.__С^СН,
1 I
сн3 сн3
и изопрену
СН2—С—СН=СН2
СН3
образуют при действии кислорода (температура 30—
40°) полимерные перекиси, имеющие вязкую консистсн-
8*
104
Органические перекиси
цию и бурно взрывающие в пламени. Они соответствуют
формулам
СН: СН2
I II
С—СН3 с—сн3
I I
—О—СН2—С—0—0—СН2—С—О— •
I I
сн3 сн3
и
сн2 сн2
II и
СП СИ
_с—сн2—с—о—о—сн2—с—о— •
1 I
сн3 сн3
Циклические диеновые углеводороды с сопряжен-
ными двойнике связями также образуют полимерные
перекиси общей формулы
• -О—/ ^>-0-0—/ О—О—---------
как уже было изложено в предыдущей главе.
Образование полимерных перекисей связано с инги-
бирующим эффектом кислорода при фотохимической и
термической псдимергаации виниловых мономеров [73а].
ЛИТЕРАТУРА
72. Пат. США 251480, Dr Pont de Nemours.
73a. Barnes C., Colson, J. Am. Chem. Soc., 210 (1950).
736. Barnes C.3 J. Am. Chem. Soc., 67, 217 (1945).
74. Stautlinger H., Bar., 59, 1075 (1925).
66a. Bodendorf K., Arch. Phann. Ber., 271, [ (1933).
75a. Kern W., Sullman J., Make. Chem., 7—8, 199 (1951—1952).
756. Kawahara F., J. Ain. Cliem. Soc., 79, 1447 (1957).
ГЛАВА X
ОЗОНИДЫ [76 а, б, в, г, д, е]
ОБЩИЕ СВЕДЕНИЯ
Озонидами называются соединения, соответствующие
формуле
RI /О—О, R3
ус/
R,/ \ о / Xr‘
Их можно рассматривать как простые эфиры диокси-
перекиссй. Два атома углерода и них связаны одновре-
менно с эфирным и перекисным мостом. Их строение
было определенно установлено Рихе и Мейстером [76д]
и основано па следующих соображениях.
1. Имеется аналогия между физическими свойствами
озонидов, с одной стороны, и перекисей алкилов и пере-
кисей оксиалкилов — с другой.
Так, озонид этилена
('[6 О-о сна
походит
а) на перекись метила в том, что касается запаха,
свойств жидкости, низкой температуры кипения, взрыв-
чатого характера (к удару, трению и нагреванию);
б) на оксиперскись метила, мало отличаясь от по-
следней по температуре кипения и плотности.
Подобным образом дело обстоит и с озонидом бути-
лена
СЦ3—сн/0
44 о
>сн-сн3
9 Заа. 1925.
10Р
Органические перекиси
перекисью этила и оксиперекисью этила
СНз—Ci I—С—О—С2Н5
ОН
В табл. 17 сопоставлены некоторые константы этих
трех труни веществ.
Таблица 17
Физические константы некоторых озонидов, перекисей
п оксиперекисей алкилов
Соединение Фирм у,-н "d Т. КПЗ!., :: С.!ММ
Перекись ме- тила CHj—О-О-СН, / О-- о, 0,868 1,3503 13,5/740
Озонид этиле- на 1ЬСф фС1Ь 1,265 1,4099 18/16
Оксиперекись метила HCCHS-O—О--СН3 1,107 1,3956 40/13
Перекись этила сгн5—с -о—сгн5 0,826 1,3701 64/740
Озонид 2, 3-бу- тилена СИ»—сн—о—О- сн—сн3 \у 1,027 1,3844 27/60
Окспперекцсь этила CHj—СН—О—0СгН3 J он 1,029 1,3926 30/20
2. Результаты спектроскопических исследований (по-
глощение в ультрафиолетовой области), выполненных
для озонидов и перекисей, также подтверждают сходство
их структур.
Итак, в озонидах имеется только одна перекисная
группа: третий кислородный атом должен быть связан
с двумя атомами углерода, уже соединенными перекис-
ным мостом, в качестве эфирной функции.
Озониды
101
3, Конечные продукты гидролиза озонидов состоят
из смеси альдегидов, кислот, перекисей и перекиси во-
дорода.
Исследуя процесс гидролиза озонида олеиновой кис-
лоты
НаС—(СН2)7—СН—О—О-СН—(СН2)7—С—ОН
’—о_________________1 11
' о
и изолировав все промежуточные и окончательные про-
дукты, а именно:
а) диоксиперекись
С113—(СН2)7—СН—О—О- СН—(СН2>7—с—он
I i II
он он о
б) пеларгоновую оксигидроперекись
,ОН
СН3 (СНг)7—сн<
хоон
в) азеланновую оксигидроперскись
НО—Ох
)СН— (СН2)7—с—он
но7 ;
о
г) пеларгоновый альдегид
СН5—(СП2)7—сно
д) азелаиновый полуальдегид
О-С— (СН2)Г—С—он
I II
н о
е) пеларгоновую кислоту
С На—(СН2)7—С ООН
ж) азеланновую кислоту
НООС—(СН2)7—СООН
з) перекись водорода.
9*
108
Органические перекиси
Рихе пришел к следующему выводу о способе гидро-
литического разложения озонида общей формулы
R> _с Н—О—О—С Н—R2
-----О---
1. Сначала рвется эфирный мост (но нс перекисный),
что сопровождается фиксацией одной молекулы воды
с образованием диоксиперекиси
R1— СН-О-О—CH—Н2О —+
R1—СИ-О—О —CH—R2
I I
ОН он
2. Второй этап реакции состоит в разрыве перекис-
ного моста, сопровождаемом перегруппировкой с обра-
зованием оксиглдролерскиси я альдегида. Таким обра-
зом, диоксиперскпсь
Н Н
Ri— С—О—С—С—R2
I !
ОН он
может образовать
а)
II
окенгидроперекжь R1—С—О—ОН
I
+ ОН
альдегид R2—С—Н
II
О
н
олсигидроперекьеь 1 R2—С—ООН 1
б) + ОН
альдегид R1—С—Н
II
О
3. Третий этап реакции соссоит в разложении каждой
из этих оксиперекисей в
Озпниды
109
а) кислоту + вода
Н
R1—С—О—ОН — -> R1—С—О-р Н2О
ОН 1 он
б) альдегид + перекись водорода
н
i н
R'—С—О—ОН —> R1—С—О-р Н2О2
ОН
Таким образом, конечные продукты гидролиза озо-
нида несимметричного строения
R1— СН—О—О—CH—R2
1---О----!
альдегидами - в R'—C-O И
R2—С=-0
ЯВЛЯЮТСЯ R1—С-0
кислотами ОН R2 С О 1
ОН
Примечание: Описанный выше путь разложения
озонидов нс единственный. В частности, он неприложим
к три- и тетразамещепным озонидам.
В действительности, а) соответствующие диоксипере-
киси кетонов неизвестны и б) действие перекиси водо-
рода па трехзамещенные олефины приводит прямо
к димерным перекисям (выход этих перекисей, впрочем,
значительно меньше, чем при гидролизе озонидов).
Чтобы объяснить образование димерных перекисей,
исходя из озонидов, необходимо допустить разрыв
по
Органические перекиси
перекисной связи с углеродным атомом, сопровождае-
мый образованней перекиси и альдегида ио схеме
R> ХС-О. R\ /0—0.
)С< >СН-R! —>
1?а/ У / R!/
0х
Этот радикал соединяется с аналогичным радикалом,
образуя димерную перекись
R2/ 'О—О7 \R2
Синтез
Наиболее обынпый способ получения озонидов со-
стоит в действа it озона па соответствующие олефины.
Реакцию осуцсствляюг при низкой температуре
-70°, —80°) в присутствии инертного растворителя,
такого, как хлористый метил или этил. Следует работать
при полном исключении следов влаги. Применяют кисло-
род, содержащий 7—10% озона, тщательно очищенный
при помощи 0,01 н. едкого натра (так как в процессе
получения озона образуется немного NO2) и высушен-
ный фосфорным ангидридом.
Озониды образуются также в результате энергичного
обезвоживания даоксиперекисей. При осуществлении
этих реакций особенно во втором случае образуются
также димерные озониды
R\ ,R3
%С—0—0-С<
RjX | | XR4
О О
R’ I I ,R3
;С—О—О-~С<
R2/ XR4
и полимерные озониды
Р R5 R1 R5
I I I
—О—О—С—О—С—О—О—С—О—С—О—О----------
I I I
R2 R4 R2 R4
Озониды
Ill
которые остаются в виде маслянистых остатков после
отделения мономерных озонидов под уменьшенным да-
влением.
Это маловзрывчатые вещества. При нагревании, од-
нако, они образуют перекиси этилидсна, исключительно
взрывчатые.
МОНООЗОНИДЫ
Это обычно жидкости с резким запахом, взрывчатые
при трении, толчке и особенно в пламени. Они могут
также взрывать при действии раствора щелочи, крепкой
серной кислоты и металлических порошков.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
ОЗОНИД ЭТИЛЕНА
]Ц zo4 .н
)С/
Hz I ; Ж
о —о
Получен действием сухого кислорода с содержанием
7% озона на этилен в растворе хлористого метила при
--70°; при комнатной температуре- жидкость. Темпера-
тура кипения 18716 мм; 1,265.
ОЗОНИД БУТИЛЕНА
//°\
снэ—сн 'сн—сн3
I I
о——о
Получен действием кислорода с содержанием 10%
озона на бутилен при —80D. Жидкость при обычной тем-
пературе; т. кип. 27—28760 мл! и 32765 мм; d™ 1,0270.
112
Органические перекиси
озонид олеиповои кислоты
,О, О
/ \ h
С Н3—(CHS)7—С J 1 СН—(CH.J7—С—011
I
о -—о
Т. пл.Т, плотносгъ 0,892.
озонид бензола
СН о
О-СН'' К СН
I >
о-сн—снх чсн
^о—о
Получен действием кислорода с содержанием 5%
озона на бензол при 5—ПС. Белая аморфная масса,
очень взрывчатая, при гидролизе дающая глиоксаль.
ЛИТЕРАТУРА
76а. Harries С., Вег., 41, 30'1—388 (1908).
766. Harries С, Ann. Chem.. 374, 288 (1910).
76в. Harries С., Ann. Chem., 22, 4)0 (1915).
76г. BrinerE., Schnorf P., Helv. Acta, 12, 154 (1929).
76д. Rieche A., Meister R., Znn. Chem.. 553, 187 (1942).
76e. Long H, Chem. Rev, 27,351 (19401.
ГЛАВА XI
АНАЛИЗ ПЕРЕКИСЕЙ
Во всех аналитических реакциях перекиси реагируют
как окислители; происходит превращение (иногда ча-
стичное) перекисного моста в простой кислородный.
АНАЛИТИЧЕСКАЯ ХАРАКТЕРИСТИКА
Известно пять характерных качественных реакций
на перекиси.
Выделение йода при действии йодидов щелочных
металлов
К ацетоновому раствору перекиси добавляют не-
сколько капель водного 40%-ного раствора йодистого
натрия. Появляется желтое окрашивание, интенсивность
которого возрастает со временем. Хотя эта реакция
с переписями алкилов протекает медленнее, чем с дру-
гими перекисями, все же она характерна для всех типов
перекисей.
Действие лейкопроизводного фенолфталеина
с регенерацией окрашенной формы
Смесь 1 г фенолфталеина, 5 а цинковой пыли, 10 г
NaOH и 20 мл воды нагревают с обратным холодиль-
ником в течение 2 час. до обесцвечивания. Фильтруют
по охлаждении и к фильтрату добавляют 500 мл воды.
Реактив сохраняют в темноте в присутствии цинка. Не-
сколько капель перекиси, прибавленные к примерно
1 мл этого реактива, дают в присутствии капли 0,01 и.
раствора сернокислой меди розовое окрашивание.
114
Органические перекиси
Действие тетраацетата свинца
Эта реакция специфична для гидроперекисей. При
добавлении тетраацетата свинца к раствору гидропере-
киси в ледяной уксусной кислоте наблюдается бурное
выделение кислорода.
Действие пентакарбонила железа
1 мл пентакарбопила железа Fe(CO)s растворяют
в 24 мл пстролейного эфира. Пробу вещества на перекись
(обычно растворенную в бензоле) добавляют в 1—2 мл
этого реактива. Происходит выделение СОа, сопрово-
ждаемое осаждением окиси железа Fe2Oa- С гидропере-
кисями реакция протекает по уравнению
2Fc (СО)5 4- 13ROOH —> FeaO3 + 13ROH + 10С02.
Эта реакция дает положительный результат с гидро-
перекисями, надкислотами и их эфирами (перекисями
ацилов). Она не идет с перекисями алкилов, озони-
дами,, перекисями кетонов (димерными и гримерными).
Действие сульфата титана в сернокислой среде
В платиновой капсуле нагревают до получения про-
зрачного раствора смесь 1 г ТЮ2 н 20 г KHSO4. По
охлаждении реакционную массу растворяют в 250 мл
62 %-цой серной кислоты. Фильтруют через тигель Гуча.
Этот раствор реагирует с эфирным раствором перекиси,
давая желтую окраску. Рекомендуется сопоставлять со
слепым опытом.
Эту реакцию дают все типы перекисей, за исключе-
нием пространственно затрудненных перекисей алкилов
(подобных перекиси трет-бутила)
ОПРЕДЕЛЕНИЕ АКТИВНОГО КИСЛОРОДА
ИОДОМЕТРИЯ
Принцип метода состоит в титровании тиосульфатом
натрия йода, выделенного перекисью, растворенной
в смешивающемся с водой растворителе, из раствора
Ана.ши перекисей
115
(обычно водного) йодистого калия или натрия. 1 мл
0,1 и. раствора тиосульфата соответствует 0,8 мг актив-
ного кислорода.
Имеется несколько вариантов метода.
Кислород воздуха принимает участие в выделении
йода из KJ *, поэтому необходимо ставить слепой опыт
или работать в инертной атмосфере.
1. В среде ацетона. Метод Свэйна [77а]
В колбу Эрленмейсра емкостью 125 мл помещают на-
веску перекиси в несколько дециграмм, добавляют 20 мл
ацетона и 1 мл водного раствора 40%-пого йодистого
натрия и перемешивают. Реакция заканчивается через
несколько секунд. Рекомендуется с самого начала доба-
вить немного твердой углекислоты. Метод применим
с точностью 0,5% к различным замещенным перекисям
бензоила.
2. В среде изопропилового спирта
Вариант 1 [776]. В колбу Эрленмейера емкостью
250 мл, снабженную отводной трубкой, помещают 40 мл
изопропилового спирта, 2 мл ледяной уксусной кислоты
и перекись.
Колбу соединяют с обратным холодильником и в те-
чение 3 мин. пропускают двуокись углерода и после пре-
кращения пропускания нагревают до кипения. Через
форштосс холодильника добавляют 10 мл изопропило-
вого спирта, насыщенного йодистым натрием.
Нагревают с обратным холодильником 15 мин., охла-
ждают в токе двуокиси углерода до комнатной темпе-
ратуры и титруют 0,1 н. раствором тиосульфата.
Этот метод очень точен а) для различных гидро-
перекисей (кумола, тетралина) и б) для разных пере-
кисей ацилов.
Он неприменим в случае перекисей алкилов и эндо-
перекисей.
Вариант 2 [77в]. В колбу Эрленмейера с притертой
пробкой помещают навеску перекиси вместе с 100 акт
116
Органические перекиси.
изопропилового спирта. Добавляют 10 мл ледяной уксус-
ной кислоты и 1 мл насыщенного раствора йодистого
калия. Нагревают с обратным холодильником в течение
3—4 мин. Холодильник промывают 10 мл изопропилового
спирта, добавляют 25 мл воды, закрывают пробкой,
охлаждают до комнатной температуры и титруют выде-
лившийся йод. Этот метод употребляется фирмой «Гер-
кголь-Паудер компанп» для определения активного кис-
лорода в гидроперекиси кумола.
3. В среде уксусной кислоты [77г]
Вариант /ДЮ мл ледяной уксусной кислоты доба-
вляют немного твердой углекислоты, затем 1—2 г
йодистого натрия и навеску примерно 20 мг перекиси.
Оставляют при комнатной температуре приблизительно
на 30 мин. Выделившийся йод титруют тиосуль-
фатом.
Метод применим к гидроперекисям, перекисям аци-
лов и озонидам. С перэфирами реакция закапчивается
не раньше, чем за 2 часа. Опа идет неполно с перекися-
ми алкилов, эндоперскисями и перекисями кетонов (ди-
мерными).
Вариант 2 [77д]. Нанеску перекиси растворяют в ледя-
ной уксусной кислоте и перемешивают этот раствор
в инертной атмосфере с равным объемом 56%-ной йоди-
стоводородной кислоты. Нагревают в течение 45 мин.
до 60°. По охлаждении и разбавлении дистиллиро-
ванной водой выделившийся йод оттитровывают тио-
сульфатом.
Этот метод применим к трудно восстанавливаю-
щимся перекисям, таким, как перекиси алкилов. Он ис-
пользуется, в частности, в случае перекиси трет-бутила.
МЕТОД, ОСНОВАННЫЙ НА ОКИСЛЕНИИ Sns“ В Sn* г Р«1
Принцип метода базируется на трех следующих ре-
акциях:
1) окисление Sn21" в Sn41- перекисью;
2) восстановление Fe?,+ в Fe24 избытком Sn2+;
3) определение Fc3+ титрованием бихроматом.
Анализ перекисей
117
Аналитические растворы
а) 0,1 н. раствор SnCh.
11,3 г SnCI2 растворяют в 75 мл ЫС1 (уд. вес 1,18).
Добавляют 925 мл дистиллированной воды.
Хранить в атмосфере азота. Закрывать каучуковой
пробкой.
б) Железные квасцы.
Растворяют 200 г железных квасцов в 1 л воды. До-
бавляют 60 мл H2SO4.
в) 0,05 и. раствор KaCiyO?.
Приготовляют растворением очень чистого бихромата
калия в рассчитанном количестве воды.
г) Раствор 75 мл Н3РО4, 75 мл H2SC>4 и 350 мл Н2О.
Методика работы
Навеску, содержащую 0,75— 1 мэкв перекиси, рас-
творяют в 10 мл ледяной уксусной кислоты в колбе Эр-
лепмейера емкостью 250 мл, предварительно заполнен-
ной азотом *.
Добавляют 15 мл раствора хлористого олова и
снова пропускают азот*. Эти операции повторяют
дважды.
Смесь оставляют на I час при комнатной темпера-
туре, затем добавляют 5 мл кипящего раствора желез-
ных квасцоп и 1 г хлористого аммония в 45 мл воды,
Температуру смеси доводят до 75° в течение 30 сек., за-
тем быстро охлаждают и добавляют 10 мл раствора
фосфорной кислоты. Далее титруют 0,05 н. двухромо-
вокислым калием с дифениламиносульфоиовой кислотой
в качестве индикатора (переход от зеленого к фиолето-
вому). Сравнивают со слепым опытом.
Метод был применен Бернардом и Харгрейвом к
различным гидроперекисям (и среди них к гидропере-
киси циклогексена) и к перекиси бензоила и дал хоро-
шие результаты.
* Автор рекомендует создать в колбе вакуум и затем запол-
нять азотом. Однако обычная колба Эрлепмейера емкостью 250 мл
при такой операции будет раздавлена. — Прим. ред.
Органилвсые' перекиси
В табл. 18 привалится количество найденного кисло-
рода (в процентах) для различных перекисей.
Таблица 18
ГГ.рекись
Количество
найденного
кислорода,
Гидропе ре к ис j »1 ре т 05 у т и л а
Гидроперекис! кумол
Гидроперекиси тетрална
Гидроперекис! циклогексена
Перекись бенюпла
I 99,9
99
99,4
96,7
99,7
Влияние разных факторов
а) Продолжительность. Реакция между хлористым
оловом ц гидроперекигями в гомогенной среде и при
комнатной температур? .завершается ровно за 30 мин.,
для перекиси бензоила за тот же срок она завершается
лишь при 80°.
б) Температура. Результаты, полученные для гидро-
перекисей при 80°, .т.езкольк) ниже результатов, полу-
ченных при комнатной температуре (примерно на 4%).
в) Природа растворителе. Растворитель должен
удовлетворять двум основным условиям: смешиваться
с водой и быть ycToiiiHBWM по отношению к раствору
бихромата. Уксусная ктслота отвечает этим условиям и
является поэтому хороним растворителем. Бутанол дает
слегка заниженные результаты. Бензол л случае опреде-
ления перекисей в углеводородах дал вполне удовле-
творительные результаты.
РАЗЛИЧНЫЕ МЕТОДЫ
Колориметрические методы. Метод, основанный на
окислении Fe2+ в Fe':+, был использован в некоторых
специальных случаях т, различных вариантах [79а, б, в, г].
Совсем недавно Юбер рейтер [79д] предложил метод,
основанный на регенерации метиленового синего из его
лсйкооспования.
Анализ перекисей
119
Хроматографический метод. Этот метод был исполь-
зован Эггерглюссом [79е],
Физические методы. Существуют также физические
методы, базирующиеся па: а) инфракрасной спектроско-
пии [80а, б] и 6) полярографии [81а, б, в, г].
ЛИТЕРАТУРА
77а. Swain Е„ J. Am. Chem. Soc., 72, 5426 (1950).
776. Peters E, Smith R, Ind. Eirg. Chem., 19, 976 (1946).
77b. Williams II., Can. J. Res, B27, 943 (1927).
77r. Raley H, Rust F, Vaughan W, J. Am. Chem. Soc, 70,
1336 (1948).
78. Barnard D, Hargrave K-, Anal. Chiin. Ada, 5, 476 (1951).
79a. Wagner C, Smith R, Peters E, Ind. Eng. Chem, 19.
980 (1947).
796. Y о i] и g C, Vogt R, Nicuwland J, Ind. Eng. Chem, 8,
198 (1936).
79b. Rolland C, S u n d г a 1 i n g h a m A, Inst. Rubber [nd, 17,
29 (1947).
79r. Farmer E, S n n d r a [ i n g h a m A, J. Chem. Soc, 1943, 125.
79л.. Sorge G, Uberrciter K, Angew. Chcrn, 68, 486 (1956).
79e. Egger sgluss W, Verlag Chemie (1951).
80a. Phillipots A, Thain W, Anal. Chem, 24, 638 (1952).
806. S c li i <?. v e, H e c t h e r, Knight H, Anal. Chem, 23, 282 (195]).
8la. Lewis W, Quackenbuseh F, Anal. Chem, 21, 762 (1949).
816. Lewis W, Q u e c k e ti b u s ch F, J. Am. Oil Chem. Soc. 26,
53 (1949).
81b. Reimers F, Quart. Pliarm, 19, 27 (1946).
81r. Bernard M, These sc. phys, Parts (1953).
Г Л A 1 A XII
РАЗЛОЖЕНИЕ ПЕРЕКИСЕЙ
НА РАДИКАЛЫ
Изучение процесса разложения перекисей с образо-
ванием радикалов оч1нь вакпо и теоретически и прак-
тически вследствие тесной евязи этого явления с поли-
меризацией.
Рассмотрим последовательно случаи разложения гид-
роперекисей, перекисей алкилов и перекисей ацилов.
ГИДРОПЕРЕКИСИ
Большое число экспериментальных фактов относится
к природе продуктов, полученных при термическом раз-
ложении третичных гидроперекисей
R1,
r2Ac-och
R3-"
(в чистом виде пли i растюре). Эти факты приводят
к выводу, что разложение начинается с разрыва пере-
кисной связи —О—О— с образованием радикалов
R\
Кг-Д-О и .01-1
R3''
Затем следует разрыв оязп С—С с образованием
кетона и радикала I? •, который может с радикалом
• ОН образовать спиот R3—ОН. В действительности
в большинстве случаев получают кетон и спирт (или
фенол в случае, если »дна тв групп ароматическая),
а) Гидроперекись гриф енил метила [82]
(С6Нз)3 С—О—ОН, нггретат. выше температуры плавле-
ния, образует фенол СЛ50Ни бензофенон (СбНзДС — О.
Разложение перекисей на радикалы
121
б) Гидроперекись кумола [83] CeH5(CH3)sC—О—ОН
при повышенной температуре превращается в смесь фе-
нола СеН5ОН и ацетона (СНз)аС = О.
в) Гидроперекись трет-бутила [19] (СНз)зС—О—ОН,
нагретая в виде пара до 250°, образует смесь метанола
CH-jOH н ацетона (СНзЪС =0.
Существование радикала
R'\
R2—С—О-
R3/
подкрепляется двумя следующими фактами:
а) нагретые в присутствии углеводородов гидропере-
киси образуют соответствующие спирты
r< R'\
R2—С— О- -р HR —> R2—С—OH-j-R.
R3/ цз/
Так, гидроперекись кумола, нагретая в кумоле до 90,5°,
даст диметплфсиилкарбинол CeHs(CH3)2COH [83].
б) Нагретые в присутствии первичных спиртов гид-
роперекиси образуют наряду с соответствующим гидро-
перекиси спиртом альдегид — производный первичного
спирта по схеме
R’4 R1 R'x
R2—С—ООН—> R2—С-О- + -ОН —^R2—С—ОН
R3/ RS/ ЦЗ/
7 —> О-С— R
+ HO-C-R ।
I Н
н
Гидроперекиси кумола и трет-бутила, нагретые до
73,5° в бензиловом спирте, дают 0,6—0,88 моля бенз-
альдегида па 1 моль перекиси [84].
Примечание: Этот путь разложения гидропере-
кисей, хотя и общий, не единственен- В определенных
условиях гидроперекись может разлагаться с образова-
нием спирта путем простой потери кислорода [способ
12’2
Органичекие перекиси
разложения такой же, как способ разложения надкис-
лот (гидроперекисей, ацил св)]. Таков случай разложе-
ния гидроперекиси тует-бушла в жидкой фазе при 95—
100° [19].
в) Караш [85] рассматривает ионный способ разры-
ва, изображаемый приведенными ниже уравнениями:
ROOH —> RO ' + ""PH к авизируемый кислотами
ROOH —> ROO -f- + Н к авизируемый основаниями
ROOH -—> RO- 4- '|"ЙН каализпруемый ионами металлов
с 1юре&енной валентностью
ПЕ1ЕКИСИ АЛКИЛОВ
Почти все исследсвания способа разложения переки-
сей алкилов производились на примере перекиси трет-бу-
тила. Установлено, ч?о первая фаза реакции состоит в
разрыве перекисного моста и образовании радикала
(СН3)3С—О •, что дсказыыстся появлением карбинола
(СНз)зСОН при нагревании этой перекиси в присутствии
углеводородов — кумола и бутилбснзола [86].
Вторая фаза разложения связана уже с разрывом
углерод-углеродной связи и образованием ацетона
(СН3)гС = О и радикала мзгила СНз-.
В противоположность пдроперекисям, где радикалы
R • (или по меньше! мерс большая их часть) связы-
ваются с радикалам! -OF, в данном случае метильные
радикалы могут давать дв: главных типа реакций [87].
а) Соединяться луг с другом с образованием этана
СН3- -СН3- -—> СН3-СН3
Эта реакция протекает главным образом в газовой
фазе при 250° [87] в условиях разрежения, достаточного
для того, чтобы была мала вероятность встречи метиль-
ных свободных радикалов в молекул исходной перекиси
или образовавшегося ацетона. В действительности глав-
ные продукты разложения гврекиси трет-бутила при этой
температуре — ацетон и гексан*.
* Так п подлиннике, Очсвид-ю смесь алифатических углеводо-
родов Cj. — При,», ред.
Разложение перекисей на радикалы.
123
б) Атаковать получающийся ацетон или исходную
перекись с образованием других радикалов и метана.
Эти радикалы могут, дезактивируясь, порождать ряд
определенных соединений. Этот тип реакции осущест-
вляется при сравнительно низкой температуре, около 110°
или при комнатной температуре в результате фотохими-
ческого эффекта.
Так, радикал СН3- может
а) дать с ацетоном
сн3х
сн3. + ;с=-о —> сн4 +
СН/
Метан Радикал
СН2х СН3СН2х
СИ,- н- )О0 —> С^О
СИ/ СН/
Метц лэти л кетон
Р) атаковать исходную перекись с образованием ме-
тана и перекисного радикала
СН3х zch3
С!ф. ф СП3—С-О-О-С—СН3 —>
СНз^ ХСН3
> СН4 +
•сн2х /СНз
сы3—С-О^О-С—сн3
сн/ ЧСН3
Метан Перекисный радикал
Этот перекисный радикал в результате разрыва пере-
кисного моста образует радикалы
•сн2ч
СН3—С—О-
сн/
/СН3
и -о—с—сн3
чсн3
124
Органмежае перекиси.
из которых первый преврядается в результате перегруп-
пировки в окись изобутилена
сн/ \0/
Таким образом объясняется наличие значительных ко-
личеств этой окиси при термическом (110°) или фото-
химическом (20°) разложении перекиси трет-бутила.
ПЕРЕИ-13И АЦИЛОВ
J1-С—О
J2—C—О
о
Термическое разложение перекисей ацилов было
предметом многочисленных исследований, обобщенных
в статье Мак-Клюра и Рсбсртсопа [89].
Сначала, как и в случе гидроперекисей и перекисей
алкилов, происходит разрыв перекисного моста с образо-
ванием двух ацилатных’ радикалов
R-С—о.
R—С—О-
существование которых было экспериментально доказано
Разуваевым [89а] на пргъере перекиси бензоила.
В действительности з результате нагревания бен-
зольного раствора этой перекиси с хлористым оловом
(стехиометрическое соотношение реагентов) он уловил * **
* В подлиннике ошибочю ацильных.—Прим. ред.
** В подлиннике изолирокл. — Прим. pet).
Разложение перекисей на радикалы
125
бензоатрадикал*
С6Н5—С-О •
II
О
в виде соединения состава
О
CeH5—С—<\ X]
/Sn\
С6Н5—С—Си хл
II
о
не обладающего ни восстановительными свойствами
хлористого олова, ни окислительными свойствами пере-
киси бензоила.
Существование этого радикала, кроме того, доказано
образованием двух кислот
О
II
R1—С—ОН и R»—C--OU
II
О
при нагревании перекиси ацила в органическом раство-
рителе НА (или одной кислоты, если перекись симме-
тричной структуры). Этот растворитель отдает свой во-
дород радикалу R—С—О-, образуя новый свободный
I1
О
радикал А-
R—С—О- + НА —► R-С- ОН -Р А-
О О
а) Так, перекись бензоила при нагревании е разными
О
—с—о
СеН5-С-Х
II
о
органическими растворителями: углеводородами (бен-
зол, циклогексан [90]), спиртами (метанол, этанол, трет-
* В подлиннике ошибочно бензоил. — Прим. р?д.
10 Зак, 1025.
126
Срганнч&гаё переписи
бутиловый спирт [91]), кислотами (уксусная [91]), эфи-
рами (этиловый), целлозольвом [92], пиридином [93], об-
разует бензойную кислоту.
б) Перекиси zt-хлорбеь-зоила («-ClCaH^COOJa и
ле-нитробензоила (h-OsN С Н4СОО) 2 при нагревании
в бензоле образуют соотвгютвенно и-хлор бензойную и
льнитробензойгую кнслогб 94].
в) Перекись и-м етоксгызнитробензоила в результате
нагревания в бензеле дае? смесь п-хлорбензойпой и
п-метоксибензойной кислот.
Второй этап разложени. перекисей ацилов состоит
в разрыве связи С—С с гилучением радикалов R1 • и
R2, и СО2-
Освобождагтдиеся радт.алы в свою очередь могут
а) дезактивироваться следствие соединения друг
с другом с образована ем угтводородов R!Rl. RlR2 и R2R2,
что подтверждается такими опытами, как получение ди-
фенила при разложении пцекиси. бензоила и образова-
ние этана при разл«женит: перекиси ацетила;
б) дезактивироваться птсм взаимодействия с ра-
О ’ О
11 II
дикалами R1—С—О-, R!—С—О* с образованием
О О 0 0
II II I II
RCOR1, R1—С— OR‘ R2—C-OR1, R2—С—OR2. Это под-
тверждается образованием фшилбензоата CsH5C—ОСеНь
О
при разложении в разных условиях перекиси бензоила;
О
II
в) реагировать срадноом R1—С—О* или
О
II
R2—С—О- с элнмишроваием водорода Н- и образо-
ванием нового замененного радикала, который при вза-
имодействии с Н образует соответствующую замещен-
ную кислоту, что ссгласусг'я:
а) с присутствием в п}сцуктах термического разло-
жения перекисей ароилов ароматических кислот, заме-
Разложение перекисей на радикалы
127
щенных в ядре. Так, образование фенилбензойной кис-
лоты из перекиси бензоила соответствовало бы приве-
денным ниже реакциям
О О
И II
С6Н6- + СсН5—С—О- СеНс-СвН4-С-О + н.
CBHs СВН4 С-ОН
о
3) с возможностью получения большого числа за-
мещенных бензойных кислот нагреванием перекиси бен-
зоила в подходящих растворителях [96].
В этом случае радикал, образованный из молекул
растворителя, вступает заместителем в радикал пере-
киси R—С—О* .
О
Так, при нагревании перекиси бензоила в изобути-
ловом спирте, уксусной кислоте, хлороформе были полу-
чены изобутилбеизойная, ацетоксибепзойная и трихлор-
метилбепзойная кислоты.
г) действовать на один из углеводородов R'R1, R’R2,
R2RS! с элиминированием Н- и образованием замещен-
ного углеводорода. Радикал Н • действует на один из
радикалов Rl—С—О- или R2 -С—О- с образованием
11 11
О О
соответствующих кислот--факт, объясняющий образо-
вание кислоты в процессе разложения перекисей ароилов.
Образование бензойной кислоты, констатированное
несколько раз при разложении перекиси бензоила, по-
видимому, обусловлено реакцией
СвНд* -f- СеНв—Св1ф > C.JT-CH.—Cells 4- Н"
С5л5-С-О. + н. —> сйн,—с-он
6 о
В результате несимметричная перекись ацила формулы
О О
II II
R’—С—О—О—С—R2 может образовать при разложении
10*
128
Органические перекиси
большое число веществ
Свободам ( радпгялы
О
!^1 —С—о.
R!*
О
il
I?2—с—о.
R2-
Замещенные радикалы
Углеюлороды
Кислоты
Определенные
соединения
[ R1!*1
j JW
] RSR2
1 Замещенные углеводороды
0
II
R1—С—ОН
О
II
К2—С..О1 [
Замещенные кислоты
Слежке
эфгр:
О
II
R2—C—OR1
Заметенные
О
.1
R'-C—OR2
О
R2—С—OR2
сложные эфиры
I СО,
Все эти вещества ic образуются каждый раз из каж-
дой данной гердспсн. Преобладающий путь разложения
определяется злифт пи ческой или ароматической при-
родой перекиси
Так, алифаг тесине перекиси (ацетила и пропионила)
и пероксиднкяслоты (янтарная и глутаровая) разла-
гаются в основном не схеме
С
II
R--C-O
| — >2CO2 + R-R
р„С_О
II
о
Разложение перекисей на радикалы
129
с образованием главным образом углеводородов и дву-
окиси углерода (2 моля на 1 моль перекиси) и незначи-
тельных количеств сложного эфира или замещенной кис-
лоты. В то же время для ароматических перекисей (на-
пример, перекиси бензоила) главный путь разложения
по схеме
О
н
Ar—С—О
I —> Ar—С—OAr-pCOj
Аг—с—О а
II о
О
приводит к образованию сложного эфира и двуокиси
углерода (1 моль па 1 моль перекиси). Эта главная реак-
ция сопровождается образованием замещенных кислот и
различных углеводородов.
ЛИТЕРАТУРА
19. Milas N., Surge nor D., J. Am. Chem Soc., 68, 205 (]946).
82. Wieland II., M a i er J., Ber., 1205 (1931).
83. Fordham AV., L a v e r n e - AV i 1 I i a m s IL, Can. J. Res., B27,
943 (1949).
84. Stanetl A'., Mescobian, J. Am, Chem. Soc,, 4125 (1950),
85. Kharasc.h M., J. Org. Chem., 15, 763 (1950).
86. Raley J., Rust F, Vaughan W., j. Am. Chem. Soc., 70,
1336 (1048)
87. Raley E., Rust F., Vaughan W., J. Ain. Chem. Soc., 70,
88 (1944).
88. Bell E., Rust F„ Vaughan AV.. .1. Am. Chem. Soc., 72, 337
(1950).
59. M acC lure H., Robertson E., C n t li с r I s о и C., Can J.
Res., 820, 103 (1942).
89a. Pan' пев 4., ЖОХ, 24, 262 (1954).
90. Gelissen, Hermans, Ber., 58, 285 (1925).
91. Gelissen IL, Hermans P., Ber., 58, 764 (1925).
92. Cass V., J. Am. Chem. Soc., 69, 500 (1947).
93. Over li off J., Tilman C., Rec. trav. Chim. Pays-Bas, 48 993
(1929).
47. AV i el a nd Ц„ Разуваев Г., Ann. Cheni., 480, 157 (1930).
95. Leffler ,L, J. Am. Chem. Soc., 72, 67 (1950).
96. Boes e lien J., Hermans P., Ann, Chem., 519, 133 (1935).
Г Л Л Е А XIII
ОБРАЗОВ АН III ПЕРЕКИСЕЙ
В ПРОЦЕССЕ АВГООКИСЛЕНИЯ
УГЛЕВОДОРОДОВ
СИЦИЕ СВЕДЕНИЯ
Всякое автоокиспенпе характеризуется следующим.
1. Большим пси меньшим периодом индукции,
являющимся фуякцпй темпратуры, структуры и кон-
фигурации вещества. Этсг период может быть со-
кращен:
а) облучентсл уы^рафцелетовым светом (вероятно,
вследствие появленья свободных радикалов);
б) введением раяообрг-згых радикалов (непосред-
ственно или в виде терекио). Так, тетралину при 76°
свойствен период индукции б несколько часов. Этот пе-
риод ипдукдит zoR«jmetiiTO подавляется в результате
добавления гидррпецкиси: тетралина в количестве не-
скольких процентов.
2. Существ с ван иск среди продуктов автоокисления
углеводородов перс шеей и продуктов их разложения
(альдегидов, кетонов води). Так, различные авторы
установил и наличие дерекпеел:
а) Грюц [9Ja] — ijn выоготемпературном автоокис-
лении парафинов;
б) Мондэн-Ис'Пваль [980-при автоокислснии раз-
ных углеводородов, гпеих, га пентан, гексан и октан,
при температуре около 3f£>
в) Мурщ Дюфесс аШо [SSi] — при автоокислении при
160° парафина, пдрешпа л керосина.
Наконец, бельшен числе [идропсрекисей можно по-
лучить автоокиелзнисл соответствующих ароматических
углеводородов (п. п I).
3. Наличие периощ ин д унции и роль свободных ра-
дикалов, вызывающие прошел (их появление совпадает
с концом периода ищукпш) приводят к выводу, что
именно свободгые р.щ и кал и, образующиеся по иривс-
Обрезывание перекисей при автоокислении углеводородов 131
денной ьиже схеме, а не перекиси •— первичные продукты
автоокисления, инициируют процесс, а именно:
а) появление свободного радикала R-;
б) окисление радикала R- в радикал ROO •;
в) действие радикала ROO- на исходный углеводо-
род RH е
а) образованием гидроперекиси ROOH;
(3) оси с вождением радикала R •
ROO- + RH —> ROOH -Р R-
Реакция сбривается при дезактивации радикалов, что
достигается образованием
а) у глеводорода R. -р R. -—> RR
?) епбильной перекиси R- -у .OOR -—> RO OR.
Этот механизм, сопровождающийся разрывом только
углерод-вэдородных связей, в чистом виде проявляется
только три сравнительно низких температурах (не
выше 150’ для предельных жирных углеводородов). При
более высоких температурах явление осложняется воз-
можностьо разрыва углерод-углеродпой связи без пред-
варительного образования гидроперекиси.
Предельные алифатические и ароматические
углеводороды
Скоросп автоокисления насыщенных углеводородов
этого типа (в условиях, указанных выше) том больше,
чем менее разветвлен углеводород и чем большее пиело
ароматических груш: связано непосредственно с атомом
углерода. Это автоокислсние приводит по уже упомя-
нутому механизму к образованию первичной, вторичной
или третичной гидроперекиси в соответствии с приро-
дой исходного углеводорода
R—СИа-ООЛ, R1RSCH—О—ОН, R‘R2R’C—О—ОН.
Последующее разложение этих гидроперекисей по при-
веденному выше механизму может привести к образова-
нию:
!32
Ораничеааи перекиси
а) для первичной .шдрогерекисп
- R—CHO + HSO
Гь. Г I—1<* ~
б) для вторичной гидротерекиси
г R>Rsc^O-|-HaO
R’R’CH-C + -OKI
R'CHO-f-^0Н
в) для третичной гидроперекиси
R\ R1.
RIR2R'C—О- Ч .ОН —> Л-ОД*
рз/ ‘ОН
Из этого видно, 'по первичная гидроперекись может
разложиться с образсваиисм
а) альдегида RCUO и веды (без разрыва углерод-
углеродной связи);
0) формальдегида — протесе, сопровождаемый осво-
бождением радикала R. (с разрывом углерод-углерод-
пой связи).
Равным образом згорнчнаа гидроперекись может раз-
лагаться с образованием
а) кетона л воды без разрыва углерод-углеродной
связи;
(3) альдегида с образованием одновременно радикала
R- (с разрывом у г л ер од-углерод ной связи).
В результате разложения перекиси в зависимости от
конкретного случая образуются альдегиды (и формаль-
дегид), кетопы и радикалы R- и -ОН, которые могут
принимать участие в деградации цепи исходного угле-
водорода. Г идропере^иси не единственные перекиси
среди продуктов автоокисле:-пя предельных и аромати-
ческих углеводородов При автоокислении образуются
перекиси алкилов в результате рекомбинации радика-
лов ROO- и R-, а та:;же и монооксиперекиси, получен-
ные конденсацией альдегидов и гидроперекисей. Присут-
ствие перекисей в ходе автоскислення углеводородного
горючего важно грактшески. Стук в моторе— следствие
их образования и спонтанного разложения.
Образование перекисей при автоокислении углеводородов 133
ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
Имеются два типа этих углеводородов, которые не-
обходимо рассмотреть.
1. Этиленовые углеводороды, имеющие в а-положе-
нии к двойной связи метиленовый углерод *
Они имеют структуру R СН2—СН = СН2. Работами
Гриджи [99а] и особенно Фармера и Сундралингсма
[13в] по автоокислению циклогекссновых углеводородов
(циклогексена, мстилцнклогекссна и димстилциклогек-
сена) доказано, что первым подвергается атаке мети-
леновый * углеводород, а не двойная связь, и образуется
гидроперекись
R—СН—СН=СН2
ООН
Такого рода гидроперекиси были изолированы и иден-
тифицированы в случае окисления упомянутых выше
циклогекссновых углеводородов.
Гидроперекись может затем разложиться разными
путями.
а) Прореагировать с исходным углеводородом с
образованием непредельного спирта
R-CH-CH - С1 [2 + R—СН2—СН-СН2 —>
ООП
—> 2R- СП(ОН)СН СН2
(Подобный алкоголь был действительно изолирован
в случае автоокисления циклогексена.)
б) Разложиться с образованием непредельново спир-
та и кислорода, причем последний фиксируется двойной
связью алкоголя и образует эпоксиалкоголь
R—СН-СП-СН2 — > R—СН—СН—СН2
I I ''Ч)/
ООН он
(Эпоксиалкоголь также был получен при автоокислснип
циклогексена.) В свою очередь эпоксиалкоголь способен
* Или метиковый, — Прим. ред.
134
Органические перекиси
а) изомеризоваться в соответствующий fS-оксиальдо-
гид (или в 3-окснкетоп)
R—СП—СН-СН, —> R—СН-СН2—С-О
I \0/ I I
ООП он н
который последующим окислением превращается
в 3-оксикис л оту R—СН (ОН) С На—-С ООН;
|3) в результате окислительного разрыва эпокси-моста
дать смесь а-окси альдегида и формальдегида
R—СН—СН—СН2 ^О2 —> R—СН—С—О + СН2О
W 2 11
он он н
в) Гидроперекись может также дать в результате,
дегидратации (элиминирования воды за счет ОН-групп
гидроперекиси и оставшегося Н метиленовой группы)
непредельный кетой
R—С—СН-СН2—> R—С—CH^CHj
/\ II
И ООН о
Разнообразные вещества, полученные в результате
всех реакций, могут быть причиной ряда реакций:
а) вода может атаковать двойную связь или эпокси-
мост;
3) альдегиды могут конденсироваться с гидропере-
кисью с 'образованием моиооксиперекисей;
различные гидроксильные соединения могут обра-
зовывать эфирные или перекисные мостики, комбини-
руясь между собой или с гидроперекисями;
5) наконец, первоначально образующаяся гидропере-
кись может вызвать полимеризацию исходного углеводо-
рода.
Заключение. Таким образом, автоокисление эти-
леновых углеводородов этого типа протекает сложно и
приводит к разнообразным продуктам деструкции и кон-
денсации.
Образование перекисей при автоокислении углеводородов 135
2. Этиленовые углеводороды, не имеющие ,
а-метиленового углерода
Углеводороды типа
X
I
СН--СН,
где X — электроотрицательная группа, при автоокисле-
нии образуют не гидроперекиси, а полимерные перекиси
общей формулы
XXX
I I I
• —О—СН—СНа—О—О—СН—СН2—О—О—СН—СН2—О—..
которые уже описаны в специальной главе [58].
ЛИТЕРАТУРА
97. Frank С., Chem. Rev., 46, 155 (1950).
98а. Griin А., Вег., 53, 987 (1920).
986. М о п d a i п М о п v а 1 Р., Quan quin. S. R., Raris, 191, 299
(1930).
98b. Moureu C., D i f г a f s s e C., Chiin. et Ind., 18, 3 (1927).
99a. Criegee R., Pilz H., Flygarc H., Всг.т 72, 1799 (1939).
136. Farmer E., S u n <1 г a I i n g h a m A., J. Chem. Soc., [942, ]21.
100. Paquot C., Bull. Soc. Chini. France, 1945, 1'20.
ГЛАВА XIV
РАЗЛИЧНЫЕ ОБЛАСТИ ПРИМЕНЕНИЯ
ОРГАНИЧЕСКИХ ПЕРЕКИСЕЙ
ПРИМЕНЕНИЕ В ОРГАНИЧЕСКОМ СИНТЕЗЕ
СИНТЕЗ ФЕНОЛА И .АЦЕТОНА ЧЕРЕЗ ГИДРОПЕРЕКИСЬ КУМОЛА
Этот синтез прспзкаст в три фазы:
а) получение купола (изопропилбензола) из бензола
и пропилена (из тагов крекинга)
СeH6 + СН2 = CH-CHs —> СеН3-СН (СН3)2;
б) окисление к/лол а в гидроперекись
Се115СН(СН;)1+О2 —> С(И5С (СИЛ—О—ОН;
в) разложение гидроперекиси кумола на ацетон
и фенол
Се115С (CHS>2—С Oil —> C6HSO11 4- (СН3)гС --= О.
Этот синтез, применяемый в настоящее время в про-
изводственном маслгабе, был распространен и на полу-
чение других фенолов. Таким путем были подучены:
н-крезол из гидроперекиси л-метилизопропилбензола;
я-трет-бутилфенол и; гидроперекиси п-трет-бутилизопро-
Пилбснзола; гпдрогшон из гидроперекиси п-диизопро-
пилбснзола; резорцтп из лг-диизопропил бензол а.
Этот синтез ис 1шочителы|0 важен, так как он обес-
печивает все возрастающее промышленное применение
фенола—основного материала для получения фенопла-
стов и полупродукта в производстве найлона. Приведем
некоторые подробности синтеза, взятые из статьи Хока и
Кропфа [100а].
а) Синтез кумова-
а) бензол Д0.Ч/КТ1 быть качества «для нитрования»,
т. е. не содержат:» тиофена, Необходимо применять из-
быток бензола, чтобл избежать образования диизопро-
Различные области применения органических перекисей 13%
пилбензола и воспрепятствовать полимеризации пропи-
лена.
₽) пропилен применяют в виде смеси состава 60%
пропилена и 40% пропана. Катализатор, применяемый
в США, H2SO4 или Н3РО4, в ФРГ — А1С13.
б) Автоокисление кумола можно проводить:
а) в эмульсии при температуре 90°, pH 8,5—10,5 с ка-
тализатором стеаратом натрия;
3) в гомогенной среде при 100—130° или лучше по
стадиям: 120а до 10% гидроперекиси, 117° до 15% гидро-
перекиси, 110° до 27% гидроперекиси, что уменьшает
разложение гидроперекиси.
После декантации продукт концентрируют в вакууме
до содержания 75% гидроперекиси.
в) Разложение перекиси происходит при действии
серной кислоты:
а) при повышенной температуре;
3) при 30"; в последнем случае концентрация H2SO4
относительно раствора гидроперекиси составляет
5-7%.
Фенол отделяют промыванием щелочью, а ацетон и
кумол — фракционированием.
Выход фенола составляет 85—90%, считая на
кумол.
Один из подобных продуктов — а-метилстирол — ис-
пользуется для получения прозрачных смол (аналогов
полистирола).
Таблица 19
Фирма Mecrp нахождения Годоем ЩЮАУКЦИЯ Л1
Р rogjl-Ejcci roeb intie Франция, Пон де К ла 10 000
Rhone-Poulenc Франция, Русильон 10 000
Pheno 1-Chiniic ФРГ, Цвекель (Рур) 10000
Standard-Oil California США, Калифорния 16 000
Hercules Powder США, Джибстоуп 12 000
Allied Chemicals and Dye США, Филадельфия 13 000
В табл. 19 приведен список фирм, осуществляющих
это производство, с их годовой продукцией фенола.
138
Срглшческиг перекиси
СИНТЕЗЫ, ОСНОа/ШМЕ НА ОКИСЛЕНИИ ПЕРЕКИСЯМИ
Получение эпоксисосдвнекпй и гликолей
Действие надкисдзг на ожфины и их производные
используется для поту юная шоксисоединений, после-
дующий гидролиз ветер ых ifиводит к синтезу а-гли-
колей.
Для этой цели обтчно лдпользуют гидроперекись
бензоила в хлорофортом растворе, но можно также
применять надфталезую или надуксусную кислоты
(в последнего случае лотучагсг прямо днацетат соответ-
ствующего гликоля)
Этим путем были полутени: окиси пропилена, изобу-
тилена, октепа и дет,се i (2D6)
Определение дввйиыг этиле ювых связей [101а, б, в, г]
Действие надкислот та этшеювые соединения можно
использовать для код юг ютвени «го определения этилено-
вых двойных связей.
Обычно употребяютт гидроперекись бензоила в хло-
роформном растворе 'ст 0,5 и до 0,1 н.). Ею воздей-
ствуют на этиленовое сседипси icпри температуре ме-
жду —-10° и +25°, пртчем берут небольшой избыток
гидроперекиси. Йодом ст [ически определяют содержание
активного кислорода i юходпем растворе и после вза-
имодействия.
Скорость фиксации кислоюда двойной связью
в значительной степени зависл от природы групп, на-
ходящихся в а-положэ-ии к двойной связи. Наличие
электроположительных цэупи, 'аких, как алкилы, за-
метно увеличивает скорость реицип, Так, реакция, очень
медленно пр отека ющат в случпе этилена, для тетра-
метилэтилена (СНзЬС^С |СН3 )2 проходит мгновенно,
тогда как присутствие этектроочрицательных групп, осо-
бенно карбоксила С О ОН и карбшила СО, весьма суще-
ственно уменьшает спер ость реакции. Практически
реакция вовсе не идет с малеиновой, фумаровой и кро-
* Навеску. — Прим. ре9.
Различные области применения органических перекисей 139
тоновой кислотами и их эфирами, а также с непредель-
ными кетонами.
В итоге этот метод определения двойных связей в не-
который специальных случаях может быть особенно
полезным, как, например, при определении двойных свя-
RR zR3
зей в олефинах общей формулы ^>С = С/ , имею-
Rs/ 4R4
щих слишком много алкильных групп по соседству
с двойной связью. В этом случае другие методы, как,
например, йодометрический, непригодны вследствие про-
странственных препятствий. Напротив, данный ;метод
неприменим при наличии электроотрицательных групп,
таких, как карбоксил или карбонил, расположенных
рядом с двойной связью.
Замечание. Гидроперекиси ацилов по реагируют
ни с бензольными двойными связями, ни с тройными
ацетиленовыми.
Синтез различных соединений
Можно получать различные другие соединения, пс-
поль’зтя окислительные свойства надкислот. Упомянем
лишь синтез а) сульфонов из сульфидов и б) окисей
аминов из третичных аминов.
ВВЕДЕНИЕ БОКОВЫХ ЦЕПЕЙ В ХИНОНЫ
1. Перекиси ацилов [103а]
Перекиси ацилов — превосходные агенты алкилиро-
вания для n-бензохинонов и 1,4-нафтохиноиов. Реакция
обязана действию радикала R- па хинон с образованием
замещенного хинона и углеводорода:
140
Орсшическт перекиси
Методика синтеза состоит з нагревании смеси пере-
киси и хинона в органически! растворителе (уксусная
кислота, лигроин) и кр и стилизации полученного заме-
щенного хинона из метанола, Посредством этого метода
удалось ввести: а) группы ье?ил и пальмитнл в 2,3,5-
триметилбензохикон; 61 группы метил, пальмитил, стеа-
рил н хаульмугрил в 2-метил-4-нафтохинон.
2. Пероксидикислоты [1024]
Пероксидикислоты, гахие, гак пероксндияптарная и
ггероксидиглутаровая, теагпруот с метил-1-нафтохицо-
ном в горячей уксуснэл кислге с образованием метил-
нафтохинонпропионовой и кетилнафтохинонмасляной
кислот. Эти пероксидткнслоъ реагируют по тому же
механизму, что и перекиси ак-иов.
Радикал
<сн5)р—г-он
образующийся при р г злодее м и пероксидикислоты
ПО—С—(СН2)д—С—О—(I—С-(СНг)р—с—он
I. II I, ||
II || ||
С1 о о
действует на хинон, образуя кклоту H3C(Cl blp.jCOOH
и кислоту — производное хиной
1—(СНП/?—с—он
I1
о
Полученные таким путчи кгююты — метилпафтохинон-
пропионовая и метилнаотохиюнмасляная - могут быть
превращены в хлор ан гидр дды, при ацилировании кото-
рыми различных сульфнмяно! образуются разнообраз-
ные сульфамиды.
Различные области применения органических перекисей 141
Эти производные хинона были использованы для син-
теза различных фармацевтических препаратов, особенно
антималярпйных. Однако вследствие необходимости при-
менения больших количеств перекиси эти синтезы не
нашли промышленного применения.
ПЕРЕКИСИ, ДЕЙСТВУЮЩИЕ В РЕАКЦИЯХ КАК ОРИЕНТАНТЫ [ИМа]
а) Галоидирование ароматических углеводородов.
Введение перекиси в реакционную смесь (углеводород,
галоид) значительно способствует галоидированию бо-
ковой цепи.
б) Присоединение бромистого водорода к этиленовым
углеводородам. Присоединение ПВт к этиленовым угле-
водородам происходит нормально в соответствии с пра-
вилом Марковникова: бром фиксируется наиболее за-
мещенным углеродом.
В присутствии перекисей — перекисей бензоила, лау-
рила и аскаридола, гидроперекиси бензоила — правило
Марковникова неприменимо и к наиболее замещенному
углероду присоединяется уже водород.
ПРИМЕНЕНИЕ ДЛЯ ВУЛКАНИЗАЦИИ КАУЧУКА [103а, б, 104]
Для вулканизации каучука пытались применить сле-
дующие перекиси: бензоила, лаурила, трет-бутилпербен-
зоат, перекись трет-бутила и 2, 2-бнс-З-бутапа.
Перекиси бензоила и лаурила дали очень плохой
результат в отношении прозрачности, механических
свойств (особенно прочности на разрыв) и старения.
трет-БутНлггсрбепзоат, перекись трет-бутила и пере-
кись 2,2-быс-р-бутана образуют прозрачные вулкани-
заты. Однако их применение наталкивается на некото-
рые трудности. Так, трет-бутилпербензоат приводит
к вязкости поверхности. Перекись трет-бутила слишком
летуча при температуре, пластификации (70—80°). Пере-
кись 2, 2-б/гс-р-бутапа приводит к слишком узкому макси-
муму нагрузки разрыва, который является функцией
температуры нагрева. Этот максимум не совпадает
с максимумом модуля.
К тому же все эти перекиси совершенно несовме-
стимы с сажей, которая их разлагает; поэтому их ни
И Зак, 1925.
142
Органически перекиси
в коем случае нельзя применять для вулканизации кау-
чука с этим наполнителем. Иэжно, однако, получить хо-
рошие вулканизаты с други пи наполнителями.
Применение переклей купила (ДКП)
В последнее время вызвало большой интерес приме-
нение этой перекиси для вулканизации как натурального
каучука (наполненною са^ей или не наполненного),
так и пербунана.
Коммерческий прсдукт одержит 90—95% чистой
перекиси и в качестве примесей гидроперекись кумола,
диметилфецилкарбинсы, ацезефеноп и метилстирол. Что
касается вулканизатор полученных вулканизацией на-
турального каучука лри псямощи ДКП, они обладают
степенью сетчатости более высокой, чем сернистые вул-
канизаты. Это выражается в повышенном модуле и мень-
шем удлинении разрыта. Кроне того, содержание сажи
оказывает большее влияние на увеличение модуля и
уменьшение удлинении.
Что касается вулканизатов пербунана при помощи
ДКП, они обладают ж .ме-ныоей мере той же термостой-
костью и лучшей хол>доустэ1чнвостью, чем сернистые
вулканизаты.
ПРИМЕНЕНИЕ ДЛЯ ПОЛИМЕРИЗАЦИИ
Применение органических перекисей для полимери-
зации— одно из важнейших грименений этих веществ.
Таким путем можне при сравнительно низкой темпе-
ратуре (ниже 100" илы самое большее при 100°), исходя
из жидких мономеров, получил, прочные твердые мате-
риалы, пригодные для разлтшых конструкций (авиа-
ционных, автомобильных, судостроительных). Примене-
ние органических переписей в процессе полимеризации
определяется следующими фиторамп.
а) Термической стогкосты» чистых мономеров
Чистые монокеры очень трудно заполимеризовать
одним нагреванием. Таг, Пран [105] не наблюдал и сле-
дов полимеризации метакрил! ш при нагревании в тече-
ние 5 час. при 65° в отсутствие шких-либо катализаторов.
Различные области применения органических перекисей 143
б) Активацией полимеризации свободными радика-
лами
Экспериментальные факты доказывают, что свобод-
ные радикалы или генерирующие их соединения служат
ускорителями полимеризации. Так, Шульц и Виттиг[10С]
показали, что свободные радикалы, полученные диссо-
циацией
а) дитгитрила тетрафенилянтарпой кислоты
(CeHs)s-C-CN
I
(СеН5)2—С—CN
б) феиилазотрнфенилметана
CeHs—N—N—С (С6Н5)з,
ускоряют полимеризацию стирола.
Активация полимеризации
Большое число перекисей резко ускоряет скорость
полимеризации.
Норриш и Брокман [107а] и Медведев и Камен-
ская [1076] объясняют роль перекисей как ускорителей
полимеризации их распадом с образованием свободных
радикалов.
Наличие радикалов, происходящих из перекиси,
в цепи полимера
Бартлетт и Коэн [108] экспериментально доказали
наличие в молекуле полистирола, заиолимеризоцаппого
при помощи перекисей n-хлор- и n-бромбснзоила, ради-
калов галоидфенила и галоидбензоила. (Определение
галоида производили по методу Кариуса, а бензоильной
группы — омылением при помощи алкоголята натрия.)
Это доказывает активное участие перекисей в полимери-
зации и то, что они не являются просто катализаторами.
Заметим, что радикалы перекиси — не единственные
возможные агенты полимеризации. Они могут действо-
вать на мономер, порождая другие радикалы но схеме
Rj,- + RmH Rpl 1 ф- Rm-
где Rp—радикал перекиси, Rm — радикал мономера.
11*
144
Органически переписи
Механизм виниловой полимеризации
В зависимости от пр и рады мономера монофункцио-
нального* или бифункционального приходится иметь
дело с полимером линейных или сетчатым.
Именно винильпы? сосдшения (монофункциональ-
ные * мономеры) быль предтегом многочисленных иссле-
дований, и механизм их полимеризации приблизительно
известен и осуществляется следующим образом:
а) присоединение радтгала R • к мономеру
X'—СН = СН2 с образование «активированного моно-
мера»
XCH_CH2 + R. —> R—CHX-CHS.
б) присоединение ?1сходкго мономера к «активиро-
ванному мономеру» с обрааэзаписм снова активирован-
ного комплекса
XCHR—СН2- 4- ХСН=СН2 —► XCHR—С[[г—ХСН—СНГ
Этот процесс нарацивант цени развивается шаг за
шагом н обрывается дезактивацией активированного
комплекса в результате встречи двух растущих цепей
полимера
XCHR—CHS—XCH- CHs- -.С1Ц—CHX-CUj CHXR.
Эта дезактивация может произойти
а) путем простой рекомбинации в предельное соеди-
нение
ХС[ [R—Cl [г—ХСН-СН2-<1 J2—СНХ-СНг—Cf [XR,
3) путем диспропирцислтьровагшя
XCHR -Cl'h— ХСН—С[Г3 (-С[[2--СХ—Cl [2—CHXR
с образованием предельного л непредельного соединений,
Требования к переписи
Перекись, используемая irjri полимеризации, должна
отвечать некоторым требованиям:
а) она должна быть рагворима в мономере и не
должна химически реагировать с пим (иначе, как с обра-
зованием «активироъатното комплекса»);
* Автор подразумевает под монофункциональным мономером
вещество с одной двойной связью. Это нестрого. — Прим. ред.
Различные области применения органических перекисей 145
б) она должна быть относительно устойчивой при
комнатной температуре;
в) необходимое относительное количество ее должно
быть невелико (от 0,5 до 2% по отношению к моно-
меру) .
Следующие перекиси были использованы при поли-
меризации:
Гидроперекиси "^'"-бутила особе1шо в кумола 1 эмульсионной пинана ) полимеризации
Перекиси алкилов тдт-бутила трт-бутилпербепзоат
Эфиры надкислот Перекиси ацилов дгг-тдгт-бутилперфталат , алкилперкарбонаты бензоила 1. лаурила ' метилэтилкетона
Перекиси кетоцов 2,2-бДсф-бутана , циклогексанона (техническая)
Органиноские перекиси очень часто применяются при
полимеризации полиэфиров.
Действие различных перекисей па продажный поли-
эфир детально описано Сивинским [109].
Органические перекиси ранным образом могут уча-
ствовать в прививке полимеров [1 10а]. Под привитыми
полимерами понимают высокомолекулярные вещества,
образованные цепью полимера А„, несущей ответвления
другого полимера Вв, и соответствующие общей формуле
—А А—А—Л- -А- Л—А—А—
I I
В—В-В в- В -В—
Принцип получения этих полимеров состоит в том,
что вызывают разрыв связи в полимере Л„ с образова-
нием свободных радикалов, начинающих полимери-
зацию.
146
('p/LHU-iSCK is пепекиеи
Этого можно достигнуть ’.ледуюшими путями:
1. Облучая смес! I«лимера. Ач и мономера В в отсут-
ствие кислорода с мэямым образованием свободных
радикалов, минуя сталию перекиси.
2. Облучая поли пр Аи в присутствии кислорода
с образованием переписи (бозиожно, перекиси поли-
мера).
Этот перокоиполтд^р, содержащий перекись (кото-
рую, впрочем, не изт-рруют), может быть применен как
обычный агент полилtразаши:. Хотя первый метод более
прямой, второй имегт го преимущество, что можно до-
статочно долго сохраить пеаоксиполимер и выполнять
операцию прививки Сет облучения.
3. Наконец, мохзе заегжить действовать данную
перекись на смесь гшимерс Ая и мономера В. Так,
Сметц [110] используй перепись бензоила при 70’ для
прививки винилацетата 1а ме'ллметакрплата к полимеру
винилбепзоата.
Следует допусгп.». что радикал Rp, образуемый
перекисью, вырывает яабилыын элемент из полимера
А„ (например, а том нщородг), образуя соединение R;)H
и новый радикал А,т - игзывааадпй полимеризацию моно-
мера В *.
ОБРАЗОВАНИЕ ЛЕРЕККЕЙ В ПРОЦЕССЕ
СИКК4.7ЛВИЗАЕИИ хМАСЕЛ
Процесс сиккатизщашца масел происходит вслед-
ствие действия кпслцода воздуха на глицериды непре-
дельных кислот:
¥ Существуют заменит'.литые т руды и монографии ио вопросам
полимеризации:
С h а ш р е t i е г G„ Forji.a ici de h aist poiimercs syrtifietiques, Grig-
nard, tome 22, p. 53C
Magat M., Nouveaux a>p<ts de 1: cinetiqucs de ia polimerisatioi’
Bulk Soc. Chim. Fnrc*. 535. reel 1956.
tardier Y., Influence cli si'steiue ie poIimSrisation sue la struclurc
du polymere, Bull. 8<c Chim. France, 542, avril [956.
M a r k H„ Alfrey T., .Acs rc i) i i a R., Etat actuel de Ln chinlie
ct de la physique te moleeu Is geairtes, Masson, Paris, 1940.
Bawn P., Tire chemistry si higji lorytners, Butterworth Publisher,
Londres, 1948.
Mark R., R’a i f H., Hijl rollireri: reactions, Intersc. Publischers
New York, 1941,
Различные области применения органических перекисей 147
а) мопоолефнновых, например олеиновой;
б) диолефиновых, например линолевой;
в) триолефиновых, например линоленовой и элеостеа-
риновой (три сопряженные двойные связи).
Первая стадия окисления, по-видимому, состоит
в образовании гидроперекиси (как и в случае олефинов
с а-метилсновым углеродом).
Так, а) Фармер и Саттон [111] путем молекулярной
перегонки и хроматографии изолировали гидроперекись
метилолеата; б) Болланд и Кох [112] выделили гидро-
перекись этиллинолсата.
Это образование гидроперекиси сопровождается пере-
мещением двойных связен, которые имеют тенденцию
занять сопряженное положение.
Полученная таким путем гидроперекись может дать
начало большому числу продуктов (см. автоокислепие
олефинов) и среди них спиртам этиленового ряда. Эти
последние могут конденсироваться с исходным веще-
ством (с выделением воды за счет ОН-группы и подвиж-
ного водорода а-метиленовой группы) или с себе подоб-
ными молекулами (с выделением воды за счет двух
групп ОН и образования кислородного моста). Таким
образом происходит образование пространственной
структуры без или с кислородными мостами.
Это лишь грубая картина очень сложного процесса
сиккативизапии масел.
Это явление основательно изучено Птн [113].
ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ОРГАНИЧЕСКИХ ПЕРЕКИСЕЙ
Органические перекиси могут быть в некоторых спе-
циальных случаях источником кислорода, используемого
для дыхания в известных растительных тканях.
В действительности Арциховская и Рубин [1 14] экспе-
риментально показали несовместимость интенсивности
дыхания мякоти плода цитрусовых с содержанием н пей
молекулярного кислорода и газонепроницаемостью ко-
журы. Они выдвинули гипотезу, что кислород, диффун-
дирующий во внешний слой кожуры, образует там пере-
киси, которые затем, транспортированные внутрь плода,
освобождают там необходимый для дыхания кислород,
148
О /яа-1ше:;к stinf’-eiiucii
Это утверждение под<реплекс экспериментальной рабо-
той авторов, основыв1мп;ейся на определении перекисей
и молекулярного кислорода г разных частях плода во
время его созревания
Были установлены следую гиг факты:
1, Во всех тканяс содержание перекиси достигает
максимума только песте долгого созревания плодов и
их снятия с дерева.
2. Содержание телеки с ей возрастает от кожуры
к мякоти.
3. Перекиси появляются в кожуре только к началу
созревания плода.
4. Мякоть зеленого плода содержит минимум пере-
кисей.
5. Содержание трекиснов кислорода мякоти во
много десятков раз бхп.гае, чти свободного кислорода.
6. Во время созретазия и зэазсния плодов содержа-
ние перекисного кислсрода в различных тканях меняется
параллельно с содержанием ло.>екулярпого кислорода
в мякоти.
7. Содержание переписей повышается в плодах, вы-
держиваемых в атксгоере г-гслорода, одновременно
с повышением содержании молекулярного кислорода
в мякоти.
Все эти факты свидгтельсгуит о том, что происхо-
дит постепенное пер(мещенце герекисей из внешних
тканей плода во внутрелпне тк;нг, где они разлагаются,
снабжая их необходимы ддя дыхания кислородом.
ЗШИОЧЕТШ
Несмотря па то, что opraEHiecKtie перекиси полезны
во многих технологичен тих областях, иногда пх образо-
вание нежелательно. В маетности, их образование может
повлечь за собой серлезиые в;ръвы, что наблюдается
в случае
а) простых эфиров (:де палнпе кислородного моста
делает связанный с нт» углерод весьма уязвимым по
отношению к автоокистенкю с )бразоваписм гидропере-
киси в качестве первичного продукта этого автоокис-
ления);
Различные области применения органических перекисей 149
б) углеводородов, подобных тетралину;
в) альдегидов, подобных ацетальдегиду. (Его окисле-
ние в производстве уксусной кислоты при помощи кисло-
рода воздуха в присутствии солей марганца было
причиной тяжелых взрывов вследствие образования над-
уксусной кислоты.)
В заключение несколько указаний об обращении
с этими веществами.
1. Перекиси необходимо хранить в отсутствие тепла
и света. Свет может играть роль нагревателя (сосуд
может сыграть роль линзы) или просто действовать
фотохимически.
2. Пи в коем случае не следует допускать контакта
этих веществ с металлическими поверхностями, так как
металлы — активные катализаторы разложения пере-
кисей.
I Гаднпслоты, озоннды и диоксиперекиси особенно
к этому чувствительны,
3. Наконец, во время работы с перекисями следует
по возможности избегать механических воздействий
(толчков, трения).
ЛИТЕРАТУРА
100а. Hock Н., КгорГ Н, Angew. Chem.. 69, Ха 10, 313 (1957)
10[а. Наметкин С., Брюсов Л, J. Prakt. Chem., 112, [70
(1926).
10 [б. Н а м с т к п н С., Абакумовой ий Л., J. Prakt. Chem.,
i 15, 56 (1927).
10lB. Boes eken J., Rec. Trav. Chiny. Pays-Bas, 45, 838 (1926).
10[r. W r a g g W., Bull. Soc. Chem. France. 1952, 911.
102a. Fieser L.r Oxford E., J. Am. Chem. Soc., 64, 2060 (1942).
1026. Fieser L., Tnurner R , J. Am. Chem. Soc', 69, 2338 (1947).
103a. В r a il e г M., Fletcher W., Sweeney G., Trans, institu-
tion Rubber Industry, 30, 44 (1954).
1036. Brader M., Fletcher W., Sweeney G., Trans. Inslitu-
tion Rubber Industry, 31, 155 (1965).
104. l.ufter C„ Rubber World, 133, 511 (1956).
104a. Walling C., Mayo R., Chem. Rev,, 27, 35[ (1940).
105. Price C., J. Am. Chem. Soc., 64, 1103 (1942).
iOS. Schulz S., W i 11 i g, Nafiirwissetischaften, 27, 387—456 (1939).
107ii. Norriscli R.. Broockman E., Proc. Roy. Soc., 171A 147
(1939).
107. Метелен С., Каменская К., ЖФХ, 13, 565 (1940).
108. Bartlett B„ Cohen S.. J. Am. Chem. Soc., 65, 543 (1943),
150
Органичен га черекиси
109. Cywiusky С., Britich Plast.ms 1956, 377.
110а. Chapiro A., Chim. et Irxl., Р5(, 754.
III. Farmer E., Sutton H., J. Caen. Soc., 1949, 543.
112. Rolland J., Koch H., J. Cicn. Soc., 1945, 445.
113. Ch amp etier G., R abate H, Traite des Peintures (Dunod,
1956).
114. Лрциховская E., P у б и и E, ДАН, 124, 99 (1950).
ОБЩАЯ ЛИТЕРАТУРА
КНИ?Т
R j e c 11 о A., Alkyl peroxyde und Ooiicle, Steinkopf, Dresden (I93[).
Tobol sky A., Mcsrobian R,, Organic Peroxydes, Interscience
Publishers, New York (1954).
СТАТЬИ
Hawkins E., Some organic percxyles and their reactions. Quar-
terly Reviews, 4, 251 (195O1-
C r i e g e e R., Herslellung und Umwaidlung von Peroxydcn, Hotibcn-
weyl, vol. 8, p. 1, Georg TTejie Verlag, Stuttgart (1952).
Milas N.T Organic Pcroxydc.s, Encyrbptdia of Chemical Technology,
Kirk-Otrilier, vol. irJ, p. 58, Iit-rscience Publishers, New York
(1953).
Manly M., Organic Pcro.xy-coni[.o;n<ls, Industrial Chemist and
Chemical Manufacturing, 32, 211—276, 319 -322 (1956).
СОДЕРЖАНИЕ
Предисловие............................................... 5
Глава I. Химическая классификация......................... 7
Введение............................................. 7
Химическая классификация органических перекисей . . 8
Изомерия в ряду органических перекисей.............. 10
Глава II. Гидроперекиси алкилов.......................... 11
Общие методы синтеза *.............................. 11
Способы с использованием Н2О2................... 11
Способы с использованием кислорода ............. 14
Общие свойства гидроперекисей....................... 20
Отдельные представители гидроперекисей.............. 21
Гидроперекись метила СНаООН..................... 21
Гидроперекись этила П3ССН2ОО][.................. 22
Гидроперекись тре/л-бутпла ..................... 23
Гидроперекись кумола............................ 25
Гидроперекись пинана............................ 26
Литература.......................................... 27
Глава III. Перекиси алкилов.............................. 29
Общие методы получения ............................. 29
Общие свойства перекисей алкилов.................... 30
Отдельные представители перекисей алкилов........... 31
Перекись метила Н3ОООСН3........................ 31
Перекись метилэтида НЭСООС2Н5................... 31
Перекись этила С2Н5ООС2115...................... 32
Перекиси, включающие /прст-бутильиый радикал и
другие третичные радикалы....................... 32
Перекиси, включающие радикалы трифенилметила и
ксагптидрпла.................................... 34
Литература.......................................... 35
Глава IV. Гидроперекиси ацилов (надкислоты) ............. 36
Общие снедеция..................................... 36
Гидроперекиси — производные одноосновных кислот - . 3G
Общие методы синтеза......................... 36
Общие свойства..................................... 38
152
Соде&хаше
Отдельные представители гидроперекисей ацилов (над-
кислот) ........................................... 39
Надмуравьиная кислот! Гидроперекись формила) . . 39
Надуксусная кислота |г.'.дроперск»сь ацетила) ... 40
Надпропиоиовая кисло!а(г1дроперскись пропионила) 40
Надмасляная кислота........................... 40
Надкапроновая кислота ........................... 41
Надбензойная кислота < ирропсрекись бензоила) . . 41
Надкоричная кислота........................... 43
Надпирослизевая кистсга (гидроперекись фуроила) 43
Гидроперекиси™ произвол!не двухосновных кислот . . 44
Отдельные представители........................... 43
Мотгоперфталевая кис,тага....................... 45
Дипертерефталевая kucjoti..................... 46
Моноперянтарная кпелота....................... 47
Моноперкамфорная кислот;...................... 48
Литература......................................... 49
Глава К Перэфиры (эфиры гидротерекисей ацилов) ... 50
Синтез............................................ 50
Общие сведения...................................... 50
н-Нитропербензоаты................................ 52
Алкилперкарбонаты ................................ 53
Алкилмоноперкарбонаы............................. 53
Алк и л дипер карбонаты....................... 53
Дитература......................................... 54
Глава VI. Перекиси — произведдые кислот............. . 55
А. Перекиси—производна.< одноосновных кислот или
перекиси ацилов ............................ 55
Общие свойства перекисей |цилов................... 57
Отдельные представители........................... 57
Перекись ацетила .... ........................... 67
Хлорсодержащие пересып ацетила................ 58
Перекись фенил а цетила......................... 59
Смешанная перекись Секзсила— ацетила ...... 59
Перекись бензоила ............................... 61
Замещенные перекиси Сепзоила.................. 61
Перекись кротонила .............................. 63
Перекись цинпамила ... 64
Перекис!! ацилов с г?,-ер«циклическим ядром ... 64
Б. Перекиси™ производные щухосновных кислот. . . 65
Перокси дикие лоты . ................................ 65
Пероксндифталесая ккюп........................ 66
Пероксидиянтарная ктелг;...................... 66
Пероксидиглутаровая стсл#та................... 67
Смешанная яптарттоглупревая псроксцдпкислота 67
Алки.шерОкспднкарбона"ы ......................... 68
Циклические перекиси ................................ 68
Перекись сукцинила............................ 69
Содержание
153
Перекись фта.тила.............................
Перекись камфорила...............................
Перекись циклопропан-!,2-дикарбоповой кислоты
Перекись фумарила.............................
Литература.......................................
Глава VII. Перекиси — производные альдегидов и кетонов
Общие сведения...................................
Перекиси — производные альдегидов................
Мопооксигидроперекиси.........................
Диоксиперекиси................•...............
Моно-а-оксиперекиси...........................
Диперскпсн....................................
Тример пая перекись пропгглидспа или ирона на ля .
Перекиси — производные кетонов...................
Перекиси — производные алифатических кетонов . . .
Диперекись ацетона............................
Триперекись ацетона ..........................
Диперекпсь мстилэтилиетона....................
Конденсация кетонов с гидроперекисями ........
Перекиси — производные ароматических кетонов.
1 [ерекиси — производные алициклических кетонов
Литература................................. . .
Глава VIII. Трансаннулярные перекиси......................
Общие сведения...................................
Отдельные представители . .......................
Внутренняя перекись циклогексена ................
Аскаридол, или эидоперекись з-терпииена..........
Эндоперекиси с фенантреновым ядром...............
Эидоперекись эргостерина.........................
Эидоперекись дсгнлроэргостерипа ............... .
Э|гдопсрскпсь дсгидрохолестерипа.................
Эидоперекись холеггадпепа........................
Эндоперекиси антраценового ряда .................
Перекиси нафтаценового ряда .....................
Литература.......................................
Глава IX. Полимерные перекиси..........................
Литература.......................................
Глава X. Озониды.......................................
Общие сведения...................................
Мопоозоииды......................................
Отдельные представители..........................
Озонид этилена ...............................
Озонид бутилена...............................
О.тонпд олеиновой кислоты.....................
Озонид бензола................................
71 итера гура....................................
69
69
70
70
70
71
71
74
74
75
77
77
80
80
81
81
82
83
84
84
87
89
91
91
92
92
93
95
95
96
96
97
97
99
100
101
104
105
105
111
111
111
111
112
112
H2
154
Содержание
Глава XI. Анализ перекисей ............................113
Аналитическая характериснк;.......................113
Определение активного кисдаэода ................. 114
Йодометрия ...................................114
Метод, основанный на ошелении Sn2+ в Sn4+ ... 116
Различные методы . ...........................118
Литература .......................................119
Глава XI!. Разложение переписки на радикалы............120
Гидроперекиси ................................... 120
Перекиси алкилов..................................122
Перекиси ацилов . . . ........................ . . 124
Литература........................................129
Глава XIII. Образование перекисей в процессе автооки-
сления углеводородов....................................130
Общие сведения................................ 130
Этиленовые углеводороды...........................133
Литература........................................135
Глава XIV. Различные области пртменення органических
перекисей...............................................136
Применение и органическом антезе................ 136
Синтез фенола и ацетола i «рез гидроперекись кумола 136
Синтезы, основанные ш окислении перекисями . . 138
Введение боковых цепей в хиноны................139
Перекиси, действующие в реакциях как ориентация 141
Применение для вулканизации каучука...............141
Применение для полимер лзагти.....................142
Образование перекисей в трсцессе сиккативизации масел 146
Физиологическая роль оргацгчгевдх перекисей.......147
Заключение........................................148
Литература.................................. . - 149
Общая литература................................ 150
В. Карножицкий
ОРГАНИЧЕСКИЕ перекиси
Редактор Г. Газиева
Художник В. Манилов
Технический редактор В. Доценко
Корректор А. Ф, Рыбацъченко
Сдано в производство 1S/XI1960 г.
Подписано к печати 21/TlI 196[ г.
Бумага 8-1X108'/а-, = 2,4 бум. л.
8,0 печ, л.
Уч.-изд. л. 6,3 Изд. № ЗЛ221
Цена 64 коп. Зак. 1925.
ИЗДАТЕЛЬСТВО
ИНОСТРАННОЙ ЛИТЕРАТУРЫ
Москва, 1-й Рижский нер., 2
Типография № 2 им. Ear. Соколовой
УПП Лепсовнархоза
Ленинград. Измайловский пр., 29