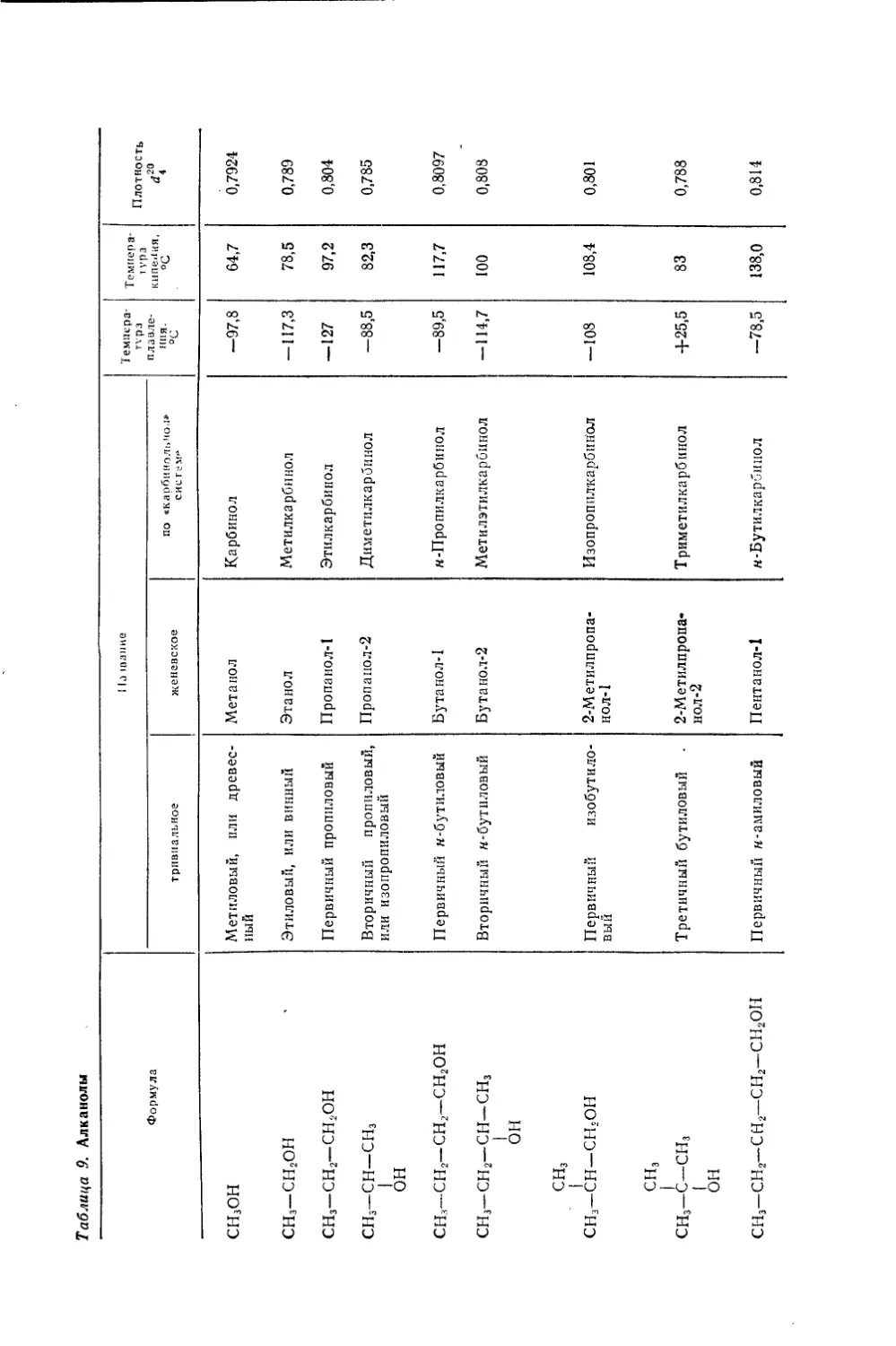
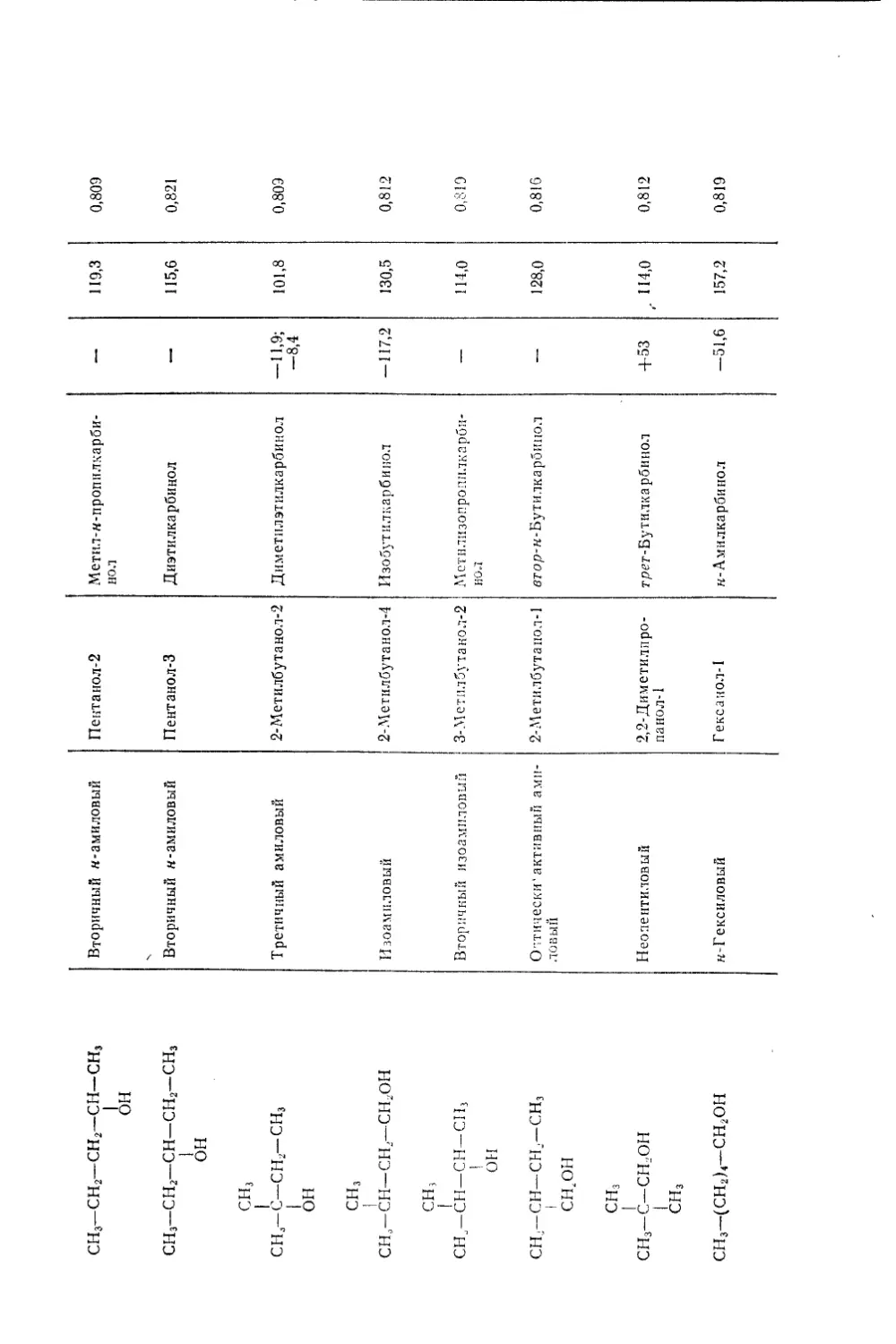
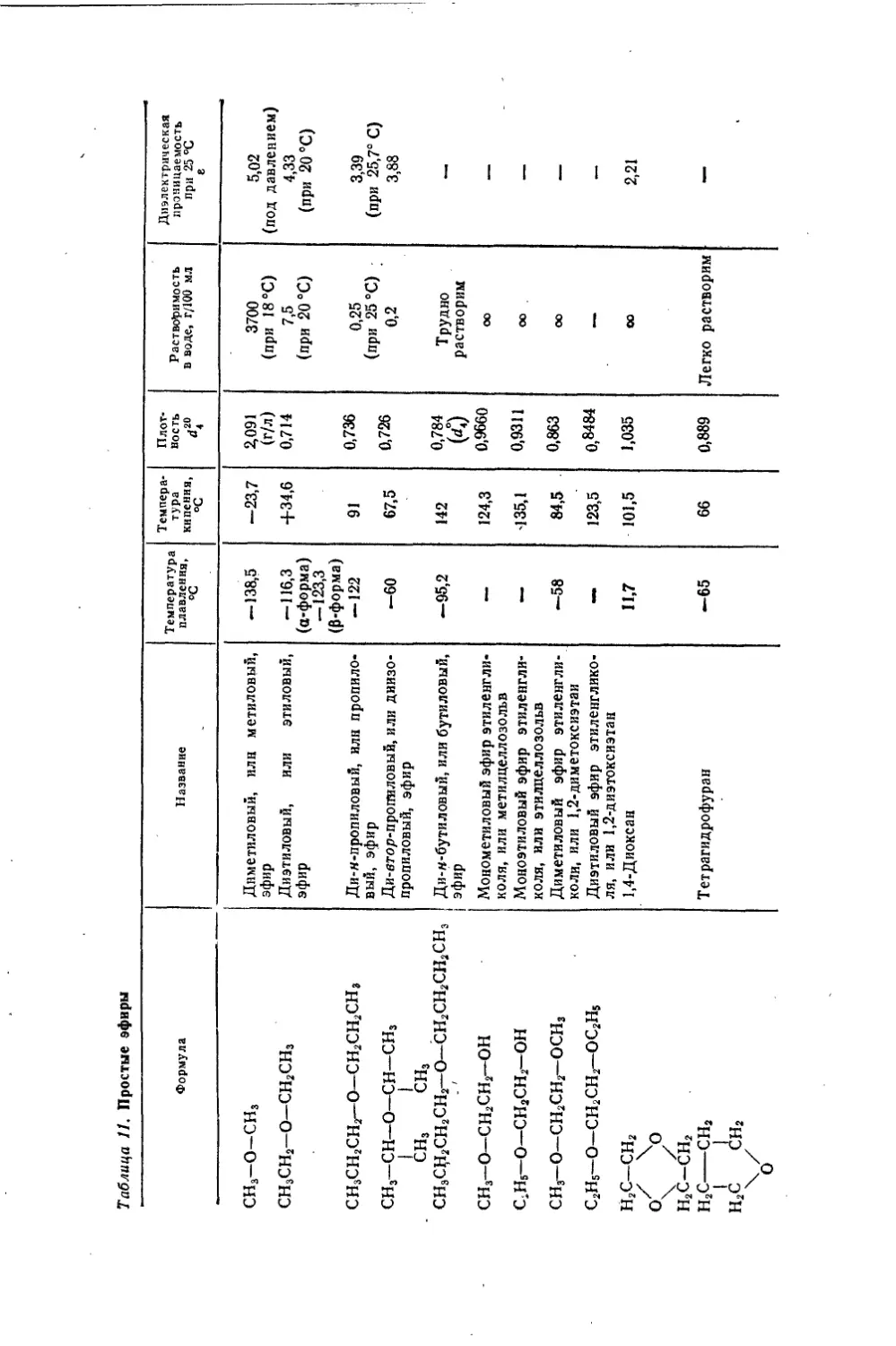
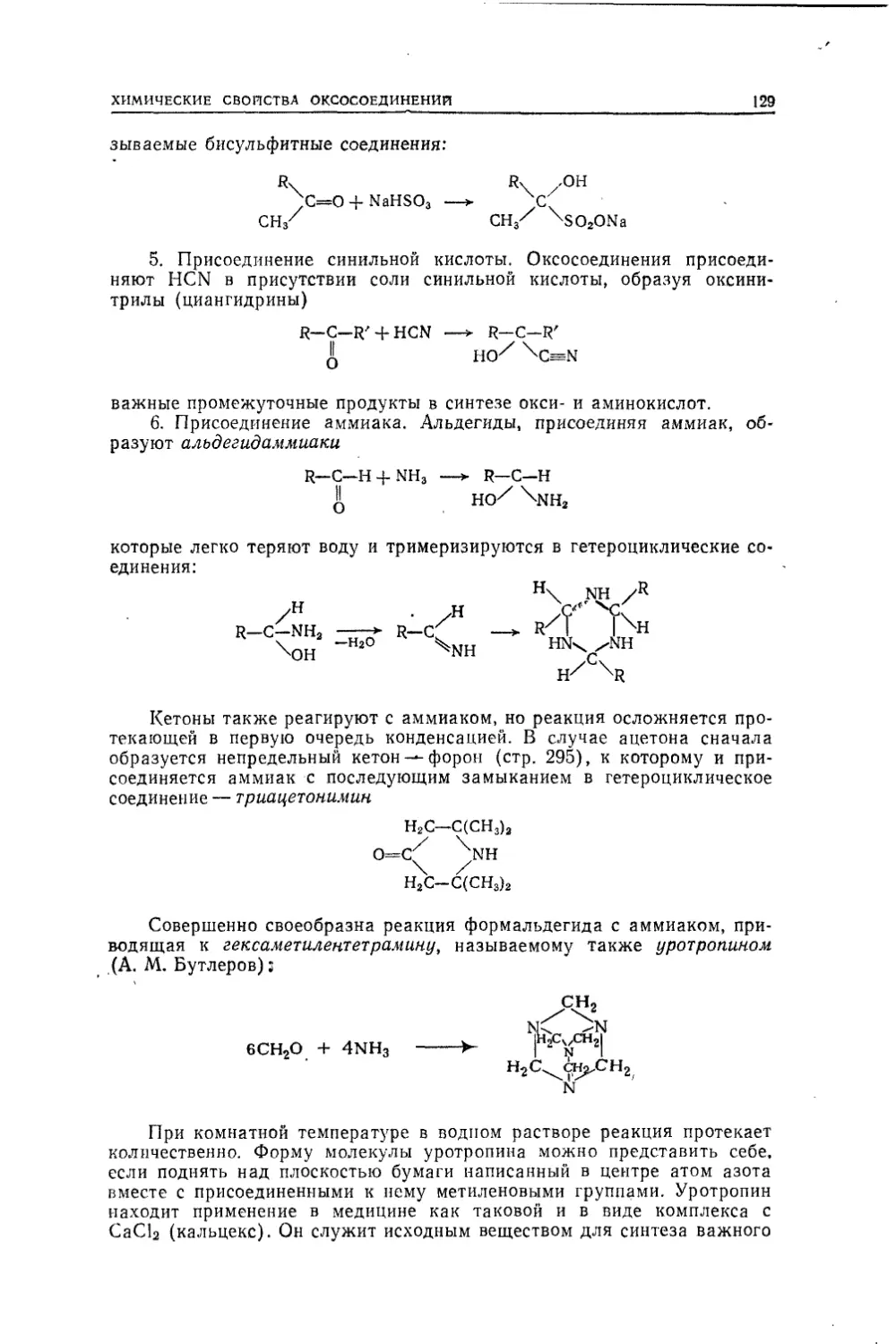
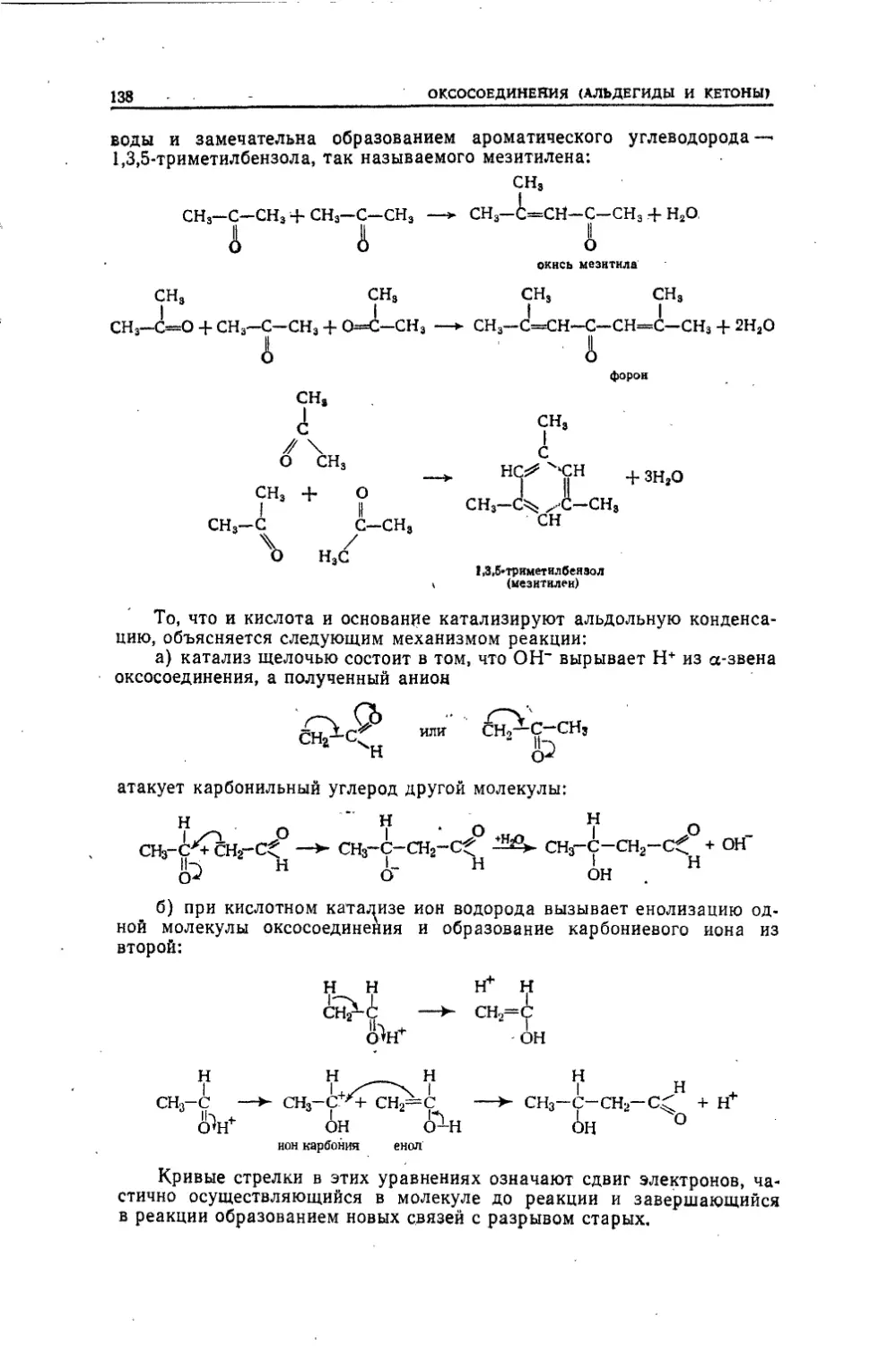
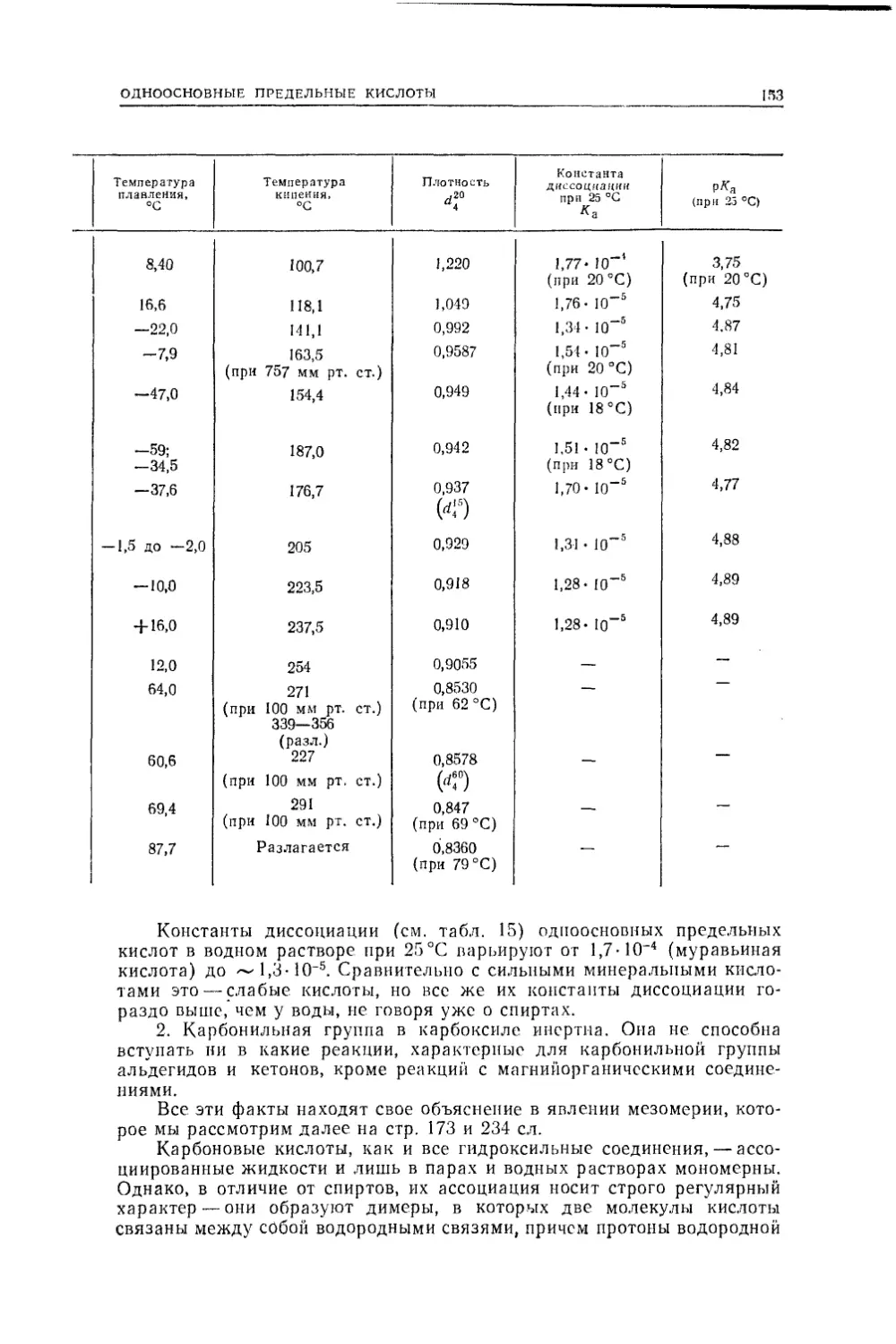
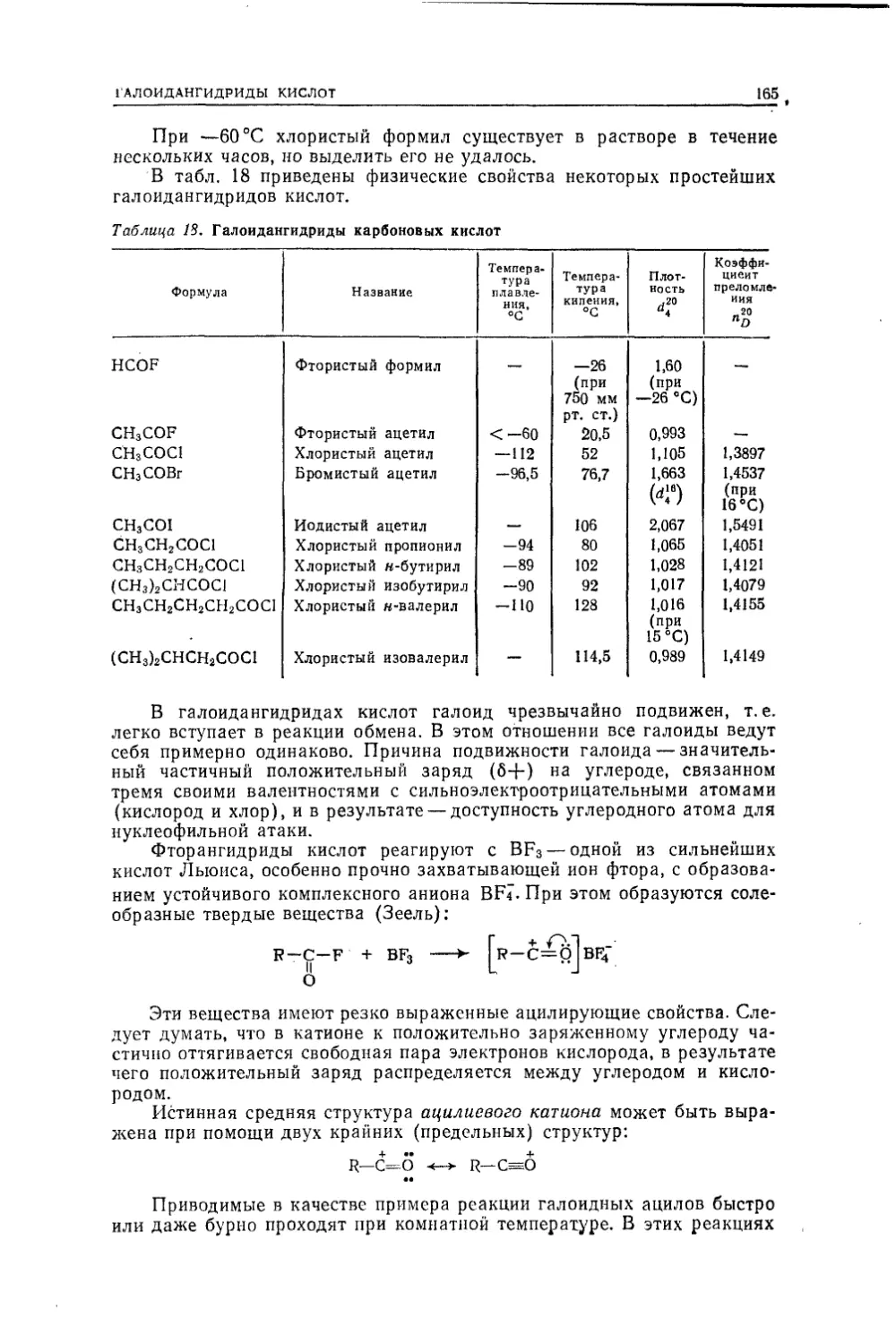
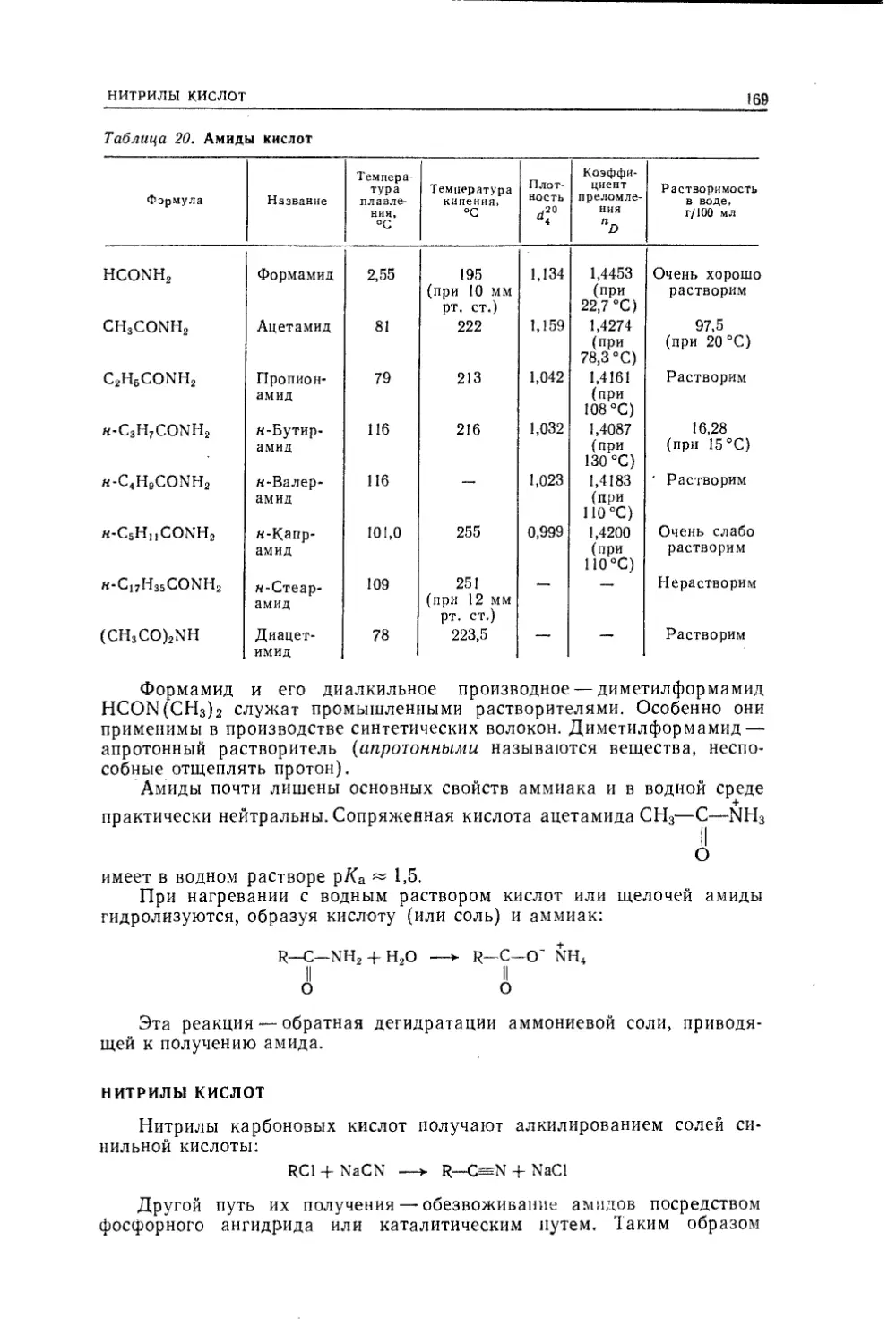
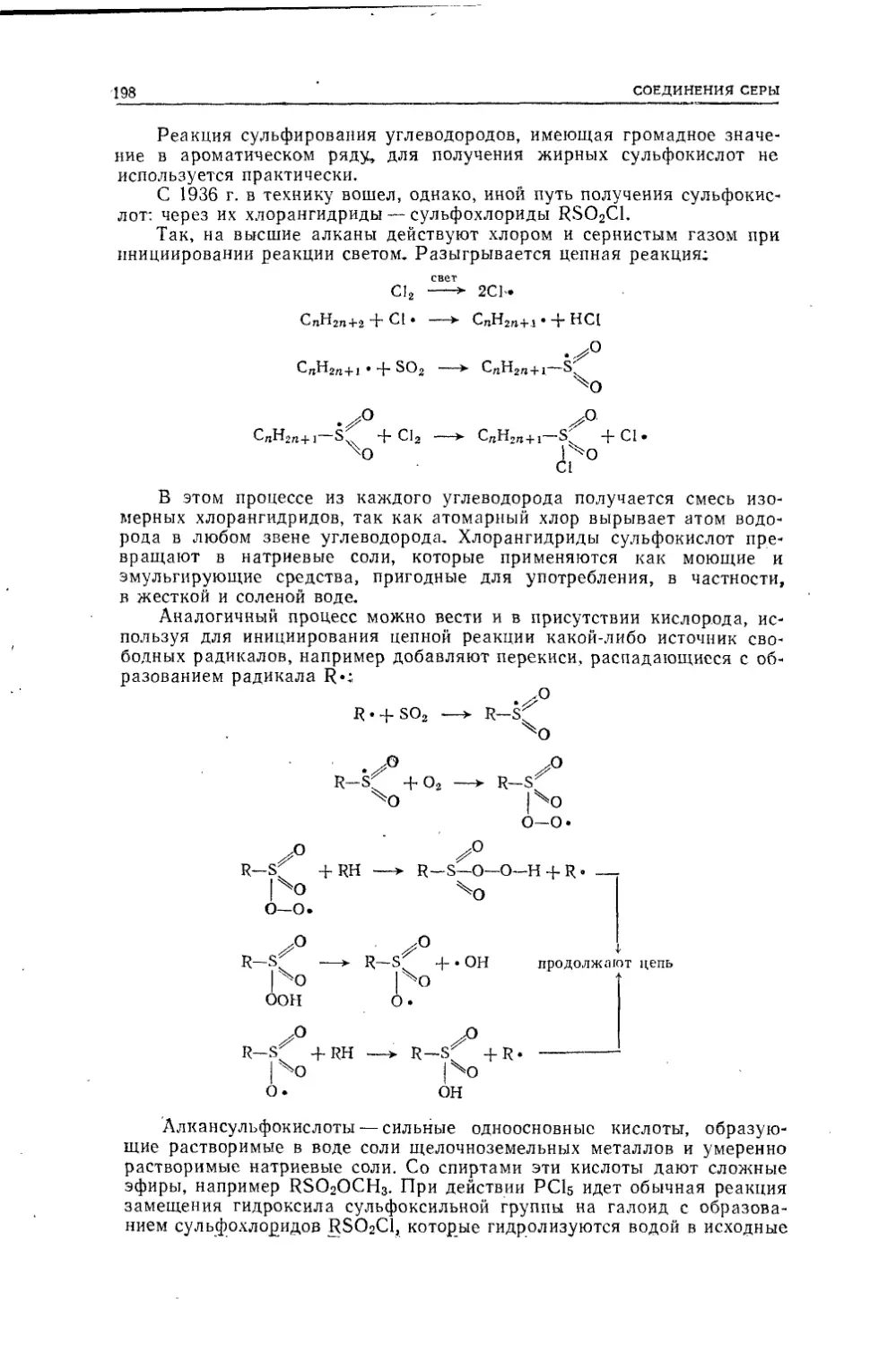
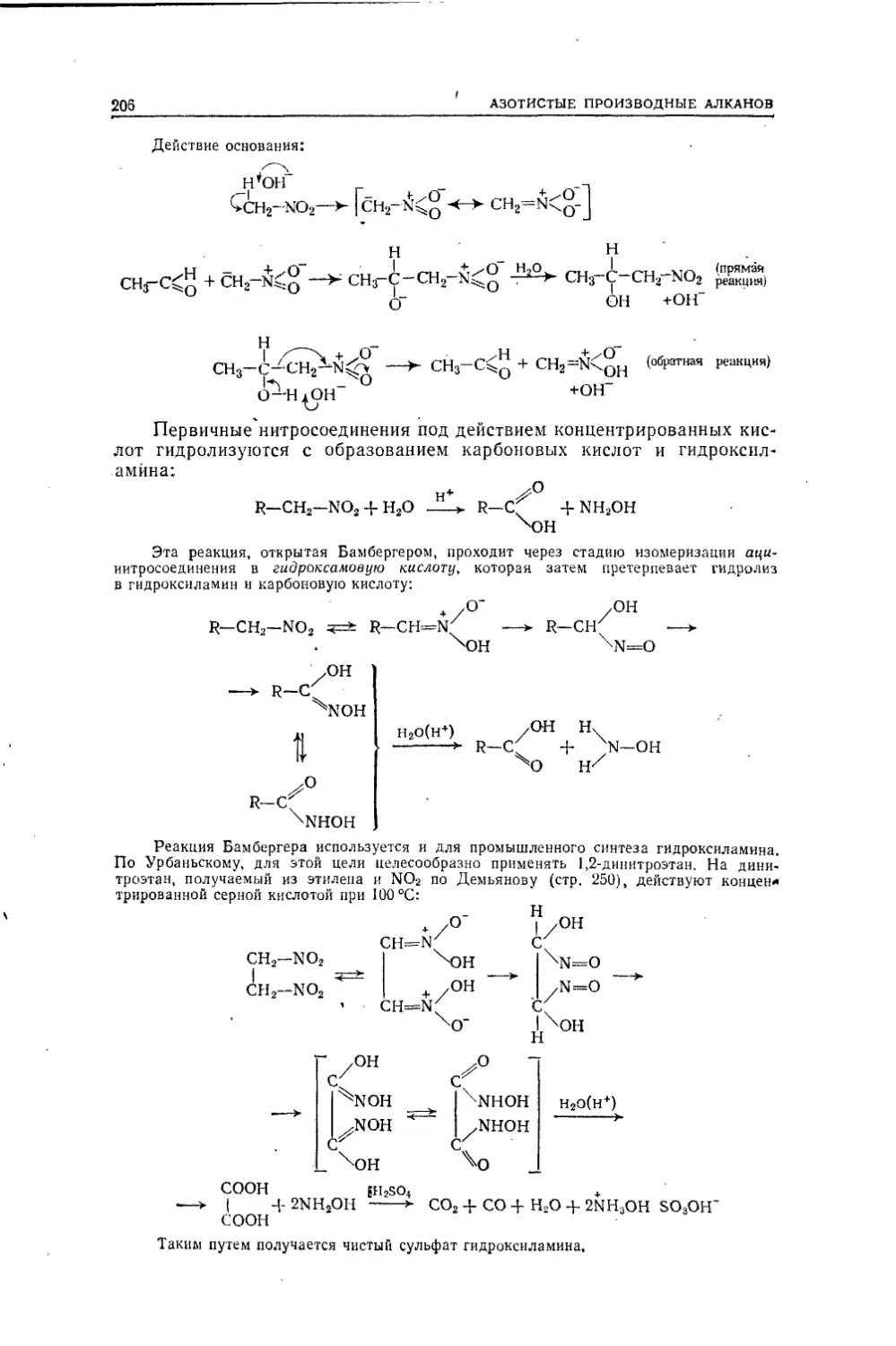
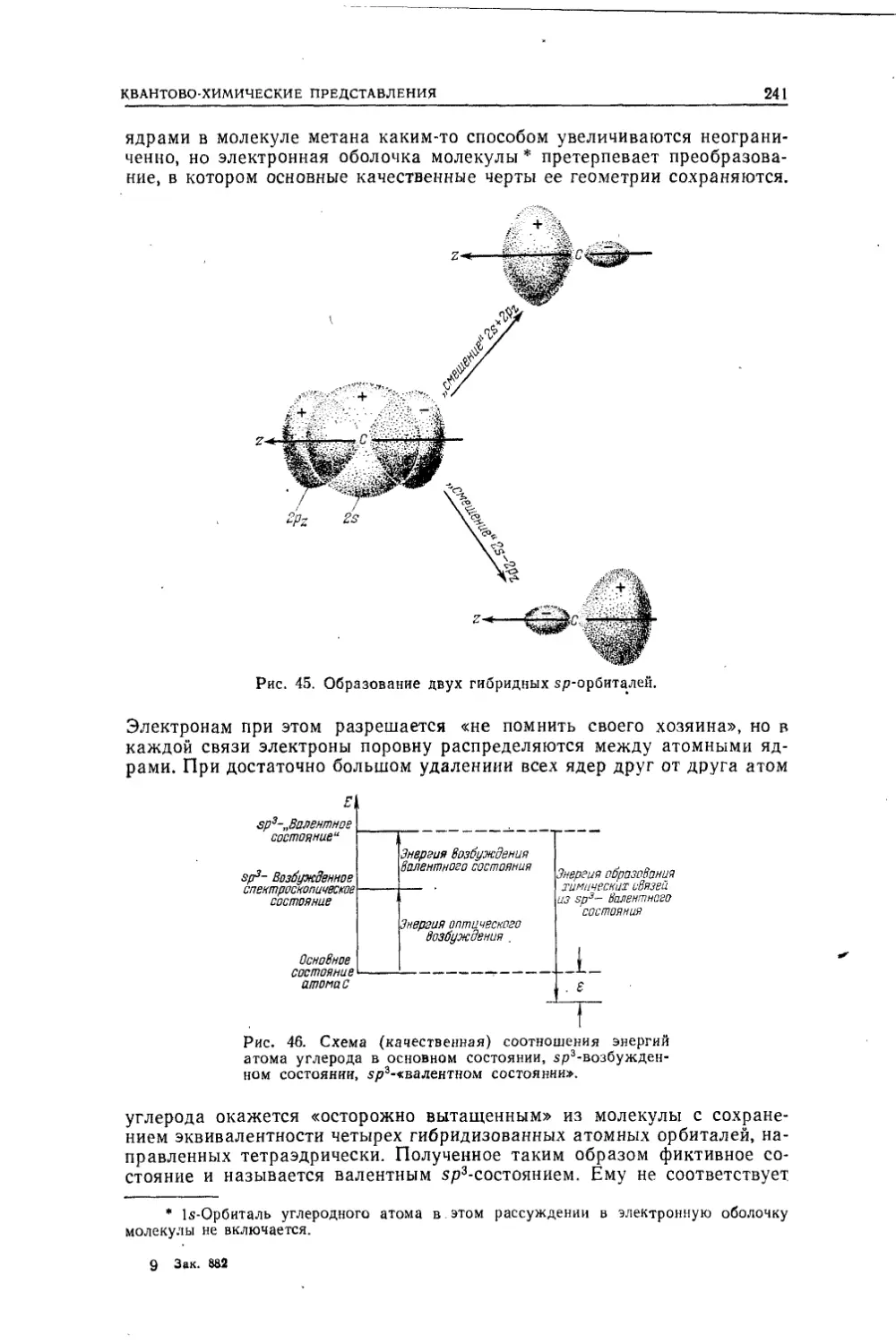
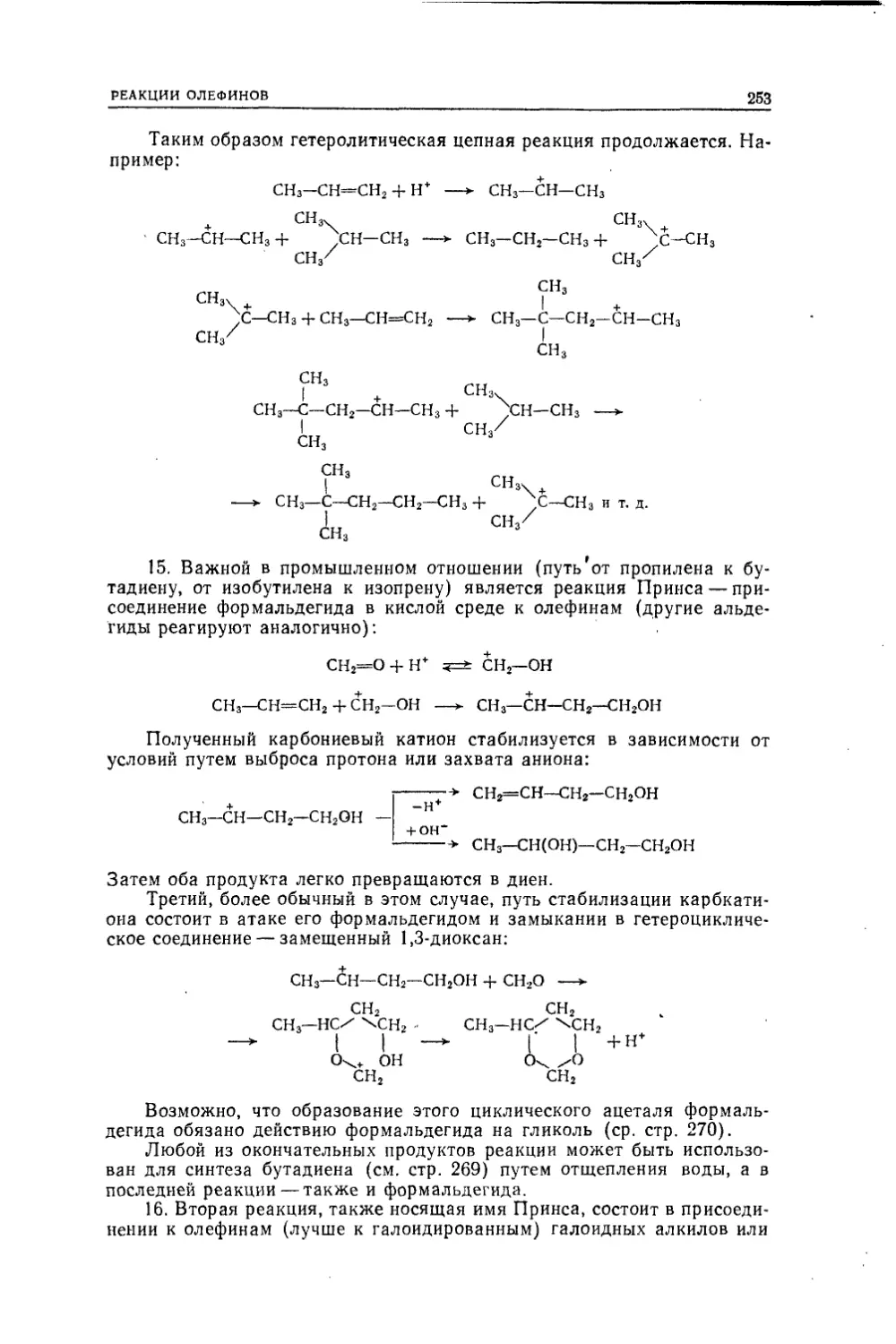
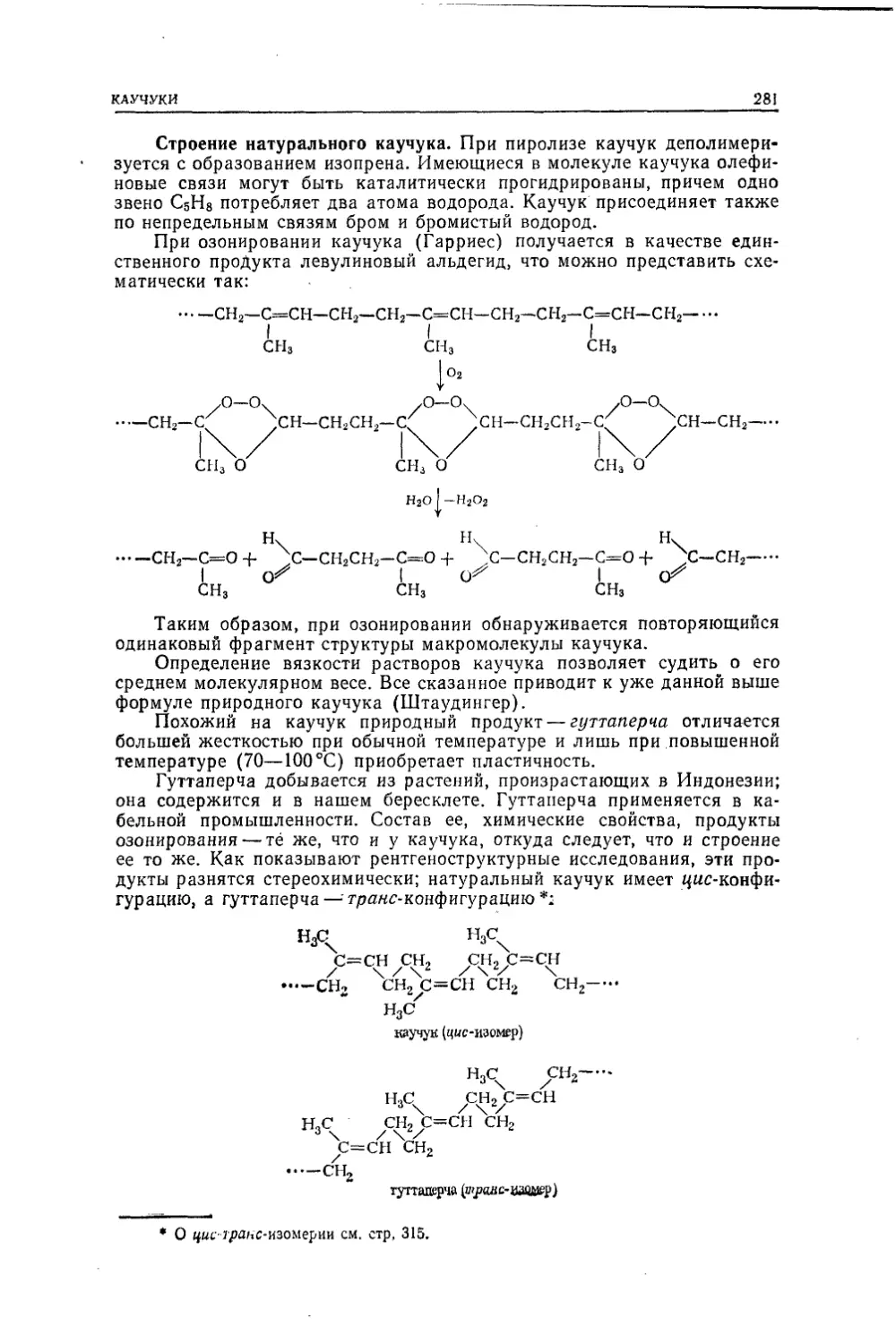
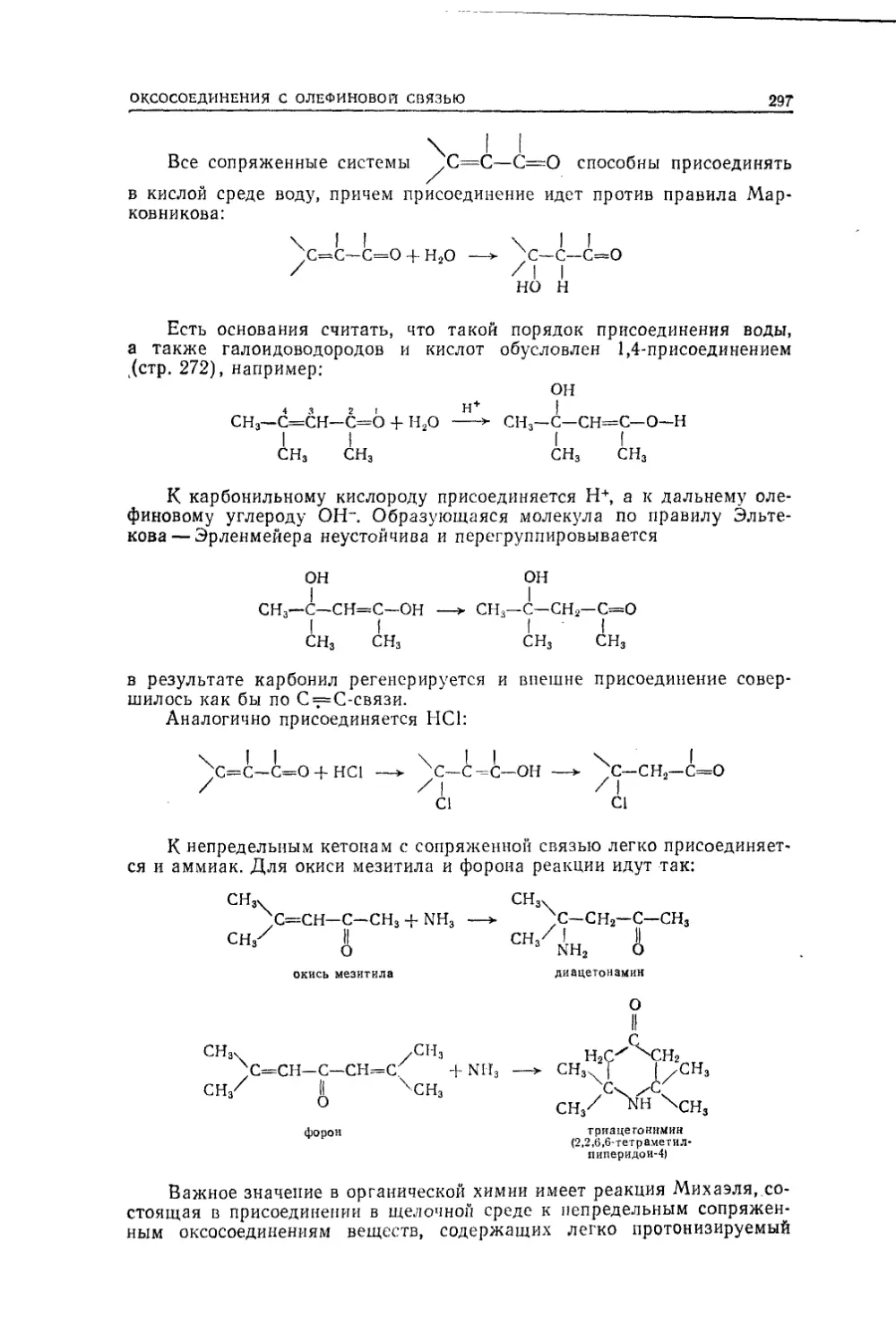
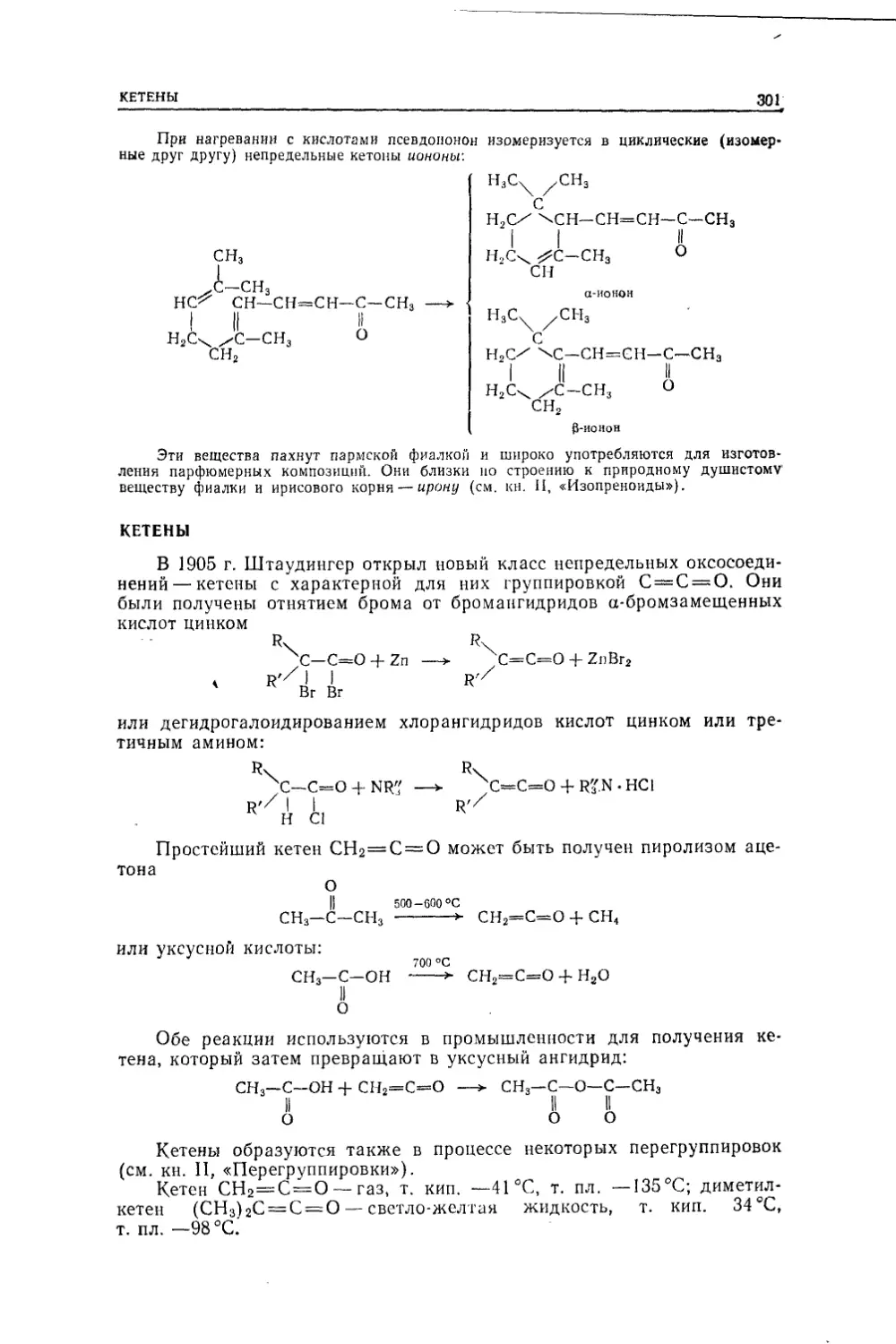
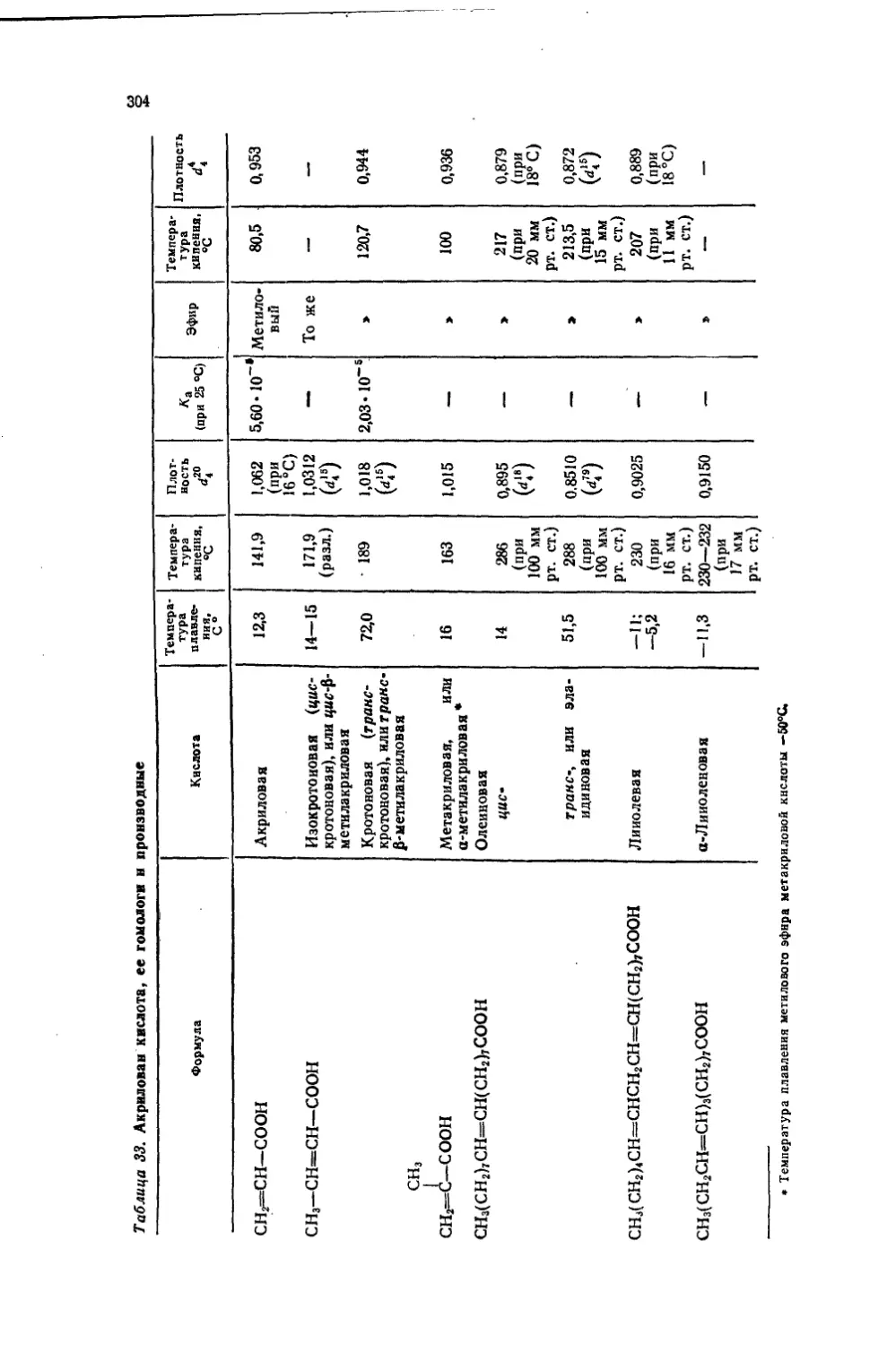
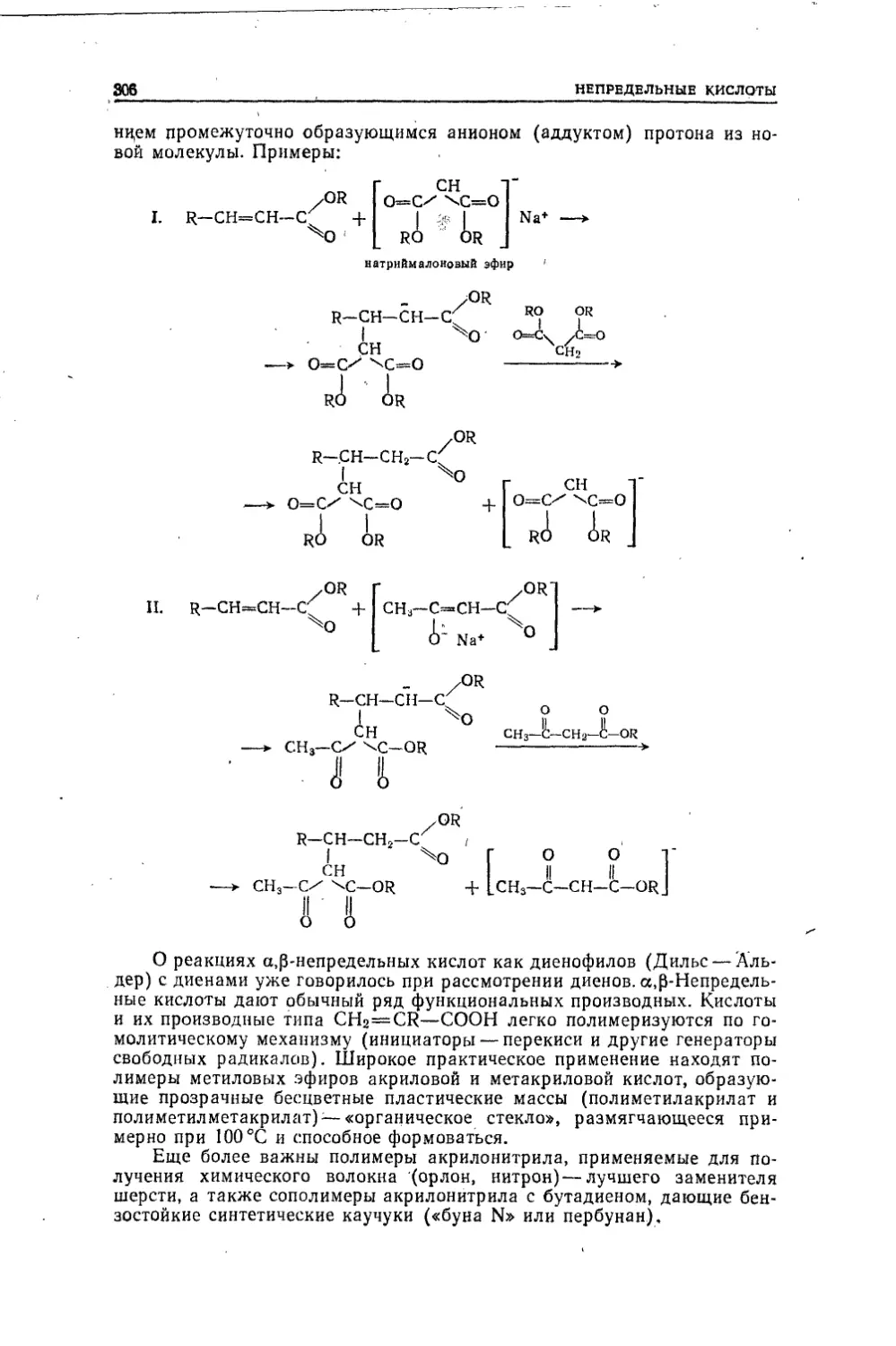
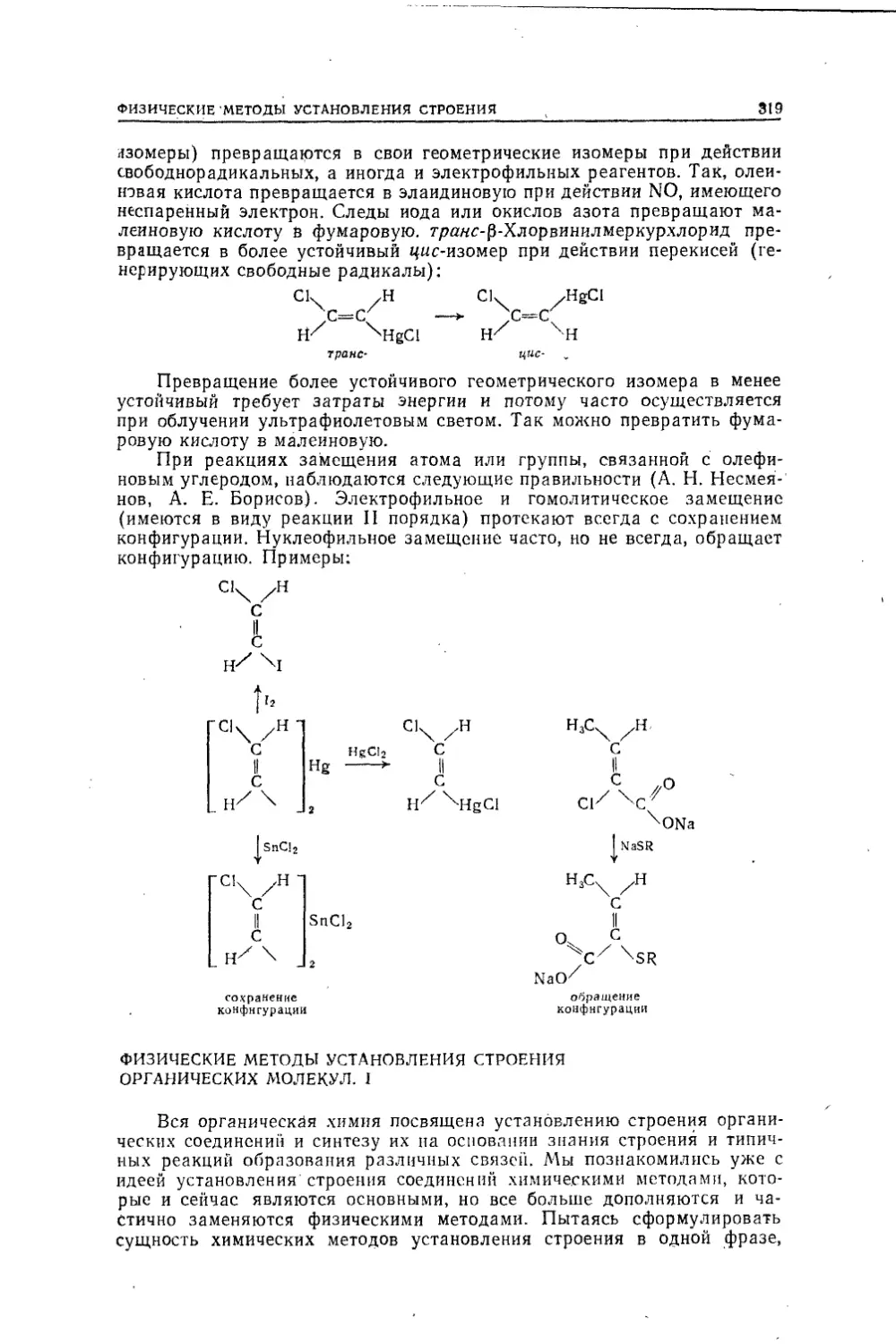
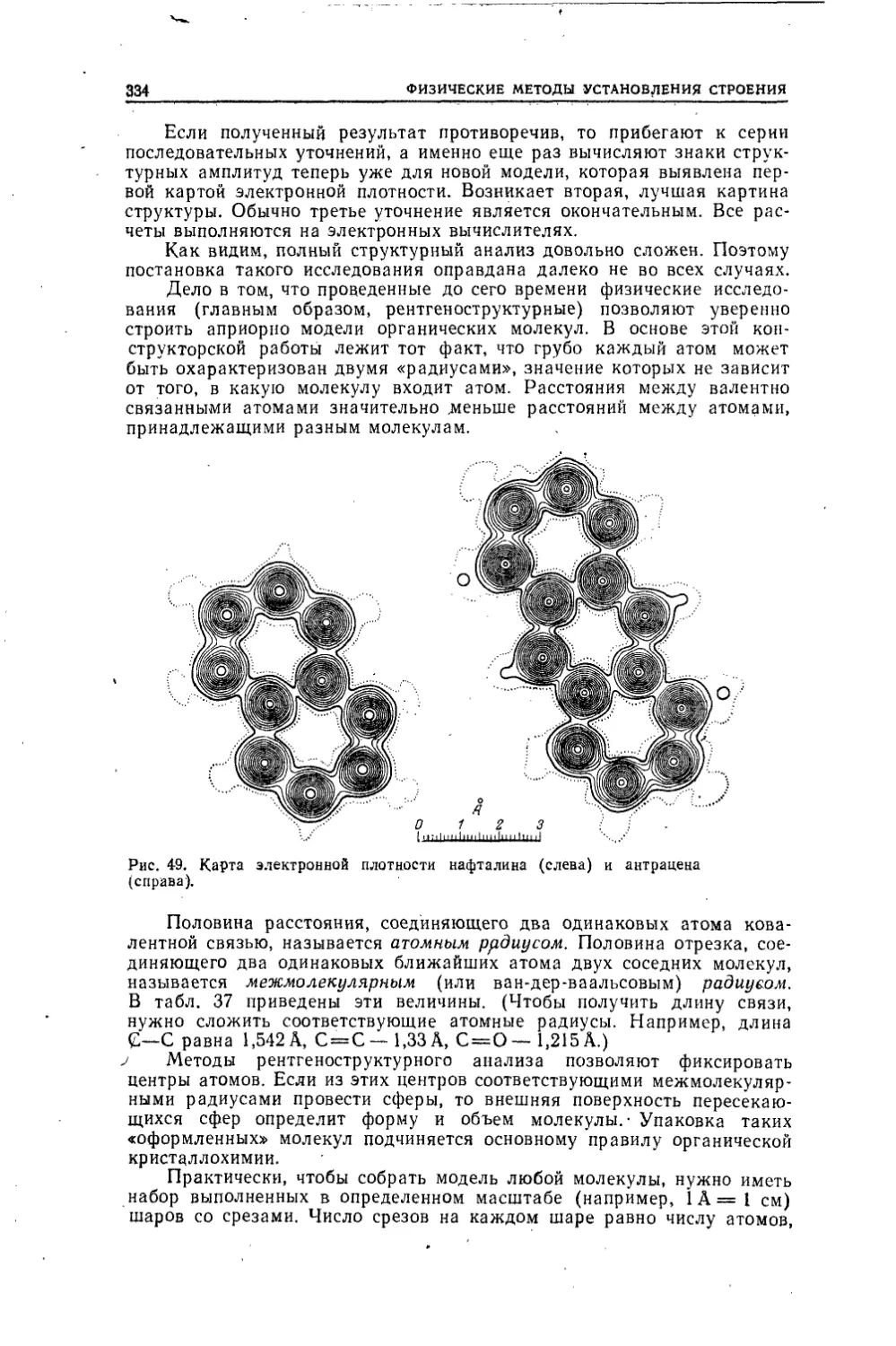
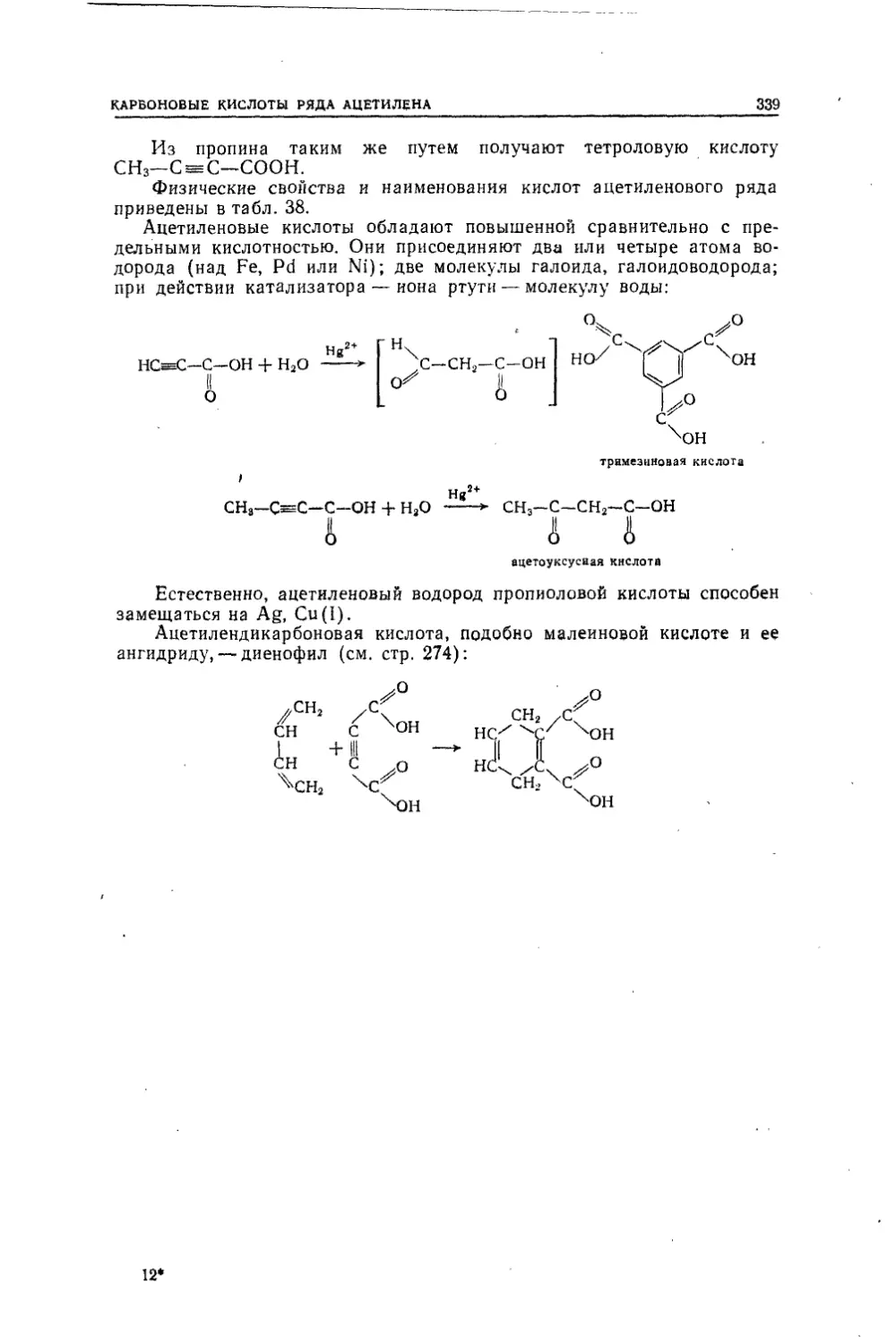
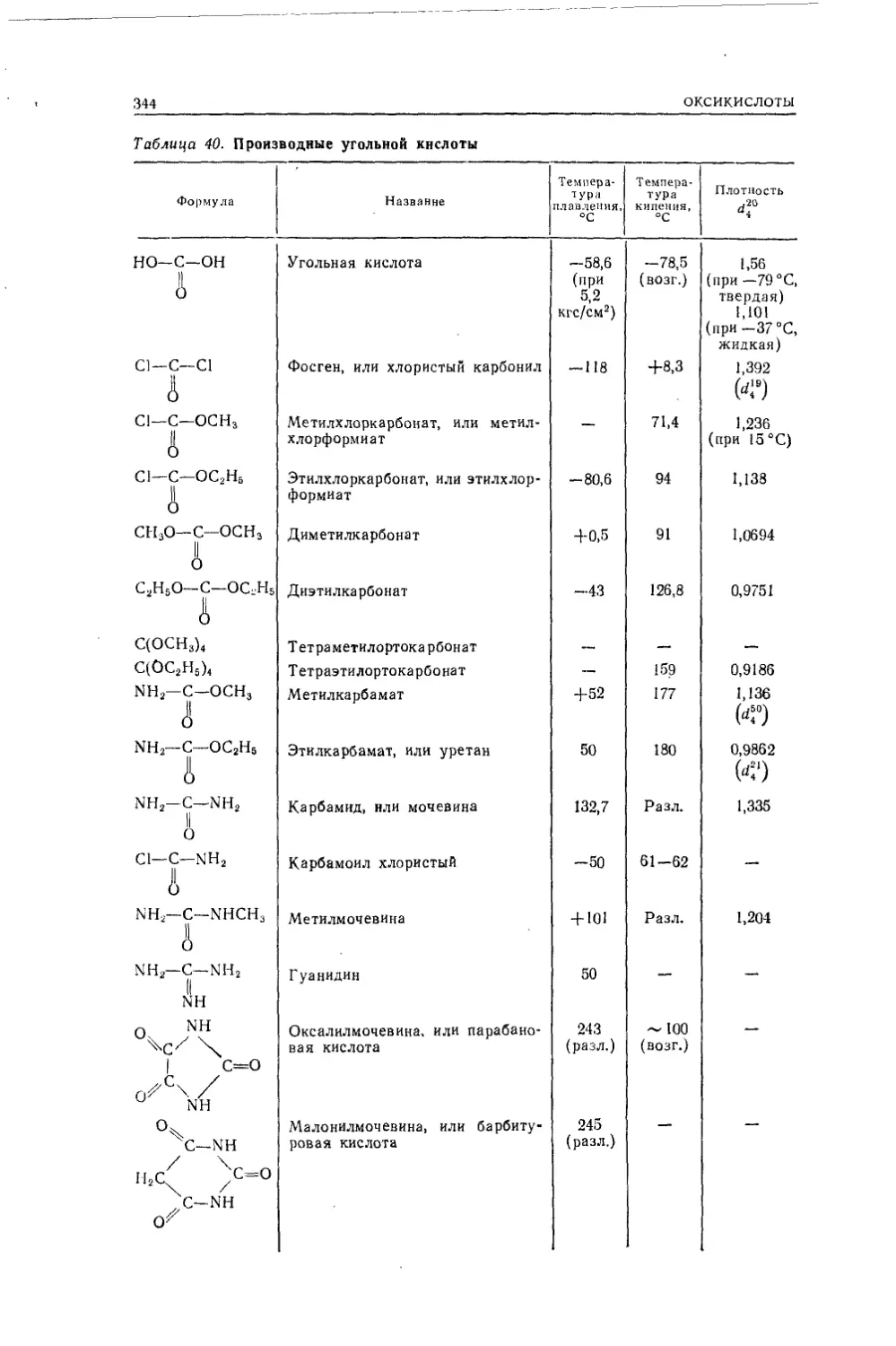
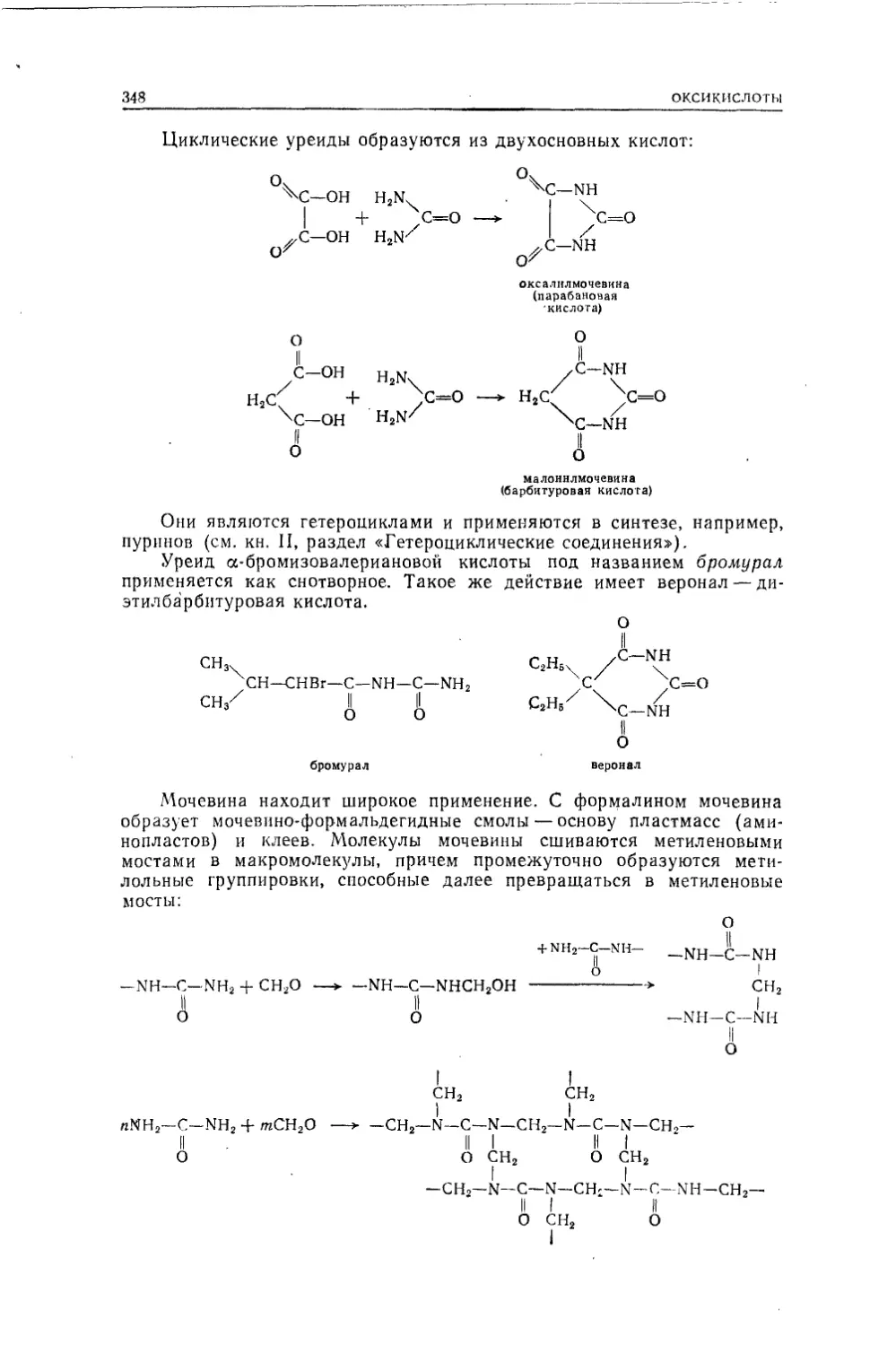
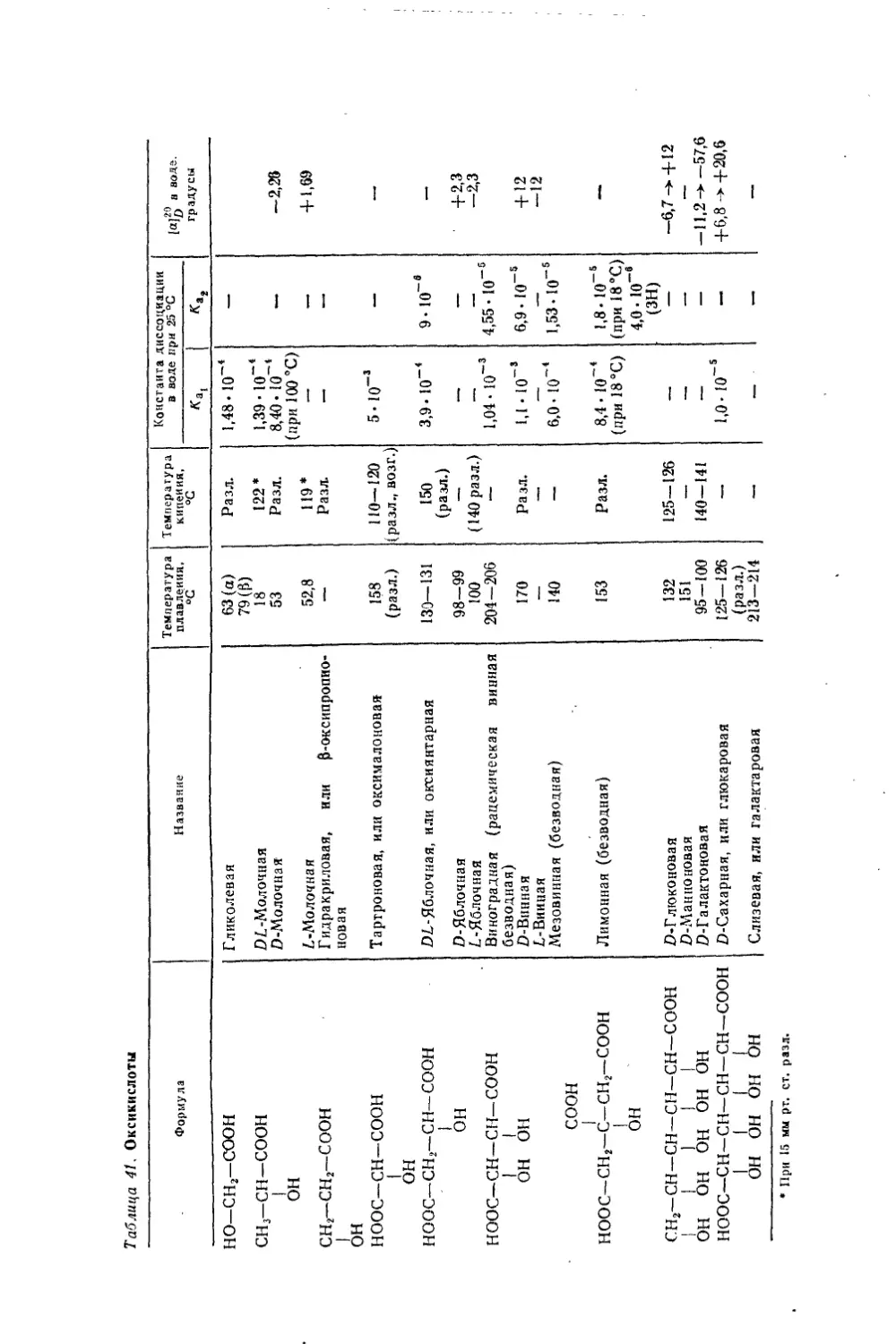
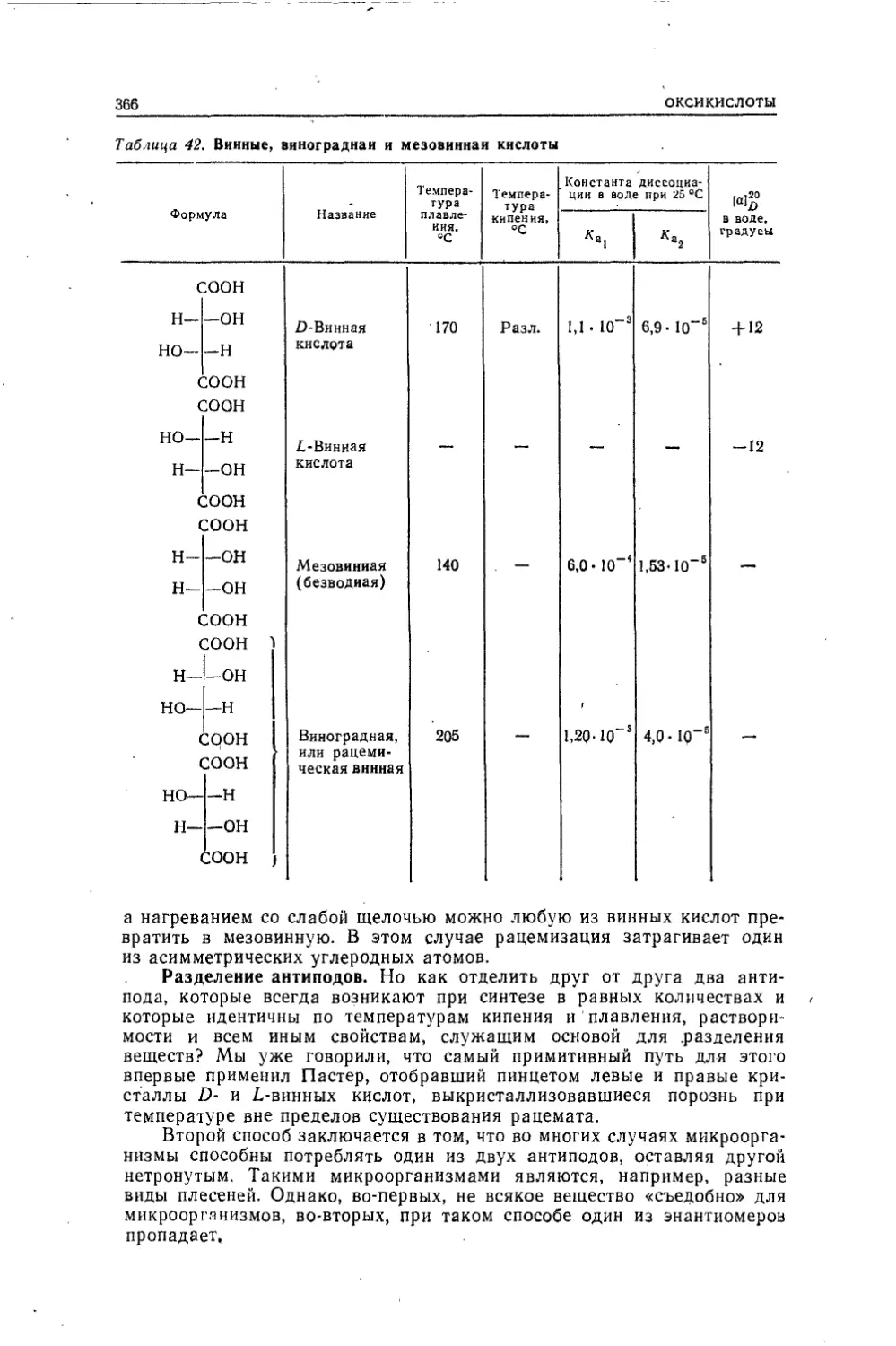
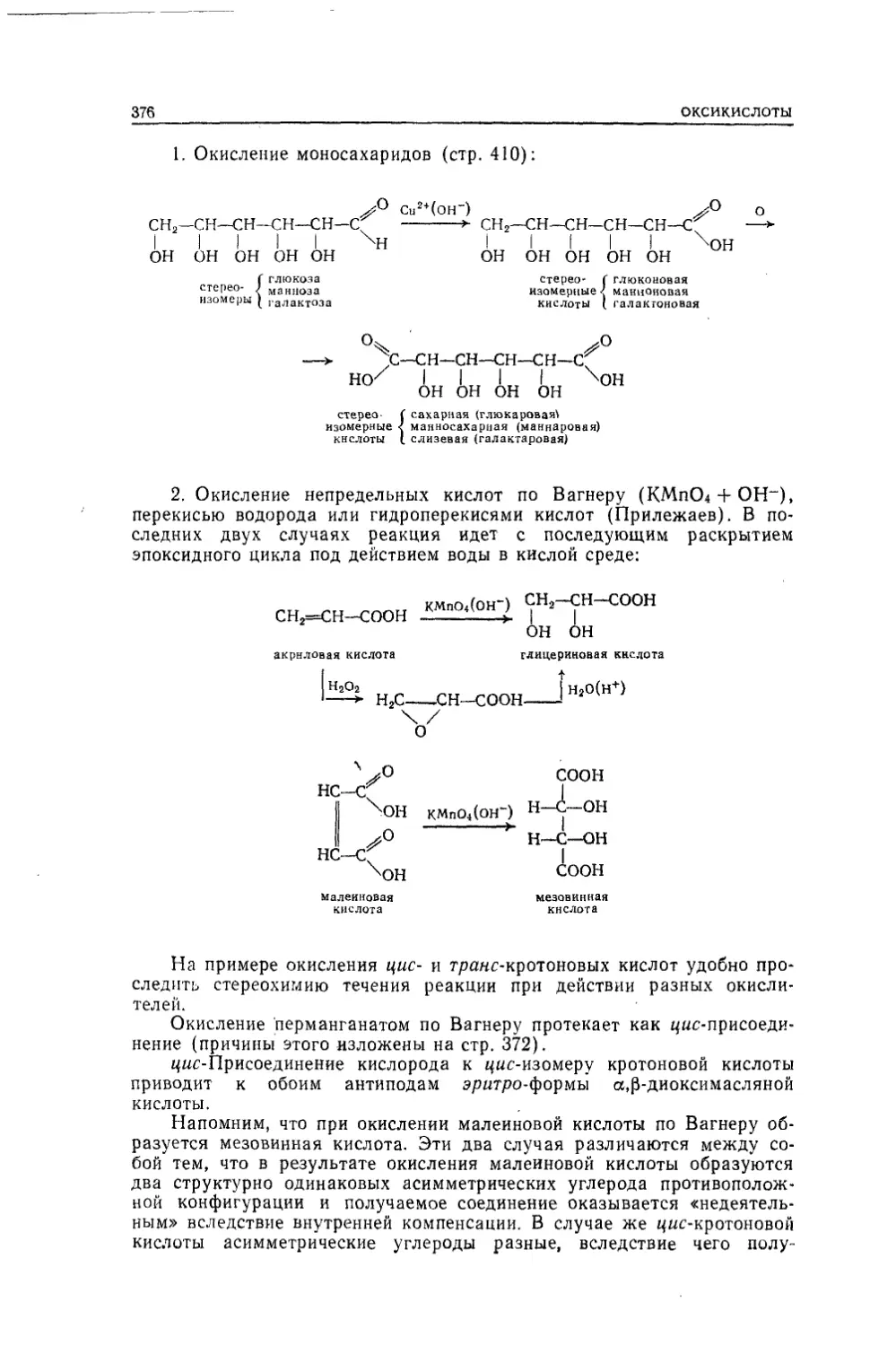
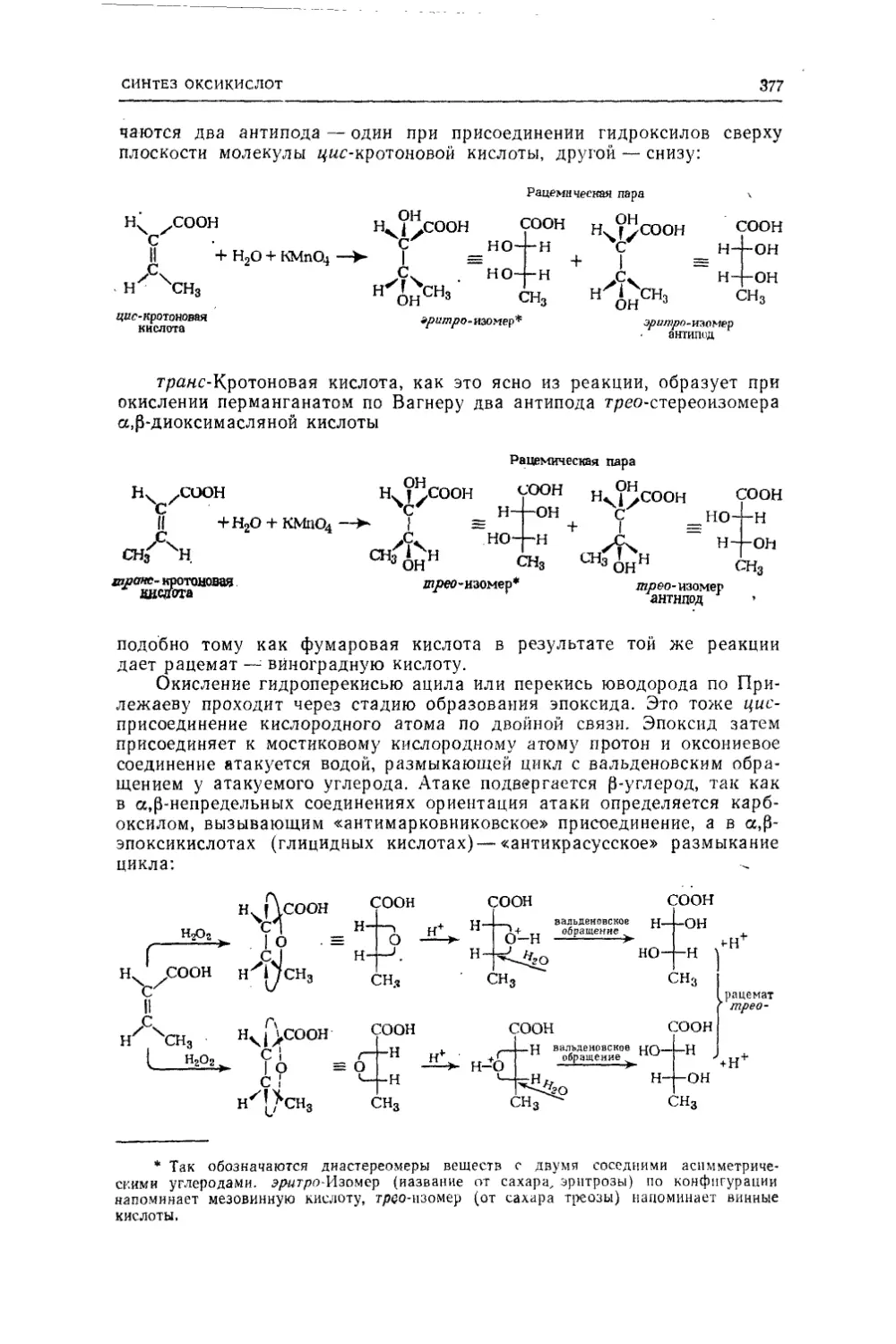
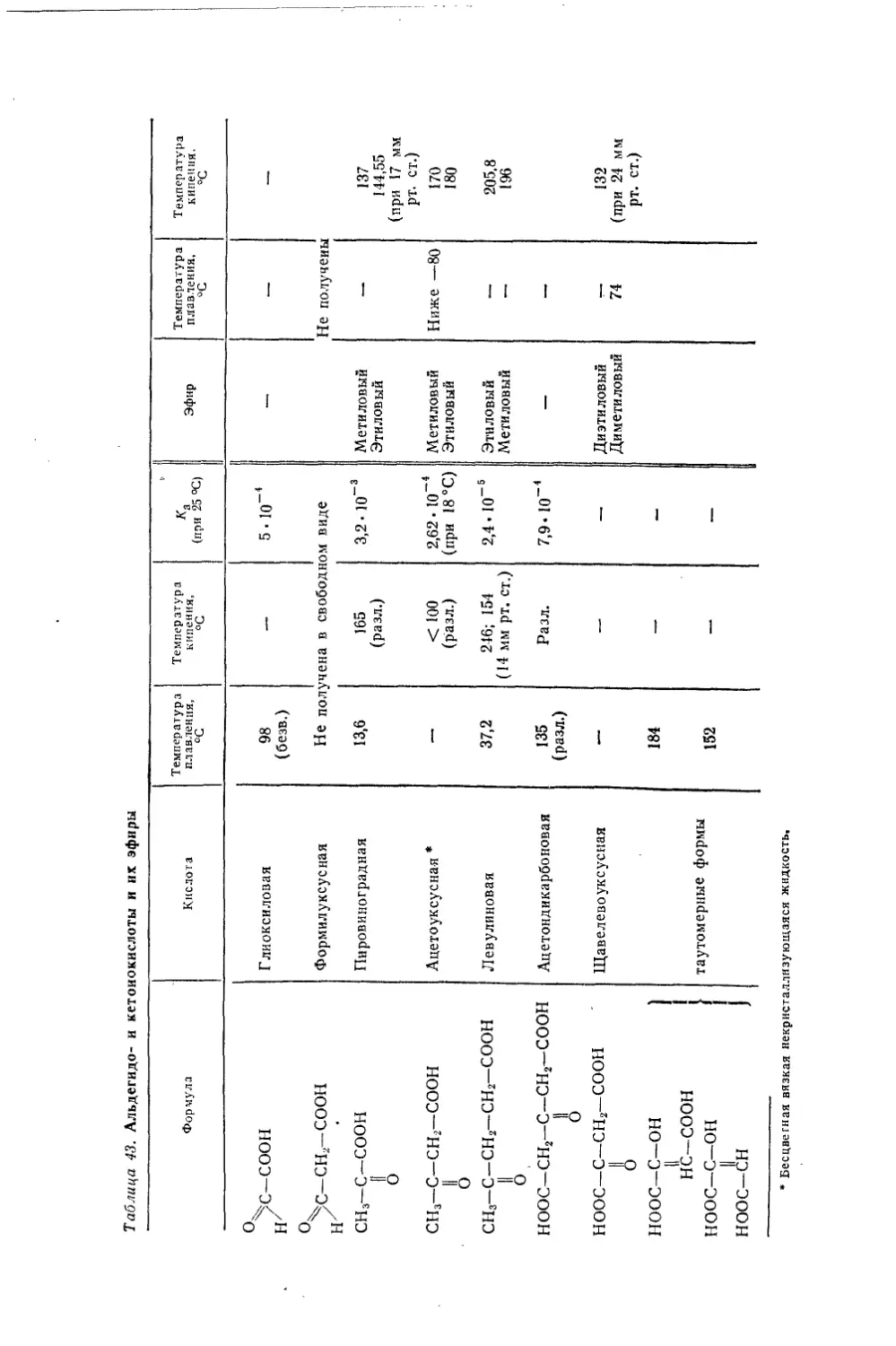
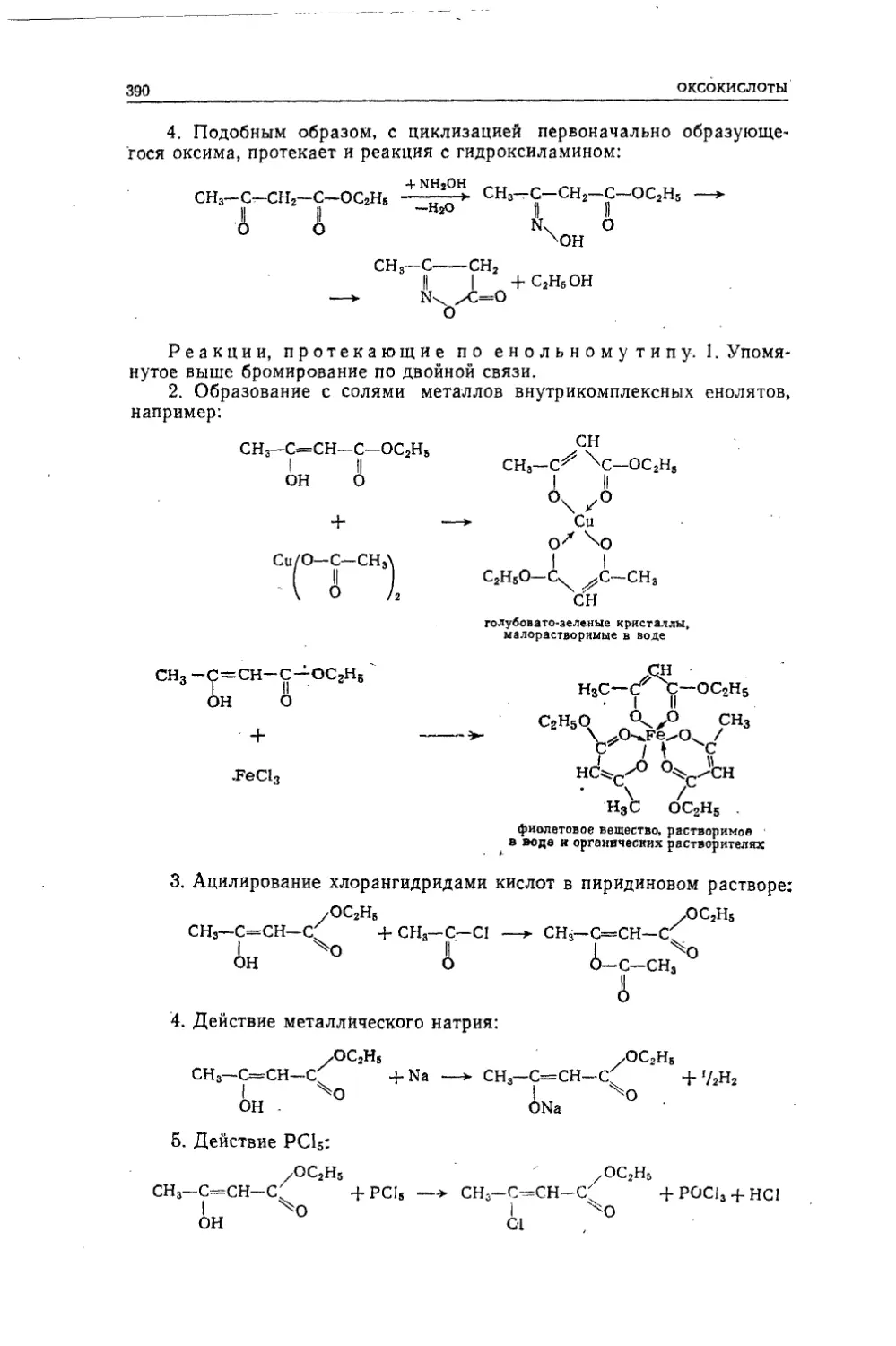
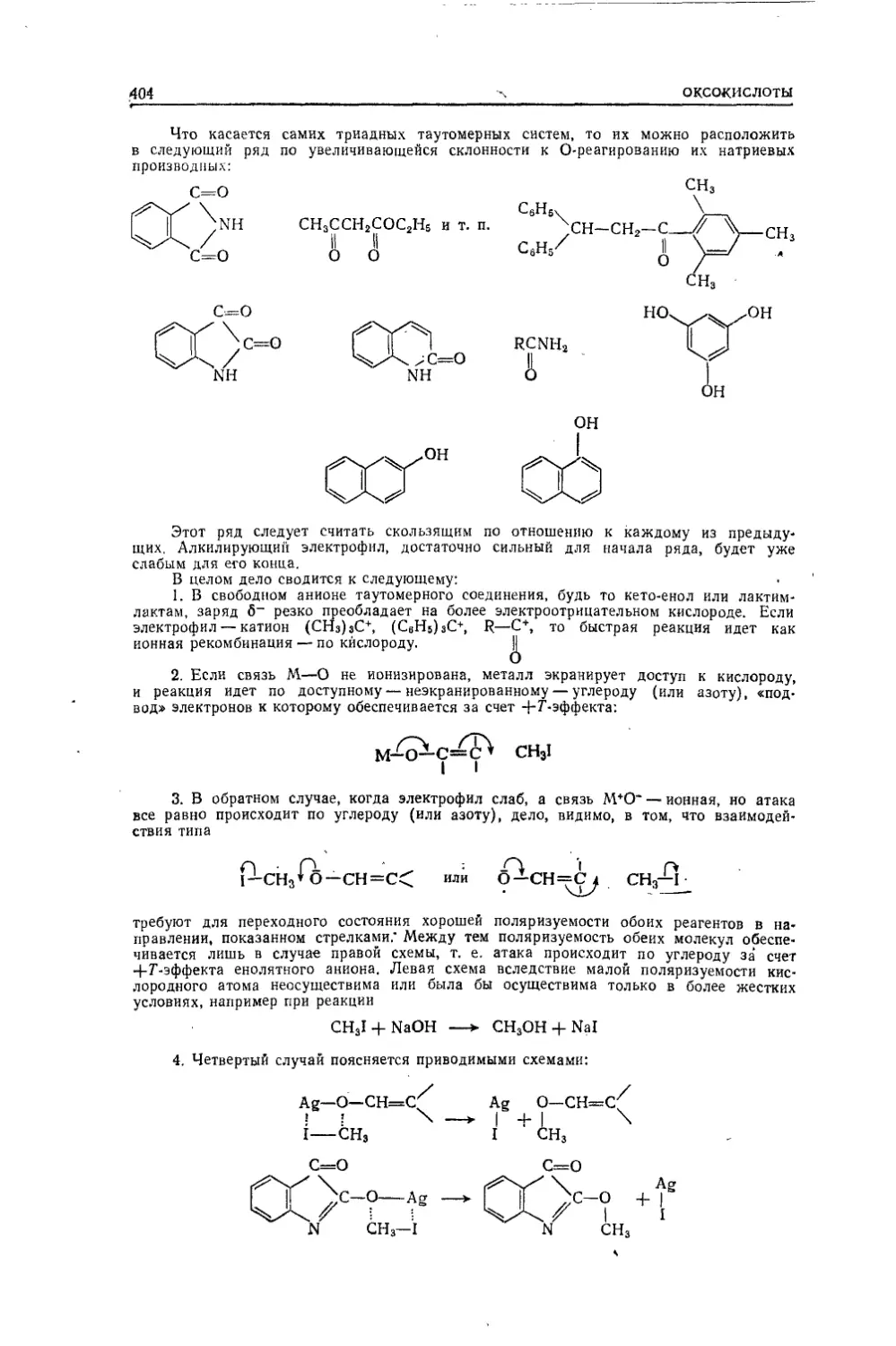
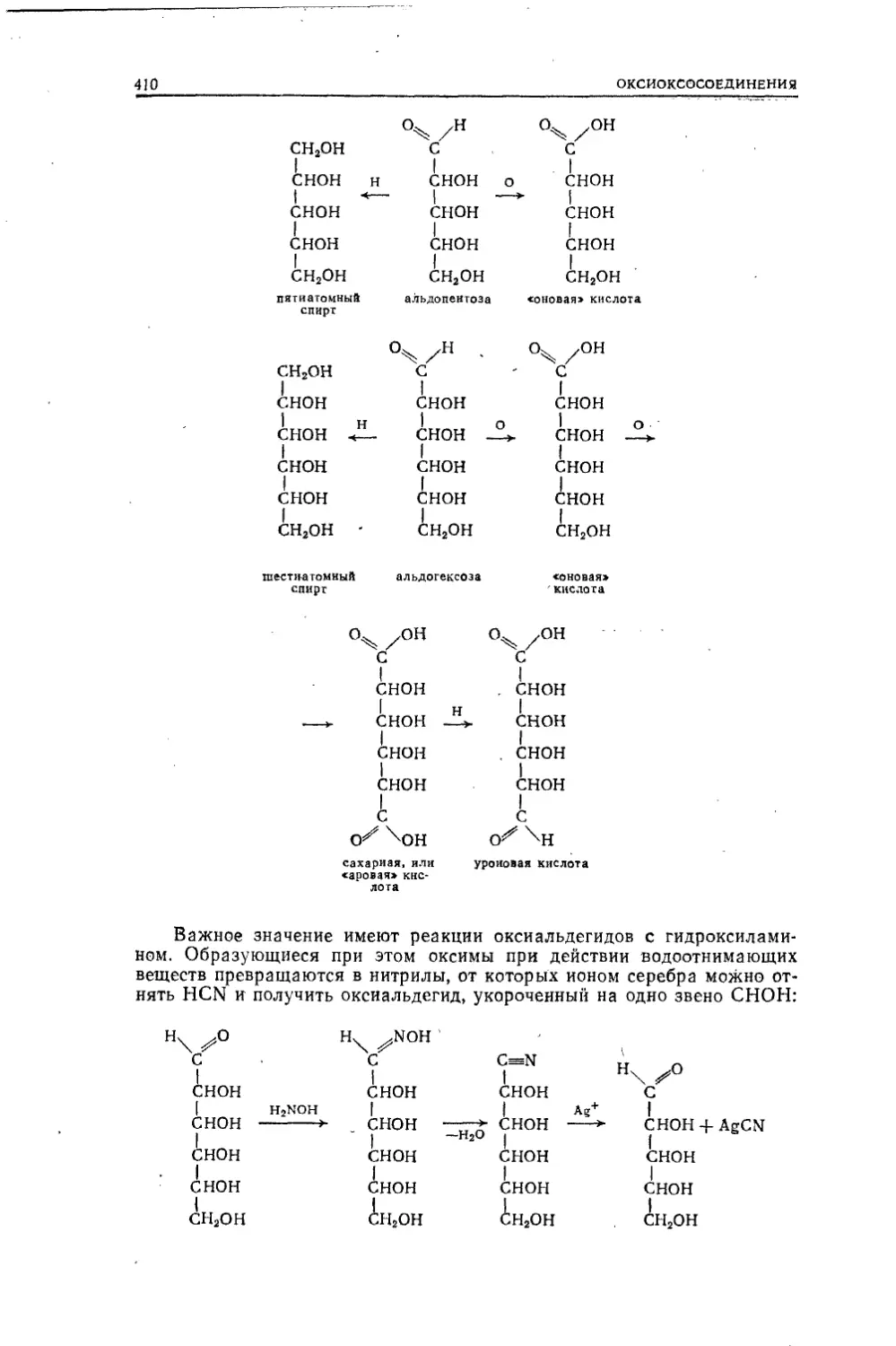
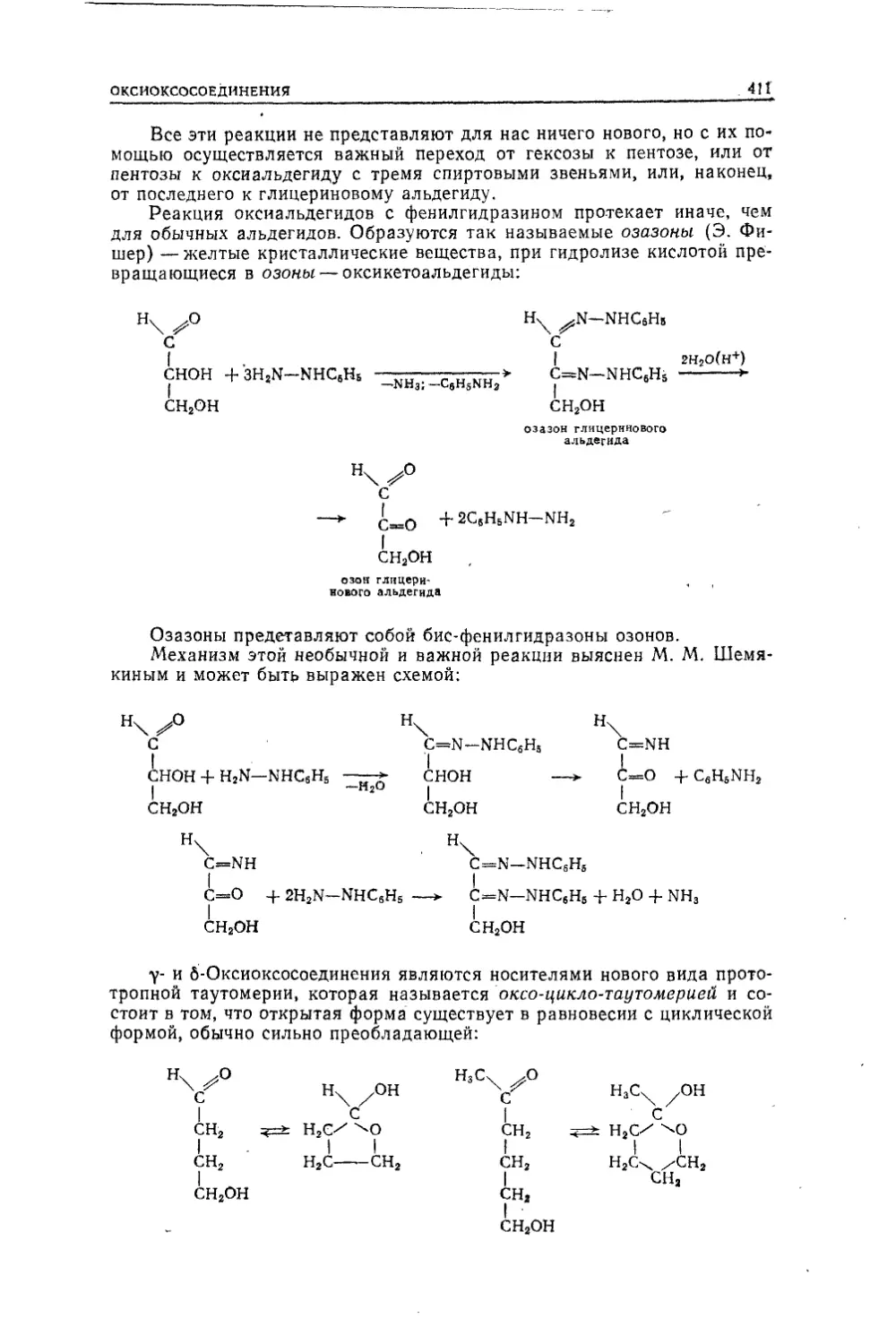
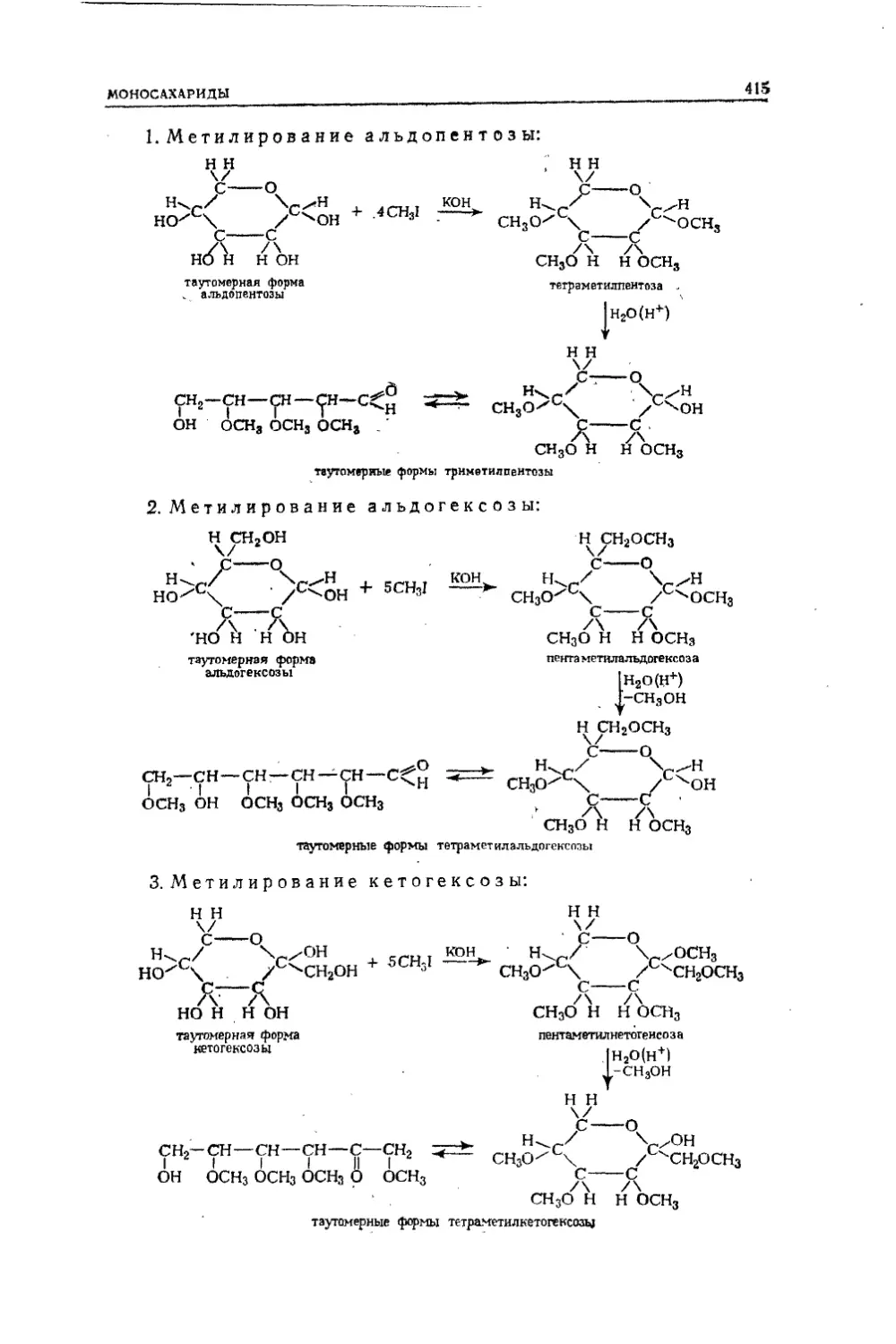
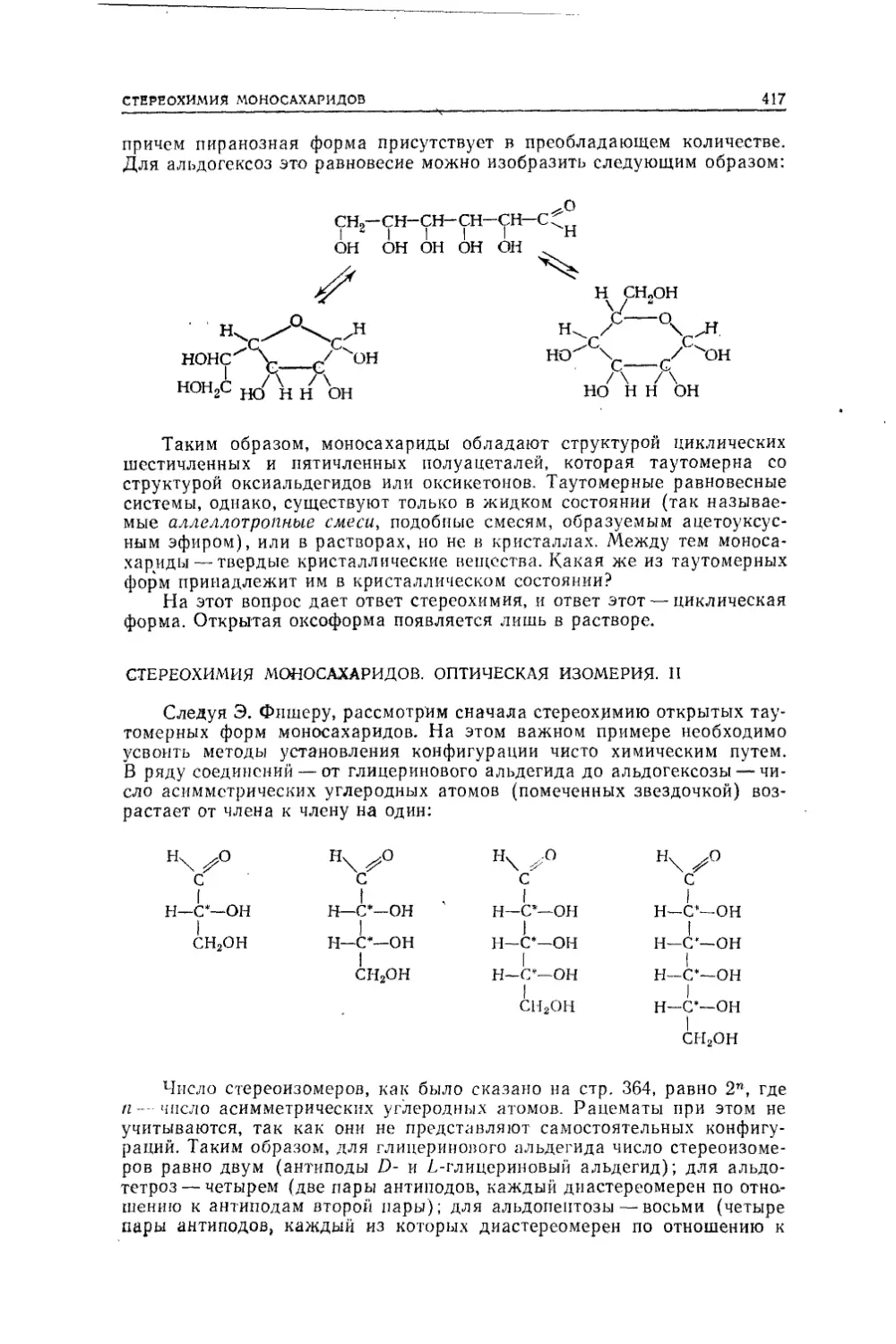
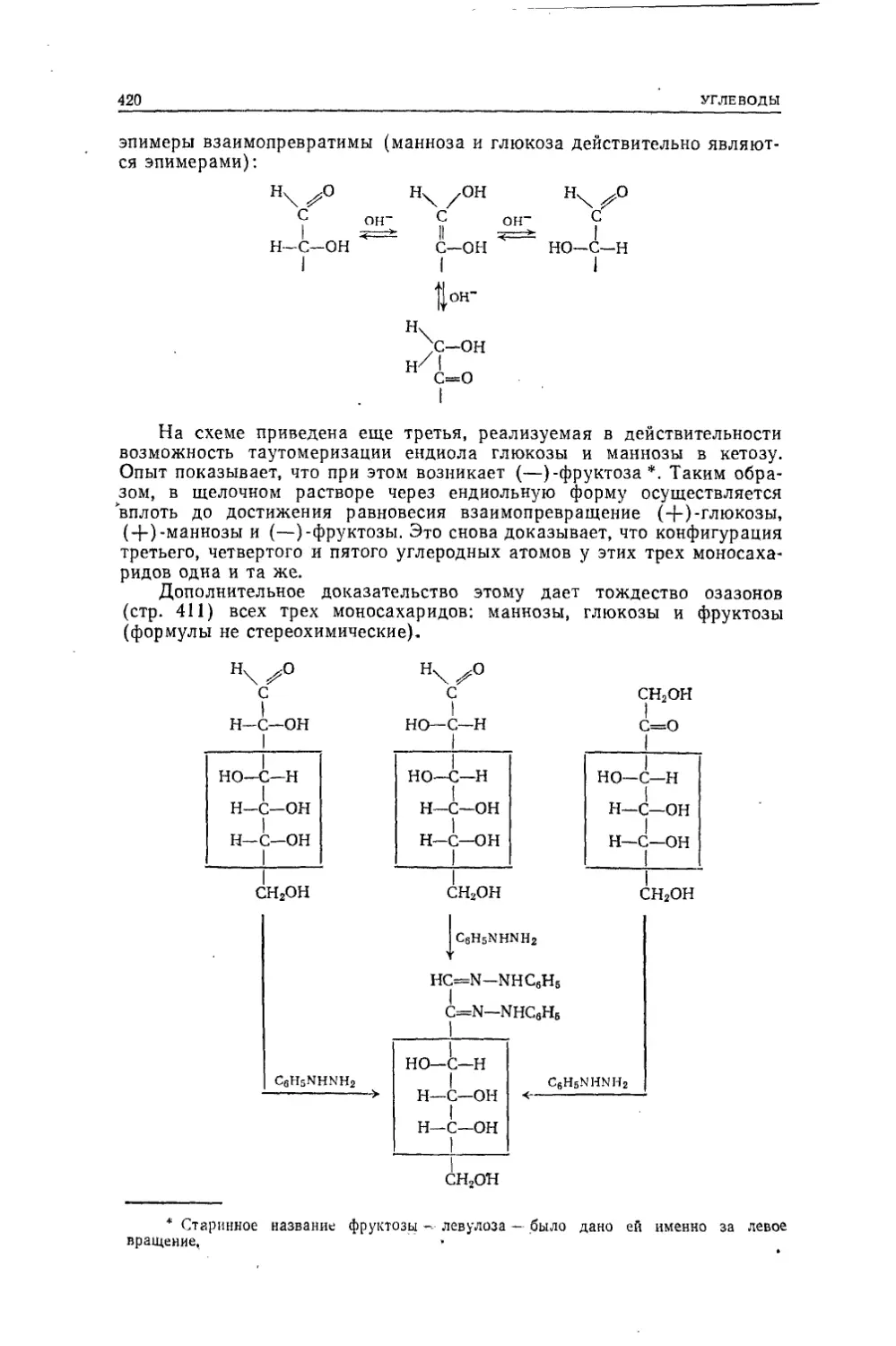
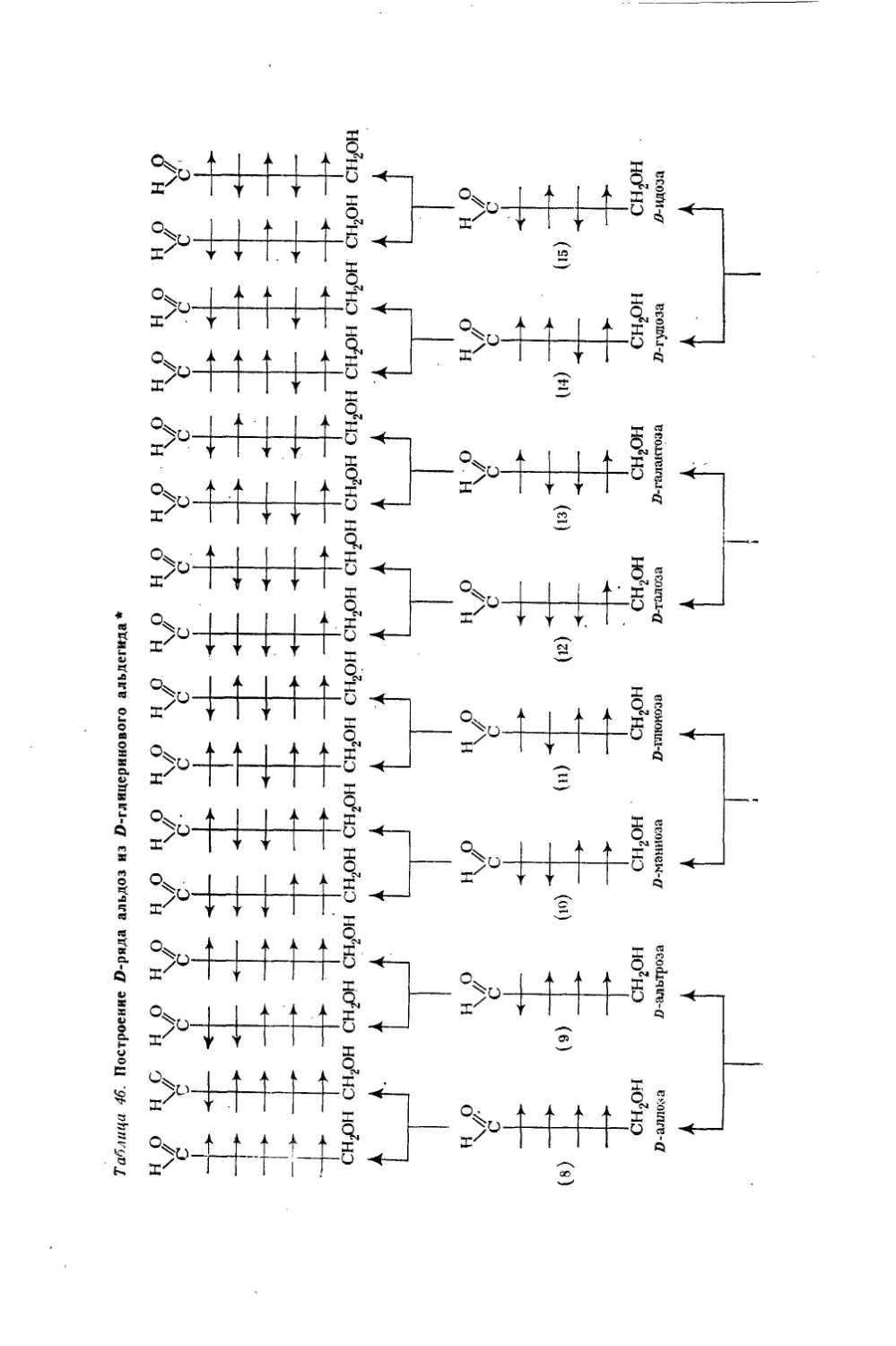
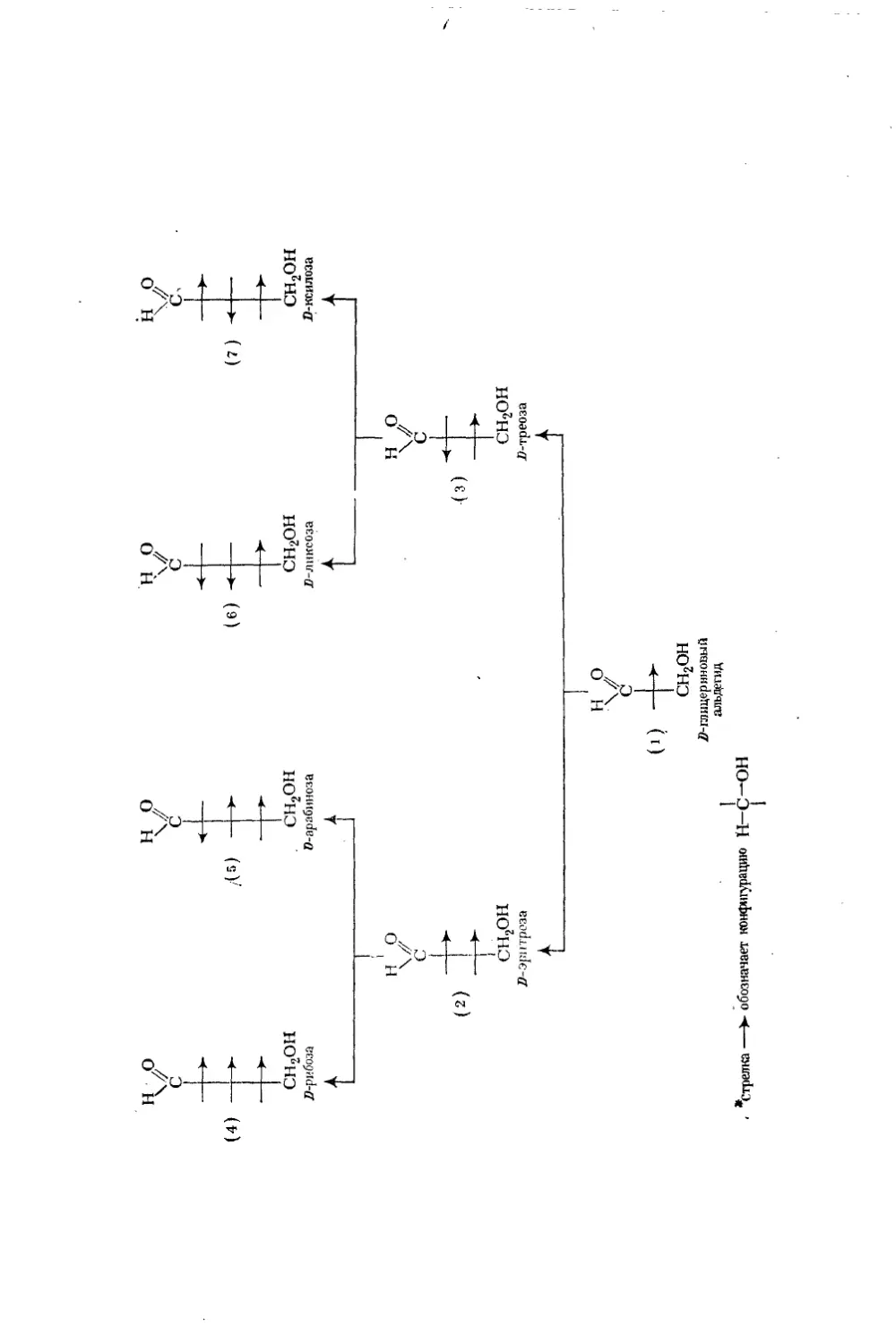
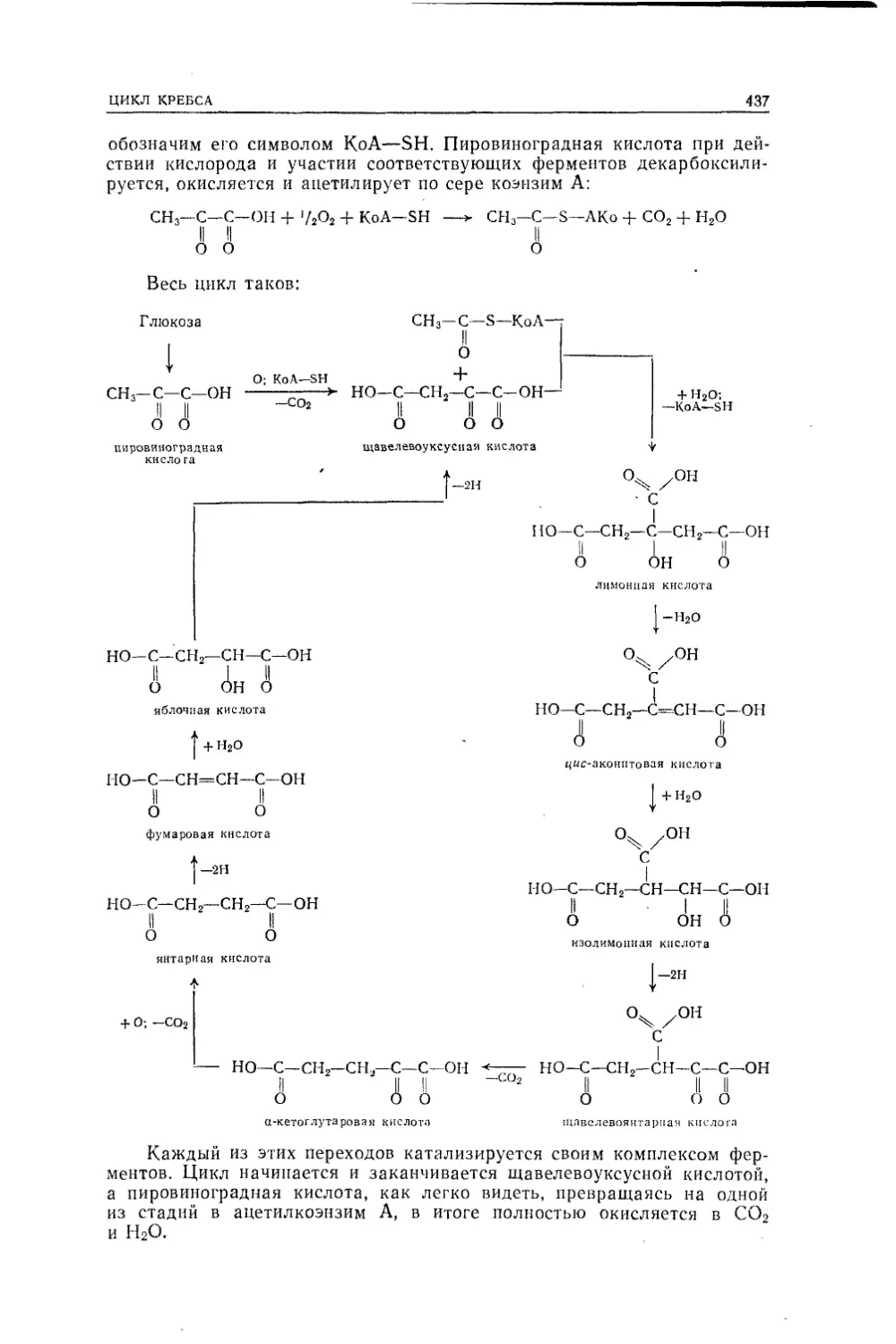
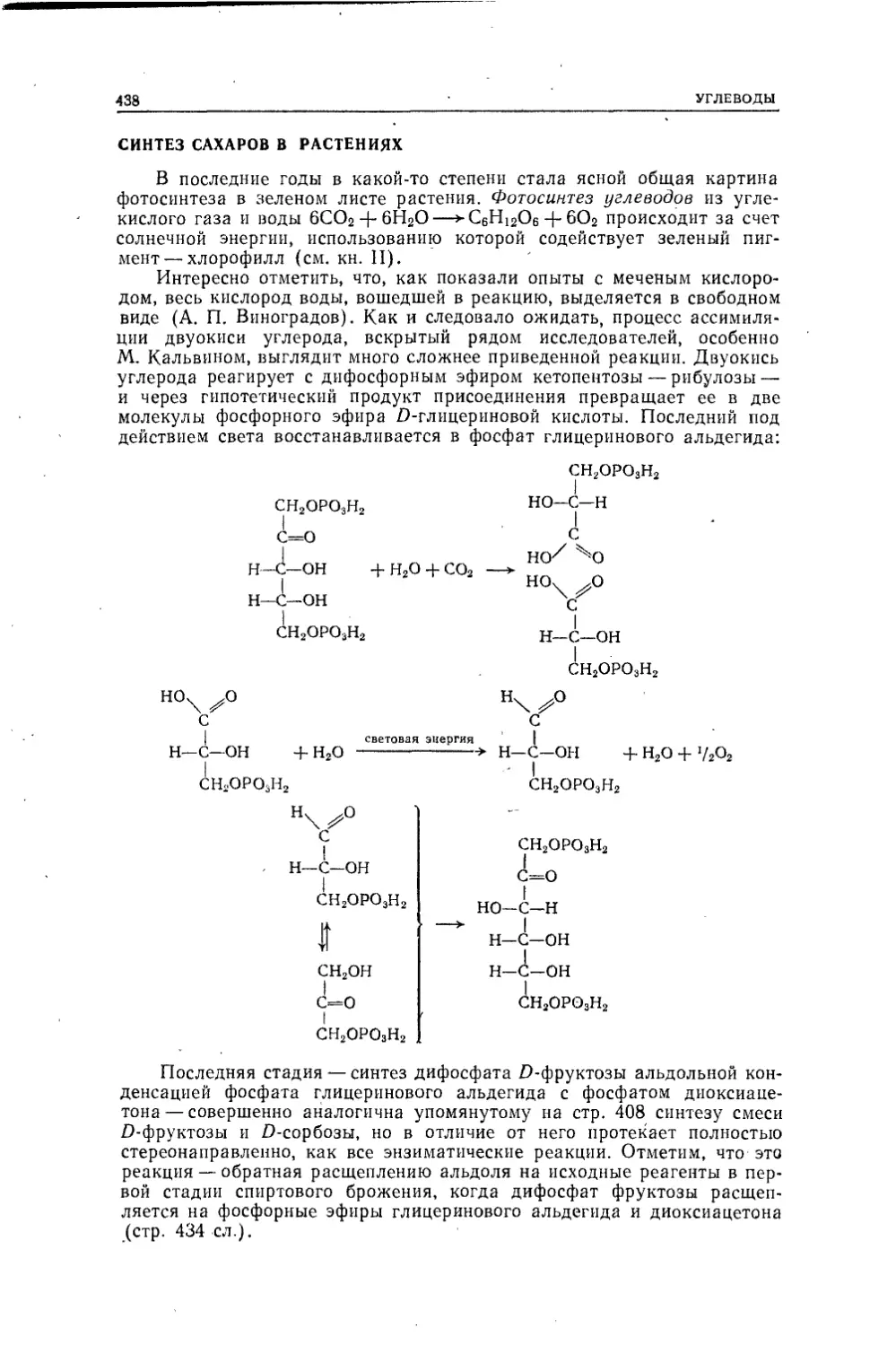
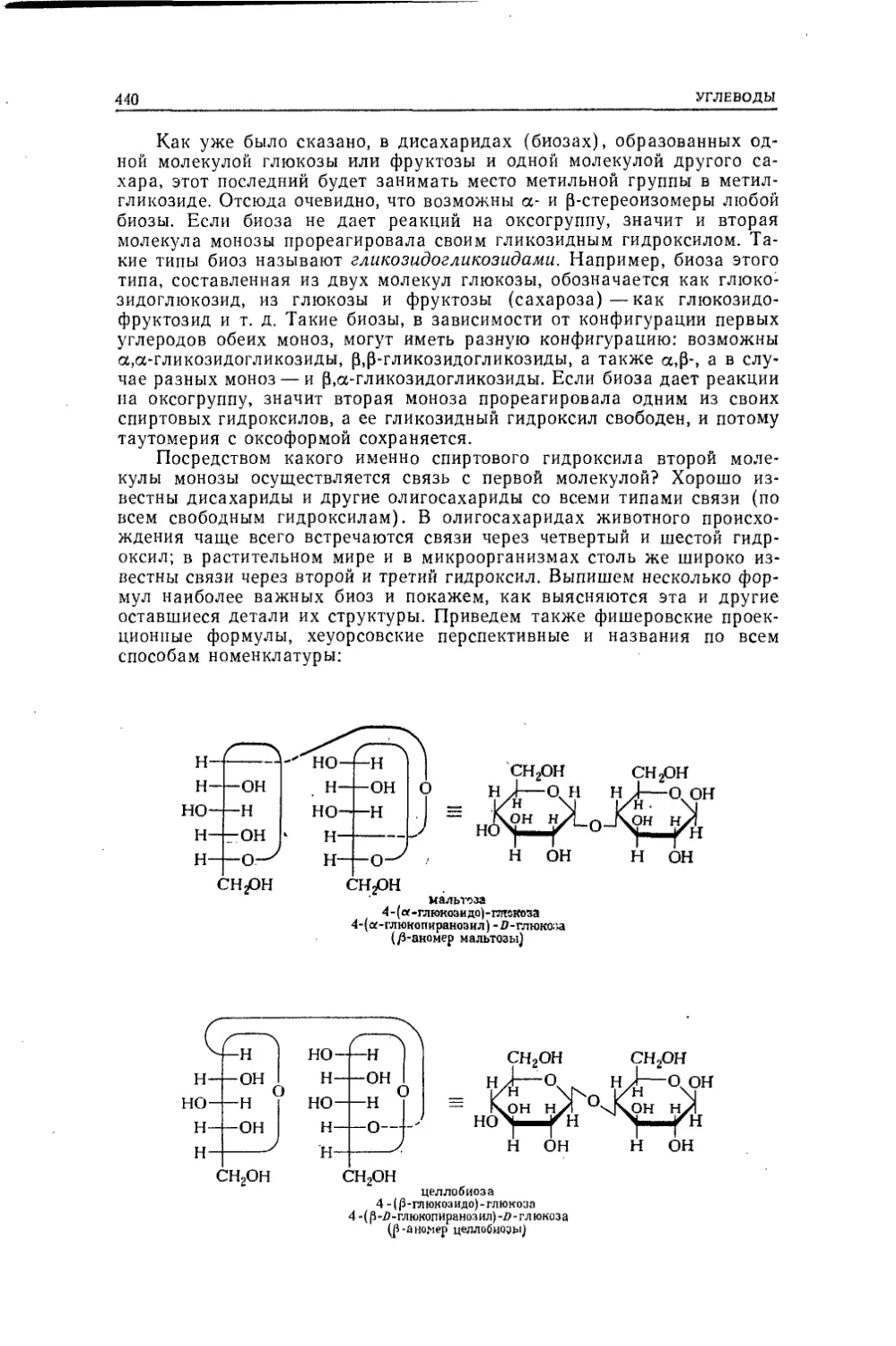
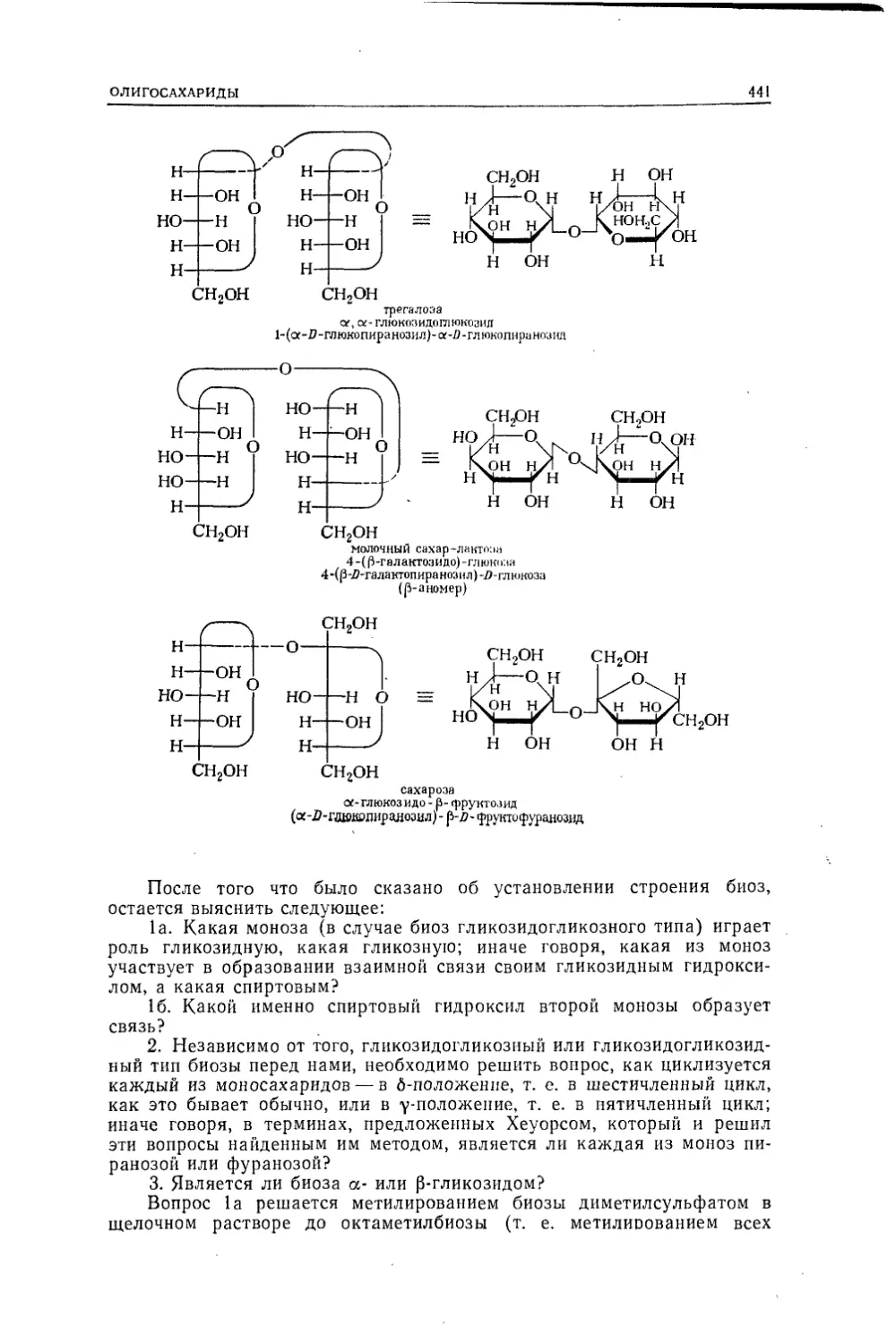
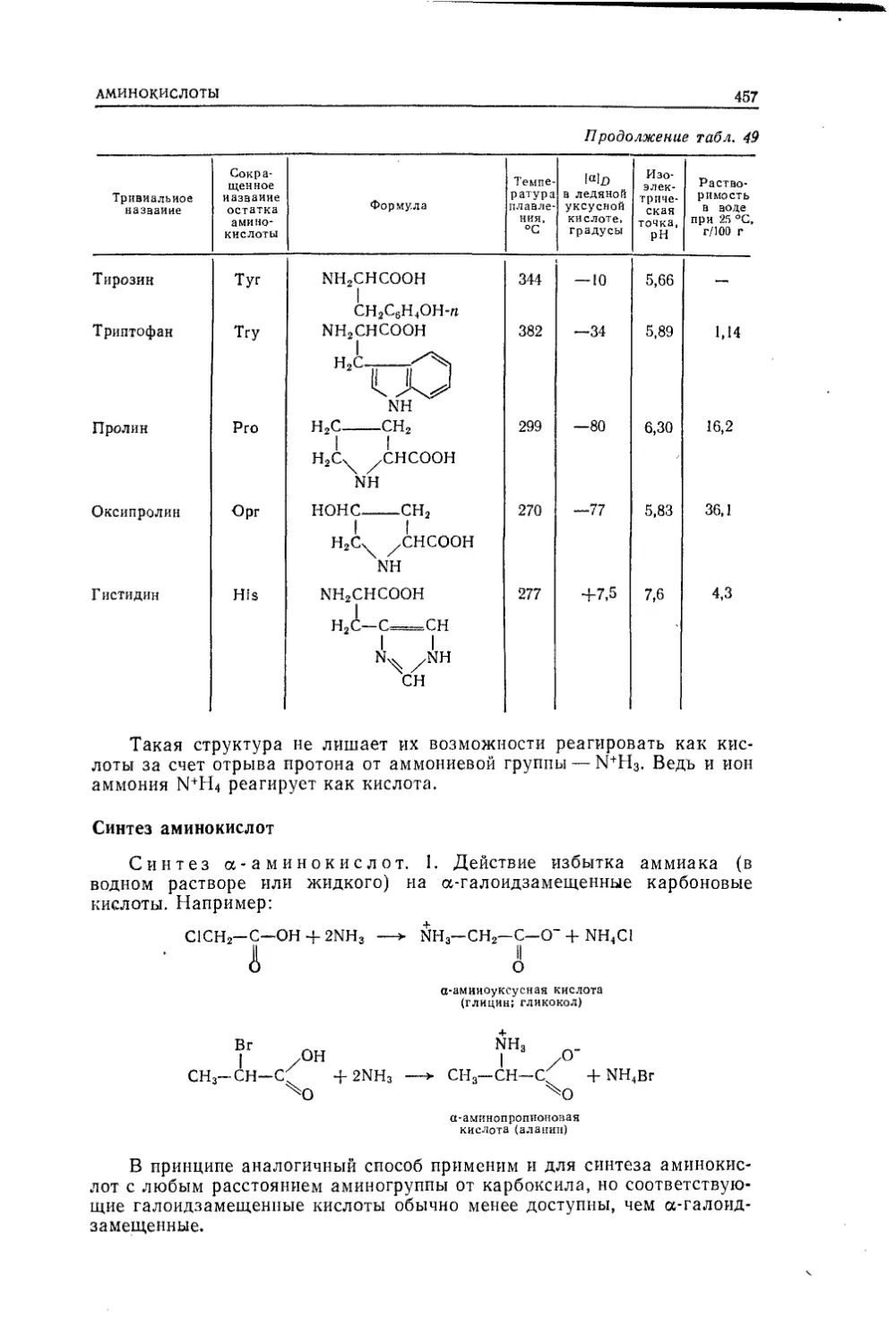
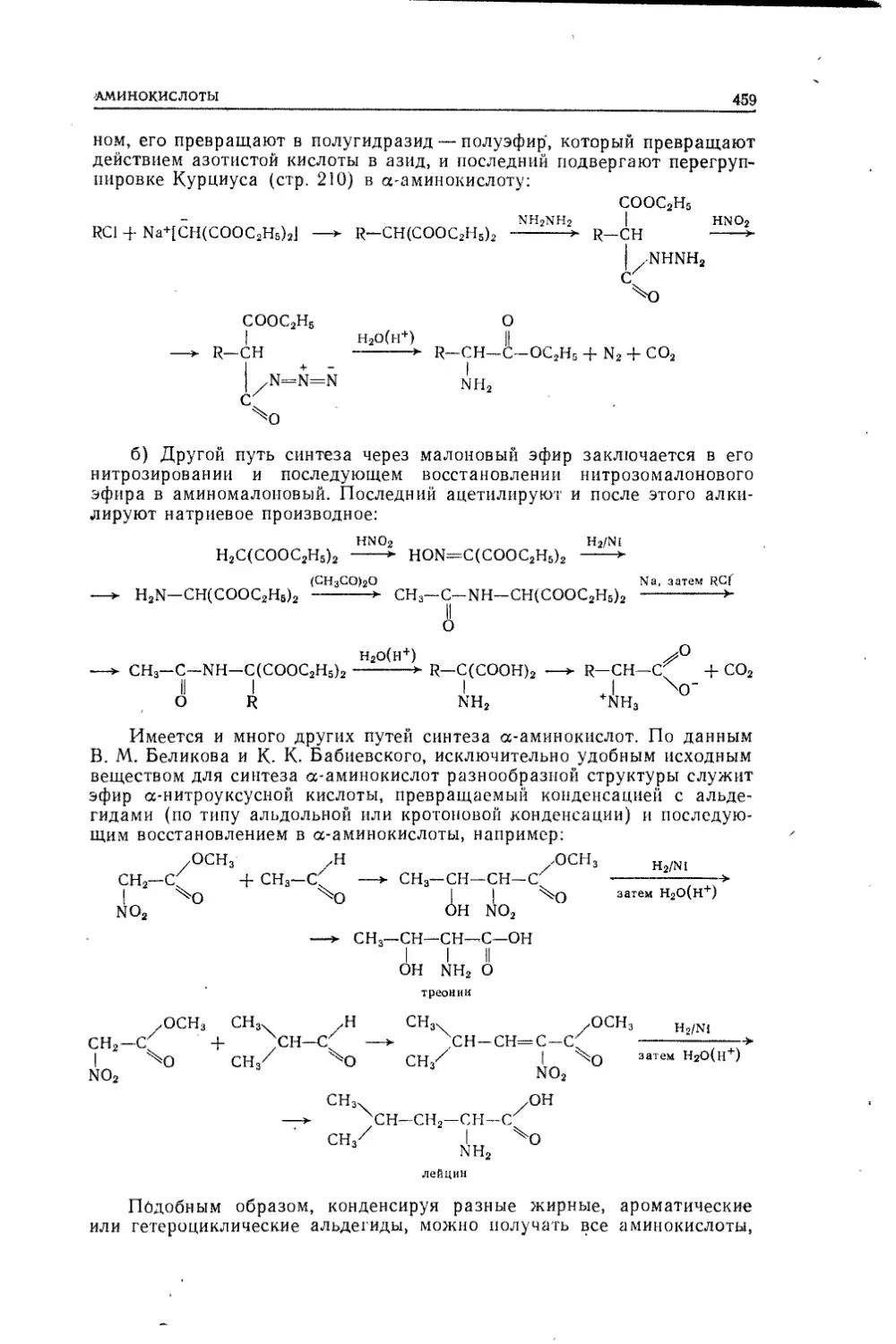
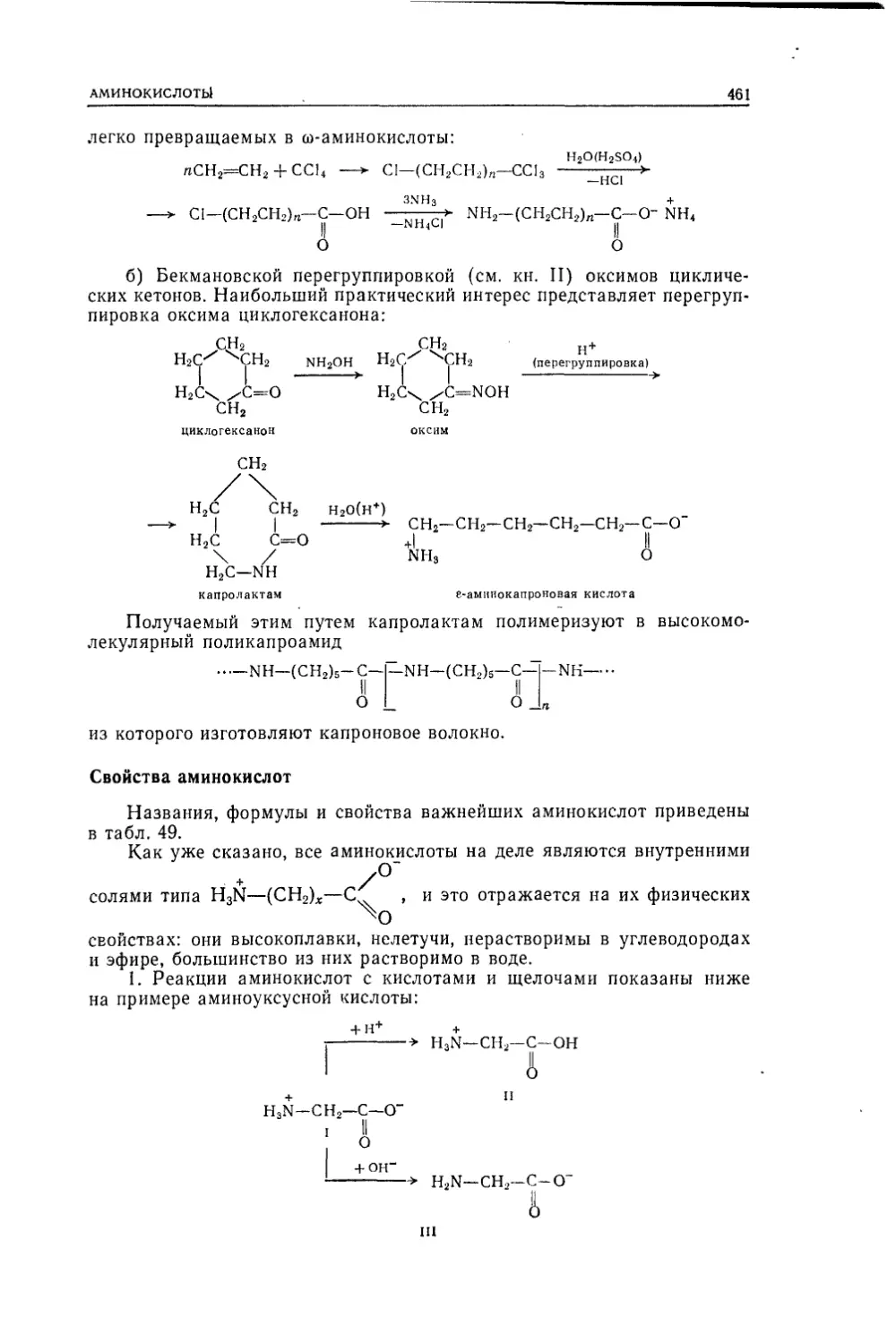
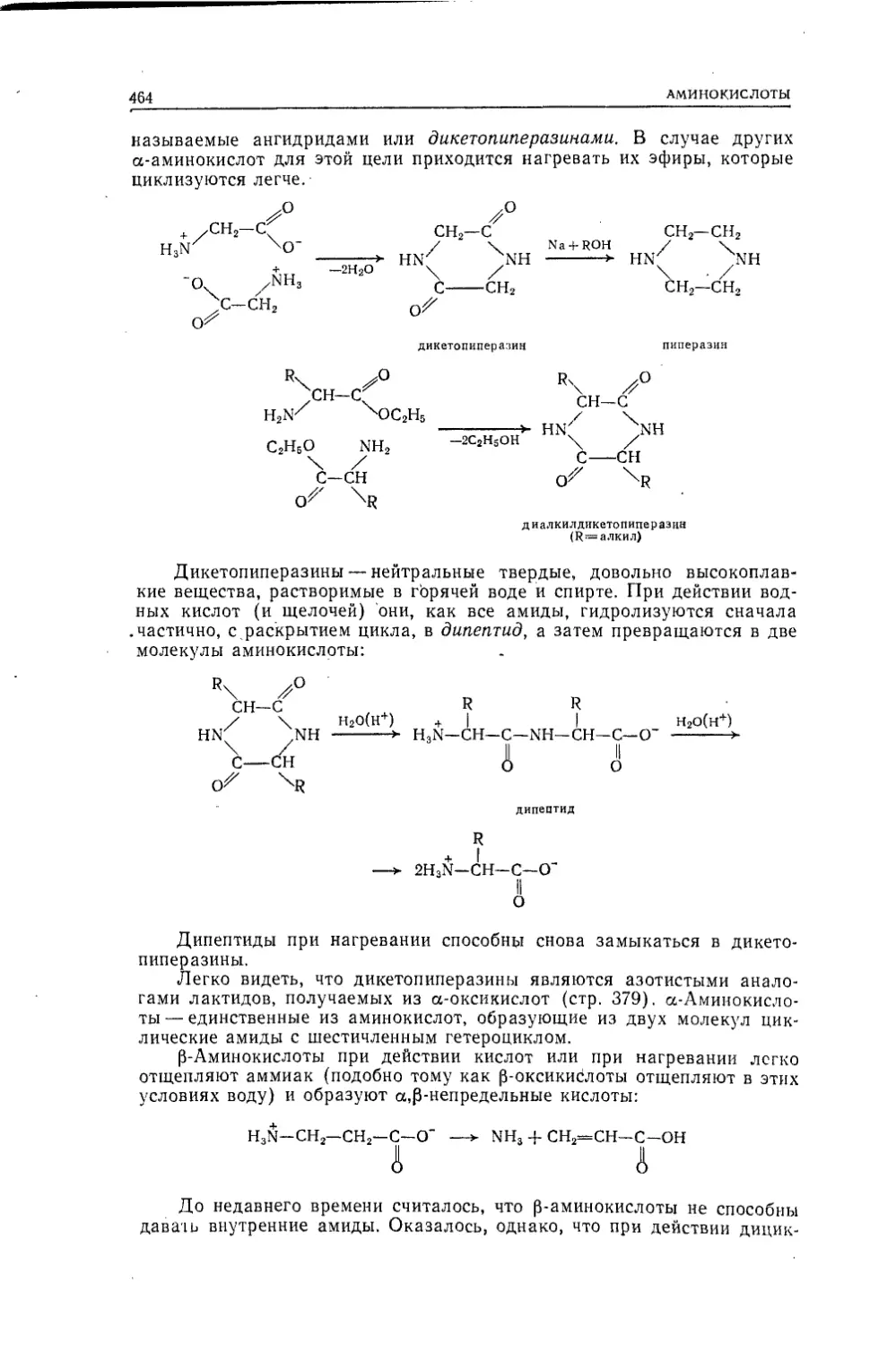
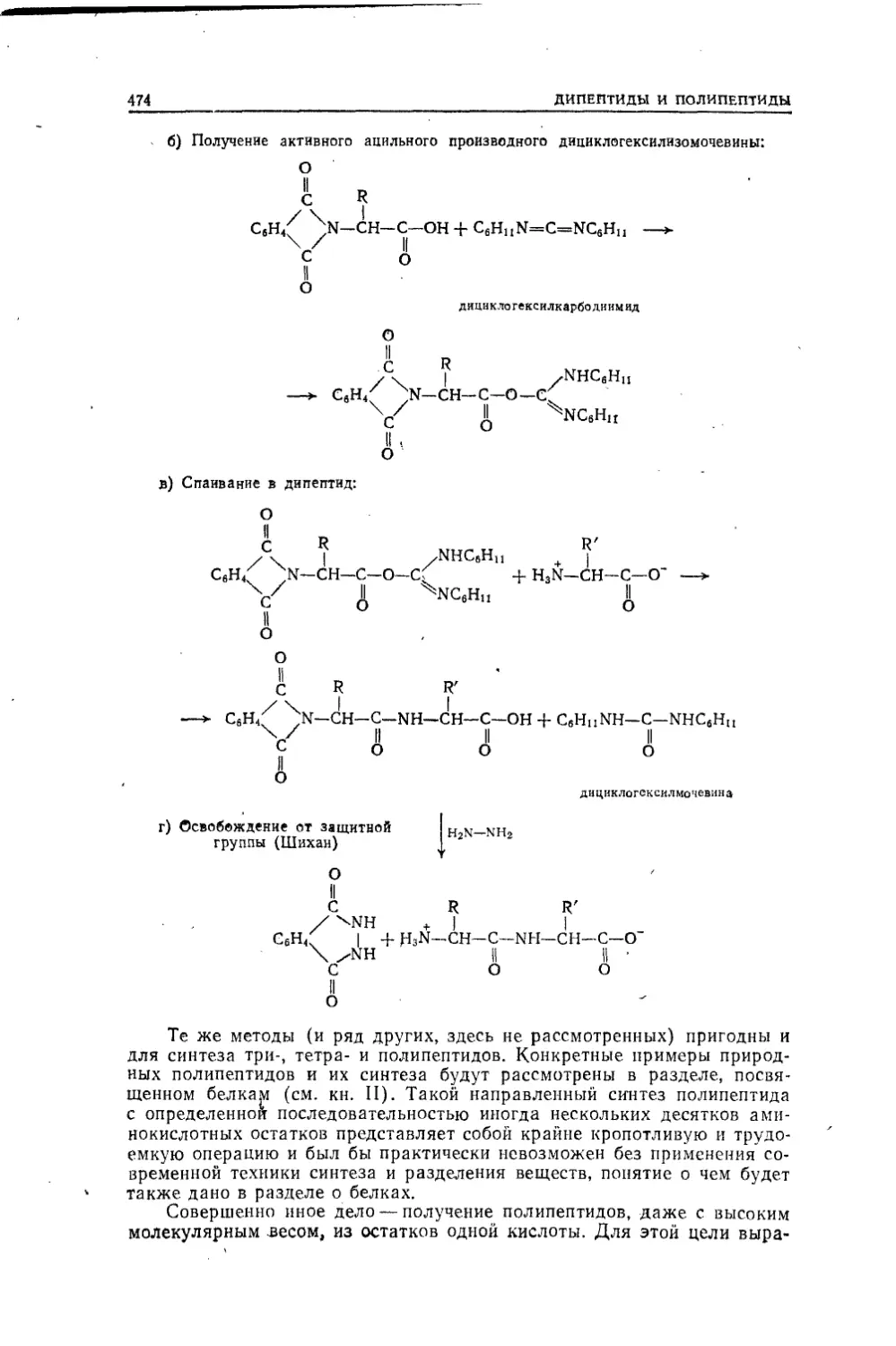
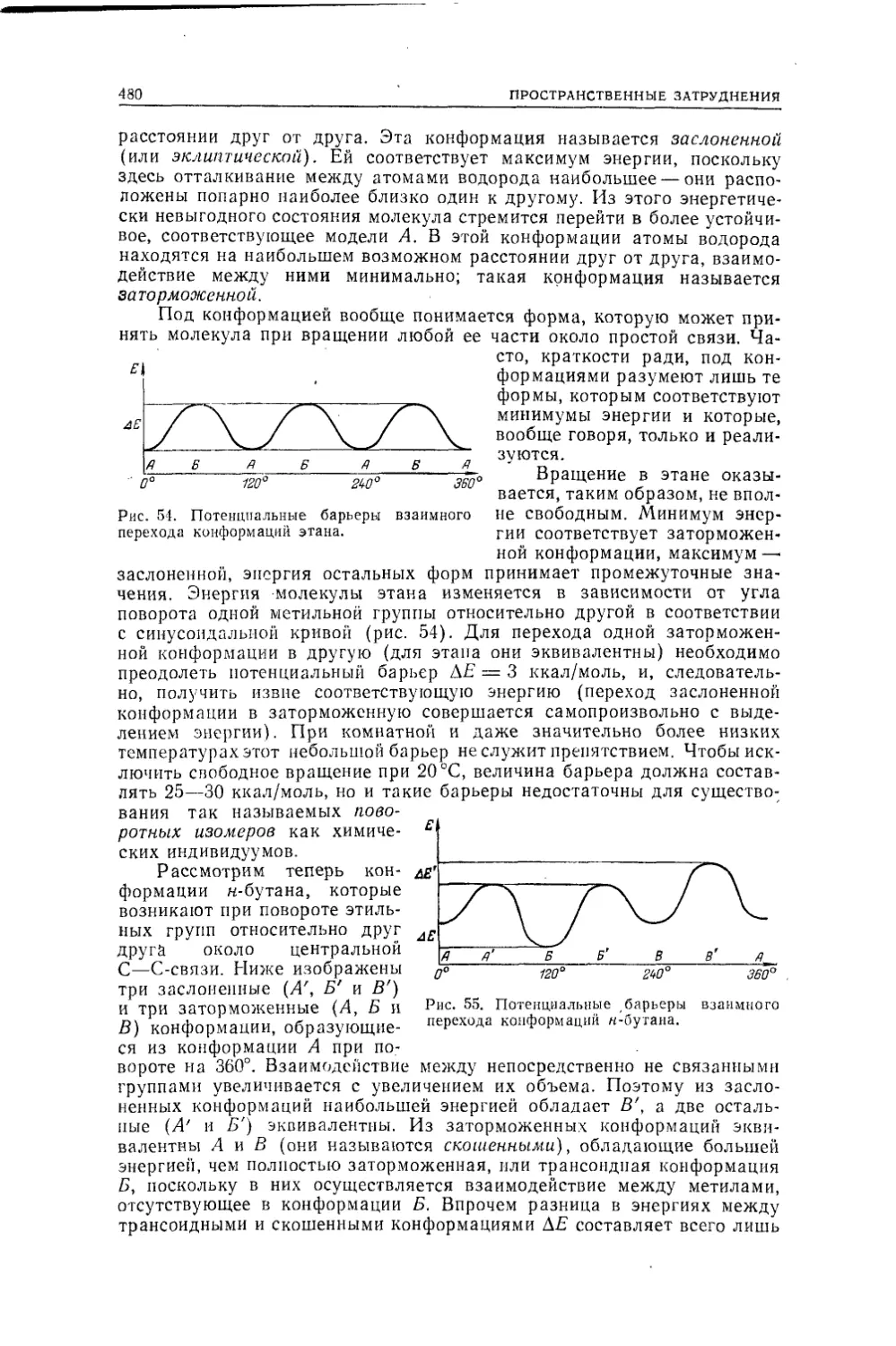
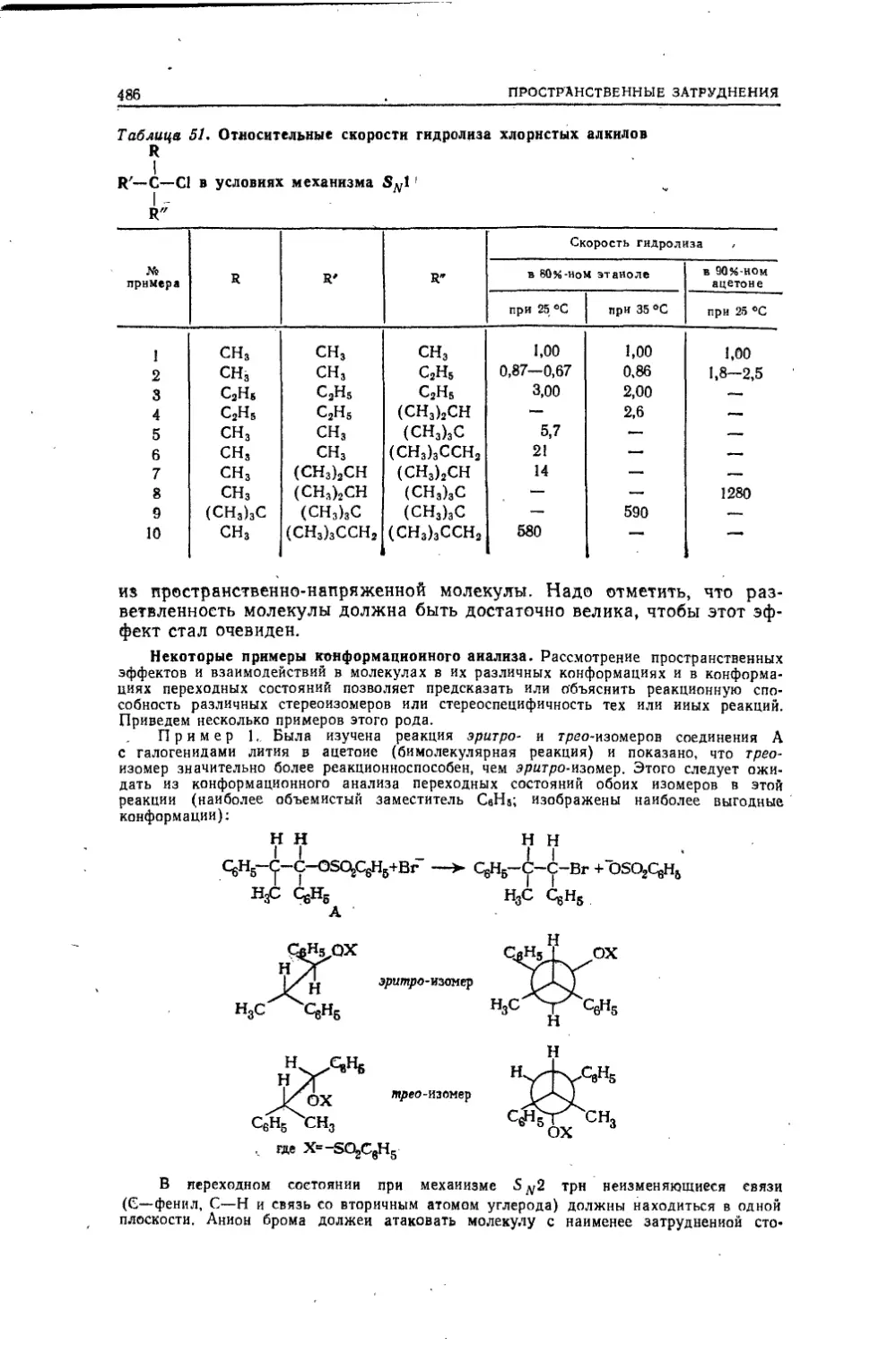
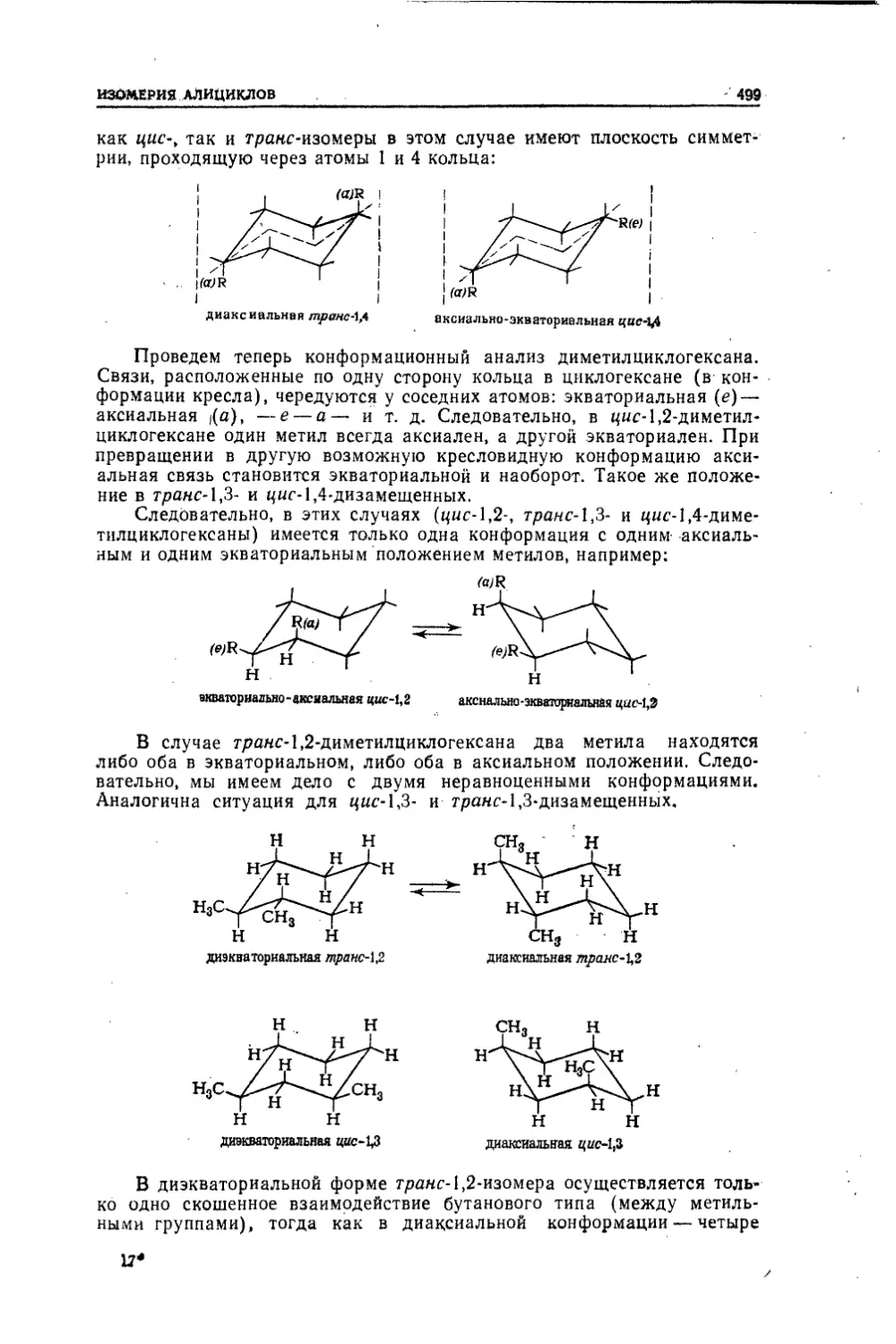
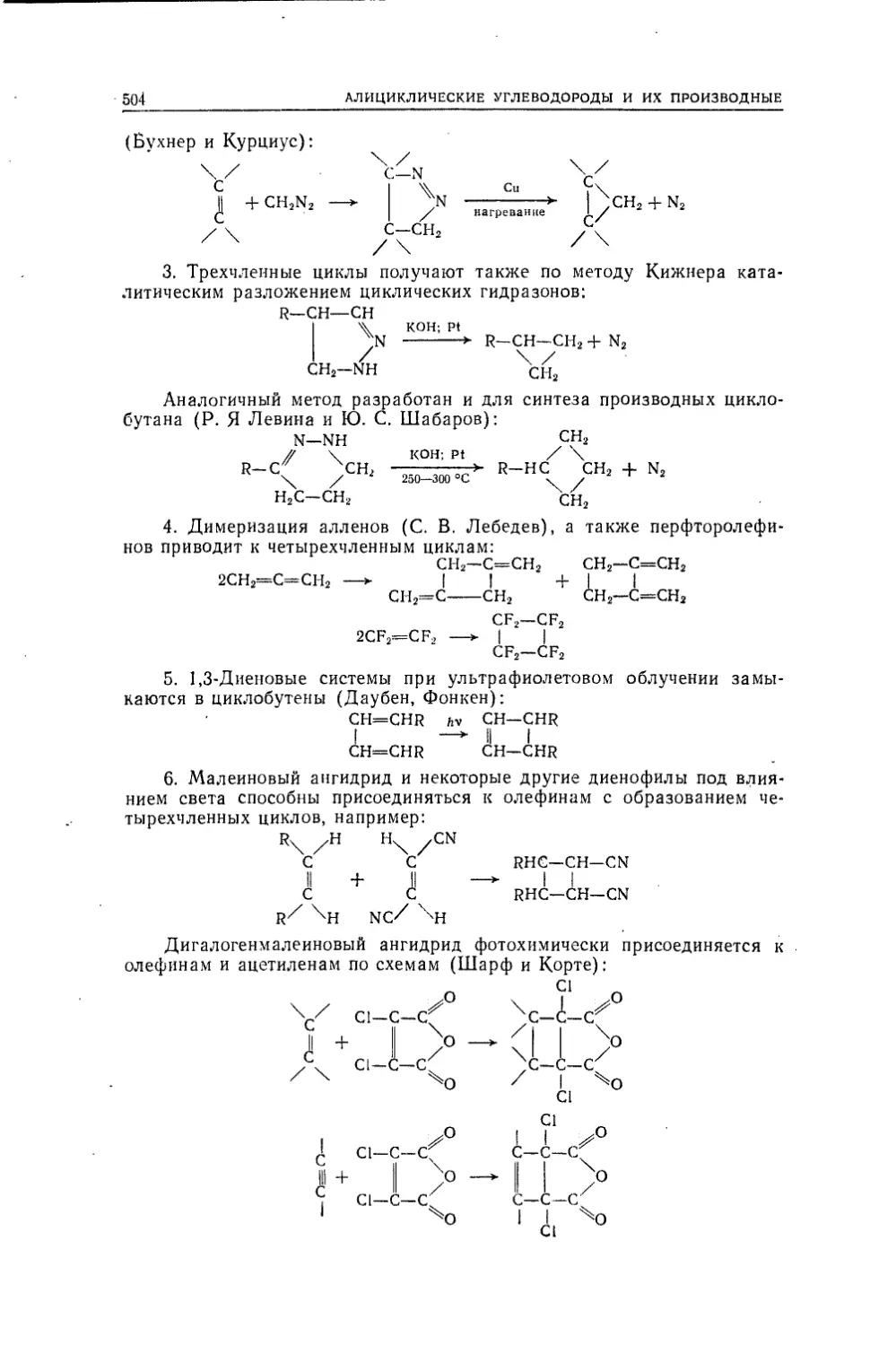
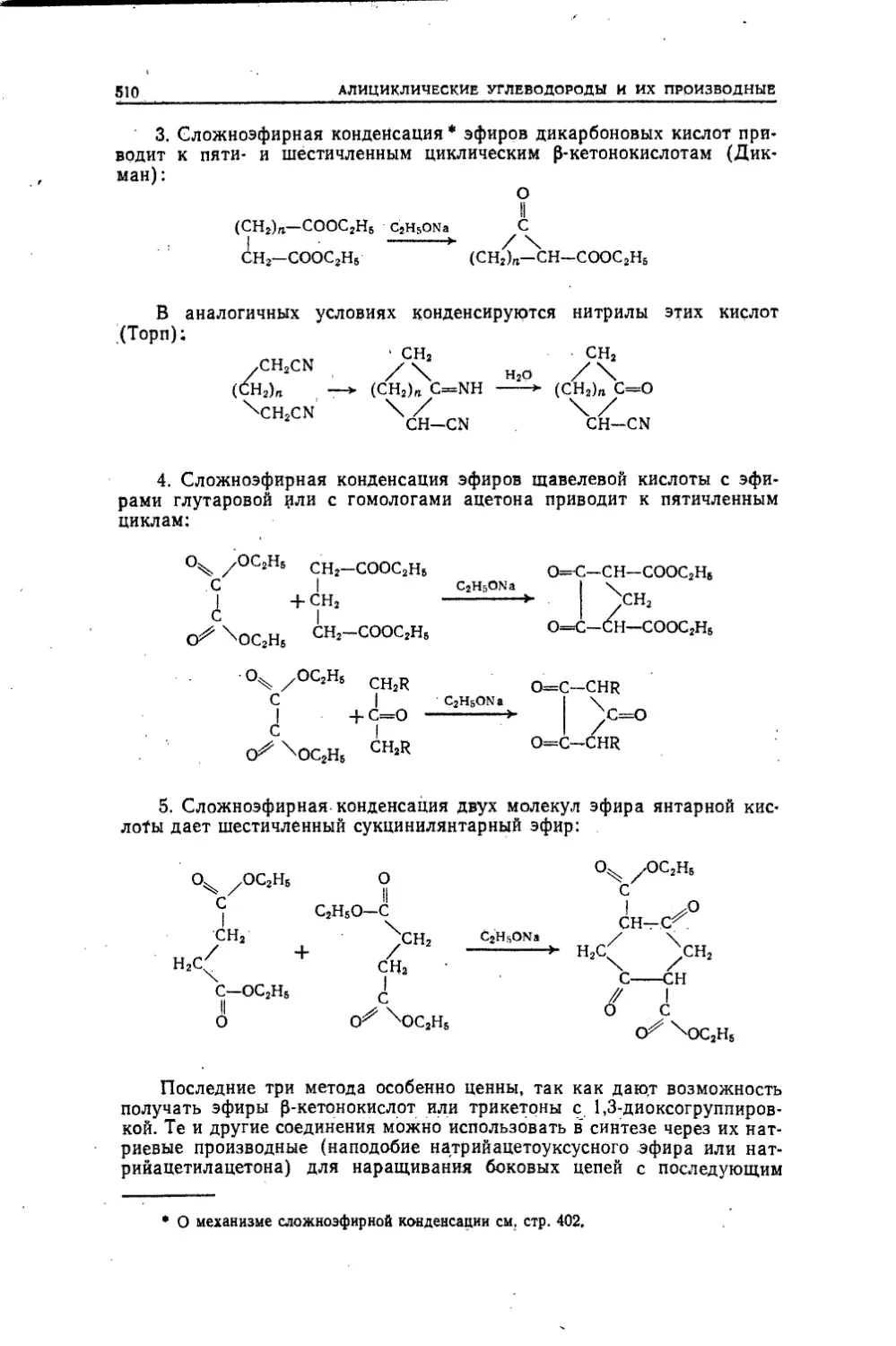
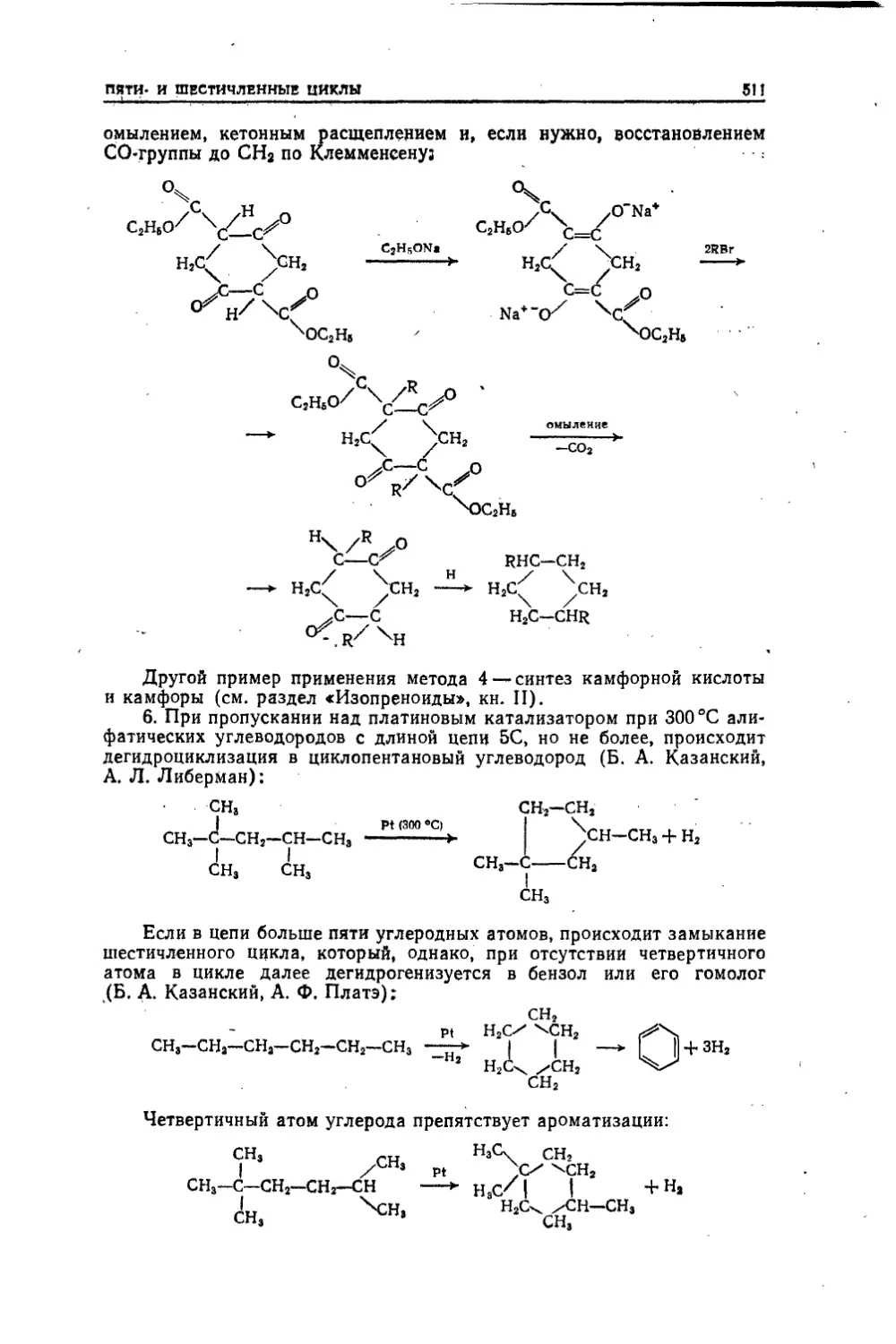
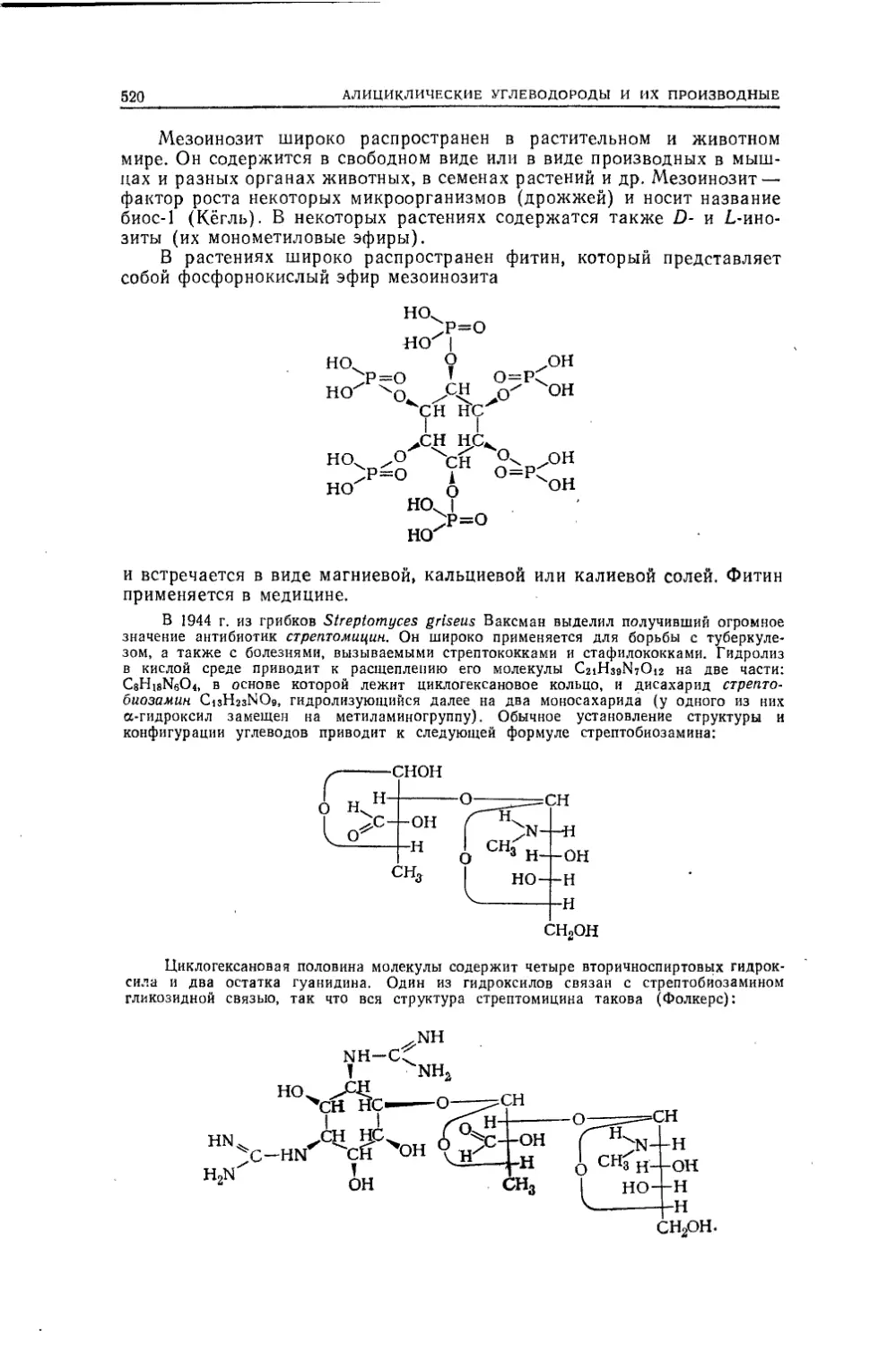
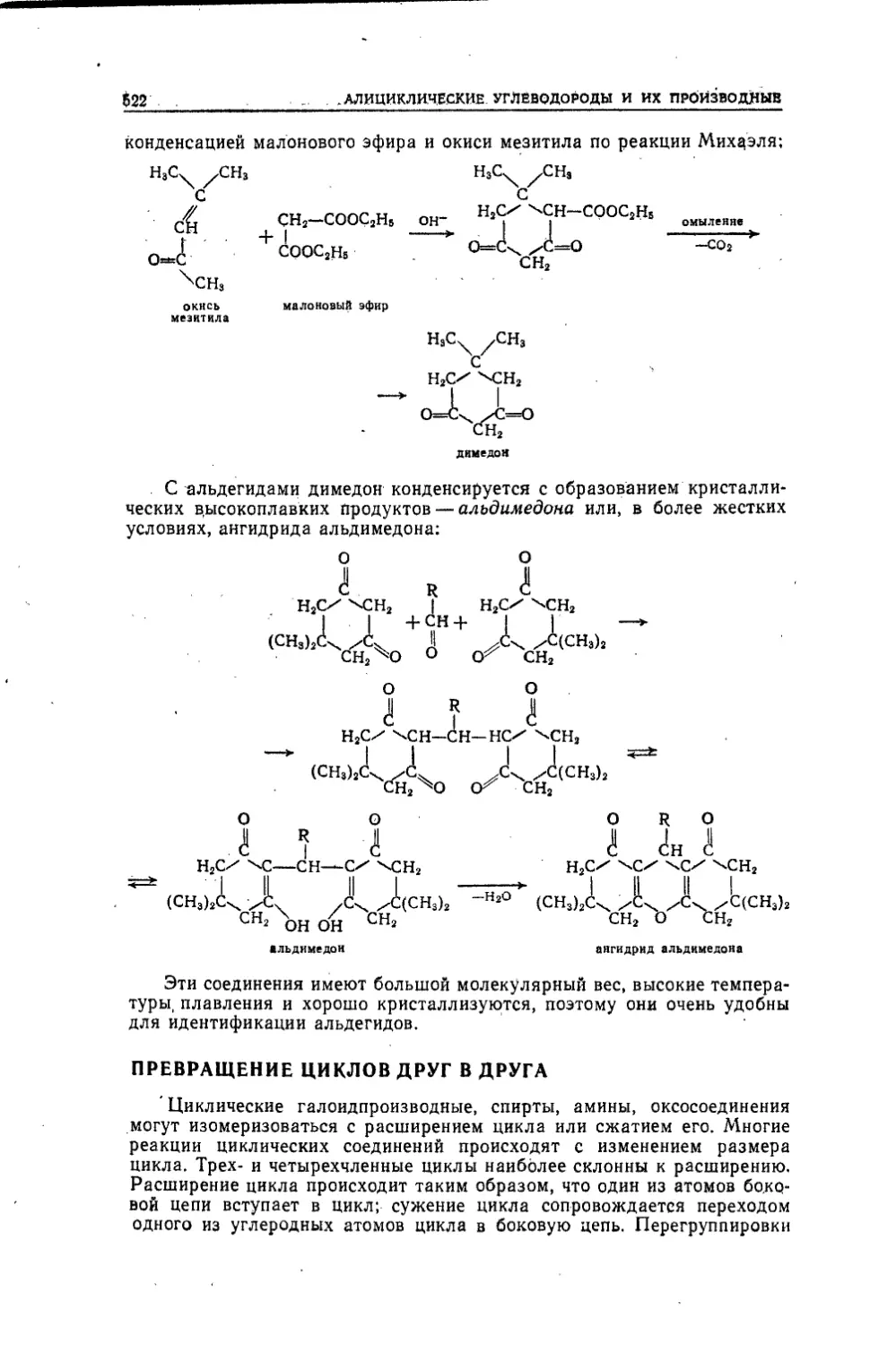
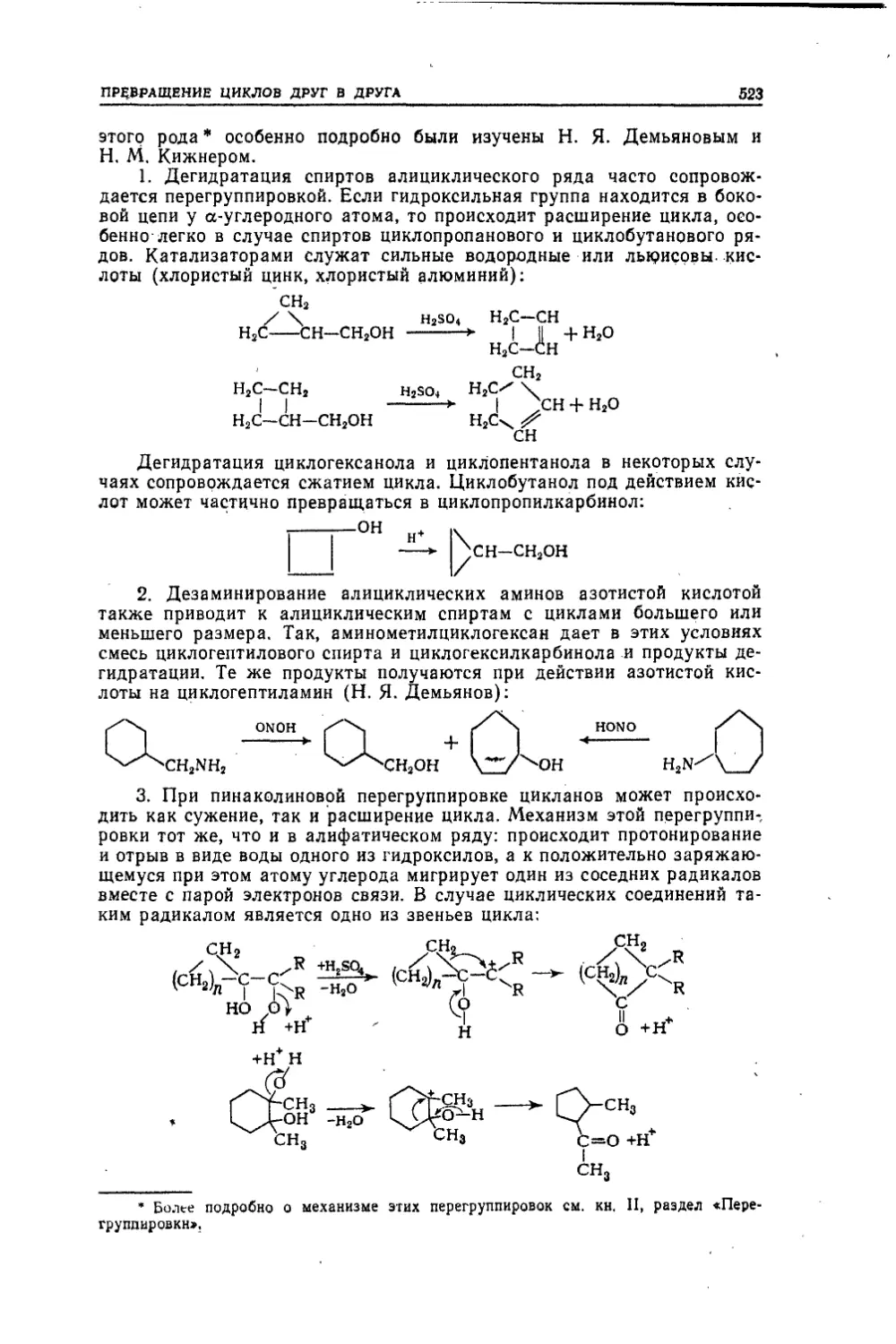
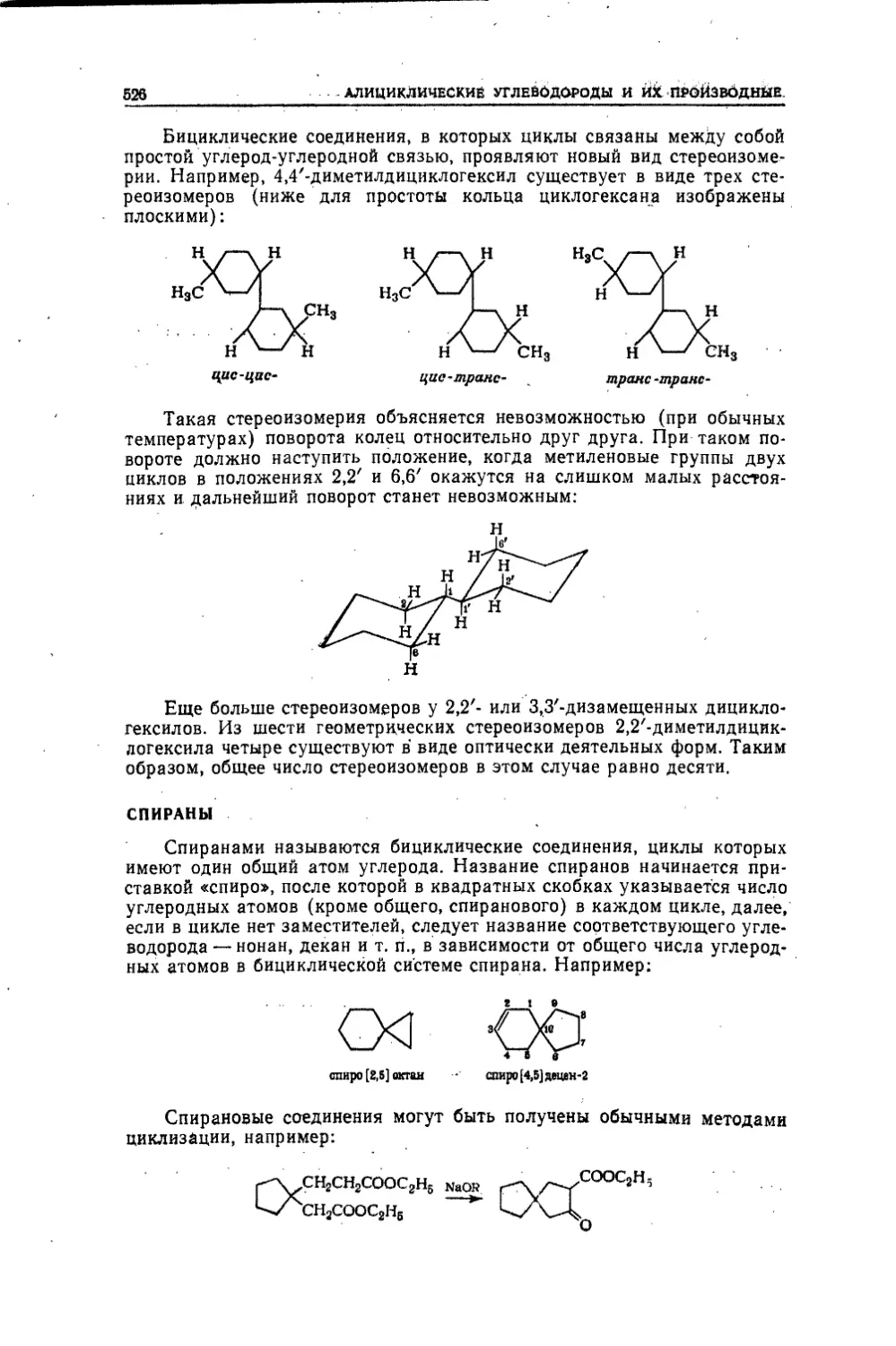
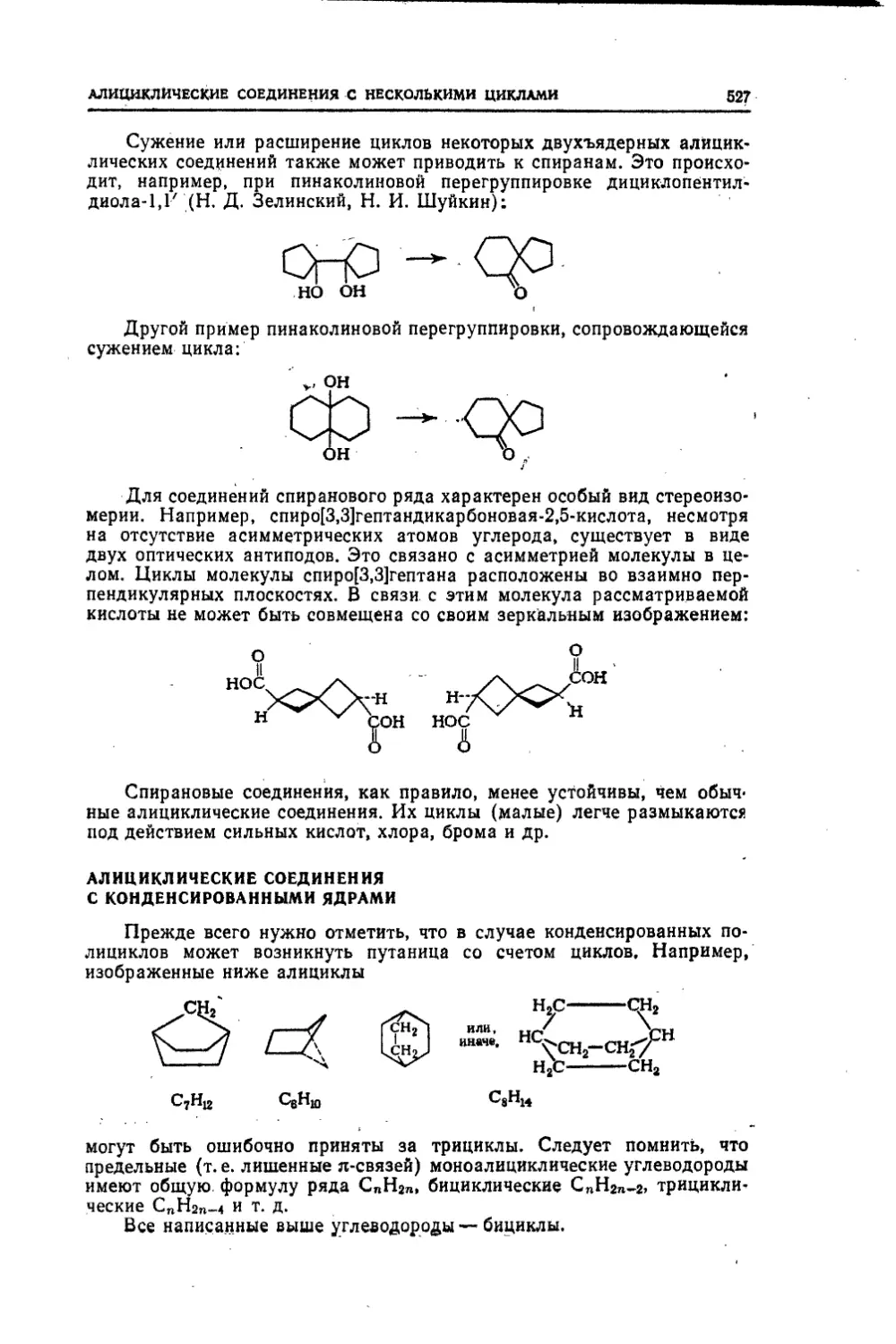
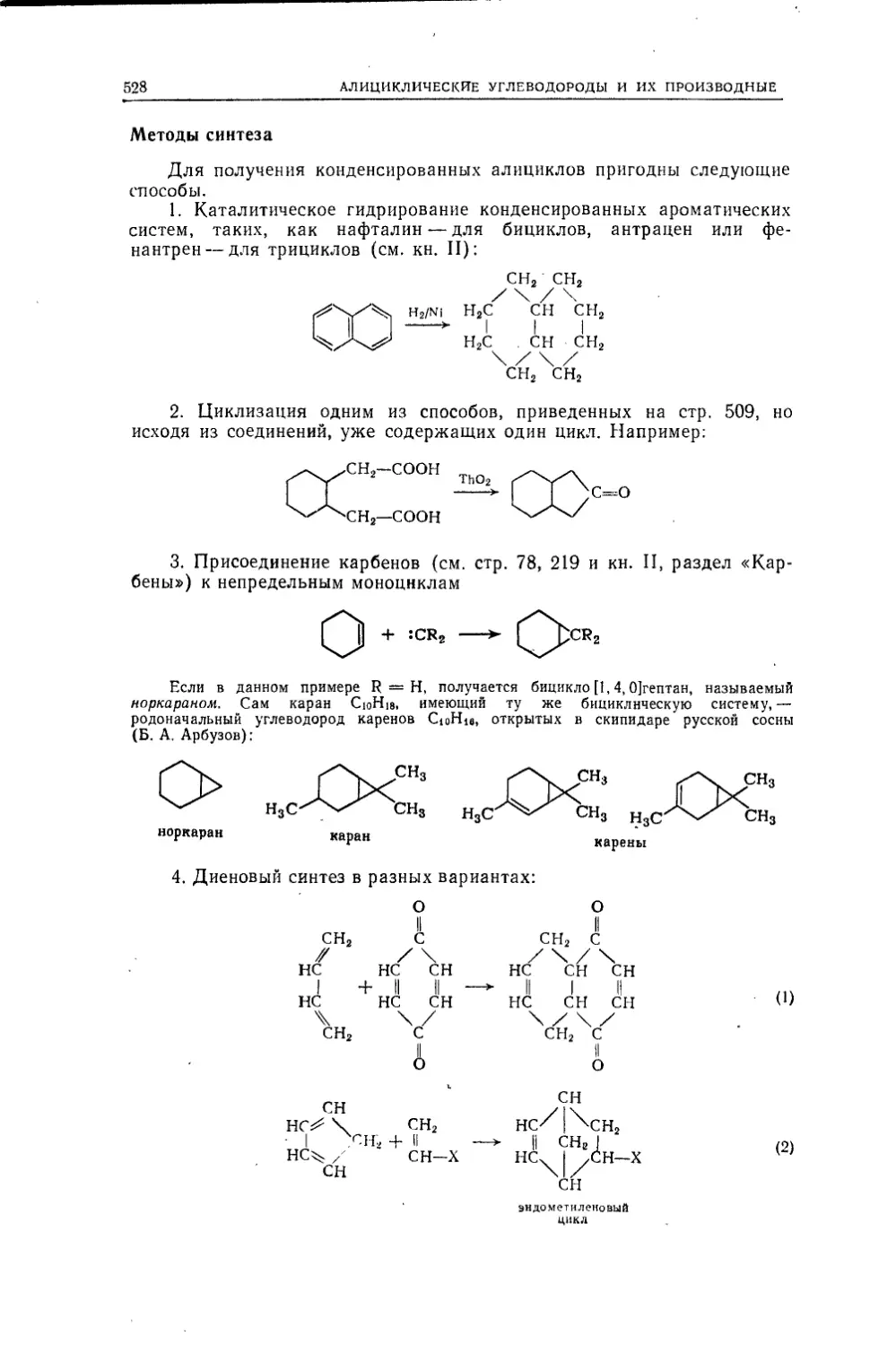
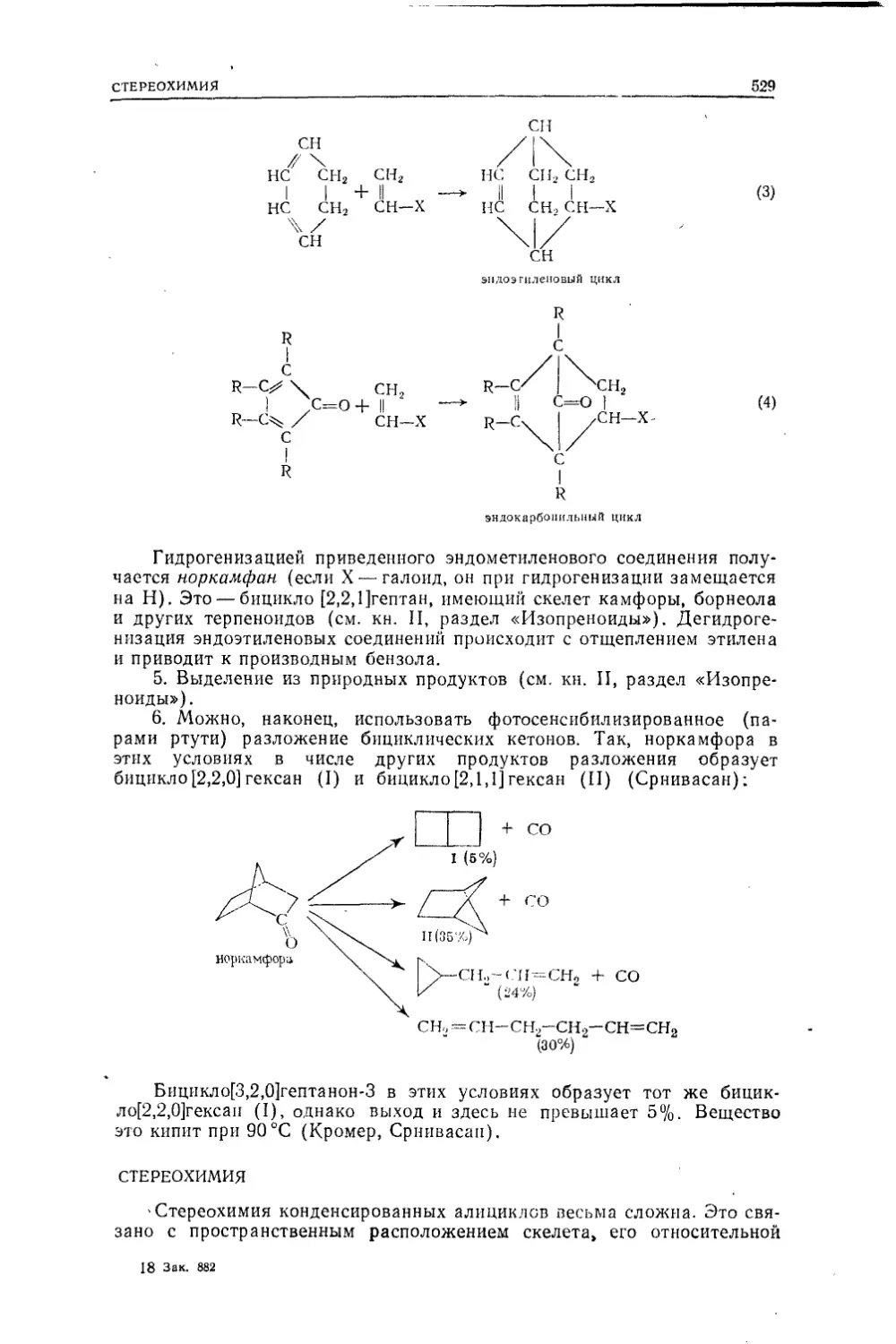
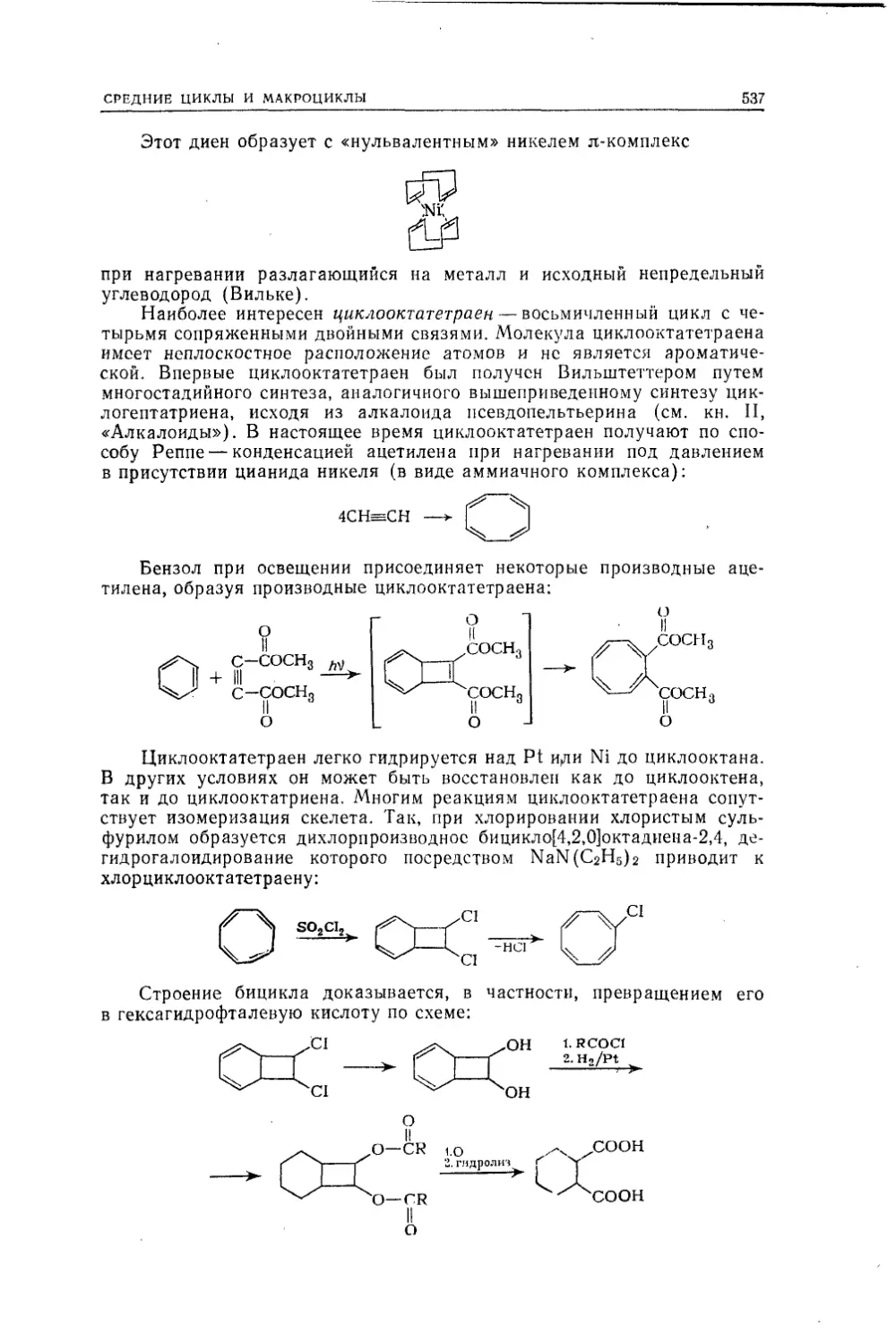
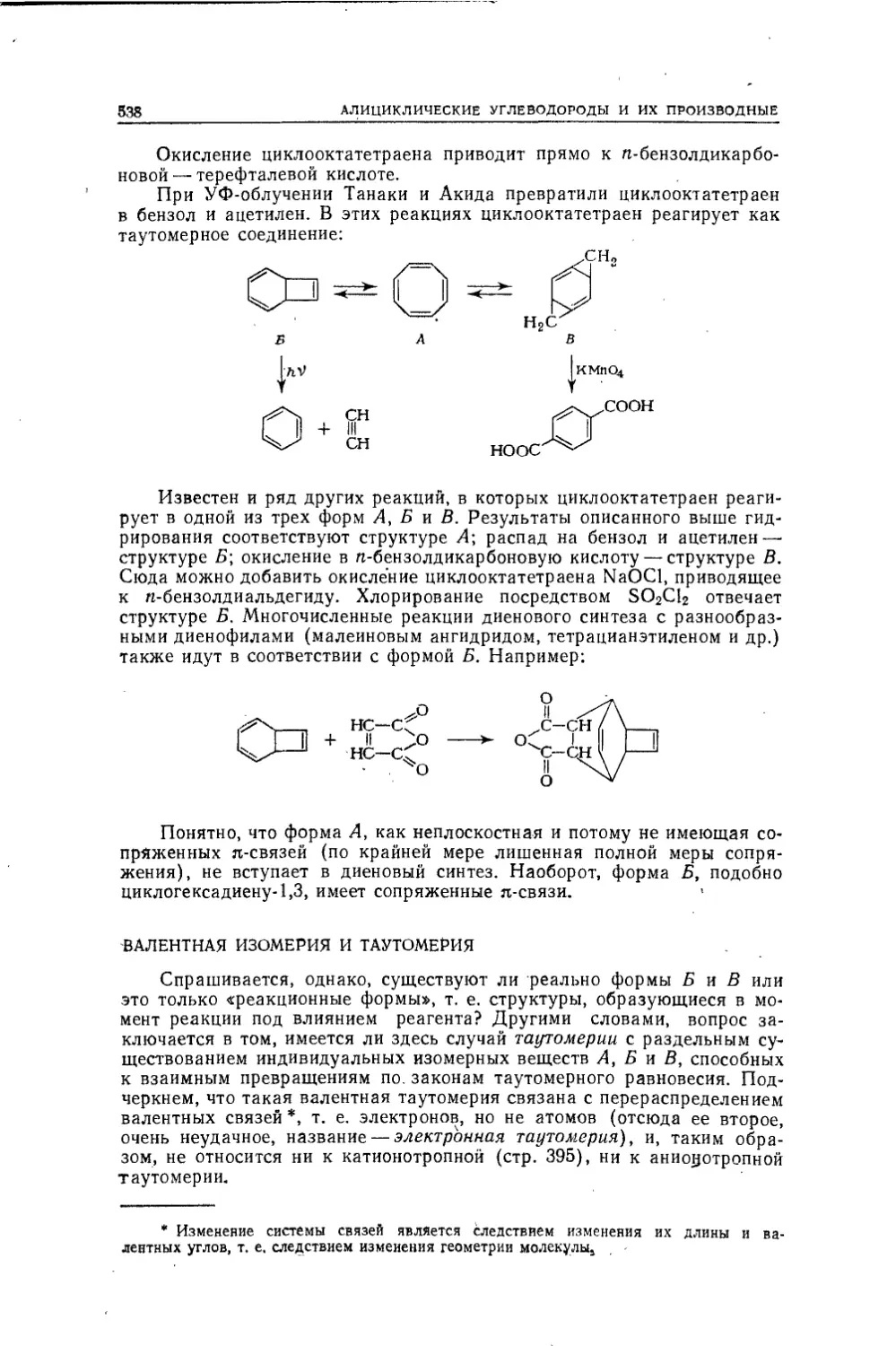
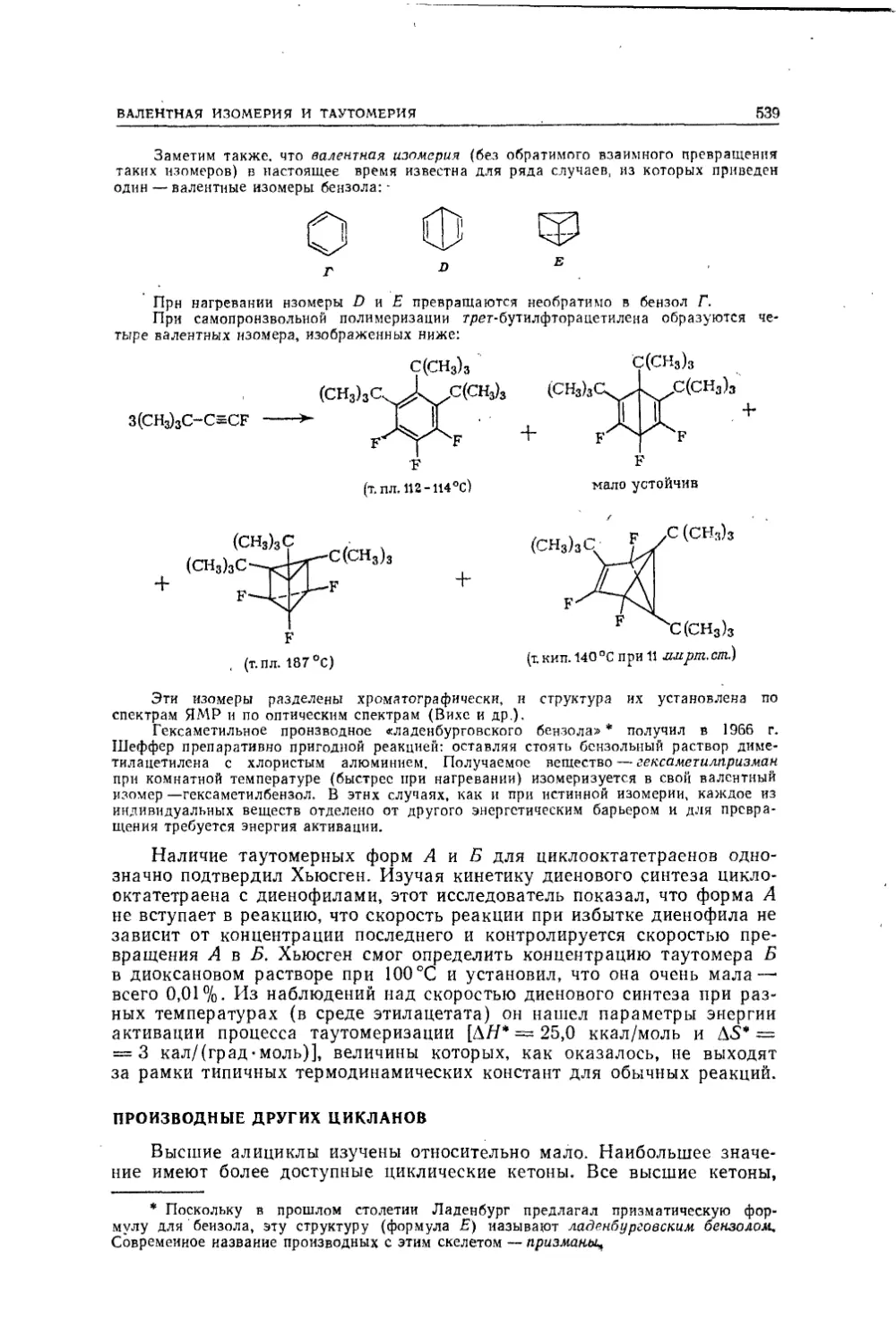
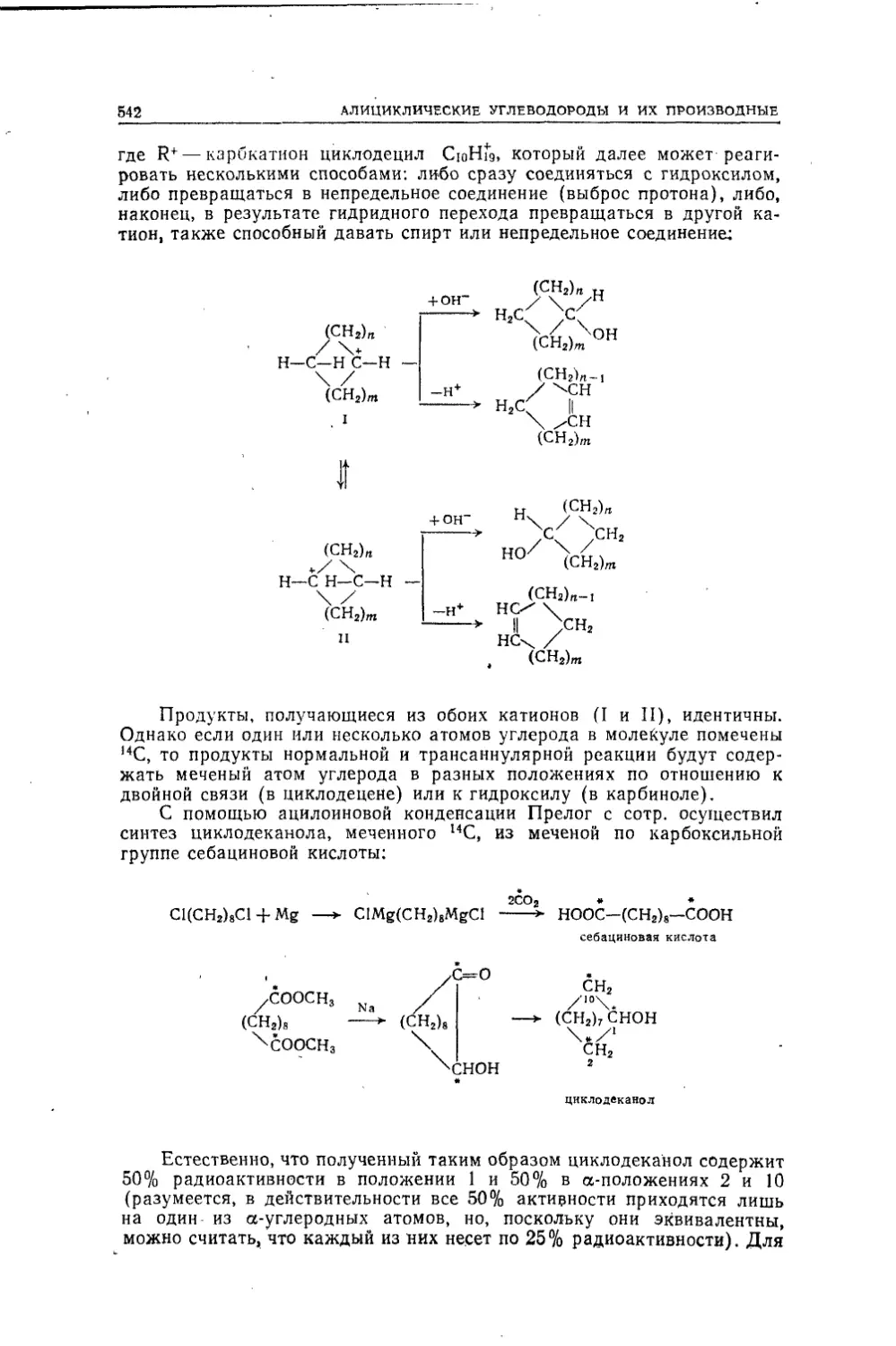
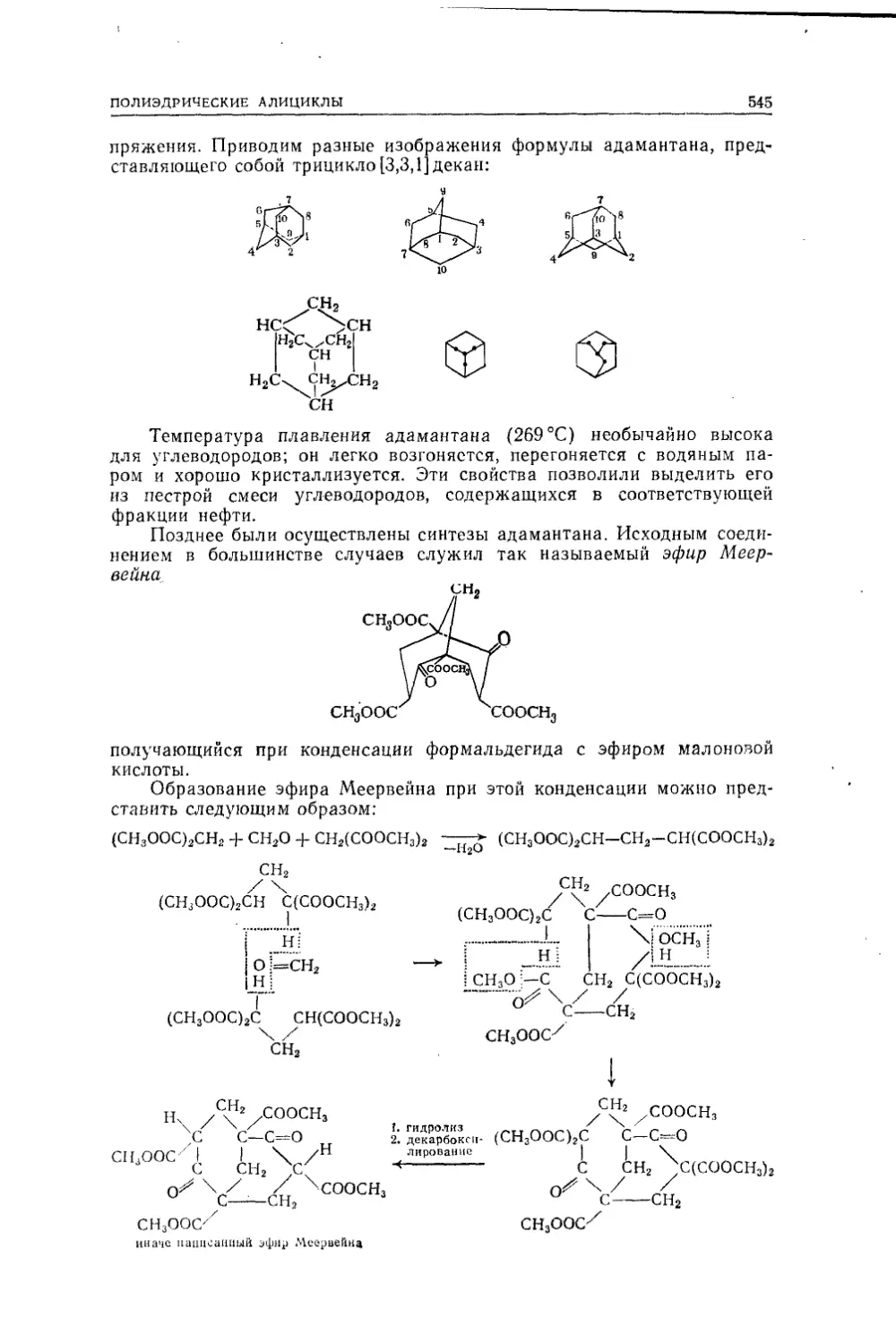
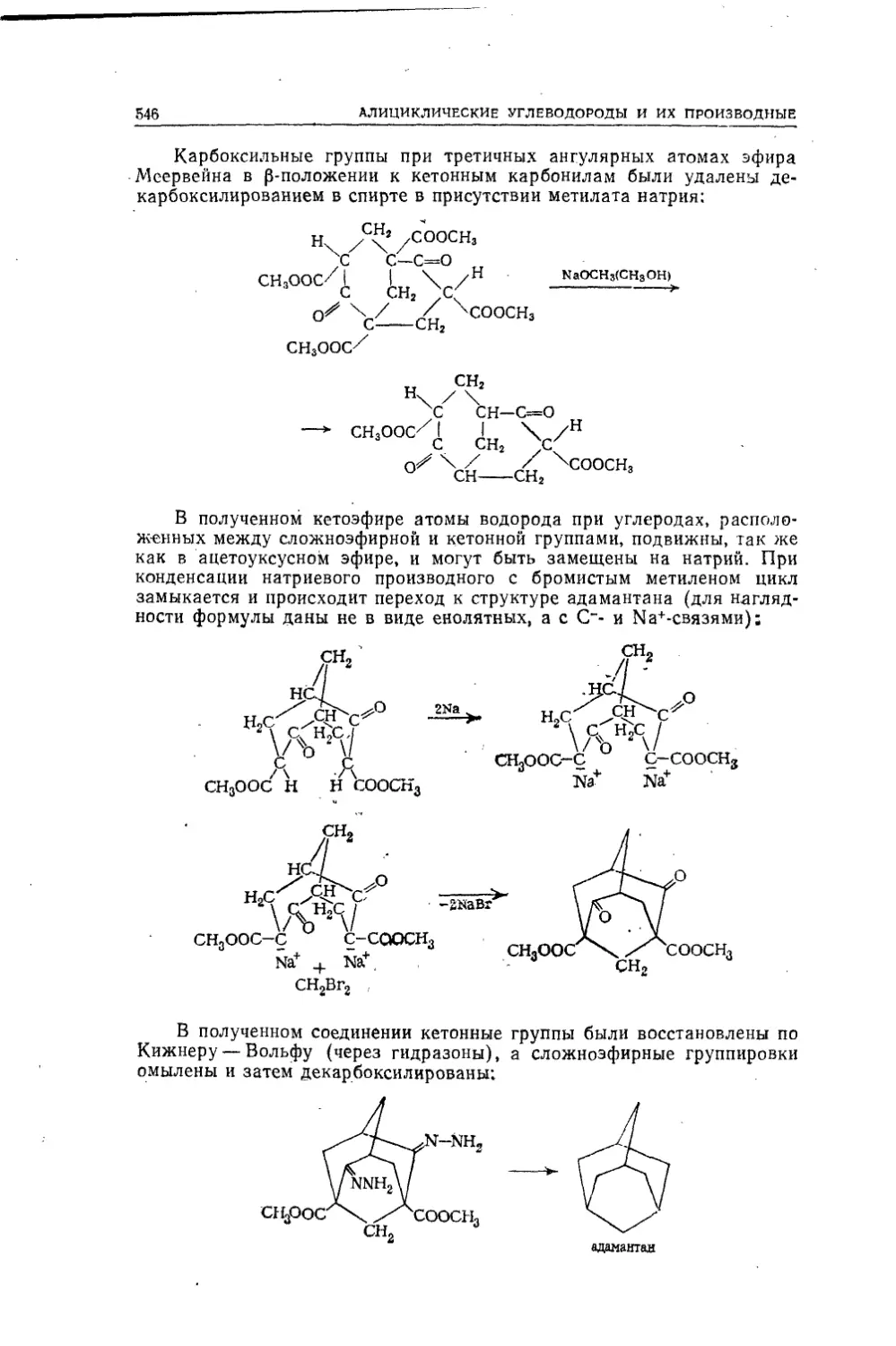
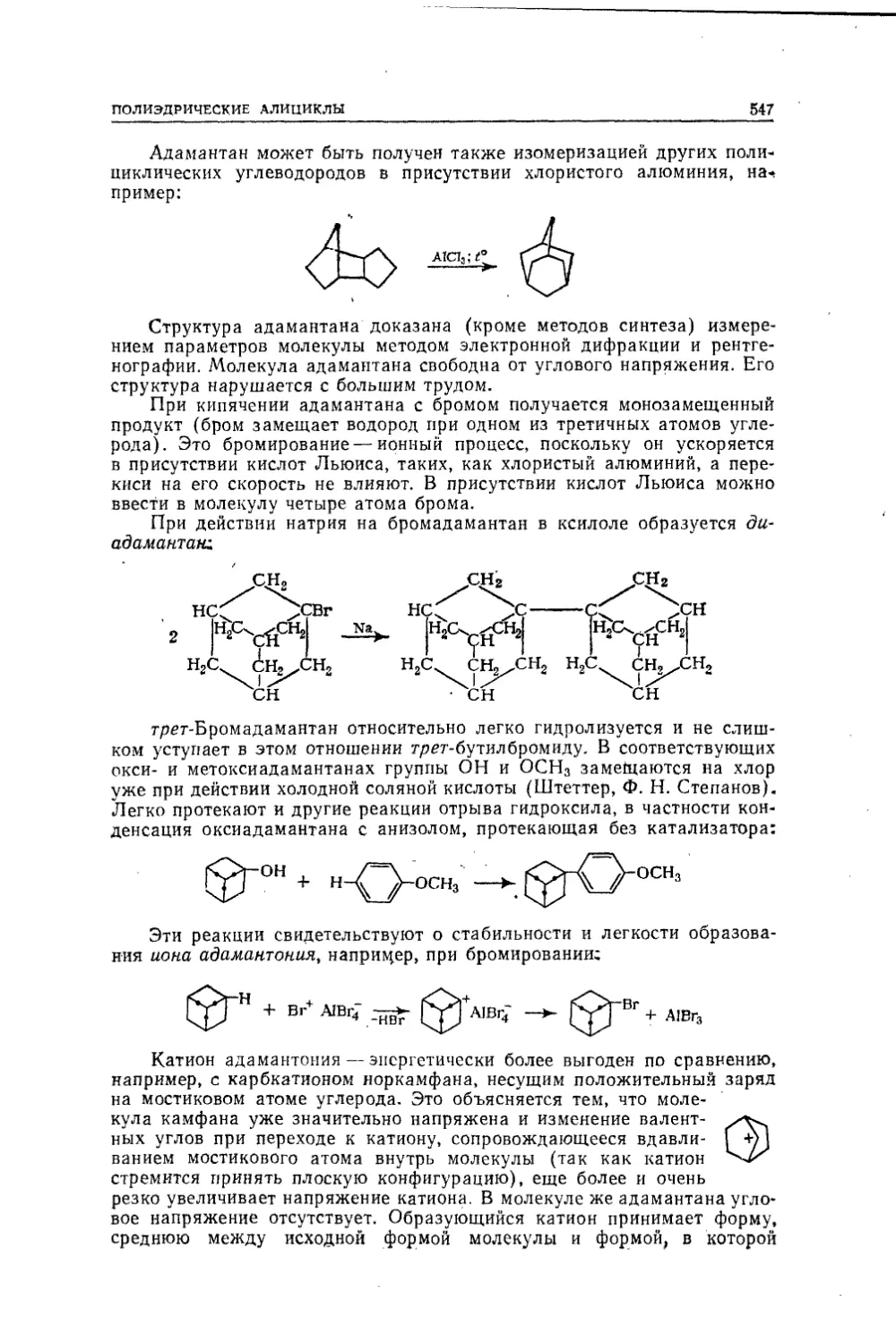
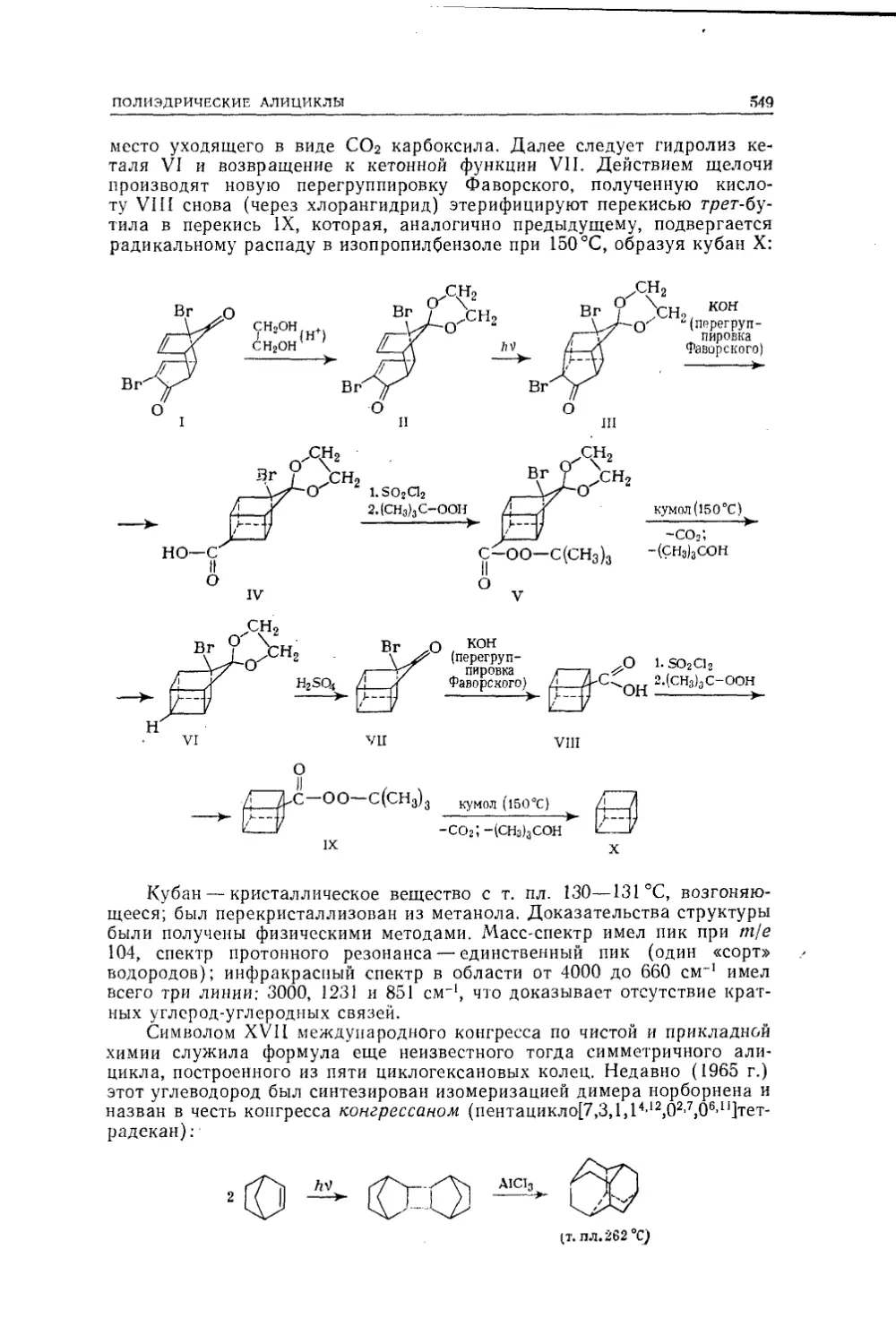
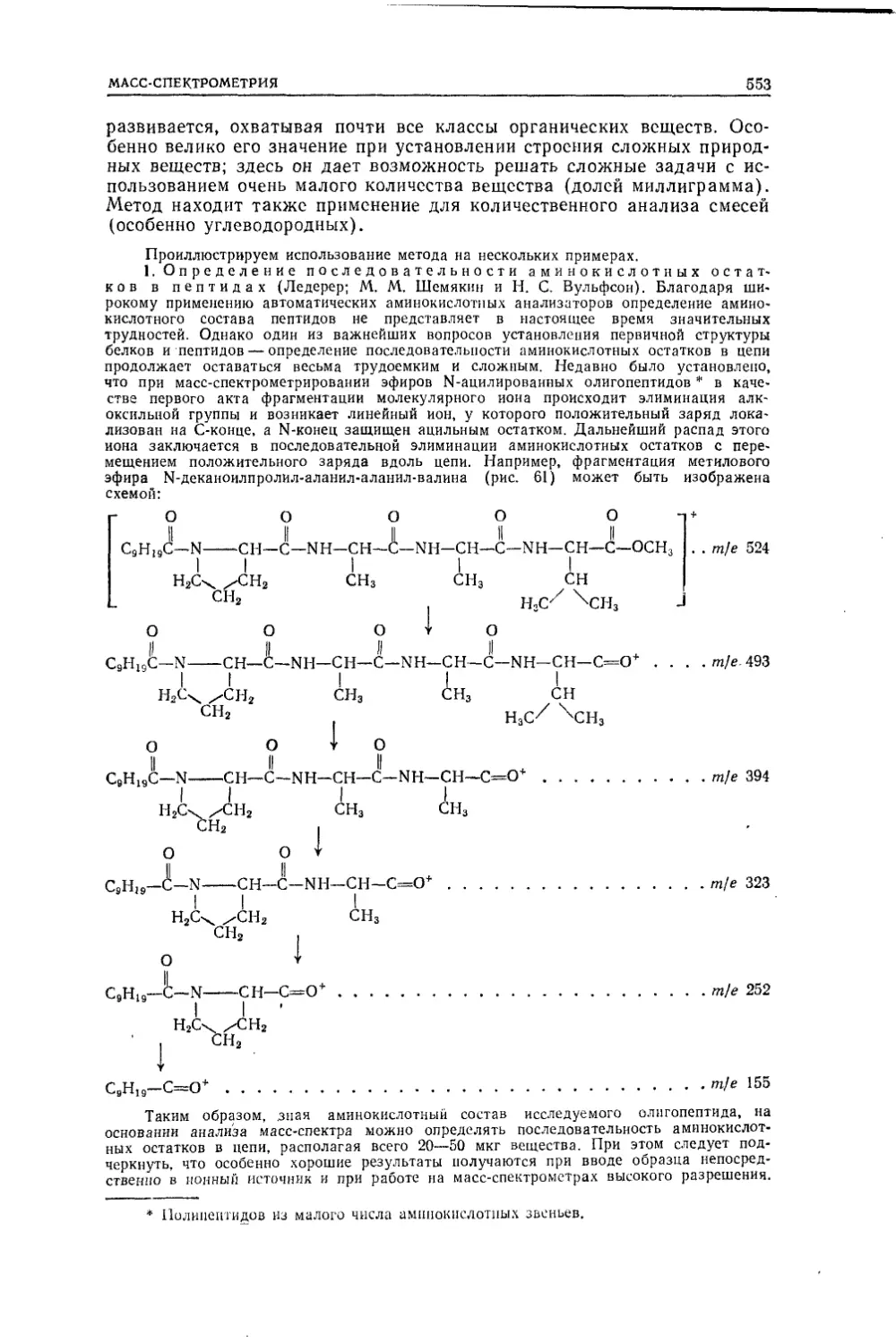
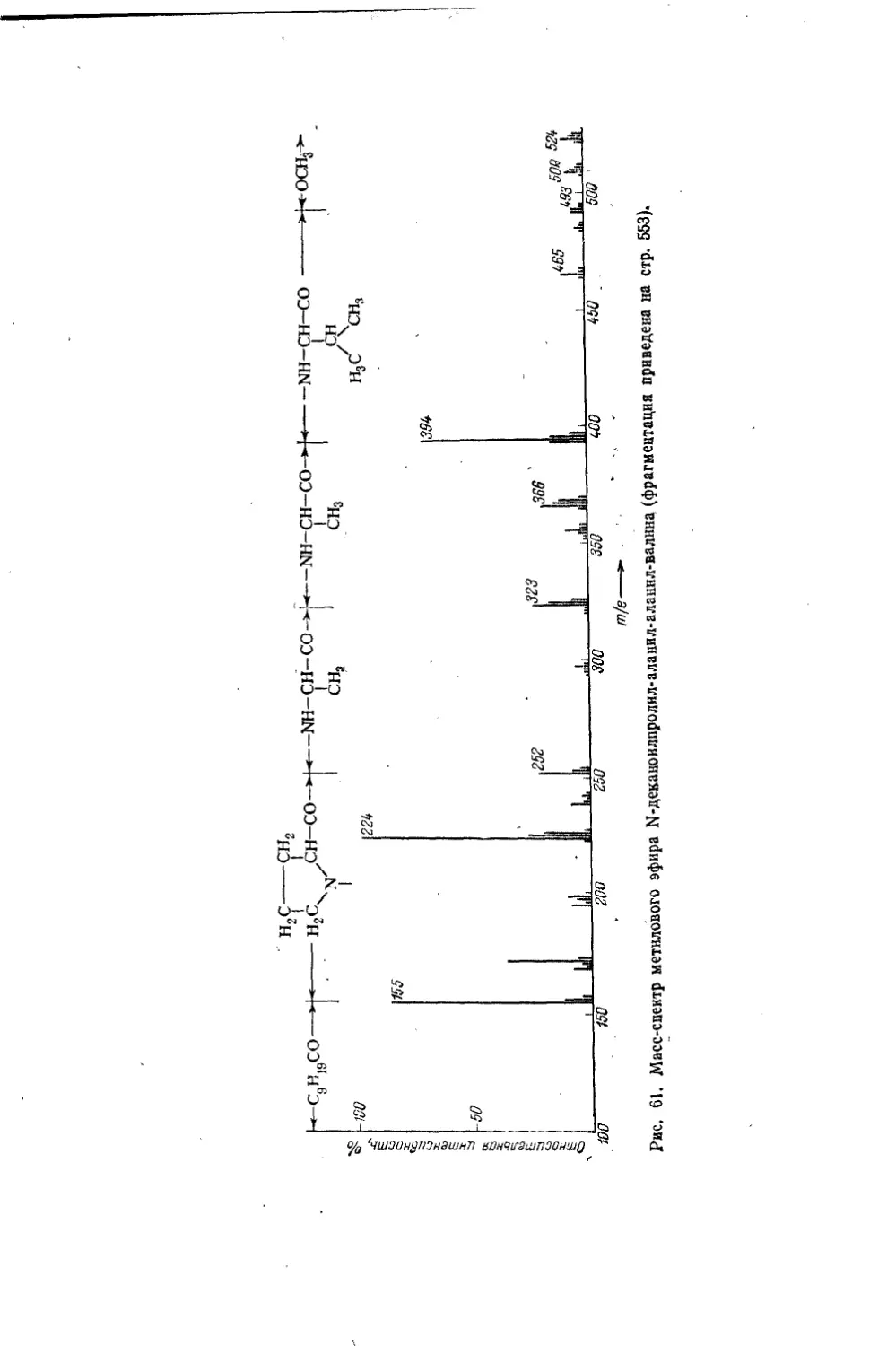
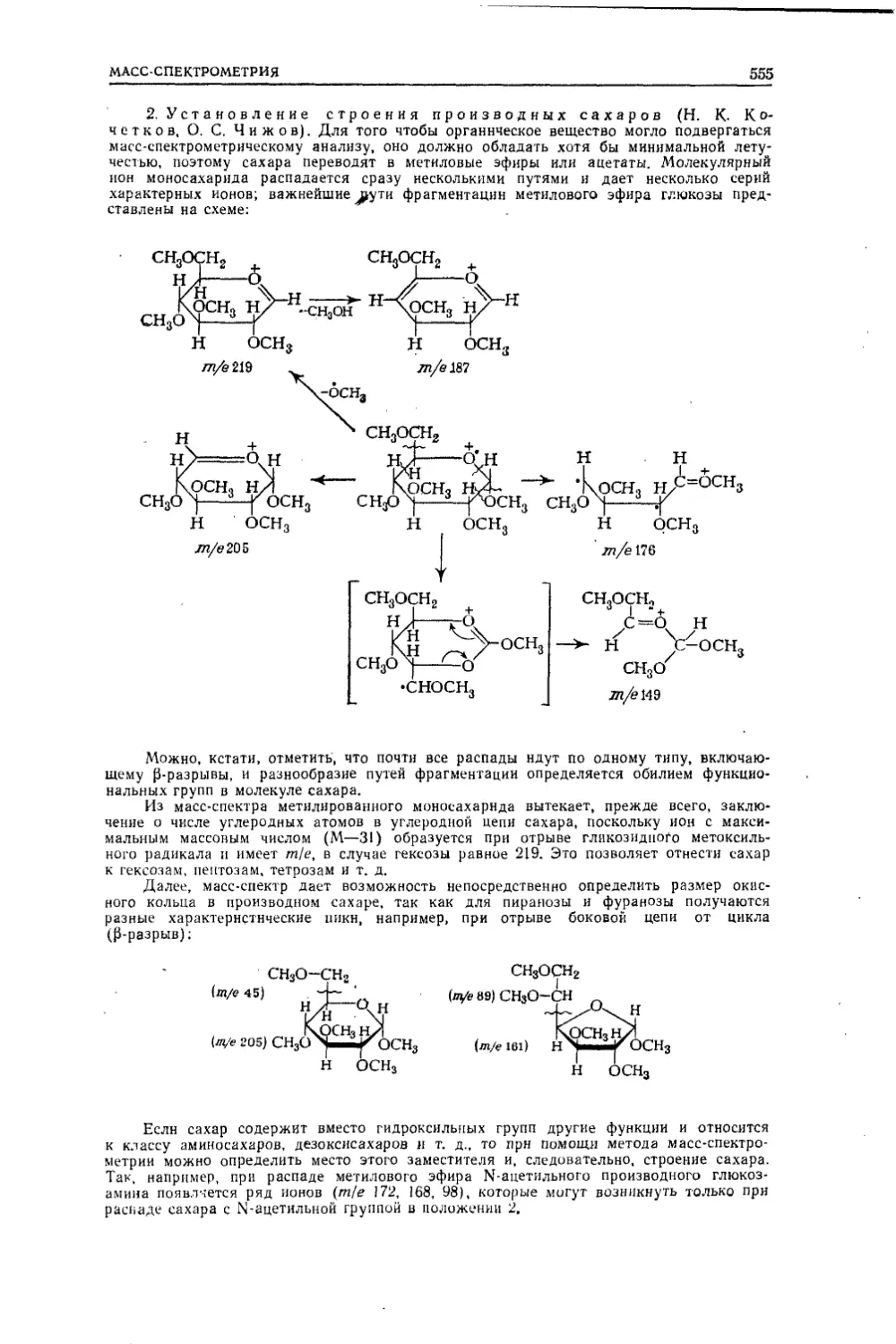
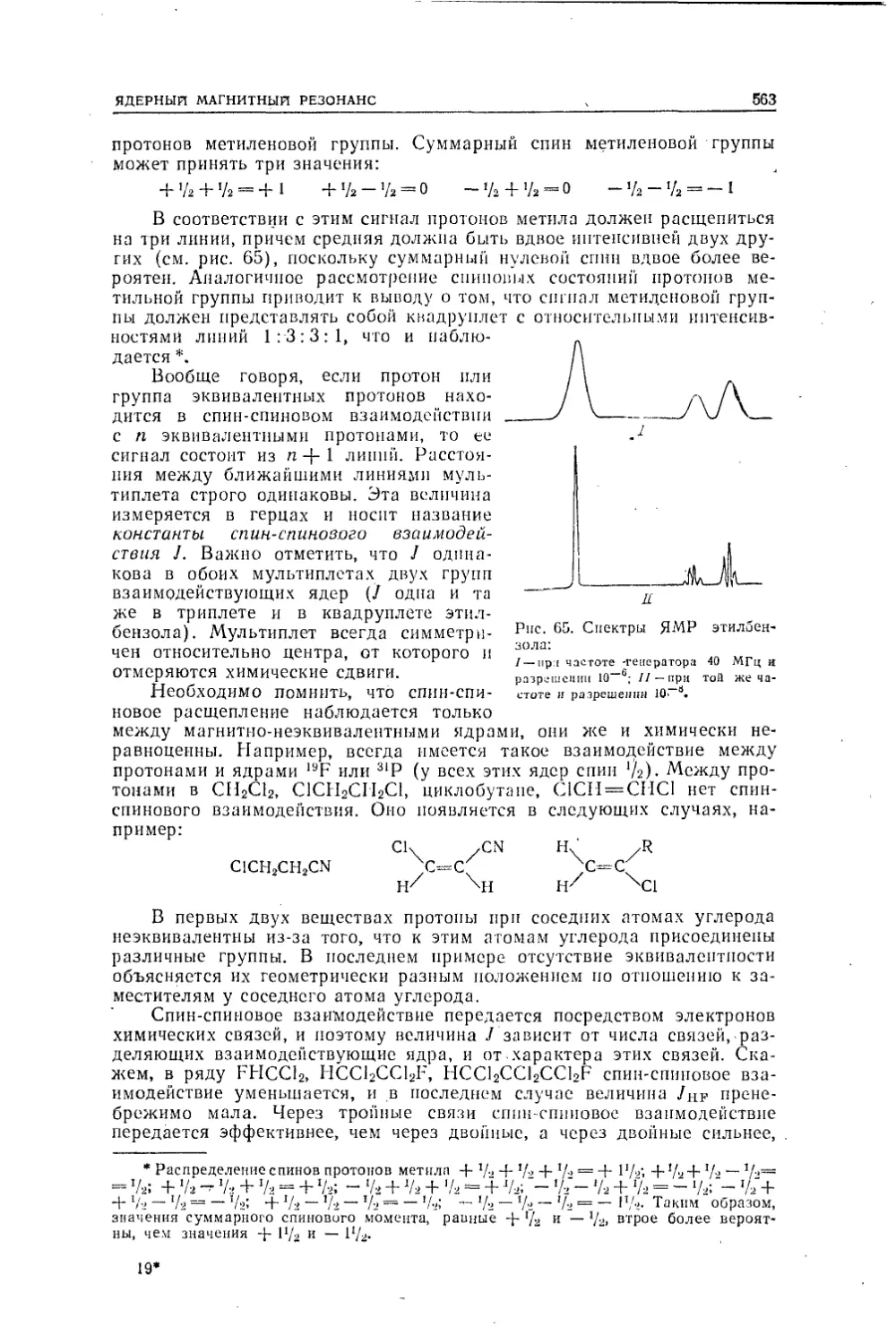
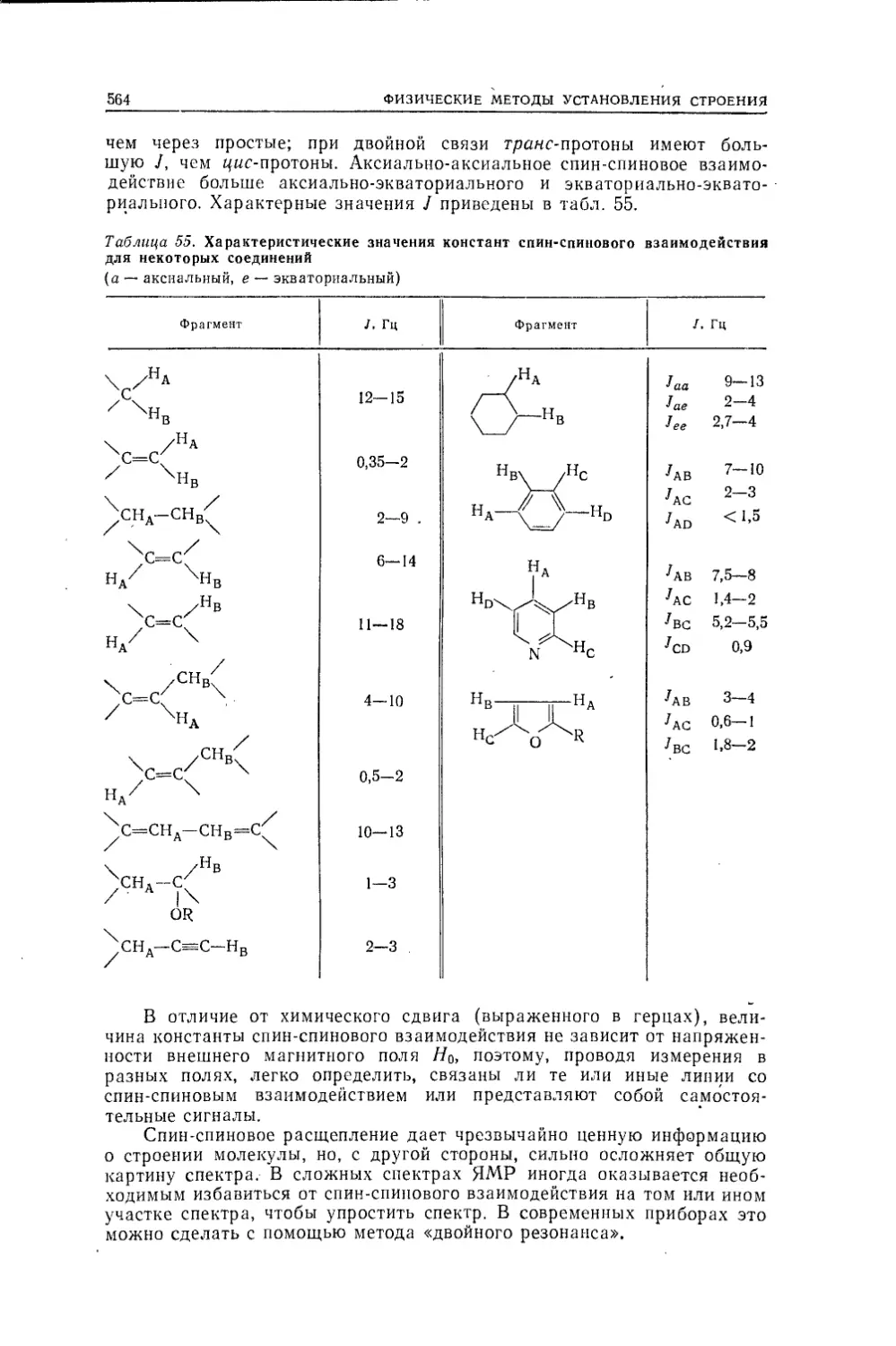
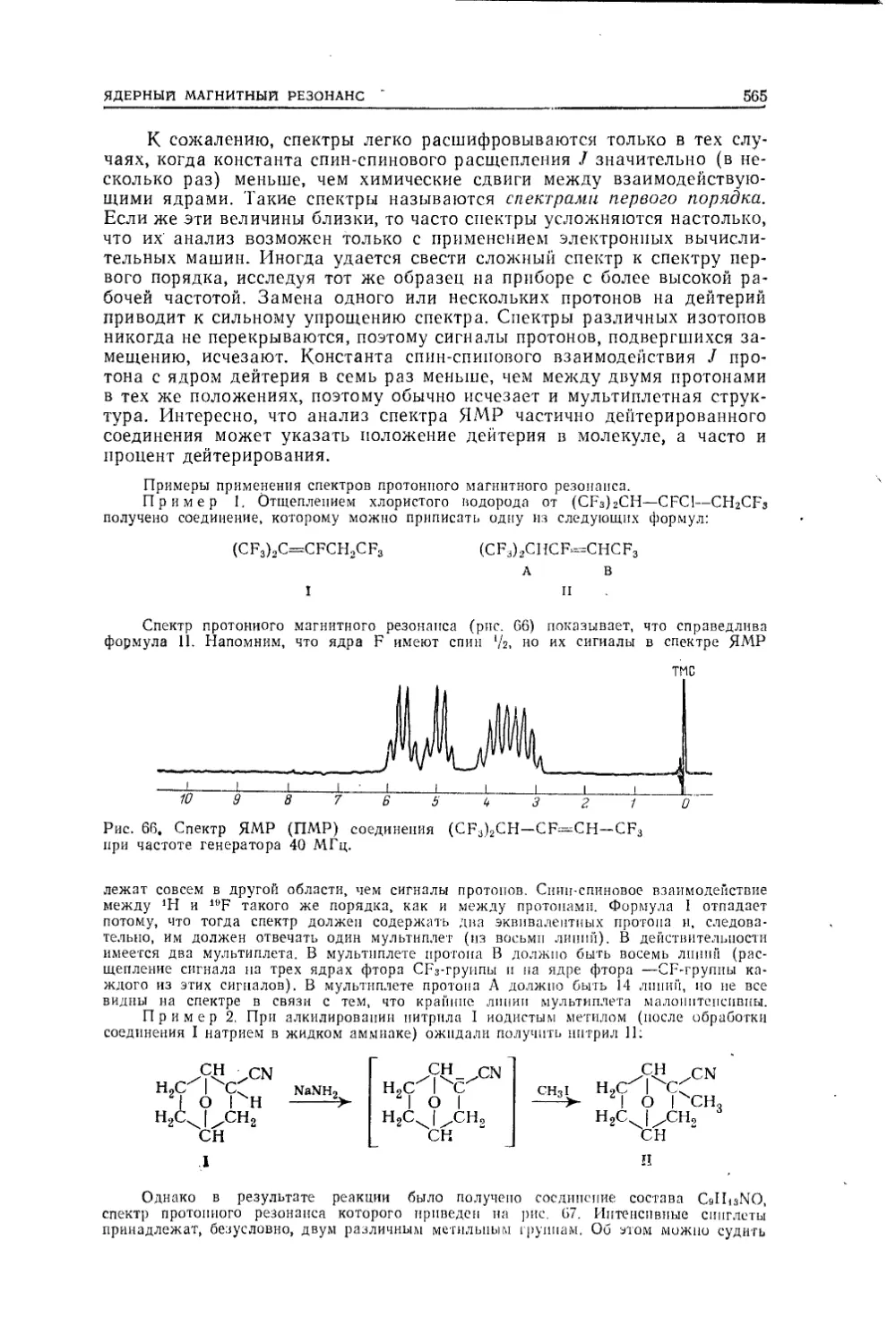
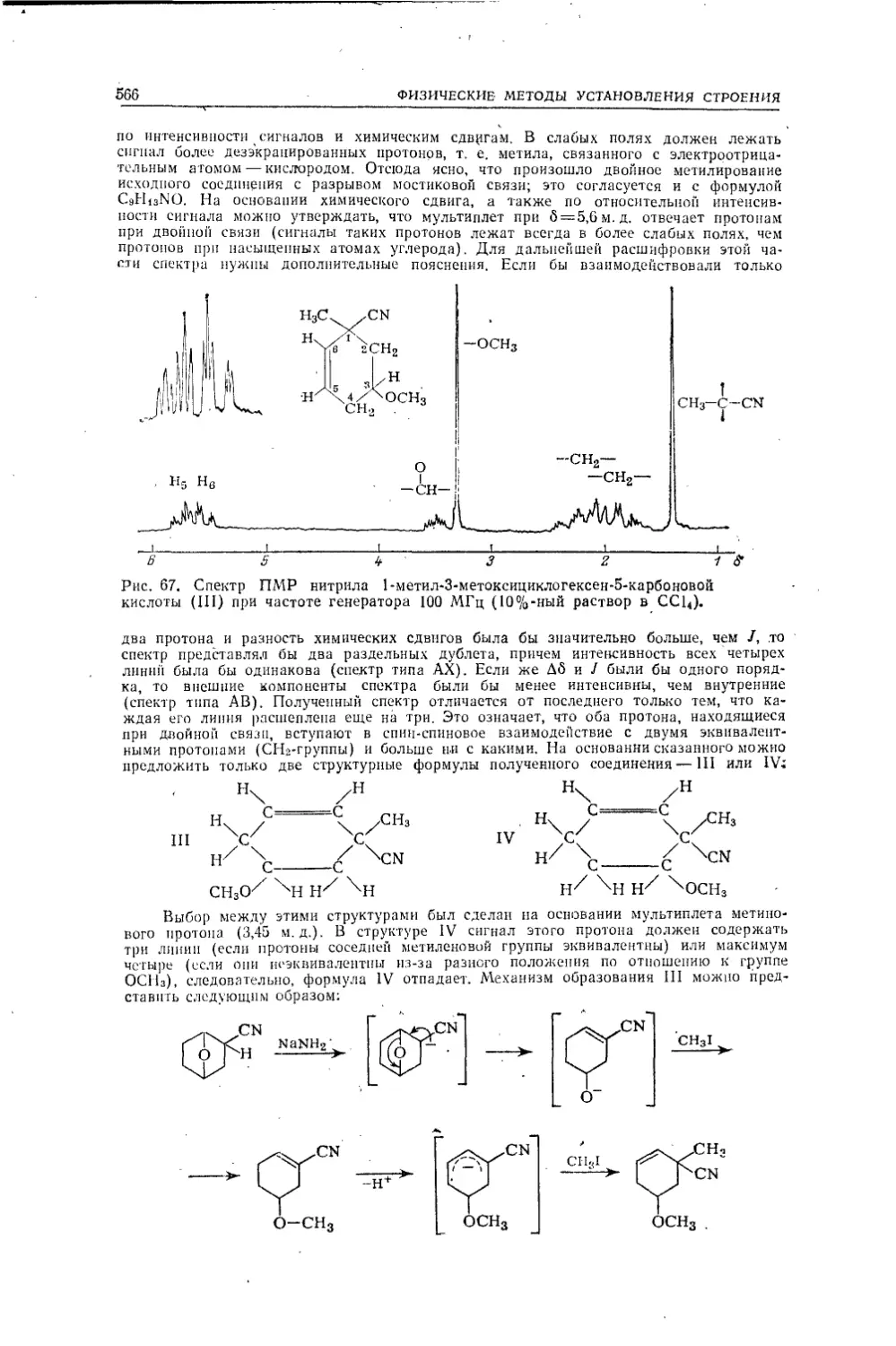
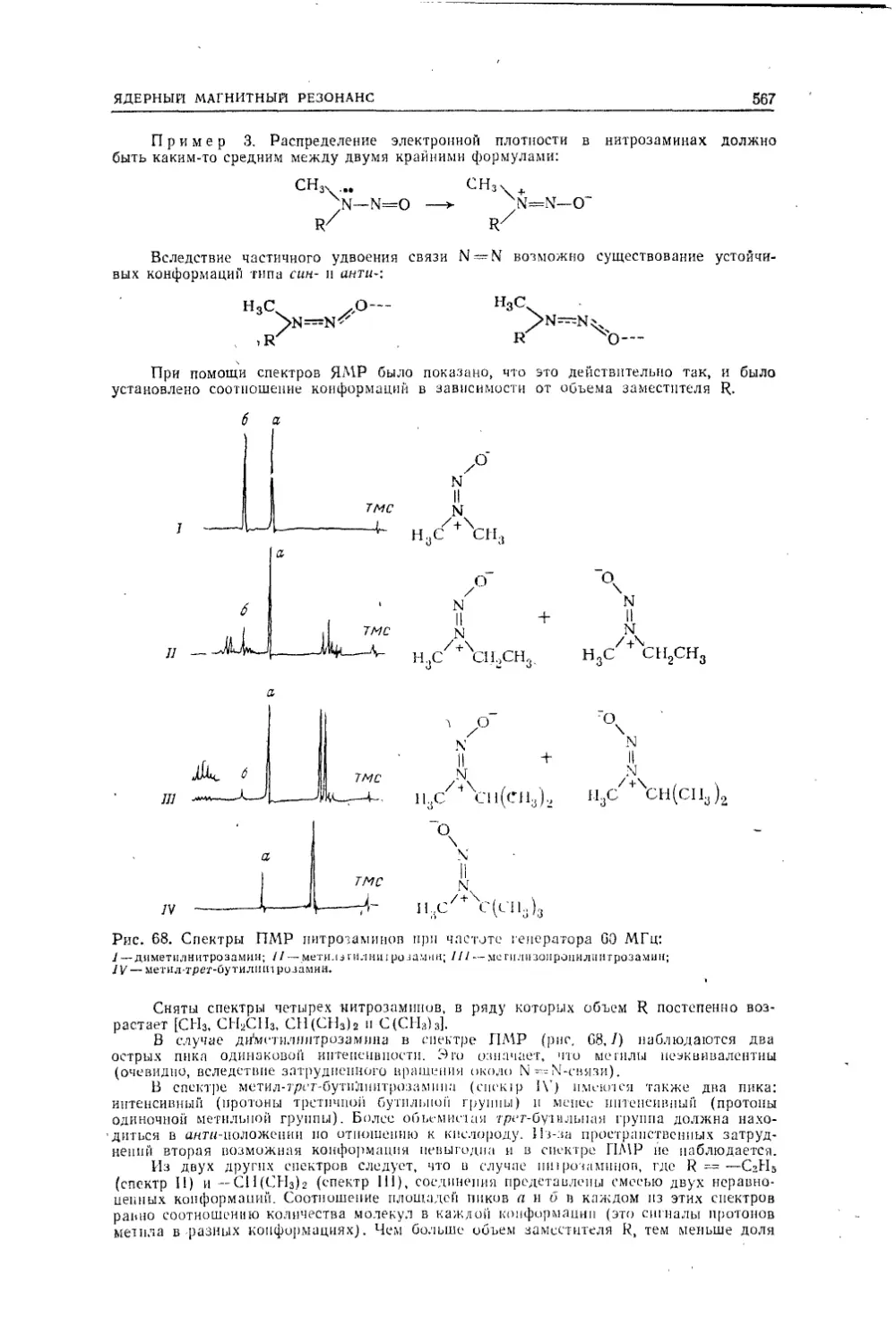
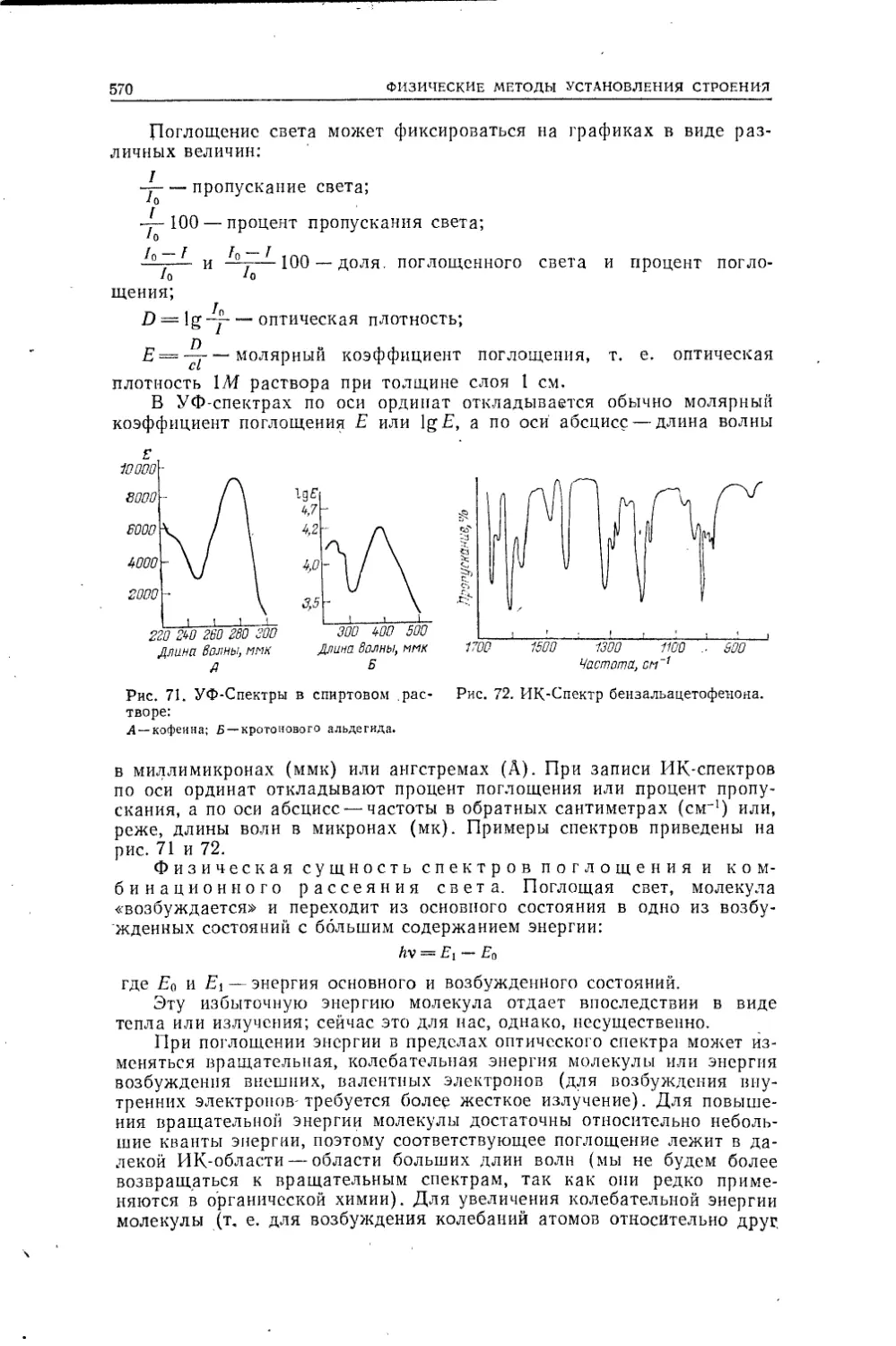
Текст
Памяти Нинолая Васильевича Несмеянова,отца и деда\
А.Н.НЕСМЕЯНОВ, Н.А.НЕСМЕЯНОВНАЧАЛА
ОРГАНИЧЕСКОЙ ХИМИИВ ДВУХ КНИГАХ@МОСКВА-1074.
А.Н.НЕСМЕЯНОВ, Н.А.НЕСМЕЯНОВНАЧАЛА
ОРГАНИЧЕСКОЙ ХИМИИКНИГА ПЕРВАЯИЗДАНИЕ ВТОРОЕ, ПЕРЕРАБОТАННОЕИЗДАТЕЛЬСТВО -ХИМИЯ*
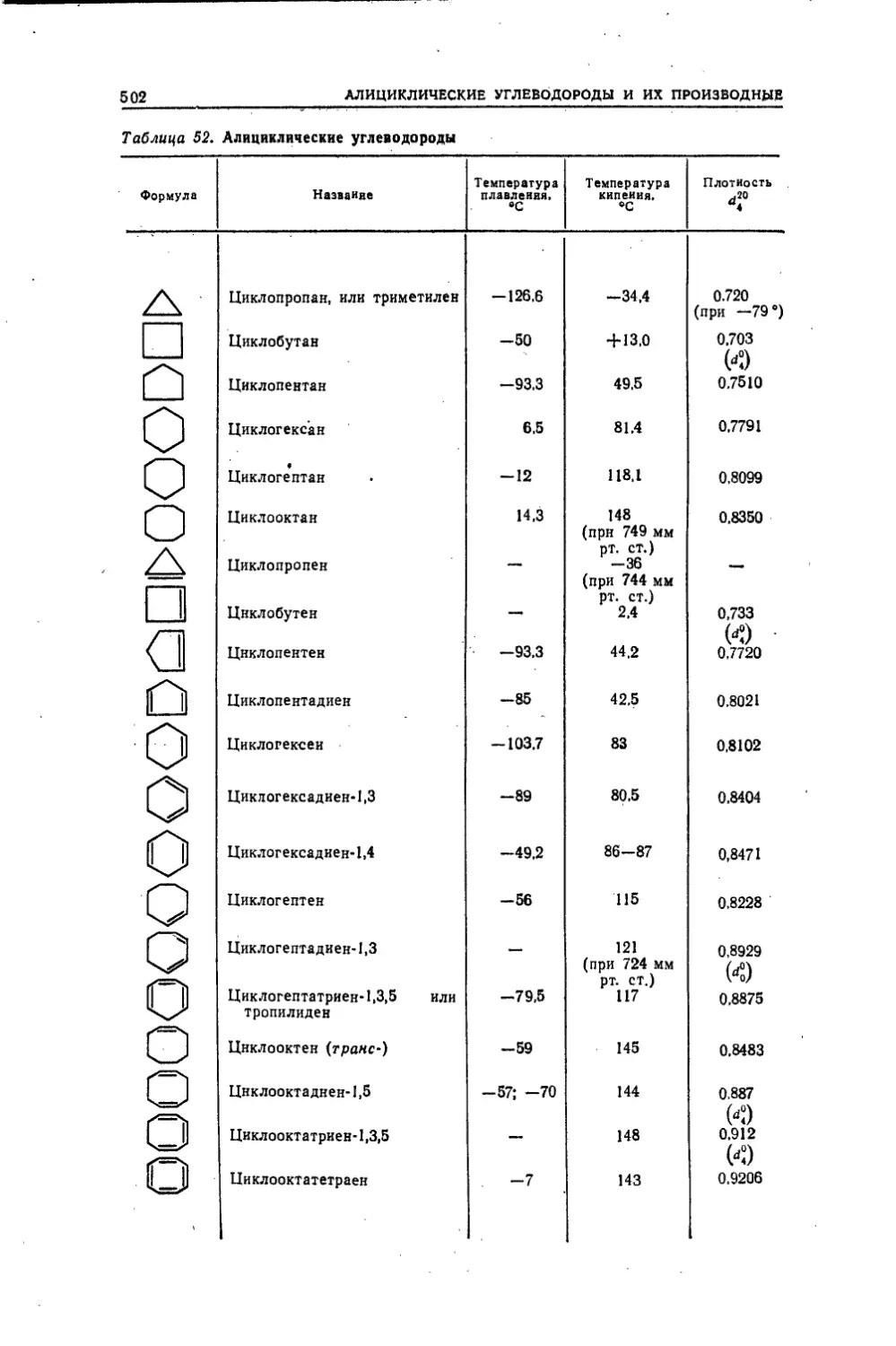
547УДК 547(075.8)
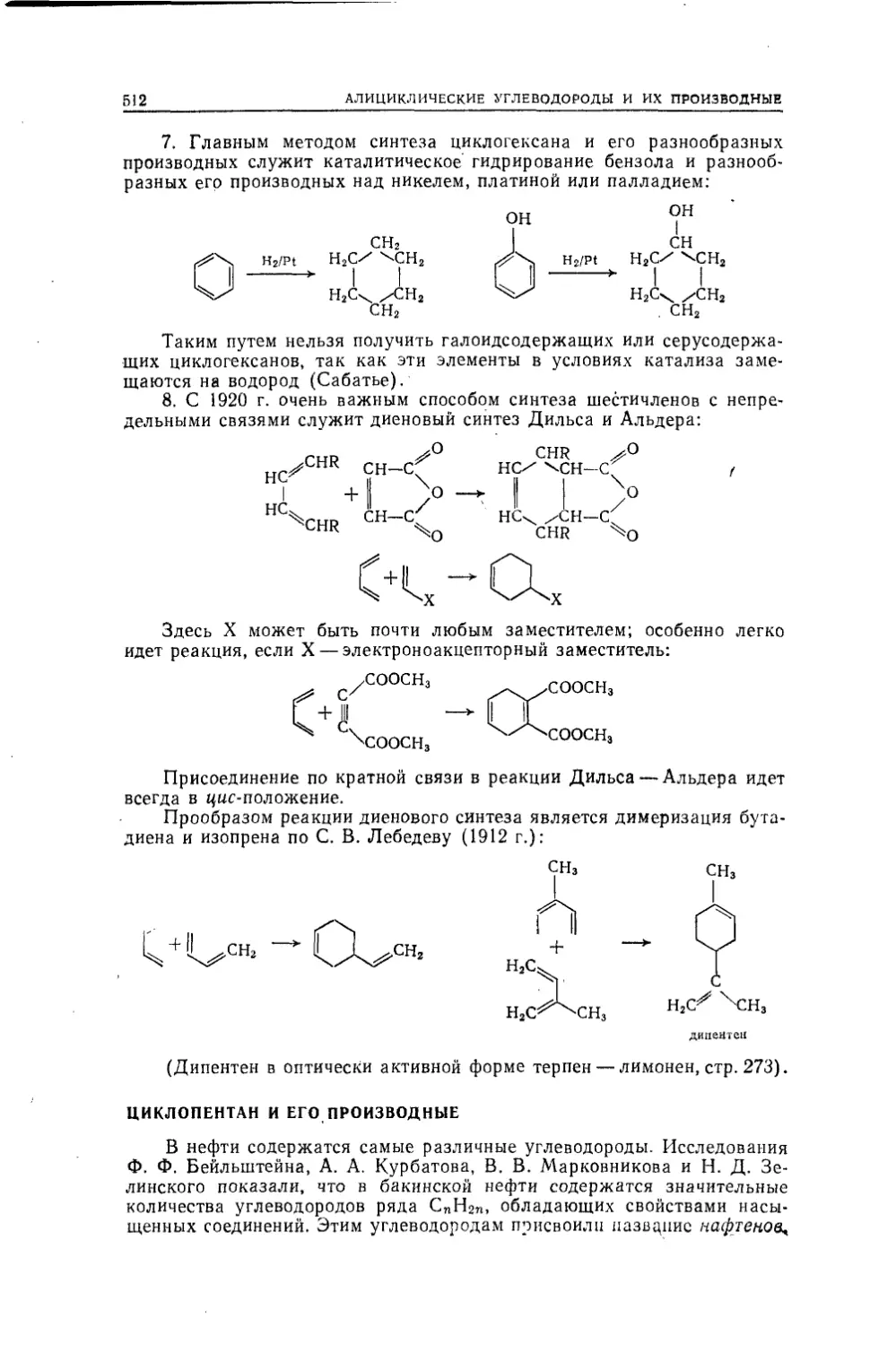
Н55Несмеянов А. Н., Несмеянов Н. А.Н55 Начала органической химии. В двух книгах. Книга I. Изд. 2-е,
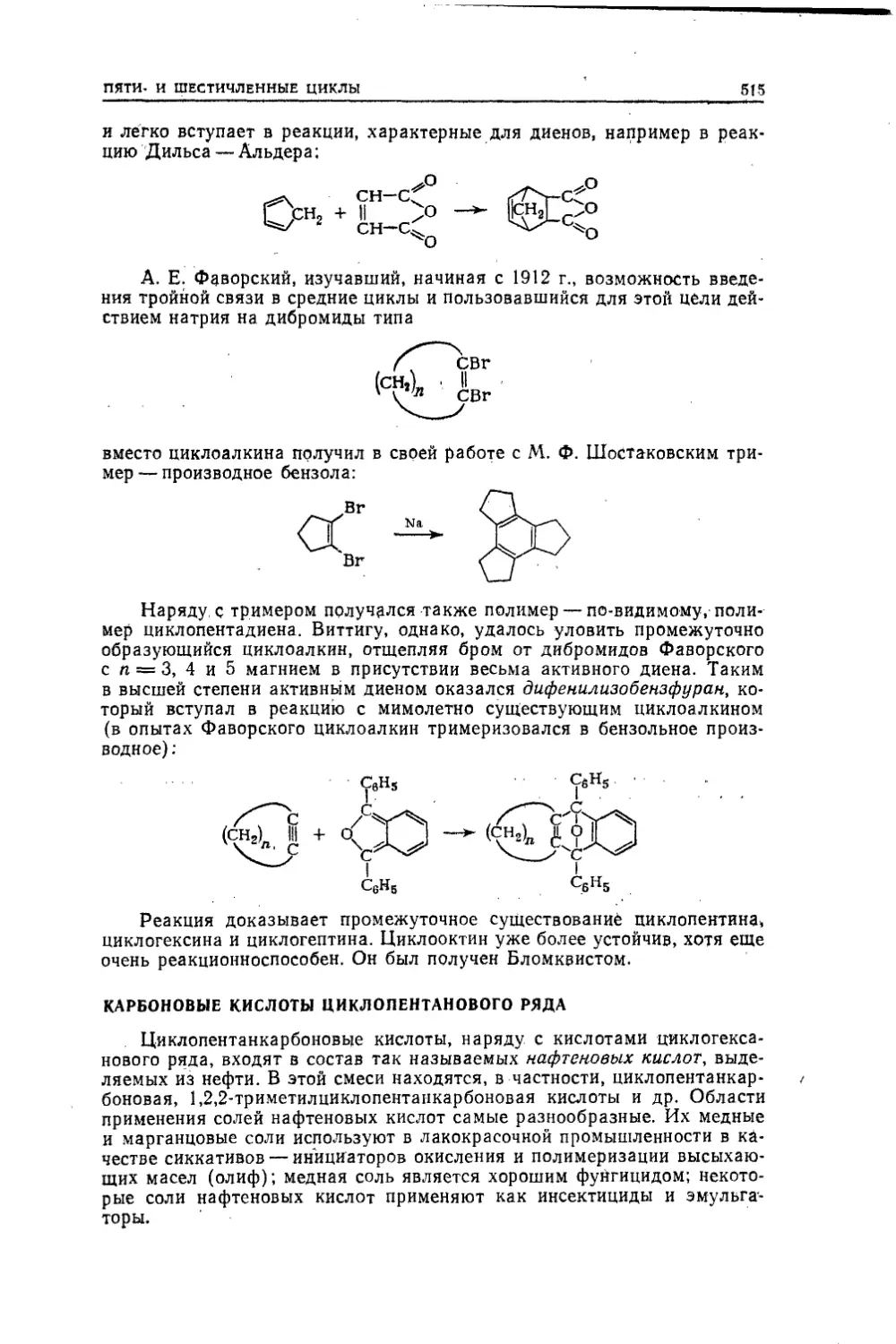
пер. М..«Химия», 1974. 624 стр., 58 табл., 79 рис.Книга представляет собой двухтомное руководство, предназна¬
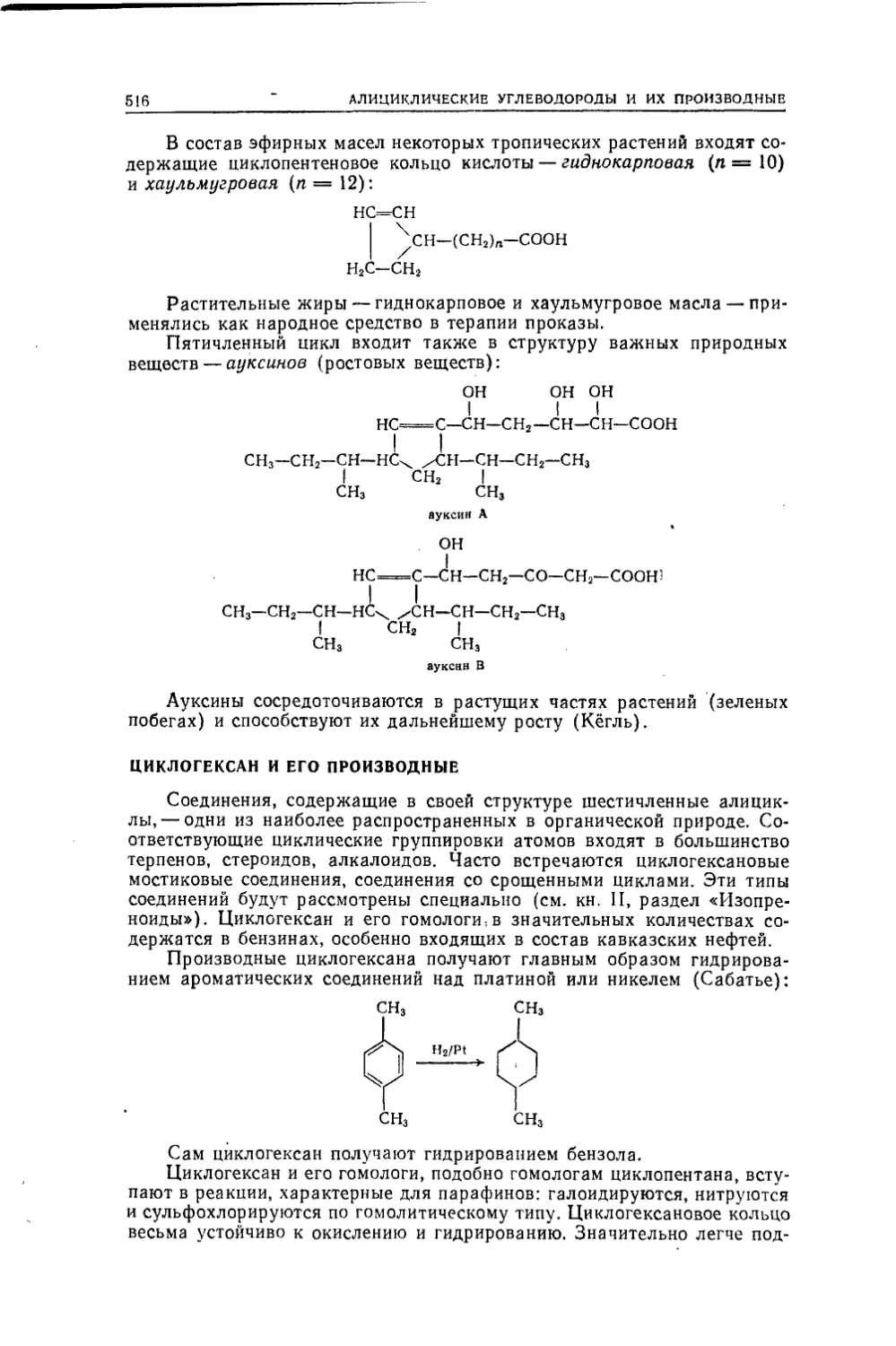
ченное для систематического изучения органической химии. Мате¬
риал разделен на две части и по объему несколько шире программы
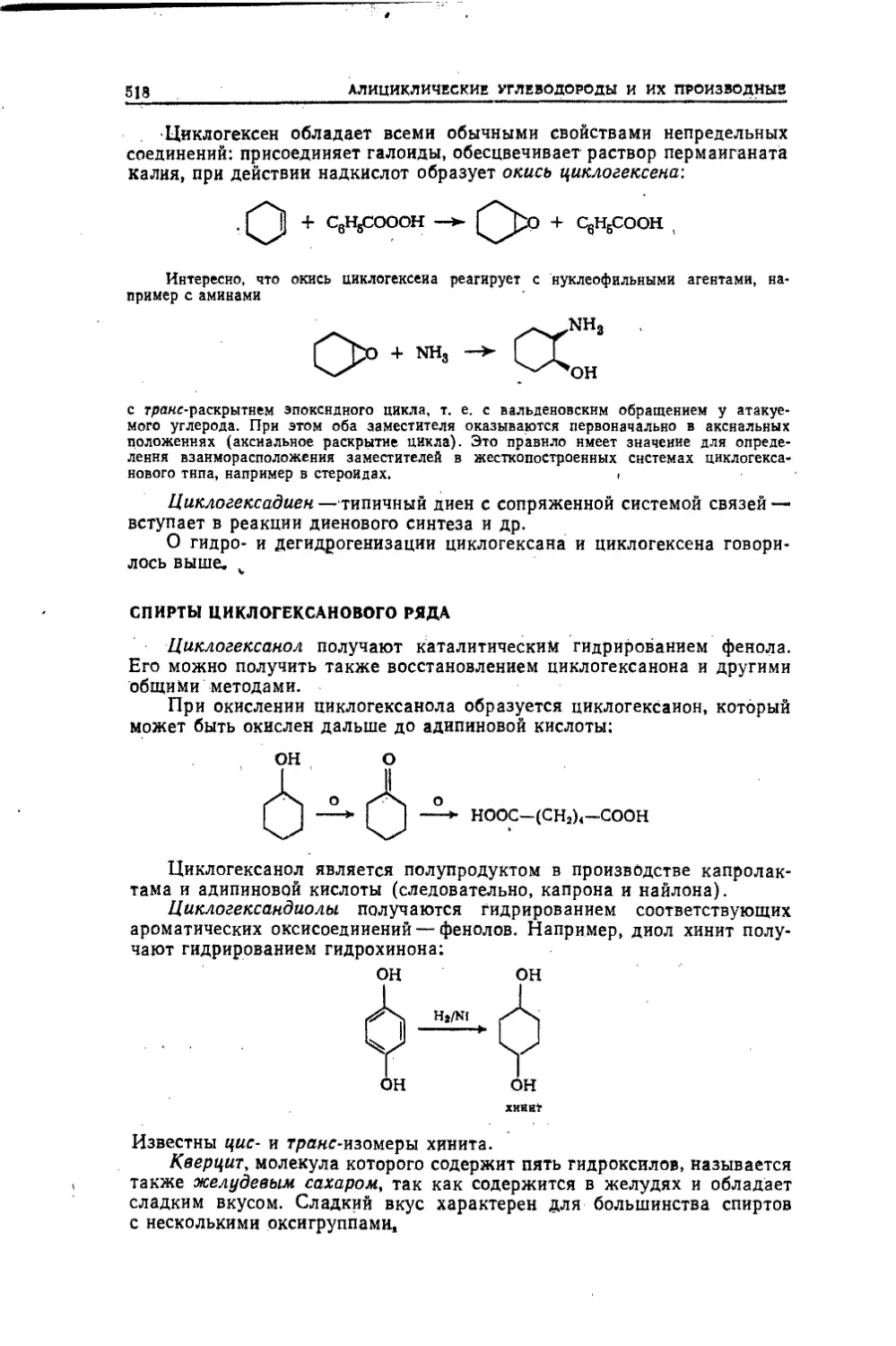
химических специальностей университетов. Первая часть руковод¬
ства построена по «классической схеме», вторая часть предназна¬
чена скорее для внимательного прочтения, чем для глубокого изу¬
чения.В книгу I вошли разделы первой части — введение, алифати¬
ческие и алициклические соединения. Материал изложен в порядке
нарастающей трудности—вначале достаточно просто и подробно,
затем все более лаконично. Данное руководство является вторым,
переработанным изданием. Первое издание было выпущено в
1969 г.«Начала органической химии» могут служить как для самостоя¬
тельного знакомства с'предметом, так и для изучения его в уни¬
верситетах и химических вузах. Книга будет, несомненно, интерес¬
на и для аспирантов, преподавателей, молодых ученых и инжене¬
ров, работающих в области органической химии.„ 20504-038"оэдИн?38-74 547© Издательство «Химия», 1974
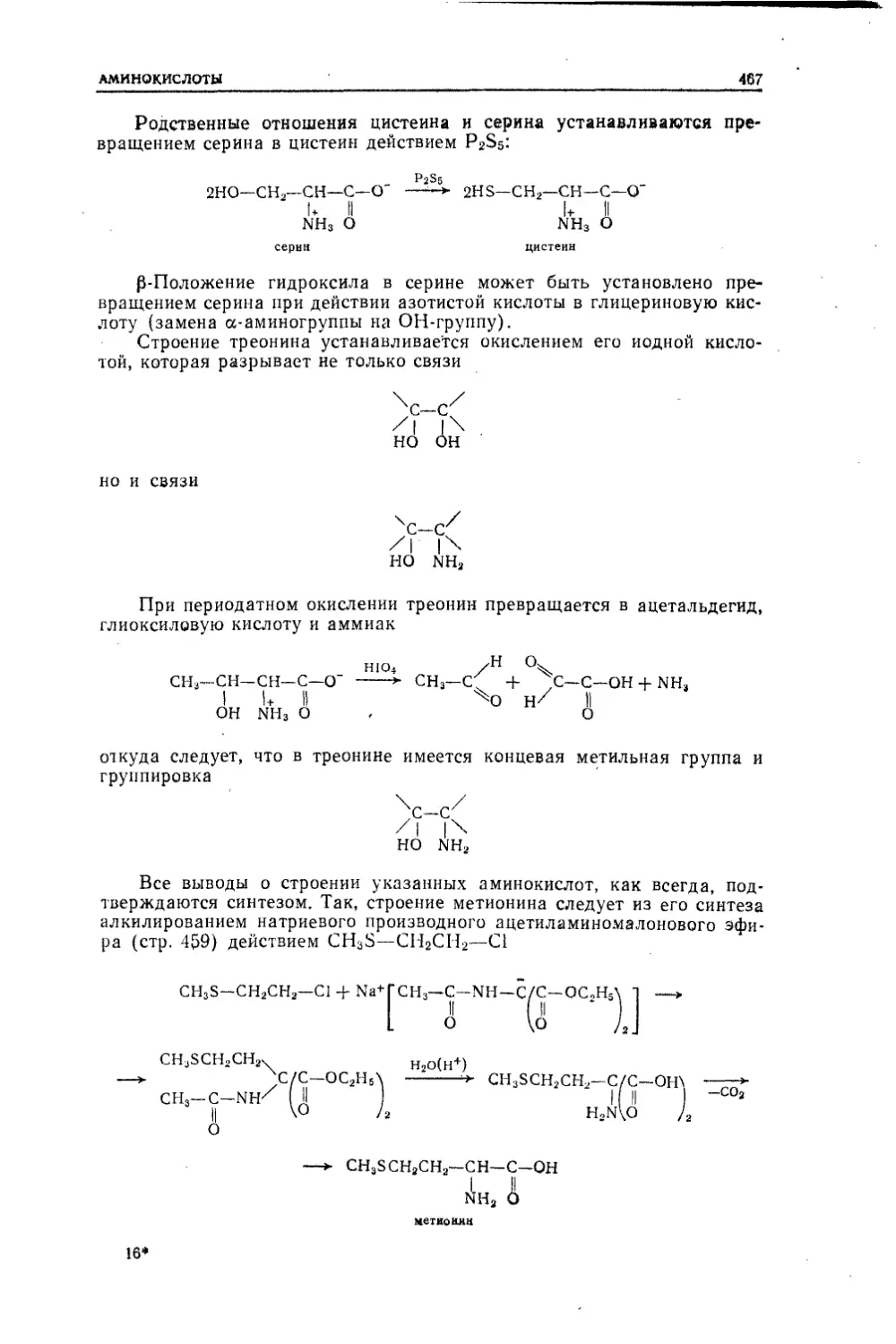
ПРЕДИСЛОВИЕДанный курс органической химии предназначен для химиче¬
ских факультетов университетов и химических вузов. Он
основан на лекциях, которые один из нас читал для студен-
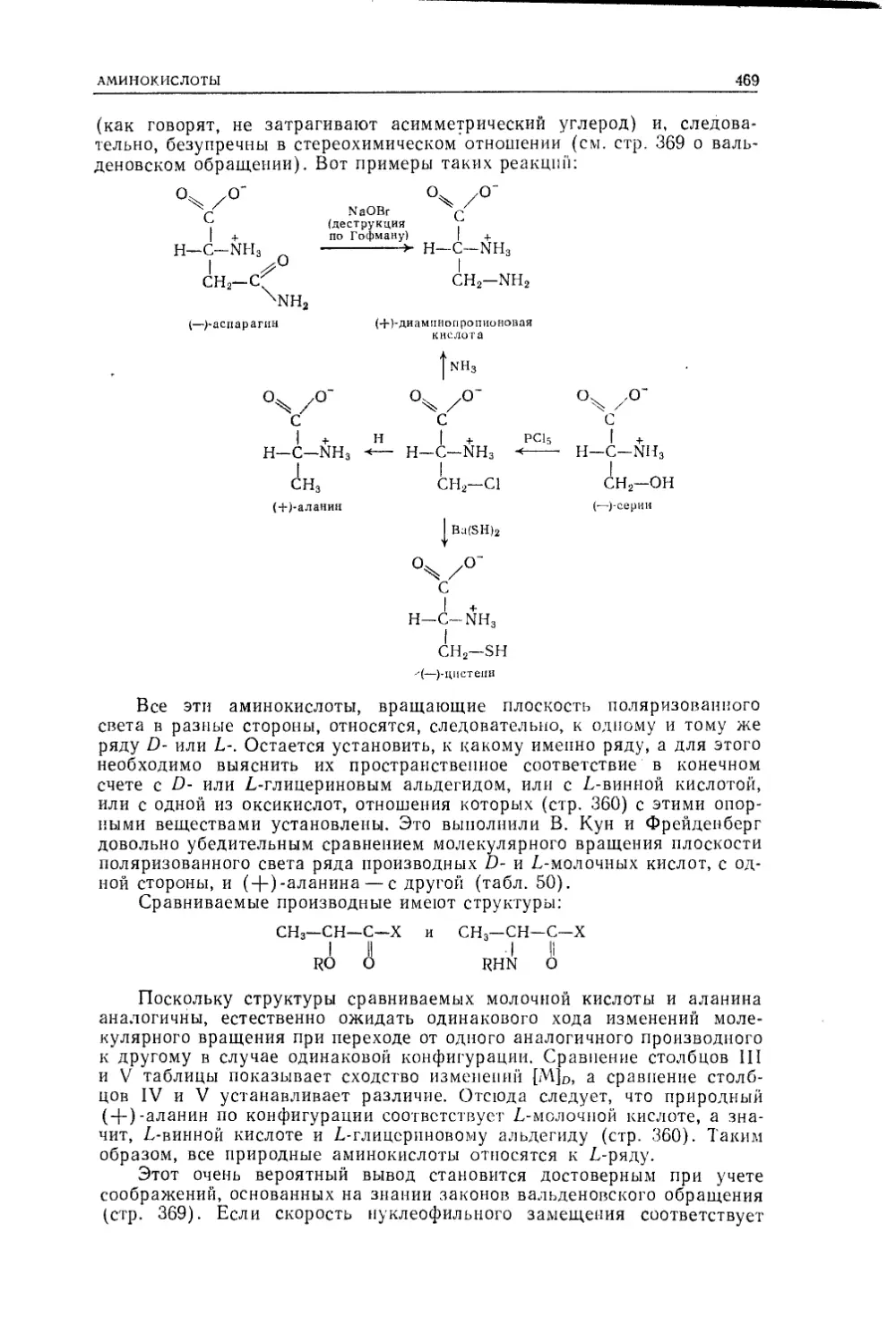
тов-химиков Московского университета, и включает элементы
материала теоретических основ органической химии — лек¬
ционного курса, который в МГУ читают акад. О. А. Реутов
и второй из авторов этой книги. Этим определяется порядок
изложения материала, более близкий к привычному класси¬
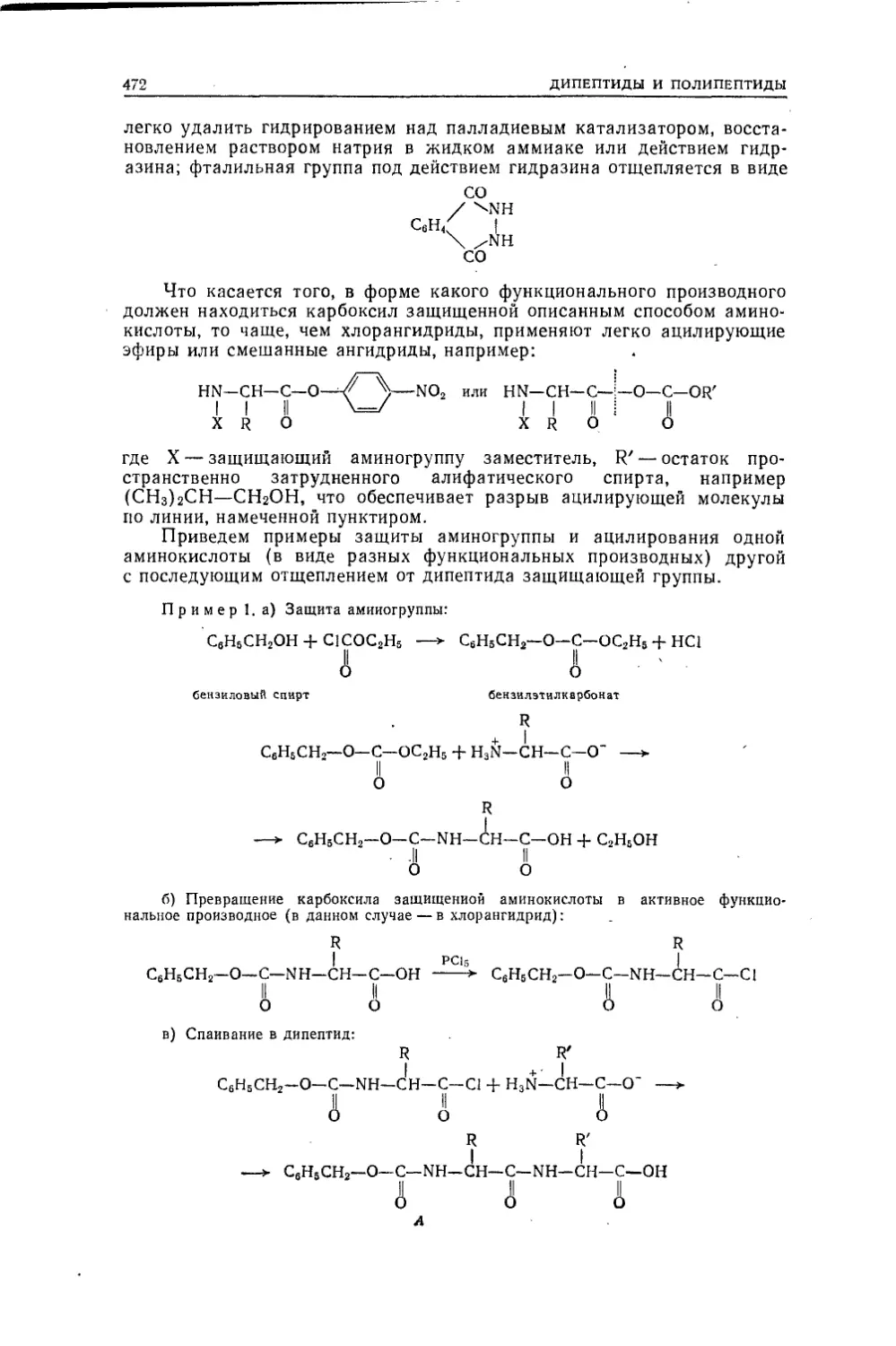
ческому, чем к принятому во многих новых курсах — Нени-.
цеску, Робертса и Касерио, Крама и Хэммонда и др. Этот
привычный порядок — введение (с элементами истории орга¬
нической химии и развития основных понятий, с методами ин¬
дивидуализации, анализа, определения молекулярной фор¬
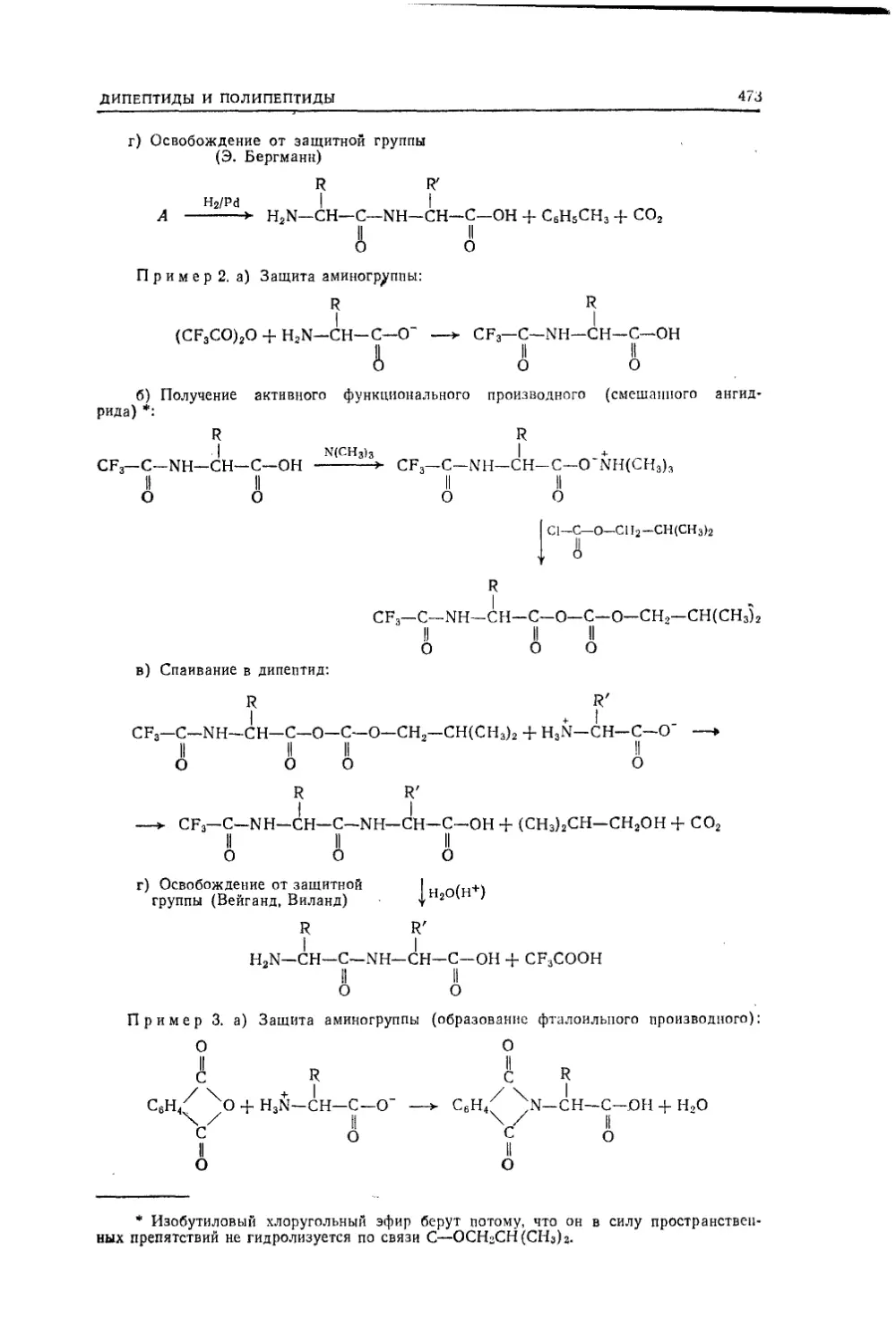
мулы, теорией строения), затем систематическое изложение
материала в последовательности: алифатический ряд, али-
циклы, ароматический ряд, гетероциклы. Все это составляет
первую, большую по объему, часть книги.Теоретические разделы—элементы учения о химической
реакции, учение о химической связи, классическая стереохи¬
мия и динамическая стереохимия, конформация — вкраплены
отдельными разделами в те места курса, где они необходимы
и где уже накопился материал для усвоения этих разделов.Также мы поступили и с физическими методами иссле¬
дования органических веществ.Такой порядок, по нашему убеждению и опыту, позволяет
осуществить менее крутой подъем на высоты органической
химии.Все изложенное составляет часть I курса, которую мы
рассматриваем как обязательную для усвоения. Часть II,
почти вдвое меньшая по объему, чем первая, и потому поме¬
щенная в одну книгу с ароматическим рядом, написана го¬
раздо более концентрированно и труднее для учащегося. Она
состоит из отдельных разделов, частично обобщающих и раз¬
вивающих понятия, связанные с механизмом реакций, которые
6ПРЕДИСЛОВИЕв более элементарном виде были вкраплены в материал ча¬
сти I. Это — разделы, посвященные карбанионам, свободным
радикалам, карбенам, карбкатионам, перегруппировкам, эли¬
минации, переходному состоянию. Кроме того, в часть II во¬
шли более сложные разделы систематической органической
химии, такие, как элементоорганические соединения, небен-
зоидная ароматика, изопреноиды, включая терпены и сте¬
роиды, алкалоиды, белки, ферменты, нуклеиновые кислоты.
Самое первоначальное понятие о металлоорганических соеди¬
нениях, изопреноидах, алкалоидах, белках имеется и в ча¬
сти I курса.Мы считаем, что все это — материал, обязательный для
внимательного прочтения й получения общего представления,
но не обязательный для усвоения студентом-химиком. Опыт
показывает, что основательное усвоение этих разделов систе¬
матической органической химии все равно не достигается
в общем курсе. Специализирующиеся по органической химии
смогут глубже усвоить этот материал уже на старших курсах.Таким образом, объем обязательной части курса не так
велик, тем более что мы не боялись в нем некоторых повто¬
рений (на новой расширенной основе), облегчающих труд
студента.Оба автора участвовали в написании всех главных раз¬
делов и обеих частей книги. Наша работа вряд ли могла бы
быть выполнена, если бы не широкая помощь товарищей,
которым мы приносим глубокую благодарность за их немалый
труд.Он выразился в том, что проф. Д. А. Бочвар написал
главу, посвященную современной теории химической связи,
проф. А. И. Китайгородский — главу о дифракционных мето¬
дах структурного анализа, акад. М. И. Кабачник, чл.-корр.
Н. К. Кочетков, акад. В. А. Энгельгардт, акад. А. Е. Браун-
штейн, проф. М. М. Ботвинник, проф. 3. А. Шабарова, заве¬
дующие лабораториями ИНЭОС доктора наук В. Т. Алекса¬
нян и Э. И. Федин прочли отдельные разделы книги, внесли
ряд ценных исправлений и сделали много критических заме¬
чаний, принятых во внимание авторами при дальнейшей ра¬
боте.Акад. М. М. Шемякин, проф. Н. С. Вульфсон, чл.-корр.
Н. К. Кочетков, доценты Ю. А. Арбузов, Ю. А. Устынюк снаб¬
дили нас некоторыми данными, вошедшими в книгу. Принося
нашу горячую благодарность, мы никоим образом не хотим
сделать всех товарищей, вложивших тот или иной вклад в
нашу книгу, в какой-либо мере ответственными за нее в це¬
лом, тем более что сознаем, как много недостатков и недоде¬
лок содержит наша книга несмотря на немалый труд, на нее
потраченный.
ПРЕДИСЛОВИЕ7Стоило ли предпринимать издание этого курса после
появления прекрасных книг Робертса и Касерио, Крама, Не-
ницеску, переведенных и изданных у нас? Ответ на это со¬
стоит, прежде всего, в том, что наша книга пишется уже
более шести лет и, следовательно, начата задолго до появле¬
ния у нас этих переводных книг. Во-вторых, каждая из этих
книг по ряду причин мало приспособлена для нашего сту¬
дента, прежде всего по объему. Великолепная монография
Неницеску слишком обширна. Книга Крама не содержит
всего необходимого в соответствии с нашими программами
материала и в то же время в известной мере трудна. Учебник
Робертса и Касерио в этом отношении ближе к нашим требо¬
ваниям и прельщает систематическим и глубоким использо¬
ванием физических методов исследования органического ве¬
щества. Однако обе последние книги написаны внеисторично,
что представляется нам крупным недостатком учебника, и
авторы их мало знакомят читателя (если вообще знакомят)
с весьма значительным вкладом русских химиков в органи¬
ческую химию.За неоценимую помощь в технической работе над руко¬
писью наша горячая благодарность М. А. Виноградовой,
Э. И. Кан и В. А. Венцковской.АВТОРЫ
КНИГА IЧАСТЬ ПЕРВАЯВведениеАциклические соединения
Предельные соединения
Непредельные соединения
Гетерофункциональные соединения
Алициклические соединенияАлициклические углеводороды и их производныеКНИГА IIАроматические соединения
Бензол и его производные
Многоядерные ароматические соединения
Гетероциклические соединенияЧАСТЬ ВТОРАЯЭлементоорганические соединенияНебензоидные ароматические системыКарбанионыСвободные радикалыКарбеныКарбониевые ионы (карбкатионы)Механизмы химических реакций
Реакция элиминации
Перегруппировки
ИзопреноидыАлкалоиды гетероциклического ряда
Белки (протеины)Нуклеотиды и полинуклеотиды. Синтез белка в организме
Ферменты
ЧастьПЕРВАЯ
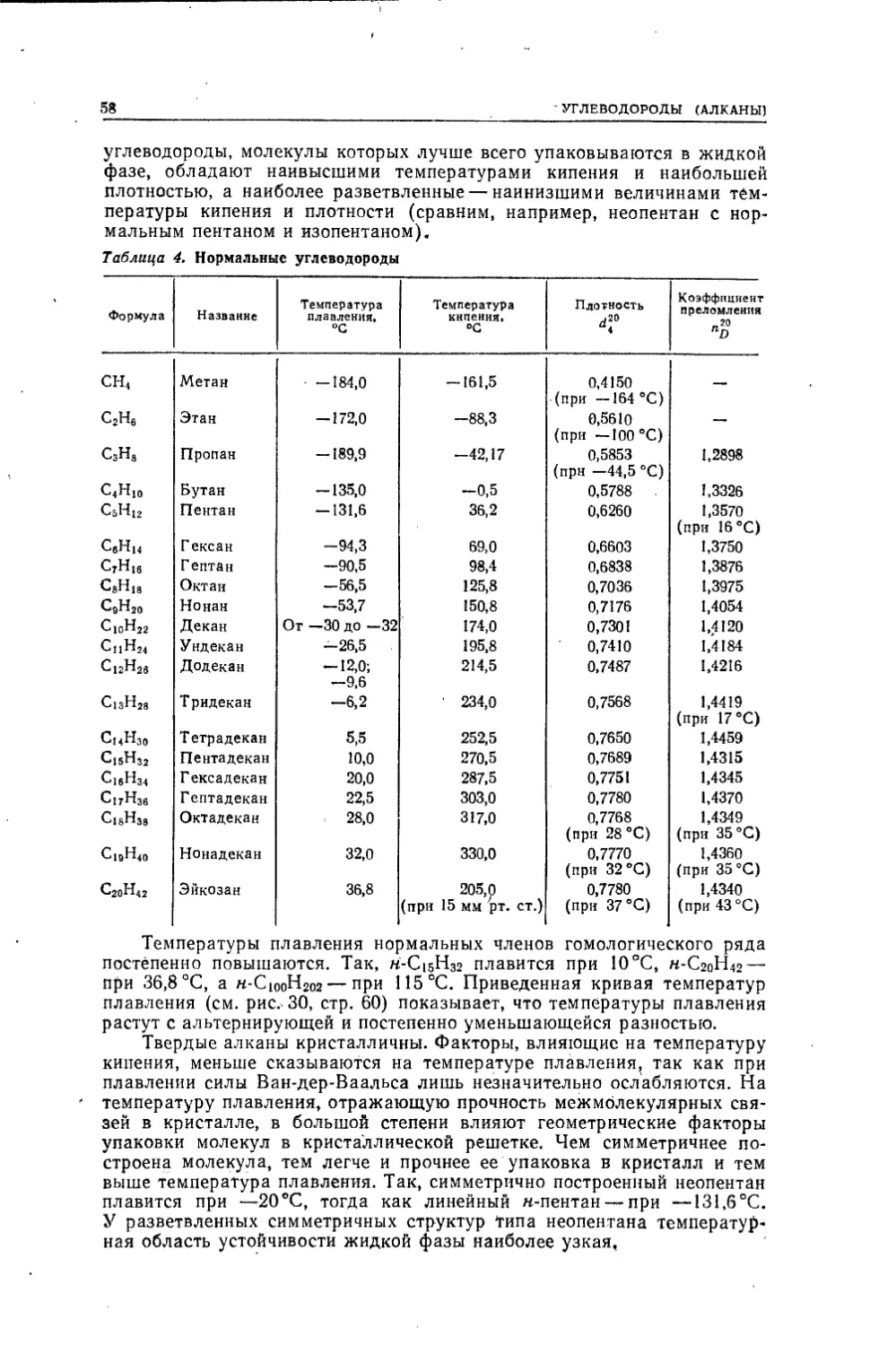
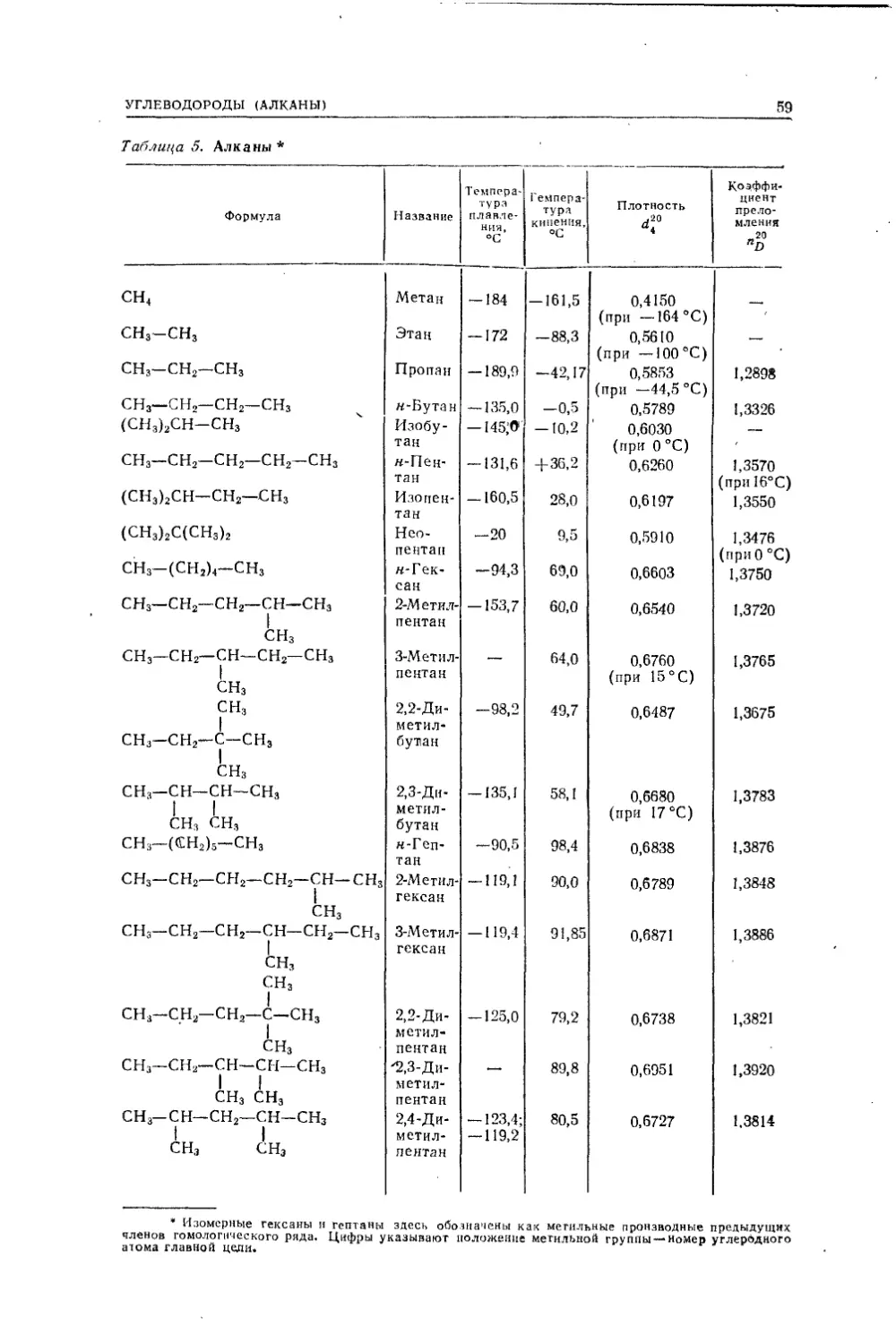
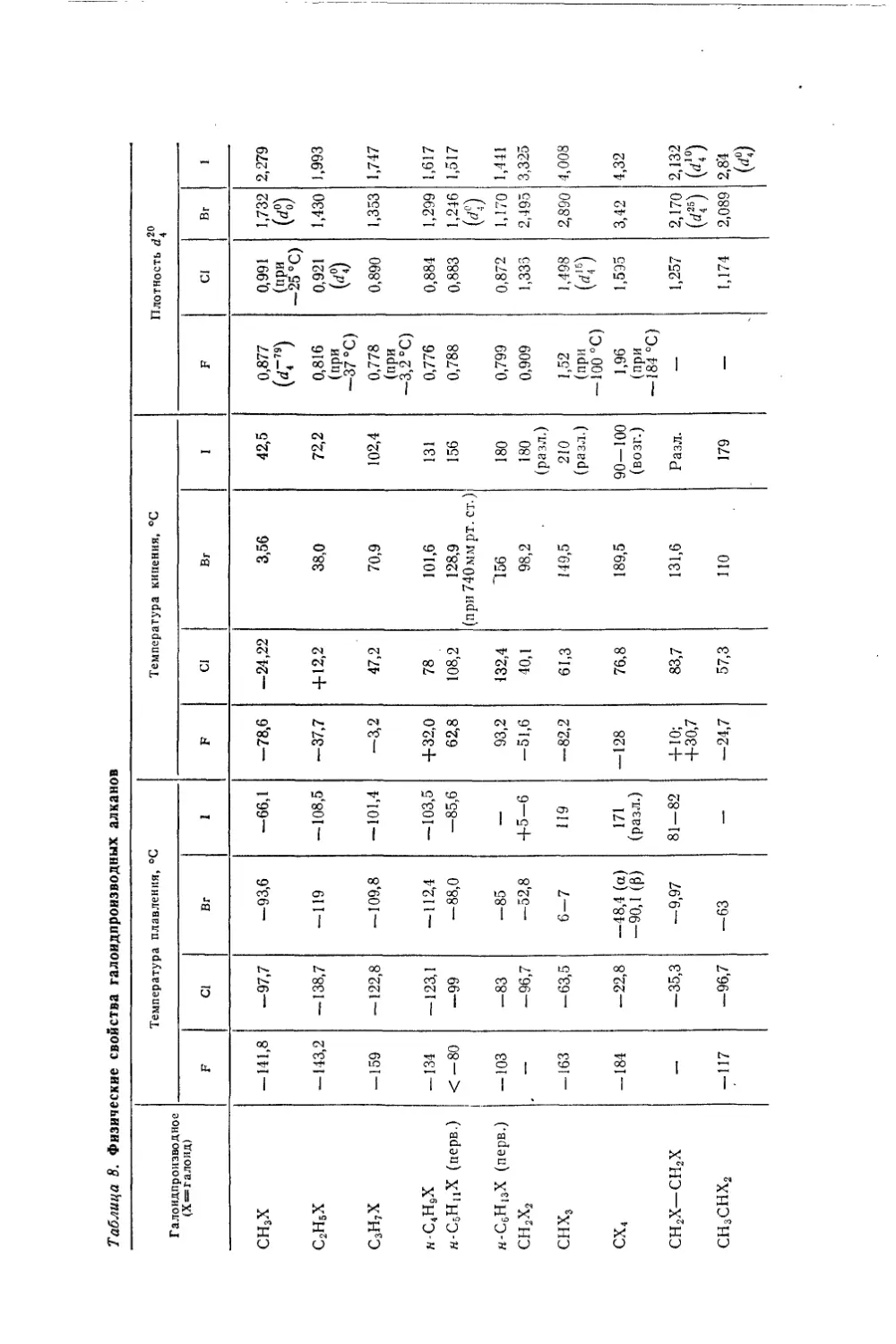
ВВЕДЕНИЕПРЕДМЕТ ОРГАНИЧЕСКОЙ ХИМИИ. ИСТОРИЧЕСКИЙ ОБЗОРОсновным объектом изучения химии являются химические индиви¬
дуумы— химические соединения и их превращения. Обособившаяся
ветвь химической науки — органическая химия изучает соединения
углерода с другими элементами. Особенно большое число соединений
углерод образует с элементами органогенами — Н, О, N, S, Р, галоида¬
ми. Эти соединения шире распространены в природе и большее число
их изучено и получено искусственно — синтезом.Некоторые органические соединения в более или менее чистом со¬
стоянии известны человеку с незапамятных времен (уксус — водный
раствор уксусной кислоты, многие органические красители). Ряд'орга¬
нических соединений, как, например, мочевина, этиловый эфир («серный
эфир»), были получены еще алхимиками. Очень многие вещества, осо¬
бенно органические кислоты (щавелевая, лимонная, молочная и др.)
и органические основания (алкалоиды), были выделены из растений и
объектов животного происхождения во второй половине XVIII века и
первых годах XIX века. Это время и следует считать началом научной
органической химии, соответствовавшей двум последним ветвям тогдаш¬
ней химии, разделявшейся на минеральную химию, химию растений и
жив'отных (название «органическая химия» возникло позднее).В XVIII веке и в первой четверти XIX века господствовало убежде¬
ние, что химия живой природы принципиально отлична от химии мерт¬
вой природы (минеральной химии) и что организмы строят свои веще¬
ства с участием особой жизненной силы (виталистические воззрения),
без которой искусственно, в колбе, их создать нельзя. Поскольку с на¬
чала XIX века стало обнаруживаться все больше веществ, общих для
мира животных и мира растений (начиная от кислот, таких, как щаве¬
левая и муравьиная, кончая жирами и белками), грани между химией
растений и животных постепенно стирались. Когда стало ясно, что хи¬
мия растений и химия животных должны быть слиты, образовавшуюся
ветвь химической науки стали называть органической химией. Этим
слиянием мы обязаны замечательному шведскому химику Берцелиусу
(1779—1848 гг.). Вслед за Лавуазье он широко использовал в своих
исследованиях количественный анализ, открыл ряд новых элементов,
установил атомные веса многих элементов, обнаружил явление изоме¬
рии и создал дуалистическую электрохимическую теорию.К органической химии были отнесены не только вещества, непо¬
средственно выделяемые из объектов растительного или животного
происхождения (которые, по убеждению того времени, нельзя было
получить синтезом), но и продукты их химического преобразования.
В 1824 г. немецкий химик Велер гидролизом дициаиа, считавшегося
представителем минеральной химии, получил щавелевую кислоту, от¬
носившуюся к органическим веществам. Критической датой считается,
12ВВЕДЕНИЕоднако, 1828 г., когда тот же Велер осуществил превращение «неорга¬
нического» циановокислого аммония в хорошо известное органическое
вещество — мочевину:NH4CNO —► NHa—СО—NH2Именно это открытие проломило брешь в стене предубеждений,
разделявших органическую и минеральную химию, и убедило химиков,
что и органические вещества могут быть получены искусственно, без
участия гипотетической жизненной'силы. Насколько прочно все же
держалось это предубеждение, следует из высказывания французского
химика Жерара, установившего некоторые основные понятия органиче¬
ской химии, например понятие гомологии, и являющегося одним из
авторов закона Авогадро — Жерара. Жерар в 1842 г., когда многие
простые органические соединения бьщи у>^е получены искусственным
путем, высказал мнение, что синтез столь сложного вещества, как сахар,
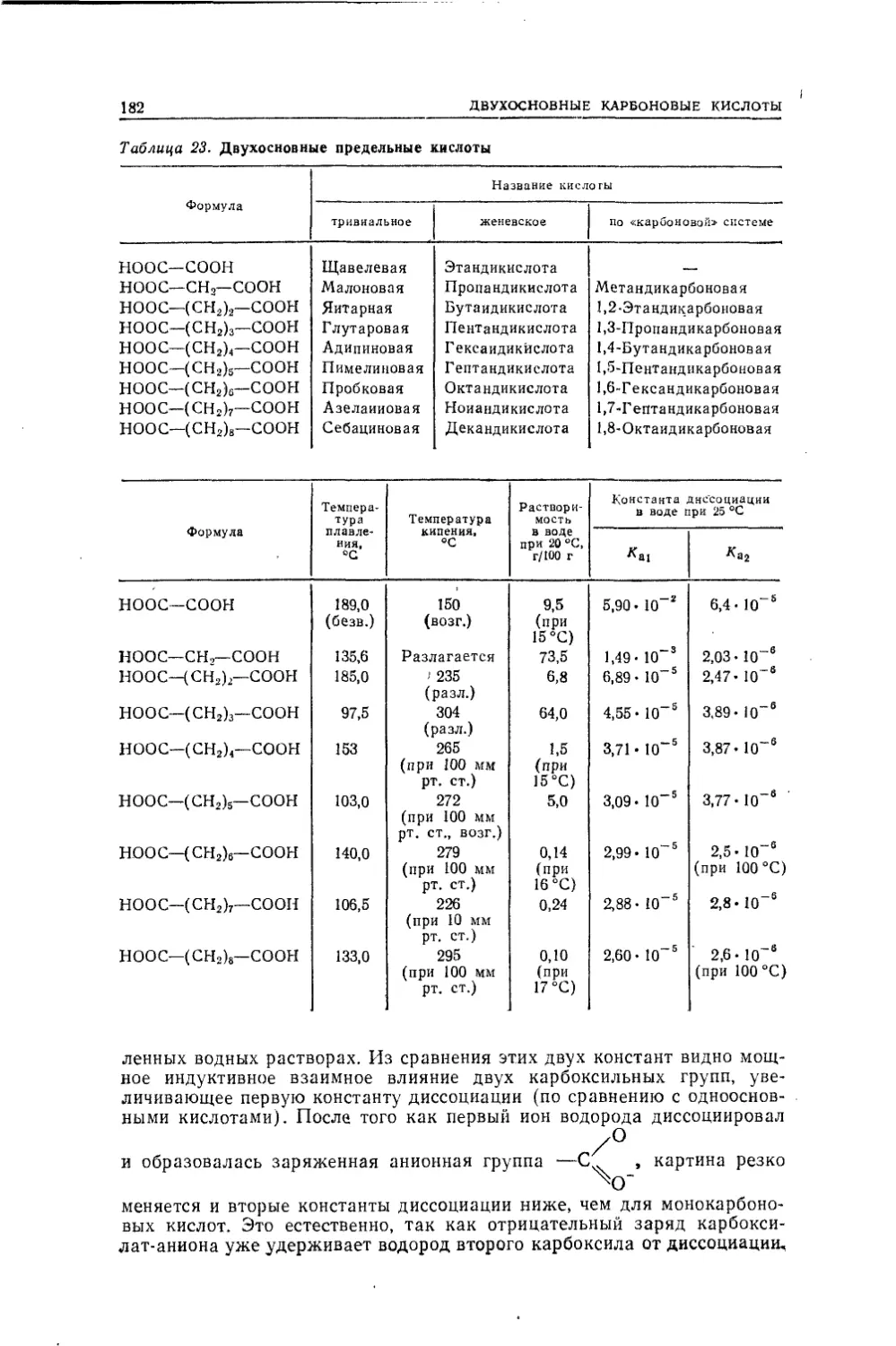
никогда не сможет быть осуществлен. Это скептическое предсказание
было опровергнуто в 1861 г., когда Д. М. Бутлеров впервые получил
синтетически сахаристые вещества (из формалина). Наряду с этим
быстро росло число индивидуализированных углеродсодержащих ве¬
ществ, не встречающихся в природе. Так, в 1825 г. Фарадей получил
бензол, еще ранее стали известны этилен, бромистый этилен, а также
ряд производных бензола. В 1842 г. Зинин из нитробензола получил
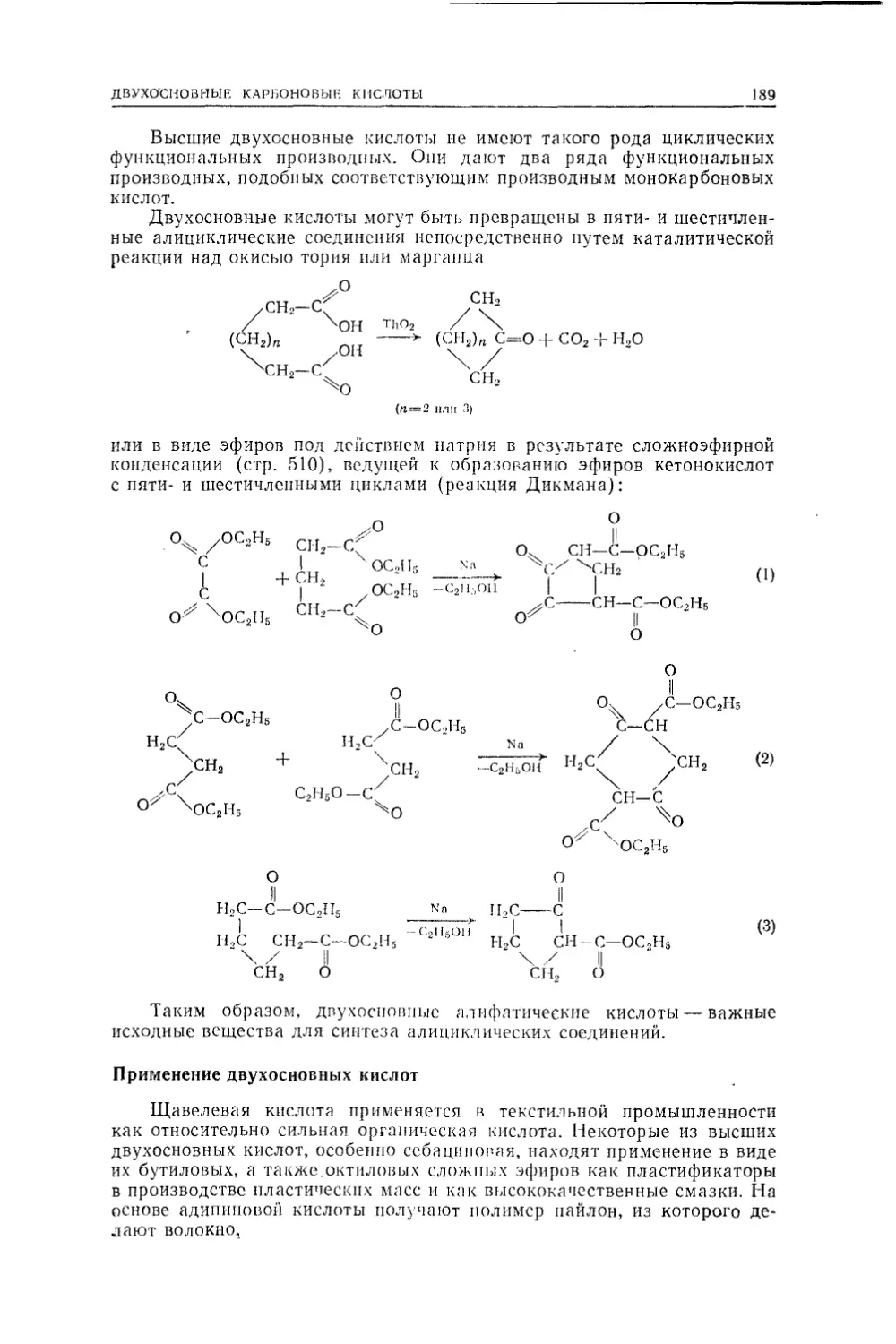
анилин, а в 50-х годах того же столетия из анилина были синтезиро¬
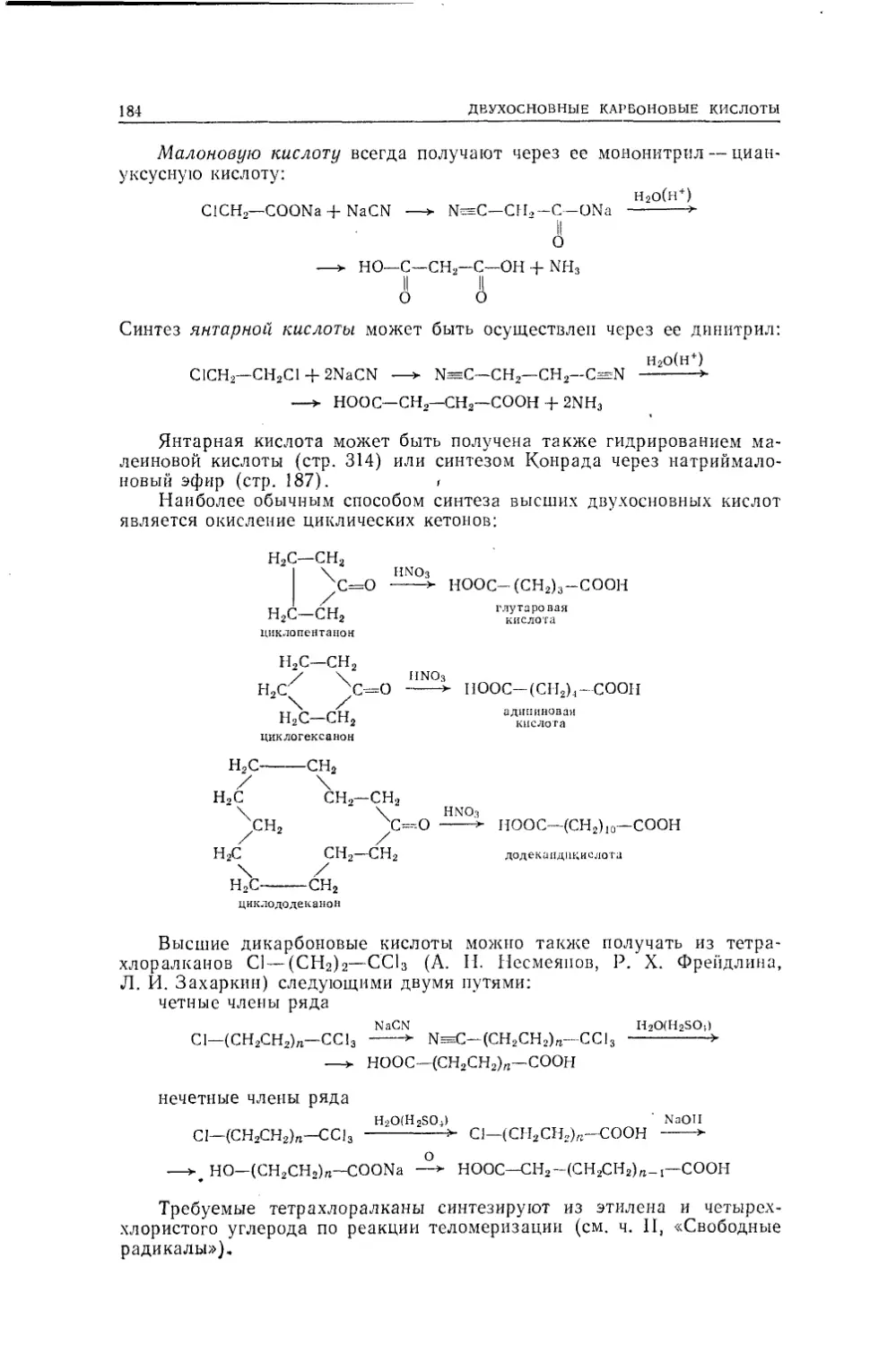
ваны первые «анилиновые красители» — мовеин Перкина и фуксин.Уже в 30-х годах прошлого века стало ясно, что для органической
химии нужно искать иное- определение, чем химия веществ органиче¬
ского происхождения. Тогда Гмелиным было дано определение органи¬
ческой химии как химии соединений углерода, принятое и в настоящее
время.При таком определении органической химии возникает, однако,
вопрос, почему же из всей сотни известных элементов именно углерод
имеет такое преимущественное положение? Что это особое положение
закономерно, ясно из сопоставления некоторых фактов из областей
органической и неорганической химии. Прежде всего число известных
в настоящее время соединений углерода примерно в 10—20 раз больше
числа соединений всех остальных элементов, образованных без участия
углерода. Но даже 1—2 миллиона изученных в настоящее время орга¬
нических соединений никак не исчерпывают безграничных возможностей
конструирования органических молекул.В органической химии чрезвычайно важное значение имеет откры¬
тое Берцелиусом явление изомерии, общее для всей химии, но широчай¬
шим образом распространенное именно в органической химии. Явление
это состоит в том, что может существовать несколько (а в органической
химии — много) отличных друг от друга веществ, имеющих один и тот
же состав и один и тот же молекулярный вес, но различающихся по¬
строением молекулы из одного и того же набора атомов. Среди простых
соединений неорганической химии привести случай изомерии не так
легко (изомерами, например, являются кислый сернокислый аммоний
NH4HSO4 и бисульфит гидроксиламина NH3OHSO3H). Но в органиче¬
ской химии, даже в веществах простейшего состава, образованных толь¬
ко из углерода и водорода, явление изомерии приводит к существованию
огромного числа различных химических индивидуумов. Достаточно ука¬
зать, что составу С20Н42 должно соответствовать 366 319 разных химиче¬
ских индивидуумов — углеводородов, изомерных друг другу, а составу
СзоН62 — 4 111 846768 разных веществ, что в тысячи раз превышает
число известных органических соединений.
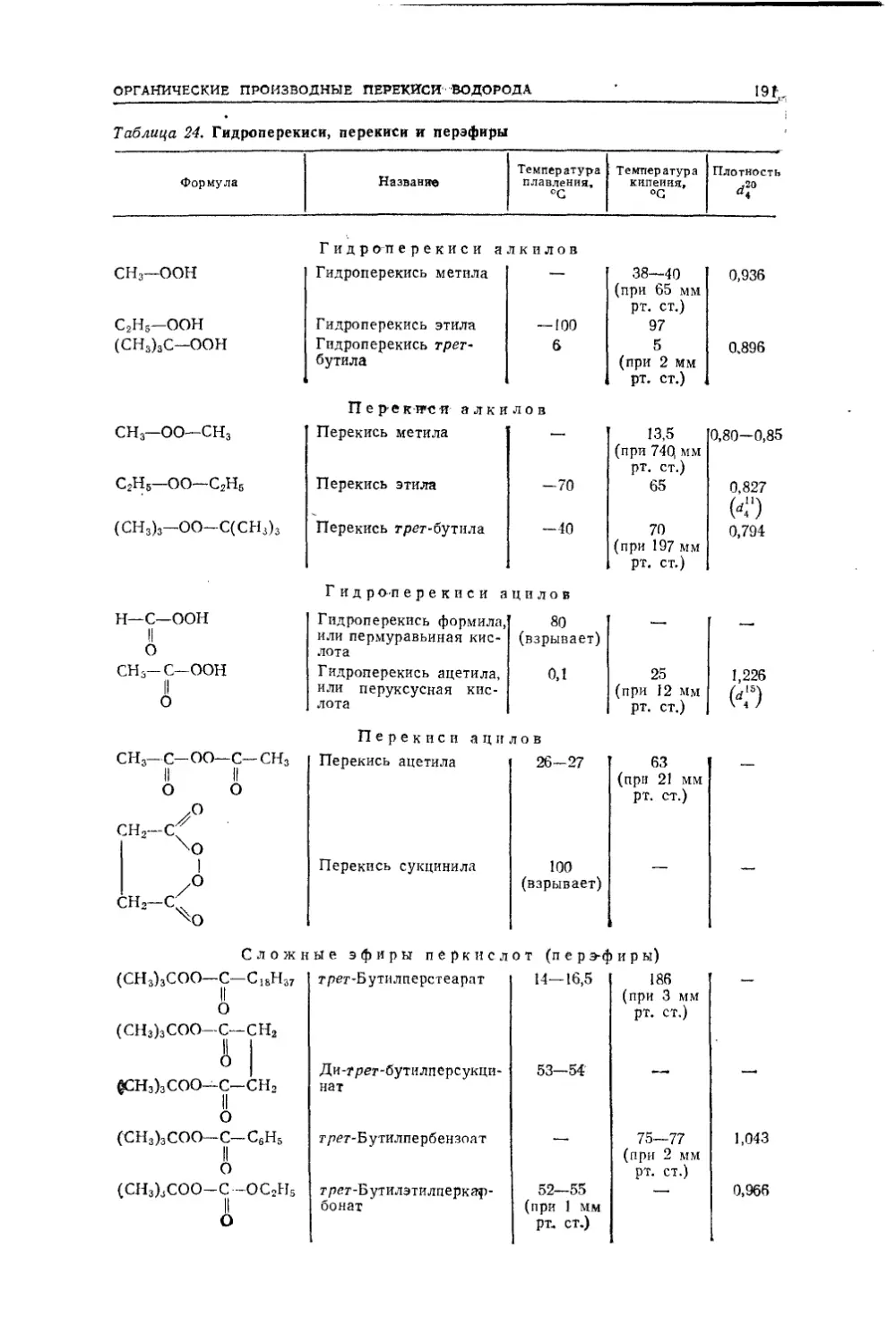
ПРЕДМЕТ ОРГАНИЧЕСКОЙ ХИМИИJ3Вторым фактором, обеспечивающим огромное число органических
соединений, служит установленное Жераром явление гомологии. Оно
состоит в существовании химически сходных между собой рядов ве¬
ществ, состав последовательных членов которых разнится друг от друга
на группу СН2 — гомологическую разность.Третий фактор — это существование изологических рядов соедине¬
ний, т. е. рядов веществ, построенных из того же числа углеродных
атомов, но отличающихся по составу таким образом, что каждый сле¬
дующий член содержит на два атома водорода меньше, чем предыдущий
(например, этан СгНб, этилен С2Н4, ацетилен СгН2). Даже для углево¬
дородов, простейших по составу органических соединений, благодаря
этим факторам имеются строго систематизированные ряды, образующие
в принципе безграничное множество веществ.Добавим к этому, что все кислородные, азотсодержащие и другие
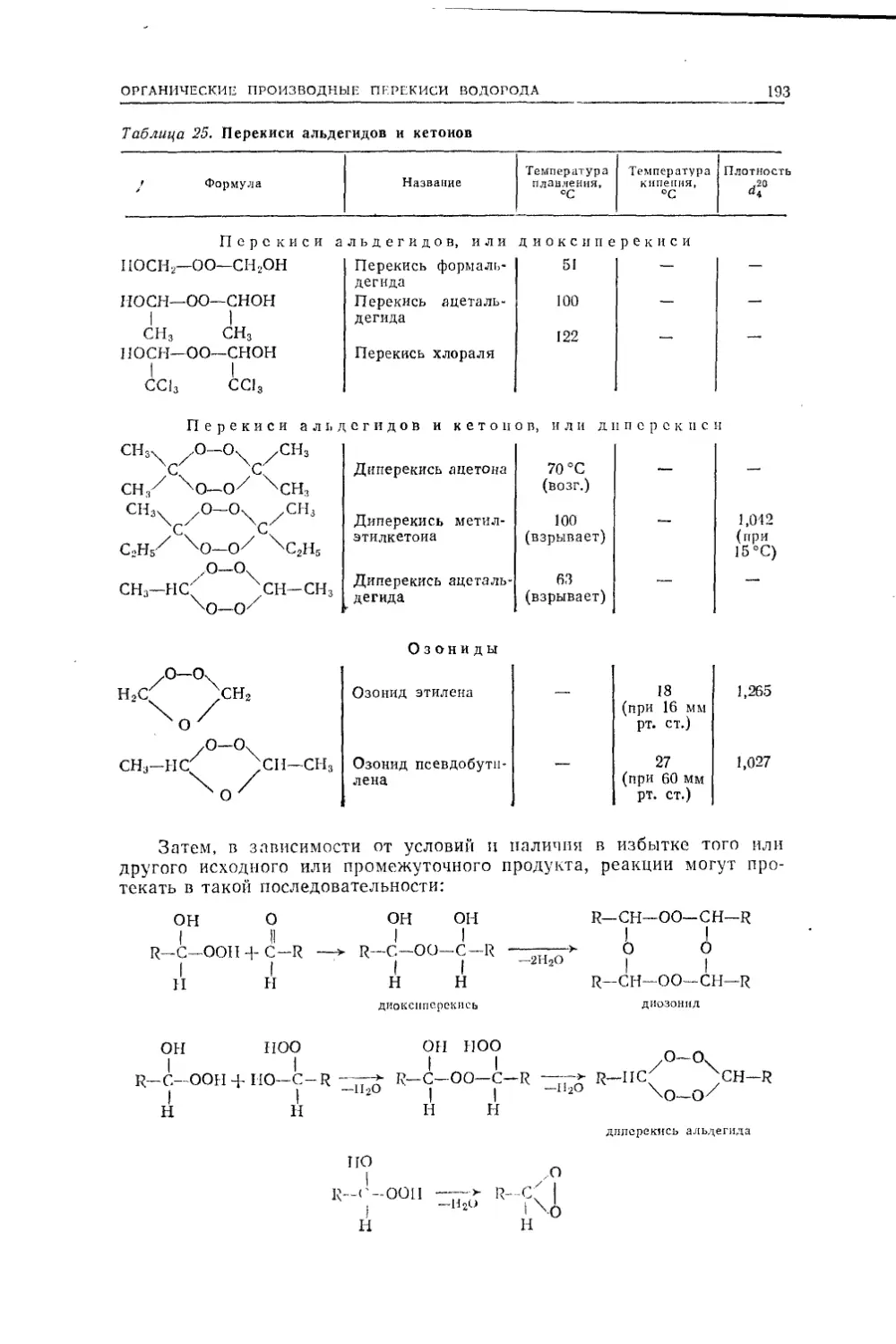
органические соединения могут рассматриваться как вещества, родствен¬
ные каждому определенному углеводороду. Можно представить себе,
что они происходят из соответствующего углеводорода путем замещения
одного или нескольких его водородных атюмов на группировки, содер¬
жащие атомы кислорода, азота и т. д. Это обстоятельство позволило
Шорлеммеру дать определение органической химии как химии углеводо¬
родов и их производных.Если в неорганической химии явление изомерии встречается крайне
редко, то гомология и изология ей вовсе не присущи. Какова же при¬
чина такого различия? Для того чтобы лучше понять эту причину, по¬
лезно вкратце рассмотреть, как она постепенно выявлялась в истории
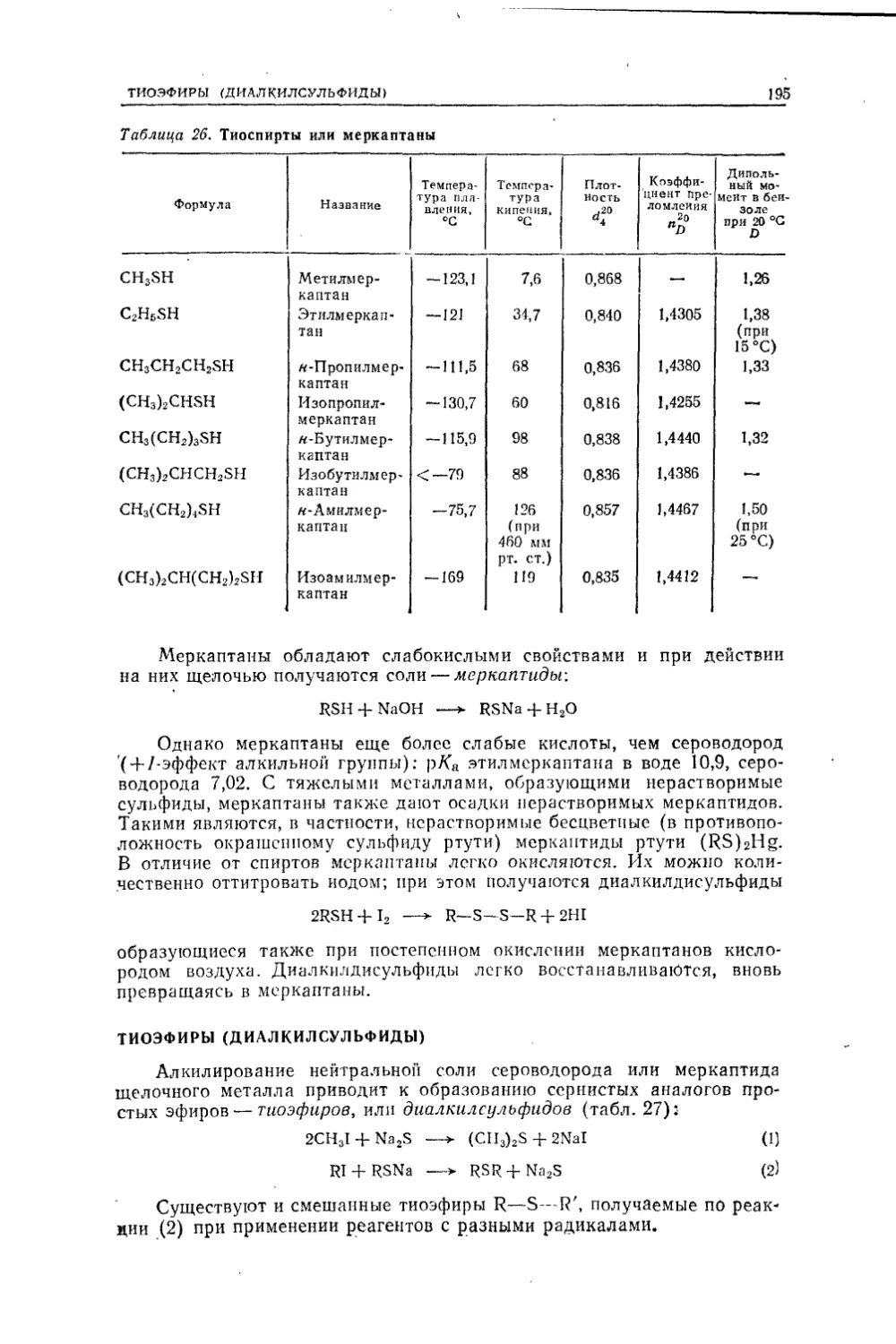
науки.. В 90-х годах XVIII века Лавуазье вскрыл важную роль незадолго
перед тем открытого кислорода. Рассматривая вещества, содержащие
кислород (окислы), он обозначал остальную часть окисла как основа¬
ние или радикал. Окислы делились на основные и кислотные, образую¬
щие при взаимодействии соли. Берцелиус, принимая во внимание уста¬
новленную в то время связь между химическими и электрическими яв¬
лениями (открытие вольтова столба, генерировавшего электричество за
счет химической реакции, использование Дэви этого химического
источника тока для разложения солей, установление Фарадеем законов
электролиза), развил ставшую знаменитой электрохимическую теорию,
химического сродства (дуалистическая теория). По Берцелиусу, атом
элемента соединяется с кислородом вследствие того, что он электропо¬
ложителен, а кислород электроотрицателен; при соединении заряды
нейтрализуются. Однако эта нейтрализация не полная: вследствие боль¬
шей заряженности металла по сравнению с кислородом в основных
окислах остается общий итоговый положительный заряд, а в кислых
окислах — отрицательный. Поэтому основные и кислотные окислы со¬
единяются между собой, образуя соли. Таким образом, «сернокислый
натрий состоит не из серы, кислорода и натрия, цо из серной кислоты
и едкого натра, каждый из которых в свою очередь может быть разло¬
жен на электроположительную и электроотрицательную часть» (Берце¬
лиус). В грубой форме дуалистическая теория предвосхищала ионную
теорию другого шведского ученого — Аррениуса (1887 г.).Берцелиус считал, что его теория приложима и к органической хи¬
мии, с той разницей, что в органических соединениях радикалы в окис¬
лах сложные, например углеводородные (а не элементы).Общее признание такой точки зрения было поколеблено, когда
французский химик Дюма открыл реакцию металепсии. При действии
хлора на органические соединения хлор вступает в вещество так, что на
каждый вступивший эквивалент хлора из вещества удаляется один
14ВВЕДЕНИЕэквивалент водорода в виде хлористого водорода. При этом химический
характер соединения существенно не изменяется, например при хлори¬
ровании уксусной кислоты последовательно получаются монохлоруксус-
ная, дихлоруксусная и трихлоруксусная кислоты — такие же однооснов¬
ные кислоты, как и уксусная. Это дало право Лорану утверждать
(1835 г.), что хлор, входя в результате реакции металепсии в вещество,
занимает то место, которое занимал водород. Тем самым начинала осо¬
знаваться определяющая роль расположения атомов в молекуле: важно
не качество атомов в молекуле, а тип соединения.Такова была старая теория типов Лорана. Противоречие с теорией
Берцелиуса, столь удовлетворявшей фактам неорганической химии (хи¬
мии кислот, оснований и солей, т. е. химии электролитов), было рази¬
тельным: хлор — «отрицательно заряженный элемент» — входил на ме¬
сто положительно заряженного водорода, и молекула не только сохра¬
нялась, но и не изменялся ее химический характер. Далее выяснилось,
что хлор не является исключением. Оказалось возможным заменять
водород (прямо или обходным путем) на другие галоиды и электроотри¬
цательные элементы — кислород, серу и т. д., и электрохимическая дуа¬
листическая теория Берцелиуса рухнула. Преобладающей стала «уни¬
тарная» точка зрения. Еще раньше радикалы постепенно стали рассмат¬
ривать как неизменные составные части органических веществ (подоб¬
ные элементам в неорганических соединениях), которые переходят в
реакциях из одного соединения в другое. Многие исследования, особенно
немецкой школы (Велер, Либих), вдохновленные открытием серии новых
элементов, направлялись идеей отыскания новых радикалов. Такими
неизменными, переходящими из соединения в соединение радикалами
оказывались во многих случаях кислородсодержащие образования, на¬
пример радикал бензоил C6HsCO или С7Н5О (фигурировавший в бензой¬
ной кислоте С6Н5СООН, хлористом бензоиле СбНбСОО, бензальдегиде
С8Н5СНО и т. д.) и радикал ацетил СН3СО или С2Н30. Берцелиус оспа¬
ривал включение кислорода в радикал, считая это бессмыслицей и с
позиции существовавшего тогда понятия о радикале как части вещества,
соединенной с кислородом (Лавуазье), и с позиций электрохимической
теории. Он предлагал, например, считать радикалом бензойной кислоты
остаток С7Н5, а радикалом уксусной кислоты С2Н3. Однако более пра¬
вильным оказалось определение радикала как неизменной в реакциях
части соединения, данное немецкой школой химиков. Кислород перехо¬
дил из соединения в соединение вместе с остальной частью радикала,
очевидно составляя с ней одно целое. Вместе с тем в нахождении кис¬
лорода, а также хлора и др. в радикале (на месте водорода!) были
заложены зерна унитарной теории.Многочисленные попытки выделить радикалы в свободном состоя¬
нии оказывались неудачными или приводили к ошибочным результатам.
Так, до установления закона Авогадро — Жерара этан, выделенный по
реакции Вюрца2CH3Br + 2Na —»- СН3—СН3 + 2NaBrсчитался сначала радикалом — метилом СНз и лишь последующее опре¬
деление молекулярного веса показало его удвоенную величину. Кроме
того, все очевиднее становилось, что неизменных радикалов не суще¬
ствует и что в одних реакциях радикалы переходят во вновь образую¬
щиеся молекулы целиком, а в других подвергаются изменениям. Поня¬
тие радикал было вытеснено понятием остатка (Жерар), т. е. части мо¬
лекулы, которая сохранилась в данной реакции, но может быть иной
ь других реакциях.
предмет'органической химии15Попытки найти что-то общее в природе органических молекул за¬
ставили отказаться от безуспешных поисков неизменяемой части моле¬
кулы и перейти к наблюдениям за ее наиболее изменяемой частью,
которую мы теперь называем функциональной группой. Эти наблюдения
привели к новой унитарной теории типов Жерара, являющейся разви¬
тием старой теории типов Лорана. В спиртах и кислотах Жерар увидел
аналоги воды, в хлорпроизводных углеводородов — аналоги хлористого
водорода, во вновь открытых Вюрием аминах — аналоги аммиака. Та¬
ким образом были установлены типы Н20, HCI, H3N, Н2. Введение в эти
неорганические типические молекулы па место водорода органических
остатков (прежних радикалов) с их гомологическим и изологическим
разнообразием и создавало разнообразие органических соединений, ко¬
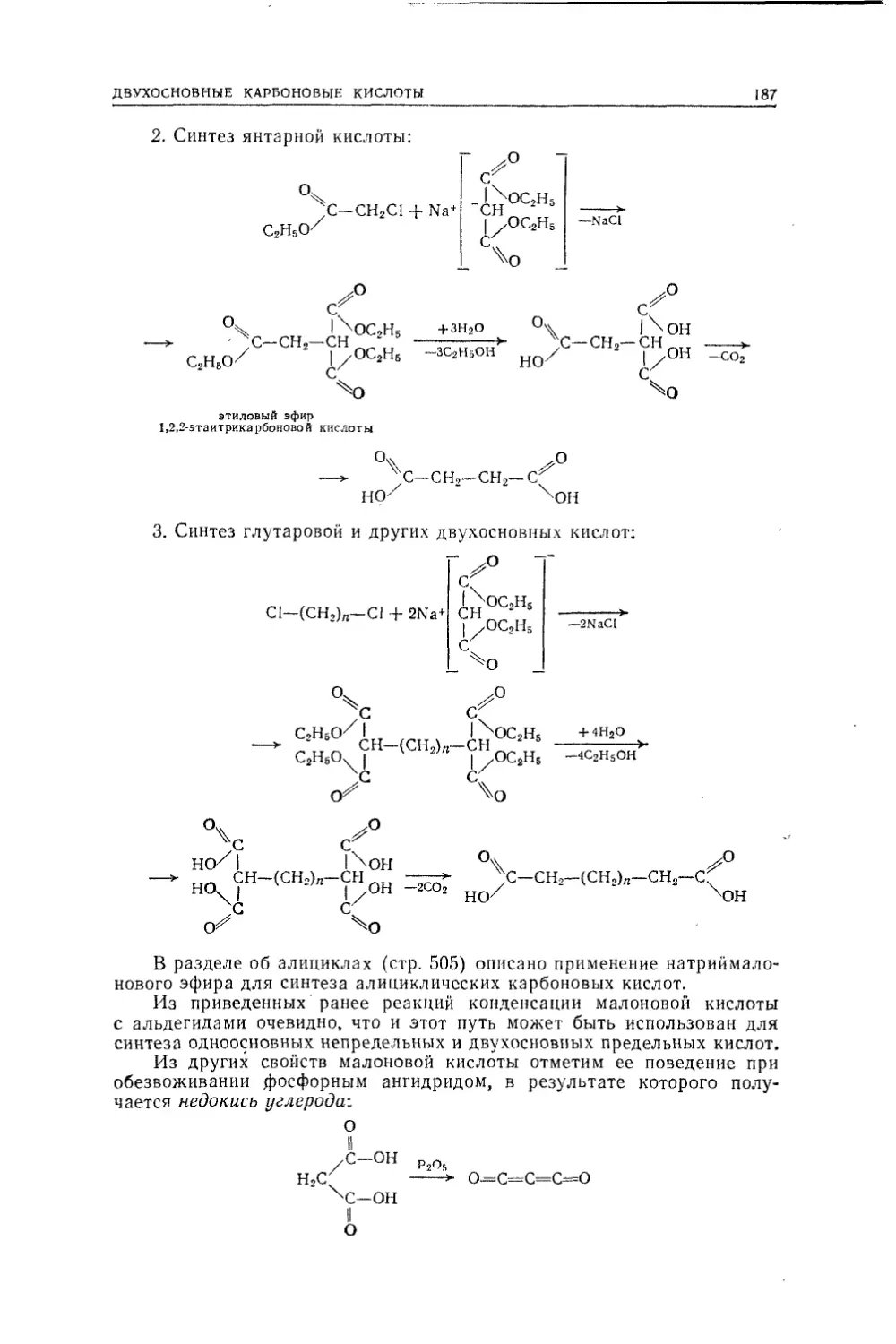
торые стали располагать в следующие ряды:Вильямсон в 1851 г. ввел понятие о так называемых многоатомных
радикалах, т. е. о радикалах, способных заместить в «типе» два и более
атомов водорода. Тем самым стало возможным относить вещества
сразу к двум и более типам, например аминоуксусная кислота может
быть отнесена к типам воды и аммиака:Такие вещества мы теперь называем гетерофункциональными со¬
единениями.Важный шаг был сделан немецким химиком Кекуле, который при¬
бавил к уже известным типам новый тип метана.водаметиловыйспиртэтиловый
сайр гуксуснаякислотахлористыйводородхлористыйметилхлористыйэтилхлористыйацетилводород
и т. д.метайэтанацетальдегидДруг по отношению к другу такие ряды называются гетерологине-скими.с2н2оннаминоуксусиаякислотаннметанКекуле систематически использовал в органической химии органо¬
генов введенное английским ученым Франкландом понятие валентности
(сам термин введен А. В. Гофманом), установленное им путем исследо¬
16ВВЕДЕНИЕвания состава и молекулярного веса летучих металлоорганических со¬
единений. В 1857 г. Кекуле распространил понятие валентности и на
сам углерод. Признание четырехвалентности углерода вскоре привело
Кекуле к необходимости принять связь углеродных атомов между собой.
Например, формула этана записывалась следующим образом:СНз)НэтанУглерод оказался способным образовывать и длинные цепи атомов,
включающие десятки и, как мы теперь знаем, сотни и тысячи атомов
углерода.Чтобы соблюсти постоянство валентности углерода и кислорода,
оказалось необходимым также принять существование двойной связи
в таких соединениях, как этилен (связь С = С), альдегиды и кетоны
(связь С=0).Формулы Кекуле выглядели так:(ТТУТТУн)метиловый
спиртРано умерший шотландский химик Купер предложил современное
изображение формул, в которых знак элемента снабжался числом чер¬
точек, равным его валентности. Формулы Купера имели уже такой вид:Н\Н-)С—О—Н Н—feNН/метиловый спирт синильная кислотаОднако и Кекуле и Куперу еще чужда была идея неразрывной связи
химических (и физических) свойств молекулы с ее строением, выражен¬
ным формулой, идея единственности этого строения. Кекуле допускал
описание одного и того же соединения посредством нескольких разных
формул, в зависимости от того, .какую совокупность реакций данного
вещества хотели выразить формулой. По существу это были так назы¬
ваемые реакционные формулы. Установление теории строения (и самый
термин строение, или структура) принадлежит А. М. Бутлерову и от¬
носится к 1861 г.Химическим строением Бутлеров назвал последовательность связи
атомов в молекуле. Он указал, каким путем на основании изучения
химических реакций данного вещества можно установить его структуру
и написать структурную формулу, которая для каждого химического
индивидуума является единственной адекватной. В соответствии с этой
формулой можно н синтезировать данное соединение. Свойства опре¬
деленного атома в соединении прежде всего зависят от того, с каким
атомом он связан. Так, свойства водорода, связанного с кислородом,
иные, чем водорода, связанного с углеродом, и, зная эти свойства,
можно установить, с каким атомом связан интересующий нас атом. На¬
пример, атом водорода, связанный с кислородом, как в спиртах, спосо-синильнаякислота
ПРЕДМЕТ ОРГАНИЧЕСКОЙ ХИМИИ17бен замещаться на натрий при действии металла (так же как водород
в воде — неорганическом прототипе с тем же характером связи), а во¬
дород, связанный с углеродом, обычно инертен по отношению к натрию.
На свойства данного атома влияют и другие его соседи, непосредственно
с ним не связанные. Хотя это влияние более слабое, по оно также
должно быть учтено при установлении химического строения.Теория строения включила и растворила в себе теорию радикалов,
поскольку любая часть молекулы, переходящая в реакции из одной
молекулы в другую, являлась радикалом (остатком), но уже не обла¬
дающим прерогативой неизменности. Она вобрала в себя и теорию ти¬
пов, ибо присутствующие в молекуле неорганические или содержащие
углерод группы, ведущие свое начало от воды (гидроксил ОН), ам-и т. д., в первую очередь определяли химическое поведение (функцию)
молекулы и делали это поведение сходным с поведением прототипа. При
этом уже снимался вопрос о том, замещает ли, например, в-метиловом
спирте СН3ОН метильный радикал место атома водорода в воде или
гидроксильная группа замещает место водорода в метане СН4.Следует отметить, что установление структуры вещества химиче¬
ским путем осуществляют каждый раз индивидуально, и этому вопросу
посвящена значительная часть курса органической химии. Для уста¬
новления структуры необходимо быть предварительно уверенным в том,
что выделено индивидуальное вещество, знать его количественный эле¬
ментарный состав и молекулярный вес. Если известен состав и молеку¬
лярный вес, то, как это будет показано ниже, можно вывести молеку¬
лярную формулу соединения, т. е. формулу, выражающую число атомов
каждого элемента в молекуле. Как конкретно химическим путем ре¬
шается вопрос о строении соединения, можно предварительно показать
на нескольких простых примерах. Пусть нам даны два индивидуальных
вещества: газ с т. кип. — 24 °С и жидкость с т. кип. 78 °С, обладающие
одной и той же молекулярной формулой С2НбО, т. е. являющиеся изо¬
мерами. Как установить последовательность связей атомов в их моле¬
кулах, т. е. вывести структурные формулы? Необходимо изучить реак¬
ции обоих веществ.Жидкое вещество с натрием реагирует по типу воды, выделяя один
атом водорода на один атом натрия, причем натрий занимает место
ушедшего водорода:В полученное твердое натриевое производное уже не удается ввести
второй атом натрия. Это доказывает, что один из атомов водорода на¬
ходился в иной форме связи, чем остальные, и группировка атомов,
в которую он входил, принадлежала к тину воды. Таким образом, мы
легко приходим к выводу, что жидкое вещество содержало гидроксиль¬
ную группу и, выделяя ее, щ>жно формулу соединения написать так:
С2Н5ОН. Подтверждением этого вывода служит то, что при действии на
исходное жидкое вещество трехбромистого фосфора гидроксильная
группа уходит из молекулы как целое, переходя к атому фосфора и за¬
меняясь на бром:Далее, если на C2HsBr в водно-спиртовом растворе подействовать
цинковой пылью, то выделится газ этан C2HG, в котором два атома
углерода связаны между собой. Его структуру, принимая во вниманиемиака (аминогруппа NH2), угольной кислоты2C2H60 + 2Na —> Н2 + 2C2H5ONaЗС2Н5ОН + РВг3 —► ЗС2И5Вг + Р(ОН)32 Зак. 882
I18 ' ВВЕДЕНИЕвалентность углерода 4, а водорода^- 1, нельзя написать иначе, как
Н НI IН—С—С—Н. Тогда веществу С2Н5ВГ следует приписать структуруН Н
Н НI IН—С—С—Вг, а для исходного жидкого-вещества с т. кип. 78 вС устанав-
Н НН НI Iливается структурная формула Н—С—С—О—Н, т. е. структура эти-Н Нлового спирта. Изомерное ему газообразное вещество, как установлено,
не реагирует с металлическим натрием, а при взаимодействии с йоди¬
стым водородом разлагается по уравнению (в молекулярных формулах).:С2НвО + Щ —► СН31 + СН40Из этого можно сделать вывод, что в газообразном веществе два
атома углерода не связаны друг с другом, так как иодистый водород
' не способен разрывать углерод-углеродные связи. В нем нет и особого
атома водорода, способного замещаться на натрий. После разрыва мо¬
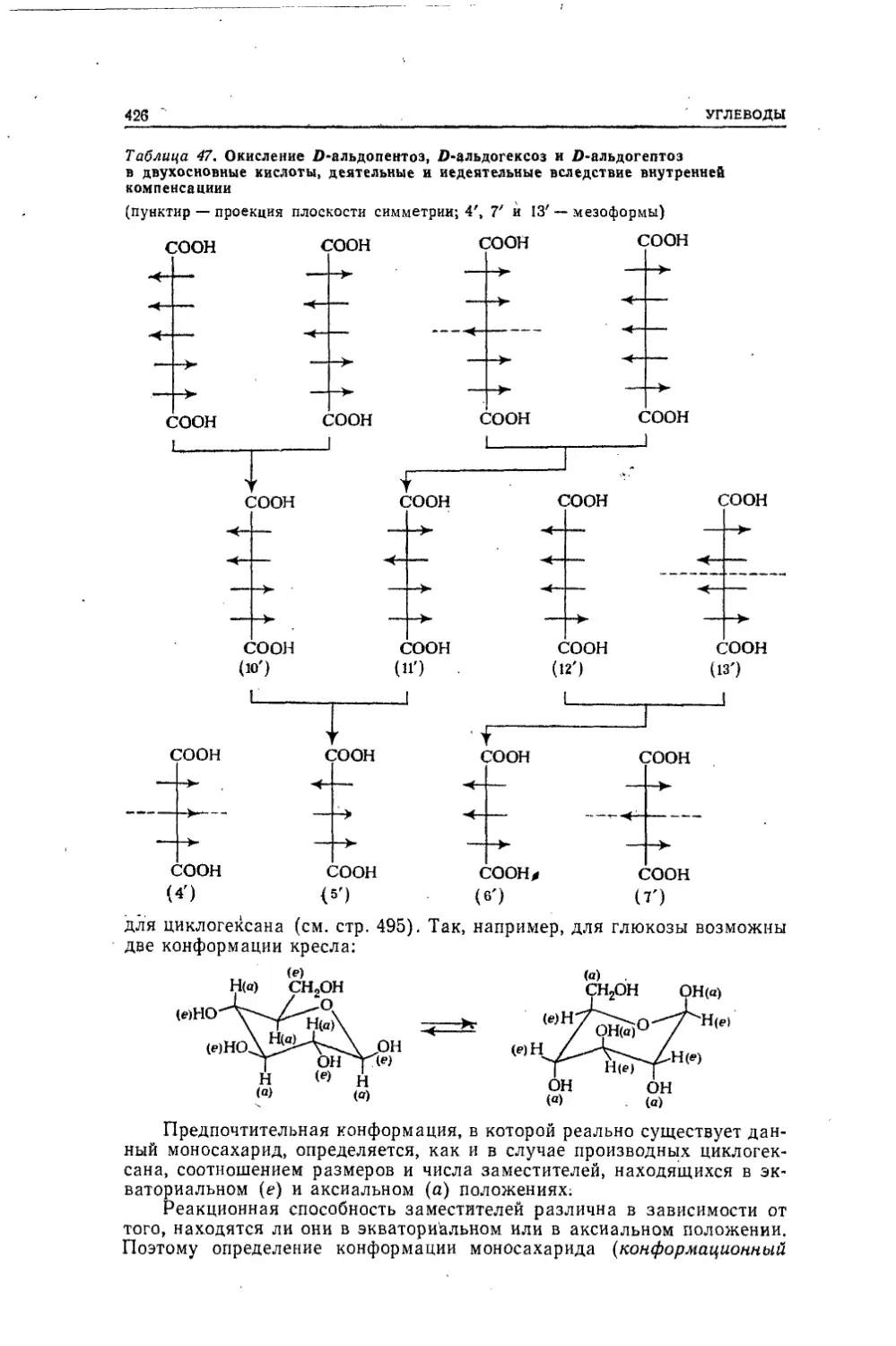
лекулы этого вещества при действии иодистого водорода образуются
СН40 и СН31. Последнему нельзя приписать иной структуры, чем
НIН—С—I, поскольку и водород и иод одновалентны. Второе из образо-IНвавшихея веществ СН40 ведет себя в реакциях с натрием и трехбро¬
мистым фосфором подобно этиловому спирту:2CH„0 + 2Na —► 2CHaONa + Н2
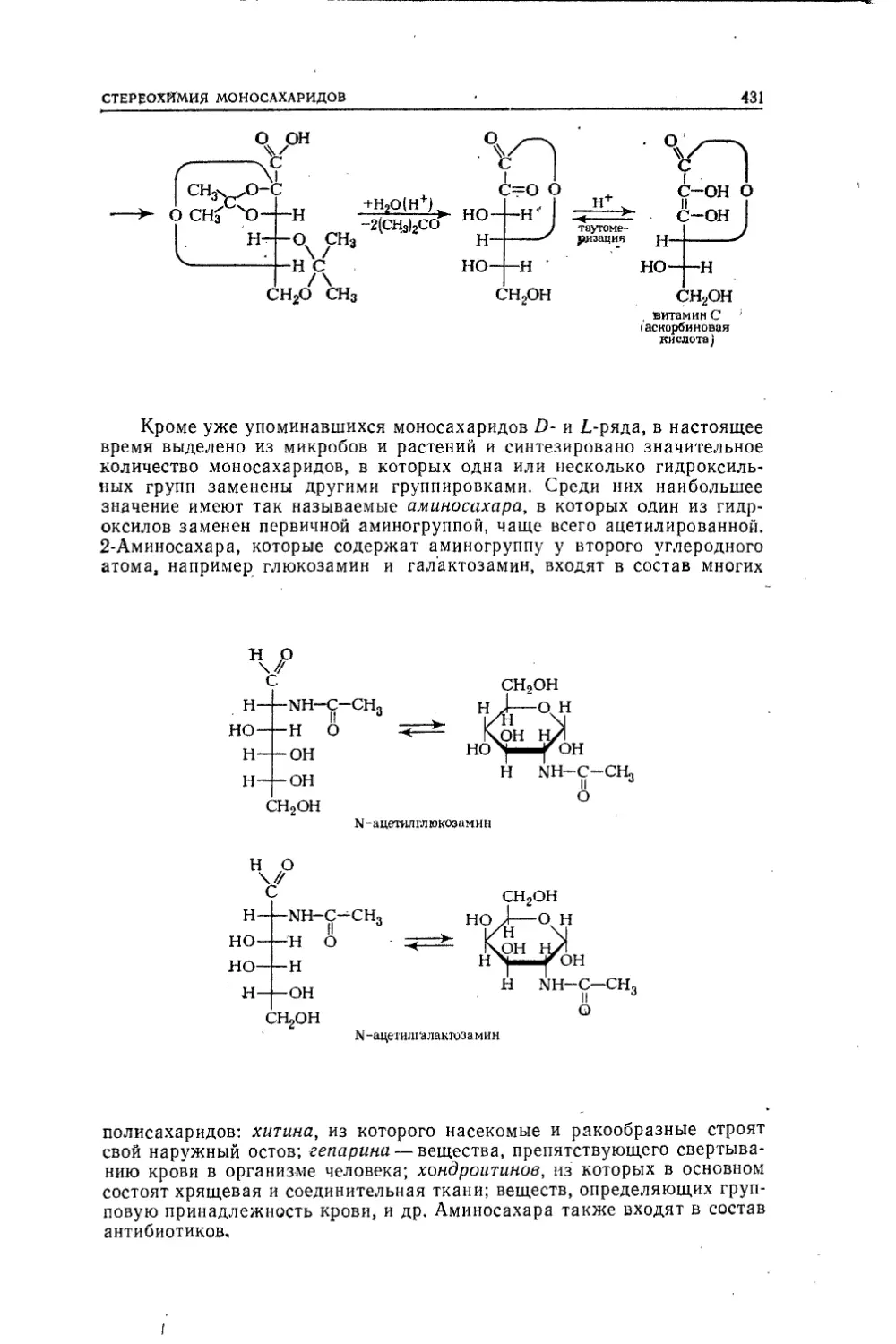
3CH40 + PBr3 —v ЗСНзВг + Р(ОН)3Таким образом, это — спирт, содержащий метальную группу, свя¬
занную с гидроксильной. Реакцию исходного газообразного вещества
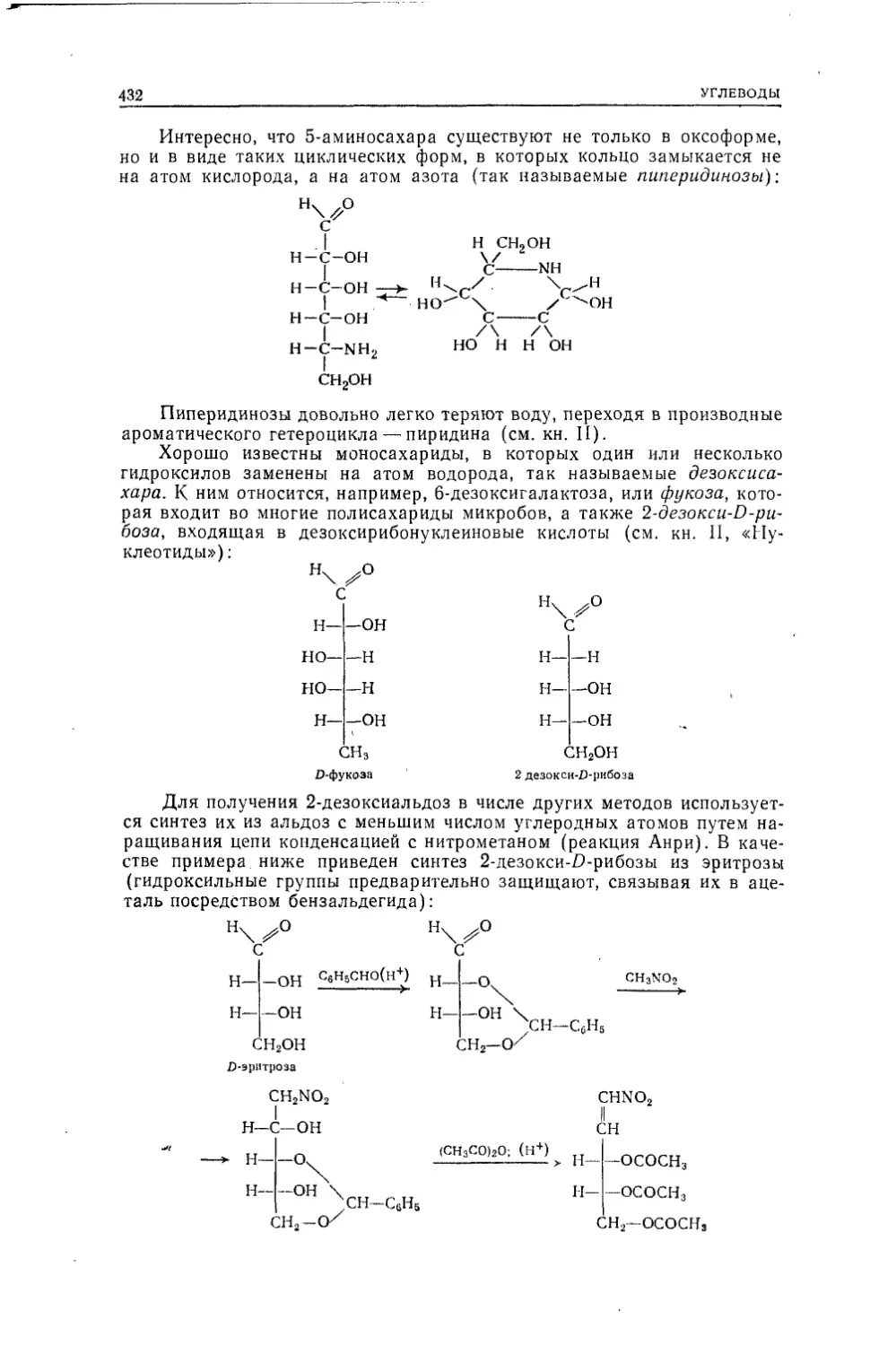
с HI можно, следовательно, написать так:Н НI ICjHeO + HI —► Н-С—I + Н—О-С—НН ' iЕстественно предположить, что HI разорвал связь двух метальных
групп, осуществлявшуюся атомом кислорода:Н Н Н Нн—i—о—i—н + hi —* н—с—I + н—о—i—н
ПРЕДМЕТ ОРГАНИЧЕСКОЙ ХИМИИпДействительно, при действии одного из продуктов этой реакцииНIН—С—I на натриевое производное другого
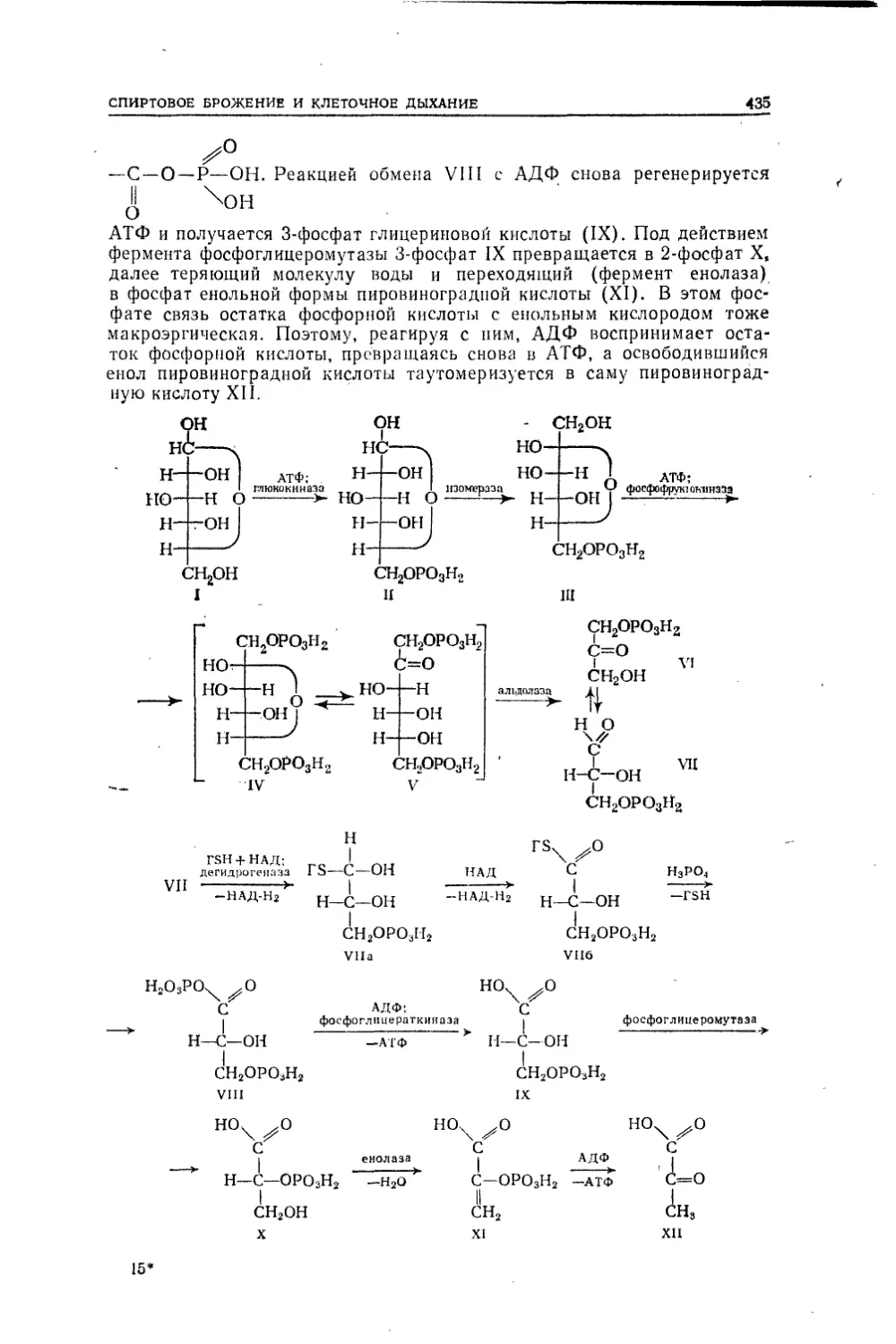
Нн н н нI I IIн—С—I + Na—О—С—Н —>■ Н-С—О—С—Н + NalI I IIн н н нудается осуществить синтез первоначального газообразного вещества,
изомерного этиловому спирту, и тем подтвердить принятую для него
структуру простого диметилового эфира.Для более сложных молекул путь установления строения оказы¬
вается гораздо более длинным. Стремятся, во-первых, качественными и
количественными реакциями определить наличие тех или иных функ¬
циональных групп в молекуле. Следующая задача — выяснение после¬
довательности связи между углеродными атомами, т. е. углеродного
скелета молекулы. Эта задача решается путем постепенной деградации
молекулы — расщепления ее (обычно путем окисления) на меньшие мо¬
лекулы— куски предыдущей, с последующим установлением строения
продуктов деградации *. Зная строение кусков, можно попытаться пред¬
ставить себе строение целой молекулы. Такую гипотетическую формулу
надо затем проверить при помощи иных процессов деградации, приво¬
дящих к иным кускам. Завершающей стадией вывода структурной фор¬
мулы является синтез соединения. Примеры установления строения
сложных соединений можно найти на всем протяжении книги.Созданная в 1861 г. теория строения служила и служит стержнем
развития органической химии и в настоящее время. В помощь чисто
химическим методам установления структуры органических веществ
были разработаны многочисленные физические методы, о которых речь
будет идти далее. Хотя химические методы сохраняют свое значение,
все большее значение приобретают такие физические методы, как масс-
спектрометрия, ядерно-магнитный резонанс, оптическая спектроскопия.Таким образом, великое разнообразие органических соединений,
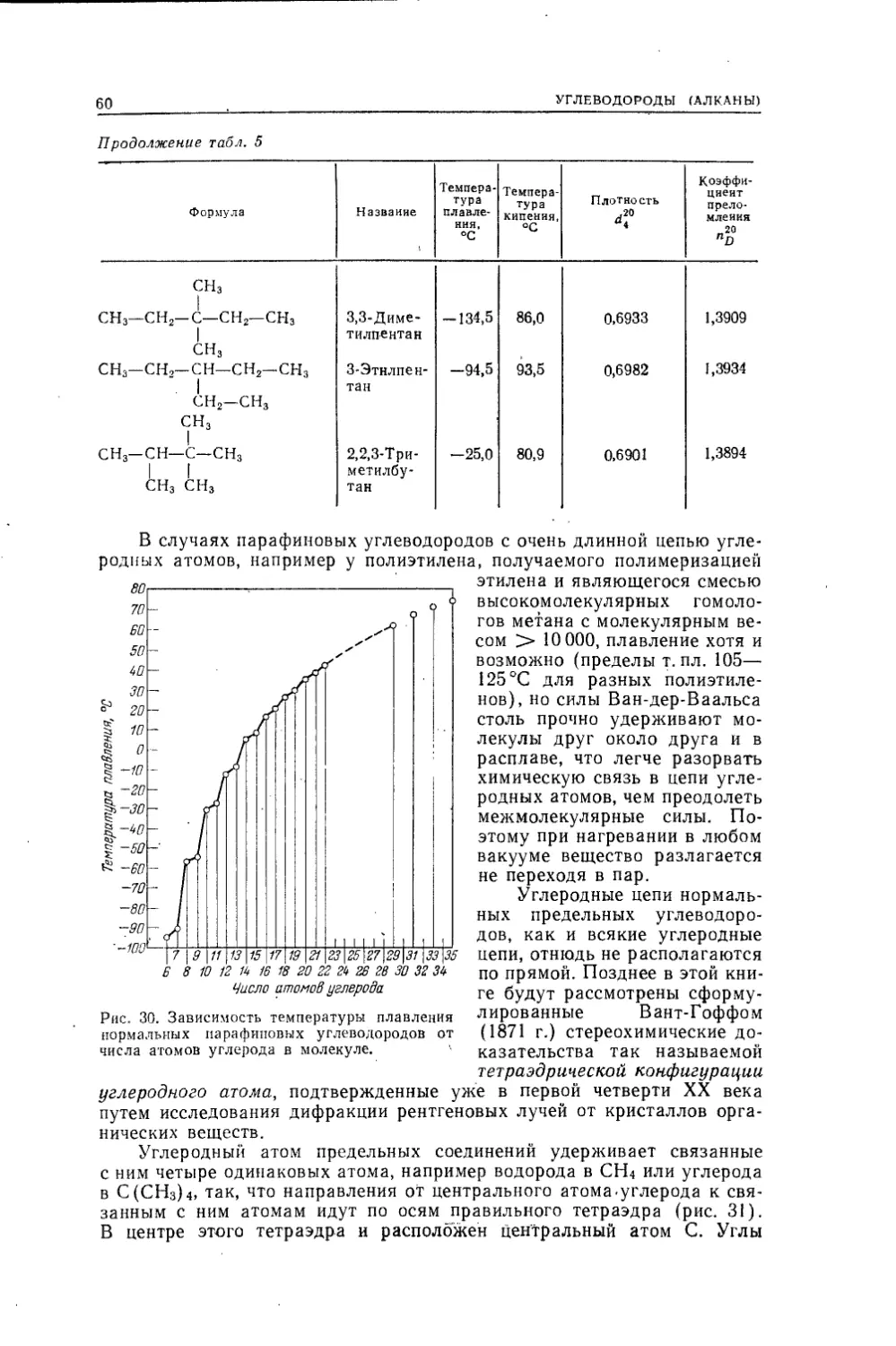
возможность образования гомологических рядов и широкое проявление
изомерии выз'ваны способностью атомов углерода образовывать цепи
(практически бесконечные) взаимосвязанных атомов и вступать в проч¬
ные связи как с электроположительными (Например, водород), так и
с электроотрицательными (галоиды, кислород, сера, азот и т. д.) эле¬
ментами, причем атомы одних элементов могут заменяться другими без
нарушения общего характера молекулярной структуры. Кроме углерода
известны лишь немногие элементы, способные образовать цепи, и то
очень непрочные, всего из нескольких одинаковых атомов (таковы азот,
сера, кремний). В большинстве же случаев дело ограничивается двумя
атомами (Н2,02, N2, НО—ОН, H2N—NH2 и т. д.).На основании всего только что сказанного, с учетом исторического
хода развития химической мысли с ее великими достижениями и разо¬
чарованиями, подобными крушению электрохимической теории Берце¬
лиуса, можно упрощённо дать следующую характеристику неорганиче¬
ской и органической химии.* В 1920 г. физик Астон ввел новый метод исследования — масс-спектрометри¬
ческий, при помощи которого были открыты изотопы стабильных элементов. С на¬
чала второй половины текущего столетия масс-спектрометрия используется в органиче¬
ской химии как мощный метод деградации и установления строения органических ве¬
ществ (см. стр. 550).
20ВВЕДЕНИЕНеорганическая химия — по преимуществу химия полярных соеди¬
нений и полярных химических связей, органическая химия — по преиму¬
ществу химия неполярных соединений и неполярных химических связей.
В том и состоит особенность углерода, что он легко образует прочные
неполярные связи как с электроположительными, так и с электроотри¬
цательными элементами.Таким образом, мы снова подошли к вопросу о природе химической
связи, заброшенному со времени Берцелиуса и возникшему вновь в
20-е годы нынешнего столетия.Теория электролитической диссоциации заложила основу ионной
теории строения солей и других электролитов. Открытие электрона,
явившееся логическим завершением установленных Фарадеем количе¬
ственных законов электролиза, было следующей предпосылкой для соз¬
дания теории электровалентности. Наиболее характерным химическим
актом стало представляться образование катионов и анионов, связанных
простым электростатическим притяжением. Катионы получаются из ато¬
мов металлов, потерявших электроны, захваченные другими атомами,
образующими анионы. Наиболее полно и последовательно это пред¬
ставление было использовано Косселем (1917 г.) в применении к соеди¬
нениям и процессам неорганической химии. Однако и Косселю было
ясно, что неполярные (или гомеополярные) вещества (например, двух¬
атомные молекулы таких элементов, как водород или азот, углеводо¬
роды и др.) следует рассматривать с других позиций. Этот другой под¬
ход был развит к 1916 г. Льюисом, однако вследствие разразившейся
в то время первой мировой войны его теория не сразу стала повсеместно
известной. Основное положение теории Льюиса, сохранившееся незыб¬
лемым для громадного большинства органических веществ, — образова¬
ние химической связи в неионно построенных соединениях (так назы¬
ваемой ковалентной связи) за счет пары электронов, выделяемых по
одному каждым из связываемых атомов. Таким образом, обычным фор¬
мулам соответствуют следующие льюисовские формулы:Н—Н СН4 С2Н„ СН3СН2ОНН НН ННII: н Н:С*.Н Н:С:С:Н HsCs“:OsH и т. д.•• •• •• •• ••Н НН Н нКаждой черте (связи) структурной теории соответствуют две точки,
символизирующие пару электронов связи. В случае двойной связи свя¬
зующими являются две пары электронов, в случае тройной — три *. Так,
этилен, ацетилен и формальдегид будут изображаться следующим об¬
разом:H ,н И й Н- £';Ос/ C:sC Н—С=С—Н Н:С:::С:Н \с=0 С::0нх hi п н н/ Нэтилен ацетилен • формальдегидУглерод при этом всегда окружен восемью электронами — окте¬
том— той же наиболее устойчивой группой электронов, что и во внеш¬
ней оболочке ближайшего благородного газа — неона, а водород —
двумя электронами, что соответствует электронной оболочке атома ге¬
лия. Согласно теории Льюиса, все другие элементы органогены также* Как будет показано впоследствии, в двойной (и тройной) связи различают
первую, более прочную связь, так называемую 0-связь, эквивалентную обычной про¬
стой связи, и вторую, так называемую зх-связь, образующуюся с меньшим выделением
энергии и более лабильную в физическом и Химическом отношении (см. стр. 243).
ПРЕДМЕТ ОРГАНИЧЕСКОЙ ХИМИИ21окружены электронной оболочкой ближайшего благородного газа (Ne
или Аг)—октетом. Однако в то время как в благородном газе октет
полностью принадлежит атому элемента, в углероде электроны октета
полностью обобщены (попарно) углеродом и связанными с ним ато¬
мами. В других элементах (О, N, S, галоиды) из четырех электронных
пар октета часть обобщена и образует ковалентные связи, а часть нахо¬
дится в виде свободных пар, как видно из следующих формул:ннн . НННН-’СЮ-.ИН:С:: С: О: С: С •' НН:С:С:0:НН: С: С1:нн н н нН ’’Н “метиловыйэтиловыйуксуснаяхлористыйспиртэфиркнслогаметилНнН :0= _НН--С::N:HH:C:S=HH:C;6ts:0:С:Нн нН ”Н '’.-О:Нметиламинметил-меркаптандиметилеульфатПредельный характер октета (невозможность для атома, окружен¬
ного октетом электронов, захвата или принятия в совместное обладание
новых электронов) и наличие свободных пар электронов позволили
Лыоису сделать важный вывод о новом типе проявления валентности
атомами подобных элементов. Атом, имеющий свободные пары элек¬
тронов, например атом кислорода, серы и особенно азота, может предо¬
ставить их в совместное обладание другому атому с неполным октетом
или какому-либо иону и образовать таким путем химическую связь,
например:НН •• N:
Наммнэд+ ННN •• N •' Н
Нион адаонияНН-О:вода+ ННН:6:Нном гидровдониянН:С:НN ••Н-С--Ннтриметил-аминН№СНСН3:.|:О:НН:Сi-iннс-н
Nf: ннс^н
нионтриметил-аммонияНнН:Я;им»С : N : С: Н + :Г
ii нН-'С:Нiiион тетрамнтил-
аммонияННН-С:НЧ=С : Ы+ЮГ
ii • ■ "
н: с;: н
hiОКИСЬ !иим< 'ТНЛ-*амина
22ВВЕДЕНИЕн нH:C:S:C:H +
Н " ЙНН:С;ГН "—►- Н--С ■ S : С=Нн •• iiдиметилсульфид иодистый
метилиоддатыйтрнметилсуяыронийСНз СНзНзСф’: + 20-- H3C:+S^OСНзднмши-сулыриддаметилсульфонСледует различать две разновидности такого нового способа обра¬
зования химической связи за счет одностороннего предоставления парыэлектронов. Во-первых, ион (в наших примерах Н+ или СН3 из СН31)
может присоединиться к свободной паре электронов. Поскольку ион
привносит свой заряд, образуется катион так называемого ониевого
(аммониевого, оксониевого, сульфониевого) соединения. Заряд теперь
находится уже не на присоединившемся ионе, а на центральном атоме
ониевого катиона. Присоединившаяся же частица — бывший катион —
присоединена теперь обычной ковалентной связью — парой электронов.
В ионе аммония все атомы водорода (или, соответственно, в ионе тет-
раметиламмония — метильные группы) находятся в совершенно одина¬
ковой связи с центральным атомом.Во-вторых, к свободной паре электронов может присоединиться ней¬
тральный атом, у которого недостает до октета одной пары электронов,
т. е. атом, обладающий секстетом электронов, например кислород, как
в вышенаписанной окиси триметиламина. Тогда на атоме, отдающем
свою свободную пару электронов, возникает один положительный заряд,
а атом, принимающий пару (кислород), приобретает один полный отри¬
цательный заряд. В результате эти два атома оказываются связанными
двояко: ковалентной связью — посредством электронной пары, и элек-
тровалентной связью — посредством противоположных полных зарядов.
Такой вид химической связи называется семиполярной связью. В клас¬
сической структурной теории семиполярная связь изображалась так же,
как и двойная связь, например (CH3)3N = 0. Впоследствии стали чащеписать более точно (CH3)3N—О или изображать такую связь прямой
стрелкой (CH3)3N-*0.Наличие семиполярной связи в молекуле резко сказывается на фи¬
зических свойствах: такие вещества имейт более высокую температуру
кипения, высокую диэлектрическую проницаемость и т. д.Отметим, что Льюис преувеличивал диапазон применимости пра¬
вила октета и распространенности семиполярных связей. Правило окте¬
та строго соблюдается только для элементов периодической системы от
бора до фтора (и неона) включительно. Кремний, фосфор и сера могут
расширять свой октет до 12 электронов (дуодецет), что явствует из
существования таких ковалентно построенных соединений, как SF6 или
анион SiFe".Уже из представлений Льюиса вытекает классификация реакций и
реагентов, понятие о которой проще всего дать нр примерах. Так, в реак¬
циях (1—3, 5) химические связи разрываются таким образом, что пара
электронов, принадлежавшая ранее двум связываемым атомам, цели¬
ком отходит к одному из них;++
ПРЕДМЕТ ОРГАНИЧЕСКОЙ ХИМИИ23;0: ! Н -О:Н:С:6:'|Н + :0: -
" ! Ндиссоциация муравьиной кислоты на ионыНН:С = 6~ + Н:О^Н (1)Н; Н
Н: С !;С1: + : О •'
Н; " "Н~Н->► Н:С:0=Н + Н = С1: (2)Нгидролиз хлористого метилаН[ , нH:G|:CI: + '"и —H:C:'l/- + :С1~
М| Н 'обмен CI на I в галоидном метиле(3)Н НН:С:С + H:C:::N:Н Н
>- Н:С : С : C:::N:
Н :0:Нприсоединение синильной кислоты к ацетальдегидуН:Ь:ннн№С:С = Сннн:С;С:Н «Гсшшкагель^ + Н:С:С:Н (5)Н Н
С;С:
Н ннн н:С:С-
H H(4)каталитическии крекингПодобный разрыв связи называется гетеролитическим или гетеро¬
лизом. Ионизация является частным случаем гетеролиза. Та часть мо¬
лекулы каждого реагента, к которой отходит пара электронов связи и
которая, следовательно, несет отрицательный заряд, в итоге объеди¬
няется с противоположно (положительно) заряженной частью молекулы
партнерша. Часть молекулы, с которой отошла электронная пара, ранее
образовывавшая связь, называется нуклеофильной (от греческого «ну¬
клеус»— ядро; ядро атома положительно заряжено), так как она спо¬
собна атаковать положительный заряд, соединяться с положительно
заряженной частицей. В частности, любой анион в разной степени ну-
клеофилен. Противоположная часть молекулы, обладающая атомом с
секстетом электронов и несущая положительный заряд, электрофилъна.
Все катионы в большей или ^еньшей степени электрофильны.Названия нуклеофильный и электрофильный прилагаются и к реагирующим
нейтральным молекулам, хотя нейтральная молекула при гетеролизе образует и
нуклеофильную и электрофильную части и, значит, объективно ее в целом нельзя
отнести к той или другой категории. В таких случаях руководствуются смыслом
реакции. Так, смысл реакции (3), очевидно, не в том, что катион натрия из йодистого
натрия атакует анион хлора, а, наоборот, в том, что анион иода атакует углерод хло¬
ристого метила и, устанавливая с ним ковалентную связь, образует иодистый метил.
В этом смысле о иодистом натрии в целом говорят как о нуклеофильном реагенте
(сокращенно нуклеофиле), а хлористый метил в данной реакции называют в целом
электрофильным реагентом (электрофилом). Аналогично для реакции (4), где синиль¬
ная кислота (цианид-ион) атакует положительный карбонильный углерод альдегида,
молекулу синильной кислоты называют нуклеофильной (хотя, по сути, это название
принадлежит- CN~), а молекулу альдегида — электрофильной (хотя, по сути, это
название относится к карбонильному углероду). Таким образом, при взаимодействии
двух нейтральных молекул по гетеролитическому механизму в сущности сочетаются
действия двух электрофильных и двух нуклеофильных частей обеих реагирующих
молекул, но смысл и значение процесса определяют один из двух элгктрофилов и один
из двух нуклеофилов, и по ним строится название обеих молекул как реагентов.
24ВВЕДЕНИЕСовершенно другой тип реакций, с го политическим разрывом свя-(6)(6 о)(7)(7а)(8)(8о)При гомолизе пара электронов связи разъединяется и образуются
свободные радикалы, соответствующий атом которых несет нечетный,
неспаренный электрон. Такие свободные радикалы* обычно очень не¬
устойчивы и тотчас превращаются в следующей фазе реакции (часто
цепной реакции, см. стр. 71) в устойчивые молекулы, как это показано
в реакциях (6а), (7а), (8а).Гемолитические реакции идут предпочтительно в газовой фазе или
растворителях с низкой диэлектрической проницаемостью, гетеролити-
ческие — по преимуществу в растворах, особенно в растворителях с
большой диэлектрической проницаемостью (вода, безводная муравьи¬
ная кислота, диметилсульфоксид, диметилформамид и др.).Приведенные предварительные данные о классификации реакций
и реагентов мы связали с теорией Льюиса, из которой она, несомненно,
вытекала. Следует указать, что эти понятия и термины в действительно¬
сти были введены позднее английской школой химиков (Лоури, Р. Ро¬
бинсон, Инголд).Представления Льюиса во многих случаях плодотворно дополняют
и расширяют классическую теорию строения. Однако нужно считаться
с тем, что представление об электроне как о заряженной точке прими¬
тивно. Электрон не только частица, но и волна, и волновые свойства
электрона во многом определяют характер химической связи. Этот
аспект будет рассмотрен позднее, на стр. 220.* Свободным радикалом называется реально, хотя бы и весьма кратковременно,
существующий незаряженный (и, следовательно, обладающий неспаренным электро¬
ном) осколок молекулы, и это понятие не следует смешивать с понятием радикала
(или остатка) как мысленно выделяемой части молекулы.зей, может быть представлен примерами:Н j Н+ .-CI- —>- Н:С- + НКЛ:н| " iiН ; НН:С- + : С1;:'С1: ► Н:С:С1: + :С1-Н "! " н "хлорирование метана ка светуННН|НН о ННН нн• С:С :С^С :С:Н > Н:С:С:С- + •С-С:н н н! Н Н ННН ннтермическим крекингННН ннН.С:С::С:Н + Н = С:С:НН Н НН-РЬ- + 4Н:С-
НЧпиролиз тетраметилсвинцан нн2Н = С- —Н:С;С:Н
Н Н Н
ПОНЯТИЕ О ХИМИЧЕСКОМ ИНДИВИДУУМЕ25ПОНЯТИЕ О ХИМИЧЕСКОМ ИНДИВИДУУМЕКогда понятие о молекуле твердо вошло в науку, под химическим
индивидуумом (простым веществом или соединением) стали подразу¬
мевать вещество, состоящее из одинаковых молекул.Практически, разумеется, нельзя достигнуть полной чистоты веще¬
ства, и в разных случаях к чистоте вещества предъявляют разные тре¬
бования. В обычных исследованиях химиков-органиков препарат с со¬
держанием, например, более 99% основного вещества признается хи¬
мически чистым. Часто довольствуются препаратами более низкой
чистоты, но иногда требуются гораздо более' чистые вещества.Обычный элементный анализ, проводимый для установления эмпи¬
рической формулы соединения, дает мало сведений о чистоте вещества.
Вещество должно быть сравнительно сильно загрязненным, чтобы от¬
клонение в элементном анализе превзошло считающуюся допустимой
ошибку в 0,2%. Чистоту вещества устанавливают по наступающей в про¬
цессе очистки неизменности его физических констант. Константами, слу¬
жащими для этой цели, являются температура плавления (или застыва¬
ния), температура кипения при определенном давлении, коэффициент
преломления, плотность, спектральные данные, в некоторых случаях —
удельное вращение плоскости поляризации света. Когда очистку веще¬
ства проводят в целях его идентификации, обычно довольствуются до¬
стижением констант, совпадающих с надежными данными предшествую¬
щих исследователей.Нужно отдавать себе отчет, что пригодность такого критерия зави¬
сит от разницы величин данных констант для искомого вещества и при¬
меси. Естественно, что если константы обоих веществ одинаковы, то
в процессе очистки вещества константа не изменяется и критерий не¬
пригоден. Если предположить, например, что разница в коэффициентах
преломления вещества и примеси равна 0,1, то, поскольку обычно счи¬
тается удовлетворительным совпадение величины этой константы для
одного и того же вещества в пределах 0,001, пределом чувствительности
метода будет 1% примеси. Конечно, для специальных целей можно без¬
гранично совершенствовать методы очистки (разделения веществ) и
точность определения констант.Следует указать, что ни один из широко применяемых в практике
органической химии и описаиных далее методов индивидуализации ве¬
щества не дает возможности разделить молекулы одинаковой структуры,
содержащие р-азные изотопы, например 12С и 13С или 160,- 170 и 180.
Даже разделение веществ, содержащих водород и дейтерий (такие со¬
единения больше различаются по физическим и химическим свой¬
ствам), несравненно труднее разделения разных веществ с близкими
свойствами. Поэтому накопившиеся в органической химии сведения от¬
носятся к «естественным» смесям веществ одного строения, молекулы
которых построены с участием разных изотопов*. Такие смеси для* Наиболее значительная разница в физических константах и константах ско¬
рости реакций наблюдается для соединений дейтерия и водорода. Так, дейтеробен-
зол C6D6 имеет т. пл. 6,5° С, т. кип. 79,3° С и относительную плотность d\a = 0,9497,
а соответствующие величины для бензола равны: т. пл. 5,5°С, т. кип. 80,1°С, плот¬
ность 0,9417. Для дейтерохлороформа CDCI3 т. пл. —64,15° С, т. кип. 61,15° С,
относительная плотность df =1,5004; для хлороформа зги величины соответственно
равны —63,90; 61,2° С; df’= 1,1880. Однако, поскольку в природе содержание дей¬
терия по отношению к водороду составляет всего около 0,016%, примесь молекул
с этим изотопом гораздо меньше содержания обычных загрязнений и не может отра¬
жаться на величинах констант, интересующих химика-оргапика. Примесь тяжелого
углерода 13С к обычному 12С составляет 1,1%; содержание |80 по отношению к |60
в воде 0,2%; l5N в HN — примерно 0,4%.
26ВВЕДЕНИЕобычных целей органической химии приходится рассматривать как ин¬
дивидуальные вещества. Это не создает каких-либо неудобств, так как
разница в физических и химических свойствах такого рода разных мо¬
лекул исчезающе мала и много меньше пределов точности обычных из¬
мерений. Здесь следовало упомянуть об этом лишь потому, что такие
примеси не случайны, а присутствуют неизбежно и при очень точных
измерениях должны приниматься во внимание экспериментатором.В принципе определение понятия «индивидуальное вещество» долж¬
но быть пересмотрено и его следует относить лишь к соединениям, все
молекулы которых построены одинаково и из одинаковых изотопов.СПОСОБЫ ВЫДЕЛЕНИЯ ИНДИВИДУАЛЬНЫХ ВЕЩЕСТВ
В ОРГАНИЧЕСКОЙ ХИМИИИмеет ли дело химик с живой или мертвой природой или искус¬
ственно получает соединение, перед ним всегда стоит задача выделить
индивидуальное вещество из смеси веществ, иногда очень сложной. Для
этого служат следующие физические методы: различные виды перегон¬
ки— фракционная при атмосферном давлении, в вакууме, в высоком
вакууме, молекулярная перегонка; фильтрование и отсасывание; кри¬
сталлизация; экстракция; хроматография и ее разновидности, в частно¬
сти распределительная хроматография. Кроме того, имеется много ме¬
тодов очень индивидуальных и не в каждом случае приложимых. Если
подлежащее выделению вещество имеет характерную химическую функ¬
цию, например является кислотой или основанием, то употребление хи¬
мических методов чрезвычайнб облегчает задачу выделения вещества.
Превращение кислоты или основания в соль резко меняет летучесть и
растворимость вещества. Если соль нерастворима, удается выделить
вещество в виде осадка, отмыть этот осадок от примесей, а затем дей¬
ствием более сильной кислоты или щелочи выделить искомое вещество
в свободном виде. Если же соль нелетуча, можно отогнать все летучие
примёви и из остатка выделить кислоту. В случаях, когда кислота или
основание не образуют нерастворимых в воде солей, можно иногда вос¬
пользоваться нерастворимостью этих солей в органических растворите¬
лях. Именно вследствие легкости индивидуализации кислот и оснований
уже в XVIII столетии и в самом начале XIX столетия был выделен и
идентифицирован ряд органических кислот и алкалоидов (последние
обладают основными свойствами).Химические методы индивидуализации, разумеется, требуют одно¬
временного применения тех или иных физических методов: отделения
осадка, кристаллизации, перегонки и т. д., но в этом случае очистка
совершается гораздо легче и часто обходится без применения фракцион¬
ных методов разделения.ПерегонкаПерегонка при атмосферном давлении проводится путем нагревания
до кипения жидкости, помещенной в колбу с отводом (колба Вюрца)
или с дефлегматором, сообщенными с холодильником Либиха (см.
рис. 1). В колбу кладут запаянные сверху капилляры или кусочки по¬
ристой тарелки (или иной источник воздуха), без которых кипение будет
идти толчками вследствие перегревания жидкости. При наличии источ¬
ника воздуха жидкость закипает при той температуре, при которой
давление ее пара станет равным атмосферному давлению, Ясно, что,
СПОСОБЫ ВЫДЕЛЕНИЯ ИНДИВИДУАЛЬНЫХ ВЕЩЕСТВ27указывая температуру кипения, надо указывать и атмосферное давле¬
ние, определяемое по барометру. После перегонки все нелетучие при¬
меси остаются в колбе, а в приемник переходит жидкость, конденсирую¬
щаяся во внутренней трубке (форштоссе) холодильника. Способ этот
применим, если только одно подлежащее индивидуализации вещество
летуче, т. е. когда величина давления пара примеси незначительна при
температуре кипения вещества, подлежащего индивидуализации. Тер¬
мометр, шарик которого омывается парами кипящего вещества непо¬
средственно перед попаданием паров в холодильник, показывает пре¬
делы температуры кипения вещества. Чистое вещество кипит при опре¬
деленной температуре — «в точке».Перегонка в вакууме. Если вещество при атмосферном давлении
кипит при такой высокой температуре, что частично разлагается, его
перегоняют при пониженном давлении, откачивая из системы воздух
водоструйным насосом (остаточное давление 10—20 мм рт. ст.) или
масляным насосом (остаточное давление может составить десятые или
сотые доли миллиметра ртутного столба). Вещество помещают в колбу
Клайзена (рис. 2). В один рог колбы на шлифе вставлен доходящий
до ее дна капилляр, на внешний конец которого надевают отрезок тол¬
стостенной трубки, зажатый винтовым зажимом. Во время перегонки
для равномерного кипения жидкости по этому капилляру осторожно по¬
дают слабую струю воздуха. Во втором роге колбы укреплен термометр
таким образом, чтобы весь его шарик омывался паром, поступающим
по отводу в холодильник при нагревании жидкости. К нисходящему
концу холодильника присоединена на шлифе насадка с приемником.
Отсасывание воздуха из системы осуществляется через отвод насадки.
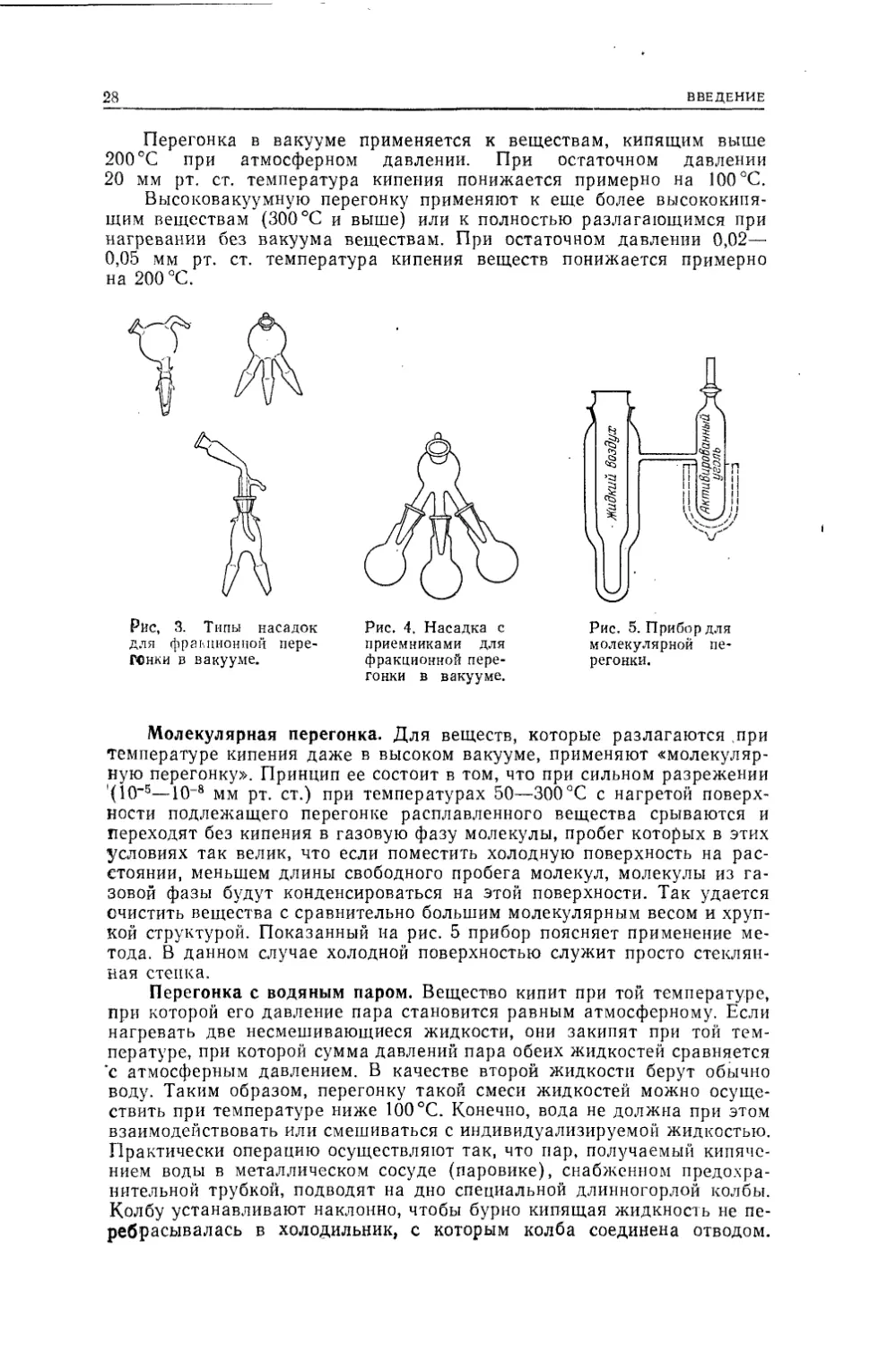
Весь прибор собран герметично на шлифах.Если необходима, как это обычно бывает, фракционная перегонка
(см. ниже), то употребляют специальные насадки и приемники (рис. 3
и 4), позволяющие путем поворота, не выключая вакуума, менять
приемник и отбирать отдельно фракции, кипящие при постоянной тем¬
пературе,Рис. 1. Прибор для перегонки
с елочным дефлегматором.Рис. 2. Прибор для перегонки
в вакууме.
28ВВЕДЕНИЕПерегонка в вакууме применяется к веществам, кипящим выше
200 °С при атмосферном давлении. При остаточном давлении
20 мм рт. ст. температура кипения понижается примерно на 100 °С.Высоковакуумную перегонку применяют к еще более высококипя-
щим веществам (300 °С и выше) или к полностью разлагающимся при
нагревании без вакуума веществам. При остаточном давлении 0,02—
0,05 мм рт. ст. температура кипения веществ понижается примерноМолекулярная перегонка. Для веществ, которые разлагаются при
температуре кипения даже в высоком вакууме, применяют «молекуляр¬
ную перегонку». Принцип ее состоит в том, что при сильном разрежении
'(10-5—10-8 мм рт. ст.) при температурах 50—300 °С с нагретой поверх¬
ности подлежащего перегонке расплавленного вещества срываются и
переходят без кипения в газовую фазу молекулы, пробег которых в этих
условиях так велик, что если поместить холодную поверхность на рас¬
стоянии, меньшем длины свободного пробега молекул, молекулы из га¬
зовой фазы будут конденсироваться на этой поверхности. Так удается
очистить вещества с сравнительно большим молекулярным весом и хруп¬
кой структурой. Показанный на рис. 5 прибор поясняет применение ме¬
тода. В данном случае холодной поверхностью служит просто стеклян¬
ная стенка.Перегонка с водяным паром. Вещество кипит при той температуре,
при которой его давление пара становится равным атмосферному. Если
нагревать две несмешивающиеся жидкости, они закипят при той тем¬
пературе, при которой сумма давлений пара обеих жидкостей сравняется
'с атмосферным давлением. В качестве второй жидкости берут обычно
воду. Таким образом, перегонку такой смеси жидкостей можно осуще¬
ствить при температуре ниже 100°С. Конечно, вода не должна при этом
взаимодействовать или смешиваться с индивидуализируемой жидкостью.
Практически операцию осуществляют так, что пар, получаемый кипяче¬
нием воды в металлическом сосуде (паровике), снабженном предохра¬
нительной трубкой, подводят на дно специальной длинногорлой колбы.
Колбу устанавливают наклонно, чтобы бурно кипящая жидкность не пе¬
ребрасывалась в холодильник, с которым колба соединена отводом.на 200 °С.Рис, 3. Типы насадок
для фрамшонной пере¬
гонки в вакууме.Рис. 4. Насадка с
приемниками для
фракционной пере¬
гонки в вакууме.Рис. 5. Прибор для
молекулярной пе¬
регонки.
СПОСОБЫ ВЫДЕЛЕНИЯ ИНДИВИДУАЛЬНЫХ ВЕЩЕСТВ29В приемнике собираются два слоя жидкЬсти, вода и перегонявшееся ве¬
щество, которые разделяют в делительной воронке. Отношение их
количеств определяется отношением произведения давлений пара ка¬
ждого вещества (при температуре кипения смеси) на его молекуляр¬
ный вес.Для перегонки высококипящих веществ вместо воды можно взять
этиленгликоль или глицерин, которые как растворители похожи на
воду и с большинством органических веществ не смешиваются. При
употреблении глицерина лучше вести перегонку при пониженном дав¬
лении.Фракционное разделение веществ, основанное
на фазовом равновесииМногие методы разделения смесей и получения индивидуальных ве¬
ществ основаны па равновесном разделении обоих компонентов между
двумя фазами — жидкой и газообразной (фракционная перегонка, газо¬
жидкостная хроматография), твердой и жидкой (дробная кристаллиза¬
ция, адсорбционная хроматография), двумя жидкими (экстракция из
жидкости, распределительная хроматография).Разделение двух веществ заключается в проведении (раздельном
или непрерывном) последовательной серии операций, каждая из кото¬
рых состоит в установлении равновесия между двумя фазами, включаю¬
щими в свой состав оба разделяемых вещества в разном соотношении;
таким образом, в состоянии равновесия фазы А и В будут включать
мольные доли первого компонента с, и второго компонента с2 и фактор
разделения а выразится:(—)° = 7ГГ-
—V с2 /вОтсюда состав фазы А можно выразить через состав фазы В и
фактор разделения:с 1 ^ „ /с 1С2 1 А. 1= ав, 1(2)п _4+-и т.д.(В знак того, что эти обозначения касаются однократной операции
разделения, они снабжены еще индексом 1.) Последовательность таких
равновесий (с индексами 1, 2, 3 ...) можно
выразить приведенной ниже схемой
(рис. 6).Для процесса ректификации, рассмот¬
ренного в следующем разделе, жидкая фаза
В] находится в равновесии с паром Аь кон¬
денсируемым в жидкую фазу В2, состав ко¬
торой, очевидно, тот же, что у пара Аь
Жидкая фаза В2 находится в равновесии со
своим паром А2, конденсируемым в 1
жидкость Вз того же состава, что пар А2, Рис. 6.
и т. д.В случае экстракции из раствора жидкостью картина та же: жидкая
фаза Bi (растворившая разделяемую смесь веществ) находится в рав¬
новесии с жидкой фазой Аь извлекающей эту смесь с коэффициентом
распределения а. Заключенное в извлекающей фазе вещество по уда¬
лении растворителя снова растворяют в фазе В (по схеме с индексом 2)
и снова извлекают жидкостью А2 и т. д.
30ВВЕДЕНИЕАналогично идет дробная кристаллизация смеси двух и т. д. ве¬
ществ.Ввиду того что всегдаи принимая во внимание соотношение (2), можно написать уравнение
для второй схемы процесса разделения:Фракционная перегонка (ректификация). Если две смешивающиеся
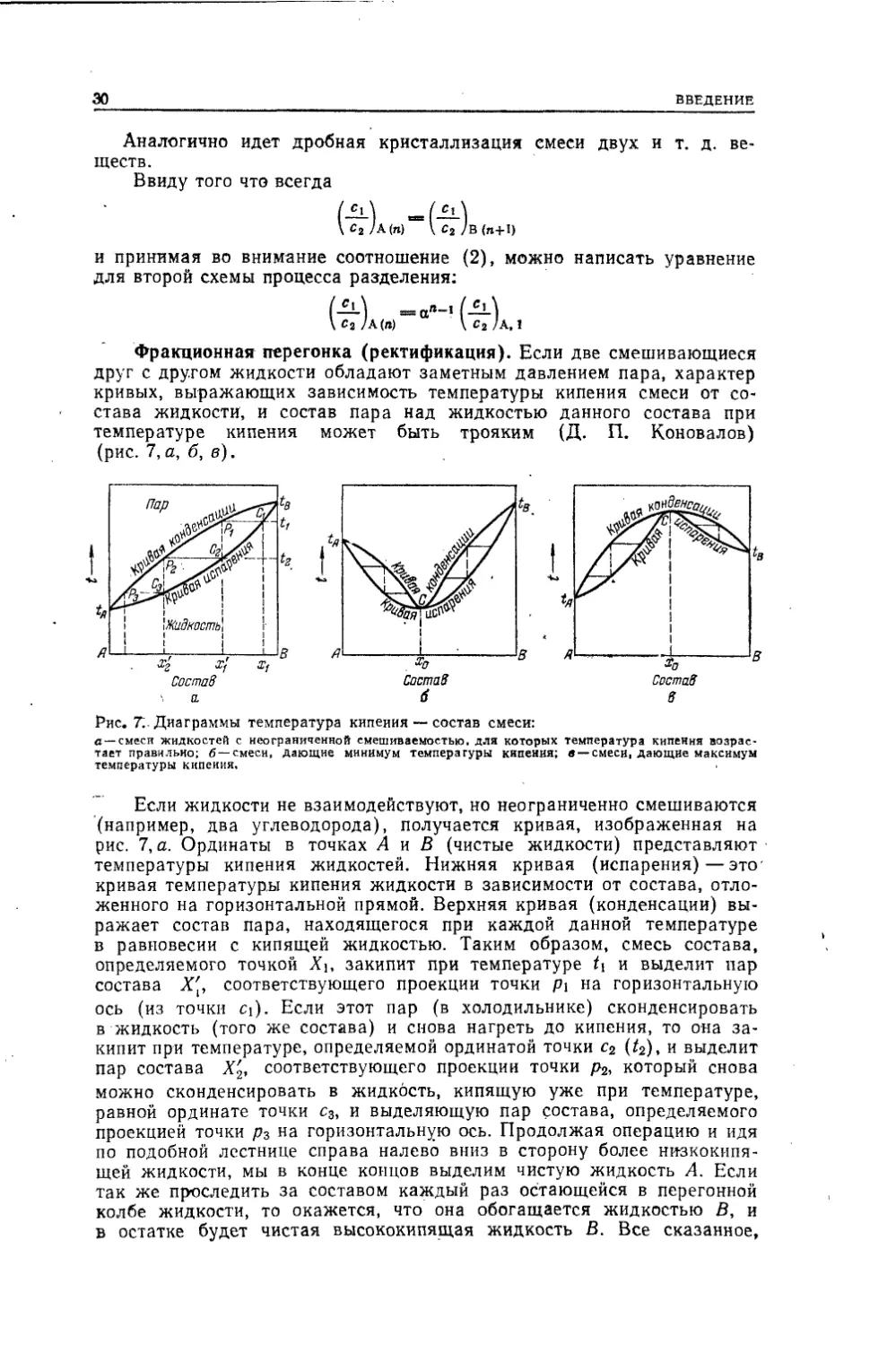
друг с другом жидкости обладают заметным давлением пара, характер
кривых, выражающих зависимость температуры кипения смеси от со¬
става жидкости, и состав пара над жидкостью данного состава при
температуре кипения может быть трояким (Д. П. Коновалов)
(рис. 7, а, б, в).Состав Состав СоставРис. Т..Диаграммы температура кипения — состав смеси:с —смеси жидкостей с неограниченной смешиваемостью, для которых температура кипения возрас¬
тает правильно; б—смеси, дающие минимум температуры кипения; в — смеси, дающие максимум
температуры кипения.Если жидкости не взаимодействуют, но неограниченно смешиваются
(например, два углеводорода), получается кривая, изображенная на
рис. 7, а. Ординаты в точках Л и В (чистые жидкости) представляют
температуры кипения жидкостей. Нижняя кривая (испарения)—это-
кривая температуры кипения жидкости в зависимости от состава, отло¬
женного на горизонтальной прямой. Верхняя кривая (конденсации) вы¬
ражает состав пара, находящегося при каждой данной температуре
в равновесии с кипящей жидкостью. Таким образом, смесь состава,
определяемого точкой Хь закипит при температуре t\ и выделит пар
состава Х[, соответствующего проекции точки Pi на горизонтальную
ось (из точки ci). Если этот пар (в холодильнике) сконденсировать
в жидкость (того же состава) и снова нагреть до кипения, то она за¬
кипит при температуре, определяемой ординатой точки с2 (t2), и выделит
пар состава Х'2, соответствующего проекции точки р2, который снова
можно сконденсировать в жидкость, кипящую уже при температуре,
равной ординате точки с3, и выделяющую пар состава, определяемого
проекцией точки р3 на горизонтальную ось. Продолжая операцию и идя
по подобной лестнице справа налево вниз в сторону более низкокипя-
щей жидкости, мы в конце концов выделим чистую жидкость А. Если
так же проследить за составом каждый раз остающейся в перегонной
колбе жидкости, то окажется, что она обогащается жидкостью В, и
в остатке будет чистая высококипящая жидкость В. Все сказанное,С2 /А (я) \С2/В(я+1)ав
СПОСОБЫ ВЫДЕЛЕНИЯ ИНДИВИДУАЛЬНЫХ ВЕЩЕСТВ31строго говоря, относится к равновесиям, установление которых требует
времени и которые в процессе перегонки не достигаются. Чтобы по воз¬
можности приблизиться к достижению равновесий, употребляют раз¬
личные приборы для фракционной перегонки или ректификации — де¬
флегматоры и колонны (рис. 8, см. также рис. 1). В этих вертикально
поставленных над перегонной колбой приборах происходит частичная
конверсия пара, который, прорываясь через
флегму (стекающий обратно конденсат), на¬
правляется в вертикально поставленный холо¬
дильник.В колоннах и других более совершенных
ректификационных приборах конденсация
пара в флегму происходит в обратном холо--
дильнике выше колонны, причем кран позво¬
ляет направлять желаемую часть флегмы в
приемник (см. рис. 8). Стекающая обратно
жидкость (флегма), полученная за счет кон¬
денсации пара и потому обогащенная легко-
кипящей составной частью, в нижних узких
местах шаров дефлегматора, или на тарелках
крупных колонн, или на «насадке» малых ко¬
лонок, приходит в соприкосновение с новой
порцией пара, прорывающегося через флегму,
что способствует приближению к равновесию
и, следовательно, к работе прибора в соответ¬
ствии с «ходом по лестнице», которая только
что была описана.Существенно, чтобы ректификационный
прибор работал в адиабатических условиях,
т. е. чтобы не было (или был минимальным)
теплообмена пара и флегмы с окружающей
средой.Различные дефлегматоры и современные ректифи¬
кационные лабораторные приборы имеют разную раз¬
решающую способность, которая выражается числом
«теоретических тарелок» или теоретических ступеней
разделения. Пользуясь кривой состав пара — состав
жидкости (для всего интервала температуры кипения),
можно рассчитать число теоретических тарелок (ч. т. т.),
необходимое для обогащения ректифицируемой смесиот данного состава до другого данного состава при выбраииой скорости ректификации.
Эта скорость измеряется так называемым флегмовым числом о;R ...° = -р (1)Рис. 8. Прибор для пере¬
гонки (эффективность 80
теоретических тарелок):1 — перегонная колба; 2—элек¬
трический нагреватель; 3—под¬
ставка; 4—колонна; 5 —обмотка
(спираль сопротивления одного
из греющих сегментов); 6—го¬
ловка; 7 — кран; 8 — холодиль¬
ник; 9 — воронка; 10— приемник
Перкина; И— круглодонная кол¬
ба; 7*1 — 7*5 — термометры нлн
термопары.где R— количество жидкости («флегмы»), возвращающейся вниз по колонне, а Е—
количество жидкости, отбираемой за то же время в дистиллят.Чем выше флегмовое число, тем лучше разделение и тем медленнее идет раз-
гонка. Существует для каждой системы указанного рода «минимальное флегмовое
число», ниже которого разделение уже невозможно.Количество выходящих из колоины паров (они все конденсируются в жид¬
кость D) складывается из количества флегмы R, возвращаемой в колонну, и количе¬
ства флегмы Е, отбираемой (по нашему произволу) в приемник (дистиллят):D—R + E (2)Обозначим через Y мольную долю более легкокипящей компоненты в паре, а че¬
рез X и ХЕ мольные доли той же компоненты в кубовой жидкости и дистилляте.
Тогда и для этой легкокипящей компоненты справедливо равенство (3), подобное
равенству (2);DY = RX+EXe ' (3)
32ВВЕДЕНИЕПодставив значение D в уравнение (3), получаем:RX ЕХГ(4)Разделив числители и знаменатели правой части уравнения на Е и приняв во внима¬
ние соотношение (1), приходим к уравнению «рабочей линии колонны»:vX+ ■(5)где при заданном значении ХЕ мольные доли X и У являются переменными.«Рабочая линия» колонны выражает зависимость состава пара У от состава
ректифицируемой жидкости X при выбранном флегмовом числе v и заданном составе
дистиллята ХЕ. Отложим теперь на оси абсцисс состав жидкости X, а на оси ординат
состав пара У в мольных долях одной (например, более легкокипящей) из составных
частей смеси при нормальном давлении и меняющейся температуре, каждый раз соот¬
ветствующей температуре кипения смеси данного состава X.Определим теперь из уравнения (5) флегмовое число как функцию состава
пара У при определенном выбранном значении X, равном Xi:v + 1Xi-1V + 1 ВОткудаХг(6)(7)Уравнение рабочей линии (5) для выбранного состава пара Ye соответствует
семейству прямых (с разными v). При бесконечном флегмовом числе и = оо уравне¬
ние рабочей линии будет X = У. Совместное ре¬
шение этого уравнения и уравнения (5) дает точ¬
ку пересечения D любой рабочей линии (с раз¬
ными v) с рабочей линией при v = 0. Это точки с
координатами Хе, Ye, причем Хе = Ye, посколь¬
ку точка лежит на рабочей линии с о = «>. Все
семейство рабочих линий для данного Хе заклю¬
чено между двумя крайними линиями, одна из
которых — биссектриса с о = “ и X = У, а дру¬
гая соответствует минимальному флегмовому
числу аМин:X,Y,-X,Рис. 9. Рабочие линии перегонки:
OD — при бесконечном флегмовом чис-
ле (°оо); ^О — прп минимальном для
X флегмовом числе (»мин); AD — ре¬
альная рабочая линия.Минимальное флегмовое число — функция
не только выбранного состава дистиллята (выра¬
жаемого через Хе), но и исходного состава пере¬
гоняемой жидкости (выражаемого через Xi). Для
исходного состава жидкости Xi и находящегося
с ней в равновесии состава пара Y\ (в мольных
долях более легколетучего вещества) рабочая ли¬
ния (прямая) с минимальным флегмовым числом
проходит через точку XJ{ кривой и через общую точку пересечения семейства рабочих
линии для состава дистиллята Хе.При приближении к бесконечному флегмовому числу разделение компонентов
наилучшес, но процесс становится бесконечно медленным и отбор дистиллята прибли¬
жается к нулю. Минимальное флегмовое число представляет собой другую границу,
по достижении которой уже невозможно выделение пара заданного состава *.Все рабочие линии, соответствующие реально возможным для достижения цели
рабочим линиям, находятся между этими крайними. На схеме (рис. 9) даны три ра¬
бочие линии: Омип, и» и средняя между ними Орсальн. Лесенка ступеней от рабочей
линии до кривой состав пара — состав жидкости и изображает количество теоретиче¬
ских тарелок, необходимое, чтобы подняться от исходного состава жидкости Xi до* Графически это выражается в том, что от кривой состав жидкости — состав
пара нельзя начать строить лесенку, откладывая горизонталь от отправной точки
XY направо до пересечения с рабочей линией, ибо кривая и рабочая линия (с мини¬
мальным флегмовым числом) именно в этой точке пересекаются.
СПОСОБЫ ВЫДЕЛЕНИЯ ИНДИВИДУАЛЬНЫХ ВЕЩЕСТВ33состава дистиллята Х& при выбранном флегмовом числе v. Чем ближе рабочая линия
будет лежать к рабочей линии с vтем меньшее число теоретических тарелок нужно
для разделения, как это видно из рис. 9 (пунктирные и сплошные ступени), но тем
медленнее процесс.Экспериментально легко установить ч. т. т. данного ректификационного прибора и
таким образом целесообразно выбрать прибор и режим его работы (флегмовое число).Рассмотрим равновесные кривые температура кипения — состав
смеси (рис. 7,6 и в, стр. 30), соответствующие случаю слабого взаимо¬
действия образующих смесь жидкостей (сольватации или ассоциации).
Эти графики имеют два вида: с минимумом температуры кипения и
с максимумом, в которых кривые состава пара и жидкости касаются
друг друга. Точка максимума или минимума температуры кипения де¬
лит весь график на две половины, из которых каждая подобна кривым
на рис. 7, а, и к ней могут быть отнесены все те же рассуждения. Из
графика с минимумом температуры кипения следует, что, какой бы ис¬
ходный состав жидкости мы ни взяли, мы будем в процессе фракциони¬
рования получать жидкость того состава, который соответствует мини¬
муму температуры кипения, а в остатке будет чистая жидкость А или В,
в зависимости от того, исходили ли мы из состава, соответствующего
левой или правой от минимума части кривой. В случае кривой с макси¬
мумом температуры кипения картина сходная, только отгон по мере
фракционирования будет обогащаться чистой жидкостью А или В,
в зависимости от того, соответствовал ли исходный состав левой или
правой части кривой (считая от максимума); останется жидкость, все
более приближающаяся к составу, соответствующему максимуму тем¬
пературы кипения. Составы жидкостей, соответствующие минимуму и
максимуму кривой, называются постоянно кипящими или азеотропными
смесями. Они не разделимы фракционной перегонкой.Чтобы их разделить, надо употребить какой-либо другой физический
метод разделения или прибегнуть к химическим методам. Или, наконец,
добавляя третью жидкость, получить иную азеотропную смесь с мини¬
мумом температуры кипения, в состав которой входила бы одна из двух
дававших первый азеотроп жидкостей, тогда другой оставшийся компо¬
нент, не входящий в азеотропную смесь, мог бы быть отделен перегон¬
кой. Этот прием применяется часто. Приводим несколько примеров
азеотропных бинарных смесей с минимумом и максимумом температуры
кицения (табл. 1, стр. 34).Примером постоянно кипящей смеси с минимумом температуры ки¬
пения может служить смесь из 95,5% этилового спирта и 4,5% воды
(спирт 96 объемн.% или иначе 96°), кипящая при' 78,15 °С. Вода кипит
при 100 °С, а безводный этиловый спирт при 78,3°С. Чтобы обезводить
спирт 96°, приходится химически связывать воду, например, негашеной
известью.Кристаллизация. Для очистки твердых веществ их перекристалли-
зовывают, подбирая такой растворитель или смесь растворителей, в ко¬
тором разница растворимости вещества при нагревании и на холоду
была бы большой. Смысл операции в том, что примеси, которых, ко¬
нечно, меньше, чем основного вещества, остаются в маточном растворе
и не выкристаллизовываются. При более быстрой кристаллизации (бы¬
стром охлаждении нагретого раствора) выпадают более чистые мелкие
кристаллы (мелкие кристаллы содержат меньше включений внутри
кристалла). Маточный раствор отделяют отсасыванием на воронке Бюх¬
нера или других подобных приспособлениях и промывкой кристаллов
холодным растворителем. Если нужно разделить кристаллизацией два
и более вещества, содержащиеся в смеси в сравнимых количествах,
применяется дробная (или фракционная) кристаллизация.
S4ВВЕДЕНИЕТаблица 1. Азеотропные бинарные смеси с минимумом
и максимумом температуры кипенияКомпонентыАзеотропные смеситемпературасостав,объемн.%температураназваниекипения,°Скипения,°СС минимумом температуры кипения50.059.154.2
64,958.367.8
ния64,779.9Экстракция. Во многих случаях, по крайней мере для первоначаль¬
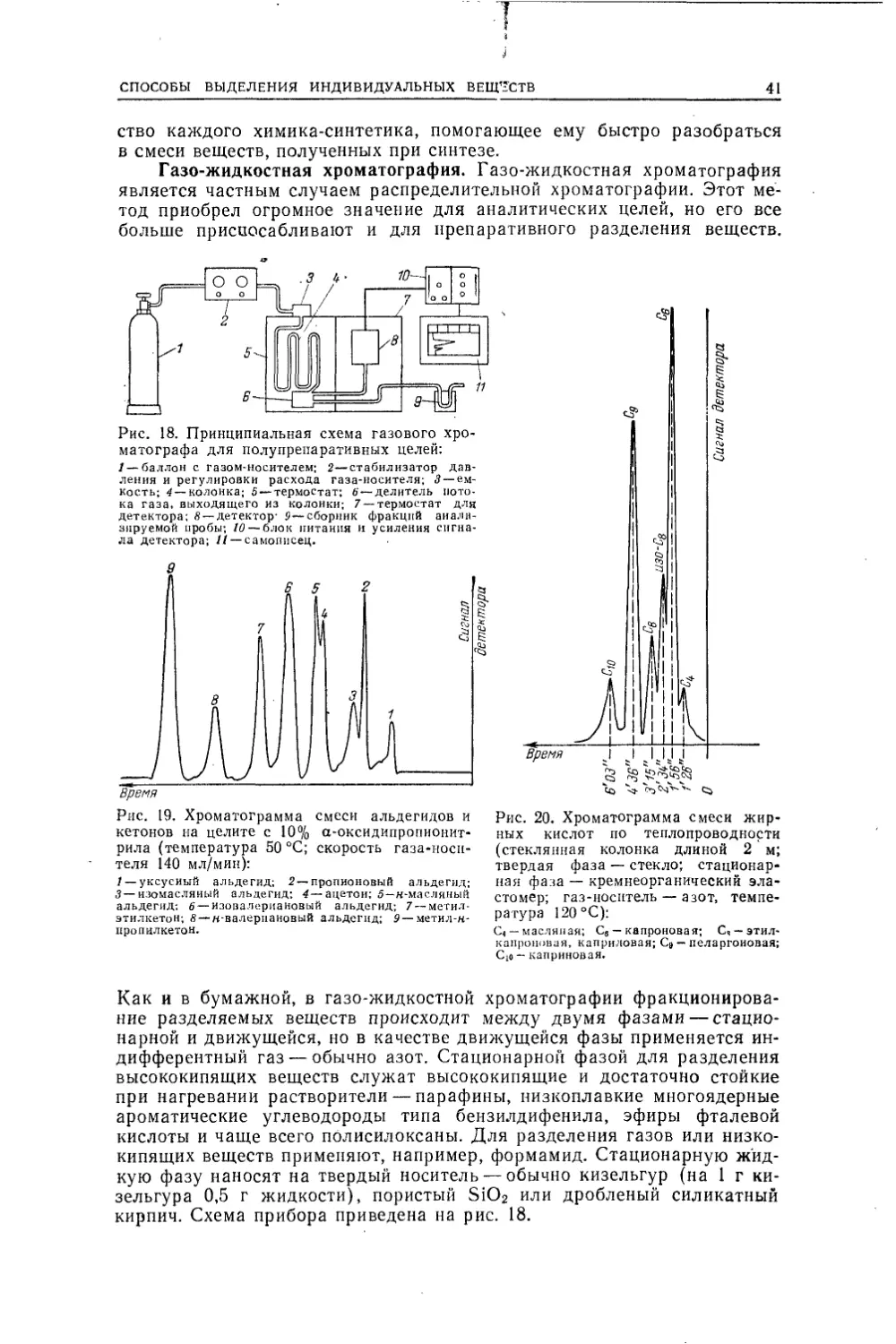
ного грубого выделения вещества из сложной смеси, применяется
экстрагирование растворителем, который растворяет данное вещество и
не растворяет другие присутствующие вещества. Простейший прибор дляГ ексан69,073,1Метанол64,6526,9Г ептан98,4348,5Метанол64,6551,5Циклогексан81,463,0Метанол64,6537,0Циклогексан81,469,5Этанол78,530,5Бензол80,160,5Метанол64,6539,5Бензол80,167,6Этанол78,532,4С максимумом температуры кипеАцетон56,520Хлороформ61,280Метилэтнлкетон79,683,0Хлороформ61,217,0тел:/—круглодонная колба;2—эстрактор с гильзой;3—пароотводная трубка;4— трубка для экстракта.Рис. И. Экстракторы для экстрак¬
ции жидкостей:. «—жидкостью легче воды; б —жидкостью
тяжелее воды' 1 — колба с экстрагирующей
жидкостью; 2—трубка для отвода пара
и возврата экстрагента; 3—воронка; 4 —
экстрактор.экстракции (из раствора) —делительная воронка, применяющаяся очень
часто в лабораторной практике. Это круглый, грушеобразный или ци¬
линдрический, достаточно толстостенный сосуд с краном внизу и при¬
шлифованной пробкой сверху. Из раствора смеси веществ (например,
СПОСОБЫ ВЫДЕЛЕНИЯ ИНДИВЙДУАЛЬНЫХ ВЕЩЕСТВ35в воде) встряхиванием с растворителем не смешивающимся с раствором
(обычно эфир или какой-либо легкокипящий углеводород или хлоро¬
форм) извлекают все, что переходит (по закону распределения) в этот
растворитель, и после расслаивания отделяют его от исходного раствора,
сливая жидкость через кран. Экстракцию новыми порциями раствори¬
теля повторяют. Существуют специальные экстракторы для извлечения
из твердой (рис. 10) и жидкой фазы (рис. И). Последние в свою оче¬
редь подразделяются на приборы для применения экстрагирующей жид¬
кости легче воды (рис. 11, а) и тяжелее воды (рис. 11,6).Особенно важны приборы для экстракции жидкости жидкостью,
сыгравшие огромную роль для извлечения и индивидуализации органи-речь идет о разделении двух веществ, находящихся в водном растворе.
Ставят прибор в положение, как показано на рис. 13, наливают в ка¬
ждую экстракционную трубку, кроме трубки № 1, воду, насыщенную
эфиром, так, чтобы при повороте системы на 90° вода заняла объем до
перетока экстракционной трубки. В трубку № 1 вводят раствор под¬
лежащей разделению смеси двух веществ, тоже до перетока. Затем
сюда же (горизонтальное положение экстракционных трубок) вводят
примерно равный объем насыщенного водой эфира. Прибор покачивают
20—30 раз и, дав отстояться, поворачивают на 90°, причем эфирный
экстракт переливается в экстракционную трубку № 2, а в трубку № 1
вводят новую порцию эфира и повторяют операцию, пока в трубку № 12
не попадет эфирный экстракт. Наиболее полное разделение достигнуто
в 1-й и 12-й трубках, но уже и во 2-, 3-, 4- и 9-, 10-, 11-й обычно разде¬
ление происходит достаточно полно и лишь в средних трубках оба слоя
содержат смесь веществ. Начальные трубки содержат в обоих слоях
лучше растворимый в воде компонент, конечные — лучше растворимый
в эфире компонент.ческих веществ из сложных
природных смесей раститель¬
ного или животного происхож¬
дения.Рис. *2. Прибор для многократной
фракционной экстракции >из 12 трубок.
Положение трубок изменяют поворотом
шарнира.Рис. 13. Секция прибора для
многократной фракционной экс¬
тракции:/—экстракционная трубка № I; 2— пе¬
реток в следующую трубку; 3—экс¬
тракционная трубка № 2.
36ВВЕДЕНИЕТаблица 2. Количество растворенного вещества в каждой фазе при многократной
стадиях фракционирования при работе на аппарате из 12 трубок; В — верхняя фаза;Трубки2виВHВHВHНачальное состояние
Равновесие после встряхнванняР• 1q1-й перенос—qPРавновесие после встряхиванияPQq2P2pq————2-й перенос—q2PQpqP2———Равновесие после встряхиванияpq2q32 p>q2pq2P3p2q——3-й перенос—q3pq22 pq22 P2qp2qP3—",Л-й переносРавновесие после встряхиванияpq11qчq1.2pq10
piq10Pqlcpq11p2q9
pVPVpV°pVpVpVp*q9Количественная сторона процесса экстракции такова. Возьмем единицу массы
каждого из веществ. Пусть объемы растворителей и коэффициент распределения
данных двух веществ между этими растворителями будут таковы, что после каждого
встряхивания в верхней эфирной фазе находится доля р одного из данных веществ,
а в нижней водной фазе доля q = (1—р). Распределение выбранного вещества
по трубкам (для аппарата из 12 трубок) после каждой операции приведено в табл. 2.Доли величин р и q зависят от коэффициента распределения между фазами. Чем
больше разница в коэффициентах распределения обоих веществ, тем скорее и полнее
пройдет разделение.Коэффициент распределения К каждого из веществ между обеими фазами равен_ г/л в верхней фазе
г/л в нижней фазеилир/у9 _ ру в
(1—p)/fB (1 — р)°эОткудаКу3
Р Киэ+v вгде vB — объем эфира; ув — объем воды.Подставив эти значения в выражение распределения я-ной операции (см. табл. 2),
мы найдем концентрацию каждого из веществ в водной и эфирной фазах в экстрак¬
ционных трубках в зависимости от коэффициента распределения.ХроматографияОткрытый в начале текущего столетия русским ученым М. С. Цве¬
том способ разделения смеси веществ путем адсорбции приобрел в по¬
следние десятилетия огромное значение. Без него немыслима теперь
работа в лаборатории. В настоящее время способ дифференцировался
в следующие важнейшие приемы:Хроматография на колонке.Распределительная хроматография на бумаге.Тонкослойная хроматография (на пластинке).Газо-жидкостная хроматография.Хроматография на колонке (адсорбционная). Работают со стек¬
лянной трубкой, наполненной порошкообразным адсорбентом. Чаще,
всего применяют окись алюминия (специальная марка — для адсорб¬
ции), силикагель, крахмал, сернокислый барий. В принципе можно при¬
менять любой адсорбент, не вступающий в реакцию с разделяемыми
веществами и растворителями.
СПОСОБЫ ВЫДЕЛЕНИЯ ИНДИВИДУАЛБНЫХ ВЕЩЕСТВ37экстракции (теоретическое распределение растворенного вещества на различных
Н — нижняя фаза)5в78910п12ВнвнВнвнВнвнвНВнрVpVp5q6рУрУрУрУрУрУрУрУрУр10?Р,09Р“Р5Я7pYpGq6рУрУpVрУрУрУрУр'УрУpnqр'УPUр11?Перед наполнением колонки приготовляют взвесь адсорбента в наи¬
более индифферентном растворителе и выливают ее в трубку, снабжен¬
ную снизу фильтром, или в трубку, укрепленную на
пробке в маленькой воронке с фильтрующим дном, и
очень медленно отсасывают. В наполненную таким
способом колонку (рис. 14), в которой сверху остав¬
ляют свободный объем, вливают раствор разделяемых
веществ в том же индифферентном растворителе и
дают ему профильтроваться через колонку. Вещества
адсорбируются частично в одной и той же зоне,
частично происходит разделение, причем менее адсор¬
бирующееся вещество спускается несколько ниже по
адсорбенту в колонке. После этого начинается про¬
мывка (элюирование) тем же или одним из следую¬
щих по силе растворителей, причем хроматографиче¬
ская колонка работает в общем подобно ректифика¬
ционной, с распределением разделяемых веществ меж¬
ду твердой фазой адсорбента и жидкой фазой раство¬
рителя. Оба вещества разделяются постепенно по дли¬
не колонки, опускаясь вниз с разной скоростью. При
этом зона поглощения каждого из веществ занимает
цилиндрический слой с максимумом концентрации по
среднему сечению этого слоя. За продвижением окра¬
шенных веществ (откуда и слово хроматография) п ^
можно следить глазом. Разделение бесцветных, но ■ д”я адсорбционной
люминесцирующих веществ наблюдают в свете ртут- хроматографии:
ной лампы. При исследовании всех других веществ / — капельная ворон-
производят перемещение вниз (вплоть до вымывания „оваТ пробка7Рз3-
в раствор) сначала нижней зоны адсорбции с менее трубка <28x1.7 см);л « * л 4 —неплотная пробкаадсорбируемым, а затем второй ЗОНЫ адсорбции С ОО- из ваты; 5-приемник
лее адсорбируемым веществом (элюирование). За 1250 мл)-
элюированием можно следить, отбирая капли выте¬
кающего раствора на часовое стекло и выпаривая их. Сначала идет
чистый растворитель, затем появляется первое вещество, потом снова
чистый растворитель, затем второе вещество. Можно автоматически со¬
бирать в разные сосуды порции элюата и следить за содержанием в них
вымытого вещества по коэффициенту преломления раствора (проточным
рефрактометром Обреимова).
3SВВЕДЕНИЕВещества с разными функциональными группами располагаются
в следующий ряд по своей способности адсорбироваться (при прочих
равных условиях):RH<R0CH3<RN02<RN(CH3)2<R-со—och3<rnh—со—сн3<
<RNH2<ROH<R—СО—NH2<R—СО—ОНАроматические углеводороды адсорбируются сильнее, чем жирные
предельные — алифатические; непредельные — сильнее, чем предельные.Растворители по их десорбирующей (элюирующей, вымывающей)
способности располагаются в ряд, почти параллельный их диэлектриче¬
ской проницаемости (величины в скобках): вода (81), метанол (31,2),
этанол (25,8), ацетон (21,3), этилацетат (6,1), этиловый эфир (4,4),
хлороформ (5,2), бензол (2,3), четыреххлористый углерод (2,2), цикло¬
гексан (2), петролейный эфир (1,9).. Элюирование производится растворителем, расположенным в этом
ряду выше первого примененного растворителя.Распределительная хроматография на бумаге. Отношение между
только что описанной адсорбционной и распределительной хроматогра¬
фией можно понять из приведенной схемы (рис. 15,а и б).Как видно из рис. 15,6, в распределительной хроматографии зерна
адсорбента адсорбировали один растворитель, а промывка происходит
другим, не смешивающимся с первым, растворителем и распределение
веществ идет между обоими этими растворителями. Наибольшее приме¬
нение этот тип хроматографии получил в
виде бумажной хроматографии. Волокна
бумаги адсорбируют воду, и распределение
разделяемых веществ идет между не смеши¬
вающимся с водой растворителем и водным
слоем волокон бумаги. Мы ограничимся ,
разбором именно этого наиболее важного
случая.Для проведения распределения лист
специальной фильтровальной бумаги разме¬
ром, например, 20 X 25 см зажимают между
двумя стеклянными пластинками так, что¬
бы узкий край (20 см) выдавался- из
стекла на 3,5 см. На этот край из капиллярной пипетки на расстоянии
2,5 см от края листа и 2 см друг от друга наносят пятнами испытуемый
раствор в количестве не более 0,005 мл. В числе этих пятен наносят для
сравнения и растворы заведомо известных веществ. Растворителю дают
высохнуть, если нужно, слегка подогревая инфракрасной лампой. Затем
для равномерного увлажнения лист пропаривают под колпаком водяным
паром и помещают его вертикально в закрытую камеру, насыщенную
при данной температуре парами того растворителя, которым будет про¬
изводиться проявление. В руководствах по хроматографии указывается,
какого рода растворители лучше подходят для тех или иных типов
веществ. Во всяком случае это должен быть растворитель (или смесь
растворителей), не смешивающийся с водой и ею насыщенный. Роль
этого растворителя будет состоять в том, чтобы из водной фазы, адсор¬
бированной на волокнах бумаги, в результате капиллярного продвиже¬
ния фракционированно извлечь и разделить вещество, не растворив вод¬
ной фазы бумажных волокон. В качестве таких растворителей приме¬
няют, например, насыщенные водой бутанол-1, бутанол-2, гексанол-1,
циклогексанол, циклогексанон, фенол, бутилацетат и др.Затем нижний край листа (ниже нанесенных пятен) погружают
в лоток с насыщенным водой выбранным растворителем и оставляютРис. 15. Сечение колонки:
а—для адсорбционной хроматогра¬
фии; б — для распределительной
хроматографии.
СПОСОБЫ ВЫДЕЛЕНИЯ ИНДИВИДУАЛЬНЫХ ВЕЩЕСТВ39в камере на несколько часов (до 2 суток), пока фронт растворителя не
поднимется, немного не доходя до верха листа. После этого лист вы¬
нимают из камеры и делают переместившиеся вверх пятна адсорбиро¬
ванных веществ видимыми посредством какой-либо цветной реакции.
Перемещение пятна исследуемого вещества на то же расстояние, что
и известного, считается достаточным для его идентификации. В случае
применения стандартной бумаги, постоянной температуры и определен¬
ных, установленных методикой растворителей такая идентификация мо¬
жет быть произведена и по измеренной величине Rf пятна исследуемого
вещества путем сравнения его с величинами, приведенными в справоч¬
ных таблицах или оригинальных работах. Величина Rf определяется
как отношение расстояний, пройденныхисследуемым веществом И фронтом Бутанал-муравьиная кислота ^
растворителя за одно и то же время,
и является характерной константой
для вещества. В случае необходимости
(когда разделяемых веществ много
или когда Rf в данном растворителе
близки) применяют двухмерную рас¬
пределительную хроматографию. Для
этого обработанный указанным обра¬
зом и высушенный, но не подвергну¬
тый цветной реакции лист снова про¬
паривают и помещают в камеру на
лоток длинной стороной. В лоток за¬
лит уже новый растворитель, тоже на¬
сыщенный водой. Остальная обработка
та же. В этом случае получается хро¬
матограмма типа приведенной на
рис. 16.Бумажная хроматография обычно
применяется для идентификации ве¬
ществ в смеси, но может быть исполь¬
зована и для грубого количественного
определения, например фотометриче¬
ски— по цвету или по площади пятен или вырезыванием пятна до обра¬
ботки цветным реактивом (его положение может быть определено по
положению соседнего пятна, подвергнутого действию реагента) и элюи¬
рованием из него подходящим растворителем исследуемого вещества.
Эту пробу можно затем подвергнуть любому виду количественного ми¬
кроанализа. Для препаративных целей получаемые таким способом ко¬
личества вещества слишком малы.Тонкослойная хроматография. Все большее значение получает
предложенная Н. А. Измайловым и М. С. Шрайбером тонкослойная
хроматография, которая в принципе может быть и адсорбционной и
распределительной, но обычно применяется ее адсорбционный вариант.
Она совмещает преимущества хроматографии в колонке (широкий вы¬
бор адсорбента, возможность препаративного применения) и бумажной
хроматографии (быстрота, пригодность для аналитических целей). По
приемам работы этот вид хроматографии более похож на бумажную
хроматографию.Адсорбент (окись алюминия той или иной марки, кизельгур, крах¬
мал, целлюлоза, порошкообразный полиамид и др.) замешивают с жид¬
костью (обычно с водой) в пасту и наливают на обезжиренную стеклян¬
ную пластинку размером ~ 10X20 или ~ 20X20 см или, что лучше,
в специальную камеру такого же размера с закраинами определеннойCys-SH
Gly Ssr Ф% JGlU.Ts'$$ та.jLys^jHiSValUryPhert Шк ШМЛгЗlie ЯШЩw Pro*fШтwr'Рис. 16. Двухмерная хроматограмма
смеси аминокислот после проявления
ниигидрином.
40ВВЕДЕНИЕвысоты (рис. 17). Излишек пасты сверх нужной толщины слоя снимают,
прокатывая вальком, и слой высушивают при 100—150 °С. Такой слой
(иногда с подмесью связующего — гипса) называют закрепленным
слоем. Чаще работают с незакрепленным слоем адсорбентов, лишь при-
трамбовав их к стеклу прокатыванием цилиндром. Для аналитических
целей наносят слой в 0,25 мм, для препаративных — от 0,75 до 2 мм. Для
ориентировки на пасту опускают из микропипетки 0,001 см раствора
изучаемой смеси, дают ему растечься, а затем в центр пятна — различ¬
ные растворители (элюенты) и выбирают подходящий. После этого на
пластинку со свежим слоем на линию, параллельную краю пластинки и
находящуюся на расстоянии 1 см от него (стартовая линия), наносят
такое же, как и в предварительном опыте, количество раствора испытуе¬
мой смеси (содержащей доли миллиграмма вещества) и рядом на той-Ц T-J-1 ■дУ-—Л6Рис. 17. Прибор для тонкослойной хроматографии:
а — устройство для прокатывания слоя адсорбента; б— камера для хромато¬
графирования с растворителем (элюентом) на дне; в — пластинка с разделен¬
ной смесью А из двух известных веществ В и С; / — цилиндр для прокатыва¬
ния; 2—пластинка; «3—адсорбент.же стартовой линии, на расстоянии ~2 см от этой точки, известное ве¬
щество и через 2 см по стартовой линии — остальные контрольные веще¬
ства. Пластинку краем, ближайшим к стартовой линии и параллельным
ей, опускают в наклонном положении в выбранный растворитель —
элюент, налитый на дно замкнутой стеклянной камеры, насыщенной его
парами. Стенки камеры и ее дно оклеены полосами фильтровальной
бумаги. Строгого термостатирования не требуется, но примерное по¬
стоянство температуры необходимо. Еще лучше, если растворитель по¬
дается на край адсорбента через капиллярнуй щель. Через 10—30 мин
пластинку вынимают и высушивают элюент. Вслед за этим «проявляют»
невидимые пятна веществ, пробег которых может составить до 10 см.
Если речь идет об окрашенных веществах, пятна видны и проявление
не требуется. Отпадает оно и для веществ, люминесцирующих в уль¬
трафиолете. «Проявляют» или парами иода, растворимыми во многих
веществах, или раствором перманганата, дающим пятна двуокиси мар¬
ганца, или другим реагентом, взаимодействующим с исследуемыми
веществами с образованием окраски. Эти приемы обеспечивают сравне¬
ние длины пробега компонентов разделяемой смеси и контрольных
веществ и идентификацию веществ смеси по величине Rf. «Проявле¬
ние», очевидно, служит только для того, чтобы сделать видимым пятно
идентифицируемого вещества. Определив из этих опытов длину пробега
и, следовательно, положение пятна каждого вещества смеси, можно
отделить уже без проявления соответствующие участки адсорбента и
раздельно элюировать каждое вещество.Тонкослойная хроматография — ныне необходимое подсобное сред¬
СПОСОБЫ ВЫДЕЛЕНИЯ ИНДИВИДУАЛЬНЫХ ВЕЩЕСТВ41ство каждого химика-синтетика, помогающее ему быстро разобраться
в смеси веществ, полученных при синтезе.Газо-жидкостная хроматография. Газо-жидкостная хроматография
является частным случаем распределительной хроматографии. Этот ме¬
тод приобрел огромное значение для аналитических целей, но его все
больше приспосабливают и для препаративного разделения веществ.Рис. 18. Принципиальная схема газового хро¬
матографа для полупрепаративных целей:1 — баллон с газом-носителем; 2—стабилизатор дав¬
ления и регулировки расхода газа-носителя; 3 — ем¬
кость; 4 — колонка; 5—термостат; 6—делитель пото¬
ка газа, выходящего из колонки; 7 — термостат для
детектора; 8 — детектор- 9—сборник фракций анали¬
зируемой пробы; 10 — блок питания и усиления сигна¬
ла детектора; // — самописец.Рис. 19. Хроматограмма смеси альдегидов и
кетонов на целите с 10% а-оксидипропионит-
рила (температура 50 °С; скорость газа-иоси-
теля 140 мл/мин):/ — уксусный альдегид; 2 — гтропионовый альдегид;
3— изомасляиый альдегид; 4— ацетон; 5 — «-масляный
альдегид; 6 — изовалериановый альдегид; 7-мегил-
этилкетон; 8 —-«-валериановый альдегид; 9 — метил-н-
пропилкетон.Рис. 20. Хроматограмма смеси жир¬
ных кислот по теплопроводности
(стеклянная колонка длиной 2 м;
твердая фаза — стекло; стационар¬
ная фаза — кремнеорганический эла¬
стомер; газ-носитель — азот, темпе¬
ратура 120 °С):С4 — масляная; С8 — капроновая; Сч —этил-
каироновая, каприловая; С» — пеларгоиовая;
— каприновая.Как и в бумажной, в газо-жидкостной хроматографии фракционирова¬
ние разделяемых веществ происходит между двумя фазами — стацио¬
нарной и движущейся, но в качестве движущейся фазы применяется ин¬
дифферентный газ — обычно азот. Стационарной фазой для разделения
высококипящих веществ служат высококипящие и достаточно стойкие
при нагревании растворители — парафины, низкоплавкие многоядерные
ароматические углеводороды типа бензилдифенила, эфиры фталевой
кислоты и чаще всего полисилоксаны. Для разделения газов или низко-
кипящих веществ применяют, например, формамид. Стационарную жид¬
кую фазу наносят на твердый носитель — обычно кизельгур (на 1 г ки¬
зельгура 0,5 г жидкости), пористый Si02 или дробленый силикатный
кирпич. Схема прибора приведена на рис. 18.
42ВВЕДЕНИЕРазделительная колонка 4 представляет собой длинную (от не¬
скольких десятков сантиметров до нескольких метров) тонкую (4—6 мм)
трубку, тщательно и равномерно заполненную зернами кизельгура рав¬
ной величины, смоченными стационарной жидкой фазой. Трубка изо¬
гнута так, чтобы она помещалась в термостате 5, обогреваемом парами
кипящей жидкости (в других конструкциях — нагревателем сопротив¬
ления). Мощность таких колонок эквивалентна мощности перегонных
колонн в сртни и иногда даже в тысячи теоретических тарелок. В ем¬
кость 3 вводят исследуемую смесь. Через систему пропускают чистый
азот (аргон или гелий). Газы, выходящие из колонки, вводят в анали¬
затор той или иной конструкции (которых много) с автоматической
записью. Различные типы хроматограмм показаны на рис. 19 и 20.По горизонтальной оси отложено время, по вертикальной — концен¬
трация вещества, элюируемого азотом, пропорциональная величине сиг¬
нала детектора. По площади, ограниченной пиком, можно судить об
общем количестве вещества. При хорошем разделении пики не нала¬
гаются друг на друга. На основании опыта с известным веществом уста-
наливают место (или, правильнее, время) появления пика, что дает
возможность идентифицировать вещество. С помощью анализаторов
можно определить наличие и количество элюируемой примеси, разлагая
основное вещество, что допустимо в анализах, либо не разлагая—для
препаративных целей. В первом случае элюат сжигают и непрерывно
измеряют теплопроводность азота с примесью образовавшегося С02, что
и служит мерой количества элюата. Во втором случае также часто при¬
меняют термоанализатор, непрерывно измеряя теплопроводность выхо¬
дящей смеси газов либо плотность выходящего газа и сравнивая ее
с плотностью «чистого» азота в параллельно поставленном контроль¬
ном опыте. Чувствительность метода такова, что можно определять
0,01—0,001% вещества в азоте.Газо-жидкостная хроматография широко вошла в практику с на¬
чала 50-х годов этого столетия и стала одним из незаменимых и глав¬
ных методов разделения малых количеств веществ — газов и любых
веществ, способных давать давление пара в несколько миллиметров
ртутного столба.Гель-хроматография. Еще более новым приемом разделения ве¬
ществ и их индивидуализации служит использование гелей. Опишем
здесь кратко гель-хроматографию (гель-фильтрацию). Примерная схема
установки приведена на рис. 21.Отличительной особенностью гель-хроматографии является то, что
в «сшитых» макромолекулах (стр. 280) гелей имеются заполненные рас¬
творителем поры определенных габаритов молекулярного размера, в
которые входят меньшие из разделяемых молекул и не входят боль¬
шие. Поэтому, в отличие от адсорбционной хроматографии, в гель-хро¬
матографии первыми проходят сквозь колонку (и первыми элюируются
растворителем) молекулы большего размера, а последними — самые ма¬
лые. Поскольку поры имеют разную величину, то выделяются и средние
фракции разделяемых веществ.Разделительная колонка наполняется зернами лиофильного или
гидрофильного геля. Примером первого могут служить природные ге-
леобразователи — агар, декстраны, например товарные препараты сефа-
декс G-25 и Q-50 (о декстранах см. стр. 453), или синтетические — поли¬
акриламид, «сшитый» полистирол.Раствор разделяемых веществ медленно просасывают нагнетатель¬
ным насосом через колонку снизу вверх и концентрацию раствора кон¬
тролируют на выходе по какому-либо физическому показателю, напри¬
мер измерением коэффициента преломления или спектрофотометрически.
АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИИ43В случае надобности раствор разделяемых веществ заставляют некото¬
рое время циркулировать и лишь затем элюируют растворителем.В качестве примера приводим кривую гель-хроматографии смеси
глюкозы и соответствующих олигосахаридов (см. стр. 439) вплоть доРис. 21. Схема циркуляцион¬
ной аппаратуры для гель-хро¬
матографии (чтобы гель не
слеживался, поток подается
снизу вверх):1 — колонка; 2— спектрофотометр на
потоке; 3~самописец; 4 — сосуд с
растворителем; 5 — насос.Рис. 22. Гель-хроматограмма смесн глю¬
козы, целлобиозы и других олигосахари¬
дов, вплоть до целлогексаозы в водном
растворе на сефадексе G-25.целлогексаозы в водном растворе на геле сефадекс G-25 (рис. 22). На
оси ординат отложены в качестве индикатора концентрации коэффициен¬
ты преломления, по оси абсцисс — объемы элюирующего растворителя.АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИИКачественный анализОбнаружение в образце органического вещества элементов органо¬
генов не представляет затруднений.Углерод. При нагревании смеси образца исследуемого вещества с
избытком порошка окиси меди образуется двуокись углерода, которую
поглощают баритовой водой [раствор Ва(ОН)2], защищенной от попа¬
дания СОг из воздуха. Выпадающий осадок ВаС03 указывает на при¬
сутствие углерода в пробе.Водород. Водород всегда содержится в органических веществах и
поэтому редко прибегают к его качественному открытию. Его можно
обнаружить косвенно при проведении пробы на углерод в удлиненной
пробирке, верх которой снаружи охлаждается. В присутствии водорода
на стенке ее конденсируется вода, что можно констатировать, напри¬
мер, по посинению бесцветного порошка безводного сульфата меди.Кислород. Так как надежных качественных реакций для обнаруже¬
ния кислорода нет, то о его присутствии судят по результатам количе¬
ственного анализа.Азот. Проще всего азот определять количественно по способу
Дюма (см. ниже). Однако если почему-либо требуется качественное
обнаружение, можно открыть азот по реакции Лоссена. В открытой
пробирке к пробе вещества примерно в 0,01 г прибавляют кусочек ме¬
таллического натрия примерно в 0,05 г. По окончании реакции (если
44ВВЕДЕНИЕреакция идет) пробирку нагревают, сначала осторожно, потом докрасна,
невзирая на горение натрия. Когда горение окончено, дно раскаленной
пробирки опускают в фарфоровую чашку, в которую налито 3—5 мл
воды. Конец пробирки лопается и сплав попадает в воду. После того
как остаток натрия прореагирует с водой, полученный раствор, содер¬
жащий цианистый натрий, образованный азотом, фильтруют и добав¬
ляют к нему каплю разбавленного раствора железного купороса, под¬
кисляют соляной кислотой до кислой реакции, затем прибавляют каплю
раствора хлорного железа. Посинение вследствие образования берлин¬
ской лазури указывает на наличие азота. Эта проба очень чувстви¬
тельна и дает положительный результат с большинством типов азоти¬
стых соединений, но не со всеми. Легко разлагающиеся ароматические
диазосоединения выделяют азот в газообразном состоянии и не обра¬
зуют в описанных условиях цианида. Поэтому часто заменяют каче¬
ственную пробу на азот количественным определением по Дюма (или
Дюма — Преглю, см. ниже).Сера. В результате сплавления пробы вещества с натрием, как это
описано при реакции на азот, в присутствии серы образуется сернистый
натрий, который открывают в растворе нитропруссидной реакцией или
по реакции с солями свинца или меди (II) (черный осадок).Можно также провести разложение по Кариусу (см. ниже пробу
на фосфор) и открыть серу, окисленную до серной кислоты, по образо¬
ванию осадка сернокислого бария.Галоиды. Толстую проволоку (~3 мм) красной меди прокаливают
в окислительном пламени газовой горелки до тех пор, пока пламя не
перестанет опрашиваться в зеленый цвет. По охлаждении проволоки на
конец ее наносят капельку (или кристаллик) испытуемого вещества.
При внесении в пламя горелки пламя окрашивается в зеленый цвет за
счет образования летучей галоидной меди. Это очень чувствительная
проба на С1, Вг и I, но гораздо менее чувствительная на F. Органиче¬
ские цианиды и при отсутствии галоидов тоже дают эту реакцию.Фосфор и другие элементы. Каплю (кристаллик) вещества запаи¬
вают вместе с 3—5 каплями дымящей азотной кислоты (d = 1,52) в
толстостенной трубке хорошего стекла (тугоплавкое стекло не обяза¬
тельно), оттягивая в толстостенный капилляр подлежащий запаиванию
конец. Постепенно нагревая трубку в специальной печи, доводят темпе¬
ратуру до 300—350 °С и поддерживают эту температуру в течение
3—5 ч. После этого выключают печь и дают пробе остыть. Осторожно
вынимают трубку, заматывая ее, по мере выдвижения из печи ее конца,
в полотенце так, чтобы незамотанным остался только капилляр, кото¬
рый осторожно вводят в пламя паяльной горелки (очки!). По размяг¬
чении стекла капилляра газы прорывают его и обращение с трубкой
становится безопасным. Конец трубки надрезают напильником, прика¬
саются к надрезу раскаленной стеклянной палочкой, после чего появ¬
ляется трещина и легко отламывается конец трубки с капилляром.
Азотнокислый раствор разбавляют водой.При нагревании в запаянной трубке органическое вещество пол¬
ностью сгорает до С02 и Н20; фосфор превращается в фосфорную кис¬
лоту, сера — в серную, другие элементы — в соответствующие кислоты
или азотнокислые соли. Их можно открыть, используя обычные приемы
качественного анализа, в частности фосфорную кислоту обнаруживают
по образованию желтого осадка с молибденовокислым аммонием.Количественный анализУглерод и водород. Принципы количественного определения угле¬
рода и водорода были разработаны Либихом. Эти методы сохранились
АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИИ45до настоящего времени. Однако чаще в настоящее время применяют ба¬
зирующийся на тех же принципах микроанализ, основание которому
положил Прегль. Для микроанализа требуется в 50 раз меньше вещества
и выполняется он в три раза быстрее. Приводим очень удобный метод
микроанализа сожжением в пустой трубке, разработанный М. О. Кор¬
шун и Н. Э. Гельман. За подробностями мы отсылаем к книге указан¬
ных авторов и другому, более современному, пособию по микроанализу*.Прибор для микроопределения углерода и водорода приведен на
рис. 23.Рис. 23. Прибор для микроопределеиия углерода и водорода пиролитическим сожже¬
нием в пустой трубке:1—платиновый контакт; 2, 8—электропечи; 3 —змеевик; 4, 5 — поглотители; 6 — трубка для сожже-
иия; 7 — стаканчик; 9—поглотительный аппарат для воды; 10 — поглотительный аппарат для
окислов азота; И — поглотительный аппарат для СО2; 12 — заключительная трубка; 13 — аспиратор.Взвешивают в длинном, узком кварцевом стаканчике 3—5 мг ве¬
щества с точностью до 0,002 мг. Вносят его в пустую кварцевую труб¬
ку 6 для сожжения и при включенной (900°С) электропечи 8 пропу¬
скают 3 мин медленный (35—50 мл/мин) ток кислорода, очищенного от
водорода, воды и СОг.Кислород очищают от водорода и органических примесей пропу¬
сканием через накаленный до 750—800 °С платиновый контакт. Грубое
отделение образовавшейся воды осуществляется конденсацией в змее¬
вике 3, полная очистка от воды и СОг — поглотителями 4 я 5, каждый
из которых наполнен безводным перхлоратом магния (ангидроном) и
аскаритом (асбестом, пропитанным расплавом едкого натра) таким 'об¬
разом, чтобы ангидрон являлся первым и последним наполнителем на
пути прохождения газа. Трубка для сожжения соединена с тремя по¬
следовательно присоединенными взвешенными на микровесах поглоти¬
телями: 9 — для воды, 10 — для окислов азота и 11 — для СОг.Устройство поглотительной трубки изображено на рис. 24. Первый
поглотитель (9) наполнен ангидроном (безводным перхлоратом магния),Рис. 24. Поглотительная трубка Прегля.а третий (Л)—аскаритом. Эти трубки взвешивают и присоединяют непо¬
средственно перед сожжением.Для регулирования давления в системе пользуются аспиратором 13
(так называемой склянкой Мариотта).* М. О. Коршун, Н. Э. Г е л ь м а и. Новые методы элементарного микро¬
анализа, Госхимиздат, 1949; В. А. Климова, Основные микрометоды анализа орга¬
нических соединений, Изд. «Химия», 1967.
46ВВЕДЕНИЕПроцесс сожжения занимает 10 мин. Его начинают с прокаливания
открытого конца трубки для сожжения, в которую помещен кварцевый
стаканчик с навеской. После завершения сожжения 2—3 мин продуваютОкислительная
зонаСеребро (Ьсм)
■ .02№ °0 750°Сили Ш°С 900°СРис. 25. Трубка для одновременного определения
углерода, водорода, галоидов и серы.воздухом поглотительные аппараты, снимают их и с обычными пред¬
осторожностями взвешивают на микровесах. Привес первого поглотителя
соответствует количеству воды, по которому вычис-8ляют содержание водорода в навеске вещества; привес
другого поглотителя 11 дает количество двуокиси угле¬
рода, по которому вычисляют содержание углерода
в навеске вещества.Расчет ведется по формуле:% С:/с- вес С02*100
навеска%Н =• вес Н О • 100Рис. 26. Поглоти¬
тельная трубка для
окислов азота.fc—таг-ода. а /н — т^г —0,1119.При наличии в сжигаемом веществе галоидов и
серы после трубки для сожжения перед поглотителем
для воды ставят дополнительную трубку-поглотитель
с металлическим серебром в виде стружки, нагревае¬
мый специальной печью. При нагревании до 450°С
поглощаются галоиды, а при нагревании до 750 °С —
окислы серы. На рис. 25 изображена трубка для одно¬
временного определения С, Н, галоидов и серы.Если вещество содержит азот, образовавшиеся
при сожжении окислы азота должны быть окислены
в азотную кислоту и поглощены, для чего после погло¬
тителя с ангидроном для воды включают поглотитель
(рис. 26) с раствором перманганата калия в крепкой
серной кислоте (осторожность при растворении!), за
ним еще один поглотитель с ангидроном для воды и уже затем поглоти¬
тель для С02 (см. рис. 23).Азот. Определение азота производят по способу Дюма — Прегля.Кварцевую трубку, наполненную медью и отрезками проволоки из
окиси меди, соединяют с микроазотометром, наполненным 40%-ным
раствором едкого кали (рис. 27). С другого, входного, конца в трубку
поступает С02 из аппарата Киппа, загруженного мрамором, прокипя¬
ченным в воде и разбавленной соляной кислоте. Аппарат должен да¬
вать чистую двуокись углерода, что проверяют по полноте поглощения
С02 щелочью в микроазотометре (допустим лишь остаток микропузырь¬
ков, практически не увеличивающий объема газа в азотометре). Всы¬
пав навеску вещества (2—3 мг), отвешенную в узком стеклянном ста¬
канчике, в трубку для сожжения, в которой уже имеется слой меди и
окиси меди, два-три раза «смывают» туда же порошком чистой окиси
меди остатки навески со стенки трубки и пропускают ток С02. Вклю-
АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ47чают печь, обогревающую часть трубки с окисью меди, и открывают
кран азотометра, предварительно наполненного доверху с помощью
груши едким кали, и начинают сожжение, передвигая печь в сторону
навески и под конец накрывая навеску печью.Слой металлическвй меди, находящийся в ближнем к азотометру
конце трубки, служит для восстановления образовавшихся при сожже¬
нии окислов азота до азота.Когда сожжение уже закончено и током углекислого газа весь азот
вытеснен в азотометр, дают выравняться температуре газа в азотометре
и, записав температуру и атмосферное давление, измеряют объем азота
над едким кали (при этом не надо вводить поправки на давление водя¬
ного пара — над 40%-ным раствором КОН оно незначительно). Так как
едкое кали смачивает стенки узкой измерительной трубки азотометра,Рис. 27. Микроопределенне азота по способу Дюма — Прегля:
I — азотометр; 2—трубка для сожжения; 3 — электрические печи.приходится вводить эмпирическую поправку на это кажущееся увеличе¬
ние объема, для чего уменьшают измеренный объем газа на 2,0%. По¬
лученный таким путем объем азота приводят к нормальным условиям,
пользуясь соответствующими таблицами, и определяют его весовое ко¬
личество.Другие элементы. Лишь вкратце скажем о количественном опреде¬
лении других элементов органогенов. Для кислорода долгое время не
было хорошего метода определения и по традиции обычно его не опре¬
деляют, а судят о его присутствии и количестве по разности после опре¬
деления других элементов. Количественное определение кислорода сво¬
дится к прокаливанию навески в кварцевой трубке в токе очень чистого
азота и пропускании образовавшихся газов через гранулированную
сажу при 1150°С. Весь кислород превращается в окись углерода, кото¬
рую окисляют до СОг над порошкообразным I2O5. Далее С02 поглощают
аскаритом во взвешенном поглотительном аппарате (см. стр. 45). .Галоиды и серу можно определять, разложив вещество по Кариу-
су — постепенным нагреванием навески до 300—350 °С в толстостенной
запаянной трубке с чистой азотной кислотой (d = 1,52). Для микро¬
определения отвешивают 2—3 мг вещества и добавляют 1—2 капли
азотной кислоты, для макроопределения берут 0,2—0,3 г вещества и
приливают 2 мл азотной кислоты. Навеску, взятую в маленькой корот¬
кой пробирке, помещают в трубку так, чтобы она до запаивания трубки
48ВВЕДЕНИЕне соприкасалась с азотной кислотой. При опредёлении галоида в трубку
предварительно добавляют отвешенное количество (в небольшой про¬
бирке) азотнокислого серебра. Запаивают трубку так, чтобы запаян¬
ный конец был оттянут в толстостенный капилляр. Постепенно нагревая
трубку в специальной печи, доводят температуру до 300°С и поддер¬
живают ее в течение 5—8 ч, затем печь выключают. По охлаждении
капилляр осторожно вставляют в пламя паяльной горелки — по размяг¬
чении газы прорывают его. Верхний конец трубки обрезают, смывают
содержимое трубки в стаканчик и определяют галоидное серебро либо
весовым способом, либо оттитровывая избыток азотнокислого серебра
одним из известных методов. Серу определяют обычными способами —•
в виде сульфата.tВывод эмпирической формулы веществаРезультаты количественного анализа выражают в процентном со¬
держании данного элемента в веществе. Для того чтобы перейти от
процентных отношений к атомарным, необходимо числа, выражающие
процентное содержание каждого элемента, разделить на соответствую¬
щий атомный вес и полученный ряд чисел — на наименьшее из них. Эти
числа и будут обозначать минимальное возможное число атомов в мо¬
лекуле.Пример расчета. При анализе мочевины определено следую¬
щее содержание элементов (точность анализа 0,2%):С 19,93%; Н 6,62%; N 46,70% (сумма 73,25%); О 26,75% (по раз¬
ности) .Делим на атомный вес:С 19,93: 12= 1,66;N 46,70 : 14 = 3,33;Н 6,62 : 1 = 6,62 *;0 26,75; 16= 1,66Разделив все полученные частные на наименьшее из них (1,66),
получаем:С 1,66; 1,66 = 1;N3,33 : 1,66 = 2;Н 6,62: 1,66 = 3,98;О 1,66: 1,66= 1Таким образом, эмпирическая формула мочевины* на основании
этого анализа соответствует C1H4O1N2.Конечно, подойдет и любая кратная формула, например C2H8O2N4.
Для того чтобы установить молекулярную формулу,'т. е. формулу, ука¬
зывающую действительное число атомов в молекуле, необходимо знать
молекулярный вес. Определив одним из описанных способов молекуляр¬
ный вес мочевины и найдя его равным 60, из всех возможных кратных
эмпирических формул избираем одну молекулярную, именно первую
CH4ON2.Определение молекулярного весаДля установления молекулярного веса органических веществ лишь
редко используют методы, основанные на законе Авогадро — Жерара.
Обычно пользуются методами эбуллиоскопии и криоскопии, основан¬* Расчет здесь упрощен: атомный вес водорода вместо 1,008 принят равным 1.
АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИИ49ными на законе Рауля, известном, так же как и закон Авогадро — Же¬
рара, из курса общей химии.При криоскопическом определении молекулярного веса навеску ве¬
щества р растворяют в навеске Р одного из растворителей, применяю¬
щихся для этой цели, чаще всего это бензол или ледяная уксусная кис¬
лота. Навеску выбирают так, чтобы на 100 г растворителя приходилосьРис. 28. Прибор Бекмана: Рис. 29. Термометр Бекмана:I — трубка для замораживания; 2—мешал* / — дополнительный резервуар; 2— капилляр; Л-ша-
ка; 3— термометр Бекмана: 4— термостат; рак термометра; 4 — вспомогательная шкала; 5 — ос-
5 — баня; 6 — терморегулятор. новная шкала, градуированная до 0,01 °С; б —конецкапилляра, из которого вытекает ртуть; 7 — пробковая
прокладка. (Количество ртути, заполняющей капил¬
ляр между концом основной шкалы и концом капил¬
ляра, эквивалентно длине столбика ртути на основной
шкале, соответствующей 7 °С.)примерно 0,05—0,02 г исследуемого вещества. Для определения приме¬
няют аппарат Бекмана (криоскоп) (рис. 28), снабженный термометром
Бекмана (рис. 29) с делениями в 0,01 °С. Пользуясь этим термометром,
сначала определяют температуру застывания чистого растворителя, а
затем раствора исследуемого вещества в этом растворителе. Понижение
температуры застывания раствора прямо пропорционально числу моле¬
кул вещества, растворенного в данной массе растворителя.Зная понижение температуры застывания раствора, полученного
при растворении 1 моль какого-либо известного вещества в 1000 г при¬
мененного растворителя, можно вычислить молекулярный вес растворен¬
ного вещества. Эта криоскопическая константа К, одинаковая для рас¬
творов всех веществ в данном растворителе, называется молекулярной
депрессией данного растворителя; она является экстраполированнойз Зак. 882
50ВВЕДЕНИЕвеличиной, так как в криоскопическом методе работают с брлее разбав¬
ленными растворами.Таким образом, молекулярный вес М вычисляют по формуле: ,. „ 1000р~P~KFгде At° — наблюденное понижение температуры застывания раствора по
сравнению с температурой застывания растворителя.Приводим величины К для некоторых растворителей:Вода .............. 1,86Уксусная кислота (ледяная) . . . 3,90
Бензол ............... 5,07Фенол 7,2Камфора ............ 40, Необычайно высокая молекулярная депрессия камфоры позволила
Расту предложить ныне широко применяющийся упрощенный метод
криоскопии, не требующий ни криоскопа, ни термометра Бекмана, а
лишь термометр с делениями 0,1 °С. Для этого осторожно расплавляют
навеску р вещества, тщательно перемешивают с навеской Р камфоры,
сплавляют и дают сплаву затвердеть. Обычным образом, как при опре¬
делении температуры плавления, набивают размельченным сплавом ка¬
пилляр и, прикрепив последний к шарику термометра, определяют тем¬
пературу плавления (она равна температуре застывания) сплава. Поль¬
зуясь тем же термометром, определяют температуру плавления чистой
камфоры (178,6 °С). Разность температур плавления At° входит в фор¬
мулу для определения молекулярного веса, которая теперь, очевидно,
принимает следующий вид:М = 40--?°?0р.РМагде р и Р выражены в граммах.Единственное неудобство исключительно простого и быстрого в ис¬
полнении метода Раста —это высокая температура плавления камфоры,
что исключает ее применение для определения легко разлагающихся или
летучих при этой температуре веществ. Для определения молекулярного
веса такого рода веществ можно применить другое вещество с высо¬
кой криоскопической константой. Таковы, например, циклогексанол
(т. пл. 24,7 °С, К = 42,5), камфен (т. пл. 49 °С, /( = 31). Камфен, однако,
непредельное вещество и надо быть уверенным, что исследуемое соеди¬
нение с ним не реагирует.. В эбуллиоскопическом методе измеряют температуру кипения чис¬
того растворителя термометром с делениями 0,01 °С, затем вносят в опре¬
деленное количество растворителя Р навеску исследуемого вещества р
и измеряют повышение температуры кипения раствора Д/°. Закон, управ¬
ляющий повышением температуры кипения раствора, тот же, что и для
понижения температуры застывания раствора, и формула для вычисле¬
ния молекулярного веса аналогична:Ю00рМ = ^эб-7д#'Приводим эбуллиоскопические константы Кэб наиболее часто упо¬
требляемых растворителей:Вода 0,51Бензол 2,(31Этиловый эфир 2,16Хлороформ 359
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ51Оба метода, основанные на законе Рауля, утрачивают свою точность
по мере увеличения молекулярного веса растворенного вещества. Для
веществ обычного молекулярного веса, т. е. с молекулярным весом, рав¬
ным нескольким десяткам или нескольким сотням, точность определения
составляет 5—10%, что достаточно для уверенного выбора молекуляр¬
ной формулы из серии кратных эмпирических. Причина этого очевидна:
величина понижения температуры застывания (или повышения темпера¬
туры кипения) для раствора той же весовой концентрации становится
все меньше, а влияние неизбежных примесей с относительно малым мо¬
лекулярным весом возрастает.Для высокомолекулярных соединений (полимеров) с молекулярным
весом во много тысяч или десятков тысяч описанные выше методы
совершенно неприменимы. В этом случае пользуются тремя методами:
вискозиметрическим, осмотическим и методом ультрацентрифугирования
(седиментационным), которые в свою очередь неприменимы к веще¬
ствам обычного молекулярного веса.КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИИОрганические вещества классифицируют в соответствии с их струк¬
турой, причем основой классификации служит характер углеродного ске¬
лета углеводородов, т. е. последовательность связанных друг с другом
углеродных атомов. Соединения, содержащие неуглеродные атомы, рас¬
сматриваются как производные углеводородов, в которых водородные
атомы замещены на эти «гетероатомы». Исключение делается только
для таких структур, в которых гетероатом замыкает цепь углеродных
атомов в цикл. Эти циклические соединения выделяются в особый
класс — гетероциклы.Все органические вещества прежде всего делятся на две большие
группы: ациклические соединения — с открытой цепью и циклические —
с замкнутой цепью.Ациклические соединения называют также жирными или алифати¬
ческими (от греческого слова «алеифар» — жир), поскольку жиры и
жирные кислоты относятся именно к этому классу. Среди этих соедине¬
ний могут быть «нормальные», т. е. имеющие неразветвленный скелет,
подобный скелету нормального пентанаН Н Н Н НII I МН—С—С—С—С—С-НI I I I I
н н н н нн-пентани вещества, содержащие сколь угодно разветвленный скелет, такие, как
изопентан и неопентан:H Н НН Н Н Н \|/II I I Н С НН—С-С—С—С—н IIIllll н—С—С—С—нн с н н III/|\ н с нННН /|\Н Н низопентан неопентанПодклассом жирных соединений являются непредельные жирные
соединения — изологи предыдущих, называемых предельными. Их3*
52ВВЕДЕНИЕхарактеризует наличие в цепи углеродных атомов одной или нескольких
двойных или тройных связей между соседними углеродными атомами.Циклические соединения делятся на изоциклические, в которых
имеется замкнутая в цикл группировка из нескольких углеродных ато¬
мов, и гетероциклические, в которых в замкнутый цикл кроме углерод¬
ных атомов входят один или несколько неуглеродных (гетероатомов).
Как изоциклические, так и гетероциклические соединения могут быть
непредельными, содержащими двойные или тройные углерод-углеродные
связи. Среди них особое место занимают так называемые ароматические
соединения — шестичленные циклы, содержащие чередующиеся три ор¬
динарные и три двойные углерод-углеродные связи или связи углерода
с гетероатомом.Родоначальным и наиболее важным ароматическим соединением
является бензолСН
НС?*1 ЧСНН<^ JLНСНбензолК ароматическим соединениям относятся также пятичленные циклы,
содержащие в цикле две двойные связи и атом (углерод или гетеро¬
атом), несущий два свободных электрона. Такое членение в значитель¬
ной степени формально, так как вещества всех классов более или менее
легко превращаются друг в друга.Иногда главные родственные связи, например, гетероциклически
построенного соединения ведут к ациклическим, а не гетероциклическим
веществам. Поэтому последовательность изложения материала в этой
книге, в отличие от справочников, будет часто отклоняться от строгой
классификационной схемы.
АЦИКЛИЧЕСКИЕСОЕДИНЕНИЯ
\1\
ПРЕДЕЛЬНЫЕ
СОЕДИНЕНИЯУГЛЕВОДОРОДЫ (АЛКАНЫ)Родоначальным углеводородом этого ряда является метан СН4. Все
остальные углеводороды, относящиеся к алканам (или парафинам),—
члены гомологического ряда метана, и, поскольку гомологи отличаются
друг от друга на гомологическую разность СНг, состав любого алкана
может быть выражен формулой СпНгп+г- Остатки, или радикалы (т. е.
мысленно выделяемые части молекулы), образуемые зачеркиванием
одного водородного атома в алканах, называются алкилами. Их общая
формула СпНгп+ь Простейший алкил — метил СНз, как и все алкилы,—
одновалентный остаток. От метана можно произвести также двухвалент¬
ный остаток метилен СНг и трехвалентный — метин СН.Следующий за метаном член гомологического ряда алканов — этан
С2Н6. Его структуру можно вывести из структуры метана путем замены
одного атома водорода на метильную группу:Структуру каждого следующего гомолога можно вывести из преды¬
дущего подобной же операцией — заменой водорода в предыдущем члене
на метильную группу (или остаток). Таким образом мы получаем из
этана пропан С3Н8.Желая применить ту же операцию к пропану, мы замечаем, что, в
отличие от замены водорода в метане и этане, не безразлично, какой из
восьми водородных атомов пропана будет замещен на новый метальный
остаток. В то время как в метане и этане все водородные атомы входили
в состав метальных групп и были равноценны, 9 пропане только шесть
крайних атомов водорода участвуют в структуре метальных остатков, а
два центральных атома водорода входят в метиленовый радикал. Если
на метильную группу будет заменен один из шести крайних водородов,
получится бутан С4Н10 с неразветвленной, или нормальной, цепью ато¬
мов углерода — с «нормальным скелетом». Если же подвергнется замене
на метил один из двух водородов метиленового звена, то цепьНн нН—С—!Нн-с-с—ннн нметанэтанИННн н нпропан
56УГЛЕВОДОРОДЫ (АЛКАНЫ)разветвится и получится углеводород того же состава С4Ню— изобутан,
изомерный предыдущему и отличающийся по свойствам.Н Н Нн н н н III| | | | н—с—с—с—нН—С—С—С—С—Н IIIII I I нейН Н Н Н /|\нннн-бутан ' изобутанНачиная с бутана, гомологический ряд алканов раздвоился и дальше
будет ветвиться.я-Бутан (нормальный бутан) содержит два сорта водородных ато¬
мов — шесть водородов метильных групп и четыре водорода метилено¬
вых групп. При замещении в нем на метил одного из водородов метиль¬
ных групп получится н-пентан C5Hi2-н н н н нI J. 1 IС—С—С—С—Hн н н н нк-пентанПри замещении на метильный остаток водорода метиленовой группы
н-бутана образуется изопентан — изомер н-пентана.Третий пентан, изомерный двум предыдущим, а именно неопентан,
можно получить из изобутана, замещая,в нем водород метиновой группы
на метил.HHHН Н Н Н Н4^нIII! IIIН—С—С—С—С—Н Н—С—С—С—НI I I I IIIН С Н Н Н С Н/|\ /|\ННН НННизопентан неопентанЛегко видеть, что в исходном изобутане имеется два сорта водород¬
ных атомов: единственный водород метиновой группы, который мы
только что подвергли замещению, и девять водородов метильных групп.
Если мы заместим один из них на новую метильную группу, то мы не
•получим четвертого изомера пентана — его не существует. Полученная
таким способом структура будет опять структурой изопентана.Таким образом, ветвление гомологических рядов таково, что ветви
эти иногда объединяются. Путем подобного же замещения одного из
одинаковых водородных атомов в каждом из изомерных пентанов после
вычеркивания одинаковых структур можно прийти к пяти изомерным
гексанам. Изучающему органическую химию необходимо поупражняться
в выводе всех возможных структур пентанов, гексанов и гептанов.Число структурных изомеров быстро растет с числом углеродных
атомов скелета, как это можно видеть из табл. 3. Число структурных
изомеров, предсказываемое теорией строения, строго оправдывается на
опыте.Углеродный атом, связанный всего с одним углеродным атомом, как,
например, углерод метильной группы в только что рассмотренных угле¬
водородах, называется первичным. Углеродный атом, связанный с двумя
углеродами (в наших примерах углеродный атом метиленовой группы),
УГЛЕВОДОРОДЫ (АЛКАНЫ)57носит название вторичного. Третичный углерод связан с тремя углеро-
дами (например, углерод метановой группы в изобутане). Наконец,'при¬
мером четвертичного углерода, связанного с четырьмя С, может служить
центральный углерод неопентана.Таблица 3. Число изомеров в ряду алкановФормулаНазваниеЧислоизомеровФормулаНазваниеЧисло изомеровСН4Метан1СцН24Ундекан159С2н6Этан1С12н26Додекан355С3н8Пропан1С13Н28Тридекан802С4Н,оБутан2СМН30Т етрадекан1 858С6н12Пентан3С^НзгПентадекан4 347С.н14Г ексан5С2оН42Эйкозан366 319С7н1бГ ептан9С25Н52Пентакозан36 797 588CeHigОктан18СзоНв2Триаконтан4 111 846 763С9Н20Нонан35СчоНягТетраконтан62 491 178 805 831С[0Н22Декан75Отметим, что радикалы тоже бывают изомерны по структуре. Та¬
ковы нормальный пропил и изопропил (вторичный пропил)которые имеют одинаковый скелет и разнятся положением заменяемого
водорода.Пример радикалов, разнящихся по скелету:Н Н НВ табл. 4 приведены некоторые физические свойства представителей
гомологического ряда нормальных углеводородов, а в табл. 5 — физиче¬
ские свойства всех изомеров бутана, пентана, гексана и гептана.В гомологическом ряду метана наиболее закономерно изменяются
температуры кипения. У членов этого гомологического ряда, начиная с
пентана (первый углеводород, жидкий при комнатной температуре), при
переходе от одного гомолога к следующему температура кипения растет
каждый раз на 25—30°С, причем эта разность постепенно уменьшается,
снижаясь у 18-го члена ряда уже до 13 °С, и т. д. Превращению жидкого
вещества в газообразное противодействуют слабые силы взаимного при¬
тяжения атомов разных молекул. Это притяжение тем больше, чем боль¬
ше атомов в каждой молекуле и чем сильнее могут, сблизиться их атомы.
Первый из этих факторов проявляется в равномерном повышении темпе¬
ратур кипения гомологов нормального строения, второй — в разных тем¬
пературах кипения изомерных углеводородов (табл. 5). Нормальныен н Нн н нн—с—с— с—н-с—с—с—нн н нн нвторичный пропилМ'ПрОПИЛн н н нН—С—С—С—Нн н нвторичный нормальный бутилн нтретичный бутил
58~ УГЛЕВОДОРОДЫ (АЛКАНЫ)углеводороды, молекулы которых лучше всего упаковываются в жидкой
фазе, обладают наивысшими температурами кипения и наибольшей
плотностью, а наиболее разветвленные — наинизшими величинами тем¬
пературы кипения и плотности (сравним, например, неопентан с нор¬
мальным пентаном и изопентаном).Таблица 4. Нормальные углеводородыФормулаНазваниеТемператураплавления,°СТемпературакипения,°СПлотностьj204КоэффициентпреломленияnDсн4Метан• -184,0— 161,50,4150
(при —164 °С)—с*н.Этан-172,0-88,30,5610
(при —100 °С)—с3н8Пропан-189,9-42,170,5853
(прн —44,5 °С)1,2898С4Н,оБутан-135,0-0,50,57881,3326С5Н12Пентан-131,636,20,62601,3570
(при 16°С)СаН,4Г ексан-94,369,00,66031,3750СгН16Г ептан—90,598,40,68381,3876CgHiaОктаи—56,5125,80,70361,3975С9Н20Нонан-53,7150,80,71761,4054С10Н22ДеканОт —30 до —32174,00,73011,4120С11Н24Ундекан-26,5195,80,74101,4184Додекан-12,0;—9,6214,50,74871,4216С13Н28Тридекан-6,21 234,00,75681,4419
(при 17 °С)СцНз0Тетрадекан5,5252,50,76501,4459С15Н32Пентадекан10,0270,50,76891,4315С16Н34Г ексадекан20,0287,50,77511,4345С17Н36Г ептадекан22,5303,00,77801,4370СиНзаОктадекан28,0317,00,7768
(при 28 °С)1,4349
(при 35 °С)С19Н40Нонадекан32,0330,00,7770
(при 32°С)1,4360
(при 35 °С)С20Н42Эйкозан36,8205,0
(при 15 мм Урт. ст.)0,7780
(при 37 °С)1,4340
(при 43 °С)Температуры плавления нормальных членов гомологического ряда
постепенно повышаются. Так, Н-С15Н32 плавится при 10°С, Н-С20Н42—
при 36,8 °С, а н-СюоН202 — при 115°С. Приведенная кривая температур
плавления (см. рис. 30, стр. 60) показывает, что температуры плавления
растут с альтернирующей и постепенно уменьшающейся разностью.Твердые алканы кристалличны. Факторы, влияющие на температуру
кипения, меньше сказываются на температуре плавления, так как при
плавлении силы Ван-дер-Ваальса лишь незначительно ослабляются. На
температуру плавления, отражающую прочность межмолекулярных свя¬
зей в кристалле, в большой степени влияют геометрические факторы
упаковки молекул в кристаллической решетке. Чем симметричнее по¬
строена молекула, тем легче и прочнее ее упаковка в кристалл и тем
выше температура плавления. Так, симметрично построенный неопентан
плавится при —20 °С, тогда как линейный н-пентан— при —131,6°С.
У разветвленных симметричных структур *гипа неопентана температур*
ная область устойчивости жидкой фазы наиболее узкая,
УГЛЕВОДОРОДЫ (АЛКАНЫ)59Таблица 5. Алканы*Формуласн4сн3-сн3СНз—СН2—СНзСН3—СН2—СН2—СНз
(СН3)2СН-СН3сн3—сн2—сн2—сн2—сн3(СН3)2СН—СН2—СНз
(СНз)2С(СНз)2
СНз-(СН2)4-СНз
СНз—СН2—СН2—СН—СНзIСНзСНз—сн2—сн—СН2—СНз
IСНзСНзIСНз—сн2—с—сн3IСНзСНз—СН—СН—СНз
I IСНз СНз
СН3-(СН2)5-СН3СНз—СН2—СН2—СН2—СН—СН;СНз-СНзСНзСНз—СН2—СН2—СН—СН2-сн,СНзСН3—СН2—СН2—С—СН3
IСНзСНз—СН2—СН—СН—СНзI IСНз СНз
СНз—СН—СН2—СН—СНзСНзСНзНазваниеТемпера¬тураплавле¬ния,°СТемпера¬туракипения,°СПлотность.204Коэффи¬циентпрело¬мленияnDМетан— 184-161,50,4150
(при —164 °С)—Этан-172—88,30,5610
(при —100 °С)—Пропан— 189,9—42,170,5853
(при —44,5°С)1,2898«-Бутан— 135,0-0,50,57891,3326Изобу¬тан— 145;©'— 10,20,6030
(при 0 °С)—и-Пен-тан— 131,6+ 36,20,62601,3570
(при 16°С)Ияопен-тан-160,528,00,61971,3550Нео¬пентан—209,50,59101,3476
(приО °С)и-Гек-сан—94,369,00,66031,37502-М етил-
пентан— 153,760,00,65401,3720З-Метил-пентан—64,00,6760
(при 15°С)1,37652,2-Ди¬
метил-
бутан—98,249,70,64871,36752,3-Ди-метил-бутан-135,158,10,6680
(при 17°С)1,3783к-Г еп-
тан—90,598,40,68381,38762-Метил-гексан— 119,190,00,67891,3848З-Метил-гексан-119,491,850,68711,38862,2-Ди-
метил-
пентан-125,079,20,67381,3821'З.З-Ди-метил-пентан89,80,69511,39202,4-Ди-метил-лентан-123,4;
— 119,280,50,67271,3814* Изомерные гексаны и гегттаны здесь обозначены как метильные производные предыдущих
членов гомологического ряда. Цифры указывают положение метильной группы — номер углеродного
атома главной дели.
60УГЛЕВОДОРОДЫ (АЛКАНЫ)Продолжение табл. 5ФормулаНазваниеТемпера¬тураплавле¬Темпера¬туракипения,Плотно сть
d20Коэффи¬циентпрело¬мленияния,°Сui°СnDСН3IСН3—СН2—С—СН2—СНзIСНзСНз—СН,—СН—СН2—СНз
Iсн2—сн3СНзIСН3—СН—С—СНзI IСНз СНз3,3-Диме--134,586,00,6933тилп-ентанЗ-Этнлпен--94,593,50,6982тан2,2,3-Три-—25,080,90,6901метилбу-тан1,39091,39341,3894л13151719zi11 IВ случаях парафиновых углеводородов с очень длинной цепью угле¬
родных атомов, например у полиэтилена, получаемого полимеризациейэтилена и являющегося смесью
высокомолекулярных гомоло¬
гов метана с молекулярным ве¬
сом > 10 000, плавление хотя и
возможно (пределы т. пл. 105—
125°С для разных полиэтиле¬
нов), но силы Ван-дер-Ваальса
столь прочно удерживают мо¬
лекулы друг около друга и в
расплаве, что легче разорвать
химическую связь в цепи угле¬
родных атомов, чем преодолеть
межмолекулярные силы. По¬
этому при нагревании в любом
вакууме вещество разлагается
не переходя в пар.Углеродные цепи нормаль¬
ных предельных углеводоро¬
дов, как и всякие углеродные
цепи, отнюдь не располагаются
по прямой. Позднее в этой кни¬
ге будут рассмотрены сформу¬
лированные Вант-Гоффом
(1871 г.) стереохимические до¬
казательства так называемой
тетраэдрической конфигурации
углеродного атома, подтвержденные уже в первой четверти XX века
путем исследования дифракции рентгеновых лучей от кристаллов орга¬
нических веществ.Углеродный атом предельных соединений удерживает связанные
с ним четыре одинаковых атома, например водорода в СН4 или углерода
в С(СН3)4, так, что направления от центрального атома.углерода к свя¬
занным с ним атомам идут по осям правильного тетраэдра (рис. 31).
В центре этого тетраэдра и расположен центральный атом С. Углы8070БО50403020О??10ъПё-10м-20-30§■-40с?s--ьоЙ-60-70-80-90-10023\25\27\29\31 \33\35Б 8 10 12 14 18 18 20 22 2k 2В 2В 30 32 34
Число атомов углеродаРис. 30. Зависимость температуры плавления
нормальных парафиновых углеводородов от
числа атомов углерода в молекуле. '
УГЛЕВОДОРОДЫ (АЛКАНЫ)61между осями тетраэдра равны 109°28'. Если углеродный атом удержи¬
вает четыре разных атома, то углы несколько (но немного) изменяются
и тетраэдр перестает быть пра¬
вильным, но в принципе дело
не меняется. Из рентгенострук¬
турных данных известно также,
что центры атомов углерода,
связанных между собой в пре¬
дельных соединениях, располо¬
жены на расстояниях 1,54 А;
расстояния от центра атома
углерода до центра атома во¬
дорода равны 1,1 А.Таким образом, нормальная цепь парафинового углеводорода дол¬
жна иметь такой видРис. 31. Модель
лерода.тетраэдрического атома уг-\/ \/ \/
v/°v/40A/\до/\Поскольку, однако, поворот вокруг связи С—С совершается легко
и почти не требует затраты энергии, то в результате таких поворотов
углеродная цепь может принимать самые различные формы, вплоть до
спиральной — разные конформации (например а — в) :J\/-4/\о->Ур—Л/.0--А-о;I\/'"-о;\О/\вНаиболее часто цепь углеродных атомов принимает конформацию а,
самую бедную энергетически. Наличие разветвлений или заместителей
может изменить конформацию цепи.Конформации легко переходят одна в другую; все они соответствуют
одному и тому же химическому индивидууму.Парафиновые углеводороды нормального строения кристаллизуются
совместно с мочевиной из спиртовых или ацетоновых растворов в виде
так называемых клатратных соединений — кристаллических соединений,
в которых молекулы углеводорода заполняют шестигранные каналы,
образованные молекулами мочевины в кристалле. Цепи нормальных
парафинов с числом углсродов не менее шести как раз входят в эти ка¬
налы. Молекулы углеводородов с разветвленными цепями не поме¬
щаются в них и поэтому таких кристаллизационных соединений с моче¬
виной не образуют. Благодаря этому при помощи мочевины можно отде¬
лять соединения с нормальными цепями углеродных атомов (не только
углеводороды, но и ряд их производных) от соединений с разветвлен¬
ными цепями или от циклических соединений.Нахождение алканов в природеАлканы, наряду с углеводородами других рядов (циклоалканами и
ароматическими углеводородами), входят в состав нефтей. Низшие газо¬
образные алканы — метан, этан, пропан — находятся в природном газе,
62УГЛЕВОДОРОДЫ (АЛКАНЫ)большая часть которого (до 98%) и состоит из метана. Эти же газооб¬
разные углеводороды растворены в нефти. Метан, выделяющийся в
угольных шахтах, носит название рудничного газа. В результате гниения
целлюлозы без доступа воздуха также образуется метан, который выде¬
ляется со дна болот (болотный газ). При перегонке нефти получаются
продукты, представляющие собой смеси углеводородов, более или менее
богатые алканами. Таковы петролейный эфир (т. кип. 40—75°С), бензин
(70—120°С), керосин (150—300°С), соляровые масла, смазочные масла,
вазелин, парафин.Богаты парафинами северокавказские грозненские нефти и нефти
Мангышлака. Групповой состав нефтей отечественного происхождения
приведен в табл. 6. Твердые, относительно высокоплавкие парафины
встречаются в виде залежей так называемого озокерита. Очищенный
озокерит — церезин применяется в тех же областях, что и воск. Наконец,
из продуктов сухой перегонки бурых углей и торфа также можно выде¬
лить парафины.Таблица 6■ Групповой углеводородный состав фракций нефтей, кипящих до 300 °СМ а н г ы ш л а к с к а я — высокопарафинистая, смолистая, малосернистая; о з е к-
суатская — высокопарафинистая, малосеринстая, малосмолистая; ромашки н-
с к а я — высокосернистая, высокосмолистая, парафинистая; у с т ь-б а л ы к с к а я —
высокосерннстая, высокосмолистая; м а р к о в с к а я — сернистая, малосмолистая,
парафинистая; сураханская (иафтеиовая) —■ малосмолиЬтая, малосернистаяУглеводородыСостав, %МангышлакСеверныйКавказТатарияСибирьБакуЯЯтао3Ё к<у ^* 3узеиьскаяозексуат-скаяромашкин-скаяусть*балыкскаясосяинскаямарковскаясурахаи-ская1 калиискаяАроматические11,1544,5314,8318,778,0*12,0*»Осо8,618,72Нафтеновые—23.9825,4828,036,016,061,2041,83Парафиновые88,8555,4761,1755,7564,052,071,030,2039,45* От начала кипения до 200 °С.В народном хозяйстве как метан, так и углеводороды нефти играют
очень важную роль, являясь наряду с углем основным энергетическим
ресурсом современного человечества и главным источником органиче¬
ского химического сырья для промышленности. Особенно большие коли¬
чества смесей углеводородов в виде фракций нефти идут в качестве мо¬
торного топлива для автотранспорта и самолетов старых типов с порш¬
невыми двигателями (бензин), а также для реактивных самолетов и
ракет (керосин).Способы получения алкановПромышленные способы. Кроме разгонки нефти и выделения таким
образом смесей углеводородов применяются следующие промышленные
способы получения смесей углеводородов.1. Гидрогенизация бурых углей (Бергиус). Топко измельченные
бурые угли смешивают с тяжелым Маслом, полученным от разгонки про¬
дукта гидрогенизации предыдущей пйрции угля, добавляют в качестве
катализатора железо и действуют водородом при температуре 450—■
УГЛЕВОДОРОДЫ (АЛКАНЫ)63500 °С и давлении 200—300 кгс/см2. Жидкий продукт гидрогенизаций
разгоняют и из него выделяют газы, бензин и более тяжелые погоны, из
которых самые тяжелые дополнительно деструктивно гидрогеннзуют.
Таким путем в Германии, не имевшей своей нефти, получали бензин,
смазочные масла и сырье для химического синтеза.2. Синтез из окиси углерода (Ф. Фишер и Тропш). При пропускании
смеси окиси углерода с водородом при температуре 200 °С и атмосфер¬
ном давлении над катализаторами, состоящими из металлического же¬
леза и кобальта, образуется смесь углеводородов — синтин, состоящая
главным образом из нормальных парафинов с примесью олефинов:иСО + (2« + 1)Н2 —--•та1ато> С„Н2„+2-f Н20Синтин служит сырьем для органического синтеза и для перера¬
ботки в моторное топливо.3. Крекинг нефти (см. стр. 66). При крекинге нефти высшие алканы
(и другие углеводороды нефти) дробятся, образуя смесь низших алка¬
нов, начиная с метана, и представляющих особую ценность олефинов:СцНгл+г —*■ QnH2m+2 + Сп—rnHiln-т)%Таким образом, крекинг служит одним из важнейших источников
промышленного получения алканов (в смеси с олефинами). Из получае¬
мых алканов особенно ценны как сырье для химической промышленности
пропан, бутан и изобутан, а также изопентан.Лабораторные синтезы. Синтез метана. 1. Действие воды на
карбид алюминия:А14Сз+ 12Н20 —»- 4А1(ОН)3 + ЗСН42. Синтез метана по Бертло из сероуглерода (синтез имеет историче¬
ское значение):CS2 + 2H2S + 8Cu --arpeBaHHe> CH4 + 4Cu2S3. Прокаливание уксуснокислого натрия со щелочью (декарбоксили-
рование уксусной кислоты):ОIIСНз-С—ONa -f NaOH —> СН4 -f Na2C03Синтез этана. 1. Синтез Вюрца:2CH3Cl-f2Na —>■ C2Ha-f2NaCl2. Синтез Кольбе — электролиз уксуснокислой соли. При этом на
аноде анион СН3СОО~ разряжается в неустойчивый незаряженный ради¬
кал СН3СОО*, который распадается с выделением С02 и этана;2СН3СОО. —► С2Нб'+2С02Метод применим и для синтеза других алканов с четным числом
углеродных атомов, если исходить из гомологов уксусной кислоты.Синтез высших алканов. 1. Восстановление при высокой
температуре иодистоводородной кислотой разнообразных производных
алканов — галоидзамещенных, спиртов, кислот:СНз—СН2—СН2—СН2—СН2С1 + 2HI —>- СН3—СН2—СН2—СН2—СНз + НС1 + I,2. Действие воды на металлоорганические соединения Li, Na, Mg, Zn:C/jH2n+]Br + Mg -—>- CnH2ra+1MgBr
C„H2„+1MgBr + II20 —> СяНгл+2 + McBrOH3. Получение алканов CnH2n+2 из олефинов CriIT2n (подробнее см.
в разделе «Олефины», стр. 247).
64УГЛЕВОДОРОДЫ (АЛКАНЫ)Химические свойства алкановЭтот класс углеводородов был назван парафинами (лат. рагит
affinittatis — лишенный сродства) за свою химическую инертность. Она
выражается в неспособности присоединять водород (отсюда название
предельные углеводороды), вступать в неинициированную (см. ниже)
реакцию с хлором и бромом (не говоря о иоде) и окисляться на холоду
такими сильными окислителями, как перманганат и хромовая кислота.
Наиболее инертны метан и этан.1.Окисление при высоких температурах. Пламенное
окисление приводит к полному сгоранию всех алканов до СОг и воды.
Эта реакция наиболее широко используется в энергетических, но не в
химических целях. Такое сгорание происходит в двигателях всех типов.
Окисление начинается уже при предпламенных температурах и идет по
типу разветвляющихся цепных реакций (см. кн. Н, «Свободные ра¬
дикалы»).В первой фазе окисления углеводорода RH в качестве малоустойчи¬
вых промежуточных продуктов образуются гидроперекиси ROOH, рас¬
падающиеся с образованием альдегидов, кетонов, спиртов, кислот, а
также мимолетно существующих в реакционной зоне свободных радика¬
лов R-.В двигателе внутреннего сгорания при сжатии смеси паров бензина
с воздухом нормальные углеводороды образуют перекиси, вызывающие
преждевременное воспламенение, т. е. воспламенение без участия за¬
пальной свечи, дающей искру только в момент наибольшего сжатия
поршнем смеси газов. Явление это называется детонацией и причиняет
вред, так как способствует изнашиванию двигателя и не позволяет пол¬
ностью использовать его мощность.Разветвленные парафины лишены этого недостатка. Особенно ценны
в качестве моторного топлива углеводороды с неоструктурой (т. е. имею¬
щие четвертичный углеродный атом) и, в частности, углеводороды со
структурой типа «изооктана»:Изооктан был положен в основу условной шкалы оценки моторных
топлив по «октановым числам». Ему было приписано октановое число
100, а «-гептану — нуль (табл. 7).Бензин сравнивают со смесью, содержащей а% изооктана и
(100 — а) % «-гептана. При одинаковом поведении обеих проб в двига¬
теле бензину приписывают октановое число а. Октановое число несколь¬
ко меняется при испытаниях на богатых и бедных смесях с воздухом.
В последнем случае октановое число ниже.Качество бензина для поршневых двигателей старых типов самолё¬
тов и автотранспорта улучшают добавлением синтетических углеводоро¬
дов, таких, как изооктан (получение этих углеводородов из олефинов
см. стр. 252). Кроме того, октановое число резко повышается при добав¬
лении небольших количеств антидетонаторов. Наиболее известным анти¬
детонатором является смесь тетраэтилсвинца РЬ(С2Н5)4 с бромистым
этилом — так называемая этиловая жидкость. «Этилированные» бен¬
зины, однако, очень ядовиты. В последнее время открыты содержащие
марганец металлоорганические антидетонаторы, еще более эффектив¬
ные, чем этиловая жидкость. Бензины с этой присадкой неядовиты.Н3С СНзI IСНз—С—СН—СН;СН3 СН;СНз—С—СН2—СН—СНз2,2,3-триметилбутан
УГЛЕВОДОРОДЫ (АЛКАНЫ)65В дизельных и ракетных двигателях, где ценной является способ¬
ность топлива быстро загораться, наблюдается обратная зависимость:
самые ценные топлива состоят из нормальных углеводородов. В оценоч¬
ной условной шкале «цетановых чисел» точке 100 отвечает углеводород
цетан (гексадекан) к-С)6Нз4, а точке 0— метилнафталин. Поскольку син-
тин состоит по преимуществу из неразветвленных углеводородов, высоко-
кипящая фракция его — когазин представляет собой ценное дизельное
топливо.Таблица 7. Октановые числа некоторых алкановНаименованиеОктановоечислоОктановое
число
смешения *НаименованиеОктанопоечислоОктановое
число
смешения *н-Бутан921102,2,3-Т риметилбутан104115я-Пентан62872,2,3,3-Тетраметил-125—к-Гексан26 (45)65иентанн-Гептан052м-Нонан—44—м-Октан-17 (-20)35н-Декшг-53—2,3-Днметилгексан79—Циклогсксан77902,2,4-Т риметилпентан100113или изооктан* Октановые- числя смешения экстраполированы из поведечгггя смесгй. Некоторые углеводо¬
роды показывают в чистом виде более низкое октановое число, нем экстраполируется из их поведе¬
ния в смесях.2. Окисление при невысоких температурах кисло¬
родом. При невысокой температуре и применении солей марганца
в качестве катализатора происходит окисление алканов в жидкой фазе,
идущее также через стадию образования перекисей. При этом цепи угле¬
родных атомов разрываются и получается смесь предельных кислот и
оксикислот. Процесс используется в крупном масштабе для окисления
парафинов и производства моющих и поверхностно-активных веществ.При более высоких температурах можно окислять алканы в газовой
фазе в смесь кислородсодержащих продуктов — альдегидов, кетонов,
кислот. Реакцию инициируют добавлением радикалоподобных молекул
с неспаренным электроном, например N0. Из бутана таким способом
можно получить уксусную кислоту СНзСООН, из метана — формальде¬
гид нсно.3. Реакция с водой. При высокой температуре над катализато¬
ром (окись хрома и никель на окиси алюминия) метан реагирует с во¬
дяным паром по уравнению:СН4 + Н20 —>■ СО + 311,На этой реакции основан важный путь химического использования
метана, так как получаемая смесь газов применяется для промышлен¬
ного синтеза метанола СН3ОН и служит источником водорода, напри¬
мер, в производство аммиака.4. Крекинг алканов. Метан — наиболее термически устойчивый
из алканов. Это связано с тем, что энергия образования связи С—Н,
равная 98,5 ккал, значительно выше энергии образования связи С—С,
равной 81 ккал. Кроме того, и это, вероятно, еще более важно, чем длин¬
нее цепь атомов, тем более вероятна случайная кумуляция энергии в
каком-либо пункте цепи. Поэтому высшие парафины термически ме¬
нее устойчивы; их термический распад (крекинг) наступает уже при
PR УГЛЕВОДОРОДЫ (АЛКАНЫ)температуре около 450 °С. Метан же подвергается термическому распаду
при температуре выше 1400 °С по уравнению:2СН4 —»- С2Н2 + ЗН2 ДЯ = +95 ккалЭто эндотермический процесс. Он положен в основу одного из путей
промышленного получения ацетилена.Этан при нагревании до 600—800 °С превращается в этилен:С2На —* С2Н4 + НгРеакция, возможно, идет через стадии разрыва углеродной цепи на
два метила, потери метилами водорода и соединения образовавшихся
метиленов в этилен.Углеводороды, содержащие более или менее длинную цепь атомов
углерода, разрываются в любом случайном месте цепи, и осколки (ра¬
дикалы) перераспределяют водород так, что получается смесь эквимоле¬
кулярных количеств алканов и олефинов, например:СН3(СН2)4СН3СН3 + СН2СН2СН2СИ2СН3
сн3сн2 +сн2сн2сн2сн3-СН3СН2СН2 + СН2СН2СН3сн4 + СН2-=СН—СН2СН2СН3
- С2Н6 + сн2=сн—СН2СН3
• сн2=сн2 + СН3СН2СН2СН3
■ СН3СН2СН3 + сн2=снсн3Реакция крекинга тяжелых фракций нефти в огромных масштабах
используется для получения богатых олефинами более легких фрак¬
ций— бензинов, обладающих высоким октановым числом, и газообраз¬
ных углеводородов, из которых особенно ценны с точки зрения химиче¬
ского использования олефины Крекинг проводят или термически (пиро¬
лиз), пропуская нефтепродукты через металлические трубчатки при
температуре 600—750 °С и различном давлении, или каталитически.Под действием твердого хлористого алюминия уже при нагревании
смеси до сравнительно невысокой температуры рвутся углеродные цепи,
причем высшие парафины, так же как при высокой температуре, превра¬
щаются в смесь низших парафинов и олефинов. Высокотемпературный
крекинг включает, кроме того, процессы циклизации парафинов в более
прочные циклоалканы и в,особенно прочные ароматические углеводо¬
роды.Каталитический крекинг на алюмосиликатных катализаторах, вве¬
денный в практику Гудри (США, 1934 г.) и все более распространяю¬
щийся, дает более высокий, чем термический крекинг, выход низкокипя-
щих фракций, причем бензин получается с очень высоким октановым
числом (до 80). В качестве катализаторов применяются природные или
искусственные алюмосиликаты при температуре порядка 500 °С. Алюмо¬
силикаты действуют в этих условиях как кислотные катализаторы.Механизмы двух типов крекинга различны: термический крекинг
протекает гомолитически (стр. 24), с разрывом цепи на свободные ра¬
дикалы, каталитический — гетеролитически, с образованием ионов (в
приведенной выше схеме не отмечено). Этим объясняется разное соотно¬
шение отдельных углеводородов в продуктах термичёского и каталити¬
ческого крекинга.5. Га лоидированке. Невозбужденные хлор и бром не реаги¬
руют с алканами. Если же хлор или бром возбудить освещением (моле¬
кула галоида при этом разрывается на атомы), происходит замещение
водорода на галоид. Эта реакция, открытая Дюма, названа им металеп~
УГЛЕВОДОРОДЫ (АЛКАНЫ)67сией. Итоговые результаты хлорирования метана можно выразить се¬
рией уравнений:СН4 + С12—► CH3CI + HCIхлористыймегнлСН4 + ЗС12—>• CHCia + 3HClхлороформСН4 + 2С12—* СН2С12 + 2НС1хлористыйметиленСН4 + 4С12—> CCU + 4HC1четыреххлори»
сгый углеродО роли свободного атома галоида и цепном механизме реакции см.
в разделе о галоидпроизводных (стр. 71). Здесь можно дать лишь пред¬
варительное понятие о цепном механизме реакции;С12 —► 2CI-(фотолиз молекулы хлора)СН4+С1* —> СН3. + НС1
СН3. + С12 —> СН3С1 + С1*Атомарный хлор, полученный в результате фотолиза молёкуля^нбго
хлора, в отличие от последнего реагирует с метаном, вырывая атом
водорода, с образованием НС1. Освобождающийся свободный радикал —
метил — в высшей степени реакционноспособная частица, которая при
встрече с молекулой хлора отрывает один атом хлора, образуя хлори¬
стый метил. Остающийся свободный второй атом хлора снова реагирует
с метаном и т. д.Хлорирование метана, особенно с целью получения четыреххлори¬
стого углерода, производится в промышленном масштабе.Хлорируются (и бромируются) все алканы, причем хлор вступает
в различные места молекулы. Низшие алканы (до С3Н8) могут быть пол¬
ностью прохлорированы (до СзСЬ), высшие при этом разрываются по
углерод-углеродной связи (хлоринолиз):^С—С^ + С12 —> ^СС1 + С1С^Иодировать предельные углеводороды не удается. Можно осущест¬
вить их прямое фторирование, действуя фтором, выделяющимся при
электролизе На катоде, или фторируя при помощи CoF3, отдающего один
атом фтора.6. Нитрование. При температурах около 600°С метан при дей¬
ствии азотной кислоты, а также двуокиси азота нитруется. Эту реакцию
можно выразить итоговым уравнением:СН4 + HN03 —»- CH3N02 + Н20Получаемый нитрометан находит применение в синтезе взрывчатых
веществ и как растворитель. Этан в этих условиях реагирует по двум
направлениям:|-> ch3ch2no,СН,-СН! + НЖ^_Ц 2CIW)0jПри нитровании по Коновалову (разб. HN03, 140 °С) водород¬
ный атом вторичного и особенно третичного углерода замещается на
68УГЛЕВОДОРОДЫ (АЛКАНЫ)нитрогруппу (N02) гораздо легче первичного. Так, например, изопентан
образует нитроизопентан:СН3 CHSI IСН3—СН—СН2—СН3 + HNO3 —> СН3—С—СН2—СНзIno2При высокотемпературном нитровании (> 400°С) в газовой фазе
такой избирательности нет.В промышленности проводят нитрование бензиновых фракций дву¬
окисью азота в газовой фазе, причем вследствие разрыва углеводород¬
ных цепей образуются главным образом нитрометан, нитроэтан и нитро-
пропаны.7. Сульфирование. Серная кислота, в которой растворен сер¬
ный ангидрид (олеум), при нагревании медленно сульфирует парафины,
содержащие Метиновую группу:So3H
I
СНз—СН—СН2—СНз + H2S04 —► СНз—С—СН2—СНзI IСНз СНз8. С у л ь ф о х л о р и р о в а н и е. При освещении ультрафиолетовым
светом алканы вступают со смесью избытка сернистого ангидрида и
хлора в реакцию замещения. В промышленности эту реакцию исполь¬
зуют для сульфохлорирования когазина (высококипящая фракция син-
тина, см. стр. 65). Она протекает по цепному механизму, причем иници¬
ирует реакцию атомарный хлор, полученный в результате фотолиза мо¬
лекулы хлора. Ниже изображен механизм реакции сульфохлорирования:С!2 „фото-^ 2С1.С„Н2„+2 + С1. —>• С„Нм+1. + НС1оIICBH2B+1. + S02 —CBH2B+[—s»IIо
о оII IIС„н2в+, S.+CI2 —> СпН2п+1‘—s—С1 + С1. и т. д.А IIо оВ результате реакции снова образуется атом хлора, инициирующий
новое звено цепной реакции. Таким образом, казалось бы, достаточно
одного кванта света, рождающего первую пару атомов хлора, чтобы
вся порция алкана прореагировала в результате такой цепной реакции.
На деле любая реакционная цепь не может быть бесконечной, а вклю¬
чает лишь немногие (десятки, редко сотни) повторные звенья, так как
случайные встречи активных частиц, ведущих цепь (С1* или C„H2n+i«
или C„H2n+i.S02*)> обрывают реакционную цепь. Такими случайными
встречами могут быть:С„Н,в+1. + С1. —► С„Н2„+1С1илиоCBH2rt+iS02 • + CBH,„+I. —> CrjH2n4.!—S—CnH^n+iо
УГЛЕВОДОРОДЫ (АЛКАНЫ)69Сульфохлориды из когазина используют для получения моющих
веществ.9. Каталитическая дегидрогенизация алканов. При
температуре 500—600° С парафины, пропущенные в виде газа или пара
над окисью хрома, теряют два атома водорода и превращаются в оле-
фины (А. А. Баландин):С/гН2п + 2 ► С„Н2„ + н2Реакция имеет важное промышленное значение (в производстве
синтетического каучука, стр. 270).Номенклатура алкановКак мы уже видели, названия членов гомологического ряда метану
с нормальным строением цепи (см. табл, 3, стр. 57), начиная с нентана,
образуются от греческих числительных прибавлением окончания ан.
Для обозначения изомеров тривиальные названия получают приставки
«изо», «нео» и т. п. По такой номенклатуре название углеводорода, на¬
пример пентан, распространяется и на его изомеры, можно сказать —
пентаны. Легко видеть, что с ростом числа изомеров невозможно обой¬
тись этой системой -номенклатуры.В 1892 г. в Женеве была принята международная научная, женев¬
ская, номенклатура. Основной принцип ее—-каждому названию должно
отвечать только одно соединение и каждому соединению лишь одно на¬
звание, которое давало бы полное представление о его структуре.Для нормально построенных углеводородов в женевской номенкла¬
туре приняты те же названия, что и в тривиальной. Для наименования
разветвленных углеводородов необходимо выбрать наиболее длинную
цепь углеродных атомов («главная цепь»), назвав углеводород, как ука¬
зано выше, в соответствии с числом углеродов в этой цепи, ответвления
же рассматривать как замещающие радикалы и названия этих радика-
лой ставить перед названием углеводорода. Положение замещающих
радикалов в главной цепи обозначают, перенумеровав ее углеродные
атомы, начиная с конца, более близкого к разветвлению, и указывая но¬
мер перед названием замещающего радикала.Если разветвления начинаются при углероде, равноудаленном от
обоих концов главной цепи, нумерацию ведут с того конца, к которому
ближе находится «старший радикал», т. е. радикал, имеющий более про¬
стое строение. Так, метил старше этила, этил старше пропила, пропил
старше изопропила и т. д.Таким образом, название изооктана по женевской номенклатуре
будет 2,2,4-триметилпентан:СН, СН31 21 .4 4| Г,СНз—с—СН2—CII—сп3
IСНзМетилы, углероды которых обозначены цифрами 1 и 5, входят в счет
главной цепи.Название следующего углеводорода будет З-метил-З-этилгексан:СНзГ, 5 4 ,ч| 2 Iсн3—сн2—сн2-с сн2-сн3СНг—СНз
ГАЛОИДПРОИЗВОДНЫЕ ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ71Получение галоидпроизводныхФторпроизводные. После 1940 г. химия фторпроизводных начала
быстро развиваться.Фторирование свободным фтором приводит к полной деструкции
молекулы углеводорода:СпН,„+2 + (6п + 2)F2 —*- nCF4 + (2п + 2) HFiПри недостаточном количестве фтора углерод выделяема в виде
сажи.При сильном разбавлении фтора инертным газо^ уже удаетсй осу¬
ществлять реакцию замещения; но лучшими приемами фторирования
углеводородов являются следующие.1. Действие CoF3. Углеводород пропускают через нагретую выше
200 °С трубку, заполненную C0F3. Последний, восстанавливаясь в C0F2,
отдает фтор для замещения водорода и выведения его в виде HF.2. Электролиз кислого фторида калия KF-HF с угольным анодом
в присутствии фторируемого углеводорода. Фторирование углеводорода
идет на аноде.Оба метода по преимуществу пригодны для получения полифториро-
ванных углеводородов, вплоть до перфорированных, т. е. таких, у кото¬
рых весь водород замещен на фтор. Этими путями удается фторировать
даже смазочные масла, имеющие в цепи несколько десятков углеродных
атомов.Монофторпроизводные и фторпроизводные с заданным положением
фтора в цепи получают из соответствующих хлор-, бром- и иодпроизвод-
ных реакцией обмена галоидов. Для получения монофторпроизводных
лучше применять в качестве исходных веществ иодпроизводные и дей¬
ствовать на них фтористым серебром. Для обмена на фтор двух и болёё
атомов галоида у одного углерода применяют хлорпроизводные и трех¬
фтористую сурьму.Дифторпроизводные с двумя атомами фтора у одного углерода
можно получить из кетонов по реакции:R\ R\;c=o + sf4 ;cf2 + sof21,1,1-Трифторпроизводные получают действием чeтыp£xфt6pиCтoй
серы на карбоновые кислоты:RCOOH + 2SF4 —► RCF3 + 2SOF2 + HFХлор- и бромпроизводные. Реакция хлорирования и бромирования
алканов свободным галоидом на свету уже была вкратце рассмотрена
на стр. 66. Остается рассмотреть механизм этой реакции. Действие света,
необходимое для.осуществления реакции, состоит в том, что он вызывает
диссоциацию молекулы галоида на два атома. Только атомарный хлор
может атаковать инертную молекулу алкана и вырвать из нее атом
водорода:С1 • + С„Н2„+2 —► НС1 + СяН,„+1.Свободный радикал С„Н2п+г, встретив молекулу хлбра, отбирйет
один атом, оставляя другой свободным:C/xH2/x+i • "Ь С12 > CrtHj/t-i-iCl -|- CI •Этот атом хлора начинает новое звено цепной реакции, подобное
первому. Реакционная цепь, состоящая из таких звеньев, продолжается
до тех пор, пока случайная причина не оборвет ее.
72ГАЛОИДПРОИЗВОДИЫЕ ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВТаким образом, обычное уравнение реакции типа
С„Н2(г+2 + С12 —•> С„Н2„+1С1 + НС1точно отражая стехиометрию реакции, ничего не говорит о ее механизме.Реакцию хлорирования (и тем более бромирования) алканов ис¬
пользуют практически довольно редко*. В лаборатории ее никогда не
применяют для препаративных синтезов, так как есть более удобные
методы получения индивидуальных галоидпроизводных.Неудобством реакции металепсии в применении к алканам с тремя
и более атомами углерода в цепи является получение смеси изомеров.Иодпроизводные. Непосредственное иодирование алканов неосу¬
ществимо. Иодпроизводные с одним атомом иода (иодистые алкилы или
моноиодалканы) лучше всего получать по реакции обмена между соот¬
ветствующим хлорпроизводным и иодистым натрием в ацетоновом рас¬
творе (Финкельштейн):RC1 + Nal —>■ RI + NaClЙодистый натрий в ацетоне растворяется, а хлористый натрий — нет.Другие методы синтеза галоидпроизводных. Поскольку в приведен¬
ных ниже методах синтеза галоидпроизводных исходят из классов соеди¬
нений, еще не рассматривавшихся в данной книге, мы приводим лишь
краткую сводку методов в виде уравнений. Подробнее эти реакции будут
рассмотрены при изложении химических свойств исходных соединений.1. Синтез из спиртов:ROH + HX —>■ RX + H20
3ROH + РВг3 (или Р13) —>■ 3RBr + Р(ОН)3
ROH + РС15 (или РВг6) —>■ RC1 + НС1 + РОС13где R — радикал СпНгп+ь X = С1, Вг, I.2. Синтез из оксосоединений (альдегиды и кетоны):О С1 С1I! \ /R—С—R' + РС15 —>- R-C—R' + РОСЦгде R' = Н или алкил.3. Синтез из олефинов:С„Н2„ + НХ —► С„Н2Л+1Х С„Н2„ + Х2 —* С„Н2„Х24. Синтез из карбоновых кислот:ОIIR—С—OAg + Вг2 —► RBr + С02 + AgBrАналогично протекает реакция с хлором.Физические свойства галоидпроизводныхФизические свойства некоторых галоидпроизводных сопоставлены
в табл. 8. Из приведенных данных видно, что введение галоида повы¬
шает плотность соединения, причем полииодпроизводные, такие, напри¬
мер, как CH2I2, СН13, СЦ, являются органическими соединениями,
обладающими наибольшей плотностью. Жидкий иодистый метилен CH2I2
применяется поэтому в минералогии для определения плотности минера-* В промышленном масштабе реакция применяется лишь для хлорирования ме¬
тана в четцреххлорнстый углерод (тетрахлорметан), хлороформ (трихлорметан),' хло¬
ристый метил, хлористый метилен и в ограниченном масштабе — для хлорирования
пентановой фракции бензина, подлежащей дальнейшему гидролизу в амиловый спирт.
Таблица 8. Физические свойства галоидпроизводных алкановОN.CNСО о о
N. ТЗОсоГ"-Г"-СОюсоГ", NСО Ю-SU - _02° CM -gvOi ГГюOs5cn О'—'со00 СО
00 0000ою<ГЪюN» о>
N t~со' S о00 «У^ ЛСОГ-~0000ст>О)ооCNи*00 | „00 &N-N. pCNN.N-N-оюо ’аб5«oSnОООоОU►f оСОs о0.0оd.Tt>. С о—С 00юCNCNcsfN.с4*озл.)о■100зг.)чсас\]саОСЗОнО-О и05а,05t-"-ою«гооо"соооСГ»О 5SCNююсомоо SСОооОО)о<n £юо00со•-*’"м ■'fг~-.30)н<Мof+rf —ci о
СО -*fсоNюСОN.СЧооо<мСОCNоо"nTctf<м~CNсо“—ГCN00N.со1со<оа>юоосм+t-"-
о о
— со
++—ююСОСОоосоinСО1ооо001Iю+сосо"оооо00а>CNСОюCNоzn001001.01N.ICDО СО.00 Оо>I IО)оГN.N.00—N*ю00соN.N-00CNСООсоСОСОCNю«ООСОCNCNо00О)СО<мсоО20)нI IаэCNОсо"0500сосоЮСО12 1to= «
g IIо>теUXоXоVхюЖ<моXж«оа.<ис* 1:£ £
■а- ЮО О
к ЖX£tOОжX«X£XииоX£иIX£иXко£и
74ГАЛОИДПРОИЗВОДНЫЕ ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВлов. Гомологическая разность температур кипения галоидных алкилов с
одним и тем же галоидом для членов ряда С3—Се составляет около 30 °С,
т.е. почти такая же, как и для самих алканов. Йодистые алкилы С6 ки¬
пят примерно на 30 °С выше, чем бромистые, а последние примерно на
25 °С выше, чем хлористые. Так же как и углеводороды, жидкие галоид¬
ные алкилы нерастворимы в воде; они смешиваются между собой, с
углеводородами и с эфиром. Иодиды отличаются необыкновенно высо¬
ким коэффициентом преломления (атом иода наиболее сильно поляри¬
зуется), фториды, напротив, низким. Особенно интересны перфториды
алканов CriF2n+2. Несмотря на огромное возрастание молекулярного веса
сравнительно с алканами (примерно вчетверо), их температуры кипения
мало отличаются от температуры кипения соответствующих углеводоро¬
дов. Это указывает на необыкновенно малые силы Ван-дер-Ваальса,
проявляемые атомом фтора в органических фторпроизводных, что зави¬
сит от его малой поляризуемости. Другими словами, атом фтора, осо¬
бенно в сравнении с атомом иода, прочно удерживает свою электронную
свиту. Этим объясняется и несмачиваемость изделий из полимерных
перфторуглеводородов никакими жидкостями и вообще плохая их адге¬
зия. Благодаря этим свойствам высокомолекулярный материал перфтор-
полиэтилен (тефлон), получаемый полимеризацией тетрафторэтилена и
представляющий собой смесь высших членов ряда CnF2rj+2, нашел при¬
менение, в частности, для изготовления подшипников.Следует отметить, что межатомные расстояния С—X в галоидпроизводных с не¬
сколькими атомами галоида у одного углерода меньше, чем в галоидных алкилах.
Особенно ярко это явление выражено для фторпроизводных, у которых расстояние
С—F равно 1,39 А в CH3F, 1,332 А в CHF3 и 1,35 А в CH2F2.С этим связана и большая химическая инертность такого типа поли-
галоидпроизводных (см. стр. 78).Химические свойства галоидпроизводныхУглеводородная цепь галоидных алкилов сохраняет свойства цепи
алканов. Наиболее важный тип реакций галоидных алкилов — реакции
замещения: обмен атома галоида на другие галоиды или другие однова¬
лентные группы атомов при действии воды, оснований и солей. Приме¬
ром таких реакций может служить приведенная при рассмотрении мето¬
дов синтеза галоидпроизводных реакция обмена хлора на иод (действие
Nal)C2H6C1 + Nal —► C2H6I + NaClили реакция обмена иода на фтор (действие AgF).Формально эти превращения напоминают ионный обмен:KCl+Nal —► KI + NaClОднако огромным и принципиальным отличием таких реакций об¬
мена в органической химии является то, что они идут очень медленно.
Механизм реакций этого рода будет рассмотрен позднее (стр. 75 и 88).Очень медленно протекает и гидролиз галоидпроизаодных водой при
повышенной температуре, ведущий к замещению галоида на гидроксиль¬
ную группу воды и к образованию спирта:RX + H20 —► ROH + HXЭта реакция — обратная реакции получения галоидпроизводных из
спиртов и галоидоводорода.Обмен галоида на гидроксил происходит быстрее, если применить
влажную окись серебра:2RX + Agj.0 -J- HjO —> 2R0H + 2AgX
ГАЛОИДПРОИЗВОДИЫЕ ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ75При применении едкой щелочи обмен (реакция 1) проходит еще
быстрее, но осложняется побочной реакцией отщепления галоидоводо-
рода с образованием олефина (реакция 2):СЙН2„+1Х + NaOH-СпН2Л+1ОН + NaX
С„Н2„ + NaX + Н20(1)(2)С галоидным метилом, из которого не может образоваться олефин,
реакция идет только но схеме (1). В случае галоидпроизводных с гало¬
идом у третичного углерода реакция нацело идет по схеме (2): это же
направление преобладает для вторичных галоидпроизводных. Реакция
(2) относится к типу реакций элиминации (отщепления), противополож¬
ному реакциям присоединения.Известно великое множество реакции обмена галоидпроизводных
с солями неорганических и органических кислот, которые идут по типу
реакции (1), например:RX + NaCN —> R—C=N + NaXОIIRX + NaO—С—СН3 -
RX + NaSH
2RX + Na2S
RX + 2NH3 -ОU► R—О—С—СН3 + NaXсложный эфир-> RSH + NaXмеркаитан-► R2S + 2NaXсульфид• rnh2 + nh4xЭти реакции делают галоидные алкилы незаменимыми в органиче¬
ском синтезе алкилирующими средствами — реагентами, служащими для
введения алкильной группы.Легче всего подвергается обмену (наиболее подвижен) атом иода,
что связано с его большой поляризуемостью, однако алкилиодиды отно¬
сительно дороги и могут быть использованы поэтому лишь в лаборатор¬
ных синтезах. Хлориды и бромиды меньше различаются по реакционной
способности, и поэтому в промышленных синтезах предпочитают исполь¬
зовать более доступные хлористые алкилы. Фтористые алкилы для целей
алкилирования не пригодны, так как фтор вследствие малой поляризуе¬
мости слишком инертен.Замена галоида может осуществляться по двум" различным меха¬
низмам, называемым по предложению Инголда 5^1 (мономолекулярное
нуклеофильное замещение) и SN2 (бимолекулярное нуклеофильное за¬
мещение) *. Бимолекулярное SN2 замещение одностадийно и состоит в
атаке атома углерода нуклеофилом, образовании повой связи за счет
электронов нуклеофила и одновременном разрыве прежней связи угле¬
род— галоид. Например, реакция хлористого метила с иод-анионом мо¬
жет быть изображена следующим образом:НН\ /НГ+ )с(
W ХС1II С С1Hx чн ,I—с-м-Н + СГ
41* S — первая буква слова — Substitution (замещение); N— первая буква слова —
Nucleophilic (нуклеофильный); цифра означает молокуляриость реакции. .
76ГАЛОИДПРОИЗВОДНЫЕ ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВВ переходном состоянии ковалентная связь' между атомами угле¬
рода и иода завязалась еще не полностью, а связь углерод — хлор еще
не полностью разорвалась, и к центральному атому углерода привязано
пять атомов. Четыре атома (ЗН и С) лежат в одной плоскости, перпен¬
дикулярно к которой проходит ось замещения I—С—С1. Таким образом,
в переходном состоянии атомы водорода «выплощаются», а затем снова
располагаются по осям тетраэдра, но теперь они уже направлены в зер¬
кально противоположную сторону. Реакции, следующие механизму Sn2,
являются по кинетике реакциями 2-го общего порядка, т. е. скорости вы¬
ражаются уравнением типа:rf[CH3Cl]dt:k [1“1 [СН3СЦКонстанты скорости реакций, идущих по механизму SN2, зависят от
нуклеофильности реагента. Например, ион гидроксила более сильный
нуклеофил, чем вода, и гидролиз щелочью идет быстрее.Строение галоидного алкила также имеет большое значение: пер¬
вичные галоидные алкилы I ‘реагируют быстрее вторичных; а тем более
третичных II. Это связано со следующим. Алкильные группы отталки¬
вают от себя электроны связи (положительный индуктивный эффект, см.
стр. 180) и тем самым частично гасят небольшой положительный заряд
на атоме углерода, уменьшая тем самым эффективность атаки послед¬
него нуклеофильной частицей:в+.R->-CH2—Cl R->-C—ClR'*I IIБолее редкий механизм Sivl двухстадиен. На первой обратимой и
очень медленной стадии реакции происходит ионизация галоидного ал¬
кила под действием растворителя, а затем быстрая реакция образовав¬
шегося карбониевого иона с нуклеофилом:" Ч НзС\+Н3С—С—С1 НзС—с + сгVН,с/ Н3с/(СН3)3С + X" (СНз)зСХСледует подчеркнуть, что константа скорости прямой реакций пер¬
вой стадии k\ намного меньше, чем обратной k-\ и чем k2, и катион тут
же расходуется по мере его образования. Реакция называется мономо-
лекулярной потому, что кинетика ее определяется первой медленной
мономолекулярной стадией. Скорость реакции выражается уравнением:Концентрация хлор-ионов увеличивается по мере прохождения ре¬
акции и со временем реакция замедляется. Можно ее замедлить и спе¬
циально добавляя хлориды металлов. (Эта добавка не должна сказы¬
ваться при протекании реакции по механизму Sn2.) Из приведенного
уравнения видно, что если концентрация хлор-ионов очень велика, то
все выражение упрощается:HS = fel[RCIlНадо подчеркнуть, что механизм Sjyl может осуществляться не во
всех, а только в таких полярных растворителях, которые способствуют
ГАЛОИДПРОИЗВОДИЫЕ ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ77отщеплению и связыванию замещаемого аниона (элсктрофильные рас¬
творители). Такими растворителями являются, например, спирт, вода,
муравьиная кислота, которые способны образовывать с ионом галоида
водородные связи. Прохождению реакции алкилирования по этому меха¬
низму способствуют серебряные соли, например AgCN, поскольку ионы
серебра отрывают ион галоида и прочно его связывают.Одним из доказательств механизма 5дг1 реакций хлористого трет-
бутила в водноацетоновом растворе является следующее.Этот галоидный алкил гидролизуется избытком воды с определен¬
ной скоростью. При введении эквимольных количеств азида натрия трет-
бутиловый спирт уже практически не образуется, получается только
грег-бутилазид:Однако константа скорости реакции хлористого алкила остается
прежней (скорость реакции — это скорость уменьшения концентрации
грег-бутилхлорида в растворе). Это объясняется тем, что азид натрия и
вода реагируют не с молекулой хлористого алкила, а с промежуточно
и медленно образующимся катионом. Значит, конкуренция между
нуклеофилами возникает на второй ступени реакции, когда общая ско¬
рость задана уже первой стадией.Прямое (спектральное) доказательство существования алкилкарбо-
ниевых катионов привел в 1963 г. Олах. Растворяя третичные и вторич¬
ные фторалкилы в сильном электрофильном растворителе — пятифтори¬
стой сурьме — он получил растворы солей карбония, устойчивых при
температуре от —80 до —100 °С (см. т. II).Третичные галоидные алкилы легче, чем вторичные, вступают в ре¬
акции по механизму Sjvl. Это объясняется большей энергетической вы¬
годностью третичных алкильных катионов, поскольку положительный
заряд в них погашается большим числом алкильных групп за счет поло¬
жительного индуктивного эффекта последних (см. стр. 180):Первичные галоидные алкилы по этому механизму в обычных усло¬
виях не реагируют. Как уже упоминалось, они реагируют по 5^2-меха-
низму.Следует, однако, отметить, что не все первичные галоидпроизводиые реагируют
быстро. Чрезвычайно интересна недавно открытая инертность в реакциях обмена га¬
лоидпроизводных углеводородов неоструктуры, например (СН3)3ССН2С1. Их инертность
объясняется тем, что в переходном состоянии громоздкой группе (СН3)зС трудно
разместиться у углеродного атома одновременно с вступающим и выходящим замести¬
телями и двумя водородами (пространственные препятствия).Особенно важной реакцией галоидных алкилов является реакция
образования магнийорганических соединений при действии эфирного
раствора галоидного алкила (иодида, хлорида или бромида, но не фто¬
рида) на стружку металлического магния:5=* (СН3)3С+ СГ* (СНз)зСОН(СН3)3СС1NaN3-> (CH3)3CN:(CH3)2CHF + SbF5 ч=* KCHjXiCHflSbFe]"R\ +R->Cкатион вторичного катион третичного
галоидного алкила галоидного алкилаRX + Mg —> RMgX
78ГАЛОИДПРОИЗВОДНЫЕ ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВПодобным образом идет реакция и с литием:RX + 2LI —*■ RLi + LiXЭти металлоорганические соединения многообразно используютсяв органическом синтезе.Полигалоидные соединения реагируют иначе, исключение состав¬
ляют дигалоидалканы с достаточно длинной углеродной цепью (не ме¬
нее С4), разделяющей атомы галоида. В остальные реакции полигалоид-
алканы с галоидами у разных углеродных атомов вступают аналогично
галоидным алкилам. Приводим как пример реакции 1,2-дихлорэтана:С1СН2—СН2С1 + Ag20 + Н20 —► НОСН2—СН2ОН + 2AgCl
С1СН2—СН2С1 + 2KCN —>• Ns=C—СН2—СН2—Cs=N -f 2КС1Галоидпроизводные алканов с двумя и более атомами галоида у од¬
ного углеродного атома значительно более инертны и, как правило, их
гидролизв более жестких условиях:Из хлороформа при гидролизе под действием щелочи получается
муравьинокислый натрий:Возможно, однако, что механизм превращения хлороформа в муравьинокислую
соль сложнее, чем в приведенном уравнении реакции. Дело в том, что при действии
сильиощелочных агентов, например алкоголятов щелочных металлов, иа хлороформ
(и фтороформ) происходит отщепление галоидоводорода и образуются производные
двухвалентного углерода — дигалогенкарбены (дихлоркарбен и дифторкарбен СС12
и CF2). Эти неустойчивые вещества часто фигурируют как промежуточные продукты
в реакциях галоформов в щелочной среде. Возможно, что и в данной реакции проме¬
жуточно образуется дихлоркарбен, реагирующий далее со щелочью и теряющий
вследствие гидролиза оставшиеся два атома хлора.В 1964 г. Кобрих описал реакцию хлористого метилена и хлороформа с бутил-
литием при —112°G, приводящую к образованию литиевых производных этих гало-
геиидов:Получаемые металлоорганические соединения обладают некоторой устойчивостью
до —60 °С и могут при такой температуре применяться для синтезов. Литиевое произ¬
водное хлористого метилена бодее устойчиво, чем производное хлороформа. При раз¬
ложении этих соединений образуются соответствующие галогенкарбены.Реакции хлористого метилена и хлороформа с бутиллитием демонстрируют воз¬
росшую сравнительно с углеводородами способность водорода галоидпроизводных
к протоиизации. С этим явлением мы еще встретимся (см. стр. 94, 139).Перфторалканы C„F2n+2 отличаются поразительной химической
инертностью и не вступают ни в какие реакции обмена с самыми агрес¬
сивными реагентами даже в жестких условиях. Перфторполиэтилен («те¬
флон») химически более стойкий материал, чем платина; он не изме¬
няется При нагревании до высокой температуры с любой крепкой кисло¬
той, щелочью или окислителем.ООR—CCl3+4NaOH —► R — ONa + 3NaCl -f 2HaOОHCCI3 + 4NaOH —> Н—С—ONa + 3NaCl + 2Н20СН2С12 + C4H9L1 —>- LiCHCl2 + C4H,o
CHCl3 + C4HeU —* LiCCl3 + C<H10
ХИМИЧЕСКОЕ РАВНОВЕСИЕ79Установление строения галоидпроизводныхСтроение скелета галоидпроизводного можно определить, получив
из него его родоначальный углеводород. Восстановление галоидпроиз¬
водных до углеводорода осуществляется действием магния в эфире и
последующим гидролизом магнийорганического соединения или (в слу¬
чае полигалоидпроизводных) действием иодистого водорода при нагре¬
вании в запаянной трубке. Если галоидпроизводное имело два атома га¬
лоида, расположенные у соседних атомов углерода, магний отщепляет
оба атома галоида и оба углерода соединяются двойной связью. Ее ме¬
стоположение устанавливается окислением образовавшегося непредель¬
ного соединения, сопровождающимся разрывом цепи по месту двойной
связи (такие реакции будут рассмотрены в разделе олефинов). В других
случаях галоидпроизводное подвергают гидролизу: моногалоидпроизвод-
ное превращается при этом в спирт, дигалоидпроизводное в двухатом¬
ный спирт (гликоль) или, если оба галоида находятся у одного углерода,
в оксосоединение (кетон или альдегид). Все эти соедииения легко отли¬
чить по их реакциям. Местоположение гидроксильной группы (ОН) в
этих соединениях или карбонильной группы (СО) устанавливают путем
окисления в кислоты (эти реакции будут рассмотрены при спиртах, аль¬
дегидах и кетонах).ХИМИЧЕСКАЯ РЕАКЦИЯМы рассмотрели уже много реакций органических веществ — реак¬
ции обмена, отщепления (элиминации) , и присоединения. Уравнения,
которые иллюстрировали эти реакции, были в большинстве случаев
ничем иным, как стехиометрическим (т.е. «бухгалтерским») итогом
реакций, который может соответствовать разным механизмам реакции,
разным промежуточным продуктам и разным скоростям течения реак¬
ции. Хотя стехиометрическое уравнение дает лишь минимум знаний о
сущности данной реакции, минимум этот совершенно необходим. По сте-
хиометрическому уравнению рассчитывают необходимое количество ре¬
агентов, выход продуктов реакции и тепловой эффект реакции, который
не зависит от пути превращения, а лишь от начального и конечного
состояний.Учение о химических реакциях состоит из двух больших разделов —
учения о химических равновесиях и учения о скорости химических реак¬
ций (кинетика). Оба эти раздела являются предметом курса физической
химии. Однако некоторые выводы, следующие из этих разделов физиче¬
ской химии, необходимы при изучении курса органической химии, чтобы
глубже понять сущность реакций органических молекул.ХИМИЧЕСКОЕ РАВНОВЕСИЕВ органической химии многие пары реагентов могут реагировать не
в одном направлении, а в нескольких параллельных, конкурирующих
направлениях. Например: > СН2=СН2 + КС1 + Н20СН3СН2С1 + КОН — > СН3СН2ОН + КС1Другие вещества в определенных условиях (в растворах или газовой
фазе) реагируют только в одном направлении. При этом реакции могут
протекать в этом единственном направлении до конца (необратимые
реакции) или в прямом и обратном направлениях (обратимые реакции).
80ХИМИЧЕСКАЯ РЕАКЦИЯПри записи уравнений обратимых реакций знак равенства заме¬
няется двумя стрелками, имеющими противоположное направление:СН3ОН + НС1 СН3С1 + Н20В случае обратимых реакций устанавливается динамическое равно¬
весие, т. е. реакция заканчивается, когда в системе присутствуют в опре¬
деленных концентрациях и продукты реакции и исходные вещества. Со¬
отношение концентраций определяется законом действия масс, согласно
которому при данной температуре отношение произведения концентра¬
ций полученных веществ к произведению концентраций исходных ве¬
ществ (причем каждая концентрация возведена в степень, равную числу
молей, которыми данное вещество участвует в реакции) есть величина
постоянная:аЛ + ЬВ 4=* d£> + e£_d „еС г) • СрK‘ = -r-f <*>СА’СВгде Кс — константа равновесия, являющаяся функцией температуры;
при постоянной температуре в разбавленных растворах она не зависит
от исходных концентраций *.Для более концентрированных растворов в уравнении константы
равновесия необходимо заменить концентрации с на активности а:Активность равна:*а = -7-Б (2)а, • аХ ...a. — с\Iгде с—концентрация в молях на 1000 г растворителя (или в других
единицах); у— коэффициент активности. Величину его находят экспери¬
ментально. В литературе уже имеются специальные таблицы активно¬
стей, где можно найти нужную величину. В разбавленных растворах1, и поэтому можно пользоваться величиной Кс.Коэффициенты активности у изменяются в зависимости от концен¬
трации и температуры по-разному для разных веществ и представляют
собой как бы поправку к концентрации, позволяющую применять закон
действия масс к растворам любых концентраций. В этом преимущество
Ка перед Кс Константа равновесия Ка называется термодинамической
константой равновесия.Термодинамика показывает, что существует связь между константой
равновесия и рядом термодинамических функций. Так, например, связь
между убылью изохорно-изотермического потенциала AF, максимальной
работой реакции при постоянном объеме Av и константой равновесия Кс
выражается уравнением:Лр = - Af = RT \nKc-RT\n C°’°‘Cf ° (3)СА, 0 ' СВ, 0 ■ • 'где F — изохорно-изотермический потенциал **; сйА 0, сьв 0 и т. д. —не¬
равновесные концентрации исходных и получаемых веществ.Если начальные концентрации выбрать равными единице, то макси¬
мальная работа при постоянном объеме будет равна —AF при переходе* Однако выход полезного вещества зависит от концентрации веществ в исход¬
ной смеси.** Иногда эту величину называют свободной энергией при постоянном объеме.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ81от исходных Ееществ с концентрациями с» = 1 к конечным веществам
с концентрациями с\ — 1А'1 — RT In Кс — — AF° (4)т. е. будет равна убыли изохорно-изотермического потенциала.Изохорно-изотермическим потенциалом F системы называют ту
часть энергии системы, которая может быть превращена в работу при
изотермическом обратимом процессе:р = и - TS (5)где U — внутренняя энергия; Т — абсолютная температура; S — энтропия
системы.Константу равновесия можно выражать не через концентрации,
а через парциальные давления полученных и исходных веществ:Pd"Ре • • •= ——ь ' (6)Рл-Рв ■■■В данном случае также существует связь между константой равно¬
весия КР и термодинамическими функциями. Убыль величины G в про¬
цессах при постоянном давлении и температуре равна максимальной
полезной работе при постоянном давлении Ар, т. е. максимальной работе
за вычетом работы расширения:Ар = — ДО = RT In Кр - RT In (7)Р'а. о'Рв.огде G — изобарно-изотермический потенциал (или свободная энергия
при постоянном давлении); раА 0, рьи 0 и т. д. — неравновесные парци¬
альные давления исходных и получаемых веществ.Функция G выражается уравнением:G=±F + pv = U— TS + pv = H— TS (8)где Н = U-f pv — функция состояния системы, называемая энтальпией;
U — внутренняя энергия; р — давление; v — объем.Константы равновесия Кс и КР для одной и той же реакции между
идеальными газами связаны между собой следующим уравнением:Кр = Кс(ЯТ)а'+ъ'+с'-а-х,~с- (9)Очевидно, для реакций, протекающих без изменения числа молекул
(a-j-b + с ... = а'+ Ь'+ с'), константы КР н Кс равны между собой.Когда парциальные давления каждого из компонентов исходной
смеси равны единице, уравнение (7) принимает следующий вид:_Д0 = А?Г1п Кр (10)Для процесса при постоянной температуре из уравнения (8) полу¬
чаем:д G° = \H°—TAS° (11)Исходя из уравнений (8) и (10) и переходя к десятичным лога¬
рифмам, находим:- 2,303#Г 1 g КР = АН - т AS (12)(R = 1,980 кал/град)Величины АН и AS можно определить из экспериментальных дан¬
ных; —АН при постоянном давлении равно QP— теплоте реакции при
постоянном давлении, определяемой калориметрически или вычисляемой4 Зак. 882
82ХИМИЧЕСКАЯ РЕАКЦИЯпо закону Гесса из теплот других реакций; AS— алгебраическая сумма
энтропий участников реакции, равная:Энтропия каждого участника реакции определяется интегрирова¬
нием Ср/Т от абсолютного нуля отчетом теплот фазовых переходов:где Ср — теплоемкость при постоянном давлении; 1ф — теплота поли¬
морфного перехода, сублимации, плавления, испарения; Тф — соответ¬
ствующая абсолютная температура.Путь расчета AG (и отсюда — константы равновесия) по уравнениям (11 —14)
называется расчетом по третьему закону термодинамики, из которого следует уравне¬
ние (14). Другой путь расчета — статистический — применим лишь к газовым реак¬
циям. По этому пути энтропия каждого газообразного участника реакции вычисляется
методами статистической термодинамики на основе молекулярных параметров веще¬
ства, т. е. частот колебаний, момента инерции и потенциалов возбуждения молекулы,
которые, в свою очередь, находят нз спектроскопических, электронографических и
других данных, относящихся к молекуле каждого участника реакции.В настоящее время имеются таблицы теплот образования веществ
из простых веществ и энтропий в стандартных условиях (25 °С и1 кгс/см2). По табличным данным легко вычислить теплоту реакции
QP = —АН и AS по уравнению (13), а отсюда и AG по уравнению (11).
Для пересчета AG к иной температуре необходимо знать теплоемкости
(см. ниже). Рассчитав AG при заданной температуре реакции, можно
по уравнению (10) найти Кр или по уравнениям (8) и (4) вычислитьДостаточно изучено лишь небольшое число сравнительно простых
органических соединений и только для них можно найти в таблицах не¬
обходимые для расчета сведения.Температурная зависимость константы равновесия выражается
уравнениями (15) и (16);где AU — прирост внутренней энергии, равный теплоте реакции при
постоянноигобъеме, а АН — прирост энтальпии, равный теплоте реакции
при постоянном давлении.Интегрирование (при упрощающем предположении, что тепловой
эффект ре'акции не зависит от температуры) приводит к урарнению (17)
для процесса при постоянном объемеAS — a Sj -t~ b S2 "Ь с S3 -t~ ... — aSj —• bS2 — cSg(13)(14)AF и Кг.(15)(16)(17)и к уравнению'(18) для процесса при постоянном давлении:(18)Переходя к десятичным логарифмам и вводя численное значение
газовой постоянной R, получаем;
ХИМИЧЕСКОЕ РАВНОВЕСИЕ83при постоянном объеме\ Г] (Тп т \lg А с/ = 1 g Кс, Н 4^7(57-^^ " (17а)при постоянном давлении, v | тг , А// {Тх — Тi) , nsoVlg Ар, — lg Кр, + 4j5767y-2 (18а>На деле, однако, тепловой эффект реакции обычно зависит от тем¬
пературы, и зависимость эта выражается законом Кирхгоффа:г, к\ur = \UTj + [ V v(.C.i; dT (19)'К iг, кМ1Т =- Л//Ги + [ V v{.Cpf dT (20)j'u 1где C„ и CP — мольные теплоемкости участвующих в реакции веществ
соответственно при постоянном объеме и постоянном давлении; v — соот¬
ветствующее число молен.Теплоемкости в свою очередь зависят от температуры; эта зависи¬
мость выражается степенным рядом. Прн интегрировании приходится
вводить под знак интеграла указанную степенную зависимость.Обратимся вновь к уравнению (12):Д Я-Г AS TAS-AH AS АН .2,303RT 2,303а1 7’ 2,3037? 2,3037?Г 1 'Логарифм константы равновесия реакции при данной температу¬
ре—функция разности, написанной в правой части цепи равенств. На¬
помним, что через —А Я обозначается выделяющееся при реакции тепло.
Логарифм константы (и тем более константа) будет, следовательно, тем
больше, чем более экзотермична реакция при прочих равных условиях.
Однако вторым не менее важным слагаемым является член, содержащий
приращение энтропии AS, который может обеспечить большие значения
константы равновесия и в случае эндотермических реакций.От каких факторов реакций зависит приращение энтропии? От пере¬
хода более упорядоченных систем к более хаотическим. Так, циклизация
(например, ацетилена в бензол) — процесс с уменьшением энтропии. При
крекинге энтропия увеличивается. При гидрировании твердого углерода
водородом с образованием смеси алканов нарушение упорядоченности
кристалла (например, графита) с переходом к менее упорядоченным
цепям алканов (с большим числом степеней свободы) вносит положи¬
тельное слагаемое в энтропийный член, а превращение газообразного
водорода в связанное состояние вносит отрицательное слагаемое.Следует, однако, помнить, что великое множество реакций органиче¬
ской химии протекает неоднозначно, в соответствии с одним уравнением
химической реакции, а представляет собой сложную совокупность после¬
довательных и параллельных реакций, идущих с разной скоростью. Не¬
которые из параллельных реакций обратимы и протекают до равновесия,
другие идут практически до конца. Для очень большого числа реакций
нет практической возможности расчленить сложную реакцию на простые
и найти для каждой из них в отдельности положение равновесия, кон¬
станту равновесия (или величину AG). Если это оказывается возмож¬
ным, то после наступления равновесия можно рассчитать сложный со¬
став реакционной смеси. Нередко это настолько сложная задача, что она
может быть решена только с помощью современной вычислительной
техники.4*
84ХИМИЧЕСКАЯ РЕАКЦИЯСКОРОСТЬ РЕАКЦИИВо многих случаях не имеет смысла даже ставить задачу полного
учета равновесия всех реакций, составляющих обычную сложную реак¬
цию органической химии. Дело в том, что конкурирующие реакции идут
с весьма различными скоростями и в ограниченный интервал времени
некоторые из реакций дойдут до возможного конца, другие же останутся
в начальной стадии.Именно сравнительные величины скоростей отдельных реакций опре¬
деляют, по какому направлению за данный промежуток времени успеет
прореагировать большее количество исходных веществ. Конкуренция
скоростей определяет и выход тех или других конечных продуктов за
данный промежуток времени.Под скоростью реакции V разумеют производную количества проре¬
агировавшего вещества (т. е. убывшего количества, отсюда знак минус)
по времени t:Мерой количества вещества служит концентрация веществ с.В кинетике различают понятия молекулярности реакции и порядка
реакции.Молекул'ярность реакции отражает механизм элементарного акта.
Так, мономолекулярные реакции — это реакции, протекающие за счет
превращения одной молекулы; бимолекулярные — за счет превращений,
происходящих при столкновении двух молекул, и т. д. Стехиометриче-
ское уравнение реакции соответствует молекулярности лишь в случае
простых реакций (реакции, в которых продукт получается сразу, непо¬
средственно из исходного вещества без каких-либо промежуточных ста¬
дий). В этом случае скорость мономолекулярной реакции, т.е. скорость
исчезновения исходного вещества, пропорциональна его концентрации:т. е. скорость реакции пропорциональна квадрату концентрации (или
произведению концентраций).Из приведенных уравнений видно, что в одном случае (уравне¬
ние 22) концентрация входит в выражение для скорости в первой сте¬
пени, а во втором случае (уравнение 24)— во второй степени. Сумма
показателей степеней при концентрациях, входящих в кинетическое
уравнение, носит название порядка реакции (первого порядка, второго
и т. д.). Очевидно, что только в случае простых реакций молекулярность
будет совпадать с порядком реакции. Исходя из этого уравнение (22)
называют уравнением скорости реакции первого порядка, а уравне¬
ния (23) и (24)—уравнениями скорости реакции второго порядка.Интегрирование уравнения (22) от времени t\ до времени ^ дает
выражение константы скорости первого порядка:(22)где k — коэффициент пропорциональности.Скорость бимолекулярной реакции выражается уравнением(23)или в случае превращения одного вещества(24)
СКОРОСТЬ РЕАКЦИИ85Это закономерность скорости реакций первого порядка; размерность
константы скорости первого порядка — секунда в степени —1(с-1).Интегральная форма уравнения (23) в случае равенств с' — с"
(для времени от t\ до /2) имеет следующий вид:1 1 ^ (23а)С| с.Это закономерность скорости реакций второго порядка; размерностьконстанты скорости второго порядка ^ ~М01Ь/С"В общем случае (с' Ф с") интегрирование уравнения (23) приведет
к уравнению (236):1 , "ft" (f2 71п^ (236)С1 — С1 С1 ’ с2Примерами мономолекулярных реакций могут служить многие ре¬
акции изомеризации, таутомеризации, реакции распада на ионы (т. е.
электролитической диссоциации) или гемолитического распада.Бимолекулярные реакции — наиболее обычный тип реакций. При¬
мерами их могут служить реакции обмена в ряду первичных галоид¬
производных под действием "ОН, CN~, RCO~ и др.ОРеакции третьего порядка встречаются более редко, так как ве¬
роятность одновременного столкновения трех молекул значительно
меньше. Их скорость, очевидно, пропорциональна произведению концен¬
траций трех веществ:_ ^ = к"’с’с"с'" (25)В случае эквимолекулярных начальных концентраций k'"c'c"c"'
превращается в k"'cz или в интегральной форме М , ;У’ - !h ~ h 2с;(26)Перепишем несколько иначе уравнение константы скорости реакции
первого порядка (22а):kt-> — kti — In Ci —- In c2 (27)Принимая во внимание, что время отсчета t и начальная концентра¬
ция С] (концентрация в момент начала отсчета времени) постоянны,
а переменны только t2 и с2, отложим по оси абсцисс t2, а по оси ординат
In с2. Мы получим прямую, из которой можно определить величину кон¬
станты скорости реакции. Для этого удобнее в уравнении (27) перейти
от натуральных логарифмов к десятичным:— lg С2 = 0,4313/г/о - 0,4343/г/, - lg с, (28)Так как в этом уравнении /2 — независимая переменная, —lg с2 —
функция, а остальные члены постоянны, приходим к выводу, что коэф¬
фициент 0,4343/г при t2 является тангенсом угла наклона прямой к оси
абсцисс, откуда можно найти и значение к.Рассуждая подобным же образом об уравнении реакции второго
порядка (уравнения 23, 24), мы приходим к выводу, что, откладывая
по оси абсцисс время, а по оси ординат lg (с"/с'), мы должны получить
прямую, если константа к сохраняет постоянство.
86ХИМИЧЕСКАЯ РЕАКЦИЯДействительно, в уравнении (236) независимой переменной яв¬
ляется /2, а функцией—In (с"/с'). Уравнение (236) можно написать
следующим образом:Третий и четвертый члены уравнений постоянны. Тангенс угла на¬
клона кривой [абсциссы t2, ординаты lg(c"/c')] равен k" (с" — с') 0,4343,
откуда легко найти значение к"-.При огромном избытке одного из реагентов бимолекулярная реак¬
ция будет идти по существу по уравнению первого порядка (псевдомо-
номолекулярная реакция), так как она не будет зависеть от изменения
(исчезающе малого) концентрации избыточного реагента. Такими псев-
домономолекулярными реакциями являются часто реакции гидролиза
в водном растворе (огромный избыток воды). Любую бимолекулярную
реакцию можно провести как псевдомономолекулярную, создавая очень
большой избыток одного из реагентов.Если реакция проходит ряд стадий, то итоговая скорость опреде¬
ляется скоростью наиболее медленной стадии реакции и кинетические
измерения позволяют судить только об этой стадии. Примером может
служить гидролиз третичных галоидных алкилов, которые при действии
воды превращаются в спирты (в каком-либо растворителе) в две
стадии:Первая стадия — ионизация третичного галоидного алкила — совер¬
шается медленно. Это, очевидно, мономолекулярный процесс*, и именно
его малая скорость измеряется при кинетических измерениях уменьше¬
ния во времени концентрации (СН3)3СС1 или увеличения во времени
концентрации Н+. Вторая стадия — бимолекулярная реакция катиона
(СН3)3С+ с молекулой воды — проходит быстро и поэтому при кинети¬
ческих измерениях остается незамеченной. Вся суммарная реакция идет
по закону скорости реакции первого порядка.Зависимость скоростей сложных реакций, отдельные стадии которых
протекают с соизмеримыми скоростями, обычно не может быть выра¬
жена простым кинетическим уравнением. Порядки таких реакций часто
являются дробными и даже могут изменяться в процессе реакции.Для обратимых реакций при наступлении равновесия скорость пря¬
мой реакции равна скорости обратной реакции (иначе не было бы рав¬
новесия и реакция шла бы в направлении большей скорости реакции).
Исходя из этого константа равновесия должна быть равна отношению
констант скоростей прямой и обратной реакции:С2 Cjа после перехода от натуральных логарифмов к десятичным(29)// Гlg —т = 0,4343/г" (с" - c\) t, + lg ~ + 0,4343/s"/,(30)tga
/ // .(c" -c[) 0,4343(31)(CH3)3CC1 —► (СН3)8С++СГ
(CH3)3C+ + H20 —> (CH3)3COH + H+k прямой реакции(32)k обратной реакции* Вернее, псевдомономолекулярный, так как сольватирующий ионы растворитель
(находящийся в огромном избытке) —■ активный участник ионизации.
СКОРОСТЬ РЕАКЦИИ87Зависимость константы скорости реакции от температуры выра¬
жается уравнением Аррениуса: Я Е_к k = Ae кТ или к =Pze кТ (33)где k — константа скорости реакции; Pz— иредэкспоненциальный мно¬
житель, который можно рассматривать как экспериментально опреде¬
ляемую величину А, постоянную для данной реакции и данных условий;
е — основание натуральных логарифмов; R — газовая постоянная; Т —
абсолютная температура; Е — энергия активации, т. е. та энергия, на
величину которой энергия эффективно сталкивающихся (реагирующих)
молекул должна превышать среднюю энергию молекул при данных
условиях.Предэкспоненциальный множитель Pz состоит из двух множителей:
z — числа столкновений реагирующих молекул в секунду, вычисляемого
на основании кинетической тео¬
рии, и Р — пространственного
фактора (Р < 1). Этот фактор
вносит поправку на то, что эф¬
фективны лишь столкновения тех
молекул, которые имеют опреде¬
ленное благоприятное взаимное
расположение.Уравнение Аррениуса пока¬
зывает, что при данной темпера¬
туре реагирует не каждая пара
сталкивающихся молекул реаген¬
тов, а только та, которая в сумме
обладает энергией, на величину Е
большей, чем средняя величина
энергии молекул в данных усло¬
виях. Но и из отвечающих этому
условию пар молекул прореаги¬
руют не все (дробный множитель
Р), а только те, которые столк¬
нутся геометрически подходя¬
щим способом. Чем сложнее строение реагирующих молекул, тем
меньше дробная величина Р\ для простейших молекул величина Р
близка к 1.Энергетические отношения реагентов и продуктов реакции иллю¬
стрируются схемой, приведенной па рис. 32.Энергию активации можно определить экспериментально, измерив
скорость реакции при нескольких температурах и отложив по оси орди¬
нат вычисленные значения логарифма константы скорости, а по осп
абсцисс 1/Т. Так как из уравнения (33) следуетlnfc = lnPz--f--4- (34)К Iто тангенс угла наклона полученной прямой и будет равен E/R.Связь константы скорости реакции с энергетическими параметра¬
ми переходного состояния. При химической реакции система реагирую¬
щих молекул, состоит ли она из одной (мономолекулярная реакция),
двух (бимолекулярная) или трех молекул (тримолекулярпая), должна
за счет затраты энергии активации превратиться в переходное состояние
(реакционный комплекс). Рассматривая переходное состояние в энер¬
гетическом аспекте, можно охарактеризовать его как самую высокую>1 УПереходник
состояниеЭнергияПереходные1 я стадая оиипюяния, '-/Т\ 2-я стадияРис. 32. Энергетические отношения ре¬
агентов и продуктов реакции:
а — экзотермическая реакция; б — эндотермическая
реакция; в —двухстадийная реакция с устойчивым
промежуточным продуктом и двумя переходными
сое гояпиямп.
88ХИМИЧЕСКАЯ РЕАКЦИЯэнергетическую точку на пути от исходных продуктов к продуктам
реакции, на которую нужно подняться и через которую нужно перева¬
лить, чтобы реакция осуществилась.Поясним это на примере простейшей бимолекулярной реакции, на¬
пример обмена хлора на иод при действии иодистого натрия на хлори¬
стый алкил (реакция Финкельштенна):В переходном состоянии углерод как бы пятивалентен, но связь его
с обоими галоидами не является настоящей установившейся связью,
такой, как в галоидном алкиле. Расстояние от углерода до того и дру¬
гого галоида на 20—40% больше, чем в начальном и конечном продук¬
тах, а энергия каждой связи меньше. Замещающий галоидный ион
атакует молекулу со стороны, противоположной находящемуся в ней га¬
лоиду, и в переходном состоянии группировка RR'R^C становится пло¬
ской *. На достижение столь неустойчивого и богатого энергией пере¬
ходного состояния и затрачивается энергия активации.От переходного состояния имеются два пути — возврат к исходным
реагентам или переход к продуктам реакции. Переходное состояние
можно трактовать как неустойчивое соединение, а реакцию, приводящую
к его образованию, как обратимую химическую реакцию (константа
скорости к).В теории переходного состояния (Лондон, Эйринг) для реакциивыведено следующее отношение между константой скорости реакции к
и константой равновесия К*где х — константа Больцмана, равная газовой постоянной R, поделен¬
ной на число Авогадро N0; h — универсальная постоянная Планка.Таким образом, и/А— постоянная величина. Для любой реакции при
постоянной температуре (300°К)Для константы равновесия К* действительны те же связи с термо¬
динамическими потенциалами, что и для константы равновесия обычной
реакции (см. уравнения 10—12), а именно:Подставив в уравнение (35) значение К*, получим соответствующее
выражение (38):RCI/\„R R>- I-C—P' + СГ
R"Исходные реагенты ^=±: Переходное состояние(35)~т = 6- 1012Аlg К* = ~ДЯ* — Т№*2,зоз/?г(36)откудаК* =(37)(38)* В конечном продукте эта группировка зеркально вывернута по сравнению
с исходным, см. стр. 76.
ОДНОАТОМНЫЕ СПИРТЫ (АЛКАНО.ПЫ)89Таким образом, константа скорости реакции является функцией
работы — AG*, которую нужно затратить для того, чтобы молекулы
реагирующих веществ достигли переходного состояния. Зная величину
—AG*, можно вычислить скорость реакции.Аналогично можно выразить К* через энтальпию и энтропию, под¬
ставив соответствующие величины в уравнение (35):AS’k=~c * е 1<т (39)hПри обычных температурах ведения органических реакций АН*
незначительно отличается от энергии активации Е, достигающей обычно
нескольких или многих десятков килокалорий, в то время как величина
RT < 1 ккал/моль. Отсюда можно положить, чтоA S*V.T R
h еравно предэкспоненциальному множителю А (или Pz) в уравнении
Аррениуса. Таким образом, предэкспоиепциальпый множитель выражает
вероятность перехода вещества в реакционный комплекс (энтропия
пропорциональна логарифму термодинамической вероятности).ПРЕДЕЛЬНЫЕ СПИРТЫОДНОАТОМНЫЕ СПИРТЫ (АЛКАНОЛЫ)Во введении (стр. 17) уже говорилось, каким образом на примере
этилового спирта было установлено, что спирты представляют собой
гидроксильные производные углеводородов. При рассмотрении галоид¬
производных предельных углеводородов установлены дополнительно
родственные отношения алканов, галоидных алкилов и спиртов:CI, Ag,0+H20СлН2п+2 QzH2n+iCI С„Н2п + 1ОНHI наЭти взаимные превращения можно попять, только приняв, что
спирты являются гидроксильными производными алканов — алкано-
лами.Очевидно, что для метана и этана, в каждом из которых все атомы
водорода равноценны, путем замещения одного водорода на гидроксил
можно получать по единственному спирту: это метиловый СН3ОН и
этиловый СНзСН2ОН спирты. У пропана имеются уже две известные
нам возможности — замещение на гидроксил одного из водородов край¬
них метильных групп или одного из двух водородов центральной мети¬
леновой группы. И действительно, существуют два нропиловых спирта:
первичный, в котором гидроксил связан с первичным углеродом, и
вторичный — с гидроксилом у вторичного углерода, обычно неправильно
называемый изопропиловым спиртом:ОНIсн3—СН,—СН2ОН сн3—сн—СНзпервичны!! ироппловый спирт в юричшлй проинловый ешфтТаким образом, изомерия спиртов, как вообще изомерия замещен¬
ных углеводородов, носит двоякий характер — изомерия скелета, уже
знакомая нам по алканам, и изомерия положения гидроксила в данном
скелете. Уже для четвертого члена гомологического ряда алканов —
90ПРЕДЕЛЬНЫЕ СПИРТЫбутана спирты придется производить от двух разных скелетов: от
н-бутана и изобутана.Спирты, в которых гидроксил связан с первичным углеродом
(—СН2ОН), называются первичными, с гидроксилом у вторичного угле¬
рода (>СНОН) —вторичными и с гидроксилом у третичного углеродаI 1 ^—СОН I—третичными.V I 'Алканолы — члены гомологического ряда метилового спирта —1
имеют общую формулу CnH2ra+iOH. По карбинольной номенклатуре
первый член ряда — метиловый спирт называется карбинолом. При по¬
строении названий его гомологов перед словом карбинол ставят наиме¬
нование алкильных (или иных) радикалов, замещающих скелетные во¬
дородные атомы в метиловом спирте. По международной женевской но¬
менклатуре название спирта образуется путем добавления окончания
ол к женевскому названию алкана. Нумерация углеродного скелета со¬
храняется та же, что в родоначальном углеводороде. После наименова¬
ния ставится цифра, обозначающая номер углеродного атома, несущего
гидроксил. Если соединение является двухатомным спиртом (или глико¬
лем), т. е. имеет две гидроксильные группы, название примет оконча¬
ние диол, а с тремя — триол. Например, этиленгликоль НОСН2— СН2ОН
называется этандиол-1,2; глицерин НОСН2—СН(ОН)—СН2ОН — про-
пантриол-1,2,3.Физические свойстваВ табл. 9 приведены физические свойства алканолов, их формулы и
названия— тривиальные и образованные по карбинольной и междуна¬
родной женевской номенклатуре.Из сравнения температур кипения спиртов сходной структуры, на¬
пример первичных спиртов с нормальным скелетом, ясно, что при пере¬
ходе от одного члена гомологического ряда к другому, подобному, по¬
вышение температуры кипения составляет ~20°С. Разветвление цепи,
так же как и при углеводородах, повышает температуру плавления (осо¬
бенно для третичных спиртов, в которых разветвление примыкает к
функциональной группе) и понижает температуру кипения. По сравне¬
нию с углеводородами спирты кипят при очень высокой температуре.
Так, я-бутан кипит при — 0,5 °С, а первичный я-бутиловый спирт—.
при 117,7 °С.Содержащие гидроксил вещества вообще обладают аномально вы¬
сокой температурой кипения. Это ясно видно из сопоставления темпе¬
ратур кипения водородных соединений кислорода и его соседей по пе¬
риодической системе:NH3 Н20 HF(—33,3 °С> (100 °С) (10.5 °с>H2S(—60,7 °С)Связано это с тем, что вода — ассоциированная жидкость, ее моле¬
кулы в жидкой фазе в среднем имеют утроенный молекулярный вес
(Н20)3. Следствием являются многочисленные аномалии воды. Из со¬
седних же с ней водородных соединений ассоциирован лишь HF в жид¬
ком состоянии, но в меньшей степени.Спирты и все органические гидроксилсодержащие вещества также
ассоциированы, хотя и в меньшей степени, чем вода, и им свойственны
некоторые подобные аномалии. Отсюда и их высокие температуры ки¬
ОДНОАТОМНЫЕ СПИРТЫ (АЛКАНОЛЫ)91пения. Ассоциация обусловлена образованием связей типа электроста-
. тических дипольных притяжений между водородом гидроксила, являю¬
щимся положительным концом диноля, и кислородом второй молекулы
спирта, несущим частичный отрицательный заряд. Такая связь носит
название водородной связи и обозначается тремя точками:R—О—Н---0—Н!RВодородные связи гораздо менее прочны, чем обычные химические
связи, что видно из сопоставления средних теплот образования связей
(в ккал/моль):С—С 82,6 О—Н 110c-S::::::: S •••• ~6Чем менее окружен гидроксил алкильными группами, тем беспре¬
пятственнее проявляется ассоциация и тем выше температура кипения
вещества. Поэтому первичные спирты кннят при более высокой темпе¬
ратуре, чем изомерные им вторичные, а третичные имеют наиболее
низкую температуру кипения:СIСН2ОН > С—СН—С > С—С—СI Iон онТемпературы плавления наиболее высоки, как всегда, у наиболее
симметрично построенных веществ: третичные спирты планятся выше
своих изомеров.Метанол, этанол и оба пропиловых спирта смешиваются с водой
во всех отношениях, бутанол растворим в воде ограниченно (~ 10%),
амиловые спирты — мало растворимы. В водных растворах спиртов
устанавливаются водородные связи между водородом воды и кислоро¬
дом гидроксила спиртов. Так, растворы этанола в воде имеют свои
«аномалии» (нарушения аддитивности плотности и др.).Получение спиртовОбщие способы синтеза. 1. Гидролиз галоидпроизводных (стр. 74).2. Гидрирование окиси углерода. В разных условиях можно полу¬
чить как чистый метиловый спиртСО + 2Н2 —*■ СИ3ОН АН — — 216 ккалтак и смесь его первичных гомологов, начиная с этилового спирта (син-
тол).Метанол в больших масштабах получают гидрированием окиси угле¬
рода водородом примерно при 400 °С и 200 кгс/см2 над катализатором,
представляющим собой смесь окиси хрома и окиси цинка.В производстве синтола в качестве катализатора применяют же¬
лезо и кобальт и процесс ведут при давлении в несколько десятков
атмосфер и повышенной температуре. Процесс можно направить в сто¬
рону преимущественного образования смеси первичных пропилового и
изобутилового спиртов.3. Восстановление оксосоединений водородом при участии катали¬
заторов (Ni, Pt) или при помощи друз их восстановителей. При этом из
<N00Осоо(М00осоСО00юооО(МСПЮмосоTf«h-осо<NюО
—' 00*
7 IСОю+ЯхооСиТОккмкюОкt?о.ЯоТОЯяя*ЮоЯо.о.\оЯТОяо.тонmi«2Кс-нМети.НОЛнmЯп(1)ХО*о(Г)h-чt—VOО,ог-токО1CVOО-Яt—лс3ХОор«Оняог;ГОЯCl,ЯХОс:нО.ок3"»ЯГОгоtQн«Я>чrjiИЯ1-1 г~
О ~схоF-СиЯ<г- ОF-аsСОа;(Мтt-о6яятото«Nсонн>,с;кхохоОок;ЯЯSГОоз{-•нь*н<1>0)Я«Г*(1)О)<СС<N<N<N—г;оОяОо.ятоТОнНя__Ьч\оХОоИ:5? —ОнЯ (L,тоCJ0JОо■5—1 ЯС1 тои:ососчCN СL-*я*я33сэИ»яоо3*=!t?оаяяоSй0303яiiSSто»я»я»s»яю333ояяЕГЕГЕГ■—<ЯяяОнОннтооо(1)онно.ffl/ CQНSсзтоОг;£ТОЭоп3«я'-чтою3*Яяооао2Sяс?яонЯ^г<ио~ >я0JЬйС-.~ 3я(1)оF—^ и
• оооUСОо £Xi£иIЖи-£о£иI£ож-ож01<мжиI£О'I<NЖижож-ои-жиI£иI-и-и-ожои •Xн-ГXи]ии1£JL'Х,^-н►-l-lи1и —
1■оU1X£Jh"XX-ии-—и1и —
1п:1X1Еиии£О£ОI—О-£и£-о£О£О£и£О
9?ПРЕДЕЛЬНЫЕ СПИРТЫ-альдегидов получаются первичные спирты, а из кетонов — вторичные:R4 Rv у ОН R4 Rn .ОНV=0 + 2H —■> ;С=0 + 2Н —хс(W W \н R'/ R'/ ^Нальдегид первичный спирт кетой вторичный спирт4. Восстановление карбоновых кислот и их производных. Особенно
известен метод восстановления сложных эфиров карбоновых кислот
действием натрия в кипящем спирте (метод Буво):R— С—ОС2Н5 + 4Na + ЗС2Н50Н —>• R—С—ОН + 4C2H5ONaЛ н/\н5. Присоединение магнийорганических соединений, а также литий-
органических, цинкорганических и часто натрийорганических соединений
к альдегидам и кетонам:н\ н2о /С1V=0 + RMgCl —R—С—OMgCl —>- R-C—ОН + Mg'нх н/ ^Н Н^ ^Н онR'v н2о R\ /С1С=0 + RMgCl —V R'—С—OMgCl —► ;снон + Mg(
н/ н/ \r R/ ^ОН*'\ н20 Ч /С1С—О + RMgCl —V R—С—OMgCl —> R'—С—OH + Mg'Я"/ Я'/ \R« R"/ 'ЮНСначала металлоорганическое соединение присоединяется к оксо-
соединению, а после разложения аддукта водой образуется спирт и
основная соль магния.Таким образом, металлоорганический синтез дает возможность по¬
лучать первичные, вторичные и третичные спирты. Для синтеза первич¬
ных спиртов на магнийорганическое соединение (гриньяров реактив)
действуют формальдегидом, для синтеза вторичных — одним из альде¬
гидов (но не формальдегидом), наконец, для синтеза третичных спиртов
применяют кетоны.6. Присоединение воды к олефинам (гидратация) в присутствии кис¬
лот. В зависимости от строения олефина образуются вторичные и тре¬
тичные спирты (из первичных спиртов таким путем можно получить
только этиловый, R = H):п+R—СН—СН2 -f Н20 —> R—СН—СНзIОНR\ н+ R\)с=сн2 + н2о —>■ ;с-сн3
к' R'/IHРеакция начинается с атаки ионом водорода того углеродного ато¬
ма, который связан с большим числом водородных атомов и является
поэтому более электроотрицательным, чем соседний углерод (правило
Марковникова; подробнее см. стр. 248). После этого к соседнему угле¬
роду присоединяется вода с выбросом Н+. Этим методом в промышлен¬
ном масштабе готовят этиловый, вгор-пропиловый и грег-бутиловый
спирты.7, Брожение сахаров. Дрожжи сбраживают некоторые виды сахаров
'(глюкозу, фруктозу, мальтозу и, после предварительного гидролиза,
ОДНОАТОМНЫЕ СПИРТЫ (АЛКАНОЛЬП95обычный сахар — сахарозу). Суммарное уравнение превращения саха¬
ров в этиловый спирт и двуокись углерода при брожении таково:Такое уравнение ничего не говорит о механизме реакции, который
будет приведен после изучения строения сахаров.Дрожжи — живые одноклеточные микроорганизмы, грибки. Броже¬
ние вызывается несколькими присутствующими в дрожжах ферментами,
которые в сумме называют зимазой. Зимаза водорастворима и из под¬
сушенных дрожжей ее можно извлечь водой (А. Н. Лебедев). Можно
раздавить дрожжи и получить раствор зимазы в клеточном соке (Бух¬
нер). В обоих случаях не содержащий живых клеток раствор зимазы вы¬
зывает брожение — каталитический многостадийный распад сахара на
спирты и двуокись углерода. Роль зимазы —чисто каталитическая.Процесс брожения наиболее давно известен в виноделии. Брожению подвергается
сок, выдавленный из винограда. Дрожжи специально не добавляют, они присутствуют
на кожице винограда, поэтому затравка изюмом, например при получении кваса,
равносильна внесению дрожжей. Виноградный сок содержит глюкозу, которая и бро¬
дит. Брожением нельзя получить раствор спирта (вина) крепче, чем 12—14° (градус —
объемный процент спирта), так как спирт препятствует жизнедеятельности дрожжей.
Более крепкие и особенно сладкие (десертные) вина получают креплением: когда
в сильно сахаристом соке выбродила еще не нся глюкоза, добавляют спирт — броже¬
ние прекращается, а часть глюкозы остается.Для производства спирта используют более дешевые источники сахаристых ве¬
ществ— крахмал (из картофеля, кукурузы и др.) или древесину. В первом случае
клубни картофеля (или зерно) нагревают с водой выше 100 °С под давлением и затем
быстро снимают давление. Получается клейстерообразная масса, которую подвергают
осахаривашпо. Для этого применяют солод или специальные микроорганизмы, осаха-
ривающие крахмал. Солод — подсушенные и размолотые проросшие зерна злака
(обычно ячменя), накопившие ферменты, необходимые растению для мобилизации
запасного крахмала — превращения его в растворимый углевод — мальтозу. Солод
содержит очень большое количество этих ферментоп, названных диастазом. При тем¬
пературе около 60 °С клейстер осахаривается диастазом в мальтозу, после чего вносят
дрожжи и совершается процесс брожения. Полученный еппрто-водныи раствор отго¬
няют и подвергают фракционированию, , получая спирт желаемой крепости, но не
крепче 96 градусов (96-градусный спирт представляет собой азеотропную смесь
спирта с водой, кипящую при 78,15 °С).Абсолютный (безводный) спирт получают, отнимая от 96-градусного спирта воду
химическим способом, для чего действуют сначала СаО или безводным CuS04, а за¬
тем металлическим кальцием. Можно также, добавив к абсолютному спирту бензол,
отогнать азеотропную тройную смесь воды, спирта и бензола с минимальной темпера¬
турой кипения, после чего подвергнуть фракционированию оставшуюся смесь этило¬
вого спирта с бензолом, не образующую азеотропноп смеси и разделяемую фракцион¬
ной перегонкой.Для поддержания жизнедеятельности дрожжей требуется добавлять
аммониевые соли как источник азота. Дрожжи, размножаясь и увели¬
чивая свою массу, превращают аммониевые соли в аминокислоты
(стр. 455) и белки. В процессе брожения некоторая часть аминокислот
теряет карбоксильную группу в виде С02 и, замещая группу NH2 на
гидроксил, превращается в спирт. Таким образом и образуются спирты
сивушного масла, являющиеся первичными спиртами;СвН12Ов —->■ 2С2Н5ОН + 2СО„ПропиловыйСН3—СН*—СН/Ш
СП,IИзобутиловый (2-метилпропанол-1) - -СНз—СН—СНгОН
СНзIИзоамиловый (3-метилбутанол-4)СП,—сн—СН2—СН^ОН
СН3Оптически активный амиловый (2-метилбута-
нол-1) . .С2Н5-СН—СН2ОН
ПРЕДЕЛЬНЫЕ СПИРТЫХимические свойства спиртовРяд химических свойств спиртов является общим для всех спиртов;
имеются также и реакции, по-разному протекающие для первичных,
вторичных и третичных спиртов. Рассмотрим сначала общие реакции
спиртов.1. Образование и свойства алкоголятов металлов. При действии на
спирты щелочных металлов, в частности натрия, происходит, хотя и ме¬
нее бурно, взаимодействие, подобное реакции натрия с водой (см.
также стр. 17):2ROH + 2Na —>• 2RONa + Н2
2НОН + 2Na —>• 2HONa + Н2Такого типа металлические производные спиртов носят общее на¬
звание алкоголяты (отдельные представители: метилат натрия CH3ONa,
этилат натрия С2Н5ОЫа, пропилат, вгор-пропилат и т. д.). Их называют
также алкоксидами (метоксид натрия, этоксид и т. д.).Известны алкоголяты и других металлов, кроме щелочных, но они
образуются косвенными путями. Так, щелочноземельные металлы непо¬
средственно со спиртами не реагируют. Но алкоголяты щелочноземель¬
ных металлов, а также Mg, Zn, Cd, А1 и других металлов, образующих
реакционноспособные металлоорганические соединения, можно полу¬
чить действием спирта на такие металлоорганические соединения. На¬
пример:2СН3ОН + Zn(CH3)2 —>• (CH30)aZn + 2СН„Можно синтезировать и смешанные алкоголятбромиды:СН3СН2ОН + CH3MgBr —> CH3CH2OMgBr + СН4Кроме того, алкоголяты можно получить и по реакции обмена алко¬
голята натрия с хлоридом металла в безводной среде:3CH3ONa + А1С13 —>• (СН30)3А1 + 3NaClАлкоголяты щелочных металлов — вещества с сильно полярной
связью О—Me, электролитически диссоциирующие в растворе в со¬
ответствующем спирте с образованием алкоксид-аниона (метоксид-,
этоксид-, пропоксид-анионы и т. д.):CH3ONa —>- СН30- + Na+Вода — более сильная кислота, чем спирты. Константа диссоциации
воды Ка = Ю~16, метанола ~ 10~17, этанола и других первичных спир¬
тов ~ 10~18 (т. е. на два порядка ниже воды); вторичные и особенно
третичные спирты — еще гораздо более слабые кислоты. Поэтому при
действии воды на алкоголяты устанавливается равновесие, сильно сме¬
щенное вправо:C2H50Na + H20 CjHsOH + NaOHили при записи в ионной форме:' С2Н60" + Н20 С2НьОН + ОН~Алкоксид-анионы полнее, чем гидроксильные ионы, связывают ион
водорода, поскольку при этом образуется менее диссоциированная мо¬
лекула спирта. Поэтому алкоксиды щелочных металлов являются еще
более сильными основаниями, чем едкий натр или едкое кали. Особенно
сильные основания — алкоголяты наименее диссоциированных третич¬
ных спиртов, например (CH3)3CONa.
ОДНОАТОМНЫН СПИРТЫ. (АЛКЛПОЛЫ)97Сииртовый раствор едкого натра — более сильное основание, чем
его водный раствор, именно потому, что в таком растворе присутствует
алкоголят натрия, образующийся в результате равновесной реакции:ROH + МаОН RONa + Н20Алкоголяты щелочных металлов — твердые вещества, разлагаю¬
щиеся при нагревании без плавления. Алкоголяты алюминия можно
перегонять — они уже не имеют типичной ионной связи металл—алк-ОКС.ИЛ.2. Образование сложных эфиров спиртов (реакция этерификации).
При действии кислородных минеральных и органических кислот на
спирты происходит реакция, которую можно представить следующими
примерами:HOv RCkROH + \ог \02 + Н20НО/ нскНОч R04
2ROH+ ^S02 <=± ^S02 + 2H20НО/ RO/R0H + H0N02 ч=* RO—N02 + H20О оII IIROH+НО—С—СНз ч=* RO—С—СНз + Н20Такого рода взаимодействие спирта с кислотами называется реак¬
цией этерификации, а полученные вещества — сложными эфирами дан¬
ного спирта и данной кислоты. Внешне уравнение этой реакции подобно
уравнению нейтрализации щелочи кислотой:О ОII IINaOH + НО—С—СН3 —>- NaO-C—СН3 + Н20Однако глубоким различием этих реакций является то, что нейтра¬
лизация— ионная, неизмеримо быстро протекающая реакция, которая
сводится в сущности к взаимодействию ионов:Н+ + ОН“ —-> Н20Реакция этерификации идет иным путем. Спирт в большинстве слу¬
чаев реагирует, отдавая не гидроксил (как щелочь при нейтрализации),
а водород гидроксильной группы; кислоты (органические и некоторые,
по не все, минеральные) отдают свой гидроксил. Этот механизм был
установлен при помощи спирта, меченного изотопом кислорода |80. Как
оказалось, при взаимодействии такого спирта с кислотами RCOOH вы¬
деляется обычная вода, а не H2's0.3. Образование сложных эфиров при действии на спирты хлоран-
гидридов неорганических и органических кислот. Приводим примеры
взаимодействия хлорангидрндов с первичными спиртами:R0H + CIN=0 —>• RO—N=0 + HCI3ROH + BCI3 —v (R0).,B + 3HC13R0H + PCla —:* (RO)3P + 3HC1
О О' II IIROH + Ci-C—СН3 —>• RO-C-CH, + HCIО ОII IIROM + Cl-С-Cl —> RO—С—a + HCI
98ПРЕДЕЛЬНЫЕ СПИРТЫПри действии неорганических галоидангидридов на третичные и вто¬
ричные спирты происходит в основном обмен гидроксила на галоид;3(СН3)зСОН + РВг3 —> 3(СН3)3СВг + Р(ОН)зОбмен гидроксила на галоид происходит и при действии РВг3 и Р1з
на первичные спирты: v 4ЗС2Н6ОН + РВг3 —> ЗС2Н5Вг + Р(ОН)34. Дегидратация спиртов в олефины. Все спирты (кроме метило¬
вого) при пропускании их паров над нагретой до ~375°С окисью алю¬
миния отщепляют воду и образуют олефин:А1203СН3-СН2ОН ► СН2=СН2 + Н£0Особенно легко элиминируется вода из третичных спиртов.Превращение в олефин происходит и при нагревании спиртов с
кислотами типа щавелевой, фталевой, а также с серной кислотой.
При этом предварительно образуется сложный эфир, который при на¬
гревании до высокой температуры распадается на кислоту и олефин
(см. стр. 247).5. Дегидрогенизация и окисление. Образование разных продуктов
в реакциях дегидрогенизации и окисления является важнейшим свой¬
ством, позволяющим отличить первичные, вторичные и третичные
спирты.При пропускании паров первичного или вторичного, но не третич¬
ного спирта над металлической медью при повышенной температуре про¬
исходит выделение двух атомов водорода и первичный спирт превра¬
щается в альдегид*;СиRCH2OH —> R-C( „+ Н2Вторичные спирты дают в этих условиях кетоны:Си R\;снон —> ;с=о + н2
R'/ R'/Такое же различие проявляют первичные и вторичные спирты при
окислении, которое можно проводить «мокрым» путем, например дей¬
ствием хромовой кислоты, или каталитически, причем катализатором
окисления служит также металлическая медь, а окислителем кислород
воздуха:rch2oh + o —> R—<г + н2о
R\ R\
)снон + о —v ;с=о + н2о
R'/ R'/Подобное окисление происходит и при действии галоидов в щелоч¬
ной среде, но полученный альдегид или кетон претерпевает дальнейшее
галоидирование по ближайшему к карбонильной группе углеродному
атому.* Отсюда и название этого класса соединений: alcohol dehydrogenatus — обез-
водороженнын спирт.
ПРИМЕНЕНИЕ СПИРТОВтГалоидзамещенные спирты (галоидгидрины)Галоид и гидроксил у одного углеродного атома составляют не¬
устойчивую группировку, и такие замещенные тут же распадаются:С11/ОНR-C( —* R— СГ +НС1хн хнТаким образом, галоидпроизводных метанола не существует. Про¬
стейший галоидзамещенный спирт этанола — p-хлорэтанол, или атилен-
хлоргидрин CICH2—СНгОН. Он получается из этилена присоединением
к нему хлора в водной среде (подробнее об этой реакции см. стр. 249):СНг=€Цг + С1* + НгО —► С1СН2СН2ОН + НС1Р-Трихлорэтанол CCI3—СН2ОН можно получить из СС13—СНО (хло-
раля) и изопропилового спирта в присутствии изопропилата алюминия
А1[ОСН(СНз)2]з по реакции Меервейна — Понндорфа (см. стр. 126).Аналогичным способом полученный Р-трибромэтанол (тривиальное
название авертин) применяется в виде раствора в грег-амиловом спирте
при операциях как усыпляющее нелетучее наркотизирующее средство
(вводится в прямую кишку). p-Трифторэтанол интересен тем, что яв¬
ляется довольно сильной кислотой (в воде р/Са = 12,4). Подобное аци-
дифицирующее действие галоидов и особенно фтора будет еще рассмат¬
риваться на етр. 179.Конденсацией ацетона с хлороформом в присутствии щелочи полу¬
чают трихлор-грет-бутиловый спирт, или хлврэтон (реакция Вильге-
родта);СНзч он- СН3чV=0 + HCCI3 ► С—ОНсн/ CH-'UПрименение спиртовСпирты — древесный, винный и сивущные масла ■— долгое время
служили главным сырьевым источником для производства ациклических
(жирных) Соединений. В настоящее время большую часть органиче¬
ского сырья поставляет нефтехимическая промышленность, в частности
в виде олефинов и парафиновых углеводородов.Метанол, этанол и высшие спирты применяются как таковые и в
виде уксусных эфиров в качестве растворителей, а высшие спирты, на¬
чиная с бутилового, — в виде эфиров фталевой, себациновой и других
двухосновных кислот — как пластификаторы.Одноатомные спирты используют в разнообразных органических
синтезах для введения соответствующих алкильных групп, для чего
спирты предварительно превращают в галоидные алкилы и далее, в
случае надобности, — в магнийорганические соединения.Основную массу метилового спирта превращают окислением воз¬
духом в соответствующий альдегид — формальдегид, нашедший много¬
образное применение. Метиловый спирт — сильный яд, его смертельная
доза при приеме внутрь составляет около 30 г, а от меньших количеств
человек слепнет. Высшие спирты не столь ядовиты.До недавнего времени одним из главных промышленных примене¬
ний этанола было превращение его по процессу Лебедева в бутадиен
и далее в синтетический каучук. Значительные количества этилового
спирта используются для приготовления разнообразных спиртных на¬
питков.
100ПРЕДЕЛЬНЫЕ СПИРТЫДВУХАТОМНЫЕ СПИРТЫ, ИЛИ ГЛИКОЛИ
(АЛКАНДИОЛЫ)Двугидроксильные производные алканов (открыты Вюрцем) носят
название гликолей или алкандиолов. Гидроксилы в алкандиолах нахо¬
дятся при соседних (наиболее обычные) или более удаленных друг от
друга углеродных атомах. 1,2-Гликоли имеют сладкий вкус, откуда и
происходит название класса. Низшие гликоли — смешивающиеся с во¬
дой вязкие жидкости большей плотности, чем одноатомные спирты. Ки¬
пят при высокой температуре (табл. 10).Таблица 10. ГликолиФормулаНазваниеТемпер а-
тураТемпера¬туракипения,°СПлотностьтривиальноеженевскоеиия,°СdTН0СН2-СН20НЭтилен¬гликольЭтандиол-1,2-17,4197,21,1155СНз-СН(ОН)—сн2онПропилен-гликольПропан¬диол-1,2—1891,040носн2—сн2—сн2он- Тримети-
ленгликольПропан-диол-1,3—214(разл.)1,0597носн2—сн2—сн2—сн2онТетрамети-ленгликольБутан¬диол-1,4+ 162301,020СНзч /СНзхс—с'СН,/| Iх СНзно онТетраметил-
этиленгли-
коль, или
пииакон2,3-Диме-тилбутан-диол-2,338172,80,9672
(при 15°СНаиболее важны этандиол-1,2, или этиленгликоль, пропандиол-1,2,
бутандиол-1,4 и пинаконы (симметрично построенные двутретичные гли¬
коли с гидроксилами у соседних атомов углерода), простейший из ко¬
торых 2,3-диметилбутандиол-2,3СНЗЧ /СН3 сСн/\ (^СНз
НО онГликоли с короткой углеродной цепью, и прежде всего этиленгли¬
коль, не растворяются в углеводородах и эфире, но смешиваются с во¬
дой и спиртами; как растворители они ближе стоят к воде и метанолу,
чем к обычным органическим растворителям.Способы полученияВ принципе гликоли могут быть получены всеми синтетическими
способами получения спиртов. Прежде всего надо назвать следующие
способы.1. Гидролиз галоидпроизводных:С1СН2—СН2С1 + 2НгО —> НОСНг—CH2OH + 2НС1илиС1СН2-СН20Н + Н20 —>• HOCH2—СН2ОН + HC1
ДНУХЛТОМПЫР. СПИРТЫ, или гликоли1012. Восстановление сложных эфиров двухосновных кислот по Був'о
(стр. 94):О ОII IIСаНбО—С—(СН2)„—С—ОС2Нв + 8Na + 6С2Н5ОН —►Н\/Н Н\/Н
—НОС—(СН2)„—СОН + 8C2H5ONa3. Наиболее важны способы получения 1,2-гликолей из олефинов.
В лаборатории можно осуществить окисление олефина по Вагнеру вод¬
ным раствором КМп04. При этом к обоим углеродам, связанным двой¬
ной связью, присоединяется по гидроксилу:ЗСН2=СН2 + 4Н20 + 2КМп04 —»• ЗНОСНг—СН2ОН + 2КОН + 2Мп02Если олефин циклический, присоединение происходит в‘ г{ис-положеш1е.4. Получение гликолей через хлоргидрины. Действием хлора и воды
на олефин можно получить хлоргидрин (стр. 99 и 249), например
С1СН2—СН2ОН. Хлоргидрин может быть превращен гидролизом непо¬
средственно в гликоль (см. выше) или сначала действием извести в
окись олефина, а затем кислотным гидролизом в гликоль:С1СН2—СН2ОН + Са(ОН)2 —Д2С СН2 + СаС12 + 2НаО'v^н+Н2С СН2 + Н20 —► НОСН2—СН2ОН\>5. Пинаконы получают восстановлением (неполным) кетонов элек¬
трохимически или действием магния в присутствии иода:СНзч СНзч >СН3 2н2о СН3ч уСНз2 ;c=o + 2Mg + i2 —> ;с с; —► ;с—с;
сн3/ сп/\ |\сн3 сн3/| |\сн,OMgl OMgl но он6. Бутандиол-1,4 (важный продукт, являющийся промежуточным
продуктом при получении бутадиена и далее синтетического каучука)
получают в промышленности гидрированием бутин-2-диола-1,4
(НОН2С—CssC—СН2ОН); последний готовят из ацетилена и формаль¬
дегида (см. стр. 270).Химические свойства гликолейТак же как и одноатомные спирты, гликоли могут иметь первич¬
ные, вторичные и третичные гидроксилы. Этиленгликоль — двупервич¬
ный спирт, пропиленгликоль — первично-вторичный, пинакон—двутре¬
тичный. Все сказанное о свойствах первичных, вторичных и третичных
спиртов приложимо и к соответствующим гликолям.1. Гликоли легко образуют хлоргидрины и бромгидрины при дей¬
ствии НС1 или НВг, но второй гидроксил замещается на галоид труднее
(лучше действием РС15 или S0C12).2. При действии кислот гликоли дают два ряда сложных эфиров:0 0 оII II IIНОСГЬ—СН2—О —С—R R—С—О—СИ,—СН2—О—С—RО npoeiux эфирах гликолей см. раздел «Простые эфиры» стр. 116.
102ПРЕДЕЛЬНЫЕ СПИРТЫ3. При окислении первичных гликолей образуются альдегиды. Так,
•окислением этиленгликоля получают глиоксаль:О /О 0 О /ОHOCHj— CHjOH —► НОСН2—С^ —» /С—С\гликолевый . глиоксальальдегидОкисление 1,2-диолов йодной кислотой (по Малапраде) или тетра¬
ацетатом свинца (по Криге) приводит к разрыву связи между углеро¬
дами, несущими гидроксилы, и превращению каждого из них в альде¬
гидную (или кетонную) группу:R' НЮ< или Н Ж'8_СН-С С |С",СО°1‘|,Ь. R-C^ +СУI IV N)ОН ОН 0Метод имеет большое значение для установления строения 1,2-гли-
колей.4. Дегидратация гликолей (кислотами или хлористым цинком) при¬
водит к образованию альдегидов (или кетонов). По аналогии с пинако-
линовой перегруппировкой (см. ниже) считают, что механизм этой
дегидратации состоит в том, что сначала путем отрыва одной гидро¬
ксильной группы протоном образуется карбониевый катион, а затем
атом водорода вместе со своей парой электронов (в виде гидрид-иона)
перемещается к карбониевому углероду (гидридное перемещение)^г-{Й_—Ж-сн, ► CHi-CH —*■ сц,-сн + н"'1в: _ш| ш . ф • sнПри дегидратаций пинаконов мигрирует не водород, а метильная
группа и происходит пинаколиновая перегруппировка (см. ч. II, «Пе¬
регруппировки»), сопровождающаяся изменением углеродного скелета;* гЩ ’■ * 9НзСН^_ г^СНз —v- снз^ЛУгн —V сн^А_г гн +
СНз^П^СНз ^ СН3/С (ЯСНэ ^ СН3/С frCU3 + НI i I ^м3 ^.13ОН он о),+! IОН1- i . Й : пинаколинI*.—J V■ пинакон5. Альдегиды в кислой среде ацеталируют 1,2-гликоли, образуя цик¬
лические ацетали (в кислой, но не щелочной среде в результате гид¬
ролиза ацеталя регенерируются исходные вещества);СН2—ОН н+ СН2—Оt4- 0=С—СН3 - I ' ХС-СН3Н2-ОН J н+> Н2о Ь2~0^1,3-Гликоли способны реагировать подобным же образом, давая
шестичленные циклические ацетали.Для осуществления реакций ацеталирования необходима возмож¬
ность приведения обоих гидроксилов в одну плоскость, т. е. возможность
свободного вращения вокруг углерод-углеродной связи:НО—С
!С—ОН
МНОГОАТОМНЫЕ СПИРТЫ103Это условие соблюдается у гликолей с открытой цепью, но не всегда
у циклических.Этиленгликоль и пропиленгликоль употребляются как антифризы.
В смеси с водой ими охлаждают автомобильные двигатели, так как та¬
кие смеси не замерзают зимой. Этиленгликоль применяют также для
производства растворителей типа диоксана, карбитола (см. раздел
«Простые эфиры»). Его сложный эфир с азотной кислотой (динитрат
гликоля)—взрывчатое вещество.МНОГОАТОМНЫЕ СПИРТЫТрехатомные спирты — алкантриолы. Единственным важным пред¬
ставителем алкантриолов является глицерин (пропантриол-1,2,3). Он
был открыт Шееле и исследован Шеврелем, Пелузом, Бертло и Вюрцем.
Это очень вязкая бесцветная сладкая жидкость; т.пл. 17°С, т. кип.
290 °С.Глицерин был получен гидролизом жиров, которые являются слож¬
ными эфирами глицерина и высших гомологов уксусной кислоты (и их
олефиновых изологов). При гидролизе жиров перегретым паром глице¬
рин остается в водном растворе, который отделяют от слоя расплавлен^
ных жирных кислот; после отгонки воды из этого раствора может быть
выделен глицерин.Некоторое количество глицерина образуется при брожении сахаров.В настоящее время осуществлен промышленный синтез глицерина
из пропилена, выделяемого из газов крекинга нефти. Этот синтез яв¬
ляется доказательством строения глицерина как пропантриола.Сначала путем хлорирования пропилена при высокой температуре
(500 °С) получают хлористый аллил, сохраняющий двойную связь (ре¬
акция Львова):СН2=СН—СН3 + С12 —>• СН2=СН—СН2С1 + HC1пропилен хлористый аллилЗатем присоединением хлора и воды хлористый аллил превращают в1,3-дихлорпропанол-2С1 ОН CII I IСН2=СН— СН2С1 + CI, + Н20 —► СНз-СН-СН, + НС1
гидролиз которого дает глицерин:С1 ОН С1 ОН ОН ОНIII 1Д1СН2—СН—СН2 + 2Н,0 —* СН2—СН—СН3 + 2НС11,3-дихлорпропанол-2 пронантриол-1,2,3(глицерин)Первый синтез глицерина (Фридель и Сильва, 1872 г.) похож на
только что приведенный, с той только разницей, что пропилен хлори¬
ровался на холоду и в результате реакции присоединения получался
1,2-дихлорпропан:I IСН2»СН—СН3 -f С12 —► СНа—СН—СН,1,2-Дихлорпропан далее хлорировался металептически в 1,2,3-три-
хлорпропанCl Cl Cl Cl ClII IIIСН2—СН—СНз + С12 —» СНа-СН~СНа + НС1при гидролизе превращающийся в глицерин.
104ПРЕДЕЛЬНЫЕ СПИРТЫНовый и перспективный способ получения глицерина разработан
польскими химиками (Береш и Л. Якубович). Сырьем служит пропилен,
который окисляют в акролеин — простейший непредельный альдегид.
Последний восстанавливают изопропиловым спиртом над смешанным
катализатором ZnO—MgO до аллилового спирта, который гидроксили-
руют в глицерин перекисью водорода:СНз—сн=сн2 —> сн2=сн—сг
СН2=СН— С^° + СНз—сн—СН3 сн2=сн—сн2он + сн3—с—сн3чн | IIон осн2=сн-сн2он + н2о2 —>- сн2—сн—СН2ОНI I
он онИзопропиловый спирт также получают из пропилена.Восстановление акролеина изопропиловым спиртом — реакция, по¬
добная восстановлению его по Оппенауэру — Меервейну — Понндорфу
(стр. 126). В последней употребляется, правда, другой катализатор —
изопропилат алюминия. Образующийся аллиловый спирт гидроксили-
руют в глицерин перекисью водорода. Схема процесса следующая;нсно + сн3-с^
хнносн2—сн2-с^
чн—? сн2=сн-с(накролеин/Р AKOR),СН2=СН—С^ +С2Н6ОН >■ СН2=СН—СН2ОН + СНз—сЧН \наллиловый спиртОН ОН онI I Iсн2=сн—сн2он + н2о2 —>- сн2—сн-сн2глицеринВ другом технически удобном способе получения глицерина исполь¬
зуют в качестве исходного сырья глюкозу. При гидрировании глюкозы
над никелем и другими катализаторами одновременно с восстановле¬
нием альдегидной группы идет разрыв по связи С3—С4 и образуются
две молекулы глицерина:сн2он-снон—снон—снон—снон—сноН2—У сн2он-снон—снон—снон—снон—сн2он—► 2СН2ОН—снон—сн2онВ качестве побочных продуктов образуется (за счет разрыва связи
С2—С3) некоторое количество этиленгликоля и треита — стереоизомера
эритрита.Гидрированию можно подвергнуть не только глюкозу, но и поли¬
сахариды, содержащие глюкозные звенья, например дешевую целлюлозу.Глицерин дает с кислотами три ряда сложных эфиров: моно-, ди-
и триэфиры. Для первых и вторых возможны изомеры: продукты
этерификации по первичным и по вторичным группам. При действии
НС1 на глицерин получается смесь двух монохлоргидринов глицерина,
содержащая больше а-монохлоргидрина СН2ОН—СНОН—СН2С1 и
меньше p-изомера СН2ОН—СНС1—СН2ОН. При обработке щелочью
МНОГОАТОМНЫЕ СПИРТЫ105оба изомера дают один и тот же глицидный спиртН2С—СН—СН,ОН\ /ОПри обработке глицерина хлористым водородом в более жестких
условиях образуются два дихлоргидрпнаСН2С1—СНОН—СН2С1 СН2ОН-СНС1— СН2С1при обработке щелочью дающие эпихлоргидрин глицеринаН.С Ci I — CI I..CI\ОЯвляясь одновременно первичным и вторичным спиртом, глицерин,
нашедший многообразное применение в органическом синтезе, при
окислении образует смесь соответствующего альдегида и кетона:,0СН2ОН-СНСН— СН2ОНСН >011-СНОН—С"чнг.игцсршювыи альдегидCI Ь.ОН— СО—СН2ОНдиоксиацетонС этими веществами мы встретимся при изучении сахаров, с кото¬
рыми они находятся в ближайших родстьсьных отношениях.Диоксиацетон может быть получен хлорированием ацетона в 1,3-ди-
хлорацетои С1СН2—СО—CHoCl и гидролизом последнего. Эта реакция
также подтверждает строение глицерина.Глицерин широко употребляется как мягчительное средство, в част¬
ности в парфюмерии. Его применяют для придания густой консистенции
и сладкого вкуса ликерам. Большие количества его идут для получения
нитроглицерина, применяемою в динамитах и бездымных порохах
(стр. 110), для получения эпоксидных (через эпихлоргидрин) и гли-
фталевых смол, применяемых как основа для лаков.Четырехатомные, пятиатомные и шестиатомные спирты (эритриты,
пентиты и гекситы). Эритрит (бутантетраол-1,2,3,4) встречается в сво¬
бодном виде и в виде сложных эфиров в водорослях и некоторых пле¬
сенях. Синтетический четырехатомный спирт эритрит был получен из
бутадиена СН2=СН—СН—СН2 следующим путем:Осн=сн2Iсн=сн2+ ВГ2сн-сн-оСНВг—СН2—ОССНзIСНВг—СН2—OCCHjIIо-СН2Вг-СН2ВгооII+2AgOCCHjосн-сн--СН2—OCCHj
-СН2—ОССНзоо4* Вг22ArOCCh3 CHjC О —СН—СН2—OCCHj ^ ICIIjCO—СН—СН 2— ОССНз+ 4НгОоо—* 2СНа—СН-СП -СП2I I I I
ОН ОН он онСтереоизомерные эритриты — твердые, отлично растворимые в воде,
сладкие на вкус вещества.
106СЛОЖНЫЕ ЭФИРЫ МИНЕРАЛЬНЫХ КИСЛОТПентаэритрит (тетраоксинеопентан) С (СНгОН) 4 в природе не
встречается. Это твердое высокоплавкое (т. пл. 262 °С) вещество. Полу¬
чается синтетически взаимодействием формальдегида с водным раство¬
ром ацетальдегида в щелочной среде:Са(ОН)2СНз—+ 4НСН=0 + Н20 ► С(СН2ОН)4 + Н—С—онН пентаэритрит ^' муравьиная кислотаВ виде сложного эфира с азотной кислотой пентаэритрит приме¬
няется как взрывчатое вещество пентрит (стр. 110).Пентиты и гекситысн2—сн—сн—сн—сн2 сн,—сн—сн—сн—сн—сн2I I I I I I I I I I Iон он он он он он он он он он онпентит гекситтвердые, растворимые в воде вещества, сладкие на вкус. Для каждого
из спиртов известно много стереоизомеров. Некоторые пентиты и гек¬
ситы встречаются в природе, например пентит адонит (в Adonis verna-
lis), стереоизомерные гекситы — мацнит, дульцит, сорбит, идит. Все онн
имеют нормальный углеродный скелет и могут быть получены восста¬
новлением соответствующих сахаров, которые являются их моноальде¬
гидами.Стереохимия многоатомных спиртов и их родственные отношения
с сахарами будут разобраны в разделе углеводов.СЛОЖНЫЕ ЭФИРЫ МИНЕРАЛЬНЫХ КИСЛОТФормально этот класс соединений можно рассматривать как про¬
изводные кислот, в которых кислотный водород замещен на алкильные
(или вообще углеродные) радикалы.Для многоосновных кислот существуют средние и кислые эфиры:эфиры серной кислоты
СН3—0Ч СНз—О^ ^ОСНз— о/ *Ч> н—о/ ^осредний кислыйэфиры фосфорной кислоты
С2Н5-0^ С2Н5—0^ С2Н5—ОС2Н5-0—Р=0 С2Н5—О—Р=0 НО—Р=0с2н6-о/ но/ но/средний кислыеВ отличие от кислот (и спиртов) средние сложные эфиры — совер¬
шенно недиссоциированные соединения; кислые эфиры — кислоты.Называют сложные эфиры или описательно — этиловый эфир азот¬
ной кислоты, кислый метиловый эфир серной кислоты, полный метило¬
вый эфир серной кислоты, или, короче, по типу солей — этилнитрат, ме-
тилгидросульфат, диметилсульфат. Метилгидросульфат и его этиловый
гомолог называют т^кже метилсерной и этилсерной кислотами.Интересно проследить переход от ионных алкоксидных производных
металлов к недиссоциированным средним сложным эфирам кислород¬
СЛОЖНЫЕ ЭФИРЫ МИНЕРАЛЬНЫХ КИСЛОТ107ных кислот. Для этого сопоставим эти соединения с гидроокисями со¬
ответствующих элементов периодической системы:LiOH Ве(ОН)2 В(ОН)3 СО(ОН)2 N02(0H)NaOH Mg(OH)2 А1(ОН)3 Si(OH), РО(ОН)3 S02(0H)2 СЮ3ОНLiOCH3 Be(OCH3)2 B(OCH3)3 СО(ОСН3)2 N02(0CH3)NaOCH3 Mg(OCH3)2 Al(OCH3)3 Si(OCH3)4 PO(OCH3)3 S02(0CH3)2 C1030CH3Формально все соединения нижних двух рядов представляют собой
метилированные (по гидроксильному водороду) аналоги соединений
верхних рядов. Однако свойства их при переходе слева направо суще¬
ственно изменяются. Так, в крайнем левом столбце алкоксиды способны
к электролитической диссоциации на ионы Ме+ и ОСНГ так же, как
соответствующие гидроокиси. Алкоксидц средних столбцов уже не дис¬
социируют на ионы, но при гидролизе более вероятен разрыв по связи
элемент —кислород. Находящиеся в правых столбцах сложные эфиры
вовсе лишены способности к диссоциации и гидролизуются с разрывом
связи С—О в алкоксиле и сохранением связи элемент —кислород. На¬
пример, при гидролизе тяжелой водой алкоксиды дают обычный, а суль¬
фаты (фосфаты)—тяжелый спирт:Mg(::OCH3)2-f 2Н2180 —v Mg('sOH)2 +2СН3ОН(CH3j0)2S02 + 2H2,80 -_> H2S04 + 2CH3180H(СН3! 0)зР0 -f ЗН2'80 —у Н3РО„ + ЗСН3180НСвойство средних эфиров серной кислоты реагировать с разрывом
связи алкил — кислород обусловливает их алкилирующее действие. Так,
алкилсульфаты широко применяются как алкилирующие средства.
Эфиры азотной и хлорной кислот для этой цели не пригодны вследствие
их взрывоопасности.Способы получения сложных эфиров1. Реакция этерификации:с2н5очС2Н60Н + H2S04 <=* S02 + н20но^CH30H-f-HN03 ч=* CH30iV0j + H20Поскольку реакция этерификации обратима, приходится заботиться
об удалении одного из продуктов реакции (или обоих) из сферы реак¬
ции. Это достигается посредством отгонки воды или эфира (если это
легкокипящее соединение) или путем связывания воды.Ионы водорода ускоряют установление равновесия (т. е. катали¬
зируют и прямую, и обратную реакции). Поэтому при этерификации
спиртов слабыми кислотами необходимо добавлять немного сильной,
например серной, кислоты. Первичные спирты этерифицируются легче
вторичных, а третичные цаиболее трудно. Эти закономерности изученыН. А. Меншуткиным и являются первыми физико-химическими кинети¬
ческими исследованиями в области органических соединений.2. Действие хлорангидридов кислот на спирты (или алкоголяты):CH3OH + Cl—N==0 —>• CH30—N=0+HC1
3CH3OH + PCU —► (СНаО)3Р + ЗНС1
4CH,OH + SiCl4 —* (CHaO)4Si + 4НС1
108СЛОЖНЫЕ ЭФИРЫ МИНЕРАЛЬНЫХ КИСЛОТВ этом случае для связывания НС1 часто добавляют аммиак или
органический амин.Следует напомнить, что некоторые галоидангндриды кислот реаги¬
руют со спиртами иначе — с образованием не эфиров, а галоидных
алкилов:ЗСНзОН + РВгз —> ЗСНзВг + Р(ОН)з
СНзОН + РС15 —> СН3С1 +.POCI3 + НС1
ЗСНзОН + РОС1з —> ЗСН3С1 + Н3РО43. Алкилирование действием галоидных алкилов на соли (серебря¬
ные или натриевые) некоторых,кислот. Этот способ более применим для
получения эфиров сравнительно слабых кислот, т. е. таких, анионы ко¬
торых легко образуют неионные связи:2CH3I + Ag2C03 —j- (СН30)2С0 + 2AgIЭфиры борной кислоты. Эфиры борной кислоты — триалкилбора-
ты — легко получаются нагреванием спирта и борной кислоты с добав¬
кой концентрированной серной кислоты. Борнометиловый эфир (три-
метилборат) кипит при 65°С, борноэтиловый (триэтилборат)—при
119 °С. Эфиры борной кислоты легко гидролизуются водой.Бор как элемент третьей группы периодической системы имеет три
валентных электрона. В борных эфирах бор связан с тремя атомами
кислорода, каждый из которых предоставил для связи еще по элек¬
трону; таким образом, бор имеет вокруг себя секстет и до устойчивой
группы электронов — октета ему не хватает пары электронов. В силу
этого молекула борного эфира способна присоединять алкоксид-анион
алкоголята с образованием солеобразного вещества:(RO)3B + RONa —^ (RO)4B' Na+Алкоксид-анион RO~ предоставил бору два электрона, дополнив его
электронную оболочку до октета и сообщив ему тем самым отрицатель¬
ный заряд.Гликоли, взаимодействуя с борной кислотой на холоду без добавки
серной кислоты, этерифицируются по трем гидроксилам двух молекул,
а четвертый спиртовый гидроксил присоединяется по типу алкоксид-
аниона; при этом бор приобретает отрицательный заряд, а водород по¬
следнего гидроксила протонизируется, и такой эфир функционирует как
сильная кислота:СН2—ОН СН2—Оч_ /О—сн221 +В(ОН)з —| | Н+ + 2Н20СН2—ОН СН2—0/ X)—сн2Подобным образом ведут себя глицерин и все многоатомные спирты со свобод¬
ным вращением звеньев СН2—СН— вокруг оси С—С.ОН ОНДля многоатомных спиртов с фиксированным положением гидроксильных групп
образование сильной кислоты за счет четвертого гидроксила возможно лишь в том
случае, если гидроксилы многоатомного спирта направлены в одну сторону и лежат
в одной плоскости. Реакция с борной кислотой служит для установления конфигура¬
ции многоатомных спиртов и была неоднократно использована при изучении сахаров.Эфиры ортокремневой кислоты. Эти эфиры получаются при взаимо¬
действии четыреххлористого кремния с алкоголятами или спиртами в
присутствии азотистых оснований:SiCU + 4CHsONa —> Si(OCH3)4 + 4NaClОртокремневые эфиры — жидкости. Метиловый эфир кипит при
122'JC, этиловый при 156 °С. Гидролиз водой проходит легко уже па хо¬
СЛОЖНЫЕ ЭФИРЫ МИНЕРАЛЬНЫХ КИСЛОТ109лоду, но идет постепенно и при недостатке воды приводит к образова¬
нию высокомолекулярных ангидридных форм, в которых атомы кремния
соединены друг с другом через кислород (силоксановые группировки):rcSi(OCH:,)4 + (п — 1)1120 -—>ОСН3 / ОСН3\ ОСН3I / I \ I—> СНзО—Si —О—Si— —О—Si— ОСП3 + (2я-2)СН3ОНI V 1/1ОСН3 V ОСН3/„-2 осн3Эти высокомолекулярные вещества (полиалкоксисилоксаны) нахо¬
дят применение в качестве связующих, выдерживающих довольно высо¬
кую температуру, в частности для покрытия поверхности форм для
точной отливки металла.Аналогично SiCU реагируют диалкилдихлорсиланы, например
'(CH3)2SiCl2, образуя диалкоксильные производные:(CH3)2SiCl2 + 2CH3OH —» (CH3)2Si(OCH3)2 + 2HC1Их гидролиз при недостатке воды дает так называемые полиалкил-
силоксаны:n(CH3)2 Si(OCH3)2 + (п— 1)Н20 —►СН, / СН3 ч СНзII I \ I—>- СН30—Si— —о—Si— I—О— Si—ОСНз + (2« - 2)СН30Н1 \ 1 / 1СНз V СНз СНзОни обладают разным (но очень значительным) молекулярным ве¬
сом и представляют собой вязкие жидкости, используемые в качестве
термостойких смазок, а при еще более длинных силоксановых скеле¬
тах— термостойкие электроизоляционные смолы и каучуки. (Об этих
соединениях см. ч. II, раздел «Элемептоорганические соединения».)Эфиры ортотитановой кислоты. Их получают аналогично ортокрем-
невым эфирам по реакции:ТiCl4 + 4СН3ОН + 4NH3 —> Ti(OCH3)4 + 4NH4CIЭто жидкости, легко гидролизующиеся до метилового спирта и
ТЮг, применяются для пропитки тканей с целью придания им водоне¬
проницаемости.Эфиры азотистой кислоты. Обычно их получают, действуя на спирт
N2O3 или приливая по каплям серную кислоту к нитриту натрия, зали¬
тому спиртом. Метилнитрит CH3ONO — газ, этилнитрит C2H5ONO —
жидкость, кипящая при 17 °С. Из эфиров азотистой кислоты особенно
часто применяют изоамилнитрит СН3—СН—СН2—СН2—ONO, кипя-СН3щий при 99 °С, так как он более удобен в обращении. Изоамилнитрит
служит удобным источником азотистой кислоты, образующейся из него
при действии кислот непосредственно в реакционной среде. Он приме¬
няется в тех случаях, когда нужно иметь гомогенную среду реакции
(нитрит натрия — другой обычный источник азотистой кислоты — в ор¬
ганических растворителях нерастворим).Эфиры азотистой кислоты очень ядовиты; при попадании в орга¬
низм ускоряют пульс и понижают кровяное давление.Эфиры азотной кислоты. Их получают действием на спирты смеси
азотной и концентрированной серной кислот. Метилнитрат CH3ONO2
(т. кип. 60 °С) и этилнитрат С2Нь0М02 (т. кип. 87 °С) при осторожной
поСЛОЖНЫЕ ЭФИРЫ МИНЕРАЛЬНЫХ КИСЛОТработе можно перегнать, но при нагревании выше температуры кипения
или при детонации они очень сильно взрывают.ch2ono2Нитраты этиленгликоля и глицерина, неправильно называемые ни¬
трогликолем и нитроглицерином, применяются в качестве взрывчатых
веществ. Сам нитроглицерин (тяжелая жидкость) неудобен и опасен
в обращении. Для применения в качестве технического взрывчатого ве¬
щества им пропитывают кизельгур (пористый Si02). Полученный таким
образом «гурдинамит» взрывает только от детонации. Существуют и
другие виды динамита — с неиндифферентным носителем; такова гре¬
мучая желатина — нитроглицерин, желатинизированный добавкой 10%
нитрата целлюлозы («нитроклетчатка»). В некоторые сорта бездымных
порохов, приготовляемых из тринитрата целлюлозы, добавляют 20—
30% нитроглицерина. Нитроглицерин застывает при довольно высокой
температуре (+11°С), становясь при этом менее чувствительным к де¬
тонации. Из нитрата гликоля получаются динамиты с низкой темпера¬
турой застывания (—23 °С); в остальном он подобен нитрату глицерина.Пентрит — тетранитрат пентаэритрита С(СНг0Ы02)4, получаемый
обработкой пентаэритрита смесью азотной и серной кислот, — тоже
сильное взрывчатое вещество бризантного действия.Нитрат глицерина и нитрат пентаэритрита обладают сосудорасши¬
ряющим эффектом и применяются как симптоматические средства при
стенокардии.Эфиры азотной кислоты лишь очень медленно гидролизуются водой,
но довольно быстро в присутствии кислот или щелочей. Они разру¬
шаются также под действием раствора Na2S, причем происходит вос¬
становление нитратной группы и отщепление ее от спирта в виде гидр-
оксиламина.Эфиры кислот фосфора. Эфиры фосфористой кислоты (фосфиты)
получают действием треххлористого фосфора на алкоголяты металлов:При окислении они переходят в эфиры фосфорной кислоты (фос¬
фаты):Фосфиты способны образовывать комплексные соединения с хлори¬
стой медью (RO)3P-CuCl. При действии галоидного алкила они претер¬
певают реакцию, называемую перегруппировкой Арбузова, в результате
которой образуется сложный эфир алкилфосфоновой кислоты:Поскольку при перегруппировке иодистый алкил освобождается,
уже малого его количества достаточно для превращения любого коли¬
чества триалкилфосфита в сложный эфир алкилфосфоновой кислоты.Метилфосфоновая кислота может рассматриваться как фосфорная,
в которой один гидроксил замещен на метил.CHONOjch2ono2вмграт этиленгликолянитрат глицерина3RONa + PC!s —> (RO)3P + 3NaClо(RO)3P —* (RO)3PO(CH30)3P + CHsI —V-СН3-Оч /СНз'СНз-О-Р^
-СНз—о/ 1 -сн3-оч—> СНз—О—Р—CH3 + CH3I
СЛОЖНЫЕ ЭФИРЫ МИНЕРАЛЬНЫХ КИСЛОТШОртофосфорная кислота дает три ряда эфиров — средние и два ряда
кислых. Эфиры фосфорной кислоты можно получать этерификацией
спиртов. Чаще, однако, их получают, действуя хлорокисью фосфора на
алкоголяты:3RONa + POCl3 —> (R0)3P=0 + 3NaClЭфиры фосфорной кислоты — высококипящие жидкости, лишь очень
медленно гидролизуемые водой, быстрее щелочами и разбавленными
кислотами. Эфиры, образованные этерификацией высших спиртов (и
фенолов), находят применение как пластификаторы пластмасс и для
извлечения солей уранила из водных растворов.Эфиры сернистой кислоты. Известны эфиры типа (R0)2S=0, но
они не имеют практического значения. При действии хлористого тионила
SOCl2 на спирты получается эфир, являющийся также хлорангидридом
и распадающийся по схеме:/С1RO——> RC1 + S02^0Эфиры серной кислоты. Получают взаимодействием первичного
спирта с концентрированной серной кислотой. Сначала образуется кис¬
лый эфир, который называется обычно алкилсерной кислотой, например:СНаО^ С2Н6Очно/ *Ч> но/ N3метилсерная кислота этилсерная кислотаЭто сильные кислоты, бариевые и кальциевые соли которых, в от¬
личие от сульфатов бария и кальция, растворимы в воде. Благодаря
этому их легко отделить от избыточной серной кислоты.При действии дымящей серной кислоты на избыток спирта полу¬
чаются средние эфиры — сульфаты:2R0H + 2S03 —> (R0)2S02 + H2S04Образующиеся из метанола и этанола диметилсульфат и диэтил-
сульфат нашли промышленное применение как алкилирующие средства.
Диметилсульфат — тяжелая маслянистая жидкость, кипящая при 188 °С,
очень ядовитая. Диэтилсульфат (т. кип. 208 °С) чаще готовят, пропуская
избыток этилена в концентрированную серную кислоту;с2н5оч2С2Н4 + H2S04 —> ^S02с2н6о/При алкилировании диалкилсульфатами используется только одна
алкильная группа:сн3ох(ch3o)2so2 + Ki —> ;so2 + ch3iкохСН3Оч(CH30)2S02 + 3NH3 —>- so2 + ch3nh2nh4o/Кислые эфиры, например этилсерная кислота, при высокой темпера¬
туре (около 150 °С) тоже могут быть использованы как алкилирующие
средства. Практически они применяются только для алкилирования
112ПРОСТЫЕ ЭФИРЫспиртов, приводящего к образованию простых эфиров:с2нГ)оч^S02 + C2H60H —у с2нБ—о-с2н6 + H,S04
НО/Эфиры хлор- и фторсульфоновой кислоты. Их получают этерифи-
кациен спиртов хлорсульфоновой и фторсульфоновой кислотами, ,яв-
ляющимися галоидангидридами серной кислоты:Х\ Х\ROH+ —>• +Н20НО/ ^О R0/ ^ОМетиловый эфир фторсульфоновой кислоты — сильно действую¬
щий яд.Эфиры хлорноватистой и хлорной кислот. Эфиры хлорноватистой
кислоты получают действием хлора в темноте на спиртовой раствор ще¬
лочи. Метиловый эфир хлорноватистой кислоты СН3ОС1 кипит при
12°С, этиловый'—при 36°С. Это неустойчивые, очень взрывчатые веще¬
ства, сильные окислители.Эфиры хлорной кислоты мало изучены, так как они очень взрыв¬
чаты.Эфиры кислородных кислот ванадия, хрома и др. Таковы (RO)3VO,
(R0)2Cr02. Для кислот, являющихся сильными окислителями, напри¬
мер для хромовой кислоты, известны главным образом эфиры третич¬
ных спиртов, так как первичные и вторичные спирты окисляются под
действием этих кислот в соответствующие альдегиды и кетоны.ПРОСТЫЕ ЭФИРЫПростыми эфирами называются такие производные спиртов, в ко¬
торых гидроксильный водород спирта замещен на углеводородный ра¬
дикал— такой же как в спирте (эфиры типа ROR) или иной (смешан¬
ные эфиры типа ROR'). По способу Вильямсона простые эфиры обоих
типов можно получать, алкилируя галоидным алкилом алгоколят на¬
трия:RONa + R'Cl —> R.OR' + NaClНаиболее важный простой эфир — диэтиловый С2Н5ОС2Н5 известен
со времен алхимиков под названием серного эфира. Его получают взаи¬
модействием этанола с серной кислотой. Сначала на этиловый спирт
действуют избытком серной кислоты, затем образовавшуюся этилсер-
ную кислоту нагревают до 140 °С, добавляют новую порцию спирта и
из реакционной смеси отгоняют эфир:С2НбО^C2H60H + H2S04 —> ^S02 + H20НО-7этилсерная кислотаС2НвОч)so2 + С2НБОН —V С2НБ—О—С2Н;, + H2S04
[НО/диэтпловый эфирТакое течение реакции также разъяснено Вильямсоном. Добавляя
во второй фазе реакции другой спирт, он получал смешанные эфиры:
С2Н5ОчNSO£ + CH3OH —> С2Н5—0-CH3 + II2S04
но/
ПРОСТЫЕ ЭФИРЫИЗЕсли пропускать этанол над окисью алюминия (дегидратирующий
катализатор), нагретой до 375°С, образуется этилен и вода, но при
300 °С дегидратация над АЬ03 приводит к простому эфиру:А1203; 300° С2С2Н6ОН >» С2Н5—О—С2Н5 + Н20Другой способ синтеза простых эфиров состоит в каталитически
ускоряемом присоединении спиртов к олефинам. Так, диизопропиловый
эфир получают в технике, присоединяя втор-пропиловый спирт к про¬
пилену в присутствии трехфтористого бора:bf3 СНз. /СНз(СН3)2СНОН + сн3—сн=сн2 —>. ;сн—о— сн(СН3/ хсн3Физические свойства простых эфиров сопоставлены в табл. 11.Простые эфиры, несмотря на больший молекулярный вес, кипят при
гораздо более низкой температуре, чем соответствующие спирты:Метиловый °С Этиловый °Сэфир . . . —23,7 эфир . . . +34,6спирт . . . +65 спирт . . . +78,3Это вызвано тем, что вследствие утраты спиртового гидроксильного во¬
дорода молекулы эфира не способны к образованию связывающих их
одна с другой водородных связей и к ассоциации (водородные атомы,
связанные с углеродом, как правило, не образуют водородных связей)
и являются уже нормальными жидкостями. Действительно, молекуляр¬
ный вес простых эфиров всегда соответствует мономерным молекулам.Диэтиловый эфир умеренно растворим в воде (6% при 20°С) и
сам растворяет воду (^— 1,2%); смешивается со спиртами, углеводоро¬
дами и большинством органических растворителей; не смешивается с
этиленгликолем и глицерином. Обладает значительной растворимостью
з серной кислоте и в концентрированной соляной.Растворимость простых эфиров в протонных кислотах обусловлена
основными свойствами эфирного кислорода. Как и азот в аммиаке,
кислород проявляет основные свойства вследствие наличия в его свите
двух свободных электронных пар (у азота одна свободная пара элек¬
тронов). Эти электронные пары не могут быть использованы для про¬
явления обычной валентности, поскольку в молекуле эфира вокруг кис¬
лорода уже имеется восемь электронов (октет). Кислород не может по¬
этому принять электроны, но может односторонне предоставить одну
пару электронов в совместное обладание для осуществления связи, на¬
пример, с катионом водорода. После присоединения катиона система
становится уже заряженной положительно(С2Н6)2о + Н+ —> [(С2Нб)2ОН]+••и следующая пара электронов новому катиону предоставлена быть не
может.Основность эфира, как и других слабых оснований, можно охарак¬
теризовать величиной константы равновесия /Са (подробнее см. стр. 146) /
реакции:[(С2Н5)2ОН]+ ч=> (С2Н5)20 + Н+Для этилового эфира р/С0 = —3,6 (р/С0 — десятичный логарифм Ка,
взятый с обратным знаком). Поскольку вода — сравнимое с эфиром по
силе основание (для воды р/Са == —3,42), эфир из растворов в кислотах
вытесняется водой в верхний всплывающий слой. Как показали изме¬
рения, электропроводность растворов хлористого водорода в сухом5 Зак. 882
Таблица It, Простые эфвры* *CQ Л
ЙС НV оО
я* 2°
Я 4)Щ
о. сз СЧ
F* Sf
X -W. ~ а
5 о с
2 &чк-I*я°
5 «О3 ин яго5 и* оS3 ег « ОQ g пЫЮ я ^е*fcfовЯа,сSg*8СО со
Я
а,
сI I ! I 1CNCsfО Uо о£ «ойсо я
а.
всчXа,с8йЗ «
о я оа.сSо я
я а.
et О>> яО. **f-T°г*а.8 8 8 1 8йжа,о0«3а,ожгг ^Oi .Г? —*я.^- •чOf'-' о» 8t'- ts.О о00 or It^. /sssооsоsfICO+Юо <&CNЮCOЮsCOCVJ ою. «Я Я та I _.я S§«|H
Т TfTt»О СО.о(ОCN00S 1
11 fI &ю«о•Яя.азое;ЯнQJЯЯр;я*5Я«ОЧЯнй>•5?Я1390
«=;1 * 1 ®•К 32fctl» Ч л»яЯ
«
о
е?
яЬ СХ,Л 1ТЧочXсоа,сяч33•яя«очЯс а.
о s
&••&иI* .
• *яД я
R. «ж33«сЯ«=гя•33*Яд CU° 54 .©*€ л§.•*■С Я
Л я
о» о
о ч
Я
? с
* 8.•ЯЯЯое?Ян>,юSчЯ•Яя§чЯн>>хоi-G.
* •&
(=ctячс-33 -ч«D КО4 йЯ Чь о
л «м* 45 с;*0- а>m гг
•я gЯ нCQ° S4 *5 я
Н С?^ aа я§ к5 SS §X4tnк0)*3 д5 >4
Н Р?
А ОСО«©'55SЯ нЯ СПозз
я чё §
•й
ag
S О•©•г
л к
*
•к СЧ
я^-09
2 s
к §оXX4Ьн5<и я4 то5 н
Н ff)
0) S•©«лЛ яС! ?Я°1ПоР? 33
Я ^5н я<Т)я t£жояс*Sтаа.>**©■оа,КягаЖаС4Жа45
а
о
©жамжаЖаi1Жи1ОL1Оt,жа1ЖагчЖижиЖаЖиЖоЖаЖаСОЖж,ааI1л ОЖЧ 1о-—о U|ЖОогч1„Жжж ч.о--о£LожжаиДОкUкиIXаЖОXае*КаIОкаОXижаЖмаОЖоCNЖи^ О **ж/ \ж VО' MJЖ а? ж ич /О о-И-i еч \ / я Ни о о ж О Ж ЖЖ:>*чж
ПРОСТЫЕ ЭФИРЫ115эфире очень мала. Это означает, что лабильные соединения эфира с кис¬
лотой лишь в малой степени имеют характер оксониевых соединений и,
по-видимому, образованы главным образом с помощью водородной
связи:R\)0--Н-С1WRv ';о—нсгПри взаимодействии газообразного диметилового эфира с газообразным НС1
(в газовой, но ие в жидкой фазе) получается «соединение Фриделя» состава
(CHsbO-HCl, газообразное, как и исходный эфир, но более высококипящее. Оно ие
может быть солеобразным, в этом случае оно было бы твердым. Действительно, физи¬
ческие исследования соединения Фриделя показали наличие в нем водородной связи
(Я. К. Сыркин):СНзЧ;о-н—ci
сн/Эфиры образуют комплексные соединения со многими солями, на¬
пример: R20-MgCl2, R20-HgBr2, (R20)2-SnCl4. Очень прочное жидкое
соединение образуют эфиры с трехфтористым бором R20-BF3.Свободная пара электронов эфирного кислорода может быть пре¬
доставлена и алкильному катиону, например по реакции (Меервейн):хб * + R'Cl + SbCl6
КRX+OSr/[SbCler(см. стр. 119, раздел «Оксониевые соединения»).Простые эфиры, в отличие от сложных, не гидролизуются ни вод¬
ными растворами щелочей, ни разбавленными кислотами. Крепкая иоди-
стоводородная кислота разлагает эфиры:ROR + HI —► RI + ROHХранящийся при доступе воздуха этиловый эфир медленно окис¬
ляется, образуя взрывчатые гидроперекиси:С2Н6—О— С2Н5 + 02 —СНз—С—ОС2Н5н/ ^О—ОНIОбразование перекисных соединений было причиной многих аварий
при перегонке эфира. Поэтому хранившийся при доступе воздуха эфир
рекомендуется проверять на наличие перекисей реакцией с KI в при¬
сутствии крахмала. В случае положительной реакции (окисление KI
до иода) перекиси надо удалить восстановлением их (например, солями
двухвалентного железа) и промыванием эфира водой.Этиловый эфир широко применяется в лаборатории как обычный
растворитель, для экстракций из водных растворов, а также как среда
для получения магнийорганических соединений. В технике он исполь¬
зуется меньше вследствие своей крайней огнеопасности. В медицине
эфир употребляется для общего наркоза и местного охлаждения.Диизопропиловый эфир — прекрасная антидетонационная добавка
к автомобильному топливу. Дибутиловый эфир применяется как рас¬
творитель.Б-
116.ПРОСТЫЕ ЭФИРЫПРОСТЫЕ ЭФИРЫ МНОГОАТОМНЫХ СПИРТОВЕсли рассматривать простые эфиры как продукты дегидратации
спиртов, то для этиленгликоля можно ожидать образования следующих
простых эфиров за счет одной или нескольких молекул этиленгликоля:Н2С СН2 НОСН2СН2—О—СН2СН2ОН Н2С—СН2\ / диэтиленглнколь q/ \qокись этилена Н^С—СН2НОСН2СН2—(ОСН2СН2)„—ОСН2СН2ОНполиэтиленглнкольНепосредственно дегидратацией этиленгликоля серной кислотой
можно получить только диоксан (А. Е. Фаворский). Все другие простые
эфиры, так же как и смешанные простые эфиры этиленгликоля типа
RO—СНг—СНг—ОН, получаются из окиси этилена. Поэтому с нее
удобно и начать рассмотрение.Окись этилена получают в крупном промышленном масштабе из
этилена двумя путями:1. Через этиленхлоргидрин уже знакомой нам последоватёльностью
реакций:С12 + СН2=СН2 + Н20 —► С1СН2—СН2ОН + НС12С1СН2—СН2ОН + Са(ОН)2 —► 2Н2С СН2 + СаС12 + 2Н20\ /О2. Прямым окислением этилена кислородом воздуха при ~250°С
над катализатором из металлического серебра, промотированного не¬
большим количеством AgCl:2СН2=СН,+ 02 —► 2Н2С СН2\/ООкись этилена кипит при 10,7 °С. По химическим свойствам она
мало похожа на простые эфиры. Это химически очень активное веще-.
ство, для которого характерно размыкание трехчленного кольца при
атаке ионом водорода, направленной на кислородный атом.Так, в водных растворах кислот цикл окиси этилена размыкается
и образуется этиленгликоль:н2о(н+) +Н2С СН2 ► [НОСН2—СН2 + Н20] —*■ носн2—СН2ОН + н+VВ безводных кислотах атака, начинающаяся так же, завершается
присоединением аниона кислоты и получением хлоргидрина (реакция 1)
или сложных полуэфиров этиленгликоля (реакция 2):Н2С—СН2 + НС1 —► НОСН2—СН2С1 (I)\ /ОН2С СН2 + НО—С—СНз —* НОСН2—СН2—О—С—СН3 (2)\ / II II0 0 о
ПРОСТЫЕ ЭФИРЫ МНОГОАТОМНЫХ СПИРТОВП7Если обработку кислотой проводить в спиртовом растворе, полу¬
чаются смешанные эфиры этиленгликоля:н+Н2С СН2 + СН3ОН —► НОСН2—СН2—ОСНз\ / моиометиловый эфирО этиленгликоля (метил-деллозольв)Дополнительным метилированием монометилового эфира, например
с. помощью диметилсульфата, получают диметиловый эфир этиленгли¬
коля— моноглим, находящий все большее применение как лаборатор¬
ный растворитель, например, в синтезе металлоорганичёских соединений.В присутствии этилового спирта получается моноэтиловый эфир:н+Н2С СН2 + С2Н6ОН —► НОСН2—СН2—ОС2Н8\ / этилделлозольвВ качестве спирта может быть взят и сам этиленгликоль:н+Н2С СН2 + НОСН2—СН2ОН —»- НОСН2—СН2—О—СН2—СН2ОНдиэтиленгликольПолный (диметиловый) эфир диэтиленгликоля называется дигли-
мом и применяется также как растворитель.Поскольку продукт реакции тоже спирт, то при избытке окиси эти¬
лена образуются и полиэтиленгликоли.Алкилированием диэтиленгликоля спиртом получают так называе¬
мые карбитолы ROCH2CH2—О—СН2СН2ОН.Целлозольвы и карбитолы вырабатываются в промышленном мас¬
штабе и применяются как растворители, сочетающие свойства спирта
и эфира, например, в лакокрасочной промышленности и вообще для
растворения эфиров целлюлозы.Сероводород и аммиак также размыкают цикл окиси этилена:Н2С CH2 + H2S —V HOCH2CH2SH\ /тиогликоль—ch2 + nh3 —V HOCH2CH2NH2s'q-// этаноламин2Н2С CH2 + NH3 —у НОСН2СН2—NH—СН2СН2ОНдиэтаноламииЗН2С CH2 + NH3 —V (HOCH2CH2)3NтриэтаноламинОкиси типаR\ /R"С-—С (где R, R', R" — алкил или Н)R"' \ / ХН
118ПРОСТЫЕ ЭФИРЫпри проведении этих реакций в кислой среде размыкаются таким обра¬
зом, что гидроксил оказывается связанным с углеродом, несущим наи¬
большее число водородных атомов, т. е. преимущественно получается
первичная группа —СН2ОН, а если это невозможно, то преимуществен¬
но вторичная —RCHOH (А. К. Красуский). Это объясняется тем, что
промежуточно образующийся карбониевый катион наиболее устойчив,
когда положительный заряд.несет третичный.углерод, и наименее устой¬
чив при положительном заряде на первичном углероде (см. ч. II, «Карб-
катионы»)N.Г/Г/\нR\+R'/R"СНзоJU-НУ-R'/О—С—сн3где R, R', R" — алкил или Н.Такого рода размыкание цикла, в частности при действии этилен-
имина (азотного аналога окиси этилена>, подробно изучил И. А. Дьяко¬
нов, подтвердивший установленную А. К. Красуским закономерность;Л"- N>я'У |INNонHjd^CH2НR\ /R",С С + NHR'/ \ У \н У \О HSC—снгМногие реакции, основанные на размыкании цикла окиси этилена,
используются в промышленных синтезах.Неустойчивость, свойственная окиси этилена, типична для трех¬
членных циклов и вообще для соединений, в которых углы валентных
связей резко отклоняются от нормы:С С С С\ / \ /
с о109° 28' 90енормальные валентные
углысредний валентный угол
окнси этиленаТермическая неустойчивость окиси этилена проявляется в изомери¬
зации ее при 400 °С в ацетальдегид (один из промышленных способов
синтеза ацетальдегида). Капля крепкой серной кислоты димеризует
окись этилена в диоксан.Циклические же простые эфиры с нормальными валентными углами
не отличаются по устойчивости от простых эфиров с открытой цепью.
Так, вполне устойчив диоксанхСНг—CHj\°\:н2-сн/°получаемый нагреванием этиленгликоля с серной кислотой (А. Е. Фа¬
ворский). Это кипящая при 101,5 °С жидкость, смешивающаяся с водой
ОКСОНИЕВЫЕ СОЕДИНЕНИЯ119во всех отношениях; превосходный растворитель, широкому применению
которого в промышленной практике препятствует некоторая токсич¬
ность. Основные свойства у диоксана выражены сильнее, чем у диэти-
лового эфира (рЛГа протонированной формы диоксана равно —3,2).
Диоксан образует многочисленные комплексы с солями тяжелых ме¬
таллов. С бромом он дает твердый дибромид следующего строения:/сн2-сн2Ч +
о( ;о s Вг вг'
хсн2—сн/‘*ОКСОНИЕВЫЕ СОЕДИНЕНИЯКак уже упоминалось, простые эфиры образуют с сильными кис¬
лотами неустойчивые связанные водородной связью соединения, ча¬
стично существующие в оксониевой форме. Это вторичные оксониевые
соединения.'RsЧ;о...нхw"\+
)о—ня/XПростейшим неорганическим оксониевым соединением является гидратированный
ион водорода — гидроксоний-катион, малоустойчивый анзлог более прочного аммоний-
катиона:Н\+ Н\+/Н
)°~н XW , W хнгидроксоний аммонийВ 1928 г. Меервейн открыл третичные оксониевые соли, которые
можно получить из эфиров в результате следующих реакций:СНЗЧ СН3ч;о + ch3f + bf3 —> ;о-сн3 bf;СНз/ сн/С2Н6ч С2Н5ч;o + c2H5ci + sbcis —> х>-сан6 sbcir
с2н/ ед/Роль галогенидов BF3 и SbCU состоит в гетеролитическом отщеп¬
лении галоида галоидного алкила и связывании его в исключительно
прочный анион. Триалкилоксониевые соединения с комплексными анио¬
нами— твердые вполне устойчивые солеобразные соединения. При по¬
пытке заменить анион в этих солях на анион какой-либо обычной
кислоты, т. е. при взаимодействии с кислотами или их солями и даже
с водой, оксониевые соли распадаются с образованием простого эфира
и алкилированного аниона:(СН3)36 SbC17 + KI —> (СНЭ)20 + CH3I + К+ SbCIsО о(С2Н5)36 SbCl* + СН3—I—ОН —» (С2Н6)20 + СН3-С—ОС2Н5 + Н+ SbCle
(С2Н5)3б BF7 + Н20 —» (С2Н5)20 + С2Н5ОН + Н+ BF*Триалкилоксониевые соли являются самыми сильными алкилирую-
щими средствами из рассмотренных до сих пор (сильнее галоидных
алкилов и диалкилсульфатов).
120ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)Следующий важный класс кислородных производных алканов —
оксосоединения. Как следует из их реакций и способов получения, оксо¬
соединения можно рассматривать как алканы, в которых два водород¬
ных атома при одном углероде замещены на двухвалентный атом
кислорода. Таким образом, функциональной группой оксосоединений яв¬
ляется карбонильная группа >С—0. Доказательством наличия в оксо-
соединениях карбонильной группы могут служить, например, следующие
реакции.При действии пятихлористого фосфора кислородный атом карбо¬
нила может быть замещен на два атома хлора с образованием ди-
хлоралкана:R\ Rv /С1y=o + pci6 —> ;с( +poci3R'/ R'/ ХС1То, что при этом строение углеродной цепи никак не меняется, яв¬
ствует из получения того же оксосоединения при гидролизе образовав¬
шегося дихлоралкана:R4 Х\ R.;с +Н20 —> \]=0 + 2НС1R'/ ЧС1 R'/По этой реакции гидролизом иодистого метилена CH2I2 Бутлеров
синтезировал простейшее из оксосоединений — формальдегид НСНО.Таким образом, доказано, что кислородный атом обеими валентно¬
стями связан с одним и тем же атомом углерода. Наличие в оксосоеди-
нениях двойной связи С = 0 подтверждается также многочисленными
приведенными ниже реакциями присоединения. Не менее убедительно
свидетельствуют о строении оксосоединений и способы их синтеза.Оксосоединения делятся на две большие подгруппы — альдегиды
и кетоны, в реакциях которых есть много общего, но имеются и суще¬
ственные различия. Номенклатура этих подгрупп строится по-разному.Тривиальные названия альдегидов связывают их с кислотами, в ко¬
торые они превращаются при окислении:/Н о /ОНR— С( —* R—СЧ0 - Ч0/НТаким образом, первый член ряда Н—С называется муравь-N)иным альдегидом или формальдегидом, второй СН3—Cv —уксуснымальдегидом или ацетальдегидом и т. д.Тривиальные названия кетонов могут строиться по радикалам, свя-СН34 С2Н54занным с карбонильной группой: ХС=0 диметилкетон, . ^С=0Сн/ СН/метилэтилкетон и т. д. Кетоны с одинаковыми радикалами иногда назы¬
вают по латинским названиям кислот, сухой перегонкой кальциевых со¬
лей которых их можно получить (см. дальше способы получения), напри¬
мер ацетон от ацетата, бутирон от бутирата, стеарон от стеарата и т. п.
ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)121По женевской номенклатуре названия альдегидов (алканалей) про¬
изводятся от названий углеводородов с тем же числом углеродных ато¬
мов путем добавления окончания аль: метаналь, этаналь и т. д. Для
кетонов (алканонов) женевская номенклатура требует окончания он;
пропанон, бутанон и т. д. Как всегда, цифрой обозначается положение
функциональной группы в цепи. Из строения простейшего представи-
снзчтеля кетонов ^С=0 ясно, что кетон не может иметь менее трехсн/углеродных атомов.Названия и некоторые физические свойства альдегидов и кетонов
приведены в табл. 12 и 13.Таблица 12. АльдегидыНазваниеТемпера¬Тем¬пера¬Плот¬ДипольныйФормулатуратураностьмоментплавле¬кипе¬.20в бензоления.ния,d4при 20 °Стривиальноеженевское°С°СDн—с(Форм¬Метаналь-92—21,00,8152,27альдегид("Г”)(газ при\н147— 247 °ССН,—СГАцет-Этаналь-123,5+21,00,7802,49альдегид\нСНз—сн2-с^Пропионо-Пропаналь-8148,80,8072,54вый\нS0СНз—сн2—сн2—с(хнМасляныйБутаналь-99,075,70,8172,57СНзЧ ^0хсн—с^Изомасля-2-Метил--65,963,50,7942,58ныйпропанальСНз^ ^нснз-(сн2)з-с;хнВалериано¬Пентаналь-91,5103,40,8092,57выйсн3-сн2—сн—с'а-Этил-З-Этилбу-—1170,814—масляныйтаналь1 ХНС2н5СНзчхсн—сн2—с^
си/ 41Изовале-2-Метил--5192,50,8032,60риановыйбутанальМОСНз-(СН2)4-С(Капроно¬Г ексаиаль—561310,833—вый'\нСНз-(СН2)5-С(ХНЭнантовый,Г ептаналь-451550,8502,56илиэиантол(при 22 °С)снз-(сн2)6-с;\нКаприло-Октаиаль—163,4;0,821—вый171,0
122ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)Таблица 13. КетоныФормулаНазваниетривиальноеженевскоео. «,Ь кт S
“ К
О. ц>5 “
s «г* Соя кО. X
о aС О)goс ъс « и —» * Ю S5-2 о-тк
R 5 а с ОСН3—С—СНзII0АцетонПропанон-2-95,056,50,7922 72
(прн 18 °С)СНз—С—С2Н5оМетнл-этнлкетонБутанон-2-86,479,60,8052,79СНз—С—С3Н7-ноМетил-к-про-пилкетонПентанон-2-77,8101,70,8092,72С2Н5—с—С2Н5
оДиэтнл-кетонПентанон-3-42,0102,70,816Ю2,72СНз—С—СН(СНз)2
оМетнлизо-пропил-кетонЗ-Метил-бутанон-2-9293.00,815№)2,76
(прн 20°С)И-С3Н7—С—С3Н 1~нIIоДнпропнл-кетонГ ептанон-4-32,61440,81742,73изо-С3Н7—С—С3Н7-изоII0Динзопро-пилкетон2,4-Днме-тилпента-нон-3-69,0123,70,80622,74 .
(прн 25 °С)/СН3
СНз—С—С—СНзII СНзМетнл-
трет-бутнл-
кетон, или
пннаколин3,3-Диме-тилбута-нон-2-52,5106,2'0,8208К)2,79Альдегиды и кетоиы, в противоположность склонным к ассоциации
спиртам, — неассоциированные жидкости. Поэтому они кипят при го¬
раздо более низкой температуре, чем соответствующие спирты, на¬
пример:СН3—СН2—СН2ОН .сн3—сн2—С\нкип., °СТ. кип.97,2СНз—СН—СНз
|.... 821ОН49СНз—С—СНз •II.... 56IIООбычно кетоны кипят при несколько более высокой температуре,
чем изомерные им альдегиды:Т. кип., °С Т. кип., °ССНз—С—СНз 56 СНз—с—СН2—СНз • • 79,611 Ао оСНз—сн2—СГ ... 49 СНз—СНг—СН2—СГ 75,7ХН ХНРазветвление цепи вызывает, как и в других рядах соединений,
понижение температуры кипения и плотности. Дипольный момент аль¬
СПОСОБЫ СИНТЕЗА ОКСОСОЕДИНЕНИЯ123дегидов и кетонов мало различается для разных представителей и со¬
ставляет значительную величину: 2.7-10-18 зл.-ст. ед., или 2,7D*. Из по¬
стоянства этой величины следует, что 2,7D — дипольный момент карбо¬
нильной группы (о дипольном моменте см. стр. 323).Как показывают рентгеноструктурные исследования, расстояние
С = 0 в карбонильной группе равно 1,22 А. Если бы карбонильная+ —группа имела строение с семиполярной связью, т. е. >С—О, дипольный
момент должен был бы равняться произведению заряда электрона
4,8-10-10 на расстояние 1,22-10-8 см, а именно 5,8-10-18 эл.-ст. ед.
(5,81>), т. е. был бы вдвое больше наблюдаемого (2,7D). В то же время
наблюдаемый дипольный момент 2,7D больше удвоенного дипольного
момента простой связи С—О в эфирах (1,2-2 = 2,40). Следовательно,
одна из двух связей в группе С—О более поляризуема, чем другая
(я-связь и о-связь, см. стр. 230), что можно схематически выразить,
показывая кривой стрелкой смещение я-электронной пары двойной
связи:8+ 8-Физически поляризуемость я-связи проявляется в высокой моле¬
кулярной рефракции ** альдегидов и кетонов.С высоким дипольным моментом карбонила, наличием на его угле¬
родном атоме частичного положительного заряда и особенно со значи¬
тельной дальнейшей поляризуемостью двойной (>С = 0) связи согла¬
суется большая часть химических свойств альдегидов и кетонов. Это
сказывается, во-первых, в способности альдегидов и кетонов легко всту¬
пать в реакции присоединения, во-вторых, в способности водородных
атомов соседнего с карбонильной группой звена СН2 (а-положение)
к протонизации — удалению из молекулы в виде протона при атаке
основными реагентами.Способы синтеза оксосоединений1. Получение из спиртов. Из структурного родства альдегидов с
первичными спиртами и кетонов с вторичными спиртами вытекает воз¬
можность получения как спиртов из оксосоединений (см. стр. 91, 98),
так и оксосоединений из этих групп спиртов путем каталитического де¬
гидрирования или окисления.Каталитическое дегидрирование спиртов проводят, пропуская пары
спирта над мелкораздробленной медью. При этом происходит отщепле¬
ние молекулы водорода:Си . /НR-CH2OH ► R— +Н2|СиR—СН—R' »• R—С—R'+HjОкисление спиртов можно осуществить каталитически — кислоро¬
дом воздуха над тем же медным катализатором. Этим путем в промыш¬* D — единица Дебая, равная 10-18 эл.-ст. ед.** О молекулярной рефракции см, стр. 328.
ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)ленном масштабе получают главную массу формальдегида из метанола:НI Си Н\2Н—С—О—Н + 02 ► 2 ;с=0 + 2Н20А н/Окисление можно проводить также «мокрым путем», используя та¬
кой окислитель, как хромовую смесь (К2СГ2О7 + H2SO4):оR-CH2OH ► R—+н20
^ноR—СН—R' —► R—С—R' + Н20I IIОН оДавно известную реакцию окисления спиртов хромовой кислотой
подробно исследовал Вестхаймер на примере вторичного пропилового
спирта.В пределах умеренной концентрации кислоты скорость реакции про¬
порциональна концентрации НСгОТ и квадрату концентрации иона
водорода. Это согласуется с предположением, что HCrOI сначала
превращается в недиссоциированную Н2СГО4, которая этерифицирует
спирт. Кислый сложный эфир спирта и хромовой кислоты претерпевает
(при участии воды в качестве акцептора протона) внутреннее окисле¬
ние— восстановление, изображенное на схеме стрелками, показываю¬
щими переходы электронных пар, в результате которых образуется
карбонильное соединение*:О О|| VI быстро ||НО-Г.г—О” + Н+ + (СН3)2С—ОН ( '* (СН3)2С—О—Сг—ОН + Н20 (1)ОО Н НООНгО.-^^СНз^Оу-О Сг ОН ► нэО+ + (СН3)2С=0 + с?—ОН (2)
° о-То, что цепь электронных перемещений завершается на атоме хро¬
ма, означает, что хром, получив пару электронов, из шестивалентного
переходит в четырехвалентное неустойчивое состояние, затем CrIV дис-
пропорционируется в CrVI и Сгш. Образование сложных эфиров хро¬
мовой кислоты при действии спиртов доказано извлечением их органи-* Следует подчеркнуть, что сплошные кривые стрелки всегда применяются для
обозначения перемещения пар электронов. Необходимо, однако, строго различать два
случая таких перемещений:1. Электронный сдвиг — полное перемещение с образованием новых связей и
гетеролитическим разрывом старых, примером чему служат приведенные здесь изо¬
бражения механизмов реакций. В этом случае кривая стрелка начинается с того атома
(или от той связи, т. е. пары электронов), от которого перемещается пара электронов,
и направляется на тот атом, к которому она переходит, или указывает на то место
между двумя атомами обеих реагирующих молекул, между которыми возникает новая
связь. Электронный сдвиг внутри одной молекулы обозначается как таутомерный
сдвиг (Т).2. Мезомерный сдвиг электронных пар (всегда внутри одно# молекулы) — это
перемещение электронных пар, не идущее до конца, т. е. до разрыва старых и обра¬
зования новых связей, а останавливающееся, так сказать, на полпути. С мезомерией,
мезомерным сдвигом и таким значением символа кривой стрелки мы встретимся впер¬
вые на стр. 173 и более подробно на стр. 234,
СПОСОБЫ СИНТЕЗА ОКСОСОЕДИНЕНИЙ125ческим растворителем. Эти эфиры способны разлагаться с образованием
оксосоединений.Сравнение скоростей окисления двух спиртов — обычного и мечен¬
ного дейтерием(сн3)2с—он (СН3)2С-ОНi iуказывает на значительно (в несколько раз) более медленное окисление
спирта, меченного дейтерием. Такой большой изотопный эффект на¬
блюдается для соединений дейтерия, когда связь D—С непосредственно
участвует в реакции, как это происходит в реакции (2). Проверка ме¬
ханизма реакции с использованием HCrOI с меченым кислородом не¬
возможна вследствие равновесия:2НСгО; ?=± Сг2072- + Н20При синтезе альдегидов окислением спиртов альдегид следует тот¬
час удалять из сферы реакции, чтобы не допустить его окисления в кис¬
лоту;R-C( + 0 —> R-СГ^ОНЧрезвычайно употребительным в лабораторной практике является
окисление вторичных спиртов по Оппенауэру избытком ацетона в при¬
сутствии алкоголята алюминия, являющегося слабоосновным катали¬
затором, ускоряющим установление равновесия:|(СНз)2СН0]3А1R-C-R'-f СН3-С-СН3 +■ -> R-C-R' + СН3-С—СН3н/ \<эн I, I н/Стехиометрическое уравнение реакции не вскрывает ее механизма,
включающего «.гибридное перемещение», т. е. перемещение водородного
атома вместе с электронной парой из одной ковалентной связи в другую.Роль алкоголята * алюминия состоит в кооординационном связыва¬
нии кетона. Гидридное перемещение происходит в пределах образую¬
щегося координационного соединения, вследствие чего наступает рав¬
новесие:fcc-O. Р-с<|. gx=<\ />-С<£[н] X Н Н ;ai( н■НГЛ У V Н3С^1_П/ \n_r^Rй3;Ос=о HzC'' ° ° 9^r'3 н нГидридное перемещение было доказано применением меченного
дейтерием исходного вторичного спирта. При этом от группировки^С—ОН к ацетону переходит дейтерий и получается дейтерирован-
Dный изопропиловый спирт СНз—С—СН3./\D ОНДля смещения равновесия и превращения всего исходного вторич¬
ного спирта в кетон равновесную смесь, содержащую избыток ацетона,* Применяемый обычно трет-бутилат или изопропилат алюминия с избытком
исходного спирта дает соответствующий вторичный алкоголят, '
126ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)нагревают так, чтобы отгонялся изопропиловый спирт с частью ацетона,
а исходный спирт и образующийся кетон, как менее летучие, оставались
в реакционной смеси.Та же равновесная система используется для реакции, обратной
окислению вторичных спиртов по Оппенауэру, — для восстановления
кетонов во вторичные спирты по Меервейну — Понндорфу. В этом слу¬
чае в избытке берут не ацетон, а изопропиловый спирт, а нагревание
ведут так, чтобы из равновесной смеси отгонялся весь образующийся
ацетон.2. Получение из кислот. Пары кислоты пропускают при темпера¬
туре выше 300 °С над катализатором — окисью марганца или окисью
тория:МпО2R—С—ОН ► R—С—R + С02 + Н,0II IIО оВ случае смеси кислот образуется смесь кетонов, в том числе и
кетон RCOR':МпОR—С—ОН + R'—С—ОН ► R— С—R' + С02 + Н20II II II0 0 оЕсли одна из взятых кислот муравьиная, то главным продуктом
реакции будет альдегид:МпОR—С—ОН + Н—С—ОН ► R—С—Н + С02 + Н20II II IIО О оЭтот метод развился из старинного метода Пириа — сухой пере¬
гонки кальциевой соли кислоты (или смеси кислот). В свое время метод
сухой перегонки ацетата кальция был единственным промышленным
методом получения ацетона (отсюда и название ацетон):(СН3—С—0)2Са —► СНз—С—СН3 + СаС03II .11О ОРеакция эта освещает и роль окислов металлов как катализаторов
описанного выше способа получения кетонов.3. Синтезы при помощи гриньярдва реактива. При действии на маг-
нийорганические соединения ряда приведенных ниже производных му¬
равьиной кислоты образуются альдегиды (низкая температура), а при
действии некоторых производных других кислот — получаются кетоны:У3RMgBr + Н—С^ —>- R—С^ + NaBr + MgO
4ONa Niмуравьинокислый
натрий^О ^О ВгRMgBr + Н—С; —► R-C( + Mg(ХОС2Н5 ХН хОС,Н5зтилформиат(избыток)RMgBr + R'—С—С1 —R—С—R'+ MgBrClО ОВгхлорангидрндкислоты2HsO /RMgBr + R'—Cs=N —> R—С—R' ► R—C—R' + NH3 + Mgнитрил 11 11 ^кислотыtlUgBr ОOH
ХИМИЧЕСКИЕ СВОЙСТВА ОКСОСОЕДИНЕНИЯ1274. Гидратация ацетиленов. Ацетилен и его гомологи при действии
воды в присутствии катализатора (солей двухвалентной ртути) пре¬
вращаются в оксосоединения. При этом только ацетилен образует
альдегид, а именно ацетальдегид (реакция Кучерова). Этот способ
является одним из главных промышленных способов получения ацеталь¬
дегида:н,**н—С==с—Н + Н20 ► СНз-СТВсе гомологи ацетилена образуют кетоны в соответствии с пра¬
вилом Марковникова (см. стр. 248):Hg2+R_С==с—Н + Н20 *■ R-С-СНзоАцетальдегид получают из этилена, превращая его в окись и изо-
меризуя (стр. 118), или действуя водой на комплекс (Шмидт, Я. К. Сыр-
кин, Н. И. Моисеев):/НNa+[Cl3Pd• С2Н4]' + Н20 —> Pd + 2НС1 + NaCl+CHs—С'V)Синтетические реакции, специфические
для альдегидов1. Восстановление некоторых производных кислот в альдегиды.
Здесь будет рассмотрена только реакция Розенмунда — каталитическое
восстановление водородом хлорангидридов кислот (катализатор — пал¬
ладий, осажденный на сернокислом барии):PdR—С—С1+Н2 *■ R— С-Н + НС1II IIО оiРеакция демонстрирует структурные отношения альдегида и хлор-
ангидрида кислоты.2. Оксосинтез. В 1938 г. Реппе открыл очень интересную реакцию
синтеза альдегидов из олефинов и смеси окиси углерода с водородом
(так называемый водяной газ). Реакция протекает при 200 кгс/см2 и тем¬
пературе * немного выше 100 °С в присутствии катализатора — кобальта.
Очевидно, что простейший альдегид, который может быть получен таким
способом (исходя из простейшего олефина — этилена), это пропионовый
альдегид:СН2=СН2 + СО + Н2 —'->■ СН3—сн2—сн=оИз гомологов этилена получается смесь альдегидов с нормальной
и разветвленной цепью.Химические свойства оксосоединенийРеакции присоединения. 1. Восстановление. О восстановлении
альдегидов в первичные спирты, а кетонов во вторичные было уже
сказано при описании способов получения спиртов. Здесь следует* При более высоких температурах образующиеся альдегиды восстанавливаютсяв спирты.
128ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)дополнительно привести только важную для лабораторной практики
реакцию восстановления альдегидов в первичные спирты по Меервей-
ну — Понндорфу агор-пропиловым спиртом в присутствии втор-пропи-
лата алюминия[(СНз)2СНО]зА1R—с; + СН3—СН—СН3 > R— СН2С)Н + СНз—С—СНзЧН I „ IIон ои реакцию восстановления альдегидов и кетонов литийалюминийгид-
ридом:ыаш4: 4н2о 4 R\ /Я
4R-C-R >• X +L10H + А1(ОН)зJ но/ \н2. Присоединение магнийорганических соединений. Эта типичная и
важная реакция была также рассмотрена в разделе спиртов. После
гидролиза аддуктов из формальдегида получаются первичные спирты,
из других альдегидов — вторичные, а из кетонов —третичные.3. Присоединение воды. По активности в реакциях присоединения
к карбонильной группе .оксосоединения располагаются в следующий
ряд:Нч СНзЧ СН3ч;с=о > )с=о > ;с=о
w w сн3/формальдегид ацетальдегид ацетои (и дру-
(и другие альдегиды) гие кетоиы)Это связано с тем, что метальная и другие алкильные группы в
большей степени, чем водородный атом, способны компенсировать поло¬
жительный заряд карбонильного углерода (стр. 180). Поэтому из пере¬
численных оксосоединений самым активным в реакциях присоедине¬
ния является формальдегид. Еще более активен трихлорацетальдегид
(хлораль), поскольку группа СС13 не только не компенсирует положи¬
тельный заряд углерода карбонильной группы, а, наоборот, оттягивает
от него электроны.Воду способны присоединять лишь самые активные оксосоединения.
Формальдегид в водных растворах находится в гидратированной
форме:Нч Нч /ОН
/С=0 + Н20 ч=ь
W W хонЖидкий хлораль присоединяет воду, образуя кристаллический хлор-
альгидрат:О /ОНСС13—cf +н20 —СС13—с—он
ЧН \нхлораль хлоральгндратТакие гидраты ведут себя в реакциях как альдегиды.4. Присоединение бисульфита натрия. Альдегиды и кетоны (только
типа R—СО—СН3) присоединяют бисульфит натрия, образуя так на¬
ХИМИЧЕСКИЕ СВОЙСТВА ОКСОСОЕДИНЕНИИзываемые бисульфитные соединения:R\ R4 /ОН;c=o + NaHso3 —>• ;с(СН3/ СН/ XS020Na5. Присоединение синильной кислоты. Оксосоединения присоеди¬
няют HCN в присутствии соли синильной кислоты, образуя оксини-
трилы (циангидрины)R—С—R' + HCN —> R—C—R'НО/ \c=Nважные промежуточные продукты в синтезе окси- и аминокислот.6. Присоединение аммиака. Альдегиды, присоединяя аммиак, об¬
разуют альдегид аммиакиR—С—Н + NH3 —>• R—С-Н]{, но/ \nh2которые легко теряют воду и тримеризируются в гетероциклические со¬
единения:н\ NH Л/Н . НR_C—NH3 ► R—С —► RX | ХН\>Н “Н2° 4NH HN^NHн/ \rКетоны также реагируют с аммиаком, но реакция осложняется про¬
текающей в первую очередь конденсацией. В случае ацетона сначала
образуется непредельный кетон ^форон (стр. 295), к которому и при¬
соединяется аммиак с последующим замыканием в гетероциклическое
соединение — триацетониминН2С—С(СН3)2
0=С^ \ш
Н2С-С(СН3)2Совершенно своеобразна реакция формальдегида с аммиаком, при¬
водящая к гексаметилентетрамину, называемому также уротропином
(А. М. Бутлеров);сн.H2C^ch^CH21STПри комнатной температуре в водном растворе реакция протекает
количественно. Форму молекулы уротропина можно представить себе,
если поднять над плоскостью бумаги написанный в центре атом азота
вместе с присоединенными к нему метиленовыми группами. Уротропин
находит применение в медицине как таковой и в виде комплекса с
СаС12 (кальцекс). Он служит исходным веществом для синтеза важного
130ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)взрывчатного вещества — гексогена (диклонита), получаемого по ре¬
акции:№Н2С снг'СН, тгMchJ + 3HN°3 ►- ' 2Л I 2 + ЗНСНО + NH3N<4> 02>f \й2^02 :сн.2Реакция формальдегида с аммиаком является уже реакцией заме¬
щения, точно так же, как и вторая стадия реакции аммиака с другими
альдегидами.Следует заметить, что реакции замещения кислорода в оксосоеди-
нениях весьма часто протекают через стадию присоединения.Реакции замещения карбонильного кислорода. 1. Реакции замеще¬
ния кислородного атома оксосоединений на два атома хлора при дей¬
ствии PCI5 или на два атома фтора при реакции с SF4 уже рассматри¬
вались на стр. 120 и 71.2. Восстановление оксосоединений. При действии амальгамирован¬
ного с поверхности цинка в присутствии соляной кислоты карбонильный
кислород замещается на два атома водорода (восстановление по Клем-
менсену). Эта реакция разработана только для кетонов:Zn; HClR—С—R' ► R—С—R'I н/ \нОксосоединения могут быть также восстановлены до соответствую¬
щих углеводородов по методу Кижнера — Вольфа. Для этого получают
гидразон оксосоединения (см. стр. 131) и нагревают его со щелочью в
присутствии платины:NH2-NH2 КОН; Pt
R—С—R' »- R—C-R' »- R— С—R' + N2I I н/ \но n-nh2 н н3. Образование ацеталей и кеталей. Реакции образования важных
функциональных производных альдегидов и кетонов — ацеталей и ке¬
талей можно формально рассматривать как замещение атома кислорода
оксосоединений на две алкоксильные группы, а сами продукты — как
простые эфиры обычно не существующих 1,1-гликолей R2C(OHb:R4 /OR' R4 .OR'СXOR' r/ '^OR'ацеталь кетальАцетали образуются непосредственно при взаимодействии альдеги¬
дов со спиртами в кислой среде (обратимая реакция):/НR-C-H-l^R'OH R—C-OR'+ Н20A ^OR'Кетали одноатомных спиртов так не получаются. Проще всего их
синтезируют действием на кетоны ортоэфира, муравьиной кислоты в при¬
ХИМИЧЕСКИЕ СВОЙСТВА ОКСОСОЕДИНЕНИЙ131сутствии капли концентрированной серной кислоты: ,h2so4Rr-C—R'+ H-C-OR" ► R—С—R'+ H—С—OR"d ^OR" WO/ \)R" dТак же как и ацеталй, кетали гидролизуются в кислой водной среде,
регенерируя исходное оксосоединение и спирт.С аналогами спиртов — меркаптанами RSH альдегиды и кетоны ре¬
агируют аналогично образованию ацеталей:/НR-C-H + 2R"SH —> R-C-SR" + Н20i ^SR"R-C-R' + 2R"SH —> R-C-R'+Н20IIОR"s/ ^SR"4. Особенно важны и разнообразны реакции замещения кислорода
карбонильной группы, протекающие при взаимодействии оксосоединений
с азотистыми основаниями. Они представляют собой вторую фазу реак¬
ции присоединения, протекающую с отщеплением воды.а) С гидроксиламином реагируют и альдегиды и кетоны. При этом
образуются оксимы — альдоксимы и кетоксимы:R—С—R' + HjNOH —► R-С—R' —> R-C—R'+ Н206 ^ но/ 4NHoH NOHПод действием водоотнимающих средств (Р2О5) альдоксимы превра¬
щаются в нитрилы кислот:R-C-H —* R-C=N|| —HjO
NOHб) С гидразином в зависимости от соотношения реагентов реакция
протекает по-разному:с одной молекулой оксосоединения образуются гидразоны:R—С—R' + HSN—NH2 —> R-C—R' + H20II IIО n-nh2с двумя молекулами — азины (альдазины или кетазины):R R2R-C-R' + H2N~NH2 —► \=N-N==C^ + 2Н30
Р R'/ \R'Ов) С замещенными гидразинами образование азинов невозможно,
так как в реакцию вступают только эквимолекулярные количества ре¬
агентов. С фенилгидразином получаются фенилгидразоньпR—С—R' + H8N—ЩСвН8 —* R-C-R'II IIО N—NHCeHsфенилгидразонс семикарбазидом (см. стр. 351) —семикарбазоныг
R_c—R' + H2N—NH—C-NH3 —> R-C-R'о О N-NH-C—NH2IIосемнкарбазон
132ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)Все эти реакции легко протекают в водных растворах при комнат¬
ной температуре в присутствии уксусной кислоты. Оксимы, гидразоны,
азины и замещенные гидразоны в кислой среде легко гидролизуются с
выделением исходных веществ.Как уже отмечалось, многие реакции замещения кислорода в оксо-
соединениях являются только второй стадией реакции присоединения
(см. стр. 130). Кинетическое изучение таких реакций показало, что они
уже на первой стадии катализируются кислотами, причем для каждой
реакции имеется оптимальное значение pH. Здесь речь идет о реакциях
со слабыми нуклеофилами (такими, как арилгидразины, семикарбазид),
так как при реакциях с сильными нуклеофилами (такими, как RSH, CN~
или NaHS03, атакующий карбонил в виде иона SO;*-) нет необходимости
в протонном катализе, поскольку реагент непосредственно атакует угле¬
родный атом карбонильной группы.Каталитическое действие водородного иона * можно представить
следующим образом (на примере реакции с семикарбазидом);HR HRH2N—C-NH—№ + C=0 + H+ H2n- C-NH-NT C- Ofi 4=^II I II м I 7О H R О rfjyстадия присоединенияH+ Rч=±: H,N-C-NH-N=C + H2O
L II IО R(кривые стрелки указывают на образование новых связей).Подобным образом протекает первая стадия реакции и с другими
слабыми азотистыми основаниями, а также со спиртами. При дальней¬
шем повышении концентрации водородных ионов происходит более пол¬
ное связывание исходного азотистого основания (вплоть до полного про¬
тонирования слабоосновной молекулы), и реакция прекращается.Реакции присоединения по карбонильной группе часто катализи¬
руются также основаниями, роль которых состоит в удалении отщепляю¬
щегося на первой стадии протона. В этих случаях реакция идет без про¬
межуточного присоединения протона к карбонильному кислороду.Замещенные гидразоны жидких альдегидов и кетонов обычно пред¬
ставляют собой твердые вещества, которые легко идентифицировать по
их температурам плавления.Гидразоны и замещенные гидразоны под действием щелочей изоме-
ризуются в азосоединения (вещества, содержащие группировку атомов—С—N=N—С—):I IR\ он- R\^C=N—NH—R" >- ;c—N=N-R"R'/ R'/lHБ. В. Иоффе впервые удалось получить мономерный фенилгидразон
формальдегида и провести его изомеризацию в метаназобензол:он-CH2=N-NHC6H5 >■ СН3—N—N—С6Н5метаназобензол
(т. кип. 51°С)* В действительности протон в водной среде всегда гидратирован и функциони¬
рует в виде НзО+,
ХИМИЧЕСКИЕ СВОЙСТВА ОКСОСОЕДИНЕНИИ133Для незамещенных гидразонов, по-видимому, именно этой предва¬
рительной изомеризацией объясняется реакция Кижнера — Вольфа, по¬
зволяющая превратить оксосоединения в соответствующие углеводородыR\ он- R\,C=N-NH2 ► С—N=NH —*■ )c—Н +N*R,/ (изомеризация) R,/ \ д,/1H HIпоскольку соединения типа —С—N=N—Н всегда неустойчивы и
моментально разлагаются по схемеI I—С—N=N—Н —► —С—H + N2I IРеакции окисления. Альдегиды и кетоны сильно различаются по
своему отношению к окислителям.1. Альдегиды окисляются как сильными (Н2Сг207, КМп04), так и
слабыми окислителями [Ag(NH3)2, Cu2+ в виде фелинговой жидкости]
в кислоты с тем же числом углеродных атомов, причем альдегидная
группа превращается в карбоксил:R—С—Н + О —v R—С—ОНII IIО О2. Кетоны окисляются лишь сильными окислителями при нагрева¬
нии. Например, на холоду ацетон хорошо растворяет перманганат калия,
не вступая с ним во взаимодействие. Окисление происходит при более
высокой температуре с разрывом углеродной цепи по обе стороны кар¬
бонила, и в общем случае получается смесь четырех кислот (правило
Попова):СНз—СН2—СН2—сн24-с4-сн2—СНз + О —► СНз— сн2—сн2-с—он +ЧМ IIо о+ СНз—СН2—С—ОН + СНз—СН2—СН2—СН2—С—ОН + СНз—с—онII II IIо о оАльдегиды проще всего можно отличить от кетонов по реакции их
с аммиачным раствором окиси серебра, из которого альдегиды выде¬
ляют осадок металла.3. Альдегиды, в отличие от кетонов, под действием ряда алкоксидов,
например (БЮ)зА1, (RO)4Ti, претерпевают важную в промышленном
отношении реакцию: одна молекула альдегида восстанавливается за
счет окисления другой и в результате образуется сложный эфир (реак¬
ция В. Е. Тищенко):А1(ОСНа)з2СН3—С—Н СНз—с—О—СН2—СН3II IIО ОРеакция Тищенко протекает с гидридным перемещением водорода
альдегидной группы.Реакции замещения в a-положении. Поляризуемость я-связи кар¬
бонильной группы и наличие на углеродном атоме карбонила частичного
положительного заряда (см. стр. 123) сказывается на поведении атомов
134ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ и КЕТОНЫ)водорода соседнего с карбонилом углеводородного звена (a-звена) аль¬
дегидов и кетонов. Естественно, что в системе8+(б+и й— означают частичный заряд, т. е.-
Н Н ср долю полного электронного заряда)S-водородные атомы под влиянием соседнего б+'-заряда удерживаются
менее прочно, чем в углеводородах, и легче удаляются из молекулы
в виде протонов. При подходе к кислородному атому карбонила какого-
либо положительно заряженного центра (электрофильного реагента)
происходит дальнейший сдвиг л-электронов карбонильной двойной связи
к кислороду, что еще более ослабляет связь С—Н и облегчает протони¬
зацию водорода. В приведенной выше системе связи Н—С—С = 0 сопря¬
жены (а—л-сопряжение), и система этих связей действует как единое
целое: разрыв связи С—Н (при действии оснований, отрывающих про¬
тон) ведет к разрыву л-связи С=0 и сосредоточению л-пары электронов
у кислорода. И обратно, атака по кислороду, разрывающая я-связь,
часто ведет к отрыву протона.1. Енолизация. Одним из проявлений этих отношений является
свойственная оксосоединениям, содержащим а-водородные атомы, реак¬
ция енолизации;н+тт 1Гт-ч ~гт п г< г* ru енольная формаацетон Н—С—'С‘~~СНз < Н С—С СНз ацетонакЬ Цн+ нДля того чтобы в оксосоединениях равновесие было значительно
смещено вправо — в сторону енольной формы, необходима, однако, еще
большая подвижность водородного атома (его протонизация), что дости¬
гается в тех случаях, когда место одного из сс-водородных атомов зани¬
мает какая-либо другая группа, оттягивающая электроны (электроноак¬
цепторная, или электрофильная, группа), например второй карбонил.В ацетоне при комнатной температуре содержится всего 2,5 • 10-4%
енольной формы. Между тем скорость многих реакций кетонов, при кото¬
рых происходит замещение водородного атома в «-углеводородном
звене, равна скорости енолизации и не зависит от концентрации дейст¬
вующего реагента. Такова, например, реакция бромирования, приводя¬
щая к образованию а-бромкетона. Скорость бромирования отвечает
реакции нулевого порядка по брому, т. е. не зависит от концентрации
брома, а определяется только скоростью енолизации. Так как енол ре¬
агирует с бромом гораздо быстрее, чем идет енолизация, то стадией
реакции, определяющей итоговую скорость процесса, является, как
всегда, более медленная реакция — именно енолизация. Это подтвер¬
ждается тем, что хлорирование и иодирование идут с той же скоростью,
что и бромирование.Весьма вероятен следующий механизм реакции:а) енолизация под влиянием кислоты
ХИМИЧЕСКИЕ СВОЙСТВА ОКСОСОЕДИНЕНИЯ135б) синхронное, или согласованное, бромированиеПодобным же образом идет окисление кетонов хромовой кислотой *
или двуокисью селена в 1,2-диоксосоединения:Таким образом, через стадию енолизации кетоны могут быть окис¬
лены в а-оксо- и а-диоксосоединения. Однако в обоих этих случаях ско¬
рость окисления соответствует реакции первого порядка как по окисли¬
телю, так и по кетону (т. е. пропорциональна концентрации обоих ком¬
понентов). Это означает, что самой медленной стадией, определяющей
общую скорость реакции, является не енолизация, а, по-видимому, ста¬
дия образования сложного эфира енола и аниона окислителя.2. Метилирование по Нефу. Поскольку кетоны, в отличие от альде¬
гидов, довольно устойчивы к действию щелочей, их можно метилировать
иодистым метилом по a-звену в присутствии едкого кали или амида
натрия:Реакция, несомненно, состоит в отнятии протона щелочью и в элек-
трофильной атаке иодистым метилом мезомерного аниона кетона.В этом анионе отрицательный заряд не фиксирован на углеродном
атоме, на котором он возник, а распределен между ним и кислородом,
что может быть изображено следующими двумя способами:+ НгСгОзIIR-C-C—RОокисление,IIООр-^-СНг -*-*■ R-C-рЪОО мезомерии см. стр. 173 и 234.* Сравнить с реакцией на стр. 124.
136ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)Однако в жестких условиях (350 °С) твердая щелочь расщепляет
кетоны с образованием кислоты и углеводорода. Кетоны CnH2n+iCOCH3
образуют под влиянием щелочи главным образом соль кислоты
CnH2n+iCOONa и метан:C„H2„+iCOCH3 + NaOH —v C„H2„+,COONa + СН43. Образование оксимов. Поучительно действие на кетоны азотистой
кислоты:R— С—СН2—СН3 + H0-N=0 > R-С—СН—СН, зе=* R—С—С—СН3
II “Н2° II I II IIО О N=0 О NOHНитрозогруппа (—N = 0) азотистой кислоты замещает подвижный
а-водородный атом кетона, в результате чего второй а-водородный атом
оказывается уже под влиянием не только карбонила, но и еще более
электроноакцепторной нитрозогруппы. Под этим воздействием он поки¬
дает свое место при углероде и перемещается, но не к карбонильному
кислороду, а к более нуклеофильному (точнее, протофильному) кисло¬
роду нитрозогруппы. Образуется оксимная группировка.Оксимы гидролизуются в кислой среде:R—С—С—СНз + Н20 R—С—С—СН3 + NH2OHII II II IIО N—ОН О ОГидролиз показывает, что вещество, образовавшееся при взаимодей¬
ствии кетона с азотистой кислотой, представляет собой монооксим дике-
тона (в случае R—СНз — бутандиона-2,3). Если на этот дикетон или
на его монооксим подействовать гидроксиламином, то по знакомой уже
реакции получается диметилглиоксимСН3—С—С—СН3 + H2NOH —► СН3—С—С—СНз + Н20II II II IIО N—ОН HON NOHизвестный реактив Чугаева на катион никеля.В случае трудно гидролизуемых оксимов снять оксимную группу и
регенерировать оксосоединение можно путем ее окисления посредством
NH4N03-Ce(N03)4 в среде низших спиртов или уксусной кислоты при
температуре от —40° до 0°С.4. Галоидирование. Подвижность а-водорода сказывается и при га-
лоидировании. При действии свободного галоида альдегиды и кетоны
легко хлорируются, бромируются и даже иодируются в а-положение
(как это изложено выше, реакция идет через енольную форму). В случае
избытка галоида все а-водородные атомы могут быть замещены на га¬
лоид:О ОII ' IIСНз—С—Н + С12 —> СН2С1—С—Н + НС1хлорацетальдегидО огСНз—С—Н + ЗС12 —> СС1з—C-H + ЗНС1хлоральО оII IIСНз—С—СН3 + С12 —> С1СН2—С—СН3 + НС1монохлорацетоно оII II:н3—С—СНз + ЗС12 —* СС13—С—СНз + ЗНС1трихлорацетон
ХИМИЧЕСКИЕ СВОЙСТВА ОКСОСОЕДИНЕНИЙ137Реакция катализируется как кислотами (ионом водорода), так и,
особенно, основаниями. В случае хлорирования, бромирования или иоди¬
рования в щелочной среде выделить продукты первой фазы галоидиро-
вания не удается, так как реакция идет сразу до третьей фазы:О ОII IIR—С—CH3 + ЗХ2 + 3NaOH —> R—С—СХ3 + 3NaX + ЗН20где R = Н или алкил.Оксосоединения этого типа в щелочи неустойчивы и тотчас пре¬
терпевают галоформное расщепление на соль карбоновой кислоты
RC—ONa и галоформ:ОR— С—СХ3 + NaOH —* СНХ3 + R—С—ONaII ■ IIО ОПрактически галоформы, т. е. хлороформ СНСЬ, бромоформ СНВгз
или йодоформ СН13, готовят галоидированием в щелочном растворе
ацетона или этилового спирта (последний в этих условиях сначала оки¬
сляется в ацетальдегид).. 5. Реакции конденсации. При конденсации оксосоединений одновре¬
менно вовлекаются в реакцию а-метиленовая группа одной молекулы
и оксогруппа второй молекулы. Альдегиды вступают в эти реакции зна¬
чительно легче, чем кетоны, — уже под влиянием слабой щелочи или
разбавленной кислоты.Первой фазой реакции является альдольная конденсация, протекаю¬
щая путем присоединения a-звена одной молекулы оксосоединения к
карбонильной группе другой молекулы. При этом из двух молекул
ацетальдегида получается альдоль (альдегидалкоголь)ОНно- |CH3-CX + СН3-С^ »■ СН3—С—сн2—с\н \н I \нноткуда и возник термин альдольная конденсация.Из ацетона при альдольной конденсации получается «ацетоновый»
(диацетоновый) спирт:СНзСа(ОН)2 I
СНз—С—СН3 + СНз—С-СНз *■ СНз-С— СН2-С—СНзII II I II0 0 он оВ более жестких условиях от продуктов этой реакции отщепляется
вода и образуется непредельное оксосоединение (из ацетальдегида—
кротоновый альдегид), причем промежуточный оксиальдегид или окси-
кетон обычно не может быть изолирован:ОНСНз—С-Н + СНз—с-н —> СНз-СН=СН-С-Н СНз-С—сн2—сII и II -н2оо окротоновый альдегид альдольII II I I NH00 онЭта реакция получила название крйтоновой конденсации.
Конденсация ацетона протекает, в частности, при взаимодействии
его с серной кислотой разной концентрации. Последняя из приведен¬
ных ниже реакций сопровождается выделением всего кислорода в виде
138ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)воды и замечательна образованием ароматического углеводорода —
1,3,5-триметилбензола, так называемого мезитилена:сн3СНз—С-СН3 + СН3-С—СНз —> СН3—£=СН—С—СН3 + н20,А А Аокись мезитилаСН3 СН3 СНз СНзI IIIСН3—-С—О + СНз—С—СН3 + 0=С—СНз •—► СНз— С=СН-С—СН=С—СНз + 2Н20<!) ' I)форонСН»1ССНз/ \1со СНзHCJ? "‘СНСНз + О1 IIСНз—С^С С—СН3сн\ Нзс"сн3! ,3,5-триметилбензол
(мезитнлеи)То, что и кислота и основание катализируют альдольную конденса¬
цию, объясняется следующим механизмом реакции:а) катализ щелочью состоит в том, что ОН- вырывает Н+ из а-звена
оксосоединения, а полученный анионс^с-сн,
н сРатакует карбонильный углерод другой молекулы:сн3-с<сн2-с^° —сн3-с-сн2-с^° ^ сн3-с-сн2-с^° + он-
н о- он . нб) при кислотном катализе ион водорода вызывает енолизацию од¬
ной молекулы оксосоединения и образование карбониевого иона из
второй:Н Н H* IjlChJt-C —►- сн,=с'h + iо*н онн н н нСН3-С —►- CHj—С- + сн2=с —►- сн3-с-сн2—СГ + н'
о^н+ <i)H dP-н Ън °ион карбония енолКривые стрелки в этих уравнениях означают сдвиг электронов, ча¬
стично осуществляющийся в молекуле до реакции и завершающийся
в реакции образованием новых связей с разрывом старых.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСОСОЕДИНЕНИЯ 139Конденсации типа альдольной и кротоновой могут происходить не
только между одинаковыми, но и между разными молекулами оксосо¬
единений и шире — между оксосоединениями и производными углеводо¬
родов типа R—СН2—X, где X — сильно электроноакцепторная группа
(>С=0, —N02, >S02, —ССЦ). Так реагирует, например, ацетон с
хлороформом, в котором соседство трех атомов хлора сильно протони-
зировало водород:СН3СНз—С— СНз + НСС1з —► СНз—С—СС13IОНАЭти реакции имеют огромное значение в синтезе.Формальдегид, не имеющий a-звена, не может вступать в реакции
этого типа. Конденсация его молекул протекает по иному типу и приво¬
дит к образованию смеси углеводов (стр. 408). С другими же оксосоеди¬
нениями формальдегид конденсируется нормально, например;Н\ нV=0 + СНз—С—СНз —► С—СН2—С—СН3 ——СН2=СН—С—СНзн/ J н/| I ~Н2° II
;о - он о оОксогруппа альдегида активнее, чем у кетона, поэтому при конденсации альдеги¬
дов с кетонами карбонил альдегида всегда присоединяет элементы a-звена кетона.
Интересен способ получения альдолей из кетонов, предложенный Виттигом. Для кон¬
денсации с кетонами Виттиг использовал азотистые производные альдегидов — шиф-
фовы основания в виде литиевых соединений:Н НI rnh2 |СНз—с=0 ► СНз—C=NR + HsOшнффовооснованиен нСНз—C=NR + Li—N(C2H5)2 —► LiCH2-C=NR + NH(C2H6)2R'\ I1 R\ 1XC=0 + LiCH2—C=NR —► NC—CH2—C=NR
R,/ R,/k;' R' 7 + R' VK \ I H K \ I:c— CH2—C=NR + 2HjO ► ,C—СН2—C=0 + RNH,R'/ I R'/ IOLi OHВ результате этих превращений кетон R^CO как бы вступил в альдольную кон¬
денсацию с альдегидом. Тип реакции здесь тот же, что и при взаимодействии кетона
с гриньяровым реактивом или литийалкилом, только металлоорганический реактив
готовят прямым металлированием легко протонизируемого а-водорода шиффова ос¬
нования.6. Реакции полимеризации. Эти реакции характерны только для
альдегидов изучаемого ряда. Кетоны не полимеризуются *.В качестве примера обычного типа полимеризации альдегида приве¬
дем полимеризацию ацетальдегида. При внесении капли серной кислоты
происходит экзотермическая реакция со вскипанием ацетальдегида, и он* Лишь в последние годы В. А. Каргнну с сотр. удалось в особых условиях
заполимеризовать ацетон в высокомолекулярный продукт (линейная полимеризация).
140ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)тримеризуется в шестичленное гетероциклическое соединение — параль-
дегид. Если проводить полимеризацию ниже 0°С, то происходит тетра-
меризация и образуется твердый метальдегид, применяемый как твердое
горючее «твердый спирт»:Н\ о /СН3 Q /СНзЗСНзС/ ^4. съп сн/1 |NH0 /с\ н\ I ; I /сн*чсн3 jyсн/ ° \нпаральдегид метальдегид(т, кип. 124 °С) ' (т, субл. 112° С)Оба полимера легко деполимеризуются, если их нагревать с каплей
серной кислоты и отгонять образующийся ацетальдегид (т. кип. ацет¬
альдегида 21 °С).Формальдегид в газообразном состоянии самопроизвольно полиме-
ризуется в тример — триоксиметилен — низший гомолог паральдегида:Н\ Q /н
нЛ 1чнО* уОсv/ \нтриоксиметилен
(т. пл. 62 °С)При стоянии 40%-ного водного раствора формальдегида («форма¬
лина») происходит самопроизвольное выпадение полимеров другого
рода — линейных высокомолекулярных соединений(и+ 1)СН20 + Н20 —> НОСН2—(—ОСН2-)д—ОНв которых п равно нескольким десяткам или сотням. Эти полимеры но¬
сят название полиоксиметилена или параформа. Они различаются еще
концевыми группами: когда полимеризация вызывается добавкой серной
кислоты, на концах появляются сложноэфирные сульфатные группы:О ОII IIНО—S—О—СН2— (—ОСН2)„—О—S—онА АЕсли в формальдегиде присутствует метиловый спирт (как это бы¬
вает в товарном формалине), на концах некоторых полимерных молекул
могут быть метоксильные группы:СН3ОСН2— (—ОСН2—)п—ОСН3Таким образом, параформ представляет собой смесь соединений не
только разного молекулярного веса, но и (незначительно в процентном
выражении) разного состава. При действии водного раствора щелочи
он деполяризуется, образуя формальдегид.Сравнительно недавно научились полимеризовать сухой формальде¬
гид в полиформальдегид гораздо большего молекулярного веса. Усло¬
вием полимеризации, осуществляемой в настоящее время в крупных
промышленных масштабах, является высокая чистота формальдегида.
Полиформальдегид — одна из самых дешевых пластмасс с ценными
ПОЛИМЕРЫ И ПОЛИМЕРИЗАЦИЯ141свойствами, применяемая для изготовления деталей машин. Как пока¬
зал Н. С. Ениколопов, тот же продукт может быть получен полимериза¬
цией триоксиметилена.ПОЛИМЕРЫ И ПОЛИМЕРИЗАЦИЯСтрого говоря, полимером данного соединения называется вещество,
имеющее тот же состав, но кратный молекулярный вес, независимо от
строения исходного и конечного веществ. Различают димеры, тримеры,
тетрамеры и т. д. и собственно полимеры. Примеры тримеров и тетра¬
мера приводились при рассмотрении альдегидов и кетонов. Альдоль по
существу является димером ацетальдегида. Другие примеры полимеров:
бензол С6Н6 по отношению к ацетилену С2Н2, бутилен С4Н8 по отноше¬
нию к этилену С2Н4.Полимеризация — образование полимера из мономера. Мономер —
термин, имеющий смысл только по отношению к его полимеру. Если нет
полимера, нет и мономера. Однако исторически содержание, вкладывае¬
мое в понятия полимер и полимеризация, менялось. Во-первых, как раз
в области альдегидов и кетонов понятие полимеризация было противо¬
поставлено понятию конденсация. Для конденсации (альдольной, крото¬
новой) характерно образование новой С—С-связи. К полимеризации
в этом узком смысле относили лишь связывание мономерных молекул
неуглеродными связями в полимерную молекулу, легко подвергающуюся
деполимеризации. В результате очевидного родства полиоксиметиленов
с другими полимерами альдегидов и вследствие недостаточной точности
обычного количественного анализа, не обнаруживающего наличия кон¬
цевых групп (в нашем примере полиоксиметиленов концевые группы
НО—, СН30— или HOSO2O—), такого рода вещества тоже начали на¬
зывать полимерными, а процесс их образования — полимеризацией, и это
наименование распространилось на все подобные линейные высокомоле¬
кулярные соединения, независимо от того, связаны ли мономеры угле-
род-углеродными или иными связями. Это ныне общепринято, хотя
назвать такие линейные высокомолекулярные вещества полимерами
данного мономера можно, только закрыв глаза на наличие концевых
групп (часто, впрочем, строго говоря, не установленных). Так, например,
полиэтилен (см. стр. 257), получаемый полимеризацией этилена'в при¬
сутствии кислорода и имеющий строение НО—(СН2СН2)П—ОН, назы¬
вают полимером этилена. Другими примерами линейных полимеров
являются серии полигликолей, получаемых действием окиси этилена на
этиленгликоль в кислой среде (стр. 117):НОСН2СН2—О—СН2СН2ОНHOCH2CH2—О—СН2СН2—О—СН2СН2ОН ^ гическая разностьносн2сн2-(-о-сн2сн2—)„-о-сн2сн2он ) —осн2—СН2-полимергомоло-Серии такого рода составляют ряд полимергомологов (не путать
с гомологами!). Полимергомологи отличаются друг от друга на одну или
несколько единиц мономера, вмонтированного в цепь. Приведем ряд
полимергомологов параформа:НОСН,—(—ОСН2—он \2 v 2 т 1 полимергсмологическаяНОСН2—(—ОСН2—)п—ОН I разностьНОСН2—(—ОСН2—ОН J -осн2-Линейные полимеры с очень высоким молекулярным весом приоб¬
рели огромное техническое значение и будут рассмотрены в разделе оле¬
финов (стр. 256).
142ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)Применение альдегидов и кетоновФормальдегид в виде ~ 40%-ного водного раствора, содержащего
5—8% метанола, изготовляют в огромных количествах каталитическим
окислением метанола. Это так называемый формалин. Все в большем
количестве формальдегид получают также прямым регулируемым оки¬
слением метана или углеводородов крекинга. Вследствие ядовитости
формальдегида для всех организмов его в виде разбавленных водных
растворов применяют как дезинфицирующее средство, для протравлива¬
ния посевного материала (уничтожение спор головни) и др. Основное
количество формальдегида иДЬт для получения разнообразных пластиче¬
ских масс, лаков и клеев на основе феноло-формальдегидных (см. кн. II),
а также мочевино- и меламино-формальдегидных смол. О его примене¬
нии для получения уротропина и взрывчатого вещества — гексогена см,
стр. 129—130.Ацетальдегид, получаемый из ацетилена, служит важным полупро¬
дуктом в промышленных синтезах спирта, уксусной кислоты, уксусно¬
этилового эфира (реакция Тищенко), кротонового и масляного альде¬
гидов и целого ряда других продуктов.Ацетон является одним из наиболее многотоннажных растворителей.
В промыщленности он получается совместно с фенолом через гидропере¬
кись кумола. Применяется он также для синтеза метакриловой кислоты
и ее метилового эфира (через присоединение синильной кислоты и от¬
щепление НгО, см. стр. 303), используемого в качестве мономера в про¬
изводстве «органического стекла». Крекингом ацетона получают кетен
СНг=С=0 (см. стр. 301), а из него и уксусной кислоты — уксусный
ангидрид и другие производные уксусной кислоты.Метилэтцлкетон широко применяется как растворитель, а также для
получения диацетила и его оксима — диметилглиоксима.ДИАЛЬДЕГИДЫ, АЛЬДЕГИДОКЕТОНЫ, ДИКЕТОНЫЭти вещества классифицируют по числу углеродных атомов углерод¬
ной цепи, разделяющих две оксогруппы. Если это число равно нулю, т. е.
обе оксогруппы соединены друг с другом, то такие соединения назы¬
ваются 1,2- или а-диоксосоединениями; при одном разделяющем звене —
1,3- или р-диоксосоединениями и т. д.Физические свойства и формулы некоторых простейших диоксосо-
едннений приведены в табл. 14.Способы полученияа-Диоксосоединения. Благодаря высокой реакционной способности
«-метиленовой группы альдегидов и кетонов эту группу можно превра¬
тить в оксогруппу главным образом двумя путями: окислением при по¬
мощи двуокиси селена (сравнительно новый путь, Райли, 1932)II °чСН3—С—H + Se02 —> /С-С^ + H20+Se
W ХНОСН3-С-СН3 + Se02ОIIСН3—С—СНг—СНз + SeOj;О ОСН3—(5—(3—н + н2о
о о2w + Se
СН3—С—С—СН3 +,Н20 + Se
ДИАЛЬДЕГИДЫ, АЛЬДЕГИДОКЕТОНЫ. ДИКЕТОНЫ143Таблица 14. ДиоксосоедииеиияФормулаНазваниетеО, ..Ь*£ X
2 ктео,ь .
те кЛноПримечаниетривиальноеженевскоеО, (У
<L> С*£ *2 те
V чуН пос~ в
v я
с ^2 сз
«ко
Н Хо§|оcVOHC—СНОГлиоксальЭтан-диаль1560,41,14Зеленые пары
или желтые
кристаллыОНС—СН2—СНОМалоновыйдиальдегидПропан-диальКрайне не¬
устойчив; выше
0 °С полнме-
ризуетсяОН С—СН2СН2—СНОЯнтарныйдиальдегидБутан-диаль1,41701,064—СНз—СО—СО—СНзДиацетил,
или диме-
тилглиок-
сальБутан-дион-2,3—2,4880,980W0Зеленовато-желтаяжидкостьСНзСО—СН2—СОСНзАцетил-ацетонПентан-дион-2,4—23,2139
(при
746 мм
рт. ст.)0,976БесцветнаяжидкостьСН3СО(СН2)2СОСН3Ацетонил-ацетонГексан-дион-2,5—91940,970—СНз—СО—СНОПировино-градныйальдегидПропа-иональ721,045
(при
24 °С)Желтаяжидкостьи действием на кетоны азотистой кислоты (см. стр- 136). Образующиеся
изонитрозокетоны являются ничем иным, как монооксимами сс-диоксо-
соединений и при гидролизе дают а-дикетоны:О О NOHII II IСН3—С—СН2—СН3 + HNO.J —► СНз—С—С—СНз + н2оО NOH О ОСНз—с—<!—сн3 + н2о сн3—i:—(!—СНз + nh2oh. Кроме получения из монооксосоединений, для синтеза а-диоксо-
соединений могут быть применены обычные методы окисления или ката¬
литического дегидрирования первичных спиртовых групп (для получения
альдегидных) или вторичных (для получения кетонных групп). По¬
скольку наиболее доступны как раз а-гликоли и а-оксиоксосоединения,
то этот путь наиболее приложим к синтезу именно а-диоксосоединений:СиHOCHj—СНгОН ► /с—Ч + 2Н*W ЧН
ОН О о оСНз—<Jh—с!—СНз 1► СНз— С—I—СНз + Н2о о
СНз—<!:—сн2он —сн3—с—с^ +н2о
\нр-Диоксосоединения. Наиболее важный путь синтеза р-диоксосо-
единений — это конденсация кетона со сложным эфиром карбоновой
144ОКСОСОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)кислоты под действием металлического натрия. В случае эфира муравьи-
ной кислоты получается р-альдегидокетон, в случае гомологичных эфи¬
ров — р-дикетокы. Простейший р-диальдегид, малоновый диальдегид
ОНС—СН2—СНО крайне неустойчив и не может быть получен этим
путем.Суммарное уравнение процесса конденсации выражается так:О ONaСНз-С-СНз СН2=С-СН3О (ci^Na О ОСНз-С-ОСаНз+СН^С-СНз—>СН3-С-СН2-С-СН3 + CjH50 Na+ацетилацетон 'О (o^-NaН ~н-с-осан5+СН2=С-СНзONa оI II .—>- н-с=сн-с-сн3 + С2Н5ОН' алкоголят окснметилен-
ацетона или енолят
формилацетонаВследствие резко возросшей подвижности протонов центрального
а-метиленового звена в р-диоксосоединении последнее в обеих реакциях
выделяется в виде натриевого производного енольной формы. Так, обра¬
зовавшийся р-альдегидокетон — формилацетон с этилатом натрия тотчас
превращается в натриевый алкоголят оксиметиленацетона (то же проис¬
ходит с ацетилацетоном). Свободный формилацетон, в отличие от аце-
тилацетона, не способен к длительному существованию и тримеризуется
по типу кротоновой конденсации в триацетилбензол (см. ниже свойства
диоксосоединений).Более подробно механизм этой важной реакции будет разобран при
рассмотрении совершенно аналогичной сложноэфирной конденсации
двух молекул сложного эфира (стр. 387, 402).Y-Диоксосоединения у'Диальдегиды можно получить восстановле¬
нием дихлорангидридов соответствующих кислот по Розенмунду:О О о оII II Pd II IICl—С—СН2-СН2—С—С! + 2Н2 ► Н—С—СН2—СН2—С—Н + 2НС1Y-Дикетоны получают, действуя хлорацетоном на натрийацетоуксус¬
ный эфир (стр. 405) и производя «кетонное расщепление» полученного
ацетонилацетоуксусного эфира или действуя на натрийацетоуксусный
эфир иодом и подвергая «кислотному расщеплению» полученный диаце-
тилянтарный эфир (см. стр. 391).Свойства диоксосоединенийВсе диоксосоединения, естественно, могут быть восстановлены в со¬
ответствующие гликоли, а диальдегиды — окислены в соответствующие
двухосновные кислоты. Здесь нет смысла рассматривать эти не требую¬
щие пояснения реакции, но изучающему органическую химию нужно
понять и усвоить отношения диоксосоединений к продуктам их восстано¬
вления н окисления — гликолям, кислотам, оксикислотам и оксиоксосо-о оН-С-СН2-С-СН3 + C2H50~ Na+-
' формилацетон
ДИАЛЬДЕГИДЫ, АЛЬДЕГИДОКЕТОНЫ, ДИКЕТОНЫ145единениям. Ниже разобраны только специфические превращения диоксо-
еоединений.а-Диоксосоединения, вследствие соседства двух электронооттяги¬
вающих групп, обладают весьма химически активными оксогруппами,
особенно в случае диальдегидов. Например, глиоксаль, подобно хлоралю
и формальдегиду, присоединяет в водном растворе по одной молекуле
воды к каждой альдегидной группе:Н Нн\ /Н II^С—СГ +2Н20 —> НО—С—С—ОНО^ 'ч'0НО онПри этом он из желтого становится бесцветным. При действии щелочи
глиоксаль претерпевает внутримолекулярную реакцию Канниццаро
(см. кн. II) и превращается в гликолевую кислоту:СНО—CHO + NaOH —> СН2ОН—COONaНаиболее интересные производные а-диоксосоединений — диокси-
мы, образующие внутрикомплексные соединения с рядом катионов ме¬
таллов, например диоксим диацетила — диметилглиоксимСН3—С—С—СН3II II
НО—N N—ОНкоторый дает с никелем малиново-красный нерастворимый осадок:Н3С СНз\ /С—С/ \0-<-N N—О: \ ✓ IН Ni НI / \ :О—N N-->0W/ \Н3С СНзСам диацетилСНз-С-С-СН3II IIО оявляется одним из существенных компонентов смеси веществ, обусловли¬
вающих запах сливочного масла (десятые доли миллиграмма на 1 кг
масла), поэтому его добавляют к маргарину и синтетическому маслу.а-Диоксосоединения применяются в синтезе гетероциклов (см.
кн. II).(З-Дикетоны характеризуются прежде всего легкостью протонизации
водородных атомов центральной метиленовой группы (повышенной кис¬
лотностью этих водородов). Поэтому р-дикетоны особенно склонны к ре¬
акциям замещения этих атомов водорода и к реакциям конденсации по* В приведенной формуле стрелки N-*■ О означают семиполярные связи (см.
стр. 22), N-*-Ni — донорно-акцепторные связи (за счет свободной пары электронов
трехвалентного азота), три точки — водородные связи.6 Зак. 8S2
146колотыметиленовой группе. Повышенная кислотность имеет следствием также
высокую степень енолизации (см. стр. 395):СНз— с—СН,—С—СН3 СНЭ—С—СН=С—СН,I! II II Iо о о он24 96 76Ир-Дикетоны образуют прочные внутрикомплексиые еноляты двух-
и трехвалентных металлов;СН снC-R-°ч/° CL/0Л УЖУI/-C с—R »&-<( -С-ЬнYh R RВ них карбонильный атом кислорода предоставляет пару электронов
металлу алкоголята (енолята) енольной формы дикетона. Таким обра¬
зом, двухвалентный металл оказывается связанным с четырьмя кисло¬
родными атомами (заняты четыре координационных места вокруг ме¬
талла)— с двумя енольными и двумя кетонными. Координационное
число трехвалентного металла равно 6, а число енольных и кетонных
кислородов 3 и 3. Такие внутрикомплексиые соединения ацетилацето-
на—с медью, хромом(Ш), железом(Ш), кобальтом(III)—очень проч¬
ные, нерастворимые в воде, окрашенные кристаллические вещества. Цвет
их отличен от цвета соответствующего катиона металла. Они хорошо
растворимы в органических растворителях — ацетоне, хлороформе, бен¬
золе. Такого рода внутрикомплексиые гетероциклические соединения
(металл и кислород — гетероатомы) называются также хелатными со¬
единениями (от греческого слова хеле — клешня): дикетон охватывает
металл, как клешней. Некоторые дикетоны этого типа употребляются
для извлечения катиона металла (например, урана) органическим рас¬
творителем из разбавленных водных растворов.р-Дикетоны находят применение в синтезе шестичленных гетеро¬
циклов.Среди у-диоксосоединений широкое применение в лабораторном син¬
тезе, в частности в синтезе гетероциклов, находит янтарный ДиальдегидН\ /Н
'С—СН2~ СН2—сО^ N)Для этой же цели применяется простейший представитель у-дикето-
ноэ — ацетонилацетонО оII 11СН3—С—сн2—СН2—с—сн3Y-Дикетоны не енолизуются в такой степени, как р-дикетоны, и не
образуют хелатных соединений.КИСЛОТЫПонятие о кислотах и основаниях в органической химии не отли¬
чается от соответствующих понятий неорганической химии. Однако надо
напомнить, что существует несколько определений кислоты, дающих раз¬
ную степень обобщения этого понятия.
кислоты147По классическому определению, кислоты — это вещества, электроли¬
тически диссоциирующие с образованием иона водорода, а основания —
вещества, связывающие ион водорода в недиссоциированную (или мало
диссоциированную) молекулу.По Лоури — Брёнстедту, кислоты — это вещества, от которых можно
отщепить протон. Второй продукт, получающийся при этом, называется
основанием. Таким образом, существует соотношение:Кислота Н+ + ОснованиеОснование, захватившее протон, превращается при этом в кислоту,
которая называется сопряженной кислотой данного основания. И обрат*
но, можно говорить об основании, сопряженном с данной кислотой.
Примеры кислот и оснований Лоури — Брёнстедта;СопряжениеКислотаОсиоваииеСН3—С—О—н ^±н+СНз—С—О'IIII00СНз—он ^=±н+СНз-О"NHtн+NH3+СНз—О—СН3
1н+СНз—О—СНз1нЛьюис еще шире обобщил понятия кислоты и основания. Все веще¬
ства (нейтральные молекулы или анионы), обладающие свободной парой
электронов, которую они могут предоставить для образования связи,
называются основаниями. Предоставление такими веществами пары
электронов для связи с протоном является частным случаем, уклады¬
вающимся в определение кислот и оснований Лоури — Брёнстедта. Все
вещества, которым для устойчивой электронной оболочки недостает
пары электронов, называются кислотами. Примеры:КислотаОснованиеСолеобразиое веществон+СНз— С—0‘СНз—с—ОНIIIIО0Н+НО"Н20+ —BF3(С2Н5)20(С2Н5)20: BF3A1C1SСГaici;ZnCl2НО“ZnCljOH"FeCl3СГFeCi;Таким образом, применяя термины «кислота» и «основание», необ¬
ходимо уточнять, в каком смысле они применены. При отсутствии ого¬
ворки эти термины обычно употребляют в классическом смысле. Термин
«сопряженная кислота» уже указывает, что речь идет о кислоте в смысле
Лоури — Брёнстедта. В тех случаях, когда говорят о веществах с недо¬
статком пары электронов, употребляют термин — кислота Льюиса.6*
148кислотыКак известно из общей химии, сила кислоты НХ измеряется кон¬
стантой диссоциации /Са, определяемой уравнением:„ W vH+[Hlvx-[x-]
а «нх YhxIHX]где [Н+], [Х-] и [НХ] — концентрации; а с соответствующими индексами —
активности; у с этими индексами — коэффициенты активности соответ¬
ствующих ионов или молекул. Произведения коэффициентов активности
(их находят по таблицам) на концентрации (см. стр. 80) дают сами
активности. В .разбавленных водных растворах для несильных электро¬
литов коэффициенты активности равны единице и выражение для кон¬
станты диссоциации принимает вид:к [н+][х-]Да [НХ]Обычно величины констант диссоциации много меньше единицы, на¬
пример константа диссоциации уксусной кислоты в воде при 25 °С равна0,0000176, что удобнее записать как 1,76 * 10-5, а еще лучше как 10~4'75.
При таком способе написания констант диссоциации кислот особенно
удобно сопоставлять силу разных кислот, сравнивая показатели степени
при 10. При этом, простоты ради, опускают знак минус у показателя
степени. Взятый с положительным знаком отрицательный показатель
(иначе говоря, десятичный логарифм) обозначается как р/<а. В данном
примере р/Са = 4,75. Основность оснований можно сравнивать, измеряя
Ка сопряженных кислот (например, в случае аммиака константу диссо¬
циации иона NH4) или же константу равновесия Къ'А + Н20 :*=* АН++-ОН Р/Сь = p/Cw — Р/Сагде p/(w = р/С воды, т. е. я* 16.функция кислотности я,Шкала pH, являющаяся мерой кислотности в разбавленных водных
растворах, не пригодна для характеристики кислотности концентриро¬
ванных кислот по той же причине, по которой концентрации в уравне¬
ниях, выражающих химические равновесия, не пригодны для характе¬
ристики концентрированных и неводных растворов и должны быть заме¬
нены в этом случае на активности. Соответствующая замена концентра¬
ций активностями приводит к обобщению меры кислотности и на кон¬
центрированные и неводные растворы. В таком обобщении значение
«функции кислотности» Я0 продолжает шкалу pH на область концентри¬
рованных кислот. Ниже описывается это обобщение, сделанное Гаммет-
том.Если в кислоту НХ внести электронейтральное основание В — амин,
любое кислородное органическое соединение и т. д., то осуществляется
равновесная реакция:В + НХ ч=±: ВН+ + Х"Катион ВН+ соли основания В диссоциирует в соответствии с урав¬
нениемЗН+ в + н +
кислоты149и константа этой диссоциации Ка, позволяющая судить о силе основания
В, выразится так:Ув °н'Ч [°1
' V wlBH-lгде а с соответствующими индексами — активности, у с индексами •
коэффициенты активности, а выражения в скобках — концентрации.VVBОбозначим выражение — через h0, тогда[вн+]YBHTЛ0 = Ка[В]Функция кислотности Но определяется как отрицательный десятич¬
ный логарифм h0, т. е. Н0 — —lgh0 и, значит//o = p/ca + lg- [В![ВН+В разбавленных водных растворах кислот коэффициенты активности
практически равны единице и h0— aH+, а Н0 = р/Са. Но в растворах
концентрированных кислот, где коэффициенты активности отличны от
единицы и меняются с концентрацией, На служит мерой кислотностии, как сказано, продолжает шкалу рКа в сторону концентрированных
кислот.Для основания В', рассуждая так, как мы это сделали для основа¬
ния В, мы получим аналогичные выражения, в которые вместо величин
[В], [ВН+], yb и YBh+ войдут величины [В'], [В'Н+], ув„ уВ'Н+> и кон'
станта диссоциации сопряженной кислоты В'Н+ будет равна Ка. Тогда[вн+] , [в'н+1 , , Yfin+VР^а - Р^а = •ё-Чш Гг,-Г + Еслиили, что то же, WV „
lg =0Wh+, YBH+ , yb'h+
lg — lg.TOYb Yb-, W , Vh+ „ , [BH+1 ,• [b'h+]-lg—— = lg—— и p/r _pKa = ig— ig-YB ё YB' F a F a b IBJ “ [B'jДля широкого круга слабых оснований в средах с высокими диэлек¬
трическими проницаемостями приведенные равенства соблюдаются, и,
как уже показано выше, функцию кислотности можно выразить так:В//о — рКа "Ь "I ТТ[ВН ]Для практического определения Н0 используют индикаторы с изве¬
стным рКа (эти данные имеются в соответствующих таблицах), свето-
поглощение сопряженной кислоты которых ВН+ резко отлично от свето-
поглощения основания В, и колориметрически или спектрофотометриче¬
ски измеряют концентрации [В] и [ВН+].
150КИСЛОТЫИз последнего уравнения следует, что Н0 — р/Са в случае[В][ВН+]1,т. е. в случае, когда 50% общего количества основания В захватило
протон и находится в форме ВН+.Поскольку каждый индикатор применим в узкой области кислотно¬
сти, приходится использовать ряд индикаторов. Приводим для примера
значения р/Са ряда сопряженных кислот слабых оснований, употребляе¬
мых в качестве индикаторов для определения Н0:ОснованиеР*аОснованиеркаи-Нитроанилии . . +1.НБензальацетофенон - .. .—5,61е-Нитроанилин . .. . - -0,13л-Бензоилбифеннл ....-6,19п-Нитродифениламин. . -2,38Бензойная кислота ...—7,26п-Нитроазобензол .. - - -3,35Антрахинон .......—8,152,4-Динитроанилин•1k1СО002,4,6-Тринитроаннлнн . .-9,29Величины Н0 для растворов серной кислоты разной концентрацииH2S04. %На'H2SO4, % Hq5+ 0,2460 —4,3210—0,1670 —5,5420—0,8980 , —6,8230—1,5490 —8,1740—2,2895 —8,7450-3,23100 —10,60Органические кислоты (в классическом, смысле) содержат в углево¬
дородной цепи те или иные функциональные группы, которые представ¬
ляют собой остатки неорганических многоосновных кислот или угольной
кислоты, сохранившие по меньшей мере один кислый водородный атом;НеорганическийпрототипОНIНО—В—ОН-борная кислотаоIIНО—С-ОНугольнаяОН
НО—Р—ОНIIофосфорнаяОIIНО—S-OH
сернистаяОIIНО—S—ОНIIС)сернаяОрганические кислотыR—В(ОН)2адкилборные0R— I—ОНкарбоновыеОН1R—Р—ОНIIОалкнлфосфоновыеОliR—S—ОНалкилсульфнновыеОIIR—S—ОНIIОалкилсульфонорыеRIr—В—ОНдиалкилборныеRIR-P-OHIIОдиалкилфосфнновые■Сюда же относятся кислые сложные эфиры минеральных кислот,
уже рассмотренные на стр. 106.
•ОДНООСНОВНЫЕ ПРЕДЕЛЬНЫЕ КИСЛОТЫКАРБОНОВЫЕ КИСЛОТЫОДНООСНОВНЫЕ ПРЕДЕЛЬНЫЕ КИСЛОТЫВ этом разделе будут рассмотрены кислоты, кислотные свойства ко¬
торых обусловлены наличием карбоксила — функциональной группы
/О с
\энГомологический ряд одноосновных предельных кислот имеет общую/°формулу СвН2„02 и начинается муравьиной кислотой Н—С . Три-' ЧЭНвиальные названия кислот этого рода — муравьиная, уксусная, пропио-
новая, масляная и т. д. (табл. 15) — привились так прочно, что, как
и названия производных этих кислот (солей, сложных эфиров) от соот¬
ветствующих латинских корней (формиат, ацетат, пропионат, бутират),
они применяются повсеместно. Женевская номенклатура устанавливает
для карбоновых кислот названия, производимые от соответствующего
предельного углеводорода, например для муравьиной кислоты — метано¬
вая-, для уксусной — этановая и т. д. Существует, однако, еще одна си¬
стема номенклатуры, очень удобная во многих случаях, которую важно
не путать с женевской. Кислоту по этой системе формально рассматри¬
вают как продукт замещения водородного атома углеводорода на карб¬
оксильную группу и в соответствии с этим, например, уксусную кислотуnJ-cfА онназывают не этановой, а метанкарбоновой./°Функциональная группа карбоновых кислот, карбоксил —С ,Х)Нпредставляет собой комбинацию карбонила С = 0 и гидроксила. Это
доказывается рядом уже известных нам реакций.Так, при действии нятихлористого фосфора на кислоту происходит
обычное замещение гидроксила на атом хлора и образуется хлорангид-
рид кислоты:R-С—ОН + РС15 —v R—С—С1 + РОС1э + НС1II IIО оПо реакции Розенмунда (см. стр. 127) этот хлор может быть заме¬
щен на водород и структура кислоты сведена к структуре соответствую¬
щего альдегида:PdR—С—С! + Н2 ► R—С-Н + НС1А АОчень важно, что при обратной реакции — окислении альдегида —
вновь образуется кислота:R—С—Н + О —► R—С—ОНII IIО о
152КАРБОНОВЫЕ КИСЛОТЫТаблица 15. Предельные одноосновные кислоты*ФормулаНазваниетривиальноеженевскоепо «карбоновой» системен—СООНМуравьинаяМетановая—СНз—соонУксуснаяЭтановаяМетанкарбоноваяСН3—СН2—соонПропионоваяПропановаяЭтанкарбоноваяСНз—СН2— СН2—СООНМаслянаяБутановая1-Пропанкарбоно-ваяСНз—СН—СООН
1Изомасляная2-Метилпропано-вая2-Пропанкарбоно-ваяСНзСНз—СН2—СН2—СН2—соонВалериановаяПентановая1-ВутанкарбоноваяСНз—сн—сн2— соонИзовалериано-З-Метилбутано-1-Изобутанкарбоно-1ваяваяваясн3СН3-(СН2)4-СООНКапроноваяГ ексановаяI -Пентанкарбоно-
ваяСНз—(СН2)5—соонЭнантоваяГептановая1-Г ексанкарбоио-
ваяСНз—(СН2)6—соонКапряловаяОктановая1-Г ептанкарбоно-
ваяСНз—(СН2)7—соонПеларгоноваяНонановая1-ОктанкарбоноваяСНз—(СН2),4—соонПальмитино¬
вая 1Гексадекановая1-Пентадеканкарбо-новаяСНз-(СН2)15—соонМаргариноваяГ ептадекановая1-Г ексадеканкарбо-
новаяСНз—(СН2)16—соонСтеариноваяОктадекановая1-Г ептадеканкарбо-
новаяСНз—(СН2)24—СООНЦеротиноваяГексакозановаяПентакозанкарбо-новая* Таблица не исчерпывает всех изомеров, а гомологи в ней приводятся выборочно.Поскольку указанные реакции затрагивают только гидроксил кис¬
лоты, значит в кислоте имелся тот же карбонил, что остался в альдегиде.Кислоты образуют многочисленный ряд функциональных произ¬
водных, в которых содержится модифицированная карбоксильная
группа. Такие производные получаются замещением или водорода карб¬
оксильной группы (как в солях), или всего гидроксила (как в хлоран-
гидриде), или, наконец, замещением карбонильного кислорода. Все эти
производные будут далее рассмотрены. Хотя карбоксил и представляет
собой группу, составленную из гидроксила и карбонила, но свойства его
резко отличаются от известных уже нам свойств гидроксила спиртов и
карбонила оксосоединений. Имеется два главных отличия.1. Карбоксил — носитель кислотных свойств, и диссоциация карбоно¬
вых кислот в воде выражается уравнением:
ОДНООСНОВНЫЕ ПРЕДЕЛЬНЫЕ КИСЛОТЫ153ТемператураТемператураПлотностьдиссоциацииР^аплавления,°Скипения,°С.204прн 25 °с(при 23 °С)8,40100,71,2201,77- 10-4(при 20 °С)3,75
(при 20°С)16,6118,11,0491,76- 10~54,75—22,0141,10,9921,34 ■ 10~54,87—7,9163,5
(при 757 мм рт.ст.)0,95871,54 • 10-5
(при 20°С)4,81—47,0154,40,9491,44- 10~5
(при 18 °С)4,84-59;-34,5187,00,9421,51 • 10-5
(при 18 °С)4,82—37,6176,70,937№1,70- 10-54,775 до —2,02050,9291,31 • ю~54,88— 10,0223,50,9181,28- 10~54,89+ 16,0237,50,9101,28- Ю-54,8912,02540,9055——64,0271(при 100 мм рт.
339—356
(разл.)ст.)0,8530
(при 62 °С)60,6227(при 100 мм рт.ст.)0,8578(О69,4291(при 100 мм рт. ст.)0,847
(при 69 °С)——87,7Разлагается0,8360
(при 79°С).—.Константы диссоциации (см. табл. 15) одноосновных предельных
кислот в водном растворе при 25 °С варьируют от 1,7-10-4 (муравьиная
кислота) до ~1,3-10~5. Сравнительно с сильными минеральными кисло¬
тами это — слабые кислоты, но все же их константы диссоциации го¬
раздо выше, чем у воды, не говоря уже о спиртах.2. Карбонильная группа в карбоксиле инертна. Она не способна
вступать ни в какие реакции, характерные для карбонильной группы
альдегидов и кетонов, кроме реакций с магнийорганическими соедине¬
ниями.Все эти факты находят свое объяснение в явлении мезомерии, кото¬
рое мы рассмотрим далее на стр. 173 и 234 сл.Карбоновые кислоты, как и все гидроксильные соединения, — ассо¬
циированные жидкости и лишь в парах и водных растворах мономерны.
Однако, в отличие от спиртов, их ассоциация носит строго регулярный
характер — они образуют димеры, в которых две молекулы кислоты
связаны между собой водородными связями, причем протоны водородной
154 КАРБОНОВЫЕ КИСЛОТЫ
_i—. —■ .связи находятся на разных расстояниях от «своего» (1А) и «чужого»
кислорода (1,7 А).;^о-н-о
r-c; ;c-r
\о-н-о^В парах димер распадается на мономеры.Будучи кислотами по отношению к основаниям (в том числе и
к воде), карбоновые кислоты в то же время являются основаниями, пра¬
вда очень слабыми, относительно концентрированных сильных кислот.
Протон сильных кислот захватывается карбоновыми кислотами:+/ОНR—С—0H + HjS04 4=2: R—с + hso;J х°нсопряженнаякислота+✓ОНхВеличина р/Са кислоты, сопряженной с уксусной R—С I,V Х)Н/достигает 6,1; Ка = Ю-6,1.Физические свойства и названия предельных карбоновых кислот —
гомологов муравьиной кислоты — приведены в табл. 15.Способы получения карбоновых кислот1. Способы, основанные на окислении. Уже при рассмотрении реак¬
ций алканов отмечалось, что, если действовать кислородом на алканы
СпНгп+2 при 100°С в присутствии солей марганца как катализатора
(берут обычно КМпС>4, который восстанавливается), получается смесь
кислот CmH2m+iCOOH, образующихся за счет разрыва цепи вследствие
окисления разных метиленовых звеньев.Кетоны окисляются по А. Н. Попову (стр. 133) энергичными окисли¬
телями (КМп04) в смесь карбоновых кислот.Альдегиды легко окисляются аммиачным раствором окиси серебра,
комплексными соединениями двухвалентной меди в щелочной среде,
например фелинговой жидкостью (щелочной раствор гидроокиси меди
в виннокислом натрии) и более энергичными окислителями в кислоты
с тем же числом углеродных атомов:оR—С—Н —► R—С—ОНПервичные спирты гладко окисляются через стадию альдегида (илинепосредственно) в кислоты с тем же числом углеродных атомог»;о оR—СН2ОН —»- R—С—Н —>- R—С—ОНII 20II II АО о*Эта реакция имеет специфическое значение в случае этилойого спирта. Винб —■
Слабый водный раствор спирта, содержащий также необходимые питательные веще¬
ства, — окисляется кислородом воздуха в процессе жизнедеятельности многих бакте¬
рий и грибков. Этим путем издавна готовили из вина уксус — слабые водные растворы
уксусной кислоты, используемые для пищевых целей. При фильтрации вина с досту¬
пам йоздуха через • слой древесных стружек, зараженный соответствующими микро¬
организмами, экзотермическое окисление вина в уксус совершается за один проход.
ОДНООСНОВНЫЕ ПРЕДЕЛЬНЫЕ КИСЛОТЫ155Чистые растворы этилового спирта, в отличие от вина той же концентрации, не про¬
кисают, так как отсутствуют необходимые для бактерий питательные вещества.Окисление любого первичного спирта в кислоту можно произвести
сильным окислителем, таким, как хромовая смесь.2. Способы, основанные на гидролизе. Любые соединения типа/ХR—С и R—С—Y, где X, Y и Z — атомы галоида, кислорода или
%0 \хазота (в последних двух случаях связанные с водородом или какими-,ОНлибо группами атомов), при гидролизе образуют кислоту R—С^ОПримеры:h2so4RCC13 + H20 »- R—+ЗНС1^ОНН+ или ОН- х?0RC=N + 2H20 >- R-C^ +NH3ХОНнятрнлкислоты/ОСИ* н+ X)R—С—ОСНз + 2Н20 —-*• R—+ЗСН3ОН
^ОСНз ОНортоэфнрr-c; +н2о —+• r-c; +hci
\ci \ОНхлорангидридВ первых трех реакциях следовало бы ожидать, что в результате^ОНгидролиза образуется соединение R—С—ОН, так называемая ортокис-\)Нлота. Однако даже два гидроксила у одного углерода удерживаются
лишь в исключительных случаях (см. стр. 128), а три гидроксила — ни¬
когда. В результате отщепления воды от ортокислоты образуется кар¬
боновая кислота: ./ОН оR—С—ОН —+• R—+Н20\он хонОсобо необходимо осветить родственные отношения муравьиной
кислоты, вскрываемые реакциями гидролиза:НСС1з + 4КОН —► Н—С—OK + ЗК.С1 + н2оIIон+HCN + 2Н20 -—* H—С—OH + NH,IIоСинильная кислота является,.таким образом, нитрилом муравьиной
кислоты.
156КАРБОНОВЫЕ КИСЛОТЫГидролиз нитрилов кислот имеет огромное значение как метод син¬
теза карбоновых кислот, поскольку нитрилы легко получать алкилиро-
ванием солей синильной кислоты:RCl + NaCN —>- RCN + NaClа при их гидролизе получаются кислоты, содержащие на один атом
углерода больше, чем исходный галоидный алкил:RCN + 2H20 —v RCOOH + NH;)Этот путь синтеза поэтому можно отнести также и к следующей
группе способов получения кислот.3. Способы с удлинением цепи углеродных атомов. При взаимодей¬
ствии окиси углерода под давлением 6—8 кгс/см2 при 120—130 °С с ед¬
кой щелочью или с алкоголятами металлов в первом случае образуется
соль муравьиной кислоты, во втором — ее гомологи:HONa + CO —v Н—С—ONaIIОRONa + CO —v R—С—ONaIIОПромышленное значение имеет только первая реакция, по которой
в настоящее время и производится вся муравьиная кислота.При действии двуокиси углерода на металлоорганические соедине¬
ния щелочных металлов, магния и алюминия получаются соли кислот,
содержащих на один атом углерода больше, чем алкильные группы взя¬
тых металлоорганических соединений:HCIRLi + С02 —>- R—С—OLi ► R—С—OH + LiClII IIО ОHCIRMgCl + С02 —v R—С—OMgCl >- R—С—ОН + MgCI2О оЭто один из важнейших лабораторных путей синтеза карбоновых
кислот.Важное промышленное значение получает синтез кислот (начиная
с пропионовой) действием на олефины окиси углерода и воды в присут¬
ствии карбонила никеля как катализатора (синтез Реппе):СН2=СН2 + СОNI(CO)4 н2о'Н2С—СН2
\ /СIIО-> СН3—СН2—С—ОНIIОВ 1958 г. Хааф и Кох открыли способ получения кислот действием
окиси углерода на олефины в концентрированном растворе серной кис¬
лоты. Смысл реакции состоит в алкилировании окиси углерода образую¬
щимся из олефина и иона водорода алкилкатионом (правило Марков¬
никова, см. стр. 248):+R—СН=СН2 + Н+ —v R-СН—СН3-СН—СНз + СО + Н—ОН —R—СН—СНзI +Н+о=с-он
ОДНООСНОВНЫЕ ПРЕДЕЛЬНЫЕ КИСЛОТЫ157В этих реакциях вместо окиси углерода можно применить муравьи¬
ную кислоту, которая с серной кислотой образует окись углерода, а сер¬
ную кислоту можно заменить фторсульфоновой или гидратом трехфто¬
ристого бора H+[HOBF3]~.4. Способы без изменения длины цепи углеродных атомов. Упомянем
о замечательной реакции Вильгеродта — превращении кетонов в кислоты
с тем же числом углеродных атомов, механизм которой не вполне ясен.
Кетон с любым, а не только a-положением карбонильной группы при
действии серы и аммиака (или амина) и последующем гидролизе дает
кислоту:СН3-(СН2)„-С-(СН2)тОСНз--СНз + s + NH3-н2оСН3-(СН2)т+„+1 С(СН2)т+„+,-С(XNH,2НгО(Н+)СН3—(СН,)т+,г+1 —СоXNH,+ H2S + NH3чОНВсе более важное значение приобретает перегруппировка а-хлорке-
тонов в кислоты под действием щелочи (А. Е. Фаворский):R—СНС1—С—СН2-
IIО-Rон"■R— НС СН—R-\ /СIIОнго(он_)R—СН2—СН—R
0=С—ОНХимические свойства карбоновых кислотНаиболее характерные и важные свойства карбоновых кислот свя¬
заны с превращением их в функциональные производные. Соответствую¬
щие реакции будут рассмотрены в разделе «Функциональные производ¬
ные карбоновых кислот» (стр. 158). Здесь же мы остановимся на осталь¬
ных химических превращениях кислот.1. При пиролизе солей щелочных металлов кислот в смеси с едкой
щелочью происходит декарбоксилирование и образование углеводоро¬
дов:СН3—С—ONa + NaOH —* СН4 + Na2C03IIОС2Н5 —С— ONa + NaOH —* C2HG + Na2C03ilО2. При пиролизе кальциевых солей кислот в отсутствие щелочи идет
образование кетона с частичным декарбоксилированием (реакция Пи-
риа);/СН3—С—0\ Са —> СН3-С-СН3 + СаС03и ДV О л о3. При электролизе натриевых солей кислот на аноде тоже происхо¬
дит декарбоксилирование аниона кислоты, и образовавшиеся радикалы
сдваиваются в углеводород (реакция Кольбе):СН3-С—О-—е —► СН3—С—О» —* СН3. + С02Ао о2СН3 • —> С2И6
158ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ4. Некоторые функциональные производные кислот могут быть вос¬
становлены в соответствующие альдегиды и первичные спирты. Наибо¬
лее простой путь восстановления кислоты в альдегид — это реакция. Ро-
зенмунда (см. стр. 127). Наиболее распространенный способ перехода
от кислоты к спирту (реакция Буво)—восстановление сложного эфира
карбоновой кислоты чистым (свободным от калия, В. В. Лонгинов) ме¬
таллическим натрием в абсолютном этиловом спирте:R— С—ОС2Н6 + ЗС2НбОН + 4Na —R—С—ОН + 4C2H5ONaII /\О н н5. Карбоновые кислоты хлорируются и бромируются подобно алка-
нам при облучении или в присутствии перекисных катализаторов, т. е.
свободнорадикально. Замещение происходит в различные положения;
в кислотах с длинной неразветвленной цепью оно идет в основном в
P-положение. Галоидангидриды кислот бромируются только в а-положе-
ние. По способу Геля — Фольгарда — Зелинского бромирование кислоты
ведут в присутствии трехбромистого или красного фосфора. При исполь¬
зовании трехбромистого (или пятибромистого) фосфора образуется
бромангидрид, который далее бромируется:+ Вгг(РВг5) 4- НгОR—СН2—С—Вг — R— СН—С—Вг > R—-СН—С—ОНII ~HBr I II -НВг I IIО Вг О Вг О6. Кислоты могут быть окислены Se02 по а-метиленовому звену
в а-кетонокислоты:R—СН2—С—ОН + Se02 —► R—С—С—ОН + Н20 + SeII .11 IIО О ООсобое место в ряду своих гомологов занимает первый член ряда —
муравьиная кислота. Уже структурная формула ее показывает, что на¬
ряду с карбоксилом (отчеркнутым пунктиром) в ней может
быть выделена альдегидная группа (сплошные линии). Как
0Н1 уже отмечалось, оксогруппа, примыкающая к гидроксилу,! теряет большую часть (см. стр. 152) своих типичныхнГ-с-IIсвойств, например способность к реакциям присоединения
и замещения, в частности — к полимеризации и конденса¬
ции. Однако эта «альдегидная» группа вполне сохраняет способность
легко окисляться даже слабыми окислителями, такими, как
Ag(NH3)2OH, фелингова жидкость и др.Н—С—ОН + 0 —► НО—С—ОН —► С02 + Н20II IIО ОФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ
КАРБОНОВЫХ КИСЛОТВ функциональных производных кислот произошло замещение в
карбоксильной группе. При этом могут быть замещены: кислотный водо¬
родный атом (на металл, алкил), гидроксил (на галоид, NH2-rpynny
и т. д.), карбонильный кислород, а также и гидроксил, и карбонильный
кислород..В первом случае (при замещении кислотного водорода) остаток кис¬
лоты имеет формулу R—С—О— и называется ацилатной группой илиО
СОЛИ КАРВОНОВЫХ кислот159)иногда ацилоксигруппдй; частные названия: Н—С—О— формиат,ОСН3—С—О— ацетат, СН3—СН2—С—О— пропионат, СН3-СН2-СН2-С-0-II II IIО О обутират и т. д. Во втором случае (при замещении гидроксила) остаток
R—С— носит название ацил; частные названия: Н—С— формил,II IIО ОСН3—С— ацетил, СН3—СН2—С— пропионил, СН3—СН2—СН2—С—II II IIО О обутирил и т. д. (от латинских названий кислот).СОЛИ КАРБОНОВЫХ КИСЛОТПри нейтрализации карбоновых кислот щелочью образуются соли.
В водном растворе соли щелочных металлов значительно гидролизуются.
Константа гидролитического равновесия равна отношению константы
диссоциации воды к константе диссоциации кислоты.Натриевые соли высших жирных кислот (например, стеариновой
С17Н35СООН), получаемые действием щелочи на растительные и живот¬
ные жиры (этот процесс осуществляется в мыловарении), называются
мылами. Отсюда реакции гидролиза сложных эфиров получили назва¬
ние омыление.Мыла являются наиболее давно вошедшими в быт и технику поверхностно-актив¬
ными веществами. Их действие как поверхностно-активных и, в частности, моющих
веществ состоит в следующем. Соли карбоновых кислот в водном растворе диссо¬
циируют на ионы:R—С—ON а «=£ R—С—О' + Na+Если анион мал (R = Н, СНз, С2Н5, СзН?), то он нормально растворяется вводе,
хотя это и происходит за счет сольватации только карбоксильной части аниона. Если
же R — длинная углеводородная цепь, например С15Н31, С17Н36 и т. п., то такой
остаток, как и углеводороды, нерастворим в воде (гидрофобен), в то время как карб¬
оксильная часть аниона сохраняет свою гидрофильность. В силу этой противополож¬
ности молекулы мыла концентрируются на поверхности воды, покрывая последнюю
слоем, в котором карбоксил-анионы погружены в воду, а жирные радикалы обращены
к поверхности. Если на воду налить слой углеводорода или масла, жирные радикалы
растворятся в нем и все молекулы мыла будут стремиться разместиться на поверх¬
ности раздела. При этом поверхностное натяжение, являющееся мерой сил, стремя¬
щихся сократить поверхность, резко уменьшится. Поверхность раздела возрастет, что
может быть достигнуто лишь распределением одной жидкости в другой капельками
(эмульгирование). При добавлении мыла к смеси воды и несмешивающейся с ней
органической жидкости образуются стабильные эмульсин, что широко применяется
в разных областях народного хозяйства. Таким способом готовят, например, эмульсии
высших углеводородов нефтяных фракций для борьбы с вредителями садов. Поскольку
загрязнения на теле и белье являются в основном жировыми загрязнениями, нерас¬
творимыми в воде, водой они не отмываются, ио при эмульгировании жира в мыльной
воде уносятся с струей воды.В более концентрированных растворах мыл все молекулы не могут разместиться
в поверхностном слое и частично распределяются также и в объеме. В этом случае
гидрофобиость радикалов заставляет их складываться в пачки по многу единиц в каж¬
дой; образуется коллоидный раствор, рассеивающий проходящий через него луч
света (явление Тиндаля). Из таких коллоидных растворов поваренная соль «высали¬
вает» твердое мыло. Поэтому для мытья в морской воде обычные мыла не пригодны
и приходится употреблять иные поверхиостио-активные вещества (например, соли
сульфокислот).Кальциевые соли высших жирных кислот мало растворимы в воде, поэтому
в жесткой воде мыло дает осадок и не выполняет своей функции.
160ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТКалиевые соли высших жирных кислот хорошо растворимы в воде и образуют
жидкие, так называемые зеленые мыла. Это — концентрированные водные растворы
(отсюда жидкие) калиевых солей, подкрашенные зеленой краской.Известны многочисленные соли низших и высших жирных кислот
с тяжелыми металлами. Во многих случаях они не имеют столь ярко
выраженного, как соли щелочных металлов, ионного характера и обра¬
зуют с металлом связь хотя и поляризованную, но ковалентную. Так,
ацетат двухвалентной меди окрашен не в сине-голубой цвет, присущий
иону этого металла, а в интенсивный сине-зеленый цвет.Марганцовые и некоторые другие соли высших жирных кислот при¬
меняются как инициаторы окислительных процессов и полимеризации
(например, «высыхания» олиф) и называются сиккативами.СЛОЖНЫЕ ЭФИРЫ КАРБОНОВЫХ КИСЛОТДля получения сложных эфиров используются следующие реакции.1. Этерификация кислот спиртами:R—С—OH + R'OH *=>: R—С—0R' + H20ООРеакция катализируется ионом водорода. Опыты с кислотой, мечен¬
ной 180, показывают, что гидроксил кислоты выделяется в виде воды
Н2180, а спирт отдает лишь свой водород. Реакция этерификации обра¬
тима и ион водорода катализирует также обратную реакцию — гидролиз
сложного эфира.Роль водородного иона можно представить себе следующим обра¬
зом:ОII , +R-C-O-R +Н,0 + НО Нт '
R-C-^O-R'СоУ \
н ноR—С + O-R + Н+IО\нВ квадратных скобках показан реакционный комплекс (переходное
состояние). Кривые стрелки показывают направление смещения электро¬
нов, начавшееся в реакционном комплексе и завершаемое в конечных
продуктах реакции. Такой механизм подсказывается результатами гид¬
ролиза сложного эфира, меченного тяжелым кислородом в сложноэфир¬
ной группе:н2оR—С—,80—R' ► R—С—ОН + R'—180—НООДля уяснения роли иона водорода в реакции этерификации следует
прочесть уравнение справа налево.Гидролиз эфира катализируется и ионами гидроксила:ОR—с—О—R' + "ОНЯR--С-т-О—RI ^ОН0II-с1он+ ~or'оII-с 4- HOR'О
СЛОЖНЫЕ ЭФИРЫ КАРБОНОВЫХ КИСЛОТ161Скорость реакции этерификации наибольшая для первичных спир¬
тов. Сложные эфиры третичных спиртов и карбоновых кислот прямой
этерификацией получить нельзя.2. Взаимодействие ангидридов кислот (стр. 167) со спиртами:R-C:R—СОО + R'OHОR—С—OR' + R-С—ОНII IIО О3. Взаимодействие галоидангидридов кислот (стр. 166) со спир¬
тами:R—С—Cl + R'OH —> R—С—OR' + HClООФизические свойства некоторых сложных эфиров приведены в
табл. 16.Таблица 16. Сложные эфиры гомологов муравьиной кислотыФормулаRНазваниеТемператураплавления,°СТемпературакипения,°СПлотностьdl°4HCOORСНзМетилформиат—99,031,50,975C2H5Этилформиат-80,554,30,917CH3COORСНзМетилацетат-98,157,10,924с2н5Этилацетат—83,677,10,901W-C3H7м-Пропил ацетат-92,5101,60,887ЮW”C4Hgн-Бутилацетат-76,8126,50,882(оизо-С6НцИзоамилацетат—78,5142,50,870c2h5coorСН3Метилпропиоиат—87,579,90,915С2Н5Этилпропионат-73,999,10,888c3h7coorСНзМетилбутират< —95,0102,30,898С2н5Этилбутират-93,3121,30,879«-c4h9coorСНзМетилвалерат-91,0127,30,910
(при 0 °С)с2н5Этилвалерат-91,2146,00,874Сложные эфиры низших карбоновых кислот и простейших спир¬
тов— жидкости с освежающим фруктовым запахом. Они употребляются
для отдушки напитков. Многие эфиры (уксусноэтиловый, уксуснобутило¬
вый, уксусноизоамиловый) широко применяются в технике как раствори¬
тели, особенно для лаков.Из химических свойств сложных эфиров упомянем способность их
к переэтерификации спиртами в кислой среде:О ОII X IIR—С—О—R' + R"OH 3=^ R—С-OR" + R'OHМеханизм этой реакции, очевидно, тот же, что и реакции кислотного
гидролиза.
162ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТС ^риньярбвым реактиййм слбжные эфиры ббразуют третичные
спирты:R—С—OR' + 2R"MgBr —»- R—С—OMgBr + R'—OMgBr
II / \О R" R"Jh,oR-C—ОН /ОН
/ \ + Mg(
R" R" \BrЖиры представляют еббой сложные эфиры глицерина и гбмологов
уксусной кислоты, начиная с масляной и до стеариновой (и выше).
В природных жирах содержатся кислоты только с четным числом угле¬
родных атомов. Кроме того, в жирах (больше в жидких, чем в твердых)
Находятся непредельные жирные кислоты с тем же числом углеродных
атомов, в цепи которых имеются от одной до трех двойных связей
(стр. 308). Строение предельных жиров следующее;СдН2л+,—С—О—СНзО
с„н2„+1-с—О—сн
оС„Н2л+1—С—О—(JlHa
1>где п — нечетное число. В одной молекуле жира могут быть и разные
остатки кислот.Сложные эфиры глицерина называются глицеридами. Жир быка
содержит много глицерида стеариновой кислоты («=17, тристеарин);
жиры барана и человека, а также кокосовое масло — глицерид пальми¬
тиновой кислоты (п =з 15, трипальмитин); коровье масло (сливочное или
топленое) содержит наряду с указанными глицеридами и глицериды
масляной и промежуточных между ней и пальмитиновой кислот с чет¬
ным числом углеродных атомов.Жидкие жиры и высыхающие масла будут рассмотрены в разделе,
посвященном непредельным кислотам.Жиры гидролизуют щелочью с целью получения мыл. Подвергнутый гидролизу
(омыленный) раствор по охлаждении застывает, причем в нем остается весь глицерин
(«глицериновое мыло»). По другому способу этот раствор насыщают поваренной
солью (высаливают); при этом выделяются твердые комки мыла, получается так
называемое ядровое мыло.При гидролизе жиров перегретым водяным паром получают нерастворимую
в воде смесь жирных кислот (в виде расплава) и водный раствор глицерина, который
концентрируют, отгоняя воду. Полученную таким путем смесь высших жирных кислот
раньше использовали для производства «стеариновых» свечей.ОРТОЭФИРЫ кислотАлкильные производные несуществующих ортоформ карбоновых
/ОНкислот R—С—ОН носят название ортоэфиров. Их получают следую-\энщими путями.
ОРТОЭФИРЫ кислот1631. Нагревание 1,1,1-трихлоралканов RCCU, не имеющих при а-углё-
роде атомов водорода, с алкоголятом натрия:/OR'RCCI3 + 3NaOR' —> R—С—OR' + 3NaCl''"•OR'Из хлороформа таким способом получают ортомуравьиный эфир;/ОСНзНСС13 + 3NaOCH3 —»- Н—С—ОСН3NxHaЕсли у а-углерода имеется атом водорода, то при действии алкого¬
лята произойдет отщепление НС1:R—СН2— СС13 + NaOR' —► R—СН=СС12 + NaCl + R'OH2. Действие на нитрилы кислот хлористого водорода и избытка
спирта:HCI R'OH 2R'OH + HC!R_C==N ► R—C=NH ► R—C=NH ►ClOR'OR'—*■ R—C—OR' + NH4CI
\0R'Физические свойства некоторых ортоэфиров приведены в табл. 17.
Таблица 17. Эфиры ортокарбоиовых хислотФормулеНазваниеТемпера¬тураплавле¬ния,°СТемпера¬туракипения,°СПлотностьdНС(ОСНз)зТриметиловый эфир ортомуравьииой
кислоты—1050,974
(при 23°С)НС(ОС2Н5)3Триэтиловый эфир ортомуравьииой
кислоты—76,1145,90,897ЮСНзС(ОСНз)зТриметиловый эфир ортоуксусиой
кислоты—1090,9437W)СНзС(ОС2Н6)зТриэтиловый эфир ортоуксуеной
кислоты■ ■1420,885юС(ОСНз),Тетраметиловый эфир ортоугольиой
кислоты—5,51141,0232№)C(Ot2H8)4Тетраэтиловый эфир ортоугольиой
кислоты1590,919(ОС(ОС3Н7)4Тетрапропиловый эфир ортоуголь-
ной кислоты224,20,911
(при 8°С)Ортоэфиры гидролизуются по стадиям: сначала образуется сложный
эфир, затем последний дает кислоту и спирт:/OR н+R_C—0R' + H20 —►
^OR'н*r-с; + н2о _н
^OR'r—с:\оOR'+ 2R'OHОR-C" + R'OH\он
164ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТГАЛОИДАНГИДРИДЫ кислотНаиболее важным и изученным классом этих соединений являются
хлорангидриды. Их обычно получают из кислот по одной из следующих
реакций:R—С—ОН + РСЦ —> R—С—Cl + HCl + РОС13 (1)II IIО ОR-C-OH + PCla —> R—С—Cl + Р(ОН)3 + HCl (la)О ОR—С—ОН + SOCl2 —>- R—С—Cl + HCl + S02 (2)II IIО охлористыйтионил2R— С—ONa + S02C12 —> R-C—Cl + Na2S04 (3)II IIО охлористыйсульфурилR—С—ОН + СОС12 —> R—С—Cl + НС1 + С02 (4)II IIО офосгенДля лабораторного синтеза пользуются главным образом реакциями
(1), (2) и (1а), а в технике их получают по реакциям (3) и (4). Бром-
ангидриды готовят по реакции типа (1а), таким же образом синтезируют
малоустойчивые иодангидриды.Фторангидриды синтезируют обменом на фтор галоида в хлоран-
гидридах, действуя на них KHF2:R—С—C1+KHF2 —»- R—С—F + KC1 + HFII IIО оМожно получить фторангидрид более низкокипящей кислоты, рас¬
творяя в ней KF или KHF2 и действуя хлорангидридом более высоко-
кипящей кислоты. Обмен гидроксила кислоты на хлор хлорангидрида
идет легко:R—С—ОН + R'—С—Cl —> R-C—Cl + R'-C—ОНII II II IIО О О оТак был получен и фтористый формил HCOF, первый известный,
впрочем малоустойчивый, галоидангидрид муравьиной кислоты
(А. Н. Несмеянов и Э. И. Кан). Остальные галоидангидриды этой кис¬
лоты разлагаются в момент образования:Н—С—С1 —► НС1 + СОIIОТолько в 1963 г. Штааб сообщил о получении при — 60 °С хлори¬
стого формила действием хлористого водорода в хлороформе на формил-
имидазол:N=CH N=CHС-II I-HCl —>- H-C-Ci f ^NHII 11CH=-CH о о сн=сн
1'АЛОИДАНГИДРИДЫ КИСЛОТПри —60°С хлористый формил существует в растворе в течение
нескольких часов, но выделить его не удалось.В табл. 18 приведены физические свойства некоторых простейших
галоидангидридов кислот.Таблица 1S. Галоидангидриды карбоновых кислотФормулаНазваниеТемпера¬тураплавле¬ния,°СТемпера¬туракипения,°СПлот¬ность.20d4HCOFФтористый формил——26
(при
750 мм
рт. ст.)1,60
(при
—26 °С)CH3COFФтористый ацетил<-6020,50,993СН3СОС1Хлористый ацетил— 112521,105СНзСОВгБромистый ацетил-96,576,71,663ДО)СН3С01Йодистый ацетил—1062,067СН3СН2СОС1Хлористый пропионил-94801,065СН3СН2СН2СОС1Хлористый к-бутирил-891021,028(СН3)2СНСОС1Хлористый изобутирил-90921,017СН3СН2СН2СН2СОС1Хлористый к-валерил-1101281,016
(при
15 °С)(СН3)2СНСН2СОС1Хлористый изовалерил—114,50,989Коэффи¬циентпреломле¬ния„20D1,38971,4537(при16°С)1,54911,40511,41211,40791,41551,4149В галоидангидридах кислот галоид чрезвычайно подвижен, т. е.
легко вступает в реакции обмена. В этом отношении все галоиды ведут
себя примерно одинаково. Причина подвижности галоида — значитель¬
ный частичный положительный заряд (6+) на углероде, связанном
тремя своими валентностями с сильноэлектроотрицательными атомами
(кислород и хлор), и в результате — доступность углеродного атома для
нуклеофильной атаки.Фторангидриды кислот реагируют с BF3 — одной из сильнейших
кислот Льюиса, особенно прочно захватывающей ион фтора, с образова¬
нием устойчивого комплексного аниона BFI. При этом образуются соле¬
образные твердые вещества (Зеель):R--C-FIIО+ BF,R-+ о.-с=оbf4‘Эти вещества имеют резко выраженные ацилирующие свойства. Сле¬
дует думать, что в катионе к положительно заряженному углероду ча¬
стично оттягивается свободная пара электронов кислорода, в результате
чего положительный заряд распределяется между углеродом и кисло¬
родом.Истинная средняя структура ацилиевого катиона может быть выра¬
жена при помощи двух крайних (предельных) структур:R—с=0R—С=0Приводимые в качестве примера реакции галоидных ацилов быстро
или даже бурно проходят при комнатной температуре. В этих реакциях
166ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТгалоидный ацил йцилируё+ реагирующую с ним молёкулу, т. е. вводит
в нее (на место водорода) ацил:О оII IIСНз—с—С1 + Н20 —► СНз—С—ОН + НС1(гидролиз хлорангидрида, или ацетилирование воды)о оII . IIСНз—С—С1 + СгН5ОН —> СНз—С—ОС2Н5 + HCI
(алкоголиз хлорангидрида, или ацетилирование этанола)О оII IIСНз-C—Cl + 2NH3 —> СН3-С—NH* + NH4C1(аммоиоли» хлорангидрида. или ацетилирование аммиака)О оII JН—С—F + СНзОН —► Н—С—OCH3 + HF(алкоголиз фторангидрида, или формилироваиие метанола)С другими примерами ацилйрования мы встретимся при рассмотре¬
нии других функциональных производных кислот.АНГИДРИДЫ кислотАнгидриды кислбт можно рассматривать как продукты дёгйдр&та-
ции двух мОлёкул кислоты:R— С—OSHII 1R—С—О—С—RR—С—!он -Hs°д i 00В случае некоторых двухосновных кислот такая реакция осущест¬
вима при нагревании, но в ряду гомологов уксусной кислоты ангидриды
можно получить лишь дегидратацией посредством Р2О5. Ангидрид
муравьиной кислоты вообще не существует.Ангидриды получают аЦилированием хлорангидридами солей кис¬
лот; ...R—С—С1 + NaO—C—R' —► R—С—О—С—R' + NaC!II II 1 II0 0 0 0При этом R и R' могут быть Одинаковыми или разными. В послед¬
нем случае получаются смешанные ангидриды двух кислот. Особенно
большое значение имеют смешанные ангидриды трифторуксусной кис¬
лотыR—С—О—С—CF3Л Аявляющиеся сильнейшими ацилирующими средствами (с их помощькЬ
вводят ацильную группу).На реакции солей кислот с их хлорангидридами основан ранее при¬
менявшийся в промышленности способ получения уксусного ангидрида.
Хлорангидрид не выделяли, а получали непосредственно в реакционной
среде действием S02C12 или С0С12 на уксуснокислый натрий. Вторая
молекула уксуснокислого натрия дает с образовавшимся хлористым
ацетилом уксусный ангидрид,
АНГИДРИДЫ кислотФизические свойства некоторых ангидридов кислот приведены в
табл. 19.Таблица 19. Ангидриды карбоновых кислотФормулаНазваниеангидридаТемпера¬тураплавле¬ния,°СТемпературакипения,°СПлот¬
ность
j 20
d4Коэффициентпреломления„20nD(СНзСОЬОУксусный—73,11401,0871,3904(С2Н6С0)20Пропноновый—45169,31,03361,4038(н-С 3НтСО)гОМасляный—75,0198; 2010,99461,4070(«-С4Н9С0)20Валериановый—56,12150,92901,4171(С8Н„С0)20Капроновый—40,6243; 2540,92791,4297(С6Н13С0)20Энантовый• 17173(при 15 мм рт. ст.)0,93201,4312(«-С17Н36С0)20Стеариновый71,50,83681,4362
(при 80°С)Уксусный ангидрид — жидкость, кипящая при 140°С и обладающая
крайне неприятным резким запахом. Этот продукт широко применяют
в технике, в разнообразных процессах ацетилирования (целлюлозы, фе¬
нолов, ароматических аминов и др.). Его предпочитают хлорангидриду,
который имеет слишком низкую температуру кипения и крайне агресси¬
вен, а потому менее удобен в заводских условиях.Современным способом получения уксусного ангидрида, приобре¬
тающим все большее значение, является действие кетена (стр. 301) на
безводную («ледяную») уксусную кислоту:О 0 0I! I! IIСНз—С—ОН + СН2=С=0 —> СНз—с—о—с—сн3кетенСам кетен — своеобразный ангидрид кислоты, который, в частности, можно по¬
лучить пиролизом уксусной кислоты:ОIIСНз-С-ОН СН2=С=~0Как видно из этой реакции, кетен сам является ацетилирующим
агентом. Действительно, его можно применять взамен уксусного ангид¬
рида или хлористого ацетила в реакциях ацетилирования, но неудобство
состоит в том, что он газообразен, быстро димеризуется и поэтому его
нельзя хранить; образующийся из него уксусный ангидрид лишен этих,
недостатков.Ацилирование ангидридами можно характеризовать реакциями,
аналогичными приведенным выше в качестве примеров ацилирования
хлорангидридами (гидролиз, алкоголиз, аммонолиз):R—C—0—С—R + Н20 —► 2R—С—ОН
168ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТНевыгодность применения ангидрида состоит в том, что половина
его молекулы не ацилирует, а возвращается в виде кислоты.АМИДЫ КИСЛОТТолько что была приведена реакция ацилирования аммиака ангид¬
ридом кислоты, а выше — аналогичная реакция с хлорангидридом.
Продуктом ацилирования в обоих случаях является амид кислотыR-<° .xnh2Ацилировать аммиак можно даже таким слабо ацилирующим аген¬
том, как сложный эфир:R—С—ОС2Н5‘+ NH3 —> R-C—NHj + CjHgOHII IIО ОПо отношению к сложному эфиру реакция эта называется аммоно-
лизом.При взаимодействии кислоты с аммиаком сначала, естественно, по¬
лучается аммониевая сольR—С—ОН + NH3 —► R—С—O' NH*II IIО Окоторая при нагревании (сухая перегонка) теряет воду, превращаясь
в амид:R—С—O' NH4 —>- R—С—NH2 + Н,0II IIО ОЭто важная реакция, используемая для промышленного получения
амидов.Физические свойства некоторых амидов приведены в табл. 20. Низ¬
шие амиды хорошо растворимы в воде. Простейший амид — формамид
HCONH2 — единственный из амидов, жидкий при комнатной темпера¬
туре, обладает высокой диэлектрической проницаемостью. Его получают,
действуя на аммиак окисью углерода в присутствии малых количеств
алкоголята натрия:CO + NH3 —► Н—С—NH2IIОСледующий представитель этого ряда — ацетамид CH3CONH2 яв¬
ляется кристаллическим веществом с т. пл. 81 °С.При ацилировании алкилированных аммиаков — аминов, например
CH3NH2 или (CH3)2NH, получаются алкил- и диалкиламиды:R—С—Cl + 2CH3NH2 —v R-C—NHCH3 + CH3NH3 СГII IIО оR-C—Cl + 2(CH3)2NH — ► R—С— N(CHs)2 + (CH3)2NH2 С Го о
НИТРИЛЫ кислот169Таблица 20. Амиды кислотФормулаНазваниеТемпера¬тураплавле¬ния,°СТемпературакипения,°СПлот¬ность«ГКоэффи¬циентпреломле¬нияПВРастворимость
в воде,
г/100 млHCONH2Формамид2,55195
(при 10 мм
рт. ст.)1,1341,4453
(при
22,7 °С)Очень хорошо
растворимCH3CONH2Ацетамид812221,1591,4274
(при
78,3 °С)97,5
(при 20 °С)c2h5conh2Пропион-амид792131,0421,4161
(при
108 °С)Растворимn-C3H7CONH2я-Бутир-амид1162161,0321,4087
(при
130 °С)16,28
(при 15 °С)n-C4H9CONH2я-Валер-амид1161,0231,4183(при110°С)' Растворимn-C5H„CONH2я-Капр-амид101,02550,9991,4200
(при
110 °С)Очень слабо
растворимh-C17H35CONH2и-Стеар-амид109251
(при 12 мм
рт. ст.)Нерастворим(CH3CO)2NHДиацет-имид78223,5РастворимФормамид и его диалкильное производное — диметилформамид
HCON(CH3)2 служат промышленными растворителями. Особенно они
применимы в производстве синтетических волокон. Диметилформамид —
апротонный растворитель (апротонными называются вещества, неспо¬
собные отщеплять протон).Амиды почти лишены основных свойств аммиака и в водной среде+практически нейтральны. Сопряженная кислота адетамида СН3—С—NH3IIОимеет в водном растворе р/Са ~ 1,5.При нагревании с водным раствором кислот или щелочей амиды
гидролизуются, образуя кислоту (или соль) и аммиак:R—С—NH2 + Н20 —* R—С—O' NH4Эта реакция — обратная дегидратации аммониевой соли, приводя¬
щей к получению амида.НИТРИЛЫ кислотНитрилы карбоновых кислот получают алкилированием солей си¬
нильной кислоты:RC1 + NaCN —* R—C=N + NaClДругой путь их получения — обезвоживание амидов посредством
фосфорного ангидрида или каталитическим путем. Таким образом
170ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТнитрилы можно получить из аммониевых солей кислот дегидратацией
в две стадии:+ пиролиз
R—С—О" NH4 ——*• R—С—NHaII “Н2° IIо о2R-C—NH2 + Р206 —-*• 2R—OsN + 2НР03 + Н20IIОВместо пятиокиси фосфора применяются и другие водоотнимающие
средства, например пятихлористый фосфор, а в некоторых случаях даже
уксусный ангидрид. Эти реакции проводят обычно при повышенных тем¬
пературах, что снижает выход и удобно не для всех амидов. В 1970 г.
предложен метод получения нитрилов действием четыреххлористого ти¬
тана на амиды кислот в тетрагидрофуране. Хорошие выходы получаются
даже при 0°С.Нитрил муравьиной кислоты — это синильная кислота. Обезвоживая
формамид, действительно получают синильную кислоту. Однако в на¬
стоящее время наиболее важным промышленным способом получения,
синильной кислоты является процесс Андрусова — пиролиз смеси метана
и аммиака с недостаточным количеством кислорода:СН4 + NH3 + 3/202 —»■ HCN + ЗН20Физические свойства некоторых нитрилов кислот приведены в
табл. 21.Таблица 21. Нитрилы карбоновых кислотТемпера¬КоэффициенттураТемператураПлотностьФормулаНазваниеплавле¬кипения,d20преломленияния,“С“С*nDHCNФормонитрил, или
синильная кислота-14,0126,00,6871,2675
(при 10°С)СН3—CNАцетонитрил-44,082,00,7831,3459
(при 16,5 °С)С2Н6—CNПропионитрнл-91,997,10,783ю1,3688
(при 14,6 °С)н-С3Н7—CNБутиронитрил—112,6118,00,796
(прн 15 °С)1,3816
(при 24 °С)СНзч;сн—cnСНз-7Изобутиронитрил-71,5108,00,7731,3720w-C4H8—CNВалеронитрил-96,0141,00,8011,3909
(при 20°С)С15Н31—CNПальмитонитрил31,0' 3330,8301,4450С,еН33—CNМаргаронитрил35,53490,8311,4467С17Н35—CNСтеароннтрил43,03620,8321,4481СНзчС—CNНитрнл трнметил-16,0106,0СН3/1уксусной кнслотысн3‘ Нитрилы кислот почти лишены основных свойств. Сопряженнаяс ацетонитрилом кислота (СНз—CsN—Н) имеет в водном растворе
рЛа = 10, а в неводных растворителях 4,2. Таким образом, нитрилы еще
гораздо более слабые основания; чем амиды.
щщнцщ171Важнейшей реакцией нитрилов является гидролиз, осуществляемый
действием воды при нагревании в кислой или щелочной среде и идущий
медленнее, чем для всех других функциональных производных кислот.
Гидролиз идет в две стадии и представляет собой обращение разобран¬
ных выше двух стадий дегидратации аммониевых флей кислот;н+R—C=N + Н20 ► R—С—NH2и+R— С—NH2 + Н20 ► R-C—0~ NH4IОНитрилы присоединяют также НС1 (аналогично присоединению
воды на первой стади гидратации)R— C=N + HC1 —> R—C==NHобразуя имидхлориды кислот —аналоги хлорангидридов- При действии
спиртов на имидхлоридыR—C=NH + R'OH —► R—C=NH 'I ICl OR'получаются иминоэфиры — аналоги сложных эфиров. Их можно полу¬
чать, пропуская НС1 в раствор нитрила в спирте.Алкилированием нитрилов солями третичных оксониев (см. стр. 119)
получаются алкилнитрилиевые соли (Меервейн);R— C=N + (CH3)3OBF* —> [R—C=N—CHj]BF; + (CH3)20АМИДИНЫПри действии аммиака на имидхлориды кислот получаются ами¬
дины кислот (обычно их называют просто амидинами):R—C=NH + 2NH3 —> R-C=NH + NH4C1di i!h2Реакция аналогична ацилированию аммиака хлорангидридами кис¬
лот. Сами амидины формально аналогичны кислотам (аммиак—аналог
воды);R-C' r-c; R-c;хон xnh2 xnh2кислота амид амидинОднако, в отличие от карбоновых кислот, обладающих сравни¬
тельно слабыми кислотными свойствами, и очень слабо основных амидов,
амидины — сильные основания (объяснение этому см. в разделе «При¬
чины кислотных свойств карбоновых кислот», стр. 173).Как и все функциональные производные карбоновых кислот, ами¬
дины гидролизуются в кислоты.
172ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТГИДРАЗИДЫ КИСЛОТАцилирование гидразина приводит к образованию гидразидов кис¬
лотR—С—OR + NH2—NH2 —* R—С—NH—NH2 + ROHII IIО , окоторые при действии азотистой кислоты дают азиды кислот:R—С—NH— NHj + HNOa —> R—С—N=N=N» До оАзиды представляют собой ацилированную азотистоводородную кис¬
лоту. Действительно, ацилирование азидов металлов также приводит
к азидам кислотR—С—Cl + NaN3 —> R—С—N=N=NII IIО оа гидролиз азидов дает карбоновую и азотистоводородную кислоты:
R—С—N=N=N + Н20 —> R-C—OH + HN3ОАзотистоводородная кислота так и была впервые получена.Присоединение натриевого производного гидразина к нитрилам
кислот с последующим гидролизом аддукта приводит к амидразонам
кислот:>NNa Н20 .NHr—c==N + NaNH—NH2 —> R—С' >■ R—СГ ч=^xnhnh2 \nhnh2/NH3
4=fc R-C^^N—NHaГИДРОКСАМОВЫЕ КИСЛОТЫАцилирование гидроксиламина приводит к образованию гидрокса-
мовых кислот:R—С—С1 + NH2OH —> R—С—NHOH + HC1II IIо оЭти производные гидроксиламина могут реагировать как слабые
кислоты в двух изомерных (таутомерных) формах:R—С—NHOH R—C=NOHII Iо онВсе кислородные и азотистые функциональные производные кислот
связаны между собой превращениями такого рода, что гидролиз ведет
к кислородсодержащим производным и в конечнем счете к карбоновой
кислоте, а аммонолиз — к азотсодержащим производным, в конечном
счете к амидину.
ПРИЧИНЫ КИСЛОТНЫХ СВОЙСТВ КАРБОНОВЫХ кислот173По легкости прохождения реакции гидролиза простейшие произ¬
водные располагаются в следующий ряд:R—С—С1 > R—С—О—С—R > R-C—OR > R—С—NH2 > R— C=NI! II II II IIО ООО оПРИЧИНЫ кислотных СВОЙСТВ КАРБОНОВЫХ кислот.ПОНЯТИЕ О МЕЗОМЕРИИ *Электролитическую диссоциацию натриевой соли карбоновой кис¬
лоты часто схематически изображают так:R—С—ONa *==£ R—С—О" + Na+II IIО ООднако на самом деле оба кислорода в анионе связаны с углеродом
совершенно одинаково и оба они, а не один из них, несут поровну (по
половине) заряд аниона. Подобным образом в анионе угольной, кислоты
в растворе соды или в кристалле кальцита, построенном из ионов Са2+
и СОз~, все три кислородных атома, как показывают рентгеноструктур¬
ные исследования, находятся на совершенно одинаковых расстояниях от
углеродного атома, а направления от центра С к центрам О лежат в од¬
ной плоскости под одинаковыми углами 120°, т. е. анион обладает осью
симметрии третьего порядка. Это было бы невозможно, если бы все
кислороды не несли равных зарядов и не были связаны с углеродом
одинаково.Между тем на том основании, что недиссоциированному карбонату
принадлежит структура А, ион СОГ часто изображают несимметрич¬
ной формулой В:/0=С 0=СО хО*вНа деле после диссоциации и в анионе карбоновой кислоты и в кар¬
бонат-анионе происходит выравнивание зарядов и связей, что можно
выразить (принимая символику английской школы Робинсона — Ин-
голда) следующим образом:a nj? о*- ,R—С. Очто означает р—/3q — qО- СГ Хо‘/2~ \ 1/з-ОИзогнутыми стрелками изображен сдвиг свободных электронных
пар кислородного атома, несущего заряд, и электронных пар двойной
связи в направлении стрелки вплоть до полного выравнивания зарядов
и достижения одинаковости всех связей атомов С и О.Другой способ выражения того же явления состоит в том, что
пишут все крайние («канонические») структуры и соединяют их* Более строгое изложение концепции мезомерии — резонанса будет дано на
стр. 234.
174ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ кислотвнаком обозначая этим, что истинная структуру лежит где-то по¬
середине (символика американской школы Полинга):/°:R— с; «-> R-cf
\г NoА/° /° -
о=с ч-> о—с -<-> о—с;
\о_ ^сгвИ та и другая символика, кроме равномерного распределения за¬
ряда, выражает и промежуточное состояние связей между С и О; эти
связи не двойные и не ординарные, а могут быть выражены дробью:
в системе А — 1 !/г; в системе В — 1 '/з-В этих случаях говорят о мезомерии (английская и немецкая
школы) или резонансе (американская щкола). Такое выравнивание свя¬
зей и растекание электронов сопровождается понижением энергии об¬
разования молекулы' по сравнению с энергией образования гипотетиче¬
ской молекулы, изображаемой крайними структурами (на языке аме¬
риканской школы) или формулой (в символике английской школы) без
изогнутых стрелок. Действительно, поскольку энергия образования мо¬
лекулы— аддитивная величина, складывающаяся из энергии образова¬
ния связей каждого типа, ее можно для гипотетической молекулы рас¬
считать, а для реальной молекулы определить термохимически (напри¬
мер, из теплоты сгорания). Разница между этими двумя величинами
называется энергией резонанса. Она характеризует повышенную: устой¬
чивость такой выровненной (или «резонирующей») молекулы по срав¬
нению с гипотетической, невыровненной.Следовательно, по сути дела, мезомерию или резонанс лишь с на¬
тяжкой можно назвать явлением. Ведь там, где возможно выравнивание
(мезомерия, или резонанс), оно неизбежно уж£ произошло и гипотети¬
ческая невыровненная форма — только абстракция. Впрочем, поскольку
производные этой невыровненной формы существуют в невыровненном
состоянии, например в случае разбираемых нами карбоксилат- и карбо¬
нат-анионов— в эфирах>> снаочR—и ;с=о'ОСН3 СН3о/можно говорить о перераспределении электронов и выравнивании свя¬
зей в момент гидролиза сложного эфира щелочью с образованием
аниона. При гидролизе действительно совершается перераспределение
электронов и преобразование связей — процесс их выравнивания:СЪR-C^° + н20 R-C^_ + СНзОН'''ОСНз оСНзО^ • он“ Г>^С=0 + Н20 £VX—О + 2СН3ОНСН3 О 0Если отвлечься от такого рода процессов, то мезомерия или резонанс
явятся способами изображения выровненных структур через невыровнен¬
ные, гипотетические, имеющие, впрочем, множество реально существую¬
щих производных.
ПРИЧИНИ кислотных СВОЙСТВ КАРБОНОВЫХ кислот175Обеднение энергией при переходе к выровненным структурам (ко¬
торое называют энергией резонанса) и является движущей силой мно¬
гих процессов, ведущих к образованию мезомерных молекул. В этом
же причина кислотных свойств карбоновых кислот.При превращении молекулы кислоты в пару ионов выравнивание
электронной плотности в анионе сопровождается обеднением энергии,
т. е. «выигрышем энергии резонанса» (разумеется, уменьшенным на
энергию гетеролитического разрыва О—Н-связи и увеличенным на энер¬
гию сольватации катиона и аниона, раз процесс происходит в раство¬
рителе). Это стимулирует отрыв протона, т. е. проявление кислотных
свойств:Q)—► R-С^П + Н+Т>Н ХСГ• Наиболее полное выравнивание (наиболее полное проявление ме-
зомерии или резонанса) с наибольшим «выигрышем энергии» происхо¬
дит при достижении наиболее симметричных структур. В этом причина
повышенных основных свойств амидинов по сравнению с амидами. Ами-
дин, захвативший протон (ион водорода)ЖR-Cf +Н+ —► R-C( >Н\чн2 \nh2мезомерно выравнивается:Жн .Хйtj<H N^HПоэтому захват амидином протона «энергетически выгоден».
Мезомерия проявляется и в менее симметрично шзстроенных моле¬
кулах. Так, в амидах кислот мезомерией можно объяснить потерю
основных свойств аминогруппой;СЬR-C^i или R-C < ► +xnh2 NH, nh2Здесь мезомерный эффект ЫН2-группы определяется как ^fM-эф-
фект, а карбонильной группы — как —М-эффект.Свободная электронная пара, обусловливающая возможность за¬
хвата протона и образования аммониевой соли (в чем и состоят основ¬
ные свойства аммиака и его органических производных), в амиде полу-
занята образованием второй связи внутри молекулы. Поэтому азот
мало способен присоединять посторонний протон, и основные свойства
амида подавлены. Можно выразить ту же мысль иначе: присоединение
протона к азоту нарушит мезомерию, и значит оно должно быть связано
не с выигрышем, а с потерей «резонансной энергии».
176ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТВо всех карбоновых кислотах и их производных в зависимости от
степени выровненности их структур более или менее полно погашен
положительный заряд на карбонильном углероде и вследствие этого
сведена к минимуму свойственная альдегидам и кетонам способность
к присоединению и замещению по карбонильному кислороду. Оба об¬
стоятельства делают карбоксил — комбинацию карбонила с гидрокси¬
лом — совершенно новой функциональной группой.Мезомерный эффект можно назвать статическим эффектом сопря¬
жения, ибо он свойствен и покоящейся молекуле *, вне реакции. Однако
в реакции смещение пар электронов, выражаемое такими же изогнутыми
стрелками (английская символика), может зайти и дальше, до полного
перемещения пары из октета одного атома в октет другого. Такой эф¬
фект может быть назван динамическим эффектом сопряжения. Обычно
его называют электромерным эффектом или, чаще, таутомерным эф¬
фектом (Г-эффект), поскольку частным случаем его проявления яв¬
ляются перемещения электронов при таутомерии. Если пара электронов
удаляется из октета интересующего нас атома, эффект обозначается
как -Г-эффект, если же пара передается интересующему нас атому —
тогда это + Г-эффект.Енолизация ацетальдегида — пример -Г-эффекта карбонильной
группы:Здесь пара электронов двойной связи карбонильной группы отошла
к кислороду и стала связующей парой с водородом, принадлежащим
образовавшейся гидроксильной группе, а пара электронов, прежде при¬
вязывавшая водород в метиле, перешла в качестве пары электронов
(л-пары) для образования двойной С = С-связи.Примеры -Г-эффекта встречались при рассмотрении кетонов и осо¬
бенно р-дикетонов; вскоре мы встретимся с ними в нитррсоединениях.Более слабый, чем в альдегидах и кетонах, — Г-эффект свойствен и
карбоксильной группе кислот.В качестве примера +Г-эффекта можно привести гидролиз непредельных вини¬
ловых простых эфиров, которые легко присоединяют соль ртути, образуя ион меркур-
ацетальдегида и спирт:Процесс зависит от сопряжения электронно^ свиты кислорода и двойной связи
С = С и от легкости передвижения электронных пар по +Г-эффекту в результате
атаки метиленовой группы ионом ртути.Таутомерный эффект ярко проявляется в реакциях непредельных соединений
(см. раздел «Винилогия», стр. 312) и в ароматическом ряду.НН01нClHgCH2-C^°* Иначе говоря, молекуле в основном невозбужденном состоянии. Более подроб¬
но сопряжение будет рассмотрено на стр, 272.
ГАЛОИДЗАМЕЩЕННЫЕ КИСЛОТЫ 1 77ГАЛОИДЗАМЕЩЕННЫЕ КИСЛОТЫПрямое хлорирование и бромирование кислот происходит при на¬
гревании на свету или в присутствии перекисных катализаторов и, по¬
добно галоидированию парафинов, является свободнорадикальным. Та¬
ким способом Дюма получил впервые моно-, ди- и трихлоруксусные
кислоты. Однако галоидирование кислот с более длинной углеводород¬
ной цепью происходит в различные положения. Например, масляная
кислота галоидируется в основном в p-положение, а валериановая в (3-
и уп°ложения. Для специфического введения галоида в а-положение
используют способ Гелля— Фольгарда — Зелинского, который заклю¬
чается в галоидировании не самих кислот, а их галоидангидридов. Прак¬
тически используют галоидангидриды или ведут бромирование кислоты
в присутствии красного фосфора, причем образующийся пятибромистый
фосфор переводит кислоту в бромангидрид, а затем идет его броми¬
рование:RCH2—С^ + Вг2 —* RCHBr—С' + НВг
\Вг ^ВгПо-видимому, ангидриды кислот галоидируются подобно кетонам и
альдегидам через енольные формы, которые легче образуются, чем
в кислотах, из-за электроноакцепторного действия атомов галоида
(—/-эффект). Енольная форма образуется (медленная стадия) в малом
количестве, но быстро присоединяет галоид:/ОН Вг, Г /ОН-RCH2—(Г 4=fc RCH=C( >^Вг \вг/кRCHBr—С—Вг
^Вг.О—> RCHBr—С^ + НВг
\вгИменно поэтому замещение происходит у а-углеродного атома.Хлормуравьиная кислота С1—С—ОН сама по себе не существует,IIОно известны ее производные, например сложные эфиры. Они получаются
действием фосгена на спирты:СН30Н + С0С12 —* С1— С—ОСН3 + НС1IIОПоскольку фосген — хлорангидрид угольной кислоты, то, судя по
реакции, полученный эфир скорее является производным угольной кис¬
лоты, чем муравьиной. Обычно его и называют метиловым эфиром
хлоругольной кислоты, рассматривая его как полухлорангидрид — по-
луэфир угольной кислоты:НО—С-ОН С1—С—Cl Cl— С-ОСНзII II IIОООМы также будем рассматривать производные хлормуравьиной кис¬
лоты как производные хлоругольной кислоты (см. стр. 343).Наиболее обычный технический способ получения монохлоруксусной
кислоты состоит в гидролизе трихлорэтилена (см. стр. 288):H2SO,С1СН-=СС12 + 2Н20 >• С1СН2—С—ОН + 2НС1IIО7 Зак. 882
178ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТПрименяют^ окисление этиленхлоргидрина:hno3С1СН2—СН2ОН * С1СН2—с—он<1Трихлоруксусную кислоту получают."превращая спирт действием
хлора в хлоральгидратДШСН3—СН2ОН + 4С12 + Н20 —>• СС13—& +5НС1А они окисляя последний в трихлоруксуснукьашслоту:/он hno3
СС13—с( ► СС1з—с—он|\>н IIн оПо силе эта кислота не уступает многим минеральным кислотам,Р-Галоидзамещенные кислоты получают, присоединяя галоидово-
дород к а,р-непредельным кислотам, например к акриловой кислоте
'(см. стр. 303):СН2=СН—С—ОН + HC1 —>• C1CH.J—СН2—С—ОНJ iГалоидзамещенные кислоты с галоидом в ю-положении можно по¬
лучать из продуктов теломеризационного присоединения четыреххло-
ристого углерода к олефинам (P. X. Фрёйдлина, см. ч. II, «Свободные
радикалы»);яСНа==СН2 + СС14 —>• CI—(СН2СН2)„—СС13
h2so4Cl—(CH2CH2)„—CCI3 + 2Н20 С1—(СН2СН2)„—С—ОН + ЗНС1ОВсе большее значение в препаративной органической химии при¬
обретает трифторуксусная кислота как в высшей степени сильная
карбоновая кислота. Ее можно получать окислением органических со¬
единений, содержащих группу —CF3, например окислением перфторпро-
лилена CF3—CF=CF2- Однако обычный способ получения трифторук-
сусной кислоты- — электролиз раствора уксусного ангидрида в безводном
фтористом водороде (метод электрохимического фторирования)ОIIсн3—Сч +HFY) -1—: »- 2CF3—С—FСНз-с/ ||II' ■ °Ос последующим гидролизом полученного фторангидрида CF-i—С—F.IIО
ГАЛОИДЗАМЕЩЕННЫЕ КИСЛОТЫ179КОНСТАНТЫ ДИССОЦИАЦИИ ГАЛОИДЗАМЕЩЕННЫХ КИСЛОТ.
ИНДУКТИВНЫЙ ЭФФЕКТПо мере замещения в цепи карбоновой кислоты водородных атомов
на галоидные константа диссоциации кислоты повышается. Особенно
резкий эффект получается при замещении водородов в а-положенин
(табл. 22).Таблица 22. Константы диссоциации галоидзамещенных уксусных кислот в воде
при 25°СФторзамещенныекислотыХлорзамещенныекислотыБромзамещенная-кислота*аFCH2COOH21 • 10~3С1СНйСООН1,40- ю~3ВгСНаСООН-F2CHCOOH57 • 10-2С12СНСООН3,32 -10-2— F3CCOOH5,9- 10-'С13ССООН2,0- КГ1Причина влияния галоида заключается в том, что а-углерод, свя¬
занный с галоидом, особенно с фтором, становится более положительно
заряженным, чем в случае связи с водородом. Другими словами, эле*&*
тронные пары связи оттягиваются в сторону атомов галоида и обнажают
положительный заряд на углероде. Тогда более положительный а-угле-
родный атом в свою очередь оттягивает к себе пару электронов, свя¬
зывающую его с углеродом карбоксила. Этот углерод становится более
положительным, чем обычный углерод карбоксила, и в большей степени
концентрирует вокруг себя электронные пары, связывающие его с-жио
лородом. Вследствие этого водород карбоксила (протон) оказываемся
менее прочно связанным с кислородом.Подобная картина набл,юдается не только при a-замещении, но ai
в случае более удаленного аТома галоида;Ка (при 25 °С)Масляная кислота СН3СН2СН?СООН . . 1,54* 10-5а-Хлормасляная СН3СН2СНСООН . . . „ 1,39-10“3IС1p-Хлормасляная СН3СНСН2СООН .... 8,9-10 5
С1Y-Хлормасляная СН2СН2СН2СООИ ... 3,0 • 10~5С1Влияние галоида очень сильно затухает по мере удаления галоида
вдоль по цепи углеродных атомов от карбоксила и уже при -у-замеще-
нии едва сказывается. Лишь в случае очень сильной электронооттяги¬
вающей группы этот эффект затухает медленнее.Константы диссоциации Кл ряда предельных со,со,со-трихлорзаме-
щенных кислот в 50%-ном (по весу) метаноле имеют следующие вели¬
чины (P. X. Фрейдлина, JI. И. Захаркин);СС13(СН2)4СООН . . 4,6 -И)-0 СС13(СН2)10СООН . 9,55-КГ7
СС13(СН2)вСООН. . 1,5 • 10—в СС13(СН2)12СООН . 8,95-10-7СС1з(СН*)8СООН . . 1,25 • 10~6Естественно, что замещение на галоид будет не только усиливать
кислотные свойства, но и ослаблять основные свойства соединений, при¬
чем эффект будет также затухать с удлинением цепи. Это -видно из7*
180ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТданных тех же авторов для серии со,ш,ш-трихлоралкиламинов (в воде
при 20°С):Kb КьCC13CH2NH2 2 • 10-э CC13(CH2)3NH, . . е ,л_5CC13(CH2)2NH22- 10'
3 - 10"CC13(CH2)4NH26- 10'
9 - 10"Такого рода эффект имеет общее значение в органической химии и
называется индуктивным (или индукционным) эффектом (/-эффект).
Он может иметь два противоположных направления.Только что рассмотренное действиечгалоида — пример -/-эффекта.
Его действие усиливает кислотные и ослабляет основные свойства клю¬
чевой группы атомов. Противоположное действие (+/-эффект) харак¬
терно для замещения водорода на метильные и вообще на алкильные
группы. Его можно проследить на знакомом уже нам ослаблении кис¬
лотных свойств в гомологическом ряду муравьиной кислоты:Ка (при25 °С)р Кнсоон ....1,72 -ю-4—сн3соон . . .■ 1,76-ю-54,75сн3сн2соон .1,34.10“54,87СН3(СН2)2СООН1,54-ю“54,81(при20 °С)СН3(СН,)3СООН
СН3(СН2)4СООН
(СН3)3ССООН .1,51 • 10'
1,43- 10"
9,4. 10'рк4.824.83
5,03Графически индуктивный эффект выражают прямой стрелкой:
<0сн,-\эн4- /^эффектС1<-СН2*-0-0<~НIIо— /‘ЭффектИндуктивный эффект проявляется не только в изменении кислотных
или основных свойств соединения при замещении, но и в изменении
всевозможных проявлений реакционной способности. Мы уже встреча¬
лись с этим эффектом на примере разной реакционной способности кар¬
бонильной группы в ряду оксосоединений:Нч СНЗЧ СНЗХс=о с=о ^С=С)
ц/ н/ сн/В этом ряду формальдегид обладает наибольшей реакционной спо¬
собностью, а ацетон наименьшей. Это связано с тем, что причиной ре¬
акционной способности карбонила служит разделение зарядов углерода
и кислородаН/С=0) или fJ^C-=0 -< ►а реакционным центром оксогруппы является положительно заряженный
углерод. Между тем замена водорода метилом и в еще большей степени
введение двух метилов подавляет положительный заряд карбониль¬
ного углерода вследствие того, что к нему оттягиваются электронные
пары связи.—/-эффектом обладает, как мы видели, группа СС13 в целом (за счет
—/-эффектов трех хлоров). Поэтому карбонил хлораля СС1а—С/
ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ181более энергично реагирует в реакциях присоединения (и замещения),
чем карбонильная группа ацетальдегида и его гомологов. Этим объяс¬
няется и присоединение воды к хлоралю с образованием хлоральгид-
рата.Может вызвать недоумение, что введение в соединения па место водорода аль¬
дегидной группы — гидроксила, алкоксила (тоже группы с —/-эффектом) не только
не оказывает заметного —/-эффекта на карбонильный углерод, но явно действует
в обратном направлении, подавляя реакционную способность карбонильной группы,
которая в уксусной кислоте, ее сложных эфирах и амиде «мертвая» и не похожа
не только на альдегидную, по и па кетонную. Причина та, что здесь мы имеем дело
с иным явлением — с уже знакомым нам мезомерным эффектом (см. стр. 173), выра¬
жаемым в разной символике следующим образом:Н3СХ HaCv
илк /С=0 -Ч ► /С—СГн—О Н—О-+Н'И-'Х (~\ HflC\ HgC^,.Х=о илн ^:с=о ■<—►- /С-огн,с-о< н,с-о/ Ч4С—СГс=0 или ^С=0 Ч—> +/С—О
H2f0 HoN HoN^Явление это всегда ярче выражено, чем индуктивный эффект, и перекрывает его.Итак, индуктивный эффект — влияние, передающееся по цепи насы¬
щенных атомов и их ординарных связей и быстро затухающее. Мезо-
мерный (или резонансный) эффект — передается по цепи сопряженных
двойных связей, мало ослабевая.Следует особенно подчеркнуть, что понятие о '+/- или —/-эффекте
возникает лишь при сравнении свойств незамещенного соединения со
свойствами продуктов замещения, т. е. стандартом для сравнения слу¬
жит водородный атом. Все остальные атомы и группы располагаются
слева (—/-эффект) и справа (-{-/-эффект) от водородного атома при¬
мерно в таком порядке:/R- /-эффект (CH3)3N > — N02 > 0=SX > CN > С^ > C=0 > C( >40 \h x>r> F > Cl > Br > I > OCH3 > OH > H < CH3 < C2H5 < CH(CH3)2 + /-эффектДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫНазвания и физические свойства кислот этого ряда с неразветвлен-
иой цепью приведены в табл. 23. Этот ряд кислот (поскольку каждый
член его отличается от предыдущего на гомологическую разницу СНг
и поскольку функции всех членов ряда тождественны) считают обычно
гомологическим рядом. Однако, как легко заметить, каждый последую¬
щий член ряда не может быть построен из предыдущего привычной для
пас (мысленной) операцией — заменой водородного атома в скелете на
метильную группу.Кроме первого члена ряда, все следующие двухосновные кислоты
имеют бесконечные ряды гомологов, в обычном, более узком смысле
этого слова, ие помещенные в таблицу и получающиеся путем замены
водорода в метиленовых группах скелета на метильную или гомологич¬
ные группы.В двух правых столбцах таблицы помещены значения Каi и КЯ2,
т. е. константы диссоциации первого и второго карбоксилов в разбав-
182ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫТаблица 23. Двухосновные предельные кислотыФормулаНазвание кислотытривиальноеженевскоепо «карбоновой» системеНООС-НООС-HOOC-НООС-НООС-HOOC-НООС-ноос-ноос--соон
-сн2—соон
~(СН2)2—соон
-(СН2)з—соон
-(СН2)4—соон
-(СН2)5—соон
-(CH2)S—соон
-(СН2)7—соон
-(СН2)8—соонЩавелеваяМалоноваяЯнтарнаяГлутароваяАдипиноваяПимелиноваяПробковаяАзелаииоваяСебациноваяЭтандикислотаПропандикислотаБутаидикислотаПентандикислотаГ ексаидикйслотаГептандикислотаОктандикислотаНоиандикислотаДекандикислотаМетандикарбоновая1.2-Этандикарбоновая1.3-Пропандикарбоновая1.4-Бутандикарбоновая1.5-Пентандикарбоновая1.6-Г ександикарбоновая1.7-Гептандикарбоновая1.8-ОктаидикарбоноваяФормулаТемпера¬тураТемператураРаствори¬мостьКонстанта диссоциации
в воде при 25 °Сплавле¬ния,°скипения,°Св воде
при 20 °С,
г/100 г*а,Ка2НООС—СООН189,0(безв.)150(возг.)9,5(при15°С)5,90- 10-26,4- 10“5НООС—СН2—СООН135,6Разлагается73,51,49- 10~32,03- 10~вНООС—(СН2Ь—СООН185,0> 235
(разл.)6,86,89- 10"52,47- 10~вНООС—(СН2)з—соон97,5304(разл.)64,04,55- 10-s3,89- 10_SНООС—(СН2)4—соон153265(при 100 мм
рт. ст.)1,5(при15°С)3,71 • 10“53,87- 10~SНООС—(СН2)5—соон103,0272
(при 100 мм
рт. ст., возг.)5,03,09- 10“53,77- 10~вНООС—(СН2)6—соон140,0279(при 100 мм
рт. ст.)0,14
(при
16 °С)2,99- 10~52,5- 10~6
(при 100°С)НООС—(СН2)7—соон106,5226
(при 10 мм
рт. ст.)0,240000о12,8- 10~SНООС—(СН2)8—соон133,0295
(при 100 мм
рт. ст.)0,10
(при
17 °С)2,60- 102,6 • 10~в
(при 100 °С)ленных водных растворах. Из сравнения этих двух констант видно мощ¬
ное индуктивное взаимное влияние двух карбоксильных групп, уве¬
личивающее первую константу диссоциации (по сравнению с однооснов¬
ными кислотами). После того как первый ион водорода диссоциировал/°и образовалась заряженная анионная группа —С , картина резкоХГменяется и вторые константы диссоциации ниже, чем для монокарбоно-
вых кислот. Это естественно, так как отрицательный заряд карбокси-
лат-аниона уже удерживает водород второго карбоксила от диссоциации.
ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ183Температура плавления в гомологическом ряду двухосновных кис¬
лот (для неразветвлепных структур) меняется альтернирующим обра¬
зом, как это видно из рис. 33. Кислоты с четным числом углеродных ато¬
мов плавятся при более высокой температуре, чем кислоты с нечетным
числом (с удлинением углеродной цепи разница постепенно умень¬
шается). Принимая во внимание на¬
правление валентных связей, которые
у предельного атома углерода нахо¬
дятся под углом 109° одна к другой,
это объясняют обычно альтернирова¬
нием расположения карбоксильных
групп четных и нечетных членов гомо¬
логического ряда.При этом следует учитывать раз¬
ные (геометрические) условия образо¬
вания водородных связей двух карб¬
оксильных групп четных и нечетных
членов ряда (стр. 153).С увеличением молекулярного ве¬
са альтернирует и растворимость кис¬
лот в воде.Способы полученияРис. 33. Температуры плавления
двухосновных предельных нормаль¬
ных кислот:А — щавелевая; / — малоновая; 2— янтарная*.
3 — глу га решая; 4 — адишшовая; 5 — пи мел-
липовая; пробковая; 7—азелаиновая;себациновая; 9 — нонанДикарбонивая-1,9
кислота; М —декандикарбоновая-1,10 кн
слога; //^-орассиловая кислота.Щавелевую кислоту, занимающую
как первый член ряда исключительное
положение, получают окислением мно¬
гих органических веществ. Так, приокислении сахара азотной кислотой образуется, в частности, и щавеле¬
вая кислота. До сравнительно недавнего времени щавелевую кислоту
в производственном масштабе получали из дре_весины окислительным
сплавлением со щелочью. В настоящее время в промышленности ее
получают, нагревая-муравьинокислый натрий;ОIIН—С—ONa
+Н—-С—ONaООIIС—ONaIС—ONaII •О+ Н2Очевидно, что окисление этиленгликоля как первичного спирта
также приведет к щавелевой кислоте:Ю!HO-CHi—сн2-он —► но—с—с—онИнтересно отметить первый синтетический путь получения щавеле¬
вой кислоты гидролизом ее нитрила — дициана (Велер, 1824 г.):
184ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫМалоновую кислоту всегда получают через ее мононитрил — циан-
уксусную кислоту:н2о(н+)С1СН2—COONa + NaCN —> N=C—СН„-С—ONa ►' <5—> НО—С—CH2—С—ОН + NH3А АСинтез янтарной кислоты может быть осуществлен через ее динитрил:н2о(н+)С1СН2—CH2Cl + 2NaCN —> N==C—СН2—СН2—C=N *—>- НООС—СН2—СН3—СООН + 2NH3Янтарная кислота может быть получена также гидрированием ма¬
леиновой кислоты (стр. 314) или синтезом Конрада через натриймало-
новый эфир (стр. 187). IНаиболее обычным способом синтеза высших двухосновных кислот
является окисление циклических кетонов:Н2С—СН2НЫОзС=0 ——>■ НООС-(СН2)3-СООН/СНциклопентанон (->тг глутаровая2L. ^п2 кислота\ HN03
Н2С ХС=0 ► НООС—(СН2)4—СООНи\ ptj аднпиноваиХ121- <^п2 кислотациклогексанонН2С-сн2/\Н2ССН;\хсн2/Н2ССН,\/Н2С -СН2циклододеканонHN03ХС= О ► НООС—(СН2)10—СООНдодеканднкислотаВысшие дикарбоновые кислоты можно также получать из тетра-
хлоралканов С1 —(СН2)г—С'С13 (А. Н. Несмеянов, P. X. Фрейдлина,
Л. И. Захаркин) следующими двумя путями:
четные члены рядаNaCN H20(H2S0,)Cl—(СН2СН2)„— СС13 >■ N=C—(CH2CH2)n—СС13 ►—► НООС—(СН2СН2)„—СООНнечетные члены рядаH20(H2S04) ' NaOH
Cl—(СН2СН2)„—СС13 >• Cl—(СН2СН,,)„—СООН ►—^ НО—(СН2СН2)П—COONa НООС—СН2-(СН2СН2)ге_!—СООНТребуемые тетрахлоралканы синтезируют из этилена и четырех¬
хлористого углерода по реакции теломеризации (см. ч. II, «Свободные
радикалы»).
ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ185Кислоты с четным числом углеродных атомов могут быть полу¬
чены по реакции Кольбе (стр. 157) электролизом солей кислых эфиров
низших двухосновных кислот:2С2Н5—О—С—(СН2)„—С—О' —> 2С„Н5—О—С—(СН2)„—С—О • —*II II “Je ' II IIО О 0 0—> 2С0, + С,Н5-0-С-(СИ2),п-С—ОС2Н5II ■ IIо оОсобенности химического поведения
двухосновных кислотЕстественно, что все изложенное в отношении свойств карбоксиль¬
ной функции (стр. 151) применимо также к двухосновным кислотам.
Здесь будут рассмотрены только специфические особенности поведения
двухосновных кислот разного типа.Особняком стоит первый член ряда — щавелевая кислота. Это одна
из самых сильных карбоновых кислот, далеко превосходящая по силе
свои гомологи. Она кристаллизуется с двумя молекулами воды
(т. пл. гидрата 101,5 °С), которые можно отщепить, отгоняя воду, на¬
пример, с парами ССЦ, и получить таким образом безводную щавелевую
кислоту.В отлнчие от своих гомологов щавелевая кислота легко окисляется
сильными окислителями, например КМп04 в кислой среде, давая С02
и воду. При нагревании с серной кислотой она разлагается с выделе¬
нием СО, С02 и Н20.Щавелевая кислота не образует ангидрида. Она дает два ряда про¬
изводных за счет одной или обеих карбоксильных групп. Например:
ХлорангидридСложные эфирыАмидыНитрилыциаимуравышая кислотаМалоновая кислота также обладает особенностями, резко отличаю¬
щими ее от следующих членов ряда (янтарной и др.). При плавлении
(135 °С) она гладко декарбоксилируется, превращаясь в уксусную кис¬
лоту:НО—с—сн2—с—он —-> С02 + СН3—С—онЭто свойство сохраняют и все непосредственные гомологи малоно¬
вой кислоты, т. е. алкилмалоновые кислоты.Водороды метиленового звена в малоновой кислоте, находясь в со¬
положении по отношению к двум карбоксилам, обладают гораздо бо¬
лее высокой подвижностью (протонизирусмостыо), чем в одноосновныхCl—С—С—ClО Охлористый оксалилRO-C—С—ORII II
о оR0—С-С-ОНII IIО ОII2N—с—с ~nh2
II IIО Ооксамид\ С С XднцнанH2N—С-С—ОН
II IIО Ооксашшовая кислотаNi^C-C—ОНIIо
186ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫкислотах. В частности, малоновая кислота особенно легко вступает в ре¬
акции конденсации с альдегидами (основной катализатор). В зависимо¬
сти от условий и соотношения реагентов с молекулой альдегида реаги¬
руют одна или две молекулы кислоты;r—с=о + н2с:соон.СООНн\coohR—с=о + 2Н2С;IНсоонНООСR-С=е
I 4НR. IС—С-+ н20СООНсоонсоон- -с; +н2оhooc^I I 1'чюон
н н нМалоновая кислота легко галоидируется в а-положение.Подвижность водородов а-метиленового звена особенно удобно на¬
блюдать в эфирах малоновой кислоты, в которых отсутствуют темня¬
щие картину наиболее подвижные кислотные водороды карбоксильных
групп. При действии на этиловый эфир малоновой кислоты (называе¬
мый обычно просто малоновым эфиром) металлического натрия или
алкоголята натрия один, а при избытке натрия и оба метиленовых во¬
дорода замещаются на натрий, и образуется натриймалоновый эфир
(или соответственно динатриймалоновый), находящий широкое приме¬
нение в синтезе; лО*с2н-,о"^с-сно-с;'Р'ос2н5+2NaOC2HB| Ч^е-с ^|С2Н50^ , xJ "'ОС2Н5
+ 2С2Н5ОН+Na2Na<Q рл QbСН-С С
С2Н5О ОС2Н5” 1/2Н2NaПри действии на натриймалоновый эфир галоидных алкилов или
других галоидпроизводных с достаточно подвижным галоидом проис¬
ходит отщепление галоида в виде натриевой соли и замещение натрия
в метиленовой группе на алкил или другой радикал, ранее связанный
с галоидом. Так можно получать гомологи и разнообразные иные за¬
мещенные малоновые эфиры, а после их гидролиза—кислоты (синтез
Конрада). Декарбоксилированием можно удалить один из «малоновых»
карбоксилов и прийти к гомологам или другим замещенным уксусной
кислоты. Таким образом, синтез Конрада представляет собой важный и
гибкий метод синтеза одноосновных и многоосновных кислот. Ниже при¬
ведены примеры синтеза Конрада;1. Синтез гомологов уксусной кислоты;RC1 + Na+CHOC2H5,ОС2Н6-NaCl/°I ХОС2Н5R—' I /0С2Н5V+ 2НаО-2С2Н5ОНR— сн2—с:о/|\он
R ?/он
о/^о-СО,оон
ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ1872. Синтез янтарной кислоты:ОЧС2Н,,о/С—СН2С1 + Na+О"СНу\о^OC2H5ОС2Н6-NaClочс2нс—сн2с^°I 'ч-ос,н6
-сн ‘| уОС2Нвео+ зн2оо,~ЗС2Н6ОНнос—сн2—сн'ОНОНI/-со2этиловый эфир
1,2,2-этаитрикарбоновой кислотыос—сн,—сн,—сно'оон3. Синтез глутаровой и других двухосновных кислот:,0Cl—(СН2)„—Cl + 2Na1СIСНос2н5хОС,Н5ч,о-2NaClOv/с
С2Н6о/ Iс2н6о0>СчI ХОС2Н,
СН—(СН2)л—СН+ 4Н20I/лОС2Н5-4С2Н5ОНОо°\но/ Iн0 сн-чсн2)„-сн
:с с{Т\оно.~2С02ноС—СН2—(СН2)„—сн2—с■Очоно/В разделе об алициклах (стр. 505) описано применение натриймало-
нового эфира для синтеза алициклических карбоновых кислот.Из приведенных ранее реакций конденсации малоновой кислоты
с альдегидами очевидно, что и этот путь может быть использован для
синтеза одноосновных непредельных и двухосновных предельных кислот.Из других свойств малоновой кислоты отметим ее поведение при
обезвоживании фосфорным ангидридом, в результате которого полу¬
чается недокись углерода;ОН2СА'\с-IIо-он-онр2о50-=С=С=С=0
188ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫВ этой реакции также сказывается подвижность а-водородных ато¬
мов. Недокись углерода относится к классу кетенов и ведет себя подобно
своеобразному ангидриду малоновой кислоты:0=С=С=С=0 —J*£L. Vch,-<°нск хон°\
х,с— сн,—с:2СН30НСНз О/ хосн3Обычного ангидрида малоновая кислота не образует.Янтарная кислота отличается от предыдущих членов ряда образо¬
ванием циклических функциональных производных, а именно ангидри¬
дов и имидов. При длительном нагревании или, лучше, при обезвожи¬
вании уксусным ангидридом янтарная кислота дает янтарный ангидридОсн2—с.
\он сн2—сОН -И2°I /°
сн2—с'х'0обладающий обычными свойствами ангидридов кислот. Так, при взаимо¬
действии с аммиаком получается имид (сущинимид):сн2-с^ сн2-с^I \)+NH3 —► |
сн2-с; сн2-с^Амид янтарной кислоты также существует и образуется при дей¬
ствии аммиака на ее хлорангидрид или сложный эфир.В сукцинимиде основные свойства еще более подавлены, чем в
амидах. Напротив, водород его иминогруппы легко протонизируется.
Так, при действии алкоголятов щелочных металлов водород имино¬
группы замещается на металл и получается калий- или натрийсукцин-
имид.За последнее время приобрел большое значение как бромирующий
агент Ц-бромсукцинимид, получаемый из сукцинимида действием
NaOBr:сн2—с^ сн2—с^| \щ + NaOBr —| \jBr + NaOHСН2-С^ £Н2-С^х) ^оС его помощью можно замещать на бром метиленовый водород
в a-положении к олефиновой связи (стр. 255).Глутаровая кислота также образует циклический ангидридА/СН2-С^сн2 о^-СНг-С:"Ч)
ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ189Высшие двухосновные кислоты не имеют такого рода циклических
функциональных производных. Они дают два ряда функциональных
производных, подобных соответствующим производным монокарбоновых
кислот.Двухосновные кислоты могут быть превращены в пяти- и шестичлен¬
ные алициклические соединения непосредственно путем каталитической
реакции над окисыо тория или марганцаru r'S° сн2/ 2 ^ОН Th02 / \(СН2)„ > (СН2)„ с=о + со2 + Н20Ч /U11 \ /чсн2—сЧ0сн2(я = 2 или П)или в виде эфиров под действием натрия в результате сложноэфирной
конденсации (стр. 510), ведущей к образованию эфиров кетонокислот
с пяти- и шестичленными циклами (реакция Дикмана):ООх Х>С„Нв Г1,Ч / ■ СН*-С о сн—С—ОС2Н5С I ОС,Л Is Na \СН2 /ПI +сн2 V у (1)с I ,ОС2Н5 -с2п.-,он I IЛ. _с/ ^с—сн-с-ос2н5ХОС2Н5 ^2-С 0^-х0оо°Чс„осн, ° °^- /с-°сли иь2н5 С-ОС,Н5 С—СНH2c( H2Cf ‘ Na / \
СН2 + Чсн2 -с2н£,он>' Н2С. ;сн2 (2)nS \ C2Ii50— С СН—С° Ч°с*н= ч0 / \0чос2н5о оII IIН2С-С-ОСЛГ5 Na II,с—сI ‘ “ГГ.;? “II (3)н2с СН2-С—ОС2Н5 ‘ 5 н2с сн-с—ос2н5\ / II \./ IIсн2 о сн, оТаким образом, двухосновные алифатические кислоты — важные
исходные вещества для синтеза алициклических соединений.Применение двухосновных кислотЩавелевая кислота применяется в текстильной промышленности
как относительно сильная органическая кислота. Некоторые из высших
двухосновных кислот, особенно себациновая, находят применение в виде
их бутиловых, а также октиловых сложных эфиров как пластификаторы
в производстве пластических масс и как высококачественные смазки. На
основе адипиновой кислоты получают полимер найлон, из которого де¬
лают волокно.
1-90ОРГАНИЧЕСКИЕ ПРОИЗВОДНЫЕ ПЕРЕКИСИ ВОДОРОДАОРГАНИЧЕСКИЕ ПРОИЗВОДНЫЕ
ПЕРЕКИСИ ВОДОРОДАПерекись водорода — вещество, электролитически мало диссоцииро¬
ванное (Ка = 1,55-10~12), хотя и более диссоциированное, чем вода.
При алкилировании или ацилировании перекись водорода (или пере¬
кись натрия) образует моно- и диалкильные (соответственно моно- и
диацильные) производные, синтез которых рассмотрен на примере более
прочных трет-бутильных и ацетильных производных:2(СНЭ)3СС1 + Na202 —> (СН3)3С-0-0-С(СН3)3 + 2NaClперекись грег-бутилан+(СН3)3СОН + Н202 у (СНз)зС—ООН + Н20гидроперекисьтрег-бутила2СН3—С—Cl + Na,0, —> СН3—С—О—О—С—СН:> + 2NaClII - II IIО О Оперекись ацетила2СН3— С—Cl + Н202 + NaOH —> СН3—С—ООН + NaCl + Н20II II-О оили лучшеСНз—С-О-О-С—СНз + NaOC2H5 —> СН3—С—OONa + СНЭ—С—ОС2Н5II II II IIО О о оI-СНз—С—ООНАгидроперекись ацетила (надуксусная,
или перуксусная кислота)Гидроперекиси ацилов обладают слабыми кислотными свойствами
и образуют соли и эфиры (перэфиры), которые можно также рассмат¬
ривать как смешанные алкил-ацильные перекиси.NaOHR- ООН + R'—С—CI R—О—О—С—R' «— R'—С—OONa + RC1|| -NaCl || -NaCl ||О о оСуществуют и смешанные алкил-алкильные и ацил-ацильные пере¬
киси, путь синтеза которых ясен из предыдущего.Физические свойства простейших перекисей приведены в табл. 24.Гидроперекиси алкилов образуются также при взаимодействии сво¬
бодных алкильных радикалов со свободным кислородом, который сам
представляет собой бирадикал -О—О- (находится в «триплетном со¬
стоянии», см. ч. II, «Свободные радикалы»);R. -j- .0—0• —V R—О—о.R—О—О • + RH —► R—О—О—H + R.И т. д.Однако продолжение цепи возможно только в том случае, если
радикал R- стабилизован (имеет пониженную энергию) вследствие рас¬
средоточения неспаренного электрона. Это возможно, когда к углерод¬
ному атому, несущему неспаренный электрон, примыкает атом, имею¬
щий двойную связь, или атом, несущий свободную пару электронов.
ОРГАНИЧЕСКИЕ ПРОИЗВОДНЫЕ ПЕРЕКИСИ ВОДОРОДА
Таблица 24. Гидроперекиси, перекиси я перэфирыНазваниеТемператураТемператураПлотностьФормулаплавления.кйпеияя..20°С°GГидр о п ерекиси алкиловСН3—ООНС2Н5—ООН
(СН3)3С—ООНГидроперекись метила—38—40(при 65 ммрт. ст.)Гидроперекись этила— 10097Гидроперекись трет-65бутила(при 2 ммрт. ст.)П е р е к тг>с я а л к и л о :СНз—00—СН3Перекись метила13,5
(при 74Q мм
рт. ст.)С2Н5—ОО—С2Н5Перекись этила-7065(СН3)3—ОО—С(СНз)зПерекись грет-бутила-4070(при 197 мм
рт. ст.)0,9360.8960,80-0,850,827ю0,794Гидроперекиси а ц и л о вН—С—ООНоСНз-с-оонIIоСНз—С—оо—С— СНзГидроперекись формила,80—или пермуравьиная кис¬(взрывает)лотаГидроперекись ацетила,0,125или перуксусная кис¬(при 12 ммлотарт. ст.)Перекиси ациловОосн,—с:осн2—с\оI,/°Сложные эфиры перки слот (пер э-ф и р ы)
(СН*)»СОО-С—с1Вн8о(СНз)зСОО— С— СН2I^Нз)зСоо—с-сн2IIо(ОНз)зСОО-С-С6Н5IIо(СНз)зСОО-С -ос,н5о1,226юПерекись ацетила26-2763(при 21 ммрт. ст.)Перекись сукцинила100(взрывает)т^ег-Бутилперстеарат14—16,5186
(при 3 мм
рт. ст.)Ди-грег-бутилперсукци-нат53—54'——г^ет-Бутилпербензоат—75—77
(при 2 мм
рт. ст.)1,043трет-Бутилэтилперка'})-бонат52—55
(при 1 мм
рт. ст.)0,966
192ОРГАНИЧЕСКИЕ ПРОИЗВОДНЫЕ ПЕРЕКИСИ ВОДОРОДАВ ранее изученных нами классах соединений это группировки°\ . / I «, I
"С—С и _с—О—С •/ \ |"|которые уже встречались нам в оксосоединениях и простых эфирах.
В структурах, которые нам еще предстоит изучить, это группировки\ I I IС=С—С • и С6Н5— С •/ I IПредельные углеводороды испытывают окисление этого типа только
при высокой «предпламенной» температуре.Цепные реакции окисления стабилизованного радикала свободным
кислородом развиваются по схемам:°\ °\I. ^С-СН2 + 02 —V ^С—СН2— О—о.°\ °\ °\ СК^с-сн2-о—о • + N:—сн3 —► N:—сн2—оон + ^с-сн2 и т. д.00 .II. СН3СН2—О—СНСНз + 02 —>■ СН3СН2—О—СНСНзII ••00*СН3СН2-0-СНСН3 + СН3СН2—О—СН2СН3 —>•• ••ООН
.. I—> СН3СН2-0—СНСНз + СНзСН2-0-СНСНз И т. д.•• ••\ I . 4 \ IIII. ^С=С-СН2 + 02 —> ^С—С—СН2—О—О •\ I \ IрС-=С-СН2-0-0 • + ^С=С—СНз —>\ 1 ~ \ 1 •—>■ ^с=с—сн2—оон + ^;с=с—сн2 и т. д.В результате такого окисления на воздухе, впрочем очень медленного, постояв¬
ший па воздухе этиловый эфир, содержащий часто гидроперекись указанного строения,
представляет поэтому опасность при перегонке; после отгонки большей части эфира
остается взрывчатая гидроперекись. Перед перегонкой эфир должен быть освобожден
промыванием водой от перекиси, если она присутствует (проба с K.I или с Fe2+).Альдегиды и кетоны при действии перекиси водорода в кислой
среде дают перекисные соединения (табл. 24), в образовании которых
участвует не-а-водородный атом, а карбонильная группа.Первой стадией реакции является присоединение перекиси водорода
к карбонильной группе с образованием оксигидроперекиси;ОНIR-C^ +Н202 —> R—С—ООНХн Аа-оксигидроперекись
ОРГАНИЧЕСКИЕ ПРОИЗВОДНЫЕ ПЕРЕКИСИ ВОДОРОДА193Таблица 25. Перекиси альдегидов и кетоиовt ФормулаНазваниеТемператураплавления,°СТемпературакипения,°СПлотность.20Перекиси альдегидов, илидиокс и перекисиН0СН2—00—сн2онПерекись формаль¬
дегида51——носн—00—снон
1 1Перекись ацеталь¬
дегида100——сн3 СНзНОСН—00—СНОН1 1
СС!3 СС13Перекись хлораля122Перекиси альдегидов и кетонов, или л и перекис иСНз\с/°-°\с/СНзсн/ ^О—о/ ''-сн,CH3\c/°-°\c/CHJс,н/ ''ю—о/ \с2н5
0-0СНз—не: СН—СНз\0—0Диперекись ацетона70 °С
(возг.)—Диперекись метил-100—этилкетоиа(взрывает)Диперекись ацеталь-63 ^дегида(взрывает)1,042
(при
15 °С)/°“°\
н2с ;сн2осн3-нсСН—СНзоО з он и д ыОзонид этилена18(при 16 ммрт. ст.)Озонид псевдобути¬—27лена(при 60 ммрт. ст.)1,2651,027Затем, в зависимости от условий и наличия в избытке того или
другого исходного или промежуточного продукта, реакции могут про¬
текать в такой последовательности:ОН оI IIR—С—ООН + С—R
&ОН онI !R—С.-00—С — RI I
н ндиоксипсрекчсь-2НгОR—СН—00—СН—RI I-> О оI IR—СН—00—CH—RдиозонидОН 1100I IR—С—ООН + НО—С—RI 1н н-II 2оон нооI IR—С-00—С—RHH0-0—> r—11C СН—R\о_о/дгшерекнсь альдегидаПОIR--<’ —ООНIн > R—с-н2о | 4
HО,А
194СОЕДИНЕНИЯ CEPbfОсобенно неустойчивы внутренние перекиси последнего типа.Все приведенные типы структур существуют и для кетонов. Свой¬
ства перекисей, образуемых альдегидами и кетонами, приведены
в-табл. 25.Перекиси алкилов (особенно более устойчивая перекись трет-бу-
тила), перекиси ацилов — ацетила и бензоила, а также эфиры надуголь-
ной кислоты (перкарбонаты ROOC—OR) находят широкое применениеОкак инициаторы цепных реакций. Такое действие основано на гемоли¬
тическом разложении перекисей с образованием свободных радикалов:
(СН3)3С-0-0-С(СН3)3 —*• 2(СН3)3СО.(СН3)3СО. —*• (СН,),С=0 + СН3.СН3—С—О—О—;с—СНз —► 2СН3. + 2СОг
о с>ROOC—OR —► 2RO. + CO,tlоРаспад перекисей с образованием радикалов происходит не только
в результате термического разложения при невысоких температурах
(ниже 100°С), но и при действии (особенно на гидроперекиси) катионов
переходных металлов — окислителей и восстановителей. НапримераR—о—О—Н + Fe2* —V RO • + [FeOH]2*r_0-0—Н + Со3+ —>- ROO • + Со2* + H+Таким образом, перекиси (при слабом нагревании) и гидроперекиси
'(в присутствии катионов металлов Cr, Mn, Fe, Со и др.) служат ини¬
циаторами цепных гомолитических реакций. Подробнее об этом см. кн. Ц,
раздел «Свободные радикалы»,СОЕДИНЕНИЯ СЕРЫТИОСПИРТЫ (МЕРКАПТАНЫ)Сероводород — аналог воды. Алкилирование кислых солей серово¬
дорода приводит к образованию сернистых аналогов спиртов RSH, на¬
зываемых тиоспиртами, меркаптанами или тиоламигCH3I + NaSH —v CH3SH + Nal
СН30\ .О NaO. JZ+ NaSH' —»- CH3SH+ S'СН3О/ ^O СНзО/ чоМеркаптаны — отвратительно пахнущие вещества. Метилмеркаптан
CH3SH —газ, а начиная с этилмеркаптана C2H5SH, все они — жидкости
(табл. 26). В отличие or воды* и спиртов меркаптаны, подобно серо¬
водороду, неассоциированы а поэтому кипят много ниже, чем соответ¬
ствующие спирты: , ,Т. -КИП., °G Т- кип., °ССН3ОН . „ . 64,7 CH3SH . . . . 7,6С2Н5ОН . . . 78,5 C2H5SH . . . 34,7По женевской номенклатуре окончание названий этого класса ве¬
ществ («тиол») присоединяется к названию углеводорода: метантиол
CH3SH, этантиол C2H5SH, пропантиол-2 СНз—•CH (SH)— СНа,
ТИОЭФИРЫ (ДИАЛКИЛСУЛЬФИДЫ)195Таблица 26. Тиоспирты или меркаптаныФормулаНазваниеТемпера¬
тура пла¬
вления,
°СТемпера¬туракипения,°СПлот¬ность.20d4Коэффи¬
циент пре¬
ломления
„2°
nDДиполь¬
ный мо¬
мент в беи-
золе
при 20 °С
DCH3SHМетилмер-каптан-123,17,60,868—1,26C2HfiSHЭтилмеркап-тан— 12134,70,8401,43051,38
(при
15 °С)CH3CH2CH2SHй-Пропилмер-каптан-111,5680,8361,43801,33(CH3)2CHSHИзопропил-меркаптан— 130,7600,8161,4255~CH3(CH2)3SH«-Бутилмер-каптан-115,9980,8381,44401,32(CH3)2CHCH2SHИзобутилмер-каптан<—79880,8361,4386CH3(CH2)4SH«-Амилмер-каптан-75,7126
(при
450 мм
рт. ст.)0,8571,44671,50
(при
25 °С)(CH3)2CH(CH2)2SHИзоамилмер-каптан-1691190,8351,4412Меркаптаны обладают слабокислыми свойствами и при действии
на них щелочью получаются соли — меркаптиды:RSH + NaOH —v RSNa + Н20Однако меркаптаны еще более слабые кислоты, чем сероводород
'(4-/-эффект алкильной группы): рКа этилмеркаптана в воде 10,9, серо¬
водорода 7,02. С тяжелыми металлами, образующими нерастворимые
сульфиды, меркаптаны также дают осадки нерастворимых меркаптидов.
Такими являются, в частности, нерастворимые бесцветные (в противопо¬
ложность окрашенному сульфиду ртути) меркаптиды ртути (RS)2Hg.
В отличие от спиртов меркаптаны легко окисляются. Их можно коли¬
чественно оттитровать иодом; при этом получаются диалкилдисульфиды2RSH + 12 —> R— S-S—R + 2HIобразующиеся также при постепенном окислении меркаптанов кисло¬
родом воздуха. Диалкилдисульфиды легко восстанавливаются, вновь
превращаясь в меркаптаны.ТИОЭФИРЫ (ДИАЛКИЛСУЛЬФИДЫ)Алкилирование нейтральной соли сероводорода или меркаптида
щелочного металла приводит к образованию сернистых аналогов про¬
стых эфиров — тиоэфиров, или диалкилсульфидов (табл. 27):2CH3I + Na2S —(CII3)2S + 2NaI (1)RI + RSNa —> RSR+Na2S (2)Существуют и смешанные тиоэфиры R—S---R', получаемые по реак¬
ции (2) при применении реагентов с разными радикалами.
196СОЕДИНЕНИЯ СЕРЫТаблица 27. Тиоэфиры, или диалкилсульфиды (нормального строения)ФормулаНазваниеТемпера¬
тура пла¬
вления,
°СТемпера¬туракипения,°СПлот¬ность4'°.Коэффициентпреломления2оnDДипольный
момент
в бензоле
при 20 °с
D(CH3)2sДиметилсульфид—83,238,00,8481,43551,40(C2H5)2SДиэтилсульфид-102,192,00,8371,44301,58(C3H7)2SДипропилсульфид— 101,9142,00,814
(при
17 °С)1,55(C4H9)2SДибутилсульфид—79,7185,00,8381,45301,57(c5Hn)2sДиамилсульфид-51,32300,8431,45561,58
(при 25 °С)(C7H16)2SДигептилсульфид 298,00,8421,4606—Тиоэфиры, так же как их кислородные аналоги, неассоциированы
и кипят выше, чем простые эфиры:Т. кип., °С Т. кип., °С(СН3)20 . . . —23,7 (CH3),S .... 38(C2HsLO . . . 34,6 (C2H5)2S . . . S2 ,Диалкилсульфиды не реагируют с кислотами — они практически не
имеют основных (протофильных) свойств. Интересно, однако, что они
образуют очень прочные комплексные соединения с рядом металличе¬
ских солей, например I^S-HgCb, R2S-AuC13. Нуклеофильные свойства
диалкилсульфидов проявляются и в их реакциях с галоидными алки¬
лами, с которыми они образуют (особенно легко с иодистым метилом)
сульфониевые соли:R2S + ri —> R3 S+ ГКатион R3S+ включает трехковалентную положительно заряженную
(формально четырехвалентную) серу. Эти давно известные третичные
сульфониевые соли — аналоги описанных Меервейном (1937 г.) третич¬
ных оксониевых солей R30+ BFI (стр. 119). Третичные оксониевые соли
гораздо менее прочны, чем сульфониевые, и образуются лишь с анионами
сильных комплексных кислот, но в то же время вторичные оксониевые
соли [R20+H]X~ существуют, а их сульфониевых аналогов нет. Послед¬
ний пример демонстрирует, что протофильность и нуклеофильность не
всегда параллельны.СУЛЬФООКИСИ И СУЛЬФОНЫДиалкилсульфиды окисляются перекисью водорода в сульфоокиси,
или сульфоксиды:R2S + Н202 —^ R2SO + н2о
*При более энергичном окислении (перманганатом или концентриро¬
ванной азотной кислотой) диалкилсульфиды, а также сульфоокиси пре¬
вращаются в сульфоны:R2S KMn04 R\ уР *• S'R2SO — r/Как установлено в последнее время, сульфоокиси реагируют с иоди¬
стым метилом аналогично сульфидам — с образованием нового типа
ЛЛКАНСУЛЬФОКИСЛОТЫ107ониевых соединений — сульфоксониевых солей (Р. Кун):СН3си/S=0 + СН31-сн.сн.-СНз3V-S—оСвяз1, S = 0, как и всегда, близка к семиполярной, так что формулу
сульфоксониевон соли можно написать и так:СЬЧ++ -■CH3—S—о
-СНз^С гидридом натрия Nall, действующим подобно сильной щелочи,
эта соль реагирует с потерей HI и образованием соединения нового ин¬
тересного типа:гСНзЧтГ + NaH —► XS^ + Nal + H2l/ ЧСН,CHч+--s=oЭто соединение представляет собой как бы сульфон, в котором один
кислород заменен на СН2.Сульфоны — нейтральные, кристаллические, очень устойчивые ве¬
щества, крайне трудно восстанавливаемые.Диметилсульфоксид (CH3)2S = 0 отличается очень высокой диэлек¬
трической проницаемостью. В последнее время он широко применяется
в научных исследованиях как растворитель, в котором диссоциируют
обычно неионизирующие вещества, такие, как галоидные алкилы или
вещества с протонизируемой связью Н—С.ЛЛКАНСУЛЬФОКИСЛОТЫЭнергичное окисление меркаптанов (и дисульфидов) приводит к
образованию алкансульфокнслот:hno3R—SH >- R—SI Ч0ОНИх можно получить также алкилированием сульфита натрия, при¬
чем наряду с нормальной реакцией образования сложного эфира сер¬
нистой кислоты (алкилирование по кислороду) проходит реакция с пе¬
реносом реакционного центра (см. стр. 399)—алкилирование по сере:СН3Оч! ►NaOxCilJ -j S оNaOCIKO'Ns-=o
//>poONnУглеводороды, содержащие третичный водород, при действии ды¬
мящей серной кислоты сульфируются до алкансульфокнслот:о л>ноч«Зс-н+ s;но/ ^оRjC- SI ^о
он
198СОЕДИНЕНИЯ СЕРЫРеакция сульфирования углеводородов, имеющая громадное значе¬
ние в ароматическом ряду, для получения жирных сульфокислот не
используется практически.С 1936 г. в технику вошел, однако, иной путь получения сульфокис¬
лот: через их хлорангидриды — сульфохлориды RS02C1.Так, на высшие алканы действуют хлором и сернистым газом при
инициировании реакции светом. Разыгрывается цепная реакция;светС1, ► 2СЬ.СпН2п+2 + С1 • ■
■>2^+1 • + S02CnH2n+j • 4" наС„н2ООооСпНгп+у—S -J- С12c„h2„+1-s( +С1.S'0В этом процессе из каждого углеводорода получается смесь изо¬
мерных хлорангидридов, так как атомарный хлор вырывает атом водо¬
рода в любом звене углеводорода. Хлорангидриды сульфокислот пре¬
вращают в натриевые соли, которые применяются как моющие и
эмульгирующие средства, пригодные для употребления, в частности,
в жесткой и соленой воде.Аналогичный процесс можно вести и в присутствии кислорода, ис¬
пользуя для инициирования цепной реакции какой-либо источник сво¬
бодных радикалов, например добавляют перекиси, распадающиеся с об¬
разованием радикала R«;./ОR . + S02 —► Я—S''\ОR-S^ + 02R—SО1^0о—о.S0R-Sf + RH|Ч>о—о.оR—S—О—О—Н + R .R-Sо1^0ООНлR-S^ +. ОН|Ч>продолжают цепьо.R—+ RH|Ч)о.| V)
онАлкансульфокислоты — сильные одноосновные кислоты, образую¬
щие растворимые в воде соли щелочноземельных металлов и умеренно
растворимые натриевые соли. Со спиртами эти кислоты дают сложные
эфиры, например RS020CH3. При действии PCI5 идет обычная реакция
замещения гидроксила сульфоксильной группы на галоид с образова¬
нием сульфохлоридов RSO2CI, которые гидролизуются водой в исходные
тиокислоты199кислоты медленнее, чем хлорангидриды карбоновых кислот. С аммиаком
хлорангидриды образуют амиды сульфокислот (сульфамиды);R—Sf +2NH3 —► R-S +NH4CI|Ч) jCl nh2Амиды сульфокислот лишены основных свойств.ТИОАЛЬДЕГИДЫ .И ТИОКЕТОНЫ (ТИАЛИ И ТИОНЫ)Тиоальдегиды быстро превращаются в циклические тримеры3R-<н\ s А
н с/к/| |\н/S6 снкоторые получаются из оксосоединений действием на них P2S3:R\ s /R3 ^СО + P2S3 R'/ \ " | \r' + р203Я'/ Sv. ,/sCjr/ '''R'Мономерные тиокетоны (алкантионы) лучше всего получать дей¬
ствием сероводорода на кетали н присутствии небольшого количества
хлористого цинка или в растворе ледяной уксусной кислоты.Мономерный тиоацетон СН3—CS—СП3 — красная, неописуемо про¬
тивного запаха жидкость (т. кип. 80 °С), которую можно хранить лишь
в течение нескольких часов, так как она самопроизвольно полимери-
зуется. Тионы гидролизуются водой в кетоны; с гидразином, семикарб-
азидом и др. они реагируют но типу кетонов, но еще легче. При действии
сероводорода в кислой среде на кетоны образуются в основном 1,1-ди-
тиолы, например из ацетона получается СНз—C(SH)2—СН3. В отличие
от двух гидроксилов две тиольные группы удерживаются у одного
углерода, и дитиолы не склонны превращаться в тиокетоны.тиокислотыИзвестны тиоловые кислоты (I), изомерные им тионовые кисло¬
ты (II) и тиоитиоловые кислоты (III):R-cf R-< R-C(\sh X0H XSHI И ШТионтиоловые кислоты можно получить, действуя сероуглеродом на
реактив Гриньяра:/SMgCl HCIRMgCI + CS2 —v R—C' —> R—С + MgCl2M XSH
200АЗОТИСТЫЕ ПРОИЗВОДНЫЕ АЛКАНОВАЗОТИСТЫЕ ПРОИЗВОДНЫЕ АЛКАНОВНИТРОЗОСОЕДИНЕНИЯПри окислении первичных аминов RNH2 (стр. 207) раствором соли
надуксусной кислоты СН3—С—О—ONa (стр. 190) в хлористом мети-IIОлене Эммонсу удалось (1957 г.) получить ряд жирных нитрозосоедине-
ний R—N=0 с первичными и вторичными углеводородными радика¬
лами, а также ранее хорошо известные нитрозосоедниения с третичным
радикалом.Другой путь получения этих соединений (Хараш) заключается во
взаимодействии свободных радикалов с окисью азота или с эфиром азо¬
тистой кислоты. Разлагая перекись ацетила СН3С—О—О—ССН3 воII IIО Оегор-бутиловом эфире азотистой кислоты (стр. 109) и генерируя таким
путем метильные радикалы, удается получить нитрозометан.Строение нитрозосоединений следует из их окисления в нитросоеди¬
нения и восстановления в первичные амины::?.:(КМп011 Sn-.HCl /Н
СН3—N=0 ч CH3-N=0 >■ СНз-N, + Н20•• •• м\цSOS Чн••Нитрозосоединения с первичными и вторичными углеводородными
радикалами неустойчивы и изомеризуются, особенно в водных раство¬
рах, в альдоксимы и кетоксимы:R\R—СН2—N=0 —► )C=N—ОН
WальдоксимR\ R\ХСН—N=0 —;c=n-ohR'/ Rr/кетоксимСледовательно, нитрозогруппа действует на а-водородный атом про¬
тонизирующим образом и в этом сходна с карбонилом и нитрогруппой.
Нитрозосоединения окрашены в сине-зеленый цвет. Это поглощение
света зависит от возбуждения одного из электронов свободной электрон¬
ной пары азота (так называемый п -> л*-переход, см. кн. II). Сине-зеле¬
ные нитрозосоединения существуют, однако, лишь в жидком (в част¬
ности, в растворе) и в газообразном состояниях. При переходе в твердое
состояние они димеризуются и при этом обесцвечиваются; в растворе
снова наступает диссоциация, подчиняющаяся обычным законам рав¬
новесия.Из многочисленных формул, предлагавшихся для димеров, следует остановиться
на формуле, аналогичной формулам азо- и азоксисоединений (см. кн. II, «Азокси-
бензол»). Лучшим доводом в пользу такой структуры служит существование недавно
открытой геометрической изомерии нитрозосоединений:R\ + + /R + /Rчис-ряд N—N N=N N=N"о/ \о‘ NrR\ + + /О R. R, /Отранс-ряд N=N N=Ny N=N-о/ +\rнитрозосоеди- азосоедине- азоксисоедине-нения . ния ния
НИТРОСОЕДИНЕНИЯ201Такого рода геометрическая изомерия — существование двух разных веществ
одной и той же структуры, по разной конфигурации — проявляется в соединениях,
содержащих двойную связь азота (с азотом или углеродом), в непредельных соедине¬
ниях с двойной углерод-углеродной связью (стр. 246). Для 'таких веществ воз¬
можны две разные конфигурации, как в приведенных примерах.Стереоизомерпые формы алифатических пптрозосоедннеиий различаются, в част¬
ности, инфракрасными спектрами. Для тра//с-изомеров характерна единственная
полоса поглощения в области 1171 —1290 см-1, для цис-изомеров — две полосы в обла¬
стях 1323—1344 см"1 и 1330—1420 см"1.Удивительна, однако, легкость диссоциации димеров, вряд ли имеющая аналогию
среди сходных структур.НИТРОСОЕДИНЕНИЯПри алкилировании солей азотистой кислоты галоидными алкилами
идут две конкурирующие реакции. Преобладание одной из них зависит
не столько от условий, сколько от характера алкила и металла азоти¬
стокислой соли. По первому, нормальному направлению получается
эфир азотистой кислоты, по второму, протекающему с переносом реак¬
ционного центра (см. стр. 399), образуется изомерное нитросоединение,
в котором азот непосредственно связан с углеродом:Ii—► R—-0—N0
RC1 + МО—N=0 — „ + MCIL-L* r—no2Доказательством разного порядка связи атомов в двух изомерах
является результат восстановления. Эфиры азотистой кислоты при вос¬
становлении образуют снирт и гидроксиламин, нитросоединепия —
амин:н\R—ONO —>■ R—OII+ /N-OH
Жн2 /н
R—N02 —> R— NT +2Н20ЧНПри взаимодействии натриевой соли мопохлоруксусной кислоты
с нитритом натрия реакция идет практически нацело по второму на¬
правлению, т. е. образуется нитросоединение:С1СН2—С—ONa + NaN02 —► 02N—СН2—С—ONa + NaClПолученная натриевая соль нитроуксусной кислоты, вероятно, пред¬
варительно перегруппировавшись в ациформу (см. ниже), далее декарб-
оксилируется, что упрощенно можно изобразить следующим образом:02N—СН2- С—ОН —> OaN-CH3 + С02Этот процесс — обычный путь получения нитрометана в лаборато¬
рии (синтез Кольбе).М. И. Коновалов открыл реакцию прямого нитрования углеводоро¬
дов жирного ряда разбавленной азотной кислотой при температуре
около 150°С. Этим путем легко замещаются на нитрогруппу третичные
водородыChV СНзХСНз—С—н + но- no2 —> СЛ Ь,—С- -NOj + Н20сн/ сн/
202АЗОТИСТЫЕ ПРОИЗВОДНЫЕ АЛКАНОВтруднее — вторичные и совсем не замещаются (в этих условиях) —■
первичные.Приведенное уравнение, однако, лишь стехиометрический итог ре¬
акции.А. В. Топчиев и А. Н. Титов, глубоко изучив реакцию нитрования
в жирном ряду, установили ее гемолитический цепной характер. Она
может осуществляться не только с участием азотной кислоты, но и
с помощью двуокиси азота. Двуокись азота, имеющая неспаренный
электрон, инициирует реакционную цепь:t°HN03 —► H0» + .N02
RH + .OII —> R. + H20
R. + .N02 —► R—N02
R. + HNO3 —■> R—NOj + • OHВ технике в настоящее время используется несколько иной процесс,
позволяющий получать нитросоединения даже из наиболее инертных
углеводородов — метана и этана. Нитрование проводится примерно при
400 °С концентрированной азотной кислотой, т. е. в присутствии окислов
азота.В этих же жестких условиях кроме нормальных реакций нитро¬
ванияСН4 + НЫ03 —► CH3N02 + H20
СН3—CH3 + HNO3 —► CH3CH2N02 + Н20СН3—СН—СН3N0,СН3—СН2—СН3 + HNO-* СНз— СН2— CH2N02проходят также реакции деструктивного нитрования (с крекингом цепей
углеводородов), в результате чего также образуются низшие нитросо¬
единения:СН3—CH3 + 2HNO3 —► 2CH3N03
СН3—СН2—СН3 + 2HN03 —► CH3N02 + C2HsN02Нитрованием хлороформа и хлорированием нитрометана можно по¬
лучить трихлорнитрометан — хлорпикрин C13CN02. В технике это ядови¬
тое слезоточивое вещество получают иначе. Хлорпикрин находит огра¬
ниченное применение как инсектицид в борьбе с амбарными вредите¬
лями..Строение нитросоединенийДолгое время химики пользовались формулами азотной кислоты,
нитратов и нитросоединений с пятиковалентным азотом:Н— О—R—О—N; R—Nч0 ч0 ч0Такое изображение неверно в том отношении, что азот — элемент
второго периода (Li—Ne) — может иметь вокруг себя не более восьми
внешних электронов, а пять ковалентных связей соответствуют десяти
электронам. Поэтому правильнее изображать формулы этих соединений
следующим образом:Н—О—. СН3—0-N( СНз—или СН3^хХ0 ЧУ ЧГ чО
НИТРОСОЕДИНЕНИЯ203т. е. одну из связей азота с кислородом изображать как двойную, а дру¬
гую как семиполярную (стр. 22). Однако на деле оба кислородных
атома связаны с азотом одинаково, находятся от него на одинаковом
расстоянии и оба несут по половинному заряду электрона. Это случай
мезомерии (или сопряжения): происходит такое же выравнивание элек¬
тронной плотности, как в карбоксилат-анионе (стр. 173);IP .о о*R-C$~a или R-СГ V R-cr'СГ Q- Ч)и аналогично ,+ ХоилиОБлагодаря наличию полного положительного заряда на азоте и
отрицательного на двух кислородах нитросоединения являются поляр¬
ными растворителями. Наличие полного положительного заряда на клю¬
чевом атоме — причина того, что нитрогруппаНЧн->с—►ггNrсильнейшая электроноакцепторная группа, обладающая —/-эффектом
'(стр. 181).Однако дело не ограничивается только ■—/-эффектом, обязанным
полному положительному заряду на азоте. Для нитрогруппы, так же
как и для карбонильной группы, кроме —/-эффекта характерен дей¬
ствующий в том же направлении —Г-эффект, причем —Г-эффект очень
ярко выражен и проявляется в таутомерии нитросоединений+/онна также во всех реакциях конденсации за счет а-водородных атомов.Свойства нитросоединенийВследствие сильнейших электроноакцепторных свойств нитрогруппы
метильная группа нитрометана и вообще а-метиленовое звено нитро-
алканов обладают еще легче протонизирующимися («подвижными») во-
дородами, чем альдегиды и кетоны. Это проявляется прежде всего в том,
что первичные и вторичные нитросоединения, т. е. соединения с нитро-
группой при первичном или вторичном углероде (R—СН2—NO2 или
R2CH—N02), реагируют со щелочью, отдавая протон. При этом пара
электронов, связывавшая углерод с ушедшим протоном, перемещается,
осуществляя связь углерода с азотом. В результате заряд аниона со¬
средоточивается на атоме кислорода и образуются соли так называемых
аци-нитросоединений:+ £о + /сгR-CH.-N^ + NaOH —У R-CH=J< _ , + Н20
J хО~ О NaR + СЬ + ,0+ NaOH —>• + + H20p" О R О Na
204АЗОТИСТЫЕ ПРОИЗВОДНЫЕ АЛКАНОВВ некоторых случаях (см. нитротолуол,, кн. II) при подкислении
таких солей образуется неустойчивая, изомерная нитросоединению
свободная ацн-форма, которая обычно мгновенно изомеризуется в ис¬
ходное питросоединение:V0'R— CH=N( —> R—CH2—N02хонЕсли эта реакция обратима и прямую стрелку можно заменить
знаком обратимости имеется явление таутомерии (подробнеесм. 387), которую называют нитро — а!{г/-иитР0‘таУтомеРией- В отличие
от очень слабо электролитически диссоциирующих нитросоединений их
изомеры — ачи-нитРосоеДинеиия — довольно сильные кислоты. Поэтому
равновесие всегда смещено в сторону малодиссоциированных истинных
нитросоединений. Например, для нитрометана в воде при 20 °С кон¬
станта таутомерного равновесия Кт — 10-17.Отношение нигросоединений и солей ог(М-иитросоединений — пример того, что
Ганч назвал отношением псевдокислоты (в данном случае нитросоедннения) и ее соли.
Псевдокислота — это практически нейтральное вещество, реагирующее со щелочыо
с образованием соли (и воды). Соль, однако, имеет иную структуру, соответствующую
структуре изомерной кислоты (истинной кислоты), в данном случае ш^м-питроформы.Подвижность водородов первичных и вторичных нитросоединений
сказывается и на их отношении к азотистой кислоте. Реакции эти про¬
текают совершенно аналогично реакциям кетонов с азотистой кислотой
(стр. 136). В случае вторичных нитросоединений их единственный по¬
движный а-водород замещается на нитрозогруппу и реакция ниурози-
рования завершается на образовании нитрозонитросоединения — псев-
донитрола:ч R\;c-no2 + hono -—v ;c-no2
2В случае первичного нитросоединения промежуточно образующееся
нитрозонитросоединение вследствие сильно возросшей протонизации во¬
дорода изомеризуется (как и в случае кетонов) с перемещением а-водо-
рода (протона) к нитрозогруппе, которая превращается при этом в
оксимную группу. Получается слабая алкилнитроловая кислота:R—СН2—N02 + HONO-Н20R—СН-Г
IN=0R—С—N02
N—ОНПонятно, что протон перемещается к нитрозо-, а не к нитрогруппе:
реакция идет в сторону образования наименее диссоциированного ве¬
щества — наименее сильной алкилнитроловой кислоты.Нитросоедннения сходны с оксосоединениями и в их отношении
к альдегидам.В слабощелочной среде нитросоединения вступают с альдегидами
и кетонами (Анри) в реакции конденсации. Нитрометан конденсируется
с формальдегидом по следующей схеме:3HCH0 + CH3N02 —>• (Н0СН2)3СК02Эта реакция похожа на конденсацию ацетальдегида с формальде¬
гидом *. Конденсации с другими оксосоединениями подобны альдольной* Так же как синтезируемый из ацетальдегида пентаэритрит (стр. 106) продукт
конденсации ннтрометана с формальдегидом подвергают этерифакации азотной кис¬
лотой для получения взрывчатого вещества:(H0CH2)3CN02 + 3HN03 —> (02N0CH2)3CN02 + 3H20
НИТРОСОЕДИНЕНИЯ205и кротоновои и приводят к непредельным нитросоединениям:• CIIj—СН—CII—NOСН3—С=0 + Н2С—NOjI IН R—>■ СН3—СП—С—N02
н2о |Эти конденсации — типичные примеры кислотно-основного катализа.
По данным Урбаньского. отношения, имеющие место в случае конден¬
сации альдольного типа, выражаются схемой:+ сн3спо-сн3сииCII,CnCH2NO,CHjN02I+OilIIон+ сносно+ 2СН3СНО CH3CHN.CIINO,-2CH3CHO CH,CH'-CH3C110ОНIII(В более жестких условиях отщепляется вода и наступает «крото-
новая» стадия конденсации).В высшей степени интересна обратимость альдольпой стадии. Так,
действием метилата натрия можно разложить продукт конденсации II
на ацетальдегид и натриевую соль а^м-питрометаиа:СНз—СН—СН2—NO, + Na4 'OCII3IОН/° +/0'СНз-С + CH2=N/ Na+Ni хо-Отщепление одной молекулы альдегида от соединения III происхо¬
дит уже в слабощелочной среде (pH 7,5—8,5).Каталитическая роль кислоты (Н+) и основания ( 011) и конденсации и обрат¬
ной ей реакции объясняется приводимыми схемами.Действие кислоты:сн3-< , т1+сно—с;,н'ОН+fciV-NOaI f Л +
ch3-cv-ch8-N<> + н,о-ннгн -C-CH.-NOo + н+ (прямая реакция)IОН->■ СН,с г И
20SАЗОТИСТЫЕ ПРОИЗВОДНЫЕ АЛКАНОВДействие основания:н*он^снг-да2—[сн2-^<о+CH2=N<q-нсн3-с<2 + сн3-й^осн3-с-сн2-к<°~ сн3-с-сн2-ш2СГ ОНнI(прямая+OH+/0СН3-С СНг Ыф(1-*\о~н^оноCH3-C<Q + CH2=N<qH (обратная реакция)
+OH-Первичные нитросоедннения под действием концентрированных кис¬
лот гидролизуются с образованием карбоновых кислот и гидроксил-
амина:R—СН2—Ш2 + Н20нR—+ NH2OH
\)НЭта реакция, открытая Бамбергером, проходит через стадию изомеризации аци-
иитросоединения в гидраксамовую кислоту, которая затем претерпевает гидролиз
в гидроксиламин и карбоновую кислоту:r-ch2-no2R—CH=N.O'R—СН/ОНОНоR-CОНNOHtОR—С\nhohн2о(н+)/ОН нч
R—С^ + XN—ОНо н■/Реакция Бамбергера используется и для промышленного синтеза гидроксиламина.
По Урбаньскому, для этой цели целесообразно применять 1,2-динитроэтан. На дини¬
троэтан, получаемый из этилена и N02 по Демьянову (стр. 250), действуют концен*
трированной серной кислотой при 100 °С:CH2-N02Iсн2—no2СН—N+ /
CH=N/°'NdhОН^О'"/ОН4=0/N=0С\АХон/ОН^NOH
NOHОX,он^NHOH^NHOH^Он2о(н+)СООН &h2so4 +■ I 2NH2OH ** С02 СО Н20 2NH3OH SO3OHсоонТаким путем получается чистый сульфат гидроксиламина.
ПРЕДЕЛЬНЫЕ АМИНЫ-207Первичные и вторичные нитросоединения при нагревании в водном
растворе с кислотами превращаются в оксосоединения (Неф):R\ R\ + /° h2so4 R\2 )ch-no2 ч=£ 2 /C=nv >• 2 ;c=o + N20 + 3H20R'/ Ц'/ X>H R'/Третичные нитросоединения не вступают в реакцию ни со щело¬
чами, ни с азотистой кислотой, ни с альдегидами.ИОЛИНИТРОСОЕДИНЕНИЯИз веществ, содержащих несколько нитрогрупп, упомянем тетра¬
нитрометан С(N02)4, который получается при действии концентриро¬
ванной азотной кислоты на ряд органических веществ, например на
уксусный ангидрид (СН3СО)20.Тетранитрометан — бесцветная жидкость (т. кип. 126°С). С угле¬
водородами и другими- органическими веществами он образует чрез¬
вычайно взрывчатые смеси. Тетранитрометан употребляется как ни¬
трующее средство (Урбаньский), так как он легко отдает четвертую
нитрогруппу, замещая ее на водород. Так образуется тринитрометан —
нитроформ СН(М02)з- Это — сильная кислота (три нитрогруппы ока¬
зывают огромный индуктивный и таутомерный эффект). Тетранитро¬
метан образует с олефинами комплексы, окрашенные в желтый цвет
^реакция И. И. Остромысленского на непредельную связь)*ПРЕДЕЛЬНЫЕ АМИНЫПродукты замещения атомов водорода в аммиаке на углеводород¬
ные радикалы называются аминами.В противоположность спиртам, нитросоединениям и всем до сих
пор рассмотренным функциям первичными аминами называются про¬
дукты замещения одного водорода аммиака RNH2, независимо от того,
является ли R первичным, вторичным или третичным радикалом. Фор¬
мула вторичных аминов R2NH, третичных — R3N. Обычные названия
аминов составляются по радикалам: CH3NH2 — метиламин, (CH3)2NH —
диметиламин, (CH3)3N — триметиламин и т. д. По женевской номенкла¬
туре, как всегда, исходят из наименования углеводорода с наиболее
длинной цепью и вводят названия замещающих аминогрупп в виде
префиксов: амино — для NH2, метиламино — для NHCH3, диметилами¬
но— для N(CH3)2 и т. д. Положение заместителя (аминогруппы) отме¬
чается номером углерода, у которого он находится, например
СН3—СН2—СН—СН3 носит название 2-аминобутан. Если аминогруппаINH2находится в боковой цепи, префикс амино (или алкиламино, диалкил-
амино) ставится перед названием радикала, образующего боковую цепь.Простейшие амины — газы, превосходно растворимые в воде, обла¬
дающие сходным с аммиаком запахом, но с более сильным «щйбным»
оттенком. Триметиламин имеет запах селедки. Физические свойства не¬
которых аминов приведены в табл. 28.Алкиламины — основания, по силе близкие к аммиаку, обычно даже
несколько более сильные (слабый -[-/-эффект алкильных групп!). Основ¬
ные свойства аминов, как и аммиака, обусловлены наличием у атома
208АЗОТИСТЫЕ ПРОИЗВОДНЫЕ АЛКАНОВТаблица 28. АминыФормулаНазваниеТемпера¬тураплавления,°СТемпера¬туракипения,°СПлот¬ностьdiКоэффи¬
циент пре¬
ломления
nDДипольный
моменг
в бензоле
при 23 °С
Dch3nh2Метиламин—92,5-6,50,769(“Г”)’1,432
(при
17,5 °С)1,46(CH3).NHДиметиламин—96,07,40,630(О1,350
(при
17,0 °С)1,17(CH3)3NТриметиламин— 124,03,50,6351,363
(при 0 °С)0,86CH3CH2NH2Этиламин—80,616,60,6831,3661,28, 1,39(CH3CH2)2NHДиэтиламин-50,055,50,70561,3873
(при 18 °С)1,20(CH3CH2)3NТриэтиламин— 114,889,50,7271,4030,90ch3ch2ch2nh2к-Пропиламин—83,048,70,7191,3900
(при
16,6 “С)1,33
(при 20 °С)(CH3CH2CH2)2NHДи-к-пропил-амин—39,6110,70,73841,4045
(при
19,5 °С)1,07
(при 20°С)(CH3CH2CH2)3NТри-к-пропил-амин—93,5156,00,7571,4176
(при
19,4 °С)0,74CH3(CH2)sNH2к-Бутиламин—50,577,80,7401,4010
(при 20 °С)1,40CH3(CH2)4NH2«■Амиламин—55,0104,00,7611,4118
(при 20 °С)J(приЗО °С)CH3(CH2)5NH2к-Гексиламин—19,0132,70,7660(О1,4130
(при 20 °С)1 59
(приЗО°С)азота свободной пары электронов, которая в результате солеобразова-
ния связывается с ионом водорода кислоты и дает соли алкиламмония:НСН3:№ + HCI
НСНз
CH3:N: + НС1
НСНз
CH3:N: +HCI
СНзН-> CH3:N=H СГ
Нсоль метиламмйнняСНз
CTVNtH Cl
Н 'сольдиметиламмонияСНз-К СН3I I CI
СНзсоль трйметиламмонйяВ третичных аминах свободная пара электронов атома азота может
быть использована и для реакции с галоидным алкилом (ср. с суль-
фониевыми солями, стр. 196):гиг„ СНз'
ПРЕДЕЛЬНЫЕ АМИНЫ209В результате получается четвертичная соль аммония. Конечно, су¬
ществуют амины и аммониевые соли с разными радикалами.Способы получения аминов1. Главный путь — алкилирование аммиака (или аминов) галоид¬
ными алкилами (реакция Гофмана), диалкилсульфатами или солями
третичных оксониев. Реакция проходит через стадию присоединения ал¬
кила к свободной паре электронов азота, после чего идет отщепление га-
лоидоводорода избыточным аммиаком (или амином):NH3 + NH3RI >- RNH3 Г ► RNH2+NH4IRNH2 + NH3
RI >- R2NH2 Г ► R2NH+NH4IRsNH + NHjRI >• R3NH Г ► RaN + NH4IRI + R3N —> R4N ГВ этой реакции галоид подвергается нуклеофильному замещению
азотом аммиака или аминов или, что то же самое, азот подтзергается
электрофильной атаке алкилом.В зависимости от соотношения реагентов и условий реакции Гоф¬
мана получается смесь первичного, вторичного и третичного аминов и
четвертичной аммониевой соли с преобладанием низко- или высоко-
алкилированных продуктов.2. Впервые алифатические амины были открыты Вюрцем (1848 г.)
в результате гидролиза эфиров изоциановой кислоты (изоцианатов):R—N=C=0 + Н20 —► RNH2 + С02Изоцианаты получают алкилированием циановокислого серебра.3. Важной реакцией получения аминов, на последней стадии сво¬
дящейся к предыдущей — гидролизу изоцианатов, является деструкция
амидов кислот по Гофману. При действии NaOCl или NaOBr на амид
кислоты один атом водорода аминогруппы замещается на галоид и
щелочь отрывает от азота галоидоводород:О оII II /нR—-С—NH2 + NaOCl —>- R—С—N\ciII /Н II /R—С—N + NaOH —► R—С—N + NaCl + НгО
ЧС] • \Образовавшаяся молекула с неполновалентным атомом азота пере¬
группировывается в изоцианатОII /R—С—N^ —v o=C=N—Rкоторый гидролизуется и дает амин:0=C=N~R + Н20 —► RNH2+C02Та же неустойчивая молекула, перегруппировывающаяся в изо¬
цианат и дающая далее первичный амин, получается при нагревании8 Зак. 882
210АЗОТИСТЫЕ ПРОИЗВОДНЫЕ АЛКАНОВгидразида кислоты (Курциус)+ - /R—С—N=N=N —>■ R—С—N + N2II II \О оили при действии кислот на гидроксамовую кислоту (Лоссен):/Н н+ /R—С-< ► R—С— < +нэ0+II N)H II \О о4. Восстановление нитрилов (каталитическое — водородом над пал¬
ладием или натрием в спирте) дает первичные амины:2Н2R—C=N ► R-CH2—NH25. Оксосоединения можно превратить в любое азотистое функцио¬
нальное производное (оксим, гидразон) и затем восстановить последнее
в первичный амин:H2NOH 4Н
R-C-R' ► R—С—R' ► R—СН—R' + Н20II II IО NOH NH2Другой путь превращения оксосоединений в амины заключается в
нагревании альдегидов и кетонов с муравьинокислым аммонием (реак¬
ция Лейкарта):R\ Ч)С=0 + 2Н-С^ —>■ ХСН—NH—С + С02 + NH3 + 2Н20R'/ ^ONH, R'/ \нзамещенныйформамнд| н2о(н+)ч;сн—nh2 + нсоонR'/• Как видно из приведенных реакций, кроме реакции Гофмана, всеми
остальными способами получаются только первичные амины.Специфическим способом получения метиламинов, и в частности
триметиламина, служит взаимодействие параформа, деполимеризующе-
гося в реакции в формальдегид, с хлористым аммонием. Образующиеся
сначала метилольные производные аммиака восстанавливаются форм¬
альдегидом в амины:О+ зсн2о + IIЗСНаО + NH,C1 —* (HOCH2)3NH СГ ► (CH3)3NH СГ + 3HC-OHХимические свойства аминов1. Амины как основания образуют соли даже со столь слабыми
кислотами, как угольная, сероводород и синильная, с водой они дают
гидроокиси алкиламмониевCH3NH2 -f нон —CH3NH3 OH'
обнаруживающие щелочную реакцию с обычными индикаторами.
ПРЕДЕЛЬНЫЕ АМИНЫ211Как и аммиак, амины образуют комплексные катионы с целым
рядом катионов тяжелых металлов (Ag+, Си~+, Со2+, Со3+ и т. д.).Четвертичные аммониевые соли при замене в них аниона на ОН",
что достигается, например, обменом с влажной окисью серебра, дают
соответствующие гидроокиси2(CH3)4N СГ + Ag20 + Н20 —у 2(CH3)4N ОН" + 2AgClкоторые представляют собой гораздо более сильные основания, чем вод¬
ные растворы аммиака и аминов. Так, гидроокись тетраметиламмония
(CH3)4N+ ОН- по основным свойствам не уступает едким щелочам, так
как построена полностью ионно.2. Амины, имеющие водород при азоте, т. е. первичные и вторичные
амины, ацилируются, как и аммиак, и теми же реагентами (стр. 168),
образуя замещенные амиды:О ОII IIСН3-С—Cl + 2C2H5NH2 —* сн3—с—nhc2h5 + C2H5NH3 СГэтиладе!амидо оII IIСН3-С—Cl +2(CH3)2NH —► СНз—с—N(CH3)2 + (CH3)2NH2 Clдиметилацетамид3. Первичные амины своеобразно реагируют с азотистой кислотой,
превращаясь в спирты:НС1 +R—NH2 + HONO —► R—NH—N=0 R—N=NOH ► R—N—N СГ —>первичный алкилдиа'ю- хлористыйннтрозамин гидрат алкйлдиазоний—► N2 + cr + R+I н*°1 ROH + НПриведенные промежуточные соединения не выделены, а написаны
по аналогии с подобными ароматическими соединениями, где они хо¬
рошо известны (см. кн. II).Вторичные амины азотистой кислотой нитрозируются по азоту,
превращаясь в нитрозамины:R\ R\;nh + ho-no —> xn-n=o + h2o
W RXДоказательством этого служит восстановление нитрозамина в двух-
замещенный гидразин:R\ н2 R\ /нN—N=0 —> )N-N
r/ r/ хНТретичные амины с азотистой кислотой подобным образом не ре¬
агируют.4. Первичные амины при нагревании с хлороформом в спиртовой
щелочи образуют карбиламины, чаще называемые изонитрилами
(стр. 214):RNH2 + CHCl3 + 3NaOH —> RNC + 3NaCl + 3H20Изонитрилы, в отличие от нитрилов, ядовиты и отвратительно пах¬
нут. Поэтому реакция их образования — чувствительная качественная
реакция на первичные амины.
212АЗОТИСТЫЕ ПРОИЗВОДНЫЕ АЛКАНОВ5. С четырехфтористой серой первичные амины реагируют двояко
(Кон и Мак-Диармид):R-NH2 + SF4 —► R-N=s^ +2HFXF(CH3NSF2 — ЖИДКОСТЬ с т, кип. 16 °С, т. пл. — 123 °С>2R—NH2+SF4 —► R—N=S=N—R + 4HFОба типа соединений полимеризуются.6. С хлористым тионилом SOCb первичные амины образуют суль-
финимины R—N—S=0 (точнее R—N=S->0).7. Третичные амины при окислении Н2Ог превращаются в окиси
трег-аминов, в которых азот и кислород связаны семиполярной связью:R3N Н2О2 —> R3N О Н2О8. Путем присоединения к третичным аминам иодистого метила,
последующей заменой иона иода в четвертичной соли на гидроксил по¬
лучаются основания, которые при пиролизе распадаются с отщеплением
воды и образованием третичного амина и непредельного углеводорода,
например:(CH3CH2CH2)3N—СН3 ОН' —► Н20+(СН3СН2СН2)2№-СН3 + СН2=СН-СН3Эта реакция (расщепление по Гофману) имеет значение для уста¬
новления структуры азотистых гетероциклов деструкций (см. кн. II).ДИАМИНЫТак же как и два гидроксила, две первичные аминогруппы лишь
в редких соединениях [например, в мочевине (ЫНгЬСО] удерживаются
у одного углеродного атома. Метилендиамина не существует. Простей¬
ший первичный диамин — этилендиамин (по женевской номенклатуре —
1,2-диаминоэтан) получается аммонолизом дихлорэтана:С1СН2—CH2C1 + 4NH3 —> H2N—СН2—СН2—NH2-f 2NH4CIЭтим способом проще всего получать и его гомологи с аминогруп¬
пой в 1,2-положении, например 1,2-диаминопропан. Гомологи с удален¬
ными друг от друга аминогруппами можно синтезировать восстановле¬
нием гидразонов или оксимов дикетоновNa; С2Н5ОНСНз-С—СН2—С—СНз *■ СНз—СН—СНо—СН—-СН3II II IINOH NOH NH2 NH2или восстановлением динитрилов:Na; С2Н6ОНN=C-(CH2)2—c=n *■ H2N—сн2—(СН2)2—СН2—nh2H2/PdN=C—(СН2)+—C=N ► H2N—CH2—(CH2)4—CH2—NH2Динитрилы получают обезвоживанием аммониевых солей двух¬
основных кислот.Последняя из этих реакций (каталитическое восстановление дини¬
трилов) приобрела огромное значение. Из адипиновой кислоты таким
способом получают гексаметилендиамин (или 1,6-диаминогексан) —
важный продукт, который поликонденсацией с адипиновой кислотой
(или ее хлорангидридом) превращают в высокомолекулярный поли¬
амид—найлон. Из расплава этого полимера при 270—280 °С формуют
найлоновое волокно, применяемое для изготовления бытовых (ткани,
ДИАМИНЫ213чулки) и технических изделий (канаты). Из полиамидов изготовляют
также прочные пленки и трубки, в частности заменители кровеносных
сосудов в хирургии. Процесс получения найлона — это по существу зна¬
комая нам реакция превращения аммониевой соли путем дегидратации
в замещенный амид. Сначала адипиновая кислота и гексаметилендиамин
образуют соль (соль АГ), которая при нагревании дегидратируется и
дает полиамид:НО—С—(СН2)4—С—СГ NH3—(СН2)6—NH3 О—С—(СН2)4—с—О- NH3—(СН2)6—nh2II II II IIОО 0 0-«н2о| С—(СН2)4—С—NH—(CH2)S—NH—С—(CH2)i—С—NH—(СН2)6—NH Л II II II0 0 0 0Расплавленный полиамид продавливают через колпачок с тончай¬
шими отверстиями — фильеру, и застывшую нить наматывают на бо¬
бину, которая растягивает нить и тем ориентирует макромолекулы по¬
лиамида параллельно друг другу, что сильно повышает прочность нити.
Другие типы полиамидных волокон описаны на стр. 476.Благодаря этому применению диамины приобрели промышленное
значение. Ранее были известны лишь некоторые природные диамины,
например «трупные яды»: путресцин NH2—(СН2)4—NH2 и кадаверин
NH2-(CH2)5—nh2.Этилендиамин используется в исследованиях неорганических соеди¬
нений, так как он легко образует комплексные соединения с теми ка¬
тионами, которые дают комплексные катионы и с аммиаком. В отличие
от последнего этилендиамин занимает у металла два координационных'
места, притом соседних. Так, комплекс его с медью имеет следующее
строение:+ +С1ch2-nh2 „nh2—сн2| Хч'
ch2-nh2 "vnh2—сн2ClРеакции диаминов подобны реакциям моноаминов, например при
действии азотистой кислоты они превращаются в гликоли.Интересное осложнение наступает, если 1,2-диамин склонен к транс-
оидной конформации (см. стр. 317), в которой аминогруппы находятся
в наиболее удаленном положении одна от другой. Тогда в момент дей¬
ствия азотистой кислоты на первую аминогруппу и вылета молекулы
азота из образовавшегося неустойчивого катиона диазония вторая
аминогруппа примыкает своей свободной электронной парой к обнажив¬
шемуся карбониевому катиону, и замыкается циклический трехчленный
нмин:NH2 nh2R-CH-CH-R + HN02 + HCl ——> R-CH-CH-R >-| —.ш2о _N2, _crNH2 СГ N=NNH2 NHI * / \—* R—CH—CH—R —> R—CH—CH—R + H+Такое течение реакции представляет собой эффект участия соседней
группы — важное явление, открытое Уинстейном.
214АЗОТИСТЫЕ ПРОИЗВОДНЫЕ АЛКАНОВАзотистый аналог окиси этилена — этиленимин можно получить по
реакции:NH
/ \NH2-CH2—СН2—Вг + У2АВ2О —► Н2С—CH2 + AgBr + H20Подобно окиси этилена, этиленимин способен легко раскрывать
свой цикл, но в отличие от нее в результате алкилирования по азоту/СН2он дает ряд производных типа R—N jх:н2Группировка этиленимина обладает, по-видимому, мутагенными
свойствами, т. е. способна воздействовать на хромосомы.ИЗОНИТРИЛЫ (КАРБИЛАМИНЫ)При действии хлороформа и щелочи на первичные амины полу¬
чаются изонитрилы, называемые также карбиламинами:RNH2 + CHCI3 + 3NaOH —-* R—N==C S + 3NaCl + 3H20Реакция, возможно, идет через промежуточную стадию образова¬
ния дихлоркарбена СС12 (стр. 78)..Карбиламины изомерны нитрилам и могут рассматриваться как
алкилированный по азоту анион синильной кислоты:- R—C==N:нитрил-I- ► R—N==C !изонитрилАнион синильной кислоты является так называемым амбидентным
ионом, т. е. анионом, в котором заряд поделен между двумя атомами,
в данном случае между углеродом и азотом:c=N:, При нуклеофильном замещении этот анион может атаковать как
атомом углерода (в результате получаются нитрилы), так и атомом
азота (с образованием изонитрилов). Обычно получается смесь нитри¬
лов и изонитрилов, хотя в случае первичных радикалов преобладают
нитрилы, а в случае третичных получаются исключительно изонитрилы.
Вообще говоря, направление реакции зависит от следующих факторов:
а) от природы галоидного алкила (о чем было уже сказано); б) от
природы растворителя; в) от природы катиона в соли синильной кис¬
лоты. Количество изонитрила возрастает в случае работы в протонном
полярном растворителе или при использовании цианида серебра вместо
цианида натрия.Как видно, все факторы, способствующие механизму замещения
галоида по механизму 5N1 (см. стр. 75 сл.), благоприятствуют образо¬
ванию изонитрилов. Рассматривая эту и подобные реакции, Корнблюм
вывел правило: амбидентные анионы реагируют наиболее нуклеофиль¬
ной частью , в условиях, способствующих механизму SN2, и наиболее
отрицательно заряженной частью — в условиях механизма 5д,1. Азот
в цианид-анионе следует считать атомом наиболее богатым электронами.Правило Корнблюма распространяется и на ряд других реакций, например на
получение нитросоединений и эфиров азотистой кислоты из галоидных алкилов под
действием нитритов металлов. В анионе азотистой кислоты наиболее нуклеофильным
ИЗОНИТРИЛЫ (КАРБИЛАМИНЫ)215центром является атом азота, а кислород имеет наибольшую электронную плотность.
В результате те же факторы, которые способствуют образованию изонитрилов, в этом
случае способствуют образованию эфиров азотистой кислоты, а те факторы, которые
способствуют образованию нитрилов, вызывают образование нитросоединений:(СН3)3СХ + AgONO —> (CH3)3CONO + AgXRCH2X+NaN02 —> RCH2-N + NaX40Лучший способ получения изонитрилов — обезвоживание алкил-
формамидов:+ -R-NH-C^ + Р205 —> R—N=s=C + 2НР03Изонитрилы родственны по структуре окиси углерода:- + ••0-0 С—ОФормула с тройной связью R—N^C лучше отражает физические
свойства изонитрилов, что следует, например, из характеристической
частоты связи N = C в ИК-спектрах:V, см-1Связь С=С 2140-2260
Изонитрилы R—N = C . . 2180—2120
Нитрилы R—CsssN .... 2260—2240Необычное валентное состояние углерода в изонитрилах прояв¬
ляется в реакциях присоединения к ним галоидов, солей ртути и др.:/С!R-N=Cs + Cl2 —> R-N=CClИзонитрилы присоединяют оксосоединения и карбоновые кислоты
(Пассерини)R—№=С + (СН3)2СО + СН3СООН —► R—NH—С—С (СН3)2—ОСОСН3IIОа также оксосоединения и амины:R—iWc + НСНО + NH(CH3)2 —> R-NH-C0~-CH„-N(C1L)2Вероятной первой стадией реакции является присоединение оксо¬
соединения к изонитрилу и последующее размыкание трехчленного ге¬
тероцикла:
216АЗОТИСТЫЕ ПРОИЗВОДНЫЕ АЛКАНОВОтличие от нитрилов проявляется также при гидролизе. Изониг-
рилы гидролизуются только в кислой средеR—N=c + 2НгО —-* н—с; + rnh24 она нитрилы при кипячении и со щелочами и с кислотами:R—C=N: + 2HaO —► R—+ NH3ЮНГидролиз синильной кислоты соответствует обеим реакциям:ЮНHCN + 2Н20 —* НС' + NH3ДИАЗОСОЕДИНЕНИЯ ЖИРНОГО РЯДАДиазометан был открыт Пехманном в 1894 г. при действии щелочи
на нитрозометилуретан (см. ниже).Пытаясь осуществить изонитрильный синтез с хлороформом исходя
, +
из гидразина, Штаудингер вместо ожидаемого изонитрила H2N—N=C:
получил диазометан:H2N— NH2 + СНС!3 + 3NaOH —► CH2=N=N + 3NaCl + 3H20Обычно для получения диазометана, ставшего важным реагентом,
пользуются одной из следующих реакций:2NaOHhno2СНз—NH—С—NH2 сн3—N-—С—NH2О NO Ометилмочевина ннтрозометилмочевина—» CH2=N=N + Na2C03 + NH3 + Н202NaOHHN02 :CH,—NH—С—ОС2Н5 ► СНз—N—I—С—ОС2Н6 I! I ; IIО NO Ометилуреган нитрозометнлуре-тан—»- CH2=N=N + Na2C03 + C2HsOH + Н20Суть этих реакций состоит в том, что нитрозированный амид (или
эфир), гидролизуясь, сначала образует первичный нитрозамип — тауто-
мер неустойчивого метилдиазогидрата (ср. с ароматическим диазогид¬
ратом, кн. II):СН3—N—С—NH2 ■I II Na OHNO ОCH3—N-C—OC2Hs*■ CH3-NH СН,—NI " IIN=0 N—OilJi первичный метилдиаю-iNUU нитрозамин гидоаг
ДИАЗОСОЕДИНЕНИЯ ЖИРНОГО РЯДА217Обладая легко протонизируемым водородом в метиле (диазогруп¬
па— электронооттягивающая группа), метилдиазогидрат отдает щелочи
протон и превращается в диазометан:CH2-N CH2j^=N-6u CH2=ft=K:H NOH 4-"^При непосредственном диазотировании первичных аминов, как было
указано ранее при рассмотрении аминов, получается спирт и выделяется
азот. Однако есть основания думать, что эта реакция протекает через
стадию образования неустойчивого диазониевого катиона:HONO +CH3NH2-HC1 ► [СН3—N=N]C1' + 2НгО+ н2оСНз—N=N ► СН3ОН + N2 + Н+| - +[CH2-N=N -<-► CH2=N=N] + н+На возможность частичного образования диазометана указывает
получение небольших количеств хлорметилмеркурхлорида при проведе¬
нии диа,зотирования в присутствии HgCb (А. Н. Несмеянов). Хлорме-
тилмеркурхлорид образуется из диазометана и HgCb по реакции Гел-
лермана:CH2=N=N + HgCl2 —► ClCH2HgCl + N2Диазоалканы, содержащие в метиленовой группе электронооттяги¬
вающие заместители (-/-эффект), более устойчивы и их можно полу¬
чить непосредственным диазотированием соответствующих аминов. Та¬
ким способом из эфира гликоколя получают, например, диазоуксусный
эфир:О ОII - + IIH2N—СН2—С—ОС2Н6 + HN02 —► N=N=CH—С—ОС2Н6 + 2НгОПрямым диазотированием трифторэтиламина получается и р,|5,|3-
трифтордиазоэтан:F3C—СН2—NH2 + HN02 —► F3C—CH==N=N + 2Н20Диазометан — очень ядовитый желто-зеленый газ (т. кип. —24 °С),
растворимый в эфире. Он в высшей степени реакционноспособен, тотчас
реагирует с кислотами, но устойчив к действию щелочей. Строение ди¬
азометана окончательно доказано измерением электронной дифракции
газообразного диазометана (Берш). Атом углерода и оба атома азота
лежат на одной линии; расстояние С—N равно 1,34 A, a N=N 1,13 А,
т. е. длина связи С—N — промежуточная между длиной ординарной и
двойной связи, а длина связи N = N — промежуточная между длиной
двойной и тройной связи. Строение диазометана можно выразитьСН,—N=Ns ч-> CH,=N=N:* В следующих двух реакциях для ясности обозначены свободные пары электро¬
нов азота; в дальнейшем они опущены и испопьзоваиы только плюсы или минусы. Ми-
н\/с при углероде означает свободную пару электронов, а на азоте, привязанном двой¬
ной связью, — две свободные пары.
218АЗОТИСТЫЕ ПРОИЗВОДНЫЕ АЛКАНОВРассредоточение отрицательного заряда между крайними атомами,
лежащими на прямой, делает понятным сравнительно малый дипольный
момент молекулы, равный 1,4D.Наиболее важная реакция жирных диазососдинсний— взаимодей¬
ствие с ионом водорода. В водной среде реакция ведет к спирту:С'Н2—N=N : + Н+ —CH3-NhsN : —>■ СНз + N2
СНз+ + Н20 —V СНзОН + н+В отсутствие или при малой концентрации воды катион метила ата¬
кует анион кислоты и образуется метиловый сложный эфир данной
кислоты:R—с—ОН + CH2=N=N —► R—С—ОСНз + N2II IIО оЭто чрезвычайно удобный способ превращения кислот в их метило¬
вые эфиры, особенно полезный при работе с малыми количествами ве¬
щества.Так же. диазометан реагирует с фенолами (см. кн. II, «Фенолы»):С6Н5ОН + CH2=N=N —v C6H5OCH3 + N2фенол метилфени-ловый эфирСпирты можно метилировать диазометаном, предварительно пре¬
вратив их в ансольвокислоты, что практически осуществляют добавле¬
нием небольших количеств ZnCl2 (ZnCI2 регенерируется в реакции) или
других льгоисовых кислот:ROH + ZnCl2 —v [ROZnCy Н*+ СНг=!У^!У1ROCH3 + N2 + ZnCl2Реакция диазометана с альдегидами и кетонами идет через его при¬
соединение и гидридное перемещение. Альдегиды при этом превра¬
щаются в метилкетоны:R-cd? + CH2-N=N —► R-C-CH2~ft=N ^ R-C-CH31ооВзаимодействие с кетонами идет с перегруппировкой скелета: R'
перемещается к СН2 и получается гомолог исходного кетона:R' R'I. - l-х Г* ' •R—С + CH,-N = N R—С—СН2—N=N > R-C—CH,RII ^ 1 -N, II 2О !о ОРеакции диазометана с хлорангидридами неорганических и орга¬
нических кислот протекают следующим образом:AcCl + CH2=N—N —^ СН/ +N2'Асгде Ас — ацил.
ДИАЗОСОЕДИНЕНИЯ ЖИРНОГО РЯДА219Таким образом из хлористого ацетила может быть получен кетон
СНз—С—СНт-С1.IIООднако если реакцию вести в избытке диазометана, то ацетил за¬
мещает подвижный водород метиленовой группы диазометана, обра¬
зуется диазокетон, а выделяющийся хлористый водород связывается
избытком диазометана в хлористый метил:О ОII + - II + -СНз—С—Cl + 2CH2=N—N —>- СНз—С—CH=N=N + СН3С1 + N2диазокетонТак по Арндту и Эйстерту получают диазокетоны.При каталитическом действии Ag+ диазокетоны перегруппировы¬
ваются в кетены, превращающиеся в водном растворе в кислоты:+ - у/СНз—С—CH-N-N —► СНз—С—СН' + N2II II \ ■о о/ н2оСНз—С—СН, —► 0=с=сн—СНз ► НО—С—СН2—СНзII \ IIо оЭтот метод широко применяется для синтеза гомолога исходной
кислоты (Вольф).Уже синтез диазокетонов демонстрирует легкую протонизируемость
водородов метиленовой группы диазометана. Это подтверждаете^ воз¬
можностью образования металлических производных диазометана:CH2=N=N + (C6Hs)3CNa —► NaCH=N=N + (С6Н5)3СНтрифенил-метанИнтересно фотохимическое разложение диазометана, приводящее
к полимеру (СНг)п через образование карбена СН2 (кн. II). При взаи¬
модействии такого осколка диазометана (метилена, иначе называемого
карбеном) с олефинами образуются трехчленные циклы:СН2=СН2 + :СН2 —► Н2С—СН2\ /
сн2До тех пор пока путем электронографического исследования газо¬
образного диазометана не была установлена его линейная структура,предполагалось, что диазометан имеет циклическое строение Н2С || .NВ настоящее время Шмитц осуществил синтез этого изомерного цикли¬
ческого диазометана окислением соответствующего гидразина:/NH „ /Nн2с( | ► Н2С( I + Н20ЧМН XNЭто — бесцветное вещество, значительно менее реакционноспособ¬
ное, чем диазометан. Путь получения циклического диазометана м его
220КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯгомологов, называемых диазиринами, следующий:R\ NH3 R\ /ЯН его- R\ /N>=o+ — xi —^ XiRr/ NH2C1 R'/ xNH R'y XNПри нагревании диазирины частично отщепляют азот, образуя кар-
бены RR'C, а частично изомеризуются в жирные диазосоединения.ОСНОВЫ КВАНТОВО-ХИМИЧЕСКОГО ОПИСАНИЯ
ЭЛЕКТРОННОГО СТРОЕНИЯ МОЛЕКУЛ *ВОЛНОВАЯ ФУНКЦИЯ СТАЦИОНАРНОГО
СОСТОЯНИЯ МОЛЕКУЛЫТеоретической основой современных представлений о строении и
взаимодействии- атомов и молекул, в частности о строении их электрон¬
ных оболочек и о природе химической связи, является квантовая меха¬
ника. Атомы и молекулы — это типичные примеры квантово-механиче¬
ских систем. Поведение квантово-механической системы описывается
уравнением Шредицгера, а ее состояния — решениями этого уравне¬
ния— так называемыми волновыми функциями.Волновая функция стационарного состояния системы зависит от
пространственных координат и от спин-координат всех частиц систе¬
мы**. Она обозначается символом1|) (*!, Уи ZU огь .... хп, уп, гп, вп)где п — число частиц в системе; Xi, у^ zt (при t = 1, 2 п) —про¬
странственные координаты t-той частицы; аг- — спин-координата г-той
частицы, определяющая одно из двух возможных значений проекции
собственного (т. е. спинового) момента количества движения i-той ча¬
стицы на некоторое выделенное направление.На волновую функцию системы электронов принцип Паули (прин¬
цип исключения или запрета) налагает требование ее антисимметрич¬
ности: при перестановке двух электронов волновая функция, сохраняясь
по абсолютной величине, меняет знак.Знание волновой функции квантово-механической системы позво¬
ляет вычислить средние значения различных физических величин для
состояния, представляемого данной волновой функцией. Энергия имеет
для стационарного состояния точное значение.Очень важную физическую характеристику квантово-механической
системы представляет квадрат модуля волновой функции, т. е. квадрат
ее абсолютной величины ***. Произведение[г|) (*1, 1/1, г,, о-,, ..., хп, Уф гп, cr„)]2 dxu dt2 dinгде dxi = dxidyidzi представляет, согласно одному из основных поло¬
жений квантовой механики, вероятность определенной конфигурации
системы, при которой для каждого i (i = 1,2, ..., п) i-тая частица
находится в объеме dxidyidzi, содержащем точку (Xi,yi,zt), и имеет
спин-координату а,. В соответствии с этим сам квадрат модуля волно¬
вой функции имеет, очевидно, смысл плотности вероятности.* Раздел написан профессором Д. А. Бочваром.** Стационарным называется состояние с определенным значением энергии. От
временном зависимости стационарного состояния в нашем изложении можно без
ущерба отвлечься (см. ниже).**♦ Численные значения волновой функции, вообще говоря, комплексные числа,
однако во многих случаях ее можно выбрать действительной.
КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ22!Для полноты формулировки после слов «вероятность определенной конфигура¬
ции системы» можно было бы добавить слова «в заданный момент времени». Однако,
как отмечено выше, мы отвлеклись от временной зависимости волновой функции ста¬
ционарного состояния, и это было допустимо именно потому, что, как можно пока¬
зать, квадрат модуля волновой функции стационарного состояния (или, что то же
самое, распределение вероятности для стационарного состояния) не зависит от
времени.Такая вероятностная интерпретация |i|)|2 предполагает, что выпол¬
няется так называемое условие нормирования волновой функции к 1,
т. е.J | г|з |2 dx = 1 (dx = dxi ... dxn)*ОСмысл условия нормирования г|) к 1 очень прост: достоверно, что
хотя бы одна конфигурация системы (в указанном выше понимании)
имеет место, а вероятность достоверного события равна 1.Математические трудности, связанные с нахождением точных вол¬
новых функций систем многих частиц, например многоэлектронных ато¬
мов и молекул, столь велики, что в настоящее время точные волновые
функции известны лишь для немногих простейших случаев. Расчет слож¬
ных систем осуществляется различными приближенными методами кван¬
товой механики. Приближенные квантово-механические расчеты элек¬
тронных оболочек атомов и молекул составляют в настоящее время
основное содержание квантовой химии.Большинство методов квантовой химии основано на так называе¬
мом орбитальном описании, при котором приближенная волновая функ¬
ция атома или молекулы строится с учетом принципа Паули из одно¬
электронных волновых функций, т. е. из функций, каждая из которых
зависит от пространственных координат только одного электрона. Такие
исходные волновые функции называются орбиталями. Орбитали атома
называются атомными (сокращенно АО), а орбитали молекулы моле¬
кулярными орбиталями (сокращенно МО).Атомные орбитали, естественно, привлекаются и для построения
волновых функций молекул в качестве «исходного материала», что со¬
ответствует обычной точке зрения на молекулу как на частицу, образо¬
ванную из атомов.Для орбитального описания электронной оболочки атома или моле¬
кулы принцип запрета Паули может быть выражен так: каждая орби¬
таль может быть занята не более чем двумя электронами, причем два
электрона в одной и той же орбитали обязательно имеют разные значе¬
ния спин-координаты (иначе говоря, имеют антипараллельные спины).Следует заметить, что выбор орбиталей при построении одной и той
же волновой функции молекулы в целом, вообще говоря, не вполне
однозначен.Антисимметричную волновую функцию молекулы ищут обычно в
виде детерминанта или линейной комбинации детерминантов. Элемен¬
тами такого детерминанта являются так называемые спин-орбитали.
Спин-орбиталь — это одноэлектронная волновая функция, получаемая
из орбитали умножением ее на «спин-функцию», описывающую спиновое
состояние отдельного электрона. Так как проекция спина на некоторое
выделенное направление может иметь лишь два значения ( + ’/г и —'/г),
то возможны лишь два спиновых состояния электрона и, следовательно,* Интеграл берется по всему Зя-мерному координатному пространству, в кото¬
ром определен |г|з|2 как функция 3/1 пространственных координат, а суммирование
распространяется на все возможные комбинации значения спин-координат всех частиц
системы (таких комбинаций всего 2").
222КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯтолько две такие спин-функции. Их обычно обозначают символами а
для а — -Н/г и 0 для ст = —'/2.В большинстве случаев орбитальные методы квантовой химии осно¬
вываются на так называемом одноэлектронном приближении, в котором
каждый электрон рассматривается как находящийся в определенном
стационарном состоянии в поле всех ядер и остальных электронов си¬
стемы (атома или молекулы), причем обычно ядра предполагаются не¬
подвижными.Каждый достаточно широко применимый приближенный метод рас¬
чета порождает некоторый теоретический язык, полезный на известном
уровне изучения и для известного круга задач.ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВВ одноэлектронном приближении волновая функция атома, как ска¬
зано выше, строится из орбиталей. С каждой орбиталью связан опреде¬
ленный набор характеризующих ее квантовых чисел. Набор квантовых
чисел атомной орбитали включает три квантовых числа: главное кван¬
товое число п, орбитальное квантовое число / и магнитное квантовое
число т. Для главного квантового числа п возможны значения 1, 2, 3 ...
Главное квантовое число определяет энергию электрона для зодородо-
подобных атомов точно, а для остальных атомов — лишь приближенно,
так как в последнем случае энергия зависит и от орбитального кванто¬
вого числа I. Совокупность элек-
■ тронов, заполняющих орбиталис одинаковым значением п, ча¬
сто называют «слоем».Орбитальное квантовое чи¬
сло I определяет орбитальный
момент количества движения
электрона. При заданном зна-ВысокаяdаSШзгпял— 1Рис. 34. Энергетические уровни орбиталей
нейтральных атомов.Рис. 35. Граничная по¬
верхность 1 s-орбитали.чении п орбитальное квантовое число I может принимать значения
О, 1,2, ...,(« — 1). Орбитальное квантовое число определяет и симмет¬
рию орбитали. Следовательно, оно определяет и симметрию распреде¬
ления плотности вероятности, а тем самым и симметрию пространствен¬
ного распределения заряда электрона (так называемого «электронного
облака» орбитали). Общеприняты следующие обозначения атомных ор¬
биталей, заимствованные из атомной спектроскопии и классифицирую¬
щие атомные орбитали по значению орбитального квантового числа:
s (1 = 0), р (1=1), d (1 = 2), f (/ = 3) и т. д. Связь орбитального
квантового числа с энергией электрона видна из схемы энергетических
уровней (рис. 34).Магнитное квантовое число m определяет проекцию момента коли¬
чества движения электрона на некоторое выделенное направление. При
КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ223заданном значении I квантовое число т может принимать 2/х+. 1 зна¬
чений:-(/- 1), .... - I, о, 1, (/- 1), IСвойства симметрии атомных орбиталей имеют большое значение
для понимания явления химической связи. С этой же точки зрения су¬
щественным является поведение орбитали с ростом расстояния от атом¬
ного ядра (радиальная зависимость орбитали). Графическое представ¬
ление зависимости атомной орбитали от пространственных координатРис. 36. Граничные поверхности 2р-орбиталей.невозможно, так как это требовало бы обращения к четырехмерному
пространству. Однако возможны вспомогательные приемы изображения
на плоском рисунке, с помощью которых достигается известная степень
наглядности, помогающая в качественных применениях орбиталей. На
рис. 35—37 показаны так называемые граничные поверхности для S-,
2р- и Зй?-орбиталей.v.-'rt; .. ■.•.sr.'дШ wifг 'г‘'40?WFi+ I-ЛЖ"•«IB*'dyz-opdumanbJrуdzz-орбитальРис. 37. Граничные поверхности За!-орбиталей.dxz-yz -орбитальЭто представление имеет качественный характер, и потому значение главного
квантового числа для него не существенно. Характер граничных поверхностей при
таком качественном представлении определяется в основном угловой зависимостью и
потому сохраняется и для приближенных атомных орбиталей, поскольку для послед¬
них характер угловой зависимости тот же, что и для точных.Граничная поверхность ограничивает в трехмерном пространстве
такой объем, что вероятность нахождения в нем электрона достаточно
велика, а значение орбитали на самой поверхности постоянно по
224КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯабсолютной величине *. Символы координат или функций от координат,
служащие индексами при обозначениях орбиталей, характеризуют угло¬
вую зависимость атомной орбитали. Атомная орбиталь с заданным зна¬
чением / вырождена (2/-f- 1)-кратно. Это значит, что существует 21 + 1
орбиталей с одним и тем же значением энергии; s-орбиталь не вырож¬
дена, р-орбиталь вырождена трехкратно, а d-орбиталь вырождена пяти¬
кратно (рис. 37).s-Орбиталь имеет сферическую симметрию; рх-, ру- и рг- орбитали
имеют ясную направленность вдоль соответствующих координатных
осей, относительно которых они обладают цилиндрической симметрией **.
Они антисимметричны относительно координатных плоскостей уг, хг,
ху***, и, следовательно, эти плоскости являются для них соответственно
узловыми (т. е. рд-орбиталь обращается в нуль всюду в плоскости уг,
ру-орбиталь — всюду в плоскости xz и рг-орбиталь— всюду в плоско¬
сти ху). Симметрия rf-орбиталей также видна из рис. 37****.Квантовые числа п, I и т принадлежат орбиталям, а электрону они
принадлежат постольку, поскольку он находится в данной орбитали
(«занимает» данную орбиталь). Кроме них существует четвертое кван¬
товое число — спиновое, более непосредственно принадлежащее элек¬
трону, определяющее ориентацию спина электрона относительно некото¬
рого выделенного направления и имеющее лишь два возможных значе¬
ния + V2 и —'/г- Чаще всего его обозначают буквой s. Таким образом,
полный набор квантовых чисел для электрона в атоме содержит четыре
квантовых числа п, I, т, s. Электроны атома с одинаковыми значениями
квантовых чисел п и I называются эквивалентными.Для электронных оболочек атомов в одноэлектронном описании
принцип запрета Паули часто выражают в следующей, более частной
форме: в электронной оболочке атома не может быть двух электронов,
для которых значения всех четырех квантовых чисел соответственно
равны.* Следовательно, постоянным на граничной поверхности является и значениеI |2 f-ф2 для действительной орбитали). На приводимых рисунках точечный характер
изображения преследует лишь цель создать впечатление трехмерности. Но иногда
вместо таких рисунков приводят плоские сечения граничных поверхностей и тогда
точечное изображение позволяет, конечно, лишь грубо качественно указать на ха¬
рактер изменения п распределении плотности. Надо иметь в виду, что изображен¬
ные на рис. 36 и 37 граничные поверхности не проходят через начало координат.** Цилиндрическая симметрия орбитали относительно данной оси означает, что
эта ось является осыо вращения данной орбитали, т. е. функция сохраняет свое зна¬
чение при любом повороте вокруг этой оси.*** Т. е. меняют знак, сохраняясь по абсолютной величине, при отражении в этих
плоскостях.**** В отношении представленных на рис. 36 и 37 2p-и З^-орбиталей следует, ради
точности, отметить, что рг- и йгз-орбитали соответственно тождественны с р0 (рт = 0)
и do (dm = o) (здесь т — магнитное квантовое число), которые действительны. рх- и
р^-орбитали являются действительными линейными комбинациями комплексных ор¬
биталей р+1 и р-i (здесь +1 и —1 являются значениями т), а орбитали dxy, dx,\
dyz и dX2_y2 — различными действительными линейными комбинациями, построен¬
ными из d+i и 1 (dyz и dxz) и из rf+2 и d_2 (dxy и dx2_y2). Например, орбитали рх
и ру связаны с р+1 и р_i так:Px = (P + i + P-i)rf 2 и ру^~ \(р + 1 ~где i — мнимая единица.Рг- и йг!-орбитали имеют цилиндрическую симметрию относительно оси г именно
потому, что для них т — 0 (предполагается, что ось г совпадает с физически выде¬
ленным направлением). При наличии магнитного поля следует применять орбитали
с определенным значением квантового числа т, т. е., например, не рх и ру, а р~\
и р+1 и т. д.
КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ225Спин и принцип Паули определяют для атомов весь ход постепен¬
ного заполнения электронами атомных орбиталей в порядке возрастания
их энергий, число же электронов возрастает с положительным зарядом
ядра. Поэтому, с точки зрения одноэлектронного описания, последова¬
тельность уровней орбитальных энергий, спин и принцип Паули опреде¬
ляют всю структуру периодической системы Менделеева.Некоторые характеристики слоя и периода в системе Менделеева
весьма просто выражаются как функции квантовых чисел п и / соот¬
ветственно. Именно максимальное возможное число электронов в слое
выражается через главное квантовое число слоя пN max “ 2rt2а длина периода L определяется максимальным значением орбитального
квантового числа I, фактически достигаемым в периоде:L = 2 (/шах + О2Распределение электронов в атоме по группам эквивалентных элек¬
тронов называется электронной конфигурацией атома. Так, электрон¬
ная конфигурация атома углерода в основном состоянии записывается
следующим образом*: ls22sz2p2. Однако в такой записи электроны зам¬
кнутых внутренних слоев обычно опускаются, и тогда в нашем примере
электронная конфигурация атома углерода записывается: 2s'l2p2.Часто бывают удобны схематические записи конфигураций с неко¬
торой детализацией. Например, для основного состояния атома угле¬
рода:11 1v2S 2рЗдесь каждая стрелка соответствует электрону, а ее направления —
двум возможным ориентациям спина электрона. Электронная конфигу¬
рация основного состояния атома азота представляется схемой:tl I t fV /Zs ZpВ обоих случаях число электронов с параллельными спинами в
;;-орбиталях (сокращенно — число р-электронов) второго слоя — мак¬
симально возможное для данной конфигурации. Это находится в соот¬
ветствии с правилом Хунда, утверждающим, что для основного состоя¬
ния, в пределах группы эквивалентных электронов, число электронов
с параллельными спинами максимально**.ОСНОВЫ МОЛЕКУЛЯРНО-ОРБИТАЛЬНОГО ОПИСАНИЯ
ЭЛЕКТРОННЫХ ОБОЛОЧЕК МОЛЕКУЛНаиболее широко применяемый квантово-механический метод рас¬
чета электронных оболочек молекул — это в настоящее время метод мо¬
лекулярных орбиталей (сокращенное обозначение — метод МО) ***.* Двойка в верхнем индексе не показатель степени, а число электронов в данной
орбитали.** Правило Хунда обобщается и соответствующей форме и на электронную
структуру молекул.*** Самые общие идеи метода ЛЮ содержатся н методе самосогласованного
поля Хартри — Фока. Различные варианты расчета но методу АЮ и его теоретический
язык развивались в работах многих ученых и прежде всего Хунда, Герцберга, Хюк-
ксля, Малликеаа, Коулсона, Ротаана
226КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯЕго обычной формой является так называемое приближение JIKAO,
в котором принимают, что молекулярная орбиталь есть линейная ком¬
бинация атомных орбиталей, причем тогда самый метод называют мето¬
дом МО JIKAO.При этом исходят из допущения, что вблизи каждого атомного ядра
молекулярная орбиталь достаточно мало отличается от соответствую¬
щей атомной орбитали, входящей в состав линейной комбинации (точ¬
нее, пропорциональна ей), что соответствует химической точке зрения
на молекулу как образованную из атомов, для которых часть электро¬
нов, а именно электроны связи, стала общей. Таким образом, в методеМО JIKAO предполагается, что каждая
молекулярная орбиталь может б^ггь за¬
писана в видеПФ (т) = 2 СЛ W 0)i=\где т — совокупность пространственных
координат электрона; ф; (i — 1, 2, ...п)—атомные орбитали (причем не¬
сколько атомных орбиталей может при¬
надлежать одному и тому же атому), а с,- — числовые коэффициенты.
Далее, единственно для простоты записи, предполагается, что все фг и
все с г действительны *.Согласно сказанному ранее, распределение плотности вероятности,
а следовательно, и распределение плотности заряда электрона («элек¬
тронной плотности») в пространстве для молекулярной орбитали
выражается какП ПФ2=2СМ + 2 с«с/ФгФ/’ (2)i—I i, jПопарные произведения фг-ф3- играют важную роль в одноэлектронном
описании электронной структуры атомов и молекул. Эти произведения,
умноженные на элемент объема dx и суммированные (точнее, интегри¬
рованные по всему пространству), определяют так называемое «пере¬
крывание» атомных орбиталей фг и ф^ представляющее собой некоторую
определенную меру совпадения.Произведение ф;ф3йт часто обозначают термином дифференциальное
перекрывание орбиталей фг и cpj.Величина перекрывания двух атомных орбиталей фд и фв атомов А
и В зависит от ряда факторов. Прежде всего, перекрывание фА и фв
отлично от нуля только в том случае, если эти орбитали имеют одина¬
ковую симметрию относительно оси АВ, соединяющей ядра атомов А
и В. Пере,крывание существенно, зависит от типов симметрии обеих
орбиталей самих по себе. Надо иметь в виду также зависимость пере¬
крывания от главных квантовых чисел обеих атомных орбиталей. На¬
конец, перекрывание очень сильно зависит от расстояния между ядрами
атомов А и В, так что и при самых благоприятных прочих перечислен¬
ных условиях перекрывание близко к нулю, если расстояние А—В до¬
статочно велико.Качественно влияние симметрии фА и фв относительно оси AB(z) на
перекрывание видно из ряда примеров, приведенных на рис. 38—41.Рис. 38. Перекрывание двух 2s-
орбиталей в молекуле Д2; слу¬
чай сг-связи.* В пределах данного рассмотрения это не уменьшает его общности.** Для краткости записи мы опускаем указание координат при символах ор¬
биталей.
КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ227В упрощенных вариантах метода МО «взаимодействие» орбиталей
Фа и фв тем больше, чем больше их перекрывание, а если перекрывание
равно нулю, то и взаимодействие их равно нулю. Обычно в этих формах
метода МО принимают, что взаимодействие пропорционально перекры¬
ванию.Рис. 39. Перекрывание двух 2рг-орбиталей в молекуле
А2; случай о-связи.Условие нормирования к 1, лежащее в основе вероятностной интер¬
претации квадрата модуля волновой функции при предположениях, сде¬
ланных выше относительно ф; и с и выражается для молекулярной орби¬
тали i|)(t) равенством:п гг .J ф2 dx ~ с\ + VJ cicjsU = 1 (3)i—l I, i (i¥=!)где sn и есть перекрывание атомных орбиталей фj и ф3- (интеграл пере¬крывания, таккак s,-j обозначает интеграл J ф{фу dx; О‘I)•I -кРис. 40. Перекрывание 2рх-
орбиталей в молекуле А2; слу¬
чай л-связи.Рис. 41. Перекрывание угловых множите¬
лей орбиталей 2яд и 2рув- При такой ори¬
ентации 2рув равно нулю вследствие раз¬
личной симметрии орбиталей относительно
оси АВ (г), поэтому равно нулю и пере¬
крывание орбиталей в целом.В простейшей форме расчета по методу МО JIKAO, которая далее
и имеется в виду, интегралами s,j пренебрегают, и условие нормирова¬
ния приобретает вид£*?=» * (4)
i=iТогда на основании уравнения (4) каждое с\ интерпретируют как
вероятность обнаружить электрон вблизи i-того атомного ядра. Числен¬
ные значения коэффициентов с,- определяются из условия минимума
энергии электрона в состоянии г|>(т).Если в расчете выбрано п исходных атомных орбиталей, то метод
МО ЛК.АО доставляет, в качестве решения задачи на минимум энергии
228КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯэлектрона в состоянии 1J3 (т), п молекулярных орбиталей *МТ) с соответ¬
ствующими им значениями орбитальных энергий е;. При этом одному
и тому же значению орбитальной энергии может соответствовать и более
одной молекулярной орбитали. Если некоторому значению е; соответ¬
ствует k молекулярных орбиталей, то говорят, что это значение е;
А-кратно вырождено.В основном (низшем по энергии) состоянии молекулы электроны,
учитываемые в расчете, должны, естественно, иметь наиболее низкие
значения орбитальной энергии, т. е. они должны заполнять орбитали с
наименьшими значениями е,. При этом должен удовлетворяться принцип
запрета Паули, а в случае вырожденных е;, вообще говоря, и приведен¬
ное выше правило Хунда. Последовательность орбитальных энергий,
расположенных в порядке их возрастания, называют схемой энергетиче¬
ских уровней молекулы (точнее, системы электронов, учитываемых в
расчете). При этом на шкале энергий выбирается начало отсчета, есте¬
ственное по физическому смыслу задачи (например, значение энергии
для некоторой атомной орбитали), и тогда молекулярные орбитали со
значениями орбитальных энергий е;, расположенными ниже начала от¬
счета («нуля» на шкале энергий), называются связывающими; орбитали
с е,, расположенными выше начала отсчета, — разрыхляющими или ан¬
тисвязывающими, а орбитали со значением ы, равным выбранному на
шкале энергий началу отсчета, называются несвязывающими.Связывающие молекулярные орбитали имеют в' областях между
атомными ядрами электронную плотность, в целом повышенную сравни¬
тельно с несвязывающими и тем более сравнительно с разрыхляющими
молекулярными орбиталями.В простейших вариантах метода МО полная энергия системы элек¬
тронов равна сумме орбитальных энергий е,, умноженной на соответ¬
ствующие «числа заполнения» Vt, т. е. на числа электронов, заполняю¬
щих орбитали i|)i(f), и таким образомПЕ = 2 vie{ (vt = 0> 1 или 2)
г=1В менее упрощенных вариантах метода МО в это равенство вво¬
дится поправка.Сравнением вычисленной по методу МО в так называемом я-элек-
тронном приближении (см. ниже) полной я-электронной энергии моле¬
кулы с полной я-электронной энергией, вычисленной тем же методом для
той же я-электронной системы, но без учета некоторых взаимодействий
между атомными орбиталями соседних атомов, находят так называемую
энергию делокализации (иначе, энергию сопряжения). Энергия делока¬
лизации определяется как разностьрп рЛ рПnd~~n 0 пгде Ео — я-электронная энергия системы — эталона; Ея — я-электрон-
ная энергия данной молекулы.Например, я-электронную энергию молекулы бензола сравнивают
с суммой я-электронных энергий тре^ изолированных л-связей. Энергия
делокализации часто называется и энергией резонанса в я-электронном
приближении Хюккеля.Так как метод молекулярных орбиталей, наряду с заполненными
орбиталями, доставляет некоторый запас вакантных орбиталей, он рас¬
полагает естественным и простым языком для физического объяснения
характера электронного спектра молекулы. При этом возбуждение мо¬
лекулы рассматривается как переход электронов из заполненных орби¬
талей в вакантные.
КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ229Энергия верхней занятой (хотя бы частично) молекулярной орби¬
тали, взятая с обратным знаком, представляет в методе МО потенциал
ионизации молекулы, а энергия низшей вакантной орбитали, также взя¬
тая с обратным знаком, — сродство молекулы к электрону.Простейшие формы метода МО являются параметрическими мето¬
дами. Это означает, что результаты расчета выражаются через некото¬
рые основные параметры. Значения этих параметров берут из опыта, и
в этом смысле расчет является и полуэмпирическим. Основными пара¬
метрами расчета обычно служат так называемые «кулоновские инте¬
гралы» (а;), характеризующие энергии атомных орбиталей, и так назы¬
ваемые «резонансные интегралы» (рг;), характеризующие взаимодей¬
ствия атомных орбиталей. На языке простейших форм метода МО. энер¬
гии часто выражают в единицах р, принимая за единицу измерения не¬
который «резонансный интеграл» р.Существенной характеристикой молекулярных орбиталей является
их симметрия. Симметрия молекулярных орбиталей влияет на прочность
осуществляемых ими химических связей.В органических молекулах очень распространены двухцентровые
молекулярные орбитали, для которых ось, соединяющая атомные ядра,
является осыо вращения и которые поэтому обладают цилиндрической
симметрией. Это пример так называемых а-орбиталей. Другой очень
важный и часто встречающийся тип молекулярных орбиталей — орби¬
тали, антисимметричные * относительно плоскости, содержащей в себе
ядерную конфигурацию молекулы или некоторый ее фрагмент. В химии
такие орбитали чаще всего называют л-орбиталями, что, однако, не все¬
гда согласуется с более строгой классификацией, в которой названия и
обозначения орбиталей по симметрии вводятся следующими определе¬
ниями.Молекулярная орбиталь 1)з(т) называется ст-орбиталью, если она
имеет ось симметрии, вращение относительно которой не изменяет знака
ф(т). о-Орбиталь всегда имеет плоскости симметрии.Молекулярная орбиталь г|з (т) называется л-орбиталью, если для нее
можно указать ось, вращение относительно которой меняет знак г|з(т)
при повороте на 180°. л-Орбиталь имеет одну и только одну плоскость
антисимметрии, проходящую через указанную ось.Молекулярная орбиталь г|з(т) называется 6-орбитальнэ, если для нее
можно указать ось, вращение относительно которой меняет знак г|з(т)
при повороте на 90°. 6-Орбиталь имеет только две плоскости антисим¬
метрии, проходящие через указанную ось.Существуют и более сложные типы орбиталей. Роль физически опре¬
деленных осей в этой классификации играют оси симметрии молекул или
их фрагментов.В органической и элементоорганической химии обычно применяется
упрощенная классификация молекулярных орбиталей, не претендующая
на строгость и полноту. Именно, как уже было сказано выше, ст-орбита¬
лями называют орбитали с аксиальной симметрией, но иногда за при¬
знак a-типа принимают симметричность относительно некоторой плоско¬
сти; л-орбиталями в рамках упрощенной классификации называют орби¬
тали, антисимметричные относительно плоскости ядерной конфигурации
молекулы или некоторого ее фрагмента.Из сказанного видно, что отнесение орбитали к тому или иному типу
симметрии всегда предполагает выбор некоторого элемента симметрии* Орбиталь называется антисимметричной относительно некоторой плоскости,
если при отражении в этой плоскости она меняет знак, сохраняясь по абсолютной
величине.
230КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ(ось симметрии, плоскость симметрии и т. д.) и основывается на поведе¬
нии орбитали относительно выбранного элемента симметрии. Поэтому,
например, понятно, что отнесения орбитали к типам симметрии по более
строгой и по упрощенной классификации могут не совпадать. Так, низ¬
шая по энергии молекулярная орбиталь молекулы бензола относится
к с-типу по более точной классификации, привлекающей в данном слу¬
чае в качестве критерия .поведение орбитали относительно оси 6-го по¬
рядка молекулы, и к я-типу по упрощенной классификации, исходящей
из поведения орбитали относительно плоскости ядерной конфигурации
молекулы.Согласно сказанному выше о перекрывании, связь, осуществляемая
молекулярной орбиталью, тем прочнее, чем больше перекрывание
атомных орбиталей фд и фв соседних атомов. Так как, вообще говоря,
перекрывание атомных орбиталей больше в случае образования связы¬
вающей сг-орбитали, чем в случае связывающей я-орбитали, то, как
правило, ст-орбитали связывают прочнее, чем я-орбитали.При качественном рассмотрении приведенные терминология и обо¬
значения часто переносятся с молекулярных орбиталей на осуществляе¬
мые ими связи, и поэтому говорят о ст-связях, я-связях и т. д. Например,
из сказанного о сравнительной прочности связывания о- и я-орбиталями
можно заключить, что, вообще говоря, ст-связи прочнее я-связей.Интерпретация понятия химической связи на молекулярно-орбиталь¬
ном языке представляет одну из основных задач квантрвой химии, в ряде
важных случаев качественно удовлетворительно решенную. Например,
уже неполное молекулярно-орбитальное описание двухатомных молекул
показывает, что атомы А и В могут связываться более чем одной мо¬
лекулярной орбиталью. Сравнительно простым является молекулярно¬
орбитальное описание случаев, для которых химики давно уже стали
пользоваться представлением о кратных (двойных, тройных) связях.На рис. 42 с помощью граничных поверхностей представлены ст-орби¬
таль, я-орбиталь и их комбинация — двойная связь.Как было сказано выше, численные значения коэффициентов моле¬
кулярных орбиталей определяются из условия минимума энергии г)?(т).Каждую молекулярную орбиталь ^(т) можно представить в виде
набора {си} ее коэффициентов, условившись об определенной нумерации
атомных орбиталей фг. Набор {сг/} можно записать несколько подробнее
в форме (с,у, с2/, ..., cnj) *. С помощью наборов {с2/} можно определить
целый ряд интересных и важных характеристик молекулярных орбита-
лей и электронных оболочек молекул. Так, например, на основе наборов
{сг/} очень естественно определяется понятие о ^-центровой молекуляр¬
ной орбитали, а именно: если в наборе {cij}k{ks^n) коэффициентовдвойная связьРис. 42. Представление при помощи «граничных поверхно¬
стей» cr-орбнтали, я-орбнтали и двойной связн.* Т. е. в виде я-мерного вектора, что отражает алгебраический характер решения
задачи методом МО ЛКАО,
КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ231существенно отличны от нуля, а прочие п—-k пренебрежимо малы, то
молекулярная ор'биталь называется k-центровой.Если k = п, то молекулярная орбиталь может быть названа пол¬
ностью дслокализованной. Если k <; п и коэффициентыct cinj, ..., ctсущественно отличны от нуля, то орбиталь локализована на атомах, ко¬
торым принадлежат атомные орбитали фг , ф(2, фtk. Двухцентровая
орбиталь представляет собой простейший частный случай локализован¬
ной молекулярной орбитали. Так как, вообще говоря, связывающие ор¬
битали имеют сравнительное несвязывающими и разрыхляющими боль¬
шую электронную плотность в областях между ядрами, то ^-центровая
связывающая орбиталь имеет более равномерное распределение элек¬
тронной плотности сравнительно с /г-центровой несвязывающей или
разрыхляющей орбиталью.Знание коэффициентов Сц позволяет далее описать на языке моле¬
кулярно-орбитальной теории некоторые черты распределения электрон¬
ной плотности молекулы, полезные для объяснения реакционной способ¬
ности молекул. Для выражения такого рода информации, содержащейся
в наборах {с{]}, вводится определяемая через коэффициенты с{/ система
электронных индексов молекулы, часто записываемая в виде так назы¬
ваемой молекулярной диаграммы.Основная идея системы электронных индексов и молекулярной диа¬
граммы состоит в том, что при априорно заданных «жестких» атомных
орбиталях ф; «гибкой» характеристикой, в которой должны отражаться,
хотя бы в первом приближении, основные черты распределения элек¬
тронной плотности, возникающие вследствие образования молекулы, яв¬
ляются именно наборы {cif} коэффициентов молекулярных орбиталей.Определяемая ниже система электронных индексов применима в
такой простой форме преимущественно к л-электронным системам
молекул, т. е. к системам электронов, находящихся в л-орбиталях мо¬
лекул. л-Электронные системы имеются в молекулах с кратными и
сопряженными связями и молекулярно-орбитальные расчеты их состав¬
ляют содержание так называемого л-электронного приближения, а про¬
стейшая форма последнего обычно называется л-электронным приближе¬
нием Хюккеля.Пренебрежение интегралами перекрывания является в л-электрон-
ном приближении существенно менее грубым упрощением, чем в расче¬
тах, включающих ст-орбитали, так как, вообще говоря, перекрывание
атомных орбиталей в л-орбиталях молекул значительно меньше, чем
в а-орбиталях.Пусть .расчет по методу МО ЛКАО для задачи об N электронах
при п исходных атомных орбиталях ф; приводит к набору п молекуляр¬
ных орбиталей ip,; пусть «число заполнения» (т. е. число электронов,
заполняющих xjjjj равно Vj (возможные значения vj—О, 1; 2), так чтоП2 v- = N, и пусть число атомов равно п. Первый электронный индекс —
(=1 1эффективный заряд i-того атома вводится следующим образом. Опре¬
делимь - i v?/y=iВыше было сказано, что c2if приближенно можно интерпретировать
как вероятность для электрона в состоянии г|); быть обнаруженным
вблизи /-того атомного ядра; поэтому сумма с2(/, распространенная на
все п молекулярных орбиталей с учетом чисел заполнения, может
232КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯинтерпретироваться как «эффективное число электронов» на г-том
атоме. Теперь эффективным зарядом i-того атома Qu по определению,
называют разностьQl—Qi Q{где qУ — исходное число электронов, доставляемых t'-тым атомом и учи¬
тываемых в расчете. Очевидно, что Qf может быть числом положитель¬
ным, отрицательным или равным нулю.Второй электронный индекс предназначается для характеристики
связей, осуществляемых молекулярными орбиталями. Он называется по¬
рядком связи и вводится следующим образом.Выберем какую-нибудь пару соседних атомов, например с номерами
г и s. Пусть далее / — номер одной из п найденных в расчете молекуляр¬
ных орбиталей, т. е. пустьП= 2 Cij4l
г=1так что плотность естьП П■ф/=2сг/<Р?+ 2 с(/сб/ФгФб
/= 1 I, k—\; i=£kВозьмем из каждой молекулярной орбитали t|)j (/ = 1, 2, ..., п)
произведение crjcSj при фиксированных г и s; из таких произведений
составим сумму, распространенную по всем грд, и теперь определим поря¬
док связи Prs между г-ым и s-ым атомами:ПPrs = 2 vicrlcslгде Vj — как и раньше, соответствующие числа заполнения молекуляр¬
ных орбиталей.В простейшем варианте метода МО ЛКАО понятие о порядке связи
вводится обычно только для пар соседних атомов. Понятие о порядке
связи введено Коулсоном. Оно представляет собой обобщение и уточне¬
ние понятия о кратности связи с точки зрения теории молекулярных ор¬
биталей и, вообще говоря, Prs не обязательно является целым числом *.
Являясь мерой связанности двух соседних атомов, порядок связи между
ними характеризует вместе с тем связь и с точки зрения прочности.Оба введенных индекса — эффективный заряд и порядок связи — без
груда обобщаются на случай, когда число атомных орбиталей больше
числа атомов. В самом деле, в приводимом выше рассмотрении номер
атомной орбитали есть также и номер атома; если же число орбиталей
больше числа атомов, нужно еще ввести суммирование по номерам атом¬
ных орбиталей одного и того же атома (при определении эффективного
заряда атома) и суммирование по всем парам атомных орбиталей двух
выбранных соседних атомоЁ, представленным в молекулярных орбита¬
лях, при определении порядка связи.Третьим электронным индексом является индекс свободной валент¬
ности (F) атома в молекуле. Его определение строится так.Предположим, что для r-ого атома молекулы известно максималь¬
ное возможное значение суммы порядков связей в молекуле,, и пусть это
будет константа Ртах. Пусть 2 Л-s есть сумма порядков всех связей, вкоторых r-ый атом участвует в данной молекуле; здесь индекс суммиро¬* Pra иногда бывает и отрицательным.
КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯвания s пробегает номера всех атомов, соседних с r-ым атомом. Тогда
индекс свободной валентности r-ого атома в данной молекуле опреде¬
ляется так:F —Р' —У'Рл г * max 1 rssНа языке я-электронного приближения определенные выше элек¬
тронные индексы называются п-электронными. Иногда я-электронные
порядки связей называются также подвижными порядками связей.
В рамках я-электронного приближения часто кроме подвижных поряд¬
ков связей говорят и о полных порядках связей, уславливаясь порядок
каждой 0-связи полагать равным 1 по определению.Система электронных индексов органической молекулы может быть
записана на диаграмме ее «0-скелета», и полученное так изображение
молекулы называется молекулярной диаграммой.Ниже приводится молекулярная диаграмма 1,3-бутадиена.В молекуле 1,3-бутадиена имеет место 5р2-гибридизация углерода
(см. стр. 240), 0-скелет ее копланарен. Молекулярно-орбитальный расчет
молекулы бутадиена в я-электронном приближении Хюккеля приводит
для него к молекулярной диаграмме (порядки 0-связей С — С приняты
равными 1, эффективные заряды равны нулю, л-связи не показаны;
справа для сравнения дана молекулярная диаграмма этилена):Н\12 3 41,894 СН |',447 СН | 894 Сн/1 I I Гн0,833 0,391 0,391 0,838Из молекулярной диаграммы видно, что связи 1—2 и 3—4 почти
двойные (порядок связи 1,894), индексы свободной валентности Fx и F4
близки к значениям F в молекуле этилена, a F2 и F3 очень близки к зна¬
чениям Fb молекуле бензола (0,40).Энергия делокализации по сравнению с двумя локализованными
я-связями в единицах р равна 0,47 («8 ккал/моль).Приведем далее молекулярную диаграмму азулена (ароматического
углеводорода, который будет рассмотрен в разделе о небензоидных аро¬
матических системах, см. ч. II).Числа в вершинах циклов обозначают эффективные заряды атомов;
стрелки, проведенные от вершин, — индексы свободной валентности;
числа на линиях 0-связей — подвижные порядки связей; симметрично
к пунктирной линии — соответственно те же индексы.+0,15В азулене, в противоположность бутадиену и бензолу, заряды С-ато-
мов отличны от нуля.Нч■ 2,000н'| рн
0.866 0,866* Ртах для атома углерода в 5р2-гибридизованном состоянии имеет значение
4,732 при предположении, что порядок каждой о-связи атого атома равен 1.
231КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯНаличие плоскости симметрии позволяет указывать индексы каж¬
дого рода только для половины диаграммы. Вершины перенумерованы
обычным образом.На основании молекулярной диаграммы азулена можно, например,
ожидать, что электрофильные реагенты будУт атаковать молекулу пре¬
имущественно в положение 1, нуклеофильные — преимущественно в по¬
ложения 4 и 6, а свободные радикалы — в положения 3 и 4 (если рас¬
сматривается основное состояние молекулы).Следует отметить, что кроме определенных выше электронных ин¬
дексов на их основе вводятся и другие интересные характеристики, на¬
пример различные типы поляризуемостей атомов и связей.Наконец, говоря об электронных индексах и молекулярных диаграм¬
мах, следует указать, что они приобрели большое значение, и в настоя¬
щее время создан ряд справочников по этим характеристикам молекул
(справочники Коулсона и Стрейтвизера, Стрейтвизера и Браумэна,
Хейльброннера).Тогда как основная идея метода МО JIKAO состоит в переходе от
атомных орбиталей разделенных атомов к молекулярным орбиталям
молекулы в соответствии с симметрией задач и принципом Паули, воз¬
можен и другой подход.Представим себе, что ядра атомов слились в одно, более сложное,
ядро и что электроны распределились теперь по атомным орбиталям
возникшего «объединенного атома» в соответствии с последовательностью
энергетических уровней в нем и с принципом Паули. Тогда можно поста¬
вить вопрос о том, какие молекулярные орбитали будут возникать из
атомных орбиталей объединенного атома и окажутся заполненными при
некотором разделении ядра объединенного атома на исходные атомные
ядра (опять-таки в соответствии с симметрией и принципом Паули).
Такой вариант метода МО называется методом объединенного атома.РЕЗОНАНС СТРУКТУР ИЛИ МЕ30МЕРИЯВторой широко применяемый способ описания некоторых сторон
электронной структуры молекул связан с другим методом расчета элек¬
тронных оболочек молекул — с так называемым методом валентных
схем (метод ВС) *. Сравнительно с молекулярно-орбитальным описа¬
нием этот способ имеет значительно более качественный характер. Зато
основные идеи метода валентных схем широко применимы вследствие
его тесной связи с аппаратом химических структурных формул.Метод валентных схем появился несколько раньше метода молеку¬
лярных орбиталей. Он возник как обобщение метода, примененного
в 1927 г. Гейтлером и Лондоном для расчета молекулы водорода. Этим
расчетом был качественно выяснен квантово-механический смысл ва¬
лентного штриха — основного символа языка химических структурных
формул. Из расчета молекулы водорода, выполненного Гейтлером и
Лондоном, следовало, что валентный штрих имеет смысл пары электро¬
нов с антипараллельными спинами. Волновая функция этой электронной
пары обеспечивает в- пространстве между двумя атомными ядрами лока¬
лизацию отрицательного заряда электронов, достаточную для удержа¬
ния обоих ядер на таком расстоянии, при котором имеет смысл рассмат¬
ривать всю систему, образованную двумя атомами, как единую моле¬
кулу.В методе Гейтлера — Лондона, обобщенном в последующих работах
Гейтлера, Румера, Слэтера, Полинга и ряда других исследователей,* Часто его называют также методом валентных связей.
КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ235приближенные волновые функции представляли собой своеобразный
перевод химических структурных формул на язык приближенного метода
квантово-механического расчета *.Для молекул, строение которых достаточно однозначно выражается
одной структурной формулой (например, метан, этилен и т. д.), форму¬
лировать приближенную волновую функцию исходя из атомных орбита-
лей (непосредственно или строя сначала приближенные волновые функ¬
ции отдельных атомов) в методе ВС нетрудно. Однако существует много
молекул, для которых такой однозначности нет. Таковы, например, моле¬
кулы с системами сопряженных связей или молекулы с внутренней иони¬
зацией. Вообще говоря, достаточная однозначность представления одной
структурной формулой возможна только для таких молекул, для кото¬
рых можно с удовлетворительным приближением считать связи двух¬
центровыми.Рассмотрение в рамках метода валентных схем молекул, не имею¬
щих однозначного представления с помощью символики структурных
формул, привело к формулированию качественно широко применяемой
и удобной (когда число возможных представлений структурными форму¬
лами не слишком велико) идеи резонанса структур **.Классическим примером молекулы, где неоднозначность представле¬
ния одной структурной формулой совершенно очевидна, является моле¬
кула бензола. Уже из соображений симметрии ясно, что формулы I и II
(так называемые структуры Кекуле)I исовершенно равноправны и должны в одинаковой степени отклоняться
от действительного положения вещей в молекуле бензола, имеющей ось
симметрии шестого порядка. Если по рецепту метода ВС построить при¬
ближенные волновые функции, соответствующие структурным формулам
бензола I и II, скажем функции фх и фн, то и для них будет справедливо
то же самое.Идея резонанса структур состоит в том, что строение молекулы,
представление которой структурной формулой неоднозначно, следует
приближенно описывать набором мыслимых структурных формул. Это
значит, что для приближенного квантово-механического расчета такой
молекулы надо образовать наилучшую линейную комбинацию правиль¬
ной симметрии из волновых функций, соответствующих отдельным мыс¬
лимым структурным формулам ***. Например, для основного состояния
молекулы бензола следует образовать волновую функцию:■ф = с1'ф1 +* Метод ВС, как и метод МО, представляет собой вариант орбитального описа¬
ния электронной структуры молекулы. В нем, как и в методе МО, может быть форму¬
лировано it-электронное приближение. Последовательное и достаточно полное развитие
методов ВС и МО позволяет установить, что в отношении вида получаемых волновых
функций оба метода по существу имеют общую основу.** Термин «резонанс» связан с формальной аналогией между уравнениями кван¬
тово-химических расчетов энергии и уравнениями, описывающими явление резонанса
в теории колебаний.*** Так как между волновыми функциями, вообще говоря, существуют линейные
зависимости, то обычно выбирают наименьший (по числу функций) набор линейно
независимых, полный в том смысле, что все возможные, не входящие в него, опреде¬
лимы через него. При этом такой набор часто называют набором канонических
структур.
236КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯВ данном случае легко было бы показать, что С\ — сц. Однако если
рассматривать вопрос полнее, то надо было бы учесть и три равноправ¬
ные между собой структурные формулы ДьюараТогда следовало бы образовать линейную комбинацию пяти соответ¬
ствующих волновых функций:Ф = a (\|ji + ■фц) + Ь (фш + Ф1У + Фу)Так как в этом случае равноценности между функциями tyi и фц,
с одной стороны, и функциями г|)ш, H’iv, — с другой, нет, то возникает
необходимость отыскания наилучшей линейной комбинации, т. е. наи¬
лучших значений коэффициентов а и Ь. Такие наилучшие значения а
и b находятся из условия минимума энергии молекулы. Волновую функ¬
цию принято называть резонансом структур tJJi, г|)ц, грш и т. д., a ijji,
^и, Н’ш и т. д. — резонансными структурами.Было бы неправильно представлять себе, что свойства молекулы,
вычисляемые с применением функции г^, окажутся средними между свой¬
ствами структур if>i, г|т, и т. д. Истинное положение достаточно
пояснить на простейшем случае, когда имеется резонанс только двух
структур:■ф = at|)i + Н>2Уже для многомерной * плотности имеем (считая функции и коэффи¬
циенты действительными):ф2 = а2ф^ + Ь2 ф| +т. е. появляется «интерференционный» член.Аналогичные «члены взаимодействия» появляются и при вычислении
средних значений физических величин по правилам квантовой механики
(поскольку значения физических величин зависят от волновой функции
не линейно, а квадратично). Особенно важно, что значение энергии,
вычисляемое для волновой функции, представляющей резонанс несколь¬
ких структур, ниже, чем для каждой из резонансных структур в отдель¬
ности. Это понятно, так как резонанс структур представляет собой их
линейную комбинацию, наилучшую именно в том смысле, что она соот¬
ветствует минимуму энергии, какой только можно получить с помощью
линейных комбинаций данных резонансных структур.Для того чтобы резонансу структур соответствовало значение энер¬
гии более низкое, чем любой структуре (чтобы, как условно говорят,
резонанс структур «стабилизовал» молекулу**), необходимо, чтобы
структуры удовлетворяли следующим условиям.1. Геометрия ядерных конфигураций структур предполагается оди¬
наковой или почти одинаковой.* Так как ф здесь многоэлектронная приближенная волновая функция, то и ф2,
т. е. соответствующая плотность, определена в многомерном конфигурационном про¬
странстве.** Иными словами, чтобы при отыскании наилучшей линейной комбинации струк¬
тур не оказалось, что она тривиальным образом сводится или почти сводится к одной,
энергетически наиболее выгодной структуре. Условие 2 особенно жесткое, затем усло¬
вие 1; условие 3 не столь жестко, но невыполнение его может свести стабилизацию
к очень малой величине.
КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ2372. Число неспаренных электронов для структур предполагается оди¬
наковым.3. Энергии, соответствующие отдельным структурам (т. е. вычисляе¬
мые с помощью соответствующих приближенных функций, построенных
согласно одним и тем же правилам метода ВС или оцениваемые при по¬
мощи определенных аддитивных схем из опытных данных), предпола¬
гаются не слишком сильно различающимися.Разность между значением энергии для энергетически наиболее вы¬
годной структуры и значением энергии для резонанса структур часто
называют энергией резонанса молекулы *.Применяя представление о резонансе структур к описанию электрон¬
ной структуры молекул, следует всегда помнить, что отдельные резонанс¬
ные структуры не выражают физически реальных состояний молекулы.На языке структурных формул резонанс изображается с помощью
двусторонней стрелки, поставленной между структурами. Например,
в случае молекулы бутадиенан\ /н н\ t 1/н
С=НС—СН=С' Ч-» хс—нс=сн—сн/ н/I ' IIРезонанс двух структур Кекуле в случае бензола записывается такКачественное описание молекулы бутадиена на языке теории резо¬
нанса выражается как резонанс структур 1 и II при незначительном
весе структуры II.Весом резонансной структуры (в- резонансе структур) называют
квадрат модуля коэффициента, с которым соответствующая ей волновая
функция входит в линейную комбинацию, представляющую резонанс
структур. Следует заметить, что при таком определении понятия веса
структуры пренебрегают перекрываниями структур.Заканчивая изложение идеи о резонансе структур, важно отметить,
что специфическим для этого подхода к описанию электронной струк¬
туры молекулы является не образование линейной комбинации волновых
функций (это весьма общий способ построения, типичный для квантовой
механики вообще), а выбор функций для образования линейной комби¬
нации. Существенным здесь является также и то, что выбираемые для
образования линейных комбинаций волновые функции являются при¬
ближенными многоэлектронными волновыми функциями молекулы в
целом.ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ
И «ВАЛЕНТНОЕ СОСТОЯНИЕ»Вся совокупность экспериментально изученных физических и хими¬
ческих свойств молекулы метана доказывает равноценность четырех
атомов водорода, одинаково связанных с атомом углерода в молекуле,
имеющей симметрию правильного тетраэдра. Еще в 1879 г. Вант-Гофф
и Ле-Бель сделали вывод, что в молекуле метана имеются четыре* Заметим, что в методе МО, в я-электронном приближении, аналогом понятия
энергии резонанса является понятие энергии делоканизации, часто, впрочем, называемой
гакже энергией резонанса.
238КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯравноценные связи между атомом углерода и четырьмя одинаково уда¬
ленными от него атомами водорода, расположенными в вершинах пра¬
вильного тетраэдра.Молекулярно-орбитальный расчет молекулы метана С учетом всех
электронов атома углерода и четырех электронов атомов водорода при¬
водит к следующей картине электронной оболочки молекулы: пять свя¬
зывающих молекулярных орбиталей заполнены десятью электронами;
самая глубокая по энергии орбиталь почти не отличается от атомной
ls-орбитали атома углерода и, в сущности, не имеет отношения к хими¬
ческой связи атомов; из остальных четырех связывающих молекулярных
орбиталей одна, более симметричная, соответствует более низкому зна¬
чению энергии, чем прочие три, менее симметричные и принадлежащие
одному и тому же, трижды вырожденному значению энергии; кроме того,
расчет доставляет еще четыре вакантные разрыхляющие орбитали.Сами по себе отдельные химические связи и отдельные молекуляр¬
ные орбитали не являются наблюдаемыми объектами и представляют
собой теоретические построения, притом принадлежащие разным уров¬
ням рассмотрения. Возникает вопрос: существует ли общая теоретиче¬
ская основа, на которой можно установить соответствие между картиной
системы четырех равноценных связей и картиной четырех связывающих
молекулярных,орбиталей, из которых одна по симметрии и энергии от¬
личается от трех остальных.Описанное положение весьма типично. Поэтому и разрешение за¬
труднения в действительности имеет очень общий характер. Направле¬
ние, в котором следует искать способ разрешения, подсказывается сле¬
дующим соображением: для решения задач, имеющих точный физиче¬
ский смысл, строго говоря, должна применяться волновая функция всей
молекулы в целом, тогда как сами по себе молекулярные орбитали отно¬
сятся, в сущности, к специфическим средствам построения волновой
функции молекулы в методе МО.Построенная из перечисленных выше молекулярных орбиталей вол¬
новая функция молекулы приводит к правильной симметрии распреде¬
ления электронной плотности и не находится в противоречии с экспери¬
ментальными данными. Что же касается молекулярных орбиталей, то
они определены не вполне однозначно.Приближенная волновая функция молекулы построена из молеку¬
лярных орбиталей так (детерминант или линейная комбинация детерми¬
нантов), что над всеми составляющими ее молекулярными орбиталями
можно одновременно совершать некоторые преобразования, относитель¬
но которых сама волновая функция молекулы инвариантна (не изме¬
няется). Оказывается, что ту же самую волновую функцию молекулы
метана можно выразить'в новых орбиталях, четыре из которых можно
с достаточным приближением считать двухцентровыми и локализован¬
ными по четырем линиям, соединяющим ядро атома углерода с ядрами
водородных атомов.Самая глубокая по энергии орбиталь сохраняет свой характер атом¬
ной ls-орбитали углерода, а четыре новые орбитали являются о-орбита-
лями и называются эквивалентными в том смысле, что при поворотах и
отражениях, переводящих правильный тетраэдр в себя самого, они пере¬
ходят друг в друга. Поэтому они равноценны в том же смысле, в каком
равноценны и четыре связи С—Н в представлении химиков. Для моле¬
кул, содержащих только ординарные связи и изолированные кратные
связи, имеет место аналогичное положение.В случае же молекул с сопряженными связями приведение к двух¬
центровым орбиталям не удается, и в результате аналогичных преобра¬
зований делокализация молекулярных орбиталей в достаточной степени
КВАНТОВО-ХИМИЧЕСКИЕ' ПРЕДСТАВЛЕНИЯ239не устраняется; в этом — некоторое отражение концепции резонанса
структур в методе МО.Находимые указанным путем эквивалентные орбитали иногда назы¬
вают орбиталями связей.Локализованные эквивалентные орбитали могут рассматриваться
как линейные комбинации атомных орбиталей, понимаемых в некотором
новом, более общем смысле. Вернемся опять к молекуле метана. Четыре
эквивалентные орбитали могут быть представлены как линейные ком¬
бинации, построенные из атомных 1 s-орбиталей атомов водорода и из
атомных орбиталей атома углерода вида-j [(2s) + ci (2рх) + с2 (2ру) + с3 (2рг)]где символы (2s) и (2р) обозначают атомные s- и р-орбитали углерода
с главным квантовым числом 2, а Сг (/ = 1, 2, 3) = ±1 *. Атомные ор¬
битали, представляющие собой линейные комбинации атомных орбита-
лей одного и того же атома, называются гибридизованными, а образова¬
ние их — гибридизацией атомных орбиталей. Понятие гибридизованных
атомных орбиталей возникло раньше, чем обнаружилась описаннаяРис. 43. Образование четырех гибридных 5р3-орбиталей.выше теоретическая ситуация, объясняющая соотношение между, вообще
говоря, делокализованными молекулярными орбиталями и эквивалент¬
ными локализованными орбиталями. Полинг и Слэтер независимо друг
от друга в период с 1928 по 1931 г., разрабатывая качественно систему
квантово-химических оснований стереохимии, ввели понятие о гибриди¬
зации, которое далее с успехом применялось к конкретным химическим
проблемам.Понятие о гибридизации является основой теории направленной
валентности. Эта последняя возникла и развивалась независимо от ме¬
тода молекулярных орбиталей **, главным образом в связи с аппаратом
расчета в первоначальных формах метода валентных схем. Она полу¬
чила довольно широкое применение также и в качественной форме.* Четыре набора с,- таковы: (1, 1, 1), (1, —1, —1), (—1, 1, —I), (—1, —1, 1).** Выше мы пришли к представлению о гибридизации атомных орбиталей от
частного, хотя и очень важного примера молекулярной орбитали. Такой прием не дол¬
жен, однако, создавать впечатления, что представление о гибридизации существенно
для метода МО. Хотя в методе МО в ряде случаев, а именно при использовании
эквивалентных орбиталей, вид вычисляемых молекулярных орбиталей позволяет гово¬
рить о гибридизации атомных орбиталей, тем не менее общая идея гибридизованного
состояния атома утратила в методе МО свое значение. Вследствие гораздо более
общего подхода метода МО простые правила, которым подчиняется представление
о гибридизации в рамках теории направленной валентности, перестают быть доста¬
точно общими л методе МО.
240КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯРассмотрим некоторые из наиболее важных примеров применения
понятия гибридизации.Описанный выше тип гибридизации атомных орбиталей углеродного
атома не единственный. Поскольку в нем принимают участие кроме
атомной 25-орбитали все три 2р-орбитали углерода, этот тип гибридиза¬
ции обозначается символом sp3 (рис. 43).Для углеродного атома кроме «^-гибридизации важны еще два типа
гибридизации, а именно обозначаемые символами sp2 и sp. Так, при
«р2-гибридизации в линейную комбинацию с атомной 25-орбиталыо вхо¬
дят две 2р-орбитали, а третья р-орбиталь
сохраняется как таковая (рис. 44).При sp-гибридизации образуется линей¬
ная комбинация атомной 25-орбитали с од¬
ной атомной 2р-орбиталью углерода, а две
р-орбитали сохраняются неизменными
(рис. 45).В то время как атомная s-орбиталь не
имеет направленного характера, р-орбиталь
обладает направленностью по определен¬
ной оси, но распространяется она по этой
оси одинаково (в обе стороны от начала ко¬
ординат, связанного с атомным ядром).
Знак в этом отношении не существенен.Гибридизованные орбитали всех трех
типов направлены почти полностью в одну
сторону от начала координат и потому осо¬
бенно приспособлены для перекрывания с
подходящими им по симметрии атомными
орбиталями других атомов.Как было сказано выше, при в/Агибри-
дизации четыре гибридизованные орбитали
направлены от ядра углеродного атома к
вершинам тетраэдра, который при наличии
разных заместителей может быть и несколь¬
ко неправильным.При 5р2-гибридизации оси трех гибри-
дизованных орбиталей расположены в од¬
ной плоскости и направлены к вершинам
правильного треугольника (симметрия —
тригональная). Чистая р-орбиталь направлена перпендикулярно к пло¬
скости гибридизованных орбиталей.При sp-гибридизации обе гибридизованные орбитали имеют общую
ось цилиндрической симметрии, но направлены в разные стороны от
начала (т. е. от углеродного ядра атома). Две чистые р-орбитали имеют
взаимно перпендикулярные оси и взаимно перпендикулярные узловые
плоскости, пересекающиеся по оси симметрии гибридизованной орби¬
тали.Для углерода $р3-гибридизация типична в предельных соединениях;
5р2-гибридизация — в соединениях с двойными связями при атоме угле¬
рода (изолированными или сопряженными); sp-гибридизация — в соеди¬
нениях с тройными связями при атоме углерода и с кумулированными
двойными связями.С понятием о гибридизации тесно связано понятие о «валентном со¬
стоянии» атома. Выясним его смысл на типичном примере. Представим
себе мысленно (на самом деле совершенно невыполнимый) следующий
эксперимент с молекулой метана. Пусть расстояния между атомнымих^„смешение"Рис. 44. Образование трех гиб¬
ридных sp2-орбиталей.
КВАНТОВО-ХИМИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ241ядрами в молекуле метана каким-то способом увеличиваются неограни¬
ченно, но электронная оболочка молекулы * претерпевает преобразова¬
ние, в котором основные качественные черты ее геометрии сохраняются.Электронам при этом разрешается «не помнить своего хозяина», но в
каждой связи электроны поровну распределяются между атомными яд¬
рами. При достаточно большом удалениии всех ядер друг от друга атомуглерода окажется «осторожно вытащенным» из молекулы с сохране¬
нием эквивалентности четырех гибридизованных атомных орбиталей, на¬
правленных тетраэдрически. Полученное таким образом фиктивное со¬
стояние и называется валентным 5р3-состоянием. Ему не соответствует* ls-Орбиталь углеродного атома в - этом рассуждении в электронную оболочку
молекулы не включается.+++Рис. 45. Образование двух гибридных sp-орбиталей.Е,Бр3-„Валентное
состояние“sp3- Возбужденное
спектроскопическое
состояниеЭнергия Возбуждения
Валентного состоянияЭнергия образования
тимических связей
из sp3- Валентного
состоянияЭнергия оптического
Возбуждения .ОсноВное
состояние
атома с. £Рис. 46. Схема (качественная) соотношения энергий
атома углерода в основном состоянии, sp3-возбужден¬
ном состоянии, sp3-*валентном состоянии».9 Зак. 882
242КВАНТОВО-ХИМИЧЕСКИЕ представленияникакое состояние, могущее быть реально наблюдаемым спектроскопи¬
ческими методами *. Если бы мы захотели вычислить его энергию (что
формально можно сделать), то нашли бы, что она значительно выше
энергии основного состояния с конфигурацией ls22s22p2 и несколько пре¬
вышает энергию возбужденного состояния с конфигурацией \s22sx2fP,
возникающего при переходе одного электрона из 2«-орбитали в 2р-орби-
таль, вакантную в основном состоянии. На рис. 46 схематически пока¬
зано и чисто качественное соотношение упомянутых энергий.Энергия образования химических связей, благодаря повышенному
перекрыванию гибридизованных атомных орбиталей атома углерода
с атомными ls-орбиталями водородных атомов, с избытком энергии е
компенсирует затрату на возбуждение «валентного состояния».В действительности процесс образования молекулы метана не про¬
ходит через стадию «валентного состояния» изолированного атома. При
сближении атомов уже начинается их связывание друг с другом в моле¬
кулу, хотя сначала и в очень рыхлую, и изменение характера орбиталей
сопутствует этому процессу, происходя постепенно.Заметим, что иногда для четырехвалентного атома углерода sp3-ги-
бридизованное валентное состояние называется первым валентным,
$р2-гибридизованное — вторым валентным и sp-гибридизованное — тре¬
тьим валентным состоянием.Гибридизация и валентное состояние — это вспомогательные теоре¬
тические концепции. Ни гибридизованные атомные орбитали, ни «ва¬
лентное состояние» атома^ не имеют, как таковые, спектроскопически
констатируемой реальности.* С квантово-механической точки зрения «валентное состояние» есть «смесь»
некоторого набора спектроскопически реализуемых «чистых» состояний (не в смысле
их линейной комбинации, а в смысле статистическом),
НЕПРЕДЕЛЬНЫЕСОЕДИНЕНИЯОЛЕФИНЫ (АЛКЕНЫ)Гомологический ряд олефинов,или, по женевской номенклатуре, алкенов Н\ /Нначинается с этилена С—С . Именно это обстоятельство и то,Wчто метилен, который должен был бы быть первым гомологов в этом
ряду, не существует в стабильном состоянии, заставило в свое время
принять представление о двойной связи как о характерной структурной
черте непредельных углеводородов.Эт°рым решающим доводом в пользу наличия двойной связи в оле-
финах явилось то, что ненасыщенные атомы углерода в олефинах всегда
встречаются попарно и являются соседями. Не бывает, например, не¬
насыщенных соединений типаН\ /Н Н\С—СН2—С , а только С=СН—СН3W ХН Wт. е. нельзя допустить, что ненасыщенные атомы углерода трехвалентны.Как уже отмечалось, в олефинах и их производных ненасыщенные
углероды находятся во втором валентном состоянии. В отличие от пер¬
вого валентного состояния, характерного для предельных соединений
(«тетраэдрический» углерод с четырьмя эквивалентными валентностями,
направленными под углом 109°28' друг к другу, — 5р3-гибридизация
электронных орбиталей), во втором валентном состоянии у углерода
гибридизованы только одна s- и две р-орбитали (5р2-гибридизация), об¬
разуя три одинаковые орбитали. Соответствующие им ст-связи (простые
связи) направлены друг к другу под углом 120° и лежат в одной плоско¬
сти. Третья р-орбиталь углерода не гибридизрвана.В олефине такие углероды связаны попарно. В этулене, например,
они образуют плоскую фигуру типаНул?0» /Н"•©-ЯнЛгёо» \нНе участвующие в образовании имеющихся в молекуле этилена пяти
о-связей две р-орбитали (по одной у каждого атома углерода) занимали
бы у не связанных между собой углер'одов пространство, приблизительно
ограниченное «пространственной восьмеркой» (фигура вращения вось¬
мерки вокруг продольной оси) * с длинной осью, перпендикулярной* Точнее о смысле пространственного ограничения см. стр. 226.9*
244ОЛЕФИНЫ (АЛКЕНЫ)к плоскости трёх сг-связей, и центром, совпадающим с центром каждого
углеродного атома. У атомов углерода, связанных между собой простой
связью (a-связь), эти пространственные восьмерки сливаются в общую
орбиталь обоих р-электронов, что сопровождается выделением энергии
(примерно 64 ккал/моль). Эти электроны образуют так называемую
л-связь, иначе говоря, вторую связь в двойной связи. л-Связь значитель¬
но менее прочна энергетически, чем a-связь С=С (83 ккал/моль), и го¬
раздо легче поляризуема.Наличие двойной связи в молекуле сказывается прежде всего в том,
что прекращается возможность вращения вокруг оси a-связи, свойствен¬
ного предельным соединениям, и конфигурация олефина становится
устойчиво плоской, что ведет за собой, как следствие, явление геометри¬
ческой изомерии, о котором упоминалось на стр. 200, а главное будет
сказано ниже.Наличие л-связи свойственно не только олефинам. В карбонильной
группе С = 0 кислород и углерод связаны также и л-связью. В нитрилах
R—C = N углерод и азот связаны одной a-связью и двумя л-связями.
Такой же характер имеют связи в рассматриваемых ниже ацетиленах
R—С = С—R.Если углероды связаны двумя л-связями и в них вовлекаются, таким
образом, 4/з-электрона, то для оставшихся трех а-связей — С—С— у ка¬
ждого углерода будут гибридизованы по одной s- и одной р-орбитали
(яр-гибридизация). Это — третье валентное состояние углеродного ато¬
ма, в kotqpom обе a-связи лежат на одной прямой, а образованные
р-электронами орбитали двух я-связей занимают в пространстве места
четырех попарно взаимно перпендикулярных и слившихся простран¬
ственных восьмерок.Первое валентное
состояние углерода109*Второе валентное •
состояние углерода120°Третье валентное
состояние углерода180'180“этанэтиленацетиленВ ацетиленах геометрическая изомерия отсутствует.Особые свойства л-связи олефинов и проявление их ненасыщенного
характера будут ясны из описания свойств олефинов.НоменклатураОлефины называют или по тривиальной номенклатуре, добавляя
к названию соответствующего радикала предельного углеводорода окон¬
чание ен (этилен, пропилен, бутилены, н-амилен, изоамилен, гексилены
и т. д.), или обозначают как производные этилена, например:СНЗЧ^ ,СН3сн/:с=счсн.тетрамегилэтилен
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ. I245Или, наконец, используют женевскую номенклатуру, кладущую
в основу названия алкена женевское название алкана, с заменой оконча¬
ния ан на ен: этен, пропен, бутен и т. д.В этом случае после названия ставят через дефис цифру — номер
атома углерода, от которого начинается двойная связь. Например:СН3I
сн3-с=сн—сн32-мегилбутен-2Иногда положение двойной связи обозначают греческой буквой А
с номером атома в виде показателя: Д2-метилбутен.В химии производных олефинов, как и в химии производных алка-.
нов, часто используют «радикальную» номенклатуру (вспомним, к при¬
меру, такие названия, как хлористый этил). Радикалы, содержащие-двойную связь, называют: СНг=СН — винил, или этенил\ СН2—С(^ви-нилиден; СНг=СН—СНг — аллил; СНз—СН=СН — пропенил.Названия и физические свбйства олефинов приведены в табл. 29.
Таблица 29. ОлефиныНазваниеТемпе*Темпе¬Плот¬Формулатриачаль- *Ноеженевскоепо«этиленовой»системератураплавле¬ния,°Сратуракипения,°Сность<Н\ н
хс=с
н/ ЧНЭтиленЭтенЭтилен-169,4— 103,90,5960*г,м)СНз—сн=сн3Пропи¬ленПропенМетилэти-лен-185,2-47,00,609К~47)СНз—сн2—сн=сн2СНз—СН=СН—СНзCH3Vа-Бути-ленПсевдо¬
бутилен
цис-
транс-Бутен-!Бутен-2Этилэтилен1,2-Диме-тнлэтилен-130,0— 139
-105-5,0+3.7
+ 10,668(О0,635;с=сн2СНзИзобу-тилен,или\-бути-лен2-Метил-пропен1,1-Диме-тилэтилен-140,3—6.90,5942СНз—СН2—СН2—СН==сн2а-Ами-ленПентен-1н-Пропил-этилен-138,029,90,6405СНз—СН2— СН=СН-
С2Н5ч;с=сн2сн3/-СНзр-Ами-ленПентен-2Метилэтил-этилен-13936,90,6515•у-Ами-лен2-Метил-бутен-11-Метил-1-
этилэтилен-137,631,20,650(СН3)2СН—сн=сн2а-Изо-амиленЗ-Метил-бутен-1Изопропил-зтилен— 13525,00,648(СНз)2С=СН—СНзр-Изо-амилен2-Метил-бутен-2Т риметил-
этилен-12438,40,668юГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ. I.Вращение групп атомов вокруг углеродной ст-связи требует затраты
лишь такого количества энергии (2—5 ккал/моль), которое легко до¬
ставляется из окружающей среды уже при комнатной и более низких
246ОЛВФИНЫ (АЛКЕНЫ)температурах. Это вращение и обусловливает отсутствие изомеров вра¬
щения (конформеров) как отдельных химических индивидуумов. Иначе
обстоит дело с вращением вокруг двойной связи, для которого требуется
уже разрыв п-связи и, следовательно, затрата для С = С-группировки
примерно 60 ккал/моль. Поэтому существуют изомеры всех олефинов
или их производных, не имеющих плоскости симметрии, проходящей че¬
рез оба связанных л-связью атома углерода перпендикулярно к плоско¬
сти молекулы. Такая пространственная изомерия — стереоизомерия —
называется в этом случае геометрической изомерией. Приводим при¬
меры геометрических изомеров:СНзЧ ^СНз - СНзх /Н_ _ С=Сн/ Nh н/ \:н3цис-бутен-2 транс-бутеи-2(т. пя. -139 “С; (т. пл. -105 СС;т. кип. +3,7 °С) т. кип. +1°С)С1Ч 7С1 С1ч /НС—С ХС=СХн/ Ntf н/ ^Cl(цие-дихлорэтеи транс-дихлорэтен(Т. КИП. +Ь0°С; (Т. КИП. -+*48 °С;дипольный момент 1,892)) дипольный момент 0)Как правило, геометрические изомеры отличаются друг от друга по
физическим свойствам не менее, чем структурные изомеры. Однако в
реакциях, доказывающих структуру, геометрические изомеры ведут себя
одинаково, что и понятно, так как их структура идентична. Так, и цис-,
и транс-бутеи-2 каталитически гидрируются, давая один и тот же бутан;
в результате озонирования каждый из них превращается в две молекулы
ацетальдегида; при действии НВг они превращаются в один и тот же
2-бромбутан и т. д.Приставка цис- придается тому геометрическому изомеру, у кото¬
рого одинаковые заместители (два водорода) находятся по одну сторону
двойной связи, а приставка транс—тому, у которого они находятся на¬
крест по отношению к двойной связи. Если олефиновые углеродные
атомы связаны с четырьмя разными заместителями, то приставка ццс-
или транс- определяется положением наиболее длинных цепей.цис-Изомеры легко отличить от грсшс-изомеров благодаря тому, что
у центросимметричных грсшоизомеров дипольный момент равен нулю.
(Дальнейшее о цис-транс-шзошерт см. стр. 315.)/Способы получения олефиновОбщие способы создания двойной связи в пре¬
дельных соединениях. 1. При действии на галоидзамещенные
соединения алкоголята натрия или спиртового раствора едкого натра
(или других столь же сильных оснований) отщепляется галоидоводород
и образуется двойная связь:СН3—СН2-СН2С1 + NaOCjHs —> СН3-СН=СН2 + C2H50H + NaCl2. Отщепление воды от спиртов и других оксисоединений:а) при пропускании их паров над нагретой примерно до 400 9С
окисью алюминия:А12о3СНз-СНЛСН^ОН ► СН3—СН=СН2 + Н20
РЕАКЦИИ ОЛЕФИНОВ247б) при нагревании спиртов с серной кислотой или релетучими карбо¬
новыми кислотами, причем реакция идет через образование и последую¬
щий распад сложного эфира:СН3—СН2ОН + H2S04 —СНз—CH2—OSO3H —* СН2=СН2 + H2S04С3Н7ОН + НО— С-С-ОН —* НО— С—СОСзН, —*■ II II иг0 0 0 0—* СНз—СН=СН2 + НО—С—С—онII IIо о3. Отщепление металлом (Zn, Mg) двух атомов галоида от 1,2-дига-
лоидных производных:R-CH-CH-R' -f Zn —> R—СН=СН—R' + ZnCl2I ICl Cl4. По реакции Виттига, заключающейся в замене карбонильного
кислорода на метиленовую группу при помощи фосфинметиленов:R— СН=0 + CH2=PR' —> R-CH=CH2 + 0=PR'Реакция Виттига протекает через образование промежуточного цик¬
лического соединения.5. Замена карбонильного кислорода на метиленовую группу не
только в альдегидах, как в реакции Виттига, но и в кетонах достигается
действием метиленгалогенида и магния на оксосоединение (Каинелли,
Бертиани, Грессели, 1967 г.):R - R RI II-CH2Br2 + С=0 + 2Mg —> СН.,—С—О —► СН2=С + BrMgOMgBrI I'll IR' MgBr R' MgBr R'6. Гидрирование соединений с тройной связью над не очень актив¬
ным катализатором (железо, частично «отравленное» Pd или Pt):Н2 (катализатор)R—С=С—R' -> R—CH=CHR'7. Крекинг алканов. Это главный промышленный путь получения
олефинов из углеводородов нефти (стр. 66):СН3—СН4—СН2—СН2—СНзСН3—СНз + СНз—СН=СН2
--> СН2=СН2 + СНз—сн2—СНз
-> СН4 + СНз—сн2—СН—СН28. Расщепление по Гофману гидроокисей четвертичных аммониев
было рассмотрено на стр. 211, 212.Реакции олефинов1. Газообразный водород в присутствии активных катализаторов
(мелкораздробленные №, Pd, Pt) присоединяется к олефинам и вообще
по кратной С = С-связи, превращая их в алканы (Сабатье):+ н2/\мR—СН—СН2 ► R-CH2-CH3
248ОЛЕФИНЫ (АЛКЕНЫ)2. Хлор и бром присоединяются к олефинам, образуя 1,2-дигалоид-
производные:R—СН=СН2 —R—СН—СН2I IВг ВгПрисоединение галоидов к олефинам начинается с электрофильной
атаки молекулы галоида на л-связь (образование я-комплекса, кн. И).
Затем атом галоида с секстетом электронов (т. е. положительно заря¬
женный) электрофильно атакует один из атомов углерода, связанных
я-связью, вытягивая я-электронную пару для осуществления своей соб¬
ственной связи с этим углеродом, а партнер последнего, лишенный
я-электронной пары, становится положительно заряженным карбкатио-
ном и нуклеофильно атакуется вторым атомом галоида (анионом, обла¬
дающим октетом электронов):R—СН==СН2уВгIВгСтереохимическое протекание и подробности такого механизма реак¬
ции приведены на стр. 371. В соответствии с этим ходом реакции пропи¬
лен присоединяет бром вдвое быстрее, чем этилен, изобутилен — в
5,5 раза, тетраметилэтилен — в 14 раз быстрее (индуктивный +/-эффект
СНз-групп повышает доступность электронов я-связи).3. Галоидоводороды присоединяются по кратной связи, образуя га¬
лоидные алкилы. При этом присоединение идет в соответствии с прави¬
лом Марковникова. Правило Марковникова' устанавливает ориентацию
присоединения галоидоводорода и других полярных молекул к несим¬
метрично построенным ^олефинам, например к пропилену. Это правило
гласит: водород присоединяется к углероду, несущему наибольшее число
водородов, галоид — к другому углероду, связанному с первым двойной
связью:СН3—СН=СН2 + НХ —>- СНз—СН—СН3IXСмысл правила Марковникова следующий: галоидоводород (как и
другие протонные кислоты) атакует олефин электрофильно своим прото¬
ном. Образуется неустойчивый карбониевый катион:На I + Вг—> СН3—СН-СН2 _н .СНз—сн=сн„ — 1б + Вг—-> сн3—сн-сн2 —IнIIИз двух возможных вариантов карбкатиона I и II при реакции про¬
пилена с бромистым водородом более устойчив катион II с положитель¬
ным зарядом на вторичном углероде (путь б), потому что +/-эффект
двух метилов сильнее гасит положительный заряд центрального угле¬
рода, чем один метил в катионе I. Вследствие этого катион II образуется
с меньшей энергией активации и, следовательно, быстрее, чем катион I.
Процесс завершается присоединением аниона Вг к катионному центру.СНз—СН2—СН2Вг
СНз—СНВг—сн3—V R—сн—СН2 —► R—СН—СН2- I I IВг Вг Вг Вг
РЕАКЦИИ ОЛЕФИНОВ249Все это и определяет ориентацию присоединения по правилу Марковни-
кова.Для бромистого водорода (но не для хлористого водорода, кислот
или воды) Хараш и Майо в 1939 г. установили возможность «антимар-
ковниковского» присоединения по двойной связи в присутствии малого
количества перекисей, инициирующих цепную реакцию путем окисления
бромистого водорода в атомарный бром:Последний гомолитически присоединяется к олефину, атакуя двой¬
ную связь и забирая для связи один ее электрон и оставляя второй так,
чтобы образующийся промежуточно свободный радикал имел неспарен¬
ный электрон на вторичном (или еще лучше — на третичном), но не на
первичном углероде. Из двух направлений присоединения (в и г) осуще¬
ствляется направление г, так как условия структуры, определяющие ста¬
бильность, одинаковы для карбкатионов и радикалов:Итак, сначала атомарный бром атакует первичный углерод, а обра¬
зующийся свободный радикал вырывает из НВг атомарный водород,
снова генерируя атомарный бром и таким образом инициируя новое
звено цепной реакции гемолитического присоединения:,5. Хлорноватистая кислота присоединяется к олефинам также в со¬
ответствии с правилом Марковникова, если принять во внимание, что
положительной частью молекулы является хлор:Тот же результат может быть достигнут просто при действии хлора
и воды на олефин:СНз—СН=СН2 + С12 + Н20 —* СНз-СН—сн2в■> СНз—СН—СН;СНз—СН=СН2 + ВгВгг—> СНз—СН—СН2ВгСНз—СН—СН2Вг + НВг —»■ СНз—СН2—СН2Вг + ВгСН3—СН—СН2 + Вг • —»■ СНз-СН—СН2Вг(продолжение цепи)4. Вода (в кислой среде) и кислоты присоединяются к олефинам
в соответствии с правилом Марковникова:ОНСНз—СН=СН2 + H2S04 —► СНз—сн-снoso3hСНз—СН=СН2 + HOC1 —► сн3—сн—сн2' ОН С1ОН С1Так обычно и поступают при получении хлоргидринов гликолей.Эта реакция служит ясным доказательством того, что атака галоида
на олефин начинается с атаки положительно заряженного иона галоида
250ОЛЕФИНЫ (АЛКЕНЫ)и является электрофильной атакой (конечно, одий из двух атомов хлора
в симметрично построенной молекуле приобретает положительный зарйд
только в момент атйкй):сн3—сн=^сн2 —СН3-СН-СН2 + сГ
Cl-CI CI/нСНз—СН—СН2 + о; —СНз—СН—СН2 —*■ СНз—сн—сн2 + н+I \н II IIС1 О С1 он С1н/ >нРеакции присоединения, протекающие подобно взаимодействию хло¬
ра и воды с олефинами, называются реакциями сопряженного присоеди¬
нения и все шире используются в химии.В качестве примеров можно привести: 1) синтез ди-р-хлордиэтило-
вого эфира (техническое название хлорекс, применяется как раствори¬
тель), получаемого присоединением хлора и воды к этилену;С12 + СН2=СН2 + Н20 —*■ СГ + С1СН2—СН2ОН + Н*С12 + СН2=СН2 + О—СН2—СН2С1 —► СГ + С1СН2СН2—0-СН2СН2С1 + н*нВо второй стадии реакции, (написанной упрощенно, без указания
промежуточных продуктов) взаимодействие хлора с этиленом протекает
при значительной концентрации продукта первой стадии — этиленхлор-
гидрина, который сопряженно присоединяется к этилену под действием
хлора. ■2) Дихлоролефины типа R—СН = ССЬ при сопряженном хлорирова¬
нии в серной кислоте, содержащей немного воды, претерпевают превра¬
щение в а-хлоркарбиновые кислоты по схеме (P. X. Фрейдлина):RCH=CC12 + C12 + 0S03H' —-► RCHC1—СС12 + СГOSO3H2Hj°jRCHCI—СООН + 2НС1 + H2S046. Присоединение хлористого нитрозила:СН2=СН2 + CI—N0 —*• СН2—СН2 —»- СН2—СНI г. I |ЬCl N=0 Cl NOH7. Присоединение N2O4 (Н. Я. Демьянов):CR2=CR2 + N204 —► cr2—cr2 -f- CR2—CRj
II IIN02 O—N=0 NOj NOj8. Окисление олефинов перманганатом калия в слйббщёлбчйбй срёд!г
приводит к образованию гликолей (реакция Вагнера):СН2=СН2 f 2КМп04 + 4Н20 —► ЗСН2—СН2 + 2К0Н + 2Мп02I IОН ОНЭту реакцию часто используют как чувствительную качественную
реакцию на кратную С===С-связь,
РЕАКЦИИ ОЛЕФИНОВ251Поскольку окисление олефинов перманганатом, содержащим тяжелый кйслород
180, приводит к получению меченного тяжелым кислородом гликоля (МпО^ не обме¬
нивается кислородом с водой), весьма вероятно, что реакция Вагнера идет через ста¬
дию образования циклического эфира:н-с ^Mnvib- н-с—о" 'оRIR, Н-С—ОН н,о Н-С—ОН , л
I .. 20 i . + но-Mnqe -
Н-с—О—MnS н-с—он I оi I ^о“ I 9R О R 'I ННСоединение пятивалентного марганца, реагируя с избытком перманганата, обра¬
зует манганат МпО^“, далее восстанавливающийся в двуокись марганца.Циклические олефины образуют по реакции Вагнера г^ыс-гликоли.9. При более энергичном окислении олефинов перманганатом калия
происходит разрыв по двойной связи и концевые углеродные атомы об¬
разуют кетонный карбонил или карбоксил:R\ /Г R4;с=с; +кмп04 —> ;с=о + о=с—R"R,/ Чн R,/ АнЭта реакция (как и следующая) важна для установления строения
данного олефина и положения двойной связи в цепи.Более гладкое расщепление двойной связи с образованием двух
молекул оксосоединения Достигается окислением смесью йодной кислоты
и четырехокиси осмия. OSO4 окисляет олефин до 1,2-гликоля, который
расщепляется на две молекулы оксосоединения (реакция Малапраде).
Восстановившаяся четырехокись осмия регенерируется под действием
йодной кислоты, таким образом для осуществления реакции достаточно
добавить небольшое ее количество.10. В органическом синтезе все чаще применяется также окисление
олефинов тетраацетатом свинца в безводной среде, протекающее следую¬
щим образом:ОСОСНз
(CH3COO|4Ph |RCH=CHR' *- RCH—CHR'IОСОСНзИз циклических олёфииов (если R и R' замкнуты в цикл) при этом образуются
ацетаты г/?а«с-диолов.11. Гидроперекиси кислот количественно превращают олефины в
эпоксиды (Н. А. Прилежаев); в частности, этилен образует простейший
эпоксид — окись этилена:+ RC—ООН —> ^С С/" + RC—ОН/ \ II / \ / \ IIО 0 0Тот же результат получают, окисляя олефины перекисью водорода
(раствор в ацетонитриле).
252ОЛЕФИНЫ (АЛКЕНЫ)12. Для установления строения олефинов важна реакция озонирова¬
ния, введенная Гарриесом:ОR\ /R" R\ / N А"с=с/ + о3 ->R'/ Х-Н R'/ хО—(У ХНОбразующиеся озониды — в высшей степени неустойчивые взрывча¬
тые вещества, которые тотчас по получении (обычно в хлороформе) раз¬
лагаются водой. Разложение протекает по типу:R\ / \ /R" ч'чс=о + о=с/ +н2о,,
X X + Н*° — R'/ \НR'' Х)-СГ ХНИдентифицируя полученные оксосоединения, можно определить по¬
ложение двойной связи в молекуле и решить, имелись ли у олефинового
углерода атомы водорода (в этом случае получается альдегид, а не ке-
тон; при наличии двух водородных атомов у одного углерода — формаль¬
дегид).13. При пропускании олефинов, содержащих концевую. группу
= СН2, над нагретой выше 500 °С окисью алюминия происходит переме¬
щение двойной связи с края молекулы в сторону центра:СНзч а12о3;сн-сн=сн2 >- ;с=сн-сн3
civ сн/14. Очень важны нашедшие широкое применение в производстве вы¬
сококачественных топлив для двигателей внутреннего сгорания реакции
алкилирования алканов алкенами. Алкилирование идет при участии ка¬
тализаторов А1С13, BF3> концентрированной H2SO4 или безводной HF
при невысокой температуре. Этилен не вступает в эти реакции. Метан
и этан не алкилируются. Результаты реакции выражаются схемой:(СН3)2СН-СН3 + СН3-СН=СН2 —V (СНз)зС—СН(СН3)2+(~100/о)+ (СН3)2СН—СН2—СН2—СН2— СН3 + (СНз)зС—сн2—сн2-сн3(до 800/0) (до зоо/0)Механизм реакции алкилирования алкана алкеном таков: протон
кислоты, инициирующей реакцию, присоединяется по правилу Марков¬
никова к олефину, в данном случае к пропилену, образуя малоустойчи¬
вый карбкатион СН3—СН—СН3 (см. кн. II, раздел «Карбкатионы»),
который вырывает гидрид-ион из изобутана и дает более стабильныйкарбкатион (СН3)3С. Дело осложняется возможной атакой олефинакатионом СН3—СН—СН3, изомеризацией образовавшегося катиона с
перемещением гидрид-иона и соответственно катионного центра, так что
в результате образуется смесь продуктов. Карбкатион присоединяется
к новой молекуле олефина, образуя более сложный карбкатион(СН3)3С + СНз—СН=СН2 —> СНз—СН—СН2—С(СНэ)зкоторый стабилизуется, вырывая гидрид-ион из новой молекулы изобу¬
тана.
РЕАКЦИИ ОЛЕФИНОВ253Таким образом гетеролитическая цепная реакция продолжается. На¬
пример:СН3-СН=СН2 + Н+ —»- СНз—СН—СНзСН3 СН.' СНз-СН—СНз + )сн—СНз —> СНз—СНг-СНз + с—сн3
СНз' сн/СНзСН3\+ I.С—СНз + СН3—СН=СН2 —*■ СНз—с—СН2-СН-СНзсн/ IСН3СН| + сн3.СНз—с—сн2—сн—СНз + ;сн—СНз —*-
I сн3/СНз?Нз сн
I СН3\ +—* СНз—с—СН2-СН2-СН3 + ,С—СНз И т. д.СНзсн/15. Важной в промышленном отношении (путь'от пропилена к бу¬
тадиену, от изобутилена к изопрену) является реакция Принса — при¬
соединение формальдегида в кислой среде к олефинам (другие альде¬
гиды реагируют аналогично):CH2=0 + H+ 4=t СН2—ОН
СН3—СН=СН2 + СН2-ОН СНз—СН—СНг—СН2ОНПолученный карбониевый катион стабилизуется в зависимости от
условий путем выброса протона или захвата аниона:СН3—СН—СН2—СН2ОН-н+ ОН-* СН2=СН—СН2—СН2ОНСН3-СН(ОН)—СН2—СН2ОНЗатем оба продукта легко превращаются в диен.Третий, более обычный в этом случае, путь стабилизации карбкати-
она состоит в атаке его формальдегидом и замыкании в гетероцикличе¬
ское соединение — замещенный 1,3-диоксан:СН3—СН—СН2—СН2ОН + сн2о —►
сн2 сн2СНз—НС/ \сн2 СНз—НС/ хсн2— 1 I — г I +н+0\+ он О^ /О
сн2 сн2Возможно, что образование этого циклического ацеталя формаль¬
дегида обязано действию формальдегида на гликоль (ср. стр. 270).Любой из окончательных продуктов реакции может быть использо¬
ван для синтеза бутадиена (см. стр. 269) путем отщепления воды, а в
последней реакции — также и формальдегида.16. Вторая реакция, также носящая имя Принса, состоит в присоеди¬
нении к олефинам (лучше к галоидированным) галоидных алкилов или
254ОЛЕФИНЫ (АЛКЕНЫ)полигалонДалканов под влиянием ZnCU, FeCb йлй AICI3:FeCl3CH2=CHCI + (СН3)3СС1 (СН3)аС—СН2—CHCljСС12=СС12+CCI4 СС1з—СС12—CCI317. Важное значение получила также открытая Реппе реакция, «ок-
сосинтеза» альдегидов, по крторой на олефин под давлением в присут¬
ствии карбонила кобальта как катализатора действуют смесью окиси
углерода и водорода (стр. 127):/НСН2=СН2 + СО + Н2 —* СНз—сн2—с^Конечно возможно и дальнейшее восстановление альдегидов в
спирты.18. Окисление кислородом воздуха. Винильные группы олефинов
СНг=СН—R, и особенно их разнообразных производных, медленно
окисляются кислородом воздуха, который в этом случае вызывает поли¬
меризацию еще не окислившегося непредельного соединения. Окисление
протекает по свободнорадикальному механизму. Наряду с собственно
полимеризацией олефинов (стр. 256) происходит их сополимеризация
с образующейся перекисью, так что полимер содержит перекисный кис¬
лород, и эти перекиси являются инициаторамй дальнейших полимериза-
ционных процессов:R. + 02 —► R—О—О.
r—0—0 • + CH2=CHR' —»- R—00—CH2—CHR'R—00—СН2—CHR' + 02 —*• R—00—CH2—СН—О—О.R'R—00-СН2—СН—О—О • + CH2=CHR' —»- R—00—CH2—СН—00—CH2—CHR'I IR' R'Гораздо быстрее протекает окисление олефинов в аллильное поло¬
жение, т. е. по Н—С-связи, гиперконъюгированной (стр. 399) с С=С-
связью. При этом образуется гидроперекись:^С=СН—CH2R + 02 —► 'ЧС=СН—CHR/ / . IООНОкисление также носит цепной характер, и течение его можно изо¬
бразить такой последовательностью реакций.R . + R'CHj—CH=CHR" ——> RH + [R'CH—CH=CHR" ■«-»• R'CH=CH—CHR"] R'CH—CH=CHR"(радикал стабилизован благодаря рассредоточению jy-.неспарениого электрона) ^*R'CH— CH=CHR" • + R'CH2—CH=CHR" —00.—> R'CH—CH=CHR" + R'CH—CH=CHR" rt т. д.ООН
РЕАКЦИИ ОЛЕФИНОВ255Повышенная скорость окисления в аллильное положение при нали¬
чии радикала-инициатора (им может быть и сам кислород) объясняется
относительно низкой энергией активации процесса вследствие стабили-
зованности аллильного свободного радикала (см. также кн. II).19. Галоидирование в аллильное положение. При высокой темпера¬
туре (>500°С) пропилен хлорируется в аллильное положение, образуя
хлористый аллил, причем двойные связи не затрагиваются (реакция
Львова):Процесс используется в промышленном синтезе глицерина
(стр.,104).Открытое Циглером бромирование в аллильное положение без при¬
соединения по двойной связи осуществляется N-бромсукцинимидом. Ре¬
акция протекает по цепному механизму и инициируется веществами,
генерирующими свободные радикалы, например перекисями. Поскольку
сам N-бромсукцинимид способен к гомолизу, нет необходимости в уча¬
стии другого инициатора:Хотя гомолитическое цепное течение реакции не вызывает сомнений,
однако данный механизм не может считаться бесспорным.Реакции окисления и галоидирования в аллильное положение де¬
монстрируют, что метилен аллильной группировки — СН = СН—СНг—
резко отличается по своей реакционной способности от инертной метиле-,
новой группы предельных углеводородов и легко подвергается атаке
радикальных реагентов. Эти цепные реакции протекают через образова¬
ние свободного аллильного радикала, значительно более устойчивого,
чем свободный алкильный радикал, вследствие возможности рассредото¬
чения неспаренного электрона взаимодействием с соседней я-связью:Поэтому, для того чтобы вырвать атом водорода из аллильного по¬
ложения, нужно затратить меньше энергии, чем для отрыва атома водо¬
рода от алкана.Такое же рассредоточение возможно и для пары электронов (отрицательный
заряд) в аллильном положении:СН2=СН—СН3 + С12 —► СН2=СН—СН2С1 + НС1RCH2CH=CHR' + Вг* —*.RCH—CH=CHR' + НВгRCH—CH=CHR' +ВгСН2-С'НВг + | N * —»•СН2-С^R—СН=СН—СН2 R—СН—СН=СН2,RCH=CH—CH2 ч-*- RCH—СН=СН2
256ОЛЕФИНЫ (АЛКЕНЫ)Поэтому не только атомарный водород, но и протон из аллильного положения
отрывается легче, чем от алканов.20. Окислительный аммонолиз. При окислении алкенов кислородом
в присутствии аммиака над гетерогенным катализатором * образуются
нитрилы. Так, из пропилена получается акрилонитрил:21. Полимеризация олефинов. Этот процесс был открыт еще Бутле¬
ровым на примере ди- и тримеризации изобутилена (2-метилпропена-1)
в присутствии серной кислоты. Процесс состоит в присоединении одной
молекулы димеризуемого олефина к другой за счет «аллильного» водо¬
рода. В кислой среде продукт присоединения частично изомеризуется
с перемещением двойной связи к центру молекулы, и получаётся смесь
двух продуктов:СНз СН3 СН3 СНзСНзЧ || ||2 • С=СН, —► СН3—С—СН2—С=СН2 + СН3— С—СН=С— СНзсн/ I IСНз СН3Оба димера при каталитическом гидрировании образуют 2,2,4-три-
метилпентан (изооктан) — топливо с октановым числом 100 (стр. 64),
вследствие чего этот процесс и осуществляется в крупном промышлен¬
ном масштабе.Триизобутилен представляет собой смесь тримеров изобутилена раз¬
ного строения, получающуюся при присоединении приведенных выше
димеров к изобутилену.Особенно важное значение получила полимеризация низших олефи¬
нов (этилена и пропилена) в высокомолекулярные полимеры с молеку¬
лярным весом 104—Ю5 и выше. Впервые в промышленном масштабе
была осуществлена полимеризация изобутилена в оппанол (немецкая
торговая марка) или вистанекс (торговая марка США). Полимеризация
проводилась при очень низкой температуре (примерно —100 °С) в при¬
сутствии трехфтористого бора (гетеролитическая полимеризация), при¬
меры которой мы уже изучали на формальдегиде.Льюисовы кислоты (BF3, А1С13), ион водорода — все это инициа¬
торы гетеролитической, а именно катионной полимеризации. Эти инициа¬
торы вытягивают пару электронов я-связи для заполнения электронной
лакуны (водород для образования" связи может принять пару электро¬
нов, а ион его не имеет ни одного; у элементов третьей группы имеется
тенденция дополнить секстет электронов до октета). Молекула олефина
приобретает при этом положительный заряд на втором олефиновом угле¬
роде (карбкатион), который, вытягивая пару электронов следующей
молекулы олефина, продолжает цепь полимеризации:катализаторСН3— СН=СН2 + NH3 + 3/2Ог> СН2=СН—C==N + 3H20СН;СН,|+3сн3СНзСн.IСН3СН3 СН,
I | +F.jB — СНо-с—сн,— С
I 2 I
СН3 СН3f3b-ch2—С г+ СН2=С'2СН3СН3* Запатентован широкий ряд катализаторов, например фосфорномолибденовые
соли висмута, сурьмы и олова.
РЕАКЦИИ ОЛЕФИНОВ257СНз+ п СН2=ССН3 СН3СН3СН, СН3 СН,I •’ I I 3СН3СН3LII IСН3 СН3 сн3СН3-‘л-1СН3Цепь растет, пока случайная встреча с каким-либо анионом не обо¬
рвет ее. В полученном высокомолекулярном соединении с молекулярным
весом, равным нескольким сотням тысяч, количества находящихся на
одном конце цепи молекул инициатора и закрывающих другой конец
анионов исчезающе малы и не могут быть обнаружены при количествен¬
ном анализе обычной точности. Вследствие малости содержания их при¬
сутствие не отражается на свойствах вещества, определяющихся цели¬
ком свойствами парафиновой цепи. При столь высоких значениях моле¬
кулярного веса полимеры с линейными молекулами проявляют свойства
эластичности (см. раздел о каучуке). Так, оппанол — химически устой¬
чивый (в отличие от каучука) эластичный материал.Наиболее легко полимеризуются олефины, имеющие на концегруппу ^/С=СН2 и несимметрично построенные. Этилен полимеризуетсятрудно, и его полимеризация была осуществлена позднее (Динцес), но
быстро перешла на индустриальные рельсы. Впервые полимеризация
этилена была достигнута при сжатии его до ~1000 кг/см2 в присутствии
следов кислорода и при нагревании. Такая полимеризация — тоже цеп¬
ной, но не гетеролитический, а гомолитический процесс. Инициатор гемо¬
литической полимеризации (в данном случае это кислород, но им может
быть и любой другой свободный радикал с неспаренным электроном,
например СНз*) вытягивает один из электронов я-связи, превращая вто¬
рой углеродный атом в свободнорадикальный углерод *:Цепь растет до тех пор, пока случайная встреча с частицей, несущей
неспаренный электрон (молекула кислорода, себе подобная частица,
свободный радикал), не оборвет рост цепи. Здесь также справедливо
сказанное об исчезающе малой роли концевых групп в столь больших
молекулах, где свойства определяются характером цепи. Полученный
таким путем полиэтилен — твердая рогообразная масса, размягчающаяся
при температуре ~120°С и имеющая молекулярный вес 18 000—50 000,
прочная механически, химически инертная, как парафин, — широко при¬
меняется в качестве электроизоляционного материала, для изготовления
посуды, упаковочных и оранжерейных пленок и др.Полиэтилен этого типа имеет все же некоторое число разветвлений
макромолекулы, образующихся за счет случайного вырывания атома.о-о-^енг^енг'’' —>■ -о-о-сн2 сн2'• о—О—СН2СН2 • + СН2=СН2 —> * О—О—СН2СН2СН2СН2.О—О—СН2СН2СН2СН2 • + гсСН2=СН2 —* * 0-0-СН2СН2СН2СН2(СН2СН2)„* Пунктирные кривые стрелки обозначают 'передвижение одного электрона.
258ОЛЕФИНЫ (АЛКЕНЫ)водорода из цепи свободнорадикальным концом другой растущей цепи:
СН2СН2СН2СН2 + • СН2СН2 —V—V СН2СН2СНСН2— + снг=сн2 —>—> СНгСН2СНСН, и т. д.сн2сн2.В 50-х годах этого столетия Циглер открыл процесс получения поли¬
этилена с неразветвленными цепями, нашедший также широкое приме¬
нение. Процесс состоит в действии триэтилалюминия на этилен. Так,
триэтилалюминий присоединяется к олефинам; этим свойством обладает
и получающийся в результате присоединения олефина триалкилалю-
миний:а1С2Н5 + СН2=СН2 —а1СН2СН2СН2СН3
а1СН2СН2СН2СН3 + СН2=СН2 —а1СН2СН3СН2СН2СН2СН3 и т. д.где а1 = >/зА1.^ Последующий гидролиз дает, чистый полиэтилен: .н2оа1СН2СН2(СН2СНг)пСН*СН3 ► al(OH) + CH3CH2(CH2CH2)/tCH2CH3При добавлении к триэтилалюминию TiCI4 полимеризация олефинов
идет особенно хорошо и отличается тем, что из несимметричных олефи¬
нов образуются изотактические полимеры. Так, пропилен дает изотак-
тический полипропилен, в котором все боковые группы (в данном слу¬
чае СНз) занимают одинаковые пространственные положения:„ ' СН3Н СН,Н СН3Н”3\„ Al(CsH6)8 + TiCl4 11’С=С ^ • •1 ■—С СW хнс—с—с—с— ■ппнБлагодаря этому цепи изотактического полимера упаковываются
друг с другом плотнее и полимер получается более прочный. Полипро¬
пилен такого типа настолько прочен, что идет на изготовление синтети¬
ческих волокон.Изотактичность — понятие стереохимическое и будет подробнее рас¬
смотрено на стр. 373.Химически все эти высокомолекулярные вещества — полиэтилен,
полипропилен, оппанол — относятся к классу парафиновых углеводо¬
родов (алканов), со свойствами которых мы познакомились уже ранее.Применение олефииовОлефины благодаря своей доступности (крекинг нефти) и высокой
и разнообразной реакционной способности служат в настоящее время
главным сырьевым источником (наряду с ароматическими углеводоро¬
дами и ацетиленом) для многообразных отраслей органической химиче¬
ской промышленности.Все большее количество этилена идет для производства поли¬
этилена. Возрастает также количество этилена, гидратируемого в этило¬
вый спирт (стр. 94). Большой узел химической промышленности — пре¬
вращение этилена окислением кислородом воздуха или через этилен-
хлоргидрин в окись этилена и дальнейшие синтезы ацетальдегида, эти-
ленгликоля (антифриз), его простых и сложных эфиров (растворители),
этаноламинов на основе окиси этилена (стр. 116 сл.).
АЦЕТИЛЕНЫ (АЛКИНЫ)259Пропилен вместе с изобутиленом идет для производства углеводо¬
родных добавок (алкилирование), повышающих октановое число мотор¬
ного топлива; из пропилена получают вторичный пропиловый спирт,
ацетон, акрилонитрил. Все большие количества пропилена потребляются
в производстве полипропилена.Дегидрогенизацией над катализатором Сг20з при 500 °С и выше из
бутиленов СНз—СН2—СН=СН2 и СН3—СН—СН—СН3 получают бута¬
диен, превращаемый в синтетический каучук (стр. 282).Из изобутилена (СН3)2С=СН2 димеризацией и последующим гид¬
рированием синтезируют изооктан — добавку к моторному топливу, по¬
вышающую его октановое число.Его применяют также для получения полиизобутилена и для про¬
изводства трет-бутилового спирта.АЦЕТИЛЕНЫ (АЛКИНЫ)О природе тройной связи, характерной для ацетилена СНэ=СН и
его гомологов, см. стр. 240, 244.Общая формула углеводородов ацетиленового ряда СПН2П_2. Пер¬
вым представителем является ацетилен СН==СН. Тривиальные названия
гомологов ацетилена строятся прибавлением к ацетилену названий ра¬
дикалов, замещающих в нем водороды, например — метилацетилен
СНз—С==СН, диметилацетилен СН3—Сз=С—СН3, метилэтилацетилен
СН3—С=С—С2Н5. По женевской номенклатуре ацетилен называется
этин, а названия его гомологов производятся от женевского названия
соответствующего по структуре алкаНа с заменой окончания ан на ин и
с указанием цйфрой номера углеродного атома (в соответствии с прави¬
лами нумерации по женевской номенклатуре), от которого начинается
тройная связь. Примеры названий имеются в табл. 30, в которой при¬
ведены также физические свойства некоторых ацетиленовых углеводо¬
родов. Радйкал ацетилена НСззС— называется этинил или ацетиленил.Таблица 30. АцетиленыФормулатриви¬альноеНазваниеженевскоепо «ацетиле¬
новой»
системеТемпера¬тураплавле¬ния.°СТемпера¬туракипения,°СПлот¬ностьXиIIIиXАцетиленЭтинАцетилен-81,8—83,60,6200(возг.)(СОXи11и1«оXиАллиленПропинМетилаце¬-104,7-23,30,6785тиленК*7)С2Н6-С = СН )Бутин-1Этилацети--130,0-8,60,6680Кротонн-лен(О\леныСНз—С S С— СНз JБутнн-2Диметил¬-32,327,20,6880ацетилен(при25 °С)«-С3Н7—СэнСНПентин-1я-Пропил--9540,00,6882ацетилен№СНз-С^С-^-С2Н6Пентин-2Метилэтил¬-10156,00,7127Валери-ацетилен(прйлены17,2 “С)СНзч;сн—с=снЗ-Метил-Изопропил--89,729,30,6854сн/бутин-1ацетилен«)
260АЦЕТИЛЕНЫ (АЛКИНЫ)Способы полученияПолучение ацетилена. Ацетилен вырабатывается в огромных про¬
мышленных масштабах.1. До недавнего времени основным источником ацетилена служил
карбид кальция, получаемый н&греванием в электрической печи до тем¬
пературы выше 2500°С смеси негашеной извести и кокса:CaO -j- ЗС —► CflCg -f- СОАцетилен получается при разложении карбида кальция водой:СаС2 + 2Н20 —► Са(ОН)г + НС=СНМетод был найден еще Велером (1862 г.) и сохранил свое значение
до сих пор.Основное количество ацетилена, используемого для сварки, и в на¬
стоящее время получают по этому способу. Главным недостатком кар¬
бидного метода является его большая энергоемкость.2. Получение ацетилена пиролизом углеводородов. В качестве сырья
используют газообразные предельные углеводороды, главным образом
доступный метан или жидкие нефтяные фракции — прямогонные бен¬
зины, керосин.Пиролиз метана (электро- или термический) осуществляют нагрева¬
нием газа до 1400°С. Он приводит к образованию ацетилено-водород-
ной смеси:2СН4 —► НС=СН + ЗН2Реакция эндотермична (95 ккал/моль) и поэтому электропиролиз по
затрате электроэнергии лишь несколько экономичнее карбидного про¬
цесса получения ацетилена.При окислительном пиролизе с добавкой ограниченного количества
воздуха часть метана Сгорает, а часть пиролизуется за счет выделив¬
шегося тепла. Выход ацетилена достигает 15%. Его выделяют из смеси
газов, пользуясь его более высокой растворимостью в воде сравнительно
с другими углеводородами.Пиролиз метана осуществляется в крупном промышленном мас¬
штабе и является в настоящее время важнейшим способом производства
ацетилена.Пиролиз жидких углеводородов при 1200—1500 °С приводит к обра¬
зованию ацетилена легче, чем крекинг метана. В частности, был пред¬
ложен способ получения ацетилена из керосина путем замыкания
вольтовых дуг под слоем жидкости.3. Ацетилен был открыт Дэви в светильном газе (1836 г.), где он
присутствует в незначительном количестве и образуется, по-видимому,
также в результате крекинга углеводородов.4. Синтез ацетилена из элементов. Пропуская вольтову дугу между
угольными электродами в атмосфере водорода, Бертло получил ацетилен
(эндотермический процесс: ~55 ккал/моль). Этот метод лишен какого-
либо практического значения, но важен исторически.Синтез ацетиленовых углеводородов (методы создания тройной
С=С-связи в цепи углеродных атомов). 1. Исходя из олефинов. При¬
соединяют к олефину R—СН=СН—R' молекулу галоида и от получен¬
ного дигалогенида, действуя спиртовым раствором едкого натра, отще¬
пляют две молекулы HHal (Савич):RCHC1—CHC1R'+ 2NaOH —>- RC=CR' + 2NaCl + 2Н202. Исходя из кетонов. Действуя на кетон при 150—170°С пяти¬
хлористым фосфором, замещают кислород на два хлора и, как в преды¬
РЕАКЦИИ ТРОЙНОЙ УГЛЕРОД-УГЛЕРОДНОЙ СВЯЗИдущем способе, отщепляют спиртовым раствором едкого натра две мо¬
лекулы НС1 (А. Е. Фаворский):РС15 2NaOHR-C-CH2R' ► R—С—CH2R' ——RC=CR'l с/ \ci3. Используя реактив Иоцича (стр. 265). Алкилированием магний-
органических производных ацетилена можно получить его гомологи.4. Электролиз замещенных фумаровых кислот (стр. 314) ведет к
замещенным ацетиленам:2е"ООС—CR'=CR"—СОО' —► R'C=CR" + 2С02
Реакции тройной углерод-углеродной связиТройная связь по реакционной способности похожа на двойную
связь, но не превосходит ее по активности. Присоединения, характерные
для кратных связей, в случае тройной связи происходят в две ступени,
примеры чему будут приведены далее.1. Присоединение водорода. С тройной связью углеводородов (как
и с двойной) водород в момент выделения не взаимодействует, но газо¬
образный водород в присутствии активных катализаторов (Ni, Pt) сразу
восстанавливает алкины в алканы:RfeCR' *■ RCH2— CH2R'Можно осуществить и первую ступень этой реакции (восстановле¬
ние до алкенов), пользуясь менее активным катализатором (палла¬
дий, «отравленный» РЬС03, железо Ренея). При этом получаются
цис-олефиныR\ /R'
W ХН2. Присоединение хлора и брома. Реакция происходит в две легко¬
разделимые стадии, из которых энергично протекает первая (транс¬
присоединение) :* ci2 /С1 ci2R—С=С—R' ► /С=С( RCC!2—CC12R'СК 'R'Ацетилен при недостаточном количестве хлора образует дихлор-
этилен (1,2-дихлорэтен С1СН=СНС1), а при избытке хлора — тетра-
хлорацетилен (1,1,2,2-тетрахлорэтан С12СН—СНС12). В технике от тетра-
хлорэтана отщепляют щелочами (известью) НС1 и получают важный
растворитель — трихлорэтилен С1СН = СС12, гидролизом которого при
действии серной кислоты готовят монохлоруксусную кислоту:h2so4 /ОН
С1СН=СС12 + Н20 ► С1СН=С( +2НС1\он1с]сн2—с;^он -3. Присоединение галоидоводорода идет в две разделимые стадии.
Например, при присоединении НС1 к ацетилену в первую стадию- полу¬
чают хлористый винил:И /И
НС==СН + НС1 —> )С=ЧW ЧС1
262АЦЕТИЛЕНЫ (АЛКИНЫ)Это один из способов промышленного получения хлористого винила,
выпускаемого в громадных количествах (стр. 288). Вторая молекула
галоидоводорода присоединяется в соответствии с правилом Марковни-
кова (стр. 248) с образованием этилиденгалогенида (1,1-дихлорэтана);Н\ /Н
;с=с( +НС1 —► СНз—сна»w ХС1Аналогично образуются бромистый винил и бромистый этилиден.
Присоединение бромистого водорода против правила Марковникова в
этом случае неизвестно.4. Ацетиленовая краткая связь окисляется перманганатом и озони¬
руется.5. В .присутствии катализаторов (ион Hg2+) ацетилены .присое¬
диняют воду в соответствии с правилом Марковникова, причем из аце¬
тилена получается ацетальдегидHgs+ Н\ /Н
нс==сн + н2о ► н—с—с;
н/ чо X. а из его гомологов — кетоны: лн*г+ /нR—СгзС—Н + Н20 ► R—С—С—Н
I \нПервая из этих двух реакций — важный технический процесс, по
которому производят значительную часть ацетальдегида, далее превра¬
щаемого в уксусную кислоту (М. Г. Кучеров), этиловый спирт и мно¬
жество других продуктов.6. При каталитическом воздействии едкого кали ацетилен и ацети¬
лены типа RCssCH под давлением в несколько атмосфер присоединяют
спирты, причем образуются простые алкилвиниловые эфиры (А. Е. Фа¬
ворский, М. Ф. Шостаковский; Реппе);конCffeCH + ROH ► RO—СН=СН2Реакция осуществляется в промышленном масштабе. Подобным об¬
разом реагируют с ацетиленами и меркаптаны.7. В условиях гетерогенного катализа (Н3Р04 или В203) ацетилен
присоединяет уксусную кислоту, образуя сложный виниловый эфир —
винилацетат-j _Н\ н —с'а/ Nd-C—СН3IIоВинилацетат — важный исходный продукт для полимеризации в по-
ливинилацетат, гидролизуемый в поливиниловый спирт (стр. 290),8. Ацетилен присоединяет хлориды некоторых металловHCssCH+ HgCl2 —> ClCH=CHHgClHgCl2НС=СН +AsCl3 ► CICH=CHAsClaЛЮИЗИТHCsCH -i- SbCl6 —* (ClCH=CH)3SbCl2H-CsC-H + HO—C-CH3A
РЕАКЦИИ ТРОЙНОЙ; УПГЕРОД-УГЛЕРОДНОИ связи263Для гомологов ацетилена эти реакции не изучены.Исключительно важны реакции полимеризации ацетилена. , ,9. При пропускании ацетилена в кислый водный раствор GttCI
в хлористом аммонии ацетилен линейно димеризуется в винилацетилен
и тримеризуется в дивинилацетилен (Ньюленд):i—* сн2=сн—с=снHCs=CH —!—> сн2=сн—с=с—сн=сн2Дивинилацетилен изомерен бензолу (см. кн. II). Процесс осуще¬
ствлен в промышленности для получения винилацетилена, а из него
хлоропренового синтетического каучука (стр. 277). В некоторых странах
путем частичного гидрирования винилацетилена получают бутадиен для
обычного бутадиенового синтетического каучука (стр. 271).10. Давно известной реакцией тримеризации ацетилена (Бертло,
1866 г.) при длительном его нагревании до 400—500°С является получе¬
ние бензола с небольшим выходом;пропуская ацетилен при ~600°С над активированным древесным углем
в качестве катализатора. При этом с хорошим выходом получен бензол
и другие ароматические углеводороды, особенно нафталин.Замещенные ацетилены тримеризуются с хорошим выходом в заме¬
щенные бензолы при действии, например, [(СбН5)зР]г[Г^1(СО)] или неко¬
торых комплексных солей хрома при комнатной температуре.11. Наиболее давно известный процесс полимеризации ацетилена
в высокомолекулярный продукт — это полимеризация его при пропуска¬
нии над металлической медью при 200—300 °С. Образуется так называе¬
мый купрен состава (C2H2):s — желтоватый, легкий, ни в чем нераство¬
римый порошок неустановленного строения.12. Замечательное открытие Реппе — тетрамеризация ацетилена
(и его пентамеризация) в циклооктатетраен и циклодекапентаен в рас¬
творе в тетрагидрофуране примерно при 20 кгс/см2. В качестве катали¬
затора используют аммиакат цианистого никеля или ацетиленид никеля:НС^ ХСН
СНН. Д. Зелинский и Б. А. Казанский модифицировали эту реакцию,III + 111н н
\ /н/ \с—с/ Niн н н/ I \Н Н Нциклодекапентаен
264АЦЕТИЛЕНЫ (АЛКИНЫ)13. В 1966 г. Шеффер нашел, что диметилацетилен при стоянии его
раствора в бензоле над хлористым алюминием тримеризуется в гекса-
метилбицикло[2,2,0]гексадиен («гексаметилдьюаровский бензол»), кото¬
рый в свою очередь при нагревании изомеризуется в гексаметилбензол:СНзIС411СIСНзн,сAIC1 з\НаО/СН;сн.3/Сн,СНз\сн.Гексаметилбензол получается непосредственно из диметилацетилена
на катализаторе — димезитиленкобальте (см. кн. II).14. При гидрировании ацетилена над никелем в присутствии хлори¬
стого цинка получается изобутилен; предполагается, что в качестве
промежуточного продукта путем «кросс-димеризации» образуется димер
приведенной ниже структуры (А. Д. Петров):+ Н-С=С— НNI (ZnCIj)\с/I_НС=СН,Hf) СНзХ
СН/С=СН,15. В присутствии карбонила никеля Ni(CO)4 и карбонилов других
металлов ацетилен присоединяет окись углерода и воду или спирт, обра¬
зуя акриловую кислоту или ее сложный эфир (Реппе):Н-С==С-Н + СО + ROHСН2=СН— С—OR
hЭто важный промышленный процесс.16. Под действием катализатора (СиСЬЧ-’NHg) ацетилен присоеди¬
няет синильную кислоту, образуя акрилонитрил:НС=СН + HCNСН2=СН—Cs=NЭто один из трех важнейших промышленных способов синтеза важ¬
ного для органической промышленности акрилонитрила (стр. 306).Реалии замещения водородных атомов
ацетиленаВодородные атомы ацетилена и ацетиленов структуры RC = CH,
связанные с углеродным атомом в третьем валентном состоянии, очень
лег'ко подвергаются протонизации *.1. При взаимодействии ацетилена ми RCssCH) с аммиачными рас¬
творами окиси серебра или полухлористой меди выпадают осадки не¬
растворимых ацетиленидов (или ацетилидов)—бесцветный ацетиленид
серебра (AgC==CAg) и окрашенные от вишнево-бурого (CuC==CCu) до* Другой общеизвестный пример легкой протонизации связанных таким образом
водородов — кислотные свойства синильной кислоты H-CsN.
РЕАКЦИИ ЗАМЕЩЕНИЯ ВОДОРОДНЫХ АТОМОВ265желто-бурого (RCssCCu) ацетилениды меди. Эти ацетилениды взрыв¬
чаты.HC=CH + 2[Ag(NH3)2]+OH' —>- AgC=CAg + 4NH3 + 2Н20
RteCH + [Ag(NH3)2]+OH' —► RC^CAg + 2NH3 + H20
HC=CH + 2[Cu(NH3)2]+OH' —>- CuC=CCu + 4NH3 + 2H20
RC=CH + [Cu(NH3)2]+OH~ —>- RC=CCu + 2NH3 + H202. При действии галоидного алкилмагния протонизируемый водород
связывается с алкильным радикалом последнего, образуя алкан, а водо¬
родный атом замещается на остаток MgHal:НС=СН-f-2CH3MgI —v IMgC=CMgI + 2СН43. Раствор металлического натрия в жидком аммиаке также заме¬
щает подвижный водород ацетилена на натрий:Производные магния (реактив Иоцича) и натрия широко приме¬
няются в органическом синтезе и ведут себя подобно гриньярову реак¬
тиву (стр. 94).Повышенная подвижность (протонизируемость) водорода сказы¬
вается и в ряде реакций конденсации, в которые вступает ацетилен и
которые имеют важное значение в лабораторном и заводском синтезе.4. В присутствии едкого кали ацетилен (под небольшим давлением)
реагирует с кетонами (А. Е. Фаворский):Так получают третичные спирты с этинильным радикалом.5. В присутствии ацетиленида меди ацетилен присоединяется и к
альдегидам (Реппе):Особенно важно присоединение ацетилена к формальдегиду, приво¬
дящее к пропаргиловому спирту НС=з=ССН2ОН или к бутиндиолу-1,4исходному веществу в промышленном синтезе (ФРГ) тетрагидрофурана
и бутадиена (см. стр. 270).RQ==CH + CH3MgI —► RCteCMgl + СННС=СН + Na(NH3) —► HfeCNa + NH3 + ‘/2H2
HC=sCH + 2Na(NH3) —* NaC^CNa + 2NH3 + H2
RC=CH Na(NH3) —>- RfeCNa + NH3 + V2H2OHR\;с=о + нс=сн
R,Xс—C=CHHCu2C2+ HC^CHR-C-C=CHOHHH+ HC=,CHС1Л2С2R—С—C=C—C—ROHOHнс=сн + 2нс:Cu2C24 *N3HOH2C—C=C—CH2OH
266АЦЕТИЛЕНЫ (АЛКИНЫ)6. Ацетилен-аллен-диеновая перегруппировка Фаворского. При на¬
гревании с металлическим натрием ацетиленов с удаленной от конца
тройной связью последняя перемещается в крайнее положениеNaR_С=С-СН3 ► R-CH2-GsCHа при нагревании ацетиленов с крайним положением тройной связи со
щелочью происходит передвижение тройной связи к центру молекулы:C2H5ONaR-CH2—CsCH : ► R—С=С—СНзРеакция, очевидно, состоит в том, что алкоксид-ион отрывает про¬
тоны от соседней с тройной связью группы: СН2 и освободившиеся пары
электронов связей С—Н одна за другой образуют две новые зт-связи
между третьим (в данном случае) и вторым углеродным атомом, застав¬
ляя электронные пары прежних я-связей перейти к крайнему углерод¬
ному атому, который заполучает на эти пары протоны из реакционной
среды:R-CHTtCsCH —>- R—СН—С=СН R-C№*C=CH2Н^>с2н5R—CjfC=CH2 —► R—С*С—Сн2 —>■ R-C=C-CH3
H^с2н5Если у третьего углеродного атома имеется лишь один водород,
дело ограничивается первой стадией, и ацетилен превращается в диен —
замещенный аллен (стр. 267), способный далее перегруппироваться в
диен с сопряженными двойными связями (см. стр. 269).АцетиленИз предыдущего видно, что по значению и изученности ацетилен
занимает исключительное положение в своем гомологическом ряду.
Вряд ли можно назвать какой-либо ацетиленовый углеводород, кроме
ацетилена и винилацетилена, имеющий заметное промышленное значе¬
ние. Мировая же продукция ацетилена исчисляется в миллионах тонн.
Большая половина его расходуется на сварку и резку металла, так как
ацетилено-кислородное пламя имеет исключительно высокую темпера¬
туру (до 2800 °С) и свободно плавит сталь. Такое применение ацетилена
связано не столько с его эндотермичностью (—55 ккал/моль), сколько с
малой теплоемкостью продуктов сгорания (образуется мало воды). Дей¬
ствительно, при сгорании этана выделяется 373 ккал/моль, что в расчете
на 1 г почти не отличается от количества тепла, выделяемого при сго¬
рании ацетилена (311 ккал/моль). Эндотермичность ацетилена обуслов¬
ливает его взрывчатость при сжатии. Под небольшим давлением
(15 кгс/см2) ацетилен превосходно растворим в ацетоне (300 объемов
газа в 1 объеме жидкости) и в таком виде безопасен. Баллоны с аце¬
тиленом заполнены пористым материалом, пропитанным раствором аце¬
тилена в ацетоне. Смеси ацетилена с воздухом взрывчаты в широких
пределах.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ267Карбидный ацетилен обладает из-за имеющихся в нем примесей
противным запахом. Чистый ацетилен имеет типичный для непредельных
углеводородов запах и оказывает наркотическое действие, благодаря
чему находит применение в хирургии (так называемый нарцилен).Химическое промышленное применение ацетилена многообразно и
определяется вышеприведенными реакциями. Особенно широко исполь¬
зуется ацетилен в промышленном синтезе в странах, не имеющих соб¬
ственной нефти. Из него получают как простейшие ключевые соединения
основного 'органического синтеза (ацетальдегид, этанол, уксусную кис¬
лоту, галоидпроизводные этилена, хлоруксусную и трихлоруксусную кис¬
лоты), так и целевую химическую продукцию — синтетические каучуки,
пластмассы и т. д.ДИЕНОВЫЕ УГЛЕВОДОРОДЫНепредельные углеводороды, включающие две двойные связи, изо¬
мерны соответствующим по скелету ацетиленам и обладают такой же
общей формулой СпНгп-г- По женевской номенклатуре их названиям
придается окончание диен: пропадиен, бутадиен, пентадиен и т. д.
(буква «н» для благозвучия опускается). Тривиальные и женевские на¬
звания некоторых диенов и их физические свойства приведены в табл. 31.Таблица 31. Углеводороды с двумя этиленовыми связями (диеиы)НазваниеСОо* *СОат £1,Я V>■ К>*АНя »Формула£ я
2 я
О. О
0J г*со £
О. Sь *ООки*триви¬женевскоеa SС Я1
•9 ?*с>альноеН КоЛ с« =оч °С ч5о°ч
*Гш «ГСН2=С=СН2АлленПропадиен-146,0-32,01,787_сн3—сн=с=сн2Метил-алленБутади¬ен-1,2-136,3+ 10,80,676(О1,4205сн2=сн—сн=сн2ДивинилБутади¬ен-1,3— 108,9-3,00,650К6)1,4292(при.-25 °С)СНз—сн=сн—сн=сн2Пипе-Пентадн--87,5+43,00,6831,4301рилеиен-1,3(транс-)СН2=С(СН3)—сн=сн2Изопрен2-Метилбу--145,934,00,6811,4194тадиен-1,3СН2=С(СН3)—С(СНз)=СН2Диизо-2,3-Диме-—76,169,60,7451,4377пропе-ннлтилбутади-ен-1,3W)(СНз )2С=СН—СН=С( СН3)2Диизо-2,5-Дпме--91,3102,50,7161,4781кротилтилгекса-(756 ммК1)диеи-2,4рт. ст.)СН2=СН—сн2— СН=СН2Диви-нилме-танПентади¬ен-1,4— 148,325,90,6611,3888СН2—СН—СН2—СН2—СН=СН2Диал¬лилГексади¬ен-1,5-140,759,60,6881,4040Диеновые углеводороды разнятся по способам получения и особенно
по свойствам в зависимости от относительного положения двойных
связей.Углеводороды типа RCH = C = CH2 называются алленами по три¬
виальному названию первого члена ряда аллена .СН2 = С = СН2, а такая
268ДИЕНОВЫЕ УГЛЕВОДОРОДЫсистема двойных связей называется алленовой или кумулированной. Ее
особенностью является то, что центральный углеродный атом, несущий
две двойные связи, находится в третьем валентном состоянии и, следо¬
вательно, все три углеродных атома аллена лежат на одной прямой; два
крайних углеродных атома находятся во втором валентном состоянии.Наиболее отличающимися по свойствам и наиболее важными с
практической точки зрения являются 1,3-диеновые углеводороды во
главе с первым их представителем бутадиеном-1,3 СНг=СН—СН=СНг.
Все четыре атома углерода бутадиена-1,3 находятся во втором валент¬
ном состоянии, а 1,3-расположение двойных связей называется сопря¬
женным, так как в реакциях присоединения вся система ведет себя ча¬
сто как единое целое (это будет видно далее). Сопряжение связей в бу¬
тадиене-1,3 (и других сопряженных системах) сказывается на энергети¬
ческом уровне системы, который на 3—4 ккал/моль ниже, чем в систе¬
мах с изолированными двойными связями. Это видно из того, что при
каталитическом гидрировании олефинов выделяется 30 ккал/моль, а при
гидрировании бутадиена-1,3 выделяется не 60, как для диенов с изоли¬
рованными я-связями, а 56,4 ккал/моль. Таким образом, сопряжение
понизило энергию двух двойных связей на 3,6 ккал/моль (эффект сопря¬
жения, энергия резонанса).Сущность эффекта состоит в том, что р-электронные облака, обра¬
зующие две я-связи, сливаются («перекрываются») не только между
первым и вторым и, соответственно, третьим и четвертым углеродами, но
и между вторым и третьим, образуя общую систему. 2,3-Перекрывание
не столь полно, как 1,2- и 3,4-перекрывания, как следует из рентгеногра¬
фических измерений расстояний между углеродами: расстояния между
углеродами 1—2 и 3—4 равны 1,37 А, а расстояние между углеродами
2—3 несколько больше (1,46А), но все же меньше нормальной длины
С—С-связи в предельных углеводородах (1,52А). Это можно символизи¬
ровать «на языке резонанса» так (стр. 173, 234):СН2=СН—СН=СН2 ч-* СН2-СН=СН—СН2 ч-»I нt IЧ-» сн2-сн=сн—сн2 -<-► сн2—сн=сн—сн3III IVВ формуле IV стрелки над крайними углеродными атомами обозна¬
чают единичные электроны, а их противоположное направление — про¬
тивоположный спин и, следовательно, спаренность этих электронов.На языке ЛКАО строение бутадиена-1,3 было рассмотрено на
стр. 237.Наконец, углеводороды, подобные дивинилметану или диаллилусн2 - сн-сн2-сн=сн3 сн2=сн—сн2—сн2—сн=сн3Дйвинилметан диаллилили с еще более удаленными друг от друга двойными связями, имеют
так называемые изолированные двойные связи, которые ведут себя не¬
зависимо одна от другой.Общие способы получения диеновОбщие способы получения диеновых углеводородов те же, что и
для олефинов: отнятие цинком галоида от соседних атомов углерода,
отнятие галоидоводорода алкоголятом натрия, дегидратация гликолей’.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ269Но один акт отнятия необходим для создания одной двойной связи, а
для создания двух двойных связей нужны два акта, которые могут быть
и разными. Так, аллен обычно получают, превращая глицерин в1,2,3-трибромпропан и отнимая от него сначала бромистый водород, а
затем бром:BrCH2—CHBr—CH2Br + CH3ONa —► CH2=CBr—CH2Br + СН3ОН + NaBr
СНг=СВг—СН2Вг + Zn —► CHS=C=CHS + ZnBrsАналогичными путями можно получать и диены с изолированными
связями.Углеводороды типа диаллила легко получаются, кроме того, «сдваи¬
ванием» аллильных радикалов при действии металла на галоидный
аллил2СН2=СН—СН2С1 + 2Na —► CH2=CH—СН2—СН2—СН=СН2 + 2NaClили действием галоидного аллила с его подвижным галоидом на гринья-
ров реактив, уже содержащий в радикале двойную связь:СН2=СН—CH2MgBr + С1СН2—СН=СН2 —►—► СН2=СН—СН2—СН2—СН=СН2 + MgClBrПолучение 1,3-диенов' Что касается 1,3-диеновых углеводородов, служащих для производ¬
ства синтетического каучука, то для их получения разработано много
специальных способов. В особенности это касается двух первых членов
гомологического ряда углеводородов с сопряженными двойными свя¬
зями— бутадиена-1,3 и 2-метилбутадиена-1,3 (изопрена).Бутадиен-1,3 можно синтезировать следующими способами.1. Альдоль, получаемый альдольной конденсацией ацетальдегида,
восстанавливают в 1,3-гликоль2НСНз-СН—СН2-С-Н ► СНз—СН—СН2—СН2II IIон о он онкоторый затем дегидратируют в бутадиен действием кислоты ил» ката¬
литически — в присутствии А1203:СНз—СН—СНа— СЙ2 —> СН2=СН—СН=СН2i—2Н20нЭтот синтез доказывает нормальное строение цепи и наличие двух
двойных связей. 1,3-Положение двойных связей окончательно доказы¬
вается типичными для сопряженных диеновых связей реакциями (см.
ниже).2. Применяемый в СССР, начиная с 1932 г., промышленный синтез
бутадиена-1,3 по С. В. Лебедеву в конечном счете сводится к предыду¬
щему. Этанол пропускают при 400—500 °С над катализатором из окислов
MgO—ZnO. Такой катализатор обладает свойством дегидрировать
спирты в альдегиды и, будучи щелочным, способен вызывать альдоль-
ную конденсацию альдегида. Дегидрирование и гидрирование—обрат¬
ные процессы — катализируются одними катализаторами; поэтому тот
же катализатор осуществляет присоединение к альдегидной группе во¬
дорода, выделившегося при дегидрировании спирта. Наконец, этот ка¬
тализатор осуществляет (подобно окиси алюминия) также и дегидра¬
тацию. Таким образом, разностороннее действие катализатора Лебедева
270 ДИЕНОВЫЕ УГЛЕВОДОРОДЫ* 1 11 .позволяет за один проход паров спирта над катализатором превратить
его с прекрасным выходом в бутадиен:/НС2Н5ОН —т-> СНз—С'~Нг Ч>/Н /Н /Н2СН3-С^. —> СНа—СН—СН2—С^_ ——*■ СН3—СН=СН-С(So I No ~На° N>ональдоль кротоновый альдегид/Н +Н2сн3—сн^сн—с > СН3—СН=СН—СН2ОНSoCH3—CH=CH—СН2ОН ——> сн2=сн—сн—сн2—-H21JПоследняя стадия реакции заключается в дегидратации и изомери¬
зации (перемещение двойной связи).Итоговое уравнение процесса:2С2Н6ОН —> С4Н6 + 2Н20 + Н23. Разработанный Реппе способ основан на конденсации ацетилена
с формальдегидом, затем гидрировании полученного бутиндиола в
бутандиол-1,4, частичной дегидратации его с фосфорной кислотой в
тетрагидрофуран и полной дегидратации последнего над NaP03 в бута¬
диен-1,3: - • .
2СН20 + НС^СН —v НОСН2—Сз=С—СН2ОНh2/ni. HOCH2-C==C—СН2ОН —► носн2—сн2—сн2—сн2рнн3ро4 Н2С СН2носн2—сн2—сн2—СН2ОН —-*■-н*° HiCv^ch.н*_С\ SCI4-?С\ JllН2С CH2 NaP03' I —57Г” сн2-сн-сн=сн2
н2С\ /Сн, -н“°о4. Двухстадийное дегидрирование бутана сначала до бутилена (ка¬
тализатор— окись xpoi\ia на окиси алюминия), а затем до бутадиена
над окисью железа на окиси алюминия (А. А. Баландин, О. К. Бог¬
данова):катализаторСН3-СН2-СН2-СН3 >» СНз—сн2—сн=сн2 + н2катализаторСНз— CH2— CH=CHj у сн2=сн—сн=сн2 + н2Процесс может быть осуществлен в промышленном масштабе и в
одну стадию.5. Конденсация пропилена с формальдегидом над кислотным ката¬
лизатором .(реакция Принса, см. стр. 253);/Ч н+ +/Н
Н-С' »■ Н-<^о \он f’u СН3 СН СН2 ■CH3-CH_CH2 + | I +СНг0 /СН2-СН2Ч,сн2 —г но сн2 ———► СНз—не;
-Ь н20 + НОу н но/ 2 —сн2
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ271Отщепляя от полученного гомолога 1,3-диоксана формальдегид и
воду, получают бутадиен:уСН2—СН2чСНз-НС( ;о ■■■■■■■ > сн2=сн—сн=сн2чо—сн/ 2; _СН2°Способ, несомненно, очень перспективен.6. Частичная гидрогенизация винилацетилена (стр. 263)Нг (катализатор)СН4=СН—С=СН > сн2=сн—СН=СН2также применяется в некоторых странах для производства бутадиена.Ближайший гомолог бутадиена — изопрен, приобретший важное
значение за последние годы, можно получать методами, лишь частично
аналогичными синтезам бутадиена.1. По А. Е. Фаворскому конденсацией ацетона с ацетиленом (ката¬
лизатор КОН) получают диметилэтинилкарбинолСНзч кон сНа\;с=о + нс==сн ► ;с-с==снсн/ СНз iHкоторый гидрируют (электрохимически) до диметилвинилкарбинолаСН3ч 2^ СНз^ЧС—С=СН ► )С—СН=СН2ch/,Jh сн/^а последний дегидратируют в изопрен:СН3\ХС-СН=СН2 ——► СН2— С-СН=СН2сн/J “Нг° I3 ОН СНз2. Дегидрирование изоамилена на хромалюминиевом катализаторе:А1203; Сг203; Си2+СН3-СН-СН=СН2 > СН2=С-СН=СН2 + Н2<1нз <!:Нз3. Конденсацией изобутилена с формальдегидом получают гомолог1,3-диоксана, который дегидратируют в изопрен:/Н н* +/Н• Н-С' ► Н—с(X) чон(СН3)2С=СН2 (СНз)2С-СН2 /СН2-СН2Ч. —? но сн2 —► (сн3)2с; ;о —>+ Н20+СН2 _н но/ чо—сн/но/
—► сн2=с—сн=сн2 + сн2о + н2о
сн3Все эти реакции ясно доказывают строение изопрена как 2-метил-
бутадиена-1,3,-
272ДИЕНОВЫЕ УГЛЕВОДОРОДЫРеакции диеновАллены не отличаются сколько-нибудь заметно по реакциям от оле¬
финов, за исключением полимеризации при нагревании до 150 °С. При
этом аллен образует димеры, тримеры и тетрамеры с четырехчленным
циклом (С. В. Лебедев):СН2=С=СН2 СН2=С—СН2
сн2=с=Сн2 СНг=С—СН2димерПри гидратации в кислой среде аллен дает ацетон:н+СН2=С=СН2 + HjO ► СНз—С—СНзРеакции диенов с изолированными связями также не отличаются
от поведения олефинов: присоединение происходит по обеим двойным
связям, а при недостатке реагента — сначала по одной.Следует отметить лишь особые свойства метиленовой группы в
дивинилметане и его производных. Выше уже отмечалась повышенная
способность к протонизации водородов метильной или метиленовой
группы, примыкающей к двойной связи (стр. 254). Так, метил в пропи¬
лене можно подвергнуть в жестких условиях (Львов) металептическому
замещению на хлор с образованием хлористого аллила. В соединениях
с системой связей-СН=СН-СН2-СН=СН-подвижность водорода метиленовой группы еще более возрастает. Такие
диены особенно способны к окислению кислородом воздуха с образова¬
нием гидроперекисей (стр. 192)R—СН=СН—СН— СН=СН—RАонРеакции диенов-1,3 с сопряженными двойными связями наиболее
отличаются от реакций олефинов и представляют наибольший интерес.Сопряженность двойных связей (стр. 268) проявляется энергетиче¬
ски в несколько (на 3—5 ккал|моль) меньшей энергии системы и, соот¬
ветственно, несколько пониженной реакционной способности углеродных
атомов 2 и 3, тогда как углероды 1 и 4 обладают нормальной или даже
повышенной способностью присоединять как электрофильные, так и ра¬
дикальные реагенты.Для диенов с сопряженными связями характерны следующие реак¬
ции.1. Водород в момент выделения (радикальная атака) присоединяет¬
ся следующим образом:+ 2НCHj=CH-CH=CHs ► СНз— СН=СН—СНза газообразный водород над никелем или платиной гидрирует все четыре
углерода, образуя бутан.2. Бром и хлор (электрофильная атака) присоединяются также в
значительной степени в положения 1,4СН2=СН-СН=СН2 -+—> СН*- СН=СН—СН2Вг
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ273но наряду с этим образуется и продукт 1,2-присоединениясн2—сн-сн=сн2I IВг Вг3. Хлористый водород на 4Д присоединяется в 1,4-положения и лишь
на lls в положения 1,2:+ HCIСН2=СН-СН=СН2 ► СН3—СН=СН—СН2С1Механизм присоединения бромистого водорода менее ясен, так как
соответствующие бромиды легко претерпевают аллильную перегруппи¬
ровку (см. кн. II) с перемещением двойной связи, и не просто решить, не
является ли образующийся главным образом СНз—СН = СН—СН2Вг
продуктом аллильной перегруппировки первоначального продукта
1,2-присоединения. Обширные работы, уточняющие вопросы 1,2- и1,4-присоединения к диенам, принадлежат А. А. Петрову.4. Важной реакцией 1,4-присоединения является открытая С. В. Ле¬
бедевым димеризация бутадиена при нагревании до ~150°С в винил-
циклогексен:3СНсн/ V// \2СН сн2IIНС сн2'СН2 сн2 ^ 1 1“> н2с сн2/\ /гснсн1jзсн1сн/н,//сн2вииилциклогексенИзопрен в этих условиях образует дипентенСНз1СНз11с1сНС,/ ^сн2НС^ ХСН2
-> 1 1hJ ^сн2Н2С\ /СН2сн1СН
1 *1сIс// \// \СН2 СНзСН2 СНздипентенкоторый встречается в смоле хвойных растений в виде так называемого
лимонена (стр. 512) и представляет собою терпен — составную часть
скипидара.В этих реакциях одна молекула диена реагирует 1,4-положениями,
присоединяясь к второй молекуле диена в 1,2-положения.Лебедевская димеризация явилась первым особым случаем откры¬
той позднее реакции «диенового синтеза», или реакции Дильса — Аль¬
дера (1928 г.), получившей выдающееся значение в синтетической химии.5. Реакция Дильса — Альдера. Диеновые углеводороды присоединяютj q Зак. 382
274ДИЕНОВЫЕ УГЛЕВОДОРОДЫв 1,4-положения производные олефинов, так называемые диенофилы
(присоединение протекает в цис-положение):сна1н сн2L +L 0V Чс(2акролеинсн2 лз// CH-cf“ +1 >СН Н СЧ0сн2 uмалеиновыйангидридсн2
нсх хсн27НС'ох/СН-С^
СН3 \ноНС/С^СН —cf/НС\ /СН—с'снг ЧооВ данных примерах диенофилами служат простейший непредельный
альдегид — акролеин и ангидрид малеиновой кислоты. Присоединение
таких активных диенофилов протекает при комнатной температуре или
при легком нагревании. Активные диенофилы — вещества, содержащие
системы связей С—С—С=0, являющиеся тоже сопряженными. Впослед¬
ствии круг диенофилов все расширялся; хорошими диенофилами ока¬
зались несимметрично построенные галоидпроизводные, такие, как
СН2=СН—С1, СН2=СН—СС13, и виниловые эфиры СН2=СН—OR.
Даже несимметричные углеводороды СН2—СН—R были введены в дие¬
новый синтез, ставший универсальным методом построения шестичлен¬
ных циклов.6. Реакция 1,3-диенов с молекулярным кислородом может протекать
с образованием как полимерных (низкомолекулярных) перекисей — про¬
дуктов 1,2 и 1,4-присоединенияС=С—С==с^ + о2 —-с-с(—С—с—О—О—
|/\—с—с=с—с—о-
I 1 |/\-о—так и перекисных соединении типа аддуктов диенового синтеза:\чс=с—с=
/ I I=с^ + о27. Полимеризация 1,3-диенов. Этот процесс, представляющий огром¬
ный промышленный интерес, под влиянием ряда реагентов может про¬
текать полностью по типу 1,4-присоединения (под влиянием литий-
алкилов) или по смешанному 1,2- и 1,4-механизму — под влиянием ини¬
циаторов цепных реакций (веществ, генерирующих свободные радикалы,
например перекисей, диазоаминосоединений), а также металлического
натрия. Металлоорганические инициаторы полимеризации типа RLi вы¬
зывают анионную полимеризацию, начинающуюся с нуклеофильной
ПОЛИСТОВЫЕ УГЛЕВОДОРОДЫ278атаки алкиланиона R~ на диен. Приводим суммарные уравнения анион¬
ной 1,4-полимеризации бутадиенаC4H9LinCH2=CH—СН=СН2 '-*■—► С4Н9—(СН2—СН=СН—СН2)„-!—СН2—СН=СН—СН2 + Li+и изопренаc4h9liпСН2=С—СН=СН2 *■IСНз—► С4н9—(СН2—С=СН-СН2)П-,- СН,—С=СН— CH2 + Li*I ‘ IСН3 СН3Как было впоследствии установлено, натуральный каучук тожде¬
ствен с продуктом анионной 1,4-полимеризации изопрена и имеет также
Ч«с-конфигурацию (стр. 281).Схематическое уравнение радикальной 1,2—1,4-полимеризации бу¬
тадиена следующее:пСН2=СН-СН=СН2
—*> R—СН2—СН=СН—СН2—СН2—СН—СН2—СН—СН2—СН=СНСН2 И т. д.^Н СНII J1СНг СН2К этому типу полимеров принадлежит лебедевский синтетический
бутадиеновый каучук.8. Под влиянием катализатора Циглера [TiCU'-f-АЦСгНбЫ бута¬
диен тримеризуется в двенадцатичленный цикл — циклододекатрией:сн2 сн,
цс ^сн нгсг х:НС сн НС сн
не "^cHg —*r wof' сн2 илиснЭта тримеризация также идет в 1,4-положения.Все сказанное дает представление о реакциях 1,4-присоединения
как характернейшей черте химии сопряженных систем с двумя двой¬
ными связями или, как их удобно называть, я,я-сопряженных систем.
С другими видами сопряжения, также характеризующегося 1,4-реак¬
циями, мы еще встретимся.ПОЛИЕНОВЫЕ УГЛЕВОДОРОДЫСистематический синтез полиенов с нормальной цепью и сплошь
сопряженными двойными связями был осуществлен путем кротоновой
конденсации ацетальдегида (Р. Кун).Дело в том, что кротоновый альдегид благодаря подвижности во-
дородов его метильной группы способен вступать в конденсацию с10*
276ПОЛИЕНОВЫЕ УГЛЕВОДОРОДЫацетальдегидом, удлиняя свою систему сопряженных связей (кротоно¬
вая конденсация):/Н /Н /Н
СНз— СУ + СН3—СН=СН—С —> СН3—СН=СН—СН=СН—С + Н20ч0 ч0 ч0Полученный таким образом новый альдегид—гексадиеналь всту¬
пает с новой молекулой ацетальдегида в тот же тип конденсации и т. д.,
так что при обычной кротоновой конденсации в качестве побочных про¬
дуктов получается серия непредельных альдегидов общей формулы/НСНз-(СН=СН)„-<Следует подчеркнуть, что предельные альдегиды вступают в конденсацию только
по a-звену, например:СН—СН3/Н /Н || /НСН3-СН2-СН2-С( +СНз-< —гг* СНз-СН2-С-С(_Н2°Следующие СНг-звенья (|3-, у- и т. д.) и СНз-группа обладают углеводородным
характером и водородные атомы в них неподвижны. Система же сопряженных двой¬
ных связен «электропроводна» и в полной мере передает влияние карбонила последней
метальной- группе, делая ее водороды протонизируемыми. Такое поведение типично
для цепи сопряженных двойных связей. Вместо быстро затухающего по предельной
цепи индуктивного эффекта (в приведенном примере —/-эффект) действует почти
незатухающий и хорошо передающийся —7-эффект (или эффект сопряжения,
—С-эффект *):н V СоН-^С^-СН=^СН^-СН—СН—У
НДействуя на непредельный альдегид бромистым этилмагнием, по¬
лучают соответствующий спирт, а его дегидратацией — полиен:СНз—(СН=СН)„—С—Н + C2H6MgBr —* СН3—(СН=СН)„— СН— СН2—СНз -7Г^,1 Iо он—* СНз— (СН=СН)„— СН=СН— СНзАлкаполиены (вплоть до Сю) бесцветны, но уже тетрадекагексаен-
2,4,6,8,10,12 представляет собой ярко-желтое вещество, довольно высоко¬
плавкое для углеводорода (т. пл. 205 °С). В настоящее время известны
также высокомолекулярные соединения со сплошь сопряженными двой¬
ными связями ...—СН=СН—(СН=СН)„ — ... . Это твердые темпера¬
туроустойчивые черные вещества, обладающие свойствами полупровод¬
ников. Они получаются, например, дегидратацией поливинилового
спирта СН-СН2-(СН-СН2)„ ОН ОННекоторые низшие полиены с изопреноидным скелетом встречаются
в природе. Таковы алифатические терпены состава Ci0Hi6, находящиеся* Как уже отмечалось (стр. 176), Г-эффект отличается от М-эффекта того же
направления (т. е. того же знака) тем, что он проявляется лишь в реакции, а не
в нереагирующей молекуле. Эффект сопряжения суммирует оба предыдущих.
ЕНИНЫ277в некоторых эфирных маслах (например, хмеля). К ним относятся
мирценСН3—С=СН—СН2—СН2—С— СН=СН2
СН3 Ин2и оцименСН3— С=СН—СН2-СН=С-СН=СН2
I IСНз сн3Строение их установлено озонированием.В жире печени акул обнаружен интересный углеводород сквален
С30Н50, который представляет собой как бы два фрагмента натурального
изопренового каучука (по три звена), встречно соединенных друг с дру¬
гом, а по краям — с двумя атомами водорода:СНз СН3I I(СН3)2С=СНСН2СН2С=СНСН2СН2С=СНСН2(СН3)2С=СНСН2СН2С=СНСН2СН2С=СНСН2I IСНз СНзОкраска зрелых помидоров зависит от наличия в них углеводорода
ликопина С40Н56, имеющего длинную систему сопряженных связей в
полиизопреноидной молекуле:СН3 СН3 СН3I I I(СНз)2С=СНСН2СН2С==СНСН=СНС==СНСН=СНС=СНСН(СН3)2С=СНСН2СН2С=СНСН=СНС=СНСН==СНС=СНСНI I IСНз СНз СНзЛикопин изомерен красящим веществам моркови — каротинам, фор¬
мулы которых включают один или два шестичленных цикла и имеют
поэтому на одну или две двойные связи меньше, чем ликопин.Подробнее об этих изопреновдах см. кн. II.КУМУЛЕНЫР. Кун получил кумулены, т. е. полиены со сплошь кумулирован¬
ными двойными связями, следующим путем, через гликоли:СНзЧ СНзЧ /СН32 + NaCssC—C=CNa —► )с—С==С— С=С— С^СН3/ CH3/1 | \сн3ОН ОНТакого рода гликоли он восстановил посредством СгС12 в кумулены
(СНз)2С=С=С=С=С=С(СНз)2ЕНИНЫЭто простейшие непредельные углеводороды, содержащие двойные
и тройную связь. Упоминания о них имеются на стр. 263.Представитель этого ряда — винилацетилен, получают димеризацией
ацетилена в растворе CuCl и NH3-I-NH4CI (Ньюленд):2СН=СН —v СН2=СН-С=СНВ качестве побочного продукта при этом процессе образуется три-
мес ацетилена — дивинилацетилен СН2—СН—С=С—СН = СН2.
278полииныДивинилацетилен, являющийся изомером бензола, взрывчат, не¬
устойчив и склонен к самопроизвольной полимеризации.Винилацетилен путем гидрохлорирования превращают в «хлоро-
прен»СН2==СН— С=СН + НС1 —► СН2=СН—С=СН2IС1из которого далее получают хлоропреновый синтетический каучук.Наличие в молекуле винилацетилена подвижного ацетиленового во¬
дорода обусловливает и протекание всех характерных для него реакций:
замещения на Ag, Си1, MgCl (при действии гриньярова реактива).
С кетонами в присутствии КОН винилацетилен реагирует по Фаворскому
с образованием винилэтинилдиалкилкарбинолов (И. Н. .Назаров)СН3кон IСН2=СН—С=СН + СНз—С—СНз •—>■ СН2=СН—С=С—С—ОН4 Ан.которые способны к различным превращениям и потому нашли широкое
применение в синтезе.А. А. Петров, изучавший реакции присоединения к енинам с сопря¬
женной системой связей С=С—С = С и изолированными связями С=С
и Сн=С, сформулировал следующие правильности.В несопряженных енинах галоидирование идет в первую очередь
по двойной связи, а присоединение галоидоводородов — сначала по трой¬
ной связи.Енины с сопряженными связями гидрогенизуются (каталитически
или электрохимически) в первую очередь по тройной связи. Винил¬
ацетилен и его гомологи строения RCH = CH—С==СН присоединяют
бром главным образом в положения 1,4, образуя алленовую систему
л-евязей:СН2=СН—Сэ-СН + Вг2 —► ВгСН2—СН=С=СНВгГомологи винилацетилена типа СН2=СН—C==CR бромируются' и
хлорируются по двойной связи, а иодирование идет по тройной связи.
Галоидоводороды также атакуют тройную связь, но частично присоеди¬
няются и в 1,4-положения.К 1,3-диполярным присоединениям (см. раздел «Гетероциклы», кн. II)
диазометана и др. более способна тройная связь.ПОЛИИНЫПростейший полиин — диацетилен, или бутадиин, НС = С—С==СН
проще всего получить из бутиндиола (стр. 265):SOCl2 NaOC2H5
НОСН2—С==С—СН2ОН ► С1СН2—С=С—СН2С1 *- НС^С—С=СНДиацетилен — бесцветная жидкость с т. кип. 10 °С, крайне неустой¬
чив и склонен к полимеризации. Оба его водорода замещаются на ме¬
таллы и через его натриевое или магниевое производное возможны раз¬
нообразные синтезы (стр. 265).Из диацетилена и формальдегида по Реппе можно получить диол
НОСН2—С^С—С=С—СН2ОНа заменив в диоле гидроксилы на хлор и действуя аммиачной окисыо
серебра, отщепить НС1 и непосредственно получить серебряное произ¬
водное триацетилена (гексатриина)НС-бС—СжС—СзвСНI/
КАУЧУКИ279Этот углеводород самопроизвольно полимеризуется уже при —20 °С.При окислении медных солей ацетиленов типа R—С = СН и поли-
инов типа R—(С = С)П—Н кислородом воздуха или K3Fe(CN)6 сдваи¬
ваются остатки их молекул и получаются полиины:2R— (feC)„—Си + 02 —► R—(С=С—Cs=C)„—R + 2СиОЭтим путем В. В. Коршак и А. М. Сладков получили из диацетилена
окрашенную в черный цвет смесь нерастворимых полимергомологов: С=С—С=С—С=С—С=С По существу, это новая аллотропная модификация углерода.Неожиданным было открытие полииновых углеводородов, а также
соответствующих спиртов и сложных эфиров в некоторых грибах
(Е. Р. Г. Джонс). Например, были открыты следующие полиины:СНз—(С=С)6—СН=СН2 СН3—СН=СН—(Сз=С)4—СН==СН2КАУЧУКИПриродный каучук добывается из млечного сока ряда растений.
Главным каучуконосом является гевея — растение южноамериканского
происхождения, культивируемое также в Индонезии. Обыкновенный фи¬
кус и некоторые виды одуванчика (кок-сагыз, тау-сагыз) также каучуко¬
носы.В Европу каучук попал лишь в начале XVIII века. Индейцы — первооткрыватели
каучука — использовали сырой каучук, многократно покрывая млечным соком глиня¬
ные формы и высушивая их. Образовавшийся эластичный и водонепроницаемый слой
отделяли от глины, разбивая форму и извлекая ее осколки через отверстие образо¬
вавшегося сосуда. Полученные каучуковые изделия применялись как фляги.В Англии научились такой сырой каучук растворять в углеводородах каменно¬
угольной смолы (смесь бензола с гомологами) и получать таким образом резиновый
клей. Первым применением такого раствора была пропитка ткани для придания ей
водонепроницаемости. Чтобы пропитанная с одной стороны ткань была не липкой,
ее складывали вдвое. Плащи из такой двойной ткани по имени ее изобретателя Мак-
Интоша назывались макинтошами. Дальнейшие попытки устранить липкость ткани
посредством присыпки порошками, в том числе и «серным цветом», привели к откры¬
тию вулканизации — процесса, превращающего каучук в резину.Процесс получения и переработки натурального каучука таков.Собранный из надрезов на стволах гевеи млечный сок — латекс —
«створаживают» добавлением уксусной кислоты. Осевшие упругие комья
сырого каучука отделяют и вальцуют, многократно пропуская массу
через вальцы с зубьями. В процессе вальцевания высокоупругий сырой
каучук превращается в пластический материал, который можно смешать
с порошкообразными наполнителями, в частности с серой, служащей
для вулканизации, с ускорителями вулканизации и «наполнителями» —
сажей (серые каучуки), окисью кремния (белые каучуки), сернистой
сурьмой (красные каучуки).При вальцевании, как выяснилось примерно через столетие после
его введения, происходит интереснейший механо-химический процесс.
Сырой каучук представляет собой смесь молекул состава (С5Н8)„ с мо¬
лекулярным весом 100 000—150 000. Огромной длины молекулы каучука
под механическим воздействием вальцов гомолитически разрываются, и
вновь образованные концы их с неспаренными электронами (свободно¬
радикальные концы) поглощают кислород воздуха, образуя перекиси на
концах все еще длинных молекул, которые затем стабилизуются, отда¬
вая на окисление перекисный кислород. С уменьшением длины молекул
увеличивается пластичность каучука, становится возможным ввести в
него серу для вулканизации и наполнители. Из наполненного каучука
280КАУЧУКИформуют изделия (например, шины), которые вулканизуют при нагрева¬
нии. В процессе вулканизации сера присоединяется по непредельным
связям молекул каучука, образуя «мостики» и «сшивая» линейные мо¬
лекулы в практически бесконечные пространственные структуры:СНз СН3I I
сн2—с=сн—сн2—сн2—с=сн—сн2 СН,—с=сн—сн2—сн2—с=сн—сн2 I IСНз СНз
S S I IS S СН,—С—СН—СН2—СН2—С—СН— сн2 II IIН3С S Н3С SI I—> НзС S Н3С SII II
сн2—С—СН—СН2—СН2—С—СН—сн2 I IS SI IS S При сшивании молекулярных цепей каучук теряет пластичность и
приобретает упругие свойства.Вулканизованный наполненный каучук называется резиной.Если дисульфидные мостики редки, пространственная система ча¬
стично сохраняет подвижность, а следовательно, и эластичность. Если
дисульфидных мостиков много, система делается жесткой (эбонит).
Кроме серы существуют и другие вулканизаторы, действующие по прин¬
ципу сшивания молекул.Причина эластичности каучука и других высокомолекулярных ве¬
ществ с очень длинными линейными молекулами такова. Цепь предель¬
ных атомов углерода с валентными углами 109° может принимать вслед¬
ствие свободного вращения вокруг связей С—С самые разнообразные
конформации. Например:Расположенные в 1,5-положениях двойные связи молекулы каучука
существенно не меняют дела.При очень большой длине молекулы наиболее вероятной будет хао¬
тически скрученная конформация молекулы эластомера. При растяги¬
вании куска каучука нитевидные молекулы частично распрямляются,
но более вероятно менее правильное их расположение, и при снятии
растягивающего усилия они снова скручиваются. Это легко понять, если
представить себе на месте атомов углерода растянутой молекулы (нити
каучука) вставшие в ряд молекулы любого газа. Хаотическое тепловое
движение молекул газа тотчас собьет ряд и разбросает молекулы в сто¬
роны. Представим себе теперь, что молекулы связаны так, что каждая
молекула должна находиться на строго определенном расстоянии от
двух своих соседей, иначе говоря, что они связаны валентностями в
цепь. Тогда хаотическое тепловое движение будет сокращать цепь и
действовать, таким образом, противоположно растягиванию.
КАУЧУКИ281Строение натурального каучука. При пиролизе каучук деполимери-зуется с образованием изопрена. Имеющиеся в молекуле каучука олефи-
новые связи могут быть каталитически прогидрированы, причем одно
звено СбН8 потребляет два атома водорода. Каучук присоединяет также
по непредельным связям бром и бромистый водород.При озонировании каучука (Гарриес) получается в качестве един¬
ственного продукта левулиновый альдегид, что можно представить схе¬
матически так: СН2—С—СН—СН2—СН2—С—СН—СН2—СН2—С=СН—СН2 I I IСНз СНз СНз|о21С/О—Оч /О—Оч /О—СХ—сн2-с^ ^сн—сн2сн2—с^ )сн—сн2сн2-с; ;;сн—сн2—СНз о СНз О сн3 он2о I -н2о2н\ н\ н\
—сн2—с=о+ ,с— сн2сн2-с=о + )с-сн2сн2-с=о + ;с—сн2—I I IСНз СНз СНзТаким образом, при озонировании обнаруживается повторяющийся
одинаковый фрагмент структуры макромолекулы каучука.Определение вязкости растворов каучука позволяет судить о его
среднем молекулярном весе. Все сказанное приводит к уже данной выше
формуле природного каучука (Штаудингер).Похожий на каучук природный продукт — гуттаперча отличается
большей жесткостью при обычной температуре и лишь при повышенной
температуре (70—100 °С) приобретает пластичность.Гуттаперча добывается из растений, произрастающих в Индонезии;
она содержится и в нашем бересклете. Гуттаперча применяется в ка¬
бельной промышленности. Состав ее, химические свойства, продукты
озонирования — те же, что и у каучука, откуда следует, что и строение
ее то же. Как показывают рентгеноструктурные исследования, эти про¬
дукты разнятся стереохимически; натуральный каучук имеет ^ыс-конфи-
гурацию, а гуттаперча —' транс-конфигурацию *;Н3Сх Н3Сч/С^СНДТг CU2C=CUСН2 сн2 с=сн сн2 сн2—Н3Скаучук (цые-иэомер)Н;,Сч СН2~-
н3сч /СН2/С=СН
н3сч снгс=сн сн2
с=сн сн2-сн2гуттаперча (даране-дамер)* О цис траыс-тоыерт см. стр, 315.
282НЕПРЕДЕЛЬНЫЕ ГАЛОИДПРОИЗВОДНЫЕСинтетические каучуки. Первым промышленным синтетическим кау¬
чуком (автор С. В. Лебедев) был советский бутадиеновый каучук, полу¬
чаемый из бутадиена полимеризацией посредством металлического нат¬
рия (натрийбутадиеновый каучук). Затем был разработан более удоб¬
ный способ полимеризации, при котором бутадиен эмульгируют в воде,
добавляя для этого мыла (стр. 162). Полимеризация капель бутадиена
вызывается добавляемым инициатором, образующим свободные ра¬
дикалы (например, диазоаминобензол, кн. II). Строение бутадиенового
каучука как продукта смешанной 1,2- и 1,4-полимеризации дано на
стр. 275. Бутадиеновый каучук, так же как и натуральный, превращают
в резину. Для варьирования свойств каучуков бутадиен часто полимери-
зуют совместно с другими непредельными соединениями — стиролом
С6Н5—СН—СНг, акрилонитрилом CH2—СН—C = N (стр. 303) и др. По¬
лучаются макромолекулы полибутадиена с вкрапленными остатками мо¬
лекул сомономера. Бутадиен-стирольные СК прочны к истиранию и идут
для производства шин, бутадиен-акрилонитрильные (бутадиен-нитриль-
ные) каучуки обладают повышенной стойкостью по отношению к угле¬
водородам (бензостойкость) и применяются для изготовления бензопро¬
водов, шлангов и т. п. Схематически их строение можно изобразить так:сн2—сн—сн2—сн=сн—сн2—сн,—сн—сн2—сн-сн2-сн—сн2—сн—I I I I IСН СН R СН RII I II
сн2 сн2 сн2где R = C6Hs или CsN.Сополимеризацией изобутилена с небольшим количеством бутадиена
получают «бутилкаучук», химически более стойкий (содержащий меньше
двойных связей), но способный вулканизоваться благодаря непредель¬
ным бутадиеновым звеньям.Аналог изопрена — хлоропрен (2-хлорбутадиен-1,3) легко полимери-
зуется в хлоропреновый каучук, отличающийся бензостойкостью.НЕПРЕДЕЛЬНЫЕ ГАЛОИДПРОИЗВОДНЫЕМы уже встречались со многими непредельными галоидпроизвод-
ными и с некоторыми способами их синтеза. Формуль!, названия и фи¬
зические свойства ряда непредельных галоидпроизводных приведены
в табл. 32. Необходимо вкратце напомнить и сопоставить методы син¬
теза этих галоидпроизводных.Простейшее галоидпроизводное этилена — галоидный винил. С прак¬
тической точки зрения очень важен хлористый винил СНг=СНС1, при¬
меняющийся в огромных количествах для полимеризации в •поливинил¬
хлорид. Его получают следующими промышленными способами.1. Крекингом дихлорэтана (катализатор А1203):C1CH2—СН2С1 —► СН2=СНС1 + НС}2. Присоединением хлористого водорода к ацетилену.Способ применяется в странах, бедных нефтью, для которых этилен,
следовательно, менее доступен:А1С!3НС==СН + НС1 ► СН2=СНС1Можно комбинировать оба метода, используя для гидрохлорирова¬
ния выделяющийся при крекинге дихлорэтана хлористый водород.Хлористый винилиден СНг=СС12, применяемый, как и хлористый
винил, для полимеризации, получают* отнимая щелочью НС1 от три-
Таблица 33. Непредельные галоидпроизводныеЬ 85Я Я2 м^ Чо
S чм Ч>1 СI I1Л ю— СОTt- <г»«КО*о5Г*» СО
S. 1ЛО-чу- IftI I00<мО Ч SNW коо о© оо
~£-5сосо12Й о.ео 05 ^ 2 2СП *м ”0 С> "q Е 05 СО 00 *СЗo'—'-5 с-fо^—о -Г«'—
S °1—г оЛГ^'О^'СЛ <--'СО х^—v„со .2 -ЛЛ 12 -Я5 S -.см - -r СМ "0й <N *q* -*• с£> тзЛ .
>»сеs 2• <УнSgя *2.so
0) й°
« *
а ч
w и
но>со00.1Л7^ °-сО со —Г
5- — со«* _ы10«5‘Ь
— ю ”1 +t"- о00Tf*h-оооoo~ь~ГCOCOoo<N§со«« 3а-
оо m СМ'7 3 I1 <м
соооо0005f-«-LOco3I г Т4f Tf Tf соh-" со" Cft 05
со СО — СПЮCM1Лоc-lCO<MC'lЮ1CM1СЧ1юсоа.очXо2S'о 3-i*5о- о ?s
B3S-к £ зз •d> 4» 0) я
с С с 1>
ОООЕ
о. О-О-о
д н С О.
ОнЛЙ со о о **Ч Ч р. О к-чХХйХ (ЛСМ СО СО СО —о-оXк .G,о<3О.£а>ОноОнназ0)ЛОноо,о к
н s•0- Н5S
~ о
- а,Г о Iга J 2^ aО- Он <*; L--L *v~н О о . ^
а> ч р. см
h X W —a:аакч4яsяяsяffiffi•SB»s7\3 ■HsseuЙооа-XlQ\ч
£
33
}е
. *К
1 3£0)С0,4
g§
со Ч
S сзЯ Чч кч ч#§ а | ’§й Н Н л^ ° У Йs * 5 £о- Он Я SSо о о п.Ч Ч О- ОX X U3 XяС)Ч£НmОн•I-ИarStlаQ.яа)чЯоя<иРЭчня<пнОнЛо, нсичооXSчОнXСиоF-ча.а>XНЬк f- ^ 33г а> а а»р, га сз s
Q о- Й нн о о <*>.£, ч О- Й »
О $
Я о о а, a
£- я я ю ггн •< ■< ^~ЧэгаQ.Ь.а£иt-4 ИиИ - II£ЕЕЕиIIооип н 11£II II 1
Е ЕЕиOOUЯ N«ЕЕ -.
EOOIVi 11 VНее »oOUEuj. IV
I UfS XЧ М М »|ЕЕЕЕиииии<NЕяООиОIIиIIо«чоЕЕЕииоиииоэЕbo«S?
S?oo IIi iii iii aU.EEEи . uuuu
284НЕПРЕДЕЛВНЫЕ ГАЛОИДПРОИЗВОДНЫЕхлорэтана, в свою очередь образующегося присоединением хлора к хло¬
ристому винилу:СН2=СНС1 + С12 —► СН2С1—СНС12 ——*■ СН2=СС12—НС1Отщепление галоидоводорода от несимметричных галогенидов про¬
исходит в соответствии с правилом А. М. Зайцева: водородный ион от¬
щепляется от углерода, связанного с большим числом галоидных атомов
(о правиле Зайцева см. ч. II, «Реакции элиминации»).Симметрический дихлорэтилен — изомер хлористого этилидена —
синтезируют присоединением недостаточного количества хлора к ацети¬
лену; образуется транс-изомер (транс-присоединение):СН=СН + С12 —► СНС1=СНС1Трихлорэтилен СНС1 = СС12 получают отщеплением НС1 от тетра-
хлорэтана (последний образуется присоединением 2 моль хлора к аце¬
тилену):С12СН—СНС12 ——*■ СНС1=СС12—rlLaТрихлорэтилен не способен к полимеризации.Тетрахлорэтилен СС12=СС12 можно синтезировать, отнимая I моль
хлора от гексахлорэтана (отход при хлорировании этилена и ацетилена)
действием цинка или нагреванием с хлористым алюминием:CCI3-CCI3 -Х7*- СС12=СС12■—L.12Тетрахлорэтилен также не полимеризуется.Из фторпроизводных этилена наибольшее значение имеют тетра-
фторэтилен (CF2 = CF2) и трифторхлорэтилен (CC1F=CF2), которые по-
лимеризуются, давая исключительно устойчивые полимеры.Тетрафторэтилен получают, действуя на хлороформ жидким фтори¬
стым водородом (или трехфтористой сурьмой). Образующийся дифтор-
хлорметан подвергают пиролизу, причем он отщепляет хлористый водо¬
род и оставшиеся дифторметиленовые радикалы сдваиваются в тетра¬
фторэтилен:2CHC1F* > [2CF2] —> CF2=CF2Гомологи галоидзамещенных этиленов получают так же или присое¬
динением галоидоводородов к ацетиленамR— С=СН + НХ —»- R—СХ=СН2
СН2=СН—С=СН + НС1 —»- СН2=СН— СС1=СН2. или отнимая галоидоводород от предельных полигалоидпроизводных
путем их перегонки с небольшим количеством хлорного железа
(P. X. Фрейдлина):FeCl3R-CH2-CC13 R-CH=CC12Непредельные соединения, содержащие галоид у предельного угле¬
рода, получают обычными способами; например, хлористый аллил из
аллилового спирта (стр. 292):СНг=СН—СН2ОН + РС15 —> СН2=СН—СН2С1 + РОС13 + НС1Как уже указывалось ранее (стр. 103), в промышленности хлори¬
стый аллил получают, хлорируя пропилен при высокой температуре по
Львову. В этих условиях идет только замещение в метальную группу.
НЕПРЕДЕЛЬНЫЕ ГАЛОИДПРОИЗВОДИЫЕ285Галоидпроизводные ацетилена можно получить отнятием щелочью
галоидоводорода от симметричного дигалоидэтилена:ХСН=--СНХ нс=схСвойства галоидпроизводных олефиновСоединения, содержащие галоид, связанный с углеродом во втором
валентном состоянии, резко отличаются от соединений, в которых галоид
связан с предельным углеродным атомом.Хлор в хлористом виниле СН2=СНС1, хлористом винилидене
СН2 = СС1г и дихлорэтилене С1СН = СНС1 (так же как бром и иод в
соответствующем положении) мало способен вступать в обычные для га¬
лоидных, алкилов реакции обмена. Это связано со слабым мезомерным
эффектом, действующим в направлении, противоположном обычной по-
6+ б-ляризации связи С—С1 (уменьшающим отрицательный заряд на С1 и
положительный на С), что выражается схемами:Н. — +Но=сС.. ИЛИ СН2=СН—С1 СН2-СН=С1С?Здесь кривыми стрелками изображено мезомерное смещение элек¬
тронов, а прямой стрелкой — поляризация. Следует хорошо уяснить себе,
что с помощью символики прямых стрелок хлористый винил сравни¬
вается с этиленом:/И к
сна=с( и сн2=с(
^С1 \нИз этого сравнения следует, что углерод, соседний с отрицательным
хлором, должен нести сильный положительный заряд.Символика кривых стрелок служит для сравнения хлористого ви¬
нила с предельными хлорпроизводными типа хлористого этила, где нет
взаимодействия электронных пар хлора с электронами я-связи (отсут^
ствующими в молекуле галоидалкила):н г*/ /S/'T'Cl: " С,1>ЛН'О' СР.Частичная (слабая) подача свободной электронной пары хлора в
совместное обладание соседнему углероду (+М-эффект) не может ней¬
трализовать положительный заряд этого углерода. Но следствием этого
является частичная двоесвязность хлора с углеродом и укорочение рас¬
стояния С—С1 по сравнению с галоидными алкилами, а также частичная
подача я-электронной олефиновой связи к крайнему углероду (сравни¬
тельно с тем как если бы описанного выше взаимодействия с хлором
не было). Однако оба атома углерода остаются положительно заряжен¬
ными, хотя и в меньшей степени, чем если бы не проявлялся +М-эффект
хлора. Положительный заряд на углеродах создается мощным оттяги¬
ванием электронов атомом хлора (прямая стрелка С-»С1).Все описанное уменьшает дипольный момент молекулы в целом (для
хлористого винила он равен 1,5 D, а для хлористого этила ~2D),
в частности делает связь хлора с углеродом менее полярной и менее
286НЕПРЕДЕЛЬНЫЕ ГАЛОИДПРОИЗВОДНЫЕреакционноспособной к нуклеофильным атакам, например к атакам та¬
ких групп, как ОН", CN- и др. Иначе говоря, хлор становится менее по¬
движным, т. е. менее обменоспособным.Утверждение, что соседний с хлором углерод несет некоторый поло¬
жительный заряд, доказывается экспериментом Кебриха, который, дей¬
ствуя бутиллитием на хлористый винил примерно при —100 °С, осуще¬
ствил реакцию:/И /Liсн2==с( +ис4н9 —^ ся2=с; +с4н10
\ci \С1
оII/Li /С—OLiсн2=с/ + С02 —> СН2=С^\С1 \С1Отщепление под действием сильного основания соседнего с хлором
водорода в виде протона, связавшегося с бутильным остатком в бутан,
ясно указывает на положительный заряд углерода; несущего хлор.Итак, в обычных условиях галоид в галоидных винилах не заме¬
щается на нуклеофильные частицы. В жестких условиях под действием
сильных оснований — нуклеофилов (КОН, KOR) отщепляются элементы
галоидоводорода и возникает тройная связь; наряду с этим происходит
и замещение. В принципе продукты замещения (например, этилвинило-
вый эфир при взаимодействии хлористого винила с этилатом натрия)
могли бы образоваться двумя путями: в результате присоединения ну¬
клеофила к ацетилену и в результате непосредственной атаки хлористого
винила и вытеснения аниона галоида. При помощи дейтериевой метки
было показано, что оба механизма осуществляются параллельно.Для доказательства этого транс-дейтерохлорэтилен был введен в
реакцию с метилатом натрия. В том случае, если реакция идет как не¬
посредственный обмен, должен получаться исключительно дейтериро-
ванный метоксиэтилен, поскольку атом углерода, несущий дейтерий, не
затрагивается;°\ /Н °\ /Н
)с=сг + ОСН3 —> /С=С^ +СГW NC1 W ХЗСНзЕсли же сначала происходит элиминирование, то должен получиться
недейтерированный ацетилен, транс-Элиминирование более выгодный
процесс, и действительно — побочно образуется только обычный ацети¬
лен. В результате присоединения метилата к ацетилену должен полу¬
читься только дейтерированный простой эфир:сн3о:Dl JA Чо /НСН30" + С—С^_ > С—С^гу —Н' С1 Н XI-—->► CHgOD + н—с=с— н + сгнчн—С5=С—н -^НОСНз > ^С=СН2 + ОСНзснаоД СНзО"
НЕПРЕДЕЛЬНЫЕ ГАЛОИДПРОИЗВОДИЫЕ287Практически образуются и дейтерированный и обычный эфиры в
соотношении 1,4: 1, т. е. преобладает непосредственное замещение атома
галоида.Присоединение хлористого водорода к хлористому винилу идет по
уравнениюно атака протона на удаленный от хлора углерод не доказывает заря-
женности этого углеродного атома. Дело в том, что промежуточно обра¬
зующийся катион (в квадратных'скобках) энергетически выгоднее изо¬
мерного ему промежуточного катионакоторый образовался бы, если бы присоединение шло в обратном по¬
рядке (в сторону образования С1СН2—СН2С1). Значит, энергия актива¬
ции первой реакции много ниже, чем последней. Эта устойчивость про¬
межуточного катиона достигается опять-таки благодаря участию элек¬
тронных пар хлора (см. выше).Наоборот, галоид в галоидных аллилах (и их гомологах) обладает
повышенной обменоспособностью.Это связано со способностью хлористого аллила, так же как и его
аналогов н гомологов, к электролитической диссоциации (как ни мало
он диссоциирован, но гораздо больше, чем галоидные алкилы), что в
свою очередь является результатом большей устойчивости аллильного
катиона сравнительно с катионом алкила. Благодаря мезомерному эф¬
фекту положительный заряд аллильного катиона не локализован на пре¬
дельном углероде, а частично гасится передвижением электронов двой¬
ной связи, вследствие чего обнажается частичный 6+-заряд на крайнем
непредельном углеродном атоме. Таким образом, положительный заряд
распределяется между двумя крайними углеродами аллильной системы,
которые становятся совершенно эквивалентными;Подобно всем явлениям мезомерного (резонансного) выравнивания
электронной плотности, это сопровождается снижением энергии системы
и стабилизацией.Опыты замены галоида в не столь симметричных гомологах галоид¬
ного аллила или в галоидных аллилах с меченым углеродом 14С показы¬
вают, что при таком обмене весьма часто, и даже обычно, наблюдается
аллильная перегруппировка (Прево), в результате которой замещающая
галоид группа связывается не с тем атомом, с котррым был связан га¬
лоид, а с третьим атомом системызСН2=СН—ИСН2С1 + KCN —■* NC—СН2—СН=“СН2 4- КС1В тех случаях когда обмен галоидного аллила течет как реакция
мономолекулярная, т. е. когда сначала галоидный аллил электролитиче¬
ски диссоциирует (медленная стадия реакции, определяющая ее ско¬
рость), а затем аллильный катион быстро соединяется с анионом,♦ /С1сн2-с—но+ > 8+ tСН2=СН~СН2 ИЛИ СН2=СН-СН2 ■<—V- СН2-СН=СН2
288НЕПРЕДЕЛЬНЫЕ ГАЛОИДПРОИЗВОДНЫЕпоследний с равной вероятностью присоединяется к обоим крайним
углеродам и получается смесь обоих продуктов:CH2=CH-I4CH2-CN и NC-CH2—СН="СН2Однако аллильная перегруппировка протекает, и притом нацело,
также и в тех случаях, когда реакция соответствует второму порядку,
т. е. когда актом, определяющим скорость реакции, является столкно¬
вение'двух молекул реагентов. В этом случае аниону, атакующему мо¬
лекулу, легче атаковать крайний углеродный атом с его б+-зарядом,
чем связанный с галоидом углерод, который галоид экранирует своим
отрицательным зарядом. Атакуя крайний углерод с б +-зарядом, анион
вследствие легкой поляризуемости я-связи отодвигает ее электроны к
углероду, несущему галоид, и выталкивает последний в виде анионазIN-61 CH-Gi-ai.-tt. —► MSC-CH-CH-CH, + сГR " А ■Система работает как единое целое с сопряженными связями С = С
и С—С1 (я,ст-сопряжение). Формально такую атаку можно описать как1,4-присоединение, аналогичное присоединению к я,я-сопряженным си¬
стемам:Так же как при 1,4-присоединении к я,я-сопряженным системам,
здесь разрываются связи 1,2 и 3,4 (в нашем случае 3,4 это ординарная
связь С—С1 и поэтому С1 отщепляется) и в положении 2,3 устанавли¬
вается я-связь.Сравнительно недавно открыта возможность получать из галоид¬
ных винилов винилмагнийгалогениды, для чего по методу Нормана вме¬
сто эфира в этой гриньяровой реакции применяют циклический эфир —
тетр агидр офу р а н.Применение галоидпроизводных олефиновЭти вещества применяются как ценные негорючие растворители
(например, СНС1 = СС12) и как полупродукты в промышленных синте¬
зах. Например,:h2so4С1СН=СС12 + 2Н20 >■ С1СН2— +2НС1^ОНГлавное применение они находят как мономеры для полимеризации
в пластические материалы. Для этой цели пригодны лишь вещества, у
которых двойная связь стоит с краю молекулы при группе СН2 или CF2,
а именно СН2=СНС1, CH2=CCl2, CFC1=CF2, СН2=СС1—СН=СН2,
СН2=СН—СС13.Особенно широко используются полимеры хлористого винила (поли¬
винилхлорид), получаемые гомолитической полимеризацией. Пластифи¬
цированные эфирами себациновой или других двухосновных кислот, они
применяются как заменители кожи, для изготовления газопроводных
труб, волокна, имеющего техническое применение, и т. п., а также как
носители пигментов в лакокрасочных материалах. Хлористый винил-
иден в виде полимера или сополимера с хлористым винилом употреб¬
ляется для изоляции кабелей.
НЕПРЕДЕЛЬНЫЕ СПИРТЫ И ИХ ЭФИРЫ289Тетрафторэтилен при гомолитической полимеризации образует поли¬
мер — тефлон, проявляющий поразительную химическую стойкость («ор¬
ганическая платина»). На него не действуют самые концентрированные
кислоты и щелочи при'довольно высокой температуре, он совершенно
устойчив по отношению к действию окислителей и царской водки, выдер¬
живает температуру до 330 °С. Тетрафторэтилен применяют в химиче¬
ском машиностроении и в приборостроении для изготовления* деталей
аппаратов, которые должны выдерживать действие химически весьма
агрессивной среды. Вследствие крайне малой поляризуемости фтора, ко¬
валентно связанного с углеродом, тефлон, каждая молекула которого
обрамлена такими фторами, проявляет очень малые ван-дер-ваальсовы
силы и поэтому не смачивается никакими жидкостями и ни в чем нерас¬
творим. Полихлортрифторэтилен образует пластмассы, сходные с теф¬
лоном. - -НЕПРЕДЕЛЬНЫЕ СПИРТЫ И ИХ ЭФИРЫОлефины не могут нести гидроксил при углероде во втором валент¬
ном состоянии. Структуры ^С=С— неустойчивы и изомеризуются вОН—С— (правило Эльтекова — Эрленмейера). Лишь в некоторых спе-/i IIН Оцифических случаях (стр. 387) такая изомеризация в заметной степени
обратима и мы имеем дело с таутомерным равновесием:N'C=C- *=± \с—С—/ ! /
он>1 АДля структур, в которых не несущий гидроксила непредельный
углеродный атом не связан с электронооттягивающими группами
—С—, N02 и др.), правило Эльтекова — Эрленмейера имеет полнуюI!осилу. Поэтому виниловый спирт и его гомологи не существуют, а при
попытках их получить —перегруппировываются в ацетальдегид (и со¬
ответственно его гомологи)СНо=СН —> СН3—С—нi>„ Аили в кетоны.Причина перегруппировки — проявление того же (мезомерного) эф¬
фекта, что и в хлористом виниле, но в этом случае подходящего до
конца — до полной передачи электронных пар — и являющегося таким
образом t+ Г-эффектом (стр. 176, 276):
290НЕПРЕДЕЛЬНЫЕ СПИРТЫ И ИХ ЭФИРЫЭффект этот протонизирует водород гидроксила и создает у второго
ненасыщенного атома углерода с его 6 —зарядом удобное место атаки
для иона водорода. В результате происходит изомеризация — переход
протона к углероду.Однако алкоголяты, а также простые и сложные эфиры винилового
спирта не только существуют, но в последних двух случаях даже исполь¬
зуются в промышленном масштабе в качестве мономеров. Разумеется,
их приходится получать непрямым путем. При действии металлического
лития или натрия в растворе в жидком аммиаке на ртутное производное
ацетальдегида получаются алкоголяты винилового спирта (И. Ф. Лу¬
ценко);/ОМClHgCH2—+2М —► сн2=с( +MCl + HgЧНгде M=Li или Ма.Эти алкоголяты (точнее, еноляты, так как виниловый спирт — эте-
нол, а его металлическое производное — этенолят) очень неустойчивы и
при попытке ввести их в реакции алкилирования или ацилирования
дают вместо этого альдоль и кротоновый альдегид с ацетальдегидом,
освобождающимся за счет протолиза растворителем (спиртом или во¬
дой). ; ”
Простые и сложные виниловые эфиры, как уже упоминалось (см.
стр. 262), получаются в промышленном масштабу присоединением к аце¬
тилену спиртов (в присутствии КОН) и карбоновых кислот [в присут¬
ствии солей ртути (II), кадмия, цинка]:конROH + НС=СН >• RO—СН—СН2R-С—ОН + НСз=СН *- R—С—О—СН=СН,IIG&Сюда следует добавить действие уксусного ангидрида на кетоны в
присутствии серной кислотын+сн3 С СН3 + СН3 С О С СНз у СН2=С—О—С—сн3 + сн3—с—оно 0 0 СН3 О (!)и действие кетена на ацетальдегид:СНз-С—Н + СН2=С=0 —>- СН,=СН ОА ■ 1 11О О—С—СНзИз виниловых эфиров особенно важен винилацетат, полимеризую-
щийся гомолитически в поливинилацетат. Последний используется для
получения прозрачных пластмасс, в производстве триплекса (склеива¬
ние слоев силикатного стекла) и для получения поливинилового спирта
гидролизом поливинилацетата:
НЕПРЕДЕЛЬНЫЕ СПИРТЫ И ИХ ЭФИРЫ291Поливиниловый спирт находит применение для получения важных
полимерных материалов ацеталированием альдегидами, в частности ма¬
сляным альдегидом (поливинилбутираль):н+ СН2— СН-СН2-СН—СН2-СН~СН2-СН + R-< —►I I I Iон он он он
—>■ —сн2~сн—сн2-сн-сн2-сн-сн2-сн I I I Iо—сн—о о—сн—оI IЯ RШироко используются также сополимеры винилацетата с хлористым
винилом.Алкилвиниловые простые эфиры независимо друг от друга получены
А. Е. Фаворским и М. Ф. Шостаковским и Реппе (стр. 262). Их особен¬
ностью является легко проходящий гидролиз в кислой среде (в отличие
от диалкиловых эфиров), причем вместо винилового спирта получается
его изомер — ацетальдегид:н+R—О—СН=СН2 + Н20 >■ ROH + СН3—С—НРеакция, можно думать, начинается с атаки Н+ на крайний непре¬
дельный углерод. По крайней мере так протекает атака иона ртути
(А. Н. Несмеянов, И. Ф. Луценко), которая приводит к получению из
алкилвинилового эфира ацетальдегида, замещенного в a-положении на
группу ClHg:crH(J2+^CT^CH-^jR/^Vcr Hg+-CH2-C^” + ROH
Cf СГ H+тci-Hg-cH2-c<Q + начСинтез из ацетилена простого винилового эфира и гидролиз его в
ацетальдегид (реакции, не требующие ртутного катализатора, применяе¬
мого при прямой гидратации ацетилена в ацетальдегид по Кучерову)
предложены как способ получения ацетальдегида из ацетилена непрямой
его гидратацией (А. Е. Фаворский, М. Ф. Шостаковский).При нагревании алкилвиниловые эфиры претерпевают перегруппи¬
ровку Клайзена, превращаясь в альдегиды *ck!!7ch <Ё7СНз снз~сн2-сн=овследствие сильного Г-эффекта р,я-сопряженной группы*Г\^с=с-о-сн3
^ I* Ср. с перегруппировкой аллилфенолов, кн. II.
292НЕПРЕДЕЛЬНЫЕ СПИРТЫ И ИХ ЭФИРЫПростые виниловые эфиры, например винилбутиловый, также легко
полимеризуются, но по преимуществу гетеролитически, при иницииро¬
вании реакции кислотами Льюиса, например FeCU:Получаются жидкие вязкие полимеры, применяемые как загустители.Простые виниловые эфиры образуют и твердые сополимеры, но в
результате инициируемой перекисями гомолитической полимеризации.Аллиловый спирт СН2=СН—СН2ОН— наиболее простой из непре¬
дельных спиртов с удаленным от двойной связи положением гидр¬
оксила— по свойствам гидроксила мало отличается от алканолов. Само
собой разумеется, что наличие двойной связи обусловливает его непре¬
дельные свойства и ряд уже известных нам реакций. Промышленный
способ получения аллилового спирта — гидролиз хлористого аллила, по¬
лучаемого хлорированием пропилена при высокой температуре:Ранее аллиловый спирт получали нагреванием глицерина со щаве¬
левой кислотой (образующийся эфир при пиролизе теряет элементы
оксалатной группы в виде 2С02):В растительном мире находится ряд непредельных спиртов, имею¬
щих скелет изопреноидов, т. е. димерного, тримерного, тетрамерного
и т. д. изопрена. Из них назовем спирт с одной двойной связью — цит-
ронеллолЭто — душистая жидкость, входящая в состав эфирного масла розы,
цитронеллового масла и других эфирных масел *. Строение его устанав¬
ливается озонированием.Две двойные связи содержат гераниол и изомерный ему линалоол:Гераниол содержится как главная составная часть в эфирном масле
листьев герани (откуда и добывается) и обусловливает его запах. Со¬
держится он также в розовом масле. При озонировании образует леву-
линовый альдегид (как и каучук, см. стр. 281), ацетон и гликолевый
альдегид, чем и доказывается его строение. Линалоол пахнет ландышемон-CHj=CH—СН3 + С12 ——*- СН2=СН-СН2С1НС1снг=сн—сн2онСН2—СН—СН2+ НО—с—с—он —>■III II IIон он он о оо осн2—сн—СН2ОН —•»| | —2С020=С—с=о
—>- СН2=СН—сн2онСНз—с=сн—сн2—сн2—сн—сн2—сн2онСНзСН;СН;СН;СН;СН;СН3С=СНСН2СН2С=СНСН2ОНСН3С=СНСН2СН2ССН=СН2IОНгераниоллиналоол* Эфирные масла цветов (или листвы) получают, отгоняя с водяным паром
летучие составные части этих объектов. Легкий слой эфирного масла отделяют от
воды и используют.
АЦЕТИЛЕНОВЫЕ СПИРТЫ И ПРОСТЫЕ ЭФИРЫ293и используется в парфюмерной промышленности сам по себе и в виде
сложных эфиров (линалоолацетат). Находится он в лавандовом, берга¬
мотовом и кориандровом эфирных маслах. Может быть получен из гера¬
ниола аллильной перегруппировкой (стр. 287).Фарнезол содержится в цветах липы и обусловливает их запах. Он
имеет следующее строение:СНз—с=сн-сн2-сн2—с=сн-сн2—СН2-С=СН-СН2ОНI I IСНз СНз СНзПрименяется в парфюмерии.ФитолСН3-СН-СН2-СН2-/СН2-СН-СН2—СН2\—СН2-С=СН-СН2ОНI I IСНз V СНз /, СНзв виде сложного эфира входит в состав молекулы хлорофилла (см. кн. II,
«Порфирины»).Исследуя вещества, выделяемые самками бабочек и служащие для
привлечения своим запахом самцов, Бутенандт выделил из самок шел¬
копряда непредельный спирт бомбиколН Н НI I I
СНз-(СН2)2-С=С-С=С—(СНг)»-СН2ОНцис- J. транс-
ггБабочки чувствуют его запах на огромном расстоянии.АЦЕТИЛЕНОВЫЕ СПИРТЫ И ПРОСТЫЕ ЭФИРЫЭти вещества не получили большого значения и изучены сравнитель¬
но мало. Назовем из них один пропаргиловый спирт СНз=С—СНгОН,
который в настоящее время проще всего получают по Реппе (стр. 265):CuC=CCuHCs=CH + CH20 ► HCs=C-CH2OHОн обладает обычной спиртовой функцией, при замене гидроксила
способен к аллильной перегруппировке; имея ацетиленовый водород,
может замещать его, как и ацетилен, на металлы, в частности на серебро
и на медь.О бутиндиоле НОСНг—С==С—СНгОН см. стр. 265 и 270.Простые алкилэтиниловые эфиры были впервые получены М.. Н. Щу¬
киной, исходя из простых виниловых эфиров:CjHeONaСН2=СН—OR + Вгг —► CH2Br—CHBr—OR ► СН=С—ORПо Якобсу, их получают, действуя цинковой пылью в спирте на
ацетали дибромацетальдегида и затем отщепляя НВг от образовавше¬
гося алкилбромвинилового эфира:zn; С2Н5ОН /ВгВг2СН—CH(OR)2 *• BrCH=CH.-OR+Zn(xORC2H5ONaBrCH=CH—OR ► Cte=C—ORЭти вещества нашли применение в диеновом синтезе, так как они
легко конденсируются с диенами.
294НЕПРЕДЕЛЬНЫЕ ОКСОСОЕДИНЕНИЯНЕПРЕДЕЛЬНЫЕ ОКСОСОЕДИНЕНИЯ
ОКСОСОЕДИНЕНИЯ С ОЛЕФИНОВОЙ СВЯЗЬЮВ оксосоединениях двойные связи (олефиновая и карбонильная) мо¬
гут быть сопряженными — в этом случае они разделены одной простой
связью и вся группировка имеет вид —С=С—С=0 —или изолирован¬
ными, т. е. разделенными большим количеством простых связей.Альдегиды и кетоны с удаленными друг от друга изолированными
карбонильной и олефиновой я-связью получаются обычными методами
синтеза альдегидов и кетонов, но с участием соответствующего непре¬
дельного реагента. Свойства их суммируют свойства оксосоединений и
олефинов.С точки зрения особенностей синтеза и реакций интересны только
оксосоединения с сопряженными связями. Поэтому мы уделим внимание
только им.Синтез непредельных альдегидов с сопряженными
связями С=С и С=0В ряду этих альдегидов особняком стоит первый член ряда — акро~леин (пропеналь) СН^СН—С . Давно известный способ его полу-чения — дегидратация глицерина — осуществляется нагреванием глице¬
рина до 200 °С с гидросульфатами щелочных металлов, например с
KHSO4. Смысл реакции виден из уравнения! „ - -Н+ I /н . .СН2—CH—СН2 ——»■ СН2—СН-СН »■ СН2—СН2—о/ »I I I -НаО , I -н+ I ^О ~Н2°ОН ОН ОН ОН ОН ОНН+/н—► сна=сн—с:Ч>Технически гораздо более важны новые пути получения акролеина:а) окисление пропилена воздухом над катализатором CuO при
350—400 °С и давлении немного выше атмосферного;СцО /НСН2=СН—СНз + о2 —► сн2=сн— с' + н20
^об) конденсация формальдегида с ацетальдегидом над силикагелем
(щелочным) с одновременной дегидратацией (300 °С) получающегося
p-оксипропионового альдегида;/н /Н /НСН^О + СНз-С^ —► носн2—сн2—С^ ——*- сн2=сн—сч0 ч0 -н*° ч0Гомологи акролеина получают кротоновой конденсацией альдегидов
'(стр. 138), например кротоновый альдегид из ацетальдегида;/И /Н /Нсн3~с( +сн3-с( —► сн3-сн=сн-с'
чо чо 2
ОКСОСОЕДИНЕНИЯ С ОЛЕФИНОВОЙ СВЯЗЬЮ235Кротоновый альдегид, как уже упоминалось (стр. 275), благодаря
передающей влияние сопряженной системе связей С = С—С = 0 имеет
активную метильную группу (протонизируемые водороды) и в свою оче¬
редь конденсируется с альдегидами по кротоновому типу-/Н ,Н м
сн3-с^ + сн3-~сн=сн-с^ ——*■ сн3—сн=сн—сн=сн—сЧ> ~2Н* Ч>сорбино»ый альдегидПодвижность водородов метальной группы сохраняет и сорбиновый
альдегид.Синтез непредельных кетоновЭти вещества получаются путем конденсации альдегидов с кетонами
(альдольная конденсация с последующей кротонизацией) или кетонов
между собой. В реакциях альдегидов с кетонами применяют щелочной
катализатор — немного щелочи или вторичный амин—пиперидин (см.
кн. II, «Гетероциклические соединения»)он-СН20 + СН3—С—СН3 ► НОСН2—СН2—С—СН3 —>• СН2=СН—С—СН3 + Н20II II IIО о о/н он-
СНз-С + СН3-С-СН3 ► СНз—СН=СН—С-СН3 + Н20чо Л ко опри взаимодействии кетонов — серную кислоту или кислоты ЛьюисаСНзЧ н+ СН3чС—О + СН3—С—СНз ► ,С=СН—С—СНз + н2осн/ I сн/ 4окись мезитилаСН3ч /СН3 СН3ч /СН3,С=0 + СНз—С—СНз + 0=с( —»• ;с=сн—С-СН=С
СН/ ^ ЧСН3 СН3/ II хсн3форонСвойства оксосоединений с сопряженными
двойными связямиТакие оксосоединения очень реакционноспособны и, как это обычно
бывает в подобных случаях, имеют резкий запах.Особенно агрессивен акролеин, который обладает столь сильным
слезоточивым действием, что во французской армии его применяли в
первую мировую войну в качестве слезоточивого ядовитого газа. Кухон¬
ный чад также слезоточив вследствие присутствия малых количеств
акролеина, образующегося за счет разложения глицерина и его эфиров
(жиров) при пиролизе на сковороде. Винилкетоны типа СН2=СН—С—R
тоже пахнут довольно резко. ||О
296НЕПРЕДЕЛЬНЫЕ ОКСОСОЕДИНЕНИЯКетоны типа окиси мезитила и форона уже обладают сравнительно
приятными запахами, так же как и высшие непредельные альдегиды.\ I IНаиболее общим свойством систем ^/С=С—С=0 является повы¬
шенная активность олефиновой связи к реакциям присоединения, в част¬
ности к реакциям олефиновой (винильной) полимеризации, причем в
первую очередь это относится к системам с незамещенной метиленовой
группой, т. е. СН2=С—С=0. Такие вещества, как винилкетоныСН2=СН—С—R, служат, например, мономерами для получения поли-IIОмеров практического назначения. Акролеин полимеризуется настолько
легко, что долгое время его не умели хранить (это было особенно важно
в связи с его военным применением).Французский химик Муре вскрыл связь между окислением и поли¬
меризацией акролеина и показал, что введение малых количеств ингиби¬
торов окисления (например, гидрохинона, см. кн. II) прекращает не
только окисление, но и полимеризацию. Дело в том, что при окислении
образуются перекиси, из них некоторые (и продукты их распада) обла¬
дают свойствами свободных радикалов и инициируют полимеризацию.Связь между окислением и полимеризацией сопряженных оксосое¬
динений имеет общее значение. На примере акролеина она выразится
такзСН2=СН-С^ + Fe3t —> СН2=СН-СГ + Н+ + Fe2+Н инициатор
окисления
(один нз
многих
возможных)СН2=СН-(Г + о2 —> сн2=сн-сг\о-о.сн2=сн-с; +сн2=сн-сг —> сн2=сн-сг +сн2=сн-с-оон41 X)—о.« ¥
© лs о5 я6* м5 °=r е*оОоСН2=СН-С—ООН + СН2=СН-С^ —> 2СН2=СН—сХН ^онооулО ||СН2=СН-С^ + пСН2=СН —> СН2=СН—С—СН2—СН— /СН2СН N, • I I IСНО СНО ^ СНО/я-,инициатор
полимеризации
(один из миогнх
возможных)Роль ингибитора окисления (антиоксиданта) и ингибитора полиме¬
ризации состоит в перехвате и иммобилизации свободных радикалов (бо¬
лее подробно процесс рассмотрен при описании гидрохинона, см. кн. II).Стабилизованныи гидрохиноном акролеин хранится неограниченно
долго,
ОКСОСОЕДИНЕНИЯ С ОЛЕФИНОВОИ СВЯЗЬЮ297\ I IВсе сопряженные системы ^/С=С—С=0 способны присоединятьв кислой среде воду, причем присоединение идет против правила Мар¬
ковникова:\ I I^С=С—С=0 + Н20\ 1 1
чс—с—с=о/| !
но нЕсть основания считать, что такой порядок присоединения воды,
а также галоидоводородов и кислот обусловлен 1,4-присоединением
(стр. 272), например:ОН4 3 2 1 Н+ |СНз—с=сн—с=о + Н20 —»■ сн3—с—сн=с—о—нСНзСНзсн.,СНзК карбонильному кислороду присоединяется Н+, а к дальнему оле-
финовому углероду ОН". Образующаяся молекула по правилу Эльте¬
кова— Эрленмейера неустойчива и перегруппировываетсяОНIСНз—с—СН=С—онСНзСНзонIСН3—С—СН2—С=0
I IСНз СН3в результате карбонил регенерируется и внешне присоединение совер¬
шилось как бы по С = С-связи.Аналогично присоединяется НС1:\/С=С—С=0 + HCI\ I I \ХС—С“= С—ОН —>- _/1 /ДCl С1с—сн,—с=оК непредельным кетонам с сопряженной связью легко присоединяет¬
ся и аммиак. Для окиси мезитила и форона реакции идут так:СН3ч,С=СН—С—СНз + NH34окись мезитилаСНз'7СН3.сн/ IС—СН2—С—СНзnh2диацетонаминоуСН3С=СН—С—сн=сСН:\офоронСНзNILсн.сн4CV /ь
/ NH \сн3”:П>>триацегонимин
(2,2,6,6-тетраметил*
пиперидои-4)Важное значение в органической химии имеет реакция Михаэля, со¬
стоящая в присоединении в щелочной среде к непредельным сопряжен¬
ным оксосоединениям веществ, содержащих легко протонизируемый
298НЕПРЕДЕЛЬНЫЕ ОКСОСОЕДИНЕНИЯ(подвижный) водород, например, малонового эфира, эфиров р-кетоно-
кислот, а также р-дикетонов, по схеме:R" R."' „ R" R"'R\ I I R\ I 1С="С—С=0 + СНз—С—CHj-C—R"" —*- 'с—сн—с=оК'7 А Iо=с/ Nj:=o
г" сн3По реакции Михаэля анион дикетона, эфира-р-кетонокислоты, мало¬
нового эфира и т. д. атакует p-углеродный атом непредельного оксосое¬
динения.По сути дела, присоединение синильной кислоты относится к этому
же типу реакций (см. ниже).Из всего изложенного видно, что имеется известная аналогия между
сопряженными системами С=С—С—О и С—С—С=С (стр. 272).Особенно интересно течение реакций с реагентами, способными при¬
соединяться по карбонильной двойной связи. Здесь проявляется до¬
вольно резкая разница между альдегидами и кетонами. Альдегиды ре¬
агируют нормально по своей карбонильной группе, например:/И • /НСН2=СН—с' 4- RMgCI —>- сн2=сн-сЧ) I ^-OMgCI/И /НCHS=CH-C' +HCN —> СН2=СН—С'чо |\онCNКетоны же часто (хотя и не всегда) реагируют, присоединяя реагент
в 1,4-положения:<821 4921 Н20СН2=СН-С==0 + R'MgCl —> CH2-CH=C-0-MgCl >•I II —MgOHClR R' Ri n—► CH2—CH*=C—OH —>• CH2—CH2—C=0II IIR R R' Rш IVТаким образом, после гидролиза продукта присоединения гринья-
рова реактива к непредельному кетону образуется (через неустойчивую
енольную форму III) предельный кетон IV. Прн присоединении гринья-
рова реактива в 1,4-положения двойная связь, как всегда (сгр. 272), пе¬
ремещается в 2,3-положение. Это было доказано озонированием еноля-
тов (Колер). По аналогии такой же ход реакции — присоединение в1,4-положения — принимается и для реагентов с подвижным водородом
(HCN, NaHS03 и т. п.), где изолировать первично образующийся енол
нельзя:СНг=СН—С=0 + HCN -IRСН2=СН—С=0 + NaHS03АСН2-~СН=С—ОН1 —V СН,-СН2—С=0
iN R J CN RГСН2—СН=С-ОН1 —V сн2—сн,—с=оI I I.SOjONa R J S030Na R
ОКСОСОЕДИНЕНИЯ С ОЛЕФИНОВОЙ связью299В отличие от изолированной олефиновой связи и подобно сопряжен¬
ной системе С —С—С = С, непредельные альдегиды и кетоны восстанав¬
ливаются водородом в момент выделения. При этом образуются пре¬
дельные оксосоединения:-*■ СНз—СН2—с=оСНг=СН-С=0 + 2Н —> ГСН3-СН=С-ОН
1 1
R I RIRт. е. и здесь дело выглядит так, как если бы водород присоединялся к
связи С—С, не затрагивая связь G=0. Следует отметить, что кроме
этой, явно гомолитической реакции, все остальные являются гетеролити-
ческими: четвертый (углеродный) атом системы подвергается нуклео¬
фильной атаке (CN~, HSOJ, ОН"), что несвойственно олефинам (обыч¬
но присоединение к олефинам начинается с электрофильной атаки
Вгг, Н+, Hg2+ и т. п.). Все указывает на то, что сопряжение в этом случае
можно выразить, скорее, символамиСН2=СН^-С=0> или снг*=сн-с=о ч—>- сн2-сн=с-огчемR R RСН2=СН—С=0 • СН2-СН=С—О*I * IR Rт. е. что сопряжение имеет гетеролитический характер. Иными словами,
перекрывание орбиталей я-электронов совершается так, что они в боль¬
шей степени концентрируются на более отрицательном кислороде, при¬
чем в момент атаки эта неравномерность концентрации электронов
резко усиливается (динамический эффект сопряжения или таутомерный
Г-эффект).Из встречающихся в растительных объектах и имеющих промышленное приме¬
нение (парфюмерия) непредельных оксосоединений упомянем цитронеллаль и цитраль.Цитронеллаль — альдегид цитронеллового масла (нард), содержащийся также
в лимонном и эвкалиптовом эфирных маслах *. Он имеет скелет изопреноида (см.
кн. II);СН3ч ^О;с=сн—сн2—сн2—сн—сн2—ссн/ UДве олефиновые связи содержит цитраль, находящийся во многих эфирных
маслах (вербены, лимонном, особенно лемонграссовом). Его можно также получить
осторожным окислением гераниола (стр. 292)оСН3—С=СН—СН2—СН2—С=СН—СН2ОН —>^н3 £н3—+ СН3—С=СН—СН2-СН2—С=СН—С'I I ЧНСНз СН3чем устанавливаются родственные отношения обоих природных продуктов.Содержат также трудноотделимую примесь„ОСН. сн,СНз-С—СН2—СН*—СН2-СН-СН2-СII I \н
500 НЕПРЕДЕЛЬНЫЕ ОКСОСОЕДИНЕНИЯПри кипячении в щелочных растворах цитраль распадается на ацетальдегид ц
метилгептенон:СНз—С=СН—СН3—СН3—С=СН—СГ + Н20 —>I I ХНСН3 СН3онI он-
—> CH3-C=CH-CH2-CH2-C-CH2-Cf »•I I \нСН3 СНзСН3-С=СН—СН2-СН2-С=0 + СНз-С;I I \нСНз СНзПервая фаза реакции — гидратация сопряженной системы С = С—С=0; вторая
фаза — реакция, обратная альдольиой конденсации. Строение метилгептенона уста¬
навливается окислением его в ацетон и левулиновую кислоту (стр. 384)о СНзч Осн3-с=сн-сн2-сн2-с=о —> ;с=о+ ХС—СНг-СН2—с=оI i СН/ но/ IСНз СНз СНзоткуда следует строение цитраля, а также и гераниола.А. А. Петров предложил такой синтез цитраля: к молекуле изопрена присоеди¬
няется в присутствии хлористого цинка продукт 1,4-присоединения хлористого водо¬
рода к другой молекуле изопрена:ZnCl2СНг==С—СН=СН2 + СН3—С=СН-СН2С1 —►I IСНз СНз—> СН3-С=СН-СН2-СН2—С=СН-СН2С1I IСНз СНзПолучается геранилхлорид, который кипячением с водным раствором уротропина
(реакция Соммле *) превращает! в альдегид — цитраль:СН3-С=СН—СН2—СН2-С=СН—СН2С1 + (CH2)eN4 + Н20 —>СНз СН3—сн3-с=сн-сн2-сн2-с=сн-с^^н3 СНзЦитраль вступает в кротоиовую конденсацию с ацетоном, образуя непредель¬
ный кетон псевдоионон:СН3-С=СН-СНа-СН2-С=СН-С^ +CH3-C-CH3 —>Ан, Ан, Хн <5—> СН3—С=СН—CHg—СН2—С=СН—СН=СН—С—СНзI I IIСНз СНз о* О механизме реакции Соммле (окисление уротропином группировки —СН2С1
в — СН==0) см. кнА II, «Перегруппировки*,
КЕТЕНЫ301При нагревании с кислотами псевдоионон изомеризуется в циклические (изомер¬
ные друг другу) непредельные кетоны иононы:Н3СЧ /СНз
ССН3А—СНзHC^ СН—СН=СН—С—СН3Н2с/ \сн—СН=СН—С—СНзН2сх ^С—СНз
СНоН2СХ /С-СН3
СН2оНзСч.СНзСН2С/ \С-СН=СН-С—СНзН2СХ /С-СНзоСН,g-иононЭти вещества пахнут пармской фиалкой и широко употребляются для изготов¬
ления парфюмерных композиций. Они близки по строению к природному душистому’
веществу фиалки и ирисового корня — ирону (см. кн. II, «Изопреноиды»),КЕТЕНЫВ 1905 г. Штаудингер открыл новый класс непредельных оксосоеди¬
нений— кетены с характерной для них группировкой С = С = 0. Они
были получены отнятием брома от бромангидридов а-бромзамещенных
кислот цинкомR"С—С=0 + ZnI I
Вг ВгС=С=0 + ZnBr*или дегидрогалоидированием хлор ангидридов кислот цинком или тре¬
тичным амином:ч,С—С=0 + NR"R'/ I I
Н С1С=С=0 + Rif N • НС1R"Простейший кетен СНг=С = 0 может быть получен пиролизом аце¬тонаО|| 500-600 °С
СНз—С—СНз »■ СН2=С=0 + СН4или уксусной кислоты:СНз-С-ОНIIО700 °ССН2=С=0 + НгООбе реакции используются в промышленности для получения ке-
тена, который затем превращают в уксусный ангидрид:СНз-С-ОН + СН2=С=0 -IIОСН3—С—О—С—СНзII IIО ОКетены образуются также в процессе некоторых перегруппировок
(см. кн. II, «Перегруппировки»).Кетен СНг=С = 0 — газ, т. кип. —41°С, т. пл. —135 °С; диметил-
кетен (СН3)2С = С — О — светло-желтая жидкость, т. кип. 34 °С,
т. пл. —98 °С.
902НЕПРЕДЕЛЬНЫЕ КИСЛОТЫКетены могут рассматриваться как своеобразные ангидриды кислот.
Действительно, с водой они тотчас превращаются в кислоты, со спир- г
тами — в сложные эфиры, с аммиаком и аминами — в амиды и замещен¬
ные амиды, с кислотами — в ангидриды:ОIIн2с=»с=о + н2о —*■ СН3—С—он
О
Н2С=С—О + ROH —► СН3—C-OR
ОIIН2С=С=0 + NH3 —► СНз—с—nh2
НгС=С=0 + СН3—С—ОН —► СН3—С-О—С—СН3II II IIо о оОни ацилируют также амиды кислот, образуя по стадиям диацил-
аМины (имиды) и триациламины (К. А. Кочешков) зУ . ssKf0' ( “Ich3-c-nh2 *- \CH3-C/2NH >- \CH3-C/3NКетены ацилируют также оксосоединения с незамещенной а-метиле-
новой группой. При этом получаются ацильные производные енольной
формы:СН2=С=0 + СНз—с—СНз —► СНз—с—О—с=сн2
II II I
о о сн3Кетены легко самопроизвольно димеризуются в «дикетены»сн2=с=о сн2=с—О
+ —►II
сн2—с=о сн2—с=0из которых пиролизом при 600 °С можно регенерировать кетены.Простейший дикетен, формула которого приведена выше, представ¬
ляет собой (3-лактон енола ацетоуксусного эфира (см. стр. 405). При
действии этанола он превращается в ацетоуксусный эфир, чем доказы¬
вается его строение:СН2=С О
I I + CjH5OH —► СН3—С—СН2— С—ОС2Н6
СН2-С=0 II II
О Оэтиловый эфир ацетоуксусной
кислотыПродукт обезвоживания малоновой кислоты — бис-дикетен, недокись
углерода 0=С=С=С—О, был упомянут на стр. 188.НЕПРЕДЕЛЬНЫЕ КИСЛОТЫ
ОДНООСНОВНЫЕ КИСЛОТЫ ЭТИЛЕНОВОГО РЯДАНепредельные кислоты типа —С—С—С—О с сопряженными кар-IIIОНбонильной и этиленовой двойными связями (сс,р-непредельные) резко
отличны по способам получения и свойствам от кислот с изолирован¬
ными кратными связями типа —С=С —(СН2)*--С=0.J J IОН
ОДНООСНОВНЫЕ КИСЛОТЫ ЭТИЛЕНОВОГО РЯДА303Физические свойства представителей кислот обоих типов приведены
в табл. 33.Простейшие и важнейшие кислоты с сопряженными связями: акри¬
ловая и ее гомологи — а-метилакриловая, или метакриловая, и р-метил-
акриловая, или кротоновая. Первой и последней соответствуют знакомые
нам альдегиды — акролеин и кротоновый альдегид, и родство их может
быть установлено окислением этих альдегидов в соответствующие им
кислоты окислителями, не затрагивающими двойные связи, например
фелинговым реактивом.Имеющие большое техническое значение акриловая и метакриловая
кислоты могут быть изготовлены следующими промышленными спосо¬
бами.1Акриловая кислота. 1. Из этиленхлоргидрина или окиси этилена
через нитрил p-оксипропионовой кислоты гидролизом и одновременной
дегидратацией этого нитрила концентрированной серной кислотой:Н20;НОСН,—СН2С1 +KCN —г , „„r h2so4—> СНз—CH2CN ——► СН2—СН—C=Qн2с—ch2 + hcn — 1 I\ / OH OHо2. Гидролизом акрилонитрила:h2so4CH2=CH—C=N + 2H20 »■ CH2=CH—C=0 + NH«HS04IOHАкрилонитрил в промышленности получают последующим реакциям:
Н2С CH2-fHCN —* HOCH2-CH2CN —-*• CH2=CH-CN (I)у — Н2иОCuCl; NH4C1; НС1HC=CH + HCN > CH2=CH-CN (2)гейшей—CH3 + 3/202 + 2NH3 —> 2CHS=CH—CN + 3H20 (3)из которых реакция (3) — окисление смеси пропилена и аммиака недо¬
статочным количеством воздуха над катализатором (это, по-видимому,
самый экономичный и перспективный путь).3. Реакцией Реппе из ацетилена (см. стр. 264):Ni(CO)4НС=СН -f СО + Н20 ► СНг=СН— С=0ОН4. Присоединением фосгена к этилену в присутствии А1С13:А1С13 +н2оСН2—СН2 + СОС12 > С1СН2— СН2—С—CI ——f- СН2=СН—с==оI "HC1 Iо он'Метакриловую кислоту обычно синтезируют из ацетона и синильной
кислоты:h2so4СН3—С—СНз + HCN —► СНз-С-СНз ► СН3-С — С=0 + Н20 + NH3II / \ ■ II • IО НО CN СН2 ОНциангидрин
аце гона
Таблица S3. Акрилован кислота, се гомологи н производные304ВО!*4*! 358о2 SU
00 Э1*©еч ,—чN. «л
00 ~® guоо й-°оо©о52о 32ч ss§,S
ем вН и * ;° го о. ■о.о|СЧ 0_S о-S.fl>§ #яS Яо 04)*f2«е5
* =*иэ 'оо11§1 СО
ОюечЛ ь Оо о N •»
Е аСЧ Я U — <<о Очо со !
°. В <£> о00-иГ*4ю1Cо Vоо00—зо «чГ
о'—ою(Лоgsiy|£-ё“wi ч
тЬ- св
— Л3я-r§.sS=og.*&°g.IS~ A — Q. ЛСО S ,*
CS| Я 5 *?I Л * <•>I #й Ле-з.|«о
§гг|£иS SСОеч~о£юю"счЕЙсвЯОчао.к<8*а«33.«is2 58 3
2саS'*
* £gs’i *
18&а§ в“23о о н
.5 £."S 5? а• *54 3
X 9Ъ.ь* w
ь » се
и <В3 о„Д§
з s &о в «5 S 5
о S Э6 8 Sл р* а»
<§&?
ж «ва,**#«CQ
.. в*8я 3m *"* S"1
о) S1 S йШ§
Я
4>^ т чSaO*<■>а5ГСвчв>Sч* вСОI* я^ о* «
Q Я*• 5f
к яксвЛ4>*=:ояяt?ИС⧫VчояяпXООи5А§ои4tЯ'иSои±иIIкиЯиЯОоп* Ч
жО—иАиИОоО*•»ечЯиЧа'ЯиIIЯиГчXо07XиXикиIIXоечЯоXоIIКCJечКО•ояоя8и(чечЯисоЯи5яипXиТемпература плавления метилового эфира метакриловой кислоты —50°С*
ОДНООСНОВНЫЕ КИСЛОТЫ ЭТИЛЕНОВОГО РЯДА305Поскольку применение находит не сама метакриловая кислота, а ее
метиловый эфир, практически в смесь циангидрина ацетона с серной
кислотой добавляют метанол и получают сразу метилметакрилат (из
p-оксинитрила пропионовой кислоты так же получают непосредственно
метилакрилат).Кротоновую кислоту можно, кроме окисления кротонового альде¬
гида, получить также конденсацией ацетальдегида с малоновой кислотой
в пиридиновом растворе (Кневенагель):СНз+ н2соо оII IIС—ОН /С—ОН—► СНз—СН=С^чС-ОН ^С—ОНII IIО ОСН3—СН=СН—С—ОН + С02IIОНепредельные кислоты рассматриваемого типа в некоторых реак¬
циях ведут себя по типу альдегидов и кетонов с сопряженной системой
связей. Сюда относится легкое присоединение по олефиновой двойной
связи воды в кислой среде, галоидоводородов и аммиака. Все эти реак¬
ции дают р-замещенные пропионовые кислоты, т. е. реакции идут против
правила Марковникова, например:СН,=СН— СООНн,о-> НОСН,—СН,—СООНнх-> ХСН,—СНо—СООНNH3--> H2NCH2—СН,—СООНПрямых доказательств, что эти реакции идут как 1,4-присоединение,
нет, но довольно вероятно, что они протекают, как показано в разделе
«Винилогия» (стр. 312), по существу, как 1,4-присоединение.Поскольку карбонил карбоксила не присоединяет синильной кис¬
лоты, бисульфита и т. д., то в эти реакции непредельные кислоты не
вступают; не наблюдается также 1,4-присоединения гриньярова реактива
к сложным эфирам кислот.Отсутствие прямых доказательств 1,4-присоединения к а,р-непре-
дельным кислотам позволяет рассматривать присоединение воды, ам¬
миака и галоидоводорода как антимарковниковское 1,2-присоединение
по олефиновой связи. Во всяком случае реакция начинается с нуклео¬
фильной атаки аниона по одному из углеродов связи, обедненной элек¬
тронами, а именно по р-углероду.К числу важных в синтетической химии реакций относится реакция
Михаэля (стр. 297), частным случаем которой является присоединение
в сильнощелочной среде ацетоуксусного и малонового эфиров, ацетил-
ацетона или подобных соединений к а,р-непредельным кислотам и их
производным.Смысл реакции состоит в том, что анионы (мезомерные) этих ве¬
ществ нуклеофильно атакуют обедненную электронами двойную связь
а,р-непредельных кислот (а также оксосоединений) с антимарковников-
ской ориентацией атакующего аниона. Реакция завершается вырыва-п Зак. 832
зовНЕПРЕДЕЛЬНЫЕ КИСЛОТЫни,ем промежуточно образующимся анионом (аддуктом) протона из но¬
вой молекулы. Примеры:/ORI. R—СН=СН--С +ч0СНо=с/ \с=оп,Na+RO ORнатриймалоновый эфирr—сн—сн—с:
Iсн-> 0=с^ \С=0/OR/ RO OR0=0^ /i=o
CH2«IORR-.CH-CH2-C
ICH0=C^ \C=0/OR^O«А+ORCH0=0' \c=0
Rci d)R/ORii. r—сн=сн—c; +^OCH3—C=CH—c;
i' Na+✓ORORоr-сн—сн—с:
ICHCHS—O' ^C—OR4оСНз—^—CH2——orJ I/ORR—CH—CH2-C /I NdCHСНз-O' \C-OR +I liО оII II
LCHs—C—CH-C-ORJО реакциях а,р-непредельных кислот как диенофилов (Дильс — Аль-
дер) с диенами уже говорилось при рассмотрении диенов, а,р-Непредель-
ные кислоты дают обычный ряд функциональных производных. Кислоты
и их производные типа CH2=CR—СООН легко полимеризуются по го-
молитическому механизму (инициаторы — перекиси и другие генераторы
свободных радикалов). Широкое практическое применение находят по¬
лимеры метиловых эфиров акриловой и метакриловой кислот, образую¬
щие прозрачные бесцветные пластические массы (полиметилакрилат и
полиметилметакрилат)—- «органическое стекло», размягчающееся при¬
мерно при 100 °С и способное формоваться.Еще более важны полимеры акрилонитрила, применяемые для по¬
лучения химического волокна (орлон, нитрон) — лучшего заменителя
шерсти, а также сополимеры акрилонитрила с бутадиеном, дающие бен-
зостойкие синтетические каучуки («буна N» или пербунан).
ОДНООСНОВНЫЕ КИСЛОТЫ ЭТИЛЕНОВОГО РЯДА307Полимеры акрилатов и акрилонитрила, как все «виниловые поли¬
меры», имеют структуру типа: Сн,—СН—СН2—СН—СН2—СН I I IC=N Cs=N C==Nполиакрилоинтрил—сн2-сн-сн2-сн-сн2-сн I I Iс=о с=о с=оI I IОСНз ОСНз ОСНзполиметила^рилатСНз СНз СНзI I I
СН2—С—СН2—С—СН2—С 1,1 Iс=0 С=0 С=0I I IОСНз ОСНз ОСНзполиметнлметакрилат
(плексиглас, органическое стекло)Особо следует отметить важные для синтетической химии свойства
акрилонитрила. Он способен присоединять в щелочной среде по двойной
С=С-связи множество соединений с подвижным (протонизируемым)
атомом водорода, включая и протонизируемые С—Н-группы, например:СН3-С-СН3 + CH2=CH-C=N —► СН3—С—СНг—СН2—СНа—OsNА АПо существу, атака совершается анионом реагента на p-углерод ак¬
рилонитрила. Дело не ограничивается соединением с одной молекулой
акрилонитрила. Все а-водороды альдегидов и кетонов могут, заменяться
на остаток акрилонитрила. В результате реакции на место подвижного
водорода в альдегид или кетон вводится группа —СН2—СН2—CN, и по¬
тому эта реакция носит название реакции цианэтилирования. Она, оче¬
видно, родственна реакции Михаэля (стр. 297).К акрилонитрилу легко присоединяются гидроксильные и аминопро¬
изводные:ROH + CH2=CH~OsN —► RO—СН2—СН2— C=N
RNH2 + СН2=СН—C==N —► RNH—СН2—СН2—C=NТаким образом, сопряжение связей С = С—C = N сказывается на
свойствах системы в том же направлении, что и сопряжение в системе
С = С—С = 0. Реакция цианэтилирования (Брусон) широко разработана
А. П. Терентьевым и его учениками.Простейшая из непредельных кислот с изолированной двойной свя¬
зью— винилуксусная кислота СН2 = СН—СН2—СООН может быть по¬
лучена из хлористого аллилмагния и двуокиси углерода:СН2=СН—CH2MgCl + С02 —► СН2=СН—СН2—С—OMgClАп*
308НЕПРЕДЕЛЬНЫЕ КИСЛОТЫПри нагревании со щелочью соли винилуксусной кислоты переходят
в соли кротоновой кислоты:он~СН,=СН—CH2-C—ONa ► CH3—СН=СН—С—ONaII IIО оЯвление передвижения двойной связи под действием щелочи в со¬
пряженное положение довольно распространено и связано с более низ¬
ким энергетическим уровнем веществ с сопряженной двойной связью
сравнительно с их изомерами с изолированной двойной связью. Меха¬
низм передвижения связи состоит в том, что основание ОН- снимает
протон, находящийся в a-положении к карбоксилу и в то же время в
аллильном положении и потому легко отделяющийся:CH2=CH-CH-Cf° rjqT^ сн2-сн=сн-с<0№h . ONa 2 ' H#OH"он'ВЫСШИЕ ЖИРНЫЕ НЕПРЕДЕЛЬНЫЕ КИСЛОТЫ.ЖИРЫ. ЛИПИДЫОсобенно важны высшие жирные непредельные кислоты, входящие
в состав жиров в виде сложных эфиров с глицерином. Простейшей из
них является олеиновая кислота. Гидролизом («омылением») оливкового
масла («прованское масло») может быть получена жидкая олеиновая
кислота состава С17Н33СООН, которая при каталитическом гидрирова¬
нии (Нг/Ni) поглощает 1 моль водорода и переходит в стеариновую кис¬
лоту С17Н35СООН. Отсюда ясно тождество скелетов обеих кислот и на¬
личие одной двойной связи в олеиновой кислоте. Местоположение этой
связи устанавливается на основании озонирования или окисления. Окис¬
ление приводит к образованию пеларгоновой и азелаиновой кислот и
проходит по схеме:ОСН3—(СН2)7—СН=СН—(СН2)7—с^он°ч• сн3-(сн2),-с; + ^C-(CH2)7-Cf\он он•/'ОНТаким образом, оливковое масло, так же как многие жидкие жиры,
прежде всего растительные, содержит жидкий глицерид — триолеин, ко¬
торый при гидрировании водородом над никелевым катализатором пе¬
реходит в твердый предельный тристеарин:о оСН2—О—С—С,7н33оIIсн-о-с—с17н33 + зн2
оСН2—о—<!—Ci7H33N1СН2—О—С—Ci7H35оIIсн—о—с-с17н35оIIсн2-о-с-с17н35Этот процесс и аналогичные ему переходы лежат в основе «отверж¬
дения жиров» — превращения жидких непредельных растительных масел
ВЫСШИЕ НЕПРЕДЕЛЬНЫЕ КИСЛОТЫ309в твердый маргарин, к которому для придания ему запаха сливочного
масла добавляют отдушки, например:СНз—С—С—СНз СН3-СН-С—СНзII II . I IIо о он одиацетил ацетоииСН3— СН2—СН2—СН2—СН2—СН2—СН—(СН2)2—с=оI о—!Y-декалакгон ОУ*лекаколид)В состав жидких растительных жиров входят и еще более непре¬
дельные, чем олеиновая, кислоты, в частности,
линолеваяСН3—(СН,)4—СН=СН—СН2—СН=СН—(СН2)7—С'хОНлиноленоваяСНз—СН2—СН=СН—СН2—СН=СН—СН2—СН=СН—(СН2)7—с;чонарахидоновая/'СН3—(СН2)4—сн=сн—СН2—СН==СН—СНг-СН=СН-СН2-СН==СИ-(СН2)з-С.0она всего до 40 разных кислот, главным образом С!8—С2о, которые разли¬
чаются числом и положением двойных связей. В виде своих глицеридов
эти кислоты находятся в льняном, конопляном, подсолнечном, ореховом
и других так называемых высыхающих маслах.В последнее время установлено, что именно эти.высоконепредель¬
ные кислоты или соответствующие жиры в небольших количествах, в
сумме около 5 г в сутки, необходимы для жизни человека, они выпол¬
няют функцию особого витамина (с той разницей, что другие витамины
требуются в гораздо меньшем количестве). Строение этих кислот уста¬
новлено озонолизом. Они получены также синтезом.Интересно, что по реакции Виттига (см. кн. II) можно получить из
одних илидов фосфора (реакционноспособных, нестабильных) почти
чистые цис-олефины, а из других (мало реакционноспособных, стабиль¬
ных) транс-олефшы. Л. Д. Бергельсон и М. М. Шемякин синтезировали
ряд чистых цис-иепредельных кислот. Ниже приведен синтез цис-олси-
новой кислоты:(ссн6)3р + с1сн2-(сн2)7-с; —XOLi(свн5)3р-сн2-(сн2)7-с;xOLi.RLIСГ (С.Нб),Р=СН-(СН4)г-С-ОНIIо
о(С6Н6)зР=СН-(СН2)7-С-ОН + СН3-(СН2)7-С^ —нII \но—> (СсН6)3Р0 + СН3-(СН2)7-С=С-(СН2)7-С(Н7 \н XLiH
310НЕПРЕДЕЛЬНЫЕ КИСЛОТЫЖиры выполняют функцию энергетического питания и играют также
роль энергетического запаса, отлагаясь в тканях организма. Непредель¬
ные кислоты с системой связей —СН—СНСН2—СН=СН— организм
человека, в отличие от непредельной олеиновой кислоты, сам синтезиро¬
вать не может и должен получать их готовыми с пищей (как витамины).
Эти кислоты образуют липиды клеточных стенок и играют большую роль
в придании полупроницаемости этим стенкам, задерживающим одни
вещества и пропускающим другие.Липидами называются нерастворимые в воде и растворимые в угле¬
водородах и эфире вещества, входящие в состав тканей животных.
К ним, в частности, относятся жиры, т. е. полные сложные эфиры гли¬
церина, и фосфатиды, т. е. диглицериды жирных кислот, в которых
глицерин частично этерифицирован фосфорной кислотой, а кислота
вторым своим гидроксилом этерифицирует аминоспирты — холинНОСН2—СН2—N(CH3)3 или этаноламин НОСН2—СН2—NH2. Приво¬
дим схему строения двух важных фосфатидов — кефалина (из мозга) и
лецитина, содержащегося во многих животных и растительных объектах
(яйце, ткани печени, сое и др.):СН*ОIIО—С—R
ОIIСН—О—С—R
/°нСН2—О—Р—О—СН,—СН,—N—Н
'''Ю" '\нкефалиновСН2—О—С—RОI!СН—О-С— R
/°+/СНзСН2—О—Р—О—CH2^-CH2—N—СНаЧСНзлецитинчо*В клеточных стенках указанную функцию выполняют фосфатиды с
непредельными кислотами, особенно с кислотами, содержащими группи¬
ровки дивинилметана —СН=СН—СНг—СН=СН—.В качестве примера подробного исследования состава растительных
масел укажем на работы А. С. Садыкова и Н. М. Исхакова, которые вы¬
делили из хлопкового масла 13 глицеридов, дающих в сумме 98% со¬
става масла. Наряду с предельными — стеариновой и пальмитиновой —
кислотами в эти глицериды входят в различных сочетаниях олеиновая
и линолбвая кислоты. Главные глицериды хлопкового масла — это паль-
мито-дилинолеин (27%), трилинолеин (17%), пальмито-олео-линолеин
(17%).Большие количества льняного масла идут на изготовление олифы
и масляных красок. Олифу готовят, проваривая масло с небольшим ко¬
личеством окислов марганца или свинца или солей этих металлов со
смоляными кислотами (см. кн. II, «Изопреноиды»), При этом происхо¬
дят двоякого рода процессы. Во-первых, изолированные двойные связи
линолевой и линоленовой кислот перемещаются в сопряженное положе¬
ние, а сопряженные двойные связи окисляются кислородом воздуха по
схеме своеобразного диенового синтеза:
ВЫСШИЕ НЕПРЕДЕЛЬНЫЕ КИСЛОТЫ/311Образовавшаяся перекись далее распадается с образованием сво¬
бодных радикалово. о.
I ■ I
-с—с=с-с—которые вызывают полимеризацию по сопряженным и изолированным
С —С-связям. Так, тунговое масло, дающее знаменитый китайский лак,
содержит глицерид элеостеариновой кислоты, включающий три сопря¬
женные двойные связи; оно полимеризуется (под влиянием воздуха)
быстрее, чем льняное масло.Кроме того, группировки —СН = СН—СН2—СН = СН—, содержа¬
щие метиленовую группу в дважды аллильном положении, окисляются
кислородом под влиянием инициатора (иона металла высокой валентно¬
сти) с образованием гидроперекисей—СН=СН—СН2—СН=СН— + М3+ —* —СН=СН-СН—СН=СН ь М1,+ + н+—сн=сн—сн—сн=сн—ь о2 —► —сн=сн—сн—сн=сн—Iо—о.—СН=СН—СН—СН=СН 1- -СН=СН-СН-СН=СН— —►I ' I0—0. Н
—V —СН=СН—СН—СН=СН 1- —СН=СН—СН—СН=СН— и т. д.<!)-0НГидроперекись порождает ряд новых свободных радикалов, которые
либо возникают в результате отрыва аллильного водорода от другой
цепи, либо являются продуктами ее распада' например:—СН=СН—СН—СН=СН v —СН=СН—СН—СН=СН—I . IООН О • + • ОНВсе эти свободные радикалы вызывают полимеризацию как по дие¬
новым связям, так и по изолированным С = С-связям.Кроме полимеризации, происходит сшивание молекул непредельной
кислоты и за счет таких реакций:СН=СН—СН—СН=СН—I0101СН—СН—СН—СН=СН—В результате этой сложной суммы процессов происходит затверде¬
вание олифы — «высыхание» и образуется твердая пленка, в случае
масляной краски включающая и добавленный пигмент.Олеиновая кислота имеет цис-конфигурацию; ее геометрическим
изомером является твердая и более устойчивая злаидиновая кислота.
Строение обеих кислот одинаковое, так как они дают совершенно оди¬
наковые продукты окисления; разнятся они пространственным располо¬
жением атомов вокруг углеродных атомов, связанных двойной связью
(стр. 315). Олеиновая кислота превращается в элаидиновую при пропу¬
скании в нее окиси азота.—СН=СН—СН—СН=СН—А—о.—СН=СН—СН—СН=СН—
312НЕПРЕДЕЛЬНЫЕ КИСЛОТЫВИНИЛОГИЯ И Г-ЭФФЕКТ ДВОЙНОЙ С=С-СВЯЗИВещество, отличающееся от другого наличием вмонтированной в
цепь группы —СН = СН—, получает название его винилога. Таким об¬
разом, например, ряд альдегидов/Н^О/Нсн3—сн=сн—
/нсн3—сн=сн—сн=сн—счо/нсн3—(—СН=СН—)п—СГчопредставляет собой ряд винилогов ацетальдегида, а СН3—С—СН=СНС1IIОявляется винилогом СН3—С—С1. Термин винилог взят по очевиднойОаналогии с гомологами, отличающимися друг от друга на гомологиче¬
скую разность СН2. Однако «изюмина» винилогии отлична от «изюмины»
гомологии. Дело в том, что как группа —СН=СН—, так и сопряженные
системы из га(СН = СН)-групп способны передавать далеко по цепи
'+Г- и —Г-эффекты. Поэтому взаимодействие X и Y, связанных цепью
—СН = СН— в молекулу X—(—СН = СН—)„—Y, сохраняет в какой-то
мере тот же характер, что и при непосредственной связи X—Y. Примеры
см. стр. 273 сл.В приведенной выше серии альдегидов каждый способен к кротоно¬
вой конденсации с ацетальдегидом за счет своей концевой метильной
группы/Н уН он- ,Нсн3—с; + сн3—(—сн=сн—)„—с —>- сн3-сн=сн—(—сн=сн—)„—счо ^о ^отак что очевидна передача—Т-влияния альдегидного карбонила на угле¬
род метильной группы, причем это влияние имеет тот же характер, что
и в непосредственно связанных метиле и карбониле ацетальдегида:Со H^-v /-v ГоH-tC Н^НС^СЬ^СН-С^Н' хнВ хлорвинилкетонах хлор, стоящий при винильной группе, совсем
не похож на неподвижный хлор хлористого винила. Напротив, он
почти так же легко замещается в реакциях нуклеофильного замещения
/СНзна CN~, —, N01 и т. д., как и хлор в хлорангидриде кислоты:ХСН3ch2=ch-ci icH3-cJ^a^»eH-ci ch3-c-ci 4(р сР
ВИНИЛОГИЯ И Г-ЭФФЕКТ ДВОЙНОЙ с-с-связи313Причина этого очевидна: хлор в хлорангидриде кислоты своей по¬
движностью обязан сильному положительному заряду б+ на карбониль¬
ном углероде, доступном благодаря этому нуклеофильным атакам анио¬
нов и вообще нуклеофильных частиц. В хлорвинилкетоне —Г-эффект и
его статическая часть — мезомерный —М-эффект сообщает 6-Ь-заряд
углероду винильной группы, несущему хлор. На этот углерод перено¬
сится реакционный центр карбонила, приглушающийся за счет передви¬
жения к нему я-электронной пары группы —СН=СН—.Очевидно, что таково и происхождение особенностей свойств
непредельных альдегидов, кетонов и кислот с сопряженной системой
С = С—С = 0:г* г* /'"Лн-сн=сн-с=о н-сн=сн-с=о H--CH=CHiC=0+ I IIСНз Н о(винилог Н-С=о\
СН3 )/винилог н—С = 0\ /винилог Н—С=0\ н / \ о-Представим себе, что анион X: атакует каждую из молекул по кон¬
цевой СНг-группе (I) и — альтернативно — по карбонилу (II):I. X: СН^сД X: CH2=^CI^~C=Q) X: СН2=СН-<>=0
СН3 Н ОГX X Xи. сн2=сн-с=о сн2=сн^-с=о сн2=сн-с=оСНз и °_В случае атаки анионом X: группы СНг кетона пары электронов
обеих сопряженных я-связей синхронно перемещаются в направлении
стрелок и X: беспрепятственно привязывается к СН2-группе. Если атака
идет по карбонильному углероду, ей несколько (сравнительно с альде¬
гидом) препятствует -f-^-эффект метила, подающий электроны и частич¬
но компенсирующий 6 + -заряд карбонильного углерода. У альдегида нет
этого препятствия и здесь атаки часто направляются по карбонилу (на¬
пример, действие гриньяройа реактива). Когда анион X: атакует непре¬
дельную кислоту, создается иное положение: карбоксилат-анион вслед¬
ствие внутреннего сопряжения почти полностью утратил способность к
сопряжению с СН2=СН-группой и ни атака по СНг, ни по С = 0 не
приводит к присоединению X.В кислой среде атаки некоторых реагентов (Н20, НС1) на непре¬
дельные кислоты проходят успешно по СНг-группе благодаря содей¬
ствию иона водорода:
314НЕПРЕДЕЛЬНЫЕ КИСЛОТЫДВУХОСНОВНЫЕ КИСЛОТЫ ЭТИЛЕНОВОГО РЯДА.МАЛЕИНОВАЯ И ФУМАРОВАЯ КИСЛОТЫПри действии спиртовой щелочи на хлорянтарную кислоту отщеп¬
ляется хлористый водород и образуется фумаровая кислота (в виде
соли):NaO—С—СНС1—СН3—С—ONa + C2H6ONa —►. I А. —► NaO—С—CH=CH—С—ONa + C2H5OH +NaCl .II 1Гo оТа же кислота получается при дегидратации яблочной (оксиянтар-
ной) кислоты перегонкой с кислотой:н+НО—С—СН—СН2—С—ОН ——*■ НО—С—СН=СН~С—ОНII I II 'Н2° II IIО ОН ' о о оФумаровая кислота найдена в ряде растений, в том числе в дымянке
(Fumaria), откуда и произошло ее название.При медленной и осторожной дегидратации яблочной кислоты об¬
разуется изомерная фумаровой кислоте малеиновая кислота, резко от¬
личная от нее по свойствам, как это видно из сопоставления свойств
обеих кислот (табл. 34).Таблица 34. Сопоставление свойств малеиновой и фумаровой кислотФормулаНазваниеТемпер,атура
плавления,°гТемпературакипения,°СiНООКнEVДнпольный
момент
(в дноксане
при 25 °С)D*а,ЧН\ /Нхс=с(
НООС/ \cOOHМалеииовая,
или цис-1,2-
этиленди-
карбоновая130135(анги-дриди-зуется)1,5902,381,7- 10~2
(при
25 °С)2,6- 10-7
(при
25 °С)Нч хоон
с=с
НООС/ \нФумаровая,
или транс-
1,2-этилен-
дикарбоно-
вая287*(295)2901,6352,469,3- 10"“
(при
18 °С)2,9- 10~5
(при
15 °С)* В запаянном капилляре.Основным химическим различием этих двух однонепредельных
двухосновных кислот является способность малеиновой кислоты образо¬
вывать при нагревании циклический малеиновый ангидрид, строение
которого можно доказать гидрированием его в янтарный ангидрид;
фумарового ангидрида не существует.СН—С^■ ! >
сн—с:
V>малеиновыйангидрид
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ. II315Малеиновый ангидрид — промышленный продукт. Его получают
'окислением бензола кислородом в присутствии катализатора — пяти-
окиси ванадия:Огн 11СН сНС^ЧСН v2o51 I +ЗОг * X О + 2СОг + 2Н20НС\ ^СН НС\ /СН С41оСТЕРЕОХИМИЯ. ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ. ИФумаровая и малеиновая кислоты дают много идентичных реакций.
Так, водород над никелем или платиной гидрирует обе кислоты в янтар¬
ную. Обе кислоты присоединяют молекулу воды (в присутствии сильных
кислот), образуя яблочную кислоту. Присоединение хлористого водорода
приводит в обоих случаях к одной и той же хлорянтарной кислоте, а
озонирование — к глиоксиловой кислоте°ЧжIV хонОтсюда следует, что строение фумаровой и малеиновой кислот оди¬
наково и их различие вызвано иной причиной. То обстоятельство, что
именно малеиновая кислота циклизуется в ангидрид, а фумаровая к
этому не способна, привело к выводу, что в малеиновой кислоте карб¬
оксилы расположены ближе друг к другу, чем в фумаровой, а следова¬
тельно, изомерия этих кислот является изомерией геометрической (типа
цис-транс-изомерии) и их конфигурации можно изобразитьН\ уСГ Нч /С''у ^он у \онно\ /К /К /он
с/ N-I W сфумаровая киcлota малеиновая кислотаТермин конфигурация выражает пространственное расположение
атомов в стереоизомерах и противопоставляется терминам строение
(структура) и конформация (стр. 316).Расположение одинаковых групп по одну сторону от двойной связи
и от углеродных атомов, как было сказано на стр. 246, называется цис-
расположением; расположение их накрест называется транс-расположе¬
нием. Таким образом, фумаровая кислота — транс-этилендикарбоновая
кислота, а малеиновая — ее цис-изомер.Вывод о таком строении двух кислот подтверждается и тем, что при
окислении бензола получается малеиновый ангидрид, а не фумаровая
кислота. Ведь в бензоле оба углеродных атома, окисляемые в карб¬
оксилы, явно имеют цыс-положение вследствие циклической структуры
бензола. Вывод этот находится и в соответствии с взаимным влиянием
двух карбоксилов. В этом случае речь идет о так называемом эффекте
поля — электростатическом влиянии, осуществляемом не передачей по
цепи атомов (по предельной цепи — индуктивный эффект, по сопряжен¬
ной непредельной — таутомерный или электромерный эффект), а непо¬
средственно через пространство. Естественно, что эффект поля сильнее
НЕПРЕДЕЛЬНЫЕ КИСЛОТЫу малеиновой кислоты, у которой карбоксилы ближе друг к другу. Один
карбоксил, находясь близко к другому, отталкиванием (за счет наличия
в нем протонизированного водорода) увеличивает протонизацию вто¬
рого водорода. Поэтому первая константа диссоциации малеиновой кис¬
лоты больше, чем фумаровой кислоты с удаленными друг от друга карб¬
оксилами. После того как ион водорода оторвался от одного карбоксила,
карбоксилат-анион, напротив, начинает своим отрицательным зарядом
притягивать ион водорода второго карбоксила, и тем сильнее, чем ближе
оба карбоксила. Поэтому вторая константа диссоциации малеиновой
кислоты меньше, чем фумаровой.Заметим, что янтарная кислота не имеет геометрических изомеров,
и это общее правило; геометрическая изомерия не свойственна предель¬
ным нециклическим соединениям, а является принадлежностью только
соединений с двойной связью типов:R Н\ /
СIIС/ \
R НR Н\ /
СIIС
/ \
Н RR' R"\ /Сi/ \R" R""
R' R"
\ /СIIС
/ \
R"" R'"Геометрические изомерыОтсутствие геометрических изомеров объясняется тем, что поворот
вокруг оси, связывающей два предельных углеродных атома, например
в янтарной кислоте, совершается (с точки зрения хими-
н2с—Cxqu ка) свободно, т. е. он требует такой малой затраты энер-
он гии (2—3 ккал/моль), какая может быть обеспечена теп-
ловым движением при комнатной температуре и не тре¬
бует химического воздействия. Поэтому заместители
принимают расположение, в котором одинаковые или
одинаково заряженные заместители занимают наиболее удаленное по¬
ложение, как, например, в янтарной кислотеОIIно-с-сн2
сн2—с-онIIочто не мешает янтарной кислоте образовать циклический ангидрид (сво¬
бодный поворот).То или иное расположение атомов в молекуле, зависящее от пово¬
рота вокруг оси, связывающей предельные атомы (пару или цепь ато¬
мов), называется конформацией. Разные конформации одной и той же
молекулы не являются разными изомерами, так как они свободно пере¬
ходят друг в друга.В качестве примера на рис. 47 изображены разные конформации
янтарной кислоты в проекции (проекция Ньюмена); ось С—С перпен¬
дикулярна плоскости бумаги.
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ. IIHV°но.\■Лнннс-оннВ отличие от предельных углеродных атомов для олефиновых ато¬
мов (второе валентное состояние) поворот вокруг связывающей их оси
требует весьма значительной затраты энергии — такого же порядка, как
обычные химические превращения. По¬
этому конформация закреплена в этом
случае в конфигурацию,' и в результате
появляется геометрическая (или цис-
транс) изомерия.Мы уже встречались с явлением гео¬
метрической изомерии, которая является
частным случаем стереоизомерии, на
примерах цис- и транс- 1,2-дихлорэтиле-
нов, олеиновой и элаидиновой кислот.Сюда можно добавить кротоновую
(транс-) и изокротоновую (цмс-изомер)
кислоты.Заметим (более подробно см.
стр. 497), что цмс-гранс-изомерия свой¬
ственна также циклическим соединениям, в которых наличие цикла пре¬
пятствует превращению цмс-изомеров в транс- или наоборот, например:чонh-V-^h
наКонформации янтарнойРис, 47.
кислоты:а — трансоидиая; б — скошен и а я. Устой¬
чива лишь трансоидная конформа¬
ция а. »г^соон г^н г^соон .—н/V^-соон УV>.И /V^COOHх'^СООН 2\^СООН \/.^СООН °\Ъсоонцис- транс- цис-Из приведенного в табл. 34 сопоставления физических свойств цис-
и гранс-изомеров фумаровой и малеиновой кислот видно, что различия
свойств геометрических изомеров не меньше, чем для структурных изо¬
меров. Особого внимания заслуживает разница дипольных моментов
цис- и гранс-изомеров, которая служит одним из основных критериев для
установления их конфигурации.Так, в случае замещенных этиленов типаR\ /R'R\ /R'ССIIIIССR'/ 4Rя/ 'Vтранс*цис-дипольный момент транс-изомера равен нулю, так как он вскторно сум¬
мируется из дипольных моментов отдельных связей, которые, как оче¬
видно, направлены попарно в противоположные стороны (угол 180°)
и, взаимно складываясь, дают 0. цмс-Соединение имеет дипольный мо¬
мент, отличный от нуля.Если заместители неодинаковы, то все же можно судить о конфигу¬
рации на основании сравнения величин дипольного момента. Так, на¬
пример, хотя дипольный момент гранс-хлорбромэтилена и отличен от
нуля, но,' конечно, он будет меньше, чем для цме-хлорбромэтилена
318НЕПРЕДЕЛЬНЫЕ КИСЛОТЫтак как при векторном сложении моменты связей С—С1 и С—Вг в
г/занс-соединении, направленные под углом 180° друг к другу,'вычтутся
и дадут относительно малую разность, а в цис-изомере онй направлены
под углом 120° и диагональ параллелограмма, стороны которого равны
дипольным моментам связей С—С1 и С—Вг, будет величиной, близкой
к средней величине между сторонами параллелограмма, и будет больше
их разности.Измерение дипольных моментов молекул введено Дебаем в 20-х го¬
дах нашего века. До этого времени суждения о цис- и транс-конфигура¬
циях основывались на соображениях, приведенных выше при рассмотре¬
нии конфигураций фумаровой и малеиновой кислот, т. е. прежде всего
на способности цыс-изомеров замыкаться в цикл или на их образовании
при раскрытии ликла. При таких химических превращениях не должны
затрагиваться связи заместителей с олефиновыми углеродами, так как
это часто ведет к изменению конфигурации. В приведенном примере с
фумаровой и малеиновой кислотами это требование соблюдено. Но, ра¬
зумеется, этот критерий приложим не ко всякой паре геометрических
изомеров. Например, он принципиально неприложим к дихлорэтилену,
так как из него нельзя получить циклических производных, не затронув
связей С—С1, а сам он не может быть получен из цикла без разрыва
связей с олефиновыми углеродами. В этцх случаях можно с некоторой
степенью вероятности судить о конфигурации по аналогии физических
констант с каким-либо известным объектом. Так, если конфигурация
обоих дихлорэтиленов известна, а обоих дибромэтиленов неизвестна, то
очевидно, что можно довольно уверенно судить о последней, сравнивая,
например, температуры кипения всех четырех соединений (см. табл. 32,
стр. 283).Для этой цели можно использовать и более отдаленную аналогию,
как это сделал Вернер (правило Вернера). Дело в том, что, как видно
из их формул, орто-дизамещенные бензолы имеют некоторую геометри¬
ческую аналогию с цыс-изомерами, а пара-замещенные с граис-изоме-
рами (об орто- и пара-изомерах см. кн. II, «Бензол и его строение»);О г\ о оII н Л иН\ /С-он сн Д_он нч /С-ОН сн » онс НС^ хс/ с НС^ vc/JL I II II I IIс НС** /Сч с /СНн/ \c-OH сн \с-он но-c/ \н НО-С/ сн|| А || Ао О о 0т. пл. 130 °С т. пл. 131 °С т. пл. 287 °С возг. выше 300 °СЕсли, например, более низкоплавким изомером является орто-диза-
мещенный бензол, а «ара-замещенный более высокоплавок, то и геомет¬
рически близкий к первому цис-изомер будет обладать более низкой
температурой плавления, чем транс-изомер.Конечно, такое же сравнение можно провести и по другим констан¬
там, например в данном примере по константам диссоциации Кщ и К&г
всех четырех кислот.Правилом Вернера, как всякой аналогией, надо пользоваться с из¬
вестной осторожностью.цис- и транс-Изомеры разнятся также энергосодержанием: в случае
сходных или тождественных заместителей (электростатически отталки¬
вающихся друг от друга) более устойчив (т. е. ниже по энергетическому
уровню) транс-изомер, цис- и гронс-Изомеры способны превращаться
друг в друга. Более богатые энергетически соединения (часто это цис-
ФИЗИЧЕСКИЕ-МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯ319лзомеры) превращается в свои геометрические изомеры при действии
свободнорадикальных, а иногда и электрофильных реагентов. Так, олеи¬
новая кислота превращается в элаидиновую при действии N0, имеющего
неспаренный электрон. Следы иода или окислов азота превращают ма-
леиновую кислоту в фумаровую. транс-p-Хлорвинилмеркурхлорид пре¬
вращается в более устойчивый цыс-изомер при действии перекисей (ге¬
нерирующих свободные радикалы):С1-\н/с=с;нС1HgClн/HgClс=с'Нтранс-цис-Превращение более устойчивого геометрического изомера в менее
устойчивый требует затраты энергии и потому часто осуществляется
при облучении ультрафиолетовым светом. Так можно превратить фума¬
ровую кислоту в малеиновую.При реакциях замещения атома или группы, связанной с олефи-
новым углеродом, наблюдаются следующие правильности (А. Н. Несмея¬
нов, А. Е. Борисов). Электрофильное и гомолитическое замещение
(имеются в виду реакции II порядка) протекают всегда с сохранением
конфигурации. Нуклеофильное замещение часто, но не всегда, обращает
конфигурацию. Примеры:С1\уНс|\ /н
сIIсН'HgCIj
Hg ►С1\ /Н
С\SnCl2HgClCl-\ /
сII/V/0"ONaNaSRС,\ /Н
СIIсНSnCl,сохранениеконфигурацииН3сч /Н0:NaOЧС^4SRобращениеконфигурацииФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯ
ОРГАНИЧЕСКИХ МОЛЕКУЛ. IВся органическйя химия посвящена установлению строения органи¬
ческих соединений и синтезу их на основании знания строения и типич¬
ных реакций образования различных связей. Мы познакомились уже с
идеей установления строения соединений химическими методами, кото¬
рые и сейчас являются основными, но все больше дополняются и ча¬
стично заменяются физическими методами. Пытаясь сформулировать
сущность химических методов установления строения в одной фразе,
320ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯможно сказать, что они состоят в констатации родственных связей серии
веществ (веществ с родственной структурой) и в выяснении строения
одного или нескольких узловых веществ этой серии путем их постепен¬
ной деструкции (или, как ее иногда называют, деградации). Такой хи¬
мический путь позволяет установить строение любого сколь угодно слож¬
ного вещества, однако ценой большого труда. И этот большой труд все
более облегчается благодаря новым физическим методам разделения и
идентификации продуктов деградации, особенно благодаря различным
видам хроматографии (стр. 36). Одновременно и методом деградации и
методом идентификации осколков молекулы (по их молекулярному
весу) служит масс-спектрометрия (стр. 550). Разнообразные, все более
развивающиеся физические методы дают возможность установить такие
важные детали структуры, как характер связи, межатомные расстояния
и углы, наличие или отсутствие того или иного рода взаимодействия
электронных орбиталей, подобного сопряжению, наличие или отсутствие
неспаренных электронов (т. е. наличие некомпенсированного спина).
Методом ядерного магнитного резонанса (стр. 557) можно для ато¬
мов, имеющих ядерный магнитный момент (таков водород), устано¬
вить наличие в молекуле и число по разному связанных водородных
атомов — гидроксильных, метильных, метиленных, метинных, цис- и
гранс-расположенных и т. д. Есть методы, выявляющие иные детали
структуры — наличие двойных и тройных связей и их характер — в
цикле, семициклические (примыкающие к одному из угле-
?-> родов цикла), вне цикла, сопряженные и т. д. Многие ме-( С=СС тоды позволяют быстро и'уверенно решать вопрос о кон-
фигурации вещества, что можно сделать и химическим пу¬
тем, или судить о конформации, что почти недоступно
химическим методам. Лишь рентгеноструктурный метод (стр. 330 сл.)
может претендовать на полное установление структуры, и, следова¬
тельно, на замену химического исследования. Однако на деле этот ме¬
тод далек от такой способности, так как он, во-первых, ограничен кри¬
сталлическими веществами с хорошо образованными кристаллами; во-
вторых, он не фиксирует положения водорода и, в-третьих, необычайно
громоздок, в особенности по вычислениям.Знание возможностей каждого из физических методов исследования
и сотрудничество с физиками-специалистами становится все более необ¬
ходимым в работе химика-органика. Ввиду того что физические методы
исследования соединений рассматриваются в курсах физики и физиче¬
ской химии, здесь они будут изложены очень кратко^-лишь с точки
зрения их использования химиком-органиком.ТЕПЛОТЫ ОБРАЗОВАНИЯ СОЕДИНЕНИЙ
И ЭНЕРГИЯ ОБРАЗОВАНИЯ СВЯЗЕЙЭти важные величины измеряются термохимическим путем. В основе
таких измерений лежит закон Гесса (1840 г.). Если система переходит
из состояния I в состояние II двумя разными путями через разные про¬
межуточные состояния, то при непременном условии постоянства объема
и давления сумма тепловых эффектов перехода по первому пути равна
сумме тепловых эффектов перехода по второму пути. Отсюда, подвергая
тому или иному химическому превращению исследуемое соединение (на¬
пример, сжигая его в кислороде в бомбе Вертло) и определяя тепловой
эффект превращения, а затем подвергая превращению в те же продукты
(в данном примере — сжигая) элементы в стандартном состоянии* и* Стандартное состояние определяется как та аллотропная модификация эле¬
мента и то агрегатное состояние его, которое устойчиво в стандартных условиях (25 °С,1 кгс/см2).
ТЕПЛОТЫ ОБРАЗОВАНИЯ СОЕДИНЕНИЙ321определяя теплоту этого превращения, можно найти разность тепловых
эффектов двух процессов. Эта разность по закону Гесса есть теплота
образования данного соединения из элементов в стандартном состоянии.
Тепловой эффект реакции при постоянном объемеЧлен PAV, т. е. произведение давления на изменение объема, для
конденсированной фазы (жидкость и твердое тело) практически равен
нулю, и QP = Qv Но для газов разница между Qp и Qv значительна.Следует отметить, что «стандартное состояние элементов» выбрано
очень условно — для углерода это графит с его сложной структурой и
вторым валентным состоянием углерода, для водорода, кислорода и
азота — газообразное состояние (25 °С и 1 кгс/см2) с двухатомными мо¬
лекулами и т. д. Таким образом, при переходе от элемента к соединению
связи не только образуются, но и разрываются. Поэтому более показа¬
телен расчет теплоты образования из свободных атомов элементов в
расчете на газообразное состояние при 25°С и 1 кгс/см2. Для этого к
теплоте сгорания элементов в стандартном состоянии надо добавить
теплоты образования свободных атомов из элементов (для стандартного
состояния тех и других), равные следующим величинам (в ккал/г-атом):Теплоты же сгорания элементов: 94,05 ккал/г-атом для С и
34,16 ккал/г-атом для Н (в жидкую воду).Наиболее распространенный метод сожжения обладает крупным не¬
достатком: теплота образования вычисляется как разность теплот сго¬
рания вещества и элементов. Эта разность невелика сравнительно с
обеими теплотами, ее образующими, и поэтому точность определения
теплоты образования страдает: на нее ложатся все ошибки экспери¬
мента. Для более точных определений (но в более частных случаях) ис¬
пользуют, например, теплоты каталитического гидрирования олефиновых
связей.Из теплот образования соединений из атомов (или из элементов) в
стандартном состоянии можно рассчитать для разных элементов теп¬
лоты образования простых, двойных и тройных связей, значения кото¬
рых и приводятся в табл. 35. Расчет основан на предположении адди¬
тивности теплоты образования соединения из теплот образования всех
его связей. Отклонения от аддитивности встречаются, например, при
сопряжении связей и называются «энергией резонанса» или' «энергией
сопряжения». Это отклонение равно, например, для бутадиена-1,3 вели¬
чине в 3,5 ккал/моль, а для бензола 39 ккал/моль (т. е. величина, адди¬
тивно найденная из теплот образования связей, больше на «энергию ре¬
зонанса», чем определенная экспериментально).Следует ясно представлять себе, что полученные указанным путем
энергии образования (или разрыва) связей — усредненные величины.Qv = [/, - игравен убыли внутренней энергии системы.Тепловой эффект при постоянном давленииравен убыли энтальпии системы.Оба тепловых эффекта связаны соотношениемСНОN170 F51,7 С158.6 Вг112.6 I1928,522,717,2
322ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯТаблица 35: Энергии химических связейСвязьЭнергия,ккал/мольСвязьЭнергия,ккал/мольС—НC==N212,6в алканах98,7О—Н110,6в алкенах99,4N—Н93,4в алкиках96,3N=0 в нитросоединениях45в бензоле100,7N—N39с—сN=N100в алканах82,6NssN225,8в бензоле116,4С—F116С=С в алкенах145,8С—Cl81С==С в алкинах199,6С—Вг в брбмалканах68С—085,5С—I в иодалканах51С=0F—F36,6в формальдегиде166CI—С158,0в других альдегидах176Вг—Вг46,1в кетонах179I—I36,1в С02192,0С—S65Сг=0 в окиси углерода255,8S—н83С—Ы ••72,80—035С=М147* Данные заимствованы нз следующих источников: taullne W The Nature of the Chemi¬
cal Bond, 3d ed., 1960; Rossini F. D. et al., Selected Values of Chemical Thertnodinamic Proper¬
ties, Circular of the National Bureau of Standarts, Washington, 1952.Энергия отрыва, например, первого водородного атома из молекулы
даже симметрично построенного углеводорода —* метана или этана —
всегда несколько меньше, чем энёргия отрыва второго атома водорода,
и т. д. Энергия связи водорода с первичным углеродом немного больше,
чем с вторичным, а с вторичным — больше, чем с третичным, и т. д.Истинные энергии образования (или разрыва) связей — это энергии
'диссоциации. Их можно определять, в частности, кинетическим путем,
измеряя при разных температурах скорость диссоциации молекулы, на¬
пример;СН* СН3 • + н •Поскольку энергия активации обратной реакции — образования мо¬
лекулы из свободных радикалов — равна нулю, то энергия активации
реакции диссоциации как раз и равна теплоте разрыва связи. Получен¬
ные этим и другими путями энергии диссоциации в общем хорошо со¬
гласуются со значениями, определенными термохимически.ШКАЛА ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ ЭЛЕМЕНТОВИз энергии образования связей из атомов в стандартном состоянии
можно, по Полингу, вычислить относительную электроотрицательность
элементов.Обозначим определенную из эксперимента энергию образования
связи двух одинаковых атомов, например связи С—С, ^ерез £сс, а
связи С—Н через £сн- Тогда среднее геометрическое этих величин будет
равно ]/ЕссЕсн. Обозначим через Д' отклонение экспериментально най¬
ДИПОЛЬНЫЕ МОМЕНТЫ' МОЛЕКУЛ321денной энергии связи С—Н от средней геометрической величины. Тогда— ^СН ~ V^CCECH 0)v v VECCECHу А'(2)Отношение (2) служит энергетической мерой отклонения реальной
связи С—Н от идеально гомеополярной связи С—Н, т. е. характеристи¬
кой разности электроотрицательностей атомов С и Н, обозначаемых как
Хс и Лц. При обычных различиях величин энергий связи в 'несколько де¬
сятков калорий геометрическЬе среднее мало отличается от арифмети¬
ческого, и почти тот же результат получается и при использовании
отношения среднего арифметического к отклонению от него реальной
энергии связи.Поступив описанным выше образом для ряда связей атомов А и В,
составляют разности электроотрицательностей ХА—Хв, откуда нетрудно
определить и сами величины электроотрицательностей Ха и Лв- Полинг
при проведении всего расчета пользуется вместо величины А' величиной
0,18А', которая есть не что иное, как У А'/30, т. е. он выражает А' в ве¬
личинах, равных 30 ккал/моль. Кроме того, к каждой полученной таким
образом величине электроотрицательности он добавляет 2,05, т. е. изме¬
няет начало отсчета на эту величину, чтобы получить почти всю шкалу
электроотрицательности положительной. Имеют значение лишь разности
электроотрицательностей. Так была получена следующая шкала элек-
троотрицательности:к. . . .. . 0,8В . . . ., . . 2,0Вг . . .Na . . .. . 0,9н . . ., . . 2,1N . . .. . 3,0Li . . .. . 1,0р. . . ., . . 2,1С1 . . .. . 3,0Са . . .. . 1,0с . . ., . . 2,5О . . .. . 3,5Mg . . .. . 1,2S . . . .. . 2,5F . . . .. . 4,0Be . . .. . 1,5I . . . .. . 2,5Электроотрицательность элементов в соединении не следует смеши¬
вать ни с электродным потенциалом, который зависит от разности сво¬
бодной энергии элемента в стандартном состоянии и его ионного рас¬
твора, ни со сродством к электрону (потенциалом ионизации).Частично полярную ковалентную связь двух атомов А и В, имею¬
щих неодинаковую электроотрицательность, Полинг выражает в терми¬
нах резонанса как суперпозицию чисто ковалентной и чисто ионной
структур, где электроотрицательность В больше, чем А:А: В •*—*■ А+В~Волновая функция такой молекулы А—В может быть представленакак+AB“fl*A:B + 6VB-(метод локализованных пар).ДИПОЛЬНЫЕ МОМЕНТЫ МОЛЕКУЛЛюбая молекула построена из распределенных в пространстве по¬
ложительных ядер атомов и электронов. В общем случае центры «тяже¬
сти» положительных зарядов ядер, в сумме составляющих +е, и отри¬
цательных зарядов электронов, в сумме равных —е, не совпадают и
находятся друг от друга на расстоянии /. Векторной величиной — ди-
польным моментом р, молекулы называется р. = el. Если е измеряется
324ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯв абсолютных электростатических единицах (в этих единицах заряд
электрона равен 5,1 -Ю'10), а I в ангстремах (10~8 см), то ц будет выра¬
жено в дебаях: 1 дебай (1 D) равен 10~18 абсолютным единицам CGS
дипольного момента.Естественно, что дипольный момент —это важная характеристика
молекулы. Лишь для имеющих центр симметрии молекул, подобных СН4,
С2Н6, ССЦ, СбН6, центры «тяжести» -\-е и —е совпадают и /, а значит
и (х, равны нулю. Для каждого атома из слагающих'молекулу внутрен¬
ние, не участвующие в валентных связях электроны имеют «центр тяже¬
сти» в центре атома с его положительным зарядом. Следовательно, на
проявлении итогового дипольного момента молекулы должны сказы¬
ваться лишь итоговые (остаточные) положительные заряды атомов и
отрицательные заряды электронов связи. Последние в большей мере со¬
средоточиваются на более электроотрицательных атомах.Дипольный момент молекулы можно считать векторной суммой ди-
польных моментов отдельных связей. Дипольные моменты связей можно
рассчитать, зная дипольный момент молекулы (о его экспериментальном
измерении см. ниже) и точную ее геометрию: углы между валентными
направлениями, межатомные расстояния. Так из дипольного момента
молекулы воды (в газообразном состоянии), равного 1,84 D, и угларавного 104°, дипольный момент связи О—Н рассчитывается как длина
стороны параллелограмма, у которого углы составляют 104° и 76°, а
малая диагональ равна 1,84:1Л®В табл. 36 приведены дипольные моменты ц связей, обычных в орга¬
нической химии.Таблица 36. Дипольные моменты связей в предельном ряду
в единицах Дебая (D)СвязьиСвязьиСвязьИС—С0с=о3,2н—О1,51с—н0,4С—F2,3Н—S0,68С—N1,20С— С12,3Н—С11,08C=N1,25С—Вг2,2Н—Вг0,78C=N4,0С—I2,0Н—I0,38С-01,6Н—N1,31Дипольный момент молекулы, вернее модуль этой векторной вели¬
чины, определяют, измеряя диэлектрическую проницаемость вещества в
газообразном состоянии или в растворе в неполярном растворителе и
пользуясь зависимостью Клаузиуса — Моссоти—Дебая:_ е — 1 М 4п .. ( , и2 \е + 2 '~1 3~ °(а+Ш7') ^где Р — молекулярная поляризация вещества в газообразном состоянии;
е — его диэлектрическая проницаемость; М — молекулярный вес; d.—'
плотность; N о— число Авогадро (число молекул в грамм-молекуле, рав¬
ное 6,023-1023); а — молекулярная поляризуемость молекулы, равная
величине дипольного момента, вызываемого в молекуле единицей элек-
ДИПОЛЬНЫЕ МОМЕНТЫ МОЛЕКУЛ325трического поля; k — постоянная Больцмана; Т — абсолютная темпера¬
тура, в К; (х — дипольный момент, в D; постоянная R из уравнения
PV = RT в применении к одной молекуле равна 1,38-10~16.В правой части уравнения (1) неизвестными являются ^ и а (пред¬
полагается, что е измерена *). Исключив а, можно определить ц.Существует два пути исключения а. Идя по первому пути, надо из-п / е — 1 М \мерить Р 1т. е. ■_ 2' • ~g~j ПРИ РяДе температур и отложить его значе¬
ния начоси ординат, а на оси абсцисс отложить 1/Т. Поскольку зависи¬
мость имеет характерP = a + jг (2)(а от температуры практически не зависит), она графически будет вы¬
ражаться прямой с тангенсом угла наклона к оси абсцисс, равным Ь.
Это Ь, как нетрудно рассчитать, сопоставляя уравнения (1) и (2), равно:4я N оТ" k2Подставив численные значения л, N0 и k, найдем величину диполь-
ного момента в дебаях:|х =ь 0,0127 уТВторой путь исключения а таков. Известно, что мерой молекулярной
поляризуемости является молекулярная рефракция MR (стр. 328):„п пг — I мMR = "2 "г о—т
п2 + 2 агде п — показатель преломления для избранной длины волны, обычно
линии/) натрия; М — молекулярный вес; d — плотность при данной тем¬
пературе.В переменном электромагнитном поле с частотой видимого света
молекулы не успевают поворачиваться, чтобы расположить свои диполи
в соответствии с направлением поля. Действие переменного поля сказы¬
вается лишь на смещении электронов в соответствии с их поляризуемо¬
стью, мерой чего и является молекулярная рефракция MR. Однако ве¬
личину MR нужно экстраполировать на бесконечную длину волны (т. е.
на то же постоянное поле, в котором измерялась величина Р), что можно
сделать по простой формуле дисперсии. Получаются величины на 3—4%
меньшие, чем MR для D-линии натрия.Запишем уравнение (1) в видеп Ап 4я ,, (х23 oCt+ 3 ШГи вычтем из обеих частей MR^:4л ,, IX2Р — МЯж — -гг- Лг03 0 шТеперь правая часть свободна от члена поляризуемости а, и урав¬
нение включает в качестве неизвестного только величину ц, откуда
значение дипольного момента и определяется:М = 0,0127 у (Р- MR) Г* Как известно, измеряя разность потенциалов на обложках плоского конденса¬
тора (при том же заряде) со средой между обложками, имеющей диэлектрическую
проницаемость е, ив вакууме, мы в первом случае получаем разность потенциалов
в е раз меньшую, чем во втором.
326ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯТаким образом, измерение проводится при одной выбранной тем¬
пературе и измеряются е, п и d для данного вещества с молекулярным
весом М.Так обстоит дело с измерениями (х для газов. Для смеси двух жид¬
костей молекулярная поляризация—■ 1 -I- С2М2Р 1.2 = С\Р 1 + CtP jоткудае -j- 2 dPV2-PX+ PlЗдесь Р\ и Р2 — молекулярные поляризации компонентов; С) и С2—
их молекулярные доли в смеси; Mi и М2 — их молекулярные веса.Измерение дипольного момента интересующего вещества производят
в неполярном растворителе (имеющем нулевой дипольный момент), на¬
пример в С6Н6, С6НМ, СС14 и т. д., при нескольких концентрациях, на¬
пример при С2 от 0,001 до 0,01 или от 0,02 до 0,10, в зависимости от
растворимости, точности определения и значения Р2. В большинстве слу¬
чаев Р\ растворителя несколько зависит от Р2 и приходится экстраполи¬
ровать к С2 —>■ 0. Для этого откладывают по оси ординат полученные
значения Р2, а по оси абсцисс — соответствующие С2 и находят значение
ординаты при С2 —► 0, т. е. при пересечении кривой с осью ординат.Обычно значения ц в растворе мало отличаются от значений в газе.Некоторые области применения дипольных мо¬
ментов в химии. Строение. Предельные углеводороды даже несим¬
метричной структуры имеют дипольный момент, равный или очень близ¬
кий нулю. То же относится и к чисто ароматическим простейшим струк¬
турам, таким, как бензол, нафталин, антрацен. Однако сочетание али¬
фатической метильной группы с бензольным ядром (толуол С6НБСН3)
уже создает небольшой дипольный момент (ц = 0,34).Из сравнения дипольного момента хлорбензола (1,55), у которого
отрицательный конец диполя лежит явно на атоме хлора, и дипольного
момента я-хлортолуола (1,95)СНз~\С_2>г£.1; л-хлортолуолясно, что дипольные моменты, вносимые метильной группой и хлором,
суммируются, и значит, пространственно направлены одинаково, откуда
ясно направление диполя метильной группы толуола.Существуют углеводороды со значительным днпольным моментом,
например фульвены и азулен;диметилфулиеи (ji—!,48D) ' азуленСвоими дипольными моментами они обязаны некоторому разделе¬
нию зарядов вследствие затягивания электрона пятичленным циклом,
становящимся в результате этого ароматическим. В азулене и семи¬
членный цикл, потерявший электрон, тоже становится ароматическим
(см. кн. II). Небольшая величина дипольного момента говорит, однако,о том, что в обоих соединениях крайняя резонансная структура (б)
с полностью разделенным зарядом далеко не достигается, .
ДИПОЛЬНЫЕ МОМЕНТЫ МОЛЕКУЛ327В рядах монофункциональных алифатических соединений диполь-
ные моменты сохраняют практически постоянную величину в пределах
гомологического ряда. Это свидетельствует о том, что дипольный момент
целиком сосредоточен в функциональной группе, например:Алкилы Спирты 1,65фтористые и иодистые .... 1,9 Альдегиды и кетоны . .. . 2,72
хлористые и бромистые ... 2 Нитрилы 4,05Несколько отклоняются только первые члены гомологического ряда.
Так, дипольный момент формальдегида (2,27) значительно меньше, чем
ацетальдегида (2,72). Это следствие индуктивного +/-эффекта метиль¬
ной группы, т. е. большей «подачи» электронов метилом сравнительно
с водородом (эффект, который мы уже констатировали на примере
толуола):н\а+ «- б_;с=о *с=оW IVПри переходе к замещенным у непредельного углерода алкенам или.
ароматическим монофункциональным соединениям наблюдаются харак¬
терные отклонения от величин, приведенных выше для предельных со¬
единений. Так, [х хлористого винила 1,44, а хлорбензола 1,57 (сравни¬
тельно с хлористым метилом, у которого ц= 1,86, и хлористым этилом,
у которого (л = 2). Ниже приведены дипольные моменты ц, (в дебаях)
предельных и ароматических соединений:А1ЮСН3. . .1,22AlkN02 . .3,68ArCHO ....2,76AlkOH ....1,65AlkCN . . .4,05АгСОСНз . .3,0AlkCOOH . .1,68АгОСНз . .1,48ArNO-j. . . .4,21AlkCHO . . .2,72ArOH . . .1,4ArCN ....4,39AlkCOCH3 . .2,78AtCOOH . .1,73Конфигурация. Измерение дипольных моментов, как уже говори¬
лось, позволяет различить центросимметричные молекулы по их нуле¬
вому дипольному моменту. Так можно различить цис- и транс-конфигу¬
рации олефиновых соединений. Если замещающие группы разные, то
все же, сравнивая величины дипольных моментов цис- и транс-соедине¬
ний, можно различить эти конфигурации.Такое же суждение возможно и для цис- и транс-расположения
заместителей в 1,4-положениях циклогексана, несмотря на то что моле¬
кула последнего не плоская и поворот в цикле не полностью устранен.
Все же для цис-производного (конечно, при одинаковом характере заме¬
стителей) дипольный момент больше, чем для транс-изомера.Конформация. Примером суждения о конформации молекулы может
служить рассмотрение дипольного момента сложного эфира, для кото¬
рого возможны две крайние конформации:*-< л *-с;хо/ х0RII/Сложные эфиры гомологов уксусной кислоты имеют ц, =
==. ~ 1,73, что резко отлично от ц = 4,12 бутиролактона — циклического
328ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯвнутреннего эфира, структура которого может соответствовать только
конформации II.Н2С-С^НгС^\
сн2бутиролактоиПоэтому для эфиров гомологов уксусной кислоты вопрос решается в
пользу конформации I.МОЛЕКУЛЯРНАЯ РЕФРАКЦИЯМолекулярная рефракция MR является мерой поляризуемости мо¬
лекулы под влиянием переменного электромагнитного поля света, в ко¬
тором успевают перестроиться лишь электроны, но не успевают повер¬
нуться и переориентироваться постоянные диполи молекул:где п — коэффициент преломления света определенной длины волны
(обычно желтая линия натрия D) при определенной температуре; d —
плотность при той же температуре.Молекулярная рефракция, например при 20 °С, обозначается
Впрочем, MR мало зависит от температуры.Самое важное для химика то, что MR для ряда веществ, особенно
углеводородов, их галоидных и кислородных производных, — довольно
точно аддитивная величина и может рассматриваться как сумма атом¬
ных рефракций.Атомные рефракции могут быть рассчитаны таким путем: из экспе¬
риментально найденных значений молекулярной рефракции для членов
гомологического ряда определяют среднюю разность MR, приходя¬
щуюся на СНг — гомологическую разность. Если из величины MR, на¬
пример для гексана СбНн, вычесть шесть значений MR, приходящихся
на СНг, получится значение для двух водородов:МХс'Ни ~ 6mrch2 = М#2НРазделив пополам, получают атомную рефракцию водорода Ап- Оче¬
видно, что атомная рефракция углерода Ас будет равна:"*С,Нн ~ 14^н
Лс_ _Из значения MR, например для СНз—СНгОН, можно найти атом¬
ную рефракцию спиртового кислорода Ао, если вычесть из MRc2h3oh
атомную рефракцию пяти углеродов (5Лс) и шести водородов (6ЛН),
и т. д.Однако для кислородного атома значение атомной рефракции полу¬
чается разным в зависимости от его функции; так же как и для угле¬
рода, в зависимости от того, является ли он предельным (тетраэдриче¬
ским), олефиновым или ацетиленовым. Но в расчетах атомных рефрак¬
ций предпочитают в этом случае считать Ас постоянной величиной и
вводить поправку (инкремент) на двойную или тройную связь.
МОЛЕКУЛЯРНАЯ РЕФРАКЦИЯ329Атомные рефракции элементов и инкременты кратных связей С = С
и С = С для D-линии натрия приводятся ниже:С Н О (в ОН)... .О (эфирный) . .0 (карбонильный)С1 Вг 1 Систематическим исследованием молекулярных рефракций мы обя¬
заны Брюлю, Эйзенлору и Ауверсу. Молекулярная рефракция была
первой по времени физической константой, широко использованной в
органической химии для суждения о строении органических молекул.
К сожалению, область ее применения, по существу, ограничена углево¬
дородами, их галоидными и кислородными производными, так как для
прочих элементов постоянство атомных рефракций невелико. Имеется и
второе существенное ограничение — метод приложим лишь к жидким
веществам. Для твердых веществ можно определить MR в растворе по
разности, но это гораздо менее точно, так как все ошибки ложатся на
эту разность.Первое и самое широкое применение MR в органической химии —
аналитическое. Определив, например, п2£ и d'f, можно вычислить MR
для вещества с известным молекулярным весом. С другой стороны, в
соответствии с предполагаемой структурной формулой можно рассчи¬
тать MR из атомных рефракций и инкрементов двойных и тройных свя¬
зей. Для чистого вещества совпадение двух величин, найденной и рас¬
считанной, обычно лежит в пределах 0,1—0,2 и часто достигает 0,02. По
этому совпадению судят о правильности предложенной формулы. Ко¬
нечно, так нельзя отличить изомеры, если только они не различаются
функционально, или наличием и отсутствием кратных связей, или чис¬
лом последних.Характер разветвления в предельных углеводородах, однако, влияет
на величину MR, и для сильно разветвленных алканов MR ниже рассчи¬
танной: например, для С (СНз) 4 — на 0,24; для (СгНв^СН — на 0,42;
для (СН3)3С—СН(СН3)2 — на 0,37. Такие отклонения MR (так же как
рассматриваемая ниже экзальтация) дают основание для суждения о
структуре, обычно же MR лишь подтверждает независимым путем дан¬
ные анализа, что, разумеется, тоже очень ценно.Наиболее ценные применения MR связаны с отклонением этой ве¬
личины от аддитивности (с так называемыми экзальтациями) при нали¬
чии определенных структурных особенностей. Например, сопряжение
двух связей в открытой цепи дает повышение (экзальтацию) MR против
расчета почти до 2,0. Однако наличие в сопряженной системе метальных
групп при втором или третьем углероде (а еще более — у обоих) сни¬
жает экзальтацию до 1,0 (в случае двух СН3) и даже ниже — до 0,75.
Так, экзальтация изопрена снижена до 1,0, а 2,3-диметилбутадиена—
до 0,75, в то время как у бутадиена экзальтация нормальная. Сопряже¬
ние СНг=СН с бензольным кольцом (стирол) дает экзальтацию 1,3,
снижающуюся для а-метилстирола и увеличивающуюся (до 1,4) для
p-метилстирола. Бензол и циклогексадиен имеют почти расчетную вели¬
чину MR (без экзальтации), для бензола даже ниже. Вообще же
сопряженное положение двойных связей в циклах лишь немного повы¬
шает MR; например, циклооктатетраен имеет экзальтацию 0,33,2,418 N (в NH2) 2,3221,100 N (в NHR, жирн.) .... 2,4991,525 N (в NR2, жирн.) .... 2,8401,643 Инкремент С=С 1,7332,211 Се=С .... 2,3985,967 с8’865 С- С 0,613,900
330ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯциклооктатриен— 0,66. Очень характерна экзальтация для так называе¬
мой семициклической двойной связи, т. е. для структуры типаQ=ch2достигающая 0,3. СЬ’пряжение С = С с С=0 также дает экзальтацию
около 1,0.ДИФРАКЦИОННЫЕ МЕТОДЫ АНАЛИЗА
В ОРГАНИЧЕСКОЙ ХИМИИ *Атом обладает способностью рассеивать падающее на него излуче¬
ние. Лучи света, потоки электронов, нейтронов, рентгеновское излуче¬
ние— все известные виды излучения, падая на атом, рассеираются им.
Лучи, рассеянные отдельными атомами, усиливают или ослабляют друг
друга в зависимости от взаимного расположения. Это явление назы¬
вается дифракцией излучения на атомах. Ясно, что дифракция излуче¬
ния приносит нам сведения о строении вещества. Определяя направления
и интенсивность рассеянных лучей, можно получить ценные сведения о
строении молекулы, и прежде всего о ее геометрии, т. е. о взаимном
расположении центров атомов. Наиболее плодотворным в последнем
отношении способом исследования является -метод рентгеноструктурного
анализа кристаллов органических веществ.Кристаллическое тело, в отличие от аморфного, имеет ясно выра¬
женную внешнюю огранку, хорошо видимую в лучах обычного света, а
также четкую трехмерную периодичность внутреннего — атомного —
строения, выявляемую лишь при рассеянии рентгеновских лучей, нейтро¬
нов или электронов. Другими словами, трехмерная периодичность озна¬
чает, что каждому кристаллу можно мысленно приписать такую ре¬
шетку, один параллелепипед которой при параллельном самому себе
перемещении заполнит все кристаллическое пространство, и притом так,
что вершины этого параллелепипеда будут попадать только в тожде¬
ственные точки. Такой параллелепипед называется элементарной ячей¬
кой, а величины трех его ребер равны периодам идентичности кристалла.Благодаря такой четкой трехмерной периодичности в расположении
частиц вещества (атомов или молекул) возникают дифракционные эф¬
фекты при рассеянии рентгеновских лучей: в некоторых направлениях
рассеянные лучи усиливают друг друга, а в других — гасят. На реги¬
стрирующей их фотопленке — рентгенограмме — возникает система пя¬
тен— рефлексов, отличающихся друг от друга по степени почернения.Основной закон, которому подчиняется геометрия дифракционного
изображения, установлен английскими физиками — отцом и сыном Брэг¬
гами и русским кристаллографом Г. В. Вульфом. Оказывается, направ¬
лению, в котором все волны усиливают друг друга, соответствует про¬
стой и наглядный смысл: сильный луч как бы отразился от плоскости,
проходящей через узлы решетки. Все узловые плоскости кристалличе¬
ской решетки выступают параллельными семействами. Каждому такому
семейству соответствует определенное межплоскостное расстояние, обо¬
значаемое обычно буквой d. «Отражение» луча от системы плоскостей
происходит не при любом угле падения, а только в том случае, когда
длина волны излучения К, угол отражения 0 и межплоскостное расстоя¬
ние связаны формулой:2d sin 0 = пХгде п — целое число.Т'"’" ""* Раздел написан профессором А. И. Китайгородским/
ДИФРАКЦИОННЫЕ МЕТОДЫ АНАЛИЗА331Владея этим законом, можно построить систему правил, при помощи
которых по геометрии дифракционной картины удается исчерпывающим
образом охарактеризовать геометрию решетки, т. е. определить симмет¬
рию и размеры элементарной ячейки кристалла. Удается избавить ис¬
следователя от этих расчетов, используя остроумные методы съемки, в
которых кристалл поворачивается, а пленка, закрытая специальной
ширмой с тонкой прорезью, находится в движении, согласованном с
вращением кристалла. В подобных камерах в известном смысле удается
фотографировать кристаллическую решетку. На рис. 48 изображена та¬
кая рентгенограмма. Пятна рентгенограммы расположились в прямо¬
угольной сетке, ячейка которой отображает соответствующее сечение
ячейки кристалла. Благодаря осо¬
бенности дифракции изображение
получается «обратным» — рас¬
стояния между пятнами пропор¬
циональны не самим периодам
повторяемости в кристаллической
решетке, а их обратным величи¬
нам.Рентгеновские лучи рассеи¬
ваются на электронах (электрон-
ные лучи рассеиваются на элек¬
тронах и ядрах атомов; нейтрон¬
ные лучи рассеиваются на ядрах).Методом рентгеноструктурного
анализа находят своего . рода
«электронный центр» атома. Ве¬
роятно, среднее положение ядра
мало сдвинуто по отношению к
«электронному центру» атома.Для проведения полного
рентгеновского эксперимента ну¬
жен кристалл, линейные размеры
которого не превышали бы 1 мм. Рис. 48. Рентгенограмма молекулярного
Возможны как оптическая (по ОТ- соединения анилина с трнннтробензолом.
ражению светового луча от внеш¬
них граней), так и рентгенографическая ориентировка кристалла в рент-
геновскЬй камере.Существуют различные типы рентгеновских камер, позволяющих
снимать неподвижный или вращающийся кристалл при неподвижной
или движущейся синхронно с ним пленке. Получаемый при любом ме¬
тоде съемки богатый дифракционный материал используется на двух
стадиях рентгеноструктурного анализа.Первая стадия. Геометрические измерения. Расстояния между
рефлексами, а иногда и углы позволяют вычислить объем элементарной
ячейки V, после чего легко определить молекулярный вес вещества М,
если известна его плотность р:где g = 1,67-10~24 г — масса атома Еодорода, a Z— число молекул в эле¬
ментарной ячейке.При изучении геометрии дифракционной картины легко обнаружи-_
ваются определенные закономерности в погасании некоторых семейств
рефлексов, откуда можно почти всегда однозначно определить симмет¬
рию изучаемого кристалла. Симметрия накладывает ограничения на
332ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯвеличину Z, которая, разумеется, не может быть дробным числом, но для
органических кристаллов чаще всего принимает значения 1, 2, 4 или 8.Симметрия кристалла нередко однозначно определяет не только Z,
но и, как следствие, собственную симметрию молекулы в кр'исталле.Руководствуясь основной идеей органической кристаллохимии
(А. И. Китайгородский)—идеей плотной упаковки молекул в кристалле,
т. е. такой укладки молекул, при которой «выступы» одной молекулы
входят во «впадины» другой, нередко можно из нескольких моделей
строения выбрать единственную для данной молекулы.Вторая стадия. Оценка интенсивностей рефлексов на рентгено¬
граммах и последующая их математическая обработка. Эта стадия тре¬
бует во много раз большего труда, чем первая. Но в результате полу¬
чают величины всех межатомных расстояний (с точностью до 0,01 А) и
всех валентных углов (с точностью до 0,5°) в молекуле изучаемого ве¬
щества.Интенсивность каждого рассеянного луча связана со структурой
кристалла. Пусть в элементарной ячейке кристалла (для простоты пред¬
положим, что кристалл центросимметричен) находится N атомов с коор¬
динатами X\tj\Z\, х2У2^2, Обозначим далее буквами h, k, I так назы¬
ваемые индексы интерференции. Это три числа, которыми нумеруют
отраженные лучи. Как известно из кристаллографии, каждая узловая
плоскость в кристаллической решетке описывается тремя целочислен¬
ными индексами Миллера h\ k', I'. Индексы интерференции связаны с
индексами Миллера следующим образом:h = nhk = nk'; I —til'Можно показать, что амплитуда F волны дифракционного луча с
индексами h, k, I может быть представлена формулой:JV/2Fhki = 22tficos2}l{hxi + kyi+lzi) Wi=\ ‘ litЗдесь суммирование происходит по всем атомам, входящим в эле¬
ментарную ячейку. Величина /,■ представляет собой рассеяние одного
атома. Значения атомных амплитуд для всех элементов табулированы
и могут быть найдены в специальных изданиях.Подчеркнем, что эксперимент дает значение интенсивности луча, а
интенсивность пропорциональна квадрату амплитуды. Таким образом,
если известна структура, то амплитуда рассеянного луча и его интен¬
сивность вычисляются однозначно. Но, к сожалению, химика в большей
степени интересует обратная задача — установление структуры по из¬
вестным интенсивностям. Так как из опыта нельзя узнать, имеет ампли¬
туда положительный или отрицательный знак, то эта задача непосред¬
ственно не решается. Можно сказать, что основная работа исследователя
в области структурного анализа кристаллов заключается в применении
разного рода приемов, с помощью которых удается определить знаки
амплитуд.Вполне возможно, что дальнейшее развитие вычислительной тех¬
ники позволит нам всегда ограничиваться решением прямой задачи.
При огромном числе операций в секунду машина может рассчитать кар¬
тину интенсивностей от миллионов различных «пробных» структур. Эти
расчеты должны сравниваться с опытными данными. Правильной будет
та из «пробных» структур, для которой рассчитанные амплитуды совпа¬
дут с измеренными.Несмотря на грандиозность подобной задачи (в результате опыта
измеряются 1—3 тысячи дифракционных лучей, и для каждой из «проб¬
ДИФРАКЦИОННЫЕ МЕТОДЫ АНАЛИЗА333ных» структур надо анализировать совпадение с опытом этой большой
информации), она безусловно выполнима даже - для очень сложных
структур. Дело в том, что вовсе не требуется перебрать все без исклю¬
чения мыслимые структуры. Как правило, до начала анализа мы рас¬
полагаем приближенными сведениями о химической формуле, расстоя¬
ния между ковалентно связанными атомами также известны заранее с
достаточной точностью. Наконец, используя принцип плотной упаковки,
мы в состоянии отбросить все взаимные размещения молекул, не со¬
гласующиеся с этим правилом. Таким образом, составив достаточно
сложную программу действия, мы можем вести достаточно уверенный
поиск правильной структуры. Используя математический метод, так на¬
зываемый «метод оврагов», разработанный в СССР И. М. Гельфандом,
удалось решить весьма сложные структурные задачи.Однако пока процедура решения структурной задачи строится
иначе. Работа начинается с «угадывания» знаков структурных амплитуд.
Первоначальное определение знаков удается произвести, если есть хотя
бы грубая модель структуры. Эту грубую модель получают с помощью
вычисления рядов Фурье, коэффициентами которых являются измеряе¬
мые на опыте интенсивности дифракционных лучей. Речь идет о так
называемых рядах Патерсона, или рядах межатомных векторов. Эта
трехмерная функция может быть представлена следующей формулой:А (и, v, w) = 2 cos 2я + kv +Сумма вычисляется обычно для миллиона точек в ячейке делением
каждого из ребер ячейки на сто частей и состоит из 1—3 тысяч слагае¬
мых. Совершенно ясно, что такой объем вычислений можно сделать
только с помощью электронных вычислителей. В этом случае задача
решается быстро, и, как показал Патерсон, ряды такого типа большей
частью дают возможность построить грубую модель структуры благо¬
даря их следующему замечательному свойству. Максимумы трехмерной
функции Патерсона дают координаты межатомных векторов, существую¬
щих в реальной структуре, причем высоты максимумов пропорциональны
произведению атомных номеров атомов. Благодаря этому свойству меж¬
атомные векторы, соединяющие тяжелые атомы, резко выделяются в
ряду Патерсона.Структуры, содержащие тяжелые атомы, особенно удобны для ис¬
следования. Дело в том, что при расчете знаков структурных амплитуд
по формуле (1) в первом приближении можно пренебречь вкладом в
сумму со стороны легких атомов. Если так, то процедура определения
структуры складывается следующим образом. Первый шаг: из ряда
Патерсона находят координаты тяжелых атомов; второй шаг: по фор¬
муле (1) находят знаки всех структурных амплитуд; третий шаг: строят
ряд электронной плотности:р (х, у, г) = 2 РШ cos (А* + ky + 1г)Последняя формула весьма похожа на формулу (2), но между ними
имеется существенное различие. Множителями при косинусах являются
не квадраты измеренных структурных амплитуд, а сами амплитуды. Их
подставляют в эту формулу со знаками, найденными из координат тя¬
желых атомов.Подсчет примерно в миллионе точек позволяет построить карту
электронной плотности в любом сечении элементарной ячейки. В каче¬
стве примера на рис. 49 приведено такое сечение для кристаллов наф¬
талина и антрацена. Проведенные линии — это линии равной плотности.
Вершины электронных гор интерпретируются как центры атомов.
334ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯЕсли полученный результат противоречив, то прибегают к серии
последовательных уточнений, а именно еще раз вычисляют знаки струк¬
турных амплитуд теперь уже для новой модели, которая выявлена пер¬
вой картой электронной плотности. Возникает вторая, лучшая картина
структуры. Обычно третье уточнение является окончательным. Все рас¬
четы выполняются на электронных вычислителях.Как видим, полный структурный анализ довольно сложен. Поэтому
постановка такого исследования оправдана далеко не во всех случаях.Дело в том, что проведенные до сего времени физические исследо¬
вания (главным образом, рентгеноструктурные) позволяют уверенно
строить априорно модели органических молекул. В основе этой кон¬
структорской работы лежит тот факт, что грубо каждый атом может
быть охарактеризован двумя «радиусами», значение которых не зависит
от того, в какую молекулу входит атом. Расстояния между валентно
связанными атомами значительно .меньше расстояний между атомами,
принадлежащими разным молекулам.Рис. 4-9. Карта электронной плотности нафталина (слева) и антрацена
(справа).Половина расстояния, соединяющего два одинаковых атома кова¬
лентной связью, называется атомным радиусом. Половина отрезка, сое¬
диняющего два одинаковых ближайших атома двух соседних молекул,
называется межмолекулярным (или ван-дер-ваальсовым) радиуаом.
В табл. 37 приведены эти величины. (Чтобы получить длину связи,
нужно сложить соответствующие атомные радиусы. Например, длина
£—С равна 1,542 А, С = С— 1,33 А, С=0— 1,215 А.)
j Методы рентгеноструктурного анализа позволяют фиксировать
центры атомов. Если из этих центров соответствующими межмолекуляр-
ными радиусами провести сферы, то внешняя поверхность пересекаю¬
щихся сфер определит форму и объем молекулы. • Упаковка таких
«оформленных» молекул подчиняется основному правилу органической
кристаллохимии.Практически, чтобы собрать модель любой молекулы, нужно иметь
набор выполненных в определенном масштабе (например, 1А=1 см)
шаров со срезами. Число срезов на каждом шаре равно числу атомов,
ДИФРАКЦИОННЫЕ МЕТОДЫ АНАЛИЗА- 335Таблица 37. Атомные и межмолекулярные радиусы элементовЭлементАтомныйрадиус.АМежмолеку-лярныйрадиус,АЭлементАтомныйрадиус,АМежмолеку-ляряыйрадиус,Ан0,301,17F0,641,35в—0,881,76Р—1,101,9в=0,76»Р=1,00»в=0,68>Р=0,93»с—0,7711,8(1,72 *)S—1,041,85С—0.665s=0,94»с=0,602Cl0,991,80N—0,701,57As—1,212,0N=0,60Se—1,172,00■ N=0,55>Вг1,141,95О—0,661,38I1,332,10о=0,55• В крупных ароматических молекулах.валентно связанных с данным атомом. Плоскости срезов перпендику¬
лярны направлению валентностей, а расстояния от этих плоскостей до
центра шара равны соответствующему атомному радиусу; радиусы ша¬
ров равны межмолекулярным радиусам. На рис. 50 показаны некоторые
модели молекул.5 В 7 8Рис. 50. Модели молекул Стюарта — Бриглеба:/ — метиловый спирт; 2 —этиловый спирт; 3—уксусный альдегид; 4 — ацетон; 5 —уксусная кислота;
6—бутан; 7 — изооутан; « — бензол.Рентгеноструктурные исследования органических веществ явились
прямым подтверждением основных правил стереохимии. Одни из первых
результатов получены для кристаллических структур алмаза и графита.В структуре алмаза (рис. 51) расстояние между ближайшими ато¬
мами углерода 1,54 А. Если исходить из идеи о тетраэдричности свя¬
зей четырехвалентного углерода, то оказывается, что все атомы углерода
в кристалле алмаза связаны ковалентно, т. е. весь кристалл — это одна
громадная молекула. Чтобы механически раздробить кусочек алмаза,
336ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯнеобходимо преодолеть силы химических связей, чем и объясняется не¬
обыкновенная твердость алмаза. 1В структуре графита атомы углерода расположены на плоскостях
в вершинах правильных шестиугольников (рис. 52) СО'стороной, равной
1,41 А. Расстояние между соседними плоскостями равно 3,35 А, т. е.
лишь слегка меньше суммы межмолекулярных радиусов углерод — угле¬
род. Следовательно, в графите молекулой является каждая плоскость,
составленная из углеродных ароматических шестиугольников. Слабая
связь между плоскостями -является причиной совершенной спайности,
чешуйчатости графита перпендикулярно этой связи.При исследовании структуры симметричных органических молекул
эти результаты были строго подтверждены: все молекулы типа CR4
имеют тетраэдрические валентные углы, а бензол и его гексапроизвод¬
ные— углы, равные 120°, и плоскую структуру. Отклонения валентных
углов от этих «нормальных» значений были найдены и тщательно изу¬
чены. Они возникают при несимметричном замещении как результат так
называемых пространственных взаимодействий (такое название полу¬
чили взаимодействия между валентно несвязанными атомами одной и
той же молекулы). Оказалось, что если в какой-либо молекуле расстоя¬
ния между атомами значительно меньше суммы межмолекулярных ра¬
диусов, то между этими атомами возникает пространственное взаимо¬
действие, которое приводит к искажению нормальных валентных углов
или к затруднению свободного вращения около связей. Напряжения,
существующие в циклических системах, частично объясняются подходом
несвязанных атомов на расстояния, которые меньше суммы межмолеку¬
лярных радиусов.В связи со сказанным очевидно, что к рентгеноструктурному иссле¬
дованию стоит прибегать в следующих случаях: прежде всего тогда,
когда имеются неясности в строении химического соединения; когда не¬
ясна стереохимия молекулы; когда ставится цель уточнения межатомных
расстояний, поскольку атомные радиусы, приведенные выше, являются
средними значениями.Последняя задача представляет сравнительно небольшой интерес,
так как межатомные расстояния — это лишь очень грубая характери¬
стика химических особенностей связи, а точность их определения сравни¬
тельно невелика. Скажем, расстояние между ароматическим атомом уг¬
лерода и присоединенным к нему атомом хлора в пределах точности
измерения совпадает с расстояниями от алифатического атома углерода
до хлора. В то же время ряд свойств этих связей (например, дипольный
ДИФРАКЦИОННЫЕ МЕТОДЫ АНАЛИЗА337момент, частоты валентных колебаний) для приведенных двух случаев
резко различны.В противоположность этому в определении пространственного рас¬
положения атомов дифракционные методы не имеют конкурентов. Рент¬
геновские методы стоят здесь на первом месте, но достаточно велика
и роль нейтронографии. Дело в том, что атом водорода очень слабо рас¬
сеивает рентгеновские лучи. Установление его координат рентгеновским
методом является задачей, осуществимой лишь с большим трудом. При
этом результаты такого определения очень грубы. Нейтронография орга¬
нических веществ имеет большое значение именно потому, что помогает
восполнить этот пробел — с ее помощью можно точно локализовать
атомы водорода в кристалле.Что же касается электронографии, то этот метод обладает преиму¬
ществами лишь при исследовании вещества в газообразном состоянии.
Однако дифракция от газа несет несравненно меньшую информацию о
структуре, чем дифракция от кристалла. Структура простых молекул в
основном уже известна; в более сложных случаях применение электроно¬
графии нецелесообразно. Электронография полезна при определении
расстояний между тяжелым атомом и атомами органогенами. Поэтому
она сохраняет свое значение для исследования металлоорганических
соединений.Экспериментальные и теоретические методы рентгеноструктурного
анализа доведены за последние годы до высокого совершенства. Практи¬
чески нет ограничения в сложности молекулы для определения простран¬
ственного расположения ее атомов (достаточно упомянуть витамин В12
и белок — миоглобин). Вопрос лишь во вложенном труде и в возможно¬
сти располагать хотя бы маленьким монокристаллом исследуемого ве¬
щества.Значение рентгеноструктурного анализа в органической химии не
ограничивается возможностью определения структуры молекулы. Для
многих проблем оказывается существенным взаимное расположение мо¬
лекул (упаковка) в кристалле. В качестве примера остановимся на ре¬
зультатах изучения кристаллов, построенных из длинноцепочечных
молекул.Для парафинов, жирных кислот и других длинноцепочечных соеди¬
нений характерным является плоский зигзаг, образованный СНг-груп-
пами. Из-за тетраэдрического угла между направлениями валентных
связей при длине С—С-связи 1,54 А атомы углерода повторяются вдоль
прямой, являющейся осью зигзага, через 2,54 А:Идеальный тетраэдрический угол 109° 28' увеличен в этой молекуле
примерно на 2° из-за отталкивания валентно несвязанных атомов
углерода.Рентгеноструктурными исследованиями показано, что при увеличе¬
нии молекулы на лСН2-групп один из периодов идентичности возрастает
на п-2,54 А, тогда как два других размера элементарной ячейки практи¬
чески не изменяются. Следовательно, длинные оси молекул распола¬
гаются в кристалле параллельно.В сечении, перпендикулярном большому периоду элементарной
ячейки, упаковка определяется размещением боковых групп. В парафи¬
нах две соседние молекулы сдвинуты по отношению друг к другу вдоль12 Зак. 882
338КАРБОНОвЫЕ КИСЛОТЫ РЯДА АЦЕТИЛЕНАдлинной оси так, чтобы атомы водорода СН2-группы одной молекулы
попали во «впадину» между двумя СНг-группами соседней молекулы,
т. е. на Уг от 2,54 А.В жирных кислотах карбоксильные группы двух соседних молекул
повернуты друг к другу и образуют прочные водородные связи, а ме¬
тальные группы соприкасаются с детальными же группами двух дру¬
гих молекул, здесь связь слабая. Понятно, почему жиры, как и графит,
являются хорошими смазками.С наибольшим успехом рентгеноструктурный анализ может быть
применен к веществам, образующим одиночные кристаллы. Однако изу¬
чение полимеров также приводит к интересным результатам. Ряд важ¬
ных свойств высокополимерных соединений, в которых длинноцепочеч¬
ные молекулы расположены с высокой степенью упорядоченности, стал
ясным лишь после привлечения рентгенографии.Природа каучука, целлюлозы, синтетических полимеров, белковых
молекул не могла бы быть выяснена без применения рентгеноструктур¬
ного анализа.Дальнейшее о физических методах исследования органических ве¬
ществ см. стр. 550.КАРБОНОВЫЕ КИСЛОТЫ РЯДА АЦЕТИЛЕНАКроме обычных способов получения кислот ацетиленового ряда из
соответствующих этиленовых кислот, напримерВг2 +2C2H6ONa sP“-"Кон “* |Н,Т_<он "“Ко*.Вг Вгкислоты ряда ацетилена с соседним положением карбоксилу и ацетиле¬
нового углерода можно получать из соединений Иоцича:MgBrСIIIсIMgBrсо2 +HC1
> C=C-Cf —— -r-т--* НС=С—СГI ^OMgBr \он
BrMgпропиоловаякислотагсо2 + 2НС1 О. ,0—> е-с==с—сг ——► с—с=с—сBrMgO^ ^OMgBr -wfcif НО/ Х'ОНТаблица 38. Кислоты ацетиленового рядаацетилеидикарбоноваякислотаФормулаНазваниеТемператураплавления,°СТемпературакипения,°СНС==С-СООНПропиоловая, или пропаргиловая *9144(разл.)СН3-С=С—СООНТетроловая, или метилпропиоловая76,5203С2Н6-С==С—СООНЭтилпропиоловаяSo—С3Н7-Сн=С-СООНПропилпропиоловая27127(при 24 мм
рт. ст.)НООС-С==С—СООН.Ацетилендцкарбоновая179—* Плотность кислоты (djg) 1.139.
КАРБОНОВЫЕ КИСЛОТЫ РЯДА АЦЕТИЛЕНА339Из пропина таким же путем получают тетроловую кислоту
СН3—С 5= С—СООН.Физические свойства и наименования кислот ацетиленового ряда
приведены в табл. 38.Ацетиленовые кислоты обладают повышенной сравнительно с пре¬
дельными кислотностью. Они присоединяют два или четыре атома во¬
дорода (над Fe, Pd или Ni); две молекулы галоида, галоидоводорода;
при действии катализатора — иона ртути — молекулу воды:HCs=C-C-OH + н2оIIоHg"н0:\лс—сн,—с-онАСНз—С=С—С-ОН + HsO4HgJCH3-C-CH2-C-OHА Аацетоуксусиая кислотаЕстественно, ацетиленовый водород пропиоловой кислоты способен
замещаться на Ag, Cu(I).Ацетилендикарбоновая кислота, подобно малеиновой кислоте и ее
ангидриду, — диенофил (см. стр. 274):/СН2
СНIСН^сн2+с"0с чонсн2нс*"III —>J 1V0НС\ /Ссн2Xо/с^/\Оон
охон12*
ГЕТЕРОФУНКЦИОНАЛЬНЫЕСОЕДИНЕНИЯТак называются вещества, содержащие две или более разные функ¬
циональные группы. Число таких комбинаций, очевидно, необозримо. Мы
рассмотрим только главнейшие, начав с аминоспиртов и комбинаций
карбоксила с другими группами (ОН, С = 0, N02, NH2) и перейдя за¬
тем к комбинациям карбонила с другими группами (главным образом,
с ОН). Именно к этим типам относятся многие важные природные
соединения.Изучая комбинации функциональных групп, мы будем обращать
внимание на возникающие в таких комбинациях новые свойства, не
возвращаясь к уже знакомому нам поведению отдельно взятых функ¬
циональных групп. Чем ближе расположены друг к другу функциональ¬
ные группы, тем резче проявляется их взаимодействие и тем в большей
степени выявляются новые свойства комбинации. Иллюстрировать эти
отношения можно на примере комбинации гидроксила и карбонила,
сомкнутых друг с другом непосредственно в карбоксил — совершенно
новую функцию, резко отличную от гидроксила и карбонила, взятых
в отдельности.АМИНОСПИРТЫПри действии формальдегида на вторичные амины в некоторых
случаях можно изолировать их «метилольные» производные, которые
при избытке амина превращаются в метилен-бис-амины:hnr2CH.O + HNRj —► НО—СН2—NR2 R2N—CH2—NR2 + HsOГидроксил метилольных производных аминов очень легко отщеп¬
ляется в виде воды с достаточно подвижным водородом второго реа¬
гента. Это происходит, например, при реакции Манниха, протекающей
по типу:R'H + CH20 + HNR2 —► R'H + [HOCH2NR2] —> R'—CH2—NR2 + H20где R'H — алифатическое соединение с подвижным водородом или аро¬
матическое соединение.По существу метилольные соединения не относятся к аминоспиртам,
так как являются функциональными производными формальдегида и их
реакции своеобразны.Простейший истинный аминоспирт — этаноламин (коламин) может
быть получен взаимодействием аммиака с окисью этилена:Н2С—CH2 + NH3 —► носн2—сн,~ын2
\ /
о
АМИНОСПИРТЫВ зависимости от соотношения реагентов та же легко протекающая
реакция может привести к диэтаноламину и триэтаноламину:2Н.С CH2 + NH3 —> (HOCH2CH2)2NH\ /ОЗН2С CH2 + NH3 —J- (HOCH2CH2)3NДругой путь получения аминоспиртов с первичной аминогруппой
основан на взаимодействии нитропроизводных жирных углеводородов
с формальдегидом:н2/жch2o + ch3no2 —> hoch2-ch2no2 ► носн2—ch2nh2Нг/Ni3CH20 + CH3N02 —»- (H0CH2)3CN02 ► (HOCH2)3CNH2Свойства некоторых аминоспиртов приведены в табл. 39.Таблица 39. АминоспнртыФормулаНазваниеТемператураплавления.°СТемпера¬туракипения,“СПлот¬ность<Кь (при
й °С)HOCH2-CH2-NH2Этаноламин,
или коламин10,5172,21,01803,63-10"10HOCH2-CH2-N(CH3)22-Диметил-аминоэтанол—1350,8866—[HOCH2~CH2—N(CH3)3]OH~Холин, илигидроокисьР-окснэтил-триметил-аммонияВязкаяжидкость8,77- 10_б(НОСН2—CH2)2NHДиэтаноламин282681,09661,32 • 10-9(HOCH2~CH2)3NТриэтанол-амни21,2279
(прибОмм
рт. ст.)1,12421,70 - 10~аНаибольшее применение' находит триэтаноламин — как поглотитель
СОг и других кислых газов при газоочистке (например, при очистке
водорода). Триэтаноламин, поглотивший С02, отдает его при нагрева¬
нии и так регенерируется. Он применяется также как безвредный мяг-
читель в текстильной промышленности, в мыльных пастах и т. д.При замене гидроксилов на хлор (действие НС1 или РС1з) триэта¬
ноламин превращается в три{$-хлорэтил)-амин (С1СН2СН2)зЫ—ана¬
лог иприта (C1CH2CH2)2S по строению и ядовитому действию.Группировка (C1CH2CH2)2N— входит в молекулу сарколизина и
других канцеролитических средств.При метилировании этаноламина через стадии монометиламиноэта-
нола и диметиламиноэтанола получается этанолтриметиламмониевая
соль:СН3
+ 1НОСН2— CH2—NH2 + ЗСН31 —> HOCH2—СН2—N—CH3 'IСН3
342оксикислотыДействием на эту соль влажной окиси серебра синтезируют холинСНз+1НОСН2-СН2—N—СН3 'ОНIсн3вещество, играющее важную роль в регулировании обмена веществ
в животном организме и приравниваемое к витаминам. Его уксусно¬
кислый эфир — холинацетат, называемый обычно ацетилхолином, слу¬
жит медиатором (посредствующим веществом) в работе нервов — выде¬
ляется окончанием нерва, передающего раздражение от одной нервной
клетки к другой и в конце концов двигательным мускулам. Ацетилхолин
обладает исключительно сильным физиологическим действием. Будучи
введен в организм, он вызывает сокращение мышц, судороги, сильную
перистальтику кишечника и, в противоположность самому холину, рез¬
кое понижение кровяного давления. Ацетилхолин, выделённый нервом
и сыгравший свою роль медиатора, тут же гидролизуется под дей¬
ствием энзима холинэстеразы в холин, обладающий сравнительно сла¬
бым (и во многом противоположным) физиологическим эффектом. Дез¬
активирование холинэстер&зы равносильно по эффекту введению в орга¬
низм ацетилхолина. Такое дезактивирование осуществляется «нервными
ядами», подобными табуну I, зарину II и еще более ядовитому веще¬
ству III, открытому шведским ученым Таммелином
(СНз)2КЧр/0 снЗЧр/о СНзЧр/0СгНьО// N:N (СНзЬСН-о/ 4F С2Н5о/ \s-CH2-CH2—N(C2Hs)I II IIIили инсектицидами (у насекомых), такими, как тиофос, меркаптофос,
М-81 и др. (см. кн. II, раздел «Элементоорганические соединения»).Дегидратация холина приводит к ядовитому нейрину — гидроокисивинилтриметиламмония СНг=СН—Ы(СНз)з ОН~.В виде своего фосфорнокислого эфира холин входит в состав ве¬
ществ класса липидов, а именно фосфатидов — лецитинов (стр. 310).
Лецитины построены как смешанные глицериды жирных кислот и фос¬
фата холина, т. е. одной из их возможных формул является формула
типао~+ I(CH3)3N-CH3-CH2-0— p-o-ch2— ch-ch,-o-c-rII I IIО О—С—R ОIIоИзвестны и кефалины, построенные по этому же типу на основе
моноэтаноламина. Лецитины во многих случаях сопровождают жиры и
в пище являются одним из источников необходимой для жизни фосфор¬
ной кислоты. ,оксикислотыОксикислотами называются карбоновые кислоты, имеющие вторую
функцию — гидроксил.Первым и особняком стоящим членом ряда оксикислот является
оксимуравьиная кислота, иначе говоря, угольная кислота НО—С—ОН.
УГОЛЬНАЯ КИСЛОТА И ЕЕ ПРОИЗВОДНЫЕ343УГОЛЬНАЯ КИСЛОТА И ЕЕ ПРОИЗВОДНЫЕВ отличие от других оксикислот, гидроксил которых, более удален¬
ный от карбоксила, имеет слиртовый характер, гидроксилы угольной
кислоты сомкнуты с карбонильной группой и не различаются между
собой: оба они карбоксильные гидроксилы. Поэтому угольная кислота,
формально относящаяся к оксикислотам, на деле ближе (хотя и зна¬
чительно отличается от них) к двухосновным карбоновым кислотам.
В сущности, она занимает совсем особое место и по свойствам и по¬
тому, что не имеет гомологов, так как любое замещение в ней ведет
к образованию функционального производного. Мы рассмотрим по¬
этому угольную кислоту отдельно от других оксикислот.Угольная кислота существует лишь в слабых водных растворах
(растворы углекислого газа в воде), причем в этих растворах равновесиеС02 + Н20 ч=* Н2С03сильно сдвинуто влево, что и создает впечатление о слабости угольной
кислоты. Измеренную концентрацию водородных ионов относят ко всей
концентрации двуокиси углерода, в то время как в действительности
лишь малая часть СОг гидратирована в Н2С03.Функциональные производные угольной кислотыФормулы, названия и физические свойства ряда производных уголь¬
ной кислоты приведены в табл. 40.Соли угольной кислоты здесь рассматриваться не будут, так как их
изучают в курсе общей химии.Хлорангидрид угольной кислоты — фосген COCI2 получается соеди¬
нением окиси углерода с хлором (на свету или при действии катали¬
затора— угля) и является промышленным продуктом. Он очень ядовит
и в первую мировую войну применялся как боевое отравляющее ве¬
щество. Фосген кипит при 8,3 °С, хорошо растворяется в углеводородах,
водой медленно гидролизуется:С0С12 + Н20 —»- С02 + 2НС1Щелочи гидролизуют его быстро.Со спиртами фосген образует эфиры хлоругольной (хлормуравьи-
ной) кислоты, не существующей в свободном состоянии:CI-C-C1 + СН3ОН —> С1—С—ОСН3 + НС1II IIО оПри более энергичном взаимодействии с избытком спирта реагирует
и второй атом хлора, и образуется полный эфир угольной кислоты;С!—С—ОСН3 + СН3ОН —■* СН30—С—-ОСН3 + НС1II • ’ IIО оОба эфира могут быть полностью прохлорированы; первый из них
называется дифосген, второй трифосген:С1—С—ОСНз + ЗС12 —С1—С—0СС13 + ЗНС1II 1ГО оСН30 - С - ОСН3 + 6С!г —> СС130 -С—OCCI3 + 6НС1|| • IIо о
344ОКСИКИСЛОТЫТаблица 40. Производные угольной кислотыФормулаНазваниеТемпер а-
тура
плавления,
°СТемпера¬туракипения,°СПлотность.204но—с—онАУгольная кислота—58,6(при5,2кгс/см2)—78,5(возг.)1,56
(при — 79 °С,
твердая)
1,101
(при —37 °С,
жидкая)С1—С—С1АФосген, или хлористый карбонил-118+8,31,392М')Cl—С—ОСНзАМетилхлоркарбонат, или метил-
хлорформиат—71,41,236(при 15°С)CI—С—ОС2Н5IIОЭтилхлоркарбонат, или этилхлор-
формиат-80,6941,138СН30—С—ОСНз
ОДиметилкарбонат+0,5911,0694сан5о—с—ос,.н5С)Диэтилкарбонат-43126,80,9751С(ОСН3)4Т етраметилортока рбонат———С(ОС2Н5)4Т етраэтилортокарбонат—1590,9186NHj—С—ОСН.
iМетилкарбамат+521771,136(ОNH2—С—ОС2Н5АЭтилкарбамат, или уретан501800,9862Юnh2—с—nh2
оКарбамид, или мочевина132,7Разл.1,335C1—с—nh2
1Карбамоил хлористый-5061-62—иNH2—С—РШСНзАМетилмочевина+ 101Разл.1,204nh2—с—nh2IINHГ уанидин50— о NH
| с=оо^х /и NHОксалилмочевина, или парабано-
вая кислота243(разл.)— 100
(возг.)°чС—NH/ V пН,С /-о, C-NH
0^Малонилмочевина, или барбиту¬
ровая кислота245(разл.)
УГОЛЬНАЯ КИСЛОТА И ЕЕ ПРОИЗВОДНЫЕ3'15Продолжение табл. 40ФормулаНазваниеТемпера¬тураплавления,°СТемпера¬туракипения,°СПлотность4C1-C=NHO-C=Nс2н5о—g^nNH2—CssNХлористый циаи
Циановая кислотаЭтиловый эфир циановой кислоты
Цианамид\-6-79+4413,8; 23,5
Разл.162(разл.)140
(при
19 мм
рт. ст.)1,186
1,140
(rf°, жидк.)0,8901,0729юПо запаху и ядовитым свойствам они похожи на фосген и при пи¬
ролизе превращаются в последний:С1—С—ОССЦI!о2СОС1, СС130—С—ОСС13IIОЗСОС1,Такое превращение происходит и при многих реакциях. Например,
со спиртами, аммиаком или аминами эти вещества реагируют так, как
если бы это был фосген.Полные эфиры угольной кислоты можно также получить алкилиро-
ванием галоидными алкилами серебряной соли угольной кислоты. Они
гидролизуются в кислой и щелочной среде, как все сложные эфиры
карбоновых кислот. Кислые эфиры угольной кислоты не существуют, но
известны их соли, получаемые взаимодействием СОг с алкоголятами
натрияCOj + RONa —► R—О—С—ONaIIОкоторые при подкислении тотчас распадаются:R—О—С—ONa + НС1 —► ROH + СОг + NaCiIСуществуют циклические эфиры угольной кислоты, например эфир,
образующийся при взаимодействии фосгена с этиленгликолем:CHjOH Ck| + )с=о
СНоОН с кСН,—о.СН,—оС=0 + 2НС1Ортоугольные эфиры получают действием ССЦ (или, лучше, хлор¬
пикрина CCI3NO2) на алкоголяты натрия:CC13N02 + 4NaOR —► C(OR)4 + 3NaCl + NaN02Гидролиз (в кислой среде) ортоугольных эфиров, как и всех орто¬
эфиров, идет в две стадии. Сначала образуется средний эфирC(OR)4 + н2он+(R0)2C=0 + 2ROHкоторый затем также гидролизуется.С гриньяровым реактивом ортоугольные эфиры образуют ортоэфиры
соответствующих кислот:RMgCl + С(0С,Н5)4 —> RC(OC,H8)a+. С2Н50МвС1
346ОКСИКИСЛОТЫСернистые производные угольной кислотыСероуглерод CS2 — аналог угольного ангидрида. Это жидкость, ки¬
пящая при 46°С, плотность ее rff° = 1,262. Технический сероуглерод
отвратительно пахнет и по запаху напоминает редьку. Запах чистого
сероуглерода несколько похож на запах хлороформа. Сероуглерод
крайне огнеопасен и вспыхивает на воздухе уже от прикосновения на¬
гретой стеклянной палочкой. Его получают прямым взаимодействием
угля и серы при высокой температуре. Основная масса сероуглерода
употребляется в производстве вискозного волокна из целлюлозы
(стр. 452). Из него получают также четыреххлористый углерод:CS2 + 3C12 —► CCl4-fS2Cl2С Na2S сероуглерод образует тритиокарбонат натрия ЫагСБз—ана¬
лог соды. Со щелочью дает соль дитиоугольной кислотыNaCXCS2 + 2NaOH —* \>=S + H20
NaS/а с алкоголятами металлов — соли ксантогеновых кислот:С2НьОчCS2 4- NaOCjHs —► ^C=SNaS/RO^Сами ксантогеновые кислоты C=S неустойчивы и, образуясьHS^при подкислении их солей, тотчас разлагаются с образованием исход¬
ного спирта и сероуглерода.Алкилированием солей ксантогеновой кислоты получают полные
эфиры дитиоугольной кислоты:с2н6оч с2н6очV=S + CH3I —>- ^C=S + NaINaS/ CH3S/При нагревании эти эфиры гладко разлагаются с образованием оле-
фина и отщеплением меркаптана и сероокиси углерода:
с2н6оч^C=S —* СН2==СН2 + COS + CH3SH
СНзБ^Отщепление меркаптана и сероокиси углерода происходит в цмс-положеиии, что
можно констатировать в случае их отщепления от алициклических систем. Это не.
частый случай цис-элиминации.Такой путь образования олефина носит название реакции Чугаева
и ценен при исследовании спиртов сложной структуры, которые дают
по этой реакции олефин без изомеризации. Изомеризация часто на¬
ступает при применении кислоты или кислотного катализатора дегид¬
ратации. Для получения простейших олефинов реакция эта, конечно,
не имеет значения.Азотистые производные угольной кислотыПолный амид угольной кислоты — карбамид, или мочевина, Давно
известен как вещество, посредством которого организм человека осво¬
бождается от избытка азота. Мочевина открыта в моче Руэллем
УГОЛЬНАЯ КИСЛОТА И ЕЕ ПРОИЗВОДНЫЕ347(1773 г.), где ее содержание составляет около 2%. В настоящее время
мочевину в огромных масштабах синтезируют из смеси двуокиси угле¬
рода и аммиака нагреванием под давлением:С02 + 2NH3 —> NH2— С—NH2 + Н20IIОЭто самый экономичный способ синтеза мочевины. Раньше ее полу¬
чали гидролизом цианамида кальция, который в свою очередь полу¬
чается из карбида кальция нагреванием до высокой температуры в токе
азота:CaC2+N2 —► CaN—C==N + С
CaN—C==N + 2H20 —» H2N—Cs=N + Ca(OH)2Jh2oH2N—C—nh2IIОО строении мочевины дает понятие синтез ее из фосгена
С1—С—Cl + 4NH3 —NH2—С—NH2 + 2NH4C1II IIО оНапомним, наконец, что первый синтез мочевины осуществлен Ве¬
лером (1828 г.) изомеризацией циановокислого аммония путем нагрева¬
ния его водного раствора:NHtCNCT —V H2N—С—NH2IIОМочевина реагирует с азотистой кислотой количественно по урав¬
нениюNH2—С—NH2 + 2HN02 —V 2N2 + C02 + 3H20
IIои применяется для уничтожения избытка азотистой кислоты в реак¬
ционной среде.При нагревании мочевина превращается в биурет:2NH2—С—NH2 —>- NH2—С—NH—С—NH2 + NH3II II IIО 0 0Как амид мочевина гидролизуется и в кислой и в щелочной среде:н2оNH2— С—NH2 ► 2NH3 + С02IIООна алкилируется, образуя алкилмочевину:RI + NHj-C-NH2 —► RNH-C—NH2 + HIII IIО ои ацилируется, образуя так называемые уреиды:R—С—Cl + NH2—С—NH2 —> R—C—NH—C-NH2 + HC1
II II II IIО о о о
348оксикислотыЦиклические уреиды образуются из двухосновных кислот:°Vc—ОН H2N4 . ^с—+ 'с=ос-он h2n nhи о"с=о
/оксалилмочевняа(парабановая'кислота)°С-ОН H.N. /C-NHт iN 11\ / \н2< + ;с=0 —> н2с( )с=о^С—ОН H2Nмалонилмочевина
(барбитуровая кислота)Они являются гетероциклами и применяются в синтезе, например,
пуринов (см. кн. II, раздел «Гетероциклические соединения»).Уреид а-бромизовалериановой кислоты под названием бромурал
применяется как снотворное. Такое же действие имеет веронал — ди-
этилбарбитуровая кислота.ОIIШг и /С NH34 / чсн—снвг—с—nh—с—nh2 с ;с=оСП/ j J с,н/ \с_ /обромурал вероналМочевина находит широкое применение. С формалином мочевина
образует мочевино-формальдегидные смолы — основу пластмасс (ами-
нопластов) и клеев. Молекулы мочевины сшиваются метиленовыми
мостами в макромолекулы, причем промежуточно образуются меги-
лольные группировки, способные далее превращаться в метиленовые
мосты:О+ N„r_c_NH_ _NH-C-NH
о I
—NH—С—NH2 + CH20 —► —NH—С—NHCH2OH > СН,II II IО О —NH—С—NHIIОI Iсн2 сн2I I«МН2—С—NH2 + mCH20 —> —СН2—N—С—N—СН2—N—С—N—СНо—II II I II IО О СН2 о сн2I I—СН2—N—С—N—СН;—N—С—NH—СН2—II I IIО СН, о
УГОЛЬНАЯ КИСЛОТА И ЕЕ ПРОИЗВОДНЫЕ349Мочевину применяют для подкормки жвачных животных, так как
бактериальная флора их желудка способна за счет азота мочевины
создавать белки, которые и усваиваются животным.Благодаря легкому гидролизу мочевина находит применение и как
удобрение источник аммиака в почве.Некоторые производные мочевины служат гербицидами. В качестве
примеров можно привести продукты конденсации хлораля с мочеви¬
ной— дихлоральмочевину и монурон (Ы-4-хлорфенил-Ы/,Ы/-диметилмо-
чевину) и др.С!3С—СН—NH-C—NH—СН—СС1з я-С1С6Н4—NH—С—N(CH3)2I I! I IIон О он одихлоральмочевина монуронНеполный амид угольной кислоты NH2—С—ОН— карбаминоваяОкислота не существует в свободном виде. Ее аммониевая соль обра¬
зуется соединением С02 и NH3 при комнатной температуре и атмосфер¬
ном давлении:СО, + 2NH) —► NH2—С—O' NHtIIОЭфиры карбаминовой кислоты называются уретанами и могут быть
получены действием аммиака на сложные эфиры хлоругольной кислоты:С1—С—ОСНз + 2NH3 —>- NH2—С—ОСНз + NH4CIII IIО оНекоторые уретаны применяются как транквиллизирующие лекар¬
ства, например мепробамат/СН3
NH2—С—ОСНЛС^, чС3Н7-коУретаны, производные анилина (кн. II), применяются как гербициды
избирательного действия для «прополки» свеклы, капусты, хлопка. Та¬
ковы «ИФК» и «хлор-ИФК»:А—NH-C-OCH(CH3)2 NH-C-OCH(CH3)2\=/ II \=/ IIО С1/ о«ИФК» «хлор-ИФК»Метилуретан, продукт этерификации метилкарбаминовой кислотой
а-нафтола, носит техническое название севин и применяется как эф¬
фективный инсектицид, сравнительно быстро гидролизующийся и по¬
тому менее опасный, чем хлорорганические инсектициды.Севин получается по реакции:О+ сн3—N=C=0 —>а-нафтол мегилизоцианат а-нафтнлмегилкарбамат(севин)
350оксикислотыЗамещенные при азоте урётаны можнб синтезировать из хлоруголь-
ного эфира и амина. Например, с метиламином получается метилуре-
танС1—С—ОСНз + 2NH2CH3 —► СН,—NH—С—ОСНз + CH3NH3 СГ
II IIо окоторый служ^ обычно исходным веществом в синтезе диазбметана:
CH3-N-C-OCH3 + HNO, —► CH3-N-C-OCH3 + Н2I II I IIН О 0=N онитрозометилуретанСНз—N—С—ОСНз + 2NaOH —* СН3—NH—NO + Na2C03-f СН3ОН
0=N О |СН3—N=N—ОН CH2=N=N—H2UдиазомегаиКарбодиимиды, соединения общей формулы R—N=C=N—R, в
частности дициклогексилкарбодиимид, приобрели большое значение
как вещества ангидридизующие (со спаиванием) две разные молекулы,
например две аминокислоты в пептид (см. стр. 471). При этом карбо¬
диимиды превращаются в соответствующие мочевины.Карбодиимиды могут быть получены из соответствующих дизаме-
щенных. мочевины действием на них брома и трифенилфосфина в при¬
сутствии триэтиламина:RHN-C-NHR + Вг2 + (С6Н5)3Р ► RN=C=NR + (С6Н6)3РО + 2НВгОГуанидин NHo—С—NH2 получайт из ортоутольного эфира дей-
NHствием аммиака:С(ОС2Н6)4 + 3NH3 —► NH2-C-NHa + 4С2Н5ОНIINHЕго можно приготовить также из цианамида и хлористого аммония
(в виде соли):NH2-C=N + NH4CI —> TNH2—С—NHIINH2
,+СГГуанидин — одно из самых сильных оснований в органической хи¬
мии (в противоположность слабоосновной мочевине). Это объясняется
симметрией соли и обычным'снижением энергии молекулы при мезо-
мерном распределении заряда, особенно полном в симметричной мо¬
лекуле:
УГОЛЬНАЯ КИСЛОТА И ЕЕ ПРОИЗВОДНЫЕ351Гуанидин связывает даже слабые кислоты, такие, как угольную.
Семикарбазид NHg—С—NH—NH2, важный реактив на альдегидыIIОи кетоны (стр. 131), можно рассматривать как гидразид карбаминовой
кислоты.Его получают, нагревая гидразин с мочевиной или с уретанами
NH2—С—NH2 + NH2—NH2 —► NH2—C-NH—NH2 + ROHо оили действуя солью гидразина на циановокислый калий:Н-О—C=N + NH2-NH2 —► NH2—С—NH—NH2IIОТиомочевина NH2—С—NH2 получается нагреванием роданистогоIISаммония:NHt[S—C=N]~ —►' NH2—C-NH2IISТиомочевина таутомерна и реагирует также в форме изоТиомоче-
вины:NH2—С—NH2 *=► NH—С—NH2П IS SHТак, с иодистым метилом она дает S-метильное производноеNH=C—NH2ISCH3Подобным же образом тиомочевина алкилируется даже простыми
эфирами (P. X. Фрейдлина). Сульфокислоты образуют с тиомочевиной
характерные изотиурониевые соли, служащие для их идентификации.Тиомочевина применяется для синтеза тиазольных гетероциклов (см.
кн. II).Нитрилы угольной кислоты
и ее функциональных производныхНитрил угольной кислоты — нестойкая циановая кислота НО—C = N,
быстро полимеризуется выше 150 °С в циануровую кислоту;онIСЗНО—C==NII IНОх N хОНциановая кислота циануровая кислотаПри нагревании до еще более высокой температуры циануровая кис¬
лота деполимеризуется и образует в охлажденном приемнике жидкую
циановую кислоту, уже при О^С довольно быстро полимеризующуюся
в линейный полимер циамелид:... —О - С-О—С—О— С I! II IINH NH NH
352оксикислотыСоли циановой кислоты получают окислением солей синильной кис¬
лоты, например:KCN + РЬ02 —► KOCN + РЬОПри алкилировании серебряной соли циановой кислоты получается
алкильное производное («сложный эфир») изомерной изоциановой кис¬
лоты Н—N = C = 0, не существующей в свободном виде:Ag+ [O^C^n] + CH3I —*■ СН3—N—С=0 + Aglметилизодианатт. е. алкилирование аниона циановой кислоты происходит не по кисло¬
роду, а по азоту.Изоцианаты можно получить нагреванием аминов с фосгеном:3RNH2 + СОС12 —► RN=C=0 + 2RNH3CrИзоцианаты ароматического ряда часто применяются как реактив
на спирты, с которыми они образуют замещенные уретаны:R— N=C=0 + R'0H —> R— N—С=0I IН OR'Реакция этого типа (с гидроксильным производным нафталина)
была приведена на стр. 349.Ароматические уретаны — твердые вещества с характерными темпе¬
ратурами плавления.С водой изоцианаты гидролизуются и дают амины:R—N=C=0 + Н20 —» RNH2 + C02Именно этой реакцией впервые были получены амины (Вюрц).С аминами изоцианаты дают замещенные мочевины:R—N=C=0 + NH2R' —► RNH— С—NHR'IIОВ настоящее время приобрели важное промышленное значение ди¬
изоцианаты, которые можно получить из диаминов жирного или аро¬
матического ряда. С гликолями и другими двугидроксильными соеди¬
нениями они образуют высокомолекулярные полиуретаны:nO=C=N—R—N=C=0 + «НО—Q—ОН —>( У \—> 0=C=N—R— —N—С—О— — Q-OHV & LПолиуретаны, мировое производство которых достигло в 1970 г.
106 т, нашли применение в производстве высококачественных шин, пе-
нопластов разной степени упругости и жесткости, применяемых в про¬
изводстве мебели, автомобильных диванов, в качестве теплоизолирую¬
щих материалов и др.Имеется третий изомер циановой кислоты, известный только в виде
солей, — гремучая кислота. Она относится к циановой кислоте как изо¬
нитрил к нитрилу. Гремучая кислота имеет строение Н—О—N = C.
Углерод в ней находится в таком же валентном состоянии, как в изо¬
нитрилах и окиси углерода. Наиболее известна ее ртутная соль — гре¬
мучая ртуть, получаемая действием азотной кислоты на металлическую
УГОЛЬНАЯ КИСЛОТА И ЕЕ ПРОИЗВОДНЫЕ353ртуть в этиловом спирте:HN03 +HN02 sPсн3-сн2-он >- СНз—С. ГТТГ* 0=N—СН2-С, —►\н -»*° \но HNO3—* НО—N=CH—С —>- НО—N=CH— С^ ►4 н хон—► HO-N=C——Т* НО—N=CH —► НО—N=C: + HN02I \он ~с°2 I IN02 N02 |+Hg2+Hg(ONC)aГремучая ртуть и сейчас иногда применяется как инициирующее
взрывчатое вещество, хотя почти вытеснена азидами более дешевых
металлов.Роданистоводородная кислота Н—S—C = N сравнитльно устойчива.
Это нитрил монотиоугольной кислоты. Соли ее получают присоедине¬
нием серы к солям синильной кислоты:KCN + S —v к+ “S—C=NПри осторожном действии галоидов на роданиды можно получить
свободный родан, вернее, диродан (Зедербек)2KSCN + Вг2 —► Ы=С—S—S—Cs=N + 2КВгггсевдогалоид, имеющий многие черты сходства с галоидами. Так, ро¬
дан присоединяется по двойной связи:^С=С^ + (N=C-S-)2 —*/ \ /| |ЧNCS SCNСложные эфиры роданистоводородной кислоты получаются алкили-
рованием ее солей:KSCN + RI —► R—S-C=N + KIЭфиры роданистоводородной кислоты при восстановлении образуют
меркаптаны, а при окислении — сульфокислоты, чем доказывается их
строение:н -> R—SHR-S—C=N —о -> R-SO3HПри нагревании они изомеризуются в изотиоцианаты, аналогичные
по строению изоцианатам:R—S—C==N —> R—N=C=SИзотиоцианаты могут также быть получены реакцией, доказываю¬
щей их строение:hrso.2RNH2 + CS2R—N—С—S- I II
H s[R-NH3]R—N=C=S + H-jS -i- RNH3 HSOi
354IоксикислотыИзотиоцианаты называют горчичными маслами, так как один из
них, аллиловое горчичное масло (иахучее и острое начало горчицы),
является продуктом гидролиза содержащегося в семенах горчицы глю-
козида (стр. 414) синигрина. Синтетически аллиловое горчичное масло
можно получить следующим путем:СН2—СН—СН2С1 + KSCN —► СН2=СН—СН2—S—C=N + КС!|нагреваниеСН2=СН—СН2—N=C=SОКСИКИСЛОТЫ-ГОМОЛОГИ ГЛИКОЛЕВОИ кислотыЭти оксикислоты, содержащие гидроксил не в функциональной
группе, как угольная кислота, а в углеводородной цепи, являются уже
настоящими спирто-кислотами. Их названия производятся от названий
карбоновых кислот с приставкой окси, которой предшествует цифра,
обозначающая номер углеродного атома — носителя гидроксила (в же¬
невских названиях), или греческая буква, имеющая то же назначение
(а — первый от карбоксила углеродный атом, р — второй и т. д.). Фи¬
зические свойства и названия ряда монокарбоновых монооксикислот,
монокарбоновых полиоксикислот и поликарбоновых моно- и полиокси-
кислот приведены в табл. 41. Многие оксикислоты давно известны
(Шееле, последняя четверть XVIII столетия) как природные продукты,
тривиальные названия которых указывают на' их происхождение: мо¬
лочная, яблочная, винная, лимонная и т. д. Среди оксикислот так рас¬
пространено и важно явление стереоизомерии, что до систематического
рассмотрения их синтеза и свойств необходимо рассмотреть вопросы
стереохимии.СТЕРЕОХИМИЯ. ОПТИЧЕСКАЯ ИЗОМЕРИЯ. IМы уже встретились с изомерией структурно идентичных соедине¬
ний на примере геометрической изомерии (стр. 245, 315) соединений
с двойной связью типаR\/HСА ■R\/HС4н/ \rr/ \н1 транс-цис-Геометрическая изомерия — частный случай стереоизомерии. Дру¬
гим видом стереоизомерии является так называемая оптическая стерео¬
изомерия, впервые обнаруженная Пастером (1848 г.) на примере сте-
реоизомерных винных кислот и объясненная Вант-Гоффом и Ле-Белем
(1871 г.).Факты таковыД что вещества, имеющие предельный углеродный
атом, связанный с четырьмя разными замещающими группами (такой
атом называется асимметрическим), существуют в двух структурно оди¬
наковых стереоизомерных формах. Эти стереоизомеры одинаковы по
всем своим физическим и химическим свойствам и различаются лишь
в двух отношениях.1. Они кристаллизуются в кристаллических формах, не имеющих
плоскости симметрии и относящихся друг к другу, как предмет
к своему зеркальному изображеник>!|Именно это свойство и дало Пастеру
«35Saf«Оs’0о я
в а,ж ияза .
г** *£ 52
2 «г 1
£ С
« s
3*£*>*к£ 52
2 ^cj
&§Г£ яas ч*> и
нечaОa«?'оаКв><£>+Ct) wем <24+ I+ I** S-s
+ T?
1111
5- w-«I ZZ «о
1 I +осл1»1и»1Л|7 и?о| т2О| 72*> 2;1Л1Л05пХЛ«в g. в!rfСО— с ТСI I 1 I I1 т ^°2o
• •211»• __*• «»
-1» ао1ЛI Iсл«ГосеТ 91ft|2®ОMl.£§■оао с■ ** tJ * tjСЧ n 05 Мем еа — я— а —о.87в ч— fn§31сиева.ts£ «СО {Мw а> — ю 1Л
40 Г-00 *
окS *S3 лZ я
2 в*
5 оО t-£ О• а-J7QCJоЯвоо.ftвкеввзксаS3а,ок>о?саое-еасанЙвк5?SКрSоже;ьзокок*3е-SСЕЯ03к*. Й
5 §
!§.ксааокеаa9Ос;2 «
S»«Ч О* соосинVOS 5 31 К О
kJ и, S3сиеаН-iС)ев«аякя0Я(У£5КЕ « «" vk2 я в teя *"С яеа дCU С*2 ®S 3*О оЧ е2 40* кs-3 3к я
я яCl m S (игеа£КtfеаОS3взetРООа>еаО' ГОа>к\осаaквсакяооСПгО£St?Xо8киIоXXоосоон-соонXи1XX1ои-соон-сооно0
и1XXи-1ечX хонн—сн-но н1ои1иLXЕXечXо-1-О уО'1—оо1и -
1-ои11о1и1о1иLооооXXX ооооиV--о XXXX-126Iю1 1
осм8 8^2
_ — 4(N8*2 I I S Iw uo d.«—taосисаьгЯе-« ч. *гя 2 §в 5 2о о ** 5 8
о о г:ьг = 5*
S “ §
ч ,2 га
t_«a t-,QQQолеаX93оаолгамО-ОЖо0
оX g
а—ОX £
и-О1 ^О—окоо01X К|-°s_§X-оXи-X X
(J—ОЯ Xг°оооXПри 15 мм рт. ст. разл.
356оксикислотывозможность открыть явление оптической изомерии: при кристаллизации
виноградной кислоты он визуально обнаружил наличие двух типов
кристаллов и, разделив их с помощью пинцета, выделил чистые стерео-
изомерные винные кислоты.2. Оба стереоизомера по-разному относятся к поляризованному
свету."В луче света колебания электрического и магнитного векторов про¬
исходят, как известно, в плоскостях, взаимно перпендикулярных и пер¬
пендикулярных также к направлению луча. В поляризованном луче
света колебания электрического и магнитного векторов совершаются
для каждого в фиксированной плоскости, а не в хаотически меняющихся
взаимно перпендикулярных плоскостях.г'При прохождении луча поля¬
ризованного света через «оптически активную» среду плоскость поля¬
ризации света поворачивается (вокруг оси луча) на угол, пропорцио¬
нальный длине слоя оптически активного вещества.! В кристалле опти¬
ческая активность может зависеть от асимметрии его строения (таковы,
например, левовращающие и правовращающие модификации кварца
БЮг). В жидкой и газообразной фазах единственной причиной вращения
плоскости поляризации света может быть асимметрия молекулы£_Сте-
реоизомеры антиподы вращают плоскость поляризации на один и тот
же угол в разные стороны (влево и вправо)^]при равных условиях —
одинаковой концентрации раствора, в одинаковом растворителе, при
одинаковой длине волны и длине пути луча. Углы вращения плоскости
поляризации измеряются посредством поляриметра.Причина оптической стереоизомерии связана с расположением че¬
тырех разных замещающих групп, связанных с углеродом в первом
валентном состоянии, т. е. с предельным углеродом, по вершинам тет¬
раэдра (расположение атомов в пространстве, ведущее к наличию сте¬
реоизомерии, называется конфигурацией). Такая геометрическая фи¬
гура не' имеет плоскости симметрии (плоскости, режущей предмет на
две зеркально подобные половинки). Отражение в зеркале всякого
предмета, не имеющего плоскости симметрии, не тождественно пред¬
мету, а представляет собой его зеркальный антипод (энантиомер). Так,
отражение человеческой фигуры в зеркале не тождественно ориги¬
налу, это отражение — левша. Левая сторона человека в отражении
предстает как правая, и наоборот. Таким же образом и отражение асим¬
метричной молекулы имеет иное, антиподное расположение замещаю¬щих групп вокруг асимметрического углеродасзеркалоа илиа—с-~сЬ\с—С—а
У
dзеркааоВместо выражений асимметрическая молекула, асимметрический атом в послед¬
нее время предпочитают применять термин хиральиая молекула, хиралъный атом,
чтобы слово «асимметрический» ие привело к недоразумению, как якобы требование
отсутствия любых элементов симметрии в молекуле.Следует обратить внимание на то, что в каждой из энантиомерных
молекул замещающие группы находятся друг по отношению к другу
на одинаковом расстоянии, и влияние их друг на друга поэтому оди¬
наково. Отсюда тождество физико-химических свойств. Легко видеть,* В таких перспективных изображениях молекулы толстый конец линии валент¬
ности поднимается над плоскостью рисунка, а тонкий — направлен на эту плоскость.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ. I357особенно на модели *, что перемена местами любых двух заместителей
у асимметрического углеродного атома ведет к инверсии — образованию
антиподной (энантиомерной) конфигурации:ь d ьа—С~с J2SE2S+. а == с—С—аJ I. iМы уже встречались с веществами, содержащими асимметрический
углеродный атом. Это были, например, нормальный вторичный бутило¬
вый спирт (бутанол-2) и «активный» амиловый спирт брожения (2-ме-
тилбутанол-1):C2HS4 /ОН сан5ч уСН2ОНХ(Г ССНз^ '''И сн/ ХНбутанол-2 2-метилбутаиол-1Во всех подобных случаях возможно двоякое расположение заме¬
стителей вокруг асимметрического углерода: «левая* и «правая» кон¬
фигурации. Амиловый спирт брожения указанной выше структуры, на¬
пример, оптически активен и вращает плоскость поляризации влево. Его
удельное вращение [а]о =—5,90°.[При синтезах, в которых возникает (первый) асимметрический угле¬
родный атом в молекуле, равна вероятность образования левой и пра¬
вой конфигураций, и получается равное количество молекул обеих кон-
фигураций/ТГакая смесь, естественно, не вращает плоскости поляриза¬
ции, она «оптически неактивна». Например, асимметрия атома углерода,
прежде бывшего карбонильным, возникает в акте присоединения
гриньярова реактива к альдегиду:OMgl ОНI H2o |C2H5-Cf + CH3MgI —> с2н5-с-н >- С2Н6—С—н\н I IСНЭ СНзПоскольку метил присоединяется к плоскому (углерод во втором
валентном состоянии) фрагменту молекулы С—С—Н, то когда он при-Осоединяется сверху от плоскости рисунка, получается одна конфигура¬
ция, а когда снизу — другая, причем оба варианта равновероятны.£ Эквимолекулярная смесь двух антиподов всегда способна образо¬
вать (в определенном температурном интервале) кристаллы, в которых,
строго чередуясь, упакованы молекулы левой и правой конфигураций.
Такие кристаллы по свойствам отличаются от кристаллов одной левой
или одной правой конфигураций. Эти кристаллы называются рацематом
или рацемическим соединением^ Очевидно, что они не представляют са¬
мостоятельной конфигурацииГ*Однако поскольку при упаковке в кри¬
сталл только левых или только правых молекул расстояния между
любой парой групп в соседних молекулах будут одни, а при упаковке
левых и правых вместе расстояния между теми же группами неизбежно* Такую модель можно сделать из шариков мятого черного хлеба и спичек
358оксикислоты(±1-форма(+)-формабудут иными, то и силы, связывающие молекулы в кристалле, будут
разными для рацемата, с одной стороны, и для левой или правой кон¬
фигурации— с другой. Поэтому рацемат плавится при иной темпера¬
туре (выше или ниже), чем левая и правая формы, его растворимость
иная, его кристаллы отличаются большей симметрией (например, на¬
личием плоскости симметрии) и т. д. *Типичные диаграммы температур плавления для рацематов, левых
(—)- и правых (+)-форм и их смесей приведены на рис. 53.Вне температурных пределов существования рацемата из растворов
выкристаллизовываются порознь кристаллы левой и правой • формыJН-форт (опыт Пастера с разделе-
-М-форма нием кристаллов пинцетом).Устойчивость конфигу¬
раций для разных соедине¬
ний очень различна, но в об¬
щем конфигурация не менее
устойчива, чем структура.Процесс превращения
одного энантиомера в дру¬
гой называется рацемиза~
цией, поскольку в- условиях
превращения, например, ле¬
вовращающего энантиомера
в правовращающий, конечно, и последний превращается опять в >лево-
вращающую форму и по достижении рацемической смеси наступает рав¬
новесие. Легче рацемизуются соединения, имеющие асимметрический
атом углерода в a-положении к карбонилу, карбоксилу и вообще к элек-
трофильному заместителю, при условии, что асимметрический углерод
несет атом водорода. Объясняется это протонизацией водорода. Поэтому,
в частности, а-оксикислоты рацемизуются относительно легко при кипя¬
чении со щелочами;'100% М-формяО
0(-)-форма—
а100% (i) -форма О
0(-)-форма -*~100°/о
6Рис. 53. Диаграммы температур плавления ра¬
цематов:о —кривая с максимумом температуры плавления;
б —кривая с минимумом температуры плавления.нГН-Г г^°СН3 у~с\ _ +=±он ^нооонСН,Г-С-С' _А- °сгH3CV=r-'
но Ч)+ онHgCLКакие же конфигурации вращают плоскость поляризации вправо
и какие влево? На этот вопрос нельзя дать общего ответа уже потому,
что некоторые вещества меняют знак вращения при перемене раство¬
рителя, а иногда даже при изменении концентрации раствора.Для каждой данной пары антиподов совершенно законен вопрос об
их абсолютной конфигурации, однако химическими методами можно
установить лишь относительную конфигурацию, т. е. установить серию
веществ одной конфигурации путем химического превращения одних
веществ этой серии в другие. При этом нельзя затрагивать химические
связи с асимметрическим углеродом, так как это часто связано с изме¬
нением конфигурации в энантиомерную (см. вальденовское обращение,
стр. 369). Однако достаточно установить абсолютную конфигурацию
для любого вещества серии, как для всех этих веществ станут известны
их абсолютные конфигурации. Такие опорные определения абсолютных
конфигураций сделаны путем рентгеноструктурного анализа кристал¬
ОПТИЧЕСКАЯ ИЗОМЕРИЯ. Iлов, так что абсолютные конфигурации многих стереомерных веществ
теперь известны. До того как это стало возможным, довольствовались
условно (наугад) принятой конфигурацией одного из таких опорных
веществ — глицеринового альдегида. Догадка оказалась верной.Фишеровские проекции. Для того чтобы выяснить отноше¬
ния между относительной и абсолютной конфигурацией, необходимо
сначала ознакомиться с изображением на плоскости (в двух,измере¬
ниях) стереохимических формул, которые имеют пространственный
смысл (три измерения). Приводим два способа изображения. Слева
(формула 1а и 16)— это, по существу, перспективный рисунок, который
мало применим для случаев с многими асимметрическими атомами,
справа — проекционные формулы Фишера (Па и 116):н
iс»-с— dть1а\взеркалоЬПегЬII взеркалоОбе пары формул соответствуют друг другу. В формулах 1а и 16
знаки связей, направленные острием к углероду, изображают связи,
торчащие сверху плоскости чертежа, а направленные острием к заме¬
стителю— под плоскостью. В фишеровской проекции пространственная
модель молекулы располагается над плоскостью проекции, и так, что
по вертикали проекции располагаются заместители, связанные нисхо¬
дящими валентными связями, а по горизонтали — восходящими, как это
и показывает соответствие изображений Iа—Па и Iб—116. Чтобы по¬
казать, что дело идет о проекционной формуле, символ углерода С в ме¬
стоположении асимметрического углерода обычно опускают (это пра¬
вило не всегда соблюдается), подразумевая его на пересечении гори¬
зонтальной и вертикальной линий.При пользовании фишеровскими моделями требуется знать некото¬
рые правила обращения с ними.1. Фишеровские модели нельзя выводить из плоскости. Поворот
на 180° с выводом из плоскости проекции Фишера приводит к проекции
антипода:2. Фишеровские формулы можно поворачивать в плоскости только
на 180°.3. В фишеровских моделях можно поменять местами по часовой
стрелке или против часовой стрелки три заместителя у одного и того
же углеродного асимметрического атома.4. Перемена местами в фишеровской формуле двух любых замести¬
телей (и значит, любое нечетное число таких перемен), как и в реальной
молекуле, приводит к формуле антипода. Четное же число таких пере¬
мещений не меняет значения формулы. Это правило одинаково для
пространственных моделей ц проекционных формул.
360оксикислотыНедоумение может вызвать лишь правило 2. Поэтому поясним его:
повернем исходную проекцию на 90°, что запрещено правилом 2, и из
проекции I получим проекцию II:Теперь поменяем местами в новой проекции II заместители а и d
(проекция III); произведем затем новую перестановку бис (проек¬
ция IV) и, наконец, поменяем местами с и b (проекция V);с1ПdIVdVТаким образом, путем нечетного (трехкратного) числа парных пере¬
мещений мы вернулись к исходной конфигурации. Между тем, если бы
конфигурация II была идентична с I, мы должны были бы прийти
к энантиомерной конфигурации (правило. 4). Следовательно, проек¬
ция II есть проекция энантиомерная (антиподная I) и поворот на 90°
меняет конфигурацию. Естественно, что поворот на 180° (в плоскости
чертежа) оставляет конфигурацию ненарушенной.ОТНОСИТЕЛЬНАЯ И АБСОЛЮТНАЯ КОНФИГУРАЦИИВозвращаемся к вопросу об относительной и абсолютной конфигу¬
рации. Гораздо более важным является первый вопрос. По предложению
М. А. Розанова и Воля стандартом для установления относительной
конфигурации выбран глицериновый альдегид СНгОН—СНОН—СНО.
По предложению Фишера правовращающему (что обозначается зна¬
ком + ) глицериновому альдегиду была приписана конфигурацияН\н-онСНгОНВажно было установить соотношение конфигурации этого веще¬
ства с другими опорными веществами: ( + )- и (—)-яблочной кисло¬
той НООС—СНОН—СН2—СООН и ( + )- и (—)-винной кислотой
НООС—СНОН—СНОН—СООН. Посредством циангидринового синтеза
(стр. 129) ( + )-глицериновый альдерид превращается, как показывает
опыт, в смесь нитрилов (—)-винной кислоты и так называемой мезовин-
ной кислоты, недеятельной вследствие симметрии молекулы, которая
ОПТИЧЕСКАЯ ИЗОМЕРИЯ. I361будет рассмотрена ниже. После гидролиза нитрилов и окисления
СН2ОН-группы образуются и сами названные кислоты:КН-ОCN-ОН + HCNНО—Н—СН2ОН
(+)-глицериновый альдегидНОН
СН2ОН
|гн20СООН+CNОН
ОН
СН2ОН
|2н2°СООННО-н-—н
—онн-н—соон(—)-вннная
кислота-онон
СООНмезовиннаякислотаТем самым устанавливаются относительные конфигурации ( + )-гли-
церинового альдегида и (—)-винной кислоты*. Поскольку при вос¬
становлении ( + )-винной кислоты посредством HI образуется (+)-яб¬
лочная кислота, то этим путем; устанавливается и относительная кон¬
фигурация этих кислот:СООНСООНн—он-—он
—нHIсоон(+)-виннаякислота■ идентичнын—онсн2
Iсоон
соон
<!:н8
но—н
соон<+)-яблочная кислотаНеобходимо заметить, что во всех этих превращениях не затраги¬
ваются связи с асимметрическим атомом углерода (тем, о конфигура¬
ции которого мы судим).Относительные конфигурации других соединений устанавливаются
подобным образом применительно к одному из трех указанных опорных
соединений.Для рубидиевой соли обеих деятельных винных кислот удалось пу¬
тем рентгеноструктурного исследования установить и абсолютную кон¬
фигурацию и, следовательно, абсолютные конфигурации всех веществ,
относительные конфигурации которых по отношению к винным кисло¬
там были известны, в том числе и конфигурацию глицериновых альде¬
гидов. Догадка Фишера (за которую, так же как и против нее, было
50 шансов из 100) оказалась правильной!Знаки ( + ) и (—) обозначают, как сказано, направление враще¬
ния плоскости поляризации. В более старой литературе для этого* Именно эта кислота содержится в виноградном соке и в «винном камне» —
кислой калиевой соли, выпадающей в винных бочках.
362оксикислотыупотреблялись знаки d (dexter) — для правовращающих формы и I
(laevus) — для левовращающих. Затем значение этих буквенных обозна¬
чений изменилось. Буквой D обозначают, независимо от знака враще¬
ния, ту же относительную конфигурацию, что у ( + )-глицеринового аль¬
дегида, а буквой L — энантиомерную конфигурацию. Таким образом,
буквы D и L — это «фамильные» признаки.Если за родоначальное соединение принять ( + )-D-глицериновый
альдегид, то установленная выше серия превращений, связывающая его
с (—)-винной и (—)-яблочной кислотами, должна была бы заставить
придать этим соединениям знаки D. Такая условность была бы неудоб¬
ной, так как по крайней мере для родоначальных соединений важно
было бы сохранить единство обозначения и по знаку вращения, и по
«фамильному» признаку. Это соответствовало бы и тому, что историче¬
ски уже привычно (-f)-винную кислоту обозначать как D-винную и
(+) -яблочную как D-яблочную. Между тем «фамильные связи» и со¬
ответствующие обозначения через D и I имеют большое значение (и
устойчивость) в длинных сериях однотипных веществ, связанных друг
с другом однотипными же переходами. С таким случаем мы познако¬
мимся на примере сахаров и там увидим пользу обозначений D и L
независимо от знака вращения.Известную условность этих обозначений можно продемонстрировать,
установив, например, генетическую связь ( + )-винной кислоты, но не с
(—)-, а с ( + )-глицериновым альдегидом:н\ /°ссоонсооно0HCN Н——онн—-ОН —■»н—-он —►н—-он >-н—+X01но—СН2ОНсн2онснон-(+)-глицериновыйальдегидсоон соон
-он
—нCN CNJ2H*o
СООНн—он
но—н
соон(-Н'ВиннаякислотаТаким образом, на этот раз ( + )-винную кислоту надо обозначать
как £>-винную, а ( + )-яблочную, за ее генетическую связь с (+)-вин¬
ной, необходимо считать D-яблочной. Это последнее обозначение, соот¬
ветствующее исторической традиции, и выбирается.Указанная только что условность заставила в некоторых случаях
для большей определенности применять знаки D и L с индексами, на¬
пример Da, £)r, Ds (то же и для L), где G обозначает глицериновый
альдегид, R — молочную кислоту, S — оксиаминокислоту серин. Таким
образом, знак Ls обозначает, что конфигурация та же, что у левовра¬
щающего серина (стр. 456).Итак, любые знаки D и L выражают лишь конфигурацию, относи¬
тельную к тому или иному опорному соединению. Между тем, поскольку
теперь можно всякую относительную конфигурацию довести до абсолют¬
ной, следует условиться о таком обозначении абсолютной конфигура¬
ции, которое было бы лишено некоторой неопределенности, свойствен¬
ной обозначениям D и L, разъясненной'выше. Такой способ рбозначе-
оптическая ИЗОМЕРИЯ. I363ния введен в науку Каном, Инголдом и Прелогом. Вот его сущность:
четыре атома, непосредственно связанных с асимметрическим, распола¬
гаются в порядке своих убывающих атомных номеров, например для
CHClBrI в порядке I > Вг > Cl > Н, и молекула располагается так,
чтобы в сторону, противоположную глазу наблюдателя, смотрел атом
с наименьшим атомным номером, в данном примере Н:С1ч Вгч<£ вг--с-н ci-c-HI IА вОстальные три заместителя могут быть расположены & молекуле
так, что их атомные номера убывают по часовой стрелке (с точки зре¬
ния глаза наблюдателя), как в случае А; такая конфигурация обозна¬
чается буквой R. Если же атомные номера указанных заместителей убы¬
вают против часовой стрелки (Б), это конфигурация S (sinister —
левый).Если атомы, непосредственно связанные с асимметрическим угле¬
родом, одинаковы (например, два, или три, или все четыре являются
атомами углерода), то вопрос о «старшинстве» решается уже непосред¬
ственно связанными с ними атомами — «атомами второго слоя», именно
суммой атомных номеров последних, причем для двоесвязных атомов
«второго слоя» атомный номер удваивается. Так, карбонильный кисло¬
род считается за 16, а не за 8, как гидроксильный. Поясним это на при¬
мере глицеринового альдегида. 'скнои' \ \< но-с-н с-н
/ н /
нон2с нон2сЯ S,Здесь «цена» групп второго слоя следующая: СН2ОН = 8 + 1 +'
+ 1 — 10, СНО = 16-}- 1 = 17, а все заместители вокруг асимметриче¬
ского атома идут, следовательно, в таком порядке убывающего стар¬
шинства: ОН (8 по кислороду первого слоя) > СНО (6 по первому
слою, 17 по второму) > СН2ОН (6 по первому слою, 10 по второму)
> Н (1 по первому слою).Таким образом, конфигурация глицеринового альдегида на левой
формуле есть /^-конфигурация, а энантиомерная (справа) представляет
собой S-конфигурацию. Легко видеть, что на фишеровской проекции
^-конфигурация изобразится какСНОН-~ОНт. е. в данном опорном соединении обозначения R и D (и соответствен¬
но S и L у антипода) совпадают *.Конечно, такое совпадение неслучайное, правила Кана — Ингол-
да — Прелога именно так и выбраны, чтобы это совпадение на опорном* Надо помнить, что при проектировании молекулы по Фишеру верхний и ниж¬
ний атомы, связанные с асимметрическим, должны быть повернуты за плоскость
рисунка, а остальные два, проем ируемые на горизонтальную линию, должны быть
расположены над плоскостью рисунка.
364оксикислотысоединении получилось. Совершенно ясно, что совпадение или несов¬
падение знаков R и D (и соответственно S и L) для всех других соеди¬
нений— дело случая. Таким образом, символы R и 5, приобретая смысл
обозначения абсолютной конфигурации, утрачивают значение «фа¬
мильного» обозначения. Поскольку обычно «фамильный» признак ва¬
жен, символы D и L сохраняют употребление.А. П. Терентьев, В. М. Потапов, А. М. Цукерман и А. Н. Кост разработали
иную систему обозначения абсолютной конфигурации, которая может быть связана
с любой системой номенклатуры, например с женевской или тривиальной. По этой
системе антиподные конфигурации обозначаются греческими буквами р и а. Выписы¬
вают проекционную фишеровскую формулу, располагая вертикально главную цепь и
используя обычный порядок нумерации атомов. Асимметрический атом углерода,
таким образом, получает свой номер п. Если * слева от него располагается замести¬
тель X (а справа заместитель Y), то вещество обозначается как яр-Х-[наименование
вещества] или гго-У-[наименование вещества]. Оба наименования равноправны. Анти¬
поды этих веществ соответственно па-Х-[наименование вещества] и ^^-[наименова¬
ние вещества]. Пример пояснит сказанное:З-бром-Зр-метилпентановая кислота
илиЗсг-бром-З-метилпентановая кислота
илиЗо-бромвалериаиовая кислота5СН3
' 4СН0СН3-^-Вг2СН2liooHСОЕДИНЕНИЯ С ДВУМЯ АСИММЕТРИЧЕСКИМИ
УГЛЕРОДНЫМИ АТОМАМИ. ДИАСТЕРЕОМЕРИЯДо сих пор мы рассматривали стереохимию соединений с одним
асимметрическим углеродным атомом. Исключение представляли вин¬
ные кислоты, содержащие два таких атома, но мы не фиксировали
внимания на этом обстоятельстве. Переходим к рассмотрению соедине¬
ний с двумя и более асимметрическими углеродами. Легко прийти
к выводу, что число стереоизомеров (не считая рацематов) при двух
асимметрических углеродных атомах возрастает до четырех, а при п
асимметрических атомах до 2П. Возьмем в качестве примера веществ
с двумя асимметрическими атомами хлоряблочные (оксихлорянтарные)
кислоты и выпишем все возможные их конфигурации:НО-соонс—нн——нн—соонсСООНОНС1ЮН
IIн-С1-соонс-—онно-нн—соонсIIIсоон
—н—С1IVзеркалозеркалоВсе четыре вещества оптически деятельны, поскольку молекулы (и
проекции) не имеют плоскости симметрии (в проекциях плоскость
рисунка по понятной причине не считается плоскостью симметрии). Они
попарно (1 и II; III и IV) являются энантиомерами (антиподами), л
к этим парам применимо все сказанное раньше. Новым является отно¬
шение I к III и 1 к IV или II к III и II к IV. Это новое заключается* Предполагается, что наблюдатель смотрит вдоль главной цепи от начала ее
нумерации.
СОЕДИНЕНИЯ С ДВУМЯ АСИММЕТРИЧЕСКИМИ УГЛЕРОДАМИ365в том, что эти пары не являются антиподами, но они и не тождествен¬
ны, а стереоизомерны друг к другу. Такие не энантиомерные (не зер¬
кальные) стереоизомеры называются диастереомерами. В отличие от
двух энантиомеров два диастереомера отнюдь не тождественны по
свойствам, а имеют разные физико-химические характеристики. Это
понятно, так как в диастереомерах замещающие группы не могут при¬
нять такое расположение, чтобы все заместители оказались в обоих
соединениях на одинаковом расстоянии друг от друга. А раз расстоя¬
ния разные, то и взаимное влияние будет разным, отсюда и разница
в константах.Важный частный случай — одинаковость заместителей вокруг обоих
асимметрических углеродных атомов. Продемонстрируем это на клас¬
сическом примере винных (диоксиянтарных) кислот:СООННО-Н--НСООНн-онСООН■но--онн--н
соонVIн-соонс-онно——онно-соонссоон
н-нVIIVIIIПри взгляде на формулы V—VIII видно, что и V и VI — антиподы,
а VII и VIII — идентичные конфигурации, так как при повороте про¬
екции VIII на 180° в плоскости рисунка она превращается в проекцию
VII. Таким образом, одна из четырех конфигураций (22 = 4) выпадает
и остаются три : два антипода (—)-£-винная (V), (+)-й-винная (VI)
и их диастереомер — мезовинная кислота. Конфигурация обоих асим¬
метрических атомов в (—)-L-винной кислоте (V) одинакова; то же
в (+)-/)-винной кислоте (VI). Действительно, если мы разрежем зер¬
калом (пунктир) проекции V и VI, то констатируем, что нижняя поло¬
вина не является зеркальным изображением верхней. Значит, поло¬
винки идентичны, так как никакой третьей возможности нет. Можно
выразиться так, что (—)-1-винная кислота имеет лево-левую конфигу¬
рацию, а (+)-£>-винная — право-правую. Иную картину представляет
проекция VII. Зеркало, поставленное перпендикулярно к плоскости
проекции углеродного скелета, режет ее на взаимные зеркальные изо¬
бражения. Таким образом, это лево-правая конфигурация. Молекула
симметрична (плоскость зеркала и есть плоскость симметрии), и ее
зеркальное изображение (проекция VIII) тождественно с предметом.
Поэтому мезовинная кислота (VIII) оптически недеятельна. Такие сим¬
метричные молекулы, имеющие асимметрические атомы, которые не¬
деятельны благодаря «внутренней компенсации», называются по ме-
зовинной кислоте мезо-формами.' Позднее при рассмотрении стерео¬
химии сахаров мы увидим, что эти мезо-формы служат опорными при
установлении конфигурации соединений с многими асимметрическими
углеродами.В табл. 42 приведены свойства винных кислот: двух антиподов —
левой и правой, их рацемата — виноградной и мезовинной кислоты.
Как видно, разница в свойствах диастереомеров настолько значительна,
что они могут быть без труда разделены в случае нахождения их
в смеси.Рацемическая винная кислота (виноградная кислота) получается
продолжительным нагреванием с водой D- или L-винной кислоты
(рацемизация, стр. 358). При этом возникает и мезовинная кислота,
366оксикислотыТаблица 42. Вииные, винограднаи и мезовиннаи кислотыТемпера¬тураКонстантадиссоциа-ФормулаТемпера¬туракипения,ции в воде при 25 °Сi<4°Названиеплавле¬в воде*ния,“С°СSЧградусыН-но-соон
он
нсоонсоонно—н—-н-онн-н-н-но-соон
соон-он-онсоон
соон-он-нcqoh
соонно—н—н
—он
соонD-Винная
кислотаL-ВиннаякислотаМезовиниая(безводная)Виноградная,
или рацеми¬
ческая винная170140205Разл.1,1 • 10"6,9 • Ю"+ 12-126,0-10"1,53-10"1,20- Ю"4,0-10"а нагреванием со слабой щелочью можно любую из винных кислот пре¬
вратить в мезовинную. В этом случае рацемизация затрагивает один
из асимметрических углеродных атомов.Разделение антиподов. Но как отделить друг от друга два анти¬
пода, которые всегда возникают при синтезе в равных количествах и
которые идентичны по температурам кипения и плавления, раствори¬
мости и всем иным свойствам, служащим основой для .разделения
веществ? Мы уже говорили, что самый примитивный путь для этого
впервые применил Пастер, отобравший пинцетом левые и правые кри¬
сталлы D- и L-винных кислот, выкристаллизовавшиеся порознь при
температуре вне пределов существования рацемата.Второй способ заключается в том, что во многих случаях микроорга¬
низмы способны потреблять один из двух антиподов, оставляя другой
нетронутым. Такими микроорганизмами являются, например, разные
виды плесеней. Однако, во-первых, не всякое вещество «съедобно» для
микроорганизмов, во-вторых, при таком способе один из энантиомеров
пропадает,
СОЕДИНЕНИЯ С ДВУМЯ АСИММЕТРИЧЕСКИМИ УГЛЕРОДАМИ367Универсальный и обычно используемый способ разделения (часто
называемого расщеплением) на антиподы состоит в том, что рацемат
(или рацемическую смесь) вводят в реакцию с оптически активной
формой (одной только левой или правой) какого-либо соединения, спо¬
собного взаимодействовать с подлежащим разделению веществом. Та¬
кое оптически активное вспомогательное вещество берут обычно из при¬
родного источника. Для разделения рацематов аминов (или иных осно¬
ваний) и спиртов может быть, например, применена природная (из вин¬
ного камня) D-винная кислота. Амины образуют с ней соли, спирты —
эфиры. Для разделения рацематов кислот используют обычно алкалои¬
ды, такие, как хинин или стрихнин, добываемые из растений и нахо¬
дящиеся там в оптически активной форме. Рацемическая смесь обра¬
зует при этом две диастереомерные формы производного с оптически
активным реагентом. Если мы обозначим буквами JI и П антиподы
разделяемого соединения, а буквой JV оптически активный реагент, то
оба производных (соли, эфиры и т. п.) будут иметь символыЛ и П
Л' Л'т. е. будут диастереомерами, отличными друг от друга по физико-хими¬
ческим свойствам, например по растворимости, и их можно разделить
одним из обычных путей, например кристаллизацией. После этого вспо¬
могательный оптически активный реагент удаляют из молекулы (если
диастереомер — соль, действуют кислотой или щелочью, если это слож¬
ный эфир, его гидролизуют) и выделяют чистые формы энантиомеров.В последнее время антиподы начали разделять и без превращения
их в диастереомеры, используя адсорбцию на природных асимметриче¬
ских материалах, или применяя оптически активный растворитель. Так,
например, удается разделить антиподы методом газожидкостной хро¬
матографии, используя в качестве подвижной фазы эфиры оптически
активных спиртов.Наконец, разделение может быть основано на том, что из пересы¬
щенного раствора рацемата при добавке затравки одного из антиподов
выкристаллизовывается именно этот антипод.Предложен еще и такой метод, имеющий, правда, ограниченное при¬
менение: мочевина, с ее симметричной молекулой, кристаллизуется
в двух энантиоморфных формах кристаллов (как и кварц). Мы уже
упоминали о клатратных соединениях мочевины с предельными нор¬
мальными углеводородами, которые заполняют пустоты в кристаллах
мочевины. Используя кристаллы мочевины левой и правой формы,
можно отделить энантиомеры углеводородов, при условии, что эти угле¬
водороды или их производные способны образовать клатратные соеди¬
нения с мочевиной, т. е. их молекулы по габаритам близки к нормаль¬
ным углеводородам. Таким путем Е. И. Клабуновский, В. В. Патрикеев
и А. А. Баландин разделили на антиподы 3-метилоктан и 3-метилнонан.Асимметрический синтез. Поскольку синтез в лаборатории всегда
дает рацемическую смесь, возникает вопрос, откуда в живой природе
возникли чистые энантиомерные формы? Чтобы ответить на этот воп¬
рос, надо вспомнить, что все катализаторы живой природы — ферменты
или, что то же самое, энзимы, с помощью которых осуществляется бук¬
вально каждая биохимическая реакция, — сложные асимметрические
молекулы. Поэтому промежуточно возникающие реакционные ком¬
плексы реагирующей молекулы с катализатором (ферментом) имеют
характер диастереомеров. Именно этим объясняется тот факт, что дей¬
ствие ферментов избирательное и они синтезируют строго только один
из двух возможных энантиомеров.
368ОКСИКИСЛОТЫМарквальд и Маккензи, нагревая кислую соль метилэтилмалоновой
кислоты с алкалоидом бруцином (чистый природный энантиомер) до
отщепления карбоксила, создавали асимметрический углерод:хОН ■ Бруцинс2н6Ч /НС + Бруцин-HC1сн/ хс;ХОНПри этом в продукте реакции несколько преобладал энантиомер
метилэтилуксусной кислоты с левым вращением. Разница заключается
в том, что действие ферментов гораздо специфичнее. Тогда поставлен¬
ный ранее вопрос принимает такую форму: как же впервые появились
в природе, живой или минеральной, разделенные энантиомеры?На этот вопрос дают ответ опыты по так называемому асимметриче¬
скому синтезу. В природе есть два асимметрических фактора, способ¬
ных оказывать химическое действие. Во-первых, это поляризованные по
кругу лучи света. Известно, что при отражении от поверхностей (на¬
пример, от воды) свет поляризуется частично, а при определенном угле
падения — полностью. Может ли поляризованный свет вызывать хими¬
ческие превращения, ведущие к получению одного из энантиомеров?
Чешский ученый Бык пришел к выводу, что это возможно. В. Кун и
Браун, разлагая поляризованным (по кругу) светом этил-а-бромпро-
пионат, осуществили асимметрический синтез и получили, правда очень
небольшое, преобладание право- или левовращающего изомера (в за¬
висимости от направления круговой поляризации света). Тенн и Аккер¬
ман также при освещении правополяризованным по кругу светом дей¬
ствовали перекисью водорода на эфир фумаровой кислоты и получали
винную кислоту с небольшим преобладанием D-энантиомера (удельное
вращение [аЬ = +0,073°). Таким образом была доказана возможность
фотохимического синтеза энантиомеров.Во-вторых, в природе имеются энантиоморфные формы кристаллов,
например кварца. Швабу удалось, нанеся никель на кристаллы кварца
одной модификации, дегидрировать нормальный вторичный бутиловый
спирт в метилэтилкетон так, что в остатке преобладал один из энантио¬
меров исходного бутанола, правда преобладание это и тут было не¬
велико и выражалось лишь небольшой оптической активностью смеси
([а]о = +0,13°). А. П. Терентьев и Е. И. Клабуновский, нанеся щелочь
на кристаллы правого кварца, провели цианэтилирование (стр. 307)
метилциклогексанона на этом катализаторе. Получилась оптически
активная смесь с небольшим преобладанием правовращающего нитрила.
Таким образом, и возможность первичного синтеза с преобладанием
одного из энантиомеров на асимметрических кристаллах как катализа¬
торах тоже доказана.Никелем Ренея, полученным обработкой сплава Ni/Na водой, содер¬
жащей оптически активную кислоту, например ^-яблочную, можно, со-
СОЕДИНЕНИЯ С ДВУМЯ АСИММЕТРИЧЕСКИМИ УГЛЕРОДАМИ369гласно Ицуми, прогидрировать ацетоуксусный эфир в оптически дея¬
тельный эфир р-оксимасляной кислоты с оптическим выходом 27%:СН3—С—СН2—С—ОС2Н5 —► СН,-СН—СН2—С—ОС,Н5II II 'I II0 0 он оИнтересно проследить взаимоотношение цис-транс-изомеров и опти¬
ческих изомеров. Его можно проиллюстрировать па отношении малеи-
новой и фумаровой кислот к винным. Оказывается, при окислении
перманганатом в воде (по Вагнеру) фумаровая кислота образует раце¬
мическую смесь левой и правой винных кислот, а малеиновая — мезо-
винную кислоту:НчНООС/.СООНсоонсIIсНгО; Онно-чнНч,соон-он но—
+-н н—
соон
соонсоон
н
он
соонНг0; Он/ \н-нсоонон
он
соонВ среде оптически активных простых эфиров ахиральный (диссим-
метричный) гриньяров реактив присоединяется к ахиральным оксо-
соединениям с образованием оптически активных хиральных спиртов
с оптическим выходом до 70%.Течение процессов становится ясным при взгляде на формулы, а еще
лучше — на модели. Однако только окисление по Вагнеру проходит
в цис-положение и может служить методом отличия г<ис-изомеров от
транс-изомеров по оптической деятельности продукта присоединения
(конечно, после разделения рацемата на антиподы) или недеятель-
ности и нерасщепляемости продукта реакции на антиподы. Другие
присоединения по л-связи, например присоединение молекулы брома,
проходят, наоборот, в транс-положение. Чтобы понять это, необходимо
познакомиться с так называемым вальденовским обращением (или
оптической инверсией), явлением, открытым Вальденом в 1896 г.
в Риге.Вальденовское обращение. Смысл явления состоит в том, что ну¬
клеофильное замещение типа SN2 у асимметрического углеродного
атома, где это легко обнаружить, а на деле у всякого предельного угле¬
родного атома, протекает с обращением конфигурации. Пример валь-
деновского обращения:COO” соо~А 1НО + СН3— С—CI —>■ НО—С^СНз + С1Н НОднако на таком примере вальденовское обращение можно было
бы открыть, зная абсолютные конфигурации веществ, а в 1896 г.13 Зак. 8S2
370оксикислотырентгеноструктурный анализ еще не существовал. Вальден же устано¬
вил наличие оптической инверсии на следующих циклах превращений:соонн-С1
СН2iooHI(+)-£-хлор-янтарнаякислотаkoh||pci5СООНAgOH у.н-СООН—онСНа
IСООНи(+)-С-*блочнаякислотаkoh||pci5СООННО Н AgOH Cl—ч СН2СООНIV(—)-£-яблочная
кислотанСН2(!:оонш(-)-L-хлор-
янтарная
кислотаАбсолютные конфигурации Вальдену не были известны, он наблю¬
дал лишь знаки вращения, но и так факт одного обращения конфигу¬
рации на пути I-*II-»III или IIIV был ясен, так как двумя
операциями из (+)-хлорянтарной кислоты I в первом случае или из
(+)-яблочной кислоты II во втором получился их антипод. Значит,
одна операция проходила с обращением, другая — без обращения.Точнее говоря, согласно гипотезе Хьюза и Уинстейна, последняя реакция про¬
текает с двойным обращением:СООНН-—С1AgOH1 обращениеСООН—нHOOC-CH,Н20II обращениен-соон-оно=с—сн2Р-лактон
идентичные конфигурацииНООС—СН2
*Реакции бимолекулярного нуклеофильного замещения у неасиммет¬
рического предельного углеродного атома, конечно, проходят по этому
же типу: с атакой нуклеофильного заместителя с противоположной
стороны от замещаемого атома, выплощением в переходном состоянии
остальных групп, связанных с углеродом, и выворачиванием их в ко¬
нечном продукте:НчНО' + H-C-CI
WНО"¥■•С-■CI^ чнпереходное состояние/ННО-С^-Н + CIнВальденовское обращение является правилом для реакций нуклео¬
фильного замещения, протекающих как реакции второго порядка (SN2).
Единственное исключение — это реакции «с участием соседнего атома»,
подобные приведенной выше реакции с промежуточной циклизацией
в лактон.
СОЕДИНЕНИЯ С ДВУМЯ АСИММЕТРИЧЕСКИМИ УГЛЕРОДАМЙ37!Однако это является иключением лишь в том смысле, что изоли¬
руемый конечный продукт реакции имеет ту же конфигурацию, что
исходный. По существу, эти реакции протекают с двойным вальденов-
ским обращением и, значит, являются не исключением, а подтвержде¬
нием общего правила.Реакции нуклеофильного замещения первого порядка (S^l) проте-,
кают с предварительной диссоциацией исходного соединения на катион
и анионR\ R\ + .R'-C— X —► R'—С + XR"/ R'"7и в принципе должны иметь результатом рацемизацию, так как катион
должен приобрести плоскую конфигурацию, и нуклеофил, заменяю¬
щий X, может атаковать его как справа, так и слева. Фактически раце¬
мизация иногда бывает частичной, поскольку катион не всегда успевает
до атаки выплощиться, а анион Х“ не всегда успевает отойти достаточно
далеко и экранирует одну сторону плоскости. (Иногда в экранирова¬
нии принимает участие и растворитель.)транс- и цис-Присоединение к олефинам. Здесь удобно разобрать
также стереохимическое течение реакций присоединения галоида по
двойной связи олефинов. Мы уже выяснили (стр. 248), что это реакция
гетеролитическая и атака начинается с электрофильного присоедине-
нения одного атома галоида. Доказательством этому служит то, что
в среде, содержащей избыток иных анионов, например СНзО", проте¬
кает следующая реакция:ГУ ” НвДвг + ^с=сс” + ОСН3 —^ Вг—С—ОСН3 + Вг~A RПри этом второй атом галоида (или другой анион, в данном при¬
мере СНзО”) присоединяется так, что из цис-олефина образуется pane¬
ls RI Iмат оптически деятельного продукта Вг—СН—СН—Вг (т. е. происхо¬
дит г/>а«с-присоединение),-а из транс-олефина получается мезо-форма:Of. DpVR H\*/R v8 H^/R-Br2 + . н 1 .Вг, + H ^h' nr h^^r r' 4H R^jNtBr BrТак идут, как правило, и другие электрофильные присоединения.
Объяснение этому транс-присоединению Уинстейн нашел в том, что
атакующая электрофильная частица сначала (возможно, через стадию
я-комплекса) присоединяется к обоим непредельным атомам, образуя
трехчленный ониевый цикл (в данном случае бромониевый), а он уже
при последующей нуклеофильной атаке аниона размыкается с валь-
деновским обращением. В результате первая (электрофильная, в дан¬
ном примере Вг+) и вторая (нуклеофильная, в данном примере Вг-
или СН30~) атакующие частицы неизбежно оказываются присоединен¬
ными «в гране-положении», так что получается рацемат.13*
372оксикислотыИз транс-олефинов при этом образуется мезо-форма:Н\ /R н< /R H4T/RС г\ С вальденовское р|| + вДвг —>- | >г+ + Вг' -обР-а-^н.У . к Y '* С с сНХ NR у/ 4R H<i4RВгHN /R Нч /R HxBfr RГ Сч вальденввское VXД + вг^Вг —I >г+ + Вг- » Ус с сRX ЧН ЧН ! ЧНВгБромониевые и хлорониевые стабильные соединения действительно
существуют в ароматическом ряду (см. кн. II).В случае присоединения галоидоводорода, которое также идет по
транс-типу, предполагается промежуточное существование протониевого
соединения с неклассическими химическими связями (на 3 атома 2 элек¬
трона):, _ ВгRn М r\„/R хс/С +нДг-^ ?Х + Вг-->- IR7 V R/*l4R"Присоединения редко проходят в ^«с-положении. Рассмотренное
выше (стр. 369) окисление олефинов перманганатом по Вагнеру про¬
текает как ^«с-присоединение, потому что промежуточно образующийсяциклический эфир кислоты Н3МПО4 (стр. 251) гидролизуется без затра¬
гивания связей С—О, а с разрывом по связям Мп—О (без вальденов-
ского обращения):*VH Rxc-oxII + КМПО4 ►-
Н'/’С'ЧНСТЕРЕОРЕГУЛЯРНЫЕ ПОЛИМЕРЫНа этом месте удобно рассмотреть вопрос о стереорегулярных по¬
лимерах. При радикальной (например, инициированной перекисями)
полимеризации мономера R—СН=СН2 получается знакомый нам тип
структуры, который включает асимметрические атомы (отмечены звез¬
дочкой)R R R
.1 .1 J
—сн-сн2—сн-сн2—сн-сн2 расположенные без соблюдения какой-либо определенной последова¬
тельности их конфигураций.Впервые в 1948 г. Шильдкнехт открыл на примере полимеризации
стирола под действием трехфтористого бора, а Натта широко развил,
введя гетеролитическую полимеризацию анионного типа* иной вид поли¬
СТЕРЕОРЕГУЛЯРНЫЕ ПОЛИМЕРЫ373меризации — стереоспецифическую. При стереоспедифической полиме¬
ризации могут получаться стереорегулярные полимеры двух типов
с разным стереохимическим характером цепи:1. Синдиотактический полимерR Н Н R R Н Н R\/ \/ \/ \/С С С СV/\/\сн2 сн2 СН2 СН2 •••в котором конфигурации асимметрических атомов правильно чере¬
дуются и вся цепь в целом представляет собой внутренний рацемат.2. Изотактический полимер:R Н R Н R Н R Н\/ \/ \/ \/С С С СХСН2 Х‘СН2 ХСН2 NsCH2'S'--V V V Vс с с . с
сн2 сн2 сн2 сн2 ••Одна цепочка содержит только левые конфигурации, вторая — энан-
тиомерна по отношению к ней. Пара ценен представляет собой рацемат.И изотактические, и синдиотактические полимеры по сравнению с
неупорядоченными атактическими полимерами проявляют гораздо бо¬
лее высокие механическую прочность и температуру размягчения, обя¬
занные правильной кристаллической упаковке молекул. Это можно про¬
иллюстрировать следующим сопоставлением:Полипропилен
атактический изотактическийПлотность, г/см3 0,85 0,92Температура плавления,°С 80 От 165 до 170Прочность при растяжении изотактического полипропилена дости¬
гает 350—410 кг/см2, т. е. соответствует порядку прочности стали, не
уступая полиамидному волокну.В каучуках — полимерах бутадиена и изопрена — дело обстоит так:
при анионной полимеризации, достигаемой действием литийалкилов
(анион — алкил), получаются 1,4-полнбутадиен или, соответственно,1,4-полиизопрен, стереорегулярность которых имеет иной характер, по¬
скольку такие полимеры не имеют асимметрических атомов углерода.
Их цепи имеют сплошь ц«с-конфигурациюН\ /Н—сн2 снг с=с сн, сн2 /С=Ч сн, сн2 с=с
н/ \н - н/ ЧНцыс-иолибутадиеинч /СНз СН2 СН, С=С СН2 СН» \Г г/ \ / \ / \ /.с==сч СН2 СН2 С=Сп СНз н/ хсн3^де-иолнизодрен (натуральный кауч>к>
,374оксикислотыКонфигурации цис- или транс- рассматривают по отношению к про¬
должению цепи.Катализаторы Циглера [А1 (С2Н5)з + TiCI4], широко использованные
в работах Циглера и Натта, также вызывают стереоспецифическую по¬
лимеризацию. Открыты и гетерогенные катализаторы, действующие при
повышенной температуре и приводящие к стереорегулярным полимерам;
это — окись хрома (а также окиси ванадия, молибдена) на окиси алю¬
миния.По-видимому, стереоспецифическая полимеризация — обычно реак¬
ция гетеролитическая.Синтез оксикислотОчевидно, что общие и уже рассмотренные методы введения в со¬
единение гидроксильной и карбоксильной групп в той или иной мере
используются и для синтеза оксикислот. Однако не все эти методы оди¬
наково приложимы к синтезу разных типов оксикислот, так как и по
свойствам, и по способам получения а-, у- и т. д. оксикислоты до¬
вольно сильно различаются.Синтез а-оксикислот. 1. Окисление самых доступных из гли-
колей—1,2-гликолей с концевой первичной спиртовой группой;носн2—сн2он носн2—с;:2-с' +нао
\онгликолевая кислота2. Гидролиз а-галоидзамещенных кислот;н2оСНз—СНС1——*-
Х)Нмолочная кислота3. Циангидриновый синтез:СН3—с( +HCN —»- СНз—СН—CN\н2Н20(Н+)сн3—сн—с;+ NH;хонон4. Восстановление а-альдегидо- или а-кетонокислот;пировинограднаякислотамолочная кислотаСинтез р-оксикислот. 1. Окисление альдолей:альдоль2. Присоединение воды к а-непредельным кислотам:н+ ‘сн2=сн—с^ + НаО ™ —сна—с
Х)Ц
СИНТЕЗ ОКСИКИСЛОТ3753. Восстановление р-кетонокислот;/Р 2НСНз—с—сн2——» сн3-с—сн2—
II юн / \ хон
о н он4. Реакция С. Н. Реформатского:R\ R\ H2o;с=о + zn + R"—chci—с' —> ;c-chr"—cr —►R'/ (или Mg) OR/w R iznCl WR\ ^O OH—> chr"—c; + Zn'r'/ ! 4>rw N:iOHгде R' и R" могут быть и атомами водорода.Реакция Реформатского находит очень широкое применение в слож¬
ных синтезах.Синтез v-оксикислот. Г идролиз их внутренних сложных эфи¬
ров — лактоновН2С—снг 0\ . н20(н+);о ► сн2-сн2-сн,-с(
н г—Г I 4 ОН2 Ч0 ОНполучаемых восстановлением циклических ангидридов кислот,о.н2с—сVн2с-с/ н2с—сн22 \ 4Н/°н2С-(Г Н2с-с% %или нагреванием p-непредельных кислот с разбавленными минераль¬
ными кислотами:,о Н2С—СН2СН2=СН—СН2-С\ОНН2С—С:ООСинтез кислот с удаленным концевым ©-положе¬
нием гидроксила. Такие оксикислоты можно получить последо¬
вательным кислотным, а затем щелочным гидролизом тетрахлоралка-
нов — продуктов теломеризации (см. кн. II, «Свободные радикалы») эти¬
лена с четыреххлористым углеродом (P. X. Фрейдлина):С1(СН2-СН2)„СС13н-*ОС1(СН2-СН2),г~С:\онон"НО—(СН2—СН2)„—Со0~Кроме того, существуют специфические способы получения ряда
важных оксикислот, в частности полиоксикислот. Например:
376оксикислоты1. Окисление моносахаридов (стр. 410):sP Cu2+(OH~) sPСН2—СН—СН—СН—сн—с' >- СН2—СН—СН—СН—СН—сI I I I I \н I I I I I \онон он он он он он он он он он{глюкоза стерео- Г глюконоваяманноза изомерные< манноноваягалактоза кислоты ( галактоновая°ч—> ;;с—сн—сн—сн—сн—с,
но^ I I I I \он
он он он онстерео- ( сахарная (глюкаровая\
изомерные < манносахарная (маннаровая)
кислоты I слизевая (галактаровая)2. Окисление непредельных кислот по Вагнеру (КМ11О4 + ОН-),
перекисью водорода или гидроперекисями кислот (Прилежаев). В по¬
следних двух случаях реакция идет с последующим раскрытием
эпоксидного цикла под действием воды в кислой среде:кмпо4(он~) CH2—CH—COOH *- Iонакриловая кислота глицериновая кислотаI ^Н202 Н»0(Н+)1 * Н2С—сн-соон I 2 v\ /ОN СООНнс-< III ЧОН кмп04(0Н-) Н-С-ОН|| н—С—онHC-C, I\он СООНмалеиновая мезовиннаякислота кислотаНа примере окисления цис- и гранс-кротоновых кислот удобно про¬
следить стереохимию течения реакции при действии разных окисли¬
телей.Окисление перманганатом по Вагнеру протекает как цис-присоеди-
нение (причины этого изложены на стр. 372).г^ыс-Присоединение кислорода к г^ис-изомеру кротоновой кислоты
приводит к обоим антиподам эритро-формы а,р-диоксимасляной
кислоты.Напомним, что при окислении малеиновой кислоты по Вагнеру об¬
разуется мезовинная кислота. Эти два случая различаются между со¬
бой тем, что в результате окисления малеиновой кислоты образуются
два структурно одинаковых асимметрических углерода противополож¬
ной конфигурации и получаемое соединение оказывается «недеятель¬
ным» вследствие внутренней компенсации. В случае же г^мс-кротоновой
кислоты асимметрические углероды разные, вследствие чего полу-
СИНТЕЗ оксикислот3 77чаются два антипода — один при присоединении гидроксилов сверху
плоскости молекулы цис-кротоновой кислоты, другой — снизу:н. соон
сн ' СНз+ Н20 + KMnQjцис-кротоновая
кислота«сHvi"c°°HС
' i
н'йсн>но-но-Рацемическая параСООН Н^СООН
н с
+ I
н >сч
сн, нЛнсн,СООН
-ОН-онСНзэритро-изонер*эршпро~ш о мер
антиподтранс-Кротоновая кислота, как это ясно из реакции, образует при
окислении перманганатом по Вагнеру два антипода грео-стереоизомера
а,р-диоксимасляной кислотыНч ХООНс/*4СНз нтроне- кротоновая
аиспота+ Н20 + КМПО4нч°”соонСН^ 1ЧН3 ОНРацемическая параСООИ Н.^СООН
Н—ОН+ у =НО-HO-j-H X. - Н-№3 0ННСНзи/>ео-изомер*СООНнOh
СНзтрео-изомер
антиподподобно тому как фумаровая кислота в результате той же реакции
дает рацемат — виноградную кислоту.Окисление гидроперекисью ацила или перекись юводорода по При¬
лежаеву проходит через стадию образования эпоксида. Это тоже цис-
присоединение кислородного атома по двойной связи. Эпоксид затем
присоединяет к мостиковому кислородному атому протон и оксониевое
соединение атакуется водой, размыкающей цикл с вальденовским обра¬
щением у атакуемого углерода. Атаке подвергается p-углерод, так как
в а,р-непредельных соединениях ориентация атаки определяется карб¬
оксилом, вызывающим «антимарковниковское» присоединение, а в сс,(3-
эпоксикислотах (глицидных кислотах) — «антикрасусское» размыкание
цикла:НгОгн'Ас. I ОсоонСООНсоонсоонI ^ 1Нч ^соон п'ПСЩ
ifн' чсн3Г\Н\|>СООНfi soс гн'!>.исн.[рацемат
трео-* Так обозначаются диастереомеры веществ с двумя соседними асимметриче¬
скими углеродами. эритро-Изомер (название от сахара, эритрозы) по конфигурации
напоминает мезовинную кислоту, г/?ео-изомер (от сахара треозы) напоминает винные
кислоты.
378оксикислотын. .соон сн^Т>нчс'нч[>соонс 1 Г
I о = о
<-■соон-нсоонСООН..'*1СНнНгогI 9Унсн, |,соонОСНзСООНОJ-нСНз.и вальденовское ил--Н
обращениеНО—н
СНз.+н+вальденовское
лг- обращение ^О—Н 1Гт"^JСНзЭОСООНН--ОН.Н—ОН
СНз /рацемат
'эритро-Таким образом, окисление перекисью водорода приводит к иному
диастереомеру, чем окисление перманганатом.3. Получение молочной кислоты брожением сахаров (глюкозы, мо¬
лочного сахара— лактозы, сахарозы) под действием бактерий молочно¬
кислого брожения (Bacillus acidi laevalactici и др.). В зависимости от
вида бактерий образуется левая или рацемическая кислота. Суммар¬
ное уравнение:сн,—сн—сн—сн—сн—с:АОН ОН ОН ОН ОНН2СНз—СН—С
IОНоонТехнически рацемическую молочную кислоту готовят сбраживанием
сахарозы или мальтозы посредством бактерий Bacillus Delbriicki при
50 °С, добавляя необходимые питательные вещества (РО4", NH4) н по¬
степенно нейтрализуя мелом.Свойства и реакции оксикислотОксикислоты — более сильные кислоты, чем их родоначальные кар¬
боновые кислоты. Это особенно относится к а-оксикислотам. Здесь ска¬
зывается —/-эффект гидроксила в насыщенной цепи углеродных атомов.
Как и обычные карбоновые кислоты, оксикислоты способны образовы¬
вать со спиртами сложные эфиры: -СНз—СН—С;
IОНо+ с2н6ононСНз—сн—с
Iон\о0СгН5+ Н20Водород гидроксила действием алкоголята натрия (или металличе¬
ского натрия) может быть замещен на натрийСНа—СН—С
IОН;0oc2Hs+ CjHsONaСН3-СН-С^ + C2H5OHAn, Чосла затем проалкилирован
<0сн3—сн—с:
IONa\0СгН6+ CH3IСНз—СН—С;
ОСН3:0+ NalОС2Н6
СВОЙСТВА И РЕАКЦИИ ОКСИКИСЛОТ379При гидролизе отщепляется алкил сложноэфирной группировки и
остается простой эфир оксикислоты:сн3—СН—с;
IОСНзуXон2о(н+) ► СНз—сн-с; + с2н6онOC2Hsосн.онЕсли же ацилировать оксикислоту ангидридом или хлорангидридом
кислоты, в этерификацию вступает спиртовая функция и образуется
сложный эфирСНз—СН—СIОНо+ СН3—С—О—С—СН3оноосн3-сн—с;; + сн3соон
| мэнO'—С—сн3
IIокоторый в отличие от простого эфира легко гидролизуется.Оксикислоты дают и другие функциональные производные, свой¬
ственные кислотам и спиртам.Окислением по гидроксильной группе оксикислоты превращаются
в альдегидо- или кетонокислоты.Наиболее своеобразно образование оксикислотами внутренних цик¬
лических сложных эфиров, т. е. этерификация своим карбоксилом своего
же гидроксила. В этом случае ярко выступает общее для всей орга¬
нической химии предпочтительное образование пятичленных и шести¬
членных циклов.а-Оксикислоты образуют также внутренние шестичленные гетеро¬
циклические сложные эфиры (из двух молекул), которые носят общее
название лактиды:Н2С-/%-О01ННОюн0:Н-С—СН»ОН2С—2НгО + о/ ^О
\ /
X-СН,
о^СИз пНС-С,/ ЮН
НОНО он\ /
С—сн/ \
о сн,СНзНС—\о2Н20 + 0^ ^0
С—СН
О СНзлактидлактадыВ кислой среде лактиды гидролизуются в исходные а-оксикислоты.
(З-Оксикислоты при нагревании легко отщепляют воду и образуют
а,р-непредельные кислоты:
380оксикислотыПри этом циклические внутренние сложные эфиры не образуются
(малая устойчивость четырехчленного цикла). Однако иным путем не¬
которые (З-лактоны могут быть получены, например, из формальдегида
и кетена:/Но=с(+о=с=сн.О—сн2I I
о=с—сн2|3-лактону-Оксикислоты легко самопроизвольно замыкаются в у-лактоны, на¬
пример при подкислении их солей:сн2—сн2—сн2——ONa н+ Н2С—СН:2он Н2С—с=оу-бутнролактону-Лактоны — важный класс соединений. Они открыты А. М. Зайце¬
вым на примере бутиролактона, полученного при восстановлении ангид¬
рида янтарной кислоты:Н,С—С=0 Н,С-СН,)°^О/н2с—с=о н2с—сIIоПо женевской номенклатуре у-лактонам присваивается окончание
олид, добавляемое к названию соответствующего алкана: например,
бутанолид.Щелочи гидролизуют у-лактоны, превращая их в соли кислот. Га-
лоидоводороды размыкают лактоны, которые образуют у-галоидзаме-
щенные кислоты.Цианистый калий размыкает лактон по следующей схеме;Н2С-СН2 СН2—СН2—CN^O + KCN —►Н2С—С сн2—с—окII I!Эта реакция является довольно важным приемом в синтезе дикар-
боновых кислот.Восстановление бутиролактона приводит к тетрагидрофурану. Реак¬
ции восстановления янтарного ангидрида до тетрагидрофурана ясно
доказывают строение бутиролактона:.
доказательство строения оксикислот381С гриньяровым реактивом лактоны реагируют с образованием окси-
кетонов:Н2С СН2 Н2С СН2 н2о| | + RMgCl —► | | /OMgCl »-Н2С\ /С=0 Н2С\ /Со о \R/ОН—»■ R—С—СН2—СН2—СН,ОН + Mg,II \ci
ою-Лактоны с девятью и десятью углеродными атомами (нонанолид и
деканолид) в малых количествах встречаются в молоке и молочных
продуктах и частично обусловливают запах сливочного масла (наряду
с СН3—С—С—СН3, СН3—СН—С—СН3 и другими веществами). По-11 I I IIО О он оэтому их употребляют для отдушки маргарина.Известны лактоны с еще большими циклами, хотя ю-оксикислоты и
не замыкаются в такие лактоны самопроизвольно. Так, лактон тибето-
лид, широко применяемое душистое вещество с запахом мускуса, яв¬
ляющееся стабилизатором духов, получается следующим образом
(P. X. Фрейдлина, В. H. Белов):СС14 + сн2=сн, -Г.”:Х С1-(СН2СН2)Г-СС1,-ЗНС1+он~ н+—> С1—(СН2СН2)7—COOH ——*■ НО-(СН2СИ2)7—СОО' ~>— НСЛ—> НО—(СН2СН2)7-С00Н |,аГрепа,1ИеНО~(СН2СН2)7-С—0-(СН2СН2)7о—П.Н20нагревание СН2—(СН2СН2)в—С—OHI!п Оо—с—сн2IIотибетолидДоказательство строения некоторых оксикислотСтроение гликолевой кислоты ясно из ее отношения к этиленгли-
колю и щавелевой кислоте:х° сх хоН0СН2-СН20Н —> НОСН2—С(" _*\он НО/ ^ОНгликолевая кислотаМолочная кислота восстанавливается иодистым водородом в про-
пионовую, чем устанавливается ее скелет, и окисляется в кетонокисло-
ту — пировиноградную, из чего следует, что спиртовая группа у нее
вторичная:СН3-СН2-С^ СН3—СН-Л. СНз-С-С^^он I хон II ^он
он омолочная кпелогаСинтезы, приведенные на стр. 374, окончательно утверждают ее
строение как а-оксипропионовой кислоты.
382оксикислотыТартроновая кислота окисляется в кетонокислоту — мезоксалевую —
и восстанавливается в малоновую кислоту:°Ч о °Ч HI °ЧС-С-С' <— yZ—СН—с —>■ хс—сн2—от
НО/ II NoH но/ I \ш но/ \эно онмезоксалевая тартроновая малоиоваякислога кислота кислотаПолучают ее гидролизом хлормалоновой кислоты.Строение винных кислот устанавливается превращением их в ди-
хлорянтарную кислоту путем замены гидроксилов на хлор (РСЬ) и
восстановлением HI сначала в яблочную, а затем в янтарную кислоту:°Ч „ pcis °чj;c~CH—сн——>■ ^с—сн—сн-с^
но/ I I \он но/ I I \онОН ОН CI С1Iм,с-сн2-сн-с^ г-сн:, -сн,—но/ I \оН но/ Ч)Ноняблочная кислота янтарная кислотаЛимонная кислота имеет три карбоксила (титрование щелочью) и
один третичный гидроксил (устойчивость к окислению). Восстановление
ее приводит к трикарбаллиловой кислоте, при нагревании с серной кис¬
лотой образуются муравьиная и ацетондикарбоновая кислоты; послед¬
няя при нагревании распадается на двуокись углерода и ацетон:СН2— СООН СНг—СООН СН2—СООНI H2SO4 1 н IНС00Н + С=0 С(ОН)—СООН —► СН-СООН
<1н2—СООН СН2-СООН СН2—СООНацетондикарбоновая лимонная трикарбаллиловаянагревание ► 2С02 + СН3—СО—СН3Образование оксогруппы с отщеплением НСООН типично для
а-оксикислот. Это означает, что центральный углерод, ставший карбо¬
нильным, нес и карбоксил и гидроксил.Строение лимонной кислоты подтверждено синтезом:С1СН2—С—СН2С1 + 2KCN —> N=C—СН2—С—СН2—C=N tО оNs=C—CH2—G-CHj-CssN Н"°>- НООС—СН2—С—СН2—СООН + 3NH,НО7 \cN но/ \соонЗначение оксикислотОксикислоты широко распространены в растительном мире. Глико¬
левая кислота НОСН2—СООН встречается во многих растениях (свек¬
ла, виноград). Молочная кислота СН3СН(ОН)СООН, как уже говори¬
лось, является продуктом жизнедеятельности ряда бактерий. Она
с незапамятных времен используется как консервирующее и предохра¬
няющее от гниения вещество. Кислое молоко, простокваша, кефир, ва¬
оксокислоты383ренец — продукты молочнокислого брожения молока: молочный са¬
хар— лактоза превращается в молочную кислоту, и она свертывает,
«створаживает» белок (казеин молока). Приготовление кислой капу¬
сты, моченых яблок, солка огурцов, помидоров, арбузов и т. д. — это
все процессы молочнокислого брожения сахаров, содержащихся в этих
овощах и плодах. Накапливающаяся молочная кислота обеспечивает
сохранность заготовленных овощей. Силос — продукт молочнокислого
брожения ботвы и зелени.Все сказанное относится к L- и £)-молочным кислотам. В мышцах
содержится D-молочная (мясомолочная) кислота, которая образуется
из глюкозы подобным образом и накапливается во время работы
мышцы. Ее предшественником является простейшая кетонокислота —
. пировиноградная, восстанавливающаяся в молочную.Об образовании в процессах жизнедеятельноти пировиноградной
кислоты из глюкозы см. стр. 434 сл.Яблочная кислота найдена в рябине, незрелых яблоках и многих
других плодах. D-Винная кислота в свободном виде и в виде солей на¬
ходится также во многих плодах. В виде труднорастворимой кислой ка¬
лиевой соли она осаждается в бочках с бродящим вином, и из этого
«винного камня» и добывается «виннокаменная», т. е. D-винная, кис¬
лота *. Лимонная кислота НООССН2С(ОН) (СООН)СН2СООН нахо¬
дится во многих растениях, в том числе в плодах лимона, откуда и
добывается. У нас эту кислоту добывают из махорки после извлечения
никотина, а также из ботвы хлопчатника (А. С. Садыков). Ее получают
также особым лимоннокислым брожением сахаров (глюкозы, мальтозы,
патоки) с помощью цитромицетов.Все эти а-оксикислоты безвредны для человека и многие из них
(молочную, винную, лимонную) применяют в кулинарии и для изго¬
товления напитков.Лимонная и яблочная кислоты играют важную роль во многих био¬
химических процессах, протекающих во всех клетках, в частности в кле¬
точном дыхании (см. цикл Кребса, стр. 436).оксокислотыПо свойствам а-, {3- и \-оксокислоты достаточно резко различаются
между собой. Альдегидо- и кетонокислотам присущи также обычные
различия альдегидов и кетонов.В табл. 43 приведены названия и физические свойства ряда оксо-
кислот.Поскольку оксогруппа — сильная электроноакцепторная группа, об¬
ладающая резко выраженными —/- и —Г-эффектами, оксокислоты яв¬
ляются более сильными кислотами, чем родоначальные карбоновые
кислоты, а а-оксокислоты относятся к самым сильным карбоновым
кислотам.Синтез оксокислотДля синтеза оксокислот приложимы многие из обычных методов
введения как карбоксильной, так и оксогруппы. Таковы, например,
синтез из хлорзамеще'нных оксосоединений через нитрилы, окисление* Виннокислый натрий плюс щелочь растворяют гидроокись меди, давая темно¬
синий фелингов реактив, служащий для мягкого окисления (например, альдегидов).
Ион меди в этом реактиве связан с четырьмя кислородами гидроксилов двух молекул
виннокислой соли.
Таблица 43. Альдегиде- и кетоиокислоты и их эфирын g
S.50о tr 0
с S
S £4)Sюсо rt- — ^—< г}»— К н
Си Онв2S0005,196W5- уео счCN* &
о. си
и£;«С s
^ к
а^О
ё «°
S§•3'S*SкI 1-8-Л*я
3 JS
я 3О £,
м СП5 о
£ чо £SmО. у У££S а
а;НЙ£„fcfЯSояко\ооя2 п
V Gн(Q00 СП
05 О)осчсо»«12 SSЯ ЯО со
§1
|г«S3»я 3
3 g
и 2§ё“Iчч:7 и' о2 00СЧ JSJЧ О.<м соо»—<•-Ч••4f05счN.-*“'Ч165(разл.)< 100
(разл.)246; 154
(14 мм рт. ст.Разл.ю Д2 Sо.чиКК#33Яякс?СЗг>>Оняо«?*■>4Я5ояЯяоиоСиЛояsfеС<кКч>>mяояо\оОнтамSfcfконсия<ксеояSо.о•в4воf-к
о0
о1о/\ ..
О £ ОXооиЖоIо/\жкоооо1кЖооL1Nжооо£о1о1жоо1LоXОО1£L£:2“||0£о1но-о01-ониоо1111=о*т*1ж|1о0=00:и;=ои “О0=00=01111о1111ооооСОСО1ооооожк£оооооиоожXжXжБесцветная вязкая некристаллизующаяся жидкость.
СИНТЕЗ оксокислот385первичной спиртовой группы кетоноспиртов в карбоксил, окисление пер¬
вичной или вторичной спиртовой группы оксикислот в оксогруппу, гид¬
ролиз гем-дигалоидзамещенных * карбоновых кислот в оксокислоты,
восстановление (например, электрохимическое) одного из двух карб¬
оксилов двухосновных кислот в альдегидную группу и т. д. Так, простей¬
шая из оксокислот — альдегидокислота, глиоксиловая, получается окис¬
лением гликолевой кислоты, а также этиленгликоля, например, азотной
кислотойо ° °ЧНОСН2-СН2ОН НОСН2—С^ —> /С-С'ХОН W \он
и восстановлением на катоде щавелевой кислоты:°Ч °Ч S0:с-с( +2Н —* £-с( +Н20НО/ NOH W чэнПростейшая а-кетонокислота — пировиноградная, как и другие
а-кетонокислоты, может быть получена через нитрил:н2о; н+СНз-С—C1+KCN —► СН3-С—CN »- СН3—С—С' + NH3• « к А хонОООа-Кетонокислоты удобно также получать окислением а-оксикислот.
Некоторые методы, например введение карбоксила через магнийоргани-
ческие соединения, разумеется, здесь неприложимы. Есть, однако, важ¬
ные специфические методы синтеза оксокислот, на которых и необхо¬
димо сосредоточить внимание. Так, при пиролизе виноградной кислоты
(что является частным случаем) получается пировиноградная кислота:НО—С—СН—СН—С—ОН —г* ГСН2-СН—С-ОН ——СН2=С— С—ОН! —►«I I II -со* I I I “Н2° I IО ОН ОН О LOH ОН О НО О J—> СНз—С—С-ОНII II
О О(Формулы, заключенные в скобки, поясняют смысл реакции, но не
соответствуют каким-либо изолируемым промежуточным продуктам и
стадиям процесса.)Специфическим методом синтеза р-оксокислот является новая для
нас реакция сложиоэфирной конденсации — конденсация Гейтера —
Клайзена. Она заключается в том, что на сложный эфир карбоновой
кислоты или смесь двух сложных эфиров разных карбоновых кислот
действуют металлическим натрием (или алкоголятом натрия). Формаль¬
ные итоговые уравнения реакции следующие:О О О ОII II Na II IIН—С—ОС2Н5 + СН3—С—ОС2Н5 Н-С-СН2-С-ОС2НБ + CjHsONa+'/jHj (1)
О ОII II NaСНз—С—ОС2Н5 + СНз—С-ОС2Н5 —> (0SО О ()II II—► СН3—С—СН2—С—ОС2Н5 + C2H5ONa + 72Н2* Приставка гем применяется для обозначения положения двух одинаковых
заместителей, стоящих при одном углеродном атоме.
386оксокислотыОднако эти уравнения совершенно не вскрывают смысла процесса
и не точны в том отношении, что алкоголят натрия не индифферентен
к эфирам р-оксокислот (эти отношения удобнее изложить несколько
ниже, после знакомства с кето-енольной таутомерией).В сложноэфирную конденсацию можно вводить и эфиры двухоснов¬
ных кислот с эфирами одноосновных, равно как эфиры двух разных
двухосновных кислот:0 0 оII . II ■ II NaСгн50—С—С—ОС2Н6 + СНз— с—ОС2Н6 —►ООО 'II II .11—► C2H60-C-C—CHS-C—OC2Hs + CjHbONa + »/sH2В последнем случае образуются циклические кетонокислоты (реак¬
ция Дикмана):COOC2H8 COOCjHsСН, 0=С—сн^)СН2 + 2CjHs0Na + Н2 (4):оос2н6 соос2н6Эфиры двухосноёных кислот с болёе длинной цепыб углеродных
атомов способны конденсироваться сами на себя:.Nac2hso-c—сн2—сн2—сн2-сн2-соос2н6 ЛХАН2С CH-COOC2He + C2H6ONa + */2Нян2С\ J:=oСН2" При циклизациях, как всегда, легко получаются лишь пяти- и ше¬
стичленные циклы.Из всех этих примеров ясно, что конденсация связана с наличием
в сложном эфире, являющемся вторым компонентом реакции, свобод¬
ного а-водородного атома (или, даже лучше, незамещенного метиле¬
нового звена, т. е. двух а-водородных атомов). По существу, реакция
является ацилированием одним сложным эфиром другого по сс-углерод-
ному атому. Образующиеся сложные эфиры так и называются: формил-
уксусноэтиловый (реакция 1), ацетилуксусноэтиловый или, сокращенно,
ацетоуксусный (реакция 2), щавелевоуксусный (реакция 3). Раз¬
умеется, полученные всеми этими реакциями сложные эфиры гидро¬
лизом могут быть превращены в свободные оксокислоты.Из эфиров (5-кетонокислот можно легко получить эфиры гомологич¬
ных кетонокислот, так как при действии металла или алкоголята во-
дороды а-звена —С—СН2—С—ОС2Н5 легко протонизируются и заме-О Ощаются на натрий (стр. 400), а такое натриевое производное может
быть проалкилировано галоидным алкилом (примеры см. на стр. 405).Сложные эфиры можно конденсировать и с кетонами. Так полу¬
чаются р-дикетоны. Если же с кетонами конденсировать щавелевый
ТАУТОМЕРИЯ387.эфир, то получаются эфиры р-кетонокислот, являющиеся в то же время
и эфирами а-кетонокислот, например:2С2Н50—С—С—0С2Н5 + СН3—С-СНз %,II II II0 0 о—>■ С*Н60—С—С—СН2—С—СН2—С—С—ОС2НБ + 2C2H50Na + Н2II В II II II0 0 о о оэфир ацетондищавелевой кислотыТаким образом, метод сложноэфирной конденсации предстает как
один из мощных синтетических методов построения скелетов органи¬
ческих молекул.■у-Кетоиокислоты, простейшим представителем которых является ле-
вулиновая кислотаСНз-С-СН2-СН2-С-0Н4 4можно получать через натриевые производные эфиров кетонокислот
(в данном примере через натриевое производное ацетоуксусного эфира).
Левулиновая кислота получается также при кипячении с концентриро¬
ванной соляной кислотой левулозы (фруктозы) и других гексоз, откуда
и возникло ее название.В связи с тем что в химии оксокислот, особенно р-оксокислот и их
функциональных производных, огромную роль играет кето-енольная
таутомерия, необходимо, прежде чем идти дальше, рассмотреть вопросы
таутомерии.ТАУТОМЕРИЯВсе эфиры р-кетонокислот, имеющие в a-положении группировку
С—Н или СНг, — ярко выраженные таутомерные соединения. Рассмот¬
рим для примера таутомерию ацетоуксусного эфира (так, краткости
ради, принято называть этиловый эфир ацетоуксусной кислоты). Легко
показать, что ацетоуксусный эфир не представляет собой индивидуаль¬
ного соединения, а- является смесью двух обратимо взаимопревращаю-
щихся изомеров:СНз—С—СН2-С—ОС2Н6 сн3—С—СН—С—ОС2Н5II II II0 0 он оI и; В результате устанавливается равновесие двух таутомеров I и II
(I — кетонная форма, II — енольная форма). Положение равновесия
зависит от температуры и, в сильной степени, от растворителя. Ско¬
рость взаимопревращения таутомеров в разных условиях различна. Она
сильно возрастает при катализе как ионами водорода, так и ионами
гидроксила и вообще основаниями, даже такими, как стекло.Кислотно-щелочный катализ этой реакции таутомеризации — один
из многочисленных примеров ускорения реакций воздействием ионов
водорода и гидроксила. Причины этого явления можно понять из сле¬
дующих схем.
388ОКСОКИСЛОТЫКатализ щелочью:СН„-С-гСН-С-ОСпНч —сн3-с=сн-с-ос2н5V-Н ll II I- IIмз н о о о'ОН|нонсн3-с=сн-с-ос2н5
он _ о+ОНОбратное превращение:СН3- С==СН-С-ОС2Н- —►- CHg-C^CH-C-OCgHs0 о о" н о1 ' 1
н» он он\СН.-С-СН-С-ОСпН.
II I II ьоно+ОНКатализ кислотой:СН3-С-СН-С-ОС2Н5 СН3—C-j^CH—с—ОС2Н5(о н о онон+ н Iсна— с=сн—с—ОС2Н5
он о
+н+Обратное превращение:сн:~ С=-СН -С—ОС^Н = —> СН3-С-СН-С-0С2Н5I ** 11 JTI I 110 н+ о Го н о1 41I чн нсн3- с - СН2-С-ОС2Н,II ^ II 1 ьо о
+н+Поэтому при перегонке в отсутствие стекла, например из кварцевой
колбы, сначала отгоняется более низкокипящая енольная форма. Ско¬
рость таутомеризации при температуре перегонки в вакууме невысока,
и разделение двух форм в известной степени удается. Однако отогнан¬
ная енольная форма при стоянии постепенно переходит в равновесную
смесь обеих форм. При охлаждении жидким воздухом раствора адето-
уксусного эфира в петролейном эфире (смесь углеводородов СпН2пн-2)
выкристаллизовывается чистая кетонная форма, имеющая т. пл. —39 °С.
При комнатной температуре она также постепенно переходит в равно¬
весную смесь. В условиях химических реакций ацетоуксусный эфир,
ТАУТОМЕРИЯ389т. е. смесь кетонной и енольной форм, обычно реагирует нацело по
одному из направлений (как кетон или как енол), как если бы он был
индивидуальным веществом. По мере вывода одной из форм в резуль¬
тате реакции, другая форма по законам равновесия снова частично пе¬
реходит в первую, и реакция продолжается.Одной из немногих реакций, по которым можно проследить и коли¬
чественно определить процентное содержание в смеси одной из форм,
именно енольной, служит реакция присоединения брома по двойной
связи:Если реакцию проводить на холоду и достаточно быстро, удается
оттитровать всю енольную форму (К. Мейер) до того, как она замет¬
ным образом успеет перейти в кетонную. Так было определено содер¬
жание енола в ряде таутомерных веществ в разных растворителях.
Эти числа и вошли в приведенную далее таблицу констант ионизации
(стр. 395).О процентном содержании кетонной и енольной форм в равновесной
смеси можно судить и по физическим свойствам такой смеси, так как
кетонная и енольная формы имеют разное поглощение света в ультра¬
фиолетовой области, разные коэффициенты преломления. По этим дан¬
ным Кнорр вычислил содержание двух форм в равновесной смеси.Большая часть других реакций протекает одинаково как с равно¬
весным ацетоуксусным эфиром, так и в отдельности с енолом и с кето-
ном. Приведем некоторые реакции ацетоуксусного эфира, характерные
для структуры обеих форм.Реакции, протекающие по кетонному типу. 1. При¬
соединение синильной кислоты:OjH О4СН3-С-СНВ1—С-ОС2Н6 + НВг
О оСН3—С—СН2—С—ОС2Н5 + HCN—► СН3— С—СН2—С—ОС2Н5но/ \cN I2. Присоединение бисульфита натрия:СНз—С—СН2—С—ОС2Н5 + NaHSO:► СН3—С—СН2—С—ОС2Н5
NaOaS/ ^ОН3. Реакция с замещенными гидразинами:СН3—С—СН2—С—ОС2Н5 + H2N—NHRII IIО оЗдесь обычная реакция кетона осложняется второй фазой — цикли¬
зацией в R-метилпиразолон (см. кн. II).
390ОКСОКИСЛОТЫ4. Подобным образом, с циклизацией первоначально образующе¬
гося оксима, протекает и реакция с гидроксиламином:СНз— С—СН2—С—ОС2Нб СНз—с—сн2—С—ОС2Н5 —►—Н2оЧчонА о осн3—с—СН2+ с2н6он—->• Nv /С=0ОРеакции, протекающие по енольномутипу. 1. Упомя¬
нутое выше бромирование по двойной связи.2. Образование с солями металлов внутрикомплексных енолятов,
например:СН3—С=СН—С—OCjHsI || СНз—хС-ОС2Н,ОН О | ||°\^°+ —-* СиСи/О— С— СНз
0О^ \о
С2Н50-Сч ^с-снгс:нголубовато-зеленые кристаллы,
малорастворимые в водеСН’ТСНТ°С!НГ н^-^-осл? 1 ' w.Fed, НС^-'° <4 ^СН• \ ГН3С ОС2Н5 .фиолетовое вещество, растворимое
^ в воде и органических растворителях3. Ацилирование хлорангидридами кислот в пиридиновом растворе;/ОС2Нв /ОС2Н5
СНз—с=сн— С +сна— С— С1 —* СН3—С=СН—сАв 40 А А-с_сн>44. Действие металлического натрия:xOCjHs /ОС2Нв
СН3-С==СН-С( +Na —> СН3-С=СН-С( + '/2Н2I Ч0 1^0ОН ONa5. Действие РС15:/ОС2Н5 ' ^ос2н5
СН3-С=СН-С^ +РС18 —* СНа-С-=СН-С( +Р0С13 + НС1I ^о I "'Ч)OH С1
ТАУТОМЕРИЯ391Кроме того, необходимо привести реакции ацетоуксусного эфира,
не имеющие столь ясного отношения к его таутомерии и типичные для
всех эфиров {3-кетонокислот.1. При гидролизе в кислой среде ацетоуксусный эфир превращается
в ацетоуксусную кислоту, которая при нагревании в водной среде де-
карбоксилируется и превращается в ацетон:СНз—С—СН2—С-ОН —СНз-С—CHSII II _С°2 IIО О оЭто так называемое кетонное расщепление р-кетонокислот. Есть
основание считать, что этот кетонный распад идет через циклическое
переходное состояние и еиольиую форму кетона:•сн2СНо-С^е>С-0 ^сн2&Л А ^ СН>_<Г “*■ сн^“сн>ОН о2. При действии сильных щелочей распад ацетоуксусного эфира
(в дополнение к гидролизу сложиоэфирной группы) идет по связи
между карбонильной и центральной метиленовой группой, и образуются
две молекулы уксусной кислоты (в виде соли):СН3—С—СН2—С—ОС2Н5 + NaOH —► 2СН3—С—ONa + С2Н5ОНII ■ II II0 0 ОЭто — кислотное расщепление ацетоуксусного эфира.Ряд реакций, из которых мы приведем немногие,, характеризует
большую подвижность водородов метиленовой группы:взаимодействие с альдегидамиОIIСНз—с—СН2—С—0С2Н5 + R—сно —>- СН3—С—С—С—ос2н5 + н2о11 1 II0 0 О CHRреакция Михаэля (стр. 305)ОСН3—С-СН2-С—ОС2Н5 + CH2=CH-C-OC2Hs —> СНз—с-сн—с-ос2н5I II ! II Iо о о о сн,—сн2-с-ос2н5IIореакция с азотистой кислотой (ср. реакцию кетонов, стр. 136)ОСНз— С—сн2—с—ос2н5 + hno2 —► сн3-с-с—С-ОС2Н5II II II II0 0 О NOHРеакции, протекающие по кетонному или енольному типу, создают
ясную картину двойственной реакционной способности ацетоуксусного
эфира, наиболее просто объясняемую обратимой изомеризацией, т. е.
таутомерией. Это было установлено (хотя и на других примерах) еще
до приведенных выше решающих опытов по разделению и количествен¬
ному определению таутомеров и их взаимопревращению.Интересно отметить, что А. М. Бутлеров, исходя из теории строения,
предсказал еще в 1877 г. возможность двойственного реагирования и
таутомерии как обратимой изомеризации. Однако первые явления этого
392оксокислотырода были открыты Байером в 80-х годах прошлого века не в области
кето-енольной таутомерии, рассмотренной нами на примере ацетоуксус-
ного эфира, а на так называемой лактим-лактамной таутомерии
(стр. 397) изатина; первые же исследования кето-енольной таутомерии
относятся к самому концу XIX и началу XX века.Для кето-енольной таутомерии характерен обратимый переход:С=с ^с-с{
II I \
}н она;енольная груп- оксо-груп-пировка пировкаПравило Эрленмейера — Эльтекова (стр. 289) констатирует неустой¬
чивость енольных систем (простейших) и их изомеризацию в оксо-
системы. Действительно, для монокетонов и моноальдегидов равновесие
практически нацело сдвинуто вправо и концентрация енольной формы
СН2=С—СН3 в ацетоне составляет лишь 2,5-10"4%- Это соответствуетОНбольшему содержанию энергии енола и большей его кислотности.
Чтобы компенсировать такую разницу, необходимы соответствующие
структурные изменения (дополнения) кето-енольной системы, которые
делали бы енольную форму энергетически более выгодной. На примере
ацетоуксусного эфира можно видеть характер этих обычных структур¬
ных дополнений:СНа—С=СН—С—OR СНз—С—СН,—С—ORI II II ' Iон о о оВ кетонной форме электрофильный , карбэтоксил (дополнительно
к карбонилу) оттягивает электроны от метиленовой группы и делает
водороды более протонизируемыми (иначе говоря, повышает кислотность
СН2-группы). Возникшая в енольной форме олефиновая связь оказы¬
вается сопряженной с карбонильной двойной связью карбэтоксила.
Сопряжение дает энергетический выигрыш, т. е. ионижает энергию
системы. Наконец, енольная форма дополнительно стабилизуется вну¬
тримолекулярной водородной связью — опять маленький дополнитель¬
ный выигрыш энергии:СНсн3-с^ \с-ос2н5I II
°\ . °
нВ результате в ацетоуксусном эфире содержание енольной формы
значительно больше, чем в ацетоне, и достигает 7%, но енольная форма
все же остается несколько менее устойчивой, чем кетонная. Соотноше¬
ние енола и кетона для разных веществ, естественно, разное (при оди¬
наковых прочих условиях). Существуют таутомерные системы, где енол
преобладает и даже доминирует, например в феноле:НС—СН^ \НС с—он
\ /
НС—снЭто соотношение резко зависит и от растворителя.
ТАУТОМЕРИЯ393енолкетонСоотношение енола и кетона целесообразно выражать в величинах
константы равновесия, где СеНол и Снетоп— соответствующие концен¬
трации, а К — константа равновесия, выражающая отношение этих кон¬
центраций (константа енолизации). Приводим значения К = ~^для ацетоуксусного эфира в разных растворителях при комнатной тем¬
пературе (20 °С):Вода 0,004 Этапов 0,13Муравьиная кис- Бензол 0,22лота 0,011 Эфир 0,43Метанол .... 0,074 Гексан 1Кетон и енол в разных растворителях в разной степени электроли¬
тически диссоциируют, и в этом заложена причина разных констант
енолизации в разных средах.Анион енола и кетона имеет одну и ту же (выровненную, мезомер-
ную) структуру:снз-с=сн-с-ос,н5 ч=±: сн3-с=0:н-с-ос,нг + н+I н - 5 J in II “ 5он о о оа б+СН3-С-СН2-С-ОС2Н5 м=±: СН3-С~СН~С-ОС2Н5 + Н
6 II 2 II г II—, IIО О О* Ов гФормулы б иг выражают на языке мезомерии одну и ту же струк¬
туру; в резонансной символике эта структура выразится так:СН3—С=СН—С—ОС2Н5 -<-> СН3—С—СН—С—ОС2Н5А- А А од еЭто означает, что истинной является какая-то средняя структура ме¬
жду структурами дне, но, конечно, не значит, что эта средняя струк¬
тура лежит точно посередине и заряд электрона распределен поровну
между О и С. Заряд в гораздо большей степени сосредоточен на более
электроотрицательном кислороде, и, таким образом, истинная структура
аниона значительно ближе к д, чем к е.Исходя из несомненно правильного допущения об идентичности ани¬
она енола и аниона кетона, М. И. Кабачник развил фундаментальную
теорию таутомерии Как кислотно-основного равновесия. Ход его мыслей
мы приведем в несколько упрощенном виде. При электролитической
диссоциации енола и кетона в растворителях, подобных воде, спирту,
эфиру, бензолу, эти растворители не остаются индифферентными и
играют роль льюисовых оснований* (см. стр. 147). Поэтому уравнения
электролитической диссоциации обеих таутомерных форм следует изо¬
бразить так:А,Н + S A' + SH (1)АПН + S ч=± A" + SH (2)* В растворителях, подобных бензолу или гекспну, не способных к присоедине¬
нию протона, при электролитической диссоциации енола и кетона роль льюисова
основания играют другие молекулы кетона или енола ^ауюиротолнз).
394оксокислотыЗдесь для краткости введены следующие обозначения: А~—анион,
общий для кетона и енола; AiH — кетон; АцН — енол; S — молекула рас-+творителя, отрывающего протон и переходящего в SH — л'ьюисову со¬
пряженную кислоту [Н30 для воды; (С2Н5)2ОН для эфира и т. д.].Обозначим через Кк константу равновесия для реакции (1), т. е.
константу кислотности кетонной формы, через Ке— то же для реакции
(2), т. е. для енольной формы; константу таутомерного равновесия в
среде S или, что то же самое в данном случае, константу енолизации
обозначим через /Стз. Напишем выражения для всех трех констант:у (3)*TS“ £А,Н] { )к _IA-][SH] ( )~ JAjH] [S] Wrr [A"] [SH]— [a^hJTs] (5)где выражения в квадратных скобках — концентрации реагентов.Выразим члены [AiH] и [АцН] через концентрации остальных ком¬
понентов и константыГАН1-ЬПМ1 га Н1-ЮМI 1 /Ск[S] lAUnJ- Л'е [S]и подставим их значения в уравнение (3);Кт (6)Выражение (6) означает, что константа енолизации в данном раство¬
рителе равна отношению константы диссоциации кетона к константе дис¬
социации (в том же растворителе) енола*. Таким образом, чем выше
константа кислотности кетона Кк по сравнению с константой кислотно¬
сти енола /Се, тем сильнее таутомерное равновесие смещено в сторону
енола, и наоборот.Из данных, приведенных на стр. 393, видно, что в спиртах й бензоле
енол кислее, а в воде много кислее, чем кетон; значит, равновесие в этих
средах смещено в сторону кетона. В эфире кислотности обоих таутоме-
ров становятся ближе и в гексане достигают равенства. Таким образом,
в сущности, здесь мы сталкиваемся с общей закономерностью — равно¬
весие смещено в сторону менее диссоциированного продукта.На основе теории кислотно-основного таутомерного равновеоия полу¬
чило объяснение соотношение кислотности и енолизируемости. Более
старое правило Клайзена признавало параллелизм кислотных свойств
и енолизируемости, т. е. чем «кислее» кето-енол, тем больше содержание
енольной формы в системе. Так, например, ацетилацетон, являясь более
сильной кислотой, чем ацетоуксусный эфир, содержит и больше енольной
формы. Однако имеется и ряд серьезных отклонений от правила Клай¬
зена. Так, циклогексанонкарбоновый эфир I — более слабая кислота по* В более общем выражении нужио взять термодинамические константы кислот¬
ности и помножить каждую на соответствующий коэффициент активности недиссоции-
рованной таутомерной формы в данном растворителе. Тогда это выражение определит
константу таутомерного равновесия для любого растворителя.
ТАУТОМЕРИЯ895сравнению с циклопентанонкарбоновым эфиром II, но он енолизирован
на 76%, в то время как последний — только на 4,5%:СН2
Н,0" \СН—Сн,Ао-сн—с:/С=0
СН2ОС2Н5Н2С\ /0=0
СН2
IIоОС2Н5По М. И. Кабачнику, соотношение кислотности и енолизируемости
имеет простое объяснение. Енолизируемость зависит от отношения кон¬
стант диссоциации кетонной и енольной форм, а кислотность — от абсо¬
лютных величин этих констант.Таутомерия, при которой частицей, перемещающейся в процессе тау¬
томерного превращения, является катион, называется катионотропией.
Частным, но самым важным случаем катионотропии является протоно-
тропия, или, сокращенно, прототропия. Частный случай прототропии —
кето-енольная таутомерия.В табл. 44 приведен ряд веществ, которым свойственна кето-еноль¬
ная таутомерия.Таблица 44. Константы равновесия н константы ионизации равновесных смес«й
некоторых кето-енолов в водных растворахiCTS — константа таутомерного равновесия; Кке ~ константа ионизации равновесной
смеси; Кк — константа ионизации кетонной формы; Ке — константа ноннзации
енольной формыВеществоПо литературным даннымПо данным Кабачннка **TS*ке*еАцетон2,5* 10““1,6-10“151,6. ю“156,4 -10“10Этнлацетоуксусный эфир9,2 ■ 10~41.8- 10“131,8 -10-13ОтООсчЦиклопентанонкарбоновый эфнр0,0022,1 • Ю“п2,1 • 10“"1,0- 10“Ацетоуксусный эфнр0,0042,1 • 10“"2,1 • 10~и5,3 • 10“®2-Метилннданднон0,0117,1 • 10“77,2- 10“76,5 - 10“5Метилацетнлацетон0,0161,5- 10""1,5-10““1,0-10“9Циклогексанонкарбоновый эфир0,0481,4 - 10“1Э1,4 • 10“133,2 • 10“12Бромацетнлацетон0,0811,0- ю“71,1 • 10“71.4-10“6Ацетнлцнклопентанон0,1781,5- 10“81.8- 10“81.0 - 10“7Ацетнлацетон0,221,2- Ю“91,4-10“96,5 - 10“9Ацетнлцнклогексанон0,418,1 • 10““1,2- 10“'°2,8 • Ю“10Бензоилацетон0,482,0- 10~93,0- 10“96,2- Ю“9Формилцнклопентанон0,681,5 - 10“62,5 -10“63,7- 10“®Формилциклогексанон0,944,5- 10“78,7-10“79,2- 10~7Димедон20,35,6-10~61,2- 10“46.0- 10“в* Вычисления производились по формулам:■(*Т5 + ‘)ДТ8
396ОКСОКИСЛОТЫОбращает на себя внимание гораздо более сильная енолизация дике-
тоноа сравнительно с эфирами р-кетонокислот. Причина, по-видимому,
в большей способности карбонила сравнительно с карбалкоксилом к со¬
пряжению с двойной связью енола (больший —Г-эффект).В малоновом эфире, напротив, и электролитическая диссоциация и
енолизация малы, несмотря на сильно протонизированный водород, кото¬
рый даже непосредственно замещается на металл при действии металли¬
ческого натрия. Это значит, что в енольной форме малонового эфираC2HsO—С—СН=С—ОС2НбII IО ОНводород енола относительно гораздо более кислый. Таково, по-видимому,
влияние соседнего этоксила.По протонизирующему влиянию на связанное с ними СНг-звено
(—/-эффект, стр. 179) различные функциональные группировки можно
расположить в следующий ряд (Арндт):-N02 > -S^ > -X > —C=N > -(Г ' > -cf > —с;СЖ° R ^Другими словами, группы этого ряда расположены по убывающей
(слева направо) способности оттягивать электроны от СН-связи в систе-
+ ^°мах типа H->C->N и таким путем усиливать кислотность водорода.NrОднако эта способность не стоит в параллельной связи со способностью
протона к перемещению к кислороду (или к азоту в группе —CsN).no
схемам типаI IН—С—С=0 с=с—о-нII 11илиI +^° I + /°н—с—n c=n:I Nr I ^о—нЕсли в углеводородном радикале имеется единственный заместитель
из приведенного ряда, то форма R—СН2—А (где А — функциональный
заместитель) всегда гораздо менее кислая, чем таутомерная форма
R—СН—АН, в которой протон перекочевал к кислороду или азоту
группы А. Равновесие же в таких монофункциональных соединениях на¬
столько сильно смещено в сторону форм R—СН2—А, что с наличием
форм R—СН=АН можно не считаться. Если же в p-положение к А вво¬
дится второй заместитель из того же ряда, то в полученной системе типа—С—СН2—С— или —С—CH2—NO, или —С—CH2—C=NII II II IIООО опротоны метиленовой группы становятся гораздо более кислыми, чем
в монофункциональном соединении, и могут быть сравнимы по кислот¬
ности с протонами таутомерной формы—С=СН— С-- — С=СН—N0, —С=СН—Cs=N и т. д.I И I Iон о он он
ТАУТОМЕРИЯ397Кроме того, как уже говорилось, таутомерная форма стабилизуется
понижением уровня энергии за счет сопряжения кратных связей С = С
и С = 0, С = С и N = 0 или С = С и Cs=N. Поэтому тенденция к еноли¬
зации и кислотность возрастают. При этом протонизирующее влияние
заместителей на связи С—Н является фактором, определяющим главным
образом кислотность С—Н-формы таутомерного вещества, а способность
групп А к присоединению протона с образованием енольной системы
связей определяет главным образом енолизируемость.При качественной оценке положения равновесия на основании струк¬
туры таутомерного вещества надо принимать во внимание действие за¬
местителей (как по /-, так и по Г-эффекту) в обеих таутомерных
формах.Имеется еще третий фактор — энтропийный. Чем больше степеней
свободы вращения и изменения своей конформации имеет молекула,
тем выше ее энтропия. Всякое закрепление формы связано с уменьше¬
нием рнтропии. Появление двойной С = С-связи в еноле с жестким плос¬
костным расположением заместителей при олефиновом углероде умень¬
шает энтропйю. Вероятность, таким образом, действует против енолиза¬
ции. Но и в без того жестких системах — в небольших циклах, например
в циклопентаноне,—это закрепление уже произошло и енолизация не
вызовет дополнительного уменьшения энтропии. Поэтому в жестких фор¬
мах енолизация относительно больше, чем в подвижных, например в
циклопентаноне больше, чем в пентанонах:СН2 СН2Н2СУ \с=0 Н2с/ \с—ОН СНз—СН2-С—С2Н6 3s=fc СНз—СН=С-С2Н5H.d:--СН, Н,С сн о онНапомним о других прототропных таутомерных системах, с кото¬
рыми мы уже встречались. Это нитро-аци-нитро-таутомерия, например+/°- +/о-R—СН2—N( R—CH=n'ч^0 М>Ннитрозо-оксимная таутомерия:R—СН—X <=* R—С—XI IIN==0 N—ОНгде X = —С—R или —N02 (в алкилнитроловых кислотах, стр. 202).ОСовершенно аналогична кето-енольной таутомерии не имеющая
большого значения имино-енаминная таутомерия—С=С// —С—</I \ II I \nh2 nh ни широко распространенная лактим-лактамная таутомерия (А. Байер)—С—N— —C=N—II I IО H оно которой будет идти речь при изучении гетероциклов (см. кн. II).Упомянем также тион-тиольную таутомерию тиокарбоновых кислотySHR-c! ч=± R—г;'чон о
398ОКСОКИСЛОТЫизученную в последние годы М. И. Кабачником, С. Т. Иоффе и
Ю. Н. Шейнкерам, и аналогичную таутомерию тиооксикислот фосфора
(М. И. Кабачник, Т. А. Мастрюкова):Ч R\ /SHRN)H Я'^ N)Все эти виды таутомерии, включая кето-енольную, называются три~
адной таутомерией, так как все таутомерное превращение — передвиже¬
ние протона и перемещение двойных связей — разыгрывается между
тремя атомами: триадой С—С = 0 в случае кето-енольной таутомерии и
выделенными жирным шрифтом триадами в-других только что приведен¬
ных случаях таутомерии.Существует также диадная прототропия. Примеры ее: таутомерия
синильной кислотыН—С=№ 4=fc »C=sN—н
таутомерия фосфористой кислоты и ее производныхОС2Н5 ОС2Н6Н—Р=0 Ч=* !Р—он
)СгН6 ОС2Н6icЗдесь таутомерное превращение происходит между двумя атомами —
С и N в первом, Р и О во втором случае.'Легко видеть, что в отличие от
триадной таутомерии диадная обязательно связана с переменой валент¬
ности одного из атомов (в наших примерах С и Р). ^Существует пентадная и более сложные системы таутомерии, которые
здесь не рассматриваются. По существу, прототропия обнимает почти
все известное о катионотропной таутомерии. Только около 1960 г.
Д. Н. Кравцов открыл ранее неизвестную металлатропию на примерах
циклических систем, включающих скелет типа:N—<i==c—с—(!: ч=* N=(i—<L=c—сI) OHgR <!)HgR огде R — ароматический радикал, а четыре углеродных атома, связанных
в сопряженную систему, входят в состав бензольного цикла.Прототропия такого рода (Н на месте HgR) давно известна. Это при¬
мер гептадной таутомерии.Обычно металлические производные таутомерных систем не тауто-
мерны, но обладают двойственной реакционной способностью наподобие
самих таутомерных систем. Прежде чем перейти к наиболее известным
веществам такого рода — енолятам натрия разного типа, к которым от¬
носится и натрийацетоуксусный эфир (стр. 390), упомянем о полученных
около 1950 г. ртутных производных оксосоединений (А. Н. Несмеянов,
И. Ф. Луценко).. Вещества типа I и II не таутомернысшгсн2-с^ шг=<°НгСТанвснг-с-снд сн2=с—сн3
ц ° <Wci -
ТАУТОМЕРИЯ399и имеют оксострук гуру, что доказывается отсутствием ионов ртути в рас¬
творах и отрицательной реакцией на углерод-углеродную двойную
связь. Между тем они обладают двойственной реакционной способ¬
ностью: иногда реагируют соответственно оксоструктуре, а чаще соответ¬
ственно енольной структуре. Ниже приведены примеры обоих типов
реакций;ООЛУ /О-С—сн3ClHg—СН2—+ СН3—С—С1 —► СНг=(/ +HgCl*. щ\н £ NhУ*ClHg-CH2-C; + Аг3СС1 —* Аг3с-сн2-с; +HgCI2 щ
\н хнгде Аг — ароматический радикал, например остаток бензола —1 фенилс6н5.Дело здесь заключается в том, что в реакции (1), проходящей с пе¬
ренесением реакционного центра (нормальным центром ацилирования
должен был бы быть углерод, связанный с металлом), электрофильная
атака карбонильного углерода хлористого ацетила проходит по кисло¬
роду. Это облегчается тем, что сильно поляризуемая связь Hg—С может
легко подать пару электронов соседней С—С-связи и компенсировать
отход пары электронов разомкнувшейся связи С=0 (кривые стрелки
показывают передвижение пары электронов):И (аС1-Нб-/СН^-С^0^С=0 —сз-н/ч сн2=с-о-с=о + сГ4 3 г ‘ ^Hj Н СИзПо существу, такое взаимодействие Hg—С- и С=0-связей имеет
много черт аналогии с сопряжением двойных связей (я,я-сопряжение),
например в системе С=С—С=0 (стр. 298), и может быть названо
о,я-сопряжением илц гиперконъюгацией. Действительно, на данном при¬
мере видно, что продукты ацилирования хлормеркурацетальдегида обра¬
зованы за счет 1,4-присоединения, и эта реакция 1,4-присоединения
сходна с присоединением, например, гриньярова реактива к непредель¬
ным кетонам в 1,4-положенияR RI1 XСН2=СН— С=0 + RMgCl —► R— СН2—СН=С—OMgCl4 3 2 1 4 3 2 1в том отношении, что в обеих системах рвутся связи 1,2 и 3,4 и появ¬
ляется кратная связь 2,3. Разница же в том, что при 1,4-присоединении
к я,хс-сопряженной системе вся молекула остается связанной (так как
рвутся лишь двойные связи), а при 1,4-присоединении к а, хс-сопряжен-
ной системе разрывается не только двойная 1,2-связь, но и простая3,4-связь (о-связь). Поэтому в результате реакции образуются две раз¬
дельные молекулы. Таким образом, перенесение реакционного центра
связано с сопряжением л,л- или о,л-связей.Аналогично дело обстоит и с двойственной реакционной способностью
натриевых производных оксо-енольных систем. Не вызывает сомнений,
что, например, натрийацетоуксусный эфирМяСН3—С—СН2-С-ОС2Н6 сн3-с=сн—с-осгн6 СН3—С=СН—С—OC2Hs
Л О <!>Н A d)Na А
400оксокислотыимеет енолятное строение, которое, по всей вероятности, близко к ион¬
ному, или ионное. В этом случае анион мезомерен, т. е. электроны в нем
только слегка сдвинуты в направлении кривых стрелок, так как кисло¬
род гораздо более электроотрицателен, чем углерод:СН3—С==СН—С—ОС2Нг:I*? II
0! оNa+В неполярных или малополярных средах катион натрия, очевидно,
образует ионную пару с кислородом енолят-аниона:ch3-c=ch-c-oc2h5
^ + нО Na ОВ случае лития и, еще более, магния, в большей степени склонных
образовывать ковалентные связи с кислородом, формулы металлических
производных правильнее уже изображать с ковалентной, хотя и сильно
поляризованной связью О—М:СНз—с=сн-с—ОС2Нб СНз— С=СН— С—ОС2Н5JL 11 А 11OLi О OMgCl ОМежду тем и натрийацетоуксусный эфир и только что упомянутые
другие металлические производные алкилируются не по кислороду, а по
углероду, т. е. с перенесением реакционного центра *:СНз—С=СН-С—ОС2Н6 + СН31 —► СНз—С—СН—С—ОС2Н5 + Nali-Na* А А А„, АВ момент атаки на углерод электрофильной частицы. СН3—I си¬
стема связейГЛ Г*м—о—С==С4 3 2 1ведет себя, следовательно, как а,п-сопряженная система, доставляющая
необходимую пару электронов новой связи с метальной группой за счет
разрывающейся простой связи 3,4. Таким образом, это опять 1,4-присое¬
динение по сопряженной системе связей.Высказывались предположения, что натрийацетоуксусный эфир таутомерен, а
именно металлотропенСНз—С=сн—С-ОС2Н5 ?=± СН3—С—СН—С—ОС2Н6-II II I IIONa О О Na ОI IIи что именно таутомерная форма II, не обнаружимая вследствие ничтожной кон¬
центрации, ответственна за алкилирование по углероду. Такого рода системы, в кото¬
рых из-за их двойственного реагирования предполагается таутомерия, но второй
таутомер нельзя реально выделить или обнаружить, были названы псевдомерными.
С этих позицийСНз—С—СН—С—ОС2Н6АNa Опсевдомер натрийацетоуксусного эфира.* Недавно М. И. Кабачиик и С. Т. Иоффе установили, что направление алкили-
рования натрийацетоуксусного эфира и особенно ацетилацетоната натрия изменяется
при наличии пространственных препятствий. Так, с вторичным йодистым пропилом
ацетилацетонат натрия дает 27% О-егор-пропильного производного, а с вторичным
иодистым бутилом — 35% О-втор-бутильного производного.
ТАУТОМЕРИЯ401Псевдомерия — отвергнутая в настоящее время точка зрения. Во многих случаях
предполагавшейся ранее псевдомерии можно доказать отсутствие псевдомера не¬
смотря на способность молекулы реагировать и в соответствии с предполагаемой струк¬
турой псевдомера, как мы только что видели на примере хлормеркурацетальдегида.
Это будет показано далее еще раз на конкретном примере. Общее же соображение
таково: если бы даже псевдомер и присутствовал в иеподдающихся обнаружению
малых количествах, то константа скорости реакции, протекающей через этот псевдомер,
должна была бы быть невероятно и небывало велика, чтобы компенсировать малость
концентрации псевдомера (М. И. Кабачник). Ведь скорость реакции пропорциональна
константе и концентрации реагента *.На следующих конкретных примерах енолятов металлов А. Н. Не¬
смеянову и В. А. Сазоновой удалось показать, что никакой кето-енолят-
ной таутомерии этих енолятов нет, но двойственная реакционная спо¬
собность енолятов независимо от этого существует. Показано это было
так. Полученные с использованием гриньярова реактива (или литий- или
натрийорганических соединений) цис- и гранс-изомерные еноляты (I иII) в определенных условиях устойчивы и друг, в друга не превра¬
щаются. Это доказывает, что они не превращаются и в кетонную фор¬
му III, иначе через нее шло бы и цис-транс-превращение:Однако при алкилированиях и ацилированиях цис- и туншс-форм I
и II каждая из них способна образовать как соответствующие ей по
строению и конфигурации производные, так и производные кетонной
формы III, т. е. вступать в реакцию, идущую с перенесением реакцион¬
ного центра. Реакции типа а проходят при R=—CQHs, реакции типа аPh2OKIPh,CH-CH-C-Ms
I (IIIIгде Ph- фенил C6H5Ms-мезитнл С6Н2(СНз)зОи б (одновременно) —при R == —СН2ОСН3:e Ph2CHN /MsR ОаPh2CH4 .OR'г* n'c=cи/ \visPh2 CH—CH—С—MsR О* Очень высокие константы скорости реакции наблюдаются только при рекой-
бинации ионов или радикалов.
\402 . ' оксокислотыПростейший мыслимый енолят — литиевый, енолят адетальдегида
СН2=СН—OLi получен А. Н. Несмеяновым и И. Ф. Луценко также
реакцией с перенесением реакционного центра:Hg СНа—+ 2Li —► 2СН2=(Г + Hg\ ^нЛ NhДействием трифенилметилнатрия '(PhJa’CNa на этилацетат можно
получить натриевое производное уксусноэтилового эфира:СН3— С—OCjH5 + Ph8CNa —► СН2==С—OC2Hs + Ph3CH
I) d)"Na+*Этот енолят (получающийся также при действии этилата натрия
или металлического Na на этилацетат) и служит реагентом при образо¬
вании ацетоуксусного эфира по реакции Гейтера — Клайзена, протекаю¬
щей с перенесением реакционного центра, которую можно представить
так:?С2Не ^ £сГНа+ • ?СаН5 ' JOснЛсс. ■ . '—>• СНо—с-СН„-С + СН?=СС ■ . '—>• СНо—с—сн2—сх4- ос*н* ^ "осА ‘—>- СН3-С=СН-С^° + C2HE(TNa+он . ' V. ОС2Н5Такая трактовка подчеркивает, что реакция натриевого енолята
сложного эфира протекает с перенесением реакционного центра и яв¬
ляется дополнением к общепринятой точке зрения Арндта на механизм
сложноэфирной конденсации (стр. 385), предполагающей, что уксусно¬
этиловый эфир атакуется мезомерным анионом:ОС2Н6СН3—С +А/>■ - />
сн2=с( •«-> СН2—С'NdCjHb ХОС2Н5.Na+ОС2Нв—► СНз—i—СН2—С—OCsH5 —► СН3—С=СН—С—ОС2Н6 + с2н6он
d)"Na+ (!) 0'Na+ I)Возникает вопрос, способны ли простейшие альдегиды и кетоны
двойственно реагировать, и притом с образованием именно производных
енольных форм, но не через таутомерный енол, содержание которого
слишком мало, а с перенесением реакционного центра? Такие реакции
известны. Так кетен ацилирует ацетон по уравнению:СНз— С—СНз + СН2=С=0 —► CHj=C—СНз
& О—С- СН3А
ТАУТОМЕРИЯ403Действием трифенилметилнатрия (стр. 402) можно заместить в аце¬
тоне водород на натрий:СН3—С—СН3 + Ph3CNa —► СН2=С—СН3 + (Ph)3CHII IО ONaГруппировка Н—С—С = 0, как и разобранная выше Hg—С—С = 0,
содержит систему о,я-сопряженных связей, только сопряжение здесь
менее ярко выражено и требуется более энергичный электрофильный
реагент, чтобы оно проявилось.Таким образом, металлические производные диадных и триадных
таутомерных систем могут вступать в реакцию или в состоянии, диссо¬
циированном на ионы, или в виде молекул и подвергаться в обоих слу¬
чаях атаке электрофила. Пусть А и В изображают крайние атомы диады
или триады, С — центральный атом триады, М — металл. Нижняя строч¬
ка конкретизирует эти схемы на примерах;М-А-В М++£в М—А—С=В М+ А-^-С'=ВM-0-N=0 М+ 0~N=0 М-О—С = С< М+ 6^С=0<I IСпрашивается, какие факторы способствуют реакции без переноса
реакционного центра (т. е. реакции по атому, с которым связан металл
или от которого он отделился при диссоциации) и какие вызывают пере¬
несение реакционного центра (т.е. атаку по другому крайнему атому
таутомерной диады, триады и т. д.)?А. Н. Несмеянов и М. И. Кабачник сформулировали для кето-енольной и лактнм-
лактамной триад следующие правила:1. Если связь М-^-0 сильно ионизирована, а реагент является катионом или
сильно электрофильной молекулой, то протекает быстрая О-реакция. Сюда относятся:O-ацилирование по Клайзену (т. е. хлорангидридом .в пиридиновом растворе), другие
реакции алкилирования четвертичными аммониевыми катионами, О-ацнлирование нат-
рийаЦетоуксусного эфира хлоругольным эфиром и др.2. Если связь О—М не ионизирована или ионизирована слабо, а реагент сильно
электрофилеи, то О-реакция протекает медленнее; начинает преобладать С-реакция
с перенесением реакционного центра. Так .протекает реакция хелатного медного про¬
изводного енола ацетоуксусного эфира с хлоругольным эфиром.3. Тот же результат наблюдается и в обратном случае, когда реагент слабо
электрофилен, но связь О—М сильно ионизирована. Это реакции алкнлнрования
(лучше — в ионизирующих средах) галоидными алкилами натриевых еиолятов и
натриевых производных лактим-лактамных триад или соответствующие реакции аци¬
лирования.4. При неионизированной связи О—М и слабо электрофильиом реагенте также
происходит О-реакция, на этот раз медленная, возможно, через четырехчленное пере¬
ходное состояние. Сюда относится, например, О-алкилирование галоидными алкилами
серебряных солей кето-енолов и лактим-лактамов.Приводим ряд алкилирующих реагентов в порядке возрастающей электрофиль-
ности:RI, R2S04, СН2=СН—СН2С1, С6Н5Вг, СН3ОСН2С1, R30 BFi
(CeHe)2CClfc (С6Н5)3СС1. (*-02NC6H4)3CBrТо же для ацилирующих реагентов:R—С—Cl, С1—С—ОС2Нб, [R—C—NRnCfA A L 4 J14*
404оксокислотыЧто касается самих триадных таутомерных систем, то их можно расположить
в следующий ряд по увеличивающейся склонности к О-реагированию их натриевых
производных:СНз\'NH СНзССН2СОС,Н5 и т. п./ II II0 0С=0С=05\СН—СН2—С /7%С6н5оСН3СНз/NHС-=0
с=оRCNH24но^ч^онUАнЭтот ряд следует считать скользящим по отношению к каждому из предыду¬
щих. Алкилирующий электрофил, достаточно сильный для начала ряда, будет уже
слабым для его конца.В целом дело сводится к следующему:1. В свободном анионе таутомерного соединения, будь то кето-енол или лактим-
лактам, заряд 6~ резко преобладает на более электроотрицательном кислороде. Если
электрофил —катион (СН3)зС+, (С6Н5)зС+, R—С+, то быстрая реакция идет как
ионная рекомбинация — по кислороду. ^2. Если связь М—О не ионизирована, металл экранирует доступ к кислороду,
и реакция идет по доступному — неэкранированному — углероду (или азоту), «под¬
вод» электронов к которому обеспечивается за счет +Г-эффекта:m-^o-lc==c'^I Iсн313. В обратном случае, когда электрофил слаб, а связь М+0~ — ионная, но атака
все равно происходит по углероду (или азоту), дело, видимо, в том, что взаимодей¬
ствия типаP-СНо'fo-CH=(-О I
?±сн=фСНо—Iтребуют для переходного состояния хорошей поляризуемости обоих реагентов в на¬
правлении, показанном стрелками: Между тем поляризуемость обеих молекул обеспе¬
чивается лишь в случае правой схемы, т. е. атака происходит по углероду за счет
+7'-эффекта енолятного аниона. Левая схема вследствие малой поляризуемости кис¬
лородного атома неосуществима или была бы осуществима только в более жестких
условиях, например при реакцииСН31 + NaOHСН3ОН + Nal4. Четвертый случай поясняется приводимыми схемами:Ag—о—сн=с:
2 !I СНз\С=0\Nс-0 AgCH3-IAg 0-CH=C/1+1 \
I СН3С=0
\ Ag
/С~0\ + I
N СНз
ЭФИРЫ P-ОКСОКИСЛОТ405Сходные причины управляют и алкилированием металлических солей диадных
таутомеров (Корнблюм):“->■ RONO + MX (M==Ag)MONO + RX—+ //QR—N + MX (M— Na)\o'Наиболее лаконично правило двойственной реакционной способности сформули¬
ровал Пирсон, разделивший все реагенты и фрагменты молекул двойственно реагирую¬
щих систем на «жесткие» (т. е. сильно полярные, но трудно поляризуемые) и «мягкие»
(противоположная характеристика). Правило Пирсона гласит: жесткое с жестким, мяг¬
кое с мягким.Во многих случаях направление двойственного реагирования зависит также от
других факторов — сольватирующен способности растворителя, его диэлектрической
проницаемости, гетерогенности или гомогенности среды, пространственных факторов.Растворитель, сильно сольватирующий электрофил, понижает его электрофиль-
ность со всеми вытекающими отсюда последствиями. Если растворитель сильно соль-
ватирует кислород триады (прочная водородная связь) и этим его блокирует, реакция
направляется на другой конец триады. То же действие оказывает образование ион¬
ных пар в неполярных средах или гетерогенность среды (Корнблюм).Эфиры ^-ОКСОКИСЛОТКак мы показали, эфиры (5-альдегидо- и р-кетонокислот при дейст¬
вии на них алкоголята натрия в спиртовом растворе превращаются в
натриевые еноляты, например:C2H5ONaС~СН2-С-ОС2Нъ <=> Н-С=СН—С-ОС2Н5 : ► H-C=CH-C-OCsH5II I II I IIО ОН О ONa Оформнлуксусный эфирСНз—С—СН2—С—ОС2Н6 =г=* СНз— С=СН—с—ос2н6 .С2Н.5(Ж.а>0 0 он оацетоуксусный эфир—V СН3-С=СН-С-ОС2Н5IONaIЭти еноляты широко используются в синтезах с образованием новых
углерод-углеродных связей. Почти все реакции таких натриевых произ¬
водных с разнообразнейшими соединениями RX, где R— любой органи¬
ческий радикал, а X — достаточно подвижный галоид, связанный с угле¬
родом, проходят по углероду. Приведем несколько примеров реакций
натрийацетоуксусного эфира с RX, где R = —СН3, —C2H4CI,
—СН2—СООС2Н5 причем продукт реакции подвергнем и кетонному
и кислотному расщеплению (стр. 391):I. СНз—С=СН-С—ОС2Н5 + СН31 —>- СНз-С-СН—С—ОС2Н6 + NalI II II I IONa О О CHjONa+OH~: Н20СНз—С—СН—С—ОС2Н5 СН3—С—ONa + СН2—С—ONaII I II -C2H5OH . , цО СНз О О СНз О| Н+; Н20СН3--С -СН-С-ОН ——> СНз—С-СН2—СНз
II | || -со2 иО СНз О О
406ОКСИОКСОСОЕДИНЕНИЯII.2CHS—С=СН—С—ОС2Н5 + ClCHj—СН2С1—2N аС1ONa О
О ОII II ,
сн3—С—СН—С—осан5I(CHS)S
СН3—С—СН—С-ОС*Н6II IIо оNa+OH~i Н2о-2CHjCOONa; NaO-C-(CH2)4-C-ONa
-2CsH6OH Д,Н+; Н20—2С02:
-2С2Н59НОсоль адипиновой кислоты+■ СН,—С—(СН2)4—С—СН3II IIо о. октандион-2,7III. СН3—С=СН-С—ОС*Н6 + С1СН2-С—ОСгН6 СНз-С-СН-С-ОС2Н6ONa Оh01О CHj-C-OCsH6IIоо оСНз—с—СН—С—OC2H6 Na+OH"; Н2о СН2—с:—ONaАсн2—с—осан6АН+;н2о*■ I • + 2С2Н5ОН + CH3COONaСН2—С—ONa
&соль янтарной:
кислоты2С£Н6ОН +ОIIСН,—С—СН—С-ОНЬ СНг— С—ОНАацетилянтарная кислотаси3-~с—СН2СН2—с—онII IIо олевулнновая кислота+ со2Сравнивая вещества, полученные кислотным расщеплением продук¬
тов алкилирования натрийацетоуксусного эфира, с веществами, получен¬
ными алкилированием натриймалонового эфира с последующим декарб-
оксилированием замещенной кислоты (стр. 187), мы видим, что они
одинаковы. Но кетонное расщепление ацетоуксусного эфира дает новые
возможности синтеза кетонов, полиоксосоединений, кетонокислот и т. д.
Поскольку сложноэфирной конденсацией можно получать великое раз¬
нообразие эфиров р-кетонокислот открытой и циклической структуры,
с одной и двумя оксогруппами, одной и двумя карбоксильными груп¬
пами, а эти эфиры можно ввести в реакцию Михаэля, то ясно, что алки-
лирование натриевых производных всех этих структур с последующим
кетонным или кислотным расщеплением дает в руки химика чрезвы¬
чайно гибкий и могущественный метод построения углеродных скелетов.Синтез кетонов и кислот через эфиры р-кетонокислот нужно доба¬
вить к другим ранее изученным методам синтеза этих типов веществ.ОКСИОКСОСОЕДИНЕНИЯПростейшие оксиоксосоединения приведены в табл. 45. Они могут
быть синтезированы общими методами введения гидроксила в оксосое-
динения и введения оксогруппы в вещества, содержащие гидроксил. Так,
ОКСИОКСОСОЕДИНЕНИЯ407гликолейый альдегид можно получить окислением гликоляСН2—СН2 СН2-СГI I —> I чн
он он онили частичным восстановлением глиоксаля:Н\ /Н
;с-< —»■ сн2-сг
о^ I чн
онГлицериновый альдегид получается при частичном окислении глице¬
ринасн,—сн—сна —* СН2-СН-С'III I I ^НОН ОН ОН ОН она диоксиацетон — путем гидролиза 1,3-дихлорацетона:С1—-СНа—С—CH2—CI —► СН2-С-СН2А Ан А АнГлицериновый альдегид и диоксиацетон в щелочной среде вслед¬
ствие енолизации могут взаимопревращаться:он-сн2—сн—с сн2~с=с; ч=* сн2—с—Сн2I I II ^ОН I 1 Iон он он он он о онТакое превращение (до достижения равновесия) типично для всех
а,р-оксиоксосоединений.Таблица 45. ОксиоксосоединеиияФормулаНазваниеТемпера¬тураплавления,°СТемпературакипения,°СПлотностьdсн2—сх
1 чн
онснасн—сн2—ск ЧНонГликолевый альдегидАльдоль, или р-окси-
масляный альдегид97Сироп83(20 мм рт. ст.)1,366
(при 100°С1,103юсн2—сн—с,1 1 ^н
он онГлицериновый альдегид138; 145140—150
(0,8ммрт. ст.)1,455Юсн2—с—сн2
1 1! 1Диоксиацетон89*— он d> онСНз—CH С—СНзi IОН 0Ацетоин151481,002ю* Кристаллизуется а виде димера.
'08ОКСИОКСОСОЕДИНЕНИЯАльдольная конденсация приводит к (5-оксиоксосоединениям:ОН"СНз-С—Н + СНз—с-н —»• сн3—сн—сн2—С—нII II I IIо о он оальдольСНзОН- I2СН3—с—СН3 * СНз—с—СН2—с—СНз4он одиацетоновый спиртИного типа конденсацией, открытой еще А. М. Бутлеровым, форм¬
альдегид в водном растворе под действием известковой воды превра¬
щается в смесь изомерных и стереоизомерных гексоз, т. е. пентаоксимо-
нооксогексанов, относящихся уже к сахарам и подробно обсуждаемых
ниже:он~6СН20 ► СН2—СН—CHv-CH— СН—С—Н и СН2-СН— СН—СН—С—СН2ОНI I I I I II I I I I IIОН ОН ОН ОН ОН О ОН ОН он он о(Такую смесь Бутлеров назвал «метиленитан», а Эмиль Фишер вы¬
делил из этой смеси «акрозу» — рацемат фруктозы.) Тот же результат
получается при альдольной конденсации глицеринового альдегида с ди-
оксиацетоном:/НСН2—CH-C +СН2—С—СН2 —V сн2—сн—сн—сн—С-СН2ОНI I 'Ч) I II I I I I I IIон он он О ОН он он он он оЕсли взять D-глицериновый альдегид, то получается углевод —
фруктоза и в несколько меньшем количестве ее диастереомер — сорбоза.
Если исходить из рацемического глицеринового альдегида в смеси с ди-
оксиацетоном (такая смесь получается осторожным окислением глице¬
рина и называется глицерозой), получается та же акроза Бутлерова и
Э. Фишера.Существенно важным для понимания дальнейшего является метод
надстройки оксиальдегидов, приводящий к оксиальдегидам, имеющим
в цепи на одно звено СНОН больше. Этот метод заключается в присое¬
динении к оксиальдегиду синильной кислоты, гидролизе полученного
оксинитрила в оксикислоту и восстановлении эфира или лактона этой
оксикислоты в оксиальдегид. В качестве примера приводим наращива¬
ние цепи глицеринового альдегида:HCN н20(н+)СН2— СН— с( ► СН2—СН—СН—CN ► СН2—СН—СН—СТ I хн III III \он-Н2°он он он он он он он онуР H20(NaHg)' сн2—сн-сн—сх * сн2-сн—сн—схон он
—о I I I
он он онЗаметим, что при реакции возникает новый асимметрический угле¬
родный атом в a-положении по отношению к альдегидной группе.
ОКСИОКСОСОЕДИНЕНИЯ409Новый метод наращивания окси- и полиоксиальдегидов сразу на
два звена СНОН с использованием реакции Виттига (стр. 247) разра¬
ботали Н. К. Кочетков и Б. А. Дмитриев:СООС2Н;IСНО1СН!(СН0Н)„(С6Н5)3Р=СН—СООС2Н5
.— >IIСН1СН2ОН1(СНОН)„1СН.ОНIIIСООС2Н5СНОjСНОН1СНОН1 NaHg
—► СНОН ►1СНОН1(СНОН)„1(СНОН)*11СН2ОНСН2ОНшIVОксиальдегид I реагирует с трифенилфосфинкарбэтоксиметиленом,
образуя непредельную кислоту II с транс-конфигурацией. Двойная связь
в непредельной кислоте может быть прогидроксилирована (например,
действием OSO4), а полученный эфир полиоксикарбоновой (альдоновой)
кислоты III восстановлен амальгамой натрия в полиоксиальдегид IV,
имеющий на два углеродных атома больше, чем исходное соединение.Метод позволяет наращивать сразу два углеродных звена и регули¬
ровать стереохимию возникающих асимметрических центров.Свойства оксиоксосоединенийЕстественно, что оксиоксосоединения вступают во многие уже изве¬
стные нам реакции своими спиртовыми и альдегидными или кетонными
группами. Эти реакции здесь не будут рассматриваться, если только для
этого не будет оснований с точки зрения дальнейшего изложения.Так, спиртовые группы оксиоксосоединений ацетилируются уксус¬
ным ангидридом, и по его расходу можно судить о числе оксигрупп в мо¬
лекуле. Первичные спиртовые группы могут быть окислены в альдегид¬
ные и затем в карбоксильные. Альдегидные группы можно восстановить
в первичные спиртовые, а кетонные — во вторичные спиртовые. Все эти
реакции устанавливают родственные связи оксиоксосоединений с окси-
кислотами и многоатомными спиртами. Проиллюстрируем такие род-
ственные отношения на примере структур глицеринового альдегида, тет-
раоксипентаналя (альдопентозы) и пентаоксигексаналя (альдогексозы),
не вникая пока в стереохимические отношения (см. схему).<Ч/Но\/оСН,ОНс1сСНОН Л-' 0
СНОН —>1СНОН "jСН2ОНIСН2ОН1СН2ОНглицеринглицериновыйальдегидглицериноваякислота
410ОКСИОКСОСОЕДИНЕИИЯсн2онЧ/нсЧ/онсСНОН1СНОН1н СНОН
СНОН1о СНОН
СНОН1СНОНjСНОНjСНОН1сн2он1СН2ОН1СН2ОНпятиатомный альдопентоза «оновая» кислота
спиртсн2онЧ/н -сЧ/онС1СНОН1СНОН11СНОН11СНОНн 1СНОН2+ снон Д1СНОН1СНОН1снон1СНОН1СНОН1снон1СН2ОН1СН2ОН1СН2ОНзестиатомный альдогексоза
спирт«оновая»
'кнелотаЧ /ОН
сч /онс1СНОНj, снон—*■I н
СНОН1снон1СНОН1. снон1СНОН1снонС\энсахарная, или
«аровая» кис¬
лотаС^ '"'Ноуроновая кислотаВажное значение имеют реакции оксиальдегидов с гидроксидами-
ном. Образующиеся при этом оксимы при действии водоотнимающих
веществ превращаются в нитрилы, от которых ионом серебра можно от¬
нять HCN и получить оксиальдегид, укороченный на одно звено СНОН:Н\СIСНОНIСНОНСНОНСНОНСН,ОНh2nohН^ ^NOHСНОНIСНОНIСНОНIСНОНIСН2ОН-н2оC=NIСНОНIСНОНIСНОНIСНОНс:н2онА г;о\ SСIСНОН + AgCNСНОНIСНОНIСН2ОН
ОКСИОКСОСОЕДИНЕНИЯВсе эти реакции не представляют для нас ничего нового, но с их по¬
мощью осуществляется важный переход от гексозы к пентозе, или от
пентозы к оксиальдегиду с тремя спиртовыми звеньями, или, наконец,
от последнего к глицериновому альдегиду.Реакция оксиальдегидов с фенилгидразином протекает иначе, чем
для обычных альдегидов. Образуются так называемые озазоны (Э. Фи¬
шер) — желтые кристаллические вещества, при гидролизе кислотой пре¬
вращающиеся в озоны — оксикетоальдегиды:^N—NHC5H5С СI . I 2Н20(Н+)СНОН + 3H,N-NHC6H5 > C=N-NHC6Hs »■J —'NH3;—C5H5NH2 jCH2OH CH2OHозазон глицеринового
альдегидан\^°с—► Q=0 + 2C6H6NH—NH2
ICH2OHозон глицери-
нового альдегидаОзазоны представляют собой бис-фенилгидразоны озонов.Механизм этой необычной и важной реакции выяснен М. М. Шемя¬
киным и может быть выражен схемой:НЧ ^о нч нчС C=N-NHC6H5 C=NHI I IСНОН + HjN—NHC6Hs ——► CHOH —► C=0 + C6HSNH2I -H2o J (CH2OH CH2OH CH2OHH\ . H4C=NH C=N—NHCeHsC=0 + 2H2N—NHC6HS —► C—N—NHC6HS -j- H20 + NH3
I ICH2OH CH2OHу- и 6-Оксиоксосоединения являются носителями нового вида прото-
тропной таутомерии, которая называется оксо-цикло-таутомерией и со¬
стоит в том, что открытая форма существует в равновесии с циклической
формой, обычно сильно преобладающей:Н\ Х> Н3СЧ .Охс^ Н^ /ОН Н3С-Х /ОНI С I с
сн2 ^ н2с/ \о сн2 *=*: н2су \оI I I I IIСН2 Н2С СН2 СН2 Н2С\ /СН2сн2он сн2Iсн2онсн
412УГЛЕВОДЫУГЛЕВОДЫВ живой природе широко распространены вещества состава С5Н10О5,
С6Н1206, (С6Ню05)ж, С^НггОн. которые явным образом находятся
между собой в родственных химических отношениях. Например, послед¬
ние два типа превращаются во второй тип в результате гидролиза. Все
они имеют ряд сходных реакций. Ввиду того что по составу эти веще¬
ства представляют собой как бы Cri(H20)m, их назвали углеводами
(Шмидт, 1844 г.), и это название сохранилось, хотя химического смысла
оно не имеет.К углеводам относятся простейшие сахара (обыкновенный свекло¬
вичный, или тростниковый, сахар — сахароза, виноградный сахар — глю¬
коза, фруктовый сахар — фруктоза, молочный сахар — лактоза), крах¬
мал и гликоген, клетчатка, из которой строится оболочка растительных
клеток (отсюда и название «клетчатка» или «целлюлоза»), известная
в обыденной жизни в почти чистом состоянии в виде ваты и фильтро¬
вальной бумаги, а в связанном с лигнином состоянии — в виде древе¬
сины.В растениях находятся полисахариды (полиозы)—высокомолеку¬
лярные продукты поликонденсации моносахаридов (моноз), образую¬
щиеся из них с потерей воды и являющиеся, таким образом, ангидрид¬
ными формами сахаров. Гидролизом в кислой среде они превращаются
в моносахариды. Дисахариды, трисахариды — тоже ангидридные формы,
включающие соответственно два и три остатка моноз и также гидроли¬
зующиеся с образованием моносахаридов. Это так называемые олигоса¬
хариды. К ним относят биозы, триозы, тетраозы и другие полиозы с ма¬
лым числом монозных кирпичей, образующих молекулу полиозы. Нако¬
нец, в свободном состоянии в небольших количествах в растениях нахо¬
дятся и сами монозы, являющиеся основной структурной единицей биоз,
триоз и т. д., полиоз. Из моноз чаще всего встречаются пентозы С5Н10О5
и гексозы C6Hi206. Известны также гептозы, октозы и другие высшие
моносахариды.МОНОСАХАРИДЫСтроение моносахаридовВосстановлением иодистоводородной кислотой все пентозы превра¬
щаются во вторичный нормальный иодистый амил (пениил)
СНзСН2СН2СН1СНз, а гексозы — во вторичный нормальный иодистый
гексил СН3СН2СН2СН2СН1СН3, чем устанавливается, что пентозы имеют
неразветвленную цепь из пяти, а гексозы — из шести углеродных атомов.
По аналитическим данным и молекулярному весу все пентозы соответ¬
ствуют формуле С5Н10О5, а гексозы — C6Hi206. Пентозы ацетилируются
уксусным ангидридом или хлористым ацетилом, приобретая четыре аце¬
тильных остатка, т. е. образуют сложный эфир. Значит, они имеют че¬
тыре гидроксила. Та же реакция устанавливает для гексоз пять гидр¬
оксилов (А. А. Колли, 1869 г.). Большинство пентоз в реакциях присо¬
единения синильной кислоты, образования оксима с гидроксиламином и
окисления посредством окиси серебра или фелинговой жидкости обнару¬
живают, что один из пяти их углеродных атомов — альдегидный. Во всех
гексозах по первым двум реакциям устанавливается наличие одной оксо-
группы. Но в одних гексозах (глюкоза, манноза, галактоза и др.) это
альдегидная группа, окисляемая фелинговой жидкостью или аммиачным
раствором окиси серебра в карбоксил; в других гексозах (фруктоза,
МОНОСАХАРИДЫ413сорбоза), а также в пентозе — рибулозе — это неточная группа, не вос¬
станавливающая ни фелинговой жидкости, ни аммиачной окиси серебра,
но присоединяющая синильную кислоту с образованием бокового ответ¬
вления, в отличие от моноз-альдегидов, которые с синильной кислотой
удлиняют скелет неразветвленно, нормально.Гексозы-альдегиды называются альдогексозами, гексозы-кетоны —
кетогексозами. Легко установить, что в природных кетогексозах кетон-
ная группа занимает второе положение, так как именно в этом месте
присоединение синильной кислоты создает ответвление в цепи углерод¬
ных атомов. Все эти факты приводят к следующей структуре моноз (или
моносахаридов):П е н т о з ыСН,—СН—СН—СН—С си2-сн-сн—с-сн3I I I I 4l ! I I II Iон он он он он он он о ональдопентозы кетопентозысн2-сн-сн—сн—с-сн2
I I I I II I
он он он он о онкетогексозыДействительно, каждый гидроксил должен один занять место у угле¬
родного атома; два гидроксила у одного углеродного атома не удержи¬
ваются (правило Эрленмейера), а с отщеплением воды образуют оксо¬
группу.Таким образом, казалось оы структура моноз устанавливается про¬
сто (Э. Фишер). Дело, однако, осложняется таутомерией, а именно
оксо-цикло-таутомерией, свойственной у и б-оксиоксосоединениям. Эта
таутомерия, называемая также кольчато-цепной таутомерией, может
быть выражена схемами:Г ексозысн2—сн—сн—сн—сн—сI I I I I \н
он он он он ональдогексозы
414\УГЛЕВОДЫДоводы в пользу циклической структуры моносахаридов были изве¬
стны еще до исследований Э. Фишера, и первыми формулами, предло¬
женными для моносахаридов, были циклические формулы, которые отли¬
чались от приведенных выше тем, что предполагалось взаимодействие
оксогруппы не с б-оксигруппой, а с а-оксигруппой (А. А. Колли) или
с Y-оксигруппой (Толленс), и цикл соответственно писался не шестичлен¬
ный, а трех- или пятичленный. Впрочем, как мы увидим, ^-замыкание
в моносахаридах тоже бывает.Э. Фишер придал моносахаридам открытую структуру, убедившись,
что они дают почти все реакции оксосоединений. Какие же доводы
в пользу циклического строения моноз заставили вернуться к оставлен¬
ным было циклическим структурам?При алкилировании иодистым метилом или диметилсульфатом в ще¬
лочной среде пентозы получают четыре, а гексозы — пять метилов, что
согласуется с числом гидроксильных групп, установленным путем аце-
тилирования. Однако тетраметилпентозы и пентаметилгексозы при этом
теряют свою способность к альдегидным (или кетонным) реакциям.
Кроме того, одна из этих метальных групп резко отличается по свой¬
ствам от остальных и вообще от поведения алкоксилов простых эфиров:
в то время как простые эфиры не гидролизуются ни в щелочных, ни в
кислых растворах, эта особая метальная группа, хотя и устойчива к дей¬
ствию щелочей, тотчас гидролизуется разбавленными кислотами, и после
этого к моносахариду, еще несущему остальные метилы, возвращаются
свойства альдегида (или кетона).Напомним, что есть три главных вида алкоксильных групп: алк-
оксилы простых эфиров, не гидролизуемые ни кислотой, ни щелочью;
алкоксилы сложных эфиров, гидролизуемые и кислотой, и щелочью; аце-
тальные алкоксилы, устойчивые к щелочи и гидролизуемые кислотами:Простой эфирный Сложноэфириый . Ацетальиыеыетоксил метоксил метоксилы/ОСН3С2Н6-0-СНз СНз-С-ОСН, СНз—сI ^осн,Таким образом, судя по его свойствам, четвертый (в.пентозах) или
пятый (в гексозах) особый метил входит, очевидно, в состав ацетильной
группы.Еще один факт. Моносахариды в кислой среде легко метилируются
метиловым спиртом, заполучая один-единственный метил, обладающий
только что описанными свойствами ацетального метила. Такие производ¬
ные называются гликозидами * (в данном случае образуется метилгли-
козид)*В метилгликозиде свойства оксофункции снова исчезают. Кроме
того, от метилгликозида в кислой среде легко отщепляется при гидро¬
лизе метил и снова образуется исходный моносахарид. Таким образом,
в гликозидах алкилированию подвергся гидроксил, несомый в таутомер-
ной циклической форме бывшим карбонильным углеродом. Все это со¬
гласуется с приведенными ниже схемами метилирования;* Гликозид — типовое название, общее для алкильных и других ацетальных
производных сахаров, глюкозид—термнн, обозначающий такие производные именно
глюкозы.
МОНОСАХАРИДЫ4151. М ети л иров а ни е альдопентозы:н н , н нV ~ \/
с о с ог/ \Г^Н КОН V^Hно^с\ / ^ОН + -4СНя! - *- сн3о/сч /с"осн,
с с с с/\ /\ /\ Ано н н он сн3о н н ОСНзтаутомерная форма теграметилпентоза -. альдопентозы г ч|н2о(н+)н н
\/с-—-оснг-сн—<j:h—^ сн,о>< )с<онОН ОСНз ОСНз ОСНз ' у ссн3о Н Н осн3таутомерные формы трнмвтилпентозы2. М ет и л и р о в а н и е а л ьд ore к с о з ы:н сн2он н сн2осн3> с о с оН^-У V^H 4- чгнг Шн> Н^г/ \_^Н
но^с\ ■ /с^он + г сн3о^с\ /с^осн3с—с с с/\ . /\ /\ /\'HO Н Н ОН СНзО Н Н ОСНзтаутомерная форма пента метила льдогексо эа^ н2о(н+)-СН3ОНальдогексозыН СН2ОСН3с оот2-сн-сн-сн-^-с^° /с<шОСНз он ОСНз ОСНз ОСНз . Д—Дсн3о н н ОСНзтаугомерныв формы тетраметилалъдогекспзы3. Метилирование кетогексозы:Н Н Н н\/ \/С—О С—он^г/ \г/ОН тн^ • / \ /ОСН3но/С\ /с^сн2он + 3 СН30^Ь\ /ЬхСН20СН3Я—я я яНО Н н он сн3о н н осн3таутомерная форна пентаметилнетотенсозакетогексозы |н30(н+)1-СН3ОНН НУ Он / онСН2-СН—сн—СН—С—СН2 XrunruI 2 I I I II I сн3о^ \ / СН2ОСН3ОН ОСНз ОСНз ОСНз О ОСНз с—дсн3о Н Н ОСНз
таутомерные фермы тетраметилкетогексозц
416УГЛЕВОДЫ4. Действие метилового спирта:Н Н\/С о\^Н СН3ОН(Н+)./с\—с\но н н он но Н Н ОНальдодантоза метилгаикозидОсобенно ясный аргумент в пользу особых свойств одного гидр¬
оксила— исчезновение реакции альдегида (или кетона) при замещении
гликозидного гидроксила на метил и ее появление при удалении метила
гидролизом. Гликозидным гидроксилом называется гидроксил при (быв¬
шем) карбонильном углероде.Остается выяснить вопрос, является ли цикл в циклической форме
шестичленным или пятичленным, как принимал Толленс, или каким-либо
иным. Путем окисления в дикарбоновые кислоты продуктов метилирова¬
ния моносахаридов решается и этот вопрос. Обратимся к открытым тау-
томерным формам метилированных моноз из схем 1—3 и напишем реак¬
ции их окисления перманганатом. Окисление направится на неметилиро-
ванные гидроксилы и оксогруппы, так как простые эфиры более устой¬
чивы к окислению:сн,—сн—сн— сн—с:оКМп04онI I I \нОСНз ОСНз ОСНзKMnOiнсн2-сн—СН—СН—СН—с
I I I I I
ОСНз ОН ОСНз ОСНз ОСНзСН^-СН—СН—СН С—СН2ОСН3 ■ КМп?4 >I I I I II
ОН ОСНз ОСНз ОСНз Оонос—сн—см—сн—С'уо\ОСНз ОСНз ОСНз
триметоксиглутаровая кислв*аонНаличие триметоксйглутаровой кислоты в продуктах окисления ясно
доказывает 6-замыкание (шестичленный цикл). В случае у-замыкания
получалась бы диметоксиянтарная кислота, а триметоксиглутаровая
полностью отсутствовала бы.При использовании этих методов было получено доказательство су¬
ществования трех таутомерных форм сахаров — ациклических полиокси-
альдегидных форм (аль-формы), циклических форм, имеющих шести¬
членный цикл (пиранозы), и соединений с пятичленным циклом (фура-
нозы) *. Эти три формы в растворе находятся в таутомерном равновесии,* Эти названия (Хеуорс) происходят от названий гетероциклов: пиран (шести¬
членный) и фуран (пятинленный).
СТЕРЕОХИМИЯ МОНОСАХАРИДОВ417причем пиранозная форма присутствует в преобладающем количестве.
Для альдогексоз это равновесие можно изобразить следующим образом:Н,НОНС"I>сн2-он■с.У ''он
А-сн-сн-сн-сн— с
1111
он он он он.0Н°Н2С HO н н оннн сн?он-s>Vно н н онТаким образом, моносахариды обладают структурой циклических
шестичленных и пятичленных полуацеталей, которая таутомерна со
структурой оксиальдегидов или оксикетонов. Таутомерные равновесные
системы, однако, существуют только в жидком состоянии (так называе¬
мые аллеллотропные смеси, подобные смесям, образуемым ацетоуксус-
ным эфиром), или в растворах, но не в кристаллах. Между тем моноса¬
хариды— твердые кристаллические вещества. Какая же из таутомерных
форм принадлежит им в кристаллическом состоянии?На этот вопрос дает ответ стереохимия, и ответ этот — циклическая
форма. Открытая оксоформа появляется лишь в растворе.СТЕРЕОХИМИЯ МОНОСАХАРИДОВ. ОПТИЧЕСКАЯ ИЗОМЕРИЯ. IIСледуя Э. Фишеру, рассмотрим сначала стереохимию открытых тау¬
томерных форм моносахаридов. На этом важном примере необходимо
усвоить методы установления конфигурации чисто химическим путем.
В ряду соединений — от глицеринового альдегида до альдогексозы — чи¬
сло асимметрических углеродных атомов (помеченных звездочкой) воз¬
растает от члена к члену на один:Hw° Н\^° Hw° Hw°с с с сI 1.1 Iн—с*—он н—с*—он н—с*—он н-с*—онIII!сн2он н—с*—он н—с*—он н—с*—онI I Iсн2он н-с*—он н—с*—онI Iсн2он н—с*—онIсн2онЧисло стереоизомеров, как было сказано на стр. 364, равно 2", где
п — число асимметрических углеродных атомов. Рацематы при этом не
учитываются, так как они не представляют самостоятельных конфигу¬
раций. Таким образом, для глицеринового альдегида число стереоизоме¬
ров равно двум (антиподы D- и L-глицериновый альдегид); для альдо-
тетроз — четырем (две пары антиподов, каждый диастереомерен по отно¬
шению к антиподам второй пары); для альдопентозы — восьми (четыре
пары антиподов, каждый из которых диастереомерен по отношению к
418УГЛЕВОДЫшести остальным); для альдогексоз — 16 (восемь пар антиподов). Таким
должно быть число стереоизомеров для открытых структур сахаров.
Между тем для альдопентоз на деле известно 16, а для альдогексоз
32 стереоизомера (8 и 16 антиподных пар соответственно). Значит, от¬
крытые структуры не учитывают наличие еще одного асимметрического
углеродного атома в альдопентозах и альдогексозах. В циклических
формах имеется четыре асимметрических углеродных атома в альдопен¬
тозах и пять в альдогексозах, что находится в полном согласии с фак¬
тами;НН НСН2ОНС—-Q С ОЬКС< >С/Н н_/* V, н
НО^°\* */Cv-OH НО-'С\* !*/С'"'ОНс-—с с—с
/\ /\ /\ /\
но н н он но н н ональдопечтоза альдргексозаВ твердом состоянии все 16 альдопентоз и 32 альдогексозы вполне
устойчивы. Но стоит любую из них растворить, например в воде, как
начинается рацемизация вокруг одного из углеродных атомов, за кото¬
рой можно количественно следить, поместив такой раствор в трубку по¬
ляриметра. Вращение плоскости поляризации луча постепенно меняется
(мутаротация) и наконец достигает постоянной величины. Это значит,
что установилось равновесие двух диастереомерных форм моносахарида,
отличающихся лишь конфигурацией первого (бывшего карбонильного)
углеродного атома и одинаковых в остальной конфигурации. (Количе¬
ство открытой формы пренебрежимо мало.)Причина мутаротации вполне понятна — это явление связано с тау-
томеризацией в растворе и выражается, например для альдогексозы,
следующей схемой (в перспективном изображении циклических форм
фиксировано только расположение вокруг первого углеродного атома,
а альдегидная форма приведена только в структурном, но не конфигура¬
ционном изображении);Н О\//Н СН2ОН .. с Н снрни Л—л он н~гон н я-л нно н н он н-с-он но НН он
сн2онДйастереомеры сахаров, различающиеся конфигурацией только быв¬
шего карбонильного углерода, обозначаются как а- и (3-формы данного
сахара. Они, как это и свойственно диастереомерам, отличаются по свой¬
ствам, например имеют разную растворимость, благодаря чему их можно
отделить друг от друга, так как скорость превращения диастереомеров
не слишком велика.До выяснения вопроса, какие конфигурации соответствуют сс- и р-
формам, необходимо решить более фундаментальный вопрос — о конфи¬
СТЕРЕОХИМИЯ МОНОСАХАРИДОВ419гурации всех остальных асимметрических углеродов, устойчивой в рас¬
творах.Напомним, что ряд соединений, изображенных на стр. 410, связан
возможностью взаимных превращений. Исходя из альдогексозы, можно
через оксим отщеплением воды получить нитрил альдопентоновой кис¬
лоты, а действуя на него солью серебра, — отщепить синильную кислотуи получитьальдопентозу:НЧ^°С^NOHСHw°сjН—С—ОН1Н—С—он1Н—С—онjН-с-OHjН—с—он
1jnh2oh Н—С—ОН1н—с—он
> 1jAg+ H-C-OHH-C-OHН—С-ОН-н20 н—С-ОНH-C—OHjН-с—он1Н-С—он1н—с—ОН1CH2OH1<• CHjOHjснаон1CHjOHОчевидно, что эта реакция позволяет установить стереохимическое
родство или различие альдогексоз, с одной стороны, и альдопентоз —
е другой.Тот факт, что из (+)-глюкозы (виноградного сахара) и из (^)-)-ман-
нозы (и только из этой пары) при таком переходе образуется (-f-)-apa-
биноза, устанавливает стереохимическое родство этих трех моносахари¬
дов в области, отчеркнутой на формулах (формулы не стереохимиче-
ские):HW°сHW°сIн-с--онн\^°сIно—С—н12345СНоОНСН,ОНСН2ОН бОчевидно также, что глюкоза и манноза могут различаться лишь
конфигурацией вокруг второго атома углерода. Такие два сахара назы¬
ваются эпимерами*. Поскольку в щелочной среде моносахариды способ¬
ны к кето-енольной таутомерии, причем енольная форма (точнее говоря,
ендиольная форма) имеет двойную связь между углеродами 1—2, асим¬
метрия второго углерода в этой форме теряется, и при обратной тауто-
меризации ендиола в альдегид возможно образование как левой, так и
правой конфигурации второго углерода. Значит, в щелочном растворе* В специальной литературе в настоящее время эпимерами называются два са¬
хара, различающиеся конфигурацией у одного углеродного атома. Так, например, глю¬
коза и галактоза — эпимеры по С4.
420УГЛЕВОДЫэпимеры взаимопревратимы (манноза и глюкоза действительно являют¬
ся эпимерами):Н\СIН—С-ОНОН'Н^ у ОНс—он
Iьон-н.нОН'"С-ОН'\С=0H\s°сIно-с—нНа схеме приведена еще третья, реализуемая в действительности
возможность таутомеризации ендиола глюкозы и маннозы в кетозу.
Опыт показывает, что при этом возникает (—)-фруктоза *. Таким обра¬
зом, в щелочном растворе через ендиольную форму осуществляется
вплоть до достижения равновесия взаимопревращение (+)-глюкозы,
(-f)-маннозы и (—)-фруктозы. Это снова доказывает, что конфигурация
третьего, четвертого и пятого углеродных атомов у этих трех моносаха¬
ридов одна и та же.Дополнительное доказательство этому дает тождество озазонов
(стр. 411) всех трех моносахаридов: маннозы, глюкозы и фруктозы
(формулы не стереохимические).HW°сIH-с—ОНHW°сIНО—С—НСН2ОНС=0c6h5nhnh2НС—N—NHC6H5
C=N—NHCeH6C6HsNHNH2НО—С—HIН—С—ОНIН—С—ОНc6hbnhnh2СН,ОН* Старинное название фруктозы -- левулоза — было дано ей именно за левое
вращение,
СТЕРЕОХИМИЯ МОНОСАХАРИДОВ421Ясно, что среди 16 стереоизомеров альдогексоз (не принимая во вни¬
мание а- и |3-форм) имеются восемь пар эпимеров, связанных подобными
отношениями, и соответствующая каждой такой паре стереохимически
родственная ей кетогексоза.Как же выяснить конфигурацию каждой из восьми альдопентоз и 16
альдогексоз?Кроме выяснения конфигурационного родства высших моносахари¬
дов с низшими посредством деструкции через оксим и нитрил, мы упоми¬
нали обратный — синтетический путь установления родства (стр. 408).Используем его для превращения альдопентозы в альдогексозу::NН\Сн-с-онч /онСIН—С—онН-С-ОН hcn н—С—ОН ан2о(н+) н—С—ОНН—С—онIн—С—онIСНоОНН—с—онIн—с—онIСН,0Но.чН-С—ОНIН-С-ОНIН—с-оNaHg; Н20н—с—он:н2онн—с—он
Iн—С—онIсн,он°ч/н—н2о1H—С—ОН 2Iн—С—ОН 3IН—С—ОН 4IН—С—ОН 5IСН2ОН 6В результате этой серии реакций углерод синильной кислоты стал
углеродом альдегидной группы альдогексозы, а альдегидный углерод
альдопентозы стал носителем новой группировки Н—С—ОН и превра¬
тился в асимметрический углерод. Принимая во внимание обязательное
возникновение вокруг вновь образующегося асимметрического углерод¬
ного атома обеих возможных группировок — левой и правой, приходим
к выводу, что в таком синтезе из альдопентозы образуются две эпимер:
ные альдогексозы (так как вновь образованный асимметрический угле¬
род с группировкой Н—С—ОН — это второй по счету углерод альдогек¬
созы) .Проведем теперь систематическое построение этим методом (циан-
гидриновый метод) всех возможных тетроз, пентоз и гексоз, исходя из
одного из Знантиомеров глицеринового альдегида. Выберем за исходный
(-j-)-D-глицериновый альдегид. Краткости ради в стереохимических
формулах — проекциях Фишера (стр. 359) — условимся группировку
Н—С—ОН обозначать стрелкой, направленной от Н к ОН. Тогда
формула _(rh).-глицеринового альдегида будет выглядеть так:Н\ Н\С СII : OK - - UСН2ОН СН2ОН
422УГЛЕВОДЫЗаметим, что каждое наращение нового звена Н—С—ОН посред¬
ством циангидринового метода осуществляется в соответствии с обеими
возможностями, т. е. —»■ и *— . Условимся в таблице получаемых так
стереоизомеров помещать сначала (слева) тот стереоизомер, в котором
вновь написанная стрелка ложится в том же направлении, что и преды¬
дущая, а рядом (справа) — тот стереоизомер, в котором стрелка ложится
в противоположную сторону от предыдущей. Выпишем теперь весь ряд
альдоз, произведенных таким путем из (+)-0-глицеринового альдегида
(табл. 46). Можно было бы такую же операцию проделать с (—)-£-гли-
цериновым альдегидом, тогда мы получили бы зеркальное отражение той
же схемы и каждому имеющемуся в ней моносахариду соответствовал
бы его антипод. В приведенной таблице антиподов нет. В ней имеются
только стереохимические формулы альдоз D-ряда. Ясно, что знак D —
«фамильный» признак — признак родства с D-глицериновым альдегидом
и только. Никакого отношения к правому или левому.вращению плос¬
кости поляризации, обозначаемому знаками (+) и (—), он не имеет.
Конкретно этот знак D означает, что конфигурация предпоследнего, счи¬
тая от альдегидной группы (пятого в случае гексоз), углеродного атома
у моносахарида со значком D та же, что у D-глицеринового альдегида.В результате первого наращения D-глицеринового альдегида обра¬
зуются две альдотетрозы — D-эритроза и D-треоза. Путем окисления их
альдегидной и первичноспиртовой групп в карбоксилы из эритрозы (2)
получается мезовинная кислота 2', а из треозы 3—(—)-£-винная кис¬
лота 3' (в таблице не показаны, см. стр. 366), чем и решается вопрос
о конфигурации альдотетрозы.Зададимся теперь целью установить конфигурации уже несколько
знакомых нам трех родственных моносахаридов — арабинозы, глюкозы
и маннозы, так как этого совершенно достаточно, чтобы понять принцип
выбора конфигурации в соответствии с химическими (и оптическими)
свойствами соединения (см. табл. 46 и 47). Известны четыре D- и столь¬
ко же L-альдопентоз: рибоза, арабиноза, ликсоза и ксилоза (4, 5, 6, 7).
При окислении (см. табл. 47) в дикарбоновые кислоты (4', 5', 6' и 7')
рибоза и ксилоза образуют оптически недеятельные (мезо-формы) кис¬
лоты (4' и 7'), а арабиноза и ликсоза — деятельные (5' и 6'). Это можно
установить, разрезая формулы точно посредине (в данном случае по
третьему атому углерода) плоскостью симметрии — зеркалом и конста¬
тируя зеркальность обеих половин молекул — признак оптически недея¬
тельной вследствие внутренней компенсации лезо-формы. Значит, араби-
нозе может соответствовать конфигурация (5) или (6), но не (4) и (7).
Чтобы сделать выбор между (5) и (6), нужны дополнительные экспери¬
ментальные факты. Частично мы их знаем. При наращении арабинозы
образуются глюкоза (11) и манноза (10). Сообщим далее, что обе они,
окисляясь в дикарбоновые кислоты — сахарную (глюкаровую) и ман¬
носахарную (маннаровую), дают оптически деятельные кислоты. Легко
видеть, что этот факт исключает конфигурацию (6) для арабинозы, так
как полученная из альдопентозы (6) альдогексоза (13) при окислении
дает лезо-форму — кислоту (13'). Поэтому для арабинозы устанавли¬
вается конфигурация (5), тем самым для маннозы и глюкозы — конфи¬
гурации (10) и (11). Попутно решается вопрос и о конфигурации ри-
бозы: рибоза и арабиноза дают один и тот же озазон, т. е. разнятся толь¬
ко конфигурацией второго (считая первым альдегидный) углеродного
атома. Значит рибоза имеет конфигурацию (4).Но на основании сообщенных фактов нельзя решить, какая из двух
формул принадлежит маннозе, а какая глюкозе. Нужны новые факты.
Они заключаются в том, что если нарастить обе эти альдогексозы в аль-
догептозы, То манноза образует две альдогептозы, которые обе при окис¬
СТЕРЕОХИМИЯ МОНОСАХАРИДОВ423лении образуют оптически деятельные дикарбоновые кислоты. Глюкоза
же при наращивании дает две альдогептозы, которые при окислении
в дикарбоновые кислоты дают одну оптически деятельную, а другую
мезо-форму. Это заставляет остановиться для глюкозы на конфигурации
(11), а для маннозы на (10). Подобным образом, сведением к мезо-фор¬
мам, устанавливают и конфигурацию остальных пентоз и гексоз.Выбором конфигурации глюкозы и маннозы решается вопрос и о
конфигурации фруктозы. Запишем конфигурации этих гексоз в тауто-
мерной оксоформе (аль-форма):НоHW°но——нн——он1сно——нно——нно—н——онн——онн—н——онн——онн—СН2ОН2Э-(+)-маннозаСН2ОН7)-(+)-глюкозаСН2ОН
=0
нон
онСН2ОН£-(—).фруктозаЦиклические таутомерные формы этих трех сахаров изображены
ниже в проекциях Фишера и в перспективных формулах Хеуорса (в этих
формулах плоскость шестичленного цикла следует рассматривать как
лежащую перпендикулярно плоскости рисунка). Асимметрические атомы
углерода в формулах Хеуорса, как и в проекциях Фишера, не указы¬
ваются.. Н-но-HG-н-н--он-н
-н
-оноСН2ОНили, что то же
СН2ОНГ\ОН НПуИН0>4-ДГ0НманнозаНОЩ>НО-Н-Н-ОН
Н
ОНон
сн2—оили,что то женД“°№,г0Н\Н НО/1HO>j—он
он н«рруктозаНужно иметь в виду, что и перспективные формулы Хеуорса не соот¬
ветствуют истинной геометрической форме молекулы моносахарида.
Дело в том, что пиранозное кольцо *, так же как и кольцо циклогексана,
не является плоским, а существует в конформациях кресла или ванны,
причем, как правило, креслообразная форма энергетически более выгод¬
на (стр. 495).Из-за наличия в пиранозном цикле кислородного атома, меняющего
симметрию кольца, для него возможно большее число конформаций, чем* Пиранозное, т, е. шестичленное — из пяти углеродов и одного кислорода.
Таблица 46. Построение D-ряда альдоз из Л-глицеринового альдегидаг/1*Г'Vг/о-о-> >< v >’о-О:о->-хужёX1 ^
-и Ч-I0
аГ-о Ч-10
зГ-о Ч-XО,£ ^
-и ч-XЧ.£ „
-о ч-1Я.X-о ч-IО,-о ч-Iq,-о ч-Iж °-
t I0 ч-1I I-о ч-Iq.-о ч-qI-и ч-I0.I ■-о ч-1.q-и ч-IО.I-и ч-Iq,I-и ч->V-*■чр/о-о-и-и-'Чг/и->г'X0,8-5 ?q,§
Я *’U *г5ffvjX-оО яq* о
S §-О ir
<43 соq.s£ 1
-О |С)IE яО г:о^ Яи ?
чт ®0*-U л
оСЧ1 g-X й
“О гсО gсч о
£ §
-О я
-/о-5 «О g® 5
-О %
ееО-XОсоX-иX яО §■<N оX S-о ч'■чг4/о-* 50 1СЧ ж1 vi-о й -Ч-т./и-х/и-Й
огм-IН~оXЧ/о-'U*§ 3То О ес
►чм X 5X а С-о ||Л
426УГЛЕВОДЫТаблица 47. Окисление D-альдопентоз, D-альдогексоз и D-альдогептоз
в двухосновные кислоты, деятельные и недеятельные вследствие внутренней
компенсаииии(пунктир — проекция плоскости симметрии; 4', Т и 13' — мезоформы)СООНс:оонсоонсоон
*- ~4гсоонсоонсоонсоонсоонсоонсоонсоон(10')L соон(и')соонсоон(12'»I соон(13')СООН
>-соонсоон(4')f—соонсоон<5')соон
*-соон*(6')соон(?')для циклогексана (см. стр. 495). Так, например, для глюкозы возможны
две конформации кресла:(а)СН2ОН(е)НПредпочтительная конформация, в которой реально существует дан¬
ный моносахарид, определяется, как и в случае производных циклогек¬
сана, соотношением размеров и числа заместителей, находящихся в эк¬
ваториальном (е) и аксиальном (а) положениях;Реакционная способность заместителей различна в зависимости от
того, находятся ли они в экваториальном или в аксиальном положении.
Поэтому определение конформации моносахарида (конформационный
СТЕРЕОХИМИЯ МОНОСАХАРИДОВ427анализ) имеет очень важное значение в химии углеводов. Ориентировоч¬
ное определение конформации может быть осуществлено посредством
оценки наиболее выгодного с энергетической точки зрения положения
заместителей в конкурирующих конформациях: молекула стремится при¬
нять такую конформацию, в которой максимальное число более тяжелых
заместителей находится в экваториальном положении (глюкоза поэтому
реально существует только в конформации, написанной слева). Зная из
экспериментальных данных величину фактора неустойчивости каждого
заместителя и учитывая наличие определенных неблагоприятных кон-
формационных факторов, например так называемый Д2-эффект (разме¬
щение гликозидного гидроксила между циклическим кислородом и гидр¬
оксилом у второго углеродного атома, а следовательно, сближение трех
кислородных атомов), можно предсказать наиболее вероятную конфор¬
мацию молекулы.Для экспериментального определения конформации воспользовались
тем, что сахара, подобно глицерину, имеют более кислые, чем в алкого-
лях, гидроксилы и поэтому дают алкоголяты (сахараты) с ионами тяже¬
лых металлов.Такие сахараты меди имеют циклическое строение и образуются
лишь в том случае, когда два соседних гидроксила расположены в одной
плоскости или близки к такому расположению. Если наблюдать свойства
сахара в растворе, например его оптическое вращение, то можно отме¬
тить, когда образуется такое медное производное. Контролируя измене¬
ние оптического вращения отдельных моносахаридов при добавлении
к ним медных солей, удалось установить, в каких случаях образуются
медные сахараты, т.е. сделать заключение об относительном располо¬
жении в пространстве соседних гидроксильных групп в этих моносахари¬
дах и, следовательно, установить конформации всех моносахаридовВ настоящее время заключения о конформации моносахаридов делаются на осно¬
вании исследования их ЯМР-спектров *. Дело в том, что химический сдвиг и особенно
спин-спиновые взаимодействия для протонов, занимающих зкваториальное и аксиаль¬
ное положения, различны. Это позволяет, зная соответствующие параметры протонов
связей С—Н, определить положение в пространстве этих связей, т. е. конформацию
молекулы.Во всех приведенных выше формулах не уточнена и пока простав¬
лена произвольно конфигурация гликозидного углеродного атома. По¬
следнее, что нам осталось выяснить, какова конфигурация у этого глико¬
зидного углеродного атома в а- и р-монозах. Для глюкозы этот вопрос
решается на основании ее реакции с борной кислотой. Гликоли и много¬
атомные спирты, у которых гидроксильные группы могут свободно пово¬
рачиваться в одну сторону (нежесткие структуры, такие, как этиленгли-
коль и глицерин) или обращены в одну сторону (в жестких структурах,
таких, как небольшие циклы), образуют с борной кислотой сильные кис¬
лоты:Аг~эффект
(максимально невыгодная конформация!(Ривз).рС—ОН\L- он
/* О спектрах ядерно магнитного резонанса см. стр. 557.
428УГЛЕВОДЫИх кислую реакцию можно обнаружить с помощью индикаторов.
р-Глюкоза не вступает в реакцию с борной кислотой; значит, в ней нет
гидроксилов, повернутых в одну сторону. а-Глюкоза дает эту реакцию.
Это означает, что глюкозидный и соседний с ним гидроксил (т. е. гидр¬
оксилы в положениях 1 и 2) расположены по одну сторону от цикла.
Таким образом, а- и |3-глюкозы имеют следующие конфигурации:снрн
н J—оч нсн2он
н J—о. онКон н> Конн/:> j-^он но у—riно J w он
Н онот-/)-глюкозаноН ОНр-Д-глюкозаТакие две формулы глюкозы называются аномерами (а- и р-ано-
меры). Формулы изображают-аномеры D-глюкозы. ,Такой метод отнесения моносахарида к а- или |3-ряду применим, однако, только
в том случае, если нет другой пары гидроксилов по одну сторону плоскости кольца
(в 1)иС'Положенйи). q настоящее время для этой цели пользуются главным образом
методом ЯМР-спектроскопии (стр. 557).Химический сдвиг для протонов гликозидного гидроксила а- и 13-моносахари¬
дов резко различается:для а-аномеров (D-ряд) сдвиг составляет около 4,8т, для |3-аномеров сдвиг ко¬
леблется в пределах 5,2—5,45т.Метод ЯМР используется даже для определения равновесия а- и |3-аномеров
в растворе.Вообще a-конфигурацией альдоз называют такие, в которых конфи¬
гурация первого углеродного атома такая же, как у родоначального гли¬
церинового альдегида (или, что то же, как у пятого углеродного атома
гексоз). Хадсон установил одинаковость конфигурации первого углерод¬
ного атома в а-глюкозе, а-маннозе и а-галактозе, превратив их в соот¬
ветствующие метилгликозиды и окислив йодной кислотой (стр. 251).
При этом он получил одно и то же вещество IV:HIQ,Н—f—ОСН3чонЧ/ононю4Н-СН2ОНIсг-метилглкжозидСН2ОНIVГ 'Nн——ОСНзно——нно—-н он——онн—JСН2ОН11ос-метилманноэнд.СН2ОНIIIос-метилгалактозид
СТЕРЕОХИМИЯ МОНОСАХАРИДОВ429Поскольку при таком окислении связи с первым углеродным атомом
остаются неприкосновенными (значит, не может быть ни вальденовского
обращения, ни рацемизации), тождество кислоты IV доказывает тожде¬
ство конфигураций первого углеродного атома всех трех моносахаридов.Важный метод синтеза гликозидов, дающий определенный аномер,
разработали Н. К. Кочетков и А. Ф. Бочков. Метод заключается во вза¬
имодействии ортоэфиров сахаров (ортоацетатов или ортобензоатов
моно-, ди- и т. д. сахаридов) с гидроксилсодержащими соединениями
в присутствии катализатора — бромной ртути. Например, для глюкозы:СН2ОН СН2ОНJQJ + нон -VН 0-i-0CH3 н ОСОСНзсн3Реакция применима к самым различным гидроксилсодержащим со¬
единениям: к простым и сложным спиртам (например, стероидным),
к сахарам с наращивание^ нового звена моносахарида (синтез ди-, три-
и т. д. сахаридов), к фенолам (синтез арилгликозидов) и др. Таким пу¬
тем можно синтезировать гликозиды из любых сахаров пиранозной и фу-
ранозной структуры. Метод вполне универсален. Он имеет преимущества
перед единственным известным общим методом гликозилирования по
Кенигсу — Кнорру (через ацетогалогенозы), так как идет в очень мягких
условиях и строго стереоспецифично, с образованием только 1,2-транс-
гликозидов (в случае глюкозы получаются р-глюкозиды).Интересны методы перехода от моноз D-ряда к монозам L-ряда, ил¬
люстрируемые следующим примером:О НСО ОНУн--ОН. н--ОНно--но, но--Нн--ОН* н--ОНн--ОНн--ОНс:н2он(■чООНД-ядакозал-са*арнаякислота(D-глюкаровая)н-но-н-н--он-н-оно^'Ьнл&ктоно. н
сн-NaHg;H2Q но-
н--он-и-он-онно-аглткуройоваякислотанн-но-н-н-сн2он
-он
-н
-он
-онсно оо он'Wсно-но-н-но-н
н
он
нСн2он-н2о/-гулинованкислотано-но-н-но--но-н | КаН^НЮij mнСн2онЛЙКТОНо н
снононнон
н
он
нсн2онZ-гулоза
430УГЛЕВОДЫОписанный метод перехода от D-ряда к L-ряду используется в за¬
водском масштабе для получения витамина С (аскорбиновой кислоты),
играющего настолько важную роль в клеточных окислительно-восстано¬
вительных процессах, что существование человека без поступления вита¬
мина С с пищей невозможно (суточная потребность составляет ~0,1 г).
Недостаток витамина С вызывает ослабление организма, повышенную
восприимчивость к инфекции, а в более резкой форме —болезнь цингу
(скорбут). Аскорбиновая кислота была первым витамином, выделенным
в индивидуальном состоянии (Сент Дьорди), а затем синтезированным.
Ее строение (I) — это строение ендиола лактона а-кетогулоновой кис¬
лоты (Хеуорс, Каррер, Херст), что следует из окисления ее в дикетогу-
лоновую кислоту II и превращения при энергичном восстановлении в
лактон III. Окисление в дикетонную форму II и обратное восстановлениеII в ендиольную ферму IО О Nс
с-онIIс-онн-
но--н
сн2онI2Н
(в мягких
условиях)О О-чУ ^Iс=оIс=он-
но-(энергично)
~-Зн V-н
сн2он
по о—.
сI •н-с-он
н-с-он
н-но--нСН2ОНIIIсовершаются чрезвычайно легко и обеспечивают некоторые из окисли¬
тельно-восстановительных реакций в клетке.Для технического синтеза аскорбиновой кислоты исходят из глюкозы, которую
восстанавливают в сорбит, а последний сбраживают посредством Acetobacter xylinum
в 1-сорбозу:°ч/нсн-нонн—-ОН-Н-он-онH2/Niсн2онD-глюкозан-но-н-н-снгон
-он
—н
—он
онсн,онбактериальноеокисление н-нон—он
н
—он
с=оно-н-но-сн2онсорбитсн^онL-сорбозасн*онIс=о
■н
он
■нCHjOHL-Сьрбозу действием ацетона в кислой среде превращают в кеталь для защиты
от окисления двух .вторичных и одной из первичных гидроксильных групп. В днацето-
ниде сорбозы окисляют другую первичноспиртовую группу в карбоксил, после чего
гидролизом удаляют ацетон. Тогда карбоксил этерифицирует ^-гидроксил, образуя
лактон, н наступает таутомеризация в ендиол:СН2ОНСН2ОНс:=оно--нн--онно--н(:н2он+ 2(СНз);£0СН3.СНз"'чо-н--н-О. /СНз'
-Н с
СНff хснэ
СТЕРЕОХИМИЯ МОНОСАХАРИДОВ431СН.О СНзb'V'1Vйл?о-с1о-н--нЛ /сн>-идСН20 СНз+ НгО(Н+)
-2(СНэ)2СОно-н-но--нСН2ОНо о
НИнттаутоме-рязациян-но-пJон о
он-нСН2ОН, витамин С
(аскорбиновая
кислота jКроме уже упоминавшихся моносахаридов D- и L-ряда, в настоящее
время выделено из микробов и растений и синтезировано значительное
количество моносахаридов, в которых одна или несколько гидроксиль¬
ных групп заменены другими группировками. Среди них наибольшее
значение имеют так называемые аминосахара, в которых один из гидр¬
оксилов заменен первичной аминогруппой, чаще всего ацетилированной.2-Аминосахара, которые содержат аминогруппу у второго углеродного
атома, например глюкозамин и галактозамин, входят в состав многихН О\//СН-НО-н-н--NH-C-CHo
II 3
-Н О-ОН-ОНСН2ОНСН2ОН
Н X—онНО>| I I foHН NH-C-
IIО■СН,N-ацетил глюкозаминн о\//сн-но-но-н-NH-C-CH,
II 3
н ононсн2онсн2он
НС Jr—о. нH' )НН NH-N -ацетилгалактозамин-СНополисахаридов: хитина, из которого насекомые и ракообразные строят
свой наружный остов; гепарина — вещества, препятствующего свертыва¬
нию крови в организме человека; хондроитинов, из которых в основном
состоят хрящевая и соединительная ткани; веществ, определяющих груп¬
повую принадлежность крови, и др. Аминосахара также входят в состав
антибиотиков*
432УГЛЕВОДЫИнтересно, что 5-аминосахара существуют не только в оксоформе,
но и в виде таких циклических форм, в которых кольцо замыкается не
на атом кислорода, а на атом азота (так называемые пиперидинозы):н\*°сJн-с-онIн-с-онIн-с-онIH-C-NHI-UНО'н сн.он(> NH/ \/С:-H'ОН2/\
НО Н/\Н ОНСН2ОНПиперидинозы довольно легко теряют воду, переходя в производные
ароматического гетероцикла — пиридина (см. кн. II).Хорошо известны моносахариды, в которых один или несколько
гидроксилов заменены на атом водорода, так называемые дезоксиса-
хара. К ним относится, например, 6-дезоксигалактоза, или фукоза, кото¬
рая входит во многие полисахариды микробов, а также 2-дезокси-D-pii-
6оза, входящая в дезоксирибонуклеиновые кислоты (см. кн. II, «Ну¬
клеотиды») :Н\СНч*он——онсно——нн——нно——нн——онн——онн——он-СНз СН2ОНD-фукоза 2 дезокси-В-рибозаДля получения 2-дезоксиальдоз в числе других методов использует¬
ся синтез их из альдоз с меньшим числом углеродных атомов путем на¬
ращивания цепи конденсацией с нитрометаном (реакция Анри). В каче¬
стве примера ниже приведен синтез 2-дезокси-£>-рибозы из эритрозы
(гидроксильные группы предварительно защищают, связывая их в аце-
таль посредством бензальдегида):Н\СН—н-HW°-он-онсвн5сно(н+) УН-н-СН2ОНD-эритрозаch2no2IН—С—ОНочОН \
СН2—Оch3no2;сн—C6HSchno2IIснн-н-°\
он \СН3-СУ^(СНзС0)20; (н+)СН-С6Н5н-Н-ОСОСНз
■ОСОСНз
СН2—ОСОСН,
СПИРТОВОЕ БРОЖЕНИЕ И КЛЕТОЧНОЕ ДЫХАНИЕ433CHN02IIСНН——ОСОСНз
н— — ОСОСНз
СН2—ОСОСНзH2/Pd н_
Н-ch2no2
(!н,-ОСОСНз
-ОСОСНз
СН,—ОСОСНзн\СH2S04
(реакция Нефа)-> н-
н-сн2
—он
онсн2он2-дезокси-£)-рибозаСуществуют также тиосахара, где SH-группа занимает место гидр¬
оксила.Из некоторых водорослей и антибиотиков выделены сахара, имею¬
щие не прямую, а разветвленную цепь углеродных атомов, например
апиоза:. Н\Н-нон,с-—он
онCHjOHапнозаСПИРТОВОЕ БРОЖЕНИЕ И КЛЕТОЧНОЕ ДЫХАНИЕРяд моносахаридов (глюкоза, фруктоза, манноза, галактоза), а
также дисахаридов (мальтоза, сахароза, лактоза) под влиянием жизне¬
деятельности дрожжей бродит, превращаясь в этанол и двуокись угле¬
рода. При этом дисахариды предварительно гидролизуются. Итоговое
уравнение для моноз:СвН,2Ов —2С2Н5ОН+ 2С02Дрожжи — живые одноклеточные организмы (грибки), размножаю¬
щиеся в сахаристой среде; для их жизнедеятельности нужно, чтобы
среда содержала соли аммония (как источник азота для синтеза ими
белков своего тела), соли фосфорной кислоты и еще некоторые мине¬
ральные соли. Можно, однако, раздавить и таким образом убить дрож¬
жи (Бухнер) или подсушить их и экстрагировать водой (А. Н. Лебедев),
и все равно их сок или экстракт оказывает каталитическое действие и
вызывает такое же превращение сахаров в спирт, как и живые дрожжи.
Ферментный препарат, сбраживающий сахара, был назван зимазой.
Оказалось, что он содержит целый комплекс ферментов, из которых мно¬
гие присутствуют и в клетках животных и растений, катализируя в про¬
цессе клеточного дыхания те же превращения сахаров (глюкозы или
фруктозы), что и в первой фазе брожения. Названия этих ферментов
приведены в схеме на стр. 435. Строение ферментов рассмотрено в от¬
дельной главе книги II.Брожению и «сгоранию» в процессе клеточного дыхания за счет
(в конечном итоге) кислорода воздуха подвергаются не сами монозы, а
их сложные эфиры с фосфорной кислотой. Этерификация моносахарида
фосфорной кислотой в водном растворе осуществляется при действии на
него аденозинтрифосфата.Аденозинтрифосфат (обозначаемый в дальнейшем буквами АТФ)
играет исключительно важную биохимическую и физиологическую роль.15 Зак. 882
434УГЛЕВОДЫПодробно он будет рассмотрен позднее, в разделах о гетероциклах и
ферментах (см. кн. II). Пока же укажем, что АТФ содержит группировкуООООтдавая монозе один остаток фосфорной кислоты, АТФ превращает
ее в сложный эфир — монозофосфат, а сам трансформируется в адено-
зиндифосфат (АДФ) с группировкойО ОКак видно уже из этого фрагмента формулы, АДФ, по существу, есть
сложный эфир пирофосфорной кислоты. И АДФ, и особенно АТФ —
очень реакционноспособные вещества, обладающие так называемыми
макроэргическими связями Р—О—Р; в реакциях фосфорилирования,
т.е. передачи остатка фосфорной кислоты, когда эти связи разрываются,
освобождается много энергии. И обратно, образование АТФ из АДФ
требует затраты энергии (8—10 ккал/моль), которую концентрирует его
макроэргическая молекула.При брожении или «сгорании» глюкозы в процессе клеточного дыха¬
ния первой фазой этих многостадийных реакций (см. схему на стр. 435)
является фосфорилирование глюкозы I, т.е. превращение ее в сложный
эфир фосфорной кислоты. Этерификация осуществляется по гидроксилу
шестого углеродного атома глюкозы посредством АТФ при содействии
фермента глюкокиназы. Образующийся 6-фосфат глюкозы (II) под дей¬
ствием фермента изомеразы превращается в 6-фосфат фруктозы (III).,
(Если сбраживанию подвергается фруктоза, то при фосфорилировании
непосредственно образуется 6-фосфат III.) Далее III еще раз фосфори-
лируется по первому гидроксилу при действии новой молекулы АТФ
(фермент фосфофруктокиназа). Полученный так 1,6-дифосфат фруктозы
(IV—V) претерпевает под влиянием фермента альдолазы расщепление
(реакция, обратная альдольной конденсации) на фосфат диоксиацетона
(VI) и 3-фосфат глицеринового альдегида (VII). Эти два фосфата триоз
под действием соответствующей изомеразы (фермент) обратимо превра¬
щаются друг в друга (VI VII). В дальнейшем превращении фигурирует
лишь фосфат VII. Смысл этого дальнейшего превращения в том, что3-фосфат глицеринового альдегида своеобразным процессом * (соеди¬
нения Vila и VI16) окисляется в производное 3-фосфата глицери¬
новой кислоты, а именно в смешанный ангидрид последнего и фосфор¬
ной кислоты (VIII), также обладающий макроэргической связью* С участием связанного с ферментом дегидрогеназой глутатиона TSH (стр. 475),
отдающего эфиру VII меркантогруппу, и никдтинамидадениндинуклеотида (НАД),
выступающего в качестве переносчиков водорода. Воспринимая водород, НАД вос¬
станавливается в НАД-Нг; прн этом часть его сложной молекулы претерпевает сле¬
дующие изменения: * ‘—О—Р—О—Р—О—Р—ОНОН ОН ОНО—Р—О—Р—ОНОН ОН
СПИРТОВОЕ БРОЖЕНИЕ И КЛЕТОЧНОЕ ДЫХАНИЕ435О-Р—ОН. Реакцией обмена VIII с АДФ снова регенерируется\он-С-0-11оАТФ и получается 3-фосфат глицериновой кислоты (IX). Под действием
фермента фосфоглицеромутазы 3-фосфат IX превращается в 2-фосфат X,
далее теряющий молекулу воды и переходящий (фермент енолаза)
в фосфат енольной формы пировиноградной кислоты (XI). В этом фос¬
фате связь остатка фосфорной кислоты с енольным кислородом тоже
макроэргическая. Поэтому, реагируя с ним, АДФ воспринимает оста¬
ток фосфорной кислоты, превращаясь снова в АТФ, а освободившийся
енол пировиноградной кислоты таутомеризуется в саму пировиноград-
ную кислоту XII.ИН-но-н-Н-Н-н о
-ононнс-СН2ОНАТФ; .
глюкокиназанНОн-нсн2он-ОН-н о
-он|но-НО-шомеразан-Ь-он
но АТф;V фосфофрук! окиназдСН20Р03Н2IIсн2оро3н2шсн,оро3н2но-но-н-н-сн2оро3н6=0-оноVно-н-H-сн2оро3н2IVHон
он
сн2оро3н2СН20Р03Н2Iс=осн2онн оVсIн-с-онVIVIIVIIrSH + ИАД;
дегидрогеназа »--НАД-Н2rs-нI-с-rsонНАДн—с—он-над-н2\ ^
сIн—с—онСН20Р03НаоH3P04
—ГБНСН20Р03Н2VilaСН20Р03Н2VI16Н203Р0х ^осIН—С—ОНно,0АДФ:фоефоглниераткиназа
—АТФ\ ^
сIн-с-онфосфоглинеромутазаСН20Р03Н2VIIIСН20Р03Н2IXноч ^оСН—С—0Р03Н2IСН2ОНX-н2оН0Ч^ АДФС-0Р03Н2 -АТФIIсн2XIн°х ^о
с■«и(!н.XII15*
436УГЛЕВОДЫЗдесь пути спиртового брожения, анаэробного дыхания и клеточ¬
ного окислительного дыхания расходятся:спиртовое брожекнеСООН над-н2;I ГНО дегидрогеназа PfrOH• декарбоксилаза у*!'-' этанолаС==0 > | >- || -со2 СН3 СН3СН,СООН НАД-Нг; I 1/з°2; тиаминпирофосфат; КоА S! лактогидрогеназа HS-коэнзнм А (СН—ОН < —1 > С=0 —►I IСНз СНзанаэробное дыхание клеточное окислительное дыхание|далее превращение по циклу Кребса (см. нил^е))При спиртовом брожении фермент декарбоксилаза декарбоксили-
рует пировиноградную кислоту в ацетальдегид, который восстанавли¬
вается в этанол за счет молекулы НАД-Н2, присоединившей в свое
время водород при переходе VII в VIII. В анаэробном дыхании тот же
восстановитель НАД-Н2 восстанавливает пировиноградную кислоту в мо¬
лочную. На пути от глюкозы до молочной кислоты освобождается
~50 ккал/моль, из которых 16—20 ккал расходуется на образование2 моль АТФ. В процессе дыхания с участием кислорода пировиноград-
ная кислота, окисляясь кислородом в присутствии тиаминпирофосфата
и коэнзима А (сокращенное обозначение КоА—SH), превращается в
ацетилкоэнзим А, ацетильная группа которого окисляется далее в С02
и Н20 по реакциям цикла Кребса.ЦИКЛ ДИКАРБОНОВЫХ И ТРИКАРБОНОВЫХ КИСЛОТ
(ЦИКЛ КРЕБСА)Из приведенной схемы видно, какую важную роль в процессах де¬
струкции сахаров играет пировиноградная кислота. При молочнокис¬
лом брожении она также служит узловым соединением, образуясь по
той же схеме и восстанавливаясь далее в молочную кислоту:лактогидрогеназаСНз—С—С—ОН + 2Н СНз—сн—С—ОНII II I II0 0 ОН ОПировиноградная кислота является узловым продуктом и в так на¬
зываемом цикле Кребса, играющем огромную роль в обмене веществ
в растительных и животных организмах. Посредством отдельных звеньев
этого цикла строятся такие биохимически важные кислоты, как лимон¬
ная, кетоглутаровая, янтарная, фумаровая, яблочная. Полный цикл —
это цикл клеточного дыхания животных и растений, приводящий к окис¬
лению 1 моль пировиноградной кислоты (в свою очередь образующейся
из глюкозы) в 3 моль С02 и 2 моль Н20.Первая фаза цикла — это уже рассмотренное нами превращение пи¬
ровиноградной кислоты в ацетилкоэнзим А, обладающий крайне актив¬
ной ацетильной группой, способной ацетилировать, например, а-углерод
щавелевоуксусной кислоты, превращая ее в лимонную.Коэнзим А имеет сложную структуру, включающую последова¬
тельно связанные остатки гетероцикла аденина, фосфорного эфира пен-
тозы — рибозы, остаток пирофосфорной кислоты, связанный далее с
остатком пантотеновой кислоты, ацилирующей в свою очередь тиаэта-
ноламин. Структура коэнзима А рассматривается в книге II. Пока
ЦИКЛ КРЕБСА437обозначим его символом КоА—SH. Пировиноградная кислота при дей¬
ствии кислорода и участии соответствующих ферментов декарбоксили-
руется, окисляется и ацетилирует по сере коэнзим А:СН3—С—С—ОН + ‘/202 + КоА—SHII IIО О
Весь цикл таков:ГлюкозаСН3—С—S—АКо + С02 + Н20IIОСНз—С—С—ОНII IIО Опировиноградная
кисло гаО; КоА—SH у—со2СН3—С—S—КоА-IIО+НО—С—СН2—с—с-он-
II II IIО О Ощавелевоуксусная кислота
-2Н+ Н20;
-КоА—SHJ-*Оч/°нно-с—сн2О• с
Iс—сн2—с—онI IIОН Олимонная кислотаНО— С- СН2—СН—С—ОНII I IIО ОН Ояблочная кислотаf + н2о
110—С—СН=СН—С—ОНО-н2о/ОННО—С—СН2—С==СН—С—ОН1 IIО Оцис-аконитовая кислотаоIIОфумаровая кислота
j—2ННО-С—сн2—сн2—с-
II IIО Оянтарная кислота
*О| + н2о
он-ОНч /
сНО—С—СН,—СН—СН—С—ОНО ОНизолимониая кислотаА+ 0; —С02О,ч-2Н/ОННО—С—СН2
«?-СН,—с—с—он ■<-сI<5со2оАа-кетоглутаровая кислотаО Ощавелевоянтарпаи кислогаКаждый из этих переходов катализируется своим комплексом фер¬
ментов. Цикл начинается и заканчивается щавелевоуксусной кислотой,
а пировиноградная кислота, как легко видеть, превращаясь на одной
из стадий в ацетилкоэнзим А, в итоге полностью окисляется в С02
и Н20.
438УГЛЕВОДЫСИНТЕЗ САХАРОВ В РАСТЕНИЯХВ последние годы в какой-то степени стала ясной общая картина
фотосинтеза в зеленом листе растения. Фотосинтез углеводов из угле¬
кислого газа и воды 6С02 + 6H20—>-C6Hi206 + 602 происходит за счет
солнечной энергии, использованию которой содействует зеленый пиг¬
мент— хлорофилл (см. кн. II).Интересно отметить, что, как показали опыты с меченым кислоро¬
дом, весь кислород воды, вошедшей в реакцию, выделяется в свободном
виде (А. П. Виноградов). Как и следовало ожидать, процесс, ассимиля¬
ции двуокиси углерода, вскрытый рядом исследователей, особенно
М. Кальвином, выглядит много сложнее приведенной реакции. Двуокись
углерода реагирует с дифосфорным эфиром кетопентозы — рибулозы —
и через гипотетический продукт присоединения превращает ее в две
молекулы фосфорного эфира D-глицериновой кислоты. Последний под
действием света восстанавливается в фосфат глицеринового альдегида:СН20Р03Н2Iс=он—с—он + Н20 + со2н—с—онIСН20Р03Н2НО-СН20Р03Н2-с—нсно/ ^0Н0\ ^о
С.н--с—онСН20Р03Н2нох ^о
сIн—с—он + Н20
СН20Р03Н2н\сн.,0световая энергиян--с-онIСН20Р03Н2IСН2ОНIс=оIСН20Р03Н2\ ^
с
Iн—с-он
- IСН20Р03Н2СН20Р03Н2с=оIНО-С—Н
Iн—с—он
Iн—с—он+ Н20 + 7г02СН,0Р03Н,Последняя стадия — синтез дифосфата D-фруктозы альдольной кон¬
денсацией фосфата глицеринового альдегида с фосфатом диоксиаце-
тона — совершенно аналогична упомянутому на стр. 408 синтезу смеси
D-фруктозы и D-сорбозы, но в отличие от него протекает полностью
стереонаправленно, как все энзиматические реакции. Отметим, что это
реакция — обратная расщеплению альдоля на исходные реагенты в пер¬
вой стадии спиртового брожения, когда дифосфат фруктозы расщеп¬
ляется на фосфорные эфиры глицеринового альдегида и диоксиацетона
(стр. 434 сл.).
ОЛИГОСАХАРИДЫ439Наряду с этой главной линией фотосинтеза идет вторая: из части
фосфата фруктозы регенерируется дифосфат рибулозы,' необходимый
для новой ассимиляции С02.ОЛИГОСАХАРИДЫ.БИОЗЫ И ТРИОЗЫ
(ДИСАХАРИДЫ И ТРИСАХАРИДЫ)Уже было сказано, что в растительном и животном мире наряду
с монозами, или моносахаридами, находятся в общем очень близкие
к ним по свойствам сахара, которые в результате гидролиза слабыми
кислотами или ферментами превращаются в моносахариды. На основа¬
нии этого факта, аналитических данных и определений молекулярного
веса установлено, что такие олигосахариды являются ангидридными
формами двух, реже трех или четырех молекул моноз. Поскольку гидро¬
лиз олигосахаридов в монозы идет в кислой, но не в щелочной среде
(стр. 442),. ясно, что монозы связаны в эти более сложные молекулы
ацетальной (гликозидной) связью. В дальнейшем мы будем говорить
главным образом о биозах, т. е. об олигосахаридах, построенных из двух
молекул моноз (одинаковых или разных), от которых отщеплена моле¬
кула воды.Биозы (как впрочем и все олигосахариды) можно разделить на две
группы. К первой группе относятся дисахариды, не дающие реакций на
оксогруппу (с гидроксилам'ином, фенилгидразином, синильной кислотой,
фелинговой жидкостью, аммиачным раствором окиси серебра и др.).
Из них упомянем сахарозу (обычный тростниковый или, что то же,
свекловичный сахар) и трегалозу. Поскольку гликозиды тоже не дают
таких реакций, ясно, что связь двух моносахаридов в этих биозах
гликозидная с обеих сторон.Ко второй группе относятся дисахариды, которые дают упомянутые
реакции на оксогруппу, но только с одной половиной молекулы, т. е.
потребляя реагент в расчете 1 моль на 1 моль дисахарида. Отсюда сле¬
дует, что в них одна молекула моносахарида связана за счет своего
гликозидного гидроксила, а в другой гликозидный гидроксил свободен.
Поэтому таутомерия циклической формы с оксоформой сохранена и
реакции на оксогруппы положительные.Вопрос о том, какие' именно моносахариды образуют дисахарид,
решается кислотным гидролизом и выделением из продуктов гидролиза
индивидуальных моносахаридов или их характерных производных. Уже
эти реакции освещают, хотя и не до конца, строение биоз. Напомним,
■что простейший метилгликозид имеет следующее строение и конфигура¬
ции для конкретных случаев D-глюкозы и D-фруктозы;СН2ОНа-метил-Я-глю#оэидсн2онfl-метил -D-
глюкизидНОН2С.от-метил -D-
фруктозид/З-метил-Я-фруктозид
440УГЛЕВОДЫКак уже было сказано, в дисахаридах (биозах), образованных од¬
ной молекулой глюкозы или фруктозы и одной молекулой другого са¬
хара, этот последний будет занимать место метильной группы в метил-
гликозиде. Отсюда очевидно, что возможны а- и p-стереоизомеры любой
биозы. Если биоза не дает реакций на оксогруппу, значит и вторая
молекула монозы прореагировала своим гликозидным гидроксилом. Та¬
кие типы биоз называют гликозидогликозидами. Например, биоза этого
типа, составленная из двух молекул глюкозы, обозначается как глюко-
зидоглюкозид, из глюкозы и фруктозы (сахароза)—как глюкозидо-
фруктозид и т. д. Такие биозы, в зависимости от конфигурации первых
углеродов обеих моноз, могут иметь разную конфигурацию: возможны
а,а-гликозидогликозиды, р,р-гликозидогликозиды, а также а,р-, а в слу¬
чае разных моноз — и р,а-гликозидогликозиды. Если биоза дает реакции
на оксогруппу, значит вторая моноза прореагировала одним из своих
спиртовых гидроксилов, а ее гликозидный гидроксил свободен, и потому
таутомерия с оксоформой сохраняется.Посредством какого именно спиртового гидроксила второй моле¬
кулы монозы осуществляется связь с первой молекулой? Хорошо из¬
вестны дисахариды и другие олигосахариды со всеми типами связи (по
всем свободным гидроксилам). В олигосахаридах животного происхо¬
ждения чаще всего встречаются связи через четвертый и шестой гидр¬
оксил; в растительном мире и в микроорганизмах столь же широко из¬
вестны связи через второй и третий гидроксил. Выпишем несколько фор¬
мул наиболее важных биоз и покажем, как выясняются эта и другие
оставшиеся детали их структуры. Приведем также фишеровские проек¬
ционные формулы, хеуорсовские перспективные и названия по всем
способам номенклатуры:снрн снрнмальтоза
4-(«-глюкозидо)-гшкоза
4-(<*-глюкопиранозил) - Д-глюко;!а
{fi-аномер мальтозы)СН2ОН СН2ОНцеллобиоза
4 -(|3-глюкоз идо)-глюкоза
4-(|3-Л-глюкопиранозил)-Л-глюкоза
(j3 -а номер целлобиозы}
ОЛИГОСАХАРИДЫ441СН2ОН СН2ОНтрегалозаO', ос-глюкояидоглюкозил
1-(а-Д-глюкопиранозил)-а-.0-глюкопнранозндсн2он СН2ОНмолочный сахар-лакгоаа
4-(р-галактозидо)-глкж<«а
4 -((3 -Д-га лантопира ноз ил) -Д-гл юкоза
ф-а номер)сахароза
of-глюкоз идо - р- фруктозид
(а-Я-щшолиргщоаил) - р-д- <ррукто<руранозмдПосле того что было сказано об установлении строения биоз,
остается выяснить следующее:1а. Какая моноза (в случае биоз гликозидогликозного типа) играет
роль гликозидную, какая гликозную; иначе говоря, какая из моноз
участвует в образовании взаимной связи своим гликозидным гидрокси¬
лом, а какая спиртовым?16. Какой именно спиртовый гидроксил второй монозы образует
связь?2. Независимо от того, гликозидогликозиый или гликозидогликозид-
ный тип биозы перед нами, необходимо решить вопрос, как циклизуется
каждый из моносахаридов — в 6-положение, т. е. в шестичленный цикл,
как это бывает обычно, или в уположение, т. е. в пятичленный цикл;
иначе говоря, в терминах, предложенных Хеуорсом, который и решил
эти вопросы найденным им методом, является ли каждая из моноз пи-
ранозой или фуранозой?3. Является ли биоза а- или р-гликозидом?Вопрос 1а решается метилированием биозы диметилсульфатом в
щелочном растворе до октаметилбиозы (т. е. метилиоованием всех
442УГЛЕВОДЫсвободных гидроксилов) и последующим гидролизом, при котором об¬
разуются две метилированные монозы.Например, для лактозы:СН2ОСН3СН2ОСН3окгаметиллакгозасн2осн3тетраметилгалактозаСН2ОСН3триметилглюкозаВ приведенном примере, когда тип биозы гликозидогликозный и,
значит, имеется один свободный гликозидный гидроксил,, этот гидр¬
оксил метилируется.При гидролизе простые эфирные связи не рвутся, а гликозидные
(ацетальные) разрываются; в частности, и этот гликозидный метил ухо¬
дит в виде метилового спирта. Поэтому одна из метилированных мойоз,
полученных в результате гидролиза, несет четыре простые эфирные
группировки (четыре метила). Это и есть гликозидная моноза. Другая
же — гликозная — моноза несет три метила.При метилировании биозы типа трегалозы или сахарозы (тип гли-
козидогликозидный) оба моносахарида имеют после гидролиза по че¬
тыре метила, чем еще раз доказывается, что спиртовые гидроксилы не
участвовали в связывании моноз в биозу и что эта связь осуществля¬
лась за счет обоих гликозидных гидроксилов.Вопрос 16 решается посредством окисления полученной триметил-
монозы (в приведенном выше случае лактозы это — триметилглюкоза).
В ней имеется один свободный спиртовый гидроксил и один гликозид¬
ный, и окисление азотной кислотой (Хеуорс), естественно, направляется
на эти два гидроксила:СН2ОСН3о онVHNO, н-сн,о--ОСН3-н/ЯО онНаличие среди продуктов окисления триметилмонозы диметилового
простого эфира L-винной кислоты доказывает, что уязвимым при окис¬
лении (т. е. несущим свободный гидроксил) оказался четвертый угле¬
родный атом. Значит, сюда и примыкала связь с гликозидным кислоро¬
дом первой (глйкозидной) монозы.
ОЛИГОСАХАРИДЫ443В случае трегалозы продуктом окисления оказалась бы тримет-
оксиглутаровая кислота (а именно так называемая ксыло-триметокси-
глутаровая):Гн-" ' — ‘Н--ОСНзОсн3о--нн—-ОСНзUJГ1с:н2осн3СН2ОСН3октаметилтрегалозаО н2о(н+)СН2ОСН3н о
\//
сн-сн3о-н-н-ОСН3н • •ОСНзон
сн2осн3HNOaЯ,/0» .С ' 1н-сн3о-н-ОСНз 2н зОСНз 4
5оАонтриметоксиглу-
таровая кислотаЗдесь окисление по пятому углероду обусловливается уже тауто-
мерным раскрытием пиранозного цикла, а не связью двух моноз, что
ясно из того, что обе метилированные глюкозы (после гидролиза) яв¬
ляются триметилглюкозами.Таким образом, проясняется путь решения и вопроса 2: пиранозный
или фуранозный цикл имеют монозы, образующие биозу. Этот вопрос
также решается окислением продуктов гидролиза октаметилбиоз. Но
ответ будет не вполне однозначным, если в результате гидролиза окта-
метилбиозы получится триметилмоноза, поскольку в ней будут иметься
два спиртовых гидроксила и один гликозидный гидроксил и не будет
ясно без косвенных соображений, который гидроксил освободился за
счет таутомерного размыкания цикла, а который за счет гидролиза связи
двух моноз.Дополнительным доводом может служить прямое окисление биозы
йодной кислотой — метод, применяемый и для установления положения
кислородного мостика в монозах.Йодная кислота количественно окисляет многоатомные спирты (со
свободными гидроксилами), в которых гидроксилы находятся у соседних
углеродов. При этом разрываются все С—С-связи между углеродами,
несущими гидроксилы, и каждая отщепляющаяся группа * СН2ОН пре¬
вращается в формальдегид, а отщепляющая СНОН-группа — в муравьи¬
ную кислоту.!* Конечно, имеется в виду группа СН2ОН, соседняя с группой С—ОН.I
444УГЛЕВОДЫНапример, периодатное окисление сахарозы проходит так:H -/—лс:н2онН—но—-он (—нно-э-„'i0н—-онУн—н—онУс;н2он с;н2онн-сню4о + н-с-онIIон-ссн2онсн2онЭтим доказывается у-замыкание (иначе говоря, наличие фураноз-
ного пятичленного цикла) в фруктозе, связанной в сахарозу. Это яв¬
ляется правилом. Свободная фруктоза имеет шестичленный (пираноз-
ный) цикл — замыкание осуществлено в шестое положение. В биозах
с участием фруктозы, а также в соответствующих полиозах ее цикл —
пятичленный, с замыканием в пятое положение.В настоящее время все три перечисленных вопроса — отличие гли-
козидной и гликозной моноз, определение гидроксильной группы, во¬
влеченной в гликозидную связь, и размер окисного кольца в монозе—
очень легко решаются с помощью масс-спектрометрии (см. стр. 555).Наконец, последний вопрос (вопрос 3)—а- или ^-конфигурацию
имеет первый углерод в биозах — наиболее просто решается фермента¬
тивным гидролизом. Существуют ферменты, способные гидролизовать
только a-формы (например, фермент мальтаза); другие ферменты (на¬
пример, эмульсин) гидролизуют только р-формы.Свойства некоторых моноз и биоз приведены в табл. 48.Принципы построения триоз и тетраоз те же, что и биоз; анало¬
гичны и методы их исследования. Многие из этих олигосахаридов нахо¬
дятся в растениях. Так, находящаяся в некотором количестве в свекле
рафиноза — это 6- (a-D-галактопиранозил) -а-Д-глюкопиранозил-р-Д-
фруктофуранозид; генцианоза — 6-(р-/)-глюкопиранозил)-а-/)-глюкопи-
ранозидо-р-Д-фруктофуранозид. Целлотриоза построена из трех моле¬
кул глюкозы по типу целлобиозы и является, следовательно, 4-[4-(p-D-
глюкопиранозил) -р-Д-глюкопиранозил]-0-глюкопиранозой. Дополни¬
тельный метод исследования триоз и тетраоз заключается в частичном
гидролизе, приводящем к образованию биоз и моноз. Так, рафиноза
при частичном гидролизе образует галактозу и сахарозу.Ацетилируя монозы уксусным ангидридом, их превращают в пен-
та-ацетилмонозы, в которых один из ацетилированных гидроксилов —
гликозидный. Действием на пентаацетилмонозы хлористым или броми¬
стым водородом этот ацетоксил при первом углеродном атоме замещают
на галоид. Полученное вещество, называемое ацетогалогенозой или аце-
гогалогенмонозой, широко применяется в синтезе биоз и других простыхи сложных гликозидов. Например, для глюкозы реакции текут так:СНгОАсН /I НВг. |/Н \JО Ас Н ОАсСН2ОАс .н - очнНОАсО Епентаацетил-глюкозасе-ацетобромглюкоза
(в смеси с ii-ацето-
бромглюкозой)где Ас — ацетильная группа СН3СО-
ОЛИГОСАХАРИДЫ445Таблица 48. Свойства моносахаридов и дисахаридовТемператураРаствори¬Сладость по
сравнениюНазваниемость в водесо сладостьюплавления,при 25 °С,сахарозы,°Сградусыг/100 млпринятой
за 100Моносахариды C6Hi20а-Аллоза1Р-Аллоза> 128—128,5—0,2 -» +14,4 а-Альтроза169—+33,1Р-Альтроза> 103—105а-Манноза133+ 29,3 \248 'Р-Маииоза132-17,0/ +14’2(при 17°С)а-Г люкоза146+ 112,2\ „82Р-Глюкоза148—150+ 18,7 /+52'7154
(при 15 °С)а-Т алоза133—134+ 68\^пя—Р-Талоза120—121+ 13,2/ +20’8—а-Г алактоза
Р-Галактоза| 167+150,7 \ „
+52,8/ +80’268,3а-ГулозаР-Гулоза| Сироп—20,4—а-Идоза1Р-Идоза> Сироп+53,0—Р-Фруктоза102—104— 132,2->—92,4—Дисахариды С12Н220иСахароза186 (разл.)66,53—100а,а-Трегалоза| 203197—Р,Р-Трегалоза—41,5—Р-Мальтоза (гидрат)102 (разл.)+ 111,7 — +130,4! 0832Р-Целлобиоза225+ 14,2 — +34,6——а-Лактоза (молочный
сахар) (гидрат)202+85,0 — +52,617(при 20 °С)16Р-Лактоза252+34,9 — +55,3——Р-Генциобиоза195+5,9 -> +9,8—* Стрелки соединяют начальную и конечную величину [а]^1 мутаротирующих сахаров.Действуя ацетобромглюкозой на моносахариды в щелочном рас¬
творе, А. А. Колли (Москва, 1879 г.) впервые осуществил, а позднееЭ. Фишер развил синтез дисахаридов. Такой синтез, однако, не целе¬
направлен, так как нельзя по желанию заместить любой спиртовый
гидроксил монозы, а приходится довольствоваться тем, что получится.Если в молекуле монозы как-либо защитить все гидроксилы, кроме
того, который нужно связать с молекулой ацетобромглюкозы, то полу¬
чится нужная структура, которую затем следует освободить от защи¬
щающих групп. В качестве таких защитных групп использованы
ацетильные (СН3СО) и бензоильные (С6Н5СО) остатки. Взаимодей¬
ствие ацетоброммонозы со второй молекулой монозы, имеющей один
446УГЛЕВОДЫнезащищенный гидроксил, приводит к биозам (метод Кенигса — Кнор-
ра). Гельферих осуществил синтез генциобиозы из р-ацетобромглюкозы
следующим путем:СН2ОАс
Н ^—Оч ВгСН2ОНАсО\рАс Н/1
эЧ-_/нн -и 0„ ОСН3 . гпJ Ag2co34- l/H+ PvOCOPh H,PhOCO Nj. ■ м I f HH QAc H OCOPhр-ацетобромглюкоза 2,3,4-трибензошшетилглюкозидCH2OAc .CH2H J Q. O'H J——Ov OCH,AcOH OAc OCOPh. OCOPh
где Ac=CH3CO-; PhCO=C6H5CO-CH2OH .CH2H J О O^H I—QOH- О К|ГйHO HO>f——f HH OH H OHгенциобиозаЗащиту гидроксилов монозы (кроме одного) при реакции с ацето-
бромглюкозой осуществляют также путем образования с ацетоном ке-
талей, как в синтезе аскорбиновой кислоты (стр. 430).При действии соляной кислоты на глюкозу возникает целый ряд
биоз (генциобиоза, целлобиоза, мальтоза, трегалоза и др.), которые
в виде ацетатов можно разделить хроматографически.Целенаправленно, но с плохими выходами, синтезы биоз произво¬
дятся ферментативным катализом. Как всякий катализатор, фермент
ускоряет реакцию в обоих направлениях — прямом и обратном. Поэтому
ферменты, катализирующие гидролиз биоз в монозы, катализируют и
синтез тех же биоз из моноз. Действительно, мальтоза уже в 1902 г.
была получена действием ферментов из дрожжей на концентрирован¬
ный раствор глюкозы (такие концентрированные, растворы не бродят).
При действии фермента эмульсина (из горьких миндалей) на концен¬
трированный раствор глюкозы получена генциобиоза. Из фосфорнокис¬
лого эфира глюкозы (1-фосфат) и фруктозы при действии фермента
фосфатазы получается сахароза.ПОЛИСАХАРИДЫПолисахариды представляют собой высокомолекулярные вещества
(молекулярный вес от 20 000 до 1 000 000 и выше), построенные по типу
биоз и полиоз. При полном гидролизе в кислой среде они образуют
монозы. Те из них, которые образуют одну монозу,— а это наиболее
важные полисахариды, — называются гомополисахаридами. Если обра¬
зуется смесь двух или более моносахаридов — это гетерополисахариды.
К гомополисахаридам относится крахмал с его разновидностями — ами¬
лозой и амилопектином, гликоген, целлюлоза (клетчатка), инулин; к ге¬
терополисахаридам— так называемые гемицеллюлозы, камеди, много¬
численные полисахариды микроорганизмов и др. Полисахариды бывают
линейно-поликонденсированные, как целлюлоза, и разветвленные, как,
например, крахмал.
ПОЛИСАХАРИДЫ447Крахмал. Совершенно особое значение в жизненных процессах
имеют крахмал и гликоген. Крахмал представляет собой запасный угле¬
вод растений. Он откладывается в зернах злаков и других семенах
растений, в клубнях картофеля, при прорастании энзиматически гидро¬
лизуется до растворимых олиго- и моносахаридов (мальтоза или глю¬
коза) и в таком виде служит для строительных и энергетических целей
при прорастании растений. Прорастающие зерна злаков накапливают
так много фермента гидролиза крахмала (диастаз), что подсушенные и
размолотые проросшие зерна ячменя (солод) применяют для осахарива-
ния — превращения в мальтозу — «постороннего» крахмала картофеля
или кукурузы в производстве спирта или пива (мальтозу далее сбра¬
живают). Крахмал имеет форму микроскопических миндалевидных зе¬
рен концентрической структуры и не представляет собой индивидуаль¬
ного вещества. Он содержит растворимую в воде амилозу («раствори¬
мый крахмал»), образующую не особенно вязкие растворы и дающую
с иодом чисто синее окрашивание, и амилопсктин, который в холодной
воде нерастворим, но в горячей воде образует очень вязкий клейстер,
а с иодом дает красно-фиолетовое окрашивание. Как всякие высокомо¬
лекулярные вещества, и амилопектин и амилоза не являются, в строгом
смысле слова, индивидуальными веществами, а представляют собой
смеси полимергомологов (стр. 141). Наиболее обычные виды крах¬
мала— картофельная мука, рисовый крахмал. Картофельную муку по¬
лучают, механически разрушая клетки клубней картофеля и отмучивая
в воде зерна крахмала, которые оседают на дно.При частичном гидролизе крахмала, достигаемого нагреванием с ад¬
сорбированной им водой, получаются декстрины разного молекуляр¬
ного веса, но всегда гораздо меньшего, чем у амилопектина и амилозы.
Декстрины растворимы в воде и в зависимости от молекулярного веса
дают с иодом синее, фиолетовое, красное, оранжево-красное и желтое
окрашивание. Один из употребительных видов канцелярского клея —
раствор декстрина.Крахмал составляет по весу главную составную часть пищи чело¬
века (хлеб, картофель, крупы, овощи) — главный энергетический ре¬
сурс его организма. Содержание крахмала в некоторых видах богатых
им пищевых продуктов таково: мука — 74%, рис — 78%, хлеб белый —
51%, картофель— 16%. Уже во рту, под действием слюны, содержащей
гидролитический фермент амилазу, начинается гидролиз крахмала.
В кислой среде желудка гидролиз завершается расщеплением до глю¬
козы, которая из кишечника поступает в кровь и разносится током крови
до каждой клетки, подвергаясь там ряду превращений (стр. 434), обус¬
ловливающих теплоту тела, энергию мускульной и мозговой работы
человека и животного. В крови поддерживается довольно строго опре¬
деленная концентрация глюкозы: как значительный избыток, так и, осо¬
бенно, недостаток ее гибельны для организма'. Концентрация глюкозы
регулируется действием гормонов. При повышении содержания глюкозы
в крови избыток ее за счет специфического действия выделяемого под¬
желудочной железой гормона инсулина (белок, см. кн. II) откладывается
в печени и частично в мышцах в виде «животного крахмала»— глико¬
гена. Цечень может содержать до 20 вес.% гликогена. При недостатке
глюкозы в крови часть гликогена печени гидролизуется в глюкозу и
поступает в кровь (гормон глюкагон). Если деятельность поджелудочной
железы нарушена и она не продуцирует инсулина, наступает сахарная
болезнь — диабет, характеризующаяся повышенным содержанием глю¬
козы в крови. Организм вынужден тогда сбрасывать избыток глюкозы
с мочой. Систематическое введение в кровь инсулина, выделенного из
448УГЛЕВОДЫподжелудочной железы животных, восстанавливает правильное функ¬
ционирование глюкозы в крови.Инулин. Полисахарид земляной груши (топинамбура) и клубней
георгина — аналог крахмала, построенный из остатков D-фруктозы. Он
гидролизуется в желудке в фруктозу и, значит, так же питателен, как
крахмал.Целлюлоза. Целлюлоза, или клетчатка, — вещество стенок клеток
растений. В чистом виде она известна в виде ваты и фильтровальной
бумаги (писчая и все другие виды бумаги проклеиваются). Древесина
наполовину состоит из клетчатки и, кроме того, содержит связанный
с ней лигнин — высокомолекулярное ароматическое вещество феноль¬
ного характера (см. кн. И).Нативная целлюлоза имеет молекулярный вес не ниже 2 000 000;
число глюкозных остатков — свыше 10 000 (О. П. Голова).Производство целлюлозы из древесины, принявшее ныне огромные
размеры, осуществляется двумя основными способами.1. Сульфитный способ. Главная масса писчей и типографской
бумаги готовится из сульфитной целлюлозы. Еловую древесину обраба¬
тывают при нагревании и под давлением бисульфитом кальция. При
этом ароматические фенольные циклы лигнина приобретают сульфо-
группы, образующиеся лигносульфокислоты растворимы в воде («суль¬
фитные щелока»). Остается обезлигниненная целлюлоза в виде волокон,
которая используется для изготовления бумаги, искусственного волокна,
в производстве пластмасс и порохов. Вследствие слабой кислотности
среды происходит частичный гидролиз цепей целлюлозы и образуется
целлюлоза с более низким молекулярным весом (с числом глюкозных
остатков в макромолекуле в несколько сотен).2. Сульфатный способ. При производстве целлюлозы этим
способом используется любой лес —хвойный, лиственный и смешанный.
Древесину обрабатывают смесью щелочи и сернистого натрия, полу¬
ченного восстановлением (прокаливанием) природного сульфата нат¬
рия с органическими остатками (лигнин) от предыдущей партии суль¬
фатной целлюлозы. В таком щелочном растворе лигнин растворяется
и остается целлюлоза, менее затронутая деструкцией, чем при сульфит¬
ном способе, так как в щелочной среде она не гидролизуется. Такая
целлюлоза прочнее, чем сульфитная, и применяется для изготовления
«крафтцеллюлозы» для мешков, оберточной бумаги, требующей проч¬
ности, и т. п.Строение полисахаридовИсследование строения гомополисахаридов слагается из следую¬
щих ступеней.1. Полный гидролиз и идентификация монозы, являющейся струк¬
турным элементом макромолекулы.2. Установление наличия разветвлений основной цепи полисахарида,
типов связей между монозными звеньями и размер окисных колец по¬
следних, что производится обычно методом метилирования, окислением
полисахарида йодной кислотой, а также частичным гидролизом разбав¬
ленными кислотами, позволяющим выделить небольшие фрагменты по¬
лисахаридной цепи.3. Ферментативный гидролиз (полный или неполный) в целях уста¬
новления конфигурации (а- или р-) первого (в кетозах второго) 'атома
углерода.
ПОЛИСАХАРИДЫ449При неполном гидролизе полисахарида образуется смесь олигоса¬
харидов, которые исследуют так, как это описано при рассмотрении
строения биоз (метилирование, гидролиз, окисление полученных три-
метил- и тетраметилмоноз). Такое исследование, примененное к крах¬
малу и его разновидностям — амилозе и амилопектину, показало, что
они построены по типу мальтозы, т. е. имеют а-глюкозидо-(глюкози-
до)п-а-глюкозное строение. Для целлюлозы, которая при полном гид¬
ролизе, как и крахмал, образует только глюкозу, этим путем установ¬
лено р-глюкозидо-(глюкозидо)„-р-глюкозное строение. Связь глюкозных
остатков в целлюлозе, следовательно, та же, что в продуктах ее непол¬
ного гидролиза — целлобиозе и целлотриозе.Участки макромолекул крахмалов и целлюлозы могут быть изо¬
бражены схемами:для крахмала
СНоОН
н Jz—О. Н
.он нсн2онн оностаток мальтозыдля целлюлозыостаток целлобиозыостаток целлотриозыПерспективное изображение участка молекулы целлюлозы, учиты¬
вающее конформацию;СН2ОН НО ОН СНоОН
®* \ \ / \ — \Ho\^yV/^o/ hoV-^V3"он сн2он ОНБолее тщательное исследование различных фракций крахмала (ами¬
лозы, амилопектина) и гликогена показывает, что при гидролизе, на¬
пример, полностью метилированного крахмала образуется не только
2,3,6-триметилглюкоза — за счет гидролиза средних звеньев макромоле¬
кулы, но и 2,3,4,6-тетраметилглюкоза — очевидно, за счет концевых
звеньев глюкозы. Кроме того, получается 2,3-диметилглюкоза, наличие
которой указывает ira занятость (и в результате неметилируемость)
первичноспиртовой группы (шестой углеродный атом) некоторых
450УГЛЕВОДЫзвеньев глюкозы, что свидетельствует о наличии разветвлений в макро¬
молекулах крахмалов;СН2ОСНСНаОз СН2ОСН3 СН2ОСН3'н °'И Н 1ОС Нан осн3 н осн3 н ОСН3 Н ' ОСНзСН2ОСН3нIIгоснз& ОСН3 Н ОСНз Н ОСН3 Н осн3
vr VII VIII IX]н2о(н+)•I"СН2ОСНз
Н J—о. нI.IV, V, IX
(концевые звенья)II, Ш, VI
(средние звенья)vn, vm(места ветвления)- 2,3,4,6 -тетршетйЛглюкозаСН2ОСН3
Н J О Н- 2,3,6 - триметилглюкозаНО>|—ZfOH
Н ОСН3СН2ОНн J—О. н-2,3 -диметилглюкйзаН ОСН3По относительному количеству 2,3-диметилглюкозы можно судить
о степени разветвленности крахмала, а по количеству 2,3,4,6-тетраметил-
глюкозы—о числе концевых групп и, значит, о средней длине цепей.Другой метод суждения о количестве концевых групп основан на
определении восстановительных свойств неметилированных крахмалов,
которые обусловлены наличием концевых групп со свободным глико-
зидным гидроксилом;CHjjOH
Н Jr—0„ НL/H Ч|Н Н ОНН■ ■ т г таутомерия i - i i i iОН хонцевой группы ОН ОН О Н ОНН ОНI j.°Н Н ОН Нсн2-| 1
ОН он о н он-с:'он
ПОЛИСАХАРИДЫ451Легко видеть, что определение 2,3,4,6-тетраметилглюкозы в продук¬
тах метилирования дает содержание и глюкозидных и глюкозных кон¬
цевых групп, а метод восстановления — только глюкозных.Из данных, полученных всеми этими путями и посредством опреде¬
ления молекулярного веса, можно сделать вывод, что растворимая в
воде разновидность (или фракция) крахмала — амилоза — имеет не-
разветвленные цепи длиной — 1000 глюкозных остатков, связанные по
типу мальтозы. Нерастворимая фракция крахмала — амилопектин —
представляет собой сильно разветвленный полисахарид гораздо боль¬
шего (1 000000—10000000) молекулярного веса, состоящий из 5000—
50 000 глюкозных остатков. Животный крахмал — гликоген, наиболее
разветвленный из крахмалов, построен по тому же типу, что и амилопек¬
тин. Его молекулярный вес 1000000—10000000 (5000—50000 остатков
глюкозы), цепи его ветвятся через каждые три-четыре глюкозных
остатка.'Молекулы гликогена и амилопектина вследствие ветвления при¬
ближаются к шарообразной форме. Молекулы амилозы имеют линей¬
ную форму, однако это следует понимать довольно условно, лишь в том
смысле, что глюкозные остатки связаны друг с другом последовательно,
без ветвления. Рентгеноструктурный анализ устанавливает спиральное
закручивание последовательно связанных друг с другом шестиугольни¬
ков амилозы Вокруг оси цилиндра, на поверхности которого распола¬
гается эта спираль. Общеизвестное синее окрашивание, которое дает
крахмал с иодом, обусловлено именно амилозой. Она образует с иодом
типичное «клатратное» соединение, так как молекулы иода по разме¬
рам подходят к полости этого цилиндра и размещаются внутри него,
образуя молекулярное соединение включения состава СбНюОбЬ.Что касается целлюлозы, то ее частичный гидролиз приводит, как
говорилось уже, к целлотетраозе, целлотриозе, целлобиозе, а полный —
к глюкозе. Все три первых ол.игосахарида построены по одному типу и
представляют собой, в отличие от крахмалов, р-глюкозидо-(р-глюкози-
до)„-глюкозы. Методом гидролиза метилированных целлюлоз установ¬
лено практически полное отсутствие 2,3-диметилглюкозы, т. е. отсут¬
ствие ветвления. Незначительная восстановительная способность самой
целлюлозы и незначительное содержание 2,3,4,6-тетраметилглюкозы в
продуктах гидролиза полностью метилированной целлюлозы доказы¬
вают большую длину ее цепей. Целлюлоза нерастворима ни в воде, ни
в органических растворителях, но растворима в швейцеровом реактиве,
представляющем собой водный раствор [Си(ЫНз)4](ОН)2. По методу
Штаудингера, определяя вязкость таких растворов (полностью исклю¬
чив соприкосновение с воздухом, который, окисляя, разрывает цепи
целлюлозы), можно установить молекулярный вес различных образцов
целлюлозы.Не меньшее значение, чем химическое строение целлюлозы, для
практики имеет ее так называемая «вторичная структура», т. е. жесткая
конформация отдельных цепей и упаковка их в пучки, которые по рент¬
генографическим данным дают картину «кристалличности».Производные целлюлозыПри обработке целлюлозы концентрированной щелочью происходит
замещение водорода первичного гидроксила в каждом остатке глюкозы
на натрий и получается щелочная целлюлоза (алкалицеллюлоза), а при
обработке водой регенерируется целлюлоза, изменившая свою вторич¬
ную структуру, так называемая гидрат целлюлоза. Процесс называется
452УГЛЕВОДЫмерсеризацией и широко используется в текстильной промышленности
для придания тканям лучшего вида и лучшей окрашиваемости.При действии сероуглерода на щелочную целлюлозу, полученную
непосредственно из древесины, образуется соль ксантогената целлю¬
лозы:ОН ОН онЭта соль растворима в воде, и такие растворы высокомолекуляр¬
ного вещества обладают большой вязкостью (отсюда название вискоза).
Продавливая вискозный раствор через тонкие отверстия в кислотную
ванну, отщепляют сероуглерод и регенерируют целлюлозу в виде тон¬
чайшей нити, которую растягивают, наматывая на бобины. Так готовят
вискозное волокно. Это основной процесс производства искусственного
волокна для текстильных тканей и для технических целей (шинный
корд).Другой, наиболее старый, ныне почти утративший техническое зна¬
чение способ получения искусственного волокна состоит в выдавлива¬
нии через отверстия в кислую ванну раствора целлюлозы в швейцеро-
вом реактиве. При разрушении медноаммиачного комплекса целлю¬
лоза регенерируется в виде нити.При алкилировании целлюлозы образуется в пределе триалкилцел-
люлоза (три алкила на каждое глюкозное звено). Алкилированные цел¬
люлозы применяются при производстве полимерных материалов.Действием уксусного ангидрида получают триацетат целлюлозы.
В отличие от самой целлюлозы это вещество растворимо в ацетоне и
сложных эфирах. Ацетаты целлюлозы используются для получения ки¬
нопленки, пластмасс и «ацетатного шелка».Обработкой целлюлозы смесью азотной и серной кислот можно
получить динитрат целлюлозы (коллоксилин), растворимый в спирто¬
эфирной смеси. При использовании концентрированной азотной кислоты
и 95%-ной серной кислоты получается тринитрат целлюлозы — пирокси¬
лин, лежащий в основе «бездымных» порохов. Бездымные пороха
получают желатинизацией пироксилина добавкой до 30% нитрата глице¬
рина (нитроглицерина) в присутствии стабилизатора, например дифе¬
ниламина, и формованием массы в зерна, куски или цилиндры требуе¬
мых для каждого типа применения формы и размеров.Одно из все расширяющихся применений древесной целлюлозы —
гидролиз кислотами до глюкозы, подвергаемой далее брожению для
получения спирта (гидролизная промышленность). Лигнин при этом
остается — «гидролизный лигнин».
ПОЛИСАХАРИДЫ453Декстраны — 6- (а-£>-глюкопиранозил) - (6-а-£>-глюкопиранозил) „-D-
глюкозы с числом звеньев в несколько десятков или сотен. Вырабаты¬
ваются бактериями на растворах сахарозы. Водные растворы декстра-
нов употребляются в медицине как заменители плазмы крови; они слу¬
жат также для получения молекулярных сит — сефадексов, которые
являются декстранами, имеющими поперечную сшивку молекул.Пентозаны. Такие пентозы, как ксилоза, арабиноза и др., также
образуют целлюлозоподобные полисахариды — пентозаны. Так, ксило-
заном особенно богаты скорлупа орехов, подсолнухов, кукурузные ко¬
черыжки, солома. Из этих продуктов гидролизом может быть получена
ксилоза.Пектиновые вещества. Окислеиие галактозы по первичноспиртовой
группе (шестой углеродный атом) при сохранении альдегидной группы
приводит к галактуроновой кислоте, которая сохраняет способность
к оксо-циклотаутомерии, присущей монозам. Цепи, построенные, напо¬
добие целлюлозы, из остатков галактуроновой кислоты (вместо остат¬
ков глюкозы), но только относительно невысокого молекулярного веса
(20 000—200 000), называются пектовыми кислотами и широко распро¬
странены в растениях:ОН ОН онИх неполные эфиры — пектиновые кислоты — частично обусловли¬
вают густую консистенцию.многих джемов и варений.Декарбоксилируясь, пектовая кислота превращается в пентозан
арабан — полисахарид арабинозы (спутник пектиновых веществ). По¬
лисахариды галактозы — галактаны, имеющие структуру пектовой кис¬
лоты, но с группой СНгОН вместо карбоксила, также входят в состав
пектиновых веществ.Панцирь раков и насекомых состоит из хитина — полисахарида типа
целлюлозы, построенного из остатков N-ацетилглюкозамина:Гемицеллюлозы. Древесина содержит растворимые в щелочи ком¬
поненты, которые частично переходят в сульфитную целлюлозу. Это
так называемые гемицеллюлозы, которые представляют собой гетеропо¬
лисахариды сравнительно невысокого молекулярного веса (~ 30000).
Построены они по типу целлюлозы, но из разных моноз, в значительной
степени из пентоз — £)-ксилозы, D-арабинозы, но также £)-галактозы,
иногда D-маннозы и D-глюкозы, на которые и распадаются при гидро¬
лизе.Камеди. «Вишневый клей», гуммиарабик, трагакант — примеры ра*
стительных камедей. Это гетерополисахариды, которые при гидролизе
454УГЛЕВОДЫдают D-галактозу, D-арабинозу, иногда £)-ксилозу, и уроновые кисло¬
ты— /)-глюкуроновую и /)-галактуроновую.Полисахариды морских водорослей. Морские водоросли содержат
очень большое количество гетерополисахаридов, многие из которых
имеют пищевое или техническое значение. Эти полисахариды содержат
остатки галактозы, маннозы и других моносахаридов, а также дезокси-
сахаров и уроновых кислот. Многие из них являются эфирами серной
кислоты и содержат по одному, а иногда и по два остатка серной кис¬
лоты на моносахаридный остаток. В бурых водорослях содержатся
альгиновые кислоты, структурной единицей которых является маннуро-
новая кислота. Галактуроновая кислота — структурная единица пектино¬
вых веществ фруктов и овощей. Альгиновые кислоты находят примене¬
ние как пищевые загустители. Для той же цели используют извлекаемые
из яблок или свеклы пектиновые вещества.Полисахариды животных тканей. В организме животных и чело¬
века широко распространены гетерополисахариды, которые входят в со¬
став соединительных тканей, крови, нервной ткани. Эти полисахариды
содержат аминосахара, ма-ннозу, галактозу, уроновые кислоты, реже
глюкозу. В некоторых из них часть гидроксильных групп также этери-
фицирована остатками серной кислоты. ч
, Полисахариды микроорганизмов. Мир микроорганизмов особенно
богат самыми разнообразными гетерополисахаридами, которые содер¬
жат широкий набор моносахаридов, в том числе амино- и дезоксиса-
хара и более сложные по структуре моносахариды. Эти полисахариды,
находясь в наружных слоях тела микроба, определяют его биологиче¬
скую специфичность. Известно, например, что каждый тип пневмокок¬
ков— возбудителей воспаления легких — содержит свой собственный
специфический полисахарид. Так, один из этих полисахаридов состоит
из остатков глюкозы и глюкуроновой кислоты, другой — из остатков га¬
лактозы и глюкозамина и т. д.В настоящее время особенно широко исследованы полисахариды
граммотрицательных микробов, которые играют роль антигенов, т. е.
веществ, определяющих иммунологическую характеристику микроба и
отличающих один штамм патогенного микроорганизма от другого. Эти
полисахариды представляют собой гетерополисахариды, содержащие
повторяющиеся звенья три- или тетрасахарида, причем структура этого
звена строго и однозначно «химотипирует» микроб. Полисахаридные
цепи, через сложные по структуре липиды, прикреплены к внешней мем¬
бране микробной клетки.О синтезе полисахаридовПри обработке моносахаридов кислотой в водном растворе полу¬
чается смесь олигосахаридов и сравнительно низкомолекулярных поли¬
сахаридов с ветвящимися цепями и случайным распределением а- и
p-типов связей. Полисахариды с большим молекулярным весом, но
также разветвленные и со смешанной а- и p-конфигурацией образуются
при действии на моносахариды газообразным НС1 или фосфорной кис¬
лотой (Фрам, Ю. Л. Погосов, 3. А. Роговин).Н. К. Кочетков и А. Ф. Бочков применили поликонденсацию орто¬
эфиров сахаров под действием бромной ртути в спиртовом растворе
(спирт — инициатор реакции) для синтеза полисахаридов с определен¬
ным постоянным типом связи в цепи моносахаридных звеньев.Исходными веществами могут служить внутренние ортоэфиры (на¬
пример, ортоэфир арабйнофуранозы, реакция 1) или ортоэфиры, имею-
АМИНОКИСЛОТЫ455щие свободную гидроксильную группу в молекуле (например, ортоэфир
галактозилглюкозы, реакция 2):пкюн(ндвг2)ОСН, ОVОп п
СНоОН ОАсСН,СН2ОНОАс АсО) 64-ОСН-\ОАс ,7'СН2 ОАсО^ OR(1)пСН2 ОАс^ 2
АсО i ОСН,,ОАс АсО ОАсТаким путем получены полисахариды с однородным типом меж-
мономерной связи.АМИНОКИСЛОТЫАминокислоты по взаимному расположению карбоксильной и ами¬
ногруппы делятся на а-, (3-, у- и т. д. аминокислоты, причем имеются не¬
которые специфические способы синтеза аминокислот каждого из этих
классов и свойства их в некоторых отношениях различаются. С биоло¬
гической точки зрения колоссальное значение имеют а-аминокислоты,
ряд которых (табл. 49) можно получить и? природного материала, гид¬
ролизуя белки — мясо, кожу, желатин, шерсть, волос, перо, белки про¬
топлазмы и ядра любой растительной или животной клетки, казеин из
творога, ряд гормонов, подобных инсулину, ферменты (например, пеп¬
син) и т. д. а-Аминокислоты являются простейшими кирпичами в струк¬
туре высокомолекулярных веществ — белков, без которых никакая
жизнь не существует. Белки включают как жирные а-аминокислоты, так
и ароматические и гетероциклические, поэтому их удобнее рассмотреть
в конце курса (часть II).Все природные аминокислоты, кроме аминоуксусной, содержат асим¬
метрический углеродный атом. Все они относятся к L-ряду. Простей¬
шая р-аминокислота — аминопропионовая — входит в состав важного
и универсального витамина — пантотеновой кислоты, но в общем роль
р-аминокислот несравненно более скромная, чем а-аминоКислот. Из дру¬
гих аминокислот важное промышленное значение получили со-аминокис-/°лоты типа NH2—(СН2)„—С, , где п = 5, 6, 8, 10. Из них (точнее, из\эних лактамов) производят синтетические волокна типа капрона (п — 5).
Эти аминокислоты в природе не встречаются.Все аминокислоты, имея в молекуле кислотный карбоксил и основ¬
ную аминогруппу, должны были бы представлять собой неустойчивые
молекулы, но на деле они построены как внутренние соли:СН2—С—ОН —СН2-С-0"NH, ОNH3 О
456АМИНОКИСЛОТЫТаблица 49. Важнейшие аминокислоты белкаТривиальноеназваниеСокра¬щенноеназваниеостаткаамино¬кислотыФормулаТемпе¬ратураплавле¬ния,°cWdв ледяной
уксусной
кислоте,
градусыИзо-элек-триче-скаяточка,pHРаство¬
римость
в воде
прн 25 °С,
г/100 гГликокол,
или глицииG!yNH2CH2COOH262—5,9725АланинAlaNH2CH(CH3)COOH297+336,0016,6ВалинValnh2chcooh1CH(CH3)2315+625,968,85ЛейцинLeuNH2CHCOOH1CH2CH(CH3)2337+22,55,982,2ИзолейцинlieNHjCHCOOH1CH3—CH—C2H5284+496,024,12АспарагиноваякислотаAspNH2CHCOOH1CH2COOH270+25,42,770,5АспарагинAsp1nh2NH2CHCOOHICH2CONH2236+34,35,412,5ГлутаминоваякислотаGIuNH2CHCOOH1CH2CH2COOH249+31,83,220,84ГлутаминGlu1nh2NH2CHCOOH1CH2CH2CONH21856,1(в воде)5,654,2Орнитин (+)OrnNH2CHCOOH1CH2CH2CH2NH2140+ 11,5~“1ЛизинLysNH2CHCOOH1CH2CH2CH2CH2NH2224(разл.)+25,99,74Хорошораство¬римАргининArgNHjCHCOOH1CH21CH2CH2NH—C—NH,IINH238+29,410,7615СеринSernh2chcooh1CH2OH228+ 155,685ТреонинTrenh2chcooh1CH(OH)CH3253—306,1620,5ЦистеинCysNH2CHCOOH1CH2SH178+ 135,02Хорошораство¬римЦистннCys—S
1Cys—S/NH2CHCOOH\
[ CH2S— j2260' -2325,030,011МетионинMetNHjCHCOOH1CH2CH2SCH3283+205,743,5ФенилаланинPheNHjCHCOOH1CH2C6H6283(разл.)-7,53,0
АМИНОКИСЛОТЫ457Продолжение табл. 49ТривиальноеназваниеСокра¬щенноеназваниеостаткаамино¬кислотыФормулаТемпе¬ратураплавле¬ния,°Gl«j£>
в ледяной
уксусной
кислоте,
градусыИзо-элек-триче-скаяточка,pHРаство¬
римость
в воде
при 25 °С,
г/100 гТирозинТугNH2CHCOOH1СН2С6Н4ОН-гг344— 105,66—Т риптофанTryNH2CHCOOH“ijONH382—345,891,14ПролинProH2C CH21 1
H2C^ ^CHCOOHNH299—806,3016,2ОксипролинOprHOHC CH2I 1
H2C^ yCHCOOUNH270—775,8336,1Г истидинHisNH2CHCOOHH2C—C=CH1 1Nx. /NHCH277+7,57,64,3Такая структура не лишает их возможности реагировать как кис¬
лоты за счет отрыва протона от аммониевой группы — N+H3. Ведь и ион
аммония N+H4 реагирует как кислота.Синтез аминокислотСинтез а-аминокислот. 1. Действие избытка аммиака (в
водном растворе или жидкого) на а-галоидзамещенные карбоновые
кислоты. Например:С1СН2—С—ОН + 2NH3 —> NH3—СН2—С—0~ + NH4C1А Аа-амииоуксусная кислота
(глицин; гликокол)I /он IСНз-СН-С^ +2NH3 —> СН3—СН—с( + NH4Brа-аминопропионовая
кислота (алании)В принципе аналогичный способ применим и для синтеза аминокис¬
лот с любым расстоянием аминогруппы от карбоксила, но соответствую¬
щие галоидзамещенные кислоты обычно менее доступны, чем а-галоид¬
замещенные.
458АМИНОКИСЛОТЫ2. Гидролиз а-аминонитрилов, получаемых действием цианистого
аммония (или смеси хлористого аммония и цианистого калия) на оксо¬
соединения (Штреккер, Н. Д. Зелинский):лоNH,NH.О'I 2Н20(Н+) |СН3—с; + NH4CN СН3—С—CN *■ СНз—с—с\н -н*о I I Ч0н наминонитрилNH,NH3(СН3)2С=0 + nh4cnн2о(н+) I /°(СН3)2С—CN »- (СН3)2С—С'чоа-аминоизомаслянаякислот^3. Восстановление оксимов, гидразонов и фенилгидразонов а-кето-
нокислот:NOHnh2oh ' II , > СНз—С—с^.ОНСНз—С—С—ОНnh2nh2 V-> СНз4.УЛонN—NH2опировинограднаякислотаNH2NHCeH5/ОН-> СНзчN—NHC6H5оNH3
СНз— сн—с',0-^оФенилгидразоны а-кетонокислот можно получать также по
В. В. Феофилактову, действуя на ацетоуксусный эфир ароматическими
диазосоединениями (см. кн. II) с последующим кислотным расщепле¬
нием (стр. 391):О R ОII I IIСН3— С—СН— С—ОС2Н6-ЬС6Н5— N^N СГО R ОII I II
СНз—С—С—С—ОС2Н5
IN=NCeH5NaOHО ОII II—>- R—С—С—ONa + СН3—С—ONaIIN— NHC6H5Можно получать а-аминокислоты также непосредственно из а-ке¬
тонокислот, действуя на них аммиаком и водородом над никелевым ка¬
тализатором:+ h2/ni +СНз-С-С-ОН + 2NH3 v СН3—С—С—О" NH4 ► СНз-СН-С-О’ NH4. А А „А А Л А4. Ряд синтезов а-аминокислот осуществлен через малоновый эфир
следующими путями.а) Сначала через натриймалоновый эфир (стр. 186) получают тре¬
буемый для избранной цели алкилмалоновый эфир. Действуя гидрази-
АМИНОКИСЛОТЫ459ном, его превращают в полугидразид — полуэфир, который превращают
действием азотистой кислоты в азид, и последний подвергают перегруп¬
пировке Курциуса (стр. 210) в а-аминокислоту:СООС2Н5NH2NH2 I HNOo
RC1 + Na+{CH(COOC2H5)2j —R-CH(COOC2H5)2 >• R-CH ►| ,-NHNHj
СV)COOC2H6 о
I h2o(h+) II—* R—CH ► R—CH—C—OC2H5 + N2 + C02| /N=N=N nh2^0б) Другой путь синтеза через малоновый эфир заключается в его
нитрозировании и последующем восстановлении нитрозомалонового
эфира в аминомалоновый. Последний ацетилируют и после этого алки-
лируют натриевое производное:hno2 h2/ni
Н2С(СООС2Н6)2 ► HON=C(COOC2H5)2 ►(CH3C0)20 Na, затем RCf—* H2N—СН(СООС2Н5)2 ► СН3—С—NH—СН(СООС2Н5)2 >IIон2о(н+)—* СНз—С—NH—С(СООС2Н5)2 ► R—С(СООН)2 —>■ R—СН—С + С02II I I +1 \гО R NH2 +NH3Имеется и много других путей синтеза а-аминокислот. По данным
В. М. Беликова и К- К. Бабиевского, исключительно удобным исходным
веществом для синтеза а-аминокислот разнообразной структуры служит
эфир а-нитроуксусной кислоты, превращаемый конденсацией с альде¬
гидами (по типу альдольной или кротоновой конденсации) и последую¬
щим восстановлением в а-аминокислоты, например:/°СНз /Н /ОСН3 н /N,СН2-СГ + СН3-< —> СН3-СН-СН-СГ ——>I Чс I I затем н2°(н+)no2 он no2—► СН3—СН—СН—с—онI I II
он nh2 отреонинуОСН3 СН3^ /Н СН3ч /ОСН3 H2/niсн2—с + ^сн-с —> ,сн-сн=с-с' —*I СНз' Ч0 СнУ I затем н2°(н )no2 no2СНзч /ОН—* хсн—сн2—СН—с/сн/ Лн, Ч°лейцннПйдобным образом, конденсируя разные жирные, ароматические
или гетероциклические альдегиды, можно получать все аминокислоты,
460АМИНОКИСЛОТЫявляющиеся производными аланина с заместителем R в метальной
группе.Превращения нитроуксусного эфира можно варьировать, алкили-
руя его в щелочной среде галоидным алкилом или вообще галоидпроиз-
водным (В. В. Перекалин):/ОСНз он- /ОСН3 H2/NiСН2-С' + (СН3)2СНС1 >- (СН3)2СН-СН-С( —*| Ч0 ! затем нго(н+)no2 no2/ОН—»- (СН3)2СН—сн— сI Ч)NH,/ОСНзСН2— CH=CH—CHJ 4- сн2—с^ —>I I ! ^оN02 Cl no2/ОСНз h2/niсн2—сн=сн—сн2— сн—сI | Ч0 затем Н20(Н+)no2 no2/ОН—> СН2—СН2—СН2—СН2—СН—СХI- 14)NHj NHjСинтез р-аминокислот. 1. Важнейший способ — присоедине¬
ние аммиака к а,р-непредельным кислотам:СН2=СН—С—ОН + NH3 —V H2N—СН2—СН2—С—О-А ||О О2. В. М. Родионов предложил метод, в котором совмещаются в од¬
ной операции получение а,р-непредельной кислоты конденсацией аль¬
дегида с малоновой кислотой и присоединение аммиака:СОО"R-C^ +Н2С +2NH3 ——> R-CH-CH2—С-O' NH4
\н | _ ~с°2 | ||coo nh2 оСинтез у-аминокнслот и кислот с еще более уда¬
ленным положением аминогруппы. 1. Для синтеза таких
аминокислот пригоден способ 3, описанный для а-аминокислот.2. (о-Аминокислоты могут быть синтезированы двумя следующими
способами.а) Теломеризацией этилена с четыреххлористым углеродом полу¬
чают ряд тетрахлоралканов (А. Н. Несмеянов, P. X. Фрейдлина и сотр.),* Продукт сопряженного 1,4-присоединения:СН2-СН—СН=СН2+ Cl2 + HNOj —* сн.-сн=сн—сн2NO* Cl
АМИНОКИСЛОТЫ461легко превращаемых в со-аминокислоты:H20(H2S04)яСН2=СН2 + СС14 —> С1—(СН2СН2)„—СС1з ——>-—HL.13.\Н3 +—> С1—(СН2СН2)п—С—ОН мц Г|> NH2-(CH2CH2)„—с—о- nh4
|| —nh4u ЛО об) Бекмановской перегруппировкой (см. кн. II) оксимов цикличе¬
ских кетонов. Наибольший практический интерес представляет перегруп¬
пировка оксима циклогексанона:СН2 СН2 |[+Н2С СН2 NH2OH Н2с СН2 (перегруппировка)—>Н2С\ /С=0 Н2С\ /C=NOHсн2 сн2циклогексанон оксимсн2Н2С СН2 н2о(н+)—>• | I >- СН2—СН2—СН2—СН2—СН2—С—О"Н2с С=0 +| II\ / NHs оН2С—NHкапролактам е-аминокапроновая кислотаПолучаемый этим путем капролактам полимеризуют в высокомо¬
лекулярный поликапроамид—NH—(CH,)s—с-IIО-NH- NH—(СН2)5— СIIО _из которого изготовляют капроновое волокно.Свойства аминокислотНазвания, формулы и свойства важнейших аминокислот приведены
в табл. 49.Как уже сказано, все аминокислоты на деле являются внутренними/°"солями типа H3N—(CH2)*—С , и это отражается на их физическихсвойствах: они высокоплавки, нелетучи, нерастворимы в углеводородах
и эфире, большинство из них растворимо в воде.1. Реакции аминокислот с кислотами и щелочами показаны ниже
на примере аминоуксусной кислоты:+ н+ +5 * H3N—СН2—С—ОНАH3N-CH2—С—О"; А+ ОН'-•> H2N—сн,—С-0-■ АШ
462АМИНОКИСЛОТЫВ первом случае образуется катион II соли аминокислоты как
основания, во втором — анион III соли аминокислоты как кислоты, и
лишь при строго определенной для каждой аминокислоты концентрации
водородных ионов среды (изоэлектрическая точка) существует только
внутренняя соль I. При электролизе такого раствора аминокислота не
перемещается ни к катоду, ни к аноду. В более кислых средах амино¬
кислоты при электролизе движутся в виде катиона II в сторону катода,
в менее кислых — в виде аниона III в сторону анода.а-Аминокислоты образуют характерные медные внутрикомплексные
соли, структура которых показана на примере медной соли аминоук¬
сусной кислоты:о. о nh2
\ / \сн2
| |Н2сх / \ /С
NHa О ^02. Аминокислоты образуют сложные эфиры при действии хлори¬
стого водорода на их спиртовые растворы. При этом, разумеется, об¬
разуются солянокислые соли эфиров, из которых свободные эфиры мож¬
но получить, удаляя хлористый водород окисью серебра, окисью свинца
или триэтиламином:NH3—СН2—С—О" + С2Н5ОН + НС1 —V Г NH3—СН2—С—ОС2Н5А АС Г■+NH3—CHS—С—ОС2Н5АСГ + Ag20 —>- NH2—СН2—С—ОС2Н5 + 2AgCl + Н20ОЭфиры обычных аминокислот —жидкости, перегоняющиеся в ва¬
кууме. Именно этерификацией суммы аминокислот, получающихся в ре¬
зультате гидролиза белка, разгонкой в вакууме и последующим гидро¬
лизом Э. Фишер выделил индивидуальные аминокислоты и дал способ
установления аминокислотного состава белков.3. При действии пятихлористого фосфора на аминокислоты обра¬
зуются солянокислые соли хлорангидридов аминокислот, довольно не¬
устойчивые соединения, при отщеплении НС1 образующие совсем не¬
устойчивые свободные хлорангидриды:... _ _ - -сг + р0с1зNH3—СН2—С—О" + РС15 —>- rNH3—СН2—С—CIА [ А4. Аминокислоты ацилируются по аминогруппе:NH3—СН2—С—О' + /СН3—С\0 —>- СН3—С—NH—СН2—С—ОН + СН3—С—ОНА ( A), h ' h !>ацетилгликоколNH3—СН2—С—О- + С6Н5—С—С1 —► С6н5—С—NH— СН2—С—ОН + НС1А А А Абензоилгликокол
(гиппуровая кислота)\Образующаяся в последней из написанных реакций гиппуровая
кислота — вещество, в виде которого травоядные животные выделяют
с мочой небезвредную бензойную кислоту, попадающую в организм
с пищей.
АМИНОКИСЛОТЫ4635. Аминокислоты можно алкилировать по аминогруппе. Алкилиро-
ванием глицина получается метиламиноуксусная кислота — саркозинNH3—СН2—С—O'+ CH3I —V CH3NH2—СН2—С—СГ + Н1
II IIо осаркозинкоторая в связанном виде содержится в некоторых белках.При избытке иодистого метила образуется замещенная на четвер¬
тичноаммониевую группировку уксусная кислотаNH,—СН2— С—O' + ЗСН31 —v Г (CH3)3N—СН2—С—ОН'II IIО I оГ +2HIот которой можно отщепить HI и получить бетаин, лучше синтезируе¬
мый из триметиламина и хлоруксусной кислоты:(CH3)3N + С1СН2—С—ONa —>• (CH3)3N—СН2—С—О" + NaClII IIО ОбетаинБетаин, получивший свое название от свеклы (Beta vulgaris), в соке
которой он находится, дал название и всему классу внутренних солей,
в которых анион и катион связаны внутри одной молекулы. В этом
смысле говорят о бетаинообразной структуре самих аминокислот:H3N—СН2—С—O' (CH3)3N—СН2—С—О-II IIО о .Бетаины обладают большим дипольным моментом и солеобразны
(тверды, нелетучи, водорастворимы).6. Действие азотистой кислоты на первичные аминокислоты проте¬
кает так же, как и действие на жирные первичные амины — выделяется
азот и аминогруппа замещается на оксигруппу:NH3— СН2—С—O' + HN02 —v НО—СН2—С—ОН + N2 + 2Н20II IIО оТак может быть установлено структурное родство аминокислот с соот¬
ветствующими оксикислотами.Все предыдущие реакции являются общими для аминокислот, не¬
зависимо от положения аминогруппы. При действии азотистой кислоты
на сложные эфиры а-аминокислот реакция идет иначе: 1H2N—СН2— С—0С2Н6 + HN02 —v N=N=CH—С—ОС2НЕ + 2Н20
0 ООбразуется эфир а-диазокислоты, относящийся к важному типу
жирных диазосоединений, который рассмотрен на стр. 216.Все другие типы эфиров аминокислот (|3-, у- и т. д.) реагируют
с азотистой кислотой только как сами аминокислоты — с заменой
ЫНг-группы на ОН.7. Особенно интересны реакции самоацилирования аминокислот.
Они проходят по-разному для разных типов аминокислот.Многие а-аминокислоты уже при простом нагревании превра¬
щаются с выделением воды в циклические замещенные амиды, часто
464АМИНОКИСЛОТЫназываемые ангидридами или дикетопиперазинами. В случае других
а-аминокислот для этой цели приходится нагревать их эфиры, которые
циклизуются легче.-
/°+ /СН2-С^ СН2—сУ сн2—сн2H,N Ч0~ / \ Na + ROH / \„ (ш ^ "< >" " "< - >Н0 /МН3 с СНг сн2—СН,;с-сн2одикетопиперазин пиперазинЧн с--0 R\сн—с сн—сh2n/ ХОС2Н5 / \ *- HN NHС2НБ0 NH2 -2С2н6он \ /\ / С—снС-СН о/ \Rдиалкилдикетопиперазин(И^алкил)Дикетопиперазины — нейтральные твердые, довольно высокоплав¬
кие вещества, растворимые в горячей воде и спирте. При действии вод¬
ных кислот (и щелочей) они, как все амиды, гидролизуются сначала
.частично, с раскрытием цикла, в дипептид, а затем превращаются в две
молекулы аминокислоты:R\сн-с R R/ \ н2о(н+) + | | н2о(н+)HN. ,NH »- H3N—СН—С—NH—СН—С—О"'с—dH i б\rдипептид2H3N—СН—С—0~ОДипептиды при нагревании способны снова замыкаться в дикето¬
пиперазины.Легко видеть, что дикетопиперазины являются азотистыми анало¬
гами лактидов, получаемых из а-оксикислот (стр. 379). а-Аминокисло-
ты — единственные из аминокислот, образующие из двух молекул цик¬
лические амиды с шестичленным гетероциклом.р-Аминокислоты при действии кислот или при нагревании легко
отщепляют аммиак (подобно тому как р-оксикислоты отщепляют в этих
условиях воду) и образуют а,р-непредельные кислоты:H3N—СН2—СН2—С—О" —► NH3 + СН2=СН—С—ОНА АДо недавнего времени считалось, что р-аминокислоты не способны
давать внутренние амиды. Оказалось, однако, что при действии дицик-
АМИНОКИСЛОТЫ465 7 логексилкарбодиимида R—N = C = N—R (где R — циклогексил
СбНи) —сильного водоотнимающего реагента — они образуют лактамы:СН2—с; + R—N=C=N—R —>- СН2—+ RNH—С—NHRI + I I IIСН2—NH3 СН2—NH ОЭти необычные р-лактамы лабильны и легко размыкаются при гид¬
ролизе. р-Лактамная структура найдена, например, в пенициллине
(см. кн. II).у-Аминокислоты образуют лактамы очень легко
сн2—СН2)сн‘ -=& н\ /сн*'о/ ^с'IIочто находится в соответствии с. обычно наибольшей устойчивостью пя¬
тичленных циклов. Как кислотным, так и щелочным гидролизом у-лак-
тамы, хотя и труднее, чем р-лактамы, размыкаются в у-аминокислоту
(или ее соль).Высшие лактамы также способны существовать. Их проще (с пре¬
красным выходом) получать бекмановской перегруппировкой оксимов
циклических кетонов (стр. 461):Н.С-СН, н+ „2с/С%-:0C=N—ОН —>■ | |н г гн НгС^ /NHН2С—СН2 СН28. Кроме циклических амидов (дикетопиперазинов и лактамов),
все аминокислоты способны образовывать уже упомянутые ацикличе¬
ские амиды — дипептиды — путем ацилирования карбоксилом одной кис¬
лоты аминогруппы другой. Эти важные вещества будут рассмотрены
после разделов об установлении строения и конфигурации аминокислот,
которые дополнят сведения о реакциях аминокислот.Установление строения природных аминокислотМногие простейшие аминокислоты известны с 20-х годов прошлого
столетия. В 1820 г. из продуктов гидролиза белков Браконно выделил
гликокол (глицин).Принадлежность природных аминокислот к ос-аминокислотам легко
устанавливается по их способности образовывать дикетопиперазины и
характерные внутрикомплексные медные соли. Азотистая кислота пре¬
вращает их в а-оксикислоты, из которых многие известны уже со вто¬
рой половины XVIII столетия. Если при этом получается неизвестная
оксикислота, то аминогруппу можно заменить на хлор действием хло¬
ристого нитрозилаR RI INH3—СН-С—О + NOC1 —► С1—СН— С—ОН + N2 + Н200 с!а затем, заменив действием цинка в кислой среде хлор на водород, по¬
лучить известную карбоновую кислоту (в случае аминодикарбоновыхЮ .зал., влг
466АМИНОКИСЛОТЫкислот — двухосновную). Таким путем, например, из валина образуется
изовалериановая кислота, из лейцина — изокапроновая, из глутамино¬
вой — глутаровая, которые легко идентифицировать по каким-либо твер¬
дым производным (например, по анилидам, см. кн. II).В диаминокислотах нужно еще установить положение второй ами¬
ногруппы, для чего можно в некоторых случаях использовать легкое
замыкание кислот в цикл в присутствии отнимающих аммиак веществ:Можно также, действуя азотистой кислотой, заместить обе амино¬
группы на гидроксилыи убедиться затем, что одна гидроксильная группа — первичная, напри¬
мер, при окислении образует альдегидную, а не кетонную функцию.В случае наличия кроме аминогруппы и карбоксила еще и третьей
функциональной группы (практически это может быть НО—, HS—,
CH3S— или —S—S—) необходимо установить строение углеродного
скелета. Это достигается восстановлением в тех или иных условиях
групп SH и —S—S—, которые при гидрировании над никелем удаляются
в виде сероводорода (р случае CH3S-rpynnbi — в виде метилмеркаптана)
и замещаются на водород. О замене гидроксила на водород уже было
сказано.Место второй функциональной группы можно установить приведен¬
ными ниже реакциями. При этом необходимо иметь в виду, что речь идето четырех найденных в белках аминокислотах, имеющих по три различ¬
ные функциональные группыне считая цистина, строение которого определяют по его легкому взаи¬
мопревращению с цистеином:н2с—сн2CHj—снг—снг— СН— С—О"1+NHaNH3 ООорнитиипроливH2N-CH2-CH2—СН2—СН2—СН—С—О" + 2HN02 —►лизииНОСН.—СНг—СНа—СН2—СН— С-ОН2,6-диоксикапроновая кислотаНО-СН2—СН—С-О'1+ II
NH3 ОСНз-СН—СН-С-О'I U IIОН NH3 ОсериитреонинHS—CHj—СН-С—О"СН8—S—СН2—СН2—СН—С—0~цистеинметионинО2HS—CH2—СН—С—0‘ ч=* "О—С—СН—СН2—S—S—СН2—СН—с—0~нцистеиыцнстин
АМИНОКИСЛОТЫ467Родственные отношения цистеина и серина устанавливаются пре¬
вращением серина в цистеин действием P2S5:P2S52HO—СН2—СН—С—О ——» 2HS—СН2—СН—С—ОU II 1+ IINH3 О NH3 Осерии цистеинP-Положение гидроксила в серине может быть установлено пре¬
вращением серина при действии азотистой кислоты в глицериновую кис¬
лоту (замена а-аминогруппы на ОН-группу).Строение треонина устанавливается окислением его йодной кисло¬
той, которая разрывает не только связи^С—о//\ |\но (!>нно и связихс—о//\ |\НО NHaПри периодатном окислении треонин превращается в ацетальдегид,
глиоксиловую кислоту и аммиакню, /нснз-сн-сн-с-о" ► сн3—с; + c-c-oh + nh,I U I! чо н/ IIОН NH3 о - ооткуда следует, что в треонине имеется концевая метильная группа и
группировка>-</| |\
но nh2Все выводы о строении указанных аминокислот, как всегда, под¬
тверждаются синтезом. Так, строение метионина следует из его синтеза
алкилированием натриевого производного ацетиламиномалонового эфи¬
ра (стр. 459) действием CH3S—СН2СН2—С1CH3S-CH2CH2—Cl + Na+СН3—С—NH—с/с—ос2н5о Vo /2jCH3SCH2CH24 н2о(н+);с/с-ос2нл ch3sch2ch2—с/с—он\сн3—С—NH^ ill I II II I -с°2Vo 12 h2nVo /2о—► CH3SCH2CH2—СН—с-онI 1NHa О
метиошш16*
ч468 АМИНОКИСЛОТЫи подтверждается также синтезом из пропилена через акролеин (про¬
мышленный метод):CH3SH nh4cnСН2=СН—С^ ► CH3S-CH2-CH2—С^ ►ХНн2о(н+)—9- CH3S—СН,—СН2—СН—CN ► CH3S—СН2— СН2—СН—с—ОНI I IInh2 nh2 оСерии получен (Э. Фишер и Лейхс) синтезом Штреккера из глико¬
левого альдегида:NH3 2Н20(Н+)СН2—С—Н + HCN —>- СН2—СН—CN ► СН2—СН—CN ►I I II IIОН О ОН ОН ОН NHg—>- СН2—СН-С-O'+ NH3J+ОН, NH3Треонин может быть получен альдольной конденсацией ацетальде-
гида с медной солью глицина (Акабори). Ион меди, связанный с ами¬
ногруппой, служит здесь не только защитой аминогруппы, но и прото-
низирует водороды а-метиленового звена (так как в медном комплексеазот приобретает аммониевое состояние Си—NH2—):СН3О*. о NH2 °v ° H2Nсн—он,Си' I + 2СН3-СГ —► I Wн2С\ / \ /С. \н нй\ / \ /С^nh2 о ^о I nh2 о ^оНО—НССН3JHC12СН3—СН—СН—с' + СиС12I 1+ \о-ОН NH3Дальнейшие реакции синтеза и взаимопревращения а-аминокислот
будут приведены в следующем разделе.Конфигурация природных а-аминокислотВсе а-аминокислоты (кроме H2N—СН2СООН) имеют асимметриче¬
ский углеродный атом (именно а-углеродный атом); некоторые из них
имеют два асимметрических углерода, например треонинН НI. I.СН3—С—С—С—О"I |+ IIНО NH3 ОКонфигурация а-асимметрического углеродного атома у всех при¬
родных а-аминокислот одинаковая. Это доказано взаимным превраще¬
нием природных а-аминокислот друг в друга реакциями, которые не
разрывают и не создают связей с асимметрическим углеродным атомом
АМИНОКИСЛОТЫ469(как говорят, не затрагивают асимметрический углерод) и, следова¬
тельно, безупречны в стереохимическом отношении (см. стр. 369 о валь-
деновском обращении). Вот примеры таких реакций:°Ч /°'
Сн--с
Iсн2NH3Оnh2(—)*аспарагииNaOBr
(деструкция
по Гофману)
>-°ч /°‘н-с
I-с-
ICH2—NH2-NH3(Нг)-диаминопро пионовая
кислота°ч /°“СI +
Н-C—NH3
IСН3(+)-аланинОч.■ЧМН3хуOs.0'н-сI +
-с—NH3ICH2—C1|Ba(SH)2РС15Н-сI-с--NH33Iсн2—он(—)-серино.Ч
сI +Н—C-NH3ICH2—SH
'(—)-цистеинВсе эти аминокислоты, вращающие плоскость поляризованного
света в разные стороны, относятся, следовательно, к одному и тому же
ряду D- или L-. Остается установить, к какому именно ряду, а для этого
необходимо выяснить их пространственное соответствие в конечном
счете с D- или L-глицериновым альдегидом, или с L-винной кислотой,
или с одной из оксикислот, отношения которых (стр. 360) с этими опор¬
ными веществами установлены. Это выполнили В. Кун и Фрейденберг
довольно убедительным сравнением молекулярного вращения плоскости
поляризованного света ряда производных D- и L-молочных кислот, с од¬
ной стороны, и (+)-аланина — с другой (табл. 50).Сравниваемые производные имеют структуры:СН3—СН—С—XI II
RO Осн3—сн-с-х■ I IIRHN ОПоскольку структуры сравниваемых молочной кислоты и аланина
аналогичны, естественно ожидать одинакового хода изменений моле¬
кулярного вращения при переходе от одного аналогичного производного
к другому в случае одинаковой конфигурации. Сравнение столбцов III
и V таблицы показывает сходство изменений [M]D, а сравнение столб¬
цов IV и V устанавливает различие. Отсюда следует, что природный
( + )-аланин по конфигурации соответствует L-молочной кислоте, а зна¬
чит, L-винной кислоте и L-глицериновому альдегиду (стр. 360). Таким
образом, все природные аминокислоты относятся к L-ряду.Этот очень вероятный вывод становится достоверным при учете
соображений, основанных на знании законов вальденовского обращения
(стр. 369). Если скорость нуклеофильного замещения соответствует
470АМИНОКИСЛОТЫТаблице SO. Сравнение Молекулярного вращения [М]в аналогичных
производных D- и i-молочных кислот в природного аланинаRXПроизводные молочных кислотсн3-сн-с<1 . чхORПроизводныеприродного(+)-аланинасн3-сн-с<1 Nx
NHR(+>-£-l-)-DIиIIIIVVС6Н5СОnh2+ 120°— 120°+70— 80°С6Н5СООС2Н5+49°—49°+ 12°С6Н5СООСНз+35°1СОСПо0°СН3СООС2Н5+76°—76°1Оn-CH3C6H4S02ОС2Н5—129°+ 129°ОООГ'-1реакции второго порядка (символ Sn2), т. е. если скорость пропорцио¬
нальна произведению концентраций обоих реагентов, то, как установили
Инголд, Хьюз и сотр., реакция всегда идет с вальденовским обраще¬
нием. Эта закономерность позволила упомянутым английским авторам
еще раз, независимым образом, установить тождество конфигураций
(+)-аланина и (+) -L-молочной кислоты:1-ряд°ч/°нD-ряд°Ч /он
с1-рядоч/он1-ряд°Ч /онно--нNaOH‘«ЛЬГн-сн3-ВгМаМзSjv2N3СН3-нСНо(—И,-молочная
кислота(+)-бромпропио-
новая кислотаа*а зидопро пио но*
вая кислотаh2n-СН3(+)-аланинНПонятие о способе установления конфигурации второго асимметри¬
ческого атома углерода, если он есть, можно дать на примере треонина.
Как всегда в природных а-аминокислотйх, а-углеродный атом треонина
имеет L-конфигурацию. Это следует из того, что треонин восстанавли¬
вается посредством иодистого водорода в Присутствии красного фосфора
в L-аминомасляную кислоту (реакция не затрагивает асимметрический
углеродный атом):°Ч /°~
‘ С°Ч/°СH3N--НснонIсн3Н1(Р)H,N--нСН2<^наПри окислении же треонина образуется Р-молочная кислота0Ч/°"СH3N-H--н
-онСНз„ ov .он
о. Ч /—> Сн-—онСНз
ДИПЕПТИДЫ И ПОЛИПЕПТИДЫ471откуда следует D-конфигурация p-углеродного атома. Диастереомер
треонина называется аллотреонином. При описанном ранее (стр. 468)
синтезе треонина конденсацией ацетальдегида с медной солью глицина
образуются оба диастереомера.Треонин соответствует по конфигурации L-треозе (трео-конфигура¬
ция), а аллотреонин — L-эритрозе (э^игро-конфигурация) (стр. 425);°Ч/°"О.Ч/уH3N—
Н--Н-НОСН3треонин(греа-конфигурация)H3N-НО--н-нСН3аллотреонин<эригро-конфигурация)ДИПЕПТИДЫ И ПОЛИПЕПТИДЫДипептидами называются а-амино-Ы-ациламинокислоты
R—СН—С—NH—СН-С—О'l+ I! I IINH3 О R ОПолипептиды построены по тому же амидному принципу из не¬
скольких одинаковых или разных аминокислот. Они называются по чис¬
лу участвующих остатков аминокислот ди-, три- и т.д. полипептидами.Дипептиды с одинаковыми а-аминокислотными остатками можно
получать гидролитическим размыканием дикетопиперазинов (стр. 464).
Дипептиды с любыми а-аминокислотными остатками были полученыЭ. Фишером путем ацилирования аминокислоты по аминогруппе хлор-
ангидридом а-галоидзамещенной кислоты и последующей заменой а-га-
лоида на аминогруппу действием аммиака:С1—СН-С—NH—СН—С—ОН + НС1I 1 I IIR О R ОH3N-CH—С-NH—СН-С—O' + NH4C1I II I IIR О R ОПодобная же последовательность реакций, примененная к получен¬
ному дипептиду, приведет к трипептиду и т. д. Э. Фишер получил таким
путем октадекапептид, состоящий из 18 остатков аминокислот.В более новых методах синтеза полипептидов исходят из хлорангид-
ридов аминокислот (или из иных функциональных производных амино¬
кислот с резко выраженной ацилирующей способностью) с защищенной
аминогруппой. Такая защита необходима, чтобы хлорангидрид первой
аминокислоты не проацилировал себе подобную молекулу, а осуществил
связь со второй аминокислотой. Защита аминогруппы ацетилированием
мало удобна, так как условия удаления ацетильной группы гидролизом
таковы, что сам ди- или полипептид будет гидролизоваться, распадаясь
на аминокислоты. Поэтому аминогруппу кислоты, предназначенной в ка¬
честве ацилирУющего агента и превращаемой для этого в хлорангидрид,
защищают, вводя в аминогруппу такую группировку, которую можно
удалить из дипептида гидролизом в очень мягких условиях или каким-
либо другим методом. Например, группу CF3CO— можно удалить об¬
работкой слабой щелочью или гидрогенолизом; группу С6Н5СН2ОСО—С1—СН—С—С1 + H2N—СН—С—ОНI II I IIR О R ОCl—СН—С-NH—СН—С-ОН + 2NH3I II I IIR О R' О
472ДИПЕПТИДЫ И ПОЛИПЕПТИДЫлегко удалить гидрированием над палладиевым катализатором, восста¬
новлением раствором натрия в жидком аммиаке или действием гидр¬
азина; фталильная группа под действием гидразина отщепляется в видеСО
/ '''NH
СбН/ I
\ /NH
СОЧто касается того, в форме какого функционального производного
должен находиться карбоксил защищенной описанным способом амино¬
кислоты, то чаще, чем хлорангидриды, применяют легко ацилирующие
эфиры или смешанные ангидриды, например:HN—СН—С—О—-V \—N0, или HN—СН—С-2. . I I IIX R О X R О-О—С—OR'<5где X — защищающий аминогруппу заместитель, R' — остаток про¬
странственно затрудненного алифатического спирта, например
(СН3)2СН—СНгОН, что обеспечивает разрыв ацилирующей молекулы
по линии, намеченной пунктиром.Приведем примеры защиты аминогруппы и ацилирования одной
аминокислоты (в виде разных функциональных производных) другой
с последующим отщеплением от дипептида защищающей группы.Пример 1. а) Защита аминогруппы:СвН6СН2ОН + С1СОС2Н5 —♦ С6Н5СН2—О—С—ОС2Н6 + НС1<!) Ьбензиловый спирт бензилэтилкврбонатRС6Н6СН,—О—С—ОС2Н6 + H3N—СН—С—0~ —>•II IIО ОRI—♦ С6Н5СН2—О—С—NH—СН—С—ОН + С2Н5ОН• .11 IIО Об) Превращение карбоксила защищенной аминокислоты в активное функцио¬
нальное производное (в данном случае — в хлорангидрид):R RI РС16 IС6Н5СН2—О—С—NH—СН—С—ОН »- С6Н5СН2—О— С—NH— СН—С—С1II II II IIО О О Ов) Спаивание в дипептид:R R'
ДИПЕПТИДЫ И ПОЛИПЕПТИДЫ473г) Освобождение от защитной группы
(Э. Бергманн)R R'H2/Pd I IА >- H2N—СН—С—NH—СН—С—ОН + С6Н5СН3 + С02II IIО ОП р и м е р 2. а) Защита аминогруппы:R R(CF3CO)oO + H2N—СН—С—О' —>- CF3—С—NH—СН—С—ОНII II IIО о об) Получение активного функционального производного (смешанного ангид¬
рида) *:R RI N(CH3)3 | +CF3—С—NH—СН—С—ОН ► CF3—С—NH—СН-С—О NH(CH3)3II II II IIО О 0 0CI-C—0-СИ2—СН(СНз)2дRCF3—С—NH—СН—С—О—С—О—СН2—СН(СН3)2А АО 0 0в) Спаивание в дипептид:R R'I + ICF3—С—NH—СН—С—О—С—О—СН2—СН(СН3)2 + H3N—СН—С—О —»II II II АООО оR R'—► CF3—С—NH—СН—С—NH—СН—С—ОН + (СН3)2СН—СН20Н + С02II II IIОООг) Освобождение от защитной I 0(н+\
группы (Вейганд, Виланд) j 2 'R R'H,N—СН—С—NH—СН—С—ОН + CF3COOHII IIО оПример 3. а) Защита аминогруппы (образование фталоилыюго производного):О ОII о HDс R с RСвН^ чо + H3N-CH-C-0‘ —> с6н/ %-СН-С-ОН + н20II \/ IIс о С оII IIо о* Изобутиловый хлоругольный эфир берут потому, что он в силу пространствен'
ных препятствий не гидролизуется по связи С—ОСНзСЩСНзЬ-
474ДИПЕПТИДЫ И ПОЛИПЕПТИДЫб) Получение активного ацильного производного дициклогексилизомочевины:
Ос R/ \ 1С6Н4' ,N-CH—С—OH + C6HuN=C=NCeHn —►N /
сIIоодициклогексилкарбодиимидС.Н,в) Спаивание в дипептид:
О/ \ 1
с,н/ ;n—сн-с-Y АооIIс/Ч\/
с
I!.
оRIN—CH—С-
IIО-о—с/NHC6Hi4NC6H,t-o-c■NHCeH);NC6HUR'+ I+ H3N—СН-С—ОIIОC6H4^ ^N-cIIоR R'I I-CH-C-NH—CH—C--OH + CeHnNH—C—NHC6H,Ог) Освобождение от защитной
группы (Шихан)ООдициклогексилмочевинаh2n—nh2R'С R/ ^NH + |С6н/ I + HsN—CH—C—NH—CH-C—O'
\ /NH || И ■С О ОТе же методы (и ряд других, здесь не рассмотренных) пригодны и
для синтеза три-, тетра- и полипептидов. Конкретные примеры природ¬
ных полипептидов и их синтеза будут рассмотрены в разделе, посвя¬
щенном белкам (см. кн. II). Такой направленный синтез полипептида
с определенной последовательностью иногда нескольких десятков ами¬
нокислотных остатков представляет собой крайне кропотливую и трудо¬
емкую операцию и был бы практически невозможен без применения со¬
временной техники синтеза и разделения веществ, понятие о чем будет
также дано в разделе о белках.Совершенно иное дело — получение полипептидов, даже с высоким
молекулярным весом, из остатков одной кислоты. Для этой цели выра¬
ДИПЕПТИДЫ И ПОЛИПЕПТИДЫ475ботан следующий метод (Лейхс), рассмотренный на примере глицина
<R=H):IСвН6СН2-0-С-С1 + h2n—сн-с-он —*•II IIо ояI—V с6н5сн2—о—с—nh—сн—с-он —►II IIо оv R—сн—С'\ нагревание i Ч—С6Н5СН2-0—С—NH—СН—С—С1 ► ;о+СвН5СН2С1i А ™-<0Такие циклические внутренние смешанные ангидриды при нагре¬
вании распадаются с выделением С02 и образованием высокомолеку¬
лярных полипептидов:R-CH-C^ ^ fп I О —>- иС02 + —NH—СН—C-(NH—СН—С-)„_хHN С 11 11Ч0 ° °Полипептиды, так же как и сами аминокислоты, амфотерны и ка¬
ждому свойственна своя изоэлектрическая точка. Они представляют со¬
бою соединения, промежуточные между аминокислотами и белками,—
в условиях кислотного и щелочного гидролиза и те и другие распа¬
даются на аминокислоты. Низшие полипептиды кристалличны, раство¬
римы в воде; по мере перехода к более высокомолекулярным полипеп¬
тидам способность к кристаллизации ослабевает. Полипептиды могут
также включать моноаминодикарбоновые кислоты, подобные аспараги¬
новой и глутаминовой. Тогда они приобретают кислотные свойства за
счет второй карбоксильной группы. Полипептиды, образованные с уча¬
стием диаминокислот, имеют основной характер. Свойства полипепти¬
дов, образованных с участием серина (|3-окси-а-аминопропионовой кис¬
лоты) и цистеина (p-меркапто-а-аминопропионовой кислоты), отражают
наличие ОН- и соответственно SH-групп. Некоторые полипептиды
играют важную биологическую роль в живых организмах. Таков, на¬
пример, трипептид глутатионНО—С—СН—СН2—СН2— С—NH-CH—С—NH—СН2-С—ОНII I II I II IIО NH, О СН2 О ОISHроль которого состоит в участии в окислительно-восстановительных про¬
цессах.В химии белков и полипептидов для сокращения принято писать
формулы, обозначая остатки аминокислот буквами (таблица с такими
обозначениями приведена на стр. 456). Например, Glu — обозначение
глутаминовой кислоты, Cys — цистеина, Gly — глицина и т. д. Сокра¬
щенная формула глутатиона будет в таком изображенииGlu—Cys—Gly
476ПОЛИЛМИДЫ ИЗ ю-АМИНОКИСЛОТГлутатион, как все меркаптаны, легко окисляется в дисульфидную
форму и из нее легко получается снова восстановлением:—2Н2Glu—Cys—Gly 2н> GIu—Cys—GlyGlu—Cys—GlyПолипептиды могут иметь и макроциклическое строение, например:
Val—Orn—Leu—Phe—ProI IPro—Phe—Leu—Orn—Valграмицидин (антибиотик)Здесь Val — валин, Orn — орнитин, Leu — лейцин, Phe — фенилала¬
нин, Pro — пролин.Представление о том, каким путем идет включение в цикл новых
звеньев аминокислот и, таким образом, расширение циклического по¬
липептида, дают опыты М. М. Шемякина, который показал, что при
ацилировании аминокислотой (конечно, в виде одной из аминоацилирую-
щих ее форм) амидной группировки полипептидного цикла происходит
следующий ряд превращений:ОН оNH2 0=C'-'g NH—C"-g NH—с:-NHrCH-C-X + °“5j ^ ^ Ah-C-NH jR о R О R с R ооI II IIIТаким образом, на стадии III новая аминокислота оказывается
включенной в цикл.Ряд относительно сложных полипептидов (или, что то же, простых
белков) играет в организме роль гормонов и ферментов. Однако эти
вещества удобнее рассмотреть позднее вместе с белками.ПОЛИАМИДЫ ИЗ (й-АМИНОКИСЛОТАналоги (хотя и отдаленные) полипептидов можно получить син¬
тетически из ш-аминокислот, причем практическое применение находят
соединения этого типа, начиная с «полипептида» со-a минокапроновой
кислоты. Эти полипептиды (лучше называть их полиамидами) полу¬
чаются нагреванием циклических лактамов, образуемых посредством
бекмановской перегруппировки оксимов циклических кетонов (например,
См. стр. 461):СН2
/ \СН, СН2| нагреваниеС=0 у NH(CH2)6—CNH(CH2)5-CNH(CH2)5—С I II II IIСН2 NH ООО\ /
сн2капролактам фрагмент макромолекулыполлкапроамнда
ИМИНОКИСЛОТЫ И НИТРИЛОКИСЛОТЫ477Из расплава этого полимера — капроновой смолы (т. пл. 215 —
220 °С) вытягиванием формуют волокно капрон (или найлон 6). В прин¬
ципе этот метод применим и для получения гомологов капрона.Полиамиды можно получать и поликонденсацией самих аминокис¬
лот (с отщеплением воды):Полиамиды указанного типа идут для изготовления синтетического
волокна, искусственного меха, кожи и пластмассовых изделий, обла¬
дающих большой прочностью и упругостью (типа слоновой кости). Наи¬
большее распространение поручил капрон вследствие доступности сырья
и наличия давно разработанного пути синтеза. Энант и рильсан обла¬
дают преимуществом большей прочности и легкости.ИМИНОКИСЛОТЫ И НИТРИЛОКИСЛОТЫТак называются соединения типаНазвание нитрилокислота неудачно, так как может вести к пута¬
нице с нитрилами. При п = 1 написанные выше формулы изображают
сс-иминодиуксусную и а-нитрилотриуксусную кислоты. Иминокислоты
получаются как побочные продукты при синтезе аминокислот дей¬
ствием аммиака на галоидзамещенные кислоты, особенно при отсут¬
ствии большого избытка аммиака. Обе эти кислоты можно получить,
действуя монохлоруксусной кислотой на глицин:п1ЧН3-(СН2)6-С-0“ —> NH(CH2)6-CNH(CH2)S-CNH(CH2)S-C—..оооофрагмент макромолекулы
полиамида энангnNH3—(СН2)ю—С—О” —> NH(CH2),o-CNH(CH2)io—CNH(CH2),o—С—••IIОооофрагмент макромолекулы
полиамида рильсан
(или ундекан)онH3NCH2-C-0IIО+N(CH2—С,-ОН)3 + 2НС1
IIО
478АМИНООКСОСОЕДИНЕНИЯНитрилбтриуксусная кислота, называемая в технике НТУ, со мно¬
гими металлами образует комплексные соли (отсюда название ком-
плексоны),оv-f У Уh^c-i^-ch, /‘СН2и находит применение в аналитической химии и в технике для разделе¬
ния металлов, так как многие соли такого типа растворимы в органи¬
ческих растворителях и извлекаются ими из водных растворов. НТУ на¬
ходит широкое применение для устранения жесткости воды (связывание
кальция в растворимый комплекс).Для аналогичных целей применяется и этилендиаминтетрауксусная
кислота ЭДТУ, получаемая действием монохлоруксусной кислоты на
этилендиамии:СН2—СН2 + 4СН2—С—ОН —* (НО—С—CH2)2N—СН£СН2—N(CH2—С—ОН)2I I I II II IIh2n nh2 Cl о О оАМИНООКСОСОЕДИНЕНИЯВ отличие от аминокислот аминоальдегиды и аминокетоны не свя¬
заны с какими-либо природными продуктами и не получили большого
практического значения, поэтому мы ограничимся кратким упоминаниемо них. • .а-Аминоальдегиды очень неустойчивы. Их применяют в синтезе
в виде ацеталей, получаемых из ацеталей а-хлоральдегидов:С1СН2—СН(ОС2Нв)2 + 2NH3 —V NH2CH2—СН(ОС2Н5)2 + NH4C1а-Аминокетоны более устойчивы. Они получаются из хлорзамещен-
ных кетонов:CICHj—С—СН3 + 2NH3 —► NH2CH2—С—СНз + NH4C1O ' ОP-Аминоальдегиды и р-аминокетоны получают присоединением ам¬
миака к непредельным оксосоединениям:СНзЧ СНзч^С=СН—С—СНз + NH3 —► ,С—СН2~С—СНзсн/ A <1Как всегда, ориентирующее влияние карбоксила таково, что водород
присоединяется по двойной связи в соседнее положение, а аминогруп¬
па— в p-положение (против правила Марковникова).Действуя формальдегидом на кетоны со свободным a-звеном СН2
в присутствии амина R2NH, получают р-аминокетон (реакция Манниха);,ОR—-СН2—С—R' + СН20 + HNRT —► R—СН—С—R'II IО СН2—NRj'Реакция идет через промежуточную стадию образования непредель¬
ного кетона.
ПРОСТРАНСТВЕННЫЕ ЗАТРУДНЕНИЯ479ПРОСТРАНСТВЕННЫЕ ЗАТРУДНЕНИЯ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
ПОНЯТИЕ О КОНФОРМАЦИОННОМ АНАЛИЗЕПоворот вокруг двойной связи невозможен без нарушения.тс-связи,
что требует большой затраты энергии — около 60 ккал/моль. Это являет¬
ся причиной цис-транс-изомерии олефинов и их производных.Вращение вокруг простой связи долгое время считалось вполне сво¬
бодным. Лишь в 1936 г. была высказана и обоснована мысль, что это
вращение затруднено, и притом у различных предельных соединений в
разной степени (Кемп и Питцер). Расчет термодинамических свойств
молекул углеводородов, при котором учитывались все возможные коле¬
бания и вращения атомов в молекуле, приводил к результатам, заметно
отличающимся от экспериментальных данных. Кемп и Питцер показали,
что эти отклонения сводятся к минимуму, если отбросить гипотезу о сво¬
бодном вращении и применить в расчетах модели с синусоидальным по¬
тенциальным барьером (смысл этого термина станет ясен из дальней¬
шего).При сближении двух несвязанных атомов на расстояние, чуть мень¬
шее суммы их ван-дер-ваальсовых радиусов, начинается противодейст¬
вие, отталкивание электронных оболочек этих атомов, которое резко уве¬
личивается по мере их дальнейшего сближения. Таким образом, при
оценке энергии молекулы и ее реакционной способности следует учиты¬
вать не только энергию связей, полярные эффекты и др., но и простран¬
ственное взаимодействие не связанных между собой атомов. При образо’-
вании связи между двумя атомами углерода расстояние между ними
становится меньше суммы их ван-дер-ваальсовых радиусов. Вследствие
этого сближаются в пространстве и связанные с ними группы и, даже
если объем их невелик, становится возможным пространственное взаимо¬
действие между этими группами (длина связей всегда значительно мень¬
ше, чем сумма ван-дер-ваальсовых радиусов соответствующих атомов).Рассмотрим, например, молекулу этана. При вращении одной из ме¬
тальных групп относительно другой молекула принимает одну из форм,
приведенных ниже, или одну из промежуточных между ними. Слева изо¬
бражены проекционные формулы Ньюмена (вид на молекулу этана
«сверху» вдоль оси С—С; верхний атом углерода обозначен точкой, ниж¬
ний—кругом). В формуле Б атомы водорода при разных атомах угле¬
рода для удобства рассмотрения несколько смещены относительно друг
Друга,п заторможенная конформацияАзаслоненная конформацияПри вращении метильной группы в этане относительно другого ме¬
тила на 360°' молекула трижды принимает каждую из приведенных
форм. В положении Б атомы водорода находятся на наименьшем
480ПРОСТРАНСТВЕННЫЕ ЗАТРУДНЕНИЯЛЕ0°120°2Ы)а380°Рис. 54. Потенциальные барьеры взаимного
перехода конформаций этана.расстоянии друг от друга. Эта конформация называется заслоненной
(или эклиптической). Ей соответствует максимум энергии, поскольку
здесь отталкивание между атомами водорода наибольшее — они распо¬
ложены попарно наиболее близко один к другому. Из этого энергетиче¬
ски невыгодного состояния молекула стремится перейти в более устойчи¬
вое, соответствующее модели А. В этой конформации атомы водорода
находятся на наибольшем возможном расстоянии друг от друга, взаимо¬
действие между ними минимально; такая конформация называется
заторможенной.Под конформацией вообще понимается форма, которую может при¬
нять молекула при вращении любой ее части около простой связи. Ча¬
сто, краткости ради, под кон¬
формациями разумеют лишь те
формы, которым соответствуют
минимумы энергии и которые,
вообще говоря, только и реали¬
зуются.Вращение в этане оказы¬
вается, таким образом, не впол¬
не свободным. Минимум энер¬
гии соответствует заторможен¬
ной конформации, максимум—■
заслоненной, энергия остальных форм принимает промежуточные зна¬
чения. Энергия молекулы этана изменяется в зависимости от угла
поворота одной метальной группы относительно другой в соответствии
с синусоидальной кривой (рис. 54). Для перехода одной заторможен¬
ной конформации в другую (для этапа они эквивалентны) необходимо
преодолеть потенциальный барьер АЕ = 3 ккал/моль, и, следователь¬
но, получить извне соответствующую энергию (переход заслоненной
конформации в заторможенную совершается самопроизвольно с выде¬
лением энергии). При комнатной и даже значительно более низких
температурах этот небольшой барьер не служит препятствием. Чтобы иск¬
лючить свободное вращение при 20 °С, величина барьера должна состав¬
лять 25—30 ккал/моль, но и такие барьеры недостаточны для существо¬
вания так называемых пово¬
ротных изомеров как химиче¬
ских индивидуумов.Рассмотрим теперь кон¬
формации н-бутана, которые
возникают при повороте этиль-
ных групп относительно друг
друга около центральной
С—С-связи. Ниже изображены
три заслоненные (АБ' и В')
и три заторможенные (А, Б и
В) конформации, образующие¬
ся из конформации А при по¬
вороте на 360°. Взаимодействие между непосредственно не связанными
группами увеличивается с увеличением их объема. Поэтому из засло¬
ненных конформаций наибольшей энергией обладает В', а две осталь¬
ные (А' и Б') эквивалентны. Из заторможенных конформаций экви¬
валентны А и В (они называются скошенными), обладающие большей
энергией, чем полностью заторможенная, или трансоидная конформация
Б, поскольку в них осуществляется взаимодействие между метилами,
отсутствующее в конформации Б. Впрочем разница в энергиях между
трансоидными и скошенными конформациями АЕ составляет всего лишьРис. 55. Потенциальные барьеры
перехода конформаций «-бутана.взаимного
КОНФОРМАЦИОННЫй АНАЛИЗ4810,8 ккал/моль. Энергетическая разность АЕ' заслоненных (например, В'
и Л') конформаций составляет примерно 4,4—6,1 ккал/моль.Xнн©ниНн нжннн а
н нннБН Н Н н©н5^н нн н н нН'Н ■н ннв’На рис. 55 приведена диаграмма изменения энергии молекулы бу¬
тана при повороте одной из этильных групп на 360°. Главный максимум
соответствует полностью заслоненной конформации, главный минимум —
полностью заторможенной.Очевидно, качественно та же картина должна наблюдаться у 1,2-ди¬
хлор- или 1,2-дибромэтанов; в случае более сложных молекул обычно
нужно принимать во внимание большее количество конформаций.У 1,1,2-трихлорэтана — две конформации (Л и Б), обе скошенные.
В одной из них атом хлора при нижнем атоме углерода взаимодействует
с двумя атомами хлора при верхнем; в другой — только одно такое вза¬
имодействие. Поэтому конформация Б энергетически более выгодна,
чем А.С1С1С1-ннАCIУстойчивость конформации следует понимать в статистическом смы¬
сле. Молекула может принимать любые конформации; однако в каждый
момент большая часть молекул представлена наиболее энергетически
выгодной конформацией. В следующий момент процентное содержание
различных конформаций остается прежним, но это не значит, что каж¬
дая отдельная молекула не изменила конформацию.С повышением температуры содержание менее выгодных конформа¬
ций увеличивается. Напротив, с понижением температуры повышается
содержание наиболее устойчивой конформации, поскольку становится
менее возможным преодолеть потенциальный барьер за счет энергии,
482ПРОСТРАНСТВЕННЫЕ ЗАТРУДНЕНИЯвзятой из среды. При достаточно низкой температуре молекулы прини¬
мают наиболее выгодную конформацию.Установлено, что спектры некоторых 1,2-дизамещенных этанов (ИК-
спектры, спектры комбинационного рассеяния), исследованных в жидком
состоянии, содержат пики двух конформаций, а в твердом состоянии
(т. е. при пониженных температурах) обнаруживается” полосы только
одной конформации. Таким путем могут быть выделены полосы, относя¬
щиеся к каждой конформации. Относительная интенсивность полос дает
возможность вычислить относительные концентрации конформаций при
данной температуре:*-4где К — константа равновесия (между двумя конформациями); I —
мера интенсивности данной линии; А — некоторая постоянная.Изучив изменение интенсивности линий в зависимости от темпера¬
туры, можно вычислить теплоту превращения, т. е. разность между сво¬
бодными энергиями конформаций:d In К п d In IgUi
AH = R d(\/T) = R ' d (1/Г)Аналогичные выводы можно сделать на основании спектров ядер-
ного магнитного резонанса (ЯМР), если снимать их при разных темпе¬
ратурах.Потенциальные барьеры внутреннего вращения, представляющие со¬
бой, собственно, энергии активации превращения одной конформации
в другую, могут быть в некоторых случаях тоже вычислены из термоди¬
намических постоянных и из спектроскопических данных о вращатель¬
ных энергетических уровнях. Ниже приведены результаты расчетов для
некоторых простейших соединений.Энергетические разности между трансоидной и скошенной конфор¬
мациями в газообразном состоянии (кал/моль):Бутан 770 + 90 1-Хлор-2-бромэтан . . . 1460±301.2-Дихлорэтан .... 1140 + 20 1,1,2-Трихлорэтаи . . . >23001.2-Дибромэтаи .... 1700±40Потенциальные барьеры внутреннего вращения (кал/моль):СНз—СН3 2875 ±126 СН3—SiH3 1300±300СН3—CF3 3000 + 200 СН3—ОН 1072Для вычисления разницы свободных энергий между конформациями
более сложных соединений и, в частности, циклических употребляются
косвенные методы, основанные на том, что энергия пространственного
взаимодействия между отдельными атомами уже изучена на простейших
примерах. Однако для большинства целей достаточно качественной
оценки сравнительной энергии конформаций.Рассмотрение возможных конформаций соединения, выбор наиболее
выгодной, а также сравнение конформаций переходных состояний, объ¬
яснение направления реакции с точки зрения конформационных предста¬
влений или предсказание этого направления объединяются понятием
конформационный анализ. Особенно важны эти представления в алицик-
лическом ряду для шестичленных и больших циклов. Рассмотрим некото¬
рые примеры применения конформационного анализа для объяснения
реакционной способности ациклических соединений.
ПРОСТРАНСТВЕННЫЕ ЗАТРУДНЕНИЯ4?3ПРОСТРАНСТВЕННЫЕ ЗАТРУДНЕНИЯВыше был приведен конформационный анализ некоторых простей¬
ших нециклических соединений. Как мы видели, понятия конформации и
энергии конформации тесно связаны с пространственным взаимодейст¬
вием между атомами, иначе говоря, с пространственными затруднениями
в молекуле. Под пространственными затруднениями первоначально по¬
нимали накопление объемистых атомов или групп вблизи реакционного
центра, геомётрически затрудняющее реакцию или делающее ее невоз¬
можной. Позднее, в связи с развитием конформационного анализа и
появлением более четких представлений о механизмах реакций, это по¬
нятие было расширено: теперь можно говорить о том, что пространствен¬
ные накопления вблизи реакционного центра могут не только тормо¬
зить, но иногда и облегчать реакцию и часто влияют на направление
реакции и соотношение образовавшихся продуктов не в меньшей сте¬
пени, чем'полярные эффекты.Обобщенная концепция пространственных эффектов сформулиро¬
вана и развита главным образом Инголдом и его школой. Собственно
пространственные затруднения впервые были описаны В. Мейером
(1894 г.), который показал, что ароматические кислоты, содержащие в
орто-положениях два достаточно объемистых заместителя, не этерифи-
цируются, например, при многодневном кипячении спиртового раствора
кислоты, насыщенного хлористым водородом, а эфиры этих кислот не
омыляются. Это явление не связано с полярными влияниями заместите¬
лей, потому что карбоксильная группа пассивируется и электроноакцеп¬
торными (N02, Вг), и электронодонорными (СН3) группамиМейер объяснил это явление экранированием реакционного центра
заместителями, которые создают пространственные затруднения для
подхода атакующего агента. Постепенно количество подобных фактов
возрастало.С другой стороны, развитие кинетических методов предоставило воз¬
можность проводить количественные сравнения реакционной способности
соединений с различными «пространственными нагрузками», а современ¬
ные представления о механизмах реакций позволили связать простран¬
ственные эффекты с переходными состояниями. Наконец, были развиты
представления конформационного анализа. Все вместе взятое дало воз¬
можность подойти к проблеме пространственных влияний и, в частности,
пространственных затруднений с более общей современной точки зрения.Как уже говорилось выше (стр. 87), каждая реакция характери¬
зуется определенной структурой и энергией переходного состояния. Чем
больше разность свободных энергий исходной молекулы и переходного
состояниятем медленнее идет реакция, тем больше ее энергия активации. Высота
потенциального барьера увеличивается при возрастании энергии пере¬
ходного состояния и уменьшается с повышением энергии молекулы. По¬
этому всякие пространственные изменения в молекуле, которые влекутд F=*Fn-Fm
484ПРОСТРАНСТВЕННЫЕ ЗАТРУДНЕНИЯза собой увеличение энергии переходного состояния, можно назвать про¬
странственными затруднениями. Пространственные затруднения этого
типа называются кинетическими, поскольку они связаны с изменением
энергии активации. В отличие от них существуют и термодинамические
пространственные эффекты (в частности, и затруднения), которые свя¬
заны, например, с блокированием реакционного центра объемистыми за¬
местителями и трудностью достижения этого центра реагентами. Как мы
увидим ниже, кинетические пространственные эффекты могут не только
замедлять, но и ускорять реакции.ПРОСТРАНСТВЕННЫЕ ЭФФЕКТЫ ПРИ НУКЛЕОФИЛЬНОМ
ЗАМЕЩЕНИИКак известно, нуклеофильное замещение может протекать по моно-
молекулярному (SjvT) и бимолекулярному (SN2) механизмам. Рассмот¬
рим, например, наиболее изученный случай нуклеофильного замеще¬
ния-обмен галоида в галоидных алкилах на другие анионы. Путем вы¬
бора условий (растворителя, соотношения реагентов) можно добиться
того, что почти любой галоидный алкил будет реагировать по бимолеку¬
лярному (Sff2) механизму. Особенно склонны к реакциям по этому меха¬
низму первичные галоидные алкилы. Ниже сопоставлены для различных
галоидных алкилов относительные скорости трех реакций, протекающих
(что было установлено .кинетически) по бимолекулярному механизму:R 1 RBr + Cl“ RBr + Br- RBr + 5C2H5С2Н5 100 100 100к-С3Н7 65 65 28' (СН3)2СНСН2 . . 15 3,3 2,98(СН3)3ССН2 . . . 0,0026 0,0015 0,000424Как видно из этих данных, по мере разветвления радикала скорость
всех трех реакций падает. Это можно было бы объяснить и увеличением
положительного индуктивного эффекта в ряду этил — неопентил. Однако
индуктивные эффекты этих радикалов мало отличаются один от другого,
поскольку разветвленность увеличивается не у самого реакционного
центра. Особенно резкое изменение скорости происходит при переходе
от изобутила к неопентилу, где не должно быть заметного изменения
индуктивного эффекта, но как раз следует ожидать сильного возраста¬
ния напряженности как самой молекулы, так и переходного состояния.
Чья же энергия и напряженность возрастает в большей степени — моле¬
кулы или переходного состояния?Переходное состояние для бимолекулярного механизма имеет строе¬
ние, изображенное на стр. 75. Четыре атома (углеродный атом — центр
реакции и три связанных с ним) располагаются в одной плоскости, тогда
как входящая и уходящая группы находятся на прямой, перпендикуляр¬
ной этой плоскости. Существенно то, что в переходном состоянии цент¬
ральный атом углерода связан с пятью группами, тогда как в исходной
молекуле — только с четырьмя. Поэтому всякое увеличение объема этих
групп скажется более резко на напряженности переходного состояния;
при увеличении объема заместителей потенциальный барьер увеличится',
энергия активации возрастет и реакция замедлится. Таким образом, в
случае механизма SN2 пространственные нагрузки вблизи центра реак¬
ции скажутся как пространственные затруднения, что и наблюдается в
действительности.
ПРОСТРАНСТВЕННЫЕ ЭФФЕКТЫ485Обратное положение создается при мономолекулярном механизме.
Первая стадия этого процесса — ионизация в растворителемедленная стадия, и поэтому она определяет общую скорость реакции.
В исходном соединении валентные углы тетраэдрические (— 109°); в
карбониевом катионе, который в идеальном случае приобретает плос¬
кую конфигурацию, валентные углы составляют 120°. Отсюда напряжен¬
ность молекулы, вызываемая взаимным отталкиванием заместителей, в
исходной молекуле будет больше, чем в катионе, и увеличение объема
заместителей должно в большей степени повышать энергию исходной
молекулы. В табл. 51 приведены относительные скорости гидролиза га¬
лоидных алкилов с разными радикалами в условиях механизма 5дг1. Не¬
большие изменения объема радикала (примеры 1—4) мало влияют на
скорость реакции: вклады пространственного и полярного эффектов в
этих случаях соизмеримы. С введением же трет-бутильного радикала
(пример 5) на место метильного скорость реакции увеличивается более
чем в 5 раз. Особенно велико возрастание скорости в примерах 8—10, из
чего следует, что играют роль не индуктивные эффекты, а именно про¬
странственные.Из приведенных данных можно сделать еще один интересный вывод,
что па напряженности молекулы сказываются главным образом развет¬
вления у p-углеродного, а не у а-углеродного атома (относительно реак¬
ционного центра). Так, в примере 10 скорость приблизительно в 45 раз
больше, чем в примере 7. Этот, на первый взгляд, странный факт стано¬
вится понятным, если провести конформационный анализ соединений с
а- и p-разветвлением. Сравним формулы и конформации двух таких со¬
единений (связь, вдоль которой рассматривается молекула, обозначена
жирной чертой; метальные группы обозначены кружочками);В первом случае (Л), когда три метила находятся в а-положении,
в конформации имеется шесть средних взаимодействий между группами
примерно равного объема (скошенные взаимодействия бутанового типа).
Во втором случае (Б) имеется два сильных взаимодействия между трет-
бутильной группой и метилами. Эти взаимодействия должны превосхо¬
дить по величине все остальные вместе взятые.В целом можно сделать вывод, что увеличение напряженности моле¬
кулы галоидного алкила вследствие взаимного отталкивания атомов и
групп ведет к увеличению скоростей реакций, протекающих по моно-
молекулярному механизму Sjvl. Такое явление называется простран¬
ственным содействием. Ион галоида как бы физически выталкиваетсямедленно± И'—с( + X'\r"R'—С—Xя"/быстроА а/
А СН,—С-
J \\:н3 сНдон
486ПРОСТРАНСТВЕННЫЕ ЗАТРУДНЕНИЯТаблица 51. Отяосительные скорости гидролиза хлористых алкилов
RIR'— С—С1 в условиях механизма SN11
R"Скорость гидролиза /№примераRR*в 80%-ноМ этанолев QOW-hom
ацетонепри 25 °Спри 35 °СПри 25 °С12345678910СН,СН,С2Н„С2Н8СНзСН3СН3СНз(СНз)зССНзСН,СН,С2Н5С2Н5СНзСН,(СН3)2СН(СН3)2СН(СНз)зС(СНз)зССН2СНзС2Н5С2н6(СНзЬСН(СНз)зС(СН,)3ССН2(СН3)2СН(СНз)зС(СНз)зС(СНз)зССН21,000,87—0,673,005,721146801,000.862,002,65901,00
1,8-2,51280ив пространственно-напряженной молекулы. Надо отметить, что раз-
ветвленность молекулы должна быть достаточно велика, чтобы этот эф¬
фект стал очевиден.Некоторые примеры коиформациоиного анализа. Рассмотрение пространственных
эффектов и взаимодействий в молекулах в их различных конформациях и в конформа¬
циях переходных состояний позволяет предсказать или объяснить реакционную спо¬
собность различных стереоизомеров или стереоспецифичность тех или ииых реакций.
Приведем несколько примеров этого рода.Пример 1. Была изучена реакция эритро- и трео-изомеров соединения А
с галогенидами лития в ацетоне (бимолекулярная реакция) и показано, что трео-
изомер значительно более реакционноспособен, чем эритро-шзамер. Этого следует ожи¬
дать из конформационного анализа переходных состояний обоих изомеров в этой
реакции (наиболее объемистый заместитель CeHs; изображены наиболее выгодные
конформации):Н НQHg-^-c-osqCgHg+Br"HgC СбНБ
А2?■ с с :Н3СI IВг + 0S02CgHbнэритро-изомерН3С 'с6н5с«н51 охжсенБ снян
нСб^Бжрео-изомергде X=-S02CeH5HYXY^HsВ переходном состоянии при механизме 5 N2 три неизменяювдиеея связи
(С—фенил, С—Н и связь со вторичным атомом углерода) должны находиться в одной
плоскости. Анион брома должен атаковать молекулу с наименее затрудненной сто-
ПРОСТРАНСТВЕННЫЕ ЭФФЕКТЫ487роны, т. е. противостоять атому водорода (с которым он окажется в заслоненном
положении). Ниже изображены переходные состояния для трео- и эритро-изомеров:НСН,-4-охС6НБ
зритро -Поскольку объем фенила больше объема метила, очевидно, что переходное со¬
стояние для грсо-изомера выгоднее (менее напряжено), чем для э/шгро-изомера. По¬
этому скорость реакции трео-изомера больше.Пример 2. Эфиры янтарной кислоты сдваиваются при нагревании в присут¬
ствии перекиси. По-видимому, реакция состоит в образовании свободных радикалов,
которые затем соединяются друг с другом:СНзООС—СН •IСНзООС—СНг. СН—СООСНз
<!:н2—соосНзСНзООС—CH—CH—СООСНз
СНзООС—с1н2 СН2—СООСНзднмерВ результате реакции в молекуле появляются два асимметрических центра.
Стереохимическое отношение в молекуле димера такое же, как в винной кислоте;
формуле димера соответствуют три стереоизомера: D-, L- и .иезо-ф«)рма.Поскольку асимметрические центры возникают в результате синтеза, а в исход*
ных молекулах их не было, то соотношение D- и L-форм в продуктах реакции должно
быть 1:1 (рацемическая смесь). Что касается количества диастереомеров — меэо-
формы и рацемата, то оно должно быть различным в зависимости от пространствен¬
ных факторов.Ниже изображены проекционные формулы Фишера и Ньюмена для жезо-формы
и одного из антиподов. Формулы Ньюмена даны для наиболее выгодных конформаций
(конформации, возникающие из приведенных при повороте вокруг центральной
С—С-связи на 120°, невыгодны, так как одна из объемистых групп при верхнем атоме
углерода будет располагаться между двумя группами при нижнем):Н-Н-СООСНзСН2СООСН3CHjjCOOCHj
COOCH3мезо-формаСН3ООСCHjCOOCHg
,COOCHgнСНгСООСНзСООСН,Н3СООСН2С -
Н--н-СН,СООСН3
СООСНпНаСООСН2СD-изомерCOOCH3ну"'>гС°ОСН:'S0*4HСН2СООСН3Общая скорость реакции определяется, как всегда, скоростью, с которой обра¬
зуются радикалы. Однако относительная скорость образования лгезо-формы или раце¬
мата зависит от того, каким образом выгодное этим радикалам соединиться друг
с другом, иными словами, от энергии переходных состояний к конформациям 1 и II.
Какая конформация обладает меньшей энергией, можно решить, даже не зная срав¬
нительного объема групп СООСНз и СН2СООСН3. Важно, что одна из них более
объемиста и, следовательно, более сильное взаимодействие характеризует конформа-
488ПРОСТРАНСТВЕННЫЕ ЗАТРУДНЕНИЯцию II, где в скошенном положении находятся одинаковые заместители. Одно из об¬
щих правил конформационного анализа заключается в том, что энергию конформации
в первую очередь определяет наибольшее взаимодействие. Например, если
СООСНз-группа больше других, то конформация II менее выгодна, так как в ией
такие группы находятся в скошенном положении, тогда как в конформации I они
удалены одна от другой. Если более объемиста группа СН2СООСН3, то в отношении
этой группы применимо то же рассуждение. Итак, преимущественно должна образо¬
вываться конформация I, т. е. мезо-форма, что и наблюдается в действительности:
образуется 98% лезо-формы и лишь 2% рацемической смеси.Пример 3. Известно, что если в результате реакции рядом с уже имеющимся
асимметрическим атомом углерода возникает новый асимметрический центр, то обычно
образуется неравное количество двух возможных диастереомеров. Пусть, например,
к 2-фенилпропионовому альдегиду присоединяется реактив Гриньяра; при этом могут
получиться два стереоизомерных спирта — эритро- и трео-:По правилу Крама «преимущественно образуется тот изомер, который полу¬
чается в результате приближения присоединяющейся группы (здесь СНз) с наименее
затрудненной стороны двойной связи в тот момент, когда последняя фланкирована
(прикрыта) двумя наименее объемистыми заместителями». Наименее объемистые
заместители здесь Н и СН3, наиболее выгодная конформация — когда кислород распо¬
ложен между этими группами. В этом случае наименее затрудненная сторона для
атаки — между фенилом и водородом. В результате преимущественно образуется
эритро-изомер, что очевидно из приведенной схемы,.При рассмотрении пространственных эффектов мы абстрагирова¬
лись от полярных эффектов и приводили примеры, в которых последние
не играли существенной роли. Следует помнить, что полярные эффекты
начинают превалировать над пространственными как только вблизи
реакционного центра оказывается сильный электроноак'цепторный заме¬
ститель.Конформационный анализ широко используется для объяснения или
предсказания направления некоторых перегруппировок, для предсказа¬
ния конфигураций, образующихся в результате асимметрического син¬
теза, и даже иногда для определения абсолютной конфигурации. Наи¬
большее развитие этот метод получил в применении к алициклическим
соединениям, особенно к содержащим шестичленные циклы. С простран¬
ственными затруднениями мы встретимся также в ароматическом ряду
при обсуждении орто-эффекта и пространственного затруднения сопря¬
жения (см. кн. II).СН3"ОНэритро-трео-
А Л И ЦИ К Л ИЧЕСКИЕ
СОЕДИНЕНИЯ
Алициклическими называются все карбоциклические соединения, т. е.
соединения, включающие цикл углеродных атомов, за исключением боль¬
шого класса ароматических соединений (см. кн. II). Приставка али
дана за сходство этих веществ с алифатическими.Первой в Истории химии карбоциклической системой с установлен¬
ной структурой был бензол, для которого Кекуле в 1865 г. предложил
формулу шестичленного цикла (из 6СН) с тремя чередующимися двой¬
ными связями. Вскоре после этого было описано большое число соедине¬
ний, содержащих шестичленные циклы. Некоторое время считалось, что
возможны только шестичленные циклы, и химики относились с недове¬
рием к циклам с большим или меньшим числом атомов. Однако с накоп¬
лением фактов эти искусственные барьеры были преодолены: в 1882—
1885 гг. стали известны трехчленные и четырехчленные карбоциклы
(Фрейнд, Перкин мл.) и производные пятичленного циклопентана (Пер¬
кин мл.); в 1895 г. В. В. Марковников синтезировал семичленный цикло¬
гептан, тем самый открыв дорогу соединениям по другую сторону шести¬
членного цикла. В дальнейшем стало известно большое число макроцик¬
лов; Ружичка синтезировал все цикланы вплоть до 24-членного и 34-
членный; в настоящее время ясно, что нет верхнего предела для размера
кольца.Номенклатура алициклических соединенийАлициклы различаются по числу членов в цикле и по числу цикли¬
ческих группировок в соединении. Алициклические соединения с одной
циклической группировкой называют в соответствии с общими прави¬
лами женевской номенклатуры, но главной считается цепь атомов, вхо¬
дящая в цикл; перед ее названием добавляется приставка цикло. Если
направления отсчета не эквивалентны, то их выбирают так, чтобы все
ответвления получили возможно меньшие номера; точнее, сумма всех
этих номеров должна быть наименьшей. Например:СН—СЙ;,СН—СН3
в/ \г
НО—СН СН-*С2Н5СН—СН;5СНг СН2
\ /3
«СН—С3НГ\ /*СН—С3Н71,2,4-триметил-циклогексаиЬметил-4'пропил-циклогексанол-2
492АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯОднако при большой длине и сложности боковой цепи такой способ
неудобен; в этих случаях открытую цепь атомов называют по правилам
женевской номенклатуры, а цикл рассматривают как заместитель в ос¬
новной цепи, например:Алициклические соединения с несколькими циклами в молекуле мо
гут быть подразделены на следующие основные группы:Для первых двух групп пользуются рациональной номенклатурой,
например:В более сложных случаях нумеруют основную цепь, соединяющую
циклы, обычными цифрами, а углероды в каждом кольце — цифрами со
штрихами:Номенклатура двух последних групп (г, д) строится следующим об¬
разом. Все эти соединения рассматриваются как мостиковые, нумерацию
начинают от одного из узловых атомов, ведут ее вдоль наиболее длин¬
ного мостика и возвращаются к исходному атому наиболее длинным
путем; после этого нумеруют атомы меньшего мостика. Если в циклах
имеются ответвления, то отсчет начинают от того узлового углеродного
атома, к которому ближе ответвление. К названию главной цепи при¬
соединяют приставку «бицикло» и вслед за ней в квадратных скобках/СН2—СН2—СН2—С(СН3)2—СН—СН;
/ I I^CHj—СН2ОН2,2-диметил-I-циклопеитилбутаио л-3ас изолированными циклами, разделенными цепью
углеродных атомов (а);бс циклами, соединенными простой углерод-углерод-
ной связью (б);вс циклами, имеющими один общий атом (спирано-•
вые системы) (в);гс циклами, имеющими два общих атома [г);aс числом общих атомов в цикле больше двух (мо¬
стиковые соединения) (д).циклопропилцикло-гексилметанциклопентилцикло-гексан2,2 -димегил -1 - (4'- бромциклогексил)-
4-(2" бромццклопропил)-бутан
АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ493указывают число атомов в каждом мостике. Узловые атомы, т. е. атомы,
стоящие «в голове моста», в счет атомов мостика не входят:В алициклическом ряду часто пользуются тривиальными названия¬
ми и условной для данного родоначального углеводорода нумерацией
атомов, особенно это практикуется для терпенов и других природных
соединений (см. кн. II).Строение алициклических соединенийПервоначально считали (Байер), что все атомы цикла расположены
в одной плоскости. Отсюда вытекало, что валентные углы равны: в 3-
членном цикле —60°, в 4-членном — 90°, в 5-членном — 108°, в 6-член¬
ном— 120° и т. д. Однако для цепей предельных углеродных атомов
характерны тетраэдрические углы (109° 28'), и в 1885 г. Байер высказал
предположение, что чем больше отклонение валентного угла в цикле от
тетраэдрического, тем больше напряженность и тем меньше устойчивость
цикла. Он предложил мерой напряженности того или иного цикла счи¬
тать половину разности между тетраэдрическим и валентным углом —
величину а, выражающую отклонение одной валентности от нормы:
п .... 3 4 5 6 7 8 9а . . . . 24° 44' 9° 44' 0° 44' -5° 16' -9° 33' -12° 46' —35° 16'Ближе всего к тетраэдрическому угол С—С—С в циклопентане,
больше всего напряженность трехчленного цикла и макроциклов (если
они плоские).Судя по величинам байеровского напряжения, наименьшей энергией
должен был обладать циклопентан, наибольшей — циклопропан и макро¬
циклы. Это качественно более или менее согласовывалось с имевшимися
в то время данными, поскольку макроциклы не были известны. Действи¬
тельно, кольцо циклопропана способно размыкаться под действием
галоидоводородов и брома, легко каталитически гидрируется; циклобу¬
тан значительно устойчивее; циклопентан, как и следовало ожидать,
чрезвычайно устойчив, и прочность его цикла напоминает прочность
обычной парафиновой цепи. Единственным исключением представлялся
циклогексан: этот цикл устойчив не менее циклопентанового и образует¬
ся он в реакциях циклизации, пожалуй, легче всех других. Синтезиро¬
вать средние циклы (С7—Си) оказалось довольно трудной задачей, толь¬
ко циклогептан был получен В. В. Марковниковым сравнительно рано —
в 1893 г. Трудность их получения, казалось, подтверждала правильность
теории Байера.В 1890 г. Саксе впервые обратил внимание на то, что циклогексан
необязательно должен иметь плоское расположение атомов цикла.
Однйко большинство ученых продолжало придерживаться прежних
взглядов до тех пор, пока в 1919 г. Мор не обосновал пространственноеСН3I 31,7,7-тримегилбмдикло [2,2,1]-
гептанон-2 (камфора]н
494АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯрасположение атомов в диклогексане и не предложил для этого соеди¬
нения две возможные модели: форму «кресла» и форму «ванны», сво¬
бодные от байеровского углового напряжения.К тому времени накопилось достаточно данных, противоречащих
первоначальной теории Байера. Как уже говорилось, циклогексан не
уступает по прочности и легкости образования циклопентану. Далее,
судя по теплотам сгорания, рассчитанным на одно метиленовое звено,
энергия всех циклов от пятичленного и выше приблизительно одинакова
(см. табл. 53 на стр. 503), тогда как по теории Байера она должна все
время возрастать. Наконец, были получены некоторые макроциклы,
устойчивость которых не отличалась от устойчивости циклогексана или
алифатических изологов. Позднее структура циклогексана была под¬
тверждена спектроскопическими данными. Стало ясно, что его доста¬
точно большой цикл изгибается в пространстве, стремясь принять такую
форму, в которой углы тетраэдрические или близкие к ним. Относитель¬
ную трудность получения больших циклов стали связывать с малой ве¬
роятностью встречи концевых групп циклизукЗщейся молекулы (эта ве¬
роятность уменьшается с увеличением длины цени).КОНФОРМАЦИОННЫЙ АНАЛИЗ ПРОСТЕЙШИХ АЛИЦИКЛОВКроме углового напряжения в циклических соединениях существует
напряжение, связанное с тем, что атомы водорода находятся частично
или полностью в заслоненных (см. стр. 479 сл.) положениях: в циклопро¬
пане, циклобутане и циклопентане каждый атом водорода практически
соприкасается с двумя соседними. Для циклопропана к энергии углового
напряжения добавляется энергия взаимного отталкивания трех пар ато¬
мов водорода. В циклопропане каждый углерод связан с двумя другими,
и невалентных взаимодействий атомов углерода друг с другом нет. Ина¬
че обстоит дело в случае циклобутана, где помимо углового напряжения
и энергии взаимодействия четырех пар атомов водорода существует не¬
которое дополнительное напряжение, связанное со взаимодействием
между первым и четвертым атомами углерода, расстояние между кото¬
рыми равно всего 2,2 А. Теоретический расчет суммы всех напряжений
в циклобутане приводит к цифре, которая намного превосходит экспери¬
ментальную величину, полученную из термохимических данных. Поэтому
в настоящее время принято считать, что в циклобутане один из атомов
цикла несколько выдается над плоскостью трех остальных. Такой выход
из плоскости уменьшает общую энергию циклобутана. Напряжение мо-
, лекулы, выводящее один из атомов из плоскости цикла, называется тор¬
сионным (поворачивающим).В циклопентане почти нет углового напряжения (0°44'), однако тор¬
сионное напряжение значительно. Оно связано с взаимным отталкива¬
нием пяти пар атомов водорода, находящихся в заслоненных положе¬
ниях. В результате один из атомов цикла выходит из плоскости цик^а
на 0,5 А, хотя такое искривление цикла несколько увеличивает угловое
напряжение. Неплоскостное расположение атомов в циклопентане дока¬
зано методом электронной дифракции. В таком особом положении ока¬
зываются поочередно все атомы кольца, так что оно находится в непре¬
рывном волнообразном движении.
КОНФОРМАЦИОННЫЙ АНАЛИЗ АЛИЦИКЛОВ495В первом приближении, которое вполне годится для химических це¬
лей, скелеты циклобутана и циклопентана можно представлять как ле¬
жащие в одной плоскости.Чтобы избежать углового напряжения, циклогексан может принять
две конформации — ванны и кресла (Мор,. 1919 г.). В одной из них (ван¬
на) четыре атома углерода лежат в плоскости, а два возвышаются над
ней, в другой (кресло) атомы расположены по три в двух параллельных
плоскостях.тинОбе модели полностью свободны от углового напряжения, однако
энергетически неравноценны. Исследование циклогексана с помощью
спектров комбинационного рассеяния (Кольрауш, 1963 г.), а позднее
с помощью ИК-спектров и методом электронной дифракции показало,
что в пределах точности этих методов циклогексан имеет форму кресла.
Это означает, что конформация кресла энергетически выгоднее ванны.Рассмотрим последовательно каждые два углеродных атома цикло¬
гексана с их связями как вторичные углеродные атомы молекулы бутана
(стр. 480). Тогда в случае кресла речь каждый раз будет идти о скошен¬
ной конформации бутанового типа. В форме кресла молекула циклогек¬
сана будет иметь шесть таких относительно слабых взаимодействий.
Действительно, как следует из пространственной модели, направления
связей в форме кресла чередуются в пространстве. Такое же рассмотре¬
ние конформации ванны показывает, что наряду с четырьмя скошенными
имеется два заслоненных (эклиптических) взаимодействия бутанового
типа, которые резко повышают энергию этой конформации. Действитель¬
но, такие взаимодействия выявляются, если рассматривать связи между
атомами 2, 3 и 5, 6 подобно связям между вторичными углеродными ато¬
мами в бутане. Энергия взаимодействия метилов в скошенной конфор¬
мации бутанового типа принимается равной 0,8 ккал/моль, а в заслонен¬
ной 4,4—6,1 ккал/моль. Отсюда разница в энергии между конформация¬
ми составляет от 7,2 до 10,6 ккал/моль;2-6,1 + 4 • 0,8 — 6 • 0,8 = 10,6 ккал/мольТакой метод расчета условен, поскольку скошенное взаимодействие
в бутане обусловливается наличием трех атомов водорода в метильной
группе, а в циклогексане взаимодействуют только метиленовые группы
(по два водорода); однако метод оправдывает себя при сравнении энер¬
гии кресла и ванны, так как при вычитании эти отличия взаимно пога¬
шаются.Итак, в более выгодной конформации кресла атомы углерода распо¬
ложены по три в двух параллельных плоскостях, перпендикулярно кото¬
рым проходит ось симметрии третьего порядка. Расстояние между пло¬
скостями примерно 0,5 А.(а> ! (а)
496АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯДвенадцать связей С—Н циклогексана подразделяются на два
класса: связи, параллельные оси симметрии (и друг другу), называются
аксиальными (а); другие шесть атомов водорода связаны экваториаль¬
ными связями (е), направленными под углом 109,5° к оси симметрии.Молекула циклогексана может принимать две во всех отношениях
эквивалентные креслообразные конформации. При переходе из одной
в другую аксиальные атомы водорода становятся экваториальными и об¬
ратно. В замещенном циклогексане, например метилциклогексане, две
креслообразные конформации уже не равноценны, поскольку в одной
из них метил занимает аксиальное, а в другой экваториальное поло¬
жения:Если метил аксиален, возникают два дополнительных скошенных
взаимодействия бутанового типа между метилом и метиленовыми груп¬
пами в положениях 3 и 5. Эти взаимодействия отсутствуют в экватори¬
альной конформации. Поэтому энергетическая разность между конфор¬
мациями составляет примерно удвоенную величину скошенного взаимо¬
действия бутанового типа, т. е. 2-0,8= 1,6 ккал/моль. Итак, конформация
монозамещенных циклогексанов с экваториальным положением замести¬
теля выгоднее, чем с аксиальным.Все сказанное можно резюмировать следующим образом. Циклогек-
сан (и его производные) может иметь конформацию двух типов: кресла
и ванны. Первая более устойчива (обладает меньшей энергией) и обыч¬
но рассматривается как единственная форма существования циклогек¬
сана. Монозамещенный кресловидный циклогексан может иметь две
конформации: с аксиальным и экваториальным заместителем; последняя
обладает меньшим запасом энергии.Ценные сведения о конформационном равновесии могут быть получены спек¬
тральными методами, в частности методом ядерного магнитного резонанса (о методециями труднее преодолим и время жизни каждой конформации больше. При пониже¬
нии температуры сигнал расширяется, расщепляется на два максимума и, наконец,
при —J00°C появляются два сигнала, соответствующие двум разным расположениям
ядер фтора (справа пики аксиального атома фтора несколько уширены за счет спин-
спинового взаимодействия их с протонами кольца). Из данных спектров может
быть вычислено время жизни т отдельной конформации при каждой температуре поН Ннн■>ннннЯМР см. стр. 557 сл.). Приведем в ка¬
честве примера данные исследования1,1-Дифторциклогексана.F фтора) при разных температурах.
При +30 °С наблюдается одиночный
пик; это значит, что оба атома фто¬
ра — аксиальный и экваториаль¬
ный —практически эквивалентны
вследствие быстрого перехода одной
конформации в другую (так что один
атом фтора поочередно становится
то аксиальным, то экваториальным).L При низких температурах энергети¬
ческий барьер между конформа-На рис. 56 показан спектр ЯМР1,1-дифторциклогексана (на ядрахРис. 56. Спектр ЯМР 1,1-дифторциклогексана.формуле;
ИЗОМЕРИЯ АЛИЦИКЛОВ 497где 6t — химический сдвиг между сигналами атомов фтора при данной температуре
измерения; 6,* — химический сдвиг при —100 °С (или более низкой температуре),
когда пики четко разделены.Так, время жизни конформации при разных температурах следующее:°с т, с °с т, с+30. . . . 1,0-10“6 -60. . . . 1,2* 10-3—49. . . . 6,5- 10-4 -100 . . . 2,0- 10-2ИЗОМЕРИЯ АЛИЦИКЛИЧЕСКИХ СОЕДИНЕНИЙДля того чтобы понять конформационные отношения в дважды за¬
мещенном циклогексане, следует предварительно разобрать изомерию
алициклических соединений.В алициклических соединениях известны следующие виды изомерии:1. Изомерия, связанная с разной величиной цикла. Например, изо¬
мерны друг с другом циклопентан, метилциклобутан, диметилциклопро-
пан — изомеры с эмпирической формулой С5Ню.2. Изомерия боковых цепей (разное строение боковых цепей); на¬
пример, изопропилциклобутан, пропилциклобутан, этилметилцикло-
бутан.3. Изомерия положения, связанная с различным относительным
расположением заместителей в цикле. Для дизамещенного циклопропана
возможны два изомера этого рода: 1,1- (или гем-) и 1,2-. В дизамещен-
ном циклобутане положения 2 и 4 эквивалентны; дизамещенные цик-
лобутаны представлены тремя изомерами: 1,1*, 1,2- и 1,3:г, СН2—СН2 СН2—СН2 СН2—CHRЧ Л I J II/С СН2 R'CH—CHR R'CH—СН2R'X4. Стереоизомерия. В алициклах, в отличие от предельных алифа¬
тических соединений, существует (при наличии двух или более заме¬
стителей) геометрическая цис-транс-изомерия. Кроме того, как это бу¬
дет ясно из дальнейшего изложения, в данном случае геометрическая
изомерия неразрывно связана с оптической. Дело в том, что несмотря
на конформационные повороты, все более свободные по мере увеличе¬
ния размера цикла, малые и средние циклы (вплоть до восьми-девяти
членов) в известной мере жесткие образования. Поэтому два замести¬
теля у двух разных углеродных атомов цикла могут быть расположены
или по одну сторону плоскости цикла — это будет 1{ыс-расположение,
или по разные стороны этой плоскости — гранс-расположение. Конечно,
начиная с шестичленного цикла и выше, выражение «плоскость цикла»
носит условный характер и говорить приходится о некоторой средней
плоскости молекулы.Для различения цис- и гранс-изомеров в случае малых циклов
(трех — пятичленных) могут служить те же методы, что и для цис- и
гранс-изомеров олефиновых соединений: циклизация 1{ис-заместителей
(например, для карбоксилов — образование ангидрида, для гидрокси¬
лов— образование циклического сложного эфира с борной кислотой)
и оценка на основании дипольн«гп момента молекулы. Добавляется
еще один метод.Монозамещенные цикланы всегда имеют плоскость симметрии, про¬
ходящую через заместитель, водородный атом и углеродный атом, с
которым оба они связаны. Значит, молекула симметрична и стереоизо¬
меров не имеет. Иначе обстоит дело, если циклан имеет два замести¬
теля, даже одинаковых, но находящихся при разных углеродах цикла.17 Зак. 882
498АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯВ этом случае цис-соединение всегда имеет плоскость симметрии и, зна¬
чит, оно оптически недеятельно, а его зеркальное изображение тожде¬
ственно с оригиналом. транс-Соединение, напротив, обычно не имеет
плоскости симметрии, в нем появляется сразу два асимметрических
углерода и его зеркальное изображение энантиомерно (стр. 356) с ори¬
гиналом. С точки зрения оптической изомерии тут наблюдается полная
аналогия с винными кислотами: 4{ыс-изомер соответствует недеятельной
вследствие внутренней компенсации мезовинной кислоте, транс-изо¬
мер— левой и правой винным кислотам*. При разных заместителях и
цис- и транс-изомер всегда имеют энантиомерные оригиналу зеркальные
изображения и, таким образом, существуют в виде четырех стереоизо¬
меров— двух антиподов и двух диастереомеров, которые можно схема¬
тически йзобразить так (см. стр. 367);появляется один асимметрический атом углерода и, следовательно, ле¬
вый и правый энантиомеры. В этом и подобных соединениях, например
в замещенных цикланонахским углеродом, и это явление не связано с геометрической изомерией.Дважды замещенным циклогексанам также свойственна геометри¬
ческая и оптическая стереоизомерия. Поскольку кольцо циклогексана
неплоское, отнесение изомеров к цис или транс-формам не так нагляд¬
но. Как уже говорилось, в кресловидной конформации имеются две па¬
раллельные плоскости, в каждой из которых расположено по три угле¬
родных атома кольца. Плоскостью молекулы может считаться средняя
между ними. Каждые две соседние аксиальные связи оказываются в
гране-положении, поскольку находятся по разные стороны этой плос¬
кости; это же касается и экваториальных связей, хотя их углы относи¬
тельно плоскости кольца значительно меньше. Поэтому 1,2-, 1,3- и
1,4-дизамещенные циклогексаны проявляют геометрическую изомерию
и могут существовать в виде цис- и транс-изомеров; 1,2- и 1,3-дизаме-
щенным циклогексанам наряду с этим свойственна и оптическая стерео¬
изомерия, тогда как 1,4-изомер лишен этой возможности, поскольку* Единственным исключением являются такие дизамещенны.е цикланы с четным
числом звеньев в цикле, например циклобутаны, циклогексаны и т. д., у которых
заместители (одинаковые или разные, в цис- или транс-положениях) находятся у наи¬
более удаленных друг qt друга атомов углерода. В этом случае и транс-соединение
имеет плоскость симметрии, проходящую через эти два удаленных углерода и два
заместителя, а потому и цис- и транс-соединений оптически недеятельны и ие имеют
энантиомерных форм.Л |ПIл!пЛ !ПП! Лцис-изомергранс-нзоыерВ случае циклена с одним заместителеммы имеем дело с обычной оптической изомерией с одним асимметриче-
ИЗОМЕРИЯ АЛИЦИКЛОВ499как цис-, так и транс-изомеры в этом случае имеют плоскость симмет¬
рии, проходящую через атомы 1 и 4 кольца:(а/Яаксиально-экваториальнаяПроведем теперь конформационный анализ диметилциклогексана.
Связи, расположенные по одну сторону кольца в циклогексане (в кон¬
формации кресла), чередуются у соседних атомов: экваториальная (е)—
аксиальная ((а), —е — а— и т. д. Следовательно, в цыс-1,2-диметил-
циклогексане один метил всегда аксиален, а другой экваториален. При
превращении в другую возможную кресловидную конформацию акси¬
альная связь становится экваториальной и наоборот. Такое же положе¬
ние в транс-1,3- и цыг-1,4-дизамещенных.Следовательно, в этих случаях (цис-1,2-, транс-1,3- и цис- 1,4-диме-
тилциклогексаны) имеется только одна конформация с одним аксиаль¬
ным и одним экваториальным положением метилов, например:(a)R(e)R'Ц(а)ННэкваториально - аксиальная цис-1,2В случае транс- 1,2-диметилциклогексана два метила находятся
либо оба в экваториальном, либо оба в аксиальном положении. Следо¬
вательно, мы имеем дело с двумя неравноценными конформациями.
Аналогична ситуация для цис-1,3- и транс- 1,3-дизамещенных.НзС'^'сн7^~^'нН Йдиэкваториальная mpaw-i,213 ндиаксиальная транс-1,2диэкваториальная uuc-U3 диаксиальная цис-1,3В диэкваториальной форме транс- 1,2-изомера осуществляется толь¬
ко одно скошенное взаимодействие бутанового типа (между металь¬
ными группами), тогда как в диаксиальной конформации — четыре/
500АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯвзаимодействия (между каждой метильной группой и метиленовыми
группами в положениях 3 и 5 по отношению к ней). Для цис-1,3- и
транс- 1,4-изомеров диэкваториальная конформация также оказывает¬
ся более выгодной, чем диаксиальная.Исходя из этих соображений можно предсказать относительное
энергосодержание цис- и транс-изомеров и, таким образом, их устойчи¬
вость. Найример, сравнивая наиболее выгодные конформации 1,2-диме-
тилциклогексанов (для ^«с-изомера возможна только аксиально-эква¬
ториальная, для гранс-изомера — диэкваториальная), приходим к вы¬
воду, что транс- 1,2-изомер лежит на низшем энергетическом уровне,
так как аксиальное положение метила менее выгодно, и потому он бо¬
лее устойчив. В случае 1,3-диметилциклогексана, напротив, на более
низком энергетическом уровне находится г^мс-изомер, поскольку он
может существовать в диэкваториальной конформации.Следует учитывать, однако, что если в молекуле имеются поляр¬
ные заместители, между которыми возможно электростатическое взаи¬
модействие, эти выводы могут оказаться неверными.
АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ
И ИХ ПРОИЗВОДНЫЕАлициклические углеводороды представляют собой легкие жидкости
(циклопропан и циклобутан — газы), не смешивающиеся с водой, но
смешивающиеся во всех отношениях с большинством неполярных рас¬
творителей. Некоторые физические свойства низших и средних алицик¬
лических углеводородов сведены в табл. 52.Как уже говорилось, термодинамическая устойчивость циклов раз-
' лична. Об этом можно судить по теплотам сгорания (АН), рассчитан¬
ным на одну метиленовую группу (табл. 53). Наибольшие теплоты
соответствуют циклопропану, затем циклобутану, в которых велики иска¬
жения валентных углов (угловое напряжение) и торсионное напряже¬
ние (стр. 494). Большие циклы обладают довольно близкими значе¬
ниями АН. Однако и здесь имеются довольно характерные отличия.
Наименьшим запасом энергии из первых десяти членов ряда обладает
циклогексан. Более высокая энергия циклопентана объясняется тор¬
сионным напряжением, возникающим, как уже говорилось, в резуль¬
тате пространственного взаимодействия атомов водсрода, которые на¬
ходятся в невыгодных, заслоненных, положениях. В средних циклах
(Cg—Со) теплота сгорания на метиленовую группу немного больше,
чем в циклогексане, вследствие другого типа напряжения, небайеров-
ского (взаимодействие атомов водорода, находящихся по разным сто¬
ронам кольца); с этим эффектом мы встретимся еще в разделе, спе¬
циально посвященном большим и средним циклам. Наконец, энергия
макроциклов наименьшая и близка к энергетическому уровню нецикли¬
ческих парафинов с нормальной цепью.Химические свойства циклопентана и высших цикланов в общем
подобны свойствам обычных парафинов: это трудноокисляемые и ма¬
лореакционноспособные соединения. Они хлорируются по радикаль¬
ному типу, могут быть пронитрованы в условиях реакции Коновалова
и т. д. (стр. 64 сл.). Реакцией циклопентана, указывающей на наличие
в нем небольшого конформационного напряжения, является открытый
Б. А. Казанским и А. Ф. Платэ каталитический гидрогенолиз над плати¬
ной при 300 °С, приводящий к пентану;Н2С СН2 н /р,| | ►. СН3—СН2-СН2—СН2—СНзН2СХ ^СН2
СН2Ииклогексановые углеводороды (если они не имеют 1,1-заместите¬
лей) при пропускании над платиной при повышенных температурах
502АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕТаблица 52. Алициклические углеводородыНазваниеТемператураТемператураПлотностьФормулаплавления.кипения,d20«СеС4А□ОООоАооооооооЦиклопропан, или триметилен
Циклобутан
Циклопентан
Циклогексан
♦ЦиклогептанЦиклооктанЦиклопропенЦнклобутенЦнклопентенЦиклопентадиенЦиклогексеиЦиклогексадиен-1,3Циклогексадиен-1,4ЦиклогептенЦиклогептадиен-1,3Циклогептатриен-1,3,5 или
тропилиденЦнклооктен (транс-)
Цнклоокта днен-1,5
Циклооктатриен-1,3,5
Циклооктатетраен-126,6-34.40.720
(при —79°)-50-93,3+13,049,50.703М)0,75106,581.40.7791-12118,10,809914,3-93.3148(прн 749 мм
рт. ст.)
-36
(при 744 мм
рт. ст.)2.444.20.83500,733(О0,7720-8542,50.8021-103.7830,8102-8980.50.8404-49.286-870,8471-561150,8228-79,5121(при 724 мм
рт. ст.)
1170,8929(О0.8875-591450.8483-57; -70
-71441481430,887(О0.912(О0,9206
МАЛЫЕ ЦИКЛЫ503Таблица 53. Теплоты сгорания цяклоалканов в расчете на одну GHj-группу (ккал)СоединениеЧислоатомовугле¬родаАНИзбыток
энергии
по сравнению
с цикло-
гексаном
(в расчете
на одну
CHj-группу)СоединениеЧислоатомовугле¬родаД ЯИзбыток
энергии
по сравнению
с цикло-
гексаном
(в расчете
на одну
СНа-группу)Циклопропан3166,69,2Циклононан9158,71.3Цнклобутан4163,96,5Циклодекан10158,51,1Циклопентан5158,71,3Циклопента¬15157,1-0,3Циклогексан6157,40деканЦнклогептан7158,30,9Циклогепта¬17157,0-0,4Циклооктан8158,61,2деканвыделяют 3 моль в'одорода и превращаются в углеводороды ряда бен¬
зола (Н. Д. Зелинский):сн2 снН2С/ \сн2 р. НС/ ^снЛ I +ЗН2iC\ ^сн
сннс! с!»с5н.неМАЛЫЕ ЦИКЛЫРЯДЫ ЦИКЛОПРОПАНА И ЦИКЛОБУТАНА
Методы синтеза1. Действие металлического натрия на 1,3-дигалоидные производ¬
ные алканов приводит к образованию углеводородов ряда циклопропа¬
на (Фрейнд):Н,С;СНаВгCHoBrNa /СН2 ► H2C + 2NaBrХС1:н.По существу, это внутримолекулярная реакция Вюрца., Как установил Г. Г. Густавсон, дегалогенирование протекает с луч¬
шим выходом при применении цинковой пыли в спиртовом растворе.В 1967 г. Коннор и Уилсон нашли, что 1,4-дибромбутан в диоксане или тетра-
гидрофуране с амальгамой лития образует с хорошим выходом циклобутан:СН2—СН2Вг сн2—сн2I +2Ы—Hg —► I | +2LiBr + HgCHo—CHoBr СН,-СН22. Важным способом получения трехчленных циклов является при¬
соединение карбенов .(стр. 219, подробнее см. кн. II) к непредельным
соединениям:V Vс V\
II +scci2 —♦ ;cci2
с I//\ /\Если применять для этой цели диазосоединения, то вначале обра¬
зуются гетероциклические соединения, которые при нагревании в при¬
сутствии меди выделяют азот и образуют производные циклопропана
504АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕ(Бухнер и Курциус):
+ ch2n2\ / \—Nс V, Сц .с /N нагревание1* l/CH. + N,/ \ дсн- А3. Трехчленные циклы получают также по методу Кижнера ката¬
литическим разложением циклических гидразонов:R—CH—СНКОН; Pt,N ► R—CH—СН2 + N2/ \ /CH2-NHАналогичный метод разработан и для синтеза производных цикло¬
бутана (Р. Я Левина и Ю. С. Шабаров):N—NH СН,/ \ КОН; Pt / \я-с' *-нсч <*, + n*
Н2с-сн2 С'н24. Димеризация алленов (С. В. Лебедев), а также перфторолефи-
нов приводит к четырехчленным циклам:СН2—С=СН2 СН2—С=СН2
2СН2=С=СН2 —► | I +11СН2=С СН2 СН2—С=СН2cf2—cf22CF2=CF> —► I Icf2—cf25. 1,3-Диеновые системы при ультрафиолетовом облучении замы¬
каются в циклобутены (Даубен, Фонкен):CH=CHR hv СН—CHRI —* II ICH=CHR CH—CHR6. Малеиновый ангидрид и некоторые другие диенофилы под влия¬
нием света способны присоединяться к олефинам с образованием че¬
тырехчленных циклов, например:R^ уП Нч уСЫС С RHC—С.Н—CN11+11 —IIС С RHC—СН— CNr/ \н Nc/ \нДигалогенмалеиновый ангидрид фотохимически присоединяется к
олефинам и ацетиленам по схемам (Шарф и Корте):С1 л
МАЛЫЕ ЦИКЛЫ5057. Наиболее старый способ синтеза четырехчленов заключается во
взаимодействии натриймалонового эфира с дигалоидпроизводными угле¬
водородов (Перкин):/СН2ВгСН2^CHjBr+ Na+[CH(COOC2II5)2—NaBr,СН2—СН(СООС2Н5)2+ Na + [CH(COOC2H5l2l—>- сн2 ^СНгВгСН2—>- Н2С^ ^С(СООС2Н5)2 + NaBr + СН2(СООС2Н6)2
СН2Натриймалоновый эфир играет здесь роль основания, отщепляю¬
щего бромистый водород от продукта первоначальной конденсации.8. При фотолизе циклопентанона среди других продуктов разложе¬
ния образуются циклобутан и окись углерода (Бенсон, Кистяковский):-С=0fcv+ соСвойстваНапряженность молекулы циклопропана объясняется главным об¬
разом ненормальными углами между С—С-связями — взаимным оттал¬
киванием электронных облаков этих связей. В результате этого связи
(т. е. максимумы перекрывания электронных обла¬
ков) не находятся на прямых, соединяющих центры
атомов углерода, а располагаются на некотором
расстоянии — вне треугольника молекулы (рис. 57).Несмотря на то что при подобном искажении элек¬
тронного облака перекрывание становится менее
полным, такое расположение связей оказывается
энергетически более выгодным. Таким образом, по
современным представлениям о-связи в циклопро¬
пане отличаются от обычных о-связей * и их гибри¬
дизация отличается от обычной я/Агибридизации.Они носят название банановых связей (бананооб¬
разное электронное облако искаженной о-связи) н,
по существу, занимают промежуточное положение
между обычными о- и я-связями. Это отражается на многих свойствах
циклопропана, особенно на его способности к сопряжению с кратными
связями (см. далее). Угол между связями в циклопропане 106° вместо
60° по классическим представлениям, угол Н—С—Н примерно 120°.
Благодаря такому строению циклопропан склонен к реакциям электро-
фильного присоединения и в этом отношении напоминает соединения с
двойными связями (хотя значительно пассивнее последних).Циклопропан гидрируется над никелем с разрывом С—С-связи при
80 °ССН2 Hs/Ni
/ \ ► СНз-СН2-СНзН2С—сн2Рис. 57. Циклопропан
и его «банановые
связи».* В циклобутане а связи тоже изогнуты относительно оси С—С, но это откло'
нение невелико.
506АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕтогда как циклобутан —при 120 °С;Н2С—СН2 h2/ni -| | ► CH3-CH2—CH2—CH3H2C-CH2При действии галоидоводородов, галогенов и сильных минеральных
кислот может происходить размыкание трех- и четырехчленных циклов
(при этом циклобут'ан реагирует более вяло, Чем циклопропан);Н2С СН2'\ /
(СН2)„НВг * СНз—(СН2)„—СН2ВгВгг * ВгСН2-(СН2)„-СН2Вг> CH3-(CH2)„-CH20S03HH2S04где п = 1,2.При действии хлора наряду с разрывом цикла идет также замеще¬
ние водородов (реакция металепсии):СН2 Clj; Av CHj/ \ > / V + НС1Н2С СН2 Н2С СНС1Интересно, что при наличии электроноакцепторных заместителей
/°в кольце (СООН, С' и др.) размыкание циклов сильно затруд-няется.. Напротив, присутствие алкильных заместителей облегчает этиреакции. Так, алкилзамещенные циклопропаны легко присоединяютацетат ртути (Р. Я. Левина):СН2 СН2. /\ . /\R-СН—СН—R + Hg(OCOCH3)s —* R—СН СН—HgOCOCH3СН3ОСО RТаким образом, многие реакции циклопропанового кольца говорято его аналогии с двойной связью. В особенности характерно сопряжение
с кратными связями. Например, присоединение бромистого водорода
к бензоилциклопропану происходит против правила Марковникова:сн2н2с-~сн7-с-с6н5 + НВГ —► СН2-СН2~СН2-С-СвН5о) ВГ оХлористый водород присоединяется к сабинену по крайним ато¬
мам сопряженной системы циклопропан — двойная связь;
МАЛЫЕ ЦИКЛЫ507Гидрирование изопропилциклопропана и изопропенилциклопрбпа-
на вследствие наличия сопряжения во втором соединении приводит к
разным продуктам (Б. А. Казанский и М. Ю. Лукина);(ГНз нг сн3.„СН,f%CH-CH—сна сн>н-сн'.снHjC снз ЬН3сн.Н,С. Г ° гнЕ /СН321 >СН-С=СН2 ► СНз-СНг-СНг-СН^ЭгС 4 ^Сопряжение циклопропана с двойной связью можно заметить и по
смещению пиков поглощения в инфракрасных и ультрафиолетовых
спектрах. Таким образом, уже по спектральным данным можно судить,
сопряжена ли двойная связь с циклом или изолироаана от него.Циклопропан — газ, анестетик общего действия; широко приме¬
няется при любых хирургических операциях; его преимущество заклю¬
чается в том, что он совершенно безвреден для организма и не вызывает
неприятных последствий. Циклопропан получают в промышленных
масштабах по Густавсону действием цинка на 1-хлор-З-бромпропан,
который синтезируют присоединением бромистого водорода к хлори¬
стому аллилу в присутствии источника свободных радикалов — пере¬
киси бензоила:С1СН2—СН=СН2 + НВг —> С1СН2—СН2—СН2Вгzn СН2С1СН2—СН2-СН2Вг —>- / \Н2С—сн2НЕПРЕДЕЛЬНЫЕ ТРЕХ- И ЧЕТЫРЕХЧЛЕННЫЕ ЦИКЛЫЦиклопропен и циклобутен были получены разложением гидрооки¬
си циклоалкилтриметиламмония при нагревании:сн2 сн2/ \ + ► / \ + N(CH3)3 + Н20 (Н. Я. Демьянов)Н2С СН—N(CH3)3 ОН' НС»=СНН2С—СН2 . t„ Н2С—СНаI I + ► 1 I (Робертс)Н2С—СН—N(CH3)3 ОН" НС=^СНЭти соединения малоустойчивы, особенно циклопропен, который
легко полимеризуется.Известны и более устойчивые производные циклопропеиа. Их можно получить,
иапример, действием некоторых карбенов на производные ацетилена:н2оC6H6-teC-C6Hs+CCl2 —♦ СеНб—G=^C—С6Н6 *■ С6Н6—С==С—С6Н6снс13) 'ЧС/ ''с/Cl/ ^Cl dC6H6-C=C-CeH6 + СНСООС2Н6 —* С6Н6-С=С-С6Н5(карбен и» диаао-уксусного эфира) (-НСООС2Н6
508АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕЦиклобутадиен в свободном состоянии неизвестен. Он был получен
Неницеску действием амальгамы лития на тетрабромциклобутан и вы¬
делен в виде л-комплекса с азотнокислым серебром:ВгНС—CHBr Li—Hg^ AgN°Y Hfr--^Ag+Ncr3
ВГНС-СНВГ НС—CHПозднее были получены другие л-комплексы циклобутадиена (см.
раздел «Эл^ементоорганические соединения», кн. И).ОКСОСОЕДИНЕНИЯ ЦИКЛОПРОПАНОВОГО
И ЦИКЛОБУТАНОВОГО РЯДАЦиклопропанон, по-видимому, в чистом виде еще не получен. При
взаимодействии диазометана, воды и кетена образуется непрочный,
легко изомеризующийся в пропионовую кислоту гидрат циклопропа-
нона:ттН2СЧ ^ОНсн2=с=о + ch2n2 + Н20НгС^ \0НПредполагается, что синтез циклобутанона из кетена проходит че¬
рез стадию образования циклопропанона:СН2=С=0 СН2=С—О Н2С С=0+ —>■ I. + w —► \ / + N2СН2—N=N СНCH,=N=NН2С С=0 + - Н2С—С=0\ / + CH2=N=N —> II + n2
сн2 Н2С—сн2Циклобутанон — жидкость, кипящая при 99 °С.Циклобутандион-1,3, описанный впервые в 1912 г. Вассерманом и
Демловом, был получен следующим путем:СН2=С=0 H2C—С=0 H2o(H2so4) Н2С—С=0+ — II I IС2Н50—С=СН С2н50—С—СН О—С—сн2Этот дикетон — бесцветные пластинки с т. пл. 119—120 °С, замет¬
но енолизующийся. Он дает окрашивание с водным раствором FeCl3; об¬
ладает довольно сильными кислотными свойствами (р/Са~3).КАРБОНОВЫЕ КИСЛОТЫ ЦИКЛОПРОПАНОВОГО
И ЦИКЛОБУТАНОВОГО РЯДАЭти кислоты получаются при многих синтезах циклопропанового
и циклобутанового колец, например в синтезе при помощи малонового
эфира (стр. 505). При димеризации некоторых а,р-непредельных кислот
образуются циклобутанкарбоновые кислоты, например:2СН2=С(СООС2Н5)2 —* Н2С-С(СООС2Н5)2 омыленнеI —со2(С2Н5ООС)2С—сн2н2с—сн-соонI Iноос—не—сн2
ПЯТИ- И ШЕСТИЧЛЕННЫЕ ЦИКЛЫ 509.Действием диазоуксусного эфира (стр. 463) на ацетиленовые соеди¬
нения или диазометана на эфиры малеиновой кислоты получаются цик-
лопропанкарбоновые кислоты:CHCOOR /CH-COORch2n2 + II —> нас; + N2CHCOOR \СН—COORЦиклопропанкарбоновая кислота может быть получена также дей¬
ствием едкого кали на нитрил у-броммасляной кислоты:/СН2—C=N кон /СН—C=N Hj0 ' ,СН—СООНн2с( —► н2с; I —► H2c( I
ХСН2Вг хсн2 хсн2Карбоновые кислоты алициклического ряда обладают обычными
свойствами карбоновых кислот. Могут быть получены все их функцио¬
нальные производные. При декарбоксилировании они образуют соответ¬
ствующие циклоалканы.ПЯТИ- И ШЕСТИЧЛЕННЫЕ ЦИКЛЫ
РЯДЫ ЦИКЛОПЕНТАНА И ЦИКЛОГЕКСАНА
Методы синтеза1. До недавнего времени не были известны методы синтеза пяти¬
членных циклов, аналогичные таковым для низших циклов. Лишь в
1967 г. Коннор и Уилсон нашли, что при действии литиевой амальгамы
на диоксановый раствор 1,5-дибромпентана можно получить циклопен-
тан с выходом 75%:-СН2СН2Вг /СН2— сн2Н2С^ + 2Li—Hg —> Н2С^ | +2LiBr + Hg\;н2сн2вг 'сн2—сн22. Наиболее старый метод синтеза пяти- и шестичленных цикличе¬
ских кетонов, пригодный и для получения более многочленных циклов,
это вариант метода Пириа — пиролиз кальциевых солей двухосновных
.кислот:сн2—сн2—с
сн2-сн2-с^осоль адипиновой
кислотыч) ,0 CH2-CHgС a | рс-О + СаС03q) сн2-сн2Этим способом могут быть синтезированы с хорошими выходами
циклопентанон, циклогексанон и, несколько хуже, суберон (циклогепта-
нон). Кетоны с большим числом атомов в цикле получаются с очень
малыми выходами; трех- и четырехчленные циклы этим путем получить
не удается.Циклопентанон и циклогексанон готовят также нагреванием двух¬
основных кислот с окисью марганца, тория или бария.
510АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕ3. Сложноэфирная конденсация * эфиров дикарбоновых кислот при¬
водит к пяти- и шёстичленным циклическим р-кетонокислотам (Дик-
ман):о
II(СН2)„-СООС2Н6 CjHjONa СI ► / \СН2—СООС2Н6 (СН2)„—СН—СООС2Н6В аналогичных условиях конденсируется нитрилы этих кислот
(Торп);гн гм ' сн* сн*,CH2CN / н,0 /\(СИ2)п —> (CH2)rt C=NH * (СН2)„ с=оN^cn \/_cn \c/cn4. Сложноэфирная конденсация эфиров щавелевой кислоты с эфи¬
рами глутаровой рли с гомологами ацетона приводит к пятичленным
циклам:°Ч /0С2Нб СН2-СООС2Н6 О—С—СН—СООС2Н6\на.С | c2H5ONaI +СН2 »- -0^С\0С2н8 сн2-соос2н6 о=с-сн—СООС2Н6■0Ч/0С2Н8 свд о=с—CHRС I C2H5ONaI +с=о оАОСгн, 1=вд 0-C-CHR^)с=о5. Сложноэфирная, конденсация двух молекул эфира янтарной кис¬
лоты дает шестичленный сукцинилянтарный эфир:°ч /осл ? Ч/*,н.I сло-счСН,- - )сн, / чн< А - . ’V-diС-ОС.Н, с ^ IО СГ ХОС2Н5 Чот \ОС2НбПоследние три метода особенно ценны, так как давдт возможность
получать эфиры р-кетонокислот или трикетоны с. 1,3-диоксогруппиров-
кой. Те и другие соединения можно использовать в' синтезе через их нат¬
риевые производные (наподобие натрийацетоуксусного эфира или нат-
рийацетилацетона) для наращивания боковых цепей с последующим* О механизме сложноэфирной конденсации см. стр. 402,
ПЯТИ- И ШЕСТИЧЛЕННЫЕ циклы511омылением, кетонным расщеплением и, если нужно, восстановлением
СО-группы до СНа по КлемменсенузО,CjH60/CvV>н2с^ \:н2CjHsO0'Na+CjHsON*%/ wHjC^ N:H22RBr\c=c оNa+ ~СУ^ S'r/'OCjH6°4СгНа0/\OCjH5h,c;< >:ch.—co2xC—С о0 r/NDC2H5H\ /* y>с—of
н2с^ ^ch2
JZ— с
°^. r/ 4hRHC—CHj
HSC^ ^CH2
H2C—CHRДругой пример применения метода 4 — синтез камфорной кислоты
и камфоры (см. раздел «Изопреноиды», кн. II).6. При пропускании над платиновым катализатором при 300 °С али¬
фатических углеводородов с длиной цепи 5С, но не более, происходит
дегидроциклизация в циклопентановый углеводород (Б. А. Казанский,А. Л. Либерман);СН;сн,
,-сIСНаСН2-СН—СНзсн,Pt (300 «С)сн,-с—IСНзснг-сн2\:н-снз + н2
сн2Если в цепи больше пяти углеродных атомов, происходит замыкание
шестичленного цикла, который, однако, при отсутствий четвертичного
атома в цикле далее дегидрогенизуется в бензол или его гомолог
,(Б. А. Казанский, А. Ф. Платэ);снг
Pt н2с/ м:н2CHa-CHj—CHj—сн2—СНг—СНз I | —* | + ЗН2-Нг Н2С\ /СНг
СНгЧетвертичный атом углерода препятствует ароматизации:н3сч сн
512АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕ7. Главным методом синтеза циклогексана и его разнообразных
производных служит каталитическое' гидрирование бензола и разнооб¬
разных его производных над никелем, платиной или палладием:ОНСН2 I снH2/Pt Н2С/ \СН2 Нг/Pt ^ Н2с/ \СН2Н2С\ /СН2 Н2С\ /СН2сн2 . сн2Таким путем нельзя получить галоидсодержащих или серусодержа-
щих циклогексанов, так как эти элементы в условиях катализа заме¬
щаются на водород (Сабатье).8. С 1920 г. очень важным способом синтеза шестичленов с непре¬
дельными связями служит диеновый синтез Дильса и Альдера:thr CHRНС^ СН-С( НС/ хсн-с( /1 + II /° —II I )°hcVhp сн-с; нсх /сн-с(CHR Ч0 CHRЗдесь X может быть почти любым заместителем; особенно легко
идет реакция, если X — электроноакцепторный заместитель:^ с/С0°СНз /х/СООСНзГ+i “"(Г^СООСНз СООСНзПрисоединение по кратной связи в реакции Дильса — Альдера идет
всегда в цис-положение.Прообразом реакции диенового синтеза является димеризация бута¬
диена и изопрена по С. В. Лебедеву (1912 г.):СНзПЛ'н2с^\сн3 НгС^ Х'СНздипентен(Дипентен в оптически активной форме терпен — лимонен, стр. 273).ЦИКЛОПЕНТАН И ЕГО ПРОИЗВОДНЫЕВ нефти содержатся самые различные углеводороды. Исследования
Ф. Ф. Бейльштейна, А. А. Курбатова, В. В. Марковникова и Н. Д. Зе¬
линского показали, что в бакинской нефти содержатся значительные
количества углеводородов ряда СпНгп, обладающих свойствами насы¬
щенных соединений. Этим углеводородам присвоили иазвдпис нафтеном
ПЯТИ- И ШЕСТИЧЛЕННЫЕ ЦИКЛЫ 5 I 3В. В. Марковникову и В. Н. Оглоблину удалось выделить из нефти цик-
лопентан. Позднее Н. Д. Зелинским было показано, что главная масса
нафтенов состоит из гомологов циклопентана и циклогексана. Содержа¬
ние нафтенов в разных нефтях различно. Россини (США), начиная
с 1928 г., исследовал состав некоторых нефтей физико-химическими
методами и выделил около 90 индивидуальных углеводородов. Надо ска¬
зать, что многие изомеры гомологов циклопентана и циклогексана нераз¬
делимы методами обычной перегонки даже с помощью мощных ректи¬
фикационных колонн, поскольку их температуры кипения очень близки.
Спектроскопические методы дают возможность определять состав не
слишком пестрых смесей углеводородов (разумеется, этому предшество¬
вал большой труд выделения и изучения спектров соединений заведомо
известного строения).В Советском Союзе разработан комбинированный метод исследова¬
ния состава бензинов (Б. А. Казанский, Г. С. Ландсберг и сотр.), заклю¬
чающийся в разделении бензина на узкие фракции путем тщательной
ректификации, затем хроматографии и дегидрогенизации над платиной;
нолученные узкие фракции углеводородов исследуются затем с помощью
спектров комбинационного рассеяния. В последнее время для исследова¬
ния таких смесей приобрел особое значение метод газо-жидкостной
хроматографии.Синтетически производные циклопентана проще всего получать из
циклопентанона, который образуется с хорошим выходом при прокали¬
вании кальциевой соли адипиновой кислоты или путем сложноэфирной
конденсации ее эфиров (конденсация Дикмана). Можно также превра¬
щать циклопентанон в циклопентанол или в гомологи циклопентена (че¬
рез реакцию Гриньяра), дающие при гидрировании гомологи циклопен¬
тана:Циклопентан и его гомологи могут быть пронитрированы (по
М. И. Коновалову); при нитровании, например, метилциклопентана по¬
лучаются два продукта:N02Циклопентановое кольцо размыкается только в очень жестких усло¬
виях. Так, циклопентан гидрируется с разрывом цикла до пентана над
платиновым катализатором при 250—300°С (Б. А. Казанский и
А. Ф. Платэ).Непредельные соединения с пятичленным циклом могут быть полу¬
чены обычными способами:
514АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕЦиклопентадиен. Цикдопентен и его гомологи обладают свойствами
обычных непредельных углеводородов. Особенно интересными свойст¬
вами обладает циклопентадиен, получаемый в промышленности из га¬
зов коксования, головного погона сырого бензола, продуктов пиролиза
керосина или бензина. Циклопентадиен замечателен тем, что атомы во¬
дорода его единственной метиленовой группы чрезвычайно подвижны.
Один из этих атомов может быть замещен на натрий, причем в анионе
образующегося натриевого соединения все атомы углерода равноценны
и отрицательный заряд равномерно распределен между ними;Этот анион — циклопентадиенил представляет собой ароматическую
в смысле Хюккеля систему (см. кн. II, раздел «Карбанионы»); он весьма
стабилен, не изомеризуется и не вырывает протон из таких растворите¬
лей, как эфир или тетрагидрофуран.Действием галоидных алкилов на натрийциклопентадиенил могут
быть получены гомологи циклопентадиенаа при действии хлоридов многих металлов —«металлоорганические соеди¬
нения типа ферроцена *Магнийорганическое соединение циклопентадиена получается при
обработке циклопентадиена алкилмагнийгалогенидами;Подвижность водорода в циклопентадиене проявляется и в легко
идущей конденсации его с альдегидами и кетонами:Получаемые таким образом фульвены — непредельные окрашенные
углеводороды с большим дипольйым моментом 1,5 D).
Циклопентадиен быстро димеризуется в дйциклопентадиен2О»+ 2Na —► н2 + г(-))СН Na++ NaBrО'О'CHMgBr + С2Н,ОСН2 + 0=С/СН3 /СН3* Подробнее см, кн. И, раздел «Небензоидные ароматические системы».
ПЯТИ- И ШЕСТИЧЛЕННЫЕ ЦИКЛЫ515и легко вступает в реакции, характерные для диенов, например в реак¬
цию Дильса— Альдера:А. Е. Фаворский, изучавший, начиная с 1912 г., возможность введе¬
ния тройной связи в средние циклы и пользовавшийся для этой цели дей¬
ствием натрия на дибромиды типавместо циклоалкина получил в своей работе с М. Ф. Шостаковским три
мер — производное бензола:Наряду с тримером получался также полимер — по-видимому, поли¬
мер циклопентадиена. Виттигу, однако, удалось уловить промежуточно
образующийся циклоалкин, отщепляя бром от дибромидов Фаворского
с я = 3, 4 и 5 магнием в присутствии весьма активного диена. Таким
в высшей степени активным диеном оказался дифенилизобензфуран, ко¬
торый вступал в реакцию с мимолетно существующим циклоалкином
(в опытах Фаворского циклоалкин тримеризовался в бензольное произ¬
водное) :Реакция доказывает промежуточное существование циклопентина,
циклогексина и циклогептина. Циклооктин уже более устойчив, хотя еще
очень реакционноспособен. Он был получен Бломквистом.КАРБОНОВЫЕ КИСЛОТЫ ЦИКЛОПЕНТАНОВОГО РЯДАЦиклопентанкарбоновые кислоты, наряду с кислотами циклогекса¬
нового ряда, входят в состав так называемых нафтеновых кислот, выде¬
ляемых из нефти. В этой смеси находятся, в частности, циклопентанкар-
боновая, 1,2,2-триметилциклопентанкарбоновая кислоты и др. Области
применения солей нафтеновых кислот самые разнообразные. Их медные
и марганцовые соли используют в лакокрасочной промышленности в ка¬
честве сиккативов — инициаторов окисления и полимеризации высыхаю¬
щих масел (олиф); медная соль является хорошим фуйгицидом; некото¬
рые соли нафтеновых кислот применяют как инсектициды и эмульга¬
торы.С8н5сйн5
616АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕВ состав эфирных масел некоторых тропических растений входят со¬
держащие циклопентеновое кольцо кислоты — гиднокарповая (п = 10)
и хаульмугровая (п = 12):НС=СН^.СН—(СН2)„—СООНН2С-СН2Растительные жиры — гиднокарповое и хаульмугровое масла — при¬
менялись как народное средство в терапии проказы.Пятичленный цикл входит также в структуру важных природных
веществ — ауксинов (ростовых веществ):ОН ОН ОНI I IНС—С—СН—СН2—СН-СН—соонI IСНз—СН2—СН—НС\ /СН—СН—с н2—с н3I сн2 IСНз СН3ауксин АонIНС=С—СН—сн2—со—сн2—соон?I IСНз—сн2—СН—НС\ /СН—СН—СН2—СНзI сн2 IСН3 СНзаукснн ВАуксины сосредоточиваются в растущих частях растений (зеленых
побегах) и способствуют их дальнейшему росту (Кёгль).ЦИКЛОГЕКСАН И ЕГО ПРОИЗВОДНЫЕСоединения, содержащие в своей структуре шестичленные алицик-
лы, — одни из наиболее распространенных в органической природе. Со¬
ответствующие циклические группировки атомов входят в большинство
терпенов, стероидов, алкалоидов. Часто встречаются циклогексановые
мостиковые соединения, соединения со срощенными циклами. Эти типы
соединений будут рассмотрены специально (см. кн. II, раздел «Изопре-
ноиды»), Циклогексан и его гомологи,в значительных количествах со¬
держатся в бензинах, особенно входящих в состав кавказских нефтей.Производные циклогексана получают главным образом гидрирова¬
нием ароматических соединений над платиной или никелем (Сабатье):СН3 СНзСНз СНзСам циклогексан получают гидрированием бензола.Циклогексан и его гомологи, подобно гомологам циклопентана, всту¬
пают в реакции, характерные для парафинов: галоидируются, нитруются
и сульфохлорируются по гомолитическому типу. Циклогексановое кольцо
весьма устойчиво к окислению и гидрированию. Значительно легче под¬
пяти- и шестичленные циклы517вергаются окислению кислородсодержащие производные циклогексана —
циклогексанон и циклогексанол.Дегидрогенизация циклогексана. Необратимый
катализ. Гидрогенизация производных бензола, как и многие катали¬
тические реакции, является обратимым процессом. В тех же условиях и
на тех же катализаторах, но в отсутствие водорода циклогексан может
быть дегидрирован до бензола (над платиной или палладием при
~300 °С):, О^0 + зн,Водород постепенно уходит из сферы реакции, и поэтому превраще¬
ние протекает практически количественно.Гомологи циклогексана также могут быть превращены в гомологи
бензола без изменения углеродного скелета (Н. Д. Зелинский). Это, ра¬
зумеется, не может касаться 1,1-диметилциклогексана и других гем-за¬
мещенных циклогексанов. Их дегидрогенизация происходит в значитель¬
но более жестких условиях и сопровождается отщеплением одной из
алкильных групп или изомеризацией. Так, из 1,1-диметилциклогексана
получается смесь орто- и жега-ксилолов, толуол и метан (Б. А. Казан¬
ский, А. Л. Либерман):Н3С^ /СНзpt а°)+ СН4о-ксилол я-ксилол толуолЦиклогексен и циклогексадиены гидрируются примерно так же, как
обычные непредельные соединения. Легкость же их дегидрирования объ¬
ясняется тем, что при этом получается энергетически выгодная аромати¬
ческая система бензола.В этой связи интересна способность циклогексена к диспропорцио-
нированию. В присутствии платинового или палладиевого катализатора
циклогексен уже при комнатной температуре диспропорционируется на
бензол и циклогексан в результате экзотермической реакции:зП^П-нЭта реакция была названа Н. Д. Зелинским необратимым катали¬
зом, поскольку обратная реакция неосуществима — из смеси бензола
с циклогексаном не может быть получен ни циклогексен, ни циклогекса-
диен. Очевидно, реакция заключается в дегидрировании циклогексена,
причем выделяющийся водород гидрирует не успевший вступить в реак¬
цию циклогексен.Дегидрирование гомологов циклогексена, т. е. сведение их к гомоло¬
гам бензола, используется для установления их структуры.НЕПРЕДЕЛЬНЫЕ СОЕДИНЕНИЯ РЯДА ЦИКЛОГЕКСАНАЦиклогексен получают каталитической дегидратацией циклогекса-
нола, пропуская его пары над окисью алюминия при 350—400°С. Водо¬
отнимающими средствами при дегидратации могут служить также сер,-
ная или фосфорная кислота.
518АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕ■Циклогексен обладает всеми обычными свойствами непредельных
соединений: присоединяет галоиды, обесцвечивает раствор перманганата
калия, при действии надкислот образует окись циклогексена:. [^j] + CgHgCOOOH —+ CgHgCOOH ,Интересно, что окись циклогексена реагирует с нуклеофильными агентами, на¬
пример с аминамио—сСс гракс-раскрытнем эпоксидного цикла, т. е. с вальденовскнм обращением у атакуе¬
мого углерода. При этом оба заместителя оказываются первоначально в аксиальных
положениях (аксиальное раскрытие цикла). Это правило имеет значение для опреде¬
ления взаиморасположения заместителей в жесткопостроенных системах циклогекса¬
нового типа, например в стероидах. tЦиклогексадиен — типичный диен с сопряженной системой связей —
вступает в реакции диенового синтеза и др.О гидро- и дегидрогенизации циклогексана и циклогексена говори¬
лось выше. vСПИРТЫ ЦИКЛОГЕКСАНОВОГО РЯДАЦиклогексанол получают каталитическим гидрированием фенола.
Его можно получить также восстановлением циклогексанона и другими
общими методами.При окислении циклогексанола образуется циклогексаион, который
может быть окислен дальше до адипиновой кислоты:—► НООС—(СН2)4-СООНЦиклогексанол является полупродуктом в производстве капролак-
тама и адипиновой кислоты (следовательно, капрона и найлона).Циклогександиолы получаются Гидрированием соответствующих
ароматических оксисоедииений — фенолов. Например, диол хинит полу¬
чают гидрированием гидрохинона:ОН ОНИзвестны цис- и транс-изомеры хинита.Кверцит, молекула которого содержит пять гидроксилов, называется
также желудевым сахаром, так как содержится в желудях и обладает
сладким вкусом. Сладкий вкус характерен для большинства спиртов
с несколькими оксигруппами,
ПЯТИ- И ШЕСТИЧЛЕННЫЕ ЦИКЛЫ519,При окислении кверцита азотной кислотой получается слизевая ки¬
слота! конфигурация которой известна:сн2ноне/ \снонНОНС\ /СНОН
СНОНHNO.,СООНннонон--он
—н
—н
—онCOOHслизеваякислотаСледовательно, кверциту, который оптически деятелен, следует при¬
писать одну из следующих двух формул, в которых конфигурация четы¬
рех асимметрических центров совпадает с конфигурацией четырех цент¬
ров в слизевой кислоте:НОчОН Но/-Н2н нБыло показано, что кверциту соответствует именно левая из приве¬
денных формул.Инозитами называются стереоизомеры циклогексачгексаола (восемь
геометрических изомеров, из которых один может быть разделен на оп¬
тические антиподы).Во всех стереоизомерах, кроме D- и L-инозитов, имеется хотя бы
одна плоскость симметрии, обозначенная на схеме пунктирными ли¬
ниями. Молекулы D- и L-инозитов построены асимметрично.он онно4,'он онСЦИЛЛИТ(сциллоинозит)
520АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕМезоинозит широко распространен в растительном и животном
мире. Он содержится в свободном виде или в виде производных в мыш¬
цах и разных органах животных, в семенах растений и др. Мезоинозит —
фактор роста некоторых микроорганизмов (дрожжей) и носит название
биос-1 (Кёгль). В некоторых растениях содержатся также D- и L-ино-
зиты (их монометиловые эфиры).В растениях широко распространен фитин, который представляет
собой фосфорнокислый эфир мезоинозитансх.ноно.>=о
НОГ о;р=оIо онт 0=рСснсн НСно^ /О>=оно>СН H.cvЧн оЬр-
оно. I
>=0ноононони встречается в виде магниевой, кальциевой или калиевой солей. Фитин
применяется в медицине.В 1944 г. из грибков Streptomyces griseus Ваксман выделил получивший огромное
значение антибиотик стрептомицин. Он широко применяется для борьбы с туберкуле¬
зом, а также с болезнями, вызываемыми стрептококками и стафилококками. Гидролиз
в кислой среде приводит к расщеплению его молекулы C21H39N7O12 на две части:
CsHtsNeO^ в основе которой лежит циклогексановое кольцо, и дисахарид стрепто-
биозамин CjjHjsNO», гидролизующийся далее на два моносахарида (у одного из них
а-гидроксил замещен на метиламиногруппу). Обычное установление структуры и
конфигурации углеводов приводит к следующей формуле стрептобиозамина:-сноно н.сн2онЦиклогексановая половина молекулы содержит четыре вторичноспиртовых гидрок¬
сила и два остатка гуанидина. Один из гидроксилов связан с стрептобиозамином
гликозидной связью, так что вся структура стрептомицина такова (Фолкерс):
ПЯТИ- И ШЕСТИЧЛЕННЫЕ ЦИКЛЫ521КЕТОНЫ ЦИКЛОГЕКСАНОВОГО РЯДАЦиклогексанон получается при окислении циклогексанола или ката¬
литическим окислением самого циклогексана. Он -является важным рас¬
творителем и полупродуктом в одном из синтезов капролактама. Более
старый способ получения циклогексанона — пиролиз кальциевой соли пи-
мелиновой кислоты (Пириа), почему этот кетон и называли пимелинке-
тоном. Химические свойства его подобны свойствам алифатических ке-
тонов.При окислении HNO3, КМп04 или Н2СГ2О7 циклогексанон образует
с хорошим выходом адипиновую кислоту (обычный путь ее получения).
Окисление кислотой Каро приводит к капролакгону (Байер и Вилли-
гер):СН,СН2 Н2С/ Х'С=0' ' тт ” IО + H2S04Н2с/ \С==0 НО—Ov хОXН2С\ /СМ2 но/ VСН2 Н2С\_/СН2СНПод действием света циклические кетоны размыкаются и в присут¬
ствии воды дают одноосновные жирные кислоты (Чиамичиан): циклогек¬
санон дает капроновую кислоту СН3—(СНгЬ—СООН, метилциклогекса-
нон — энантовую кислоту:-СН3hv. Н20 CHj—(СН2)8—СООНс=оВ аналогичных реакциях, протекающих в отсутствие воды, инфра¬
красной спектроскопией обнаружено образование кетена, откуда можно
заключить, что механизм этой реакции включает стадии, изображенные
на схеме:С=0СНз hv г^^СН-СН,с==0 —-* 0=С=СН-(СН2)4-СН3Напомним, что фотолиз жирных кетонов протекает следующим об¬
разом:hvR-C-R ► R. + R-C-Циклогексанон содержит в равновесии при 25 °С на два порядка
больше енольной таутомерной формы, чем ацетон, а именно 0,02%.1,1-Диметилциклогександиин-3,5 (димедон), используемый как
реагент для открытия и идентификации альдегидов, получается
622.АЛИЦИКЛИЧЕСКИЕ УГЛЁВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕконденсацией малонового эфира и окиси мезитила по реакции Михаэля;
Н3С. /СНз Н3СЧ /СНзс с/6 CHs-COOC2H5 OH- Н>С^ ^H-C00CSH6 омыленн> ^0=t-c +COOCSHS ° сн ° ~С°2^СНзокись малоновый эфирмезитила" Ч/1
С
Н2с/ ''СНз
— I I
0=С\ сн2днмедоиС альдегидами димедон конденсируется с образованием кристалли¬
ческих вгысокоплавких продуктов — альдимедона или, в более жестких
условиях, ангидрида альдимедона:0 о1 R iн2с/м:н2 | н2с/ \сн2
I . I +сн+ I | —*(CH3)jC\ /С. Д ж /С(СНз)2СнЛо ° сг сн2о ос? ? i
Н2С/ \СН—СН—НС/ \СН2II II -р*(СНз)^ /С^ /С(СНз)2сн2 сг сн2О О О R О.г ч I I l Iн2с/ \с—сн—с/ м:н2 н2с/ \с/ \с/ м:н2(сНз)^ JL А /С(СН3)2 -Н2°* (сн3)2(Ц >1^ JL ^(сн3)2
СН2 NOH СН2 СН2 О СНгальднмедон ангидрид альдимедонаЭти соединения имеют большой молекулярный вес, высокие темпера¬
туры, плавления и хорошо кристаллизуются, поэтому они очень удобны
для идентификации альдегидов.ПРЕВРАЩЕНИЕ ЦИКЛОВ ДРУГ В ДРУГА' Циклические галоидпроизводные, спирты, амины, оксосоединения
могут изомеризоваться с расширением цикла или сжатием его. Многие
реакции циклических соединений происходят с изменением размера
цикла. Трех- и четырехчленные циклы наиболее склонны к расширению.
Расширение цикла происходит таким образом, что один из атомов боко¬
вой цепи вступает в цикл; сужение цикла сопровождается переходом
одного из углеродных атомов цикла в боковую цепь. Перегруппировки
ПРЕВРАЩЕНИЕ ЦИКЛОВ ДРУГ В ДРУГА523этого рода * особенно подробно были изучены Н. Я. Демьяновым иН. М. Кижнером.1. Дегидратация спиртов алициклического ряда часто сопровож¬
дается перегруппировкой. Если гидроксильная группа находится в боко¬
вой цепи у а-углеродного атома, то происходит расширение цикла, осо¬
бенно легко в случае спиртов циклопропанового и циклобутанового ря¬
дов. Катализаторами служат сильные водородные или лырисовы. кис¬
лоты (хлористый цинк, хлористый алюминий):СН8/ \ H2so4 Н2С—СНН2С СН—СН2ОН *■ | II + Н20
Н2С-СН
сна
Н2С—СН2 Hsso4 Н2С-^ \
I I » I ;сн + н2о
Н2С-СН—СН2ОН Н2С\ ^
СНДегидратация циклогексанола и циклопентанола в некоторых слу¬
чаях сопровождается сжатием цикла. Циклобутанол под действием кис¬
лот может частично превращаться в циклопропилкарбинол:-он ... V^CH-CHsOH2. Дезаминирование алициклических аминов азотистой кислотой
также приводит к алициклическим спиртам с циклами большего или
меньшего размера. Так, аминометилциклогексан дает в этих условиях
смесь циклогептилового спирта и циклогексилкарбинола и продукты де¬
гидратации. Те же продукты получаются при действии азотистой кис¬
лоты на циклогептиламин (Н. Я. Демьянов):аONOH HONOCH2NH, ^"Х:Н2ОН V*y's'OH HSN3. При пинаколиновой перегруппировке цикланов может происхо¬
дить как сужение, так и расширение цикла. Механизм этой перегруппи¬
ровки тот же, что и в алифатическом ряду: происходит протонирование
и отрыв в виде воды одного из гидроксилов, а к положительно заряжаю¬
щемуся при этом атому углерода мигрирует один из соседних радикалов
вместе с парой электронов связи. В случае циклических соединений та¬
ким радикалом является одно из звеньев цикла:К'К “2^ Ж1/V % sRС.*+н+н0ОсСНз —* [ ftSHi, —>- fVcH,СН„ сн3 С=0 +Нсн3* Более подробно о механизме этих перегруппировок см. кн. II, раздел «Пере¬
группировки»,
'524АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕ4. При нагревании с хлористым алюминием наступает равновесная
изомеризация между углеводородами циклопентанового и циклогексано-
вого рядов (Н. Д. Зелинский, О. Ашан, К. Неницеску). Например:AlCIs—СН,В смеси находятся одновременно метилциклопентан и циклогексан,
причем при температурах 70—80 °С равновесие устанавливается при от¬
носительной концентрации циклогексана и метилциклопентана 3:1. От¬
сюда следует, что по термодинамической устойчивости циклопентановый
и циклогексановый циклы довольно близки.Под влиянием того же катализатора гомологи циклобутана необра¬
тимо превращаются в гомологи циклопентана (М. Б. Турова-Поляк).
Например:СН2СН2—СН-СНз Aicig Н2С^ ^СН2L L —*11сн2—сн2 Н2С—сн2Циклогептан изомеризуется в этих условиях с сужением цикла.5. Сжатие циклов перегруппировкой Фаворского. Циклические а-
хлоркетоны при действии щелочи претерпевают перегруппировку
А. Е. Фаворского, гладко превращаясь в циклоалканкарбоновые кислоты
с меньшим на одно звено циклом:СС ~ 0-соон+сгО механизме перегруппировки см. кн. И, раздел «Перегруппиров¬
ки». Об использовании этой реакции при построении тетрациклического
алицикла кубана см. стр. 548 сл.6. Расширение циклов при помощи карбенов. При фотохимическом
разложении диазометана в присутствии циклических кетонов происходит
внедрение образующегося карбена :СН2 (стр. 536 и кн. II, «Карбены»)
между карбонильным атомом углерода и соседним атомом цикла:(СН2)„ (СН,),/ \ hv / ^СН2н2< ;сн2 + ch2n2 —* н2с |\ / \ /СН29 с&оДихлоркарбен гладко присоединяется к двойной связи циклогек-
сена:СНС13 + (сн3)3сок —:CCIo + КС1 + (сн3)3сон
Q) + :cci2 (^y.CCl2дихлорноркаранПолученный дихлорноркаран может быть пиролитически изомеризо-
ван в производные циклогептана:пиролиз
-4НС1"СН,:cci, 'л и
АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С НЕСКОЛЬКИМИ ЦИКЛАМИ525АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С ДВУМЯ
ИЛИ НЕСКОЛЬКИМИ ЦИКЛАМИДВУХЪЯДЕРНЫЕ АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
С ИЗОЛИРОВАННЫМИ ЦИКЛАМИЗдесь мы рассмотрим соединений двух классов, близких по свой¬
ствам и методам получения: алициклы, кольца в которых разделены
цепью атомов, и алициклы с кольцами, соединенными только простой
связью.Эти соединения могут быть получены теми же способами, что приве¬
дены для моноциклических соединений. Проще исходить из соединений,
у которых один цикл уже имеется в молекуле, пользуясь, например, ме¬
тодом ацилоиновой конденсации (стр. 535):Н2С—СН2 /СН2СООС2Н6 Na Н2С—СН2 /СН2—с=о\н—снг—сн^^СН—СНг-СН'^Н2С—СН2 СН2СООС2Н5 н2С—снЧСН,—СНОНИх можно также получать конденсацией двух молекул, в каждой из
которых имеется циклическая группировка, следующими путями.1. Реакцией Вюрца:-СН2С1 + 2Na —>- [^>—СН2—СН22. При помощи магнийорганических соединений:Вг + Mg —*■ —MgBrОН=о+Оневг - ою3. Конденсацией циклических альдегидов, кетонов и др.:=0 +4. Восстановлением кетонов (получение циклических пинаконов):Мг— Hg=° * СНО ОН5. Гидрированием соответствующих ароматических соединений0-^0 ™ 0~сн'^С>и многими другими методами.Свойства бициклических соединений с изолированными циклами
практически не отличаются от свойств моноциклических соединений.Важными природными веществами этого класса (с двумя изолиро¬
ванными циклическими группировками в молекуле) являются многие
каротиноиды (см. кн. II, раздел «Изопреноиды»).
526-АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕБициклические соединения, в которых циклы связаны между собой
простой углерод-углеродной связью, проявляют новый вид стереоизоме¬
рии. Например, 4,4'-диметилдициклогексил существует в виде трех сте¬
реоизомеров (ниже для простоты кольца циклогексана изображены
плоскими):цис-цас- цио-транс- транс-транс-Такая стереоизомерия объясняется невозможностью (при обычных
температурах) поворота колец относительно друг друга. При таком по¬
вороте должно наступить положение, когда метиленовые группы двух
циклов в положениях 2,2' и 6,6' окажутся на слишком малых расстоя¬
ниях и дальнейший поворот станет невозможным:Еще больше стереоизомеров у 2,2'- или 3,3'-дизамещенных дицикло-
гексилов. Из шести геометрических стереоизомеров 2,2'-диметилдицик-
логексила четыре существуют в виде оптически деятельных форм. Таким
образом, общее число стереоизомеров в этом случае равно десяти.СПИРАНЫСпиранами называются бициклические соединения, циклы которых
имеют один общий атом углерода. Название спиранов начинается при¬
ставкой «спиро», после которой в квадратных скобках указывается число
углеродных атомов (кроме общего, спиранового) в каждом цикле, далее,
если в цикле нет заместителей, следует название соответствующего угле¬
водорода — нонан, декан и т. п., в зависимости от общего числа углерод¬
ных атомов в бициклической системе спирана. Например;сх2 1 9■ОФспиро [8,5] октаа спиро [4,5] децен-2Спирановые соединения могут быть получены обычными методами
циклизации, например:|—'wPн2сн2соос2Н5 ШОТ г-у^СООСгН5‘''-УСН2С00С2Н5 куЧД.
АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С НЕСКОЛЬКИМИ ЦИКЛАМИ527Сужение или расширение циклов некоторых двухъядерных алйцик-
лических соединений также может приводить к спиранам. Это происхо¬
дит, например, при пинаколиновой перегруппировке дициклопентил-
диола-1,1' (Н. Д. Зелинский, Н. И. Шуйкин);Другой пример пинаколиновой перегруппировки, сопровождающейся
сужением цикла:Для соединений спиранового ряда характерен особый вид стереоизо¬
мерии. Например, спирб[3,3]гептандикарбоновая-2,5-кислота, несмотря
на отсутствие асимметрических атомов углерода, существует в виде
двух оптических антиподов. Это связано с асимметрией молекулы в це¬
лом. Циклы молекулы спиро[3,3]гептана расположены во взаимно пер¬
пендикулярных плоскостях. В связи с этим молекула рассматриваемой
кислоты не может быть совмещена со своим зеркальным изображением:Спирановые соединения, как правило, менее устойчивы, чем обыч¬
ные алициклические соединения. Их циклы (малые) легче размыкаются
под действием сильных кислот, хлора, брома и др.АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
С КОНДЕНСИРОВАННЫМИ ЯДРАМИПрежде всего нужно отметить, что в случае конденсированных по¬
лициклов может возникнуть путаница со счетом циклов. Например,
изображенные ниже алициклымогут быть ошибочно приняты за трициклы. Следует помнить, что
предельные (т. е. лишенные я-связей) моноалициклические углеводороды
имеют общую формулу ряда С„Н2п, бициклические С„Н2„_2, трицикли-
ческие СпНгп-4 и т. д.Все написанные выше углеводороды —- бициклы., ОНС7Н12
528АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕМетоды синтезаДля получения конденсированных алициклов пригодны следующие
способы.1. Каталитическое гидрирование конденсированных ароматических
систем, таких, как нафталин —для бициклов, антрацен или фе-
нантрен — для трициклов (см. кн. II):СН2 СН2/ \ / \^ H2/Ni Н2С сн сн2
—»- I I I
Н2С . сн сн2
\ / \ /
сн2 сн22. Циклизация одним из способов, приведенных на стр. 509, но
исходя из соединений, уже содержащих один цикл. Например:^CH2—COOH „Th02сн2—соонс=о3. Присоединение карбенов (см. стр. 78, 219 и кн. II, раздел «Кар-
бены») к непредельным моноцнклам(^J) + :CR2 ► (^tcR2Если в данном примере R = Н, получается бицикло [1,4,0]гептан, называемый
норкараном. Сам каран СюНш, имеющий ту же бициклнческую систему,—
родоначальный углеводород каренов CmHie, открытых в скипидаре русской сосны
(Б. А. Арбузов):о> „дх .х>ссн3норкаран каранз Н3С СН3 н3с"^^ СНзкареаы4. Диеновый синтез в разных вариантах:О ОII IIсн2 с сн2 с/ / \ / \ / \НС НС СН НС сн снI + II II —* II I II mНС НС СН НС сн сн w\ \ / \ / \ /
сн2 с сн2 сII I!о оснсннс^ \ сн2 НС/ I \СН2• I +11 —->11 снг ■нс^ / CH-X НСЧ I >сн \1/
сн<^Н—X «2|эн до метиленовый
цикл
СТЕРЕОХИМИЯ529СНСН/ \НС СН2 СН2I I + II
НС СН2 СН—X\ /СНRIСR-C^ \
! 4
R—,сIRс=о +сн2IIсн-хзидоэгилеиовый циклRIсR—С/IIR-Csс=оRЧ'СН21 I,сн—X-(3)(4)эндокарбоннльный циклГидрогенизацией приведенного эндометиленового соединения полу¬
чается норкамфан (если X — галоид, он при гидрогенизации замещается
на Н). Это — бицикло [2,2,1]гептан, имеющий скелет камфоры, борнеола
и других терпеноидов (см. кн. II, раздел «Изопреноиды»). Дегидроге¬
низация эндоэтиленовых соединений происходит с отщеплением этилена
и приводит к производным бензола.5. Выделение из природных продуктов (см. кн. II, раздел «Изопре¬
ноиды»).6. Можно, наконец, использовать фотосенсибилизированное (па¬
рами ртути) разложение бициклических кетонов. Так, норкамфора в
этих условиях в числе других продуктов разложения образует
бицикло[2,2,0] гексан (I) и бицикло[2,1,1]гексан (II) (Срнивасан);Бицикло[3,2,0]гептанон-3 в этих условиях образует тот же бицик-
ло[2,2,0]гексап (I), однако выход и здесь не превышает 5%. Вещество
это кипит при 90°С (Кромер, Срнивасан).СТЕРЕОХИМИЯ'Стереохимия конденсированных алициклов весьма сложна. Это свя¬
зано с пространственным расположением скелета» его относительной18 Зак. 882
530 АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕ —...и... — ...—— - ■■п.—.. р.жесткостью и малой симметрией молекул. Уже монозамещенные би¬
цикло [1,1,0]бутаны представлены двумя геометрическими изомерами*:нСН То<1> л ^СНзлз0~К!-СициклоСутан э//<?о-К-бициклобутанн2с; I ;chrКонденсированные систе.мы с большим числом атомов в циклах сами
по себе, даже без заместителей, могут существовать в виде двух изо¬
меров. Так, пенталан, гидриндан и декалин — каждый представлен па¬
рой геометрических изомеров.СН2 СН2 СН2 СН2 СН2 СН2~/\й\ н/Чс^Чсн,/ Хсй \ н/2с I СНо |n2C I СН2 II СН2 .11,1\ СН / Н2С СН / Н2С СН сн2X / \ / \ / \ / ч/\/СН2 СН2 СН2 СН3 сн2 СН2пенталан гидриидан декалинбицикло[3,3,0]октаи бидикло[3,4,0]нонан бидикло{4,4,01деканРассмотрим подробнее изомерию декалина, предсказанную в 1918 г.
Мором и доказанную в 1925 г. В. Хюккелем, который разделил дроб¬
ной перегонкой смесь декалинов, получающуюся при гидрировании наф¬
талина, и выделил транс-декалин (т. кип. 185 °С) и г^ис-декалин
(т. кип. 194°С). Можно представить себе две модели, в которых кресло¬
видные конформации циклогексана сконденсированы друг с другом.
В модели А ангулярные атомы водорода (при узловых атомах моле¬
кулы) расположены по разные стороны циклической системы (транс-
декалин); в цис-декалине (модель Б) они лежат по одну сторону:Н (а)Н (а)транс-дека лин
АЭти модели не- могут быть переведены друг в друга поворотом
около простых углерод-углеродных связей и являются изомерами, а не
разными конформациями одного соединения. Как цис-, так и транс-де¬
калины могут принимать несколько конформаций; здесь изображены
наиболее выгодные конформации каждого изомера, а именно кресло —
кресло (Хассель, 1946 г.).Если рассматривать одно из колец декалина как дважды замещен¬
ный циклогексан (заместители — углеродные атомы другого кольца), то
в транс-декалине эти заместители оба экваториальные, тогда как ан¬
гулярные атомы водорода — аксиальные. В г{ис-декалине сочленение
колец экваториально-аксиальное, и один из ангулярных водородов акси¬
ален, а другой экваториален. Как уже говорилось, в циклогексане более
выгодно диэкваториальное расположение заместителей. С этой точки
зрения транс-декалин должен обладать меньшим запасом энергии. К та¬
кому же выводу моЗкно прийти, если оценить энергию двух изомеров по
теплотам сгорания, как это было сделано для циклогексана (стр. 495) 1* Приставка эндо обозначает внутрь, экзо — вовне.
СТЕРЕОХИМИЯ631Разный характер связей в декалинах обусловливает и некоторыедругие их различия. Диэкваториальное сочленение колец в транс-дека¬
лине придает относительную жесткость его молекуле. Действительно,
хотя каждое кольцо транс-декалина может принять конформацию ванны,
полная конверсия молекулы в новую креслообразную конформацию не¬
возможна, поскольку экваториальные связи у третичных атомов угле¬
рода не могут стать аксиальными. Это и понятно: нельзя построить цикл
с участием двух соседних аксиальных связей, направленных в противо¬
положные стороны под углом 180°. Ангулярные водороды транс-дека¬
лина могут быть только аксиальными. Если |3- (или 2-) заместитель в
г/?анс-декалине находится в цис-положении к ближайшему из этих во-
дородов, то он может быть тоже только аксиальным, если в транс-поло¬
жении— только экваториальным. Например, транс-декалол-2 представ¬
лен двумя геометрическими изомерами; в одном из них гидроксил аксиа¬
лен (а), в другом|—экваториален (е):Таким образом, в транс-декалинах речь идет уже не об эквато¬
риальной или аксиальной конформациях, но об экваториально-аксиаль¬
ной изомерии.Система цис-декалина, построенная за счет экваториальной и
аксиальной связей, более гибка, и переходы между аксиальной и эква¬
ториальной конформациями замещенного цис-декалина возможны. Од¬
нако число изомеров остается тем ,же самым, поскольку заместитель
может находиться либо по ту же сторону кольца, что и ангулярные водо¬
роды (цис-цис-изомер), либо с противоположной стороны (цис-транс-
изомер).Для изображения конденсированных систем приняты компактные
формулы, в которых связи ангулярных водородов и заместителей, рас¬
положенных под кольцом, обозначаются пунктиром, а над кольцом —
черточкой.Например, для четырех возможных изомеров р-декалола:Н Н Н нУже на примере декалинов видна значительно большая жесткость
(закрепленность конформации) бициклов сравнительно с моноциклами.
Эта жесткость становится еще гораздо большей в системах с мостиками
из одного и двух звеньев, например в бицикло[1,2,2]гептане I (норкам-
фане) и в бицикло [2,2,2]октане II:н™ранс-/а)-цекапап-'1Нтранс - /е) - дека ло л-2НННтранс-(а)-Нтранс-(е)-цис-цис-цис-транс-сщ сн2н-сСНо-сн3III18*
532АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕЭта закрепленность отражается на стереохимии таких жестких цик¬
лов в следующем:1. Конформация в большей или меньшей степени закреплена.2. В явлениях, связанных с геометрической изомерией, действует
эмпирическое правило Бредта: «двойная связь неосуществима у головы
моста». Другими словами, систем типа III и IV не существует:СН2-СНн-с\\\ сн2-снij
сщ сн2IVЭто правило легко понять с точки зрения геометрии олефиновой
группировки атомов, которой присуще плоское расположение всех ато¬
мов и углы 120°. Очевидно, что искажения геометрии второго валент¬
ного состояния углерода в системах с я-связью у «головы моста» невоз¬
можны энергетически. В частности, поэтому кетоны, подобные камфе-
нилону VСН,н,ссовершенно не способны к енолизации, которая привела бы к образо¬
ванию двойной связи у головы моста.3. В оптической изомерии. Кетоны и другие подобные соединения,
как норкамфора VI и камфора VIIимеющие по два асимметрических атома в молекуле, тем не менее су¬
ществуют только в двух энантиомерных формах каждая и не образуют
диастереомеров. Происходит это по той очевидной причине, что мост
может быть замкнут только в цмс-положение на оба асимметрических
углерода, стоящих в голове моста, между тем как перемена на антипод¬
ную конфигурацию одного из двух углеродов требовала бы замыкания
моста в транс-положение, что геометрически невозможно.4. В динамической стереохимии. Поскольку реакции SN2 идут с
вальденовским обращением, замещения этого типа невозможны у голо¬
вы моста. Например, в бромноркамфоре VIII или бромкамфенилоне IX
СРЕДНИЕ ЦИКЛЫ И МАКРОЦИКЛЫ533бром неподвижен, т. е. не поддается нуклеофильному замещению, хотя
нормально бром в a-положении кетонов весьма подвижен. Это не ка¬
сается радикальных реакций — водород у головы моста норкам-
форы VI может быть замещен на бром действием бромсукцинимида.
Радикальные реакции идут без вальденовского обращения.Если на месте брома в бромкамфепилоне IX находится карбоксил,
то такая камфенилоновая кислота, несмотря на то что она является
(3-кетонокислотой, не теряет карбоксила даже при перегонке при 312 °С.
Это также объяснимо с точки зрения правила Бредга, так как декарб-
оксилирование р-кетонокислот идет через циклическое переходное со¬
стояние с образованием енола кетоначто в данном случае невозможно.. Однако есть еще один факт, подтверждающий прочность связи
атома с углеродом у головы моста, что, по-видимому, не может быть
объяснено с точки зрения правила Бредта, — устойчивость ртутного про¬
изводного камфенилона (А. Н. Несмеянов, И. И. Крицкая)совершенно беспрецедентная для а-ртутных производных кетонов (см.
кн. II, раздел «Элементоорганические соединения»).По мнению авторов, это явление вызвано отсутствием а—jr-сопря¬
жения соседних связей С—Hg и С = 0 вследствие пространственной не¬
возможности перекрывания орбиталей соответствующих о- и я-связей
(направления их осей взаимно перпендикулярны). С явлениями этого
рода в случае я—я-сопряжения и р—я-сопряжения мы встретимся
при изучении соединений ароматического ряда; укажем также на
неподвижность водорода в триптицене и брома в бромтриптицене
(см. кн. II).СРЕДНИЕ ЦИКЛЫ И МАКРОЦИКЛЫСредними циклами обычно называют циклы, включающие 7—12
(реже 7—14) атомов углерода. Макроциклы содержат более 14 звеньев.Методы синтезаДля получения больших и средних циклов можно применять те же
общие методы, что и для синтеза пяти- и шестичленных циклов, а имен¬
но: пиролиз двухосновных кислот над Th02, конденсацию нитрилов и
особенно ацилоиновую конденсацию. Многие макроциклические соеди¬
нения впервые были синтезированы Ружичкоп прокаливанием ториевых
солей двухосновных кислот в вакууме. Ему удалось получить этим
534АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕспособом почти все кетоны от 5- до 20-членного, а также 34-членный и
некоторые другие.Th02 у-—(СН2)Л—Vноос—(снг)л—соон >■ ' ) + со2 + н2ооДля синтеза требуемых двухосновных кислот с нормальной цепью Ружичка
применял два способа: -СН2(СН*)„СН2CH2(CH2)„CH2 + 2Na+[CH(COOC2H5)2] -Вг Вг(С2Н6ООС)2СНСН(СООС2Н5)2Br(CH2)„Br + 2KCNHOOCCH2CH2(CH2)„CH2CH2COOH
NC(CH2)„CN —► HOOC(CH2)„COOHЭфиры полученных двухосновных кнслот восстанавливали натрием в спирте
до глнколей, которые затем переводили в бромиды, а последние использовали для
дальнейшего удлинения цепи:ROOC(CH2)„COORНОСН2(СН2)„СН2ОНВгСН2(СН2)„СН2ВгСоединения со средними циклами могут быть получены также в ре¬
зультате сложноэфирной конденсации (Дикман) и конденсации нитри¬
лов двухосновных кислот (Торп)
(стр. 510). Всеми этими методами
с хорошими выходами получались
пяти-, шести- и семичленные циклы,
но наблюдалось резкое падение вы¬
ходов (иногда до 0%) в случае
средних циклов, особенно 9- и 10-
членных. С удлинением цепи до 13
углеродных атомов и выше выход
макроциклов несколько возрастал,
но ненамного.Низкий выход макроциклов
объясняется меньшей вероятностью
встречи концевых групп (энтропий¬
ный фактор). С увеличением длины
цепи вероятность встречи концов
двух разных молекул становится
больше вероятности столкновения
концов одной молекулы. Для уменьшения возможности таких побочных
реакций Циглер предложил метод сверхразбавления. Конденсация, во¬
обще говоря, может идти внутримолекулярно — с образованием цикли¬
ческих продуктов и межмолекулярно — с образованием димеров и поли¬
меров. Скорость циклизации пропорциональна концентрации вещества
в первой степени, тогда как скорость линейной конденсации пропорцио¬
нальна квадрату концентрации, поскольку реакция бимолекулярна. По¬
этому разбавление уменьшает возможность межмолекулярной конден¬
сации. Метод сверхразбавления заключается в том, что, во-первых,
используются большие количества растворителя и, во-вторых, реагирую¬
щее вещество вводят по каплям в раствор, содержащий конденсирую¬
щий агент. Метод сверхразбавления давал хорошие результаты при
получении макроциклов, однако средние циклы, особенно 9—11-членные,
получались с выходами 0,2—2%. Ацилоиновый метод (Штолль, Прелог),
при котором конденсация происходит на поверхности натрия, позволил
резко увеличить выход средних циклов. При медленном введении10 12 % 16
Число зВеньеВ циклаРис. 58. Выходы производных цикланов
при разных способах циклизации:1— ацхлоиноаая конденсация (Прелог): 2—спо-
coo i орпа — Циглера (конденсация нитрилов
двухосновных кислот в условиях сверхразбав¬
ления); J — сухая перегонка редкоземельных
солей двухосновных кислот (Ружнчка).
чСРЕДНИЕ ЦИКЛЫ И МАКРОЦИКЛЫ535сложного эфира дикарбоновой кислоты в кипящий растворитель (кси¬
лол, толуол), содержащий расплавленный натрий, происходит ацилои-
новая конденсация (циклизация):(СН2)„Na / \C2HsOOC(CH2)nCOOC2H5 —■> 0=С СНОНацилоинОбразующийся оксикетон (ацилоин) может быть затем подвергнут
дальнейшим превращениям: переведен в дикетон, гликоль, углеводород
И т. д.(СН2)„ (СН2)„ (СН2)„/ \ / \ / \0=С С=0 ч— 0==С СНОН —► НОНС—СНОНпо Кижнеру —Вольфу(СН2)„/ \НгС СНОННа рис. 58 приведены выходы алициклов при различных способах
их получения.ПРОИЗВОДНЫЕ ЦИКЛОГЕПТАНАСоединения циклогептанового ряда синтезируют одним из общих
методов циклизации или расширением шестичленных циклов до семи¬
членных. Например, суберон (циклогептанон) можно получить либо из
производных пробковой кислоты (сгр. 540), либо действием диазоме¬
тана на циклогексанон при освещении:| + ch2n2 —► \ +N2;х.ооЦиклогептанон может быть использован для получения других про¬
изводных соединений циклогептанового ряда (см. выше для циклопен-
танона).Чрезвычайно интересны производные максимально ненасыщенного
углеводорода — циклогептатриена. Впервые их синтез был осуществлен
Вильштеттером, исходя из циклогептанона, по следующей схеме:Onh2oh \ н3 s' \ СН31=0 ► I \=NOH > I У— NH2Г-N(CHs)arAgOH; ГВг2/Вг-Вг2NH(CH3)2/N(CH3)2ch<>iВг,Вг2N(CH,)a Гциклогеп*тадненчВг\дикло-гепта-триен
536АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕПроизводные диклогептатриена могут быть получены также дей¬
ствием жирных диазосоединений на бензол. Образующийся первона¬
чально при распаде диазосоединения карбен присоединяется к бензолу,
и осуществляется переход к производным норкарана:О+ :chr kchrОбразующееся бициклическое соединение при пиролизе изомери-
зуется:CHRt°ch2rt°СГСтроение продукта взаимодействия бензола с диазоуксусным эфи¬
ром доказывается тем, что при окислении он дает циклопропан-1,2,3-три-
карбоновую кислоту, а при восстановлении — циклогептанкарбоновую
кислоту:ноос-нс 0 н
I сн—соон рсн-сорн —>- сн-соонНООС—НС Ч-'Сам циклогептатриен представляет собой реакционноспособное не¬
предельное легко полимеризующееся вещество, растворимое в органи¬
ческих растворителях и нерастворимое в воде. Получаемый из него
бромистый тропилий — это соль, где катионом является ароматический
ион — тропилий-ион (подробнее см. кн. И, раздел «Карбкатионы»):Бромистый тропилий солеобразен, хорошо растворяется в воде, при
добавлении нитрата серебра ион брома полностью и сразу осаждается
в виде AgBr. По способу Д. Н. Курсанова и М. Е. Вольпина соли тро-
пилия можно получить в результате присоединения к бензолу хлоркар-
бена, генерируемого из хлористого метилена:ПРОИЗВОДНЫЕ ЦИКЛООКТАНАПроизводные циклооктана могут быть получены способами, опи¬
санными на стр. 534, циклооктаполиены — конденсацией ацетилена по
Реппе и бутадиена по Циглеру.Бутадиен над катализаторами Циглера [А1 (C2H5)3^TiCl3] димери-
зуется в циклооктадиен:
СРЕДНИЕ ЦИКЛЫ И МАКРОЦИКЛЫ537Этот диен образует с «нульвалентным» никелем л-комплексФ)Ж№при нагревании разлагающийся на металл и исходный непредельный
углеводород (Вильке).Наиболее интересен циклооктатетраен — восьмичленный цикл с че¬
тырьмя сопряженными двойными связями. Молекула циклооктатетраена
имеет неплоскостное расположение атомов и не является ароматиче¬
ской. Впервые циклооктатетраен был получен Вильштеттером путем
многостадийного синтеза, аналогичного вышеприведенному синтезу цик-
логептатриена, исходя из алкалоида псевдопельтьерина (см. кн. II,
«Алкалоиды»). В настоящее время циклооктатетраен получают по спо¬
собу Реппе—конденсацией ацетилена при нагревании под давлением
в присутствии цианида никеля (в виде аммиачного комплекса):4СН=СНБензол при освещении присоединяет некоторые производные аце¬
тилена, образуя производные циклооктатетраена:ОIIс—сосн3 м
+ III —*'С-СОСНоIIооIIхсосн3"СОСН-II 3
оЦиклооктатетраен легко гидрируется над Pt и,ли Ni до циклооктана.
В других условиях он может быть восстановлен как до циклооктена,
так и до циклооктатриена. Многим реакциям циклооктатетраена сопут¬
ствует изомеризация скелета. Так, при хлорировании хлористым суль-
фурилом образуется дихлорпроизводное бицикло[4,2,0]октадиена-2,4, де-
гидрогалоидирование которого посредством NaN^Hg^ приводит к
хлорциклооктатетраену:SOaCI^С1С1-наОС1Строение бицикла доказывается, в частности, превращением его
в гексагидрофталевую кислоту по схеме:1. RCOC1
2-H2/Pt ^,соонсоон
538АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕОкисление циклооктатетраена приводит прямо к п-бензолдикарбо-
новой —- терефталевой кислоте.При УФ-облучении Танаки и Акида превратили циклооктатетраен
в бензол и ацетилен. В этих реакциях циклооктатетраен реагирует как
таутомерное соединение:/СН,н,сTlV+снIIIснНООСв|кмпо4хтсошИзвестен и ряд других реакций, в которых циклооктатетраен реаги¬
рует в одной из трех форм А, Б и В. Результаты описанного выше гид¬
рирования соответствуют структуре А; распад на бензол и ацетилен —
структуре Б; окисление в n-бензолдикарбоновую кислоту — структуре В.
Сюда можно добавить окисление циклооктатетраена NaOCl, приводящее
к м-бензолдиальдегиду. Хлорирование посредством S02C12 отвечает
структуре Б. Многочисленные реакции диенового синтеза с разнообраз¬
ными диенофилами (малеиновым ангидридом, тетрацианэтиленом и др.)
также идут в соответствии с формой Б. Например:Понятно, что форма А, как неплоскостная и потому не имеющая со¬
пряженных я-связей (по крайней мере лишенная полной меры сопря¬
жения), не вступает в диеновый синтез. Наоборот, форма Б, подобно
циклогексадиену-1,3, имеет сопряженные я-связи.ВАЛЕНТНАЯ ИЗОМЕРИЯ И ТАУТОМЕРИЯСпрашивается, однако, существуют ли реально формы Б и В или
это только «реакционные формы», т. е. структуры, образующиеся в мо¬
мент реакции под влиянием реагента? Другими словами, вопрос за¬
ключается в том, имеется ли здесь случай таутомерии с раздельным су¬
ществованием индивидуальных изомерных веществ А, Б к В, способных
к взаимным превращениям по. законам таутомерного равновесия. Под¬
черкнем, что такая валентная таутомерия связана с перераспределением
валентных связей *, т. е. электронов, но не атомов (отсюда ее второе,
очень неудачное, название — электронная таутомерия), и, таким обра¬
зом, не относится ни к катионотропной (стр. 395), ни к аниодотропной
таутомерии.* Изменение системы связей является следствием изменения их длины и ва¬
лентных углов, т. е. следствием изменения геометрии молекульц
ВАЛЕНТНАЯ ИЗОМЕРИЯ И ТАУТОМЕРИЯ539Заметим также, что валентная изомерия (без обратимого взаимного превращения
таких изомеров) в настоящее время известна для ряда случаев, из которых приведен
один — валентные изомеры бензола: -Прн нагревании изомеры D и Е превращаются необратимо в бензол Г.При самопроизвольной полимеризации трег-бутилфторацетилена образуются че¬
тыре валентных изомера, изображенных ниже:С(СН3)3С(СНэ)зС(СНз)з
(СН3)3СЧ ^С(СН3)33(CH3)3C-CsCF(т,пл.иг-и4°с)(СНз)зСч+ гмало устойчив+, (т. пл.-187 °С)(СНз)зС+К /С(СНз)зС(СН3)з(т. кип. 140 °С при 11 мирт, ст.)Эти изомеры разделены хроматографически, и структура их установлена по
спектрам ЯМР и по оптическим спектрам (Вихе и др.).Гексаметильное производное «ладенбурговского бензола» * получил в 1966 г.
Шеффер препаративно пригодной реакцией: оставляя стоять бензольный раствор диме-
тилацетилена с хлористым алюминием. Получаемое вещество — гексаметилпризман
при комнатной температуре (быстрее при нагревании) изомеризуется в свой валентный
изомер —гексаметилбензол. В этих случаях, как и при истинной изомерии, каждое из
индивидуальных веществ отделено от другого энергетическим барьером и для превра¬
щения требуется энергия активации.Наличие таутомерных форм А и Б для циклооктатетраенов одно¬
значно подтвердил Хьюсген. Изучая кинетику диенового синтеза цикло-
октатетраена с диенофилами, этот исследователь показал, что форма А
не вступает в реакцию, что скорость реакции при избытке диенофила не
зависит от концентрации последнего и контролируется скоростью пре¬
вращения А в Б. Хьюсген смог определить концентрацию таутомера Б
в диоксановом растворе при 100 °С и установил, что она очень мала—■
всего 0,01%. Из наблюдений над скоростью диенового синтеза при раз¬
ных температурах (в среде этилацетата) он нашел параметры энергии
активации процесса таутомеризации [АН* — 25,0 ккал/моль и AS* =
= 3 кал/(град• моль)], величины которых, как оказалось, не выходят
за рамки типичных термодинамических констант для обычных реакций.ПРОИЗВОДНЫЕ ДРУГИХ ЦИКЛАНОВВысшие алициклы изучены относительно мало. Наибольшее значе¬
ние имеют более доступные циклические кетоны. Все высшие кетоны,* Поскольку в прошлом столетии Ладенбург предлагал призматическую фор¬
мулу для бензола, эту структуру (формула Е) называют ладенбурговским бензолом.
Современное название производных с этим скелетом — призманм.
540АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕначиная с циклододеканона, обладают характерным запахом-. Кетоны
с 10, 11 и 12 атомами в цикле пахнут камфорой, с 14—18 атомами имеют
мускусный запах. Циклопентадеканон применяется в парфюмерии под
названием экзальтон. Душистым ' веществом животного мускуса яв¬
ляется главным образом кетон мусконСН2
/ Ч
СНз-СН с=о
\ /(сн2),2мусконЦибетон, душистое вещество циветты, представляет собой непре¬
дельный кетон с 17 углеродными атомами в цикле. При окислении ци-
бетона получаются азелаиновая и пробковая кислоты, а в результате
гидрирования двойной связи — циклогептадеканон:(СН2)7
НС^ \ оС—О >■ НООС—(СН2)7-СООН + НООС—(СН2)в—сооннсх(СН2)7цпбстоназелаиновая кислота пробковая кислота(СН2)7
Н2с/ \I ;с=о
н2С\ /(СН2)7циклогептадеканонЦиклогептадеканон окисляется до тетрадекандикарбоновой кислоты.ТРАНСАННУЛЯРНЫЙ ЭФФЕКТ -Трудность образования средних циклов (8—13-членных) и их не¬
сколько более высокие теплоты сгорания (в расчете на одну метилено-зую группу) связаны главным образом с
новым типом неклассического напряжения
в цикле. Оно вызывается тем, что некоторые
атомы водорода, расположенные по разные
стороны кольца, оказываются слишком
сближенными и взаимно отталкиваются
(трансаннулярное взаимодействие, или вза¬
имодействие через кольцо). Особенно велик
этот эффект в 9—11-членных цикланах.Судя по рентгеноскопическим данным,
молекула циклодекана в твердом состоянии
находится в конформации, изображенной на
рис. 59. Из этого рисунка (вид молекулы
сверху) ясно видно, что три атома водорода
над кольцом и три атома водорода под
кольцом располагаются особенно близко
друг к другу. Это взаимодействие приводит
к некоторому отклонению валентных углов от тетраэдрических и к ряду
аномальных реакций.Большая часть известных трансаннулярных реакций происходит
так, что положительный карбониевый центр, возникающий в результате
той или иной реакции на одном из углеродов цикла, перемещается на
другой углерод, удаленный по цепи, но пространственно близкий. Это
ТРАНСАННУЛЯРНЫП ЭФФЕКТ541,перемещение реакционного центра происходит по механизму гидрид-
ного перехода, т. е. миграции атома водорода вместе с парой электро¬
нов связи. Приведем примеры реакций этого типа, открытых одновре¬
менно Коупом и Прелогом в 1952 г.Казалось бы, кислотный гидролиз а-окиси циклодецена должен
привести к циклодекандиолу-1,2. В действительности же этот гликоль
совсем не образуется. Вместо него получается смесь продуктов, в ко¬
торой преобладает циклодекандиол-1,6. Аналогично из окиси циклоно-
нена получается циклононандиол-1,5, а из окиси циклооктена — смесь
нормального продукта реакции с диолом-1,4. Механизм реакции заклю¬
чается в следующем. При размыкании а-окисного кольца окиси цикло¬
децена под действием протона образуется карбоний-катион I. Затем про¬
исходит перескок к положительно заряженному углеродному атому про¬
странственно сближенного с ним атома водорода в виде гидрид-иона и
образуется новый карбоний-катион II, который и присоединяет гидроксил:Это только приближенный механизм превращения. Возможно, что
переход гидрид-иона начинается одновременно с размыканием окисного
цикла, и тогда становится понятным отсутствие 1,2-диола в продуктах
реакции.Таким образом, гидроксилы оказываются в положениях 1,6, а не
в соседних положениях, как этого следовало бы ожидать, исходя из
классических представлений.Превращение а-окисей в гликоли — удобная реакция для изучения
трансаннулярного эффекта, так как в результате нормальной и транс-
аннулярной реакций образуются разные изомерные гликоли *.Трансаннулярный переход гидрид-иона отмечен и в других случаях,
причем для доказательства такого перехода были использованы мече¬
ные атомы. Разберем, например, гидролиз п-толуолсульфонатов (този-
латов) ** циклодеканола. Гидролиз по мономолекулярному механизму
5дг1 заключается в обратимом образовании карбоний-катиона* В действительности, реакция значительно сложнее, чем это представлено нашей
схемой. Например, в реакции циклодей£ип с надмуравьипон кислотой (идущей через
стадию образования а-окиси) получается кроме гликоля еще восемь продуктов. По¬
требовался большой труд, чтобы разделить эти вещества, идентифицировать и дони¬
зать их строение.** Тозил — остаток п-толуолсульфокислоты —CH3CdH4 — S ; тозилат — слож-IIО ОО оный эфир этой кислоты.
542АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕгде R+ — карбкатион циклодецил CioHig, который далее может-реаги¬
ровать несколькими способами: либо сразу соединяться с гидроксилом,
либо превращаться в непредельное соединение (выброс протона), либо,
наконец, в результате гидридного перехода превращаться в другой ка¬
тион, также способный давать спирт или непредельное соединение;Н-Н-(СН,)„/ \+
-с—н с—н
\ /
(СН2)тI(СН2)„\-с н—с—\ /
(СН2)тIIн+ он“(СН2)п н/ V/H•> н2с; ;с(С'Н2)тN-/Aoh(CHj)n-i
~н+ / ^СН—-> н2с; ||\ /С,н
(СН2),„и (СН2)Л
+ он_ нч / ч * ;с; ;сн2н0 (сн2)т(сн2)„-,-н+ НО'' \—- 11 ,сн2HCV /
(СН2)ЯПродукты, получающиеся из обоих катионов (I и II), идентичны.
Однако если один или несколько атомов углерода в молекуле помечены
14С, то продукты нормальной и трансаннулярной реакции будут содер¬
жать меченый атом углерода в разных положениях по отношению к
двойной связи (в циклодецене) или к гидроксилу (в карбиноле).С помощью ацилоиновой конденсации Прелог с сотр. осуществил
синтез циклодеканола, меченного 14С, из меченой по карбоксильной
группе себациновой кислоты:C1(CH2)8C1 + MgClMg(CH2)8MgCl2С02-> НООС—(СН2)8—СООН
себациновая кислота/СООСНз Na
(СН2)8 —»
^СООСНз/(СН2)8\С=0чСНОНСН2
/,0\.
(СН2)7 СНОНСН22циклодеканолЕстественно, что полученный таким образом циклодеканол содержит
50% радиоактивности в положении 1 и 50% в а-положениях 2 и 10
(разумеется, в действительности все 50% активности приходятся лишь
на один из а-углеродных атомов, но, поскольку они эквивалентны,
можно считать, что каждый из них несет по 25% радиоактивности). Для
ТРАНСАННУЛЯРНЫИ ЭФФЕКТ543доказательства такого распределения активности в полученном алко¬
голе его окисляют до себациновой кислоты. В последней 75% актив¬
ности должно приходиться на карбоксилы и 25% на а-углеродные ато¬
мы. Это и подтверждается тем, что октаметилендиамин, полученный из
себациновой кислоты по Курциусу — Шмидту, содержит 25% активностиСН2
/ \.
(СН2)7 СНОН
\ /СНзСНз/ \.
(СН,)7 С=0
\ /СН2/СН2СООН(CH2)eN:h2cooh/СН2СООН(СН2)6Ч'СН,СООНHN3; H2S04/CH2NH2(CH2)fi\:H2NH2а гексаметилендиамин, полученный из октаметилендиамина (превраще¬
ние в гликоль действием HNO2, окисление гликоля до пробковой кис¬
лоты и перегруппировка последней по Курциусу — Шмидту), практиче¬
ски неактивен;/CH2NH3(СНз)9^CHjNHshno2/СН2ОН(СН2)в\сн2он/СООН(СН2)«\соонHN3; H2S04/CH2NH2(СН2)4'''CH^HjПерейдем теперь к анализу продуктов гидролиза тозилатов цикло-
деканола, меченного ИС в положениях 1, 2 и 10. При гидролизе по
мономолекулярному механизму получается главным образом циклоде¬
цен и небольшое количество циклодеканола. Доказательство распреде¬
ления радиоактивности основывается на окислении этих соединений до
себациновой кислоты и постепенной «стрижке» концов цепи атомов;СН3/ \
(СН2)7 сн
\ /
снOs04(CH2)eсн2СНОНо2СНОНч /
СН,/СН2СООН(СН2)в\:Н2СООН/СН2СООН(СН2)6Ч'СН2СООНHN3; H2S04(реакция Шмидта)/CH2NHj(СН2)в^CHaNHjhno2/СНзОН(СН2)6\:Н,ОНо2/СООН(СН,),N:OOH/СН2С00Н(СН2)4\сн2соонHN3; H2S04(реакция Шмидта)hno2 о2/СООН(СН2)4VoQH/СН2СООН(СН2)2^СНлСООНHN3; H2SO,(реакция Шмидта)hno2 о2/СООН(СН2)2\:ООНОказалось, что даже янтарная кислота, полученная из себациновой
кислоты, содержит значительную долю радиоактивного изотопа !4С. При
алициклические углеводороды и их производныеэтом метку несет не только тот атом углерода, где был тозилатный за¬
меститель, но и углерод, находившийся по другую сторону кольца. Сле¬
довательно,’и в этом случае наблюдается трансаннулярный гидридный
переход.Трансаннулярные реакции другого типа, не связанные с гидридным
переходом, были обнаружены у некоторых циклических полиенов. На¬
пример, циклооктатетраен, как уже указывалось на стр. 538, способен
к трансаннулярной циклизации, приводящей к валентной таутомерии:Подобного вида трансаннулярная циклизация свойственна и цик-
лононатриену:При этих таутомерных превращениях не происходит значительного
изменения геометрии молекулы (т. е. ее формы).Трансаннулярная циклизация происходит также при действии орга¬
нических оснований на 2,2-дибромциклононанон (или 2,2-дибромцикло-
деканон)нТрансаннулярные реакции известны и в гетероциклическом ряду.ПОЛИЭДРИЧЕСКИЕ АЛИЦИКЛЫИзвестны также алициклические соединения с более высокой сте¬
пенью конденсированности, в которых каждый из циклов сконденсиро¬
ван с тремя или четырьмя соседними, например:;у1:зн^н куйан адамантан конгрессамНаиболее давно известен адамантан. Он был выделен из нефти
С. Ланда и В. Махачеком в 1933 г. (содержание в нефти ~0,0004%).
Особый интерес химиков к адамантану объясняется отчасти тем, что
скелет этого соединения представляет собой структурную единицу ал¬
маза. Кристалл алмаза — это как бы полимер, построенный на основе
скелета адамантана, в котором все С—Н-связи заменены С—С-связями.Молекула адамантана обладает высокой симметрией; все три цикло-
гексановых кольца закреплены в форме кресла и лишены углового на-
ПОЛИЭДРИЧЕСКИЕ АЛИЦИКЛЫ545пряжения. Приводим разные изображения формулы адамантана, пред¬
ставляющего собой трицикло [3,3,1] декан:7^8
пс.СНонс<;СНH2CV/CH2
СНН2С\СН^СН2
СНТемпература плавления адамантана (269°С) необычайно высока
для углеводородов; он легко возгоняется, перегоняется с водяным па¬
ром и хорошо кристаллизуется. Эти свойства позволили выделить его
из пестрой смеси углеводородов, содержащихся в соответствующей
фракции нефти.Позднее были осуществлены синтезы адамантана. Исходным соеди¬
нением в большинстве случаев служил так называемый эфир Меер-
вейнаполучающийся при конденсации формальдегида с эфиром малоновой
кислоты.Образование эфира Меервейна при этой конденсации можно пред¬
ставить следующим образом:(СН3ООС)2СН2 + СН20 + СН2(СООСН3)2СН,(СН3ООС)2СН С(СООСН3)2СНг .СООСН,i°iHHi=сн2/ \ /^—"3(СН3ООС)2С С С=0\1осн.Н(СН3ООС)2С СН(СООСН3)2
\ /СН,СН30С/1» :СН2 С(СООСН3)2. / /С СН2СНзООС/НчVCILOOC'^^СООСНз
ЧС—С=0I , V/HоС СН2 'С\ / / ХСОосн.
С——СН2СН3ООСхиначе написанный эфир МеервейнаСООСНз1. гидролиз г>пг\ г г г—п2. декарбокси- (L.ri3vJvJ^)2'-' V~J~—^
лирование | | \■4 С СН2 С(СООСН3)2о^\/ Уи С СН2СНзООС^
546алициклические углеводороды и их производныеКарбоксильные группы при третичных ангулярных атомах эфира
Мсервейна в p-положении к кетонным карбонилам были удалены де-
карбоксилированием в спирте в присутствии метилата натрия:В полученном кетоэфире атомы водорода при углеродах, располо¬
женных между сложноэфирной и кетонной группами, подвижны, так же
как в ацетоуксусном эфире, и могут быть замещены на натрий. При
конденсации натриевого производного с бромистым метиленом цикл
замыкается и происходит переход к структуре адамантана (для нагляд¬
ности формулы даны не в виде енолятных, а с С-- и Ыа+-связями);В полученном соединении кетонные группы были восстановлены по
Кижнеру — Вольфу (через гидразоны), а сложноэфирные группировки
омылены и затем декарбоксилированы:Нч /С\ /С°ОСНзп Г' _г\NaOCH3(CH3OH)СНзООс/сн2/ \ А
СН3ООС н н сооск3Na+ + Na+,сн2спроссоосн3-щ6сн2адамантал
ПОЛИЭДРИЧЕСКИЕ АЛИЦИКЛЫ547Адамантан может быть получен также изомеризацией других поли-
циклических углеводородов в присутствии хлористого алюминия, на-*
пример:Ala,,; t°Структура адамантана доказана (кроме методов синтеза) измере¬
нием параметров молекулы методом электронной дифракции и рентге¬
нографии. Молекула адамантана свободна от углового напряжения. Его
структура нарушается с большим трудом.При кипячении адамантана с бромом получается монозамещенный
продукт (бром замещает водород при одном из третичных атомов угле¬
рода). Это бромирование—ионный процесс, поскольку он ускоряется
в присутствии кислот Льюиса, таких, как хлористый алюминий, а пере¬
киси на его скорость не влияют. В присутствии кислот Льюиса можно
ввести в молекулу четыре атома брома.При действии натрия на бромадамантан в ксилоле образуется ди-
адамантами.сн.сн2сн2нет
НРч■dP*!Ха¬нсСН;2/СН2Н2С.:схннйх ^сн2
2 сн 2снСН2 ХН2 H2CVснсн2 хн2СНтрет-Бромадамантан относительно легко гидролизуется и не слиш¬
ком уступает в этом отношении трет-бутилбромиду. В соответствующих
окси- и метоксиадамантанах группы ОН и ОСН3 замечаются на хлор
уже при действии холодной соляной кислоты (Штеттер, Ф. Н. Степанов).
Легко протекают и другие реакции отрыва гидроксила, в частности кон¬
денсация оксиадамантана с анизолом, протекающая без катализатора:0-°н +н V/ОСНзЭти реакции свидетельствуют о стабильности и легкости образова¬
ния иона адамантония, например, при бромировании;(^рН + Вг+ А1Вг4-НВг0'АШгГегВг+ АШг,Катион адамантония — энергетически более выгоден по сравнению,
например, с карбкатионом норкамфана, несущим положительный заряд
на мостиковом атоме углерода. Это объясняется тем, что моле¬
кула камфана уже значительно напряжена и изменение валент¬
ных углов при переходе к катиону, сопровождающееся вдавли-ванием мостикового атома внутрь молекулы (так как катион
стремится принять плоскую конфигурацию), еще более и очень
резко увеличивает напряжение катиона. В молекуле же адамантана угло¬
вое напряжение отсутствует. Образующийся катион принимает форму,
среднюю между исходной формой молекулы и формой, в которой
548АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕположительно заряженный .атом углерода Находится в одной плоско¬
сти с тремя соседними атомами углерода.Адамантилметил-катион, который можно получить, действуя кис¬
лотой на адамантилкарбинол или азотистой кислотой на соответствую¬
щий амин, претерпевает скелетную перегруппировку в гомоадамантил-
катион, включающий одно дополнительное звено СНг и стабилизую¬
щийся захватом аниона из среды (Ф. Н. Степанов):Производные кубана были синтезированы в последние годы. При¬
водим синтез кубандикарбоиовой кислоты. При действии бромсукцин-
имида на циклопентенон-2 получено бромпроизводное, которое присо¬
единяет бром по двойной связи. Образующийся при этом 2,3,4-трибром-
циклопентанон-1 под действием амина легко отщепляет две молекулы
бромистого водорода, образуя а-бромциклопентадиенони - bxj вгтх:—и..ООО окоторый самопроизвольно димеризуется:ВгО вгПолученный димер имеет две двойные связи. Под действием излу¬
чения происходит его циклизация за счет этих двойных связей, причем
возникает новый четырехчленный цикл. Образующееся соединение, со¬
держащее четыре пятичленных и два четырехчленных цикла, при дей¬
ствии 50%-ной щелочи претерпевает перегруппировку Фаворского. При
этом образуется кубандикарбоновая кислота:Вг о' " СООНW . и—Л кон >■ 7 НООСВ 1966 г. Итон и Коул сходным путем осуществили и синтез самого
кубана. Они исходили из того же димера бромциклопентадиенона I,
который действием этиленгликоля в кислой среде превращали в цикли¬
ческий кеталь II, циклизуемый при действии света в соединение III. Под
действием щелочи происходит перегруппировка Фаворского, а затем
превращение полученной при этом кислоты IV в хлорангидрид, из кото¬
рого взаимодействием с гидроперекисью трет-бутила получается пере¬
кись сложноэфирного типа V. При нагревании в изопропилбензоле (ку-
моле) до ~150°С перекись V распадается по радикальному механизму
и захватывает из изопропилбензола водородный атом, становящийся на
ПОЛИЭДРИЧЕСКИЕ АЛИЦИКЛЫ549место уходящего в виде СОг карбоксила. Далее следует гидролиз ке-
таля VI и возвращение к кетонной функции VII. Действием щелочи
производят новую перегруппировку Фаворского, полученную кисло¬
ту VIII снова (через хлорангидрид) этерифицируют перекисью трет-бу¬
тила в перекись IX, которая, аналогично предыдущему, подвергается
радикальному распаду в изопропилбензоле при 150°С, образуя кубан X:/СН2Вг ? \н2/ кон^(перегруп¬
пировка
Фаворского)
*-, Н,1.S02C12
2.(СН3)3С-ООННО—С
IIоIVС-ОО—С(СН3)3 -(СНз)зСОНоСН,ВГ Г Хсн,Вг ,0 . кон
\ ^ (перегруп-
-V/ пировка1 Фаворского)VUVIII£> 1. so,cio
'с^он Д-(СН3)3С-ООНоС ОО с(сн3)3 кумол (i50°c)IX-со2; -(сн3)3сонКубан — кристаллическое вещество с т. пл. 130—131 °С, возгоняю¬
щееся; был перекристаллизован из метанола. Доказательства структуры
были получены физическими методами. Масс-спектр имел пик при т/е
104, спектр протонного резонанса — единственный пик (один «сорт»
водородов); инфракрасный спектр в области от 4000 до 660 см-1 имел
всего три линии: 3000, 1231 и 851 см-1, что доказывает отсутствие крат¬
ных углерод-углеродных связей.Символом XVII международного конгресса по чистой и прикладной
химии служила формула еще неизвестного тогда симметричного али-
цикла, построенного из пяти циклогексановых колец. Недавно (1965 г.)
этот углеводород был синтезирован изомеризацией димера норборнена и
назван в честь конгресса конгрессаном (пентацикло[7,3,1,14’12,02'7,06'и]тет-
радекан):2(DМСГОА1С13(т. пл. 262 °С)
650ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯЕго строение было доказано измерением параметров молекулы в
Х-лучах и подтверждено другими физическими методами.Одним из интереснейших полиэдрических углеводородов является
так называемый бульвален, или трицикло[3,3,2,0]декатриен-2,7,9, полу¬
ченный в 1965 г. Шредером путем облучения ультрафиолетом нижепри¬
веденного углеводорода — димера циклооктатетраена. При этой фотохи¬
мической реакции от димера отщепляется бензол:Этот углеводород замечателен тем, что выше 100 °С он непрерывно
претерпевает перегруппировку Коупа (см. кн. II), которая в данном
случае изображается следующими формулами:При повышенной температуре (100°С) этот углеводород в резуль¬
тате такой непрерывной быстрой перегруппировки обнаруживает оди¬
наковость протонов по ЯМР-спектру, который имеет один четкий пик
при т = 5,8. Это означает, что все водородные атомы равноценны. Од¬
нако при — 25 °С эта перегруппировка уже исключается, водороды пере¬
стают быть эквивалентными и ЯМР-спектр усложняется.ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯ
ОРГАНИЧЕСКИХ МОЛЕКУЛ. II*УСТАНОВЛЕНИЕ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИИ
МЕТОДОМ ОСКОЛОЧНОЙ МАСС-СПЕКТРОМЕТРИЙЕсли молекулу органического соединения, находящегося в парооб¬
разном состоянии в условиях высокого вакуума (10-7—10~9 мм рт. ст.),
подвергнуть бомбардировке пучком электронов средних энергий (25—
70 электрон-вольт), то происходит элиминирование одного из валентных
электронов и возникает сильно возбужденный, положительно заряжен¬
ный молекулярный ион (М+). Как правило, электронная бомбардировка
выбивает один из электронов свободной (неподеленной) пары гетеро-
атома или один из я-электронов ароматической системы или кратной
связи. Молекулярный ион, будучи весьма лабильным вследствие вы¬
сокой степени возбуждения, претерпевает ряд последовательных распа¬
дов с образованием положительно заряженных ионов (фрагментов) и
нейтральных молекул или радикалов.Суммарный пучок ионов после ускорения в электростатическом поле
поступает в перпендикулярно направленное магнитное поле, в котором
ионы с различным отношением массы к заряду (т/е) дифференциро¬
ванно отклоняются от первоначального направления. Разделенный ион-И* Физические методы исследования строения органических молекул см. стр. 3.19.
IМАСС-СПЕКТРОМЕТРИЯ 551ный пучок попадает на коллектор* где после усиления регистрируется
осциллографически или при помощи самописца. В получаемом масс-
спектре исследуемого вещества каждый ион образует отдельный пик, ин¬
тенсивность которого соответствует величине т/е образующегося при
распаде иона.Пути распада молекулярного иона и последующие распады оско¬
лочных ионов определяются уже строением самой молекулы органиче¬
ского вещества, т. е. набором и последовательностью в нем атомов, групп
и связей. Характер масс-спектра достаточно точно отражает строение
молекулы и может служить для определения ее структуры. Распад (так
называемая фрагментация) включает в себя как гомолитические, так
и гетеролитические разрывы связей, хотя чаще наблюдаются первые. Та¬
ким образом, в отличие от других физико-химических методов исследо¬
вания органических веществ, масс-спектрометрический метод основан
на деструкции молекулы, точнее, возбужденного положительного иона,
возникающего из молекулы органического вещества под действием удара
электрона. Этим самым масс-спектрометрический метод близок к клас¬
сическим методам установления строения органических веществ путем
деструкции молекулы, но в данном случае весь ход деструкции регистри¬
руется сразу и для всего сложного распада нужно менее одного милли¬
грамма вещества.В целом распад ионов подчиняется обычным для органических ре¬
акций закономерностям. Например, преимущественно образуются энер¬
гетически более выгодные третичные карбкатионы, а не первичные или
вторичные (см. кн. II, раздел «Карбкатионы»), устойчивые аллильные
и бензильные группировки, ионы и радикалы, легко протекают процессы
дегидратации и декарбонили- }т
рования и т. д. 1Обычно при распаде моле¬
кулярного иона происходит
разрыв связей вблизи места
локализации положительного
заряда, что позволяет класси¬
фицировать происходящие раз¬
рывы следующим образом: раз¬
рыв связи у углеродного атома,
связанного с гетероатомом (т. е.
неуглеродным атомом) или
группой, на которой локализо¬
ван положительный заряд, на¬
зывается a-разрывом. Соответ¬
ственно разрывы следующихС—С-связей называются |3-, у~ и т. д. разрывами; чаще всего наблюда¬
ются a-разрывы. Разрывы связей без миграции отдельных атомов или
групп называются простыми разрывами, а сопровождающиеся мигра¬
цией— перегруппировочными разрывами.Если рассмотреть масс-спектр, например, н-масляного альдегида
(рис. 60), то в нем можно обнаружить ряд пиков, обусловленных иона¬
ми, возникающими в результате различных разрывов. Образование пика
иона (М — 1) * с т/е 71 и пика иона (М — 43) ”■ с т/е 29 обусловлено
простыми a-разрывами. В результате одного такого разрыва (а) эли¬
минируется атом водорода, а в результате другого (а') — алкил в виде
радикала *СзН7. Как видно из сравнения интенсивностей этих пиков,^ 80
1143(М-4з/
29J Ы-10 2030т/еАГ7257 (М-1)*
7/Ч40 50 ВО ТО 80Рис. 60. Масс-спектр масляного альдегида.
Образование пика иона (М — 1)+ с т/е 71 и
пика нона М+ с т/е 72.* (Af—1), (М — 43) и т. д. обозначают однозарядные ионы, на I и на 43 массо¬
вых числа более легкие, чем М —- молекулярный вес исходной молекулы,
552ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯпредпочтителен а'-разрыв с элиминированием более тяжелого радикала:М-43; т/е 28
г' -А 'СН3-^-СН2-)-СН2-)-С-)-Н\ I I °+<Г fi а’ се,У V— М-1; т/е 71Пики с т/е 57 и 43 соответственно обусловлены простыми р- и у-раз-
рывами. Однако самый интенсивный пик в спектре (принятый за'100%)
с т/е 44 обусловлен ионом, возникающим вследствие перегруппировоч-
ного p-разрыва с миграцией у-в°Д°Р0ДНС1Г0 атома. Разрыв протекает
через шестичленное переходное состояние:«Л _ hi . гн2сХХсн Н2с ХНсн2 сн2М+; т/е 72 т/е 44(Перемещение одного электрона при гемолитическом разрыве связи изображается
обычно изогнутой сплошной или пунктирной стрелкой.)В случае аминов и амидов аналогичные перегруппировки часто про¬
текают через четырехчленное переходное состояние (радикал элими¬
нируется в результате простого а-разрыва):9н2Тн сН2 +l*1-—-А >- || 4- NHn—СН2 + -СН3сн2—NH—СН2СН3 сн2В масс-спектрах непредельных полициклических соединений часто
встречаются пики фрагментов, образование которых обусловлено рас¬
падом, обратным диеновому синтезу (ретродиеновый распад). Примером
может служить распад, наблюдаемый в спектре транс- 10-метил-Д6-окта-
нона-2;Справедливость структур, приписываемых образующимся под дей¬
ствием электронного удара фрагментам, и их происхождение из той
или иной части молекулы подтверждают сравнением с масс-спектрами
модельных соединений с заведомо известной структурой и изучением
масс-спектров дейте;роаналогов. В отдельных случаях прибегают к метке
другими стабильными изотопами (180, 150) или к химической метке
(например, к введению СНз- или ОСНз-группы). Однако последнее воз¬
можно только в том случае, если нет опасения, что данная химическая
метка вызовет изменение всего пути фрагментации.Масс-спектрометрический метод уже сейчас очень широко приме¬
няется для установления строения органических соединений. Он быстро
МАСС-СПЕКТРОМЕТРИЯ553развивается, охватывая почти все классы органических веществ. Осо¬
бенно велико его значение при установлении строения сложных природ¬
ных веществ; здесь он дает возможность решать сложные задачи с ис¬
пользованием очень малого количества вещества (долей миллиграмма).
Метод находит также применение для количественного анализа смесей
(особенно углеводородных).Проиллюстрируем использование метода на нескольких примерах.1. Определение последовательности аминокислотных остат¬
ков в пептидах (Ледерер; М. М. Шемякин и Н. С. Вульфсон). Благодаря ши¬
рокому применению автоматических аминокислотных анализаторов определение амино¬
кислотного состава пептидов не представляет в настоящее время значительных
трудностей. Однако один из важнейших вопросов установления первичной структуры
белков и пептидов — определение последовательности аминокислотных остатков в цепи
продолжает оставаться весьма трудоемким и сложным. Недавно было установлено,
что при масс-спектрометрировании эфиров N-ацилированных олигопептидов * в каче¬
стве первого акта фрагментации молекулярного иона происходит элиминация алк-
оксильной группы и возникает линейный ион, у которого положительный заряд лока¬
лизован на С-конце, а N-конец защищен ацильным остатком. Дальнейший распад этого
иона заключается в последовательной элиминации аминокислотных остатков с пере¬
мещением положительного заряда вдоль цепи. Например, фрагментация метилового
эфира N-деканоилпролил-аланил-аланил-валина (рис. 61) может быть изображена
схемой:ОIIС9Н|9С—N-О О О ОII I II II-С—NH-CH—C-NH—СН—С—ОСН3-СН—С—NH—СН-оН2С\ /СН2сн2оСНзснаСННас/ ^СНз. . т/е 524ооCqHiqC—N-Н2С\ /СН2сн2СН—С—NH—СН—С—NH—СН—С—NH—СН—С=I IСНа СНзт’з^' ч^н3=о+СНн3с/ \:н.о о 1 оII II IIC9H19C—N СН—С—NH—СН—С— NH—СН—С==0+С8Нс0нН2С\ /С112сн2СНЯСНЯ, т/е 493т/е 394. т/е 323. т/е 252Н2С\ /СН2
СН2с9н19-с=о+ т!е 155Таким образом, .зная аминокислотный состав исследуемого олигопептида, на
основании анализа масс-спектра можно определять последовательность аминокислот¬
ных остатков в цепи, располагая всего 20—50 мкг вещества. При этом следует под¬
черкнуть, что особенно хорошие результаты получаются при вводе образца непосред¬
ственно в ионный источник и при работе на масс-спектрометрах высокого разрешения.* Полипептидов из малого числа аминокислотных звеньев.
LffоСэ-яЗЯ§?-0V 5
5-5(1 $
Z кооIE E
0-0I33zооК в”'
о-ооо<м I
Й X
о оч2/
0-0
CJ CJк воио>sf02иОь«о«>}£>*>5CsjCsj§§'Sis% 'чшоинутнашнп umwaumoomoРис. 61. Масс-спектр метилового эфира N-деканоилпролил-алаиил-алацнл-валнна (фрагментация приведена на стр. 553).
МАСС-СПЕКТРОМЕТРИЯ5552. Установление строения производных сахаров (Н. К- К о-
четкое, О. С. Чижов). Для того чтобы органическое вещество могло подвергаться
масс-спектрометрическому анализу, оно должно обладать хотя бы минимальной лету¬
честью, поэтому сахара переводят в метиловые эфиры или ацетаты. Молекулярный
ион моносахарида распадается сразу несколькими путями и дает несколько серий
характерных ионов; важнейшие ^Цути фрагментации метилового эфира глюкозы пред¬
ставлены на схеме:СНяОн“\осн, hZ~hсн3осн2осн..т/е.187сн3оН ОСН3
т/е 205СН3ОСН2сирсн3оНOCH, Н/С=ОСН3ГСН3ОСН2•CHOCHН ОСН3
т/е 176СНчОСН,,3 | 2 +/С=°\ /Н
н с-осн3сн3олг/еМЭМожно, кстати, отметить, что почти все распады идут по одному типу, включаю¬
щему (3-разрывы, и разнообразие путей фрагментации определяется обилием функцио¬
нальных групп в молекуле сахара.Из масс-спектра метилированного моносахарида вытекает, прежде всего, заклю¬
чение о числе углеродных атомов в углеродной цепи сахара, поскольку ион с макси¬
мальным массовым числом (М—31) образуется при отрыве гликозидноГо метоксиль-
ного радикала и имеет т/е, в случае гексозы равное 219. Это позволяет отнести сахар
к гексозам, нентозам, тетрозам и т. д.Далее, масс-спектр дает возможность непосредственно определить размер окис-
ного кольца в производном сахаре, так как для пиранозы и фуранозы получаются
разные характеристические пикн, например, при отрыве боковой цепи от цикла
({5-разрыв):сн3о-сн3(т/е 45)(т/е 205) СН30 N—■■ ОСН3н осн3сн3осн2(т/е 89) CH3O-CH(т/е1в1) НЕсли сахар содержит вместо гидроксильных групп другие функции и относится
к классу аминосахаров, дезоксисахаров и т. д., то прн помощи метода масс-спектро-
метрии можно определить место этого заместителя и, следовательно, строение сахара.
Так, например, при распаде метилового эфира N-ацетильного производного глюкоз-
амииа появляется ряд ионов (т/е 172, 168, 98), которые могут возникнуть только при
распаде сахара с N-ацетильной группой в положении 2.
556ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯМожно определить также структуру многочисленных лроизводных сахаров. Наи¬
большее значение имеет определение строения частично метилированных сахаров,
получаемых при установлении строения полисахаридов методом метилирования
(стр. 415). Для определения местоположения свободных гидроксильных групп ча¬
стично метилированный моносахарид подвергают действию йодистого дейтерометила
CD3I, в результате чего свободные гидроксильные группы замещаются на дейтеро-
метоксильные. Так, например, метилгликозиды 2,3,4-триметилглюкозы и 2,3,6-три-
ыетилглюкозы дают дейтерометильные производные Лий:сн2оно. нСНоО , 1н осн„снрсн3°\?КОСН, Ну]росн3Н ОСНпНиже приведены величины т/е некоторых пиков масс-спектров метилглюкозидов
6-дейтерометил-2,3,4-триметилглюкозы (Л), 4-дейтерометил-2,3,6-триметилглюкозы (В)
и 2,3,4,6-тетраметилглнжозы (С).А . ,, , 222205190176173162152В ,. 222208187179173162149С ,. . 219205187176173159149Как видно из этих данных, масс-спектры двух дейтерированных производных
различны и отличаются от масс-спектра недейтерированного тетраметильного произ¬
водного С, взятого для сравнения.Введение трех атомов дейтерия должно увеличить т/е соответствующего иона
на три единицы. Поэтому, зная структуру и происхождение соответствующего иона
(см. схему на стр. 555) и сравнивая значение т/е пика с величиной его в недейтериро-
ванном производном, мы можем легко определить, у какого углеродного атома вместо
метоксильной группы находится дейтерометоксильная, т. е. в каком месте исходного
частично метилированного сахара находился свободный гидроксил. Так, например,
ион с т/е 205 (см. ту же схему) для дейтерированного производного В увеличился
на 3 единицы, а для А остался неизменным. Ясно, что во вт'ором случае дейтеромет¬
оксильная группа отщепилась. Но мы знаем, что этот ион возникает с отщеплением
шестого углеродного атома и связанного с ним метоксила; следовательно, дейтериро-
ваниое производное А содержало дейтерометоксильную группу у Сб. Наоборот, ион
с т/е 187 сохранил свою величину в случае дейтерометильного производного В и уве¬
личился на 3 единицы для А. В то же время мы знаем, что ион с т/е 187 возникает
за счет отщепления метоксильной группы у С4. Следовательно, дейтерированное про¬
изводное В содержало дейтерометоксильную группу у четвертого углеродного атома.
Отсюда можно сделать вывод о местарс свободных гидроксилов в исходных частично
метилированных производных.Масс-спектрометрический анализ дает возможность решать и более сложные
задачи при исследовании углеводов. Так, например, удается на основании одного
только масс-спектра определять структуру дисахаридов, поскольку ряд пиков в масс-
спектрах дисахаридов с разным типом связи между моносахаридами различается.В самое последнее время удалось применить масс-спектрометриче¬
ский анализ для решения сложного вопроса — установления строения
олигосахаридов, для чего требуется менее 1 мг вещества. Обработкой
анилином олигосахарида в виде ацетата переводят его в анилид, кото¬
рый и подвергают масс-спектрометрическому изучению. Анилид, имею-
ЯДЕРНЫЙ МАГНИТНЫЙ Р.ЕЗОНАНС557щий ароматическую систему, при ударе электрона дает устойчивый мо¬
лекулярный ионкоторый далее испытывает распад с последовательным отщеплением мо-
нозных единиц с восстанавливающего конца цепи (серия R) или с не¬
восстанавливающего конца цепи (серия N). По величине т/е образую¬
щихся фрагментов можно установить последовательность монозных еди¬
ниц в олигосахаридной цепи. Образующиеся первичные фрагменты рас¬
падаются далее на более мелкие осколки, структура которых зависит от
типа гликозидной связи. Это позволяет определить не только последо¬
вательность монозных единиц в цепи, но и характер связи между ними,
отличая 1 ->6 связные звенья от 1 ->4 и т. п.Таким образом, употребляя только масс-спектрометрический метод,
можно практически установить полную структуру олигосахаридов.Ниже приведены величины т/е некоторых характерных 'пиков метилированных
изомерных глюкозилглюкоз, содержащих связи 1—>-6, 1->-4:Генциобиоза (1->6-связь) — 353 — —Целлобиоза (1->4-связь) 380 — 305 161Из этих данных видио, что мы можем на основании масс-спектров различать
между собой генциобиозу (I-j-6-связь), целлобиозу (1-*-4-связь) и т. д. Различия
в масс-спектрах являются следствием разных путей фрагментации дисахаридов за
счет распада восстанавливающей моносахаридной единицы, поскольку последняя за¬
мещена невосстанавливающим моносахаридом в разных положениях — у шестого,
четвертого и т. д. углеродных атомов.ЯДЕРНЫЙ МАГНИТНЫЙ РЕЗОНАНСС момента открытия явления ядерного магнитного резонанса
(ЯМР) прошло немногим более 20 лет. За этот относительно короткий’
период ЯМР стал одним из основных методов исследования органиче¬
ских молекул. ЯМР предоставляет значительно больше информации, чем
любой другой вид спектроскопии или масс-спектрометрия. При его по¬
мощи можно изучать строение молекул, их конформацию, распределе¬
ние электронной плотности, слабые межмолекулярные взаимодействия
(комплексообразование, сольватация, водородные связи), заторможен¬
ное внутреннее вращение, таутомерное равновесие, а иногда и кинетику
реакций. Ниже будут изложены лишь простейшие представления и при¬
меры применения метода.Метод. Многие атомные ядра обладают спиновым магнитным мо¬
ментом, связанным с циркуляцией атомного заряда вокруг оси ядра.
По значению спинового квантового числа / атомные ядра можно разде¬
лить на следующие группы:а) 1 — 0 (нет спинового момента) . 12С, 1еО. 28Siб) / = >/* 'Н, 3Н (ядро трития), 13С, 19F, 31Рв) / = 1 2Н (ядро дейтерия), HNг) / = 3/2 ПВ, 35С1> 37С1> Asд) Ядра с более высокими значениями /.
558ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯВ качестве примеров приведены только наиболее важные для орга¬
нической химии ядра.Ядра со спином / = 0 не имеют магнитного момента и не чувстви¬
тельны к методу ЯМР. Ядра со спином 7г наиболее удобны для иссле¬
дования методом ЯМР. Особенно большой чувствительностью к методу
обладают протоны и ядра 19F. Ядра со спинами, большими '/г, обладают
также электрическим квадрупольным моментом. Наличие квадруполь-
ного момента сильно усложняет наблюдение сигналов ЯМР, однако та¬
кие ядра могут быть изучены методом ядерного квадрупольного резо¬
нанса (ЯКР). Метод ЯКР имеет меньшее значение для органической
химии и здесь не рассматривается. Для исследования с помощью ЯМР
используются главным образом протоны, поскольку они присутствуют
почти в каждой органической молекуле, а также в связи с особой чув¬
ствительностью протонов к этому методу. В дальнейшем речь будет
идти почти исключительно о протонном магнитном резонансе (ПМР)„Если поместить ядро с магнитным моментом ц и спиновым кванто¬
вым числом I во внешнее магнитное поле Я о, то в соответствии с прин¬
ципами квантовой механики магнитный момент может занимать 2/ + 1
устойчивых ориентаций относительно направления Я0. Так, для протона
(I — Уг) возможны две ориентации магнитного момента — параллельно
направлению напряженности поля Я0 (по полю) т — -\-]/2 и антипарал¬
лельно ему (против поля) т = —1/2. Таким образом, протоны во внеш¬
нем магнитном поле располагаются на двух энергетических уровнях
с энергией Е\ = +|лЯ0 и £2 = —цЯ0. Ориентация магнитного момента
по полю более выгодна, разность уровней составляет:Энергетическая разность АЕ зависит только от напряженности маг¬
нитного поля Н0, и ее можно оценить, подставив в выражение (1) зна¬
чение ц протона ■ 1,42-10-23 и напряженность магнитного поля в эрсте¬
дах, например 10000 Э;'т. е. энергетическая разность очень мала. Тем не менее если бы не было
теплового движения, то все протоны находились бы на нижнем уровне.
Однако энергия теплового движения стремится привести «населенно¬
сти» уровней в соответствие с законом Больцмана;где N\ и N2 — количество молекул на соответствующих уровнях. При
приведенном значении Но это соотношение составляет при комнатной
температуре примерно 1,000007 (т. е. если на верхнем уровне находится
1000000 протонов, то на нижнем всего на 7 протонов больше). Раз¬
ность в населенности уровней ничтожна, однако она существует, и си¬
стема протонов, находящихся в магнитном поле, способна поглощать
небольшие кванты так, чтобы выполнялось условие:Это соответствует примерно метровым электромагнитным волнам.
Частоты резонанса для протонов составляют: в поле напряженностью
10 кГс (килогаус) — 42 МГц, 14 кГс —60 МГц, 24,5 кГс—100 МГц.
Важно отметить, что резонансные частоты для разных ядер (1Н, 19F, 31Р
и др.) резко отличаются друг от друга и никогда не происходит пере¬
крывания их спектров.ДЕ=2ц#о(1)Д£ = 2 • 1,42 • 10~м • Ю4 == 2,84 • 10~19 эргАЕAv — 2цЯ0(3)
ЯДЕРНЫй МАГНИТНЫЙ РЕЗОНАНС559>Итак, частота, при которой происходит поглощение, называется ре¬
зонансной, а само явление — ядерным магнитным резонансом. При по¬
степенном изменении частоты специально наложенного на образец элек¬
тромагнитного поля при некотором значении v начинается поглощение,
интенсивность которого зависит от концентрации протонов в образце.
При дальнейшем повышении частоты энергия квантов возрастает выше
необходимого значения и поглощение прекращается. Таким образом,
спектр ЯМР должен иметь форму узкого пика.Практически для получения спектра ЯМР поступают следующим
образом. В зазор между полюсами электромагнита (рис. 62), создаю¬
щего однородное постоянное поле вы¬
сокой напряженности, помещают ам¬
пулу с образцом. Ампула окружена ка¬
тушкой, в которую пропущен перемен¬
ный ток для создания радиочастотного
электромагнитного поля. Далее теоре¬
тически безразлично, будем ли мы
плавно изменять частоту этого электро¬
магнитного поля v, оставляя 'постоян¬
ной напряженность магнитного поля
Н0, либо, напротив, изменять Н0 при
постоянной v. Имеются приборы, осно¬
ванные нэ обоих принципах. Если изменяют напряженность магнит¬
ного поля Н0, то при некотором значении Н0 происходит поглощение
энергии образцом, причем сила тока в катушке падает. Это изменение
усиливается и передается на самописец или осциллограф.Обычно снимают спектры жидкостей или растворов, иногда газов.
В кристаллах магнитные* моменты ядер находятся под' воздействием
фиксированных в пространстве магнитных моментов соседних ядер, и
полосы поглощения получаются размытыми. В жидкостях влияние ядер
соседних молекул усредняется до нуля в результате быстрого хаотиче¬
ского движения. Разумеется, растворителями должны быть жидкости,
не дающие спектра ЯМР (СС14, CS2) либо поглощающие в другой об¬
ласти (CDC13).Приборы ЯМР характеризуются тремя основными параметрами:
рабочей частотой (40, 60 и 100 МГц), которая зависит от напряженно¬
сти поля Н0 в магните, чувствительностью и разрешающей способностью.
Более чувствительный прибор дает более интенсивные сигналы при той
же концентрации протонов в образце. Современные приборы позволяют
различать две линии, которые отстоят друг от друга всего на 0,2—0,5 Гц.
Разрешающей способностью называется отношение этого минимального
расстояния (когда линии еще можно различать как раздельные) к ра¬
бочей частоте прибора в герцах. Разрешающая способность лучших при¬
боров с рабочей частотой 100 МГц составляет:С уширением линий разрешение спектра, естественно, ухудшается.
Разрешение спектра зависит от разрешающей способности прибора, ско¬
рости развертки спектра и от свойств образца (например, от вязкости
раствора).Химический сдвиг. На основании изложенного может пока¬
заться, что ядро одного и того же изотопа, например протон, всегда
дает один и тот же пик в спектре ЯМР. Ведь в уравнении hv = 2|аЯ
Л и (а постоянные, a v и Я постоянные при достижении резонанса.
Однако атомные ядра в молекулах окружены электронами, которыеА — ампула с образцом; М — магнит,■ Г —
генератор; У —усилитель; О —осцилло¬
граф; С —самописец.
560ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯэкранируют их от действия поля Н0. Поэтому на каждый протон фак¬
тически действует не поле Н0, а несколько меньшее поле ЯЭфф:Я,эфф= #0 — оН0 = (1 — а) Н0(4)Коэффициент а называют константой экранирования данного про¬
тона в данной молекуле. Значения о для протонов очень невелики (по¬
рядка 10~6 и несколько больше для других ядер). Постоянная экрани¬
рования неодинакова для протонов, находящихся в разном окружении,
-и определяется прежде всего плотностью окружающего их электронного
облака. Электроноакцепторные груп¬
пы и атомы по соседству с протоном
уменьшают плотность электронного
облака и константу экранирования,
и поэтому резонанс наступает при
меньшей напряженности поля Н0.К таким группам относятся N02, F,Cl, CN, OR, COOR и др. Обратное
действие оказывают электронодо-
норные группы.На рис. 63 приведен спектр ук¬
сусной кислоты. Он состоит из двухон<?г-12,0г,о11,01,010,0
0,0 <Рис. 63. Спектр ЯМР (ПМР) уксусной кислоты при частоте генератора
40 МГц (приведены шкала 6 и шкала т).сигналов в соответствии с двумя типами атомов водорода в молекуле.
Сигнал в более слабом поле относится к атому водорода карбоксильной
группы. Расстояние между сигналами, которое можно измерить в еди«
ницах частоты или напряженности поля, называется химическим сдви¬
гом. Экранирование аН0 пропорционально напряженности поля Н0, по¬
этому значения химических сдвигов, выраженные в единицах частоты
или напряженности, также будут зависеть от Н0. Для удобства сравне¬
ния данных, полученных на приборах с различной рабочей частотой, хи¬
мические сдвиги выражают в долях поля или частоты, умножая это
отношение на 106. Тогда химический сдвиг между двумя протонами А
и В равен:Н л Но — VoвАв=10б —- = — — • 10е (51АИ ff0 v0где va и vb — значения резонансных частот для протонов А и В, a v0 —
рабочая частота прибора.Химический сдвиг бдв уже не зависит от Н0 и измеряется в безраз¬
мерных единицах — миллионных дрлях (м. д. в русской и р. р. т. в ан¬
глийской литературе).Если смешать ряд соединений, каждое из которых имеет протоны
только одного сорта, то спектр этой смеси будет содержать столько
узких одиночных линий, сколько веществ в смеси. На рис. 64 приведен
спектр смеси тетраметилсилана, циклогексана, ацетона, 1,1,1-трихлор-
этана, диоксана, хлористого метилена и хлороформа. Легко видеть, что
ЯДЕРНЫй МАГНИТНЫЙ РЕЗОНАНС561химические сдвиги хорошо согласуются с представлением об электроно-
акцепторности атомов и групп, с которыми связан протон. Удобно от¬
считывать величину химического сдвига от сигнала одного стандартного
соединения. Чаще всего в качестве стандарта используется тетраметил-
силан (ТМС), который в небольшом количестве добавляют в ампулу
с образцом. Его узкая интенсивная линия находится в более сильном
поле по сравнению с сигналами большинства атомов водорода в других
соединениях, кроме того, ТМС химически инертен.Рис. 64. Спектр ЯМР смеси веществ.в настоящее время существуют две шкалы для измерения химиче¬
ских сдвигов — шкала дельта (б) и шкала тау (т). В обеих шкалах от¬
счет производится в м. д. и стандартом служит ТМС. Однако в шкале б
сигнал ТМС принят за 0, а в шкале т за 10 м. д., т. е.Площадь под кривой пика в спектре ЯМР пропорциональна числу
ядер данного типа в образце. Например, в уксусной кислоте (см. рис. 63)
отношение площадей (которое можно определить графически или с по¬
мощью электронного интегратора) составляет 3:1. Благодаря этому
спектры ЯМР можно применять для количественного анализа смесей.
Так, на рис. 64 интенсивности всех сигналов одинаковы, поэтому кон¬
центрации компонентов смеси обратно пропорциональны числу одно¬
типных протонов, содержащихся в их молекулах, а именно:Итак, протон каждого сорта должен иметь свой собственный хими¬
ческий сдвиг. На очень большом числе примеров было показано, что
протоны изоструктурных фрагментов разных молекул дают резонансные
сигналы в постоянной узкой области спектра. Это позволяет использо¬
вать данные ЯМР для суждения о строении молекул. Большую помощь
при расшифровке спектров оказывает определение интенсивности линий
и анализ тонкой структуры линий, обусловленной спин-спиновым взаи¬
модействием.В табл. 54 приведены примерные значения химических сдвигов про¬
тонов, стоящих у атомов углерода в различном окружении. Видно, что,^тмс ~"х
^тмс• 10s• 106т = 10 — 6[С6Н12]: [С3Н60] : [СН3СС13] : [С4Н802]: [СН2С12]: [СНС13] = 2 : 4 : 8 : 3 : 12 : 2419 Зак. £82
562/IФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯво-первых, экранирование возрастает при переходе от метановой к ме¬
тиленовой и метильной группам (сравнить данные различных колонок
в одних и тех же горизонтальных графах); это соответствует уменьше¬
нию химического сдвига в шкале 5. Во-вторых, значения химических
сдвигов существенно зависят от заместителей. Это можно проследить
на примере альдегидной группы в ароматических соединениях. С умень¬
шением электроноакцепторности заместителя в пара-положении бенз-
альдегида сигнал протона группы СНО смещается- в область более
сильных полей.Таблица 51. Химические сдвиги протонов в шкале 8 (в скобках —в шкале т)1. Протоны групп СН3, СН2 и СН,2. Протонысвязанных сразличнымиальдегидной группыгруппами Y«-CsH4(CHO)210,08 (—0,08)С6Н6СНО9,965 (0,035)УCHSYRCH2Yr2chy«-С1С6Н4СНО9,933 (0,67)«-СН3С6Н4СНО9,98 (0,02)R (алкил)0,90(9,10)1,25(8,75)1,50(8,50)СН3СНО9,72 (0,28)сн2=сн1,70(8,30)1,90(8,10)' —COOR2,00 (8,00)2,10(7,90)—3. П р о.т о н ынекотарыхCN2,00(8,00)——ароматическихСООН2,07(7,93)2,34 (7,66)—соединенийСНО2,17(7,83)2,20(7,80)—Пиридин (-2)8,50(1,50)nr22,15(7,85)2,50 (7,50)2,87(7,13)п-С6Н4 (СНО),7,54 (2,46)I2,15(7,85)3,15(6,85)4,20 (5,80)Бензол7,27(2,73)С6Н62,34(7,66)2,62(7,38)2,87 (7,13)Т.олуол7,10(2,90)С13,05 (6,9,5)3,40 (6,60)4,00(6,00)«-Крезол6,75(3,23)OR3,30(6,70)3,35 (6,65)3,80(6,20)Пиррол (-3)6,09(3,91)ОН3,38 (6,62)3,56 (6,44)3,85(6,15)OCOR3,65 (6,35)4,15(5,85)5,01 (4,99)ОС6Н53,70 (6,30)3,90(6,10)—ОСОС0Н53,90(6,10)4,23 (5,77)5,12(4,88)Спи н-спиновое взаимодействие. Спектры редко имеют
такой простой вид, как приведенный спектр уксусной кислоты. В ре¬
зультате взаимодействия между близко расположенными протонами од¬
ной молекулы появляется тонкая структура спектра. Ниже (рис. 65)
приведен спектр этилбензола при разном разрешении. При более высо¬
ком разрешении полоса, отвечающая метиленовым протонам, расщеп¬
ляется на четыре линии (квадруплет), а полоса метальных протонов—■
на три (триплет). Спин-спиновое взаимодействие состоит в том, что маг¬
нитный момент соседнего протона (или другого ядра, обладающего маг¬
нитным моментом) вносит некоторую поправку в эффективное магнитное
поле Яафф, в котором находится рассматриваемый протон или группа
эквивалентных протонов. Рассмотрим молекулу с двумя различными
взаимодействующими протонами А и В. Во внешнем магнитном поле
протон А может занимать только две ориентации: по полю (спин +7г)
и против поля (—Чг)- Тогда на протон В будет действовать в одном
случае поле Я0фф — а, в другом ЯЭфф + а, где а —поправка, вносимая
магнитным моментом ядра А. Поскольку в образце практически одина¬
ковое количество протонов А с обеими ориентациями, то появятся две
линии равной интенсивности (дублет); Так же расщепится и сигнал
протона А на ядре В. Рассмотрим теперь более сложный случай, а
именно спектр этильной группы этилбензола, протоны которой не взаи¬
модействуют с протонами кольца. Итак, кроме эффективного магнитного
поля протоны метильной группы находятся под суммарным воздействием
ЯДЕРНЫИ МАГНИТНЫЙ РЕЗОНАНС5631протонов метиленовой группы. Суммарный спин метиленовой группы
может принять три значения:+ V2 + '/2 = +l + 7*-7*=“0 — '/2 + V2 — 0 — Va — V* =• — IВ соответствии с этим сигнал протонов метила должен расщепиться
на три линии, причем средняя должна быть вдвое интенсивней двух дру¬
гих (см. рис. 65), поскольку суммарный нулевой спин вдвое более ве¬
роятен. Аналогичное рассмотрение спиновых состояний протонов ме¬
тальной группы приводит к выводу о том, что сигнал метиленовой груп¬
пы должен представлять собой квадруплет с относительными интенсив¬
ностями линий 1: 3:3:1, что и наблю¬
дается *.Вообще говоря, если протон или
группа эквивалентных протонов нахо¬
дится в спин-спиновом взаимодействии
с п эквивалентными протонами, то ее
сигнал состоит из п + 1 линий. Расстоя¬
ния между ближайшими линиями муль-
типлета строго одинаковы. Эта величина
измеряется в герцах и носит название
константы спин-спинозого взаимодей¬
ствия /. Важно отметить, что / одина¬
кова в обоих мультиплетах двух групп
взаимодействующих ядер (/ одна и та
же в триплете и в квадруплете этил-
бензола). Мультиплет всегда симметри¬
чен относительно центра, от которого н
отмеряются химические сдвиги.Необходимо помнить, что спин-спи-
новое расщепление наблюдается толькомежду магнитно-неэквивалентными ядрами, они же и химически не¬
равноценны. Например, всегда имеется такое взаимодействие между
протонами и ядрами 19F или 31Р (у всех этих ядер спин '/г) - Между про¬
тонами в CH2CI2, OCH2CH2CI, циклобутане, С1СН = СНС1 нет спин-
спинового взаимодействия. Оно появляется в следующих случаях, на¬
пример:jUиРис. 65. Спектры ЯМР этилоен-
зола:/— при частоте -генератора 40 МГц и
разрешении 10~а; // — при той же ча¬
стоте и разрешении 10~s.ClC1CH,CH,CN\/CNН.Н/С С\RС --- СНн/С1В первых двух веществах протоны при соседних атомах углерода
неэквивалентны из-за того, что к этим атомам углерода присоединены
различные группы. В последнем примере отсутствие эквивалентности
объясняется их геометрически разным положением по отношению к за¬
местителям у соседнего атома углерода.Спин-спиновое взаимодействие передается посредством электронов
химических связей, и поэтому величина / зависит от числа связей, раз¬
деляющих взаимодействующие ядра, и от характера этих связей. Ска¬
жем, в ряду FHCC12, HCCI2CCI2F, HCCI2CCI2CCI2F спин-спиновое вза¬
имодействие уменьшается, и в последнем случае величина /НР прене¬
брежимо мала. Через тройные связи спин-спиновое взаимодействие
передается эффективнее, чем через двойные, а через двойные сильнее,* Распределение спинов протонов метила + 7-> + ’Д, + 7-> = + 1’А/, + 7- + 7-> 7,=== 7а; + 73 -Г 7s + 7 а = + 7а; - 7а + 7а + '/а = + J/a; 7а'~ 7а + f/a = ~ 7а=7а"+
+ Va — !/а = — 7а! + 7а — '/а — 7а = — Ч-/, — 7а — 7а — 7а = — 11/о- Таким образом,
значения суммарного спинового момента, равные + 7а и — 7а> втрое более вероят¬
ны, чем значения -f- Р/а и — 11/г.19*
564ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯчем через простые; при двойной связи транс-протоны имеют боль¬
шую /, чем ^ис-протоны. Аксиально-аксиальное спин-спиновое взаимо¬
действие больше аксиально-экваториального и экваториально-эквато¬
риального. Характерные значения J приведены в табл. 55.Таблица 55. Характеристические значения констант спин-спинового взаимодействия
для некоторых соединений(а — аксиальный, е — экваториальный)ФрагментГдФрагмент/. Гд1аа9—131ае2-4J ее2,7—4^ АВ7—10^АС2—3^AD<1,5^АВ7,5—8^АС1,4—21ВС5,2—5,5^CD0,9Jab3—4*«■4>О0,6—1*«■4дао1,8—2\Г/Нд/ХНВ\ /НА
с=сHr/ \^СНд-CHj/
^0=0^\нв\ /Нв/с=с\НА Х\ /СНв(
7 чнА^с=с7сн./NНд7\/\/'\/с=снА—снв=сн./Нв-с|\ORснА—с=с—нв12-150,35—22—9 .
6—1411—184-100,5-210—131—32—3НгА,HtN НсНгн,■с ОВ отличие от химического сдвига (выраженного в герцах), вели¬
чина константы спин-спинового взаимодействия не зависит от напряжен¬
ности внешнего магнитного поля Я0, поэтому, проводя измерения в
разных полях, легко определить, связаны ли те или иные линии со
спин-спиновым взаимодействием или представляют собой самостоя¬
тельные сигналы.Спин-спиновое расщепление дает чрезвычайно ценную информацию
о строении молекулы, но, с другой стороны, сильно осложняет общую
картину спектра. В сложных спектрах ЯМР иногда оказывается необ¬
ходимым избавиться от спин-спинового взаимодействия на том или ином
участке спектра, чтобы упростить спектр. В современных приборах это
можно сделать с помощью метода «двойного резонанса».
ЯДЕРНЫИ МАГНИТНЫЙ РЕЗОНАНС565К сожалению, спектры легко расшифровываются только в тех слу¬
чаях, когда константа спин-спинового расщепления / значительно (в не¬
сколько раз) меньше, чем химические сдвиги между взаимодействую¬
щими ядрами. Такие спектры называются спектрами первого порядка.
Если же эти величины близки, то часто спектры усложняются настолько,
что их' анализ возможен только с применением электронных вычисли¬
тельных машин. Иногда удается свести сложный спектр к спектру пер¬
вого порядка, исследуя тот же образец на приборе с более высокой ра¬
бочей частотой. Замена одного или нескольких протонов на дейтерий
приводит к сильному упрощению спектра. Спектры различных изотопов
никогда не перекрываются, поэтому сигналы протонов, подвергшихся за¬
мещению, исчезают. Константа спин-спипового взаимодействия / про¬
тона с ядром дейтерия в семь раз меньше, чем между двумя протонами
в тех же положениях, поэтому обычно исчезает и мультйплетная струк¬
тура. Интересно, что анализ спектра ЯМР частично дейтерированного
соединения может указать положение дейтерия в молекуле, а часто и
процент дейтерирования.Примеры применения спектров протонного магнитного резонанса.Пример 1. Отщеплением хлористого водорода от (СРзЬСН—CFC1—CH2CF3
получено соединение, которому можно приписать одну из следующих формул:(CF3)2C=CFCH2CF3 (CF3)2CHCF=CHCF3а вI IIСпектр протонного магнитного резонанса (рнс. 66) показывает, что справедлива
формула II. Напомним, что ядра F имеют спин ’/г, но их сигналы в спектре ЯМРТИСРис. 66. Спектр ЯМР (ПМР) соединения (CF3)2CH-CF=CH-CF3
при частоте генератора 40 МГц.лежат совсем в другой области, чем сигналы протонов. Спин-спиновое взаимодействие
между *Н и 10F такого же порядна, как и между протонами. Формула I отпадает
потому, что тогда спектр должен содержать дна эквивалентных протона и, следова¬
тельно, им должен отвечать один мультиплет (из восьми линий). В действительности
имеется два мультиплета. В мультиплете протона В должно быть восемь линий (рас¬
щепление сигнала на трех ядрах фтора СРз-группы и па ядре фтора —CF-группы ка¬
ждого из этих сигналов). В мультиплете протона А должно быть 14 линий, но не все
видны на спектре в связи с тем, что крайние линии мультиплета малоиптепсивны.Пример 2. При алкилировании нитрила I йодистым метилом (после обработки
соединения I натрием в жидком аммиаке) ожидали получить нитрил II;н r/?VCNrirtC I CL NaNHoI О ! H VH2CXI/CH2CHI/CH_ CN
HoC С2I о IH2CX|^CH2CHch3iCHH,C/"c;„CNH2c.I О I CH,,.СП,CHIIОднако в результате реакции было получено соединение состава CJI^NO,
спектр протонного резонанса которого приведен на рис. 67. Интенсивные сииглеты
принадлежат, безусловно, двум различным метальным группам. Об этом можно судить
566———-— гФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯпо интенсивности сигналов и химическим сдвигам. В слабых полях должен лежать
сигнал более дезэкраиированных протонов, т. е. метила, связанного с электроотрица¬
тельным атомом — киелюродом. Отсюда ясно, что произошло двойное метилирование
исходного соединения с разрывом мостиковой связи; это согласуется и с формулой
C9H13NO. На основании химического сдвига, а также по относительной интенсив¬
ности сигнала можно утверждать, что мультиплет при 6 = 5,6 м. д. отвечает протонам
при двойной связи (сигналы таких протонов лежат всегда в более слабых полях, чем
протонов при насыщенных атомах углерода). Для дальнейшей расшифровки этой ча¬
сти спектра нужны дополнительные пояснения. Если бы взаимодействовали толькон, н„Н3Сн.CN-SH■Н/Х\4/\ОСН3
СН2 . 301-сн—-ОСНз"СН2—_сн2-СН3—С—CNРис. 67. Спектр ПМР нитрила 1-метил-3-метоксициклогексен-5-карбоновой
кислоты (III) при частоте генератора 100 МГц (10%-ный раствор в СС14).два протона и разность химических сдвигов была бы значительно больше, чем J, ,то
спектр представлял бы два раздельных дублета, причем интенсивность всех четырех
линий была бы одинакова (спектр типа АХ). Если же Дб и J были бы одного поряд¬
ка, то внешние компоненты спектра были бы менее интенсивны, чем внутренние
(спектр типа АВ). Полученный спектр отличается от последнего только тем, что ка¬
ждая его линия расщеплена еще на три. Это означает, что оба протона, находящиеся
при двойной связи, вступают в спин-спиновое взаимодействие с двумя эквивалент¬
ными протонами (СНа-группы) и больше ни с какими. На основании сказанного можно
предложить только две структурные формулы полученного соединения — III или IV;IIIH\/нH c =
\ /
XC\ /СН3xIVjj/ \H c-/ CNСНзО/4H H^ \нННн\/нс==N/\С/СН:1 с / \CNн/ ^Н н/ ^ОСНзВыбор между этими структурами был сделан на основании мультиплета метило¬
вого протона (3,45 м. д.). В структуре IV сигнал этого протона должен содержать
три линии (если протоны соседней метиленовой группы эквивалентны) или максимум
четыре (если они неэквивалентны из-за разного положения по отношению к группе
ОСНз), следовательно, формула IV отпадает. Механизм образования III можно пред¬
ставить следующим образом:.CNNaNH2'CN.CNCH3I.CNO-CH3-нCNOCHqСН.Л<7OCH3■CH3CN
ЯДЕРНЫИ МАГНИТНЫЙ РЕЗОНАНС567Пример 3. Распределение электронной плотности в нитрозаминах должно
быть каким-то средним между двумя крайними формулами:СН,СНз?/N—N=0N=N—СГR'Вследствие частичного удвоения связи N-—N возможно существование устойчи¬
вых конформаций типа син- и анти-:нзС. ^О-
>N—N*'i Rн3с>N-N4
R xO—При помощи спектров ЯМР было показано, что это действительно так, и было
установлено соотношение конформаций в зависимости от объема заместителя R.IIтмс-4-о/N
IIN
/+\Н,С CH.,ОN+Nн3с/+хсн2сн3°чNIINн3с/+чсн2сн3IIIIVтмстмс_4-' /°NII
N/-t\ /
н3с с н(сн3.+оNIIN.н.(сc(ai3)3о\NIIN/ +\ /II С СН(СН,3/2Рис. 68. Спектры ПМР иитрозаминов при частоте генератора GO МГц:1 — диметил нитроз амин; // —■ метилзти.-ши i родамин; ill — ми гилизонроцилиитрозамин;
JV — метил-грег-бутилиитрозамин.Сняты спектры четырех нитрозаминов, в ряду которых объем R постепенно воз¬
растает [СНз, СН2СНз, СЩСНзЬ и С(СНз)з].В случае ди’метилннтрозамина в спектре ГШР (рис. 68, /) наблюдаются два
острых пика одинаковой интенсивности. Эго означает, что метилы неэквивалентны
(очевидно, вследствие затрудненного вращения около N—N-связи).В спектре метил-'г/огг-бутилнитрозампна (cm'Kip IV) именпсн также два пика:
интенсивный (протоны третичной бутильпон группы) и менее интенсивный (протоны
одиночной метилыюй группы). Более обы-мисчая трст-бутильпан группа должна нахо¬
диться в аятм-положеннн по отношению к кислороду. Из-за пространственных затруд¬
нений вторая возможная конформация невыгодна и в спектре ПМР не наблюдается.Из двух других спектров следует, что в случае шпрочамнноп, где R — —С2Н5
(спектр 11) и — СИ (СНз)2 (спектр 111), соединения представлены смесью двух неравно¬
ценных конформаций. Соотношение площадей пиков а и 6 в каждом из этих спектров
равно соотношению количества молекул в каждой конформации (это сигналы протонов
метила в разных конформациях). Чем больше объем заместителя R, тем меньше доля
568ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯтой конформации, в которой этот заместитель находится в син-положении по отноше¬
нию к кислороду. Об этом можно судить и по сравнительной интенсивности сигналов
протонов этильной и изопропильной групп в разных конформациях.Пример 4. Изучение конверсии циклогексана (рис. 69). Молекула циклогексана
имеет устойчивую конформацию кресла. В соответствии с этим в молекуле должнысуществовать протоны двух типов — аксиаль¬
ные и экваториальные. Однако при комнатной
температуре в спектре ПМР содержится толь¬
ко один острый синглет. Это связано с очень
быстрой конверсией цикла из одной кресло¬
видной конформации в другую, так что акси¬
альные и экваториальные протоны все время
меняются местами. При пониженных темпера¬
турах (раствор циклогексана в сероуглероде)
начиная с —30° С сигнал уширяется и при
—100° С уже ясно видны два сигнала и их
тонкая структура, обусловленная спин-спино-
вым взаимодействием. Изучая температурные
fyb зависимости подобных переходов, можно вы¬числить энергетические барьеры таких конфор-
мационных превращений.ОПТИЧЕСКАЯ СПЕКТРОСКОПИЯ
В ОРГАНИЧЕСКОЙ ХИМИИВ основе всех спектроскопических
методов лежит измерение зависимо¬
сти интенсивности поглощения, испу¬
скания или рассеяния света веще¬
ством от частоты света (или длины
волны). В оптической спектроскопии
используются спектры поглощения в
инфракрасной, видимой или ультра¬
фиолетовой областях в интервале длин
волн от 10*1 до 10_в см-1, а также
спектры комбинационного рассеянияРис. 69. Спектры ПМР циклогексана Света И спектры люминесценции (ме-
при частоте генератора 100' МГц и нее ВАЖНЫЙ И ООЩИИ метод спек-
температурах +20 °С (/); —30 °С (II); тров люминесценции здесь не рас-
—100 °С (III). ' сматривается). На рис. 70 приведенаклассификация спектров в зависимо¬
сти от длины волны (или частоты). Разделение оптического спектра на
эти участки связано- с возможностями приборов, а также с природой
поглощения света в разных областях. Для химиков-органиков наи¬
большее значение имеют: ближняя ультрафиолетовая и видимая (от 220
до 800 нм*), фундаментальная инфракрасная (от 5000 до 200 см-1).Принцип измерения оптических спектров очень прост. Через слой
вещества (чаще в растворе) пропускают пучок монохроматического
света, длина волны которого постепенно меняется с помощью специаль¬
ного прибора, так называемого монохроматора.Интенсивность прошедшего света / измеряется и передается на са¬
мописец, который записывает ее в виде графика (спектра), где на оси
ординат отложено значение /, а на оси абсцисс — длина волны или ча¬
стота.Описанная схема измерения характерна для так называемых одно¬
лучевых приборов. Современные спектрофотометры действуют по схеме
двухлучевого измерения, которая состоит в следующем. Приемник из¬
лучения и регистрирующее устройство фиксируют интенсивность не
только прошедшего через вещество света I, но и интенсивность падаю¬* нм — нонаметр = 10 А = 10~7 см; то же самое, что миллимикрон (ммк).
ОПТИЧЕСКАЯ СПЕКТРОСКОПИЯ569щего света h. Сигнал записывается либо в виде разности /0 — /, либо
в виде отношения /о//; при этом принимают меры, чтобы оба измеряе¬
мых пучка света — падающего и проходящего — были оптически экви¬
валентны. При измерении спектров поглощения растворов один из из¬
меряемых пучков света (/о) проходит сквозь кювету с растворителем,
а другой (/) сквозь кювету с раствором испытуемого вещества.10 500 10005-IOJДлинно¬волноваяИКФундамен¬тальнаяИКБлижняяИК5-Ю510яБлижняяУФВакуумная(далекая)УФСМ800 400 220200 ммкВращательные Колебательные Электронные 'спектры спектры спектрыРис. 70. Области оптического спектра.При работе в ультрафиолеторой области спектра применяется квар¬
цевая, а в инфракрасной — солевая оптика (призмы из NaCl, LiF и
КВг, в зависимости от длины волны); источниками света обычно слу¬
жат лампы или (в ИК-области) накаливаемые стержни из определен¬
ных материалов.Основополагающими законами спектрофотометрии являются законы
Ламберта и Бера.Закон Ламберта. Относительное количество поглощенного света не
зависит от интенсивности падающего света, и каждый последующий слой
всегда поглощает одну и ту же долю проходящего света. Эту законо¬
мерность записывают в видеIn -у- = аI или I —
а в переводе на десятичные логарифмыig-j =klгде I — толщина слоя, k — коэффициент, зависящий только от погло¬
щающей среды.В законе Ламберта не учитываются концентрации.Закон Бера. Поглощение света пропорционально числу молекул по¬
глощающего вещества на его пути:/ = /0 • lo-Eci /) = 1БА = £С/где Е — молярный коэффициент поглощения (погашения); с — моляр¬
ная концентрация вещества; D — оптическая плотность.Надо сказать, что закон Бера соблюдается не всегда. Отклонения
связаны с различной степенью ассоциации, сольватации и диссоциации
молекул в растворах разной концентрации. Поэтому при измерении
спектров поглощения в растворах разной концентрации необходимо про¬
верять соблюдение этого закона (например, увеличение концентрации
вдвое должно быть эквивалентно удвоению толщины пропускающего
слоя при той же концентрации).
570ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯПоглощение света может фиксироваться на графиках в виде раз¬
личных величин: пропускание света;'04-100 — процент пропускания света;'0/о и --т~~ ЮО ~ доля, поглощенного света и процент погло-
10 *0щения;D — \g—j оптическая плотность;£ = -^—молярный коэффициент поглощения, т. е. оптическаяплотность 1М раствора при толщине слоя 1 см.В УФ-спектрах по оси ординат откладывается обычно молярный
коэффициент поглощения Е или 1 gE, а по оси абсцисс — длина волныРис. 71. УФ-Спектры в спиртовом рас- Рис. 72. ИК-Спектр бензальацетофенона.творе:Л —кофеина; Б — кротонового альдегида.в миллимикронах (ммк) или ангстремах (А). При записи ИК-спектров
по оси ординат откладывают процент поглощения или процент пропу¬
скания, а по оси абсцисс —частоты в обратных сантиметрах (см-1) или,
реже, длины волн в микронах (мк). Примеры спектров приведены на
рис. 71 и 72.Физическая сущность спектров поглощения и ком¬
бинационного рассеяния света. Поглощая свет, молекула
«возбуждается» и переходит из основного состояния в одно из возбу¬
жденных состояний с большим содержанием энергии:hv — Ex — Е0где Е0 и Ei — энергия основного и возбужденного состояний.Эту избыточную энергию молекула отдает впоследствии в виде
тепла или излучения; сейчас это для нас, однако, несущественно.При поглощении энергии в пределах оптического спектра может из¬
меняться вращательная, колебательная энергия молекулы или энергия
возбуждения внешних, валентных электронов (для возбуждения вну¬
тренних электронов-требуется более жесткое излучение). Для повыше¬
ния вращательной энергии молекулы достаточны относительно неболь¬
шие кванты энергии, поэтому соответствующее поглощение лежит в да¬
лекой ИК-области — области больших длин волн (мы не будем более
возвращаться к вращательным спектрам, так как они редко приме¬
няются в органической химии). Для увеличения колебательной энергии
молекулы (т, е. для возбуждения колебаний атомов относительно друг.
ОПТИЧЕСКАЯ СПЕКТРОСКОПИЯ571Grпоглощение лежит вП-е3:
ь-Uпридруга) требуются кванты большей величины
близкой ИК-области.Большие кванты энергии требуются для возбуждения внешних элек¬
тронов молекулы (поглощение в видимой и УФ-областях). При этом
кванты, необходимые для изменения электронной энергии, примерно на
один-два порядка больше, чем тре¬
буемые для изменения колебатель¬
ной энергии. Поэтому при облуче¬
нии ультрафиолетовым светом ме¬
няются все три вида энергии моле¬
кулы; поглощение же в длинновол¬
новой ИК-области сопровождается
изменением только вращательной
энергии.Изменение энергии молекулы
при поглощении (энергетические пе¬
реходы) представлено на рис. 73,
где изображены электронные и ко¬
лебательные уровни (каждому ко¬
лебательному уровню сопутствует
также ряд вращательных уровнен,
что на схеме не отражено). Макси¬
мумы в спектрах поглощения соот¬
ветствуют наиболее вероятным пе¬
реходам между энергетическими
уровнями молекул. Каждый макси¬
мум относится к определенному ви¬
ду электронного или колебатель¬
ного возбуждения молекулы.На основании приведенных рас-
суждений и рис. 73 можно заклю¬
чить, что электронные спектры должны быть наиболее сложными, так
как в них одновременно должна проявляться топкая структура спектра:
колебательная и вращательная. Однако колебательная структура элек¬
тронного спектра наблюдается только в газовой фазе и редко в раство¬
рах (рис. 74). Это же можно сказать о враща¬
тельной структуре колебательного спектра.Итак, спектры поглощения тесно связаны со
строением молекулы: колебательные — с колеба¬
ниями атомов молекулы около равновесных по¬
ложений, а ультрафиолетовые и в видимой об¬
ласти— с возбуждением валентных электронов
в молекуле. При этом каждый максимум по¬
глощения соответствует определенному виду
электронного или колебательного возбуждения
молекулы. Некоторые максимумы настолько
характерны для отдельных групп атомов или
связей, что положение этих максимумов мало
меняется при переходе от одной молекулы к
другой. Такими являются, например, валентные
колебания связи С = 0 (ИК-область, около 1700 см-1), связи C = N
( — 2250 см-1), связи О—Н (3550—3650 см-1) и др. Они называются ха¬
рактеристическими и позволяют определить наличие или отсутствие в
молекуле тех или иных групп атомов или связей.Спектры комбинационного рассеяния света (СКР), или раман-
спсктры, также являются колебательными спектрами. Для их изученияРис. 73. Возбуждение молекулы
поглощении кванта света:1:о~~основное электронное состояние; О, F —
возбужденные электронные состояния; Е\—Е^~
возбужденные колебательные состияння ос¬
новного электронного состояния. Как видно:
£„ — £л</?п — Eq. Схема условна: расстоянияравны.jn-rи т. д. отнюдь неММКРис. 74. УФ-Спектр ук¬
сусного альдегида в га¬
зовой фазе (/) и спирто¬
вом растворе {II). На
спектре / видна топкая
структура.
Ь59внтастоксоВы линии217Ь59Рис. 75. Спектр комбинационного рассеяния света СС14 (лазерный спектро¬
метр Кодерг-РНО).1DDUюзо78В993Г 81k623. 730Рис. 76. Спектр комбинационного рассеяния света толуола в
1100 см.-1 (спектрометр Кодерг-РНО).области до
ОПТИЧЕСКАЯ СПЕКТРОСКОПИЯ573измеряют спектр излучения, рассеянного веществом. Практически по¬
ступают следующим образом. Образец индивидуальной жидкости или
раствора облучают светом определенной длины волны (длина волны
не имеет принципиального значения) и исследуют спектральный состав
излучения, обычно рассеянного под углом 90°. В спектре появляются
очень интенсивные линии источника света, рассеянного с неизмененной
длиной волны. По одну сторону от этих линии имеется серия слабых
спутников (линии Стокса); по другую сторону — еще менее интенсив¬
ные антистоксовы линии, расположенные симметрично линиям Стокса
на тех же расстояниях от интенсивной линии источника света
(рис. 75, 76).Рис. 77. Комбинационное рассеянно света. Энергетические
переходы, отвечающие:I — возбуждающей линии источника свсгп фалеевское рассеяние);II — линиям Стокса; III — антистоксовым линиям.Практически всегда пользуются более интенсивными линиями
СтокСа. Расстояние максимумов этих линий (выраженное в единицах
частоты) от центра линии источника света и является частотой спектра
комбинационного-рассеяния (рамаи-спектра).При рассеянии света в молекулярной среде возможны два случая.
В первом случае световые кванты рассеиваются в неизменном виде
(упругое релеевское рассеяние). Это приводит к появлению в спектре
рассеянного излучения линии с той же частотой vo (с той же длиной
волны Яо), что и падающее излучение (релеевская линия). Во втором
случае в результате обмена энергией между квантом падающего излу¬
чения и молекулой рассеяние света имеет иную частоту vh (неупругое
рассеяние). Разность соответствует частоте колебаний молекулы. Эта
разность положительна (стоксовы линии), если рассеяние света со¬
провождается повышением запаса колебательной энергии молекулы.
В этом случае в результате неупругого рассеяния молекула переходит
на один из возбужденных колебательных уровней (Еь Е2 и т. д.,
рис. 77). Разность Avj, может быть и отрицательной, если молекула
была возбуждена и находилась на одном из возбужденных колебатель¬
ных уровней (антистоксовы линии). В этом случае реализуется пере¬
дача колебательной энергии падающему кванту и его энергия, а значит
и частота рассеянного света, растет (Av;,<0). Поскольку доля воз¬
бужденных молекул по сравнению с невозбужденными мала, интенсив¬
ность антистоксовых линий меньше, чем стоксовых.
574ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯКолебательные спектры. Итак, два спектроскопических ме¬
тода связаны с переходом молекулы на различные колебательные уров¬
ни энергии — метод ИК-спектров и метод спектров комбинационного
рассеяния. Однако эти методы не заменяют, а удачно дополняют друг
друга. Чтобы получить полный колебательный спектр молекулы, во
многих случаях надо изучить как ИК-спектры, так и спектры комби¬
национного рассеяния.Всего в молекулах с п атомами возможно 3п — б независимых ко¬
лебательных движений (цифра 6 исключает согласованные движения
атомов, которые приводят к перемещению всей молекулы в простран¬
стве, т. е. в трех измерениях). Каждому виду колебаний должна была
бы отвечать своя полоса в спектре поглощения (соответствующий квант
света возбуждает именно этот вид колебаний). В действительности
часть полос не проявляется в ИК-спектре, если соответствующие энер¬
гетические переходы «запрещены». Для поглощения в ИК-области
спектра необходимо, чтобы отвечающее ему колебание атомов в моле¬
куле было связано с изменением дипольного момента молекулы.
По этой причине в ИК-спектре некоторые типы симметричных колебаний
запрещены. Напротив, именно эти колебания, как правило, «активны»
и наиболее характерны для спектра комбинационного рассеяния света.
Например, в ацетилене возможны три вида валентных колебаний, изо¬
браженных ниже: ' .1) ч—- Н ч—- С С —»• Н —-> . . . Колебания связи С—С2) ч——- Н С -»<- С Н —-> . . . Симметричные колебанияДипольнмй момент молекулы меняется только в случае колебаний
третьего типа. Поэтому в ИК-спектре проявляется лишь частота этих
колебаний, а колебания первого и второго типов запрещены. Напротив,
в спектре комбинационного рассеяния «разрешены» колебания первых
двух типов, а колебания третьего типа запрещены.Число линий в спектре может уменьшиться также за счет нало¬
жения отдельных близколежащих полос.Для молекул возможны колебания двух основных типов: валентные
и деформационные. Колебания атомов вдоль- оси, соединяющей их
центры (т. е. типа растягивание — сокращение связи), называются ва¬
лентными. В двухатомной молекуле это единственно возможный вид
колебания. Деформационные колебания сопровождаются изменением
валентных углов. В молекуле бензола, например, возможны два вида
деформационных колебаний связи С—Н — плоские и неплоские:3) Н ч~ С ч— Ссвязей С—И
Антисимметричные колеба¬
ния связей С—НплоскиенеплоскиеСистема из двух колеблющихся атомов может быть представлена
в виде двух гирек с массой mi и tn2 на концах пружины, сокращаю¬
щейся с частотой v по закону Гука для гармонического осциллятора:
ОПТИЧЕСКАЯ СПЕКТРОСКОПИЯ575где k — упругая, или силовая, постоянная 'связи; ц — приведеннаямасса (ц=—'"j-h •).V т} + т2 )Согласно законам квантовой механики, энергия такого осциллятора
определяется выражением:£» = Шгде v — колебательное квантовое число, принимающее целочисленные
положительные значения (и = 0,1).Для гармонического осциллятора «разрешены» только переходы
между состояниями, квантовые числа которых различаются лишь на
единицу, т. е. переходы с Av = 1. Энергия перехода при поглощении
равна:ДЕа = £(о + I) + -i-j Av — jo + у] h<i = ЛУТакие переходы приводят к появлению в спектре так называемых
«основных», или «фундаментальных», полос, которые и определяют об¬
щий вид спектра поглощения. Реальные осцилляторы в молекуле обла¬
дают ангармоничностью, поэтому в спектре поглощения проявляются
не только переходы с Av — ±1, но и переходы с Av = ±2; ±3 и т. д.,
а также переходы, сопровождающиеся возбуждением двух и более ко¬
лебаний. Полосы таких колебательных переходов (обертонов и состав¬
ных тонов), как правило, значительно слабее.По формуле Гука можно примерно рассчитать частоту той или иной
характеристической полосы поглощения. Для этого надо знать силорую
постоянную k и массы атомов. Однако в многоатомных молекулах та¬
кой упрощенный расчет будет очень приблизителен, поскольку не учи¬
тывается окружение рассматриваемой связи другими атомами.Валентные колебания отдельных связей. Полосы по¬
глощения, отвечающие колебаниям простых С—С-связей, как правило,
нехарактеристичны, т. е. существенно меняются при переходе от одной
молекулы к другой. Валентные и валентно-деформационные колебания
углеродного скелета лежат преимущественно в области 600—1300 см-1.
Линии этой области- отличны и специфичны даже для родственных мо¬
лекул. Поэтому иногда ее называют областью «отпечатков пальцев»
молекулы. Если она не всегда может служить для выяснения строения
молекулы, то наиболее удобна для идентификации индивидуальных сое¬
динений. В эту же область попадают валентные колебания простых
связей С-О, С—N, N—О.Напротив, частоты поглощения двойных связей С = С, С —О, N = 0
характеристичны, т. е. мало Отличаются для разных молекул и лежат
в области 1500—1950 см-1. Поглощение тройных связей находится в еще
более коротковолновой области: для С = С-связи, например, при 2100—
2250 см-1. Частоты колебаний связей С—Н, О—Н и N—Н также ха¬
рактеристичны, и соответствующие полосы поглощения интенсивны. Ча¬
стота валентного колебания гидроксила, не участвующего в водородной
связи, лежит в области 3590—3650 см-1; во вторичных аминах полоса
валентного N—П-колебания лежит при 3300 — 3500 см-1; С—П-связи
поглощают вблизи 3000 см~!, причем поглощение различно для метнль-
ной, метиленовой и метиновой групп, а также зависит от того, связан
ли атом углерода простой, двойной или тройной связью с соседним
атомом.В метиленовой группе возможно два вида валентных колебаний
(С—Н: симметричное и антисимметричное. При симметричных валентных
576ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯколебаниях оба атома водорода одновременно приближаются и уда¬
ляются от атома углерода, при антисимметричных — поочередно:71 Z71\/7 Ч 7 ^симметричное антисимметричноеТакие же колебания наблюдаются для метальной группыН-С—н-> —с—н->н\н\симметричное антисимметричноеа также для первичноаминной. В парафинах полосы симметричных и
антисимметричных колебаний четко различаются:Симметричные АнтисимметричныеЧастоты СН3 2872 см-1 2962 см-1Частоты СН2 2853 см-1 2926 см-1Частоты С—Н-связей в этиленовых углеводородах (Н при двойной
связи) лежат выше — при 3000—3100 см-1.Деформационные колебания. Как уже говорилось, де-
формацирнные колебания сопровождаются изменением валентных
углов. В бензоле, например, атомы водорода могут совершать угловые
колебания в плоскости кольца (плоскостные) и с выходом из этой
плоскости (внеплоскостные, стр. 574). Атомы водорода метиленовой
группы могут участвовать в четырех видах деформационных колебаний,
изображенных ниже:ножничные маятниковые веерные крутильныеСтрелки показывают направление движения атомов в одной из
фаз колебания; знак (+) означает движение вверх от плоскости чер¬
тежа; знак (—) — в обратном направлении; атом угдерода принимается
неподвижным.Для метильной группы возможно два вида деформационных ко¬
лебаний.Полосы деформационных колебаний скелета молекул лежат в длин¬
новолновой части спектра и за редкими исключениями нехарактери¬
стичны. Полосы деформационных колебаний связей типа А—Н (где
А = С; N; О) имеют более высокие частоты (от 600 до 1650 см-1); они
достаточно характеристичны и их число используют для выводов
о строении. Так, основываясь на положении полос неплоских колебаний
ОПТИЧЕСКАЯ СПЕКТРОСКОПИЯ■577ароматических связей С—Н в области 680—860 см-1, можно сделать за¬
ключение о положении заместителей в ароматическом кольце, например:На основании частот неплоских деформационных колебаний С—Н-
связей в олефинах можно судить о цис- или транс-строении этих соеди¬
нений. Для ацетиленовых соединений характерна полоса при 600—
650 см'1, которая относится к деформационным колебаниям С—Н-
связи.Применение Ш\-спектров и спектров комбинацион¬
ного рассеяния. ИК-Спектры и спектры комбинационного рас¬
сеяния применяются для идентификации соединений и для установления
степени их чистоты (качественно). ИК-Спектр (особенно в области «от¬
печатков пальцев») специфичен для каждой молекулы, поэтому, как
правило, нет необходимости в определении молярного коэффициента
поглощения Е (в отличие от УФ-спектров). ИК-Спектры могут быть
использованы также для качественного анализа смесей при контроле
за ходом реакции и для кинетических измерений.Однако наиболее распространенное и важное применение ИК-спект-
ров и спектров комбинационного рассеяния в органической химии — это
выяснение и подтверждение предполагаемого строения соединений. На¬
личие почти любой функциональной группы в молекуле можно устано¬
вить с помощью одних только ИК-спектров. Поскольку положение по¬
лосы характеристического колебания изменяется в небольших пределах
в зависимости от ближайшего окружения рассматриваемой группы, ча¬
сто “можно не только установить присутствие той или иной функциональ¬
ной группы в соединении, но и сделать выводы о ее «соседях».Рассмотрим несколько примеров:Пример 1. Полоса валентного колебания С=0. В табл. 56 приведены значе¬
ния частот этой линии спектра для различных классов соединений, содержащих карбо¬
нильную группу.Прежде всего следует сказать, что карбонильная полоса в ИК-спектре очень
интенсивна и легко идентифицируется. Из таблицы видно, что значение частоты повы¬
шается при переходе от кетонов к альдегидам и сложным эфирам.На основании ИК-спектра можно составить себе более тонкие
суждения об окружении карбонильной группы. Например, легко судить
о расположении электроноакцепторных групп по отношению к карбонилу.
Если электроноакцепторные группы (F, C = N, >С = 0 и др.) занимают
а-положепие, то частота поглощения увеличивается (табл. 56, примеры
5, 6), то же наблюдается и для альдегидов. Напротив, если карбониль¬
ная группа сопряжена с ароматическим кольцом или двойной С = С-
связью, то частота поглощения смещается в обратную сторону на 20—
40 см-1.На рис. 78 приведен спектр сложного эфира с сильным электроно¬
акцепторным заместителем (vc=o 1787 см~‘ вместо обычной для слож¬
ных эфиров частоты поглощения 1740 см'1), на рис. 79 — спектр непре¬
дельного альдегида (смещение карбонильной полосы поглощения в низ¬
кочастотную область). На спектре непредельного альдегида виден
также меньший пик при 1650 см-1, соответствующий валентным колеба¬
ниям С^С-связи.пара-и др.
578'ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯТаблица 56. Характеристические частоты ИК-спектров карбонильной группы
в разных типах соединений№примераТип соединенияИнтервалы частот,
см— 11Насыщенные кетоны1725—17052Арилкетоны1700—16803Диарилкетоны *1670—16604а,р-Непасыщенные кетоны1685—16655а-Галоидированные жирные кетоны1745—17256а-Дикетоны1730—17107р-Дикетоны1640—15408Алифатические альдегиды1740—17209а-Непредельные альдегиды1705—168010Ароматические альдегиды, 1715—169511Сложные эфнры жирных кислот1750—173012Сложные эфиры с электроноакцепторными заместите¬
лями в а-положении1770—174513Карбонилы металлов< 1900 *мостиковая группа СОодносвязная1900—2150* См. кн. II, раздел «Элементоорганические соединения».Полоса валентного колебания С = О-связи удобна для количествен¬
ных определений, например для кинетических измерений или для KOHt-
роля за ходом реакции.Рис. 78. Инфракрасный спектр эфи- Рнс. 79. Инфракрасный спектр алъ-
ра CHF;CFClCOOCH3 в тонком дегида СН3СН2СН=С(СН3)СНО в
слое: vc==0 = 1785 см-1. ' тонком слое: vc_c=1650 см-1;vc_Q sz 1710 см-1.Пример 2. Валентные колебания 0-Н-связи. Полоса поглощения гидроксила
очень характерна и лежит, как правило, в области 3500—3650 елг1, где мало других
полос поглощения. Гидроксильная группа обычно образует внутри- и межмолекулнр-
ные водородные связи. С увеличением их прочности интенсивность полосы поглощения
растет, полоса смещается' в низкочастотную область и расширяется. Узкая полоса при
3550—3650 см~‘ характерна для несвязанного водородной связью гидроксила. Коли¬
чество межмолекулярных водородных связей изменяется с концентрацией раствора
и зависит от природы растворителя, поэтому внд и положение этой полосы поглоще¬
ния зависят также и от этих факторпв. Прочные внутримолекулярное водородные
связи сдвигают полосу поглощения до 3200—2500 см 1 (например, в хелатных соеди¬
нениях).
ОПТИЧЕСКАЯ СПЕКТРОСКОПИЯА579Пример 3. Ароматические соединения. Часто требуется определить характер
замещения в ароматическом кольце, например, в какое положение к первому замести¬
телю прошло замещение — в орто-, мета- или пара-. Для решения этого вопроса часто
пользуются полосами поглощения в интервале 860—700 см'1, соответствующими не¬
плоским деформационным колебаниям С—Н-связей. В случае орто-дизамсщенных
соединений интенсивная полоса поглощения лежит в интервале 735—770 иг1. Для
мета- и пара-дизамещенных она сдвигается в более высокочастотную область:
750—810 см-1 и 800—860 см~*. Определение строения по этой полосе затрудняется,
если оиа попадает на границу интервалов (^800 см-1 или ~740 см-1); однако
помощь могут оказать тогда другие полосы в этой же и в других областях
спектра.Если известны спектры эталонных образцов, то можно определить относительное
содержание изомеров (орто-, пара-, мета-) в смеси. Это может быть очень существен¬
ным, например, при определении ориентирующего влияния заместителя в той или иной
реакции или для выяснения относительных количеств изомеров, образующихся в раз¬
ных условиях.Для аналогичных целей применяются и спектры комбинационного рассеяния.Электронные спектры. Электронные спектры поглощения,
охватывающие область электромагнитного спектра от 100 до 800 нм сле¬
дует разделить на три части: видимая часть спектра (400—800 нм),
ближняя ультрафиолетовая (200—400 нм) и далекая (или вакуумная)
ультрафиолетовая (200 нм и менее). В органической химии обычно при¬
меняется область спектра от 220 до 800 нм. Очень важная область
спектра, короче 220 нм, доступна для специальных вакуумных спектро¬
фотометров.Возбуждение молекулы при поглощении кванта энергии ведет
к перестройке, вообще говоря, всего электронного облака, однако прак¬
тически изменяется лишь распределение облака валентных элек¬
тронов.Процесс возбуждения можно приближенно описать моделью одно¬
электронных переходов. Валентные электроны располагаются на моле¬
кулярных орбиталях, энергии которых могут быть вычислены прибли¬
женными методами квантовой' химии. В основном состоянии молекулы
электроны расположены (как правило, попарно) на молекулярных
орбиталях с наименьшим значением энергии. В процессе возбуждения
электроны молекулы переходят на более высокие незанятые орбитали.
Различают переходы трех типов.a) N —► V-переходы. Этот тип связан с переходом электрона со свя¬
зывающей орбитали на разрыхляющую (или, что то же, антисвязы¬
вающую). Возбужденное состояние поляризовано. Тем самым переход
электрона сопровождается большим изменением дилольного момента
и соответствующая полоса очень интенсивна. Переходы N—► V для
nr-электронов связей (о —»о*-переходы) лежат в вакуумной УФ-области
спектра. Соответствующие я-* п*-переходы требуют меньшей энергии
возбуждения и расположены в ближней УФ-, видимой, а иногда даже
в ближней ИК-области спектра.Полосы поглощения, соответствующие я—* л*-переходам, характе¬
ризуются большой интенсивностью, коэффициенты е обычно больше
1000. В полярных растворителях поглощение сдвигается в этом случае
в длинноволновую область спектра.б) JV -* Q-переходы. В этом случае электрон переходит с несвязы¬
вающей орбитали на антисвязывающую. Наиболее распространенный
вид iV—*• Q-перехода — переход электрона неподеленной пары на воз¬
бужденную я-орбиталь (р -* л*-переход) : Эти переходы лежат в более
длинноволновой области, чем л-* я*-переходы, и малоинтенсивны. Со¬
ответствующие коэффициенты экстинкции е обычно меньше 100. В по¬
лярных растворителях поглощение сдвигается в коротковолновую
область. Так же действует введение в молекулу электронодонорных
5*0ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯзаместителей. По этим и ряду других признаков р —► я*-переходы можно
отличить от я —*■ я*-переходов.в) «Атомарные», или ридберговы, переходы. Если энергия возбуж¬
дения велика, то возможен выход электрона из валентной оболочки
молекулы. При очень больших энергиях возбуждения молекула теряет
электрон, т. е. происходит фотоионизация. Ридберговы переходы про¬
являются в вакуумной УФ-области спектра в виде очень интенсивных,
довольно узких полос.Наиболее интересны для органической химии переходы первых
двух типов (т. е. а и б).Часто возмущение электронного облака при поглощении кванта
энергии затрагивает в основном небольшую часть молекулы. На этом
основана грубая интерпретация наблюдаемых полос поглощения как
переходов электронов отдельных связей или групп связей молекулы.
Это приближение в ряде случаев очень плодотворно. Так, поглощение
в области 1700—2100 А в спектрах моноолефинов относится к возбуж¬
дению я-электронов двойных связей (я-'-*я*-переходы). Число изоли¬
рованных двойных связей в молекуле практически не влияет на поло¬
жение этой полосы, лишь пропорционально возрастает ее интенсивность.
Если увеличивается число двойных сопряженных связей, полоса
я-♦ л*-перехода смещается в длинноволновую область спектра (бато-
хромный сдвиг). Достаточное удлинение сопряженной системы связей
само по себе может вывести максимумы поглощения в видимую область
спектра, и соединение станет окрашенным (табл. 57, 58).Таблица 57. Значения Хмакс для молекул с различной длиной цепн сопряженияСоединениелмакс нмп — 1я = 2я=3п = 4п = 5СН3-(СН=СН)„—СООН (в спирте)204254294327СН3—(СН=СН)„—СНО (в спирте)220271315353393С6Нб—(СН=СН)/г—С6Н6 (в бензоле)306334358384420Значения 8-10"" для последнего
примера24407586114/Таблица 58. Значеняя ХМакс и е для углеводородов
с постоянно увеличивающейся цепью сопряженияСоединениеЧислосопряженныхсвязей^макс’нме • 10 3ЦветБутадиен221721БесцветенГ ексатриен325835»Декатетраен431042»Витамин «А»5328»Т етрадекагексаен636070»а-Каротин10445145ОранжевыйНепредельные группировки, ответственные за поглощение в указан¬
ной области спектра, например С —С, С = 0, C = N, N = N, C = S, на¬
зываются хромофорами.
ОПТИЧЕСКАЯ СПЕКТРОСКОПИЯ5SIПодключение к хромофорам электронодонорных групп, особенно
групп, обладающих неспаренными электронами, приводит к батохром-
ному сдвигу полос поглощения (соответствующих я —► я*-переходам).
Группы, которые сами по себе не обладают интенсивной полосой по¬
глощения при 200—800 нм, но приводят к батохромному сдвигу полос,
ответственных за я -> я*-переход хромофоров, называются ауксохром-
ными группами или ауксохромами. Наиболее типичными ауксохромамиявляются NH2, NR2, OH, OR, SH, SR.Полоса поглощения, ответственная за я —*я*-переход, называется
обычно /(-полосой. В случае сопряженных систем имеется не несколько,
а одна общая /(-полоса, по расположению максимума и интенсивности
которой, вообще говоря, можно сделать заключение о длине сопряжен¬
ной системы (табл. 57 и 58).Интенсивность поглощения связана с изменением дипольного мо¬
мента при возбуждении; естественно, что в случае длинных сопряжен¬
ных систем дипольные моменты возбужденных биполярных состояний
должны быть больше. С другой стороны, для возбуждения я-электронов
таких длинных сопряженных систем требуется меньшая энергия; этим
и объясняется батохромный сдвиг.В случае карбонильных соединений (альдегидов, кетонов, сложных
эфиров и др.) кроме интенсивной /(-полосы имеется еще малоинтенсив¬
ная, расположенная в более длинноволновой части спектра полоса
р -* я*-перехода. Она отличается от /(-полосы не только меньшей ин¬
тенсивностью, но и другим «поведением». Так, с увеличением поляр¬
ности растворителя полоса р—* я*-перехода подвергается гипсохром-
ному сдвигу (в коротковолновую часть спектра), тогда как /(-полоса
(л —>■ я*-переход) сдвигается обычно в обратном направлении.Бензол имеет три полосы поглощения: Ямакс = 180 нм (е = 47 000),
200 нм (е = 7400) и 260 нм (е = 220). При помощи обычных приборов
можно исследовать только две последние полосы: К я В. /(-Полосу при¬
писывают биполярному возбуждению (подобно /(-полосе полиенов), а
малоинтенсивную В-полосу — «запрещенному» бирадикальному возбу¬
ждению. Любые заместители вызывают батохромное смещение К- и
5-полос и возрастание их интенсивности, хотя количественно эти влия¬
ния сильно различаются.Особенно сильное влияние па спектр бензола оказывают замести¬
тели, способные к сопряжению. Таковы группировки с двойными свя¬
зями, с атомами, несущими неспаренные электроны (NH2, ОН и др.),
и, наконец, такие электроноакцепторные группы, как N02, С=0 и др.По величине оказываемого ими влияния (батохромного сдвига)
заместители I и II рода можно расположить в два ряда:—CN < — S02R < —СООН < —СОСН3 < —СНО < —N02
Cl < ОН < SR < NR2Очевидно, вместе с увеличением возможности групп к сопряжению
возрастает и батохромный сдвиг. Когда заместители разного рода (спо¬
собные к сопряжению) расположены в пара-положении, происходит
особенно сильный батохромный сдвиг: для анилина (аминобензола)
Хмакс = 230 нм, для нитробензола 269 нм, для п-динитробензола 266 нм,
а «-нитроанилин имеет интенсивный максимум поглощения при 381 нм (!),
в то время как Хмакс. для ж-нитроанилина 280 нм. Такой значительный
батохромный сдвиг /(-полосы бензола под влиянием сопряжения исполь¬
зуется химиками в самых разных целях, например для определения по¬
ложения заместителя в бензольном кольце — для анализа смесей мета-
и пара-замещенных.
582ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯКак мы увидим из дальнейшего, такое сопряжение электроноакцеп¬
торной и электронодонорной групп наблюдается во многих красителях;
при этом в цепь сопряжения могут входить не только ароматические
кольца, но и обычные системы сопряженных связей.УФ-Спектры хорошо известны для всех обычных классов соединений.
Известны спектры различных гетероциклов и их производных, конден¬
сированных систем, многих стероидов, терпенов и др. Для многих
классов соединений выведены свои эмпирические правила, позволяю¬
щие иногда судить о расположении заместителей или двойных связей.Окраска соединений и красители. Окрашены все сое¬
динения, поглощающие свет в видимой области спектра, т. е. от 700
до 400 нм. Видимый цвет соединения является дополнительным к по¬
глощенному. Так, если максимум поглощения лежит в области 400-^
435 нм (поглощаются фиолетовые лучи), то окраска соединения желто-
зеленая. Поглощение желтого цвета при 580—595 нм приводит к синей
окраске. Батохромный сдвиг, т. е. смещение поглощения в длинноволно.-
вую область, называется углублением окраски, а обратное, гипсохром-
ное смещение — повышением окраски или тона. Так что переход от жел¬
того к красному, фиолетовому, синему и, наконец, зеленому цвету — это
углубление цвета.Как мы видели, удлинение цепи сопряжения может привести к по¬
глощению в видимой области спектра и появлению окраски. Это на¬
блюдается, например, в каротинах (кн. II). У p-каротина одиннадцать
сопряженных связей (Ямакс 483 и 453 нм). Хотя интенсивность окраски
такого рода соединений велика, она недостаточна для их практического
применения как красителей (не говоря уже о том, что красители дол¬
жны прочно связываться с волокном).Для красителей особенное значение имеет присутствие на концах
сопряженной цепи двух групп, способных к сопряжению, но носящих
противоположный характер (в смысле электроотрицательности). Это
ведет к сопряжению этих двух групп через всю соединяющую сопря¬
женную цепь и к распределению заряда между этими группами. Одним
из таких примеров, приведенных выше, был n-нитроанилин. В качестве
другого, еще более характерного примера можно указать на азомети-
новые красители. Они представляю? собой соли е катионом, построен¬
ным из полиметиновой цепи с нечетным числом членов —СН = , кото¬
рая заканчивается с одной стороны трехвалентным азотом,, а с дру¬
гой — четырехковалентным, положительно заряженным азотом (или
подобными группами). Сопряжение неподеленной пары электронов
трехвалентного азота с положительным зарядом через всю полимеги-
леиовую цепь приводит к равномерному распределению заряда между
обоими атомами азота:Такая система, естественно,' характеризуется легкостью биполяр¬
ного возбуждения молекулы до одной из полярных структур(сн3)2: (СН3)2=Уг+=(ch;!)2n--^ch—сн-сн^сн— сн—n(ch3)24- - ••(CH3)2N=CH-CH=CH-CH=CH—N(CH3)2Вероятность поглощения такой системой очень велйка, поэтому
велика и интенсивность поглощения.
ПОЛЯРИМЕТРИЯ583ПОЛЯРИМЕТРИЯПри изучении «оптической» стереоизомерии первостепенное значе¬
ние имеет измерение угла вращения плоскости поляризации света при
прохождении луча, поляризованного в определенной плоскости, через
жидкое вещество или раствор известной концентрации. Для измерения
угла вращения применяются поляриметры. Если а — наблюденный
угол вращения (в градусах), I — толщина слоя, через который проходит
свет (в дециметрах), с — концентрация раствора, г/мл, d — плотность
жидкости, г/см3, А— длина волны света, [а]1 —удельное вращение для
данной t° и Я, то[а]^° = (для растворов) [а]^° = (для жидкостей)Молекулярное вращение [М] равно:[М]А,100где т — молекулярный вес исследуемого вещества.Как уже говорилось, [а], а следовательно и [М], для оптических
антиподов в одинаковых условиях равны по абсолютной величине и
противоположны по знаку. В неодинаковых условиях, например в раз¬
ных растворителях, [а]Г и [М]Г могут меняться вплоть до перемены
знака.Диастереомеры вообще обладают разными [а]1 и [М]1. Молекулы,
содержащие асимметрические атомы, но имеющие плоскости симмет¬
рии, не вращают плоскость поляризации, т. е. [а]1° — 0 и [М]х = 0.
В более общей форме: молекула асимметрична, если она не имеет ни
плоскости, ни центра симметрии. Вещество, состоящее из таких оди¬
наковых молекул, вращает плоскость поляризации света и в жидком,
и в газообразном состояниях. Уже отсюда видно, каким мощным сред¬
ством исследования стереоизомерии является измерение вращения пло¬
скости поляризация (см., например, раздел «Стереохимия моносаха¬
ридов»).Л. А. Чугаев, широко использовавший сопоставление молекулярных
вращений рядов соединений, установил, что в ряду гомологов и произ¬
водных оптически активных веществ молекулярное вращение постоянно
(выпадают только первые члены ряда). Так, для сложных эфиров опти¬
чески активного амилового спирта (2-метилбутанол 1) значения моле¬
кулярного вращения таковы:[М] [MlФормиат .... 3,96° Валерат 4,33°Ацетат 2,33° Калроат 4,46°Пропионат . . . 3,99° Лаурат 4,21°Бутират 4,25° Стеарат 4,49°Чугаев установил также правило, согласно которому наиболее
сильное влияние на оптическую активность оказывают заместители, не¬
посредственно связанные с оптическим центром, причем это влияние
быстро ослабляется по мере их удаления по цепи.В результате большой предварительной работы 'и ряда попыток
(Л. А. Чугаев, Эйринг, В. Кун) в 1959 г. Брюстеру удалось полуэмпири-
чески количественно связать структуру, конфигурацию и конформацию
584ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯмолекулы с ее оптической активностью, а именно с величиной [М]. По¬
следняя оказалась функцией поляризуемости групп, связанных с асиммет¬
рическим центром, а поляризуемость функционально связана (как уже
было сказано) с молекулярной и атомной рефракцией.Если с углеродом связаны атомы, подобные галоидам,- вращение
которых вокруг валентной связи как оси ничего не меняет, или группы,
подобные метилу, гидроксилу и другим простейшим группировкам, по¬
вороты которых вокруг связи их ключевого атома с асимметрическим
углеродом меняют конформацию незначительно, знак вращения можно
предсказать. Для этого нужно расположить (проекция Фишера) про¬
екцию молекулы с асимметрическим углеродом так, чтобы атом [а] был
наиболее поляризуемым (в проекции Фишера, как известно, одна пере¬
мена мест двух заместителей приводит к антиподу, а две перемены не
меняют конфигурации), а остальные атомы по возможности распола¬
гались бы по часовой стрелке в порядке убывающей поляризуемости:ькС-5Вг-CIТакое расположение дано в приведенной справа формуле CIBrClF.
Это расположение соответствует правому вращению, обозначаемому
знаком (+)• Противоположное расположение соответствует левому
(—) вращению.Ниже приведены атомные рефракции, приходящиеся на один свя¬
занный с асимметрическим углеродом атом в следующих группах, т. е.
величины, которые и следует принимать во внимание при расчете знака
вращения:I . . . .. . 13,954C = N . .. 3,580NH2 . . .. . 2,382Вг . . . .. . 8,741С=С . .. 3,379ОН . . .. . 1,518SH . . .. . 7,729СбНй . .. 3,379н . . . .. . 1,028С1 . . . .. . 5,844соон . .. 3,379D . . . .. . 1,004с=с . .. . 3,580СН3 . . .. 2,591F . . . .. . 0,81Так обстоит дело, когда с асимметрическим углеродом связаны
сравнительно простые группы или атомы. По такому расчету вращение,
например, антиподов предельных углеводородов с асим¬
метрическим атомом, типа соединения I, должно было
бы быть равно нулю, поскольку поляризуемость всех
предельных углеродных атомов, привязанных к асиммет¬
рическому, одинакова. На деле это не так: в данном
случае [M]D = 9,9°. Здесь приходится принять во внима¬
ние «конформационную асимметрию», вклад которой, как
будет показано ниже, можно оценить количественно. Можно привести
следующий пример:Cl С1С2Н6СН3-|-С3Н7С4НЭIВг—С—СН3
Iнатомная асимметрияСН3—С—СН2СН2СН3нкокформациоиная асимметрияЕстественно, что возможны случаи, когда имеется и та и другая
асимметрия. Тогда общее молекулярное вращение представляет собой
сумму вкладов «атомной» и «конформационной» асимметрии. При этом
ПОЛЯРИМЕТРИЯ585вклад конформадионной асимметрии можно рассчитать, тогда как
вклад атомной поддается лишь качественной оценке. Следует отметить,
что атомный вклад часто можно определить экспериментально, по¬
скольку углы вращения многих простых соединений хорошо известны.Смысл «конформационной асимметрии» заключается в следующем.
Различные конформации одного и того же соединения имеют различную
симметрию и различный статистический вес (т. е. их процентное содер¬
жание различно). Поэтому общий эффект, оказываемый на поляриза¬
цию света, будет зависеть от того, как расположены атомы в той или
иной конформации, а также от статистического веса той или иной кон-*формации. Например, в случае СН3СН2СН(СН3)Вг имеется только кон-
формационная асимметрия, поскольку у асимметрического центра на¬
ходятся два одинаковых атома (С). Для этого соединения возможны
три заторможенные конформации:СН,н3сВгСН,мнсн,. нА,сн,н'-у'" ^Н
Н
ВнВгнНсн3вКонформация А исключается как невыгодная (с малым весом), по¬
скольку в ней все три заместителя находятся в скошенных положениях
(правило 1) (см. ниже). Оценим вклад каждой из двух остальных кон¬
формаций.Постулируется, что фрагмент-Yвносит вклад Ц-kXY, где k — постоянная, равная 160, а х=У*ъ
Y= (здесь Rx и Ry—атомные рефракции атомов X и Y).Осуществим по методу Брюстера обход каждой конформации по
часовой стрелке следующим образом (причем переход от верхнего
атома к нижнему идет со знаком плюс, а обратный переход — со зна¬
ком минус):д [М]Б = 160 (С • С—С • Н + Н • Н—Н • Вг + Н • Вг—Н • С) == 160 (C-H)2 = 160 ( - ]/R^)2д [Щв = 160 (С • Н-Н • Н + Н • C-C • Вг + Вг • Н-Н • С) = — 160 (Вг—Н) (C-H)160[М](утс- 1/TQД[М]В ММ]
k ^ k2 2В предыдущем случае имелись только три конформации, однако
если цепь атомов углерода более длинна, то количество конформаций
резко возрастает. Расчет по Брюстеру для таких соединений более
сложен и требует построения пространственных моделей. Для ознаком¬
ления с методом следует обратиться к оригинальным статьям Брюстера.
ФИЗИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯУкажем только, что при расчете производится сравнение возможных
конформаций и отбрасываются наименее энергетически выгодные типа
Г и Д, в которых заместители X, Y и Z более объемисты, чем Н.г ДОстальные конформации считаются условно равновероятными, по¬
скольку обычно нет возможности определить их относительный стати¬
стический вес. Несмотря на такое приближение расчет хорошо соот¬
ветствует экспериментальным данным,
ПРЕДМЕТНЫЙУКАЗАТЕЛЬ
Авертин (Р-Трибромэтанол) 99
Адамантан (Трицикло[3,3,1,1]декан)544 сл.Адамантилкарбинол 548
Адамантилметил-катион 548
Адамантоний-катион 547
Аденин 436Аденозиндифосфат (АДФ) 434 сл.
Аденозинтрифосфат (АТФ) 433 сл.
Адипиновая кислота (Гександикислота,1,4-Бутандикарбоновая кислота)
182, 183, 513
получение 184, 518, 521
применение 212
соли 406
Адонит 106Адсорбционная хроматография 36 сл.,513
АДФ 434 сл.Азелаиновая кислота (Нонандикислота,1,7-Гептандикарбоновая кислота)
182, 183
образование 308, 540
Азеотропные смеси 34, 95
а-Азидопропионовая кислота 470
Азиды кислот 172
Азины 131Азоксисоединения 200
Азометиновые красители 582
Азосоединения 132, 200
Азот, определение 45, 46
Азулен 233, 326
Аконитовая кислота 437
Акриловая кислота 303, 304полимеры метиловых эфиров (Поли-
метилакрилаты) 306, 307
получение 264, 303
реакции 178, 305, 374, 376
физические свойства 304
Акрилонитрилполимеры и сополимеры 282, 306, 307
получение 256, 259, 264, 303
реакции 303
Акроза (Глицероза) 408
Акролеин (Пропеналь) 294, 303
в синтезе глицерина 104
реакции 274, 296, 468
Аксиальное раскрытие цикла 518
Аксиальные связи 426, 496, 498, 530, 568Аланин (а-Аминопропионовая кислота)
456, 457, 469, 470
производные 460
Алициклические соединения 51, 55 сл.,
189, 491 сл.
двухъядерные 525 сл.
дегидрирование 511, 517
изомерия 497 сл., 538 сл.
классификация 492
конформационный анализ 494 сл.
макроциклы 533, 539
малые циклы 503 сл.
мостиковые 492, 527 сл.
напряженность циклов 493, 505
непредельные 507, 513, 517, 535
номенклатура 491, 492, 493
полиэдрические 544 сл.
превращения циклов друг в друга
522 сл., 527
пятичленные циклы 509 сл.
с изолированными циклами 492,
525 сл.с конденсированными циклами 492,
527 сл.с циклами, соединенными С—С-
связыо 492, 526
спирановые 492, 526
средние циклы 533 сл.
стереохимия 497, 527, 529 сл.
строение 493 сл.
углеводороды 501 сл.
шестичленные циклы 516 сл.
Алкалицеллюлоза (Щелочная целлюло¬
за) 451
Алкалоиды 11, 516
Алканали см. Альдегиды
Алкандиолы см. Спирты двухатомные
Алканолы см. Спирты одноатомные
Алканоны см. Кетоны
Алкансульфокислоты 197 сл.Алкантионы см. Тиокетоны
Алкантриолы 103Алканы (Парафины, Предельные углево¬
дороды) 55 сл.азотистые производные 200 сл.
бромирование 66, 71
галоидирование 66, 71 сл.
дегидрирование 69, 270
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ589Алканыдегидроциклизация 511
иодпроизводиые 72 сл.
клатратные соединения 61
конформации 61
крекинг 65, 66, 202, 247
нахождение в природе 61
нитрование 67
номенклатура 69
окисление 64, 65
получение 62, 63
структурные изомеры 56
сульфирование 68
сульфохлорирование 68
физические свойства 57—60
фторпроизводные 67, 71
хлорирование 66, 71
Алкены см. Олефины
Алкилборные кислоты 150
Алкилбромвиниловый эфир 293
Алкилвиниловые эфиры 262
Длкилированиеалканов алкенами 252
аминокислот 463
аммиака и аминов 209
натриймалонового эфира 186
синильной кислоты 214
целлюлозы 452
Алкилирующие средства 75, 107, 111
электрофильность 403
Алкилмалоновый эфир 458
Алкилнитрилиевые соли 171
Алкилнитроловая кислота 204
Алкилсерные кислоты 111
Алкилсульфиновые и алкилсульфоновые
кислоты 150
Алкилформамиды 215
Алкилфосфоновые кислоты 150
Алкилы 55Алкилэтиниловые эфиры 293
Алкииы (Ацетилены) 259 сл.Алкоголяты (Алкоксиды) 96, 97, 107, 125,
286Алкоксид-анион 96, 106, 107
Алкоксильные группы 414
Аллелотропные смеси сахаров 417
Аллен (Пропадиен) 266, 267, 269, 272
димеризация 504
полимеризация 272
Алленовая (кумулированная) система
двойных связей 268Аллилбромистый (З-Бромпропен-1) 283
йодистый (З-ИодпропеН'1) 283
реакционная способность 255
свободный радикал 255
хлористый (З-Хлорпропен-1) 103, 255,
272, 283, 284, 507— гидролиз 292
Аллиле н см. Метилацетилен
Аллиловое горчичное масло 354
Аллиловый спирт 104, 292, 284
Аллильная перегруппировка 273, 287,288,293Аллильная система 256, 287, 311
Аллозы 424, 445
Аллоинозит 519
Аллотреонин 471
Алмаз 335, 336, 544
Альгиновые кислоты 454Альдазины 131
Альдегидаммиаки 129
Альдегидокислоты, эфиры 383, 405
Альдегиды (Алкапали) 120 сл., 294 сл
бисульфитные соединения 129
галоидирование 137
идентификация 522
мезомерш^й сдвиг 124
номенклатура 120 •
отличие от кетонов 133, 298
полимеризация 139 сл.
применение 142реакции замещения 130 сл., 133 сл.— присоединения 127 сл.— с диазометаном 218
спектры ЯМР 562
Т-эффект 124, 176
физические свойства 121Альдимедон 522Альдогексоза (Пентаоксигексаналь) 409,
410, 413, 421, 422
Альдогексозыметилирование 415
окисление 426
стереохимия 417 сл.
таутомерия 415
Альдогептозы 423, 426
Альдозы 412, 424—425, 428
Альдоксимы 200
Альдолаза 434
Альдоли 137Альдоль ((З-Оксимасляный альдегид)
137, 290, 374, 407, 408
Альдольная конденсация 137, 139, 141,
408, 459, 468
Альдоновая кислота 409
Альдопентоза (Тетраоксипентаналь) 409,
410, 413, 416, 417, 421, 422
окисление 426
стереохимия 417 сл.
таутомерия 415
Альдопентоновая кислота 419
Альдотетрозы 417, 422
Альтрозы 424, 445
Амбидентный ион 214
Амидины 171, 175
Амидразоны кислот 172
Амиды карбоновых кислот 168 сл.
ацилирование 302
внутренние 492, 493
деструкция по Гофману 209
замещенные 211
Амиды сульфокислот (Сульфамиды) 199
Амил йодистый 412
Амилаза 447
я-Амиламин 208а-Амилен (Пентен-1, н-Пропилэтилен)
245(3-Амилен (Пентен-2, Метилэтнлэтилен)
245у-Амилен (2-Метилбутен-1, 1-Метил-1-
этилэтилен) 245
н-Амилкарбинол см. Гексанол-1
н-Амилмеркаптан 195
Амиловые спирты (см. также Пентано-
лы) 92, 93, 99
вторичный см. Пентанол-3
оптически активный см. 2-Метилбу-
танол-1третичный см. 2-Метилбутанол-2
590ПРЕДМЕТНЫЙ УКАЗАТЕЛЬАмилоза (Растворимый крахмал) 447,
449 сл.Амилопектин 447, 449 сл.
Амииоальдегиды 478
а-Амино-М-ациламинокислоты (Дипеп¬
тиды) 471 сл.Аминогруппа, защита 471 сл.
а-Аминоизомасляная кислота 458
Аминокапроновая кислота 461, 476
Аминокапроновая кислота 461, 476
Аминокетоны 478
Аминокислоты 455 сл.
алкилирование 463асимметрический углеродный атом
455, 468, 470
внутренние соли 455, 461, 462
выделение индивидуальных 462
конфигурация 468 сл.
природные 456—457— конфигурация 468 сл. '— установление строения 465 сл.
самоацилирование 463
свойства 456, 457, 461 сл.синтез 457 сл.Аминомалоновый эфир 459
Аминомасляная кислота 470
Аминометилциклогексан 523
а-Аминонитрилы, гидролиз 458
Аминооксосоединения 478 сл.
Аминопласты 348а-Аминопропионовая кислота см. Ала¬
нин(З-Аминопропионовая кислота 455
Амииосахара 431, 454
Аминоспирты 340 сл.
а-Аминоуксусная кислота см. Глиции
Амины предельные 207 сл.
ацилирование 211, 302
получение 75, 209 сл.
реакции 210 сл., 213
свойства 207, 208
третичные 208, 211
/-эффект 207
Аммонолиз 168, 212окислительный 256, 303
Анализ органических соединений 43 сл.
Ангидриды карбоновых кислот 166 сл.
Ангидрон (Перхлорат магния) 45
Ангулярные атомы водорода 530, 531
Анилин 12, 556, 581
Анизол 547Анилиновые красители 12
Аномерия 428
Ансольвокислоты 218
Антигены 454Антимарковниковское присоединение 305
Антидетонаторы 64Антиоксиданты (Ингибиторы окисления)
296Антиподы оптические (см. также Энан-
тиомеры) 356, 357
инверсия 357
разделение 366 сл.Антисимметричные орбитали 229
Антистоксовы линии 573
Антифризы 103, 258
Антрахинон 150
Антрацен 334, 528
Али оз а 433Алротонные растворители 169Арабан 453Арабиноза 419, 422, 425, 453, 454
озазон 422
Арабинофураноза, ортоэфир 455
Арахидоновая кислота 309
Аргинин 456
Арилгидразин 131Аровые кислоты см. Сахарные ки¬
слоты
Ароматизация 511
Ароматические соединения 52, 62
гидрирование 512, 516, 525
ИК-сиектры 579
протоны в спектрах ЯМР 562
Асимметрический синтез 367 сл.
Асимметрический углеродный атом 354.
356, 358, 364 сл., 583, 584
в алициклах 498
в аминокислотах 455, 468, 470
в камфоре 532
в кверците 519
в оксиальдегидах 408
в оксикислотах 354, 356
в полимерах 372
в углеводах 417 сл., 421
Асимметрияатомная и конформационная 584
молекулы 527
Аскарит 45Аскорбиновая кислота (Витамин С) 430,
431, 446
Аспарагин 456, 469
Аспарагиновая кислота 456, 475
Атактические полимеры 373
Атом, электронная структура 222 сл.
Атомарные (ридберговы) переходы 580
Атомныеорбитали 222 сл., 237 сл.
радиусы элементов 334, 335
АТФ 433 сл.Ауксины (Ростовые вещества) 516
Ауксохромные группы 581
Аутрпротолиз 393
Ацетали 102, 291, 293
Ацетальдегид (Уксусный альдегид, Эта-
наль) 23, 120, 121, 277, 468
альдольная конденсация 205
диперекись 193
дипольный момент 327
енолизация 176, 402
конденсация с формальдегидом 106294кротоновая конденсация 276, 294
модели Стюарта-Бриглеба 335
образование 246, 289, 291, 300, 436,467полимеризация 140
получение из ацетилена 262
применение 142
реакции 290, 326, 468, 471
Г-эффект 312
УФ-спектр 571
физические свойства 121
Ацетамнд 168, 169
Ацетатный шелк 452
Ацетил 14Ацетиламиномалоновый эфир 459, 467
Ацетилацетон (Пентандиои-2,4) 143,144,
394, 395
в реакции Михаэля 305
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ591Ацетилацетон
енолят 400
хелаты 146
N-Ацетилгалактозамин 431
Ацетилгалогепиды 104, 165
Ацетилгликокол 4С2
N-Ацетилглюкозамин 431, 453
метиловый эфир 555
Ацетиле» (Этим) 20, 101, 244, 259 сл.
алкилировапие 261
галоидирование 261, 284
галоидпроизводиые 285
гидратация 127, 202
гидрирование 261
димеризация 263, 277
озонирование 262
окисление 262
полимеризация 263
применение 206, 2G7, 303
протонизация водородных атомов 264
реакции 270, 271, 290, 291, 507— замещения 264 сл,— присоединения 261 сл., 286
синтез из элементов 260
способы получения 66, 260 сл.
тетрамеризация 263, 536, 537
тримеризация 83, 263
физические свойства 259
эндотермичность 266Ацетилен-аллен-диеновая перегруппиров¬
ка Фаворского 266
Ацетилендикарбоновая кислота 339
Ацетилениды металлов 264, 265, 279
Ацетиленкарбоновые кислоты 338 сл.
Ацетиленовые простые эфиры 293
Ацетиленовые спирты 293
Ацетилены (Алкипы) 259 сл.
Ацетилирование 167
Ацетилкоэнзим А 436
Ацетилуксусноэтиловый эфир см. Ацето-
уксусшлй эфир
Ацетилхолин (Холинацетат) 342
Ацетилциклогексапон 395
Ацетилциклопеитанон 395
Ацетилянтарпая кислота 406
Ацетобромглюкозы 444, 445
Ацетогалогенозы 429, 444
Ацетоин 309, 407Ацетон (Диметилкетоп, Пропанон-2) 120,
122, 126, 128
альдольная конденсация 137
ацилирование 402
диперекись 193константы ионизации и таутомерного
равновесия 395
модели Стюарта-Бриглеба 335
окисление 133
пиролиз 301полимеризация 139, 140
применение 142, 303
реакции 99, 127 сл., 271, ССО, 510
хлорирование 105, 136
элюирующая способность 38
/-эффект 180
Ацетопдикарбоновая кислота 382, 384
Аиетондищавелевая кислота, эфир 387
Ацетониды моноз 430, 446
Ацетонилацетон (Гександион-2,5) 143,
146Ацетоиитрил 170Ацетоновый (диацетоновый спирт) 137,
408Ацетоуксусная кислота 339, 384, 391
Ацетоуксуепый (ацетилуксусноэтило¬
вый) эфир 302, 387, 402
кето-енольиая таутомерия 387 сл.,
392, 394
кетоипое расщепление 406
кислотное расщепление 391
константа еполизации 393
константы ионизации и таутомерного
равновесия 395
Р'Лактон енола 302реакции 305, 369, 389 сл., 405, 406,
458, 546Ациклические соединения 51, 55 сл.Ацнл 159галоидный 164, 165
гидроперекись 377
Ацнламины 302Ацилатная группа (Ацилоксигруппа)158, 159
Ацилиевый катион 165
Ацилирование 166 сл.
аминов 211аммиака 166, 168, 171, 211
гидразина 172
гидрокснламииа 172
этанола 166О-Ацилирование 403
Ацилоии 535Ацилоиновая конденсация 525, 533, 534,535Ацилоксигруппа 159
Лцн-нитросоединения 204Байеровское напряжение 493
Банановые связи 505
Барбитуровая кислота (Малонилмочеви-
на) 344, 348
Батохромный сдпиг 580 сл
Бездымный порох 452
Бекмановская перегруппировка оксимов
461, 465, 476
Белки 455, 475, 476
Бензальацетофенон 150, 570
Бензальдегид 432, 562
Бензиловый спирт 472
Бензилэтилкарбонат 472
Бензин 62, 64, 66, 516комбинированный метод исследова¬
ния 513
нитрование 68
октановое число 64, 66
Бензоил 14
Бензоилацетон 395Бензоилгликокол (Гиппуровая кислота)
462Бензоилциклопропан 506
Бензойная кислота 150, 462
Бензол 12, 25, 38, 50азеотропные смеси 34, 95
валентные изомеры 539
гидрирование 512, 516
деформационные колебания 576
дыоаровский 264константы эбуллиоскопическая и
криоскопическая 50
ладенбурговский (Призман) 539, 544
592ПРЕДМЕТНЫЙ УКАЗАТЕЛЬБензолмодели Стюарта-Бриглеба 335
окисление 315получение 83, 263, 503, 511, 538, 550
реакции 536, 537
спектр ЯМР 562
спектры поглощения 581
строение 235 сл.
энергия резонанса 321
я-Бензоилбифенил 150
я-Бензолдиальдегид 538
я-Бензолдикарбоновая (терефталевая)
кислота 538
Бетаин 463Бимолекулярные реакции 75, 84, 87, 88
Биозы см. Дисахариды
Биос-1 (Мезоинозит) 520
Бис-дикетен (Недокись углерода) 187,
188, 302
Биурет 347Бициклические соединения 525 сл.двухъядерные с изолированными
циклами 525, 526
с конденсированными циклами 527
сл.спираны 526, 527
Бицикло[1,1,0]бутаны, замещенные 530
Бнцикло[2,1,1]гексан 529
Бицикло]2,2,0[гексан 529
Бицикло[1,2,2]гептан (Норкамфан) 529,
531карбкатион 547
Бицикло[1,4,0]гептан 528
Бицикло[3,2,0]гептанон-3 529
Бицикло 4,4,0]декан см. Декалин
Бицикло 3,4,0]нонан (Гидриндан) 530
Бицикло[4,2,0]октадиен-2,4, дихлорпро-
изводное 537
Бицикло[3,3,0]октан (Пенталан) 530
Бицикло[2,2,2]октан 531
Болотный газ 62
Бомбикол 293Борнометиловый эфир (Триметилборат)
108Борноэтиловый эфир (Триэтилборат)
108Брожение 95
крахмала 95
лимоннокислое 383
молочнокислое 378, 383
спиртовое 94, 95, 433 сл.
Бромадамантан 547
Бромангидриды кислот 158, 164, 177
Бромацетилацетоп 3952-Бромбутан 246Зст-Бромвалериановая (З-бром-З-метил-
пентановая) кислота 364
Бромгидрины 101а-Бромизовалериановая кислота, уреид■ (Бромурал) 348
Бромирование 66, 71, 135, 158, 177
Бромкамфенилон 532, 533
у-Броммасляная кислота, нитрил 509
3.-Бром-3-метилпентановая (Зо-бромвале-
риановая) кислота 364
Бромноркамфора 532
Бромоформ 1373-Бромпропен-1 (Аллил бромистый) 283
Бромпропионовая кислота 470этиловый эфир 368N-Бромсукцинимид 188, 255, 533, 548
Бромтриптицен 533Бромурал (а-Бромизовалериановая кис¬
лота, уреид) 348
а-Бромциклопеитадиенои 548
Бромэтен (Винил бромистый) 262, 283
Бромэтин (Монобромацетилен) 283
Бульвален (Трицикло[3,3,2,0]декатриен-
2,7,9) 550
Бутадиен-1,2 (Метилаллен) 267
Бутадиен-1.3 (Дивинил) 267 сл.
гидрирование 268, 272
ди- и тримеризация 273, 275, 512,
536молекулярная диаграмма 233
полимеризация 273 сл., 282
получение 99, 101, 253, 259, 269 сл.
промышленный синтез 265, 269 сл.
реакции 105, 272
резонанс структур 237
спектры поглощения 580
экзальтация молекулярной рефракции
329энергия резонанса 321
Бутадиен-акрилоиитрильные (бутадиен-
нитрильные) каучуки 282
Бутадиеновый каучук 263. 275, 282
Бутадиен (Диацетилен) 278, 279
Бутан 56, 58, 59, 63
дегидрирование 270
конформации 480, 481, 495, 496
модель Стюарта-Бриглеба 335
окисление 65физические свойства 58, 59
Бутаналь (Масляный альдегид) 41, 121,
291, 551Бутандиаль (Янтарный диальдегид) 143,
, 1461,4-Бутандикарбоновая кислота см.Адипиновая кислота
Ъутандикислота см. Янтарная кислота
Бутандиол-1,4 (Тетраметиленгликоль)
100, 101, 270
Бутандион-2,3 см. Диацетил1-Бутанкарбоновая кислота см. Валериа¬
новая кислота
Бутановая кислота см. Масляная кисло¬
таБутанол-1 (Бутиловый спирт первичный,
н-Пропилкарбинол) 38, 92
Бутанол-2 (Бутиловый спирт вторичный,
Метилэтилкарбинол) 38, 92, 357,
368Бутанон-2 см. Метилэтилкетон
Бутантетраол-1,2,3,4 (Эритрит) 105
Бутен-1 см. а-Бутилен
Бутен-2 см. Псевдобутилен
втор-Бутил иодистый 400
трет-Бутилбромистый 547
гидроперекись 190, 191, 548
перекись 190, 191, 194, 587
хлористый 77
трет-Бутилазид 77 'н-Бутиламин 208
н-Бутилацетат 38, 161
а-Бутилен (Бутен-1, Этилэтилен) 245
Y-Бутилен см. Изобутилен
н-Бутилены 259н-Бутилкарбинол см. Пентанон-1
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ593агор-я-Бутилкарбинол см. 2-Метилбута-
нол-1трет-Бутилкарбинол см. Неопентиловый
спирт
Бутилкаучук 282
Бутиллитий 78, 286
ч-Бутилмеркаитан 195
Бутиловый спиртвторичный см. Бутанол-2
первичный см. Бутанол-1
третичный см. 2-Метилпропанол-2
Бутиловый (ди-м-бутиловый) эфир 114,
115трет-Бутилпербензоат 191
грет-Бугилперстеарат 191
трет-Бутилфторацетилен 539
/■рет-Бутилхлорид 485, 486
■грет-Бутилэтилперкарбонат 191
Бутин-1 (Кротонилен, Этилацетилен) 259
Бутин-2 (Кротонилен, Диметилацетилен)
259, 539
тримеризация 264
Бутин-2-диол-1,4 101, 293
получение 265
реакции 270, 278
и-Бутирамнд 169
Бутираты 159, 161
н-Бутирил хлористый 165
у-Бутнролактон 380
Бутирон 120
Бутиронитрил 170Вазелин 62Валентная таутомерия 538, 544Валентность 16Валентныеизомеры 539 сл.
колебания 574 сл.состояния углерода 213, 242, 243, 244
углы 118, 332, 493— искажение 336, 337, 538
н-Валерамид 169Валериановая (пептановая, 1-бутанкар-
боновая) кислота 152
эфир 161«-Валериановый альдегид (Пентаналь)41, 121Валериановый ангидрид 167
н-Валерил хлористый 165
Валерилены 259
Валеронитрил 171
Валин 456, 460, 466, 476
Вальденовское обращение 369,469, 470,
518, 532Вандерваальсовы радиусы 334, 335, 749
Веронал (Диэтилбарбнтуровая кислота)
348
Винилбромистый (Бромэтен) 262, 283
иодистый (Иодэтен) 283
хлористый (Хлорэтен) 261, 282 сл.,
285 сл., 327— мезомерный эффект 285 сл.— полимеры и сополимеры 288, 291
Винилацетат 262, 290сополимеры с хлористым винилом
288, 291Винилацетилен 263, 271, 277, 278
Винилбутиловый эфнр 292Винилиден хлористый (1,1-Дихлорэтен)
282, 283, 285, 288
Винилкетоны 296
Винилмагнийгалогениды 288
Виниловые эфиры 290 сл.
гидролиз 176
полимеризация 290 сл.
таутомерный эффект 176
Виниловый спирт 289 сл.Винилогля 312 сл.Винилтриметиламмония гидроокись 342
Винилуксусная кислота 307
Винилэтинилдиалкилкарбинолы 278
Виннокаменная кислота 383
Винные (диоксиянтарные) кислоты D- и
L- 355, 364 с л., 383, 422, 498
конфигурация 360 сл.
мезовинная 354, 361, 366, 369, 422,498
оптическая изомерия 354, 365 сл.
разделение антиподов 366
рацемическая (виноградная) 355, 366,
385установление строения 382
физические свойства 355
Винныйкамень 361спирт см. Этиловый спирт
Виноградная кислота 355, 366, 385
Виноградный сахар см. Глюкоза
Вискоза 452Вистанекс {Изобутилен, полимер) 256
Витамины
А 580
В |2 337С (Аскорбиновая кислота) 430, 431
Вишневый клей 455Водород в органических соединениях 43,
44 .Водородные связи 91, 115, 119в карбоновых кислотах 153, 154, 338
в спиртах 91изучение методом ЯМР 557
сдвиг в ИК-спектрах 578
теплота образования 91
Водяной газ 127
Волновая функция 220 сл.Восстановление (см. также Гидрирова¬
ние)нитрилов 210, 212
оксимов 210
по Буво 94по Кижнеру — Вольфу 130, 133, 535,
546по Клемменсену 130, 511
по Меервейну—Понндорфу 104, 126,
128Вращательные спектры 568
Вращениевнутреннее в молекуле 479 сл., 557
плоскости поляризации 361 (см. так
же Поляриметрия)Вулканизация 279, 280Галактаны 453Галактаровая (слизевая) кислота 355
376, 519
Галактоза 412, 444, 453, 454
конфигурация 428
окисление 376, 45320 Зак. 882
594ПРЕДМЕТНЫЙ УКАЗАТЕЛЬГ алактозаспиртовое брожение 433
физические свойства 445
Галактозамин 4314-(р-Галактозидо)-глюкоза см. Лактоза
Галактозилглюкоза, ортоэфир 455
Галактоновая кислота 355, 376
4-(P-D-r алактопиранозил) -D-глюкоза
см. Лактоза
6- (a-D-Г алактопиранозил) -a-D-глюко-
пиранозил-|3-£>-фруктофуранозид
(Рафиноза) 444
Галактуроновая кислота 453, 454
Галогенкарбены 78, 524, 536
Галоидалканы 70 сл.
гидролиз 74, 75, 78
номенклатура 70 /получение 71 сл.• реакции 74 сл.физические свойства 72 сл.
Галоидангидриды карбоновых кислот
164, сл., 312, 313
Галоидгидрины (Спирты галоидзаме-
щенные) 99, 101
Галоидпроизводиые предельных углево¬
дородов см. Галоидалканы
Галоформы 78, 137Гамметта функция кислотности 148 сл.
Гексагидрофталевая кислота 537
Гексадекан 58, 651-Гексадеканкарбоновая кислота см.Маргариновая кислота
Гексадекановая кислота см. Пальмити¬
новая кислота
Гексадиен-1,5 (Диаллнл) 267, 268, 269
Гексадиеналь 276Гексакозановая кислота см. Церотино-
вая кислота
Гексаметилбензол 264, 539
Г екса метилбицикло[2,2,0]гексадиен (Гек-
саметилдъюаровский бензол) 264
Г ексаметилендиамин (1,6-Диаминогек-
сан) 212, 543
Гексаметилентетрамин см. Уротропин
Гексаметилпризман 539
Гексан 57, 58, 59азеотропная смесь 34
октановое число 65
Гексаналь (Капроновый альдегид) 1211,6-Гександикарбоновая кислота см.Пробковая кислота
Гександикислота см. Адипиновая кисло¬
таГександион-2,5 (Ацетоиилацетон) 143,
1461-Гексанкарбоновая кислота см. Энанто-
вая кислота
Гексановая кислота см. Капроновая кис¬
лотаГексанол-1 (я-Гексиловый спирт, я-
Амилкарбинол) 38, 93
Гексатриен 580Гексатриин (Триацетилеи) 278
Гексахлорэтан 70
Гексил йодистый 412
н-Гексиламин 208к-ГексилоЕый спирт см. Гексанол-1
Гекситы см. Спирты шестиатомные
Гексоген (Циклонит) 130
Гексозы 412 сл.Г ель-хроматография (Г ель-фильтрация)
42Гея-заместители 385
Гемицеллюлозы 446, 453 сл.Генцианоза 444
Генциобиоза 445, 446, 557
Гепарин 431
Гептадекан 581-Гептадеканкарбоновая кислота см.
Стеариновая кислота
Гептадекановая кислота см. Маргарино¬
вая кислота
Гептадная таутомерия 398
к-Гептан 57 сл.азеотропная смесь 34
октановое число 64, 65
Гептаналь см. Энантовый альдегид1,7-Гептандикарбоновая кислота см.Азелаиновая кислота
Гептандикислота см. Пимелиновая кис¬
лота1-Гептанкарбоновая кислота см. Капри-
ловая кислота
Гептановая кислота см. Эиантовая кис¬
лотаГептаиои-4 (Дипропилкетои) 122
Гептозы 412
Геранилхлорид 300
Гераниол 292, 293
окисление 299
Гербициды 349
Гетеролиз 23Гетеролитическая реакция 23, 119, 253,
299Гетеролитический разрыв связи 23 cjl,
124Гетерологический ряд 15
Гетерополисахариды 446
Гетерофункциональные соединения 15
Гетероциклические соединения 51, 52
Гибридизация атомных орбиталей
237 сл., 243
Гиднокарповая кислота 516
Гидразиды кислот 172
Гидразоны 130, 131, 132
циклические 504
Г идракриловая (Р-оксипропиоНовая)
кислота 355, 374
Гидратцеллюлоза 451
Гидридное перемещение 102, 125, 133,
252, 541 сл.Гидриндан (Бицикло[3,4,0]нонан) 530
Гидрирование (см. также Восстановле¬
ние)алициклических соединений 505, 506
ароматических конденсированных си¬
стем 528ароматических соединений 512, 516,
525ацетиленов 261, 271
бурых углей 63
гидрохинона 518
малеиновой кислоты 184
нафталина 528, 530
олефинов 247
теплота реакции 321
фенола Е>18
Гидроксамовые кислоты 172, 206, 210
Гидроксиламин 172, 206, 210
Гидроксоиий-катиои 21, 119
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ595Гидролиз
белков 455виниловых эфиров 176
галоидпроизводных алканов 74, 75,
78],3-дихлорадетона 407
жиров 159, 162
крахмала 447, 449
нитрилов 155, 171, 183, 216
полисахаридов 439 сл., 448 сл.
сложных эфиров 159, 174
ферментативный 444, 447, 448
целлюлозы 449, 451
Гидроперекиси 64, 190 сл., 311ацетила (Надуксусная, Перуксусная
кислота) 190, 191, 194, 200
ацилов 190, 191, 377
г/?ег-бутила 190, 191, 548
дивинилметанов 272
метила 191формила (Пермуравьиная кислота)
191этилового эфира 192
Гидрохинон 296, 518
Гиперконъюгация см. о,я-Сопряжение
Гиппуровая кислота (Бензоилгликокол)
462Гипсохромное смещение 581
Гистидин 457
Гликоген 446, 447, 451
Гликозидная связь 439, 442, 520
Гликозидный гидроксил 416, 442, 443
Гликозидогликозиды 440
Глнкозиды 414, 428, 429
Гликокол см.' Глицин
Гликолевая кислота 145, 354, 379, 385
получение 374
строение 381
физические свойства 355
Гликолевый альдегид 292, 407
Гликоли {Спирты двухатомные) 90, 100 сл.
алициклические 541
ацеталирование 102
взаимодействие с борной кислотой
108дегидратация 102
окисление 102, 407
получение 100 сл., 251
реакции 101, 102
хлоргидрины 101, 249
Гликолид 379Глиоксаль (Этандиаль) 102, 143
восстановление 407
присоединение воды 145
Глиоксиловая кислота 315, 385 сл., 467
Глифталевые смолы 105
Глицериды 162, 310Глицерин (Пропантриол-1,2,3) 29, 90,
103 сл.
в фосфатидах 310
дегидратация 292нитрат (Нитроглицерин) 105, 110, 452
окисление 407
пиролиз 295
получение 103 сл.
промышленный синтез 104, 255
реакция с борной кислотой 108, 427
сложные эфиры (Глицериды) 162,310
Глицериновая кислота 376, 409, 467
фосфорный эфир 434 сл., 438Глицериновый альдегид 105, 407 сл.
наращивание цепи 408
озазон 411
озон 411относительная и абсолютная конфи¬
гурации 3(30 сл., 417 сл.D- р L-формы 417, 421 сл.
фосфат 434 сл., 438
Глицероза (Акроза) 408
Глицидиые кислоты (ц,р-Эпоксикисло-
ты) 377
Глицидный спирт 105
Глицин (а-Аминоуксусная кислота, Гли-
кокол) 455, 456, 457, 465, 475 сл., 477
алкилироваиие 463
ацилирование 462
медная соль 468, 471
Глутамин 456Глутаминовая кислота 456, 466, 475'
сл.Глутаровая кислота (Пентадикислота,1,3-Пропандикарбоновая кислота)
182, 183, 184, 466
ангидрид 188
синтез 187эфиры, конденсация 510
Глутатион 434, 475, 476
Глюкаровая кислота см. Сахарная кис¬
лотаГлюкоза (Виноградный сахар) 94, 104,412, 419 сл., 429, 444 сл.
ацилирование 444
в составе полисахаридов 447 сл.
в цикле Кребса 437
восстановление 430
гель-хроматограмма 42
конфигурации 427, 428
конформации 426 сл.
масс-спектры производных 555
окисление 376спиртовое брожение 433 сл.
физические свойства 445
фосфорилирование 434
Глюкозамин 431, 453
4-(а-Гдюкозидо)-глюкоза см. Мальтоза
4-(р-Глюкозидо)-глюкоза см. Целлобио-
заа,а-Глюкозидоглюкозид см. Трегалоза
u-Глюкозидо-р-фруктозид см. Сахароза
Глюкозид 414
Глюкокиназа 434
Глюконовая кислота 355, 376
4- (а-Глюкопиранозил)-О-глюкоза см.
Мальтоза4- (P-D-Глюкопиранозил) -D-глюкоза см.Целлобиоза1-(а-0-Глюкопиранозил)-а-0-глюкопи-
ранозид см. Трегалоза
(6- (p-D-Глюкопиранозил) -a-D-глюколи-
ранозидо-р-/)-фруктофуранозид
(Генцианоза) 444
(a-D-Глюкопиранозил) -P-D-фруктофу-
ранозид см. Сахароза
4-[4-Р-£)Тлюкопиранозил)-(Ю-глюкопи-
ранозил]-0-глюкопираноэа (Цел-
лотриоза) 444, 449, 451
Глюкуроновая кислота 429, 454
Гомеополярные вещества 20
Гомоадамантил-катнон 548
Гомолиз 24
596ПРЕДМЕТНЫЙ УКАЗАТЕЛЬГомолитические реакции 24, 299
цепные инициированные 194, 202
Гомологическая разность 13
Гомологические ряды 19
Гомология 12 сл.Гомополисахарнды 446
Горчичные масла (Изотиоцианаты) 353,
354аллиловое 354
Гофмана расщепление 212, 247
Грамицидин 476
Графит 336
Гремучая кислота 352
Гремучая ртуть 352, 353
Грнньяров реактив (см. также Магний-
органические соединения)
в синтезе оксосоединений 126
реакции с альдегидами и кетонами 94,
128, 357, 369, 488, 513— с лактонамн 381— с непредельными оксосоединениями276, 298, 399— с ортоугольным эфиром 345
Гуанидин 344, 350, 351, 520
Гулозы 424, 429, 445
Гулоновая кислота 429
Гуммиарабик 454
Гурдинамит 110Гуттаперча 281Двойная связь 16, 20, 230, 242 сл.
передвижение 308
семициклическая 330
сопряжение 268, 274, 294, 295
Двуокись углерода в фотосинтезе 438
Дегидратацияалициклнческнх спиртов 523 сл.
амидов 169, 170
аммониевых солей 168, 170
глнколен 102.
глицерина 292
поливинилового спирта 276
спиртов 98, 113, 246 сл., 270, 523
Дегидрирование (Дегидрогенизация)
алканов 66, 69, 270
глнколей 143
спиртов 98, 123
циклопарафинов 511, 517
Дегидрогеназа 434, 436
Дегидроциклизацня 'алканов 511
Деградация (деструкция) молекул 19,
320, 551 сл.Дезаминирование 5232-Дезоксиальдозы 432
6-Дезоксигалактоза (Фукоза) 4322-Дезокси-£)-рибоза 432
Дезоксирибонуклеиновые кислоты 432
Дезокснсахара 432
Дейтеробензол 256-Дейтерометил-2,3,4-триметилглюкоза5564-Дейтерометил-2-3,6-триметилглюкоза556Дейтерохлороформ 25
Дейтерохлорэтилен 286
\-Декалактон (\-Деканолид) 309, 381
Декалин (Бицикло[4,4,0]декан) 530
изомерия 530 сл.
конформации 530, 531
Декалолы 531Декан 57, 58, 65Декандикислота см. Себациновая кис¬
лотаN-Деканоилпролил-аланнл-аланил-валин,
метиловый эфир 553, 554
Деканолид (Декалактон) 309, 381
Декарбоксилаза 436
Декатетраен 580
Декстраны 43, 453
Декстрины 447
Депрессия молекулярная 49
Деструкция (деградация) органических
соединений 19, 320, 551 сл.
Детонация 64
Дефлегматоры 26, 31
Деформационные колебания молекул
574, 576 сл.Диадамантан 547
Диадная прототропия 398
Диазирины 220
Диазоаминобензол 282
Дназокетон 219
а-Дназокислоты 463
Диазометан 216 сл.
получение 350присоединение по двойной связи 508,
509реакции 218 сл., 524, 535
строение 217
Диазосоединения жирного ряда 216 сл.в синтезе циклогептатриена 536
Диазоуксусный эфир 217, 507, 509, 536
Диалкилборные кислоты 150
Диалкилдихлорсиланы 109
Диалкилсульфаты 111
Диалкилсульфиды см. Тиоэфиры
Диалкилфосфиновые кислоты 150
Диаллнл (Гексадиен-1,5) 267, 268, 269
Диальдегиды 142 сл.Диамилсульфид 1961,6-Днаминогексан (Гексаметиленди-
амин) 212, 5431.2-Диаминопропан 212
Диамннопропионовая кислота 4691.2-Днаминоэтан см. Этилендиамнн
Диамины 212 сл., 352Диастазы (Ферменты солода) 95, 447
Диастереомерия 364 сл., 471
моносахаридов 408, 418
Диастереомеры 365 сл., 377
удельное вращение 583
Диацетимид 169Диацетил (Диметилглиоксаль, Бутан-
дион-2,3) 143, 145 сл., 309
Диацетилен (Бутадиин) 278, 279
Диацетилянтарный эфир 144
Диацетонамин 297
Диацетониды 430
Диацетоновый спирт 137, 408
Диациламины (Имиды) 302
Дибромацетальдегид, ацеталь 2931.4-Дибромбутан 5031.5-Дибромпентан 5092.2-Дибромциклодеканон 5442.2-Дибромциклононанон 5441.2-Дибромэтан, конформации 481, 4821.2-Дибромэтилен 283
Ди-к-бутиловый (бутиловый) эфир 114,115Ди-грег-бутилперсукцинат 191
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ597Дибутилсульфид 196
Дивинил см. Бутадиен-1,3
Дивинилацетилен 263, 277, 278
Дивинилметан (Пентадиен-1,4) 267, 268,
272гидроперекись 291
Дигалогенкарбены 78, 214, 524
Дигалогенмалеиновый ангидрид 504
Дигалоидалканы 78
Дигептилсульфид 196
Диглим (Диэтиленгликоль, диметиловый
эфир) 117
Диеновые углеводороды 267 сл.
перекиси 274полимеризация 272, 274 сл., 282
получение 268 сл.1,4-присоединение 272 (см. также Ди¬
еновый синтез)
реакции 272 сл.с сопряженными двойными связями268, 269 сл., 272 сл.
циклизация под действием ультра¬
фиолетового облучения 504
Диеновый синтез 273, 306, 310, 504, 512
Диенофилы 274, 306, 339
Диизокротил (2,5-Днметилгексадиен-2,4)
267Диизопропенил (2,3-Диметилбутадиен-
1,3) 267, 329
Диизопропилкетон (2,4-Диметилпента-
нон-3) 122Диизопропиловый (ди-втор-пропиловый)
эфир 113 сл.Диизоцианаты 352Дикарбоновые кислоты 181 сл., 314 сл.,
510, 533, 534
нитрилы, конденсация 510, 534
Дикетен 302Дикетогулоновая кислота 430
Дикетоны 142 сл.
енолизация 146
реакция Михаэля 297, 298
Г-эффект 176
Дикетопиперазины 464 сл., 471
Димедон (1,1-Диметилциклогександион-
3,5) 521, 522
Димезитиленкобальт 264
Диметиламин 207, 2082-Диметиламиноэтанол 341
Диметиламмоний, соль 208, 209, 211
Диметилацетамид 211
Диметилацетилен см. Бутин-22.2-Диметил-1 - (4'-бромциклогексил) -4-
(2"-бромциклопропил)-бутан 4922.3-Диметилбутадиен-1,3 (Диизопропе¬
нил) 267, 3292.3-Диметилбутандиол-2,3 (Пинакон, Те-
траметилэтиленгликоль) 100, 1023.3-Диметилбутанон-2 см. Пинаколин
Диметилбутаны 59
Диметилвинилкарбинол 2712,5-Диметилгексадиен-2,4 (Диизокротил)2672.3-Диметилгексан 65
Диметилглиоксаль см. Диацетил
Диметилглиоксим 136, 142, 1452.3-Диметилглюкоза 449, 450
Диметилдициклогексил 526
Диметилкарбинол см. ИзопропиловыйспиртДиметилкарбонат 344
Диметилкетен 301
Диметилкетон см. Ацетон
Диметилнитрозамин 567
Диметиловый (метиловый) эфир 19, 114,
1152.4-Диметилнептаио11-3 (Диизопропилке¬
тон) 122Диметилпентаны 592,2-Диметилиропанол-1 см. Неопентило-
вый спирт
Диметилсульфат 21, 111
метилирование биоз 441
Диметилсульфид 22, 196
Диметилсульфоксид 24, 197
Диметилсульфон 22
Диметилформамид 24, 169
Диметилфульвен 326, 514
1,1 -Д иметилциклогександион-3,5 (Диме¬
дон) 521, 522
Диметилциклогексаны 499 сл., 516, 517
Диметилциклопропан 4971.1-Диметилэтилен см. Изобутилен1.2-Диметилэтилен см. Пс.евдобутилен
Диметилэтилкарбинол см. 2-Метилбута-нол-2Диметилэтинилкарбинол 2711.2-Диметоксиэтан см. Этиленгликоль,.
диметиловый эфирДинамит 110Динамический эффект сопряжения см.Таутомерный эффект
Динатриймалоновый эфир 1862.4-Динитроанилин 150
Динитробензол 581
Динитроэтан 206
Диозонид 193Диоксаны 114, 116, 118, 253комплексы с солями тяжелых метал¬
лов 119
спектр ЯМР 560
Диоксиацетон 105, 407, 4382,6-Диоксикапроновая кислота 466
Диоксимасляные кислоты 376
Диоксиперекиси 193
■у-Диоксисоединения 144
Диоксиянтарные кислоты см. Винные
кислоты
Диоксосоединения 142 сл.
восстановление 144
диоксимы 145
получение 142 сл.
реакции 144 сл.Дипентен 273, 512
Дипептиды 464, 471 сл.Диперекиси альдегидов и кетонов 193
Дипольные моменты 323 сл., 574
геометрических изомеров 317
Ди-н-пропиламин 208
Дипропилкетон (Гептанол-4) 122
Ди-«-пропиловый (пропиловый) эфир 114
Ди-вгор-пропиловый (диизопропиловый)
эфир 114, 115
Дипропилсульфид 196
Диродан (Родан) 353
Дисахариды (Биозы) 412, 439 сл.
гидролиз 439, 440
окисление 443
спиртовое брожение 433
а- и р-стереоизомеры 440
598ПРЕДМЕТНЫЙ УКАЗАТЕЛЬДисахаридыфизические свойства 445
фрагментация 557
Диспропорционирование циклогексеиа
517Дисульфиды 195 сл., 280
Дитиоугольная кислота, соль 346
Дифениламин 452
Дифенилизобензфуран 515
Дифосген 343Дифракционные методы анализа 330 сл.
Дифторкарбен 78
Дифторхлорметан 2841.1-Дифтордиклогексан 496
Дихлоральмочевина 3491,3-Дихлорацетон 105, 407
Дихлоргидрины 105Ди-Р-хлордиэтиловый эфир (Хлорекс)
250Дихлоркарбен 78, 214, 524
Дихлорноркаран 5241.2-Дихлорпропан 1031.3-Дихлорпропанол-2 1031.1-Дихлорэтан (Этилен хлористый) 70,
73, 78аммонолиз 212
конформации 481, 4821.1-Дихлорэтен см. Вииилиден хлористый1.2-Дихлорэтен (Дихлорэтилен) 261, 283,
284 сл.геометрическая изомерия 246, 317, 318
Дициан см. Щавелевая кислота, нитрил
Дициклогексилкарбодиимид 350, 465, 474
Дициклогексилизомочевина 474
Дициклогексилмочевина 474
Дициклопентадиен 514
Диэлектрическая проницаемость раство¬
рителей 24, 38
Диэтаноламин 117, 341
Диэтил а мин 208Диэтилбарбитуровая кислота (Веронал)
348Диэтиленгликоль 116диметиловый эфир (Моноглим) 117
Диэтилкарбинол (Пентанол-3) 93
Дйэтилкарбонат 344
Диэтилкетон (Пентанон-3) 122
Диэтнловый (этиловый, серный) эфир11, 112 сл.,гидроперекись 192
окисление 115
применение 1L5эбуллиоскопическая константа 50
элюирующая способность 38
Диэтилсульфат 111
Диэтилсульфид 1961.2-Диэтоксиэтан (Этиленгликоль, диэти-
ловый эфир) 114Додекан 57, 58
Додекандикислота 184
Дрожжи 95Дуалистическая электрохимическая тео¬
рия 13, 14
Дульцит 106
Дыхание клеточное 433
Дьюаровский бензол 264Енины 277 сл.
Енолаза 435Енолизация 134, 144, 176, 298, 387 сл.,394Еноляты металлов 401, 402, 405Жиры 162, 308 сл.ЗаконАвогадро — Жерара 12, 14, 49
Бера 569
Гесса 82, 320
Гука 574
действия масс 80
Кирхгоффа 83
Ламберта 569
Рауля 49, 51
Замещениенуклеофильное см. Нуклеофильное за¬
мещение
электрофильное 319
Зарин 342Заслоненная (эклиптическая) конформа¬
ция 479, 480, 495
Защита аминогруппы 471 сл.Зимаза 95, 433Идит 106
Идозы 423, 445
Изатии 392
Изоамилацетат 161а-Изоамилен (З-Метилбутен-1, Изопро-
пилэтилен) 245, 271
Р-Изоамилен (2-Метилбутен-2, Триметил-
этилен) 245
Изоамилмеркаптан 195
Изоамилнитрит 109
Изоамиловый спиртвторичный см. З-Метилбутанол-2
оптически активный см. 2-Метилбу-
та нол-1первичный см. З-Метилбутанол-1
Изобарно-изотермический потенциал
(Свободная энергия при постоян¬
ном давлении) 81
Изобутан 56, 63, 252модель Стюарта — Бриглеба 335
физические свойства 591-Изобутанкарбоновая кислота см. Изо-
валериановая кислота
Изобутилен (у-Бутилен, 2-Метилпропен,1,1-Диметилэтилен) 245 сл.
полимеризация 256 сл.
получение 264
применение 256, 259
реакции 248, 253, 256, 271
физические свойства 245
Изобутилкарбинол см. З-Метилбутанол-1
Изобутилмеркаптан 195
Изобутиловый спирт первичный см.2-Метилпропанол-1
Изобутирил хлористый 165
Изобутиронитрил 170
Изовалериановая (3-метилбутановая, 1-
изобутанкарбойовая) кислота 152,
466Изовалериановый альдегид (2-Метилбу-
таналь) 41; 121
Изовалерил хлористый 165
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ599Изокапроновая кислота 466
Изокротоновая (цис-fi-метил акриловая)
кислота 304, 317, 376
Изолейцин 456
Изолимонная кислота 437
Изологи. 51
Изологический ряд 13
Изомасляная (2-метилпропановая, 2-про-
панкарбоиовая) кислота 152
Изомасляный альдегид (2-Метилпр.опа-
наль) 41, 121
Изомераза 434Изомеризация циклов друг в друга
522 сл.Изомериявалентная 538геометрическая 200 сл., 244, 245 сл.,
315 с л., 354, 498
декалинов 530 сл.
нитрозосоединений 200
оптическая см. Оптическая изомерия
спиртов 89фумаровой и малеиновой кислот 315
сл.циклических соединений 317, 519, 526
экваториально-аксиальная 531
Изомерывалентные бензола 539
вращения (конформеры) 246
поворотные 480
структурные 56, 57
трео-эритро- 376, 377
цис-транс 200 сл., 245 сл., 281, 315
экзо-эндо- 530
Изонитрилы (Карбиламины) 211, 214 сл.,
216Изонитрозокетоны 143
Изооктан (2,2,4-Триметилпеитан) 64, 65,
256, 259
октановое число 65, 256
Изопентаи 51, 56
нитрование 68
получение 63
физические свойства 59
Изопрен (2-Метилбутадиен-1,3) 253, 267
ди- и полимеризация 273, 275, 512
получение 269, 271 сл., 281
реакции 300
экзальтация 329
Изопреновый каучук 275, 277, 281, 373
Изопреноиды 276, 292, 299
Изопропенил хлористый (2-Хлорпропен-1)
283Изопропенилциклопропан 507
Изопропилацетилен (З-Метилбутин-1, Ва-
лерилеи) 259
Изопропилбензол см, Кумол
Изопропилкарбинол см. Изобутиловый
спирт первичный
Изопропилмеркаитаи 195
Изопропиловый спирт (Пропиловый
спирт вторичный, Диметилкарби-
нол, Пропанол-2) 89, 92, 94, 99,
ИЗ, 259
реакции 104, 124, 126, 128
Изопропилциклобутан 497
Изопропилциклопропан 507
Изопропилэтилен см. а-Изоамилен
Изотактические полимеры 258, 373
Изотомочевина 351Изотиоцианаты (Горчичные масла) 353,
354Изотиурониевые соли 351
Изотопный эффект 125
Изохорно-изотермический потенциал 80,
81Изоциановая кислота, эфиры (Изоциа¬
наты) 209, 353
Изоциклические соединения 52
Изоэлектрическая точка 462
ИК-спектрьг 568 сл., 574
применение 577 сл.Имидхлориды кислот 171
Имиды (Диациламины) 302
Имино-енаминная таутомерия 397
Иминокислоты 477 сл.Иминоэфиры 171
Инверсия антиподов 357
Ингибиторы окисления (Антиоксиданты)
296Индекс свободной валентности (F) 233
Индексы Миллера 332
Индуктивный эффект (Индукционный,
/-Эффект) 76, 77, 180, 181, 207, 334,
396, 397, 484- в аминах 207
в диазоалканах 217
в олефинах 248, 276
гидроксильной группы 378
нитрогруппы 203, 207
Инициаторы цепных реакций 194
полимеризации 256, 296
Инкременты кратных связей 329
Инозиты 519, 520
Инсектициды 202, 349
Инсулин 447, 455
Инулин 446, 448
Иодангидриды кислот 164
Йодоформ 137З-Иодпропен-1 (Аллил иодистый) 283
Иодэтен (Винил иодистый) 283
Ионная теория строения 13, 20
Иононы 301
Иприт 364
Ирон 301Искусственное волокно 452
«ИФК» 349Кадаверин 213
Калийсукцинимид 188
Кальцекс см. Уротропин
Камеди 446, 454
Камфан 547
Камфен 50
Камфенилон 532, 533
Камфенилоновая кислота 533
Камфора (1,7,7-Триметилбицикло[2,2,1]-
гептанон-2) 50, 493, 511
оптическая изомерия 532
Камфорная кислота 511
Канонические структуры 173, 235
Канцеролитичеекие средства 341
н-Капрамид 169Каприловая (октановая, 1-гептанкарбо-
новая) кислота 41, 152
Каприловый альдегид (Окганаль) 121
Каприновая кислота 41
Капролактам 461, 47С, 518, 521
Капролактон 521
600ПРЕДМЕТНЫЙ УКАЗАТЕЛЬКапрон (Найлон-6) 212, 455, 476, 518,
521Капроновая (гексановая, 1-пентанкарбо-
новая) кислота 41, 152, 521
ангидрид 167
Капроновый альдегид (Гексаналь) 121
Каран 528Карбамид см. Мочевина, ^
Карбаминовая кислота (349/
гидразид 351
Карбамоил хлористый 344
Карбены 219, 524галоидзамещенные 78, 214, 524, 536
реакции 503, 507, 528, 536
Карбиламины (Изонитрилы) 211, 214 сл.,
216Карбииол см. Метанол
Карбитолы 117
Карбкатионы 252
Карбодиимиды 350, 465, 474
Карбоксилат-анион 174
Карбоксильная группа 151, 152, 173
Карбонат-анион 173, 174
Карбонилкобальта 254
никеля 156, 264хлористый (Фосген) 164, 177, 343
Карбонилирование 156
Карбонильная группа 120, 123, 153, 180
поляризуемость 123
характеристические частоты ИК-спек-
тров 578Карбоновые кислоты 151 сл., 302 сл.,
308 сл., 314 сл., 338 сл., 515 сл.
азиды 172амиды см. Амиды карбоновых кислот
ангидриды 166 сл.
ацетиленовые 338 сл.
водородные связи 153, 183
высшие непредельные 308 сл.
галоидангидриды 164 сл.
галоидзамещенные 177 сл.
гидразиды 172двухосновные 126, 181 сл„ 314 сл., 338,
509, 533
иминоэфиры 171индуктивный эффект 180 сл., 313
константы диссоциации 153, 154,
179 сл., 182, 314, 316
мезомерия 174 сл., 181
непредельные 302 сл.
нитрилы см. Нитрилы
номенклатура 151, 152, 182
окисление 158, 376 с л.
причины кислотных свойств 173 сл.
распределение заряда в анионе 173,
174сложные эфиры см. Сложные эфиры
соли 159 сл., 515— дегидратация 170— пиролиз 157, 170, 509, 513, 533— электролитическая диссоциация159, 1737-эффект 176
удлинение цепи 156
физические свойства 153, 182
функциональные производные 158 сл.
хлорангидриды см. Хлорангидриды
циклопентанового ряда 515 сл.
этерификация 97 сл., 160 сл.Карены 528
Каротиноиды 525
Каротины 277, 580, 582
Катализаторы
аммонолиза 256
асимметрического синтеза 368
гидратации 339гидрирования-дегидрирования 269,
339, 512, 513, 516 'дегидратации 246, 517
дегидрирования-окисления 69, 154,
270, 315, 517
изомеризации и крекиага 66, 523, 524
карбонилирования 156
Лебедева 269
Циглера 275, 374, 536
Каталитический крекинг 66
Катионотропия 395
Катионы 21, 77адамантилметил 548
адамантоний 547
аллильный 287
ацилиевый 165
гидроксоний 21, 119
гомоадамантил 548
диазоний 217
норкамфана 547образование при масс-спектрометрии
551сульфоксоний 197
сульфоний 196
циклодецил 542
каучук (и) 279 сл., 373
бутадиен-акрилонитрильный 282
бутадиеновый 263, 275, 282
бутилкаучук 282
вулканизация 279, 280
изопреиовый 275, 277, 281, 373
натуральный (цыс-Полиизопрен) 275,
279 сл., 373
озонирование 281
рентгеноструктурный анализ 338
синтетические 99, 101, 259, 282 сл., 306
строение 281хлоропреновый 263, 278, 282
Качественный анализ органических со¬
единений 43 сл.Квадрупольный резонанс 558
Квантовые числа 222
Кверцит 518, 519
Керосин 62, 514
Кетазины 131
Кетали 130
Кетены 167, 306 сл.образование 142, 218, 301, 521
реакции 290, 402, 508, 509
Кетогексозы 413, 415
а-Кетоглутаровая кислота 436, 437
а-Кетогулоновая кислота 430
Кето-енольнаятаутомерия 387 сл., 400, 52Г
триада 403
Кетоксимы см. Оксимы
Кетонное расщепление 391, 511
а-Кетонокислоты 383, 384, 385 сл.
Р-Кетонокислоты 387 сл., 510 сл., 533
получение 385 сл., 510
таутомерия 387 сл.
эфиры 298, 387, 405 сл., 510
у-Кетоиокислоты 387
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ601Кетоны 120 сл., 295 сл., 508, 521 сл.
бисульфитные соединения 129
бициклические 529восстановление по Меервейну — Поин-
дорфу 126, 128
галоидирование 130, 136
действие азотистой кислоты 136
координационные соединения с алко-
голятами алюминия 125
мезомерный сдвиг 124, 135
метилирование по Нефу 135
непредельные 295 сл.
номенклатура 120, 121
окисление 133 сл., 154, 184
отличие от альдегидов 133, 298
реакции замещения 130 сл., 133 сл.— присоединения 127— с диазометаном 218
7':эффект 176
физические свойства 122
циклические 508, 521 сл., 529, 532, 534Кетопентозы 413
Кефалины 310, 342
Кислородбирадикал 190открытие в органических соединениях
43, 47Кислотное расщепление 391
Кислотно-основной катализ 205
Кислоты 146 сл.функция кислотности 148 сл.
Классификация органических соединений
51, 52Клатратные соединения 61, 367, 451
Клетчатка см. Целлюлоза
Ковалентная связь 20 сл.Когазин 65, 68, 69Коламин (Этаноламин) 117, 310, 341
Колебательные спектры 568, 571, 574 сл.
Коллоксилин (Целлюлоза, динитрат) 452
Кольчато-цепная (оксо-цикло) таутоме¬
рия 411, 413, 453
Комбинационное рассеяние света-(КРС)
482, 570 сл.
применение метода 577 сл.
я-Комплексыциклобутадиена 508
цнклооктадиена с никелем 537
Комплексоны 478
Конгресса н 544, 549
Конденсацияальдольная 137, 139, 141, 408, 459
ацилоиновая 525, 533, 534, 535
Гейтера — Клайзена 385
кротоновая 137, 139, 141, 276, 300, 459
нитрилов дикарбоновых кислот 510,
534по Перкину 505сложноэфирная 189, 385, 402, 406,
513, 534
КонстантыБольцмана 88диссоциации кислот 153, 154, 179 сл.,
182, 314, 316
енолизации ацетоуксусного эфира 393
ионизации кето-енолов 395
равновесия 80 сл.— кето-енолов 395— между двумя конформациями 482— таутомерного 394, 395Константыскорости реакции 84 сл.
спин-спинового взаимодействия 563
экранирования протона 560
Конфигурации 315, 356абсолютная и относительная 358, 360
сл.альдоз 428«-аминокислот 468 сл.
биоз 444 сл.глицеринового альдегида 360, 417декалинов 530декалолов 531дихлорэтиленов 318инозитов 519 сл.кверцитов 519методы установления 320, 417 сл.
моносахаридов 417 сл.
обращение 319, 370
хлорбромэтиленов 317
хлоряблочиых кислот 364
Конформации 316, 479
алканов 61бутана 480 сл., 495 сл.
гликозидного углерода 428 сл.
глюкозы 426
декалина 530 сл.1.2-диамина 2131.2-дибромэтана 481, 482
диметилциклогексана 499, 5001,1-дифторциклогексана 496
заслоненные 479, 480, 495
заторможенные 213, 317, 472, 480, 585
методы установления 320, 557 сл.
моносахаридов 426 сл.оптически активных веществ 583 сл.
относительная устойчивость 481
переходных состояний 482
пиранозного цикла 423
скошенные 480, 481, 495
торсионное напряжение 494, 501
трансоидные 213, 4801.1.2-трихлорэтана 481
целлюлозы 449циклогексана 495 сл., 530, 568
циклопентана 494
эклиптические 480
энергия 481, 482, 500
этана 479, 480
янтарной кислоты 317
Конформационная асимметрия 584
Конформационный анализ 426 сл.,
479 сл., 482, 494 сл., 499 сл.
Конформеры 246
Кофеин 570
Коэнзим А 436, 437
Коэффициентактивности 80, 148, 149
распределения 36
Красители 581, 582
Крахмал 446, 447 сл., 451
ге-Крезол 562
Крекинг 24, 83алканов 66, 202, 247
нефти 63, 66, 258
Криоскоп 49Криоскопические константы 50
Криоскопическое определение молеку¬
лярного веса 49
Кристаллизация 26, 29, 33 сл.
602предметный указательКросс-димеризация 264
Кротонилены см. Бутии-1 и Бутин-2
Кротоиовая (гране-ft-мет акриловая) кис¬
лота 303, 304, 305, 308, 317, 377
Кротоновый альдегид 137, 290, 294, 295,
570реакции 275, 303, 305
КРС см. Комбинационное рассеяние
светаКсантогеновые кислоты 346
Ксилоза 422, 453, 454
Ксилозан 453
Ксилолы 517
Кубан 544, 548 сл.Кубандикарбоновая кислота 548
Кумол (Из'опропилбензол) 548
гидроперекись 142
Кумулены 277Кумулированная (алленовая) система
двойных связей 268, 277
Купрен 263Ладенбурговский бензол (Призман) 539,
544гексаметильное производное 539
Лактамы 461, 466, 476
Лактиды 379, 464Лактим-лактамная таутомерия 392, 397,
403Лактогидрогеназа 436
Лактоза [Молочный сахар, 4-(|3-Галак-
тозйдо)-глюкоза 4-ф-Ь-Галакто-
пиранозил)-0-глюкоза] 378, 433,
441, 445
Лактоны 302, 380 сл.Латекс 279Левулоза см. ФруктозаЛевулиновая кнелота 300, 384, 387, 406Левулиновый альдегид 281, 292Лейции 456, 459, 466, 476Лецитины 310, 342Лигнин 448, 452Лигносульфокислоты 448Лизин 456, 460, 466Ликогшн 277Ликсоза 422, 425Лимонен 273, 512Лимонная кислота 355, 382, 383, 436, 437
Лимоннокислое брожение 383
Линалоол 292
Линалоолацетат 293
Линолевая кислота 304, 309, 310
Линоленопая кислота 304, 309, 310
Липнды 310, 342, 454
Литийорганические соединения 78, 401
Льюисакислоты 147, 256 сл., 547
формулы 20 сл.Люизит 262Магнийорганические соединения (см.
также Гриньяров реактив и Ме¬
таллоорганические соединения)
199, 247, 278, 288, 357, 488, 514
реакции 63, 94, 96, 126, 128, 265, 269,
298, 338, 381, 399, 513, 525
Макроциклы 533 сл.Макроэргические связи 434
Малеиновая (цис-1,2-этилендйкарбоно-
вая) кислота 184, 314 сл.
реакции 369, 376
эфир 509Малеиновый ангидрид 274, 314, 315
галоидзамещенный 504
реакции 504, 538
Малонилмочевина (Барбитуровая кисло¬
та) 344, 348
Малоиовая кислота (Пропандикислота,
Метандикарбоновая кнелота) 182,
184 сл., 305, 382, 460
Малоновый диальдегид (Пропандиаль)
143, 144Малоновый эфир (см. также Натрийма-
лоновый эфир) 186, 298, 305, 396,
458, 508, 522, 545
Мальтоза [4-(а-Глюкозидо)-глюкоза, 4-
(а-ГлюкоБнранозил)-О-глюкоза]
433, 440, 445, 446
брожение 94, 95, 433
Маннаровая (маииосахарная) кислота
376, 422
Маннит 106Манноза 412, 419 сл., 424, 428, 453
реакции 376, 433
физические свойства 445
Манноновая кислота 355, 376
Манносахарная (маннаровая) кислота
376, 42,2Маргариновая (гептадекановая, 1-гекса-
деканкарбоновая) кнелота 152
нитрил 170
Масло (а)аллиловое горчичное 355
бергамотовое 293
вербеновое 299
высыхающие 309, 515
гиднокарповое 516
горчичные 353, 355
кокосовое 162
конопляное 309
кориандровое 293
коровье 162
лавандовое 293
лемоиграссовое 299
лимонное 299
льняное 309, 310
оливковое (прованское) 308
ореховое. 309
подсолнечное 309
растительные 310 сл.
сивушное 95
смазочное 62, 63
соляровое 62
тунговое-311
хаульмугровое 516
хлопковое 310
цитронелловое 292, 299
эвкалиптовое 299
. эфирные 292, 299, 516
Масляная (бутановая, 1-пропанкарбоно-
вая) кислота 41, 152, 179
ангидрид 167
производные 161, 162
Масляный альдегид (Бутаналь) 4Г, 121
291, 551Масс-спектрометрия 19, 320, 444, 550 сл.
Межатомные расстояния 332
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ603Межмолекулярныевзаимодействия 557 сл.
радиусы элементов 334, 335, 479
Мезитила окись 138, 295, 522
Мезитилеи (1,3,5-Триметилбензол) 138
Мезовинная кислота 353, 361, 366, 369,
376, 422
Мезоинозит (Биос-1) 519, 520
Мезоксалевая кислота 382
Мезомерия 175 сл., 234 сл.Мезомерный эффект (М-эффект, Стати¬
ческий эффект сопряжения) 124,181, 276, 285
в аллильном катионе 287
в амидах кислот 176
в гуанидине 350
в кетонах 124, 135
в натрийацетоуксусном эфире 400
Мезо-формы сахаров 422, 423
Мепробамат 349Меркаптаны (Тиоспирты, Тиалы) 75,
194 сл., 346
Меркаптиды 195Р-Меркапто-а-амииопропионовая кисло¬
та см. Цистеии
Меркаптофос 342
Меркурацетальдегид, иои 176
Мерсеризация 452Метакрилог.ая (а-метилакриловая) кис¬
лота 303, 304
производные 142, 306, 307
Металепсия 13, 66, 72, 506
Металлоорганические соединения 63, 77,
78, 96, 247, 258, 265, 401 ,
получение 47, 217, 262, 514
реакции 63, 77, 94, 126, 128, 218, 261,269, 276, 286, 338, 401, 514, 525
Металлотропия 398, 400
Метальдегид 140
Метан 15, 55, 57
в природе 62гомологический ряд 55, 57
крекинг и пиролиз 65 сл., 260
реакции 24, 65 сл.
синтез 63физические свойства 58, 59
эквивалентные орбитали 239
Метаназобензол 132
Метаналь см. Формальдегид
Метандикарбоновая кислота см. Мало-
новая кислота
Метанкарбоновая кислота см. Уксусная
кислотаМетановая кислота см. Муравьиная кис¬
лотаМетанол (Карбинол, Метиловый спирт.
Древесный спирт) 15, 16, 21,
96 сл.
азеотропные смеси 34
модели Стюарта — Бриглеба 335
получение 65, 91 сл.
применение 99
реакции 96 сл., 124, 166
физические свойства 92
Метил 55иоднстый 22, 23, 73
радикал 66, 67хлористый 21, 23, 67, 70, 72, 75, 327
Метила гидроперекись 191
Метилакрилат 305а-Метилакриловая кислота см. Метакри-
ловая кислота
грсшс-Р-Метилакриловая (кротоиовая)
кислота 303, 304, 305, 308, 377
цмс-Р-Метил акриловая (изокротановая)
кислота 304, 317, 376
Метилаллен (Бутадиен-1,2) 267
Метиламин 21, 207, 208, 210
Метиламмоний, соль 208
Метил ацетат 161
Мегилацетилацетон 395
Метилацетилен (Аллилен, Пропии) 259,
3392-Метилбицикло[5Д0]декан 493
2-Метилбутадиен-1,3 см. Изопреи2-Метилбутаналь (Изовалериановый аль¬
дегид) 41, 1213-Мегилбутановая кислота см. Изовале-
риановая кислота2-Метилбутанол-1 (Амиловый .спирт оп¬
тически активный, втор-н-Бутил-
карбинол) 93, 95, 357
молекулярное вращение 5832-Метилбутанол-2 (Амиловый спирт тре¬
тичный,. Диметилэтилкарбинол) 93,
993-Метилбутанол-1 (Изоамиловый спирт
первичный, Изобутилкарбинол) 93,
95З-Метилбутанол-2 (Изоамиловый спирт
вторичный, Метилизопропилкарби-
нол) 9.3З-Метилбутанон-2 (Метилизопропилке-
тон) 122
2-Метилбутен-1 см. уАмилен2-Метилбутен-2 см. Р-Изоамилен
ЗМетилбутен-1 см. а-Изоамилен
Метил-трсг-бутилкетон см. Пинаколин
Метил-грег-бутилнитрозамин 5673-Метилбутин-1 см. Изопропилацетилен
Метилбутират 161Метилвалерат 161
а-Метилгалактозид 428
Метилгексаны 59
Метилгептенон 300
Метилгликозиды 414, 428, 429
Метилдиазогидрат 217
Метилен 55йодистый 72, 73, 121
хлористый 67, 70, 72, 73, 78, 536, 560,
561Метилеиитан 408Метилизопропилкарбииол см. З-Метилбу-
танол-2Метилизопропил кетой (З-Метилбутаион-2) 122Метилизопропилнитрозамии 567
Метилизоцианат 349, 3522-Метилиндандион 395
Метилирование сахаров 414 сл., 448
Метилкарбамат (Метилуретан) 216, 344,
350Метилкарбинол см. Этиловый спирт
а-Метилманноза 428
Метилмеркаптан 21, 191, 195
Метилметакрилат 305
полимеры 306, 307
Метилмочевина 216, 344
Метилняфталин 65
Метнлнитрат и метилнитрит 109
604ПРЕДМЕТНЫЙ указательМетилнонан 367
Метиловый спирт см. Метанол
Метиловый (диметиловый) эфир 19, 113,
115З-Метилоктан 367
траяс-10-Метил-Лв-сжтанон 552
Метилоламины 340
Метилпентаны 592-Метилпентен см. Изобутилен2-Метилпропаналь (Изомасляный альде¬
гид) 41, 1212-Метилпропановая кислота см. Изомас-
ляная кислота2-Метилпропанол-1 (Изобутиловый спирт
первичный, Изопропилкарбинол)
92, 952-Метилпропанол-2 (Бутиловый спирт
третичный, Триметилкарбинол) 92,
94, 2592-Метилпропен см. Изобутилен
Метил-н-пропилкарбинол см. Пентанол-2
Метил-н-пропилкетон (Пентанон-2) 41,
1221-Метил-4-пропилциклогексанол-2 491
Метилпропиоловая (тетроловая) кислота
338, 339
Метилпропионат 161
Метилсерная кислота 106, 111
а-Метилстирол 329Метилуретан (Метилкарбамат) 216, 344,350Метилфениловый эфир 218
Метилформиат 161
Метилфосфиновая кислота 110
Метил-Д-фруктозиды 439
Метилхлорформиат (Метилхлоркабонат)
344Метилцеллозольв (Этиленгликоль, моно-
метиловый эфир) 114, 117
Метилциклобутан 497
Метилциклогексанон 368, 521
Метилциклопентан 513, 524
Метилэтилацетилен см. Пентин-2
Метилэтилен см. Пропилен
Метилэтилкарбинол см. Бутанол-2
Метилэтилкетон (Бутанон-2) 34, 41, 122,
143, 368
диперекись 193
Метилэтилмалоновая кислота 368
Метилэтилнитрозамин 567
1-Метил-2-этил-4-пропилциклогексанол-6
4911 -Метил-1 этилэтилсн см. у-Амилен
Метин 55Метионин 456, 466, 467
Метод (ы)Брюстера 585
Буво 94валентных схем (валентных связей),
234Гейтлера — Лондона 234
Кенингса — Кнорра 446
Кижнера 504
Лейхса 475локализованных пар 323
молекулярных орбиталей (МО)
225 сл.
объединенного атома 234
оврагов 333Пириа 126, 509, 521, 533Метод (ы)Раста 50
Родионова 460
сверхразбавления 534
Метоксиадамантан 547
Микроанализ 45
Миоглобин 337
Мирцен 277
Мовеин 12Молекулярность реакции 84 сл.
Молекулярныедиаграммы 231, 233, 234
орбитали 221, 225 сл.Молекулярныйвес, определение 48 сл.
ион 550Молочная кислота 11, 382 сл., 469,
470получение 374, 379, 436
физические свойства 355
Молочнокислое брожение 378, 383
Молочный сахар см. Лактоза
Монобромацетилен (Бромэтин) 283
Моноглим см. Этиленгликоль диметило¬
вый эфир
Монозы см. Моносахариды
Монозофосфаты 434
Мономер 141Мойомолекулярные реакции 75, 76, 84,
87Моносахариды (Монозы) 412 сл.
аномерия 428конфигурации 417 сл., 427, 444
конформации 426 сл.
метилирование 414 сл.
окисление 376, 426
оксо-цикло-таутомерня 411, 413, 453
синтез в растениях 438 сл.
спиртовое брожение 433 сл.
стереохимия 417 сл.
физические свойства 445
фосфаты 433 сл.Монохлорацетилен (Хлорэтин) 283
Монохлорацетон 136
Монохлоруксусная кислота 14, 177, 261
реакции 201, 47.7
Монурон 349Мочевина (Карбамид) 11, 12, 48, 61, 212,
346 сл.клатратные соединения 61, 367
производные 350, 352
физические свойства 344
Мочевино-формальдегидные смолы 348
Моющие средства 198
Мукоинозит 519Муравьиная (метановая) кислота 24,
151, 152 сл„ 155, 158
нитрил см. Синильная кислота
ортоэфир 130, 163
получение 156
реакции 126, 158
соли 183, 210
физические свойства 152
эфиры 161Муравьиный альдегид см. Формаль¬
дегид
Мускон 540Мутагенные свойства 214
Мутаротация 418
Мыла 159
предметный указатель605Надмуравьиная (пермуравьииая) кисло¬
та 191, 541
Надугольная кислота, эфиры (Перкарбо-
наты) 194Надуксусная кислота (Перуксусиая кис¬
лота, Гидроперекись ацетила) 190,
. 191, 194
соли 200
Найлон 189, 212, 518
Найлон-6 (Капрон) 212, 455, 476, 477,
518, 521
Нарцилен 267
Натрийацетилацетон 510
Натрийацетоуксусный эфир 144, 390, 398,
399 сл.реакции 400, 403, 405, 406, 510
таутомерия 400
Натриймалоновый эфир 184, 186 сл.,458 сл.конденсация по Перкину 505
Натрийорганические соединения 401
Натрийсукцинимид 188
Натрийциклопентадиенил 514
Нафталин 263гидрирование 528, 530
карта электронной плотности 334
Нафтеновые кислоты 515
Нафтены 512а-Нафтилметилкарбамат (Севин) 349
а-Нафтол 349Нсдокись углерода (Бис-дикетен) 187,
188, 302
Нейрин 342
Нейтронография 337
Нсопентан 51, 56, 58, 59
Пеопентиловый спирт (2,2-Диметилпро-
панол-1, трег-Бутилкарбинол) 93
Неопреновый каучук см. Хлоропреновый
каучукНепредельные соединения 243 сл. (см.также Олефины, Ацетилены)
Неспаренный электрон 24
Нефть 62, 512крекинг 63, 66, 258
состав 62, 512, 515
сырье для олефинов 247
Ннкотинамидадениндинуклеотид 434
Нингидрин 39
Нитрилокислоты 477 сл.
Нитрилотриуксусная кислота (НТУ) 478
Нитрилыгидролиз 155, 156, 171, 183, 184, 216
двухосновных кислот 510, 534
ИК-спектры 215
одноосновных кислот 169 сл.
получение 75, 156, 169
я-Ннтроазобензол 150
Нитроанилиныбатохромный сдвиг 581, 582
величины pfta 150
Нитро-ачм-нитро-таутомерия 397
Нитробензол 12, 581
Нитрованиепарафинов 67, 68, 201
циклопещана 513
Нцтрогликоль 110
Нитроглицерин 105, 110, 452
п-Нитродифсниламин 150
Нитрозамины 211, 567
Нитрозомалоновый эфир 459Нитрозометан 200
Нитрозометилуретан 216, 350
Нитрозо-оксимная таутомерия 397
Нитрозосоединения 200 сл.геометрическая изомерия 200
Нитроизопентан 68
Нитроклетчатка 110
Нитроловые кислоты 204
Нитрометан 67, 68, 201, 202конденсация с оксосоединениями 204,
205, 432
Нитрон 306Ннтросоедннения 67, 68, 201 сл., 214,
215Нитроуксусная кислота 201, 459
Нитроформ (Тринитрометан) 207
Номенклатура 51
алициклов 491
алканов 69 сл.
аминов 207галоидпроизводных 70
диенов 267
кислот 151, 182
меркаптанов 194
оксикислот 354
оксосоединений 120, 121
олефинов 244, 246
спиртов 90
Нонадекан 58
Нонан 57, 58, 65Нонандикислота см. Азелаиновая кис¬
лотаНоиановая кислота см. Пеларгоновая
кислота
Нонанолид 38!Норборнен, димер 549
Норкамфан (Бнцнкло[1,2,2]гептан) 529,
531карбкатион 547
Норкамфора 529, 532
Норкаран 528, 536Нуклеофильное замещение 75 сл., 214,
319, 369 сл., 469, 532, 533 ,
пространственные эффекты 484 сл.
Нуклеофильная атака 23, 305, 371Озазоны 422Озокерит 62Озониды 193, 252Озоны (Оксикетоальдегиды) 411Окисиаминов 212мсзитила 138, 295 сл., 522
триметиламина 21, 22
углерода 127, 156, 168, 215— в синтезе Фишера — Тропша 63
циклогексена 518
циклодецена 541циклононена 541
циклооктена 541
этилена 116 сл., 141, 251, 258— получение 116— реакции 116, 117, 303, 340, 341
Окислениеалканов 64, 65
кетонов 154, 184механизм образования перекисей 192,
193моносахаридов 376оксосоединений 133, 135, 142, 192 сл.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬОкислениеолефинов 250, 251, 254 сл., 372
спиртов 123 сл.Оксалил хлористый 185
Оксалилмочевина (Парабановая кисло¬
та) 344, 348
Оксамид 185Оксаминовая кислота 185
Оксиадамантаи 547Р-Окси-сс-аминопропионовая кислота см.. Серии
Оксигидроперекиси 192
Оксикетоальдегщщ (Озоны) 411
Оксикислоты 342 сл., 354 сл.
доказательство строения 381
получение 374 сл.
реакции 378 сл.
стереохимия 354 сл.
физические свойства 355
Оксималоновая (тартроновая) кислота
355, 382
Р-Оксимасляная кислота 374
эфир 369р-Оксимасляный альдегид (Альдоль)
137, 290, 374, 407, 408
Оксиметиленацетон 144
Оксимуравьиная кислота см. Угольная
кислота
Оксимы 131, 136, 200циклические 461, 465, 470
Оксипитрилы (Циангидрииы) 129, 303,
374Оксиоксосоединения 406 сл.реакции 409 сл.Оксипролин 457Р-Оксипропионовая (гидракриловая)
кислота 355, 374
иитрил 303
Р-Оксипропионовый альдегид 294
Оксихлорянтарные (хлоряблочные) кис¬
лоты 364Р-Оксиэтилтриметиламмония гидроокись
(Холин) 310,. 341, 342
Оксиянтарная кислота см. Яблочная кис¬
лотаОксокислоты 383 сл.
реакции 385 сл.
синтез 383 сл.
таутомерия 387
физические свойства 384-
эфиры 405 сл.Оксоииевыесоединения 22, 115, 119 сл.
соли 115
Оксосинтез 127, 254
Оксосоединсния 120 сл., 294 сл.
восстановление 127, 130, 144
галоидирование 136 сл.
галоформное расщепление 137
дипольные моменты 123
енолизация 134
конденсация 137 сл.— альдольная 137, 139, 141, 408, 459,468— кротоиовая 137, 139, 141, 276, 300,459непредельные 294 сл.
номенклатура 120, 121
окисление 133, 144, 192 сл.
получение 123 сл., 222Оксосоединенияпротонизация 123, Н5
реакции 127 сл., 144 сл., 210, 215,295 сл., 458— замещения 130 сл., 133 сл.— присоединения 127 сл.
ртутные производные 398, 533
физические свойства 121, 122Оксо-цикло-таутомерия 411, 413, 453
Октадекаи 58Октадекановая кислота см. Стеариновая
кислота
Октадекапептид 471
Октаметилбиозы 471, 472
Октаметилендиамин 543
Октан 57, 58Октаналь (Каприловый альдегид) 1211,8-Октандикарбоновая кислота см. Се-
бациновая кислота
Октандикислота см. Пробковая кислота
Октандион-2,7 4061-Октанкарбоновая кислота см. Пеларго-
новая кислота
Октановая кислота см. Каприловая кис¬
лотаОктановое число 64, 65, 256, 259
Октозы 412Олеиновая кислота 304, 308 сл., 317, 319
Олефины (Алкены) 243 сл.галоидирование 248, 249, 282 сл.— аллильное 255 сл.
геометрическая изомерия 246 сл., 354
гидрирование 247качественные реакции 207, 250
номенклатура 244, 246
озонирование 252
окисление 250, 251, 254 сл., 372
окислительный аммонолиз 256
оксосиитез по Реппе 127, 156, 254
полимеризация 256 сл.
получение 66, 75, 246 сл., 346
применение 258, 259
присоединение галоидных алкилов
253— галоидоводородов 248, 249— сопряженное 250 сл.— транс- и цис- 371 сл.— формальдегида 253
Олигосахариды 412, 439 сл., 556 сл.
Олифа 310, 515Омыление 159 сл., 162
Ониевые соединения 22, 115, 119 сл., 197
Оновые кислоты 410
Оппанол (Изобутилеи, полимер) 256
Оптическая изомерия 354 сл., 417 сл.,
498, 532
Орбиталиатомные 222 сл.. 237 сл.
молекулярные 221, 225 сл.— типы 229
Орбитальное квантовое число 222
Органическое стекло 306, 307
Органогены 11Орлон 306Ориитин 456, 466, 476
Ортокислота 155
Ортомуравьиный эфир 130, 163
Ортоуксусные эфйры 163
Ортоэфиры 162 сл., 345
сахаров 454, 455
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ607Орто-эффект 488
Осколочные ионы 551
Основания 147 сл.константа диссоциации сопряженной
кислоты 148, 149
функция кислотности 149
Отверждение жиров 308
Оцимен 277Пальмитиновая (гексадекановая, 1-пен-
тадеканкарбоновая) кислота 152,
310глицерид 162
нитрил 170
Пальмито-дилиноленн 310
Пальмито-олео-линолеин 310
Пантотеновая кислота 436, 455
Парабановая кислота (Оксалилмочеви-
на) 344, 348
Паральдегид 140
Парафин 62Парафиновые углеводороды см. Алканы
Параформ (Полиоксиметилен) 140, 210
Пектиновые вещества 453
Пектиновые кислоты 453
Пектовые кислоты 453
Пеларгоновая (нонановая, 1-октанкарбо-
новая) кислота 41, 152, 308
Пенициллин 465
Пентаацетилглюкоза 444
Пентадекан 57, 581-Пентадеканкарбоновая кислота см.Пальмитиновая кислота
Пеитадиен-1,3 (Пиперилен) 267
Пентадиен-1,4 (Дивинилметан) 267, 268,
272гидроперекись 291
Пентадная таутомерия 398
Пентакозан 57Пентакозанкарбоновая (церотиновая)
кислота 152
Пенталан (Бицикло[3,3,0]октан) 530
Пентаметилальдогексоза 415
Пентаметилкетогексоз'а 415
к-Пентан 51, 56 сл., 65физические свойства 58, 59
Пентаналь (Валериановый альдегид) 41,
1211,5-Пентандикарбоновая кислота см. Пи-
мелиновая кислота
Пентандикислота см. Глутаровая кисло¬
таПентандион-2,4 см. Ацетилацетон1-Пентанкарбоновая кислота см. Капро¬
новая -кислота
Пентановая кислота см. Валериановая
кислотаПентанол-1 (н-Амиловый спирт первич¬
ный, н-Бутилкарбииол) 72, 92
99Пентанол-2 (я-Амнловый спирт вторич¬
ный, Метнл-к-пропилкарбинол) 93
Пентанол-3 (Амиловый спирт вторичный,
Диэтилкарбинол) 93
Пентаноны 41, 122Пеитаоксигексаналь (Альдогексоза) 409,
410, 413Пентацикло[7,3,1,14’ |2,02- 7,06> и]тетраде-
кан см. КонгрессанПентаэритрит (Тетраоксинеопентан) 106
нитрат 110, 204тетранитрат (Пентрит) 106, 110
Пентен-1 см. а-Амилен
Пентен-2 см. Р-Амилен
Пентин-1 (к-Пропилацетнлен, Валери-
лен) 259Пентин-2 (Метилэтилацетилен, Валери-
лен) 259
Пентиты 105, 106
Пентозаны 453
Пентозы 412, 413Пентрит (Пентаэритрит, тетранитрат)
106, 110
Пепсин 455
Пептиды 471 сл., 553
Перегонка 26 сл.
вакуумная 27 сл.
молекулярная 28
рабочая линия 32
с водяным паром 28
сухая солей двухосновных кислот
126, 509, 521, 533
фракционная 29 сл.Перегруппировкиаллильная 273, 287, 288, 293
Арбузова 110ацетилен-аллен-диеновая 266
Бекмана 461, 465, 476
Клайзена 291
Коупа в бульвалене 550
Курциуса 210, 459
пинаколиновая 102, 523, 527
спиртов алицнклического ряда 523
Фаворского 157, 266, 524, 548, 549
Перекиси органические 190 сл.
алкил-алкильные 190
ацетальдегида 193
ацетила 190, 191, 194
ацил-ацильные 190
бензоила 194трет-бутила 190, 191, 194, 549
источники свободных радикалов 296
мстила 191
распад 194
сукцинила 191
формальдегида 193
хлораля 193
этила 191
Перекись водорода 190
Перенесение реакционного центра 399,
401Переходное состояние (Реакционный
комплекс) 76, 87, 160
конформации 482при вальденовском обращении 370
теория 88 сл.Периодатное окисление 443 сл., 448
Перкарбопаты (Надугольная кислота,
эфиры) 194
Пермуравьиная кислота (Гидроперекись
формила) 191, 541
Перуксусная кислота (Гидроперекись
ацетила) 190, 191, 194
Перфторалканы 71, 74, 78
Перфторолефины 178, 504
Перфторполиэтилен (Тефлон) 74, 78, 289
Перфторпропилен 178
Перфторуглеводороды см. Перфторалка-
608ПРЕДМЕТНЫЙ УКАЗАТЕЛЬПерэфиры 191
Петролейный эфир 38, 62
Пимелинкетон 521Пимелиновая кислота (Гептандикислота,1,5-Пентандикарбоновая кислота)
182, 183
соли 521Пинаколин (Метил-грег-бутилкетон, 3,3-
Диметилбутанон-2) 102, 122
Пинаколиновая перегруппировка 102,
523, 527Пинакон . (2,.3-Диметилбутандиол-2,3,
Тетраметилэтиленгликоль) 100, 102
Пинаконы 100 сл.Пиперазин 464
Пиперидинозы 432
Пиперилен (Пентадиен-1,3) 267
Пиранозы 416 сл., 441, 444
таутомерия 416, 443
Пиридин '432, 562Пировиноградная кислота 374, 381, 384,
435 сл., 458
фосфат 435
Пировиноградный альдегид (Пропано-
наль) 143Пироксилин (Целлюлоза, тринитрат) 452
Пиролизметана 260— с аммиаком 170солей двухосновных кислот 126, 509,• 521, 533
Пиррол 562Плексиглас см. Полиметилметакрилат
ПМР см. Протонный магнитный резо¬
нансПоверхностно-активные вещества 159
Поворотные изомеры 480
Полиакриламид 43
Полиакрилонитрил 306, 307
Полиалкилеилоксаны 109
Полиалкоксисилоксаны 109
Полиамиды 43, 461, 476 сл.Полибутадиен см. Бутадиеновый каучук
Поливинилацетат 262, 290
Поливинилбутираль 291
Поливиниловый спирт 262, 276, 290, 291
Поливинилхлорид 282, 288
Полигалоидные соединения 78
Полиеновые углеводороды 275 сл., 544
Полиизобутилен 259Ч«с-Полиизопрен (Натуральный каучук)
275, 279 сл., 373
Полиины 278 сл.Поликапроамид 461, 476
Полимергомологи 141
Полимеризация 141 сл.стереоспецнфнческая 373
Полимеры 141изотактические 258, 373
рентгеноструктурный анализ 338
синдиотактические 373
стереорегулярные 372 сл.
Полиметилакрилат 306, 307
Полиметилметакрилат (Плексиглас, Ор¬
ганическое стекло) 142, 306, 307
Полинитросоединення 207
Полиоксиальдегиды 409
Полиоксикислоты 375, 376, 409
Полиоксиметилен (Параформ) 140, 210
Полипептиды 471 сл., 553Полипропилен 258, 373
Полисахариды (Полиозы) 412, 446 сл.
животных тканей 454
микроорганизмов 454
морских водорослей 454
синтез 454
строение 448 сл.Полисилоксаны 41, 109
Полистирол 43
Полиуретаны 352
Полихлортрифторэтилен 289
Полиэдрические циклы 544 сл.
Полиэтилен 60, 257 сл.
Полиэтиленгликоль 116, 117
Полуацетали 417
Поляризуемость 123, 133, 583
Поляриметрия 356, 582 сл.Пороха 448, 452
Порядокреакции 76, 84 сл.
связи 232
Потенциал ионизации 229
Потенциальный барьер 479 сл.ПравилоБредта 532, 533
Вернера 318
Зайцева 284Каиа — Инголда — Прелога 363
Клайзена 394
Кориблюма 214
Крама 488Марковникова 94, 127, 156, 248, 249,
297, 305, 478
октета 22
Пирсона 405
Попова 133
Хунда 225, 228Эльтекова — Эрленмейера 289, 297,
392Эрленмейера 413
Призмак (Бензол ладенбурговский) 539,
544Принцип Паули 221, 224, 228, 234
Природный газ 61Пробковая кислота (Октандикнслота,1,6-Гександикарбоновая кислота)
182, 183, 535, 540, 543
Проекционные формулыНьюмена 316, 317, 479 сл., 585
Фишера 359 сл., 363, 414, 421, 440,
487, 584
Пролин 457, 466, 476
Пропадиен см. Аллен
Пропан 55, 57, 58, 59 , 61, 63
Пропаналь (Пропионовый альдегид) 41,
121, 127Пропандиаль (Малоновый диальдегнд)
143, 144Пропандикарбоновая кислота см. Глута-
ровая кислота
Пропандикиелота см. Малоновая кислота
Пропандиол-1,2 (Пропиленгликоль) 100
Пропандиол-1,3 (Триметнленгликоль) 1001-Пропанкарбоновая кислота см. Масля¬
ная кислота2-Пропанкарбоновая кислота см. Изо-
масляная кислотаПропановая кислота см. Пропионовая
кислотаПропанол-1 см. м-Пропиловый спирт
предметный указатель609Пропанол-2 см. Изопропиловый спирт
Пропанон-2 см. Ацетон
Пропанональ (Пировиноградный альде¬
гид) 143
Пропантиол 194Пропантриол-1,2,3 см. Грицерин
Пропаргиловая (лропиоловая) кислота
338, 339Проларгиловый спирт 265, 293
Пропей см. Пропилен
Пропеналь см. Акролеин
Пропенил хлористый (1-Хлорпропен-1)
283Пропил нодистый 400
н-Пропиламин 208
втор-Пропилат алюминия 128
н-Пропилацетат 161
н-Пропилацетилен см. Пентин-1
Пропилен (Пропей) 103, 248
алшлирование 252конденсация с формальдегидом 253,
270окисление 104окислительный аммонолиз 256, 303
полимеризация 256 сл.
применение 252, 259, 468
физические свойства 245
хлорирование 103, 255, 272, 292
Пропиленгликоль (Пропанднол-1,2) 100 сл.
н-Пропилкарбипол см. Бутанол-1
н-Пропилмеркаптан 195
н-Пропиловый спирт первичный (Пропа-
нол-1, Этилкарбинол) 89, 92, 95
н-Пропиловый спирт вторичный см. Изо¬
пропиловый спирт
Проциловый (ди-«-пропиловый) эфир 114
Пропилпропиоловая кислота 338
Пропилциклобутан 497
н Пропилэтилен см. а-Амилен
Пропин см. Метилацетилен
Пропиоловая (пропаргиловая) кислота
338, 339
Пропионамид 169
Пропионил хлористый 165
Пропионитрил 170Пропионовая (пропановая, этанкарбоно-
вая) кнелота 152, 156, 381, 508
ангидрид 167
Р-оксинитрил 305
эфир 161Пропионовый альдегид (Пропаналь) 41,
121, 127Пространственное содействие 485
Пространственные взаимодействия несвя¬
занных атомов 336
Пространственные затруднения 77, 484 сл.
Простые эфиры 1,12 сл.
водородная св*язь 115
многоатомных спиртов 116 сл.
оксониевые соединения 115, 119
смешанные 112
физические свойства 114
Протонизация водорода 123, 264, 272
Протонный
катализ 132магнитный резонанс 558 сл., 568
Прототропия 395Псевдобутилен (Бутен-2, 1,2-Диметил-
этилен) 245, 246
Псевдоионон 300Псевдокислоты 204
Псевдомерня 400, 401
Псевдомономолекулярные реакции 86
Псевдонитролы 204Раман-спектры (Спектры комбинацион¬
ного рассеяния) 482, 570, 577 сл.
Расширение циклов 522, 524, 527
Рафиноза 444
Рацемизация 358
Рацемическое соединение 357 сл.
РеактивыГриньяра см. Гриньяров реактив
Иоцича 261, 265, 338
Фелинга 383
Чугаева 136
Швейцера 451
Реакции
Анри 432
Бамбергера 206
бимолекулярные 84 сл., 88
Буво 158
Вагнера 250, 251
Вильгеродта 99, 157
Вильямсона 112
Виттига 247, 309, 409
Вюрца 14, 63, 503, 525
Гейтера — Клайзена 402
Геллермана 217Гелля — Фольгарда — Зелинского 158,
177Гофмана 209 сл., 212
Гриньяра см. Магнийорганические со¬
единения
Дикмана 189, 386, 510, 513, 534
Дильса — Альдера см. Диеновый син¬
тезКанниццаро 145Кижнера — Вольфа 130, 133, 535, 546Кольбе 63, 157, 185, 201Коновалова 67Конрада 184, 186Курциуса — Шмидта 543Кучерова 127, 291Лейкарта 210Львова 103, 255, 272Малапраде 251Манниха 340, 478Меервейна 115Меервейна — Понндорфа 99, 126, 128
металепсии 13, 66, 72, 506
Михаэля 297, 298, 305, 391, 406, 522
молекулярность 84 сл.Нефа 433Остромысленского 207
порядок 84 сл.Прилежаева 251, 377
Принса 253, 270радикальные 24, 64, 71, 192, 296, 311,
372Реппе 127, 156, 254, 303
Реформатского 375
Розенмунда 127, 151, 158
с перенесением реакционного центра
399, 402, 403
скорость 76, 84 сл.Соммле 300теломеризации 178, 184, 375, 381, 460
Тищенко 133, 142
610предметный указательРеакциитрансаниулярные 540 сл.Фаворского 271
Финкельштейна 72, 88
Фишера — Тропша 63
цепные 24, 64, 67, 68, 71, 192, 198, 254,
255цианэтнлирования 307
Чугаев а 346
Шмидта 543
Штреккера 468
Реакционный комплекс см. Переходное
состояние
Резина 279, 280
Резонансструктур (Мезомерня) 173 сл., 234 сл.
ядерный квадрупольный 558 -— магнитный 320, 427, 428, 496, 550,557 сл.Ректификация 26, 30 сл., 513
Рентгеноструктурный анализ 320, 330 сл.,
337 сл., 451
Ретродиеновый распад 552
Рефракция 325 сл.экзальтация 329, 330
Рибоза 422, 424, 436
озазон 422
Рибулоза 413дифосфорный эфир 438, 439
Ридберговы («атомарные») переходы 580
Рильсан 477
Родаи (Диродан) 353
Ростовые вещества (Ауксииы) 516
Рудничный газ 62Сабинен 506
Саркозин 463
Сарколизин 341
Сахара см. Углеводы
Сахараты 427Сахарная (глюкаровая) кислот# 355, 376,
410, 422, 429
Сахароза (Тростниковый сахар, Свекло¬
вичный сахар) 95, 439 сл., 444, 446
брожение 433
физические евойства 445
Сверхразбавление (Метод Циглера) 534
Свободная энергияконформации 482, 500
при постоянном давлении (Изобарно¬
изотермический потенциал) 81
Свободные радикалы 64, 71, 192, 257,
296, 311
Связь (и)алленовые 268
банановая 505водородная см. Водородная связь
гибридизация 239 сл., 243, 244
двойная см. Двойная связь
ковалентная 20 сл.
кумулированные (алленовые) 268
макроэргическая 4340-евязь 230 сл., 244
семиполярная 22, 197, 212
семицнклическая 330
сопряженные 268, 274, 296 ел., 299
углерод — азот 217
уГлерод — водород 61Связь (н)углерод—кислород 123
углерод — углерод 60, 61
углерод — фтор 74
энергия образования 65, 320 сл.
Связывающие молекулярные орбитали
228Себациновая кислота (Декаидикислота.1,8-Октандикарбоновая кислота)182, 189, 542, 543
Севин (а-Нафтилметилкарбамат) 349
Семикарбазид 131, 132, 351
Семикарбазоны 131
Семиполярная связь 22, 197, 212
Семициклическая двойная связь 330
Сера, определение 45
Серин (Р-Окси-а-аминопропионовая кис¬
лота) 467, 468, 475
физические свойства 456
Серный эфир см. Диэтиловый эфир
Сероокись углерода 346
Сероорганические соединения 194 сл.,
346Сероуглерод 346
Сефадексы 42, 43, 453
Сивушное масло 95
Сиккативы 160, 515
Силоксановые группировки 109
Синдиотактический полимер 373
Синигрин 354Синильная кислота (Формонитрил, Му¬
равьиная кислота, нитрил) 16, 23,
155, 170промышленный способ получения 170
реакции 216, 303физические свойства 170 »Синтетические волокна 306, 477
Синтетические каучуки 99, 101, 259, 282
сл., 306
Синтин 63, 65
Синто л 91
Сквален 277
Скипидар 273Скорость реакции 76, 84 сл.СКР см. Спектры комбинационного рас¬
сеянияСлизевая (галактаровая) кислота 355,
376, 519Сложноэфирная конденсация 189, 385,
402, 406, 513, 534
механизм 385
Сложные эфиры
гидролиз 160, 174
карбоновых кислот 75, 97, 160 сл.■ минеральных кислот 106 сл.перкислот (Перэфиры) 191
Согласованное (синхронное) бромивова-
ние 135
Солод 95, 447о,я-Сопряжение (Гиперконъюгация) 134,
399, 403эффект (С-эффект) 276 см. также
Динамический, Мезомерный,
Таутомерный эффект
Сопряжение кратных связей 268, 274,296 сл., 299, 397, 533
Сопряженные кислоты 147, 154
Сорбииовый альдегид 295
Сорбит 106, 430
Сорбоза 408, 413, 430, 438
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ611Спектры 568 сл..ИК- см. ИК-Спектры
комбинационного рассеяния света
(Раман-спектры) 482, 568, 570 сл.
УФ- см. Ультрафиолетовые спектры
ЯМР см. Ядерный магнитный резо¬
нансСпиновое квантовое число 224, 557
Спиновый магнитный момент ядра 557
Спин-орбиталь 221Спин-спиновое взаимодействие 562 сл.константа 563
Спирановые системы 492, 526 сл.
Спиро[3,3]гептан 527Спиро[3,3]гептандикарбоновая-2,5-кисло¬
та 527Спирты 89 сл., 100 сл., 289 сл., 518 сл.
азеотропные смеси 05
алициклического ряда 518 сл„ 523
вторичные 123, 125, 127
галоидзамещенные (Галоидгидрины)99двухатомные (Гликоли, Алкандиолы)
90, 100 сл.
дегидратация 98, 113, 246, 247, 523
дегидрогенизация 98, 123
изомерия 89
изотопный эффект 125
константа диссоциации 96
многоатомные 103 сл.
непредельные 289 сл.
номенклатура 90
одноатомные (Алканолы) 89 сл
окисление 123 сл.
получение 74, 91 сл.
применение 99, 103
пятиатомные (Пентиты) 106
реакции 96 сл., 101 сл., 123 сл.
физические свойства 90 сл., 100
четырехатомные (Эритриты) 105
шестиатомные (Гекситы) 106
Статический эффект сопряжения см. Me-
зомерный эффект
Стеариновая (октадекановая, 1-гептаде-
канкарбоновая) кислота 152, ,308,
310
амид 169
ангидрид 167
нитрил 170
соли (мыла) 159эфиры с глицерином (Глицериды)
162, 310
Стеарои 120Стереоизомерия 246 сл., 315 сл.
бициклов 526нитрозосоединений 200 сл.
оптическая 354 сл., 417 сл., 532
егшранов 527
Стереорегулярные полимеры 372 сл.
Стереохимияалициклов 494 сл., 527, 529 сл.
моносахаридов 417 сл.Стероиды 516
Стирол 282, 329, 372
Стоксовы линии 573
Стрептобиозамин 520
Стрептомицин 520
Стрихнин 367Суберон (Циклогептан'он) 509, 535
Сукцинилянтарный эфир 510Сукцинимид 188
Сульфамиды 199
Сульфиды 75
Сульфиннмины 212
Сульфирование алканов 68
Сульфитная и сульфатная целлюлоза
448Сульфокислоты 197 сл.Сульфоксониевые соли 197
Сульфониевые соли, 196 'Сульфоны 196
Сульфоокиси 196. 197
Сульфохлориды 198Сульфохлорирование алканов 68 сл., 198
Сухая перегонка солей двухосновных
кислот 126, 509, 521, 533
Сцилит (Сциллоинозит) 519Табун 342
Талозы 445Тартроновая (оксималоновая) кислота
355, 382
Таутомерия 177, 387 сл.аскорбиновой кислоты 430
аци-нтра 204
валентная 538, 544
гептадная 398
диаднан 398
имино-енаминная 397
кето-енольная 387 сл., 400, 521
кислотно-основное равновесие 392 сл.
кольчатогцепная (оксо-цикло-) 411,413, 453лактим-лактамная 392, 397, 403
моносахаридов 420
нитрозо-оксимная 397
оксо-цикло- 411, 413, 453
иентадная 398
пиранозного цикла 416, 443
пировиноградной кислоты 435
сахаров в растворе 416'сл., 418
тион-тиольная 397
тиооксикислот фосфора 398
три^дная 398, 404
циклооктатстраена 538, 544
электронная 538
Таутомерное равновесие 289, 392 сл.сахаров 417
Таутомерный эффект (Динамический,
Электромерный эффект, Г-эффект)
124, 176, 276, 291, 397, 404
в непредельных спиртах 289
двойной связи 312 сл.
карбонильной группы 176, 299, 312 сл.
нитрогруппы 203, 207
Теломеризация 178, 184, 375, 381, 460
ТеорияБайера 493
Льюиса 20направленной валентности 239
переходного состояния 88 сл.
радикалов 14, 17
таутомерии 393 сл.
типов 14 сл.химического строения Бутлерова 16,
19электролитической диссоциации 20
электрохимическая 13, 14, 19
Тепловой эффект реакции 81, 82, 83
612ПРЕДМЕТНЫЙ УКАЗАТЕЛЬТеплотыобразования связей 320 сл.
полиморфного перехода 82
Терефталевая (я-бензолдикарбоновая)
кислота 538
Термодинамическая константа равнове¬
сия 80
Термометр Бекмана 49
Терпены 273, 276, 512, 516
Тетрабромциклобутан 508
Тетрагидрофуран 114, 265, 270, 288, 380
Тетрадекан 57, 58Тетрадекагексаен-2,4,6,8,10,12 276, 580
Тетрадекандикарбоновая кислота 540
Тетраконтан 57
Тетраметилальдогексозы 415
Тетраметиламмоний 21
Тетраметилгалактоза 4422.3.4.6-Тетраметилглюкоза 449, 450, 555,
556 .Т етраметиленгликоль (Бутандиол-1,4)100, 101, 270
Тетраметилкетогексозы 415
Тетраметилортокарбонат 3442,2,3,3-Тетраметилпентан 65 '
Тетраметилпентоза 4152.2.6.6-Тетраметилпиперидон-4 (Триаце-
тонимин) 129, 297Тетраметилсвинец 24
Тетраметилсилан 560, 561
Тетраметилэтилен 244, 248
Тетраметилэтилеигликоль см. 2,3-Диме-
тилбутандиол-2,3
Тетранитрометан 207
Тетраозы 412, 444Тетраоксинеопентан см. Пентаэритрит
Тетраоксипентаналь см. Альдопентоза
Тетрапептиды 474
Тетрафторэтилен 74, 283, 284, 289
Тетрахлоралканы 184
Тетрахлорметан 701,1,2,2-Тетрахлорэтан 261, 284
Тетрахлорэтилен 223, 284
Гетрацианэтилен 538Тетраэдрическая конфигурация углерод¬
ного атома 61, 242, 337
Тетраэтилортокарбонат 344
Тетраэтилсвинец 64Тетроловая (метилпропиоловая) кислота
338, 339Тефлон (Перфторполиэтилен) 74, 78, 289Тиали см. ТиоальдегидыТиаминпирофосфат 436Тибетолид 381Тиоальдегиды (Тиали) 199Тиоацетон 199Тиогликоль 117Тиокетоны (Алкантионы, Тионы) 199
Тиокислоты 199
Тиоловые кислоты 199
Тиолы см. Меркаптаны
Тиомочевина 351
Тионовые кислоты 199
Тионтиоловые кислоты 199
Тион-тиольная таутомерия 397
Тионы см. Тиокетоны
Тиооксикислоты фосфора 398
Тиосахара 433
Тиоспирты см. Меркаптаны
Тиофос 342Тиоэтаноламин 436Тиоэфиры (Диалкилсульфиды) 195 сл.сульфониевые соли 196
Тирозин 457Тозилаты (я-Толуолсульфонаты) 541
Толуол 326, 517, 562, 572
я-Толуолсульфонаты (Тозилаты) 541
Торсионное напряжение 494, 501
Трагакант 454
Транквиллизаторы 349
Трансаннулярный эффект 540 сл.
Трансоидная конформация 213, 480
Трегалоза 439, 441, 445, 446
реакции 442, 443
Треозы 422
Трео-изомер 377, 471
Трео-конфигурация 471
Треонин 456, 459, 466, 468, 470
Триадная таутомерия 398, 404
Триаконтан 57
Триалкилбораты 108
Триалкилоксониевые соли 119
Триацетилбензол 144
Триацетилен (Гексатриин) 278
Триацетонимин 129, 297
2,3,4-Трибензоилметилглюкозид 4461.2.3-Трибромпропан 2692.3.4-Трибромциклопентанон-1 548
Р-Трибромэтанол (Авертин) 99
Тридекан 57, 58
Триизобутилен 256
Трикарбаллиловая кислота 382
Трикетоны циклические 510
Трилинолеин 310
Тримезиновая кислота 339
Триметиламин 21, 207, 208, 210
Триметиламмония соль 21, 2081.3.5-Триметилбензол (Мезитилен) 1381,7,7-Триметилбицикло12,2,1]гептанон-2 см.Камфора
Триметилборат 1082.2.3-Триметилбутан 60, 64, 65
Триметилглюкоза 442, 450, 556
Триметилен см. Циклопропан
Триметиленгликоль (Пропандиол-1,3)100Триметилкарбинол см. 2-Метилпропа-
нол-2
Триметилмоноза 4422.2.4-Триметилпеитан (Изооктан) 64, 65,
256, 259Трйметилпентоза 415
Триметилсульфоний иодистый 22
Триметилуксусная кислота, нитрил 1701.2.4-Триметилциклогексан 4911,2,2-Триметилциклопентанкарбоноваякислота 515
Триметилэтилен см. Р-Изоамилен
Триметоксиглутаровая кислота 416, 4432.4.6-Тринитроанилин 150
Тринитрометан (Нитроформ) 207
Триозы (Трисахариды) 412, 439 сл., 444
Триоксиметилен 140Триолеин 308
Трипептиды 471, 474
Триплекс 290
Три-н-пропиламин 208
Триптицен 533
Триптофан 457Трисахариды 412, 439 сл., 444
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ613Тристеарин 308Трифенилметилнатрий 402, 403
Трифенилфосфин 309, 350
Трифенилфосфинкарбэтоксиметилен 409
Трифосген 343
Трифтордиазоэтан 217
Трифторуксусная кислота 178
смешанный ангидрид' 166
Трифторхлорэтилен 284
|3-Трифторэтанол 99
Трифторэтиламин 217
Трйхлорацетальдегид (Хлораль) 99, 128,
136, 193
Трихлорацетон 136Трихлор-грег-бутиловый спирт (Хлор-
этон) 99
Трихлорметан см. Хлороформ
Трихлорнитрометан (Хлорпикрин) 2021,2,3-Трихлорпропан 103
Три-(Р-хлортриэтил)-амин 341
Трихлоруксусная кислота 14, 1781.1.1-Трихлорэтан 560, 5611.1.2-Трихлорэтан 284, 481, 482
Трихлорэтанол 99
Трихлорэтилен 177, 261, 283, 284
Трицикло[3,3,1,1]декан (Адамантан) 544сл.Трицикло[3,3,2,0]декатриен-2,7,9 (Бульва-
лен) 550
Триэтаноламин 117, 341
Триэтилалюминий 258
Триэтиламин 208, 350
Триэтилборат 108ТрЪпилиден (Циклогептатриен-1,3,5) 502,
535, 536
Тропилий 536Тростниковый сахар см. Сахароза
Г-эффект см. Таутомерный эффектУглеводы (см. также Моносахариды)
412 сл.
брожение 378, 383 сл.— спиртовое 94 сл., 433 сл.
масс-спектрометрический анализ 555
сл.синтез в растениях 438 сл.
стереохимия 417 сл.
таутомерия 416, 417, 423
ЯМР-спектры 428
Углерод 12, 20аллотропная модификация 279
валентные состояния 242, 243, 244
вторичный 58гибридизация атомных орбиталей 237,
243качественное обнаружение 43
первичный 57
третичный 58
четвертичный 57
четырехвалентность 16, 20
Угли бурые, гидрогенизация 62
Угольная (оксимуравьиная) кислота 344
нитрилы 351 сл.
производные 343 сл.
хлорангидрид см. Фосген
Уксусная (этановая, метанкарбоиовая)
кислота 14, 21, 152 сл., 185
декарбоксилирование 63
криоскопнческая константа 50Уксусная кислотамодели Стюарта — Бриглеба 335
пиролиз 167, 301
получение 65, 262
спектр ЯМР (ПМР) 560
физические свойства 152, 153
Уксусный альдегид см. Ацетальдегид
Уксусный ангидрид 142, 167, 170, 207,290получение 166, 167электрохимическое фторирование 178
Ультрафиолетовые спектры 568, 571,
579 сл.Ундекан 57, 58Унитарная теория типов 15УравненияАррениуса 87, 89
Шредингера 220Клаузиуса — Моссоти — Дебая 324
Уреиды 347 сл.Уретан (Этилкарбамат) 344
Уретаны 349, 352
Уроиовые кислоты 410, 454
Уротропин (Гексаметилентетрамин) 129
комплекс с СаС1г (Кальцекс) 129Фазовое равновесие 29
Фарнезол 293
Фелингов реактив 383
Фенантрен 528
Фенилаланин 456, 476
Фенилгидразоны 1312-Фенилпропионовый альдегид 488
Фенолы 38, 50, 142, 218
гидрирование 518
Ферментативныйгидролиз 444, 448 сл.
катализ 446
Ферменты 95, 367, 433, 446, 447, 455, 476
Ферроцен 514Физические методы исследования 319 сл.,
550 сл.Фитин (Мезоинозит, фосфорнокислый
эфир) 520
Фитол 293
Флегмовое число 31
Формалин 140, 142Формальдегид (Метаналь, Муравьиный
альдегид) 20, 120, 121 сл., 180
дипольный момент 327
конденсация 139, 204, 408— с ацетальдегидом 104, 294— с ацетиленом 101, 278
полимеризация 140
получение 65, 99, 120, 124 сл.
применение 101, 142
реакции 128 сл., 210, 253
фенилгидразон 132
физические свойства 121Формамид 41, 168, 169, 215
Формилфтористый 164, 165
хлористый 164
Формилацетон 144
Формилимидазол 164
формилирование метанола 166
Формилуксусная кислота 384
Формилуксусноэтиловый эфир 386, 405
Формилциклогексанон 395
614ПРЕДМЕТНЫЙ УКАЗАТЕЛЬФормилциклопеитанон 395
Формонитрид см. Синильная кислота
Формулы строения 17
Льюиса 20 сл.Ньюмена 316, 317, 479 сл., 585
Фишера 359 сл., 363, 414 , 421, 440,
487, 584
Форон 129, 138, 295, 296 сл.Фосген (Карбонил хлористый. Угольная
кислота, хлорангидрид) 164, 177,343 сл.Фосфатаза 446
фосфатиды 310Фосфиты (Эфиры фосфористой кислоты)
110 сл.Фосфоглицеромутаза 435
Фосфор, определение 44
Фосфорилиды 309
Фосфофруктокиназа 434
Фотолиз (Фотосенсибилизироваиное раз¬
ложение) 67, 521, 529
Фотохимический синтез 368, 438
Фрагментация 551 сл.Фракционное разделение веществ 29 сл.
Фриделя соединений 115
Фруктоза (Левулоза) 94, 408, 412 сл.,
420, 423
в полисахаридах 448
дифосфат 438
реакции 387, 446
спиртовое брожение 433 сл.
строение 444
физические свойства 445
Фталевая кислота, эфиры 41, 99
Фторангидриды кислот 164 сл.Фукоза (6-Дезоксигалактоза) 432
Фуксин 12
Фульвен 3^6, 514Фумаровая (тра«с-1,2-этилеидикарбоио-
вая) кислота 261, 314 сл., 369, 436,
437
эфир 368
Фунгициды 515
Фуранозы 416, 444
таутомерия 416Хаульмугровая кислота 516
Хелатные соединения 146
Химические волокна 306
Химический сдвиг 428, 559 ел.
Химическое равновесие 79 сл.Хинин 367
Хинит 431, 453Хиральные и ахиральиые атомы и моле¬
кулы 356, 369
Хитин 431, 453Хлораль (Трихлорацетальдегид) 99, 128,
136, 145, 180
Хлоральгидрат 128, 178
Хлорангидриды кислот 151, 164 сл.реакции 127, 166, 218
Хлорацетальдегид 136
Хлорацетон 144
Хлорбензол 3271-Хлор-З-бромпропан 5071-Хлор-2-бромэтан 482
Хлорбромэтилены 3172-Х лорбутадиеи-1,3 (Хлоропрен) 278,282Хлорвинилкетои 313(З-Хлорвинилмеркурхлориды 319
Хлоргидриигликолей 101, 249
глицерина 104, 105
Хлорекс (Ди-р-хлордиэтиловый эфир)
250Хлоринолиз 67
Хлорированиекарбоновых кислот 158, 177
метана 67, 72
пропилена 103
Хлор-ИФК 349
Хлоркарбен 536а-Хлоркарбоновые кислоты 250
а-Хлоркетоны 157
Хлормалоновая кислота 382
Хлормасляные кислоты 179
Хлормеркурацетальдегид 3992-Хлорметил-2,4,4-триметил-1-фтор-3-
хлорпентан 70
Хлорметнлмеркурхлорид 217
Хлормуравьиная кислота 177
Хлоропреи(2-Хлорбутадиен-1,3) 278, 282
Хлоропреновый каучук 263, 278, 282
Хлорофилл 293, 438
Хлороформ (Трихлорметан) 26, 70
азеотропные смеси 34
получение 67, 72, 137
реакции 78, 99, 163, 202, 214, 284
спектр ЯМР 560, 561
физические свойства 72, 73
эбуллиоскопическая константа 50
Хлорпикрин (Трихлорнитрометан) 2021-Хлорпропен-1 (Пропенил хлористый)283 . 12-Хлорпропен-1 (Изопропенил хлори¬
стый) 2833-Хлорпропен-1 см. Аллил хлористый
п-Хлортолуол 326
Хлоругольный эфир 403, 473
Хлоруксусные кислоты 14, 177, 188
К-4-Хлорфенил-М',М'-диметил мочевина(Монурон) 349
Хлорциклооктатетраен 537
0-Хлорэтанол см. Этиленхлоргидрин
Хлорэтен (Винил хлористый) 261, 282 сл.,
327Хлорэтин (Монохлорацетилен) 283
Хлорэтон (Трихлор-грег-бутиловыйспирт) 99Хлоряблочные (оксихлорянтарные) кис¬
лоты 364Хлорянтарные кислоты 314, 315, 370
Холин (p-Окснэтилтриметиламмония гид¬
роокись) 310, 341, 342
Холинацетат (Ацетилхолин) 342
Хондроитины 431
Хроматография 36 сл., 513
адсорбционная 36 сл.
бумажная 38 сл.
газо-жидкостиая 41 сл., 367, 513
тонкослойная 39 сл.Хромофоры 580Целлобиоза 43, 440, 446, 449, 451масс-спектрометрический анализ 557
физические свойства 445
Целлогексаоза 43
Целлозольвы 114, 117
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ615Целлотетраоза 451
Целлотриоза 444, 449, 451
Целлюлоза (Клетчатка) 412, 448 сл.
гидролиз 449, 451
конформации 449
производные 451 сл.
промышленное получение 448
сульфатная 448
сульфитная 448физико-химические методы анализа42, 43, 338, 451
Цейные реакцииокисление алкаиов 64, 192
сульфохлорирование алканов 68 сл.,
198хлорирование алканов 67, 71
Церезин 62Церотиновая (гексакозановая, пентако-
занкарбоновая) кислота 152
Цикланы см. Алициклические соедине¬
ния
Циклены 498Циклизация (см. также Ацилоиновая
конденсация) 503 сл., 535
парафинов 66, 511
трансаннуляриая 544
Циклоалкилтриметиламмоний 507
Циклоалкины 515
Циклобутадиен 508
Циклобутанкарбоновые кислоты 508
Циклобутанол 523
Циклобутанон 508
Циклобута ны 494, 501
гидрирование 506
изомеризация 497, 524
напряжение 494
получение 503 сл.
производные 523
реакции 506
теплота сгорания 503
физические свойства 502
Циклобутены 502, 504, 507
Циклогексадиены 502, 517, 518
Циклогексан 493 сл., 503, 513, 516 сл.
дегидрирование 517
дизамещенный 498 сл.
конформации 493 сл., 530, 568
окисление 521
октановое число 65
получение 509 сл., 524
производные 498 сл., 516 сл.
спектры ПМР 568— ЯМР 560, 561
физические свойства 502
элюирующая способность 38
энергия цикла 501, 503
Циклогексангексаолы см. Инозиты
Циклогександиолы 508
Циклогексанол 38, 518
реакции 521, 523
Циклогексанон 184, 461, 509, 521 сл.
применение 38, 521
реакции 518, 521, 535
таутомерия 521
Циклогексанонкарбоновый эфир 394,395Циклогексен 502, 517
а-окись 518
Циклогексилкарбинол 523
Циклогексин 515Циклогептадекаи 503
Циклогептадеканон 540
Циклогептадиен-1,3 502, 535
Циклогептан 491, 493, 502, 503
производные 524, 535 сл.
Циклогептанкарбоновая кислота 536
Циклогептанон (Суберон) 509, 535
Циклогептатриен-1,3,5 (Тропилиден) 502,
' 535, 536
Циклогептен 502
Циклогептиламин 523
Циклогептиловый спирт 523
Циклогептин 515
Циклодекан 503, 540
Циклодекандиолы 541
Циклодеканол 541, 542 сл.
Циклодекапентаен 263
Циклодецен 542
а-окись 541
Циклододеканон 184, 540
Циклододекатриен 275
Циклонит (Гексоген) 130
Циклононан 503
Циклононандиол 541
Циклононатриеи 544
Циклононен, а-окись 541
Циклооктадиены 502, 536
Циклооктан 502, 503, 536 сл.
Циклооктандиол 541
Циклооктаполиены 536
Циклооктатетраен 263, 329, 502
производные 537 сл., 550
реакции 538, 544
таутомерия 538, 544
Циклооктатриен 502, 537
Циклооктен 502, 537
а-окись 541
Циклооктин 515
Циклопентадекан 503
Циклопентадеканон (Экзальтои) 540
Циклопентадиен 502, 514 сл.
Циклопеитадиенил-анион 514
Циклопеитан 501, 502, 503, 512 сл.
изомеры 497
конформации 494
получение 509 сл., 513, 524
производные 509 сл., 512 сл., 524
энергия цикла 501
Циклопентанкарбоновые кислоты 515 сл.
Циклопентанол 513, 523
Циклопентанон 184, 397, 509, 513
Циклопентанонкарбоновый эфир 395
Циклопентен 502, 513
I1иклопентенои-2 548
Циклопентилциклогексан 492
Циклопентин 515Циклопропан (Триметилен) 501, 502,
503 сл., 507
гидрирование 505
изомерия гомологов 497
напряженность цикла 493, 505
получение 503 сл., 507
применение 507
производные 523
реакции 505, 506
сопряжение 506
теплота сгорания 503
Циклопропанкарбоновые кислоты 509,536Циклопропанон 508
616ПРЕДМЕТНЫЙ УКАЗАТЕЛЬЦиклопропан-1,2,3-трикарбоновая кисло¬
та 536
Циклопропен 502, 507
Циклопропилкарбинол 523
Циклопропилциклогексилметан 492
Цистеин (Р-Меркапто-а-аминопропионо-
вая кислота) 467, 469, 475
реакции 466 ^
физические свойства 456
Цистин 456, 467
Цитраль 299 сл.Цитронеллаль 299
Цитронеллол 292Четыреххлористый углерод 38, 67, 70, 72,
345, 346, 381
спектр комбинационного рассеяния
572Шелк ацетатный 452
Шиффовы основания 139Щавелевая кислота (Этандикислота) И,
98, 183 сл., 185, 381
нитрил (Дициан) 11, 183, 185
применение 189
производные 185, 510
реакции 292, 385, 510
Щавелевоуксусная кислота 384, 436, 437
таутомерные формы 384 •
Щавелевоуксусный эфир 386
Щавелевоянтарная кислота 437
Щелочная целлюлоза (Алкалицеллюло-
за) 451Эбонит 280Эбуллиоскопический метод определения
молекулярного веса 50
Эйкозан 57, 58Экваториально-аксиальная изомерия де¬
калинов 531
Экваториальные связи 426, 496, 498, 499,
530, 568Экзальтация молекулярной рефракции
329Экзальтон (Циклопентадеканон) 540
Экзо-соединения 530Эклиптическая (заслоненная) конформа¬
ция 479, 480, 495
Экстракция 26, 34 сл.Элаидиновая кислота 304, 311, 317, 319
Электромерный эффект см. Таутомерный
эффект
Электроннаяструктура атомов 222 сл.
таутомерия 538
Электронные спектры 568, 579 сл.
Электронный
сдвиг 124, 173
центр атома 331
Электронография 337
Электроотрицательность элементов 322 сл.
Электрофильное
замещение 319присоединение 248, 371, 399, 400, 403
Электрофильные реагенты 23, 403Электрохимическая теория строения 13,
14, 19Элеостеариновая кислота 311
Элиминация (Элиминирование) 75, 286,
346Эмульгирующие средства 198, 515
Эмульсин 444, 446
Энант 477Энантиомеры 356, 357, 368
Энантиоморфные кристаллы 368
Энантовая (гептановая, 1-гексанкарбо-
новая) кислота 152, 521
Энантовый альдегид (Энантол, Гепта-
наль) 121
Энантовый ангидрид 167
Эндометиленовый цикл 528
Эндосоединения 528, 529, 530
Эндоэтиленовый цикл 529
Энергияактивации 87, 482, 483
конформаций 482, 500
образования и разрыва связей 65,
246, 320 сл.
резонанса (делокализации, сопряже¬
ния) 174, 175, 228, 237, 268, 321
Энергосодержание цис- и транс-изоме¬
ров 318
Энзиматические реакции 438
Энтальпия 82, 89
Энтропийный фактор 397, 534
Энтропия 81, 82, 83, 89
Эпиинозит 519
Эпимеры 419, 420
Эпихлоргидрин глицерина 105
Эпоксидные смолы 105
а, Р-Эпоксикислоты (Глицидные кисло¬
ты) 377Эритрит (Бутантетраол-1,2,3,4) 105
Эритриты 105
Эритрозы 422, 432, 471
Эритро-изомеры 376, 377
Эритро-конфигурация 47!Этан 16, 17, 55 сл.
конформации 479
крекинг 66
нитрование 67
получение 63
строение 244физические свойства 58, 59
Этаналь см. Ацетальдегид
Этандиаль см. Глиоксаль1.2-Этандикарбоновая кислота см. Ян¬
тарная кислотаЭтандикислота см. Щавелевая кислота
Этандиол-1,2 см. Этиленгликоль
Этанкарбоновая кислота см. Пропионо-
вая кислота
Этановая кислота см. Уксусная кислота
Этанол см. Этиловый спирт
Этаноламин (Коламин) 117,310,341
Этаноламины 117, 258
Этанолтриметиламмоний, соль 341
Этантиол (Этилмеркаптан) 194, 1951.2.2-Этантрикарбоновая кислота 187
Этен см. Этилен
Этерификация 97, 160Этилбромистый 64
гидроперекись 191
хлористый 70, 327
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ617Этиламин 208
Этилацетамид 211
Этилацетат 38, 161
Этилацетилен см. Бутин-1
Этилацетоуксусный эфир 395
Этилбензол, спектр ЯМР 562, 563З-Этилбутаналь (а-Этилмасляный аль¬
дегид) 121
Этилбутират (Масляная кислота, этило¬
вый эфир) 161
Этилвалерат (Валериановая кислота,
этиловый эфир) 161
Этилвиниловый эфир 286
Этилен (Этец) 12, 20, 245, 258
бромистый 12молекулярная диаграмма 233окисление 116окись см. Окись этиленаполимеризация 141, 256 сл.получение 66, 246 сл.реакции 111, 127, 206, 247 сл., 303строение.244теломеризация 178, 184, 375, 381, 460
хлористый см. Дихлорэтан
Этиленгликоль (Этандиол-1,2) 29, 90, 100,
116, 117, 548
дегидратация 116диметиловый эфир (1,2-Диметокси-
этан, Моноглим) 114, 117
диэтиловый эфир (1,2-Диэтоксиэтан)
114, 117моноэтиловый эфир (Этилцеллозольв)
114, 117
нитрат 110окисление 183, 381, 385
получение 100, 101
реакции 101 сл., 141, 427
Этилендиамин (1,2-Диаминоэтан) 212, 478
комплексные соединения 213
Этилендиаминтетрауксусная кислота
(ЭДТУ) 478
Этилен-1,2-дикарбоновые кислоты см.Малеиновая кислота
Этиленимин 118, 214Этиленовые углеводороды см. Олефины
Этиленхлоргидрин ((З-Хлорэтанол) 99,101, 116, 250, 258
реакции 178, 303
Этилиденбромистый 262
хлористый 70
Этилкапроновая кислота 41
Этилкарбамат (Уретан) 344
Этилкарбинол см. к-Пропиловый спирт
а-Этилмасляный альдегид (З-Этилбута-
наль) 121
Этилмеркаптан (Этантиол) 194, 195
Этилметилциклобутйн 497
Этилнитрат 106, 109
Этилнитрит 109Этиловая жидкость 64
Этиловый спирт (Этанол, Метилкарби-
нол) 18, 38, 89 сл.
азеотропная смесь с бензолом 34,
95модель Стюарта — Бриглеба 335
получение 94 сл., 258, 433 сл.
применение 99, 154
реакции 96 сл., 112, 166
физические свойства 91, 92
этерификация 97
Этиловый эфир см. Диэтиловый эфирЗ-Этилпентан 60
Этилпропиоловая кислота 338
Этилпропионат 161
Этилсерная кислота 111
Этилформиат (Муравьиная кислота, эти¬
ловый эфир) 161
Этилхлорформиат (Этилхлоркарбонат)344Этилцеллозольв (Этиленгликоль, моно¬
этиловый эфир) 114, 117
Этилэтилен см. а-Бутилен
Этин см. Ацетилен
Эфир(ы)ацетиленовых спиртов 293
двухосновных карбоновых кислот 185,
189карбоновых кислот 160 сл.
конденсация см. Сложпоэфирная кон¬
денсация
Меервейна 545, 546
минеральных кислот 106 сл.
непредельных спиртов 289 сл.
(3-оксокислот 405 сл.
простые см. Простые эфиры
сложные см. Сложные эфиры
Эффект
поля 315участия соседней группы 213
Эффективный заряд атома 232Яблочная (оксиянтарная) кислота 315,
355, 360 с л., 370, 383, 435
реакции 314, 370, 382, 436
Ядерный резонансквадрупольный (ЯКР) 558
магнитный (ЯМР) 320, 427, 428, 496,
550, 557 сл.Янтарная кислота (Бутандикислота, 1,2-
Этандикарбоновая кислота) 182,183, 184, 188, 316 сл., 436
ангидрид 188, 314, 380
конформации 317
меченная 14С 543
получение 187, 382
производные 188, 406, 437, 487, 510
реакции 436, 487, 510
Янтарный диальдегид (Бутандиаль) 143,
146
содержание книги IПредисловие - 5ЧАСТЬ ПЕРВАЯВведение ИПредмет органической хнмин. Исторический обзор ИПонятие о химическом индивидууме 25Способы выделения индивидуальных веществ в органической химии .... 26Перегонка 26Фракционное разделение веществ, основанное на фазовом равновесии . . 29Хроматография 36Анализ органических соединений 43Качественный анализ 43Количественный анализ 44Вывод эмпирической формулы вещества 48Определение молекулярного неса 48Классификация органических соединений 51АЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Предельные соединенияУглеводороды (алканы) 55Нахождение алканов в природе 61Способы получения алканов 62Химические свойства алканов : 64Номенклатура алканов 69Галоидпроизводные предельных углеводородов 70Получение гадоидпроизводных 71Физические свойства галоидпроизводных 72Химические свойства галоидпроизводных 74Установление строения галоидпроизводных 79Химическая реакция 79Химическое равновесие . 79Скорость реакции 84Предельные спирты 89Одноатомные спирты (алканолы) 89Физические свойства
СОДЕРЖАНИЕ КНИГИ I619Получение спиртов .91Химические свойства спиртов 96Галоидзамещенные спирты (галоидгидрины) 99Применение спиртов 99Двухатомные спирты, или гликоли (алкандиолы) ,100Способы получения 100Химические свойства гликолей 101Многоатомные спирты 103Сложные эфиры минеральных кислот 106Способы получения сложных эфиров 107Простые эфиры 112Простые эфиры многоатомных спиртов 116Оксониевые соединения 119Оксосоединения (альдегиды и кетоны) 1?0Способы синтеза оксосоединений 123Синтетические, реакции, специфические для альдегидов 127Химические свойства оксосоединений 127Полимеры и полимеризация 141Применение альдегидов и кетонов 142Диальдегиды, альдегидокетоны, дикетоны 142Способы получения 142Свойства диоксосоединений 144Кислоты 146Функция кислотности Но 148Карбоновые кислоты 151Одноосновные предельные кислоты 151Способы получения карбоновых кислот 154Химические свойства карбоновых кислот . . 157Функциональные производные карбоновых кислот 158Соли карбоновых кислот 159Сложные эфиры карбоновых кислот 160Ортоэфиры кислот 162Галоидангидриды кислот 164Ангидриды кислот 166Амиды кислот 168Нитрилы кислот 169Амидины 171Гидразиды кислот 172Гидроксамовые кислоты 172Причины кислотных свойств карбоновых кислот. Понятие о мезомерии . . . 173Галоидзамещенные кислоты 177Константы диссоциации галоидзамещенных кислот. Индуктивный эффект . .179Двухосновные карбоновые кислоты 181Способы получения 183Особенности химического поведения двухосновных кислот 185Применение двухосновных кислот 189Органические производные перекиси водорода 190Соединения серы 194Тиоспирты (меркаптаны) 194Тиоэфиры (диалкилсульфиды) 195Сульфоокиси' и сульфоны 196
620СОДЕРЖАНИЕ КНИГИ IАлкансульфокислоты , 197Тиоальдегиды и тиокетоны (тиали и тионы) 199Тиокислоты 199Азотистые производные алканов . 200Нитрозосоединения 200Ннтросоединення 201Строение нитросоединений 202Свойства нитросоединений • 203Полинитросоединения 207Предельные амины 207Способы получения аминов 209Химические свойства аминов 210Диамины 212Изонитрилы (карбиламины) 214Диазосоединения жирного ряда 216Основы квантово-химического описания электронного строения молекул .... 220Волновая функция стационарного состояния молекулы 220Электронная структура атомов 222Основы молекулярно-орбитального описания электронных оболочек молекул . 225Резонанс структур ' или мезомерия 234Гибридизация атомных орбиталей и «■валентное состояние» 237Непредельные соединенияОлефины (алкены) 243Номенклатура 244Геометрическая изомерия. I 245Способы получения олефннов 246Реакции олефинов 247Применение олефинов 258Ацетилены (алкины) 259Способы получения 260Реакции тройной углерод-углеродной связи 261Реакции замещения водородных атомов ацетилена 264Ацетилен 266Диеновые углеводороды ■ 267Общие способы получения диенов 268Получение 1,3- диенов 269Реакции диенов 272Полиеновые углеводороды 275Кумулены 277Енины 277Полиины 278Каучуки 279Непредельные галоидпроизводные 282Свойства галоидпроизводных олефинов 285Применение галоидпроизводных олефинов 288Непредельные спирты и их эфиры 2Г9Ацетиленовые спирты и простые эфиры 293
СОДЕРЖАНИЕ КНИГИ I621Непредельные оксосоединения 294Оксосоединения с олефиновой связью 294Синтез непредельных альдегидов с сопряженными связями С = С и С = 0 294Синтез непредельных кетонов 295Свойства оксосоединений с сопряженными двойными связями 295Кетены , . . . . 301Непредельные кислоты 302Одноосновные кислоты этиленового ряда 302Высшие жирные непредельные кислоты. Жиры. Липиды 308Винилогия и Т-аффект двойной С=С-связи 312Двухосновные кислоты этиленового ряда. Малеиновая и фумаровая кислоты 314Стереохимия. Геометрическая изомерия. II . . 315Физические методы установления строения органических молекул. I ... . 319Теплоты образования соединений и энергия образования связей 320Шкала электроотрицательности элементов 322Дипольные моменты молекул 323Молекулярная рефракция 328Дифракционные методы анализа в органической химии 330Карбоновые кислоты ряда ацетилена : 338Гетерофункциональные соединенияАминоспирты 340Оксикислоты 342Угольная кислота и ее производные 343Функциональные производные угольной кислоты 343Сернистые производные угольной кислоты 346Азотистые производные угольной кислоты 34GНитрилы угольной кислоты и ее функциональных производных 351Оксикислоты — гомологи гликолевой кислоты 355Стереохимия. Оптическая изомерия. I 355Относительная и абсолютная конфигурации . 360Соединения с двумя асимметрическими углеродными атомами. Диастерео-мерия 364Стереорегулярные полимеры 372Синтез оксикислот 374Свойства и реакции оксикислот 378Доказательство строения некоторых оксикислот 381Значение оксикислот 382Оксокислоты 383Синтез оксокислот 383Таутомерия 387Эфиры р-оксокислот 405Оксиоксосоединения 406Свойства оксиоксосоединений 409Углеводы 412Моносахариды 412Строение моносахаридов 412Стереохимия моносахаридов. Оптическая изомерия. II 417• Спиртовое брожение и клеточное дыхание . ■ 433Цикл дикарбоновых и трикарбоновых кислот (цикл Кребса) 436
622СОДЕРЖАНИЕ КНИГИ IСинтез сахаров в растениях . - 438Олигосахариды. Биозы и триозы (дисахариды и трисахариды) 439Полисахариды 446Строение полисахаридов 448Производные целлюлозы 451О синтезе полисахаридов 454Аминокислоты 455Синтез аминокислот 457Свойства аминокислот 461Установление строения природных аминокислот 465Конфигурация природных а-аминокислот • 468Дипептиды и полипептиды >471Полиамиды из ш-аминокислот 476Имииокислоты и нитрилокислоты 477Аминооксосоединения 478Пространственные затруднения и конформационный анализ 479Понятие о конформационном анализе 479Пространственные затруднения 483Пространственные эффекты при нуклеофильном замещении 484АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯНоменклатура алициклических соединений .... 491Строение алициклических соединений ..... 493Конформационный анализ простейших алициклов 494Изомерия алициклических соединений 497Алициклические углеводороды и их производныеМалые циклы 503Ряды циклопропана и циклобутана ' 503Методы синтеза 503Свойства 505Непредельные трех- и четырехчленные циклы 507Оксосоединения циклопропанового и циклобутанового .ряда 508Карбоновые кислоты циклопропанового и циклобутанового ряда 508Пяти- и шестичленные циклы 509Ряды циклопентана и циклогексана . 509Методы синтеза 509Циклопентаи и его производные ■ 512Карбоновые кислоты циклопентанового ряда 515Циклогексаи и его производные 516Непредельные соединения ряда циклогексаиа 517Спирты циклогексанового ряда 518Кетоны циклогексанового ряда 521Превращение циклов друг в друга 522Алициклические соединения с двумя или несколькими'циклами 525Двухядерные алициклические соединения с изолированными циклами . . . 525Спираны 526Алициклические соединения с конденсированными ядрами 527Методы синтеза 528Стереохимия 52д
4 иСОДЕРЖАНИЕ'ДНИГИ Г 623Средние циклы и макроциклы 533Методы синтеза 533Производные циклогептана 535Производные циклооктана 536Валентная изомерия и таутомерия 538Производные других цнкланов 539Трансаннулярный эффект » 540Полиэдрические алнциклы 544Физические методы установления строения органических молекул. II ... . 550
Установление строения органических соединений методом осколочной масс-спектрометрии 550Ядерный магнитный резонанс 557Оптическая спектроскопия в органической химии 568Поляриметрия - 582Пред м-е тный указатель 587
АЛЕКСАНДР НИКОЛАЕВИЧ НЕСМЕЯНОВ,
НИКОЛАИ АЛЕКСАНДРОВИЧ НЕСМЕЯНОВНАЧАЛАОРГАНИЧЕСКОЙ ХИМИИ
Книга IИздание второе, переработанноеРедактор Ф. Б. Рабнн-овнч
Технический редактор А. С. Кочетова /Художник Е. В. БекетовКорректоры М. С. Хрипунов а, М. М. НовичковаТ-09053. Сдано в наб. 27/XI 1973 г. Подп. к печ. 5/V 1974 г. Формат
бумаги 70Х I08*/ie- Бумага тип. N* 2. Уел. печ. л. 54,6. Уч.-изд. л. 53,5&
Тираж 35 000 экз. Зак. 882. „Изд. № 490. Цена в переплате» 2 р. 20 к.
Цена в суперобложке 2 р<26 'к.Издательство «Химия», 107076, Москва, Стромынка, 23.Ордена Трудового Красного ЗнамениЛенинградская типография № 2 имени Евгении Соколовой
Союзполнграфпрома прн Государственном комитете Совета Министров
СССР по делам издательств, полиграфии и книжной торговли
198052, Ленинград, Л-52, Измайловский проспект, 29