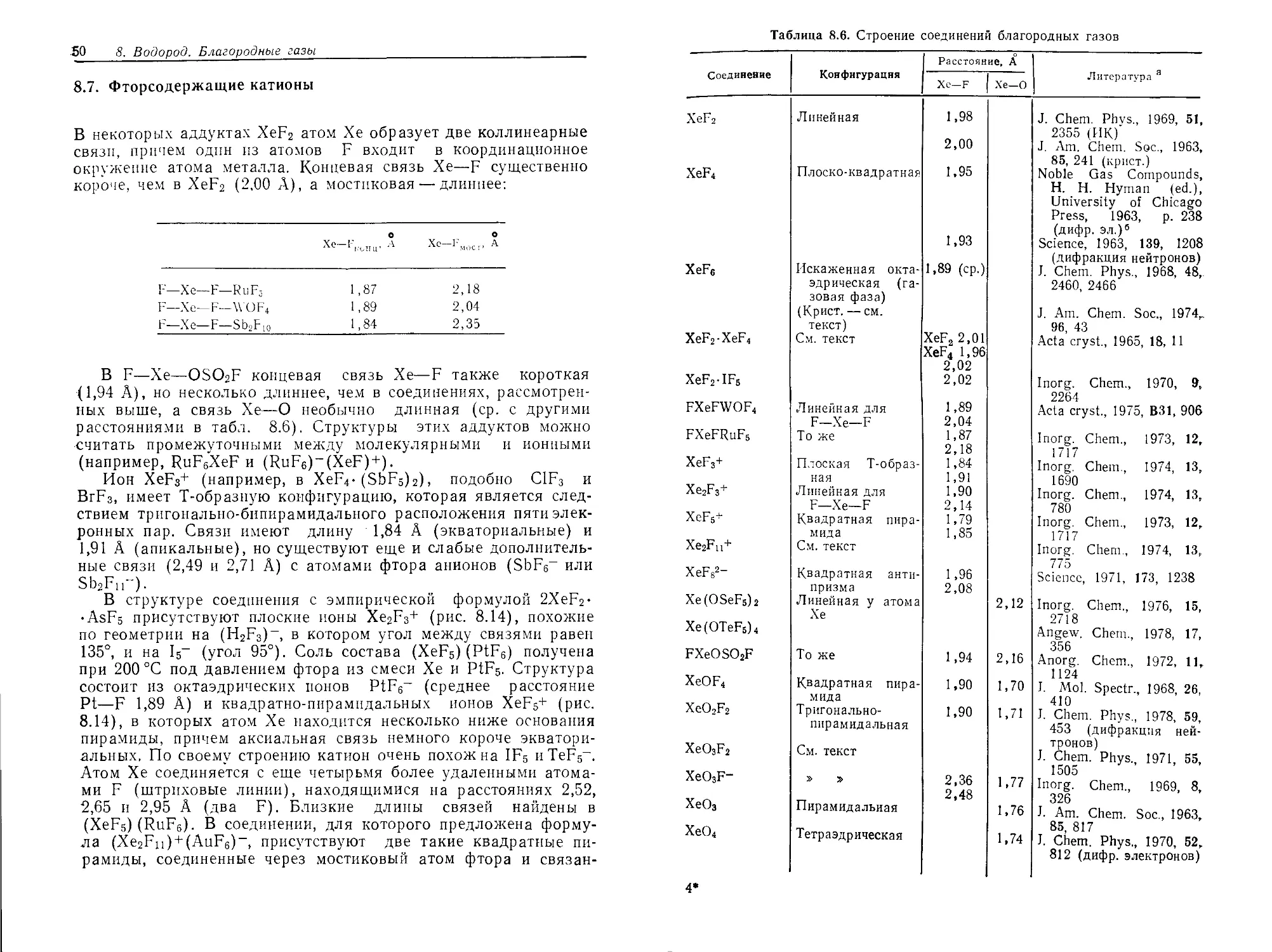
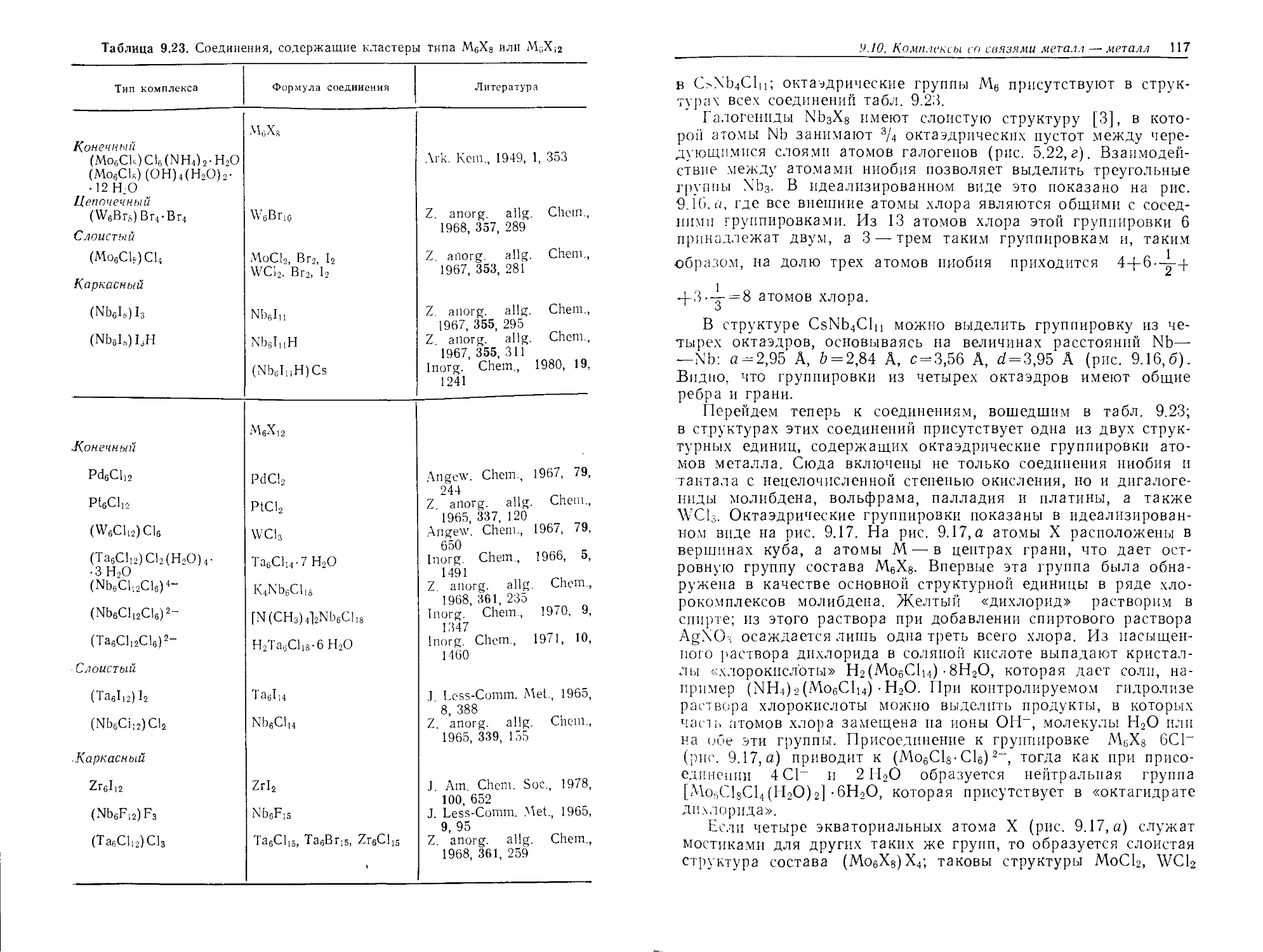
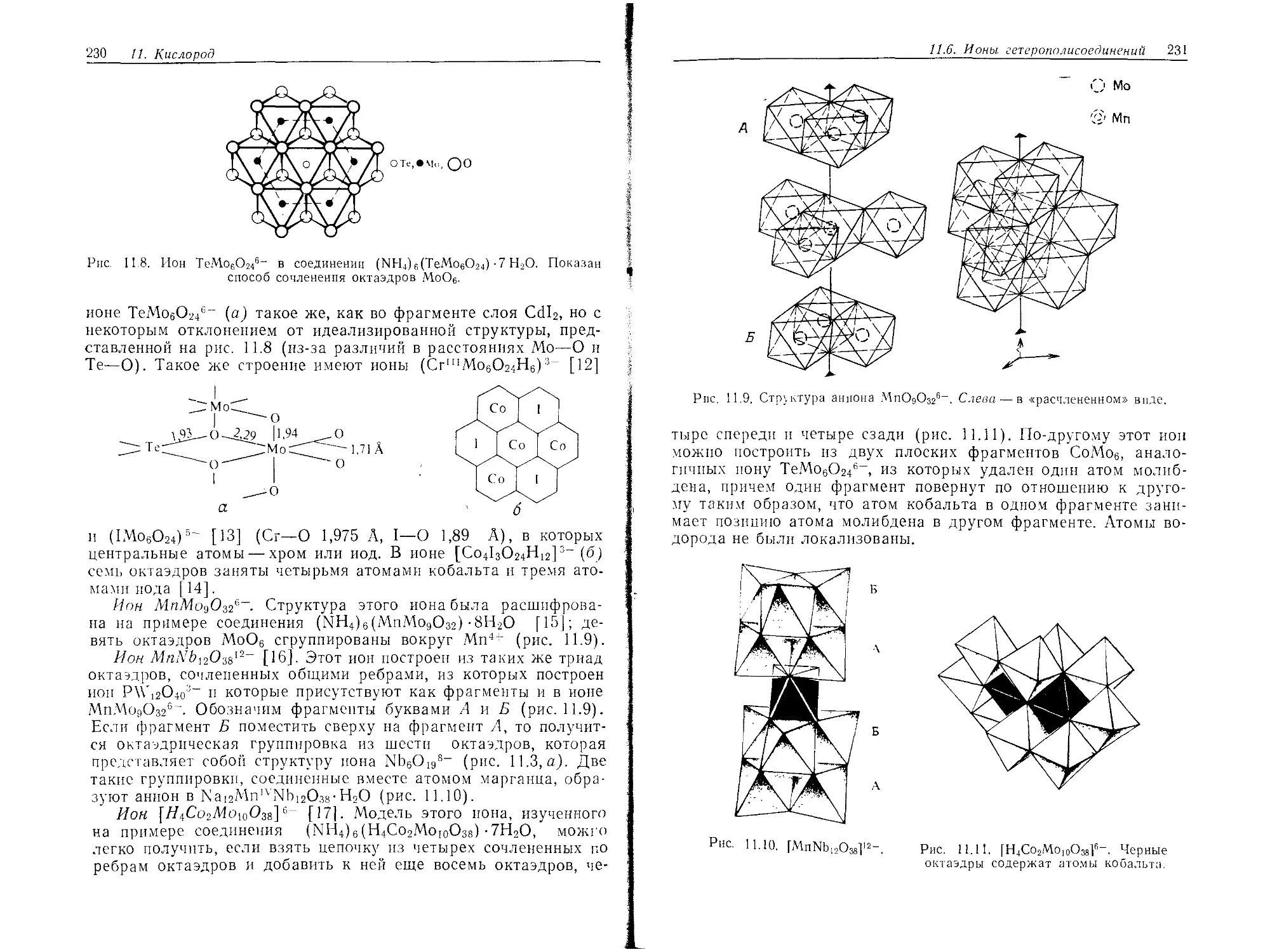
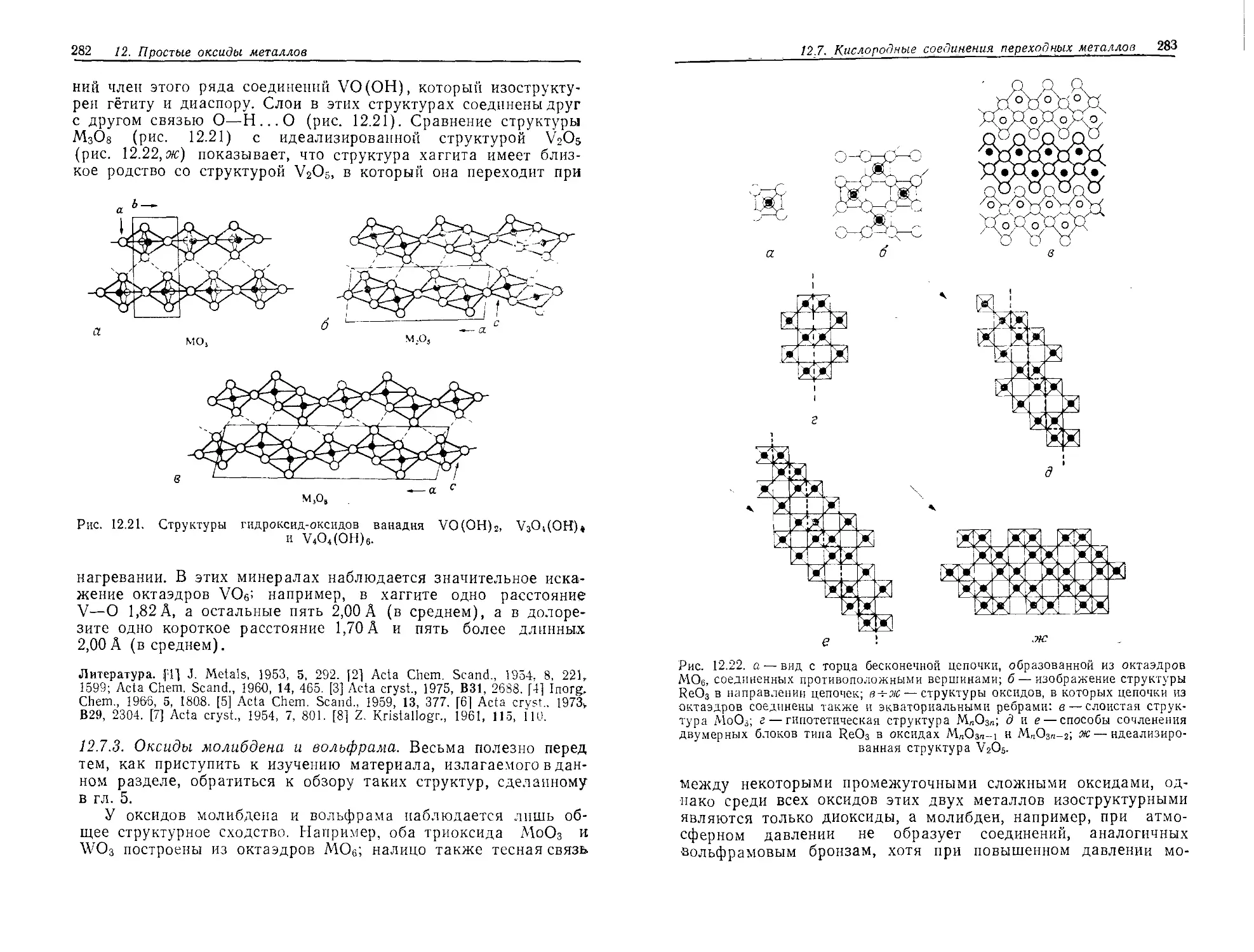
Текст
A.F. Wells
STRUCTURAL
INORGANIC
CHEMISTRY
Fifth Edition
А. Уэллс
СТРУКТУРНАЯ
НЕОРГАНИЧЕСКАЯ
ХИМИЯ
В 3-х томах
Том 2
Перевод с английского
канд. хим. наук В. А. Долгих,
канд. хим.наук Ф.М. Путилиной
и канд. хим. наук С. И. Троянова
под редакцией
чл.-корр. АН СССР М. А. Порай-Кошица
Clarendon Press ¦ Oxford
Москва «Мир» 1987
ББК 24.12
У98
УДК 548
Уэллс А.
У98 Структурная неорганическая химия: В 3-х т. Т. 2: Пер.
с англ. — М.: Мир, 1987. — 696 с, ил.
Фундаментальный труд автора из Великобритании, выдержавший за рубе-
жом пять изданий, содержит наряду с общими принципами кристаллохимии не-
органических соединений конкретные данные о структуре огромного количества
неорганических соединений, что делает его ценным энциклопедическим изданием.
Большой фактический материал и самый современный урозень теоретического ма-
териала позволяет рекомендовать книгу как учебное пособие для студентов при
изучении неорганической химии, кристаллографии, минералогии.
В т. 2 обсуждается структурная химия соединений водорода, благородных
газов, галогенов, кислорода, серы, селена, теллура, азота, фосфора, мышьяка,
сурьмы и висмута.
Для химиков-неоргаников, специалистов в области химии и физики твердо-
го тела, химической технологии, кристаллографов, а также студентов и аспи-
рантов соответствующих специальностей.
1802000000—402
041@1)—87
-подписное издание
ББК 24.12
Редакция литературы по химии
This book was originally published in the English
language by Oxford University Press, Oxford, England
© Oxford University Press, 1975, 1984.
Reprinted (with corrections) 1986
© перевод на русский язык, «Мир», 1987
Часть II
8. ВОДОРОД.
БЛАГОРОДНЫЕ ГАЗЫ
ВОДОРОД
8.1. Введение
Из всех элементов атом водорода имеет самую простую элект-
ронную структуру: лишь один валентный электрон и одну ор-
биталь, доступную для образования связи. Тем не менее водо-
род способен давать соединения с большинством химических
элементов, за исключением благородных газов, и поэтому игра-
ет в химии чрезвычайно важную роль. Можно выделить не-
сколько наиболее простых возможностей вовлечения атома во-
дорода в химическую связь.
1) При потере электрона образуется ион Н+ (протон). Кис-
лоту можно определить как источник протонов:
А ^
кислота
н+ + в
основание
Согласно этому определению, NH4+ можно рассматривать
как кислоту (NH4+^NH3+H+), а воду — и как кислоту, и как
основание:
Н+ + ОН" Н+ + Н2О
основание
основание
кислота
Последнее уравнение отражает тот факт, что в водных рас-
творах присутствуют преимущественно гидратированные, а не
свободные протоны.
2) При присоединении второго электрона образуется ион
Н~. В водных растворах он существовать не может, поскольку
сразу же соединяется с Н+, но в ряде кристаллических гидри-
дов этот ион обнаружен.
3) Атом водорода может образовывать простую ковалент-
ную связь за счет пары электронов. Это имеет место в молеку-
лярных гидридах неметаллов, в таких ионах, как, например,
ОН~, NH4+, в органических соединениях, а также в некоторых
гидридных соединениях переходных металлов.
Помимо этих трех случаев существует много молекулярных
и кристаллических структур, в которых атом Н соединяется од-
новременно с двумя (или более) атомами.
si
8.2. Гидриды
4) Если атом водорода связан с атомом сильноэлектроотри-
цательного элемента, то образующийся диполь А"—Н+ притя-
гивается к другому электроотрицательному атому той же самой
или другой молекулы
^А —Н —
§
I
o;
<Z
> CO X. —
О ci Jiz
со -зж
3 C^ 60 t
< r-
, СЧ г- ТГ
К
1) Ч> О
IX Z ¦—¦
t
.t;
!
i
4
.—.
H
u
ca
CJ
<
ri
ri
00
Z
i_
N
СЛ
j2
о
00
o->
r-
H
4-i
ж
re
CQ
<
¦fl
ЙЙ
c
00
00
00
00
ЧО
00
•о ¦
О -
о °°
Z г-
сл^
1/",
if
zS
73 ^С ,-» ОС
С fN
Is
2 ^с
? -н с'
1
J
I
При этом образуется водородная связь (водородный мо-
стик). Этот тип связи играет существенную роль в структур-
ной химии многих групп соединений, среди которых в первую
очередь надо отметить кислоты и кислые соли, гидроксосоеди-
нения, воду и гидраты.
В связи с тем что исчерпывающее описание соединений с во-
дородной связью включало бы значительную часть структурной
химии, в этой главе будут рассмотрены только кислоты и кис-
лые соли.
5) В некоторых электронодефицитных соединениях (напри-
мер, соединениях лития, бериллия, бора и алюминия) атомы
водорода образуют мостики между двумя атомами (например,
атомами В в В2Н6); известны линейные или нелинейные мости-
ковые связи типа М—Н—М также в некоторых карбонилгидрид
ных ионах металлов, таких, как [(СОMСгНСг(СОM]~. (Боро-
водороды описаны в гл. 24, а карбонилгидриды металлов —
в гл. 22; см. также обсуждение природы связей в гл. 7.)
В структурах многих кристаллических гидридов атом водо-
рода связан с более высоким (чем 2) числом атомов металла.
Этот факт легко объясним для структур ионных гидридов (на-
пример, LiH), где окружение иона Н~ сходно с окружением
F~ в LiF. Менее ясен вопрос о природе связи в гидридах неко-
торых переходных металлов, в особенности в нестехиометрнче-
ских гидридах внедрения.
В настоящей главе рассмотрены следующие аспекты струк-
турной химии водорода:
гидриды и гидридные комплексы переходных металлов;
водородная связь;
кислоты и кислые соли.
8.2. Гидриды
Бинарные гидриды известны для большинства элементов, ис-
ключая благородные газы. Другими важными исключениями
являются Mn, Fe, Co, а также следующие элементы второго и
третьего длинных периодов:
Мо
W
Тс
Re
Ru
Os
Rh
Ir
Pt (Au)
8 5. Водород. Благородные газы
мн4
тетраэдри-
ческие
С
Si
Ge
Sn
Pb
МН3
пирамидаль-
ные
N
Р
As
Sb
Bi
MHj
уголковые
О
s
Se
Те
Po
Выделяют три основных типа гидридов:
1) молекулярные гидриды;
2) солеобразные гидриды электроположительных элементов;
3) гидриды включения переходных металлов.
8.2.1. Молекулярные гидриды. Гидриды MH8_,V образуют неме-
таллы двух коротких периодов (бор образует гидриды особого
типа, см, гл. 24) и элементы главных подгрупп IV—VII групп
периодической системы:
мн
F
С1
Вг
I
Структурные исследования выполнены для гидридов всех
приведенных элементов, кроме PbH4, BiH3 и РоН2; подробные
данные можно найти в других главах книги. Гидриды тяжелых
металлов мало устойчивы.
Во всех агрегатных состояниях присутствуют одни и те же
молекулярные формы этих гидридов. Как правило (исключая
гидриды наиболее электроотрицательных элементов), в крис-
таллическом состоянии между этими молекулами действуют
лишь слабые вандерваальсовы взаимодействия. При обсужде-
нии водородной связи мы рассмотрим кристаллические струк-
туры NH3, ОН2 и FH. Многие короткоживущне гидридные ча-
стицы были обнаружены спектроскопическими методами; в по-
следнее время строение некоторых радикалов было исследовано
в матрицах при низких температурах (например, плоский СН:ь
пирамидальные SiH3 и GeH3). Многие из неметаллов помимо
указанных выше простых молекулярных гидридов образуют бо-
лее сложные гидриды М^Н^. Данные о наиболее важных из
них включены в последующие главы, посвященные структурной
химия соответствующих элементов.
8.2.2. Солеобразные гидриды.
LiH
NaH
кн
RbH
CsH
[1]
[21
MgH2
СаН2
SrH2
ВаН2
[31
[4]
А1Н3 [5]
EuH,
YbH2 [6]
8.2. Гидриды
Слева находятся солеобразные соединения, содержащие
ион Н~.
Все они — бесцветные вещества, их можно получить при
нагревании металла в атмосфере водорода (MgH2 под умерен-
ным давлением). Соединения имеют более высокую плотность,
чем исходные металлы, причем различие в плотности металла
и соответствующего гидрида наибольшее для щелочных метал-
лов B5—45%) и меньшее для щелочноземельных E—10%).
Твердый LiH такой же хороший ионный проводник, как LiCl,
и в 1000 раз лучший, чем LiF. При электролизе расплава LiH
со стальными электродами при температуре лишь немного вы-
ше температуры плавления на катоде выделяется литий, а на
аноде — водород. Эти ионные гидриды имеют значительно бо-
лее высокие температуры плавления, чем рассмотренные выше
молекулярные гидриды, например LiH 691 °С, NaH 700—800°С
(с разложением); гидриды других щелочных металлов разлага-
ются до плавления. Все они энергично реагируют с водой, вы-
деляя водород и давая раствор гидроксида. Существует значи-
тельное структурное сходство между этими соединениями и фто-
ридами (эффективный радиус иона Н~ составляет 1,3— 1,5 А,
радиус F~ — 1,35 А).
Гидриды щелочных металлов имеют структуру типа NaCl,
однако положение атомов Н установлено только для LiH (рент-
геновская дифракция) и NaH (дифракция нейтронов); расстоя-
ние Li—Н составляет 2,04 A, Na—Н — 2,44 А. Структура типа
рутила для MgH2 была исследована нейтронографически на
образце MgD2; расстояние Mg—Н составляет 1,95 А, кратчай-
шее расстояние Н—Н 2,49 А.
Все гидриды щелочноземельных металлов кристаллизуются
в структурном типе РЬС12, причем расположение атомов метал-
ла примерно соответствует плотнейшей гексагональной упаков-
ке. Из двух систем неэквивалентных атомов Н одна занимает
тетраэдрические пустоты, тогда как остальные атомы Н имеют
координацию 3+2:
Са: 7Н 2,32 А
2 Н 2,85 А
Hi: 4Са 2,32 А
Н,
3 Са 2,32 А
2Са 2,85 А
Атомы Н упакованы компактно: Нг имеет 8 Н-соседей на рас-
стоянии 2,50—2,94 А, а Ни — 10 Н-соседей на расстоянии 2,65—
3,21 А. В этих гидридах кратчайшее расстояние металл—металл
короче, чем в самих металлах (например, в СаН2 Са—Са со-
ставляет 3,60 А, а в металле 3,93 А). Аналогично кристаллизу-
ются дигидриды ЕиН2 и YbH2, исследованные в виде дейтери-
дов; их образование из металлов сопровождается уменьшением
объема на 13%.
10 8. Водород. Благородные газы
При получении А1Н3 действием избытка А1С13 на LiH в
эфире оказалось невозможным выделить чистый А1Н3, свобод-
ный от эфира. Однако этот гидрид удалось получить путем бом-
бардировки очень чистого алюминия ионами водорода, причем
из нескольких кристаллических модификаций этого соединения
одна оказалась изоструктурной A1F3 (разд. 9.9.3). Атомы ме-
талла занимают '/з октаэдрических пустот в приблизительно
плотнейшей гексагональной упаковке атомов водорода, так что
структура состоит из октаэдрических групп А1Н6, соединенных
вершинами. Угол А1—Н—А1 141° близок к величине для иде-
альной плотнейшей упаковки A32°). Такое строение заставляет
предполагать, что этот гидрид относится к ионным. Кратчай-
шее расстояние А1—А1 составляет 3,24 А, А1 — 6 Н 1,72 А, Н—
Н 2,42 А, что очень близко к соответствующим расстояниям в
A1F3 (A1 —6 F 1,79 A, F—F 2,53 А). Существует аминопроиз-
водное А1Н3; предполагается, что связи А1—Н в нем носят пре-
имущественно ковалентный характер (однако атомы водорода
в этом соединении не были локализованы). Кристаллический
A1H3-2N(CH3K [7] состоит из молекул, в которых имеются ли-
нейная группа N—А1—N (А1—N 2,18 А) и 3 атома Н, возмож-
но дополняющих координацию атома алюминия до тригональ-
но-бипирамидальной. По-видимому, аналогичная координация
осуществляется в А1Н3[(СН3JМСН2СН2М(СНзJ], где молекулы
диамина связывают группы А1Н3 в бесконечные цепи [8].
При действии LiAlH4 на галогениды (или в случае Be на ди-
алкилпроизводное) были выделены гидриды других элементов,
в том числе дигидриды Be, Zn, Cd и Hg, тригидриды Ga, In, Tl,
а также CuH. Некоторые из этих гидридов чрезвычайно не-
устойчивы; гидриды Cd и Hg разлагаются при температуре ни-
же 0°С. Чистый кристаллический ВеН2 не получен, но в крис-
таллическом виде выделен его комплекс с амином, имеющий
мостиковое строение (структура а) [9].
\
8.2. Гидриды
11
Наличие мостиков Be—Н предполагается также в структуре
соли Na2LR4Be2H2] [10]. В структуре эфирата [Na2(C4HioOJ-
• [Ве2(С2Н5LН2] имеются содержащие водородные мостики
ионы Be2H2Et42~ (изоэлектронные B2H2Et4), связанные друг с
другом через ионы NaOEt2r [И]. Штриховые линии между
атомами металла (структура б) перпендикулярны оси цепочки
и между собой также образуют угол 90°, в результате чего атом
Н оказывается связанным с 2 Na и 2 Be (искаженный тетра-
эдр). Относительно существования GaH3 еще имеются некото-
рые сомнения; однако предполагается, что в кристаллическом
GaH3-N(CH3K атом Ga имеет тетраэдрическое окружение
3 H+N, причем определено, что длина связи Ga—N составляет
2,0 A i[12].
Аморфный кирпично-красный CuH образуется при взаимо-
действии Cul и LiAlH4 в органических растворителях; однако
при восстановлении Си2" водным раствором фосфиновой (фос-
форноватистой) кислоты Н3РО2 получено растворимое в воде
вещество со структурой вюртцита (Си—Н 1,73 А, Си—Си
2,89 А; ср. в металле Си—Си 2,56 А) [13]. Красное окрашива-
ние растворов этого соединения в органических растворителях
трудно объяснить [14]; при нейтронографическом исследовании
в нем обнаружены примеси металлической меди и Си2О.
Несмотря на то что гидриды элементов главных подгрупп
отнесены нами к солеобразным, возможно, что связь в некото-
рых или во всех этих соединениях имеет, по крайней мере ча-
стично, ковалентный характер. Очевидно, это справедливо для
ВеН2, структура которого содержит водородные мостики и сход-
на с Ве(СН3J.
Здесь можно также упомянуть гидрид элемента главной
подгруппы, не относящийся ни к уже рассмотренным типам
гидридов, ни к следующему типу, а именно РЬНолэ. Это соеди-
нение образуется при действии при 0°С атомарного водорода
на пленку свинца, полученную путем испарения; по-видимому,
оно довольно устойчиво [15].
Литература. [П Z. Phys. Chem., 1935, 28В, 478. [2] Phys. Rev., 1948, 73, 842
[3] Acta cryst., 1963, 16, 352. [4] Acta cryst., 1962, 15, 92. [51 Inorg. Chem.. 1969
8, 18. [61 Acta cryst., 1956, 9, 452. [71 Inorg. Chem., 1963, 2, 508. [8] Acta crvst
1964, 17, 1573. [9] Inorg. Chem., 1969, 8, 976. [10] J. Chem. Soc, 1965, 692
[11] Acta Chem, 1981, B37, 68. [12] Inorg. Chem., 1963, 2, 1298. [13] Acta cryst
1955, 8, 118. [14] J. Am. Chem. Soc, 1968, 90, 5769. [15] Proc. Chem Soc
1964, 173.
8.2.3. Гидриды, переходных металлов. Известные к настоящему
времени гидриды сведены в табл. 8.1, из которой видно, что
для значительного числа этих металлов возможность образо-
вания бинарных гидридов не доказана. При этом критерием
служат определенные структурные изменения в металле, сопро-
8. Водород. Благородные сазы.
вождающие образование водородсодержащей фазы. Многие из
этих металлов в сильноразмельченном состоянии способны ад-
сорбировать большие объемы водорода, откуда становится оче-
видной трудность с помощью чисто химических методов отли-
чить подобные системы от нестехиометрических гидридных си-
стем. Для гидридов переходных металлов наиболее характерны
металлический внешний вид, металлическая проводимость или
Таблица 8.1. Бинарные гидриды переходных металлов
5сНг
YH?
YH34
LaH2
LqH3
TLH
TiHzM
ZrH,
HfH2[l]
VH[2] СгНИ
VH2 OH,
NbH™ -
NbH2
TaH
NiHOiGW
PdH[5]
мегпаллы
La Ce Pr Nd
MH,g -MH3
гцк\ё\
jf-металы
Ac
MHZ
мн3
Sm, Gd-Tm, Lu(Y)
MH2 структура флюорита
MH3 гексагональная структура типа LaF3?7]
C4/wEuH2,YbH2 и УЪНг<55[$] слг текст)
Ac Th
Г ЦК ГЦКЫ
Pa
U
S-UH3 a-UH3[ll]
/HJH3[1Z]
[!] Acta cryst., 1956, 9, 607. [2] Inorg. Chem., 1970, 9, 1678. [3] Phys. Stat. Sol., 1963,
3, K249. [4] J. Phys. (Paris), 1964, 25, 460. [5] J. Phys. Chem. Solids, 1963, 24, 1141.
[6] J. Phys. Chem., 1955, 59, 1226. [7[ J. Phys. (Paris), 1964, 25, 454. [8] Inorg. Chem.,
1966, 5, 1736. [9] Acta cryst., 1962, 15, 287. [10] Acta cryst., 1953, 6. 393. [11] J. Am. Chem.
Soc, 1954, 76, 297. [12] J. Am. Chem. Soc, 1951, 73, 4172. [13] J. Phys. Chem., 1965, 69,
1641. [14] Кристаллография, 1970, 14, 522.
полупроводниковые свойства, во многих случаях переменный
состав, увеличенные по сравнению с соответствующим метал-
лом межатомные расстояния. Увеличение объема, происходящее
при их образовании, резко контрастирует со сжатием, наблю-
даемым в случае солеобразных гидридов (включая ЕиН2 и
YbH2). Представляет интерес и то, что количество водорода в
единице объема для некоторых гидридов металлов больше, чем
в твердом Н2 или в воде. Этот факт в сочетании с высокой тер-
мической устойчивостью некоторых из этих соединений делает
их перспективными при использовании в качестве материала
для нейтронной защиты, а возможно, и для аккумуляторов
энергии (разд. 8.2.4).
Эти соединения первоначально описывались как гидриды
внедрения, т. е. в предположении, что они образуются путем
проникновения атомов водорода в пустоты (обычно тетраэдри-
8.2. Гидриды
13
ческие) в структуре металла; однако теперь стало известно,
что расположение атомов металла в гидриде, как правило,
отличается от расположения в исходном металле. Для гидри-
дов, как и для других соединений металлов, характерна своя
собственная структура:
Сг (ОЦК) >¦ СгН (ГПУ) >• СгН2 (КПУ)
Ti, Zr и Ш (ГПУ) >¦ МН2 (КПУ)
Гидриды V, Nb и Та, возможно, в наибольшей степени со-
ответствуют понятию о соединениях внедрения; их структуры
обсуждаются ниже. В других случаях, когда расположение ато-
мов металла в гидриде такое же, как в металле или в одной из
его модификаций, при образовании гидрида может наблюдаться
непрерывное увеличение параметров решетки (Pd) или же мо-
жет существовать промежуточный гидрид с отличным распо-
ложением атомов металла. Так, например, 4/-металлы Gd—Tm
(ГПУ) образуют гексагональные тригидриды, тогда как про-
межуточные дигидриды имеют структуру флюорита с КПУ ато-
мов металла. Кроме того, мольный объем фазы МН3 на 15—
25% больше, чем для металла. В гидриде YbH2,55, как и в Yb,
осуществляется ГЦК-расположение атомов Yb, но фаза гидрида
получается только под давлением и имеет меньший параметр
решетки E,19 А), чем металла E,49 А), а помимо этого име-
ется промежуточный гидрид YbH2 (см. выше) с совершенно
другой структурой (СаН2).
а. Гидриды 4f- и Б^-элвментов. Все 4/-металлы при комнатной
или несколько более высокой температуре поглощают водород,
давая гидриды примерного состава МН^д, имеющие структуру
типа флюорита (за исключением ЕиН2 и YbH2 — структурный
тип СаН2). В противоположность ЕиН2 и YbH2 образование
этих кубических «дигидридов» сопровождается увеличением
объема. Для европия известен лишь ЕиН2, а иттербий при ат-
мосферном давлении дает лишь YbH2, но при повышенном
давлении водорода образует YbH2,55 (возможно, ионное соеди-
нение, содержащее Yb2+ и Yb3+); метастабильный кубический
YbH2 получен при нагревании YbH2,55 или YbH2. Дигидриды ос-
тальных ^-элементов реагируют далее с водородом при атмо-
сферном давлении, давая «тригидриды»; однако при этом для
лантаноидов следует различать две группы. Более легкие
4^металлы с атомами больших размеров образуют непрерыв-
ный ряд твердых растворов с ГЦК-структурой от состава MHi.9
до состава МНз. Занимая первоначально тетраэдрические пус-
тоты (структурный тип флюорита), атомы водорода в дальней-
шем статистически заполняют октаэдрические пустоты, что бы-
ло показано нейтронографически для СеН2 и СеН2,7. Атомы во-
14 8. Водород. Благородные газы
дорода в структуре слегка смещены из идеальных позиций. Для
4/-элементов, начиная с Sm (и Y), характерно, что еще до до-
стижения состава МН3, образуются новые фазы со структурой
ГПУ. Как и в случае дигидридов, здесь имеется область со-
ставов, отвечающая устойчивости фазы. Между областями со-
ставов, отвечающих устойчивости фаз дигидридов и тригидри-
дов, имеется разрыв, небольшой у гидридов самария, но более
значительный у гидридов других лантаноидов. Для нескольких
гидридов ниже приведен наиболее типичный состав (в виде от-
ношения Н : М) их фаз, существующих при комнатной темпера-
туре.
Кубический дигидрид
Гексагональный тригидрчд
Sm
Но
Ег
1,93—2,55
1,95—2,24
1,95—2,31
2,59-3,0
2,64—3,0
2.82—3,0
Гексагональные фазы МН3 имеют структуру типа LaF3 (ис-
правленная) (разд. 9.9.3), которую можно считать производ-
ной от структуры металла (растянутая ГПУ). Нейтронографи-
ческое исследование HoD3 (которому изоструктурны остальные
соединения МН3) показало, что атомы Н (D) занимают все тет-
раэдрические и октаэдрические пустоты, но вследствие близко-
го расположения пар тетраэдрических пустот атомы Н в них
несколько смещены от идеальных позиций, что в свою очередь
вызывает небольшое смещение атомов Н в октаэдрнческих пу-
стотах. В результате оказывается, что атомы Н имеют 3 бли-
жайших атома металла, а атомы металла — 9 (+2) атомов
водорода:
Но:
9Н 2,10—2,29 А
BН 2,48 А)
Н: ЗНо
2,10 А или
2,17 А или
2,24—2,29 А
Типичные гидриды 4/-элементов пирофорны, по внешнему
виду металло- или графитоподобны. Электрическое сопротивле-
ние дигидридов, формулы которых можно представить в виде
М3+(Н~)г(е), ниже, чем чистых металлов, но оно увеличивает-
ся по мере дальнейшего поглощения водорода. Например, при
80 К наблюдается 10б-кратное увеличение сопротивления при
превращении LaHi,9s в LaH2,92, а для гидридов церия —
104-кратное. По-видимому, в дигидридах (но не в ЕиН2 и YbH2,
являющихся диэлектриками) связь имеет частично ионный и
частично металлический характер, так что дальнейшее при-
8.2. Гидриды 15
соединение водорода приводит к образованию иона Н~ путем
удаления электрона из зоны проводимости, в результате чего
"получается тригидрид с существенно ионным типом связи.
Некоторые структурные сведения о гидридах 5/-элементов
приведены в табл. 8.1. В отличие от других элементов торий
образует дигидрид с искаженной флюоритоподобной (гране-
центрированной тетрагональной) структурой, что обнаружива-
ет его сходство с Ti, Zr и Ш. Однако эта структура переходит
в кубическую в присутствии небольшого количества кислорода.
Кроме того, для тория известен гидрид состава ТП4Н15, в кото-
ром имеется два типа неэквивалентных атомов водорода; крат-
чайшее расстояние Th—Th C,87 А) существенно больше, чем
в металле C,59 А):
9 Н 2,29 А Н, : 3 Th 2,29 А
ЗН 2,46 А
Ни: 4Th 2,46 А
В ThH2 расстояния Th—8 Н равны 2,41 А.
Уран образует только один металлоподобный гидрид соста-
ва UH3, известный в двух модификациях. Положение атомов
металла в p-UH3 соответствует структуре p-W (разд. 29.1.4,6),
но не связано со структурой металлического урана. Расстояния
U—U намного больше, чем в а- или у-уране; даже кратчайшее
из них (U—2 U 3,32 А) указывает на наличие лишь очень сла-
бого взаимодействия металл — металл (ср. в -y-U U—8U 2,97 А,
а в cc-U кратчайшее расстояние 2,76 А). Как было установлено
нейтронографически, атомы водорода занимают очень большие
пустоты, в которых они окружены (приблизительно тетраэдри-
чески) четырьмя атомами U на расстоянии 2,32 А. Наличие у
каждого атома U 12 соседних атомов Н и металлоподобный
(а не солеобразный) характер соединения служат подтвержде-
нием того, что взаимодействие между атомами обусловлено
некоторым видом делокализации ковалентных связей. В a-UH3
атомы металла занимают позиции, соответствующие заштрихо-
ванным кружкам на рис. 29.4, а атомы Н находятся в позици-
ях, соответствующих светлым кружкам. Здесь связи U—U так-
же чрезвычайно слабые (U—8 U 3,59 А); атомы Н, как и в
P-UH3, имеют тетраэдрическое окружение из четырех атомов
U (Н—4 U 2,32 А). Тригидриды Np, Pu и Am изоструктурны
гексагональным тригидридам 4/-элементов.
б. Гидриды 3d-, 4d- и 5й-металлов. Кратко остановимся на ос-
тальных гидридах, представленных в табл. 8.1. Для всех эле-
ментов, образующих ГПУ, а именно Ti, Zr и Hf, известны ди-
гидриды со структурой типа флюорита, которые при более вы-
соких температурах существуют в кубической фазе, а при низ-
ких температурах образуют фазу с более низкой (тетрагональ-
16
8. Водород. Благородные газы
ной) симметрией. Обе фазы характеризуются областью соста-
вов, которая зависит от температуры. Приведенные ниже дан-
ные (для комнатной температуры) показывают, что кубическая
фаза включает и состав TiH.
Кубическая фаза
Тетрагональная фаза
TiH—TiH2
ZrHi.so—ZrHi,61
HfH,,86-HfH2,oo
6—НЩ2
В дополнение к этим фазам могут существовать твердые
растворы в фазе металла с ГПУ (при небольшом содержании
водорода), а также твердые растворы в высокотемпературной
модификации (ОЦК), причем в последней концентрация водо-
рода может быть значительной, например вплоть до состава
ZrHi,5. Для TiD2 структура типа флюорита подтверждена нейт-
ронографически. Следует подчеркнуть, что гидриды, которым
ранее приписывали формулы Zr2H и Zr4H, не являются индиви-
дуальными соединениями, а соответствуют произвольно выбран-
ным точкам на фазовой диаграмме. Тот факт, что в тетраго-
нальных гидридах Zr и Ш (состава МН2) расположение ато-
мов металла менее симметрично, чем в структурах с дефектами,
указывает на важную роль в этих структурах связей металл—
водород. Приводимые ниже данные о гидридах гафния показы-
вают, что образование этих гидридов не следует интерпретиро-
вать как простое внедрение атомов или ионов водорода в плот-
ноупакованную структуру металла:
a-Hf (гексагональный) HfHi,7 (кубический) ШНг (тетрагональный)
Ш—6ШЗ,13А Hf—12 Hf 3,31 A Hf—8 НЕ 3,27 А
—6 Hf 3,20 Hf—Н 2,03 —4 Hf 3,46 А
Hf—8 Н 1
Н-4Ш } 2'04
Металлические V, Nb и Та имеют ОЦК-структуры. сс-Моди-
фикациям твердого раствора водорода в этих металлах отвеча-
ют предельные составы VHo,o5, NbH0,i и ТаН0,2. Следующая ин-
дивидуальная фаза в этих системах — р-гидрид; это нестехио-
метрическая фаза с тетрагональным искажением ОЦК-структу-
ры раствора, которая устойчива в широком интервале состэвое
(например, VH0,45 — VHo.g). Тетрагональный объемноцентриро-
ванный p-NbH выше ~200°С переходит в кубический. Нейтро-
8.2. Гидриды
17
нографически доказано, что в этой фазе, охлажденной ниже
комнатной температуры, атомы водорода полностью упорядоче-
ны. На указанном участке фазовые диаграммы водородных си-
стем этих элементов сходны с системой Pd—Н (рис. 8.1), так
что выше определенной критической температуры происходит
непрерывное поглощение водорода приблизительно до состава
МН. иг сопровождающееся существенными изменениями в
структуре металла. Такое поведе-
ние связано главным образом с тем, т,\9 _
что в ОЦК-структуре имеется
шесть (деформированных) тетра-
эдрических позиций на атом, тогда
как в структурах с плотнейшей
упаковкой на каждый атом упа-
200 -
0,5 i,0
Отношение Н: Pd
ковки приходится две (правиль-
ные) тетраэдрические позиции
(разд. 4.1.3). В соответствии с
этим реализуется много различ-
ных типов разупорядоченных струк-
тур и сверхструктур. При особых
условиях (например, при высоком
давлении водорода) можно полу-
чить дигидриды V и Nb с обыч-
ной ГЦК-структурой; максималь-
ное содержание водорода в гидри-
де тантала реализуется в соедине-
нии ТаНо.д.
Синтезированы (электрохимиче- Рис. 8.1. Фазовая диаграмма
ски) два гидрида хрома. СгН име- системы палладий—водород.
ет структуру анти-NiAs (Cr—6H
1,91 А, Сг—Сг 2,71 А); структура СгН2 близка к флюоритной
(ГЦК).
Палладий способен поглощать большой объем водорода. Из
фазовой диаграммы (рис. 8.1) видно, что при комнатной тем-
пературе растворимость водорода в металле незначительна
(a-твердый раствор); затем следует двухфазная область, пере-
ходящая в фазу р-гидрида PdH056- Параметры элементарных
ячеек a-фазы равны а = 3,890А (РсШо.оз) и р-фазы — а = 4.018 А
(РAН0,5б). При температуре —78 °С содержание водорода в
Р-фазе граничного состава соответствует формуле PdH;,«s. Вы-
ше 300 °С в системе обнаружена лишь одна фаза вплоть до
давления водорода 1000 атм. Гидрид никеля был получен элект-
рохимически лишь в виде тонкой пленки на поверхности нике-
ля; максимальное соотношение Н : Ni равно ~0,6. Для гидри-
дов Pd и Ni нейтронографически установлена ГЦК-структурэ
(дефектная структура типа NaCl).
2—985
18 8. Водород. Благородные газы
8.2. Гидриды 19
8.2.4. Тройные гидриды. Структурные особенности этих веществ
(табл. 8.2) указывают на присутствие среди них как солеобраз-
ных соединений, так и соединений, родственных гидридам пере-
ходных металлов, рассмотренным в предыдущем разделе. Син-
тез тронных гидридов обычно проводят действием водорода на
Таблица 8.2. Тройные гидриды металлов
УВеНз [1]
NaBeH3
Li2BeH4
Na2BeH4
EuLiH3
SrLiH3
BaLiH3 [2]
LiAlH4 [31
NaAlH4 [4]
(также К,
Li3AlH6
Na3AlH6 [5J
Mg(AlH4J
Ca(AlH4J
Cs)
LiGaH4
LiInH4
NiZrH3
AlTh2H4
Mg2NiH
Li4RhH4
Sr2IrH4
[6]
[7]
4 [8]
[9]
[9]
[1] J. Chem. Soc. (London), A 1968, 628. [2] J. Chem. Phys., 1968, 48, 4660 [3]
Inorg. Chem., 1967, 6, 669. [4] Acta cryst., 1979, B35, 1454. [5] Inorg Chem., 1966, 5, 1615.
[6] J. Phys. (Paris), 1964, 25, 451. [7] Acta cryst., 1961, 14, 223. [8] Inorg. Chem., 1968,
7, 2254. [9] Inorg. Chem., 1969, 8, 1010.
смесь металлов (например, BaLiH3 получают из смеси Ba+Li
при 700СС) или на сплав (например, под давлением водорода
при температуре 325 °С из Mg2№ образуется Mg2NiH4). При
действии водорода под давлением на смесь Na и А1 в толуоле
при 165 °С сначала образуется Na3AlH6, а далее — NaAlH4.
Нейтронографическим методом подтверждено, что BaLiHs
(а следовательно, и изоструктурные ему соединения стронция
и европия) имеет структуру, подобную перовскиту. В этих со-
единениях расстояния М—Н оказались значительно длиннее,
чем в МН2.
Ей—Н
Sr-H
Ва—Н
КЧ 12 (МЫНз)
КЧ 7 (МН2)
2,68 А
2,45
2,7Ь
2,49
2,84 А
2,67
Расстояния Li—Н существенно длиннее в BaLiH3 B,01 А), чем
в SrLiH3 A,92 А) или в EuLiH3 A,90 А) (ср. в LiH 2,04 А).
В LiAlH4 КЧ атома А1 4 (почти правильный тетраэдр, А1—Н
1,55 А), а атома Li 5 (искаженная координация: 4 Н на рас-
стоянии 1,88 — 2,00 А, 1 Н —2,16 А). Из четырех атомов Н
в группе А1Н4 три атома имеют КЧ 2 (Al+Li), а четвертый —
КЧ 3 (Al+2Li). Сходная почти правильная тетраэдрическая
группа А1Н4 обнаружена в NaAlH4 (A1—Н 1,53 А); атом Na
находится в необычной восьмерной координации (додекаэдр с
треугольными гранями, Na—Н 2,50 А). В этих структурах, по-
видимому, присутствует ион А1Н4~; имеются сведения, что
структура Na3AlH6 относится к типу криолита. При поглощении
водорода соединением AlTh2 (структура типа СиА12, разд.
29.6.5) в конечном счете образуется AlTh2H4, в структуре ко-
торого атомы Н занимают все тетраэдрические пустоты" между
четырьмя атомами Th структуры исходного сплава. Расстояния
Tii—H ( — 2,4 А) примерно такие же, как в структуре ThH2.
Структура NiZrD3 более сложная, так как в ней часть атомов
D занимают тетраэдрические пустоты, а остальные имеют пять
металлов-соседей:
Zr 1,96 А
D: 2Zr 2,18
Ni 1,77
D:
Zr 1,9 5 А
2Zr 2,38
2Ni 1,78
Для того чтобы быть пригодным для использования в каче-
стве накопителя и передатчика энергии, гидрид должен быть
довольно устойчивым соединением, из которого, однако, водо-
род можно было бы извлекать. В качестве предполагаемых ак-
кумуляторов энергии рассматривались некоторые тройные гид-
риды, особенно те из них, которые содержат элемент, образую-
щий устойчивый гидрид (например, Mg или Ti) и другой ме-
талл, не дающий гидридов или образующий их с трудом (на-
пример, Fe, Си и т. д.). Один из подобных гидридов — СиТлНо.э
[Acta cryst., 1978, В34, 2059], получаемый из y-CuTi, по струк-
туре очень близок к флюоритной структуре TiH2. В структуре
этого соединения чередуются пары плотноупакованных слоев
:п атомов Си и Ti; атомы водорода занимают тетраэдрические
пустоты только между слоями атомов титана.
8.2.5. Гидридные комплексы переходных металлов. d-Металлы
образуют большую группу элементов, занимающих промежу-
точное место между электроположительными металлами (гид-
риды ионного типа) и элементами главных подгрупп и неме-
таллами (ковалентные молекулярные гидриды). Помимо гид-
ридов внедрения переходные металлы могут образовывать ко-
валентные молекулярные соединения MPLLj,, в которых атомы
водорода непосредственно связаны с металлом. Молекулы с
этой общей формулой формально сходны с замещенными гид-
ридами неметаллов и элементов главных подгрупп, например
PHF2) GeH2Cl2 и т. д. Отличительная особенность соединений
переходных металлов состоит в том, что лиганд L должен, во-
первых, способствовать спариванию электронов на rf-орбиталях
атома металла и, во-вторых, его количество должно быть до-
20
8. Водород. Благородные газы
8.2. Гидриды 21
статочным для того, чтобы были заняты все несвязывающие
d-орбитали. К таким лигандам относятся СО, циклопентадие-
кил, третичные фосфины и арсины. Некоторые примеры приве-
дены в табл. 8.3. Существование у рения и технеция иона
(МНэJ~ показывает, что с атомами некоторых переходных ме-
Таблица 8.3. Некоторые гидридные соединения переходных металлов"
Далее в этом разделе во всех рассматриваемых примерах
атом водорода соединен только с одним атомом металла, как
обычный ковалентно связанный лиганд с расстоянием М—Н
1,6—1,7 А.
Согласно данным нейтронографических или рентгенографи-
ческих исследований, можно привести следующие примеры мо-
лекул или ионов, в которых атом Н надежно локализован:
HNb6Iu
ТаНз(С5Н5J
[Сг2Н(СОI0[-
СгН(С5Н5)(СОK
МоН2(С5Н5J [3]
\VH2(CBHB),
[W2Ha(CO)g]*- [10]
MnH(CO)B
Mn2H(CO)8(P(PhJ) [1]
ТН]2- [4]
[]2- [6]
ReH7P2
-Н
FeH2(PPJ
RuHCl(PPJ
OsHBr(CO)(P(PhKK
OsH4P3
[7]
CoH(PPJ
CoH(PF3L [2]
RhH(CO)(P(PhKK [5]
RhHCl2P3
IrHCl2P3
PtHBrP2 [8]
PtHClP2 [9]
- a")
аР —третичный фосфин PR3; PP - R2PCH2CH2PR2 и
[11 J. Am. Chern. Soc, 1967, 89, 4323. [2] Inorg. Chem., 1970, 9, 2403. [3] Inorg. Chem.,
1966 5, 500. [4] Inorg. Chem., 1964, 3, 567. [5] Acta cryst.. 1965, 18, 511. [6] Inorg. Chem.,
1964 3, 558. [7] Proc. Chem. Soc, 1962, 333. [8] Acta cryst., 1960, 13, 246. [9] Inorg.
Chem., 1965, 4, 773. [10] Chem. Comm., 1973, 691.
таллов водород может связываться и в отсутствие таких лигап-
дов.
Большинство элементов, вошедших в табл. 8.3, образует
карбонилгидриды, часто кластерного строения, причем атомы
водорода в них играют роль мостиков между двумя и тремя
атомами металла. В некоторых кластерах металлов атом во-
дорода занимает положение в пустотах, например в HNb6In
(разд. 9.10.3 и 22.3.3). Структуры карбонилов металлов рас-
смотрены в гл. 22; здесь же приведено лишь несколько приме-
ров молекул, в которых атом Н непосредственно связывает два
атома металла:
[(СОMСг—Н-Сг(СОM1-
НМпз(СОI0(ВН3J
(COLMnH(PPh2)Mn(COL
tW2H2(CO)8]2-
(линейный мостик, Сг—Н—Сг 3,4 А)
(разд. 22.3.3)
(изогнутый мостик, Мп—Н 1,65 А)
(разд. 22.8, а)
(изогнутый мостик, Мп—Н 1,87 А)
(двойной водородный мостик)
1,68 А
ОС\
Н 1,60 А
|^СО
со
Н 1,60 + 0,1 2 А
Ph 3P-Rh^
СО
[ReH9]<
Косвенное заключение о положении атомов водорода можно
сделать при рентгенографическом исследовании комплексов в
тех случаях, когда положение остальных лнгандов явно указы-
вает на местонахождение атома (атомов) водорода. Было; об-
наружено, например, что в кристаллическом PtHBr(P#t3J
связи Pt—Р и Pt—Br компланарны /'
Н
Et,P-
2,26 А
¦PEt,
2,56 А
Br
а утлы Р—Pt—Br равны 94°; это не оставляло сомнений в том,
что атом Н непосредственно связан с Pt и находится в транс-
положении к Вг. Некоторое удлинение связи Pt—Br по срав-
нению с суммой ковалентных радиусов B,43 А) можно было
объяснить высокой химической лабильностью атома брома.
В результате неполного рентгенографического исследования
Диамагнитного комплекса OsnHBr(CO) (PPh3K установлено,
что пять более тяжелых лигандов занимают пять из шести ок-
таэдрических позиций, а водород, по-видимому, шестую пози-
цию. В некоторых случаях присутствие непосредственно связан-
ного с металлом атома водорода подтверждается наличием в
ИК-спектре определенной полосы поглощения, обусловленной
связью М—Н; в частности, это относится к иридиевому коми-
22 8. Водород. Благородные газы
лексу с тройным мостиком [Acta cryst., 1976, В32, 1513]:
Ph
РЬ3Р s PPh3
H— Ir — Cl—1r— H
s PPh3
Ph3P
Ph
Еще менее определенные выводы могут быть сделаны на ос-
нове данных спектроскопических методов [J. Am. Chen:. Soc,
1966, 88, 410] и измерений дипольного момента [Proc. Chem.
Soc, 1962, 318]. На основе таких данных были сделаны заклю-
чения о строении следующих комплексов:
ОС
N,
/
P
I н
!XH
p
H
1
P-Rh<
CO
,p
-p
H
P4I /H
n/Ir4D
?y | P
H
(P = третичный
cpoctpmt)
8.3. Водородная связь
Как давно известно, свойства некоторых жидкостей и раство-
ров указывают на наличие необычно сильного взаимодействия
между молекулами растворителя, или между молекулами рас-
творителя и растворенного вещества, или же между молекула-
ми самого растворенного вещества. Первый тип взаимодейст-
вия, т. е. между молекулами в чистой жидкости, лег в основу
подразделения растворителей на «ассоциированные» и с.неассо-
циированные». Примерами ассоциированных растворителей мо-
гут служить NH3, НгО и HF; то же относится и ко многим ор-
ганическим растворителям, в особенности тем, которые содер-
жат группы ОН, СООН или NH2. При сравнении таких свойств,
как температуры плавления и кипения, теплоты испарения для
ряда гидридов Н2Те, H2Se, H2S и Н2О, обнаруживается, что из-
менения носят достаточно правильный характер, пока мы не
достигнем последнего члена ряда Н2О (рис. 8.2). Сходная си-
туация наблюдается и для гидридов элементов главных под-
групп V и VII групп, причем «аномальные» свойства проявля-
ют NH3, HF и в некоторой степени также НС1. В то же время
гидриды элементов главной подгруппы IV группы, включая
СН4> обнаруживают монотонные зависимости соответствующих
свойств (рис. 8.2). Вместо температуры плавления —100°С,
как это можно было бы ожидать при экстраполяции темпера-
тур плавления Н2Те, H2Se и H2S, вода плавится при 0°С. Из
8.3. Водородная связь 23
того факта, что температуры кипения и теплоты испарения ха-
рактеризуются такого же типа отклонениями, как и температу-
ры плавления, можно заключить, что в жидких NH3, H2O и
IIF вплоть до их температур кипения реализуются многочислен-
ные водородные связи. В случае HF эти связи сохраняют ус-
тойчивость и в газообразном состоянии.
i Н.О
6
NH,
SbH,
SnH4
JCH4
Рис. 8 2. Температуры плавления (о) и кипения (б) рядов изоэлектронных
гидридов.
Наличием специфического взаимодействия между некоторы-
ми атомами растворителя и растворенного вещества объясня-
ется, например, значительно лучшая растворимость анилина
С6Н5>. Н2 и фенола С6Н5ОН в воде, чем в нитробензоле, хотя
последний имеет гораздо больший дипольный момент D.19 Д),
чем вода A,85 Д).
Ассоциация молекул растворенного вещества происходит
при растворении, например, уксусной кислоты СН3СООН в не-
ассощшрованных растворителях, таких, как бензол. Ассоциа-
цию обнаруживают, определяя молекулярную массу криоскопи-
ческим или эбулиоскопическим методами.
Химические особенности молекул с очевидностью свиде-
тельствуют в пользу того, что это взаимодействие связано с
наличием водорода, обычно в виде ОН, СООН, NH2 или дру-
гих полярных групп. При замене водорода, например, алкиль-
24 8. Водород. Благородные газы
ной группой ассоциации не происходит, что указывает на су-
щественную роль атома водорода, присоединенного к электро-
отрицательному атому N, О или F. Некоторые, хотя и гораздо
менее отчетливые, отклонения в поведении наблюдаются так-
же, если наряду с водородом в молекулу входят несколько ме-
нее электроотрицательные атомы S и С1. Некоторые данные об
этих более слабых взаимодействиях включены в табл. 8.4.
В дальнейшем основное внимание уделено соединениям, содер-
жащим атомы N, О и F. Межмолекулярные взаимодействия
типа
N...H...O, 0...Н...0 или
.Н.
называют водородными связями пли водородными мостиками;
они могут осуществляться и между атомами одной и той же
молекулы или сложного (комплексного) иона (внутримолеку-
лярные водородные связи).
8.3.1. Свойства водородных связей. Тот факт, что водородные
связи образуются лишь между атомами наиболее электроотри-
цательных элементов, говорит в пользу их существенно элект-
ростатического характера. Атомы указанной группы элементов
имеют неподеленные электронные пары, которые не только
оказывают влияние на свойства связывающих орбитален, но
вносят существенный вклад в дипольный момент молекулы.
Предполагая различные типы гибридизации, можно рассчитать
орбитальные дипольные моменты неподеленных пар на атомах
N, О и F. Эти диполи могут взаимодействовать с На+ фрагмен-
тов FH, ОН, NH2 и т. д. с образованием водородных связей, ко-
торые должны быть ориентированы в соответствии с типом гиб-
ридизации неподеленной пары и связывающих орбиталеп. По-
добная направленность водородных связей проявляется в струк-
туре льда, где каждый атом О тетраэдрически окружен че-
тырьмя соседями, в HF, H2F3~ и H4F5-, в большинстве гидратов.
Однако в структурах некоторых кристаллов неподеленные па-
ры атома О не направлены вдоль водородных связей; так, в
К2С2О4-Н2О два иона К+ расположены почти компланарно со
связями ОН молекулы воды [J. Chem. Phys., 1964, 41, 3616].
8.3.2. Длина и энергия водородной связи. Энергия водородной
связи варьирует от ПО кДж/моль (или, возможно, еще боль-
ших величин) [Inorg. Chem., 1963, 2, 996] для наиболее силь-
ных (в ионе F—Н—F~) до 30 кДж/моль для О—Н—О и еще
меньших значений для более слабых водородных связей. В со-
ответствии с типом водородной связи X—Н—X меняются и
длины связей (табл. 8.4).
Таблица 8.4. Длимы водородных связен
Связь
F. . .Н. .
О—Н
О-Н.
О—Н.
о—н..
о-н.
О—Н..
O-II..
к—н..
X—Н..
N-H.
N-H.
N-H.
N-H.
(S-H
(С-Н
.F
.0
.0
.F
.С1
Вг
.N
.S
.0
.F
.С1
.1
.N
.S
. S)?
...0)?
Длина, А
2,27
2,45
2,49
2,26
2,40-2,56
2,40—2,63
2,7—2,9
2,56, 2,87
(ср. 2,68)
2,50
2,95—3,10
3,2—3,4
3,4—3,6
3,2—3,4
2,68
2,79
3,1-3,4
2,86
2,79
2,6—2,96
3,00, 3,11
3,20
3,46
2,94—3,15
3,35
3,23, 3,29
3,94
2,92а
Соединение
NaHF2
KH4F5
HF
(n-CH3C6H,NH3) (HF2)
Тип 1 1
См. разд. 8.3.3
Тип 2 J
Лед, гидраты, гидроксо-
сосдинения
Гндратированные фтори-
ды металлов
Te(OHN-NaF
Гидраты НС1
Гидраты хлоридов ме-
таллов
NaBr-2H2O
НВг-4Н2О
1у,Н4-4СН3ОН
N2H4-H2O
Гидратпрованные тио-
сульфаты
(NH,JH3IO6
Циануровая кислота
NH,F, (N2H6)SiF6
(CH,hNHCl,
(CH:5JNH2C1
(NH3OH)C1
[(CH,KNH1I
NH4N3, дициандиамид
NH3
N,HS(HS)
H2S (крист.)
Органические соединени
Литература
См. текст
» »
» »
. Am. Chem. Soc,
1973, 95, 5780
Acta cryst., 1978, В34.
2074
Acta crvst., 1978, B34,
436
См. текст
\da cryst., 1978, B34,
355
4cta cryst., 1976, B32,
1025
См. разд. 15.2.7
\cta cryst., 1977, B33,
1608
Acta cryst., 1979, B35,
1G79; разд. 15.2.7
Acta Chem. Scand.,
1967, 21, 2669
\cta cryst, 1964, 17,
15 '^ 3
Acta cryst., 1975, B31,
135
Acta cryst., 1980, B36,
10^8
Acta"crvst., 1971, B27,
134, 146
Acta crvst, 1980, B36,
1917
Acta cryst, 1968, B24,
554, 549
Acta cryst, 1967, 22,
928
Acta cryst, 1970, B26,
1334
См. гл. 21
См. текст
Acta cryst, 1975, B31,
2355
Nature, 1969, 224, 905
J Chem. Soc, 1963
1105
аЗн.-,чительно более слабые взаимодействия трудно с определенностью отнести по
типу свяшвания к водородной связи, вандерваальсовой или слабой ионной связи, ид
нако если атом водорода располагается на прямой, соединяющей два атома (вдоль
связи), такое взаимодействие часто рассматривается как водородная снизь, подробно
не обсуждая этот вопрос, мы привели несколько соответствующих ссылок на лптерату-
РУ- В связях типа С—Н—О атомы водорода локализованы не были.
в ряде случаев приведен пример лишь одного соединения с данным типом связи,
в то время как цитируемая литература часто относится к более ранним раоотам или
к родственным соединениям.
26
8. Водород. Благородные газы
8.3.3. Положение атома водорода. Положение атомов водорода
во многих структурах определено рентгенографическими и нейт-
ронографическими методами, а также косвенно из протон-про-
тонного расстояния в структурах некоторых гидратов при ис-
следовании методом ПМР. Следует подчеркнуть, что положе-
ние атомов водорода по данным рентгенографических и нейтро-
нографических исследований различается, причем первый из
упомянутых методов дает более короткое расстояние от атома
водорода до того более тяжелого атома, с которым он связан.
о о
I.S4A \ /2,0! А
К 768° 156°s~
D Л 106' it
0 т°
гидраты фторидов
у. О"
KHS0*
3.:i —ЗАО
a-(CO0DJ-ZD2O BaS2O3-H2O Nc,S2O3-5H2O
Рис. 8.3. Особенности геометрии водородных связей различных типов.
Это различие для расстояния О—Н в среднем составляет 0,15 А
(нейтронограф. 1,0А; рентгенограф. 0,85А). Эффект несколько
меньше для более тяжелых атомов; он связан, по-видимому, с
несферичностью электронного распределения, обусловленного
образованием химической связи. Это сказывается на рентге-
новском факторе рассеяния атома (который зависит от орби-
тальных электронов), но не на рассеянии нейтронов, которое
для диамагнитных атомов определяется лишь ядерными свойст-
вами. В методах уточнения структур кристаллов используются
рассчитанные атомные факторы рассеяния, так что если пред-
полагается сферическое электронное распределение, а положе-
ние атомного ядра определяется как центр тяжести его элект-
ронной оболочки, то «рентгенографическая» позиция атома мо-
жет отличаться от позиции, определенной нейтронодифракцн-
онным методом {1].
Во многих водородных связях, в особенности в наиболее
сильных, атом водорода располагается на прямой, соединяющей
связываемые атомы; это имеет место в ионе F—Н—F~, в корот-
ких связях типа О—Н—О, О—Н—F и N—Н—О. В некоторых
8.3. Водородная связь 27
структурах угол X—Н—Y оказался в пределах ^160—170°
(рис. 8.3). Очевидно, величины этих углов можно обсуждать
лишь в связи с конкретной упаковкой молекул или ионов в
каждом отдельной структуре. Результаты многочисленных оп-
ределений положения атома водорода в линейных связях F—
Н—Г и О—Н—О изложены ниже.
Связи F—Н—F. Все физические методы (дифракция нейт-
ронов. ИК-спектроскопия и метод ЯМР) указывают на то, что
в солях, подобных NaHF2) имеется симметричный ион бифтори-
да с коротким расстоянием F—Н—F B,27 А). Однако нейтро-
нографическое исследование бифторида /г-толуидина показало,
что ион НРг~ хотя и линеен, но несимметричен и характеризу-
ется одним минимумом:
1,78\
2,52/
Н
N
Z.ZSA
Щ5А
/l,68
г
\1,61
Н
N
Такая сильная асимметрия приписывается влиянию окруже-
ния нона в кристалле; она связана с тем, что атом F2 образует
более сильные водородные связи с соседними атомами азота,
чем атом Fb Намного более длинные водородные связи в крис-
таллическом HF B,49 А) и KH4F5 B,45 А) почти наверняка не-
симметричны; природа связи промежуточной длины в КН2Рз
B.--13 А) неизвестна.
Связи О—Н—О. По-видимому, существует определенное
различие в природе длинных связей О—Н—О (^2,7 А в струк-
тур?), льда, гидратов и гидроксосоединений) и коротких
(sCz'J.o А в кислотах и кислых солях). В некоторых кристаллах
одновременно присутствуют водородные связи различной дли-
ны. Тпк, в Na3H(СОз)г-2Н2О связь между парами ионов СО32^
имеет длину 2,53 А, тогда как связи между молекулами воды и
ионами СО32~ характеризуются средней длиной 2,74 А; в струк-
туре (СООНJ-2Н2О связи между группами ОН в (СООНJ
и ОН короткие B,53 А), а связи между группами Н2О и СО
молекул (СООНЬ значительно длиннее B,84—2,90 А) (рис.
8.3).
Оказалось, что все длинные связи О—Н—О, для которых
были локализованы атомы водорода, являются асимметричны-
ми, клк и следовало ожидать в случае, если атом Н принадле-
жит группе —ОН или Н2О; для связей N—Н—О, образованных,
например, группами —NH2 или NH4+, ситуация аналогична.
В случае кислот и кислых солей оксокислот наблюдается более
28
S. Водород. Благородные газы
сложная картина. Прежде всего необходимо отметить, что тер-
мин «симметричная водородная связь» используется в двух
различных смыслах: он может означать, во-первых, что посере-
дине связи имеется центр симметрии или ось 2-го порядка и,
во-вторых, что потенциальная кривая для атома водорода име-
ет один минимум посередине связи. Первый случай может реа-
лизовываться, если справедливо второе или если существует
разупорядочение в положении атома Н с равной вероятностью
его нахождения на равном расстоянии по обе стороны от сере-
дины связи. Длина коротких кристаллографически симметрич-
ных связей О—Н—О меняется в пределах 2,4—2,6 А, и, по-ви-
димому, те из них, которые короче ~2,5 А, имеют один ми-
нимум на потенциальной кривой. В то же время в структуре
(МНЦЬНзЮб центросимметричность связей длиной 2,64 А воз-
никает из-за динамического разупорядочения атомов водорода
между двумя позициями, связанными центром симметрии и от-
стоящими друг от друга на 0,7 А. Короткие связи О—Н—О без
элементов симметрии также варьируют в пределах 2,4—2,6 А;
они могут быть симметричными (с атомом Н посередине), как,
например, в кислом хлоромалеате калия B,40 А), почти сим-
метричными— в КН5(РО4J B,42 А с двумя минимумами на
расстоянии 0,08 А) или сильно асимметричными, как в тетра-
гональном КН2РО4 B,49 А) (а), в (COODJ-2D2O (б) и DCrO2
B,55 А) (в); относительно особенностей структуры НСгО2 см.
разд. 14.2.5.
о н
1,07 1,42 А
а
/с
2.WA
D
^\ 1,03 1,49 А
6
О D О
0,96 1.S9 А
Н3С
\
с-
-С-
о--н—о
с,н
2П5
3-) °°?,\2,38Л
•с
-с
X_
н г ' сн3
H5L2 I 3
о—н--о
г
Интересно было применить метод дифракции нейтронов для
локализации атомов водорода в очень коротких связях О—Н—
—О в таких комплексах, как этилметилглиоксимат никеля (г)
I I
С1—Р1—S О
С1 °
д
8.4. Водородная связь в кристаллах 29
[2], и в анионе комплекса Кз[РЦEО3JН}С12] (д) [3]. Обзор
работ по сильным водородным связям см. в [4].
Сведения о положении атомов водорода несколько более
косвенного характера дают также метод ПМР и определение
остаточной энтропии. Так, положение протонов молекул воды
в гипсе определено по тонкой структуре линии в спектре ЯМР;
в линейной связи О—Н—О протон находится на расстоянии
0.98 А от атома кислорода [5]. О результатах исследования
гидратов методом ЯМР см. разд. 15.2.6, а; метод был использо-
ван для локализации атомов Н в Mg(OHJ (разд. 14.1.2). Из-
мерения остаточной энтропии подтверждают существование
двух различных позиций протона в водородных связях для льда
(разд. 15.1.1, а) и солей типа КН2РО4, Na2SC>4-10H2O (в кото-
ром остаточная энтропия составляет ~0,2 величины, найденной
для льда).
Литература. [1] Ada cryst., 1969, В25, 2451. [21 Ada cryst, 1972, B28, 2318,
[3] Ada cryst., 1980, B36, 2545. [4] Chem. Soc. Rev., 1980, 9, 91. [51 J. Chem
Phys., 1948, 16, 327.
8.4. Водородная связь в кристаллах
Водородные связи играют важную роль в формировании крис-
таллических структур соединений, содержащих наряду с водо-
родом атомы N, О или F, например для гидридов этих элемен-
тов, некоторых фторидов, оксокислот и кислых солей. Лед и
вода, а также гидраты рассмотрены в гл. 15, а оксокислоты и
гидроксиды •—• в гл. 14.
В гл. 3 отмечалось, что с геометрических позиций представ-
ляет интерес разнообразие способов, которыми группы атомов
небольшого размера, т. е. молекула или нон, могут соединять-
ся водородными связями в систему больших размеров, в пре-
деле— в трехмерный каркас. Системы, построенные за счет
связывания водородными связями, можно классифицировать-
ся едующим образом:
Конечные группы:
Бесконечные цепи:
Бесконечные слои:
Трехмерные каркасы:
[ЩСОзЫ3- (в Na3H(CO3J-2H2O), димеры кар-
боновых кислот
ионы НСО3~ и HSO4~
В(ОНK, В3Оз(ОН)з, N2H6F2, H2SO4
лед, Н2О2, Те (ОН) 6, ион Н2РО4- в КН2РО4
Кристаллические органические соединения, имеющие в сво-
ем составе группы ОН, СООН, NH, NH2 и другие водородсодер-
жащие полярные группы, дают много примеров перечисленных
выше типов структур.
30 8. Водород. Благородные газы
8.4.1. Гидриды. Уже указывалось на то, что только гидриды
азота, кислорода и фтора проявляют признаки наличия водо-
родных связей. Наиболее простые структуры должны образо-
вываться, если каждый атом соединен водородными связями со
всеми ближайшими соседями и если все атомы водорода уча-
ствуют в образовании этих связей. Тогда в твердом гидриде
АН., каждый атом А должен быть окружен 2я соседними ато-
мами А, т. е. координационное число А по атомам А должно
быть равно 6 для NH3, 4 для Н2О и 2 для HF.
Структура кристаллического аммиака может быть описана
как искаженная кубическая плотнейшая упаковка. Вместо
12 эквидистантных ближайших соседей каждый атом азота
имеет 6 соседей на расстоянии 3,35 А и 6 значительно более
удаленных — на расстоянии 3,88 А, что указывает на образо-
вание атомом азота шести водородных связей. Прецизионное
определение положения атомов D в ND3 выполнено методом
дифракции нейтронов [1]. С этой упорядоченной структурой ес-
тественно сравнить структуру обыкновенного льда (лед It,).
связьN — D... N з ND3:
2,374 А
Как и ожидалось, каждый атом О тетраэдрически окружен че-
тырьмя другими; однако атомы водорода статистически распре-
делены по эквивалентным позициям на расстоянии 1 А от ато-
ма кислорода вдоль направления каждой водородной связи.
Наличие в твердом HF лишь одного атома Н у каждого ато-
ма F ограничивает координационное число и Н и F до двух,
так что имеются лишь две возможности — образование беско-
нечных цепей или замкнутых колец. Нейтронографическое ис-
следование твердого DF при 85 К [2] показало, что кристалл
состоит из бесконечных плоских зигзагообразных цепей:
'1,56А
0.95 А
Полярная цепь вполне упорядочена. Многочисленные иссле-
дования газообразного HF [3] указывают на существование
смеси мономера и различных линейных и циклических поли-
меров; средний угол F—F—F составляет 104°, расстояние F—
•—Н—F 2,53 А. Однако опыты по отклонению молекулярных
пучков и масс-спектрометрия показали, что полимеризация яв-
8.4. Водородная связь в кристаллах 31
ляется динамической и, по всей видимости, зависит от давления
и температуры. Л
Поведение НС1 и НВг в твердом состоянии отличается боль-
шой сложностью [4]. Тщательное изучение методом нейтроно-
ботее высокой температуре реализуется ГЦК-структура с осо-
бым видом неупорядоченности. В любой момент каждая меле-
Вг с-4
О положения ашомсв Э
q в неупорядоченной молекулярной
структуре (с = 0 или у)
Рис. 8.4. Структуры кристаллических DC1 при 77,4 К (а) и DBr при 100 К (б)
Маленькие кружки — атомы D, большие — атомы С1 или Вг.
кула имеет одну из 12 возможных ориентации, так что она свя-
зана водородной связью с одним из ее ближайших соседей, ко-
торый в свою очередь связан через водород с одним из своих
12 соседей и т. д. Каждая водородная связь существует лишь
определенное время; она разрывается при переориентации мо-
лекулы, так что «мгновенная» структура кубического DL1
(НС1) представляет собой смесь образовавшихся за счет водо-
родных связей короткоживущих полимеров различной длины
и формы. При температуре ниже точки перехода структура име-
ет ромбическую симметрию. Каждый атом D направлен в сто-
рону соседнего атома С1 (рис. 8.4,а), и структура состоит, та-
ким образом из цепочек молекул, связанных водородными
связями (D—С1 1,28 А; С1—D—С1 3,69 А; угол С1—С1—CI
93,5°).
Кристаллический DBr имеет два фазовых перехода 2-го ро-
да (л-типа) при 93,5 и 120,3 К. При температурах значительно
ниже нижней ^-области (например, при 74 К) структура ана-
32
л. Водород. Благородные газы
8.4. Водородная связь в кристаллах 33
логична упорядоченной ромбической структуре DC1 (рис.
8.4, а), причем расстояния D—Вг равны 1,38 А, Вг—D—Вг
3,91 А, угол Вг—Вг—Вг 91°. Вблизи температуры 93 К проис-
ходит постепенный переход в частично разупорядоченную струк-
туру, в которой для каждой молекулы возможны две равновес-
ные ориентации (рис. 8,4,б). В отличие от резкой потери упо-
рядоченности в DC1 для DBr этот переход растянут на интервал
~20 1\. При втором л-превращении, по-видимому, происходит
постепенный переход от разупорядоченной ромбической струк-
туры к разупорядоченной структуре с 12-кратной координацией,
характерной для высокотемпературного DC1. Поведение НС1 еще
более сложно; это соединение имеет три перехода ^-типа. Осо-
бенности поведения HI пока не выяснены. На основании изу-
чения ИК-спектров НС1, сконденсированного в твердом Хе, был
сделан вывод о присутствии циклических димеров НС1, но их
структура не была определена [5].
Литература. [1] J. Chem. Phys., 1961, 35, 1730. [2] Acta cryst., 1975, B31, 1998.
[3] J. Chem. Phys., 1969; 50, 3611; Z. Naturforsch., 1972, 27a,'983; J. Chem. Phys.,
1972, 56, 2442. [4] Nature, 1967, 213, 171; 1967, 215, 1265; 1968, 217, 541. \Ъ] J.
Chem. Phys., 967, 47, 5303.
8.4.2. Средние фториды. Структура фторида аммония NH4F от-
личается от структур других галогенидов аммония (и щелочных
металлов). Хлорид, бромид и иодид аммония при температурах
ниже 184,3, 137,8 и —17,6°С имеют структуру типа CsCl, а вы-
ше этих температур переходят в модификации со структурой
типа NaCl. NH4F кристаллизуется в структуре типа вюртцита,
причем каждый атом N образует связи N—Н—F длиной 2,71 А,
[1], направленные к четырем соседям, расположенным тетра-
эдрически. Это в значительной степени соответствует структу-
ре обычного льда.
Фторид гидразиния N2H6F2 представляет очень интересный
пример кристаллов, в которых структурные единицы (ионы
N2H62+ и F~) связаны водородными связями N—Н—F в слои
[2]. В ионе N2H62+ длина связи N—N равна 1,42 А, а угол
N—N—Н 110 °С. Проекцию этого иона вдоль оси N—N можно
изобразить следующим образом:
Положение атома водорода водородной связи было опреде-
лено методом ПМР [3]:
N Н F
1,08 А 1.54А
Каждый ион гидразиния образует шесть «октаэдрических»
связей N—Н—F, а каждый ион F~ образует три такие связи (с
различными ионами N2H62+), ориентированные пирамидально.
Это в точности такое же расположение связей, как в структу-
рах CdCl2 или Cdl2. Однако в структуре N2H6F2 атомы галоге-
на не образуют плотноупакованные слои, как в CdCl2 или Cdl2.
Из-за наличия направленных связей N—Н—F B,62 А; ср.: в
NH4F 2,68 А, в NH4HF2 2,76 А) слои имеют очень рыхлое стро-
ение (F—F 4,43 А). Способ наложения слоев друг на друга гео-
метрически сходен со способом упаковки слоев в слоистых ди-
галогенидах. В последних атомы галогена одного слоя касают-
ся трех атомов другого слоя, так что во всей структуре атомы
галогена плотно упакованы. В N2H6F2 слои упакованы анало-
Рис. 8.5. Структура фторида гидразиния (по Кронбергу и Харкеру). а—¦
проекция слоя структуры. Нижние атомы N (заштрихованы) в каждом
ионе ЫгН62+ немного смещены. Светлые кружки (сплошные и штриховые) —
ионы F~ соответственно выше и ниже плоскости рисунка. Линии изобража-
ют связи N—Н—F; б—разрез, показывающий упаковку слоев. Штриховая
линия соответствует плоскости рис. а.
гичным образом, но из-за большой удаленности друг от друга
атомов F в слоях атом F одного слоя (на рис. 8.5 один из свет-
лых кружков) сквозь сетку из атомов F другого слоя приходит
в соприкосновение с атомом N (и/или с тремя связанными с
ним атомами Н). Это межслоевое расстояние для F—N состав-
ляет 2,80 А, а для F—F 3,38 А. По имеющимся оценкам, заряд
иона N2H62+ почти равномерно распределен между всеми ато-
мами, т. е. на каждом атоме катиона заряд равен +1/4. По-
этому межслоевое взаимодействие ионов F^ и атомов N (и/или
Н) соседнего слоя имеет слабо выраженный ионный характер.
Слабость этих связей объясняет очень хорошую спайность па-
раллельно слоям. Подобно тому как NH4F и NH4C1 имеют раз-
3—985
34 8. Водород. Благородные газы
личные структуры из-за того, что только атом F, но не С1 мо-
жет образовать сильную водородную связь, N2H6C12 отличает-
ся по типу структуры от N2H6F2. Хлорид гидразиния образует
несколько деформированную флюоритоподобную структуру, в
которой каждый ион N2H62+ окружен 8 С1~, а каждый ион С1~
окружен четырьмя ионами N2H62+ [4].
Литература. [I] Acta cryst., 1970, В26, 1635. [21 J. Chem. Phys., 1942, 10, 309.
[3] Trans. Faraday Soc, 1954, 50, 560. [4] J. Chem. Phys., 1947, 15, 115.
8.4.3. Бифториды (гидрофториды, кислые фториды) MHF2. Кри-
сталлические структуры бифторидов MHF2 щелочных металлов,
аммония и таллия (I) тесно связаны со структурами NaCl и
CsCl, хотя структура NH4HF2 имеет интересные отличия от
структуры обычной модификации K.HF2 из-за образования в
аммониевой соли связей N—Н—F.
Все ионы (F—Н—F)~ параллельны Ионы (F—Н—F)~ находятся в четы-
рех ориентациях, параллельных объ-
емным диагоналям куба
"¦структура пирита T1HF2
высокотемпературные
неупорядоченная модификации KHF2 и
"-структура пирита RbHF2
NaHF2
ромбо-
эдрический)
структура NaCl —
Бифториды MHF2 имеют следующие
м
Li
Na
К
Rb
Cs
NH4
T1(I)
Структура
Ромбоэдрическая, такая же, как v
NaHF2
Ромбоэдрическая (разд. 6.7.2)
Низкотемпературная модификация —
тетрагональная сверхструктура ти-
па CsCl
Высокотемпературная модификация
(>196СС)—кубическая (неупоря-
доченный пирит)
Низкотемпературная — тетрагональ-
ная, типа KHF2
Высокотемпературная — кубическая
(неупорядоченный пирит)
Низкотемпературная — тетрагональ-
ная
Высокотемпературная — кубическая
(неупорядоченный CsCl, связи F—
—Н—F вдоль ребер куба)
См. рис. 8.6, а
Структура типа пирита (без перехода
к более низкой симметрии)
структуры:
Литература
Acta cryst., 15,286 A962)
J. Chem. Phys., 1963, 39,
2677
J. Chem. Phys., 1964, 40,
402
I. Am. Chem. Soc, 1956,
78, 4256
J. Am. Chem. Soc, 1956,
78, 4256
Acta cryst., 1960, 13, 113
Z. anorg. allg. Chem.,
1930, 191, 36
8.4. Водородная связь в кристаллах 35
Структура обычной (тетрагональной) модификации KHF2
приведена на рис. 8.6, б. Соли калия и аммония часто изо-
структурны, поскольку ионы К+ и NH4+ имеют очень близкие
радиусы. Структуры KHF2 и NH4HF2 являются сверхструктура-
ми от типа CsCl, но в этих структурах ионы HF2~ ориентиро-
ваны различным образом (рис. 8.6). В K.HF2 каждый ион К+
а
Рис. 8.6. Кристаллические структуры NH4HF2 (а) и KHF2 (б). Атомы водо-
рода не показаны. Меньшие по размеру кружки соответствуют атомам фто-
ра, попарно соединенным связями F—Н—F.
окружен на одинаковом расстоянии воемью соседними F~, а в
NH4HF2 ионы NH4+ имеют лишь по 4 ближайших соседних иона
F~~ B,80 А) и еще 4 на более далеких расстояниях C,02 и
3,40 А). Разделение группы с КЧ8 на две группы с КЛ 4 сле-
дует приписать образованию связей N—Н—-F.
Расстояние F—Н—F 2,27 А можно сопоставить с расстояни-
ем Н—F 0,92 А в молекуле HF.
8.4.4. Другие кислые фториды (гидрофториды) MHnFn+i. Поми-
мо K.HF2 были синтезированы еще четыре «кислых» фторида ка-
лия, а именно KH2F3, KH3F4, KH4F5 и K2H5F7. Рентгенографи-
ческим исследованием KH2F3 [Acta cryst., 1963, 16, 58] уста-
новлено строение аниона H2F3~ (а), причем найдено, что рас-
стояния F—Н—F несколько больше, чем в ионе (F—Н—F)~, и
угол между связями равен 135° вместо 120° в твердом HF.
F.
,,F
,н'
) 105° (четыре)
а
Н 119'
F-' (два)
6
36
8. Водород. Благородные газы
В KH4F5 имеется ион (H4F5)~ (б), в котором 4 атома фтора
тетраэдрически окружают центральный атом фтора на расстоя-
нии F—Н—F 2,45 A [J. Solid State Chem., 1970, 1, 386].
8.4.5. Другие ионы (X—Н—Х)~. При обсуждении водородной
связи уже упоминалось об образовании ионов этого типа в со-
лях KH(RCOOJ; ион [Н(СОз)г]" встретится позже при описа-
нии структур кислых солей. Если не считать уже рассмотрен-
ного устойчивого бифторидного иона, другие ионы X—Н—Х~
(где Х = С1, Br, I, NCS или NO3) устойчивы только в присутст-
вии крупных катионов; примером может служить соль
[Р(С6Н5L](Шз-Н-ЫОз) [1]. Такие соли, как [N(CH3L]HC12,
[N(C2H5L]HBr2 и [N(C4H9L]HI2, при комнатной температуре
устойчивы, но имеют тенденцию довольно легко отщеплять мо-
лекулу НХ; некоторые из них чрезвычайно легко разлагаются
при действии влаги и кислорода. Соль CsHCl2 была получена,
но она стабильна лишь при очень низких температурах или под
высоким давлением НС1, тогда как соли, получаемые при ком-
натной температуре из насыщенных водных растворов CsCl и
НС1, имеют иной состав. Формула одной из них, возможно,
CsCl-3/4H3OCl [2], другой —CsCl-Уз (Н3О+-НС12-). Рентгено-
графически показано [3], что последнее соединение и изострук-
2,92 А ,0
u!io°: u
С1
турный бромид содержат пирамидальные ионы гидроксония и
линейные ионы (С1—Н—С1)~ и (Br—H—Вг)~ с расстоянием
X—X 3,14 и 3,35 А. Однако для локализации атомов водорода
необходимо нейтронографическое исследование. ИК- и
КР-спектроскопическое изучение солей таких ионов, как
(С1—Н—С1)~, подтверждает высокую чувствительность их
структуры к внешнему окружению, так что окончательные вы-
воды относительно их строения еще не могут быть сделаны [4].
Литература. [1] J. Chem. Soc, A 1966, 1185. [21 Inorg. Chem., 1963. 2, 657.
[3] Inorg. Chem., 1968, 7, 594. [41 J. Phys. Chem., 1966, 70, 11, 20, 543.
8.5. Кислоты и кислые соли
8.5.1. Кислоты. Для обсуждения строения неорганических кис-
лот удобна следующая классификация:
а) Кислоты НщХп. Наиболее важные из них (галогеноводо-
роды и H2S) при обычной температуре — газы, другие — жид-
кости (HN3, H2Sn, H2O2). Структуры галогеноводородных кис-
лот НХ, а также H2S уже обсуждались. Структуры других кис-
8.5. Кислоты и кислые соли
37
лот этого класса описаны в разделах, посвященных структур^
ной химии соответствующего элемента X.
б) Оксокислоты, содержащие два или более непосредственна
связанных атома X. Они относительно малочисленны. К ним от-
носятся H2N2O2, Н4Рг06 (обе — твердые, кристаллические) и
политионовые кислоты H2SnO6 (n = 3-^-6), полученные только в
виде их водных растворов. Известны и другие оксоионы этого
типа (например, S2O32~ и S2O52~), но мы ограничимся лишь те-
ми случаями, когда может быть выделена свободная кислота.
в) Пероксокислоты содержат группу О—О и описаны в
гл. 11 после пероксида водорода. (К сожалению, получила ши-
рокое распространение и стала уже традиционной номенклату-
ра, согласно которой некоторые ортокислоты называют перкис-
лотами, например соли НС1О4 — перхлораты, соли НМпО4 —
перманганаты).
г) Оксокислоты HmXOn. Эта обширная группа включает
все простые оксокислоты. В парах или кристаллическом со-
стоянии молекула кислоты содержит один атом X, связанный с
несколькими атомами О, к одному или нескольким из которых
присоединены атомы Н. В водных растворах и кристалличе-
ских солях часть или все из этих атомов водорода удаляются,
давая в остатке оксоанион. При обсуждении структур кристал-
лических кислот удобно выделить из них подгруппу кислот
Х(ОН)П, с тем чтобы описывать их вместе с гидроксидамн
(гл. 14). Это относится, например, к кристаллическим Н3ВОз
и Н6Те0б, тогда как H3PO3 не принадлежит к этому типу. По-
скольку все атомы Н в оксокислотах HmXOn присоединены к
атомам кислорода (в отличие, например, от некоторых кислот
фосфора, где часть атомов Н непосредственно связана с ато-
мом Р) и образуют ОН-группы (т. е. XOn_m(OH)m), эти соеди-
нения формально аналогичны оксогидроксидам металлов, рас-
сматриваемым в гл. 14. Структурное отличие состоит в том, что
в соединениях неметаллов присутствуют молекулы конечных
размеров, тогда как в оксогидроксидах металлов связывание
типа М—О—М приводит к образованию бесконечных систем.
При обычных температурах некоторые из оксокислот пред-
ставляют собой жидкости (НгТОз, H2SO4, HC1O4), многие дру-
гие—твердые вещества (Н3РО2, Н3РО3, Н3РО4, H2Se03,
H2Se04, HIO3, НЮ4 и Н5Ю6). Некоторые менее устойчивые
кислоты известны лишь в виде их водных растворов (Н2СО3„
HNO2, H2SO3, HFO, НСЮ, НВгО, НЮ, НС1О2, НС1О3, НВгО3).
При замене группы ОН в некоторых оксокислотах образуются
замещенные оксокислоты типа HSO3F, HSO3NH2.
д) Пиро- и метакислоты. При связывании двух или более
групп ХО„ через атомы кислорода образуются многочислен-
ные сложные оксоионы. Для обозначения ионов из двух анио-
38
8. Водород. Благородные газы
нов ортокислот принято применять приставку «пиро-». Извест-
ны также примеры более сложных ионов сходного типа (на-
пример, P3Oi05~, S3Oio2-, P4O136"). При участии в мостиковых
X—О—X связях двух атомов О от каждой группы ХОп возни-
кают либо циклические, либо бесконечные цепочечные анионы
(соответствующие кислоты называют метакислотами). Среди
сравнительно небольшого числа кислот этого класса, получен-
ных в чистом кристаллическом состоянии, можно назвать мета-
борную кислоту НВОг (три модификации) и H2S2O7; метафос-
форная НРО3 и пирофосфорная Н4Р2О7 (или дифосфорная)
кислоты склонны к стеклообразованию. К этому же общему ти-
пу принадлежат значительно более сложные изо- и гетеропо-
ликислоты таких металлов, как Мо и W (гл. 11).
Некоторые из неорганических кислот, например серная, из-
вестны химикам очень давно. Однако даже сейчас мы сравни-
тельно немного знаем об особенностях строения (о структурах)
неорганических кислот как класса. Это связано главным об-
разом с тем, что многие из них при обычных температурах —
жидкости или не могут быть выделены из-за своей низкой
устойчивости. Только переход к рентгенографическим исследо-
ваниям при низких температурах сделал возможным определе-
ние структур ряда кислот и их гидратов, жидких при комнат-
ной температуре (например, серной и азотной кислот и их гид-
ратов). Спектроскопия молекул, замороженных в инертной
матрице при низких температурах, открывает возможность ис-
следования строения кислот, которые из-за их неустойчивости
не могут быть выделены при обычных условиях (например,
НКОг; см. разд. 18.8.7, а). В этой главе рассмотрены структуры
только безводных кристаллических кислот; гидраты кислот рас-
смотрены наряду с другими гидратами в гл. 15. Строение кис-
лот, исследованных в газообразном состоянии, таких, как H2S,
HN3, HNO3, HNCS и HNCO, описывается в других главах.
8.5.2. Кислые соли. Кислые соли — кристаллические соединения,
промежуточные по составу между кислотами и средними соля-
ми; они содержат простые (F~) или комплексные (ХО„) анио-
ны, связанные системой водородных связей.
Наряду с солями, содержащими анионы (X—Н—Х)~ и бо-
лее сложные фторосодержащие анионы, строение которых об-
суждалось выше, еще только для оксокислот известны безвод-
ные кислые соли. В гидратированных кислых солях молекулы
воды, внедряясь между связанными водородными связями
комплексными анионами, не затрагивают, насколько это изве-
стно, основной принцип строения этих солей: атомы Н остаются
связанными исключительно с оксоанионами, образуя комплекс-
8.5. Кислоты и кислые соли
39
Таблица 8.5. Комплексные анионы, образующие водородные связи
в кристаллах оксокислот и кислых солеи
Отно-
шение
Н:ХОП
1:2
2:3
1:1
3:2
2:1
3:1
Число
а язей
О—Н—О
у каждого
аниона
1
1 и 2
2
3
4
6
Тип комплекса
Н (ХО )
Димер
Тример
Цикличе-
ский димер
1-мерный
1-мерный
2-мерный
3-мерный
1-мерный
2-мерный
3-мерный
2-мерный
3-мерный
Примеры
Кислые соли
NTa3H(SO4J [1]
Na3Il(CO3J-2H2O [21
NH4H2(N03h [31
KHSO4 [4]
КНСО, [5]
SnHPO4 [61
NaHCO, [71
NH4HSO4 [8]
LiH3(Se03J [91
NaH3(Se03J [101
RbH3(Se03J [11]
NH4H3(Se03J [121
(NH4JH2P2O6 [131
KH2PO4 [14]
(NH4JH3IO6 [151
Кислоты
H[PO2(OCH2C6H5J] [16]
U-HIO3 [171
H[SeO2(C6H5)] [18]
(CH,JPO-OH [191
HPO2(OC6H4C1J [20]
р-Щавелевая кислота
H,SeO3 [21]
H2SO4 [221
H2Se04 [23]
а-Щавелевая кислота
H3PO4 [24]
-O3S-NH3+ [25]
[1] Ada cryst.. 1979, B35, 525. [2] Acta cryst., 1956, 9, 82 (дифракция нейтронов);
Acta cryst., 1962, 15, 1310 (ПМР). [3] Acta cryst., 1950, 3, 305. [4] Acta cryst.. 1975, B31,
302. [5] Acta cryst., 1974, ВЗО, 1155. [6] Acta cryst., 1976, B32, 3309. [7] Acta cryst., 1965.
18, 818. [8] Acta cryst., 1971, B27, 272. [9] J. Solid State Chem., 1972, 4, 255. [10] Acta
cryst., 1977, B33. 2108. [11] J. Solid State Chem., 1973, 6, 254. [12] Acta cryst., 1974,
B30, 2497. [13] Acta cryst., 1964. 17, 1352. [14] Phys. Stat. Solidi, 1955, A230. 359. [151
Acta cryst., 1980, B36, 1028. [16] Acta cryst., 1956. 9, 327. [17] Acta cryst., 1949, 2, 128.
[18] Acta cryst., 1954, 7, 833. [19] Acta cryst., 1967, 22, 678. [20] Acta cryst., 1964, 17,
1097. [21) J. Chem. Soc, 1949; 1282. [22] Acta cryst., 1965, 18, 827. [23] J. Chem. Soc,
1951, 968. [24] Acta Chem. Scand., 1955, 9, 1557. [25] Acta cryst., 1960, 13, 320.
ный кислый анион*. Кристаллические оксокислоты также со-
держат соединенные водородными связями оксоанионы. Поэто-
му возможности структурной организации этих соединений точ-
но такие, как в анионах кислых солей Нх(ХОп)у, при условии
равенства отношения Н : ХОП- В кислых солях катионы разме-
щаются между связанными водородными связями анионами.
* В гидратах кислых солей сильных кислот протоны часто находятся в-
гидратированном состоянии и образуют ионы Н3О+, Н5О2+ и НэО4+ [Мака-
тун В. Н. Химия неорганических гидратов. — Минск: Наука и техника,
1985]. — Прим. перев.
40 8. Водород. Благородные газы
8.5.3. Строение кислых солей и кристаллических оксокислот.
В кристаллических оксокислотах и кислых солях степень свя-
занности системы соединенных между собой анионов равна
удвоенному отношению Н: ХОП, поскольку каждая водородная
связь соединяет два атома кислорода различных анионов. По-
этому для пар таких соединений, как замещенная фосфорная
кислота H(PO4R2) и кислая соль KHSO4 или сульфаминовая
QO
д
сГр
Q
Q
0.
О.
ос
Оо
Н2О
Рис. 8.7. Схематическое представление слоя в структуре ЫазН(СО3J-2НгО,
показывающее ионы СОз2", соединенные в пары короткими О—Н—О-связя-
*ш; о молекулами воды — более длинными водородными связями. Ионы Na+
не показаны.
кислота SO3NH3 и (ЫН^гНзЮб, имеются одинаковые топологи-
ческие возможности при образовании структур. Для первой па-
ры соединений на один атом водорода приходится один анион,
что делает возможным образование либо циклической системы,
либо бесконечных цепей. Для второй пары это отношение рав-
но 3:1, и с учетом наличия у каждого аниона шести водород-
ных связей с соседними анионами это приводит к реализации в
структурах двух- или трехмерных шестисвязанных сеток.
Возможные типы соединенных водородными связями анион-
ных комплексов представлены в табл. 8.5 (в порядке возраста-
ния отношения Н: ХОП)-
а) Н: ХОп = 1:2. Имеется лишь один вариант — связыва-
ние ионов ХОп в пары, как это имеет место в Na3H(SO4b и в
кислом карбонате натрия Na3H(CO3J-2H2O (рис. 8.7).
В Na3H(SO4J группы SO4 соединены попарно короткими асим-
метричными связями О—Н—О (О—Н—О 2,43 А; О—Н 1,03 А).
В кислом карбонате для длины водородной связи внутри ди-
аниона получено значение 2,53 А; водородные связи, соединяю-
8.5. Кислоты и кислые соли 41
щие дианион и молекулы воды, удлинены B "'5 А). Об анало-
гичных дианионах в солях типа кислого фенилацетата калия
уже упоминалось ранее.
б) Н: ХОп = 2:3. В этом случае в противоположность всем
остальным примерам, приведенным в табл. 8.5, не все ионы
ХО„ эквивалентны друг другу. Имеется лишь один пример кис-
лой соли NH4H2(NO3K, в структуре которой нитрат-ионы соеди-
нены водородными связями в группы по три.
в) Н :ХОп = 1:1- Ионы ХОП могут образовывать цикличе-
ские системы или бесконечные цепочки. Наблюдаются интерес-
ные различия в строении химически сходных солей. Так„
в КНСОз имеются димеры (центросимметричные), в NaHCO3
и NH4HSO4 — цепочки, в KHSO4 — цепочки, и димеры (а)*.
При нейтронографическом исследовании КНСОз и KDCO3 об-
наружено разупорядочение в связях О—H(D)—О длиной
<Х5/О---Н.--ох§/О
О' ""О-'-Н-.-О7 ЧО
V V0
—о/ хо— н— ох о—н— & х
S
о—н—
а
О7 О
\1
1,564А\
1Ш
/
о о
Н-,-
-о
!5в А
2,58
1.249А
1,07 А 1,345,
.? \п/п
2,59 А (КНСОз) и 2,61 A (KDCO3). Однако в KHSO4 длины
связей S—О указывают на то, что атомы Н присоединены к
вполне определенным атомам О (б). В структуре SnHPO4 так-
же обнаружены димеры.
* Другой тип цепочек — с «отростками» — обнаружен в структурах кис-
лых сульфатов CaSr Ва [ДАН СССР, 1985, т. 283, с. 1241; Кристаллогр.,
1986, т. 31; ДАН СССР, 1986, т. 288, с. 1376]. — Прим. перев.
42 8. Водород. Благородные газы
В NaHCO3 бикарбонат-ион образует бесконечные цепочки
(НСО3~)п, удерживаемые друг относительно друга за счет
взаимодействия с ионами Na~. Атомы Н локализованы; асим-
метрия связей О—Н—О позволяет рассматривать линейный
анион как ансамбль ионов НСО3~ (в).
Среди кислот также имеются примеры связывания подобно-
го типа. В а-НЮ3 способ соединения отдельных единиц весьма
сходен с тем, как это реализуется для NaHCO3. Первоначаль-
но расстояния между атомами О различных ионов Ю3~ были
Рис. 8.8. Кристаллическое строение а-иодноватой кислоты, показанное в ви-
де системы соединенных друг с другом октаэдров Юб или групп Ю3 (за-
штрихованы), соединенных водородными связями (штриховые линии). Ма-
ленькие кружки — атомы иода.
интерпретированы в предположении наличия «вилочных» водо-
родных связей. Однако здесь I(V) проявляет координацию
C+3), характерную для атомов многих элементов, имеющих
неподеленную электронную пару. На рис. 8.8 три более слабые
связи для одного из атомов иода показаны штрихами. Если не
принимать во внимание коротких «межмолекулярных» расстоя-
ний О—О, соответствующих ребрам искаженной октаэдрической
группы Юб, получится, что каждая группа 1О3 присоединена к
соседним лишь за счет двух связен О—Н—О с образованием
таких же цепей, как в ионе бикарбоната. Методом дифракции
нейтронов установлено, что связи О—Н—О B,68 А) являются
обычными линейными водородными связями.
Среди двузамещенных фосфорных кислот HPO2(ORJ встре-
чаются и димерные, и цепочечные структуры, что точно соот-
ветствует двум типам ионов HSCU"; бесконечные цепи обнару-
жены также в кристаллической фенилселенистой кислоте. Ниже
изображена димерная структура в дибензилфосфорной кисло-
те (г) и цепочечная структура в HSeO2(C6H5) (д). Весьма
похожие цепочки обнаружены в диметилфосфиновой кислоте
(СН3JРО(ОН) и в НРО2(ОС6Н4С1J (табл. 8.5). К этому же
классу принадлежат карбоновые кислоты, в которых отношение
Н к RCOO равно единице. И в парах, и в кристаллах эти со-
единения существуют в виде димеров, подобных (HSO4~J (я)-
8.5. Кислоты и кислые соли
43
г) Н : ХОп = 3 : 2. Осуществление трех водородных связей у
каждого оксоаниона делает возможной реализацию разнообраз-
ных трехсвязанных систем. В качестве примера приведем струк-
туры кислых селенитов щелочных металлов MH3(Se03J, инте-
рес к которым в последние годы обусловлен наличием у них
сегнетоэлектрических свойств. Эти свойства обнаружены у мно-
4 2,494 А *¦
RCK ,о н-
Kp/OR
RCK XO H CK XOR
,Se
О
О
S\
1,71 A / \ 1,765 A
98,5°
,03,5°
Р'
1,90 А
гих сложных оксидов (например, у некубических перовскитов)
и в соединениях с водородными связями, например в тартратах
(соль Рошеля) и дигидрофосфатах (КН2РО4) NH4H2PO4). Для
сегнетоэлектриков с водородными связями основной интерес
представляет определение положения и поведения атомов водо-
рода; но сейчас нас интересует лишь структурная топология:
«тяжелых» атомов. Каждая группа SeO3 соединена с другими
группами с помощью водородных связей; среди солей щелоч-
ных металлов имеются примеры 3-связанных систем трех ти-
пов. В LiH3(Se03J обнаружены цепочки (е), в которых каждая
группа SeO3 связана с двумя другими простым и двойным мос-
тиком. Эту цепочку можно изобразить в виде топологической
схемы ж:
о-н-ск
4
о-н-о/
ж
44
5. Водород. Благородные газы
В структуре NaH3(Se03J каждая группа SeO3 соединена водо-
родными мостиками с тремя другими, что приводит к образова-
нию простейшей 3-связанной плоской сетки (б3). В аналогичных
солях калия, рубидия и аммония реализуются структуры с
трехмерным 3-связанным каркасом H3(Se03J, причем в солях
рубидия и аммония он имеет форму искаженной тетрагональ-
ной сетки типа A0,3) -Ь (рис. 3.29). Основываясь па длинах
связей Se—О (Se—О 1,66 A, Se—ОН 1,75 А), можно предло-
жить другую форму записи формул этих соединений:
M+(H2Se03)(HSe03)-
д) Н: ХОп = 2 :1. Основываясь только на величине этого
отношения, можно предположить, что каждый оксо-ион соеди-
Рис. 8.9. Цепочки (Н2Р2О6)п2п~, образовавшиеся за счет водородных свя-
зей, в структуре (ЫН^НРО
ияется с соседними посредством четырех водородных связей.
Поэтому имеется возможность реализации всех типов компле-
ксов с водородными мостиками от островных до трехмерных,
¦как и для случая г. Среди кислых солей имеются примеры од-
но- и трехмерных структур; слоистые структуры в этом классе
шока не обнаружены. В (ЫН^гНгРгОб анионы объединены ко-
;роткими связями О—Н—О B,53 А) в цепи (рис. 8.9), а цепи в
¦свою очередь соединены в трехмерный каркас за счет связей
N—Н—О. В гл. 3 при обсуждении структуры алмаза уже отме-
чалось, что в КН2РО4 ионы РО2(ОНJ~ соединены водородными
мостиками в трехмерный ассоциат (рис. 8.10).
В структурах же неорганических кислот обнаружены приме-
ры слоистых структур. В структурах H2Se03, H2Se04 и H2SO4
имеются слои одного и того же топологического типа, основан-
ного на простейшей 4-связанной плоской сетке. В то время как
в кислотах Н2ХС>4 каждый атом кислорода участвует в образо-
вании только одной водородной связи (рис. 8.11, a), BH2Se03
(меньшее число атомов кислорода) один из атомов О образует
две водородные связи, а два других атома О — по одной (рис.
8.11,6). Это показывает, что величина отношения Н:ХОП опре-
деляет только общий тип структуры, а для более детального
обсуждения следует принимать во внимание строение группы
ХО„.
8.5. Кислоты и кислые соли 45
Атпомь;
фосфора
на высоте:
Атомы
кислорода
и водородные
связи
на высоте:
0 О
i e
i— -О
I—-О
—--О
Рис. 8.10. Часть структуры КНгРО4 в проекции на базисную плоскость
(ионы К+ не показаны). Штриховые линии — водородные связи, соединяю-
щие тетраэдры РО4 в бесконечный трехмерный каркас.
Щавелевая кислота (СООНJ имеет две полиморфные мо-
дификации, одна из которых характеризуется слоистой структу-
рой, а другая содержит цепочки:
а - щавелевая
кислота
—Н-Оч
0-
./
,c-c:
--ox o-H—o/ xo-h—
c—c/
-H-C/ N0-H-04 /0—-
-о7 Чо-н-
р-щаввлевая
кислота
—H-0 '
с-с
,-о-н—о-
/О-Н —
с-с
>— Н-СК ЧО —
е) Н: ХОП = 3:1. Кристаллическая структура Н3РО4 — сло-
истая. В пределах слоя каждая молекула РО(ОНK соединена
с шестью другими с помощью водородных связей двух типов и
различной длины. Связи между О и ОН короткие B,53 А),
а между двумя ОН-группами соседних молекул длиннее B,84 А)
(рис. 8.12). Структура (NH4hH3IO6 — трехмерная каркасная;
каждая группа Ю6 (правильный октаэдр) соединена разупоря-
доченными водородными связями О—Н—О B,64 А) с шестью
другими. Каждый атом О образует также связи О...Н—N
46 8. Водород. Благородные газы
Ж
а б
Рис. 8.11. Схемы водородных связей, формирующих слои в структурах кри-
сталлической H2SO4 (а) и ромбической модификации НгЭеОз (б). Штрихо-
вые линии — связи О—Н—О.
B,85 А) с ионом NH4+, в котором один из атомов Н не вовле-
кается в водородную связь. По три водородные связи от каж-
дого иона NH4+ объединяют группы Ю6 в слои, плоскость кото-
рых перпендикулярна оси 3-го порядка ромбоэдрической
структуры, тогда как между «слоями» действуют связи О—Н—
—О. Сульфаминовая кислота, выступающая в кристалле в ви-
де цвиттер-иона ~O3S-NH3+, — это при-
мер структуры, в которой каждая струк-
турная единица образует водородные
связи с шестью другими.
Как уже отмечалось, структуры гид-
роксокислот, в том числе В(ОНK и
Те (ОН) 6, рассматриваются в гл. 14 со-
вместно с гидроксидами, к которым они
со структурной точки зрения примыкают
более тесно. В них, как во многих орга-
нических гидроксосоединениях, молеку-
лы соединены длинными связями
О—Н—О (по две от каждой группы
ОН). Сюда относится также одна из
форм метаборной кислоты, состоящая из циклических молекул
В3О3(ОНK; три атома кислорода в кольцевой молекуле не уча-
ствуют в водородных связях.
Здесь мы ограничились рассмотрением структур кристалли-
ческих оксокислот и «кислых» солей, хотя системы с водород-
ными связями могут быть представлены и другими типами со-
единений. Два примера в табл. 8.5 иллюстрируют трехмерные
системы водородных связей, основанные на простейших сетках
со связанностью 4 и 6. Этот ряд можно дополнить примерами
Рис. 8.12. Водородные
связи в кристаллической
ортофосфорной кислоте
Н3РО4.
8.6. Фториды ксенона 47
«гидроксидов» олова и свинца, дающих трехмерную систему с
объемноцентрированными сетками со связанностью 8:
3-мерные сетки
(Н2РО4)П"~ алмазная
(Н3Юб)п2я~ примитивная кубическая
Sn6O4(OHL объемноцентрированная кубическая
СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ
Существование димерных ионов благородных газов было впер-
вые доказано масс-спектрометрически в 1936 г.; впоследствии
были выполнены многочисленные исследования в этом направ-
лении. Эти частицы образуются при столкновениях возбужден-
ного и нейтрального атомов (Х*+Х—ОС2++е). Было показано,
что в разрядных трубках могут быть получены и другие не-
устойчивые частицы, например ArO, KjO, XeO (полосатые
спектры), ХеС14~ при превращении 1291 в 129Хе (эффект Мёс-
сбауэра) и XeF в кристаллах XeF4, облученных у-квантами
(ЭПР). Существование вандерваальсовых комплексов ArFH и
АгСШ установлено при масс-спектрометрическом изучении пуч-
ков, получаемых при прохождении смесей Аг+НХ через ультра-
звуковое сопло; в комплексах углового строения (Аг—X—Н
44°) расстояния Аг—X оказались равными 3,54 и 4,01 А. Устой-
чивые соединения благородные газы образуют только с наибо-
лее электроотрицательными элементами F и О, причем соеди-
нения ксенона наиболее многочисленны. Впервые в 1962 г. при
непосредственном взаимодействии Хе и PtF6 при комнатной тем-
пературе был получен оранжево-желтый XePtF6. Из соединений
криптона получены фторид KjF2 и ряд аддуктов, содержащих
ионы KrF^ и Kr2F3+ (разд. 8.11). Описано получение KrF4, но
это соединение охарактеризовано, по-видимому, недостаточно
подробно и строение его неизвестно.
Ниже мы рассмотрим строение соединений ксенона без осо-
бого углубления в их стереохимию. Взаимное расположение
связей большей частью отвечает простым соотношениям стерео-
химии непереходных элементов, изложенных в гл. 7, что дела-
ет очень сходными стереохимию ксенона и иода. Очевидно так-
же, что осложнения, возникающие при наличии определенных
валентных групп в стереохимии сурьмы, теллура и иода, обна-
руживаются и здесь.
8.6. Фториды ксенона
Эти соединения получены при непосредственном взаимодейст-
вии простых веществ в различных условиях. Известны бинар-
ные фториды XeF2, XeF4 и XeF6 — бесцветные кристаллические
48
8. Водород. Благородные газы
вещества (^пл 140, 114 и 46 °С). Нет никаких достоверных све-
дений об октафториде; однако выделено молекулярное соеди-
нение XeF2-XeF4. Фториды ксенона образуют многочисленные
аддукты с другими галогенидами, например XeF2-AsF5, 2XeF2*
•AsF5, XeF2-MF5, XeF2-2MF5 и XeF6-MF5 (где M = Pt, Ir и др.).
Существование подобных соединений возможно благодаря пе-
реходу одного иона фтора из фторида ксенона к молекуле пен-
тафторида MFs с образованием катионов и анионов:
(XeF)+ (M2FU)-, (Xe2F3)+ (AsFe)-, (XeF6)+ (PtF,)"
(Подробнее о катионе (XeF)+ см. ниже.) Известны также комп-
лексные галогениды, образующиеся из XeF6, например RbXeF7,
Rb2XeFs и соответствующие цезиевые соли.
Строение молекул XeF2 и XeF4 сходно со строением соответ-
ствующих галогенидных ионов 1С1г~ и 1С14~, т. е. линейное и
плоско-квадратное. В XeF2-XeF4 имеется равное число молекул
обоих фторидов того же самого строения, как и в индивидуаль-
ных соединениях.
Линейная конфигурация XeF2 обнаружена также в XeF2-IFs,
причем молекула IFs оказалась пирамидальной с расстоянием
I—F 1,88 А и углом при аксиальном атоме иода 81°.
В противоположность XeF2 и XeF4 трактовка строения гекса-
фторида встречает большие затруднения. Последние данные по
дифракции электронов не согласуются ни с моделью правиль-
ного октаэдра, ни с с пентагонально-пирамидальным строени-
ем, ожидаемым для группы с 14 валентными электронами. По-
лученные данные больше соответствуют модели в виде непра-
вильного октаэдра с большой амплитудой деформационных ко-
лебаний и со средней длиной неэквивалентных связей 1,89 А.
XeF6 существует в четырех кристаллических модификациях,
причем с понижением температуры образуются все более слож-
ные структуры; ни одна из них не содержит дискретных моле-
кул XeF6:
IV 180 °С III — 25 °С II +10 °С 1
кубическая
Z 144
моноклинная
64
ромбическая
16
моноклинная
8
Модификации I, II и III состоят из тетрамеров. Переход I—>-П
сопровождается значительной перестройкой половины тетраме-
ров, тогда как при переходе II—ЯП происходит лишь упорядо-
чение «правых» и «левых» форм тетрамеров. В более сложной
по строению модификации IV имеется два вида полимерных
единиц, образованных за счет связывания квадратно-пирами-
дальных ионов XeF5+ через ионы F~ (слабые связи Хе—F) в
циклические тетраметры и гексамеры, причем в элементарной
ячейке находятся 24 первых и 8 вторых. В тетрамере (рис,
8.13, а) каждый ион F~ участвует в образовании несимметрич-
8.5. Кислоты и кислые соли 49
а
1.84 А
2,23 А,.—
2,60А~
-. 2,5бА
Рис. 8.13. Структура кристаллического XeF6 (объяснения см. в тексте).
ного мостика между двумя атомами Хе; поэтому каждый атом
Хе имеет дополнительно двух соседей. Вгексамере (рис. 8,13,6)
каждый ион F~ связывает (симметрично) по три атома Хе.
Окружение атомов Хе в тетрамере и гексамере показано на
рис. 8.13, в и г.
Тетрамер
Гексамер
Хе
5F 1,84 А
F 2,23
F 2.60
Хе
IF 1,76 А
4F 1,92 А
3F 2,56
4-985
50
8. Водород. Благородные газы
8.7. Фторсодержащие катионы
В некоторых аддуктах XeF2 атом Хе образует две коллинеарные
связи, причем один из атомов F входит в координационное
окружение атома металла. Концевая связь Хе—F существенно
короче, чем в XeF2 B,00 А), а мостиковая — длиннее:
Xe-F,
F—Хе—F—RuF5
F—Хе—F—\YOF4
F—Хе—F—Sb2Fio
1,87
1,89
1,84
2,18
2,04
2,35
В F—Хе—OSO2F концевая связь Хе—F также короткая
A,94 А), но несколько длиннее, чем в соединениях, рассмотрен-
ных выше, а связь Хе—О необычно длинная (ср. с другими
расстояниями в табл. 8.6). Структуры этих аддуктов можно
¦считать промежуточными между молекулярными и ионными
(например, RuF6XeF и (RuF6)-(XeF)+).
Ион XeF3+ (например, в XeF4- (SbF5h), подобно C1F3 и
BrF3, имеет Т-образную конфигурацию, которая является след-
ствием тригонально-бипирамидального расположения пятиэлек-
ронных пар. Связи имеют длину 1,84 А (экваториальные) и
1,91 А (апикальные), но существуют еще и слабые дополнитель-
ные связи B,49 и 2,71 А) с атомами фтора анионов (SbF6~ или
Sb2F,r).
В структуре соединения с эмпирической формулой 2XeF2-
•AsFs присутствуют плоские ионы Xe2F3+ (рис. 8.14), похожие
по геометрии на (H2F3)~, в котором угол между связями равен
135°, и на 15~ (угол 95°). Соль состава (XeF5) (PtF6) получена
при 200 °С под давлением фтора из смеси Хе и PtF5. Структура
состоит из октаэдрических ионов PtF6~ (среднее расстояние
Pt—F 1,89 А) и квадратно-пирамидальных ионов XeF5+ (рис.
8.14), в которых атом Хе находится несколько ниже основания
пирамиды, причем аксиальная связь немного короче экватори-
альных. По своему строению катион очень похож на IFs и TeF5~.
Атом Хе соединяется с еще четырьмя более удаленными атома-
ми F (штриховые линии), находящимися на расстояниях 2,52,
2,65 и 2,95 А (два F). Близкие длины связей найдены в
(XeF5) (RuF6). В соединении, для которого предложена форму-
ла (Xe2Fn) + (AuF6)~, присутствуют две такие квадратные пи-
рамиды, соединенные через мостиковый атом фтора и связан-
Таблица 8.6. Строение
Соединение
XeF2
XeF«
XeF6
XeF2-XeF4
XeF2-IF5
FXeFWOF4
FXeFRuFs
XeF3+
Xe2F3+
XeF5+
Xe2Fn+
XeF82-
Xe(OSeF5J
Xe(OTeF5L
FXeOSO2F
XeOF4
XeO2F2
XeO3F2
XeO3F-
XeO3
XeO4
Конфигурация
Линейная
Плоско-квадратная
Искаженная окта-
эдрическая (га-
зовая фаза)
(Крист. — см.
текст)
См. текст
Линейная для
F Yo F
г—Ае—г
То же
Плоская Т-образ-
ная
Линейная для
F—Хе—F
Квадратная пира-
мида
См. текст
Квадратная анти-
ППИЧМ1
11 U rl j 14 <д
Линейная у атома
Хе
То же
Квадратная пира-
мида
Тригонально-
пирамидальная
См. текст
» »
Пирамидальная
Тетраэдрическая
соединений благородных газов
Расстояние,
Хе—F
1,98
2,00
1,95
1,93
1,89 (ср.)
XeF22,01
XeF4 1,96
2,02
2,02
1,89
о 04
1,87
2,18
1,84
1,91
1,90
2,14
1,79
1,85
1,96
1,94
1,90
1,90
2,36
,48
А
Хе-0
2
2
1
1
1
1
1
,12
,16
.70
,71
,77
,76
,74
Литература а
J. Chem. Phvs., 1969, 51,
2355 (ИК)"
J. Am. Chem. Soc, 1963,
85, 241 (крист.)
Noble Gas Compounds,
H. H. Hyman (ed.),
University of Chicago
Press, 1963, p. 238
(дифр. эл.N
Science, 1963, 139, 1208
(дифракция нейтронов)
J. Chem. Phys., 1968, 48,
2460, 2466
J. Am. Chem. Soc, 1974,.
96, 43
Acta cryst., 1965, 18, 11
Inorg. Chem., 1970, 9r
2264
Acta cryst., 1975, B31, 906
Inorg. Chem., 1973, 12,
1717
Inorg. Chem., 1974, 13,
1690
Inorg. Chem., 1974, 13,
Inorg. Chem., 1973, 12,
1717
Inorg. Chem., 1974, 13,
775
Science, 1971, 173, 1238
Inorg. Chem., 1976, 15,
2718
Angew. Chem., 1978, 17,
356
Anorg. Chem., 1972, 11,
1124
J. Mol. Spectr., 1968, 26
410
J. Chem. Phys., 1978, 59,
453 (дифракция ней-
тронов)
J. Chem. Phys., 1971, 55,
1505
Inorg. Chem., 1969 8,
326
J. Am. Chem. Soc, 1963,
85, 817
J. Chem. Phys., 1970, 52,
812 (дифр. электронов)
52 8. Водород. Благородные газы
Продолжение
Соединение
ХеО64-
ХеОзСЬ2-
ХеС!2
KrF2
KrF+, Kr2F3+
ArHCl, ArHF
Конфигурация
Октаэдрическая
См. текст
Линейная
См. текст
» »
Расстояние, А
Хе—F
(Kr-F
1,88)
Хе—О
1,86
а
Литература
Inorg. Chem., 1964, 3,
1412, 1417; J. Am.
Chem. Soc, 1964, 86,
3569
J. Am. Chem. Soc, 1977,
99, 8202
Inorg. Chem., 1967, 6,
1758 (ИК.)
J. Am. Chem. Soc, 1968,
90, 5690 (ИК)
J. Am. Chem. Soc, 1967,
89, 6466 (дифр. элек-
тронов)
Inorg. Chem., 1976, 15
00
I. Chem. Phys., 1973, 59
2273; J. Chem. Phys.
1974, 60, 3208
a См. также обзор: Нейдинг А. Б., Соколов В. Б. — Усп. химии, 1974, т. 43, № 12,
С. 2147. — Прим. перев.
"Ссылки на более ранние работы см. в обзоре [Science, 1964, 145, 773]. Обсуж-
дение природы связи в соединениях благородных газов см. [J. Chem. Soc, 1964, 1442;
Inorg. Chem., 1972, 11, 1124].
ные также с одной группой AuF6", Хе образует 5 связей длиной
1,84 А, одну — 2,23, одну 2,64 и две 3,40 А. Вопрос о заряде
иона Xe2Fu+ все же остается спорным. Заметим, что предпо-
ложение о присутствии ксенона в степени окисления VI застав-
ляет считать, что золото находится в степени окисления V
(разд. 25.1).
8.8. Ксенонсодержащие анионы 53
8.8. Ксенонсодержащие анионы
Описаны соединения, содержащие два типа фторидных анио-
нов. При взаимодействии XeF6 с фторидами щелочных метал-
лов (за исключением LiF) получаются соли, содержащие ион
XeF7~. При термическом разложении этих солей образуются
XeFe6 и M2XeF8. Строение аниона XeF82~ исследовано в соедине-
нии (NOJ+(XeF8J-, которое получено из 2 NOF и XeF6. Ани-
F
.F
XeO2F2
XeO3F~ в KXeO^F
Рис. 8.14. Фрагменты структур соединений ксенона
и XeO3F-.
1", XeF5+, XeO2F2
он имеет конфигурацию слегка искаженной квадратной анти-
призмы; средние значения расстояний Хе—F до атомов F, ле-
жащих в вершинах двух квадратных граней, равны Хе—4F
1,96 А и Хе—4F 2,08 А.
В солях рубидия и цезия состава Мд^еОзСЬЬСЛ линейный
анион представляет особый интерес как первый пример соеди-
нения со связями Хе—С1, устойчивый при обычной температу-
„ С1 „
\
хе
С1
\
С1
54 8. Водород. Благородные газы
ре. В ионе (XeO3Cl2)n2"- осуществляется почти линейная мос-
тиковая связь между искаженно октаэдрическими группами
ХеО3С13; длины связей равны Хе—О 1,77 А, Хе—С1 2,96 А.
8.9. Оксиды и оксоанионы
Триоксид ксенона образует бесцветные кристаллы, устойчивые
в атмосфере сухого воздуха; во влажном воздухе они расплыва-
ются; соединение чрезвычайно взрывчато. По кристаллическо-
му строению оно сходно с а-НЮ3 (ХеО3 изоэлектронен иону
Ю3-), за исключением, разумеется, того обстоятельства, что в
нем отсутствуют водородные связи:
Расстояние
М-О, А
Угол О—М—О,
град
ХеО3
ю3-
1,76
1,82
103
97
Тетраоксид получен действием H2SO4 на перксенат Na4XeC>6.
В газообразном состоянии молекулы имеют правильную тетра-
эдрическую конфигурацию, причем длина связи Хе—О A,74 А)
является промежуточной между длинами связей Хе—О в ХеОз
A,76 А) и BXeOF4 A,70 А).
Известны ксенаты, содержащие Xe(VI), и перксенаты [про-
изводные Xe(VIII)], например CsHXeO4 синтезирован из ХеО$
и CsOH в присутствии ионов F~, а гидратированные соли, со-
держащие ион ХеО64", получены при взаимодействии XeF6 и
гидроксидов щелочных металлов. В кристаллогидратах
Na4XeO6-6H2O, Na4XeO6-8H2O и К4ХеО6-9Н2О, представляю-
щих большой интерес ввиду высокой степени окисления ксено-
на, содержится октаэдрический ион перксената (Хе—О 1,86 А).
Здесь можно упомянуть и о двух других соединениях, со-
держащих связи Хе—О. В структуре одного из соединений
Xe(OSeF5J впервые обнаружены атомы ксенона (II), симмет-
рично связанные с двумя атомами кислорода
F5Se
1,53 А
Другое соединение — Xe(OTeFsL — единственное из известных к
настоящему времени соединений, в структуре которого атом
Xe(IV) связан исключительно с атомами кислорода.
8.10. Оксофториды и KXeO3F 55
8.10. Оксофториды и KXeO3F
Известно три оксофторида ксенона. XeOF4 — бесцветная жид-
кость, получаемая при взаимодействии ХеО3 и XeF6, проявляет
сходную с фторидами галогенов способность давать комплекс-
ные соединения типа CsF-XeOF4 и XeOF4-2SbF5. Согласно ре-
зультатам исследований микроволновых спектров, молекула
имеет конфигурацию квадратной пирамиды с атомом Хе, рас-
положенным приблизительно в центре основания, т. е. это поч-
ти такая же структура, как у XeF5~, где один F заменен на О.
При действии ХеО3 на XeOF4 образуется XeO2F2. По моле-
кулярной структуре он сходен с IO2F2-, т. е. это тригональная
бипирамида, в которой одну из экваториальных позиций зани-
мает неподеленная электронная пара (или линейная молекула
XeF2 плюс два экваториальных атома О; рис. 8.14). Углы меж-
ду связями составляют О—Хе—О 105,7°, F—Хе—F 174,7°. Две
более слабые дополнительные экваториальные связи Хе—О
B,81 А) каждого атома Хе приводят к формированию псевдо-
октаэдрического слоя (такого же типа, как в SnF4).
Очень неустойчивый оксофторид ксенона (VIII) XeO3F2 изу-
чался спектроскопически (изоляция в матрице). Ему приписа-
на симметрия D3ft.
К этим оксофторидам тесно примыкает соль состава
K(XeO3F), получаемая взаимодействием KF и раствора ХеО3.
В кристаллах этого соединения имеются пирамидальные группы
ХеО3 того же строения, что и исходные молекулы ХеО3:
Расстояние Угол О—Хе—О,
Хе—О, А град
KXeO3F
ХеО3
Для сравнения
Юг
1,77
1,76
1,82 (I—O)
100
103
97@-1-0)
Группы ХО3 через мостиковые атомы F соединены в беско-
нечные цепи состава XeO3F (рис. 8.14). Связи Хе—F неравно-
ценны по длине B,36 и 2,48 А), причем обе значительно длин-
нее, чем в XeF4 или XeF6 A,95—2,0 А), но существенно короче,
чем можно было бы ожидать при чисто ионном или вандерва-
альсовом взаимодействии (~3,5 А). Пять связей атома ксено-
на, три обычные связи Хе—О и две слабые связи Хе—F направ-
лены к пяти вершинам октаэдра.
56 8. Водород. Благородные газы
8.11. Соединения криптона
По данным спектроскопических методов (ИК и КР) и электро-
нографии, молекула KrF2 имеет линейное строение. Этот фто-
рид образует аддукты, в которых присутствуют ионы KrF+ и
Kr2F3+ (данные ЯМР 19F и КР-спектроскопии). Первый из упо-
мянутых ионов содержится в KrF(AsF6) и KrF(Sb2Fn), вто-
рой—в Kr2F3(AsF6) и Kr2F3(SbF6).
Детали строения соединений благородных газов, а также
ссылки на литературу приведены в табл. 8.6.
9. ГАЛОГЕНЫ.
БИНАРНЫЕ ГАЛОГЕНИДЫ
9.1. Введение
В каждой группе периодической системы элементов первый ее
член характеризуется наличием у атома только четырех орби-
талей, в то время как атомы остальных элементов помимо s-
и р-орбиталей могут использовать также d-орбитали. Вследст-
вие этого наибольшие различия наблюдаются в химии первого
и последующих элементов группы. Кроме того, свойства иода
заметно отличаются от свойств брома и хлора, так что между
крайними членами группы галогенов фтором и иодом можно
обнаружить лишь незначительное химическое сходство.
Фтор характеризуется чрезвычайно высокой химической ак-
тивностью. Он непосредственно реагирует со всеми неметалла-
ми, за исключением азота и легких благородных газов (Не, Ne,
Аг), и со всеми металлами. Более того, продукты такого взаи-
модействия представляют собой (или содержат) высший фто-
рид данного элемента. Примерами могут служить AgF2 (но
AgCl), CoF3 (но СоС12); платиновые металлы также дают выс-
шие фториды (RuF5, OsF6, IrF6 и PtF6). Вообще многие эле-
менты, особенно неметаллы, в соединениях с фтором свою наи-
высшую степень окисления проявляют чаще, чем при взаимо-
действии с другими галогенами; можно сравнить фториды AsF5,
SF6, IF7 и OsF6* (вначале полагали, что это OsF8) с высшими
хлоридами — AsCU, SCU, IC13 и OsCU.
Атом фтора редко образует более одной ковалентной связи
(см., например, межгалогенные соединения и полигалогениды)
хотя линейное расположение двух связей (со значительной ион-
ной составляющей) найдено в структурах кристаллических со-
единений MF3, MF5 и др. (см. ниже) и в ионе (С2Н5)зА1—F—
—А1(С2Н5)з~, присутствующем в калиевой соли [1]. Атомы
хлора и брома образуют до четырех связей с атомами кислоро-
да; во фторопроизводных этих элементов число связей может
быть даже большим (C1F5, BrF5 и BrF6~), тогда как иод шес-
тиковалентен в некоторых оксосоединениях и даже образует
гептафторид. Наиболее устойчивый для иода ион 13~ для фтора
не обнаружен. Другой особенностью фтора является его малое
сродство к кислороду, что характерно также для брома и в не-
* Описано получение OsF7 [Chem. Ber., 1966, 99, 2652]. — Прим. перев.
58
9. Галогены. Бинарные галогениды
которой степени для селена, находящегося в периодической си-
стеме перед бромом.
Фтор — наиболее электроотрицательный элемент, так что
его связи с атомами большинства других элементов носят су-
щественно ионный характер. За исключением галогенидов ще-
лочных элементов, большинство кристаллических фторидов
имеют структуры, отличные от структур других галогенидов
того же металла. Целый ряд дифторидов и диоксидов имеет
сходные структуры, тогда как структуры дихлоридов, днбрсми-
дов и дииодидов во многих случаях аналогичны структурам ди-
сульфидов, диселенидов и дителлуридов. Высокая электроотри-
Таблица 9.1. Некоторые свойства галогенов
Элемент
F
С1
Вг
I
Ионный
радиус,
А
1,36
1,81
1,95
2,16
х-х
1
1
2
2
в Хг.
,43
,99
,28
,66
А
н-х
0
1
1
1
з НХ, А
,92
,28
,41
,60
Энергия дис-
социации
X—X,
кДж/моль
154,8
242,7
192,5
150,6
Потенциал
ионизации,
эВ
17,42
12,96
11,81
10,45
Сродство к
электрону.
эВ
3,448
3,613
3,363
3,063
цательность атома фтора по сравнению с атомами других эле-
ментов позволяет ему давать значительно более прочные водо-
родные связи. Это приводит к появлению особых свойств у HF
по сравнению с другими кислотами НХ, к большей устойчиво-
сти иона (F—Н—F)~ в сравнении с другими ионами НХ2~,
а также к структурным различиям между гидратами фторидов
и других галогенидов. Строение ионов НХ2~, H2F3~ и H4F5~ уже
обсуждалось в гл. 8.
Аномально низкая энергия диссоциации связи F—F обычно
объясняется отталкиванием неподеленных электронов валент-
ных оболочек двух атомов. Экстраполяция зависимости энер-
гии диссоциации молекулы галогена Х2 от 1/R (где R — длина
связи X—X) дает значение для фтора на ~ 226 кДж/моль бо-
лее высокое, чем приведенное в табл. 9.1. Было высказано мне-
ние [2], что аналогичные количественные аномалии возникают
и при участии только одного атома фтора. Например, зависи-
мость сродства к электрону от потенциала ионизации для иода,
брома и хлора является линейной, а при экстраполяции на
фтор дает величину на 1,14 эВ A08,8 кДж/моль) большую,
чем наблюдаемая. Сходные отклонения наблюдаются для энер-
гии диссоциации ковалентных молекул типа НХ или СН3Х или
молекул галогенидов щелочных металлов (в газообразном со-
стоянии), связь в которых является ионной. Эти факты под-
9.1. Введение
59
F
1,
1,
14
43
Cl
1,94
1,99
Br
2,
2,
24
28
I
2,
2,
64
66
тверждают наличие значительных сил отталкивания, испыты-
ваемых электроном, внедряющимся во внешнюю оболочку, не-
зависимо от того, образуется ли при этом ион или происходит
обобществление электронов и образование ковалентной связи.
Сравнение с удвоенным атомным радиусом (определяемым как
среднее расстояние от ядра до внешних р-электронов) показы-
вает, что связь в молекуле F2 необычно длинная:
r.x-x в Х2, Л
Остановимся на строении некоторых катионов, содержащих
только атомы галогена. Для иода известны также ионы типа
(R—I—R)+, в которых группы R обычно являются ароматиче-
скими радикалами (Аг). Галогениды (Аг—I—Аг)Х не очень
устойчивы, тогда как гидроксиды представляют собой сильные
основания, дающие при диссоциации ионы (Аг—I—Аг)+. Со-
единения иодония (IR2)X аналогичны соединениям аммония и
сульфония (NR4)X и (SR3)X.
Ожидаемое уголковое строение иона (IR2)+ обнаружено в
кристаллическом (С6Н5J1+AС12)^; в этом ионе угол между
связями I—С составляет 94°, а длина связи I—С 2,02 А [3].
В то же время ионы (R—I—R)+, в которых связь с атомом I
осуществляется через донорный атом, например атом азота,
являются линейными, подобно AС12)^, поскольку в гибридиза-
ции участвуют 5 орбиталей, в том числе три, занятые неподе-
ленными электронными парами. Такая геометрия реализуется
в структурах соединений с пиридином и уротропином
[(РУЬ1]+Ь~ [4] и ;[((СН2)бН4J1]+1з~ [5]. Сходное тригонально-
бипирамидальное расположение пяти пар электронов осуществ-
ляется в С6Н51С12 и диацетате иодобензола (а), причем две не-
поделенные пары занимают экваториальные положения [6].
ООССНз
OOCCH3
Среди других необычных соединений иода можно отметить ио-
дозо- и иодилсоединения R—1 = 0 и R—Ю2, вступающие в ре-
акцию друг с другом
[6IO2 + Ag+ > (C6H5JI+-fAgIO3
60
9. Галогены. Бинарные галогениды
Для иода еще известны так называемые соли иода IPO4,
1(С1Н2ССООK, а также другие соединения, строение которых
не изучено, но которые иногда рассматриваются как содержа-
щие ион 13+, что в некоторых случаях используется для под-
тверждения «основных» свойств иода. На самом деле нет ника-
ких доказательств того, что они являются «обычными» солями;
так, нитрат (полученный действием 100%-ной HNO3 на иод) име-
ет формулу IO(NO3), а не I(NO3K, как считалось ранее [7]. (Ср.
строение ковалентного нитрата фтора, разд. 18.8.7.) И бром, и иод
образуют с нитратом анионы [Br(NO3J]~, [I(NO3J]~ и
[I(NO3L]~, устойчивые в присутствии крупных катионов, на-
ч.Х'Х.Х
-s—
¦—s—
Z,39A
0
—S—(
I
i
а 6
Рис. 9.1. Структура I2O2SO4. a — фрагмент одной из цепей и указанием длин
связей; б — топологическая схема строения слоя.
пример N(CH3L+ [8]. В то же время известны безводные суль-
фаты и селенаты иодозила (IOJSO4 и (IOJSeO4. В структуре
I2O2SO4 [9] имеются спиральные цепи из чередующихся ато-
мов I и О, уложенные в слои и связанные между собой суль-
фатными группами, каждая из которых соединяет две цепочки
(рис. 9.1). Вокруг атома иода расположение связен приблизи-
тельно плоско-квадратное, причем две связи длиннее двух
остальных (сходное положение в структуре 1С13, разд. 9.4.1, а).
На топологической схеме (рис. 9.1,6) атомы кислорода, нахо-
дящиеся на линиях S...I, не показаны.
О структурной химии астата ничего не известно. Изотоп
At211 получается путем бомбардировки висмутовой мишени
а-частицами. Образование соединений регистрировалось во вре-
мяпролетном масс-спектрометре; были обнаружены HAt, AtCH3,
AtCl, AtBr и Atl. Доказательств образования молекул At2 по-
лучено не было [10].
Литература, fl] Acta cryst., 1963, 16, 185. [2] J. Am. Chem. Soc, 1969, 91, 6235
[3] Acta cryst., I960, 13, 1140. [4] Acta Chem. Scand., 1961, 15, 407 \5\ Acta
cryst., 1975, B31, 1505. [6] Acta cryst., 1977, B33, 1620. [71 Сотр. rend. (Paris)
1954, 238, 1229. [8] Inorg. Chem., 1966, 5, 2124. [9] Acta Chem. Scand, 1974
A28, 71. [10] Inorg. Chem., 1966, 5, 766.
9.2. Стереохимия хлора, брома и иода 6t
9.2. Стереохимия хлора, брома и иода
Стереохимия этих элементов связана с наличием валентных
групп из 8, 10, 12 и 14 электронов, исключая немногочислен-
ные случаи молекул с нечетным числом электронов, таких, как
С1О2. Конфигурация известных к настоящему времени молекул
и ионов, содержащих 4, 5, 6 или 7 пар валентных электронов^
является соответственно тетраэдрической, тригонально-бипира-
мидальной, октаэдрической и пентагонально-бипирамидальной.
При этом предполагается, что неподеленные пары локализуют-
Число пар
электронов
в а-связях
4
5
6
7
Таблица 9.
Тип гибриди-
зации
sp4z2
Sffidf
spdfd.
2. Стереохимия хлора, брома
Число не-
поделенных
электрон-
ных пар
0
1
2
0
1
2
3
0
1
2
0
1
Геометрия коорди-
национного окру-
жения
Тетраэдрическая
Тригонально-
пирамидальная
Уголковая
Тригонально-би-
пирамидальная
Искаженная тетра-
эдрическая*
Г-образная
Линейная
Октаэдрическая
Квадратно-пира-
мидальная
Квадратно-пло-
скостная
Пентагонально-би-
пирамидальная
Искаженная окта-
эдрическая
и иода
Примеры
сю4-, ю4-
С1О3-, ВгО3-, НЮз
ClCv, BrF2+, Ш2+
ю53-
IO2F2-
CIF3, BrF3, R-ICb
[3-, IC12-, BrlCl-
io65-
BrF5
BrF4-, 1СП-
IF7
IFe-?
* Промежуточная между тетраэдрической и квадратно-пирамидальной. — Прим. ред.
ся так же, как и электроны связей, и что л-связывание, имею-
щееся в кислородсодержащих молекулах и ионах, в первом
приближении не оказывает сильного влияния на стереохимию.
Соответствующие примеры приведены в табл. 9.2. При рассмот-
рении конфигурации ионов XF6~ возникают те же проблемы,
что и в случае SeX62~ и сходных с ним ионов.
9. Галогены. Бинарные галогениды
9.3. Строение простых веществ
Имея по семь валентных электронов, атомы галогенов достига-
ют электронной конфигурации благородных газов при образо-
вании одной связи с участием пары электронов. В соответствии
с этим во всех агрегатных состояниях галогены присутствуют в
виде двухатомных молекул. (Детали строения двух кристалли-
ческих модификаций фтора рассмотрены в разд. 29.1.2. Обе эти
структуры отличны от структур кристаллических С12, Вг2 и
12.) Особенность кристаллических структур состоит в том, что
молекулы Х2 упакованы в слои, причем в пределах слоя крат-
чайшие межмолекулярные расстояния значительно короче, чем
расстояния между молекулами из разных слоев (табл. 9.3). На
Таблица 9.3. Межатомные расстояния в кристаллических галогенах
Элбмеьт
F
Cl
Br
I
X-X, A
1 ,?8
2,27
2,72
X—X
Cm.
3,32
3,31
3,50
(межмолекулярное), А
в слое
разд. 29.1.2
3,82
3,79
3,97
между
слоями
_
3,74
3,99
4,27
a: J. Solid
225
Литература
State Chem., 1970, 2
C: Acta cryst., 1964, 17, 777
Acta cryst.
Acta crvst.
Acta cryst.
1965, 18, 568
1965, 18, 568
1967, 23, 90
рис. 9.2 проведено сравнение упаковки молекул в кристалли-
ческих I2, IC1 и IBr. Дополнительное слабое связывание обнару-
жено также в структурах полииодидов, которые рассмотрены
ниже в этой главе. Здесь прослеживается аналогия со связями
в комплексах с переносом заряда в молекулярных аддуктах,
образованных галогенами (или галогенидами галогенов), в ко-
торых эти связи параллельны оси молекулы X—X и значитель-
но укорочены по сравнению с суммой соответствующих вандер-
ваальсовых радиусов [Acta cryst., 1968, В24, 713; 1964, 17,
712; Quart. Rev. Chem. Soc, 1962, 16, 1]:
С
(CH3J
2,28 A ?(CH3J
:o—вг-вг—о.
2.82A
2,84 A
H3CCN —Br-Br—NCCH3 [1]
2,33 A
Н2Г
e7 (
2,91 A
I-I Se/
2'76ah,Vch2
9.4. Межгалогенные соединения
9.4. Межгалогенные соединения
Соединения, устойчивые при обычных температурах, имеют об-
щую формулу ХХ'„,гдега=1,3, 5 или 7; не известны соедине-
ния, содержащие в своем составе более двух видов атомов га-
логенов. (При пропускании смеси Вг2, С12 и благородного газа
через микроволновой разряд с последующей конденсацией при
20 К, по-видимому, образуются молекулы Br2Cl2 [Inorg. Chem.,
1968,'7, 1695].) ИК-спектры таких молекул, как C1F3, подтверж-
дают их Т-образную конфигурацию (см. ниже). Межгалоген-
ные соединения обычно получают при непосредственном взаи-
а
Рис. 9.2. Взаимное расположение молекул в структурах кристаллических
a-lCl (a), IBr (б) и 12 (в).
модействии простых веществ; только IF7 синтезируют из IFs.
Из шести возможных соединений с формулой XX' были получе-
ны все, кроме IF, о существовании которого свидетельствуют
только спектроскопические данные. В чистом виде не удалось
синтезировать и BrF, который легко превращается в смесь
BrF3 и Вг2; изучение фазовых диаграмм дало указания на то,
что BrF может существовать в жидком состоянии, а в твердом
€4
9. Галогены. Бинарные галогениды
разлагается. Из других соединений получены C1F3, BrF3 и
IC13; C1F5, BrF5 и IF5 и IF7. Насколько известно, фтор не спо-
собен давать соединения типа FX3, FX5 или FX7; ковалентность,
равная семи, обнаружена лишь у иода. Пента- и гептасоедине-
ния представлены исключительно фторидами.
9.4.1. Строение межгалогенных соединений. Длины связей в мо-
лекулах XX' (газообразное состояние) приведены в табл. 9.4.
В кристаллическом а-1С1 [1] (среднее расстояние I—C1 2,40 А)
молекулы образуют зигзагообразные цепи за счет довольно
сильных межмолекулярных взаимодействий типа I—I C,08 А)
Таблица 9.'
Молекула
F—C1
F—В г
Cl—Br
С1—I
. Межатомные расстояния в молекулах
типа XX'
о
Расстояние, А
1,628
1,759
2,138
2,303
Литература
Phys. Rev., 1949, 76, 1723
Phys. Rev., 1950, 77, 420
Phys. Rev., 1950, 79, 1007
Phys. Rev., 1948, 72, 1268
и I—Cl C,00 А) (рис. 9.2, а). Углы между внутримолекулярной
связью I—Cl и этими слабыми дополнительными связями равны
102° (у атома С1) и 94° (у атома I). Близкие значения длин
связей и углов найдены в структуре другой (р) модификации
IC1 [2]. Структура кристаллического 1Вг весьма сходна со
структурой 12; здесь также в пределах слоя имеются более ко-
роткие расстояния I—Вг (рис. 9.2,6) [3]. Наиболее короткие
расстояния X—X между слоями составляют I—Вг 4,18 А, I—I и
Вг—Вг 4,27 А. Это стремление образовывать дополнительные
слабые связи проявляется также у полигалогенидов (см. ниже).
а. Молекулы ХХг'. Строение C1F3 исследовалось методом
микроволновой спектроскопии, а также в кристаллическом со-
стоянии [4]. Плоская молекула имеет Т-образную конфигура-
цию (а); параметры молекулы, полученные рентгенографически
для кристаллического состояния, составляют 1,716 и 1,621 А;
1,698 А С] 1,698 А
87° 29'
1,598 А
2,38 А4-
2,39
у
2,68 ,
2,72 ~~
,. С1-,
84°
*'СГ''
(;i
Q 94°
F
а
9.4. Меж галогенные соединения
65
угол 86С59'. Аналогичное строение имеет молекула BrF3 (мик-
роволновая спектроскопия) [5] с параметрами: расстояния
Вг—F 1,810 и 1,721 А, угол F—Br—F 86°13'. Структура 1С13 в
твердом состоянии совершенно иная [6]; кристалл построен из
плоских молекул 12С16 (б), в которых концевые связи I—C1 име-
ют примерно ту же длину, что и в IC1, 1С12~ и 1С14~, тогда как
мостиковые связи значительно длиннее. Геометрическое строе-
ние этой молекулы не получило еще теоретического объясне-
ния*.
Значительный интерес представляла бы структура изолиро-
ванной молекулы 1С13; к сожалению, измерения плотности па-
ра показали, что при 77 °С 1С13 в паре нацело диссоциирует на
IC1 и СЬ, хотя он и плавится при 101 °С под давлением собст-
венных паров A2 атм). Спектр поглощения его растворов в
ССЦ является наложением спектров IC1 и СЬ. В фенилдихло-
роиоде линейная группа 1С12 приблизительно перпендикулярна
плоскости фенильного кольца [7]. Связь I—С занимает здесь
одну из трех экваториальных позиций; связь I—С1 оказывается
значительно длиннее B,45 А), чем в 1С1г~.
Соединения 1А1С16 и ISbCl8, получаемые при взаимодействии
А1С13 или SbCls и 1С13, можно рассматривать, как соли, содер-
жащие ион AС1г)+. Однако они имеют не столь простое строе-
ние [8]. Структура ISbClg состоит из групп 1С12 (уголковых) и
SbCl6, причем эти группы соединены между собой в цепи за
счет слабых дополнительных связей. Каждый атом I образует
две слабые связи (длиной ~2,9 А) в дополнение к связям в ио-
не 1С1г+ B,31 А) {в). Учитывая (по-видимому, вполне реаль-
ci a
2,31 а,
ск
сг
;sb;
Cl 2,9
С1.
2,43 А
х2-31 А
4Sb"
Cl
.П
ЧС1
См., однако, Коттон Ф., Уилкинсон Дж. Современная неорганическая
химия, —м.: Мир, 1969, ч. 2, с. 250. — Прим. перев.
5—985
9. Галогены. Бинарные галогениды
ное) удлинение двух связей Sb—С1, строение соединения можно
рассматривать как промежуточное между (ICl2) + (SbCl6)~ и
(ICl4)~(SbCl4)+ с преобладанием первой формы. Аналогич-
ным образом строение соединения алюминия можно считать
промежуточным между AС12) + (А1С14)~ и AС14)~(А1С12)+. Эти
структуры представляют дополнительный интерес в связи с
тем, что длины связей в Юз хорошо согласуются с резонанс-
ной структурой типа
СГ
С1Ч С1
б. Молекулы ХХъ'. Ожидаемое для этих молекул квадратно-
пирамидальное строение подтверждено электронографическим
исследованием ClFs [9] (Cl—F 1,57 А), а также рентгенографи-
чески. В кристаллическом BrF5 (при —120 °С) атом Вг рас-
положен ниже плоскости четырех атомов [10], а апикальная
связь A,68 А) короче, чем остальные четыре A,75—1,82 А).
Строение молекулы IF5 исследовано на примере кристалличе-
ского IFs (при 193 К) [И] ив XeF2-IFs (разд. 8.6). Конфигу-
рация молекулы аналогична конфигурации изоэлектронного
иона XeF5+ (разд. 8.7).
F
1,75 А\
1,87А
в. Молекулы XX-]'. Согласно данным ПК- и КР-спектроско-
пии и электронографии [12], молекула IF7 имеет пентагональ-
но-бипирамндальное строение со связями I—F примерно одина-
ковой длины A,825+0,015 А); при этом, однако, пять эквато-
риальных атомов F не находятся точно в одной плоскости. Ин-
терпретация рентгеновских дифракционных данных, получен-
ных для ромбической модификации (устойчивой ниже—120сС),
натолкнулась на значительные затруднения. Наиболее опреде-
ленное заключение, содержащееся в обзоре рентгеноструктур-
ных данных, состоит в том, что нет достаточных доказательств
отличия молекулярной симметрии IF7 от ?>5л [13].
Литература. [1] Acta cryst., 1956, 9, 274. [2] Acta cryst., 1962, 15, 360. [3] Acta
cryst., 1968, B24, 429, 1702. [4] J. Chem. Phys., 1953, 21, 609, 602. f5J J. Chem.
Phys., 1967, 27, 223. [6] Acta cryst., 1954, 7, 417. Щ Acta cryst., 1953, 6, 88.
[8] Acta cryst., 1959, 12, 859. [9] ДАН СССР, 1978, 241, 360. [10] J. Chem. Phys.,
1957, 27, 982. [11] Inorg. Chem., 1974, 13, 1071. [12] J. Chem. Phys., 1960, 33,
182. [13] Acta cryst., 1965, 18, 1018.
9.4. Межгалогенные соединения
67
9.4.2. Галогенные и межгалогенные катионы. Открытие этих ка-
тионов произошло в результате изучения реакций в неводных
растворах. Эти ионы чрезвычайно электрофильны; их можно
получить окислением галогенов при помощи S2OaF2, AsFs или
SbFs в сильнокислотных растворителях, например в HSO3F и
«суперкислоте» HSO3F-SbF5-3SO3; выделение этих комплекс-
ных катионов возможно только в сочетании с анионами очень
сильных кислот, например с SO3F~, AsF6~, Sb2Fn~ или Sb3Fi6~.
Представления о строении некоторых из этих ионов большей
частью основаны на спектроскопических данных; в некоторых
случаях определены кристаллические структуры солей.
" Установлено существование следующих ионов:
C1J Вг2 П FC1, ClFj BrFj IFt
си вг; n cifj BrF: if;
If ICI2 C1F? BrF? IFj
Br^ I|
а. Ионы Х2+. Частицы С12+ не устойчивы ни в растворе, ни
в твердом состоянии. Данные об их строении получены при
изучении электронных спектров в газообразном состоянии. Ио-
ны Вг2+ и 12+ образуются при окислении Вг2 и 12 действием
S2O6F2 в среде «суперкислоты» или HSO3F. Изучение кристал-
лической структуры алого парамагнитного соединения ([х =
= 1,6[1В) Br2(Sb3Fi6) показало [1], что она содержит ионы
Вг2+ и анионы, состоящие из трех октаэдрических групп SbF6,
сочлененных друг с другом через грамс-атомы фтора централь-
ной группы (а). Строение катионов 12+, ответственных за си-
KF.Sb;
148°
a
2,68
2,68 Я
Ж
F42,29A
F^ 93,5°
г
^г\ У
1,58 A
96°
в
l,69 A
68 9. Галогены. Бинарные галогениды
нюю окраску растворов иода в HSO3F, изучено на примере
темно-синего I2(Sb2Fii) (ц = 2,0цв) [2], полученного из U к
SbF5 в жидком SO2. Длины связей X—X в катионах Хг+ (С12+
1,89 А, Вг2+ 2,15 А, 12+ 2,56 А) во всех случаях короче на
~0,1 А, чем в соответствующих молекулах Х2.
б. Ионы Х3+. Изучение КР-спектров Cl3(AsF6), выделенного
при —78°С, подтвердило уголковое строение катиона, изоэлект-
ронного SC12 [3]. Кристаллический Br3(AsF6) получен из
O2(AsF6) и Вг2, а ион 13+ (подобно 12+)—при окислении иода
стехиометрическим количеством S2O6F2 в среде HSO3F. Угол
между связями в ионе 13+ (97,1 °С) был определен при исследо-
вании A3)(А1С14) методом ЯМР [4].
в. Ионы /42+ и h+. Диамагнитный ион 142+ (красное окраши-
вание) образуется при охлаждении раствора, содержащего
h+ в HSO3F. Строение иона 15+ определено в кристаллическом
(Is) (SbF6) [5]. Он имеет плоское строение (б), причем ионы
Is+ соединены в группы по три за счет более слабых связей
I—I C,42 А), подобных дополнительным связям, обнаружен-
ным в пределах слоя в структуре кристаллического иода.
г. Ионы ХХ2'+. Для ионов ХХ2'+ B0 валентных электронов)
следует ожидать уголковое строение. Уже отмечалось (разд.
9.4.1, а), что в структурах аддуктов 1С13 с SbCl5 и А1С13 в прин-
ципе можно выделить ионы 1С12+, но за счет довольно сильно-
го взаимодействия между анионами и катионами в кристаллах
этих соединений реализуется приблизительно квадратное рас-
положение четырех атомов С1 вокруг атома I. Взаимодействие
такого же типа осуществляется в (ClFb) (SbF6) [6] и
(BrF2) (SbF6) [7] между ионами C1F2+ (BrF2+) и атомами фто-
ра из аниона (в и г). КР-спектры соединений AsF5-2ClF и
BrF3-2ClF показывают, что в них содержатся асимметричные
катионы (С1—С1—F)+ [3].
д. Ионы XF4+. Ион BrF4+ в (BrF4) (Sb2Fn) [8], как и сле-
довало ожидать по аналогии с SF4, имеет конфигурацию триго-
нальной бипирамиды с неподеленной парой, занимающей эква-
ториальное положение. Средняя длина четырех коротких свя-
зей Br—F составляет 1,81 А; две слабые связи в экваториаль-
ной плоскости дополняют координацию до искаженно октаэд-
рической (д). Асимметрия мостика в ионе (Sb2Fn)~ подтверж-
173
<
96е
171-
\ средняя длина „
шести связей Sb-F1,9OA
''S
1 73°
-Sb'
~~-~ средняя длина <,
пяпи связей Sb-F1,1SA
9.5. Полигалогениды 69
дает, что его строение в значительной степени соответствует
форме записи (SbF6)-(SbF5), поскольку средняя длина шести
связей Sb—F в SbF6~ равна 1,90 А, а пяти связей в SbF5 (не
считая мостиковую связь) — 1,75 А.
Ион IF4+ в (IF4) (Sb2FM) [9] имеет сходную конфигурацию
с экваториальными и апикальными связями I—F 1,77 и 1,84 А
и углами между связями 92 и 160° (ср. углы в TeF4 (89 и
161°) и GeF2 (92 и 163°)). Однако в этой структуре более уда-
ленные соседи атома иода расположены совсем иначе, чем у
атома Вг на схеме д: два атома F расположены на расстоянии
2,53 А и два — на расстоянии 2,88 А.
е. Ионы XF6+. Для этих ионов еще нет точных структурных
данных. Колебательный спектр иона C1F6+ изучался в соедине-
нии (C1F6) (PtF6) [10]. Из анализа дебаеграмм следует, что
(BrF6)(AsF6) [11] и (IF6)(AsF6) [12] имеют структуру типа
NaCl, предположительно содержащую октаэдрические катионы
и анионы.
Литература. [1] J. Chem. Soc, A 1971, 2318. [21 Сап. J. Chem., 1974, 52, 2048.
[3] Inorg. Chem., 1970, 9, 811. [4] Inorg. Chem., 1975, 14, 428. [5] Can. J. Chem.,
1979, 57, 968. [6] J. Chem. Soc, A 1970, 2697. [71 J. Chem. Soc, A 1969, 1467.
[81 Inorg. Chem., 1972, 11, 608. [9] J. Chem. Soc, D 1975, 2174. [10] Inorg. Chem.,
1973, 12, 1580. [11] Inorg. Chem., 1975, 14, 694. [12] J. Chem. Phys., 1970, 52,
1960.
9.5. Полигалогениды
Эти соединения содержат в своем составе указанные ниже
анионы (в случае полииодидов довольно сложного состава, ко-
торые рассмотрены отдельно):
С1з Вгз Ij
BrF2"
C1F; BrCl2 1С1г IBiF"
С1Вг2 Brl2 IBri IClBr
12ВГ
CIF4 BrFi IFJ IC13F- ICI4
BrF^ if;
Подобные соединения получают при взаимодействии гало-
генида металла (или неметалла) и межгалогенного соединения
(или галогена при получении CsIF4, CsBrF4, CsClF4, CsBr3 и
Csl3) либо в растворе, либо при действии паров межгалоген-
ного соединения на сухой галогенид. KBrF4 получают растворе-
нием KF в BrF3 с последующей отгонкой избытка растворите-
ля; кристаллический KIF4 можно выделить при охлаждении
раствора КЛ в IF5, a KIF6 кристаллизуется из горячего раство-
ра. При низких температурах можно выделить очень неустойчи-
вые соединения, например получить NO(C1F2) при взаимодей-
70
9. Галогены. Бинарные галогениды
ствии XOF и C1F при — 78 °С. В общем случае при обычных
температурах устойчивы лишь соли крупных катионов щелоч-
ных металлов или крупных органических катионов. Например,
единственными устойчивыми солями MI3, MICb и М1С14 явля-
ются соли с катионами NH4+, Rb+ и Cs+, а также такими ка-
тионами, как NH(CH3K+ и (C6H5N2)+. Устойчивость солей воз-
растает с увеличением размеров катиона; так, в ряду КЮЬ,
RbICl2 н CsICU лишь последняя соль стабильна при комнатной
температуре. Соответствующие полигалогенидам свободные
кислоты в безводном состоянии неизвестны, однако описано
соединение Н1С14-4Н2О.
9.5.1. Строение полигалогенидных анионов
а. Ионы (X—X—Х)~. Относительно строения этих линейных
ионов (табл. 9.5) важно подчеркнуть два момента. Во-первых,
обнаружено, что в некоторых солях ионы Вг3~~, 1СЬ~ и 13~ по-
строены симметрично, тогда как в других они имеют асиммет-
ричное строение. Во-вторых, длина всего иона 13~, изученного
весьма детально, примерно на 0,5 А больше, чем удвоенная ве-
личина простой связи I—I, причем для ионов симметричного и
асимметричного строения колебания составляют лишь ~0,1 А,
тогда как различия в длинах связи I—I достигают 0,32 А.
Структурные различия между ионами 13~ связывают с различ-
ным окружением концевых атомов в структуре, хотя этот эф-
фект носит более сложный характер. Неясен и вопрос о влия-
нии размера катиона. В (Ph4As)I3 анионы находятся на значи-
тельном расстоянии друг от друга (кратчайшее расстояние
I...I между различными ангионами составляет 5,20 А); соль име-
ет бледно-желтую окраску и содержит симметричные ионы
13~. В солях щелочных металлов, в том числе в КЬ'НгО, упа-
ковка анионов в значительной мере сходна с расположением
молекул 12 в кристаллическом иоде (расстояние I...I ~4 А).
Несмотря на то что катион Cs+ большой, ионы 13~ в кристал-
лическом Csl3 асимметричны, тогда как в черных блестящих
кристаллах К1з-Н2О содержатся симметричные ионы (с от-
клонением не более 0,005 А). Данные по строению ионов 13~
см. в литературе, цитируемой для К1з-Н2О в табл. 9.5.
Сопоставление длин связей в ионе (I—I—Вг)~, где I—I ко-
роче, чем I—Вг, позволяет представить строение иона следую-
щим образом:
г, 78 2,91 А
Точно так же асимметрия иона Вг3~ в ряде солей (табл. 9.5)
указывает на то, что состояние системы соответствует записи
Br—Br...Br-
9.5. Полигалогениды 71
Ион
F—Cl—F
Вг—Вг—Вг
С1—I—С1
Cl—I—Br
Вг—I—Br
I—I—Br
I—I—I
Таблица 9.5.
Строение
Соединение
KC!F2
(C6H5N2)Br3
[N(CH3KHbBr(Br3)
(C6H7NHJ(SbBr6)Br,
CsBr3
(PBr4)Br3
(PC1,)IC12
[N(CH3L1IC12
KIC12
CsICl2
C,H12N2(IC12J
NH4(ClIBr)
KIBr,-H2O
CsIBr2
CsI2Br
KI3-H2O
fAs(C6H5),ll3
NH4I3
Csl3
ионог
Расстояние.
A
X-X'
X'—X"
(По данным
роскопии
2,54
2,54
2,54
2,44
2,39
2,55
2,47
2,91
2,71
2,62
2,78
2,93
2,92
2,79
2,84
2,54
2,54
2,54
2,70
2,91
2,55
2,69
2,51
2,71
2,78
2,91
2,93
2,92
3,11
3,04
(X—Х-—X
Удлинение
по сравне-
нию с
парно!"
зыо
X—X'
орди-
свя-
. А
X'— X"
ИК-спект-
линеен)
0,26
0,26
0,20
0,16
0,11
0,23
0,15
0,59
0,24
0,15
0,1?
0,27
0,26
0,13
0,18
0,26
0,26
0,26
0,42
0,63
0,23
0,37
0,04
0,24
0,31
0,43
0,27
0,26
0,45
0,38
')-
Литер j гур;
Inorg. Chern., 1967,
6, 1159
Acta Chem. Scand.,
1962, 16, 1882
3roc. ned. Acad.,
i УаО, DU1, O~iO
Inorg. Chem., 1968,
7, 2124
Acta cryst., 1969,
B25, 1073
Acta cryst., 1967,
23, 467
J Am. Chem. Soc,
1952, 74, 6151
Acta cryst., 1964,
17, 1336
Acta cryst., 1973,
B29, 2104
Acta cryst, 1973,
B29, 2613
Acta Chem. Scand.,
1958, 12, 668
Acta crvsi., 1967,
22, 812
Acta cryst, 1973,
B29, 2556
Chem. Cor.im., 1969,
1374
Acta cryst., 1966,
20, 330
Acta cryst, 1980,
B36, 2869
Acta crvst., 1972,
B28, 1331
Ada cryst., 1970,
B26, 904
Acta cryst.. 1972,
B28, 133!
б. Ионы XX/ . Согласно ИК-спектроскопическим исследова-
ниям [1], ион C1F4- в солях с катионами NO+, Rb+ и Cs" имеет
плоское строение. Рентгенографические данные подтвердили
плоско-квадратную конфигурацию ионов BrF4" и KBrF4 [2]
72 9. Галогены. Бинарные галогениды
(Br—F 1,89 А) и 1СЦ- в К1СЦ-Н20 [3] и в Н1СЦ-Н20 [4]
(I—C1 2,53 А).
Литература. [П Inorg. Chem., 1966, 5, 473. [2] J. Chem. Soc, A 1969, 1936.
|3] Acta cryst., 1963, 16, 243. [4] J. Am. Chem. Soc, 1972, 94, 1130.
9.5.2. Полииодидные ионы. К этим ионам относятся \п~ (я = 3, 5,
7, 9) или 1П2~ (п=4, 8, 16), образующие соли с катионами
больших размеров. Как уже отмечалось, структуры трииоди-
дов состоят из катионов и ионов 1з~, но в высших полииодидах
сложный анион построен из ряда субъединиц A~, 13~, 1г), до-
вольно слабо связанных в более сложную систему \п. Общая
особенность всех полииодидных ионов состоит в том, что не-
которые или даже все расстояния I—I являются промежуточ-
ными между длинами ковалентной связи I—I B,72 А в 1г) и
кратчайшим межмолекулярным расстоянием C,50 А в крис-
таллическом иоде).
В структуре [Cu(NH3L]l4 [1] линейные ионы 142~ дополня-
ют координацию Си (II) до D+2), что приводит к образова-
нию зигзагообразных цепей:
-Си —
/ \
\,/
Длины связей в ионе 142~ 3,34, 2,80 и 3,34 А (следующее
наиболее короткое расстояние I—I 4,65 А) позволяют предста-
вить формулу в виде (I...I—I...IJ~. Сообщалось о наличии ли-
нейных групп U в Т16РЫю Г2], но все расстояния I—I оказа-
лись в пределах 3,114-3,18 А; не совсем ясно, можно ли это
соединение рассматривать как соль, содержащую анионы 142~.
В структуре N(CH3Ll5 [3] имеются приблизительно квад-
ратные сетки атомов иода (рис. 9.3, а); анализ расстояний I—I
показывает, что ионы 15~, имеющие форму буквы V, можно
рассматривать как ион 1~, очень слабо связанный с двумя по-
ляризованными молекулами 12. Две ветви буквы V линейны
(отклонение не более 6°), а весь ион плоский (отклонение
~0,1 А). Этот ион, очевидно, не имеет структурной аналогии с
1СЦ-.
В структуре [ЩСгНбЫЬ [4] анионная часть состоит из
двух молекул Ь и, по-видимому, линейного иона 13~ (см. выше).
Наиболее короткое расстояние I—I между этими группами рав-
но 3,435 А, а внутри групп —2,735 и 2,904 А.
Окрашенная в фиолетовый цвет соль состава Csl4 диамаг-
нитна, хотя ион 14~, как имеющий нечетное число электронов,
V
\f? ч ш?
а
\3,63
3,39 А
3,04. 2,83
\3,49А
4, згу
3,49\ /4,32
3'67/ \4,зг
2,92 2,94
' ) 2,67JiP
3,24 "
3,43
2,84 3,03
0^—О—О
Рис. 9.3. Строение высших полииодидных ионов, о—16~ в Ы(СНз)«Ь5
б— V- в Cs2I8; в — I8S- в [(CH2NN4CH3]2I8; г —слои h~ в N(CH8Lh;
д — окружение иона 1~ (заштрихован) в N(CH3Lle; e — W~ в (теобро*
mhhJH2Is. Расстояния в А.
74
Галогены. Бинарные галогениды
должен быть парамагнитным. Рентгеноструктурное исследова-
ние показало [5], что в структуре имеются весьма необычные
плоские группы из восьми атомов иода (рис. 9.3, б). В этом
ионе I8L'~ концевые группы 13 очень сходны с ионами 13~ в три-
иодидах, так что строение этого иона можно представить в ви-
де комбинации двух ионов 13~ и поляризованной молекулы Ь.
Менее компактная, но в целом очень похожая конфигурация
этого иона обнаружена в структуре [(СН2)б^СН3]218 (рис.
9.3>6) [6].
Еще более сложную структуру имеет ЩСНз^Ь [7]. 5/э всех
атомов иода упакованы в довольно плотные слои (рис. 9.3, г),
между которыми располагаются молекулы 12(I—I 2,67 А, близ-
ко к величине в изолированной молекуле иода); катионы также
находятся между слоями в пустотах между молекулами 12. Рас-
стояния I—I в слое составляют примерно 2,9, 3,2 и 3,5—3,7 А,
и способ описания строения слоя в значительной мере зависит
от способа интерпретации этих расстояний. Связи длиной 2,9 и
3,2 А связывают атомы иода в ионы Is", имеющие форму буквы
V, но здесь (в отличие от ионов 15~ в N(CH3Ll5) ион 1~ конце-
вой. Следующее наиболее короткое расстояние I—I в слое,
равное 3,49 А, соответствует объединению двух ионов 1$~ в
замкнутые кольца. Связывание ионов 1~~, лежащих в слое,
с молекулами 12, расположенными между слоями, показано на
рис. 9.3, д.
В кристаллической структуре темно-синего (теоброминJH2Is
[8] атомы иода располагаются центросимметричными группа-
ми по 16 (рис. 9.3, е), причем кратчайшее расстояние между
атомами иода из различных групп составляет 3,84 А (штрихо-
вая линия). Этот ион Ii64~ выделяется в структуре не так отчет-
ливо, как остальные полииодпдные ионы, так как расстояние
3,84 А значительно короче, чем расстояние между слоями в
кристаллическом иоде D,27 А). Это, возможно, связано с на-
личием более сильного связывания, чем только за счет вандер-
ваальсовых сил.
Таким образом, в самом иоде и в полииодидах прослежи-
вается тенденция образовывать компактные плоские слои с рас-
стояниями I—I до 3,5—3,6 А, тогда как более длинные (ван-
дерваальсовы) расстояния между слоями составляют ~4,3 А.
В полииодидах осуществляется взаимодействие между ионами
1~ и легко поляризуемыми молекулами 12 с образованием ио-
нов 13~, 1б~\ 1э2~ и Ig~. По мере увеличения числа атомов иода,
входящих в состав анионов, наблюдается все более слабое
искажение молекул 12, так что в эннеаиодиде связь I—I имеет
обычную длину. Углы между слабыми связями, образуемыми
ионами 1~, близки к 90°, что указывает на участие в связыва-
нии р-орбиталей.
9.6. Галогеноводороды
75
Литература. [1] Helv. Chem. Acta, 1975, 58, 2604. [2] Z. anorg. allg. Chem.,
1977, 432, 5. [3] Acta cryst., 1957, 10, 596. [4] Acta cryst., 1958, 11, 733. fo] Ada
cryst., 1954, 7, 487. [61 Inorg. Chem., 1979, 18, 2416. [71 Acta cryst, 1955, S, 814.
[8]'Chem. Comm., 1975, 677.
9.6. Галогеноводороды и ионы HX2^, Н2Х3~ и др.
Межатомные расстояния (в А) в молекулах галогеноводородов
были определены спектроскопическими методами:
Н—F 0,917 А Н—Вг 1,410 А
Н—С1 1,275 Н—I 1,600
В ряду HF, HC1, НВг и HI физические свойства меняются
не монотонно; HF отличается по свойствам от других соедине-
ний по той же причине, по которой Н2О отлична от H2S, H2Se
и Н2Те. Аномальные свойства HF, а также другие особенности
водородных связей уже обсуждались в гл. 8. Там же рассмот-
рены структуры кристаллических галогеноводородов.
Фтор, хлор и бром образуют ионы типа (X—Н—X)", но в
отличие от устойчивых и хорошо изученных дифторндов щелоч-
ных металлов ионы НС12~ и НВг2~ обнаружены лишь в не-
скольких солях с очень крупными катионами. При попытках
выделить соли, содержащие НС12", из водных растворов полу-
чались гидратированные соединения (например, (C6H5LAsHCl2»
•2Н2О), в которых эти ионы, по-видимому, отсутствуют (см.
ниже). Однако безводный (C6H5LAsHCl2 оказалось возмож-
ным получить из (C6H5LAsCl и безводного HCi [1]. Выясни-
лось, что в ряде соединений, где ранее предполагалось наличие
ионов НС12~, на самом деле их нет. Так, соединение состава
CH3CN-2HC1 представляет собой не (CH3CNH) + (HC12)-,
а солянокислый имин [СН3С(С1) =NH2]+C1^ [2]; в
(С12еп2Со)С1-НС1-2Н2О протон оказался связанным не с двумя
ионами С1~, а с двумя молекулами воды, образуя (Н5О2)~ [3].
Структуры Cs3(Cl3-H3O)HCl2 и соответствующего производно-
го брома, по-видимому содержащие ионы НХ2~ [4], обсужда-
лись в гл. 8.
Более сложные ионы Н2Х3~, H4Xs~ образует только фтор
(гл. 8). О гидратах НС1 см. разд. 15.2.7.
Литература. [1] Inorg. Chem., 1968, 7, 1921. [21 Inorg. Chem., 1968, 7. 2577.
[3] J. Inorg. Nucl. Chem., 1961, 19, 208. Щ Inorg. Chem., 1968, 7, 594.
9.6.1. Гидрид-галогениды металлов. Соли щелочноземельных
металлов состава МНХ (где М=Са, Sr или Ва, Х = С1, Вг или I)
синтезированы сплавлением гидрида МН2 и дигалогенида МХг
или путем нагревания смеси М+МХ2 в атмосфере водорода
при 900 °С [1]. Соединению CaHCl первоначально приписывав
76 9. Галогены. Бинарные галогениды
ли формулу моногалогенида СаС1. Все эти соединения принад-
лежат к структурному типу PbFCl (разд. 10.4.5), но атомы Н
локализовать не удалось. Показано, что соединения, описан-
ные как MgHX (Х = С1, Вг, I), на самом деле представляют со-
бой механическую смесь MgH2 и MgX2 [2].
Фторид-гидриды СаН^Рг-х [3] имеют структуру флюорита
со статистическим размещением атомов; они представляют ин-
терес как ионные проводники.
Литература. [1] Z. anorg. allg. Chem., 1956, 283, 58; 1956, 288, 148, 156. [2]
Inorg. Chem., 1970, 9, 317. [3] J. Solid State Chem., 1979, 30, 183.
9.7. Оксосоединения галогенов
5.7.7. Оксиды. В табл. 9.6 приведены лишь те соединения, для
которых либо имеются количественные структурные данные,
либо на основании КР- и ИК-спектроскопических исследований
и по аналогии с другими молекулами были сделаны выводы о
наиболее вероятной конфигурации частиц.
Таблица 9.6. Оксиды, оксофториды галогенов
F20 [11 C!20 [3] I2O5 [7] C!OF3 [8] BrO3F IOF3 [12] IOF4- [16
BrO3F[l!l IO2F2- [17
F2O2 [2] CiO2 [41 C1O2F3 [9] IOF5 [13] IO2F4- [18
C12O6 [5] C!O3F [10] (IO2F3J [14] CiO2F2+[
C!o07 [6]
(IOF3-IO2F3J [15]
A 1968, 657.
Frans. Fara-
[1] J. Phys. Chem., 1953. 57. 699. [2] См. разд. 11.3.6. [3] J. Chem. Soc,
[4] J. Chem. Soc, A 1970, 46. [5] Сотр. rend. (Paris), 1971, 272C, 1495. [6]
day Soc. 1965, 61, 1821. [7] Acta Chem. Scand.. 1970, 24, 1912. [8] Inorsj. v.,ic,.,., ia,z,
11. 2196. [9] Inorg. Chem., 1973. 12, 2245. Г10] J. Chem. Soc, A 1970, 872. [HI Inorg
Chem., 1970, 9, 622. [12] J. Fluorine Chem., 1974, 4, 173. A31 Inorg. Chem., 1976 15 3009
[14] Chem. Comm., 1977, 519. [15] J.. Chem. Soc, D 1980, 481. [16] Acta cryst, 1972'
B28, 979. [17] J. Chem. Phys.. 1976, 64, 3254. [18] J. Inorg. Nucl. Chem., Suppl., 1976 91
[19] Inorg. Chem., 1973, 12. 1356.
Согласно данным электронографии и спектроскопии, F2O и
С12О имеют сходное строение (а и б); на основании микровол-
новых спектров для СЮг получена структура в. С1О2 представ-
ляет особый интерес в связи с тем, что молекула содержит не-
четное число электронов. По строению молекула С1О2 очень
похожа на SO2. Соединение С12О4 описано как перхлорат хло-
ра СЮСЮз. Согласно спектроскопическим исследованиям, для
твердого С12О6 предполагается ионное строение (С1О2) + (С1О4)-.
Структура молекулы С12О6 не известна. Для молекулы С12О7
установлена заслоненная конфигурация (г).
Пентаоксид иода (ангидрид йодноватой кислоты) представ-
ляет собой твердое белое вещество, устойчивое до 300 °С. Кри-
9.7. Оксосоединения галогенов 77
сталл состоит из молекул {д), образованных двумя пирами-
дальными группами Юз, соединенными через атом кислорода,
однако, как и в других оксосоединениях иода, имеются допол-
нительные связи промежуточной длины, причем наиболее силь-
ными из них B,23—2,72 А) связаны концевые атомы кислоро-
да. Двум другим оксидам иода (оба желтые порошки) припи-
сывают формулы ЬО., и 14О9, хотя существование второго со-
единения вызывает сомнения [Acta Chem. Scand., 1968, 22,
F p'
¦1,41 8 к/ 1.70А У ' I 47 Л /°
103,2"
Cl
ClQ 117,5°
4o
из-
Cl
1,71 A
\
¦ 1,405 A 0
Cl
о
\ /
о о
2
о
3309]. Ввиду диамагнетизма 12О4 исключается наличие в нем
молекул Юг, но существование молекул 12О4 пока не доказано.
При масс-спектрометрическом исследовании не было получено
данных о существовании молекул I2O7.
9.7.2. Оксофториды. Оксофторидные ионы. Строение большинст-
ва подобных молекул согласуется с «правилом» 8я+2т (разд.
7.3). Молекулы XOF2 (Х = С1, Вг, I) и ион C1OF2+, содержащие
по 26 электронов, предположительно имеют пирамидальное
строение (подобно SF2O), тогда как молекулы типа CIO3F
C2 электрона)—тетраэдрическое (е). Молекула BrO3F имеет
следующие параметры: Вг—О 1,582 А, Вг—F 1,708 А; О—Вг—О
114,9°, F—Вг—О 103,3°. Колебательный спектр (C102F2) + (PtF6)-
весьма сходен со спектром SO2F2. 34-электронные молекулы
XOF3 (X = C1, I) имеют строение, аналогичное SF4, причем
атом О занимает одну из экваториальных позиций. Сходное
строение имеет ион IO2F2"", у которого в экваториальных поло-
жениях находятся два атома О и неподеленная пара электро-
нов (подробнее см. разд. 9.7.4,5). В 40-электронной молекуле
C1O2F3 третье экваториальное положение занято одним из ато-
мов фтора. Ион IOF4~ представляет собой 42-электронную груп-
пу; он имеет квадратно-пирамидальное строение и более по-
дробно описан ниже (разд. 9.7.4, д). В молекуле IOFs (ж) и ио-
ле IO2F4~ (обе частицы содержат по 48 электронов) шесть свя-
78
9. Галогены. Бинарные га.югениды
зей направлены к вершинам октаэдра, причем для IO2F4~ из-
вестны цис- и гракс-формы.
В противоположность простой молекулярной структуре
C1O2F3, упомянутой выше, IO2F3 в кристаллическом состоянии
образует димеры (з); по-видимому, это связано с тем, что
атом I в высшей степени окисления стремится к октаэдрическо-
му окружению.
1,811 А
1,74 Л
1.80А F 1.94А F
В структуре (IOF3-IO2F3J половина атомов I имеет окта-
эдрическую координацию; остальные атомы I образуют три бо-
лее сильные и две более слабые связи. Кристаллическая струк-
тура состоит из циклических «молекул» (к). Мостики I—О—I в
восьмичленном кольце несимметричны, что позволяет предста-
вить соединение и другой формулой— (IOF2) + (IO2F4)~. Ионы
7.5ОЛ
;,27А
1,85 А
1,83 А
соединены друг с другом слабыми связями I—О длиной 2,27 А,
тогда как в пределах ионов эти расстояния равны 1,76 и 1,80 А.
9.7.3. Оксокатионы. Получены соли, содержащие катионы
СЮ2+ [1], ВгО2+ [2] и Ю2+ [3] с одним и тем же анионом
AsF6~. ИК-спектроскопические исследования подтвердили, что
соединение, получаемое из IO2F и AsF5, в твердом состоянии
имеет ионное строение. Фторосульфат иодила получен в виде-
гигроскопичного порошка, устойчивого вплоть до 100 °С [4]_
Однако строение ионов ХО2+ пока не известно.
9.7. Оксосоединения галогенов 79
Литература. \Ц Inorg. Chem., 1969, 8, 2489. [2] Angew. Chem., 1976, 88, 189.
[3J Inorg Chem, 1965, 4, 257. [4] Inorg. Chem., 1964, 3, 1799.
97 4 Оксокислоты и оксоанионы. По устойчивости оксокислот
галогены сильно различаются между собой. Существование
единственной оксокислоты фтора окончательно не установлено;
все три других галогена С1, Вг и I способны давать оксоанио-
ны типов ХО-, ХО3- ХО4" (табл. 9.7). Структурные исследова-
ния выполнены для НОС1, НОВг, а-НЮ3, НС1О4-Н2О, Н5Ю6 и
Н13О8.
Таблица 9.7. Строение оксоионов галогенов типа ХОП
хо,-
уголковый
сю,-
iBrOr)
хо-
пирамидаль-
ный
сю3-
ВгО3-
Юз-
ХО4~
тетраэдри-
ческий
сю4-
ВгО4~
ю4-
хо53-
квадратно-
пирампдаль-
н ы И
ю53-
хо65-
октаэдри-
ческий
Юв5-
а. Кислоты НОХ. До последнего времени не были известны
ни HOF, ни ее соли. Вслед за идентификацией HOF в низкотем-
пературных матрицах ее удалось получить в миллиграммовых
количествах при пропускании тока F2 под пониженным давле-
нием через воду при 0 °С с последующим вымораживанием в ло-
вушке при —183 °С.
Все кислоты НОХ малоустойчивы. За исключением HOF,
все они получены только в виде растворов, хотя НОС1 и НОВг
образовывались при фотолизе смесей Аг—НХ—О3 при 4 К и в
дальнейшем исследовались ИК-спектроскопически в Аг-матрице
[1]. HOF имеет достаточно большое время полураспада E—
60 мин); это позволило провести изучение микроволновых
спектров газа при комнатной температуре [2]. Установлено
следующее строение (длина связи О—Н равна 0,96 А):
Соответствующие соли (следовательно, и строение ионов
не известны.
б. Кислоты НХО2 и их соли. До сих пор нет убедительных
доказательств существования кислот НХО2 (X = F, Вг или I),
а из солей этих кислот были получены только ЫВгО2 и NaBrO2
[3]. Предполагается, что LiBrO2 образуется при взаимодейст-
вии в сухом состоянии LiBr и LiBrO3; NaBrO2 можно выкри-
80
Р. Галогены. Бинарные галогениды
сталлизовать из раствора, содержащего NaOH и Вг2. Чистая
хлористая кислота НС1О2 не выделена; однако при обработке
ее бариевой соли серной кислотой получают бесцветный рас-
твор, который даже при 0°С быстро желтеет из-за образования
С1О2 (и С12).
Строение хлорит-иона исследовано для солей с несколькими
катионами (Na, NH4, Ag, Zn) [4]. Эти исследования показали,
что расстояние С1—О составляют -—-1,56 А, углы О—С1—О
108°, хотя для Zn(C102J-2H20 получены значения 1,59 А и
111,4° [5]. Здесь, возможно, уместно заметить, что введение
поправки на тепловые колебания атомов в отдельных случаях
может приводить к увеличению вычисленного межатомного
расстояния на ~0,02 А.
в. Кислоты НХОъ и их соли. Свойства кислот в ряду НС1О3,
НВгОз и НЮз меняются не монотонно, что видно из сравнения
их теплот образования (—100, 52 и 234 кДж/моль соответст-
венно). Йодноватая кислота наиболее устойчива, тогда как
растворы НСЮз и НВгО3 могут быть сконцентрированы (в ва-
кууме) лишь до содержания 50 мол. %; концентрирование вода-
ных растворов НЮ3 приводит к кристаллизации кислоты»
В разбавленных растворах НЮ3 ведет себя как довольно силь-
ная одноосновная кислота; в то же время измерения темпера-
тур замерзания и электропроводности концентрированных рас-
творов интерпретированы в предположении наличия в них бо-
лее сложных ионов или, возможно, прохождения диссоциации
основного типа на Юг+ и ОН" [6].
Кристаллическая а-НЮ3 [7] состоит из пирамидальных мо-
лекул (а), соединенных друг с другом водородными связями
(см. гл. 8). Среднее значение угла между связями О—I—О рав«
0
i,80A
98" q
1,90 A
en
a
°\
97
',: ,0
/""93'-
6
1,97 A
¦• i:"'
/°
,79 A
но 98°, еще три атома кислорода, дополняющих координацию?
атома I до искаженной октаэдрической, находятся на расстоя-
ниях 2,45, 2,70 и 2,95 А.
Кристаллическая структура так называемой ангидроиоднова-
той кислоты Н13О8, образующейся при дегидратации НЮ3 при
110 °С, свидетельствует о том, что это — аддукт НЮ3 и hOs,
связанных водородным мостиком между группой ОН из НЮ3 и-
атомом О из I2O5 [8]. Длины связей в пирамидальной молеку-
ле НЮз, кристаллической сс-Н103, а также в неплоской молеку-
9.7. Оксосоединения галогенов 81
ле I2O5 близки (б). Последняя состоит из двух пирамидальных
групп Юз, соединенных через общий атом кислорода.
Рентгенографическим исследованием кристаллов солей уста-
новлено, что ионы ХО3~ имеют пирамидальную конфигурацию
(табл. 9.8). В структурах кристаллических иодатов атом I
обычно имеет еще 3 соседа (на расстояниях 2,6—3,2 А), допол-
няющих координацию до октаэдрической, искаженной за счет
неподеленной пары, хотя в ряде случаев обнаружено менее
симметричное окружение с 2 или 4 дополнительными атомами.
Обзоры по этим структурам цитируются в табл. 9.8. (Ранние
Таблица 9.8. Строение ионов ХО3~
Ион
С1О3-
ВгОз-
ю,-
Расстояние
X—О, А
1,49
1,65
1,81
Угол О—X—О,
град
107 1
104 )
100
Литература
Acta cryst., 1977, ВЗЗ,
2698, 3601
Acta cryst., 1980, В36,
2130
работы по структурам ТПО3 и одной из трех модификаций
LiIO3, согласно которым атому иода приписывалось окружение
6 соседями на равных расстояниях, по-видимому, ошибочны.)
Связи I—ОН значительно длиннее, чем I—О (табл. 9.8), на-
пример в НЮз (а). В структуре КН(Ю3J обнаружено три ти-
па связей иод — кислород: I—O 1,78 А, I—ОН (донор) 1,93 А
и I—O...H (акцептор) 1,87 А [9].
г. Кислоты HXOi и их соли. По устойчивости своих кислот
НХО4 галогены различаются еще больше. Хлор образует НСЮ4
и перхлораты. Перброматы не были известны до 1968 г., когда
путем окисления бромата фтором в щелочном растворе удалось
получить КВгО4. Периодная кислота обычно выделяется при
упаривании ее растворов в виде Н5Ю6. Установлено, что при на-
гревании до 100 °С в вакууме Н5Ю6 переходит в НЮ4; при
80 °С в качестве промежуточного продукта образуется Н412Од.
Необычно протекает разложение йодной кислоты: при нагрева-
нии НЮ4 ангидрид не получается (по-видимому, 12О7 не суще-
ствует), вместо этого выделяется кислород и образуется НЮ3.
В то время как все перхлораты имеют формулу М(СЮ4)П, со-
став периодатов зависит от температуры кристаллизации и кис-
лотности раствора. Так, при окислении NaIO3 хлором в щелоч-
ном растворе получается раствор Na2H3IO6, из которого можно
путем добавления AgNO3 выделить ряд периодатов серебра,
6—985
Ф2 9 Галогены. Бинарные галогениды
в том числе AgIO4> Ag3IO5, Ag2HIO5, Ag5IO6 и Ag2H3IO6. Сле-
дует, однако, заметить, что в тех случаях, когда соединения
являются гидратами, этими формулами следует пользоваться с
осторожностью (см. ниже).
Строение молекулы НСЮ4 в газовой фазе исследовано
электронографически [10]; оказалось, что наблюдается анало-
гия с C1O3F (разд. 9.7.2): С1—О 1,41 А; С1—ОН 1,64 А;
О—С1—О 113 и 117°.
Ионы ХО4~ имеют тетраэдрическую конфигурацию, причем
длины связей почти такие же, как в ионах ХО3~: С1—О 1,43 А
[11], Вг—О 1,61 А [12] и I—O 1, 78 А [13]. В структуре NaIO4
анион представляет собой слегка сплющенный тетраэдр; два уг-
ла О—I—О равны 114°, а четыре угла— 107°.
Для иода (VII) известен ион Ю53~, промежуточный между
Ю4~ и Юб5-; его строение исследовано в соли К3Ю5 [14]. Уста-
новлена квадратно-пирамидальная конфигурация с расстояни-
ем I—О 1,77 А и углом О—I—О между апикальным и экватори-
альными атомами кислорода 95° (см. обсуждение структур с
40-электронными группами в разд. 7.3.4, г). Сходное строение
имеют ионы ReO53~, OsO53~ и ТеО53~.
д. Периодаты с октаэдрическим окружением атома иода.
Из галогенов только иод способен к октаэдрической координа-
ции атомами кислорода. Кристаллическая Н5Ю6 состоит из
почти правильных октаэдрических молекул Ю@НM, соединен-
ных между собой водородными связями О—Н—О (по десять у
каждой молекулы) в трехмерный каркас. Длина связей состав-
ляет: 1—0 1,78 А, I—ОН 1,89 А, О—Н 0,96 А [15]. Ион
Юз(ОН)з2~ присутствует в таких солях, как Cd[IO3(OHK] •
• ЗН2О [16] и [Mg(H2ON][IO3(OHK] [17]. В этом ионе (а)
длины связей равны: I—О 1,86 А, I—ОН 1,95 А. О строении
(NH4JH3IO6 см. разд. 8.5.3, е. Похоже, что многим «гидрати-
рованным периодатам» первоначально приписывали неправиль-
ные формулы (ср. с боратами, гл. 24). Например, уже упомя-
нутую соль кадмия сначала идентифицировали как Cd2H2l2O10-
• 8Н2О по аналогии, по-видимому, с К.4Н212Ою-8Н2О. В свою
очередь калиевую соль, получаемую из растворов КЮ4 в кон-
центрированном КОН, описывали как КгНЮб^НгО и К412Од-
•9Н2О. В действительности в структуре соли имеются ионы,
состоящие из двух октаэдрических групп Ю5@Н), соединенных
по ребру (б). Атомы водорода не локализованы, но их поло-
жение следует из того, что все связи, отмеченные на схеме б
буквой а, имеют длину 2,00 А, тогда как остальные расстоя-
ния I—О (концевые) равны 1,81 А [18]. При дегидратации
К4Н212Ою-8Н2О или путем кристаллизации из раствора выше
78 °С получают соль КЦЬОд, анионы которой состоят из двух
октаэдров Ю6, имеющих общую грань {в) [19].
9.7. Оксосоединения галогенов
Простой октаэдрический ион Ю65~, вероятно, присутствует
в безводных солях М51О6. Подобно ТеО66~, этот ион способен
стабилизировать высшие степени окисления металлов (напри-
мер, Ni(IV), Cu(III)). В структуре KNiIO6 [20] атомы К, Ni
и I занимают все октаэдрические пустоты в несколько иска-
женной гексагональной плотнейшей упаковке атомов О (I—О
-1,85 А).
/. PCS A
На примере трех ионов, образованных иодом (V), можно
проиллюстрировать стереохимию атома с неподеленной парой
электронов, связанного соответственно с 3, 4 и 5 лигандами
(валентные группы 2, 6, 2,8 и 2,10). Расположение 4, 5 и 6 пар
электронов является соответственно тетраэдрическим, триго-
нально-бипирамидальным и октаэдрическим.
Соль КСгЮ6, получаемая в водном растворе из К2СГ2О7 и
НЮз, содержит в структуре ионы г, состоящие из тетраэдрнче-
ской группы СгО4, соединенной через атом О с пирамидальной
группой Ю3 [21]. Фтороиодат калия KIO2F2, получаемый дей-
ствием HF на КЮз, содержит в структуре ионы, имеющие сле-
дующее строение: четыре связи направлены к четырем верши-
нам тригопалыюй бипирамиды, а одно экваториальное положе-
ние занято неподеленной парой (д). Плоскость связей I—О пер-
пендикулярна оси F—I—F, а угол О—I—О уменьшен до 100°
[22]. В анионе соли CsIOF4 [23] лнганды располагаются в пя-
ти вершинах октаэдра (е), причем атом I находится несколько
ниже основания квадратной пирамиды (в отличие от иона
Ю53~). Изоэлектронная молекула XeOF4 имеет структуру того
же типа, однако угол F—Хе—О составляет 91,8° (см. литера-
туру, цитируемую в табл. 8.6).
9. Галогены. Бинарные галогениды
9.9. Кристаллические галогениды 85
Литература. [1] J. Am. Chem. Soc, 1967, 89, 6006. [2] J. Chem. Phys., 1972, 56,
1. [3] Сотр. rend. (Paris), 1965, 260, 3974; Z. anorg. allg. Chem., 1970, 372, 127.
|4] Acta cryst., 1976, B32, 610. [51 Acta cryst., 1979, B35, 2670. [6] Quart. Rev.
Chem Soc. 1954, 8, 123. [71 Acta cryst., 1049, 2, 128. [81 Acta crysl., 1966, 20,
769. [9] Acta cryst., 1977, B33, 2795. [10] J. Chem. Soc, A 1970, 1613. [11] Acta
cryst., 1977, B33, 2913. [12| Inor?. Chcni.. 1969, 8, 1190. [131 Acta cryst., 1970,
B26, 1782. [141 Z. anorg. allg. Chem., 1975, 411, 41. [151 Acta cryst., 1966, 20,
765. [161 Acta cryst., 1970, B26, 1069. [17] Acta cryst., 1970, B26, 1075. [18] Acta
cryst., 1965, 19, 629. [191 Z. anorg. allg. Chem., 1968, 352, 301. [20f Acta Chem.
Scand., 1966, 20, 2886. [21] Acta Chem. Scand., 1967, 21, 278!. [22] J. Chem.
Phys., 1976, 64, 3254. [231 Лс*а cryst., 1972, B28, 979.
9.8. Галогениды металлов
*¦>
При обычных температурах большинство галогенидов металлов
представляет собой твердые тела; при этом лишь немногие из
них имеют в кристаллическом состоянии молекулярное строе-
ние. В связи с тем что при плавлении и испарении галогени-
дов образуются молекулы или ионы конечных размеров, для со-
ставления исчерпывающего обзора необходима структурная
информация о твердом, жидком и газообразном состояниях
этих веществ. Однако большая часть данных относится к твер-
дому состоянию; кратко будут приведены сведения о строении
этих соединений и в других агрегатных состояниях.
Галогениды металлов образуют очень большую группу со-
единений. Это вызвано следующими причинами:
а) На четыре галогена (не считая астата, данные о кото-
ром скудны, см. разд. 9.1), приходится <~80 металлов, кроме
того, большинство переходных металлов и многие металлы
главных подгрупп дают с одним и тем же галогеном более од-
ного соединения, например хром образует пять фторидов от
CrF2 до CrF6 (а также Cr2F5, см. ниже); кроме того, в парах
при взаимодействии CrF2 и Сг в ячейке Кнудсена были обна-
ружены молекулы CrF. Получены следующие иодиды ниобия:
Nb6ln, Nb.-Js, Nbl3, Nbl4 и Nbl5. Галогенид металла может иметь
несколько кристаллических модификаций; вообще полиморфизм
галогенидов — довольно обычное явление.
б) Помимо твердых растворов двух или более галогенидов
и полигалогенидов (в которых атомы галогена соединены друг
с другом в полигалогенидный ион, см. ранее в этой главе) из-
вестны галогениды металлов, содержащие в своем составе бо-
лее одного вида галогена. О структуре этих соединений пока
известно не слишком много, но, по-видимому, они образуют
свои структурные типы. Некоторые из них являются ионными
(например, SrCIF, BaCIF и BaBrF) [1], другие имеют молеку-
лярное строение (TiClF3, TiCl2F2, WC1F5 и т. д.). Галогениды
металлов V группы по крайней мере в некоторых случаях мо-
гут существовать либо в виде жидкости или легкоплавких кри-
сталлов молекулярного строения, либо в виде ионных кристал-
лов [2] (аналогия с соединениями фосфора). Так, известны
жидкий SbCl2F3 и кристаллический (SbCl4) (SbF6), молекуляр-
ный NbCl4F и ионный (NbCl4)F. Смешанные галогениды, та-
кие, как UC1F3, возможно, по строению близки к соответству-
ющим фторидам.
в) Кроме обычных галогенидов МХ„ известны галогениды,
имеющие следующие особенности строения:
1) атомы металла присутствуют в двух различных степе-
нях окисления; соответственно сильно различается координа-
ционное окружение атомов металла, но формула соединения
отвечает простой стехиометрии. В качестве примеров можно
привести Ga'GaH'CU (GaCl2), PdIIPdIIIF6 (PdF3) и Cr2F5 [3]
(разд. 5.3.5);
2) в фазе, имеющей область гомогенности, также могут на-
ходиться атомы металла в двух степенях окисления. В окра-
шенных галогенидах, промежуточных по составу между SmF2 и
SmF3 [4] (кубический SmF2,0o-2,i4, тетрагональный SmF2,35,
ромбоэдрический SmF2,4i-2,46), происходит постепенное замеще-
ние в исходной флюоритной структуре ионов Sm2+ на Sm3+ с
одновременным внедрением соответствующего количества ио-
нов F~.
3) Возможно связывание металл — металл. В этом случае
средняя степень окисления необычно низкая; она может быть
целочисленной (BiBr (разд. 20.2), ScCl, ZrCI, Zrh) или не яв-
ляется таковой (Ag2F, Nb3Cl8). Строение некоторых «субгалоге-
нидов» с кластерной структурой будет рассмотрено ниже в
разд. 9.10.3 и 9.10.4.
Литература. [11 J. Chem. Phys., 1968, 49, 2766. [2] Z. anorg. allg. Chem., 1964,
329, 172. [3] Acta cryst., 1964, 17, 823. [41 Inorg. Chem., 1970, 9, 1102.
9.9. Строение кристаллических галогенидов МХП
Для строения галогенидов металлов справедливы два обобща-
ющих положения. Во-первых, фториды отличаются по структу-
ре от других галогенидов данного металла, за исключением слу-
чаев молекулярных галогенидов (например, кристаллические
SbF3 и SbCl3 имеют молекулярное строение) и галогенидов ще-
лочных металлов, образующих кристаллы с преимущественно
ионным типом связи. Очень часто фторид металла имеет трех-
мерную каркасную структуру, тогда как хлорид, бромид и ио-
дид образуют кристаллы, состоящие из слоев, а иногда и це-
пей. (Исключением из этого правила среди галогенидов
МХ3—МХ6 являются в основном фториды; см. табл. 9.9). Во-
аторых, многие фториды изоструктурны оксидам той же сте-
86
9. Галогены. Бинарные галогениды
9.9. Кристаллические галогениды 87
Фор-
мула
MX
мх2
МХ3
мх4
MX
мх6
Таблица 9.9. Кристалличес
КЧ
атома
М
4
6
8
4
4
6
6
7
7+2
8
6
7+2
9
6
8
8
8
Трехмерные
Динковая об-
манка, вюрт-
иит
NaCl
CsCl
Структуры типа
кремнезема
Znl,
Зутил
СаС12
Srl2, Eul2
PdCl2
Флюорит
ReO3 и сходные
структуры
(табл. 9.16)
LaF3
YF3
UC13
IrF4
ZrF4
UCI4
p-UFs
KM
атома
M
5-r2
4
4
6
6
6
8+1
6
7
8
<ая структуре
Слоистые
ГЦ (желт.)
Hgl2
краен.)
Hgl2
оранж.)
Cdl2
:dci2
Thl2
YCI3
3il3
PuBr3
PbF4
'JBr4
ГЫ4
1 галогенидов металлов
КЧ
атома
М
2
3
3
4
4
4
6
5
6
6
6
6
6
6
7
Цепочеч-
ные
Aul
SnC12
GeF2
ВеС12
PdCl2
AuF3
Zrl3
TeF4
cx-NbI4
Zrl4, Hfl
TcCl4
ReCl4
BiF5
CrF5
PaCl3
КЧ
атома
M
2
4
4
3
4
4
4
4
5
6
6
6
Молеку-
лярные
HgCI2
PteCl12
Pd0Cl12
SbF3
A12C16
Au2Cle-
SnBr4
Snl4
SbCl5
Nb2Clw
•Mo4F20
IrF6
к ионным кристаллам и характеризующихся высокой симмет-
рией:
хиометрии, а хлориды, бромиды и иодиды по структуре часто*
схожи с сульфидами, селенидами и теллуридами. Это видно из.
следующих примеров:
FeF2
PdF2
SnO2
FeCl2 слоистая структура
структурный pdc, цепочечная структура (и
тип рутила гексамер)
SnS2 слоистая структура
Как видно из табл. 9.9, среди галогенидов металлов встре-
чаются примеры всех четырех основных типов структур — трех-
мерных (каркасных), цепочечных, слоистых и молекулярных.
Большая часть галогенидов MX, MX2 и МХ3 имеет структуры,,
указанные в табл. 9.9 слева (от жирной линии). Большин-
ство моногалогенидов и фторидов MF2 и MF3 кристаллизуются
в одном из структурных типов, относящихся (но не всегда)
Структурный тип
Окружение
Окружение
X
MX
мх2
MX;
XaCl
CsCl
TiO2 (рутил)
CaF2 (флюорит)
ReO3
Октаэдр
Куб
Октаэдр
Куб
Октаэдр
Октаэдр
Куб
Треугольник
Тетраэдр
Гантель
Эти и большая часть других структур, вошедших в табл. 9.9,
уже рассматривались в гл. 3—6. Здесь мы уделим особое вни-
мание структурам, которые еще не были описаны, причем рас-
положение материала от MX до МХ6 будет следовать шести де-
лениям таблицы по горизонтали; мы коснемся также структур
двух известных гептагалогенидов металлов.
9.9.1. Моногалогениды. а. Галогениды щелочных металлов. При
обычных температурах все галогениды щелочных металлов
кристаллизуются в структурном типе NaCl, за исключением
CsCl, CsBr и Csl, имеющих структуру типа CsCl. Для данного
галогенида соли, построенные по типу CsCl, имеют более высо-
кую плотность, чем те, которые построены по типу NaCl, и под
давлением соли Na, К и Rb также переходят в модификации со
структурой CsCl; подобных структурных изменений для солей
лития не происходит [1]. Обратный переход «CsCl»—>-«NaCl»
имеет место при нагревании CsCl до 469 °С, но у CsBr и Csl
такой переход не наблюдается по крайней мере вплоть до тем-
ператур на несколько градусов ниже, чем температуры плавле-
ния [2]. Однако все галогениды, кристаллизующиеся при обыч-
ных условиях в структурном типе CsCl, могут быть «выраще-
ны» со структурой NaCl из пара на подходящей подложке
(NaCl, KBr) [3]. Межионные расстояния для галогенидов Cs
и Т1 приведены в табл. 9.10 (При 90 К Lil переходит в модифи-
кацию с ГПУ-структурой [4]).
б. Галогениды меди [5] (за исключением CuF, который при
обычных температурах не выделен в достаточно чистом виде)
кристаллизуются в структурном типе цинковой обманки. CuCl,
CuBr и Cul претерпевают превращение в модификации со
структурой вюртцита при температурах 435, 405 и 390 °С соот-
ветственно. CuBr и Cul при более высоких температурах испы-
тывают дальнейшее превращение.
88 9. Галогены. Бинарные гадогениды
9.9. Кристаллические галогениды 89
в. Галогениды серебра [5] AgF, AgCl и AgBr (a Agl —под
давлением) кристаллизуются в структурном типе NaCl. В обыч-
ных условиях Agl имеет структуру цинковой обманки или
вюртцита, причем первая, по-видимому, метастабильна. При
145,8 °С Agl переходит в высокотемпературную модификацию,
обладающую очень высокой ионной проводимостью A,3 Ом/см-
при 146 °С). В этой модификации осуществляется ОЦК-распо-
ложение атомов иода, так что каждый атом I имеет только 8
соседних атомов I вместо 12 в низкотемпературной модифика-
ции. Совокупность рентгенографических, данных по электриче-
ской проводимости и самодиффузии указывает на то, что ионы
Таблица 9.10. Расстояния между ионами (в А)
в кристаллических галогенидах цезия и таллия
Галогенид
CsCl
CsBr
Csl
Т1С1
TIBr
Til
Тип решетки
NaCl
3,47
3,62
3,83
3,15
3,29
3,47
CsCl
3,56
3,72
3,95
3,32
3,44
3,64
серебра свободно перемещаются по позициям с 2, 3 и 4-кратной
координацией между легкодеформируемыми атомами иода. Су-
ществуют по крайней мере три модификации высокого давле-
ния, одна из которых соответствует структурному типу NaCl
(расстояние Ag—I 3,04 А, ср. с 2,81 А в структурах типа ZnS)
[6].
г. Галогениды золота. Структурная информация имеется
только для Aul, который состоит из цепочечных молекул сле-
дующего строения [7]:
Аи'
I
72° Аи 2,62 A
д. Моногалогениды металлов IIIБ группы. Моногалогениды
галлия, кроме Gal (гл. 26), известны только в газовой фазе;
мало сведений имеется также о InF. Данные о структурах
остальных моногалогенидов этих элементов сведены в табл.
9.11. У InCl ниже 390 К устойчива желтая модификация, а вы-
ше этой температуры — красная. Красные InCl, InBr, Inl и
желтый T1I имеют слоистую структуру (ВЗЗ), показанную на
рис. 6.1. В структуре ТП ближайшие соседи атома таллия: один
I 3,36 А, четыре I 3,49 А, два I 3,87 А и два Т1 3,83 А. В табл.
9.11 помещены также две структуры с различным искажением
структурного типа NaCl. В структуре желтого а-1пС1 имеется
четыре типа неэквивалентных ионов 1п+ (и С1~). Подробное
рассмотрение строения групп 1пС16 (и СПп6) показывает [8],
что в них осуществляются два из трех основных типов искаже-
ния октаэдрических групп, содержащих ион с конфигурацией
(nsJ. Неподеленная пара электронов может быть направлена
вдоль оси 4, 2 или 3-го порядка. Первый тип искажения наиме-
нее вероятен, так как в этом случае неподеленная пара направ-
лена к лиганду, но это состояние стабилизируется при удале-
Таблица 9.11. Кристаллическое строение (структурные типы)
моногалогенидов индия и таллия
Галогевид
InX
T1X
? и
[4]
F
NaCl
(искаж.)
NaCl
[11
CsCl
Cl
(искаж.)
, ТП
Вг
ТП Г2]
CsCl
ТП
ТП
I
[31
и CsCl
[1] Acta cryst., 1978, В34, 3333. [2] Austral. J. Sci. Res., 1950, ЗА, 581. [3] Acta
Cryst., 1955, 8, 847. [4] J. Chem. Soc, D 1974, 1907.
нии лиганда и замене его на другие, занимающие меньше про-
странства, что имеет место в желтом ТП. Направление неподе-
ленной пары вдоль оси 2-го порядка к середине ребра октаэдра
вызывает удлинение последнего; если же электронная пара
расположена вдоль оси 3-го порядка искажение октаэдра со-
провождается увеличением размера одной из его граней.
В структуре а-InCl наблюдаются искажения второго и третьего
типов; расстояния In—Cl (усредненные) равны (в А):
In,
Inn
1пш
Iniv
2,93 (два), 3,26 (два), 3,48 (два); второй тип
2,91 (три), 3,50 (три); третий тип
Существуют две модификации T1F. Есть некоторые сомнения
в правильности определения структуры тетрагонального T1F.
Ромбический T1F с сильно искаженной структурой типа NaCl
содержит двойные слои. Имеется два типа ионов Т1+, координа-
ция каждого из которых — сильноискаженная октаэдрическая,
причем 4 соседа (F~) находятся ближе, чем 2 остальных; TU—F:
2,54, 2,62, 2,79 (два), 3,25, 3,50 А; Т1„—F: 2,25, 2,52, 2,67 (два),
о,07 и 3,90 А. Четыре ближайших соседа расположены с одной
90
9. Галогены. Бинарные галогениды
9.9. Кристаллические галогениды 91
стороны от иона Т1+, а наиболее длинные связи соответствуют
расщеплению структуры типа NaCl на двойные слои, в преде-
лах которых ион Т1+ имеет четырех ближних и одного более
удаленного соседа. Строение слоя почти такое же, как в желтом
РЬО. Под действием высокого давления Т1С1, TIBr и ТП стано-
вятся проводниками с металлическим типом проводимости.
Уменьшение объема ТП под давлением 160 кбар очень велико
C3%) [9].
Остальные известные моногалогениды представлены гало-
генидами элементов IV группы HfCl и ZrCl*, а также единст-
венным соединением элемента VIII группы Osl.
Литература, fl] J. Chem. Phys., 1968, 48, 5123. [21 J. Am. Chem. Soc., 1955. 77,
2734. f31 Acta cryst., 1951, 4, 487. [4] Z. Phys., 1956, 143, 591. [5] Acta crvst.,
1964, 17, 1341; J. Phys. Chem., 1964, 68, 1111. [61 J. Chem. Phys., 1968," 48,
2446. [71 Z. Kristallogr., 1959, 112, 80. [8] J. Solid State Chem., 1980, 34, 301.
[9] J. Chem. Phys., 1965, 43, 1381.
9.9.2. Дигалогениды. Удобно разделить эти соединения на пять
групп.
а. Тетраэдрические структуры. Сюда следует отнести BeFg
со структурами кремнезема (низко- и высокотемпературные мо-
дификации кристобалита и кварца) и цепочечную структуру
ВеС12 (имеющего 3 модификации). Модификация с цепочечной
структурой типа
устойчива в температурном интервале 403—425 °С (т. пл.), но
ее можно получить и при закаливании расплава, и путем суб-
лимации [1]. Строение ВеВг2 и Ве12 неизвестно.
Кристаллохимия ZnCl2 более сложная, чем это кажется на
первый взгляд. Первоначально были описаны 3 полиморфные
модификации [2], две из которых характеризуются трехмерным
каркасом тетраэдров со связыванием через вершины, а третья
кристаллизуется в структурном типе красного Hgl2 (разд.
5.2.1). Все модификации основаны на приблизительно плотней-
шей упаковке атомов С1 и имеют следующую последователь-
ность слоев: а—АВС...; 0—АВАС.(гк); у—ABC.... Имеются
данные [3], что структура ZnCl2 очень чувствительна к присут-
ствию воды. При тщательном исключении доступа влаги при
кристаллизации образуется ромбическая модификация с ГПУ
(АВ...), которая на воздухе переходит в одну из вышеописан-
ных структур. Возможное объяснение этого заключается в том,
* К тому же или близкому структурному типу (ZrBr) относятся некото-
рые моногалогениды редкоземельных элементов; см. табл. 9.24. — Прим. перев.
что на самом деле ГПУ — единственная устойчивая форма без-
водного ZnCl2, а в присутствии ионов ОН~ происходит перерас-
пределение слоев. Во всех четырех структурах тетраэдры
ZnCU связаны с другими тетраэдрами через 4 общие вершины.
Особая структура у иодида цинка [4]. Четвертая часть тет-
оачдрических пустот в КПУ атомов иода занята атомами цин-
ка, так что группы по четыре тетраэдра образуют «супер-тет-
раэдры» Zn4lio (разд. 5.2.1). Эти группы соединены между со-
бой через 4 общие вершины, образуя 3-мерную структуру. По-
хожие группировки содержит также и слоистая структура
оранжевого Hgl2 (разд. 26.3.3, а).
Литература. [11 J. Phys. Chem., 1965, 69, 3839. [21 Z. Kristallogr., 1961, 115,
373. [3] Inorg. Chem., 1978, 17, 3294. [4] Acta Chem., 1978, B34, 3160.
б. Октаэдрические структуры (галогениды Mg и Зй-метал-
лов). Сведения о строении галогенидов этих металлов с радиу-
сом, близким к 0,7 А, сведены в табл. 9.12. Два типа структур
R* и R**, производных от структуры рутила, сильно отличают-
ся друг от друга, как это было показано в гл. 6. В CrF2 (и в
изоструктурном ему CuF2) атомы металла имеют координ?"
Таблица 9.12. Кристаллическое строение (структурные типы)
дигалогенидов магния и металлов 4-го периода
си
Вг2
Mg
R
С
I
I
Ti
I
I
I
V
R
I
I
I
Ст
R*
R** Г
1 . 1
I*
I*
Мп
Ra
С
I
I
Fe
R
С
I
I
Со
R
С
С/1
I
№
R
С
I
С?
Си
R*
I*
I*
Zn
R
тетра-
эдриче-
сте
струн-
R — тип рутила; R* и R« — искаженные структурные типы рутила; С — тип CdCV.
I — тип Cdlj; I* — искаженный тип Cdl2.
аР1-зулъТ?Ты подробного исследования дифторидов 3<2-металлов со структурой ру-
тила приведены в работах [J. Am. Chem. Soc. 1954, 76, 5279; Acta cryst., 1958, H, 488].
0+2), причем четыре более сильные связи выделяют слои, ос-
нованные на четырехугольных плоских сетках. В то же время
в структуре СгС12 четыре более сильные связи выделяют цепи
такого же типа, как в PdCl2 (и в СиС12). Данные о соединени-
ях меди приведены в гл. 25, а о соединениях хрома — в табл.
•9.13.
в. Дигалогениды 4d- и 5й~переходных металлов. Дигалоге-
ниды этих элементов построены совсем иначе, чем соединения
92 9. Галогены. Бинарные галогениды
Зй-металлов (табл. 9.14). Можно отметить следующие особен-
ности: почти полное отсутствие дифторидов, отсутствие дигало-
генидов Тс, Rh, Hf, Та и 1г, образование элементами Hf, Nb и-
Та галогенидов с нецелочисленными степенями окисления; на-
личие «металл-кластеров» в соединениях Nb, Та, Mo, W, Pd
Таблица 9.13. Координация атома хрома в дигалогенидах
Галогеннд
CrFj
CrCl2
СгВга
Crl2
Cr—4X, A
2,00
2,39
2,54
2,74
Cr—2X, А
2,43
2,91
3,00
3,24
Литература
Proc. Chem. Soc, 1957, 232
Acta cryst., 1961, 14, 927; Helv. Chera.
Acta, 1961, 44, 1049
Acta cryst., 1962, 15, 672
Acta cryst., 1962, 15, 460; Acta crvst.,
1973, B29, 1560.
Таблица 9.14. Дигалогениды (и близкие им соединения)
переходных металлов 5 и 6-го периодов
ZrCl2
Zrl2
NbF25
NbCl2 зз
NbBr2
Nbl,,83
МоСЪ
MoBr2
Mol2
Для Тс —
неиз- RuCl2
вестны —
Для Rh PdF2
неиз- PdCl2
вестны PdBr2
Pdl2
HfCl2,6
TaCl2,s
ТаВг2,зз
WC12
WBr2
WI2
Rel,
OsC!2
OsBr2
Osl2
Для Ir —
неиз- PtCl2
вестны PtBr2
Ptlj
и Pt. Последняя группа соединений рассмотрена в следующем
разделе.
Единственный из известных дифторидов представлен PdF*
с обычной структурой рутила. PdCb, по-видимому, триморфен
[1], причем одна из модификаций (устойчивая в промежуточ-
ном интервале температур) имеет простое цепочечное строение
(рис. 9.4) [2]. Другая модификация [3] состоит из гексамер-
ных молекул Pd6Cli2 (изоструктурна Pt6ClL2 и Pt6Bri2) [4]; ее
структура описана в разд. 9.10.3. Структура PdBr2 состоит из-
цепей в целом такого же строения, как в <z-PdCl2, но здесь они
гофрированы, и (по-видимому) две связи Pd—Вг короче, чем
остальные две B,34 и 2,57 A) i[5]. Строение Pdl2 не определе-
но. Интересно отметить, что дихлориды никеля, палладия а
9.9. Кристаллические галогениды
платины образуют структуры трех различных типов'1
№С12
PdCl2
PtCl2
Слоистая структура
Цепочечная структура и гексамер
Гексамер (кластер) Pt6Cli2
КЧ атома М
6
4
4*
• Вопрос о том, имеет ли PtCh модификацию с цепочечной структу-
рой (рис. 9.4), рассмотрен в работе [4].
Литература. [1] J. Phys. Chem., 1965, 69, 3669. [2] Z. Kristallogr., 1938, 100;,.
189. [31 Angew. Chem., 1967, 79, 244. [4] Z. anorg. allg. Chem., 1965, 337, 120.
[5] Z. anorg. allg. Chem., 1966, 348, 162.
г. Дигалогениды щелочноземельных металлов, кадмия, евин*
ца и 51-элементов. Кадмий сюда включен потому, что его дига-
логениды занимают промежуточное место между типами в и г\,
к этим соединениям стоит близко и свинец.
о О
Pd CI
Рис. 9.4. Кристаллическая структура a-PdCl2.
Как это ни удивительно, но структурные соотношения для
галогенидов щелочноземельных металлов оказываются не таки-
ми простыми: двенадцать соединений кристаллизуются в шести
разных структурных типах. Фториды имеют структуру типа
флюорита (а под давлением — структуру РЬС12). Особенности
структур других галогенидов обусловлены тем обстоятельством,
что ионы металла оказываются слишком большими для того,
чтобы образовать полярные слоистые структуры АХ2. Вместо
этого реализуются менее симметричные структуры с координа-
* В PtCl2 учтены только связи Pt — С1. — Прим. перев.
94 9. Галогены. Бинарные галогениды
ционныыи числами 7 и 8. Ионы Eu2+, Sm2+ и Pb2+ по размеру
близки к Sr2+ и поэтому по свойствам очень близки к ионам
щелочноземельных металлов (табл. 9.15). Дииодиды тулия и
иттербия, подобно Са12 и РЫ2, кристаллизуются в структурном
типе Cril2. Особую структуру имеет золотисто-желтый ТЫ2, об-
Таблица 9.15. Кристаллическое строение (структурные типы)
некоторых дигалогенидов
F
С1
Вг
1
С а
F/P
С [4]
С |Ь|
L
Sr
F/P [11
C/F [3]
Sb [8]
S, [91
Ba
F/P П1
F/P [2]
P [21
P [21
Eu
F
P
Sb [11
E [7]/S,
Sm
F
P
Sb [1]
Pb [10]
F/P [6]
P [3]
P
L
Cd
F
L
L
L
Am [11]
P
Sb
E
L —слоистая структура типа CdCl2 или Cdl2; R — тип рутила: С — тип СаСЬ;
Р — тип РЬСЬ; Е — тип ЕиС12 (моноклинный); Sb — тип SrBr2; Sl — тип Srl2; F — тип
CaF..
Я] Materials Res. Bull., 1970, 5, 759. [2] J. Phys. Chem., 1963, 67. 2132. [3] J. Phys.
Chcra.. 1963. 67, 2863. [4] Acta cryst., 1965, 19, 1027. [5]. J. Inorg. Nucl. Chem., 1963, 25,
1265 [6] Acta cryst., 1967, 22, 744. [7] Acta cryst., 1969, B25, 1104. [8] Inorg. Chem.,
1971. 10, 145S. [9] Z. anorg. allg. Chem., 1969, 368, 62. [10] Acta cryst.. 1969, B25. 769 (сме-
шанные гллдгениды свинца). [11] J. Inorg. Nucl. Chem., 1972, 34, 3427; J. Inorg. Nucl.
Chem , 1973. 35, 483.
ладающий проводимостью металлического типа; его структура
описана в гл. 4 как пример «гибрида» между структурами
типа Cdl2 и MoS2. Координация атомов тория частью октаэдри-
ческая, частью тригонально-призматическая, а длина связи
Th—I C,20 или 3,22 А) такая же, как средняя величина для
ТпЦ. Предполагают, что формулу соединения следует представ-
лять как ThIV(eJI2 с двумя электронами, делокализованными
в пределах слоев [Inorg. Chem., 1968, 7, 2257]. Описаны два
черных хлорида DyCl2 и DyCb.oe; первый из них изоструктурен
YbCl2, но по-видимому, некоторые неопределенности в отноше-
нии этих структур еще остаются [Inorg. Chem., 1966, 5, 938].
Галогениды неодима (II) представлены NdCl2i3, NdCl2,2, NdCl2
(структурный тип РЬС12) и Ndli 95 (структурный тип SrBr2)
[Inorg. Chem., 1964, 3, 993].
В табл. 9.15 наряду со структурными типами рутила и
флюорита имеется ряд других каркасных структур с менее сим-
метричным расположением ионов. Структура типа СаС12 бли-
же к идеальной ГПУ-структуре АХ2 (разд. 4.3), чем структура
рутила. У ионов С1~ (Вг~) в незначительной степени уже про-
является тенденция к пирамидальной координации, что означа-
ет движение в направлении слоистого структурного типа Cdl2
¦с гораздо более четко выраженной пирамидальной координаци-
ей аниона.
9.9. Кристаллические галогениды
95
Структура типа РЬС12, на которую уже ссылались, характер-
на для солеобразных соединений (дигалогенидов, РЬ(ОН)С1,
СаН2). Соединения, относящиеся к этому структурному типу,
существенно различаются отношениями осевых параметров и по
атомным координатам, так что, по существу, речь идет о не-
скольких различных структурах, которые не следовало бы опи-
сывать в рамках одного и того же структурного типа РЬС12.
Этот вопрос обсуждался в гл. 6. Общие черты структуры наи-
более отчетливо выступают, если координационное окружение
иона РЬ2+ представить в виде трехшапочной тригональной приз-
мы (рис. 6.23), хотя этот многогранник сильно искажен. Всег-
да имеется два более удаленных соседа, и представляется бо-
лее правильным описывать координацию в этой структуре как
7: C,4). В определенной с хорошей точностью структуре низ-
котемпературной модификации PbF2 (устойчивой также под
высоким давлением) расстояния между ионами равны (в А):
Pb—F: 2,41, 2,45 (два), 2,53, 2,64, 2,69 (два) и 3,03 А (два)
Среднее из первых семи расстояний B,55 А) очень близко
к величине расстояния для иона Pb2h с КЧ 8 в модификации со
структурой флюорита B,57 А). У половины ионов X" три наи-
более близко расположенных катиона находятся по.одну сторо-
ну. В структуре UC13 это справедливо для всех анионов
(рис. 9.8). Несмотря на то что это примеры трехмерных струк-
тур, в них часть или все анионы находятся в асимметричном
анионном окружении, что, вообще говоря, более характерно
для слоистых, цепочечных и молекулярных структур.
Дигалогениды европия представляют особый интерес, по-
скольку все четыре соединения имеют различные структуры.
Иодид диморфен; одна модификация (ромбическая) изострук-
турна Srl2, другая имеет моноклинную симметрию. В обоих
случаях КЧ 7: C,4) с почти такой же координацией, как у
атомов Zr в бадделеите. Основное различие между структура-
ми моноклинного Eul2 и Srl2 состоит в величинах углов между
связями для иона I- с КЧ 3: они равны 100, 100 и 140° и соот-
ветственно 101, 127 и 127° (в структуре ZrO2 104, 109 и 146°).
Три галогенида АтС12, АтВг2 и Ат12 изоструктурны соответст-
вующим галогенидам европия.
По непонятной причине в сложной структуре SrBr2 имеется
два типа ионов Sr2f с различным расположением восьми сосе-
дей. Один тип Sr2+ окружен 8 ионами Вг~ по вершинам анти-
призмы C,14 А), а другой тип Sr2+ имеет весьма далекое от
симметричного окружение ближайшими соседями: шесть на
среднем расстоянии 3,14 А, один — на 3,29 А и еще один — на
3,59 А.
D6 9. Галогены. Бинарные галогениды
д. Дигалогениды элементов подгрупп Б. Эти структуры,
обычно характерные для одного соединения или для небольшо-
го их числа, описаны в гл. 25 и 26 (т. 3); они включают соеди-
нения Си, Ag, Hg, Ga, Ge и Sn.
9.93. Тригалогениды. Здесь достаточно выделить три группы:
а) октаэдрические структуры (Al, Sc, переходные металлы,
In, T1);
б) структуры с более высокими координационными числа-
ми (в основном 4f- и 5/-металлы);
в) особые структуры, характерные для небольшого числа
соединений.
а. Октаэдрические структуры MXZ- Как и для дифторидов,
где основным является структурный тип рутила, а менее рас-
пространенными слоистые структурные типы Cdb (ГПУ) и
CdC!2 (КПУ), в случае тригалогенидов также можно выделить
основные структурные типы: каркасная структура ReO3 (с ва-
риантами) и слоистые структуры Bil3 и YC13. В последних двух
структурных типах кристаллизуются соответственно низкотем-
пературная модификация СгС13 и высокотемпературная СгВгз.
В ряде хлоридов, бромидов и иодидов осуществляется цепочеч-
ная структура типа Zrl3 с октаэдрами, соединенными гранями.
Трифториды. В гл. 5 рассмотрены структуры, в которых ок-
таэдрические группы соединены друг с другом только через
вершины. Показано, что число различных вариантов структур,
в которых общими являются все вершины, бесконечно.
Можно выделить два случая: 1) атомы типа X занимают
позиции гексагональной плотнейшей упаковки (ГПУ) и 2) ато-
мы X занимают 3Д позиций кубической плотнейшей упаковки
(КПУ). Ряд трифторидов имеет структуры с ГПУ, но в боль-
шинстве этих соединений осуществляется упаковка атомов фто-
ра промежуточного типа (табл. 9.16). Более того, по всей види-
мости, в структурном типе кубического ReO3 трифториды вооб-
ще не кристаллизуются. Соединения с такой структурой либо
являются нестехиометрическими (со смешанной валентностью),
например Nb(O, FK или Mo (О, FK, либо относятся к оксофто-
ридам (NbvO2F). Недавно, однако, появилось сообщение о син-
тезе чистого стехиометрического NbF3 со структурой типа ИеОз
(нагревание до 750°С смеси 3NbF5+2Nb под давлением
3,5 кбар). Представляет интерес точное определение положения
анионов в упаковке, так как при этом можно установить вели-
чину угла М—F—М. Выявляется определенная (еще не объяс-
ненная) связь между структурами этих соединений и положени-
ем металла в периодической системе. По последним данным,
в структурах A1F3 и InF3 расстояния составляют Al—6F 1,80 А,
In—6F 2,05 А, а угол М—<F—M 156,5 и 146,8° соответственно.
9.9. Кристаллические галогениды 97
Искаженную октаэдрическую координацию в сложной моно-
клинной структуре MnF3 (длины связей Mn—F равны 1,79,
1,91 и 2,09 A) [Acta cryst., 1957, 10, 345] можно противопоста-
вить правильному октаэдрическому окружению в VF3. Инте-
ресно заметить, что и в MoF3, и в VF3 длина связи М—F равна
1,95 А, но эти соединения не изоструктурны. Соединение с ана-
литическим составом PdF3 на самом деле представляет собой
Таблица 9.16. Кристаллическое строение трифторидова
Al
Sc
Ti
V
Nb
Cr
Mo
Mn
Fe
R~u"
Co
Rh
lr
Pd
Ga
In
ГПУ
Структура с ГПУ
PdF3, RhF3, IrF3 (также Pt(O, FK)
Упаковки промежуточного типа
RuF3, MoF36
GaF3, TiF3, VF3, CrF3, FeF3, CoF3
MnF3B
ScF3, InF3r, AlF3r
Кубическая структура типа ReO3
NbF3«
Угол M—F—M,
град
132
~150
180
Более подробное описание структур см. обзор [Structure and Bon-
ding, 1967, 3, 1].
6 Тип ромбоэдрического VF3 (близко к ГПУ).
Тип VF3 с моноклинным искажением в результате проявления эф-
фекта Яна —Теллера.
J. Fluorine Chem., 1984, 24, 327.
д Сотр. rend. (Paris), 1971, С27Э, 1093.
PduPdIVF6 с расстояниями Pd11—F 2,17 А и PdIV—F 1,90 А
[Сотр. rend. (Paris), 1976, С282, 1069]. Комплексные галогени-
ды Pd"MivF6 (M = Ge, Sn, Pt) и MnPdIVF6 (M = Mg, Ca, Zn, Cd)
оказались изоструктурны PdF3 ;[Z. anorg. allg. Chem., 1968,
359, 160]; этот структурный тип (LiSbF6) описан в разд. 10.1.5.
PtF3 изоструктурен PdF3 [Materials Res. Bull., 1976, 11, 689].
Другие тригалогениды. Большинство тригалогенидов (ис-
ключая трифториды) металлов относится к одному (или более)
из следующих структурных типов (табл. 9.17):
Bil3: слоистая структура, ГПУ (низкотемпературный СгС!3)
YC13: слоистая структура, КПУ (высокотемпературный СгС13)
Zrl3: цепочечная структура
7- 985
98
9. Галогены. Бинарные галогениды
В структуре Zrl3 расстояние М—М сравнимо по величине
с расстоянием в металлическом цирконии, так как соединение
октаэдров происходит через противоположные ребра, но не обя-
Таблица 9.17. Кристаллическое строение тригалогенидова
A1C13 (L)
AlBr3 (D)
АПз (D)
ScCl3 (L)
YC13 (L) [2]
YI3 (L)
TiCl
TiBr
T1I3
ZrCl
ZrBr
Zrl3
Hfl3
(L/C)
3 (L/C)
(C)
j (C)
3 (C)
(C)
(C)
VC1,(L)
VI3(L)
CrCl3
CrBr3
MoBr
WC13>
разд.
(L) [П
(L) [Л
3 (C)
ReCl3 (cm.
9.10.3)
FeCl3
FeBr3
RuCl3
[3]
(L)
(L)
(L/C)
GaCl3 (D)
Gal3 (D)
InCl3 (L)
Inl3 (D)
T1C1, (L)
L — слоистая структура типа Bils или YCU; С — цепочечная структура типа Zrl3;
D — структура построена из димеров M2XS.
[1] J. Chem. Phys., 1964, 40, 1958. [2] J. Phys. Chem., 1954, 58, 940. [3] J. Chem.
Soc, A 1967, 1038.
a О тригалогенидах мышьяка, сурьмы и висмута см. разд. 20.2.7. Строение трига-
логенидов описано также в работах [Inorg. Chem., 1964, 3, 1236; Inorg. Chem., 1966, 5,
281; Inorg. Chem., 1969, 8, 1994].
зательно это интерпретировать как связь металл—металл. Ве-
личина магнитного момента ZrCl3 @,4 цв) указывает на значи-
тельную степень перекрывания орбиталей атомов металла, од-
нако магнитный момент TiCl3 A,3цв) лишь немного ниже, чем
ожидаемый при наличии одного неспаренного электрона
A,75 |дв). Аналогичным образом в CsCuCl3 и CsNiCl3, у кото-
рых анионы имеют цепочечное строение, магнитный момент со-
ответствует наличию одного и двух неспаренных электронов
[Inorg. Chem., 1966, 5, 277].
В табл. 9.17 помещены также А1С13 и тригалогениды неко-
торых элементов подгрупп Б. В связи с этим отметим, что в
противоположность А1С13 бромид алюминия А1Вгз имеет мо-
лекулярную структуру. В плотнейшей упаковке атомов брома
атомы А1 занимают соседние пары тетраэдрических пустот (ср.
октаэдрическую координацию А1 в A1F3 и А1С13), так что кри-
сталл оказывается построенным из молекул А1гВг6 (рис. 9.5).
Такого же типа молекулы обнаружены в кристаллическом GaCls
[J. Chem. Soc, 1965, 1816] и в Inl3, которому, вероятно, изо-
структурны АПз и Gal3 [Inorg. Chem., 1964, 3, 63]. В структуре
Ck
Ga
Ck
94°
2,29(9) A
Cl
2,06C) A
9.9. Кристаллические галогениды 99
inl3 длины связей равны In—1КОнЦ 2,64 A, In—Imoct 2,84 А; углы
близки к углам в GaCl3. Аналогичным образом построены ди-
мерные молекулы этих соединений, а также А1С13, А1Вг3 и АП3
в газообразном состоянии (рис. 9.6).
б. Структуры с высокими коорди-
национными числами. Для ионов боль-
шого размера октаэдрические структу-
ры, описанные в предыдущем разделе,
становятся неприемлемыми, что хоро-
шо видно на примере тригалогенидов
группы IIIA. Эти соединения по слож-
ности своей структурной химии сопо-
ставимы с дигалогенидами щелочнозе-
мельных элементов (табл. 9.18). Для
девяти исследованных соединений реа-
лизуются структуры семи различных
типов, из которых три относятся к
слоистым (нижняя часть таблицы),
а четыре — к каркасным.
Структурный тип LaF3 известен
как структура тисонита — по назва-
нию минерала состава (Се, La,...)F3.
Предполагавшая ранее структура
LaF3 была пересмотрена; ее описание
зависит от способа интерпретации
различных расстояний La—F. В окру-
жение атома La входят 7F (на рас-
стоянии 2,42—2,48 A), 2F B,64 А) и
еще 2F C,00 А), т. е. имеется три ти-
па неэквивалентных атомов фтора. Ес-
ли все указанные выше ионы фтора
считать ближайшими соседями, то ио-
ны металла оказываются 11-координи-
рованными, две трети атомов F имеют
КЧ 4, а остальные —КЧ 3. Координа-
ционная группа, включающая 11F,
представляет собой искаженную три-
гональную призму, имеющую «шапки»
на всех гранях. Если в координацион-
ное окружение катиона включить
только 9 (т. е. 7+2) соседей, то соотношение координационных
чисел La и F становится 9:3. Координационный полиэдр ка-
тиона не поддается простому описанию, как и тройная коорди-
нация фтора, которая осуществляется тремя способами —от
почти плоской до отчетливо пирамидальной. Этот структурный
тип реализуется в ряде трифторидов 4/- и 5/Ч>лементов (табл.
Рис. 9.5. Проекция крис-
таллической структуры
А1Вгз на плоскость @10),
показывающая расположе-
ние молекул А[2Вг6, приво-
дящее к размещению пар
атомов А1 в соседних тет-
раэдрических пустотах плот-
ной упаковки атомов гало-
гена. Крестики обозначают
вершины моноклинной эле-
ментарной ячейки.
Рис. 9.6. Строение А12Х6
(где Х=С1, Вг, I) (по
Пальмеру и Эллиоту).
100 9. Галогены. Бинарные галогениды
Таблица 9.18. Кристаллическое строение тригалогенидов
элементов группы ША
F
С1
Вг
I
Sc
ReO3
YC13
-
Y
YF3 fl]
YC13
B1I3
La
LaF3[2]
UC13
UCI3
PuBr3
[1] J. Am. Chem. Soc, 1953, 75, 2453. [2] Acta cryst., 1976, B32 94
(дифракция нейтронов).
9.19), в тригидридах (разд. 8.2.3, а), в некоторых комплексных
фторидах (например, CaThF6 и SrUF6) и в BiO0,iF2,8 (разд.
10.4.3, а). Строение высокотемпературных модификаций LaF3 и
трифторидов 4/-элементов неизвестно.
В структуре YF3 также осуществляется девятерная коорди-
нация иона M3"L (трехшапочная тригональная призма): 8F на
расстоянии ~2,3 А и F — на расстоянии 2,6 А, так что коорди-
нацию можно представить как (8+1). Этот структурный тип
реализуется в ряду SmF3—LuF3> а также в T1F3 и p-BiF3 [Acta
Chem. Scand., 1955, 9, 1206, 1209].
Описанный в литературе кубический «трифторид иттрия»,
по-видимому, представляет собой NaY3Fi0 (рис. 9.7); известны
аналогично построенные соединения гольмия, эрбия и тулия
(например, NH4Ho3F10). Элементарная ячейка содержит Ша,
3Y и 10F; последние статистически размещены по 12 позициям
[J. Am. Chem. Soc, 1953, 75, 2453]. Раньше считали, что сход-
В элементарную
ячейку входят:
© Na
О
ф
О
3Y
4F
8F
Рис. 9.7. Кристаллическая структура
9.9. Кристаллические галогениды 101
Таблица 9.19. Кристаллическое строение (структурные типы)
тригалогенидов 4/- и 5/-элементова
Трига.югениды 4j-элементов
Галогенид
Ы Се Рг Nd Ргп" Sm Eu Gd Tb Pi/ Но Er Tm Yb Lu Y
-Структурный тип LaF3 (mueonum)
Структурный тип YF3
Высоко-
температурные ¦
модификации.
MCl3 [2]
МВг3
MIj [3]
-Структурный тип UCl3-
UCl3 UCl3 UCl3 PuBr3
-Структурный тип Y
PuBr,
- Структурный тип Bi 13 •
Трига.югениды 51-элементов
Галогенид
MF3 M
MCl3
MBr3
MI3
Ac
LaF
UCl
UCl
Th
3
3
3
Pa U
LaF3
UCl3
UCl3
PuBr,
[ID]3
Np
LaF3
UCl3
PuBr3
PuBr3
Pu
LctF3
UCl3
PuBr3[5]
Р11БГ3Н
Am
LaF3
UCl3
№3[5]
BiI3[3j
Cm
LaF3
ucu
PuEi
Bil3
К
[5]
В к
ua3
Cf
LaF3 и
AlCl3
PuEn,
[9]
Es
UClj
Нейтронографическое уточнение структуры UC13 подтисрднло прежние данные:
U—6С1 2,93! Л, U—ЗС1 2,938 °Л JAcia cryst., 1974, ВЗО, 2803]. Для структуры GdCb
(тип иС13) получено Gd—6C1 2,82 jl, Gd—3C1 2.91 A JActa cryst., 1967, 23, 1112], а для
структуры AmCb — Am—6C1 2,874 К, Am—3C1 2.915 Л [Acta cryst., 1970, B26, 1885].
[11 Inorg. Chem., 1966, 5, 1937, [2] Inorg. Chem., 1961, 3. 185; J. Chem. Phys., 196S,
49, 3007. [31 Inorg. Chem., 1964, 3, 1137. [4] Acta cryst., 1949, 2, 388. [5] Inorg. Chem.,
1965, 4, 985; Inorg Nucl. Chem. Lett 1969 5, 307. [6] J. Inorg. Nucl. Chem., 1973. 35,
1171. [7] J. Inorg. Nucl. Chem., 1973, 35. 1525. [8] J. Inorg. Nucl. Chem., 1973. 35. 3481.
[9] J. Inorg. Nucl. Chem., 1975, 37, 743. [10] Acta cryst., 1975, B31, 880, (дифракция ней-
тронов): U—2 I 3,165, U—4 I 3,24 и U—2 I 3,46 %.
ную кубическую структуру имеет кубическая модификация BiF3,
параметры решетки которого и NaY3Fio очень близки. Предпо-
лагалось, что в структуре, показанной на рис. 9.7, положения
всех ионов металлов занимают четыре иона Bi3+, а все двенад-
цать анионных позиций заняты ионами F~ (что соответствует
структуре флюорита с добавочными ионами F~ — они показаны
заштрихованными кружками в центре кубической элементарной
ячейки и на середине ребер). В дальнейшем оказалось, что
эта кубическая фаза на самом деле имеет состав Bi2OF4 [Ann.
102 9. Галогены. Бинарные галогениды
Rev. Phys. Chem., 1952, 3, 369], вероятно, с формулой, приходя-
щейся на элементарную ячейку, Ш4(О, F)i0 [ср. (Na-f3Y)Fi0].
Данные по другим оксофторидам висмута см. в гл. 20.
В структуре UC13 ионы металла имеют координационное
окружение в виде трехшапочной тригональной призмы. В этом
структурном типе кристаллизуются многочисленные тригалоге-
ниды 4f- и 5/-элементов (табл. 9.19), а также тригидроксиды
La, Pr, Nd, Er, Sm, Gd и Dy. Сравнение проекций структур
Рис. 9.8. Проекция кристаллической структуры иС!з, показывающая коор-
динацию атомов U в виде трехшапочной тригональной призмы (см. текст).
(рис. 9.8) и РЬС12 (рис. 6.23) показывает, что соотноше-
ние между ними такое же, как между структурами YC13 и
CdCb; различие лишь в том, что последние являются слоисты-
ми, тогда как UC13 и РЬС12— каркасные. В гл. 7 уже отмеча-
лось, что в этих структурах несимметричное расположение
ионов металла по одну сторону от ионов С1~ аналогично ситуа-
ции в слоистых структурах.
В структуре UC13 атомы металла имеют девять примерно
эквидистантных соседних атомов галогена [Acta cryst., 1967,
23, 1112]. В структуре РиВг3, проекция которой приведена на
рис. 9.9, координационное число атомов металла снижается до
восьми. Это тем более удивительно, что атомы галогена распо-
ложены близко к тем положениям, которые соответствуют де-
вятерной координации атомов металлов. Если бы осуществля-
лась девятая связь Ри—Вг (штриховая линия в), то координа-
ция была бы такой же, как в UC13. Однако это расстояние
Ри—Вг равно 4,03 А, т. е. намного больше, чем остальные во-
семь расстояний Ри—Вг C,08 А). По-видимому, сближению
9.9. Кристаллические галогениды 103
слоев препятствуют контакты Вг-—Вг (штриховые линии а я б),
которые и так необычно коротки для не связанных друг с дру-
гом атомов брома C,81 и 3,65 А соответственно).
в. Особые структуры галогенидов элементов подгрупп Б
описаны в других главах: АиХ3 (гл. 25), AsX3 и др. (гл. 20).
Выше уже отмечалось, что PdF3 соответствует Pd"PdlvF6,
в котором оба вида атомов Pd находятся в октаэдрической ко-
ординации. Структура PtBr3 совершенно другого типа [Angew.
Chem., 1969, 8, 672]. Атомы Pt(II) участвуют в образовании
гексамеров Pt6X12 (как в PtCl2 и PtBr2), в которых каждый
ОРи у = О
OPu y=±i
Рис. 9.9. Слоистая структура РиЬгз. Плоскости слоев перпендикулярны пло-
скости рисунка.
атом Pt имеет четыре компланарных атома брома на расстоя-
нии 2,45 A (Pt—Pt 3,49 А). Атомы Pt(IV) образуют изогнутые
цепи сочлененных по ребрам октаэдров АХб (концевые атомы
Вг находятся в г^ыс-положениях), как это имеет место и в
a-PtI4. Расстояния Pt—Вг составляют 2,44—2,57 А; имеются и
слабые связи Pt—Вг B,93 А) между Pt(II) и атомами брома
из цепей с участием Pt(IV).
9.9.4. Тетрагалогениды. Более трети всех металлов образуют
тетрагалогениды по крайней мере с одним из галогенов. В не-
которых случаях известны тетрагалогениды данного металла
для всех четырех галогенов. Так, по четыре тетрагалогенида по-
лучено для металлов Ge, Sn, Ti, Zr, Hf, Nb, Та, Mo, W, Th
и U; в то же время для Mn, Ru, Rh, Pd, Ir, Ce, Pr и Tb синте-
зированы только тетрафториды.
Кристаллическая структура исследована более чем для по-
ловины из примерно 70 известных тетрагалогенидов. Получен-
ные структуры относятся к различным типам — каркасным,
слоистым, цепочечным и молекулярным. Большая часть струк-
тур уже рассмотрена в предыдущих главах.
104 9. Галогены. Бинарные галогениды
Структуры SnBr4 [1] и Snl4 '[2] строятся из тетраэдричес-
ких молекул; в первой из них атомы галогена образуют ГПУ,
во второй — КПУ. К соединениям второго типа относятся Gel4,
SnCl4, TiBr4, Til4 и ZrBr4*. Одна из двух модификаций TiBr4
изоструктурна SnBr4; к структурному типу Snl4 относится и
модификация Zrl4 (см. ниже)**.
Среди октаэдрических структур тетрагалогенидов встреча-
ются три из четырех основных типов, а именно цепочечные,
слоистые и каркасные. В цепях транс-типа октаэдры соединены
друг с другом через противоположные ребра (a-NbI4 .[3], NbCl4,
Z.69A
Рис. 9.10. Цепи из сочлененных по ребрам октаэдров в структурах Nbl4 (a.)
и ТсС14 (б).
ТаС14, Та14, a-MoCl4, WC14) OsCl4, a-ReCl4) -[4]. В структуре
a-NbI4 атомы ниобия смещены из центров октаэдров и образу-
ют пары (рис. 9.10,а); взаимодействие между соседними ато-
мами ниобия оказывается достаточным для того, чтобы не на-
блюдался парамагнетизм, ожидаемый для Nb(IV); связи с мо-
стиковыми атомами иода значительно длиннее, чем с концевы-
ми. При соединении октаэдров через непротивоположные ребра
образуются зигзагообразные цепи; как отмечалось в разд. 5.3.4,
число конфигураций таких цепей бесконечно. В простейшем слу-
чае атомы металлов образуют плоскую зигзагообразную цепь
(ТсСЦ [5], ZrCl4 l[6]***, PtCl4, Ptl4 [7], UI4 [8]); в таких цепях
отсутствуют связи металл—металл (рис. 9.10,6); в ТсСЦ крат-
чайшее расстояние составляет 3,62 А. Более сложная конфигу-
рация цепей обнаружена в структурах НП4 [9] и Zrl4 [10]
* ZrBr4 имеет цепочечную структуру типа ТсСЦ. ¦— Прим. перев.
** Последними исследованиями [Acta cryst., 1979, В35, 274; Кристаллогра-
фия, 1986, 31, 446] эти данные не подтверждаются. — Прим. перев.
*** Такую структуру имеет и ромбическая модификация Zrl4 [Деп.
ВИНИТИ, № 3150-80, 1980]. —Прим. перев.
9.9. Кристаллические галогениды 105
с периодом повторения в цепях соответственно 4 и 6* октаэд-
ров, тогда как в ТсСЦ период составлял 2 октаэдра.
Совершенно другая структура у |3-ReCl4 [11]: пары сочле-
ненных через грань октаэдров образуют бесконечные цепи, со-
единяясь через мостиковые атомы хлора:
С1
С1
С1
В структуре SnF4 октаэдрические группы SnF6 образуют
слои путем объединения через четыре экваториальных атома
фтора, как это имеет место в структуре K2'NiF4 (разд. 5.3.3).
Такая же структура у NbF4 и PbF4 [12].
Первая из трехмерных структур тетрагалогенидов недавно
обнаружена у IrF4 [13]. Каждая октаэдрическая группировка
IrF6 соединена четырьмя вершинами с четырьмя другими груп-
пировками IrFe, а две вершины, находящиеся в цис-положении
друг к другу, являются концевыми. Эта структура тесно свя-
зана со структурой рууила, из которой она получается при
удалении каждого второго атома металла из цепочек, соеди-
ненных через ребра. Соотношение между структурами такое
же, как между структурами типа NaCl и атакамита (АХ2)
(рис. 4.22). В то же время структуру IrF4 можно описать, взяв
за основу алмазный каркас, так как каждый атом 1г связан с
четырьмя другими через общие атомы фтора. Аналогичные
структуры имеют тетрафториды родия, палладия и платины.
Было высказано (пока еще не подтвержденное) предполо-
жение, что структура VF4 близка к структуре VOF3 [15]. В по-
следней пары сочлененных по ребру октаэдрических группиро-
вок VOF5 связаны между собой через оставшиеся четыре из
восьми вершин и образуют слои
и
v
i
Структуры ряда тетрагалогенидов Зс/-металлов представляют
особый интерес в связи с наличием у атома избытка электро-
* Скрученные цепочки с повторением через 4 октаэдра обнаружены в од-
ной из модификаций Zrl4 (Кристаллография, 1986, 31, 446).—Прим. перев.
10S 9. Галогены. Бинарные галогениды
нов. Можно отметить, что, по довольно старым электроногра-
фическим данным, молекула VC14 в парах представляет собой
правильный тетраэдр [16].
Среди других октаэдрических структур высокотемператур-
ная модификация МоСЦ характеризуется статистическим запол-
нением 3/4 позиций атомов металла в структуре Bil3 [17]. При
таком заполнении в структуре образуются как изолированные
октаэдры МоС16, так и фрагменты цепочек (за счет объедине-
ния октаэдров через ребра).
С1
Рис. 9.11. Проекция структуры ThCl4 (UCI4).
Редкий для тетрагалогенидов случай семерной координации
реализуется в структуре UBr4 (разд. 28.2.4).
Из трех структурных типов с соотношением координацион-
ных чисел 8 : 2 два имеют координационный многогранник в
виде антипризмы, а один — в виде додекаэдра. Интересная
структура Thl4 [18] состоит из слоев, образованных квадрат-
ными антипризмами ТЫ8, имеющими общими по две треуголь-
ные грани и по одному ребру. Структура этого типа рассмот-
рена в гл. 3 в качестве примера слоев, основанных на плоских
6-угольных сетках. В противоположность ZrCl4 и ZrBr4 тетра-
фторид циркония имеет типично ионную структуру с соотноше-
нием координационных чисел 8:2 [19]. Оба неэквивалентных
атома циркония окружены восемью атомами фтора, образующи-
ми слегка искаженные квадратные антипризмы, каждая из ко-
торых имеет общие вершины с восемью другими. Такой струк-
9.9. Кристаллические галогениды 107
турой обладают тетрафториды, содержащие большие по разме-
рам ионы М4+ (Ш, Се, Pr, ТЬ и 5/-элементы Th—Bk). Иной тип
структуры при соотношении координационных чисел 8 : 2 име-
ют тетрахлориды Th, Pa, U и Np, а также ThBr4 и РаВг4.
В структуре UC14 атом металла окружен восемью соседями,
расположенными в вершинах додекаэдра; каждый координаци-
онный многогранник сочленен через четыре ребра с четырья
другими додекаэдрами, расположенными по спирали вдоль оси
4Ь что приводит к образованию трехмерной структуры с соот-
ношением КЧ 8:2 (рис. 9.11). В структуре ТЬСЦ [20] четыре
расстояния Th—С1 равны 2,72 А, четыре других — 2,90 А. Кон-
фигурация додекаэдрической группы близка к форме, рассчи-
танной из условия минимума энергии отталкивания лигандов
(разд. 3.3.8). Очень похожие координационные группы обнару-
жены в структурах РаВг4 [21] (Ра—Вг 2,83 и 3,01 А)
и UCU i[22] (U—C1 2,64 и 2,87 А).
По поводу единственной в своем роде структуры TeF4, в ко-
торой квадратно-пирамидальные группы TeFs, имеющие по два
мостиковых атома фтора, образуют бесконечные цепи, читатель
может обратиться к рис. 16.4.
На примере структур кристаллических тетрагалогенидов
удобно проследить за тем, как достигается одно и то же соот-
ношение М : X при соединении координационных групп МХ„ со
все увеличивающимися значениями п за счет увеличения числа
мостиковых атомов:
Координация атома М
Коор-
динаци-
онное
число
(КЧ)
Общие элемен-
ты координаци-
онных много-
гранников
Примеры
Тетраэдрическая
Квадратно-пирамидальная
Октаэдрическая
Пентагонально-
пирамидальная
Антипризматическая
Додекаэдрическая
Антипризматическая
4
5
6
7
Нет
2 вершины
4 вершины
2 ребра
1 грань+1 вер-
шина
3 ребра
Snl4
TeF4
SnF4
ТеС14, Nbl4
ReCl4
UBr4
8 В вершин ZrF4
8 4 ребра ThCl4
8 2 грани+1 реб- ГЫ4
ро
Литература. [1] Acta cryst., 1963, 16, 446. [2] Acta cryst., 1955, 8, 343. [3] Acta
cryst., 1962, 15, 903. [4] Inorg. Chem., 1968, 7, 2602. [5] Inorg. Chem., 1966, 5,
1197. [6] Z. anorg. allg. Chem, 1970, 378, 263. [7] Z. anorg. allg. Chem., 1969,
108 9. Галогены. Бинарные галогениды
369 154 [8] Inorg Chem., 1980, 19, 672. [9] J. Less-Comm. Met., 1980, 76, 7.
Г101 Acta cryst 1979, B35, 274. [11] J. Am. Chem. Soc., 1967, 89, 2759. [12]
Inorg Chem., 1965, 4, 182. [131 Сотр. rend. (Paris), 1974, 278C, 1501. [141 Inorg.
Chem 1978 17, 748. [151 Chem. Comm, 1970, 1475. [16] J. Am. Chem. Soc.,
1945 67 2019 [17] Z. anorg. allg. Chem., 1967, 353, 281. [181 Inorg. Chem., 1964,
3 639 [19] Ada cryst., 1964, 17, 555. [201 Acta cryst., 1969, B25, 2362. [211 J-
Chem. Soc, A 1971, 908. [221 Ada cryst., 1973, B29, 1942.
9.9.5. Пентагалогениды. За исключением SbCls, молекулы кото-
рого имеют одну и ту же тригонально-бипирамидальную конфи-
гурацию в кристаллическом и газообразном состоянии, коорди-
национные числа в кристаллических пентагалогенидах равны
6, 7 или 8.
Ряд октаэдрических структур состава АХ5 описан в гл. 5;
это были димерные и тетрамерные молекулы типа М2С1ю и
M4F2o (рис. 9.12), а также цепочечные структуры цис- или
Q О
Рис. 9.12. Молекулы пентагалогенидов МгС1ю (а) и M4F2o (б).
транс-строения. Димерные структуры реализуются у хлоридов,
бромидов и у двух иодидов, тогда как тетрамеры и цепочки
встречаются у фторидов. Как и в случае других галогенидов,
молекулы типа М2С1ю (рис. 9.12, а) или M4F20 (рис. 9.12,6)
могут укладываться различным образом, приводя к различным
типам плотнейших упаковок атомов галогенов. И для димеров
(а), и для тетрамеров (б) известны структуры с ГПУ и КПУ,
а для димеров — и более сложная упаковка гк-типа (табл.
9.20). В димерных молекулах атомы металла смещены из цент-
ров октаэдров (в и2С1ю на 0,2 А); связи с мостиковыми атома-
ми длиннее, чем с концевыми (например, в U2Clio 2,69 и 2,44 А).
Особый интерес представляет различие двух типов структур
М4Х2о; в структуре с КПУ угол у мостикового атома фтора со-
ставляет 180° (как показано на рис. 9.12,6), в структуре с
ГПУ— 132°. (В первом случае кубическая плотнейшая упаков-
ка искаженная и симметрия является моноклинной.) Это не-
сколько напоминает рассмотренные ранее структуры трифтори-
дов. Большое значение имело бы установление причин, опреде-
9.9. Кристаллические галогениды 109
Таблица 9.20. Кристаллическое строение пентагалогепидов
Димерный
М,С1,0
М2Вгю
M2I,o
Тип плотнейшей упаковки
атомов X
Гексагон. ]
Nb Та Mo W
Nb Та
Кубич.
и
р-Ра2Вг10
гк
Re
Os
Литература
J. Chem. Soc, A 1967, 1825, 2017
Acta cryst., 1967, 22, 300
Acta cryst., 1968, B24, 874
Inorg. Chem., 1979, 18, 3081
Acta cryst., 1969, B25, 178
Acta cryst., 1979, B35, 2502
Пентафториды с тетрамерным и цепочечным строением
V [1]
Nb
Та
M,F20
—F— 180°
КПУ
Сг [11
Мо
W [51
Также
WOF4 [21
NbCUF [81
TaCl4F [9]
Тс [I]
Re [11
цис-Цепочки
р
Также
MoOF4
ReOF4
TcOF4!
150°
[3]
[4]
[И]
RuRh [12]
Os [10] Ir Pt
M4F20
—F— 132°
ГПУ
транс-Цепочки [6]
-F— 180°
BiF5
a-UFs
Пентагонально-
бипирамидальные
цепочки
РаС15 [71
аСуществует также модификация (зел.), содержащая триыеры, —F— 161° [J. Chem
Soc, A 1970, 2521].
[11 J. Chem. Soc. A 1969, 1651. ,[2] J. Chem. Soc, A 1968, 2074. [3]. J. Chem. Soc
1968, 2503. [41 J. Chem. Soc,. A 1968, 2511. [5J J. Chem. Soc, A 1969, 909. [6]
[6]
J. Am. Chem. Soc, 1959. 81, 6375. [7] Acta cryst., 1967, 22. 85. [8] Z. anorg. allg. Chem '
1968. 362, 13. [9] Z. anorg. allg. Chem., 1966." 346, 272. [101 J. С " " ""
fill s~~ 1^ ,. /—- , r, i — , , * -* r.-^-i - *~. - . - . . ___
. , 3 [9] Z. anorg. allg. Chem., 1966. 346, 272. [10] J
Chem. Comm., 1967, 462. [12] Inorg. Chem.. 1973, 12, 2610.
] g g
hem. Soc, A 1971, 2789.
ляющих принадлежность данного пентафторида к структуре
того или иного типа (табл. 9.20).
Возможны два типа октаэдрических МХ5-цепей {цис- и
транс-) в зависимости от того, через какие вершины (соседние
или противоположные) сочленяются октаэдры МХ6. Здесь
опять-таки весьма интересно выяснить, какие факторы опреде-
ляют выбор типа цепи.
В структуре РаС15 (уникальной среди пентагалогенидов)
пентагонально-биппрамидальные группы объединяются в бес-
конечные цепи через ребра (рис. 9.13). Длины связей равны
Pa—CL (мост.) 2,73 А, Ра—С1 (конц.) 2,44 А.
В p-UF5 осуществляется восьмерная координация атома U
(разд. 28.2.4, а).
110 9. Галогены. Бинарные галогениды
Следует отметить, что в структурах пентагалогенидов ме-
таллов, а также в кристаллических РС15 и РВг5 не реализуется
(за исключением SbCl5) координационное число, равное пяти.
9.9.6. Гексагалогениды. Для кристаллических гексагалогенидов
известны только октаэдрические молекулярные структуры, хотя
в принципе возможны и бесконечные образования, например
цепи или слои с КЧ 7, 8 или 9. При рентгенографическом иссле-
довании порошков многочисленных гексафторидов переходных
4d- и 5с1-металлов обнаружено, что все они изоструктурны друг
другу и могут существовать в двух модификациях: низкотем-
Рис. 9.13. Цепи в кристаллической структуре Pads.
пературной (ромбической) и высокотемпературной с разупоря-
доченной ОЦК-структурой [1]. Более подробное исследование
было выполнено для структурно сходной низкотемпературной
модификации OsVIIOF5 [2], которая построена из почти пра-
вильных октаэдрических молекул. Как и в галогенидах М2Хю,
в структурах гексагалогенидов могут осуществляться различ-
ные типы плотнейших упаковок атомов галогена, например»
UC1,[3], WC1,[4], MoCle
UFe (и OsOF5), MoF6 (ромбич.) [5]
Гексахлорид WC16 имеет две модификации с ГПУ, различа-
ющиеся способом заполнения октаэдрических пустот атомами
металла.
При нейтронографическом исследовании UF6 [6] установле-
но значительное отклонение координации от октаэдрической:
пять расстояний U—F близки 1,91 А, а шестое равно 2,28 А,
что было объяснено несимметричным окружением молекул в
структуре.
Литература. [1] Inorg. Chem., 1966, 5, 2187. [21 J. Chem. Soc, A 1968, 54a,
[31 Acta cryst., 1974, B30, 1481. [41Acta cryst., 1974, B30, 1216. [5] Acta cryst.,.
1975, B31, 398. [6] Acta cryst., 1973, B29, 7.
9J0. Комплексы со связями металл — металл 111
9.9.7. Гептагалогениды. Из гептагалогенидов металлов извест-
ны ReF7 и OsF7; последний устойчив лишь при низких темпе-
ратурах [Chem. Ber., 1966, 99, 2652]. Кроме них получен еще
только один гептафторид IF7. Данные, указывающие на пента-
юнальную симметрию ReF7 (и IF7), приведены в работе
[J. Chem. Phys., 1968, 49, 1803].
Другие высшие галогениды не получены. Показано, что со-
единение, считавшееся ранее OsFe, на самом деле имеет состав
OsF6.
9.10. Полиядерные комплексы со связями металл — металл*
9.10.1. Биядерные галогенидные комплексы молибдена, техне-
ция и рения. Для целого ряда элементов известны ионы
МгСЬ"", состоящие из двух октаэдрических групп, имеющих об-
щую грань (разд. 10.1.9); в структуре p-ReCl4 (разд. 10.1.9)
группировки объединены также в бесконечные цепочечные мо-
лекулы через мостиковые атомы хлора. Внутри группировки
расстояние Re—Re равно 2,73 А, что указывает на наличие ор-
динарной связи металл—металл. Такое же строение имеют
ионы Re2Cl93~ и Мо2С193"". Первоначально предполагали, что в
диамагнитной соли М3(Мо2С18Н) [Inorg. Chem., 1976, 15, 522]
присутствует ион (Мо2С18K~ того же строения, что и ион
(Мо2С19) 3~, в котором лишь удален один из мостиковых атомов
хлора. В действительности один из мостиковых галогенов за-
мещается на атом Н (рис. 9.14,а). Эта замена приводит к зна-
чительному укорочению длины связи Мо—Мо:
Мо—Мо, А
Мо,С193- 2,665
Мо2С18Н3- 2,38
Мо—Мо, А
Мо2Вг93- 2,82
Мо2Вг8Н3- 2,44
Совсем другое строение имеет ион (Мо2С18L~ (рис. 9.14,6)
(а также ионы Те2С183~ и Re2Clg2~). В этих ионах расстояние
М—М очень короткое, конфигурация атомов галогена заслонен-
ная; они располагаются по вершинам почти правильного куба.
Согласно представлениям теории молекулярных орбиталей
связь металл—металл четверная (ол2б); именно б-компонента
и обусловливает заслоненную конфигурацию**.
Фрагмент Re2X8 может служить основой для реакций заме-
щения лигандов без изменения конфигурации фрагмента в це-
* Успехи развития химии кластеров отражены в обзорах: [Усп. химии,
1985, т. 54, № 4, с. 556—590; Structure and Bonding, 1985, v. 62, Springer-
Verlag]. — Прим. перев.
** Этим вопросам посвящена книга: [Коттон Ф. А., Уолтон Р. Кратные свя-
зи металл — металл.—М.: Мир, 1985]. — Прим. перев.
112 9. Галогены. Бинарные галогениды
\з.згл
2П5
~-zns
(С6Н5KР' С1
3
Рис. 9.14. Биядерные галогенидные ионы и сходные по строению молекулы
Мо2С18Н3- (a), Re2Cl82- (б), Re2l4(C6H5COOJ (e), Re2OCl5(C2H5COO)-
[Р(С6Н5)зЬ (г), Re2OCl3(CHCOO)[P(CH)] (?)
лом; примеры — Re2Cl6(PEt3J, в котором два транс-атома X
замещены на молекулы фосфина, или Re2l4(C6H5COOJ (рис.
9.14, в). В обеих молекулах расстояние Re—Re близко 2,2 А.
В молекулах, схематически изображенных на рис. 9.14, г и д,
имеются мостиковые атомы О и С1 (к каждому атому металла
присоединены шесть лигандов) и длина связи металл — металл
составляет ~2,5 А. Отметим, что длины связей Re—Re в би-
ядерных комплексах лежат в трех интервалах: при 2,2, 2,5 и
2,7 А (см. литературу, цитируемую в табл. 9.21).*
* Расстояния Re—Re, равные ~2,2 А, свойственны только комплексам
Re(III), поскольку лишь d4—^-конфигурация делает возможной четверную
связь Re—Re. Расстояния Re—Re, равные —2,5 и —2,7 А, осуществляются
в соединениях Re(IV) (конфигурация d3—d3), причем первое — в комплексах
с мостиковыми лигандами, второе — в комплексах без мостиковых лиган-
дов. — Прим. ред.
9.10. Комплексы со связями металл —металл
Таблица 9.21. Длина
связей
и комплексны}
Ион или молекула
ReCU (крпст.)
(Re,Cl9)-
Re,OCl5(O2CC2H3)[P(C6H5Kl2
Re2OCl3(O2CC2H5J[P(CeH5Kl2
Re2Cle(PEt3JO
(Rc2ClsJ~
(Tc2Cla)(NH4K-2H2O
(Mo2Cl8)K4-2H2O
(Mo2C!8)Cl(NH4M-H2O
(Mo2Cl8H)Cs3
Re3I9
Re3Cl9(PC6H5Et2K
(Re3Cli,)[As(C6H5L]2
(Re3CI12)CsS3
(Re4Br15)(QnHJ
M—M
в некоторых простых
i галогенидах
M—M, j
2,73
2,71
2,52
2,51
2,20
2,22
2,24
2,13
2,13
2,15
2,38
2,44;
2,49
2,49
2,44;
О Л Q •
2,46,
2,48
2,47
2
2
I
i
51
48
Ad
4У
J. Am
2759
Stokeh
мл;
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Литература
. Chem
/ P. F
Г., 1969
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
. So
, Ph
1968,
1969,
1969,
1968,
1965,
1970,
1969,
1970,
1969,
1968,
1964,
1964,
1966,
1966,
1963,
1965,
7,
8,
8,
7,
4,
9,
8,
9,
8,
7,
3,
3,
5,
5,
2,
4,
i
1967, 89,
D. Thesis
1784
950
1299
2135
330, 334
789
7
346
1060
1563
1402
1094
1758
1763
1166
59
Следует отметить пионерские работы в этой области, выполненные Козьми-
ным П. А. и сотр. (см. литературу, цитируемую в обзоре [Коорд. химия, 19S0, т. 6,
с. 643—694]). — Прим. ред.
9.10.2. Трехъядерные галогенидные комплексы рения*. Рений
образует большое число ионов и молекул, в основе которых ле-
жат треугольные группировки из трех атомов рения, например
Re3Cl3(NCS)82- и Re3Cl3(NCS)c
X X B
Re3X
10
Mpyh 33()8 33()
Re3Xn2- и Re3Xi23~ (X = C1, Br); при этом для выделения солей
в твердую фазу необходимы такие крупные катионы, как Cs+,
As(C6H5L+ и т. д. (В [N(C2H5L]2Re4Br15 нет группировок Re4).
а присутствуют ионы ReBr62~ и группы Re3Br9.) Анион Re3Cli23~
(рис. 9.15, а) обнаружен в соединении CsReCl4. Длина связи
Re—Re B,48 А) намного короче, чем в металле B,75 А), и со-
ответствует порядку связи 2. Расстояние Re—С1Я B,36 А) и
Re—С1й B,39 А) отвечают ординарным связям (ср. 2,37 А в
K4ReOCl10-H2O), а необычно большая длина связи Re—С1С
О строении кластерных соединений технеция см. [Усп. химии, 1985,
т. 54, № 4, с. 637—670; ДАН СССР, 1982, т. 265, с. 1420—1423; Коорд. химия,
1985, т. 11, с. 1559—1567]. — Прим. ред.
8—985
114 9. Галогены. Бинарные галогениды
B,52 А) приписывается перегруженности молекулы. Такие же
группировки Re3 присутствуют в Re3Cl9(PC6H5Et2K и во многих
других комплексах. Похожее строение имеет ион Re3Cln2 , ко-
торый получается при удалении из иона Re3Cli23~ одного из эк-
ваториальных атомов С1с
9.10. Комплексы со связями металл — металл 115-
Рис. 9.15. Трехъядерные галогенидные комплексы рения (Re3Cli2K (а), кри-
сталлический ReCl3 (б), мостиковые связи в ReCl3 (в) и кристаллический
Re3I9 (г).
Масс-спектрометрически установлено, что при испарении
ReCl3 и ReBr3 образуются молекулы Re3X9. В кристаллическом
ReCl3 присутствуют молекулы Re3Cl9 (рис. 9.15, а, но без эква-
ториальных атомов С1С). Эти молекулы объединены за счет сла-
бых мостиковых связей Re—C1 B,66 А) в слои, строение кото-
рых основано на шестиугольных сетках (рис. 9.15,6). В каждом
мостике атом С1а одной молекулы занимает положение С1С со-
седней молекулы (рис. 9.15,в). В Rel3 молекулы Re3I9 имеют
такое же строение, но они объединены не в слои, а в цепи (рис.
'9.15, г).
9.10.3. Галогенидные комплексы Nb, Та, Mo, W, Pd и Pt, со-
держащие металл-кластеры. Рассматриваемые здесь соедине-
ния образуют только некоторые элементы из второго и третье-
го рядов переходных металлов:
Nb
Та
Мо
W
Pd
Pt
Из металлов Б-подгрупп лишь немногие способны давать
галогениды со связями металл-—металл; в основном это от-
носится к ртути и висмуту (гл. 20). О соединениях ртути см.
гл. 26, а о соединении Cu4I4(AsEt3L— гл. 25.5.2.
Таблица 9.22. Некоторые галогениды и галогенидные комплексы ниобия
Степень окисления ниобия
1,83
2
NbBr2
2,33
(Nb6Cl12)Cl2
K4(Nb6ClI2)Cl6
(NbeCl,2J+
2,50
Nb6F15
CsNb4CIn
(Nb6Cl12K+
2,67
Nb3Cl8
(Nb6Cl,2L+
Nb3I8
3
NbCl3
Cs3Nb2Cls
Nbl3
4
NbF4
NbCl4
Nbl,
5
NbF5
NbCI5
Nbl5
Особенность химии ниобия и тантала заключается в том, что
во многих соединениях с галогенами степень окисления метал-
ла оказывается нецелочисленной (табл. 9.22). Галогениды по-
лучают различными методами: Nb3I8 термическим разложением
высших иодидов; Nbelii нагреванием Nb3I8 с металлом;.
CsNb4Cln по транспортной реакции из смеси CsCl, Nb3Cl8 и Nb;
KtNbeClie нагреванием смеси КС1 и Nb6Cl14. Другую группу со-
единений, содержащих Nb6Xi2) получают из растворов, причем
эта группировка может находиться в нескольких состояниях
окисления. Ион Nb6Cli22+ можно рассматривать как структур-
ную единицу, присутствующую в (Nb6Cli2)Cl2 и в соответству-
ющем октагидрате. При окислении этого иона воздухом в раство-
ре НС1—С2Н5ОН образуется (после добавления NEt4Cl)
(NEt4K(Nb6Cli2K+Cl6 (ц= 1,65 fiB); при окислении хлором полу-
чают (NEt4J(Nb2Cli2L+Cl6 с почти нулевым магнитным момен-
том [1]. Аналогичным образом и ионы (Ta6Cli2)"+ (л = 2, 3 и 4)
могут быть обратимо окислены или восстановлены [2].
Во всех соединениях, помещенных в табл. 9.22, за исклю-
чением NbF4 и пентагалогенидов, осуществляется взаимодейст-
вие металл — металл. Оно может выражаться в образовании
чередующихся пар атомов ниобия в цепочечной структуре NbX4>.
в образовании группировок Nb3 в галогенидах Nb3X8 или Nb4
Таблица 9.23. Соединения, содержащие кластерь
Тип комплекса
Конечный
(Mo6Ck)Cl6(NH4J-H2O
(Mo6Cls)(OHL(H2OJ-
•12Н;О
Цепочечный
(W6Brs)Br4-Br4
Слоистый
(Мо6С18)С14
Каркасный
(Nb6I8)I3
(Nb6Is)I3H
¦Конечный
Pd6Cl12
PteClla
(W6C112)C16
(Та6С1!2)С12(Н2ОL-
•3H2O
(Nb6Cl12Cl6L-
(Nb6Cl12Cl6J-
(Та6С112С16J-
Слоистый
(TaeIls)I2
(Nb6Ci12)Cl2
Каркасный
Zr6ll2
(Nb6F12)F3
(Ta6ClI2)Cl3
Формула соединения
AUX.
W6Br10
МоСЬ, Br2, I2
WC12, Br2, I2
Nb6ln
Nb I iH
(Nb6I,,H)Cs
M6X12
PdCI,
PtCl2
WCI3
Ta6Cl14-7H2O
K4Nb6Cli8
fN(CH3Ll2Nb6Cl18
H2Ta6Clis-6H2O
Ta6I14
Nb6Cll4
Zrl2
Nb6F15
Ta6Cl15, Ta6Br15, Zr6Cl,5
>
1 типа М6Х8 или MGXi2
Литература
Ark. Kern., 1949, 1, 353
Z. anorg. allg. Chem.,
1968, 357, 289
Z anorg. allg. Chem.,
1967, 353, 281
Z anorg. allg. Chem.,
1967, 355, 295
Z anorg. allg. Chem.,
1967, 355, 311
Inorg. Chem., 1980, 19,
1241
Angcv. Chem., 1967, 79,
ОЛ 1
/44
Z anorg. allg. Chem.,
1965, 337, 120
Angew. Chem., 1967, 79,
650
Inorg Chem., 1966, 5,
1491
7 anorg. allg. Chcm.,
1968, 361, 235
Inorg. Chem, 1970, 9,
1347
Inorg. Chcm, 1971, 10,
1460
J Less-Comm. Met, 1965,
8, 388
Z anorg. allg. Chem.,
1965, 339, 155
J Am. Chem. Soc, 1978,
100, 652
J Less-Comm. Met, 1965,
9,95
Z anorg. allg. Chem,
1968, 361, 259
9.10. Комплексы со связями металл -
117
в С>\Ь4С1ц; октаэдрические группы М6 присутствуют в струк-
турах всех соединений табл. 9.23.
Галогеннды Nb3X8 имеют слоистую структуру [3], в кото-
рой атомы Nb занимают 3/4 октаэдрических пустот между чере-
дующимися слоями атомов галогенов (рис. 5.22,г). Взаимодей-
ствие между атомами ниобия позволяет выделить треугольные
группы Nb3. В идеализированном виде это показано на рис.
¦9.16, а, где все внешние атомы хлора являются общими с сосед-
ними группировками. Из 13 атомов хлора этой группировки 6
принадлежат двум, а 3 — трем таким группировкам и, таким
образом, на долю трех атомов ниобия приходится 4+6—^"-f-
-Г-3- — = 8 атомов хлора.
О
В структуре CsNb4Cln можно выделить группировку из че-
тырех октаэдров, основываясь на величинах расстояний Nb—
—Nb: a = 2,95 A, 6 = 2,84 А, с = 3,56 A, d = 3,95 А (рис. 9.16,6).
Видно, что группировки из четырех октаэдров имеют общие
ребра и грани.
Перейдем теперь к соединениям, вошедшим в табл. 9.23;
в структурах этих соединений присутствует одна из двух струк-
турных единиц, содержащих октаэдрические группировки ато-
мов металла. Сюда включены не только соединения ниобия и
тантала с нецелочисленной степенью окисления, но и дигалоге-
ниды молибдена, вольфрама, палладия и платины, а также
WC13. Октаэдрические группировки показаны в идеализирован-
ном виде на рис. 9.17. На рис. 9.17, а атомы X расположены в
вершинах куба, а атомы М — в центрах грани, что дает ост-
ровную группу состава М6Х8. Впервые эта группа была обна-
ружена в качестве основной структурной единицы в ряде хло-
рокомплексов молибдена. Желтый «дихлорид» растворим в
спирте; из этого раствора при добавлении спиртового раствора
AgNCK; осаждается лишь одна треть всего хлора. Из насыщен-
ного раствора дихлорида в соляной кислоте выпадают кристал-
лы «хлорокисл'оты» Нг(МобС114)-ЗНгО, которая дает соли, на-
пример (NH4J(Mo6Cli4) -H2O. При контролируемом гидролизе
раствора хлорокислоты можно выделить продукты, в которых
часть атомов хлора замещена на ионы ОН~, молекулы Н2О или
на обе эти группы. Присоединение к группировке М6Х8 6С1^
(рис. 9.17,а) приводит к (Мо6С18-С16J~, тогда как при присо-
единении 4С1~ и 2 Н2О образуется нейтральная группа
[MoftCl8Cl4(H2OJ] -6Н2О, которая присутствует в «октагидрате
дн.хлорида».
Если четыре экваториальных атома X (рис. 9.17, а) служат
мостиками для других таких же групп, то образуется слоистая
структура состава (Мо6Х8)Х4; таковы структуры МоС12, \VC12
общая грань
общее ребро
общее ребро
а
Рис. 9.16. а —группировка М3Х8 в Nb3Cl8. Атомы х2 и х3 общие для двух или
для трех групп М3Х8 соответственно; б — группировка M4XU в CsNb4Cln. Все
атомы X, относящиеся к общим ребрам или граням, участвуют в сочленении
двух групп М4Хц.
2,57/4
Рис. 9.17. Комплексные металл-кластеры М6Х8 (или МбХ8-Х6) (а), М6Х12 (б),
кристаллический МоСЬ (фрагмент) (в) и WeBrie (г).
9.10. Комплексы со связями металл — металл 119
и др. (табл. 9.23). Фрагмент структуры МоС12 показан на рис.
9.17,в. Если же все шесть атомов X будут обобществлены с
другими группировками, то это приводит к трехмерной каркас-
ной структуре состава M6XU, например Nb6lu. Выше 300°С
парамагнитный Nb6ln поглощает водород при атмосферном
давлении и образуется гидрид предельного состава NbelnH, ко-
торый при низкой температуре диамагнитен. Нейтронографиче-
ское исследование показало, что атом водорода располагается
в центре группировки Nbeln. Каркас состава Nbeln может
быть не только нейтральным, но и в виде иона, в пустотах ко-
торого располагаются, например, ионы Cs+. Кроме того, подоб-
но ЫЬб1ц, цезиевая соль может быть подвергнута гидрированию
с образованием Cs(Nb6InH), который имеет почти те же пара-
метры решетки.
При действии жидкого брома на WBr2 (W6Bri2) последова-
тельно образуются W6Bri4, W6Bri6 и W6Br18. В структуре
W6Bri6 группировки (W6Br8)Br4 соединены через линейные
группы Вг4 в бесконечные цепи (рис. 9.17,г).
Группировка, показанная на рис. 9.17,6, состава МбХ^ со-
ответствует строению одной из модификаций PdCl2 и PtCl2,
г также частиц, обнаруженных при исследовании этих веществ
в газовой фазе; для атома М осуществляется плоская квадрат-
ная координация атомами X. В структуре Zrl2 группировки
M6Xi2 упакованы таким образом, что координация атома цир-
кония дополняется пятым атомом иода, расположенным на
рис. 9.17,6 на продолжении штриховой линии. Эти атомы иода
одновременно играют роль мостиковых в соседних кластерах
Zr6li2. Поэтому половина всех атомов иода образует мостики
с двумя атомами Zr, а другая половина — с тремя. При допол-
нительной координации каждого атома М атомом X получается
состав M6Xi8; такое строение имеют молекулы в трихлориде
вольфрама. Ионы (Nb6Xi2)"+ и (ТабХ^)^ могут быть окислены,
так что п принимает значения от 2 до 4, а для соответствую-
щих ионов (M6Xi8)m~ m = 4, 3 и 2. Соли, содержащие указанные
ионы, выделены, а для некоторых определено и строение
(табл. 9.23):
(Nb6Cl18L-
(Nb6Cl18J-
(Та6С118J-
М—М, А
2,92
3,02 (см. табл. 9.23)
2,96
Как и в комплексах молибдена, основанных на фрагменте
Мо6Х8, хлорокомплексы ниобия и тантала могут включать до-
полнительные лиганды, например молекулы воды; так, в соеди-
нении Та6С1н-7Н2О структурная единица имеет состав
1Та6С112(СЬ) (Н2ОL]. Предположения о строении этой частицы
120 9. Галогены. Бинарные галогениды
высказывались ранее на основании рентгенографического ис-
следования концентрированных спиртовых растворов соедине-
ния.
Если за счет четырех дополнительных (экваториальных)
атомов X фрагменты М6Х12 соединены в слои, состав соедине-
ния отвечает формуле М6Х14; таковы, например, структуры
Nb6Clu и Та61н. И наконец, при соединении фрагментов М6Х12
с шестью другими через дополнительные атомы X получится
трехмерная каркасная структура состава M6Xi5; такого типа
структура установлена для Nb6F15, Та6С115, Та6Вг,5 и Zr6Cl]5.
Следует отметить, что группировка М6Х12, представленная
на рис. 9.17,6, соответствует также элементарной ячейке в
структуре NbO, который, как и в рассмотренных выше соедине-
ниях, содержит также октаэдры Nb6. Однако в случае NbO си-
стема связей Nb—Nb простирается через весь кристалл, что
объясняет металлический блеск и высокую электропроводность
этого оксида.
Возможно, что в структуре [N(CH3L]4Pt3Sn8Cl2o в составе
иона (Pt3Sn8Cl2oL~ имеется полиядерная тригонально-бипира-
мидальная группировка атомов металла Pt3Sri2. Это соединение
получено взаимодействием PtCl2 с SnCl2 в ацетоне в присутст-
вии ионов [N(CH3L] + [4]. Предположения о строении иона
(Pt3Sn8Cl20L^ основаны на данных ИК-спектроскошш. Синтези-
ровано еще два соединения, содержащие лиганды SnCl3. Де-
тальное строение аниона в [ (C6H5KPCH3]3[Pt (SnCl3M] (a)
определить не удалось из-за разупорядочения в кристалле [5].
Но, во всяком случае, выяснено, что это соединение не содер-
Sik
Srr
Sn
2,54 А
t Sn
Sn
R-Ptf-/-
жит полиядерных кластеров. Кластеры с тригонально-
бипирамидальным строением присутствуют в структуре
(C8H12KPt3(SnCl3J (б) {б]: длины связей Pt—Pt 2,58 A, Pt—
—Sn 2,80 А и Sn—Cl 2,39 А. О строении Pt4(OHL(CH3I2 и ему
подобных см. в гл. 27*.
* О строении халькогенгалогенндных кластеров переходных металлов см.
[Усп. химии, 1985, т. 54, № 4, с. 694—719]. — Прим. перев.
9.10. Комплексы со связями металл — металл 121
Литература. [1] J. Am. Chem. Soc, 1967 89, 159. [21 Inorg. Chem., 1968, 7,
631, 636. [31 J. Less-Comm. Met., 1966, It, 31; J. Am. Chem. Soc, 1966, 88, 1082.
[41 Iimrg. Chem., 1966, 5, 109. [51 J. Am. Chem. Soc, 1965, 87, 658. [61 Chem.
Comni., 1968, 512.
9.10.4. Низшие галогениды элементов IIIA u IVА групп. Взаи-
модействием металла и его галогенидов при высоких темпера-
турах получен целый ряд соединений со структурами, основан-
ными (как и соединения, приведенные в табл. 9.23) на кластер-
ных группировках типа М6Х8 или M6Xi2. Первым достаточно
полно охарактеризованным соединением этого типа был Gd2Cl3,
но сейчас уже известны соединения с соотношением X : М (т. е.
со средней степенью окисления металла) вплоть до 1,00. В пре-
дыдущем разделе показано, что комплексы, основанные на ок-
таэдрических кластерах, существуют при соотношении X : М в
пределах 2,00-^3,00. При снижении отношения X : М ниже 2,00
октаэдры М6 объединяются в более протяженные системы со
связями М—М путем сочленения через общие ребра. Структу-
ра GcUCb возникает за счет объединения таких бесконечных
(одинарных) цепочек (рис. 9.18, а) через атомы С1 в трехмер-
ную структуру (рис. 9.18,6). При дальнейшей «конденсации»
октаэдров М6 образуются двойные цепочки, обнаруженные в
структурах Ег617 и ТЬ6Вг7, и в конце концов двойные слои ато-
мов металла, как это имеет место в структурах ZrCl и ZrBr.
В соединениях промежуточного состава имеются дополнитель-
ные атомы М, расположенные в пустотах упаковки атомов С1,
как, например, в Sc5Cl8 и Sc7Cli0 (рис. 9.18, в и г). Эти атомы М
не дают связей М—М, но формируют собственные цепочки, со-
ставленные из октаэдрических групп МС16, сочлененных через
противоположные ребра (как это показано на рис. 9.18, в и г,
где цепочки показаны штриховой линией, а октаэдры М6 за-
штрихованы). (Ср. простую и двойную октаэдрические цепочки
на рис. 5.22, а и б). В структуре ZrCl имеются двойные слои
атомов металла, заключенные между слоями атомов хлора, как
это показано на рис. 9.18, д. При более подробном рассмотрении
этих структур следует еще принимать во внимание расположе-
ние атомов X относительно октаэдров М6, т. е. необходимо раз-
личать (хз-мостиковые атомы X, которые находятся над граня-
ми октаэдра, и цг-мостиковые атомы X, расположенные против
ребер октаэдра. Это различие соответствует введению в табл.
9.24 обозначений «тип M6Xi2» и «тип М6Х8».
Структуры ZrCl и ZrBr интересны также в связи с вопросом
о способах наложения слоев в плотнейшей шаровой упаковке.
На рис. 9.18, е для структуры ZrCl показана проекция двойного
слоя в направлении стрелки на рис. д. Если пренебречь разли-
чиями между атомами Zr и С1, то видно, что способ наложения
слоев атомов в двойном слое соответствует кубической плотней-
3,89 А
вид сбоку
С А В С А В С А
Рис. 9.18. Структуры низших галогенидов. а —цепь из октаэдров М6, сочленен-
ных по ребрам, в Gd2Cl3; б—д — проекции структур Gd2CI3, Sc5Cl8, Sc7Cl10 и
ZrCl; e — атомы одного двойного слоя в структуре ZrCl в проекции,'перпенди-
кулярной направлению стрелки на рис. д. На рис. д светлые кружки — атомы
в плоскости рисунка @10), а заштрихованные — на высоте j/='/2. На рис. е
маленькие кружочки — атомы металла, расположенные на двух уровнях в пре-
делах двойного слоя.
9.10. Комплексы со связями металл — металл 123
шей упаковке (принято обычное обозначение позиций в плотно-
упакованных структурах, см. рис. 4.7,а). Структуру ZrCl в це-
лом схематически можно представить следующим образом:
Cl Zr Zr Cl Cl Zr Zr Cl Cl Zr Zr Cl
ABCA BCAB CABC
[А] [В] [С]
и двойные слои в зависимости от типа позиций внешних слоев
атомов хлора можно обозначить как [А], [В] или [С]. Ясно,
Таблица 9.24. Строение низших галогенидов
Отно-
шение
Х:М
1,71
1,60
1,50
1,43
1,17
1,00
Соедине-
ние — родо-
начальник
структурно-
го типа
Sc7Cl12
Sc5Cl8
Gd2Cl3
Sc7Cl10
Ег6Ь
ZrCl
ZrBr
Примеры других
соединений
La7II2(Pr,Tb)
Gd5Br8(Tb)
Y2C13, Y2Br3
Tb6Br7
GdCl, TbCl, YBr \
HfCl, ScCl, YCl /
Тип комплекса со
связями М—М
Изолированные
группы МбХ12+М
Простые цепочки
типа M6Xi2+M
Простые цепочки
типа М6Х8
Двойные цепочки
типа МбХа+М.
Двойные цепочки
типа МбХ8
Двойные слои типа
м6х8
гт &
Литература
J. Am. Chem. Soc,
1978, 100, 652
J. Am. Chem. Soc,
1978, 100, 5039
Z. anorg. allg.
Chem., 1979, 456,
207
Inorg. Chem., 1977,
16, 1109
Z. Nuturforsch.,
1980, B35, 626
Inorg. Chem., 1976,
15, 1820
Inorg. Chem., 1977,
16, 2029
По многим соединениям этой группы (YCl, YBr, Y2CI3 и Y2Br3) см. литературу,
цитируемую в работе [Inorg. Chem., 1980, 19, 2128]. О структурах Ег,15 и Ег71,0 см. ра-
боту [J. Less-Comm. Met., 1980, 76, 41].
что могут реализоваться различные последовательности двой-
ных слоев. Например, в весьма сходных структурах ZrCl и ZrBr
осуществляются такие последовательности:
[А] [В] [С]... ZrCl
[А] [С] [В]... ZrBr
Возможны также и политипы. Такие структуры различаются
только типом окружения — тригонально-антипризматическим
(октаэдрическим) или тригонально-призматическим — атомов X,
находящихся на внешних поверхностях двойных слоев.
Отметим еще два общих момента. Во-первых, моногалогени-
Ды элементов Б-подгрупп, таких, как Bi (гл. 20) и Те (гл. 16),
124 9. Галогены. Бинарные галогениды
9.11. Галогениды металлов 125
как и следовало ожидать, имеют структуры совершенно друго-
го типа. Во-первых, из расчета энергетических уровней можно
заключить, что связывание между цепочками (например, в
Gd2Cl3) имеет существенно ионный характер. Это соответствует
представлению формулы соединения в виде [ (М3+J(е^K] (С1~K.
Здесь ситуация противоположна той, которая имеется для низ-
ших оксидов щелочных металлов: связывание в пределах ме-
талл-кислородного кластера преимущественно ионного типа, а
связывание между кластерами носит металлический характер.
9.11. Галогениды металлов в жидком
и газообразном состояниях
Для полного представления о структурной химии соединения
необходимо знание о его строении в твердом, жидком и газо-
образном состояниях. Количество полученной информации о
строении жидких галогенидов весьма ограниченно. Рентгеногра-
фические исследования проведены лишь для небольшого числа
соединений, например Snl4 [1], InCl3 [2] и Cdl2 [3]. Это вы-
нуждает проводить сравнение между строением кристалличе-
ского тела и пара. Строго говоря, это сравнение относится к
процессу сублимации, а если соединение обладает полимор-
физмом, то следует рассматривать кристаллическое строение
модификации, устойчивой при температуре сублимации.
Иногда о структурных изменениях можно судить на основа-
нии физических свойств. Кристаллический А1С13 имеет слоистую
структуру, и его электропроводность сильно возрастает по ме-
ре приближения к температуре плавления, но при плавлении
она внезапно понижается почти до нуля. Одновременно проис-
ходит необычно большое уменьшение плотности (почти на 45%)
за счет того, что ионный кристалл, в котором атомы А1 имеют
КЧ 6, превращается в расплав, состоящий из молекул AUClg
-[4], которые построены из двух тетраэдров А1СЦ, соединенных
по ребру; из этих частиц в основном состоит также пар при
температурах ниже ~400°С. Вязкость водных растворов ZnClo
резко возрастает при увеличении концентрации, а вязкость рас-
плавленной соли намного выше [5], чем у обычных неассоци-
ировапных дигалогепидов, например MgCl2 или CdCl2, по не-
сколько ниже, чем вязкость такого соединения, как BeF2. По-
добно ZnCl2, структура BeF2 составлена из тетраэдрических
групп МХ4, связанных через вершины (структура типа кремне-
зема). Поэтому вязкость расплавленного BeF2 при температуре
плавления [6] того же порядка, что у GeO2 и В2О3, т. е. при-
мерно в 108 раз больше, чем у «нормальных» дигалогенидов.
Интерпретация кривой рассеяния рентгеновских лучей для
стеклообразного BeF2 указывает на существование некоего
«усредненного» каркаса со структурой типа кремнезема, по-
строенного из групп BeF4. Подобным же образом высокая вяз-
кость SbF5 (при комнатной температуре) подтверждает его це-
почечную структуру, образованную из октаэдров SbF6, соеди-
ненных двумя вершинами.
Строение молекул многих галогенидов в газообразном со-
стоянии определено в большинстве случаев электронографиче-
ски. Для молекул МХ„ установлены следующие конфигурации:
МХ2 Линейная; дигалогеннды Zn, Cd и Hg j
Уголковая; дигалогениды Sn и Pb > табл. 9.25
МХ3 Плоская; тригалогеннды Al I
Пирамидальная; тригалогеннды As, Sb и Bi
МХ4 (гл. 20)
Тетраэдрическая; тетрагалогениды элементов
МХ5 IV группы (подгрупп А и Б) (табл. 21.1)
Тригонально-бипирамидальная; пентагалогени-
МХ6 ды Nb, Та, As и Sb (табл. 9.25 и 20.3)
Октаэдрическая; MoFe, WCI6, TeF6; см. также
:оединения в табл. 9.25
Разработаны разнообразные методы исследования строение
частиц в газовой фазе (главным образом дифракция электро-
нов и спектроскопия). Например, используется микроволновая
спектроскопия молекул, генерируемых либо непосредственным
испарением твердых тел (Ag—C1 2,28 A, Ag—Вг 2,39 А) [7] ли-
бо специальными методами, если частицы в газовой фазе не-
устойчивы. Так, при проведении реакции галогенидов алюминия
с металлом образуются моногалогениды (А1—F 1,6544 А, А1—
—С1 2,1298 А) [8]. Из других методов можно назвать ИК-
спектроскопию молекул в паре или замороженных в матрицах
[9], что дает оценочные значения для углов в молекулах типа
GeF2 (94+4°) и TiF2 A30+5°), а также метод, основанный на
определении дйпольных моментов [10]. При исследовании от-
клонения молекулярных пучков в неоднородном электрическом
поле было показано, что некоторые молекулы МХ2 имеют по-
стоянный электрический дипольный момент и, по всей видимо-
сти нелинейное строение [11]. Подразделение галогенидов.
II группы на два типа (линейные и уголковые) в некотором ро-
BeF, ВеС12
MgF2
CaF2
SrF2
линейные
СаС12
СаВг2
Са12
BaF,
уголковые
126 5. Галогены. Бинарные галогениды
де неожиданно, но оно подтверждено в ряде случаев результа-
тами ИК-спектроскопических исследований галогенидов в твер-
дом криптоне при 20 К.
Оценочные значения углов между связями получены для
CaF2 A40°), SnF2 A08°) и BaF2 A00°). Для других молекул
установлен только тип структуры без дальнейшего уточнения
деталей: оказалось, что молекулы FeCl2, СоС12 и NiCl2 линей-
ные (ИК-спектроскопия в матрице) [12], a SmF2, EuF2 и YbF2—
уголковые (отклонение молекулярных пучков) [13].
Соотношение между строением в кристаллическом и газооб-
разном состояниях выглядит наиболее просто в случае молеку-
лярных кристаллов, которые при испарении дают молекулы та-
кого же вида, что уже имеются в кристалле. Процесс испарения
состоит в простом отделении молекул, удерживаемых вандер-
ваальсовыми силами, что не сопровождается сильными измене-
ниями в структуре самих молекул. Молекулы могут быть моно-
ядерными (Snl4, WC16) или, реже, полимерными (А12Вг6). Во
:всех других случаях распад более протяженных систем ме-
талл—галоген идет либо сразу на молекулы МХЛ, либо сту-
пенчато на полимерные частицы, которые диссоциируют на мо-
номеры при более высоких температурах. Процесс испарения
сопровождается понижением координационного числа атома
металла (К.Ч указано в скобках).
Тип кристалли-
ческой струк-
туры
Трехмерный
Слоистый
Молекулярный
Галогснид
LiCi F)
CuCl D)
Cdl2 F)
Sbl3 C+3)
A1C13 F)
Nb2Cl,0 F)
Частицы в паре
Li2Cl2 B)->-LiCI A)
Cu3Cl3 B) [-»CuCl AI
Cdl2 B)
Sbl3 C)
A12C16 D) [-+AICI3 C)]
NbCl5 E)
-Строение молекул некоторых галогенидов в газовой фазе тес-
но связано со структурой кристаллов (рис. 9.19).
Масс-спектроскопическое исследование паров галогенидов
щелочных металлов показало, что среди ионов, получаемых
электронным ударом, присутствуют димеры, тримеры, а в не-
.которых случаях и тетрамеры, Галогениды лития отличаются
тем, что в их парах присутствует больше димерных, чем моно-
мерных молекул.
Строение трех димеров Li2X2 было установлено электроно-
трафически. Как и следовало ожидать из теоретического рас-
смотрения в предположении преимущественно кулоновского
взаимодействия между противоположно заряженными ионами,
9.11. Галогениды металлов 127
окружение
в кристалле
РЫ?
Рис. 9.19. Взаимосвязь кристаллической структуры и строения молекулы в га-
зообразном состоянии, а — молекулы АХ, А2Хг и А4Х4, производные от струк-
туры типа NaCl; б — молекулы АХ2 и АХ3, производные от галогенидов СО'
слоистой структурой.
димерные молекулы имеют плоское ромбовидное строение. Дли-
ны связей М—X являются промежуточными между длинами в
мономерной молекуле и кристалле (табл. 9.25). Димеры обна-
ружены и в парах TIBr [14].
Плоское строение (а) установлено для димерных молекул в
парах FeCl2, СоС12 и NiCl2 [12], а неплоское (б) —для диме-
ров GeF2 [15], аналогичных по строению Se2O4.
С1
М
М
С1
Ge
Ge
а б
При температурах выше 435 °С CuCl имеет разупорядочен-
ную структуру вюртцита. Масс-спектральными исследованиями:
доказано, что при 450 °С в насыщенном паре преобладают мо-
лекулы Си3С13. В одном из ранних электронографических ис-
следований ;[16] для этой молекулы была предложена почти
плоская 6-угольная конфигурация, но более точные сведения-
° строении пока отсутствуют. В более поздней работе по масс-
спектрометрии пара, находящегося в равновесии с твердым
^ "' B80—430 °С), обнаружены молекулы Си3С13 и Cu4CU
Таблица 9.25. Межатомные расстояния в молекулах некоторых галогенидов
X
С1
Вг
I
мономер
2,02
2,17
2,39
Li-
-X.
димер
2,
2,
2,
2,
23
17
35
54
А
кристалл
2
2
3
,57
,75
,03
Угол X—М—X в ди-
мере, град
108D)
116
110D)
116D)
J.
Z
Chem.
Phys.
Литература
Phvs.,
Chem.,
1960,
1960,
33,
213
685
, П1
Линейные молекулы МХ2 [2]
Zn
Cd
Hg
F
1,81
1,97
—
Cl
2,05
2,21
2,25
Br
2,21
2,37
2,44
i
2,38
2,55
2,61
LiF
LiCl
LiBr
Lil
NaF
NaCl
NaBr
Nal
KF
KC1
KBr
KI
RbF
RbCl
RbBr
Rbl
CsF
CsCl
CsBr
Csl
M—X,
Пар [11
1,5639
2,021
2,1704
2,3919
1,926
2,3606
2,5020
2,7115
2,171
2,6666
2,8207
3,0478
2,266
2,7868
2,9448
3,1769
2,3453
2,9062
3,0720
3,3150
A
Кристалл
2,009
2,566
2,747
3,025
2,307
2,814
2,981
3,231
2,664
3,139
3,293
3,526
2,815
3,285
3,434
3,663
3,005
3,560a
3,713a
3,950a
A1F3
A1C1
AIL;
FeCl
Плоские mo
По, Щ
3
з Г5]
лекулы
MX,
M-X, I
1,
2,
2,
2,
63
06
42
14
Нелинейные молекулы MX2 [3]
Sn
Pb
2
2
Cl
,42
,46
2
2
Br
,55
,60
2
2
I
,73
,79
CuCl
CuBr
Cul
F6]
2
2
2
,051
,173
,338
9.11. Галогениды металлов 129
M2X6[Aj:
А12С1б [4]
Al2Bre [4]
A12I6 [4]
Ga2Cl6 [4]
Ga2Br6 Г4]6
Fe2Cl6 [51
м~Хконц'
2,07
2,22
2,45
2,10
2,25
2,11
A
М-Хмост. А
2,25
2,41
2,63
2.30
2,45
2,28
Октаэдрические молекулы MF6 [9]
w
Os
Ir
M—F
1,833
1,831
1,830
U
Np
Pu
M-F
1,996
1,981
1.971
Продолжение
GaF [7]
GaCl
GaBr
Gal
InF
T1F
T1C1 [8]
TIBr
Til
1,775
2,20
2,35
2,57
1,985
2,084
2,55
2,68
2,87
Hg2Cl2 [12] Hg—C12,23
Тригонально-бипирамидальные моле-
кулы MX5
NbF5
TaF5
M—X
[131
1,88
1,86
NbCl5
NbBr5
M—X
114]
2,29
2,46
TaClj
TaBr5
M-X
L14]
2,3
2,45
аСтруктурный тип GsCl.
бВ более ранней работе [J. Am. Chem. Soc, 1942, 64, 2514] для Ga2Brs и InjX,
приведены лишь усредненные значения для связей М—Хк и М—Хм.
[1] J. Chem. Phys., 1964, 40, 156. .[2] ЖФХ, 1956, 30, 155; Bull. Chem. Soc. (Japan),
1973, 46, 410. 13] Trans. Faraday Soc., 1941, 37, 406. [4] Shen Q., Dissert., Oregon State
University, Corvallis, Oregon, 1973. ,[5] Teplfiz. Vys. Temp., 1964, 2, 705. i[6] J. Chem.
Phys., 1975, 62, 1040, 4796; 1975, 63, 2724. i[7] J. Chem. Phys., 1966, 45, 263. [8] Ann.
Phys.,1936, 26, 1. [9] J. Chem. Phys., 1968, 48, 4001. A01 Кристаллография, 1959, 4, 186.
[Ill Ж. структ. химии, 1967, 8, 391. [12] Ann. Phys., 1940, 57, 21. [13] Вестн. МГУ, сер. 2,
химия, 1968, т. 9, №. 5, с. 7. [14] Trans. Faraday Soc, 1940, 36, 668.
в сравнимых концентрациях и C115CI5 в более низкой концентра-
ции [17]. Пары ReCl3 и ReBr3 в температурном интервале 240—
350 °С почти целиком состоят из тримеров. Согласно электроно-
графическим данным, в парах молекулы Re3Br9 ![17] имеют
строение, сходное со структурой Re3l9 в кристаллическом три-
иодиде. Также электронографически установлено, что при низ-
ких температурах в парах над NbFs и TaF5 имеются цикличе-
ские тетрамеры, построенные из октаэдрических групп, соеди-
ненных через вершины; при более высоких температурах тет-
9—985
130 9. Галогены. Бинарные галогениды
рамеры разрушаются и образуются тригонально-бипирамидаль-
ные молекулы (табл. 9.25).
В противоположность примерам, указанным на рис. 9.19,
при испарении других веществ происходят более существен-
ные изменения в окружении ближайшими соседями. Например:
Кристаллический А1С13
(октаэдрическая
координация)
Кристаллический NbCls
(октаэдрические димеры
NbjClio)
испарение
Димер А!2С1б
-¦ (тетраэдрическая
координация)
" NbClg
(тригональ-
но-бипира-
мидальние
молекулы)
В табл. 9.25 включены данные о межатомных расстояниях,
которые не вошли в материал других глав.
Литература. [1] J. Am. Chem. Soc, 1952, 74, 1763. [21 J. Am. Chem. Soc, 1952,
74, 1760. [3] J. Am. Chem. Soc, 1953, 75, 471. [4] J. Am. Chem. Soc, 1951, 73,
3151. [5] J. Chem. Phys., 1960, 33, 366. [6] J. Chem. Phys., 1960, 32, 1150. [7] J
Chem. Phys., 1966, 44, 391. [8] J. Chem. Phys., 1965, 42," 1013. [91 J. Chem. Phys.,
1965, 42, 902. [10] J. Chem. Phys., 1964, 40, 3471. [11] J. Chem. Phys., 1963, 39,
2023; J. Am. Chem. Soc, 1964, 86, 4544. [121 J- Chem. Phys., 1968, 49, 4379.
[13] J. Chem. Phys., 1972, 56, 5392. [14] J. Phys. Chem., 1964, 68, 3835. [151
Inorg. Chem., 1968, 7, 608. [161 J. Am. Chem. Soc, 1957, 61, 358. [17] J. Chem..
Phys., 1971, 55, 4566. [18] Ж- структ. хим., 1971, 12, 315
10 КОМПЛЕКСНЫЕ ГАЛОГЕНИДЫ,
' ОКСО- И ГИДРОКСОГАЛОГЕНИДЫ
10.1. Комплексные галогениды
Комплексные галогениды — это твердые соединения, содержа-
щие два или более вида ионов металлов (или других катионов)
•и, обычно, один тип атомов галогена. Наиболее простые соли
этого типа содержат только два вида катионов и общий анион;
раньше их называли «двойными солями». Общепринято не от-
носить к комплексным галогенидам твердые растворы типа
(Na,K)Cl, состав которых может меняться в пределах, опреде-
ляемых соотношением размеров двух катионов; однако стехио-
метрические соединения со статистическим размещением двух
или более видов катионов также относят к комплексным гало-
генидам (см. ниже). Известны также соединения металла с бо-
лее чем одним видом галогена, например CaFCl (со структурой
типа PbFCl; разд. 10.4.5), PbClBr [1] (со структурой типа
РЬС12; разд. 6.8) и CsICl2 (гл. 9). Многие комплексные галоге-
ниды не содержат в своем составе воды, другие в той или иной
степени гидратированы. За несколькими исключениями, гидра-
тированные соли в этой главе не рассматриваются; их строе-
ние описано в гл. 15.
Ниже мы ограничимся обсуждением строения комплексных
галогенидов в кристаллическом состоянии. По-видимому, в па-
рах многих комплексных галогенидов существуют молекулы
типа NaBeF3, Na2BeF4, NaAlF4, Na2AlF5 и т. д. Электроногра-
•фические исследования газовой фазы при высоких температу-
рах были выполнены преимущественно советскими учеными.
Здесь не будут обсуждаться различные модели строения, пред-
ложенные для этих молекул, поскольку интерпретация элект-
ронографических данных весьма затруднена из-за больших амп-
литуд тепловых колебаний; кроме того, в краткой форме до-
вольно трудно дать достойную оценку исследованиям в этой
области. Обзор многих из этих работ содержится в книге [Хар-
¦гиттаи М., Харгиттаи И. Геометрия молекул координационных
соединений в парообразной фазе: Пер. с англ. — М.: Мир,
* См. также [Вилков Л. В., Мастрюков В. С, Садова Н. И. Определение
геометрического строения свободных молекул.— Л.: Химия, 1978; Vilkov L. V.,
Mactryukov L. S., Sadova N. I. Determination of the geometrical Structure of
free Molecules. —Moscow: Mir, 1983]. — Прим. перев.
132 10. Комплексные галогениды, оксо- и гидроксогалогениды
Таблица 10.1. Строение
Характеристика структур-
ного типа
А„,ВХ,
АтВХ.
а. Статистика или сверх-
структурное упорядо-
чение в рамках струк-
турных типов АХЛ
Флюорит
Трирутил
LaF3
ReO3
VF3
Ge3N4 (фенакит)
[Каркасные структуры
Перовскит
б. Слоистые структуры
(Слои+ионы Х~)
в. Цепочечные структуры
(Цепочки+ионы Х~)
г. Моноядерные
(+ионы Х-)
д. Полиядерные
е. Комплексные ионы
двух типов
АВХ3
K2CtrCls
CsBeF3
CsNiCl3
NH4CdCIa
a-NaYFi
Li2BeF4
K2NiF4
T1A1F4
BaMnF*
K2HgCU- H2G
Структуры, содержащие дискретные
fK2PtCU
См. текст
Эмпирические формулы комплексных галогенидов могут
быть весьма различной сложности, например CsAgb, CsHgCl3,
TIAIF4, CS3C0CI5, Na3AlF6, Na5Zr2F13, Rb2Fe5F17 и Na7Zr6F3i. Как
это справедливо вообще для химии твердого тела, сходство в
типе формул не означает, что соединения имеют сходное строе-
ние. Так, структуры соединений KMgF3, NH4CdCl3 и CsAuCl3
совершенно различны. Кроме того, ни в одной из структур этих
солей АВХ3 не содержатся отдельные комплексные ионы ВХ3;
на самом деле в структуре CsAuCl3 имеется два вида ионов, и
его формулу лучше записывать как Cs2(AuCl2) (АиСЦ).
10.1. Комплексные галогениды 133
комплексных галогенидов
Атвх6
Атвх7
Tl2AlFs
(NH4JMnF5
комплексные ионы
О ионах CuCl53-, InCl52-,
s" см. соответст-
вующие разделы
Cs3(CoCl4)Cl
a-K2UF6
Li2TiF6
BaThFe
CaPbFe
LiSbF6
Ba(CrF4)F2
(NH4JCeF6
K2ZrF6
RbPaF6
Sr(PbF6)F
ABX6
A2BX6
A3BX6
A4BX6
K2PaF7
K3ZrF7
K2NbF7
K2TaF7
(NH4K(SiF6)F
Большинство рассматриваемых ниже соединений имеют об-
щую формулу AmBXn, хотя мы коснемся некоторых соединений
с более сложными формулами. Среди них важное место за-
нимают биядерные комплексные ионы, например ВгХц, В2Хю
и В2Х9, образованные двумя октаэдрическими группами, соеди-
ненными через общую вершину, ребро или грань. Более слож-
ные «металл-кластерные» ионы описаны в гл. 9. Если считать,
что В — катион с более высоким зарядом, чем А (или что сте-
пень окисления В выше, чем А), большинство комплексных га-
логенидов должно содержать ионы А+ (ионы щелочных метал-
134 10. Комплексные галогениды, оксо- и гидроксогалогениды
лов, Ag+, T1+, NH4+ и т. д.) или А2+ (ионы щелочноземельных
металлов и др.)- При значениях п, не превышающих 6, возмож-
ны следующие типы комплексных галогенидов:
А'В'Х,
А'В"Х,
A'BI"X4
A,'B"X4
(AnB"X
4)
ArBIVX3
A21BI1IX3
ЛпВП1Хз
А'ВуХб
Ao'BIVX6
A"B1VX6
А3'ВШХ6
(AIIIBIIIX6
Большая часть известных комплексных галогенидов пред-
ставлена фторидами; в частности, те из них, у которых n^s7, —
почти исключительно фториды элементов IV—VI групп, Се и
5/-металлов.
В простейших случаях комплексный галогенид имеет струк-
туру бинарного галогенида (или оксида) АтХп, причем атомы
А и В занимают (статистически или упорядочение) положения,
соответствующие атомам одного вида в структуре бинарного
галогенида (или оксида). Это соответствует в табл. 10.1 первой
группе (а). Подобные соединения относятся к ионным кристал-
лам, причем основное условие для построения такой кристал-
лической структуры состоит в том, чтобы ионы А и В имели
близкие размеры и требуемый заряд, например Na+Y3+F4 или
K2+U4^F6 (со структурой флюорита). Совсем иного типа струк-
туры образуются, если ионы А и В сильно различаются по раз-
меру, как, например, в CsBe2Fs (см. далее) или в CsMnF3-II
(разд. 13.3.1). В структурах обоих соединений имеется заря-
женный трехмерный каркас, построенный из связанных верши-
нами полиэдров МХЯ, содержащих ионы небольших размеров
(тетраэдры BeF4 и октаэдры MnF6 соответственно); в этом кар-
касе ионы Cs+ занимают большие пустоты; они окружены
12 ионами F~.
Другие комплексные галогениды удобно классифицировать
в зависимости от типа групп, образуемых в структуре атомами
В и X. Из этих атомов могут формироваться конечные группы
(в простейшем случае моноядерные группы ВХп) или бесконеч-
ные системы, если атомы В соединяются друг с другом через
мостиковые атомы X с образованием одно- или двумерных
комплексных ионов, что и отражено в делении комплексов на
группы в табл. 10.1. Далее отдельно выделяются структуры, со-
держащие дополнительные ионы Х~ (не координированные
атомами В). В принципе было бы логичным выделить в от-
дельную группу и трехмерные системы связанных атомов В и
X. Например, в структуре типа перовскита АВХ3 атомы В и X
образуют трехмерный каркас из октаэдров, соединенных через
вершины (структура типа ReO3); ионы А с координационным
числом 12 занимают пустоты в каркасе. Однако такое выделе-
10.1. Комплексные галогениды 135
ние В—Х-комплексов малооправданно в случае ионных фто-
ридов первой группы («а»), особенно для тех из них, которые
имеют разупорядоченные структуры (см. далее), поскольку это
повело бы к распределению этих структур по разным группам
(«б», «в» и «г»). По-видимому, более целесообразно объеди-
нить такие структуры в одну подгруппу в рамках группы «а»,
с тем чтобы подчеркнуть их взаимосвязь со структурами более
простых типов. Так, в структуре Li2BeF4 можно выделить дис-
кретные ионы BeF42~, но поскольку в этой структуре тетраэдри-
чески координированы и Li+, и Ве2+, ее с равным успехом мож-
но отнести к одному из типов А3Х4. Аналогичным образом со-
единение Li2TiF6 (сверхструктура от структуры рутила АХ2)
можно было бы поместить и в группу «г», поскольку в структу-
ре имеются ионы TiFe2"". В то же время если координационное
число атома В (или А) больше, чем отношение X : В (или
Х:А), то координационные группы вокруг атома В (А) долж-
ны сочленяться за счет общих атомов X. Подобная ситуация
характерна для K.2UF6 со структурой (статистической) типа
флюорита. Величина отношения F : U показывает, что коорди-
национные группы UF8 должны иметь общие атомы F; однако
протяженность U—F-комплексов (степень олигомеризации
групп UF8) изменяется в структуре по статистическому закону,
так что однозначное ее отнесение к одной из групп «б» — «г»
становится невозможным.
При образовании ионных соединений AmBXn способ упаков-
ки ионов А, В и X должен соответствовать максимальному зна-
чению энергии решетки. Принадлежность ионов X одновремен-
но нескольким координационным группам ионов В (А), по-ви-
димому, является следствием необходимости достижения при-
емлемых координационных чисел для А и В. Это видно из сле-
дующего сопоставления:
Соединение
Характеристика структуры
КЧ атома А
КЧ атома В
CaPbF6 Сверхструктура ReO3 (дискретные
ионы PbF62~)
SrPbF6 Линейные ионы {РЪ?ь)п"~ и ионы F~
BaPbF6 Структура типа BaSiF6 (дискретные
ионы PbF62-)
10
12
На примере структуры SrPbF6 хорошо видно, что соответствие
отношения F : В координационному числу В еще не определяет
фактического присутствия дискретных групп BF6, хотя это и
имеет место в структурах многих соединений типа АВХ6 и
136 10. Комплексные галогениды, оксо- и гидроксогалогениды
А2ВХ6. Так, в структуре Ba2ZnF6 содержатся слои состава ZnF4
и 2 иона F~, а не дискретные ионы ZnFV".
Близость размеров и электроотрицательностей F~ и О2~ при-
водит к значительному структурному сходству между бинар-
ными фторидами и оксидами, тогда как структура галогенидов
с более тяжелыми галогенами обычно родственны структурам
Таблица 10.2. Изоструктурные комплексные хлориды и оксиды
Комплексный оксид
Комплексный хлорид
Литература
Ильменит
Перовскит
ВаТЮ3 (гексагональный)
Sr2Ti04 (K2NiF4)
А12Ве04
P-K2SO4
Sr2Pb0«
Шпинель (обращенная)
Ва3МоО5 (M=Si, Ge,Ti V
и др.)
Sr3Ti207
Sr4MoO6 (M=Pt, Ir, Rh)
Mg6Mn08
NaMnCl3
KMnCl,
RbMnClj
K2MgCl4
Na2ZnCl4
Cs2CoCl4
Na2MnCU
Li2MCl4 (M=Mg, Mn, Fe,
Cd)
CS3C0CI5
Rb3Mn2Cl7
K4CdCl6
Na6MCl8 (M=Mg, Mn,
Fe, Cd)
Acta cryst., 1973, B29,
1224
J. Chem. Phys., 1966, 45,
4652
Acta cryst., 1977, B33,
256
Acta cryst., 1977, B33,
188
Кристаллография, 1956,
1, 291
Acta Cryst., 1971, B27,
1672
Acta cryst., 1975, B3I,
2549
Acta cryst., 1980, B36,
2893
Acta cryst., 1978, B34,
2617
Acta cryst., 1959, 12,
519
Acta cryst., 1975, B31,
770
сульфидов. Это различие между фтором и другими галогенами
сохраняется и в комплексных галогенидах, но оно выражено
здесь менее отчетливо, чем в простых галогенидах. Много при-
меров структурного сходства с комплексными оксидами можно
найти не только среди комплексных фторидов, но также и у
комплексных хлоридов (табл. 10.2).
Отметим еще следующее. Понятно, что во многих комплекс-
ных галогенидах переходных металлов и металлов Б-подгрупп,
особенно в хлоридах, бромидах и иодидах, имеются определен-
ные различия в степени ионности (ковалентности) связей А—X
В—X. Однако выделение цепочек, слоев и т. д. в структурах
комплексных фторидов делается в основном для удобства опи-
сания и классификации соединений, а не из-за различий в ха-
10.1. Комплексные галогениды 137
рактере связей А—X и В—X. Так, например, в структуре
NaKThF6 [2] ион Na+ (меньший по размеру катион) координи-
рован шестью, а ионы К+ и Th4+ оба девятью ионами фтора.
В координационных группах, образуемых вокруг К и Th, есть
общие атомы F, а в координационных октаэдрах Na все атомы
фтора — концевые. Однако выделять группы NaF6 в качестве
комплексного иона только по той причине, что у них нет мости-
ковых ионов фтора, все-таки нельзя.
Устойчивость кристаллического комплексного галогенида
зависит от природы (размера, формы и заряда) всех имеющих-
ся ионов; в частности, устойчивость комплексного иона ВХЯ за-
висит от размера иона А. Многие комплексные ионы были вы-
делены только в комбинации с крупными катионами. Напри-
мер, соли l[N(C2H5L]2CeBr6 и [N(C2H5L]2CeI6 можно получить
в ацетонитрильном растворе, исходя из твердого хлорида и без-
водной кислоты НХ. В сочетании с катионом [(С6Н5)зРН] +
удалось синтезировать соли анионов PrI63~ (и другими гекса-
иодоанионами 4/-металлов), FeI4~, kuU~ и др. В водных рас-
творах гексахлоро-анионы МС163~ Зй-металлов неизвестны, но
они устойчивы в виде солей в присутствии крупных катионов,
таких, как Co(NH3N3+. Многие комплексные хлориды, бромиды
и иодиды, которые не удавалось выделить из водных раство-
ров, синтезированы в безводных условиях, т. е. при использова-
нии неводных растворителей или кристаллизацией из распла-
вов.
Уже для очень многих комплексных галогенидов выполнены
структурные исследования, однако некоторые группы этих со-
единений еще требуют детального изучения. Это прежде всего
соединения, образованные галогенидами щелочных и щелочно-
земельных металлов [3]:
КСаС13
K2SrCl4
KSr2Cl5
К2ВаС14
NaCa2Br5
КСаВгз
LiSr2Br5
K2SrBr4
KSr2Br5
K2BaBr4
Соединения KSr2Cl5 и KSr2Br5 относятся к группе комплекс-
ных галогенидов, изоструктурных соответствующим соединени-
ям свинца (II) (разд. 26.7.3).
Число известных комплексных фторидов щелочных металлов
и металлов I—IV групп велико (см. литературу, цитируемую
в работе [4]). Структуры RbBe2F5 [5] и CsBe2F5 [6] уже упо-
минались в гл. 3 как примеры структур с плоскими шести-
угольными сетками и кубическими A0,3) -сетками. У каждого
138 10. Комплексные галогениды, оксо- и гидроксогалогениды
тетраэдра BeF4 мостиковыми являются три вершины, за счет
чего формируется либо слой, либо трехмерный каркас состава
Be2F5.
Далее изложение следует в соответствии с наиболее важ-
ными группами комплексных галогенидов и основано на деле-
нии, предлагаемом в табл. 10.1 (до группы «г») с включением
небольшой группы галогенидов состава АВХ2. Затем рассмотре-
ны группы «д» и «е» и, наконец, некоторые специфические груп-
пы комплексных галогенидов отдельных элементов.
Литература. [11 Acta cryst., 1969, В25, 796. [2] Acta cryst., 1970, B26, 1185.
j31 Inorg. Chem., 1965, 4, 1510; Acta Chem. Scand., 1966, 20, 255. [4] Inorg.
Chem., 19-62, 1, 220. [5] Acta cryst., 1972, B28, 1159. [61 Acta cryst., 1972, B28,
2115.
JO.1.1. Галогениды АВХ2. Число таких соединений невелико, по-
скольку они могут образоваться только с участием однозаряд-
ных катионов. Многие пары галогенидов щелочных металлов
дают твердые растворы (в некоторых случаях во всей области
составов), и лишь первый и последние члены ряда щелочных
металлов образуют соединения (RbLiF2 и CsLiF2). В структу-
рах этих фторидов тетраэдрические группы L1F4 образуют
слои путем сочленения через ребро и две вершины; ионы вто-
рого щелочного металла занимают большие по размеру пусто-
ты между слоями (восьмерная координация в виде искаженной
антипризмы). В структуре RbLiF2 расстояния 8Rb—F находят-
ся в пределах 2,78—3,16 А (среднее 2,95 А), а в CsLiF2 два из
восьми соседей иона цезия более удалены, чем остальные шесть
(Cs—6F 2,96-7-3,15, среднее 3,07 A, Cs—2F 3,50 и 3,53 А)
[Inorg. Chem., 1965,4, 1510].
10.1.2. Галогениды АтВХ3- Это большая группа комплексных
галогенидов; структуры определены не менее чем для 60 со-
единений. Установлено, что анион может быть двух типов —
цепочечный и трехмерный каркасный. Цепочка наиболее про-
стого вида образуется при соединении тетраэдрических групп
ВХ4 через две вершины (а). Цепочки такого строения обнару-
жены в структурах сравнительно небольшого числа соединений,
например в CsBeF3 [1], KHgBr3-H2O [2], K2CuCl3, Cs2AgCl3
и Cs2AgI3 (см. гл. 26). В различных структурах цепочки распо-
X
В В
/\ /\
X X X X
X X
х \ / \ / \ /
" ^ -в-х-в-х-в-
/ \ / \ / \
X X
Y
X
X
10.1. Комплексные галогениды '39
лагаются таким образом, чтобы создать подходящее окружение
для крупных ионов А+, а в K.HgBr3-H2O между цепочками на-
ходятся и молекулы воды. В отличие от структуры этого моно-
гидрата в структуре a-K.ZnBr3-2 Н2О содержатся дискретные
тетраэдрические группы [ZnBr3(H2O) ]~, и поэтому формулу
этого соединения следует представить в виде К[2пВг3(Нг0)] •
¦Н2О [3]. Цепочка типа б образована из октаэдрических групп
ВХ6, сочлененных по противоположным граням. Такое строение
имеет анион в структуре BaNiO3, к которой мы вернемся поз-
же. В двойной цепочке в каждая октаэдрическая группа ВХ6
имеет по четыре общих ребра с другими. Как и цепочки типа а,
двойные цепочки в представлены лишь небольшим числом
структур, например NH4CdCl3, RbCdCl3 и KCuCl3 (в последнем
соединении обнаружены в несколько измененном виде) (разд.
25.7.6).
В подавляющем большинстве комплексных галогенидов
АВХ3 атом В имеет октаэдрическую координацию. Все элемен-
ты Mg, V—Си, Zn, Hg и Pb образуют один или более комп-
лексный галогенид с Ag, Na—Cs или с большими катионами
типа [N(CH3L]+, хотя при заданной комбинации А и В реа-
лизуются не все возможные соединения. Так, например, в си-
стеме Cs—Zn—F образуется только одно соединение Cs4Zn3Fi0
(хотя существует RbZnF3), а в системе Cs—Mg—F найдено
также лишь одно соединение Cs4Mg3Fi0 (но не CsMgF3), в то
время как получены и CsMgCl3, и CsMgBr3, и CsMgI3.
Структурная химия многих из этих соединений, в особенно-
сти галогенидов, содержащих большие катионы К+, Rb+ и Cs+,
весьма сходна со структурной химией оксидов АВО3, базирую-
щейся на плотноупакованных слоях АО3 (более подробно см.
гл. 13). Наиболее часто встречающиеся структуры — это тип 3 С
(тип перовскита) и 2Н (тип BaNiO3) [4]; еще можно назвать
4Н (CsCuBr3), 6H (CsFeF3> CsMnF3l RbMnCl3( CsCdCl3) и 9R
(CsCoF3 [5], CsMnCl3). В некоторых случаях реализуется
«идеальная» структура с максимальной симметрией, как, на-
пример, в KNiF3, KMgCl3 и CsPbCl3 (выше 320 К) [6]; как и в
оксидах, обнаружены структуры с искажениями. Например, в
NaMgF3 (и в соединениях Со, Ni и Zn) реализуется вариант
перовскитоподобной структуры типа GdFeO3 (разд. 13.3.2, а),
тогда как NaMnF3, NaCuF3 и NaCrF3 характеризуются сверх-
структурой от типа перовскита. В KCuF3 ион Си2+ приобретает
в результате искажения структуры координацию 2+2+2: 2F
на расстоянии 1,89 A, 2F —на 1,96 А и 2F — на 2,25 А [7]. Не-
сколько типов искажений может быть у структуры 2Н. Струк-
тура типа CsNiCl3, характеризующаяся плотнейшей упаковкой,
в случае KNiCl3 :[8] видоизменяется таким образом, что менее
крупный по сравнению с Cs+ катион К+ имеет КЧ 9 вместо 12
140 10. Комплексные галогениды, оксо- и гидроксогалогениды
(для Cs+ в цезиевой соли). Различного типа искажения харак-
терны и для соединений, содержащих ионы Си2+ и Сг2+ и
склонных к проявлению эффекта Яна — Теллера. В одной из
структур ион Сг2+ имеет координацию 3+3 [9], а в полиморф-
ных модификациях RbCrCl3) CsCrCl3 и соответствующих иоди-
дов |[10] осуществляются координации типа 4+2 и 2+4. Иска-
женный вариант структуры CsNiCl3, реализующийся в структу-
ре CsCuCl3, показан на рис. 4.32.
Формулы таких солей, как A2(Pt2Br6) (разд. 10.1.8) и
Cs2(AuCl2) (AuCl4) (разд. 10.1.9), содержащих соответственно
мостиковый биядерный анион и два аниона различного типа,
не следует «сокращать», т. е. сводить к более простому виду
АВХ3.
Литература. [1] Acta cryst., 1968, В24, 807. [2] Acta cryst., 1969, B25, 647.
[3] Acta cryst., 1968, B24, 1339. [4] Acta cryst., 1973, B29, 1330. [5] Z. anorg.
allg. Chem., 1969, 369, 117. [6] Acta cryst., 1980, B36, 1023. \T] Z. anorg. allg.
Chem., 1963, 320, 150. [8] Acta cryst., 1980, B36, 28. [9] J. Chem. Phys., 1972,
57, 3771; Acta cryst., 1973, B29, 1529. [101 Acta cryst., 1978, B34, 1973; J. Solid
State Chem., 1980, 34, 65.
10.1.3. Галогениды AmBXt. Большинство соединений этой груп-
пы имеют состав АВХ4 (А'В11^ и AnBnX4) и А21ВПХ4. Среди
них встречаются как типичные ионные фториды, содержащие
крупные катионы с высокими координационными числами (на-
пример, девятерная координация для обоих видов катионов в
одной из модификаций KCeF4; разд. 28.2.4, в), так и цепочечные
и слоистые структуры с октаэдрической координацией металла
(описанные в гл. 5) и, наконец, многочисленные соединения ти-
па АВХ4 и А2ВХ4 с дискретными ионам ВХ4. Для соединений
состава АВХ4 с большими катионами возможны структуры ти-
па флюорита. Это могут быть структуры со статистическим
распределением катионов (например, во второй модификации
KCeF4) или сверхструктуры. Интересная искаженная сверх-
структура типа флюорита обнаружена у некоторых фторидов
ABF4 (где А = Са или Sr, В = Сгп или Си11), причем ионы пере-
ходного металла имеют искаженное тетраэдрическое окруже-
ние ближайшими соседями вместо обычной для флюорита ку-
бической координации (КЧ 8). Эта структура описана среди
флюоритовых структур в гл. 6.
Слои октаэдров могут быть двух типов (разд. 5.3.3): пло-
ский (транс) слой, образованный соединением октаэдрических
групп ВХ6 через все экваториальные вершины, и гофрирован-
ный (цис) слой, в котором две немостиковые вершины занима-
ют ^ис-положение друг относительно друга, например:
, ( структура типа K2NiF4: K2MF4 (M=Mg, Zn, Co, Си (искаж.))
транс-слой | структу;;а ТИПа T1A1F4: |3-RbFeF4 [1]
цис-слоа структура типа BaMnF4 [2]: SrNiF4, BaMF4 (M=Mn, Fe, Co,
Ni, Cu, Zn)
10.1. Комплексные галогениды 141
В структурах K2NiF4 (рис. 5.16) и T1A1F4 (рис. 10.10) слои
BF4 чередуются со слоями ионов А. В [NH3(CH2LNH3]MnCl4
[31 линейные катионы, несущие на обоих концах положитель-
ный заряд, ориентированы перпендикулярно плоскости слоев,
причем концевые группы NH3^ располагаются в углублениях
соседних слоев.
По аналогии с двумя типами слоев ВХ4 и в цепочечных
структурах концевые вершины группы ВХ6 могут занимать
транс- или цыс-положения. В первом случае говорят о цепочке
«рутилового» типа, поскольку октаэдры в ней сочленяются по
параллельным ребрам. Подобные цепочки обнаружены в
структуре K2HgCl4-H2O (рис. 1.12) и в варианте с искаженной
D+2)-координацией в Na2CrF4 и Na2CuF4 [4]. Известны также
соединения с винтовыми цепочками ВХ4, в которых немости-
ковыми являются две цис-вершины каждой группы ВХ6 (разд.
5.3.3); простейший вариант такой структуры реализуется в
CsCrF4 [5]. Большинство дискретных ионов ВХ4 имеют форму
тетраэдра, и многие комплексные галогениды изоструктурны
оксосолям с тем же типом формулы, например*:
NH4BF4 и RbBF4 изоструктурны BaSO4
Cs2CoCl4 и Cs2ZnCl4 изоструктурны Кг5О4
Фенакитовая структура (разд. 3.5.1) Li2BeF4 [6] может быть
описана либо как содержащая тетраэдрические ионы BeF42",
либо с учетом того, что и Li+, и Ве2+ координированы тетраэд-
рически как трехмерная ионная структура. Атомы Li и Be на-
ходятся в узлах C,4)-связанной сетки. В структуре
(N2H5)LiBeF4 [7] эти же атомы рас-
полагаются в узлах трехмерной 4-свя-
занной сетки, а ионы N2Hs+ — в кана-
лах.
Некоторые хлоро-, бромо- и иодо-
ионы, которые не могут быть выделе-
ны из водных растворов в виде солей
с катионами металлов, стабилизиру-
ются в присутствии очень крупных ка-
тионов, например в виде (NEt4LMBr4
(M=Mn, Fe) и ;[(C6H5KAs(CH3)]2FeI4
[8]. Строение ряда ионов типа МС14"~ изучено в солях типа
[(C6H5KAs(CH3)]2NiCl4 [9] и [(C2H5LN]InCl4 [10].
В структурах Cs2CuCl4 и Cs2CuBr4 анионы имеют форму
уплощенного тетраэдра (гл. 25), а в K2PtCl4 и в изоструктур-
* Следует отметить изоструктурность комплексных фторида K2NiF4 и
оксида La2Cu04, при легировании которого щелочноземельными элементами
впервые получены высокотемпературные сверхпроводники fPhvs. Rev Letters
1987, 58, № 10, 1024, 1028]. — Прим. перев.
Рис. 10.1. Кристаллическая
структура K2PtCI4.
142 10. Комплексные галогениды, оксо- и гидроксогалогениды
ном палладиевом аналоге ионы ВХ42" — плоские (рис. 10.1).
Похожее строение имеет и РсЦЫНз^СЬ-НгО, причем ионы
Pd(NH3L2+ занимают положения ионов PtCl42^, а ионы С1~ —
ионов К+ в структуре I^PtCU, тогда как молекулы воды распо-
лагаются в позициях, отмеченных на рисунке маленькими чер-
ными кружками. По этому вопросу см. также разд. 27.9.1.
Девятерная координация (трехшапочная тригональная приз-
ма) ионов 4/-металлов осуществляется в NaNdF4 (и в изо-
структурных соединениях Се и La); эта структура может рас-
сматриваться как производная от структуры P2-Na2ThF6 (разд.
28.2.4,в), но отлична от нее, хотя ранее эти структуры не раз-
личали [11]. Единственный в своем роде анион Re3Cli23^ в соли
Cs3Re3Cli2 (CsReCl4) обсуждался ранее (разд. 9.10.2).
Литература, fl] Bull. Soc. franc, mineral, cristallogr. (Switzerland), 1969, 92,
335. [2] J. Chem. Phys., 1969, 51, 4928. [3] Acta cryst., 1980, B36, 1355. [4] Z.
anorg. allg. Chem., 1965, 336, 200. [5] Z. anorg. allg. Chem., 1978, 442, 151.
[6] Acta cryst., 1966, 20, 135. Щ Acta cryst., 1973, B29, 2625. [81 Inorg. Chem..
1966, 5, 149-8, 1510. [9] J. Am. Chem. Soc, 1962, 84, 167. [10} Acta cryst., 1969.
B25, 603. [11] Inorg. Chem., 1965, 4, 881.
10.1.4. Галогениды АтВХ$. Уже говорилось о том,, что лишь не-
многие из кристаллических пентагалогенидов состоят из моле-
кул МХ5. Аналогичным образом в структурах многих комплекс-
ных галогенидов с отношением Х:В = 5: 1 не обнаружено ко-
ординационного числа, равного пяти. Установлено существова-
ние следующих типов структур:
Тип структуры
КЧ атома В
Примеры*
а. Трехмерная
структура
б. Цепочка
ВХ5
ионная
октаэдров
9
6
в. Дискретный ион ВХ5
г. Ионы ВХ„2- и X-
[1].
F
LiUF5 (разд. 28.2.4)
T12MF5 (M = A1, Fe, Ga, Cr)
(NH4JMnF5 [2], CaCrF5 [3],
[41, Rb2CrF5 [51, SrFeFs [6]
t-6. [Сг(МН3N]МС15 (M = Cu [7], Hg:
[8]),[Co(NH3N]CdCl5r9],
(C28H2ICl)SnCl5 [10], (FeClsJ- (разд.
27.6)
т-п. (NEt4hInCl6[lll, (NH4),SbF5 [121,
(NH4JSbCl5 [131, (bipyH2)MnCl5 [14lJ
Cs3(MCl4)Cl (M=Mn [151, Ni, Co [161,.
Hg [17]),[Cr(NH3hl(ZnCl4)Cl[181
* T-6. — тригонально-бипирамидальный; т-п. — тетрагонально-пирамидальный.
[11 J. Solid State Chem., 1970, 2, 269. [2] J. Chem. Phys., 1969, 50. 1066. [3] Mate-
rials Res. Bull., 1971, 6. 561. [4] Acta cryst., 1971, B27, 2345. [5] Acta cryst., 1974, B30,
2688. [6] J. Solid State Chem., 1973. 8, 206. [7] Inorg. Chem., 1968, 7, 1111. [8] J. Chem. Soc,
D 1975, 2591. [9] J. Chem. Soc, A 1971, 3638. [10] J. Am. Chem. Soc, 1964, 86, 6733. [11]
Inorg. Chem., 1969, 8, 14. [12] Inorg. Chem., 1972, 11, 2322. [13] J. Chem. Soc, A 1971
298. [14] Chem. Comm., 1971, 803. [15] Acta cryst., 1976, B32, 631. [16] Acta cryst., I960,
B36, 2893. [17] Acta cryst., 1976, B32, 2905. [18] Acta cryst., 1976, B32, 2907.
10.1. Комплексные галогениды 143
В гл. 5 было показано, что простая октаэдрическая цепочка
состава АХ5, составленная из октаэдров, может иметь две кон-
фигурации — транс- и цис-, причем для пентафторидов извест-
ны оба типа структур. Таким же образом и для структур со-
единений АВХ5 обнаружены оба типа цепочек. Отнесение кон-
фигурации цепочки к транс- или цис-, а также строение цепоч-
ки в этом случае зависят от природы катиона А. Так, в CaCrF5
присутствуют транс-, а в Rb2CrF5 — цмс-цепочки. Отметим так-
Рис. 10.2. Строение цепочек ВХ5 в структуре BaFeF5. а —два типа цепочек
(FeF5)/i2"~; б — разветвленная цепочка.
же, что могут осуществляться различные конфигурации цне-це-
почек; в структуре Rb2CrF5 они — плоские, а в SrFeF5 — спи-
ральные. Особый интерес представляют изоструктурные друг
другу BaFeFs и SrAlF5 в связи с тем, что в их структурах име-
ется равное число цепочек двух видов — линейные транс-цепоч-
ки и «разветвленные» цепочки, в которых к каждому звену про-
стой цепочки дополнительно присоединены по две октаэдриче-
ские группы ВХб, как показано на рис. 10.2. Состав таких
цепочек по-прежнему отвечает формуле МХ5. Предположитель-
но, такое усложнение структуры обусловлено необходимостью
размещения между цепочками крупных катионов Sr2+ и Ва2+
с неправильной восьмерной и девятерной координацией, тогда
как в структуре CaCrFs ион Са2+ имеет семерную координацию.
Примеры структур типа в с дискретными ионами BXs пока
ограничены соединениями элементов Б-подгрупп. Тригонально-
бипирамидальная конфигурация ионов во всех случаях стаби-
лизируется катионами больших размеров; однако такие катио-
ны могут стабилизировать и структуры иного типа, например
[Cr(NH3N](ZnCl4)Cl и [Cr(NH3)e](CoCl4)Cl:[Acta cryst, 1976,
В32, 2907].
144 10. Комплексные галогениды, оксо- и гидроксогалогениды
Существует большое число моногидратов солей А2(МХ5-
•Н2О), кристаллизующихся в структурном типе K^PtCU (разд.
10.1.5) или в искаженных вариантах этой структуры. Анион в
таких солях представляет собой октаэдрическую группу (МХ5-
•Н2О), а А — крупный катион:
(NH4J(VF5.H2O)
Rb2(VF5-H2O)
T12(VF5-H2O)
Rb2(CrF5-H2O)
Tl2(CrF5-H2O)
(NH4J(FeCl5-H2O)
(NH4J(InCl6-H2O)
Однако не все моногидраты такого состава содержат дис-
кретные группировки (МХ5-Н2О). Так, в структурах K2A1F5-
•Н2О и K2MnF5-H2O [J. Chem. Soc, A 1971, 2653] присутству-
ют бесконечные цепочки МХ5, состоящие из соединенных через
противоположные вершины октаэдров МХ6; молекулы воды и
катионы расположены между цепочками.
10.1.5. Галогениды АтВХ6. В некоторых комплексных фторидах
состава AmBF6 ионы А и В занимают положения катионов в
структурах бинарных ионных соединений АХ либо статистиче-
ски, либо упорядоченно (сверхструктуры):
Структура АХ„
КЧ атомов А и В
Статистическое
расположение
Сверхструктура
Рутил
Флюорит
ReO3
LaF3
Mg2FeF6
a-K2UF6
BaThF6
Li2TiF6
Y-Na2UF6
CaPbF6
Уже указывалось, что в сверхструктурах Li2TiF6 и CaPbF6
типа трирутила и ReO3 имеются дискретные группировки ВХ6.
Вторая структура представлена на рис. 10.7, где маленькие
светлые и темные кружочки показывают положение ионов Са2+
и РЬ2+ соответственно, а большие светлые кружки — ионов F~.
Поэтому такие структуры можно отнести и к группе «г» табл.
10.1 как структуры, содержащие отдельные ионы ВХ6. Подоб-
ным же образом во флюоритовой сверхструктуре -y-NasUFe
группировки UF8 соединены через противоположные ребра в
цепочки, что можно видеть на рис. 28.5. Эту структуру можно
отнести к группе «в».
Наличие мостиковых атомов фтора между координационны-
ми группами BFn характерно также для ряда других комплекс-
ных фторидов (табл. 10.3). Это должно наблюдаться, если
ионы В большого размера имеют координационное число боль-
ше шести. п ,.;.',
10.1. Комплексные галогениды 145.
Две близкие по строению структуры K.2UF6 описаны в гл. 28.
В структурах RbPaF6 и K^ZrFe додекаэдрические координаци-
онные группы объединены в цепи через два общие ребра, как
показано на рис. 10.3, а; в структуре (NH.4JCeF6 сочленение ан-
типризматических групп происходит через ребра, выделенные'
на рис. 10.3, б. Здесь уместно рассмотреть также цепочечную
структуру SrPbF6, в которой отношение F: В = 6: 1 достигается!
совершенно другим способом. В этой структуре имеются цепоч-
Таблица 10.3. Строение комплексных фторидов AmBF6
Соединение
КЧ
атома В
Координация атома В
Литература
Одномерные цепочечные комплексы ВХ„
K2UF6 9 Трехшапочные# триго-
нальные призмы, сочле-
ненные по двум граням
RbPaF6 8 1 Додекаэдры, сочлененные
K2ZrF6 8 / по двум ребрам
(NmbCeFg 8 Антипризмы, сочлененные
по двум ребрам
Y-Na2ZrF6 7 Неправильные много-
гранники с двумя об-
щими вершинами
Sr(PbF5)F 6 Октаэдры с двумя общи-
ми вершинами
Двумерные комплексы ВХп
Ba2MnF4(F2)
Октаэдры с четырьмя об-
щими вершинами
Acta cryst., 1948, 1, 265
Acta cryst., 1968, B24, 1675
Acta cryst, 1956, 9, 929
Inorg. Chem., 1969, 8, 33
Acta cryst, 1969, B25, 2164
Z. anorg. allg. Chem, 1957;
293, 251
Z. anorg. allg. Chem, 1967,
353, 13
ки состава PbF5, образованные из октаэдрических групп PbF6,
сочлененных через противоположные вершины; шестая часть
атомов фтора присутствует в виде отдельных ионов F~ (рис.
10.3, в). Поэтому формулу этого соединения следует записывать
в виде Sr(PbF5)F. Двумерные комплексы ВХ„ довольно редки;
они встречаются в солях Ba2MF6 (M = Cr, Mn, Fe, Co, Ni, Zn).
Слои MF4 здесь такого же типа, как в структуре K2N1F4; они
состоят из октаэдрических групп MF6, соединенных через все
экваториальные вершины; структуре этих соединений отвечает-
формула Ba2(MF4)F2.
Число соединений, относящихся к группе «г», т. е. содержа-
щих в структурах дискретные группировки ВХ6, очень велико.
Сюда попадают соединения состава АВХ6, А2ВХ6, А3ВХ6 и
А4ВХ6 (в том числе для АВХ6 — A'BVX6 и AUBIVX6). Известно
не менее сотни фторидов A'BVF6. Октаэдрические группы ВХ6 —
это довольно крупные ионы, имеющие приблизительно сфериче-
скую форму; строение кристаллических солей этого типа опре-
10—985
• 146 10. Комплексные галогениды, оксо- и гидроксогалогениды
10.1. Комплексные галогениды 14?~
деляется не столько химической природой элементов А и В,
сколько относительным размером и зарядами ионов А и ВХ6.
Так, BaSiF6 имеет структуру типа TlSbF6, а одна из модифика-
ций K^SiFe изоструктурна K2PtCl6, K2SeBr6 и множеству дру-
гих соединений, как будет видно из дальнейшего.
Структуры многих из этих соединений можно описать дву-
мя способами. Считая ионы А и ВХ6 структурными единицами,
можно описать структуры АВХ6 как производные от структур
а
Sr
О
F
в
Pb
ГРис. 10.3. а — фрагмент бесконечного цепочечного иона (ZrFs)n2n~ в структуре
K2ZrF6; б — ребра антипризматической группы CeF8, участвующие в связыва-
нии групп в цепочки в структуре (NH4JCeF6; в — структура Sr(PbF4)F.
бинарных соединений АХ„, заменяя А или X на ионы ВХ6. На-
пример, в структурах многих соединений АВХ6 ионы А и ВХв
располагаются таким же образом, как ионы в структурах NaCl
и CsCl. В структуре K^PtCU (рис. 10.5) положение ионов К+
и PtCl62~ такое же, как ионов F~ и Са2+ в структуре CaF2, т.е.
соответствует «антифлюоритовому» мотиву. В то же время если
атомы А и X образуют плотную упаковку, как, например, в
KOsF6 и во многих галогенидах АтВХ3т, то можно описывать
структуру как совокупность плотноупакованных атомов (ионов)
А и X, в которой атомы В занимают определенные октаэдриче-
екие пустоты между группами из шести атомов X. Этот под-
ход, подробно рассмотренный в гл. 4, позволяет, например, вы-
явить связь между тремя типами структур А2ВХб, основанными
на плотноупакованных (ПУ) слоях (А+ЗХ):
Структура
Последовательность
ПУ-слоев АХ3
Cs2PuCl6 (KsGeF6)
K2PtCl6
.K2MnF6
г
к
гк
а. Структуры АВХ6. Большая часть соединении A:BVX6 и
A"BIVX6 представлена фторидами. Соединения, содержащие
более тяжелые галогены, намного менее устойчивы, а во мно-
гих случаях вообще неизвестны, хотя для некоторых анионов
ВС16"~ получены соли этого типа с большими катионами, на-
пример [Co(NH3N]TlCl6 и [Ni(H2ON]SnC]6. Все фториды со-
става ABF6 кристаллизуются в структурных типах, производ-
ных от типов NaCl и CsCl. При этом для создания окружения
ионов А из необходимого числа соседей X идеальные кубиче-
ские структуры претерпевают различного рода искажения. Для
фторидов принято выделять пять структурных типов, а к ше-
стому типу с тетрагональной структурой, производной от NaCl,
можно отнести структуру Na[Sb(OHN].
Ромбоэдрическая структура, которую
можно также рассматривать как
сверхструктуру от VF3 с шестерной
координацией А и В
Обе структуры кубические с КЧ ато-
ма А, равным соответственно 6 и 12.
В отношении этих структур в литера-
туре все еще имеется некоторая пу-
таница
Тетрагональная с восьмерной коорди-
нацией атома А (додекаэдр)
Ромбоэдрическая (тип BaSiF6); отно-
сятся также SrPtFe, BaPrFe, BaTiF?
и CsUF6
Тип
I
II и
Тип
IV
NaCl
III
CsCl
LiSbF6
NaSbF6 и CsPF
KSbF6
V
KOSF6
Из табл. 10.4 видно, что тип структуры соединений A'BVF6
определяется главным образом размером иона А, координаци-
онное число которого может быть 6 (I и II) 8+4 (IV) и 12
(III и V).
Структуру KOsF6 можно также рассматривать как слегка
искаженную плотнейшую кубическую упаковку почти пло-
ских слоев состава КРб (рис. 10.4); в октаэдрических пустотах;
между слоями размещаются атомы Os.
6. Структуры А2ВХ6. Уже приводились примеры структур
А2ВХ6, относящихся к статистическим или сверхструктурам со-
единений АХ2. Комплексные галогениды этого типа обязательно
содержат в своем составе ионы щелочных металлов, NH4+, TI+
или Ag+. Большинство из них содержат катионы, сравнимые по
размеру с галогенид-ионами, и в этом случае структуры можно<
описать как основанные на плотнейшей упаковке слоев АХ3.
Такие структуры невозможны для меньших по размеру ионов
Na+ или Li+, которые, подобно ионам В, могут размещаться в
октаэдрических пустотах плотнейшей упаковки ионов X. В со-
10*
Д48 10. Комплексные галогениды, оксо- и гидроксогалогениды
Таблица 10.4. Кристаллическое строение комплексных фторидов A'BvFe
10.1. Комплексные галогениды 149
р
As
V,
Re
Ru,
, Mo
в
Ir, Os
, W, Sb, Nb, Та
Li
a
Na
b
b
Ag
b/c
b/c
d
A
К
c/e
Tl
с
Rb
С
e
Cs
с
Обозначение
в таблице
а
b
с
А
?
Структурный тип
LiSbF6
NaSbF6 1
CsPF6 j
KSbF6
[ KOsF6
( BaSiF6
Литература
Acta cryst., 1962, 15, 1098
Acta cryst., 1956, 9, 539
Acta cryst., 1976, B32, 2916
J Inorg. Nucl. Chem., 1956, 2,
79
J Am. Chem. Soc, 1940, 62,
3126
аПо некоторым из соединений серебра и таллия данные отсутствуют. Обзор по
структурам см. работу [J. Chem. Soc, 1963, 4408].
ответствии с этим для соединений Li2BX6 и Ыа2ВХб характерны
свои структурные типы, тесно примыкающие к структурам АХг
(иногда к их сверхструктурам), поскольку в данном случае
речь идет о способах заполнения BА+В) половины октаэдри-
ческих пустот в плотнейшей упаковке ионов X (группа Хв). Ва-
рианты заполнения были рассмотрены в гл. 4; сюда относятся
OF" на 0,27/5 выше^
плоскости слоев К
n T'на 0,27А низке
и плоскости слоев К
Рис. 10.4. Слегка гофрированный слой KFe в структуре KOsFe.
три близких структурных типа:
Структурный
тип
Примеры*
Литература
Тпипутил в-т Li2SnF6, н-т Li2GeF6 I. Solid State Chem., 1971,
3 525
NanSiFs Na2MF6 (M=Si, Ge, Mn, Cr, Ti, Pd, 4cta cryst., 1964, 17, 1408;
Rh, Ru, Pt, Ir, Os) J. Chem. Soc, 1965,
1559
LbZrFe Li2Nb0F5 A.cta Chem. Scand., 1969,
23, 2949
• в т — высокотемпературная модификация; н-т — низкотемпературная модификация.
Некоторые из этих соединений обладают полиморфизмом; на-
пример, известны фазовые переходы из низкотемпературной в
высокотемпературную модификацию для Li2SnF6 (из типа
Li2ZrF6 в тип трирутила) и для Li2GeF6 (из типа трирутила в
тип Na2SiF6).
Рассмотрим теперь три структурных типа K2PtCl6, K^GeFe
и K2MnF6, в которых осуществляется совместная плотнейшая
упаковка атомов A-j-ЗХ.
Структура K.2PtCl6. В этой структуре (рис. 10.5) ионы К.1"
и PtCl62~ занимают соответственно положения ионов F~ и Са2+
в структуре флюорита. В противопо-
ложность структурным типам I^GeFe
и K2MnF6, которые в значительной сте-
пени ограничены лишь структурами
фторидов, в структурном типе K2PtCl6
ломимо гексафторидов кристаллизу-
ются также гексахлориды, гексабро-
миды и некоторые гексаиодиды тяже-
лых щелочных металлов (например,
Rb2SnI6, Cs2TeI6), аммония и таллия.
Для некоторых гексабромидов и гек-
•саиодидов реализуется менее симмет-
ричный вариант этого структурного
типа. K'2SnCl6 [1] кристаллизуется в
структурном типе K2PtCl6 [2], а в K2SnBr6
К2Те16 осуществляется искаженный вариант этой структуры,
при котором размер полостей для ионов А несколько уменьшен
за счет поворота ВХ6, поскольку размер полостей, удобный
для ионов К+ в гексахлориде, был бы слишком велик в кубиче-
ских структурах гексабромида и гексаиодида.
Рис. 10.5. Кристаллическая
структура КР1С1
[3], КгТеВге и
150 10. Комплексные галогениды, оксо- и гидроксогалогениды
К этому же структурному типу относятся (NH4J(FeCl5-
•Н2О), К2ТсС15(ОН) [4], а также K2(PtF3Cl3) |5] и Cs2Co'vF6.
В (NH4JSbBr6 осуществляется сверхструктура K2PtCb с чере-
дующимися ионами SbBr63^ и SbBr6~ (разд. 20.2.5 и 20.2.6).
Связь структурных типов K2PtCl6, криолита и перовскита об-
суждается ниже.
Структура КгСе/ч (Cs2PuCl6) (рис. 10.6). Почти все соеди-
нения с этой структурой —фториды, кроме нескольких соедине-
Рис. 10.6. Кристаллическая структура Cs2PuC!6 (или K2GeF6). Цифры в скоб-
ках указывают высоту атомов над плоскостью рисунка в долях параметра с
F,03 А).
ний, таких, как Cs2PuCl6, и тригональных модификации
Cs2ThCl6 и Cs2UCl6. В «идеальной» структуре у иона А долж-
но быть 12 соседей X на одинаковых расстояниях, за исключе-
нием, возможно, структуры Cs2PuCl6; в действительности А
имеет либо только 9 атомов X на равных расстояниях, а ЗХ на
большем расстоянии, либо группировку 3+6+3. Типичное рас-
пределение расстояний таково:
K2GeF6
К—9F 2,85 А
K-3F 3,01 А
K2TiF6
К—3F 2,75 А
К—6F 2,87 А
К—3F 3,08 А
В отличие от этих структур в структуре типа K2PtCl6 ионы А
Есегда имеют 12 равноудаленных атомов X, идет ли речь об-
идеальной или о несколько искаженной плотнейшей упаковке.
В последнем случае координационный многогранник уже не яв-
ляется правильным кубооктаэдром.
Структура K2MnF6. Этот структурный тип встречается у
очень большого числа гексафторидов, многие из которых обла-
10.1. Комплексные галогениды 151
дают полиморфизмом (табл. 10.5) ;[6]. Значительный интерес
представляют красные соли M2NixvF6 (Ni—F 1,70 А) и окра-
шенные в розовый цветМ2СгпТ6 (Сг—F 1,72 А). Коль скоро
все три структуры — K.2PtCl6, K2GeF6 и K2MnF6 — основывают-
ся на плотной упаковке ионов А и X, они не обнаруживают той
простой связи между относительными размерами ионов А и
ВХб, которая была характерна для структур соединений АВХ6,
приведенных в табл. 10.4.
Таблица 10.5. Кристаллическое строение комплексных фторидов АгВХба
BX;i
SiF6
GcF6
TiF6
MnF6
CrF6 fl]
ReF6 [21
NiF6 [11
PdFe
PtF6
A2
K?
ТС
TH
THC
тнс
НС
т
с
н
т
Rb2
с
тн
тнс
НС
НС
т
с
НС
т
Gs2
с
с
тс
с
с
т
с
с
т
(NH4J
тс
т
т
—
—
—
—
¦—
С [31
ть
с
—
тс
—.
—
—
¦—
—
— t
аТ —структура KjGeFe; H — структура КгМпр6; С — структура KjPtCU.
[1] Z. anorg. allg. Chem., 1956, 286, 136. [2] J. Chem. Soc, 1956, 1291. [31 Acta
.cryst., 1980. B36, 1921.
¦Литература. [1] Acta cryst., 1976, В32, 2671. [2] Acta cryst., 1973, B29, 1369.
;[3] Acta cryst., 1979, B35, 144. [4] J. Chem. Soc, A 1967, 1423. [5] J. Chem. Soc,
A 1966, 1244. [61 J. Chem. Soc, 1958, 611.
в. Структуры соединений семейства криолита с формулами
¦А3ВХ6 или А2(В'В")Хе. Структуры некоторых солей А3ВХ6 име-
ют простую связь со структурой KzPtCU. В структуре
(NH4KA1F6 две трети ионов NH4+ и ионы A1F63~ занимают по-
ложения ионов К+ и PtCl62~ (рис. 10.5); остальные ионы NH4+
расположены посередине ребер и в центре кубической элемен-
тарной ячейки. В этой структуре, как и в K^PtCU, положение
атома X на ребре куба может варьировать («00 и т. д.) вблизи
"~74. Удобно рассматривать эту структуру как производную
от структуры криолита, хотя сам криолит Na3AlF6 [1] имеет
искажения, приводящие к понижению симметрии (аналогичным
•образом минерал перовскит кристаллизуется в искаженном
структурном типе того же названия).
С учетом структурного подхода более правильно представ-
лять формулы соединений семейства криолита в виде
А2(В'В//)Х6, а не А3ВХ6, поскольку в этих структурах одна
152 W. Комплексные галогениды, оксо- и гидроксогалогениды
треть атомов А (при формуле А3ВХ6), как и атомы В, занима-
ет октаэдрические пустоты в кубической плотной упаковке
А2Х6(АХ3). Остальные две трети, соответствующие ионам К+ в
структуре КгРЮб, окружены двенадцатью равноудаленными
ионами X. В то же время структурный тип криолита тесно свя-
зан с типом перовскита. На рис. 10.7 атомы А и X размещены
по позициям кубической плотнейшей упаковки состава АХ3.
Ов'
Рис. 10.7. Связь между структурными типами перовскита,
и криолита.
Заполнение октаэдрических позиций атомами В", как показано'
на рис. 10.7, приводит к структуре А2В"Х6 (K2PtCl6), для ко-
торой объем элементарной ячейки в восемь раз больше объ-
ема малого куба. Заполнение дополнительных октаэдрических
позиций, выделенных на рисунке для атомов В', приводит к
структуре криолита А2(В/В//)Х6, а если В'=В", то это уже
структура типа перовскита АВХ3 с элементарной ячейкой мень-
шего размера. Другими словами, высокосимметричная структу-
ра, приведенная на рис. 10.7, при u — xU представляет собой
сверхструктуру перовскита (ср. рис. 4.31,6 и д).
Как и в случае перовскитовых структур, для криолитовых
структур возможны различные варианты понижения симметрии.
При обсуждении этих вариантов важно иметь в виду, что при
наличии полной кубической симметрии (Fm3m) атомы X долж-
ны располагаться на ребрах куба, причем их позиции опреде-
ляются величиной варьируемого параметра и. Если атомы X
смещаются с ребер элементарной ячейки, то возможен вари-
ант кубической сингонии с симметрией, сниженной до пр. гр.
10.1. Комплексные галогениды 153
Ра2>. Этому случаю соответствует кубический структурный тип
эльпасолита; к нему относится, например, K2NaAlF6 [2]. Эти два
типа структур обозначены в табл. 10.6 буквами К и Э. Другие
криолитоподобные структуры обладают тетрагональной или мо-
ноклинной симметрией [3].
Большинство соединений А3ВХ6, имеющих при комнатной
температуре кубическую симметрию, представлены аммониевы-
ми солями (например, (ЫН4)зА1,Р6, (NH4KFeF6 и (NH4KMoO3F3;
как исключение можно рассматривать калиевую соль K2M0F6
[4]). Значительно чаще наблюдаются структуры с отклонения-
ми от кубической симметрии; однако, как видно из табл. 10.6,
Таблица 10.6. Соединения с криолитоподобными структурами
Соединение
K2NaAlF6
(NH4KA1F6 1
(NH4KFeF6 /
K3A1F6
Na3AlF6
Температура, °С
>-180
Кубич. (Э)
Тетрагон.
20
Кубич. (Э)
Кубич. (К)
Тетрагон.
Моноклин.
800
Кубич. (К)
550
Кубич. (К)
при высоких температурах структуры переходят в кубические.
Значительно сложнее поведение Li3AlF6, для которого описано
пять полиморфных модификаций [5]. В структуре модифика-
ции, устойчивой при комнатной температуре, имеется три типа
ионов Li+ с сильно искаженной координацией.
Сходное поведение обнаруживают изоструктурные оксиды
M3\VO6 и M2'M"WO6 и соответствующие производные молибде-
на [6]. Так, Ba2CaWO6 и Ва2СаМоОб при обычных температу-
рах кубические, a Ba2SrWO6 — некубический, но переходит в
кубическую модификацию при 500 °С. Соединения с более про-
стыми формулами (Ca3WO6, Sr3WO6 и Ba3WO6) при комнатной
температуре тоже имеют структуры с отклонениями от кубиче-
ской симметрии.
Структура типа криолита обнаружена также более чем у
Двадцати хлоридов состава Cs2NaMUICl6 (где M = In, Tl, Sb, Bi,
Fe, Ti, Sc, Y, La и 4/- и 5/-элементы [7]) и у соединений с комп-
лексными катионами или анионами, среди которых можно на-
звать 1з![Со(ЫН3)б] и многочисленные гексанитриты
M3'[M"(NO2N] (где M' = NH4, К, Rb, Cs и Tl, a M" = Co, Rh
или Ir). Известны также соли, содержащие сразу два типа
атомов М', например К2Са[№(Ш2)б]; о строении
К.2РЬ[Си(МО2)б] см. разд. 25.7.5. Среди оксофторидов имеют-
ся примеры криолитоподобных структур не только с моноклин-
154 10. Комплексные еалогениды, оксо- и гидроксогалогениды
ной или тетрагональной, но и с кубической структурой (типа
эльпасолита, табл. 10.11).
Литература. [11 Acta Chem. Scand., 1965, 19, 261. [21 J. Inorg. Nucl. Chem., 196U
21, 253. [3] Acta cryst., 1953, 6, 49. [41 Inorg. Chem., 1969, 8, 2694. [51 Acta cryst.,.
1968, B24, 225. [6] Acta cryst., 1951, 4, 503. [7] Inorg. Chem., 1970, 9, 1771.
г. Галогениды АцВХ6. Сюда относятся (МН4LСс1С1б [Z. anorg-.
allg. Chem. 1956, 284, 10] и изоструктурные ему соединения
K.4MnCl6, KsNaFeCls и K4PbF6, в структурах которых присутст-
вуют октаэдрические ионы (ВХ6L\ Упоминание о KtZnCl6
имеется в книге Грота [Groth, Chemische Kristallographie, \тоГ.
1, p. 309, 1906], но ее структура неизвестна. Если в ее структу-
ре содержатся ионы ZnCls4", то это был бы единственный при-
мер шестерной координации атома Zn атомами С1, но представ-
ляется более вероятным, что в ней присутствуют тетраэдриче-
ские ионы ZnCl42~ (или тригонально-бипирамидальньге ZnCl53~)
и дополнительно ионы С1~. Имеются многочисленные примеры:
октаэдрической координации атома цинка фторид-ионами.
10.1.6. Галогениды АтВХ7. Комплексные фториды с такой фор-
мулой характерны для различных металлов подгрупп IVA, YA
и VIA, 5/-элементов, а среди 4/-элементов — для тербия. Соль
Cs3TbF7— первый фторокомплекс тербия (IV) [1]. Среди этих
соединений встречаются следующие типы структур:
Дискретные ионы ВХ7
Линейные ионы (ВХ7)п
Дискретные ионы ВХ6-\-Х~
Примеры
K3UF7, K3ZrF7, (NH4KZrF7 (пентаго-
нальная бипирамида)
K2TaF7, Rb2UF7, Rb2PuF7 (одношапоч-
ная тригональная призма) [2]
K2PaF7 [3] (гл. 28)
(NH4K(SiF6)F
Соединения элементов подгрупп IVA и VA подробнее рас-
смотрены далее (разд. 10.1.13), а соединения Th и U— в гл. 28.
Структуры таких соединений, как RbMoF7 и RbWF7, пока не-
известны.
Цепочечный ион в КгРаР7 (и в изоструктурных солях руби-
дия, цезия и аммония) образован из трехшапочных тригональ-
ных призм PaF9, сочлененных по двум ребрам; об этом уже-
упоминалось в гл. 1 как об интересном способе реализации от-
ношения X: М = 7:1 из исходных групп с девятерной коорди-
нацией.
Литература. [1] Z. anorg. allg. Chem., 1961, 312, 277. [2] J. Am. Chem. Soc.t,
1965, 87, 5803. [31 J. Chem. Soc, 1967, 1429, 1979.
W.I. Комплексные галогениды 155
10.1.7. Галогениды AmBX%. Переходные и 5/-металлы образуют
значительное число фторидов с такой формулой, например
K2MoFs и I\2WF8[1] (структуры не определены), Na3TaF8 и со-
единения тория, урана и т. д. (о NaHTiFs см. разд. 10.1.13).
Предполагается [2], что в Na2UF8 (раньше этому соедине-
нию приписывали формулу Na3UF9) реализуется трехмерная ион-
ная структура с восьмерной координацией ионов обоих метал-
лов. Изолированные ионы UF84~ в виде искаженной антиприз-
мы присутствуют в структуре (NH^UFe и в изоструктурных
солях Се, Pa, Np, Pu и Am [3]. Координация в виде квадрат-
ной антипризмы осуществляется также в Na3TaF8 (см. разд.
10.1.13). Совершенно иное строение имеет соединение тория
(NH4LThF3 [4]. В нем присутствуют цепочки состава ThF7,
весьма близкие по строению к цепочкам в КгРаР7. Цепочки об-
разованы из трехшапочных тригональных призм ThF9) имею-
щих два общих ребра. Восьмой атом фтора присутствует в ви-
де отдельного иона F~. В этом отношении наблюдается анало-
гия со структурой SrPbF6:
SrPbF6 Цепочечные ионы (PbF5);i"~-f-F~
(NH4LThF8 Цепочечные ионы (ThF,)n3"-+ F~
Эти структуры можно поставить в один ряд с соединениями,
в которых присутствуют конечные комплексные ионы и от-
дельные ионы Х~:
CS3C0CI5
Ионы в структуре (СоСЦJ-
CI-
(NH4KSiF7
F-
(NH4MMo2CI9-H2O
(Мо2С18L-
ci-
B структуре Na3UF8 (и в изоструктурных соединениях Ра
и Np) осуществляется почти правильная кубическая координа-
ция 5/-иона [5].
На примере комплексных хлоридов марганца (II) выявля-
ется изоструктурность комплексных галогенидов и комплекс-
ных оксидов (табл. 10.2). Так, Na6MnCl8 имеет такую же струк-
туру, что и Mg6Mn08 (разд. 13.6.6), a Na2MnCl4 изоструктурен
Sr2Pb04. Структура Na2Mn3Cl8 [6] характеризуется наличием
фрагментов плотнейшей упаковки слоев ионов С1~ с ионами
Na+ в тригонально-призматических (тр-пр.) пустотах и ионами
Мп-~, занимающими 3/4 октаэдрических (окт.) пустот:
А в
окт. тр.-пр.
ВС С А...
окт. тр.-пр. окт.
Таким образом, мы рассмотрели материал по комплексным
•галогенидам, следуя делению табл. 10.1 на колонки. Остается
156 10. Комплексные галогениды, оксо- и гидроксогалогениды
теперь обсудить классы соединений «д» и «е» и добавить не-
большой раздел по комплексным галогенидам отдельных ме-
таллов.
Литература. [1] J. Chem. Soc, 1956, 1242; 1958, 2170. [2] Inorg. Chem., 1966, 5,
130. [3] Acta cryst., 1970, B26, 38. f4] Acta cryst., 1969, B25, 1958. [5] J. Chem.
Soc, A 1969, 1161. [6] Acta cryst., 1975, B31, 770.
10.1.8. Комплексные галогениды, содержащие полиядерные
комплексные ионы конечного размера. Ионы, в которых су-
щественную роль играет взаимодействие металл —металл, рас-
сматривались в разделе, посвященном металл — кластерным
соединениям (разд. 9.10.3). Это в основном соединения Nb, Та,
Mo, W, Тс, Re и Pt. Ниже обсуждаются три простейших типа
ионов, в которых имеются простые, двойные или тройные мо-
стики из атомов галогена, что соответствует сочленению коор-
динационных групп атомов металла через вершину, ребро или
грань:
10.1. Комплексные галогениды 157
М—X—М
м
м
или
м—х—м
Простые галогенные мостики связывают плоские группы
AgCl3 в ионе Ag2Cls3- (разд. гл. 25), пирамидальные группы
МХ3 в структуре NaSn2F5 (разд. 26.7.3), тетраэдрические груп-
пы МХ4 в структурах Те4(А12С17J (разд. 16.2.3), NH4(Al2Br7)
{1] и K(Ga2Cl7) [2]; октаэдрические группы МХб в структуре
(SeF3) (Nb2Fn) (разд. 16.10.2) и тригонально-призматические
группы МХ6 в Na5(Zr2Fi3) (разд. 10.1.13).
Через двойные галогенные мостики связаны плоские груп-
пы МХ4 в Pt2Br62~ [3], тетраэдрические группы МХ4 в Cd2Cl62~
[4] и Hg2I62~ l[5] и октаэдрические группы МХ6 в "ПгСЬо2" [6]
и Bi2Br104- [7].
Тройные галогенные мостики характерны для структур но-
нагалогенидов А3В2Х9, в которых А+ — крупный катион, а X —
обычно С1, Вг или I. Особенно много солей такого состава обра-
зует цезий. Кристаллическое строение этих соединений доволь-
но простое вследствие того, что ион Cs+ сравним по размеру
с галогенид-ионами и может участвовать в образовании плотно-
упакованных структур со слоями CsX3, октаэдрические пустоты
между которыми занимают атомы Мш (разд. 4.6,6). Имеется
три типа структур солей с формулой Cs3M2X9. В структуре пер-
вого типа каждая октаэдрическая группа МХ6 сопряжена с
другими через три вершины, принадлежащие одной грани, что>
приводит к образованию двумерного аниона (рис. 4.35). Из-
вестен лишь один пример структуры такого типа, а именно
Cs2Bi2Brg i[8] с кубической плотнейшей упаковкой. В структур
pax второго типа атомы металла занимают две соседние окта-
эдрические пустоты и образуют ионы М2Х93~, строение которых.
показано на рис. 10.8:
Cs3M2F9 M=Fe, Ga (разд. 10.1.12)
Cs3M2Cl9 M=Ti, V, Cr, Mo, Tl, Rh
Cs3M2Br9 M=Cr, Mo
Cs3M2I9 M=Sb, Bi
Такое строение иона Ti2Clg- найдено в соединении
(РС14) (TiaCIg) [6]; длины связей Ti—С1 (концевая 2,23 А, мос-
тиковая 2,49 А) оказались очень близки к длинам связей в
ионе Ti2Clio2~. В анионе соли K2W2C19 [9] со структурой того
же типа, которая характерна для перечисленных выше цезие-
вых солей, между атомами металла имеется непосредственная;
связь (W—W 2,44 А), что приводит к понижению магнитного'
момента. В других перечисленных солях взаимодействия ме-
талл— металл нет (например, Сг—Сг 3,1 А) и магнитный мо-
мент не понижен. По-видимому, в этом от-
ношении ионы M02CI93- и Мо2Вг93~ (Мо—
—Мо 2,66 и 2,82 А) занимают промежу-
точное положение [10]*.
Существует еще третий тип соединений
Cs3M2Cl9, не содержащих эннеагалогенид-
ионов (ни дискретных, ни двумерных). В
соединениях этого типа атомы М смещены
из центров октаэдров МХ6 и образуют дис-
кретные пирамидальные молекулы МС13,
внедренные между ионами Cs+ и С1~. Та-
кую структуру имеют Cs3As2Cl9 [11] (As—
—ЗС1 2,25 A, As—3C1 2,75 А), обе модифи-
кации Cs3Sb2Cl9, а также Cs3Bi2Cl9 [12]. рис. 10.8. Строение
В ряду соединений Cs2Bi2X9 наблюда- иона Т12С193-.
ется интересное изменение характера
структуры: комплексный хлорид содержит молекулы BiCU, бро-
мид имеет кубическую плотноупакованную структуру, о кото-
рой говорилось выше, а в структуре иодида присутствуют дис-
кретные ионы Bi2I93^ [13]. В то же время можно отметить и
зависимость строения эннеагалогенидных комплексов от типа
катиона. Так, соединение [ (С6Н5LР]зВЬВг9 [14] содержит дис-
кретные ионы Bi2Br93-, а в (C5H5NHM(Sb2Br9)Br2 [15] имеют-
ся ионы Sb2Br93~ и ионы Вг~. Из соединений с общей формулой
АтВ2Х9, однако не содержащих эннеагалогенидных ионов, из-
* Проблема связи металл—металл в подобных соединениях подробно рас-
смотрена в монографии {Коттон Ф. А., Уолтон Р. Кратные связи металл —
металл. — М.: Мир, 1985]. — Прим. перев.
'58 10. Комплексные галогениды, оксо- и гидроксогалогениды
вестей гидрат (NH4MMo2Cl9, строение которого соответствует
• формуле (NH4M(Mo2C18)C1-H2O (табл. 9.21), и KU2F9 с ти-
пично ионной структурой с девятерной координацией для U4+
(трехшапочная тригональная призма) и восьмерной для К+
(искаженный куб) [16].
К эннеагалогенидам тесно примыкают молекулярные соеди-
нения типа Ru2Cl5'[P(C4H9K]4 [17] и Ru2Cl4[P(C6H5) (С2Н5J]5
[18]. Здесь, как и в ионе Сг2С193~, нет связывания металл — ме-
1—3,115 А—>
С1
Рх / \ /Р
Р—Ru—Cl-5-Ru—С1
Q/ \-^ хр
LP = р(я-с4н9K]
а
талл. Это следует из величин расстояний М—М и углов р. При
сочленении правильных октаэдров через грань этот угол равен
70,5°, в ионе Сг2С193- он равен 77°, в структуре а 79,5°, а в ионе
W2C193- —лишь 58°.
..Литература. [1] Ada cryst., 1975, В31, 2177. [2] Acta cryst., 1976, B32, 247.
[31 Acta cryst., 1964, 17, 587. [4] Ada cryst., 1980, B36, 2616. [5] J. Cryst. Mol.
Struct, 1972, 2, 183. [6] Inorg. Chem., 1971, 10, 122. [7] Acta cryst., 1980, B36,
2745 2748 [81 Acta cryst., 1977, B33, 2961. [91 Acta cryst., 1958, 11, 689. [10]
Inorg Chem., 1971, 10, 1453. [11] J. Chem. Phys., 1935, 3. 117. [121 Acta cryst.,
1974. B30, 1088. [13] Acta Chem. Scand., 1968, 22, 2943. [141 Acta cryst., 1977,
B33, 2686. [15] J. Chem. Soc, A 1970, 1359. [16] Acta cryst., 1969, B25, 1919.
[171 J- Chem. Soc, A 1968, 1981. [18] J. Chem. Soc, A 1968, 2108.
10.1.9. Комплексные галогениды, содержащие более одного ти-
па комплексных анионов. Известно много комплексных гало-
тенидов, содержащих одновременно комплексный катион и
комплексный анион. Гораздо меньше соединений с комплексны-
ми анионами двух типов. В качестве примеров таких соедине-
ний можно назвать Na3(HF2) (TiF6) (разд. 10.1.13) и интенсив-
но окрашенные соли (NH4L(SbvBr6) (SbUIBr6) (разд. 20.2.6) и
Cs2(Au!Cl2)(Au!IICl4) [J. Am. Chem. Soc, 1938, 60, 1846]. Для
последнего соединения может быть прослежена близкая анало-
гия со структурой перовскита. Искажение структуры приводит
к тому, что вместо шести соседей, координированных по октаэд-
ру, атомы золота имеют либо по два коллинеарных, либо по
четыре компланарных ближайших соседа. Линейные ионы
(С1—Аи1—С1)~ и плоско-квадратные (Аи'пС14)- представлены
на рис. 10.9,6. Для сравнения на рис. 10.9, а показан фрагмент
.идеальной кубической структуры перовскита, элементарная
10.1. Комплексные галогениды 159'
ячейка которой соответствует внутреннему кубу. Другой спо-
соб выбора ячейки показан на рис. 13.3, а. Описание структуры
соли (NH4N(AuCl4KAg2Cl5 см. в разд. 25.9.
10.1.10. Другие комплексные галогениды. Помимо галогенидов,.
описываемых в этой главе, некоторые комплексные галогенн-
ды рассмотрены в других главах: сурьмы — в гл. 20, элементов
Б-подгрупп — в гл. 25 и 26, урана и 5/-элементов — в гл. 28,
ОСа
О Аи1
Рис. 10.9. Структуры RbCaF3 (a) — структурный тип перовскита и-
СвгА^Ли111^ (б) в сходной ориентации.
10.1.11. Комплексные хлориды Зй-металлов CsMCh, Cs2MCU и
Cs3MCl5 (см. цитированную в работе [1] литературу). Все во-
семь Зс?-элементов от Ti до Си образуют ионы М2~; число^
о'-электронов у этих ионов возрастает от 2 до 9. Для этих эле-
ментов известны комплексные хлориды состава CsMCl3, Cs2MCl4
и Cs3MCl5:
CsMCI3. Соединения этого состава известны для всех Зс(-элементов. Струк-
тура (тип CsNiCl3) состоит из плотноупакованных ионов Cs* и С1~ с атомами
М2+ в октаэдрической координации, которая несколько искажена в изострук-
турных друг другу соединениях хрома и меди.
Cs2MCl4. Соединения этого состава найдены во всех исследованных систе-
мах (система CsCl—СгС12 не изучалась), за исключением V и Ni. В системе
CsCl—VC12 существует только CsVCl3, а в системе CsCl—NiCb не обнаружен,
только Cs2NiCl4. Соли Cs2MCl4 содержат тетраэдрические попы МС142~.
Cs3MCl5. Соединения этого состава известны для Мп, Со, Си (но не V)
и Ni, правда Cs3NiCl5 устойчив только при повышенных температурах. Его син-
тезируют из расплава солей с последующей закалкой, а при медленном охлаж-
дении он распадается на смесь CsCl и CsNiCl3. Все полученные соли изострук-
'160 10. Комплексные галогениды, оксо- и гидроксогалогениды
турны Cs3CoCl5 [2]; в их структуре присутствуют тетраэдрические ионы МС142-
и ионы С1~. (Ион NiCl42~ может существовать при комнатной температуре в
¦сочетании с катионами очень большого размера, например в соли
>[(СбН5) )CH3As]2NiCl4, в которой анион имеет форму правильного тетраэдра
(Ni—С1 2,27 А) [31.)
Эти данные хорошо согласуются с представлениями теории
кристаллического поля. Сильное стремление к реализации ок-
таэдрической координации должно быть у V2+(d3) и Ni2+(d8).
В CsMCl3 сильное искажение октаэдрических координационных
.групп, ожидаемое для ионов с конфигурациями Ф и d9, дейст-
вительно было обнаружено в изоструктурных CsCuCl3 и CsCrCl3
(координация 4+2). Неправильная тетраэдрическая координа-
ция ионов Си2+ установлена в Cs2CuCl4, a Cs2CrCU вообще не
•был получен.
Что касается аналогичных соединений цинка, то ион Zn2+(d10)
•стоит в одном ряду с Зс?-ионами, давая соединения CS2Z11CI4 и
Cs3ZnCl5, в которых атом Zn имеет тетраэдрическую координа-
цию; однако для цинка неизвестно соединение CsZnCl3. Склон-
ность атома цинка к тетраэдрической координации вообще вы-
ражена очень сильно; она обнаружена в структурах трех моди-
'фикаций ZnCl2 и даже в Na2ZnCl4-3H2O {[4]. Однако в ZnF2
(структура типа рутила) координационное число атома Zn
;,равно 6; это же справедливо для KZnF3, имеющего, подобно
соответствующим соединениям Mn, Fe, Co и Ni, идеальную
-структуру типа перовскита. Как и ожидалось, в KCrF3 и KCuF3
реализуется искаженный вариант этой структуры. Структурная
химия комплексных галогенидов Си(II) подробно рассмотрена
в гл. 25.
.Литература. Щ J. Phys. Chem., 1962, 66, 65. Г.21 Acta cryst., 1964, 17, 506.
.[3] Inorg. Chem., 1966, 5, 1498. [4] Z. Kristallogr., 1960, 114, 66.
¦10.1.12. Комплексные фториды алюминия и железа [1, 2]. Эти
соединения могут служить хорошим примером целого семейст-
ва структур, базирующихся на простом принципе: отношение
F:Al(Fe) в этих соединениях меняется лишь в результате со-
членения октаэдрических групп A1F6 (FeF6) через общие вер-
шины. Большинство обсуждаемых ниже соединений представ-
ляют собой соли калия, рубидия и таллия (иногда также ам-
мония), но в образовании некоторых из них участвует меньший
по размеру ион Na+. Отношение F : А1, равное 6: 1, соответст-
вует наличию дискретных групп АШб, как это имеет место в
структурах типа криолита, например у Na3AlF6, а также в бо-
лее сложной структуре криолитионита Na3Li3Al2Fi2. Этот ми-
нерал имеет структуру граната, так что его формулу можно
представить и в виде Al2Na3(LiF4K. Это иллюстрирует тот
10.1. Комплексные галогениды 161
факт, что описание таких комплексных фторидов, как постро-
енных из октаэдров A1F6 или FeF6, весьма произвольно в том
смысле, что связи Al—F по своей природе не очень существен-
но отличаются от других связей М—F в тех же структурах. Со-
членение октаэдров MF6 по двум вершинам дает цепь состава
MF5 (цис или транс), а в случае обобществления четырех вер-
шин образуются слои цис- или транс-типа (рис. 10.10,а).
Рис. 10.10. Фрагменты слоев A1F4 в структуре T1A1F4 (а) и слоев Al3Fi4 в струк-
туре Na5Al3F,4 (б).
В промежуточных по составу слоях M3Fi4, обнаруженных в
хиолите Na5Al3Fi4, одна треть октаэдров имеет по 4 общих эк-
ваториальных вершины, а остальные октаэдры — по 2 транс-
вершины (рис. 10.10,6). В структуре NaFeF4 имеются гофриро-
ванные (цис-) слои, в которых соседними являются немостико-
вые вершины октаэдров.
Объединение нечетного числа A, 3 или 5) вершин октаэдров
MF6 приводит соответственно к образованию дискретного иона
M2Fn, слоя M2F9 (рис. 4.35) или двойного слоя M2F7, представ-
ляющего собой плоский срез структуры типа ReO3 (разд. 5.3.4).
Лишь последний из этих трех комплексов известен в рассмат-
риваемой группе соединений; это — двумерный анион в струк-
туре KjFe2F7 :[3]. Структура Cs3Fe2F9 [4] интересна в связи с
тем, что она содержит пары октаэдров FeF6 с общей гранью, а
не слои связанных через вершины октаэдров, как можно было
предположить.
Интересная структура, основанная на пространственной
аналогии с оксидом MoWnO36, была предложена для соедине-
П—985
162 10. Комплексные галогениды, оксо- и гидроксогалогениды
ний M2Fe5F17 [J. Solid. State Chem., 1970, 2, 269]. На рис.
10.11, а каждый квадратик изображает цепочку соединенных че-
рез вершины октаэдров WO6, ориентированную перпендикуляр-
но плоскости рисунка (цепочка типа ReO3), а небольшие за-
штрихованные кружки соответствуют атомам Мо. После уда-
а
Рис. 10.11. Сравнение октаэдрического слоя М5Х17 (б) и трехмерной структуры
МХ3 (а).
ления части атомов металла и атомов кислорода, расположен*
ных между ними, остаются слои состава Wi0O34, отвечающие
структуре, приписываемой M2Fe5Fi7. На рис. 10.11,6 эти слои
расположены перпендикулярно плоскости рисунка. В таком
слое '/б октаэдров имеет по 6 общих вершин, а остальные —
по 5. Простейший трехмерный каркас, образованный октаэдри-
Таблица 10.7. Строение комплексных фторидов железа и алюминия
Число мо-
стиковых
вершин в ок-
таэдрах
Al(Fe)F6
0
2
2 и 4
4
5
E и 6
6
Тип комплекса
Изолированные
Цепочечный: цис
транс
Слоистый
Слои ((ыс-типа
Слои транс-тяпа
Двойные слои
Многослойный
комплекс
Трехмерный каркас
M3FeF6
K2FeF5
Na5Fe3Fi4
NaFeF4 '
MFeF4
K3Fe2!IF7
M2Fe5F17)
FeF3
Примеры
Na3AlF6 (криолит)
Na3Li3Al2Fi2 (криолитио-
нит)
T!2A1F5
Na5Al3Fi4 (хиолит)
MA1F4
A1F3
10.1. Комплексные галогениды 163
ческимп группами, сочлененными по всем вершинам, присут-
ствует в структурах A1F3 и FeF3; каркас более сложного строе-
ния обнаружен в гидратированном гидроксофториде алюминия
со структурой пирохлора (разд. 6.4.3). Сведения о структурах
комплексных фторидов железа и алюминия сведены в табл. 10.7.
Литература. [1] Z. anorg. allg. Chem., 1937, 235, 139; 1938, 238, 201; 1938, 239,
301 [2] J. Solid State Chem., 1970, 2, 269. [3] Bull. Soc. Chem. France, 1965, 12,
3489 ]4[ J. Less-comm. Met., 1971, 25, 257.
W.I. 13. Некоторые комплексные фториды элементов групп IVA
и VA. Интересные изменения свойств наблюдаются в группе VA
при переходе от V к Та. Атом ванадия в комплексных солях
предпочитает связи с О, а не с F (он образует большое число
кислородных соединений и, подобно Nb, — многочисленные ок-
согалогениды), тогда как для тантала известен лишь TaO2F.
Наиболее устойчивые соли, получаемые при добавлении фтори-
дов металлов к раствору Nb2O5 в HF, содержат ион NbOF52~.
Этот ион намного устойчивее, чем простые ионы Nb.Fn. Напри-
мер, K2NbF7 получают из раствора K2NbOF5-H2O в HF, но он
легко подвержен гидролизу с образованием исходной соли, тог-
да как Rb2NbF7 образуется при многократной перекристаллиза-
ции Rb2Nb0F5 из HF. И наконец, тантал дает преимуществен-
но комплексные фториды типа RmTaFn-xH2O (а не оксофтори-
ды), в которых п достигает 8. Соли V и Nb, аналогичные
Na3TaF8) неизвестны.
Приведенная ниже схема показывает, как меняется состав
продуктов в зависимости от относительной концентрации со-
ставляющих фторидов и HF в системе фторидов калия и нио-
бия.
эквимолярное
количество
KF
избыток
KF
K3Nb0F6
NbF,
\
высокая х\
концентрация ч
HF
избыток KF
при небольшой
• --концентрации
K3HNb0F7
X
11»
164 10. Комплексные галогениды, оксо- и гидроксогалогениды
Комплексные фториды и оксофториды нередко изоструктур-
ны, как, например, соединения, помещенные в горизонтальных
рядах:
M(IV)
M(V)
M(VI)
K2TiFe-H2O
(NH4KTiF7
K3ZrF7
K3HSnF8
K3HPbF8
K2NbOF5-H2O
(NH4KNb0F6
(NH4KTa0F6
K3Nb0F6
K3HNb0F7
K2WO2F4-H2O
Особый интерес в этих соединениях вызывает форма коор-
динационных групп атома металла в комплексных ионах.
Ион Zr4+ в комплексных фторидах может иметь координа-
цию 6, 7 и 8 (табл. 10.8). Шестикоординационный полиэдр име-
ет форму октаэдра; семикоординационный — форму, близкую
либо к пентагональной бипирамиде, либо к одношапочной три-
гональной призме; восьмикоординационный может быть в фор-
ме додекаэдра, квадратной антипризмы или двухшапочной три-
гональной призмы. В гл. 3 уже отмечалось, что некоторые па-
ры полиэдров близко связаны между собой; это справедливо,
например, для квадратной (тетрагональной) антипризмы и двух-
шапочной тригональной призмы (рис. 10.12, а)*. Если в дан-
ной кристаллической структуре координация не очень близка
к одному из «идеальных» полиэдров, могут возникнуть трудно-
сти в выборе наилучшего способа описания типа координации.
Октаэдрическая координация Zr4+ в комплексных фторидах
не является распространенной. Как один из примеров такой
координации ниже рассмотрен CuZrF6-4H2O. Разумеется, на
тип координации оказывают влияние и природа катионов, и
геометрические условия, накладываемые определенным отно-
шением F : Zr. Необоснованность попыток связать размер иона
с координационным числом и геометрией координационного по-
лиэдра хорошо демонстрируется структурой Rb5Zr4F2i. В кри-
сталлах этого соединения осуществляются четыре типа коор-
динации (координационное число) ионов Zr4+: 8 — неправиль-
ная антипризма, 7 — неправильная антипризма без одной вер-
шины, 7 — пентагональная бипирамида и 6 — октаэдр.
Простейший пример КЧ 7 — пентагонально-бипирамидаль-
ный анион в структуре (NH4KZrF7. В структуре К2С11 (Zr2Fi2) •
* Двухшапочная тригональная призма может рассматриваться как поли-
эдр, промежуточный между антипризмой и додекаэдром. — Прим. ред.
Таблица 10.8. Координационные многогранники в
и оксофторидах
Отно-
шение
F:Zr
5,17
5,25
6
6
6
6
6
6
6,5
7
7
7
8
8
Формула
Na7Zr6F3i
Rb5Zr4F2i
KoZrF6
(N2H6)ZrF6
Y-Na2ZrF6
K2CuZr2F12-6H2O
н. т. BaZrFe
CuZrF6-4H2O
Na2Zr2F13
Cu3Zr2F14-16H2O
Na3ZrF7
(NH4KZrF7
Cu2ZrFs-12H2O
Li6BeF4(ZrF8)
КЧ
а тома
Zr
8
6, 7, 8
8
8
7
7
7
6a
7
8
7a
7a
8a
8a
Координационный
многогранник
Антипризма
См. текст
Додекаэдр
Двухшапочная
тригональная
призма
Неправильный
многогранник
Пентагональная
бипирамида
То же
Октаэдр
Одношапочная
тригональная
призма
Антипризма
Неправильный
многогранник
Пентагональная
бипирамнда
Антппрпзма
Додекаэдр
комплексных фторидах
Литература
Acta cryst., 1968, В24,
230
Acta cryst., 1971, B27,
1944
Acta cryst., 1956, 9, 929
Acta cryst., 1971, B27
638
Acta cryst., 1968, B25,
2164
Acta cryst., 1973, B29
1958
Acta Cryst., 1978, B34,
1070
Acta tryst., 1973, B29
1955
Acta cryst., 1965, 18, 520
Acta cryst., 1973, B29
1963
Acta cryst., 1948, 1, 265
Acta cryst., 1970, B26.
2136
Acta cryst., 1973, B29,
1967
J. Chem. Phys., 1964 41,
3478
an
рисутствует дискретный ион ВХ .
Отно-
шение
F:Ce
6
7
8
Формула
(NH4JCeF6
(NH4KCeF7.H2O
(NH4LCeF8
КЧ
атома
Се
8
8
86
Координационный
многогранник
Антипризма
Додекаэдр
Антипризма
Литература
Inorg. Chem., 1969, 8, 33
Acta cryst., 1971, B27,
1939
Acta cryst., 1970, B26,
38
Присутс
твует дискретный ион ВХ
166 10. Комплексные галогениды, оксо- и гидроксогалогениды
Продолжение
10.1. Комплексные галогениды 167
Формула
K3SiF7
K2NbF7, K2TaF7
K3Nb0F6
K2NbOF5-H2O
K3HNb0F7
Na3TaF8
Мя„НТ1Р
lNa3n 11Г 8
Тип комп-
лексного иона
SiF62-
NbF72-, TaF72-
NbOF63-
NbOF52"
{ NbOFs2~
Ihf2-
TaF83-
(HF2-
\ TiF62~
Тип координации
Октаэдрическая
Одношапочная
тригональная
ГТ ГЧ 11 О \Л Q
И у) И э М а
(Пентагонально-
бипирамидаль-
ная)в
Октаэдрпческая
»
Линейная
Антипризматиче-
ская
Линейная
Октаэдрическая
J.
Литература
Am. Chem. Soc,
с л coo
1942,
Ut, VOO
Acta cryst., 1966, 20, 220
J.
J.
J.
J.
Am. Chem. Soc,
64, 1139
Am. Chem. Soc,
63, 11
Am. Chem. Soc,
63, 11
Am. Chem. Soc,
76, 3820
1942,
1941,
1941,
1954,
Acta cryst., 1966, 20, 534
Вероятно, координация такая же, как в (NHthZrF7. но надежные данные от-
сутствуют.
• 6Н2О и в низкотемпературной модификации BaZrF6 две подоб-
ные группы имеют общее ребро и образуют ион Zr2Fi24~.
В Na5Zr2Fi3 две группы с К.Ч 7 в виде одношапочных триго-
нальных призм связаны через общую вершину (рис. 10.12,6).
Строение аниона в K.2ZrF6, образованного из сочлененных по
ребрам додекаэдрических групп, было уже показано на рис. 10.3.
Сходные цепочки лежат в основе структур высокотемператур-
ной модификации BaZrF6 (тип RbPaF6), PbZrF6 и т. д. Четко
выражена додекаэдрическая координация Zr4+ в Li6BeZrFJ
(рис. 10.12, в); в структуре этого соединения ионы Li+ имеют
искаженно октаэдрическую координацию, ионы Ве2+ — тетраэд-
рическую, а ионы Zr4+ находятся в виде дискретных групп
ZrF84~. Другой вид цепочек ZrF6 с координацией Zr в форме
двухшапочной тригональной призмы найден в структуре
(N2H6)ZrF6 (рис. 10.12,г). В дискретных ионах ZrF84~ в струк-
туре Cu2ZrF8-12Н2О координация близка к квадратной анти-
призматической. Две такие группы, сочлененные по ребру, об-
разуют анион в Cu3Zr2Fi4-16Н2О; такой же тип координации
обнаружен в структуре Na7Zr6F3i и в изоструктурных соедине-
ниях Pa, U и других 5/-элементов. Тридцать атомов F и атомы
Zr образуют трехмерный каркас, построенный из антипризм
ZrF8. Антипризмы соединены через вершины в группы по шесть
вокруг кубооктаэдрических «пустот». Эти группы из шести ан-
типризм образуют трехмерный каркас за счет обобществления
части ребер. Состав такого каркаса отвечает формуле (Zv?5)n;
оставшиеся ионы F^ и ионы Na+ расположены в пустотах кар-
каса. (Можно проследить известную аналогию между этой
структурой и структурами пирохлора (разд. 6.4.3) и La4Re60i9
(разд. 5.3.5).)
В структурах фтороцирконатов меди (гидратированных) мы
встречаемся как с разной F, 7 и 8) координацией Zr4+, так и
Рис. 10.12. Строение комплексных фторидов циркония, а — связь между двух-
шапочной тригональной призмой и тетрагональной антипризмой; б—семерная
координация в структуре Na5Zr2F13; в — восьмивершинный полиэдр в струк-
туре Li6BeZrFi2; г — цепочка двухшапочных тригональных призм в структуре
" (N2H6)ZrF6.
с различными координационными группами ионов Си2+.
В CuZrF6-4H2O присутствуют цепочки из чередующихся ше-
стикоординационных групп атомов Си и Zr, а именно
Cu(H2OLF2H ZrF6:
F 0Hz F
\/ I/ \/
—F — Zr—F—Cu—F — Zr—F —
Структура ^Cu2ZrF8-12H2O состоит из антипризматических
анионов Zrrv и октаэдрических катионов Си(Н2О)б2+, тогда
как в Cu3Zr2F14-16H2O по две антипризмы ZrF8 соединены че-
рез ребро и имеются два вида аквакомплексов меди: моно-
ядерные комплексы Си(Н2ОN2+ и биядерные группировки со-
168 10. Комплексные галогениды, оксо- и гидроксогалогсниды
члененных по ребру октаэдров. Поэтому структурные формулы
двух последних соединений следует записывать в виде
[Cu(H2ON]2(ZrF8) и [Cu(H20N][Cu2(H20Io](Zr2F14).
В K2CuZr2Fi2*6H2O координация атома циркония семерная —
две пентагонально-бипирамидальные группы имеют общее реб-
ро. Таким образом, в этих четырех соединениях с. отношением
F : Zr, равным 6, 8, 7 и 6, КЧ атома циркония равно 6, 8, 8 и 7,
что опять-таки демонстрирует положение об отсутствии простой
связи между отношением F : Zr и КЧ атома Zr; лишь в первых
двух структурах содержатся моноядерные группы ZrFn. Это же
подчеркивают данные верхней части табл. 10.8. В остальных
частях этой таблицы указаны некоторые характеристики комп-
лексных фторидов других элементов. Например, она демонстри-
рует, что одно и то же КЧ иона Се4~ может выполняться при
разных отношениях F: Се; в нижней части таблицы показано
разнообразие типов комплексных ионов в структурах комплекс-
ных фторидов и оксофторидов Nb и Та. В отличие от структур
KsSiF7 и (NH4KSiF7, содержащих октаэдрические SiF62~ и дис-
кретные F~, в (NH4KZrF7 присутствуют пентагонально-бипира-
мидальные ионы ZrF73~ (ср. структуры K3UF7 и K3UO2F5,
разд. 28.2.4, в), тогда как ионы NbF72~ и TaF72~ имеют форму
одношапочных тригональных призм. В то же время в
(NH4KCeF7-H2O реализуется другая возможность: две доде-
каэдрические группы объединены по общему ребру, образуя
ион (Ce2Fi4N~. Таким образом, эти соединения иллюстрируют
три способа достижения отношения F : В, равного 7 : 1: при КЧ
атома В, равном 6, 7 и 8. И напротив, в структурах трех фто-
роцератов аммония, указанных в табл. 10.8, при координацион-
ном числе Се, равном 8, отношение F : Се составляет 6:1, 7:1
и 8 : 1. При этом структура соединения (NH4JCeF6 дает третий
пример соли А2ВХ6 с анионами в виде бесконечных цепочек,
построенных из восьмивершинников. Во всех трех примерах
полиэдры имеют различную форму:
Тип координационного полиэдра
K2ZrF6 Додекаэдр
(N2H6)ZrF6 Двухшапочная тригональная призма
bCF Антипризма
В структуре Na3TaF8 анион имеет форму квадратной анти-
призмы; в то же время в Na3HTiF8 нет ионов ВХ8, а имеется
равное число ионов HF2~ и TiF62~. Аналогичным образом в
K3HNb0F7 присутствуют HF2~ и октаэдрические ионы NbOF52~;
последний имеется и в соединении K2NbOFs-H2O.
Представляют значительный интерес также комплексные
фториды тория и урана(IV), описанные в гл. 28. В их структу-
рах часто осуществляется девятерная координация.
10.2. Нитридогалогениды 169
10.2. Нитридогалогениды металлов
Нитридогалогениды можно синтезировать разнообразными спо-
собами. Например, Mg2NCl (а также соединения с F, Вг, I)
получали непосредственным взаимодействием нитрида и галоге-
пида металла; Mg3NF3 получен при действии азота на смесь ме-
талла п его фторида при 900 СС, a ZrNI — при нагревании Zrl4 •
• /1NH3. Работы, посвященные структурным исследованиям этих
соединений, приведены в табл. 10.9. Соединение VNC14, по-ви-
Таблица 10.9.
Соединение
Mg"NCl(F)
ZrNCl(Br, I) 1
TiNCl(Br, I) /
ThNF
ThNCl(Br, 1)
UNCl(Br, I) ¦
fU(NH)Cl?|
LaNvF3_,
VC13(NCI)
Ca2NX
Нитридогалогениды
Структурный run
NaCl (дефектный)
—
FeOCl (атомы N
не локализова-
ны)
LaOF (ромбоэдр.)
BiOCl
BiOCl
LaF3
Lm. текст
металлов и родственные
!
им соединения
Литература
Acta cryst., 1969, В25,
Z. anorg. allg. Chem.
J. Solid State Chem
Z. anorg. allg. Chem.,
Z. anorg. allg. Chem.,
Z anorg. allg. Chem.,
Z. anorg. allg. Chem.,
1009
1968, 363, 191;
, 1970, 1,
1964, 327,
1968, 363
1969, 366,
1966, 348,
Materials Res. Bull, 1871, 6, 57
/.. anorg. allg. Chem.,
1968, 357,
Сотр. rend.,' 1971, C272, 1657;
wiss., 1971, 4, 219
406
207
, 258
43
50
325
Natur-
димому, представляет собой хлоримид трихлорида ванадия в
соответствии с приписываемой ему структурой, в которой при-
сутствуют не очень прочные ассоциаты из двух молекул. Распо-
С1
ложение связей вокруг атома ванадия квадратно-пирамидаль-
ное или октаэдрическое в зависимости от того, учитываются ли
слабые связи с атомами хлора соседних димерных молекул;
точность определения расстояний не указана. Длина связи V—
N такого же порядка, как и в других комплексах переходных
металлов со связями М—N и М—С1 (например, для KoOsNCl5
Os—N 1,61 А).
170 10. Комплексные галогениды, оксо- и гидроксогалогениды
Строение Mg3NF3 (дефектная структура NaCl) показано на
рис. 6.1,E; окружение атома Mg октаэдрическое B,11 A, 4F-+-
+ 2N), у атома N ближайшие соседи 6Mg (октаэдр), а у атома
F — 4Mg (компланарны). По данным рентгенографического ис-
следования порошка, тетрагональная структура Mg2NF, по-ви-
димому, близка к упорядоченной структуре типа NaCl, рас-
тянутой в одном направлении, так что ближайшими соседями
атома Mg являются 3N и 2F (на среднем расстоянии 2,13А)
с еще шестью F на расстоянии 2,86 А. Координация атома N —
искаженно октаэдрическая, а атом F окружен 4 атомами Mg
таким же образом, как в структуре Mg3NF3. Структура моди-
фикации Mg2NF, устойчивой при высоком давлении, по-видимо-
му, намного ближе к кубическому NaCl, что и следовало ожи-
дать, учитывая изоэлектронность Mg2NF и MgO.
Л 0.3. Тиогалогениды
К сожалению, структурные исследования были выполнены лишь
для некоторых групп тиогалогенидов, что делает преждевремен-
ной попытку дать систематический обзор структур этих соедине-
ний. Тиогалогениды фосфора рассмотрены в гл. 19; здесь обсуж-
даются лишь структуры тиогалогенидов металлов. Самую боль-
шую группу составляют соединения состава MSX. Их образу-
ют такие элементы, как La, Y, 4/-элементы, элементы Б-под-
групп, например In, Sb и Bi. Более сложные структуры обнару-
жены для Hg и Nb: Hg3S2Cl2 (разд. 26.3.3,6) и NbS2Cl2 (см.
ниже).
Структуры тиогалогенидов 4/-элементов, многие из которых
обладают полиморфизмом, часто свойственны только этим со-
единениям; атом металла в них имеет координационное число
6, 7 или 8. Например, структура SmSI состоит из слоев соста-
ва SmS, образованных из тетраэдров SSm4, имеющих по 3 об-
щих ребра (рис. 28.9, а), проложенных атомами иода. В резуль-
тате атом Sm оказывается 7-координированным CS 2,73 А,
1 S — 2,84 А и 31 3,29 А) [1]. Также семерная координация
атома металла осуществляется в изоструктурных тиобромидах
Pr, Sm, Gd и Tb D S и 3 Br) [2], структурно-эквивалент-
ных Eul2 (разд. 9.9.2, д). В более сложной структуре p-YSF
(и в изоструктурных тиофторидах Но, Er, Yb и Lu) [3] имеют-
ся слои состава YS2 (аналогичные слоям в Cdl2), содержащие
половину всех атомов Y (октаэдрическое окружение шестью
атомами S). Атомы S этих слоев связаны с остальными атома-
ми Y, которые лежат в плоских гексагональных слоях состава
YF2. Координация этих атомов Y — гексагональная бипирами-
дальная, осуществляемая 6 атомами F и 2 атомами S. Синте-
зированы все тиогалогениды индия (III); на основе данных по
10.3. Тиогалогениды 171
О 5
О
Вг
порошкограммам для соединений InSCl и InSBr была предло-
жена «статистическая» структура типа CdCl2 [4]. Однако этот
пезутьтат желательно было бы проверить на основе структур-
ного" исследования монокристаллов, если, конечно, последние
утастся вырастить.
"' Hi двенадцати возможных соединений с формулой АВХ (где
A = Sb, Bi, B = S, Se, X = C1, Br, I) получены все, за исключением
SbSCl'n SbSeCl, и все они (кроме BiSeCl) изоструктурныдруг
другу. Структура SbSBr [5] состо-
ит из зигзагообразных цепочек
(SbS).;"+, между которыми находят-
ся ионы Вг- (рис. 10.13). Цепочку
можно отнести к простейшей трех-
связаиной линейной системе (см.
рис. 3.19, а); по строению она очень
близка к цепочкам в Sb2S3 (разд.
1?0 5) В пределах цепочки расстоя-
ния Sb—S равны 2,49А A) и 2,67А
B), углы при атоме Sb составляют
84° B) и 96° A), а все углы при
атоме S близки к 95°. Ближайшими
соседями ионов Вг~ являются 2 Sb
B,94 А) и 1 S C,46 А). О структу-
ре HgsSoCb см. гл. 26.
Соединение NbS2Cl2 не относится к простым тиогалогени-
дам, поскольку в его структуре имеются группы S2. Структура
соединения — слоистая типа А1С13, в которой один атом С1 за-
менен на группу S2 (расстояние S—S 2,03 А) [6]. Ближайшее
окружение ниобия — 4С1 B,61 А) и 4 S (две группы S2, Nb—S
2,50 А). Атомы Nb располагаются парами; расстояние Nb—Nb
составляет 2,90 А.
Тиогалогениды с молекулярной структурой представлены к
настоящему времени лишь WSC14 и сходным по строению (но
С1 С1
Рис.
10.13. Кристаллическая
структура SbSBr.
Cl'
-ci-
Cl
\s
-2.10A
Cl
не изоструктурным) \VSBr4 [7]. Квадратно-пирамидальные мо-
лекулы ассоциированы по две, причем расстояние в мостике
W С1 C,05 А) намного больше, чем среднее расстояниеW—С1
B,28 А) в молекуле WSC14 B,10 А).
Литература. [1] Ada cryst., 1973, В29, 345 [21 Acta cryst., 1973, B29, 1532.
11 t ,nKst" 1973' B29' 1567- Г41 Z. anorg. allg. Chetn., 1962, 314, 303. [5] Acta
VE12 14 [6] Z l' Ch 1966 47 23L № J Ch S
, 2o 15.
g g
- Chem" 1966> 347>
- Chem- Soc'>
172 10. Комплексные галогениды, оксо- и гидроксогалогениды
10.4. Оксогалогениды
Соединения, содержащие в своем составе один или более эле-
ментов в сочетании с кислородом и галогеном, могут быть са-
мых разнообразных типов. Как и в случае комплексных галоге-
нидов, по эмпирической формуле оксогалогенида МОХХУ невоз-
можно сделать заключение о его строении. Так, гипохлорид
кальция СаО2С12 представляет собой соль, содержащую анио-
ны СЮ~, его формула Са(ОС1J; хлорид уранила иО2С1г со-
стоит из ионов UO22+ и С1~, т. е. имеет состав (UO2)C12, тогда
как хлористый сульфурил SO2C12 имеет молекулярную структу-
ру. Материал по некоторым группам этих соединений включен
в состав других глав:
соли кислородных кислот галогенов рассмотрены в гл. 9;
оксогалогениды и оксогалогенидные ионы неметаллов (на-
пример, POF3, PO2F", PO3F2~) описаны в главах, посвященных
структурной химии тех элементов, с которыми связаны атомы
О и X;
комплексы РОСЬ, SeOCl2 и др. с галогенидами рассмотре-
ны в гл. 19 и 16.
В эту главу включен лишь небольшой раздел, касающийся
соединений переходных металлов, содержащих оксогалогенид-
ные ионы.
Оксогалогениды того или иного типа известны для большин-
ства металлов периодической системы, за исключением щелоч-
ных и, возможно, металлов 1Б-подгруппы. В то же время пока
имеется лишь немного примеров, когда один и тот же тип фор-
мулы реализуется в оксогалогенидных соединениях данного ме-
талла со всеми четырьмя галогенами, как, например, в ряду со-
единений NbOX3. В табл. 10.10 приведены известные оксогалоге-
ниды металлов групп VA—VIIA и VIII; это преимущественно
соединения с фтором и хлором, очень редко — с иодом. В ходе
дальнейшего развития химии такое положение может, разуме-
ется, измениться. Для оксогалогенидов получено по крайней ме-
ре десять различных типов формул:
МОХ, МОХ2,
мо2х,
МО3Х,
мох3,
МО2Х2,
МО3Х,
мох4> мох5
МО2Х3
С большой вероятностью можно утверждать, что если соедине-
ния не относятся к типу молекулярных оксогалогенидов, то бу-
дут наблюдаться существенные различия между структурами
кристаллических оксофторидов и других оксогалогенидов дан-
ного металла.
О О°к
с
О О
с с
5 S
о
о
о о
о о
^j ей О
О О О О
о о w с*
OS OS OS OL.
О С О О
U 'J У О
е: os oS os
cj со
00-
O
О
с
00
> >
174 10. Комплексные галогениды, оксо- и гидроксогалогениды
10.4.1. Оксогалогенидные ионы. Для переходных металлов в
различных степенях окисления обнаружено большое разнообра-
зие образуемых ими оксогалогенидных ионов. Строение некото-
рых солей имеет значительное сходство со структурами оксо-
солей или комплексных галогенидов. Например, ион CrO3F~ в
KCrO3F имеет форму почти правильного тетраэдра; вследствие
близости размеров атомов О и F в кристаллической структуре
осуществляется статистическая ориентация этого аниона (струк-
турный тип CaWO4). В то же время в КСгО3С1 из-за различия
в длинах связей Сг—О A,53 А) и Сг—С1 B,16 А) осуществля-
ется искаженный вариант этого структурного типа. Соединение
(ЫН4)зМоО3Рз с октаэдрическим ионом MoO3F33~ имеет такую
же структуру, как (NH4KA1F6. Но если K2OsCl6 имеет кубиче-
скую структуру типа K2PtCl6, то в соли K20s02Cl4 [1] та же
структура сильно деформирована (Os—С1 2,38 A, Os—О 1,75 А;
ср. с 2,36 А в КгОэОб и 1,66 А в OsO4). Соли с формулой
Cs2MvOCl5 (M = Nb, Cr, Mo, W) также кристаллизуются в струк-
турном типе K2PtCl6 [2]; дискретные октаэдрические ионы
UO2C142~ (а) с двумя короткими связями U—О, характерными
для уранила (гл. 28), присутствуют в структуре CS2UO2CI4 [3].
Некоторые оксогалогенидные ионы устойчивы в струк-
турах только в сочетании с большими катионами.
2,62 А
2,51 А
о
! 1,9 А
F
Ч
О
в
-Ru-O-Ru-
,2 А
9 ci ci С1
i / i /
H,O-Ru-N-Ru-OH-
/I /1
С1 О С1 С1
д
В (C2H5LN[ReBr40(H20)] @) [4] осуществляется квадратно-
пирамидальное расположение четырех атомов Вг и одного ато-
ма О (с атомом металла, расположенным на 0,32 А выше осно-
вания пирамиды); шестая «октаэдрическая» связь с молекулой
Н2О — очень слабая.
10.4. Оксогалогениды 175
Квадратно-пирамидальные ионы обнаружены также в солях
Ca3(WO5)Cl2 [5] и [As(C6H5L](Re0Cl4) [6]. В ионе WO54-
длина аксиальной связи W—О равна 1,725 А, остальных —
1,90 А; атом W расположен на 0,55 А выше плоскости квадрат-
ного основания, а ближайший атом (С1~) в направлении шестой
октаэдрической связи находится на расстоянии 3,40 А.
В ReOCU~ атом Re находится на 0,41 А выше плоскости осно-
вания, расстояния составляют Re—О 1,63 А и Re—С1 2,34 А.
Сходное строение имеет ион ТсОСЦ" [7].
Примеры более сложных оксогалогенидных ионов приведе-
ны на схемах в и г. В (NH4KUO2F5 [8] анион имеет конфигура-
цию пентагональной бипирамиды (в). Структурные характери-
стики ионов с мостиковым кислородом М2ОС1ю4~ (M = W, Re,
Ru и Os) (г) и Re2OClio3~ приведены в табл. 11.5.
Линейный ацион д в K3[Ru2NCl8(H2OJ] [9] хотя и не от-
носится к оксогалогенидным, однако о нем естественно упомя-
нуть, поскольку по своему строению он аналогичен структу-
ре г.
Помимо дискретных оксогалогенидных ионов в структурах не-
которых комплексных соединений встречаются и бесконечные
оксогалогенидные ионы. Такое строение имеют анион в
K2(NbO3F) со слоистой структурой типа K2NiF4 (табл. 10.11)
и quc-октаэдрический цепочечный ион АХ5 в K2(VO2F3) [10]
и в (NH4J(VF4O) [11], в которых мостиковыми являются ато-
мы фтора*.
Литература. [1] Acta cryst., 1961, 14, 1035. [2] J. Chem. Soc., 1964, 4944. [3] Acta
cryst., 1966, 20, 160. Щ Inorg. Chem., 1965, 4, 1621. [51 Acta cryst., 1974, B30,
2587. [61 Acta cryst., 1977, B33, 1248. [71 Inorg., 1979, 18, 3034. [8| Acta cryst.,
1969, B25, 67. [9] J. Chem. Soc, A 1971, 1792, 1795. [101 Acta cryst., 1971, B27,
1270. [11] Ada cryst., 1980, B36, 1925.
10.4.2. Структуры оксогалогенидов металлов. Рассмотрение этих
соединений будет проведено по следующим группам:
ионные оксофториды;
оксогалогениды переходных металлов в высших степенях
окисления;
оксогалогениды МОС1, МОВг и MOI;
структуры других оксогалогенидов.
10.4.3. Ионные оксофториды. К настоящему времени известны
оксофториды, имеющие такое же строение, как и бинарные
оксиды или фториды МХ2 или МХ3, или структуры, типичные
* В этих структурах, как и в описанных выше, связь М.. .F (или М. ..О)
в транс-позиции к кратной связи М=О резко удлинена. См. обзор стереохи-
мии комплексов с кратными связями металл — лиганд [Coord. Chem. Rev.,
1975, 17, 1-98].-Прим. ред.
Таблица 10.11. Кристаллическое строение оксофторидов
Тип структуры
Рутил
а-РЬОа
ZrC>2 (бадделеш
Флюорит
Сверхструк-
тура:
CaF2—YF3
PbC!2
ReO3
МоОз
LaF3
Перовскит
K2NiF4
Шпинель
Криолит
Элпазолнт
Тетрагональ-
ная бронза
Пирохлор
Гранат
Магнетоплум-
бит
Примеры
FeOF, TiOF, VOF (высокое
давление, температура)
NaNbO2F2 (сверхструктура)
ScOF
AcOF, HoOF
Ромбоэдр.: YOF, LaOF,
SmOF и др.
Тетрагон.: YOF, LaOF,
PuOF
Искаженная: TIOF
YnOn-lFn + 2
InOF
LaOF и др. 4/-металлы (вы-
сокое давление)
TiOF2
NbO2F, TaO2F
WO3-xFx, MoO3-*F, 1
Mo4OnF J
ThOF2
BiO0,iF2!8
KNbO2F, NaNbO2F
T1'T1I"OF2
K2Nb03F
Sr:FeO3F
Cu2Fe03F
Fe3O4-.vF.v
Na3VO2F4 (монокл.) \
K3Ti0F5 (тетрагон.) /
K->NaVO,F4
KNb2O5F
Cd2TbO,F2
Y3Fe56.l2-.vF,
/Y3Al4Ni0nF 1
\ BaCoFenOi8F /
Литература
J. Solid State Chem., 1970. 2,
49
Acta cryst., 1969, B25, 847
Acta Chem. Scand., 1966, 20,
1082; Acta cryst., 1970,
B26, 2129; Acta cryst,
1957, 10, 788; J. Am. Chem.
Soc, 1954, 76, 4734, 5237;
Inorg. Chem., 1969, 8, 232
Acta cryst., 1972, B28, 3426
Acta cryst., 1975, B31, 1406
Acta cryst., 1973, B29, 627
Materials Res. Bull., 1970, 5,
769
Acta cryst., 1955, 8, 25
Acta cryst., 1956, 9, 626
Inorg. Chem., 1969, 8, 1764
Acta cryst., 1949, 2, 388
Acta Chem. Scand, 1955 ft
1209 ' '
Z. anorg. allg. Chem., 1964,
329, 211
Materials Res. Bull, 1970 5
185
J. Phys. Chem., 1962, 66,
1318
J. Phys. Chem., 1963 67,
1451
J. Phys. Chem. Solid., 1963,
24, 759
Сотр. rend., 1970, 270C,
2142
Z. anorg. allg. Chem., 1969,
369, 265
Acta Chem. Scan., 1965 19,
1510
Сотр. rend., 1969, 269C, 228
Materials Res. Bull., 1971, 6,
63
J. Phys. Chem. Solid., 1963,
24, 759
10.4. Оксога.югсниОы 177"
для комплексных оксидов или фторидов (табл. 10.11). В этих
структурах может осуществляться как статистическое располо-
жение атомов О и F по позициям анионов, так и их упорядочен-
ное расположение (сверхструктура). Последнее встречается ре-
же; ниже в качестве примеров сверхструктур от структуры
флюорита рассмотрены две модификации LaOF.
Для иттрия известен ряд оксофторидов с формулой
Y,,O,,-il-V.-2 (« = 4-=-8), например Y7O6F9. Элементарная ячейка,
имеющая параметры а, па, а, состоит из п соединенных друг с
другом субъячеек флюоритового типа, в двух из которых содер-
жится избыток анионов. В элементарной ячейке можно выде-
лить две области, почти точно соответствующие структурам
CaF2 н YF3, между которыми находится участок с постепен-
ным изменением типа структуры. Многие из оксофторидов пере-
ходных металлов, имеющие состав, очень близкий к составу
оксида, по структуре сходны с оксидами тех же металлов. При-
мерами могут служить Nb3O7F и LiNb6Oi5F (гл. 13); к более
сложным случаям можно отнести Nbi7O42F и Nb3i077F [Acta
Chem. Scand., 1965, 19, 1401], которые по структуре являются
производными от одной из модификаций Nb2Os. Члены семейст-
ва структур M3n+iX8H-2 построены из структурных блоков ReCb
различного размера:
II
п
= 9
= 10
= 11
М
м
2SO70
з.Х78
34^86
(Nt>205)
(Nb31O77F)
(Nb!7042F)
В отличие от соединений указанного типа, содержащих:
очень мало фтора, известны и другие, такие, как Zr7O9F]0 [Acta
cryst., 1970, В26, 830] с индивидуальной структурой (в данном
случае КЧ Zr4+ равно б и 7), больше напоминающие комплекс-
ные фториды, такие, как Na7Zr6F3i (разд. 10.1.13).
У некоторых оксофторидов состав может меняться в опре-
деленных пределах; в этом случае формула, приводимая в табл..
10.11, попадает в наблюдаемый интервал изменения состава.
Ранее мы уже отмечали, что в случае чистого BiF3 структура
типа LaF3, по-видимому, является неустойчивой; стабилизация
фазы происходит при замещении незначительной части фтора
на кислород (приближенная формула BiO0,iF2,8).
Сверхструктуры флюорита. Кубическая структура флюорита
(CaF2) уже была представлена на рис. 6.9. Ту же структуру
можно отнести к ромбоэдрической элементарной ячейке (а =
= 7,02 А, а = 33,3°), содержащей две формульные единицы, как
это показано на рис. 10.14, а. В ромбоэдрической модификации
LaOF расположение ионов F~ и О2~ таково, что симметрия дей-
ствительно понижается до тригональной, поскольку атомы ока-
зываются связанными осью третьего порядка, проходящей толь-
12—985
178 10. Комплексные галогениды, оксо- и гидроксогалогениды
ко через одну объемную диагональ исходного куба (рис.
10.14,6). Согласно недавнему исследованию ромбоэдрического
YOF, позиции, которые ранее приписывали атомам О и F, сле-
дует поменять местами. Расстояния Y—О и Y—F различны,
и первоначально предполагалось, что последнее расстояние
должно быть короче; по последним данным, Y—О 2,24 и
10.4. Оксогалогениды 170
Рис. 10.14. а —выбор ромбоэдрической элементарной ячейки в структуре
флюорита. Ионы Са2+ находятся в центрах всех граней малых кубов, но пока-
заны лишь ионы, необходимые для выделения ромбоэдрической ячейки; б и
в — структуры двух модификаций LaOF (см. текст).
2,34 A, Y—F 2,41 и 2,47 А. (В структуре ScOF расстояния Sc—F
на ~0,1 А больше, чем расстояния Sc—О.) В тетрагональной
сверхструктуре распределение анионов совершенно иное (рис.
10.14, в). Эта модификация устойчива в некотором интервале
состава в соответствии с формулой MOnF3-2n @,7<я<1,0).
При максимальном содержании фтора состав отвечает формуле
MO0,7Fi,6, т. е. имеется некоторый избыток фтора по сравнению
с его относительным количеством во флюоритоподобной струк-
туре. По-видимому, для этого состава четыре позиции атомов О,
показанные на рис. 10.14,6, заняты атомами 2,80+1,2 F, а из-
быток ионов фтора A,2 F) размещается по некоторым из поло-
стей, обозначенных небольшими черными кружочками.
Молекула
У0С1з
СгО2С12
Сг(№
МоО;,С1;
MoO3F
RcO3F
ReO,Cl
VloOCU
WOCU
а э -,
Таблица 10.12. Строение молекул оксогалогенидов
о
Расстояние, А
М — О
1,57
1,57 C)
1,58
1,75A0)
1,586E)
1,692C)
1,702D)
1,66
1,69
М —X
2,14
2,12 B)
1,74
2,28C)
1,724E)
1,859(8)
2,229D)
2,28
2,28
Угол, град
О—V—С1 108
С1—V—С1 111
О—Сг—О 105 D)
О—Cr—C1 109,5 C,0)
С1—Сг—С1 113 C)
О—Сг—О 102
F—С г—F 119
(О—Мо—О 109,5)
О—Mo—C1 108 G)
Cl—Mo—C1 113 G)
О—Mn—F 108,5 A)
О—Re—F 109,5 C)
Cl—Re—О 109,4 A)
Cl—Mo—О 103
Cl—W—О 102
Метод
иссле-
дова-
ния8
э
э
э
э
м
М 1
м/
э
э
металлов
Литература
J. Am. Chem. Soc,
1938, 60, 2360
Inorg. Chim. Ada,
1975, 13, 113
J. Am. Chem. Soc,
1938, 60, 2360
Chem. Comm., 1973,
633
Skinner H. A., The-
sis, Oxford, 1941
Phys. Rev., 1954,
96, 649
J. Chem. Phys.,
1959, 31, 633
Bull Chem. Soc.
(Japan), 1975,
48, 666
Bull. Chem. Soc.
(Japan), 1975,
47, 1393
азовая электронография; М — микроволновая спектроскопия.
10.4.4. Оксогалогениды переходных металлов в высших степенях
окисления. Некоторые из соединений, приведенных в табл. 10.10,
были исследованы в газообразном состоянии. Детали строения,
ряда тетраэдрических молекул МОХ3 и МО2Х2 и квадратно-пи-
рамидальных молекул МОХ4 приведены в табл. 10.12. По всей
вероятности, многие из соединений, приведенных в табл. 10.10,
образуют молекулярные кристаллы, как, например, это имеет
место в случае ReOCl4 (квадратная пирамида [1]) и обеих
модификаций OsOF5 [2]. В других случаях (табл. 10.13) за
счет образования олигомерных молекул или одно-, двух- или.
трехмерных систем реализуются более высокие координацион-
ные числа атомов металла. Так, NbOCl3 (так же как VOC13)
в газообразном состоянии мономерен, а в кристаллическом об-
разует полимерную цепочечную структуру [3]. Как видно из
Рис- *9v*p" эти Цепи создаются октаэдрическими группировками
rpaHC-NbO2Cl4, объединенными в димеры через общее ребро
12*
180 10. Комплексные галогениды, оксо- и гидроксогалогениды
Таблица 10.
13. Оксогалогениды, сходные по строению с галогенидами МХ4
Структура галогеннда
Тетрамер
Зктаэдриче-
ские цепо-
чечные
структуры
Слоистая
Каркасная
Nb4F20
ТсС14
a-UF5
CrF5
SnF,
P-UF5
и МХ5
Оксогалогенид
:wof4L
?еОВг3, ТсОС13
VloOCb (моноклинный)
А'ОСЦ, WOBr4
HoOF4, ReOF4; TeOF4
v\'O2Cl2
JOF4
Литература
. Chem. Soc, A 1968,
2074
f. Chem. Soc, A 1969,
2415
'. anorg. allg. Chem.,
1 Qfifi 444 1 ^7
1 yuu, ot^, ы/
l\i. табл. 9.20
'. anorg. allg. Chem.,
1968, 363, 58
\cta cryst., 1974, B30,
1701
B Cl) и в цепь через противоположные вершины (атомы О).
Тесная связь между структурами кристаллических NbOCl3 и
NbCl5 проявляется в том, что при замене атомов О (рис. 10.15)
на атомы С1 состав димерного фрагмента цепочки оказывается
.NbjClio, а это и соответствует строению дискретных молекул в
кристаллическом пентахлориде. Структуру типа NbOCl3 имеют
и другие оксогалогениды: МоОС13 (тетрагональный), WOC13,
WOBr3, ТсОВгз, NbOBr3 и МоОВг3 [4].
Из двойных цепочек типа NbOCl3 легко получить слои со-
става МОХ2:
о
о
о
I
т
О
т
О
т
О
По-видимому, именно такую структуру имеют NbOCl2
NbOBr2 и NbOI2 [5].
Структуры ряда оксогалогенидов сходны со структурами га-
логенидов. Они отличаются лишь заменой части атомов галоге-
на на атомы кислорода. Поскольку многие из трехмерных ион-
ных структур, приведенных в табл. 10.11, свойственны и фтори-
дам, и оксидам, к этой группе можно отнести структуры целого
ряда оксофторидов той же таблицы. В табл. 10.13 сведены изве-
стные в настоящее время примеры оксогалогенидов, имеющих
структуры, свойственные только галогенидам (но не оксидам).
Некоторые оксохлориды и оксобромиды М0Х3 имеют строе-
ние, сходное со структурой ТсСЦ (чыс-октаэдрическая, цепочеч-
10.4. Оксогалогениды 181
1,99 А
Z,Z4A
пая); сюда относятся МоОС13 (мо-
ноклинный), ТсОС13 и ReOBr3. В
структурах этих соединений атом М
смещен из центров октаэдрических
групп в направлении атома О. На-
пример, в структуре моноклинного
МоОСЬ мостикевыми служат атомы
С1, причем в несимметричном мос-
тике более длинной является связь,
противоположная атому О.
В структурах WOC14 и WOBr4
(структуры типа cc-UF5) мостиковы-
ми являются атомы О, но они лока-
лизованы недостаточно надежно.
Структура WO2C12 состоит из
слоев, составленных из октаэдриче-
ских групп \VO4C12> сочлененных
через четыре экваториальных атома О (ср. со структурой SnF4).
Кислородные мостики несимметричны, так что в обоих направ-
лениях связывания в слое чередуются короткие и длинные свя-
зи W—О (средние расстояния 1,67 и 2,28 А). (В этой связи
О
Nb
2,53А
О
О
С1
Рис. 10.15. Фрагмент бесконеч-
ной цепочечной молекулы в
структуре кристаллического
NbOCl3.
1,60
см. структуру WO3.) Величина угла между связями атома О
составляет ~160°, длина связи W—С1 2,31 А.
Литература. [1] J. Chem. Soc, D 1972, 582. [2] J. Chem. Soc, A 1968, 536, 543.
[3] Acta cryst., 1959, 12, 21. [4] J. Chem. Soc, A 1968, 1061; Acta cryst., 1970,
B26, 1161. [51 Angew. Chem., 1964, 76, 833.
10.4.5. Оксогалогениды М0С1, MOBr и MOI. Оксохлориды МОС1
известны для Al, Ga, La, Ti, V и 4f- и 5/-металлов; большинст-
во этих металлов образуют также соединения МОВг и MOI.
Для сурьмы и висмута получены также оксогалогениды более
сложного состава; они рассматриваются в гл. 20. К данной груп-
пе оксогалогенидов принадлежит BiOF. Другие оксофториды
вышеназванных элементов рассмотрены вместе с ионными оксо-
¦фторидами.
182 10. Комплексные галогениды, оксо- и гидроксогалогениды
Оксогалогениды МОХ в структурном отношении резко отли-
чаются от других оксогалогенидов. Они кристаллизуются в од-
ной из трех слоистых структур с 4-, 6- и 8 (9-) координацией
атома М соответственно.
GaOCl. Структура GaOCl [1] (и нзоструктурных ему А1ОС1,
АЮВг и A1OI) состоит из слоев тетраэдров GaOsCl (Ga—О,
1,91 A, Ga—С1 2,22 А), способ сопряжения которых показан на
рис. 10.16. Каждый атом О принадлежит трем тетраэдрам; чет-
О С1 выше плоскости Ga-0
О С1 ниже плоскости Ga-0
Рис. 10.16. Слой структуры GaOCl Рис. 10.17. Боковая проекция (вдоль
(идеализированный). слоев) кристаллической структуры
InOCl или FeOCI.
вертая, не связанная с другими тетраэдрами вершина, занята
атомом С1. Атомы С1 размещаются поровну по обе стороны от
(гофрированного) слоя атомов Ga и О.
FeOCI, Слои в этой структуре имеют такое же строение,
как и в Y-FeO(OH), но их упаковка существенно отличается от
способа, описанного в разд. 14.2.4. В то же время структура
FeOCI имеет определенное сходство со структурой BiOCl, как
это легко видеть из сравнения их боковых проекций на рис.
10.17 (FeOCI) и 20.8 (BiOCl). Существенное различие этих
структур состоит в значении координационного числа атома М:
6 в FeOCI и 8 в BiOCl. Ниже для структуры FeOCI (а) при-
ведены длины связей [2]. Изоструктурны следующие соедине-
ния: InOCl и InOBr [3], InOI [5], VOC1 [6], TiOCl [7] и
CrOCl [81. В структуре VOC1 (б) наблюдается значительное
искажение правильной октаэдрической координации.
BiOCl. Остальные оксогалогениды состава МОХ (не считая
SbOCl, структура которого рассматривается отдельно в гл. 20)
строятся из слоев уже иного типа (свойственного также смешан-
ным галогенидам PbFCl и PbFBr). Каждый тройной слой со-
10.4. Оксогалогениды 183
стоит из слоя компланарно расположенных атомов О и двух
плоских слоев атомов галогена, расположенных по обе стороны
от атомов кислорода; атомы металла размещены между слоями
атомов С1 и О. Проекция структуры показана на рис. 10.18; там
же приведена последовательность чередования атомов в направ-
el .
О
о
о
Ct выше
плоскости рис.
Bi выше
плоскости рис.
О в плоскости
рис.
Bi ниже
плоскости рис.
Cl ниже
плоскости рис.
Bi
О
Bi
iCl
О
Bi
Cl
а
Рис. 10.18. а — расположение атомов
в слое кристаллической структуры
BiOCl (или PbFCl); б — последова-
тельность чередования атомов в на-
правлении, перпендикулярном слою
на рнс. а; в — элементарная ячейка
структуры.
BHPb)
лении, перпендикулярном слоям. Внутри такого тройного слоя
атомы висмута имеют окружение из четырех атомов О и четы-
рех атомов С1 по вершинам квадратной антипризмы. Однако
имеется еще один атом С1, расположенный за центром большей
квадратной грани антипризмы; эти дополнительные контакты
Bi—Cl показаны на рис. 10.18,6 штриховыми линиями. Коор-
динация атома висмута (8 или 9) более наглядно показана на
рис. 10.18,6, на котором выделена тетрагональная элементарная
:,}в А
Длины связей в FeOCI
а
1,97 А
Длины связей в VOCI
6
184 10. Комплексные гилогенайы, икса- и гидроксогалогениОы
ячейка структуры. Различие в расстояниях до четырех ближай-
ших атомов галогена и до пятого существенно увеличивается
при переходе от BiOCl к BiOI и от LaOCl к LaOI. Несколько
меньшее увеличение этих расстояний обнаружено при переходе
от BaFCl к BaFI. На этих структурах можно проследить посте-
пенное изменение координации от девятерной в BaFCl и LaOCl
к восьмерной в слоистых структурах LaOI и BiOI; структуры
BaFI, BiOCl и BiOF (Bi—4F 2,75 A, Bi—1 F 2,92 A [9]) зани-
мают промежуточное положение.
Таблица 10.14. Межатомные расстояния (в А) в оксогалогенлдах
и фторогалогенидах со структурой типа PbFCl
М—4Х
Л1-Х
BiOCl
3,07
3,49
BiOI
3,36
4,88
LaOCl
3,18
3,14
LaOI
3,48
4,79
ВаГС1
3,29
3,20
BaFI
3,58
3,84
Небольшой интервал изменений в параметре а элементарных
ячеек в ряду LaOCl—LaOBr—LaOI D,11—4,14 А) в сравнений
с сильным увеличением параметра с (направление, перпендику-
лярное плоскости слоев) от 6,87 до 9,13 А отражает значитель-
ную жесткость системы М2О2, состоящей из двух слоев атомов-
М по обе стороны от слоя атомов кислорода. Такой тип тетраго-
нальных слоев М—О—М характерен также для структур ряда
соединений Bi, La и Pb (например, La2MoO6, РЬО; разд. 12.6.1)^
в особенности для комплексных оксогалогенидов и оксидов вис-
мута, рассмотренных в разд. 20.3.4, 20.3.7 и 20.3.8.
В структурном типе PbFCl (BiOCl) кристаллизуются сле-
дующие группы соединений:
гидридгалогениды металлов МНХ (разд. 9.6.1);
фторогалогениды (MFX) кальция, стронция и бария [10,11];
оксогалогениды BiOX и МОС1, МОВг и MOI многих 4/- и
[12] 5/-элементов (разд. 28.2.1);
оксосульфиды Zr, Th, U и Np (разд. 17.3);
многие полупроводниковые тройные пниктиды и халькогени-
ды, например ZrSiS и NbSiS, в которых атомы металлов не
проявляют своих обычных валентностей.
Структуры всех этих соединений описываются аналогичным
образом (разд. 6.7), но тип связи в них изменяется в широких
пределах. В соединениях второй и третьей групп связь носит
ионный или ионно-ковалентный характер, а изменение в строе-
нии состоит в переходе от трехмерных структур с девятерной
координацией у фторохлоридов щелочноземельных металлов и
10.5. Гидроксогалогениды 185
оксохлоридов лантаноидов к типичным слоистым структурам
соответствующих фтороиодидов или оксоиодидов. Структуры
пятой группы соединений стоят особняком; они были описаны
как вариант структуры aHTH-Fe2As [13], распространенный на
тройные системы. Об оксосульфидах MOS (M = Th, Pa, U, Np)
см. в конце гл. 17.
Литература. [1] Сотр. rend. (Paris), 1963, 256, 3477. [2] Acta cryst., 1970, B26,
1058 [3] Acta Ch'em. Scand., 1956, 10, 1287. [41 J. Chem. Soc, A 1966, 1004.
f51 Z anorg. al!g. Chem., 1978, 438, 203. [6] Acta cryst., 1975, B31, 2521. [71 Z.
anon' a!!" Chem., 1958, 295, 268. [81 Acta Chem. Scand., 1975, A28, 1171.
[91 Acta Chem. Scand., 1964, 18, 1823. [101 J- Solid State Chem., 1976, 17, 275.
Ill] Acta cryst., 1977, B33, 2790. [12] Inorg. Chem., 1965, 4, 1637. [131 J- Solid
State Chem., 1974, 9, 125.
10.4.6. Структуры других оксогалогенидов. По всей видимости,
многие из исследованных структур свойственны только одному
оксогалогениду или небольшой их группе. Например, соедине-
ния состава М4ОС16 и М4ОВг6, получаемые нагреванием смеси
оксида и галогенида, характерны только для ионов Са2+, Sr2+ и
Ва-~. В структуре Ва4ОС16 осуществляется почти правильная
тетраадрическая координация атома кислорода четырьмя ато-
мами Ва, а в координационное окружение атома Ва входят ли-
бо 7 С1-О, либо 9С1+О [Acta cryst, 1970, В26, 16].
В табл. 10.10 приведены оксохлориды МпОС13, МпО2С12 и
МпОзСК содержащие Mn(V), Mn(VI) и Mn(VII), а также
Мп8О; :С13. Последнее соединение имеет совершенно иную, от-
личную от предыдущих структуру и является ионным кристал-
лом 'Мп-¦¦-Мп73^ОюС1з, содержащим Мп(П) и Mn(III) [Acta
cryst.. 1977, ВЗЗ, 1031].
10.5. Гидроксогалогениды
Известные к настоящему времени структуры гидроксофторидов
сходны со структурами оксогидроксидов или оксидов. Это —
ZnF(OH) [1] со структурой диаспора (разд. 14.2.3); CdF(OH)
[2] со структурой типа СаС12 (разд. 6.3.1), но со статистиче-
ским распределением ионов F~ и ОН"; HgF(OH) [3], близкой
по структуре к рутилу (разд. 6.4.1 и 26.3.3), и InF2(OH) [4],
имеющий искаженную структуру ReO3 с 1п3+ в октаэдрическом
окружении двумя ионами ОН~" и четырьмя F~ (все на расстоя-
нии 2,07 А). Гидратированный оксофторид алюминия со струк-
турой пирохлора [5] (разд. 6.4.3) был получен при добавлении
аммиака к раствору A12(SO4K, содержащему переменное коли-
чество A1F3.
К наиболее представительной группе гидроксохлоридов и
гидроксобромидов относятся соединения состава MX (ОН) и
М2Х(ОНK, образуемые магнием и Зй-металлами Mn, Fe, Co, Ni
186 10. Комплексные галогениды, оксо- и гидроксогалогениды
и Си (II). Структуры этих гидроксогалогенидов состоят из плот-
ноупакованных слоев состава Х(ОН) или Х(ОНK (рис. 4.15),
между которыми атомы металла занимают соответственно '/г
или 'А октаэдрических пустот. Подобные плотноупакованные
структуры неприемлемы для ионов больших размеров, напри-
мер для РЬ2+ или Y3+. Структуры, содержащие такие ионы,
рассмотрены ниже.
10.5.1. Гидроксогалогениды MX (ОН). Для некоторых из этих
соединений выполнено частичное или полное рентгеноструктур-
ное исследование. Это относится, напри-
мер, к соединениям СоВг(ОН) [6],
CuCl(OH) [7] и p-ZnCl(OH) [8]. Раз-
личные последовательности слоев, най-
денные в этих соединениях, в целом со-
ответствуют структурным типам дигало-
генидов и дигидроксидов С6, С19 и С27.
В структуре CuCl(OH) обнаружено
обычное для соединений Си (II) искаже-
ние октаэдрической координационной
группы: С1 находится на расстоянии
2,30 А, ЗОН —2,01 А и 2С1 —• 2,71 А.
Структура CdCl(OH) [9] отличается
от вышеупомянутых тем, что в ней плот-
ноупакованные слои состоят либо из ато-
мов С1, либо из ОН-групп (рис. 10.19),
а не из равного числа С1 и ОН.
Рис. 10.19. Фрагмент слоя
в структуре Cd(OH)Cl.
Группы ОН (заштрихо-
ваны) находятся выше,
а атомы С1 ниже плоско-
сти атомов металла.
10.5.2. Гидроксогалогениды М2Х(ОНK. Структуры этих соеди-
нений бывают двух типов — слоистые и трехмерные (каркас-
ные). Помимо упорядоченных структур, описанных ниже и ос-
нованных на слоях Х(ОНK с упорядоченным строением, суще-
ствуют гидроксохлориды МгС1(ОНK (M = Mg, Mn, Fe, Co и
Ni) с неупорядоченной структурой типа С 6 (Cdl2) со статисти-
ческим распределением С1 и ОН [10].
Для гидроксогалогенидов М2С1(ОНK (или M2XY3) структур-
ные варианты в целом те же самые, что и для дигалогенидов
или диоксидов МХ2; они основаны на плотной упаковке атомов
X с заполнением октаэдрических пустот атомами М. Соответст-
вующие структурные типы можно найти в табл. 4.6. Однако в
данном случае следует иметь в виду следующее:
1) существуют два типа плотноупакованных слоев состава
XY3 (рис. 4.15) с ромбическим (в) и тригональным (г) распре-
делением атомов X в слое, что приводит к удвоению числа воз-
можных структур для каждого типа плотнейшей упаковки. При
этом предполагается, что в плотнейшей упаковке все слои отно-
10.5. Гидроксогалогениды 187
сятся к одному и тому же типу, как это было установлено для
всех структур, исследованных к настоящему времени;
2) в то же время число возможных структур уменьшается
из-за условия, что и у атомов X, и у атомов Y должно быть по
три соседних атома М, расположенных пирамидально, а углы
X—М—X (Y—М—Y) должны быть равны 90°. Звездочкой (*)
Таблица 10.15. Кристаллические структуры гидроксогалогенидов М2Х(ОНK
Слои XY3 ромбической
симметрии (рис. 4.15,s)
Слои XY3 тригональной
симметрии (рис. 4.15,г)
Последовательность слоев
АВ...
Слоистая структура типа
Cdl2 (C6)
Со2Вг(ОНK [11
Си2С1(ОНK [2]
(боталлакит)
Cu2Br(OH)-, [3]
Cu2I(OHK [31
Каркасная структура
*
Слоистая структура
—
Каркасная структура
*
АВС...
Слоистая структура типа
CdCl2
—
Каркасная структура
Си2С1(ОНK (атакамит)
[41
p-Mg2Cl(OH), [51
Слоистая структура
—
Каркасная структура
|3-Со2С1(ОН)з [61
[!} Acta cryst., 1950, 3, 370. [2] Mineral. Mag., 1957, 31, 237. [3] Helv. Chim.
Ada. H.ic.l, 44, 2103. [4] Acta cryst., 2, 175. [5] Appl. Sci. Res., 1954, B3, 400. [6] Acta
cryst.. H'53, 6, 359.
в табл. 10.15 отмечены случаи, когда не существует структур,
удовлетворяющих этому условию.
Возможные структуры с гексагональной или кубической плот-
нейшей упаковкой приведены вместе с примерами в табл. 10.15,
которая соответствует разделу более общей табл. 4.6 с рубри-
кой «'/г занятых октаэдрических пустот». В «идеальных» плот-
ноупакованных структурах окружение атома металла октаэдри-
ческое DОН+2Х или 5ОН+Х), причем связи М—О и М—X
имеют их обычную длину. Как и в случае других соединений ме-
Ди(П), в ее гидроксогалогенидах также обнаруживается иска-
жение октаэдрической группировки в направлении координа-
ции 4+2. По этому вопросу см. гл. 25; там же содержатся за-
мечания по поводу структур Cu2Br(OHK и Си2С1(ОНK , а так-
же описание структур боталлакита и атакамита.
188 10. Комплексные галосениды, оксо- и гидроксогалогениды
10.5.3. Другие гидроксогалогениды. Гидроксохлорид РЬС1(ОН)
встречается в природе в виде минерала лаурионита. Его струк-
тура очень похожа на структуру РЬС12 (разд. 6.3), в которой
атом РЬ имеет координацию 7+2.
К структурам с высокими координационными числами ионов
металла следует отнести структуры обеих модификаций
YC1(OHJ [П] с восьмерной координацией иона Y3+ в виде
двухшапочной тригональнои призмы.
10.5.4. Гидратированные гидроксохлориды. Два из этих со-
единений представляют собой особый интерес. При дейст-
вии раствора MgCl2 на MgO сначала получается соединение
5 Mg(OHJ-MgCl2-7H2O (?), которое медленно превращается
в Mg2(OHKCl-4H2O. Основу структуры этого соединения
(и, по-видимому, ряда других гидратированных гидроксосолей
магния) составляют двойные цепи состава Mg2(OHK(H2OK>
период
повторяемости
двойные беск
ОМд ©ОН
а
\ положение Cl и H2i
' на разной высоте
6
Рис. 10.20. Кристаллическая структура Mg2(OHKCl-4 Н2О.
построенные как анионные двойные цепочки в структуре
NH4(CdCl3). Фрагмент одной из таких цепочек показан на рис.
10.20, а; на рис. 10.20,6 представлен вид структуры в направле-
нии бесконечных цепочек; последние скрепляются ионами С1~
и молекулами Н2О. Структурную формулу этого соединения
следует записать в виде [Mg2(OHK(H2OK]CbH2O [12].
Связь между слоистой структурой Zn5(OH)8Cl2-H2O и
структурой Cdl2 рассмотрена в гл. 6. Структура интересна тем.
10.6. Аддукты аммиака 189-
что 3 атома Zn находятся в октаэдрических пустотах (Zn—О
2 16 А), а 2 атома Zn —в тетраэдрических (Zn—3 0 2,02 А,
z'n_Cl 2,33 А) [13].
Литература. [1] Кристаллография, 1978, 23, 951. [21 Acta cryst., 1979, В35.
9184 [3] Acta cryst., 1979, B35, 949.-[4] Acta Chem. Scand., 1957, 11, 676.
[51 J Am. Chem. Soc, 1948, 70, 105. [6] Helv. Chim. Acta, 1962, 45, 479. [7] Hclv.
Chim Acta, 1961, 44, 2095. [81 Acta Chem. Scand., 1959, 13, 1049. [9] Z. Kristal-
loo-r 1934, 87, 110. [10] Helv. Chem. Acta, 1964, 47, 272. [Ill Acta cryst., 1967.
22 435. [12] Acta cryst., 1953, 6, 40, [13] Z. Kristallogr., 1962, 117, 238.
10.6. Амминогалогениды
Давно известно, что многие твердые галогениды способны по-
глощать аммиак, причем состав и устойчивость продуктов реак-
ции меняются в широких пределах. Например, CaCl2-8NH3 и
CuCl2-6NH3, получаемые из безводных галогенидов и газооб-
разного аммиака, легко отщепляют аммиак. Однако другие ам-
миногалогениды можно синтезировать из аммонийных солей,
и некоторые из них довольно устойчивы. Простейшие соедине-
ния этого типа имеют общую формулу MXn-mNH3 (иногда при-
сутствует кристаллизационная вода), где m — обычное коорди-
национное число атома М. В их структурах содержатся комп-
лексные ионы M(NH3)m'i+ (например, Ag(NH3J+, Zn(NH3L2+,
Co(NH3N3+ и т. д.) и ионы Х~. Многие из солей состава
[M(NH3N]X2 и [М(МНз)б]Х3 имеют простые структуры; в каче-
стве примера назовем [Со(ЫН3)б]С12 со структурой типа
K2PtCl6 и [Со(ЫН3)б]1з со структурой типа (NH4K*A1F6.
В координационном окружении атома М могут одновременно
присутствовать NH3 и X, как это имеет место в структурах
[Co(NH3MCl]Cl2 и [Pt(NH3KCl3]Cl. Некоторые из этих «вер-
неровских» координационных соединений подробнее рассмотре-
ны в гл. 27. Соединения с формулой М(КН3)ЖС1Х являются не-
электролитами при условии, что 2х равно координационному
числу атома М. Например, такое соединение цинка имеет фор-
мулу Zn(NH3JCl2; оно состоит из тетраэдрических молекул
(а), которые можно сравнить с ионами Zn(NH3L24~ (б) в солях
типа Zn(NH3LCl2-H2O.
NH3
NH3
NH3'
Строение молекулы Pd(NH3JI2 сходно со строением соот-
ветствующего соединения цинка (а), но первая плоская, а не
J90 10. Комплексные галогениды, оксо- и гидроксогалогениды
тетраэдрическая*. Однако не все соединения с аналогичными
эмпирическими формулами относятся к этому типу. Например,
одна из модификаций Pt(NH3JCl2 (соль Магнуса) состоит из
плоских ионов Pt(NH3L2+ и PtCI42~, в то время как в структу-
ре Cd(NH3hCl2 имеются бесконечные цепочки, построенные из
•октаэдрических групп Cd(NH3JCl4> соединенных через проти-
воположные ребра:
И. КИСЛОРОД
NH3
NH,
NH3
NH,
NH3
NH3
Такое цепочечное строение характерно для большой группы
соединений (табл. 25.4).
Сведения об амминогалогенидах меди, серебра и ртути мож-
но найти в гл. 25 и 29, а по соответствующим соединениям ме-
таллов VIII группы — в гл. 27.
Сравнение структур амминов и гидратов выполнено в гл.15,
* Вряд ли можно говорить о каком-либо сходстве соединений двух метал-
лов, которым присуща принципиально разная координация, что накладывает
свой отпечаток на всю химию этих металлов (возможность геометрической
изомерии, трансвлияния и т. д. в случае Pd(II)). Их объединяет в некоторой
степени лишь то, что оба относятся к классу «вернеровских» комплексов —
Прим. ред.
После нескольких вводных замечаний относительно стереохи-
мии кислорода и обсуждения некоторых различий между кисло-
родом и серой рассмотрим простые молекулы и ионы, содер-
жащие кислород, а затем остановимся на следующих соедине-
ниях:
пероксосоли и надпероксосоли;
оксомолекулы и оксо-ионы;
кислородсодержащие ионы, изополи-ионы и гетерополи-ионы..
11.1. Стереохимия кислорода
У кислорода валентная оболочка содержит шесть электронов,,
поэтому он может достраивать свою электронную оболочку до-
октета одним из следующих простейших способов:
1) принимать электроны с образованием О2~;
2) принимать один электрон и образовывать одну ковалент-
ную связь, как в ионе ОН~;
3) образовывать две ковалентные связи.
Оксиды и гидроксиды металлов содержат ионы О2~ и ОН"
соответственно. Хотя в принципе атом кислорода может обра-
зовывать максимум четыре ковалентные связи, так как у него
имеется четыре орбитали, образование более чем двух сущест-
венно ковалентных связей наблюдается очень редко (см. ниже).
Допуская, что расположение связей определяется числом ст-свя-
зей и неподеленных электронных пар, можно обобщить данные
о стереохимии кислорода (табл. 11.1). В таблицу включен ион
Ru2OCli04~ (разд. 10.4.1), в котором кислород образует две ли-
нейные связи; в этом ионе связи атомов кислорода имеют замет-
ный кратный характер; другие примеры можно найти при рас-
смотрении оксосолей. Линейные связи в соединении Sc2Si207
рассмотрены позднее.
И-2. Различия между кислородом и серой
Здесь совсем не предполагается обсуждать стереохимию серы,
которая гораздо сложнее стереохимии кислорода из-за наличия
^-орбиталей; остановимся только на некоторых различиях меж-
19211. Кислород
11.2. Различия между кислородом и серой 193
ду кислородом и серой. При переходе от кислорода к теллуру
увеличивается размер атомов, и изменение в поведении внешних
валентных электронов можно связать с увеличивающимся экра-
нированием заряда ядра лежащими внутри заполненными обо-
лочками электронов, что имеет далеко идущие последствия.
1. Уменьшение устойчивости отрицательных ионов. Оксиды
щелочных металлов, сульфиды, селениды и теллуриды — все эти
соединения кристаллизуются с типично ионными структурами,
а это показывает, что ионы О2", SL'~, Se2~ и Те2" существуют в
кристаллах. Все эти соединения растворимы в воде, но безвод-
ные соединения не могут быть регенерированы из растворов.
Таблица 11.1. Стереохимия кислорода
Число
ст-связей
2
3
4
Тип гибри-
дизации
Ф
Число непо-
деленных
электронных
пар
0
1
0
1
2
Расположение
связен
Линейное
Угловое
Тетраэдрическое
Пирамидальное
Угловое
Примеры
(C!5Ru0RuCl5L-
0,
Ве4О(СНзСООN
Н30-
Н20, F20, H2O2
Если оксид натрия Na2O растворить в воде, то при выпарива-
нии раствора образуется кристаллический гидроксид натрия
NaOH. При выпаривании концентрированного раствора сульфи-
да натрия Na2S образуется гидрат Na2S-9H2O, а в разбавлен-
ном растворе сульфида сера почти полностью находится в виде
гидросульфид-иопов SH~, которые значительно менее устойчи-
вы, чем гидроксид-ионы, а при нагревании растворы гидросуль-
фидов выделяют сероводород. Растворы селенидов и теллури-
дов гидролизуются еще легче, образуя гидриды, которые могут
окисляться до элементов. Следовательно, в случае кислорода
комбинация ионов О2^ и Нь дает очень устойчивый ион 0Н~.
Аналогично ведет себя сера, образуя менее устойчивый SH-hoh,
но у ионов Se-~ и Те2~ гидролиз легко доходит до следующей
стадии — до образования H2Se и Н2Те. Возрастание тенденции
к образованию гидрида у двухвалентного иона (Х2~—>-ХН~—>
—>-ХН2) происходит не из-за увеличения устойчивости гидри-
дов, которая быстро уменьшается от Н20 к Н2Те (последний
сильно эндотермичен), а вследствие уменьшения устойчивости
отрицательных ионов в водном растворе.
Эти элементы, за исключением теллура, не образуют устой-
чивых одноатомных катионов. Образование иона Те4т (в ТеО2,
л также, по-видимому, в Те(МОзL и Te(SO4J) происходит
вследствие инертности двух s-электронов (см. более подробно о
соединениях теллура в гл. 16).
2. Связи, образуемые серой с каким-либо элементом, имеют
менее ионный характер, чем связи между кислородом и тем же
элементом. Полинг приписывает этим элементам следующие ве-
личины электроотрицательности:
О 3,5 F 4,0
S 2,5 ср# С1 3,0
Во многих случаях диоксид имеет простую ионную структу-
ру, в то время как соответствующий дисульфид — слоистую
структуру; в общем случае кристаллические оксиды и фториды
с одинаковым типом формулы кристаллизуются в одном и том
же структурном типе; то же относится к паре сульфиды — хло-
риды.
Диоксиды серы, селена, теллура и полония, описываемые
ниже, имеют разные структуры — от молекулярных до ионных.
3. Наивысший известный фторид кислорода — OF2, а сера,
селен и теллур образуют гексафториды. Действием электричес-
кого разряда на смеси О2—F2 при низких температурах получен
O4F2 наряду с O2F2, но единственные фториды, содержащие
связи S—S, Se— Se или Те—Те, — это S2F2, S2F10 и Te2F10. Как
и во многих других случаях, эти три элемента проявляют свою
высшую валентность в соединениях с фтором, и фтор — это
единственный элемент, с которым сера образует шесть связей.
4. За исключением озона, озонидов щелочных металлов, не-
стабильного O4F2 и ряда органических пероксидов и триоксидов
(например, F3C-OOO-CF3), ковалентное связывание атомов
кислорода не распространяется больше чем на два атома (свя-
зи типа 0 = 0 или —О—О—). В то же время у серы наблюда-
ется гораздо большее разнообразие, а именно характерная осо-
бенность химии серы состоит в легком образовании цепочек из
атомов серы — в самой сере, в галогенидах SnX2, в полисуль-
фидах и политионатах.
5. В отличие от серы кислород в простых молекулах или ио-
нах редко образует больше двух ковалентных связей. Существу-
ет много ионных кристаллов, в которых кислород образует три
связи (рутил, фенацит и др.). В гидратах солей, где молекула
Н
н
I +
a
воды связана с атомом металла (а), либо в гидроксидах, где
ОН образует мостик между двумя атомами металла (б), связи
13—985
194 П. Кислород
с атомами металла, по-видимому, имеют заметный ионный ха-
рактер*, что, вероятно, также справедливо для соединений
А1ОС1 (разд. 10.4.5) и [Ti(ORL]4 (разд. 27.2). Три эквивалент-
ные (ковалентные?) связи образуются в катионе оксония (в),
содержащемся в кристаллических моногидратах соляной и дру-
гих кислот. Различные методы показывают, что катион оксония
имеет довольно плоскую пирамидальную структуру с длинами
связей О—Н 1,02 А и углом Н—О—Н 115—117°. Почти плос-
11.2. Различия между кислородом и серой 195
н,с
(СН3J
Al CH3 Нг°-
(CH3KSi—О'
Ч
СН2
(Н3СJА1 А1(СН3J
СН3
. д
гЬО
кий ион O(HgClK+ (угол Hg—О—Hg 118°) существует в кри-
сталлическом Hg3OCl4 (разд. 26.3.3). Известны другие примеры
образования кислородом трех приблизительно компланарных
связей: борат-ион в SrB6O9(OHJ-3H2O (разд. 24.7.5), цикличе-
ские молекулы г и д, а также структурно подобные ионы
[ОСгз(СН3СООN(Н2ОK]+ (е) и [OFe3(SO4N(H2OK]5- (ж)
[Acta cryst., 1980, В36, 1278], в которых пары ацетатных или
сульфатных групп являются общими для двух атомов металла,
связанных с центральным атомом кислорода. Молекула
Мп12(СН3СООIб(Н2ОLО12 (рис. 11.1) представляет собой ин-
тересный пример сложной молекулы с симметрией S4D) '[Acta
cryst., 1980, В36, 2042]. В этой молекуле атомы марганца име-
ют окружение трех типов, есть 16 мостиковых ацетатных групп
(не показанных на рис. 11.1, а) и 12 атомов кислорода ^3.
Группа Мп4О4, подобная кубану, образует центральное ядро.
Координационные октаэдры вокруг атомов металла построены
следующим образом: Мщ: 5 О+1 ОМОст; Мп2: 2 О+4 Омоет;
Мп3: 2 0+3 ОМост+Н2О (где индекс «мост» обозначает атом
кислорода мостиковой ацетатной группы).
Существует много молекул и кристаллов, в которых кисло-
род образует четыре почти неискаженные тетраэдрические свя-
зи; некоторые из них (либо все) направлены к атомам ме-
* Это утверждение довольно спорно, в особенности в отношении молекул
воды, координированных металлом в составе комплексного иона. Кроме того,,
приводимые автором в этом же разделе многочисленные примеры, в которых
атом кислорода имеет координационное число 3 или 4, опровергают его тезис
о том, что кислород редко образует больше двух ковалентных связей. — Прим,
ред.
Н20
Н,0
Н?0
С
Рис. 11.1. с — топологическая схема строения молекулы Mni2(ac)i6(H2OLOi2;
б — молекула оксоацетата бериллия ОВе4(СНзСОО)е (без соблюдения масшта-
ба). Отчетливо виден центральный атом кислорода (большой заштрихованный
кружок), окруженный четырьмя атомами бериллия (маленькие заштрихован-
ные кружки), образующими тетраэдр. Ацетатные группы размещены над каж-
дым ребром тетраэдра. Центральный атом кислорода и три атома кислорода
различных ацетатных групп образуют ближайшее тетраэдрическое окружение
каждого из атомов бериллия. Маленькие незаштрихованные кружки — атомы
углерода; атомы водорода опущены.
таллов и, по-видимому, существенно полярны. Примерами явля-
ются такие оксиды, как ZnO и PdO (однако отметим четыре
компланарные связи в NbO, кристалле, в котором есть связь
металл — металл), тетраэдрические молекулы, такие, как
ОВе4(СН3СООN (рис. 11.1,6) и другие подобные молекулы,
приведенные в табл. 3.8, OZn4B6Oi2 (разд. 24.7.6), 0La4Re60i8
(разд. 5.3.5), и молекулы, содержащие группы М4О4, подобные
кубану, такие, как [Т1ОСН3]4 (разд. 26.5), метилцинкметоксид
V
.сн,
-Zn
-о-
Zn
/ СН3
<?) [Acta cryst., 1980, В36, 2046], и комплексы Cu4X4L4 (разд.
v А)• ^°Раздо более сложное строение имеет соединение
Zr13O8@CH3K6 [Acta cryst., 1977, ВЗЗ, 303]. Центральное яд-
ро zru8 окружено 12 атомами циркония и 36 группами ОСН3 и
13'
196 11. Кислород
11.3. Простые молекулы и ионы 197
образует комплекс с почти неискаженной кубической симмет-
рией 0h(m3m), в котором каждый атом кислорода связан с
4 атомами циркония.
6. И наконец, еще одно важное различие между кислородом
и серой, которое необходимо здесь упомянуть. Кислород обра-
зует сравнительно сильные водородные связи; это свойство ха-
рактерно только для наиболее электроотрицательных элемен-
тов. В результате многие соединения кислорода имеют свойст-
ва, очень отличающиеся от тех, которые можно было бы ожи-
дать по аналогии с соответствующими соединениями серы.
11.3. Простые молекулы и ионы
В этом разделе остановимся на следующем: молекулы О2 и Оз,
ионы О2+ и О3~; простые молекулы OR2; простые молекулы и
ионы, содержащие О—О, а именно:
пероксид водорода Н2О2;
фториды кислорода;
пероксид-ион О22~ и надпероксид-ион О2~.
11.3.1. Молекула кислорода и катион диоксигенила \lnorg.
Chem., 1969, 8, 828]. Величина магнитного момента молекулы
Ог указывает на присутствие двух неспаренных электронов.
Согласно подходу, известному как метод валентных связей,
в молекуле кислорода имеются одна ковалентная и две трех-
электронные связи. В то же время другой подход—метод моле-
кулярных орбиталей — объясняет парамагнетизм кислорода тем,
что состояние молекулы с параллельными спинами у двух
электронов CЕ) более стабильно, чем другое возможное со-
стояние ('2) с противоположными спинами, и в соответствии с
этим молекула кислорода имеет двойную связь @ = 0 1,211 А).
В табл. 11.2 приведены выборочные длины связей О—О.
Молекула или ион
02+
о2
Оз
02~ (в а-КО2)
О22~ (в ВаО2)
Н2О2
Таблица 11
Расстояние
О-О, А
1,1227
1,2107
1,278
1,28B)
1,49D)
/ 1,475
1 1.467
2. Длины связей 0—0
Литература
Herzberg G., InFra-red Spectra of Diatomic
Molecules. 2nd. ed., Van Nostrand Co. N. Y.
Phys. Rev., 1953, 90, 537
J. Chem. Phys., 1956, 24, 131
Acta cryst., 1955, 8, 503
Acta cryst., 1954, 7, 838
J. Chem. Phys., 1962, 36, 1311
J. Chem. Phys., 1965, 42, 3054
Молекула кислорода может быть ионизирована с помощью
PtF6 до катиона диоксигенила О2+; красное кристаллическое ве-
щество O9PtF6 получается при непосредственном взаимодейст-
вии эквнмолярных количеств газообразного кислорода и PtFg
при 21 °С. Эта соль катиона диоксигенила существует в двух
кристаллических модификациях, структуры которых похожи на
структуры KPtF6 и (NO)OsF6. Соли O2(BF4) и O2(PF6) полу-
чены из O2F2 и BF3 или PF3 соответственно. Тщательным нейт-
ронографическим исследованием O2PtF6 [J. Chem. Phys, 1966,
44, 1748] не удалось установить значение длины связи О—О;
валентная силовая постоянная О2+, определенная из спектров
комбинационного рассеяния (КР) O2(PtF6) и O2(SbF6). оказа-
лась равной валентной силовой постоянной, определенной из
электронных спектров, и близка к силовой постоянной изо-
электронной молекулы N0; все это говорит о том, что длина
связи О—О в О2+ составляет 1,12 А.
Были получены многочисленные комплексы переходных ме-
таллов, которые содержат молекулу О2 в качестве лиганда; пер-
оксо- и надпероксопроизводные металлов кратко обсуждаются
ниже.
11.3.2. Озон и озониды. Угловая конфигурация молекулы озона
установлена на основе изучения микроволновых спектров: мо-
лекула Оз имеет дипольный момент 0,49 Д.
Ц78А
Озониды МО3 (M = Na, К, Rb, Cs)—соединения красного
цвета; они были получены действием озона на сухие порошко-
образные гидроксиды при низких температурах, причем полу-
чаемые озониды экстрагировались жидким аммиаком. Литий
образует соединение Li(NH3LO3, которое, по-видимому, разла-
гается при удалении аммиака; соединение NH4O3 также не бы-
ло получено в отсутствие избытка аммиака, однако удалось по-
лучить N(CH3LO3 [Inorg. Chem., 1962, 1, 659; J. Am. Chem.
boc. 1962, 84, 34]. Изучение рентгенограммы порошка КО3)
содержащей небольшое число отражений, привело к длине свя-
зи О—О 1,19 А и углу между связями 100° [Proc. Acad. Sci.,
19bd, 49, 1]. Однако в целом ион О3~ нуждается в более де-
тальном исследовании.
11.3.3. Пероксиды, надпероксиды и «полуторные» оксиды. Пер-
оксиды М2О2 образуют все щелочные металлы; известны также
пероксиды МО2 цинка, кадмия, кальция, стронция и бария.
*98 11. Кислород
Кристаллографическое изучение пероксидов щелочных метал-
лов [Z. anorg. allg. Chem., 1962, 314, 12], ZnO2 и CdO2 (струк-
тура пирита) [J. Am. Chem. Soc, 1959, 81, 3830], BaO2 и СаО2-
•8H2O показало, что эти кристаллы содержат ионы О22~, в ко-
торых длина связи О—О равна 1,49 А (одинарная связь) [Acta
cryst., 1954, 7, 838]. О соединении HgO2 см. разд. 6.9 и 26.3.3.
Надпероксиды МО2 образуются при нагревании пероксидов
щелочных металлов при температуре 500 °С под давлением кис-
лорода, либо при пропускании кислорода при —78 °С через рас-
твор металла в жидком аммиаке. Все щелочные металлы обра-
зуют надпероксиды, но получены без примесей и устойчивы при
комнатной температуре только надпероксиды натрия и более
тяжелых щелочных металлов, а также [(CH3LN]O2 [Inorg.
Chem., 1964, 3, 1798]. Надпероксид лития получен окислением
атомного пучка лития смесью кислорода и аргона при 15 К в
матрице из инертного газа. Структура надпероксида лития
точно неизвестна; по-видимому, эта молекула имеет форму рав-
нобедренного треугольника с расстояниями О—О 1,33 A, Li—О
1,77 A [J. Chem. Phys., 1969, 50, 4288].
Надпероксиды содержат ионы О2~, в которых длина связи
0.28 А) соответствует кратности связи, равной 1,5, как в озоне
(табл. 11.2). Надпероксиды — парамагнитные соединения (маг-
нитный момент близок к 2 |ав; ср. с теоретической величиной
1,73 [Лв для одного неспаренного электрона). Надпероксид нат-
рия имеет три полиморфные модификации. При температурах
ниже —77 °С он кристаллизуется в структуре марказита (разд.
6.3), выше этой температуры — в структуре пирита (разд. 6.2),
а выше —50 °С структура становится неупорядоченной из-за
вращения анионов. При обычной температуре соединения КО2,
RbO2 и CsO2 изоструктурны и кристаллизуются в тетрагональ-
ной структуре СаС2 (разд. 22.1.5), а КО2 имеет и высокотемпе-
ратурную кубическую модификацию со структурой NaCl (или
неупорядоченного пирита) [Acta cryst., 1952, 5, 851].
«Полуторные» оксиды рубидия и цезия получены в виде
темноокрашенных парамагнитных порошков (в отличие от жел-
тых М2О2 и МО2). Им была приписана структура анти-Тп3Р4
(разд. 5.1.2), т. е. их формула должна иметь вид М4(Ог)з
[Z. anorg. allg. Chem., 1939, 242, 201]. Симметрия этой кубиче-
ской структуры предполагает эквивалентность трех ионов О2 в
М4(О2~J(О22-); из данных рентгенограммы порошка не уда-
лось определить длину связи О—О. Поэтому необходимо даль-
нейшее изучение этих соединений.
11.3.4. Молекулы OR2- Молекулы этого типа имеют угловую
конфигурацию, валентный угол обычно лежит в интервале 100—
110°. Для чистых р-связей угол должен быть равен 90°, но ча-
11.3. Простые молекулы и ионы 199
стичное использование s-орбитали приводит к увеличению уг-
лов, в предельных случаях до 109 72° для 5р3-гибридизации или
120° для 5р2-гибридизации. Если атом кислорода связан с дву-
мя ароматическими ядрами, то угол действительно близок к 120°.
В табл. 11.3 включен оксид этилена, вероятно имеющий «пзо-
Таблица 11.3. Валентный угол при атоме кислорода в простых молекулах
Молекула
(СН2JО
F2O
н2о
ось
О(сн3J
п-СеНЛОСНзЬ
O(SiH3J
O(GeH3J
O[Ge(C6H5K]2
Валентный
угол при
атоме О,
град
61,6
103,3
104,5
110,9
111,5
121
144
126,5
135
Расстояние,
О—R, А
1,436
1,409
0,97
1,700
1,416
1,36
1,634
1,766
1,77
Метод
Микроволновая
спектроскопия
То же
ИК
Микроволновая
спектроскопия
То же
Рентгенографи-
ческое исследо-
вание
Электронографи-
ческое исследо-
вание
То же
Рентгенографи-
ческое исследо-
вание
Литература
J. Chem. Piivs,
1951, 19, 676
J. Chem. Plivs.,
1961, 35, 2240"
J. Chem. Plivs.,
1965, 42, 1147'
J. Chem. Soc, A
1966, 336
J. Chem. Phvs,
1959, 30, 1096'
Acta crvst., 1950, 3,
279
Acta Chem. Scand.,
1963, 17, 2455
J. Chem. Soc. A
1 r\ *J г\ О 1 T*
1970, 31t>
Acta cryst., 1978,
B34, 119
гнутые» связи, как в циклопропане. В O(SiH3J, в ионах и мо-
лекулах Х2О7, а также в «метасолях» углы имеют гораздо боль-
шую величину. В структуре ReO3 кислород образует две ли-
нейные связи; то же относится к некоторым силикатам (напри-
мер, анион Si2O76~ в Sc2Si207), где связи предположительно
имеют преимущественно ионный характер. (О линейных связях
кислорода в некоторых дифосфатах см. разд. 19.6.8). Линейны-
ми являются также связи кислорода в Тс2О7 и в оксосоедине-
ниях металлов, содержащих мостики М—О—М; в этих случаях
длины связей указывают на заметный кратный характер связи.
11.3.5. Пероксид водорода. Конфигурация молекул Rr— О—О—
Кг и аналогичных соединений серы, селена и теллура пред-
ставляет особый интерес, так как квантовомеханическне расче-
ты-показывают, что связь О—R, не может лежать в плоскости
V U Кг4 вследствие сильного отталкивания несвязывающих
200 //. Кислород
(рЛ) электронов атомов кислорода молекула должна иметь кон-
фигурацию, схематически изображенную ниже (а). Стереохи-
мия молекул O2R2, S2R2 и т. д. обсуждается позднее (разд.
16.9) вместе с соединениями серы, которые изучены более пол-
но. Для молекулы Н2О2 значения углов 0 и<р, рассчитанные в
предположении sp-гибридизации неподеленных электронных
пар, близки к 100°, но в соответствии с более поздними расче-
тами, учитывающими 5р3-гибридизацию, двугранный угол ф ра-
вен 120°.
Были выполнены многочисленные исследования молекулы
Н2О2 и найдено, что длина связи О—О близка к 1,47 А, а ва-
лентный угол при атоме кислорода равен 103° (твердое вещест-
во) или 98° (газ). Двугранный угол меняется от 90° для кри-
сталлического пероксида водорода до 180° в соединении
Na2C2O4-H2O2, причем установлено, что молекула Н2Ог в этом
Таблица
Соединение
Н2Ог (тв., нейтроногр.)
(газ. ИК)
Н2О2-2Н,О
Na2C2O4-H2O2
Li2C2O4-H"O2
К2С2О4-Н"О2
Rb,C2CVHo02
O2F2
O2R2 (органич.)
Теоретическое значение
11.4. Двугранные углы ROO/OOR
Двугранный
угол, град
90,2
111,5
119,8
129
180
180
101,6
103,4
87,5
81 — 146
90—120
Литература
J. Chem. Phys., 1965, 42, 3054
J. Chem. Phys., 1965, 42, 1931
J. Chem. Phys., 1962, 36, 1311
Ada Chem. Scand., 1960, 14, 1325
Ada Chem. Scand., 1964, 18, 1454
Acta Chem. Scand., 1969, 23, 1871
Ada Chem. Scand., 1967, 21, 779
Ada Chem. Scand., 1967, 21, 779
J. Chem. Soc, 1962, 4585
Acta cryst., 1967, 22, 281 I
Acta cryst., 1968, B24, 277
Can. J. Phys., 1962, 40, 765
J. Chem. Phys., 1962, 36, 1311
Acta cryst., 1967, 22, 281
11.3. Простые молекулы и ионы 201
соединении имеет плоскую транс-конфигурацию F = 97°). Та-
кой большой диапазон значении двугранного угла показывает,
что конфигурация этой молекулы очень чувствительна к ее
окружению. Энергетический барьер, соответствующий транс-
конфигурацин, всего на 3,8 кДж/моль выше, чем значение энер-
гии для равновесной конфигурации (q: = 111,5е) по сравнению с
барьером в 16,7 кДж/моль для ijuc-конфигурации. Таким обра-
зом величина угла ф может быть легко изменена под влиянием
водородной связи, а в Na2C2O4-H2O2 —под влиянием двух ио-
нов натрия, которые дополняют тетраэдр вокруг атома кисло-
рода. Двугранные углы, найденные в органических пероксидах,
также находятся в широком диапазоне значений (табл. 11.4).
Значение 60° в циклическом ионе [В2(О2J(ОНL]2^ составляет
исключение, так как в этом случае система В—О—О—В обра-
зует часть шестичленного кольца.
„
0..47 А
2,43/
Na'+
Na +
11.3.6. Фториды кислорода. Об уголковой молекуле OF2 уже
упоминалось. Смеси фторидов кислорода получены действием
электрического разряда на смеси O2+F2, но более современный
способ синтеза этих соединений — радиолиз жидких смесей про-
стых веществ при низких температурах под действием тормоз-
ного излучения с энергией 3 МэВ. Ранее утверждали, что суще-
ствуют все соединения OnF2 (га = 2-ь6), но последние данные
подтверждают существование только соединений O2F, O2F2 н
O4F2 [J. Am. Chem. Soc, 1969, 91, 4702]. Полагают, что O3F2
и, вероятно, также O5F2 и O6F2 представляют собой смеси со-
единений. ИК-спектроскопическое изучение фторида O2F
[J. Chem, Phys., 1966, 44, 3641], поглощенного твердым кисло-
родом, показало, что его молекулы имеют изогнутую форму с
длинами связей, аналогичными расстояниям в O2F2 (см. ниже).
Молекула O2F2 имеет такую же геометрию, как и Н2О2; дву-
гранный угол 87,5°, валентный угол 109,5°, однако длины связей
имеют весьма необычные значения: О—О 1,217 Аи О—F
1,575 A [J. Chem. Soc, 1962, 4585]. Очень большая длина по-
следней (ср. в OF2 1,40 А) и очень короткая связь О—О (как г
О2) наводят на мысль об аналогии с галогенидами нитрозила.
Описано [J. Am. Chem. Soc, 1966, 88, 3288, 4316] получение
органических соединений, содержащих систему —О—О—О—
(например, F3COOOCF3), однако их структуры неизвестны.
202 11. Кислород
11.3.7. Пероксокислоты неметаллов включают соединения следу-
ющих типов:
1. Пероксомонокислоты, по-видимому содержащие системы
Н—О—О—А (например, Н3РО5, H2SOs). Соединения, описывае-
мые как «пероксобораты» и «пероксокарбонаты», получают дей-
он
но-
.СЦ47Л
В-0^°-1
©
~он
он
.0 —S-
o-f-o
1,64А О
о:
ю-.
[дипиридил)
2,11 А
NH3
1,85 А
•°-с/
/,з/л Vis3i7^'.WA
Н,0
0-1—NH3
7,53,4
1,68 А
Рис. 11.2. Пероксо-ионы и молекулы, а — [В2(О2J(ОНL]2~; б — S2Oe2~; в —
(C5H5N)Cr05; г— (дипиридил)СгО(О2J; д — [Мо@2L12-, е- (NH3KCr(O2J;
ж - 1г(Р (С6Н5) зJ(СО) (О2) I; э - [W2O3(О2L(Н2ОJ]2-; и - [UO2(O2)зГ".
ствием пероксида водорода на обычные соли. Соединение
Na2[B2(O2J(OHL]-6H2O [Acta cryst., 1978, В34, 3551], кото-
рому первоначально приписывали формулу NaBO3-4H2O или
NaBO2-H2O2-3H2O, в действительности является пероксобора-
том, содержащим циклический ион (рис. 11.2, а) с расстоянием
О—О, равным 1,47 А, как в пероксиде водорода. В то же время
применяемому в качестве отбеливающего агента так называемо-
му «пероксокарбонату» натрия на самом деле соответствует
формула пергидрата натрия Na2CO3- IV2H2O2 [Acta cryst., 1977,
ВЗЗ, 3650]; структура этого соединения построена из слоев, со-
держащих связанные водородным мостиком ионы СО32~" и мо-
11.3. Простые молекулы и ионы
203
лекулы Н2О2. Эти слои соединены друг с другом ионами натрия.
2. Пероксодикислоты, содержащие группировки А—О—О—А;
к ним относятся Н2С2О6, Н4Р2О8 и H2S2O8. Структура иона
S2O8:~ была определена на примере соли аммония (рис. 11.2, б),
структуры других ионов этого класса не установлены.
11.3.8. Пероксо- и надпероксопроизводные металлов. И пероксо-,
и надпероксо-ионы могут, функционируя в качестве лигандов,
связываться обоими атомами кислорода с одним и тем же ато-
мом металла либо образовывать мостики между двумя атомами
металла;
шпг
I
о
м-сг
.о—м
Многие переходные металлы, включая титан, ниобий, тан-
тал, хром, молибден, вольфрам, кобальт, никель, родий, иридий,
платину и уран, образуют ионы или молекулы, в которых груп-
пы О2 связаны с одним атомом металла. Примерами компле-
ксов, в которых имеется один лиганд О2, связанный с атомом
металла, могут служить квадратно-плоский Pt(O2) [Р(СбН5)з]2
[1], М1(ОJ(тетрабутилизоцианидJ [2] и другие, упоминае-
мые далее. Существуют также молекулы и ионы, в которых с
атомом металла связаны две или более группы О2. Помимо
групп О2 в координационную сферу металла обычно входят
один или несколько таких лигандов, как галоген, амин, фосфин,
арсин или СО.
Молекула (C5H5N)Cr05 имеет форму искаженной пентаго-
нальной пирамиды (или тригональной, если считать О2 одним
лигандом); она показана на рис. 11.2, в, причем оба атома кис-
лорода каждой группы О2 находятся на одинаковом расстоянии
от атома металла [3]. Молекула в синей модификации соедине-
ния СгО(О2J(дипиридил) имеет близкое строение (рис. 11,2,г);
здесь атомы лигандов расположены в вершинах пентагональ-
ной бипирамиды [4]. Предполагают, что синий и фиолетовый
пероксохроматы в целом имеют такой же тип строения; напри-
мер, взрывчатый фиолетовый КНСгО6, возможно, имеет форму-
1,94 А ,--0
Сг;' 11,41 a
. 1,85 А'~--А
лу K[CrVIO(O2JOH]. Красные пероксохроматы, такие, как
КзСгО8 и изоструктурные соединения ниобия и тантала содер-
жат ион Crv(O2L3~, в котором четыре иона О22~ расположены
в виде додекаэдра (как в Mo(CN)84") и, по-видимому, имеют
слегка несимметричную ориентацию групп О2 относительно ато-
204 П. Кислород
ма металла [5]. Парамагнетизм КзСгОз указывает на наличие
одного неспаренного электрона, что подтверждает трактовку
этого соединения как пероксосоединения пятивалентного хрома.
Очень похожую структуру имеет и анион в темно-красном
[Zn(XH3L][Mo(O2L] [6] (рис. \\.2,д); все расстояния М—О
1,97 А, О—О 1,55 А.
Под действием пероксида водорода на (NH4JCr04 в водном
растворе аммиака образуются темные красно-коричневые кри-
сталлы A\'Нз)зСгО4, имеющие металлический блеск. Молекулы
этого соединения построены в форме пентагональной бипира-
миды (рис. 11.2,6) в которой четыре атома кислорода, один
атом азота и один атом хрома находятся в одной плоскости
(атом хрома и три атома азота также лежат в одной плоско-
сти) [7]. Что касается стехиометрии этого соединения, то его
можно рассматривать либо как надпероксид двухвалентного
хрома, либо как пероксид четырехвалентного хрома. Судя по
величине магнитного момента (указывающего на наличие двух
неспаренных электронов) и его химическим свойствам, более
подходяще считать его соединением Cr(II), поскольку в этом
случае и два иона О2~~ должны сохранять по два неспаренных
электрона. Связь О—О аномально укорочена, однако очень боль-
шой разброс величин этой связи для различных тетрапероксо-
ионов (см. выше) позволяет предположить, что не все длины
связей О—О определены с достаточной точностью. На основа-
нии данных о длине связей О—О иодопроизводные иридия [8]
(рис. 11.2, ж) описывают как пероксид двухвалентного иридия
(О—О 1,51 А), а соединение с хлором, имеющее такое же строе-
ние [9], формально может быть описано как надпероксид
двухвалентного иридия (О—О 1,30 А). При этом возника-
ет проблема объяснения диамагнетизма последнего. В ионе
Rh(O2)[P(C6H5)(CH3h]4- (Ю] длина связи О—О 1,43 А. Неко-
торые соединения этого типа (например, хлорный аналог ири-
диевого производного, рис. 11.2, ж) представляют интерес в ка-
честве обратимых переносчиков кислорода; в других соединени-
ях кислород связан необратимо, как, например, в том же иодо-
производном иридия (рис. 11.2, ж) и в катионе i[Rh(O2)As4] +
[11], где As обозначает группу As(CH3hC6H5 (О—О 1,46 А).
В этих комплексах лиганды расположены в виде тригональной
бипирамиды (если рассматривать О2 как один лиганд).
Бесцветный тетрагидрат пероксодивольфрамата(У1) калия
K2W2On-4H2O содержит двуядерный ион (рис. 11.2, з) [12].
Лиганды вокруг каждого атома вольфрама имеют конфигура-
цию пентагональной бипирамиды; длины связей свидетельству-
ют о наличии двойных связей с одиночными атомами кислоро-
да (ср. CaWO4, W—О 1,78 А). Очевидно, что связи с молеку-
лами воды являются слабыми. Диамагнитное соединение
U.3. Простые молекулы и ионы 205
К2Мо2Оц-4Н2О [13] имеет очень похожую структуру. На рис.
Ка[иО(О)]
К2Мо2Оц2 [] у
11.2, и показана структура аниона в соединении 4[гB)]
• 9Н2О [14]; в этой структуре три группы О2 в экваториальной
плоскости и два уранильных атома кислорода образуют триго-
нальную (гексагональную) бипирамиду вокруг атома урана.
Для ниобия характерны соединения, которые являются при-
мерами пероксокомплексов с двумя, тремя и четырьмя группа-
ми О>2~, соединенными с одним атомом металла:
(NH4K"[Nb(O2J(C2O4J]-H2O [15], K[Nb(O2KC12H8N2]-3H2O
[16] и KMg[Nb(O2L]-7H2O [17]. Во всех этих комплексах
атомы, связанные с ниобием, образуют додекаэдры, это либо
8 атомов кислорода, либо 6 атомов кислорода и 2 атома азота
(в фенантролиновом комплексе). Строение иона Nb(O2L3~ по-
хоже на строение ионов хрома и молибдена, и во всех этих со-
единениях у пероксолигандов расстояние О—О близко к 1,50 А.
В диоксалатном комплексе два лиганда О2 занимают цис-по-
зиции
Для кобальта характерны соединения с пероксо- и надпер-
оксомостиками, соединяющими атомы металлов, причем при
этом образуются два иона, имеющие одинаковый химический
состав, но разный заряд; соли одной серии окрашены в темно-
(а) [(NH3MCo-02-Co(NH3M]5+&e] (в) [(NH3MCo-O2-Co(NH3M]
{6) [fNH3'LCo:
„NH3
B)
зеленого кзета, парамагнитные
красного цвета, диамагнитные
зеленый цвет и парамагнитны (величина магнитного момента
этих соединений соответствует наличию одного неспаренного
электрона); соли второй серии имеют красновато-коричневую
окраску и диамагнитны. Парамагнитные соединения содержат
надпероксомостики; согласно данным, полученным методом
ЭПР, неспаренный электрон одинаковое время находится у обо-
их атомов кобальта, которые имеют степень окисления (III).
В соединении (а) длина связи О—О A,30 А) типична для
надпероксосоединений, и система Со—О—О—Со компланарна;
в соединении (б) центральное пятичленное кольцо является
плоским. В красных диамагнитных соединениях связь О—О по
длине аналогична связи в пероксиде водорода A,47 А).
Для системы Со—О2—Со иона [ (NH3MCo—O2—Co(NH3M]4+
(в) установлены две конфигурации: вх и е2. В красном диамаг-
нитном дисульфате [20] двугранный угол равен 146° (ei), а в
тетратиоцианате [21] система Со—О—О—Со компланарна (в2).
Образование этих двух конфигураций (в\ и в2) объясняют раз-
личными схемами водородных связей в кристаллах этих соеди-
206 //. Кислород
нений; такая трактовка означает, что окружение в кристалле
играет более важную роль, чем даже число электронов, участ-
вующих в связи О—О, так как компланарное расположение ато-
мов в окрестности связи О—О обнаружено как в надпероксо-
мостике (а), так и в пероксомостике (в2). Подчеркнем, что в
(NH3MCo
,Co(NH3M
—14-1-
(NH3MCo двугранный CO(NH3M
угол
в,
NHZ
0-0
-i 4 +
(NH3MCo-
О ^Co(,NH3-M
обеих сериях соединений группы О2 образуют мостики, в кото-
рых от каждого атома кислорода направлена одна связь, как
это видно и на приводимых схемах (а—в2). Иной тип мостико-
вой связи, по-видимому, существует в красной диамагнитной со-
ли, которую первоначально считали изомером зеленой
[(enJCo(NH2)O2Co(enJ] (NO3L-H2O. Зеленая соль содержит
обычную надпероксомостиковую связь (б), в то время как дли
красной соли предполагается следующее строение [22]:
(NO3L-2H2O
Литература. [1] Acta cryst., 1975, B31, 2711. [2] J. Am. Chem. Soc, 1969, 9T,
2123. [3] Acta Chem. Scand., 1963, 17, 557. [4] Acta Chem. Scand., 1968, 22, 1439:
[5] Acta Chem. Scand., 1963, 17, 1563. [6] Acta Chem. Scand., 1969, 23, 2755.
[7] J. Phys. Chem., 1959, 63, 1279; J. Chem. Soc, 1962, 2136. [81 Inorg. Chem.,
1967, 6, 2243. [9] J. Am. Chem. Soc, 1965, 87, 2581. [101 Acta cryst., 1976, B32,
1410. [11] Acta cryst., 1975, B31, 2223. [12] Acta cryst., 1964, 17, 1127. [131 Acta-
Chem. Scand., 1969, 22, 1076. [14] J. Chem. Soc. A 1968, 1588. [15] Acta cryst.,
1971, B27, 1572. [16] Acta cryst, 1971, B27, 1582. [17] Acta cryst., 1971, B27,
1598. [18] Acta cryst., 1981, B37, 34. [191 Inorg. Chem., 1969, 8, 291. [201 Inorg.
Chem., 1968, 7, 725. [21] Acta cryst., 1974, B30, 117. [22] J. Am. Chem. Soc,
1967, 89, 6364.
11.3. Простые молекулы и ионы
207
11.3.9. Оксо-ионы и оксомолекулы металлов. Многие переходные
металлы, включая ниобий, ванадий, хром, молибден, вольфрам,
рений и осмии, образуют конечные ионы и нейтральные моле-
кулы, содержащие кислород, непосредственно связанный с ато-
мом металла. Молекулярные оксид-галогениды и оксид-галоге-
нидные ионы рассмотрены в гл. 10, а соединения ванадила и
уранила описаны детально в гл. 27 и 28. Примерами соединений
с достаточно простым строением являются молекула соедине-
ния осмия (VI) (а) в виде квадратной пирамиды и искаженно-
октаэдрическне комплексы ниобия, такие, как NbOCl3(NCCH3J
(б).
Н-С /
NC —
1,83 А
-CN
Мо
NC
-CN
а
6 [2]
в [3]
Весьма многочисленны оксокомплексы молибдена. Ион
[Mo!VO2(CNL]4- (в) в соединении NaK3[MoO2(CNL]-6Н2О
имеет октаэдрическую форму; это не комплекс молибдена (IV)
с координационным числом 8 [Mo(OHL(CNL]4~, как полагали
ранее. Имеются примеры комплексов молибдена (VI), в которых
два или три атома кислорода связаны с металлом; это
Mo[(CH3JNCHO]2O2Cl2 (г) и MoO3-NH(CH2CH2NH2J (д).
С1
Мо
С1
Mo[(CH3JNCHOh02Cl2 MoO.,[NH(CH2CH2NH2J]
В последнем комплексе на приведенной схеме его строения
(д) фрагмент МоО3 очень похож на часть тетраэдрическои груп-
пы МоО4; длина связи Мо—О 1,74 А, а углы между связями
О—Мо—О A06°) близки к тетраэдрическому. Фрагменты МоО3
*08 11. Кислород
в более сложных комплексных ионах (е) имеют такие же дли-
ны связей и валентные углы в отличие от величин Мо—О
B,20 А) и Mo—N B,40 А) в комплексе с EDTA.
О
\,ЬЬ К
О—Мо—
(/V
-Мо-0
/ \
1,94 a ;
о
с
2 с
[O3Mo(?7777))MoO3]Na4- 8 Н2О [б]
н,о
OMo(O2),L (H2O)[7]
Ж
Пероксокомплекс ж (L — фосфиноксид ОР[Ы(СН3J]з) [7]
представляет интерес с нескольких точек зрения. В этой моле-
куле значения длин связи Мо—О лежат в широком интервале,
что явилось предметом всестороннего изучения [8]. Расположе-
ние связей соответствует пентагональной бипирамиде (или три-
гональной бипирамиде, если рассматривать О2 как один ли-
ганд); весьма похоже построен и анион в соединении
Cs'[NbO(C2O4J(H2OJl -2H2O [9], в котором на месте пероксо-
групп размещены оксалат-ионы, а вторая молекула воды зани-
мает оставшуюся экваториальную позицию. Длина аксиальной
связи Nb—О равна 1,69 А. Если фосфиноксид в комплексе ж
заменить на кислород, то мы перейдем к мостиковому иону
[(Н2О)(О2JОМо—О—МоО(О2J(Н2О)]2-, (Мо—Ом 1,92 А;
Мо—О—Мо 149°), у которого каждая половина имеет структу-
ру, аналогичную комплексу ж. Существует также ион, который
содержит два гидропероксидных мостика (О—ОН 1,46 А) [10].
он
I
(О2JО Мо Мо О (О2J
I
ОН
2-
Литература. [1] Acta cryst., 1975, В31, 1814. [2] Acta crysi, 1975, B31, 1828.
Г31 J. Am. Chem. Soc, 1968, 90, 3374. [4] Inorg. Chem., 1968, 7, 722. [5] Inorg.
Chem., 1964, 3, 397. [6] J. Am. Chem. Soc, 1969, 91, 301. [71 Acta cryst., 1972,
B28, 1278. [8] Acta cryst., 1975, B31, 2294 [9] Acta cryst., 1973, B29, 864.
[10] Acta cryst., 1972, B28, 1288.
11.3. Простые молекулы и ионы 2Ф
Таблица 11.5. Мостиковые оксосоединения металлов
Соединение
Длина
мостико-
вой сьязи
М-О, А
Литература
Тип М—О—М
А12О B-метил-8-хинолинолL (о)
Cl2 (C5HS) Ti-O—Ti (С5Н5) CI2
К2[ТШ5(С7НзО4ЫJ1-5Н2О1
Ti2OCI2(acacL-CHCl3 J разД'
|Ре2О(тетраэтиленпентамннJ114
Mo203(S2COC2H5L (б)
К2[Мо2О5(С2О4J(Н2ОJ] (в)
Mo2O3[S2P(OEtJl4
Мп2О (руг) 2 (фталоцпанин) о
(Cl5Ru—О—RuCl5)K4-H2O
(ClsRe-O—ReCl5)K4-H2O
(C15W—О—WC15)K4
(CI5Os—O-OsCl5)Cs4
(Cl5Re^O—ReCl5)Cs3
[(ЫНзMСг-О-Сг(К11зK]С14-Н2О
O3Re—O-ReO3(H2OJ
fFe,O(HEDTAJl2-
rORe(CNL—O—Re(CNL014-
Г (NH3) 5R u—O—Ru (en) 2—O—
—Ru(NH3Ml6+
Tun
ВаГМо2О4(С2О4J"|-5Н2О (г)
("Mo2O4(uncTeiiHJl2Na2-5 H2O
[Re2O2(C2O4LlK4-3H2O
68
78
83
80
77
1,86
1,88
1,86
1,71
1,80
1,86
1,87
1,83
1,82
2,10
1,79
1,92
1,87
1,91
1,93
1,94
J. Am. Chem. Soc, 1970, 92, 91
J. Am. Chem. Soc, 1959, 81,
5510
Inorg. Chem., 1970, 9, 2391
Inorg. Chem., 1967, 6, 963
Acta cryst., 1975, B31, 1438
J. Am." Chem. Soc, 1964, 86,
3024
Inorg. Chem., 1964, 3, 1603
Acta cryst., 1969, B25, 2281
Inorg. Chem., 1967, 6, 1725
Inorg. Chem., 1965, 4, 337
Acta cryst., 1962, 15, 851
Acta cryst., 1975, B31, 1783
7. anorg. allg. Chem., 1973, 396;.
66_4
Acta cryst., 1976, B32, 867
J. Am. Chem. Soc, 1971, 93,
1512
Angew. Chem., 1968, 80, 296,
291
Inorg. Chem., 1967, 6, 1825
Inorg. Chem., 1971, 10, 2785
Inorg. Chem., 1971, 10, 1943
norg. Chem., 1965, 4, 1377
Acta cryst., 1969, B25, 1857
Ada cryst., 1975, B31, 1594
ионах и мо?I™Lf K«Tnr' ^ Р »™™
атомами металла пример мНРЭЗуеТ ДВе лиыейные связи с
типа приведены в табГп ,многочисленных соединений такого
миния, это все соединения Sn? исключением соединений алю-
ны фрагменты неско?ьких ^РеХ0ДНЫХ металлов. Ниже показа-
мостики М-О- комплексов, содержащих одинарные
210 //. Кислород
MV линейно расположенных связей А1—О—А1; если бы угол
между связями был 140°, то связи А1—О имели бы нормальную
длину A,79 А). В некоторых мостиковых комплексах трехва-
¦0 А1
0'
;мо.
о
-1.86 А
J s-
1.65 А
О. i 2,10 А
а
л
'"-S
;со(с2н5)
лентного железа валентные углы при атоме кислорода нахо-
дятся в интервале 140—180°*, а расстояния Fe—О остаются не-
изменными и близкими к 1,75 А; предполагается, что валентный
угол при атоме кислорода очень чувствителен к конфигурации
сложных органических лигандов. Следует отметить, что конце-
2,33 А
1,91 А
О
j
О
о
2,19
вые связи М—О в таких комплексах, как б и в, заметно короче,
чем коллинеарные связи М—О—М. Это также справедливо для
иона [О—Re(CNL—О—Re(CNL—О]4", в котором концевые
связи Re—О A,70 А) значительно короче мостиковых связей
A,92 А).
Кроме ионов типа (М2ОС1юL- для рения известен также ион
(Re2OClioK~, в котором у атома кислорода, по-видимому, име-
ется один неспаренный электрон, обусловливающий парамагне-
тизм. Существуют также катионы с кислородным мостиком,
как, например, в соединении [Cr2O(NH3) ю]С14-Н2О; ион такого
же типа, но сложного строения имеется в «рутениевом крас-
11.4. Кислородсодержащие ионы 2111
ном» Он представляет собой линейную систему из трех окта-
эдрических групп [ (NH3MRu—О—Ru(NH3L—О—Ru(NH3M]6+,
в которой средняя степень окисления металла равна 10/3.
В двойных мостиках типа
связи кислорода обяза-
тельно нелинейны. Примером может служить ион в соединении
Ва[Мо2О4(С2О4J] -5Н2О [г], в котором длина связи Мо—Мо
B,54 А) указывает на взаимодействие между атомами метал-
ла, достаточное для того, чтобы соединение имело почти диа-
магнитные свойства @,4 [Хв). Отметим широкий диапазон длин
связей Мо—О в этих соединениях: 1,65—1,7 А (очень корот-
кие) для связей молибдена с концевыми атомами кислорода,.
1,9 А в мостиках и, наконец, 2,1 А и более (длинные), по-ви-
димому, для одинарных связей.
11.4. Кислородсодержащие ионы
Связанный кислород составляет 9/ш объема земной коры,
и большая часть неорганической химии так или иначе посвяще-
на соединениям, содержащим кислород. Чистые оксиды среди
минералов встречаются редко. Соединения, содержащие помимо^
кислорода два и более элементов, можно классифицировать на
основе электроотрицательностей этих элементов. Поскольку со-
единения kxXvOz, содержащие два элемента с высокой электро-
отрицательностью, немногочисленны, можно выделить две ос-
новные группы:
1) А и X — электроположительные элементы;
2) А —электроположительный элемент, X — электроотрица-
тельный.
Соединения первой группы — сложные оксиды — могут рас-
сматриваться как состоящие из ионов двух (и более) металлов
и ионов О2-. Число ионов кислорода, окружающих катион (его
координационное число по кислороду), зависит от размера ка-
тиона (гл. 7). Для самых больших ионов, например Cs+ и Ва2+,
координационные числа высоки (вплоть до 12) и обычно варьи-
руются в определенных пределах при переходе от одной струк-
туры к другой. Кристаллические структуры сложных оксидов,
описаны в гл. 13.
Соединения второй группы называют солями оксокислот,
так как они образованы при соединении основного оксида
электроположительного элемента А с кислотным оксидом элект-
роотрицательного элемента X. Последним обычно является не-
металл, но может быть и переходный металл в высшей степени
окисления. Соли оксокислот представляют собой соединение
ионов А и сложных (комплексных) ионов ХО„, причем связь
между ионами А и атомами кислорода анионов имеет сущест-
14*
212 //. Кислород
венно ионный характер. Следует подчеркнуть, что здесь рас-
сматриваются исключительно анионы, так как известно всего
несколько многоэлементных катионов, в состав которых входит
кислород (например, NO+, NO2+, СЮ2+; они описаны в соответ-
ствующих разделах). Сложный ион — это заряженная группа
атомов, которая может быть либо конечной, либо бесконечно
простираться в одном, двух или трех направлениях и внутри
которой связи между атомами X и О имеют существенно кова-
лентный характер. (Чтобы не привлекать понятие природы свя-
зей, можно предложить другое определение: например, слож-
ный ион — это группа атомов X и О, соединенных связями X—
—О. Однако для того, чтобы учесть небольшое число кислород-
содержащих ионов, в которых есть связи X—X (O3S—S2~,
О3Р—РО34- и др.) или связи О—О (O3S—О—О—SO32~ и др.),
следует включить эти связи в определение.) Если сложный ион
представляет собой бесконечную группировку атомов, то разру-
шение кристалла обязательно означает и разрушение иона. Ес-
ли сложный ион является конечным, то та же группа атомов
ХО„ может сохраняться в растворе или в расплаве; устойчиво-
сти сложных ионов и кристаллов, содержащих эти ионы, раз-
личаются очень сильно. Соли некоторых очень устойчивых ио-
нов ХО„ испаряются в виде молекул с простыми формулами,
структуры которых напоминают так называемые структурные
формулы, принятые сто лет назад. Структуры таких молекул
были изучены методом электронографии паров с температура-
ми сопла в интервале 600—900 °С для соединений ТЩеО4,
T12SO4 и Cs2WO4 {1] и 1800—2000 °С для BaWO4 [2].
м
UNO3
О X
м
XI
о
NaNO3
О
Cs2WO4
\ /
Re
О "О
TIReO* BaW04
Прежде чем приступить к описанию определенных типов
сложных ионов, следует сделать два замечания. Во-первых, не
во всех случаях можно провести резкую границу между слож-
ными оксидами и солями оксокислот, особенно в тех случаях,
когда связи А—О имеют заметно ковалентный характер. На-
пример, такое соединение, как ВРО4, содержащее элементы бор
и фосфор с близкими электроотрицательностями, имеет струк-
туру, похожую на структуру кварца, а различие в степени ко-
валентности связей В—О и Р—О, по-видимому, невелико. Во-
вторых, существуют кристаллические соединения, которые мож-
но отнести к оксид-солям оксокислот, так как они содержат как
.дискретные ионы О2", так и сложные оксо-ионы. Примерами
11.4. Кислородсодержащие ионы 213
таких соединений, описанных в других главах, являются:
Sr3Si05 (разд. 23.12.2), структура которого похожа на структу-
ру Cs3CoCl5 [т. е. формула его Sr3(SiO4)O]; Fe7SiOi0 (разд.
23.12.3); Fe3BO6 (разд. 24.7.7), изоструктурный Mg3Si04(ОН, FJ;
Bi4O3(BO3J (разд. 24.7.7) и Cu2O(SO4) (разд. 25.7.4). Из ок-
сид-фосфатов с известными структурами можно указать следу-
ющие: Zr2O(PO4J [3], Cu5O2(PO4J [4], РЬ4О(РО4J и
РЬ8О5(РО4J [5].
Литература. [1] Ж. струк. хим., 1973, 14, 548. [21 Ж- физ. хим.. 1973, 47, 3030.
[3] Acta cryst., 1975, В31, 1768. [4] Acta cryst., 1977, ВЗЗ, 3465. [51 J. Solid State
Chem., 1973, 7, 149.
11.4.1. Типы кислородсодержащих ионов. Известно множество
типов кислородсодержащих ионов: от простейших одноядерных
ионов ХО„ до трехмерных (каркасных). Обычно выделяют не-
сколько типов кислородсодержащих ионов.
1) Одноядерные ионы. В эту группу входят всем известные
ионы, представленные в табл. 11.6. Их стереохимия обсужда-
лась в гл. 7, а также в других главах. Несмотря на то что наи-
Таблица 11
Конфигурация
Нелинейная
Плоская
Пирамидальная
Тетраэдрнческая
Тетрагонально-
пирамидальная
Октаэдрическая
ВО
6. Конфигурация
I3- СО32-
SiO44-
анионов кислородсодержащих кислот
Анионы
NO2-
NO3-
РО43-
AsO43-
vo43-
сю2-
SO32- CIO3-
BrO3-
ю,-
SO42- СЮ4-
IO4-
MnO4-
ReO53-
TeO66- IO65-
более важными ионами этого типа являются ионы, образован-
ные неметаллами или переходными металлами в высших сте-
пенях окисления, аналогичные группировки были найдены, на-
пример, в соединениях K2Ni02 (линейные ионы О—Ni—О2~)
[1], К4РЬО3 (пирамидальные ионы РЬО34~ с валентными угла-
ми, близкими к 100°, и расстояниями РЬ—О, равными 2,17 А)
[2] и Na4Fe03 (плоские ионы FeO34-) [3].
2) Конечные многоядерные ионы. Существует небольшое
число многоядерных кислородсодержащих ионов, в которых
атомы X (или О) связаны непосредственно, как в приведен-
214 11. Кислород
ных выше примерах, но большинство многоядерных кислород-
содержащих ионов содержат группировки ХОП, объединенные
общими атомами кислорода. Такие ионы известны для многих
элементов, а именно бора, кремния, фосфора, молибдена, воль-
фрама и (реже) мышьяка, ванадия, ниобия, серы и хрома (VI).
Поэтому выделение определенных типов кислородсодержащих
сложных ионов может быть основано на том, каким образом
группировки ХОз (плоские или пирамидальные), ХО4 (тетраэд-
рические) или ХО6 (октаэдрические) соединяются друг с дру-
гом— через общие вершины (атомы кислорода) или общие реб-
ра; соединение координационных полиэдров посредством общих,
граней в сложных кислородсодержащих ионах наблюдается;
редко. Таким путем из орто-иона ХО„ можно получить следую-
щие ионы:
ои..,х-о-хо„_1
пирооксо-ион
О" ^0
о„_2х^о^хоп_2
другие циклические
Г 0„..2
Л1етаоксо - иа.'.ч/
Если тетраэдры имеют по две общие вершины, то возможно
образование как циклического, так и бесконечного цепочечного'
иона. Существует много соединений с ионами Х2О7 и цикличе-
скими ионами (Х03)п, образованными из тетраэдрических групп
Х04; в соединениях КбРе2О6 [4] и КбМп2О6 [5] обнаружена
группировка Х2Об, структурно подобная молекуле А12С1б. Пока
неизвестно соединение, содержащее группировку Х2Оц, постро-
еннную из двух соединенных общей вершиной октаэдров, но
установлено, что ион Те2Ою8~ состоит из двух октаэдров, со-
члененных через общее ребро, а ионы 12О94~ и W2O96~—из двух
октаэдров с общей гранью.
Промежуточными между пиро-ионами н бесконечными ли-
нейными мета-ионами являются ионы, образованные из трех
или более ХОп-групп, например:
ХП . р Г\ fi— До О 5- ^ П 2— Сг П -- РГг О 3— Д^Рг О S-»
з^Ю' *з 10 » "SgUjQ , о3*^^о , V-I3io » ^^^ lo » ri^^^g 10
Х4О13: S4O132-, Cr4O132-
В PCr3Oi33~ и PCr4Oi63- центральный атом фосфора связан по-
средством атома кислорода с тремя (треугольник) или четырь-
мя (тетраэдр) атомами, хрома, т. е. эти ионы образованы из че-
тырех и пяти тетраэдрических группировок (соответственно).
Детально такие ионы описаны в соответствующих главах, по-
священных элементу X.
11.4. Кислородсодержащие ионы 215
Здесь следует упомянуть два других типа конечных слож-
ных кислородсодержащих ионов. Это прежде всего ионы, в ко-
торых группировки ХОП соединены с атомом металла либо по-
средством атома X, как в [Co(NO2h]3~ и [Pd(SO3L]6~, либ°
посредством одного и более атомов кислорода, как в
[Со(МОзL]2~ и [Се(МОз)б]2~. Более сложно построен ион
[иО2(КОз)з]~, в котором координационный полиэдр урана со-
держит два уранильных кислорода и шесть кислородов от би-
дентатных нитратных групп. Вторая группа более многочислен-
на: это ионы изополисоединений, построенные из различного
числа октаэдрических группировок (X=V, Nb, Та, Mo, W),
сочлененных вершинами и ребрами, а также ионы гетерополи-
соединений, содержащие не один элемент в качестве комплек-
сообразователя, а два или даже три таких элемента в количе-
стве одного или более атомов.
3) Бесконечные многоядерные кислородсодержащие ионы.
В данной книге рассматривается много кислородсодержащих
ионов, которые простираются бесконечно в одном, двух или трех
направлениях, в частности это борат-ионы (построенные из пло-
ских групп ВО3 и (или) тетраэдров ВО4), описанные в гл. 24,
силикат- и алюмосиликат-ионы (построенные из тетраэдров
(Si, A1)O4), описанные в гл. 23, и многие структуры, построен-
ные из тетраэдров или октаэдров, включенные в гл. 5. Для же-
леза (III) известен ряд ионов, аналогичных ионам кремния: это
конечные ионы FeO45~ [6] и Fe2O78~ [7], одинарный цепочеч-
ный ион в КзРеОз [8], сдвоенный цепочечный ион (а) в
Na14Fe60i6 [9], по-видимому, подобный иону в Na2Ca3Si6Oi6,
а
и анион в Na4Fe205 [10], в основе которого лежит плоская ре-
шетка б3. Интересно отметить, что железо образует также ионы
Fe2O66-, состоящие из двух сочлененных ребрами тетраэдров;
такие структуры неизвестны для кремния.
216 //¦ Кислород
Литература. [1] Z. anorg. allg. Chem., 1964, 324, 214. [2] Z. anorg. allg. Chem.,
1978, 428, 105. [31 Z. anorg. allg. Chem., 1977, 437, 95. [41 Z. anorg. allg. Chem.,.
1974, 408, 151. [5] Natunviss, 1976, 63, 339. [6] Naturwiss, 1975, 62, 138. [71 Z.
anorg. allg. Chem., 1978, 438, 15. [81 Z. anorg. allg. Chem., 1974, 408, 152.
[9]| Angew. Chem., 1977, 16, 43. [10] Naturwiss., 1977, 64, 271.
11.5. Ионы изополисоединений
11.5.1. Ионы изополисоединений ванадия, ниобия и тантала. Су-
ществует множество экспериментальных доказательств того,,
что в подкисленных растворах ванадатов, ниобатов и тантала-
тов образуются более сложные кислородсодержащие ионы.
В гл. 12 и 13 рассмотрены структуры некоторых кристалличе-
ских ванадатов; здесь прежде всего остановимся на конечных
сложных ионах, которые существуют как в растворах, так и в
кристаллических солях. Было показано, что в Na7H(Nb6Oi9) ¦
•15Н2О [1] существует ион, изображенный на рис. 11.3, а. При
изучении рассеяния света в водных растворах КвСТэбОш)-
•16Н2О, установлено, что и в растворе анион содержит 6 ато-
мов тантала и, по-видимому, имеет такое же строение, как и
ион в кристаллической соли >[2].
Nb6 о% v;, О?в
а 6
Рис. 11.3. Ионы Nb6O198- (а) и V,cOi&6- (б).
Соли, содержащие аналогичные ионы пятивалентного вана-
дия, по всей видимости, не могут быть получены кристаллиза-
цией из раствора, однако соли, содержащие такие ионы, как
VWsOig3" и V2W4Oi94~, этим способом получены, и структура
соединения последнего иона с гуанидинием расшифрована [3].
Кроме того, в а-ванадате меди обнаружена «супероктаэдриче-
ская» группировка УбСЧэ и получено нестехиометрическое со-
единение ванадияAУ) состава Сит-зЛ^О^-ж (х = 0,22) [4].
11.5. Ионы изополисоединений 2П
Ранее считали, что декаванадат-ион VHO2s6- существует
только в растворах, теперь доказано его существование в кри-
сталлических солях, и по крайней мере две соли встречаются
в виде минералов —Ca3Vio028-27H20 и K2Mg2Vio028- 16H2O.
Соли этого типа получают выпариванием растворов ванадатов
при рН 2ч-6. Ион Vio0286~~ (рис. 11.3,6), структурно исследо-
ванный в солях кальция [5] и цинка [6], содержит 10 атомов
ванадия, расположенных в вершинах двух октаэдров, имеющих
общее ребро. При геометрическом подходе к структуре (рис.
11.3) оба иона можно описать в виде фрагментов структуры
NaCl, заменив ниобий и тантал на натрий, а кислород — на
хлор. Аналогичный ион ниобия был изучен в соединении
[N(CH3L]6Nb,o028 [7].
В соединении Rb4Nb6Oi7-3H2O [8] нет конечного сложного
иона. Анионы образуют слои, которые содержат фрагменты
А6Хг2 (рис. 11.4,6), связанные 10 вершинами (атомами кисло-
рода), по две вершины сверху и снизу и по три по правой и
левой стороне фрагмента на рисунке. Это довольно необычная
слоистая структура, в которой некоторые слои соединены друг
с другом лишь посредством половины ионов рубидия, а осталь-
ные ионы рубидия вместе с молекулами воды расположены
между чередующимися парами слоев.
Литература. [11 Ark. Kern., 1953, 5, 247; Ark. Kem., 1954, 7, 49. [21 Inorg. Chem.,
1963, 2, 985. [3] Bull. Chem. Soc. (Japan), 1975, 48, 889. j1 J. Solid State Chem.,
1973, 7, 17. [51 Acta cryst., 1966, 21, 397. [61 Inorg. Chem., 1966, 5, 967. [7] Acta
¦cryst., 1977, B33, 2137. [8] J. Solid State Chem., 1980, 33, 83.
11.5.2. Ионы изополисоединений молибдена и вольфрама. Не-
смотря на то, что простейшие ионы молибдатов и вольфрама-
тов, строго говоря, не относятся к многоядерным, здесь рас-
сматриваются все ионы М„ОЖ, образуемые молибденом и воль-
фрамом, включая ионы М2О7. Уже отмечались структурные раз-
личия между триоксидами серы и хрома (тетраздрическая ко-
ординация) и триоксидами молибдена и вольфрама (октаэдри-
ческая координация, но разные структуры). Между структура-
ми кислородсодержащих ионов этих элементов существуют по-
хожие различия. Некоторые ортомолибдаты и ортовольфрама-
ты похожи на сульфаты и хроматы в том отношении, что они
содержат тетраэдрические ионы МО4 (разд. 13.5.1); однако в то
же время между структурами сульфатов и хроматов, с одной
стороны, и структурами молибдатов и вольфраматов — с дру-
гой, очень мало сходства. Полисульфаты и полихроматы по-
строены из тетраэдрических группировок, соединенных общими
вершинами; для них неизвестны соединения с «>4. Полимо-
либдаты и поливольфраматы гораздо более многочисленны и
а
.¦1\ л
Рис. П.4. а — Мо7О246~; б — фрагмент, общий для ионов а и г; в и =: — проек-
ции иона p-MojOse4"; д -=- а-М0802в4~; е и ж—две проекции группы Мо8028:
3-W,o0324-.
11.5. Ионы изополисоединений 219
имеют более сложное строение. Например, из расплава были
получены следующие соединения цезия [1]: Cs2Mo2O7,
CS2M03O10, CS2MO4O13, Cs2MosOI6 и Cs2Mo7O22- Почти все мно-
гоядерные кислородсодержащие ионы молибдена и вольфрама
построены из октаэдров МОб, хотя имеются и исключения.
В соединении MgMo2O7 [2] молибден имеет тетраэдрическую
координацию (анион похож на ион Сг2О72~), а в изоструктур-
ных соединениях Na2Mo2O7 [3] и Na2\V2O7 [4], содержащих
цепочечные анионы (рис. 5.43, а), тетраэдрической координаци-
ей характеризуется половина атомов М. В Li2W2O7 [5],
Ag2Mo2O7 и Ag2W2O7 [6] существуют бесконечные цепочечные
ионы, построенные из октаэдров МОб. В двух последних соеди-
нениях цепочки строятся однотипно — сочленением октаэдров
по вершинам и ребрам, они отличны от цепочки в I^W^O?.
Следует отметить, что полимолибдаты и поливольфраматы с
аналогичными по типу формулами часто имеют различные
структуры (ср. триоксиды), причем структура аниона зависит
от природы катиона (ср. совершенно разные структуры
КгМозОю ;[7] и K2W3O10 [8]). Последнее соединение имеет трех-
мерную каркасную структуру, в то время как анион в К2М03О10
представляет собой бесконечный одномерный ион (рассмотрен
позднее). Его структуру можно представить построенной из
октаэдров и тетраэдров (рис. 5.43,6), однако его можно также
описать в виде иона, содержащего молибден с координацион-
ными числами 5 и 6. В соединении Na2Mo207 расстояния Мо—О
в тетраэдре МоО4 имеют лишь небольшой разброс (в интерва-
ле 1,71—1,79 А), а в соединении КгМозОю эти группировки ис-
кажены (Мо—4 0 1,64—1,95 А, а пятый атом кислорода нахо-
дится на расстоянии 2,08 А), так что молибден в этом соедине-
нии, скорее всего, имеет координационное число 5, а не 4. У обо-
их этих молибдатов, как и в других полимолибдатах, а также в
МоОз, расстояния Мо—О находятся в интервале от —1,70 до
2,2-^2,3 А. (Соединение, которому первоначально приписывали
формулу Rb2W30io, по-видимому, имеет состав Rb22W32Oi07 [9].)
Соединения M2Mo4Oi3 и M2W4O13 кристаллизуются по край-
ней мере в четырех структурных типах: низкотемпературный
Li2Mo4Oi3 Г10] имеет трехмерную октаэдрическую каркасную
структуру, родственную V6Oi3; структура К.2М04О13 [11] пред-
ставляет собой сложную цепочку из полиэдров, соединенных
общими ребрами; Tl2Mo4Oi3 [12] имеет слоистую октаэдриче-
скую структуру, a K2W4O13 [13]—трехмерную каркасную
структуру, построенную из полиэдров, соединенных общими
вершинами, которая напоминает структуру гексагональной
бронзы. Две довольно компактные группировки из четырех ок-
таэдров, имеющие состав A4Xi6, показаны на рис. 5.8. Фраг-
мент, изображенный на рис. 5.8, з, — это анион в Ag8W4Oi6 [14].
220 11. Кислород
В гл. 5 отмечалось, что очень простой структурный элемент
A4Xi6> изображенный на рис. 5.8, к, не существует в виде иона
в растворе. Однако было установлено, что в вольфраматах ти-
па Lii4(WO4KW4Oi6-4H2O [15] и изоструктурном ему соединении
(LinFe) (WO4KW4Oi6 [16] наряду с тетраэдрическими ионами
\VO42~ существует дискретный элемент W4Oi5 с такой конфигу-
рацией. В то же время имеются разногласия в вопросе о том,
занимает ли ион лития центральную тетраэдрическую пустоту
в группировке W4Oi6 или все катионы размещены между иона-
ми W4Oi68" и WO42~ в позициях с октаэдрической координа-
цией.
Ионы (Мо6О19J- и (W6Oi9J-. Анионы в соединениях
[HN3P3(NMe2N]2Mo6Oi9 [17] и (NBu4JW6Oi9 [18] имеют
структуру, изображенную на рис. 11.3, а. При уточнении струк-
туры соединения с вольфрамом получен обычный разброс в
расстояниях W—О A,693, 1,924 и 2,325 А). «Супероктаэдр»
W6Oiy выступает как один из фрагментов структурного каркаса
в SnioWi6048, который построен из группировок W6Oi9 и W2Os
[19].
Ион Mo7O2i6~ (рис. 11.4, а) содержится в соли (NH4NMo7O24-
¦4Н2О [20], которую первоначально описывали как парамолиб-
дат. Интересно , что этот ион не имеет компланарную структу-
ру иона ТеМо6О246~ (см. ниже), а представляет собой более
компактную группировку из семи октаэдров МоО6. В этой груп-
пировке наблюдается значительный разброс расстояний Мо—О,
что соответствует наличию в анионе атомов кислорода, связан-
ных с одним, двумя, тремя и четырьмя атомами металла.
При сочленении фрагментов Alo7O24 друг с другом через
атомы кислорода образуется слой состава Мо7О22. Такой дву-
мерный анион содержится, например, в Т12Мо7О22 [21].
Ионы Мо3О2е^~ и Н2Мо8О2&6~. Рентгеноструктурное исследо-
вание гидратов (NH4LMo8O26 [22] показало, что октамолиб-
дат-ион имеет структуру, показанную на рис. 11.4,s и г, в ко-
торой шесть из восьми октаэдров МоО6 расположены таким же
образом, как и в ионе Мо7О246~ (рис. 11.4,6). Этот ион теперь
называют р-Мо80264~-ионом, так как в соединении
[N(C4H9L]4Mo8O26 [23] обнаружен изомерный сс-Мо8О264~-ион.
Он представляет собой кольцо из шести октаэдров, подобное
кольцу в ТеМо6О246~ (рис. 11.8), но центральная октаэдриче-
ская пустота не заселена, а перекрыта двумя тетраэдра ми
МоО4, расположенными над и под плоскостью кольца (рис.
11.4,5). Возможные механизмы перехода одного изомера в дру-
гой обсуждались в работе [24].
Другой, конечный октамолибдат-ион обнаружен в соли изо-
пропиламмония (C3HioNN[H2Mo8028] -2Н2О [25] (рис. 11.4, е к
ж). Этот комплекс, состоящий из восьми соединенных ребрами
11.5. Ионы изополисоединений 221
октаэдров, представляет особый интерес, так как он выступает
в качестве структурного фрагмента в двух других октамолибда-
тах. При соединении фрагментов двумя атомами кислорода, по-
казанными кружочками на рис. 11.4, ж*, образуется цепочка
состава Мо8О27; такую конфигурацию имеет анион в соединении
(NH4NMo8O27-4H2O [26]. Эта соль может кристаллизоваться
из раствора либо в виде гексамолибдата, либо в виде гептамо-
либдата; этот факт показывает, что различные слоистые много-
ядерные ионы взаимопревращаемы и, возможно, в растворе на-
ходятся в равновесии. Цепочка, образованная из таких же
фрагментов, по соединенных ребрами (рис. 11.4, ж) имеет со-
став Мо8О26; такую структуру имеет анион в соединении
К2МО4О13, полученном кристаллизацией из расплава.
Ранее уже отмечалось, что слой Nb6O!7 построен из фраг-
ментов М6Х22 (рис. 11.4,6), соединенных 10 атомами кислорода.
Характерной чертой многих сложных полимолибдатов и поли-
вольфраматов является то, что их структуры содержат фраг-
менты, состоящие из соединенных ребрами октаэдров; далее
фрагменты соединены через атомы кислорода в цепочки, слои
или каркасы; обычно такое соединение осуществляется общими
вершинами, но иногда и общими ребрами октаэдров. Напри-
мер:
Фрагмент [М6Х22]*
Фрагмент М7Х24
Фрагмент М8Х2а
"слой MeX,7 (Rb4Nb6Oi7-3H,O)
"слой М7Х22 (Т12Мо7О22)
"цепочка М8Х27 (связь вершинами)
((NH4NMo8O27-4H2O) [26]
цепочка М8Х26 (связь ребрами) (К2Мо4О13)
Ион Wio0324~ (рис. 11.4, з), изученный на примере соли три-
бутиламмония [27], можно получить, если в каждом из двух
«супероктаэдров» W6Oig удалить по одному октаэдру и затем
соединить два полученных фрагмента Ws общими вершинами
так, что в центре образуется незаселенная октаэдрическая пус-
тота***.
Молибденовые и вольфрамовые кислоты. Если щелочной
раствор обычного вольфрамата щелочного металла нейтрали-
зовать и закристаллизовать при упаривании, то получится «па-
равольфрамат», который содержит ион (H2\Vi2O42I0~. При ки-
пячении раствора паравольфрамата с желтой «вольфрамовой
кислотой» (ее получают при подкислении горячего раствора
* Существенно то, что в [H2MoeO28l6~ в этих позициях располагаются не
одиночные атомы кислорода, а гидроксидные группы. — Прим. ред.
** Фрагмент [МбХ22] не получен в виде конечного иона.
*** Анализ причин, обуславливающих специфику строения изополианионов,
см. в работах: [Коорд. хим., 1975, т. 1, с. 1271—81; Ж. неорг. хим., 1981, т. 20,
с. 3171—3180]. — Прим. ред.
-222 П. Кислород
вольфрамата или паравольфрамата) образуется «метавольфра-
мат», а при подкислении этого раствора получают растворимую
«метавольфрамовую кислоту», которую можно экстрагировать
эфиром; она образует крупные бесцветные кристаллы. Мета-
вольфраматы содержат ионы (H2Wi204oN~.
Конечными продуктами при подкисленни растворов молиб-
датов и вольфраматов являются молибденовая и вольфрамовая
«кислоты». Структуры соединений МоО3-2Н2О и МоО3-Н2О
(желтого цвета) построены из слоев состава Мо03(Н20) (разд.
5.3.3), образованных из координационных группировок
•Рис. 11.5. а и б — фрагменты из трех октаэдров, из которых построен пара-
вольфрамат-ион; в — паравольфрамат-ион.
:[МоО5(Н2О)], соединенных вершинами; в дигидрате вторая
молекула воды расположена между слоями [28]. Соединения
вольфрама имеют такие же структуры. Существует также со-
единение МоОз-НгО белого цвета, оно имеет цепочечную струк-
туру, в которой полиэдры соединены общими ребрами [29];
проекция этой структуры такая же, как проекция слоя МоО3,
показанная на рис. 5.30, а.
Паравольфрамат- и метавольфрамат-ионы. Паравольфрамат-
¦ион изучен на примере ряда солей, среди них (NH4)io(H2Wi2042) •
•10Н2О [30], гидраты соли натрия с 20 и 27 молекулами воды
[31] и (NH4NH4[H2W12O42]-10H2O [32]. Паравольфрамат-ион
построен из 12 октаэдров WO6) разделенных на четыре группы;
каждая группа состоит из трех октаэдров, сочлененных общими
ребрами. В структуре выделяются два типа групп (рис. 11.5):
две группы типа а и две—типа б. Эти группы по три октаэдра
сочленены общими вершинами, как показано на рис. 11.5, в.
В полученном ионе 42 атома кислорода расположены по пози-
циям искаженной гексагональной плотнейшей упаковки. Было
установлено, что два не подвергающихся замещению атома во-
дорода связаны с кислородными атомами, лежащими на цент-
ральной вертикальной оси*. Как и в полимолибдатах, расстоя-
* И находятся во внутренней полости аниона. — Прим. ред.
11.6. Ионы гетерополисоединений 223'
пия металл — кислород имеют значительный разброс, в данном
случае расстояния W—О равны 1,8, 2,0 и 2,2 А для атомов кис-
лорода, связанных с одним, двумя и тремя атомами вольфрама
соответственно. Интересно сравнить этот ион с метавольфрамат-
поном, который построен из 12 октаэдров \VO6, принадлежа-
щич четырем группам типа б (рис. 11.5), что приводит к со-
ставу H2Wi2O406". Этот ион в целом имеет ту же структуру, что
н ион гетерополикислоты (PW^CUoK" (разд. 11.6). При хими-
ческом восстановлении метавольфраматов образуются окрашен-
ные ионы, синие [33] и коричневые [34]. Исследование корич-
невого соединения Rb4H8(H2Wi2O40), в котором три атома воль-
фрама (вероятно, относящиеся к одной триаде W3Oi3 иона Кег-
пша) восстановлены до W(IV), очень затруднено из-за раз-
упорядочения в кристалле*.
Литература. П] Acta cryst., 1975, В31, 1293. [2] Ada cryst., 1977, ВЗЗ, 3859.
[31 Acta Chem. Scand., 1967, 21, 499. [4] Acta cryst., 1975, B31, 1200. [5] Acta
crvst 1975 B31, 1451. [6] J. Chem. Soc, D 1976, 1316. [71 J. Chem. Soc, A 1968,
1398 [81 Acta cryst., 1976, B32, 1522. [9] Acta cryst., 1977, B33, 3345. [10] J. Solid
State Chem., 1974, 9, 247. [11] J. Chem. Soc, A 1971, 2107. [12] Acta cryst., 1978,.
B34 3547. [131 Chem. Comm., 1967, 1126. [14] Material Res. Bull., 1975, 10, 791.
[15] Ber, 1966, 70, 598. [16] Кристаллография, 1968, 13, 980. [17] Inorg. Chem.,
1973 12, 2963. [181 Acta cryst, 1978, B34, 1764. [19] Acta cryst., 1980, B36, 15.
[20] J. Chem. Soc, D 1975, 505. [211 Acta cryst., 1976, B32, 1859. [22] J. Less-
comm. Met., 1977, 54, 283. [231 J- Am. Chem. Soc, 1977, 99, 952. [24] Inorg.
Chem, 1980, 19, 3866. [25] Acta cryst., 1978, B34, 2728. [261 Acta cryst., 1974,
B30, 4». [27] Acta cryst., 1976, B32, 740. [281 Acta cryst., 1972, B28, 2222. [29}
Acta cryst., 1974, B30, 1795. Г301 Acta cryst., 1971, B27, 1393. [31] Acta cryst.,
1976, B32, 1565. [32] Acta cryst., 1979, B35, 1675. [33] J. Inorg. Nucl. Chem., 1976,
38, 807. [34] Inorg. Chem., 1980, 19, 2933.
11.6. Ионы гетерополисоединений
Наиболее известными гетерополиионами являются 40-оксодо-
декамолибдофосфат(У) PMoi2O403~~ и 40-оксододекавольфрамо-
фосфат(У) PWi204o3~, которые легко образуются в различных
несложных реакциях. 40-Оксододекамолибдофосфат(У) аммо-
ния осаждается из раствора, содержащего фосфат, молибдат
аммония и азотную кислоту. 40-Оксододекавольфрамофосфа-
ты(У) щелочных металлов получают при кипячении раствора
фосфата щелочного металла с WO3. Гетерополикислоты хорошо
растворимы в воде и эфире и легко кристаллизуются, как пра-
вило, с большим числом молекул кристаллизационной воды.
Эти кислоты имеют примечательное свойство образовывать не-
растворимые осадки со многими сложными органическими со-
* Более полный обзор стереохимии изополианионов (учитывающий ряд
новых сложных структур) и ссылки на работы последних лет см. в ежегод-
нике [Кристаллохимия, сер. ИНТ. — М.: ВИНИТИ, т. 18, 1984, с. 3—63].—
Прим. ред.
224 //. Кислород
единениями, такими, как красители, альбумин и алкалоиды.
И кислоты, и соли обладают значительной устойчивостью к
действию кислот, но легко восстанавливаются под действием
диоксида серы и других восстановителей. Соли, содержащие
небольшие по размеру ионы щелочных металлов, как и кисло-
ты, сильно гидратированы. При длительном хранении ионы
PMi204o3~ преобразуются в более сложные ионы, такие, как ион
Р2^18Об26", структура которого описана далее. PMi2O403~ пред-
ставляет собой глобулярный ион, который построен из октаэд-
ров МоО6 или WO6, соединенных вершинами и ребрами. В цент-
ре иона имеется тетраэдрическая пустота, занятая атомом фос-
фора; в состав гетерополи-иона вместо Р может входить один
из следующих гетероатомов: В, Al, Si, Ge, As, Fe, Cu или Со.
Примером другого иона, содержащего каркас из октаэдров,
полностью окружающий гетероатом, является ион СеМо^С^г8",
в котором центральная пустота имеет форму икосаэдра.
В самом широком смысле термин «гетерополиион» приме-
ним по крайней мере к еще двум другим группам ионов. Суще-
ствуют ионы, у которых имеется неполное окружение гетеро-
атома, однако во всех случаях он окружен координационной
группой из атомов кислорода, принадлежащих к октаэдриче-
ским группировкам, таким же, как в ионах РМ^Оад3^ и
РМО6
Оз8Н4в-, CeWI0O36H26-
38u-, TeMo6O246-
октаэдр антипризма
11.6. Ионы, гетерополисоединений 225
Координация гетероатома тетраэдр
Хотя гетероатомы в ионах MnNbi2 и CeWio* имеют различные
типы координации, структуры этих двух ионов имеют много об-
щего (рис. 11.10 и 11.12). И наконец, существуют такие ионы,
в которых гетероатомы вообще не расположены внутри карка-
са из октаэдров; это ионы Р2Мо5, У2Мо6 и VsMxu, которые рас-
смотрены несколько позже. (Другими кислородсодержащими
ионами, в которые наряду с кислородом входят атомы еще двух
сортов, являются ионы (РСг2ОюK~ и (PCr4Oi6K~ (разд.
19.6.10); в этих ионах как атомы фосфора, так и атомы хрома
имеют тетраэдрическую координацию.)
Рассмотрим более детально строение различных гетеропо-
лианионов, сгруппированных ниже в соответствии с типом ко-
ординации гетероатома. При этом такие ионы, как V2W4Oig4~ и
VW5Oi93~ (разд. 11.5.1), в которых атомы двух сортов занима-
ют аналогичные (октаэдрические) позиции в структуре «супер-
октаэдра» W6Oi92~, не включены в рассмотрение. Из-за близо-
* Здесь и далее автор часто использует сокращенные формульные обозна-
чения гетерополианионов, в которых опущены атомы кислорода. — Прим.
перев.
стп строения ионов
PMOg, P2MOi8
все вместе после обсуждения иона
Координация
гетероатома
Трнгональная пи-
рамида
Тетраэдр
Октаэдр
Антипризма
Икосаэдр
Тетраэдр
Гр;:гональная бн-
пирамида
РМо9О34Н63-
PW О з—
ТеМо6О246-
Се\У10ОзбН26-
СеМо,2О428-
и H2AsWi806o они описаны
PW12O403-.
Примеры
H2,\s\VlsO60-
P2MolsO626-
Со2Мо10Оз5Н/-
Р2Мо5О236-
V2Mo6O266-
V5Mo8O4U7-
VsMo4O368-
11.6.1. Тетраэдрическая координация гетероатома.
Ион PWi2O403~. В соответствии с данными рентгеноструктур-
ного исследования кристаллов первоначально предполагали,
что изучаемое соединение является пентагидратом кислоты, од-
нако уточнение структуры показало, что ион имеет строение,
показанное на рис. 11.6,6. Эту структуру часто называют струк-
турой Кеггииа.
Ион PWi204o3" состоит из 12 октаэдров WO6, расположен-
ных вокруг центрального тетраэдра РО4 и связанных с ним по-
средством общих атомов кислорода. Двенадцать октаэдров WO6
можно разделить на четыре группы, по три октаэдра в каждой
(рис. 11.5,6), и внутри такой группы каждый октаэдр сочленен
с двумя другими общими ребрами. Объединение этих триад ок-
таэдров через общие вершины приводит к образованию закон-
ченной структуры иона (рис. 11.6,6). На рис. 11.6, а показано
расположение одной группы из трех октаэдров WO6 по отноше-
нию к центральному тетраэдру РО4. Каждый октаэдр WO6 име-
ет два общих ребра, по одному ребру с каждым из двух бли-
жайших октаэдров, а каждый атом кислорода в тетраэдре РО4
принадлежит трем октаэдрам WO6. В отличие от паравольфра-
мат-иона, описанного ранее, который состоит из фрагментов
двух типов, ион PWi2O403- образован из четырех одинаковых
фрагментов — группировок по три сочлененных общими ребра-
ми октаэдра.
Недавнее детальное рентгеноструктурное и нейтронографи-
ческое исследование монокристаллов [1] показало, что «пента-
гидрат» кислоты НзР\\^2О40 в действительности является гек-
сагидратом, содержащим ионы Н5О2+. В результате была пред-
15—985
226 11. Кислород
а
в
Рис. 11.6. а — расположение одной триады октаэдров WO6 по отношению к
центральному тетраэдру РО4 в анионе PWi204o3~; б — PWi204o3~; в — «поло-
винный фрагмент»; г — P2Wi8O626~-
ложена более правильная формула соединения— (Н5О2+)з-
(PWiaCUoK". по аналогии с ней изоструктурные «пентагидраты»
соответствующих кислот также являются гексагидратами,
а именно:
(H502+K(HSiW1204oK-
(H5(VK(H2BW12O40K-
(H6O2+K(H3H2W12O40K-
11.6. Ионы гетерополисоединений 227
В приведенных выше соединениях содержится соответственно
один, два и три подвергающихся замещению атома водорода;
по-видимому, они связаны с немостиковыми атомами кислоро-
да сложного иона. Более того, оказалось, что соль цезия, кото-
рую ранее считали дигидратом на основе структуры «пентагид-
рата», на самом деле является безводной, а цезий замещает ион
(HsCb)- Вероятно, необходимо также уточнить формулы неко-
торых других гидратов.
К перечню ионов типа Кеггина недавно добавили анион в
соединении Na4(GeMo1204o) -8H2O [2]. Хотя ионы, содержащие
молибден, в общем имеют строение того же типа, что и ионы
вольфрама, координационные полиэдры молибдена искажены
сильнее. Например, в соединении Нз(РМо1204о) • ( ~30 Н2О)
[3] координационный полиэдр молибдена — скорее квадратная
пирамида, чем октаэдр, а атом молибдена находится на 0,41 А
выше центра основания пирамиды.
0 О
Значительно более сложный вариант кеггиновской структуры
осуществляется в соединении K6{Vv[VlvVvMo10vl]04o}- 13H2O
[4], окрашенном в черный цвет. Тетраэдр VVO4 в центре комп-
лексного иона имеет правильное строение, а атомы V1V, Vv и
MoVI статистически размещены в октаэдрическом каркасе.
В ионе PWi2O403^ атомы металла расположены по вершинам
кубооктаэдра, который, однако, имеет лишь тетраэдрическую,
а не полную кубическую симметрию, так как четыре его тре-
угольные грани соответствуют группам из трех октаэдров, соч-
лененных по общим ребрам, а остальные четыре треугольные
грани — группами из трех октаэдров, соединенных общими вер-
шинами. «Метавольфрамат-ион» (разд. 11.5.2), [CoW12O40]5 "
[5] и анион в cx-Ba2[SiWi204o] ¦ 16Н2О имеют такое же строение.
Если одну группировку из трех октаэдров в ионе PWi2O403^
повернуть на 60°, то получится структура, в которой фрагмен-
ты из трех октаэдров все также будут соединены только верши-
нами, но симметрия понизится от кубической до тригональной.
Анион в P-K4[SiW12O40]-9Н2О [6], по-видимому, имеет структу-
ру такого «изомера». Если, помимо этого, повернуть на 60° еще
и вторую группу из трех октаэдров, то два повернутых фрагмен-
15*
228 11. Кислород
та будут иметь уже общее ребро; поворот третьего и четвертого
фрагментов приводит к появлению новых общих ребер:
„ , Точечная
Связь между фрагментами симметрия
Примеры
п 1 Только вершинами
3 1 ребром
4 3 ребрами
5 6 ребрами
2т т
jiiiiii
23
i-O^oJ-, u-(Si\V1204oL-
p4SiW1204oL-
[А113О4(ОНJ4(Н2ОЫ7н
Последний из этих пяти изомеров М12Х4о, как и первый, имеет
кубическую симметрию и соответствует фрагменту структуры
шпинели. Такую структуру имеют комплексы, содержащиеся в
частично гидролизованных растворах солей алюминия, что было
установлено при изучении соединений Na[Ali3O4(OHJ4(H2O) 12]-
(SO4L-13H2O [7] и родственного ему [А113О4(ОНJ5(Н2О) п] ¦
(SO4K-16H2O [8] (рис. 11.7, а). Центральная тетраэдрическая
пустота и все центры октаэдров заняты атомами алюминия. На
рис. 11.7,6 представлена другая проекция иона [PWi204op~ с
Рис. 11.7. а — группа Mi2X40 с плотнейшей кубической упаковкой, содержащая-
ся в ионе [Ali3O4(OHJ4(H2O)i2]7+ и родственных ему ионах; б — PWi204o3~.
вертикальной ориентацией оси второго порядка, тогда как на
рис. 11.6,6 вертикально расположена ось третьего порядка.
Ионы PMo9O34H&z~ и /VWoi80626~ [9]. При обсуждении строе-
ния этих ионов можно для простоты исходить из структуры иона
PWi2O403~. При удалении трех октаэдров из основания иона
PWi204o3~ получается «половинный фрагмент», показанный на
рис. 11.6,6. Именно такую структуру имеет анион в соединении
(РМо9Оз4Н6)Ыа3- (<~7Н2О). Если два «половинных фрагмента»
11.6. Ионы гетерополисоединенип 229
соединить выступающими атомами кислорода (три из них пока-
заны па рис. 11.6, в черными кружочками), то получим ион
Р2.Мо1йОб2°~, изображенный на рис. 11.6, г. Верхняя половина
иона связана с нижней половиной плоскостью симметрии АБВ,
показанной па рис. 11.6,6. Строение этого иона установлено на
примере соединения (P2Mo]8O62)Na4H2- (~20Н2О), а его
вольфрамового аналога — на примере соединения
(P2WlsO62)(NH4N-(-9H2O).
Ион H2AsWiHO607 . Если из фрагмента \У]2нарис. 11.6,6 уда-
лить не три нижних октаэдра, а верхнюю триаду октаэдров и
соединить два таких фрагмента с помощью выступающих шести
атомов кислорода, то образуется другой комплекс W18. Эти две
принципиальные возможности можно схематически изобразить
следующим образом:
W,0,
W18O,,2 fa)
W18O6O F)
Вариант а реализуется в ноне P2W!s062G", описанном выше,
а вариант б— в ионе H2AsWi806o7^ [Ю]- Можно предположить,
что существуют изомеры как ионов а, так и б, у которых две
половины связаны друг с другом либо зеркальной плоскостью,
либо центром симметрии. В ионе а экваториальное кольцо из
шести атомов кислорода не является правильным шестиуголь-
ником, так как октаэдры, к которым принадлежат эти атомы
кислорода, соединены поочередно общими ребрами и общими
вершинами. Таким образом, во фрагменте Wi8O62 имеется гори
зонтальная плоскость симметрии. Каждая половина содержит
тетраэдрическую пустоту, подходящую для гетероатома, так
что ион имеет состав P2WiS062. Ион H2AsWi806o7~, принадле-
жащий к типу б, центросимметричен. Во фрагменте W^Oec нет
двух тетраэдрических пустот, необходимых для обычных гете-
роатомов, но в нем есть позиция с координацией тригональной
пирамиды, пригодная для одного атома, такого как As(III),
с неподеленной электронной парой. Два таких атома нельзя
разместить, так как их неподеленные электронные пары были
бы направлены навстречу друг другу вдоль центральной осп
иона. Таким образом, одна половина фрагмента содержит атом
мышьяка, а другая половина—-два протона.
11.6.2. Октаэдрическая координация гетероатома.
Ион ТеМо6О2^~ (рис. 11.8) содержится в таких солях, как
(NH4N(TeMo6O24)-7Н2О, а детально он был изучен на примере
соединения (NH4N(TeMo6O24)-Те(ОНN.7Н2О [11]. Кристаллы
этого соединения содержат также молекулы Те(ОНN (почти
правильный октаэдр, Те—ОН 1,91 А). Расположение атомов в
230 П. Кислород
О Те, «М», QO
Рис. 11.8. Ион ТеМо6О246- в соединении (ЫН4)б(ТеМо6О24)-7 Н2О. Показан
способ сочленения октаэдров МоО6.
ионе ТеМо6О246~ (а) такое же, как во фрагменте слоя Cdl2, но с
некоторым отклонением от идеализированной структуры, пред-
ставленной на рис. 11.8 (из-за различий в расстояниях Мо—О и
Те—О). Такое же строение имеют ионы (СгшМо6О24Н6K~ [12]
и AМо6О24M- [13] (Сг—О 1,975 A, I—O 1,89 А), в которых
центральные атомы — хром или иод. В ионе [CO4I3O24H12]3" (б)
семь октаэдров заняты четырьмя атомами кобальта и тремя ато-
мами иода [14].
Ион МпМо9Оо,26~- Структура этого иона была расшифрова-
на на примере соединения (NH4N(MnMogO32) -8Н2О [15]; де-
вять октаэдров МоО6 сгруппированы вокруг Мп4+ (рис. 11.9).
Ион МпМЬпОъап~ [16]. Этот ион построен из таких же триад
октаэдров, сочлененных общими ребрами, из которых построен
ион P\\"i204o3~ н которые присутствуют как фрагменты и в ионе
МпМо9Оз26~. Обозначим фрагменты буквами А и Б (рис. 11.9).
Если фрагмент Б поместить сверху на фрагмент А, то получит-
ся октаэдрическая группировка из шести октаэдров, которая
представляет собой структуру иона Nb6O198~ (рис. 11.3, а). Две
такие группировки, соединенные вместе атомом марганца, обра-
зуют анион в Nai2MnlvNbi2038-H20 (рис. 11.10).
Ион \Н4Со2Мои)О^]6- [17]. Модель этого иона, изученного
на примере соединения (NH4N(H4Co2Mo10O38) -7Н2О, можго
легко получить, если взять цепочку из четырех сочлененных по
ребрам октаэдров и добавить к ней еще восемь октаэдров, че-
11.6. Ионы гетерополисоединений 231
Рис. 11.9. Структура аниона МпО9О326~. Слева — в «расчлененном» виде.
тыре спереди и четыре сзади (рис. 11.11). По-другому этот ион
можно построить из двух плоских фрагментов СоМо6, анало-
гичных иону ТеМо6О246~, из которых удален один атом молиб-
дена, причем один фрагмент повернут по отношению к друго-
му таким образом, что атом кобальта в одном фрагменте зани-
мает позицию атома молибдена в другом фрагменте. Атомы во-
дорода не были локализованы.
Рис. п.ю. [MnNb12o38l12-.
Рис. 11.11. [Н4Со2Мо10О3816-. Черные
октаэдры содержат атомы кобальта.
232 //. Кислород
11.6.3. Координация гетероатома в виде квадратной антипризмы.
Ион Се\Х'10О3бН26~. Если удалить один октаэдр из «суперок-
таэдра», изображенного на рис. 11.3, а (такую структуру имеет
ион WeOig""), то остается фрагмент «\?5» с четырьмя атомами
кислорода па одном конце. Два таких фрагмента, повернутые
друг относительно друга на 45° и связанные посредством ато-
ма Ce(IV), образуют анион в соединении Na6[CeWio036H2] •
•30Н2О [18], в котором атом церия име-
ет окружение в виде квадратной анти-
призмы (рис. 11.12).
Ион ¦[f/(GeW11O39J]12". Только что
было показано, что удаление одного ато-
ма вольфрама и связанного с ним атома
кислорода из \V6Oi9 создает фрагмент
W5O18, а два таких соединенных вместе
фрагмента образуют анион
[M(W5O18HJ]»-
где М = Се или U. Если такую же опера-
цию применить к нону Кеггина, то обра-
зуется ион [М(Р\\тц0зэJ] • Атом М в
этом ионе тоже имеет координационное
число 8 (антипризма) и является 4/- или
5/-элементом, а центральным атомом в
каждой половине фрагмента может быть
фосфор, мышьяк, кремний, германий, бор
и т. д. Структура этого иона была уста-
новлена на примере соединения
Cs12[U(GeWnO39J]-13-M4H2O [19]*.
11.6. Ионы гетерополисоединений 233
Рис. 11.12.
tCeW10O,i6H2N-.
11.6.4. Координация гетероатома в виде икосаэдра.
Ион Н&СеМо12Ою2^ [20]. На рис. 11.13, а изображена пара
сочлененных общими гранями октаэдров. Шесть таких пар мо-
гут быть соединены вместе совмещением вершин типа А и Б
разных пар. Тогда грани, заштрихованные на рис. 11.13, а, ста-
новятся двенадцатью гранями икосаэдра, а гетероатом занима-
ет пустоту в виде почти правильного икосаэдра в центре груп-
пы. Расстояние Се—О B,50 А) такое же, как в гексанитрато-
иератеAУ) аммония, и, действительно, 12 атомов кислорода
шести бидентатных нитратных групп в ионе Ce(NO3N2~ распо-
ложены так же, как внутренние 12 атомов кислорода на рис.
11.13,6. Расстояния Мо—О имеют значительный разброс: 1,68,
* Гетерополианионы fM(W5OlsHJ]"-> [МСМЧУпОмЫ"- и
(рис. 11.10) можно выделить в отдельный класс «комплексов с изополи- и гете-
рополп-.трандами». Существуют и другие комплексы, относящиеся к этом •
классу [Кристаллохимия: Ежегодник. Сер. ИНТ. — М.: ВИНИТИ, т. 19, 1985,
с. 3—147]. — Прим. ред.
а
Рис. 11.13. [H6CeMoi2O42l2-.
1,98 и 2,28 А в связях с атомами кислорода, принадлежащими
одному, двум или трем октаэдрам МоОЁ.
11.6.5. Другие гетерополиионы, содержащие молибден и вана-
дий (или фосфор). Рассмотрим ряд гетерополиионов, которые
построены из различного числа координационных полиэдров
двух сортов и которые большей частью имеют менее правиль-
ные структуры, чем те, которые уже описывались. Все они со-
держат молибден, и хотя его координационный полиэдр — окта-
а 6
Рис. 11.14. Структуры гетерополиионов. а — Р2Мо5О2з6~; б — У5Мо804о7~.
эдр МоО6, следует помнить, что атом молибдена находится вне
центра октаэдра и имеет характерную для него координацию
B+2+2), т. е. разные по длине пары связей Мо—О: ~1,7, 1,9
и 2,3 А.
В Р2Мо5О23с>- [21] (рис. 11.14, а) пять октаэдров МоО6 об-
разуют кольцо, в котором четыре связи между октаэдрами осу-
ществляются общими ребрами, а пятая — общей вершиной.
234 11. КислороО
11.6. Ионы гетерополисоединенип 235
С обеих сторон кольца расположены тетраэдры РО4, которые
соединены с пятичленным кольцом через три атома кислорода.
Ион V2Mo6O266~ [22] построен в виде кольца из шести октаэд-
ров МоО6, с каждой стороны которого прикреплены тетраэдры
VO4; ему изоструктурен Мо8О264^ [23] (рис. ИА,д). Строение
V8Mo4O368~ [24] нелегко представить без модели структуры: ее
основу составляет кольцо из шести октаэдров — двух МоО6 и
четырех VO6, к которому с каждой стороны прикреплена пира-
мидальная группа VO4. Еще два октаэдра МоО6 и две триго-
нальные бипирамиды VO5 дополняют очень компактную груп-
пировку из двенадцати соединенных общими ребрами полиэд-
ров. Описание координационного полиэдра ванадия не вполне
четкое, и детально ознакомиться с этой структурой читатель
может в оригинальной работе.
Гораздо более симметричную структуру имеет анион в со-
единении K7[V5Mo804o] ¦ (~8 Н2О) [25] (рис. 11.14.6J. Четыре
пары октаэдров МоО6 образуют гофрированное кольцо из вось-
ми октаэдров, а каждая из четырех тригональных бипирамид
VO5 сочленена двумя ребрами с октаэдрами. Пятый атом вана-
дия находится в центральной полости, представляющей собой
почти правильный тетраэдр VO4 (V—О 1,71 А). Группы VO5
характеризуются двумя короткими расстояниями V—О A,6 А),
двумя более длинными A,85 А) и одним очень длинным B,7н-
2,8 А), так что эти группы можно описать также в виде искажен-
ных тетраэдров. Как и во всех многоядерных ионах, атомы ме-
талла внутри своих координационных многогранников смещены
в направлении от центра иона.
Структура иона [(CH3JAsMo4Oi5H]2- (изученная на приме-
ре соли гуанидиния [26]), которая содержит кольцо, построен-
ное только из четырех октаэдров МоО6, наводит на мысль о том,
что возможно существование других гетерополиионов с таким
мышьяк или ванадий, имеет все более сложное строение, и так
может продолжаться до бесконечности; в этой связи кажется
уместным завершить данный раздел упоминанием о соедине-
нии (NH4J3[NH4As4W40O140Co2(H2OJ]-«H2O [27], содержа-
щим весьма замечательный ион. Не будем пытаться детально
описать этот ион; однако некоторое представление о его струк-
туре можно получить из следующих замечаний. Если удалить
o'ihv группу, состоящую из трех октаэдров, из кеггиновского
изомера" W12O40, то остается фрагмент W9O33, как было отмече-
но при описании иона H2AsWi806o7~. В центре такого фрагмен-
та может быть размещен атом мышьяка, неподеленная элект-
ронная пара которого будет направлена к открытому концу.
Если четыре таких фрагмента AsW9O33, связанных друг с дру-
гом осью S4 четвертого порядка, соединить дополнительными
октаэдрами WO6, то образуется цеолитоподобная структура со-
става As4W4oOho, в тетраэдрических пустотах которой разме-
щены два атома кобальта*.
Литература. [1] Acta cryst., 1977, ВЗЗ, 1038. [21 Acta cryst, 1977, ВЗЗ, 3090.
[3] Acta cryst., 1976, B32, 1545 [4] Acta cryst., 1980, B36, 1018. [51 Acta cryst.,
I960 13 1139. [6] Chem. Comm., 1973, 648. [71 Acta Chem. Scand., 1960, 14,
771 [81 Akt Kern., 1963, 20, 324. [9] Acta cryst., 1976, B32, 729. [10] Inorg. Chem.,
1979 18 3010 [11] Acta cryst., 1974, B30, 2095. [121 Inorg. Chem., 1970, 9, 2228.
[13] Acta cryst., 1980, B36, 661. [14] Acta cryst., 1980, B36, 2530. [151 Z. Kris-
tallgr, 1975, 141, 342. [161 Inorg. Chem., 1969, 8, 325. [17] J. Am. Chem. Sot,
19G9 91, 6881. [18] J. Chem. Soc, D 1974, 2021. [19] Acta cryst., 1980, B36,
20P 1201 J. Am. Chem. Soc, 1968, 90, 3589. [21] Acta cryst., 1977, B33, 3083;
1979, B35, 278. [221 Acta cryst., 1979, B35, 1995. [23] Angew. Chem., 1976, 88,
385. [24] Acta cryst., 1979, B35, 1989. [251 Acta cryst., 1980, B36, 1530. [26| Inorg.
Chem., 1980, 19, 2531. [27] Inorg. Chem., 1980, 19, 1746.
О
Mo 'As' Mo
O'
"Mo''
4)
ч. I s
Mo
же общим типом структуры, какой изображен на рис. 11.14, а.
В структуре иона [(CH3JAsMo4Oi5H]2- (а) октаэдры МоО6 со-
членены друг с другом поочередно ребрами и гранями, а два
атома кислорода соединены мостиковой группой (CH3JAs.
Создается впечатление, что каждый последующий гетеро-
полиион, содержащий молибден (или вольфрам) и фосфор,
* С более детальным обзором стереохимии гетерополианпопов, в который
вошли описания новых структур таких анионов, можно познакомиться в лите-
ратуре [Кристаллохимия: Ежегодник. Сер. ИНТ. — М.: ВИНИТИ, т. 19, 1985,
с. 3—147]. —Ярил«. ред.
22. ПРОСТЫЕ ОКСИДЫ МЕТАЛЛОВ
12.1. Введение
Б данной главе в основном рассмотрены кристаллические
структуры оксидов металлов, так как почти все они находятся
л твердом состоянии при обычных температурах. При этом так-
же упомянуты некоторые низшие оксиды, но исключены из рас-
смотрения пероксиды, надпероксиды и озонаты, так как такие
соединения со связью О—О обсуждались в гл. 11. Структуры
оксидов металлов, в обычных условиях находящихся в жидком
и газообразном состояниях, мало изучены; сведения о несколь-
ких оксидах металлов в газовой фазе включены в табл. 12.1.
Структуры оксидов полуметаллов и элементов Б-подгрупп опи-
саны в других главах.
Структуры оксидов металлов чрезвычайно разнообразны.
Так, в структурах «низших» оксидов цезия и таких переходных
металлов, как титан и хром, присутствует связь металл — ме-
талл; соединения элементов первой и второй А-подгрупп и пе-
реходных металлов в низших степенях окисления имеют ион-
ные структуры, а оксиды Cr(VI), Mn(VII) и Ru (VIII) относят-
ся к соединениям ковалентной природы. Наряду с основными
Таблица 12.
Оксид
1.ьО
I.iO
Li,O-
CsoO
SrO
BaO
МоОз
OsO4
RuO«
Расстояние
M—0, A
1,59
1,55
1,62
1,90
1,92
1,94
См. раз-
дел 12.7.3
1,71
1,705
. Оксиды металлов в газообразном
и. Д
8,91
7,93
Угол
М—О—М,
град
180
64
^=180
Метод
Масс-епсктроско-
пия, ИК
То же
» »
Масс-спектроско-
пия
То же
Микроволновая
спектроскопия
Электронографи-
ческое исследо-
вание
То же
состоянии
Литература
J Chom Phvs.
1963, 39, 2463'
J Chem Phvs.
1963, 39, 2299'
J Chcm. Phvs.
1963, 39, 2463'
J. Chcm. Phvs.
1967, 46, 605
J. Chem. Phvs.
1965, 43, 943
J. Chem. Phvs.
1963, 38, 2705'
Acta Chem. Scand.
1966. 20, 385
Acta Chem. Scand.
1967, 21, 737
12.1. Введение 237
оксидами большинства электроположительных металлов из-
вестны кислотные оксиды СгО3 и Мп2О7 — ангидриды Н2Сг04
][ НМпСЧ. Различны и физические свойства оксидов: ионные
соединения имеют высокие температуры плавления, например
для НЮ2 /Пл 2800 °С, такие молекулярные оксиды, как RuO4 и
OsO4, при обычных условиях летучи (tnjl 25 и 40юС, tKan 100 и
101СС, оба соединения растворимы в тетрахлориде углерода и
воде), а оксид Мп2О7 плавится при 6°С. Разнообразием отлича-
ются также окраска оксидов металлов и их электрические свой-
ства; они могут быть диэлектриками (Na2O, CaO), полупровод-
никами (VO2), проводниками с металлическим типом проводи-
мости (CrO2, RuO2). В ряду простых оксидов есть и ферромаг-
нетики (ЕиО и СгО2).
При рассмотрении кристаллических структур оксидов ме-
таллов выделяют четыре основных типа: молекулярные, цепо-
чечные, слоистые и каркасные структуры (первые три типа
структур насчитывают гораздо меньше представителей, чем по-
следний). Интересно отметить, что тип структуры оксида ме-
талла (молекулярный, цепочечный или слоистый) связан с по-
ложением металла, образующего данный оксид, в периодиче-
ской системе.
Ti2O !
TijO V2(
i
D:O '¦
Cs.,()c
m -молекулярная
структура
\ i_CrO.,c Mn2O7m
с- цепс-
empy
Tc2O7m
Re2(O
гечная
нтура
RuO.,'"
OsO4m
| 1
.
НцОс
SnO
PbO
i
слоистая
структура
Sb4
Sb
J
06m
:O3C
Сделаем несколько полезных обобщений (однако следует
помнить, что, как и всякие обобщения, они имеют множество
исключений, некоторые из которых будут отмечены позже).
1) Большинство оксидов металлов имеют существенно ион-
ные структуры с высоким координационным числом атомов ме-
талла (как правило, 6 или 8), причем их структуры во многих
случаях сходны со структурами фторидов, имеющих такой же
брутто-состав. Однако наличие простой структуры, характерной
для ионных соединений, вовсе не исключает того, что связи в
некоторой степени имеют ковалентный или металлический ха-
рактер, например структуру NaCl имеют не только UO, но и
UC, UN.
2) Ионный радиус металлов с координационным числом 6
(за исключением Rb+, Cs+ и Т1+) меньше, чем ионный радиус
О2"". Например, ионные радиусы алюминия, магния и всех
238 12. Простые оксиды металлов
Зс(-металлов лежат в пределах 0,5^-0,8 А. По этой причине ио-
ны кислорода во многих оксидах, как простых, так и сложных,
образуют плотнейшую или близкую к ней упаковку, а меньшие
по размерам ионы металлов обычно занимают октаэдрические
пустоты.
3) Сопоставление данных, приведенных в табл. 12.2 и 17.2,
показывает, что, за исключением ионных соединений наиболее
электроположительных металлов, а также соединений бериллия
и цинка, между структурами оксида и сульфида одного и того
же металла очень мало сходства. В некоторых случаях оксиды
и сульфиды, имеющие один и тот же тип брутто-формулы, не-
известны или резко отличаются по своей устойчивости. Напри-
мер, диоксид свинца РЬО2 устойчив при атмосферном давлении,
а дисульфид свинца PbS2 может быть получен только при по-
вышенном давлении; дисульфид железа FeS2 имеет структуры
пирита и марказита, в обеих модификациях содержатся груп-
пы Бг, а диоксид FeO2 неизвестен. Сравнив известные высшие
оксиды металлов VIII группы периодической системы, легко
увидеть, насколько велика индивидуальность элементов и на-
сколько сложно делать какие-либо обобщения:
Fe2O3
RuO4
OsO4
Со3О4
Rh2O3
IrO2
NiO
PdO
PtO,
4) В отличие от существовавших ранее представлений об
оксидах металлов детальное исследование дифракционными
методами, измерение плотности и изучение других свойств этих
соединений показали, что многие системы металл — кислород
являются сложными. Помимо оксидов с простыми формулами,
такими, как М2О, МО, М2О3, МО2 и т. д., содержащими элемент
в одной степени окисления, и оксидов М3О4, содержащих М(П)
и М(Ш) или M(IV), существует множество более сложных
оксидов, имеющих определенный состав и содержащих металл
в двух степенях окисления, например:
U4O9 MnA VCO13 Tb7O12
U3Og
Сг5О1
VCO13
Рг„Оп
Некоторые металлы образуют гомологические ряды оксидов,
такие, как TinO2n-i или МопОзп-ь со структурами, родствен-
ными структурам простых оксидов МО2 и МО3. Многие оксиды
переходных металлов имеют отклонения от стехиометрии и
вследствие этого являются полупроводниками, другие оксиды
обладают интересными магнитными и электрическими свойст-
вами, которые интенсивно изучались в последние годы. Обсу-
дим некоторые из этих свойств оксидов при более детальном
рассмотрении выборочных систем металл — кислород; при этом
будем отмечать особенности некоторых оксидов.
12.2. Структуры
12.2. Структуры простых (бинарных) оксидов
Наиболее важные типы структур представлены в табл. 12.2;
invnie упомянуты позднее. Большинство простых структур уже
описаны в предыдущих главах. В табл. 12.2 структуры распо-
ложены в соответствии с типом комплекса в кристалле (трех-,
дву-, одномерный или конечный), и для каждой структуры при-
Таблица 12.2. Кристаллические структуры оксидов металлов3
Характер
структуры
Тип формулы
и координацион-
ные числа М
и О
Название струк-
турного тина
Примеры
Бесконечный
трехмерный
каркас
Слоистые
структуры
Цепочечные
структуры
Молекулярные
структуры
МО,
МО,
М2О3
МО
МО.,
м2о
6:2
ReO3
8:4 Флюорит
6:3
6:4
См. текст
6:4
6:6
4:4
4:2
2:4
4:8
Рутил
Корунд
Л-М2О3
В-М2О3
С-М,О3
Хлорид натрия
Вюртцит
Структуры
кварца
Куприт
Антифлюорит
WO3
ZrO2, НГО2, СеО2,
ThO2, UO2, NpO2,
PuO2, AmO2, CmO2>
PoO2> PrO2, TbO2
TiO2, VO2, NbO2, TaO2,
CrO2, MoO2, WO2)
MnO2, TcO2) ReO2,
RuO2, OsO2, RhO2,
IrO2, PtO2, GeO2>
SnO2> PbO2, TeO2
A12O3, Ti2O3, V2O3,
Cr2O3, Fe2O3, Rh2O3,
Ga2O3
Оксиды 4/-элементов
Мп2О3, Sc2O3, Y2O3,
In2O3, T12O3
MgO, CaO, SrO, BaO,
TiO, VO, MnO, FcO,
CoO, NiO, CdO,
EuO
BeO, ZnO
GeO2
Cu2O, Ag2O
Li2O, Na2O, K2O, Rb2O
MoO3, As2O3,
SnO, Re2O7
HgO, SeO2,
Sb2O3
RuO4, OsO4,
Sb4O6
PbO,
CrO3,
Tc2O7,
: указаны различия между наиболее симметричными формами структуры и
ными вариантами, сверхструктурами или дефектными структурами, за дета-
"Не
искаженными вар
лями следует обращаться к тексту
240 12. Простые оксиды металлов
ведены координационные числа атомов металла и кислорода.
В отдельных семействах оксидов изменения в характере струк-
туры могут быть соотнесены с изменением типа связи от су-
щественно ионных трехмерных структур к слоистым и цепочеч-
ным структурам и далее к ковалентным молекулярным оксидам.
Эти изменения можно проследить на примере структур диокси-
дов элементов четвертой группы периодической системы. Для
каждого соединения приведены координационные числа метал-
ла и кислорода, а также структурный тип. Наблюдается пере-
ход от молекулярного диоксида углерода к структурам оксидов
кремния с ионно-ковалентной связью и к ионным структурам
СО2 B:1) молекулярная структура
SiOt D : 2) различные трехмерные (каркасные) структуры
ТЮ, F:3) рутил и т.д. GeO2 { [J ; |J
ZrO2 )
НЮ2 (8:4) флюорит SnO2 F : 3) рутил
ThO2 j
PhD
Ib°2
I F:3) 1 РУТИЛ
\ F:3) / колумбит
остальных диоксидов. Структуры этих соединений могут быть
сопоставлены со структурами соответствующих дисульфидов,
которые аналогичным способом описаны в гл. 17.
Остановимся прежде всего на некоторых низших оксидах,
которые свойственны исключительно рубидию и цезию, а затем
рассмотрим кристаллические структуры оксидов металлов по
группам в следующем порядке: М3О, М2О, МО, МО2, МО3,
МО4; М2О3, М2О5, М2О7) М3О4 и смешанные оксиды МХОУ.
В заключение сделан краткий обзор оксидов некоторых метал-
лов, представляющих особый интерес.
12.2.1. Низшие оксиды рубидия и цезия. Элементы рубидий и
цезий примечательны тем, что образуют ряд низших оксидов,
таких, как Rb6O и Rb9O2 [I], Cs7O [2|, Cs4O [3], CsilO3
[4], Rb7Csn03 [5] и метастабильный Rbi9O3. Структура Cs3O
описана в разд. 12.1.1. Два устойчивых оксида рубидия содер-
жат группировки Rb9O2, состоящие из двух октаэдров ORb6,
сочлененных по общей грани («антигруппировка» М2Х9). В со-
единении Rb6O слои этих группировок чередуются со слоями
атомов металла, имеющих плотнейшую упаковку, так что струк-
турная формула оксида— (RbgO2)Rb3. Оксид Rb9O2 — медно-
красный, с металлическим блеском — построен из фрагментов
Rb9O2, соединенных друг с другом посредством связи Rb—Rb
длиной 5,11 А; это расстояние существенно больше, чем длина
связи в металле D,85 А), и гораздо больше кратчайшего рас-
стояния Rb—Rb внутри группировки C,52 А).
12.2. Структуры 241
Рис.
12.1. Фрагмент
O3Cs,,.
В отличие от соединений рубидия все три низших оксида це-
зия — фиолетово-голубой CsnO3, фиолетовый Cs4O и бронзо-
вый Cs7O —содержат фрагменты O3Csn (рис. 12.1), построен-
ные из трех октаэдров OCs6, каждый из которых сочленен с
двумя другими по общим граням с образованием тригонального
фрагмента, подобного субъячейке Nb3S4 (разд. 17.1.10). Оксиды
Cs4O и CS7O построены из таких же фрагментов с дополнитель-
ными атомами цезия; их структурные формулы—(CsuO3)Cs и
(CsnOs)Csio. Судя по длине связи, внутри фрагментов O3Csn
связи имеют ионный характер (Cs—О
2,7^-3,0 А), а между фрагментами — ме-
таллический. Расстояния Cs—Cs внутри
фрагмента — это длины ребер октаэдров
OCs6, и они, таким образом, определя-
ются длинами связей Cs—О; расстояния
Cs—Cs вне фрагментов близки к рас-
стояниям Cs—Cs в металлическом це-
зии; в оксиде Cs7O расстояния Cs—Cs
внутри и вне фрагментов равны 3,76 и
5,27 А. Особый интерес вызывает оксид
Rb7Csii03, получаемый либо из CsuO3
и Rb, либо из сплава Rb—Cs. В его
структуре группировки CsuO3 разделе-
ны слоями из атомов рубидия, и строение этого соединения по-
хоже на строение Csio(Csn03) [5]. Несоответствие между брут-
то-формулами и структурами наблюдается не только в низших
оксидах рубидия и цезия, но и в оксиде RbyCsnOs, у которого
атомы химически сходных металлов распределены по позициям
с различным координационным окружением. Типичный для ме-
таллов внешний вид и проводимость оксидов цезия позволяют
описать их структуры в виде матриц из атомов цезия, в кото-
рых атомы (ионы) кислорода занимают (в различном порядке
и соотношении) октаэдрические пустоты.
Литература. [1Ц Z. anorg. allg. Chem., 1977, 431, 5. [2] Z. anorg. allg. Chem.,
1976, 422, 20.8. [3] Z. anorg. allg. Chem., 1976, 423, 203. [4] Z. anorg. allg. Chem.,
1977, 428, 187. [51 Inorg. Chem., 1978, 17, 875.
12.2.2. Оксиды М3О. Две известные структуры оксидов М3О яв-
ляются «антиструктурами» галогепидов МХ3. Темно-зеленые с
металлическим блеском кристаллы Cs3O [J. Phys. Chem., 1956,
60, 345] построены из колонок состава Cs3O, которые состоят из
октаэдров OCs6, сочлененных по противоположным граням (рис.
'2.2); это «антиструктура» Zrl3. Длина связи Cs—О B,89 А)
близка к длине связи в Cs2O. Длины связей Cs—Cs между це-
почками (~5,8 А) больше, чем в металле E,26 А); а в иска-
женных октаэдрах цепочек имеется шесть расстояний Cs—Cs,
16—985
'242 12. Простые оксиды металлов
12.2. Структуры 243
равных 3,80 А, и шесть — 4,34 А. Первые шесть расстояний
Cs—Cs (не указанные в работе [J. Phys Chem., 1956, 60, 345])
близки аналогичным расстояниям в октаэдрах структуры Cs7O.
Структура оксида Ti3O [Acta cryst., 1968, В24, 211] имеет
сходство со слоистой «антиструктурой» ВПз, описанной в гл. 4.
Об оксидах Сг3О, Мо3О и \V3O см. в разд. 12.7.3.
Cs. c-0
Cs, c4
Рис. 12.2. Проекция кристаллической структуры Cs3O.
12.2.3. Оксиды. М2О. Оксиды М2О и сульфиды M2S щелочных
металлов, за исключением соединений цезия, имеют структуру
антифлюорита с координацией 4:8. В этих структурах ионы
щелочных металлов занимают позиции фтор-иона, а анионы —
позиции катиона кальция в структуре CaF2. Строение соедине-
ний цезия уже обсуждалось в гл. 7. Уникальная структура суль-
фида цезия описана в разд. 17.1.2. Кристаллическая структура
оранжево-желтого Cs2O резко отличается от структур оксидов
других щелочных металлов и наиболее близка к структуре
Cs3O. Оксид Cs2O имеет слоистую антиструктуру CdCb
[J. Phys. Chem., 1956, 60, 338], расстояния Cs—Cs между
слоями равны 4,19 А, а расстояния Cs—О внутри слоев 2,86А
и близки аналогичным расстояниям в Cs3O. Большие ионы це-
зия сильно поляризованы.
Другими оксидами с близкими структурами являются "ПгО
(разд. 12.7.1, антиструктура Cdl2) и Т12О (разд. 26.5, антиполи-
тип
Кристаллическая структура Си2О (и изоструктурного Ag2O)
описана в разд. 3.10.3 вместе с другими структурами, родствен-
ными структуре алмаза.
Приводимые доказательства существования оксида 1п2О в
твердом состоянии не убедительны [Acta Chem. Scand., 1966,
20, 1966], а соединение, описываемое обычно как Sm2O, на са-
мом деле является соединением SmH2 [Inorg. Chem., 1968, 7,
060].
Таблица 12.3. Кристаллические структуры моноксидов
А<а)
®
(Са)
©
(ва)
(т?)
(zr)
(tu)
(Th)
©
Nb
©
л структура
о структура
(г) © ©)
© ©
вюртцита
NaCl
@
©
©
Pd i
©
структура PtS
и ее искажения
:аг";
i
А<'
©
Sn
pbW
^ Тип структуры высокотемпературной модификации.
° Модификация высокого давления имеет структуру Nad [5].
в Имеются полиморфные модификации.
г Существование оксида СгО надежно не доказано.
Об оксидах лантаноидов высокого давления см. в тексте.
12.2.4. Оксиды МО. Структуры моноксидов металлов представ-
лены в табл. 12.3. Отнесение структуры соединения к указан-
ному в таблице типу не обязательно предполагает соблюдение
идеальной структуры данного типа максимальной симметрии.
Интересным моментом в структуре вюртцита является то, что
если не соблюдается условие 4а2=A2и—3)с2, где и — коорди-
ната г атома кислорода по отношению к атому цинка в пози-
нпи @00), то существует небольшое, но заметное различие
между одним расстоянием М—О и другими тремя; например,
в моноксиде цинка имеются три расстояния, равные 1,973 А,
п одно—1,992 А [1]. Для_идеальнон структуры с правильным
тетраэдром и = ?'/& и с[а = 2у27уЗ^= 1,633.
По-видимому, оксид ЕиО является единственным монокси-
Дом лантаноида, который может быть получен без примесей
при атмосферном давлении, в то время как при повышенном
Давлении A0—80 кбар) и температурах от 500 до 1200 °С по-
-244
12. Простые оксиды металлов
лучены следующие оксиды со структурой NaCl : LaO, CeO, PrO,
NdO [2], SmO [3] и YbO [4]. Оксиды EuO и YbO —полупро-
водники; оба — ионные оксиды двухвалентных металлов.
Остальные оксиды (золотисто-желтого цвета) обладают метал-
лическими свойствами и содержат металлы в степени окисле-
ния +3, т. е. им соответствуют формулы типа М3+О2~(е), за
исключением SmO, в котором, судя по свойствам, степень окис-
ления металла равна +2,9.
В то время как оксиды магния, щелочноземельных метал-
лов и кадмия имеют неискаженную структуру NaCl, в структу-
рах оксидов некоторых переходных металлов наблюдаются сле-
дующие отклонения от идеальной структуры:
а) структура имеет исходную (кубическую) симметрию
только при высоких температурах, при понижении температуры
происходит фазовый переход с понижением симметрии, а имен-
но: FeO, NiO, MnO переходят в ромбоэдрическую модифика-
цию, а СоО — в тетрагональную [Phys. Rev., 1951, 82, 113];
б) оксид имеет дефектную структуру, т. е. нет 100%-ной за-
селенности как катионных, так и анионных позиций. При ат-
мосферном давлении оксид FeO нестехиометричен (разд. 12.3).
Стехиометрический оксид NiO бледно-зеленого цвета (как ион
Ni2+ в водном растворе) —диэлектрик. При нагревании в кисло-
роде или включении небольших количеств Li2O он приобрета-
ет серо-черный цвет и становится полупроводником (благода-
ря одновременному присутствию в кристалле ионов Ni2+ и
№3+ [6]).
У оксидов TiO, NbO и VO наблюдаются заметные колебания
состава, при составе МО они имеют либо сверхструктуру, ли-
бо дефектную структуру. Оксиды титана и ванадия обсуждают-
ся позднее в этой главе. На структуре NbO остановимся лишь
коротко.
Наличие больших элементарных ячеек у таких антиферро-
магнетиков, как МпО, связано с антипараллельным расположе-
нием магнитных моментов ионов металла, что подтверждается
данными нейтронографии. Их не надо путать с большими эле-
ментарными ячейками многих сверхструктурных соединений,
в которых происходит упорядочение статистически расположен-
ных атомов двух или более сортов.
Из табл. 12.3 следует, что большинство моноксидов имеют
структуру NaCl. Другие структуры свойственны лишь отдель-
ным оксидам или небольшим группам оксидов; к таковым от-
носятся следующие соединения.
ВеО. В структуре высокотемпературной модификации [3-ВеО
[7] пары тетраэдров ВеО4 сочленены общими ребрами и затем
такие пары соединены друг с другом вершинами (рис. 12.3).
Расположение атомов кислорода по существу такое же, как в
12.2. Структуры 245
рутиле (рис. 6.6), и так как это расположение близко к гекса-
гональной плотнейшей упаковке, то структура |3-ВеО тесно свя-
зана со структурой низкотемпературного ВеО, имеющего тип
вюртцита. Одна структура преобразуется в другую путем сдви-
га половины атомов бериллия в соседние тетраэдрические пус-
тоты. Поскольку в структуре |3-ВеО тетраэдры ВеО4 соединены
общим ребром, в ней имеются короткие расстояния Be—Be
B,24 А), такие же как в металлическом бериллии, но это не
означает, что в оксиде бериллия существует связь металл — ме-
талл. Такую же структуру имеет у-ЛЮ
о За
ОО
Рис. 12.3. Структура р-ВеО.
NbO. Этот оксид уникален, он имеет структуру, изображен-
ную па рис. 6.1,г [8], в которой как атомы ниобия, так и кис-
лорода образуют четыре компланарные связи, поочередно за-
нимая позиции в одной из простейших трехмерных сеток, обра-
зованных из связанных вершинами квадратов. Альтернативно
структура может быть описана как дефектная структура NaCl
с тремя молекулами NbO в элементарной ячейке и вакансиями
в позициях @00) и ('/г 7г '/'г)- Отметим, что в структуре мож-
но выделить и трехмерный каркас, построенный из октаэдри-
ческих структурных единиц Nb6 (Nb—Nb 2,98 А), напоминаю-
щих галогенидные комплексы ниобия и тантала (разд. 9.10.3).
Правильность этой модели структуры подтверждена нейтроно-
графнческим исследованием.
PdO. В этой структуре, как и в PtS, атомы металла образу-
ют четыре компланарные связи, а кислород имеет тетраэдриче-
скую координацию (рис. 12.4). Как было отмечено в гл. 1,
вследствие чисто геометрических факторов валентные углы
имеют значения, промежуточные между идеальными 90 и
10972°. Структура СиО представляет собой разновидность
246 12. Простые оксиды металлов
структуры PtS с более низкой симметрией. Интересно то, что,
в то время как СиО имеет менее симметричную, чем PtS, мо-
ноклинную структуру, a PtO, по-видимому, не существует вовсе,
при повышенном давлении могут быть получены твердые рас-
творы CUxPti-sO @,865>x>0,645), которые имеют структуру
тетрагонального PtS [9]. Структуры СиО и AgO описаны "бо-
лее детально в гл. 25.
Рис. 12.4. Кристаллические структуры тенорита СиО и AgO (a), a также PdO
и PtS (б).
Структуры других моноксидов металлов Б-подгрупп обсуж-
даются в гл. 25 и 26, структура РЬО — в разд. 12.6.1.
Литература. [1] Acta cryst., 1969, В25, 1233, 2254. [21 J. Solid State Chem., 1981,
36, 261. [3] Inorg. Chem., 1980, 19, 2252. [4] J. Solid State Chem, 1979 27 29
[51 Science, 1962, 137, 993. [61 J. Phys. Chem., 1961, 65, 2154. [7] Acta cryst
1965, 18, 393. [81 Acta cryst., 1966, 21, 843. [9] J. Less-Comm. Metals 1969 19
209. ' '
12.2.5. Оксиды МО2. Большинство диоксидов кристаллизуются в
одном из двух простых структурных типов: наиболее крупные
ионы М4+ имеют координационное число 8 в структуре флюори-
та, а менее крупные — координационное число 6 в структуре
рутила. Термин «структурный тип рутила» в табл. 12.4 "подра-
зумевает как наиболее симметричную (тетрагональную) разно-
видность этой структуры, так и менее симметричные' варианты,
причем последние выделены в таблице штриховыми линиями.
Для этих соединений характерен полиморфизм, например РЬО2
и ReO2 кристаллизуются также в структурном типе а-РЬО2
(разд. 4.3), a GeO2 — в структурном типе а-кварца, в то время
как ТЮ2 и ZrO2 при атмосферном давлении имеют по три по-
12.2. Структуры 247
лиморфные модификации. Под давлением TiO2 переходит в
структуру а-РЬО2, а под действием ударной волны с давлени-
ем "больше чем 150 кбар он превращается в еще более конден-
сированную форму, которая хотя и не похожа на структуру
и-РЬО2, но переходит в нее после снятия давления [1]. Оксид
PtO2 получен при высоком давлении в двух формах: а (гекса-
гональная, структура неизвестна) и р со структурой СаС12 [2].
Это единственный известный диоксид, который имеет структу-
Таблица 12.4. Кристаллические структуры диоксидов
Tia
1 Nba
t7'\
Ce
Th
Cr
Mo
W
Pr
Pa
Mna
Tc
Rea
U
Ru
Os
Np
структура
типа рутила
Rt/
[г У\6
Tb
Pu Am Cm
Gea
Sn
Pb*
Po
Структура
типа флюоригла
аПмеются полиморфные модификации.
^Оксиды, полученные при атмосферном давлении, аморфные, однако
при высоком давлении имеют кристаллическую структуру. См. обзор [Inorg.
Chem., 1969, 8, 841].
ру, более близкую к идеальной гексагональной плотнейшей упа-
ковке, чем тетрагональная структура рутила (гл. 4 и 6).
Хотя координационный полиэдр иона металла в структуре
тетрагонального рутила близок к правильному октаэдру, при
точном определении расстояний М—О в них обнаруживаются
небольшие различия. Например, в структуре TiO2 [3] четыре
расстояния Ti—О равны 1,944 D) А и два расстояния —
1,988 F) А; в структуре RuO2 [4] есть четыре расстояния
Ru—О, равные 1,917(8) А, и два—1,999(8) А. В структуре
р-РЮ2 типа рутила (главный компонент свинцово-кислотных
аккумуляторов) аксиальные связи B,150 А) короче, чем эква-
ториальные связи B,169 А) [5]. Искажение координационно-
го октаэдра характерно не только для структуры рутила; на-
пример, различные расстояния обнаружены в анатазе [6]
(Ti—О 1,934 и 1,980 А), а в структуре брукита [7] окружение
катионов еще менее симметрично (Ti—О 1,87-^2,04 А).
В неискаженной структуре рутила каждый атом металла в
цепочке октаэдров расположен на одинаковом расстоянии от
двух соседних атомов. Оксиды, включенные в табл. 12.4 и вы-
деленные штриховой линией, имеют тетрагональную структуру
рутила в качестве высокотемпературных модификаций (за ис-
248 12. Простые оксиды металлов
ключением ReO2, высокотемпературная форма которого имеет
ромбическую симметрию); ниже температуры перехода оксиды
VO2, NbOo и ReO2 имеют менее симметричные структуры, в ко-
торых чередуются короткие и длинные расстояния между ато-
мами металла. Эта менее симметричная (моноклинная) струк-
тура характерна и для оксидов МоО2, WO2 и ТсО2, не имеющих
ТЮ2
vo2
NbO2
Mo 0
\VO2
ТсО2
ReO,
RuO2
OsO2
Таблица 12.5.
Оксид
(тетрагон.)
(моноклин.)
(тетрагон.)
(сверхструкту-
ра)
(моноклин.)
Расстояния
Число
(/-электро-
нов в ме-
талле
0
1
1
2
2
3
3
метал.
2
2
2
2
2
2
i —
- мета;
Расстояния
.W—
,62
,71
,51
,48
,5
,5
по
2
2
C
3,
3,
\1 в
1Ке,
96
?5
,0)
107
184
це-
Л
3,
3,
3,
3,
3,
3,
л в
17
30
10
10
1 1
1 I
юкоторых диоксидах
Лhiсратура
J. Phys. Soc
23
Ada
•? d
Ada
1380
Chem.
dOC\
"tZU
cryst.,
2836
Acta
21,
Acta
Chem.
661
cryst..
2199
Ada
9
Ada
24,
Acta
24,
Chem
1378
Chem.
116
Chem.
123
. Japan,
Scand.,
1979,
Scand.,
1979,
Scan;!.,
Scand.,
Scand.,
1
1
1
1
№7
'O j
li.i;
967
B35
'.155
¦O0
970
полиморфных модификаций, и для низкотемпературных моди-
фикаций оксидов VO2 и ReO2; низкотемпературная форма
NbO2 типа рутила имеет сложную (тетрагональную) сверхст-
руктуру также с чередованием расстояний М—М в цепочках.
В табл. 12.5 высокотемпературные модификации диморфных ди-
оксидов упоминаются первыми. Близкое расположение пар ато-
мов металла в искаженной структуре рутила может служить
причиной металлической проводимости и аномально низкого
парамагнетизма, однако связь между структурой, числом
d-электронов и физическими свойствами является сложной.
Например, оксид R11O2 обладает высокой электропроводностью,
а также низкой парамагнитной восприимчивостью, в то время
как низкотемпературная модификация VO2 — полупроводник.
Если очень короткую связь М—М (~2,5 А), найденную в струк-
турах некоторых диоксидов, считать кратной, необходимо при-
знать существование в этом семействе по крайней мере четы-
рех типов структур, а именно: неискаженная структура (с на-
12.2. Структуры 249
личием взаимодействий М—М или без них) и искаженная
структура (с одинарными или кратными связями М—М). 5;тот
вопрос обсужден в гл. 6.
Полиморфизм оксида ZrO2 интересен с нескольких точек
зрения. Обычная (моноклинная) модификация — минерал бад-
делеит — при температуре — 1100 °С переходит в тетрагональ-
ную форму, а при температуре ~2300°С — в кубическую
(структура флюорита). Переход при 1100°С имеет практиче-
ское значение, так как ограничивает применимость чистого
оксида в качестве тугоплавкого мате-
риала; циклическое изменение темпе-
ратуры в этой области приводит к
растрескиванию и разрушению мате-
риала. Твердые растворы со структу-
рой флюорита, содержащие оксиды
СаО или MgO, не подвергаются та-
ким изменениям [8]. Тетрагональная
модификация не может быть получе-
на при комнатной температуре мето-
дом закаливания, однако тетрагональ-
ный ZrO2 может существовать при
комнатной температуре, если его по-
лучать осаждением из водного рас-
твора или прокаливанием солей при
низкой температуре. По-видимому, в
его стабилизации играет роль более высокая поверхностная
энергия меньших по размеру частиц (<300 А) [9]. Эта тетра-
гональная модификация [10] имеет искаженную структуру
флюорита. Вместо восьми одинаковых расстояний Zr—О, рав-
ных 2,20 А в кубической высокотемпературной модификации
ZrO2, в тетрагональной модификации наблюдаются два набора
расстояний — 2,065 и 2,455 А, что соответствует сжатым и вы-
тянутым тетраэдрам; такое искаженно-кубическое размещение
ионов О'~ похоже на размещение их в структуре ZrSiO4. В
структуре моноклинного ZrO2 [11] цирконий имеет КЧ 7, и
существует два сорта ионов кислорода: с КЧ 3 и 4. Ионы пер-
вого сорта Oi (КЧ 3) практически находятся в одной плоско-
сти с тремя соседними ионами циркония (Zr—О 2,07 А), углы
между связями равны 104, 109 и 143°, в то время как ионы вто-
рого сорта Оп (КЧ 4) имеют окружение в виде тетраэдра со
средним расстоянием 2,21 А. Все углы между связями, за ис-
ключением одного A34°), лежат в интервале 100—108°. Коор-
динационное окружение иона циркония с КЧ 7 показано в идеа-
лизированном виде на рис. 12.5; следующий ближайший ион
кислорода находится на расстоянии 3,58 А; следовательно, он
не входит в координационную сферу циркония.
Рис. 12.5. Координацион-
ный полиэдр Zr'+ в мо-
ноклинном ZrO2 (в идеа-
лизированном виде).
250 12. Простые оксиды металлов
В этой связи представляет интерес оксид-нитрид тантала
TaON [12]. Его низкотемпературная модификация имеет слож-
ную гексагональную структуру, а высокотемпературная моди-
фикация— структуру бадделеита с упорядоченным расположе-
нием атомов кислорода (КЧЗ) по позициям I на рис. 12.5 и ато-
мов азота (К.Ч 4) по позициям II.
Связь структуры С-М2О3 со структурой флюорита обсужда-
ется в разд. 10.1. Структуры некоторых оксидов 4/- и 5/-элемен-
тов связаны со структурами соответствующих диоксидов (типа
флюорита) более сложным образом. Например, РгО2 при на-
гревании теряет кислород, образуя Рг6Оц с флюоритоподобной
структурой, из которой статистически удалена !/i2 часть анио-
нов [131. Помимо ТЬО2 тербий образует оксиды других соста-
вов: TbOi.7i5, TbOi.sog, TbOi,823 [14]; первый из них, Tb7Oi2, упо-
минается в разд. 13.6.6 при обсуждении изоструктурных слож-
ных оксидов M'M6"Oi2. PuO2 теряет кислород с образованием
низших стехиометрических оксидов '[15] в отличие от UO2,
который при повышенных температурах присоединяет кисло-
род. Оксиды урана обсуждаются более детально в разд. 28.2.4.
Литература. \\] J. Chem. Phys., 1969, 50, 319. [2] J. Inorg. Nucl. Chein., 1969,
31, 3803. [3] Acta cryst., 1956, 9, 515. [4] Inorg. Chem., 1966, 5, 317. [51 Acta
cryst., 1980, B36, 2394. [6? Z. Kristallogr., 1972, 136, 273. [7] Acta cryst., 1961,
14, 214. [8] PRS, 1964, 279A, 395. [9] J. Phys. Chem., 1965, 69, 1238."[lO] Acta
cryst., 1962, 15, 1187. [11] Acta cryst., 1965, 18, 983. f 121 Acfa cryst., 1974, B30,
809. [13] J. Am. Chem. Soc, 1950, 72, 1386. [14] J. Am. Chem. Soc, 1961, 83, 2219.
[15] J. Inorg. Nucl. Chem., 1965, 27, 541.
12.2.6. Оксиды МО?,. Известны следующие оксиды: МСЬ, СгО3,
М0О3, WO3, ReO3, TeO3 и UO3. Цепочечная струтура CrCb опи-
сана в разд. 27.4. Одна из модификаций оксида ТеО3 изострук-
турна соединению FeF3 (разд. 16.7.9). Строение оксида ReO3
описано в разд. 5.3.3, а соединений МоО3 и WO3—позднее в
данной главе. О триоксиде урана см. в разд. 28.2.4.
12.2.7. Оксиды МО$. Известны только два тетраоксида метал-
ла: легкоплавкие летучие RuO4 и OsO4. Оба оксида в твердом
и газообразном состояниях существуют в виде правильных
тетраэдрических молекул.
Расстояние
М—О, А
Литература
RuO, 1,705 (пар) Acta Chem. Scand., 1967, 21, 737
OsO4 1,71 (пар) Acta Chem. Scand., 1966, 20, 385
1,74 (кристалл) Acta cryst., 1965, 19, 157
12.2. Структуры 251
Таблица 12.6. Кристаллические структуры оксидов М2О3
Sc
(In)
(fl)
О С-структура (g) С-структура при атмосферном давлении; структура
корунда при высоком давлении.
iO структура пору яда..
ба При низких температурах переходит в полупроводниковую модификацию.
Б Имеются другие полиморфные модификации.
Существование оксидов СО2О3 и М1гОз не доказано.
Кристаллические структуры оксидов 4}- и 5/-элементов
La Се Pr Nd Sm Eu Gd Tb Рц Но — Lu U Np Pu Лт Cm Bk ~C?~
\A А А В/А А
щи высоком
JSSSSOL'L—i
Структура корунда. [Acta cryst.. 1969, 8, 1985]; Rh2O3 [Acta cryst.. 19,0. B26.
1876]; 1п2Оз [Acta Chem. Scand., 1967, 21, 1046]; Fe2O3 [Am. Mineral., 1966, 51, 123];
o-Ga.O. [J. Chem. Phys., 1967, 46. 1862].
Структура A-M2O3. [Ada cryst., 1953. 6, 711]; Pr2O [Inorg. Chem., 1963, 2. 79:1;
Kd2O3 [Acta cryst., 1975, B3I, 27-151; Bk2O3, С12О3 [J. Jnorg. Nucl. Chem., 1973, .'i.i,
4149].
Структура B-M2Ox. Gd2O,, [Acta cryst., 1958, 11, 746]; Sm2O3 [J. Phys. Chem,
1957, 61, 753]; ТЬ2Оз [Z. anorg. allg. Chem., 1968, ;N3, 115].
Структура C-.VfjO-. In2Oi [Acta cryst., 1966, 20, 723]; Mn2O:< [Acta Chem. Scan:!.
1967, 21, 2871]; Y2O3 [Ada cryst., 1969, B25, 2140]; Sc.,O3 [Z. Kristallogr., 1967, 124,
136].
Оксиды M2OZ ^-элементов. [Inorg. Chem., 1965, 4, 426; Inorg. Chem., 1966. 5,
751; Inorg. Chem., 1969, 8, 165].
Другие структуры: |3-Ga2O3 [J. Chem. Phys., I960, 33, 6761; Rh2O3 (высокитемп.)
[Inorg. Сист., 1963, 2, 972], (вые. давл.) [J. Solid State Chem., 1970, 2, 131]; AusO,
[Acia cryst., 1979, B35, 1435].
12.2.8. Оксиды М2О3. Для оксидов металлов М2О3, вошедших в
табл. 12.2, за исключением оксидов 4/- и 5/-элементов, характер-
ны два типа структур: структура корунда (а-А12О3) и С-МоОз.
Многие оксиды М2О3, включая большинство (возможно, все)
оксидов Af- и 5/-элементов, имеют полиморфные модификации.
В табл. 12.6 приведена литература последних лет, включая ра-
боты по уточнению ранее изученных структур.
252 12. Простые оксиды металлов
В структуре корунда атомы кислорода образуют почти неис-
каженную гексагональную плотнейшую упаковку, ионы алюми-
ния занимают 2/3 октаэдрических пустот. В определенном
смысле эта структура представляется неожиданно сложной, ибо
в ней координационные группы А1О6 сочленены и по вершинам,
и по ребрам, и по граням. Однако анализ моделей этой и дру-
гих, плотненших упаковок позволяет думать, что такое описа-
ние структуры оказалось предпочтительнее других геометриче-
ски возможных моделей потому, что в нем окружение иона О-~
четырьмя ионами А13+ наиболее близко к правильно-тетраэдри-
ческому. В корунде валентные углы А1—О—А1 равны: 85°
(один), 94° (два), 120° (один), 132° (два). Эти углы можно
сравнить с «идеальными» величинами, рассчитанными при со-
членении полиэдров посредством общих вершин, ребер и гра-
ней (разд. 5.1.1). Ранее (разд. 5.1.1) отмечалось, что трехмер-
ная структура соединений М2Х3 с неискаженной октаэдрической
координацией атомств М и одновременно неискаженной тетра-
эдрической координацией атомов X неосуществима по чисто
геометрическим причинам. В структуре корунда из-за наличия
общих граней у пар октаэдров А1О6 наблюдается два набора
расстояний М—X; при уточнении структуры a-Fe2O3 установ-
лено, что три расстояния Fe—О равны 1,945 А и три 2,116 А.
(О структурах C- и Y'Fe2O3 см. разд. 12.3.) Оксид Ti2O3 имеет
структуру корунда при всех температурах, но тем не менее в
интервале 400—600 К тип проводимости у него меняется от по-
лупроводникового к металлическому. Этот переход сопровож-
дается небольшим увеличением расстояний Ti—Ti в направле-
нии, перпендикулярном обобщенным граням октаэдров (от
2,579 А при 23"°С до 2,725 А при 595°С); упомянутые тонкие
структурные изменения согласуются с моделью Гудеиау [Phys.
Rev., 1960, 117, 1442].
Расшифрованы структуры трех модификаций Rh2O3; при
обычных температурах этот оксид имеет структуру корунда, его
высокотемпературная модификация кристаллизуется в ромбиче-
ской сингонии, а фаза высокого давления получена при 1200 °С
и 65 кбар. В структуре последней модификации, как и в струк-
туре корунда, сохраняются пары октаэдров, сочлененных общи-
ми гранями, но сочленение по общим ребрам происходит ина-
че; структуру можно рассматривать как построенную из слоев
структуры корунда.
Структура С-М2О3 —это структура CaF2, из которой удале-
на одна четверть анионов (показанная штриховыми кружками
на рис. 12.6) с последующим небольшим перераспределением
атомов. При удалении двух из восьми атомов кислорода, рас-
положенных в вершинах куба, образуются два типа атомов
металла с координационным числом 6. У четвертой части ато-
12.2. Стрцктиры 253
мов металла удалены два атома кислорода на концах телесной
диагонали, а у остальных — на концах диагонали грани. Оба ко-
ординационных многогранника можно описать как искаженные
октаэдры. Атомы кислорода имеют координационное число 4;
возможно, что и в данной структуре именно стремление к наи-
более правильной тетраэдрической координации О2~ ответст-
венно за искажения координационных полиэдров атомов ме-
талла. В отличие от структуры корунда в структуре С-М2О3
Рис. 12.6. Структура С-М2О3 оксида марганца а-Мп2О3 п других оксидов М_ОЧ,
демонстрирующая их связь со структурой флюорита (слева), и два типа коор-
динационных полиэдров ионов металла (справа).
искаженные октаэдры имеют общие ребра. В структуре флюори-
та каждая кубическая группировка МХ8 сочленена по обшпм
ребрам с каждой из 12 ближайших группировок МХ8. Удаление
двух атомов X на концах либо телесной диагонали, либо диаго-
нали грани оставляет свободными шесть ребер исходного куба,
так что в структуре С-М2О3 каждый октаэдр соединен с други-
ми октаэдрами шестью ребрами.
Не все соединения со структурой типа С-М2О3 имеют наи-
более симметричную (кубическую) модификацию структуры,
характерную для минерала биксбиита (Fe, MnJO3. В кубиче-
ском 1п2Оз ионы металла первого сорта имеют одинаковые рас-
стояния с шестью ближайшими ионами О2~ B,18 А), у ионов
металла второго сорта есть два иона О2~ на расстояниях 2,13 и
2,19 А, остальные — на расстоянии 2,23 А (среднее значение
2,18 А), и наблюдается некоторое искажение тетраэдрического
окружения ионов кислорода (четыре угла равны 100° и два уг-
ла 126°). Гораздо менее симметрично окружение иона М1: в.
254 12. Простые оксиды металлов
12.2. Структуры 255
синтетическом Мп2О3, который кристаллизуется не в кубиче-
ской сингонии. В его структуре каждый ион металла окружен
четырьмя ближайшими ионами кислорода (на расстоянии
~1,96 А) и двумя более удаленными (с расстояниями 2,06 и
2,25 А для двух типов ионов Мп3+); ср. с аналогичным окруже-
нием иона Mn3+(d4) в соединении ZnMn2O4: четыре расстояния
Мп—О равны 1,93 А и два — 2,28 А.
Структуры Л-М2О3 и В-М2О3 характерны в основном для ок-
сидов 4/- и 5/-элементов. Если у оксида имеются полиморфные
превращения, то при повышении температуры изменение струк-
Оо
О La
Рис. 12.7. Структура Л-М2Оз оксида лантана La2O3 и оксидов других редко-
земельных элементов. Слева показана проекция координационного семпвер-
шпнника иона М3+, построенного из октаэдрической группировки ионов О2~
с дополнительным ионом О2" (он обозначен жирным кружком) над одной из
граней октаэдра.
туры происходит в следующем порядке: С—>В—>А. Структур-
ные типы некоторых оксидов 4/- и 5/-элементов приведены в
табл. 12.6. Интересным моментом в структуре Л-М2Оз является
необычное координационное число атомов металла, равное 7
(рис. 12.7), подтвержденное как данными рентгеноструктурного
анализа, так и нейтронографии и электронографии [J. Solid
State Chem., 1980, 34, 39]. В оксиде La2O3 три ближайших к
лантану иона кислорода находятся на расстоянии 2,38 А, один —
на расстоянии 2,45 А и три — на расстоянии 2,72 А.
В довольно сложной структуре В-М2О3 существует три типа
кристаллографически неэквивалентных ионов металла, часть с
КЧ 6 (октаэдр), а остальные с КЧ 7 (одношапочная тригональ-
ная призма). У последних седьмой ион кислорода значительно
более удален от иона металла по сравнению с остальными ше-
стью, находящимися в вершинах призмы (например, в Sm2O3
шесть кислородов характеризуются средним расстоянием 2,39А,
а седьмой 2,73 А). На основании различия в плотности соеди-
нений предполагается следующий порядок изменения типов
структуры при повышении давления:
С -»- корунд ->- В
Координационное число атома металла 6 б б И 7
И действительно, 1п2О3 и Т12О3 (С-структура) при повышении
давления переходят в фазы со структурой корунда, тогда как
изоструктурные оксиды марганца, скандия и иттрия, содержа-
щие сравнимые по размеру ионы, не образуют модификации со
структурой корунда, а переходят сразу в фазы с В-структурой.
Ga2O3 при комнатной температуре и при повышенном давлении
имеет структуру корунда, а при высокой температуре — другой
тип структуры. В этой высокотемпературной модификации
p-Ga2O3 половина ионов металла занимает тетраэдрические,
а вторая половина — октаэдрические пустоты в искаженной ку-
бической плотнейшей упаковке ионов кислорода. Такая же
структура найдена у 0-А12О3; другие полиморфные модификации
этого оксида описаны несколько позже в данной главе.
Структуры Sb2O3, Bi2O3, Pb2O3, Ag2O3 и Au2O3 описаны в
других главах.
12.2.9. Оксиды М2О5. Этот раздел посвящен пентаоксидам ме-
таллов VA группы. Оксиды мышьяка, сурьмы и висмута рас-
смотрены в гл. 20, Ра2О5 и иО2,6 —в разд. 28.2.3 и 28.2.4. Име-
ются сведения о соединении, которому приписывают формулу
Re2C>5, но данный оксид охарактеризован не полностью [1].
Структура оксида V2O5 рассмотрена в разд. 12.7.2; для ва-
надия характерно КЧ 5 с одной очень короткой связью V—О.
В противоположность V2O5 структурная химия оксидов Nb2C>5
и Та2С>5 весьма сложна. Для обозначения многочисленных по-
лиморфных модификаций Nb2O5 пришлось использовать многие
буквы латинского и греческого алфавитов [2]. Во всех этих
модификациях присутствуют октаэдры NbO6, сочлененные друг
с другом по общим вершинам и ребрам в различных комбина-
циях. Читателю полезно сначала обратиться к разд. 5.3.5, а за-
тем уже к обсуждению сложных оксидов титана, ванадия, нио-
бия и др. в разд. 13.7, где описано, как из слоев или блоков
структуры ReO3 образуются более сложные структуры. Причи-
на сложности кристаллохимии оксидов Nb2O5 кроется в том, что-
субъячейки могут быть соединены друг с другом бесчисленным
множеством способов. Не исключено, что эти «модификации»
следует рассматривать скорее как проявление политипии, чем
как полиморфизм, так как образование таких фаз зависит от
механизма роста, и в некоторых случаях они могут стабилизи-
256 /2. Простые оксиды металлов
роваться посторонними атомами. В этом отношении модифика-
ции ХЬ2О5 имеют больше общего с политипами таких соедине-
нии, как SiC пли ZnS, чем с обычными полиморфными модифи-
кациями. Поскольку часть октаэдров в них сочленена по общим
ребрам, отношение О : М, равное у ReO3 3: 1, уменьшается: для
i\bs05 O:M = 5:2. Тот же процесс приводит к возникновению
оксидов состава Nbi2O29, КЬ22О54 и Nb25O62, а также многочис-
ленных оксидов молибдена и вольфрама с составами, лежащи-
Рпс. 12.8. Кристаллические структуры P-Nb2O5 (а), #-Та2О5 (б) и a-U3O8 (в).
Цепочки сочлененных вершинами октаэдров или пентагональных бипирампд
перпендикулярны плоскости чертежа.
ми между МО2 и МО3. Приведем только несколько примеров.
Блоки структуры ReO3 могут объединяться друг с другом так,
как показано на рис. 5.38 или 5.39; в последнем случае вдоль
линии сочленения блоков ReO3 возникают тетраэдрические пус-
тоты. Примерами структур первого типа являются структуры
оксидов P-Nb2O5 [3], M-Nb2O5 [4] и jV-Nb2O5 [5]. Структура
H-Nb2Os [6] описана в разд. 13.7. На рис. 12.8, а приведена
проекция сравнительно простой структуры P-Nb2O5. Известна
также структура высокотемпературной модификации высокого
давления i-Nt^Os [7].
Та2С>5 имеет по крайней мере две модификации с различ-
ной структурой, температура перехода 1360°С. Та2О5, образую-
щийся при нагревании тантала на воздухе или в кислороде при
600 °С, кристаллизуется плохо, но после нагревания при темпе-
ратуре 1350 °С степень его кристалличности возрастает, и окон-
12.2. Структуры 257
чательная структура образца (как показывают сверхструктур-
ные линии) зависит от его тепловой обработки. После длитель-
ного отжига структура достигает равновесного состояния. (Это
справедливо и для ряда фаз, содержащих вольфрам, вплоть до
граничного состава 11 Та2О5-4 WO3.) Структуры низкотемпера-
турной модификации L-Ta2Os [8] и всех этих фаз в общем од-
нотипны; они содержат цепочки из октаэдров или пентагональ-
ных бипирамид, связанных двумя противоположными вершина-
ми; эти цепочки объединены друг с другом вершинами или реб-
рами с образованием трехмерного каркаса. При охлаждении
высокотемпературная модификация #-Ta2Os, по-видимому, пре-
терпевает различные фазовые превращения, но тетрагональная
фаза может быть стабилизирована добавлением 2—4 мол. %
Sc2O3. Структура #-Ta2Os (рис. 12.8,6) [9] в общем принадле-
жит к тому же типу, что и L-Ta2Os; она состоит из блоков, по-
строенных из октаэдров и пентагональных бипирамид. Эти бло-
ки расположены на двух различных «уровнях» (разд. 5.3.5), так
что атомы металла имеют К.Ч 6 и 7. Обе структуры Ta2Os мож-
но сопоставить со структурой a-U3O8 (рис. 12.8,6), в которой
все атомы металла расположены в цепочках, построенных из
пентагональных бипирамид, имеющих общие вершины, а так-
же со структурами WNb2O8 и NaNb6Oi5F (рис. 13.14), где име-
ются координационные полиэдры металла обоих типов: и иска-
женные октаэдры, и пентагональные бипирамиды. Третья
«форма» Та2О5, изоструктурная одной из модификаций Nb2Os,
вероятно, содержит калий в качестве стабилизатора структуры
[10].
Литература. [1] Materials Res. Bull., 1973, 8, 627. [2] Z. anorg. allg. Chem., 1978,
440, 137. [31 Naturwiss., 1965, 52, 617. [4] J. Solid State Chem., 1970, 1, 419.
fS] Z. anorg. allg. Chem., 1967, 351, 106. [6] Acta cryst., 1976, B32, 764. [7] Acta
cryst., 1975, B31, 673. [8] Acta cryst., 1971, B27, 1037. [9] J. Solid State Chem.,
1971, 3, 145. [10] J- Solid State Chem., 1970, 2, 24.
12.2.10. Оксиды М2О7. Эта небольшая группа оксидов включа-
ет Мп2О7) который при обычных температурах представляет со-
бой темное масло, Тс2О7 и Re2O7. Два последних оксида имеют
желтый ивет, летучи, растворимы в воде. Мп2О7, по-видимому,
в любом агрегатном состоянии находится в виде молекул,
а Тс2О7 имеет молекулярную структуру и в кристаллическом
о.
8;
1,84 А
180
1,67 А
О
состоянии. В центросимметричной молекуле [1] фрагмент
Тс—О—Тс линеен, мостиковые связи по длине близки к анало-
17—985
258 12. Простые оксиды металлов
гичным связям в ионах Re2OCli04~ и Ru2OCli04~, а концевые
связи имеют приблизительно ту же длину, что и связи Re—О в
ReO3Cl, Re2O7 A,70 А) и KReO4 A,72 А) [2].
Пары Re2O7 состоят из молекул такого же типа, а в кристал-
лическом состоянии данный оксид имеет интересную слоистую
структуру [3] (рис. 12.9, а), в которой половина атомов метал-
°
\l,80A2,10A|/'.75A
О Re О Re О
/ /12.21 А
о н.о I
в ' н'°
Рис. 12.9. а — один слой в кристаллической структуре РчегСу, маленькими
кружками обозначены атомы кислорода, связывающие октаэдрические и тет-
раэдрические группировки, т. е. атомы кислорода в кольце (б); б — детальное
изображение одного кольца, состоящего из двух тетраэдров и двух октаэдров;
е — молекула Re2O7 (H2O) 2.
ла имеет тетраэдрическую координацию, а остальные — октаэд-
рическую. (Ср. строение цепочечного иона в Na2Mo2O7, где осу-
ществляется третий способ реализации требуемого соотношения
О:М = 7:2, также с равным количеством координационных
группировок МО4 и МОб.) Если цепочки из связанных верши-
нами октаэдров, расположенные на двух различных уровнях,
соединить посредством тетраэдров, то в плоскости, перпендику-
лярной плоскости рис. 12.9, а, образуются кольца, состоящие из
двух тетраэдров и двух октаэдров. В каждом октаэдре ReO6 три
связи Re—О заметно длиннее, чем другие три расстояния
Re—О. Если разрушить две из этих связей, как показано на
примере одного из колец в кристаллическом Re2O7 (рис. 12.9,6),
то образуются молекулы Re2O7, что объясняет летучесть твердо-
го оксида. Структура Re2O7 имеет очень много общего со струк-
турой Re2O7(OH2J {4] —первичного продукта гидратации дан-
ного оксида (рис. 12.9, в).
12.3. Оксиды железа 259
Литература [1] Angew. Chem., 1969, 81, 328. [2] Acta cryst., 1975, B31, 1764.
[31 Inorg. Chem., 1969, 8, 436. [41 Angew. Chem., 1968, 80, 286.
12.2.11. Оксиды МгОА. Оксиды такого состава характерны лишь
для некоторых металлов, причем металл обязательно имеет две
степени окисления. Возможны три варианта: M2'MVIO4,
M2UMIVO4 и AVWCu; первый из них реализуется в таких со-
лях, как K2WO4, второй —в РЬ3О4 и третий в Fe3O4, Co304,
МП3О4, Е113О4. Структура РЬ3О4 описана далее в разд. 12.6.3,
а структура Еи3О4 — в разд.
13.5.4. Оксиды Зй-элементов со-
става М3О4 имеют структуру
шпинели, которая описана в гл.
13, так как многие двойные ок-
сиды состава XY2O4 принадлежат
к классу шпинелей. О структуре
Со3О4 более детально см. в разд.
27.7.1.
Модель структуры, которая
изображена на рис. 12.10, была
предложена много лет назад для
соединения с предельным соста-
вом NaPt3O4 [J. Chem. Phys.,
1952, 20, 199]. Хотя маловероят-
но, чтобы полное заполнение по-
зиций натрия вообще достига-
лось, несомненно существуют фазы NaxPt3O4, где 0<х<1; фазы
такого же типа образует и палладий. Вероятно, базисный кар-
кас, построенный из атомов платины и кислорода, может сущест-
вовать и без атомов натрия — в виде оксида состава Pt3O4) тем
не менее фаза NaxPd3O4 не может быть получена в отсутствие
натрияj[J. Less-Comm. Metals, 1968, 16, 129]. В каркасе Pt3O4
каждый атом кислорода связан с тремя атомами платины (Pt—
—О 1,97 А), и каждый атом платины образует четыре компла-
нарные связи с атомами кислорода. Два атома платины, от-
стоящие на 2,79 А, дополняют координационное окружение ме-
талла до удлиненного октаэдра (рис. 12.10). Атомы натрия за-
селяют пустоты; их координационное окружение образовано
восемью атомами кислорода, расположенными в вершинах куба
(Na—О 2,46 А).
12.3. Оксиды железа
Ранее уже упоминались структуры FeO и a-Fe2O3. Теперь бо-
лее подробно рассмотрим FeO, Fe3O4 и четыре модификации
ге2О3, структуры которых свидетельствуют о том, что структур-
ная химия оксидов железа является довольно сложной.
17*
OPi
Рис. 12.10. Модель структуры,
предложенная для NaxPti,Oi.
260 12. Простые оксиды металлов
FeO. Синтезом при атмосферном давлении получают фазу
(дефицитную по железу) «вюстит» Fei-xO со структурой NaCl.
В его структуре часть ионов Fe2+ замещена ионами Fe3+ так,
что два иона Fe3+ замещают три иона Fe2+ с сохранением
электронейтральности структуры в целом. Стехиометрический
FeO синтезируют из Fe0,95O и металлического железа при дав-
лении >36 кбар и температуре 770° [1]. При температуре
~ 1000 °С состав оксида находится в интервале Fe0,946O—
Feo,8750, а при более низких температурах приближается к гра-
ничному. При 570 °С оксид имеет состав Fe0,93O, а при еще бо-
лее низких температурах происходит диспропорционирование на
a-Fe+Fe3O4 [2], так что синтез следует проводить при темпе-
ратурах >570 °С с последующей закалкой. При температуре
~200 К наблюдается переход второго рода, который происхо-
дит в интервале температур и сопровождается возникновением
антиферромагнетизма и очень небольшими структурными пре-
образованиями с понижением симметрии до ромбоэдрической
[3]; параметр элементарной ячейки меняется с составом почти
линейно, например a = 4,3010 А для 48,56 ат. % железа и а =
= 4,2816 А для 47,68 ат. % железа. Предполагается [4], что в
структуре закаленных образцов состава Feo.gO вакансии рас-
полагаются периодически в виде кластеров, окружающих (по
тетраэдру) ту тетраэдрическую пустоту шаровой упаковки ио-
нов О2~, в которую внедряется один из ионов Fe3+; отношение
числа вакансий к числу катионов в таких пустотах равно
~ 3,2:1 [4].
Fe3O4. Этот оксид имеет структуру обращенной шпинели —
Fe3+(Fe2+Fe3+)O4; это значит, что 7з катионов занимает тетра-
эдрические пустоты в кубической плотнейшей упаковке анио-
нов О2", а равные количества катионов Fe2+ и Fe3+ располага-
ются в октаэдрических пустотах. Высокая электронная прово-
димость Fe3O4 (магнетита), например, по сравнению с оксидом
Мп3О4 (искаженная нормальная структура шпинели) обуслов-
ливается постоянным обменом электронов между ионами Fe2+
и Fe3+, расположенными в октаэдрических позициях. (При тем-
пературе 119 К магнетит становится антиферромагнетиком,
а его симметрия понижается до ромбоэдрической либо еще бо-
лее низкосимметричной [5].)
a-Fe2O3. Структура корунда (гексагональная плотнейшая
упаковка атомов кислорода).
C-Fe2O3. По-видимому, под p-Fe2O3 понимают две различ-
ные кристаллические фазы. Одна из них — тетрагональная —
образуется при дегидратации p-FeOOH, а другая со структу-
рой биксбиита (С-М2О3) может быть получена гидролизом
FeCl3-6H2O, а также в виде поверхностной пленки при разло-
жении трифтороацетилацетоната железа '[6].
12.4. Оксиды алюминия 261
y-Fe2O3. В структуре этого оксида 21'/з ионов Fe3+ стати-
стически распределены по 8 тетраэдрическим и 16 октаэдриче-
ским позициям в элементарной ячейке шпинели, содержащей
32 иона кислорода, расположенных по мотиву кубической плот-
нейшей упаковки.
Структуры FeO, Fe3O4 и y-Fe2O3 имеют много общего. В ку-
бической элементарной ячейке данных оксидов (а ж 8,5 А) со-
держатся 32 атома кислорода (кубическая плотнейшая упаков-
ка) и следующее число катионов:
FeO: 32 иона Fe2+ во всех октаэдрических пустотах
Fe3O4: 8 ионов Fe3+ в тетраэдрических позициях, 8 ионов Fe2++8 ио-
нов Fe3+ в октаэдрических позициях
Y-Fe2O3: 21-g- ионов Fe3+, статистически расположенных по 24 выше-
указанным позициям
Теперь становится понятным, почему Y-Fe2O3 и Fe3O4 легко
взаимопревращаемы. Осторожным окислением iFe3O4 можно по-
лучить v-Fe2O3, который переходит обратно в Fe3O4 при нагре-
вании в вакууме до температуры 250°С. Процесс окисления
FeO—>Fe3O4—>~Y-Fe2O3 можно интерпретировать следующим
образом. Анионная подрешетка в FeO достраивается за счет
добавления новых слоев атомов кислорода в плотнейшую упа-
ковку. В эти слои мигрируют катионы, что приводит к непре-
рывному уменьшению концентрации атомов железа в заданном
объеме и увеличению доли ионов Fe3+.
Литература. [1] J. Chem. Phys., 1967, 47, 4559. [2] Сотр. rend. (Paris), 1956
?nfk77fQ1[3lActa СГУ51- 1953> 6- 827- [41 Acta cryst., 1969, B25, 275; Acta crvst.,
1975 A31, 586; J. Solid State Chem., 1980. 33, 271. [5] Acta cryst., 1953 6
565; Acta cryst., 1955, 8, 257. [6] Acta cryst., 1976, B32, 667.
12.4. Оксиды алюминия
Гидроксиды М@НK) гидроксид-оксиды МО (ОН) и оксиды
М2О3 алюминия (а также некоторых других трехвалентных
элементов) существуют в виде а- и у-модификаций. Ниже при-
водятся названия минералов алюминия, так как они часто упо-
минаются в литературе.
А1(ОН),
АЮ(ОН)
А12О3
а байерит у гиббсит, гидраргиллит
а диаспор у бёмит
а корунд у —
При нагревании диаспор дегидратируется непосредственно до
а-А12и3> а бемит, обе модификации А1(ОНK и такие соедине-
ния, как алюмоаммонийные квасцы, превращаются в а-А12О3
только после длительного нагревания при высоких температу-
262 12. Простые оксиды металлов
рах. При более низких температурах образуется смесь фаз, в це-
лом обозначаемая как у-А12О3, в различных исследованиях для
названий этих фаз использовано много букв греческого алфа-
вита. Эти фазы различаются по степени упорядочения атомов
алюминия в кубической плотнейшей упаковке атомов кислоро-
да и могут быть описаны как дефектная структура шпинели,
поскольку в ней 16 октаэдрических и 8 тетраэдрических пози-
ций статистически заняты только 21'/з атомами металла.
у-А12О3 имеет практическое значение вследствие большой ад-
сорбционной способности («активированный оксид алюминия»)
и каталитической активности; он используется также в произ-
водстве синтетического сапфира в печи Вернейля. Степень упо-
рядочения и пористость структуры зависят от выбора исходно-
го материала. Например, в структуре байерита атомы кислоро-
да имеют гексагональную плотнейшую упаковку, и переход к
структуре шпинели с кубической плотнейшей упаковкой означа-
ет перестройку всей структуры. Структуру бёмита в целом нель-
зя описать по принципу плотнейших упаковок, однако строение
отдельного слоя можно рассматривать как кубическую плот-
нейшую упаковку атомов кислорода, прэтому для образования
•у-А1263 из структуры у-АЮ(ОН) необходима менее существен-
ная перестройка (по сравнению с предыдущим случаем). Ниже
приведены типичные схемы превращений, полученные в резуль-
тате рентгенографических или электронографических исследо-
ваний [J. Electrochem. Soc, 1950, 42, 1398; Acta cryst., 1964,
17, 1312]:
450 °C 750 °C 1000 °C 1200 °C
бёмит *- 7 *¦ 6 »- 9 + a »• a
230 °C 850 °C 1200 °C
байерит > т) *¦ 0 >¦ a
Первая фаза, -у-А12Оз, образующаяся при дегидратации бёмита
[J. Solid State Chem., 1980, 34, 315], имеет дефектную структу-
ру шпинели со статистическим размещением ионов металла.
Структура б-фазы представляет собой тетрагональную сверх-
структуру шпинели с утроенным параметром с, в которой вакан-
сии располагаются упорядоченно по октаэдрическим позициям.
6-Фаза изоструктурна p-Ga2O3 (разд. 12.2.8). В структурах всех
этих модификаций атомы кислорода имеют кубическую плот-
нейшую или близкую к ней упаковку; таким образом, структур-
ные изменения включают перемещение только катионов (ср. с
процессом окисления FeO).
Об оксиде р-А12О3 и родственных ему соединениях см.
разд. 13.5.3.
12.5. Оксиды марганца 263
12.5. Оксиды марганца
Известны следующие оксиды марганца: МпО, Мп3О4, Мп2О3,
Мп5О8, МпО2 и Мп2С>7. Последний является ангидридом марган-
цовой кислоты (которая представляет собой летучее твердое
вещество, устойчивое при температуре <1°С) [1] и существу-
ет в виде масла или темно-зеленых кристаллов. Оксид Мп2От
необратимо разлагается при температурах приблизительно
>0°С с выделением кислорода и образованием МпО2; он яв-
ляется сильным окислителем и больше похож на С1гО7, чем на
оксиды металлов.
В то же время первые три оксида марганца очень похожи
на оксиды железа. Устойчивость зеленого МпО к окислению за-
висит от температуры его синтеза, при низкотемпературном
прокаливании карбоната образуется очень реакционноспособ-
ный оксид. По-видимому, он окисляется до состава МпОцз без
образования новых фаз и, как и
FeO, имеет структуру NaCl.
Мп2Оз (черного цвета) существует
в двух модификациях. а-Мп2О3
имеет структуру С-М2О3, а структу-
ра ¦у-М-Пгбз связана со структурой
Мп3О4 таким же образом, как
структура Y-Fe2O3 со структурой
Fe3O4 (разд. 12.3). При нагрева-
нии всех оксидов и гидроксид-окси-
дов марганца до температуры
~Ю00°С образуется пурпурно-
красный Мп3О4, который при обыч-
ных температурах имеет искажен-
ную структуру шпинели, а при тем-
пературах >1170°С, по-видимому,
переходит в кубическую модифика-
цию i|_2J. И у-Мп2О3, и Мп3О4 име- перпендикулярны
ют один и тот же тип тетрагональ-
ного искажения (с : а= 1,16).
Оксиду Мп5О8 соответствует формула Mn2nMn3IV08; этот
оксид изоструктурен Cd2Mn308. Структуру Мп5О8 можно пред-
ставить в виде слоев типа Cdl2, из которых удалена '/4 атомов
металла (Mn3IVO8), а атомы Мп11 расположены выше и ниже
вакансий, что и приводит к составу М5Х8; здесь имеется анало-
гия с Zn5(OH)8Cl2-H2O (разд. 6.5.5) или Zn5@H)8(N03J-2H2O
(разд. 14.3.4). Атомы Мп11 связывают «слои» в трехмерный кар-
кас. Координационный полиэдр (рис. 12.11) ионов MnIV — иска-
женный октаэдр (среднее расстояние MnIV—О 1,87 А), а ионов
Мп11 — тригональная призма (среднее расстояние Мп11—О
плоскости
чертежа.
264 12. Простые оксиды металлов
2,22 А), которая очень искажена B,05; 2,17 (два); 2,28 и
2,31 А (два)) [3].
Диоксид марганца широко известен как минерал пиролюзит,
он имеет простую тетрагональную структуру рутила. В лабора-
торных условиях получены различные соединения, имеющие
приблизительно состав МпО2 и хорошо знакомые химикам-не-
органикам. Они считаются полиморфными модификациями ок-
сида МпО2, хотя их состав, как правило, значительно отличает-
ся от чистого МпО2; например, у-МпО2, согласно анализу, име-
ет состав MnOi,93, а а-МпО2 содержит 91,5% МпО2. В-Модифи-
кация (пиролюзит) может быть синтезирована без примесей,
однако не гидротермальными методами. Имеется обширная ли-
тература, посвященная оксидам марганца, в особенности хоро-
шо описан диоксид марганца, применяемый в качестве катали-
затора и компонента сухих батарей [4]. Рентгеноструктурными
методами удалось установить, почему структура МпО2 является
настолько сложной и почему при синтезе оксида из растворов,
содержащих различные сорта ионов, образуются различные ти-
пы структур. Были выявлены два основных типа структур: кар-
касные и слоистые.
Литература. [1] J. Am. Chem. Soc, 1969, 91, 6200. [21 J. Res. Nat., Bur. Stand.,
1950, 45, 35. [3] Helv. Chim. Acta, 1967, 50, 2023. [41 J. Am. Chem. Soc, 1950,
72, 856; Rev. Pure Appl. Chem., 1951, 1, 203; Z. anorg. allg. Chem., 1961, 309,
1, 20, 121.
12.5.1, Каркасные структуры. Эти структуры построены из од-
нон или нескольких цепочек октаэдров, связанных вдоль своей
большой оси вершинами. Обычно эти структуры графически
изображают так, чтобы цепочки лежали в плоскости проекции.
в ' д
Рис. 12.12. Структуры Р-МпО2 (а), рамсделлита (б), а-МпО2 и голландита (в),
псиломелана (г) и «v-MnO2» со структурой, промежуточной между а и б (д).
Таким способом на рис. 12.12, а представлена структура В-МпО2
(тип рутила). Минерал рамсделлит и у-МпО2 Глемзера имеют
структуру, изображенную на рис. 12.12,6, которая построена из
цепочек сдвоенных октаэдров [1]. Эта структура в своей основе
совпадает со структурой диаспора (рис. 14.12), но отличается
лишь тем, что в АЮ(ОН) [и МпО(ОН)] из-за наличия водо-
12.5. Оксиды марганца 265
родной связи существует короткое расстояние О—О, равное
2 65 А, а в рамсделлите оно значительно длиннее и равно 3,34 А.
Общее название у-МпО2 имеют различные соединения. Рентге-
ноструктурное исследование показывает, что плохо закристал-
лизованные образцы близки по строению к пиролюзиту, а при
большей степени кристалличности образцов обнаруживается
сходство со структурой рамсделлита. Предполагается [2], что
•у-фазы могут иметь структуры, промежуточные между теми, ко-
торые показаны на рис. 12.12, а и б, т. е. они построены из сло-
ев В- и у-структур (рис. 12.12,5).
Если часть ионов Мп4+ в каркасе МпО2 замещена на ионы
Мп2+ или другие ионы с меньшим положительным зарядом,
каркас приобретает отрицательный заряд и может включать в
пустоты посторонние положительно заряженные ионы. Соедине-
ние Li2Ti307 — ионный проводник, в его структуре неупорядочен-
ные ионы лития занимают тетраэдрические позиции внутри ка-
налов структуры рамсделлита (рис. 12.12,6), а также часть ок-
таэдрических позиций в каркасе. Для этого соединения была
предложена структурная формула (Li1.72n2.2s) (Т1з,4зЬЬ,57О8)
[3], ? — вакансия. Группа минералов — голландит, криптоме-
лан и коронадит — имеет структуру, изображенную на рис.
12.12,6; вместе с а-МпО2 эти минералы образуют ряд изострук-
турных соединений с общей формулой A2-j,B8_2Xi6 [4] (где А —
большие ионы, такие, как Ва2+, РЬ2+ или К+; B = Fe3+, Mn4+
или Мп2+; Х = О2~, ОН~). К большому семейству голландитов
относятся также Ba(MIV, А1)О8 (где MIV = Si, Ti, Sn, а алюми-
ний может быть замещен на Сг, Fe, In) [5]. Очевидно, что в бо-
лее открытых структурах, таких, как изображенные на рис.
12.12, виг, для предотвращения разрушения каркаса необходи-
мо некоторое количество крупных ионов, и поэтому так назы-
ваемый а-МпО2 может быть получен только в присутствии та-
ких крупных ионов, как К.+. В некоторых из этих соединений,
как и в цеолитах, имеет место катионный обмен. Еще более от-
крытая структура у псиломелана (Ва, Н20JМп50ю [6]; она со-
стоит из сдвоенных и строенных цепочек октаэдров и больших
туннелей, содержащих ионы бария и молекулы воды (рис.
12.12, г). Дегидратация этого соединения сопровождается пре-
вращением в структуру голландита, которое происходит при
нагревании до 550 °С.
О двойных оксидах марганца, характеризующихся совгршен-
но другим структурным типом, см. обсуждение в разд. 13.6.6
структуры Mg6Mn08.
В литературе описана новая интересная модификация МпОг,
которая имеет шпинельный каркас LiMn2O4, но фактически не
содержит атомов лития [7]. Таким образом, данная модифика-
ция МпО2 имеет «атакамитовую» структуру (рис. 7.3, а), кото-
266 12. Простые оксиды металлов
рая до настоящего времени не была обнаружена у соединений
типа АХ2. В этой связи см. структуры меланофлогита и силика-
лита (разд. 23.11.1 и 23.12.8).
Литература. [1] Acta Chem. Scand., 1949, 3, 163. [2] Acta cryst., 1959, 12, 341.
[3] Acta cryst., 1979, B35, 798. [4] Acta cryst., 1950, 3, 146; Acta cryst., 1951, 4,
469. [5] Acta cryst, 1978, B34, 3554. [61 Acta cryst., 1963, 6, 433. [7] J. Solid
State Chem., 1981, 39, 142.
12.5.2. Слоистые структуры. Существует множество плохо оха-
рактеризованных минералов оксида марганца, содержащих во-
ду, чем-то напоминающих глинистые минералы и, вероятно, как
и они, имеющих слоистые структуры. Хорошо закристаллизован-
ный минерал литиофорит (Alo,68Lio,32)Mn0,i72+Mno,824+02(OHJ
обладает двухслойной структурой, в которой оба слоя типа
Mg(OHJ (разд. 6.5) имеют идеальные составы МпО2 и
(Li,Al)(OHJ [Acta cryst., 1952, 5, 676]. Слои соединены друг
с другом связями О—Н—О, как в А1(ОНK, причем из приве-
денной выше формулы следует, что, если в слое МпО2 сосредо-
Проекция одного слоя
О-Mn О
Проекция, перпендикулярная
плоскости слоя
Рис. 12.13. Кристаллическая структура халькофанита 2пМпзО7-3 Н2О.
точены все анионы О2~, а в слое (Li,Al)(OHJ — все анионы
ОН~, то первый слой несет заряд —0,38, а второй +0,38 (в рас-
чете на одну формульную единицу). Детальное расположение
катионов и атомов водорода точно не установлено.
В структуре халькофанита ZnMn3O7-3H2O '[Acta cryst., 1955,
8, 165] марганецсодержащий слой в целом имеет то же строе-
ние, что и в предыдущем соединении, однако l/j позиций метал-
ла вакантны, так что слой имеет состав МП3О7, а не МпО2. Ио-
ны цинка располагаются непосредственно над и под вакансия-
ми марганца и окружены тремя атомами кислорода из слоя и
тремя молекулами воды, так что образуется несколько иска-
женный октаэдр (три расстояния Zn—О 1,95 @,05) А и три
2п О 2,15 @,05) А). Слои соединены друг с другом связями
О Н—О от молекул воды (рис. 12.13). Природа связен Zn—О
в этом и других кристаллах обсуждается в разд. 26.2.
12.6. Оксиды свинца
Долгое время признавалось существование трех оксидов свин-
ца РЬО, РЬ3О4 и РЬО2, однако не было общего мнения относи-
тельно других оксидов, промежуточных между РЬО и РЬСЬ
[J. Chem. Soc, 1956, 725]. РЬ2О3 (черного цвета) синтезируют
либо гидротермальным методом, либо путем нагревания РЬО
при температуре 600 °С и давлении кислорода 1 кбар. Корич-
нево-черный РЬ^Ош можно получить при нагревании РЬО или
РЬО2 при 500 °С и давлении кислорода 175 бар; существование
еще одного оксида (Pbi2Oi7?) полностью не доказано [J. Am.
Cer. Soc, 1964, 47, 242]. Поскольку РЬО, РЬ3О4 и РЬО2 до не-
которой степени взаимопревращаемы (путем нагревания на
воздухе или другими способами), обычно получают смеси этих
оксидов. Например, установлено, что РЬ3О4 образуется при на-
гревании либо РЬО, либо РЮ2 на воздухе до 500 °С, в то вре-
мя как >550°С устойчив только РЬО. Таким образом, на
практике при необходимости получить небольшие количества
чистых оксидов РЬ3О4 и РЬО2 их нельзя синтезировать термиче-
ским способом без дальнейшей обработки. РЬО получают осто-
рожным разложением РЬСО3 или РЬ(ОНJ, РЬ3О4 синтезируют
окислением РЬО с последующим удалением непрореагировав-
шего исходного оксида уксусной кислотой, а РЬО2 может быть
получен взаимодействием азотной кислоты с РЬ3О4 или окис-
лением суспензии РЬО гипохлоритом в щелочной среде. Оксиды
свинца окрашены в яркие цвета: РЬО — желтый и красный,
РЬ3О4 — красный, РЬ2О3 — черный, РЬО2 — темно-бордовый и
черный (как и полупроводник PbS, обладающий, кроме того,
ярким металлическим блеском); вышеуказанные свойства сви-
детельствуют о том, что в оксидах свинца связи имеют неодно-
значную природу.
12.6.1. Моноксид свинца РЬО. Этот оксид имеет две полиморф-
ные модификации; красную (тетрагональную) синтезируют на-
греванием РЬО2 на воздухе до температуры 550 °С, а желтую
(ромбическую)—нагреванием РЬО2 до 650°С или быстрым
охлаждением расплава РЬО. Тетрагональный РЬО имеет слоис-
тую структуру (рис. 12.14), в которой каждый атом металла
окружен четырьмя атомами кислорода, расположенными в уг-
лах квадрата в плоскости по одну сторону от атома свинца,
причем неподеленная электронная пара, по-видимому, занимает
268 12. Простые оксиды металлов
вершину тетрагональной пирамиды '[Acta cryst., 1961, 14, 1304
(дифракция нейтронов)]; об этой структуре см. также ргзд.
3.10.2 и 4.2. Структурная химия соединений свинца обсуждается
в гл. 26. Методом рентгеноструктурного анализа не удалось ло-
кализовать атомы кислорода в структуре желтой модификации
РЬО, это было сделано с помощью нейтронографии [Acta cryst.,
1961, 14, 66, 80]. Структура желтого РЬО построена из слоев,
которые являются очень искаженными вариантами слоев, пока-
Рис. 12.14. Кристаллическая структура тетрагонального РЬО (и SnO). Малень-
кие заштрихованные кружки — атомы металла. Справа — конфигурация бли-
жайшего окружения атома металла, два черных маленьких кружка — неподе-
ленная электронная пара (разд. 26.1.2).
занных на рис. 12.14; в отличие от четырех одинаковых расстоя-
ний РЬ—О B,30 А) в структуре красной модификации в коор-
динационном полиэдре свинца в структуре желтого РЬО два
расстояния РЬ—О равны 2,20 А и два — 2,49 А. Из-за более ко-
ротких связей образуются зигзагообразные цепочки (угол
О—РЬ—О 148°), которые объединяются в слои более длин-
ными связями РЬ—О. Кратчайшие расстояния РЬ—РЬ в слое и
между слоями равны 3,47 и 3,63 А соответственно.
12.6.2. Оксид Pb3Oi. Структура РЬ3О4, изображенная на рис.
12.15, построена из цепочек октаэдров РЬ1УОб, сочлененных про-
тиволежащими ребрами; эти цепочки связаны друг с другом
атомами РЬ(П), каждый из которых окружен тремя атомами
кислорода, образующими пирамиду. Длины связей и валент-
ные углы равны: PbIV—О 2,14 А (шесть); РЬП—О 2,18 А (два)
и 2,13 А (одно); средний угол О—РЬ—О 76° (как в РЬО)
[Z. anorg. allg. Chem., 1965, 336, 104 (нейтронография)].
12.6. Оксиды свинца 269
12.6.3. Оксид РЬ2О3. В структуре моноклинного РЬ2О3 атомы
РЬ(П) расположены между слоями, построенными из искажен-
ных октаэдров PbIV06 (PbIV—О 2,08^2,28 А, среднее 2,18 А).
Каждый атом РЬ(Н) окружен шестью атомами кислорода, рас-
положенными в вершинах искаженного куба (две вершины на
концах диагонали грани остаются незанятыми). Имеется два
набора расстояний РЬ11—О: три коротких B,31, 2,43 и 2,44 А)
O
Рис. 12.15. Кристаллическая структура РЬ3О4 (и ZnSb2O4). a — фрагмент
структуры, который выделен на проекции б, показывающий цепочки из октаэд-
ров PblvOs, соединенные между собой атомами РЬ" с пирамидальной коорди-
нацией.
и три более длинных B,64, 2,91 и 3,00 А), а расстояния
РЬ11—РЬП, как и в металле {Acta cryst., 1970, А26, 501 (рент-
генографические методы и нейтронография)], равны ~3,5 А,
Эти длины связей явно не согласуются с аналогичными рас-
стояниями в других оксидах и с суммой ионных радиусов, со-
ставляющей ~2,6 А (для КЧ 6).
12.6.4. Диоксид свинца РЬО2- Обычная темно-бордовая модифи-
кация этого оксида имеет структуру рутила, среднее расстоя-
ние РЬ—О в октаэдрах РЬО6 2,18 А. При температуре 300 °С и
давлении 40 кбар эта модификация превращается в черную
ромбическую модификацию, структура которой описана в гл. 4
{при обсуждении структур с плотнейшими упаковками).
12.6.5. Некоторые двойные оксиды четырехвалентного свинца.
Некоторые двойные оксиды Pb(IV) имеют структуры, родствен-
ные структуре РЬО2, с КЧ атомов Pb(IV) 6 (октаэдр). Структу-
270 12. Простые оксиды металлов
pa Sr2Pb04 \Z. anorg. allg. Chem., 1969, 371, 225] состоит из
цепочек рутилового типа, связанных друг с другом ионами
Sr2+ с КЧ 7 (аналогично атомам РЬ(П) в РЬ3О4); соединение
Ва2РЬО4 имеет слоистую структуру K2NiF4 (разд. 5.3.3), в ко-
торой большие ионы бария занимают позиции с КЧ 9.
Изоструктурные
соединения
Са2РЬО4
Sr2Pb04
Ва2РЬО4
Ca,SnO4
Cd,SnO4
SroSn04
Ba2Sn04
В отличие от октаэдрической координации M(IV) у вышепере-
численных соединений в структурах гигроскопичных оксидов
K2M1VO3 (M = Zr,Sn, Pb) [J. Solid State Chem., 1970,2,410] четы-
рехвалентный металл имеет КЧ 5. Структуры этих соединений
построены из необычных цепочек МХ3 (рис. 12.16); координа-
D,'43A) Q
0,64 А
6
Рис. 12.16. Цепочка МХ3 в структуре K2Zr03
ционный полиэдр металла (IV)—тетрагональная пирамида,
причем апикальная связь М—О короче, чем четыре остальные,,
а атом металла лежит выше основания пирамиды. Структура
КгРЬОз полностью не расшифрована; в структуре K2S11O3 дли-
ны связей Sn—О равны: 1,93 А (одна), 2,03 А (две) и 2,21 А
(две). В заключение отметим, что изоструктурность соединений
Sn(IV) и Pb(IV) является довольно распространенным явле-
нием.
17. Кислородные соединения переходных металлов 271
12.7. Химия кислородных соединений
некоторых переходных металлов
Для обсуждения некоторых аспектов химии кислородных со-
единений переходных металлов удобно объединить 6 элементов:
титан, ванадий, ниобий, молибден, вольфрам и рений. Можно
сделать следующие обобщения. Диагональное структурное со-
ответствие, о котором пойдет речь ниже, связано с двумя об-
стоятельствами. Во-первых, цирконий, гафний и тантал по
сравнению с элементами, находящимися правее в периодиче-
ской системе, имеют больший размер, меньшую электроотри-
(Р)
Ti
Zr
Hf
V
Nb
Та
Cr
Mo
W
Mn
Tc
Re
(Fe)
цательность и пониженную устойчивость в низших степенях
окисления. Во-вторых, в ряду соединений титана, ванадия, хро-
ма, марганца с высшей степенью окисления возрастает сход-
ство с соединениями соответствующего ряда Si, P, S и С1. Так,
например, в кислородных соединениях титан обычно находится
в виде иона, и, хотя известны соединения титана в низших сте-
пенях окисления, наиболее широко распространенное состояние
титана в кислородных соединениях — Ti4+ с октаэдрической ко-
ординацией. Некоторые соединения пятивалентного ванадия с
кислородом похожи на соединения фосфора и других «тетраэд-
рических» элементов — кремния, германия и мышьяка — тем,
что в них ванадий образует тетраэдрический анион VC>43~, в то
время как в других соединениях он имеет октаэдрическое окру-
жение атомами кислорода. Однако для многих кристаллов бо-
лее подходит описание окружения в виде тригональной бипира-
миды либо квадратной пирамиды (при значительных искаже-
ниях идеальных многогранников различие между этими двумя
вариантами становится до некоторой степени произвольным).
Насколько известно, хром (VI) в кислородных соединениях
имеет только КЧ 6. Хром (VI) содержится в некоторых, а воз-
можно, и во всех оксидах черного цвета, имеющих состав, про-
межуточный между СгО2 и СгО3 (разд. 27.4.4), по-видимому,
обладающих свойствами металлических оксидов и похожих на
оксиды молибдена и вольфрама. Имеется мало данных о струк-
турной химии кислородных соединений марганца (VII); из-
вестно, что перманганат-ион МпО4~ имеет тетраэдрическую кон-
272 12. Простые оксиды металлов
фигурацию. Мп2О7 уже обсуждался. Молибден(VI) и вольф-
рам (VI) могут образовывать тетраэдрические оксо-ионы, но в
большинстве сложных кислородных соединений и даже в таких
«пиросолях», как Na2Mo2O7 и Na2W2O7 (разд. 11.5.2), молибден
и вольфрам имеют октаэдрическую координацию. Некоторые
конечные оксо-ионы ванадия, ниобия, молибдена и вольфрама
описаны в гл. 11. Сравнительно мало изучена химия сложных
кислородных соединений рения, еще меньше — технеция, а хи-
мия сложных кислородных соединений тантала только начина-
ет развиваться. Однако того, что уже известно об элементах
титане, ванадии, ниобии, молибдене, вольфраме и рении, вполне
достаточно, чтобы можно было сгруппировать их вместе в це-
лях обсуждения структурной химии их кислородных соедине-
ний.
Ключом к пониманию структур многих сложных кислород-
содержащих соединений этих элементов является их связь со
структурами ТЮг (рутил) и ReO3. VO2 имеет одну модифика-
цию со структурой рутила, другую — с искаженной структурой
рутила, NbO2 — сложную сверхструктуру типа рутила. Все
структуры модификаций WO3 относятся к типу ReO3 с теми или
иными искажениями, только МоО3 характеризуется особой сло-
истой структурой (разд. 12.7.3). В структуре ReO3 октаэдры
МО6 соединены друг с другом только вершинами, но путем ком-
бинирования различного числа связанных вершинами и ребра-
ми октаэдров из фрагментов структуры ReO3 можно получить
большое число более сложных структур с составами в интерва-
ле МО2—МО3. Таким же способом из фрагментов структуры
рутила посредством сочленения октаэдров общими гранями
можно получить более сложные типы структур. Далее рассмот-
рены:
оксиды титана;
кислородные соединения ванадия;
оксиды молибдена и вольфрама.
В гл. 13 обсуждаются сложные оксиды этих элементов, в том
числе «бронзы».
12.7.1. Оксиды титана. Чрезвычайную сложность некоторых си-
стем металл — кислород можно продемонстрировать на приме-
ре титана и ванадия.
Металлический титан (ГПУ) растворяет кислород вплоть до
состава Ti00,5o, и в этом интервале установлено существование
трех различных фаз. Вначале образуется статистический твер-
дый раствор кислорода в титане, затем происходит выборочное
заселение определенных позиций, приводящее к возникновению
частично упорядоченных структур с составами, близкими к
12.7. Кислородные соединения переходных металлов 27J&
ТЮо.зз (слоистая структура типа анти-АХ3) и TiOo.so (струк-
тура типа анти-Cdb). При более высоком содержании кис-
лорода ГПУ атомов металла разрушается. Оксид титана_
состав которого лежит в интервале ТЮ0,б8—TiOojs» получают
окислением металла при низком давлении кислорода и темпе-
ратуре <900°С. Этот оксид имеет структуру e-TaN (рис.,
29.22), но с дефицитом по кислороду; атомы металла не обра-
зуют плотнейшую упаковку — каждый атом титана имеет два
атома титана на расстоянии 2,88 А и двенадцать более удален-
ных на расстояниях 3,22 А; последние окружают исходный атом<
Ti в виде гексагональной призмы. Каждый атом кислорода окру-
жен шестью атомами титана, расположенными в вершинах вы^
тянутого октаэдра.
При составе TiOi.oo фаза имеет дефектную структуру NaCI.
При высоких температурах эта структура имеет кубическую!
симметрию с равным числом статистически расположенных ва-
кансий в позициях катионов и анионов. При обычных темпера-
турах этот оксид имеет упорядоченную дефектную структуру
типа NaCI (рис. 12.17), в которой у каждого типа ионов '/в по-
зиций вакантна. Симметрия моноклинная с углом р, близким:
к 90° (89,9°). При 800 °С оксид состава TiOj.is с кубической-
структурой типа NaCI имеет узкую область гомогенности, при1
повышении температуры область гомогенности расширяется^
соответственно изменяется и количество вакансий, например:.
Отношение
О : Ti
Количество занятых пози-
ций, %
Ti О
1,33
1,12
0,69
74
81
96
91
66.
Интерполяцией получаем, что при составе TiO занято 85% по-
зиции каждого типа.
При увеличении содержания кислорода происходит обра-
зование оксида Ti2O3, который при обычных темпера-
турах имеет структуру корунда и претерпевает поли-
М°Д.Ф^Оет-пРеВраЩенИе ПРИ Ш°С' затем следует оксид
состава 113U5 и не менее чем семь различных фаз в интервале'
составов _liUi,75 —TiOi.go. Эти фазы образуют гомологический
ряд общей формулы Т1яО2п_, D</г<10), похожий на ряды ок-
сидов образуемые ванадием, молибденом и вольфрамом (см
Далее). При температурах <Ю0°С структура Ti3O5 построена,
из октаэдров 1Ю6, сочлененных общими ребрами и вершинами
18-985
274 12. Простые оксиды металлов
¦О о о ,\О о О
о • о/О\О °
О о ф о О4; О
о о/° • о/о о
О \О о 0 о о
о О \О/ ° • °
О о OV О о О
• О о Ц о О •
О о О/о \ о О
о о / о о Ъ °
• о /О о о/° •
о Оч о О / О о
О о \ О//О о о
• О о t) ° О •
Рис. 12.17. Последовательность слоев в структуре TiO (дефектная сверхструк-
rrypa NaCl). Черные точки — катионные или анионные вакансии ('/б часть
ионов каждого сорта).
Рис. 12.18. Кристаллическая структура низкотемпературной модификации ТЛ3О5.
в трехмерный каркас (рис. 12.18). При 100 °С этот оксид пре-
терпевает быстрое и обратимое превращение в модификацию со
слегка искаженной структурой псевдобрукита (разд. 13.6.1),
которая при низких температурах, по-видимому, может стаби-
лизироваться присутствием небольших количеств железа.
В структуре низкотемпературной модификации Ti3O5 существует
12.7. Кислородные соединения переходных металлов 27S
Таблица 12.7. Оксиды титана3
Оксид
Ti,0
тьо
S-TiO,
TiO
Ti2O3
Ti3O5 1
TuO7 \
Ti,O9 I
TiO,
I
II
Структура
Анти-АХз (слоист.N
Анти-СсИг (слоист.)
Дефицитная по кислороду
8-TaN
Сверхструктура NaCl
Корунд
Члены гомологического ряда
Т0 D9)
Рутил, анатаз, брукит
а-РЬО2
Литература
Acta cryst., 1968, В24, 211
Acta Chem. Scand , 1957, 11,
1641
Acta Chem. Scand., 1959, 13,
415
Acta cryst., 1967, 23, 307
Acta cryst., 1977, B33, 1342
Acta cryst., 1959, 12, 575
J. Solid State Chem., 1971, 3,
340
Acta Chem. Scand., 1960, 14,
1161
J. Chem. Phys., 1969, 50.
519
а Литература по системе титан — кислород: Acta Chem. Scand., 1962, 16, 1245,
Ark. Kem., 1963, 21, 413; J. Chem. Phys., 1967, 46, 2461, 2465.
" Существует бесчисленное множество слоистых структур АХз с плотненшнми упа-
ковками атомов X, в которых атомы А размещаются по тому или иному мотиву в
октаэдрических пустотах между парами слоев, образующих «пакет». Мотиву занятых
пустот, изображенному на рис. 4,24,6, в случае ГПУ соответствует структура Bib,
(н низкотемпературная СгСЬ), в случае КПУ—структура YC!?. В оксиде TiO атомы
титана образуют ГПУ, а атомы кислорода занимают систему пустот, изображенную на
рис. 4.24,(9, однако соответствующие трансляции (параллельные плотноупакованным
слоям) атомов кислорода в Ti36 отличаются от трансляций атомов металла в структу-
ре ВПз.
три типа расстояний металл — металл по направлениям, пере-
секающим общие ребра октаэдров: 3,1, 2,8 и 2,6 А (ср. Ti—Ti
в a-Ti: 2,93 А). Оксиды Ti4O7 и Ti5O9, принадлежащие к ряду
"ПлОгл-ь построены из полос структуры рутила, бесконечных
в двух направлениях, толщиной соответственно в 4 и 5 октаэд-
ров, сочлененных друг с другом гранями граничных октаэдров
(ср. с корундом).
Высший оксид титана — это хорошо известный ТЮг. Все три
его модификации, устойчивые при атмосферном давлении,—
рутил, анатаз и брукит — встречаются в виде минералов.
Их структуры, а также модификация высокого давления со
структурой а-РЬО2 построены из октаэдров, длины связей
Ti—О в которых приведены в разд. 12.2.5. Пятая полиморфная
модификация, получаемая при давлениях >150 кбар, неустой-
чива при атмосферном давлении; вероятно, в ее структуре ато-
мы титана имеют более высокое координационное число. Мно-
гочисленные сложные оксиды, содержащие титан, описаны
в гл. 13. Простые оксиды титана представлены в табл. 12.7.
18*
276 12. Простые оксиды металлов
Цирконий и гафний не образуют низших оксидов, подобных
гомологическому ряду TinOzn-\, так как ионы М4+ этих элемен-
тов слишком велики для того, чтобы образовывать структуры
типа рутила с КЧ 6. В следующей группе периодической систе-
мы также существуют значительные различия между свойст-
вами кислородных соединений первого представителя А-под-
труппы (ванадий) и остальных элементов (ниобий и тантал).
Особенность системы Nb—О заключается в уникальной струк-
туре NbO и в очень сложной кристаллохимии Nb2Os и родст-
венных ему оксидов, о которых уже упоминалось. В системе
Та—О [Acta Chem, Scand., 1954, 8, 240] обнаружены следую-
щие фазы: а — твердый раствор кислорода в металлическом
а-тантале с объемноцентрированной кубической структурой, со-
держащий до 5 ат. % кислорода; р — искаженный вариант
сс-структуры с максимальным содержанием кислорода, соответ-
ствующим составу Та4О; у — ТаО со структурой NaCl; б —ТаО2
со структурой рутила; Та2Оэ.
12.7.2. Кислородные соединения ванадия
Низшие оксиды. Методами термического и рентгенофазово-
го анализов установлено, что система V—О имеет заметное
сходство с системой Ti—О в области составов вплоть до оксида
МО2, а единственное существенное различие состоит в том, что
структуры обеих полиморфных модификаций V3O5 отличаются
от структур обеих полиморфных модификаций Ti3Os (см. ниже).
Помимо сс-фазы — твердого раствора кислорода в кубиче-
ской объемноцентрированной решетке ванадия (граничный со-
став VO0,03 при 900 °С), и р-фазы («V4O»)—тетрагонально ис-
каженной решетки ванадия с небольшим содержанием кислоро-
да в интервале составов VOo.is—VO0,25 [1], в системе V—О
обнаружены оксиды, приведенные в табл. 12.8 [2].
В области составов между оксидами V2O3 (структура ко-
рунда) и VO2 (структура рутила) существует ряд соединений
V/iO2,-:-i C<n<8), построенных из полос структуры рутилового
типа, сочлененных общими гранями. Аналогичный ряд оксидов
со «сдвиговыми» структурами типа рутила существует, как
-было показано выше, и у оксидов титана, но начинается он с
соединения Ti4O7. Сочленение октаэдров посредством общих
граней, характерное как для низко-, так и для высокотемпера-
турного V3O5, не наблюдается в структурах Ti3O5. В оксидах
VnO2n-i, как и в V2O3 и VO2, ванадий имеет октаэдрическую
координацию, но в некоторых случаях октаэдр очень искажен.
•Например, в оксиде V4O7 расстояния V—О находятся в интер-
вале 1,78 -т- 2,12 А, а в моноклинном VO2 — в интервале 1,76н-
н- 2,06 А. Оксиды состава, промежуточного между VCb и V2Os,
имеют более сложное строение, и хотя в некоторых из них окру-
12.7. Кислородные соединения переходных металлов 277
Оксид
VOo,53
VO
VO..27
vo,.5A
VO,67—
VO,,87
vo2
VO2.17
VO2=5
VO2.33
VO2.5
Таблица 12.8. Оксиды
Структура
—
Структура NaCl (при 900 °C
область гомогенности в ин-
тервале V00,8o—VOlm)
Объемноцентрированная тетра-
гональная сверхструктура ти-
па NaCl (с дефицитом вана-
дия)
Структура корунда
Шесть оксидов, образующих
гомологический ряд VnO2n-i
(от V3OS до V8O,5)
Моноклинная (искаженная ру-
тиловая типа МоО2)
(>68°С) Тетрагональная струк-
тура рутила
v6o13
V4O9
v3o7
V2O5
см. текст
ванадия
Литература
Acta Chem. Scand.,
465
J. Metals, 1953, 5,
1960
292;
Chem. Scand., 1954, 8.
1599, 1960, 14, 465
Acta Chem. Scand.,
465
Acta cryst., 1980, I
(V3O5); Acta cryst.,
1404 (V4O7)
Acta Chem. Scand.,
420
J. Phys. Soc. Japan,
1380
Acta Chem. Scand.,
2675
Acta Chem. Scand.,
3409
Acta cryst., 1974, B30
Z. Kristallogr., 1961,
1960,
Ш,
1972,
1970,
1967
1971,
1970
2644
14,
Acta
221,
H,
1332
B28,
24,
23,
25,
24,
115, 110
жение ванадия может быть описано в виде октаэдра, последний
так искажен, что координация ванадия лучше описывается как
пятнвершинная.
Оксид V6Oi3, в котором средняя степень окисления металла
равна 2,17, по-видимому, играет важную роль в работе вана-
диевых «пентаоксидных» катализаторов, используемых при
окислении БОг до SO3 и нафталина до фталевого ангидрида.
В его структуре, которая была описана в разд. 5.3.5, существу-
ет три сорта неэквивалентных атомов ванадия, ближайшее ок-
ружение которых находится на расстояниях (в А):
Среднее зна-
чение
1,77
1,88 (два)
1.96
1,99
2,06
1,92
1,66
1,76
1,90 (два)
2,08
2,28
1,93
1,64
1,92 (два)
1,93
1,98
2,26
1,94
278 12. Простые оксиды металлов
Очевидно, что эти три сорта атомов ванадия невозможно-
различить на основании длин связей V—О. В V4O9 имеется
одна короткая связь V—О A,60—1,65 А), четыре связи в интер-
вале 1,87-^2,02 А и длинная связь; причем длины последней
связи для четырех неэквивалентных атомов ванадия равны
2,23, 2,40, 2,50 и 3,00 А, так что 'Д часть атомов ванадия имеет
по существу координационное число 5. По-видимому, невоз-
можно выявить корреляцию между типом координации и сте-
пенью окисления индивидуальных атомов (если не предполо-
жить, что соединение имеет состав V3lvVvOs(OH)).
V3O7 имеет сложную каркасную структуру, которая образо-
вана путем соединения через общие вершины и ребра коорди-
национных полиэдров трех типов. Из 36 атомов ванадия в эле-
ментарной ячейке 12 имеют октаэдрическую координацию»
(среднее расстояние V—О 1,94 А, причем одна связь V—О ко-
роткая— 1,62 А, а остальные ~2 А); 16 атомов имеют окруже-
ние в виде тригональной бипирамиды с таким же средним рас-
стоянием V—О и 8 атомов — в виде квадратной пирамиды о>
средним расстоянием V—О 1,83 А; ср. с очевидной формулой
для этого оксида в виде V4+V25+O7. Используя расстояния V—О,.
найденные в структурах различных оксидов ванадия, можно по-
лучить следующие приближенные средние значения (в ангстре-
мах), хотя необходимо помнить, что в длинах отдельных свя-
зей имеется значительный разброс, особенно при координаци-
онных числах 5 и 6.
Координацион-
ное число
V(IH)
V(IV)
V(V)
2,00 А
1,95
1,90
1,90 А
1,83
1,72 А
Даже при тетраэдрическом окружении V5+ все четыре связи
имеют одну и ту же длину только в простом ионе VO43~, а на-
пример, в соединении Са2УгО7-2Н2О [3] существует заметное
различие между расстояниями для концевого и мостикового-
кислорода: V—OKOra, A,69 А) и V—ОМОст A,80 А).
Пентаоксид ванадия и ванадаты. Структурная химия пяти-
валентного ванадия и ванадатов резко отличается от структур-
ной химии низших оксидов. Ортованадаты, содержащие пяти-
валентный ванадий с тетраэдрической координацией, часто изо-
структурны ортофосфатам и ортоарсенатам. Например, доде-
кагидраты солей Na3PO4, Na3As04 и Na3VO4 изоструктурны; то
же относится к сложным солям РЬз(РО4KС1, РЬ(АО)С?
12.7. Кислородные соединения переходных металлов 279
и Pb5(VO4KCl; соединения же редкоземельных элементов
NdVO4, SmVO4, EuVO4 и YVO4, как и YPO4 и YAsO4, кристал-
лизуются в структуре циркона (ZrSiO4). Диванадат ZrV2O7
нзоструктурен ZrP2O7.
Несмотря на то что ванадий (V), как и фосфор (V), образует
ионы VO43~ и V2O74~, он проявляет более сильную, чем фосфор,
тенденцию к конденсации кислородсодержащих ионов. Извест-
ны растворимые орто-, мета- и диванадаты, однако по сравне-
нию с соответствующими фосфатами устойчивость этих солей
в водных растворах меняется в обратном порядке. В то время
как мета- и дифосфаты при кипячении раствора превращаются
в ортофосфаты, т. е. более сложные ионы распадаются на про-
стые РО43~-ионы, ортованадат-ион VO43~ на холоду быстро пре-
вращается в диванадат-ион V2O74~, а при кипячении происходит
дальнейшая конденсация до метаванадат-ионов (VO3)n"~. Тип
ванадата, получаемого из раствора, зависит от температуры,
а также от кислотности среды. Подкисление растворов ванада-
тов приводит к образованию яркоокрашенных поливанадатов.
Слабокислый раствор ванадата натрия содержит ионы УюОгв6"
(разд. 11.5.1), а при длительном хранении или нагревании
осаждаются менее растворимые поливанадаты, например
КУзОя [4] и K3V5OH [5]. Обе эти соли имеют слоистые струк-
туры, в которых координационное окружение ванадия образо-
вано пятью или шестью атомами кислорода в виде неправиль-
ного многогранника. В K.V3Os атом ванадия имеет один бли-
жайший атом кислорода A,6 А) и четыре более удаленных
A,9 А); эти пять атомов образуют квадратную пирамиду,
.а шестой атом кислорода находится гораздо дальше B,5 А)
я завершает очень искаженный октаэдр. Такой искаженный
.координационный полиэдр характерен для многих сложных
.кислородсодержащих соединений ванадия, что отличает их от
•аналогичных соединений фосфора, у которого во всех фосфатах
сохраняется тетраэдрическая координация. Но в то же время
в СозУ2О8 '[6] пятивалентный ванадий имеет неискаженное тет-
раэдрическое окружение; в этой структуре атомы ванадия за-
нимают тетраэдрические, а атомы кобальта — октаэдрические
пустоты в К.ПУ атомов кислорода. По всей вероятности, такой
.же координационный полиэдр имеет V(V) и в K2V3O8, по-
скольку последний является диванадатом ванадила-калия
K.2(VO)V2O7. В бесцветном гигроскопичном NaVO3 (имеющем
•структуру диопсида) окружение ванадия детально не установ-
лено. В структурах KVO3-H2O [7] и V2O5 [8] атомы ванадия
имеют К.Ч 5, но различные типы координационных полиэдров.
На рис. 12.19, а показана цепочка в метаванадат-ионе, об-
разованная из тетраэдров, связанных общими вершинами.
Если соединить вместе две такие цепочки, то каждый атом ва-
280 12. Простые оксиды металлов
надия получит в ближайшее окружение пятый атом кислорода
из другой цепочки (рис. 12.19,6). Такая двойная цепочка со-
держится в структуре КУО3-Н2О; на рис. 12.19,6 приведены
длины связей в ней. Пять атомов кислорода, окружающих ва-
надий, расположены в вершинах искаженной тригональной би-
пирамиды, а атом ванадия смещен в направлении двух из трех
экваториальных атомов кислорода. (Ионы калия и "молекулы
воды располагаются между цепочками.) Структура Sr(VO3J-
•4Н2О построена из аналогичных цепочек.
2.0ZA
Рис. 12.19. а — метаванадат-ион (VO3)n"~; б — двойной цепочечный иов
в KVO3-H2O; в — слой в структуре V2Os.
Если эти двойные цепочки соединить посредством атомов А
с образованием слоев, то получим структуру V2Os
(рис. 12.19, е). В этой структуре различают атомы кислорода
трех сортов — Oi, Оц и От, присоединенных соответственно-
к одному, двум и трем атомам ванадия. В KVO3-H2O и V2Os
имеются следующие длины связей V—О:
V
KVO3-H2O
2ОХ 1,63 1,67 А
2ОШ 1,93
1ОШ 1,99
V2O5
Юг 1,59 А
v I 1ОП 1,78
v 2Ош1.88
1Ош2,02
У атома ванадия в ванадате KVO3-H2O нет атомов кислорода,
помимо указанных выше, которые можно было бы включить
в его координационную сферу, а в оксиде V2Os имеется шестой
атом кислорода, лежащий в соседнем слое на расстоянии 2,8 А,
как показано штриховыми линиями на рис. 12.19, в. На
рис. 12.22, а/с идеализированная структура V2Os представлена
как совокупность сопряженных октаэдров для того, чтобы под-
черкнуть ее связь со структурой МоО3. Учитывая расстояния1
V—О, более правильным для этой структуры является описа-
ние координационного полиэдра ванадия в. виде квадратной
12.7. Кислородные соединения переходных металлов 281
пирамиды. Проекция структуры, представленной на рис. 12.22, ж
в направлении, указанном стрелкой, приведена на рис. 12.20, а.
На этом рисунке каждый квадрат, как и раньше, изображает
цепочку типа ReO3, перпендикулярную плоскости чертежа; это
те цепочки, которые направлены вдоль стрелки. Более длин-
ная (шестая) связь V—О в каждом октаэдре показана штри-
ховой линией. Если представить координационный полиэдр ва-
Рис. 12.20. Структура V2O5 (см. текст).
надия в виде квадратной пирамиды, т. е. удалить шестой атом
кислорода из октаэдра, получим структуру, изображенную на
рис. 12.20,6. Этот координационный полиэдр характерен для
всех атомов ванадия также в двух ванадиевых бронзах, одна
из которых имеет по существу такую же структуру, как V2O5,
в то время как в других бронзах ванадий имеет КЧ 5 и 6 (на-
пример, в ЬЬ+яУзОз) или только 6 (в Ago,6sV205) (гл. 13).
Гидроксид-оксиды ванадия. Как отмечалось в гл. 5, некото-
рые интересные слоистые структуры возникают при сочленении
цепочек рутилового типа через общие боковые вершины. Ряд
Таблица 12.9. Структуры гидроксид-оксидов ванадия (рис. 12.21)
МО,
м2о6
м3о8
Формула
VO2(OH)
VO(OHJ
V3O4(OHL
V3O3(OHM
V4O4(OHN
VO(OH)
Название
минерала
Парадаттонит
Даттонит
Долоресит
Протодолоре-
сит
Хаггит
Монтрозеит
Степень
окисления
ванадия
5 1
4 /
4
32/з
372
3
Литература
Acta cryst, 1958, 11,
56
Am. Mineral, 1960,
Ле 11 л л
40, 11 Ч Ч
Am. Mineral, 1960,
45, 1144
Am. Mineral, 1960,
45, 1144
Am. Mineral, 1953, 38,
1242
таких структур обнаружен у минералов, причем некоторые из
этих минералов представляют собой темноокрашенные соедине-
ния, содержащие ванадий в более чем одной степени окисле-
ния. В табл. 12.9 приведены эти минералы, а также указана
средняя степень окисления металла; в таблицу вошел и послед-
282 12. Простые оксиды металлов
ний член этого ряда соединений VO(OH), который изострукту-
рен гётиту и диаспору. Слои в этих структурах соединены друг
с другом связью О—Н...0 (рис. 12.21). Сравнение структуры
M3Os (рис. 12.21) с идеализированной структурой V2O5
(рис. 12.22, ж) показывает, что структура хаггита имеет близ-
кое родство со структурой V2O5, в который она переходит при
Рис. 12.21. Структуры гидроксид-оксидов ванадия VO(OHb, V3O,(OH)»
и V4O4(OH)e.
нагревании. В этих минералах наблюдается значительное иска-
жение октаэдров VOeJ например, в хаггите одно расстояние
V—О 1,82 А, а остальные пять 2,00 А (в среднем), а в долоре-
зите одно короткое расстояние 1,70 А и пять более длинных
2,00 А (в среднем).
Литература. Щ J. Metals, 1953, 5, 292. f21 Acta Chem. Scand., 1954, 8, 22U
1599; Acta Chem. Scand., I960, 14, 465. [3] Acta cryst., 1975, B31, 2688. [4] Inorg,
Chem., 1966, 5, 1808. [5] Acta Chem. Scand., 1959, 13, 377. Г61 Acta cryst., 1973y
B29, 2304. [7] Acta cryst., 1954, 7, 801. [81 Z. Kristallogr., 1961, 115, 110.
12.7.3. Оксиды молибдена и вольфрама. Весьма полезно перед
тем, как приступить к изучению материала, излагаемого в дан-
ном разделе, обратиться к обзору таких структур, сделанному
в гл. 5.
У оксидов молибдена и вольфрама наблюдается лишь об-
щее структурное сходство. Например, оба триоксида МоОз и
\VO3 построены из октаэдров МО6; налицо также тесная связь
12.7. Кислородные соединения переходных металлов 283
X
XX
X&J
XX
.ж
Рис. 12.22. а —вид с торца бесконечной цепочки, образованной из октаэдров
МОб, соединенных противоположными вершинами; б — изображение структуры
ReO3 в направлении цепочек; в-^-ж-—структуры оксидов, в которых цепочки из
октаэдров соединены также и экваториальными ребрами: в — слоистая струк-
тура МоОз; г — гипотетическая структура МпОзп| д и е — способы сочленения
двумерных блоков типа ReO3 в оксидах Ь\пОзп-\ и М„Озп-2| ж — идеализиро-
ванная структура V2O5.
между некоторыми промежуточными сложными оксидами, од-
нако среди всех оксидов этих двух металлов изоструктурными
являются только диоксиды, а молибден, например, при атмо-
сферном давлении не образует соединений, аналогичных
вольфрамовым бронзам, хотя при повышенном давлении мо-
284 12. Простые оксиды металлов
либден действительно образует бронзы со структурами, похо-
жими на структуры вольфрамовых бронз (разд. 13.8.1).
В целом структурная химия кислородных соединений молиб-
дена сложнее, чем аналогичных соединений вольфрама; причи-
ны этого пока не установлены.
Прежде чем приступить к обсуждению высших оксидов
этих металлов, необходимо упомянуть, что оба они образуют
так называемые оксиды М3О. Вторую модификацию металли-
ческого вольфрама, описываемую как «р-вольфрам», получают
такими методами, как электролиз расплавленной смеси WO3
и фосфатов щелочных металлов, или из расплава вольфрама-
тов щелочных металлов при температурах <700°С; выше этой
температуры «р-вольфрам» необратимо переходит в а-воль-
фрам. Предполагается [1], что «р-вольфрам» в действительно-
сти является оксидом W3O и что шесть атомов вольфрама и
два атома кислорода в элементарной ячейке этого соединения
(рис. 29.4) статистически располагаются по восьми позициям
(соответственно светлые и заштрихованные кружочки). В ок-
сиде Сг3О [2] атомы металла занимают позиции с шестикрат-
ной координацией, а атомы кислорода — с двукратной. В то
же время показано [3], что «р-вольфрам» может быть получен
с содержанием кислорода меньшим чем 0,01 атома на один
атом вольфрама (путем восстановления водородом оксида
WO2.9), хотя присутствие небольшого количества примесных
атомов представляется необходимым для устойчивости струк-
туры «р-вольфрама». Мо3О имеет дефектную структуру анти-
BiF3 (разд. 9.9.3); в этой структуре девять атомов молибдена
статистически занимают девять из двенадцати позиций @ 0 0)
и т. д. (четырехкратная координация), (-г--г- -г-) и т. д. (вось-
микратная координация), а три атома кислорода расположе-
ны в позициях с четырехкратной координацией (-»- -к- -у ) и т. д.
[4]. В более позднем исследовании [5] существование оксидов
состава Мо3О (или Сг3О) ставится под сомнение.
Диоксиды и триоксиды молибдена и вольфрама. Изострук-
турные диоксиды молибдена и вольфрама имеют искаженную
структуру рутила (разд. 12.2.5), а триоксиды не изоструктурны.
МоО3 имеет слоистую структуру (рис. 12.22,в), присущую
только ему одному [6]. Каждый октаэдр МоО6 двумя смежны-
ми ребрами сочленен с другими октаэдрами, а в направлении,
перпендикулярном плоскости чертежа, октаэдры соединены
друг с другом вершинами. Таким образом, в каждом окта-
эдре Мо06 три атома кислорода принадлежат трем соседним
октаэдрам, два атома кислорода — двум октаэдрам, а шестой
12.7. Кислородные соединения переходных металлов 285
атом кислорода — концевой (см. также разд. 5.3.5). Координа-
ционный октаэдр в МоО3 сильно искажен, и это искажение ок-
таэдра MoVIO6 характерно также для структур других соеди-
нений (например, гетерополикислот, разд. 11.6); о длинах свя-
зей Мо—О см. разд. 11.6.5.
Для WO3 характерны чрезвычайно сложные полиморфные
превращения, в интервале до 900 СС у него наблюдается не ме-
нее восьми фазовых переходов. Все модификации, по-видимому,
представляют собой искаженные варианты кубической струк-
туры ReO3:
—40 °С 17 °С
моноклинная (I) »¦ триклинная [7] *¦ Моноклинная (II) [8] >¦
330 °С 740 °С 900 °С
*¦ ромбическая [9] *• тетрагональная »¦ кубическая
Атом металла смещен из центра октаэдра О6, и это приводит
к разбросу в расстояниях W—О в интервале 1,7-=-2 0 А. Харак-
терной чертой изученных структур является чередование длин-
ных и коротких связей вдоль направлений осей.
Гексагональная модификация WO3 была получена единст-
венным методом — дегидратацией WO3--g-H2O [10]. Эта моди-
фикация имеет структуру гексагональной вольфрамовой бронзы
(рис. 10.11,а и 13.12,г). Однако это не «бронза», а белый по-
рошок; существование в туннелях молекул воды или посторон-
них атомов не доказано. В этой структуре октаэдры WO6 иска-
жены незначительно.
Масс-спектрометрическим и электронографическим исследо-
ваниями установлено, что в парах СгО3, МоО3 и WO3 присут-
ствуют полимерные молекулы. Молекулы М3Оэ (М = Сг, Мо,
W) имеют форму циклических «кресел», аналогичных S3Og,
с длинами связей для Сг—О (ср.) 1,68 А, Мо—ОКОнц 1,67 А,
Мо—Омоет 1,89 A, W—О (ср.) 1,77 А [11].
Литература. [11 Acta cryst., 1954, 7, 351. [2] Acta Chem. Scand., 1954, 8, 221.
[3] Z. anorg. allg. Chem., 1957, 293, 241. [41 Acta Chem. Scand., 1954, 8, 617.
[5] Acta Chem. Scand , 1962, 16, 2458. [6] Akt. Kern., 1963, 21, 357. [71 Acta cryst.,
1978, B34, 1105. [81 Acta cryst., 1969, B25, 1420. [91 Acta cryst., 1977, B33, 574.
[10] J. Solid State Chem., 1979, 29, 429. [11] J. M. St., 1971, 8, 31.
Другие оксиды. Ряд оксидов молибдена и вольфрама полу-
чают при нагревании различной длительности (вплоть до тем-
пературы 700°С) смесей металла и триоксида в вакууме [1].
Эти оксиды идентифицированы по рентгенограммам порошка,
а большинство их структур было определено из монокристаль-
ных данных. Промежуточные оксиды молибдена и вольфрама,
286 12. Простые оксиды металлов
имеющие цвета от синего до фиолетового, включают следующие
соединения: Мо4Оц [2], Мо5Ом [3], Мо8О23 [4], Мо9026 [4]
и Мо,-О47 [5]; WiS049 [6] (в ранних работах W2O5 или W4OU),
W20O58 [7], W24O70 [8], W25O73 [9] и W40On8 [Ю].
В структуре ромбической модификации Мо4Оц 3Д атомов
молибдена имеют КЧ 6, а остальные — КЧ 4. Эта структура
построена из двумерных блоков типа ReO3, соединенных между
собой атомами молибдена с КЧ 4. Структуры оксидов Мо5Ои,
МО17О47 и WisO49 относятся к иному типу; в них координацион-
ные полиэдры атомов металла — октаэдры и пентагональные
•биппрамиды (разд. 13.8).
Рис. 12.23. Кристаллическая структура Мо8О2з.
Мо8О23 и Мо9О2б, ряд смешанных оксидов и \У20О58 образуют
;.группу соединений, структуры которых построены по общему
принципу. В структуре ReO3 октаэдры связаны только верши-
нами (рис. 12.22,б). Если через определенные интервалы со-
единить октаэдры общими ребрами, то возникает ряд родст-
.венных структур, которые построены из двумерных блоков
структуры типа ReO3. Простейший пример такой структуры
приведен на рис. 12.22г, где октаэдры двух цепочек сочленены
ребрами. Штриховой линией отмечено место соединения двух
фрагментов структуры ReO3. Поскольку каждый атом кислоро-
да продолжает принадлежать двум октаэдрам МО6, сохраняет-
ся формула М«О3п. Примеры таких структур неизвестны. В бо-
лее сложных вариантах структур октаэдры МО6, сочлененные
экваториальными ребрами, принадлежат группам из 4, 6 и т. д.
«приграничных» цепочек ReO3 (рис. 12.22E и е); формулы этих
¦ оксидов М„О3п_1 и MnO3,i_2, где п зависит от периода повторяе-
мости в направлении, указанном стрелками на рис. 12.22, д
,ие [11].
Примеры простых оксидов с такими структурами — Мо8О2з
•и Мо9О26 (которые принадлежат к ряду M.nOin-i), а также
W20O58, W24O70, W25O73 и W4oOU8 (ряд М„О3„-2). Фрагмент
12.7. Кислородные соединения переходных металлов 287~
груктуры Мо8О23 изображен на рис. 12.23. Высшие члены ряда
1„6зя-1 представлены смешанными оксидами молибдена и
ольфрама, причем размеры блоков ReO3 определяются соот-
ошением вольфрама и молибдена. Возрастание п с повышени-
м содержания вольфрама может быть связано с тем обстоя-
ельством, что в WO3 октаэдры сочленяются только по верши-
ам, а в МоО3 — и по вершинам, и по ребрам.
Содержание
W, «>/о
Структура [12]
0 Мо8О2з, Мо9О26
14—24 (Mo, W)i0O29, (Mo, W)uO32
32—44 (Mo, W) i2O35
48 (Mo, W)i4O4i
В сечениях структур, изображенных на рис. 12.22, г — е,.
рисутствуют в каждом случае одна, две или три пары смеж-
ных октаэдров МОб, сочлененных общими ребрами; предельная
труктура (рис. 12.22, ж) соответствует составу M2Os. Она^
[редставляет собой идеализированную структуру V2O5.
разд. 12.7.2).
Очень искаженный координационный полиэдр ванадия мо-
<ет быть описан либо в виде квадратной пирамиды, либо (при
¦ключении шестого атома кислорода на гораздо большем рас-
тоянии) в виде сильно искаженного октаэдра. Хотя шестой
том кислорода находится на расстоянии почти в два раза,
юлыием, чем расстояние до ближайшего атома кислорода,
!юбопытное соответствие между идеализированной структурой
f2O5 (рис. 12.22,ж) и структурой МоО3 (рис. 12.22, в), веро-
[тно, может быть причиной значительной растворимости МоОз
i V2O5. При 650 °С —30% атомов ванадия может быть замеще-
ю на атомы молибдена, и структура (Мо0,зУо,7J05 [13] в об-
цем имеет тот же тип, что и V2O5. Однако МоО3 не растворяет
/2О5 с образованием твердого раствора, так как это потребова-
ю бы избытка атомов металла в структуре.
В работе [14] описана серия оксидов молибдена другого
'яда МоХзл-m+i («=13, т = 2; и=18, т = 3; га = 26, т = 4), ос-
юванных на структуре типа МоО3.
Два соединения, изоструктурные МоО3, упоминаются в дру-
'их главах, а именно Mo4Oni2F0,8 (оно включено в табл. 10.11
^ак соединение с формулой Mo4OnF) и Мо2О5(ОН)
(разд. 13.8.4). Окружение молибдена в этих двух соединениях.
288 12. Простые оксиды металлов
почти одинаковое—A + 4+1) в отличие от координации B+
+ 2 + 2) в МоО3:
13. СЛОЖНЫЕ ОКСИДЫ
Расстояния до 6 ближайших соседей, \
Мо4О„^0, 1,65 1,95 (четыре) 2,31
McuO10(OHh 1,69 1,96 (четыре) 2,33
МоО3 1,67 1,73 1,95 (два) 2,25
2,33
Оксид-фторид MoO2,4F0,6 с более высоким содержанием фто-
ра имеет кубическую структуру (типа ReO3) *.
Литература. [1] Acta Chem. Scand., 1959, 13, 954; Inorg. Chem., 1966, 5, 136.
[2] Acta Chem. Scand., 1964, 18, 1571. [3] Acta cryst., 1975, B31, 1666. [4] Acta
Chem. Scand., 1948, 2, 501. [51 Acta Chem. Scand., 1963, 17, 1485. [61 Akt Kern,
1963, 21, 471. [7] Akt. Kern., 1950, 1, 513. [8] J. Solid State Chem., 1980, 35, 120
(9) Acta cryst., 1976, B32, 2144. [101 Acta Chem. Scand., 1965, 19, 1514. [11] Acta
¦cryst., 1953, 6, 495. [12] Acta Chem. Scand., 1955, 9, 1382. [131 Acta Chem Scand,
Л967, 21, 2495. [141 Akt. Kern., 1963, 21, 443.
* Более детальный анализ кристаллохимии оксидов fa также оксид-гало-
генидов, галогенидов и соединений других классов) молибдена и вольфрама
(а частично также Ti, Nb, Та), включая косвенные данные о строении, полу-
ченные из ИК-, КР-спектроскопии и другими физико-химическими методами
см. \Порай-Кошиц М. А., Атовмян Л. О. Кристаллохимия и стереохимия соеди-
нений молибдена. — М.: Наука, 1974, 232 с] —Прим. ред.
13.1. Введение
При обсуждении различий между солями оксокислот и слож-
ными оксидами в гл. 11 подчеркивалось, что между этими дву-
мя группами соединений не существует четкой и резкой грани-
цы. Что касается кристаллических структур сложных оксидов,
то их можно разделить на два основных класса.
I. Атомы занимают главным образом те же позиции, что и
в простых оксидах.
а) У большинства простых оксидов атомы металлов нахо-
дятся в одной степени окисления, и все атомы металла имеют
либо одинаковое, либо приблизительно одинаковое окружение.
(Исключения: структура С-М2Оз, где имеются незначительные
различия между двумя типами искаженных октаэдров, струк-
тура p-Ga2O3) в которой металл имеет тетраэдрическую и окта-
эдрическую координацию, и структура В-М2О3 с КЧ атомов
металла 6 и 7.) В сложных оксидах с такой структурой может
встречаться либо случайное распределение атомов двух или
более сортов (статистическая структура), либо упорядоченное
расположение атомов (сверхструктура).
б) Если простой оксид содержит металл в двух степенях
окисления, то разные сорта ионов металла могут иметь различ-
ное окружение, как, например, в РЬ3О4 (КЧ ионов РЬ(Н) и
Pb(IV) 3 и 6 соответственно) или в Еи3О4 (КЧ ионов Ей (III)
и Ей(II) 6 и 8). Подобные структуры могут иметь и сложные
оксиды, причем чаще встречаются упорядоченные структуры
(как в простых оксидах), чем статистические.
Структурные типы, наиболее характерные как для простых,
так и для сложных оксидов, приведены з табл. 13.1.
II. В структурах некоторых сложных оксидов разные сорта
ионов металла имеют столь различное окружение, что такие
типы структур не реализуются в простых оксидах. Одна из
возможных причин заключается в том, что различие в разме-
рах ионов, необходимое для обеспечения устойчивости структу-
ры, слишком велико (например, в перовските и родственных
ему структурах) либо металл не может иметь две (или более)
степени окисления, необходимые для сохранения электроней-
тральности структуры. (В структуре шеелита, например, необ-
ходимо присутствие равных количеств атомов с координацион-
19—985
290 13. Сложные оксиды
Таблица 13.1. Структуры, характерные как для простых,
так и для сложных оксидов
Структура
NaCl
Вюртцит
Р-ВеО
Рутил
Корунд
С-М2О3
Колумбит
Вольфрамит
Структура
Шпинель
CaFe2O4
Псевдобрукит
)
Простой оксид
MgO и т. д.
ZnO
|3-ВеО
TiO2 и т. д.
а-А12О3
Мп2О3 и т. д.
ReO2 (высокотем-
пературный)
<х-РЬО2
Оксид с металлом
в двух степенях
окисления
a-Sb2O4
P-Sb2O4
Fe3O4 и т. д.
РЬзО4
Еи3О4
Ti3O5
Мп5О8
ТЬ7О,2
Nb12O29
Сложный оксид
Статистическая
структура
Li2Ti03, LiFeO2
СгТаО4> CrNbO4
CaUO3
Статистическая
структура
Обращенные
шпинели
Ti2Nb10O29
Свирхструктура
LiNiO^, LiInO2
LiGaO2
LiAlOo
ZnSb2Oe
FcTiO3
LiNbOs
FeNb2Oc-
NiWO4
Упорядоченная
структура
SbNbO4; SbTaO4
BiSbO4
MgAl2O4
LiAI5O8 (низкотемпе-
ратурный)
ZnSb2O4
SrEu,O4
Fe2Ti05
Cd2Mn,O«
UVIM6ln0.2
ными числами 8 и 4 и суммарной степенью окисления 8.) Сле-
дует заметить, что в структурах сложных оксидов позиции
с различными координационными числами не обязательно заня-
ты атомами разных металлов. Как только что было отмечено,
в некоторых простых оксидах ионы одного сорта занимают две
кристаллографически неэквивалентные позиции; такое же яв-
ление наблюдается в структурах некоторых сложных оксидов.
В структуре граната (разд. 13.6.5) ионы металла занимают по-
зиции с КЧ 4, 6 и 8. В структурах некоторых гранатов ионы од-
ного сорта распределены по позициям с КЧ 4 и 6, в других гра-
натах— с К.Ч 6 и 8. Однако маловероятно, чтобы все три типа
позиций в кристалле были заняты ионами одного сорта. Струк-
туры, принадлежащие ко второму основному классу, могут
быть охарактеризованы как структуры, свойственные исключи-
тельно сложным оксидам.
13.2. Оксиды АВО2 291
Структуры сложных оксидов можно описать таким образом,
чтобы при этом подчеркивались их характерные особенности.
Именно таким образом многие из них были описаны в преды-
дущих главах, что позволило выделить следующие типы
структур:
структуры, содержащие цепочки и слои, построенные из
простых плоских сеток, или каркасы, построенные из простых
трехмерных сеток (гл. 3);
структуры, в которых атомы кислорода имеют плотнейшую
упаковку, а атомы металла занимают тетраэдрические и (или)
октаэдрические пустоты. В оксидах А^ВтОзя плотнейшую упа-
ковку образуют совместно атомы А и 30 (гл. 4);
структуры, не обязательно имеющие плотнейшую упаковку,
но построенные из тетраэдров и (или) октаэдров (гл. 5).
Проведенное таким образом распределение структур по
группам подчеркивает геометрию или топологию структур;
в данной же главе за основу классификации взят «химический»
признак. Сначала рассмотрим более простые структуры, распо-
ложенные в порядке усложнения химических формул, а затем
посвятим отдельные разделы некоторым выборочным группам
соединений.
Здесь следует сделать одно общее замечание. Вследствие
близости размеров ионов F~ и 02~ и величин их электроотрица-
тельностей существует много общего в структурах фторидов и
оксидов с одинаковым типом брутто-формулы, а также в
структурах оксид-фторидов и оксидов (табл. 10.11); кроме того,
известны многочисленные примеры изоструктурности сложных
хлоридов и сложных оксидов (табл. 10.2).
13.2. Оксиды АВО2
Многие оксиды MIMIII02 имеют структуры, близкие структурам
оксидов М"О (табл. 13.2). К «октаэдрическим» структурам от-
носятся неупорядоченные структуры типа NaCl, а также раз-
личные сверхструктуры, описанные в разд. 6.1. Тетрагональная
сверхструктура такого типа приведена на рис. 6.4, а связь меж-
ду ромбоэдрической сверхструктурой и структурой NaHF2
{который здесь удобнее записывать как HNaF2) описана
в разд. 6.7.2. Сложные оксиды натрия и редкоземельных эле-
ментов NaLnO2 имеют структуры, принадлежащие к трем ти-
пам сверхструктур NaCl:
Lu Yb Tm Er Y Ho Dy Tb Gd Eu Sni Nd ' La
'3* °>82 0,89 0,94 1,06 A.
< моноклин: >
< ромбоэдры-v. > < тетрагон. »
19*
292 13. Сложные оксиды
Многочисленные соединения серебра и меди состава
М1МП1О2, где МШ = А1, Cr, Co, Fe, Ga, Rh, а также PdCo02,
PdCrO2) PdRhO2 и PtCo02 имеют структуру CuFeO2 [1]. Мето-
дом мессбауэровской спектроскопии установлено, что СиРеОг
содержит ионы Fe3+ (и, следовательно, ионы Си+); поэтому,
по-видимому, в соединениях палладия и платины благородные
металлы имеют формальную степень окисления +1. (Сущест-
вуют некоторые сомнения относительно стехиометрии PtCoO2;
Таблица 13.2. Структуры оксидов MW'Oj
Координационный
полиэдр атомов
металлов
Структура
Примеры
Тетраэдр у обоих
Октаэдр у обоих
М1 линейная
Мш октаэдр
Сверхструктура сфалерита
Сверхструктура вюртцита
Р-ВеО
Неупорядоченный NaCl
Сверхструктура NaCl:
тетрагональная
ромбоэдрическая
кубическая
моноклинная
HNaF2 (CuFeO2)
LiBO2 (высокого давления)
[1]
LiGaO2 [21
Y-LiA102 [3]
LiFeO2 (высокотемп.),
NaErO2
LiFeO2, LiInO2 [4]
LiScO2) LiEuO2
LiNiO2, LiVO2
NaFeO2) NaInO2 [5]
LiVO2 (высокого давления)
NaLnO2 [6]
CuCrO2 [7]
6-AgFe02 [81
[1] J. Chem. Phys., 1966, 44, 3348. [2] Acta cryst., 1965, 18, 481. [3] Acta cryst., 1965,
19, 396. [4] J. Chem. Phys., 1966, 44, 3348. [5] Z. anorg. allg. Chem., 1958, 295, 233.
[6] J. Phys. Chem. Soc, 1972, 33, 1927; Acta cryst., 1972, B28, 722. [7] J. Am. Chem. Soc,
1955, 77, 896. [8] Acta cryst., 1972, B28, 1774,
при наличии дефицита по металлу оксид имеет, вероятно, со-
став Pto,82+Co0,83+02.) Предполагается, что в соединениях пал-
ладия и платины имеется связь металл — металл. В соединени-
ях АВО2 со структурой HNaF2 каждый атом А и два ближай-
ших атома кислорода расположены линейно, но, помимо этого,
каждый атом А окружен шестью одноименными атомами, так
что координационное окружение палладия и платины в этих
соединениях, вероятно, может быть описано как 2 + 6 (гекса-
гональная бипирамида), причем шесть экваториальных ато-
мов— это атомы металла (табл. 13.3). Делокализация элек-
тронов в гексагональных слоях, состоящих из атомов металла,
является причиной возникновения металлического типа прово-
димости, что отвечает формуле Pt"ConiO2 (e).
Метабораты МВО2 обычно содержат метаборат-ионы, но при
высоких давлениях LiBO2 имеет сверхструктуру сфалерита.
13.3. Оксиды АВО3 293
Расшифрованы некоторые структуры оксидов МПМ"О2, со-
держащие ионы, значительно различающиеся по размерам.
В структуре SrZnO2 [2] тетраэдры ZnO4 (связанные всеми вер-
шинами) образуют слои, а ионы Sr2+ с КЧ 7 расположены меж-
ду слоями (см. слой на рис. 5.6). В структуре BaZnOs [3] тет-
раэдры ZnO4 образуют каркас типа кварца, в котором ионы
Ва2+ занимают позиции с координационным окружением в ви-
де неправильного восьмигранника. В отличие от BaZnO2 (и изо-
структурных ему оксидов кобальта и марганца) BaCdO2 [4]
Таблица 13.3. Расстояния металл — металл в оксидах ABOj
Соединение
CuFeO2
AgFeO2
PtCoO2
PdCo02
Расстояние
A-6A, A
3,04
2,83
о
Расстояния в металле, А
2 89 (Аг) I ПОЛУПРОВ°ДНИКИ
2,77 (Pt) 1 металлические
2,75 (Pd) J проводники
имеет структуру с довольно искаженным D+1) координацион-
ным окружением иона кадмия, а КЧ бария в ней равно 7.
Структура BaNiO2 [5] построена из слоев перовскитного типа,
из которых удалена 7з атомов кислорода. Слои смещены друг
относительно друга так, что при этом образуется несколько
искаженная ГПУ; атомы никеля располагаются между слоями
в позициях, которые должны были бы иметь октаэдрическое
окружение, однако из-за отсутствия двух атомов кислорода в
окружение атомов никеля входят только четыре атома кисло-
рода, лежащие в одной плоскости.
Литература. [1] J. Solid State Chem., 1971, 10, 713, 719, 723. [21 Z. anorg. allg.
Chem., 1961, 312, 87. [3] Acta cryst., 1960, 13, 197; Z. anorg. allg. Chem., 1960,
<5O5, 241. [4] Z. anorg. allg. Chem., 1962, 314, 145. [5] Acta cryst., 1951, 4, 148.
13.3. Оксиды ABO3
Среди оксидов состава АВО3 выделяют две наиболее многочис-
ленные группы соединений:
1) оксиды, содержащие ионы А и В приблизительно одного
размера, подходящего для октаэдрической координации иона-
ми кислорода (например, Зй-ионы М2+ и М3+; Zn2+, Me2+ In3*
и т. д.); s
2) оксиды, содержащие ионы гораздо больших размеров
таких, что эти ионы вместе с ионами кислорода могут создать
плотноупакованные слои АО3.
294 13. Сложные оксиды
13.3. Оксиды АВО3 295
Оксиды первой группы имеют структуры оксидов М2О3 со
статистическим или упорядоченным размещением ионов А и В,
а в некоторых случаях — особые структуры, свойственные лишь
небольшому числу соединений (например, LiSbO3). В табл. 13.4
приведены примеры структур первой группы и соответствую-
щая литература. Структура ильменита FeTiO3 и структура
Условная
ipynna
1
2
Коорди-
национные
числа
атомов
А и В
6:6
12:6
Таблица 13.4. Структуры оксидов
Структура
С-М2О3
Корунд:
статистиче-
ская
сверхструк-
тура
Ильменит
LiNbO3
LiSbO3
Структуры с
плотнейшими
упаковками
Примеры
ScTiO3, ScVO3
А3+В3+О3
А2+В4+О3
А+Вб+О3
BiSbO3
(См. табл. 13.5)
АВО
3
Литература
Inorg. Cherr
Acta
J.
cryst.,
Solid
., 1967, 6
1964, 17,
, 521
240;
State Chem.,
1970. 1, 512
Acta
CO
cryst.,
ooo
Acta Chem.
8,
Acta
9,
1021
Chem.
1219
1968,
Scand.,
Scand.,
A24,
1954,
1955
ЫМЬОз отличаются друг от друга (рис. 6.19) распределением
двух сортов ионов по данной системе октаэдрических пустот.
В то же время в структуре LiSbO3 ионами металла заселена
уже иная система пустот (рис. 4.24, е), а оксиды NaSbO3 и
ЫаВЮз имеют структуру ильменита. Как правило, оксиды пере-
ходных металлов М3+М3+О3 имеют неупорядоченную структуру
корунда, а оксиды М2+М4+О3— сверхструктуру ильменита, на-
пример:
(при высоком давле-
нии)
(искаженная структу-
ра)
Корунд
Ильменит
FeV, MnFe,
TiV
FeTi
CoTi
NiTi
FeCr,
VCr
NiCr
CoMn4+
NiMn
MgMn
InFe
GaFe
CoV4+
NiV
MgV
Соединения KSbO3, LuMnO3 и PbReO3 (а также изострук-
турные им оксиды) имеют структуры, которые нельзя отнести
ни к первой, ни ко второй группе. В структуре KSbO3) описан-
ной в разд. 5.3.5 (рис. 5.33), ионы калия занимают пустоты
каркаса, образованного октаэдрами SbO6, сочлененными общи-
ми ребрами. При обычных температурах ионы калия располо-
жены упорядоченно (пространственная группа РпЗ), а в оксн-
де, полученном из ильменитной модификации KSbO3 при высо-
ких давлении и температуре, калий образует неупорядоченную
структуру (также кубическую, пространственная группа 1глЗ)
с тем же каркасом. При нагревании до 1200 °С при атмосфер-
ном давлении он переходит в упорядоченную модификацию. Все
соединения MSbO3 (M = Li, Na, К, Rb, Tl, Ag) образуют неупо-
рядоченные структуры; соединение лития вследствие миграции
ионов Li+ по туннелям структуры является ионным проводни-
ком [1]. В оксиде LuMnO3 [2] ионы металла имеют К.Ч 5 и 7.
В некоторых системах сложных оксидов образуются струк-
туры типа пирохлора А2В2О7-.* с дефицитом по кислороду, ус-
тойчивые при х=1 (например, PbReO3 [3], BiYO3, AgSbO3,
BiScO3, PbTcO3). Под воздействием давления они могут перехо-
дить в фазу со структурой перовскита, как, например, в случае
соединений BiYO3 и BiScO3. Этот переход включает в себя пере-
группировку связанных вершинами октаэдров ВО6 с образова-
нием другого трехмерного каркаса и увеличением КЧ атомов А
до 12. В других системах фаза, устойчивая при атмосферном
давлении, имеет дефектную структуру пирохлора с .v<l. На-
пример, при нагревании компонентов, взятых в стехнометриче-
ском соотношении, образуется РЬгИигО?-*, который при 1400 СС
и давлении >90 кбар превращается с потерей кислорода в
PbRuO3 со структурой типа перовскита.
Структуры, построенные из слоев АО3 с плотнейшей упаков-
кой, имеют состав АВО3 в том случае, если все октаэдрическне
пустоты заняты атомами В. Эти структуры, а также некоторые
родственные им структуры, в которых часть пустот не заселе-
на, обсуждаются в следующем разделе.
Литература. [1] J. Solid State Chem., 1974, 9, 345. [21 Acta cryst., 1975. B31,
2770. [3] Materials Res. Bull., 1969, 4, 191.
13.3.1. Структуры, построенные из плот но у пакованных слоев
АО3. Некоторые катионы, сравнимые по своему размеру о ио-
ном О2~, образуют плотноупакованные слои АО3, которые могут
чередоваться в различной последовательности. Меньшие по раз-
меру катионы занимают октаэдрические пустоты, находящиеся
между группировками из шести ионов О2~, с образованием
структур типа АлВтО3п. Некоторые из таких структур были
описаны в гл. 4, а в гл. 5 указывалось, что возможно альтерна-
S96 13. Сложные оксиды
Таблица 13.5. Структуры, в основе которых лежат
плотноупакованные слои AOj (ft — гексагональная, с — кубическая)
Число
слоев
2
Q
и
4
6
9
Тип
плотневшей
упаковки
h
с
he
hcc
chh
Отвошевне
числа запол-
ненных МОе
с вакантным
2:1
3:1
4:1
5:1
Фрагменты,
образован-
ные из со-
единенных
гранями
октаэдров
Цепочки
Пары
>
Группы по 3
Тип плот-
нейшей
упаковки
h
hhc
ccch
cchh
hhccc
hhcccc
Примеры
BaNiO3
Перовскиты
Высокотемператур-
ный ВаМпОз
Гексагональный
ВаТЮз
BaRuO3
Примеры
Ba3W2nO9
Ba3Re2nO9
Sr4Re2SrnOi2 1
Sr4Re2Mgn012 J
Ba5Ta4DOi6
ВавВзшаШз018
Литература
Acta cryst, 1976, В32,
2464
Acta cryst, 1962, 15, 179
Acta cryst, 1948, 1, 330
Inorg. Chem, 1965, 4,
306
Литература
Z. anorg. allg. Chem,
1979, 455, 65
Inorg. Chem, 1978, 17,
699
Inorg. Chem, 1965, 4,
235
Acta cryst, 1970, B26,
102
Z. anorg. allg. Chem.,
1979,448, 119
тивное описание этих структур, при котором за основу берется
способ сочленения октаэдров ВОб друг с другом. Октаэдры объ-
единяются только вершинами и (или) гранями; в результате
сочленения гранями образуются группировки, указанные
в верхней половине табл. 13.5, которая включает только струк-
туры типа АВОз, т. е. такие структуры, в которых атомы В за-
нимают все октаэдрические позиции. На рис. 13.1 приведена
структура гексагонального ВаТЮ3 в сравнении со структурой
перовскита, а на рис. 13.2 — сечения трех структур, показы-
вающие способы сочленения октаэдров ВОб. В дальнейшем рас-
смотрим детально только структуру перовскита.
Наиболее часто встречаются структуры с 2, 3, 4, 6 и 9-слой-
ными упаковками, однако последовательность слоев может
быть изменена под воздействием давления, приложение которо-
го неизбежно сопровождается повышением температуры. Сопо-
• Ti
• B.i
О О
Рис 131 Кристаллические структуры титаната бария BaTiOs. в — гексагональ-
' ная модификация; б —кубическая модификация.
Рис. 13.2. Сечения структур, построенных из слоев АСу, показаны способы
сочленения октаэдров ВОв посредством общих вершин или граней, о — 9-слой-
ная структура BaRuO8; б —5-слойная структура Ba5Ta40iS (показаны только
октаэдры, заселенные атомами тантала); в— 12-слойная структура A4Re|MO|j
(атомы А опущены и показаны только 9 слоев с плотнейшей упаковкой).
298 13. Сложные оксиды
ставлепие имеющихся данных показывает, что «степень гекса-
гональностп» структуры отдельного соединения уменьшается
под действием давления, а также с уменьшением размера ио-
нов А в ряду таких соединений, как BaMnO3, SrMnO3 и СаМпО3
(табл. 13.6). Те же базисные структурные типы АВО3 харак-
терны и для следующих двух структурных групп:
Таблица 13.6. Влияние давления на структуры АВО3 и АВХ3
с плотнейшими упаковками11
Тип плотней-
шей упа-
ковки
Обозначение6
Группы из
сочлененных
гранями
октаэдров
h
2Н
Бесконечные
цепочки
CsNiF3-I —
5
BaMnO3-I
hhc
9R
C)
—>CsNiF3-II
кбар
BaRuO3-I -*
15
-*-BaMnO3-I
30 кбар
he
4Н
B)
50 кбар
BaRuO3-H —
кбар 30
-«>ВаМпО
90 кбар
SnMnO3-I
50 ь
cch
6Н
B) + A)
CsMnFs-I -
CsNiF3-III
BaRuO3-III
<бар
,-Ш
-*-SrMnO3-II
!бар
с
ЗС
—
CsMnF3-II
СаМпОз
аОб оксидах SrMnOj и ВаМпОз см. рабош [J. Solid State Chem., 1969, I, 103, 505;
1971, 3. 323].
H — гексагональная, R — ромбоэдрическая, С — кубическая.
1) часть позиций В занята ионами Li+. Это имеет место
в структурах с менее распространенной последовательностью
слоев, таких, как Ba4Nb3Li0i2 (8-слойная упаковка) и
Ba5W3Li2Oi5 A0-слойная упаковка) [1]. В соединении
Ba5W3Li2Oi5 колонки связанных вершинами октаэдров пооче-
редно заселены атомами лития и вольфрама, а пары октаэдров,
соединенных гранями, заняты статистически атомами Li + W.
В кристаллах данного типа катионы расположены таким обра-
зом, чтобы свести к минимуму отталкивание между высокоза-
рядными ионами М5+ или М6+;
2) некоторые из позиций В вакантны. Примеры таких струк-
тур, расположенные в порядке уменьшения числа октаэдриче-
13.3. Оксиды АВО-
299
ских вакансий, приведены в нижней части табл. 13.5. Заполне-
ние 2/з позиций В соответствует соединениям с простыми форму-
лами, например Ba3W2Og и Ba3Re209 (последнее соединение,
строго говоря, имеет формулу Ba3Re2_xO9). В структуре
Ва3\\'2Оу, которая похожа на структуру Cs3Tl2Cl9 (разд. 4.6),
имеются пары октаэдров \\'О6 с общими гранями; атомы
вольфрама смещены из центров своих октаэдров, что приводит
к расстояниям W—W 2,90А. В то же время в девятислойной
структуре Ba3Re209 октаэдры ИеОб разделены пустыми октаэд-
рами О6. Проекция этой структуры похожа на сечение структу-
ры BaRuO3 (рис. 13.2,а), причем в идеальной стехиометриче-
ской структуре в каждой группе из трех октаэдров средний ок-
таэдр не заселен.
Примечательной особенностью подобных оксидов является
присутствие высокозарядных ионов, таких, как Ni4+ или Fe4+,
в смежных октаэдрах с общими гранями, в частности в беско-
нечных колонках, построенных из сочлененных гранями ок-
таэдров (структура BaNiO3). Наличие общих граней, как пра-
вило, сопровождается возникновением укороченных расстояний
металл — металл (например, Ru—Ru 2,55 А в BaRuO3), а так-
же аномальными магнитными и электрическими свойствами.
Пример структуры BaNiO3 свидетельствует о том, что наличие
сочлененным по граням октаэдров не обязательно указывает на
существование связи металл—металл. Хотя в BaNiO3 расстоя-
ние Ni—Ni равно всего 2,41 А, что даже короче, чем в металле
B,49А), это вещество не обладает металлической проводи-
мостью; это означает, что связь Ni—Ni отсутствует. В чисто
ионном кристалле должно проявляться сильное отталкивание
между ионами Ni4+, находящимися на таком расстоянии. Одна-
ко расстояние О—О в грани, объединяющей октаэдры, равно
всего 2,47 А, что значительно меньше, чем расстояния между
слоями B,76 А) и в слоях C,16 А); это означает, что ионы Ni4+
экранированы друг от друга вдоль оси с (Ni—О 1,86А)*.
Многие оксиды АВО3, полученные при различных темпера-
турах, имеют разную последовательность слоев, например
ВаМпОз B, 4, 6, 8, 10, 15-слойные упаковки) [2] и ВаСгО3
D, 6 и 27-слойные упаковки) [3], однако из всех фаз «ВаМпОз»
только двухслойная модификация соответствует стехиометриче-
скому ВаМпО3. Фазы, полученные при высоких температурах,
имеют возрастающие отклонения от стехиометрии; данное
утверждение справедливо также для BaFeO3, состав которого
зависит от температуры отжига и атмосферы печи. Эти пере-
* Само искажение октаэдра Ni, приводящее к уменьшению угла О„№Оч
(где Ом — атом кислорода, мостиковый в паре октаэдров) до 83 вместо 90 ,
указывает на отталкивание ионов. — Прим.. ред.
300 13. Сложные оксиды
менные определяют долю ионов Fe4+; например, BaFeC>2,5 со-
держит все железо в степени окисления 3 + , в то время как
фаза с 6-слойной упаковкой имеет формулу BaFeO2,67 [4] и со-
держит !/з ионов железа в степени окисления 4 + . Модифика-
ции соединений «АВО3» с различной последовательностью сло-
ев довольно часто, но неточно называют политипами, вероятно,
за неимением более подходящего термина. Следует отметить,
что такой же термин используют для модификаций СсПг, ZnS
и SIC, имеющих различную последовательность слоев, однако
в этом случае политипы являются стехиометрическими соеди-
нениями.
Литература. [1] Acta cryst., 1974, ВЗО, 816. [2] Acta cryst., 1976, В32, 1003.
[3] J. Solid State Chem., 1980, 34, 59. [4] Acta cryst., 1973, B29, 1217.
13.3.2. Структурный тип перовскита. Структуру перовскита
имеют некоторые сложные галогениды и сульфиды и очень мно-
гие сложные оксиды. Последняя группа соединений чрезвычай-
но многочисленна, так как сумма зарядов А+В ( + 6) может
быть получена как сумма 1 + 5, 2+4 или 3 + 3, а также более
сложными способами, как, например, в соединениях
Pb(B'1/2B"i/2)O3 (где B'=Sc или Fe; B" = Nb или Та) или
Рис. 13.3. а —структура перовскита у соединений АВО3 (или АВХ3); б —кри-
сталлическая структура ReC>3.
в соединениях La(B'i/2B"i/2)O3 (где B'=Ni, Mg и т. д., В"=»
= Ru(IV) или Ir(IV)). К тому же многие соединения типа
АВО3 имеют по 4 или 5 полиморфных модификаций, некоторые
из них являются лишь незначительными искажениями наибо-
лее симметричной модификации типа перовскита. Изучение
этих соединений при высоких давлениях дает еще больше при-
меров проявления полиморфизма (например, 1пСгО3 и TlFeO3).
Структура перовскита таких соединений, как CaFeO3 (высоко-
го давления), SrFeOe и ВаРеОз, представляет интерес как при-
13.3. Оксиды АВО3 301
мер стабилизации иона с высокой степенью окисления (Feiv)
в оксидных структурах.
«Идеальная» структура перовскита (рис. 13.3, а) характе-
ризуется кубической симметрией, атомы А окружены 12, а ато-
мы'В— 6 "атомами кислорода. Известно сравнительно немного
соединений, имеющих такую идеальную кубическую структуру,
а большинство (включая сам минерал перовскит СаТЮ3 [1])
представляют собой слегка искаженные варианты с более низ-
кой симметрией. Примеры соединений со структурой перовски-
та приведены в табл. 13.7.
Таблица 13.7. Соединения со
Идеальная кубическая структура
По крайней мере хоть одна поли-
морфная модификация имеет сле-
дующую искаженную элементарную
ячейку (а*»4 Л):
кубическую (С)
тетрагональную (Т)
ромбическую (О)
ромбоэдрическую (R) :
Искаженные кратные (па) элементар-
ные ячейки
структурой типа перовскита
SrTiOs,
SrSnO2,
Ва2гОз
ВаСеОз
EuTiO3,
ВаТЮз
KNbO3
КТаОз
RbTaO3
РЬТЮз
СаТЮз,
РЬНЮз
PbTiO3
NaNbO
NaNbO
SrZrO3, SrI-НОз
SrFeO,,
ВаНГОз, BaSnO3
LaMnO3
(С, Т, О, R)
(С, Т, О, R)
(С,?)
(С, Т)
(С, Т)
GdFeO3, NaNbO3
LaCrO3
(низкотемпературный)
з (низкотемпературный)
з (высокотемпературный)
Уже отмечалось (разд. 5.3.5), что в идеальной структуре
ReO3 (рис. 13,3,6) октаэдры могут быть повернуты друг отно-
сительно друга, так что в итоге образуется структура АХ3
¦с ГПУ. В структуре перовскита существует такой же октаэдри-
ческий каркас, и поэтому октаэдры в этой структуре также мо-
гут быть повернуты различными способами с образованием ти-
пов координационного окружения атомов А, отличающихся от
кубооктаэдра (координационное число 12) в идеальной куби-
ческой структуре. Например, в соединении GdFeO3 [2] КЧ га-
долиния понижено до 8 (слегка искаженная двухшапочная
тригональная призма), в то время как в некоторых оксидах
AC3B4Oi2 (разд. 13.3.2) координационное число атомов А оста-
ется равным 12, но полиэдр приобретает форму икосаэдра,
а КЧ атомов С понижается до 8. (В этой связи см. также
рис. 4.4, а и описание структуры CoAs3 в разд. 6.6). Такие раз-
новидности структур перовскита имеют более низкую симмет-
302 13. Сложные оксиды
рию и представляют интерес в связи с диэлектрическими и
магнитными свойствами этих соединений, например многие со-
единения являются сегнетоэлектриками (в частности, ВаТЮ3),
другие — антисегнетоэлектриками (PbZrO3 и NaNbO3)
(разд. 13.3.2); известны также соединения с ферромагнитными
(ЬаСоо.гМпо.вОз) и антиферромагнитными свойствами (GdFeO3,
LaFeO3 и др.).
Сложный оксид ВаТЮ3 («титанат бария») замечателен тем,
что он имеет пять кристаллических модификаций, три из кото-
рых— сегнетоэлектрики. Структура высокотемпературной гек-
сагональной модификации, устойчивой от 1460 °С до плавления
A612 °С), уже была описана. Ниже приведена схема поли-
морфных превращений ВаТЮ3.
>• —80° С -< »¦
ромбоэдриче- ромбическая;
екая; ось по- ось поляриза^
ляризации: ции: диаго-
объемная диа- наль грани
гональ куба куба
+5° С-« »20° Сч—И46О°С ч—>1612°С
тетрагональ- (темпе- куби- гекса-
ная; спонтан- ратура чес- гональ-
ная поляри- Кюри) кая ная
зация вдоль
оси с (ребро
исходного
куба)
Сегнетоэлектрики
KNbO3, очень похожий на ВаТЮ3, имеет три модификации
(тетрагональная, ромбическая и ромбоэдрическая), в то время
как NaNbO3 обладает совершенно другими диэлектрическими
свойствами и его фазовые переходы (при 350, 520 и 640 °С)
имеют другой характер [3].
Пытаясь объяснить искажения кубической структуры у ок-
сидов АВО3, их вначале рассматривали как чисто ионные кри-
сталлы. Из геометрии структуры следует, что для «идеальной»
структуры справедливо следующее соотношение между радиу-
сами ионов А, В и О2~:
га + го = У2 (/"в + го)
В действительности кубическую структуру перовскита (либо
слегка искаженные ее варианты) имеют соединения, ионы кото-
рых могут точно не подчиняться этому уравнению, что было от-
ражено введением «фактора толерантности»:
Если размеры ионов заданы приблизительно правильно, то
должно выполняться только одно дополнительное условие —
злектронейтральность структуры, т. е. сумма зарядов А и В
должна быть равной 6.
13.3. Оксиды АВО3 303
Оказалось, что для всех соединений со структурой типа пе-
ровекпта «фактор» t лежит приблизительно в интервале 0,80-г-
-=-1,00 (при более низких t соединения имеют структуру ильме-
нита), для идеальной кубической структуры />0,89. Однако,
в настоящее время установлено, что хотя в некотором задан-
ном ряду соединений АВО3 (с одним и тем же А или В) ис-
пользование самосогласующегося набора ионных радиусов дей-
ствительно дает возможность использовать фактор толерантно-
сти t для прогнозирования степени искажения от идеальной
структуры, невозможно провести сравнение двух серий перов-
скитоподобных соединений, в которых меняется и А, и В, так
как эффективные ионные радиусы не являются постоянными
для всех кристаллов. Например, в соединениях иттрия разброс
расстояний Y—О очень велик и составляет 0,09 А (в соединени-
ях железа разброс расстояний Fe—О 0,05 А). Более того, все
вышесказанное относится к ионным радиусам, определенным по
Гольдшмиту. Если используются другие «ионные радиусы» (на-
пример, по Полингу), то связь между фактором / и степенью
отклонения от кубической структуры не такая простая.
Изучение твердых растворов показывает, что описанная
выше картина чрезвычайно упрощена. Например, замещение
Ва2+ меньшими по размеру ионами, такими, как Sr2+ или РЬ2+,
в А-позициях, казалось бы, должно оказывать такой же эф-
фект, как и замещение Ti4+ более крупными Zr4+ или Sn4+
в В-позициях. И в самом деле, замена титана цирконием или
оловом снижает температуру Кюри у ВаТЮ3; замена бария
стронцием дает такой же эффект, однако в случае меньшего по
размеру иона РЬ2+ (также вместо Ва2+) эффект оказывается
противоположным. В действительности ситуация еще более
сложная, так в системе (Ва, Pb)TiO3 по мере того, как свинец
замещает барий, высокотемпературная точка перехода смеща-
ется вверх, а две низкотемпературные точки перехода смещают-
ся вниз по температурной шкале. В чистом PbTiO3 переход
при 490 °С сопровождается такой обширной перестройкой
структуры, что при охлаждении ниже температуры Кюри про-
исходит разрушение больших кристаллов.
Расшифровка структур тетрагональных модификаций
ВаТЮ3 [4] и РЬТЮз [5] прекрасно демонстрирует большие
возможности, открывающиеся при совместном применении ме-
тодов рентгеноструктурного анализа и нейтронографии, особен-
но в тех случаях, когда метод рентгеноструктурного анализа
сам по себе не в состоянии дать однозначный ответ. Смещение
атомов титана и бария обычно указывают относительно центра
октаэдра Об, внутри которого находится исходная позиция ти-
тана. В ВаТЮз атом титана смещен на 0,12 А, а атом бария —
в том же направлении на 0,06 А (рис. 13,4, а). В тетрагональ-
304 13. Сложные оксиды
ном РЬТЮз титан смещен относительно кислородного октаэдра
на 0,30 А, а атом свинца — в том же направлении на 0,47 А
(рис. 13.4,6). Координационное окружение титана в кристаллах
этих соединений показано на рис. 13.4, в и г. В обоих случаях
титан смещен из центра своего октаэдра, что приводит к уко-
рачиванию одного расстояния Ti—О: 1,86 А в ВаТЮ3 и 1,78 А
г с ; о
Рис. 13.4. Окружение ионов в структурах типа перовскита (см. текст).
в РЬТЮз (ср. в рутиле среднее расстояние 1,97А)*. Что каса-
ется бария, то его сдвиг незначительно отражается на двенад-
цати расстояниях Ва—О, а в соединении свинца большой сдвиг
атомов свинца, действительно, заметно сказывается на величи-
не расстояний РЬ—О (рис. 13.4, д). Эти расстояния могут быть
сопоставлены с величиной 2,78 А — суммой ионных радиусов по
Гольдшмиту для КЧ 12. В этом состоит наиболее значитель-
ное различие между сегнетоэлектриками ВаТЮ3 и РЬТЮз,
а координационное окружение атома свинца с четырьмя корот-
кими расстояниями РЬ—О по одну сторону напоминает его ок-
ружение в тетрагональном РЬО. Вопрос о том, какой фактор
для перехода в сегнетоэлектрическое состояние является ре-
шающим: дальнодействующие силы диполь-дипольного взаимо-
действия или увеличение гомополярного характера связей
* И что очень важно — к удлинению второго расстояния Ti—О по другую
сторону от атома Ti B,17 А в BaTiO, и 2,38 А в PbTiOj). — Прим. ред.
13.3. Оксиды АВОз 305
ONb
РЬ—О, все еще дискутируется (и в данной книге не обсужда-
ется). Было также проведено детальное изучение смещения
ионов и в других перовскитах, включая СаТЮ3, CdTiO3,
NaTaO3, KNbO3 [6] и NaNbO3 [7].
При сравнительном изучении ряда соединений установлено,
что строение соединений АВО3 зависит не только от размерных
факторов, но также и от природы атомов В. Например, в то
время как все оксиды AFeO3 (A — лантаноид) относятся к
структурному типу перовскита, соединения АМп3+О3 кристал-
лизуются в структуре перов-
скита только в случае, когда
A=La, Се—Dy, соединения с
А=Но—Lu, Y имеют гексаго-
нальную структуру совсем
другого типа с КЧ атомов Мп
и А, равными соответственно
5 и 7 [8]. В серии соединений
Bai-;eSr*RuO3 при переходе от ; п ¦ ' ! о о
х=0 к лг=1/б и 7з наблюдает- д"
ся переход от структуры с
9-слойной к структуре с
4-слойной упаковкой и далее к
структуре перовскита, а в ря-
ду оксидов Bai_*Sr;JrO3 на-
блюдаются более сложные пре-
вращения [9]. Рис. 13.5. Структура соединенна
Сверхструктуры перовски- LaNb3O».
та. Если атомы В постепенно
замещать на атомы другого металла, то при больших разли-
чиях в их размерах обычно наблюдается не статистическое раз-
мещение двух сортов ионов, а возникновение сверхструктуры.
Связь между структурами криолита и перовскита уже описана
в гл. 10, где отмечалось, что такие оксиды, как Ba2CaWO6,
имеют именно этот тип сверхструктуры. [Соединение
Ca2'(Ca"U)Oe [10] имеет искаженную структуру криолита, воз-
можно, из-за тенденции урана(VI) образовывать две более
сильные связи; ионы Са" имеют аналогичное координационное
окружение (ср. с Mg в MgUO4).] В структурах Ва3МпТа209
(где M" = Fe, Co, Ni, Zn, Са) наблюдается статистическое раз-
мещение атомов М11 и Та по октаэдрическим позициям, в то
же время Ba3SrTa209 имеет гексагональную (упорядоченную)
сверхструктуру [11].
Структуры оксидов MNb3O9 (M=La, Се, Рг, Nd) и МТа3О9
(M=La, Се, Рг, Nd, Sm, Gd, Dy, Ho, Y, Er) представляют со-
бой октаэдрический каркас типа ReO3, в котором позиции А'
с КЧ 12 заселены лишь частично (т. е. эти соединения имеют
20—985
306 13. Сложные оксиды
дефектную структуру перовскита) [12]. На рис. 13.5 все пози-
ции А" вакантны, а позиции А' заселены на 2/3.
Некоторые оксиды AC3(B4Oi2) имеют структуру, производ-
ную от структуры перовскита, которую можно получить сле-
дующим образом. Кубическая элементарная ячейка удваивает-
ся, а ионы А и С упорядочение располагаются в пустотах кар-
каса, образованного октаэдрами ВО6. Октаэдры ВО6 повернуты
так, что координационные кубооктаэдры атомов А в структуре
перовскита преобразуются в правильные икосаэдры; координа-
ционное окружение атомов С образуют восемь ближайших ато-
мов кислорода, расположенных в вершинах квадрата и прямо-
угольника (а), и четыре более удаленных атома кислорода; та-
кая координация подходит для ян-теллеровских ионов (в част-
ности, для Си2+ и Мп3+). Примеры соединений с такой струк-
турой: CaCu3Ge4Oi2 (фаза высокого давления; К.Ч германия 6),
NaMn33+Mn40i2 и СаСизМп44+О!2 [13]. В первом из этих соеди-
нений длины связи Си—О равны 1,96 А (четыре), 2,68 А (че-
тыре) и 3,13 А (четыре).
Литература. [1] Ada cryst., 1957, 10, 219. [2] J. Chem. Phys., 1956, 24, 1236.
[31 Ada cryst., 1973, B29, 2171. [4] Phys. Rev., 1955, 100, 745. [51 Acta cryst.,
1956, 9, 131; Acta cryst., 1978, B34, 1065. [6] Acta cryst., 1967, 22, 639. [7] Acta
cryst., 1969, B25, 851. [81 Acta cryst., 1975, B31, 2770. [9] Inorg. Chem., 1966, 5,
335, 339. [10] Acta cryst.. 1966, 20, 508. [11] J. Am. Chem. Soc, 1961, 83, 2830.
[12] Acta cryst., 1967, 23, 740. [13] Acta cryst., 1977, B33, 3615.
13.4. Оксиды ABO4
Типы кристаллических структур соединений АВО4 весьма раз-
нообразны. Многие оксиды АВО4 имеют полиморфные модифи-
кации при атмосферном давлении и претерпевают структурные
превращения при повышении давления. Диапазон структурных
различий этих соединений очень широк; от структур типа квар-
ца с тетраэдрическим окружением атомов А и В до оксосолей,
содержащих обособленные ионы ВО4 и атомы А с высокими
координационными числами. Некоторые из этих структур при-
ведены в табл. 13.8; отметим здесь только некоторые общие
моменты. (Об уранатах CaUO4 и др. см. гл. 28.)
13.4. Оксиды АВОА 307
Таблица 13.8. Кристаллические структуры соединений АВО4
к.ч
ат 1-
мов В
КЧ
ато-
мов А
Структура
Примеры
Литература
4
6
12
6
Структуры типа
кварца
CrVO4
а-МпМоО4
Шеелит CaWO4
Фергусонит
Циркон ZrSiO4
Ангидрит CaSO4
Барит BaSO4
Сверхструктура
рутила
Рутил (статисти-
ческая)
Вольфрамит (ста-
тистическая)
Вольфрамит
Вольфрамит (иска'
женная)
СоМоО4
Дефектная струк-
тура шеелита
ВРО4, BeSO4,
AlAsO4
CaWO4
MniNbO4
YVO4
MgUO4
A1WO4
CrVO4 (высокого
давления)
AlAsO4
FeVO4 (высокого
давления)
FeWO4
MnWO4
NiWO4
CuWO4
Eu2(WO4)s
Acta cryst., 1967, 22, 321
J. Chem. Phys. 1965 43
2533
J. Chem. Phys., 1964. 40,
501, 504
Acta cryst., 1963, 16, 888
Inorg. Chem., 1964, 3, 600
Acta cryst., 1968, B24,
292
Acta cryst., 1954, 7, 788
J. Solid State Chem., 1975,
14, 144
Acta cryst., 1962, 15, 1305
Acta cryst., 1964, 17, 1476
Acta cryst., 1964, 17, 1476
Z. Kristallogr., 1967, 124V
192
Z. Kristallogr., 1967, 125,
120
Acta cryst., 1957, 10, 209
Acta cryst., 1970, B26,
1020
Acta cryst., 1965, 19, 269
J.Chem. Phys., 1969, 50
86
Рассмотрим ряд соединений, в частности хроматы двухва*
лентных металлов: покажем, как меняется координационное
окружение атомов А в зависимости от их размера.
Структура КЧ атома А
BaSO4
ZrSiO4
CrVO4
Примеры
12 PbCrO4, BaCrO4, SrCrO4
8 CaCrO4
6 ZnCrO4, CdCrO4, CuCrO4
Тетраэдрическое окружение молибдена (VI) в а-МпМоО4 мо*
жет быть сопоставлено с октаэдрическим окружением Mo(VI)
20*
308 13. Сложные оксиды
в СоМоО4, а окружение хрома (III) с КЧ 6 в CrVO4 — с тетра-
эдрическим окружением Cr(VI) в изоструктурном CuCrO4.
[Тетраэдрическая координация ванадия в CrVO4 подтвержде-
на данными по тонкой структуре К-края полосы поглощения:
с одной стороны, путем сравнения NiCrO4 (тетраэдрический
Cr(YI)) и CrVO4 (октаэдрический Сг), а с другой — сопоставле-
нием CrVO4 и Na3VO4 (тетраэдрический V(V) в обоих случаях
с характерной формой абсорбционной кривой).] Из других со-
единений со структурой CrVO4 следует привести 1пРО4, Т1РО4
и неустойчивую модификацию СгРО4.
Известно много соединений, в которых под действием высо-
кого давления координационный полиэдр атомов В меняется
от тетраэдра до октаэдра. У оксида AlAsO4, например, КЧ воз-
растают от 4 до 6 как для атомов А, так и для атомов В.
В других случаях координационное число атомов В возрастает,
в то время как координационное число атомов А либо сохра-
няется без изменений (например, в CrVO4 происходит измене-
ние координации от 0:4 до 6:6), либо увеличивается незначи-
тельно, что справедливо для таких больших ионов, как Ва2+
или РЬ2+, которые и до воздействия давления занимают пози-
ции с большим координационным числом. Например, при пере-
ходе BaWO4-I->BaWO4-II координационное число вольфрама
меняется от 4 до 6, а бария — от 8 до 8 и 9 [1], а в модифика-
ции высокого давления PbWO4-III, изоструктурной Ba\VO4-II
(высокого давления), координационные числа атомов W и Ва
равны 6 и 8 [2]. В структуре полиморфной модификации
PbWO4-II, которая встречается в природе в виде минерала рас-
пита [3], координационный полиэдр атомов вольфрама — окта-
эдр, причем расстояния W—О, как обычно, лежат в интервале
1,70-г-2,17 А, а координационный полиэдр атомов свинца — не-
правильный семигранник.
Часто наблюдается, что фаза высокого давления имеет та-
кой же тип структуры, как и соединение при атмосферном дав-
лении для следующего по группе (или подгруппе) периодиче-
ской системы элемента. Например, изоструктурны ZnO высо-
кого давления и обычный CdO (структура NaCl) или SiO2 вы-
сокого давления и обычный GeO2 (структура рутила). Приве-
дем несколько примеров такой изоструктурности среди окси-
дов АВО4.
Структура
вольфрамита
Неупорядоченный
вольфрамит
Рутил
MgMo04 (высокого FeVO4 (высокого CrVO4 (высокого
давления) и др. давления) давления)
MgWO4 и др. FeNbO, CrNbO4
/3.4. Оксиды АВОА 309
Известно много соединений АВО4 со структурой типа рути-
ла; их можно разделить на две группы. Многие соединения
M"'MVO4 имеют статистическую структуру рутила, например:
RhVO4
СгТаО4
Fe
Rh
V
CrNbO4
Fe
Rh
AlSbO4
Cr
Fe
Rh
Ga
Структуры AlNbO4 и изоструктурного GaNbO4 описаны да-
лее (разд. 13.7).
В разд. 4.3 приведены два примера сверхструктур рутила,
один из них — MgUO4, а другой — A1WO4. В обеих структурах
два сорта атомов металла размещены по разным цепочкам, од-
нако происходит это по различным причинам. В MgUO4
уран (VI) образует две более сильные связи U—О, что приводит
к значительному искажению октаэдров UO6 и как следствие
к искажению октаэдров MgO6. В структуре A1WO4 в цепочках,
построенных из октаэдров WO6, искажение возникает вследст-
вие взаимодействия металл — металл, направленного перпен-
дикулярно чередующимся общим ребрам, что приводит к су-
ществованию различных расстояний W—W вдоль цепочки B,613
и 3.108 А). Эти взаимодействия, по-видимому, стабилизируют
вольфрам в степени окисления V. В моноклинном WO2, где у
вольфрама на один d-электрон больше, расстояния W—W рав-
ны 2,48 и 3,1 А.
Литература. [1] Acta cryst., 1974, ВЗО, 2069. [2] Acta cryst., 1976, В32, 928
[3] Acta cryst., 1977, B33, 162.
13.4.1. Структурный тип вольфрамита. Название этого структур-
ного типа произошло от минерала вольфрамита (Fe,Mn)WO4.
Атомы металла каждого сорта занимают "Д октаэдрических пу-
стот в искаженной ГПУ атомов кислорода. Мотив заполнения
пустот, расположенных между двумя плотноупакованными слоя-
ми атомов О, показан на рис. 4.24,6 (маленькие черные и свет-
лые кружки — атомы никеля и вольфрама в октаэдрических по-
зициях между чередующимися парами плотноупакованных сло-
ев). В NiWO4 (изоструктурном оксидам магния, марганца, же-
леза, кобальта и цинка) окружение никеля состоит из шести
равноудаленных атомов кислорода B,08±0,05 А), а октаэдр
WO6 очень искажен — четыре расстояния W—О 1,79 А и два
А19 А. Как было отмечено выше, такую структуру имеют моди-
фикации высокого давления соответствующих молибдатов, из-
вестны также оксиды с неупорядоченной разновидностью дан-
ной структуры. В CuWO4 (искаженная структура вольфрамита)
¦четыре расстояния Си—О 1,98 А и два 2,40 А. Как и во всех
310 13. Сложные оксиды
октаэдрах \VVIO6, расстояния W—О в этом соединении находят-
ся в интервале 1,76-^-2,2 А.
13.4.2. Структурные типы шеелита и фергусонита. Название
структурного типа шеелита происходит от одноименного мине-
рала CaWO4. Ниже приведены примеры соединений с такой
структурой :
MIMV»O4
M"MVI04
M"rMvO4
NaIO4, KIO4, KRuO4
MMoO4 и MW04 (M=Ca, Sr, Ba, Pb)
MNbO4 и МТаО4 (M=Y или 4/-металл)
Детальное рентгеноструктурное и нейтронографическое изуче-
ние тетрагональной структуры шеелита показало, что октаэдр
WO4 слегка искажен (четыре угла 107,5° и два 113,4°, расстоя-
ния W—О 1,78 А). Многие из перечисленных выше соединений,
относящихся к третьей группе, имеют искаженную моноклинную-
разновидность этой структуры (структуру фергусонита). Окси-
ды YTio,5lvMoo,5VI04 и YTio.5Wo.5O4 отличаются друг от друга
тем, что соединение молибдена обладает тетрагональной струк-
турой шеелита, а соединение вольфрама — структурой фергусо-
нита. Такие различия в строении соединений молибдена в
вольфрама встречаются довольно часто, и их примеры приве-
дены в других главах книги.
Иной тип искажения структуры шеелита найден в КСгОзО.
При замене трех атомов кальция в структуре шеелита на
два М3+ образуется «дефектная структура шеелита»-
M2/3Di/3WO4, где ? — вакансия. В структурах таких соедине-
ний, как Bi2(WO4K, а также молибдатов и вольфраматов скан-
дия, лантана и 4/-металлов [Acta cryst., 1973, В29, 2074, 2433],
обнаружено по крайней мере 5 различных вариантов размеще-
ния таких вакансий.
13.5. Оксиды АВ2О4
Этот большой класс соединений включает оксиды и соли трех,
составов; АУ1В2Ю4, AIVB2nO4 и АПВ2ШО4; иногда их обознача-
ют как соединения 6 : 1, 4 : 2 и 2 : 3. Три структуры такого типа
уже описаны при обсуждении плотнейших шаровых упаковок,,
в которых занята определенная часть тетраэдрических и(или)
октаэдрических пустот:
3/в тетраэдрических пустот
Ve тетраэдрических пустот
7г октаэдрических пустот
фенацит Be;SiO4
оливин Mg2Si04 с гексагонально»
плотнейшей упаковкой, хризоберилл.
А12Ве04
шпинель (AbMgCi) с кубической1
плотнейшей упаковкой
13.5. Оксиды /4В2О4 311
¦фенацит и оливин — ортосиликаты, и так как рассматриваемая
группа АВ2О4 включает и все соединения В2(АО4), содержащие
тетраэдрические ионы АО4 и ионы В различных размеров, она
является очень большой и насчитывает много различных струк-
тур, из которых в табл. 13.9 приведена лишь часть. Например,
вольфраматы щелочных металлов имеют четыре различных ти-
ла кристаллических структур:
Li2WC>4 (фенацит), Na2WO4 (модифицированная шпинель),
KVWO4 (и изоструктурный Rb2WO4) и Cs2WO4 (структура
|-)-K:SO4) с КЧ ионов М+ 4, 6, 8 и 9—10 соответственно.
Таблица 13.9. Кристаллические структуры соединений AB2CV
6
8
<Ренацит
6
Оливин
Шпинель
| Сл
CaFe2O4
5
K2WO4
vi. примечание
9 и/или Ю
/3-К25О,
П Кг№А
а Обсуждение кристаллохимии соединений ABiO4 см., например, в работах
[Inorg. Chem., 1968, 7, 1762; J. Solid State Chem., 1970, 1, 557].
Примечание. Сюда можно отнести ряд структур, в которых цепочки типа
рутила, содержащие А, соединены вместе атомами В в позициях с КЧ 6
(SrjPbO,, разд. 5.3.4) или 6, 7 и 9 (Ca2Ir04 [Z. anorg. allg. Chem., 1966, 347,
282]).
Однако в этой главе рассматриваются сложные оксиды, а не
кислородсодержащие соли с обособленными оксо-ионами, хотя
разделение на эти две группы соединений до некоторой степени
все-таки весьма произвольно, что подтверждают такие соеди-
нения, как Li2BeF4, Zn2Ge04 и LiAlGeO4 со структурой фенаци-
та и LiNaBeF4, Cs2BeF4 и Ba2Ge04 со структурой оливина.
Среди структур, упомянутых в табл. 13.9, наиболее важной
является структура шпинели. Приведенный недавно обзор
структур показал, что более 130 соединений имеют кубическую
структуру шпинели или близкую к ней; 30 из них — сульфиды,
а большинство остальных — оксиды. После структуры шпинели
будут кратко рассмотрены два других структурных типа, в ко-
торых В имеет КЧ 6, а именно структуры CaFe2O4 и CaTi2O4,
а затем — структура K2NiF4.
Повышенный интерес исследователей к модификациям вы-
сокого давления оксидов АВ2О4 связан с предположением о
312 13. Сложные оксиды
том, что модификации высокого давления оливина
(Fe, MgJSi04 — важные компоненты земной коры. Под дейст-
вием высокого давления наблюдаются превращения структур с
увеличением координационных чисел, т. е. переход от структур,
находящихся в левом верхнем углу табл. 13.9, к структурам в
правом нижнем. Например:
,!: оливин-хтруктура Кг№Р4 (увеличение плотности на 25%)
Mn2Ge04: оливин-*-структура Sr2Pb04 (увеличение плотности на 18%)
13.5.1. Структуры нормальной и обращенной шпинели. Струк-
тура шпинели показана на рис. 7.4, а. Наиболее просто ее мож-
но описать как октаэдрический каркас состава АХ2 (атакамит),
который получается из структуры NaCl путем удаления череду-
ющихся рядов ионов металла (рис. 4.22,6). Дополнительные
ионы металла размещены по тетраэдрическим позициям
(рис. 7.3,а). В полученной таким образом структуре каждый
ион О2~ также получает тетраэдрическую (искаженную) коор-
динацию, его ближайшее окружение образуют три атома метал-
ла из октаэдрического каркаса и один атом металла с тетраэд-
рической координацией.
Кристаллографическая элементарная ячейка в структуре
шпинели содержит 32 атома кислорода с почти неискаженной
кубической плотнейшей упаковкой (КПУ). (Существуют не-
большие отклонения от идеальной плотнейшей упаковки, кото-
рые, вероятно, связаны с зарядами атомов (ионов) В, образую-
щих октаэдрические группы с общими ребрами [1].) На каж-
дые 32 атома кислорода с плотнейшей упаковкой приходятся
32 октаэдрические и 64 тетраэдрические пустоты, но в простран-
ственной группе шпинели существуют эквивалентные позиции
только для 8 атомов с тетраэдрической и 16 атомов с октаэд-
рической координацией. Поэтому было бы естественно в тетра-
эдрические позиции поместить атомы А, а в октаэдрические —
атомы В. Шпинели МА12О4, где M = Mg, Fe, Co, Ni, Mn или Zn,.
имеют именно такую структуру, но у некоторых шпинелей ато-
мы А и В расположены по-другому. В таких структурах восемь
тетраэдрических позиций заняты не атомами А, а половиной
атомов В; остальная половина атомов В вместе с атомами А
статистически размещена по 16 октаэдрическим позициям. Та-
кие «обращенные» шпинели обычно обозначают формулой
B(AB)C>4, чтобы отличить их от шпинелей первого типа АВ2О4.
Примеры обращенных шпинелей — Fe(MgFe)O4 и Zn(SnZn)C>4.
Тип шпинели характеризуется параметром Я, который равен
доле атомов В, находящихся в тетраэдрических пустотах; в не-
которых работах используется степень инверсии у ( = 2\). Для
обычной шпинели Х = 0, для обращенной — Я = Уг. Параметр %,
13.5. Оксиды АВгОА 313
может иметь и промежуточные значения (например, '/з в не-
упорядоченной шпинели) и для данной шпинели не обязатель-
но постоянен, а в некоторых случаях может меняться при соот-
ветствующей термической обработке. У NiMn2O4 Я изменяется
от 0,37 (закаленные образцы) до 0,47 (медленно охлажденные)
[2]. Значение К определялось методами рентгеноструктурного
и нейтронографического анализов, измерением намагниченно-
сти насыщения, а также методом ИК-спектроскопии. В благо-
приятных случаях могут быть идентифицированы ИК-полосы
поглощения, относящиеся к тетраэдрическим группировкам
АО-ь таким способом показано, например, что в соединении
Li(CrGe)O4 литий занимает тетраэдрические позиции [3].
Если различие в рассеивающей способности рентгеновских
лучей у атомов А и В достаточно велико, то распределение этих
атомов можно определить обычными методами рентгеноструктур-
ного анализа, но, например, для самой шпинели MgAl2O4 этот
метод неприменим. Однако сечение рассеяния нейтронов у маг-
ния значительно больше, чем у алюминия, и это дало возмож-
ность установить, что MgAl2O4 имеет структуру нормальной
шпинели [4]. Многие шпинели 2:3 имеют нормальную струк-
туру, хотя для некоторых (включая большинство «ферритов»)
характерна обращенная структура, например Ga(MgGa)O4
(Я = 0,42) [5]. Оба типа структур встречаются и у шпинелей
4:2. К нормальным шпинелям относятся Fe2Ge04, Co2GeO4,
Ni2Ge04 и Mg2Ge04 [6] (который при 810 °С переходит в мо-
дификацию со структурой оливина); другие имеют обращенную
структуру, например Zn(ZnTi)O4 и Fe(FeTi)O4 (Я=0,46) [7].
В этой связи представляют интерес шпинели с составом,
промежуточным между MgFe2O4 и MgAl2O4, которые были изу-
чены магнитными методами, а также методом нейтронографии
[8]. MgFe2O4 по существу имеет обращенную структуру шпине-
ли (Я = 0,45), т. е. 9/ю ионов магния находятся в октаэдриче-
ских (В) позициях. По мере того как происходит замещение
железа на алюминий, последний заселяет В-позиции и вынуж-
дает магний заполнять тетраэдрические (А) позиции, так что
наблюдается непрерывный переход от структуры обращенной
шпинели (в MgFe2O4) к структуре нормальной (в MgAl2O4).
При обсуждении структуры шпинелей возникают два инте-
ресных вопроса. Во-первых, почему одни соединения имеют нор-
мальную структуру шпинели, а другие — обращенную? Во-вто-
рых, почему у некоторых шпинелей наблюдаются искажения
кубической симметрии? Последний вопрос является частью бо-
лее общего вопроса о возникновении незначительных искаже-
ний у высокосимметричных структур, о чем уже упоминалось
при изложении теории поля лигандов в гл. 7. Остановимся по-
очередно на этих вопросах.
314 13. Сложные оксиды
Расчеты энергии решеток на основании простой электроста-
тической теории без учета эффекта кристаллического поля по-
казывают, что, в то время как обращенная структура должна
быть более устойчивой для шпинелей 4 : 2, нормальная струк-
тура должна быть наиболее предпочтительной для шпинелей
2 : 3. На самом деле ряд соединений 2 : 3 имеет обращенную
структуру, о чем свидетельствуют приведенные в табл. 13.10
Таблица 13.10. Распределение катионов в шпинелях 2 :3 (значения X)
\ А2+
N.
В3+ ^\
А13+
Сг3+
Fe3+
Мп3+
Со3+
Mg2+
0
0
0,45
—
Мп2+
0
0
0,1
0
Fe2+
0
0
0,5
Со2+
0
0
0,5
—
0
№2+
0,38
0
0,5
—
Си2 +
_
0
0,5
Zn2 +
0
0
0
0
0
(приближенные) значения X. Распределение катионов в шпи-
нелях было обосновано в рамках теории кристаллического по-
ля ![9]. Несмотря на то что величины А (разд. 7.6.5), присущие
шпинелям, неизвестны, их можно приблизительно оценить, а
отсюда получить энергию стабилизации при октаэдрической и
тетраэдрической координациях. Разность этих двух величин
(первая из них больше) показывает, насколько предпочтитель-
нее размещение иона в октаэдрических позициях по сравнению
с тетраэдрическими.
Избыток энергии стабилизации (в кДж/моль) при октаэдрической координации
Мп2+ Fe2+ Со2+ Ni2+ Cu2+ Ti3+ V3+ Cr3+ Mn8+ Fes+
0 17 31 86 64 29 54 158 95 0
Теперь понятно, почему Сг3+ и Мп3+ занимают октаэдрические
позиции (нормальные шпинели), а большинство «ферритов» от-
носятся к обращенным шпинелям; это происходит потому, что
ион Fe3+ не имеет избытка энергии стабилизации октаэдриче-
ских позиций. Только Zn2+ и Мп2+ образуют ферриты со струк-
турой нормальной (либо слегка искаженной) шпинели, посколь-
ку эти двухвалентные ионы также не имеют избытка энергии
стабилизации в октаэдрических позициях. Единственным «обра-
щенным» алюминатом является шпинель двухвалентного нике-
ля, ибо из всех вышеприведенных двухзарядных ионов \Ч2+
имеет наибольший избыток энергии стабилизации в октаэдриче-
13.5. Оксиды АВ2О< 315
ских позициях*. Отметим, что в предлагаемом здесь рассужде-
нии отбрасываются все другие факторы (ковалентные связи и
различия в обычных энергиях решеток), а учитываются только
энергии стабилизации кристаллическим полем. Например, клас-
сический расчет энергии решетки для №А12О4 как суммы элект-
ростатического потенциала Маделунга, энергии поляризации и
энергии отталкивания Борна показывает, что структура нор-
мальной шпинели должна быть на ¦—¦ 105 кДж/моль более ус-
тойчива, чем обращенная, так что стабилизация кристалличе-
ским полем октаэдрического Ni2+ почти компенсирует эту раз-
ность. В действительности структура NiAl2O4 очень близка к
неупорядоченной, для которой Я, = 0,33. Тот факт, что Fe3O4 име-
ет структуру обращенной шпинели с кубической симметрией, а
МпзО4 — структуру нормальной шпинели с небольшим тетра-
гональным искажением (разд. 12.5), объясняется тем, что при
октаэдрнческом окружении ионами кислорода иона Мп3+ полу-
чается выигрыш энергии по сравнению с такой же ситуацией
для иона Fe3+, что показывают величины энергий стабилизации,
приведенные выше. Очевидно, теория кристаллического поля в
упрощенном варианте оказывается весьма полезной при объ-
яснении распределения катионов в шпинелях 2: 3.
Второй, поставленный в связи со шпинелями вопрос касает-
ся отклонений от кубической симметрии. Например, CuFe2O4
имеет кубическую симметрию при высоких температурах (а так-
же при комнатной температуре, если он получен закалкой с
температур >760°С [10], но при медленном охлаждении по-
лучают образцы, структура которых характеризуется тетраго-
нальной симметрией (с:а=1,06 при комнатной температуре).
Такие образцы имеют структуру обращенной шпинели с ионами
Fe:!+ в тетраэдрических позициях, причем тетраэдры FeO4 не
искажены. По-видимому, тетрагональная симметрия этого окси-
да является следствием тетрагонального искажения октаэдров
Си"Об (разд. 7.6.5). CuCr2O4 тоже имеет тетрагональную сим-
метрию, однако с:а = 0,91 [11]. В этом оксиде атомы меди за-
нимают тетраэдрические позиции, но величины валентных уг-
лов, равные 103 и 123°, свидетельствуют о проявлении тенден-
ции к окружению в виде квадрата, т. е. к тетрагональному ис-
кажению («сплющивание») тетраэдра, (тип «в» в табл. 7.13),
предсказываемому теорией поля лигандов. Еще более интерес-
ными являются шпинели с промежуточным составом
CuFe2-;tCr.*O4 [12]. При х = 0 (CuFe2O4) происходит тетраго-
нальное искажение структуры с с : а=1,06, при х = 2 (CuCr2O4)
* NiCr2O,( имеет структуру нормальной шпинели, потому что энергия ста-
билизации в поле октаэдрической симметрии для Сг3+ еще больше, чем для
NP+. — Прим. ред.
316 13. Сложные оксиды
соединение имеет тетрагональную структуру с с:а = 0,91. В ин«
тервале 0,4<х<1,4 структура соединения кубическая. Посколь-
ку при х=0 оксид имеет структуру обращенной шпинели, а
при х = 2 — нормальной шпинели, в тетраэдрических позициях
происходит непрерывное замещение атомов железа атомами ме-
ди. В этом отношении имеется сходство с рядом MgFe2C>4—•
MgAl2O4, однако в системе CuFe2O4—CuCr2O4 на одном конце
ряда структура искажена из-за наличия атомов меди в октаэд-
рических позициях («вытянутые» октаэдры), а на другом конце
ряда — из-за наличия атомов меди в тетраэдрических позициях
(«сплющенные» тетраэдры); удлинение октаэдра приводит к
с : а> 1, а сплющивание тетраэдра — к с : а< 1.
(О некоторых сульфидах со структурами, родственными
структуре шпинели, см. разд. 17.1.7.)
Литература. [1] Acta cryst., 1974, ВЗО, 1872. [21 Acta cryst., 1969, В25, 2326,.
[31 Acta cryst., 1963, 16, 228. [4] Acta cryst., 1952, 5, 684. [51 Acta cryst., 1966,
20, 761. [6] Acta cryst., 1977, B33, 2287. [71 Acta cryst., 1965, 18, 859. [8] Acta
cryst., 1953, 6, 57. [9] J. Phys. Chem., Solids, 1957, 3, 318; Phys. Rev., 1955, 98*,
391. [101 Acta cryst., 1956, 9, 1025. [11] Acta cryst., 1957, 10, 554. [121 J. Phys»
Soc. Japan, 1956, 12, 1296.
13.5.2. Сверхструктуры шпинели. Известно много шпинелепо-
добных структур, содержащих атомы металлов более чем одно-
го сорта. Если атомы разного сорта присутствуют в достаточ-
ных количествах, то могут располагаться упорядоченно; напри-
мер, 16-кратная позиция может быть занята набором 8А+8В
или 4A-f-12B. Большие различия в зарядах ионов способствуют
упорядочению катионов, а так как в «дефектных» структурах
вакансии также имеют тенденцию к упорядочению, возможно
образование сверхструктур с упорядоченными вакансиями. Не-
которые примеры сверхструктур шпинели приведены в табл.
13.11. Соединение может иметь упорядоченную структуру при
температурах ниже точки фазового перехода и неупорядочен-
ную— при более высоких температурах. Например, в Fe3O4 ни-
же 120 К наблюдается упорядочение ионов Fe2+ и Fe3+ по ок-
таэдрическим позициям, а при более высоких температурах —
статистическое их размещение, приводящее к свободному об-
мену электронами. Соединения LiAUOs и LiFe5Os имеют упо-
рядоченные структуры при температурах <1290 и 755 °С и не-
упорядоченные— при более высоких температурах. В низкотем-
пературных модификациях 4 иона лития и 12 ионов М3+ упо-
рядоченно размещены по 16 октаэдрическим позициям, а в вы-
сокотемпературных модификациях — статистически.
13.5.3. «Ферриты» и другие структуры, родственные шпинели.
Некоторые оксиды, а именно оксиды щелочных, щелочноземель-
/3.5. Оксиды АВ2О<
Таблица 13.11. Сверхструктуры шпинели
Соединение
Zn(LiNb)O4
Vv(LiCu)C4
Fe3O4 «120 К)
Fe5Li08 (Al2LiOs)
Y-Fe2O3
(LiFe)Cr4O8
In2S3
Zn2Ge308
LiZn(LiGe3)O8
Co3(VO4J (низкотем-
пературный)
LiGaTiO4
Заселенность позиций*
тетраэдри-
ческих
Zn
V
Fes+
I
8Fe
8Fe
4 Li 4 Fe
16 8
I1" 1D
2Zn
Li, Zn
2V
2 Ga, Li
октаэдри-
ческих
Nb Li
Li Cu
pe2+ pe3+
i i
.'6
1
4 Li 12 Fe
J
4 8 12Fe
3Fe3+3D
16 Cr
16 In
3GeD
3GeLi
ЗСоП
3Ti, Ga, 2 Li
Анионы
o4
o4
o4
o32
o32
o32
o32
s32
o8
oa
o8
o12
Литература
Acta cryst., 1955, 8^
257
J. Chem. Phys., 1964,
40, 1988
Nature, 1968, 181, 44
J-C. Joubert, Thesis
Grenoble, 1965
? — вакансия.
иых металлов и свинца образуют так называемые «алюминаты»
и «ферриты» с общей формулой M2O-m(Al,FeJO3 или МО-
•n(Al, FeJO3. Некоторые простейшие «ферриты», например
LiFeO2, NaFeO2 и CuFeO2 (все они имеют различные структу-
ры), а также MgFe2O4 и CaFe2O4l рассмотрены в других разде-
лах данной главы. Можно привести примеры соединений более
сложного состава:
Na2O-llAl2O3 и аналогичное соединение калия
K20-llFe203 и аналогичное соединение рубидия
ЗСаО-16А12О3 и аналогичные соединения бария и стронция
SrO-6Fe2O3 и аналогичные соединения бария и свинца
Первое из них, Na2O-11А12О3, вначале считалось полиморфной
модификацией А12Оз, отсюда его название — р-оксид алюминия.
Однако рентгеноструктурное исследование показало, что это
соединение имеет структуру, родственную структуре шпинели,,.
и не меньше 50 из 58 атомов в его элементарной ячейке распо»
318 13. Сложные оксиды
ложены точно так же, как в структуре шпинели. Крупные ионы
натрия или калия расположены между полосами шпинельной
структуры (рис. 13.6, а), и их присутствие существенно влияет
на устойчивость структуры. Эти ионы можно заместить на Rb+,
Ag+ и другие ионы путем нагревания с соответствующими рас-
плавленными солями, а ион Ag+ может быть замещен на N0"
(при нагревании в расплаве N0C1—А1С13) или Ga+.
Более поздние исследования показали, что содержание нат-
рия в этом соединении несколько выше, чем соответствует фор-
плсскостпь
зеркально:
отражен.
•плоскость
зеркального
отражетт
Рис. 13.6. а — связь структуры fi-оксида алюминия NaAlnOi; со структурой
шпинели (по Биверсу и Россу). Большие кружки — Na, маленькие — О, тем-
ные— А1; б — связь структуры магнетоплумбита PbFe^Oig со структурой маг-
нетита Fe;04 (по Адельшкольду). Большие кружки — РЬ, маленькие — О, тем-
ные — Fe.
муле NaAlu0i7. Кристалл, использованный для уточнения кри-
сталлической структуры [1], имел состав Na2,58Al2i,8O34) и, по-
видимому, распределение ионов натрия в нем гораздо сложнее,
чем в исходной структуре (рис. 13.6,с). В гидратированном
оксиде |5-А12О3, не содержащем щелочного металла, угол при
мостиковом атоме кислорода равен 158, а не 180°, и между
слоями структуры шпинели статистически расположены моле-
кулы воды [2].
В р-А12О3 ионы натрия, находящиеся между слоями шпи-
нели, очень мобильны; это соединение интенсивно изучалось
вследствие возможности его использования (в виде керамики) в
качестве твердого электролита в Na—S-батареях. Полосы
структуры шпинельного типа состоят из четырех плотноупако-
ванных слоев атомов кислорода; между ними располагаются
слои атомов кислорода, принадлежащие той же кубической
ллотнейшей упаковке, но занимающие в ней только 'Д пози-
13.5. Оксиды AB2Oi 319'
ций. Эти частично заполненные слои, удаленные друг от друга
на 11,3 А, содержат ионы Na+, что объясняет ионную проводи-
мость соединения. В C-оксиде алюминия плоскости этих сло-
ев— это плоскости зеркального отражения, так что последова-
тельность слоев, перпендикулярных гексагональной оси, следую-
щая:
С (АВСА) В (АСВА) С.. .или иначе С ( ) В ( ) С...
где в скобки заключены 4 слоя шпинели с плотнейшей упаков-
кой, а символы между ними обозначают заполненные на !Д-
слои. Во второй структуре оксида алюминия р"-А12Оз с ромбо-
эдрической симметрией последовательность слоев следующая:
С (АВСА) В (САВС) А (ВСАВ) С.. .или С ( ) В ( ) А ( ) С...
Период повторяемости вдоль оси с равен 33,85 А по сравнению
с 22,53 А для р-А12О3. Р"-Структура обычно стабилизируется не-
которым количеством Mg и (или) Li. Очевидно, что C- и
р"-структуры можно считать политипами и обозначить 2Н и 3R
(разд. 4.1.8) либо при желании указать число слоев кислорода
в базовой субъячейке 2НE) и 3RE). Более сложные структуры
этого семейства были расшифрованы методом электронной мик-
роскопии (динамическое рассеяние от кристаллов с большой
толщиной) и обозначаются 15R E) и 30RE) с периодами повто-
ряемости вдоль гексагональной оси, равными 169,5 и 339 А [3].
Имеются сведения о других структурах, в основе которых ле-
жат повторяющиеся элементы, построенные из большего числа
слоев шпинели, например 2НG) и 3RG).
Структура магнетоплумбита PbFi2Oi9 построена из слоев
магнетита Fe3O4, чередующихся со слоями, содержащими ионы
РЬ2+. Проведено детальное рентгеноструктурное исследование
изоструктурного соединения SrAl12Oi9 [4]. В структуре магне-
топлумбита (рис. 13.6,6) существует последовательность из
пяти плотноупакованных слоев, четыре слоя состоят из атомов
кислорода (О4 на ячейку), в пятом слое 'Д позиций занимают
ионы РЬ2+ (РЬО3). Таким образом, состав оксида — PbOi9
плюс атомы железа в тетраэдрических и октаэдрическнх пусто-
тах. В последние годы интенсивно изучались соединения, со-
держащие барий вместо свинца, так как они образуют большую
группу ферромагнитных соединений, применяемых в электрон-
ных приборах. Первыми были изучены изоструктурный магне-
топлумбиту BaFe12Oi9, а также BaFei5O23 [5] и BaFei8O27 (со-
держащие 5 и 6 слоев О4 в повторяющемся элементе). Гексаго-
нальные ферриты еще более многочисленны, чем политипы SiC.
которые насчитывают по крайней мере 50 соединений с пара-
метром с, доходящем вплоть до 990 А.
320 13. Сложные оксиды
Эти соединения подразделяют на две серии. В каждой из
них возможны различные последовательности «единиц» (эле-
ментов), составленных из «субъединиц» (блоков) трех типов,
в свою очередь образованных слоями О4 или ВО
о4
2 слоя
блок S-M2Fe408
5 слоев
длок М-BaFe
04
О3Ва
04
04
04
6 слоев
блок Y -
-04
- 03 Ва
- О3Ва
-о;
-о4
-О4
(М — обычно Zn, Ni, Co или Fe).
Блоки S, М и Y могут сочетаться в различном соотношении
и в разной последовательности, но с соблюдением определенно-
го порядка: блоки М обычно сочетаются с Y (реже с S), бло-
ки Y не сочетаются с S, а блоки М, Y и S не могут сочетаться
все вместе. Так образуются две основные серии ферритов:
1) MnS (один блок S и п блоков М, в пределе M(BaFei2Oi9));
2) MpYn (предельный член Y(Ba2M2Fei2022))- Получено пять
членов первой серии, например МбБ — это Ba6M2Fe76Oi22 с с =
= 223 А; вторая серия более многочисленна и включает ~60 со-
единений. Например, M4Y33 имеет последовательность
MYeMYjoMYrMYio с составом Ba7oM66Fe44408o2 и с =1577 А. Рас-
шифровка таких структур методом рентгеноструктурного анали-
за связана с большими трудностями, однако последовательность
элементов может быть определена методом электронной мик-
роскопии протравленных азотной кислотой образцов с исполь-
зованием платинированных углеродных реплик. Протравлен-
ные образцы принимают форму тонких уступов вдоль краев
слегка скошенных от травления впадин, и, зная абсолютное
увеличение, из реплик можно определить высоты двух типов
ступенек. Например, образец M2Y7 имеет большую и малень-
кую ступеньки, соответствующие элементам MY и MYs, соеди-
ненным в последовательности MYMYsMYMYe... Более сложный
четырехступенчатый протравленный образец феррита M4Y15 ин-
терпретирован в виде последовательности MYMY2MY3MY9...,
с = 793 А (см. литературу, цитируемую в работе [6]).
Структура BaFei2Oig [7] представляет собой интересный
пример 10-слойной плотнейшей упаковки (ккггг):
ВАВ'АВСАС'АС...
;тде В' и С — слои ВаО3. Структура примечательна также тем,
13.5. Оксиды
321
что атомы железа имеют три типа координационных много-
гранников:
18 Fe
4 Fo
2 Fe
Октаэдр
Тетраэдр
Григональная бипирамида
для двух молекул
Литература. [11 Ada cryst., 1971, В27, 1826. [2] Acta cryst., 1977, ВЗЗ, 1596.
[3] J Solid State Chem., 1980, 33, 37. [41 Acta cryst., 1975, B31, 2940. [5J Acta
cryst., 1954, 7, 640. [6] Science, 1971, 172, 519. [71 Z. Kristallogr., 1967, 125,
437.
13.5.4. CaFe2Oi, CaTi2Oi и родственные им структуры. Для
оксидов с большими ионами А структура шпинели уже не мо-
жет быть устойчивой. Для них предпочтительнее структуры, по-
строенные из «двойных цепочек рутила», которые образуют
трехмерный каркас; внутрь этого каркаса внедряются большие
ионы А в позициях с координационным числом 8. Известен ряд
таких структур; они были описаны в гл. 5.
Пока неизвестны какие-либо другие соединения, имеющие
структуру CaTi2O4, но существует много соединений со струк-
турой CaFe2O4; среди них не только оксиды MnM2niO4 (и не-
которые сульфиды), но также и более сложные соединения,
в которых ионы М3+ и М4+ статистически занимают позиции
Fe3+, а ионы Na+ — позиции Са2+ [Inorg. Chem., 1967, 6, 631;
Inorg. Chem., 1968, 7, 113, 1762; Acta cryst., 1967, 23, 736]:
Y,
Ho,
и т. д.
Во всех случаях окружение Са2+ (или эквивалентного ему
иона) состоит из восьми атомов кислорода (серы), а еще один
атом (девятая вершина трехшапочной тригональнон призмы)
находится на гораздо большем расстоянии.
Еи3О4 Ей3-- — 6 О (октаэдр) 2,34 А
( 6 О (призма) 2,67 А
Еи2+ 2 О 2,72 и 2,96 Л
I 1 О 3,99 А
В NaScTiO4 восемь расстояний Na—О лежат в интервале 2,43-г-
-4-2,65 А, а девятое равно 3,34 А.
В структурах CaFe2O4 и CaTi2O4 большие по размеру ионы
(Са2+) размещены между двойными октаэдрическими цепоч-
ками, которые содержат меньшие по размеру ионы Fe2+ или
21—985
ЕипЕи2ш04
SrEu2O4
CaFe2O4
v,
Cr,
In2
и т. д.
NsScTiO4
NaScSnO4
NaAlGeO4
и т. д.
Eu
Sm
РЬ
Sr
Ва
322 13. Сложные оксиды
Ti3+. Интересную структуру имеет BeY2O4, у которого меньшие
по размеру ионы Ве2+ (Be—О 1,55 A; Y—О 2,29 А) размещены
по позициям с КЧ 3 (компланарные связи) между учетверен-
ными цепочками. Эти цепочки соединены друг с другом не
только двумя крайними точками, но и серединами с обеих сто-
рон, как показано на проекции структуры (рис. 13.7). (Такое
необычное координационное число, равное 3, имеют также че-
тыре из семнадцати ионов Ве2+ в Са^ВепОгэ [Acta cryst.,
О Be
Рис. 13.7. а — структура ВеУгС^, спроектированная вдоль направления учетве-
ренных цепочек рутила; б — структура ТИпгОа.
1966, 20, 295]). Трехмерный каркас на рис. 13.7, а имеет состав
МО2 (М2О4), он обнаружен также у ряда оксоборатов. В син-
тетическом FeCoBO4 существует упорядоченное расположение
атомов железа и кобальта в каркасе, а атомы бора занимают
позиции бериллия (рис. 13.7,а). Поскольку в этой структуре
присутствуют плоские группировки ВОз, формулу соединения
можно записать в виде FeCo(BO3)O. В минерале варвиките
Mg3TiB2O8 атомы титана занимают 'Д позиций металла в кар-
касе структуры, а магний может быть замещен на железо. По-
этому формулы этих соединений можно записать следующим
образом:
Be (Y2O4), В (FeCoO4), B2 (Mg,TiO8)
Было бы интересно установить, может ли эта серия быть до-
полнена синтезом таких соединений, как Li(MniMIVO4) (см..
также разд. 6.11).
Структуры оксидов TiM2O5 (M=La, Y, Gd, Sm, Eu) по су-
ществу имеют такой же каркас МХ2 с атомом титана и пятым
атомом кислорода, размещенными в туннелях каркаса. Титан
имеет КЧ 5 (тригональная бипирамида); его полиэдр сочленя-
ется с другими группировками TiOs двумя экваториальными
13.5. Оксиды
323
атомами кислорода (не входящими в каркас) с образованием
цепочек; окружение атомов М в каркасе дополнено седьмым
атомом кислорода. Структура TiIn2O5 содержит похожие цепоч-
ки построенные из полиэдров TiO5, а каркас МО2 (рис. 13.7,0)
очень близок к каркасу в соединении BeY2O4. VIn2O5 имеет та-
кую же структуру.
Тип каркаса
на рис. 13.7
Соединение
Состав кар-
каса
Атом(ы) о
туннелях (КЧ)
Литература
BcYoO4
FeCoBO4
TiLa2O5
TiIn2O5
Y2O4
FeCoO4
Be C)
В C)
Mg3Ti08 B2 C)
La2O4
1п2О4
Acta cryst., 1967, 22, 354
Z Kristallogr., 1972, 135,
321
Acta cryst., 1950, 3, 98,
473
Ti E) О Acta cryst, 1968, B24,
1327
Ti E) О Acta cryst., 1975, B31,
1614
13.5.5. Структурный тип /C2A/tF4. Структуры ряда сложных
оксидов X2YC>4 родственны структуре перовскита, которая со-
ответствует оксиду XYO3. Слой структуры перовскита в одну
элементарную ячейку толщиной
имеет состав X2YO4. Если такие
слои сместить один относительно
другого так, как это показано на
рис. 13.8, то образуется тетраго-
нальная структура с с = 3а, где
а — параметр ячейки в структуре
перовскита. В полученной структу-
ре атомы Y имеют такое же окру-
жение, как в перовските, а именно
6 атомов кислорода в виде октаэд-
ра, а атомы X — необычное КЧ 9
вместо исходного, равного 12. Если
слои структуры перовскита имеют
толщину в п элементарных ячеек,
то состав кристалла будет выра-
жаться формулой Хп-Н^пОзл+Ь Из
ряда сложных оксидов стронция —
титана были изучены первые три
члена: Sr2Ti04, Sr3Ti207 и Sr4Ti3O10
[Acta cryst., 1958, П, 54]. Структу-
ра типа X2YO4 впервые была иссле-
дована на примере соединения
о N1
О
Рис. 13.8. Структура K2NiF«.
21"
324 13. Сложные оксиды
K2N1F4. Ниже приведен ряд соединений с такой структурой
[J. Phys. Chem., 1963, 67, 1451]:
K2MF4: M = Mg, Zn, Co, Ni
M,UO4: M = K, Rb, Cs
Sr,MO4: (M = Ti, Sn, Mn, Mo, Ru, Ir, Rh)
Ba,MO4: (M=Sn. Pb)
Sr2Fc03F, K2Nb03F, La2Ni04
Интересно сравнить изоструктурные между собой Sr2Ti04,
Са2Мп04 и K2NiF4 с соединениями SrTiO3, СаМпО3 и KNiF3, ко-
торые кристаллизуются в структуре перовскита.
K2C11F4 и (NH4JCuCl4 с искаженной структурой KsNiF4
рассмотрены в гл. 5. Там они были описаны как построенные
из слоев (NiF42~)n, образованных октаэдрами, сочлененными по
четырем экваториальным вершинам; слои соединены в трех-
мерный каркас ионами К+.
13.6. Структуры других сложных оксидов
13.6.1. Структурный тип псевдобрукита А2ВО5. В этой струк-
туре [1] ионы В имеют октаэдрическую координацию, а коор-
динация ионов А — необычная. Она может быть описана либо
в виде сильно деформированного октаэдра, либо в виде иска-
женного тетраэдра, ибо в структуре Fe2Ti05 четыре расстояния
Fe—О равны 1,92 А (в среднем), а еще два — 2,30 А. Коорди-
национное окружение титана — октаэдр, как в соединениях
TiO2, FeTiO3 и др. Оксид А12ТЮ5 также имеет структуру псев-
добрукита. Об оксиде Ti3O5 см. разд. 12.7.1.
13.6.2. Оксиды АВ2О6. В гл. 4 уже упоминался ряд соединений,
в которых ионы металла занимают половину октаэдрических
пустот в структурах с плотнейшей упаковкой. Ниже приведены
три структуры с гексагональными плотнейшими упаковками
этого типа:
структура трирутила: см. разд. 4.3 и 6.3.1
структура колумбита (ниобита): см. разд. 4.3 [2]
структура Na2SiF6: см. разд. 4.3 и 10.1.5
Поскольку во всех этих структурах и ионы А, и ионы В за-
нимают октаэдрические пустоты, такой тип структуры подходит
только для соединений с небольшими по размеру ионами метал-
ла, что можно видеть из следующих примеров: ZnSb2O6 (струк-
тура трирутила), (Fe, Mn)Nb2O6 (структура ниобита) и NiU2OG
[3] (структура Na2SiF6).
13.6. Структуры других оксидов 325
Структура СаТа2Об [4] описана вместе с другими октаэдри-
ческими структурами в гл. 5; как и в структуре CaFe2O4, в со-
единении тантала ионы Са2+ имеют К.Ч 8; девятый, более уда-
ленный атом кислорода мог бы дополнить полиэдр до трехша-
почной тригональной призмы.
Литература. [1] Acta cryst., 1953, 6, 812. [21 Ark. Kem., 1963, 21, 407. [3] Z.
anorg. allg. Chem., 1968, 358, 226. [4] Acta Chem. Scand., 1963, 17, 2548.
13.6.3. Структурный тип пирохлора А2В2О7. Эта структура уже
упоминалась в связи с анализом трехмерных сеток в гл. 3, а
также в качестве примера трехмерного каркаса, построенного
из октаэдров, в гл. 5. Геометрия этой структуры в дальнейшем
обсуждалась в гл. 6. Было отмечено, что состав каркаса описы-
вается формулой В2О6 (ВО3) н что этот каркас может сущест-
вовать и без атомов А или без седьмого атома кислорода.
В последнем случае каркас представляет собой структуру ок-
сидов ряда АВОз («дефектная структура пирохлора»). Описы-
ваемая структура получила свое название от минерала пиро-
хлора, который приближенно имеет состав (CaNa)Nb2O6F, и
так как позиция седьмого аниона может быть занята ионами
ОН", F~~ и даже молекулами воды, в табл. 13.12 приводится
Таблица 13.12. Соединения А2В2Х7 со структурой пирохлораа
Соединение
AgSbO,
Sb-,O6OH
BiTa2O6F
A1(OH,FK-—H2O
Hg2Nb,O7
A2
Ag
Sb
BiHI
—
Hg2
B2
Sb2
Sb2v
Ta2
Al2
Nb2
X6'
o6
o6
o6
(OH,FN
о6
X"
ОН
F
(H2O)jL
О
'См. более поздние исследования сложных оксидов с такой структурой [Inorg.
Chem., 1965, 4, 1152; Inorg. Chem., 1968, 7, 1649, 1704, 2553; Inorg. Chem., 1969, 8, 1807].
общая формула АгВгХв'Х". Самую большую группу соединений
со структурой пирохлора образуют оксиды А2В2О7, которые
включают следующие соединения:
M2nM2vO7: Cd,Nb,O7> Cd2Re207, Ca2Ta207, Hg.2Nb207
M2mM2IVO,: M2Pt207 (M = Sc, Y, In, Tl; получены
при высоком давлении кислорода)
Координационный полиэдр А в соединениях А2В2Х7 состоит из
6 атомов X, входящих в каркас В2Х6, и двух дополнительных
атомов X. В структурах некоторых оксидов восемь атомов кис-
лорода находятся приблизительно на одинаковом расстоянии
326 13. Сложные оксиды
от А, образуя слегка искаженный куб, по в других случаях су-
ществует заметное различие между шестью расстояниями А—О
и двумя другими расстояниями А—О. Поэтому вполне оправ-
данно описание структуры в виде двух взаимопроникающих
каркасов — А2О и октаэдрического В2Об. Таким способом в
гл. 3 описана структура Hg2Nb207 как производная от структуры
алмаза. Было показано, что атомы ртути образуют с атома-
ми кислорода две линейные связи (Hg—20 2,26 А) в трехмер-
ном каркасе того же типа, что и одна из двух эквивалентных
трехмерных сеток в Си2О. (Остальные шесть атомов кислорода
находятся на расстоянии 2,61 А.) Эта особенность структуры
пирохлора отмечена в гл. 7 (рис. 7.3,6).
13.6.4. Слоистые структуры АтВ^Хт, родственные перовскиту.
В разд. 5.3.4 описаны две слоистые структуры соединений
АтВгХ~, построенных из двумерных блоков типа перовскита.
Существует два семейства таких структур: со слоями состава
ВлХз,-.-ц и ВпХзп+2. Состав В2Х7 возможен и в первом семействе
при л = 2, и во втором при /г = 4. В слоях В2Х7 первого семейст-
ва каждый октаэдр ВХ6 соединен с другими октаэдрами пятью
общими вершинами, в то время как во втором семействе поло-
вина октаэдров ВХ6 имеет по четыре общие вершины с соседни-
ми, а вторая половина — по шесть вершин. Примеры соедине-
ний с такой структурой:
Acta cryst., 1958, 11, 54
Acta cryst., 1976, B32, 2564
Acta cryst., 1975, B31, 1912
Acta cryst., 1975, B31, 2129
13.6.5. Структурный тип граната. Гранаты известны очень дав-
но и представляют собой группу ортосиликатных минералов
M3nM2In(Si04K, в которых М" = Са, Mg или Fe, а Мш = А1,Сг
или Fe3+. Поскольку суммарный отрицательный заряд в них,
равный —24, может быть компенсирован различными способа-
ми, структура граната имеет множество сложных оксидов; не-
которые примеры таких соединений приведены в табл. 13.13.
Возникший в последние годы интерес к оптическим свойствам
этих соединений вызвал интенсивное исследование их струк-
тур.
Основу структуры граната образует трехмерный каркас, по-
строенный из октаэдров М"Об и тетраэдров М"'О4; в этом кар-
касе каждый октаэдр соединен с шестью другими октаэдрами
через тетраэдры, имеющие с ними общие вершины. Каждый
тетраэдр связывает своими вершинами четыре октаэдра, так что
каркас имеет состав о2^3 = (М3J(М//'02)з=М2//Мз///012.
Большие по размеру ионы М' размещены по позициям с КЧ 8
П Y
ВпХзл+2'.
(/t=2) Sr3Ti207
(п—4) Sr2Ta207
Sr2Nb20,
La2Ti207
13.6. Структуры других оксидов 327
(додекаэдр) в пустотах каркаса, что дает окончательный состав
соединения Мз'М2"Мз'"О12 или, если желательно, как в случае
ортосиликатов, подчеркнуть тетраэдрические группировки,—
]Ц3/М2//(М"/О4)з. В некоторых соединениях все позиции М" и
М'" заняты атомами одного элемента, тогда состав соединения
упрощается, например Y3AI5O12. Если, помимо этого, половина
позиций М" занята атомами М', то формула сводится, напри-
мер, к Y4A14O12 (или УАЮз).
Таблица 13.13. Соединения со структурой граната
М'
(КЧ8)
Ме?ч
Са3
Y3
NaCa2
NaCa2
Y3
CaNa2
Ca3
Na3
Ca3
Cd3
Ca3
M"
(КЧ6)
Al2
Al,
Al2
Zn2
YA1
Ti2
Tc2
Te2
CaZr
CdGe
Al2
M"
(КЧ4)
Si3, O12
Si3
Al3
As3
v3
Al3
Ge3
Zn3
Ga3
Ge3
Ge3
(OHIS
Литература
Acta crvst., 1961, 14, 835; Am
Mineral., 1965, 50, 2023
Z. Kristallogr., 1966, 123, 81
Inorg. Chem., 1969, 8, 1000
Inorg. Chem., 1969, 8, 1000
Inorg. Chem., 1969, 8, 183
Science, 1969, 163, 386
Acta crvst., 1934, 17, 1329
J. Chem. Phys., 1968, 48, 3037
(нейтронография)
Упорядоченное расположение двух сортов ионов по октаэд-
рическим позициям обнаружено также в тетрагональных (псев-
докубических) модификациях высокого давления соединений
CaGeO3 и CdGeO3. Структуры полиморфных модификаций
СаОеОз прекрасно иллюстрируют возрастание координацион-
ных чисел катионов при повышении давления.
Координационные чис-
ла катионов
Структура
6, 4
CaGeO3-I
волластонит
8 и 6 6 и 4
CaGeCvII
тип граната
12, 6
CaGeCh-III
перовекпт
Каркас граната может существовать и в отсутствие ионов
М', т. е. в соединениях с формулой M/'iVVO^, как, например,
в Al2(WO4K. В таких соединениях существуют значительные
искажения структуры, приводящие к увеличению углов при мо-
стиковых атомах кислорода, соединяющих атомы М" и W
A43—175°). Такой же каркас обнаружен у так называемых
«гидрогранатов». Нейтронографическое исследование гидро-
гроссулара Са3А12(ОНJ показало, что места групп SiO44~ за-
323 13. Сложные оксиды
нимают тетраэдрические группировки О4Н44^, причем центр
группировки приходится на позицию кремния в структуре гра-
ната. Слегка искаженный тетраэдр атомов кислорода окружен
тетраэдрической группировкой из атомов водорода. Координа-
ционный ^полиэдр кальция — многогранник, промежуточный
между кубом и антипризмой.
1,3.6.6. Другие структуры сложных оксидов. Структуру Li4UO5
[1] (и изоструктурного Na4UO5) можно описать "либо как
структуру NaCl, в которой уран занимает У5, а литий 4/5 ка-
тионных позиций, либо как структуру, содержащую цепочки,
построенные из октаэдров UO6, соединенных противоположны-
ми вершинами. Группировки UO6 имеют тетрагональное иска-
жение, в них четыре экваториальные связи A,99 А) короче,
чем две другие B,32 А), в отличие от оксидов состава UMO12
(см. ниже), в которых все шесть связей U—О имеют одинако-
вую длину, и соединения BaUO4, содержащего две более ко-
роткие линейно расположенные связи.
Оксиды Mg6Mn08 и Cu6Pb08 имеют слегка искаженную
структуру NaCl [2], в которой lU катионов М2+ замещена вдвое
меньшим числом ионов М4+. Поскольку размер иона Мп4+ на-
много меньше, чем иона Mg2+ (Mg—6 0 2,10 А; Мп—6 0
1,93 А), кубическая плотнейшая упаковка ионов кислорода
слегка искажена. Расчеты электростатической энергии дефект-
ных структур показали, что в общем случае ионные кристаллы
с вакансиями должны иметь упорядоченные, а не статистиче-
ские структуры.
Структура Zn2Mo3!VO8 представляет интерес с нескольких
точек зрения [3]. Тип плотнейшей упаковки атомов кислорода
в этой структуре АВСВ Атомы молибдена занимают окта-
эдрические пустоты, группами по три, как показано на рис.
5.22, г. Вследствие взаимодействия металл — металл (Мо—Мо
2,52 А) соединение имеет диамагнитные свойства. Одна поло-
вина атомов цинка занимает тетраэдрические пустоты, вто-
рая—октаэдрические; длины связей (в среднем) равны Zn—
—40 1,98 A; Zn—6 0 2,10 А.
Твердые растворы UO2+;t: Y2O3 [4] имеют дефектную
структуру флюорита, причем степень дефицита анионов зави-
сит от состава и парциального давления кислорода. Когда де-
фицит по кислороду становится слишком большим, происходит
структурная перестройка с образованием ромбоэдрической
структуры M'M6"Oi2, которую можно получить из флюорита
путем удаления двух атомов кислорода вдоль оси третьего по-
рядка и упорядочения вакансий; образующаяся при этом
структура (называемая б-структурой) содержит одну катион-
ную позицию с КЧ 6 (октаэдр) и шесть позиций с КЧ 7 G вер-
13.6. Структуры других оксидов 329
шин слегка искаженного куба). Такую структуру имеют Рг7О,2
[5] (а также Tb7Oi2 и Ce7Oi2) и следующие соединения:
UMeO12: М = La и все 4 /-металлы от Рг до Lu
WMeO12: M = Y и все 4 /-металлы от Но до Lu
МоМеО12: М= Y и все 4 /-металлы от Ег до Lu
а также сложные оксиды Zr3Sc4Oi2 и Zr3Y4Oi2. Структуры ок-
сидов UM6Oi2 представляют собой сравнительно редкие приме-
ры структур, в которых уран(VI) имеет почти неискаженное
координационное окружение в виде октаэдра из шести атомов
кислорода (о структуре 6-Ш3 см. разд. 28.2.4). При рентгено-
структурном анализе оксида Zr3Y4Oi2 не удается определить
распределение ионов Zr4+ и Y:!+ по катионным позициям вслед-
ствие близкой рассеивающей способности двух сортов катио-
нов, но по величине расстояний М—О можно предположить, что
октаэдрические позиции заняты ионами Zr4+, а шесть позиций
с КЧ 7 заселены статистически двумя ионами Zr4+ и четырьмя
ионами Y3+ [6].
Из многочисленных сложных оксидов рения с лантаном и
другими 4/-элементами до сих пор в книге была описана толь-
ко" структура La4Re6Oi9 [7] (разд. 5.3.5). Она содержит груп-
пировки OLa4, расположенные в пустотах трехмерного каркаса,
который образован из пар сочлененных ребрами октаэдров
ДеОб, соединенных концевыми вершинами. Другой оксид с ин-
тересной структурой имеет эмпирический состав La2Re05 [8].
В решетке типа флюорита, состоящей из атомов кислорода,
ионы La3+ занимают 4/5 кубических пустот, остальные пустоты
заняты парами атомов рения со связью Re—Re B,26 А), парал-
лельной ребру куба. Окружение группировки Re2 аналогично
окружению Re2 в ионе Re2Cl82~ (рис. 9.14,6). Таким образом,
формулу этого оксида предпочтительнее писать в виде
La4Re2Oio-
Структуры семейства сложных оксидов с формулами
Bii2Ge02o, Bi2sFe04o и Bi38Zn06o описаны в разд. 20.3.1.
В структуре Ca2Fe205 октаэдры FeO6, соединенные четырьмя
экваториальными вершинами, образуют слои; эти слои связаны
в трехмерный каркас состава Fe2Os через тетраэдры FeO4. Кар-
кас состоит из равных количеств тетраэдров и октаэдров, ко-
торые соединены общими вершинами:
и о | (см. разд. 5.4)
Ионы кальция заполняют пустоты каркаса, имеющие форму не-
правильных многогранников [9].
Литература. [1] J. Inorg. Nucl. Chem., 1964, 20, 693. [21 Acta cryst., 1954, 7,
246. [3] Acta cryst., 1966, 21, 482. [4] Inorg. Chem., 1964, 3. 949; 1966. 5, 74P.
330 13. Сложные оксиды
[5] Acta cryst., 1975, В31, 971 (нейтронография). [6] Acta cryst., 1977, ВЗЗ, 281.
[7| Acta cryst., 1968, B24, 1466. f8J Acta cryst., 1976, B32, 1485. [9] Acta cryst.,
1970. B26, 1469.
13.7. Сложные оксиды, содержащие титан, ванадий,
ниобий, молибден или вольфрам
В гл. 5 построение некоторых из простейших структур описано
путем сочленения друг с другом октаэдрических группировок
АХ6 через общие вершины, ребра и (или) грани с образованием
бесконечных одно-, дву- или трехмерных структур. Теперь рас-
ширим рамки этой процедуры, чтобы получить некоторые го-
раздо более сложные структуры. В гл. 5 в качестве конструк-
тивных элементов использовались сначала цепочка АХ5 (струк-
туры ДеОз), образованная из октаэдров, соединенных двумя
противоположными вершинами, и цепочка АХ4 (структуры ру-
тила), образованная из октаэдров, сочлененных по двум про-
тивоположным ребрам, а затем соответствующие двойные це-
почки, образованные из двух простых цепочек путем сочлене-
ния ребрами. О «структурах сдвига», встречающихся в неко-
торых оксидах молибдена и вольфрама, также упоминалось
(эти структуры построены из слоев структуры ИеОз); обсужда-
лись и некоторые более сложные структуры, построенные из
блоков ИеОз (УбС^з, высокотемпературный ND2O5).
Как уже отмечалось, существует два способа сочленения
блоков структуры ReO3 с использованием общих ребер октаэд-
ров, приводящих к построению всей структуры в целом (рис.
5.35,а и б). Отмечали также, что тип а встречается в некото-
рых оксидах молибдена и вольфрама, тип б— в \VNb12O33, a
оба типа — и а, и б — в одной модификации Nb2O5, в NaVMoOe
с простой структурой «браннерита» и метамиктных минералах
ТЬТ12Об и 11Т12Об. Образуемые структуры можно разделить на
несколько типов:
а) структуры простых или сложных оксидов, в которых все
атомы металлов имеют координационный полиэдр в виде ок-
таэдра;
б) трехмерные каркасы, внутри которых находятся ионы
натрия, калия и др., заселяющие позиции с высокими коорди-
национными числами (>6), причем эти ионы играют важную
роль в стабильности каркаса, который без них, т. е. как струк-
тура оксида переходного металла, не может существовать. При-
мерами обычных стехиометрических соединений такого типа
являются оксиды Na2Ti6Oi3 и KTi3Nb09 с КЧ ионов щелочных
металлов 8 и 10. В некоторых каркасах, имеющих состав МО2
или МОз, который соответствует составу простого оксида, у ча-
сти атомов металла М происходит изменение валентности, что
13.7. Сложные оксиды, содержащие Ti, V, Nb, Mo или У/
331
приводит к образованию таких нестехиометрических фаз. как
NaxMO2 или NaxMO3, имеющих довольно необычные физиче-
ские и химические свойства. Эти соединения, называемые брон-
зами, описаны ниже в последнем разделе этой главы;
в) слоистые структуры таких соединений, как Кг^гОв,
Na2Ti307 и KTiNbOs, содержащие ионы щелочных металлов
с КЧ 8, 7 и 9, 8. Они демонстрируют другой способ размещения
крупных катионов;
г) надо упомянуть также большую группу структур, кото-
рые близки к бронзам и в которых некоторые атомы металла
Рис. 13.9. а и б — кратная цепочка, образованная из четырех цепочек струк-
туры ИеОз; в — слои в KTiNbOs; г — трехмерный каркас в KTiaNbOj.
имеют координационный полиэдр в виде бипирамиды. К этой
группе относятся простые оксиды МО5О14, МО17О47 и Wi8O49-
Очень простой метод построения структур из цепочек ReOj
с применением обоих типов сочленения ребрами заключается в
том, что сначала строится двойная (либо другой кратности) це-
почка, а затем две такие цепочки объединяются вместе с образо-
ванием более сложной цепочки (рис. 13.9, а и б). Такие сложные
цепочки далее могут быть соединены посредством общих вер-
шин в слои (рис. 13.9, е), а слои — в трехмерный каркас (г),
Оба типа структур могут содержать щелочные или щелочнозе-
[ельные катионы, как в тех примерах, которые показаны на
исунках. Можно взять в качестве исходной, например, трой-
ую, четверную и т. д. цепочки (табл. 13.14). Возможно суще-
твование более сложных структур, в целом такого же типа,
ю с октаэдрами B + 3) или C + 4) в первичной «цепочке»;
результате образуются трехмерные структуры с промежуточ-
[ыми формулами М5О11, M70is и т. д., например Na2Ti7Oi5 [1].
332 13. Сложные оксиды
Таблица 13.14. Структуры, построенные из кратных октаэдрических цепочек
Тип цепочки
Из 4 октаэдров
(рис. 13.9)
Из 6 октаэдров
Слоистая
структура
М2О5
KTiNbO5
М3О7
Na2Ti307
Каркасная
структура
М4О9
KTi3Nb09
BaTi4O9
М6О13
Na2Ti6013
Литература
Acta cryst., 1964, 17, 623
J. Chem. Phys., 1960, 32
1515
Acta cryst., 1961, 14, 1245
Acta cryst., 1962, 15, 194
Второй принцип построения структур заключается в том,
чтобы взять бесконечный блок структуры ReO3 и соединить
его с другими блоками с образованием либо изолированных
кратных блоков, либо бесконечного слоя, а затем посредством
сочленения общими ребрами по второму типу (рис. 5.35,6)
объединить полученные элементы в трехмерный каркас с рас-
положением одинаковых элементов на различных уровнях.
Структуры второго типа более простые, чем первого, и поэтому
они будут рассмотрены раньше. Минимальный возможный блок
структуры ReO3 содержит четы-
ре цепочки ReO3 (блок 2x2); из
таких фрагментов построен трех-
мерный каркас соединения
AlNbO4 [2]. Простые диоксиды,
имеющие каркас такого типа, не-
известны, но он обнаружен в сое-
Na+ динении Na^TiO2[3], бронзе, со-
держащей ионы Ti3+ и Ti4+ и
ионы Na+, частично заселяющие
позиции, показанные на рис.
13.10. Ряд оксидных фаз имеют
структуры такого типа с больши-
ми по размерам блоками ReOs,
например V6Oi3 (блоки 3X2), структура которого изображена
на рис. 5.38, TiNb2O7 (блоки 3x3), Nbi2O29 и Ti2Nbi0O29 (блоки
3X4). Все члены этого ряда, в котором блоки структуры ReO3
содержат (ЗХп) цепочек, могут быть описаны общей форму-
лой М3„О8«-з. Конечный член ряда представлен оксидами
Nb3O7F и V2MoO8 (табл. 13.15).
В структурах, которые мы только что описали, базисные
блоки ReO3 объединены в бесконечные «слои» посредством
сочленения ребрами по первому типу. Существуют также струк-
туры, в которых блоки на обоих уровнях соединены лишь в
Рис. 13.10. Структура Na/riO2.
333
Таблица 13.15. Оксиды
п
2
3
4
00
Формула
М6О13
М9О21 (=М3О7)
М12О29
М3О8
Примеры
v6o13
TiNb2O7
Nb12O29
ТШЬкАд
V2MoO8
Nb3O7F
Литература
Helv. Chem. Acta, 1948, 31, 8
Acta cryst., 1961, 14, 660
Acta Chem. Scand., 1966, 20,
Acta cryst., 1961, 14, 664
Acta Chem. Scand.,
1658
Acta Chem. Scand.,
2233
1966, 20
1964, 18
Рис. 13.11. Структуры, построенные из блоков ReO3. a — TiNb24Oe2; б — высоко-
температурная модификация NbjCV
334 13. Сложные оксиды
пары, при этом также имеется возможность образования бло-
ков различных размеров. На рис. 13.11, а показана структура
ИЬгбОбг [4] (и TiNb24O62). в которой размер первичных, связан-
ных в пары блоков — 3X4. В промежуточном классе структур
наблюдается соединение блоков ReO3 одного семейства в бес-
конечные слои (слабо заштрихованы на рис. 13.11,6), в то вре-
мя как блоки на другом уровне являются дискретными. К этой
группе структур принадлежат Nb22O54 [5] и высокотемператур-
ная модификация Nb2Os [6], которые различаются размерами
блоков ИеОз на двух уровнях. В структуре высокотемператур-
ной модификации Nb2O5 (рис. 13.11,6) блоки размером 3x5
октаэдров соединены на одном и том же уровне с образованием
бесконечных полос, а эти полосы соединены друг с другом с
помощью блоков 3X4, сдвинутых на другой уровень (выделены
жирными линиями). В обоих структурах, показанных на
рис. 13.11, имеются тетраэдрические пустоты, отмеченные чер-
ными кружками, некоторые из них заселены (упорядоченно)
атомами металла. В элементарной ячейке высокотемператур-
ного Nb2O5 27 атомов ниобия находятся в октаэдрических пози-
циях, а один атом ниобия занимает тетраэдрическую пустоту.
Литература. [l]Acta cryst., 1968, В24, 392. [21 Ada Chem. Scand., 1962, 16, 421;
Acta cryst., 1965, 18, 874. [3] Acta cryst., 1962, 15, 201. [4] Acta cryst., 1965, 18,
724. [5] Acta Chem. Scand., 1965, 19, 1401. [6] Acta cryst., 1964, 17, 1545. Обзор
некоторых соединений см. в работе fHelv. Chim. Acta (Fasc. extra, A. Werner).
1967, 207].
13.8. Бронзы и родственные им соединения
Название «бронза», которое в 1824 г. Велер впервые присвоил
соединениям вольфрама, в настоящее время применяется для
твердых оксидных фаз, обладающих следующими характерны-
ми свойствами: интенсивная (или черная) окраска и металличе-
ский блеск, металлическая проводимость или полупроводнико-
вые свойства, существование области гомогенности и устойчи-
вость к воздействию кислот, не обладающих окислительными
свойствами. Например, бронзы NaxWO3 имеют цвета от золо-
тисто-желтого (л;«0,9) до красного (х«0,6) и интенсивно-
фиолетового (л:даО,3). Большинство бронз имеют структуру
прототипа, т. е. оксида состава МО2 или МО3, где М—(пере-
ходный) металл, способный проявлять валентность, меньшую
чем 4 или 6. Если часть атомов M(VI) в МОз переходит в
M(V), в структуру внедряются катионы (щелочных или щелоч-
ноземельных металлов, La3+ и т.д.), необходимые для поддер-
жания электронейтральности структуры в целом, причем элект-
роны, высвобождающиеся при этом процессе, не принадлежат
индивидуальным ионам металла в структуре прототипа, а рао
13.8. Бронзы 335
пределяются по всей структуре, приводя к возникновению ме-
таллической проводимости или полупроводимости. Исходя из
геометрии структур, можно предположить, что металлическая
проводимость бронз возникает не из-за непосредственного пе-
рекрывания орбиталей металлов, а из-за их взаимодействия
через атомы кислорода.
Были синтезированы бронзы, в которых M = Ti, V, Nb, Та,
Mo, W, Re или Ru (см. также Na*Pt3O4, разд. 12.2.11). Как пра-
вило, все они получены при нагревании смесей Na2WO4, WO3 и
WO2 в вакууме, либо восстановлением Na2WC>4 водородом или
расплавленным цинком (для Na — W-бронз), либо сплавлением
V2O5 с оксидом щелочного металла, при котором теряется кис-
лород и образуются ванадиевые бронзы, либо восстановлением
водородом при 950 °С оксида Na2Ti307, при котором образуются
сине-черные кристаллы Na/TiO2. Свойства бронз и причины их
образования полностью не установлены; в частности, не найде-
но связи между возникновением свойств, типичных для бронз,
и структурой фазы. Например, существуют фазы со структура-
ми как тетрагональных, так и гексагональных вольфрамовых
бронз, но тем не менее не являющиеся бронзами (см. ниже).
Оксид LuTi4-A74O8 — это нестехиометрическая фаза со структу-
рой рамсделлита (разд. 12.5.1), но она бесцветна (т. е. не брон-
за), в то время как КолзТЮ2 имеет очень близкую к ней струк-
туру голландита, однако это уже бронза. Некоторые бронзы
имеют слоистые структуры (их примеры приведены ниже),
но большинство бронз имеют трехмерные каркасные структуры,
причем состав структуры-прототипа соответствует составу про-
стого оксида, как в случае Na/ПОг, Na^V^Os и Na.sWO3. Очень
часто такой каркас, характерный для бронзы, не обязательно
является устойчивым для чистого оксида, в частности структура
голландита, которую имеет КЛ"Ю2, неустойчива при х = 0, а для
всех изоструктурных соединений калия, рубидия и цезия
х«0,13. В то же время кубический каркас вольфрамовой брон-
зы имеют не только простые оксиды — ReO3 и сам WO3 (с раз-
личными искажениями), но также и стехиометрическое соеди-
нение Na\VvO3 с полным заполнением позиций натрия. Эта фаза
высокого давления (см. литературу в табл. 13.16) имеет внеш-
ний вид (бронзовый цвет) и металлическую проводимость,
характерные для бронз. О бесцветной модификации WO3 с кар-
касом гексагональной вольфрамовой бронзы см. разд. 12.7.3.
Были синтезированы многочисленные аналоги бронз, содер-
жащие нещелочные металлы, например La*TiO3 и SrxNbO3 (ку-
бическая структура) [1], IrbWO3 (гексагональная) [2], SruWO3
13], Ba0,i2WO3 и Pbo,35W03 (тетрагональная) [4J, CuxWO3 [5]
и соединения Mo,iW03 [6] 4/-элементов. Как в тетрагональных,
так и в гексагональных бронзах часть атомов вольфрама мож-
336 13. Сложные оксиоы
но заместить на тантал, как, например, в соединениях
Ko,5(Ta0,5W0,5H3 (тетрагональная структура) и Rbo,3(Ta0,3Wo,7H3
(гексагональная) [7], которые имеют кремово-белый цвет и
являются не бронзами, а обычными оксидами. При высоких
давлениях получены бронзы, содержащие рений [8].
Рутениевая бронза Nas-^RiuOg [9] имеет особый тип трех-
мерной структуры, образованной из одинарных, двойных и
тройных цепочек рутила, которые соединены общими верши-
нами.
Литература. \l] J. Am. Chem. Soc, 1955, 77, 6132, 6199. [2| Ada cryst., 1978,.
B34, 1433. [3] Inorg. Chem., 1968. 7, 1646. [4| Inorg. Chem., 1965, 4, 994. [5] J.
Am. Chem. Soc, 1957, 79. 4048. [6| Inorg. Chem., 1966. 5, 758. [71 J. Phys. Chem.,
1964, 68, 1253. [8] Solid Slate Comm., 1969, 7, 299. [91 Ada cryst., 1974, B30,.
1459.
13.8.1, Вольфрамовые бронзы. В табл. 13.16 даны приближен-
ные границы устойчивости различных вольфрамовых бронз,
но поскольку интервалы устойчивости, приводимые в различ-
ных работах, имеют небольшие отличия, они, вероятно, в неко-
торой степени зависят от температуры получения бронз.
Структуры вольфрамовых бронз очень наглядно демонстри-
руют способ образования трехмерных решеток состава МОз пу-
Таблица 13.16. Границы устойчивости вольфрамовых бронз
х_
1,00
Li
Кубиу.
Тетрагон.
II
Na
Кубича
Тетрагон. -1
Тетрагон.
II
К
Кубич*
Тетрагон.
Rb ; Cs
i
i
!
Гехсагон.
fe/rca ген Гекса гон.
(
о,5а
0,00
аВерхияя граница, указанная сплошной жирной линией, относится к соединениям,
полученным при атмосферном давлении. При высоких давлениях интервал устойчиво-
сти кубической натриевой бронзы включает стехиометрнческое соединение NaWO3; ка-
лиевые бронзы были синтезированы вплоть до состава Ко 9WO3 [Inorg. Chem., 1969, 8,
11831.
13.8, Бронзы 337
тем соединения октаэдров МО6 всеми вершинами. Простейшей
и наиболее симметричной структурой этого типа является струк-
тура ReO3; внедрение атомов щелочного металла в центры эле-
ментарных ячеек приводит к возникновению структуры типа
перовскита (рис. 13.12, а и б), который характерен для кубиче-
ских фаз, указанных в табл. 13.16. По существу та же базисная
решетка содержится в соединениях лития и натрия, принадле-
жащих к тетрагональному типу II, которые имеют слегка иска-
женную структуру типа перовскита [1]. Две совершенно иные
структуры обнаружены у тетрагональной калиевой бронзы
О
Рис. 13.12. Проекции структур вольфрамовых бронз, а — структура типа пе-
ровекпта в кубических бронзах; б — та же проекция, показывающая только
ионы щелочных металлов (заштрихованные кружки) и атомы вольфрам;, (ма-
ленькие кружки); в и г — вольфрамовые каркасы и ионы щелочных ме^лллон
в тетрагональной и гексагональной бронзах.
(я«0,48—0,57) и гексагональной бронзы, образуемой калием,
рубидием и цезием при #«0,3 [2]. (Соединение натрия, принад-
лежащее к тетрагональному типу I [3], имеет структуру, очень
близкую к структуре тетрагональной калиевой бронзы.) Проек-
ции этих двух структур (рис. 13.12, е и г) показывают, что бо-
лее крупные ионы щелочных металлов размещены в каналах,
которые расположены внутри колец, состоящих не из четырех
октаэдров WO6, а из пяти или шести таких октаэдров. Отме-
тим, что ионы щелочных металлов не лежат на том же уровне,
что и атомы вольфрама, а находятся на с/2 выше или ниже
последних. Необходимо учитывать, что верхний предел х в
МД\Юз определяется чисто геометрическими факторами. Отно-
шение числа пустот, предназначенных для атомов щелочных
металлов, к числу атомов вольфрама падает от 1 в структуре б
до 0,6 в структуре в и 0,33 в структуре г, так что из определен-
ных экспериментально составов фаз следует, что могут быть
получены бронзы с почти полным заполнением пустот и что
катионы щелочных металлов действительно играют важную
роль в стабилизации тетрагональной и гексагональной фаз.
Литература. 'П1 Acta Chem. Scand., 1951, 5, 372, 670. [21 Acta Chem. Scant!.,
^53, 7, 315. [3] Ark. Kem., 1949, 1, 269.
22-985
.338 13. Сложные оксиды
13.8. Бронзы 339
13.8.2. Структура тетрагональной бронзы. Рассмотрим эту
структуру более детально, потому что она является основой
структур трех групп соединений. Имеются в виду:
\) бронзы, ярко окрашенные нестехиометрические соедине-
ния, которые только что обсуждались;
2) сегнетоэлектрики, как правило, бесцветные соединения,
•большинство которых имеют формулы MuNb206 или М'ЧагОб,
¦по в некоторых случаях содержат дополнительные атомы, как
K0
Q О на высоте О
Г М на высоте О
О на высоте ±
Рис. 13.13. Структура тетрагональной бронзы, демонстрирующая три вида
каналов.
3) большое семейство стехиометрических соединений с фор-
мулами тМЬ2О5-п\\Юз, в структурах которых атомы металлов
и дополнительные атомы кислорода заселяют некоторые из пен-
тагональных каналов в структуре бронзы. В эту группу вклю-
чены и такие соединения, как LiNb6Oi5F, имеющие структуры
того же типа, в основе которых лежат похожие октаэдрические
каркасы.
В структуре тетрагональной бронзы имеются каналы трех
сортов (рис. 13.13), из них в бронзах заселены только два сор-
та (S и Р) (первая группа соединений). Окружение атома в
канале зависит от высоты его расположения относительно ато-
мов в каркасе. В соединениях первой и второй групп атом в
канале находится на высоте 7г> и координационными полиэдра-
ми таких атомов являются:
Т: трехшапочная тригональная призма (КЧ 9); позиция, пригодная
лишь для очень маленького иона (Li+)
5: искаженный кубооктаэдр (КЧ 12)
Р: в неискаженном пентагональном канале координационным полиэдром
должна быть пентагональная призма с дополнительными атомами
кислорода, расположенными за каждой из вертикальных (прямо-
угольных) граней призмы. В действительности пентагональные кана-
лы имеют удлиненное поперечное сечение, и координационный поли-
эдр близок к трехшапочной тригональной призме (КЧ 9)
(F — это (искаженная) октаэдрическая позиция в каркасе МО3)
Примеры, приведенные в табл. 13.17, показывают, как неко-
торые из позиций в каналах заселены в сегнетоэлектриках вто-
рой группы, цифры в обозначениях колонок показывают число
Таблица 13.17. Соединения со структурами, родственными
структуре тетрагональной бронзыа
Сегнетоэлектрики (вторая группа)
Состав эле-
ментарной
ячейки
4Т
Lie
2S 4Р
(Ва, SrM
10F
Nb10
Ti2Nb,
Nb10
Nb10
30 О
'so
Литература
J. Cryst. Growth., 1967, 1. 315,
318
Acta cryst., 1968, B24, 984
J. Chem. Phys., 1968, 48, 5048
Acta cryst, 1958, 11,696
Сверхструктуры (третья группа) и структуры, в основе которых лежат другие
каркасы МО3 того же общего типа (с Т-, S- и Р-каналами)
Тип формулы
МзО8
Mi7O«7
М2з063
Смешанные
Состав
WNb2O8
NaNb6O,5F (или ОН)
LiNb6Oi5F
Ta3O7F
Мо17О47
Nb8W9O47
Nb.zWuOes
МО6О,4
W,8O49
N. Bureau
Acta Chem.
Acta Chem.
Acta Chem
Acta Chem
Acta cryst.
Acta cryst.
Ark. Kem.,
Ark. Kem.,
Литература
Standarts, 1966, 70A, 281
Scand, 1965, 19, 2285
Scand., 1965, 19. 2274
Scand, 1967, 21, 615
Scand., 1963, 17, 1485
1969, B25, 2071
1968, B24, 637
1963, 21, 427
1963, 21, 471
О сетках в этих соединениях см. [Acta cryst, 1968, В24, 50].
позиций каждого типа в элементарной ячейке, содержащей
30 атомов кислорода. В соединении ^К^ЬюОзо заселены все
позиции металла, включая Г-позиции для очень маленьких ионов.
Если степень окисления всех атомов металла в каркасе рав-
на 5, то для электронейтральности структуры требуется только
пять ионов М2+, которые статистически занимают 2S + 4P пози-
ции. Если все ионы М2+ — это ионы одного и того же элемента,
то химическая формула приобретает простой вид (например,
РЬЫЬ2Об). Если, однако, некоторые из атомов Mv в позициях
22*
40 13. Сложные оксш!ы
10F замещены (тоже статистически) на MIV, то позиции 2S + 4P
могут быть полностью заселены атомами М", как, например,
в ВабИгМЬвОзо.
В третьей группе соединений осуществляется другой прин-
цип заполнения каналов. Атом металла, расположенный в
Р-канале, имеющем в данном случае почти неискаженное пен-
тагональное поперечное сечение (рис. 13.13), находится на вы-
соте 0, так что этот атом окружен кольцом из пяти атомов кис-
лорода, находящихся на той же высоте. С каждым атомом ме-
13.8. Бронзы 341
Рис. 13.14. Элементарные ячейки в структурах LiNbeO^F (а) и NaNbjOisF (б).
Ионы щелочных металлов опущены.
талла в канал вводится дополнительный атом кислорода; атомы
этих двух сортов чередуются, так что атом М имеет окружение
из семи ближайших ионов кислорода, расположенных в верши-
нах пентагоиальной бипирамиды. Очевидно, что формула соеди-
нения зависит от числа Р-каналов, занятых таким способом.
Если занята половина Р-каналов в структуре бронзы (ато-
мами 2М + 2О), то состав выразится формулой Мю+гОзо+2 (или
М3О8). Заселение '/з Р-каналов (что подразумевает увеличение
размера элементарной ячейки) дает состав МпС^М^+гС^+г)-
Существует множество оксидных фаз со структурами такого
типа. Некоторые из них (относящиеся к третьей группе) явля-
ются сверхструктурами тетрагональной бронзы (с кратными
ячейками), в то время как другие имеют в основе родственные,
но отличающиеся по топологии трехмерные каркасы МОз.
К последним относится очень большое число соединений; они
имеют различное соотношение Т-, S- и Р-каналов и (или) раз-
личное пространственное их расположение (см. литературу в
табл. 13.17). Интересно, что соединения LiNb6Oi5F и NaNb6Oi5F,
очень близкие по химическим свойствам, имеют структуры,
в основе которых лежат разные трехмерные октаэдрические
сетки; обе структуры, как и WNb2O8, принадлежат к типу М3О8,
но содержат дополнительные атомы щелочного металла (не по-
казанные на рис. 13.13).
Альтернативно эти структуры можно описать в виде сочета-
ния композиционных элементов, которые показаны на рис. 13.14.
Каждый композиционный элемент построен в виде колонки,
состоящей из пентагональных бипирамид, которая сочленена
посредством общих ребер с окружающими ее колонками из ок-
таэдров; такие композиционные элементы образуют трехмер-
ный каркас, соединяясь общими вершинами. В серии стехиомет-
ричееких оксидов, образуемых в системе Nb2C>5—WO3, струк-
туры соединений вплоть до состава W8Nbi8Oe9 построены из бло-
ков ReO3, а фазы, более богатые вольфрамом, начиная от
оксида WNb2O8, имеют структуры такого типа, который только
что описан.
13.8.3. Молибденовые бронзы. В литературе описано получение
при высоком давлении F5 кбар) молибденовых бронз со струк-
турами вольфрамовых бронз, например кубических Na*MoO3 и
КхМоОз (л;»0,9) и тетрагональной К^МоО3 (л;»0,5) [1J.
Молибденовые бронзы, полученные электролизом расплавлен-
ных смесей молибдатов щелочных металлов и МоО3 [2], имеют
более сложные структуры. Бронза с приближенным составом
Na0,9Mo6Oi7 имеет гексагонально искаженную структуру пе-
ровскита с упорядоченным расположением ионов натрия по 7б
имеющихся позиций и, по-видимому, статистическим распреде-
лением 17 атомов кислорода по 18 позициям [3]. (Наблюдае-
мая усредненная структура, вероятно, является результатом
дношшкования моноклинной структуры, в которой атомы кис-
лорода расположены упорядоченно.)
Две молибденовые бронзы, содержащие калий, красная
Ко,з3Мо03 [4] и сине-черная Ко,зоМо03 [5], имеют близкие слои-
стые структуры, построенные следующим образом. Сочленен-
ные общими ребрами группировки по 6 или 10 октаэдров по-
средством общих вершин объединены в слои, как показано на
рис. 5.34, слой в обоих случаях имеет состав МоОз. Слои удер-
живаются вместе ионами калия, которые занимают позиции с
КЧ 8 —в первом соединении, 7 и F + 4)—во втором. Структу-
ра Cso,2oMo03 состоит из похожих по строению слоев [6], в ко-
торых основной повторяющийся элемент — другая группировка
из шести октаэдров (рис. 13.15, а). Эти элементы сочленены
друг с другом ребрами и вершинами (рис. 13.15) с образовани-
ем слоев, между которыми могут быть размещены крупные
ионы цезия.
Молибденовые бронзы, содержащие водород, образуются
лри электрохимическом восстановлении Мо03 либо с помощью
342 13. Сложные оксиды
различных химических методов. Они представляют собой окра-
шенные соединения Н^МоОз, которые обладают металлической
проводимостью. Три такие фазы имеют следующие области го-
могенности (указаны значения х): синяя ромбическая @,23-н
4-0,4), синяя моноклинная @,85-=-1,04) и красная моноклинная
A,55-М,72); зеленая моноклинная фаза, по-видимому, является
стехиометрической (х — 2) [7\. Создается впечатление, что в
первом соединении присутствие атомов водорода почти не ска-
зывается на его структуре, которая по существу такая же, как
общие
,*f ребра
общие
зеришны
обилие ребра
13.8. Бронзы 343
а
Рис. 13.15. Структура бронзы Cso,2oMo03. Приведена группировка из шести
октаэдров (а), которая соединяется с другими группировками с помощью вер-
шин и ребер, образуя слои (б), которые перпендикулярны плоскости чертежа.
у МоОз. Это впервые было установлено для соединения с фор-
мулой Мо2О5(ОН) [8], что соответствует х = 0,5. Выполненное
позднее исследование соединения Н0,збМоО3 показало, что ато-
мы водорода лежат между слоями и присоединены в виде
ОН-групп к мостиковым атомам кислорода [9]; необходимы, од-
нако, дальнейшие исследования с целью выяснения позиций
атомов водорода в фазах с более высоким содержанием водо-
рода. !
Литература. [1] Inorg. Chem., 1966, 5, 1559. [21 Inorg. Chcm., 1964, 3, 545.
[31 Acta cryst., 1966, 20, 59. [4] Acta cryst., 1965, 19, 241; Inorg. Chem., 1967, 6,.
1682. [5] Acta cryst., 1966, 20, 93. [6] J. Solid State Chem., 1970, 2, 16. О молиб-
деновых бронзах лития см. [J. Solid State Chem., 1970, 1, 3271, фтора (J. Solid
State Chem., 1970, 1, 3321. [71 J. Solid State Chem., 1980, 34, 183; Materials Res.
Buli , 1978 13, 311 [8] Acta Chem. Scand., 1969, 23, 419. [9] Z. anorg. allg. Chem.,
1977, 435, 247; J. Solid State Chem., 1979, 28, 185.
13.8.4. Ванадиевые бронзы. Ванадиевые бронзы получают путем
сплавления V2O5 с оксидом щелочного металла или ванадатом.
а
. ис. 13.16. Структуры ванадиевых и титановых бронз, а — Li0 04V2CV структура
аналогична структуре V2O5, дополненной ионами лития (маленькие кружки)
с тригонально-призматической координацией; б — LiV2Os (литий имеет окта-
эдрпческую координацию); в — Li,+JCV3O8 (октаэдрическая координация Li+)-
? - Na0,15V2O5 (КЧ Na+ 7); d - Ag0,68V2O5 (КЧ Ag+ 5); e_Na02TiO2 (КЧ
Na+ 8).
При этом теряется кислород и образуются фазы черного цвета
с полупроводниковыми свойствами, содержащие некоторое ко-
личество атомов щелочного металла и ванадия (IV). Были по-
лучены бронзы, содержащие различные щелочные металлы,
медь, серебро, свинец и т. д., и во многих системах существует
несколько бронз с различным интервалом составов и различ-
ными структурами.
Бронза Ыо.смУгОб (рис. 13.16, а) по существу имеет такую
же структуру, как оксид V2O5, она содержит небольшое количе-
344
13. Сложные оксиды
13.9. Оксиды, построенные из октаэдров и тетраэдров 345
ство ионов лития, координационный полиэдр которых — триго-
нальная призма. В структуре LiV2O5 (рис. 13.16,6) КЧ ванадия
тоже равно 5; оба эти соединения имеют слоистые структуры.
В структурах двух других соединений, изображенных на
рис. 13.16, атомы ванадия имеют КЧ как 5, так и 6. Соедине-
ние Lii+лЛ''зОв (рис. 13.16, в) имеет слоистую структуру; на
рис. 13.16, г, где представлены структуры p-Liu .адХ'гО-, и
Na0ii5V2O5, группировки VOs и VO6 образуют трехмерный кар-
кас. Натриевая бронза NaxV2Os устойчива в интервале 0,15<
<л:<0,33, и верхняя граница соответствует формуле NaVoOis»
что отвечает заселению только половины имеющихся позиций
Na+; если бы они были заселены полностью, то каждый ион
натрия в канале помимо семи ионов кислорода имел бы в бли-
жайшем окружении еще один ион натрия. Таким образом, фор-
мулу этого соединения можно записать в виде Ыаг-^УеО^.
Синтезирована также голубовато-стальная бронза Pb0,2oV205 со
структурой, изображенной на рис. 13.16, г.
В системе Ag2O—V2O5 существуют бронза Ag^VeOis, изо-
структурная натриевой бронзе (рис. 13.16,г), и бронза
Ago,68V205 (рис. 13.16,<9), в которой окружение атомов ванадия
может быть описано в виде октаэдра, хотя расстояния V—О
лежат в интервале 1,5ч-2,4А.
На рис. 13.16, в изображена структура Na0,2TiO2 с целью
показать ее близкое родство со структурой бронзы, показанной
на рис. 13.16,E. Слоистая структура (рис. 13.16,5) превращает-
ся в трехмерный каркас (рис. 13.16, е) титановой бронзы при^
соединении слоев октаэдров общими вершинами.
Синтезирован ряд ванадиевых бронз, содержащих цезий,,
они имеют либо трехмерные каркасные структуры (Сво.зУгОб,.
CS035V3O7), либо слоистые структуры (СэУгОз, CS2V5O13) [Acta
cryst., 1977, ВЗЗ, 775, 780, 784, 789].
В системах М2О3—VO2—V2O5 (M = A1, Cr, Fe) существует фа-
за (А1о,ззУ205) со структурой, близкой к структуре УбО^, из ко-
торой ее можно получить путем внедрения атомов алюминия
и кислорода в каналы структуры оксида ванадия. В этих систе-
мах существуют также фазы MZV2-ZO4 со сверхструктурой типа
рутила, содержащие равные количества атомов Мш и Vv, кото-
рые замещают часть атомов VIV (как в Feo,o7nlVo,o7vVi,86IV04).
(См. литературу в табл. 13.18.)
13.9. Сложные оксиды, построенные из октаэдров АО6
и тетраэдров ВО4
Некоторые из наиболее простых структур этого типа были упо-
мянуты в гл. 5 при обсуждении структур, построенных из тетра-
эдров и октаэдров. Теперь рассмотрим детальнее некоторые и$
структур, приведенных в табл. 5.7, а также более сложные
структуры, в общем принадлежащие к тому же типу. Состав
соединения зависит от соотношения октаэдрических и тетраэд-
рических группировок и способа распределения общих вершин.
В простейшем случае каждый тетраэдр соединен всеми верши-
Таблица 13.18. Координационные полиэдры ванадия в бронзах
Рис.
13.16
а
6
в
г
д
е
Бронза
LiV,O5
Lii+.VV3O8
Na0.,5V2O5
Ago D3V2O5
Na0,2TiO2
Pb0l2uV2O5
AI0.33V2O5
КЧ
атомов
V
5
5
6
5
6
5
6
о
Расстояние V—О, А
1,6—2,45 (затем
2,82)
1,61-1,98 C,09)
1,6-2,3 —
1,6-2,1 B,86)
1,6-2,3 —
1,6—2,0 B,68)
1,5-2,4 -
Литература а
Bull. Soc. chim. (Fran-
ce), 1965, 1056
Acta cryst., 1971, B27,
1476
Acta cryst., 1957, 10
Acta cryst., 1955, 8,
Acta Chem. Scand.,
1965, 19, 1371
Acta cryst., 1962, 15,
201
Inorg. Chem., 1967, 6,
321
Bull. Soc. franc, mine-
ral, crystallogr. chi-
mia (Switzland),
1969, 92, 17
Bull. Soc. chim. (Fran-
ce), 1967, 227
Более поздние данные о фазах M^VjOj см. в работах: [J. Solid State Chem., 1970,
I 339; Acta cryst., 1975, B31, 1481]. О новой титановой бронзе КзТ18О17 см. [J. Solid
Suite Chem., 1970, 1, 319].
нами с октаэдрами, а каждый октаэдр соединен четырьмя вер-
шинами с тетраэдрами и двумя вершинами — с другими окта-
эдрами. В этом случае состав соединения выражается форму-
лой АВО5.
Две простые структуры такого типа можно описать как це-
почки типа ИеОз (каждый октаэдр связан двумя противополож-
ными вершинами), которые затем «сшиты» поперек тетраэдра-
ми ВО4 с образованием трехмерных структур. В NbOPO4 (и изо-
структурных VOPO4, MOOPO4, V0M064 и тетрагональном
VOSO4) каждый тетраэдр ВО4 связывает вместе четыре такие
Цепочки (рис. 13.17,а), образуя структуру, близкую к кубиче-
346 13. Сложные оксиды
ской плотнейшей упаковке атомов кислорода, в которой атомы
ниобия занимают Чъ октаэдрических пустот, а атомы фосфо-
ра — 7ю тетраэдрических пустот (рис. 13.17,6). Во второй мо-
дификации VOSO4 каждый тетраэдр SO4 также связывае?
своими вершинами четыре октаэдра VO6, но два из них при-
надлежат к одной и той же цепочке, так что в результате каж-
дый тетраэдр связывает три цепочки типа ReO3, а не четыре,
как в NbOPO4.
Несмотря на то что обычно эти структуры описывают с по-
мощью октаэдров АО6 и тетраэдров ВО4, необходимо подчерк-
Рис. 13.17. Проекции кристаллических структур NbOPO4 и VOPO4 (см. текст).
нуть, что, в то время как ВО4-группы являются по существу
неискаженными тетраэдрами, группы АО6 нельзя отнести к
правильным октаэдрам. Атом металла смещен из центра по на-
правлению к одной из вершин октаэдра, и конфигурация пяти
связей может быть описана в виде тетрагональной пирамиды.
Во многих оксидных соединениях TiIV, VIV, Vv, Nbv и Mov обна-
ружено такое искажение координационного октаэдра, когда
имеются одна очень короткая и одна очень длинная связи и че-
тыре связи промежуточной длины. Некоторые примеры таких
координационных групп приведены в табл. 13.19. Если проек-
цию на рис. 13.17, а рассматривать как слой структуры, парал-
лельный плоскости чертежа, и если самые длинные связи в
каждом координационном полиэдре ванадия расположены по
одну и ту же сторону слоя, то структура приобретает ярко вы-
раженный слоистый характер; примером может служить оксид
a-VOPO4 (табл. 13.19). Искажение координационного «октаэд-
ра» настолько велико, что координационный многогранник пред-
почтительно описывать в виде тетрагональной пирамиды.
13.9. Оксиды, построенные из октаэдров и тетраэдров 347
Очень близкую структуру имеет K2V3O8. Вернемся к
рис. 5.7, в, который изображает тетраэдрический слой состава
АгД7 (слой мелилита). Если считать, что квадраты на этом ри-
сунке обозначают не тетраэдры АХ4, а квадратные пирамиды
ВО5, а треугольники — тетраэдры АО4, то состав слоя будет
А2ВО8 или ВО(А2О7), если желательно выделить пары соеди-
ненных вершинами тетраэдров АО4. Такую структуру имеет
Таблица 13.19. Координационные полиэдры металлов в некоторых
кислородсодержащих соединениях
Соединение
NbOPO4
Kb3O7F
M0OPO4
VOMOO4
VOSO4 (f>) (ромбоэдри-
ческий)
(а) (тетраго-
нальный)
VOPO4
Na2(Ti0Si04)
Длины
в с
корот-
кая
(одна)
1,78
1,86
1,66
1,68
1,59
1,63
1,58
1,70
связей
ктаэдре
(четы-
ре)
1
1
1
1
2
2
1
1
97
98
97
97
03
.04
,87
,99
, А
цлинная
(одна)
2,32
2,20
2,63
2,59
2,28
2,47
B,87)
Литература
Acta Chem.
Acta Chem
2233
Acta Chem.
2217
Acta Chem
722
Acta Chem
1906
Scand., 1966, 20,
Scand.,
Scand.,
Scand.,
Scand.,
J Solid State Chem.
394
Acta cryst.,
Acta cryst.,
1976, B32,
1978, B34,
1964,
1964,
1966,
1965,
1970,
2899
905
72
18,
18,
20
19,
1
анион в Ba2[Ti0(Si207)] [1], минерале фресноите, и аналогич-
ный анион в K2[VIVO (V2VO7)] [2]. В последнем соединении че-
тырехвалентный ванадий имеет координационное окружение в
виде квадратной пирамиды (V—О 1,58А (одна), 1,98 А (четы-
ре)), а пятивалентный ванадий — в виде тетраэдра:
О 1,70 {мосгликовый)
О 1,63 (концевой)
О 1,70 (мосглиновыи)
(Ионы калия расположены между слоями и имеют КЧ 10 —
пентагональная антипризма.)
Рассмотрим теперь еще два ванадата с близкими структу-
рами, содержащие только четырехвалентный ванадий с таким
же координационным окружением, как в K2V3O8. На рис. 13.18
короткие связи V—О в квадратных пирамидах направлены
вверх или вниз, как показано сплошными или штриховыми ли-
348 13. Сложные оксиды
13.9. Оксиды, построенные из октаэдров и тетраэдров 349
к 1 /
ж
х
X
X
X
у \
ч ^
Рис. 13.18. Слои в CaV3O7 (а) и CaV4O9 (б), построенные из координационных:
полиэдров, имеющих форму квадратных пирамид.
ниями внутри квадратов. Слои, показанные на рис. 13.18, отра-
жают строение анионов в СаУзО7 [3] и CaV^g [4].
Различными методами синтезирован целый ряд оксидных
соединений, содержащих фосфор и молибден (или вольфрам),
с низким соотношением Mo(W):P. Например, Мо(ОНKРО^
получен нагреванием раствора МоО3 в концентрированной
Н3РО4 при 180 °С с последующим разбавлением концентриро-
ванной HNO3; WOP2O7 — из WO3 и Р2О5 путем длительного
нагревания в автоклаве при 550°С. Эти соединения построены^
из тетраэдров РО4 и октаэдров MoO6(WO6), соединенных об-
Таблица 13.20. Некоторые кислородсодержащие соединения,
построенные из групп РО4 и МоО6 (WONa
Соединение
Мо(ОНKР04
Р2МоО8
P2WO8
NaPWO6
P2\V2On
Р2Мо2Оц
МоО2(РО3J
WOP2O7
Na\VO2PO4
\V2O3(PO4J
(MoO2JP2O7
Структурная формула
(Р003)[Мо03(ОН)з1
(РО4J„(МоО2О4)„
(PO4-POO3)(WOO5)
Naf(PO4)(WO2O4)]
(РО4) (WOO5)
(РО4-РО4)(МоОО5J
Природа структуры
3-связанная
двой-
ная цепочка
4-связанны?
ной слой
3,4,5-связан
слой
4-связан- '
ная
4,5-свя-
занная
4,5-свя-
занная
двой-
ный
3-мер>-
ная
сетка
щими вершинами. Общей структурной деталью, характерной для
ряда соединений, является цепочка, состоящая из чередующих-
ся группировок РО4 и МоО6. В некоторых соединениях тетраэд-
ры РО4 всеми вершинами связаны с октаэдрами МоОб, в дру-
гих РО4-группы соединены друг с другом в пары или бесконеч-
1 Литература [Ark. Kem., 1962, 19, 51; Acta Chem. Scand., 1964, 18, 2329].
О Группа РОг,, связанная
4 атомами О
@ Группа Мо06, связанная
4 атомами О
Рис. 13.19. а и б — двойная цепочка в структуре Мо(РО4) (ОН)з; б —двойной
слой в структуре Р2МоО8.
ные цепочки, а последующее объединение таких элементов с
помощью октаэдров МоОб приводит к образованию бесконеч-
ных цепочек, слоев или трехмерных решеток. Формулы, припи-
санные этим соединениям во второй колонке табл. 13.20, выяв-
ляют распределение атомов кислорода между группами РО4,
а более громоздкие структурные формулы з третьей колонке
показывают, сколько вершин у каждой РО4- или МоО6-группы
являются мостиковыми и, следовательно, природу базисной ре-
шетки (четвертая колонка). Символ О обозначает атом кисло-
рода, общий для двух координационных групп (РО4 или МоО6)..
350 13. Сложные оксиды
Уже отмечалось ранее необычно малое число пар изоструктур-
ных соединений молибдена и вольфрама. В данном случае сое-
динения Na(PMoO6) и Na(PWO6) изоструктурны, а пары
Р2МоО8 и P2WO8, P2MO2O11 и P2W2On нет. Рассмотрим теперь
общие принципы построения таких структур на примере трех
соединений из табл. 13.20.
Структурным элементом МоРО4(ОНK является двойная це-
почка, показанная на рис. 13.19, а. Атомы водорода не были
локализованы, но, предположительно, они присоединены к трем
концевым атомам кислорода каждой МоО6-группы и участвуют
в образовании водородных связей между цепочками. Поскольку
каждая РО4- и МоО6-группа имеет по три общие вершины, то-
пология структуры может быть проиллюстрирована двойной це-
почкой (рис. 13.19,6). В Р2МоО8 цепочки из тетраэдров РО4,
имеющих по две общие кислородные вершины, связаны друг с
другом посредством октаэдров Мо06, что приводит к образова-
нию двойного слоя (рис. 13.19, в). Простейший тип трехмерной
сетки обнаружен в структуре Na(PWO6), в которой все верши-
ны каждого тетраэдра РО4 являются общими с вершинами ок-
таэдров МоОб, а каждая МОб-группа связана четырьмя верши-
нами с РОггруппами. Если мы выделим два концевых атома
кислорода каждой группы МоО6, формула приобретет вид
Na(PWO4-O2); ср. с NaAlSiO4. По существу анион представляет
собой каркас, аналогичный каркасам, найденным в алюмосили-
катах; фактически он очень сходен с каркасами, на которых
основаны структуры полевых шпатов (гл. 23).
Литература. [1] Z. Kristallogr., 1969, 130, 438. [2] Acta cryst., 1975, В31, 1794.
[31 Acta cryst., 1973, B29, 269. [41 Acta cryst., 1973, B29, 1335.
14. ГИДРОКСИДЫ,
ГИДРОКСИД-ОКСИДЫ
И ГИДРОКСОСОЛИ МЕТАЛЛОВ
В этой главе мы рассмотрим следующие группы соединений: гидроксиды:
М(ОН)„ (вместе с ними мы рассмотрим гидросульфиды щелочных металлов-
MSH); сложные гидроксиды М/М/'@НJ; гидроксид-оксиды МО (ОН);,
гидроксосоли (основные соли).
14.1. Гидроксиды металлов
Гидроксиды М(ОН)„ составляют широкий класс соединений от
сильноосновных гидроксидов щелочных и щелочноземельных,
металлов, затем так называемых амфотерных гидроксидов (бе-
риллия, цинка, алюминия и т. д.) и гидроксидов переходных,
металлов до гидроксокислот, образуемых неметаллами (В(ОНK)
или полуметаллами (Те(ОНN). Соединения последней группы,
немногочисленны и поэтому рассматриваются в других главах.
За исключением довольно хорошо растворимых в воде гид-
роксидов щелочных металлов (и Т11) и гораздо менее раство-
римых соединений щелочноземельных металлов, большинство-
гидроксидов металлов почти или совсем нерастворимы в воде.
Некоторые из них, например Ве(ОНJ, А1(ОНK и Zn(OHJ,.
осаждаются гидроксидом натрия в виде гелеобразной массы и
растворяются в избытке щелочи, в то время как другие, такие,,
как Си (ОН) 2 и Сг(ОН)з, после растворения в избытке щелочи
при хранении снова выпадают в осадок. Такие гидроксиды, ко-
торые «растворяются» не только в кислотах, но и в щелочах,
называют амфотерными, причем растворимость в щелочах счи-
тается проявлением кислотных свойств. На самом деле в неко-
торых случаях растворимость является следствием образования
гидроксо-ионов, которые могут быть одноядерными, например,
Zn(OHL2- [1], либо многоядерными. Из раствора А1(ОНK в-
КОН может быть закристаллизована калиевая соль мостиково-
го иона а. (В этом ионе не было обнаружено различия между
длинами связей А1—О и А1—ОН; среднее значение 1,76 А [2].)
НО.
,ОН
2'
НО
OH
352 14. Гидроксиды, гидроксид-оксид и гидроксосоли
14.1. Гидроксиды металлов 353
Весьма вероятно, что некоторые типы гидроксо-ионов сущест-
вуют в растворах. Из растворов, содержащих ноны Ва2+, AF+
и ОН', могут быть закристаллизованы такие соли, как
Ba2[Al2(OH)io] и Ba2[Al4(OH)i6] (разд. 14.1.2). Помимо этого,
гидроксо- или гидроксоаквакомплексы содержатся в «основных»
солях, образованных при неполном гидролизе обычных солей
(см. последний раздел данной главы), и было показано, что в
таких растворах существуют некоторые интересные многоядер-
ные ионы. С помощью КР- и ИК-спектроскопии гидролизован-
ных растворов перхлората висмута [3], а также исследованием
Рис. 14.1. Гидроксокомплексы; Bi6(OH)i26+ (а); РЬ6О(ОН)в4+ (б). На рис. б
показаны атом кислорода центрального тетраэдра и ОН-группы, находящиеся
над каждой гранью боковых тетраэдров.
рассеяния рентгеновских лучей [4] было установлено, что в ши-
роком интервале концентраций ионов висмута и Н+ в растворах
гидролизованного перхлората висмута содержатся преимущест-
венно ионы Bi6(OH)i26+ (рис. 14.1, а). Из таких растворов мо-
гут быть закристаллизованы соли, содержащие этот ион и род-
ственные ему ионы [5]. Методом рентгеновского рассеяния от
гидролизованных растворов перхлората свинца установлено,
что при соотношении ОН:РЬ = 1 в растворе существует комп-
лекс, содержащий тетраэдр из атомов свинца, а при ОН:РЬ =
= 1,33 (это максимально возможное соотношение ОН : РЬ, после
чего происходит осаждение) существует РЬб-комплекс, подобный
комплексу в кристаллической основной соли РЬ5О (ОНN (С1О4L-
•Н2О (рис. 14.1,6) [6].
В других случаях электропроводность «вновь растворен-
ных» в избытке щелочи гидроксидов равна электропроводно-
сти щелочи той же концентрации, а это означает, что «раство-
римость» гидроксида, вероятнее всего, является следствием об-
разования золя. Например, свежеосажденный кремового цвета
Ge(OHJ «растворяется» в сильноосновных растворах с обра-
зованием красновато-коричневых коллоидных растворов [7].
При гидролизе растворов солей металлов, как правило, обра-
зуются коллоидные растворы гидроксидов; это справедливо
для гидроксидов железа (III) и хрома (III) и гидроксидов эле-
ментов IV группы периодической системы, таких, как олово (IV),
титан (IV), цирконий (IV) и торий(IV). Маловероятным являет-
ся присутствие в таких растворах гидроксидов состава М(ОНL,
где М — элементы IV группы, поскольку содержание воды в ге-
лях МОт-хНгО изменяется в широких пределах.
Следует подчеркнуть, что данные о структурной химии гид-
рокспдов очень неполные. Для изучения структуры необходи-
мы кристаллические образцы, предпочтительно в виде моно-
кристаллов, а некоторые гидроксиды легко разрушаются до
оксидов даже при кипячении в водном растворе (например,
Си (ОН) 2, Sn(OHJ, Т1(ОНK). Неизвестны многие простые
гидроксиды, например CuOH, AgOH, Hg(OHJ, Pb(OHL. Хотя
многие из высших оксидов не устойчивы при обычных условиях,
тем не менее такие соединения, как Ni(OHK, Mn@HL, U(OHL,
Ru(OHL и др., описаны в литературе; поэтому необходимы ис-
следования с целью подтверждения их существования и рас-
шифровки структуры. Некоторые из таких соединений не явля-
ются простыми гидроксидами; например, Pt(OHL-2H2O на
самом деле имеет формулу H2[Pt(OH)eJ. Кондуктометрическим
титрованием и измерениями молекулярной массы было уста-
новлено, что «аураты» и получаемая из них «ауровая кислота»
содержат ион Аи(ОНL~ [8]. В литературе описано выращива-
ние кристаллов РЬ(ОНJ в состаренных гелях, но более позд-
ние исследования показали, что такой гидроксид не существует
[9]. Кристаллическое твердое вещество, получаемое при мед-
ленном гидролизе растворов солей свинца, имеет состав
РЬ6О4(ОНL (см. рис. 14.15 ниже и разд. 26.7.3, т. 3).
Литература. [1] J. Chem. Phys., 1965, 43, 2744. [21 Acta Chem. Scand., 1966, 20,
505. [3] Inorg. Chem., 1968, 7, 183. [41 J. Chem. Phys., 1959, 31, 1458. [5] Acta
cryst., !i>,9, B35, 448. [6] Inorg. Chem., 1969, 8, 856; Acta Chem. Scand., 1972,
26, 3505. [7] J. Inorg. Nucl. Chem., 1964, 26, 2123. [81 Z. anorg. allg. Chem., I960,
304, 154, 164. [91 Inorg. Chem., 1970, 9, 401.
14.1.1. Структуры гидроксидов М(ОН)п. За небольшими иск-
лючениями, мы рассматриваем структуры соединений в твердой
фазе. Только гидроксиды наиболее электроположительных ме-
таллов могут быть расплавлены без разложения, и только гид-
роксиды щелочных металлов могут существовать в парообраз-
ном состоянии. Микроволновое исследование паров КОН, RbOH
и CsOH и ИК-исследование молекул в аргоновых матрицах по-
казали, что (ионные) молекулы имеют линейное строение.
23-985
354 14. Гидроксиды, гидроксид-оксид и гидроксосоли
М—О, А
О-Н, А
V-. Д
Литература
КОН
RbOH
CsOH
(ср. с CsF)
2,18
2,31
2,40
2,35 (Cs—F)
0
0
—
,96
,97
—
—
7,1
7,87
J. Che;
3131
) J. Che;
} 2911
J J. Choi
4763
Phvs
Гзоз
ii. Phys,
п. Phys,
ii. Phys.,
, 1966, 44,
, 1969, 51,
, 1967, 46,
Rev., 1965, 138A,
Типы структур кристаллических гидроксидов металлов и
гидроксид-оксидов МО (ОН) определяются поведением иона
ОН^ в непосредственной близости от катионов. Мы можем вы-
делить три типа поведения иона ОН" как иона а) с эффектив-
ной сферической симметрией, б) с цилиндрической симметрией
или в) поляризованного так, что при этом возникает тетраэдри-
ческое распределение заряда. В варианте (в) взаимодействие
между положительными и отрицательными областями различ-
ных ионов ОН~ приводит к образованию водородных связей.
Переход от (б) к (в) следует ожидать при увеличении заряда
и уменьшении размера катиона. Если считать, что поляризую-
щая сила катиона М"+ пропорциональна пе/г2, то легко понять,
почему, например, в А1(ОНK есть водородная связь,
а в Са(ОНJ или La(OHK ее нет; поляризующая сила катиона
А13+ значительно выше, чем Са2+ и La3+:
Са2+ La=>+ А13+
1,8 2,0 9,2
Вариант (а), в котором подразумевается случайная ориентация
или свободное вращение, по-видимому, реализуется в высоко-
температурной модификации КОН (и RbOH?). Первоначально
предполагали, что высокотемпературная модификация NaOH
имеет такую же структуру (NaCl), но это не подтверждается
более поздними исследованиями (см. ниже). По-видимому, та-
ким же образом ведет себя ион SH~ в CsSH и в высокотемпе-
ратурных модификациях NaSH, KSH и RbSH, что согласуется
с тем фактом, что сера образует гораздо более слабые водород-
ные связи по сравнению с кислородом. Вариант (а) встреча-
ется всего в одном или двух соединениях. В целом мы можем
14.1. Гидроксиды металлов 355
выделить две основные группы кристаллических гидроксидов,
различающихся по типу структур. Характерной чертой гидрок-
сидов первого класса является отсутствие водородной связи
между ионами ОН".
/. Гидроксиды. МОН, М@НJ и М(ОН)Ъ, не содержащие водо-
родных связей
а) Случайная ориентация или вращение ОН-ионов. В высо-
котемпературной модификации КОН ионы ОН^ ведут себя как
сферические ионы с эффективным радиусом 1,53 А, промежу-
точным между радиусами F~ и С1~; это соединение имеет струк-
туру NaCl. Пока не установлено, является ли кубическая сим-
метрия следствием случайной ориентации анионов или же ре-
зультатом их свободного вращения.
Образование гидросульфидов характерно только для наибо-
лее электроположительных щелочных и щелочноземельных ме-
таллоз. Гидросульфид LiSH чрезвычайно неустойчив, особенно
по отношению к гидролизу и окислению; он разлагается при
температурах выше ~50°С. LiSH можно получить без приме-
сей при действии H2S на н-амилоксид лития в эфирном раство-
ре. Гидросульфид лития имеет структуру типа сфалерита, похо-
жую на структуру LiNH2, но со значительным искажением ко-
ординационных тетраэдров:
SH
2 Li 2,43 А
Li 2,46 А
Li 2,67 А
Li,—4 SH 2,43 A L;,,
] 2 SH 2,46 А
I 2 SH 2,67 A
Высокотемпературные модификации NaSH, KSH и RbSH
имеют структуру NaCi; CsSH кристаллизуется в структурном
типе CsCl. Размеры элементарной ячейки CsSH такие же, как
у CsBr, и это свидетельствует о том, что ион SH~ представляет
собой поп со сферической симметрией, имеющий такой же ра-
диус, как у иона Вг~. В отличие от низкотемпературных моди-
фикаций гидроксидов натрия, калия и рубидия, которые описа-
ны ниже в п. „б", гидросульфиды при комнатной температуре
имеют ромбоэдрическую структуру. В этих структурах типа
кальцита ион SH~ имеет более низкую симметрию, чем в высо-
котемпературных модификациях, и внешне ведет себя как плос-
кая группа. По всей вероятности, протон вращается вокруг
атома серы в одной плоскости, образуя ион в виде диска, по-
добный вращающемуся иону СО32~.
б) Ориентированные ионы ОН~. Структуры гидроксидов
наиболее крупных щелочных металлов, щелочноземельных ме-
таллов и Ьа3т проявляют близкое сходство с простыми ионными
структурами АХ„. Гидроксиды лития, натрия и небольших ионов
23*
356 14. Гидроксиды, гидроксид-оксид и гидроксосоли
М2+ образуют слоистые структуры, что указывает на большую
поляризацию попа ОН~.
Полиморфные модификации КОН и изоструктурного ему
RbOH, устойчивые при обычных температурах, имеют искажен-
ную структуру NaCl с координационными многогранниками не-
правильной формы (расстояния К—ОН имеют разброс от 2,69
до 3,15 А). Кратчайшими расстояниями О—О C,35 А) являют-
ся расстояния между ОН-группами, связанными с одним и тем
же ионом калия; они очерчи-
вают зигзагообразные цепоч-
ки, вдоль которых лежат ато-
мы водорода. Эти взаимодей-
ствия ОН—О являются сла-
быми, что показывает низкое
значение теплоты перехода из
низкотемпературной в высоко-
температурную модификацию
F,3 кДж/моль; ср. с величи-
ной связи О—Н—О для льда,
Рис. 14.2. Кристаллическая структу- равной 21—25 кДж/моль).
pa La(ODK. Все атомы находятся на Структуры CsOH И ТЮН не-
/4 (
в
p ()
высоте с/4 (показаны тонкими линия-
линиями),3^. со(оГт™нЖоИнРаЬГ
А
известны
Гидроксид Са(ОНJ имеет
d SH
линиями),^. сооГт™нонаГ р ()
соте 0,96 А над или под плоскостью структуру Cdl2, а ИОНЫ SH ¦ и
чертежа. Ва2+ слишком велики для
структуры такого типа. Соеди-
нение Sr(OHJ имеет структуру с координацией G:3,4), очень
похожую на структуру YO(OH), которая представляет собой
трехмерную систему из соединенных общими ребрами одноша-
почных тригональных призм [1]. В этой структуре нет водород-
ных связей (кратчайшее расстояние О—Н—О равно 2,94 А).
Было выполнено предварительное исследование кристаллов од-
ной из модификаций Ва(ОНJ, но в целом его структура еше не
установлена [2]. (О структуре Sr(OHJ-H2O см. в разд. 15.2.C.)
Гидроксиды лантана, иттрия [3], празеодима, неодима, са-
мария, гадолиния, тербия, диспрозия, эрбия и иттербия, а так-
же Ат(ОНK [4] кристаллизуются с образованием типично
ионных структур, в которых каждый атом металла окружен
девятью ионами OH", а каждый ион ОН" —тремя ионами Мл+.
Такую же структуру, изображенную на рис. 9.8 (разд. 9.9.3),
имеет описанное ранее соединение UC13; в этой структуре ко-
ординационный полиэдр атома металла имеет форму трехша-
почной тригональной призмы. Методом нейтронографии [51 были
определены позиции атомов дейтерия в соединении La(ODK.
На рис. 14.2 все атомы (включая дейтерий) лежат на высоте
с/4 или Зс/4 над или под плоскостью чертежа (с = 3,86 А). Из
14.1. Гидроксиды металлов 357
этого следует, что атом дейтерия, отмеченный звездочкой (на
высоте с/4), лежит приблизительно в центре квадрата, образо-
ванного четырьмя атомами кислорода, два из которых находят-
ся на с/4 ниже, а два — на Зс/4 выше плоскости чертежа, и сред-
нее расстояние D—О равно 2,74 А. В ионе OD~ расстояние
О—D равно 0,94 А.
Рис. 14.3. Кристаллическая структура LiOH с указанием позиций протонов.
а — элементарная ячейка; б—проекция структуры, параллельная (П-.О, iu
которой видно отсутствие водородных связей между ОН-группами соседних
слоев.
Исследования [6] посвящены изучению индивидуальных гид-
роксидов лантаноидов, а работа [7] содержит обзор структур
Ln(OHK.
На рис. 3.33 (т. 1) был показан слой в структуре LiOH в
качестве примера простейшего плоского слоя, построенного из
связанных вершинами квадратов. В слое каждый ион Li+ имеет
тетраэдрическое окружение, состоящее из четырех ионов ОН~,
а каждый ион ОН" окружен четырьмя ближайшими ионами
Li+, причем все они лежат с одной стороны (т. е. в одном слое).
С помощью нейтронографического исследования установлено,
что связи О—Н направлены перпендикулярно плоскости слоя
(О—Н 0,98 А), а из проекции структуры на рис. 14.3,6 видно,
что между слоями нет водородных связей.
Полиморфная модификация NaOH, устойчивая при обычных
температурах, имеет структуру желтой модификации ТП. Она
построена из слоев структуры NaCl, в которых ион Na+ окру-
358 14. Гидроксиды, гидроксид-оксид и гидроксосоли
жен пятью ближайшими ионами ОН~, расположенными в пяти
из шести вершин октаэдра (Na—ОН 2,35 А). Ближайшими со-
седями иона Na+ в направлении «пропущенной» вершины окта-
эдра являются два иона ОН~ на расстоянии 3,70 А, а кратчай-
шее расстояние ОН—ОН между слоями равно 3,49 А. Методом
нейтронографии были локализованы
,т ] -71 атомы водорода, их позиции показа-
ны на рис. 14.4, из которого видно,
что система Na—О—Н является ли-
нейной. Высокотемпературная моди-
фикация NaOH, устойчивая в очень
узком интервале температур (^пл
299,6—318,4 °С), построена из слоев
того же типа. По-видимому, по ме-
ре повышения температуры эти слои
сдвигаются друг относительно друга
(изменяется угол моноклинности
Р), так что структура постепенно
приобретает все большее сходство
со структурой NaCl.
Третьим типом слоя, обнаружен-
ного в структурах этой группы сое-
динений, является слой Cdb; так
построены структуры гидроксидов
двухвалентных магния, кальция,
марганца, железа, кобальта, никеля
и кадмия. (Помимо простой струк-
туры Cdl2 некоторые из этих соеди-
нений имеют другие структуры с
различной последовательностью сло-
ев, как в случае некоторых дигало-
генидов.) Каждый ион ОН~ обра-
зует три связи с атомами металла
своего собственного слоя и три свя-
зи с тремя ионами ОН" соседнего
слоя. Окружение иона ОН" в соеди-
нениях LiOH и Mg(OHJ показывает, что в этих структурах пет
водородных связей.
Рис. 14.4. Низкотемператур-
ная модификация NaOH,
имеющая структуру желтого
Til. Тт.к как координаты ато-
мов водорода не были опре-
делен!-', расстояния О—Н
приняты равными 1 А.
Li.
Li Li
\ I
OH
u
Mg
i
'он'
-Mg
cp.
OH//\XOH
OH OH
OH'
OH
4 OH
Zn Zn
\ /
OH
/ \
OH OH
Как si в LiOH, ионы ОН" в этих гидроксидах ориентированы
так, что атомы водорода направлены к внешней поверхности
14.1. Гидроксиды металлов 359
слоев; это подтверждает исследование Mg(OHJ [8] методом
ЯМР и нейтронографическое изучение Са(ОНJ [9]. Проекцию
структуры Са(ОНJ на рис. 14.5,6 можно сравнить с проекцией
структуры LiOH на рис. 14.3,6. Интересно, что при повторной
расшифровке структуры Мп(ОНJ [10] было получено расстоя-
ние Мп—ОН, равное 2,21 А; сравнение его с величиной 2,22 А
для связи Мп—О в оксиде МпО показывает, что радиус иона
Рис. 14.5. Кристаллическая структура Са(ОНJ с указанием позиции протонов
а — элементарная ячейка; б — проекция, параллельная плоскости (ПО) Ионы
1 2
кальция расположены в вершинах ячейки, а ионы ОН- — на линиях -„—о~ г
о о
2 1
ОН", равный 1,53 А, подходит только для таких структур, как
высокотемпературная модификация КОН.
В соответствии с данными рентгенограммы порошка соеди-
нению Си(ОНJ была приписана структура, аналогичная струк-
туре y-FeO(OH) (ее описание см. ниже), но модифицирован-
ная таким образом, чтобы атомы двухвалентной меди имели
окружение в виде искаженного октаэдра (четыре иона ОН" на
расстоянии 1,94 А и два — на расстоянии 2,63 А) [11]. Такая
структура для этого соединения представляется довольно неожи-
данной, так как она содержит два типа неэквивалентных ато-
мов кислорода, что, очевидно, более уместно для структуры
гидроксид-оксида. Поскольку кратчайшее расстояние между
ионами ОН", соединенными с различными атомами меди, равно
2,97 А, в этой структуре предположительно нет водородных свя-
зей. Выяснение позиций атомов водорода в этой структуре
представляло бы большой интерес, но для детального исследо-
вания структуры необходимы более крупные монокристаллы,
чем те, которые удавалось вырастить до сих пор.
360 14. Гидроксиды, гидроксид-оксид и гидроксосоли
Некоторые гидроксиды двухвалентных металлов имеют по-
лиморфные модификации. Новый тип структуры АХ2 был пред-
ложен для 7-Cd(OHJ [12]; эта структура построена из коор-
динационных октаэдров, соединенных в двойные цепочки с по-
мощью общих граней, а двойные цепочки соединены общими
вершинами с образованием трехмерного каркаса нового типа
(рис. 14.6).
О Cd на высоте О
О Cd на высоте 4-
О ОН на высоте С
О ОН на высоте у
Рис. 14.6. Проекция структуры Y-Cd(OHJ; двойные цепочки перпендикулярны
плоскости чертежа.
Литература о гядроксидах и гидросульфидах щелочных ме-
таллов содержится в табл. 14.1.
Литература. [1] Z. anorg. allg. Chem., 1969, 368, 53. [2] Ada cryst., 1968, B24,
1705. [3] Acta Chem. Scand., 1967, 21, 481. [41 Acta cryst., 1968, B24, 979. [5] J
Chem. Phys., 1959, 31, 329. [61 Nd(OHK: Acta cryst., 1976, B32, 2227; Tb(OHK
(нейтроногр.): Acta cryst., 1977, B33, 3134; Ce(OHK: Acta cryst., 1979, B35.
2668. [71 J. Inorg. Nucl. Chem., 1977, 39, 65. [8] J. Chem. Phys., 1956, 25, 742.
[91 J. Chem. Phys., 1957, 26, 563 (нейтроногр.); Am. Mineral., 1962, 47, 1231
(ЯМР). [10] Acta Chem. Scand., 1965, 19, 1765. [11] Acta cryst., 1961, 14, 1041.
[121 Acta cryst., 1967, 22, 441.
//. Гидроксиды M(OH)z и М@НK с водородными связями
Гидроксид цинка. В литературе описан ряд полиморфных
модификаций этого гидроксида, одна из них имеет структуру
Сб (Cdb), а другие — структуры с более сложной последова-
тельностью слоев, однако некоторые из этих фаз устойчивы
только в присутствии посторонних ионов '[1]. Кристаллы гидр-
оксида цинка могут быть выращены при выпаривании раствора,
полученного растворением в аммиаке обычного осажденного ге-
ля. Кристаллы е-модификации построены из тетраэдров Zn(OHL
со всеми вершинами, общими с другими такими же группиров-
ками [2]. Если описать структуру таким образом, что в основе
ее будет лежать трехмерная сетка из атомов цинка, каждый
из которых связан с четырьмя другими атомами цинка посред-
14.1. Гидроксиды металлов 361
ством ОН-групп, то структура е-гидроксида будет представлять
собой искаженный вариант решетки алмаза (или кристобалита)
(см. т. 1, разд. 3.10.3). Это искажение приводит к сближению
каждой ОН-группы с двумя другими ОН-группами, соединен-
ными с различными атомами цинка, так что в результате каж-
дая ОН-группа приобретает тетраэдрическое окружение, состоя-
Таблица 14.1. Кристаллические структуры соединений ДЮН и MSH
Низкотемператур-
ная модифика-
ция
Температура пере-
хода
Высокотемпера-
турная модифи-
кация
Низкотемператур-
ная модифика-
ция
Температура пере-
хода
Высокотемпера-
турная модифи-
кация
LiOH
Рис.
14.3
[1]
LiSH
См. текст
[6]
NaOH
Ромбическая
[2, 51 (струк-
тура T1I)
299,6 °С
Моноклинная
[5]
NaSH
Ромбоэдрическ
90°
Струк
КОН
Моноклинна;-
248°
NaCl [3]
KSH
ая структура
160-170°
тура NaCl [7]
RbOH
[41
?
RbSH
?
CsOH
?
CsSH
Структура
[1] Z. Kristallogr., 1959. 112, 60 (нейтроногр.); J. Chem. Phys., 1962, 36, 2665 (ИК).
12] J. Chem. Phys., 1955, 23, 933. [3] Z. anorg. allg. Chem., 1939, 243, 138. [4] J. Chem.
Phys., 1960, 33, 1164. [5] Z. Kristallogr., 1967, 125, 332. [6] Z. anorg. allg. Chem., 1954,
275, 79. [7] Z. Kristallogr., 1934, 88, 97; Z. anorg. allg. Chem., 1939, 243, 86.
щее из двух атомов цинка и двух ОН-групп. Такое окружение
и короткие расстояния ОН—ОН B,77 и 2,86 А) свидетельству-
ют об образовании в этой структуре водородных связей. Такую
же структуру имеет р-модификация Ве(ОНJ [3]; о структуре
а-Ве(ОНJ см. в работе [4].
Одна из менее устойчивых модификаций Zn(OHJ, так на-
зываемая 7"м0ДиФикаЦия, имеет очень необычную структуру
[5], содержащую кольца из трех тетраэдров Zn(OHL, объеди-
ненных через свои свободные вершины в бесконечные колонки
(рис. 14.7). Верхние вершины A) тетраэдров одного кольца
являются нижними вершинами B) тетраэдров из расположен-
ного выше кольца, так что все тетраэдры внутри колонки свя-
заны друг с другом всеми вершинами, и колонка, следователь-
362 14. Гидроксииы, гидроксид-оксид и гидроксосоли
но, имеет состав Zn(OHJ. Каждая колонка соединена с дру-
гими такими же колонками только водородными связями
(О—Н—О 2,80 A; Zn—О 1,96 А).
Гидроксиды скандия и иттрия. В т. 1, разд. 5.3.3 мы отме-
чали, что простейшая трехмерная структура АХ3 с координа-
цией F: 2) обычно не реализуется в своей наиболее симмет-
ричной форме, так как последняя требует линейного располо-
жения связей А—X—А и приводит к энергетически невыгодной
О ¦?
Рис. 14.7. Структура Y"Zn(OHJ Рис. 14.1
(см. текст.)
Кристаллическая структура
Sc(OHK.
упаковке анионов. Проекция структуры Sc(OHK (рис. 14.8)
или 1п(ОНK показывает, что ОН-группы лежат вне линий,
соединяющих атомы металла, и что каждая из них соединена с
двумя другими ОН-группами посредством водородных связей.
ОН-группа А соединена с атомом металла М и с вертикально
расположенным над ним таким же атомом М, а также она свя-
зана водородными связями с ОН-группами В и С. Нейтроно-
графическое исследование 1п(ОНK [6] показало, что атомы
водорода распределены в структуре статистически, а расстоя-
ния О—Н—О равны 2,744 и 2,798 А. Гидроксид Lu(OHK [7]
имеет такую же (кубическую) структуру.
Гидроксид алюминия. Существует ряд полиморфных моди-
фикаций А1(ОНK, которые подразделяются на два основных
типа: а (байерит) и у (гиббсит); внутри каждого типа структур
имеются лишь небольшие различия, возникающие из-за различ-
ных способов наложения слоев. В основе всех модификаций
лежит один и тот же слой АХ3, показанный в идеализирован-
ном виде на рис. 14.9. Его можно описать либо в виде системы
14.1. Гидроксиды металлов 363
из координационных октаэдров АХ6, каждый из которых соеди-
нен с другими октаэдрами тремя общими ребрами, либо в виде
пары слоев атомов X со слегка искаженной плотнейшей упа-
ковкой, в которой атомы металла занимают две трети октаэдри-
чсч'ких пустот. Структуры различных модификаций отличаются
Рис. 14.9. Фрагмент слоя А1(ОНK (в идеализированном виде). Незаштрпхеван-
ные кружки, показанные светлыми и жирными линиями, обозначают ОН-груп-
пы, расположенные соответственно над и под плоскостью атомов алюминия
(заштрихованные кружки).
друг от друга способом наложения слоев. В байерпте все ато-
мы кислорода занимают слегка искаженную гексагональную
плотнейшую упаковку (как в Mg(OHb), а в структуре nupap-
гиллита (моноклинного гиббсита) ОН-группы на нижней сто-
роне одного слоя лежат непосредственно над ОН-группами
находящегося ниже слоя, как показано на проекции структуры
рис. 14.10, а. По-видимому, в нордстрандите реализуется про-
межуточный случай, когда слои налагаются приблизительно
Рис. 14.10. Структуры А1(ОНK (а) и Mg(OHJ (б), спроецированные вдсп,
плоскости слоев; они демонстрируют различия в упаковке ОН-групп соприка-
сающихся слоев.
364 14. Гидроксиоы, гидроксид-оксид и гидроксосоли
таким же способом, как в гидраргиллите; сравните расстояния
между слоями (d):
й, А
Литература
Байерит 4,72
Норлстранднт 4,79
Гидрзргиллит (гнббсит) 4,85
Z. Kristallogr., 1967, 125, 317
Ada crysl., 1970, В26, 649
Z. Kristallogr., 1974, 139, 129
Способ наложения слоев в гидраргиллите отвечает существова-
нию направленных связей между ОН-группами соседних слоев
в отличие от Mg(OHJ и подобных ему кристаллических соеди-
нений, в структурах которых действуют ненаправленные силы.
В литературе обсуждался вопрос о позициях протоноз в гиббси-
те и байерите; они были рассчитаны для всех трех модифика-
ций [8J.
Литература. [1] Helv., Chim. Acta, 1966, 49, 1971. [2] Z. anorg. allg. Chem.,
1964, 330, 170. [3] Z. anorg. allg. Chem., 1950, 261, 94. [4] J. Nucl. Materials,
1964. 11, 310. [5] Acta Chem. Scand., 1969, 23, 2016. [61 Acta Chem. Scand., 1967,
21, 1046. [7] J. Inorg. Nucl. Chem., 1980, 42, 223. [8] Acta cryst., 1976, B32,
1719.
14.1.2. Сложные гидроксиды. Эти соединения более многочис-
ленны, чем полагали ранее, так как многие из них первоначаль-
но считали гидратами или метасолями (так, например,
NaSbO3-3H2O в действительности имеет формулу NaSb(OHN).
В соединениях М/М/'(ОНJ осуществляются те же структур-
ные возможности, что и в сложных галогенидах. Среди сложных
гидроксидов встречаются: 1) соединения, в которых оба металла
электроположительны, и тогда кристалл строится как упаковка
ионов ОН~ с ионами металлов, размещенными по пустотам
подходящего размера и полностью окруженными ионами ОН~;
2) соединения, в которых один металл (или неметалл)
гораздо менее электроположителен, чем другой, и образует
с ОН-группами существенно ковалентный гидроксо-ион.
К соединениям первого типа относятся: Ca3Al2(OH)i2 (в соот-
ветствии с результатами анализа его формула — ЗСаО-А12О3-
•6Н2О), в котором ионы Са2+ и А13+ имеют окружение, состоя-
щее из восьми и шести ионов ОН~ соответственно с расстояния-
ми 2,50 и 1,92 А; Ва2А12(ОН)ю [2] и Ва2А14(ОНI6 [3]. В соеди-
нениях бария более высокозарядные ионы А13+ ассоциируются
в пары или в группы по четыре, образуя двухъядерные ионы (а)
14.2. Гидроксид-оксиды 365
и тетрамерные ионы такого типа, который был изображен на
рис. 5.8,з (т. 1).
ОН ОН
¦ОН+
А1
-ОН
/
но у о\\ кон
он он
В ионах [М(ОНN]"^, образуемых элементами подгруппы Б
или переходными металлами, связи М—О, вероятно, имеют за-
метно ковалентный характер. Примерами являются ионы
Go (ОН)б2" [4], Sb(OHN- (т. 3, гл. 20), соединения M2[Pt(OHN],
где М = Н [5], Na, К [6], и Ва2Си(ОНN [7] —все со структура-
ми типа K2PtCl6, а также Ca[Pt(OHN], У которого упаковка
анионов и катионов такого же типа, как у NiAs [8].
Литература. [1] Acta cryst., 1964, 17, 1329. [2] Acta cryst., 1970, B26, 867.
|3| Acta cryst., 1972, B28, 519. [4] Acta Chem. Scand., 1969, 23, 1219. [5] Acta
cryst., 1979, B35, 3014. [6] Z. anorg. allg. Chem., 1975, 414, 160. [7] Acta cryst.,
1973, B29, 1929. [8] Z. Kristallogr., 1975, 414, 169.
14.2. Гидроксид-оксиды
Гидроксид-оксиды можно охарактеризовать как такие соеди-
нения металлов, в которых координационная группа атома ме-
талла включает лиганды О и ОН. Это название неприменимо
к соединениям неметаллов, таким, как SO2(OHJ, РО(ОНK,
или ионам, полученным из них: SO3(OH)~ и т. д. Металлы не
образуют такие тетраэдрические ионы, хотя в ионе
[(бН)"зА1—О—А1(ОН)з]2~ алюминий все же имеет тетраэдриче-
ское окружение, образованное из О и ОН, как уже отмечалось
в начале разд. 14.1. Определенный интерес представляют ионы
[RuO3(OHJ]2~ [1] (тригональнаябипирамида) и [OsO2(OHL]2~
[2] (октаэдр), так как оба иона являются анионами в солях,
которые ранее считали гидратами, а именно BaRuO4-H2O и
K2OsO4-2H2O. Мы уже приводили несколько примеров много-
ядерных гидроксид-оксид-ионов, образуемых висмутом и свин-
цом, и нейтральных молекул М6О4(ОНL, образуемых оловом и
свинцом. Однако большинство гидроксид-оксидов металлов
МОх(ОН)(/ состоит из обширных массивов образующих их ато-
мов (ионов), имеющих слоистые или трехмерные структуры.
Некоторые из этих соединений описаны в других главах: гидрок-
сид-оксиды ванадия — в разд. 12.7.2, Н*МоО3 — в разд. 13.8.4,
UO2(OHJ — в разд. 28.2.4.
366 14. Гидроксиды, гидроксид-оксид и гидроксосоли
Самую большую группу соединений с известными структу-
рами образуют соединения типа МО (ОН), где М — алюминий,
скандий, иттрий, ванадий, хром, марганец, железо, кобальт,
галлий и индий. Ряд соединений МО (ОН), так же как гидрок-
сиды трехвалентных металлов и оксиды М2О3 алюминия и же-
леза, имеют а- и 7-модификации. Так называемый p-FeO(OH),
строго говоря, не является гидроксид-оксидом; он имеет струк-
туру а-МпОг и устойчив только в присутствии определенных
ионов, таких, как С1~, внедренных в пустоты каркаса [3]. Темно-
коричневый 6-FeO(OH), обладающий ярко выраженными маг-
нитными свойствами, получают быстрым окислением Fe(OHJ
в растворе NaOH; он имеет очень простую структуру, в основе
которой лежит гексагональная плотнейшая упаковка О (ОН),
а ионы Fe3+ заселяют определенные пустоты. Результаты иссле-
дования магнитных свойств лучше согласуются со статистиче-
ским распределением ионов металла по всем октаэдрическим
позициям, чем с частичной заселенностью некоторых тетраэдри-
ческих позиций, как предполагали ранее [4]. Структура
s-FeO(OH) рассматривается ниже.
Как и в случае гидроксидов, мы можем разделить структуры
гидроксид-оксидов на две категории: структуры с водородной
связью и без нее; обычно начинают обзор со структур второго
типа.
14.2.1. Структура YO(OH). Все соединения МО (ОН) 4/-элемен-
тов и YO(OH) имеют моноклинную структуру, в которой атом
металла окружен семью ближайшими О (ОН), расположенными
в вершинах одношапочной тригональной призмы (как в моно-
клинном S1TI2O3 [5]). Судя по межатомным расстояниям, атом
кислорода с координационным числом 3 входит в ион ОН~,
а атом кислорода с координационным, числом 4 является
ионом О2~:
М М
\ /2,41 А
ОН
I
м
м
о
м
/ 2,27 А
м м
Среднее расстояние О—ОН, равное 3,01 А, указывает на отсут-
ствие водородных связей, что подтверждают данные нейтроно-
графического исследования YO(OD) [6].
14.2.2. Структура InO(OH). Это соединение имеет структуру
типа рутила, искаженную вследствие образования коротких
несимметричных водородных связей B.54 А) между определен-
ными парами атомов (рис. 14.11) [7]. |3-СгО(ОН) (разд. 14.2.5)
14.2. Гидроксид-оксиды 367
и модификация (е) высокого давления FeO(OH) [8] имеют
такую же структуру.
14.2.3. Структура а-Мо(ОН). Структура а-МО(ОН) имеют сле-
1\-ющие соединения: а-АЮ(ОН) (диаспор), а-FeO(ОН) (гётит),
a-MnO(OH) (грутит), a-ScO(OH) [9J, a-GaO(OH) [10] и
VO(OH) (монтрозеит).
О In да высоте 0 Cj 0 на высоте 0 О Н на высоте 0
О In на высоте \ Q 0 на высоте \ О Н на высоте ~
Piic. 14.11. Структура InO(OH), имеющая искаженный тип рутила; указаны
водородные связи.
При обзоре октаэдрических структур в гл. 5 мы говорили
о том, что двойные цепочки типа рутила могут быть далее соч-
ленены общими вершинами с образованием либо трехмерных
каркасных структур, простейшей из которых является структу-
ра диаспора, либо гофрированного слоя, как в лепидокроките.
Объемные изображения обеих структур представлены на
рис. 14.12. На рис. 14.13, а двойные цепочки перпендикулярны
плоскости чертежа; на нем также можно видеть слои с плотней-
шей упаковкой из атомов кислорода. Атомы водорода в диаспо-
ре были локализованы методом нейтронографии; они показаны
в виде маленьких черных кружков, соединенных с заштрихо-
ванными атомами кислорода. Связи О—Н—О B,65 А) указа-
368 14. Гидроксиды, гидроксид-оксид и гидроксосоли
Рис. 14.12. Структуры диаспора АЮ(ОН) (а) и лепидокрокита FeO(OH) (б)
(по Эвингу). Атомы кислорода расположены в вершинах каждого октаэдра,
а атомы алюминия (или железа)—в центрах октаэдров. Двойные линии
обозначают связи О—Н—О.
ны пунктирными линиями, а атомы водорода лежат немного в
стороне от прямой, соединяющей два атома кислорода:
?,65А
Из рис. 14.13, а видно, что ближайшее окружение атома кисло-
рода ОН-группы состоит из трех атомов алюминия, образую-
щих основание пирамиды, четвертой вершиной которой являет-
ся атом водорода (А1—ЗОН 1,98 А), в то время как ион О2~
лежит почти в плоскости трех ближайших атомов алюминия
(А1—30 1,86 А), причем связь О—Н—О располагается вдоль
14.2. Гидроксид-оксиды 369
О Fe
Оо
© о
Рис. 14.13. Проекции структур диаспора а-АЮ(ОН) (а) и лепидокрокита
y-FeO(OH) (б). (В обозначениях нижний заштрихованный кружок означа-
ет ОН.)
четвертого направления от центра тетраэдра. В структуре типа
а-МО(ОН) в отличие от структуры типа -у-МО(ОН) каждая
группа 0Н~~ образует водородную связь с атомом кислорода.
О
В табл. 14.2 приведены длины связей в а-структурах; в эту
таблицу для сравнения с а-МпО(ОН) включен также
Y-MnO(OH). В грутите длина связи О—Н—О равна 2,63 А.
Эти соединения трехвалентного марганца представляют особый
интерес вследствие ожидаемого ян-теллеровского искажения
координационного октаэдра. Это основное искажение наклады-
вается на небольшие различия в длинах связей М—О и М—ОН,
как видно из сравнения МпО(ОН) с АЮ(ОН) и VO(OH)
24-985
370 14. Гидроксиды, гидроксид-оксид и гидроксосоли
(табл. 14.2). Координационный многогранник в грутите деталь-
но показан на схеме а (см. выше).
14.2.4. Структура у-МО(ОН). Структуру Y-MO(OH) имеют сле-
дующие соединения: y-AIO(OH) (бёмит), v-FeO(OH) (лепидо-
крокит), у-МпО(ОН) (манганит) и y-ScO(OH) [9].
В результате двух независимых рентгеноструктурных иссле-
дований бёмита, проведенных в центросимметричной простран-
ственной группе Cmcm, для длины связи О—Н—О были получе-
ны значения 2,47 и 2,69 А. Методом ПМР [11] было показано,
Таблица 14.2. Длины связей (А) в структурах МО (ОН)
Связь М—О
(одна)
(две)
Связь М—ОН
(одна)
(две)
а-АЮ(ОН)
(диаспор)
Ш
1,858
1,851
1,980
1,975
Si.: ¦'¦ >Й*ф„
a-VO(OH) "
(монтрозеит)
1[2]
1,94
1,96
2,10
2,20
a-FeO(OH)
(гётит)
'[31
1,89
2,02
2,05
2,12
a-MnO(OH)
i'(rpVTHT)
1141
2,18
1,90
2,34
1,97
V-MnO(OH)
(манганит)
/[5]
2,20
1,87
2,33
1,97
[11 Acta cryst., 1958, 11, 798. [2] Am. Mineral., 1955, 40, 861. [3] Z. Kristallogr 1941
103, 73. [4] Acta cryst., 1968, Б24, 1233. [5] Z. Kristallogr., 1963, 118, 303.
что эта связь не является симметричной, поэтому структура
нуждается в дальнейшем изучении.
Объемное изображение структуры лепидокрокита y-FeO(OH)
показано на рис. 14.12,6. На проекции этой структуры
(рис. 14.13,6) кружки, показанные тонкими линиями, обозна-
чают атомы, лежащие на с/2 A,53 А) выше и ниже плоскости,
в которой находятся атомы, обозначенные жирными кружками;
период повторяемости последних равен с C,06 А). Таким обра-
зом, каждый атом железа имеет координационный многогран-
ник в виде искаженного октаэдра, образованный атомами кис-
лорода, и эти октаэдры объединены с образованием гофриро-
ванных слоев. Атомы водорода в этой структуре не были лока-
лизованы, однако на основании известного окружения атомов
кислорода можно идентифицировать О- и ОН-группы. Атомы
кислорода внутри слоев находятся на приблизительно одинако-
вом расстоянии от четырех атомов железа (два атома железа
на расстоянии 1,93 А и два — на расстоянии 2,13 А), в то время
как атомы кислорода на поверхности слоев связаны только с
двумя атомами железа B,05 А). Расстояния между атомами
14.2. Гидроксид-оксиды 371
кислорода различных слоев равны всего 2,72 А, поэтому оче-
видно, что на внешней поверхности каждого слоя имеются
ОН-группы. В этой структуре наблюдается образование водо-
родных связей только между ОН-группамн, причем каждая
ОН-группа образует две водородные связи.
Образованием связей О—Н—О между ОН-группами различ-
ных слоев объясняется тот факт, что атомы кислорода сосед-
них слоев не накладываются друг на друга плотнейшим обра-
:;<>м, хотя внутри каждого отдельного слоя существует слегка
искаженная кубическая плотнейшая упаковка атомов кислоро-
да. Как видно из рис. 14.12 и 14.13, каждая ОН-группа лежит
в той же плоскости, что и ОН-группы следующего слоя, с кото-
рыми она соединена водородными связями, так что атомы водо-
рода должны быть расположены так, как показано па
рис. 14.13,6. Оксид-хлорид FeOCl построен из слоев точно тако-
го же типа, как в лепидокроките, но эти слои упакованы вместе
таким образом, что атомы хлора внешних сторон соседних
слоев плотно упаковываются друг с другом. Это различие меж-
ду структурами FeOCl и y-FeO(OH) вполне сопоставимо с раз-
личиями в структурах Mg(OHJ и А1(ОНK, причем в обоих
случаях эти различия объясняются образованием связей
О—Н—О между слоями в структурах соединений Y-FeO(OH)
иА1(ОНK.
Исследование структур двух модификаций АЮ(ОН) пред-
ставляет интерес с практической точки зрения, так как при де-
гидратации А1(ОНK и АЮ(ОН) образуются катализаторы и
адсорбенты. В диаспоре а-АЮ(ОН) атомы кислорода имеют
гексагональную плотнейшую упаковку, и это соединение дегид-
ратируется непосредственно до а-А12О3 (корунд), в структуре
которого атомы кислорода размещены таким же образом. Струк-
туру'бёмита у-АЮ(ОН) в целом нельзя описать на основе плот-
нейших упаковок, однако внутри каждого слоя атомы кислоро-
да образуют кубическую плотнейшую упаковку. Бёмит не де-
гидратируется непосредственно до у-А12О3 со структурой типа
шпинели, а при его дегидратации образуется ряд промежуточ-
ных фаз, причем до сих пор нет единого мнения относительно
числа и строения этих фаз [12]. Среди предложенных схем име-
ются следующие:
А1(ОН"K {ги6
или гиббсигп—i-бемшп
о.
Возможно, эти промежуточные фазы, в целом обозначаемые
24'
372 14. Гидроксиды, гидроксид-оксид и гидроксосоли
как модификации у~оксиДа алюминия, представляют собой
структуры с различной степенью упорядочения атомов алюми-
ния в более или менее искаженной плотнейшей упаковке ато-
мов кислорода (см. разд. 12.4).
14.2.5. Структура а-СгО(ОН) (НСгО2). Обычно СгО(ОН) полу-
чают в виде красной или сине-серой (ромбоэдрической) а-моди-
фикации. Она построена из слоев типа Cdb, которые налагают-
ся друг на друга таким образом, что атомы кислорода одного
слоя лежат непосредственно над атомами кислорода нижнего
слоя (рис. 14.14) [13]. Таким образом,
в целом структура не представляет со-
бой плотнейшую упаковку. Такой
л способ упаковки слоев в структуре
а-СгО(ОН) является следствием обра-
А зования связей О—Н—О, которые от-
в личаются небольшой длиной (ОН—О
2,47 A, OD—О 2,55 А). Данные иейтро-
в нографии и ИК-спектроскопии показа-
ли, что эти связи определенно несим-
метричны, но локализация атомов во-
с дорода в связях О—Н—О встретила
определенные трудности. В соответст-
А вии с результатами последнего нейтро-
нографического исследования [14] с
каждой стороны от центра связи на
расстоянии 0,15 А расположено по
7г Н-атома, из чего следует, что рас-
стояние О—Н равно 1,16 А (или
1,31 А). Возможно, что вопрос о стати-
стике размещения атомов водорода
носит до некоторой степени академический характер, так как
потенциальный барьер между двумя минимумами, по-видимому.
очень низкий. (Весьма похожие результаты были получены для
Р-СгО(ОН) '[15], который имеет структуру InO(OH);
разд. 14.2.2.) Такую же структуру имеет СоО(ОН), образую-
щийся при окислении р-Со(ОНJ [16].
Рис. 14.14. Проекция кри-
сталлической структуры
НСгО;, иллюстрирующая
способ наложения слоев.
Штриховые линии обознача-
ют связи О—Н—О.
Литература. [1] Ada cryst., 1976, В32, 2413. [2] Жури, структ. хим., 1962, 3.
685. [31 Mineral. Mag. (J. Mineral. Soc), 1960, 32,45. [4] J. Am Cer Soc,
1968, 51, 594. [5] Acta Chem. Scand., 1966, 20, 896. [6] Acta Chem. Scand., 1966,
20, 2658. [71 Acta Chem. Scand., 197ft, 24, 1662. [8] Solid State Comm., 1975, 17,
1505. [91 Acta Chem. Scand., 1967, 21, 121. [10] Acta cryst., 1977, B33, 3224.
[Ill J. Phys. Chem., 1958, 62, 992. [12] J. Chem. Soc, A 1967, 2106. [131 Acta
cryst., 1963, 16, 1209. [141 J- Solid State Chem., 1977, 21, 325. [151 J- Solid State
Chem., 1976, 19, 299. [16] J. Chem. Phys., 1969, 50, 1920.
14.3. Гидроксосоли 373
14.3. Гидроксосоли (основные соли)
Термин «основная соль» применяется для ряда соединений,
промежуточных между нормальной солью и гидроксидом пли
оксидом. Это широкое определение включает в себя такие сое-
динения, как оксоацетаты бериллия и цинка (разд. 11.2), оксо-
и гидроксогалогениды (гл. 10) и гидроксооксосоли. В этом раз-
деле мы почти полностью сосредоточим наше внимание па
последней группе соединений. Координационные соединения с
мостиковыми ОН-группами, такие, как [ (NH3hCo(OHJCo-
(ХНзL]С14, рассмотрены в главах, посвященных соответствую-
щим элементам.
Основные соли многочисленны и имеют определенное прак-
тическое значение. Основные соли образуют такие элементы,
как бериллий, магний, алюминий, многие из переходных метал-
лов А-подгрупп (например, титан, цирконий), Зс?-элементы, та-
кие, как железо, кобальт, никель, 4/- и 5/-элементы (церий, то-
рий, уран) и большинство элементов Б-подгрупп, в частности
медь(П), цинк, индий, олово, свинец и висмут. Образующиеся
при действии кислорода и влаги на сульфидные и другие руды,
они входят в обширный класс вторичных минералов, а некото-
рые из них являются продуктами коррозии металлов. Минера-
лы брошантит Cu4(OHNSO4 и атакамит Си2(ОНKС1 образуют-
ся в виде налета на меди под воздействием окружающей среды;
лепидокрокит Y-FeO(OH) образуется при ржавлении железа,
а гидроцинкит 2п5(ОНN(СОз)г является обычным продуктом
коррозии цинка во влажном воздухе. «Белый свинец»
РЬ3(ОНJ(СО3J является представителем большого числа ос-
новных солей, используемых в качестве пигментов, в то время
как Mg2(OHKCl-4H2O образуется при схватывании цемента
Сопел я.
Основные соли могут быть получены различными методами,
которые обычно включают — непосредственно или косвенно —
гидролиз обычной соли. Гидролиз может быть проведен в ус-
ловиях контролируемой температуры, кислотности и концентра-
ции ионов металла либо (косвенно) путем нагревания гидрата
соли. Многие гидроксосоли получаются в результате последне-
го процесса вместо обычных безводных солей, например
Сиг(ОН)зМО3 образуется при нагревании гидрата нитрата
меди. Осадки, образующиеся при добавлении раствора карбо-
ната натрия к растворам солей металлов, как правило, пред-
ставляют собой гидроксокарбонаты. Некоторые металлы не об-
разуют нормальных карбонатов (например, медь; см. разд. 25.7);
другие (такие, как свинец, цинк, кобальт и магний) в зависимо-
сти от условий осаждения могут образовывать нормальные соли
или гидроксосоли. Свинец, например, образует гидроксосоли
374 14. ГидроксиОы, гидроксид-оксид и гидроксосоли
2РЬСО3-РЬ(ОНJ и РЬСО3-РЬ(ОНJ, обе они встречаются в ви-
де минералов, а кобальт помимо нормального карбоната обра-
зует Со4(ОНNСО3.
Прежде чем описывать структуры ряда гидроксосолей, мы
должны упомянуть, что некоторым из этих соединений «струк-
турные формулы» были приписаны на основе предположения,
что они являются координационными соединениями Вернера.
Мы можем привести в качестве примера две формулы:
Си<!
ОН.
Oh"
J3j
j [он Л
Cl2 и |Cu< Си И С03
L i0H J.J
для атакамита Си2(ОНKС1 и малахита Си2(ОНJСО3 соответ-
ственно. Такие формулы абсолютно ошибочны, так как эти
соединения не содержат комплексных ионов с центральным
атомом меди. Малахит, например, состоит из бесконечного трех-
мерного массива ионов Си2+, СОз2" и ОН~. (О структуре атака-
мита см. в разд. 25.7.7.) С другой стороны, в некоторых основ-
ных солях конечные комплексы, содержащие атомы металла
с мостиковыми ОН-группами, действительно встречаются; да-
лее кратко будут приведены соответствующие примеры.
14.3.1. Кристаллические структуры основных солей. Первое,
что следует отметить в структурах гидроксосолей, — это суще-
ствование широкого диапазона отношений ОН : М:
Cu(OH)IO3 Zn5(OHNCO-;
1 6/5
Са5(ОН)(РО4), Си2(ОН)РО4
Отношение Vs 72
ОН:М
Cu2(OHKNO3 Th(OHJSO4
Отношение 3/г 2
ОН :М
Ионы ОН~ в структурах гидроксосолей связаны с ионами ме-
талла, поэтому при небольшом отношении ОН : М координаци-
онная группа вокруг металла состоит в основном из атомов
кислорода оксо-ионов; при увеличении отношения ОН : М доля
ОН~-ионов в координационном окружении металла увеличива-
ется. Этот процесс хорошо иллюстрируется примером гидролиза
Zr(SO4J-4H2O при 100°С до Zr2(OHJ(SO4K-4H2O и при 200°С
до Zr(OHJSO4, причем окружение Zr4+ рассматривается в
сравнении с его окружением в кубическом ZrO2, который явля-
ется конечным продуктом нагревания этих солей на воздухе.
(В моноклинной модификации ZrO2 катионы имеют координа-
ционное число 7.) В приведенной ниже таблице атомы О в ко-
ординационных группах вокруг ионов металла, конечно, входят
в состав ионов SO42~.
14.3. Гидроксосоли 375
В таких кристаллах, как гидроксилапатит Са5(ОН) (РО4)з,
который изоструктурен Ca5F(PO4K, нельзя выделить комплекс
гпдроксид-ион — металл, однако при больших отношениях
Координационные группы вокруг Zr4 +
Zr(SO4J-4H2O[ll Zr2(OHJ(SO4K-4H2O [2] Zr(OHJSO4 [2] ZrO2
4H2O 2H2O 4 OH
4 0 2 OH 4О 8 0
4 OH
Антипризма Додекаэдр Антипризма Куб
111 Acta cryst., 1959, 12, 719. [2] Inorg. Chem., 1966, 5, 284.
OH: M в общем случае ОН-группы являются общими для коор-
динационных групп различных атомов металла, так что можно
выделить взаимосвязанную систему ОН и М. Такой протяжен-
ный комплекс гидроксид-ион — металл может быть конечным
или бесконечным (одно-, дву- или трехмерным), и при описа-
нии структур гидроксооксосолей обычно сначала выделяют
М—ОН-комплекс, а затем показывают, как такие комплексы
соединены друг с другом в кристаллической основной соли. Опи-
сание структуры в терминах М—ОН-комплекса — это в значи-
тельной степени вопрос удобства. Например, система М—ОН
может быть одно- или двумерной, а оксо-ионы могут связывать
эти одно- или двумерные фрагменты в обычную трехмерную
структуру, т. е. в структуру, не являющуюся ни цепочечной,
ни слоистой. Так, например, в то время как Си2(ОНKХО3 и
Zn5fOH)8Cl2-H2O имеют слоистые структуры, Си (ОН) Юз,
Fe(OH)SO4, Zn2(OHJSO4 и Zn5(OHN(CO3J имеют трехмер-
ные структуры, хотя хорошо видно, что они построены из одно-
или двумерных фрагментов М—ОН. Следует подчеркнуть, что
не существует простой зависимости между отношением ОН : М
и возможными типами комплексов М—ОН. В предположении,
что каждая группа ОН связана с двумя атомами металла, при
отношении ОН:М>1 возможно образование как циклических,
так и линейных М—ОН-комплексов. Некоторые из комплексов
М—ОН в основных солях, образованных из разбавленных рас-
творов с высоким отношением ОН : М, сходны со структурами
конечных продуктов гидролиза, а именно со структурами соот-
ветствующих гидроксидов или оксидов металла.
1-4.3.2. Конечные гидроксокомплексы металлов. Одним из про-
дуктов гидролиза A12(SO4K щелочью является соль с эмпириче-
ской формулой A12O3-2SO3- ПН2О, которая содержит мостико-
вые гидроксоаквакомплексы а (см. ниже) и, следовательно,
376 14. Гидроксиды, гидроксид-оксид и гидроксосоли
должна иметь формулу [A12(OHJ(H2O)8](SO4J-2H2O [1]. Бо-
лее сложным примером является двумерный комплекс
Th2(OHJ(NO3N(H2ON (б), образующийся при гидролизе
нитрата в растворе [2]. Три бидентатных иона NO3~ и три моле-
кулы воды вместе с гидроксид-ионами образуют координацион-
ный 11-вершинник вокруг каждого атома
металла.
Соединения, которым первоначально
приписывали формулы ZrOCl2-8H2O и
ZrOBr2-8H2O, также являются гидроксо-
комплексами. Сложное поведение этих сое-
динений в водных растворах свидетельст-
вует о возможности полимеризации, и, дей-
ствительно, кристаллы содержат четырехъ-
ядерные (квадратные) комплексы (е), в
которых каждый атом циркония окружен
восемью атомами кислорода, расположен-
ными в виде искаженной квадратной анти-
призмы. Ионы галогенов и остальные моле-
кулы воды расположены между комплекса-
комплекс U6O4(OHL ми; таким образом, это соединение имеет
BUso!(OHL(SO)fi структурную формулу [Zr4(OH)8(H2O)I6]X8.
ueu4(UHMbO4)a. .12H2O [3J. Позже мы снова вернемся к
этому типу комплекса.
Полиэдрический комплекс обнаружен в соединении
U6O4(OHL(SO4N [4] и изоструктурном соединении церия. Этот
комплекс (рис. 14.15) содержит октаэдр из атомов урана и
соединенную с ним кубическую группировку из восьми атомов
14+
(Н2ОK
и
Рис. 14.15.
О
О, ОН
Конечный
Н,0
Н2ОХ I /ОН
ЧА1
АГ
Н,0
Г
Х
-Н20
Н,0
Н,0
o-n:
Th"
"Th
¦О,
N-0
о-
(Н2О,Ь
ОН
он он он он !
\/ он \/ I
(H2OLZrC >Zr(H2OL i
СИ J
кислорода (позиции атомов водорода не определены) и в об-
щем относится к тому же типу, что и ион Mo6Cl84f (разд. 9.10.3).
14.3. Гидроксосоли 377
Однако в то время как в комплексе молибдена расстояния ме-
талл— металл даже короче, чем в металлическом молибдене,
в комплексе урана расстояния U—U C,85 А) такие же боль-
шие, как в иОз, из чего можно заключить, что комплекс удер-
живается связями U—О. Из молекул такого же типа построены
и гидроксид-оксиды цинка и свинца МбО4(ОНL (разд. 26.7.3).
14.3.3. Одномерные гидроксокомплексы металлов. Для ряда
структур гидроксосолей с отношением ОН:М=1 характерна
цепочка, состоящая из координационных октаэдров, сочленен-
ных по противоположным ребрам, причем одной из вершин
О Си »1 ОО ООН
Рис. 14.16. Две проекции структуры Си (ОН) Юз. а — вид сверху; б — вид сбо-
ку, причем октаэдричсские цепочки перпендикулярны плоскости чертежа.
каждого ребра является ОН-группа. В простейшем случае эти
цепочки далее соединены оксо-ионами с образованием трехмер-
ной структуры, как показано на проекциях структуры
Си (ОН) Юз (рис. 14.16) [5]. Остальными четырьмя атомами в
координационном октаэдре металла в цепочке обязательно
являются атомы кислорода оксо-ионов. Структуры Fe(OH)SO4
[6] и In(OH)SO4 в общем принадлежат к тому же типу. Еще
одна интересная возможность реализуется в структуре
Zn2(OHJSO4 [7]. В отличие от структуры Си(ОН)Ю3, где па-
раллельные октаэдрические цепочки связаны друг с другом
конечными оксо-ионами, в структуре Zn2(OHJSO4 октаэдриче-
ские цепочки соединены друг с другом цепочками второго типа,
расположенными перпендикулярно первым, как показано на
рис. 14.17. Эта структура является одной из тех структур, в ко-
торых ионы Zn2+ имеют как тетраэдрическую, так и октаэдри-
ческую координацию; этот вопрос рассматривается в гл. 4 и 5.
Второй тип цепочек М—ОН до какой-то степени родствен
циклическому комплексу циркония, о котором уже упомина-
лось выше; это зигзагообразная цепочка из атомов металла,
14. Гидроксиды, гидроксид-оксид и гиОроксосплн
связанных двойными гидроксидными мостиками. Все четыре
ОН-группы лежат по одну сторону от каждого атома металла;
цепочки этого типа характерны для таких более крупных ме-
таллов, как цирконий, торий и уран, образующих ионы М4+ с
координационным числом по кислороду, равным 8 (иногда 7).
О Zn О О
Рис. 14.17. Проекции структуры Zn2(OHJSO4. б и г — схематическое изобра-
жение проекций а и е. На рис. а и б октаэдрические цепочки параллельны,
а тетраэдрические цепочки перпендикулярны плоскости чертежа; на рис. а
иг — наоборот.
Такая цепочка выделена на рис. 14.18, изображающем проек-
цию структуры гидроксосоли Th(OHJSO4 [8], которая изо-
структурна также и соединениям циркония и урана. Цепочки
соединены друг с другом ионами SO42~, атомы кислорода ко-
торых дополняют координационный полиэдр атомов металла в
цепочках до антипризмы. В соединении Hf (OHJSO4-H2O [9]
четыре ОН-группы и молекула воды образуют плоскую пента-
гональную группировку вокруг атома гафния, а два атома кис-
лорода сульфат-ионов дополняют координационный многогран-
ник до пентагональной бипирамиды.
14.3. Гидрпксосп.ш 3/9
Н2О
Н2О
н
uf
/ uf / f /
—он он—он он—он
Н2О Н2О
Диоксиды церия, циркония, тория и урана кристаллизуются
со структурой типа флюорита, и интересно отметить, что три
комплекса, которые мы описали, можно рассматривать как
ю
Th
ОН
О
Рис. 14.18. Кристаллическая структура Th(OHJSO4.
фрагменты этой структуры. В ионе [Zr4(OH)8(H2O) i6j8+ двой-
ные гидроксидные мостики перпендикулярны плоскости, в кото-
рой лежат атомы циркония, так что расположение четырех ато-
мов циркония и восьми ионов ОН~ приблизительно такое, как
показано на рис. 14.19, я, изображающем фрагмент структуры
флюорита. Аналогично этому можно рассматривать ион
MgO4(OHLI2+ как фрагмент б, а цепочку [М(ОНJ]П в структу-
ре Th(OHJSO4— как систему атомов структуры флюорита (в).
14.3.4. Двумерные гидроксокомплексы металлов. Гидроксиды
кальци", магния, марганца, железа, кобальта и никеля имеют
слоистую структуру Cdl2. Хотя структура Си(ОНJ не принад-
лежит к этому типу, ряд основных солей меди, например
Си2(ОН)зВг и гидроксонитрат меди, имеют структуры, родст-
венные Cdl2, и на них мы коротко остановимся. В Zn(OHJ
цинк имеет тетраэдрическую координацию, однако, по-видимо-
му, существуют различные гидроксосоединения цинка со струк-
турами, подобными Cdl2. В некоторых основных солях цинка,
как и в Zn2(OHJSO4, достигается как бы «компромисс» между
тетряэдрической координацией цинка в Zn(OHJ и октаэдриче-
380 14. Гидроксиды, гидроксид-оксид и гидроксосоли
ской координацией в ZnCO3 и других оксосолях, который выра-
жается в том, что в одной и той же структуре атомы цинка
имеют оба типа координации. Это приводит к усложнению
структур, поэтому сначала мы рассмотрим очень простую взаи-
мосвязь между структурой Си2(ОН)з1КО3 и структурами СиС12
и Си2(ОН)зВг, относящимися к типу Cdl2.
При замене одной четверти ОН-групп на бром в гипотети-
ческом слое Си(ОНJ типа Cdl2 образуется слой Cu2(OHKBr;
этот процесс сопровождается искажением координационного
октаэдра, так что координация Си(II) становится D^-2). Если
Рис. 14.19. Комплексы Zr4O8 (a), M6OS (б) и цепочка (МО2), (а), показанные
в виде фрагментов структуры флюорита.
вместо атома брома мы введем один атом кислорода, принад-
лежащий иону NO3~~, плоскость которого перпендикулярна пло-
скости слоя, то получим слоистую структуру Cu2(OHKNO3
[10], проекция которой изображена на рис. 14.20, а. Другие ато-
мы кислорода, входящие в ион NO3~, соединены водородными
связями с ионами ОН~ соседнего слоя.
В структуре гидроксосоли Си2(ОНK|ЫОз одна четверть по-
зиций ОН в слое М(ОНJ замещена на атомы кислорода ионов
NO3~. В структуре Zn3(OHL(NO3J [11] одна треть ОН-групп
замещена на атомы кислорода NO3~-hohob, и структура этого
соединения очень похожа на структуру, изображенную на
рис. 14.20, а, но, конечно, между слоями размещено большее
число ионов NO3~. В обоих этих гидроксонитратах октаэдриче-
ские позиции металла в слое полностью заселены, причем отно-
шение (OH + Ono3)'. М. в обеих структурах равно 2: 1. Известны
также структуры, в которых некоторые из позиций металла не
заселены.
В гл. 6 мы рассматривали ряд более сложных структур, ос-
новными структурными единицами в которых являются слои ти-
па Cdl2; к ним относятся в частности:
Zn5(OH)8(NO3J-2H2O
Zn5(OH)8Cl2-H2O
Zn5(OHN(CO3J
Acta cryst, 1970, B26, 860
Z. Kristallogr., 1968, 126, 417
Acta cryst., 1964, 17, 1051
14.3. Гидроксосоли 381
Первые две структуры являются слоистыми, причем слои в них
можно получить из гипотетического слоя Zn(OHJ типа Cdl2.
При этом одна четверть атомов цинка с октаэдрической коор-
динацией замещается на пары атомов цинка с тетраэдрической
координацией, по одному атому с каждой стороны слоя, так
что образующийся слой имеет состав Zn5(OH)8. В гидроксо-
нитрате молекула воды входит в координационный тетраэдр
дополнительных атомов цинка, а ионы NO3^ расположены меж-
—г- н2о Y н2о
I ' I
слои
Zn5(OH)g
Рис. 14.20. Проекции структур Cu2(OHKNO3 (а) и Zn5(OHK(NO3h-2 H2O (о).
ду слоями и соединены водородными связями с двумя молеку-
лами воды одного слоя и одной группой ОН соседнего слоя
(рис. 14.20,6). В соединении Zn5(OH)8Cl2-H2O четвертая связь
в координационном тетраэдре цинка — это связь с атомом хло-
ра, а молекулы воды расположены между слоями. В гидроксо-
карбонате одна четверть ОН-групп в исходном слое Zn(OHJ
замещена на атомы кислорода ионов СО32~, так что отношение
ОН : Zn становится равным 6:5, а не 8:5, как в других солях.
В этой структуре атомы цинка одного слоя с тетраэдрической
координацией соединены с СО3-группами соседних слоев, в ре-
зультате чего структура уже не является слоистой (разд. 6.5.5).
В структурах, которые мы только что описали, базисным
слоем является октаэдрический слой типа Cdl2 (Mg(OHJ), при-
годный для ионов промежуточного размера (с радиусом около
0,7 А). Слой, который может включать большие по размеру
ионы, был обнаружен в структуре соединения Рг(ОНJ1\1Оз [12].
На рис. 14.21 показана боковая проекция фрагментов двух
слоев этой структуры. Координационные многогранники атомов
3S2 14. Гидроксиды, гидроксид-оксид и гидроксоспли
празеодима в форме трехшапочной тригоналыюй призмы, со-
стояшие из шести ОН-групп и трех атомов кислорода ионов
\!О3~, объединены своими базальными (треугольными) гранями
с образованием цепочек, перпендикулярных плоскости чертежа.
Помимо этого, многогранники сочленены друг с другом общими
ребрами, в результате чего образуется гофрированный слон.
Следует подчеркнуть, что три атома кислорода в каждом коор-
динационном многограннике принадлежат двум бидентатным
ионам МОз~, причем один атом кислорода каждого такого иона
находится в треугольном основа-
нии трехшапочной тригональной
призмы и, следовательно, явля-
ется общим для двух координа-
ционных групп металла.
Некоторые основные соли со
слоистыми структурами всегда
плохо закристаллизованы. На-
пример, кристаллы «белого свин-
ца» РЬз(ОНJ(СО3J слишком
малы по размерам и неупорядо-
чепны, чтобы можно было полу-
чить их рентгенограммы; мето-
дом электронографии установле-
но, что довольно неупорядочен-
ная структура этого соединения,
по-видимому, построена из слоев
РЬ(ОНJ, а" ионы РЬ2т и СО32^
размещены между слоями [13].
В структурах гидроксооксосолей образование трехмерных
каркасов гидроксид-ион — металл маловероятно, так как число
атомов кислорода, принадлежащих ОН-группам, обычно состав-
ляет небольшую часть от общего числа атомов кислорода, и,
следовательно, многие мостики М—О—М содержат атомы кис-
лорода оксо-ионов. С другой стороны, в гидроксогалогенидах,
таких, как М2(ОНKХ, число гидроксид-ионов составляет три
четверти от общего числа анионов, и в структурах некоторых
из этих соединений действительно встречаются трехмерные кар-
касы гидроксид-ион —металл. (См. материал, посвященный
гидроксосолям Си11, в гл. 25 и раздел по гидроксогалогенидам
в гл. 10).
Литература. [If Acta Chem. Scand., 1962, 16, 403. [21 Acta Chem. Scand., 1968,
22, 389. [3] Acta cryst., 1956, 9, 555. [41 A. Kristallogr., 1953, 5, 349. [51 Acta
cryst., 1962, 15, 1105. [6] Acta Chem. Scand., 1962, 16, 1234. [71 Acta cryst.,
1962, 15, 559. [8] A. Kristallogr., 1952, 4, 421. [9| Acta Chem. Scand., 1969, 23,
3541. [10] Helv. Chim. Acta, 1952, 35, 375. [Ill Acta cryst., 1973, B29, 1703.
[121 Acta cryst., 1976, B32, 2944. [131 Acta cryst., 1956, 9, 391.
Piic. 14.21. Боковая проекция
фрагментов двух слоев в структу-
ре Pr(OHJNO3.
15. ВОДА И ГИДРАТЫ
15.1. Структуры льда и воды
Строение изолированной молекулы воды в парах хорошо изве-
стно из спектроскопических данных; однако, как отмечалось в
гл. 8, соединения, содержащие водород, часто имеют аномаль-
ные свойства из-за образования водородных связей. Следова-
тельно, нельзя считать, что структурная единица в конденси-
рованных фазах (вода и лед) имеет в точности такое же строе-
ние. Обычно структура льда обсуждается раньше, чем структу-
ра воды, так как дифракционные методы дают значительно
больше информации о структуре твердого тела, чем о структуре
жидкости. В жидкости происходит постоянное перемещение
частиц, и можно определить только среднее окружение, т. е.
число и пространственное расположение ближайших к молеку-
ле частиц, усредненные во времени и пространстве. Единствен-
ной информацией, которую можно получить при исследовании
дифракции рентгеновских лучей в жидкости при данной темпе-
ратуре, является кривая рассеяния, из которой получают кри-
вую радиального распределения, а интерпретация различных
максимумов в виде ближайшего окружения, последующего за
этим ближайшим окружения и т. д., является очень" сложной.
15.1.1. Лед. При атмосферном давлении вода обычно кристал-
лизуется в виде льда-Ih, который имеет гексагональную струк-
туру, похожую на структуру тридимита. Если тщательно конт-
ролировать температуру (от —120 до —140 °С), то лед можно
кристаллизовать также непосредственно из паров, желательно
в вакууме, в виде кубической модификации лед-1с со структу-
рой типа кристобалита. (Обычно эту кубическую модификацию
получают количественно нагреванием модификаций высокого
давления от температуры жидкого азота.) При температурах
> 153 К лед-Ic метастабилен по сравнению с обычным льдом-1я.
Существование второй метастабильной кристаллической моди-
фикации, льда-IV, твердо установлено для D2O, но с меньшей
достоверностью — для Н2О. Стекловидная модификация льда
384 15. Вода и гидраты
образуется при конденсации пара при температурах —160°С и
ниже.
Помимо льда-Ih и 1С известно несколько кристаллических
полиморфных модификаций, устойчивых только при повышен-
ном давлении, хотя фазовая диаграмма воды полностью еще не
исследована (рис. 15.1). Существует пять различных структур
VI
6 8 76 78 20
Давление, кбар
ZZ
Рис. 15.1. Часть фазовой диаграммы воды.
(отличающихся расположением атомов кислорода), и две из
них имеют низкотемпературные модификации; к сожалению, но-
мера им присвоены бессистемно:
V VI VII
II
III
VHI (низкотемпературные
модификации)
Модификации II—VII получают охлаждением воды при посте-
пенном увеличении давления; для модификации II необходимо
охлаждение до —195 °С, ее также можно получить из модифи-
кации V снижением давления до 2 кбар при низкой температу-
ре. Лед-Ш превращается в лед-IX при температурах ниже
приблизительно —100°С, а лед-VII в лед-VIII — ниже 0°С. Все
модификации высокого давления II—VII могут быть получены
при атмосферном давлении закалкой в жидком азоте.
При рассмотрении структур этих полиморфных модифика-
ций интересно обсудить ряд вопросов: 1) аналогии со структу-
рами SiO2 и силикатов; 2) присутствие в структурах наиболее
конденсированных модификаций VI и VII (VIII) двух взаимо-
проникающих каркасов; 3) упорядочение протонов. Структур-
ные аналогии с БЮг и силикатами представлены в табл. 15.1,
15.1. Структуры льда и воды 385
а именно: льда-Ш — со структурой типа кеатита, льда-VI —
с двумя взаимопроникающими каркасами типа эдингтонита
(разд. 23.12.8), льда-VII (и VIII)—с двумя взаимопроникаю-
щими каркасами типа кристобалита. При сравнении строения
льда со структурами модификаций SiO2 или силикатов подра-
зумевается, что атомы кислорода молекул воды в этих структу-
рах льда занимают позиции, занятые атомами кремния в струк-
Таблица 15.1. Полиморфные модификации льда
Модифика-
ция
Ih
Ic
II
III 1
1
TY 1
1Л J
[IV
Y
VI
VII
VIII
Плотность,
г/смЗ
0,92
0,92
1,17
1,16
—
1,23
1,31
1,50
Упорядочен-
ное (У) или
неупорядо-
ченное (Ш
размещение
протонов
Н
Н
У
н
У
—
н
н
н
У
Аналогичная
структура SiO2
или силиката
Тридимит
Крнстобалит
Кеатит
»
—
Эдингтонита
Кристобалита
Литература
Ada cryst, 1957, 10, 70
(нейтронограф.)
J. Chem. Phys, 1968, 49,
4365 (нейтронограф.)
Ada cryst, 1964, 17, 1437;
J. Chem. Phys, 1968, 49,
4361 (нейтронограф.)
Ada cryst, 1968, B24, 1317
J. Chem. Phys., 1968, 49,
2514 (нейтронограф.)
J. Chem. Phys, 1937, 5, 9641
Ada cryst, 1967, 22, 706
Proc. Acad. Sci, 1964, 52,
1433
J. Chem. Phys, 1965, 43,
3917; N. Bureau Stand,
1965, 69C, 275
J. Chem. Phys, 1966, 45, 4360
Структура построена из двух взаимопроникающих каркасов.
туре S1O2 или атомами кремния и алюминия в случае эдингто-
нита. Проекция атомов кремния в кеатите похожа на проекцию
атомов германия в структуре полиморфной модификации гер-
мания высокого давления (рис. 3.41). Атомы кислорода в струк-
туре льда-VII (или VIII) расположены в виде объемноцент-
рированного куба (рис. 15.2). Каждая молекула воды окру-
жена восемью молекулами Н2О, которые одинаково удалены от
нее, но водородными связями она соединена только с четырьмя
из них. При атмосферном давлении (закалка в жидкий азот)
длина связи О—Н—О равна 2,95 А, а при —50 °С и давлении
25 кбар 2,86 А.
Каркасы водородных связей в структурах полиморфных мо-
дификаций льда-П и V отличаются от любого, из каркасов
25—985
386 15. Вода и гидраты
Si(Al)—О. Ромбоэдрическая структура льда-П имеет некото-
рое сходство со структурой льда-I типа тридимита, причем бо-
лее высокая плотность льда-П объясняется тем, что ближай-
шее окружение в его структуре, состоящее из 4 молекул воды
(расстояние 2,80 А), дополнено пятой молекулой Н2О на рас-
стоянии 3,24 А; ср. последнюю величину с расстоянием до сле-
дующих за ближайшими молекул воды D,5 А) в модификации
льда-Ih. Каркас льда-V также не имеет очевидных аналогий со
структурами SiO2 или силикатов; отметим только, что отноше-
ние плотностей льда-V и льда-1
совпадает с отношением плотностей
коезита SiO2 и тридимита. В струк-
туре льда-V молекула HgO окру-
жена четырьмя ближайшими моле-
кулами со средним расстоянием
2,80 А, а следующие за ближайши-
ми молекулы воды находятся на
расстояниях 3,28 и 3,45 А. Наибо-
лее яркая черта этой структуры —
сильное искажение тетраэдрическо-
го расположения ближайшего окру-
жения; углы О—О—О лежат в ин-
тервале 84—128°.
Позиции протонов в полиморф-
ных модификациях льда. При пер-
воначальном рентгеноструктурном исследовании льда-Ih были
локализованы только атомы кислорода. Каждый атом кислоро-
да имеет окружение, состоящее из четырех атомов О в виде
почти не искаженного тетраэдра; расстояния О—О равны: для
связи, параллельной оси с, 2,752 А, для трех других — 2,765 А;
углы О—О—О очень близки к ЮЭ'/г0- Каждый атом водорода
должен быть помещен где-то между каждой парой атомов кис-
лорода. Частоты ИК-спектров поглощения показывают, что-
расстояние О—Н в молекуле Н2О не может измениться от 0,9&
(в изолированной молекуле воды) до 1,38 А (половины рас-
стояния О—О у льда); таким образом, атом водорода должен
располагаться несимметрично вдоль линии О—О. Существует
два возможных варианта: либо атомы водорода занимают фик-
сированные позиции (упорядоченные протоны), либо наблюда-
ется статистическое размещение атомов водорода (неупорядо-
ченные протоны) с наложением ограничения, заключающегося
в том, что в любой данный момент времени только два атома
водорода находятся вблизи определенного атома кислорода,
т. е. имеются обычные молекулы Н2О. Полинг полагает, что
«усредненная» структура, содержащая У2 атома водорода в
каждой из 4N позиций (каждая позиция находится на расстоя-
Рис. 15.2. Кристаллическая
структура льда-VIII.
15.1. Структуры льда и воды 387
нии 0,96 А от атома кислорода вдоль линии О—О) в решетке
из N атомов кислорода, может объяснить наблюдаемое значе-
ние остаточной энтропии льда @,82 э. е.).
В настоящее время различными физическими методами уста-
новлено, что в некоторых из модификаций льда высокого дав-
ления протоны размещаются упорядоченно, а в некоторых —
неупорядоченно, в частности низкотемпературные модифика-
ции IX и VIII являются упорядоченными модификациями
льда-Ш и льда-VII. Особенности длинноволновой части ИК-
спектров свидетельствуют о том, что в модификациях II и IX
протоны упорядочены (узкие полосы поглощения), а в моди-
фикации V не упорядочены (диффузные полосы) [1]. Были изу-
чены диэлектрические свойства следующих модификаций льда:
1С [2], II, III, V, VI [3], VII и VIII [4]; выводы относительно
упорядоченного или неупорядоченного размещения протонов в
этих модификациях включены в табл. 15.1.
Вторая проблема заключается в определении положений
протонов относительно линии О—О. В модификации льда-Ih
углы О—О—О близки к ЮЭ'/г0, но данные нейтронографиче-
ского исследования показывают, что атомы водорода лежат
немного в стороне от этих линий, так что их позиции соответст-
вуют углу Н—О—Н, равному ~ 105°. Неискаженное тетраэдри-
ческое расположение четырех ближайших атомов кислорода
достигается благодаря случайной ориентации молекул в струк-
туре в целом. Ранее уже отмечалось существование очень боль-
шого диапазона значений углов в модификации льда-V с неупо-
рядоченно расположенными протонами. Исследования метода-
ми нейтронографии и ПМР [5] упорядоченных модификаций II
и IX также подтвердили, что угол Н—О—Н близок к 105°.
Однако углы О—О—О в этих двух модификациях равны соот-
ветственно 88 и 99, 87 и 99°; следовательно, протоны в их струк-
турах лежат заметно в стороне от линий О—О.
Литература. П1 J- Chem. Phys., 1968, 49, 775. [21 J. Chem. Phys., 1965, 43, 2376.
13] J. Chem. Phys., 1985, 43, 2384. [4] J. Chem. Phys., 1966, 45, 3976. [5] J. Chem.
Phys., 1968, 49, 4660.
15.1.2. Вода. Тот факт, что вода при обычных температурах —
жидкость, в то время как все гидриды (CH-i, NH3, HF, PH3,
SH2 и НС1) элементов, близких в периодической системе к кис-
лороду, — газы, свидетельствует о существовании необычного
взаимодействия между соседними молекулами. То, что эти взаи-
модействия охватывают небольшое число соседних молекул, до-
казывает низкая плотность жидкости по сравнению с величиной
A,84 г/см3), рассчитанной для жидкости с плотнейшей упаков-
кой молекул приблизительно одинакового размера, имеющих
радиус 1,38 А, как у льда. При плавлении льда происходят два
25*
388 15. Вода и гидраты
процесса, вызывающих противоположные эффекты: разрушение
цельной системы водородных связей в структуре льда типа три-
димита с образованием более плотной жидкости и термическое
расширение, действующее в обратном направлении. Чтобы
можно было объяснить минимум на кривой зависимости объема
от температуры, первый процесс должен происходить в интер-
вале температур. Проблема концентрации и энергии водород-
ных связей в воде при различных температурах подвергалась
широкому обсуждению. Спектры комбинационного рассеяния
(КР) и измерения вязкости пока-
зывают, что число водородных свя-
зей в воде при 20 °С составляет
приблизительно половину по срав-
нению с числом водородных связей
у льда. Представление о том, что
большое число водородных связей
разрушается при плавлении льда
или нагревании воды, в общем не-
приемлемо, и оно является мало-
вероятным, если допустить, что ве-
личина энергии водородной связи
Рис. 15.3. Передвижение ионов (согласно ПоЛИНгу) 19 кДж/
Н+ (а) и ионов ОН- (б) как К V •" rt '
следствие небольших сдвигов /моль. Существуют также другие
протонов (по Берналу и Фау- гипотезы, например, о том, что ВО-
леру). дородные связи изгибаются, а не
разрушаются, либо что разрушают-
ся более слабые водородные связи. Прежде чем описывать су-
ществующие в настоящее время структурные модели воды,
уместно упомянуть о двух других ее свойствах, а именно: об
аномальных подвижностях ионов Н+ и ОН~ и о диэлектриче-
ской проницаемости, которая в области низких частот практи-
чески совпадает для воды и льда.
Подвижности ионов Н+ и ОН~ равны 32,5-10~4 и 17,8Х
ХЮ см/с в приложенном поле напряженностью 1 В/см,
в то время как у других ионов подвижности имеют порядок
6-10~4 см/с. Расчеты показывают, что требуется очень неболь-
шая энергия, чтобы оторвать протон от одной молекулы воды,
к которой он был присоединен с образованием иона НзО+,
и присоединить его к другой молекуле, так как процесс Н3О,
НгОч^НгО, Н3О не сопровождается изменением энергии. Если
предположить, что ион Н+ служит связующим звеном между
двумя молекулами, то тогда процесс, изображенный схемати-
чески на рис. 15.3, а, сводится к движению Н+ от А к В. Ана-
логичный механизм эффективного движения ионов ОН~ в воде
показан на рис. 15.3,6. В то время как другие ионы должны
перемещаться в воде сами, ионы Н+ и ОН~ двигаются таким
/5./. Структуры льда и воды
389
способом, который Бернал назвал «эстафетной гонкой»: необхо-
димы лишь небольшие смещения протонов.
Для того чтобы объяснить высокое значение диэлектриче-
ской проницаемости воды, необходимо предположить, что су-
ществуют группы молекул с псевдокристаллической структурой,
т. е. с ориентацией связей О—Н—О, достаточной для появле-
ния заметного электрического момента. Верхняя граница раз-
меров таких «кластеров», определенная при изучении ИК-спект-
ров поглощения в области 1,1—1,3 мкм, была оценена прибли-
зительно в 130 молекул при 0°С, 90 молекул при 20°С и 60 мо-
лекул при 72 °С. В жидкости существует постоянное перемеще-
ние молекул, поэтому считается, что каждый такой «кластер»
существует только очень короткое время (~10~и—10~10 с).
Гипотеза о том, что в целом структура воды подобна струк-
туре льда (эта гипотеза, конечно, допускает существование
большего беспорядка в жидкости, чем в твердом теле), под-
тверждается исследованиями дифракции рентгеновских лучей.
Из рентгенограмм воды при различных температурах A,5-т-
Ч-83°С) были получены кривые радиального распределения, от-
куда далее из площадей пиков можно оценить среднее число
соседних молекул на различных расстояниях. Первый пик на
кривой означает, что при 1,5 °С у каждой молекулы воды в
среднем имеется 4,4 соседние молекулы на среднем расстоянии
2,90 А; при 83°С соответствующие цифры равны 4,9 молекулы
и 3,05 А. За первым пиком кривая постепенно выходит на пло-
хо разрешенный максимум в области 4,5—4,9 А, который ука-
зывает на существование молекул, находящихся между бли-
жайшим и следующим за ближайшим окружением в структуре
льда B,8 и 4,5 А). Вследствие того что кривая радиального
распределения содержит лишь небольшое число сравнительно
хорошо разрешенных пиков, она может быть интерпретирована
многими способами.
Если ввести только одно условие, что каждая молекула во-
ды окружена четырьмя соседними с образованием тетраэдра,
то все равно остается много разных вариантов расположения
молекул воды, причем требуется, чтобы такая структура была
более плотной, чем структура льда-I типа тридимита. Были
предложены три модели структуры псевдокристаллических об-
ластей. Первая — это упаковка, аналогичная структуре кварца;
при высоких температурах она должна переходить в жидкость
с более плотной упаковкой (плотность кварца 2,66 г/см3; плот-
ность тридимита 2,30 г/см3). Вторая структура похожа на кар-
кас, образуемый молекулами воды в структуре гидрата хлора
(разд. 15.2.2), во всех полиэдрических пустотах которого нахо-
дятся молекулы воды без водородных связей; имеется 8 таких
пустот в элементарной ячейке, содержащей 46 молекул каркаса.
390 15. Вода и гидраты
Третья структура — это слегка «раздвинутая» структура типа
тридимита с молекулами в пустотах. Наиболее вероятным пред-
ставляется то, что более высокая плотность воды по сравнению
с плотностью льда является следствием внедрения молекул в
пространство между ближайшим и следующим за ближайшим
окружением в структуре типа льда. Одна из моделей струк-
туры для достижения хорошего согласия с наблюдаемой кри-
вой радиального распределения была уточнена методом наи-
меньших квадратов; в этой модели каждая молекула воды в
каркасе имеет ближайшее окружение, состоящее из четырех
молекул воды каркаса (одна на расстоянии 2,77 А и три на
расстоянии 2,94 А), а каждая из молекул, размещенных в пус-
тотах каркаса, окружена двенадцатью ближайшими молекула-
ми каркаса (три на расстояниях 2,94, 3,30 и 3,40 А, остальные
на расстоянии 3,92 А); отношение числа молекул в каркасе к
числу молекул в пустотах равно 4:1.
Ввиду наличия обширной литературы о структуре воды
здесь можно рекомендовать только несколько работ, в которых
цитируются более ранние исследования. (Rec. Trav. chim.
(Belg.), 1962, 81, 904; J. Am. Chem. Soc, 1962, 84, 3965; J. Chem.
Phys., 1965, 42, 2563; J. Phys. Chem., 1965, 69, 2145; J. Chem.
Phys., 1966, 45, 4719J.
15.1.3. Водные растворы. Некоторые водные растворы были изу-
чены рентгеновскими методами. Из кривой а (г), полученной
для концентрированных растворов, можно извлечь некоторую
информацию о ближайшем окружении отдельного иона; однако
сомнительно, что те более детальные выводы, которые были
сделаны относительно структур растворов HNO3, H2SO4 и NaOH,
представляют единственно возможные интерпретации экспери-
ментальных данных [1]. В растворах, содержащих сложные
ионы, могут быть идентифицированы межатомные расстояния,
соответствующие связям внутри ионов, например пики при 1,33
и 1,49 А на кривых радиального распределения водных раство-
ров NH41NO3 и НС1О4 естественно отнести к связям N—О и
С1—О [2]. В ряде работ содержатся выводы об окружении ка-
тионов в растворах ЕиС1з [3], КОН [4], FeCl3 [5J, ZnCl2 [6],
ZnBr2 [7] и СоСЬ [8]. (О гидролизованных растворах солей
свинца и висмута, содержащих; гидроксокомплексы, см.
разд. 14.1.)
При исследовании нейтральных растворов FeCb неизбежно
возникают некоторые сомнения относительно существования в
них октаэдрических (а не тетраэдрических) комплексов, так как
пик при 2,25 А может быть интерпретирован либо как резуль-
тат тетраэдрической координации Fe3+ ионами Cl~ (Fe—С1
2,25 А), либо как средняя величина из шести расстояний (четы-
15.2. Гидраты 391
ре расстояния Fe—О 2,07 А и два Fe—С1 2,30 А) в октаэдриче-
ских комплексах такого типа, какой существует в кристалличе-
ском гексагидрате. В то же время, по-видимому, считается до-
казанным существование ионов FeCU" в разбавленных раство-
рах, содержащих избыток ионов С1~, и молекул Fe2Cl6 в раство-
рах неводных растворителей с низкой диэлектрической прони-
цаемостью (метиловый спирт и др.).
Хлорид цинка очень хорошо растворим в воде, даже при
комнатной температуре, и его очень вязкий 27,5 М раствор
близок по составу к чистому расплаву соли Zn0,2oClo,4o(H20)o,4o-
Кривая радиального распределения для этого раствора согла-
суется с существованием тетраэдрических группировок
гпС1з(Н2О), которые должны быть связаны друг с другом в
среднем двумя атомами хлора. В более разбавленных раство-
рах E М) преобладают группировки ZnCl2(HeOJ; аналогич-
ные координационные группировки обнаружены в концентриро-
ванных водных растворах ZnBr2. В присутствии достаточного
избытка ионов Вг~ эти группировки преобразуются в ионы
ZnBr42~. В то же время данные рентгенографического исследо-
вания концентрированных растворов СоСЬ были интерпрети-
рованы на основе модели с октаэдрическими группировками
Со(Н2О)б2+ (расстояния Со—О ~2,1 А); однако в метанольных
и этанольных растворах СоС12, по-видимому, существуют силь-
но ассоциированные тетраэдрические группировки CoCU (рас-
стояния Со—С1 ~2,3 А).
Литература. [Ц Tidsskrift for Kjemi, 1943, 3, 83; 1944, 4, 5, 26. [2] Acta Chem.
Scand., 1952, 6, 801. [3] J. Am. Chem. Soc, 1958, 80, 3576. [4] J. Chem. Phys.,
1958, 28, 464. [51 J. Chem. Phys., 1969, 50, 4013. [6] Inorg. Chem., 1962, 1, 941.
[7] J. Chem. Phys., 1965, 43, 2163. [8] J. Chem. Phys., 1969, 50, 4313.
15.2. Гидраты
Один из простейших способов очистки вещества заключается в
его перекристаллизации из подходящего растворителя. Кристал-
лы, выделенные из раствора, могут состоять из чистого веще-
ства, а могут содержать и растворитель. Для большинства со-
лей вода — наиболее подходящий растворитель, и естественно,
что кристаллы, содержащие воду, — гидраты — были известны
еще на ранних этапах развития химии, и многие неорганические
соединения обычно получают в виде гидратов. Уже отмечалось
при обсуждении гидроксидов, что часто соединения, содержа-
щие ОН-группы, также первоначально считали гидратами, на-
пример NaSb(OHN ранее считали гидратом NaSbO3-3H2O,
a NaB(OHL—NaBO2-2H2O и т. д. Термин «гидраты» должен
применяться только для кристаллических соединений, содержа-
щих молекулы Н2О, или в случае гидратированных кислот, та-
392 15. Вода и гидраты
кие ионы, как Н3О+, Н5О2+ и т. д. Помимо неорганических и
органических кислот, оснований и солей в виде гидратов могут
кристаллизоваться некоторые простые вещества и неполярные
соединения, в частности хлор и бром, инертные газы, метан и
алкилгалогениды. Многие из этих гидратов содержат ~6—8
или 17 молекул воды на каждую молекулу (или атом) «раство-
ренного вещества». Гидраты газообразных веществ образуются
только под действием давления, они чрезвычайно неустойчивы
и имеют температуры плавления, обычно близкие к 0°С. Струк-
туры этих гидратов «типа льда» представляют собой трехмер-
ный каркас, построенный из молекул воды, в туннелях или по-
лиэдрических пустотах которого содержатся молекулы «раство-
ренного вещества» («клатраты»). На другом структурном «по-
люсе» находятся гидраты, в структурах которых молекулы воды
и катионы размещены в каналах или пустотах внутри жесткого
каркаса, такого, как алюмосиликатные каркасы цеолитов. Та-
кой гидрат может быть обратимо гидратирован или дегидрати-
рован без разрушения каркаса в отличие от клатратов, в кото-
рых сам каркас построен из молекул воды. Между этими двумя
предельными структурными решениями находятся гидраты со-
лей, кислот и гидроксидов, в которых молекулы воды, анионы
и катионы упакованы вместе с образованием структуры, харак-
терной для данного гидрата. Удаление части или всей воды
обычно приводит к разрушению такой структуры, которая, как
правило, не связана со структурой безводного соединения. Мо-
ногидрат Na3P3O9 является исключением из этого правила.
В структуре безводной соли имеется немного меньшее, чем не-
обходимо, пространство для молекулы воды, поэтому для того,
чтобы ее поместить, нужна очень небольшая перестройка гро-
моздких ионов Р3Од3~. По этой причине структуры Na3P3O9 и
ЫазРэОд-НгО очень сходны.
В данной главе рассмотрены клатраты и гидраты солей, кис-
лот и гидроксидов. Структуры цеолитов описаны в гл. 23, там
же рассмотрены глинистые минералы, которые могут содержать
воду между слоями. Примеры гидратированных «основных со-
лей» и гидратов гетерополикислот и их солей также обсужда-
ются в других главах.
15.2.1. Клатраты. В этом типе гидратов молекулы воды обра-
зуют взаимосвязанную трехмерную систему, в полостях кото-
рой размещены атомы или молекулы «растворенного вещества»;
перечислим последние приблизительно в порядке возрастания
взаимодействия с каркасом из молекул воды: атомы инертных
газов Аг, Хе и такие молекулы, как СЬ, СОг, СзН8 и алкилгало-
гениды; молекулы таких соединений, как Ы4(СН2)б, которые
связаны с каркасом слабой водородной связью; и наконец,
15.2. Гидраты 393
Классифи-
кация
Группа а
I
II
Группа 6
i
и
ш
IV
Группа в
I
11
III
Группа г
1
II
Таблица 15.2. Клатраты
Каркас только из
молекул HjO
Каркас из молекул
Н2О и F, N, S
Полиэдрические каркасы
HPF6-6H2O
(CH3KCNH2-9—H2O
1
2 4 2
6,4С2Н4О-46Н2О
СНС13-17Н2О
7,33H2S-8C4HSO-
• 136 Н2О
Вг2-8,6Н2О
(CH3LNOH-5H2O
(h-C4H9KSF-20H2O
(u3o-C5HnLNF-38H2O
Промежуточные структуры
о
(C2H5JNH-8-^-H2O
4 (CH3KN-41H2O
(k-C4H9KSF-23H2O
Литература
Acta cryst., 1955, 8,
J.
J.
6ii
Chem. Phys.,
44, 2338
Chem. Phys.,
47. 1229
Proc. Acad. Sci.,
J.
J.
J.
J.
J.
J.
J.
J.
J.
J.
36, 112
Chem. Soc,
4131
Chem. Phvs.,
42, 2725
Chem. Phys.,
37, 2231
Chem. Phys.,
19, 1425
Chem. Phys.,
42, 2732
Chem. Phys.,
35, 1863
Chem. Phys.,
38, 2304
Chem. Phys.,
40, 2800
Chem. Phys.,
47, 1222
Chem. Phys.,
48, 2990
Структуры, отличные от полиэдрических каркасов
N4(CH2N-6H2O
(CH3LNF-4H2O
J.
J.
Chem. Phvs.,
43, 2799
Chem. Phys.,
47, 414
1966,
1967,
1952,
1959,
1965,
1962,
1951,
1965,
1961,
1963,
1964,
1967,
1968,
1965,
1967,
ионные соединения, в которых ионы одного или более сортов
связаны с каркасом из молекул воды или включены в него.
Что касается типов структур, то их можно расположить в ряд
от каркасов с вполне сформированными полиэдрическими пусто-
тами вплоть до 3- и C + 4)-связанных сеток, в которых" нет
явных пустот подобного вида. В первой группе соединений мо-
394 15. Вода и гидраты
лекулы воды расположены в каждом узле 4-связанной сетки,
и их связи (О—Н—О) образуют ребра заполняющих простран-
ство полиэдров. Такие структуры «типа льда» неустойчивы до
тех пор, пока все или большинство самых больших пустот не
будут заняты молекулами «растворенного вещества», и темпе-
ратуры плавления таких соединений, как правило,, близки к
0°С. В табл. 15.2 включены также некоторые менее правиль-
ные структуры, которые обсуждаются позднее. Полиэдрические
каркасы подразделяют на две группы: а и б; последняя вклю-
чает пентагональный додекаэдр и родственные ему полиэдры
с гексагональными гранями, которые упоминались в гл. 3.
15.2.2. Полиэдрические каркасы.
Группа а. Аналогию между структурной химией воды и
диоксида кремния можно продемонстрировать на примере
структуры соединения HPF6-6H2O. В этом кристалле молекулы
воды расположены в вершинах заполняющих пространство фе-
доровских усеченных октаэдров, т. е. в тех же позициях, что и
атомы Si(Al) в каркасе ультрамарина (разд. 23.12.8). Каждая
молекула воды в каркасе (рис. 15.4) связана водородными свя-
зями с четырьмя ближайшими молекулами воды, находящимися
на расстоянии 2,72 А; ионы PF6~ занимают пустоты (Н2О—F
2,74 А, Р—F 1,73 А).
В соединении состава М-6Н2О имеется достаточное число
атомов Н для того, чтобы расположить водородные связи по
всем отрезкам, соединяющим соседние узлы федоровской трех-
мерной сетки. В гидрате HPF6-6H2O имеется 13 Н, и тринадца-
тый Н+ предположительно связан с каркасом. Интересное иска-
жение этой решетки наблюдается в (CH3LNOH'5H2O, у кото-
рого в вершинах усеченных октаэдров расположены ОН~+5Н2О.
Поскольку в этом гидрате имеется только 11 атомов водорода,
то не все ребра полиэдров закреплены водородными связями.
Введение катионов внутрь усеченных октаэдров приводит к
расширению последних, так что часть ребер удлиняется до
4,36 А (рис. 15.5).
Значительно менее симметричные полиэдрические пустоты
найдены в (СН3)зС^1Н2-93/4Н2О. Каркас представляет собой
пространство, заполненное 8-гранниками (f4=4, /s = 4) и 17-гран-
никами ([з = 3, /5 = 9, /б = 2, fj = 3). Элементарная ячейка содер-
жит 156 молекул воды A6 формульных единиц), молекулы ами-
на занимают 16 больших пустот A7-гранники); 8-гранники не
заселены.
Группа б. В этом классе пространство заполняется пентаго-
нальными додекаэдрами и родственными ему полиэдрами одно-
15.2. Гидраты 395
Рис. 15.4. Кристаллическая структура Рис. 15.5. Каркас, построенный из со-
HPF6-6H2O. единенных водородными связями
нонов ОН~ и молекул Н2О, в струк-
туре (CH3LN-OH-5H2O. Показано
искажение усеченных октаэдров в фе-
доровской сетке. Штриховые линии —
ребра О—О длиной 4,36 А.
го или нескольких типов: fs=12, f6 = 2, 3, 4 (табл. 15.3) с обра-
зованием сеток с 4-связанными узлами.
Особый интерес вызывает гидрат хлора. Первоначально его
считали хлором в твердом состоянии, однако в 1811 г. X. Дэви
доказал, что эта фаза содержит воду. Позднее М. Фарадей
предложил для состава этой твердой фазы формулу СЬ-ЮНгО.
Элементарная ячейка этой кубической структуры (а» 12 А) со-
Таблица 15.3. Структуры гидратов, содержащие додекаэдры
Гидрат
Cb.7-j-H2O
СНС13-17Н,О
(;no-C,JH1,),,N+F--38H20
Br,-8,6H2O
z
6
8
2
20
Число
LepiuHii
46
136
80
172
Пустоты (л-гранники)
12
2
16
6
10
¦ 4
6
4
16
.5
4
4
16
1 1 00 I
Общее чис-
ло крупных
пустот
6
8
8
20
держит 46 молекул воды, образующих каркас (рис. 15.6), в ко-
тором присутствуют 2 додекаэдрические пустоты и 6 пустот,
значительно больших по размеру A4-гранных пустот). Если
заполнены все пустоты, что возможно в структурах гидратов
аргона, ксенона, метана и сероводорода, то это соответствует
46:8 = 53Д молекулам воды на атом (молекулу) «растворенно-
го вещества». Заполнению только самых больших пустот отве-
396 15. Вода и гидраты
а*
чает формула С12-72/3Н2О. В сответствии с результатами перво-
начальных анализов полагали, что гидрат хлора содержит 8 мо-
лекул воды; это означает, что 2 молекулы воды должны
находиться в меньших по размеру пустотах. Однако согласно
последним данным (химический анализ и измерения плотности),
формула близка к С12-7У4Н2О, что означает частичную (не бо-
лее 20%) заселенность меньших по размеру пустот молекулами
хлора.
Рис. 15.6. Кислородный каркас в Рис. 15.7. Фрагмент каркаса, состоя-
структуре гидрата газа первого типа щего из молекул воды, в структуре
6,1. В центре изображены две из ше- гидрата М-17Н2О, построенный как
сти пустот A4-гранники), приходя- упаковка пентагональных додекаэд-
щихся на одну элементарную ячейку. ров и гексакаидекаэдров. В центре
часть одной из больших пустот.
Фторид сульфония (h-C4H9KSF образует три гидрата, один
из которых (с 20 молекулами воды) имеет такую же структуру,
причем два иона S+, по-видимому, занимают позиции в каркасе
(статистически). При этом остаются четыре вакантные позиции,
две из которых могут быть заселены двумя ионами F~. В гид-
ратах замещенных солей сульфония и аммония громоздкие ал-
кильные группировки занимают пустоты по соседству с теми
позициями в каркасе, которые заселены ионами S+ или N+.
Структура-«прототип» обычно имеет более высокую симметрию,
чем производная структура, в которой возникают различные
типы разупорядочения.
Структуру, приведенную во второй строке в табл. 15.3, также
с кубической симметрией (а«17,2 А), имеют гидраты таких
жидкостей, как СНС13; фрагмент этой структуры изображен на
рис. 15.7. Элементарная ячейка содержит 136 молекул воды и
15.2. Гидраты 397
пустоты двух размеров, 16 малых и 8 большего объема. При за-
полнении только больших пустот соединение содержит
136:8=17 молекул воды на молекулу СНС13, СН31 и т. д.,
но в структуре могут быть размещены и молекулы двух совер-
шенно различных размеров, каждая в пустоте подходящего
размера; такова структура CHC13-2H2S-17Н2О. В структуре
гидрата сероводорода, содержащего также тетрагидрофуран,
включенного в табл. 15.2, молекулами H2S заселено меньше по-
ловины малых пустот.
В третьей структуре, включенной в табл. 15.3 ((изо-
C5HnLN+F~-38H2O), на элементарную ячейку приходится 80
вершин полиэдров, из них 76 заселены молекулами воды, две —
ионами N+ и две — ионами F~. Четыре алкильные группиров-
ки, связанные с ионом N+, размещены в четырех (расположен-
ных тетраэдрически) полиэдрах (два 14-гранника и два
15-гранника), причем вершина, в которой находится ион N+ —
общая для всех четырех полиэдров.
Группа в. В структуре (h-C4H9KSF-23H2O имеются слои,
построенные из пентагональных додекаэдров, подобные слоям
в структуре гидрата с 38 молекулами воды (только что опи-
сан), а между слоями находятся большие пустоты неправиль-
ной формы, в которых заключены катионы. Образование этой
структуры представляет собой нечто вроде попытки включе-
ния катиона («-C4H9KS+ в гидратный каркас, по составу
близкий к каркасу 20-гидрата, имеющего описанную выше ку-
бическую структуру.
Амины образуют многочисленные гидраты с температурами
плавления от —35 до +5°С; они содержат от З'/г до 34 моле-
кул воды на молекулу амина и имеют различные структуры,
среди которых кубическая структура (гидратов хлора и бла-
городных газов) и некоторые менее симметричные структуры.
Например, в соединении (С2Н5JМН-82/зН2О слои из 18-гран-
ников (/5=12, /б = 6) связаны дополнительными молекулами
воды с образованием менее симметричных пустот A2 пустот
в ячейке, содержащей 104 молекулы воды). Атомы азота не
включены в каркас, но образуют водородные связи с молеку-
лами воды, как в структуре N4(CH2N-6H2O (см. ниже).
Группа г. Эти гидраты отличаются тем, что у них нет пол-
ностью сформированных полиэдрических пустот; сетки в них
3- и C+4)-связанные. В структуре N4(CH2N-6H2O Ц„я 13,5 °С
существует такой же 3-связанный каркас (рис. 3.31), как один
из двух одинаковых взаимопроникающих каркасов в клатратах
K-гидрохинона. Поскольку в каркасе такого типа, построенном
из молекул воды, на каждые 6 молекул воды приходится толь-
ко 9 реберных сочленений (связей О—Н—О), то остаются еще
3 атома водорода, способные к образованию водородных связей
398 15. Вода и гидраты
с «внедренными» молекулами. Последние, как летучие мыши,
«подвешены» в пустотах между шестичленными кольцами
(рис. 15.8); иначе говоря, они занимают позиции колец во вто-
ром каркасе структуры C-гидрохинона. Половина молекул воды
образует три пирамидально расположенные связи О—Н—О, а
Рис. 15.8. Структура (CH2NN4-6 Н2О. Молекула (CH2)eN4 «подвешена» в од-
ной из пустот. Молекула (CH2NN4 изображена схематически в виде тетра-
эдра из атомов азота, соединенных с каркасом из молекул воды посредством
связей N.. .Н—О (жирные штриховые линии).
остальные молекулы воды — по четыре водородные связи, рас-
положенные тетраэдрически (одна из них с атомом азота). По-
ловина протонов размещена неупорядоченно (это те протоны,
которые находятся в шестичленных кольцах), остальные — упо-
рядочены: ср. со структурой льда-I с полностью неупорядочен-
ным размещением протонов и со структурой льда-П с пол-
ностью упорядоченным размещением.
В (CH3LNF-4H2O ионы F~ и молекулы воды образуют кар-
кас водородных связей (рис. 15.9), в котором ионы F~ окруже-
ны четырьмя ближайшими молекулами воды с образованием
15.2. Гидраты 399
«сплющенного» тетраэдра (углы О—F—О равны 156 (два) и
92,5° (четыре)), а молекулы воды имеют по три приблизитель-
но компланарных «соседа» (О—О 2,73А; О—F 2,63А). Ка-
тионы занимают пустоты между парами ионов F~.
> j = 10,90 А
Рис. 15.9. Каркас, построенный из ионов F- и молекул воды, в структуре
<CH3LNF-4 H2O. Высота атомов над плоскостью чертежа указана в единицах
с/100 (с=8,10 А).
15.2.3. Гидраты оксосолей, гидроксидов и галогенидов. В боль-
шинстве случаев в обсуждение не включаются структуры гид-
ратированных комплексных соединений, так как принципы,
определяющие их строение, значительно сложнее, чем некомп-
лексных солей. Например, в структурах гидратированных комп-
лексных галогенидов Ат(ВХп)-рНгО, на которых мы кратко
становимся позднее, в некоторых случаях молекулы воды свя-
заны с атомом В (например, в (NH^CVFs-tbO)), а в других
случаях (как в K^MnFs) -H2O; разд. 10.1.4) они вместе с иона-
ми А расположены между группировками BXrt (в данном слу-
чае бесконечными октаэдрическими цепочками). В структуре
K^HgCU-FbO также имеются октаэдрические цепочки
(HgCU)n2n~, между которыми расположены ионы калия и мо-
лекулы воды.
Прежде чем провести обзор структур этих соединений, из-
ложим некоторые общие вопросы. Рассматриваемые гидраты
образуют чрезвычайно большую группу соединений, среди ко-
торых есть и гидраты с большим числом молекул воды, такие,
400
15. Вода и гидраты
как MgCl2-12H2O и FeBr2-9H2O, моногидраты и даже полугид-
раты, например Li2SO4-H2O и CaSO4-V2H2O. Более того, для
некоторых соединений известны ряды стехиометрических гид-
ратов. Многие простые галогениды образуют три, четыре или
пять различных гидратов; сульфат FeSO4 кристаллизуется с 1,
4, 5, 6 и 7 молекулами воды, a NaOH образует гидраты с 1, 2,
3,5, 4, 5 и 7 молекулами воды. Степень гидратации соедине-
ния зависит от природы как аниона, так и катиона. В ряду не-
которых солей щелочных металлов, содержащих большие анио-
ны, такие, как SO42~ или SnBr62~, соли лития и натрия гидрати-
рованы, в то время как соли крупных катионов (калия, руби-
дия и цезия) являются безводными. Аналогичная закономер-
ность наблюдается в ряду хлоридов щелочных металлов, в то
время как у фторидов — обратная. Данные, приведенные в
табл. 15.4, свидетельствуют о том, что сведения, касающиеся
Таблица 15.4. Гидраты некоторых солей щелочных металлов
Соль
MF
МС1
М2СО3
M2SO4
Число молекул кристаллогидратной воды
Li
1, 2, 3, 5
1
Na | К
2
1, 7, 10
1, 7, 10
2, 4
2, 6
Rb
172
1, Г/2
Cs
7з, Г/2
3V»
степени гидратации в рядах солей, с трудом поддаются обоб-
щению. ./*--
Как уже отмечалось, структуры полиморфных модификаций
льда и структурно подобных ему гидратов дают основание счи-
тать, что строение молекулы воды в них отвечает тетраэдриче-
скому распределению двух положительных и двух отрицатель-
ных областей заряда. Расположение ближайшего окружения
молекул воды во многих кристаллических гидратах согласуется
с таким тетраэдрическим строением молекулы воды. В гидра-
тированных оксосолях молекула воды обычно связана, с одной
стороны, с двумя атомами кислорода оксо-ионов, а с другой —
с двумя ионами М+ или одним ионом М2+ следующим образом:
0nR-0
CR-0
-л м+
м+
или
0nR-0
М:
2+
15.2. Гидраты 401
В ближайшее окружение молекулы воды могут входить другие
молекулы воды, ориентированные подходящим образом так,
чтобы противоположно заряженные области примыкали друг
к другу. Таким способом могут возникать большие группы мо-
лекул воды, удерживаемые вместе, как, например, в структуре
H3PWi2O40-29H2O, или могут присутствовать молекулы воды
сверх тех, которые непосредственно окружают ионы металла,
как в соединении NiSO4-7H2O, формулу которого можно запи-
сать в виде [Ni(H2ON]H2O-SO4. При обсуждении структур-
а-
или
Рис. 15.10. Окружение молекул воды в кристаллах. Большие заштрихованные
кружки — М+, ОН~, F~ или атомы кислорода кислородсодержащих ионов,
гидроксидов отмечалось, что при подходящем окружении
ОН-группы поляризуются до такой степени, что образуются
связи О—Н—О; аналогичный эффект наблюдается и в гидра-
тах. В гидратированных оксосолях и гидроксидах короткие
расстояния B,7^-2,9 А) между атомами кислорода молекул
воды и атомами кислорода оксо-ионов похожи на аналогичные
расстояния, найденные в структурах некоторых гидроксидов и
гидроксид-оксидов, что свидетельствует об образовании водо-
родных связей. В гидратах фторидов имеются довольно силь-
ные связи О—H---F; позднее будут приведены примеры структур
со связями О—Н—С1. Отдельно мы рассмотрим гидраты кислот
и кислых солей, в которых протоны связаны с некоторыми (или
всеми) молекулами воды с образованием катиона оксония Н3О+
или более сложных группировок.
Некоторые из многочисленных возможных типов окружения
молекулы воды в гидратах показаны на рис. 15.10. На первый
взгляд представляется логичным классифицировать гидраты в
соответствии со способом связывания молекул воды друг с дру-
гом. Если все молекулы воды в каком-либо гидрате имеют ок-
26-985
402 15. Вода и гидраты
ружение, принадлежащее к одному из типов, указанных на
рис. 15.10, с четырьмя, тремя, двумя, одной молекулой воды или
без молекул воды в окружении вообще, то для систем связан-
ных друг с другом молекул воды (аквакомплексов) возникают
следующие возможности: для а и б — всевозможные типы,
включая трехмерные каркасы: для в — кольца или цепочки;
для г — пары молекул воды; для д — отсутствие аквакомплек-
сов. Например, каждая молекула воды в гидрате Li2SO4-H2O
принадлежит к типу в; она связана водородными связями с
двумя другими молекулами, так что в кристалле можно разли-
чить цепочки, состоящие из молекул воды, в то время как в
гидрате KF-2H2O каждая молекула воды имеет окружение в
виде тетраэдра, образованного двумя ионами калия и двумя
ионами фтора (рис. 15.10, д), т. е. аквакомплекс отсутствует.
Однако любая подобная классификация часто оказывается бес-
полезной, так как во многих гидратах не все молекулы воды
имеют один и тот же тип окружения. Различия в окружении
могут быть большими в том случае, если некоторые молекулы
НгО связаны с атомами металлов, а другие расположены меж-
ду комплексами, как, например, в [СоСЫНгО^^НгО, или
если имеются различия в окружении разных молекул воды,
входящих в один и тот же комплекс М(Н2О)л. Так, например,
в соединении NiSO4-7H2O седьмая молекула воды не связана
с ионом металла, а шесть других молекул воды группировки
№(Н2О)б2+ характеризуются различным окружением — не ме-
нее чем четырех типов. Часть молекул воды имеет окружение,
образованное из трех приблизительно компланарных «соседей»
(ион №2+ и два атома кислорода ионов SC>42~ или двух молекул
воды), а другие молекулы воды имеют тетраэдрическое окру-
жение (№2+, 20 и Н2О или Ni2+, О и 2Н2О). Сложность струк-
тур гидратов во многом объясняется такой неэквивалентностью
молекул воды, а она в свою очередь связана с тем, что с тет-
раэдрическим распределением заряда в молекуле воды совме-
стимо очень большое число типов ближайшего окружения Н2О
(рис. 15.10). Возможно, нет необходимости напоминать что в
большинстве кристаллических структур встречаются элементы
«компромисса» и молекула воды не всегда имеет один из типов
•окружения, указанных на рис. 15.10. Например, в соединении
Na2(H2SiO4)-7H2O [Acta cryst., 1976, В32, 705] некоторые из
молекул воды имеют необычное окружение в виде тригональ-
ной бипирамиды из пяти ближайших соседей: 3Na и 2Н2О или
ЗН2О, О и ОН.
Очевидно, что для детального описания связей в гидратах
требуется знание позиций атомов водорода. Ранее при рентге-
ноструктурных исследованиях не существовало методов лока-
лизации этих атомов, поэтому можно было только предпола-
15.2. Гидраты 403
гать, что они играют важную роль в возникновении некоторых
необычно коротких расстояний О—О или О—X в кристаллах.
Более поздние исследования, в особенности методами нейтроно-
графии и ЯМР, подтвердили это предположение и позволили
точно локализовать атомы водорода. Сейчас появилась возмож-
ность обсуждения не только общих моделей структур соедине-
ний, т. е. пространственного распределения наиболее тяжелых
атомов, но и двух аспектов более тонкой структуры, а имен-
но — позиций атомов водорода в водородных связях и упоря-
дочения протонов (далее приведена литература по этим темам).
Поскольку в обсуждаемых гидратах молекулы воды имеют
тенденцию к ассоциации с катионами, в любой классификации
целесообразно указывать природу координационной группы
вокруг катионов. В гидратах оксосолей или галогенидов коор-
динационная группа катиона может быть построена из атомов
кислорода оксо-ионов, галогенид-ионов или атомов кислорода
молекул воды (атомы водорода в которых должны быть на-
правлены в противоположную сторону от металла). Если обо-
значить через п КЧ атома М в соединении МЖХУ-2Н2О, (где
Х = С1~, SO42~, O22~, ОН- и т. д.), то удобно располагать гид-
раты в соответствии с величиной отношения z/xn (табл. 15.5).
Очевидно, что можно ожидать образования очень простых
структур у соединений с z/xn—X (z = xn), так как в этом слу-
чае количество молекул воды как раз такое, которое необхо-
димо для образования полной координационной группировки
М(НгО)п вокруг каждого иона металла. Однако на самом де-
ле ситуация может быть более сложной: ведь если молекулы
воды являются общими для двух координационных группиро-
вок М(Н2О)„, то полная гидратация металла будет достигаться
и при меньших значениях z/xn, например для октаэдрической
координации металла (я = 6).
zfxn
Состав и характеристика координационной
группировки M(HjO)
Примеры
1 Дискретные группировки М(Н2О) 6 MgCl2-6H2O
2/3 М(Н2ОN, имеющие два общих ребра KF-4H2O
1/2 М(Н2О)е, имеющие две общие грани LiC104-3 Н2О
Таким образом, не существует простой зависимости между ве-
личиной z/xn и составом координационной группы вокруг атома
металла, что хорошо демонстрируют данные табл. 15.5.
26*
Таблица 15.5. Классификация гидратов солей
Группа
А
Б
zjxn
2
Уе
7в
7е
1
3А
7з
7.2
'Л
I (избыток Н2О)
М полностью
MgCl2-12H2O [11
FeBr2-9H2O
См. текст
NiSO4-7H2O [21
NaOH-7H2O [31
Na2SO4-10H2O [191
и
гидратирован
Sm(BrO3K-9H2O [41
Nd(BrO3K-9H2O[5]
CaO2-8H2O [61
Sr(OHJ-8H",O [71
Zn(BrO3J-6H2O [81
CoL-6H2O [91
M?jCI2-6H2C> [101
Л1С1,-6Н2О [11|
CrCl,-6H2O [121
Mg(C104J-6H20ri3]
BeSO4-4H2O [14]
Na2CO3-10H2O [20]
SrCl2-6H2O [211
4F-4H2O [22]
Na2HAsO4-7II2O |23|
|
NaOH-Зт/ H2O [24]
LiC104-3H20[25]
III (избыток Н2О)
IV
M не полностью гидратирован
СоС12-6Н2О [15]
NiCl2-6H2O 1161
FeCl3-6H2O [17]
СгС13-6Н2О [18]
CuSO4-5H2O [26]
SnCl2-2H2O [27]
FeF3-3H2O [28j
CaCO3-6H2O [29]
GdCl3-6H2O [30]
FeF2-4H2O [311
FeCl2-4H,O [32]
MnCl2-4H2O[33]
CuSO4-3H2O[34|
Ve
7e
CdSCV-3- H2O [35]
KF-2H2O [36]
NaBr-2H2O [37]
CoCl2-2H2O [38]
NiCl2-2H2O [39]
BaCl2-2H2O [40]
CaCI2-2H2O [41]
SrCl2-2H2O [42]
CaS04-2H2O [13]
LiOH-H2O [-141
CnSO4-H,.O [45]
Li2SO4-H2O [40]
Sr(OHJ-H2O [471
SrBr2-H2O [48]
Na2CO3-H2O [49]
Г1] Acta cryst., 1966, 20, 875. [2] Acta cryst , 1964, 17, 1167, 1361;
[4] Acta cryst., 1969, A25, 621. [51 J. Am. Chera. Soc, 1939, 61, 1544.
Z. Kristallogr., 1936,95, 426. [9] Ж. структ. хим., 1963, 4, 63. [10]
Z. Kristallogr.. 1934, 87, 446. [13] Z. Kristallogr., 1935, 91, 480. [141
1574. [16] J. Chem. Phys., 1969, 50, 4690. [17] J. Chem. Phys., 1967,
[20] Acta cryst., 1969, B25, 2656. [21] Acta cryst., 1977, B33, 2938.
1584. [24] Bull. Soc. franc, mineral, cristallogr. Chim. (Switz.), 1958,
A 1962, 266, 95. [27] J. Chem. Soc, 1961, 3954. [28] Acta cryst., 1964,
[31] Acta cryst., 1960, 13, 953. [32] Acta cryst., 1971, B27, 2329. [33]
1968, B24, 508. [35] Phys. R. Soc, 1936, 156, 462. [36] Acta cryst.,
1176. [39] Acta cryst., 1967, 23, 630. [40] Acta cryst., 1978, B34, 2290.
Matem.-fys. Med., 1943, 20, Nr. 5. [43] Acta cryst., 1974, B30, 921.
722. [46] J.Chem. Phys., 1968, 48, 5561. [47] Acta cryst., 1967, 22,
NaOH-4H2O: J. Chem. Phys., 1964, 41, 924.
Acta cryst., 1969, B25, 1784. [3] Сотр. rend. (Paris), 1953, 236, 1579.
[6] Acta cryst., 1951, 4, 67. [7] Acta cryst., 1953, 6, 604. [8]
Z. Kristallogr., 1934, 87, 345. [11) Acta cryst., 1968, B24, 954. [12]
Acta cryst., 1969, B25, 304, 310. [15] J. Phys. Soc. (Japan), 1961, 16,
47, 990. [18] Acta cryst., 1966, 21, 280. [19] Acta cryst., 1978, B34, 3502.
[22] J. Chem. Phys., 1964, 41, 917. [23] Acta cryst., 1970, B26, 1574,
81, 287. [25] Acta cryst., 1977, B33, 3954. [26] Phys. Roy. Soc,
17, 1480. [29] Inorg. Chem., 1970, 9, 480. [30] Acta cryst., 1961, 14, 234.
Inorg. Chem., 1964, 3, 529; Inorg. Chem., 1965, 4, 1840. [34] Acta cryst.,
1951, 4, 181. [37J Acta cryst., 1979, B35, 1679. [38] Acta cryst., 1963, 16,
[41] Acta cryst., 1977, B33, 1608. [42] Konig. Danske Vidensk. Sel.
[44] Acta cryst., 1971, B27, 1682. [45] Сотр. rend. (Paris), 1966, B262,
252. [48] J. Phys. Chem., 1964, 68, 3259. [49] Acta cryst., 1975, B31, 890.
406 15. Вода и гидраты
Для удобства описания соединения, приведенные в этой таб-
лице, удобно разделить на три группы *.
A. (z/xn)^l. В таких гидратах имеется достаточное (либо
более чем достаточное) количество молекул воды, необходимое
для полной гидратации катионов без наличия общих молекул
воды у координационных групп М(НгО)„. Пока неизвестны ис-
ключения из следующего правила: если z/xn>\ (группа AI), то
ион металла полностью гидратирован, а избыток молекул во-
ды размещен либо между комплексами М(Н2О)П, либо ассо-
циирован анионами**. Обнаружен ряд очень простых структур
с z/xn=l (группа АН), но наиболее интересны структуры
группы AIII, которая в настоящее время представлена только
двумя структурными типами галогенидов ЗЙ-металлов. Хотя в
этих структурах z/xn=\, некоторые из координационных пози-
ций в окружении атома металла заняты вместо воды атомами
хлора. Соединений группы AIV просто не существует, так как
все возможности уже исчерпаны, и при z/xn^ 1 катион либо
полностью гидратирован, либо имеется избыток кристаллиза-
ционной воды.
Б. l>(z/xn)>'ll2. Такие гидраты содержат достаточное чис-
ло молекул воды для полной гидратации металла, если пред-
положить, что молекулы воды могут быть связаны с двумя (и
только с двумя) координационными группировками М(НгО)„.
В этой группе известны структуры всех четырех типов (I—IV),
причем наиболее интересны структуры типов I и особенно III,
где, как и в структурах AIII, с ионами металла должны быть
связаны все молекулы воды, а вместо этого только часть мо-
лекул воды гидратирует катионы.
B. (z/xn)<Cll2- В этих гидратах количество молекул воды
недостаточно для полной гидратации ионов металла, даже если
допустить связывание молекул воды двумя координационными
группами М(Н2О)п- За исключением одного соединения, все
примеры, приведенные в табл. 15.5, представляют собой моно-
и дигидраты и принадлежат к типу IV (как и следовало ожи-
дать). В соответствии с характером распределения заряда ма-
ловероятно, чтобы молекула воды имела больше чем два бли-
* В табл. 15.5 все соединения разделены на три группы А, Б и В, в кото-
рых различаются еще четыре типа (I, II, III и IV). К группе А отнесены соеди-
нения с 2/jm»1, к группе Б —с l>z/xn>1!2, к группе В —с xl2>z/xn. Типы I
и II объединяют те соединения, в которых катионы М координированы только
молекулами воды, типы III и IV — соединения со смешанной координацией
катионов. В соединениях типа I и III помимо этого присутствуют молекулы
воды, непосредственно не связанные с катионами, в соединениях типа II и IV
таких молекул воды нет. — Прим. ред.
** То есть, иначе говоря, при г/хп>\ не существует соединений, относя-
щихся к типу III.
15.2. Гидраты 407
жайших катиона, т. е. гидратов, принадлежащих к группам
BI и ВП, не существует.
Как уже отмечалось, во многих гидратах молекулы воды
неэквивалентны и часто имеют довольно различное окружение.
Обнаружено также, что во многих гидратах есть два или более
вида неэквивалентных катионов. Подобный факт в структурной
химии гидратов встречается не очень часто, например в
Na4P2O7-10H2O [Acta cryst., 1957, 10, 428] половина ионов нат-
рия имеет окружение, образованное шестью молекулами воды,
а остальные — окружение из четырех молекул воды и атомов
кислорода анионов. В табл. 15.5 включены только те гидраты, в
которых все катионы имеют одинаковое окружение, что отно-
сится к большинству гидратов (такое ограничение будет приня-
то при последующем обсуждении). После обзора, основанного
на данных табл. 15.5, последуют короткие разделы, посвящен-
ные гидратам сложных галогенидов, хлориду кальция, оксосо-
лям кальция и сульфату ванадила.
15.2.4. Гидраты группы A:
Тип AI. По-видимому, к этому типу принадлежит очень не-
большая группа соединений, для некоторых из них расшифро-
ваны кристаллические структуры.
MgCl2-12H2O. Интерес к этому соединению обусловлен тем,
что это простая гидратированная соль с известной структурой,
содержащая большое число молекул воды. Соединение устой-
чиво только при низких температурах:
MgCl2-12H2O
—16,4 СС
8Н2О
-3,4 °С
6Н3О
116,7 °С
4Н2О
181 °С
2Н,0
(Известны гидраты MgBr2 и Mgl2, содержащие в случае бро-
мида 6 и 10, а в случае иодида 8 и 10 молекул воды.) Структу-
ра MgCl2-12H2O построена из неискаженных октаэдров
Mg(H2ON и очень искаженных октаэдров С1(Н2ОN
(С1—О 3,11-^-3,26 А, длины ребер октаэдров лежат в интервале
3,86-^5,55 А). Каждая октаэдрическая группировка имеет об-
щие вершины: Mg(H2ON с четырьмя С1(Н2О)б, а С1(Н2ОN с
двумя С1(Н2О)б и двумя Mg(H2ON (рис. 15.11). Слои состава
MgCl2(H2O)]2 удерживаются вместе посредством связей
О—Н—О между молекулами воды. Каждая молекула воды,
связанная с ионом Mg2+, имеет два других ближайших соседа
(Н2О или С1-), а остальные, т. е. половина общего числа моле-
кул воды, имеют тетраэдрическое окружение BС1~+2Н2О или
1С1~+ЗН2О). Эта структура прекрасно иллюстрирует поведе-
ние молекулы воды в гидратах такого типа.
408 /5. Вода и гидраты
zjxn = 8/6. В эту группу можно вклю-
чить две соли, содержащие гексанитрат-
ионы, Mg[Th(NO3N]-8H2O [Acta cryst.,
1964, 18, 698] и Mg3[Ce(N03N]>-24H2O
[J. Chem. Phys., 1963, 39, 2881]; в обоих
соединениях ион Mg2+ полностью гидра-
тирован, а четвертая часть молекул во-
ды не связана с катионами.
NiSO4-7H2O. Как уже отмечалось,
в этом гидрате существует пять различ-
ных сортов молекул воды, отличающих-
3 ся окружением в кристалле. Однако при
химическом подходе существенно лишь
различие между молекулами воды, об-
разующими октаэдрические группиров-
ки вокруг ионов Ni2+ (шесть молекул
Н2О), и седьмой молекулой воды, окру-
Рис 15.11. Слой, образо- жение которой образовано тремя моле-
ванный из соединенных кулами ВОДЫ групп Ni(H2ON И ОДНИМ
?MPU(HHon2+ ГРУ"и атомом кислорода сульфат-иона.
[СЦН2О)в]-, в структуре Тип Ап- в этом простейшем из ти-
"" " ~ Квадра- пов гидратов солей все молекулы воды
связаны с катионами. Количество ато-
мов кислорода, которое может быть
размещено вокруг иона металла, опре-
деляется отношением радиусов гм : г0,
и так как связи М—О, в сущности, явля-
ются электростатическими по своей при-
роде, ионы металла имеют координационные полиэдры, кото-
рые характерны для ионных кристаллов.
MgCl2-12H2O.
ты — катионы
[Mg(H2ON]2+, ромбы —
анионы [С1(Н2ОN"|~. Две
концевые вершины у каж-
дого октаэдра не пока-
заны.
Форма комплекса
M(HjO).
Примеры
Тетраэдр BeSO4-4H2O
Октаэдр MgCl2-6H2O, CoI2-6H20, А1С13-6Н2О, СгСЬ-6Н2О
Mg(C104J-6H20 и т. д.
Квадратная анти- СаО2-8 Н2О, Sr(OHJ-8 Н2О
призма
Трехшапочная три- Nd(BrO3K-9 H2O, Sm(BrO3K-9 H2O
тональная приз-
ма
Окружение молекул воды, например, в BeSO4-4H2O согласует-
ся с проведенным ранее описанием молекулы воды; оно соот-
ветствует рис. 15.10, д (структура 2).
15.2. Гидраты 409
2,62 А ,.
...oso.
...-С1
ч.
2,68 А"--.
¦oso3 3'03A '~-а
Если бы единственным фактором, определяющим структуру
соединения Mg(H2ONCl2, было отношение размеров ионов
Mg(H2ON2+ и С1~, то этот гидрат мог бы иметь структуру
флюорита, т. е. каждая молекула воды была бы связана с че-
тырьмя нонами С1~. И в самом деле, соответствующий аммиа-
кат Mg(NH3NCl2 имеет именно эту структуру, но гексагидрат
хлорида магния имеет менее симметричную (моноклинную)
структуру, в которой каждая молекула воды связана только
с двумя ионами С1~. Аналогичным образом аммиакат
Al(NH3)eCl3 имеет структуру YF3, в то время как А1(Н2ОNС13
имеет гораздо более сложную ромбоэдрическую структуру, в
которой каждая молекула воды связана только с двумя ионами
С1~, так что ее окружение очень похоже на окружение в
BeSO4-4H2O.
Тип AIII. Обе структуры из этого типа — структуры гекса-
гидратов галогенидов Зс?-металлов; и та, и другая являют собой
разительный контраст с двумя структурами АН. Они содержат
октаэдрические координационные группировки М(Н2ОLС12 с
транс-конфигурацией. (NiCl2-6H2O изоструктурен соединению
кобальта.)
MgCl2-6H2O А1С13-6Н2О СоС!2-6Н2О FeCl3-6H2O
Координа- 6 Н2О 6 Н2О 4 Н2О, 2 С1 4 Н2О, 2 С1
ционная
группа ато-
ма металла
Структур- [Mg(H2ON]Cl2 [А1(Н2ОN1С13 [СоС12(Н2ОL"|- [FcC12(H2OL1C1-
ная формула -2Н2О -2Н2О
В отличие от гидрата СоСЬ-бНгО иодид имеет формулу
Со(Н2О)бЬ (тип АН). У трихлоридов устойчивости двух воз-
можных типов строения гидратов, по-видимому, различаются
не очень сильно, так как гексагидрат СгС13 образует структуры
обоих типов. В соответствии с данными химического анализа
(например, учитывая общее количество хлора, осажденного
AgNO3) ранее полагали, что гидраты хлоридов хрома имеют
следующие структуры:
[Сг(Н2О),;1 С13 голубая окраска
[СгС1(Н2ОM]С12-Н2О
[СгС!2(Н2ОL]С1-2Н2О
зеленая окраска
410 15. Вода и гидраты
Рентгеноструктурное исследование подтвердило правильность
первой и третьей моделей структуры. Ср. строение этих гидра-
тов со структурой соединения GdCl3-6H2O, тип BIV (см. ни-
же).
15.2.5. Гидраты группы Б: l>z/xn>-]/2-
Тип Б1.
Na2SO4-10Н2О. В двух хорошо известных декагидратах
Na2SO4 и Ыа2СОз отношение Н2О:М = 5:1 достигается различ-
ными способами, причем в обоих гидратах ион Na+ полностью
гидратирован. В структуре сульфата имеются бесконечные це-
почки, построенные из октаэдрических группировок Na(H2ON,
сочлененных по общим ребрам, так что остальные молекулы
воды размещены между цепочками: [Na(H2OL]2SO4-2H2O.
Оказывается, что сочленение октаэдрических группировок
М(Н2О)б через общие вершины встречается крайне редко, ве-
роятно, из-за того, что угол М—О—М при этом не мог бы
быть меньше 130° (разд. 5.1.1). Например, цепочка с общими вер-
шинами [М(Н2ОM]п, по-видимому, до сих пор не была обна-
ружена, хотя в соединении FeSO3-2V2H2O [1] одна молекула
воды и является общей для пары октаэдрических координаци-
онных группировок [Ре(Н2О)зО3]; о топологии этой структуры
см. в разд. 3.9.4.
Тип БП. Это очень интересная группа гидратов, в которых
катионы полностью гидратированы, а различное соотношение
Н2О: М создается за счет различного числа мостиковых моле-
кул воды в каждой координационной группе, что иллюстриру-
ют следующие примеры, в которых катионы имеют октаэдри-
ческую координацию:
Число мостико-
вых молекул
Н2О в каждой
координацион-
ной группе
М(НгО)я
Отношение
Н2О : М в гидрате
Примеры
О
4
5
6
5
4
4
Na2CO3-10H2O
KF-4H2O
1
Na2HAsO4-7H2O, \aOH-3—
LiC104-3H20
Na2CO3-ЮН2О. В этой структуре группировки Na(H2O)e
ассоциированы в пары с образованием фрагментов Ыа2(Н2О)ю,
которые в целом имеют тот же тип, что и димеры в некоторых
пентагалогенидах (ср. со структурой Na2SO4- 10H2O, описанной
выше).
15.2. Гидраты 411
Рис. 15.12. Цепочки состава
Na2(H2OO в структуре
Na2HAsO4-7H2O.
KF-4H2O. Координационные груп-
пировки K(H2O)S сочленены друг с
другом двумя ребрами и отношение
Н2О: М = 4: 1.
Na2HAsO4-7H2O. Структура этого
гидрата содержит уникальную цепоч-
ку состава Na2(H2OO (рис. 15.12),
образованную из сочлененных по гра-
ням пар октаэдров Na(H2ON, даль-
нейшее сочленение осуществляется
концевыми ребрами. В поперечном
направлении цепочки соединены через
равные интервалы связями О—Н—О;
ионы AsO3(OHJ~ размещены между (J
цепочками. Такое же отношение
НгО: М имеется в соединении NaOH-
•З'/гЬЬО, у которого, как и з арсена-
те, катионы полностью гидратиро-
ваны.
LiC104-3H20. В этом гидрате
z/xn=ll2, поскольку образуются беско-
конечные цепочки, построенные из октаэдров Ы(Н2О)б, сочле-
ненных по противоположным граням (рис. 15.13). Ближайшее
окружение молекулы воды (не считая молекул воды из той
же цепочки, так как очевидно, что взаимодействия с ними не
являются взаимодействиями между противоположно заряжен-
ными областями молекул) образуют два иона лития и два
атома кислорода различных ионов СЮ4~. Связи Li—H2O—Li
и О—Н2О—О лежат в перпендикулярных плоскостях, так что
ближайшее окружение молекулы воды соответствует по форме
тетраэдру. Структура LiClC>4-3H2O имеет близкое родство со
структурами большой группы изоструктурных гексагидратов
M(BF4h-6H2O и M(C1O4J-6H2O, где M=Mg, Mn, Fe, Co, Ni, Zn.
В LiC104-3H20 бесконечная цепочка из молекул воды (рис. 15.13)
содержит ионы лития, находящиеся в центре каждого октаэдра.
При удалении этих ионов и замене их в каждом втором октаэд-
ре ионами Mg2+ кристалл будет уже иметь состав Mg(C104J-
•6Н2О, и в нем появятся дискретные группировки Mg(H2ON2+-
{тип АН). Вместо двух ионов лития каждая молекула воды
связана в этом случае только с одним ионом магния.
-О
О
Н'
Mg2+-o'
ср. с
102° X) 130°
О
412 15. Вода и гидраты
Рис. 15.13. Проекция структуры ЫС1О4-ЗН2О. Жирные и штриховые линии-
связи О—Н—О между молекулами воды и атомами кислорода ионов СЮ4-,
которые находятся приблизительно в одной плоскости. Таким образом, эти
связи соединяют вместе колонки, построенные из октаэдров Li(H2ON, сочле-
ненных по противоположным граням, и ионы СЮ4-. Черные кружочки'—ионы
Li+, размещенные в плоскостях, находящихся посередине между следующими
друг за другом группировками из трех молекул воды.
SrCl2-6H2O. Структура этого гидрата содержит колонки,
построенные из трехшапочных тригональных призм, сочленен-
ных друг с другом парами противоположных граней (рис.
15.14). Такую структуру имеют гексагидраты следующих гало-
генидов:
СаС12
СаВг2
Са12
SrC!,
SrBr2
Sri,
Bal2
Тип БШ. Хотя в соединениях этого типа имеется достаточ-
ное число молекул воды, для того, чтобы полностью гидрати-
ровать ионы металла, в их структурах не только наблюдается
неполная гидратация катионов, но имеются и молекулы воды,
не связанные с катионами.
CuSO4-5H2O. В этом гидрате металл имеет координацион-
ное число 6, и хотя на каждый катион приходится только пять
молекул воды, пятая молекула с ним не связана. Координаци-
онный полиэдр иона меди состоит из четырех молекул воды и
двух атомов кислорода сульфат-ионов, а пятая молекула воды
связана с двумя молекулами воды, входящими в окружение
катионов, и с двумя атомами кислорода сульфат-ионов (рис.
15.2. Гидраты 413
Рис. 15.14. Фрагмент бесконечного од-
номерного образования катион — во-
да в кристаллической структуре SrCl2-
•6Н2О. Каждый ион Sr2+ (маленький
кружок) окружен девятью молекула-
ми воды.
Рис. 15.15. Окружение пятой молеку-
лы воды (в центре) в кристалличе-
ской структуре CuSO4-5H2O. Коор-
динационный октаэдр вокруг атома
меди состоит из четырех молекул во-
ды и двух атомов кислорода суль-
фат-ионов (заштрихованные кружки).
15.15). Эту структуру можно также представить в виде цепо-
чек, состоящих из ионов SO42~ и октаэдров ЛЦНгО^Ог, и пятой
молекулы воды, расположенной между цепочками. Гидрату
\ /
-м-
CuSO4-5H2O изоструктурны гидраты хромата и сульфата маг-
ния [2], причем для сульфата магния известно восемь гидра-
тов с 1, 5/4, 2, 3, 4, 5, 6 и 7 молекулами воды, но только гидра-
ты с 1, 6 и 7 молекулами воды можно получить из растворов.
Соль MgSO4-5H2O интересна в качестве одного из немногочис-
ленных примеров изоструктурности солей магния и меди; в
качестве другого примера можно привести пару солей.
M(NH4J(SO4J-6H2O(M = Mg, Си).
Sn
2,16 К/ I \
Н2О С1
2,59 А
С1
SnCl2-2H2O. Этот гидрат интересен как представитель
структурной химии двухвалентного олова. Дискретные пирами-
414 15. Вода и гидраты
дальные комплексы SnCl2(H2O), в которых угол между связя-
ми в среднем равен 83°, расположены в двойных слоях, кото-
рые чередуются со слоями, состоящими из молекул воды.
FeF3-3H2O. В этом гидрате не реализуются другие простей-
шие структурные возможности, такие, как конечные группи-
ровки FeF3(H2OK. Структура одной из его модификаций пост-
роена из бесконечных цепочек состава FeF3(H2OJ (рис.
15.16, е), между которыми расположены остальные молекулы
воды. В цепочке два иона фтора и две молекулы воды стати-
6 6
аде
FeCl24H20 МпС12-4Н2О
СоС12- 6Н20 (устойчивая v
FeCl3 • 6Н20 модификация)
KMnQ3-2H20
V (Н20J]ш
д
СоС12-2Н2О
п-
Ж
RbMnCl3-2H2Ow
О F.CI
© Н20
е f, нго
Рис. 15.16. Координационные группировки З^-ионов в некоторых гидратах га-
логенидов и сложных галогенидов (см. текст).
стически размещены по четырем экваториальным позициям
каждого октаэдра. В структуре RbMnCl3-2H2O содержится по-
хожая цепочка, в которой, однако, два иона хлора и две моле-
кулы воды расположены по тем же позициям упорядоченно
(рис. 15.16, ж).
Тип EIV.
СаСО3-6НгО. Помимо хорошо известных безводных модифи-
каций СаСО3 существуют кристаллогидраты с 1 и 6 молекула-
ми воды. В структуре гексагидрата изолированные ионные
пары Са+СО3~ окружены оболочкой из 18 молекул воды.
Шесть из них дополняют координационный восьмивершинник
вокруг иона кальция, а остальные связаны с другими катиона-
ми. (Каждая молекула воды связана только с одним ионом
кальция.) Этот тип кристаллогидрата, в котором ионные пары
\1
2-
15.2. Гидраты 415
(похожие на классическое изображение «молекулы» СаСО3)
внедрены в массу молекул Н2О, может быть сопоставлен с гид-
ратом MgCb-12H2O, в структуре которого изолированные ионы
магния и хлора полностью окружены молекулами воды (неко-
торые из них являются общими для соседних координационных,
групп) и с клатратами, описанными ранее.
ОёСЬ-бНгО. В этой структуре катионы также имеют коор-
динационное число 8 F молекул воды и два иона С1~) в отли-
чие от соединений [А1(Н2ОN]С13 и [Fe(H2OLCl2]Cl-2H2O.
Такой же тип структуры у гексагидратов трихлоридов и три-
бромидов 4/-металлов, имеющих наименьшие радиусы, а также
в АтСЬ-бНгО и ВкС13-6Нг0 [5]. Более крупные катионы М3^
лантана, церия и празеодима образуют гептагидраты трихло-
ридов МС13'7Н2О, структуры которых еще неизвестны.
FeF2-4H2O и FeCl2-4H2O. В обоих этих гидратах присутст-
вуют дискретные октаэдрические молекулы FeX2(H2OL.
В" структуре фторида не удалось различить ионы фтора и
молекулы воды; хлорид имеет транс-строение. Хотя содержа-
ние воды в этих гидратах достаточное для образования беско-
нечной цепочки из октаэдрических группировок Fe(H2ON, свя-
занных противоположными ребрами, структура построена из
конечных группировок, содержащих два иона хлора, которые
связаны с катионом.
MnCl2-4FI2O. Уже давно были известны две полиморфные
модификации этого гидрата (обе моноклинные), одна из кото-
рых метастабильна при комнатной температуре. Эта модифи-
кация имеет такую же структуру, как и FeCl2-4H2O, т. е. состо-
ит из молекул МпС12(Н2ОL гранс-строения (рис. 15.16, а);
несколько неожиданно выяснилось, что устойчивая модифика-
ция построена из молекул такого же состава, но имеет не
транс-, а цис-строение (рис. 15.16, б).
CuSO4-3H2O. Сульфат меди образует гидраты с 1, 3 и 5 мо-
лекулами воды. В отличие от пентагидрата, в котором только
четыре молекулы воды связаны с катионом, в тригидрате все
молекулы воды координированы ионом Си2+. Координацион-
ный полиэдр иона металла образован 3 молекулами воды,
одним атомом кислорода (среднее расстояние Си—О 1,94 А) и
двумя более удаленными атомами кислорода SO42~-hohob (на
расстоянии 2,42А), дополняющими группировку до искаженно-
го октаэдра.
Литература. [1] Acta cryst., 1980, В36, 1184. [2] Acta cryst., 1972, B28, 1448.
[3] Acta Chem. Scand., 1968, 22, 647. [4] Acta Chem. Scand., 1967, 21, 889; Act»
Chem. Scand., 1968, 22, 641. [5] Inorg. Chem., 1971, 10, 147.
416 15. Вода и гидраты
15.2. Гидраты 417
15.2.6. Гидраты группы В: z/xn<l/2.
Тип Bill.
CdSO4-8/3H2O. Вследствие необычного отношения Н2О : М
этот единственный пример гидрата типа Bill характеризуется
довольно сложной структурой. В структуре имеется два сорта
ионов кадмия с несколько разным окружением, но в обоих слу-
чаях координационным полиэдром является октаэдр, построен-
ный из двух молекул воды и четырех атомов кислорода SO4-
групп. В структуре содержится четыре сорта кристаллографи-
чески неэквивалентных молекул воды, причем 3/4 молекул воды
связаны с катионом. Остальные молекулы воды не имеют свя-
зей с ионами металла; в их окружении находятся две другие
молекулы воды и два атома кислорода сульфат-ионов. Важ-
ным представляется то обстоятельство, что структура обеспе-
чивает окружение каждой молекулы воды тремя или четырьмя
соседями, которыми могут быть следующие частицы:
:н2о:
Cd
2+ :
или La
:н2о:
н2о+
н2о+
;н2о+
о"
о"
На сегодняшнем уровне наших знаний трудно вообще понять,
почему образуется гидрат с такой необычной формулой, как
CdSO4-8/3H2O; по-видимому, в его структуре и, следовательно,
в химической формуле удовлетворены «потребности» и ионов
кадмия, и SO42~, и молекул воды.
Тип BIV. Приведем примеры моно- и дигидратов. Сначала
опишем структуру некоторых дигидратов галогенидов.
Рис. 15.17. Проекция кристаллической структуры KF-2H2O. Выделенные жир-
ными линиями кружки — атомы, лежащие в плоскости чертежа, а остальные
кружки — атомы, лежащие в плоскостях, находящихся на 2 А выше и ниже
плоскости чертежа. Заштрихованные кружки — молекулы воды.
KF-2H2O. В этом гидрате каждый ион калия (фтора) окру-
жен четырьмя молекулами воды и двумя ионами фтора (ка-
лия), расположенными в вершинах слегка искаженного окта-
эдра. Каждая молекула воды имеет ближайшее окружение в
виде тетраэдра, состоящего из двух ионов калия и двух ионов
фтора (рис. 15.17).
NaBr-2H2O. Этот кристалл, а также изоструктурные ему
NaCN-2H2O и NaCl-2H2O [1] построены из сходных коорди-
национных полиэдров (т. е. 4«c-NaX2(H2OL). Данная (слои-
стая) структура связана со структурой МпС12-4Н2О следую-
н,о
Рис. 15.18. Слой в структуре NaBr-2H2O.
щим образом. Если из цмс-октаэдров МХ2 (Н2ОL построить
слой МХ3 типа А1С13 (А1(ОНK), то его состав выразится фор-
мулой МХ-2Н2О. Такой слой и имеется в структуре NaBr-
•2Н2О (рис. 15.18). При удалении половины катионов (тех,
которые обозначены на рис. 15.18 небольшими светлыми кру-
жочками) образуется слой состава МХ2-4Н2О, состоящий из
изолированных молекул МХ2(Н2ОL. Именно такую
структуру имеет устойчивая модификация МпС12-4Н2О, кото-
рая уже рассматривалась. Связь между этими гидратами мож-
но сравнить со связью между структурами соединений LiC104-
•ЗН2О и Mg(C104J-6H20, о которых упоминалось выше.
СоС12-2Н2О. Структуры дигидратов некоторых дигалогени-
дов Sd-металлов построены из сочлененных ребрами октаэдри-
ческих цепочек МХ4 (рис. 15.16,5); такую структуру имеют дих-
лориды и дибромиды марганца, железа, кобальта и никеля.
В структуре гидрата NiCl2-2H2O, который не изоструктурен
соединению кобальта, наблюдается интересное искажение це-
почки (рис. 15.19). Плоскости следующих друг за другом эква-
ториальных группировок NiCl4 наклонены относительно одна
другой под небольшим углом, так что расстояния между моле-
27—985
418 15. Вода и гидраты.
кулами воды, следующими друг за другом с каждой стороны
цепочки, равны поочередно 2,92 и 3,96 А.
Совершенно другой тип искажения октаэдров наблюдается
в структуре СиС12-2Н2О, где ближайшее окружение иона меди
образуют две молекулы воды (на расстоянии 1,93 А), два иона
хлора B.28А) и два иона хлора B,91 А). Из-за очень больших
различий между длинами связей Си—С1 структуру предпочти-
тельнее описывать как построенную из транс-молекул
СиС12(Н2ОJ. Нейтронографическое исследование показало,
что в целом эта молекула, включая и атомы водорода, плоская
ст
Cl
Си-
V
Ib4=
С1
Рис. 15.19. Искаженная октаэдриче- Рис. 15.20. Строение группировки
екая цепочка в структуре NiCI2-2H2O. CuCl2(H2OJ.
и что атомы водорода лежат вблизи линий, соединяющих ато-
мы кислорода молекул воды с двумя ближайшими ионами хло-
ра (рис. 15.20).
SrCl2-2H2O и ВаС12-2Н2О имеют очень близкие слоистые
структуры (рис. 15.21): в обеих структурах координационные
полиэдры ионов металла состоят из четырех ионов хлора и
четырех молекул воды.
СаС12-2Н2О также имеет слоистую структуру, а координа-
ционный октаэдр иона кальция, имеющего меньший размер,
чем ион стронция, построен из четырех ионов хлора и двух
молекул воды; слои представляют собой складчатую модифи-
кацию слоев типа SnF4 (K2NiF4) с обобщенными экваториаль-
ными вершинами октаэдров. Ионы хлора расположены в этих
экваториальных вершинах октаэдрических координационных
групп (разд. 5.3.3).
В качестве примера дигидрата оксосоли рассмотрим струк-
туру CaSO4-2H2O.
CaSO4-2H2O. Этот гидрат (минерал гипс) имеет довольно
сложную слоистую структуру (рис. 15.22). Слои связаны друг
с другом посредством водородных связей между молекулами
15.2. Гидраты 419
воды и атомами кислорода сульфат-ионов; эти связи имеют
длину 2,816 и 2,896А. Каждая молекула воды связана с ионом
кальция и с атомами кислорода сульфат-ионов двух соседних
слоев, так что ее окружение сходно с окружением молекулы
воды в BeSO4-4H2O или Zn(BrO3J-6H2O. Водородные связи
О—Н—О являются самыми слабыми в структуре, что объяс-
няет совершенную спайность кристалла и заметную анизотро-
пию термического расширения, которое значительно больше в
направлении, перпендикулярном слоям, чем в любом направле-
,. Sr' ил:
О СГ
?>) Н,0
а
Рис. 15.21. Проекции слоев в кристаллических структурах SrCl2-2H2O (а) и
ВаС12-2Н;О (б). Выделенные (жирные линии) кружки — атомы, лежащие
над плоскостью, в которой находятся ионы металла, а другие кружки (тон-
кие линии) — атомы под этой плоскостью."
нии в плоскости слоев. Локализация атомов водорода на ли-
ниях, соединяющих атомы кислорода молекул воды и атомы
кислорода сульфат-ионов, подтверждена данными ЯМР и ней-
тронографии.
Структуры СаНРО4-2Н2О (брушит) и CaHAsO4-2H2O (фар-
маколит) очень похожи на структуру гипса, но содержат допол-
нительные водородные связи, в которые вовлечены ОН-группы
анионов [2].
В моногидратах по мере увеличения координационного чис-
ла катиона роль молекул воды в образовании координационно-
го окружения катиона уменьшается:
Моногидрат
КЧ атома
металла
Состав координацион-
ной группы
LiOH-H2O
Li2SO4-H2O
Na2CO3-H2O
SrBr2-H,0
4
4
6
9
2Н2
/ !Н2
\
/ 2Н2
1 1 Н2
2Н2
о,
О,
о,
о,
о,
2 ОН
ЗО
40
40
5 0
7Вг
420 15. Вода и гидраты
Рис. 15.22. Проекция кри-
сталлической структуры гип-
са, перпендикулярная слоям.
Слои построены из ионов
SO42- и Са2+ (большие свет-
лые кружки), а молекулы
воды (заштрихованные
кружки) находятся на внеш-
ней поверхности слоев. Жир-
ная штриховая линия пока-
зывает спайность кристалла,
при которой разрушаются
только связи О—Н—О.
Рис. 15.23. Фрагмент двой-
ной цепочки в структуре
ЫОН-Н2О.
(В структурах Li2SO4-H2O и Na2CO3-
•Н2О наблюдается по два типа катио-
нов с неэквивалентным окружением.)
LiOH-H2O. Каждая структурная
единица — Li+, ОН~ и Н2О — имеет
по четыре ближайших соседа. Ион ли-
тия окружен 2 ионами ОН~ и двумя
молекулами воды; такие тетраэдриче-
ские группировки сочленены друг с
другом одним ребром и двумя верши-
нами с образованием двойных цепо-
чек (рис. 15.23), которые «сшиты» по-
перечными водородными связями
между ионами ОН~ и молекулами
воды. Каждая молекула воды имеет
тетраэдрическое окружение, состоя-
щее из двух ионов лития и двух ионов
ОН~ различных цепочек; похожий тип
окружения наблюдается в структуре
LiC104-3H20.
Li2SO4-H2O. В этой структуре
молекулы воды имеют тетраэдриче-
ское окружение B Н2О, Li+ и О из
SO4-rpynnbi) и соединены водород-
ными связями в бесконечные цепочки.
Ориентация вектора Н—Н в элемен-
тарной ячейке хорошо согласуется с
величиной, полученной из данных
ПМР. Молекулы воды имеют два ти-
па связей О—Н—О: связи с атомами
кислорода сульфат-ионов B,87 А) и
связи с молекулами воды B,94 А).
Na2CO3-H2O. В оксосолях большой
по размеру ион натрия обычно имеет
окружение в виде октаэдра. В данном
гидрате присутствуют катионы двух
типов: у половины катионов окруже-
ние образовано одной молекулой во-
ды и пятью атомами кислорода, у ос-
тальных— двумя молекулами воды и
четырьмя атомами кислорода карбо-
нат-ионов. В этой структуре молекула
воды также имеет тетраэдрическое окружение, состоящее из
двух ионов натрия и двух атомов кислорода карбонат-ионов.
SrBr2-H2O. Необходимо отметить, что в этом гидрате КЧ
иона стронция не 8, как в SrBr2, a 9; ближайшее окружение
15.2. Гидраты. 421
его больше похоже иа окружение катиона в ВаВг2, причем
в координации участвуют две молекулы воды.
Sr(OHJ-H2O. В структуре этого гидрата (и изоструктурно-
го Еи(ОНJ-Н2О) координационный полиэдр металла пред-
етасляет собой двухшапочную тригональную призму, образо-
ванную шестью ОН-группами и двумя молекулами воды.
Использованная здесь
классификация без соответст-
вующего усовершенствования
неприменима к гидратам, в
которых катионы имеют раз-
личные степени гидратации.
Например, в ZnCl2-17з Н2О
[3] 2/з атомов цинка имеют
тетраэдрическое окружение,
состоящее из ионов хлора; они
образуют бесконечные цепоч-
ки состава (ZnCl3)nn~; осталь-
ные атомы цинка располага-
ются между этими цепочками
и имеют окружение в виде "А 3 112W'
октаэдра, образованное че-
тырьмя молекулами воды и двумя ионами хлора из цепочек
(рис. 15.24). Длины связей равны: Zn—4C1 2,28 A, Zn—2C1
2,60 А и Zn—4 Н2О 2,03 А.
Литература [1] Acta cryst., 1974, ВЗО, 2363. [2] Acta cryst., 1969, В25, 1544
Г31 Acta cryst., 1970, B26, 1679.
Рис. 15.24. Два типа окружения
ионов Zn2+ в структуре "ZnCU-
Гидраты галогенидов 3 d-мет ал лов. Приведенное выше
описание структур гидратов позволяет сделать некоторые обоб-
щения:
1) Группировки М(Н2О)„ сочленены друг с другом ребрами
или гранями, но не вершинами; этот вывод справедлив для
всех гидратов.
2) В Со12-6Н2О и в одной из модификаций CrCls-6H2O
наблюдается полная гидратация металла, но во многих случа-
ях даже при достаточном количестве молекул воды полной
гидратации металла не происходит. Обычно молекулы воды в
координационной группе металла замещены на X; иногда и
Н2О, и X лишь частично координированы металлом, а частич-
но находятся вне координационной группы катиона, как это
имеет место в [СгС12(Н2ОL]С1-2Н2О. В тригалогениде 4/-
металла один из ионов хлора (в большой по размеру коорди-
национной группе) замещен на молекулу воды; в данном слу-
чае имеется в виду [GdCl2(H2ON]CI.
422 is. Вода и гидраты
15.2. Гидраты 423
3) Если возникает необходимость в сочленении координа-
ционных групп, то предпочтение отдается иону X, а не Н2О.
Примерами могут служить многочисленные соединения MX?-
•2Н2О.
4) Многие из кристаллогидратов имеют полиморфные моди-
фикации, и, по-видимому, не наблюдается большого различии
в устойчивости структур, содержащих различные типы коорди-
национного окружения катиона; доказательством тому являют-
ся три модификации СгС1з-6Н2О и две модификации МпСЬ-
•4Н2О.
Гидраты комплексных галогенидов. Эти соединения упоми-
нались в предыдущих главах от случая к случаю. Например, а
разд. 10.1.5 отмечалось, что гидраты комплексных галогенидон
аналогичного состава могут иметь совершенно различные
структуры и что в соединениях А,„ (ВХ„) -рН2О не обязательно,
чтобы все молекулы воды были связаны с атомом В; ср. коор-
динационное окружение марганца (шесть ионов фтора) в
КзМпрБ-НгО с координационным окружением ванадия (пять
ионов фтора и одна молекула воды) в (NHU^CV'Fn-HoO). Раз-
личие в строении координационных групп в дигидратах КМпСЬ
и RbMnCl3, а такжев K2MnCl4-2H2O было показано на рис. 15.16.
Остановимся на распределении молекул воды между двумя ка-
тионами в некоторых сложных галогенидах с более высокой сте-
пенью гидратации. В разд. 6.2 была описана структура NiSnC.br
•6Н:О типа CsCl, построенная из группировок (SnCbJ" и
[ХЦН2О)б]2!". Комплексный катион такого же строения обна-
ружен в структуре СсЬХЮб- 12Н2О, но анионом здесь является
цепочка АХ4, составленная из октаэдров СdС1 е (а); остальные
молекулы воды не входят в состав комплексных частиц.
В структуре CcUNiCho-ЮНоО присутствуют
ci с:
'Ci
С I
Н2О
кратные октаэдрические цепочки (б), в которых равные коли-
чества октаэдров сочленены друг с другом тремя или пятью
ребрами (ср. с цепочкой АХ3 в соединении ХН4Сс1С1з, где во
октаэдры сочленены четырьмя ребрами). Эти цепочки имекг
состав Cd2Cl5(H2O). В структуре Mg2CaCl6-12Н2О все йоги
хлора связаны с ионами кальция, а все молекулы воды — с ио-
нами магния. Структуры гидрата Са2Сс1С1б- 12Н2О и изострук-
турного ему р-СаС12-4Н2О (см. ниже) связаны друг с другом
следующим образом. В последнем соединении 7з ионов каль-
ция имеет октаэдричеекое окружение, состоящее из шести ио-
нов хлора, а остальные ионы кальция — окружение, образован-
ное одним ионом хлора и семью молекулами воды. В комплекс-
ном галогениде ионы кальция с К.Ч 6 замещены на ноны
кадмия. Эти гидраты имеют следующие структурные формулы:
Cl.NiCl,- 12H,O: [CdCl3(H2O)l2[Ni(H2ONV4H,O
Acta cryst., 1980
В36, 3088
Cd4NiCl,(,-10 II2O: [Cd2Cl5(H,O)l2[Ni(H2ONl-2 HO Acta cryst.,
B36, 3090
Acta cryst.,
B36. 2726
Acta cryst.,
B34, 3341
Mg2CaCl6-12H,O:
Ca2CdCl6-12H2O:
(CaCl6)[Mg(H2ONl2
[CdC!6Ca2(H2OI2l,
1980.
1980.
1978.
Гидраты хлорида кальция. Известны гидраты с 1, 2, 4 и о
молекулами воды, а также три полиморфные модификации
тетрагидрата. Структура дигидрата построена из октаэдрпче-
ских слоев АХ4, состоящих из групп СаС14(Н2ОJ с четырьмя
общими экваториальными вершинами (атомами хлора). Этот
слой представляет собой модификацию слоя в структуре
I\2(NiF4) (разд. 5.3.3). Структура неустойчивой (у) модифика-
ции СаС12-4Н2О очень проста: она построена из октаэдриче-
Н,0
Н,0
(Н2ОM
Са
,Са KUO
CI
CI
CL
Н-0
Н20
Н20
H2L
а н2о
Са
(НЕ0M
Са
С1
С1
тц
Н,0
а
(н2оM
ских молекул CaCI2(H2OL с транс-конфигурацией; зато другие
две модификации имеют значительно более интересное строе-
ние. а-Модификация построена из димеров (а), в которых 1\Ч
кальция 7 (три иона хлора и четыре молекулы воды), а струк-
тура C-модификации содержит сложные цепочки, в которых
имеется два сорта неэквивалентных атомов (ионов) кальция
(б). Пары атомов кальция, связанные двойными мостиками пз
молекул воды, объединены в цепочки посредством октаэдриче-
ских групп СаС1б. Гексагидрат хлорида кальция нзоструктурен
гексагидрату SrCl2-6H2O (рис. 15.14). Его структура содержит
бесконечные линейные гидратированные катионы, состоящие
из группировок Са(Н2О)9, имеющих форму трехшапочных три-
гональных призм, призмы сочленены по треугольным основа-
ниям.
424 15. Вода и гидраты
Основные характеристики структур гидратов хлорида каль-
ция приведены ниже.
Гидрат
КЧ
атома
Са
Состав коорди-
национной
группы
Мостик
Литература
СаС12-2Н2О
СаС!2-4Н2О-у
-а
¦В
СаС!2-6Н2О
6 4С1, 2Н2О
6 2 С1, 4 Н2О
7 3CI, 4Н2О
6 6С1
Одинарный Cl Acta cryst., 1977,
ВЗЗ, 1608
9
1 С!, 7 Н,0
9 Н,0
Нет
Двойной С1
Одинарный С1
и
Двойной Н2О
Тройной 1Г2О
Acta cryst.,
В36, 2757
Acta cryst.,
B35, 585
Acta cryst.,
B34, 900
Acta cryst.,
B33, 2938
1980,
1979,
1978,
1977,
Гидраты оксосолей кальция. Ранее уже были рассмотрены
структуры нескольких гидратов оксосолей кальция. В СаО2-
•8Н2О и CaK(AsO4)-8НгО [1] катионы полностью гидратиро-
ваны восемью молекулами воды (в этих соединениях коорди-
национные полиэдры катионов неизбежно должны иметь об-
щие молекулы воды). В СаСО3-6Н2О и CaSO4-2H2O катионы
также имеют КЧ 8: 6Н2О + 2О и 2Н2О + 6О. В нитратах чаще
встречаются более высокие координационные числа, так как
ион КОз~ может выполнять функции бидентатного лиганда с
расстоянием между атомами кислорода всего 2,15 А. Это хоро-
шо иллюстрируют структуры трех гидратов нитрата кальция.
Дигидрат имеет слоистую структуру. Координационное число
кальция равно 10 (две молекулы воды и восемь атомов кисло-
рода, расположенных в вершинах двухшапочной архимедовой
антипризмы). Ионы кальция соединены мостиками из ионов
КОз~ (а — схематическое изображение боковой проекции фраг-
мента слоя) [2]. Тригидрат строится из тетрамеров (б), в ко-
торых кальций имеет КЧ 9, а половина ионов NO3" образует мос-
тики такого же типа, как в дигидрате [3]. Тетрагидрат состоит
из димеров (в), где КЧ кальция также 9 (трехшапочная триго-
нальная призма) [4]. Во всех трех структурах водородная
связь осуществляется только между соседними структурными
единицами: слоями, тетрамерами или димерами.
Литература. [1] Acta cryst., 1972, В28, 3056. [2] Acta cryst., 1974, B30, 605.
[3] Acia cryst, 1976, B32, 235. [4] Сотр. rend. (Paris), 1970, 271C, 1555.
Гидраты сульфата ванадила. Сульфат ванадила образует
гидраты с 1, 3, 5 (три модификации) и 6 молекулами воды;
гидраты сульфата магния включают помимо других гидраты с
15.2. Гидраты 425
4, 6 и 7 молекулами воды. Обнаружена интересная связь меж-
ду структурами пар гидратов сульфатов этих двух катионов,
так как и в солях магния, и в солях ванадила металл имеет
октаэдрическую координацию, но в солях ванадила одна из
координационных позиций вокруг атома металла занята ато-
мом кислорода катиона ванадила. Поэтому структура гидрата
MgSO4-mH2O должна быть похожа на структуру гидрата
V"OSO4-(m—1)Н2О, что в нескольких случаях действительно
наблюдается. Любопытно, что не известен тетрагидрат сульфа-
та ванадила, структура которого должна быть похожа на
структуру пентагидрата MgSO4-5H2O, изоструктурного CuSO4-
¦5Н2О (разд. 15.2.5). Естественно, что в соединениях ванадила
наблюдается значительное искажение координационного окта-
эдра (а).
Н,0
Н,0
Н20
о2
S
Н,0
6
н?о
Кристаллический VOSO4-3H2O [1] построен из димеров
(б) того же типа, что и в MgSO4-4H2O [2]. Устойчивая моно-
клинная модификация VOSO4-5H2O [3] построена из элемен-
426 15. Вода и гидраты
тов типа структуры в и молекул кристаллизационной воды, т. е.
структурная формула этого соединения [VO(H2OLSO4] -H2O.
Для гидратов MgSO4 такое распределение молекул воды не
характерно. Однако одна из двух менее устойчивых ромбиче-
ских модификаций пентагидрата сульфата ванадила построена
из группировок [УО(Н2ОM]2+ и дискретных ионов SO42~ [4],
т. е. аналогично структурам гидратов [M(H2ON]SO4, образуе-
мых атомами Fe, Ni и Mg. В структуре гидрата VOSO4-6H2O
[5] также имеются октаэдрические группировки [VO(H2OM]24,
так что его структурную формулу следует писать в виде
[VO(H2OM]SU4-H2O —¦ ср. со структурной формулой
[Mg(H2O)8JSO4-H2O для гептагидрата сульфата магния.
Литература. [1] Acta cryst, 1980, В36, 2873. [2] Acta cryst., 1962, 15, 815.
[3J J. Am. Chem. Soc, 1968, 90, 3305 [4] Acta cryst, 1980, B36, 1757. [5] Acta
cryst., 1980, B36, 249.
15.2.7. Гидраты кислот и кислых солей. Структуры гидратов
кислот и кислых солей особенно интересны тем, что некоторые
или все протоны в них могут присоединяться к молекулам во-
ды с образованием НзО+ или более сложных ионов. Спектры
ПМР показывают, что в моногидратах ряда кислот (HNO3,
НСЮ4, H2SO4, H2PtCl6) существуют группировки, состоящие
из трех атомов водорода, расположенных в вершинах равно-
стороннего треугольника. Существование коротких расстояний
О—Н—О B,4-^2,6 А) между некоторыми парами атомов кис-
лорода, которые связаны с другими атомами кислорода более
длинными водородными связями B,7-т-2,8 А), принято считать
признаком образования Н5О2+, Н7О3+ или более сложных ио-
нов гидроксония, хотя такая интерпретация не всегда однознач-
на. Например, в HAuCl4-4H2O выявлены связи О—Н—О
длиной 2,57 А между некоторыми парами атомов
кислорода и связи длиной 2,74 А с окружающими мо-
лекулами воды; однако нейтронографическое исследование
показывает, что атом водорода статистически размещен по
двум позициям, отстоящим на 0,62 А от линии короткой связи
О—О, что говорит о возможности альтернативного описания
структуры с участием Н3О+(Н2О).
Присоединение одного протона к молекуле воды с образо-
ванием катиона гидроксония НзО+ следует ожидать в гидратах,
у которых отношение Н+:Н2О = 1, например в НХ-Н2О или
H2SO4-2H2O. Аналогично можно ожидать образование иона
НзОг4", если отношение Н+:Н2О=1:2, как в НХ-2Н2О или
H2SO4-4H2O и т. д. для других отношений Н+: Н2О. В соответ-
ствии с этим допущением некоторые гидраты можно классифи-
цировать в зависимости от того, какой из ионов гидроксония
они должны содержать, а в табл. 15.6 включены также и дру-
15.2. Гидраты 4 27
Таблица М
Катионы
Н;О,-
Н:,Ов+
H:iO62'
Отношение
ц+:Н2О
2:1
1:1
2:1
2:5
1:2
1:3
1:3
1:4
1:6
1:6
1:3
.6. Группировки протон — вода в гидратах
Гплра i
F(CSO,H-l/2HoO
НС1-Н,О, НВг-Н2О,
HNO3-H,O, НС1О4-Н,О,
F3CSO3H-H,O,
H2SO4-2 11,6
[H,SO.-H,O
HoSc04-H,0
1
HC!O4-2-2- H2O
HC1-2H2O, НС1О,-2Н2О
F3CS3H-2H2O
H2SO4-4II2O
(ZnC12J-HCl-2H2O
HC1-3H,O, HAuCl4-4H2O
HXO3-3I12O
HC1O4-3H2O
F3CSO3H-4H2O, НВг-4РШ°
HC!-6H2Oa
f(C9H18K\H2CllCl,H-6H,O
HSbCl6-3 H2O
Ли гора
Acta cr\ st,
2208 "
Acta crvst,
1923 "
Acta crvst.
2384 '
Acta cryst,
898
Ada crvst,
2202
Acta cryst.
1692
Acta cryst,
1 пол
166 U
Acta cryst,
1 4 QO
14оУ
Ada crvst.
481
Acta crvst,
2428 '
Acta cryst,
2424
Science, 1975,
Acta crvst,
2001
rypn
1975,
1973,
1979,
1971,
1975,
1972,
1978,
1975,
1972,
1978,
1978,
190,
1980,
B)l,
B29,
B35,
B27,
B31,
B28,
B34
B31
B28
B34
B34
151
B36
' Содержатся также молекулы Н2О.
Содержатся также молекулы НЮ и катионы Н7Оз+.
гие гидраты с более сложными структурами. Как и в структу-
рах ряда гидратов солей, часть воды может быть не связа-
на с катионами; существуют гидраты кислот, в которых неко-
торые из молекул воды не включаются в протонированные
группировки. Обратная ситуация возникает тогда, когда в
наличии имеется больше протонов, чем необходимо для обра-
зования комплексов гидроксония (т. е. если степень гидрата-
ции очень низка), или когда ионизированы не все молекулы
кислоты. Таким образом, можно представить себе три вариан-
та:
[А-][Н,„ОП+]
[А~1!НтО,г][Н,О]
[АН][Л-][Н,„О,Г]
428 15. Вода и гидраты
fr-
Рис. 15.25. Расположение атомов в слоях кристаллических структур: а —
НС1-Н2О; б — HNCVHjO; в — НС1О4-Н2О; г — H2SO4-H2O.
где А~—анион кислоты, а НтО„+ — любая оксониевая группи-
ровка. Примерами третьего типа являются структуры F3C-
•БОзН-'/гНгО и H2SO4/H2O; более многочисленны структуры
второго типа, среди которых:
(Н,О)
Остановимся кратко на структурах некоторых гидратов.
Кислоты НХ образуют гидраты со следующим числом моле-
кул кристаллизационной воды:
HC1O4.2V2H2O
НСЬЗН2О
НАиС14-4Н2О
НВг-4Н2О
НСЬ6Н2О
(Н3О+J
(НА+)
(Н6О2+)
(Н7О3+)
(НвОв+)
(Н2ОK
(Н2О)
(Н2ОJ
(Н9О4+)
(Н2ОJ
HF
НС1
НВг
HI
1
4
1
2
1
1
1
2
2
2
3
3
3
4
4
15.2. Гидраты 429
Структуры гидратов фтороводородной кислоты HF не расшиф-
рованы. Температуры плавления гидратов соляной кислоты с
повышением степени гидратации последовательно понижа-
ются: —15,4, —17,4 и —29,4 СС; все три структуры известны.
В моногидрате структурными единицами являются ионы С1~
и Н3О+. Структура состоит из гофрированных слоев простей-
шего типа (рис. 15.25, а), в которых каждый атом О или С1
имеет по три пирамидально расположенных соседа (соответст-
венно CI или О) (а). Расстояние О—Н---С1 равно 2,95 А, а
угол Н—О—Н между связями равен 117°. Угол С1—О—С1 ра-
вен 110°, а атомы водорода лежат на ОДА в стороне от линий
О—Н---С1. (Кратчайшее расстояние между атомами кислорода
и хлора соседних слоев 3,43 А.)
Дигидрат соляной кислоты содержит фрагменты Н5О2+ (б),
в которых центральная связь О—Н—О чрезвычайно короткая,
а связи О—Н---С1 имеют среднюю длину 3,07 А (лежат в ин-
тервале 3,04-^-3,10А), т. е. заметно длиннее, чем в (Н3О)+СК
Такие же фрагменты содержатся в структуре тригидрата, где
они соединены водородными связями с двумя молекулами во-
ды (О—Н—О 2,70 А) и с двумя ионами хлора (О—Н—С1
3,03 А), а не с четырьмя ионами хлора, как в (НзО)+С1~.
Третья молекула воды имеет обычное тетраэдрическое окруже-
ние, состоящее из двух ионов хлора (среднее расстояние
О—Н—С1 3,10 А) и двух молекул воды (среднее расстояние
О—Н—О 2,70 А). Следовательно, для этих трех гидратов мож-
но записать формулы:
(Н3О)+СГ, (Н5О2)+СГ и (Н5О2)+СГ-Н2О
а--
Н>--н-оСН'
.4 2.41 A H.
а
а
2,59 A /V-U?\2,S0A
n^bios0
Гидрат НВг-4Н2О имеет еще более сложную структуру, ему
соответствует структурная формула (Н9О4) + (Н7Оз) + (Вг-J-
•Н2О. Свободная молекула воды имеет тетраэдрическое окру-
15. Вода и гидраты
жение (Вг +ЗН2О), причем кратчайшее расстояние до сосед-
них молекул воды 2,75 А. Из фрагментов О3Вг^ (в) и О4
(г) последний имеет форму пирамиды. Все расстояния О—О
внутри этих фрагментов короче других расстоянии О—Н—О в
структуре B,75 А), хотя и немного длиннее, чем в Н5О2+.
В соответствии с тем что расстояние О—Вг в фрагменте (в)
заметно короче, чем другие расстояния О—Вг (следующее бо-
лее длинное расстояние 3,28А), этот фрагмент можно описать
как пирамидальную группировку (Н7О3+Вг~), в какой-то степе-
ни сходную с (Н9О4)+.
В (H3O) + (NO3)- содержится столько атомов водорода,
сколько требуется для образования трех водородных связен
между каждым ионом Н3О+ и тремя ближайшими ионами
NO3~; эта структура (рис. 15.25,6) представляет собой еще
один пример простой гексагональной сетки. Тригидрат содер-
жит катионы (Н7О3)+, как и следовало ожидать для отноше-
ния Н+:Н2О=1:3. В модификации НС1О4-Н2О, устойчивой
при температурах >—30 °С, существует неупорядочение, свя-
занное с вращением ионов Н36+, а низкотемпературная моди-
фикация имеет структуру с точно такой же топологией, как и
структура HNO3-H2O. Как и в структуре HNO3-H2O, в ней
присутствуют три водородные связи, соединяющие каждый ион
с соседними, так что один атом кислорода каждого иона С1О4"
не участвует в водородной связи (рис. 15.25, в). В пирамидаль-
ном ионе Н3О+ угол Н—О—Н равен 112° и средняя длина свя-
зи О—Н—О 2,66 А.
Система H2SO4—Н2О является довольно сложной, линии
ликвидуса указывают на существование шести гидратов с 1, 2,
3, 4, 6,5 и 8 молекулами воды. В моногидрате H2S04-H2O
число атомов водорода достаточно для образования четырех во-
\
\ /1,4 3 А
1,45 А ,'
1,56 .
H2S(VHjO
дородных связей на одну формульную единицу. Кристаллы
построены из ионов SO4H~ и Н3О+, расположенных в слоях
(рис. 15.25, г) и соединенных водородными связями; ^Со-
участвует в трех связях, SO4H~ — в пяти. Поскольку в структу-
ре имеется одинаковое количество ионов обоих типов, то ион
SO4H~ неизбежно должен быть соединен водородными связями
с тремя ионами Н3О+ и двумя ионами SO4H^. Между слоями
15.2. Гидраты 431
водородные связи отсутствуют. Три водородные связи иона
Н3О+ образуют пирамиду (углы между связями 101, 106 и
и 126°) и имеют длины 2",54, 2,57 и 2,65 А. Отметим, что именно
О2. а не Оз образует две водородные связи. В отличие от моно-
гидрата, который характеризуется структурной формулой
(HSO4)-(H3O)^, дигидрат имеет структурную формулу
(SO4J-(H3OJ4-. Каждый ион Н3О '•- соединен водородными
связями с тремя различными сульфат-ионами и образует трех-
мерный каркас, в котором каждый ион SO42~ участвует в шести
водородных связях: два атома кислорода образуют по две
водородные связи, а два других атома кислорода — по одной
(О—Н—О 2,52^-2,59 A, S—О 1,474 А). Структурная формула
тетрагидрата, как и ожидалось, (H5O2J+(SO4J~.
В структуре дигидрата НСЮ4-2Н2О, содержащего один
протон на две молекулы воды, как и в НСЬ2Н2О, присутст-
вуют катионы Н5О2+. Длина связи О—Н—О B,424 А) в этом
ионе очень близка к длине связи в НСЬ2Н2О, но его геомет-
рия несколько иная. В структуре НСЮ4-2Н2О катион имеет
заторможенную конфигурацию, в НС1-ЗН2О—почти заслонен-
ную, в НС1-2Н2О — промежуточную. Как уже отмечалось,
НС1О4-27гН2О описывается структурной формулой
(Н3ОJ+(Н2О)з(С1О4J-, но в тригидрате протонов уже доста-
точно для образования комплексов Н7О3+, так что его струк-
турная формула (Н7О3) + (С1О4)-.
2,41 /
о—о;
2,66 X
О О
-^,69 Л
НС104-ЗН2О
HSbCl6-3H2O
Трифторметансульфоновая кислота образует 5 гидратов:
с 72, 1, 2, 4 и 5 молекулами воды. Особый интерес представляет
полугидрат; это единственное соединение среди примеров, при-
веденных в табл. 15.6, с соотношением Н+:Н2О = 2:1. Следует
также обратить внимание на структуру тригидрата HSbCle-
•ЗН2О. Этот гидрат вопреки ожиданию содержит не катионы
Н-О3+, а более сложные группы НнОб2+.
Структуры гидратов кислых солей исследованы очень мало.
В соли Na3H(CO3J-2H2O протон связан с парой анионов
(СО3—Н—СО3), а вода присутствует в виде обычных молекул
432 15. Вода и гидраты
Н20. В то же время в таких солях, как (Coen2Br2)Br-HBr-2H20
и ZnCb- '/гНСЬНгО, с тем же отношением Н+:Н2О=1:2 при-
сутствуют ионы HsO2+, аналогичные ионам, найденным в ряде
гидратов кислот. Как отмечалось в гл. 3, добавление одного
иона хлора к двум молекулам ZnCl2 приводит к образованию
трехмерной сетки состава Zn2Cl5, построенной из тетраэдров
ZnCU, сочлененных по трем вершинам (ср. с одной из модифи-
каций Р2О5). В пустотах этого каркаса размещены ионы Н5С>2+;
следовательно, соединение можно написать в виде
(Zn2Cl5)-(H5O2)+. Эту структуру можно также описать как
слегка искаженную гексагональную плотнейшую упаковку ато-
мов хлора, в которой '/б атомов замещена на значительно бо-
лее громоздкие ионы HsO2+.
15.2.8. Локализация ионов водорода в водородных связях;
остаточная энтропия. В гл. 8 уже отмечалось, что во многих
соединениях с водородными связями атом водорода лежит в
стороне от линии, соединяющей атомы, участвующие в водород-
ной связи. Такое явление наблюдается также в структурах
льда-I и таких гидратов, как СиС1г-2Н2О; в последнем соеди-
нении угол О—Н---С1 равен 164°. Очень близкие значения име-
ют углы О—H---F в гексагидрате FeSiF6-6H2O [1] (изострук-
турном №(Н2О)б5пС1б и представляющем собой упаковку
типа CsCl ионов Fe(H2ON2+ и SiF62~), а также в дигидрате
CuF2-2H2O [2]. В оксосолях и кислотах угол О—О—О, в вер-
шине которого находится атом кислорода молекулы воды,
образующей водородные связи с двумя атомами кислорода
оксо-ионов, лежит в интервале от 84° в (СООНJ-2Н:О до
~ 130° (а возможно, и больших углов). В хромовых квасцах
[К(Н2О)в] [Сг(НгО)б] (Sdb [3] у обоих типов молекул воды
этот угол меньше чем 104,5°, в то время как в гидрате CuSO4-
•5Н2О [4] все углы О—О—О, кроме одного, больше, чем уг-
лы Н—О—Н; самый большой равен 130°, а среднее значение—
119°. Из рассмотрения этих углов, по-видимому, можно сделать
единственный вывод — молекула воды в гидратах сохраняет
свою обычную конфигурацию, а водородные связи близки по
направлению к связям О—Н настолько, насколько это совме-
стимо с размещением других атомов в кристалле.
Как лед-I, некоторые гидраты обладают остаточной энтро-
пией, связанной с возможностью различного размещения ато-
мов водорода. В уже описанной выше кристаллической струк-
туре декагидрата Na2SO4-10H2O 8 молекул воды входят в
состав октаэдрических цепочек [Na(H2OL]n, а две молекулы
воды не связаны с катионами. Молекулы воды, входящие в
цепочки, не могут изменить свою ориентацию; зато водородные
связи, в которых участвуют две остальные молекулы воды,
15.2. Гидраты 433
образуют циклы, что открывает возможность для двух спосо-
бов размещения атомов водорода в любом кольце таким обра-
зом, чтобы на каждую связь О—Н—О приходилось по одному
атому водорода. Если выбор расположения атомов водорода в
различных кольцах по всему кристаллу является случайным,
то этим объясняется наблюдаемая величина энтропии, равная
21п 2 на одну молекулу.
У нас нет возможности упомянуть здесь все исследования,
посвященные локализации атомов водорода в гидратах. Срав-
нение результатов исследования 12 гидратов методами ЯМР и
нейтронографии [5] показало, что в общем имеется очень хо-
рошее согласие между результатами, полученными этими двумя
методами. Много литературы по этой теме приведено в работе
[6], подводящей итоги определения позиций протонов в гидра-
тах методом ЯМР.
Литература. [11 Ada cryst., 1962, 15, 353. [2] J. Chcm. Phys., 1962. 36, 50.
[3] Proc. Roy. Soc. A, 1958, 246, 78. [4] Proc. Roy. Soc. A, 1962, 266, 95. [5] J.
Chem. Phys., 1966, 45, 4643. [6] Acta cryst., 1968, B24, 1131.
15.2.9. Аддукты с аммиаком (аммины)* и с водой (гидраты).
Аддукты с аммиаком (аммины) получают действием аммиака
на соль, используя газообразный или жидкий аммиак и без-
водную соль, или кристаллизацией соли из аммиачного раство-
ра. При получении аддуктов солей кобальта (III) с аммиаком
из солей кобальта (II) необходимо одновременное окисление
кобальта до степени окисления +3, что может быть достигнуто
пропусканием воздуха через аммиачный раствор. Трудно сде-
лать какое-либо обобщение относительно устойчивости аддук-
тов с аммиаком по сравнению с гидратами, потому что, как ста-
нет ясно из дальнейшего изложения, аддукты с аммиаком —
это большая группа соединений, сильно различающихся по со-
ставу и устойчивости. В качестве крайних случаев можно ука-
зать чрезвычайно неустойчивые аммиачные аддукты галогени-
дов лития и устойчивые аммины кобальта и хрома.
Сравнение эмпирических формул аддуктов с водой и с ам-
миаком позволяет сделать несколько обобщений.
/. Оксосоли. Многие сульфаты кристаллизуются с нечет-
ным числом молекул воды, например купоросы MS0wH20
(M = Fe, Co, Ni, Mn, Mg и т. д.), MnSO4-5H2O и CuSCv5H2O,
MgSO4-H2O и многие другие. Многие из солей, образующих
гептагидраты, образуют также гексагидраты, но более "гидра-
тированную соль обычно получают выпариванием водного
раствора при комнатной температуре. Однако аддукты с амми-
аком тех же солей содержат четное число молекул NH3, обыч-
* Ранее аддукты с аммиаком назывались аммиакатами. — Прим. перев.
28-985
434 15. Вода и гидраты
15.2. Гидраты 435
но четыре или шесть, например NiSO4-6NH3; особо отметим
Cu(NH3LSO4-H2O.
Нитраты многих двухвалентных металлов кристаллизуются
с шестью молекулами воды (нитраты железа, марганца, маг-
ния и др.). но известно несколько гидратов нитратов и с не-
четным числом молекул воды, например Fe(NO3K-9(H 6)H2O,
Си^МОзЬ-ЗНгО. Тс нитраты, для которых известен соответст-
вующий аддукт с аммиаком, содержат четное число молекул
МНз, как в Cu(NH3L(NO3J- Существует много других сери:"!
гексагидратов солен — перхлораты, сульфиты, броматы и др.,
и хотя соответствующие аддукты с аммиаком, как правило, со-
держат шесть молекул NH3, структуры последних и структуры
гидратов совершенно различны (ср., например, структуру
[Со(Н2ОN] (CICUh, описанную в разд. 15.2.5, с простой струк-
турой [Со(КтН3)б] (С1О4J типа флюорита).
Тот факт, что не получены аддукты, содержащие боль-
шое и при этом нечетное число молекул NH3, зероятно, объяс-
няется тем, что в таких соединениях некоторые молекулы ам-
миака должны бы были размещаться между координационны-
ми полиэдрами катионов и анионами (ср. с окружением пятой
молекулы воды в CuSO4-5H2O или седьмой молекулы воды в
NiSO4-7H2O). Молекула аммиака не обладает столь высокой
способностью к образованию водородных связей, как молекула
воды, в особенности если эти связи должны образовываться с
другими молекулами аммиака.
II. Галогениды. В отличие от оксосолей галогениды редко
кристаллизуются с нечетным числом молекул воды. Если все
же это имеет место, то число молекул кристаллизационной во-
ды обычно не превышает координационное число металла
(табл. 15.5; например, FeBr2-9H2O). В гидратированных оксо-
солях, содержащих избыточное количество молекул воды по
сравнению с требуемым для полного образования координаци-
онной группы вокруг ионов металла, дополнительные молекулы
воды могут быть размещены между группировками М(Н2О)П
и оксо-ионами и присоединены к ним посредством связей
О—Н—О. Однако в случае галогенидов дополнительные моле-
кулы воды очень слабо связаны с группировками М(Н2О)„ и
ионами хлора. В системе а электростатическая связь достаточ-
но сильна (например, в таком кристалле, как [Mg(H2ON]Cl2),
но в системе б, где молекула воды находится между гидрати-
рованным ионом металла и ионом хлора, она гораздо слабее.
Например, гидраты MgCl2-8H2O и MgCl2-12H2O устойчивы
только при низких температурах (разд. 15.2.4). Аддукты с
-м-он2-сг
а
аммиаком тех галогенидов, гидраты которых кристаллизуются
с нечетным числом молекул воды, содержат четное число моле-
кул аммиака, например ZnCl2-H2O, но ZnCl2-2NH3. Хотя в
случае аддуктов галогенидов с четным числом присоединяемых
молекул Н2О или МНз число этих молекул в соответствующих
аддуктах одинаково, кристаллические структуры этих двух тп-
Н2О. NiCl2-6NH,
7 Н2О,
6 Н2О
но G NH
4NH:-H..O
4NH:
-М-ОН2-Н2О-СГ
6
в отличие от NiSO4
CuBr,-4H2O. CuBr2-4NH3 ruSO4-5 H2O
CuCl-4H2O, CuCI2-2,4 или Cu(\O3J-3 H2O
6NH3, (CuCl2-
¦4NH3-2H2O
из раствора)
пов соединений различны, как уже отмечалось для пар соеди-
нений А1(\тНзNС1з и А1(Н2ОNС1з, Mg(NH3)eCl2 и Mg(H2ONCl2.
Из этого краткого обзора видно, что аддукты МХл--яМНз
с п большим, чем координационное число металла, по-видимо-
му, встречаются редко и что обычно п = 4 или б (в зависимости
от природы металла М). В таких аддуктах молекулы МНз вхо-
дят в состав координационной сферы атома М, и группировки
M(NH3)n вместе с анионами часто образуют очень простую
кристаллическую структуру. Связь молекул NH3 с металлом в
аддуктах таких электроположительных металлов, как алюми-
ний и магний, имеет ион-дипольный характер. Устойчивость
этих соединений на порядок ниже по сравнению с устойчиво-
стью стабильных амминов трехвалентного кобальта и хрома
(гл. 27). Магнитные измерения показывают, что более сильные
связи М—МНз в комплексах Со(Ш) (а также I г A11), Pd(IV),
Pt (IV)) обычно рассматривают как «ковалентные» или, говоря
языком теории поля лигандов, как связи «сильного поля».
В первых двух группах периодической системы ковалентные
аммины металлов Б-подгрупп более устойчивы и имеют совер-
шенно другие структуры по сравнению с аммиачными аддук-
гами металлов А-подгрупп. Таким образом, можно сделать
вывод, что формальное сходство между аддуктами с водой и
с аммиаком ограничивается теми соединениями, в которых
связи М—NH3 по существу имеют электростатический
характер, и что даже в этих случаях наблюдаются
значительные различия между кристаллическими струк-
турами соединений MXX-«MH3 и МХх-лН2О. Последний
вопрос уже обсуждался, а первый лучше всего можно проил-
люстрировать при сравнении аддуктов с аммиаком и гидратов
солей металлов I и II групп периодической системы.
Среди хлоридов щелочных металлов аддукты МХ-уМНз
(УтаХ = 6) могут образовывать только хлориды лития и натрия,
28*
436 15. Вода и гидраты
причем они очень неустойчивы. Что касается гидратов, то хло-
рид лития образует пентагидрат, хлорид натрия — дигидрат
(устойчивый только ниже 0°С), в то время как хлориды калия,
рубидия и цезия кристаллизуются безводными. Таким образом,
образование аддуктов с аммиаком идет «параллельно» обра-
зованию гидратов. По мере увеличения размера иона при пере-
ходе от лития к цезию (и сохранении заряда) уменьшается
способность к поляризации молекул воды или аммиака, а сле-
довательно, и возможность их присоединения посредством
полярных связей. В Б-подгруппе обнаруживается совсем дру-
гая связь между гидратами и аддуктами с аммиаком. Послед-
ние обычно образуют те соли, которые не имеют гидратов, и
эти аддукты во многом похожи на цианидные и другие кова-
лентные комплексы. Единственным галогенидом серебра, для
которого известен гидрат, является фторид, в то время как
хлорид серебра и другие галогениды образуют аммины. Ана-
логичным образом нитрат и сульфат серебра — безводные соли,
но образуют аммины AgNO3-2NH3 и Ag2SO4-4NH3. В известной
структуре последнего соединения, а также, вероятно, и в струк-
туре первого из них содержатся линейные ионы (NH3—Ag—
NH3)+ такого же типа, как ионы (NC—Ag—CN)~ в KAg(CNJ-
Золото тоже образует аммины, например [Au(NH3L] (NO3K,
а некоторые аммины солей меди уже упоминались ранее.
Аналогичные различия между составом и устойчивостью
аддуктов с аммиаком элементов А- и Б-подгрупп существуют и во
II группе периодической системы. Магний образует ряд аддук-
тов с аммиаком, однако у щелочноземельных металлов тенден-
ция к образованию таких аддуктов очень быстро угасает. На-
пример, CaCl2-8NH3 легко теряет аммиак. Степень гидратации
солей также уменьшается от кальция к барию, за исключени-
ем октагидратов пероксидов и гидроксидов (SrO2-8H2O,
Ba(OHJ-8 НгО), устойчивость которых, по-видимому, объясня-
ется образованием водородных связей между ионами О22~ или
ОН~ и молекулами воды. Однако во II Б-подгруппе периодиче-
ской системы, как и в I Б-подгруппе, структуры аддуктов с ам-
миаком и гидратов не связаны друг с другом. Например, из-
вестны
ZnCl2-H2O
CdCI2-2H2Cr=
Однако эти два аддукта с аммиаком имеют совершенно раз-
личные структуры, в которых связи М—NH3, вероятно, облада-
ют заметным ковалентным характером. Эти структуры упоми-
нались в гл. 10.
ZnCl2-2NH3
¦¦CdCl.-2NH,
16. СЕРА, СЕЛЕН, ТЕЛЛУР
В этой главе описывается структурная химия соединений серы, селена и
теллура, кроме тех групп халькогенсодержащих веществ, которые обсуждают-
ся в других разделах книги. Оксосульфиды и сульфиды металлов (как про-
стые, так и сложные) рассматриваются в гл. 17, сульфиды неметаллов — в гла-
вах, посвященных соответствующим элементам, а гидросульфиды щелочных
металлов — в гл. 14 вместе с гидроксидами.
16.1. Стереохимия соединений серы
Основные типы конфигурации связей в соединениях серы
представлены в табл. 16.1 (построенной по аналогии с табл.
11.1 для производных кислорода). Молекуле SH2 мы для про-
стоты приписываем 5р3-гибридизацию, хотя валентный угол в
этой молекуле близок по своей величине (92°) к значению,
ожидаемому для р-связей. Информация о других молекулах
SR2 приведена в табл. 16.2 (разд. 16.4). Стереохимия соедине-
ний серы гораздо сложнее стереохимии кислородных производ-
ных, потому что при образовании химических связей сера мо-
жет использовать не только s- и р-, но и d-орбитали. Хотя для
серы гораздо характернее образование двух или четырех с-ко-
валентных связей, чем трех, последние все же найдены в SO3,
сульфооксидах R2S = O, солях сульфония (R3S)X и в некоторых
оксо-ионах. То обстоятельство, что большинство связей S—О
имеет кратность, большую единицы, не осложняет стереохи-
мию, потому что валентные углы определяются числом сг-свя-
зсн и неподеленных электронных пар (табл. 16.1).
16.2. Элементные сера, селен и теллур
При высоких температурах пары всех трех элементов состоят
из двухатомных молекул (длины связей в них составляют:
S = S 1,89 A; Se = Se 2,19 А; Те=Те 2,61 А), но при уме-
ренных температурах (например, в CS2) сера и селен обра-
зуют молекулы Ss и See соответственно. Нет, однако, никаких
доказательств существования подобных молекул у теллура, что
обусловлено его нерастворимостью в CS2 и других типичных
растворителях.
16.2.1. Сера. Отличительной особенностью серы является много-
образие ее твердофазных модификаций. Перечень их включа-
ет по меньшей мере четыре хорошо известные «нормальные»
полиморфные формы, стабильные при атмосферном давлении
[1]; многочисленные фазы высокого давления (одна из кото-
рых— волокнистая, получаемая из «пластической» серы); так
¦*38 16. Сера, селен, теллур
называемые аморфные фазы, характеризующиеся малой раст-
воримостью в CS2; окрашенные модификации, получаемые кон-
денсацией пара на поверхностях, охлажденных до температуры
жидкого азота. По крайней мере некоторые из «аморфных»
препаратов серы (например, осажденная сера) дают рентгенов-
скую дифрактограмму с линиями, что указывает на определен-
ную степень их кристалличности, и поэтому по отношению к
ним, вероятно, более правилен термин «jx-cepa» [2], чем
«аморфная сера». Термин «нормальные» полиморфные формы.
Таблица 16.1.
Число
а-электрон-
ны.ч пар
3
4
5
6
Тип гибри-
дизации
SP*
sp3
Sp3rf22
sp3d2T
конфигурация связей в соединениях серы
Число непо-
деленных
пар
0
1
0
1
2
0
1
0
Конфигурация
связей
Плеская треуголь-
ная
Уголковая
Тетраэдрнчсская
Трнгонально-
пирамидальная
Уголковая
Тригонально-бипи-
рамидальная
Тетраэдрическая
Октаэдрическая
Примеры
so3
so2
SO2CI2, O2S(OH),
SOCI2, S(CH;)^
SH2, SC12, S8
SOF4
SF4
SFc, S2F10
использованный выше, относится к модификациям, которые,
как теперь известно, состоят из молекул S6 или Se. В послед-
ние годы специальными методами, описанными ниже, были
приготовлены циклические молекулы Sn (n = 7, 9, 10, 12, 18, 20).
В стабильной при обычных температурах ромбической мо-
дификации структурной единицей является циклическая моле-
кула Ss (конфигурация в форме короны), в которой длина свя-
зи составляет 2,06 А, валентный угол— 108°, а диэдрический —
98° [3]. При 95,4 °С ромбическая модификация a-S8 перехо-
дит в моноклинную, которая при охлаждении обычно достаточ-
но быстро возвращается в ромбическую, но после предвари-
тельного отжига при 100°С реактива высокой степени чистоты
моноклинная модификация может сохраняться при комнатной
температуре в течение месяца. Моноклинная сера (p-S8)
состоит из молекул Ss с той же координацией, что и в ромби-
ческой модификации, но в отличие от последней у нее фиксиро-
вана ориентация только 2/з молекул, а остальные молекулы
расположены произвольно [4]. Такая неупорядоченность моле-
16.2. Элементные сера, селен и теллур 439
Таблица 16.2. Длины
Молекула
SH,
SF,
SC12
S(CH3J
S(CF3h
S(CNh
S(SiH3J
S(GeH3J
связей и валентные углы е
R-S-R
92°
98
100
99
106
98
97
99
S—R, А
1,35
1,59
2,00
1,80
1,83
1,70
2,14
2,21
молекулах SR2, SeR2, TeR2
Метода
MB
MB
кр
MB
эд
MB,
эд
эд
ик
Литература
J. Mol. Spectr., 1975, 28
237
Science, 1969, 164, 950
J. Chem. Phys., 1955, 23,
972
J. Chem. Phvs., 19(il, 35
47Q
Trans. Farad. Soc, 1954,
50, 452
J. Chem. Phys., 1965, 43
3423
Acta Chem. Scand., 1963
17, 2264
J. Chem. Soc, A 1970,315
SeH2
Sc(CH3J
Se(SiH3J
Sc(SCNJ
Sc(CF3J
Se[SeP{C2H5hSel2
R-Se—R
91°
98
97
101
104
104
Se—R, A
1,46
1,98
2,27
2,21
1,96
2,35
MB
ЭД
ЭД
РД
эд
РД
J. Mol. Spectr., 1962, 8
O\J\)
J. Am. Chem. Soc, 1955
77, 2948
Acta Chem. Scand., 1968
22, 51
J. Am. Chem. Soc, 1954
76, 2649
Trans. Farad. Soc 1954
50, 452
Acta Chem. Scand 1969
23, 1398
TeBr2
Te[S2P@CHoJ"l2
Te[SeP(C2H5JSl2
R_Te-R
98°
98
101
Te-R, A
2,51
2,44
2,50
ЭД
РД
РД
J. Am. Chem. Soc, 1947
69, 2102
Acta Chem. Scand., 1966
20, 24
Acta Chem. Scand., 1969
23, 1389
мв — микроволновая, кр — комбинационного рассеяния, ик —инфракрасная спект-
роскопия; эд — электронная, рд — рентгеновская дифракция.
кул приводит к остаточной энтропии, равной 7з^1п2 (на 1 моль
Sg), т. е. 0,057 э. е./г-атом), что разумно согласуется с наблю-
даемой величиной @,045 э. е./г-атом). Еще одна моноклинная
форма, полученная Мутманом (y-Ss), также состоит из коро-
нообразных молекул S8 [5a]. Очень схожи по строению с S8
440 16. Сера, селен, теллур
циклические молекулы S5Se3 (изоструктурная Y"Ss) [561 1J
S4Se4 [5в], кольца которых построены из чередующихся ато-
мов S и Se, и молекулы Ss-ti(NH),, (разд. 18.9), из которых
S6(NHJ также изоструктурна y-S&.
Ромбоэдрическая сера, приготовленная Энгелем в 1891 г.
кристаллизацией из толуола, быстро распадается на смесь
аморфной и ромбической модификаций. Ромбоэдрические кри-
сталлы состоят из молекул S& (конфигурация в форме креола)
с расстоянием S—S, равным 2,06 А, валентным углом 102° и
диэдрическим углом 75° [6]. Масс-спектрометрическое иссле-
дование показывает, что сера в энгелевской модификации ис-
паряется в виде молекул S6 [7], тогда как пар над ромбиче-
ской серой при температурах, превышающих точку кипения,
состоит преимущественно из молекул Sg с той же конфигура-
цией, что и в кристалле [8]. (Пар над FeS2 при 850°С состоит
из молекул S2, идентичных структурным единицам в кристалле
[9], а при масс-спектрометрическом изучении твердых раство-
ров S—Se обнаружены пики, обусловленные S7Se, S6Se2, S=Ses
и, возможно, другими молекулами.)
С помощью реакций полисульфанов с дихлорополисульфа-
нами или (C5H5JTiS5 с S2mCl2 было выделено много новых
кристаллических форм серы с циклическими молекулами 5П
(п = 7*, 9*, 10*, 11, 12, 13, 18, 20) (рис. 16.1); некоторые из них
(отмеченные звездочкой) неустойчивы при комнатной темпера-
туре. Мы приводим указания на литературные источники толь-
ко для тех производных, структуры которых уже определены
[11]. В высокосимметричной молекуле Si2 (S—S 2,05 А, ва-
лентный угол 106,5°, диэдрический угол 86°) шесть атомов
кольца, обозначенных как а на рис. 16.1, в, компланарны, три
атома Ь лежат выше, а три атома с — ниже плоскости шести-
угольника из атомов а. Кольца S7 будут рассмотрены при об-
суждении S7O (разд. 16.7) и S7I4" (разд. 16.5). Информация
о Si 1 содержится в статье [Пд].
Циклические и полиэдрические катионы серы, селена и тел-
лура рассматриваются ниже.
Диссоциация молекул серы на атомы в паровой фазе даже
при давлении 0,1 мм рт. ст. заметна лишь при температурах,
превышающих 1200°С. Если пар, находящийся при температу-
ре 500 °С и давлении 0,1—1,0 мм рт. ст., состоящий преимуще-
ственно из молекул S2, конденсируется на поверхности, охлаж-
денной до температуры жидкого азота, то сера осаждается в
виде твердого пурпурного продукта, который при нагревании
переходит в смесь кристаллической и аморфной модификаций.
Парамагнетизм пурпурной формы подтверждает предположе-
ние о том, что она состоит из молекул S2. Пар над жидкой
серой, находящийся при более низких температурах B00—
16.2. Элементные сера, селен и теллур 441
400 °С), может быть сконденсирован в виде твердого зеленого
препарата, не являющегося смесью пурпурной и желтой моди-
фикаций; пар над твердой серой конденсируется в виде желто-
го продукта [12]. Помимо отмеченных выше молекул с боль-
шими кольцами в парообразном и жидком состоянии у серы
идентифицированы также молекулы S3, S4, S5 [13].
Волокнистая или пластическая сера образуется в результа-
те растяжения образца, полученного путем закаливания распла-
Рис. 16.1. Конфигурация молекул: a) S? (пунктирный кружок изображает по-
зицию атома О в S7O или I в S7I+); б) Sioi е) циклической S12; г) SbO-SbC!5.
на от температур выше 300СС. Она содержит некоторое коли-
чество y-Ss — упомянутой выше моноклинной формы, которая
экстрагируется растворением в CS2. Кристалличность остав-
шейся Бф может быть улучшена отжигом растянутых волокон
при 80°С в течение 40 часов. Рентгеновское исследование таких
волокон показывает, что они представляют собой ансамбль
плотно упакованных по гексагональному мотиву спиральных
молекул, состоящих из равного количества молекул с левым
или правым винтовым вращением. Длина связи S—S в этих
молекулах составляет 2,07 А, величина валентного угла—106°,
диэдрического угла — 95° [14]. Отличительная особенность
спиралей — периодичность в 10 атомов, на которые приходит-
ся 3 витка спирали; селен и теллур, как будет показано ниже,
имеют совсем иное строение спиралей. Описанная волокни-
стая сера, по-видимому, идентична одной из фаз высокого дав-
ления.
442 16. Сера, селен, теллур
Свойства жидкой серы очень сложны, и, хотя уже имеется
большое число теоретических и экспериментальных работ на
эту тему, в настоящее время, кажется, отсутствует теория,
удовлетворительно объясняющая все особенности расплава
[15]. При плавлении сера образует высокоподвижную жид-
кость (S,.), состоящую из циклических молекул Se, но при
159°С начинается экстремально быстрое возрастание вязкости
расплава, достигающей максимального значения при 195 °С
(Sit) и уменьшающейся при дальнейшем повышении темпера-
туры. Удельная теплоемкость расплава также характеризуется
резким скачком при 159СС. Типичная Х-образная форма кри-
вой, описывающей температурную зависимость вязкости, явля-
ется следствием внезапной полимеризации серы; по оценкам,
сделанным на основании электронно-спинового резонанса и
измерений статической магнитной восприимчивости, средняя
длина цепи изменяется от 106 атомов при 200 °С до 103 при
550°С [16].
Из рентгенодифракционных эффектов от жидкой серы сле-
дует, что каждый атом в ней имеет в среднем два ближайших
соседа приблизительно на таком же расстоянии, как и в кри-
сталле.
Литература. [1] Inorg. Chem., 1970, 9, 1973, 2478. [2] J. Am. Chem. Soc, 1957
79, 4566. [31 Acta cryst., 1965, 18. 562, 566; 1972, B28, 3605. [4] Inorg. Chem
1976, 15, 1999. [5a] Acta cryst., 1974, B30, 1396. [56] Acta cryst., 1978, B34, 911
[5b| Ind. J. Chem., 1978, 16A, 335. [61 J. Phys. Chem., 1964, 68, 2363. [71 J. Chem
Phys., 1964, 40, 287. [81 J. Am. Chem. Soc, 1944, 66. 818. |9| J. Chem. Phys
1963. 39, 275. [10'| J. Inorg. Nucl. Chem., 1965, 27, 755. [lla] S7- Angew Chim
(Intern. Ed.), 1977, 16, 715. [116] S,n: Angew. Chem. (Intern. Ed.), 1978. 17
.17. [11b] S!2: Angew. Chem. (Intern. Ed.), 1966, 5, 905. fllrl S8. S,-t: Z. anorg
alls. Chem., 1974. 405, 153. [11д1 S,,: Chem. Comm. (J Chem Soc Chem
Comrn.), 1982, 1312. [12] J. Am. Chem. Soc, 1953, 75, 848, 6066. [Щ Обзор по
элементной сере: Chem. Rev., 1976, 76, 367. [141 J- Chem. Phys.. 1969, 51, 348
Г151 J. Phys. Chem., 1966, 70, 3528, 3531, 3534. [16] Trans. Faraday Soc, 1963
59, 559. [17] J. Chem. Phys., 1959, 31, 1598.
16.2.2. Селен. Обычно селен поступает в продажу в стеклооб-
разной форме, которая при нагревании и последующем медлен-
ном охлаждении превращается в серую «металлическую» моди-
фикацию. Две красные метаетабильные полиморфные формы
могут быть выкристаллизованы из раствора bCS2 [1,2], а тре-
тья— при взаимодействии CS2 с дипиперидинотетраселенаном
Se4(NC5HioJ [3]. Это — необычный случай полиморфизма,
так как все три модификации относятся к одной и той же про-
странственной группе и построены из одного и того же вида
циклических молекул Se8 (Se—Se 2,33 А; валентный угол
106°); они отличаются друг от друга только способом упаковки
молекул. Металлический селен состоит из бесконечных спи
ральных цепей (Se—Se 2,37 А, валентный угол 103°) [4]. Кри-
16.3. Циклические и полиэдрические катионы
443
пая атомного радиального распределения стеклообразного
селена, определенная с помощью как рентгеновской, так и ней-
тронной дифракции, показывает, что эта форма состоит из та-
ких же спиральных цепей (пики при 2,33; 3,7; 5,0 А) [5].
Литература. [1] Acta cryst., 1972, В29, 313. [2] Acta cryst., 1953, 6, 71. Ml J.
dun). Soc, D 1980, 624. [4] Inorg. Chem., 1%7, 6, 1589. [5] J. Chem. Phys.,
19ii7, 46. 585.
16.2.3. Теллур. Обычной модификацией теллура, стабильной
при атмосферном давлении, является гексагональная (метал-
лическая), изоструктурная металлическому селену; расстоя-
ние Те—Те в ней составляет 2,835 А, а валентный угол — 103,2'
[Acta cryst., 1967, 23, 670]. Найдены также две разновидности
кристаллического теллура, устойчивые при высоком давлении.
Одна из них (с неизвестной структурой) стабильна в интерва-
ле давлений 40—70 кбар, другая—свыше 70 кбар. Последняя,
по-видимому, нзоструктурпа р-Ро, кристаллическая решетка
которого может рассматриваться как результат сжатия про-
стой кубической решетки вдоль оси [111] [J. Chem. Phys.,
1965, 43, 1149]. Расстояния между ближайшими соседями в ре-
шетке этой модификации составляют:
3,00А Ср. в гекгаготльмом теллуре:
Те
6Те
6Те
2Те
3,
з,
72А
82.А
( 2Те
ТС \ 4То
2,
<->,
84А
50.4
16.3. Циклические и полиэдрические катионы серы,
селена,теллура
Сера, селен и телл\гр в отличие от кислорода, образующего
единственный катион О2+, формируют разнообразные виды ка-
тионов. Так, ион S5+ идентифицирован в окрашенных раство-
рах в олеуме как парамагнитная частица, а в кристаллических
солях изучена структура ряда ионов S,,2+. Эти ионы высоко-
-)лектрофильны и могут быть получены только в очень кислых
растворителях и выделены в виде устойчивых твердых соеди-
нений с анионами самых сильных кислот типа SO3F~, AsF6~,
SboFn^. A1C1.T. Методы их приготовления включают окисле-
ние серы пентафторидом мышьяка в безводном HF или SO2,
что приводит к образованию красного Si9(AsF6J и голубого
S8(AsF6J; избыток S2O6F2 и S в жидком SO2 образуют бес-
цветный S4(SO3FJ. Аналогичные соединения селена и теллура
могут быть приготовлены подобным образом, а также в рас-
плавах Se(Te)Cl4—А1С13, содержащих Se(Te) (ср. с катиона-
ми ртути, разд. 26.3.1).
444 16. Сера, селен, тел.
¦VJP
Строение этих катионов уже изучено в их солях с анионами
типа AsFe~, SbFe" или, в случае Те42+, с анионами А1С14~,
А12С17-. Ионы S42+ [1], Se42+ [2], Те42+ [3], грамс-форма
Te2Se22+ имеют планарную конфигурацию, близкую к квадрат-
ной, длины связей в которой немного короче обычной для ор-
динарной связи; строение этих ионов сопоставимо со строени-
ем планарного кольца N2S2 в N2S2(SbCl5J (разд. 18.9). Вось-
мичленные циклические катионы S82+ и Se82+ в Ss(AsF6J [4] и
Sefa(A1C14J [5] имеют одинаковую конфигурацию (рис. 16.2, а),
а ^ 6
Рис. 16.2. Конфигурации катионов: a) Ss2+; б) Se;o2+ или Te2Sea2+ (атомы
теллура заштрихованы); в) Te2Se42+; г) Te3Se32+; д) Теб4+.
являющуюся промежуточной между коронообразной в случае
S8 D8 валентных электронов) и конфигурацией N4S4 D4 ва-
лентных электрона) (разд. 18.9). Значения длин связей в коль-
цах обычные, но среди поперечных расстояний (изображенных
на рис. 16.2, а штриховыми линиями) одно очень короткое
(S—S 2,86 A; Se—Se 2,83 А), а остальные два не столь корот-
ки, но все же значительно меньше обычных для вандервааль-
совых связей (S—S 2,97 A; Se—Se 3,33 А).
Катионы, содержащие 10 атомов, представлены ионами
Se102+ [6] и Te2Se82+ [7]. Они обладают одинаковой структу-
рой, альтернативно описываемой или как шестичленное коль-
цо в форме ванны, замкнутое мостиковой цепочкой из 4 атомов,
или как конфигурация, образованная двумя «спаянными» 8-
атомными кольцами. Заштрихованные кружки на рис. 16.2, б
изображают атомы теллура в Te2Se82+ [8]. Наиболее приме-
чательный из катионов серы — катион, обнаруженный в
Sig(AsF6J: он состоит из двух 7-членных колец, соединенных
цепочкой из 5 атомов серы [8].
16.4. Молекулы SR2, SeR2, TeR2 445
Катионы S62+, Se62+, Теб2+ пока еще не получены, но из-
вестны два «гетерокатиона»: Tc2Se42+ и Te3Se32+; их строение
изображено на рис. 16.2, в и 16.2, г соответственно. В струк-
турном отношении к ним близок ион Теб4+ [10]—первый при-
мер полиэдрического катиона теллура (рис. 16.2, д). Длины
связей в треугольных «гранях» (рис. 16.2, д) имеют величины,
типичные для таких катионов (около 2,67 А), а связи, изоб-
раженные пунктиром, заметно длиннее C,12 А).
Литература. [1] Chem. Soc. Rev., 1979, 8, 315. [2] Inorg. Chem., 1971, 10, 2319.
C) Inorg. Chem., 1972, 11, 357. [4] Inorg. Chem., 1971, 10, 2781. [5] Inorg. Chem.,
1971, 10, 2749. [6] Inorg. Chem., 1980, 19, 1432. [7] Inorg. Chem., 1976, 15, 7G5.
[8] Inorg. Chem., 1980, 19, 1423. [9] Inorg. Chem., 1977, 16, 892. [10] Inorg.
Chem., 1979, 18, 3086.
16.4. Молекулы SR2, SeR2,
циклические молекулы
Структурные данные для изогнутых молекул SR2, SeR2 и TeR2
помещены в табл. 16.2. Валентные углы, близкие к 100°,
найдены также в циклических молекулах, в основе конфигура-
ции которых лежат ненапряженные шестичленные кольца,
имеющие форму кресла; в качестве примеров могут служить
1,4-дитиан [1], 1,3,5-тритиан [2], S5CH2 [3], S6(CHL [4],
структурно сходный с (СН2N(СНL и (CH2NN4 (разд. 18.4).
Показано, что в таких циклических молекулах, как
СНг-СН2 [5] и
1 S—J
= СН-СН=СН [6]
углы имеют меньшие значения F6 и 91° соответственно).
Литература. [1] Acta cryst., 1955, 8, 91. [2] Acta cryst., 1969, B25, 1432. [3] Z.
anorg. allg. Chem., 1976, 423, 103. [41 Ark. Kem., 1956, 9, 169. [5] J. Chem. Phys.,
1952, 19, 676. [61 J. Am. Chem. Soc, 1939, 61, 1769.
16.5. Галогениды серы, селена и теллура
Соединения, рассматриваемые ниже, по всей видимости, оха-
рактеризованы достаточно хорошо. Некоторые из них известны
уже давно, тогда как другие приготовлены относительно не-
давно специально разработанными методами. Примерами пос-
ледних веществ являются Se2F2 и SeF2, которые были иденти-
фицированы среди продуктов реакции селена с сильно разре-
женным фтором. Прежде чем описывать структуры дигалоге-
нидов, отметим некоторые моменты, представляющие особый
интерес. Во-первых, эти соединения значительно различаются
по своей устойчивости; во-вторых, некоторые из них существу-
44G
10. Сера, селен, теллур
ют только в кристаллическом виде, а другие — только в паро-
образном состоянии. Мало что известно об иодидах серы и се-
лена, причем не найдено никаких иодидов серы, устойчивых
при комнатной температуре, хотя и имеется спектроскопиче-
ское доказательство существования S2I2 [la]. Галогениды халь-
когенов в низших степенях окисления обсуждаются несколько
ниже; они присущи только теллуру.
Неизвестный ранее катион (S;I)+ (рис. 16.1, а) был
ружен в соли (S71) (SbF6) [16], приготовленной из
иода и пептафторида сурьмы в растворе AsF3. С
щью той же реакции получен (S14I3) (SbF6K-2AsF3, в
SI
ром катион состоит из двух единиц S7I,
линейный 1-мостик [1в]. Ион S2Li2u был
(S;I4) (AsF6J [1г]. Он состоит пз двух
S2I;, соединенных общей связью S—S;
плоскостями составляет 90°. Структура S^
соединенных
исследован в
оона-
серы,
помо-
кото-
через
соли
пшопоставлена конфигурации
(рис. 19.5, разд. 19.4.3).
планарпых единиц
угол между двумя
42+ может быть про-
пзоэлектронной молекулы Р2Ь,
Низшие хлориды типа S/,C12 вплоть до S5C12, состоящие из
цепочек S71, оканчивающихся атомами хлора, могут быть при-
готовлены из SClo и H2Sn (n—l, 2, 3), а гомологи, более бога-
тые серой, вплоть до SsCl2— из S2Cl2 и H2Sn. Действием НВг
эти хлориды могут быть переведены в SnBr2 (n = 2—8).
S,F,
SF?
SF4
Ы-e
bob.
S2Clo
SCI2
SC14
0 S,,CI2
Галоген!
s?
S,,
'¦ДЫ
Br,
Br2
Sc2F2
ScF2
ScF4
SeF6
теллура: Те
SeoCl2
ScCI2
ScCl4
2CI, Te3C
Sc2Br2
ScBr2
SsBr4
W, Te2Br;
TeF4
TeF6
Te2F,o
Te2I, Tel
TeCI2
TeCL,
(аир).
TcBr2
TeBr4
Tel4
SF2 является нестабильным продуктом: он был исследован
в ячейке микроволнового спектрометра, но в индивидуальном
16.5. Галогениды 44/
состоянии не выделен; его структура определена из моментов
инерции 32SF2 и 34SF2.
Структура SCU обсуждалась в течение многих лет. Это
соединение при температурах ниже —30°С представляет собой
твердое желтое вещество; при —30ГС оно плавится, превраща-
ясь в красную жидкость, являющуюся смесью SC12 и СЬ. Пос-
ледний выделяется в виде газа, и при комнатной температуре
происходит полная диссоциация тетрагалогепида на SCl^ и
С12. При замерзании жидкости состава SC14 ее диэлектрическая
проницаемость возрастает с 3 до 6; это подтверждает мысль о
том, что твердый продукт представляет собой соль (SCl3)Ci.
Тетрахлорид и тетрабромид селена, подобно SCU, диссоцииру-
ют при испарении на галоген и дигалогенид селена; эти тетра-
галогениды существуют только в твердом состоянии. С другой
стороны, плотность пара над ТеСЦ соответствует этой формуле
вплоть до температуры 500 °С; это единственный из всех тст-
рагалогенидов халькогенов, который может быть изучен в
парообразном состоянии.
Химия теллура и в остальных случаях, подобно рассмотрен-
ному примеру с галогенными соединениями, существенно от-
лична от химии серы и селена. Из этих элементов лишь тел-
лур образует все четыре тетрагалогенида; его дигалогениды
ТеС12 и ТеВг2 известны только в газообразном состоянии; и в
низших степенях окисления теллур образует хорошо идентифи-
цированные галогениды. В последних соединениях теллур де-
монстрирует разнообразную координацию, будучи связанным
только с двумя атомами теллура (или с 2 Те) и с одним или
двумя атомами галогена. В Те3С12 [2] имеются спиральные
цепочки из атомов Те, к каждому третьему из которых присое-
динены 2 атома С1; этот третий атом Те приобретает «трпго-
нально-бипирамидальную» координацию (схема а; см. ниже),
подобную координации в TeS7Cl2 [3], где два атома хлора
связаны с атомом Те, входящим в 8-членное кольцо (типа а).
В галогепидах Те2Х [2] имеются сдвоенные цепи (схема 6),
в которых теллур поочередно связан с 3 Те или 2 Те и 2Х.
В структурном отношении очень близка к этим соединениям
(метастабильная) р-форма Tel [2] (схема е), в которой атомы
теллура имеют поочередно планарную квадратную и триго-
нально-пирамидальную координацию. Более стабильная а-мо-
дификация Tel состоит из циклических молекул Te4l4, которые
соединяются в цепи более слабыми связями, показанными на
схеме г прерывистыми линиями. Именно к этим стехиометри-
ческим иодидам относится та информация, которая первона-
чально в литературе приписывалась Те.Л или Те„1п.
Уместно упомянуть, что существует и другой «субгалоге-
чпд», который также включает цепи —Те—Те—, а нменш;
448 16. Сера, селен, теллур
а
Те
\/
Л
Те
А .А
\/
Л
\/
Те
\/
Л
\т
Те
/\
е
-I 1—1
Те
/\
Те
Л,
СиТе2С1 [4]. Это соединение имеет слоистую структуру, пост-
роенную из таких цепей, соединенных между собой мостиками
, как показано она схеме д. Каждый атом Си связан
с двумя Те и двумя С1 и образует четыре тетраэдрические свя-
зи.
16.5.1. Галогениды типа SX2. Структурная информация
уголковых молекулах SCb и ТеВг2 приведена в табл. 16.2.
об
16.5.2. Галогениды S2X2 и их аналоги. У галогенидов серы
SoX2 помимо изомера со структурой XS—SX (имеющей две
энантиоморфные формы) возможен топологический изомер
S—SX2. Изомерию такого типа проявляет S2F2. Оба изомера
образуются, когда смесь AsF и S нагревается в вакуумирован-
ном стеклянном сосуде до 120 °С. Изомер S = SF2 — пирами-
дальный [5], его строение очень бл-изко к конфигурации OSF2
(рис. 16.3, а и б); данные для OSF2 приведены в табл. 16.3
(разд. 16.8.1). Изомер FS—SF имеет структуру типа НгСЬ с
16.5. Галогениды 449
неожиданно короткой связью S—S A,89 А по сравнению с
1,97 А в S2CI2 и 2,055 А в S2H2 [5a]) и аномально длинной
связью S—F A,635 А). О деталях структуры S2F2, S2CI2 и
S2Br2 можно судить по данным, приведенным в табл. 16.6
(разд. 16.9).
а
1,41 А
о
106,8°
S 1.5КА
Рис. 16.3. Строение молекул: a) S2F2; б) SOF2; в) SF4; г) SOF4; д) SF5OF.
16.5.3. Галогениды SX^ и их аналоги; молекулы. R2SeX2 и
R2TeX2. Как уже отмечалось, некоторые из тетрагалогенидов
халькогенов могут быть изучены в парообразном состоянии.
Молекулы SF4 и R2SeX2, R2TeX2 имеют конфигурацию триго-
нальной бипирамиды, в которой одна экваториальная позиция
занята неподеленной парой электронов. Стереохимия этих мо-
лекул уже обсуждена в гл. 6. Характерной их особенностью
является то, что аксиальные связи, во-первых, коллинеарны с
точностью до нескольких градусов и, во-вторых, длиннее, чем
экваториальные в молекулах SX4 (или имеют большее значе-
ние, чем сумма ковалентных радиусов в молекуле RSeX2).
Имеющаяся в SF4 неподеленная электронная пара использу-
ется в OSF4 для образования пятой связи, и эти две молекулы
имеют очень сходную конфигурацию (рис. 16.3):
аксиальная S—F
экваториальная S—F
SF4 Г61
1,643 А
1,542 А
OSF4 П
1,583 А
1,550 А
29—985
450 16. Сера, селен, теллур
Микроволновое исследование SeF4 показывает, что эта мо-
лекула имеет в основном ту же форму, что и SF4 с аналогич-
ным соотношением между длинами экваториальных и аксиаль-
ных связей: Se—F 1,68 А (экваториальные), 1,77 А (аксиаль-
ные); F—Se—F 100,55° (экваториальный), 169,20° (аксиаль-
ный). Информация, касающаяся соединений с NbF5, содержа-
щих ион SeF3+, приводится в разд. 16.10.2. Не имеет смысла
обсуждать результаты ранних работ по электронной дифрак-
ции парообразного ТеСЦ [8а], так как там предполагалось, что
все четыре связи в молекуле имеют одинаковую длину
B,33 А); более приемлема молекулярная конфигурация типа
J,87 A
1,92А
Z.Z6A
2,08 А
Рис. 16.4. Структура кристаллического TeF4. а — цепочечная молекула; б —
длина связей.
SF4, она соответствует тому факту, что ТеСЦ в бензольном
растворе имеет дипольный момент B,54 Д).
Примерами других молекул, имеющих такую же форму, как
SF4, являются Se(C6H5JCl2" и Se(C6H5JBr2, Те(СН3JС12 и
Те(СбН5)гВг2. Во всех этих молекулах атомы галогена занима-
ют аксиальные позиции. С деталями их структур можно позна-
комиться в разд. 16.10.2.
Кристалл TeF4 — не молекулярный, а состоит из цепей
TeF5, сочлененных парой общих цис-агошов фтора [9] (рис.
16.4, а). Имеется несколько способов описания координации
Те(IV) в этом соединении: 1) 3 атома расположены в верши-
нах тригональной пирамиды (усредненное значение валентного
угла 86,5°); 2) 4F (на рисунке заштрихованы) занимают вер-
шины тригональной бипирамиды (экваториальная неподелен-
ная пара); 3) 5F находятся в вершинах октаэдра (неподелен-
ная пара в позиции шестой связи). Атом теллура расположен
на 0,3 А ниже основания квадратной пирамиды, изображенной
на рис. 16.4.
Кристаллические SeCl4, ТеСЦ [10], SeBr4 [10a] и ТеВг4
состоят из тетрамеров типа [Pt(CH3KCl]4 с идеализированной
структурой, изображенной на рис. 5.8, к (т. 1, разд. 5.3.1).
В ТеСЦ атомы Те смещены параллельно осям С3 «куба» так,
что координация теллура оказывается искаженно октаэдриче-
16.5. Галогениды 451
ской: Те—ЗС1 2,31 А, Те—ЗС1 2,93 А; С1К0НЦ—Те—С1КоНЦ 95°;
CImoct—Те—С1М0СТ 85°. (Кристалл можно описать и как иска-
женную кубическую плотнейшую упаковку атомов хлора с ато-
мами теллура в одной четверти октаэдрических пустот, но сме-
шенных из центров этих пустот.) В пределе эта C+3)-коорди-
нация привела бы к разделению на ионы ТеС1з+ и С1~, а
последующее удаление одного или двух ТеС1з+ — к образова-
нию ионов Те3С113- и Те2С1ю2~. Первый из них уже исследован
Te-3CU,2,31 A
Те-3 CWm2,93
С1-Те-С1
95°
85°
в [(С6Н5KС] [Те3СЬз] [106]. Его структура соответствует
фрагменту, отделенному штриховой линией на диаграмме с
идеализированной структурой на рис. 5.8, д (т. 1, разд. 5.3.1).
Строение хлорокомплексов Те(IV) подчеркивает то обстоя-
тельство, что стереохимическое влияние неподеленной электрон-
ной пары —не простой вопрос. В ТеС13+ и ТеСЦ осуществлена
C+3)-координация; в ц«с-октаэдрической цепи ТеС15~ имеется
больший интервал длин связей Те—С1, чем можно было бы
ожидать при «конструировании» этого аниона простым совме-
щением двух ццс-вершин соседних фрагментов ТеС15~; в то же
время в ионе ТеСЦ2" не наблюдается каких-либо искажений
правильной октаэдрической конфигурации:
Октаэдрический
валентный
угол
Соседи теллура
Литература
(ТеС13) + (А1С14)- 95° 3 на расстоянии 2,28 A Z. anorg. allg. Chem,
3 на расстоянии 3,06 А 1971, 386, 257
ТеСЦ 90±5° 3 на расстоянии 2,31 A; Inorg. Chem., 1971, 10,
3 на расстоянии 2,93 А 2795
(ТеС15) (РС14)+ 90±5° 4 на расстоянии 2,31— Acta crysi, 1972 В28
2,51 А 1260
2 на расстоянии 2,68 А.
2,87 А
(TeCleJ-(NH4J+ 90° 6 на расстоянии 2,51 A Acta Chem Scand 1966
20, 165
29*
452 16. Сера, селен, теллур
Еще одно интересное обстоятельство: ион (ТеСЬ)?."" имеет
структуру, совершенно отличную от изоэлектронного (мономер-
ного квадратно-пирамидального) иона SbClr,2" (разд. 20.2.8);
с другой стороны, цепь TeF4 очень похожа на ионную (и изо-
молекулярную) цепь (SbF4)n"~ в NaSbF4.
Кристаллический Те14 [Юв] состоит из тетрамерных моле-
кул, но совершенно отличных от тетрамеров типа ТеСЦ, а
именно из четырех соединенных ребрами октаэдров, подобных
группам [Ti(ORL]4 (рис. 5.8, з; см. т. 1, разд. 5.3.1). Длины
связей Те—I для случаев, когда атом иода связан с одним,
двумя или тремя атомами теллура, составляют соответственно
2,77; 3,11; 3,23 А (для сравнения в Те162- — 2,93 А); интервал
длин связей сопоставим с наблюдаемым в упомянутом соеди-
нении титана. Неподеленная электронная пара, очевидно, ока-
зывает здесь малое стереохимическое влияние.
16.5.4. Гексагалогениды. С помощью электронографии или
микроволновой спектроскопии установлено, что молекулы SF6
[11], SeF6 [11], TeF6 [12], а также SF5C1 [13] и SF5Br [14]
имеют октаэдрическую конфигурацию, правильную в случае
гексафторидов:
S—F 1,56 A S—C1
Se—F 1,69 А
Те—F 1,82 А
2,03 A S—Вг 2,19 А
16.5.5. Декафторид дисеры S2F10. Электронографические дан-
ные для S2Fio согласуются с моделью, согласно которой струк-
тура этого галогенида состоит из двух групп SFs, связанных в
скрещенную конфигурацию так, что центральная связь S—S
оказывается коллинеарной с двумя связями S—F, а все ва-
лентные углы равны 90° (или 180°); длины связей S—F и S—S
составляют 1,56 и 2,21 А соответственно [15]. Возможно, что
длина связи S—S обусловлена отталкиванием атомов фтора.
Литература, [la] Z. anorg. allg. Chem., 1978, 443, 217. [16] Chem. Comm.
(J. Chem. Soc, Chem. Comm.), 1976, 689. [1в] Chem. Comm. (J. Chem. Soc,
Chem. Comm.), 1979, 901. [lr] Chem. Comm. (J. Chem. Soc, Chem. Comm.),
1980, 289. [2] Z. anorg. allg. Chem., 1976, 422, 17. [3] Acta cryst., 1972, B28,
3653. [4] Acta cryst., 1976, B32, 3084. [5] J. Am. Chem. Soc, 1963, 85, 2028.
[5a] J. Mol. Spectr., 1972, 41, 534. [6] J. Chem. Phys., 1963, 39, 3172. [7] J. Chem.
Phys., 1969, 51, 2500. [8] J. Mol. Spectr., 1968, 28, 454. [8a] J. Am. Chem. Soc,
1940, 62, 1267. [9] J. Chem. Soc, A 1968, 2977. [10] Inorg. Chem., 1971, 10,
2795. [10a] Z. anorg. allg. Chem., 1979, 451, 12. [106] Z. Naturforsch., 1979, 34b,
900. [10b] Acta cryst, 1976, B32, 1470. [11] Trans. Faraday Soc, 1963, 59,
1241. [12] Acta Chem. Scand., 1966, 20, 1535. [13] Inorg. Chem., 1976, 15, 3004.
f 141 J- Chem. Phys., 1963, 39, 596. [15] Trans. Faraday Soc, 1957, 53, 1545
1557.
16.6. Оксид-галогениды 453
16.6. Оксид-галогениды серы, селена и теллура
Перечень этих соединений подчеркивает две их особенности:
большое число производных серы и фактическое отсутствие
оксид-иодидов. Структурные характеристики пирамидальных
молекул тионилгалогенидов (SOX2) и тетраэдрических молекул
сульфурилгалогенидов (SO2X2) включены в табл. 16.3 и 16.4
(разд. 16.8). Строение SeOF2 и SeOCl2 было определено в не-
которых их аддуктах, что обсуждается в разд. 16.10.2.
SOF2
С12
Вг2
h
FC1
SOF4
SOF6
SOC1F5
SO3F2
SO2F2
Cl2
FC1
FBr
S2OF10
S2O2F10
S2O5F2
S2O6F2
S3O8F2
S3O8C12
SeOF2
Cl2
Br,
SeOF4
SeO,F2
Se2OF10
Se2O2F8
Te2OF10
Te2O2F8
TeF,,(OTeF5N-
На рис. 16.3 сопоставлено строение SOF4 [1] и SF4. Геомет-
рические формы этих молекул очень близки (S—О 1,41 А),
если отвлечься от увеличения экваториального валентного угла
F—S—F от 103° в SF4 (усредненное значение, полученное из
электронографических и микроволновых исследований) до
110° в SOF4. Длины связей S—F сопоставлялись ранее.
Электронографически подтверждено, что молекула SOF6
является гипофторитом пентафторида серы и, следовательно,
должна описываться формулой SF5(OF) (рис. 16.3,C) [1а].
Длины связей в этой по существу октаэдрической молекуле
имеют следующие величины: S—F 1,53 A; S—О 1,64 А; О—F
1,43 А; значения углов составляют: <р = 2°; 9 = 108°. SO3F2 —это,
вероятно, также гипофторит.
Диоксид-декафторид дисеры S2Fi0O2 является производным
пероксида водорода; структурная формула S2Fi0O2 выводится
из формулы Н2О2 путем замещения атома водорода группой
SF5. Диэдрический угол в S2F10O2 такой же, как в Н2О2 A07°),
а угол S—О—О составляет 105°. Согласно электронографиче-
ским данным, длины связей имеют приблизительно следующие
значения: О—О 1,46 A; S—О 1,66 A; S—F 1,56 А [2]. "
Пероксодисульфурилдифторид S2O6F2, по-видимому, имеет
строение аналогичного типа. Он представляет собой бесцвет-
ную жидкость приготовленную путем взаимодействия фтора с
SO3 при температуре выше 100°С; его химические свойства,
ИК,- и ЯМР-спектры подтверждают формулу FO2S—О—О—'
—SO2F [3].
Строение полисульфурилфторидов S2O5F2 (а) и S3O8F2
(б) установлено электронографическим методом [4]. В целом
они сходны со строением изоэлектронных им ионов S2O72~ и
$зО103~. Третьей молекулой с октаэдрической координацией
454 16. Сера, селен, теллур
серы является S2OFi0 (в), которая имеет заслоненную конфор-
мацию и характеризуется коротким внутримолекулярным рас-
стоянием F—F B,4 А); длины связей составляют: S—F 1,563 А;
S—О 1,586 А; угол S—О—S равен 142,5° [5]. Молекулы
Se2OF10 н Te2OFio имеют такое же строение [5а].
161А о 6 0 129° в у F
О \ п 1Л0А ^^О^и F | ,п
О О' 1,525A F Y У' F
Q 0 0 0
\
А
Молекула Se2O2F8 и ее аналог Te2O2F8 построены из плос-
ких 4-членных колец [6] (схема г), в которых: Se—О 1,78 А;
Те-0 1,92 A; Se—О—Se 97,5°; Те—О—Те 99,5°. Был получен
ряд соединений с общей формулой FnTe(OTeF5N-n; некоторые
из них известны как в цис-, так и в гране-форме (например,
д
о
F5Te0
F5Te0
OTeF5
OTeF,
молекула д) [7а]. Установлены структуры двух форм конечно-
го члена этой серии Te(OTeF5N [76]; аналогичную молекулу
образует также уран, U(OTeF5N [8].
Литература. [1] J. Chem. Phys., 1969, 51, 2500. [la] J. Am. Chem. Soc, 1959
81, 5287. [2] J. Am. Chem. Soc, 1954, 76, 859. [3] J. Am. Chem. Soc 1957 79
513. [4] Can. J. Chem., 1973, 51, 2047. [5] Angew. Chem. (Intern. Ed.), 1978, 90,
66. [5a] Inorg. Chem., 1978, 17, 1435. [6] Inorg. Chem., 1979, 18, 2226 [7a] Inorg
Chem., 1977, 16, 2685. [76] Inorg. Chem., 1978, 17, 1926. [8] Inorg. Chem., 1976,
15, 2720.
16.7. Оксиды серы, селена, теллура
Помимо SO2 и SO3 сера образует еще ряд малоустойчивых
оксидов, в том числе SO, SO4, S2O, S2O2, и группу циклических
молекул: S5O, SeO, S7O, S7O2 и S8O. Все соединения последней
группы, кроме S5O, существующего только в растворе, выделены
в индивидуальном состоянии и хорошо охарактеризованы. Про-
изводные S6 и S7 были приготовлены окислением серы в под-
ходящей форме действием SF3CO3H, a S8O—взаимодействием
SOC12 и H2Sn (разд. 16.9.2). В молекулах S7O [la] и S8O [16]
один атом кислорода присоединяется к кольцу, конфигурация
которого подобна конфигурации цикла S7 (рис. 16.1, а) или S8
16.7. Оксиды 455
(рис. 16.1, г). Однако атом серы, связанный с кислородом, на-
ходится на большем расстоянии от своих соседей (~2,2 А),
чем другие атомы кольца. Эти более длинные связи b и с (на
рис. 16.1, а) сопоставимы по длине с наиболее протяженной
связью а в самой молекуле S7 (длина связи S—О составляет
1,49 А). В SeO атом кислорода занимает аксиальную позицию,
отмеченную штриховой линией на рис. 16.1, г, где изображена
структура молекулы S8O-SbCl5 [1в]. Ее фрагмент S8O может
быть описан как геометрический изомер свободной молекулы,
но длина связи S—О возрастает от 1,48 А в свободной молеку-
ле до 1,55 А в SsO-SbCb, а длины соседних связей S—S умень-
шаются при таком переходе от 2,20 до 2,11 А.
16.7.1. Моноксид дисеры S2O. Этот очень неустойчивый оксид
образуется при воздействии тлеющего разряда на смесь SO2 с
парами серы и в некоторых других случаях. Из результатов
микроволнового исследования S2O [2а] следует, что связь S—О
в нем по существу двойная, как в SO2, и величина валентного
угла (схема а) близка к найденной в SO2.
16.7.2. Моноксид серы SO. Термин «моноксид серы» первона-
чально применяли (ошибочно) к эквимолярной смеси S2O и
SO2. Оксид SO является короткоживущим радикалом, образу-
ющимся, например, при взаимодействии атомарного кислорода,
возникающего в электрическом разряде, с твердой серой. При
быстром прокачивании продуктов реакции через ячейку волно-
вода может быть изучен их микроволновый спектр. На осно-
вании такого исследования установлено, что длина связи S—О
в SO составляет 1,48 А; ц=1,55 Д (для сравнения: в SOo u =
= 1,59 Д) [26].
16.7.3. Диоксид дисеры S2O2. С помощью микроволновой спект-
роскопии показано, что молекула S2O2 (см. выше схему б)
в газовой фазе должна быть планарной [2в].
16.7.4. Диоксид серы SO2. Строение этой молекулы было изуче-
но в кристаллическом и в парообразном состоянии спектроско-
пическими и дифракционными методами, а совсем недавно —
с помощью ИК-спектроскопии в матрице твердого криптона
[3]. Установлено, что валентный угол в SO2 близок к 119,5°,
456 16. Сера, селен, теллур
16.7. Оксиды 457
а длина связи S—О составляет 1,43 А. Величина диполыюго
момента в газообразной молекуле указана выше.
В качестве лиганда в комплексах переходных металлов ди-
оксид серы может вести себя различным образом: 1) атом се-
ры образует ординарную связь М—S с атомом металла, и все
три связи, исходящие от атома серы, размещаются пирамидаль-
но, как это имеет место в Ir(PPh3JCl(CO)SO2 [4]; 2) атом
серы использует свою неподеленную электронную пару для об-
разования а-связи с металлом, который в свою очередь обра-
зует л-связь с серой, что делает связь M=S кратной; при-
мер— [Run(NH3LSO2Cl]Cl [5а]; 3) молекула SO2 присоеди-
няется к одному и тому же атому металла как через серу, так
и кислород [56]; 4) молекула SO2 является мостиковой для
двух атомов металла [5в]. В случае 3 строение SO2 существенно
1,55А
(ф-(рени/г)
отличается от строения свободной молекулы, чего не наблю-
дается в случаях 1 и 2. Ситуация в случае 4 менее определен-
ная (S—О составляет 1,42—1,49 А; угол О—S—О равен 114—
117°).
4) О Рф3 О
-S Pt S-.
о
в которых длины связей составляют приблизительно: Se—О
1,78@,03) A; Se—О' 1,73@,08) А. У парообразных молекул SeO2
длина связи Se—О и величина валентного угла О—Se—О со-
ставляют (на основании микроволновых данных) 1,607 А и 114°
соответственно [7]. В паре над SeO2 также существуют димеры;
показанная ниже мостиковая структура димера основана на дан-
ных ИК-исследования (метод матричной изоляции) [8].
Se
16.7.6. Диоксид теллура ТеО2 [9а] существует в двух кристал-
лических формах: желтой ромбической (модификация, обра-
зующаяся при высоком давлении, и минерал теллурит) и бес-
цветной тетрагональной (минерал парателлурит). В обеих
¦^модификациях теллур имеет координационное число 4: ближай-
шие соседи размещены в четырех вершинах тригональной
бипирамиды, что свидетельствует о существенно ковалентном
1,93А
166,
Z.08A
1,90 А
Рис. 16.5. Структура кристаллического ТеО2. а, б—1еллурит; в — парателлу-
рит.
(ф-фенил)
16.7.5. Диоксид селена SeO2- Если кристаллический диоксид
серы состоит из дискретных молекул SO2, то кристаллический
SeO2 построен из бесконечных цепей типа
о
О'
характере связей Те—О. Теллурит имеет слоистую структуру
[96], построенную из групп ТеО4, которые образуют пары,
связанные общими ребрами (рис. 16.5, а); из этих" пар путем
обобществления оставшихся вершин формируется слой (рис.
16.5, б). Короткое расстояние Те—Те, 3,17 А (для сравнения:
кратчайшее расстояние в парателлурите равно 3,74 А), может
быть соотнесено с цветом теллурита. В парателлурите [10]
группы ТеО4, очень похожие на только что рассмотренные,
обобщают все свои вершины с образованием трехмерной струк-
туры с координацией D, 2); валентный угол при атоме О равен
140° (рис. 16.5, в). (Группы Те2О6, весьма напоминающие груп-
458 16. Сера, селен, теллур
пы в теллурите, встречаются в минерале деннингите (Мп, Са,
Zn)Te2O6.)
Рассмотренная серия диоксидов элементов VIB-группы пе-
риодической системы образует интересный ряд:
Диоксид
Координаци-
онное число
Тип структуры
so2
SeO-,
ТеО2
РоО,
2 Молекулярная
3 Цепочечная
4 Слоистая или трех-
мерная
8 Трехмерная (типа
флюорита)
16.7.7. Триоксид серы SO?,. Молекула БОз не обладает диполь-
ным моментом и, согласно электронографическим данным,
имеет симметричную планарную конфигурацию (S—О 1,43 А;
О—S—О 120°) [11]. SO3, подобно РгО5, имеет ряд полиморф-
ных модификаций, которые, как и в
случае Р2О5, заметно отличаются по
своей устойчивости к действию влаги.
Ромбическая модификация SO3
построена из тримеров (рис. 16.6, а).
Длина связи в кольце составляет
1,62 А, а между длинами аксиальных
и экваториальных концевых связей
S—О [12] имеется неожиданная (и не-
объясненная) разница A,37 и 1,43 А
соответственно). Угол S—О—S равен
121,5°.
В модификации со структурой ти-
па асбеста [13] имеются тетраэдриче-
ские группы SO4, образующие беско-
нечные цепочечные молекулы (рис.
16.6,6), где расстояние от серы до
кислорода в цепи составляет 1,61 А,
а до необобщенного кислорода —
1,41 А. Для объяснения необычных
физических свойств твердого и жидкого триоксида серы посту-
лировано, что помимо этих хорошо охарактеризованных моди-
фикаций с известными структурами существуют и другие поли-
морфные формы этого соединения. Свойства жидкого SO3 еще
не до копна понятны, и система по своей сложности, очевидно,
сопоставима с многообразием форм строения самой элемент-
ной серы, по отношению к которой SO3 топологически подобен
Рис. 16.6. а — циклическая
молекула S3O9 в ромбиче-
ской модификации триокси-
да серы; б — бесконечная
цепочечная молекула в мо-
дификации со структурой
типа асбеста.
16.7. Оксиды 459
в том смысле, что оба вещества могут образовывать цепочеч-
ные и циклические полимеры со структурными единицами соот-
ветственно —S— и —O(SO2)O—.
Из других оксидов серы описаны SO4 (получающийся при
воздействии электрического разряда на смесь О2 или Оз с SO2
или SO3) и S2O7, существование которого представляется менее
достоверным.
16.7.8. Триоксид селена SeO3. Чистый SeO3 может быть полу-
чен при нагревании K^SeCU с SO3; в результате взаимодейст-
вия веществ образуется жидкая смесь БеОз и SO3, из которой
более летучий SO3 может быть легко отогнан. Подобно БОз,
триоксид селена по крайней мере диморфен. Несмотря на то
что его циклическая модификация образует смешанные кри-
сталлы с S3O9 B5—100 мол. % SeO3), она состоит [14] из
тетрамерных молекул с конфигурацией, очень похожей на кон-
О'
1,55 А
1,77 А
фигурацию (PNCbh- Подобные молекулы преобладают и в
паре при 120°С [14а].
Соединение Se2O5, образующееся при термическом разложе-
нии SeO3, предположительно отвечает формуле SeIVSeVIC>5, так
как водой оно разлагается на эквимолярную смесь селеновой
к селенистой кислот.
16.7.9. Триоксид теллура ТеОъ. Триоксид теллура, получаемый
дегидратацией НбТеО6 в атмосфере кислорода в присутствии
концентрированной H2SO4, — относительно инертное вещество,
на которое не воздействуют холодная вода и разбавленные
щелочи, хотя оно может действовать и как сильный окислитель,
например, по отношению к горячей кислоте НС1. У ТеСь есть
вторая, еще более инертная модификация, которая образуется,
когда процесс кристаллизации проводится под давлением
[15а]. Первая из описанных форм изоструктурна FeF3, т. е.
имеет трехмерную структуру, построенную из октаэдров ТеО6,
у которых обобщены все вершины [156].
16.7.10. Оксиды Те2О5, Те^Ос, и дигидроксид-тетраоксид дител
лура Тв2.ОА(ОН)ь Три указанных соединения удобно рассмот-
реть вместе, поскольку все они содержат Те(IV) со связями
460 16. Сера, селен, теллур
направленными к вершинам тригональной призмы (ТеС^Е),
где Е—неподеленная пара электронов, и Те (VI) с октаэдри-
ческим размещением связей. В структурном отношении наибо-
лее близки между собой Те2О5 и Те2О4(ОНJ. В Те2О5 [16]
октаэдры TeVIO6, обобществляя четыре вершины, образуют
слой АХ4 (расстояние Те—О равно 1,92 А), а атомы Te(IV),
расположенные между этими слоями, связаны с двумя агома-
ми кислорода слоев АХ4 и двумя дополнительными атомами
кислорода, которые формируют цепи (TeIV0), как это показа-
Tev'O4-
у
Г
У
К
\
\
V \
L
<г
о
©
Л
Те (IV)
Te(VI)
а
Рис. 16.7. а — структура Те2О5; б — схема слоя Те4О9, изображенного как си-
стема 4-связанных атомов Те(IV) и 6-связанных атомов Те(IV).
но на рис. 16.7, а. В результате получается трехмерный каркас,
построенный из групп ТеО6 и ТеО4; это означает, что структура
(TeVIO4)TelvO почти аналогична структуре Sb2O4 (разд. 20.3.9),
(Sbv04)SbUI, отличаясь лишь наличием дополнительных атомов
кислорода у каждого атома Те(IV), расположенного между
слоями. В Те2О4(ОНJ [17] октаэдры TeVIO6 образуют цепи со-
става [ТеОз(ОНJ]я2"~, которые соединяются между собой с
помощью цепей
—Те О Те — О —
практически тем же способом, что и в Те2Оз. Результатом яв-
ляется слоистая структура, описываемая структурной форму-
лой [TeVIO3(OHJ]TeVIO. Оксид Те4О9 тоже имеет слоистую
структуру [18], но в ней каждый слой содержит как Te(IV),
так и Те(VI) (рис. 16.7, б), состав его описывается формулой
Te3IVTeVI09. Координация Те (IV) во всех трех структурах по-
добна координации в обеих модификациях ТеО2 (рис. 16.5,б).
16.8. Кислородсодержащие ионы и молекулы 461
Литература, [la] Angew. Chem. (Intern. Ed.), 1977, 16, 716. [16] Chem. Ber.,
1976, 109, 180. [1b] Chem. Comm. (J. Chem. Soc, Chem. Comm.), 1980, 180.
|2a] J. Mol. Spectr., 1959, 3, 405. [26] J. Chem. Phys., 1964, 41, 1413. [2в] J.
Chem. Phys., 1974, 60, 5005. [3] J. Chem. Phys., 1969, 50, 3399. [4] Inorg. Chem.,
1966, 5, 405. [5a] Inorg. Chem., 1965, 4, 1157. [56] Inorg. Chem., 1980, 19, 3003.
[5b] Inorg. Chem., 1977, 16, 1052. [6] J. Am. Chem. Soc, 1937, 59, 789. [7] J.
Mol. Spectr., 1970, 34, 370. [8] J. Mol. Struct., 1971, 10, 173. [9a] Phys. Rev.,
1975, B12. 1899. [96] Z. Kristallogr., 1967, 124, 228. [10] Acta Chem. Scand.,
1968, 22, 977. [11] J. Am. Chem. Soc, 1938, 60, 2360. [12] Acta cryst., 1967, 22,
48. [13] Acta cryst., 1954, 7, 764. [14] Acta cryst., 1965, 18, 795. [14a] Rec. Trav.
Chim. des Pays-Bas (Belg.), 1965, 84, 74. [15a] Z. anorg. allg. Chem., 1968, 362,
98. [156] Сотр. rend. (Paris), 1968, 266, 277. [16] Acta cryst., 1973, B29, 643.
[17] Acta cryst., 1973, B29, 956. [18] Acta cryst., 1975, B31, 1255.
16.8. Кислородсодержащие ионы и молекулы,
образованные S, Se и Те
Основное внимание в данном разделе будет уделено соедине-
ниям серы, так как в указанной группе они наиболее много-
численны и важны. Однако наряду с ними в рассмотрение бу-
дут включены и те производные селена и теллура, которые
структурно сходны с соответствующими аналогами серы, на-
пример ионы ХОз2" и ХО42~. Ионы же и молекулы со стереохи-
мией, присущей именно селену и теллуру, например комплекс-
ные кислородсодержащие ионы теллура, рассматриваются от-
дельно в последнем подразделе. Изложение материала по
тиосоединениям построено следующим образом: вначале описы-
ваются пирамидальные и тетраэдрические молекулы и ионы,
затем олигомерные и полимерные ионы, образованные тетра-
эдрами SO4 с общими кислородными атомами, и, наконец, ионы
S2O42~ и S2O52~. Тионаты включены в следующий основной раз-
дел вместе с соединениями, содержащими цепи Sn. Пероксо-
ионы рассматриваются в гл. 11, кристаллические структуры
кислот (H2Se03, C6H5SeO-OH, H2SO4, SO3NH3) — в гл. 8, а
Те(ОНN —в гл. 14.
16.8.1. Пирамидальные ионы и молекулы. Пирамидальные ионы
и молекулы включают следующие типы:
\°>-°т \к-
;s-o
R
;s-o
R
;s-r
а
а) Установлено, что все сульфит-, селенит- и теллурит-ионы
имеют форму пирамид с параметрами, охарактеризованными
в табл. 16.3.
В качестве лиганда анион SO32~ присоединяется к переход-
ным металлам через атом серы, как, например, в
Таблица 16.3. Пирамидальные молекулы и ионы
а)
Соединение
(SO3)Na2
(SO3)Fe
(SeO3)Mg.6H2O
(SeO,OH)Li
SeO(OHJ
(TeO3)Na2-5H2O
M—О, А
l,5la
1,543
1,69
1,66
1,64
1,86
M—OH, A
1,79
1,74
O—M—O,
град
106a
103
101
99,5
Литература
Acta Chem.
26, 218
Acta cryst.
1297
Acta cryst.,
Acta crvst.
3011
Acta Chem.
25, 1233
Acta cryst.,
1337
Scand.,
1980,
1966, 20,
, 1979,
Scand.,
1979,
1972,
B36,
563
B35,
1971,
B35,
a Длины этих связей и величины углов зависят от окружения кислородных ато-
мов; интервал длин S—О составляет 1,45—1,55 А, а углов О—S—О 114—102°.
б)
Молекула или ион
O2S(CH2OH)-
O2S-C(NH2J
HO-OS(CH3)
s — о„ a
1,51
1,49
1,50 (S—О)
1,60 (S-OH)
s —с, a
1,83
1,85
1,79
o—s—o.
град
109
112
108
Литература
J. Chem. Soc, 1962, 3400
Acta cryst., 1962, 15, 675
Acta cryst., 1969, B25,
350
Молекула
F2SO
C12SO
Br2SO
(CHsbSO
(C6H5JSO
SeOF2
SeOCb
R—S-O,
град
106
106
108
107
106
R—Se—О
105
106
R—S-R,
град
92
114a
96
97
97
R-Se-R
92
97
S-R, A
1,58
2,07
2,27
1,80
1,76
Se-R
1,73
2,20
s—0,
A
1,42
1,45
1,456
1,53
1,47
Se—О
1,58
1,61
Метод
ЭД
ЭД
ЭД
РД
РД
MB
ЭД
Литература
J. Mol. Struct., 1973,
10, by
J. Am. Chem. Soc,
1938, 60, 2360
J. Am. Chem. Soc,
1940, 62, 2477
Acta cryst., 1966,
Acta crvst., 1957
10, 417
J. Mol. Spectr.
1968, 28, 461
J. Mol. Spectr.
1976, 31, 261
16.8. Кислородсодержащие ионы и молекулы 463
г)
Продолжение
Соль
S(CH,);.I
[S(CH:),(CdH,)lC104
S-C, A
1,83
1,82
с - s - с.
град
103
103
Литература
Z. Kristallogr., 1959, 112
401
Acta cryst., 1964, 17, 465
Углы менее 106° не тестировались. Предполагаемые значения.
б
Coen,(NCS)SO3 [1], Pd(SO3) (NH3K [2], Na2fPd(SO3J(NH3J] •
•6H2O [3], Na6[Pd(SO3L]-2H2O [4] и K3[Pt{(SO3JH}Cl2]
(разд. 8.4), но в случае K2[Pd(SO3J] -H2O [5] он выступает в
качестве мостикового лиганда, образуя связь с одним атомом
металла через серу, с другим — через кислород:
О о
\/
J.J2A /S-—
о о
X
б) Можно было ожидать, что ион SO3H~ будет относиться
к тому же типу, т. е. должен быть представлен структурной
формулой (O2S—ОН)~. Правда, само существование гидро-
сульфитов («бисульфитов») до последнего времени считалось
сомнительным, но теперь соли M(SO3H) с M = NH4, Rb и Cs
уже хорошо известны, и из спектроскопических данных следу-
ет, что вероятная структурная формула этих веществ такая:
(Н—SO3)~ со связью S—Н. Первое рентгеновское исследование
кристаллической соли CsHSO3 показывает, что ион HSO3~ при-
надлежит к точечной группе симметрии C3v, и, хотя атом Н не
локализован, представляется вполне вероятным, что этот ион
имеет тетраэдрическое строение HSO3~, такое же, как и у иона
НРО32~. Поэтому соль CsHSO3 помещена в табл. 16.4 (е).
Из замещенных сульфитных ионов известны SO2F- (соли
щелочных металлов, получаемые прямым взаимодействием SO2
с MF) и O2S-CH2OH-. Гидроксиметансульфинат натрия (ди-
гидрат) используется в качестве восстановительного агента при
кубовом крашении. Он приготовляется путем восстановления
464 16. Сера, селен, теллур
смеси NaHS03 и формальдегида цинковой пылью в щелочном
растворе. Ион O2S-CH2OH~ имеет такую структуру:
О
109
1,51 А 101
1,83 А
ЮГ
в) Самыми простыми представителями рассматриваемого
класса являются тионилгалогениды SOX2 и аналогичные соеди-
нения селена (табл. 16.3); об аддуктах SeOF2 и SeOCl2 инфор-
мация приводится в разд. 16.10.2. Оптическая активность асим-
метрических сульфооксидов типа OS (CH3) (С6Н4СООН) и
структурные исследования (СН3)г5О и (C6H5JSO подтвержда-
ют пирамидальную форму этих молекул.
г) Непланарность конфигурации сульфониевых ионов сле-
дует из оптической активности асимметрических ионов типа
[§(СНз) (С2Н5) (СН2СООН)]+ и подтверждается рентгеновским
изучением солей [S(CH8K]I и [S(CH3bC6H6]C104 (табл. 16.3).
Литература. [1] Acta cryst., 1969, В25, 946. [2] J. Chem. Soc, A 1967, 1194.
[3] J. Chem. Soc, A 1969, 260. [4] Acta cryst., 1981, B37, 19. [5] Acta cryst.,
1979, B35, 815.
16.8.2. Тетраэдрические ионы и молекулы. Добавление одного
атома кислорода к пирамидальным ионам и молекулам ука-
занных выше четырех типов приводит к следующей серии ио-
нов и молекул:
2-
R-.
О"
е
-° г
R.
R-
ж
ж
-О
О
3
.R
^0
Замещение одного кислорода на серу в случаях «д» и «е»
дает соответственно тиосульфат-ионы (и) и ионы типа метан-
тиосульфоната (к):
,0
2-
д) Правильная тетраэдрическая конфигурация сульфат-
иона установлена уже во многих солях; многочисленные селена-
ты изоструктурны сульфатам. Те(VI), однако, не образует тет-
раэдрического иона MCV"; теллураты М2Те04 и МТеО4 содер-
16.8. Кислородсодержащие ионы и молекулы 465
жат полиядерные анионы, построенные из октаэдров ТеО6
(разд. 16.10.1).
Различные варианты функционирования SO42~ в качестве
простого мостикового или хелатного лиганда обсуждаются
в разд. 7.6.7. (т. 1). Простыми примерами являются конечный
ион [(enJCo(NH2) (SO4)Co(enJ]3+ и бесконечный цепочечный
ион в K2MnF3SO4 [1]:
Н2
3 +
(епJСо
/Со(епJ;
°ч
F
:мп:
s
F
О;
oso.
О2
о,
е) Строение иона (HSO3)~ уже обсуждалось. Строение
сульфонат-иона RSO3~ было установлено при исследовании це-
лого ряда солей. Очень стабильные фторсульфонаты щелочных
металлов, например KSO3F, изоструктурны перхлоратам.
У этилсульфат-иона в K.(C2H5O-SO3) и у бисульфат-иона в со-
лях типа NaHSO4-H2O и KHSO4 связи S—OR или S—ОН за-
метно длиннее остальных трех связей S—О (табл. 16.4). В дли-
нах этих связей имеются незначительные вариации в зависимо-
сти от окружения кислородных атомов:
Э 0
с-
Д.,49
0 0
M2SO4
г
Aj
SO4H 2,70 А
0 Р
1,48 Чч 1'
/ V'
2,90,0 0
Н2О
NaHSO4•
Н2О
''2,90 А
44
,61
н
Н2О
0 0
1,47 А\ /
/ \1,56 А
0 ОН
KHS04
0 0
\/l,43 A
А 1,54
но он
H2S04
С ионом (HSO4)" можно сопоставить ион (HSeO4)~ в
(Н3О) (HSeO4) (разд. 15.2.7), в котором длины связей состав-
ляют: Se—О 1,62 A, Se—ОН 1,71 А. Строение амидосульфонат-
(сульфамат-) иона SO3-NH2~ было определено с высокой точ-
ностью при изучении калиевой соли (I). Поскольку углы
S-—N—Н, как и угол Н—N—Н (схема I), равны 110°, связи
азота не являются компланарными, как это предполагалось ра-
нее на основании рентгеновских исследований. Сюда же можно
включить два цвиттер-иона. Нейтронографическое исследование
амидосульфоновой кислоты ~O3SNH3+ показывает, что ее моле-
кула имеет конфигурацию, близкую к скрещенной (II). Особый
интерес представляют связи N—H---0 B,93—2,98 А), в которых
30 -985
Таблица 16.4. Тетраэдрические молекулы и ионы
Д)
Ион
(so4p-
(SeO4J-
М—0, А
1,49
1,65
Литература
Acta crvst, 1972, В28, 2845
Acta cryst., 1977, ВЗЗ, 592
e)
Соль или цаит-
тер-ион
S-0, А
(SO3H)-Cs
(SO3F)-Li
(SO3OH)-Na-H2O
(SO3OH)-K
{SO3OC2H5)-K
(SO3NH2)-K
-(O3SONH3) +
-(O3SNH3) +
1,45
1,43
1,44, 1 ,48
1,47
1,46
1,45
1,44
s-x, A
O—s—o,
град
1,56
1,61
1,56
113
113
113
113
o-s-x,
град
См. текст
1,67
1,68
(S-ONH3)
1,77
ИЗ
116
116
106
106
106
ПО
102
102
1980,
Acta cryst.,
B36, 2523
Acta cryst.,
B34, 38
Acta cryst.,
19, 426
Acta cryst.,
17, 682
Acta cryst.,
11, 680
Acta cryst.,
23, 578
Inorg. Chem., 1967,
6, 511
iActa cryst., 1976,
' B32, 1563
1978,
1965,
1964,
1958,
1967,
ж)
Молекула
F:SO2
C12SO2
(NH2JSO2
(OHJSO2
F2Se02
R—S—R, град
97
111
112
104
R—Se—R
94,1
0—S—0, град
123
120
119,5
119
O-Se-0
126,2
S—0,
A
1,40
1,43
1,39
1,43
Se—0
1,575
S-R,
л
1,53
1,99
1,60
1,54
Se-R
1,685
J.Mol. Struct., 1978,
44, 187
J. Am. Chem. Soc,
1938, 60, 2360
Acta cryst., 1956, 9,
628
Acta cryst., 1965,
18, 827
J.Mol. Struct, 1978,
44, 187
lb.8. Кислородсодержащие ионы и молекулы 467
з)-к)
Продолжение
Соль
S-O, Л
S—S, А
S—С, А
[(CH3KSO]+C1O4
(S2O3J-Na2-5H2O
(CH3S2O2)-Na-H2O
1,45
1,47
1,45
2,02
1.98
1.78
1,77
Acta cryst., 1963, 16,
676, 883
Acta cryst., 1978, B34,
1975
Acta Chem. Scand.,
1964, 18, 619
связи N—Н составляют с векторами N—О углы 7, 13 и 14°;
каждая группа NH3+ образует три водородные связи. Гидрок-
силамин-О-сульфоновая кислота имеет строение типа (III):
Оч1,46А 1,00 А/
о
1,48 А
О
Ш
Строение некоторых гидроксиламин-О- и -N-сульфонатов опи-
сано в разд. 18.4.
ж) Структурно исследованы молекулы серной кислоты, не-
скольких сульфонов R2SO2, сульфамида (NH2JSO2 и сульфу-
рилгалогенидов SO2F2 и SO2CI2. Результаты микроволнового
изучения SO2F2 могут быть сопоставлены с данными для SOF2:
1,405 А
1,585 А
36
,24»
107°
1,5 30 А
з) Установлено, что триметилоксосульфониевый ион
(СН3)з5О+ в перхлоратах и тетрафтороборатах имеет тетраэд-
рическую конфигурацию с углом С—S—О 112,5° и углом
С—S—С 106°.
и) Растворение серы в теплом растворе сульфита щелочного
металла M2SO3 приводит к образованию тиосульфата. В ре-
зультате этой реакции к пирамидальному сульфитному иону
просто добавляется дополнительный атом серы с образованием
тетраэдрического иона ЭгОз2", строение которого определено.
30*
468 16. Сера, селен, теллур
при исследовании ряда солей (S—S 2,01 А). Тиосерная кислота
была получена прямым взаимодействием H2S и БОз в эфире
при —78 °С и выделена в виде эфирного комплекса H2S2O3*
.2(С2Н5JО.
В качестве лиганда ион S2O32~, по-видимому, может вести
себя по-разному: может быть 1) «мостиком», использующим
либо только один атом серы, как в Na,t[Cu(NH3L] [СиE2ОзJ]г
[2], либо оба атома серы и атом кислорода, как в
Zn(etuJS2O3 [3]; 2) монодентатным лигандом, связанным че-
рез атом серы (например, в [Pd(enJ] [Pd(en) (БгОзЬ] [4]);
3) бидентатным, образующим помимо связи М—О слабую
связь M---S (в Ni(tuLS2O3-H2O [5]). Связь Ni---0 имеет обыч-
ную длину B,1 A), a NI---S B,70 А) длиннее нормальной B,4—
2,6 А).
so3
с
SO3
о,
Pd'
Оз
,S-S
-0
к) Примером иона этого типа может служить метантиосуль-
фонат-ион, структура которого была определена при исследо-
вании моногидрата натриевой соли:
Н3С. 1,45 А/О
1,77 а4
Детали строения тетраэдрических ионов и молекул (д)—(к)
приведены в табл. 16.4.
Литература. [1] J. Chem. Soc. A, 1971, 3074. [2] Acta cryst., 1966, 21, 605.
[3] Acta cryst., 1974, B30, 2166. [4] Acta cryst., 1970, B26, 1698. [5] Acta cryst,
1969, B25, 203.
16.8.3. Пиросульфат и однотипные с ним ионы. Три родственных
иона
A 1,645 А
1 124,2° 3
пиросульфсст
н
.\\^\,ЬЫ А
°3S^>SO3
имидодисулыронат
н,
С 1,770 ^
и3й 120о ^и3
метилендисульфона
& также ион (O3S—N—БОзK" имеют сходное строение
(табл. 16.5). Нейтронографическое исследование иона
(O3S—NH—БОзJ" показывает, что атом водорода в нем ста-
тистически распределен по двум тетраэдрическим позициям.
16.8. Кислородсодержащие ионы и молекулы 469
Таблица 16.5. Пиросульфат-ион и родственные ионы (в солях К)
(O3S—О—SO3J-
(O3S—NH—SO3J-
(O3S—CH2-SO3J-
<O3S—N—SO3K-
8—О кон-
цевые, A
1,437
1,46
1,461
1,48
S-O (N, C)
мостико-
вые, А
1,645
1,68
1,770
1,62
S—M—S,
град
124,2
124
120
121
Литература
J. Chem. Soc, 1960,
5112
Acta cryst., 1979, B35,
1308
J. Chem. Soc, 1962,
3393
Acta cryst., 1979, B35,
1308
В (NO2) (HS2O7) и Se4(HS2O7J анионная часть кристалли-
ческой структуры состоит из цепочек ионов S2O7H~, соединен-
ных водородными связями:
0 0 0 0
(У \^V^ ^^
1,59 А^О 1,67 А
Л,43 А
,57 А
"О—Н—-О'
-. 2,57 А—>
Трисульфат- и пентасульфат-ионы S3Oi02~ и S5Oi62~ были
изучены в калиевых солях, но точные значения длин связей
в первом ионе не определены [1, 2]. Они построены как линей-
ные цепочки из трех и пяти групп SO4 соответственно. Уста-
новлено, что в S5Oi62~ концевые группы SO3 имеют почти пла-
нарное строение:
1,59 А 1,67 А ,/8зА
Наряду с незначительным варьированием длин связей S—О на
центральном участке здесь наблюдается экстремально длинная
связь S—О A,83 А) от концевых групп SO3, что дает основание
рассматривать данную систему как бы состоящей из иона
SeOio2", слабо связанного с двумя молекулами SO3. Было бы
желательно получить независимое подтверждение экстремаль-
ности связи S—О в других солях этого типа. Удлинение мости-
ковой связи S—О до концевой группы A,72 А) было обнаруже-
но также в ЭзОю2", но эти данные не претендуют на высокую
470 16. Сера, селен, теллур
точность. Ионы HS2O7~ и S3Oi02~ существуют наряду с нитрит-
ным ионом в солях, образованных из SO3 и N2O5 или HNO3
а именно (NO2)HS2O7 [3] и (NO2JS3Oi0 [4].
В молекуле Te(S2O7J две группы S2O7 играют роль биден-
татных лигандов: пятую (экваториальную) позицию в триго-
нально-бипирамидальном окружении Те занимает неподелен-
ная электронная пара [4а].
16.8.4. Дитиониты. Ион S2O42~ — восстановительный агент
(«гидросульфит») —существует в дитионите натрия. Это соеди-
нение приготовляют из соли цинка, которая образуется в ре-
зультате восстановления SO2 цинковой пылью в водной сус-
пензии.
108
О О
В растворе этот"ион быстро диспропорционирует на дисуль-
фит и тиосульфат: 2S2O42""-^S2O52~+S2O32~. Структура его.
весьма необычна (рис. 16.8, а) [5]. Он имеет заслоненную кон-
фигурацию, причем плоскости обеих групп SO2 почти парал-
Рис. 16.8. Строение некоторых сложных кислородсодержащих ионов серы: а —
дитионит-ион S2O42~; б — метабисульфит-ион БгС^2"; в— дитнонат-ион БгОб2";
г — тритионат-ион БзОб2"; д — перднсульфат-нон ЭгОв2".
лельны (угол между нормалями к этим плоскостям составляет
30°), а длина связи S—S очень велика и соответствует порядку
связи (по Полингу), равному лишь ~0,3. Наличие такой сла-
бой связи хорошо согласуется с фактом почти мгновенного об-
мена 35S между дитионит-ионом и SO2 в нейтральном или кис-
лом растворе; ничего подобного не происходит между S3O62~
и SC>2. Отметим также, что изоэлектронный С1О2 практически
не димеризуется. Большая длина связи S—S в таком анионе
была подтверждена и на примере комплекса ZnS2O4-(пири-
дин) [6].
16.8.5. Дисульфиты («метабисульфиты»), диселениты и дител-
луриты. При насыщении раствора K2SO3 диоксидом серы мо-
жет произойти кристаллизация соли K2S2O5. Содержащийся
16.9. Молекулы и ионы, содержащие цепи Sn 471
в ней дисульфит-ион имеет конфигурацию, показанную на
рис. 16.8,6 [7]; добавление группы SO2 к пирамидальному
иону SO32~ порождает несимметричный анион O2S—SO32~, обе
части которого соединены друг с другом очень слабой связью
S—S (см. ниже схему а). Совершенно иное строение имеют ана-
логичные по составу соединения селена и теллура.
В (r\'H4JSe205 [8] и ZnSe2O5 [9] присутствуют хорошо иден-
тифицированные ионы Se2O52", как и ожидалось, с кислород-
ным «мостиком» (схема б) и пирамидальными группами SeO3
(угол О—Se—О близок к 100°). Подобные анионы содержатся
в CuSe2O5 [10], где расстояние от Se до атома кислорода, рас-
положенного вслед за ближайшими соседями селена, составля-
ет 2,83 А (длина аналогичного расстояния в цинковой соли со-
ставляет 3,02 А). Точно такие же группы Se2O5 существуют в
VSe2O6 [И] (Se—Омоет 1,80 A, Se—ОКОнц 1,69 А), который мо-
жет рассматриваться как ансамбль из ионов VO2+ и Se2O52~.
О 1,83 А 1871,97
О \ п ^о
1.64А
О
А .
О 1,Ш
\,
а
sCo
\ .
1,50 А
725"
6
В кристаллической структуре этого соединения все атомы кис-
лорода (за исключением «мостпковых» в группах Se2Os2~) свя-
заны с V(IV), смещенном из центра координационного октаэд-
ра (V-Оакс 1,61 и 2,32 А, V—Оэкв 1,98 А). В (NH4JTe205
[12] короткие связи Те—О очерчивают группы Te2Os, анало-
гичные иону Se2O52~, но каждый атом Те образует еще четвер-
тую связь (различной длины), которая соединяет группы Те2Оз
в цепи (в)*. Координация теллура в данном случае может быть
описана как искаженная тригональная бипирамида (ТеХ4Е).
В CuTeiOs [13] также имеются группы Те2О5, но с различной
координацией двух атомов теллура (г).
Литература [1] Acta cryst., 1964, 17, 684. [2] Acta cryst., 1969, B25, 1696.
|31 Acta cryst., 1954, 7, 402. [4] Acta cryst., 1964, 17, 680. [4a] Acta cryst., 1981,
B37, 218. [5] Acta cryst., 1956, 9, 579. [6] Acta cryst., 1978, B34, 1499. \7] Acta
cryst., 1971, B27, 517. [8] Acta cryst., 1980, B36, 675. [9] Acta cryst., 1974, B30,
2840. [101 Acta cryst., 1976, B32, 2664. [11] Acta cryst., 1974, B30, 2834. [12] Acta
cryst., 1978, B34, 2830. [13] Acta cryst., 1973, B29, 963.
16.9. Стереохимия молекул и ионов, содержащих цепи Sra
Атомы цепи S3, естественно, компланарны, но цепи из четырех
или большего числа атомов обладают интересными возможно-
стями в отношении изомерии, поскольку в системе SiS2S3S4---
* Связи, показанные в нижнем левом углу схемы в, имеют следующую
длину: Те—О 1,84 А, Те--- 2,51 А. — Прим. перев.
Таблица 16.6. Параметры молекул S2R2, Se2R2. Те
содержащих цепи из атомов S (Se)
и молекул,
16.9. Молекулы и ионы, содержащие цепи 5П 473
Соединение
S2H2
S2F2
S2C12
S2Br2
S2(CH3J
S2(C6F5J
S2(QH5CH2J
S3(CNJ
S3(CH3J
S3(CF3J
S3(CC13J
S3(C2H4IJ
Se2(CH3J
Se2(C6H5J
Se2(C6F5J
SC2[(C6H5JHC]2
Se2(n-C1C6H4J
Se2(CNJ
Se2[S(C2H5JP]2
Te2(C6H5J
Te(n-C1C6H4J
Te2(rt-CH3C6H4J
Диэд-
рнчес-
кий
угол
90°
83
84
84
96
76,5
92
93
94
84
87,5°
82
75
82
74,5
104,5Г;
88,5°
72
86
S-S-R
(95°)
108
107
105
104
106
101
S-S, A
2,05
1,89
1,97
1,98
2.02
2,02
2,06
103 2,02
См. текст
S—R,
А
Метод*
Литература
104
104
106 (SSS)
102 (SSC)
ИЗ (SSS)
98 (SSC)
Se-Se-R
99
106
99
100
101
2,04
2,03
2,03
2,05
Se—Se, A
2,33
2,29
2,32
2,39
2,33
См. текст
106
R—Те—Те
99°
94
101
2,33
Те—Те, А
2,71
2,70
2,70
A,33)
1,64
2,07
2,24
1,81
1,79
1,77
1,85
1,78
1,85
1,90
1,86
Se-R,
Л
1,95
1,93
1,91
1,97
1,93
2,28
Те—R,
А
2,12
2,13
2,13
эд
MB
эд
эд
ЭД
рд
РД
РД
РД
эд
ЭД
РД
эд
РД
РД
РД
РД
РД
РД
РД
РД
РД
J. Am. Chern. Soc,
1938, 60, 2872
J. Am. Cliem. Soc,
1964, 86, 3617
Bull. Chem. Soc.
(Japan), 1958,31,.
130
To же
Trans. Faraday
Soc, 1971, 67,
3216
Acta cryst., 1975,
B31, 327
J. Organomet.
Chem., 1976, 121,
333
Acta cryst., 1969,
B25, 2497
Acta cryst., 1977,
B33, 2264
J. Chem. Phys.,
1948, 16, 92
Trans. Faraday
Soc, 1954, - 50,
452
Z. Kristailogr.,
1961, 116, 290
J. Am. Chem. Soc
1950, 72, 2701
J. Chem. Phys.,
1971, 55, 1071
Acta cryst., 1952 5
458
J. Organomet.
Chem., 1976, 121
333
Acta cryst., 1969
B25, 1090
Acta cryst, 1957,
10, 201
Acta Chem. Scand,
1954, 8, 1787
Acta Chem. Scand
1966. 20, 51
Acta cryst.,
B28, 2438
Acta cryst.,
10, 201
Acta cryst.,
B35, 1727
1972,
1957,
1979,
Обозначения см. в табл. 16.2.
значения диэдрических углов S1S2S3/S2S3S4 и т. д. близки к 90°.
Ранее уже отмечалось, что связи О—Н в Н2О2, как и связи
S—R в молекулах S2R2 и X—R (X = Se, Те) в аналогичных со-
единениях селена и теллура, не компланарны. Чтобы описать
структуру такой молекулы, необходимо охарактеризовать не
только валентные углы и связи, но и диэдрические углы ф
(см. схему а в разд. 11.3.5). Значения последних у производных
серы лежат в интервале от 70 до 110°, у селена — от 77 до
120° и у Те —от 72 до 110°. Некоторые из них приведены
в табл. 16.6.
Так как стереохимия молекул Sn-2R2 подобна стереохимии
цепей Sn, то последующие замечания равно применимыктрем
главным группам соединений: к молекулам Sn-2R2, полисуль-
фидным ионам S,.2~, политионатным ионам SnO62~ (и к близ-
ким к ним молекулам типа ТеБп-^С^г) •
Стереохимия азосоединений RN = NR подобна стереохимии,
например, дигалогенэтиленов; эти соединения существуют
в двух плоских формах — цис и транс:
"-с
Г
N'
II
N.
R'
N'
II
-N
С другой стороны, две конфигурации молекул RiSSR2 разли-
чаются по тому, с какой стороны от плоскости SSRi располага-
ется R2:
R.
Хотя на первый взгляд эти две формы соответствуют цис-
и гранс-изомерам азосоединений, на самом деле они являются
й- и /-энантиомерами. В качестве примеров можно привести
S2H2, S2F2 и БгСЬ, у которых диэдрическии угол близок к 90°.
Чтобы проиллюстрировать возможные типы изомеров более
длинных цепей Sn, удобно положить диэдрическии угол равным
90°. На рис. 16.9, а и б показаны d- и /-формы RSSR или
—S4—• Возможные структуры цепи S5 производятся присоеди-
нением пятого атома серы к S4 в а таким образом, чтобы ди-
эдрическии угол оставался равным 90°. Три из пяти позиций
для S5 компланарны с S2S3S4, что предопределяет две возмож-
ные конфигурации, изображенные на рис. 16.9, в и г; эти кон-
фигурации обозначают как цис- и транс-формы цепи —Ss—
(или молекулы RS3R), причем гранс-форма хиральна. Анало-
474 16. Сера, селен, теллур
гичная процедура приводит к выводу о том, что у цепей
—S6— имеются три формы; все они хиральные (табл. 16.7).
Ч«с-Конфигурация S5 и цис,цис-форма S6 соответствуют участ-
кам кольца S8, в то время как транс-конфигурация S5 и
транс,гранс-форма S6 соответствуют участкам бесконечнойспи-
цепь- Sn-
{напр., Sg-йот) ш
иис- и тианс- R-S^—R или — S-,—
Рис. 16.9. Идеализированная (валентные и диэдрические углы равны 90°) кон-
фигурация молекул S2R2, S3R2 и ионов Sn2~. а дано для сравнения с е, г и д,
б —для сравнения со схематическим изображением Н2О2 в разд. 11.3.5.
ралыгай цепи «металлического» селена или теллура (или во-
локнистой серы) (рис. 16.9, д).
16.9.1. Молекулы S2?!2 и SZR2- Структурные данные с указани-
ем источников литературы для соединений S2R2 и S3R2 сведены
в табл. 16.6. Галогениды S2X2 уже были описаны в разд. 16.5.2.
Цис и транс-формы молекул RS3R в идеализированном виде
показаны на рис. 16.9, в и г, где три заштрихованных кружка
обозначают атомы серы. Дицианид трисеры S3(CNJ имеет
^-конфигурацию с расстояниями S—S 2,07 A; S—С 1,70 А;
С—N 1,16 А; углами S—S—S 105°; S—S—С 99°; S—С—N
178°. Аналогичное строение имеет и молекула Se3(CNJ; рас-
16.9. Молекулы и ионы, содержащие цепи Sn 475
стояния Se—Se равны 2,33 А, а угол Se—Se—Se=10P. Моле-
кула 2:2/-дииододиэтилтрисульфана S3(C2H4IJ имеет кон-
фигурацию, изображенную на рис. 16.9, г, где заштрихованные
кружки изображают атомы серы, а одна из групп
—СН2—СН2—I показана с правой стороны. Концевой участок
S—СН2—СН2—I планарен и имеет транс-конфигурацию, так
что атомы S'iiSiSh, S1S11C и SuCCI лежат в трех взаимнопер-
пендикулярных плоскостях. Соответствующие диэдрические
углы близки к 90° (82 и 85° соответственно), а валентный угол
S—S—S составляет 113°.
s4
s3
s6
или
или
или
RSSR
RS3R
RS4R
Таблица
Изомерные формы
f
1
f
1
d или /
цис
транс (d и
цис-цис (d
цис-транс
16.7.
I)
ill)
(d и
транс-транс (d
Конфигурация
I)
И I)
Рис,
a,
в
г
д
цепей
16.9
6
s4
s5
S3
S6
s6
sn
Примеры
2-, S4O62-, S4O6(CH3J
O62~ в солях Ва
(C2H4IJ, S5O92- в со-
лях к
О62- в K2Ba(S6O6J
[Co(enJCl2lS6O6-H2O
Примеры других цепей Sn с различной конфигурацией пред-
ставлены в табл. 16.7.
16.9.2. Полисульфиды. Полисульфиды наряду с обычными суль-
фидами образуются при сплавлении карбонатов щелочных или
щелочноземельных металлов с серой или предпочтительнее при
поглощении серы раствором сульфида или гидросульфида. В по-
следнем случае из интенсивно окрашенных растворов могут
быть получены различные соли с полисульфидными анионами
от S22~ до Se2". Соответствующие соединения щелочных метал-
лов могут быть приготовлены также непосредственно из эле-
ментов в жидком аммиаке. Их относительная стабильность из-
меняется от металла к металлу. Уже синтезированы следующие
хорошо изученные соединения с общей формулой M2S«: n = 2,
4, 5 для Na; n = 6 для К; п = 2, 3, 5 для Rb; га = 2, 3, 5, 6 для Cs.
При обработке раствора Cs2S элементной серой получена
соль Cs2S5-H2O. Она может быть дегидратирована в вакууме до
CS2S5, но при упаривании спиртового раствора конечным про-
дуктом оказывается Cs2S6, из чего можно предположить, что
исходный раствор содержит S«2~, а также другие ионы Srt2""
476 16. Сера, селен, теллур
с меньшим п. Кажется вероятным, что вообще все полисуль-
фидные растворы представляют собой смесь различных ионов
Sn2- (и катионов М+ или М2+). Такие растворы мгновенно раз-
лагаются кислотами, но если раствор полисульфида вливается
в разбавленную соляную кислоту, то выделяется желтое масло,
из которого дробной перегонкой могут быть выделены в инди-
видуальном состоянии желтые жидкие кислоты H2Sn (я = 2—5).
Полисульфиды H2S6, H2S7 и H2Ss были приготовлены по сле-
дующей реакции: 2H2S2+SnCl2->-2HCl-r-H2S4+«.
Строение всех ионов от S22~ до Se2~ было изучено в кристал-
лических солях, как правило, щелочных или щелочноземельных
металлов. (Об анионе Тез2" информация дана в разд. 7.5.)
К сожалению, большинство из этих солей содержит очень тя-
желые катионы, и поэтому трудно оценить точность структур-
ных данных о полисульфидных анионах. Приведенные ниже
литературные источники относятся к наиболее поздним иссле-
дованиям. Конфигурация ионов S42~ и S&2~ в идеализированном
виде показана на рис. 16.9. На основании ряда эксперименталь-
ных данных длина концевой связи S—S оценивается приблизи-
тельно в 2,07 А, а для длин промежуточных связей в длинных
цепях приводятся более высокие значения (например, 2,16А).
Валентные углы лежат в пределах от 105° (K2S3) до 115°
(BaS3), а диэдрические —от 70° (BaS4-H2O и T12S5) до 106°
(Cs2S6). Наибольший интерес представляют следующие момен-
ты. K2S2 и одна из форм Na2S2 изост.руктурны с Na2O2. Соль
Ba2S3 содержит анионы двух сортов: Ba2S2~(S2J~. Совсем не-
ожиданный факт — наличие двух сортов атомов серы в LaS2,
где одна половина атомов серы образует группы S2 (S—S
2,10А), другая — дискретные ионы S2~, так что структурная
формула этого соединения может быть записана в виде
La2(S2~J(S2J~. В Cs2S6 анион имеет форму неразветвленной
цепи, и есть еще относительно короткая C,4 А) вандерва-
альсова связь между концами цепей. Эти слабые взаимодейст-
вия между последовательными ионами Ss2~ соединяют их в
бесконечные спирали из атомов серы, очень похожие на спи-
ральные цепи в металлическом селене и теллуре.
Группа Бг обнаружена не только в виде аниона S22~ в упо-
мянутых выше ионных дисульфидах, но и в многочисленных
сульфидах MS2 переходных металлов с пиритной и марказитной
структурой (разд. 17.1.6); она выступает и в качестве хелатно-
го лиганда в ионах [Mo2(S2N]2~ [la] (схема а, см. ниже);
[Mo2S2(S2JO2]2- [16] (схема б); [Mo3S(S2N]2- [1в] (схема в).
Ион Ss2~ образует хелатные комплексы M(S5J и M(S5K;
связи с атомом металла осуществляются через концевые атомы
серы. В (NH4JPt(S5K-2H2O [2] образуемые таким образом
шестичленные кольца имеют зигзагообразное строение; расстоя-
16.9. Молекулы и ионы, содержащие цепи Sn 477
1/
-Mo
-Mo?
¦\
V
J/
Mo с
у у
S'
в
кия между атомами и углы составляют: Pt—S 2,39 A, S—S
2,05 A; S—S—S 111°, диэдрические углы 72—83°.
Литература по полисульфидам. Na2S2, K2S2: Z. anorg. allg. Chem., 1962, 314,
12. BaS2: Acta cryst., 1975, B31, 2905. SrS2: Acta cryst., 1976, B32, 3110. LaS2:
Acta cryst., 1978, B34, 403. K2S3: Z. anorg. allg. Chem., 1977, 432, 167. BaS3,
Ba2S3: Inorg. Chem., 1975, 14, 129. Na2S4: Acta cryst., 1973, B29, 1463. BaS4-
•H2O: Acta cryst., 1969, B25, 2365. K2S5: J. Chem. Soc, D 1976, 1314. T!2S5:
Acta cryst., 1975, B31, 1675. Cs2S6: Acta Chem. Scand., 1968, 22, 3029.
Литература [la] Inorg. Chem., 1980, 19, 2835. [16] Acta cryst., 1980, B36, 2784.
[1b] Ber., 1979, 112, 778 [2] Acta cryst., 1969, B25, 745.
16.9.3. Тионаты и молекулы типа Sn(S02i?J. Ионы низших тио-
натов имеют общую формулу SnO62~, где я = 2, 3, 4, 5, 6. Дитио-
нат-ион S2Oe2~ образуется при непосредственном объединении
двух ионов SO32~, например при электролизе нейтральных или
щелочных растворов сульфитов или при пропускании SO2
в суспензию МпО2 в воде. Он не образуется по методикам, при-
меняемым для синтеза более высоких тионатов, поскольку по-
следние для приготовления требуют дополнительных атомов
серы, как это следует из их формул (O3S—Sn—SO3J~; они
легко образуются, как только в водный раствор одновременна
попадают и S, и SO32~\ В этих условиях обычно образуется
смесь всех ионов от S3O62~ до S6O62~ (ср. с полисульфидами),
и, более того, раствор одного какого-либо из высших тионатов
постепенно превращается, хотя и очень медленно, в смесь всех
указанных ионов. Однако их соли с щелочными и щелочнозе-
мельными металлами очень устойчивы в растворе, и отмечен-
ное взаимное превращение имеет место только в присутствии:
водородных ионов.
При протекании тех или иных реакций заметна тенденция
к образованию в большей мере одного какого-либо иона SnO62~,
что и используется для его получения. Контролируемое разло-
жение тиосульфата кислотой обеспечивает количественный вы-
ход S5O62~, в то время как окисление S2O32~ пероксидом водо-
рода приводит к S3O62~, а иодом (или электролитически) —
к тетратионатному иону S4O62~ е 2SO2~ + I*-SO62~ + 2I~^
2~
т. е.
478 16. Сера, селен, теллур
Некоторые из взаимосвязей этих ионов передаются с по-
мощью следующей схемы:
s4o|-
s +
Тиосерная кислота H2S2O3 может быть приготовлена непо-
средственно из H2S и SO3 в эфирном растворе при —78 °С.
Если вместо H2S использовать НгЭп, то получаются кислоты
H(O3S-SnH), которые при дальнейшем действии SO3 дают по-
литионовые кислоты H2(O3S-Sn-SO3), а при окислении ио-
дом— кислоты H2(O3S-S2n-SO3); таким путем уже получены
H2Se06, НгЭюОб и H2S12O6.
Строение дитионат-иона изучено в ряде солей, в том числе
в Na2S2O6-2H2O [1], K2S2O6 [2], MgS2O6-6H2O [3] и BaS2O6-
•2Н2О [4]. На рис. 16.8, в этот ион изображен как центросим-
метричный, но для него характерны и другие конфигурации,
встречающиеся иногда в одной и той же соли (например, скре-
щенная и почти заслоненная в K2S2O6). В соответствии с по-
следними исследованиями получены следующие данные:
S—S 2,14 A, S—О 1,45 А; угол S—S—О 105°, угол О—S—О
114°.
Строение тритионат-иона, показанное на рис. 16.8, г, найде-
но в кристаллической структуре K2S3Oe [5] (S—S 2,15 А). В се-
ленотритионат-ионе (SeS2O6) длина связи Se—S составляет
2,26 А, а угол S—Se—S 98° [5а], в то же время в очень сход-
ных между собой молекулах S(SO2C6H5J [6] и Se(SO2C6H5J
[7] углы между связями у центрального атома S(Se) равны
106,5 и 105° соответственно, а длины связей S—S и S—Se рав-
ны 2,07 и 2,20 А.
В тетратионат-ионе, исследованном в BaS4O6-2H2O [8a],
Na2S4O6-2H2O [86] и K2S4O6 [9], цепочка S4 имеет конфигура-
цию, изображенную на рис. 16.9,6; диэдрические углы близки
к 90°. По-видимому, существует определенная разница между
длинами центральных и концевых связей S—S (см. а на схеме
ниже), и это, вероятно, относится и к диметансульфонилдисуль-
фиду (б) с такой же цепочкой S4 [10] (хотя имеется опреде-
16.9. Молекулы и ионы, содержащие цепи Sn 4791
ленное сомнение, превышает ли указанная разница величину
вероятных экспериментальных погрешностей). Тетратионат-ион
диссимметричен; интересно, что если кристаллы натриевой соли
содержат только й- или только /-форму, то кристаллы кальцие-
вой и бариевой солей содержат ионы как в d-, так и в /-формах.
-o,s
CH3O2S
Существенно разные значения диэдрических углов найдены
у селенотетратионат-иона (SeS3O6J~. В солях К+ и
[Со(епJС12]+ они составляют 81 и 119° [Юа] соответственно.
Это указывает на заметную чувствительность отмеченных углов
к окружению иона в кристалле. С другой стороны, в двух поли-
морфных модификациях [Co(enJCl2]2[Se2S2O6] -H2C) [106]
для диэдрических углов были найдены почти одинаковые зна-
чения: 88,5 и 92,6°, близкие к ожидаемой величине (90°).
Для иона SsOe2"" обнаружена как цис-, так и транс-струк-
тура: цис (рис. 16.9, в)—в различных полиморфных модифика-
циях и гидратах Ba2S5O6, а транс (рис. 16.9, г)—в K2S5CV
¦1,5Н2О [11]; различные конфигурации замещенных ионов ус-
тановлены в кристаллогидратах тех же солей, например цис-
форма в BaTeS4Cv2H2O [12], а транс-форма в BaTeS4Cv
•ЗН2О [13]. Величины диэдрических углов для цис-\\оъоъ, по-
видимому, лежат в области 104—110°, а для транс-изомеров—¦
в области несколько меньших углов (обычно 80—90°), хотя для
BaTeS4O5-3H2O приводятся и большие значения: 88 и 99°.
В Sc,O62~, по-видимому, действительно существует некоторая
разница между длинами связей S—S в центре и на концах цепи
B,03 и 2,12 А). Две различные конфигурации найдены также
для молекул, близких к рассматриваемому типу:
RO,S'
цис
транс
"О
где R может быть СН3, С6Н5 и т. д.
Гексатионаты являются наиболее сложными солями этого
семейства, выделенными в индивидуальном состоянии. Как уже
упоминалось, у цепочки ¦—S6— возможны три изомера (у каж-
дой из которых может реализоваться d- и /-конфигурация),
если считать, что свободное вращение вокруг связей S—S от-
сутствует. В соли КгВаEбОбJ анион имеет цис.цис-кокфигура-
480 16. Сера, селен, теллур
цию [14], которая, подобно цис-форме пентатионат-иона, соот-
ветствует части кольца Ss. С другой стороны, в
[Со^пЬСЬ^ЭбОб-НоО анион имеет протяженную транс.транс-
конфигурацию [15]. Проекции иона БбОб2" в этих двух солях
Z.06A
2.02А
2.13А (j
Рис. 16.10. Конфигурации иона S6O62- в K2Ba(S6O6J (а) и в [Cc^en^CbbSeOe-
•Н2О (б).
изображены на рис. 16.10. В каждой конфигурации имеется два
различных диэдрических угла:
S1S2S3/S2S3S4 S2S3S4/S3S4S5
107° (усредненное значе- 89°
ние)
86° 71°
Литература. [1] Acta cryst., 1980, В36, 223. [2] Acta cryst., 1956, 9, 897. [3]
Acta cryst., 1975, B31, 615. [4] Acta cryst, 1966, 21, 672. [5] Z. Kristallogr., 1934,
89, 529. [5a] Inorg. Chem., 1980, 19, 1063. [6] J. Chem. Soc, 1949, 724. [7] Acta
Chem. Scand., 1954, 8, 42. [8a] Acta Chem. Scand., 1954, 8, 459 [86] Acta Chem.
Scand., 1964, 18, 662. [9] Acta Chem. Scand., 1979, B35, 1971. [10] Acta Chem.
Scand., 1953, 7, 1. [10a] Inorg. Chem., 1980, 19, 1040. [106] Inorg. Chem., 1980,
19, 1044 [11] Acta Chem. Scand., 1971, 25, 2580. [12] Acta Chem. Scand., 1973,
27, 1695. [13] Acta Chem. Scand., 1973, 27, 1653. [14] Acta Chem. Scand., 1973,
27, 1684. [15] Acta Chem. Scand., 1973, 27, 1705.
16.10. Структурная химия соединений селена и теллура
Совокупность данных по стереохимии соединений селена и тел-
лура представлена в табл. 16.8, строки которой соответствуют
формальным степеням окисления этих элементов. Приводимые
примеры основаны на результатах структурного анализа, если
только нет условного обозначения в виде знака вопроса (?).
(Так, неизвестны структуры газообразных молекул ТеОг, БеОз
и ТеОз.) Конфигурации, информация о которых дана в табли-
це слева от жирной линии, известны также и для соединений
серы. Выше уже рассмотрены некоторые простые представители
с
о
6
со
I
I
-
В"
р.
та
О
?
о.
Й
Окт;
я
S
га
О.
1 га
63
1ГОН
и
о
О.
е*
а
О.
Е-
0)
н
к
га
X
А
§
а
га
о.
с К
•я- :f
X
—
с?
(oil
00
СО
к
в л
Е- g
5 >i
ч о.
га u
CQ
%
Н
CJ *~*
Q- ^
4—' га
CJ QJ S
C/5HU
О
с!
i
ScO,
СО
Ч
E о ч
С/ЭН S
S. S
>>
О О)
о"
si
—'
to
а
s«
Е- g
я&
I
>? ^^^
Е~< м ^
О CJ CJ CJ
сЛ hhr
О U. аЗ —
CU CU f-ч CU
О е.
CU *-^—^ CJ О CJ QJ
1
о
сЛ 3
oQ ^>,сл
О О 4- _Q ^ ^ 4-
¦v; ^^с'—' c.t ^
SeO
SeO
Se((
(Sel
SeO
TeO
Te((
ra ra
>> >ч
CJ О CU О
(Л2 t- К
^—ч -—-
CJ CD
СЛ t-
« са
о си <и си
(ЛСЛ Н Н
к
ra
X
f-
5:
4
TO
а
ra
с
31-985
482 16. Сера, селен, теллур
описываемых валентных групп*: элементные селен и теллур;
молекулы SeR2 и Se2R2 D, 4); ионыБеОз2- B, 6), SeO42~ (8);
молекулы SeR2X2 B, 8) и SeX6 A2), а также их теллуровые
аналоги. Ниже обсуждаются в основном структуры, характер-
ные для соединений селена и (или) теллура, т. е. конфигура-
ции, сведения о которых даны в таблице справа от жирной ли-
нии, но в дополнение к ним будут приведены еще некоторые
примеры и других упомянутых выше групп, обнаруженные в
соединениях, присущих селену и теллуру.
16.10.1. Se(VI) и Te(VI)
Валентная группа A2). Выше уже была приведена иафор-
мация о правильной октаэдрической структуре молекул SeF6
и TeF6. Здесь мы рассмотрим стереохимию кислородных произ-
водных Te(VI), в которых он в отличие от остальных халькоге-
нов октаэдрически координирован шестью атомами кислорода.
В этом проявляется его определенное сходство с иодом — един-
ственным галогеном, демонстрирующим шестикратную коорди-
нацию по кислороду. Примерами могут служить изоэлектрон-
ные пары ТеО(ОНM- и Ю(ОНM или [Те2О8(ОНL]6- и
[12О8(ОНL]4~. Следует, однако, отметить отсутствие иона
ТеО42-.
Структурная химия теллуратов представляет собой прекрас-
ную иллюстрацию различных способов сочленения координа-
ционных октаэдров путем обобщения атомов кислорода с обра-
зованием конечных полиядерных групп, цепей или трехмерных
сеток. Координационное окружение теллура состоит из 6 кис-
лородных атомов, к части из которых или ко всем присоединен
водород. Такие координационные группы могут объединяться
либо через один общий атом кислорода каждой пары октаэдров
(структуры с общими вершинами), либо путем обобществления
двух атомов кислорода (структуры с общими ребрами). Про-
стейшими бесконечными системами с общими вершинами яв-
ляются транс- и цис-цепк АХ5, слой АХ4 (SnF4 и т. п.; разд. 5.3.3
вт. 1) и трехмерная сетка АХ3 (ReO3). В цепи АХ4 с общими
ребрами обобщенными могут оказаться противоположные
(транс) или непараллельные ребра. Существует только одна
форма транс-цепи — строго линейная цепь, например, в
К[ТеОз(ОН)], но возможно бесконечно большое число конфи-
гураций цепи с общими непараллельными ребрами (разд. 5.3.4
* В символ валентной группы автор включает: при отсутствии неподе-
ленных электронов общее число электронов, участвующих в о-связях цент-
рального атома (в данном случае Se или Те) с его соседями (или, иначе гово-
ря, удвоенное координационное число), при наличии неподеленных электро-
нов — число таких электронов (первая цифра в символе) и число электронов,,
участвующих в 0-связях (вторая цифра). — Прим. ред.
16.10. Соединения селена и теллура 483
т. 1); две из них уже найдены в теллуратах. В Na2Te04 [1]
(а также в СаТеО4 и SrTeO4 [2]) цепь в целом имеет плоское
зигзагообразное строение, такое же как у ТсС14 (рис. 5.20,
разд. 5.3.4), а в ЫгТеО4 [3] она имеет спиральную конфигура-
цию (ось 4i)—еще один вариант из числа трех простейших
вариантов цепей АХ4 с общими непараллельными ребрами. По-
следняя соль имеет искаженную структуру обратной шпинели
Li(LiTe)O4.
а он он 4- 6 он
г.ооА
1,9ОА
и +. о -+Л- о
г,,оза \ь<
о он
[ТеОг(ОН)$"
Рис. 16.11. Структура соединений Te(VI). а и б — мостиковые двуядерные
ионы; виг — бесконечные анионы.
Структуры ЫбТеОб, Li4Te0s, Li2Te04 и ТеОз иллюстрируют
случаи обобщения октаэдрами (ТеО6) 0, 2, 4 и 6 атомов кис-
лорода. В Ы6Те0б [4] имеются дискретные ионы ТеО6б~,
в Li4Te05 [5]—димерные ионы Те2Ою8~, в Li2Te04 [5]—цепи,
в ТеОз — трехмерные сетки (разд. 16.7.9). Теллураты могут быть
классифицированы в соответствии с координационным числом
теллура (см. табл. 16.9, которая содержит информацию только
об известных структурах). Конфигурации четырех гидрооксотел-
лурат-ионов показаны на рис. 16.11. Нейтральные системы вклю-
чают ТеО3, ТеО2(ОНJ и Те(ОНN. Вторая из них (Н2Те04)
имеет тот же тип (АХ4) слоистой структуры, что и UO2(OHJ
{разд. 5.3.3). Очевидно, что для теллуратов и «теллуровых кис-
лот» возможно большое число других вариантов структур, на-
пример в Н4Те0б образуется линейная цепочка, построенная из
групп ТеО2(ОНL. Длины связей в этих соединениях составля-
ют: 1,90 А в Те (ОН) 6 (электронография); 1,86 А для Те—ОКОнц
и 1,97 А для Те—О„ост в К[ТеО3(ОН)]; 1,87 и 1,96 А для
31*
0>
•к
я
я
tu
я
о
я
Ё
>>
а.
О
to
се
те
1Л
CO
Трехмерным
каркас с об-
щими1) вер-
шинами
Слой с общими Цепь с общими
вершинами ребрами
S
1
СУ
Q.
S
S
=f
\о
о
и
я
О
Я
«5
ю
II
о 3
?п
Координационная группа
СО
О
1
i Эй
i 2.
«
ж"
о.
о
1 1
' 2. ?
"о оо <о
о о о
? ? ?
1
о
#
X X
о о
о о
0) (U
н н
с
—^
к"
9.
о
О)
1
т4
?
б
я
1 в
^ '- .
2 о ЬТ
о о 2
си о о
Н Н Н
* • *
¦15
^ (Я Cft
qq N @
1О О ^
16.10. Соединения селена и теллура 485
Те—О и Те—ОН соответственно в (NH^tTeCMOHh]; 1,92 А
в СазТеОб [5а] (моноклинная криолитная структура;
разд. 10.1.5).
Очень изящная (кубическая) структура Ве4Те07 [6] может
быть описана как сфалеритовая, в которой Zn и S заменены на
группы ТеО6 и Ве4О соответственно. Альтернативным ее опи-
санием может служить трехмерная сетка, построенная из тет-
раэдрических групп ВеО4, которые образуют «супертетраэдры»
Ве4Ою (разд. 5.2.1), что позволяет рассматривать ее в одном
ряду с другими структурами, сформированными из супертетра-
эдров (гл. 5).
Литература. [1] Acta cryst., 1977, ВЗЗ, 2596. [2] Acta cryst., 1979, В35, 728.
[31 J. Solid State Chem., 1977, 22, 113, 385. [4] Z. Naturforsch., 1969, B24, 647,
1656. [5] Acta cryst, 1978, B34, 3156. f5a] Acta cryst., 1981, B37, 220. [6] Acta
cryst., 1977, B33, 3959. См. также табл. 16.9.
16.10.2. Se(IV) и Te(IV)
Валентная группа B, 6). Во многих своих соединениях
Se(IV) образует три пирамидальные и (как правило) еще три
более слабые связи; простейшими примерами таких соедине-
ний могут служить SeO32~, SeF3+, SeCl3+.
Взаимодействие SeF4 с NbF5 приводит к образованию
(SeF3)(NbF6) [1] и (SeF3) (Nb2FM) [2]. Обе соли содержат пи-
рамидальные ионы SeF3+ (а на схеме ниже), и Se образует еще
три слабые связи с атомами фтора анионов (NbF6)~ или
(Nb2Fn)~ (б), так что в дополнение к трем ближайшим (пи-
рамидальным) соседям селен получает три более удаленных
F-соседа, завершающих очень искаженный координационный
октаэдр.
-F\l,9lA 2,05
1,82 А
Se
/|\
в F F F
Большие расстояния F—F C,4—4,0 А) между этими тремя уда-
ленными соседями могут быть обусловлены воздействием непо-
деленной электронной пары, направленной тетраэдрически.как
это показано на схеме в. (Такая конфигурация близка к 7-крат-
ной координации в структуре Л-Ьа2О3). Найдено, что в
(SeF3) (NbF6) расстояния Se—F составляют 1,73 А (и 2,35 А),
а валентный угол — 95°.
486 16. Сера, селен, теллур
Соединение AlSeCl7 [3] состоит из тетраэдрических анионов
А1СЦ~ (А1—С1 2,13 А) и пирамидальных катионов SeCl3+
(Se—Cl 2,11 А), и селен образует еще 3 слабые связи длиной
3,04А. В кристаллическом Se(CH3KI [4] имеются пирамидаль-
ные катионы, но каждый из них связан преимущественно лишь
с одним 1~. Хотя связь Se—I и является слабой, ее длина
НХ
н,с
C,78 А) меньше расчетной вандерваальсовой D,15 А) и мень-
ше реальной S---I C,89 А) в аналогичном соединении серы.
Кроме того, эта слабая связь Se--I почти коллинеарна с одной
из связей Se—С; такая ионная пара была описана как комп-
лекс с переносом заряда. Как и в рассмотренном случае,
в комплексе 12 с 1,4-диселенаном расстояние Se--I несколько
меньше S---I в аналогичном соединении серы. В то же время
наблюдается увеличение расстояния I—I от 2,66 А в свободной
молекуле 12 до 2,79 А в соединении серы и до 2,87 А в соедине-
нии селена. По-видимому, чем сильнее связь серы или селена
с иодом, тем слабее связь I—I:
S(Se) — I, A
I - I, A
Литература
С4Н
с4н
С4Н
С4Н
8S2-2
8Se2-
sOSe
8OSe
h
2I2
¦h
¦IC1
2,87
2,83
2,76
2,63
2,79
2,87
2,96
2,73
(I—Cl)
Acta cryst., 1960, 13, 727
Acta cryst, 1961, 14, 940
Inorg. Chem., 1966, 5, 522
Inorg. Chem., 1968, 7, 365
При описании кристаллических элементов и полииодидов
уже указывалось, что образование дополнительных слабых свя-
зей с длинами, промежуточными между обычными ковалентны-
ми и вандерваальсовыми, является характерной особенностью
селена, теллура и иода. Это ярко проявляется в различии мо-
лекулярных структур I2Se(C4H8)Sel2 и Cl2Se(C4H8)SeCl2
(рис. 16.12).
Данные о строении молекул SeOF2 и SeOCl2 включены
в табл. 16.3.
Термин «аддукт» применяется к соединениям, в которых
SeOX2 (или другая молекула) сохраняет в основном структуру
16.10. Соединения селена и теллура 487
а
Рис. 16.12. Строение молекул Cl2Se(C4H8) SeCl2 (а) и I2Se(C4H8) Sel2 (б).
свободной молекулы в отличие от соединений типа SeOCb(пи-
ридин) 2 (см. ниже), в котором имеет место перестройка в рас-
положении атомов селена, кислорода и хлора с образованием
SeOFz- NbF5
валентной группы B, 10). Например, в SeOF2-NbF5 [5] атом
кислорода является частью октаэдрического окружения нио-
бия (Nb—О 2,13, Nb—F 1,85 А), а структура участка SeOF2
комплексной молекулы очень похожа на геометрию свободной
молекулы SeOF2 (имеющей пирамидальную форму). Аналогич-
но в SbCl5-Se0Cl2 [6] и SnCl4-2Se0Cl2 [7] атомы кислорода из
SeOCl2 завершают октаэдрическую координацию металличе-
ского атома. Слабые связи Se--Cl обычно доукомплектовывают
искаженно октаэдрическую координацию селена. Например,
в SnCl4-2Se0Cl2 имеются внутримолекулярная связь Se—Cl
длиной 3,01 А и связи Se—2C1 C,34 и 3,38 А) с атомами хлора
16. Сера, селен, теллур
в соседних молекулах. В трихлорооксоселенате 8-гидроксихино-
лииия C9H8NO+(SeOCl3)~ имеются две дополнительные связи
B,98 А) селена с ионами С1~, и молекулы SeOCl2 вместе с ио-
нами С!~ образуют бесконечные трехмерные комплексы
SeOCl3~ [8]. Шестая связь Se...Cl C,3 А) все еще короче, чем
сумма вандерваальсовых атомных радиусов этих элементов
C,8 А).
Соединение [N(CH3L]Cl-5Se0Cl2 представляет собой ан-
самбль ионов N(CH3L+, С1- и молекул SeOCl2 [9].
В качестве примеров пирамидальной конфигурации связей
Те(IV) могут служить ионы Те(СН3K+ (см. ниже), ТеО32~
(табл. 16.3) и TeS32~. В BaTeS3 [10] теллур образует 3 пира-
мидальные связи (Те—S 2,35 А) и имеет еще 3 более удален-
ных S-соседа C,4 А).
Литература. [1] J. Chem. Soc, A 1970, 1891. [2] J. Chem. Soc, A 1970, 1491.
[3] Acta cryst., 1971, B27, 386. [4] Acta cryst., 1966, 20, 610. [5] J. Chem. Soc,
A 1969, 2858. [6] Acta Chem. Scand., 1967, 21, 1313. [7] Acta cryst., 1960, 13,
656. [8] Inorg. Chem., 1967, 6, 1204. [9] Acta Chem. Scand., 1967, 21, 1328.
[10] Acta cryst., 1976, B32, 444.
Валентная группа B, 8). Эта валентная группа возникает
в упомянутых выше (разд. 16.5.3) молекулах типа SeX2R2 [1]
и TeX2R2 [2], в которых, как уже отмечалось, атомы галогена
занимают аксиальные, а неподеленная электронная пара —
одну из экваториальных позиций тригональной бипирамиды.
В числе изученных молекул (СбН5J5еС12, дибромид
(С6Н5JТеВг2, их замещенные производные, а также молекулы
типа Cl2Se(CH2LSeCl2 [3] (рис. 16.12, а). В молекулах
R2Se(Te)X2 углы составляют: экваториальный С—Se—С 106—
110°, С—Те—С 96—ЮГ; угол X—Se(Te)—X близок к 180°.
Аксиальные связи Se—X и Те—X гораздо длиннее, чем сумма
полинговских ковалентных радиусов этих атомов, в то время
как расстояния Se—С и Те—С близки к сумме радиусов соот-
ветствующих атомов (Se—С 1,94А; Те—С 2,14А).
Экспериментально опреде-
ленные расстояния, А
Сумма радиусов, А
Те—С1
Те—В г
Те—I
2,51
2,68
2,93
2,36
2,51
2,70
Выше обсуждались структуры двух полиморфных модифи-
каций кристаллического ТеО2. Близость длин связей в комплек-
16.10. Соединения селена и теллура 489
се пирокатехина с Те(IV) [4] и четырех коротких связей Те—О
в обеих формах ТеО2 и в TeoO4-HNO3 [5] наводит на мысль
-О
-о
о
о том, что во всех этих соединениях используются одни и те же
связывающие орбитали.
а-ТеО2
g-ТеОг
ТегО4-НМО3 Те(СбН4ОгJ
Те—Оакс А
Те—Оэкв, А
Оакс—Те—Оакс
Оэкв—Те—Оэкв
B) 2,08
B) 1,90
169°
102°
2,19
2,07
1,93; 1,88
169°
101°
2,17
2,05
1,93; 1,89
148°
100°
2,11
2,01
B) 1,98
154°
98°
«Основной нитрат» Te2O4-HNO3 кристаллизуется из раство-
ра теллура в HNO3. Структура этого соединения построена из
гофрированных слоев (рис. 16.13), основанных на плоской сетке
типа б3. Пары атомов теллура в этой соли соединяются между
собой ординарными и двойными кислородными мостиками, что
приводит к тригонально-бипирамидальному расположению свя-
зей. Атомы кислорода групп NO3 не связаны с теллуром, и вы-
бор между формулами Те2О4-
•HNO3 и [Te2O3(OH)]+NO3-
определяется размещением
атомов водорода. Длины свя-
зей в слое Те2О4 и симметрич-
ность группы NO3 (N—О со-
ставляет 1,25@,01) А) свиде-
тельствуют о том, что водород
присоединяется к атому, за-
штрихованному на рис. 16.13,
и что здесь реализуется дос-
таточно редкий случай дву-
мерного катиона.
Te2O3-Sp4 [6] также обла- Рнс 16 13. Теллур-кислородный слой
дает СЛОИСТОЙ структурой, ба- , в Te2O4-HNO3 (HNO3 не показана).
490 16. Сери, селен, теллур
зирующейся на сетке типа б3 (сравнимой с моноклинной AS2O3),
которая формируется тремя наиболее короткими связями от
каждого атома теллура A,89, 1,91, 2,00 А). Помимо ординар-
ных кислородных мостиков, формирующих сетку, соседние ато-
мы Те объединяются в пары посредством мостиковых групп
SO4, как это показано на рис. 16.14, а и б; длина связей
Те—Омоет составляет 2,26 А. Так как все остальные расстояния
о о
X
XX/
е' Те
Рис. 16.14. а — проекция слоя в Te2O3-SO4 (атомы кислорода на каждой свя-
зи не показаны); б — связывание атомов Те через бидентатные мостики SO4;
в — окружение Те (IV).
Те—X (X — какой-либо атом структуры) имеют существенно
большую протяженность, то связи, формируемые теллуром, сво-
дятся к четырем только что упомянутым, по длине сопостави-
мым со связями в других оксосоединениях. Однако их взаимное
расположение фиксирует сильное искажение тригональной би-
пирамиды.
Очень похожую структуру имеет и Те2О3-НРО4 [7].
Литература. [1] Acta cryst., 1953, 6, 746. [2] Acta cryst., 1962, 15, 887; Inorg.
Chem., 1970, 9, 797. [3] Acta cryst, 1961, 14, 940. [41 Acta Chem. Scand., 1967,
21, 1473. [5] Monatshefte Chem. u. verw. Teile anderer Wiss., 1980, 111, 789.
[6] Acta cryst., 1976, B32, 2720, 3115. [7] Z. Kristallogr., 1975, 141, 354.
Валентная группа B, 10). Соединения, в которых Se(IV) об-
разует пять связей, в структурном отношении исследованы, по-
видимому, относительно мало. Конфигурация связей селена в
таких веществах квадратно-пирамидальная или октаэдрическая
МХ5Е. В конечной молекуле SeOCl2-2C5H5N [1] (см. ниже
C5HSN
О. С1
16.10. Соединения селена и теллура 491
схему а) пять лигандов образуют слабоискаженное квадратно-
пирамидальное окружение селена, а ближайшим его соседом в
направлении шестой октаэдрической связи является атом хлора
другой молекулы. В димерной молекуле (CF3SeCl3J [2] (б),
по-видимому, имеется очень большая разница между длинами
концевых и мостиковых связей Se—С1.
Уникальная структура TeF4 уже описана вместе с другими
галогенидами Те(IV) (разд. 16.5.3); по-видимому, теллур (IV)
не образует иона TeF62~, а только TeF5~, который исследован
в соли KTeF5 [3]. Этот ион существует в виде дискретных еди-
ниц такой же пирамидальной конфигурации, как и в TeF4,
очень похожей на структуру изоэлектронного иона XeFs+ в
(XeF5) (PtF6). Атом теллура группы TeF5~ лежит на —0,4 А
ниже плоскости основания квадратной пирамиды.
Ион или
молекула
М — Х„
А М —Хосн, А
TeF5-
XeF5+
SbF52-
BrF5
1,85
1,81
2,00
1,68
1,96
1,88
2,04
1.81
79
79
8$
84т
Валентная группа B, 10) найдена также в анионе
Те(СН3I4- в соединении [Те(СН3K] + [Те(СН3I4]- [4], кото-
рое первоначально рассматривалось как геометрический изомер
Те(СН3J12- Эта соль, реагирующая с K.I с образованием
Те(СН3K1 и К[Те(СН3I4], состоит из пирамидального катиона
[Те(СН3K]+ и квадратно-пирамидального аниона [Те (СН3I4]~.
Связи Те- C,84—4,00 А) дополняют координацию обоих ато-
мов Те(IV) до октаэдрической (см. схемы в, г).
Z.92A
(среднее)
П B,74 А
ul- s соединении Вг)
(Me2NJC
Хотя «типичная» кислородная координация Те(IV) может
быть описана в том виде, как она изображена на рис. 16.5, а
или в, имеются и исключения. Уже были отмечены некоторые
492 16. Сера, селен, теллур
соединения, содержащие как Те(IV), так и Те(VI) (Те2О5;
Те4Од; Те2О4(ОНJ), в которых теллур обладает этой «типич-
ной» координацией. В двух комплексных оксидах, также со-
держащих Те(IV) и Те(VI), наблюдается квадратно-пирами-
дальная координация Те(IV). В ВаТе2О6 [5] количество атомов
Те(IV) с квадратно-пирамидальной конфигурацией связей рав-
но числу атомов Те (VI) с октаэдрическим окружением.
В K2TeIVTe3VI012 [6] каждый октаэдр TeVI06 обобщает 4 эква-
ториальные вершины с образованием слоев АХ4, основанных
на сетке типа 3262 (см. рис. 13.12,г), а слои связываются через
5-кратно координированные атомы Те (IV). Длины связей в этих
оксидах следующие:
Те—О (вершинный), А
(экваториальный), А
ВаТе2О6
1,83
2,13 (четыре)
К2Те4012
1,92
2,02 (две)
2,28 (две)
В соединении с эмпирической формулой TePClg координация
Те(IV) оказывается (искаженной) октаэдрической в отличие
от квадратно-пирамидальной конфигурации связей в TeF4 и
TeF5~. Анион этой соли имеет форму бесконечной цепи, в кото-
рой группы TeCU связаны общими ц«с-вершинами, а длины
концевых и мостиковых связей Те—С1 составляют 2,4—2,5 и
2,7—2,9 А соответственно [7]. Такая структура очень похожа
на структуру аниона в (пиперидинийJЕНВг5 (разд 20.3), но
резко отличается от квадратно-пирамидальной координации
сурьмы в изоэлектронном ионе SbCls2~. Роль катиона в TePClg
играет тетраэдрический ион РС14+,, поэтому структурная фор-
мула соли имеет вид (ТеС15)~(РС14) +
Литература. [1] Acta cryst., 1959, 12, 638. [2] Acta cryst., 1977, ВЗЗ, 139.
[31 Inorg. Chem., 1970, 9, 2100. [4] J. Chem. Soc, A 1967, 2018. [5] Acta cryst.,
1979, B35, 1439. [6] Acta cryst., 1978, B34, 1782. [7] Acta cryst., 1972, B28,
1260. ; ¦:¦
Валентная группа B, 12). Октаэдрические комплексы Те (IV)
соответствуют 14-электронной валентной группе. Тщательные
рентгеновские исследования A\тН4JТеС1б [1] и К2ТеВгб [2, 3]
показывают, что анионы в этих соединениях имеют правильную
октаэдричеекую форму и являются исключением из общего
правила, согласно которому конфигурация связей, образован-
ных непереходными элементами, соответствует наиболее сим-
метричному размещению общего числа связывающих и неподе-
ленных пар электронов. Электронные спектры этих солей дают
основание полагать, что 552-электроны частично делокализова-
'-ны в направлении галогенидных лигандов. Та же проблема воз-
16.10. Соединения селена и теллура 493
никает и в случае ионов SbX63~ и IF6~. Длина связи Те—С1
в ТеСЦ2" B,54 А) близка к соответствующим значениям, най-
денным в молекулах TeX2R2- В октаэдрической молекуле
TeCl4(tmtuJ, где tmtu — тетраметилтиомочевина [4], наблю-
дается незначительное угловое искажение связей (см. выше
схему д).
Литература. [1] Acta Chem. Scand., 1966, 20, 165. [2] Can. J. Chem., 1964, 42,
2758. [3] J. Am. Chem. Soc, 1970, 92, 307. [4] Inorg. Chem., 1969, 8, 313.
16.10.3. Se(II) и Те (II). Валентные группы D, 6) и D, 8). Для
Se(II) и Те(II) валентные группы из 8, 10 и 12 электронов
включают в каждом случае две неподеленные пары электронов.
Нелинейная конфигурация связей, возникающая при комбина-
ции D, 4), уже встречалась в элементных селене и теллуре,
в молекулах SeR2, Se2R2 и их теллуровых аналогах. 10-элект-
ронная группа D, 6) приводит к Т-образной форме молекулы,
как и в случае C1F3. Примерами соединений с такой конфигура-
цией являются молекула е и ион ж на схеме ниже, где S — атом
серы тиокарбамида (tu) в C6H5-Te(tu)Cl [1] или
[C6H5-Te(tuJ]Cl [2]. В молекуле е и ее бромном аналоге рас-
стояние Те—X необычно большое (но расстояние Те—С равно
•сумме атомных радиусов), а длина связи Те—S составляет
2,50 А. В то же время в ионе ж, как и в молекуле е, длина
связи Те—С имеет обычную величину, а расстояние Те—S ано-
мально велико B,68 А).
т 3,00 * п
Те—1 С1
Ж -
Валентная группа D, 8) предполагает для Те(II) наличие
четырех компланарных связей (по аналогии с 1С14~), т. е. че-
тырех экваториальных связей октаэдрической группы. Такая
конфигурация возникает в молекулах типа Te(tuJX2 [3], в ка-
тионе солей [Te(tuL]X2 [4] и в мостиковом ионе в
[Te2(tuN](C104L [5]. По-видимому, представляет определеный
интерес разница в длинах связей Те—S и Те—С1 в цис-молеку-
S\2,48A
S\2,69A /Br"" S4
\Je/ \ /<78 A
/ 4 3,05 A / \
Br Br Br ^S S'
3 и
/Те
3,02 A /S
\ / 2,53A
/ \ 2,47 A
2,86 A \o
494 16. Сера, селен, теллур
ле з и в ее этилтиокарбамидном аналоге Te(etuJX2 [6], имею-
щем транс-конфигурацию (и). Такая же удлиненная связь
Те—S B,68 А) найдена в ионе [Te(tuL]2+; она значительно
длиннее связи Те—S в соединениях Те(II) с двумя ковалент-
ными связями (около 2,37 А), например, в Te(S2O2CH3J. Еще
более длинные связи Те—SMoct обнаружены в мостиковом ка-
тионе [Te2(tuN]4+ (к), где к тому же, вероятно, имеет место
понижение симметрии, что, по-видимому, пока не имеет убе-
дительного объяснения.
Для полноты картины ниже приводятся типы структур про-
стых селенидов и теллуридов, не включенных в другие главы.
Структура типа антифлюорита:
Li2Se, Na2Se, K.2Se
Li2Te, Na2Te, K2Te
Se
Те
Be
Z
z
Mg
N
W
Ca
N
N
Sr
N
N
Ba
N
N
W
w
Zn
, z
, z
Cd
w
Z
Hg
Z
Z
Здесь Z— структура типа сфалерита (цинковой обманки),
W — вюртдита, N — NaCl.
Литература. [1] Acta Chem. Scand., 1966, 20, 132. [2] Acta Chem. Scand., 1966,
20. 123. ГЗ] Acta Chem. Scand., 1966, 20, 113. [4] Acta Chem. Scand., 1965, 19,
\cta Chem. Scand., 1965, 19, 2395. [6] Acta Chem. Scand., 1965, 19,
2349.
17. СУЛЬФИДЫ И ОКСОСУЛЬФИДЫ
МЕТАЛЛОВ
17.1. Структуры бинарных сульфидов металлов*
17.1.1. Введение. Все сульфиды металлов при обычных темпе-
ратурах являются твердыми веществами, поэтому здесь рас-
сматриваются только их кристаллические структуры. Эти со-
единения могут быть подразделены на три группы: а) сульфи-
ды электроположительных элементов А-подгрупп I—III групп
периодической системы элементов; б) сульфиды переходных
металлов, включая Си(II); в) сульфиды элементов Б-подгрупп
II—V групп периодической системы элементов.
Полисульфиды электроположительных элементов, имеющих
ионы Sn2~, описаны в гл. 16. Характеристика кристаллической
структуры некоторых сульфидов приведена в табл. 17.1; срав-
нение ее с данными аналогичной табл. 12.2 для оксидов пока-
зывает, что, за несколькими исключениями (например, МпО и
MnS), структурное сходство между сульфидами и оксидами
ограничивается ионными соединениями группы «в», например
ZnO и ZnS, HgO и HgS. Сульфиды элементов Б-подгрупп —
большей частью ковалентные вещества, в которых атом металла
образует малое число направленных связей, и если оксиды и
сульфиды некоторых элементов топологически могут оказаться
однотипными (например, с координацией 3:2 или 4:2), то
даже в этом случае они, как правило, неизоструктурны.
Например, в основе кристаллического строения низкотемпе-
ратурной модификации GeS2 лежит трехмерный каркас из тет-
раэдров GeS4, соединенных всеми вершинами (что сопоставимо
со строением кварцеподобного GeC^), но по своей геометрии
каркас GeS2 характерен только для него и не найден ни в одной
из модификаций GeC>2 (или SiCb).
Связь М—S более ковалентна, чем связь М—О, поэтому ок-
сиды в структурном отношении часто сходны с фторидами,
.а сульфиды проявляют тенденцию к образованию кристаллов со
¦структурами того же типа, что и хлориды, бромиды или иодиды
аналогичного состава; сравните MgF2, MnF2, TiO2 и SnC>2 (ион-
ные структуры типа рутила) с MgBr2, Mnl2, ТеЭг и SnS2 (сло-
истая структура типа Cdl2 или CdCl2). Слоистые структуры
* Рассматриваемые здесь сульфиды правильнее именовать простыми. ¦
Прим. перев.
496 17. Сульфиды и оксосульфиды
Таблица 17.1. Кристаллические структуры сульфидов металлов
Тип структуры
Бесконечные трех-
мерные комплек-
сы
Слоистые структу-
ры
Цепочечные струк-
туры
Координаци-
онные числа
М и S
4:8
6:6
6:6
6:6б
4:4
4:4
6:3
6:3
Название структуры
Антифлюорит
Хлорид натрия
Арсенид никеля
Пирит или марка-
зит
Сфалерит
Вюртцит
Куперит
Иодид кадмия
(С 6)
Хлорид кадмия
(С 19)
Сульфид молибде-
на
Примеры
Li2S, Na2S, K2S, Rb5
MgS, CaS, SrS,
MnS, PbS, LaS,
PrS, NdS, SmS,
TbS, HoS, ThS
PuS
FeS, CoS, NiSa, VS,
FeS2, CoS2, NiS2,
OsS2, RuS2
s
BaS,
CeS,
EuS,
, us,
TiS
MnS2,
BeS, ZnS, CdSB, HgS
ZnS, CdS, MnS
PtS
TiS2, ZrS2, SnS2,
TaS2, HfS2
TaS2
MoS2, WS2
Sb2S3, Bi2S3, HgS
PtS2,
a А также структура миллерита (координация 5:5).
6 Приведены координационные числа Fe no S и группы S3 no Fe или другому
металлу.
При высоком давлении структуры типа NaCl [J. Solid State Chem., 1980 33.
197, 203].
редки среди оксидов и фторидов, но они характерны для суль-
фидов и остальных галогенидов. Типы кристаллической струк-
туры диоксидов элементов IV группы обсуждались выше; на
их примере рассмотрено изменение кристаллического строения
подобных по составу соединений при движении вдоль групп
периодической системы. Теперь их можно сопоставить с приво-
димыми ниже типами структур соответствующих дисульфидов.
CS2
SiS2
TiS2
ZrS2
HfS2
(конечные молекулы)
(в основной модификации — бесконечные цепи)
GeS2 (структуры, построенные из тетраэд-
ров GeS4)
SnS2 (структура типа Cdl2)
PbS2 (стабилен только под давлением, см.
т. 3, разд. 26.7)
(слоистая структу-
ра типа Cdl2)
У сульфидов переходных металлов найден ряд важных
структурных типов, не имеющих или почти не имеющих анало-
17.1. Бинарные сульфиды металлов 49Т
гов среди оксидных соединений; это преимущественно различ-
ные слоистые фазы типа NiAs, пирита и марказита. (Отметим,
однако, пиритоподобные пероксиды ZnO2 и CdO2, т. \у
разд. 6.1, и диоксид натрия NaO2 как с пиритовой, так и мар-
казитовой структурами.) Далее, многие сульфиды, особенно
переходных металлов, демонстрируют определенное сходство с
интерметаллическими соединениями, во-первых, по своему фор-
мульному составу, где металлы оказываются не в обычных для
них валентных состояниях, как, например, в CogSs, PcUS, TiSa.
и т. д., во-вторых, по наличию областей переменного состава и,
наконец, по физическим свойствам — металлическому блеску,,
отражательным характеристикам и электронной проводимости.
В кристаллах многих сульфидов переходных металлов наряду
со связями М—S имеются связи металл—металл, как, напри-
мер, в моносульфидах со структурой NiAs (см. ниже), в «клас-
терных» соединениях молибдена и во многих сульфидах, бога-
тых металлом, таких, как Hf2S, Ta2S, Pd4S и Ta6S. Структуры
этих соединений будут описаны позднее, а в качестве простой
иллюстрации фаз со значительным взаимодействием металличе-
ских атомов может служить N13S2, упомянутый в гл. 4 как при-
мер структуры с почти ОЦК-упаковкой атомов серы, в которой
часть (искаженных) тетраэдрических пустот занимают атомы
никеля. Сходство с интерметаллическими фазами еще более
ощутимо в случае некоторых селенидов и теллуридов; чтобы
проиллюстрировать это положение, далее будут описаны струк-
туры СоТе и СоТе2.
Сульфиды и оксиды многих металлов групп «б» и «в» раз-
личаются по стехиометрическому составу, например не сущест-
вует сульфидного аналога РЬзСч или кислородного аналога
FeS2. В тех случаях, когда оксиды и сульфиды одинакового со-
става все же существуют, их структуры обычно совершенно-
различны, как, например, у нижеследующих пар: СиО и CuS,.
Cu2O и CU2S; NiO и NiS, PbO и PbS. Многие системы металл —
сера, подобно системам металл—кислород, оказываются неожи-
данно сложными, как это будет показано ниже для сульфидов
In, Cr, Ti, V, Nb и Та. Небольшие специальные разделы будут
посвящены некоторым группам сульфидов, имеющих специфи-
ческие структурные особенности или физические свойства, пред-
ставляющие особый интерес, а именно: интеркалированные,
кластерные соединения и бесконечно адаптируемые структуры.
Сначала же будут описаны некоторые более простые сульфиды.
M2S, MS, MS2> M2S3, M3S4.
17.1.2. Сульфиды M2S. Сульфиды щелочных металлов, за ис-
ключением CS2S, имеют антифлюоритовую структуру. Строение
CS2S уникально [1]: ионы S2~ находятся в позициях гексаго-
32—985
498 17. Сульфиды и оксосульфиды
нальной плотнейшей упаковки, в которой все октаэдрические
и половина тетраэдрических пустот заселены ионами Cs+. Од-
нако межатомные расстояния (S—S 5,15 A; Cs—Cs 4,00 А;
Cs—S 3,4 А) показывают, что ионы S2~ вовсе не упаковываются
плотно друг к другу и что важную роль в структуре играет
взаимодействие металл—металл (ср. с оксидами цезия,
разд. 12.21—12.23). Слоистая структура T12S (типа анти-СсП2)
рассматривается в гл. 26 (т. 3). Сульфиды металлов подгруп-
пы 1Б представлены Cu2S и Ag2S, существующими не только
в виде синтетических препаратов, но и минералов. Cu2S об-
суждается в гл. 25 (т. 3). Ag2S обладает тремя полиморфными
176°С 586°С
модификациями: моноклинная —>-ОЦК—>-ГЦК. В моноклинной
.-форме Ag2S (акантит) имеется два вида неэквивалентных ато-
мов серебра, соответственно с 2 и 3 ближайшими S-соседями,
а в высокотемпературных модификациях, которые примеча-
тельны своей электропроводностью, наблюдается перемещение
атомов серебра по полостям анионного каркаса [2]. Структу-
ра типа куприта предполагается и для кристаллов Au2S [3].
Сульфиды M2S переходных металлов представлены соеди-
нениями Ti, Zr, Hf. Физические свойства этих веществ и изо-
-структурность Ti2S [4], Zr:2S [5] (а также селенидов Ti, Zr)
с Та2Р [6] свидетельствуют о том, что эти сульфиды являются
не обычными валентными соединениями, а в значительной
мере — металлическими фазами. В сложной структуре Ti2S су-
ществует шесть сортов неэквивалентных атомов титана, в окру-
жении которых находится от 3 до 5 соседних атомов серы,
а также переменное количество атомов титана на расстояниях
-от 2,8 А и больше. Каждый атом серы окружен по крайней мере
7 атомами Ti, занимающими вершины тригональной призмы
с дополнительными «шапочными» атомами над некоторыми пря-
моугольными гранями. Взаимодействие металл—металл, оче-
видно, играет важную роль в формировании этой структуры,
которая может быть сопоставлена с модификацией Ti2O типа
-анти-СсИг. (В гораздо более сложной структуре Ti8S3 [7] име-
ется 16 неэквивалентных атомов Ti, среди ближайших соседей
которых лишь от 1 до 4 атомов серы, а общее координацион-
ное число дополняется до 9—12 атомами Ti. Координационные
группы циркония в богатых металлом сульфидах Zr^iSs и
Zr9S2 [8] также в существенной степени образованы металли-
ческими атомами.) Hf2S [9] в отличие от Zr2S и Ti2S имеет
структуру типа анти-2Н2 (гексагонального NbS2), которая уже
¦была описана в гл. 4 (т. 1). В Hf2S сера имеет в каждом слое
6 соседних атомов гафния (тригональная призма), в то время
жак у металла реализуется конфигурация, формируемая 3 ато-
мами серы (на расстоянии 2,63 А) данного слоя и 3 атомами
17.1. Бинарные сульфиды металлов 499*
гафния (на расстоянии 3,06 А) соседнего слоя. Это соединение
обладает диамагнитными свойствами и металлической проводи-
мостью; если по уравнению Полинга рассчитать в нем усилие
связей (разд. 29.3, т. 3) с учетом шести слабых связей Hf—Hf
C,37 А), то для гафния суммарное усилие связей окажется
близким к валентности 4:
Число связей
Связь
Длина свя-
зи, А
Порядок связи
3 Hf—S
3 Hf—Hf
6 Hf—Hf
2,63
3,06
3,37
0,56
0,50
0,15
общий
4,08
(в предположении что все 5^252-электроны использованы для?
образования связей Hf—S и Hf—Hf).
Литература. [1] Z. anorg. allg. Chem., 1977, 429, Ш. [2] J. Solid State Chem.,.
1970, 2, 309. [3]Compt. rend. (Paris), 1966, B263, 1327. [4] Acta cryst., 1967.
23, 77. [5] Materials Res. Bull., 1967, 2, 1087. [6] Acta Chem Scand., 1966 20
2393. [7] Acta cryst., 1974, B30, 427. [8] Acta cryst., 1972, B28, 1399 [91 Z Kris-
tallogr., 1966, 123, 133.
17.1.3. Моносульфиды. Моносульфиды представлены во всех:
введенных выше группах «а», «б» и «в». MgS и сульфиды ще-
лочноземельных металлов образуют ионные кристаллы, однако^
тот же тип структуры (NaCl) реализуется и в случае MnS (но
больше ни у каких других моносульфидов Зс?-элементов),
а также у соединений 4f- и 5/-элементов. Это свидетельствует
о том, что геометрическое сходство структур не означает сход-
ства в характере связей; подтверждением тому — серебристо
окрашенный PbS и металлический золотистый цвет LaS. Моно-
сульфиды переходных металлов (группа «б») рассматриваются;
немного позднее.
Из элементов Б-подгрупп периодической системы моносуль-
фиды (группа «в») образуются у следующих металлов: Си; Zrv
Cd и Hg; Ga, In и TI; Ge, Sn и Pb. Детали структуры, харак-
терные только для единичных сульфидов (CuS, гексагональны».
HgS, GaS, InS и T1S), приводятся в гл. 25 и 26 (т. 3). Соеди-
нения со сфалеритной и вюртцитной структурой перечислены
в табл. 17.1.
Монохалькогениды металлов IVB-групп представлены в.
табл. 17.2. Характерные для соединения германия и олова!
(табл. 17.2) структурные типы мышьяка и черной модификации'
фосфора являются слоистыми; металл в них образует только-
три сильные связи, формирующие гофрированные варианты.
32"
500 17. Сульфиды и оксосульфиды
простой гексагональной сетки, как это было объяснено в гл. 3
(т. 1). Более детально сульфиды Б-подгрупп II—IV групп рас-
сматриваются в гл. 26 (т.З).
Таблица 17.2. Структуры халькогенпдов
элементов 1\'Б-группыа
Ge
Sn
Pb
Р
Р
N
S Se
Р
Р
N
Те
А? б
N
.\
N
По данным работы [Inorg. Chem.,
1965, 4, 1363]. Обозначения: Р — структура
черного Р; As — структура As; N — струк-
тура NaCl. При температуре ниже 400 "С.
Моносульфиды переходных металлов. Имеющаяся информа-
дия о кристаллических структурах моносульфидов переходных
металлов обобщена в табл. 17.3, по поводу которой можно от-
метить следующее:
1. Моносульфиды Ti, V, Fe, Co и № в отличие от оксидов
этих металлов (принадлежащих структурному типу NaCl) кри-
сталлизуются в структуре типа NiAs.
2. Несколько своеобразно поведение соединений марганца,
имеющего наполовину заполненную Зс?-оболочку (d5).
3. Моносульфиды металлов d4(Crn) и tf9(Cun) имеют осо-
бые, присущие только им структуры. Сульфид хрома будет опи-
сан несколько позже в этой главе. Структура CuS (ковеллит)
представляется совершенно необъяснимой, если считать, что это
соединение Си11; в действительности же система Си—S чрезвы-
чайно сложна; она обсуждается в гл. 25 (т. 3).
4. В PdS и PtS атомы металла образуют по 4 планарные
связи; структура PdS гораздо менее симметрична по сравнению
со структурой PtS, которая описывается ниже.
Структура арсенида никеля. Наиболее часто встречающим-
ся типом структуры рассматриваемых веществ является струк-
тура NiAs (рис. 17.1), которая характерна также для многих
других фаз MX, где М — переходный металл, а X — один из
элементов Б-подгрупп IV—V групп (Sn, As, Sb, Bi, S, Se, Те).
Как уже отмечалось в гл. 4 (т. 1), эта структура представляет
собой гексагональную плотнейшую упаковку атомов X с атома-
17.1. Бинарные сульфиды металлов 501
ми М в октаэдрических пустотах, поэтому атом X имеет 6 со-
седних атомов М, расположенных в вершинах тригональной
призмы. Непосредственными соседями атома никеля являются
6 октаэдрически размещенных атомов мышьяка (на расстоя-
нии 2,43 А), но кроме них на расстоянии, достаточно близком для
образования связей B,52 А), оказываются еще два атома Ni,
Таблица 17.3. Структуры моносульфидов переходных металлова
Ti
Zr
Hf
Cr
Mo
/\
Mn
Fe
Co
Cu
Та
Re
Ru
Os
Rh
Pd
Pt
:mpyi<mypa
вюртцитла
структура
NaCl
структуры
типа NiAs
а Жирным шрифтом отмечены структуры простых соединений MS, для которых
ссылки' на литературу даны в тексте.
" Также миллеритная структура (координация 5:5).
в В более раннем исследовании [1] для этой фазы приводилась тетрагональная
структура типа искаженной NaCl. Это не подтверждено более поздними работами
[2, 3). в которых установлена кубическая структура типа дефектной NaCl с упорядо-
ченными вакансиями. Такая же элементарная ячейка (а=10,25 А) найдена и для всех
составов в области Zr5Ss — Zr9S8. [1] Ark. Kern., 1954, 7, 371. [2] Z. anorg. a!!g. Chem.,
1957. 292. 32. [3] Austral. J. Chem., 1958, 11, 445.
так как октаэдры NiAs6 накладываются друг на друга с образо-
ванием колонн, в которых каждый октаэдр обобщает пару про-
тивоположных граней со своими соседями. В металлических
фазах с такой структурой (например, СоТе или CrSb) все
8 соседей действительно находятся на эквивалентных расстоя-
ниях от атома переходного металла. Поэтому представляется
вероятным, что связи металл — металл вносят существенный
вклад в стабилизацию данной структуры. Кристаллы этого типа
имеют много свойств, характерных для интерметаллических
фаз: непрозрачность, металлический блеск, проводимость, а с
химической точки зрения наиболее интересная их особенность—
переменность состава. В некоторых системах соединения MX
502 17. Сульфиды и оксосульфиды
с идеальной структурой типа NiAs стабильны только при высо-
ких температурах. При переходе к умеренным температурам:
возможны различные типы изменения исходной структуры:.
1) образование менее симметричного варианта структуры NiAs;.
2) реализация совершенно иной, более стабильной структуры;.
3) диспропорционирование до M + Mi_.vX.
Некоторые фазы Mi_xS имеют последовательность плотно-
упакованных слоев серы, отличную от наблюдаемой в MS, и по-
тому должны трактоваться как
индивидуальные соединения, как,
например, в случае сульфидов
титана, описываемых ниже.
В альтернативном варианте упа-
ковка атомов серы остается та-
кой же, как и в MS, но с вакан-
сиями в системе позиций атомов-
металла. Удаление атомов М иа
решетки NiAs приводит к двум,
простым вариантам структуры:
а) произвольное распределение
вакансий по позициям @00) и
@0'/2) — рис. 17.2; б) позиции
@00) полностью заполнены, а
(ОО'/г) заняты лишь частично.
Дальнейшее размещение ва-
кансий возможно двумя альтер-
нативными путями: 1) произ-
вольное или 2) упорядоченное
их размещение в чередующихся:
металлических слоях.
В случае «б» все структуры оказываются промежуточными
между типом NiAs и С6 (Cdl2). Сульфиды хрома, которые
описываются в последнем разделе, дают примеры случаев «б»
A и 2), а фазы системы Fe—S иллюстрируют варианты «а» и
«б» B).
Сульфиды железа включают FeS2 (пирит и марказит),.
Fe2S3, только недавно выделенный в виде чистого аморфного-
продукта из водного раствора Fe3+ и Na2S при температуре
0°С или ниже [1], Fe3S4 (шпинельная структура), FeS (троилит)
и ряд дифицитных по Fe фаз, называемых пирротинами. (Была
описана также микрокристаллическая форма стехиометрическо-
го FeS (макинавита); для нее была описана структура, близ-
кая к структуре LiOH [2].) При температурах выше 138 °С сте-
хиометрический FeS имеет структуру NiAs, но при более низ-
ких температурах происходит смещение атомов, что вызывает
необходимость в увеличении исходных параметров элементарной
Рис. 17.1. Структура NiAs (атомы
As заштрихованы). Атом Ni в цен-
тре рисунка октаэдрически окру-
жен шестью атомами As и имеет
еще двух близких Ni-соседей, рас-
положенных по вертикали над и
под ним.
17.1. Бинарные сульфиды металлов 503
ячейки а и с соответственно в УЗ и 2 раза. Структуры пирроти-
нов, составы которых [3] приблизительно соответствуют форму-
лам Fe7S8 [4], FegSio, FemSn и FenSi2 [5], являют собой приме-
ры сверхструктурных фаз типа NiAs с различным размещением
вакансий; мы приводим лишь некоторые источники из обшир-
ной литературы по данному вопросу.
В системе Fe—S простая структура NiAs стабильна только
б небольшом интервале составов, и даже с учетом ее дефект-
ных вариантов этот интервал составит лишь несколько атомных
процентов серы. В системах металл — селен (теллур) ситуация
ооо г>^^=ь-—"
Рис. 17.2. Элементарные ячейки, а — СоТе (тип NiAs); б — СоТе2 (тип Cdl2).
Заштрихованные крух<ки изображают атомы Те.
•бывает различной. В системе Со—Те фаза со структурой NiAs
(при использовании закаленных образцов) гомогенна в области
50—66,7 ат. % Те, где верхняя граница соответствует составу
¦СоТег. Размеры элементарной ячейки внутри области гомоген-
ности непрерывно изменяются с составом, но это изменение
ючень мало:
Состав, ат, % Те
501^
66,7^
Параметры
3,
3
а
,882
,784
элементарной ячейки, А
5
5
с
,367
,403
Это необычное явление — непрерывное изменение состава от
СоТе до СоТе2 —объясняется следующим образом. Кристаллы
СоТе? при высоких температурах имеют структуру типа Cdb, ко-
торая сохраняется в закаленных образцах. (При длительном от-
жиге она переходит в марказитовую.) Взаимосвязь структур типа
Cdb и NiAs очень проста, как это показано на рис. 17.2. В обо-
их крайних случаях атомы Те расположены в гексагональной
шютнейшей упаковке. При составе СоТе все октаэдрические
504 17. Сульфиды и оксосульфиды
V
Pt
Pt
пустоты заняты кобальтом. Когда содержание последнего в ве-
ществе уменьшается, некоторые из этих позиций оказываются
вакантными, и, в конце концов, при составе СоТе2 только поло-
вина пустот остается занятой; при упорядоченном размещении
металлических атомов возникает структура типа Cdl2. Следует
подчеркнуть, что области гомогенности и структура образцов
зависят от температуры приготовления последних, т. е. от ус-
ловий их термообработки.
Найдено, например, что при
600 °С образец состава СоТе
представляет собой двухфаз-
ную смесь Со + Со,_д:Те (де-
фектная структура NiAs).
С увеличением содержания
теллура структура изменяется
в сторону структуры типа С6,.
но прежде, чем достигается
состав СоТе2, происходит пе-
реход к структурному типу
марказита.
Структура PtS (куперит).
Как сказано выше, FeS, CoS и
NiS кристаллизуются в струк-
турном типе NiAs, в котором
атомы металла образуют шесть
(или восемь) связей. Однако
палладий и платина в своих
моносульфидах формируют че-
7ой коорд^иеГтчетырьмГаг ™Р* компланарные связи.
мами серы и тетраэдрической коорди- Структура PtS [6J представле-
нацией s четырьмя атомами Pt. на на рис. 17.3. Каждый атом
платины образует четыре ком-
планарные, а каждый атом серы — четыре тетраэдрические свя-
зи. Валентные углы в этом соединении (и изоструктурных с ним
PtO и PdO) не точно равны 90° для Pt и 109,5° для серы, так
как их величины являются «компромиссными»: значение угла а
(97,5°) (рис. 17.3) в плоской цепи является промежуточным
между требуемым для квадратной координации платины (90°)
и тетраэдрической координации серы A09,5°). Соответственно
этому у платины два угла равны 82,5°, а два — 97,5°, а у серы —
два угла по 97,5° и четыре по 115°. В PdS [7] координация двух
видов атомов аналогична рассмотренной, но структура в целом
не столь регулярна.
О
Рис. 17.3. Структура
планар-
Литература. ГП J. Am. Chem. Soc, 1978, 100, 2553. [2] Z. Kristallogr., 1968, 36»,
94. ['3] Science, 1970, 167, 621. [4] Acta cryst., 1971, B27, 1864; 1979, B35, 722.
17.1. Бинарные сильфиды металлов 505
[5] Acta cryst., 1975, B31, 2759. [6] Mineral. Mag. (and J. Mineral. Soc), 1932,
23, 188. [7] Z. Kristallogr., 1937, 96, 203.
17.1.4. Дисульфиды. Дисульфиды образуются элементами
IV группы периодической системы, а также многими переход-
ными элементами. Структуры GeS2 и SnS2 рассматриваются в
т. 3, гл. 26. PbS2 синтезирован под давлением (см. там же).
Лантан и 4/-металлы образуют сульфиды типа MS.X с х=
= 1,7—2,0 для La и легких лантаноидов и с х=1,7—1,8 для
Ti
с
Zr
С
Hf
ст
V
Nb
Та
С*
Таблица
Сг
\ f
W
17.4. Кристаллические
M/J
Р
Тс
Re
«7
Fe
Р/Л1
Ru
Р
Os
Р
структуры дисульфидов3
Со
р
Rh
р
1г
рг
Ni Си
Р Рб
Pd
PdS2
Pt
С
Ag
Zn
ро
Cd
рб
а С — структура Cdl2 (Сб): W— структура (или политип) M0S2; М — марказитная
Струк:/р2; Я —структура пирита.
0 Синтезирован под давлением [Inorg. Chem., 1968, 7, 22081.
в Имеется также структура с более сложной последовательностью слоев.
г С кзтионными вакансиями при атмосферном давлении; при давлении 60 кбар —
Две различные пиритоподобные структуры [Inorg. Chem., 1968, 7, 389].
тяжелых 4/-элементов [1]. Структура LaS2 упоминалась в
разд. 16.9.2. BiS2 известен как фаза, стабильная только при
высоком давлении [2]. Большинство дисульфидов переходных
металлов обладают либо слоистой, либо марказитной (или пи-
ритной) структурой (табл. 17.4) в противоположность сущест-
венно ионным кристаллам типа рутила, характерным для со-
ответствующих диоксидов.
Сложные структуры подразделяются на два основных вида:
с октаэдрической или тригонально-призматической координа-
цией атомов металла. Наиболее простыми примерами первой
группы являются структуры TiS2, ZrS2, TaS2 и PtS2 (тип
CdI2-C6). Здесь, как и в случае галогенидов кадмия, найдены
политипы; например, уже показано, что TiS2 обладает поли-
типными формами 4Н, 8Н, ЮН, 12Н, 12R, 24R, 48R [3] (но-
менклатура в соответствии с табл. 4.2, т. 1). Известны две ис-
каженные формы структуры типа С6, в которых имеются корот-
кие расстояния металл — металл, указывающие на наличие
506 17. Сульфиды и оксосцльфиды
межметаллических связей. В одной из них (структура WTe2 и
высокотемпературная модификация МоТе2 [3]) атомы металла
смещаются из центров октаэдров, что приводит к возникнове-
нию гофрированных слоев и двух коротких расстояний М—М,
(ср. с 8-кратной координацией в NiAs), например:
WTe,
W—2W
W—6 Те
2,86 А
2,71—2,82 А
В ReSe2 [5] смещение Re из центров октаэдров обусловлива-
ет сближение трех ближайших атомов металла до расстояний'
2,65—3,07 А, сопоставимых с длиной связи B,75 А) в металли-
ческом кристалле.
Структуры, в которых осуществляется тригонально-призма-
тическая координация атомов металла, содержат пары смеж-
ных слоев серы, которые накладываются друг на друга без.
смещения (и поэтому не являются плотноупакованнымн), на
мультиплетные слои S—М—S укладываются точно так же, как
простые в обычной последовательности плотнейшей упаковки.
Наиболее простые структуры такого вида иллюстрируются на
рис. 4.11 (т. 1), на котором использована такая же номенклату-
ра, как для политипов слюды; цифры указывают число состав-
ных слоев (S—М—S) в повторяющейся единице. Примерами
могут служить:
2Hi(C7): MoS2 (молибденит), WS2, MoSe2, WSe2, низкотемпера-
турный MoTe2 [4]
2 Н2: гексагональный NbS2 [6]
3R: ромбоэдрический MoS2 [71, NbS2 [8], TaS2, \VS2, ReS;
Проекция слоя в структурах, представленных на рис. 4.11,
изображена на рис. 4.9, б (т. 1). Как уже отмечалось в гл. 4,
были найдены некоторые халькогениды с такой последователь-
ностью слоев, в которой осуществляются и октаэдрическая, и
тригонально-призматическая координация атомов М (например,
TaS2 и TaSe2 [9]; в работе [10] обсуждается классификация та-
ких структур).
Литература. [1] Inorg. Chem., 1970, 9, 1084. [2] Inorg. Chem., 1964, 3, 1041.
[3] Acta cryst., 1976, B32, 1302. [41 Acta cryst., 1966, 20, 268. [5] Acta Chem.
Scand., 1965, 19, 79. [61 Nature, 1960, 185, 376. [71 Schweiz. mineral, petrogr.
Mitteil., 1964, 44, 105. [8] Acta cryst., 1974, B30, 551. [9] Acta Chem. Scand.,
1967, 21, 513. [10] Acta cryst., 1965, 18, 31.
17.1.5. Интеркалаты*. Термин «интеркалаты» применяется к
твердым фазам, образующимся при введении «чужеродных»
* Иначе эти комплексные соединения называют соединениями включении
или клатратами. — Прим. ред.
17.1. Бинарные сульфиды металлов 507
ионов, атомов или молекул в пространство между слоями в
кристаллической структуре, устойчивой и в отсутствие интер-
калируемого материала. Соединения такого рода известны уже
давно: некоторые из них стехиометричны (как, например, фазы,
образованные щелочными металлами и графитом, разд. 21.4.4,
т. 3), тогда как другие имеют широкие области составов (на-
пример, гидратированные глиняные минералы). Подобные соеди-
нения на основе дисульфидов NbS2 и TaS2 привлекли к себе в
последние годы пристальное внимание из-за их физических
свойств. Эти два сульфида и их интеркалаты являются метал-
лическими сверхпроводниками. С геометрических позиций эти
комплексы могут быть разделены на два класса: комплексы,
в которых между слоями размещаются только простые (одиноч-
ные) атомы (ионы) без заметного воздействия на расстояние
слой — слой, и комплексы, в которых это расстояние сущест-
венно возрастает из-за внедрения объемистых «чужеродных»
молекул (ионов).
Между слоями S—М—S в NbS2 и TaS2 имеются вакантные
октаэдрические (и тетраэдрические) пустоты, которые могут
быть заняты «чужеродными» атомами различного размера, на-
пример Li, Ag, Си или каким-либо Зс?-металлом, или дополни-
тельными атомами Nb (Та). В последнем случае будет иметь
место просто образование сульфида промежуточного состава
между MS2 и MS с атомами М как в октаэдрической, так и
тригонально-призматической координации. Системы MxNbS2 и
МяТаБг, содержащие атомы второго металла, формируют раз-
ные типы фаз. Например, в соединениях MxNbS2, где М = Си
или Ag, инородные атомы занимают тетраэдрические позиции
в 2Нгструктуре NbS2, в то время как Зй-атомы размещаются
упорядочение и создают сверхструктуры типа 2Н2 состава
Mi/3NbS2 и Mi/4NbS2 [1]. Получено много соединений, в которых
межслойное размещение молекул и (или) ионов приводит к
увеличению, иногда весьма значительному, пространства между
слоями. В одной из групп таких соединений межслоевое про-
странство возрастает от 6 до 9 или 12 А при введении одиноч-
ного или двойного слоя гидратированных ионов Na+ или К+.
В этих соединениях, получаемых с помощью катодного или хи-
мического восстановления MS2 в электролитах, электроны при-
нимаются зоной проводимости слоя MS2, как, например, в
K+o.5(H20)o,5(TaS2)~°'5 [2]. Значительно большие межслоевые
расстояния найдены в интеркалатах, содержащих чрезвычайно
широкий круг неорганических или органических молекул (ио-
нов): от NH3 и N2H4 до алифатических и ароматических ами-
нов. Многие, а быть может, и все из этих комплексов являются
стехиометрическими соединениями, например NbS2(C6H,5NH3+)
и TaS2(C5H5NH+) (TaS2)i/2 [3].
508 17. Сульфиды и оксосульфиды
Литература. [11 J. Solid State Chem., 1971, 3, 154. [2] J. Solid State Chem.,.
1980, 34, 97, 253. [3] Science, 1970, 168, 568; 1971, 174, 493.
Пиритовая и марказитовая структуры. Пиритовая и марка-
зитовая структуры, получившие свое наименование от названий
двух модификаций FeS2, содержат дискретные S2-rpynnbi, в ко-
торых связь гомеополярна, а расстояния S—S составляют
2,17 А и 2,21 А соответственно. Геометрически пиритовая струк-
тура тесно связана со структурой NaCl: центры групп S2 и
Рис. 17.4. Структуры двух модификаций FeS2. а — пирит, б — марказит. На
рис. а расстояние S—S уменьшено, чтобы подчеркнуть сходство этой структу-
ры со структурой NaCl. На рис. б заштрихованные "кружки обозначают атомы
Fe, шесть из которых окружают каждую группу S2, как и в случае пиритовой
структуры.
атомы Fe занимают соответственно позиции Na+ и С1~ в ре-
шетке NaCl. Каждый атом железа расположен в центре окта-
эдра из шести атомов серы, а координация последней — тетра-
эдрическая (S + 3 Fe). Те же координационные числа имеют
атомы и в марказитовой структуре, которая производится из-
структуры типа рутила путем поворота цепей октаэдров с об-
щими ребрами так, что атомы серы различных цепей оказыва-
ются сближенными до расстояния 2,21 А, как показано на
рис. 6.5 (т. 1). Обе структуры представлены на рис. 17.4, а бо-
лее подробное их описание дано в гл. 6 (т. 1): пиритовой струк-
туры в разд. 6.1, а марказитовой — в разд. 6.3.
Интересные изменения расстояний S—S и М—S наблюда-
ются в ряду дисульфидов Зй-элементов с пиритовой структу-
рой; разница в этих расстояниях коррелирует с числом
ев-электронов [1].
MnS2
FeS2
CoS,
NiS2
s-
2
2
2
2
-S, A
,086
,171
,124
,065
17.1. Бинарные
M - s, A
2,59
2,259
2,315
2,396
сульфиды металлов 50?
Число! элект-
ронов е„
2
0
1
2
Аномальные значения расстояний в MnS2 связаны со ста-
бильностью заполненного наполовину Зс?-слоя. Сульфид меди.
состава CuSi>9, имеющий пиритовую структуру, был приготов-
лен из ковеллнта (CuS) и серы под высоким давлением при
температуре 350 °С и выше [2].
Подобно тому как в структуре NiAs помимо сульфидов, се-
ленидов и теллуридов кристаллизуются некоторые арсениды,
стибиды и т. д., в структуре пирита кристаллизуются соедине-
ния типа PdAs2, PdSb2 (но не PdP2), PtP2, PtAs2 и PtSb2. Кро-
ме того, вместо групп S2 или As2 могут быть смешанные груп-
пы типа AsS или SbS; существует целый ряд таких соединений,
структурно связанных с марказитом и пиритом, но с симмет-
рией, более низкой, чем у прототипа, вследствие замены сим-
метричных групп S2 и As2 группой типа AsS. Так, FeS2 н PtAs2
имеют пиритовую структуру, a NiSbS — связанную с ней, но
менее симметричную структуру. Аналогично FeS2 и FeAs2 име-
ют марказитовую структуру, a FeAsS, FeSbS — связанную с ней
менее симметричную (арсенопиритовую) структуру. Все три мине-
рала— кобальтит CoAsS, герсдорфит NiAsS, ульманнит NiSbS —
имеют структуру, явно близко связанную с пиритовой. Имеются
три простые возможности изменения структуры: 1) на место-
каждой группы S2 в пирите становится группа As—S(Sb—S);
2) половина групп S2 заменяется группами As2(Sb2); 3) реали-
зуется хаотическое размещение серы и мышьяка (сурьмы) в
пиритных позициях серы.
Первоначально для всех трех соединений предполагалась
структура A), но по результатам более позднего исследова-
ния [3] им приписаны следующие структуры: CoAsS — B);
NiAsS—C); NiSbS—A). Представляется, что наибольшего*
доверия заслуживает последняя работа по CoAsS, в которой
было показано, что его на первый взгляд кубическая решетка
в действительности является полисинтетическим двойником мо-
ноклинной решетки, и не исключено, что и другие структуры
зтого семейства на самом деле — сверхструктуры более низкой
симметрии. Как результат разницы в длинах связей между
Ni—Sb B,57 А) и №—S B,34 А) симметрия NiSbS понижает-
-510 17. Сульфиды и оксосульфиды
ся до энантиоморфного* кристаллического класса 23; для од-
ного соединения была определена абсолютная структура [4].
В марказитовой структуре кристаллизуется только один ди-
сульфид (FeS2), но к этому классу принадлежит целый ряд
других халькогенидов, а также пниктидов. Кристаллохимиче-
ски эти соединения подразделяются на две группы, отличаю-
щиеся друг от друга совершенно различным отношением
параметров ромбической элементарной ячейки, причем, по-ви-
димому, отсутствуют случаи, где это отношение имеет проме-
жуточные значения; различие в характере связывания, приво-
дящее к этим двум типам марказитовой структуры, пока еще не
понятно.
Нормальная мар-
казитовая
структура
Сжатая маркази-
товая структура
(тип лёллингита)
[51
с/а
0,74
0,55
0
0
с/Ь
,62
,48
FeS2
FeSe2,
FeTe2,
CrSb2,
OsP2,
Примеры
CoSe2
CoTe2,
FeP2,
FeAs2,
FeSb2,
OsAs2,
P-NiAs2
NiSb2
RuP2
RuAs,
RuSb2
OsSb2
В противоположность платине, которая образует только
PtS и PtS2 (структура типа Cdl2), палладий образует разно-
образные сульфиды, селениды и теллуриды [6]; среди сульфи-
дов известны Pd4S, Pd3S, Pd2,2S, PdS и PdS2. Некоторые из
них являются высокотемпературными фазами, например Pd3S,
который может быть закален, но при медленном охлаждении
превращается в смесь Pd2,2S + Pd4S. Как Pd3S, так и PdS яв-
ляются фазами типа интерметаллидов с высокими координа-
ционными числами у Pd:
Pd3S:
Pdi:
Pd,,:
2S+10Pd
2S+7Pd
Pd,S:
Pd
2S
10 Pd
В то время как RhS2 и RhSe2, имеют обычную пиритовую
структуру, в случае PdS2 и PdSe2 реализуется очень интерес-
ный ее вариант [7], который возникает в результате растяже-
ния этой кристаллической структуры вдоль одного направления
так, что у палладия оказывается четыре ближайших и два бо-
лее удаленных соседних атома S(Se) вместо октаэдрической
группы из шести равноудаленных соседей. Альтернативно
строение PdS2(Se2) может быть описано в виде слоистой струк-
туры, где слой состоит из атомов Pd, образующих по четыре
* Более правомочен здесь термин хиральный. — Прим. ред.
17.1. Бинарные сульфиды металлов 51Ь
компланарные связи с группами S2 (Se2), как это показано на
рис. 17.5, а. С этой структурой сравнима кристаллическая
структура CuF2 с координацией D + 2), которая выводится до-
некоторой степени аналогичным образом из рутильной структу-
Рис. 17.5. а — кристаллическая структура PdS2. Большие незаштрпхованные-
кружки обозначают атомы S; б — отдельный слой PdPS.
ры с октаэдрической координацией. В описанных соединениях,
найдены следующие межатомные расстояния:
PdS2:
PdSe2:
Pd—4
Pd—2
Pd—4
Pd—2
S
S
Se
Se
2,
3,
2,
3,
30
28
44
25
A
A
Л
A
s—s
2,13 A
Se—Se 2,36 A
Система связей внутри слоя PdS2 яснее видна на проекции;
одного из таких слоев, показанной на рис. 1.8 (т. 1). Слои
этого вида можно обнаружить также в структурах PdPS [8],
PdP2, марказите и пирите. В пирите они накладываются так,
что М образует сильные связи с атомами серы верхнего и ниж-
него слоев, завершая тем самым октаэдрическую координацию;
в PdS2 межслоевые связи слабы. В PdPS половина атомов се-
ры замещена атомами фосфора (рис. 17.5, б), каждый из ко-
торых образует (четвертую) связь с атомом фосфора соседнего
слоя, формируя тем самым двойной слой. Если все неметалли-
ческие атомы являются атомами фосфора и если они образуют
512
17. Сульфиды и оксосцльфиды
свои четвертые связи с такими же атомами выше- и нижележа-
щих слоев, то возникает трехмерная структура, в которой име-
ются цепочки атомов фосфора, как показано на рис. 3.43
(т. 1). Эти пентагональные слои могут соединяться также с
образованием октаэдров МХ6 с общими ребрами; при этом воз-
никает дополнительное взаимодействие между атомами метал-
ла. Такая ситуация имеет место в марказитовой структуре. Все
эти особенности взаимосвязи рассмотренных структур можно
пояснить с помощью нижеследующей диаграммы (предполага-
ется, что слои расположены почти перпендикулярно плоскости
страницы).
17.1. Бинарные сульфиды металлов 513
s — s
S S
Pd,
Pd'
,-Pd
"-¦Pd
:p — s~b
PC
\
'upizm) PdS2
— P—P-
PdP?
\ I
s—s—w^-
^M—S —S
I \
FeS2 (марказит)
PdPS
Для PdS2 описана фаза высокого давления [9], по-видимому, с
менее растянутой пиритоподобной структурой.
Литература. [1] J. Chem. Phys., 1960, 33, 903. [2] Inorg. Chem., 1966, 5, 1296
[3] Acta cryst., 1957, 10, 764. [4j Mineral. J. Japan., 1957, 2, 90. [5] Acta Chem
-Scand, 1969, 23, 3043. [6] Acta Chem. Scand., 1968, 22, 819. [71 Acta cryst., 1957
10, 329. [8] Acta cryst., 1974, B30, 2565. [9] Inorg. Chem., 1969, 8, 1198.
17.1.6. Сульфиды M2S3 и M3S4. Структуры большинства извест-
ных сесквисульфидов могут быть распределены по трем клас-
сам в соответствии с координационными числами металлов:
1) 3; 2) 4 и (или) 6; 3) больше 6 (табл. 17.5).
Под эту простую классификацию не попадают Sn2S3 и
Rh2S3. В Sn2S3 [1] двойные рутильные цепи (как в NH4CdCl3)
•состава SnIVS3 объединяются через атомы Sn(II). В октаэдре
Sn(IV) расстояния Sn—S лежат в интервале от 2,50 до 2,61 А
(среднее 2,56 A), a Sn(II) имеет 2 соседних атома серы на рас-
стоянии 2,64 А и один —на расстоянии 2,74 А (в среднем
:2,67 A). Rh2S3 (и изоструктурный с ним Ir2S3) [2] построен из
пар октаэдров с общими гранями, которые объединяются в
трехмерный каркас дальнейшим обобщением атомов серы, так
что в итоге получается структура с координацией 6 : 4 (иска-
женная октаэдрическая или тетраэдрическая). Эта структура
имеет очевидное сходство с корундовой. Кратчайшее расстоя-
ние Rh—Rh C,2 А) свидетельствует об отсутствии связей ме-
талл — металл.
Таблица 17.5. Кристаллические структуры сесквисульфидов M2S3
и родственных им соединений
Класс A). Характерны структуры М2Х3 с координационным числом метал-
ла, равным 3 (см., однако, текст): структура (слоистая) As2S3
Структура (цепочечная) Sb2S3: Bi2S3, Th2S3, U2S3, Np2S3
Класс B). Структуры с плотной упаковкой атомов S и
числом металла 4 или 6
Координация М
Тетраэдрическая
Тетраэдрическая и
октаэдрическая
Октаэдрическая
Гексагональная
плотная упаковка
Неупорядоченный
вюртцит (A12S3, P-
Qa2S3)
Вюртцит с упоря-
доченными дефек-
тами (a-Ga2S3)
Сверхструктура ти-
па NiAs
(Cr2S3)
Корундовая струк-
тура
(A12S3)
Кубическая плот-
ная упаковка
Неупорядоченный
сфалерит (v-Ga2S3)
а- и fS-In2S3 (см.
табл. 17.6)
Тип NaCl с упоря-
доченными дефек-
тами
(Sc2S3)
координационным
Более сложные
последователь-
ности
Mo2S3
Bi2Se3
Bi2Te3
Sc2Te3
Другие октаэдрические структуры:
Класс C). Структуры с более высокой координацией М:
6 и 7: H02S3
7 и 8: Gd2S3
8: Ce2S3 (La2S3, Ac2S3, Pu2S3, Am2S3)
Класс A): структуры M2S3 с ^-координированным M. Мож-
но было ожидать, что некоторые простейшие структуры суль-
фидов M2S3 будут найдены среди соединений элементов
V группы. Как это ни странно, у фосфора нет сульфида Р2Бз
(или P4S6), хотя он образует 4 сульфида других составов
(разд. 19.8). As2S3 имеет простую слоистую структуру [3]
(разд. 20.5), а строение Sb2S3 (рис. 20.13) гораздо сложнее.
Оно было подтверждено более поздним исследованием изо-
структурного с ним Sb2Se3 [4].
Класс B): структуры с плотноупакованными атомами S.
В кристаллах этого класса атомы металла занимают тетраэд-
рические и (или) октаэдрические пустоты в плотнейшей упа>
33 —985
514 17. Сульфиды и оксосульфиды
ковке из атомов серы. Сульфиды данной группы, за исключени-
ем одной модификации AI2S3, относящейся к корундовому типу,
обладают структурами, не типичными для М2Х3, а дефектными,
т. е. структурами, характерными для MX (сфалеритовымн,
вюртцитовыми, типа NiAs, NaCl), в которых отсутствует 4/з
атомов металла, или шпинельными М'МХ4 типа М'2/зМ"гХ4.
В структурах некоторых соединений размещение вакансий про-
извольное, в других — упорядоченное.
Структуры ряда сульфидов связаны между собой следую-
щим образом. Исходный кубический сфалеритовый блок, длина
ребра которого равна удвоенной величине параметра элемен-
тарной ячейки (рис. 3.35, б, т. 1), содержит 32 кубически плот-
ноупакованных атома серы. Произвольное удаление из этого
блока одной трети металлических атомов дает структуру
•y-Ga2S3 [5], в которой в среднем занято 21J/3 тетраэдрических
пустот. (При температурах выше 55О°С Ga2S3 (^-модифика-
ция) имеет неупорядоченную вюртцитовую структуру.) В CogS=
[6] атомы металла занимают то же число тетраэдрических пус-
тот C2), что и в ZnS, но, во-первых, отличается выбор этих
32 пустот, во-вторых, в сульфиде кобальта заняты еще и окта-
эдрические позиции. Соседями атома кобальта, расположенно-
го в тетраэдрическом положении, являются 1 S на расстоянии
2,13 А и 3S на расстоянии 2,21 А, а также еще ЗСо на расстоя-
нии 2,50 А (точно таком же, как длина связи Со—Со в крис-
талле самого металла). В Ип^^-аналогичной фазе в системе
Rh—S [7] связи металл — металл даже короче B,59 А), чем в
кристалле металла B,69 А).
Если в ансамбле 32 кубически плотноупакованных атомов
серы подходящим образом заняты 8 тетраэдрических и 16 окта-
эдрических пустот, то возникает шпинельная структура. Такое
строение имеет C03S4, хотя в этом случае кубическая плотней-
шая упаковка несколько деформирована. (Zr3S4— еще один
пример сульфида такого типа.) Область гомогенно-
сти C03S4, если твердофазные образцы получены из расплава,
имеет протяженность от Co3,4S4 до C02.06S4, т. е. включает в
состав C02S3; даже если последний синтезирован отжигом сме-
си кобальта, серы и флюса, то его структура ока-зывается де-
фектной шпинельной, так что C02S3 связан с Co3S4 таким же
образом, как Fe2O3 (кубический) с РезСч [8].
Описаны четыре модификации A12S3 : а и р с дефектной
сфалеритовой структурой, у (корундовая структура) и устой-
чивая при высоких давлениях тетрагональная форма с дефект-
ной шпинельной структурой [9].
Уникальная структура SC2S3 [10] может быть отнесена к
ячейке, содержащей 48 кубически плотноупакованных атомов
S, которая имеет следующие параметры: 2а, ~^2а и ЗУ2а, где
17.1. Бинарные сульфиды металлов 515
а — параметр элементарной ячейки простой структуры NaCl,
содержащей 4 кубически плотноупакованных аниона. Все ато-
мы скандия занимают октаэдрические пустоты, так что струк-
тура относится к дефектной структуре типа NaCl с упорядо-
ченными вакансиями. Каждый атом серы имеет 4 ближайших
атома Nb в четырех из шести вершин октаэдра (^«с-вершины
вакантны), и искажение исходной структуры NaCl очень неве-
лико; все углы между связями составляют 90±1,2°. Такова
структура желтой стехиометрической модификации SC2S3, об-
ладающей полупроводниковыми свойствами. Имеется также
черная нестехиометрическая форма SC2S3, обладающая метал-
лической проводимостью (Sc3+2+z(eKxS32~); она также принад-
лежит к структурному типу NaCl с простой ромбоэдрической
ячейкой (рис. 6.3, б, т. 1), содержащей, по-видимому, 1 Sc в
позиции @00), 0,37Sc в (уут) и 2S в ("Т1~тУ Ин"
формация по этой группе плотноупакованных структур сумми-
руется в табл. 17.6.
Таблица 17.6. Сульфиды с кубической плотнейшей упаковкой атомов S
CeS
Sc2S3
f3-In2S3
C03S4
V-Ga2S3
ZnS
Структура
NaCl
Дефектный NaCl
Дефектная шпинель (сверх-
структура)
Шпинель
Дефектный сфалерит (упорядо-
ченный)
/Сфалерит
\Вюртцит
Занятые пустоты
октаэдри-
ческие
Все
2/3
1/2
1/2
1/8
тетраэдри-
ческие
1/12
1/8
1/2
1/3
} 1/2
Интересно, что, хотя ScTe имеет, подобно ScS, структуру ти-
па NaCl, плотная упаковка теллура в БсгТез относится к типу
ккгг A2-слойная) с чередующимися слоями октаэдрических
металлических позиций, заполненных на одну треть (статисти-
чески) [11]. Та же последовательность слоев найдена в Fe3S4,
где каждый четвертый слой октаэдрических позиций не занят.
Информация о Cr3S4 и T13S4 дана в разд. 17.1.9 и 17.1.11.
В отличие от Bi2S3 селенид и теллурид висмута имеют
структуры, в которых металл занимает октаэдрические пустоты
в плотнейшей упаковке атомов селена или теллура. Интересные
примеры некоторых более сложных типов плотнейших упаковок
33*
516 17. Сульфиды и оксосульфиды
найдены в Bi2Se3, Bi2Te2S, Bi2Te3 (последние два вещества из-
вестны и в виде минералов — тетрадимита и висмутита соответ-
ственно) и Bi3Se4. В Bi2Se3, Bi2Te2S и Bi2Te3 найдена 9-слойная
последовательность кгг:
АсВАсВаСВаСьАСьА...,
а в Bi3Se4— 12-слойная ккгг:
СаВеАВсАьСаВСаВсАьСАьСа...,
где А, В или С обозначают (разд. 4.1.5) слои серы, селена или
теллура, а а, Ь или с — атомы висмута в октаэдрических пози-
циях между слоями.
Последовательность кгг имеется и в Mo2S3 [12], но струк-
тура этой фазы не является слоистой, так как происходит час-
тичное или полное заполнение октаэдрических позиций между
всеми последующими парами (приблизительно) плотноупако-
ванных слоев:
кгг кг
J 1_
М] Мц Мп
и т. д.
Заметное искажение относительно идеальной плотноупакован-
ной структуры (в которой атомы металла были бы в центрах
октаэдрических пустот) возникает из-за образования зигзаго-
образных цепей из связей металл — металл как в полностью,
так и в наполовину занятых металлических слоях. Эти связи
ненамного длиннее, чем в кристалле самого металла. В изо-
структурном Nb2Se3 (и Ta2Se3) [13] взаимодействие металл —
металл имеет место только в полностью занятых слоях, веро-
ятно, из-за того, что у <Nb и Та на один d-электрон меньше, чем
у Мо:
Расстояние М — М в цепях
металлических слоев, А
Nb2Se3
Mi-слой 2,85 2,97
Мц-слой 2,87 3,13
Для сравнения в метал- 2,73 2,86
ле
Рассмотренные соединения иллюстрируют три пути дости-
жения состава М2Х3 замещением двух третей октаэдрических
пустот в плотноупакованных ансамблях. Доли занятых пустот
17.1. Бинарные сульфиды металлов 517
между последовательными парами плотноупакованных слоев
следующие:
Bi2Se3
M02S3
Sc2Te3
0
1
1
1
1
2
1
3
1
1
2
•
•
1
0
1
1
*
1
1
2
1
1
2
1
1
~3~
Тип плотней-
шей упа-
ковки
кгг
кгг
ккгг
Класс C): структуры с более высокой координацией М.
Здесь мы обсудим группу сесквисульфидов Y, La, 4/- и 5/-эле-
ментов, в которых координационное число некоторых или всех
атомов металла больше 6.
Наименьшие из редкоземельных ионов, Lu3+ и Yb3+, образу-
ют 6-координированную корундовую структуру; следующие за
ними металлы (Tm—Dy) — структуры типа Ho2S3, затем типа
Gd2S3 и, наконец, типа СегЭз (табл. 17.7).
Таблица 17.7. Кристаллические структуры сесквисульфидов
4/-элементов [Inorg. Chem., 1969, 8, 2069]
'(La) Се Pr Nd Pm Sm Eu Gd Tb Dy (Y) Ho Er Tm Yb Lu (Sc)
-Структура Ce2S3 -
фазы высокого
давления
структура
неизвестные
¦*¦ *¦
структуры
- структура -
корундовая
структура
Структура Ho2S3 не относится к числу простых плотнейших
упаковок; одна половина атомов металла в ней 6-, а другая —
7-координированная, 2/з атомов серы имеют КЧ 4, а '/3 —¦ К.Ч 5.
Структура Gd2S3 также сложна; одинаковое число атомов ме-
талла в ней имеют координационные числа 7 и 8 (одно- и двух-
шапочная тригональная призма), а все атомы серы 5-координи-
рованные (у двух третей — квадратно-пирамидальная конфигу-
рация, а у одной трети — тригонально-бипирамидальная).
В решетке Ce2S3 атомы церия занимают 8/д позиций атомов
металла структуры Th3P4, иначе говоря, Ю-j- атомов Се раз-
мещены по 12 позициям в ячейке, содержащей 16 атомов серы.
Поэтому формулу этой фазы предпочтительнее записывать как
Ce2i68S4. В структуре ТП3Р4 координация атомов 8 : 6, коорди-
518 17, Сульфиды и оксосульфиды
национные полиэдры имеют форму додекаэдра с треугольными
гранями и (искаженного) октаэдра (литература по этой струк-
туре приведена в т. 1, разд. 5.1.2).
Изучение соединений M2S3 тяжелых лантаноидов осложнено
существованием сульфидов M3S4 со структурой Th3P4, образуе-
мых всеми элементами от La до Ей включительно, и тем об-
стоятельством, что эти фазы легко получаются из M2S3 удалени-
ем серы. Из-за такой взаимосвязи M2S3 и M3S4 возможен непре-
рывный переход от одной структуры к другой. Имеется, однако,
интересное различие между сульфидами La и Се, с одной сто-
роны, и сульфидами Sm и Ей — с другой. Параметры элемен-
тарной ячейки лантановой и цериевой фаз остаются почти по-
стоянными в пределах области составов от M2|68S4(M2S3) до
M3S4, в то время как в аналогичном ряду в самариевой и евро-
пиевон системах наблюдается их увеличение. Подобного воз-
растания параметров следует ожидать, если ионы М3+ заменя-
ются более крупными ионами М2+. Это, по-видимому, означает,
что в лантановом и цериевом соединениях ионы остаются в ви-
де трехзарядных М3+ с делокализацией избыточных электронов,
т. е. это (M3+KS4(e), тогда как формула соединений самария
и европия должна записываться как M2+M23+S4. Это согласует-
ся с различием в относительной стабильности двух- и трехва-
лентного состояния у указанных элементов и с тем фактом, что
Ce3S4 — вещество с хорошей металлической проводимостью, а
Sm3S4 [14] — полупроводник. Аналогична разница в свойствах у
CeS и SmS. Первый обладает металлической проводимостью и
магнитным моментом, соответствующим Се34", и должен рас-
сматриваться как Ce3+(e)S2~, a SmS — полупроводник с маг-
нитным моментом, соответствующим Sm2+S2~. К структурному
типу Ce2S3 относятся также AC2S3, Pu2S3, Am2S3.
Литература. [1] Acta cryst., 1967, 23, 471. [2] Ada cryst., 1967, 23, 832. [3] Mine-
ral. J. Japan., 1954, 1, 160. [4] Acta cryst., 1957, 10, 99. [5] Z. Anorg. allg. Chem.,
1955, 279, 241; Acta cryst., 1963, 16, 946. [6] Acta cryst., 1962, 15, 1195. [7] Acta
cryst., 1962, 15, 1198. [8] Proc. Acad. Sci. (USA), 1955, 41, 199. [9] J. Solid
State Chem., 1970, 2, 6. [10] Inorg. Chem., 1964, 3, 1220. [Ill Inorg. Chem., 1965,
4, 1760. [12] J. Solid State Chem., 1970, 2, 188. [13] Acta cryst., 1968, B24, 1102.
[14] Acta cryst., 1978, B34, 2084.
17.1.7. Сульфиды, индия. В кристаллохимии сульфидов индия
помимо необычности формул двух из них есть еще несколько
интересных моментов, а именно наличие связей металл — ме-
талл и стереохимическое влияние неподеленной электронной
пары в моносульфиде. Выполнены структурные исследования
In5S4 [I], InS [2], In6S7 [3] и In2S3 [4]; относительно In3S4 ком-
ментарии будут даны позднее.
Структура In5S4 кратко может быть описана как трехмер-
ная сетка, построенная из тетраэдров In(S3In) с общими вер-
17.1. Бинарные сульфиды металлов 519
шинами. Эти тетраэдры, состоящие из центрального атома ин-
дия, соединенного с тремя атомами серы и одним атомом ме-
талла, объединяются в группы по четыре с общей вершиной,
занятой индием. Последний связан с четырьмя другими атома-
ми индия (расстояние In—In 2,76 А); эти «центральные»
атомы металла составляют Vs их общего числа, а остальные
связаны с одним атомом металла и тремя — серы. Каждый
атом серы связан с тремя атомами индия. Структура InS опи-
сана в т. 3, разд. 26.1, в сопоставлении со строением GeS.
В InS все атомы металла имеют искаженное тетраэдрическое
окружение, состоящее из Пп и 3S, как 4/s атомов индия в
In5S4; расстояние In—In B,80 А) также близко к аналогичной
величине в In5S4. Структура In6S7 в первом приближении мо-
жет быть описана как плотнейшая кубическая упаковка ато-
мов серы, в которой атомы металла занимают определенные
октаэдрические пустоты. Но при этом возникает существенное
искажение координационного полиэдра, потому что 2 из 6 не-
эквивалентных атомов индия объединяются в пары (In—In
2,74 А). Структуры фазы с более высоким содержанием серы
и особенно природа фазовых превращений в сульфиде In2S3
при температурах около 420 и 750°С являлись предметом
оживленной дискуссии. Во всех фазах InSi,33—InSi,so имеется
плотнейшая кубическая упаковка атомов серы с возрастающим
числом вакансий в тетраэдрических позициях, но распределе-
ние вакансий, по-видимому, зависит от метода и температуры
приготовления образца. Описаны следующие модификации
1п25з: 1) дефектная шпинельная, подобная у-АЬОз; 2) сход-
ная с б-А12О3 тетрагональная сверхструктура шпинельного типа
с атетр = аКуб/У2 и стетр = ЗаКуб (якуб — параметр шпинельной ку-
бической ячейки, содержащей 32 кубически плотноупакованных
атомов серы); 3) высокотемпературная, построенная из сдвоен-
ных слоев [5] СЬЛсВ СЬАсВ..., в которой все атомы индия за-
нимают октаэдрические позиции в отличие от других структур,
где имеет место заполнение и тетраздрических, и октаэдриче-
ских позиций. Первоначально считалось, что в интервале тем-
ператур 370—840°С In3S4 существует как определенная стабиль-
ная индивидуальная фаза, но это не было подтверждено после-
дующими исследованиями. Вполне возможно, что предельный
состав In2S3, где заняты все тетраэдрические позиции в шпи-
нельной структуре, может и не реализоваться ни при каких
экспериментальных условиях. Информация по этому поводу со-
держится, например, в статье [4].
Литература. [1] Acta cryst., 1980, В36, 2220. [2] Acta cryst., 1966, 20, 566.
[31 Acta cryst., 1967, 23. 111. [4] J. Solid State Chem., 1980", 34, 353. [51 Phys.
State Solid, 1976, 36, 517.
520 17. Сульфиды и оксосульфиды
17.1.8. Сульфиды хрома. Система Сг—S гораздо сложнее, чем
это представлялось первоначально. Между составами CrS и
Cr2S3 имеются три индивидуальные твердые фазы:
CrS МОНОКЛИННЫЙ CrSo.97
Cr7Se тригональный Cro.ssS—Cro,87S
CtsS$ тригональный Cro.esS
CTiSi МОНОКЛИННЫЙ Cro,79S—Cr0 76S
Cr2S3 тригональный Cro,69S
Cr2S3 ромбоэдрический Cro.67S
Во всех тригональных сульфидах хрома атом металла имеет
в качестве ближайших соседей 6 атомов серы на расстояниях
2,42—2,46 А, но в этих кристаллах имеются также и связи
Сг—Сг длиной приблизительно 2,80 А, т. е. эти вещества ха-
рактеризуются наличием и ионных (Сг—S), и металлических
связей.
Все перечисленные выше сульфиды, за исключением CrS [1],
имеют структуры промежуточного характера между типом NiAs
и типом С6 (Cdl2). Во всех сульфидах хрома, кроме Cr7S8, ва-
кансии в чередующихся слоях атомов металла располагаются
упорядоченно, в Cr7Ss — статистически. Доли занятых металли-
ческих позиций между плотноупакованными слоями в этих ве-
ществах таковы:
1
Т 1 Т
1 о
M3S4 M2S3 MS2
Схема размещения вакансий в позициях атомов металла в
Cr2S3 (тригональная и ромбоэдрическая модификации) и в
Cr5S6 приведена на рис. 17.6; аналогичный характер имеет
структура Cr3S4 и еще одного сульфида Cr5S8, полученного при
повышенном давлении [2], а также изоструктурного с ним
V5Ss [3].
Структура CrS уникальна и является промежуточной меж-
ду NiAs и PtS (см. рис. 17.7). В окружение хрома входят
4 близлежащих атома серы на расстоянии 2,45 А (в среднем)
и два более удаленных B,88 А), что напоминает CrF2 с дефор-
мированной рутильной структурой и такой же координацией
D + 2). Хотя формально CrS изотипен PtS, их элементарные
ячейки имеют совершенно различную форму, и поэтому CrS
лучше всего рассматривать как новый структурный тип. Это и
иллюстрирует рис. 17.7.
Литература. [1] Acta cryst, 1957, 10, 620. [2] Inorg. Chem., 1969, 8, 566.
[3] Сотр. rend. (Paris), 1964, 258, 5847.
17.1. Бинарные сульфиды металлов 521
Схематическое изображение
элементарной ячейки
типа NiAs в плане
Изображение по вертикали
Рис. 17.6. Упорядоченные вакансии в структуре типа NiAs. а — Cr5Ss; б — три-
гональный Cr2S3; в — ромбоэдрический Cr2S3.
17.1.9. Сульфиды ванадия, ниобия и тантала. Сопоставление
формул и структур сульфидов ванадия, ниобия и тантала с
формулами и строением оксидов этих металлов является еще
одной иллюстрацией общих положений, отмеченных в начале
главы. Например, в системе Nb—S охарактеризовано по край-
ней мере 9 кристаллических фаз, и ни одна из них не имеет
Рис. 17.7. Взаимосвязь между структурами NiAs (a), CrS (б) и PtS (e).
На рис. а и в штриховыми линиями изображены общепринятые элементарные
ячейки.
аналога среди оксидов ниобия. У сульфидов ниобия по две мо-
дификации имеют NbSi-ж (низкотемпературная со структурой
типа NiAs и высокотемпературная, изоструктурная МпР),
Nb!+xS2 и NbS2 (гексагональная и ромбоэдрическая со структу-
рой типа MoS2). Формулы всех известных сульфидов рассматри-
522 17. Сульфиды и оксосульфиды
ваемых металлов (вместе с перечисленными) приведены ниже:
V3S [1]
VS
v3s4
V5S8 f2]
Nb21Si
NbSi-
Nb3S4
Nb,+,
NbS2
MbS3
* Г31
¦x B модификации)
[4]
S2 B модификации)
B модификации)
Ta6S
Ta2S
TaS2
TaS3
Г51
Г6]
(модификации типа Cdl2,
CdCl2, Cd(OH)Cl)
VS,
Некоторые из этих соединений имеют сложные структуры,
описать которые не просто. Примерами могут служить две мо-
дификации V3S и Nd2iS8. Последнее соединение обладает ме-
таллоподобными свойствами и содержит шесть типов атомов
ниобия с координацией от IS до 4S.
Структура Nb3S4 показана на рис. 5.43 (т. 1), она построена
из утроенных колонок, образованных октаэдрами NbS6 с общи-
ми гранями; каждый из них обобщает еще по четыре ребра
так, что получается трехмерная структура, по общей геометрии
аналогичная структуре UCU*. Упрощенная проекция структуры
(рис. 17.8, а) показывает, что в ней, во-первых, имеются сквоз-
ные незаполненные каналы, а во-вторых, что все атомы серы
кристаллографически подразделяются на два вида. Атомы (Si),
которые расположены на поверхности каналов, имеют очень
асимметричное окружение из четырех Nb-соседей, тогда как
атомы (S2), расположенные на центральной оси колонки, име-
ют 6 таких соседей (тригонально-призматическая конфигура-
ция).
Атомы Nb смещены из центров своих координационных ок-
таэдров так, что связи Nb—Nb образуют зигзагообразные цепи,
перпендикулярные плоскости проекции, как показано штрихо-
выми линиями на рис. 17.8, a. Nb3S4 обладает металлической
проводимостью, расстояние Nb—Nb B,88 А) в нем сопоставимо
с аналогичным расстоянием в кристалле металла B,86 А).
Структуры Ta2S и Ta6S родственны между собой. В обоих
этих сульфидах атомы металла образуют колонки, состоящие
из объемноцентрированных пентагональных антипризм
(рис. 17.8, б, в) с общими (пентагональными) основаниями.
Поскольку атомы тантала в центрах антипризм имеют икоса-
эдрическое окружение из 12 ближайших соседей A0 образуют
антипризму, а 2 находятся в центрах объемов смежных анти-
призм), то колонки можно рассматривать как построенные из
* В действительности общих ребер в каждом октаэдре пять. Не считая
ребра, общего для всех трех октаэдров каждого «этажа» колонки (оно при-
надлежит общим граням), два параллельных ребра соединяют соседние «эта-
жи» колонки, а три боковых—сочленяют колонки друг с другом. — Прим.
ред.
17.1. Бинарные сульфиды металлов 523
©Nb О S
О
о
Рис. 17.8. Проекции структур Nb3S4 (a); Ta2S (б); Ta6S (в).
взаимопроникающих икосаэдров. Эти колонки атомов металла
скрепляются друг с другом атомами серы, в случае Ta2S —двух
сортов (с 4 и 6 соседями), в случае Ta6S — одного (с 7 соседя-
ми в форме одношапочной тригональной призмы). Координаци-
онное окружение атомов тантала в центрах колонок целиком
состоит из 12 металлических атомов, а окружение атомов Та,
расположенных на периферии, включает 2 или 3 атома серы
в Ta2S, 1 или 2 — в la^S> и достраивается за счет атомов тан-
тала той же колонки. Расстояния Та—Та между колонками не
очень коротки, но они все же свидетельствуют о том, что хотя
наиболее сильные взаимодействия металл — металл имеют ме-
сто внутри колонок, определенное взаимодействие такого рода
может быть и между колонками. Так, в Ta2S наикратчайшим
является расстояние Та—Та между атомами в центрах анти-
призм B,80 А), тогда как расстояния лтежду атомами, располо-
524 П. Сульфиды и оксосульфиды
женными на поверхности колонок C,14 А), сопоставимы по ве-
личине с некоторыми из расстояний между колонками C,10 А).
Заслуживает внимания следующее обстоятельство: несмот-
ря на то что атомы серы и фосфора имеют близкие размеры и
Ti2S и Zr2S изоструктурны Та2Р, рассмотренная структура Ta2S
не имеет с ними ничего общего; в ней преобладает взаимодей-
ствие Та—Та, т. е. координационные числа по сере очень низки
(для сравнения отметим, что в Ti2S у атома металла среди
ближайших соседей 3—5 атомов серы).
Информация о группе сложных сульфидов, имеющих общее
структурное сходство с рассмотренными сульфидами, дается в
разд. 17.2.4.
Литература. [1] Acta cryst., 1959, 12, 1022. [2] Compt. rend. (Paris), 1964, 358,
5847. [3] Acta cryst., 1968, B24, 412. [4] Acta cryst., 1968, B24, 1614. [5] Acta
cryst., 1970, B26, 125. [6] Acta cryst., 1969, B25, 1736.
17.1.10. Сульфиды титана. Сульфиды титана помимо предель-
ных соединений TIS3 и TisS включают TiS2 и TiS — вещества
с простыми структурами (основанными на гексагональных
Таблица 17.8. Сульфиды титана:
Сульфид
TiS2
Ti5Ss (T13S5)
"Ti2S3"
T12.45S4
T13S4
Ti4S5
Ti8S9
TiS
LixTiLiS2
Последова-
тельность
слоев S
г
ккгг
кг
кг
кггкгкг
кгкгг
кгг
г
TiS2—TiS,
Доля занятых позиций
между последователь-
ными слоями S
21,0^0
^1,оКо.2г1,о2о,2
К1.0г0,4
tl.o2o,23
К0,5г1,оЗо,5'с0,95гО,7'Со]7го]95
'^0,92о.9'<:0,6г1,0г0,6
Ко,83г1,0г0,83
г1,0г1,0
LuTii,iS2
Литература
__
Rec. Trav. Chim.,
(Belg.), 1966, 85,
869
Acta cryst., 1975, B31,
2800
J. Solid State Chem.,
1970, 2, 36
J. Solid State Chem.,
1970, 1, 519
Science, 1972, 175, 884
плотнейших упаковках) типа СсИг и NiAs и ряд фаз с соста-
вами, промежуточными между дисульфидом и моносульфидом
(табл. 17.8). Последние фазы имеют структуры, базирующиеся
на более сложных (и разных) последовательностях плотноупа-
кованных слоев, в которых атомы металла занимают октаэд-
рические пустоты, — картина, противоположная наблюдаемой
в сульфидах хрома (CrjSs, Cr5S6 и Cr3S4), в которых упаковка
17.2. Сложные сульфиды и тиосоли 525
атомов серы остается неизменной (ГПУ). Определенные слои
позиций атомов титана заняты полностью (или почти пол-
ностью), тогда как другие заполнены только частично (стати-
стически).
Соединения Ы-ДЧ^Бг, приготовленные сплавлением метал-
лического лития и Tii,iS2 (структура типа Cdb) при х =
= 0,1—0,3, имеют плотнейшую упаковку кг-типа, вероятно,
со статистическим размещением атомов лития и титана по
октаэдрическим позициям в частично заполненных слоях. При
более высоких концентрациях лития @,5<х<1,0) реализуется
совершенно иная (тетрагональная) структура. Эти соединения,
а также NaxMoS2, MaZrS2, M^HfS2 (M = Na, K, Rb или Cs)
занимают значительное место в реализации сверхпроводимости
при относительно высоких температурах A0—13 К), тогда как
ни одно из бинарных веществ Li, Ti и S не является сверхпро-
водником выше 1 К.
17.2. Сложные сульфиды и тиосоли
В настоящее время известно очень большое число твердых
сульфидов, в состав которых входит несколько различных ме-
таллов. Эти фазы охватывают как соединения, синтезированные
в лаборатории, так и чрезвычайно широкий набор сульфидных
минералов. Некоторые их простые примеры уже были приве-
дены в предыдущих главах для иллюстрации определенных
структурных типов: Pb2Ga2S5 как представителя структур, ос-
нованных на планарной сетке типа 4,82 (т. 1, разд. 3.9.2);
La2SnS5 и Sm3InS6 как структур, содержащих рутилоподобные
цепи (т. 1, разд. 5.3.4); Mn2SnS4 как дефектной структуры типа
NaCl (т. 1, разд. 6.1). Как и в оксидных, в сульфидных мине-
ралах широко распространено изоморфное замещение, что при-
водит к неупорядоченным нестехиометрическим соединениям,
среди которых можно выделить три главных класса. Если для
простоты разделить связи А—S и В—S в соединениях AxBj/Sz
на два типа — существенно ионные и существенно ковалентные,
то, очевидно, можно представить себе следующие три комбина-
ции:
a —s
B-S
(а) Ионная Ионная
(б) » Ковалентная
(в) Ковалентная »
526 17. Сульфиды и оксосульфиды
В случаях (а) и (в) разница в характерах связен А—S и
В—S в конкретном соединении невелика, в то время как при
комбинации (б) атомы В и S образуют ковалентные комплек-
сы, которые могут быть конечными или бесконечными в одном,
двух или трех измерениях. По аналогии с оксидами комбина-
ции (а) и (в) надо описывать как сложные сульфиды, а (б) —
как тиосоли. Представителей класса (в) среди оксосоединении
не найдено; более того, критерий для изоморфного замещения
у сульфидов отличен от применяемого для сложных оксидов
из-за более ионного характера связей в последних. В ионных
соединениях возможность изоморфного замещения зависит
главным образом от величины ионного радиуса, а химические
свойства конкретного иона играют меньшую роль. Так, обна-
ружено, что в оксидных структурах в позициях с октаэдриче-
ской координацией взаимозаменяемы следующие ионы: Fe2+.
Mg2+, Mn2+, Zn2+, тогда как Na+ гораздо чаще замещает при-
близительно равновеликий с ним Са2+, чем К.+, к которому он
гораздо ближе по химическим свойствам. С другой стороны, в
сульфидах критерием изоморфизма является способность раз-
нородных атомов образовывать одинаковое число направлен-
ных связей; и действительно, атомы Си, Fe, Mo, Sn, Ag и Hg
замещают Zn в сфалеритной и родственных ей структурах.
Вполне очевидно, что эта классификация слишком поверх-
ностна, чтобы охватить все известные соединения, и к тому же
она обладает существенным недостатком: она заранее предпо-
лагает определенный тип связи. Однако и чисто геометрическая
классификация, основанная на известных кристаллических
структурах, имела бы в основном тот же вид. Класс (а) вклю-
чает структуры, подобные структурам сложных оксидов
(табл. 17.9), аналогия с которыми проявляется даже в том, что
ряд сложных сульфидов адаптирует ту же модифицированную
форму перовскитной структуры, которая характерна для окси-
дов типа GdFeGV Класс (а) до известной степени плавно пе-
реходит в класс (в) при изменении характера связи от ионного
к ковалентному или ковалентно-металлическому. В классе (а)
в качестве ионов А и В выступают обычно электроположитель-
ные элементы первых А-подгрупп или определенные представи-
тели Б-подгрупп периодической системы (например, In3+, Bi3+).
В тиосолях (класс (б)) А может быть щелочным металлом, Ag.
Cu(I), NH4, Tl(I), а В — неметаллом (Si, As, Sb) или переход-
ным металлом в высокой степени окисления (Vv, MoVI).
В соединениях класса (в) оба металла, как правило, из
Б-подгрупп (Си, Ag, Hg, Sn, Pb, As, Sb, Bi), но включают также
некоторые переходные элементы, например Fe.
Уже было отмечено одно различие между сложными окси-
дами и сульфидами, а именно: соединения класса (в) не име-
Таблица 17.9. Кристаллические структуры сложных сульфидов и тиосолей
(NH4JWS4
TI3VS4
Na3SbS4-9H2O
KFeS2
NH4(CuMoS4)
Ba2MnS3
Ba2ZnS2
KC114S3
(NH4)Cu7S4
К.Ч атомов
А и В
9, 10):4
4+4) :4
6:4
8:4
12:4
7:4
7:4
8:4
8:4
Тип тнонона
конечный
»
Цепочечный (с общими реб
рами)
То же
Цепочечный (с общими вер
шинами)
Сдвоенная цепь
Сдвоенный слой
Трехмерный каркас
Литература
Acta cryst., 1963,
16, 719
Acta cryst., 1964,
17, 757
Acta cryst., 1950, 3,
363
Z anorg. allg.
Chem., 1968, 359,
225
Inorg. Chem., 1970,
9, 1449
Inorg. Chem., 1971,
10, 691
Z anorg. allg.
Chem,. 1961, 312,
99
Z anorg. allg.
Chem., 1952, 269,
141
Acta cryst., 1957,
10, 549
Структура
BaTiS3
BaVS3
B.aTaS3
BaSnS3
EuHfS3, EuZrS3
CaHfS3, CaZrS3
BaZrS3, BaUS3
NaCrS2, NaInS2
LiCrS2
NiCr2S4
NaBiS2
FeCr2S4, CuCr2S4
ZnAl2S4
12:6
9:6
8:6
6:6
6:6
6:6
6:6
4:6
CsNiCU (BaNiOs)
NH4CdCl3
udFeO3
(разд. 13.3.2)
Сверхструктура NaCl
Сверхструктура NiAs
To же
NaCl (статистич.)
Шпинельная
Acta cryst., 1969,
B25, 781;
Inorg. Chem., 1969,
8, 2784
Materials Res. Bull.,
1970, 5, 789
Acta cryst., 1980,
B36, 2223
J Phys. Chem. So-
lids, 1968, 29, 977
Inorg. Chem., 1970,
9, 2581
Inorg. Chem., 1966,
5,977
Rec. Trav. chim.
(Belg.), 1944, 63,
32
Ark. Kemi, Mineral.
Geol., 1943, 17B,
No. 12
Z. anorg. allg.
Chem., 1967, 23,
142
528 17. Сульфиды и оксосульфиды
ют аналогов среди оксидов. Второе различие заключается в
том, что сульфиды (за исключением соединений наиболее
электроположительных элементов) проявляют большее сходст-
во с металлами, чем оксиды. Связь металл — металл в простых
оксидах возникает редко, тогда как во многих сульфидах пере-
ходных металлов ее существование вполне очевидно.
Во многих сложных сульфидах класса (в), так же как и в
некоторых простых сульфидах, например у производных меди,
оказывается невозможным интерпретировать размещение ато-
мов и длины связей в рамках нормальных валентных состоя-
ний металлов; это приводит к предположению о частичной
металлизации связей, что подтверждается и физическими свой-
ствами этих соединений. В пределе образование локализован-
ных связей металл — металл приводит к кластерам, примеры
которых приводятся в разд. 17.2.4.
17.2.1. Тиосоли. Большинство тиосолей щелочных металлов бы-
ло приготовлено одним из двух следующих способов.
1) Сульфиды неметаллов и электроотрицательных металлов,
переводят в раствор сульфида щелочного металла, откуда ин-
тересующие соединения могут быть затем осаждены или вы-
кристаллизованы при введении в раствор порции спирта. Они,,
как правило, хорошо растворимы в воде, часто высокогидрати-
рованы, легко гидролизуются и окисляются. Таким способом
были приготовлены тиосиликаты, тиофосфаты и другие соеди-
нения этого типа, в том числе (NFLjKVS4; Na6Ge2S7-9H2O;
K3SbS3; Na3SbS4-9H2O; тиомолибдаты M2MoS4 и тиовольфра-
маты M2WS4. Существование тетраэдрических тио-ионов уста-
новлено в Na3SbS4-9H2O, (NH4JMoS4 и (NH4JWS4; последние
два вещества изоструктурны с одной из форм K2SO4. Структу-
ры солей, содержащих тио-ионы MS4"~, упоминаются при рас-
смотрении химии элемента М.
2) Переходный металл или его сульфид прокаливают дли-
тельное время с серой и карбонатом щелочного металла, после
чего следует экстракция продукта реакции водой. Так получе-
ны KFeS2, NaCrS2 и KCu4S3. (Этот метод может быть исполь-
зован также для синтеза сложных сульфидов типа KBiS2.) Все
эти соединения нерастворимы в воде и интенсивно окрашены;
щелочные металлы присутствуют в них, вероятно, в виде ионов
М+, а тио-ионы—'В разнообразных формах: в виде цепей, сло-
ев или трехмерных сеток. Голубого цвета с металлическим от-
тенком волокнистые кристаллы KFeS2 построены из бесконеч-
ных цепочечных ионов, образованных тетраэдрами FeS4 путем
обобщения противоположных ребер; между этими цепями рас-
положены катионы К+, окруженные 8 атомами серы (рис. 17.9).
Интересны детали строения подобной цепи в NH4(CuTMoVIS4)s
17.2. Сложные сульфиды и тиосоли 529»
где вдоль цепи чередуются Си1 и MoVI. В растворе хлорида
меди-аммония кристаллы KFeS2 превращаются в металлопо-
добные CuFeS2 со сфалеритовой структурой, в которой уже нет
тио-ионов. Действием H2S на смесь ВаО и ZnO при 800 °С по-
лучают Ba2ZnS3, также содержащий бесконечный одномерный
тио-ион; в изоструктурном КгСиС13 найдены двойные цепи из
тетраэдров. Ba2MnS3, в котором имеются цепи из тетраэдров,
с общими вершинами, изоструктурен K2AgI3.
Рис. 17.9. а —размещение атомов Fe (кружки) в цепях тетраэдров FeS4
в KFeS2; б —проекция структуры KFeS2 вдоль направления цепей.
Медь образует ряд сложных тиосолей с щелочными метал-
лами. Темно-синие кристаллы KCu4S3 могут быть приготовлены
прокаливанием меди с карбонатом калия и серой с последую-
щей экстракцией продукта водой. Они являются хорошими
проводниками тока. Их структура состоит из сдвоенных слоев,
построенных из тетраэдров CuS4; слои перемежаются ионами
К+, окруженными 8 атомами серы, расположенными в верши-
нах куба. Трехмерный тио-ион найден в черных с глянцевым
блеском (тетрагональных) кристаллах NH4Cu7S4, образующих-
ся среди других продуктов реакции при длительном взаимодей-
ствии тщательно измельченной меди с раствором сульфида ам-
мония в бескислородной атмосфере. Для нас представляет ин-
терес только общий характер структуры этого соединения
(рис. 17.10). Основу структуры составляет отрицательно заря-
женный каркас состава Cu7S4~, построенный из колонок, сши-
тых в поперечном сечении атомами меди, статистически разме-
щенными по 3/4 позиций, изображенных на рис. 17.10 самыми
маленькими кружочками. Геометрия каркаса такова, что между
34—985
330 17. Сульфиды и оксосульфиды
8 атомами серы оказываются кубические пустоты, в которых
располагаются ионы NH4+.
Во всех описанных выше структурах атомы металла, обра-
зующие тио-ион, координированы тетраэдрически. Теперь при-
ведем примеры, где они координированы октаэдрически. Иска-
женная перовскитная структура BaZnS3 должна рассматривать-
ся, по-видимому, как ионная структура с координационными
числами 12 у Ва2+ и 6 у Zr4+. (Поскольку октаэдры ZrS6 связа-
ны через общие вершины в трехмерную сетку, комплекс ZrS3
Си в позиции с/4
Си в позиции Зс/4-
Сиз в позиции
5
0,35 с
и,оос
С j S в позиции с/4
(&) S в позиции Зс/4
Рис. 17.10. Кристаллическая структура NH4CU7S4.
можно рассматривать и как трехмерный «тио-ион».) Структуры
ряда соединений ABS3 представляют собой гексагональные плот-
нейшие упаковки слоев AS3 с заполнением атомами В колонок
октаэдрических пустот, имеющих общие грани (структура ВаЫЮз
дли CsNTiCl3); так формируются бесконечные линейные тио-ионы.
В BaYS3 расстояние V—V B,81 А) указывает на наличие свя-
зей металл — металл, что согласуется с металлическим типом
проводимости этого вещества, хотя BaTaS3 (Та—Та 2,87 А) —
только полупроводник. Сдвоенные цепочечные октаэдрические
ионы найдены в BaSnS3, SrSnSs, PbSnSs (структура типа
NH4CdCl3). Бесконечные двумерные октаэдрические тио-ионы
образуются в NaCrS2 и подобных ему соединениях. Кристаллы
NaCrSc имеют форму тонких хлопьев, которые выглядят темно-
красными в проходящем свете и серовато-зелеными с металли-
ческим блеском — в отраженном. Они содержат слои CrS2~ того
же типа, что и в Cdb; слои эти скрепляются друг с другом
ионами Na+ (рис. 17.11), причем как хром, так и натрий имеют
октаэдрическую координацию. Альтернативно строение этой фа-
зы можно описать как сверхструктуру NaCl. С NaCrS2 изострук-
турны NaInO2 и NaInS2, а также KCrS2 и RbCrS2. С другой
17.2. Сложные сульфиды и тиосоли 53И
стороны, LiCrS2 имеет сверхструктуру NiAs: в гексагональной
плотнейшей упаковке из атомов серы Li и Сг чередуются в ко-
лонках из координационных октаэдров с общими гранями. Стро-
ение ЫСгЭг может быть описано и по-другому: слои состава
CrS2, проложенные ионами Li+. По-видимому, взаимодействие
Li—Сг через общие грани октаэдров не очень сильное (расстоя-
ние Li—Сг 3,01 А), вследствие чего это вещество обладает вы-
соким сопротивлением. Подобно
тому как NaBiS2 (статистический
вариант структуры NaCl) родст-
вен в кристаллохимическом смыс-
ле PbS и другим простым суль-
фидам, имеющим структуру NaCl,
так и FeCr2S4 родствен C03S4,
a NiCr2S4 и NiV2S4 родственны
Cr3S4, тогда как многие сульфи-
ды класса (в) родственны наи-
более простому ковалентному
сульфиду ZnS.
s
Сг
Na,
Рис. 17.11. Кристаллическая струк-.
тура NaCrS2-
17.2.2. Бесконечно адаптируемые
структуры*. Выше уже были
описаны структуры KFeS2 и
NH4(CuMoS4), в которых катио-
ны располагаются между цепя-
ми MS2, построенными из свя-
занных ребрами тетраэдров; упа-
ковка цепей такова, что К+ координирован 8, a NH4+— 12 ато-
мами серы. Это нормальные структуры, т. е. периодичность раз-
мещения катионов в них такая же, как периодичность размеще--
ния атомов в цепях. Исследование системы Ва—Fe—S показа-
ло, что она помимо BaFe2S4 [1] содержит ряд соединений с об-
щей формулой Bai+xFe2S4 (или Bap(Fe2S4)<?), которые при зна-
чениях х = 0,062—0,143 (или p/q — 16/is—&h) имеют структуры
необычного типа. Примерами их являются [2] Ba9Fei6S32 и
Bai0Fe18S36. В этих сульфидах периодичность размещения ионов
Ва между (параллельными) цепями становится несоразмерной
с интервалом размещения атомов S вдоль цепей, в результате
чего период повторяемости в этом направлении увеличивается.
Например, в Ba9Fe!6S32 параметр субъячейки для Ва состав-
ляет 7э от 44,41 А, а для S — Vs, что и приводит к параметру
полной ячейки с = 44,41А; решетка тетрагональная, параметр
* В отечественной литературе этот термин не принят. Описываемые фазы,
называют несоразмерными или длиннопериодическими. — Прим. перев.
34*
532 17. Сульфиды и оксосульфиды
л = 7,78 А. Для структур этого типа было предложено название
«бесконечно адаптируемые структуры».
Нечто подобное наблюдается в ряду соединений состава ТВЖ
с л-=1,25—2, где Т —элемент V —VIII групп, а В —элемент
JV группы периодической системы, например MnisSi26 [3] и
iRhi7Ge22 [4]. Эти фазы имеют тетрагональную решетку с а около
6 А, но с с до 300 А. Так, элементарная ячейка Mni5Si26 (c =
= 65,3 А) состоит из 15 субъячеек, расположенных вертикально
одна над другой; каждая из них содержит 4 атома марганца.
.Эти атомы размещены по спирали, и их координаты z отлича-
ются друг от друга на величину с/60. Рассматриваемая элемен-
тарная ячейка содержит также 52 пары атомов кремния, у ко-
торых координаты z последовательно возрастают через каж-
дые г/52. Поэтому структура в целом повторяется через каж-
дые 60 атомов марганца и 104 атома кремния.
.Литература. [1] J. Solid State Chem., 1980, 32, 329. [2] J. Chem. Soc. D, 1973,
1107; Ada cryst., 1975, B31, 45. [3] Acta cryst, 1967, 23, 549. [4] Acta cryst.,
1967, 22, 417.
17.2.3. Сульфиды со структурами, родственными сфалериту и
вюртциту. Взаимосвязь со структурами сфалерита и вюртцита
'.наиболее очевидна в сульфидах типа a-AgInS2, в которых ато-
мы серебра и индия занимают произвольно позиции цинка в
вюртцитовой структуре. Может реализоваться и альтернатив-
лый вариант, когда атомы цинка в одном из двух структурных
типов ZnS упорядоченно замещаются атомами двух или
.большого вида атомов. При этом в структурах как со статисти-
ческим, так и с упорядоченным распределением атомов метал-
ла отношение металл : сера остается равным 1:1. Выше было
-показано, что в некоторых сульфидах M2S3 и M3S4 занимается
только часть позиций металла (тетраэдрических или октаэдри-
ческих) в плотнейшей упаковке атомов серы. В случае струк-
тур типа ZnS это означает заполнение 2/з или 3/4 позиций цинка
(т. е. '/з или % всех тетраэдрических пустот в плотнейшей упа-
ковке). Если же вместо «недоукомплектованности» набора ато-
мов металла образуется определенное число вакансий в пози-
циях серы, то реализуются структуры, в которых одна часть
металлических атомов тетраэдрически окружена четырьмя ато-
мами серы, а другая — пирамидально тремя. Так как последняя
•конфигурация характерна для связей мышьяка и сурьмы, то
этот вид структуры присущ соединениям типа Cu3AsS3. Воз-
можность дальнейшего модифицирования структуры ZnS путем
замещения другими атомами и Zn, и S реализуется в лаутите
CuAsS [1], в котором и металлические, и халькогенные позиции
заняты (упорядоченным образом) равным количеством атомов
.меди, мышьяка и серы. Однако эту структуру предпочтительнее
17.2. Сложные сульфиды и тиосоли 533
описывать как замещенную алмазообразную, и именно так она
была описана в гл. 3 (т. 1). Поэтому можно выделить следу-
ющие типы структур:
Отношение М : S
1) 1:1
2)
3)
Статистическое или упорядоченное
замещение Zn в сфалеритовой или
вюртцитовой структуре
fAl2CdlS4
[Cu3As]S3
Примеры соединений классов A) и B) приведены в табл. 17.10.
1) Самый простой пример сфалеритовой сверхструктуры —
структура халькопирита, или медного пирита CuFeS2, в кото-
ром равное количество атомов меди и железа упорядоченно
замещает Zn в исходной структуре. В результате этого замеще-
а
о О
2п„ s
ZnS
о о ф О
Си Fe Sn S
CuFeSz C
Рис. 17.12. с — кристаллическая структура ZnS (изображены две элементар-
ные ячейки); б — CuFeS2; в — Cu2FeSnS4.
ния в вершинах первоначальной элементарной ячейки ZnS
оказываются разнородные атомы, так что период повторяемо-
сти вдоль одного направления удваивается. Поэтому объем
элементарной ячейки CuFeS2 вдвое больше объема ячейки
ZnS. Процесс подобного замещения можно продолжить заме-
нив половину атомов железа в CuFeS2 на атомы олова: тогда
юртциту
.твенпые сфалериту и в
Таблица 17.10. Структуры, роде
Вюртцит
1 Сфалерит
Неупорядо-
ченный
Упорядоченный
Неупорядоченный
Упорядоченный
Доля занятых
металлических
позиций
В
Z
с
-- ^? ии<?
— 11 з ззз
< CQU UUU
"О С га
UNO
^ II
га" „ «>
О Х°°_
CQX II<ONUUUU U
н к со
И- О ^ S [/}
Ч 2 CU S г°
«СО ^tH S^
•в- G газ н з
UN XU UU
Все
Неупорядоченный
Неупорядоченный
2
х
X
GJ
О
о:
о,
О
СО
N
СО.
a eO
"Si
Ж
и
Неупорядоченный
Неупорядоченный
га га га ?
/7.2. Сложные сульфиды и тиосоли 535
534
возникает структурный тип станнита Cii2FeSnS4. Кристалли-
ческие структуры ZnS, CuFeS2, CuFeSnS4 показаны на
рис. 17.12. Ближайшими соседями атома серы в трех структу-
рах являются:
Zn
Zn Cu
Fe Си Fe
s s' s
/\ /\ /\
Zn Zn Fe Си Sn Си
(ZnS) (CuFeS2) (Cu2FeSnS4)
К аналогичным вюртцитным сверхструктурам относятся
Cu2CdSiS4 и Cu2CdGeS4 [2a], в которых ближайшими соседями
атома серы являются 2Cu, lCd и lSi(Ge).
Не имеет никакого значения то обстоятельство, что ни FeS,
ни SnS не обладают тетраэдрической сфалеритовои структурой,
a CuS, по-видимому, не истинный сульфид Си(II). Валентность
меди (и других элементов) в CuS, CuFeS2 и т. д. обсуждается
в разд. 25.8. Представители соединений со структурой CuFeS2
[26] указаны в табл. 17.10.
Некоторые вещества, например ZnSnAs2 [3], имеют упорядо-
ченную структуру CuFeS2 при обычных температурах и неупо-
рядоченную сфалеритовую — при более высоких температурах.
Другой пример фаз этого типа — Cu3AsS4 (луцонит) [4а],
¦обладающий сфалеритовои структурой, где 3U атомов Zn заме-
щено медью, а остальные—мышьяком. Это упорядоченное заме-
щение 4Zn комбинацией CCu + As) приводит к увеличению
элементарной ячейки (рис. 17.13). Другая модификация
O113ASS4 (энаргит) обладает вюртцитовой сверхструктурой [46].
2) Известны три правильных структурных типа с М: Х<^
<О : 1, и хотя примеры сульфидов, относящихся к каждому из
этих типов, неизвестны, мы приводим все три на рис. 17.14,
учитывая их кристаллохимическую близость к халькопириту и
станниту. Примеры приведены в табл. 17.10.
3) Представителями структур, получаемых из ZnS путем
удаления части атомов S, являются CU3ASS3 и Cu3SbS3 [5],
хотя минералы этого семейства обычно содержат железо и опи-
сываются более сложными формулами.
Хотя в ферромагнитном кубаните CuFe2S3 [6] отношение
-М : S равно единице, этот сульфид не принадлежит к классу
A), так как его связь со структурой вюртцита имеет более
сложный характер. Структура построена из вюртцитовых
блоков, соединенных друг с другом таким образом, что на гра-
ницах блоков образуются пары тетраэдров FeS4 с обобщенны-
ми ребрами (рис. 17.15). Расстояние Fe—Fe B,81 А) при этом
несколько больше, чем длины связей металл — металл, но, ве-
536 17. Сульфиды и оксосульфиды
( ) As в позиции х-0
X/fykb s позиции x = j
\^J Си 13 позиции х-0
^^ Си в позиции x=jt
О Ss позиции х*>?
Щ S в позиции х~^
17.2. Сложные сульфиды и тиосоли 537
Рис. 17.13. Проекция структуры луцонита Cu3AsS4 в направлении оси а.
О О О
In Cd Se
о оо
Си Hg I
О © О
Ад Hg I
Рис. 17.14. Структуры, родственные сфалериту: |3-Gu2HgI4 (a); |3-Ag2HgI4 (б)-у
In2CdSe4 (e).
роятно, определенное взаимодействие между атомами железа
все же возникает.
Взаимосвязь структуры вольфсбергита CuSbS2 [7] со струк-
турой вюртцита менее проста. СиБЬБг имеет слоистую струк-
туру, в которой каждый атом Sb образует 3 обычные пирами-
дальные связи, а атом меди —4 тетраэдрические связи Си—$„
Fe Си Fe
i Вершины i BepuzuHhT
Шапраеленььниправлены \
вниз вверх
Рис. 17.15. Фрагмент структуры кубанита (CuFe2S3), иллюстрирующий блоки
вюртцитовой структуры с тетраэдрами, вершины которых поочередно направле-
ны вверх и вниз.
На рис. 17.6 а, показана схема фрагмента вюртцитовой струк-
туры, на которой изображения атомов Zn и S накладываются,
так как эти атомы лежат (на разной высоте) на одной и той
же линии перпендикулярной плоскости проекции. Если в этой
структуре выделить полосу, ограниченную вертикальными плос-
костями, показанными штриховыми линиями на рис. 17.16, а,
Os »Cu osb
Рис. 17.16. а — схема участка вюртцитовой структуры. Атомы металла, цинка
в случае вюртцита, изображены в виде маленьких кружков двух типов, чтобы
облегчить сравнение с рис. 17.17; б — та же структура, но часть атомов из нее
удалена, чтобы показать связь со слоями в CuSbS2.
то окажется, что атом металла, лежащий на штриховой линии,
теряет один из соседних атомов серы (показанных пунктирны-
ми кружками), в то время как атом металла, расположенный
между этими линиями, сохраняет всех четырех соседей. (Необ-
ходимо помнить, что каждый атом металла соединен с одним
538 17. Сульфиды и оксосульфиды
атомом S, лежащим непосредственно под или над ним, так что
количество связей М—S на самом деле на одну больше, чем
это следует из схемы.) Позиции металлических атомов в слоях
CuSbS2 на штриховых линиях занимают атомы сурьмы, а
между этими линиями (рис. 17.16, а)—атомы меди; вид сбо-
ку на эти слои представлен на рис. 17.17. Сравнение рис. 17.16
и 17.17 показывает определенное сходство в структуре слоя
CuSbS2 и участка вюртцитовой структуры между штриховыми
II Ч
о
S
Си
о
Sb
Плоскость
' скола
Рис. 17.17. Вертикальное сечение структуры CuSbS2, параллельное плоскости
слоев. Соседями атома Sb в слое являются один атом S на расстоянии 2,44 А
и два атома S на расстоянии 2.57 А. Штриховые линии между слоями отме-
чают очень слабые связи Sb—S C,П А), которые обусловливают наличие
хорошей спайности, параллельной слоям.
линиями (параллельными кристаллографической плоскости
1120).
Число сложных сульфидных минералов очень велико, и хотя
многие из них можно рассматривать как производные простых
сульфидных структур (например, ZnS, PbS), подобное родство
не всегда является ближайшим. Например, позиции атомов Ag
и Sb в миаргирите AgSbS2 [8] очень близки к положениям чере-
дующихся атомов РЬ в галените (PbS), но атомы серы столь
далеко смещены из своих позиций в идеальной решетке PbS,
что сколько-нибудь заметного сходства между этими структура-
ми не возникает. Более важной особенностью AgSbS2 является
пирамидальный характер связи Sb с 3 атомами S.
S S
J i
17.2. Сложные сульфиды и тиосоли 539
Во многих сложных сульфидах сурьма образует три такие пи-
рамидальные связи и иногда в дополнение к ним еще две более
слабые, и подобные структуры лучше всего классифицировать
в соответствии с типом комплекса Sb—S. Так, в бертьерите
FeSb-S4 он представляет собой цепь SbS2 [9], а в джемсоните
FePb-iSbeS^ [10] могут быть выделены фрагменты (Sb3S7) таких
цепей. В наиболее полной классификации структур всех извест-
ных сложных сульфидных минералов [11] их общую формулу
записывают в виде A'qA"r(BmCn)Cp, где А' и А" символизиру-
ют металлы со следующими координационными числами:
( 2 Ag, Tl, Hg I 6 Pb, Fe, Co, Ni, Hg
А' | 3 Ag, Cu A"j 7 Pb, T1
[ 4 Ag, Си Zn | 9 Pb
Атомы В (As, Sb, Bi) и C(S, Se, Те) образуют систему
BmCn, построенную из пирамидальных групп ВСз и (или) тет-
раэдрических групп ВС4; Ср в общей формуле представляет те
атомы S(Se, Те), которые не входят в сульфосолевой комплекс.
Основой классификации является природа комплекса ВтС„, ко-
торая вместе с геометрическими требованиями, обусловленны-
ми координацией атомов А' и А", определяет кристаллическую
структуру рассматриваемых веществ.
Литература. [1] Acta cryst., 1965, 19, 543. [2а] Acta cryst., 1972, В28, 1626.
[26] Acta cryst., 1958, 11, 221. [3] Acta cryst., 1963, 16, 153. [4a] Z. Kristallogr.,
1967, 124, l.'[46] Acta cryst., 1970, B26, 1878. [5] Z. Kristallogr., 1964, 119, 437.
f61 Am. Mineral, 1955, 40, 213. [7] Z. Kristallogr., 1933, 84, 177. [8] Acta cryst.,
1964, 17, 647. [9] Am. Mineral., 1955, 40, 226. [10] Z. Kristallogr., 1957, 109, 161.
[11] Schweiz. mineral, petrogr. Mitteil, 1969, 49, 109 A80 библиографических
источников).
17:2.4. Сложные сульфиды, содержащие металлические класте-
ры. Взаимодействие между атомами металла, играющими в то
же время роль мостиковых для неметаллических атомов, возни-
кает, например, в кластерах галогенидов Nb, Та, Mo, W, Pd и
Pt (разд. 9.10.3) и карбонилов металлов (разд. 22.3.3). В слож-
ных сульфидах встречаются разнообразные металлические
кластеры. Так, тетраэдрические кластеры можно выделить в
соединениях типа MMo2Re2Ss, где M = Zn, Fe, Co, Ni [1], а «ку-
баноподобные» M04S4 — вокруг вакантных позиций в упорядо-
ченных шпинелях Alo,5Mo2S4 и Gao,5Mo2S4 [2]. Интересно семей-
ство соединений, содержащих кластеры из Mo-атомов, которое
описывается общей формулой Мт(Мозп5зп+2)> гДе М —один
из следующих элементов: Na, К, Rb, Cs, In или Tl. Кластеры
построены из треугольных субъединиц (схема а), которые на-
поминают структурные элементы некоторых карбонилов Ni и
Pt, но без мостиковых групп СО. Эти субъединицы могут быть
540 17. Сульфиды и оксосульфиды
в
Рис. 17.18. Кластеры, построенные из октаэдров MoS6 (или MoSe6): Mo6Xs
Мо9Х„ (б);Мо12Х,4 (е); (Мо6Хв)„ (X=S, Se) (г) [6].
расположены друг над другом по скрещенному мотиву так, что
в результате образуется либо дискретный октаэдр, либо более
сложный комплекс из октаэдров с общими гранями. Структура
кластера завершается атомами серы, расположенными на вин-
товой оси 3 на обоих концах колонки, что приводит к форму-
лам Mo6S8, MogSn или Moi2Su (рис. 17.18). Атомы М распола-
гаются в полостях структуры. Комбинация комплексов двух
сортов (Mo6Se8 и Mo9Sen) возникает в In3Moi5Sei9 [3], а также
в TI2M09S11, в котором кластеры являются не простыми комп-
лексами MgSn, а комбинацией MoeSs и M012S14, что может быть
выражено структурной формулой Tl^MoeSs) {M012S14) [4].
Mo
/\
Мо Мо
17.3. Оксид-сульфиды 541'
Предельная структура рассматриваемого типа —бесконечная
колонка октаэдров, связанных между собой общими гранями
и окруженных атомами серы (состав МОбЭб) [5]. Во всех соеди-
нениях МгМобЭб атомы М располагаются между цепями M6S6.
Рис. 17.19 показывает, что проекция структуры КгМобЭб или
изоструктурного ему K.2Mo6Se6 вдоль оси цепи похожа на анало-
гичную проекцию структуры TaeS (рис. 17.8, в), за исключены-
о о
о о
о
о о
о о
• Мо
О Se(S)
О
Рис. 17.19. Проекция структуры К
вдоль оси цепи.
ем того, что металлические цепи более плотно окружены атома-
ми серы, а между цепями расположены атомы калия. Расстоя-
ния Мо—Мо в треугольниках Мо3 и между ними (соответст-
венно 2,66 и 2,72 А) очень близки к соответствующей величине1
в самом металле B,72 А).
Литература. [11 J. Solid State Chem., 1976, 19, 305. [2] J. Solid State Chem.,.
1975, 14, 203. [3]Acta cryst, 1979, B35, 285. [4] Acta cryst., 1980, B36, 1319.
[5] J. Solid State Chem., 1980, 35, 286. [6] Acta cryst., 1980, B36, 1545.
17.3. Оксид-сульфиды
По-видимому, лишь относительно небольшое число элементов;
образует оксид-сульфиды. Оксид-сульфиды неметаллов (COS,
P4O6S4) описываются в других главах. Ниже же будут рассмот-
рены три основных структурных типа оксид-сульфидов метал-
лов, хотя известны структуры и нескольких более сложных
производных (например, Ce4O4S3 [1]): 1) кубическая структура
f542 17. Сульфиды и оксосульфиды
ZrOS [2]; 2) структура типа BiOCl (PbFCl) :ThOS, PaOS, UOS,
NpOS [3] и вторая модификация ZrOS [4]; 3) структура типа
La2O2S [5], в которой кристаллизуются также Ce2O2S и
Pu2O2S.
ZrOS получают пропусканием H2S над Zr(SO4J при тем-
пературе красного каления или над ZrO2 при 1300 °С; это
соединение диморфно. В кубической модификации ион Zr4+ ко-
ординирован 7-кратно; его соседями являются 3 иона О2^ на
расстоянии 2,13 А и 4 иона S2~ на расстоянии 2,62 А. Коорди-
национный полиэдр представляет собой искаженный октаэдр,
состоящий из комбинации CO + 3S) с четвертым ионом серы
над центром грани, содержащей три кислородных иона. Эта
координационная группа в идеализированном виде изображена
на рис. 3.6, а, (т. 1).
Структура BiOCl уже была описана и проиллюстрирована в
в гл. 10. В этом соединении атом металла координирован 8 со-
седями DО + 4С1), находящимися в вершинах антипризм, но
в изоструктурном LaOCl пятый атом хлора (за одной из гра-
ней квадратной антипризмы) находится на таком же расстоя-
нии от иона металла, как и 4 других. В ThOS и его аналогах
позиции атомов серы определены не очень точно, но тем не ме-
нее видно, что эти атомы размещены так, чтобы в окружении
атома металла в дополнение к 4 соседним атомам кислорода
было 5 равноудаленных атомов серы (Th—40 2,40 A; Th—5S
3,00 А).
Здесь можно упомянуть и о соединении ZrSiS, поскольку
одно время оно ошибочно принималось за Zr4S3. Его структура
тесно связана со структурой PbFCl; главное различие между
ними заключается в том, что в оксид-сульфидах этого вида
взаимодействие О—О является лишь вандерваальсовым, тогда
как в ZrSiS имеет место образование химических связей Si—-Si
B,51 А) [6].
Структура La2O2S родственна структуре высокотемператур-
ной модификации La2O3 (структура А—Мо2О3 на рис. 12.7).
Одна треть атомов кислорода в последней замещена серой так,
что ионы металла получают такую же координацию семью
атомами, как и в кубическом ZrOS (в данном случае она осу-
ществляется четырьмя атомами кислорода и тремя — серы).
В La2O2S длины связей составляют La—40 2,42 A, a La—3S
3,04 А.
Обсуждение структуры La2O2S будет продолжено в т. 3
(разд. 28.2.5).
Литература. [1] Acta cryst., 1978, В34, 3564. [2] Acta cryst., 1948, 1, 287.
.[31 Acta cryst., 1949, 2, 291. [4] Acta Chem. Scand., 1962, 16, 791. [5] Acta cryst.,
1973, B29, 2647. [6] Rec. Trav. chim. des Pays-Bas (Belg.), 1964, 83, 776.
T
f 18. АЗОТ
18.1. Введение
Азот стоит несколько особняком среди элементов V группы пе*
риодической системы. Он является самым электроотрицатель-
ным среди них и характеризуется двумя наиболее важными
особенностями в структурном отношении. Во-первых, для обра-
зования связей азот может использовать только четыре орбита-
ли L-оболочки, так что он формирует максимум четыре тетра-
эдрические связи (например, в NH4+, замещенных аммонийных
ионах и аминоксидах R3N-O), а в галоген- и оксопроизвод-
ных — только три связи, причем в последних соединениях связь
часто имеет кратный характер. Это вторая его отличительная
особенность: подобно своим соседям по периоду — углероду и
кислороду, азот проявляет сильную тенденцию к образованию
кратных связей. Он является единственным элементом V груп-
пы, который существует при обычных температурах в виде
двухатомной молекулы (N = N) и сохраняет эту форму в жид-
ком и твердом состояниях, предпочитая ее системе полимери-
зованных однократных связей, характерных для фосфора и
мышьяка. (О твердом N2 см. гл. 29.) Наблюдается интересное
различие между прочностью (кДж/моль) ординарных и крат-
ных связей азот — азот, азот — углерод и углерод — углерод:
С—С 347 С—N 305 N—N 163
С = С 611 C = N 615 N = N 418
С = С 837 C=N 891 N=N 946
В силу отмеченных выше обстоятельств азот образует много
соединений, структурные типы которых не реализуются другими
элементами этой группы, именно поэтому стереохимия азота
рассматривается отдельно. Например, из производных азота и
фосфора в структурном отношении подобны только ковалент-
ные молекулы, в которых эти элементы трехвалентны, и но-
ны—фосфоний и аммоний. Нет никаких аналогий между
пентагалогенидами азота и фосфора, и очень мало сходства
между кислородными соединениями этих двух элементов. Мо-
ноатомные ионы азота и фосфора известны только в твердом-
состоянии, в солеобразных нитридах и фосфидах более электро-
положительных элементов. Азид-ион N3~ с кратными связями1
характерен только для азота.
544 18. Азот
18.2. Стереохимия азота 545
Следующие соединения азота описаны в других главах:
галогеннитриды металлов (гл. 10); некоторые ионы, содержа-
щие N, S, О (гл. 16); фосфор-азотные соединения (гл. 19);
циан, цианаты, тиоцианаты (гл. 21); цианиды металлов
(гл.22); бор-азотные соединения (гл. 24); нитриды внедрения
(гл. 29).
18.2. Стереохимия азота
Во всех своих соединениях азот имеет в валентной оболочке
четыре пары электронов. В зависимости от того, сколько этих
пар оказывается неподеленными, возможно 5 вариантов моле-
кул и ионов, что иллюстрируется следующим рядом:
н
h:n:h
н
U
н:
=н=]
3-
Три последние комбинации (ионы NH2~, NH2~ и N3~) найдены
соответственно в солеподобных амидах, имидах и нитридах
¦большинства электроположительных металлов, но, за несколь-
кими исключениями, стереохимия азота базируется в основном
на двух формах: N+ без неподеленных пар и N с одной такой
;парой. Эти два состояния атома азота соответствуют класси-
ческим трехвалентному и пятивалентному состояниям (или, в
гболее современной терминологии, степеням окисления три и
лять).
Стереохимия N+ подобна стереохимии изоэлектронного С:
a) N+ 6) =n+^
/ \ х
тлетраэдричесний планарный
в) =N+= ила -N+=
коллинеарный
:Как и в случае углерода, схемы валентных связей б я в, вооб-
ще говоря, не отражают распределения электронов вокруг азо-
та в молекулах, в которых этот элемент образует три компла-
нарные или две коллинеарные связи. Такие связи часто имеют
¦промежуточные порядки и могут быть описаны в терминах ре-
зонанса нескольких структур с различным распределением ор-
динарных и кратных связей или в терминах тригональной
(sp2) или дигональной (sp) гибридизации с разным по вели-
чине вкладом я-связывания.
Центральный атом N иона N3~ в азидах характеризуется
•состоянием, близким к =N+=, а соли диазония [1] могут слу-
жить иллюстрацией состояния —N+=
[N=
115
=N+=
LISA
=N]'
Длина связи N—N в ионе диазония такая же, как и в эле-
ментном азоте (N = N), а связь С—N короче нормальной ор-
динарной связи из-за взаимодействия с ароматическим коль-
цом.
Две коллинеарные N-связи образуются в ионах типа
[(H2O)Cl4Ru-N-RuCl4(H2O)]3- ср. с (Cl5Ru-O-RuCl5L-
(разд. 10.4.1).
Если одну из четырех орбиталей занимает неподеленная
электронная пара, то возможны следующие конфигурации:
г) :n~
пирамидаль-
ная
д) ~N/ или е)
уголковая
Неподеленная пара электронов в молекулах типа NH3 может
использоваться для образования четвертой связи — координа-
ционной (->) по Сиджвику, например, в аминах металлов (см.
координационные соединения Вернера, гл. 27).
Интересное направление химии азота связано с обнаружен-
ной способностью атомов азота нейтральной молекулы N2 ис-
пользовать свои неподеленные электронные пары (подобно изо-
электронному СО) для связывания с переходным металлом.
Это связывание осуществляется либо одним, либо двумя атома-
ми, если молекула N2 выступает в роли мостика между двумя
атомами металла. В качестве примеров отмеченного выше слу-
чая е можно привести: тригоналъно-пирамидальную молекулу
СоНЫ2(Р(СбН5)з)з [2], в которой расстояние Со—N заметно
короче, чем в аминах A,96 А); октаэдрический ион в
[Ru(NH3MN2]Cl2 [3] и двуядерный анион с заслоненной конфи-
гурацией в [(NH3MRuN2Ru(NH3M](BF4L [4], в котором длина
связи Ru—N в линейном мостике существенно короче, чем рас-
стояние Ru—NH3. Катион в соли [Ru(enJN2N3]PF6 [5] приме-
N
III'
N
1.11 А
98°
| 1,81 А
1,66 А|
СоС
н
1,1 A
2 +
//3A 1/2,12 A
Ru-NsN-Ru-NH 3
4 +
35—985
546 18. Азот
чателен наличием трех различных типов связей металла с азо-
том: с молекулами N2, NH2 и лигандом N3~. Примеры комплек-
сов переходных металлов, в которых роль лиганда выполняет
одиночный атом N, приведены в разд. 27.1.
N +
'l,15 A
Данные по стереохимии азота сведены в табл. 18.1, основные
разделы которой основаны на количестве орбиталей, используе-
мых связывающими и неподеленными электронными парами.
Первый главный раздел включает простые водородные и гало-
Таблица 18.1. Стереохимия соединений азота
Число
О-Пар (свя-
зывающих
и неподе-
ленных)
4
3
2
Тип гибри-
дизации
sp3
sp
Число
не по де-
ленных
пар
0
1
2
0
1
0
Размещение связей
Тетраэдрическое
Тригонально-
пирамидальное
Уголковое
Тригонально-
планарное
Уголковое
Коллинеарное
Примеры
NH4+, (CH3KN+-O-
NH3, NH2OH, NF3 КНР,
NH2F, N2H4, N2F4
NH2-
NO2C1, NO, (OH), NO,-
N2O4, [ON (NO) SO,]-
[ON(SO3J12-
NOC1, NOF, NO2-, N2F2
N2O, NOs-:-, N3H
генидные соединения, которые и будут рассмотрены в первую
очередь в соответствии с их размещением в табл. 18.1 с той ого-
воркой, что амиды и имиды будут обсуждены вместе с аммиаком.
Второй и третий разделы включают описание большинства
оксосоединений, а так как оксиды и оксокислоты предпочти-
тельнее рассматривать как отдельные группы, то в дальнейшем
18.3. Азот, образующий тетраэдрические связи 547
не будем строго придерживаться разбиения материала по типам
конфигураций связей. Некоторые другие особые группы ве-
ществ типа азидов, сульфидов и нитридов также будут описаны
отдельно.
Литература. [11 Acta Chem. Scand., 1963, 17, 1444. [21 Inorg. Chem., 1969, 8,
2719. [3] Acta cryst., 1968, B24, 1289. [41 J. Am. Chem. Soc, 1969, 91, 6512.
[51 Inorg. Chem., 1970, 9, 2768.
18.3. Азот, образующий четыре тетраэдрические связи
Оптическая активность замещенных аммониевых ионов
(Nabcd)" и более сложных ионов и молекул (см. гл. 2), обна-
руженная еще в ранних работах, послужила первым доказа-
тельством существенно тетраэдрического расположения четырех
связей атома азота. Позднее это было подтверждено струк-
турными исследованиями, например, A IN (структура типа вюрт-
цита) и BN (структура типа вюртцита и сфалерита), аммоние-
вых солей, оксидаминов и ряда молекул типа а — в, в которых
азот тетраэдрически связан с комбинациями атомов (ЗС + 1 А1),
BС+2А1), AС+ЗА1) соответственно.
(ф-сренил)
| 1,96 А
Н,С 1 СН3
" СНз
а [>]
6 [г]
А1
Н2С^
Н3С-А1.
1,91 А
, 1 02
"сн.
А1-СН3
1,91 А
-А1-0
СН2-СН2
18.3.1. Аммоний и родственные ионы. Тетраэдрическую структу-
ру иона NH4+ в простых аммониевых солях рентгенографически
установить довольно трудно, во-первых, из-за слабого рассеяния
рентгеновских лучей атомами водорода, во-вторых, потому что
в кристаллических солях при обычных температурах ионы ам-
мония, как правило, вращаются или проявляют ориентационную
неупорядоченность. В NH4F, однако, вращению препятствует
образование связей N—Н—F, и тетраэдрическое расположение
4 ближайших соседних атомов фтора указывает направления
водородных связей. Атомы водорода можно локализовать с по-
мощью нейтронной дифракции, и уже выполнены детальные ис-
35!
548 18. Азот
следования некоторых аммониевых солей. Длины связей N—Н
в аммониевых солях были определены также методом ЯМР, и
на основе нескольких исследований получено значение, близкое
к 1,03 А [4]. Структуры замещенных аммониевых ионов опреде-
лены в [N(CH3L]2SiF6, [N(CH3L]IC12 и других.
Ион NF4+ существует в солях типа (NF4) (AsF6) и
(NF4)(SbF6), получаемых из NF3, F2 и MF5 при повышенных
температурах и давлении. (NF4) (AsFe)—устойчивое бесцвет-
ное, при 25 °С нелетучее твердое гигроскопическое вещество,
структура которого, по-видимому, аналогична структуре
(РС14) (РС16); ЯМР показывает, что все четыре атома фтора,
связанные с атомом азота, эквивалентны [5].
Согласно дифракционным данным по солям, содержащим
ионы гидроксиламмония, расстояния N—О составляют: 1,40 А
в Li(NH3OH)SO4 [6] и 1,42 А в NH3OH-C1O4 (нейтронная ди-
фракция) [7].
Аминоксиды. В тетраэдрической молекуле триметиламин-
оксида (СНз)з^О расстояние N—О равно 1,40 А [8]. Трифтор-
аминоксид NF3O— устойчивый бесцветный газ, синтезирован-
ный действием электрического разряда на смесь NF3 и кислоро-
да. Данные ИК-спектроскопии и ЯМР согласуются с представ-
лением о почти правильном тетраэдрическом строении этой мо-
лекулы.
Литература. [1] Acta cryst., 1969, В25, 377. [2] J. Am. Chem. Soc, 1970, 92,
285. [3] Acta cryst., 1972, B28, 1619. [4] J. Chem. Phys., 1954, 22, 643, 651.
[51 Inorg. Chem., 1967, 6, 1156. [61 Acta cryst., 1973, B29, 2628. [71 Acta cryst.,
1974, B30, 1167. [8] Acta cryst., 1964, 17, 102. [91 Inorg. Chem., 1968, 7, 2064.
[10] J- Chem. Phys., 1967, 46, 2904.
18.4. Азот, образующий три пирамидальные связи
18.4.1. Аммиак и родственные соединения. Обычно три орди-
нарные связи атома азота направлены к вершинам тригональ-
ной пирамиды, как это было показано спектроскопическими и
электронно-дифракционными исследованиями NH3 и многих дру-
гих молекул NR3; некоторые результаты этих исследований
обобщены в табл. 18.2. Пирамидальную конфигурацию следова-
ло ожидать независимо от того, рассматриваются ли орбитали
как три р- или как три из четырех 5р3-орбиталей; в последнем
случае позицию одной связи занимает неподеленная пара элек-
тронов. В случае чистых р-орбиталей валентные углы равнялись
бы 90°, и для того, чтобы объяснить экспериментальные величи-
ны этих углов, близкие к тетраэдрическим, необходимо принять
во внимание взаимное отталкивание атомов водорода. Однако
представляется более вероятным, что связи имеют в некоторой
степение s-характер, хотя и меньший, чем в случае яр'-гибриди-
z
>>
5
i
zi
18.
я
s
Ю
а тур;
Литер
о
CJ
О
я
к
о
И
о<
X
Z
и
1
N—Н, .
И
Ч
о
Р5
о
со
^f
CD
and.,
iem. Sc
та
106,6°
X
z
1,015
X
z
CO
CO
<M
(957,
Phys., 1
_•
20/7
Cher
CQ
CD
ОО О ¦—'
LO 00
О LO о
LO '— T
ОО" ~ -г?~
968,
969,
с, И
Phys., 1
Phys., 1
irad. So
Cher
Cher
¦ans.
5 Эч
105,9
112,1
111,6
108,8
110,9
102
X и о о и Е
"*.
1,011
X
и
?
z
LO
^.
CD —
CD Ю
- -
1,022
X <$-_
z zzz
о со"
О ^f
из
LO
Cvj' ^
in
:., 19.
hem.
hem. Soc
. allg. С
18?
CO
LO
CO oo"
79, i
963,
50, 72. I
v'., 1950,
Phys., 1
,-¦ о
с С ел
< «S4
^ N
106
106,8
и и
zz
и и
CD LO
t-- l^
с-
о «
lu
zz
¦=3,
>-5
4
01
02,2
00
CJ r_-
CJ
a-;
Я Я
CO
959,
Phys., 1
•
Chen
CO О ;o
О О —
о
о
1,026
lu
X
Z
p
"*.
—н
и
z
-
ел
C/j
""ЕЕ
<л .g jc
<
с; с[ с< с;
m m m с
о оо со оо
см см см —•
.It
ел ел ел Z_
Z22<
О
550 18. Азот
зашш, так что в орбитали неподеленной электронной пары
участвует некоторая доля р-компоненты. Из-за направленности
этой орбитали возникает атомный диполь, который в основном
и обусловливает большой днпольный момент A,44 Д) МНз. Важ-
ность атомного диполя подчеркивается тем фактом, что пира
мидальная молекула NFS почти неполярная @,2 Д) вследствие
гашения моментов, вызванных полярными связями N—F, мо-
ментом неподеленной пары. В противоположность NF3 молекула
XHF; имеет заметный момент A,93 Д).
Естественно ожидать, что молекула Nabc, содержащая три
разных атома или группы, должна проявлять оптическую актив-
ность. Однако многочисленные попытки выделить энантиоморф-
По тени, иальная
энергия
Рис. 18.1. а — вероятная форма кривой потенциальной энергии для NHS; б —
две возможные конфигурации для молекулы NH3, или Nabc.
ные формы окончились неудачей, и одно время это порождало
сомнение относительно непланарного характера конфигурации
трех связей нейтрального атома N. В отношении самого МНз
было высказано предположение, что кривая зависимости потен-
циальной энергии от расстояния (г) от атома азота до плоско-
сти водородных атомов имеет вид, изображенный на
рис. 18.1, а. На кривой имеются два минимума, соответствующих
двум возможным позициям атома азота (с каждой стороны от
плоскости атомов водорода), но они разделены энергетическим
барьером высотой всего 25 кДж/моль. Для того же, чтобы раз-
личить и разделить при комнатной температуре d- и /-модифи-
кации вещества, необходимо, как показывает расчет, чтобы
энергия активации рацемизации (изменения d^±l) была не ме-
нее 84 кДж/моль. Поэтому неудача такого разделения у заме-
щенных аммиачных соединений, вероятно, обусловлена тем, что
молекула может легко «выворачиваться наизнанку» путем пере-
мещения атома азота из положения N1 в N2 (рис. 18.1,6). Рас-
чет [1] скоростей рацемизации пирамидальных молекул XY3
с N, P, As, Sb и S в качестве центральных атомов, базирую-
щийся на функции потенциальной энергии, полученной из из-
вестных колебательных частот и размеров молекул, приводит
18.4. Азот, образующий пирамидальные связи 551
сн.
а
к заключению, что оптически активные соединения As, Sb и S
должны быть устойчивы по отношению к рацемизации при ком-
натной температуре, а производные Р, возможно, — при низких
температурах.
Три пирамидальные связи азот образует в гексаметилентет-
рамине (ГМТ) М4(СН2N (рис. 18.2), который является чрезвы-
чайно своеобразным веществом. И не
только потому, что получается при ком-
натной температуре с помощью очень
простой реакции между МН3 и Н2СО, но
и из-за необычности его кристаллохи-
мии. Структура молекулы ГМТ неодно-
кратно изучалась в кристаллическом со-
стоянии с помощью рентгено- и нейтро-
нографии, а в парах — методом элект-
ронной дифракции (расстояние С—N
1,476 А, С—Н 1,088 А; угол NCN 113,6°,
CNC 107,2°) [2]. ГМТ образует гексагид-
рат (разд. 15.2.2) и многочисленные
кристаллические соединения с разнооб-
разными органическими и неорганиче-
скими производными. Примером по-
следних может служить СаСг2О7-
•(ГМТJ-7Н2О [3], который представля-
ет собой ансамбль трех разнородных еди-
ниц, соединенных водородной связью:
групп [Са(Н2ОO]2+, ионов Сг2О72~ и
молекул ГМТ. Ион Са2+ окружен толь-
ко (семью) молекулами воды; какие-либо контакты между но-
нами Са2+ и атомами кислорода ионов СггО72^ отсутствуют.
Аналогичное соединение магния является гексагидратом "[4]
с достаточно обычным октаэдрическим окружением ионов ме-
талла. ГМТ образует два аддукта с иодом: ГМТ-12 (оранже-
вый), который медленно превращается в коричневый
[(ГМТJ1]13 с тем же самым брутто-составом, и красно-корич-
невый ГМТ-212. Структуры всех трех известны. Аддукты ГМТ-
N Л в 2,30 А
в N
Рис. 18.2. Строение моле-
кулы гексаметплентетра-
мина X.i(CH2)a. Атомы
азота заштрихованы, л
водорода не показаны.
Эту молекулу, основан-
ную на тетраэдрпческо:]
группировке атомов N,
следует сравнить с моле-
кулами Ве4О(СН'-СОО),>.
Р-АпРАо (см. рис. 11.1
и 19.8).
N^2,44 А
N^2,
\2,83 А
2,50 А
•12 [5] и ГМТ-212 [5] состоят из молекул, в которых одна или
две группы Ь связаны с атомами азота так, что образуются ли-
нейные системы —N—I—I, как это показано на схемах а и 6;
552 18. Азот
в связях N—I используются неподеленные электронные пары
атомов азота. Молекула б перестраивается в ансамбль из ионов
[(ГМТJ1]+ (б) с коллинеарными связями N—I той же длины,
что и в NI3-NH3 (разд. 18.4.5), и ионов 13~, несколько асиммет-
ричных, с расстояниями I—I 2,90 и 2,93 А [6].
К числу ионов и молекул, в которых й„-р„-связывание при-
водит к компланарности трех связей азота, принадлежит ряд
молекул, содержащих силильную группу (соединения нижней
части табл. 18.2). Al[N{Si(CH3K}2]3 [7] интересен также в каче-
стве примера образования трех компланарных связей алюми-
нием. Группы Si(CH3K расположены вне плоскости A1N3, диэд-
ричеекий угол NAlN/AlNSi составляет 50°. Такая же необычная
конфигурация трех связей атома металла обнаружена и
в Fe[N(SiMe3J]3, а в родственном соединении (Me3SiJN—Р—•
(NSiMe3J три компланарные связи образует атом фосфора [8]:
Ci 125° ^Si (CH3K
(CHjKSi
Литература. [1] J. Am. Chem., Soc, 1954, 76, 2C45. [2] PRS, 1963, 273A, 435,
455. [31 Acta cryst., 1975, B31, 423. [4] Ada cryst., 1974, B30, 22. [51 Ada cryst.,
1973, B31, 1589. [61 Acta cryst., 1975, B31, 1505. [7| .!. Chcm. Soc. A, 1969, 2279.
[6] Angew. Chem. (Intern. Ed.), 1975, 14, 261.
Амиды, имиды и нитридогидриды являются бесцветными кри-
сталлическими солями, которые образуются только наиболее
электроположительными элементами. Амиды и имиды содержат
иокы NH2~" и NH2~ соответственно, а нитридогидриды — ионы
N3~ и Н~; ионные нитриды описаны в разд. 18.10.1.
Амиды образуются при взаимодействии амиака с нагретым
металлом или в растворе в жидком NH3. Раствор NaNH2 в жид-
ком аммиаке является хорошим проводником электричества,
что указывает на ионизацию данного вещества в раствори-
теле. Структуры амидов как простых, так и сложных имеют
большое сходство со структурами галогенидов и гидроксидов.
Например, высокотемпературные модификации амидов калия,
рубидия и цезия относятся к структурному типу NaCl, но при
обычных температурах эти соединения обладают менее симмет-
ричным строением. Так, цезиевая соль имеет (тетрагональную)
деформированную структуру CsCl (подобную y-NH4Br).
В NaNH2 и LiNH2 при обычных температурах координационные
18.4. Азот, образующий пирамидальные связи 55 3
группы вокруг ионов NH2~ оказываются искаженными. В Na\H2
[1] тетраэдрически координированы как анион, так и катион,
но тетраэдр из четырех i\a " вокруг N сильно искажен, что сви-
детельствует об отсутствии вращения ионов NH2~. У LiNH_> [2]
слабоискаженная структура типа сфалерита. Тетраэдрическая
координация в ней несколько неправильная (МНг~ отстоит от 1 Li
на расстоянии 2,35 А и от 3 Li — на расстоянии 2,15 А), что,
по-видимому, связано с ориентацией диполей NH2~. Строение
LiNH2 отличается от слоистой структуры LiOH, в которой ионы
Li+ занимают другой набор тетраэдрических пустот в такой же
плотнейшей кубической упаковке анионов.
Для Ca(NH2J и Sr(NH2J известны две модификации: одна
со структурой анатаза [3], другая дефектного NaCl [4]. В обеих
этих полиморфных формах ионы NH2~, по-видимому, находятся
в фиксированной ориентации, как и в Be(NH2J [5], который
имеет трехмерную структуру того же типа, что и [3-Ве(ОНJ
(разд. 14.1.1). Из спектроскопических данных следует, что дли-
на связи N—Н в NH2~" равна 1,03 А [6]. Проведены структур-
ные исследования сложных амидов типа K[Be(NH2K] [7] и
Na[Al(NH2L] [8]; в них найдена плоская треугольная и тетра-
эдрическая координация Be и А1 соответственно (длина связи
Be—N 1,59 А, А1—N 1,84 А), а также K2Sn(NH2N [9] и
K3La(NH2N [10] с октаэдрическими ионами M(NH2)e в обоих
соединениях.
Имиды щелочных и щелочноземельных металлов имеют ти-
пичные ионные структуры. Структура Li2NH, подобно Li2O, от-
носится к типу антифлюорита [11], а имиды щелочноземельных
металлов кристаллизуются в структурном типе NaCl, как и со-
ответствующие оксиды; вращающийся ион NH2~ обладает сфе-
рической симметрией. Для амидного и имидного ионов выведе-
ны следующие значения их радиусов: 1,73 A (NH2~) и 2,00 А
(NH2-) (для сравнения: радиус С1~ 1,81 A, a SH^ 2,00 А).
Некоторые нитридогидриды в структурном отношении сход-
ны с нитридогалогенидами аналогичных составов (разд. 10.2).
Например, Ba2NH обладает структурой типа NaCl со статисти-
ческим распределением ионов N3~ и Н~ в анионных позициях
(ср. с Mg2NF), но Ca2NHnSr2NH имеют более сложное строение.
Первый из них, получаемый при нагревании смеси СазК'ь
с СаН2, по-видимому, является сверхструктурой NaCl со стати<
стическим распределением по пустотам lU ионов Н~ [12];
в структурном отношении он близок к Ca2NHx (я«0,5), описан-
ному первоначально как Ca2N [13].
Литература. [11 J. Phys. Chem., 1956, 60, 821. [2] Z. anor»-. allg. Chem., 1959,
299, 33. [31 Z. anorg. allg. Chem., 1963, 324, 278. [41 Compt. rend. (Paris), 1969,
268, 175. [51 Z. anorg. allg. Chem., 1976, 427, 1. [61 J. Phvs. Chem., 1957, 61,
384. [7] Acta cryst., 1974, B30, 2579. [81 Acta cryst., 1973, B29, 925. [9] Acta cryst.,
IX. Азот
1977. ВЗЗ, 1076. [10J Z. anorg. allg. Chem., 1974, 410, 104. [11] Z anorg all"
Chem., 1951, 266, 325. [12] J. Solid State Chem., 1976, 17, 135. [13] Inorg. Chem,
196:\ 7, 1757.
18.4.2. Гидроксиламин. В кристаллическом N112OH (N—О
1,4/А) атомы водорода не были локализованы, но их вероятные
позиции выведены из разумной схемы водородных связей. О со-
лях гидроксиламина информация дана в разд. 18 3 1 [Acta
cryst., 1958, 11, 511, 512].
18.4.3. Сульфонат-ионы, производные от NH3 и NH2OH. По-
следовательным замещением атомов водорода в NH3 ионами
SOs^ получена следующая серия ионов:
.N-SO3 H-N^or,- "^S-NC *
Взаимодействие KHSO3 и KNO3 приводит к образованию
грнсульфоната K3N(SO3K, который под действием гидролиза
количественно может быть переведен в имидодисульфонат
KA*H(SO3J, а затем в аминосульфонат (сульфамат) KNH2SOs
пли в гидроксиламин-Ы-сульфонат K[NH(OH)SO3]. Строение
молекул а и цвиттер-иона сульфаминовой кислоты +H3N-SO3~
было уже описано в разд. 16.8.2, где рассмотрен также другой
цвиттер-ион, гидроксиламин-О-сульфоновая кислота, которая
соответствует иону е, обсуждаемому ниже. Имидсульфонат-ион б
является NH-аналогом иона O3S-O-SO32~, и он включен
в табл. 16.5 (разд. 16.8.3) вместе с ионом б'.
Ионы семейства гидроксиламина более многочисленны, так
как у них могут замещаться атомы водорода как NH2-, так и
ОН-групп с образованием N- или О-сульфонатов и, в конце кон-
!'оз, трисульфонат-иона (з):
503
I
0
О, SO-
so3
ж
03S
O3SO-
S0,
so.
3 [2]
5-
N
30 3
/
O3S
so,
О N
о-
U [3]
-N
SO3
S03
18.4. Азот, образующий пирамидальные связи 555
S03
SO,
©
so3
/
N
\
so3
©
SO3
0
NO
Л [7]
Строение этих ионов не описано здесь в деталях, но указана ли-
тература по кристаллическим структурам их солей. Длины свя-
зей N—S и N—О близки к 1,73 и 1,43 А соответственно, за ис-
ключением специально оговоренных случаев. Соли, содержащие
ион д', могут быть выкристаллизованы из щелочных растворов
(например, Na3[ON(SO3J] -3H2O), а в кислых растворах эти
ионы образуют пары и, соединенные посредством (кристалле-
К S03 Л
О -N^ 3
./ / 1,2 8 A
1,66 a.N О
O-S I 2|84 A
O3S
графически симметричной) связи 0---Н---0 длиной 2,42 А, как на-
пример, в Rb5{[ON(SO3J]2H}-3H2O. ВсолиФремиК2[ОМEО3J]
(к) связи азота компланарны, так же как и в нитрозогидрокси-
ламинсульфонат-ионе (л), но расстояние N—S заметно короче
A,66 А). В последнем анионы, очень слабо ассоциированные
в пары, связаны центром симметрии, что напоминает днмеры
в кристаллическом N0 (разд. 18.8.1). Калиевая соль иона л по-
лучается абсорбцией N0 в щелочном растворе K2SO3. Все свя-
зи, изображенные сплошными линиями, лежат в одной плоско-
сти, а длины связей указывают на то, что связь S—N ординарна
A,79 А), но связь N—N имеет заметный л-характер A,33 А);
расстояния N—О и S—О составляют 1,28 и 1,44 А соответствен-
но. Понятно, что ионы к и л содержат нечетное число электро-
нов, что приводит к парамагнетизму и окрашиванию их. Соль
Фреми чрезвычайно интенсивно окрашена; она существует в ви-
де двух модификаций — оранжевой и оранжево-коричневой. Ли-
тература указана для структуры второй модификации.
Литература. [1] Acta cryst., 1966, 21, 819. [2] Acta cryst., 1977, ВЗЗ. 1591
131 Inorg. Chem., 1974, 13, 2062. [4] J. Chem. Soc, A 1968, 3043. [51 Inorg. Chem..
1975, 14, 2537. [6] Acta cryst., 1979, B35, 1308. [7] J. Chem. Soc, 1951, 1167.
18.4.4. Тригалогениды азота. Из тригалогенидов азота хорошо
охарактеризованы два: NF3 и NC13. Первый из них в отсутствие
примесей совершенно устойчив; он был изучен в парообразном
оьи
18. Азот
состоянии. Взрывчатый NC13 исследован в кристаллическом со-
стоянии (при •—125 °С). Из частично галогенированных соедине-
нии синтезированы NH2F, NHF2) ХН2С1 и NHC12. Трибромид
ХВг3 в индивидуальном состоянии, по-видимому, еще не полу-
чен, хотя (наряду с NH2Br и NHBr2) идентифицирован с по-
мощью химического анализа и УФ-спсктров в разбавленном
водном растворе (образующемся при бромировании аммиака
в буферных растворах) [1]. Имеются некоторые подтверждения
существования амина NBr3-6NH3, устойчивого при температу-
рах ниже —70 °С. Так называемый трииодид, получаемый из
иода и аммиака, имеет состав NI3-NH3 и не является простым
галогенидом. Этот аммин не содержит дискретных молекул NI3,
а состоит из цепей ЫЦ-тетраэдров: каждый тетраэдр имеет две
н3с
\
\,
N
-
2'29А
NI,-NH3
н3с сн3 н3с
(СН,JМ
сн,
1,49,
обобщенные вершины, а к одному из двух необобщенных ато-
мов иода с помощью более слабых связей присоединяется моле-
кула NH3 [2]. Аналогичные цепи найдены в пиридиновых ад-
дуктах NI3-пиридин и CH3NI2- 7г (пиридин) [3], а также
в (СНз)гМ1 [4]; эти характерные связи N—I, как и в случае
[(ГМТJ1]13 (разд. 18.4.1), имеют длину 2,3 А и заметно превы-
шают сумму ковалентных радиусов азота и иода B,07 А). Дета-
ли структур молекул NX3, NHX2 и NH2X приведены в табл. 18.2.
Литература. [1] Inorg. Chem., 1965, 4, 899. [2] Z. anorg. allg. Chem., 1968,
357, 225. [3] Z. anorg. allg. Chem., 1974, 409, 228. [4] Acta cryst., 1977, B33.
3209.
18.4.5. Гидраты аммиака. Аммиак образует два кристаллогид-
рата: NH3-H2O и 2NH3-H2O. Кристаллическая структура по-
следнего изучена при 170 К [Acta cryst., 1954, 7, 194]. В ее ос-
нове, по-видимому, лежит каркас состава NH3-H2O, сформиро-
ванный с помощью водородных связей, в котором NH3 и Н2О
образуют каждый по одной сильной связи N—Н—О B,84 А) и
по три слабых C,13; 3,22; 3,22 А). Вторая молекула NH3, кото-
рая, возможно, находится во вращательном состоянии, присо-
18.4. Азот, образующий пирамидальные связи 557
единяется к этому каркасу только с помощью одной связи
N—Н—О B,84 А). В NH3-H2O молекулы соединяются посред-
ством водородной связи в цепи, которые затем «сшиваются»,
образуя водородные связи с молекулами NH3 и создавая тем
самым трехмерный каркас [Acta cryst., 1959, 12, 827]. Непо-
средственно друг с другом молекулы NH3 водородных связей не
образуют. Как и в 2NH3-H2O, неподеленная электронная пара
атома азота образует одну сильную св-язь N—Н—О B,84 А)
и три слабые C,25 А). Интересно сравнить структуры гидратов
и кубической модификации твердого NH3 [Acta cryst., 1959, 12,
832]. Последняя представляет собой слабоискаженную кубиче-
скую плотноупакованную структуру, где каждый атом водорода
имеет шесть соседних атомов азота на раесстоянии 3,4 А и
шесть — удаленных более чем на 3,9 А, что предполагает обра-
зование трех слабых связей N—Н—N каждой неподеленной
электронной парой.
18.4.6. Аммины. Все щелочные и щелочноземельные металлы
(но не бериллий), а также Ей и Yb растворяются в жидком ам-
миаке. Растворы щелочных металлов окрашены в голубой цвет,
парамагнитны и электропроводны. Они растворяют и другие
металлы, которые сами по себе нерастворимы в жидком аммиа-
ке; например, в натриевом растворе растворяется свинец, и
таким путем получен ряд интерметаллических соединений
(Na2Pb, NaPb). Из некоторых растворов могут быть выделены
и кристаллические аммины, включая Li(NH3L, и гексааммины
Са, Sr, Ba, Ей и Yb. Гексааммины кристаллизуются в виде объ-
емноцентрированной кубической упаковки октаэдрических мо-
лекул М(МН3)б. Желто-золотистые соединения европия и иттер-
бия обладают металлической проводимостью (Me—N«3,0 А),
их магнитные и электрические свойства дают основание пола-
гать, что зону проводимости занимают два электрона [J. Solid
State Chem., 1969, 1, 10].
Аммиак взаимодействует также со многими солями с обра-
зованием амминов, в которых NH3 использует свою неподелен-
ную электронную пару для связывания с металлом. Связь
М—ХНз экстремально слаба в случае щелочных металлов, но
усиливается у производных элементов Б-подгрупп периодиче-
ской системы и переходных металлов. В ХаС1-577ХтН3, напри-
мер, Ха+ имеет в своем окружении пять атомов азота на рас-
стоянии 2,48 А и один — на расстоянии 3,39 А, а структура в це-
лом представляет собой приблизительно кубическую плотней-
шую упаковку молекул NH3 и ионов Cl~ [Acta cryst., 1965, 18,
879]. В NH4I-4NH3 ион NH4+ образует водородные связи с 4 тет-
раэдрически расположенными соседями (N—N 2,96 А), а 1~
окружен 12 молекулами NH3 [Acta Chem, Scand., 1960, 14,
558
/8. Азот
1466]. В многочисленных молекулах и сложных ионах элемен-
тов Б-подгрупп переходных металлов аммиак образует доста-
точно прочные ковалснтные связи с атомами металла в противо-
положность относительно слабому связыванию группы NH3
в амминах электроположительных элементов. Структуры этих
соединений описываются при рассмотрении соответствующих
элементов.
18.5. Молекулы, содержащие группировку
Из симметричных молекул a2N—Na2 с ординарными связями
N—N известны только гидразин N2H4 и тетрафторид диазота
N2F4. В некоторых молекулах, в которых к атомам азота при-
соединены атомы кислорода, как, например, в нитроамине (а),
замещенных нитроаминах (б) и димерах С-нитрозосоединений
(в), компланарность шести атомов, существование цис-транс-
изомеров нитрозосоединений и длина связи N—-N свидетельст-
вуют о том, что эта связь имеет до некоторой степени характер
двойной. Следует, однако, обратить внимание на экстремально
длинные связи N—N в N2O3 и К2О (разд. 18.8.1).
О
о
6
N-N4
о
N-N
О
18.5.1. Гидразин ЛГ2Я4. Гидразин во всех агрегатных состояниях
существует в виде простых молекул N2H4. Его высокая точка
кипения A14 °С) и высокая вязкость расплава обусловлены на-
личием водородных связей. В структурном отношении молеку-
ла гидразина имеет одну особенность, общую с Н2О2: из-за того
что нсподеленная электронная пара препятствует вращению
групп NH2 вокруг оси N—N, свободная молекула имеет гош-
конфигурацию (разд. 2.3.1). Информация о деталях этой струк-
туры содержится в табл. 18.3.
Моногидрат гидразина N2H4-H2O, по-видимому, имеет струк-
туру типа NaCl с неупорядоченно ориентированными или вра-
щающимися молекулами N2H4 и Н2О [1].
Гидразин образует два ряда солей, содержащих соответст-
венно ионы N2H5+ и N2H62+. Структуры его галогенидов описаны
в гл. 8. Уже из их формул очевидно, какого типа ионы они со-
держат, но такое положение не верно по отношению ко всем
оксосоединениям. Например, N2H4-H2SO4 может быть
(N2H5)HSO4 или (N2H6)SO4. Тип иона выводится из кристалли-
ческой структуры (размещения водородных связей) или из
с-
С
i<
В
ш
с;
ств
п
о
а.
вни
?
cL
к
к
=!
О)
га
Я
5.
>^
Ё
О-
О
со
20
ица
VO
н
¦ура
iTepai
ct
О
Е-
О
зоро-
сло-
кон-
ции
о ° а в
1
и
сЯ
о
1
1
га
ч
^:
§
СО
00
со
.959,
>.
и
¦
s
с
Ю
СГ-
О
СП
5
—"
?
2
CD
"ч-
со"
со
о"
CD
О.
со
ОС.
сл
Е
CU
6
nil.
m
449
—
с
967,
>,
а,
6
•
CD
-'
00
СО
1970
<
о
о
сл
и
cn"
со
со
со
—"
СЛ
2
СП
, 29/
70,
48,
СП
CJ
о
сл
ё
о
•1
¦
—"
i'
О
J?
Z
со
со
65, 4
ст>
а
5
о
00
СС
со
со
^J"
о
—'
и
Z
tu
Z
tu
к;
|
1
Z
-
со"
1972,
«r
>,
а
а
и
СП
CN
^Г
СО
¦о
О]
^
492
—"
2
,30.
67, 6
?
U01
и
о
,—;
m
<
6
ю I
S
¦ГО
со
Z
о
СО
со
со"
СЧ
969,
-а'
car
сл
g
НЗ
О
u
Cf)
1
о 1
2 о
,—,
см
со
2"
-г
—'
о
2
2
X
О
СГ)
969,
-а
га
CJ
111
си
¦С
О
eta
<^
IT)
о]
CN
со
ос
—
о
Z
Z
3
и
560 /5. Азот
спектра ЯМР-'Н. Среди сульфатов с общей формулой
I\12H4-A'H2SO4, где х=1/2, 1 и 2, первое соединение имеет струк-
турную формулу (N2H5JSO4 [2], второе—(N2H6)SO4 [3],
третье, — вероятно, (N2H6) (HSO4J. В N2H4-H3PO4 существует
трехмерный каркас Н2РО4, подобный каркасу в КН2РО4, поэто-
му формула этой соли записывается в виде (N2H5) (H2PO4) [4].
С другой стороны, N2H4-2H3PO4 представляет собой соль
(\т2Нб) (Н2РО4J, в которой катион имеет скрещенную конфигу-
рацию [5].
Длины связей N—N в катионах в (N2Hs)N3 [5a] и
(М2Нб) (TiF6) [56] незначительно отличаются от соответствую-
щей величины в N2H4 A,45 А), но сама конфигурация иона
N2H5+ может быть разной. В (N2H5)H2PO4 и (N2H5)N3 она скре-
щенная, a (N2H5JSO4 содержит ионы как с приблизительно
скрещенной, так и с заслоненной конфигурацией.
С1 С1
О /N-Ns.1 /
Zn Zn
^ 4
I
Cl
I
Cl
В солях типа Zn(N2H4JX2 (X = C1 [6], CH3COO [7], CNS
[8] и т. д.) гидразин выступает в качестве нейтрального мости-
кового лиганда, связывая атомы металла двойными мостиками
в бесконечные цепи.
Литература. [11 Ada cryst., 1962, 15, 803. [2] Acta Chem. Scand., 1965, 19,
1612. [3] Acta cryst., 1970,, B26, 536. [4] Acta Chem. Scand., 1965, 19, 1629.
[5] Acta Chem. Scand., 1966, 20, 2483. [5a] Acta cryst., 1974, B30, 2229. [56]
Acta cryst., 1980, B36, 659. [6] Z. Kristallogr., 1962, 117, 241. [7] Gazz. chim.
ital., 1961, 91, 69. [8] Acta cryst., 1965, 18, 367.
18.5.2. Тетрафторид диазота. Молекула указанного соединения,
образующегося при соприкосновении потока NF3 с нагретыми
металлами, имеет гидразиноподобную структуру, в которой угол
поворота от заслоненной конформации составляет 70°.
КР-спектральное исследование жидких образцов (от —80 до
—150 °С) указывает на наличие в них равновесной смеси транс-
и гош-изомеров [J. Chem. Phys., 1968, 48, 3216]. Данные элек-
тронной дифракции говорят о том, что обе эти конформации су-
ществуют также и в паровой фазе [J. Chem. Phys., 1972, 56,
1691]. При температурах выше 100 °С N2F4 заметно диссоцииру-
ет до свободного радикала -NF2 (ср. с ^Cu^^NC^), и этот ра-
дикал может неопределенно долго существовать в свободном
состоянии; его структура определена (табл. 18.3). Такое поведе-
ние N2F4 находится в заметном контрасте с поведением N2H4
18.6. Азот, образующий связи =N' 561
и ответственно за многие реакции, в которых —NF2 встраивает-
ся в молекулы. Примерами могут служить:
S2F10 >- SF5-NF2
N,
• NF,
NO
¦ ON-NF2
Cl-KF,
18.6. Азот, образующий две связи = N'
Круг молекул или ионов, рассматриваемых в данном разделе,
ограничен теми их представителями, которые содержат один
или несколько атомов азота, каждый из которых образует одну
кратную и одну простую связь. Что касается характера этих
связей, то он оказывается промежуточным между (редким) слу-
чаем, в котором азот образует две угловые ординарные связи
(например, в NH2 ), и случаем, когда он формирует две колли-
неарные кратные связи. Необходимо отметить, что во многих
циклических молекулах и ионах азот образует две угловые свя-
зи, несмотря на то, что обе они по длине приблизительно соот-
ветствуют двойным связям; некоторые нециклические катионы
также иллюстрируют трудность приписывания простых струк-
турных формул системам, в которых имеется я-связывание.
В" N[S(CH3J]2+ валентный угол при атоме азота составляет
111°, а расстояние N—S—1,64 А [1а]; в N(SC1J+ валентный
угол составляет 149°, а расстояние N—S—1,535 А [16] (для
сравнения: длина связи N—S равна 1,72 A, a N = S 1.54 А).
В |N(P(C6H5KJ]+ угол между связями азота составляет 147°,
а расстояние N—Р—1,57 А [1в], что близко к значению для
двойной связи.
Молекулы типа диазарина [2а] (циклического диазометана)
н перфтордиазарина [26] представляют собой особые случаи,
напоминающие циклопропан или этиленоксид.
Н2С
,23 А
1,293 А
1,3IS A
перергпородиа.зири.!-:
Если орбиталь неподеленнои пары носит в основном s-xapак-
тер (в пределе — целиком s), то можно ожидать уменьшения
углов до 90°. В молекулах, где связи формально описываются
как = N , значения углов, как правило, лежат в пределах
ПО—120°, за исключением случая N2H2 A00°С); большие зна-
36-985
562 18. Азот
чения они имеют в HN = CO A28°), HN = CS A30°C) и
CH3N = CS A42°). Такое расположение связей привлекло к себе
пристальное внимание еще до возникновения структурной хи-
мии, так как оно реализуется в многочисленных органических
соединениях. Первоначально доказательство нелинейности
одной простой и одной двойной связи атома азота вытекало из
разложения оксима на оптические антиподы и из стереоизоме-
-LH2- ЧОН
рии асимметричных оксимов (I). Позднее такое расположение
связи было подтверждено кристаллографическим исследованием
цис- и транс-азобензола (II), диметилглиоксима. В кристалли-
I!
N
N
N
II
N
N
N
6Н5
НО
он
I
II
ческом состоянии диметилглиоксим имеет транс-строение (а),
но в хорошо известных производных Ni, Pd и Си переходит
в ^нс-форму (б).
С
Н3С СН3
\ /
СН3
О
он
18.6.1. Диимид (N2H2) и дифтордиазин (N2F2). Самое простое
соединение типа RN = NR, диимид, был идентифицирован
в масс-спектрометре среди твердых продуктов разложения N2H4
под действием безэлектродного электрического разряда при
85 К. Оба изомера были идентифицированы (ИК-спектроско-
пия) в инертных матрицах при низких температурах (имеется
также имидоген NH [3]), и цис-изомеру была приписана [4]
пленарная структура (а).
100°
Н
1,230 А
[1,38 Al\
6 1,21 А
114-'°
Дифтордиазин N2F2 — бесцветный газ, устойчивый при обыч-
ных температурах, получается действием электрического разря-
18.7. Соединения, содержащие [N---N---N*] 563
да на поток \Т3 в присутствии паров ртути или, для уменьше-
ния опасности взрыва, действием КОН на Л'.М-дифтормочевину.
Изомер F2\N неизвестен, но два изомера Гч\.\Р были разделе-
ны с помощью газовой хроматографии; tjuc-изомер б — более
реакционноспособнын [5]. Структура транс-изомера в [6], ко-
торый может быть получен с выходом 45% из N2F4 и А1С13>.
подобна структуре азометана г.
106° A0°)
,40 А
1,23А
'ПО
ср. азометлан:
,47 А !
Н3С
/ 1,24 А
Кристаллическое соединение quc-N2F4 с AsFs растворимо (и
устойчиво) в безводной HF. Оно изоструктурно (NO2)AsF6 и,
предположительно, представляет собой (N2F) (AsFe) [7], содер-
жащий линейный ион N2F+, изоэлектронный NO2+.
Центросимметричная молекула био-триметилсилилдиими-
на [8] интересна необычно короткой связью N—N и длинной
связью N—Si.
.Si(CH3K
^=N 1,81 А
(CH3KSi/
Литература, [la] Acta cryst., 1975, В31, 893. [161 Angew. Chem. (Intern. Ed.).
1969, 8, 598. [1b] Inorg. Chem., 1979, 18, 3024. \2a] J. Am. Chem. Soc. 1962, 84,
2651. [26] J- Am. Chem. Soc, 1967, 89, 5527. [31 J. Chem. Phys., 1965. 4,3. 507.
[41 J. Chem. Phys., 1964, 41, 1174. [5] J. Chem. Phys., 1963, 39, 1030. [0] Inorg.
Chem., 1967, 6, 309. [7] J. Am. Chem. Soc, 1965, 87, 1889. [81 Acta crvst.. 1974,
B30, 1806.
18.7. Соединения, содержащие систему [N—N—N]
Помимо органических соединений типа вицинальных триазинов,
которые здесь не рассматриваются, группировку [N—Х- - -N]
содержат только азидоводородная кислота и азиды.
18.7.1. Азиды. Ранее уже были упомянуты ионы Sr~~ и Ь~. кото-
рые могут быть описаны с помощью простых связей, если счи-
тать, что в валентной оболочке атома I в последнем ионе нахо-
дится 10 электронов. Азид-ион (и радикал) относятся к совер-
шенно иному типу ионов, который характеризуется наличием
кратных связей; никакой другой элемент не образует ионов по-
добного рода. Азидоводородная кислота N3H может быть при-
готовлена действием гидразина (N2H4) на NC13 или HNO2, но
36*
564 18. Азот
лучше всего она получается из ее натриевой соли, которая явля-
ется продуктом очень интересной реакции. Если оксид диазота
пропускается над расплавленным амидом натрия, то имеет
место следующая реакция:
NH2" + N2O
N3"
Н2О
Когда пар азидоводородной кислоты проходит через нагретую
трубку при низком давлении, то на отростке, охлаждаемом жид-
ким воздухом, может быть выморожен очень красивый голубой
твердый продукт. При нагревании до —125 °С он превращается
в NH4N3. Исходное твердое голубое вещество не дает рентгено-
грамм и, по-видимому, является стеклообразным или аморфным.
Хотя первоначально полагали, что ему соответствует формула
(NH)x, на самом деле образец в значительной мере, если не
целиком, представляет собой NH4N3, а цвет его, вероятно, обус-
ловлен F-центрами [1].
Проведены многочисленные структурные исследования ази-
доводородной кислоты. Три атома азота в ней коллинеарны
(ср. с изоэлектронной молекулой N2O, разд. 18.8.1), и молекула
имеет следующую конфигурацию [2]:
0,98 А4
114
N,
Расчеты порядка связей методом молекулярных орбиталей дали
следующие значения: 1,65 А для N1—N2 и 2,64 А для N2—N3.
Азиды щелочных и щелочноземельных металлов — бесцвет-
ные кристаллические соли, которые могут быть расплавлены
почти без разложения. Проведены рентгеновские исследования
нескольких ионных азидов (Li, Na [3], К, Sr [3], Ва [4]); эти
вещества содержат линейные симметричные ионы с расстоянием
N—N, близким к 1,18 А. Многие азиды MN3 изоструктурны
с дифторидами MHF2. Синтезированы и другие азиды; В (N3K.
A1(N3K и Ga(N3K получены из гидридов, Be(N3J и Mg(N3J —
из М(СН3J и HN3 в эфирном растворе, a Sn(N3L —из NaN3
и SnCl4.
Азиды некоторых металлов Б-подгрупп периодической систе-
мы взрываются при детонации; они рассматриваются как ко-
валентные соединения (например, Pb(N3J и AgN3). В одной из
четырех полиморфных модификаций азида свинца имеются че-
тыре неэквивалентные группировки N3; все они приблизительно
линейны, но несколько различаются по длине связей N—N
A,16—1,20 А, среднее значение близко к 1,180 А) [5].
В Cu(N3J [6] имеется два сорта неэквивалентных групп N3,
соединенных разными способами с атомами меди. Различие
18.7. Соединения, содержащие \N--S---K] 565
в результатах двух исследований этой соли не позволяет обсуж-
дать детали строения групп N3 в ней. Можно, однако, полагать,
что любое понижение симметрии должно быть меньше, чем
в молекуле HN3.
В координационных соединениях типа [Co(N3Jen2]NO3
[/a], [Co(N3)(NH3M](N3J [76] и Zn(N3J(NH3J [8] азидная
группа может функционировать как монодентатный лиганд.
В комплексах кобальта угол между связью Со—N и линейной
группой N3 составляет около 125°.
Азидная группа может действовать и как мостиковып лиганд
в одном из двух вариантов: а я б. В а [9а] мостик симметричен,
длины связей близки к соответствующим величинам в ионных
азидах; в б [96] он асимметричен; концевая связь N—N короче
второй, в которой один из атомов N связан с одним или двумя
атомами металла.
1,18 А 2;1оХ
i,P N-N-N s/ Рф
:22°ГСиЧ99° Си
а
(ф - фенил)
N
121° Pd 103° Pd"
N—N—N^ ^^N-N-N
2.00A
1,24 A 1,12 X
N-, N N
Ковалентные азиды неметаллов включают азиды галогенов
N3X (X = F, Cl, Br, I), силилазид H3SiN3 и органические азиды.
Циануровый азид [10] и и-нитрофенилазид [11] были изучены
в кристаллическом состоянии, а метилазид [12] и цианазид
[13]—в парообразном (электронная дифракция). Структуры
трех последних показаны на схемах в—д.
Для сравнения длин связей в азидах и других соединениях
приведены стандартные длины связей N—N и С—N в табл. 18.4.
Литература. [1] J. Chem. Phys., 1959, 30, 349; 31, 564. [2] J. Chem. Phys., 1964,
41, 999 [3] Acta cryst, 1968, B24, 262. [4] Acta cryst., 1969, B25, 2638. [5] Ada
cryst., 1977, B33, 3536. [6] Acta Chem. Scand., 1967, 21, 2647. Acta cryst., 1968,
B24, 450. [7a] Acta cryst., 1968, B24, 1638. [761 Acta cryst., 1964, 17, 360.
[81 Acta Chem. Scand., 1971, 25, 1630. [9a] Inorg. Chem., 1971, 10, 1289. [961 .1
Am. Chem. Soc, 1972, 94, 3377. [10] PRS, 1935, A 150, 576. [11] Acta cryst
1965, 19, 367. [12] J. Phys. Chem., 1960, 64, 756. [13] Acta Chem. Scand., 1973
27, 1531.
566 18. Азот
Таблица 18.4. Экспериментально найденные длины связей N — N и С — N
Связь
N—N =
N = N
N = N
С—К °
Сар—N
C-N
C = N
C=N
Длина, А
1,46
1,23
1,10
1,47
1,40
1,33—1,35
A,28)
1,16
Л\олекула
N2H4 и (CH3JN2H,
N2F, и N,(CH3J
N2
CH3NH2, Ы4(СН2Nит. д.
С — часть ароматического кольца
СвНб-МН-СОСНз)
Гетероциклические молекулы (например
Точное значение для нерезонансной
неизвестно
HCN
(например.
, пиридин)
молекулы
1,86 А в N2O.,; 1,75 А в N2O.,; 1,53 Л в N2I-4.
1,51 А°в аминокислотах и (O2Xj-CH2N'2O2)K2.
18.8. Химия оксидных соединений азота
18.8.1. Оксиды. Пять оксидов азота известны уже давно: Х2О,
NO, N2O3, N2O4, N2O5. Считается, что шестой, \Ю3, должен об-
разовываться в разрядных трубках, содержащих N2O4 и О2 при
низких давлениях. Он имеет очень короткое время жизни, по-
добно другим уже описанным производным такого рода (РО3.
SO, SO4) и радикалам типа ОН и СН3, индивидуальное сущест-
вование которых доказано спектроскопически. В дальнейшем
внимание будет сосредоточено на соединениях, более устойчи-
вых в условиях обычного химического эксперимента.
Триоксид и пентаоксид азота являются ангидридами азоти-
стой и азотной кислот соответственно, a N2O не имеет аналогич-
ной связи с азотноватистой кислотой H2N2O2. Хотя К;О абсо-
лютно растворим в воде, он не образует этой кислоты. Непо-
средственно оксид диазота не может быть окислен до других
оксидов, хотя легко получается восстановлением HNO3, HNO2
или влажного N0. С другой стороны, оксиды NO, N2O3, N2O4
легко превращаются друг в друга и могут быть получены вос-
становлением азотной кислоты триоксидом мышьяка; конечный
продукт зависит от концентрации кислоты. Триоксид N2O3 су-
ществует, вероятно, только в жидком и твердом состоянии; и
в том, и в другом виде он имеет голубой цвет; в газовой фазе
он практически полностью диссоциирует на N0 и NO>, о чем
можно судить по его коричневой окраске. Тетраоксид N2O4 об-
разует бесцветные кристаллы (при —10 °С), но пар над ним
18.8. Оксидные соединения 567
при обычных температурах состоит из смеси N2O4 и NO2, а при
температуре около 150 СС его газообразные молекулы полностью
диссоциируют до NO2. При дальнейшем нагревании NO2 разла-
гается до N0 и кислорода, и этот процесс завершается около
(ii)OcC. Поскольку пентаоксид легко разлагается до N2O4, то
между рассматриваемыми оксидами имеется следующее соот-
ношение:
N2O5 -* N2O4 ^ NO2 ^ NO + О
N2O3
Оксид диазота N2O. Эта молекула линейна, и электрический
дипольнып момент ее лишь немного отличен от нуля @,17 Д).
Из-за близости рассеивающей способности атомов азота и кис-
лорода невозможно на основе электронной дифракции сделать
выбор между двумя возможными структурами NNO и NON, но
первая из них подтверждается еще спектроскопически. Рентге-
нографические данные по кристаллическому i\2O [1] (который
изоструктурен СО2) согласуются лишь с моделью произвольно
ориентированных молекул NNO. Этой неупорядоченностью мо-
жет быть объяснена остаточная энтропия 1,14 э. е., близкая
к теоретической величине B In 2 = 1,377 э.е.). Центральный
атом азота может быть описан как атом, образующий две
sp-связи и дополнительную л-связь, что дает общий порядок
связи приблизительно
2.5(N=-N)m 1,5 (N=0)
соответствующие длины связей составляют 1,126 и 1,186 А [2],
-,'¦ силовые константы— 17,88 и 11,39 [3].
Оксид азота Л'О. Молекула оксида азота — одна из немно-
гих, обладающих нечетным числом электронов. Длина связи
N—О составляет 1,1503 А [4], а дипольный момент — 0,16 Д.
Мономерная молекула N0 в газовой фазе парамагнитна, но
в конденсированном состоянии диамагнитна. В конденсирован-
ном состоянии оксид азота полимеризован, что следует не толь-
ко из измерений магнитной восприимчивости и ПК- и КР-спек-
гров жидкого и твердого [5] образцов и N0 в матрице N2 при
!о К [6], но также и из исследования структуры кристалличе-
ского твердого продукта [7]. Изменение степени ассоциации
с температурой позволяет оценить теплоту диссоциации димера
A5,52+0,62 кДж/моль). К. сожалению, в кристалле имеет мес-
то неупорядочение (и как результат — остаточная энтропия
568 18. Азот
15 э. е. на моль днмера), и хотя димер, вероятнее всего, имеет
форму
N-
-0
¦ 1,12 (-02) А
О N
" 2,40 А
тем не менее нельзя с уверенностью сказать, какова его струк-
тура
N О N N
или
О N О О
и является ли конфигурация димера строго прямоугольной.
Прочность связи между двумя молекулами димера, естественно,
гораздо меньше прочности ординарной связи.
Диоксид азота NO-л. Молекула NO2 также имеет нечеткое
число электронов, и некоторые ее реакции сходны с реакциями
свободных радикалов, например ее димеризация, способность
вытеснять водород из насыщенных углеводородов и ее реакции
присоединения к ненасыщенным и ароматическим углеводоро-
дам. Из микроволнового изучения NO2 следует [8], что рас-
стояние N—О составляет 1,197 А, а угол О—N—О равен 134°15',
что находится в согласии с результатами более ранних исследо-
ваний методами электронной дифракции и инфракрасной спек-
троскопии.
Триоксид диазота N2O3. Чистый К2Оз не может быть выде-
лен в индивидуальном виде в газовой фазе, так как он сущест-
вует в равновесии с продуктами своей диссоциации N0 и N02.
Однако его микроволновый спектр, полученный [9] при —78 °С
и давлении 0,1 мм рт. ст., позволил установить, что молекула
имеет планарное строение следующего вида:
1142А
О 105,1° 112,7° /
V- г~~-/1,202 А
Некоторые из многочисленных предположений о природе не-
обычно длинной связи N—N обсуждаются в работе [9]. Струк-
тура кристаллического N2O3 (при —115 °С) оказалась также
слишком сложной для анализа [10].
Тстраоксид диазота jV2O4. Химия этого оксида —• димера
диоксида — наиболее интересна тем, что молекула N2O4 может,
по-видимому, диссоциировать тремя различными способами
18.8. Оксидные соединения 569
Термическая диссоциация протекает в соответствии с уравне-
нием
N2O4 =f==t 2NO2
Реакции с ковалентными молекулами наилучшим образом объ-
ясняются в предположении схемы
N2O4 -<—>- NO2+ + ХО2-
(ср. с ионизацией HNO3 в H2SO4), но в среде с высокой диэлек-
трической константой имеет место ионизация типа
N2O4
NO+ -f
Ряд реакций жидкой N2O4, дающих нитрозильные соединения
и нитраты, можно интерпретировать в соответствии с этими ти-
пами ионизации. Может показаться, что указанные две формы
ионизации являются аргументом в пользу асимметричной струк-
турной формулы (б) или мостиковой (в), а не формулы типа а,
а которой две группы NO2 могут быть или компланарны, или
наклонны друг к другу. Однако слабость этого аргумента иллю-
стрируется тем фактом, что изоэлектронный оксалат-ион, о кото-
,N=0 /О
N-N
\ /л
N-0
0-N
СГ
(У
v
N-0
a v Q 6
ром известно, что он является симметричным и имеет конфигу-
рацию типа а, сходен с N2O4 не только по колебательным часто-
там, но н по химическим свойствам:
2Н+ Н+
К2О4 > N0+ + N03" ——>- N0+ + H2NO3+ *- N0+ + N02+ -f H30+
2Н+
Для сравнения: С2О42" v CO -j- СО32~ >-
н+
v СО + Н2СО3 »- СО 4- С02 + Н30+
Ниже показана наиболее вероятная планарная структура моле-
кулы К2О4 в паровой фазе [11], в твердотельной моноклинной
модификации кристаллического N2O4 [12], в кристаллах комп-
лекса с 1 : 4-диоксаном [13]:
Однако в кубической модификации кристалла N2O4 (при
—40°С) найдены несколько иные параметры молекулы, а имен-
но: расстояние N—N 1,64 А и угол О—N—О 126° [14]. Отметим
необычайную длину связи N—N по сравнению с длиной нор-
570 /5. Азот
мальной ординарной связи в гидразине A,46 А) и сопоставимую
с протяженной связью В—В в В2С14, который является также
планарным.
ИК-спектральные исследования N2O4 в матрице твердого
аргона и кислорода доказали существование у него различных
изомерных форм, например скрученной непланарной структуры
типа а и изомера типа б [15]. Спектр этого оксида, полученного
окислением NO в жидких этан-пропановых смесях при 80 К,
интерпретирован в предположении структурной формулы
(NO) + (NO3)- [16].
Пентаоксид диазота Л'Г2О-,. Указанный оксид в газовой фазе.
а также в растворах СС14, СНС13 и РОС13 состоит из молекул
N2O5. Первоначальное изучение газообразных образцов методом
электронной дифракции не позволило определить конфигурации
молекулы, поэтому желательно более прецизионное исследова-
ние [17].
При растворении в H2SO4 или НМОз этот оксид подвергается
диссоциации:
N8O5 ч=^= NO2+ -f ХО3"
и из таких растворов могут быть приготовлены соли нитропла
NO2+ (см. далее). Присутствие NO2H~ и NO3~ в кристаллическом
НгОз, первоначально обнаруженное по частотам КР-спектра,
теперь подтверждено расшифровкой кристаллической структуры
N2O5. Этот оксид при температурах ниже температуры жидкого
азота состоит из равного количества планарных ионов NO3~
(N—О«1,24 А) и линейных ионов NO2+ (N—О» 1,15 А) [18].
(ИК-спектры этого оксида наводили на мысль о том, что при
температуре жидкого гелия он является молекулярным кристал-
лом, возможно, O2NONO2 [19], но это не подтвердилось при
структурных исследованиях.)
Реакция N2O5 с SO3 описывается при рассмотрении соеди-
нений нитроила.
Литература. [1] J. Phys. Chern., 1961, 65, 1453. [2] J. Chem. Phys., 1954, 22.
275. [3] J. Chem. Phys.," 1950, 18, 694. [4] J. Chem. Phys., 1955, 23, 57. [5] J. Am.
Chem. Soc, 1952, 74, 4696. [6] J. Chem. Phys., 1969, 50, 3516. [7] Ada cryst.,
1953, 6, 760. [81 J. Chem. Phys., 1956, 25, 1040. [9] Trans. Farad. Soc, 1969, 65.
1963. [10] Acta cryst., 1953, б", 781. [11] J. Chem. Phys., 1972, 56, 4541. [12] Ada
Chem. Scand., 1963, 17, 2419. [131 Acta Chem. Scand., 1965, 19, 120. [14] Nature.
1949, 164, 915. [15] Inorg. Chem., 1963, 2, 747; J. Chem. Phys., 1965, 42, 85.
[16] J. Chem. Phys., 1965, 43, 136. [17] J. Chem. Phys., 1934, 2, 331. [18] Acta
cryst., 1950, 3, 290. [19] Spectrochim. Acta, 1962, 18, 1641.
18.8.2. Соединения нитрозила: ион NO+. Потеря электрона окси-
дом азота должна привести к образованию иона [:Ns=O:]+, так
как он содержит тройную связь, сравнимую со связью в NO,
имеющую порядок 2,5 (двойная + трехэлектронная связь).
18.8. Оксидные соединения 571
Установлено, что азотистая кислота существует в кислом рас-
пюре не в виде Н1\О2, а в виде нитрозил-ионов NO+:
NO+
- Н2О
и что некоторое количество тех же ионов присутствует и в рас-
творах «нитрозилсерной кислоты» или нитрозилгидросульфата
\O~-F1SO4~. Рентгеновскими исследованиями установлено, что
определенные нитрозильные соединения, например NO-C1O(,
NO-BF4 и (NOJSnCU (первоначально описанное как
SnCl4-2 NOCI), в структурном отношении подобны соответст-
вующим аммониевым солям (NH4C1O4 и т. д.), а соль NO(PtFe)
и-юструктурна с O2(PtF6) и KSbF6 [1]. Эти соли содержат
ион NO"r, который найден также в нитратосоедииениях, описы-
ваемых в разд. 18.8.7.
Молекулы нитразилгалогенидов не линейны (валентные углы
в NOF [2], NOC1 [3] и NOBr [4] составляют ПО, 113 и 117°
соответственно), а длина связи N—О близка к 1,14 А, т. е.
такая же, как и в NO. Последняя величина и тот факт, что
расстояния N—X A,52; 1,97 и 2,13 А) значительно больше длин
обычных ординарных связей, наводят на мысль о том, что про-
стая структурная формула 1 неадекватно изображает электрон-
ное строение этих молекул, и следует учитывать резонанс с ион-
ной конфигурацией 2:
N=o:
:№Ю:
1 2
Дополнительным аргументом в пользу полярной структуры
является то обстоятельство, что величины дипольных моментов
чистого NOC1 и NOBr B,19 и 1,90 Д соответственно) существен-
но больше значений (~0,3 Д), рассчитанных для структуры 1
[5].
Литература. [1] Inorg. Chem., 1966, 5, 1217. [21 J. Chem. Phys., 1951, 19, 1071.
[3] J. Chem. Soc, 1961, 1322. [4] J. Am. Chem. Soc, 1937, 59, 2629. [5] Rec. Trav.
rhim. (Belg.), 1943, 62, 289.
18.8.3. Нитрозосоединения. Выполнены структурные исследова-
ния свободного радикала [(CH3KC]2NO [1] (расстояние N—О
составляет 1,28 А), нитрозометана CFI3NO [2] (угол CNO ра-
вен 113°, расстояние N—О оценено как 1,22 А) и F3CNO [3],
в котором расстояние N—О составляет 1,17 А, ауголСЫО— 121°.
Связь С—N аномально длинная A,55 А), как в нитросоедине-
ниях CF3NO2 и др. (см. «Органические нитросоединения»
в разд. 18.8.7). Многие из этих соединений димерны.
572 18. Азот
O2NCH2CH2
i,304 А
N N
XCH2CH2NO2
Приведенная в качестве примера молекула получена действием
N2O3 на этилен [4]. Информация об ионах [ON(NO)SO3]~ и
[ON(SO3J]2~-, у которых имеются три компланарные связи,
дается в разд. 18.4.3.
Литература. [1] Acta Chem. Scand., 1966, 20, 2728. [21 J. С hem. Phys., 1968,
49, 591. [3] J. Phys. Chem, 1965, 69, 3727. [4] J. Am. Chcm. Soc, '1969, 91,
1371.
18.8.4. Нитрозильные производные металлов. К настоящему вре-
мени синтезированы многочисленные нитрозопроизводные ме-
таллов, большинство из которых интенсивно окрашено (от крас-
ного цвета до черного). Примерами служат хорошо известный
нитропруссид K2[Fe(CNMNO], аммины типа [Co(NH3MNO]X2
и другие разнообразные комплексные соли типа
K3[Ni(S2O3JNO]-2H2O, K2[Ni(CNKNO] и K2[RuCl5NO]. Мно-
гие из этих соединений могут быть приготовлены непосредствен-
ным взаимодействием N0 и подходящего соединения металла;
в частности, нитрозилгалогениды металлов (например,
Co(NOJCl [1]) получают из галогенидов, нитрозилкарбонилы
(Fe(COJ(NOJ и Со(СО)зМО) —из карбонилов, в то же время
действие N0 на аммиачный раствор кобальтовой соли дает два
ряда (красных и черных) солей [Co(NH3MNO]X2. По-види-
мому, красная (более устойчивая) форма представляет собой
димер, предположительно гипонитрит [(NH3MCo-ON = NO-
•Co(NH3M]X4; измерения его эквивалентной проводимости по-
казывают, что он является 4: 1-электролитом [2]. Взаимодейст-
вие N0 и Fe2(CO)g под давлением приводит к образованию
Fe(NOJ(COJ или Fe(NOL в зависимости от температуры. Рас-
творы солей железа реагируют с N0 в присутствии сульфидов
с образованием черных солей Руссена M[Fe4S3(NOO], которые
превращаются под действием щелочей в менее устойчивые крас-
ные соли M2[Fe2S2(NOJ]. Если вместо щелочных сульфидов ис-
пользуются меркаптаны, то получаются эфиры красной соли,
например Fe2S2(NOL(C2H5J.
Функцию монодентатного лиганда в комплексных соедине-
ниях металлов N0 выполняет одним из двух способов: а) как
12-электронная единица (N0~), когда образуется простая связь
с М и угол М—N—О составляет около 125°, и б) чаще как
М
180°
18.8. Оксидные соединения 5.3
Таблица 18.5. Структуры нитрозильных соединении металлов
Угол,
град
М—N,
N-O,
Литература
Тип а
[Co(enJCl(NO)lClO4
[lr (СО) С! (Р (С6Н5) 3) 2NO]BF4
[Ir(C0)I(P(C6H5KJN01BF4.
•С6Н6
Co(NO)[S2CN(CH3J]2
Тип б
[Fe(NOJIl2
Ru(NOJ(P(C6H5KJ
[Cr (CN) 5NO][Co (en) 3]• 2 H20
Fe(NO)[S2CN(CH3J]2
[Fe(CNMN012-
[Fe(CNLNO]2-
Cr(C5H5)Cl(NOJ
Cr(C5H5)(NCO)(NOJ
Mo(NO)(C5H5K
Mn(COJ(P(C6H5KJNO
M—N—Ol
I
124
124
125
(-135)
161
168, 175
176
170
176
177
170
171
179
178
1,82
1,97
1,89
A.7)
1,67
1,72
1,71
1,72
1,65
1,65
1,71
1,72
1,75
1,73
1,11
1,16
1,17
A,1)
1,15
1,22
1,21
1,10
1,12
1,16
1,14
1,16
1,21
1.18
Inorg. Chem., 1970, 9,
2760
J. Am. Chem. Soc,
1968, 90, 4486
lnorg Chem., 1969, 8,
1282
J. Chem. Soc, 19G2,
668
J Am Chem. Soc,
1969, 91, 1653
Acta cryst, 1975, B31,
897
Inorg Chem., 1970, 9,
2397
J. Chem., Soc, A 1970.
1275
Acta cryst, 1979, B39,
2193
Z. Naturforsch, 1977,
B32, 275
J Chem. Soc, A 1966,
1095
J. Chem. Soc, A 1970,
605, 611
J Am. Chem. Soc,
1969, 91, 2528
Inorg. Chem, 1967, 6,
1575
10-электронная единица (NO+), если М—N является кратной
связью, а угол М—N—О близок к линейному. Различие между
классами а и б представляет собой, быть может, самый простой
случай из того, что есть в действительности; из обзора структур
всех известных соединений железа с квадратно-пирамидальной
координацией следует, что уже зафиксированы величины углов
FcNO [2] в интервале от 122 до 180°. Конечно, наименьшие уг-
лы, 122 и 132°, в Fe(salen)NO [26] ассоциируются с наиболее
длинными связями Fe—N (около 1,8 А), но в этом кристалле
лиганды N0 разупорядочены. С другой стороны, углы порядка
155° (и расстояния Fe—N 1,70 А) найдены в структуре
Fe(N2S2)NO с упорядоченными лигандами [2в]; это наводит на
574 IS. Азот
мысль о том, что эффекты кристаллической упаковки также
могут быть существенными.
Некоторые из соединений, приведенные в табл. 18.5, интерес-
ны и с позиций стереохимии атомов переходных металлов; это
относится, например, к тетрагонально-пирамидальным структу-
рам иона [1г(СОI(Р(С6Н5)зJНО]+, комплексам железа и ко-
бальта M(NO) [S2CN(CH3J]2 (б) и к необычной молекуле
ЛкцСэНзЬ^О (г). В комплексе Fe типа в связи М—N—О при-
мерно коллинеарны, но в случае иридиевого и, возможно, ко-
бальтового соединения, структура которого определена менее
точно, связи относятся к типу а. Почти коллинеарны связи
М—N—О и в ионе нитропруссида [Fe(CN)sNO]2~ и аналогич-
ных ионах хрома и марганца.
В молекуле д N0 выступает сразу в двух ролях: как моно-
дентатный лиганд типа б (угол Сг—N—О составляет 179°) и
как мостиковый лиганд. Величина расстояния Сг—Сг указывает
на наличие связи металл — металл [3]. Еще более сложно по-
е
о
N
О
I
N
!
Мо
д
с5н5.
0х ''
Н2
.N
1,94 А ^0
А\ ,-N
—Сг 1
/ 'С
,12 А
ведение N0 в (С5Н5)зМпз(НОL [4]. Здесь N0 выполняет две
функции — двойного и тройного мостика. На рис. 18.3 молекула
спроецирована в направлении, перпендикулярном равносторон-
нему треугольнику из атомов Мп (расстояние Мп—Мп прибли-
зительно составляет 2,50 А) вдоль оси тройного нитрозильного
мостика, который расположен ниже плоскости Мп—Мп—Мп.
Известна кристаллическая структура одной из черных солей
Руссена CsFe4S3(NOO-H2O [5]. Ядро аниона составляет тет-
раэдр из атомов железа, над центрами трех граней которого на-
ходятся атомы серы (рис. 18.4, о). Один из атомов железа (Fe^
связан с тремя атомами серы и одной группой N0; кроме того,
он образует слабые связи с тремя другими атомами железа
(Fen). Атомы Fen связаны с двумя атомами серы, двумя груп-
18.8. Оксидные соединения 575-
пами N0 и атомом Fci. Расстояние Fei—Fen B,70 А) соответст-
вует приблизительно «полусвязи», если воспользоваться уравне-
нием Полинга (разд. 29.3), а между атомами Feu (Fen—Feu
3,57 А) химические связи отсутствуют. Схема классических ва-
лентных связей (рис. 18.4, а) приводит к эффективному атомно-
му номеру для атомов железа, равному 18, и согласуется с диа-
магнетизмом этого соединения, но подразумевает при этом до-
статочно высокие формальные заряды на
Fe( (—2) и Fe,i (—3), что предполагает
резонанс со структурами, которые будут
понижать эти заряды. Рассматривается
и альтернативная модель, в которой
связь атомов железа описывается четы-
рехцентровон молекулярной орбиталью.
Длины других связей в этой молекуле
составляют: Fe—S 2,32 A; Fei—N 1,57 А;
Fen—N 1,67 A; N—О 1,20 А.
В молекуле Fe2S2(NOL(C2H5J [6]
(рис. 18.4,6) атомы железа образуют
тетраэдрические связи с двумя атомами
серы и двумя группами N0. Взаимодей-
ствие Fe—Fe между этими атомами объ-
ясняет диамагнетизм соединения. Информация о нитрозилкар-
бонилах приводится в разд. 22.3.6.
Литература. [1] Acta Chem. Scand., 1967, 21, 1183. [2] Inorg. Chem., 1964. 3,
1038 [2a] Inorg. Chem., 1980, 19, 3622. [26] Inorg. Chim. Acta, 1979, 33, 119.
[2b1 Inorg Chem., 1977, 16, 3262. [31 Acta cryst., 1970, B26, 1899. [4] J. Am.
Chem. Soc, 1967, 89, 3645. [5] Acta cryst, 1958, 11, 594. [6] Acta cryst., 1958,
11, 599.
18.8.5. Соединения нитроила. Существование двух нитроилгало-
генидов NO2F и NO2C1 надежно установлено; существование же
Рис. 18.3. Конфигурация
молекулы
(СН)М
a
Fe'f,-
N
О
FeV
N
II
О
N
II
О
Рис. 18.4. Строение иона Fe4S3(NOO+ (а) и молекулы Fc2S2(\OL(C2H.-,J (ot
576 18. Азот
18.8. Оксидные соединения 577
NO2Br определенно не доказано. Фторид удобно получать дей-
ствием фтора на слабо подогретый сухой нитрит натрия
(NaNO2+F2—^NO2F+NaF); он представляет собой реакцион-
носпособный газ, который превращает многие металлы в оксиды
и фториды или оксофториды, и реагирует со многими неметал-
лами (за исключением Вг и Те) с образованием солей нитрои-
ла: примерами последних являются (NO2)BF4, (NO2JSiF6,
(NO2)PF6 и (NO2)IF6.
Нитроилхлорид может быть приготовлен из хлоросульфоно-
вой и безводной азотной кислот. Он соединяется с галогенидами
с образованием солей типа (NO2)SbCle, которые в ионных рас-
творителях (например, жидком SO2) вступают в реакции типа
(NO2) (SbCle) + N(CII3LC1O4
N(CH3LSbCle
Данные микроволновой спектроскопии для NO2F [1] и NO2C1
[2] согласуются с планарной конфигурацией молекул:
, 1,47 А
Cl-
Лзо
1,20
В солях нитроила ион МО2+ имеет линейное строение (N—О
1,10 А); исследование проведено на примере (NO2) (CIO4) [3].
Уже отмечалось, что N2O5 диссоциирует в H2SO4 на NO2+ и
\'О3~ и что кристаллический пентаоксид состоит из равного ко-
личества этих двух ионов. Смешением SO3 и N2O5 в растворе
РОСЬ могут быть получены N2O5-2SO3 и N2O5-3SO3, а из рас-
твора SO3 в HNO3 были выделены HNO3-2 SO3 и HNO3-3SO3.
Эти соединения на самом деле представляют собой (NO2JS2O7
и (N02JS3Oio, NO2(HS2O7) и N02(HS3Oio) соответственно.
Рентгеновские исследования показали, что кристаллы
(N02JS3Oio [4] и (NO2) (HS2O7) [5] состоят из линейных ионов
(О—N—О)т и ионов S3Oio2~ или HS2O7~ соответственно. О ли-
нейном ионе NS2+ информация содержится в разд. 18.9.
Литература. [1] J. Chem. Soc, Л 1968. 1736. [21 J. Mol. Spectr., 1963, 11, 349.
[3] Acta cryst., 1960, 13, 855. [4] Acta cryst, 1954, 7, 430. [5] Acta cryst., 1954,
7, 402; Inorg. Chem., 1971, 10, 2319.
18.8.6. Оксогалогенид-ионы. Соли типа (NOF2)BF4h (NOF2)AsF6,
приготовленные из NOF2 и галогенида, содержат планарный
ион NOF2+, подобный изоэлектронной молекуле COF2 (ИК,-
спектр) [Inorg. Chem., 1969, 8, 1253]. Ион NOC12+ изучен
в (NOCl2)SbCl6, приготовленной взаимодействием NC13, SbCU
и SOC12; показано, что этот ион плоский с длинами связей
N—C1 1,61 и 1,72 А и N—О 1,30 A [Angew. Chem., Intern. Ed.,
1977, 89, 569].
18.8.7. Кислоты и оксоионы. Надежно установлено существова-
ние трех оксокислот азота: азотистой (HNO2), азотной (HNO3)
и азотноватистой (H2N2O2). Описано приготовление и других
кислот или их солей. Например, Na3NO4 получен из NaNO3 и
Na2O при 300 °С; соединение очень реакционноспособно по от-
ношению к Н2О и СО2. Его спектр КР свидетельствует о тетра-
эдрической конфигурации аниона. Ниже рассматриваются глав-
ным образом соединения с известной структурой.
О катионах NO+ (нитрозил) и NO2+ (нитроил) см. выше.
Азотистая кислота. Азотистая кислота получена только в ви-
де разбавленных растворов, но и они быстро разлагаются, выде-
ляя оксиды азота. Для ее молекулы можно предложить две
конфигурации, причем для второй в двух изомерных формах
(цис и транс):
.О
H-N'
или
O-N4
W О
нас
O-N
ЧО HU О
нас j транс
Предположение о реальном существовании такой таутомерии
основано на том факте, что взаимодействие нитритов металлов
с алкилгалогенидами приводит к двум рядам соединений:
1) нитритам, в которых группа NO2 соединяется с атомом угле-
рода через атом кислорода; 2) нитросоединениям, в которых
имеется прямая связь N—С. Однако из ИК-спектроскопических
исследований азотистой кислоты в газообразном состоянии сде-
лан вывод [J. Chem. Phys., 1951, 19, 1599] о том, что нет каких-
либо доказательств наличия молекул формы а и что два изо-
мера б существуют в сравнимых количествах, причем транс-нзо-
мер более устойчив. Для гранс-изомера предложена структу-
ра в [J. Am. Chem. Soc, 1966, 88, 5071].
Н.0,95 А
Нитриты металлов и нитритосоединения. До последнего вре-
мени были известны только простые устойчивые нитриты ще-
лочных, щелочноземельных металлов, Zn, Cd, Ag(I) и Hg(I).
Нитриты щелочных металлов разлагаются при температуре
красного каления, остальные последовательно — при более низ-
ких температурах. Ионные нитриты наиболее электроположи-
тельных металлов содержат ион NO2^, который в NaNO2 [1]
имеет следующую конфигурацию: угол ONO равен 115,4°, рас-
стояние N—О составляет 1,236 А. Интересно сопоставить здесь
структурные данные для групп NO2+, NO2 и NO2^, содержащих
37—985
578 18. Азот
соответственно 16, 17 и 18 валентных электронов:
N-O, А
Угол ONO
NO2+
1,10
180°
NO2 NO2"
1,19 1,24
134° 115°
К сожалению, ничего не известно о строении двухзарядного
иона NO22~, который может существовать в нитроксилате натрия
Na2NO2 [2], образующемся в виде коричнево-желтого твердого
продукта при реакции между NaNO2 и металлическим натрием.
Парамагнитная восприимчивость этой соли слишком мала для
соединения с формулой (Na+J(NO2J^, но хорошо согласуется
с предположением о диссоциации примерно на 20% димерного
иона N2O44- [3].
Нерастворимые (более интенсивно окрашенные) нитриты ме-
таллов, например Hg, представляют собой, по всей вероятности,
существенно ковалентные соединения. Безводные нитриты
Ni(II) и Со (И) были получены из NO2 и подходящего соедине-
ния металла, например, Ni(NO2J — из №(СОL и NO2 (каждый
из которых был разбавлен аргоном) [4]. Нитрит никеля устой-
чив до 260 °С. Хорошо известны комплексные нитриты переход-
ных металлов (например, Na3[Co(NO2N] и K2Pb[M(NO2N],
где M = Fe, Co, Ni, Си).
Как лиганд, непосредственно связанный с атомом металла,
ион NO2~ может присоединяться одним из следующих четырех
способов:
M-N M-O-N
ХО
1 2
М N
3
М
,0
1 Через N группа NO2 связана в таких комплексах, как
[Co(NO2N]3- и [Cu(NO2N]4-(разд. 25.7.5) (в K2Pb[Cu(NO2N];
параметры NO2 здесь такие же, как и у иона NO2~ [5]), а так-
же в комплексах типа [Co(.NH3J(NO2L]- и Со[(NH3MNO2]2+
[6].
2. Через О группа NO2 связана в
Ni [ (СН3) 2NCH2CH2N (СН3) г] 2 (ONO) 2 [7а]:
O-N
/
Ni—O4i,29 A
\ N-0
18.8. Оксидные соединения 579
В [Cr(NH3MONO]C12 [76] две связи N—О оказались эквива-
лентны A,19 А); угол О—N—О равен 122°.
3. Через оба атома О (бидентатно) группа NO2 связана
в K3[Hg(NO2).»]NO3 [8a], где ион NO2~ имеет то же строение,
что и свободный ион: N—О составляет 1,24 А, угол О—N—О
равен 114,5°. В [Cu(bpyJ(ONO)]NO3 [86] бидентатный лиганд
практически симметричен. Обе связи Си—О слабые по сравне-
нию с нормальной связью ( — 2,0 А); их средняя длина составля-
ет 2,29 А. С другой стороны, в Cu(bpy) (ONOJ [9] одна связь
с каждой группой ONO~ имеет обычную длину, другая — очень
длинная, но усредненное их значение B,24 А) близко к соответ-
ствующей величине в симметричном мостике.
О
2,24 а\
N
о
-4,33 А
O-N4
N-0 : /О
Xo-\C^99A
2,49 A/ \1,98 A
К XN
,08 А\
4. Через атомы N и О с образованием асимметричного плос-
кого мостика группа NO2 связана в
Н2
)Co(NH3L
О
4+
Н
3+
(NH3KCoCo_N Co(NH3K
\ х/
1.21
Литература. [1] Acta cryst., 1961, 14, 56. [21 Ber., 1928, 61, 189. f3] Ada Chem.
Scand., 1958, 12, 578. [4] Inorg. Chem., 1963, 2, 228. [51 Inorg. Chem., 1966, 5,
514. [6] Acta cryst., 1968, B24, 474. [7al Chem. Comm., 1965, 476. [761 Acta
cryst., 1978, B34, 2285. \8a] J. Chem. Soc, D 1976, 93. [861 J- Chem. Soc, A 1969,
1248. [91 J. Chem. Soc, A 1969, 2081. [lOJInorg. Chem., 1970, 9, 1604. [Ill Acta
cryst., 1970, B26, 81.
Органические нитросоединения. Известно,что в органических
нитросоединениях группа NO2 симметрична; расстояние N—О
равно 1,21 А, а угол ONO 125—130° (нитрометан CH3NO2
[J. Chem. Phys., 1956, 25, 42] и различные кристаллические
нитросоединения). Несколько большие углы A32 и 134°) были
найдены в CF3NO2 и CBr3NO2 [J. Chem. Phys., 1962, 36, 1696].
В этих молекулах связи С—F, С—Вг и N—О имеют нормаль-
37*
80 /5. Азот
ную длину A,33, 1,92 и 1,21 А соответственно), но расстояния
С—N необычно велики A,56 и 1,59 А) и система
-C-N
-О
-О
непланарна.
Азотноватистая кислота. В противоположность азотистой и
азотной кислотам азотноватистая кристаллизуется из эфира
в виде бесцветных кристаллов, которые легко разлагаются при
нагревании со взрывом. Детальная молекулярная структура
этой кислоты пока не определена, но известно, что молекуляр-
ная масса свободной кислоты и ее эфиратов соответствует
удвоенной формуле H2N2O2; азотноватистая кислота разлагает-
ся серной до N2O и может быть восстановлена до гидразина
H2N—NH2. ИК- и КР-исследования убедительно показывают,
что гипонитрит-ион имеет гранс-конфигурацию а, но, судя по
колебательной частоте связи N—N, порядок центральной связи
несколько меньше двух [J. Am. Chem. Soc, 1956, 78, 1820].
-о'
N=N'
,СГ
',оо A
н
1,43 A
6
1,18 А.0
¦Ndi30°
\.
О
Изомер кислоты — нитрамид H2N-NO2, который разлагается
в щелочном растворе до N2O и подобно H2N2O2 может быть вос-
становлен до гидразина, имеет структуру б с углом между плос-
костями NH2 и NNO2 52° [J. Mol. Spectr., 1963, 11, 139]. "
Оксогипонитрит-ион. Соль Na2N2O3 («соль Анджели») при-
готавливают действием метилата натрия на гидроксиламин и
бутилнитрат при 0°С:
C4HeONO2
H,NOH + 2NaOCH4
Na2(ONNO2) -f C4H,,OH + 2CH3OH
При исследовании Na2N2O3-H2O установлено строение (планар-
ного) иона N2O32- [Inorg. Chem., 1973, 12, 286].
1,264 А
,N, ¦ N'
1,31 A
119°
1,32 A
1,35 kj ,,3.
О
Пероксонитрит-ион. Этот ион, получаемый окислением рас-
творов азидов озоном или окислением NH2C1 кислородом,
по-видимому, устойчив в метанольном растворе в течение не-
скольких недель. Его существование доказано с помощью
УФ-спектроскопии, но пока что не получено никаких его твер-
дых солей. Высказано предположение, что ион имеет структуру
18.8. Оксидные соединения 581
(O=N—О—О)- [J. Inorg. Nucl. Chem., 1964, 26, 453; J. Chem.
Soc, A 1968, 450; 1970, 925].
Азотная кислота и нитрат-ион. Чистая азотная кислота мо-
жет быть получена вымораживанием ее разбавленных раство-
ров (так как точка замерзания HNO3 около —40 °С), но в та-
ком виде кислота неустойчива — диссоциирует на N2O5 и Н2О,
причем N2Os разлагается, и кислота становится разбавленной.
Однако если концентрированный раствор HNO3 хранится в тем-
ноте, то разложение N2O5 затормаживается и концентрация кис-
лоты остается постоянной. Были исследованы безводная HNO3,
а также ее моно- и трикристаллогидраты, исследована также
и структура гидратов в растворе [1]. Показано, что в парооб-
разном состоянии НМОз существует в виде плоских молекул
с конфигурацией а [2], но достоверные данные о структуре мо-
лекул в твердой безводной кислоте получить не удалось из-за
а
субмикроскопического двойникования кристаллов [3]. Моногид-
рат [4] построен из гофрированных слоев того же типа, что на
рис. 15.25,6 (разд. 15.2.7), где заштрихованные кружочки изо-
бражают атомы О молекул воды. ЯМР-исследование указыва-
ет на наличие в его молекуле группы из трех протонов, распо-
ложенных в вершинах равностороннего треугольника, что дает
основание считать, что соединения, подобно моногидратам не-
которых других кислот (разд. 15.2.7), содержат ион (Н3О)+, и
записать его структурную формулу в виде (H3O) + (NO3)~.
В HNO3-3H2O [5] короткие водородные связи B,48 и 2,63 А)
соединяют ионы Н3О+ с двумя молекулами Н2О с образованием
ионов Н7О3+, которые в свою очередь соединяются водородными
связями (длиной 2,80 А) с другими подобными ионами, а также
с ионами NO3~. Длина связей N—О A,26 А) свидетельствует
о том, что в данной фазе более вероятно существование ионов
NO3~, чем молекул HNO3.
Простые ионные нитраты (как будет показано ниже) по
своей структуре совершенно отличны от солей типа Ат(ХО3)л,
образуемых другими элементами V группы периодической си-
стемы. Они содержат плоский равносторонний ион NO3~ (в гео-
метрическом отношении подобный ионам ВО33~ и СО32~) в про-
тивоположность пирамидальным ионам SO32^" и С1О3~, форми-
руемым элементами второго короткого периода (см. периодиче-
582 18. Азот
скую систему элементов в начале гл. 8), и полимерным ионам
(РОз)**" в метафосфатах. Длина связи N—О в NO3~ в ряде ни-
тратов близка к 1,25 А [6]. Так, на основании данных по ди-
фракции нейтронов получены значения: 1,27 А в Pb(NO3J [7],
1,26 А в AgNO3 [8], 1,256 А в HNO3-H2O, а также в высокотем-
пературной модификации NaNO3 [9], в которой ориентация
ионов NC>3~ полностью разупорядочена. В парообразном состоя-
нии LiNO3 и NaNO3 существуют в виде молекул со структурой б
(см. выше), подобной структуре HNO3 (расстояние О—Li со-
ставляет 1,60 А, О—Na — 1,90 А) [10].
Помимо нормальных нитратных солей известны и кислые
соли M[H(NO3h] и M[H2(NO3K], где М — крупный по разме-
рам ион типа К+, Rb+, Cs+, NH4+ или AsH4+. Анион H(NO3J~
состоит из двух ионов |ЫОз~, соединенных короткой водородной
связью (в). В [Rh(C5H5NLCl2]H(NO3J [11] и в CsH(NO3J
нитрат-ионы расположены в перпендикулярных плоскостях, но
в (As(C6H5L)H(NO3J найдена компланарная их конфигурация
[12]. В NH4H2(NO3K [13] группа H2(NO3K- состоит из цент-
рального нитрат-иона, соединенного водородными связями с дву-
мя молекулами HNO3, которые расположены в плоскости, пер-
пендикулярной плоскости иона NCb~ (г).
О
I 1 29 А Оч О
1,21 А
о
1,22 А
О 4
о
1,34 А
2,60 А
Оч
1,26 А
O-H-0N
/
О
11,24 А
1
0
Литература. [1] Acta Chem. Scand., 1954, 8, 374. [2] J. Chem. Phys., 1965, 42,
3106. [3] Acta cryst., 1951, 4, 120. [4] Acta cryst., 1975, B31, 1486. [5] Acta cryst.,
1975, B31, 1489 [6] Quart. Rev. Chem. Soc, 1971, 25, 289. [7] Acta cryst., 1957,
10, 103. [8] J. Chem. Soc, A 1971, 2058. [9] Acta cryst., 1972, B28, 2700.
[101 Ж. структ. хим., 1965, 6, 765. [Ill Acta cryst., 1979, B35, 1099. [12] Chem.
Comm., 1967, 1211. [13] Acta cryst., 1970, B26, 1117.
Нитраты металлов и нитратные комплексы. Имеется не-
сколько классов соединений, в которых группа NO3 непосредст-
венно соединена с одним или большим числом атомов металла
существенно ковалентными связями:
1) летучие нитраты металлов M(NO3)n;
2) нитрат-ионы, [M(NO3)n]m-;
3) оксонитраты MO4NO3)s/;
4) координационные комплексы, содержащие —NO3 в каче-
стве лиганда.
Примеры классов 1—3 даны в табл. 18.6.
а
о.
S-
с
ел
о
Z
н
О
С
N1
03
ью
|1>
О
5
О
Z
О
Z
о
СО ГГ
god
с^ 6-ZZ
й Роо
a s > >
2я2
и
О СЧ
196
1208.
em.
•-э а) со
is"<S
(J СП 5U
ш г Е
-М-
Ю. ^ .
СО ^
ел сч со
^- ел г~-
й -° -
.2 Е
•1Я —
о - .
584 18. Лзпт
В этих различных соединениях группа МО3 может выполнять
три разные функции: а) монодентатной группы, б) бидентатной
группы и в) мостика.
п.
/йонодентатный.
бидеитатныи
\ /
°Ч /°
N
0
jrtocmuxoeuu
М
По-видимому, вбив группа NO3 может быть как симметрич-
ной, так и несимметричной, т. е. две связи к атому (атомам)
металла имеют либо одну и ту же, либо различную длину. Эта
сторона вопроса обсуждается позднее (см. разд. 23.12.7) в свя-
зи со строением Cu(NO3h и родственных соединений. Из-за не-
достатка структурной информации пока еще невозможно ска-
зать, все ли отмеченные возможности реализуются в каждом из
указанных выше классов, но следующие примеры могут быть
даны с полной определенностью:
Класс A) (б) (в)
B) (б)
C) (б) (в)
D) (а) (б)
Далее кратко рассматриваются перечисленные выше четыре
класса соединений.
1) Безводные нитраты металлов. Безводные ионные нитраты
включают семейство воднорастворимых соединений щелочных
и щелочноземельных металлов, а также некоторых металлов
Б-подгрупп (например, AgNO3, Cd(NCbJ, Pb(NO3J) и переход-
ных металлов (Co(!NO3J, Ni(NO3J). Нитраты Mg и многих
Зс1-металлов обычно получаются в виде гидратов. Последние
представляют собой обычные ионные кристаллы, в то время как
безводные соли во многих случаях оказы-ваются неожиданно ле-
тучими и более трудными для синтеза. Нагревание многих нит-
ратных гидратов приводит к образованию гидроксосолей или
оксидов, но летучие безводные нитраты многих переходных и
менее электроположительных металлов (Be, Mg, Zn, Hg, SnIV,
TiIV) могут быть получены действием жидкого N2O5 или смеси
N2O4 и этилацетата на металл или какое-либо его соединение.
Например, если металлическую медь обрабатывают N2O4 и осу-
шенным этилацетатом при комнатной температуре в течение
4 ч и затем в раствор вводят дополнительную порцию N2O4, то
происходит осаждение Cu(NO3J-N2O4. При нагревании этот
комплекс превращается в безводную соль Cu(NO3J, которая
18.8. Оксидные соединения 585
может быть очищена сублимацией. Некоторые из безводных
нитратов рассматриваемой группы (например, Sn(NO3L и
Ti(NO3L) являются энергичными окислителями и при соприкос-
новении с органическими соединениями взрываются или воспла-
меняются, в то же время другие нитраты (Zn, Ni", Mn")
инертны.
Интересны различия в свойствах нитратов Zn, Cd и Hg. Про-
изводные цинка и ртути летучи в отличие от Cd(NO3J, который
является типично ионным соединением (разд.. 7.6.7).
а
2,51
Co(NO3)j Ti(NO,),
Рис. 18.5. Конфигурация молекул Co(NO3)s («) и Ti(NO3L (б).
Примеры летучих нитратов, исследованных в кристалличе-
ском состоянии, включают Cu(NO3J, пары которого содержат
молекулы типа а (его кристаллическая структура рассматри-
вается в разд. 25.7.3), Co(NO3K и Ti(NO3L, которые и в кри-
сталлическом состоянии находятся в виде молекул. Во всех этих
молекулах NO3 выступает в качестве бидентатного лиганда.
Относительная ориентация двух групп МОз в газообразной мо-
лекуле Cu(NO3J не определена. Молекула Co(NO3J почти окта-
эдрическая с поправкой на несколько меньшее значение угла на
атоме металла, стягиваемого бидентатным лигандом; величины
углов между связями на рис. 18.5 не приведены; они близки
к 100°. В молекуле Ti(NO3L 4 группы NO3 размещены вокруг
атома Ti в позициях уплощенного тетраэдра, 8 кислородных ато-
мов, связанных с металлом, формируют уплощенный додекаэдр
(рис. 18.5,6). Аналогичное строение имеет Sn(NO3L.
В молекулах типа б наблюдается некоторое понижение сим-
метрии группы NO3. Во всех этих молекулах группы NO3
586 18. Азот
1,зо А
О.
то"
а
j_0 (O3NKTiQ,,^Niilii
? О 1,292 A
присоединяются к металлу симметрично; обе связи М—О имеют
одинаковую длину.
2) Комплексные нитрат-ионы. В солях встречаются ионы
[M(NO3)x]"~ с х=4, 5, 6. Гидратированные соли готовят из
водных растворов, а безводные — специальными методами, на-
пример реакцией хлорида металла или комплексного хлорида
с жидким N2O5 или N2O4 в растворителях типа CH3CN или эти-
лацетата. Так, Cs2[Sn(NO3)e] получают из Cs2SnCl6. Особо ин-
тересные соединения, называемые Ы2О4-сольватами, получают
б в
Рис. 18.6. Строение ионов [Au(NO3L]- (a) ,[Ce(NO3N]3- (б) и [UO2(XO3K]- (a).
из хлорида металла в смеси N2O4 — этилацетат. Примером мо-
жет служить Sc(NO3K-2N2O4, который в действительности пред-
ставляет собой [Sc(NO3M]2-(NO+J.
В [Au(NO3L]~ ион Аи образует четыре компланарные связи
с монодентатными лигандами NO3 (рис. 18.6, о). Четыре рас-
стояния Аи—О длиной 2,85 А слишком велики, чтобы говорить
о сколько-нибудь заметном взаимодействии между атомами зо-
18.8. Оксидные соединения 587
лота и этими атомами кислорода. Строение ионов [Mn(NO3L]2^,
[Fe(NO3L]~ и [Co(NO3L]2^ (изученных в их тетрафениларсо-
ниевых солях) аналогично строению молекулы Ti(NO3L (т. е.
имеют симметрию, близкую к Did). Однако если в первых двух
ионах бидентатная координация металла группами NO3 сим-
метрична, то в [Co(NO3L]2~ она асимметрична, хотя в двух
группах NO3 длины двух разных связен Со—О составляют 2,03
и 2,36 А, в то время как в двух других — 2,11 и 2,54 А. Разли-
чие в поведении лигандов NO3 в этих тетранитрат-ионах связано
с пониженной симметрией Co(II) (d7, высокоспиновый) по срав-
нению с Ti(IV) (d°), Mn(II) и Fe(III) (d5, высокоспиновый),
Sn(IV) (di0). Впрочем следовало бы отметить, что асимметрич-
ное присоединение лигандов NO3 наблюдается также и в ионе
[Zn(NO3L]2~, причем более длинным связям с Zn соответству-
ют более короткие связи N—О и наоборот.
2,06 A
г/
2,58'
о
Л26
115° !> —,— 0-
1,19
Пентанитрат-ионы отличаются разнообразным поведением
групп NO3.
Если все группы бидентатны, центральный атом металла ко-
ординирован 10 атомами О, как, например, в [Ce(NO3)s]2~ и
в [Y(NO3M] (NOJ. Однако в [Sc(NO3M] (NOJ меньший по раз-
мерам ион Sc3+ имеет девятирную координацию, образованную
четырьмя бидентатными и одной монодентатной группой NO3.
Еще меньший ион А13+ имеет шестирную координацию в
[A1(NO3M]2~, создаваемую одной бидентатной и четырьмя мо-
нодентатными лигандами.
Строение гексанитрат-ионов исследовано в нескольких соеди-
нениях. В Mg[Th(NO3)e]-8H2O и Mg3[Ce(NO3N]2-24H2O атом
металла имеет почти правильную икосаэдрическую координа-
цию. Поскольку в обоих этих кристаллах Mg2+ полностью гид-
ратирован, формулы этих солей предпочтительнее записы-
вать в виде [Mg(H2ON][Tu(NO3N]-2H2O и [Mg(H2ON]3-
[Се(МО3)б]2-6 Н2О. Ионы этого типа изображены на
рис. 18.6,6. В (NH4J[Ce(NO3N.1 анион также имеет шесть би-
дентатных групп NO3, связанных с атомом металла, но их рас-
положение соответствует приблизительно симметрии 7V Группа
NO3 здесь существенно асимметрична (N—О 1,235 и 1,282 А),
но в значительно меньшей степени, чем в рассмотренном выше
случае Ti(NO3L.
3) Оксонитратные соединения. Соединения переходных ме-
таллов MOx(NO3)i/ синтезируют следующим образом: вначале
588 18. Азот
с помощью реакции жидкого N2O5 с оксидом или гидратирован-
ным нитратом металла получают аддукт с N2O5, который затем
подвергают термическому разложению в вакууме. В результате
последней операции в некоторых случаях происходит образова-
ние безводных нитратов, а в других — оксонитратных соедине-
нии. Летучий Ве4О(МО3)б, получающийся при нагревании в ва-
кууме Be(NO3J, по-видимому, имеет тетраэдрическую структу-
ру, напоминающую структуру Ве4О(СН3СООN.
К числу соединений, содержащих оксонитратные ионы отно-
сится и^Ь[иО2(КО3K]. В анионе этой соли (рис. 18.6, в) ось
линейной группы UO2 перпендикулярна плоскости чертежа,
а три бидентатные группы NO3 дополняют координационное чис-
ло атома металла до восьми.
4) Координационные комплексы, содержащие группы NOa.
Имеются многочисленные молекулы, в которых NO3-rpynna ве-
дет себя либо как монодснтатный, либо как бидентатный ли-
ганд, например:
Монодентатные:
Бидентатные:
Cu(enJ(ONO2J
Cu(CsH6NOJ(NO3J
CuI(P(CeH5KJNO3
Co(Me3POJ(NO3J
ТМЖШОР(С6Н5)зJ
La(NO3K(bpyJ
Ada cryst., 1964, 17, 1145
Acta cryst., 1969, B25, 2046
Inorg. Chem., 1969, 8, 2750
J. Am. Chem. Soc, 1963, 85
2402
Inorg. Chem., 1971, 10, 115
J. Am. Chem. Soc, 1968, 90
6548
В гранс-октаэдрических молекулах Cu(enJ(NO3J (а) Си11 об-
разует две длинные связи Си—О; в Си(Р(С6Н5)зJ^Оз имеется
искаженная тетраэдрическая координация Си1 (б). Строение
Co(Me3POJ(NO3J может быть также описано как тетраэдри-
ческое, если рассматривать бидентатный NO3 в качестве едино-
го лиганда; оптические и магнитные свойства этой молекулы
(а также иона СоA\ГОзL2~) подтверждают мысль о том, что
атом металла находится в тетраэдрическом поле лигандов.
а
ONO2
;2,59 А
ел Си
o2n6
О
А
о о
Си
(ф-фенил)
Молекулы ТЬ(ЫОзL(ОР(С6Н5)зJ (а также изоструктурного
с ним соединения церия) и Ьа(МОз)з(ЬруJ представляют собой
18.9. Сульфиды 589
интересные примеры соединений с десятирной координацией.
В первой (в) «псевдооктаэдрическая» координация достигается
четырьмя бпдентатными группами NO3 и двумя атомами кисло-
рода фосфорильных групп. (В Th2(OHJ(NO3N(H2ON и
в Th(NO3L-5H2O торий имеет координацию 11, осуществляемую
группами (OHJ(H2OK(NO3K и (H2OK(NO3L соответственно.)
Ковалентные нитраты. Группа ковалентных нитратов, если
исключить органические производные, ограничивается соедине-
ниями водорода, фтора и хлора (C1NO3 в виде жидкости, устой-
чивой при —40 °С, удалось приготовить из безводной HNO3 и
C1F в стеклянном реакторе или в сосуде из нержавеющей стали
[1]). Электронографически исследовано строение молекул
взрывчатого газообразного FNO3 [2] и пленарных молекул ме-
тилнитрата [3]. Уточнение кристаллической структуры пента-
эритритнитрата C(CH2ONO2L [4] позволило установить, что
нитратная группа в нем имеет ту же конфигурацию (г), что
и в азотной кислоте.
121°
¦1,21 А
Литература. [1] Inorg. Chem., 1967, 6, 1938. [2] J. Am. Chem. Soc, 1935, 57,
2693; Z. Elektrochemie, 1941, 47, 152. [3] J. Chem. Phys., 1961, 35, 191. [4] Acta
cryst., 1963, 16, 698.
18.9. Сульфиды азота и родственные соединения
Сульфиды и оксиды азота имеют между собой мало общего и
в химических свойствах, и в строении, хотя известен серный ана-
лог линейного нитроил-иона NCv^. Так, установлено, что соль
(NS2) (SbCl6) [la], образующаяся по реакции между S7NH и
SbCl5 в жидком SO2, содержит линейные ионы (S—N—S) +
(длина связи N—S составляет 1,46 А). Только два сульфида
N2S4 и N2S5 имеют формулы, сходные с формулами оксидов.
Структура X2S5 неизвестна; о N2S4 речь пойдет ниже.
Имеется чрезвычайно большое количество циклических со-
единений, содержащих 4-, 5-, 6-, 7-, 8- и 10-членные кольца,
в том числе планарные ионы или молекулы всех этих типов.
(Сюда же нами отнесены и NSF и NSF3 из-за их близости
с (NSFL.) Самое простое кольцо имеет состав N2S2. Оно обра-
зуется при резкой закалке продуктов сублимации N4S4 (что об-
суждается ниже; N4S4 сублимируют через затвор из посеребрен-
ной ткани при давлении 0,01 мм рт. ст. и температуре 300 °С).
Строение этого кольца впервые было установлено при исследо-
590 18. Азот
вании N2S2(SbCl5J (схема а) [16]. В плоском цикле N2S2 все
четыре связи имеют одинаковую длину A.62А, как и в N4S4).
ci
| ^ S4 |i;3iA
;Sb-r—NJ950 N-Sb-
I v \o/ /i
2,28 A S '
1,58/98° 95° \1N2
NI18° 121°(N
106° /^
1,62
1,5+
Связи Sb—N заметно слабее, чем в N4S4-SbCl5 (обсуждаемом
ниже), и одна молекула SbCU легко отщепляется, оставляя
N2S2-SbCl5. По-видимому, в аддуктах пентахлорида сурьмы
имеется корреляция между длинами связей Sb—N и Sb—Cl:
N2S2-SbC!5
CH3CN-SbCl5
N,S,SbCls
Sb—N, A
Sb—Cl, A
2,28
2,31
2,23
2,36
2,17
2,39
Полимер (NS)x привлек к себе внимание необычностью физиче-
ских свойств. Полимеризация бесцветного диамагнитного N2S2,
который состоит из плоских квадратных молекул (N—S
1,655 А), в твердом состоянии при комнатной или немного более
высокой температуре приводит к образованию голубовато-чер-
ного парамагнитного материала, который постепенно превра-
щается в золотисто-желтые кристаллы. При комнатной темпера-
туре они имеют электропроводность, сравнимую с электропро-
водностью металлов типа Hg, и становятся сверхпроводящими
при очень низких температурах. Эти кристаллы состоят из вы-
тянутых в одном направлении волокон, каждое из которых пред-
ставляет собой монокристалл (NS)*, построенный из почти
плоских цепей, в которых происходит чередование атомов N и
S [1]
y
106°/120° \ 1-61 А
s N S""
5-членное кольцо N2S3 является пленарным в случае катиона
N2S3+ в соли (N2S3) (AsFe) [2а] (расстояние S—-S составляет
2,15 А, а N—S—1,58 А) и гофрированным (б; см. выше)
в (N2S3C1)C1 [26], образующемся при дефлегмации суспензии
NH4C1 в S2C12 или при взаимодействии N4S4 пли (NSC1K с S2C12.
6-члепное кольцо N3S3 плапарно в случае иона S3N-"", кото-
рый получается, например, при взаимодействии азид-иона с N4S^
18.9. Сульфиды 591
и который выделен в виде его солей с большими катионами
типа Cs~ или NR4+ [За]. Но оно имеет форму кресла
(рис. 18.7,а) в (NSC1K [36] (образующемся при хлорировании
N4S4), в трисульфимидном ионе в Ag3(NSO2K-3H2O [Зв],
в циклической молекуле (СНз^О2)з [Зг], а также в а-сульфа-
нурхлориде N3S3O3CI3 [Зд] (рис. 18.7, б). Все связи N—S в этих
SbCl5N4S4
Рис. 18.7. Циклические системы азот — сера. N3S3CI3 (a); N3S3O3CI3 {б);
(N3S4)+ (б); N4S4 (г); N4S4-SbCls C).
кольцах N3S3 имеют одинаковую длину, составляющую в пере-
численных соединениях 1,61; 1,64; 1,67 и 1,57 А соответственно.
Аналогичное кольцо N3S3 найдено также и в ионе Ы35з04~ с той
лишь разницей, что здесь к двум атомам серы присоединены по
два атома кислорода. В родственной молекуле N3S3PO2CI4 [4],
содержащей в кольце один атом фосфора (в), длины всех свя-
1,42 А
V
Cl/|l,54A
120
1,58 A
.0
>. ir—2,02 А
Cl
-1,96 А
зей близки к соответствующим расстояниям в N3S3O3CI3, но
в этой молекуле кольцо почти плоское (для сравнения может
служить плоское кольцо (РЫСЬ)з).
592 18. Азот
7-членное кольцо N3S4 в виде катиона в (N3S4) (NO3) [5a]
и (N3S4J(SbCl5) имеет планарное строение [56] (рис. 18.7, в).
Соль N3S4CI количественно образуется при дефлегмации N3S3CI2
со смесью S2C12 и СС14 и превращается в (N3S4)NO3 при раство-
рении в концентрированной HNO3. Связь S—S, по-видимому,
ординарна, но приблизительное равенство длин связей S—N и
хорошо определенный УФ-спектр поглощения дают основание
предполагать наличие 10-электронной я-системы.
8-членное кольцо N4S4 существует как в виде катиона
N4S42+, так и в виде очень изогнутой молекулы N4S4. Упомяну-
тый ион найден в солях N4S4(SbCl6J и N4S4(SbF6) (Sb3Fi4)
[6а]; установлено, что он имеет почти плоскую конфигурацию,
6 ^
1,606
Рис. 18.8. а и &—-конфигураций пока -NSS5+; в — л
молекула N6S5.
но неупорядочение в ориентации катионов затрудняет обсужде-
ние характера связей в нем. Усредненные значения длин связей
аналогичны соответствующим величинам в N3S4+ и N5S5+.
К N4S4 мы еще вернемся по окончании настоящего обсуждения
ионов, содержащих азот и серу.
9-членное кольцо представлено ионом NsS^ [66], а 10-член-
ный циклический ион N5Ss+ изучен в солях (N5S5) (А1СЦ) [7а],
(N5S5) (SnCl5OPCl3) [76] и (N5S5) (S3N3O4) [Зе]. В первой из
них катион имеет сердцеобразную конфигурацию (рис. 18.8, а),
а в двух других — изображенную на рис. 18.8,6. Кольцо почти
плоское и, по-видимому, является 14-электронной я-системой.
Родоначальником обширного семейства соединений, содер-
жащих азот и серу, является N4S4. Он легко получается при
взаимодействии серы с аммиаком в отсутствие воды или (пред-
почтительнее) при соприкосновении паров S2C12 с нагретыми
гранулами NH4C1. N4S4 образует желтые кристаллы и обладает
рядом замечательных химических свойств. В его молекуле
4 атома серы размещены тетраэдричсски (рис. 18.7, г); такое
искривление 8-членного кольца приводит к сближению атомов
серы: в кольце возникают два (несвязанных) расстояния S—S
по 2,60 А и четыре — по 2,71 А [8а]. Эти расстояния, имеющие
18.9. Сульфиды 593
промежуточные значения между длинами вандерваальсовой
C,3 А) и простой связей B,06 А), дают основание предпола-
гать существование некоторого вида слабого ковалентного взаи-
модействия. Та же проблема характерна и для молекул N4Se4
[86].
В аддуктах N4S4 с кислотами Льюиса, такими, как BF3 [9],
SbCl5 [10] и AsF5 [10а], последние присоединены только
к одному атому азота, и конфигурация фрагмента N4S4 видоиз-
меняется (рис. 18.7, д): 4 атома серы располагаются здесь комп-
ланарно в отличие от их тетраэдрического размещения в сво-
бодной молекуле. Однако в N4S4(CuCl) '[106], где N4S4 высту-
пает в качестве мостика, связывающего через атом азота два
атома Си, сохраняется конфигурация свободной молекулы
(рис. 18.7, г).
Мягкое фторирование с помощью AgF2 в инертном раствори-
теле переводит N4S4 в (NSFL [11]. В этом гофрированном
8-членном кольце (конфигурация которого имеет форму ванны)
атомы фтора присоединяются к атомам серы, и возникает стро-
гое чередование длинных и коротких связей (г). Более энергич-
ное фторирование N4S4 приводит к образованию мономерных
NSF (д) [12] и NSF3 (e) [13], в которых фтор соединен с серой.
В результате гидролиза NSF (или действия NH3 на SOC12) по-
лучается HNSO [14]—цыс-тионилимид (цис-оксид-имид серы)
со структурой, показанной на схеме ж:
S-rN4 .F
д 1,45А с '>65 Ai
N 117°
S
11,66 А
1,55 A
122°
1,42
4T
н „ „o
\1 16 121 /
'."A^W^A^A
1,51 A
ж
NSF может функционировать в качестве лиганда, связанного
с металлом через атом азота, как в [Co(NSFN] (AsFeb [14a].
Структура такого лиганда подобна строению свободной моле-
кулы.
Теперь рассмотрим имиды S7NH, S6(NHJ, S5(XTHK и
S4(NHL. Первые три образуются при взаимодействии NH3
и S2C12 в димстилформамиде при низких температурах, и затем
эти продукты разделяются хроматографиче-ски. S4(NHL полу-
чают восстановлением N4S4 в бензиновом растворе спиртовым
раствором SnCb. В случае S6(NHJ охарактеризованы три из
четырех возможных структурных изомеров, а именно 1 :3 [15],
I : 4 [16] и 1:5 [17]. Для некоторых соединений, содержащих
циклы S,; (NH) а-«, определены кристаллические структуры. Все
• is- ' 85
594 18. Азот
они являются структурными аналогами молекулы Ss-ромбиче-
ской модификации серы, т. е. имеют конфигурацию в форме ко-
роны. В кристалле 1 : 4 S6(NHJ присутствуют оба энантиоморф-
ных варианта молекулы. Данные по нейтронной дифракции
подтверждают, что Н в N4S4H4 присоединен к азоту (усреднен-
ные значения валентных углов: SNS 124°, NSN 109°; длина свя-
зи S—N 1,665 А) [18].
Значения длин связей N—S в этом семействе соединений
позволяет выбрать в качестве стандартных следующие величи-
ны: 1,72 А для S—N (что сопоставимо с 1,73 А в O3SNH3) и
1,54 А для S=N; длины формально тройных связей в NSF и
NSF3 составляют 1,45 и 1,42 А.
При нагревании N4S4 в растворителях получается N2Ss, в то
же время под воздействием серы в растворе CS2 при повышен-
ных давлениях N4S4 превращается в N2S4 — темно-красное, до-
вольно-таки неустойчивое твердое вещество. Растворы N2S4 в ор-
ганических растворителях диамагнитны, что свидетельствует об
отсутствии диссоциации этого сульфида в противоположность
N2O4. Детальное строение молекулы N2S4 неизвестно, но ана-
лиз совокупности его спектральных характеристик (ИК, КР, УФ,
масс-спектрометрических) приводит к структурной формуле (з)
[19].
18.10. Нитриды 595
S'
N
S
I
N
Ni
1,54
4,59 А
10,82,
Синтезированы тионитрозильные комплексы ряда металлов.
Например, при взаимодействии N4S4 и карбонилов получены
Ni(N2S2HJ и его Со- и Fe-аналоги, а при действии N4S4 на
H2PtC,l6 в растворе диметилформамида получен Pt(N2S2HJ.
Рентгеновское исследование никелевого соединения указывает
на планарное строение его молекулы с цыс-конфигурацией (и)
[20].
Последним достижением химии смешанных соединений азо-
та и серы явилось приготовление NeSs из Вг2 и (Bu4N) (N5S4)
в метиленхлориде [21]. Молекула этого сульфида (рис. 18.8, в)
родственна N4S4; система —N = S = N— играет роль мостика,
связывающего два противоположных атома серы кольца S4N4.
Литература, [la] Inorg. Chern., 1978, 17, 2975. [16] Inorg. Chem., 1969, 8,
2426. [1в] J. Am. Chem. Soc, 1975, 97, 6358. [2a] Can. J. Chem., 1975, 53, 3147.
[26] Inorg. Chem., 1966, 5, 1767. [3a] Chem. Comm., 1978, 391. [36] Acta cryst.,
1966, 20, 192. [Зв] Acta cryst., 1974, B30, 2721. [3r] Acta cryst., 1974, B30
2724. [Зд] Acta cryst., 1966, 20, 186. [3e] Chem. Comm., 1975, 735. [4j Acta cryst.
1969, B25, 651. [5a] Inorg. Chem., 1965, 4, 681. [56] Z. anorg. allg. Chem., 1972
388, 158. [6a] Chem. Comm., 1977, 253. [66] Angew. Chem. (Intern. Ed.), 1976
15, 379. [7a] Acta Chem. Scand., 1972, 26, 1987. [76] J. Chem. Soc. D, 1976, 928
[8a] Inorg. Chem., 1978, 17, 2336. [86] Acta cryst., 1966, 21, 571. [9[ Inorg
Chem., 1967, 6, 1906. [10] Z. anorg. allg. Chem., 1960, 303, 28. [10a] Acta cryst.
1980, B36, 655. [106] Angew. Chem. (Intern. Ed.), 1976, 88, 807. [11] Acta cryst.
1963, 16, 152. [121 J. Am. Chem. Soc, 1963, 85, 1726. [13] J. Am. Chem. Soc.
1962, 84, 334. [14] J. Am. Chem. Soc, 1969, 91, 2437. [14a] Acta cryst., 1980
B36, 141. [15] Acta cryst., 1971, B27, 2480. [16] Acta cryst., 1969, B25, 611
[17] Acta cryst., 1973, B29, 915. [18] Acta cryst., 1977, B33, 2309. [19] J. Chem
Soc, A, 1971, 136. [20] Acta cryst., 1978, B34, 1999. [21] Chem. Comm., 1978.
642.
18.10. Нитриды
Большинство элементов образует соединения с элементным азо-
том, и среди нитридов имеется целый ряд очень устойчивых
соединений. Неизвестны нитриды лишь следующих металлов:
(Na?), К, Rb, Cs, Au, Ru, Rh, Pd, Os, Ir и P't. Все нитриды в
первом приближении можно подразделить на четыре группы:
Li3N
Ионные
Be3N2
Mg3N2
Ca3N?
и т. д.
Нитриды переходных ме-
таллов; нестехиометриче-
ские и более сложные
структуры
Полу металлические
BN
A1N Si3N4
GaN Ge3N4
InN
Hg3N2
Ковалентные
или ионно-кова-
лентные
Молекулярные
нитриды неме-
таллов
Ковалентные
Следует, однако, подчеркнуть, что между этими группами
нет резкой разграничительной линии, особенно в случае метал-
лов ПА—IVA групп периодической системы. К тому же иногда
один и тот же элемент образует нитриды совершенно различно-
го типа, а ряду из них присущи свойства как ионных веществ,
так и металлических проводников (например, HfN; см. ниже).
Так, кальций образует Ca3N2, у которого помимо модификации
(а) типа анти-МгьОз [1] имеются еще черная и желтая формы.
Кроме того, существуют Ca2N, Ca3N4 и СацКд. Первый из них
образует блестящие зеленовато-черные кристаллы со (слоистой)
структурой типа анти-Сс1С12 [2] (Са—N 2,43 А); некоторые рас-
стояния Са—Са в этих кристаллах C.23 и 3,64А) гораздо ко-
роче, чем в металлическом кальции C,88 и 3,96 А). Тем не ме-
нее данное соединение, по-видимому, является ионным; под
воздействием воды оно выделяет NH3 + H2. Наличие у него
блеска и полупроводниковых свойств позволяет рассматривать.
сто как Са22+\т"~ (е). Еще более короткие расстояния Са—Са.
38*
596 !8. Азот
C,11 А) обнаружены в CauN8 [3]—соединении, разлагающем-
ся под воздействием водяного пара. Цирконий образует не
только коричневый Zr3N4, но еще голубой ZrxN (дефектная
структура типа NaCl) [4a] и желтый с металлическим блеском
ZrN. Гафний образует нитрид HfN с дефектной структурой
NaCl [46], где, судя по плотности этой фазы, '/в позиций атомов
оказывается свободной. Этот нитрид обладает металлической
проводимостью (Hf4+N3~(e)?); при его растворении в HF весь
азот переходит в NH3 (NH4+).
В первой и третьей группах нитридов, по приведенной выше
классификации химические формулы соединений обычно соот-
ветствуют нормальным валентностям атомов, что характерно
также для некоторых нитридов переходных металлов (напри-
мер, Sc, Y, 4/-иитридов MN, Zr3N4) и некоторых молекулярных
нитридов (например, P3N5) [5]; формулы и структуры других
нитридов, например N4S4 с этих позиций пока непонятны. Мо-
лекулярные нитриды немногочисленны, и их структуры извест-
ны; они обсуждаются при рассмотрении структурной химии со-
ответствующих элементов.
Помимо описанных здесь бинарных нитридов было приготов-
лено много тройных соединений, например Li5TiN3, Li7NbN4 и
LigCrNs — все со структурой типа флюорита (в большинстве
случаев сверхструктуры) [6], и смешанные нитриды щелочно-
земельных металлов и Re, Os, Mo или W (например, Sr9Re3Nio,
Ca5MoN5) [7].
18.10.1. Ионные нитриды. Нитриды щелочных металлов, за ис-
ключением нитрида лития, по-видимому, не выделены в индиви-
дуальном состоянии, a Li3N известен уже очень давно (его
структура была определена еще в 1935 г.). В последнее время
он привлек к себе пристальное внимание в связи с его высокой
ионной проводимостью как при умеренных, так и при повышен-
ных температурах [8]. Само по себе это вещество весьма чувст-
вительно к влаге, но материал, поверхность которого целиком
покрыта тонким слоем продуктов окисления и гидролиза, мо-
жет оказаться защищенным от дальнейшего воздействия влаги.
И действительно большие красные кристаллы, которые могут
быть вытянуты из расплава, являются устойчивыми по отно-
шению к влажному воздуху вследствие образования поверх-
постного слоя оксида, гидроксида или карбоната. В простой
(и уникально]'!) структуре Li3N имеются ионы лития двух сор-
тов: Lii и Lin. Ионы Lin расположены в гексагональных слоях
состава Li2N с ионом N3~ в центре каждого кольца, а между
этими слоями размещены слои, содержащие только ионы Lii.
В итоге получается следующее координационное окружение:
для Lii — два коллинеарных атома азота на расстоянии 1,94 А;
18.10. Нитриды 597
для l.i;i — три атома азота, размещенных по вершинам тре-
угольника, с расстоянием Lin—N 2,13 А; для азота — 8 атомов
лития в позициях гексагональной бипирамиды, как это показа-
но на схеме. Необычная координация иона Li+, конечно, связа-
на с его очень малым радиусом по сравнению с ионом N3~
(в гл. 6 уже отмечалось, что структура с тетраэдрнческой коор-
динацией Li" геометрически невозможна).
В гл. 6 была упомянута также структура Cu3N типа ReO3
(и структура GaNCr3 типа перовскита).
Нитриды M3N2 (M = Be, Mg, Zn, Cd) и cc-Ca3N2) принадле-
жат к структурному типу анти-МпгО3, в котором ионы металла
окружены 4 соседями по тетраэдру, а атомы азота находятся
в искаженных координационных октаэдрах двух типов.
(У Be3N2 есть еще высокотемпературная плотноупакованная
модификация (разд. 4.2), в которой бериллий координирован
тетраэдрически [9].) Структура a-Ca3N2 типа анти-Мп2О3 при-
мечательна не столько тетраэдрической координацией Са2+,
сколько тем, что она приводит к очень открытой упаковке ио-
нов N3~. Расстояние Са—N B,46 А) составляет величину, близ-
кую к ожидаемой для шестерной координации Са2+, но расстоя-
ния N—N при этом существенно длиннее. В этой структуре име-
ются тетраэдры N4, не содержащие атомов металла; длины всех
ребер у этих тетраэдров равны 4,4 А, тогда как в полиэдрах
CaN4 четыре ребра имеют длину 3,76 А, а два — 4,4 А. Все от-
меченные расстояния велики по сравнению с удвоенным радиу-
сом N3~ (около ЗА). По-вндимому, аномально низкое коорди-
национное число Са2+ (и — как результат этого — низкая плот-
ность вещества) обусловлено либо отсутствием альтернативной
структуры с высокой координацией (скажем, 6:9 или 8:12),
либо тем обстоятельством, что структура в целом определяется
октаэдрической координацией N3~, по отношению к которой
четверная координация Са2+ оказывается случайной.
Радиус иона N3- в этих нитридах, по-видимому, близок
к 1,5 А, что превышает размеры большинства металлических
ионов. Рассмотренные соединения являются аналогами оксидов;
они образуют бесцветные прозрачные кристаллы. Получаются
эти вещества непосредственным соединением металла с азотом
или в некоторых случаях нагреванием амидов. Для иллюстра-
59S IS. Азот
цпи сказанного можно сравнить, например, реакцию
3Ba(NH2J->Ba3NT2 + 4\IH3 с реакцией Ва(ОНJ-^ВаО + Н2О.
Нитриды характеризуются высокими температурами плавления,
лежащими в интервале от 2200 °С (Be3N2) до 900 °С (Ca3N2);
водой они гидролизуются с выделением аммиака и образовани-
ем гидроксидов.
Типы структур соединений M3N2 сведены в табл. 18.7, где
символ А означает структурный тип анти-Мп2О3, В — Zn3P2 и
Таблица 18.7. Кристаллическая структура соединений M3N2
и их аналогов
N
Р
As
Sb
Bi
Be
A
A
Mg
A
A
A
С
С
Zn
A
В
Cd
A
В
Ca
A
Ни одно из этих соединений не имеет простой структуры Zn,P2>
но их структуры очень близки к структуре Zn3As2 [10], Cd3As2 [11].
С — анти-Ьа2О3. Структура Zn3P2 близка к анти-Мп2О3. Атомы
Zn в ней тетраэдрическн окружены четырьмя атомами фосфора,
а атомы Р — шестью атомами Zn, расположенными в шести
вершинах искаженного куба.
18.10.2. Ковалентные нитриды. Взрывоопасный Hg3N2, получае-
мый из Hgb и KNH2 в жидком аммиаке, в отличие от ионных
(шоколадного цвета) нитридов цинка и кадмия представляет
собой, по всей вероятности, ковалентное соединение. Для нитри-
дов бора, алюминия, галлия, индия и таллия возможны те же
геометрические конфигурации, что и для углерода; в молекуле
MN на один атом приходится в среднем по 4 валентных элек-
трона.
Известный уже давно нитрид бора представляет собой белый
порошок, характеризующийся высокой химической устойчи-
востью и высокой температурой плавления. Он обладает гра-
фитоподобной слоистой структурой, которая под воздействием
давления переходит в «боразан» — сфалеритовую структурную
модификацию, плотность которой гораздо больше C,47 г/см3),
чем у обычной модификации B,25 г/см3) соединения [12].
К типу сфалерита относится и структура ВР [13], который
в отличие от BN может быть приготовлен по реакции красного
18.10. Нитриды 599
фосфора с бором при температуре 1100 °С и давлении всего
2 атм. Этот же тип структуры реализуется и в случае BAs
[14а].
Структурные типы соединении элементов III группы перио-
дической системы с N, Р и т. д. указаны в таблице ниже. В то
время как BN является, по-видимому, ковалентным веществом,
связи в A1N, GaN, InN имеют, вероятно, в значительной мере
ионный характер, а соединения с более тяжелыми элементами
V группы по типу связей близки к металлическим. (Информа-
ция о InBi приведена в табл. 6.6, разд. 6.7.1.) Структура
BeSiN2 представляет собой сверхструктуру вютрцитовой струк-
туры A1N и т. д. [146].
N
Р
As
Sb
цит;
В
L,
Z
Z
Типы
L —
А1
Z (под давлением) W
Z
Z
Z
структур: Z — сфалерит (цинко!
слоистая (типа BN) структура.
Ga
W
Z
Z
Z
зая обманка);
In
W
Z
Z
Z
W — вюрт-
Известны структуры нескольких нитридов M3N4, в частно-
сти Si3N4 и Ge3N4. Оба эти соединения существуют в виде двух
полиморфных модификаций [15], кристаллическое строение ко-
торых тесно связано со структурой ВегЗЮ4 (фенацит); у М име-
ются четыре соседа, расположенных по тетраэдру, а N образу-
ет компланарные связи с тремя атомами М. Связи в Ge3N4,
а также в Th3N4 имеют, по-видимому, достаточно ионный харак-
тер. В Th3N4 [16] металлические атомы образуют плотнейшую
упаковку того же типа, что и в металлическом Sm (кгг), а в
пустотах этой упаковки расположены атомы азота: одна поло
вина — в тетраэдрических, другая — в октаэдрических; в итоге
7з атомов металла имеет 6 соседних атомов азота, а осталь-
ные— по 7. Атомы азота обоих сортов смещены из центров пус-
тот в направлении наибольшего разделения N—N:
2,53 А
2,9lA
Г 3Th 2,31А
тетр 1 ITh
2.47A
Мок
3Th
3Th
(Соединение, первоначально описанное как Tli2N3, па самом
деле представляет собой ТЬгХ^О; в случае этой фазы
N занимает тетраэдрические, а О — октаэдрические пус-
тоты в гексагональной плотнеишей упаковке атомов торня,
600
IS. Азот
которые имеют в качестве соседей 4 атома азота и 3 атома кис-
лорода.) Альтернативное описание этой структуры (Ce2O2S)
дано в разд. 28.2.5.
18.10.3. Нитриды переходных металлов. Некоторые из нитридов
переходных металлов уже были упомянуты. Эта группа соеди-
нений чрезвычайно многочисленна; большинство переходных
металлов образует по несколько типов нитридов. Например,
в системе Nb—N на участке до состава NbN обнаружено пять
различных фаз (помимо твердого раствора в металле) [17].
Таблица 18.8. Координационные числа металла и азота
в кристаллических нитридах
Нитрид
Cu3N
Ti2N
Co2N
Ca3N2
ScN и т. п.
Th3N4
Ge3N4
AIN
Ca3N,
AlLi3N2
Структурный тип
AnTii-ReO3
Антирутил [20]
Анти-СёСЬ
Анти-Мп2О3
NaCl
Фенацит
Вюртцит
Анти-Мп2О3
Анти-СаЁг
КЧ металла
2
3
3
4
6
6, 7
4
4
4
4
КЧ азота
6
6
6
6
6
4, 6
3
4
6
8
Из огромного разнообразия структур, приписываемых этим со-
единениям, будут упомянуты лишь некоторые из наиболее про-
стых.
В так называемых нитридах «внедрения» атомы металла
почти (а в некоторых случаях — точно) плотноупакованы (как,
например, в ScN, YN, TiN, ZrN, VN и в нитридах редкоземель-
ных элементов со структурой типа NaCl), но окружение атомов
металла в этих соединениях обычно отлично от наблюдаемого
в кристалле металла (табл. 29.13, разд. 29.7). Так как эти про-
межуточные нитриды и по физическим свойствам, и в структур-
ном отношении имеют много общего с карбидами, а в несколько
меньшей степени и с боридами, то их удобно рассмотреть вме-
сте с этими соединениями в гл. 29.
Нитриды Mn, Fe, Co и Ni образуют менее устойчивые и бо-
лее сложные соединения по сравнению с нитридами элементов
предшествующих групп периодической системы. Для сравнения
18,10. Нитриды 601
ниже приведены формулы нитридов металлов первого переход-
ного ряда: ,
ScN
t;,n
TiN
V3N
VN
Cr2N
CrN
MnN(?)
Mn6N5
Mn3N2
Mn2N
Mn4N
Mn,NF)
Fe2N
Fe3N
Fe4N
FesN
CoN
Co2N
Co3N
Co4N
Ni3N
Ni4N
C113N
Хотя в этих соединениях число атомов азота невелико по срав-
нению с числом атомов металла, они, по-видимому, оказывают
огромное влияние на общую структуру, и высказано предполо-
жение [18] о том, что проявляемая атомами тенденция к упо-
рядоченному расположению вполне достаточна, чтобы вызвать
перераспределение атомов металла, например переход от
e-F^N к !;-Fe2N. Структуры внедрения невозможны для относи-
тельно больших атомов Р и As, и если исключить некоторые
фазы типа LaP, PrP и GeP со структурой NaCl, то между нит-
ридами и фосфидами (или арсенидами) оказывается мало об-
щего. Для примера можно сравнить формулы нитридов и фос-
фидов Мо и W: Mo2N, W2N; MoN, WN, но Мо3Р, W3P; MoP,
WP; МоР2 и WP2 [19].
Небольшой раздел по структурам фосфидов металлов вклю-
чен в гл. 19.
В табл. 18.8 обобщены координационные числа атомов ме-
талла и азота в ряде нитридов.
Литература. [1] Acta crysi, 1968, В24, 494. [2] Inorg. Chem., 1968, 7, 1757.
[3] Acta cryst., 1969. B25, 199. [4al Z. anorg. allg. Chem., 1964, 329, 136. \Щ Z.
anorg. allg' Chem., 1967, 353, 329 [5] J. Am. Chem. Soc, 1957, 79, 1765. [6] Z. anorg.
allg. Chem., 1961, 309, 276. [7] Inorg. Chem., 1970, 9, 1849. [8] J. Solid State
Chem., 1979, 29, 379. [9] Z. anorg. allg. Chem., 1969, 369, 108. [10] Acta cryst.,
1956, 9, 685. [11] Acta cryst., 1968, B24, 1062. [12] J. Chem. Phys., 1957, 26,
956. [13] Nature, 1957, 179, 1075. [14a] Acta cryst., 1958, 11, 310. [146] Z. anorg.
allg. Chem., 1967, 363, 225. [151 J- Am- Ceram. Soc, 1975, 58, 90; Acta cryst.,
1979, B35, 800. [161 Acta cryst., 1971, B27, 243. [17] Z. anorg. allg. Chem., 1961,
309, 151. [18] Acta cryst., 1952, 5, 404. [191 Acta Chem. Scand., 1954, 8, 204.
[20] Acta Chem. Scand., 1962, 16, 1255.
19. ФОСФОР
19.1. Стереохимия соединений фосфора
У фосфора, как и у азота, 5 валентных электронов. Расположе-
ны они на третьем квантовом уровне, на котором помимо s- и
р-орбиталей имеется d-орбиталь. Фосфор образует до шести раз-
личных связей с другими атомами, но число а-ковалентных свя-
зей более 4 реализуется только в сочетании с галогенами (в пен-
тагалогенидах и ионах РХ6~) и с группами типа фенила С6Н5.
(Пример 5-коордипации атомами кислорода см. в разд. 19.4.7.)
d-Орбитали используются для а-связывання, если число связей
превышает 4, но эти орбитали исггользуются также для я-связы-
вания в тетраэдрических оксо-ионах и молекулах. Может быть
сделано очень простое обобщение стереохимии фосфора, если
предположить, что конфигурация связей определяется числом
о-электронных пар, которые либо задействованы для сг-связыва-
ния, либо выступают в роли неподеленных пар (табл. 19.1).
Это правило распространяется и на молекулы РХ3, если возни-
кает существенная гибридизация. В РН3 связи, по-видимому,
должны быть в значительной мере связями р3, и это может быть
справедливым также и для тригалогенидов, но интерпретация
величин валентных углов ( — 100°), наблюдаемых в этих фазах,
не проста. Значения валентных углов в кольцах Р3 в Р4 и P4S3
должны рассматриваться как особые случаи. (Например, о фос-
форе, образующем три компланарные связи, см. в разд. 18.4.1.)
19.2. Элементный фосфор
Фосфор кристаллизуется по крайней мере в пяти полиморф-
ных модификациях. Его белая метастабильная форма получа-
ется конденсацией пара. По-видимому, она существует в виде
двух чрезвычайно близких модификаций с точкой фазового пе-
рехода при —77 °С. В растворе белый фосфор, как это следует
из величин его молекулярной массы, определенных в различных
растворителях, находится в виде молекул Р4. Геометрия их,
вероятно, подобна конфигурации молекул в парообразном со-
стоянии, исследованном еще в одной из первых работ по элек-
тронной дифракции [1]. Фактически установлено также, что обе
модификации белого фосфора состоят из правильных тетраэдри-
ческих молекул Р4 с той же структурой, что и у молекул в па-
19.2. Элементный фосфор 603
Таблица 19.1. Стереохимия соединений фосфора
Число
с-электрон-
ных пар
4
5
6
Тип гибри-
дизации
sp*
sp3dz 2
sp3d\
Число непо-
деленных
пар элект-
ронов
0
1
0
0
Расположение
связей
Тетраэдрпческое
Тригонально-
пирамидальное
Тригонально-бипи-
рамидальное
Октаэдрическое
Примеры
РН4\РС14+,
РОС13,РО43-,
PO,F2-
РС13> Р(С\K,
Р(С6Н5K
РС15, РГзСЦ
Р(С6Н5M
РС16-
рообразном состоянии (валентный угол 60°, длина связи2,21 А),
но кристаллическая структура ни одной из упомянутых форм
пока еще не определена с достаточной надежностью [2].
Пар над красным фосфором состоит из молекул Р2, длина
связи Р = Р в которых составляет 1,895 А; в PN длина связи
P = N равна 1,49 А.
Черный фосфор получается при кристаллизации из раствора
в висмутовом расплаве при температуре 200 °С и повышенном
Рис. 19.1. Кристаллическая структура черного фосфора— (идеализированный)
фрагмент одного слоя.
давлении, или при отжиге белой модификации при температуре
220—370СС в течение 8 дней в присутствии катализатора (рту-
ти на медной матрице) и затравки черного фосфора. Эта мо-
дификация—наиболее устойчивая кристаллическая форма фос-
фора, о чем свидетельствуют плотности A,83; 2,31; 2,69 г/см3)
и теплоты растворения в броме B49; 178; 160 кДж/моль) для
белого, красного и черного фосфора соответственно.
Черный фосфор имеет слоистую структуру [3], в которой
каждый атом связан с тремя другими. Один слой этой структу-
ры в идеализированном виде показан на рис. 19.1. Несмотря на
604 19. Фосфор
свой необычный вид, она представляет собой лишь (гофриро-
ванный) вариант простой гексагональной сетки; величины двух
валентных углов составляют 102°, а одного — 96,5°. (О связи
этой структуры с простой кубической упаковкой см. также
в разд. 3.9.2.) Длина связи Р—Р равна 2,23 А.
Моноклинный фосфор (фосфор Гитторфа) может быть при-
готовлен медленным охлаждением раствора белого фосфора в
расплаве свинца (при их соотношении по массе 1 : 30) с после-
дующим электрохимическим удалением свинца. Он обладает
Рис. 19.2. Кристаллическая структура моноклинного фосфора: а —цепочечная
субъячейка; б — слой, образованный из поперечно-связанных цепей (схемати-
ческое изображение).
чрезвычайно сложной структурой [4]. Сложные цепи с 21 ато-
мом в повторяющейся единице образуют связи с такими же це-
пями, расположенными в параллельной плоскости, но направ-
ленными перпендикулярно исходным. Две такие системы попе-
речно-связанных цепей образуют сложный слой (рис. 19.2),
в котором атомы одной его половины (штриховые линии) не
имеют связей Р—Р с атомами другой половины (сплошные ли-
нии). Кристалл в целом представляет собой ансамбль, состав-
ленный из слоев, показанных на рис. 19.2,6 и связанных друг
с другом вандерваальсовыми силами. В пределах слоя средняя
длина связи Р—Р составляет 2,22 А, а угол Р—Р—Р ра-
вен ЮГ.
Из черного фосфора получены две фазы, устойчивые при
высоком давлении: ромбоэдрическая со структурой типа As
(при 50 кбар) и кубическая с примитивной ячейкой (при дав-
лении около ПО кбар) [5]. Детально структура первой пока
19.3. Фосфиды металлов 605
еще не известна, а в кубической (металлической) форме фос-
фор имеет 6 равноудаленных ближайших соседей на расстоянии
2,38 А.
Описаны и другие многочисленные модификации фосфора,
включая хорошо известную красную форму, образующуюся при
нагревании белого фосфора в инертной атмосфере либо привоз-
действии на него света или рентгеновских лучей. Физические
свойства этих модификаций зависят от способа их получения.
Имеющийся в продаже реактив красного фосфора является
аморфным, а другие препараты — плохо закристаллизованны-
ми веществами; их структуры не известны.
Если пар белого фосфора, нагретый до 1000 °С, или пар
красного фосфора, нагретый до 350 °С, конденсируется в от-
ростке, охлажденном до —196 °С, то происходит образование
коричневой модификации фосфора. Было высказано предполо-
жение, что она может состоять из молекул Рг [6]. Стеклообраз-
ная форма фосфора получена нагреванием белой модификации
до 380 °С в присутствии ртути; при 450 °С в этих условиях об-
разуется черный фосфор [7].
Литература. [11 J. Chem. Phys., 1935, 3, 699. [2] Nature, 1952, 170, 629. [31 Ac-ta
cryst., 1965, 19, 684. [4] Acta cryst., 1969, B25, 125. [5] Science, 1963, 139, 1291.
[6] J. Am. Chem. Soc, 1953, 75, 2003. [7] Inorg. Chem., 1963, 2, 22.
19.3. Фосфиды металлов
С фосфором соединяется большинство элементов, а многие ме-
таллы образуют по нескольку типов фосфидов; например, для
калия известны К3Р, К3Р2, K5P4, KP, К4Рб (две модификации)
и Кз?7- Уже из примеров, приведенных в табл. 19.2, видно не-
обыкновенное разнообразие формул и типов структур таких би-
нарных соединений. Некоторые менее характерные структуры
описаны в других разделах книги: PdP2 (разд. 3.10.4), TiP
(разд. 4.1.7) и TI13P4 (разд. 5.1.2 и 28.2.3). Взаимосвязь струк-
тур CoAs3 и ReO3 рассматривалась в разд. 6.6.
Способы сочетания атомов фосфора в фосфидах очень раз-
нообразны: от одиночных атомов (ионы Р3~ в соединениях
электроположительных элементов) через одно-, двумерные комп-
лексы Рп вплоть до трехмерных (заряженных) сеток. Радиус
иона Р3~, рассчитанный из ионных структур типа Mg3P2, состав-
ляет около 1,9 А. Во всех фосфидах, содержащих системы свя-
занных атомов фосфора, некоторые (или все) из этих атомов
образуют менее трех связей Р—Р; лишь в одной из модифика-
ций элементного фосфора каждый атом оказывается связан-
ным с тремя соседями. Образование одной связи Р—Р каждым
¦606 19. Фосфор
Таблица 19.2. Структуры фосфидов металлов
Структурный тип
Сфалерит
NaCl
NiAs
TIP
MnP
Анти-CaFo
Антп-РЬС12
Анти-МпоОч
Zn3P2
Th3P4
Na3As
Пирит или марка-
зит
CoAs3
Система связанных
атомов Р
Изолированные
атомы Р
Группы Р2
Кольца Р4
Кольца Р6
Ионы Р73-
Группы Рю
Ионы Рц3-
Цепн простые
сложные
Слои
Трехмерные сетки
Примеры
AlP, QaP, InP
LaP, SmP, ThP, UP, ZrP и т. д.
VP
HfP, C-ZrP
FeP, CoP, WP
Ir2P, Rh2P
Co,P, Ru2P
Be3P2, Mg3P2
Cd3P2
Th3P4
Li3P, Na3P, K3P
I\*iP2 (высокого давления) [1], FeP2
[2], PtP2 [2], OsP2, RuP2, CaP [3]
RhP3, IrP3, PdP3 [21
Rb4P6 [4]
Li3P7, Ba3P14 [5]
Cu4SnPi0 [61
Na3Pn [7]
LiP [8], NaP (KP) [9], NiP2, PdP2 [10],
CdP2[lll
BaP3 [12], Au2P3 [13], RbP7 [14], KP,s
[151
CaP3[161, SrP3 [171, T1PS[181
CdP4 (MgP4) [191, FeP4 [20], RuP4
[21], CrP4[22], MnP4 [23]
LiP5 [241, LaP5 [25]
II] Inorg. Chcm., 1968, 7, 998. 12) Acta Chera. Scand., 1969, 23, 2677. [31. J. Less-
comm. Met., 1973, 30, 211. [-1] Angew. Chem., 1974, 86, 379. [5] Naturwiss., 1973, 60, 42Я.
[6] Z Kristallogr 1980, 153, 339 [7] Naturwiss., 1973, 60, 104. [8] Naturwiss., 1967, 54,
225 19] Z anorg. allg. Chem., 1979, 456, 194. A0] Acta cryst.. 1963, 16, 1253. [11] Acta
cryst.. 1970, B26, 1883. [12) Naturwiss., 1971, 58, 623. [13] Acta cryst., 1979, B35, 573.
[14] Naturwiss., 1972 59, 78. [15] Angew. Chem. (Intern. Ed.), 1967, 6, 356. [16] Natur-
wiss 1973 60 5i8 [17] Naturwiss., 1973, 60, 429. [181 Acta Chem. Scand., 1971, 25,
1327. [19] Z. anorg. allg. Chem., 1956, 285, 15. [20] Acta cryst., 1978, B34, 3196. [21]
Acta cryst., 1978, B34, 2069. [22] Acta cryst., 1972, B28, 1893. [23] Acta cryst., 1975, B31,
571. [24] Naturwiss., 1972, 59, 78. [25] Naturwiss., 1975, 62. 180.
атомом приводит лишь к группе Р2, найденной в виде иона Р24~
в СаР (Са2Р2), а также в ковалентных дифосфидах переходных
металлов со структурой типа пирита или марказита. Результа-
том .образования двух связей Р—Р каждым атомом оказывает-
19.3. Фосфиды металлов 607
ся образование колец или цепочки. Наиболее простой вид це-
почки
в виде искаженной четырехвитковой спирали найден в LiP и
NaP и изоструктурном последнему КР. В LiP имеется одина-
ковое число цепей противоположной хиральности, и эта фаза
в структурном отношении близка к типу NaCl, тогда как в NaP
(и КР) все цепочки имеют одинаковую хиральность. Длина свя-
зи Р—Р B,23 А) в этих соединениях близка к значению, харак-
терному для ординарной связи, что справедливо и для цепочек
в CdP2, и для ковалентных соединений типа NiP2 и PdP2. В не-
которых других фосфидах переходных металлов найдены более
длинные связи Р—Р: 2,4 A (NiP) и 2,6—2,7 A (CrP, MnP, FeP,
CoP). Примеры циклических комплексов Р4 и Р6 включены
в табл. 19.2; циклический ион Р64~ рассмотрен ниже.
Полисульфиды электроположительных металлов удобно опи-
сать как единую группу, но вначале следует упомянуть об ин-
тересной адамантинового типа группировке Рю в Cu4SnP10 —
соединении, которое обладает дефектной структурой ZnS и не-
которыми особенностями тетрафосфидов, представленных в
табл. 19.2. В этих (слоистых) структурах каждый атом Р свя-
зан с двумя или тремя другими фосфорными атомами, и всю
систему атомов можно вывести из плоской сетки б3 размещени-
ем четырех 2-связанных атомов Р на соединительных линиях
каждого шестиугольника так, что при этом образуется гофри-
рованная гексагональная сетка. Существует много способов
создания таких систем: пять из них реализуются в структурах
МР4, приведенных в табл. 19.2. Слои атомов фосфора связыва-
ются друг с другом атомами металла в октаэдрической коорди-
нации, и эти атомы завершают тетраэдрическую координацию
атомов Р, одна половина которых связана с совокупностью'
(ЗР + 1М), а другая —с BР+2М). В структуре CdP4
(рис. 19.3, а) гофрированный слой Р4 в CdP4 простирается сле-
ва направо и перпендикулярно плоскости рисунка. Атомы Р раз-
мещены вокруг винтовых осей, также перпендикулярных плос-
кости страницы. Схематическая проекция этого слоя на;
рис. 19.3,6 показывает, как два сорта атомов Р создают
10-членные кольца, а штриховая линия изображает одну из-,
винтовых осей.
Многочисленные сульфиды электроположительных металлов-
получены действием паров фосфора на расплавы «металл — га-
логенид металла» при температурах, лежащих в области от 350'
до 1100 °С. Типы этих соединений представлены в табл. 19.3, но.
19.3. Фосфиды металлов 609
608 19. Фосфор
не все они образуются тем или иным конкретным металлом.
Окраска этих фаз изменяется от желтой (Ы3Р7) через красную
(LiPr,, LiP7) к черной (СаР3, MgP4). Устойчивость полифосфи-
дов по отношению к воде варьирует в широких пределах, а про-
дукты гидролиза лежат в диапазоне от РН3 и РгН4 через поли-
циклические Р7Н3 и РцН3 вплоть до твердых полимерных фос-
фанов. Полифосфиды содержат конечные или бесконечные
Рис. 19.3. Две проекции структуры CdP4 (см. текст).
¦одно-, дву- и трехмерные системы связанных атомов Р, каждый
из которых связан с 2 или 3 другими такими же атомами, и в
большинстве случаев каждый 2-связанный атом Р несет один
отрицательный заряд.
Геометрия иона Р73~ подобна конфигурации молекулы P4S3
(рис. 19.10, е, разд. 19.8), где Р^ замещает S; этот ион возника-
ет в соединениях щелочных металлов М3Р7 и в Ва3Ри. Беско-
Таблица 19.3. Формулы полифосфидов
М4 (Щелочные металлы, МР„ : п= A), 5, 7, М,Р6, М3Р,, МзР„
Т1) 11, 15
М-^ Щелочноземельные МР„: п= A), 2, 3, 4, М4Р3, М4Р5, М3Р14
металлы, Mg, Cd, 7, 10
Eu(II))
М3т (Al, La, 4?-металлы) МР„ : п = 2, 3, 5, 7
печная цепь, образованная из этих единиц с одним 2-связанным
Р~" па единицу, формируется в анионе в RbP7 (рис. 19.4,а).
Конечный ион Рц3~ найден в Ыа3Рц (рис. 19.4,6). Цепи, очень
•сходные с цепями гитторфовской модификации фосфора, обра-
зуются в анионе KPib (рис. 19.4, в). Те же цепи вместе с цепя-
ми Р7 присутствуют в CsPii. Близкие по композиции цепи обна-
ружены и в Т1Р5 (рис. 19.4, г). В последнем случае повторяю-
щаяся единица содержит 9 атомов, но в этом соединении атомы
Т1A) подобны 2-связанным атомам Р, так как половина метал-
о о о оо оо оо о
чххюо
О Оо ОС ОО ОО О
о оо оо оо оо о
Р( черный.)
ВаР,
СаР,
д
SrP3
Рис. 19.4. Структуры полифосфидиых анионов (пояснения в тексте.)
лических атомов занимает позиции, указанные на рис. 19,4, г
штриховыми кружочками, формируя две наиболее сильные свя-
зи в цепях. Оставшаяся часть атомов Т1A) вместе с эквива-
лентным количеством атомов Р соединяет цепи в слои так, что
состав фазы соответствует структурной формуле TIP (TIP9) или
Т1Р5. Попятно, что атомы металла образуют помимо отмеченных
выше многочисленные более слабые связи, а атомы фосфора
39—985
610 19. Фосфор
подразделяются на три сорта: связанные с 2Р, с ЗР или с
(ЗР+1Т1).
Структуры анионов с СаР3, SrP3 и ВаР3 отображают три
способа удаления одной четверти атомов из гофрированного
слоя б3, присущего черному фосфору (рис. 19,4, д). Истинная
геометрия цепи в ВаР3 (или Аи2Р3) показана на рис. 19.4, е.
Другой способ удаления одной четверти атомов из сетки б3 реа-
лизуется в Rb4P6 (рис. 19.4,ж). Сетка в данном случае плоская,
как сетка В в А1В2; в этой структуре заряд па Рб4~ не соответ-
ствует, очевидно, числу атомов Р, образующих две связи Р—Р.
Замещение одной четверти атомов Р в изогнутом (как у As)
слое атомов Р атомами Sn приводит к образованию слоя SnP3,
проекция которого подобна показанной на схеме ж, где штрихо-
вые кружочки изображают теперь атомы Sn. Представителями
галогепсодержащих соединений со структурами, родственными
полифосфидам и полиморфным модификациям фосфора, явля-
ются Ва2Р7С1, который содержит ионы Р73~, подобные ионам
в Ва3Ри> и Аи7Рю1 [Acta cryst., 1979, В35, 573], в котором от-
дельные атомы Аи включены в фосфорный слой. В качестве при-
меров полифосфидов, в которых анион образует трехмерный
каркас из атомов Р, имеющих по 2 или 3 связи, могут быть на-
званы ЫР5 и ЬаРб.
19.3.1. Полисульфаны и родственные соединения. Конфигура-
ции фосфорных каркасов многих полисульфанов, вероятно, мо-
гут рассматриваться как производные структур комплексов Рп
в фосфидах, подобно тому как углеродные скелеты некоторых
циклических и полициклических углеводородов представляют
собой фрагменты структуры графита или алмаза. Например,
Rb3P7 и Na3Pu быстро гидролизуются до Р7Н3 и РПН3. Инфор-
мация о наиболее простых фосфанах и родственных с ними со-
единениях приводится в разд. 19.4.3.
Выше уже отмечено, что ион Р73~ имеет структуру, подоб-
ную P4S3. Те же самые ядра Р7 найдены и в соединениях типа
(Me3SiKP7 [Naturwiss., 1975, 62, 573], где радикалы
(CH3KSi — присоединяются к тем атомам Р, которые являются
2-связанными в случае Р73". Ядра Р7 найдены и в ионе Pie2".
Этот примечательный ион был обнаружен в соли
((C6H5LPJPi6, приготовленной из Na3P7 и ((С6Н5LР)С1
19.4. Структуры простых молекцл 611
в тетрагндрофуране. Он состоит из двух единиц Р7, сочленен-
ных через пару атомов Р [Angew. Chem. (Intern. Ed.), 1981,
20,594].
19.4. Структуры простых молекул
19.4.1. Молекулы РХ3. Если в простых молекулах РХ3 исполь-
зуются р-орбитали, то валентные углы не намного больше 90°.
Экспериментально найденные их значения составляют 93,8°
в РН3 и около 100° во многих пирамидальных молекулах
(табл. 19.4). Интересно, что PF3 ведет себя при образовании
комплексов подобно СО:
Ni(PF3L Ср. с
Pt(PF3JCJ2
F-P-BH,
Ni(COL
Pt(COJCl2
ос-вн,
Fv 1,207 А/Н
lOoV 1,836 A /fl5°
^-Связывание, постулируемое в случае соединений Ni и Pt
(разд. 27.9.8), не может объяснить очень малую длину связи
Р—В в F3P-BH3 A,836 А), особенно если сравнить ее с длиной
связи A,96 А) в ВР (структура типа сфалерита) или 1,93 А в
Н3Р-ВН3. Ссылки на литературу приведены в разд. 24.6.3.
19.4.2. НСР и ион РН2~. Многие простые молекулы, содержа-
щие фосфор (например, гидриды), гораздо менее устойчивы,чем
соответствующие производные азота. Это справедливо также и
по отношению к метинфосфину НСР —аналогу HCN. Этот ре-
акцпонноспособпый газ, образующийся при прохождении РН3
через специально сконструированную для этого углеродную
дугу, легко полимеризуется; под действием НС1 он превращает-
ся в Н3С-РС12 (Н—С 1,07 А; С==Р 1,54 A) [J. Chem. Phys., 1964,
40, 1170]. У
Ион РН2~, эффективный радиус которого имеет величину
порядка 2,12 А, входит в состав КРН2 и RbPH2 —соединений с
искаженной структурой NaCl [Acta cryst., 1962, 15, 420].
19.4.3. Гидриды и молекулы Р2Х4 и Р3Х5. Помимо РН3 у фосфо-
ра имеется ряд низших гидридов [1]. Р2Н4 в присутствии воды
39*
612 19. Фосфор
Таблица 19.4. Структурные данные для молекул РХ3, РОХ3, PSX3, PX5
Связь
Р—Н
Р—F
HFP—F
Р—С1
Р—Вг
Р—I
Р—СНт
Н,Р—СН,
Р—С6Н5
Р—SiH3
Me
Длина cwi-
-U, \
зи, л
1,4206 1
1,437 I
1 570
1 58
2,04
2,20
2,21
2 43
2,46
1,843
1,858
1,828
2,248
лекулы РХ3 и и:.
Угол
Х-Р-Х,
град
93 8
97 8
99
100,3
101 0
101
102
102
Мстода
MB \
эд 1
эд
MD
MB
эд/мв
рд
ЭД
РД
98,9 эд1
- |эд[
— ,рд
96,5
эд
производные
Литература
J. Chem. Phys., 1959, 31, 449
Inorg. Chem., 1969, 8, 867
J Am Cheni Soc, 1968, 90, 1705
J. Chem. Phys., 1962, 36, 589
Inorg. Chem., 1971, 10, 2584
Ada cryst., 1979, B35, 546
Acta crvst., 1950, 3, 46
Inorg. Chem., 1976, 15, 780
J. Chem. Phys., 1960, 32, 512, 832
J. Chem. Soc., 1964, 3799
J. Chem. Soc., A 1968, 3002
Молекулы РОХ3 и PSX3
POF,
POC13
PSF,
PSC13
POC13
POBr?
(крист.)
(крнст.)
p-
1
1
1
2
1
2
-X, A
,524
,993
,53
,011
98
,'4
P-0 (S),
A
1,436
1 449
1,87
1,885
1,46
1 ,44
X—P—X,
грац
101,3
103,3
100,3
101,8
A05)
A05,5)
эд
РД
рд
(Inorg. Chem., 1971, 10, 344; Inorg.
\ Chim. Acta, 1976, 16, 29
Acta cryst., 1971, B27, 1459
Acta cryst., 1969, B25, 974
Молекулы
Р—F
Р—Cl
1,577 (акс.)
1,534 (экв.)
2,14 (акс.)
2,02 (экв.)
эд
эд
Inorg.
Inorg.
Chem.,
Chem.,
1965,
1971,
4,
10
1775
344
Обозначения см. в табл. 18.2, разд. 18.4.1.
разлагается до твердого Pi2H6, а в сухой атмосфере — до Р9Н4
или нестехиометрических гидридов. Р3Н5 был приготовлен фо-
толизом Р2Н4 [2]. Последний имеет транс-конфигурацию с дли-
нами связей Р—Р 2,20 А и Р—Н 1,42 А [2а]. Получены заме-
щенные дифосфины Р2(СН3L и P2(CF3L и изучены структуры
соединений P2R4Y2, где R —органический радикал (СН3, С6Н5
i
19.4. Структуры простых молекул 613
и т. п.), a Y — это S, ВН3 или Fe(COL, например:
!'81
а И
Н,(\
н.,с -
с"з
6 М
вн3
-сн.
/Fe(COL
НдС - —p p;~-
(COLFe-
6 M
Чн3
Длины связей в них составляют: Р—С 1,83 А; Р-—S 1,94 А;
Р—В 1,95 А и Р—Р 2.20 А. В противоположность симметричной
структуре P2S2(CH3L аналогичное мышьяковое соединение
имеет асимметричную структуру (CH3JS- As-S-As(CH3J
(разд. 20.5.1). Спектры ИК и ЯМР-3|Р наводят па мысль о сим-
метричном характере структуры P2I4S2, которое синтезировано
из элементов в растворе CS2![6].
Другие производные, содержащие систему ^Р—р/
включают дигалогениды Р2Х4, гипофосфориую и дифосфорную
кислоты и их ионы (о них речь позднее), бесконечную цепь в
CuBr[Et2P—PEt2] (разд. 25.5.2) и соли, содержащие ион
P2S64- (разд. 19.7).
Известны три дигалогенида фосфора: P2F4, P2C14 и Р214.
Фторид получается из PF2I и Hg, хлорид — под воздействием
электрического разряда на смесь РС13 и Н2, а иодид — прямым
взаимодействием элементов в растворе CS2. Молекула Р214
в кристаллическом иодиде имеет центросимметричное строение;
она изображена на рис. 19.5 [7]. Длины связей в ней состав-
Рис. 19.5. Строение молекулы P2I4.
ляют: Р—Р 2,21 А; Р—I 2,48 А; среднее значение угла I—Р—Р
94°. С помощью электронографического исследования установ-
лены следующие детали структуры P2;F4 [8]: длины связей Р—Р
2,28 А; Р—F 1,587 А; величина угла Р—Р—F 95,4°, а угла
F—P-F 99,1°.
40—985
614 19. Фосфор
Литература. [11 J. Am. Chcin. Soc, 1956, 78, 5726. [2[ J. Am. Chem. Soc, 1968,
90, 6062. |2a| J. Am. Chem. Soc, 1974, 96, 2688. [3] Acla cryst., 1971, B27, 302.
[4| Ada cryst., 1968, B24, 699. [5] J. Chem. Soc, A 1968, 622. [61 Inorg. Chem.,
1964, 3, 780. [7| J. Phys. Chem., 1956, 60, 539; см. также литературу" по этим
соединениям, цитируемую в Inor^. Cliem., 1969, 8, 2086, 2797. [8| Inorg. Chem.,
1975, 14, 599.
19.4.4. Фосфорил- и тиофосфорил-галогениды. Результаты
электроно- и рентгенографического исследований молекул фос-
форил- и тиофосфорилгалогенидов сведены в табл. 19.4. Все
эти молекулы имеют тетраэдрическую конфигурацию, но ин-
тервал значений углов X—Р—X (от 100 до 108°) свидетельству-
ет о том, что тетраэдры деформированы. Длина связи Р—О
близка к 1,45 А. В спектре КР твердого РОВг3 имеется интен-
сивная колебательная линия, указывающая на понижение сим-
метрии свободной молекулы (С3в) в кристаллическом продукте.
Это обстоятельство приписывается слабым связям с переносом
заряда между атомами кислорода и брома различных моле-
кул, па что указывает величина соответствующего расстояния
C,08 А) в бесконечных цепях. Все остальные межмолекулярные
расстояния Вг—О значительно больше, чем сумма вандервааль-
совых радиусов C,35 А). Значения межмолекулярных расстоя-
ний С1...0 в цепях кристаллического РОС13 C,05 А) могут
свидетельствовать о слабом взаимодействии между этими ато-
мами, лишь незначительно превышающем вандервааль-
сово.
Br Br Br Br
p /2,14 A P
/ \/ / \
0 Br
-' 1,44 A 4o (Вг/з,08А '
V
/\
Br Br
В тиофосфорилгалогепидах длина связи Р—S A,86 А), со-
поставимая с длиной связи Р—О в фосфорилгалогенидах, близ-
ка к величине, ожидаемой для двойной связи. Другие тиогало-
гепиды фосфора обсуждаются в разд. 19.9.
РОС13 и некоторые другие молекулы, упоминаемые ниже,
реагируют с рядом тетра- и пептагалогенидов с образованием
молекул, в которых координация атома металла дополняется
до октаэдрической одним или двумя атомами кислорода моле-
кул РОС13 (или других). На рис. 19.6 приведены примеры трех
19.4. Структуры простых молекул 615
молекул этого типа:
а) МС15-РОС13 (>L-=Sb, Nb, Та) [1] и SbClr,-OP(CH;!K [1];
б) MCl4-2PCK;i3 (M-=Sn[2], Ti [3]);
в) (МС14-РОС13J (M^Ti [4J).
В этих аддуктах наблюдается увеличение координационного
числа акцепторного атома, в то время как структура донорной
молекулы существенным образом не изменяется. Отметим, од-
нако, необычную разницу между длинами связей Sb—О в мо-
SbCls-P0Cl3
SnCU-2POCL3
ГПСЦ-РОС13J
Рис. 19.6. Строение молекул SbCl.vPOCI;i (о); SnCl4-2 РОС13 (б); (TiCL,-
•РОС1з)г («) (атомы О заштрихованы).
лекулах SbCl5-POCl3 и SbCl5-OP(CH3K: 2,17 и 1,94 А соответ-
ственно (Sb—С1 2,34 А). В аддуктах РОС13 валентный угол при
атоме О лежит в интервале значений 140—152°. Интересно, что
SnCl4-2POCl3, подобно SnCl4-2Se0Cl2, имеет г<мс-копфигура-
цию в отличие от молекул типа TpaHC-GeCl4(pyJ.
Молекула P2O3CI2F2 с мостиковым кислородом (схема а)
была идентифицирована с помощью спектра ЯМР-!1Р [5].
a
ciy
V
\
С1
2,12 А
ci
.0'
С1
/Cl
С1
p
С1У ча cup
о
2,15 А
В молекулах, изображенных па рис. 19.6, РОС13 присоединя-
ется к атому металла через одиночный атом кислорода. При
действии С12О на раствор SnCl4 в РОС13 образуется соединение,
соответствующее формуле (SnO3P2Cl8J. В этой молекуле ато-
мы металла связаны не только с лигандами РОС13, но через
кислородные мостики и с тетраэдрическимп группами О2РС12
40*
616 19. Фосфор
(схема б), так что в итоге образуется (гофрированное) 8-член-
ное кольцо [6]. Такого же типа мостики возникают в соедине-
нии Мг^РОгСЬЫСНзСООСгНзЬ [7], образующемся при воз-
действии МпО на РОС13, растворенный в этилацетате. Мостико-
вые группы РО2С12 приводят к бесконечным цепям (схема в)
октаэдрических координационных групп, в которых молекулы
СН3СООС2Н5 занимают ц»с-положения; следующие друг за
другом 8-членные кольца располагаются в почти перпендику-
лярных плоскостях. Такого же типа цепи имеются в
Mg(PO2Cl2J(POCl3J с двумя группами ОРС13 на каждом ато-
ме металла [8].
\ /
-Мп-
/
О
п2ро-
С12
-ОР
О
С12
.P
.
OR
OR'
7 I X
I XO
\
OR
О'
\p/
ЧОРС12
о
С12 С12РО-Мп-
Литература. [1] Acta Chcm. Scand., 1963, 17, 353. [2] Acta Chcm. Scand., 1963,
17, 759. [3] Acta Chem. Scand., 1962, 16, 1806. [4] Acta Chem. Scand., 1960, 14,
726. [51 Inorg. Chcm., 1964, 3, 280. [61 Acta cryst., 1969, B25, 1720, 1726. [7] Acta
Chem. Scand., 1963, 17, 1971. [81 Acta Chcm. Scand., 1970,, 24, 59.
19.4.5. Другие тетраэдрические молекулы и ионы. В дополнение
к рассмотренным ниже па схемах а [1] и б [2] приведены еще
два примера тетраэдрических молекул. Среди других структур-
но исследованных молекул можно упомянуть F3P-BH3 [3];
PS(OCH3)(C6H5J [4a]; OP(NH2K [46] и многие оксо- и тио-
ионы, которые будут описаны в этой главе несколько позднее.
В солях типа (РН4)Х ион фосфония — фосфорный аналог иона
аммония — имеет правильную тетраэдрическую структуру. По
данным электронографического исследования РН41 установле-
но, что связи Р—Н направлены к ионам 1~, а длина их состав-
ляет 1,414 А. Восемь атомов водорода, окружающих анион 1~,
размещаются по вершинам искаженного куба: 4 на расстоянии
2,87 А и 4 на расстоянии 3,35 А; атомы Р—Н—I расположены
19.4. Структуры простых молекул 617
практически коллииеарно A72°) [5]. Ионы РХ44
ются в следующем разделе.
рассматрива-
Литература. [Ц Inorg. Chcm., 1968, 7, 2582. [21 Acta Chem. Scand., 1965, 19,
879. [31 J. Chem. Phys., 1967, 46, 357. [4al Acta cryst., 1969, B25, 617. [461 J-
Chem. Soc, A 1969, 1804. [51 J. Chem. Phys., 1964, 47, 1818.
19.4.6. Пентагалогениды фосфора, ионы PXa+ и РХ6". Устойчи-
вость пентагалогенидов фосфора быстро уменьшается с увели-
чением атомной массы галогена. Пентафторид устойчив вплоть
до высоких температур; PCls диссоциирует приблизительно на-
половину при 200 °С; РВг5 еще менее устойчив; Р15 вообще не
известен. Установлено, что PF5 и РС15 в парообразном состоя-
нии существуют в виде тригонально-бнпирамидальных молекул,
стереохимия которых уже обсуждалась в гл. 7. Аксиальные свя-
зи в молекулах указанных пентагалогенидов длиннее экватори-
альных, как и в других молекулах этого типа (см. ниже). При
растворении пентагалогенидов в нитробензоле, вероятно, проис-
ходит их диссоциация; у растворов РС15 в этом растворителе
обнаружена заметная электропроводность, а кристаллический
РС15 построен из тетраэдрических РС14+ и октаэдрических
РС16~ ионов, взаимная укладка которых во многом напоминает
упаковку ионов в CsCl [1]. Ионы РСЦ+ присутствуют также
в следующих кристаллических соединениях: РС161 [2],
(PCl4)FeCl4 ![3], (РСЦ) (Ti2Cl9) и (РСЦJ (Ti2Cl10); третье со-
единение описано в разд. 10.1.8. РС161, получаемый прямым
взаимодействием РС15 и IC1 в растворе в CS2 или СС14, диссо-
циирует в полярных растворителях и состоит из ионов РСЦ+
и линейных ионов 1С12~. Кристаллический (PCl4)FeCl4 представ-
ляет собой совокупность ионов РС14+ (с длиной связи Р—С1
1,91 А) и тетраэдрических ионов FeCl4~ (Fe—Cl 2,19 А). О со-
единении (РС14) (TeCls) см. в разд. 16.5.3.
В противоположность пентахлориду РВг5 кристаллизуется
как ионное соединение вида (РВг4)Вг; длина связи Р—Вг
в ионе РВг4+ составляет 2,15 А [4]. Этот же катион образуется
в РВг7 [5], получающемся при действии Вг2 па РВг5, а анио-
ном в РВг7 является линейный (асимметричный) ион Вг3~;
РВг4+ существует, по-видимому, также в соединениях типа
РВг61 и РВг51С1.
Из солей металлов М(РХб)«, по-видимому, известны только
гексафторофосфаты, среди которых наиболее устойчивы в твер-
дом состоянии соли больших катионов, таких, как NH4+, K+,
Cs+, Ва2+ и Co(NH3N3+. Установлено, что в кристаллах первых
трех катионов ионы М+ и октаэдрические ионы PF6~ упакованы
по типу NaCl [6]. Кристаллическая структура HPF6-6H2O опи-
сана в разд. 15.2.2. Длина связи Р—F в этом кристалле в ионе
PF6^ составляет 1,73 А, а в NaPF6 [7], по-видимому, только
G18 19. Фосфор
1,58 А, и эта же величина совпадает со средним значением для
Р—F в (СНзLМ-РР6 (аксиальное расстояние равно 1,59 А, эк-
ваториальное— 1.57А). Кроме того, установлено, что в
NaPF6-H2O [9] ион PF6^ деформирован: четыре (экваториаль-
ные) связи Р—F имеют длину 1,58 А (ближайшими внешними
соседями этих атомов F являются ионы Na1), а две—1,73 А
(с этими атомами соседствуют молекулы Н2О па расстоянии
2,90 А).
Литература. [I] J. Chetn. Soc, 1942. 642. [2| J. Am. Chem. Soc, 1952, 74, 6151.
[31 Inorg. Chem., 1968, 7, 2150. |4| Acta cryst., 1970, B26, 443. [5] Acta cryst.,
1967, 23, 467. [б] Z. anorg. allg. Chem., 1951, 265, 229. |7| Z. anorg. allg. Chem.,
1952, 268, 20. [81 Ada cryst., 1980, B36, 1523. [91 Acta cryst., 1956, 9, 825.
19.4.7. Молекулы PR5, PR5-nXn и смешанные галогениды. Моле-
кулы, у которых к атому фосфора присоединено 5 независимых
лигапдов, имеют тригоналыю-пирамидальпую конфигурацию,
причем аксиальные связи в PR5 и РХ5 длиннее экваториальных.
Например, в Р(С6Н5M [1] длина аксиальных связен составляет
1,99 А, а экваториальных—1,85 А; последние имеют такую же
длину и в Р(С6Н5)з. Предполагается, что наиболее значитель-
ные стерические взаимодействия имеют место между взаимно
перпендикулярными группами и что сила отталкивания лиган-
дов возрастает в ряду F—F<jF—R<R—R. Можно ожидать,
что в молекулах PFJRs-n группы R будут занимать преимущест-
венно экваториальные позиции. Это было подтверждено (элек-
тронографически) для CH3PF4, (CH3JPF3 [2] и для CF3PF4
[3]. Структура первого очень близка по конфигурации к ана-
логичной молекуле серы SF4, а второго — к молекуле хлора
CIF3; у серы и хлора в этих соединениях имеются соответствен-
но одна и две пеподелепные электронные пары, заменяющие
группы СН3 (рис. 19.7). В молекулах (CH3)«PF5_n наблюдается
существенное и устойчивое увеличение расстояний Р—F3KB и
Р—FaKc с возрастанием числа групп СН3 (п = 0-е-3) [За]. Дли-
ны аксиальных связей лежат в интервале от 1,57 А (и = 0)
до 1,685 А (« = 3) с промежуточными значениями для п=\ и
я = 2, указанными на рис. 19.7. В PHF4 [4] экваториальная по-
зиция занята атомом водорода, но во многих молекулах этого
типа при обычных температурах, по-видимому, происходит
быстрый обмен между аксиальными и экваториальными поло-
жениями. По соединениям с координационным числом пять име-
ется обширный обзор [5]. Особый интерес представляет моле-
кула а с тремя изопропоксигруппами и одной молекулой фенан-
тренхинона, присоединенными к атому фосфора, как пример
тригонально-бипирамидального окружения фосфора пятью
атомами кислорода. В этой молекуле валентные углы очень
19.1. Структуры простых молекул 619
F
11,612 A
1,543!/L<i>»9—СНз
1,646 A
F
СН3Р1\
F
1,643 А
1,553 А
СН3
118"
F
(CH3JPF3
Рис. 19.7. Строение CH3PF4,
Рц и других молекул.
мало отличаются от их идеальных значений (90 и 120°) [6].
С другой стороны, в молекулах типа (СН3)Р (С6Н4О2J (б)
[7], содержащей два хелатных лиганда, координация стремится
к квадратно-пирамидальной (или — более строго — прямоуголь-
но-пирамидальной). В этой молекуле все углы Н3С—Р—О
близки к 104°, тогда как диагональный угол О—Р—О состав-
ляет 152,5°.
1,65A
ОСН(СН3J
L =
Получены вес смешанные галогепиды PClnF5-n. Оии обла-
дают низкотемпературными модификациями, построенными из
тригонально-пирамидальных молекул, медленно перестраиваю-
щихся при комнатной температуре с образованием ионных кри-
сталлов. Например, РС1гГ3 при комнатной температуре — газ,
620 19. Фосфор
тогда как ионная форма (PCl4)+PF<r— гигроскопичная соль,
которая сублимирует с частичным разложением при 135 °С. При
температурах выше 70 °С она превращается в PF5 + PC14F,
а последний существует как в виде неполярной жидкости, так
и в виде ионного твердого вещества (PC14)F [8].
Литература. [11 J. Chem. Soc, 1964, 2206. [21 Inorg. Chem 1965 4 1777
Г3| J. Chem. Phys., 1968, 49, 1307. [3al J. Mol. Struct., 1973, 15 209 [41 J Chem
Phys., 1968, 48, 2118. |51 Quart. Rev. Chem. Soc., 1966, 20 245 [6] J Am
Chem. Soc, 1967, 89, 2267, 2272, |7| Acta cryst., 1974, B30, 935 939 [81 Z anorg
allg. Chem., 1957, 293, 147; Inorg. Chem , 1965, 4 738
19.5. Оксиды и оксосульфиды
Помимо триоксида и пентаоксида фосфора существуют кри-
сталлические фазы, состав которых лежит в интервале
РОг.о—РО2,25 и которые в химическом отношении ведут себя как
вещества, содержащие Р(Ш) и P(V). Например, они гидроли-
зуются до смеси фосфористой и фосфорной кислот. Эти фазы
удобно обсудить после рассмотрения триоксида и пентаоксида.
19.5.1. Триоксид фосфора. Триоксид фосфора при умеренных
температурах существует в парообразном состоянии в виде
Таблица 19.5. Экспериментально наблюдаемые расстояния
и валентные углы в молекулах Р4О6, Р4О10, P4O6S4, As4O6, Sb4Oe
Моле-
кула
Р4О6
Р4О.0
Р4О054
As4O6
Sb4O6
М-°мост,
1,638
1,604
1,61
1,78
2,00
М-°ксл,ц
или М—jj,
л
1,429
1,85
—
—
Угол, град
М—О—М
126
124
124
128
129
О—М—О
П DO
Ом„стРОко1,ц
О„„стРО„ост
CW.PS
100
102
117
102
117
99
98
Литература
Trans. Faraday Soc
65, 1219
Trans. Faraday Soc,
63, 836
J. Am. Chem. Soc,
61, 1130
J. Am. Chem. Soc,
66, 818
1969
1967
1939
1944
Ж. структ. хим., 1961, 2
542
молекул P4O6; структура кристаллического РгО3 не известна.
Результаты электронографического исследования парообразных
молекул этого оксида и родственных соединений представлены
в табл. 19.5, а структура молекулы Р4О6 показана на
рис. 19.8,6.
19.5. Оксиды и оксосульфиды 621
19.5.2. Пентаоксид фосфора. Структурная химия этого оксида
в жидком состоянии довольно-таки сложна. Помимо стеклооб-
разной формы и фазы высокого давления :[1] имеются три мо-
дификации, устойчивые при атмосферном давлении. Как отме-
чено в гл. 3, эти три кристаллические модификации отражают
различные способы соединения тетраэдрических групп РО4 че-
рез три вершины с образованием: а) конечных молекул Р4Ою
[2] той же конфигурации, что и в парообразном состоянии
(рис. 19.8, в); б) слоистой структуры [3], основанной на про-
стейшей плоской 3-связанной сетке; в) трехмерного каркаса
а л
Рис. 19.8. Строение молекул Р4 (а); Р4О6 (б) и Р4Ою (в) в парообразном
состоянии (схематическое изображение). Заштрихованные кружки обозначают
атомы фосфора.
[4] из колец по десять групп РО4 в каждом, базирующегося
на одной из простейших трехмерных 3-связанных сеток. Точные
данные для слоистой структуры (Р—О 1,56 А; Р—О' 1,49 А;
Р—О—Р 145°) можно сравнить с параметрами молекулы
Р4Ою, приведенными в табл. 19.5. Рассмотренные особенности
кристаллических структур являются ключом к пониманию хи-
мических и физических свойств этих трех полиморфных моди-
фикаций. Метастабильная форма, состоящая из дискретных мо-
лекул Р5О10, наиболее летуча и гигроскопична; она образуется
при конденсации пара. Перестройки тетраэдров РО4, требую-
щейся для образования бесконечных сеток двух других форм,
не происходит, если пар конденсируется быстро; она возникает
только при длительном выдерживании расплавленного оксида
при высокой температуре. Эти формы гораздо менее летучи и
не так быстро разлагаются водой, потому что при плавлении,
испарении или взаимодействии кристалла с водой должны быть
разрушены протяженные системы связанных тетраэдров.
Молекула Р4Ою в парообразном состоянии изучена электро-
пографически, и результаты этого исследования приведены в
табл. 19.5. Внешние (концевые) атомы О обозначены как
Оконц, а мостиковые атомы О — как ОМОст- (Кратная) связь
РОконц является наиболее короткой среди связей фосфор — кис-
лород.
622 19. Фосфор
Литература. [1| J. Chcm. Phys., 1961, 35, 1271. |2| Ada cryst, 1964 17 677
[31 Acla cryst.. 1964, 17, 679. fl| Roc. Tray. Chiin., 1941, 60, 413.
19.5.3. Оксиды Р(П1) и P(V). Все оксиды промежуточных со-
ставов между Р4О6 и Р4О10 (Р4О7, Р4О8 и Р4О9) "существуют
в виде стехиометричеекпх твердых тел, и их молекулярные
структуры известны [Ada cryst., 1981, В37, 222]. Изучены так-
же твердые растворы, содержащие молекулы нескольких видов,
например твердые растворы составов Р02,о2—РО2.25 (Р4О8 и
Р4ОУ) или Р02,о—РОкэз (статистическое размещение молекул
Р4О8 и Р4О7) [Acta cryst., 1964, 17, 1593;
1966, 21, 34]. По конфигурации молекулы
Р4О7) Р4О8 и Р4О9 сходны с Р4О6 и Р4Ою,
но имеют соответствующее число концевых
атомов О; в этих двух группах соединений
сопоставимы между собой и значения длин
аналогичных связей, и величины валентных
углов. Параметры молекул, представленные
в табл. 19.5, следует дополнить длинами
связей в асимметричных мостиках:
Р (III)—ОМост A,59 А) И P(V)—Омоет
A,67 А).
1,4-9 А
Рис. 19.9. Строение
молекулы C6H9O3PS.
19.5.4. Оксосульфид фосфора. Оксосульфид
P4O6S4, образующийся при нагревании
Р4О6 с серой, построен из тетраэдрических
молекул, подобных Р4Ою. Длина связи Р—S A,85 А) сопоста-
вима с соответствующей длиной в тиофосфорилгалогенидах.
19.5.5. Другие молекулы с конфигурацией типа Р\ОМ. Целесооб-
разно здесь упомянуть о двух молекулах, по конфигурации по-
добных молекулам типа Р4О]0. Так, строение фосфорного эфира
и его серного аналога (рис. 19.9) может быть описано на осно-
ве молекулы Р4Ою, базисное кольцо которой заменено цикло-
гексановым [Acta Chem. Scand., 1960, 14, 829]. Действие избыт-
ка Ni(COL на Р4О6 приводит к образованию P4O0[Ni (COK]4.
в котором к каждому атому фосфора присоединено по одной
группе Ni(COK [Acta cryst., 1966, 21, 288].
19.6. Фосфорные оксокислоты и их соли
Оксокислоты фосфора по числу и устойчивости являют собой
резкий контраст по отношению к аналогичным производным азо-
та. Формулы п основности оксофосфорных кислот сведены в
табл. 19.6. В нее не включены так называемые перкислоты
Н3РО5 (пероксомонофосфорная) и HiP2Os (пероксодифосфор-
19.6. Фосфорные оксокислоты и их соли 623
Таблица 19.6. Фосфорные оксокислоты
Кислота
Фосфористая (фосфо-
новая)
Фосфор новатиста я
(фосфиновая)
Пмрофосфористая
Дифосфористая (фос-
фор истофосфорная)
Фосфорноватая (гипо-
фосфорная или ди-
фосфорнаяAУ))
Изофосфорноватая
Ортофосфорная (фос-
форная)
Метафосфорная
Пирофосфорная (ди-
фосфорная)
Формула
Н3РО;!
Н;,РО2
Н4Р2О5
Н4Р2О5
Н5Р3О8
Н6Р6О,2
Н4Р2О6
Н4Р2О6-
¦2Н2О
Н4Р2О6
НзРО,
(НРОзЬ
Н4Р2О;
Основ-
ность
2
1
2
3
5
6
2
2
3
3
1
4
Ион
НРО/-
н2ро2-
н,р2о5--
нр2о53-
РзО35-
р6о126-
Н2Р2Ов2-
Н2Р2О62-
НР2О63~
ро43-
(РОз),/-
р,о74-
Лнгература
Acta cryst., 1969. В25
997
Z.L t
Acta cryst., 1979, B35
1041 "
J. Am. Chem. Soc.
1957, 79, 2719
J. Am. Chem Soc.
1957, 79, 2719
Acta cryst., 1969, B25
1077
Z. anorg. allg. Chem.
1960, 306, 30
Acta cryst, 1964, 17,
1352
Acta cryst., 1971, B27,
1 ^90
Inorg. Chern., 1967, 6
1 TJ7
ll.W
См. текст
пая), поскольку об их строении ничего не известно. Последняя,
вероятно, является аналогом H2S2Os. Строение, да и само су-
ществование мета- и пирофосфорнстой кислот все еще не уста-
новлены достоверно. Однако хорошо известны кристаллические
безводные пирофосфиты, например Na2(H2P2O5), получаемый
нагреванием Na2HPO3. По аналогии с ортофосфористой кисло-
той пирокислоте естественно приписать формулу
К °1
н)р-о-р(нн2
1р oj
Спектр ЯМР Na2(H2P2O5) может служить косвенным под-
тверждением этого: из него следует, что ион (Н2Р2О5J~ сим-
метричный и что к каждому атому фосфора присоединен один
атом водорода.
За исключением метафосфорной кислоты, которая обычно
получается в стеклообразном виде, все остальные кислоты,
представленные в табл. 19.6, могут быть получены в кристал-
лическом состоянии при обычных температурах. Тем не менее
624 19. Фосфор
пока что исследованы кристаллические структуры только двух
безводных кислот: Н3РО3 и Н3РО4.
19.6.1. Ортофосфористая кислота. Весьма примечательной осо-
бенностью фосфористых кислот является их аномальная основ-
ность. Можно было предположить, что Н3РО3 будет образовы-
вать соли, содержащие пирамидальный ион РО33^, аналогич-
ный пирамидальным ионам SO32~ и С1О3~, по па самом деле
эта кислота двухосновна. Ее нормальные соли имеют формулы
типа Na2(HPO3) и Ва(НРО3), хотя получены также и кислые
соли, например NaH(HPO3).
В кристаллической ортофосфористой кислоте три атома кис-
лорода и один фосфора образуют пирамидальную группу, а чет-
вертая тетраэдрическая позиция занята атомом водорода, кото-
рый в отличие от двух других атомов водорода не участвует
в образовании водородных связей. В рентгеновском исследова-
нии атомы водорода не были локализованы, и их позиции были
выбраны на коротких межмолекулярных контактах О-Н -О
(около 2,60 А); это размещение было подтверждено нейтроно-
графическим анализом. Структура молекулы фосфористой кис-
лоты НРО(ОНJ показана на схеме а.
Нормальные фосфориты содержат ион (НРО3J~ (б), кото-
рый, как было установлено, в Mg(HPO3)-6Н2О [1] имеет три-
гональную симметрию; длина связи Р—О составляет 1,51 А,
а углы О—Р—О равны 110°. В табл. 19.6 указывается литера-
тура по Си (НРО3J-2Н2О, в которой приводится перечень ра-
бот и по Н3РО3.
О
0Н
н
о
Н
109'
О
г
9Г,*
JA9A
121
О
Гидро- или «кислые» фосфориты содержат ион [НРО2(ОН)] ~
(в): его строение было определено при исследовании LiH2PO3
[2] и Cd(H2PO3J-H2O [3].
Литература. [1] Acta cryst., 1956, 9, 991. [2] Ada cryst., 1976, B32, 412. [31
Acta cryst., 1978, B34, 32.
19.6.2. Фосфорноватистая кислота. Структура моиоосновной
Н3РО2 (или Н(Н2РО2)) неизвестна, но некоторые ее соли изу-
чены с помощью рентгено- и нейтронографии, благодаря чему
определены позиции атомов водорода. Ион (Н2РО2)~ имеет ис-
19.6. Фосфорные оксокисяоты и их соли 625
каженную тетраэдрическую структуру (г). Обзор более ранних
работ содержится в статье, указанной в табл. 19.6.
В последующих подразделах будет рассмотрена группа кис-
лот, содержащих два или большее число атомов фосфора, свя-
занных непосредственно между собой.
19.6.3. Фосфорноватая кислота. Из криоскопических измерений
следует, что молекулярные массы свободной фосфорноватой
кислоты и ее этилового эфира отвечают формулам Н4Р2О6 и
(СгИз^РгОб соответственно. Магнитные свойства этих веществ
подтверждают данную точку зрения. Молекула Н2РО3 должна
была бы быть парамагнитной, так как она обладает неспарен-
ным электроном, но ее натриевая и серебряная соли диамаг-
нитны. Рентгеновское исследование (NH4JH2P2O6 свидетельст-
вует о том, что ион (Н2Р2О6J~ имеет окрещенную конфигура-
цию. Длины связей Р—ОН и Р—О в нем очень близки к соот-
ветствующим величинам в КН2РО4 A,58 и 1,51 А) и Н3РО4
A,57 и 1,52А); аналогична структура аниона и в «дигидрате»
кислоты, который описывается формулой (Н3ОJ+(Н2Р2О6J~.
Изопропилфосфорная кислота обсуждается позднее.
19.6.4. Дифосфористая кислота. Соль, описанная в литературе
как дифосфит Na3HP2O5-12Н2О, была приготовлена путем гид-
ролиза РВг3 водным раствором NaHCO3, охлажденным с по-
мощью льда. ЯМР-спектр этой соли согласуется с приведенной
структурной формулой.
Н5Р3О8 и H6P6Oi2. Строение иона Р3О85~ было определено
при исследовании Na5P3O8- 14Н2О. Связь Р—Р в нем имеет дли-
НО
1,50 А
О'
/I
о
?/°а"
"Р\1,5 7 А
ОН
з-
НР,О|"
2 24 А
Д
о о
L 1,53 А
-1 5-
626 19. Фосфор
ну обычной ординарной связи; в этом ноне три атома фосфора
находятся в следующих формальных степенях окисления: два
атома в степени III и один атом в степени II.
Соли Н6Рб0]2 были приготовлены обработкой гипохлоритом
суспензии красного фосфора в растворе щелочного гидроксида.
Рентгеновское исследование цезиевой соли показало, что ее
анион содержит кольцо в форме кресла из шести непосредст-
венно связанных между собой атомов фосфора с длиной связи
Р—Р, приблизительно равной 2,2 А.
19.6.5. Изофосфорноватая кислота. Фосфорноватая кислота, как
указывалось в одном из предыдущих разделов, образуется
в результате окисления фосфора влажным воздухом. Мягкий
гидролиз РС13 дает сложную смесь продуктов; такая смесь
была разделена хроматографически, и один из компонентов был
идентифицирован как изофосфорноватая кислота (в свободном
состоянии эта кислота была получена из РС13 и Н3РО4). Еетри-
натриевая соль Na3(HP2O6) -4Н2О образуется при нагревании
смеси Na2HPO4 и NaH2PO3. ЯМР-спектры согласуются со сле-
дующими структурными формулами иона (НР2О6K~ и свобод-
ной кислоты:
0>
11
но'
6
он
он
19.6.6. Фосфорные кислоты и фосфаты. Перейдем к более де-
тальному анализу стереохимии кислородных соединений P(V),
в основе которых лежат дискретные ионы РО43~ или тетраэдры
Р04, связанные через один или два общих атома кислорода;
обобщение трех кислородных атомов всеми тетраэдрами Р04
приводит к образованию нейтрального оксида Р2Ог>. Дискретные
ионы РО43" найдены в ортофосфатах, а системы объединенных
групп Р04 — в пиро-, поли- и метафосфатах.
19.6.7. Ортофосфорная кислота и ортофосфаты. Дискретные
ионы РО43~ существуют в нормальных ортофосфатах. В дигид-
рофосфатах типа КН2РО4 и (N2H5)H2PO4 группы РО2(ОНJ
объединяются водородными связями с образованием протяжен-
ных анионов (разд. 8.5.3). На основе ряда рентгеновских и
нейтронографических исследований [1] известно, что в дигидро-
фосфатах длина связи Р—О близка к 1,51 А, а длина связи
Р—ОН лежит в интервале 1,55—1,58 А. Длина водородной свя-
зи составляет около 2,50 А. В (слоистой) структуре Н3РО4 [2]
также имеются водородные связи длиной 2,84 А; эта структура
19.6. Фосфорные оксокислоты и их соли 627
описана в разд. 8.5.3. Длины связен Р—О в Н3РО4 и его полу-
гидрате [3] составляют соответственно 1,52 и 1,49 А, а Р—ОН —
1,57 п 1,56 А.
Кристаллические структуры ряда ортофосфатов имеют боль-
шое сходство со структурами различных форм кремнезема или
силикатов. Например, три модификации А1РО4 принадлежат
различным структурным типам кремнезема [4]; каждая из них
претерпевает еще переход из низкотемпературной в высокотем-
пературную форму; YPO4 и YAsO4 кристаллизуются в структур-
ном типе циркона (ZrSiO4).
Литература. [1[ Ada cryst., 1974, ВЗО, 1195. [2] Acta Chcm. Scaad., 1955, 9,
1557. [3| Ada cryst., 1974, B30, 1470. [41 Z. Kristallogr., 1967, 125, 134.
19.6.8. Пирофосфаты (дифосфаты). Пирофосфаты MIVP2O7,
M2"P2O7 и М4'Р2О7 (гидратированный) исследованы достаточ-
но детально. Особый интерес представлял вопрос о величине
валентного угла у мостикового атома кислорода. У солей двух-
валентных металлов нередко наряду с низкотемпературными
(а) существуют высокотемпературные (|3) модификации; было
показано, что конфигурация пирофосфатного иона зависит от
размера М2+. В соединениях с малыми металлическими ионами
анион Р2О74 имеет конфигурацию, близкую к скрещенной, а в
соединениях с большими нонами — близкую к заслоненной [1].
В пирофосфатах наблюдается значительный разброс значений
валентных углов при атомах ОМОоТ; они лежат в интервале от
123 до 180°: 123° в Са2Р2О7-2Н2О [2], 139° в одной из форм
SiP2O7 [3], 156° в a-Mg2P2O7, 180° в фосфатах со структурой
тортвейтита. Кажущаяся коллинеарность связей при ОМОст в вы-
сокотемпературных модификациях некоторых солей М2Р2О7 те-
перь обычно связывается либо с позиционным разупорядочени-
ем, т. е. с хаотическим размещением во всем кристалле атомов
Омоет относительно линии Р—Р группировки
р..—Р
либо с резко анизотропным движением ОМОст (ср. с высокотем-
пературным кристобалитом). Результаты первоначального ис-
следования кубической модификации ZrP2O7 (с которой изо-
структурны соединения Si, Ge, Sn, Pb, Ti, Hi, Се и U) указы-
вали на коллинеарность связей в ионе Р2О7. Позднее, при более
внимательном изучении высокотемпературной модификации
SiP2O7 [4], было показано, что истинная элементарная ячейка
имеет 27-кратный объем по сравнению с ячейкой, приписывае-
мой этой структуре ранее, н средняя величина угла Р—О—Р
равна 150°, хотя, вероятно, и в этом случае все же имеется не-
628 19. Фосфор
сколько коллинеарных связен. Выявляется, по-видимому, кор-
реляция между величиной кислородного валентного угла и раз-
ностью между длинами связей Р—О,«„щ и Р—ОЫост; если угол
Р—Омоет—Р равен 123°, расстояние Р—ОМост составляет 1,62 А;
Р—ОКонц=1,52 А (Са2Р2О7-2Н2О); если угол Р—Омоет—Р равен
156°, Р—ОМост составляет 1,58 А; Р—ОКо,щ= 1,55 A (a-Mg2P2O7).
С ионом Р2О74~ в значительной мере родственны ионы
O3P-NH-PO34- и ОзР-СО-РОз4":
1.В8А
и
s
о-
0'
\
127°
н
1
/
L5ZA
0
-0
чо
0
0
0
, 1,52 А
О 1,874 A J—Г,
Структуры ионов с кислородным и NH-мостиком столь сходны,
что декагидраты их натриевых солей оказываются изоструктур-
ными [5]. Строение карбонилдифосфонат-иона было определе-
но при исследовании Na4(O3P-CO-PO3)-2Н2О [6].
Литература. [1] J. Solid State Chem., 1970, 1, 120. [2] Acta cryst, 1975, B31,
1730. [3] Acta cryst., 1970, B26, 233. [4] J. Solid State Chem., 1973, 7, 09.
[5] Acta cryst., 1974, B30, 522. [6] Acta cryst., 1976, B32, 488.
19.6.9. Линейные полифосфаты. Линейные полифосфаты содер-
жат «гибридные» ионы, промежуточные между пирофосфат-ио-
ном и бесконечным линейным метафосфат-ионом; в этих ионах
концевые группы РО4 обобщают по одному, а промежуточные
группы — по два кислородных атома. Нормальный трифосфат
натрия Na5P3Oio известен как в безводном состоянии, так и в
виде гексагидрата; были также приготовлены Ыа2Н3Р3Ош и
Na3H2P3Oi0. Трифосфат, используемый в качестве моющего
средства в смеси с мылами и сульфонатами, может быть полу-
чен различными способами, например совместным нагреванием
Na2HPO4 и NaH2PO4:
¦ 2Н,0
2Na2HPO4
NaH2PO4
Na5P3O10
Из рентгенографического исследования двух кристаллических
форм Na5P3Oio [1] следует, что структура аниона Р3О10Б~ име-
ет вид
? О/О
Л—1 122'
\(,°
о
7
0
1.50А
р^1,61 А^р-о
О
1,67 А
правда, в 7п5(Р3ОюJ-17Н2О [1а] были найдены несколько бо-
19.6. Фосфорные оксокислаты и их соли 629
лее короткие мостиковые связи A.59 и 1,63.4) и больший ва-
лентный кислородный угол 129е.
Линейный тетрафосфат-ион получается в результате щелоч-
ного гидролиза циклического метафосфата, а его соли с круп-
ными ионами, такими, как РЬ2~", Ва2~ и N(CH3L+, могут быть
выкристаллизованы из подкисленного раствора (в щелочной
среде они остаются в растворе, образуя при этом вязкую жид-
кость). Препарат, описанный в литературе как «гексанатрие-
вый тетрафосфат» NaeP4Oi3, не является химически индивиду-
альным веществом, а представляет собой смесь Na,r,P3Oio и
NaPO3. Кислоты Н5Р3Ою и H6P4Oi3 были получены пропускани-
ем растворов их тетраметиламмониевых солей через катионооб-
менную смолу. На фазовых диаграммах пет указаний на су-
ществование полифосфатов, содержащих более четырех атомов
фосфора [2], и только гексафосфат кальция может быть полу-
чен относительно легко. Тем не менее граммовые количества
чистых полифосфатов, содержащих 4—8 атомов фосфора в мо-
лекуле, были получены хроматографическим путем. Основным
исходным материалом при этом служит полифосфорная кисло-
та со средней длиной цепи около пяти звеньев; эта кислота об-
разуется при нагревании 85% -ной водной Н3РО4 в золотой чаш-
ке при 400 °С в течение 12 ч. О (NH4JSiP4Oi3 см. в разд. 23.2.
Соль К4(РзОдМН2) -Н2О содержит ион типа Р3Ою5~, в кото-
ром кислород замещен группой NH2 [3].
Литература. [11 Acta cryst., 1964, 17, 674. [la] Acta cryst., 1975, B31, 2482.
[21 J. Am. Chem. Soc, 1967, 89, 2884; Z. anorg. allg. Chem., 1964, 330, 78. [31 Acta
cryst., 1965, 19, 363.
19.6.10. Поли-ионы, содержащие Р и Cr. С дифосфат- и линей-
ными полифосфат-ионами тесно связан ряд ионов, содержащих
как атомы фосфора, так и атомы хрома в тетраэдрнческоп
координации; в этих ионах от 1 до 4 атомов кислорода групп
РО4 являются общими и для тетраэдров CrO4 [J. Solid State
Chem., 1980, 33, 325]:
-Cr.
/\
(РСгО7)
(РСг3О|3K
Сг
О
Рч
Детали строения первых трех ионов описаны в выше указанной
статье; ион PCr4O163^ [J. Solid State Chem., 1980, 33, 439] име-
ет строение, аналогичное Sir>Oi6 в минерале зуниитс
(разд. 23.12.2).
630 19. Фосфор
19.6.11. Метафосфаты. В метафосфатах каждая группа РО4
обобщает два атома кислорода с образованием колец или бес-
конечных цепей состава (РО3)«"~, аналогичных кремний-кисло-
родным группировкам в метасиликатах. Сама метафосфорная
кислота не получена в кристаллическом состоянии и известна
только в виде стекла или сиропообразного продукта; она, оче-
видно, высокополимеризована. Некоторые метафосфаты пред-
ставляют собой резипоподобиую или роговистую массу; в ряде
случаев эти фазы на самом деле являются смесью различных
метафосфатов. Так, твердое вещество с эмпирическим составом
NaPO3, полученное нагреванием NaNH4HPO4 или NaH2PO4,
оказывается негомогенпым; одна часть его растворима в воде,
а другая не растворима. Но при контролируемых условиях мо-
гут быть приготовлены многочисленные, хорошо идентифициро-
ванные кристаллические соли. Так, быстрым охлаждением рас-
плавленного NaPO3 до температур ниже 200 °С получается хруп-
кое прозрачное стекло, называемое солью Грэма. Функция ра-
диального распределения, полученная из рентгеновских данных
для стеклообразного NaPO3, показывает, что образец состоит
главным образом из длинных цепей, построенных из тетраэдров
РО4, которые соединены двумя общими вершинами и удержи-
ваются друг с другом связями О—Na—О. Однако эти фосфат-
ные стекла содержат также небольшие количества циклических
метафосфатов. Из соли Грэма были выделены пента- и гексаме-
тафосфаты, а существование 7- и 8-членных колец доказано с
помощью бумажной хроматографии. Из этих высокоцикличных
ионов наиболее устойчивы к гидролизу 6-членные.
Двумя наиболее простыми водорастворимыми (циклически-
ми) метафосфатами натрия, известными в качестве эффектив-
ных водосмягчающих агентов, являются Na3P3O9, образующий-
ся при нагревании NaH2PO4 до 550—600 °С, и Na4P4Oi2, который
удобно получать обработкой растворимой формы Р2О5 холодной
суспензией NaHCO3.
Триметафосфаты содержат циклические ионы Р3О93~ (в фор-
ме кресла) с параметрами, указанными па схеме а [1]. Специ-
фическая особенность Na3P3CvH2O [2] заключается в том, что
его структура идентична структуре безводной соли. В послед-
19.6. Фосфорные оксокислоты и их соли 631
ней имеется почти готовая позиция для молекулы Н2О, и необ-
ходимо лишь небольшое расширение структуры, чтобы вместить
-лу молекулу.
Тетраметафосфатное кольцо (б) является мобильным и при-
нимает конфигурацию, «удобную» для его окружения [3]:
2//п в (NH4LP4O12
I в Na4P4O12-4H2O
4 в Т14Р4О1а
Пепта- и гексаметафосфат-ионы изучены в Na4(NH4)P5O15-
¦ 4Н2О [4] и Na6P6Oi8-6H2O [5]. В последнем кристаллогидрате
шесть атомов фосфора в кольце компланарны, а длины связей
составляют: Р—ОКонц 1,47 А, Р—Омост 1,61 А.
Нерастворимые метафосфаты содержат бесконечные цепо-
чечные ионы, в которых длины связей и валентные углы имеют
значения, указанные па схеме а. Некоторые из этих соединений
-ч < )
'О I о'
о о о
'ov' о
о
OI'O
существуют в нескольких формах с различными конфигурация-
ми цепи (РО3)„"~, как это, в частности, имеет место в так назы-
ваемых солях Мадрелла и Курроля (две модификации NaPO3)
[6]. Конфигурации цепей в метафосфатах Li, Na, К, Rb, Ag, Pb
и Bi обсуждаются в разд. 23.12.6. В солях типа Na3H(PO3L
[7] и BiH(PO3L [8] атомы водорода присоединяются к неко-
торым кислородным атомам цепей.
Особый интерес представляет ион г со сдвоенными цепями,
обнаруженный в BiP5OH [8] и в фосфатах некоторых 4/-эле-
ментов [9].
Литература. [1] Acta cryst., 1975, В31, 2264, 2680. [2] Acta crysi, 1965, 18,
226 Г31 Acta cryst., 1974, B30, 1979. [4] Acta cryst., 1972, B28, 732. [51 Acta
cryst 1972 B28, 2740; 1977, B33, 2529. [6] Acta cryst., 1968, B24, 1621. [7] Acta
cryst! 1968! B24, 992. [8] Acta cryst., 1975, B31, 2285. [9] Acta cryst., 1974, B30,
468, 1751.
19.6.12. Mono- и дифторофосфорные кислоты. Промежуточны-
ми по составу между нейтральной молекулой POF3 и анионом
РО43~ являются ионы PO2F2~ и PO3F2-. Были получены соли
632 19. Фосфор
как моли-, так и дифторофосфорпой кислоты, например соли
NH4, К и некоторые другие. Безводная монофторофосфорная
кислота может быть приготовлена с количественным выходом
из безводной метафосфорпой кислоты и жидкого безводного
HF. Она представляет собой маслянистую жидкость, склонную
к стеклообразованию при температуре твердого СО2; эта кис-
лота проявляет значительное сходство с H2SO4.
Как BaPO3F, так и KPO2F2 в структурном отношении сход-
ны с BaSO4, a NaK3(PO3FJ изоструктурен с глазеритом
CaBa3(Si04J. В ряду PO43-, PO3F2-, PO2F2- и POF3, по-види-
мому, проявляется определенная тенденция в изменении длин
связей и валентных углов, на что указывают следующие значе-
ния усредненных параметров:
ро„3~
PO3F2-
PO2F2-
POF3
(а)
(б)
Р -
1
1
1
1
-О, А
,55
,51
,47
,44
р-
1
1
1
- F, А
,59
,57
,52
о- Р-о,
град
109,5
114
122
—
Acta cryst.,
1533
Acta cryst.,
Inorg. Chem.,
344
1975,
1975,
1971
B31,
B31,
, 10,
Ион PO2F2~ обладает заметно деформированной тетраэдриче-
скои конфигурацией и чрезвычайно похож по своему строению
на изоэлектронпую молекулу SO2F2 (в). В настоящее время
получены HPS2iF2 и многие ее соли.
1,585 А
104,5
/ 2~
1,506 А
П4ХО
F ср. с в)
1,530 А
19.6.13. Фосфорамиды и амидотиофосфагы. Соль Na(H3N-PO3)
[la] содержит цвнттер-ноны rH3N-PO32- (г), аналогичные изо-
электронпой сульфаминовой кислоте (д) +H3N-SO3~
(разд. 16.8.2). Связи N—Н—О соединяют ионы в трехмерный
каркас, в полостях которого локализуются ионы Na. В наиболее
позднем исследовании K(H3N-PO3) для длины связи Р—N при-
водится значение 1,800 А [16]. Замещение в PO3NH22^ одного
19.6. Фосфорные оксокислоты и их соли 633
атома кислорода па серу приводит к иону [PO2S (NH2)]2-;
длины связей в этом соединении, показанные на схеме е, полу-
чены из исследования диаммониевой соли [2]. Подобные же
дтины связей обнаружены в диамидотиофосфат-ионе, изученном
в NH4[POS(NH2J] [3].
Н
О
н
О
р
о
2,84 А
V' ^
1,77 А
2-
-1.52 А
О
д о
2,95 А
(среднее)
1,44 А
О
(г ср. с д)
1,76 А
О"
115°
°\
1,53 AN
4,05 А
Л,70 А
XNH2
Литература, [la] Acta cryst., 1964, 17, 671. [16] Acta cryst., 1980, B36, 2391.
[2] Acta cryst., 1969, B25, 1256. [3] Z. anorg. allg. Chem., 1968, 358, 282.
19.6.14. Тиофосфаты. Сера может замещать кислород в ионе
РО43~ с образованием целого набора тиофосфат-ионов otPSO33~
до PS43~\ Все натриевые соли гидратированы и, как правило,
гигроскопичны. Тиофосфаты получают в виде стекол из распла-
вов Na2S—P2S5 с соотношением S:P до 3,5: 1; они крайне не-
устойчивы к воздействию воды. В О-О-диметилдитиофосфате
калия анион имеет структуру, показанную на схеме ж (см. ни-
же) [Acta cryst., 1962, 15, 765].
19.6.15. Другие замещенные фосфорные кислоты и их аналоги.
Замещение водорода в Н3РО4 радикалом R приводит к образо-
ванию замещенных фосфорных кислот OP(OHJOR и
ОР(ОН) (ORJ и в конце концов к образованию эфира фосфор-
ж
сн3о
1,64
_сн3о
Л,96 А
к
о.
_с6н5о
ОС Н
ос6н5
Л52 к у
х
л
о
°-
с/
X
с2н5ох
_с2н5о/
/ОН
чсн3
х
/°
41—985
034 19. Фосфор
ной кислоты OP(ORK. Структура дибензилфосфорной кислоты
НРО2(ОСН2СбН5J [1] описана в гл. 8; молекулы этой кислоты
соединяются в пары связями О—Н—О подобно димерам карбо-
новых кислот. Примерами моно- и дизамещенных ионов могут
служить фепилфосфат-нон (з), изученный в калиевой соли [2]
и диэтилфосфат-ион (и), обнаруженный в бариевой соли [3],
а примером замещенного эфира •— трифеиилфосфат (к) [4].
Замещение в Н3РО4 группы ОН на радикал R приводит к
образованию RPO(OHJ, RsPO(OH) и в конце концов к оксиду
фосфипа R3PO. Структурно исследованы диметилфосфиновая
кислота (л) [о] (см. также разд. 8.5.3) и ее соли [6]. Некото-
рые соли типа M(R2PO2J, где М = Ве, Zn и другие двухвалент-
ные .металлы, обладают интересными свойствами. Семейство
этих соединений включает в свой состав широкий набор ве-
ществ: от высокоплавких кристаллических солей до воскообраз-
ных твердых продуктов и фаз, которые могут быть легко рас-
плавлены и вытянуты в волокна. Линейная цепочка (в цинко-
вом соединении) с чередующимися простыми и тройными мости-
ками —OP(R2)O— упоминалась в гл. 3 как один из интересных
типов цепочечной структуры.
Поскольку группы R2PO2 или R2PS2 могут выступать и как
мостиковые, и как бидентатные лиганды, возможно образова-
ние многочисленных и разнообразных полимерных систем, при-
меры которых приводятся ниже. Первые два — димеры, осталь-
ные—бесконечные линейные молекулы.
\ / асас \ '
ОГО
{Zn[PS2<
Zn'
SPS
/ \
{ZnjPS
/ \
:т-С3Н
^SPS
2(С2Н,
Zn
SPS
bh:
{(acacJCt .
(ф- фенил)
ОРО
РО2<?2
"Ъ\<::
\г \
„OF
— 01
.5]
/
'0
>Ъ—Zn
ОРО
[э]
Литература. [11 Acta cryst., 1956, 9, 327. [21 Inorg. Chem., 1967, 6, 199S.
[31 Acta cryst. 1966, 21, 49. [41 Acta cryst., 1965, 19, 645. [51 Acta cryst., 1967,.
22 678. [61 J. Chem. Soc, A 1968, 757, 763. [71 Inorg. Chem., 1969, 8, 2410.
[81 Inorg. Chem., 1965, 4, 99. [9j Acta cryst., 1969, B25, 2303. [101 Acta cryst.,
1969, B25, 1057.
19.7. Тиофосфаты и родственные соединения 635
19.7. Тиофосфаты и родственные соединения
Простейший тиофосфатный ион — тетраэдрический анион PS43~
(длина связи Р—S составляет 2,05 А)—исследован в ряде со-
единений с общей формулой MPS4 [1]:
Упаковка атомов S
Координация атомов М
BPS4
A1PS4
InPS4
GaPS4
CrPS4
BiPS4
Кубическая плотнейшая
упаковка
Гексагональная плотней-
шая упаковка
Гексагональная плотней-
шая упаковка
Некубическая плотней-
шая упаковка
Тетраэдрическая
Октаэдрическая
6 и 8
GaPS4 упоминается в разд. 4.2 в качестве примера тетраэдри-
ческой слоистой структуры редкого типа, в которой каждая
группа PS4 и GaS4 обобщает одно ребро и две вершины. Атом
висмута слишком велик для размещения в пустотах плотнейшей
упаковки из атомов серы, поэтому его координационный поли-
эдр гораздо менее симметричен, чем в соединениях других ме-
таллов, перечисленных выше.
Более сложные ионы представлены анионами P2S62~ (а),
P2S64- (б), P2S74- (в) и P2S82- (г). В Ag2P2S6 ионы P2S62-, об-
разованные из двух групп PS4, имеющих общее ребро, связы-
ваются через тетраэдрически координированные катионы Ag+
[2]. Указанный ион в структурном отношении сходен с молеку-
лой P2S4(CH3J (разд. 19.8). Ион РгЭб4- найден в солях желе-
2,12 А ©
VV
1,39А
ZO4A
(в
'^s ю«
2,13 А
s / s0
2,03А
1,96 As S
WX/Z,HA
за, кадмия, олова [3], а в Zn4(P2SeK обнаружены оба иона —
п РгЭб2", и РгЭб4" [4], поэтому соединение должно быть пред-
ставлено формулой Zn4(P2S6J2~(P2S6L~. Ион P2S74-, аналогич-
ный Р2О74~, и ион P2S62~ обнаружены в солях серебра [5].
41'
636 19. Фосфор
Пиридин реагирует с P4Si0 с образованием [(pyJH]2P2Sg
[6]; структура содержит циклический ион г, имеющий форму
кресла, как и в случае S6 (ср. с P2S6Br2; разд. 19.10).
Литература. [1] Acta cryst., 1977, ВЗЗ, 1399. [2] Ada cryst., 1978. В34, 3561
[3] Materials Research Bull., 1970, 5, 419. [4] Acta cryst., 1978, B34, 384
[5] Acta cryst., 1977, B33, 285. [61 Acta cryst., 1978, B34, 1378.
19.8. Сульфиды фосфора
В структурном отношении сейчас достаточно полно охаракте-
ризованы следующие сульфиды фосфора (некоторые имеют по
две полиморфные модификации): P4S3, P4S4 (a), P4Ss (а и р),
P4S7 (а и р), P4S9 и P4Si0. Отметим достаточно неожиданный
факт — отсутствие P4Se. Образцы некоторых составов в системе
Р—S могут быть закалены из расплава в виде хрупких стекол
(отношение S : Р = 3,5-=-3,0) или вязких смол (S:P = 1,25h 1,00),
но P4S3, P4S7 и P4Sio в таких условиях очень легко кристалли-
зуются.
Вязкость расплава, содержащего компоненты в соотношении
S:P = 24-3, максимальна при температурах, превышающих
300 °С, как и у чистой серы. Это наводит на мысль о том, что
введение фосфора в расплав серы приводит сначала к развет-
влению и поперечному «сшиванию» цепей, а затем к постепен-
ному разрушению полимерных серных структур из-за образова-
ния низкомолекулярных продуктов.
Все сульфиды фосфора — желтые кристаллические вещест-
ва; их молекулярные массы (определенные либо в растворе
CS2, либо в парообразном состоянии) соответствуют приведен-
ным выше формулам. Все эти фазы получаются при прямом
взаимодействии элементов в различных условиях. Между ними
прослеживаются интересные взаимосвязи. Например, P4S3 легко
соединяется с серой с образованием P4S5 и P4S7, a P4S5 при на-
гревании дает P4S3 и P4S7. Хотя все указанные молекулы опи-
сываются общей формулой P4Sn, они, как это следует из струк-
турных исследований, не содержат группу Р4 в качестве общей
структурной единицы. Конфигурация молекулы 01-P4S4 подобна
конфигурации As4S4 (рис. 20.15, а), но если расстояние As—As
в минерале реальгаре имеет обычное значение, то длины связей
Р—Р очень велики. Для P4S4 выделена и вторая (р) модифика-
ция [Chem. Comm., 1976, 809], состав которой подтвержден с
помощью ЯМР и химического анализа, но монокристаллы этой
модификации, пригодные для структурных исследований, вы-
растить, как выяснилось, невозможно. Полезно также ознако-
миться со строением третьей кристаллической модификации —
As4S4 (разд. 20.5).
19.8. Сульфиды 637
S' / "S
S
р
Р S
По конфигурации молекула P4S5(P) сходна с молекулой
^Структуры pX a-P4S5 и P4S7 изображены на рис. 19.10; для
них характерно наличие связей Р-Р. В первых двух молекулах
связи ординарные, приблизительно такой же длины, как и в ое-
лом фосфоре; однако в P4S7 связь Р-Р ослаблена (длина ее
2 33 А) В серодефицитном (р) P4S7 некоторые наружные атомы
S по-видимому, отсутствуют, и единственная связь Р—Р имеет
О Р
О
О
г д
Рис 19 10 Строение a-P4S5 (a),
(б), P4S3 (в) a-РАЬ (г), fi-PSih @)
u P2S6Br2 (e).
нормальную длину B,26 А). Длины связей Р—S обычно близки
к одной из двух величин: 2,10 А, если сера образует две связи,
и 1,93 А, если речь идет о связи с «наружным» атомом серы,
соединенным лишь с одним атомом фосфора. Аналогичные рас-
стояния найдены в P4S10, структурно подобном молекуле Р4От
(рис. 19,8, разд. 19.5.2). Серусодержащий аналог P4O6Jie из-
вестен; в то же время имеется сульфид P4S9, подобный Р4О9.
Его структура производится из структуры P4Si0 удалением од-
638 19. Фосфор
Таблица 19.7. Сульфиды, тиогалогениды фосфора и родственные молекулы
Молекула
P4S3
a-P4S4
a-P4S3
3-P4S5
a-P4S7
3-P4S7
P4S9-.*
P4S9
P4S,0
P2S6Br2
a-P4S3I2
3-P4S3I2
P2S4(CH3b
P2S4(u3o-C3H7OL
P—S-расплав
P4Sec.I2
p—p, К
2,235
2,350
2,25
2,295
2,33
2,36
2 20
2,22
2,22
P-S, A
2,090
2,108
2,11 (средн.)
2,12 (средн.)
2,10 (средн.)
2,11
2,10
2,10
2,12
2,14
2,07
P—Se
2,24
P=S, A
—
1,94
—
1,92
1,93
1,91
1,98
(P—I 2,49)
1,95
1,91
P—I
2,47
Литература
Acta cryst., 1957, 10, 574
Acta cryst., 1978, B34,
1326
Acta cryst., 1965, 19, 864
Acta cryst., 1975, B31,
2738
Acta cryst., 1965, 19, 864
Acta cryst., 1965, 18, 221
Z. anorg. allg. Chem.,
1969, 366, 152
Acta cryst., 1969, B25,
1229
Acta cryst., 1965, 19, 864
Inorg. Chem., 1965, 4,
186
Acta cryst., 1959, 12, 455
J. Chem. Soc. A, 1971,
1100
J. Chem. Soc, 1964, 4065
Inorg. Chem., 1970, 9,
2269
J. Inorg. Nucl. Chem.,
1963, 25, 683
Acta cryst., 1970, B26,
2092
кого из концевых атомов серы. Формула P4S9 поэтому должна
записываться как PinPv3Sg. Валентные углы в большинстве
случаев имеют значения, лежащие в интервале 100—115°; ис-
ключения составляют углы в кольце Р3 сульфида P4S3, углы в
четырехугольном кольце P3S сульфида P4S5 (усредненная вели-
чина угла составляет 87°) и внешний угол A25°) в P4S5. Соот-
ветствующая литература приведена в табл. 19.7.
С сульфидами в структурном отношении тесно связаны мо-
лекулы а и б, содержащие как простые, так и двойные связи
Р—S (литература указана в табл. 19.7).
114
Н3С
S2-14A СН3
. \ /1,83 А
95° Р
/ \1,95А
S
R R
\ /
2,11 А
s
2,07 А
R R
19.9. Тиогалогениды 639
19.9. Тиогалогениды фосфора
Известные на сегодняшний день тиогалогениды фосфора при-
надлежат четырем классам:
1) PSX3 (X = F, Cl, Br): тетраэдрические молекулы S = PX3,
информация о которых уже подытожена в табл. 19.4 (разд. 19.4).
2) P2S2I4' строение пока не известно, но, по-видимому, моле-
кула имеет структуру днфосфина I2SP—PSI2 (разд. 19.4).
3) P2S5Br4 и P2SeBr2: строение P2S5Br4 пока неизвестно.
В основе строения молекулы кристаллического P2SfiBr2 (полу-
ченном взаимодействием Вг2 и P.iS.3) лежит кольцо PjS.; в фор-
ме скрученной ванны, к каждому атому фосфора которой при-
соединено еще по два атома либо брома (длина связи Р—Вг
2,07 А), либо серы (расстояние Р—S 1,98 А). По-видимому, по-
рядок присоединения этих атомов полностью произволен. Ис-
ключительно податливая конфигурация молекулы в виде скру-
ченной ванны является, вероятно, той конфигурацией, которая
сводит к минимуму отталкивание между двумя несвязанными
атомами, что согласуется с величинами S-диэдрических углов,
близкими к 100°. Величины днэдрических углов при атомах
фосфора малы D0 и 42°) — рис. 19.10, е и табл. 19.7.
4) P4S3I2. Эта фаза существует в двух модификациях.
а-Форма получается при взаимодействии элементов в растворе
CS2 или при нагревании р-формы с избытком иода. Молекула
а-модифнкации (рис. 19.10, г) состоит из одного 6-членного и
двух 5-членных колец, но взаимное размещение атомов фос-
фора и серы при этом отличается от наблюдаемых в P4S3. Это
соединение иллюстрирует интересную особенность фосфоро-сер-
ных соединений — легкость перераспределения атомов фосфора
и серы. Взаимодействие P4S3 с иодом в мягких условиях приво-
дит к образованию E-P4S3I2- Структура этой модификации
(рис. 19.10,5) гораздо ближе к структуре P4S3: в последней
лишь разрывается одна связь Р—Р и образуются две связи
Р—I. Молекула P4Se3I2 имеет такую же структуру.
19.10. Циклические соединения фосфора
19.10.1. Соединения, содержащие кольца Рп. Уже упоминалось
о том, что в фосфидах некоторых металлов возникают системы
связанных атомов фосфора и что пары связанных атомов Р—Р
имеются в Р2Н4, замещенных дифосфинах Р2СЦ и Р214 в неко-
торых фосфит-ионах, а также в молекулах типа R2SP—PSR2.
Системы Р—Р и Р—Р—Р составляют часть колец в сульфидах
фосфора, а молекула Р4 построена из колец Р3. Известны так-
же молекулы, в основе структуры которых лежат более много-
640 19. Фосфор
численные кольца Р„; уже упоминалось одно такое соедине-
ние— кислота [РО(ОН)]6.
R
RP—PR
а
R
Циклические молекулы а я б, в которых в качестве R высту-
пает группа —CF3, получают действием ртути на F3C-PI2.
Кольцо Р4 [1], так же как и кольцо Ps [2], не планарно; валент-
ные углы Р—Р—Р в них составляют (в среднем) 85 и 101° со-
ответственно, а связи Р—Р имеют обычные длины (близкие к
2,2 А). Соединения RP = PR, которые первоначально считались
аналогами азосоединений, оказались циклическими полимера-
ми. Это относится, в частности, к (СНзРM, фосфобензолам
(РСбНэЬ и (РС6Н5N (три полиморфные модификации). Пен-
тамер содержит непланарное кольцо Р5 (а, см. ниже), диэдри-
ческие углы в котором имеют величины от 3 до 61° (усред-
ненное значение 38°) [3], а гексамер содержит 6-членное коль-
цо (б) с конфигурацией в форме кресла i[4]; шесть фенильных
групп расположены в экваториальных позициях, и диэдрические
углы составляют 85° (что сопоставимо со значениями углов 69°
в (CsPO2N (см. разд. 19.6.4) и 89° в (AsC6H5N). Сопоставление
этих циклических структур проведено в работе [5J. Реакция
между (РС2Н5L (см. выше схему а) и Мо(СОN интересна тем,
что приводит к превращению кольца Р4 в кольцо Ps; конечным
ее продуктом является (COLMo(PC2H5)s (схема в) [6].
гмА
Et
Mo EtP
PEt
Et
94,6°
1,84 A
Литература. [1] Acta cryst., 1962, 15, 564. [2] Acta cryst, 1961, 14, 250; Acta
cryst., 1962, 15, 509. [3] J. Chem. Soc, 1964, 6147. [41 J. Chem. Soc, 1965, 4789.
[5] Acta cryst., 1962, 15, 708. [6] J. Chem. Soc, A 1968, 1221.
19.10.2. Соединения, содержащие системы связанных атомов
азота и фосфора. Выше уже упоминались некоторые простые
ионы, содержащие связи N—Р, а именно O3P-NH3~ и O2SP-
•NH22- (разд. 19.6.13) и ОзР-ЫН-РОз4- (разд. 19.6.8). Хлор-
ный аналог последнего (а) —одно из многих соединений, полу-
чающихся в результате реакции РС15 с NH4C1 при различных
19.10. Циклические соединения фосфора 641
условиях; соль (Cl3PNPCly) (PC16) П] может быть синтезирована
путем взаимодействия РС15 с S7NH или S4N4. Усредненное зна-
чение длины связи Р—С1 A,94 А) сопоставимо с соответствую-
щей величиной в РС14+, а в РС16^ она составляет 2,15 А. Самой
простой циклической системой является четырехчленное кольцо
Рис. 19.11. Строение (CH3NPC13J (а) и (HN-PO2K3~ (б).
P2N2, которое было обнаружено в (СН3ЫРС1зЬ[2] (рис. 19.11,а),
в обоих (цис и транс) изомерах циклодифосфазана (б) [3],
а также в его трамс-метильном аналоге [4]
а
CL.
©
CI
Et
7,54 А
свн
l
><
^
I
Et
7,69А
Конфигурация молекулы (CH3NPC13J может быть описана как
4-членный цикл, построенный из двух молекул РСЦ, в каждой
из которых один атом хлора замещен на мостиковый атом азо-
та: в одной — в аксиальном, в другой —в экваториальном по-
ложении. Значения углов и длин связей очень близки к соот-
ветствующим величинам в PCI5.
Реакция между РС15 и CH3NH3C1 приводит к получению не
только (CH3NPC13J, но и P4(NCH3NC18 [5] (в), в котором фос-
фор имеет тригонально-бипирамидальную координацию, как и
в случае более простой молекулы, изображенной на рис. 19.11, а.
Ряд колец (PN)n с большим числом членов встречается в
циклофосфазенах. Фосфонитрилхлориды (PNC12)« могут быть
приготовлены совместным нагреванием PCls и NH4CI, например,
в тетрахлорэтане. Фракция, экстрагируемая в легком бензине,
состоит из совокупности кристаллических циклических полиме-
642 19. Фосфор
19.10. Циклические соединения фосфора 643
ров (РГ\тС12),г с я = 3-^8; остаток представляет собой масло, ко-
торое содержит полимеры с п равным по меньшей мере 17. Это
нерастворимое в бензине вязкое масло имеет общий состав
(PNClo) - PCI5, и молекулы его, по-видимому, представляют со-
бой линейные полимеры С1-(РМС12)ЛРС14. При кипячении это
масло превращается в резиноподобный материал (PNC12),,, яв-
ляющийся, по всей вероятности, линейным полимером:
Cl,
а,
Аналогичные фториды получены вплоть до члена с /г= 17
(PNF2)i7- Соединения (PNF2K и (PNF2L, например, являются
твердыми летучими веществами, устойчивыми до температуры
300 °С, выше которой они превращаются в бесцветные жидкие
полимеры.
Кольца (PN)n достаточно устойчивы. Так, (PNC12L может
быть нагрет до 250 °С без дальнейшей полимеризации, а депо-
лимеризация наступает только при температурах выше 350 °С.
Этот хлорид можно кипятить в воде, кислоте или щелочи без
заметного разложения, хотя при встряхивании его с водой в
эфирном растворе медленно гидролизуется. Но даже тогда
кольцевая система не разрушается (см. ниже). Водный рас-
твор NH3 превращает (PNC12K в P3N3C14(NH2J, а жидкий
NH3 образует с этим хлоридом P3N3(NH2N.
Рентгеновское исследование кристаллических соединений
(PNX2K с X = F, C1, Вг, SCN, С6Н5 и т. д. показало, что кольцо
P3N3 в (PN:F2K [6а] и в (PNC12K [66] имеет почти планарное
строение с углами 120° и шестью эквивалентными связями Р—N
длиной 1,56 А (ср. с длиной, предполагаемой для простой связи:
1,78 А) и отчетливо выраженным ароматическим характером
системы, в которой фосфор использует свои d-орбитали. Во всех
этих соединениях оба лиганда X присоединяются к атому фос-
фора, и длины связей Р—F A,51 А) и Р—С1 A,99 А) соответ-
ствуют длинам ординарных связей.
Восьмичленное кольцо P4N4 по своей геометрии сильно раз-
личается в соединениях P4N4X4, а еще больше в различных изо-
мерах P4N4C14(C6H5L [7а] — ситуация здесь сравнима со слу-
чаем тетраметафосфатного кольца (разд. 19.6.11). Цикл P4N4
в (PNF2L планарен [76], связь Р—N в нем относительно корот-
ка A,51 А), углы составляют: Р—N—Р 147°, a N—Р—N 123°;
в устойчивой модификации P4N4C18 [8] кольцо имеет конформа-
цию кресла, а в менее устойчивой (К) модификации этого хло-
рида [9] кольцо приобретает форму ванны. Такая же геометрия
сохраняется и в [NP(CH3J]4 [10], и в [(NPMe?LH]CuCl3 [11].
При взаимодействии [NPMe2]4 с галогенидами некоторых пере-
ходных металлов в метилэтилкетоне получаются соединения
типа [(NPMe2LH]CuCl3 и [(NPMe2LH]CoCl4. В первом сое-
динении группа СиС13 присоединяется к одному из атомов азота
кольца, а атом водорода — к противоположному атому азота,
как это показано на схеме а. Координационное окружение
Си(II) имеет форму искаженного квадрата; валентные углы в
кольце составляют 143, 134° и четыре по 97° (в среднем). В ко-
бальтовом соединении [12] к кольцу присоединяется только
атом водорода (схема б) и кристалл содержит дискретные
тетраэдрические ионы (СоС14J~. Интересная особенность струк-
тур заключается в образовании коротких связей N—Н---С1
C,20 А). В кобальтовом соединении кольца имеют конформа-
цию как ванны, так и седла.
а
v
t
N
Г
N
Н
Н
Приведены также рентгеновские исследования молекул, со-
держащих 10-, 12- и 16-членные кольца. Кольцо P5N5, подобно
P4N4, видоизменяет свою форму. В PsNsCls оно планарно [13а],
и в нем нет чередования длин связей (усредненное значение
расстояния Р—N составляет 1,52 А), но в p5Ns(CH3)io оно не-
планарно [136] (расстояние Р—N составляет 1,59 А, углы
N—Р—N 116-7-120°, Р—N—P 132-M360); непланарно оно и
в [Р5^(СНз)юН2]2+ [13в]. 12-членное кольцо в P6N6(NMe2),2
[14] сильно гофрировано, все связи в нем имеют длину 1,56 А
(«внешние» связи Р—N 1,67 А), а углы в кольце (в азотных
вершинах) составляют 148° и (в фосфорных вершинах) 120°.
16-членное кольцо в P8N8(OMe)i6 [15] состоит из двух почти
пленарных 6-членных сегментов в двух параллельных плоско-
стях, соединенных ступеньками; длина связи Р—N та же, что
и в 12-членном кольце. Выполнены структурные исследования
и более сложных бициклических фосфазенов. В соединения);
типа виг кольца приблизительно планарны [16], различие г
длинах связей Р—N невелико, длины всех связей близки у
1,60 А. В б связь Р—Р ординарная B,21 А); в г длины связей
644 19. Фосфор
Ni—N и Ni—S составляют 1,94 и 2,23 А соответственно.
В д противоположные углы кольца P4N4 соединяются азотным
СН3 фг E^HN (NMe2J
(Me2NJ NMe2
3 ^
9S2f-N CH3 N-P02
\ /A Z4
^P-n' с^з N-P02
; (ф-фенил)
в
мостиком [17], в результате чего образуются два 6-членных
кольца. Клеточная структура молекулы Рг^(СНз)б (е) [18]
аналогична структуре N(CH2CH2KN.
144А
Гидролиз галогенидов приводит к образованию соответст-
вующих циклических метафосфимовых кислот или их солей
типа Na3(PO2NH3-4Hl2O). Углеродным и серосодержащим ана-
логами этих кислот являются полимеризованные формы циа-
нуровой кислоты и сульфимида:
О(ОН) 02
о
HST
ОС
NH
СО
HN'
SNH
HN"
н
цшнцравая
кислота
(OH)OP. .PO(OH)
Н
триметафоаримовая
кислота
4NH
.SO,
H
трисульфимид
В противоположность планарному 6-членному кольцу в галоге-
нидах и в изотиоцианате в триметафосфимат-ионе в натриевой
соли кольцо имеет конформацпю кресла (рис. 19.11,6) [19],
а связь Р—N заметно длиннее A,68 А), чем в (PNX2L. Это
подтверждает, что к каждому атому азота присоединен один
атом водорода, как было показано выше для случая кислоты
[20]. В полностью метилированном соединении (ММеK(РО2Ме)з
[21] связь Р—N имеет длину 1,66 А, близкую к соответствую-
щей величине в триметафосфимат-ионе, а кольцо имеет форму
искаженной ванны. Тетраметафосфиматное кольцо подобно
19.10. Циклические соединения фосфора 645
8-членному кольцу в (PNX2L легко варьирует свою форму.
Оно имеет копформацию ванны [4] в (NH4L[P4N4HiO8]-2H2O
[22] и в (NMeL(PO2MeL [23] (связь Р—N 1,67 А; Р = О 1.47 А
и Р—О 1,58 А), конформацию кресла в калиевой соли (тетра-
гидрате) [24] и конформацию седла в цезиевой соли (гексагид-
рате) [24]. Изучение дигидрата тетраметафосфимовой кислоты
[25а] подтверждает, что она, как и триметафосфимовая кисло-
та, имеет иминное строение.
Гетероциклические системы, содержащие атомы N, Р и S,
включают кольцо N3PS2 в N3PS2O2CI4 {ж) [256],
в N3(PC12) (SOFJ [26] (с расстояниями S—F 1,57 А), кольца в
которых практически плоские, а также в интенсивно-синем
N3PS2[NH(SiMe3)]2 (з) [27]. Пример кольца N3P2S приведен на
схеме и [28]. Анион в K6(Pi2Si2Ni4) [29] служит примером
сложной клеточной структуры.*
Ж
1,58 А
1,42 А
и
p
1,96 A—V \
Г1 Cl
P^
C12P
N
-.N
Литература. [11 Acta crysi, 1980, B36, 1014. [2] Z. anorg. allg. Chem., 1966,
342, 240. [3] Acta cryst., 1973, B29, 1439. [4] Acta cryst, 1975, B31, 2333.
[5] Z. anorg. allg. Chem., 1967, 351, 152. [6a] J. Chem. Soc, 1963, 3211. [66] J.
Chem. Soc, A 1971, 1450. [7a] Acta cryst., 1974, B30, 2861. [76] J. Chem. Soc,
1961, 4777. [81 Acta cryst., 1968, B24, 707. [9] Acta cryst., 1962, 15, 539. [10] J.
Chem. Soc, 1961, 5471. [11] J. Chem. Soc, A, 1970, 455. [12] J. Chem. Soc,
A 1970, 460. [13a] J. Chem. Soc, A, 1968, 2317. [136] Acta cryst., 1977, B33,
295. [13b] J. Chem. Soc, D 1974, 382. [141 Acta cryst., 1968, B24, 1423. [15] J.
Chem. Soc, A, 1968, 2227. [161 Acta cryst., 1976, "B32, 3078. [17] Acta cryst.,
1977, B33, 443. [18] Inorg. Chem., 1971, 10, 2591. [191 Acta cryst., 1965, 19, 596.
[201 Z. anorg. allg. Chem., 1976, 419, 139. [2Ц J. Chem. Soc. A, 1968, 3026.
[221 Acta cryst., 1964, 19, 603. [231 Acta cryst., 1977, B33, 1367. [241 Acta cryst.,
1971, B27, 740; 1976, B32, 435. [25a] Acta cryst., 1977, B33, 605. [2561 Acta cryst.,
1969, B25, 651. [26] Acta cryst., 1974, B30, 2795. [271 Acta cryst., 1977, B33, 2272.
[281 Acta cryst., 1976, B32, 1192. [29] Z. Naturforsh , 1976, 31b, 419
* Детальный обзор по стереохимии циклических метафосфиматов и род-
ственных соединений, а также ссылки на последние работы см. в сборнике
Edvances in inorganic Chemistry. Edv. in Sci. and Techn. in USSR, Chem. Scr.
{M.: Mir, 1983, p. 60—103). — Прим. ред.
20. МЫШЬЯК, СУРЬМА, ВИСМУТ
20.1. Элементные мышьяк, сурьма, висмут
Обычные (металлические) модификации мышьяка, сурьмы и
висмута изоструктурны между собой и имеют слоистые струк-
туры (разд. 3.2), в которых каждый атом окружен тремя рав-
ноудаленными соседями, а следующий набор из трех соседей
располагается на несколько большем расстоянии. Различие
между этими двумя наборами соседей становится меньше при
переходе от As к Bi, как это видно из следующих данных:
Расстояние
до 3 бли-
жайших ато-
мов, А
Расстояние
до 3 более
удаленных
атомов, А
Угол
М —М-М,
град
Литература
As
Sb
Bi
2,52
2,91
3,07
3,12
3,36
3,53
96,65
95,6
95,45
J. Appl. Crystallogr., 1969, 2, 30
Acta cryst., 1963, 16, 451
Acta cryst., 1962, 15, 865
Желтые (неметаллические) модификации мышьяка и сурь-
мы метастабильны, они получаются конденсацией пара при
очень низких температурах. Мышьяк образует также поли-
морфную форму, изоструктурную с черным фосфором; ее мож-
но получить при 100—175 °С в присутствии ртути [Z. anorg.
allg. Chem., 1956, 283, 263]. Желтые модификации превращают-
ся в металлические при нагревании или освещении; они, вероят-
но, состоят из тетрамерных молекул, но вследствие неустойчи-
вости этих форм структуры их пока не изучены. Молекула As4
в паре над мышьяком имеет такую же тетраэдрическую конфи-
гурацию, как и молекула Р4 (As—As 2,44 А). Масс-спектромет-
рические исследования показали, что в парах над жидкими
смесями этих элементов существуют молекулы As4, Sb4 и Вц
и любые комбинации из этих атомов. Нет никаких указаний на
существование у мышьяка новых модификаций, образующихся
под воздействием высокого давления; в то же время под давле-
нием и сурьма, и висмут испытывают структурные изменения в
результате чего формируется простая кубическая структура
(Sb—Sb 2,97; Bi—Bi 3,18 А), а при более высоких давлениях
сурьма образует гексагональную плотнейшую упаковку, а вис-
мут— кубическую (Bi—8Bi 3,29 А).
20.2. Структурная химия As, Sb и Bi 647
20.2. Структурная химия As, Sb и Bi
В ряду Р, As, Sb, Bi происходит постепенное изменение свойств
элементов от неметаллических к металлическим. Далее рас
сматривается стереохимия, главным образом, соединений
мышьяка и сурьмы, так как висмутовые аналоги простых моле-
кул этих элементов либо гораздо менее устойчивы, либо не по-
лучены вовсе. Ни один из рассматриваемых элементов не обра-
зует простых молекул, содержащих связи с кратностью, большей
единицы. Например, AsCF3 и AsCH3 в структурном отношении
не похожи на азометан НзС—N = N—СНз; они образуют цикли-
ческие молекулы с простыми связями As—As. AsCHj. изострук-
турен с (PCF3L'i он содержит непланарные кольца As4; валент-
ный угол при As составляет 83,6°, диэдрический — 37°, расстоя-
ние As—As равно 2,45 А [1]. Арсенометан существует в двух
формах: желтой и красной. Кристаллы желтой модификации
состоят из молекул (AsCH3M, имеющих форму гофрированных
5-членных колец (средний валентный угол при As 102°, As—As
2,43 A, As—С 1,95 А) [2]. В то же время арсенобензол состоит
из 6-членных колец [As(C6H5)]6 с конфигурацией кресла
(As—As 2,46 А, а валентный угол при As 91е) [3]. Можно при-
вести примеры циклических структур, содержащих чередующие-
ся атомы мышьяка и азота; это [(CsH5JAsNJ3 [4],
[(СбНэЬАвМ^ [5] и As4(NMeN [6]. Последнее соединение полу-
чено при взаимодействии AsCl3 и CH3NH2; в структурном отно-
шении оно похоже на Ы4(СН2)б- (Структура CoAs, содержащая
кольца As4) упоминалась в разд. 6.6.) Среди немногочисленных
молекул со связями As—As значительно более короткими, чем
связи в As4 B,44 А), можно назвать структуры а и б [7], содер-
жащие тетраэдрические остовы, родственные по конфигурации
молекуле As4. Наблюдаемые различия между химией фосфора
а
2.27 А
•As 2>31K
@- фенил)
2.59 А
и мышьяка включают, например, такой интересный факт, что
тля мышьяка известен лишь один оксогалогенид AsOF3. Все три
элемента As, Sb и Bi образуют гидриды МН3. При получении
648 20. Мышьяк, сурьма, висмут
и ЭЬНз (восстановлением трихлоридов соответствующих
металлов в водном растворе НС1 гидридоборатом натрия) в
качестве вторичных продуктов образуются As2H4 и Sb2H4; появ-
ление последующих членов гомологических рядов AsnHm и
Sb«Hm не обнаружено.
Помимо соединений, в которых висмут существует в обыч-
ных степенях окисления III и V, этот металл образует также
«субгалогениды», а также многоядерные катионы и анионы,
в которых имеются связи металл — металл. В структурах BiBr
[8] и обеих кристаллических модификациях Bil [9] осуществля-
ется цепочечный мотив, в котором атомы Bi связываются двумя
совершенно различными способами. Половина атомов образует
псевдооктаэдрические связи с 4X+lBi, тогда как остальные
образуют три пирамидальные связи с 3 атомами висмута.
Bii2Cli4 (разд. 20.2.9) включает ионы Bids2", Bi2Cl82~ и Bi95+.
Из раствора висмута в расплаве NaAlCU могут кристаллизо-
ваться соединения Bi4AlCl4 и Bi5 (A1C14) з, содержащие, возмож-
но, ионы Bi82+ и Bi53+ [10]. Об анионе Bi42~ см. разд. 7.5.1.
Конфигурации связей, приведенные в табл. 20.1, были уста-
новлены на основе структурных исследований простых ионов
или ковалентных молекул указанных там элементов. Наличие
Таблица 20.1. Стереохимия As, Sb и Bi
Общее число
электронных
rtap
4
5
е
7
Тип связи
sp3
sp3d
зрЫ*
Число непо-
деленных
пар
0
1
0
1
0
1
1
Конфигурация связей
Тетраэдрическая
Пирамидальная
Тригонально-бипирами-
дальная
См. текст
Октаэдрическая
Квадратно-пирамидаль-
ная
Октаэдрическая
Объект ис-
следования
As+
As, Sb, Bi
СЛ СЛ
As-, Sb-,
(Bi)
Sb
Sb
20.2. Структурная химия As, Sb и Bi 649
неподеленной электронной пары подразумевает присутствие
валентного состояния М(Ш), в противном случае-—M(V).
Скудность информации о висмуте обусловлена более металли-
ческим характером этого элемента, вследствие чего он не об-
разует многих простых ковалентных молекул, известных для
мышьяка и сурьмы. Октаэдрические связи, формируемые вис-
мутом, например в кристаллическом пептафториде, имеют су-
щественно ионный характер.
Для координационного числа 7 (sp3d3) следует ожидать осу-
ществления пентагоналыю-бипирамидальной конфигурации свя-
зей. В гл. 7 отмечалось, что SbBr63~ должен бы образовывать
искаженный октаэдр, так как он содержит валентную группу
из 14 электронов, включая одну неподеленную пару. На самом
деле конфигурация этого иона мало отличается от правильной
октаэдрической (разд. 20.2.6).
с„н<
С5Н5(СО), Мп
140° Mn(COJCsHs
В табл. 20.1 не включены примеры «аномальных» конфигу-
раций связей, проявляемых в соединениях с необычными ли-
гандами. Примером может служить планарная молекула
(CH)Sb[C)C5H5]2 [11].
Литература. [1] Ada cryst., 1971, В27, 476. [2] J. Am. Chem. Soc, 1957, 79,
859. |3] Ada cryst., 1961, 14, 369. [4] Inorg. Chem., 1973, 12, 2304. [5] J. Chem.'
Soc, D 1974, 2527. [6] Z. anorg. allg. Chem., 1967. 350, 9. [71 J. Am. Chem. Soc.
1969, 91, 5631, 5633. [8] Z. anorg. allg. Chem., 1978, 438, 53. [9] Z. anorg allg'
Chem., 1978, 438, 37. [10] Inorg. Chem., 1969, 7, 198. [Ill Angew. Chem., 1978,
17, 843.
20.2.1. Молекулы МХ3. Валентная группа 2, 6. Тригонально-пи-
рамидальная форма многих молекул МХ3, образованных
мышьяком, сурьмой и висмутом, установлена с помощью элек-
тронографии или микроволновой спектроскопии этих веществ
в парах или рентгеновского изучения их в твердом состоянии
(табл. 20.2).
20.2.2. Тетраэдрические ионы МХА~. Валентная группа 8. Для
мышьяка и сурьмы не известно аналогов простым галогенидам
аммония или фосфоння. Тетраэдрическая конфигурация заме-
щенных арсонневых ионов уже обсуждалась на примере кри-
сталлических [As(CH3L]Br [J. Chem. Soc, 1963, 4051] в
[As(C6H5L]l3.
42—935
Таблица 20.2. Структурные данные по молекулам МХ3а
AsH3
As(CH3K
As(CF3K
AsF3
AsCl3
AsBr3
Asl3
AsCl3
AsBr3
Asl3
As(SiH3K
As(CH3)I2
AsBr(C6H5J
As(CNK
As(CNJCH3
1,519
1,96
2,053
,706
2,161
2,33
2,55
2,17
2,36
2,59
2,355
2,54
2,40
91,83
96
100
96,2
98,7
99,7
100,2
97,7
97,7
99,7
94
104
С—As—С 106
С—As—Br 95
90,5
94
Микроволн.
»
Электроногр.
Микроволн.
»
Электроногр.
Дифракция рентген, лу
чей
То же
Электроногр.
Дифракция рентген, лу
чей
То же
Phys. Rev., 1955, 97, 684
Spektrochim. Acta, 1959, 15, 473
Trans. Faraday Soc, 1954, 50, 463
Bull. Chem. Soc. (Japan), 1966, 39, 71
Inorg. Chem., 1970, 9, 805
J. Mol. Struct, 1976, 35, 67, 81
Сотр. rend. (Paris), 1978, 287C, 259
Z. Kristallogr., 1967, 124, 375
Acta cryst, 1980, B36, 914
J. Chem. Soc, A 19G8, 3006
Acta cryst., 1963, 16,922
J. Chem. Soc, 19G2, 2567
Acta cryst., 1966, 20, 777
ЫI'з
SbH3
Sb(CF3K
SbCl3
SbBr3
a
(крист.)
3
Sbl3
BiCb
BiCl3
BiBr3
Bi(CH3K
1,92
1,707
2,202
2,33
2,34 (одна)
2,37 (две)
2,49
2,50
2,49
2,719
См. текст
2,50
2,48
2,63
2,27
87,3
91,3
100,0
97,2
91 (один)
96 (два)
98
95
95
99,1
84; 94 (два)
100
100
Э6,7
» »
Микроволн.
Электроногр.
»
Дифракция рентген
чей
Электроногр.
Дифракция рентген
чей
То же
Электроногр.
Дифр. рентген, лучей
Дифракция рентген,
чей
Электроногр. 1
)
лу
лу
лу-
J. Chem. Soc, A 1970, 2751
Phys. Rev., 1955, 97, 680
Trans. Faraday Soc, 1954, 50, 463
Bull. Chem. Soc. (Japan), 1973, 46,
404
Acta cryst., 1979, B35, 3020
Bull. Chem. Soc. (Japan), 1973, 46,
413
J. Chem. Soc, 1964, 4162
|j. Chem. Soc, 1962, 2218
Acta Chem. Scand., 1963, 17, 2573
. Kristallogr., 1966, 123, 67
Acta cryst, 1971, B27, 2298
Trans. Faraday Soc, 1940, 36, 681
. Mol. Struct., 1973, 17, 429
О структурах кристаллических галогенидов см. разд. 20.2.8.
¦652 W. Мышьяк, сурьма, висмут
Имеется много соединений, в которых As(V) и Sb(V) фор-
мируют тетраэдрические связи (валентная группа 8), например
GaAs, GaSb, InAs и InSb, которые, подобно соответствующим
фосфидам, кристаллизуются в сфалеритовой структуре. Тетра-
эдрические связи образуются As(V) в ионе AsO43~ в ортоарсе-
нитах (и арсиноксидах), но следует обратить внимание на со-
вершенно иное поведение Sbv в ее оксосоединениях (о чем речь
дальше).
20.2.3. Ионы МХс- Валентная группа 2, 8. Образование четы-
рых связей атомом М(Ш) в валентной группе 2, 8 возможно
в виде двух близких между собой конфигураций а и б. Строе-
ние галогенидного иона МХ4~ иока еще не известно; одноядер-
М
°
с-о
он
он
сн-о
:ные ионы (МХ4)~, содержащие As, Sb или Bi, вероятно, не су-
ществуют. Тетрахлороарсениты (например, (CH3LN-AsCl4)
уже получены, но они, по-видимому, не содержат конечных
.ионов (AsCl4)^, а состоят из цепочечных ионов, аналогичных
(SbCl4) «л~ и т. п., описанных далее (разд. 20.2.9).
Представитель этой необычной валентной группы B, 8)
:найден для Sb (III) в антимоннлтартратах. В калиевой соли
¦KSbC4H4O7- V2H2O i[l] конфигурация связей атома Sb оказа-
лась близкой к структуре а, а в аммонийной соли [2] она бли-
же к структуре б. Строение аниона SbC4H4O7~ изображено
на схеме (е). Аналогичное строение имеет анион и в
Rb[Bi(SCNL] ,[3].
Литература. [1] Acta cryst., 1965, 19, 197. [21 ДАН СССР, 1964, 155, 545.
[3] Acta cryst., 1976, В32, 2319.
20.2.4. Пентагалогениды и молекулы МХ5. Валентная группа 10.
Для мышьяка, сурьмы и висмута известны следующие пента-
галогениды:
AsF5 SbF5 BiF6
SbClg
Тригонально-бипирамидальная конфигурация молекул AsFs
11 SbCls в парах была установлена методом электронографии;
та же стереохимия подтверждена для кристаллического SbCls
(табл. 20.3). Показано, что такую же геометрию имеют и неко-
20.2. Структурная химия As, Sb и Bi
Таблица 20.3. Структурные данные по пентагалогенидам и их аддуктам
Молекула
Расстояние
М — X, А
Расстояние
Sb—0. А
Литература
SbF5
SbCl5 (крист.)
(жидк.)
(пар)
SbF5-SO2
SbCls-РОС!з
SbC!5-OC(H)-N(CH3J
BiF5 (крист.)
1,711 (аксиал.)
1,656 (экват.)
Не определена
КР-спект-
роск.)
2,34 (аксиал.)
2,29 (экват.)
2,43 (аксиал.)
2,31 (экват.)
1,85
2,33
2,34
1,90
2,13
2,17
2,05
Inorg. Chem, 1970, 9, 805
J. Chem. Phys, 1972, 56,
5829
J. Am. Chem. Soc, 1959,
81, 811
J. Phys. Chem, 1958, 62,
364
APL, 1940, 14, 78
J. Am. Chem. Soc, 1968,
90, 1358
Acta Chem. Scand, 1963,
17, 353
Acta cryst, 1966, 20, 749
Z. anorg. allg. Chem..
1971, 384, 111
торые другие молекулы:
Sb(CH)
р у As(C6H5M [1], Sb(C6H5LOH, [2],
Sb(C6H5LOCH3 и Sb(C6H5K(OCH3J [3], Sb(CH3KCl2 [4] и
В1(С6Н5)зС12 [5J. Молекулы с кислородными мостиками вклю-
чают структуру а [6], а также соответствующее метильное сое-
а
1,985 A
.Sb 140° bb 2,24
V /IXN
динение, которое образует неупорядоченные кристаллы (Sb—О
2,10 А; валентный угол при кислороде 126—129°) [7], соответ-
ствующие висмутовые аналоги и структуру б [8J; последняя
примечательна тем, что содержит Sb (V) как с КЧ 5, так и
с КЧ 6, а также тем, что использует для образования мостиков
все три атома кислорода группы СО3. В противоположность
аналогичным соединениям фосфора и мышьяка Sb(C6HsM [9]
имеет тетрагонально-пирамидальную конфигурацию с атомом
Sb, расположенным на ~0,5 А выше основания пирамиды,
и с углом в 102° между аксиальными и экваториальными свя-
зями. В настоящее время это — единственный пример, когда
654 20. Мышьяк, сурьма, висмут
молекула элемента V группы с 10-электронной валентной груп-
пой не является тригонально-бипирамидальнои.
BiF5 обладает структурой a-UF5 (разд. 28.2.4), в которой
атом металла имеет октаэдрическую координацию. Еще одно
из ранних электронографических исследований установило
тригонально-бипирамидальную конфигурацию молекул NbCls,
NbBr5) ТаС15 и TaBr5 [10].
Литература. [1] J. Chem. Soc, 1964, 2206. [2] J. Am. Chem. Soc, 1969, 91,
297. [31 J. Am. Chem. Soc, 1968, 90, 1718. [4] Z. Kristallogr., 1938, 99, 367.
[51 J. Chem. Soc, A 1968, 2539. [6] Acta cryst., 1973, B29, 2221. [7] Acta cryst,
1975, B31, 1260. [81 Acta cryst., 1974, B30, 103. [9] J. Am. Chem. Soc, 1968," 90,
6675. [10] Trans. Faraday Soc, 1940, 36, 668.
20.2.5. Соединения Sb(lII) и Bi(IlI) с квадратно-пирамидаль-
ной конфигурацией связей. Валентная группа 2, 10. Если ва-
лентная группа атома М. в молекуле или ионе MXs содержит
шесть пар электронов, то предполагается, что неподеленная
пара занимает шестую октаэдрическую позицию, создавая
квадратно-пирамидальное размещение связей. В этом аспекте
интересны некоторые сложные галогениды Sb (III)
(разд. 20.2.9).
20.2.6. Образование октаэдрических связей As(V), Sb(V) и
Bi(V). Валентная группа 12. Октаэдрическое размещение шес-
ти связей As(V) может быть выведено из оптической активно-
сти молекул типа производных трикатехина; теперь она под-
тверждена рентгенографически [1]. Приведем наиболее простые
примеры этой координационной группы ионов МХ6~: AsFe~
(As—F 1,69 А) [2]; SbF6- (Sb—F 1,88 A) [3]; SbCle- (Sb—Cl
2,37 A) [4, 5]. Соли металлов, содержащие анион BiF6~, по-ви-
димому, не известны; ранее уже говорилось об октаэдрической
координации висмута в BiF5. Как уже отмечалось, в (Sb2Fu) ~
(разд. 8.7 и 9.5) и в (Sb3Fi6)~ (разд. 9.4.2), а также в оксофто-
ридах, аддуктах SbCls и в многочисленных соединениях, опи-
санных в последних разделах данной главы, координационный
полиэдр Sb(V)—октаэдр. Здесь же мы остановимся лишь на
некоторых оксофторидах и аддуктах SbCls.
Как мышьяк, так и сурьма образуют ионы M2Fi0O2~ и M3Fi2033~,
построенные из октаэдрических групп, связанных через мости-
ковые атомы кислорода:
1,75 А <-J
(Sb-F 1,88 X)
20.2. Структурная химия As, Sb и Bi 655
Строение иона АэгРюО2^ определено при исследовании калие-
вой и рубидиевой солей [6], Sb2Fi0O2~ — рубидиевой соли [7],
a Sb3Fi2033~— цезиевой соли [8J. Существует также ион
AS2F8O22"-, в котором угол при мостиковом атоме кислорода
составляет всего 96° [9].
0
AsF.
Валентная группа 10 в SbCl5 легко расширяется до октаэд-
рической группы 12 не только в ионе SbCls~, но также в много-
численных аддуктах, в которых атом кислорода или азота
создает шестую связь. Кристаллический SbCl5-POCl3 (а) имеет
молекулярное строение, известны также аддукты с РО(СНзK,
(CH3.JSO2 и т. д. (табл. 20.3). Предложено строение молекулы
SbF5-SO2 (б).
а А
1,98 А
В SbCl5-N4S4 шестая октаэдрическая связь создается атомом
азота циклической молекулы N4S4 (Sb—N 2,17 A, Sb—Cl
2,39 А). В ISbCls (разд. 9.4.1)—соединение SbCl5 и 1С13 —
идентифицированы ионы SbCl6~, хотя найденные величины длин
связей наводят на мысль о том, что соединение можно рас-
сматривать как равновесную систему состояний (ICl2) + (SbCl6)~
и (ICl4)-(SbCl4)+.
Литература. [1] Acta cryst., 1972, В28, 3446. [21 Acta cryst., 1974, B30, 250.
[3] Acta cryst., 1976, B32, 2916. [4] Acta cryst., 1972, B28, 2673. [5] Acta cryst.,
1973, B29, 2622. [6] Acta cryst., 1974, B30, 1722. [71 Acta cryst., 1974, B30,
2508. [8] Acta cryst., 1974, B30, 2465. [9] Ber., 1974, 107, 1009.
20.2.7. Образование октаэдрических связей Sb(lII). Валентная
группа 2, 12. В гл. 16 отмечалось, что октаэдрической конфигу-
рацией обладает не только молекула ТеС16, в которой теллур
имеет валентную группу 12, но также и ион ТеС162~ (валентная
группа 2, 12) в таких солях, как К2ТеС1б (структура типа
K2PtCle). Ионы SbIMX63~ изоэлектронны с соответствующими
656 20. Мышьяк, сурьма, висмут
ионами TeIVX62~. Черная как смоль соль с эмпирическим соста-
вом (NH4JSbBr6 на самом деле описывается формулой
(NH4L(SbIHBr6) (SbvBr6) [1]. Ее структура представляет собой
сверхструктуру типа K^PtC^, где октаэдрические ионы, содер-
жащие Sbin и Sbv, чередуются так, как показано на рис. 20.1,
что приводит к удвоению параметра с элементарной ячейки по
сравнению с этим параметром в простой структуре K2PtCle.
Несмотря на наличие у Sb111 неподеленной электронной пары,
октаэдр SbBr63~ не искажен (все
Sb—Вг 2,795 А); слабое искажение
имеют ионы SbBr6~ (Sb—Br 2,564 А).
(pyNSb4Br24 [2] также содержит и
Sb (III), и Sb(V) и должен описывать-
ся в виде формулы (C5H5NHN-
•(SbmBr6) (SbvBr6K. Длины связей
Sb—Вг очень близки к только что при-
веденным.
Литература. [1] J. Am. Chem. Soc, 1966,
88, 616. [21 Inorg. Chem., 1971,10, 701.
Sb(IIl)
Sb(V)
Рис. 20.1. Размещение ато-
мов Sb (III) и Sb(V) в
(МН4L(8ЬшВг6) • (SbvBr6).
20.2.8. Кристаллические тригалогени-
ды мышьяка, сурьмы и висмута. О три-
гонально-пирамидальной форме моле-
кул тригалогенидов As, Sb и Bi в па-
рах уже говорилось; в табл. 20.2 ци-
тирована также литература относительно тех кристаллических
галогенидов, в которых имеются хорошо идентифицированные
молекулы МХ3, т. е. о всех тригалогенидах, кроме BiF3 [1] и
Bil3 [2]. Ионная (с девятерной координацией) структура
pBiF3 описана в разд. 9.9.3. Строение рассматриваемых здесь
тригалогенидов относится к двум основным структурным типам;
начнем с более простого.
В иодидах М13 атомы М занимают октаэдрические пустоты
в гексагональной плотнейшей упаковке атомов иода, но распо-
лагаются они не в центрах октаэдров 16, причем смещение ато-
мов М в сторону одной из граней октаэдра увеличивается в ря-
ду Bil3, Sbl3 и Asl3 (в скобках приведены валентные углы):
2,87 А (96 ) , { 31 2,59 А A00°)
Bi—61
Расстояние
JVI—I в молеку-
ле М13 (паро-
вая фаза)
3,07 А (9<Г)
Sb {
31
31
3,32
2,72 (99°)
As
31 3,47
2,55 A00°)
Структура Р13 и SbF3 относится к этому же типу.
20.2. Структурная химия As, Sb и Bi 657
В трихлорпдах и трибромидах сурьмы и висмута также
имеются хорошо идентифицированные молекулы МХ3, но в этих
соединениях у атомов металла помимо трех ближайших есть
еще пять приблизительно равноудаленных соседей, которые за-
вершают двухшапочную тригонально-призматическую коорди-
нацию:
Расстояния
d(.U—ЗХ), °А
Расстояния
rf,(M — 2X), А
Расстояния d2(.\l —3X), А
SbCl;,
BiC!3
PBr,
2,34
2,50
2,21
3,46
3,24
3,93
3,61 (один)
3,74 (два)
3.36 (в среднем)
Однако между структурами SbCl3 и BiCl3 наблюдается не-
ожиданное различие. Дело не только в том, что в SbCl3 отно-
шение d{ (или d2) к d гораздо больше, чем в BiCl3, но и в том,
что абсолютные расстояния от М до второго ансамбля из 5 бли-
жайших соседей в BiCl3 короче, чем в SbCl3, хотя связь Bi—С1
B,50 А) длиннее связи Sb—С1 B,34 А). Это указывает на на-
личие в BiCl3 сильной тенденции к 8-координацпи, как в BiF3.
Значительно большее различие между расстояниями от ато-
ма М до атома ансамблей из трех и из пяти соседей проявля-
ется в РВг3, а еше большее — в РОВг3 — соединении, структур-
но аналогичном РВг3, лишь с заменой неподеленной электрон-
ной пары на атом кислорода (расстояние d2 в РОВг3 состав-
ляет 4,37 А).
Литература. [11 Acta Chem. Scand., 1955, 9, 1206, 1209. [21 Z. Kristallogr.,
1966, 123, 67.
20.2.9. Сложные галогениды, содержащие трехвалентные сурь-
му или висмут. Структурно исследован целый ряд сложных
фторидов сурьмы с фторидами щелочных металлов или подоб-
ных им фторидов: MSbF4, M2SbF5, MSb2F7, MSb3F10, MSb4Fi3,
а также MSb3Fu, который содержит как Sb(III), так и Sb(V).
Соли типа M3SbF6, по-видимому, неизвестны. K^SbFs и
(NH4JSbF5 [1] содержат ионы SbF52" с такой же тетрагональ-
но-пирамидальной конфигурацией, как и у SbCl52~B (NH4JSbCl5
(о чем речь ниже). В KSbF4 [2] группы SbFs связываются через
два общих атома фтора в циклические ионы Sb4Fi64~, тогда как
в NaSbF4 [3], по-видимому, существуют бесконечные цепи, об-
разованные из групп SbFs, соединенных аналогичным способом.
В этих комплексах атом сурьмы лежит приблизительно на
0,2—0,3 А ниже основания квадратной пирамиды; то же имеет
658 20. Мышьяк, сурьма, висмут
место и в случае 5-кратно координированных атомов сурьмы в
Sb2S3 (см. далее) и в некоторых сложных сульфидах (напри-
мер, FeSb2S4). Тип комплексов Sb—F в солях MSb2F7 зависит
от природы катиона. В KSb2F7 [4] присутствуют искаженные
тригонально-бипирамндальные ионы SbF4~ (а) и молекулы
SbF3 (Sb—F 1,94 А), очень похожие на молекулы в кристалли-
ческом SbF3. Однако если в кристаллическом SbFa искаженную
октаэдрнческую группу (пли шапочный октаэдр, если в него
включается пеподелепная пара) завершают 3 дополнительных
атома фтора на расстоянии 2,61 А от атома металла, то в
KSb2F7 у атома сурьмы имеется только два дополнительных
(Fa) соседа (на расстояниях 2,41 и 2,57 А), которые завершают
155°
а
2,07 А
90° I LSb :
1,94 А
1,98 А
искаженный октаэдр вместе с неподеленной электронной парой.
Структура CsSb2F7 [5] совершенно иная. Она содержит хорошо
идентифицированные ионы Sb2F7~~ (б), построенные из двух
искаженных трнгональных бипирамид SbF4, объединенных че-
рез общий аксиальный атом F, образующий длинные мостнко-
вые связи. (Следующее наиболее короткое расстояние Sb—F
составляет 2,77 А.) Отметим, что анион в KSb2F7 может быть
описан и как бесконечная цепь, состоящая из групп SbF2(FaJE
и псевдооктаэдров SbF3(FaJE, соединенных через общие акси-
альные атомы фтора, с несимметричными мостиковыми связя-
ми B,41 и 2,57 А).
Соль NaSb3Fio [6] имеет слоистую структуру, построенную из
октаэдров SbFsE с тремя обобщенными экваториальными вер-
шинами, две из которых объединяют два октаэдра, а третья —
три октаэдра (рис. 20.2, а). Псевдооктаэдрическая координация
Sb (III) очень сильно искажена (рис. 20.2,6); структура содер-
жит несимметричные мостики Sb—F—Sb A,98 и 2,60 А). При-
рода комплексного иона в KSb4Fi3 [7] не совсем ясна. В анионе
Sb3Fi4~ [7а] (в) имеются несимметричные мостики [Sb(V)—F
1,95 A; Sb (III) —F 2,30 А) между октаэдрически координиро-
ванной Sb(V) и 4-кратно координированной Sb (III); здесь
напрашивается сопоставление со структурой Sb2F7~ (б).
20.2. Структурная химия As, Sb и Bi 659
1,95А {среднее)
1,85А
¦2,15 А
Рис. 20.2. а —топология двумерного иона Sb3F10-; б — координация Sb(III)-
в — ион Sb2F42+ в Sb4F16; г — координация Sb (III).
«Аддукт» SbF3-SbF5 [76] содержит как Sb (III), так и Sb(V).
Для этого соединения можно записать формулу и в другом
виде (Sb2F4J+(SbF6-J, так как в нем имеются ионы SbF6~,
однако окружение одного из атомов Sb (III) при этом необыч-
но. Окружение Sb' (рис. 20.2, в) типично: SbF3E (как в SbF3)
F
\
\
Sb
\L«0
с четырьмя дополнительными контактами на больших расстоя-
ниях B,54-^2,87 А), окружающими неподеленную пару. Атом
Sb" образует 2 короткие и еще 4 длинные B,33^-2,41 А) связи
приблизительно компланарные с одной из коротких связей.
Атом Sb" лежит ниже экваториальной плоскости, что дает
основание предполагать для него пентагонально-бипирамидаль-
ную координацию с неподеленной электронной парой в акси-
альной позиции (рис. 20.2,г).
Имеются структурные данные и по комплексным хлоридам
и бромидам, содержащим ионы следующих типов: (SbX4)~
(SbX5J- (SbX6K- и (Sb2X9K-. Анион в (SbCl4) (C5H5NH) [8]
имеет бесконечную цепочечную структуру из очень искаженных
660 20. Мышьяк, сурьма, висмут
октаэдров с непараллельными обобщенными ребрами
(разд. 5.3.4). Все углы С1—Sb—С1 близки к 90°, но длины свя-
зей Sb—C1 различны: две по 2,38 А; две по 2,64 А и две по
3 12 А- последние четыре входят в несимметричные мостики
между'группами SbCl6 (рис. 20.3, а). В (NH4JSbCl5 [9] ионы
4+ и С1~ образуют искаженную плотнейшую упаковку с ва-
г,збА
S'
2,38 А
2,64 А
-Sb
L
2.83A
злу |
I/
O.ZZA
(среднее)
цепь
2,97 А
цепь
/'3,45 A
' 2,89 A
3,10 A
\ 3,02A
у\13А
l~Zfi7A
Z.87A
цепь
Рис 20.3. Координационное окружение Sb пли Bi в сложных галогенндах
(пояснения в тексте).
кантными позициями С1~ в каждом третьем слое, а атомы
сурьмы занимают пустоты, которые были бы октаэдрическими
в нормальной плотнейшей упаковке. Вследствие отсутствия не-
которых ионов С1- ближайшими соседями сурьмы оказываются
5 атомов хлора, размещенных по пяти вершинам октаэдра; дли-
ны аксиальных связей составляют 2,36 А, экваториальных —
2 58 (двух) и 2,69 А (двух); неподеленная электронная пара за-
нимает по-видимому, положение шестой вершины (рис. М.6,0).
Ион (SbBr6K^ изучен в галогенидах, которые содержат
еще и анион (SbBr6)-, как это отмечалось в предыдущем раз-
20.2. Структурная химия As, Sb и Bi 6(il
деле. В соли пиридиння (C5H5NHM(Sb2Br9)Br2 [10] анион
(Sb2Br9K^ построен из двух октаэдров SbBr6 с общими граня-
ми; длины концевых связей Sb—Вг составляют 2,63 А, мостико-
вых — 3,00 А.
Сложные фториды висмута, подобно самому BiF3, являются
ионными соединениями. Например, NH4BiF4 [11] имеет ионную
структуру, в которой бесконечный слой (BiF4)n"~ построен из
групп BiF9 того же типа, что и в ромбическом BiF3 (разд. 9.9.3);
расстояния Bi—F лежат в пределах 2,19-^2,86 А. При шестер-
ной координации Bi(lII), создаваемой хлором, бромом или
иодом, висмут образует шесть октаэдрических связей. В изоли-
рованных ионах, как, например, в кубическом Cs2NaBiCla [12]
и в Rb3BiBr6 [12а] или R5I~(Is)"(Bil6K-• 2HSO [13], связи распо-
лагаются по диагоналям правильного октаэдра, однако он ока-
зывается в разной мере искаженным, если имеет место обобще-
ние атомов галогенов, как, например, в K4(Bi2Brio) -4FLO (одно
обобщенное ребро) [14] или в M2Bi2X9. Структуры Cs3Bi2Cl9,.
Cs3Bi2Br9, Cs3BioI9 и [(C6H5LP]3Bi2Br9 описаны в разд. 10.1.8.
Ионы (SbI4)rt"~, (BiBr4)«"~ и (BiI4),2"- в солях 2-пиколиния
[15] состоят из бесконечных скрученных октаэдрическнх цепей
(рис. 20.3,в и г), очень похожих по своему строению на цепи
(SbCl4)- (рис. 20.3, а), с тремя парами связей примерно рав-
ной длины. В соли пиридиния (C5HioNH2JBiBr5 [16] (и изо-
структурном сурьмяном аналоге) присутствуют цепи, построен-
ные из октаэдров МХ6 с общими цис-вершинами; и в этом слу-
чае набор длин связей оказывается таким же (рис. 20.3, д).
Если полагать, что связь Bi—Вг в молекуле BiBr3 B,63 А)
ординарная, тогда следующие две кратчайшие связи в структу-
рах, изображенных на рис. 20.3, в и <Э, согласно уравнению По-
линга d,, = di—0,6 lg n, соответствуют связям порядка '/п. Анало-
гично если шесть октаэдрических связей в кристаллическом
Bil3 C,07 А) рассматривать как связи порядка '/г, то наиболее
короткие связи в структуре, изображенной на рис. 20.3, г, сле-
дует рассматривать как ординарные. Таким образом, в каждом
случае суммарный порядок связи близок к 3. Можно отметить,
что альтернативно четыре более сильные связи можно было бы
рассматривать и как искаженные тригонально-бипирамидаль-
пые; в этом случае две слабые (экваториальные) связи лежа-
ли в плоскости неподеленной электронной пары (рис. 20.3. f;
приведены оценочные значения порядка связей).
Примером соединений, в которых висмут образует тетраго-
нальные пирамидальные связи, служит Bi12Cln [17]. В этом
необычном соединении, получаемом при растворении металла
в расплавленном трихлориде, существуют группы из 9 атомов
висмута (в вершинах трехшапочной тригональной призмы),
тетрагонально-пирамидальные группы BiCl52~ и группы ШгОв2"»
€62 20. Мышьяк, сурьма, висмут
образованные двумя ионами BiCls2~ путем обобществления двух
атомов хлора:
Bi
\
Чтобы подчеркнуть относительные количества трех типов струк-
турных единиц, структурная формула этого галогенида может
быть записана в виде (Bi95+J(BiCl52""L(Bi2Cl82~). Существова-
ние иона Bi95+ было установлено также в Bi+Bi95+ (HfС1б) з [18J.
Литература. [1] Inorg. Chem., 1972, 11, 2322. [2] Ark. Kern., 1952, 4, 175.
[3] Ark. Kern., 1953, 6, 77. [4] Inorg. Chem., 1971, 10, 1757. [5] Inorg. Chem.,
1971, 10, 2793. [6] Acta cryst., 1975, B31, 2322. [7] Ark. Kern., 1951, 3, 17.
[7a] Chem. Comm., 1977, 253. [76] J. Chem. Soc, D 1977, 971. [8] J. Chem. Soc,
A 1970, 1356. [9] J. Chem. Soc, A 1971, 298. [10] J. Chem. Soc, A, 1970, 1359.
Ill] Acta Chem. Scand., 1964, 18, 1554. [12] Acta cryst.. 1972, B28, 653.
[12a] Acta cryst., 1978, B34, 2288. [131 Acta cryst., 1977, B33, 1957. [14] Acta
cryst., 1977, B33, 1954. [15] J. Phys. Chem., 1967, 71, 3531. [16] J. Phys. Chem.,
1968, 72, 532. [17] Inorg. Chem., 1963, 2, 979. [18] Inorg. Chem., 1973, 12,
1134.
20.3. Химия оксидов трехвалентных мышьяка, сурьмы,
висмута
Ниже сделана попытка подвести итог о том, что известно о
структурах триоксидов, сложных оксидов и оксогалогенидов,
рассматриваемых в данной главе элементов. В триоксидах и
тех сложных оксидах Sbm, которые уже изучены, стереохимия
элементов УБ-группы периодической системы достаточно про-
ста; они образуют три пирамидальные связи подобно Рш в
Р4О6. Кристаллохимия сурьмы в ее оксогалогенидах и в
5ЬзО6ОН более сложная и к тому же отлична от кристаллохи-
мии висмута. По этой причине оксогалогениды сурьмы и вис-
мута рассматриваются отдельно. В структурном отношении с
оксогалогенидами висмута родственны некоторые сложные ок-
сиды, о чем упоминается в дальнейшем.
20.3.1. Триоксиды мышьяка, сурьмы и висмута. Для каждого
из триоксидов рассматриваемых элементов известно по край-
ней мере по две полиморфных модификации (табл. 20.4). При
испарении триоксидов мышьяка и сурьмы образуются молекулы
As4O6 и Sb4O6) которые распадаются на более простые молеку-
лы AS2O3 и Sb2O3 только при высоких температурах. Установле-
но, что строение молекул As4O6 и Sb4Oe в парах схожи со
строением Р4О6 (табл. 19.5). Кристаллические кубические моди-
20.3. Оксиды As(III), Sb(III) и Bi (III) 663
Таблица 20.4. Полиморфные формы AS2O3,
Модификация
As2O3
Sb2O3
Bi2O.
Низкотемпера-
турная
Высокотемпера-
турная
Температура фа з о -
вого перехода
Моноклинная
(клаудетит)
Кубическая (лрсе-
нолпт)
! 10 °С
Ромбическая (ва-
лентннпт)
Кубическая (сснар-
монтпт)
Ь06 'С
(и) Моноклинная
(б) Кубически:
(см. текст)
729 °С (а—6)
фикации этих веществ состоят из молекул того же типа. В куби-
ческом Sb4O6 [1] сурьма имеет три пирамидально расположен-
ных соседа на расстоянии 1,98 А (угол О—Sb—О 96е) и ника-
ких дополнительных соседей на расстояниях вплоть до 3,81 А,
что дает возможность простого описания ее стереохимии в виде
тетраэдрической группы SbC^E с неподеленной электронной па-
рой, расположенной в четвертой тетраэдрической позиции;
в валентините ситуация более сложная (о чем речь ниже).
У низкотемпературного As2O3 (минерала клаудетита) име-
ются две (и обе моноклинные) полиморфные формы I и II [2];
обе имеют слоистую структуру самого простого типа, извест-
ного для соединений А2Хз, а именно сетка б3 из атомов мышьяка,
связанных через атомы кислорода. Слои гофрированные (угол
О—As—О 95'/2°; As—О 1,97 А), атомы мышьяка располагают-
ся либо выше, либо ниже усредненной плоскости из атомов
кислорода. Способ размещения атомов As выше и ниже слоя
>~ч
Клаудетит- II
клаудетит-1
As,S,
атомов О может быть разным. Именно этим и различаются две
моноклинные формы АэгОз, а в AS2S3 найдена третья конфигу-
рация слоя.
Вторая модификация Sb2O3, валентинит, имеет совершенно
иной тип структуры [3]. Вместо конечных молекул Sb4O6 она
664 20. Мышьяк, сурьма, висмут
содержит бесконечные сдвоенные цепи (Sb—О 2,01 А, валент-
ные углы О—Sb—О 80, 92 и 98° и Sb—О—Sb 116 и 131°). Огш-
/ Sb Sb Sb \
О О О)Ш°
\ \ \
\ Sb Sb Sb и6о*
V V чо/ ^
сание стереохимии в данном случае не столь очевидно из-за
того, что помимо трех ближайших (пирамидальных) соседей
сурьма имеет в качестве следующего набора соседей один кис-
лородный атом из смежной цепи на расстоянии 2,52 А и еще
один атом из той же цепи на расстоянии 2,62 А.
Кристаллохимия Bi2O3 совершенно не похожа и более
сложна, чем кристаллохимия As2O3 или Sb2O3; на эту тему су-
ществует достаточно обширная литература. Некоторая путани-
ца в описании структур высокотемпературных модификаций
Bi2O3 обусловлена тем обстоятельством, что этот оксид очень
легко легируется. Например, выдерживание расплава в фарфо-
ровом тигле в течение короткого промежутка времени приводит
к образованию объемноцентрированной фазы состава SiBii202o
(которая далее обсуждается). Обычная форма этого оксида
a-Bi2O3 имеет моноклинную симметрию; она переходит при
729 °С в кубическую б-форму, которая стабильна вплоть до тем-
пературы плавления (824°С). При охлаждении, однако, могуг
образоваться две метастабильные фазы: тетрагональная |3-мо-
дификация F50°С) и объемно центрированная кубическая
у-форма F39 °С). Еще одно осложнение связано с тем, что,
хотя и Р", и б-формы обладают флюоритовой структурой, в
C-модификации кислородные вакансии упорядочены, а в б пол-
ностью разупорядочены. Такое статистическое распределение
кислородных вакансий и подвижность ионов О2" приводят к
возникновению в 6-Bi2O3 высокой ионной проводимости. Струк-
тура обычной a-формы достаточно сложна [4J; она содержит
два сорта неэквивалентных атомов висмута, оба с искаженно
октаэдрической координацией: 5 соседей на расстояниях
2,134-2,6 А и еще один на расстоянии более чем 2,8 А или же
два на расстояниях 3,3 и 3,4 А. у-Модификация в кристаллохи-
мическом отношении родственна группе соединений, обладаю-
щих общим структурным каркасом и почти идентичными пара-
метрами элементарных кубических ячеек; каркас построен из
октаэдров ВЮ5Е с базисным составом Bi2404o. В полостях этой
структуры есть две тетраэдрические позиции, которые должны
быть заняты ионами с общим зарядом +8, необходимым для
20.3. Оксиды As (III), Sb (III) и Bi (III) 665
сбалансирования заряда на (Bi24O40)8^. Такое уравновешива-
ние зарядов проще всего достигается в стехиометрических сое-
динениях MIVBi12O20(M = Ge, Si) [5J, но существуют и другие
фазы с этой каркасной структурой, включая, по-видимому,
и v-Bi2O3 [6]:
Ионы в тетраэдрических позициях
Bi25FeO40 Bi5+; Fe3+
Bi38ZnO60 !1/3Bi5+; 2/3Zn2+
Bi5+; Bi3+
3
Y-Bi2O3
(Bi253+Bi5+O40)
Рис. 20.4. Координация Bi
в GeBi12O20.
Во многих оксосоединениях Bi111 атом металла окружен
пятью или шестью соседями, находящимися на расстояниях
~2,1 ч-2,7 А (в среднем ~2,4 А), и еще небольшим числом до-
полнительных соседей. В некоторых
случаях, например в GeBi12O20, коор-
динационная группа состоит из семи
кислородных атомов (рис. 20.4): трех
наиболее близких соседей (a, Ь, с),
размещенных пирамидально на рас-
стояниях 2,08, 2,22 и 2,23 А; трех ато-
мов (d и е), расположенных на оди-
наковом удалении от металла
B,63 А), и, наконец, еще двух атомов
(/ и g) на расстояниях 3,08 и 3,17 А.
Если же принять во внимание только
5 ближайших соседей а—е, то коорди-
национный полиэдр, образованный этими атомами, представля-
ет собой квадратную пирамиду со средним значением Bi—О
2,36 А (что имеет место и во многих других оксосоединениях
Bi111; табл. 20.5).
Литература. [1] Acta cryst., 1975, В31, 2016. [2] Monatsh. Chem 1975 106
?55- [31 Acta cryst., 1974, B30, 458. [4] Z. anorg. allg. Chem., 1978, 444, 15U
167. [5] J. Chem. Phys, 1967, 47, 4034. [6] J. Solid State Chem., 1975, 15, I.
20.3.2. Сульфаты сурьмы(Ш). Подобно некоторым другим эле-
ментам Б-подгруппы периодической системы (как, например,
Te2O3SO4 и I2O4SO4), сурьма образует ряд нормальных и основ-
ных сульфатов. Поскольку эти соединения содержат группы
SO4, связанные мостиковыми атомами сурьмы (ср. Zr(SO4J и
его гидраты, разд. 7.6.7), формулы этих соединений можно пе-
реписать в следующем виде:
Sb2O3-3SO3:
Sb2Cy2SO3:
3Sb2O3-2SO3:
Sb2(SO4K Acta cryst., 1976, B32, 2787
Sb2O(SO4J Acta cryst., 1975, B3l' 2081
Sb6O7(SO4J Acta cryst., 1976, B32, 177!
43—985
666 20. Мышьяк, сурьма, висмут
Первое из них является простейшим с топологической (но не со
структурной) точки зрения, так как каждый атом сурьмы свя-
зан в нем с тремя другими через мостиковые группы SO4. В ос-
нове довольно сложных бесконечных линейных молекул лежит
простая трехзвенная лестница (рис. 20.5,о), но в каждом звене
лестницы мостиковая группа SO4 (рис. 20.5,6). В других соеди-
нениях в дополнение к мостиковым группам SO4 имеются еще
и кислородные мостики. Бициклическая молекула Sb2O(SO4J
содержит два кольца в конформации кресла (рис. 20.5, в); одна-
Таблица 20.5. Координация Bi1" в некоторых оксосоединениях
Соединение
BiaSisOu
Bi2Ge05
Bi(OH)CrO4
(моноклин.)
Bi(OH)CrO4
(ромбич.)
Bi2O2SO4-H2O
Bi(OH)SeO4-H2O
Bii2Ge02o
Общее
кч
атома
Bi
9
7
9
9
10
9
7
Расстояние от В
до ближай-
ших 5 О
или 6 О
2,15—2,62
2,13—2,66
2,23—2,58
2,19—2,68
2,22—2,57
2,10—2,59
2,19—2,64
2,08—2,64
до более
удален-
ных О
3,55
3,18
3,33
3,09
3,45
3 35
3,16
3,17
, А
среднее до
5 О или 6 О
2,39
2,35
2,38 )
2,38 J
2,38 )
2,32
2,40 )
2,36
Литература
Z. Kristallogr,
1966, 123, 73
Acta Chem. Scand.,
1964, 18, 1555
Acta Chem. Scand.,
1964, 18, 1937
Acta Chem. Scand.,
1964, 18, 2375
J. Chem. Phys
1967, 47, 4034
ко интересно, что Sb2(SO4K не принимает аналогичной конфи-
гурации с тремя такими кольцами, а имеет гораздо более слож-
ную структуру (рис. 20.5,6). Строение Sb6O7(SO4J еще более
сложно. Этот сульфат построен из цилиндрических субъединиц,
на поверхности которых атомы сурьмы чередуются с атомами
кислорода, образуя трехсвязанную сетку. Треть атомов сурьмы
в этой сетке состава (Sbe06)n связывается в пары в поперечном
направлении внутри цилиндра через дополнительные атомы
кислорода, и состав сетки оказывается уже (Sb6O7)«; в то же
время остальные 2/3 атомов сурьмы соединяются с подобными
атомами других цилиндров через мостиковые группы SO4
(рис. 20.5,г). В результате образуется трехмерная структура
состава (Sb6O7)n(SO4J/j, в которой каждый атом Sb формирует
4 связи, три из которых имеют длину 2,0^-2,2 А, а четвертая
2,33-^2,38 А.
20.3.3. Метаарсениты. Некоторым метаарсенитам приписаны не-
верные формулы. Например, соль, трактуемая иногда как
20.3. Оксиды As(III), Sb (III) и Bi(III) 667
Рис. 20.5. а и б — структура^ Sb2(SO4K; в — молекула Sb2O(SO4J; г —
! (пояснения в тексте).
Xa2HAs03, на самом деле является полиметаарсенитом
<NaAsO2)n:
О С
4As As
V4o
As
и рентгеновское исследование показывает, что она состоит из
цепей пирамидальных групп AsO3, удерживаемых вместе иона-
ми Na+ [Acta cryst., 1958, 11, 742J.
20.3.4. Сложные оксиды трехвалентных мышьяка и сурьмы. Ряд
сложных оксидов MnSb204(Mn = Mg, Zn, Mn, Fe, Co, Ni), а так-
же NiAs2O4 изоструктурны с РЬ3О4 (рис. 12.15); Sb замещает
Pb", a M11 замещает Pbiv. Уточнение структуры ZnSb2O4 [1]
выявило небольшие искажения в пирамидальных SbO3 и окта-
эдрических группах ZnCv, средние значения длин связей Sb—О
1,97 A; Zn—О 2,11 А; углы О—Sb—О 93,4° (два) и 96,4° (один).
В работе [1] приведена литература по соединениям магния и
железа.
Некоторые кристаллические соединения, образованные AS2O3
и галогенидами щелочных металлов или аммония, например
NH4Cl-As203-'/гН2О; KCl-2As2O3 и т. д., в структурном отноше-
нии тесно связаны с оксидами мышьяка. В первом из них [2]
43*
668 20. Мышьяк, сурьма, висмут
присутствуют широкие гексагональные полосы с атомами кис-
лорода, направленными к одной стороне полосы; эти полосы
соединяются в пары так, что атомы кислорода в них повернуты
друг к другу, а между слоями расположены молекулы воды.
Между этими парами слоев АэгОз-'/гН^О находятся ионы NH4+
и С1-.
Литература. [1] Acta cryst., 1982, В38, 2022. Щ Ark. Kem., 1955, 8, 245.
20.3.5. Сложные оксиды трехвалентного висмута. Оксид висмута
образует с оксидами других металлов большое число смешан-
ных оксидов, причем в некоторых кислород может быть заме-
щен на фтор.
Системы Ca(Sr, Ba, Cd, Pb)O—Bi2O3. Исследован ряд фаз,
полученных при сплавлении Bi2O3 с одним из следующих окси-
дов: СаО [1], SrO [1], ВаО [1], CdO [2] и РЬО [3]. Выяснилось,
что эти фазы существуют в очень широкой области составов.
Например, в системе ВаО—Bi2O3 имеется ромбоэдрическая фаза
с х = 0,1-=-0,22 и тетрагональная с х = 0,22-^0,50, где х — атомная
доля Ва в Ваг^г-гЛ-*. Для некоторых таких твердых раство-
ров предложены структурные модели, в которых предполагает-
ся, что содержание металла в элементарных ячейках постоянно,
а кислорода переменно.
Таблица 20.6. Сложные оксиды
Число перов-
скитовых слоев
1
2
3
4
Формула
Bi2Nb05F, Bi2Ta05F,
Bi2Ti04F2
PbBi2Nb2O9) Bi3NbTi09
Bi4Ti3012
BaBi4Ti4Oi5
и оксогалогениды висмута
С А"
16,5
25,5
32,8
41,7
Литература
Ark. Kem., 1952, 5, 39
Ark. Kem., 1949, 1, 463
Ark. Kem., 1949, 1, 499
Ark. Kem., 1950, 2, 519
Проведены рентгеновские исследования сложных оксидов
с тетрагональной и псевдотетрагональной симметрией; парамет-
ры элементарных ячеек этих соединений а-~3,8 А; в основе
строения исследованных фаз лежат слои Bi2O2 того же типа,
что и на рис. 20.6, разделенные перовскитоподобными слоями.
Перечень таких оксидов приведен в табл. 20.6, а их строение
схематично показано на рис. 20.6. Наиболее простой член этого
семейства представлен только соединениями, в которых часть
кислорода заменена на фтор. Со структурных позиций эти фазы
тесно связаны со сложными оксогалогенидами висмута (см. да-
-,5 А 5А
»Nb ©Bi O0,F
а
-5А
3
¦2
¦7
О
в
©Bi •Ti О О
© BaBi О О
Рис. 20.6. Кристаллическая структура Bi2Nb05F (a), Bi3NbTi09 (б), Bi4Ti30|2
(8) и BaBi4Ti40i5 (г). Изображены половины элементарных ячеек. С — слой
Bi2O2 для Bi2(O, F) (а) и (Ba,BiJO2 —г); А — слой октаэдров Nb(O, FN (a)
или участок структуры типа перовскита (б, в иг); В — элементарные ячейки
гипотетических структур типа перовскита BaNb0,5Tio,503 и ВаТЮ3.
670 20. Мышьяк, сурьма, висмут
лее), в которых квадратные слои состава Bi2O2 перемежаются
галогенными слоями. Может быть получено огромное разнооб-
разие подобных соединений, например (MBiNR4Oi8, где M=Na,
К, Са, Sr, Ba, Pb, R = Ti, Nb, Та. Отметим, что члены этого се-
мейства, такие, как Bi2Ta05F, в структурном отношении не
имеют ничего общего с соединениями, описанными в разд. 20.4.2,
например с BiTa2O6F.
Литература. [Ц Ark Kem. Mineral. Geol., 1943, 16А, № 17. [21 Z phys Chem
1941, B49, 27. [3] Z. Kristallogr., 1939, 101, 483. " "
20.3.6. Оксогалогениды трехвалентной сурьмы. При термической
обработке смеси SbF3 и Sb2O3 получено четыре модификации
SbOF. Структурные данные известны для двух из них. L-форма
построена из «лесенок» (рис. 20.7) [1], тогда как М-модифика-
ция образует слоистую структуру [2]. В обеих формах коорди-
национная группа Sb(III) состоит из 3 атомов кислорода и од-
ного атома фтора, расположенных в четы-
рех вершинах тригональной бипирамиды;
неподеленная электронная пара занимает
экваториальную позицию, как и в Sb2O4
(см. далее).
Другие оксогалогениды, главным обра-
зом оксохлориды и оксобромиды, получа-
ются в результате контролируемого гидро-
лиза тригалогенидов; они представляют
интерес по двум основным причинам. Во-
первых, эти оксогалогениды сурьмы(III)
совершенно не похожи на оксогалогениды
Рис. 20.7. Двойная висмута. Хотя как сурьма, так и висмут
цепь («лестница») в образуют соединения МОХ, строение их
L-SbOF. совершенно различно (структура ВЮХ
описана далее). Оксогалогениды сурьмы
более сложных составов не имеют аналогов среди висмутовых
производных. Во-вторых, специфической особенностью извест-
ных структур оксогалогенидов сурьмы является наличие протя-
женных систем Sb—О (обычно слоев), перемеживающихся га-
логенными ионами. В этих структурах сурьма связана с 3 или
4 атомами кислорода, образующими одну из конфигураций а
или б или некоторый их промежуточный вариант.
Легко понять, что для перехода от четверной координации
к координации тремя атомами необходимо только, чтобы атом
Sb «поднялся» над экваториальной плоскостью.
Ниже перечислены соединения (в порядке уменьшения отно-
шения X:Sb), структуры которых исследованы: SbOCl [3],
Sb4O5Cl2 [4] и Sb4O5Br2, [Sb8O8(OHL][(OHJ-,(H2OI+,]Cl2+,
[5] и Sb8Oio(OHJX2 {6] (Х = С1, Вг или I).
20.3. Оксиды As(III), Sb(III) и Bi(III) 671
SbOCl построен из гофрированных полос, в которых 2/з ато-
мов сурьмы связаны атомами 2О+1С1, а остальные — 4 атома-
ми кислорода; полосы EЬ6ОбС14)„2п+ скрепляются ионами С1~.
(Различие между двумя типами атомов С1 основывается на том,
что расстояние между атомами сурьмы и межслоевым ионом
хлора B,9 А) гораздо больше расстояния Sb—С1 внутри слоя
B,3^-2,5 А).)
Sb.jO5Cl2. В этом соединении имеются бесконечные слоистые
ионы состава (Sb4O5)n2"+, в которых одна половина атомов
сурьмы имеет КЧ 3, другая — 4; между слоями расположены
ионы С1~. Координации обоих сортов атомов сурьмы относятся
к типу б; оба атома имеют три ближайших соседа на расстоя-
нии ~2 А, а четвертый удален либо на 2,46, либо на 2,91 А.
В двух оксогалогенидах (указанных выше), имеющих более
сложную структуру, по-видимому, существуют сдвоенные цепи,
в которых все атомы характеризуются четверной координацией;
цепи соединены через группы ОН с образованием в первом сое-
динении бесконечных слоев [Sb8O8(OHL]n4n+, а во втором —
сложных цилиндрических цепочечных ионов [Sb4O5(OH)Jra"+.
Известны следующие оксоиодиды сурьмы: Sb3O4I, SbsOnb, и
Sb5O7I (две модификации: a — низкотемпературная и р — высо-
котемпературная). В a-Sb5O7I [7] атомы иода размещены меж-
ду слоями, которые образованы атомами сурьмы с тройной ко-
ординацией и атомами кислорода; сурьма образует 2 или 3 сла-
бые связи с иодом.
Литература. [11 J. Solid State Chem., 1973, 6, 191. [2] Acta Chem. Scand., 1972,
26, 3849. [31 Ark. Kem., 1953, 6, 89. [41 Acta cryst., 1978, B34, 2402. [5] Ark. Kem.,
1955, 8, 257. [6] Ark. Kem., 1965, 8, 279. [7] Acta cryst., 1975, B31, 234.
20.3.7. Оксофториды висмута. Выше уже было показано, что
BiF3 в структурном отношении отличен от других тригалогени-
дов мышьяка, сурьмы и висмута. Точно так же и оксофториды
висмута, за исключением BiOF, в структурном отношении не по-
хожи на другие оксогалогениды висмута (или сурьмы). Окисле-
ние BiF3 приводит к образованию следующих оксофторидов,
672 20. Мышьяк, сурьма, висмут
структуры которых описаны в цитируемых ниже работах:
Тип структуры
Литература
BiO0iF28
B1O0.5F2 (Bi2OF4)
BiOF
Тизонитовая (LaF3)
(разд. 9.9.3)
Кубическая (разд. 9.9.3)
Тип ВЮС1 (разд. 10.4.5)
Acta Chem. Scand., 1955,
9, 1206
Am. Rev. Phys. Chem.,
1952, 3, 369
Acta Chem. Scand., 1964,
18, 1823, 1851
20.3.8. Сложные оксогалогениды висмута с участием Li, Na, Ca,
Sr, Ba, Cd, Pb. Сплавлением оксогалогенидов висмута с избыт-
ком галогенида одного из перечисленных металлов Силлен с
сотр. приготовили большое число сложных оксогалогенидов (где
галоген — С1, Вг и реже I). Все эти соединения кристаллизуют-
ся в форме тетрагональных листочков с параметрами а«4 А,
с<50 А. Кристаллохимически эти вещества очень близки к ок-
согалогенидам висмута, подобно которым содержат характер-
ные кислородные слои. Металл-кислородные полосы показаны
на рис. 20.8, а. В самом простом варианте структуры полосы
этого типа чередуются с одиночным, сдвоенным или строенным
слоем атомов галогена, формируя тем самым структуры Xi, X2,
Х3 (рис. 20.8,6, виг). Простые оксогалогениды висмута пред-
ставляют собой силленовский структурный тип Х2. Более слож-
ная структура возникает, когда в каких-либо фазах содержатся
не один, а несколько типов галогенных слоев, как в SrBi3O4Br
(Х]Х2-структуры). В структурах Xi (МПВЮ2Х или M1Bi304Cl2)
и XiX2 (М.иВ13О4С1з) все атомы металла находятся в металл-
кислородном слое (рис. 20.8, а) и, по-видимому, произвольно
размещены по возможным для металла позициям, а в структу-
рах Х3 атомы металла располагаются также и между галоген-
ными слоями (рис. 20.8,г). Однако последние позиции заняты
не полностью, так что структуры, содержащие слой Х3, вероятно,
всегда дефектны, как это видно из формул оксагалогенидов
кадмия и висмута, приведенных в табл. 20.7. Еще один струк-
турный тип (О[Х2) предполагается для оксоиодида бария-вис-
мута, в котором характерные металл-кислородные слои разде-
ляются поочередно сдвоенными галогенными и кислородными
слоями.
Другие соединения, родственные в структурном отношении
с рассматриваемыми оксогалогенидами, включают Bi2403iClio
и его бромидный аналог. Существование каких-либо оксогало-
генидов висмута помимо BiOX считалось спорным, но, согласно
выводам Силлена, соединения Bi24O3iXi0 (которым первоначаль-
20.3. Оксиды As(III), Sb(III) и Bi(III) 673
О
Галоген
I'
Рис. 20.8. Структуры сложных оксогалогенпдов висмута, а — проекция металл-
кислородного слоя в направлении, параллельном и перпендикулярном слою,
бн-г— вертикальные сечения структур с участием единичных галогенных сло-
ев Xi (б); двойных галогенных слоев Х2 (в) и тройных галогенных слоев Х3 (г)
(по Силлену).
но была приписана формула Bi7O9X3) все же существуют,
и хлорид, например, может быть получен нагреванием BiOCl
выше температуры 600°С. Для этих соединений предложены
структурные модели. Различные их варианты, разработанные
Силленом, схематически изображены на рис. 20.8, и некоторые
представители этих структурных типов приведены в табл. 20.7.
Следует, вероятно, отметить, что некоторые особенности этих
структур нельзя считать надежно установленными, хотя общая
схема их построения серьезных сомнений не вызывает. Общая
геометрическая аналогия этих структур с гидрогалогенидами
слоистого типа достаточно очевидна.
674 20. Мышьяк, сурьма, висмут
Таблица 20.7. Структурные типы оксогалогенидов
висмута3
Структурный
тип
х,
X,
Хз
Х]Х2
ХгХ3
X[XtX2
Х!Х2Х3
Примеры
ВаВЮ2С1, CdBiO2Br, LiBi3O4Cl2
BiOCI, LaOCl
Cai 25Bi, 5O2C13
SrBi3O4Cl3
Ca2-3*Bi3+2JtO4Cl5
SrBi2O3Br2
Cd2-3^Bi5-|-2jeOeCl7
a Z. anorg. allg. Chem., 1942, 250, 173; Z. Kristallogr.,
1942, 104, 178; Ark. Kern. Mineral. Geol., 1947, 25, 49.
20.3.9. Оксиды MluMv0i. Помимо оксидов М2шО3 и M2VO5
мышьяк и сурьма образуют оксиды МШМЮ4, изоструктурные
соединениям, содержащим ниобий и тантал:
AsIIIAsv0«
SbIHAsvO4
a-SbinSbv04
BiUISbvO4
Sb"'Nbv04 ,
p-SbIIISbv0«
Координация
MHI
Тригонально-
пирамидаль-
ная
Четверная пира-
мидальная
(рис. 20.9, в)
Координация
Mv
Тетраэдр иче-
ская
Октаэдрическая
Литература
Acta cryst., 1980,
439
Acta cryst., 1980,
1923
Acta cryst., 1977,
1 o-r 1
Ark Kem., 1952, 3
Chem. Comm.,
611
Proc. Chem. Soc,
400
В 36,
B36,
взз,
, 153
1965,
1964,
Гигроскопичный AsO2(AsIHAsvO4) получается нагреванием в
автоклаве кубического AS2O3 под давлением кислорода. Он со-
стоит из слоев, основанных на гексагональной сетке (такой же,
как в моноклинном Аэ2Оз, разд. 20.1.3) с дополнительными ато-
мами кислорода, присоединенными по-разному к атомам As так,
что половина металлических атомов образует три пирамидаль-
ные связи (As—О 1,81 А, угол О—As—О 90°), а остальные —
четыре тетраэдрические (с мостиковой связью As—О 1,72 А и
концевой 1,61 А). Этот слой промежуточный между слоем типа
М2О3 в As2O3 (все М с тройной координацией) и слоем М2О5
как в одной из форм P2Os (все М с четверной координацией).
20.3. Оксиды As(III), Sb(III) и Bi(III) 675
В отличие от тригонально-пирамидальной координации As111
в As2O4 координация Sb111 в этих соединениях характеризуется
«односторонней» пирамидальной координацией (рис. 20.9,в).
Ромбическая (и) модификация Sb2O4 (минерал сервантит) изо-
структурна SbNbO4 и SbTaO4; известна также моноклинная
C-форма, получающаяся при нагревании а-модификации на воз-
духе или в кислороде. Структуры этих двух полиморфных форм
90°
Рис. 20.9. а — слой состава SbO4l образованный октаэдрами Sbv06, соединен-
ными через общие экваториальные вершины; б — пирамидальная координация
Sbm в cc-Sb2O4; в — размещение атомов SbIU между слоями SbO4, располо-
женными перпендикулярно плоскости рисунка, штриховые линии — удлинен-
ные связи Sb—О.
очень схожи; одна представляет собой «урезанный» вариант
другой. Обе состоят из складчатых слоев (рис. 20.9,а), образо-
ванных октаэдрами Sbv06 путем обобщения всех экваториаль-
ных вершин (как в плоском слое в K2NiF4), а атомы Sb (III)
располагаются между слоями и имеют существенно искажен-
ную пирамидальную координацию четырьмя атомами О
(рис. 20.9, в). Структура p-Sb2O4 приведена на рис. 20.9,6. Окру-
жение Sb (III) и Sb(V) в двух формах Sb2O4 очень похожи меж-
ду собой; с a-Sb2O4 изоструктурны соединения SbIUNbvO4 и
BiIUSbvO4. Нейтронографическое уточнение структуры a-Sb2O4
позволило установить значения длин связей и величин углов,
которые приведены на рис. 20.9, в.
Структура SbmAsvO4 отличается от структуры и As2O4,
и Sb2O4; в ней Sb и As координированы четырьмя атомами О,
но по-разному: Sb «односторонне», As тетраэдрически. В сово-
купности же эти атомы образуют слои, основанные на самой
простой 4-связанной сетке D4), состоящей из 8-членных колец
м4о4.
676 20. Мышьяк, сурьма, висмут
?0.4. Химия оксидов пятивалентных мышьяка и сурьмы
20.4.1. Оксосоединения пятивалентного мышьяка. Пентаоксиды
As, Sb и Bi не могут быть синтезированы подобно P2Os прямым
окислением элемента, так как при высоких температурах разла-
гаются с потерей кислорода. As2O5 получают дегидратацией его
«гидратов»:
-30 °С 36 °С 5 170 °С . .
As2O5.7H,O *- As2O5-4H2O >- As2Cy-g-H2O *- As2O5
(H3AsO4.2H2O) ^AO^HOj (H5As3Ol0)
H3AsO4-V2H2O — истинный гидрат H3As04, потому что он
состоит из ансамбля тетраэдрических молекул AsO(OHK, свя-
занных водородными связями, и молекул Н2О [1]. Н5Аз30ю
состоит из бесконечных цепей октаэдров и тетраэдров, связан-
ных через общие вершины (рис. 20.10) [2]. Атомы водорода не-
посредственно не локализованы; их вероятные позиции выведе-
ны из сопоставления расстояний О—О между цепями.
В основе структуры кристалличе-
ского As2O5 лежит сложный трехмер-
ный каркас из тетраэдров AsO4
(As—О 1,68 А) и октаэдров AsO6
(As-0 1,82 A) [3].
По-видимому, невозможно полу-
чить орто-, пиро- или метамышьяко-
вые кислоты дегидратацией гидратов
H3As04, но соли всех трех типов хо-
рошо известны, и в структурном отно-
шении они аналогичны соответствую-
щим фосфатам. Во всех этих солях
(в ионах AsO43- AsO3(OHJ-,
AsO2(OHJ- и в молекуле AsO(OHK,
отмеченной выше) As(V) координиро-
ван тетраэдрически. YAsO4 изострук-
Рис. 20.10. Структура турен YPO4 И ZrSiO4, KH2As04—
H5As3O10. КН2РО4. Ион AsO3(OHJ- изучен
в ряде солей, например CaHAsCV
•ЗН2О [4] и MgHAsO4-4H2O [5], а ион AsO2(OHJ- —
в NaAsO2(OHJ [6]. Длины связей As—О близки —1,67 А,
a As—ОН —1,73 А. Метаарсениты содержат линейные или цик-
лические ионы, подобные ионам, обнаруженным в фосфатах и
силикатах; например, в NaAsO3 — линейный ион [7], а в
Tl4(As03L — циклический As4Oi24~" [8]. Интересно, что анион
в K5As3Oio [9] в отличие от линейного РзОю5" (в фосфорном
.--н—
20.4. Оксиды As(V) и Sb(V) 677
скелете угол Р...Р...Р составляет 173°) имеет изогнутую кон-
фигурацию с углом As... As... As 105°. То же имеет место и в
анионе в соли BaH(AsCr2Oi0) {a) [10]. Обратим внимание на
строение иона AsCr3Oi33~ (б) [10а].
Тетраэдрическая координация Asv атомами кислорода уже
найдена в арсиновых кислотах R-AsO(OHJ [11] и в диметил-
арсиновой кислоте (CH3JAsO(OH) [12], молекулы которой с по-
мощью водородных связей образуют в кристаллах димеры, по-
добные димерам карбоновых кислот.
О3Сг СУО3
о о
As
о2
03О0 ОСгО3
А
О OCrOj
Октаэдрическая координация As(V) атомами кислорода от-
мечена в пирокатехиновом производном, а также в H5AS3O10.
Как уже упоминалось, в As2Os и HsAs3Oi0, атомы As(V) нахо-
дятся и в тетраэдрической, и октаэдрической координации;
то же относится и к дискретным циклическим анионам As4Ou8~
в BaH6As40i4 {в) 1[13]. В NaHAs2O6 [14] анион состоит из
слоев, основанных на простейшей плоской 4-связанной сетке,
сформированной из единиц типа в, соединенных друг с другом
путем обобщения кислородных атомов (показанных на схеме
в виде заштрихованных кружочков).
Литература. [11 Acta cryst., 1968, В24, 987. [2] Acta cryst., 1966, 21, 808.
C7 Z. anorg. allg. Chem., 1978, 441, 5. [4] Acta cryst., 1973, B29, 90. [51 Acta
cryst., 1976, B32, 1460. [6] Acta cryst., 1977, B33, 2684. [71 Acta cryst., 1956, 9,
87, 811. [8] Z. anorg. allg. Chem., 1969, 367, 92. [9] Acta cryst., 1980, B36, 1634.
Jl01 Acta cryst., 1979, B35, 726. [10a] Acta cryst., 1978, B34, 3350. [11] Bull.
Chem. Soc. (Japan), 1962, 35, 1600. [12] J. Chem. Soc, 1965, 4466. [13] Acta
cryst, 1977, B33, 3222. [14] Acta cryst., 1978, B34, 3727.
20.4.2. Оксосоединения пятивалентной сурьмы. При получении
пентаоксида сурьмы металл растворяют в НС1, затем с по-
мощью HNO3 осаждают пентаоксид и прокаливают его при
780 °С в течение 3 мин. Кристаллическая структура пентаоксида
сурьмы — это сложный трехмерный ансамбль, построенный из
соединенных вершинами и ребрами октаэдров SbO6i[l], анало-
гичный тому, который был найден в одной (В) из многочислен-
ных форм Nb2O5. Bi2O5, приготовленный окислением раствора
Bi2O3 или сплавлением Bi2O3 с КС1О3, плохо идентифицирован,
часто содержит щелочь и (или) воду; пока что нет полной уве-
ренности в том, что чистый Bi2O5 уже получен.
678 20. Мышьяк, сурьма, висмут
До недавнего времени химия оксидных соединений пятива-
лентной сурьмы была чрезвычайно запутанной, и многие соеди-
нения— некоторые ангидриды, гидраты — были описаны как
орто-, мета- и пироантимонаты, и им приписывались формулы,
аналогичные формулам соответствующих фосфатов. В результа-
те же структурных исследований многих из указанных кристал-
лических веществ выяснилось, что структурная химия этих сое-
динений очень проста, совершенно непохожа на химию фосфа-
тов, арсенатов и ванадатов и основана не на тетраэдрической,
а на октаэдрической координации сурьмы атомами кислорода.
Многие из прежних формул потребовали пересмотра.
Описываемые соединения подразделяются на две главные
группы:
а) соли, содержащие ионы Sb(OHN~;
б) сложные оксиды следующих (а возможно, и других) ти-
пов, в основе структуры которых лежат координационные окта-
эдры SbO6: MSbO3, MniSbO4, N[uSb206, MIISb207. Свободные ок-
сокислоты сурьмы даже менее устойчивы, чем соответствующие
производные мышьяка. Различные гидратные формы триоксида и
пентаоксида были описаны как сурьмянистая и сурьмяная кис-
лоты, но их структуры пока неизвестны. Конечные ионы SbO43~,
SbO3~ и Sb2O74~ не существуют. Все соединения, первоначально
описанные как орто-, мета- и пироантимониты, содержат Sb(V),
октаэдрически координированную атомами кислорода, либо в
виде ионов Sb(OH)e~ (в соединениях, рассматривавшихся ра-
нее как гидратированные мета- или пироантимонаты), либо в
виде групп SbC>6 в соединениях типа б, которые лучше всего
описывать как сложные оксиды по причинам, обсуждаемым
ниже.
а) Соли, содержащие ионы Sb(OH)e~. Первоначально этим
соединениям приписывались формулы гидратированных мета- и
пироантимонатов, например LiSbO3-3H2O и Na2H2Sb2O7-5H2O.
На самом деле ни мета-, ни пиро-ионов в этих солях нет; преж-
няя интерпретация основывалась на идее об их прямой анало-
гии с соединениями фосфора. Однако в действительности не за-
фиксировано ни одного случая структурной аналогии между со-
ответствующими производными фосфора и сурьмы. Исследова-
ние кристаллической структуры натриевого «пироантимоната»
Na2H2Sb2O7-5H2O показывает, что его правильная структурная
формула NaSb(OHN, а изоструктурной ему соли серебра —
AgSb(OHN [2]. В псевдокубической соли натрия атомы металла
размещены таким же образом, как ионы Na+ и С1~ в NaCl,
и каждый атом сурьмы является центром иона Sb(OHN~. Под
действием 40%-ной HF соль Na[Sb(OHN] превращается в
Na(SbF6), который имеет точно такую же структуру. Осадок,
выпадающий при добавлении раствора «пироантимоната» нат-
20.4. Оксиды As(V) и Sb(V) 679
рия к раствору какой-либо магниевой соли, имеет эмпирический
состав Mg(SbO3J-12Н2О и рассматривался поэтому как гидра-
тированный метаантимонат. Его формула [Mg(H2ON][Sb(OHN]2,
основанная на результатах исследования кристаллов [3], пока-
зывает, что он в такой же степени является гидратированным
.антимонатом, как и натриевый пироантимонат. Ниже приведе-
ны первоначально принятые формулы и формулы, следующие
из структурных исследований:
Первоначально принятая формула
Правильная структурная формула
Na2H2Sb2Or-5H2O
Mg(SbO3h-12 Н2О (аналогичные со-
ли Со н Ni)
Cu(NH3K(SbO3J-9H2O
LiSbO3-3H2O
Na[Sb(OHNl
Mg[Sb(OHN]2-6H2O или
[Mg(H2ON][Sb(OHNl2
[Си(ЫН3)з(Н2О)зРЬ(ОНЫ2
Li[Sb(OHNl
Частичный гидролиз NaSbFe приводит к образованию соли, ко-
торую первоначально рассматривали как NaF-SbOF3-H2O.
Ее правильная формула Na[SbF4(OHJ] показывает, что она
принадлежит к тому же типу, что и NaSbF6, и NaSb(OH)e-
Литература. [1] Acta cryst., 1979, В35, 539. [21 Z. anorg. allg. Chem., 1938, 238,
241. [3] Rec. Trav. chim. (Belg.), 1937, 56, 931.
б) Сложные оксиды, основанные на координационных груп-
пах SbO6. Во всех соединениях этой группы сурьма октаэдриче-
ски координирована кислородом, и в некоторых случаях их
структуры сходны со строением простых ионных кристаллов; так,
например, NaSbO3 имеет структуру типа ильменита (FeTiO3,
разд. 6.6); FeSbO4 — неупорядоченную типа рутила (разд. 13.4.1);
ZnSb2O6 — типа трирутила. Поэтому эти фазы предпочтительнее
описывать как сложные оксиды, а не как «антимонаты» различ-
ных типов.
M'SbO3. Соль NaSbO3 можно приготовить нагреванием
NaSb(OHN на воздухе или сплавлением Sb2O3 с карбонатом
натрия; известны аналогичные соли серебра и лития. Натрие-
вое производное имеет структуру ильменита; фаза, которая счи-
талась его полиморфной модификацией, в действительности
представляет собой Na2Sb205@HJ (рассматривается позднее).
Взаимосвязь между структурами LiSbO3 [1] и NaSbO3 описана
в гл. 4. В обеих этих структурах атомы М и Sb занимают по
*/з октаэдрических пустот в гексагональной плотнейшей упаков-
ке атомов кислорода, но при этом выбор занимаемых пустот в
двух структурах разный (разд. 4.1).
680 20. Мышьяк, сурьма, висмут
KSbO3 получается нагреванием KSb(OHN; его низкотемпе-
ратурная модификация имеет структуру ильменита. При 1000 °С
она превращается в кубическую полиморфную модификацию
(пространственная группа Im3) [2], а при повышенных давле-
ниях— во вторую кубическую модификацию с пространствен-
ной группой РпЗ [3]. Обе эти кубические формы, имеющие
практически одинаковые структуры (рис. 5.33), построены иа
пар октаэдров с общими ребрами — структурная особенность,,
характерная для целого ряда подобных соединений. Трехмерный
каркас в K2Sb40n также построен из пар октаэдров, тогда как
в КзйЬбОн [4] наряду с такими парами присутствуют одиночные
октаэдры.
Соединение, первоначально описанное как CaSb2Os, на самом
деле имеет формулу CaNaSb2O6OH. При прокаливании
NaSb(OHN вначале образуется Na2Sb205@HJ или, возможно,
NaSbO3-xH2O, который в конце концов разлагается до NaSbO3
[5J.
Многие соединения имеют очень похожие структуры, напри-
мер Na2Sb205@HJ, минералы пирохлор CaNaNb2O6F и роменит
CaNaSb2O6(OH), Sb3O6(OH), BiTa2OeF и AgSbO3. Соединение
Sb3O6(OH) интересно в связи со структурой Sb2O4. При прока-
ливании гидратированного (~800°С) Sb2C>5 он превращается не
в Sb2O4, как это одно время предполагалось, а в Sb3O6(OH),
и уже последнее соединение превращается в тетраоксид только
после продолжительного отжига при 900 °С, и поэтому Sb3O6(OH)
был принят за тетраоксид, который получается также окисле-
нием Sb2O3 кислородом воздуха.
Соединение BiTa2OeF приготавливается нагреванием BiOF
с Та2О5. Структуры отмеченных выше соединений взаимосвяза-
ны следующим образом. Элементарная ячейка структуры пиро-
хлора (разд. 6.4.3) содержит восемь формульных единиц, т. е.
8[CaNaNb2O6F]. Комбинация атомов (8Ca + 8Na) может быть
заменена 8 атомами Sb(III), атомы Nb — атомами Sb(V) и ато-
мы фтора — группой ОН, что в результате дает SbnISb2vO6(OH).
В то же время 8Ca + 8Na можно заменить на 16 атомов серебра;
если одновременно убрать 8 групп ОН, это приведет к структу-
ре AgSbO3. Эти взаимосвязи можно обобщить следующим об-
разом:
Пирохлор
AgSbO3
Sb3O6(OH)
BiTa2O6F
8Ca+8Na
16Mb
48 0
8F
16 Ag
16Sb(V)
48 0
8 Sb(III)
16Sb(V)
48 0
8 OH
(
16 Та
48 О
8F
20.4. Оксиды As(V) и Sb(V) 681!
MnSb206. У соединений MnSb206 найдено три типа структур.
М11 с малыми радиусами — ионы магния и некоторых Зй-метал-
лов —образуют структуру трирутила (разд. 6.3.1), иногда та-
пиолита (по названию минерала FeTa2Oa). Соединения этого
типа включают:
FeSb2O6
MgTajOe
FeTaz0e
Zn
Co
Ni
Co
Ni
Несколько более крупный Мп2+ приводит к структуре ниобита
(разд. 4.3). Обе эти структуры невозможны для ионов М2+ с
еще большими радиусами. Если радиус иона близок пли превы-
шает 1 А, то возникает гексагональная фаза (рис. 20.11), в ко-
торой ионы М2+ и Sb5+ разделяются в слоях так, что за счет
РЬ
Рис. 20.11. Кристаллическая структура PbSb2O6. а —общая схема; б — верти-
кальное сечение (в направлении указанном стрелкой на рис. а) в несколько
увеличенном масштабе.
дальнейшего раздвижения слоев Sb—О в решетку могут войти
ионы от Са2+ до Ва2+ {6].
MIHSbO4. Ряд соединений этого типа, как установлено, обла-
дает статистической структурой рутила, т. е. ионы М3+ и Sb5+
размещены произвольно по позициям Ti4+ в решетке рутила.
Этот ряд включает FeSbO4, AlSbO4, CrSbO4, RbSbO4 и GaSbO4
[П.
44—985
682 20. Мышьяк, сурьма, висмут
M2"Sb2O7. Среди этих соединений найдено два кристаллохи-
мических типа [8]: веберит (Ca2Sb207, Sr2Sb207 и Cd2Sb207) и
пирохлор (Pb2Sb207) Ca2Ta207, Cd2Ta207 и Cd2Nb207 [9]). Эти
две тесно связанные между собой структуры характерны для
делого ряда сложных оксидов и фторидов. В структуре веберита
(Na2MgAlF7) [10] можно выделить каркас, построенный из окта-
эдров MgF6 и A1F6 путем обобществления всех вершин каждо-
го октаэдра MgF6 и четырех вершин каждого A1F6 так, что кар-
кас имеет химический состав MgAlF7 или в более общем виде
,М2Х7, если октаэдры образованы атомами одного сорта. В ха-
о Мд
О Al
Рис. 20.12. а — каркас М2Х7 в веберите Na2(MgAlF7); б— (пирохлорный) кар-
кас М2Х6 в ралстоните Na^MgxAl2-^(F, ОНN-6 Н2О.
рактере связей М—F или Al—F и Na—F нет существенных раз-
личий, но тем не менее ионы Na+ располагаются в полостях с
координацией 8 или, более точно, с координацией 4 + 4 или
2 + 4 + 2; поэтому при сравнении структур удобно опираться на
¦каркасы Mg—Al—iF. В решетке пирохлора у октаэдров МХб
обобществлены все атомы X так, что каркас имеет состав
МХ3(М2Х6). В этом каркасе имеется место и для седьмого ато-
ма X, но его наличие или отсутствие не оказывает существенно-
го воздействия на устойчивость структуры, и поэтому среди пи-
рохлорных фаз встречаются как соединения типа ралстонита
Na.vMg.vAh-* (F, ОНN-Н2О, Са2Та207 и т. д., так и уже упоми-
навшийся AgSbO3. Поскольку трудно воспроизвести наглядно
целостную картину упаковки октаэдров, на рис. 20.12 показаны
только атомы Mg и А1 описанных каркасов М2Х7 и М2Х6. Каж-
дая линия, соединяющая два атома, изображает М—X—М, т. е.
включает обобщенную октаэдрическую вершину, хотя в прин-
ципе атомы X не лежат точно на этих линиях. Структура пиро-
хлора рассматривается также в гл. 6 и 13 (см. также рис. 7.3,6).
20.5. Сульфиды 683
Литература. [1] Acta Chem. Scand., 1954, 8, 1021. [2] Ark. Kem., 1940, 14A, 1.
[31 J. Solid State Chem., 1973, 6, 493. [41 Acta cryst., 1974, B30, 945. [51 Can. J.
Chem 1970, 48, 1323. [6] Ark. Kem., Mineral, Qeol., 1941, 15B, №3. [71 Ark.
Kem., Mineral, Geo!., 1943, 17A, № 15. [8] Ark. Kem. Mineral., Geol., 1944, 18A,
№ 21. [9] Phys. Rev., 1955, 98, 903. [101 Ark- Kem., Mineral., Geol., 1944, 18B,
X° 10.
20.5. Сульфиды мышьяка, сурьмы и висмута
Известны следующие сульфиды:
As2S3 As2S5 As4S3 As4S4 As4S5 As4Se
Sb2S3 Sb2S6
Bi2S3
Структуры пентасульфидов пока неизвестны; As4Ss — димерная
форма парообразных молекул As2S3 — в структурном отноше-
нии подобна As4O6 и Р4О6 (разд. 19.5.1).
Кристаллический As2S3 (орпимент) [1] имеет слоистую струк-
туру (рис. 20.13), построенную, в принципе, так же, как моно-
клинные формы As2O3 (разд. 20.3.1).
Простая цепь состава M2S3 для элемента М, образующего
три связи, имеет вид:
ч /
м2
Такие цепи осуществляются в Sb2S3 и изоструктурном Bi2S3.
Межатомные расстояния указывают, однако, на то, что эти цепи
ассоциируются в пары (рис.
20.14), вследствие чего только
атомы Mi сохраняют по 3 сосед-
них атома серы и не имеют ни-
каких других соседей ближе, чем
на 3,14 А, тогда как у атомов
М2 набор соседей становится бо-
лее обширным: один атом серы
находится на расстоянии 2,46 А,
два — на расстоянии 2,68 А и еще
два — на 2,85 А, не считая еще
более удаленных. На рис. 20.14
связи М2—S B,85 А) показаны
штриховыми линиями. Вполне
Рис. 20.13. Слой кристаллической
структуры орпимента As2S3-
44*
'684 20. Мышьяк, сурьма, висмут
очевидно, что для кристаллического Sb2S3 невозможно предло-
жить простую картину связей; но обоим сортам неэквивалент-
ных атомов Sb в соответствии с уравнением Полинга можно
приписать дробные значения порядков связи (разд. 29.3). Та-
кое строение Sb2S3 подтверждено более поздним исследованием
изоструктурного Sb2Se3 [2].
Минерал гетчеллит AsSbS3 [3], примечательный своей чрез-
вычайной мягкостью, имеет сложную слоистую структуру, в ко-
торой атомы металлоидов разупорядочены по позициям с пира-
мидальной координацией, а атомы
серы имеют КЧ 2. По-видимому,
сложность картины обусловлена тем
обстоятельством, что As в своих
сульфидных соединениях обычно
окружен пирамидально тремя ато-
мами серы, тогда как Sb в Sb2S3
находится в окружении как трех,
так и пяти атомов.
В Bi2S3 [4] четыре ближайших
соседа Bi образуют почти плоский
прямоугольник, а полный набор его
соседей формирует сильно искажен-
Рис. 20.14. Схема двойных це- ный 7-вершинныЙ ПОЛИЭДр. Крорди-
лей в Sb2S3. Большие кружки — нацию BiIU атомами серы в Bi2S3
атомы серы. Все атомы одного [{ в других соединениях (BiPS4 [5]
слоя заштрихованы, и слабые
вторичные связи Sb—S изобра-
жены в виде штриховых линий.
и Bi2in4S9 [6]) описать довольно
трудно; к тому же, как и в соедине-
ниях Sn", она часто не одинакова
для всех атомов одной и той же структуры. Обычно в коорди-
национную группу Bi входят 3 или 4 атома S B,7 А) и еще не-
сколько более удаленных атомов C,5 А), формируя сильно ис-
каженный 6-, 7- или 8-вершинный полиэдр.
В двух модификациях As4S3 [7, 8] молекула имеет ту же кон-
фигурацию, что и молекула P4S3 (рис. 19.10, в).
Реальгар AS4S4 представляет собой молекулярный кристалл,
который легко сублимирует в вакууме и превращается при воз-
действии света в орпимент. При температурах до 550°С плот-
ность его пара соответствует молекуле AS4S4. При более высо-
ких температурах начинается (и при 1000 °С завершается) дис-
социация As4S4 на As2S2. Структура As2S2, по-видимому, пока
неизвестна, а молекула As4S4, как было показано сначала элек-
тронографическим исследованием пара [9], а позднее — рентге-
новским изучением кристаллического реальгара [1], а также
второй кристаллической модификации As4S4 [10J, имеет конфи-
гурацию, изображенную на рис. 20.15, а. Существует еще третья
кристаллическая форма As4S4 [И] с изомерной молекулярной
20.5. Сульфиды 685
структурой, присущей P4S4 (разд. 19.8). В этой модификации
атомы мышьяка подразделяются на три вида:
,2 As
.As
один As'.
один As—3S и два As!
В реальгаре все четыре атома мышьяка связаны с атомами
1AS + 2S.
В кристаллическом As4Ss молекула имеет конфигурацию,
показанную на рис. 20.15,6 [12]; она похожа на структуру
As4S4, но содержит дополнительный мостиковый атом серы. Раз-
мещение еще одного атома серы между другими парами атомов
мышьяка приводит к молекуле As4S6.
Рис. 20.15. Структуры As4S4 (a), As4S5 (б) и As4S62- (e).
Длины связей в сульфидах мышьяка лежат в интервале от
2,15 до 2,20 А для As—S (концевой или мостиковый атом S)
и 2,50—2,55 А для As—As, а валентные углы близки к 100°, за
исключением углов As—As—As в AS4S3 F0°)*.
Литература. [1] Z. Kristallogr., 1972, 136, 48. [2] Z. Kristallogr., 1972, 135
308. [3] Acta cryst., 1973, B29, 2536. [4] Miner, petrogr Mitt 1970 14 55
;[5] Acta cryst., 1975, B31, 2003. [6] Acta cryst., 1972, B28, 3128. [71 j Chem
Soc, A 1970, 1800. [8] J. Chem. Soc, D 1973, 1737. [9] J. Am. Chem. Soc 1944'
66, 818. [10] J. Chem. Soc, D 1972, 1347. [11] Z. anorg. allg. Chem., 1976 419'
176. [12] J. Chem. Soc, D 1973, 1740.
20.5.1. Тиопроизводные мышьяка и сурьмы. Дисульфид диме-
тиларсина. Перечень тиоарсенатов включает пирамидальный
анион AsS33- (As—S 2,25 А) [1] и метадитиоарсенат (AsS2)nn-,
образованный из сходных пирамидальных групп (углы ~ 100°)
2K2 Я I 2,17 Я
Детальный обзор стереохимии халькогенпроизводных трехвалентных As
Sb и Bi читатель найдет в работе {Михайлов Ю. Н., Копищева А С в сб ¦'
Проблемы кристаллохимии. Т. 2, с. 70-121, М.: Наука, 1985] -Прим ред
686 20. Мышьяк, сурьма, висмут
Оба иона были изучены в их натриевых солях.
Известны также следующие ионы: AsS43~ [3], AsS3O3^,
AsS2O23~ [За] и AsSO33- [4]; в этих тетраэдрических ионах дли-
ны связей составляют As—О 1,67 A; As—S 2,15 А.
Строение иона As4S62"~ установлено при исследовании соли
пиперидиния (C5Hi2NJ(As4S6) [5]. Его связь с As4S4 и As4S5 по-
казана на рис. 20.15,6. Расстояние As—As для несвязанных
атомов составляет 3,51 А.
Молекула «дисульфида диметиларсина» [6] интересна тем,
что содержит три сорта связей As—S: As111—S; Asv—S и
Asv=S. Координация As111 пирамидальная, a Asv — тетраэдри-
ческая.
2,21 А
2,28 А
Н3С СН3
Информацию об ионе SbS43~ см. в разд. 17.2.
Литература. [1] Acta cryst., 1976, В32, 3175. [2] Acta cryst., 1977, ВЗЗ, 908.
[3] Acta cryst., 1974, B30, 2378. [За] Acta cryst., 1976, B32, 2119. [4] Acta cryst.,
1976, B32, 516. [5] J. Chem. Soc, A 1971, 3130. [6] J. Chem. Soc, 1964, 219.
ОГЛАВЛЕНИЕ
Часть II
8. Водород. Благородные газы. Перевод С. И. Троянова .... 5
водород 5
8.1. Введение . . 5
8.2. Гидриды 7
8.2.1. Молекулярные гидриды 8
8.2.2. Солеобразные гидриды 8
8.2.3. Гидриды переходных металлов 11
8.2.4. Тройные гидриды 18
8.2.5. Гидридные комплексы переходных металлов .... 19
•8.3. Водородная связь 22
8.3.1. Свойства водородных связей 24
8.3.2. Длина и энергия водородной связи 24
8.3.3. Положение атома водорода 26
¦8.4. Водородная связь в кристаллах 29
8.4.1. Гидриды 30
8.4.2. Средние фториды 32
8.4.3. Бифториды (гидрофториды, кислые фториды) MHF2 34
8.4.4. Другие кислые фториды (гидрофториды) MHnFn+i . . 35
8.4.5 Другие ионы (X—Н—Х)~ 36
8.5. Кислоты и кислые соли 36
8.5.1. Кислоты 36
8.5.2. Кислые соли 38
8.5.3. Строение кислых солен и кристаллических оксокислот 40
СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ 47
8.6. Фториды ксенона . 47
8.7. Фторсодержащие катионы 50
8.8. Ксенонсодержащие анионы . 53
8.9. Оксиды и оксоанионы 54
8.10. Оксофториды и KXeO3F 55
8.11. Соединения криптона 56
3. Галогены. Бинарные галогениды. Перевод С. И. Троянова ... 57
9.1. Введение 57
9.2. Стереохимия хлора, брома и иода 61
9.3. Строение простых веществ 62
9.4. Межгалогенные соединения 63
9.4.1. Строение межгалогенных соединений 64
9.4.2. Галогенные и межгалогенные катионы 67
9.5. Полигалогениды 69
9.5.1. Строение полигалогенидных анионов 70
9.5.2. Полииодидные ионы 72
ОГЛАВЛЕНИЕ
Часть II
8. Водород. Благородные газы. Перевод С. И. Троянова .... 5
водород 5
8.1. Введение 5
8.2. Гидриды 7
8.2.1. Молекулярные гидриды 8
8.2.2. Солеобразные гидриды 8
8.2.3. Гидриды переходных металлов 11
8.2.4. Тройные гидриды 18
8.2.5. Гидридные комплексы переходных металлов .... 19
•8.3. Водородная связь 22
8.3.1. Свойства водородных связей 24
8.3.2. Длина и энергия водородной связи 24
8.3.3. Положение атома водорода 26
•8.4. Водородная связь в кристаллах 29
8.4.1. Гидриды 30
8.4.2. Средние фториды 32
8.4.3. Бифториды (гидрофториды, кислые фториды) MHF2 34
8.4.4. Другие кислые фториды (гидрофториды) MHnFn+i . . 35
8.4.5 Другие ионы (X—Н—Х)~ 36
8.5. Кислоты и кислые соли 36
8.5.1. Кислоты 36
8.5.2. Кислые соли 38
8.5.3. Строение кислых солен и кристаллических оксокислот 40
СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ 47
8.6. Фториды ксенона . 47
8.7. Фторсодержащие катионы 50
8.8. Ксенонсодержащие анионы 53
8.9. Оксиды и оксоанионы 54
8.10. Оксофториды и KXeO3F 55
8.11. Соединения криптона 56
3. Галогены. Бинарные галогенидьь Перевод С. И. Троянова ... 57
9.1. Введение 57
9.2. Стереохимия хлора, брома и иода 61
9.3. Строение простых веществ 62
9.4. Межгалогенные соединения 63
9.4.1. Строение межгалогенных соединений 64
9.4.2. Галогенные и межгалогенные катионы 67
9.5. Полигалогениды 69
9.5.1. Строение полигалогенидных анионов 70
9.5.2. Полииодидные ионы 72
Оглавление
9.6. Галогеноводороды и ионы НХ2~, Н2Х3- и др 75
9.6.1. Гидрид-галогениды металлов 75
9.7. Оксосоединения галогенов ... 76
9.7.1. Оксиды 7S
9.7.2. Оксофториды. Оксофторидные ионы 77
9.7.3. Оксокатионы 78
9.7.4. Оксокислоты и оксоанины 79
9.8. Галогениды металлов 84
9.9. Строение кристаллических галогенидов МХ„ 85
9.9.1. Моногалогениды 87
9.9.2. Дигалогениды 90
9.9.3. Тригалогениды 96
9.9.4. Тетрагалогениды 103
9.9.5. Пентагалогениды 108
9.9.6. Гексагалогениды . . 110
9.9.7. Гептагалогениды 111
9.10. Полиядерные комплексы со связями металл — металл . . 111
9.10.1. Биядерные галогенидные комплексы молибдена, техне-
ция и рения 111
9.10.2. Трехъядерные галогенидные комплексы рения . . . 113
9.10.3. Галогенидные комплексы Nb, Та, Mo, W, Pd и Pt, содер-
жащие металл-кластеры 115
9.10.4. Низшие галогениды элементов ША и IVA групп . . 121
9.11. Галогениды металлов в жидком и газообразном состояниях 124
10. Комплексные галогениды, оксо- и гидроксогалогениды.
Перевод С. И. Троянова 131
10.1. Комплексные галогениды 131
10.1.1. Галогениды АВХ2 138
10.1.2. Галогениды А,„ВХ3 138
10.1.3. Галогениды АтВХ4 140
10.1.4. Галогениды А„,ВХ5 142
10.1.5. Галогениды А„,ВХ6 144
10.1.6. Галогениды АтВХ7 154
10.1.7. Галогениды АОТВХ8 155'
10.1.8. Комплексные галогениды, содержащие полиядерные
комплексные ионы конечного размера 156
10.1.9. Комплексные галогениды, содержащие более одного
типа комплексных анионов 158
10.1.10. Другие комплексные галогениды
10 1 11. Комплексные хлориды Зй-металлов CsMCl3, Cs2MCl4
и CsMCl5 159
10.1.12. Комплексные фториды алюминия и железа . . . 160
10.1.13. Некоторые комплексные фториды элементов групп IVA
и VA 163
10.2. Нитридогалогениды металлов 169
10.3. Тиогалогениды 170
10.4. Оксогалогениды 172
10.4.1. Оксогалогенидные ионы 174
10.4.2. Структуры оксогалогенидов металлов 175
10.4.3. Ионные оксофториды 175
10.4.4. Оксогалогениды переходных металлов в высших степе-
нях окисления 179
10.4.5. Оксогалогениды МОС1, МОВг и MOI 181
10.4.6. Структуры других оксогалогенидов 185
10.5. Гидроксогалогениды 185
10.5.1. Гидроксогалогениды МХ(ОН) . ...... 18S
Оглавление 689
' 10.5.2. Гидроксогалогениды М2Х(ОНK i86
10.5.3. Другие гидроксогалогениды 188
10.5.4. Гидратированные гидроксохлориды 188
10.6. Амминогалогениды 189
11. Кислород. Перевод Ф. М. Путилиной 191
11.1. Стереохимия кислорода 191
11.2. Различия между кислородом и серой 191
11.3. Простые молекулы и ионы 196
11.3.1. Молекула кислорода и катион диоксигенила . . . 196
11.3.2. Озон и озониды 197
11.3.3. Пероксиды, надпероксиды и «полуторные» оксиды 197
11.3.4. Молекулы OR2 198
11.3.5. Пероксид водорода 199
11.3.6. Фториды кислорода 201
11.3.7. Пероксокислоты неметаллов 202
11.3.8. Пероксо- и надпероксопроизводные металлов . . . 203
11.3.9. Оксо-ионы и оксомолекулы металлов 207
11.3.10. Оксосоедипения металлов, содержащие мостики
М-О-М 209
11.4. Кислородсодержащие ионы 211
11.4.1. Типы кислородсодержащих ионов 213
11.5. Ионы изополисоединений 216
11.5.1. Ионы изополисоединений ванадия, ниобия и тантала 216
11.5.2. Ионы изополисоединений молибдена и вольфрама . . 217
11.6. Ионы гетерополисоединений 223
11.6.1. Тетраэдрическая координация гетероатома .... 225
11.6.2. Октаэдрическая координация гетероатома .... 229
11.6.3. Координация гетероатома в виде квадратной антипризмы 232
11.6.4. Координация гетероатома в виде икосаэдра . . . 232
11.6.5. Другие гетерополи-ионы, содержащие молибден и вана-
дий (или фосфор) 233
12. Простые оксиды металлов. Перевод Ф. М. Путилиной .... 236
12.1. Введение 236
12.2. Структуры простых (бинарных) оксидов 239
12.2.1. Низшие оксиды рубидия и цезия 240
12.2.2. Оксиды М3О 241
12.2.3. Оксиды М2О 242
12.2.4. Оксиды МО 243
12.2.5. Оксиды МО2 246
12.2.6. Оксиды МО3 250
12.2.7. Оксиды МО4 250
12.2.8. Оксиды М2О3 251
12.2.9. Оксиды М2О5 255
12.2.10. Оксиды М2О7 257
12.2.11. Оксиды МзО4 259
12.3. Оксиды железа 259
12.4. Оксиды алюминия 261
12.5. Оксиды марганца 263
12.5.1. Каркасные структуры 264
12.5.2. Слоистые структуры 266
12.6. Оксиды свинца 267
12.6.1. Моноксид свинца РЬО 267
12.6.2. Оксид РЬ3О4 268
12.6.3. Оксид РЬ2О3 269
12.6.4. Диоксид свинца РЬО2 269
690 Оглавление
12.6.5. Некоторые двойные оксиды четырехвалентного свинца 269
12.7. Химия кислородных соединений некоторых переходных метал-
12.7.1. Оксиды титана . 272
12.7.2. Кислородные соединения ванадия 27&
12.7.3. Оксиды молибдена и вольфрама 282
13. Сложные оксиды. Перевод Ф. М. Пути.шной 289
13.1. Введение 289
13.2. Оксиды АВО2 291
13.3. Оксиды АВОз 293
13.3.1. Структуры, построенные из плотноупакованных слоев
АО, . . 295
13.3.2. Структурный тип перовскита 300
13.4. Оксиды АВО4 306
13.4.1. Структурный тип вольфрамита 309=
13.4.2. Структурные типы шеелита и фергюсонита .... 310
13.5. Оксиды АВ2О4 310
13.5.1. Структуры нормальной и обращенной шпинели . . 3'12
13.5.2. Сверхструктуры шпинели 316
13.5.3. «Ферриты» и другие структуры, родственные шпинели 316-
13.5.4. CaFe2O4, CaTi2O4 и родственные им структуры . . . 321
13.5.5. Структурный тип KzNiF4 323:
13.6. Структуры других сложных оксидов 324
13.6.1. Структурный тип псевдобрукита А2ВО5 324
13.6.2. Оксиды АВ2О6 324
13.6.3. Структурный тип пирохлора А2В2О7 325
13.6.4. Слоистые структуры АтВ2Х7, родственные перовскиту 326
13.6.5. Структурный тип граната 326^
13.6.6. Другие структуры сложных оксидов 328
13.7. Сложные оксиды, содержащие титан, ванадий, ниобий, молиб-
ден или вольфрам 330'
13.8. Бронзы и родственные им соединения 334
13.8.1. Вольфрамовые бронзы 33&
13.8.2. Структура тетрагональной бронзы 338
13.8.3. Молибденовые бронзы 341
13.8.4. Ванадиевые бронзы 342'
13.9. Сложные оксиды, построенные из октаэдров АО6 и тетраэдров
ВО4 ¦ 344
14. Гидроксиды, гидроксид-оксиды и гидроксосоли металлов.
Перевод Ф. М. Путилиной 351
14.1. Гидроксиды металлов 351
14.1.1. Структуры гидроксидов М(ОН)„ 35$
14.1.2. Сложные гидроксиды 364
14.2. Гидроксид-оксиды 365
14.2.1. Структура YO(OH) 366
14.2.2. Структура InO(OH) 366
14.2.3. а-МО(ОН) 367
14.2.4. Структура y-MO(OH) 370
14.2.5. Структура а-СгО(ОН) (НСгО2) 372
14.3. Гидроксосоли (основные соли) 373
14.3.1. Кристаллические структуры основных солей . . . 374
14.3.2. Конечные гидроксокомплексы металлов 375
14.3.3. Одномерные гидроксокомплексы металлов .... 377
14.3.4. Двумерные гидроксокомплексы металлов .... 379'
Оглавление 691
15. Вода и гидраты. Перевод Ф. М. Путилиной 383
15.1. Структуры льда и воды . . .... . 383
15.1.1. Лед 383
15.1.2. Вода 387
15.1.3. Водные растворы 390
15.2. Гидраты 391
15.2.1. Клатраты 392
15.2.2. Полиэдрические каркасы 394
15.2.3. Гидраты оксосолей, гидроксидов и галогенидов . . 399
15.2.4. Гидраты группы A: z/xn^l 407
15.2.5. Гидраты группы Б: l>zjxn^lJ2 410
15.2.6. Гидраты группы В: 2/xn<'/2 416
15.2.7. Гидраты кислот и кислых солей 426
15.2.8. Локализация ионов водорода в водородных связях;
остаточная энтропия 432
15.2.9. Аддукты с аммиаком (аммины) и с водой (гидраты) 433
16. Сера, селен, теллур. Перевод В. А. Долгих 437
16.1. Стереохимия соединений серы 437
16.2. Элементные сера, селен и теллур 437
16.2.1. Сера 437
16.2.2. Селен 442
16.2.3. Теллур 443
16.3. Циклические и полиэдрические катионы серы, селена, теллура 443
16.4. Молекулы SR2, SeR2, TeR2: циклические молекулы . . . 445
16.5. Галогениды серы, селена и теллура 445
16.5.1. Галогениды типа SX2 448
16.5.2. Галогениды S2X2 и их аналоги 448
16.5.3. Галогениды SX4 и их аналоги; молекулы R2SeX2 и
R2TeX2 449
16.5.4. Гексагалогениды . 452
16.5.5. Декафторид дисеры S2Fi0 452
16.6. Оксид-галогениды серы, селена и теллура 453
16.7. Оксиды серы, селена, теллура 454
16.7.1. Моноксид дисеры S2O 455
16.7.2. Моноксид серы SO 455
16.7.3. Диоксид дисеры S2O2 455
16.7.4. Диоксид серы SO2 455
16.7.5. Диоксид селена SeO2 456
16.7.6. Диоксид теллура ТеО2 457
16.7.7. Триоксид серы SO3 458
16.7.8. Триоксид селена SeO3 459
16.7.9. Триоксид теллура ТеО3 . 459
16.7.10. Оксиды Те2О5, Те4О9 и дигидроксид-тетраоксид дител-
лура Те2О4(ОНJ 459
16.8. Кислородсодержащие ионы и молекулы, образованные S, Se
и Те 461
16.8.1. Пирамидальные ионы и молекулы 461
16.8.2. Тетраэдрические ионы и молекулы 464
16.8.3. Пиросульфат и однотипные с ним ионы .... 468
16.8.4. Дитиониты 470
16.8.5. Дисульфиты («метабисульфиты»), диселениты и дител-
луриты 470
16.9. Стереохимия молекул и ионов, содержащих цепи Sn 471
16.9.1. Молекулы S2R2 и S3R2 474
16.9.2. Полисульфиды 475
16.9.3. Тионаты и молекулы типа Sn(SO2RJ 477
692 Оглавление
16.10. Структурная химия соединений селена и теллура . . . 48<J
16.10.1. Se(VI) и Te(VI) . .48^
16.10.2. Se(IV) и Te(IV) 480
16.10.3. Se(II) и Te(II). Валентные группы D, 6) и D, 8) 493
17. Сульфиды и оксосульфиды металлов. Перевод В. А. Долгих . . 495
17.1. Структуры бинарных сульфидов металлов 495
17.1.1. Введение . . .495
17.1.2. Сульфиды M2S 497
17.1.3. Моносульфиды 499
17.1.4. Дисульфиды 505
17.1.5. Интеркалаты 506
17.1.6. Сульфиды M2S3 и M3S4 512
17.1.7. Сульфиды индия 518
17.1.8. Сульфиды хрома 520
17.1.9. Сульфиды ванадия, ниобия и тантала 521
17.1.10. Сульфиды титана 524
17.2. Сложные сульфиды и тиосоли 525
17.2.1. Тиосоли 528
17.2.2. Бесконечно адаптируемые структуры 531
17.2.3. Сульфиды со структурами, родственными сфалериту и
вюртциту 532
17.2.4. Сложные сульфиды, содержащие металлические кла-
стеры 539
17.3. Оксид-сульфиды 541
18. Азот. Перевод В. А. Долгих 543
18.1. Введение
18.2. Стереохимия азота
18.3. Азот, образующий четыре тетраэдрические связи
18.3.1. Аммоний и родственные ионы
18.4. Азот, образующий три пирамидальные связи
18.4.1. Аммиак и родственные соединения ....
18.4.2. Гидроксиламин
18.4.3. Сульфонат-ионы, производные от NH3 и NH2OH
18.4.4. Тригалогениды азота
18.4.5. Гидраты аммиака
18.4.6. Аммины
18.5. Молекулы, содержащие группировку у N—N <
18.5.1. Гидразин N2H4
18.5.2. Тетрафторид диазота
18.6. Азот, образующий две связи =N'
18.6.1. Диимид (N2H2) и дифтордиазин (N2F2)
18.7. Соединения, содержащие систему [N—N—N]
18.7.1. Азиды
18.8. Химия оксидных соединений азота ....
18.8.1. Оксиды
18.8.2. Соединения нитрозила: ион N0+
18.8.3. Нитрозосоединения
18.8.4. Нитрозильные производные металлов
18.8.5. Соединения нитроила
18.8.6. Оксогалогенид-ионы
18.9. Сульфиды азота и родственные соединения
543
544
547
547
548
548
554
554
555
556
557
558
558
560
561
562
563
563
566
566
570
571
572
575
576
589
Оглавление 693'
18.10. Нитриды 595
18.10.1. Ионные нитриды 59°
18.10.2. Ковалентные нитриды 598
18.10.3. Нитриды переходных металлов 6001
19. Фосфор. Перевод В. А. Долгих 602
19.1. Стереохимия соединений фосфора ^2
19.2. Элементный фосфор ™2
19.3. Фосфиды металлов °05
19.3.1. Полисульфаны и родственные соединения .... oly
19.4. Структуры простых молекул °''
19.4.1. Молекулы РХ3 ьп
19.4.2. НСР и ион РН2- 9
19.4.3. Гидриды и молекулы Р2Х4 и Р3Х5 ^П
19.4.4. Фосфорил- и тиофосфорил-галогениды 614
19.4.5. Другие тетраэдрические молекулы и ионы . . . °j6
19.4.6. Пентагалогениды фосфора, ионы РХ4+ и РХ6~ . . ° ?
19.4.7. Молекулы PR5, PR5-nX« и смешанные галогениды °1°
19.5. Оксиды и оксосульфиды °*0
19.5.1. Триоксид фосфора ^20
19.5.2. Пентаоксид фосфора ^'
19.5.3. Оксиды Р(Ш) и P(IV) bAf
19.5.4. Оксосульфид фосфора °^
19.5.5. Другие молекулы с конфигурацией типа Р4Ою ¦ ¦ z^4
19.6. Фосфорные оксокислоты и их соли °^2
19.6.1. Ортофосфористая кислота ^24
19.6.2. Фосфорноватистая кислота ^24
19.6.3. Фосфорноватая кислота ^5
19.6.4. Дифосфористая кислота °^>
19.6.5. Изофосфорноватая кислота °^°
19.6.6. Фосфорные кислоты и фосфаты ;?2Ь
19.6.7. Ортофосфорная кислота и ортофосфаты .... 626
19.6.8. Пирофосфаты (дифосфаты) Ь27
19.6.9. Линейные полифосфаты ^2«
19.6.10. Поли-ионы, содержащие Р и Сг °~-*
19.6.11. Метафосфаты bj®
19.6.12. Моно- и дифторофосфорные кислоты °э'
19.6.13. Фосфорамиды и амидофосфаты Ь62
19.6.14. Тиофосфаты ?33
19.6.15. Другие замещенные фосфорные кислоты и их аналоги Ъоб
19.7. Тиофосфаты и родственные соединения ^35
19.8. Сульфиды фосфора ^ЗЬ
19.9. Тиогалогениды фосфора °^
19.10. Циклические соединения фосфора °М
19.10.1. Соединения, содержащие кольца Р„ ь^
19.10.2. Соединения, содержащие системы связанных атомов
азота и фосфора ^
20. Мышьяк, сурьма, висмут.Перевод В. А. Долгих 646
20.1. Элементные мышьяк, сурьма, висмут °4Ь
20.2. Структурная химия As, Pb и Bi °^
20.2.1. Молекулы МХ3. Валентная группа 2, 6 Ь49
20.2.2. Тетраэдрические ионы МХ4+. Валентная группа 8 . . °49
20.2.3. Ионы МХ4~. Валентная группа 2, 8 «52
20 2.4. Пентагалогениды и молекулы МХ5. Валентная группа 10 652
'694 Оглавление
20.2.5. Соединения Sb(III) и Bi(III) с квадратно-пирамидаль-
ной конфигурацией связей. Валентная группа 2, 10 654
20.2.6. Образование октаэдрических связей As(V), Sb(V) и
Bi(V). Валентная группа 12 654
20.2.7. Образование октаэдрических связей Sb(III). Валентная
группа 2, 12 655
20.2.8. Кристаллические тригалогениды мышьяка, сурьмы и
висмута 656
20.2.9. Сложные галогениды, содержащие трехвалентные сурь-
му или висмут 657
¦20.3. Химия оксидов трехвалентных мышьяка, сурьмы, висмута 662
20.3.1. Триоксиды мышьяка, сурьмы и висмута .... 662
20.3.2. Сульфаты сурьмы(III) 665
20.3.3. Метаарсениты 666
20.3.4. Сложные оксиды трехвалентных мышьяка и сурьмы 667
20.3.5. Сложные оксиды трехвалентного висмута .... 668
20.3.6. Оксогалогениды трехвалентной сурьмы 670
20.3.7. Оксофториды висмута 671
20.3.8. Сложные оксогалогениды висмута с участием Li, Na, Ca,
Sr, Ba, Cd, Pb 672
20.3.9. Оксиды МШМЧL 674
'20.4. Химия оксидов пятивалентных мышьяка и сурьмы . . . 676
20.4.1. Оксосоединение пятивалентного мышьяка .... 676
20.4.2. Оксосоединения пятивалентной сурьмы 677
-20.5. Сульфиды мышьяка, сурьмы и висмута 683
20.5.1. Тиопроизводные мышьяка и сурьмы 685
СОДЕРЖАНИЕ ДРУГИХ ТОМОВ
ТОМ 1
Часть I
Предисловие редактора перевода
Предисловие
1. Введение
2. Симметрия
3. Полиэдры и сетки
4. Шаровые упаковки
5. Тетраэдрические и октаэдрические структуры
6. Некоторые простые структуры АХ„
7. Химические связи в молекулах и кристаллах
ТОМ 3
Часть II (продолжение)
21. Углерод
22. Цианиды, карбиды, карбонилы и алкилы металлов
23. Кремний
24. Бор
25. Медь, серебро, золото
26. Элементы ПБ, ШБ и IVB групп
27. Элементы VIII группы и другие переходные металлы
28. Лантаноиды и актиноиды
29. Металлы и сплавы
Формульный указатель
Предметный указатель
УВАЖАЕМЫЙ ЧИТАТЕЛЬ!
Ваши замечания о содержании книги, ее оформ-
лении, качестве перевода и другие просим при-
сылать по адресу: 129820, Москва, И-110, ГСП,
1-й Рижский пер., д. 2, издательство «Мир».
МОНОГРАФИЯ
Александр Франк Уэллс
СТРУКТУРНАЯ НЕОРГАНИЧЕСКАЯ ХИМИЯ
В 3-Х ТОМАХ
Том 2
Научные редакторы Т. И. Почкаева, И. С. Беленькая
Мл. научный редактор Н. Н. Устякова
Художник А. С. Гейнце
Художественый редактор М. Н. Кузьмина
Технический редактор М. А. Страшнова
Корректоры Т. П. Пашковская, М. А. Смирнов
ИБ № 6095
Сдано в набор 23.04.87. Подписано к печати 19.11.87.
Формат 60X90'/j6. Бумага типографская № 1. Печать
высокая. Гарнитура литературная. Объем 21,75 бум. л.
Усл. печ. л. 43,50. Усл. кр.-отт. 43,50. Уч.-изд. л. 42,10.
Изд. № 3(/4884. Тираж 6000 экз. Зак. 985.
Цена 7 р. 60 к.
ИЗДАТЕЛЬСТВО «МИР».
129820, ГСП, Москва, И-110, 1-й Рижский пер., 2.
Московская типография № И Союзполиграфпрома при
Государственном комитете СССР по делам изда-
тельств, полиграфии и книжной торговли. II3I05,
Москва, Нагатинская ул., д. 1.