Автор: Уэллс А.
Теги: кристаллография общая и неорганическая химия неорганическая химия
ISBN: 5-03-001271-0
Год: 1988
Текст
A. F. Wells А УЭЛЛС
=Z СТРУКТУРНАЯ
CHEMISTRY ^y J- л. у m.^j~ ^
НЕОРГАНИЧЕСКАЯ
химия
В 3-х томах
Том 3
Перевод с английского
д-ра хим. наук Н. Н. Желиговской,
канд. хим. наук Ф. М. Спиридонова
и канд. хим. наук С. И. Троянова
под редакцией
чл.-корр. АН СССР М. А. Порай-Кошица
и д-ра хим. наук, профессора П. М. Зоркого
, п . , , Москва «Мир» 1988
Clarendon Press ¦ Oxford
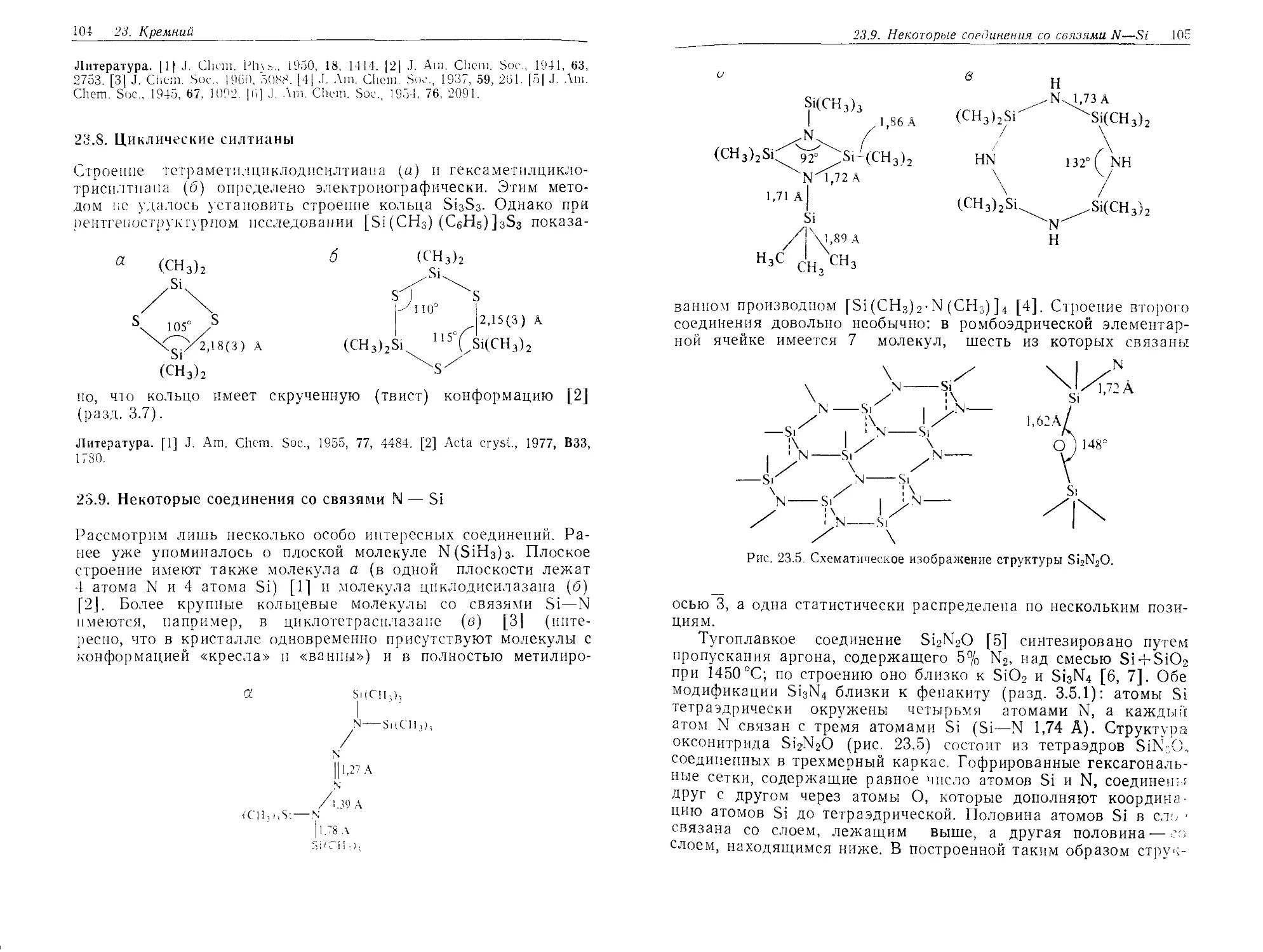
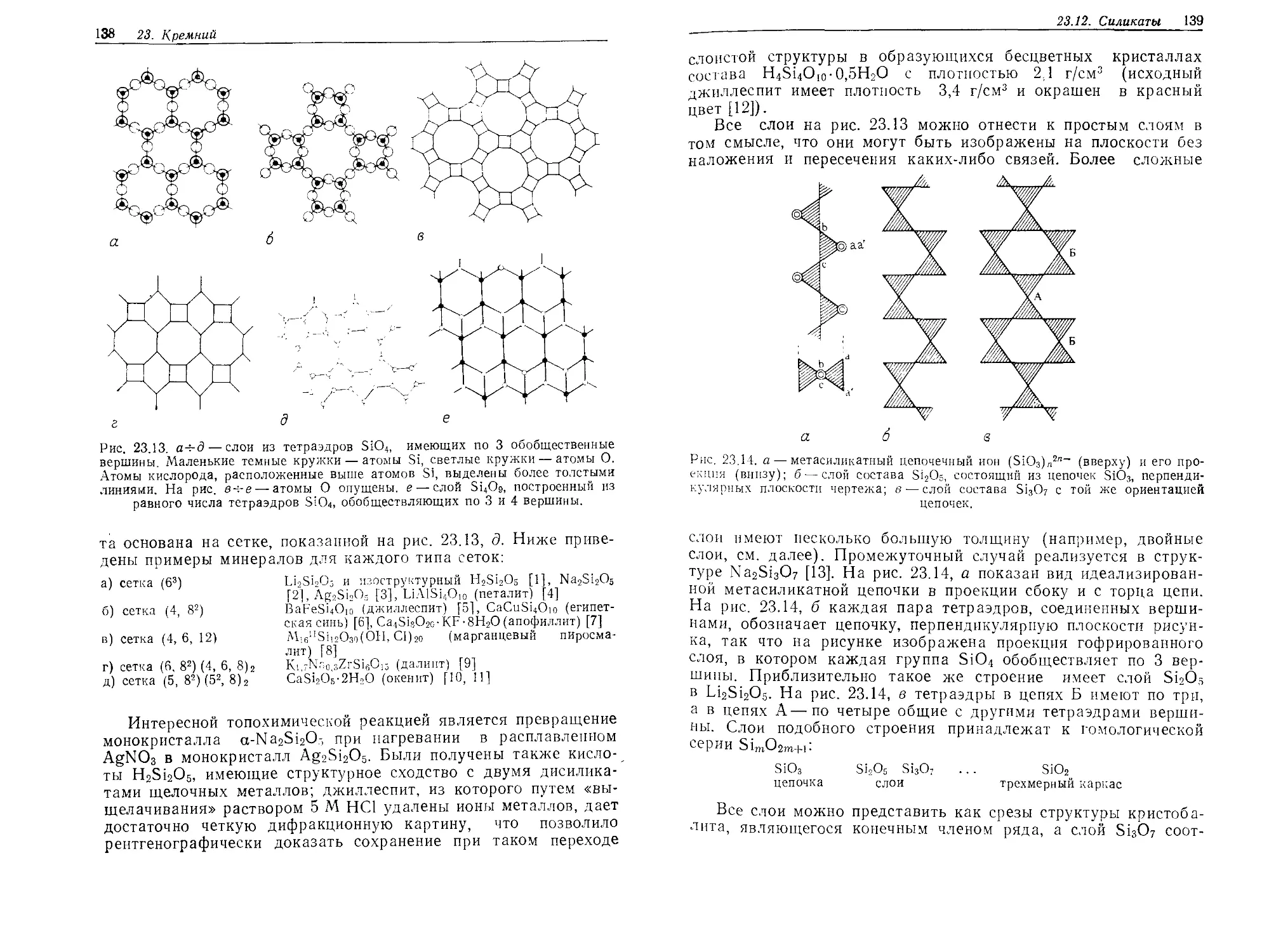
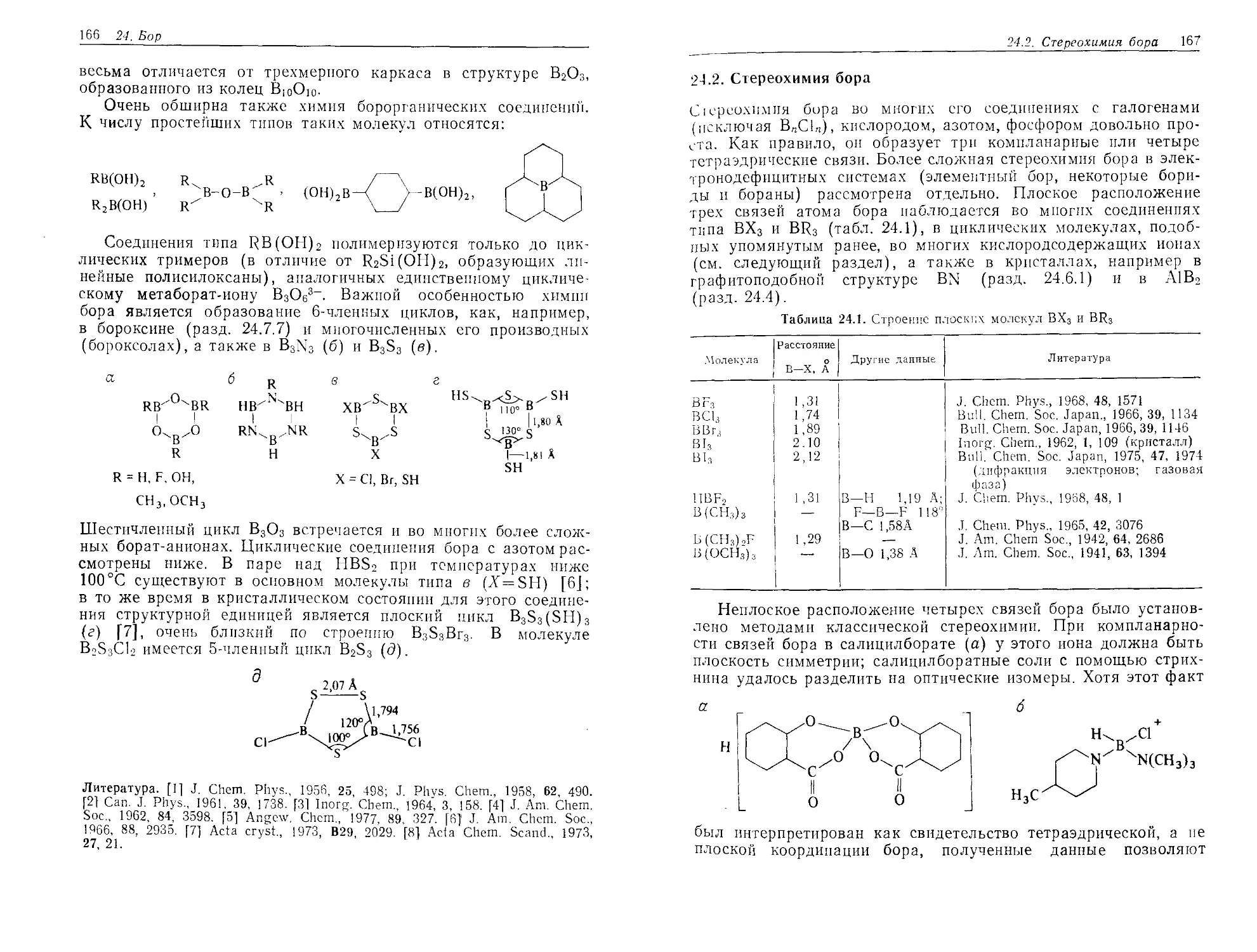
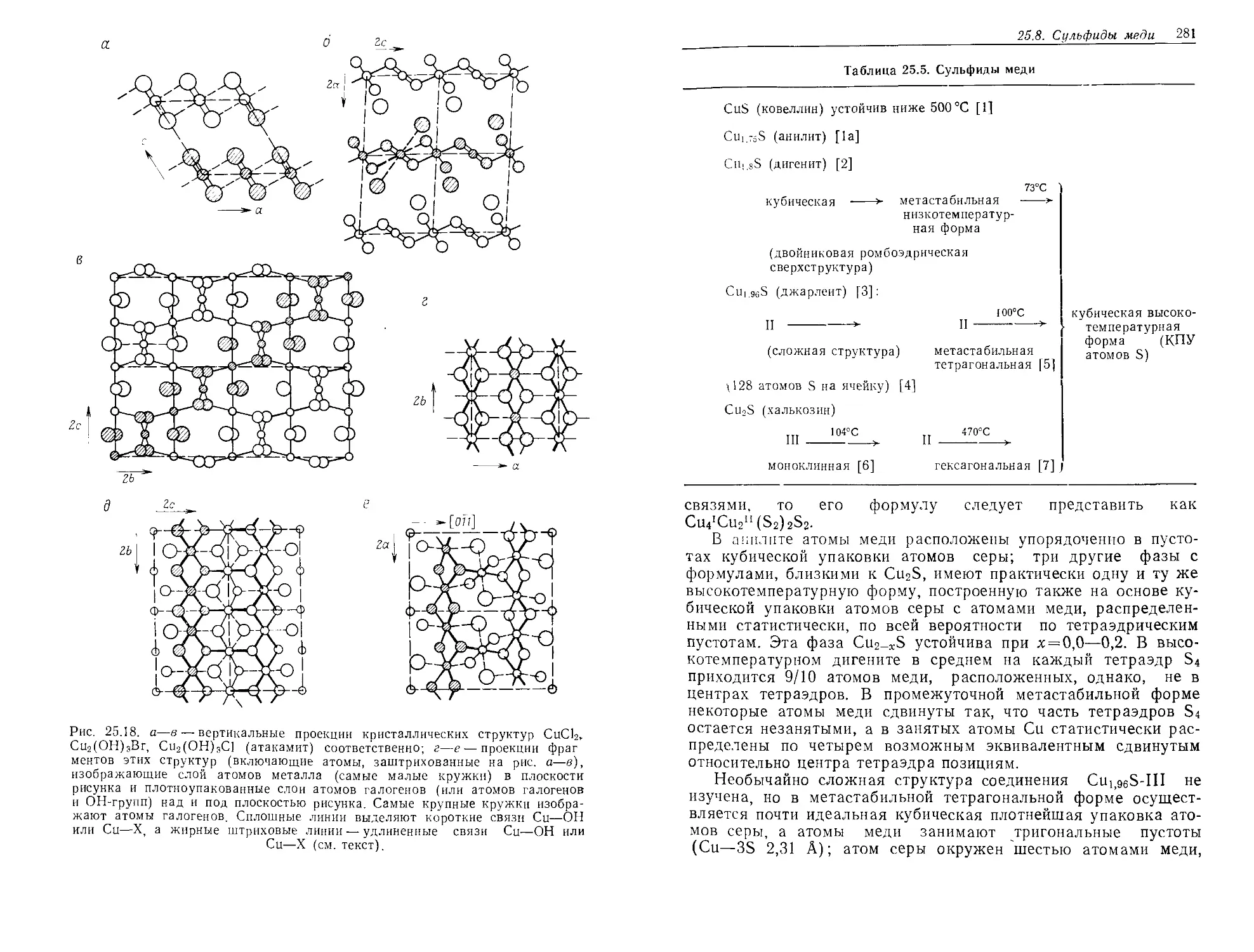
DJD1\ Z4.1
У98
УДК 548
Уэллс А.
У98 Структурная неорганическая химия: В 3-х т. Т. 3: Пер.
с англ.— М.: Мир, 1988.— 564 с, ил.
ISBN 5-03-001271-0
Фундаментальный труд автора из Великобритании, выдержавший за рубе-
жом пять изданий, содержит наряду с общими принципами кристаллохимии не-
органических соединений конкретные данные о структуре огромного количества
неорганических соединений, что делает его ценным энциклопедическим издани-
ем. Большой фактический материал и самый современный теоретический уровень
позволяют рекомендовать книгу как учебное пособие для студентов при изучении
неорганической химии, кристаллографии, минералогии.
В т. 3 обсуждается структурная химия соединений углерода (цианидов, кар-
бидов, карбонилов и алкилов металлов), кремния, бора, меди, серебра, золота,
элементов ЦБ—IVB групп, VIII группы периодической системы и других пере-
ходных элементов, лантаноидов, актиноидов, а также металлов и сплавов.
Для химиков-неоргаников, специалистов в области химии и физики твердого
тела, химической технологии, кристаллографов, а также студентов и аспирантов
соответствующих специальностей.
1802000000—066
041@1)—88
-подписное издание
ББК 24.12
Редакция литературы по химии
ISBN 5-03-001271-0 (русск.)
ISBN 0-19-855370-6 (англ.)
This book was originally published
in the English language by Oxford
University Press, Oxford, England
©Oxford University Press, 1975, 1984
Reprinted (with corrections) 1986
© перевод на русский язык, «Мир»,
1988
Часть II
(продолжение)
21. УГЛЕРОД
21.1. Введение
В этой главе мы рассмотрим только некоторые простые соеди-
нения углерода, так как изучение широкого класса его соеди-
нений составляет предмет органической химии. Углерод — уни-
кальный элемент с точки зрения числа и многообразия его
соединений, в основе структуры которых лежит скелет из оди-
наковых атомов С, непосредственно связанных между собой.
Существуют также соединения, содержащие в скелете связи
С—N, С—О и С—N—О, в том числе циклические системы. Не-
которые из них мы рассмотрим позже. Известны два боль-
ших класса органических соединений: алифатические соедине-
ния, образованные тетраэдрическими атомами углерода, и
ароматические соединения, содержащие гексагональные кольца
С6, в которых отдельные атомы углерода могут быть заменены
атомами азота и т. п. Этим двум типам углеродного скелета
в островных молекулах соответствуют две полиморфные моди-
фикации кристаллического углерода: алмаз, в котором каждый
атом С связан тетраэдрическими «^-связями с четырьмя со-
седними атомами, и графит, где каждый атом участвует в трех
лежащих в одной плоскости 5р2-связях, вследствие чего атомы
образуют слои.
\/
^.С^ (алмаз)-алифатические соединения
С"" [графит)-ароматические соединения
Существуют также «смешанные» соединения, содержащие
кольца С6 и, например, алифатические боковые цепи.
Химии живых организмов, основанной на системах, вклю-
чающих непосредственно связанные атомы углерода, можно
противопоставить химию силикатов, образованных атомами
Si, связанными между собой через атомы О. В гл. 23 мы обра-
тим внимание на некоторые наиболее важные различия между
21. Углерод
стереохимией углерода и кремния. Здесь же мы укажем только
на одну черту химии углерода, отличающую этот элемент от
кремния, а именно: возможность образования кратных связей
во многих простых молекулах, что характерно также для азо-
та и кислорода.
21.2. Стереохимия углерода
В основе структурных формул соединений углерода лежат че-
тыре типа атомов углерода:
\/
=с=
Известно, однако, что конфигурация б неточно отражает со-
стояние углерода в молекулах, где он связан с тремя другими
атомами. Аналогично схемы виг неудовлетворительно описы-
вают ряд молекул, содержащих атом углерода, образующий
две коллинеарные связи, так как осуществляется резонанс
(я-связывание), ведущий к появлению связей дробного поряд-
ка, когда ни схема =С = , ни схема =С— не передает точно
электронную структуру. Длины и физические свойства таких
связей показывают, что многие углерод-углеродные связи пред-
ставляют собой нечто промежуточное между связями С—С,
С = С и СэС.
Поэтому стереохимию углерода удобно обсуждать в соот-
ветствии с характером связеобразования:
а) тетраэдрический атом углерода, образующий четыре свя-
зи sp3;
б) 3-ковалентный углерод, образующий 5р2-связи; принимая
во внимание, что связи часто носят промежуточный характер,
мы сможем упростить изложение, если рассмотрим три типа
связанности углерода, которые достаточно хорошо описывают
разные молекулы.
I тип: простая, уже упомянутая система с одной двойной
и двумя ординарными связями =С^ .например (Н3СJС =
Н2С = О, Х2С = О;
II тип: одна ординарная и две эквивалентные связи _г
например карбоксилат-ионы, бензол и циклические системы
С—N-связей;
21.3. Тетраэдрический атом углерода
III тип: три эквивалентные связи
—С:'
например кароо-
нат-ион, гуанидиний и другие ионы, мочевина, графит.
в, г) 2-ковалентный углерод (sp-связи); к этому классу со-
единений относятся СО2, COS и CS2 (вместе с которыми удоб-
но рассмотреть моноксид и субоксид; разд. 21.5.1 и 21.5.3), аце-
тилен, дициан, цианаты и тиоцианаты. Известны также отно-
сительно неустойчивые системы, содержащие 2-ковалентный
атом углерода, например CF2 [1] (для которого микроволно-
вая спектроскопия дает следующие результаты: длина связи
С—F 1,30 А, валентный угол 105° в основном состоянии или
135° в возбужденном состоянии), а также ион СО2~. Как пока-
зано методом ЭПР-спектроскопии, ион СОг~ образуется при
адсорбции СО2 на MgO, облученном УФ-светом, и в -у-облучен-
ных образцах формиата натрия; в матрице КВг он может су-
ществовать в течение нескольких месяцев. Валентный угол
в СО2~ составляет 127±8° [2].
Приведенная очень простая схема не позволяет включить
в рассмотрение некоторые специальные типы связей, которые
существуют в карборанах и металлалкилах, где атом С связан
более чем с четырьмя соседними атомами; они будут рассмот-
рены особо.
Хотя мы принимаем приведенную упрощенную классифика-
цию связей, образуемых углеродом, нам не всегда будет удоб-
но точно ее придерживаться. Например, производные циана
полимеризуются, давая циклические молекулы, в которых угле-
род образует три связи. Эти циклические соединения со связя-
ми С—N логично рассмотреть после производных циана.
В гл. 22 описаны следующие группы соединений: цианиды,
карбиды и карбонилы металлов, а также некоторые типы ме-
таллоорганических соединений.
Литература. [Ц J. Chem. Phys., 1966, 45, 1067, 1068. [21 J. Phys. Chem, 1965 69
2182; J. Chem. Phys., 1966, 44, 1913.
21.3. Тетраэдрический атом углерода
21.3.1. Алмаз; насыщенные органические соединения. Кристал-
лическая структура алмаза представляет собой первый пример
правильного тетраэдрического расположения связей углерода.
В этом кристалле каждый атом углерода соединен с четырьмя
равноудаленными соседями, и соответственно способ образова-
ния связей, показанный на рис. 21.1, сохраняется во всем
кристалле. Валентные углы и длины связей С—С A,54 А) име-
21. Углерод
-о
Рис. 21.1. Кристалличе-
ская структура алмаза.
ют те же значения, что и в такой простой молекуле, как
С(СН3L, или в любой насыщенной углеводородной цепочке.
Гексагональная форма алмаза, относящаяся к его кубической
форме так же, как вюртцит к цинковой обманке, была получе-
на при высоких температурах и давлении [1]. Молекула сим-
метричного тетрациклодекана (адамантана) СюН16 имеет такое
же строение, как N4(CH2N (см. т. 2, рис. 18.2), и эту молекулу
можно рассматривать как гидрированный фрагмент структуры
алмаза. Большие фрагменты структуры алмаза представляют
собой углеродные скелеты диамантана
Ci4H2o и антитетрамантана С22Н28 [2].
Особенно интересны полиэдрические мо-
лекулы, например С4(н-С4Н9L, где при-
сутствует центральный тетраэдр из ато-
мов углерода, кубан С8Н8 с кубическим
каркасом, образованным атомами угле-
рода (С—С 1,552 А) [3], и метилзаме-
щенные додекаэдраны. В 1Д6-С20Н18-
(СН3J [4] атомы углерода расположе-
ны в вершинах почти правильного пен-
тагондодекаэдра (средняя длина связи
С—С 1,546 А). Октафенильное производное кубана С8(С6Н5)8
является производным циклооктатетраена (разд. 21.4.1) с че-
редованием связей длиной 1,343 и 1,493 А в восьмичленном
кольце [5].
Дифракционными или спектроскопическими методами было
исследовано много простых соединений углерода, и во всех мо-
лекулах типа Са4 валентные углы в пределах ошибки измере-
ния совпадают с тетраэдрическими A09°28'). Некоторые на-
дежно определенные длины связей в простых молекулах угле-
рода и других элементов четвертой группы приведены в
табл. 21.1.
Литература. [1] J. Chem. Phys., 1967, 46, 3437. [2] Acta cryst., 1977, ВЗЗ, 2335
[31 J. Am. Chem. Soc, 1964, 86, 3889. [4] Science, 1981, 211, 575. [5] J. Chem.
Soc, 1965, 3136.
21.3.2. Фториды углерода (фтороуглероды). Продукт разложе-
ния (CF)n (см. ниже) или прямого фторирования углерода
является смесью фтороуглеродов, из которой были выделены
и изучены следующие соединения: CF4, C2F6, C3F8, C4F10 (два
изомера), C2F4, C5F10, C6Fi2 и C7FI4. Химически все они совер-
шенно инертны и отличаются очень слабым межмолекулярным
взаимодействием, что делает их похожими в этом отношении
на благородные газы. Существует большое различие между
температурами кипения фтороуглеродов и углеводородов, как
это видно из рис. 21.2.
Таблица 21.1. Длины связей в молекулах соединений элементов IV группы
Связь
Длина свн-
о
зи. А
Молекула
Литература
с-н
с-с
с=с
с=с
С—N
С—О
C-S
С—F
С—С1
С—Вг
С—I
Si—Н
Si—С
Si—Si
Si—О
Si—F
Si—Cl
Si—Br
1,06
1,10
1,11
1,53—
1,56
1,34
l,205
Cm.
табл. 18.4
См.
табл. 21.5
См.
табл. 21.6
1,32—
1,39
1,75В—
1,77
1,91 —
1,94
2,14
1,48
1,83—
1,87
2,32
2,36
1,64
1,625
1,56—
1,59
С2Н2
С,114
С2П6
с2п6
С2С16
с2н4
С2Н2
1,98—
2,05
2,15—
2,21
CF4
CH3F, CCI3F
CF3C1
ССЦ
CF3Br
CH3Br, CBr,
CF3I, CH3I
SiH4
H3SiC = CH
(CH3KSiH
Si2F6
SifSi(CH3K]4
Si(OCH3L
Si(OOCCH3L
SiBrF3
SiH3F
S1F3CI
SiH3Cl
SiF3Br
SiH.Br
Prcc. Roy. Soc, A 1956,
234, 306
J. Chem. Phys., 1965, 42,
2683
J. Chem. Phys., 1968, 49,
4456
Acta Chem. Scand., 1964,
18, 603
J. Chem. Phys., 1965, 42,
2683
Proc. Roy. Soc, A 1956,
234, 306
Ann. Rev. Phys. Chem.,
1954, 5, 395
J. Chem. Phys., I960, 33,
508
J. Chem. Phys., 1962, 36,
2808
Acta cryst., 1979, B35,
1670
Trans. Farad. Soc, 1954,
50, 444
J. Chem. Phys., 1952, 20,
1112
J. Chem. Phys., 1958, 28,
1010
J. Chem. Phys., 1955, 23,
922
J. Chem. Phys., 1963, 39,
1181
J. Chem. Phys., 1960, 33,
907
J. Mol. Struct., 1976, 31,
237
Inorg. Chem., 1970, 9,
2436
J. Chem. Phys., 1950, 18,
1414
Z. Kristallogr., 1975, 141,
97
J. Chem. Phys., 1951, 19,
965
Phys. Rev., 1950, 78, 64
J. Chem. Phys., 1951, 19,
965
Acta Chem. Scand., 1954,
8, 367
J. Chem. Phys., 1951, 19,
965
Phys. Rev., 1949, 76, 1419
11 рииилжепие
Связь
Длина свя-
о
зи, А
Молекула
Литература
Si—I
Si—N
Ti—Cl
Ti—Br
Zr—Cl
Th—Cl
Ge—H
Ge—С
Ge—Ge
Ge—Si
Ge—F
Ge—Cl
Ge—Br
Ge—I
Sn—H
Sn—С
Sn—Cl
Sn—Br
Sn—I
Pb—С
Pb—Cl
Pb—Pb
2,39—
2,43
1,72
2,19
2,32
2,33
2,61
1,52-
1,54
1,90—
1,95
1,957
2,41
2,36
1,69—
1,73.
2,07—
2,31
2,50
1,70
2,11—2,15
2,28
2,31—2,35
2,44—
2,4!
'.2,64—
2,7:
2,20
2,43
2,88
SiFr,l
SiH,I
(CH3bSi(NHCH3)
ThCl4
TiBr4
ZrCl4
TiCl4
GeH4
GeH3F—GeH3Br
H3GeC = CH
GeH2(CII3J
Gc(C6HsL
Ge2H6, Ge3H8
H3Ge-SiH3
GeF3Cl
GeH3F
GeF3Cl
GeH3Cl 1
GcH-Br j
Gel4
SnH4
CH3S11CI3, (CH3JSnH2
SnCU
CH3SnCl3— (CH3KSnCl
SnBr4
CH3SnBr3—(CH3KSnBr
Snl4
CH3SnI3— (CH3KSnI
Pb(CH3L
РЬСЦ
Pb2(CII3)e
Chcm. Phys., 1967, 47,
1314
Nature, 1953, 171, 87
Trans. Farad. Soc, 1962,
58, 1686
Bull. Chem. Soc. (Japan),
1956, 29, 95
i rans. Farad. Soc., 1941,
37, 393
J. Chem. Phys., 1954, 22,
1723
J. Chem. Phys., 1965, 43,
J. Chem. Phys., 1966, 44,
2602
J. Chem. Phys., 1969, 50,
3512
Ada cryst., 1972, B26,
2889
J. Am. Chem. Soc., 1938,
60, 1605
J. Chem. Phys., 1967, 46,
2007
Phys. Rev., 1951, 81, 819
J. Chem. Phys., 1965, 43,
333
Phys. Rev., 1951, 81, 819
J. Chem. Phys., 1965, 43,
333
Trans. Farad. Soc, 1941,
37, 393
J. Chem. Phys., 1956, 25,
784
Acta Cryst., 1974, B30,
444
Bull. Chem. Soc. (Japan),
1970, 43, 1933
Acta cryst., 1974, B30,
444
Trans. Farad. Soc, 1941,
37, 393
Trans. Farad. Soc, 1944,
40, 164
Trans. Farad. Soc, 1941,
37, 393
Trans. Farad. Soc, 1944,
40, 164
J. Chcm. Phys., 1958, 28,
1007
Trans. Farad. Soc, 1941,
37, 393
Trans. Farad. Soc, 1940,
36, 1209
21.4. Углерод, образующий три связи .11
Смешанные фторохлоропроизводные, например CHC1F2,
CCI2F2, CHCbF, CCI3F и CC12F-CC12F, были получены путем
фторирования соответствующих хлорсодержащих соединений.
Ненасыщенное соединение тетрафтороэтилен C2F4 при повы-
шенном давлении можно полимеризовать с образованием твер-
дого полимера, который, как и мономерные фтороуглероды,
химически очень инертен. Политетрафтороэтилен (CF2)n co-
-300
100 ZOO 300
Молекулярная масса
Рис. 21.2. Температуры кипения углеводородов, фтороуглеродов и инертных
газов.
держит цепочку — CF2—CF2—, но в противоположность плос-
ким зигзагообразным цепям (СН2)« в полиэтилене цепи
¦—CF2—CF2—¦ имеют спиральную конфигурацию. Твердый мо-
нофторид углерода (CF)n очень близок по строению к графиту,
слои которого раздвигаются вследствие введения атомов фтора
(см. ниже).
21.4. Углерод, образующий три связи
В разд. 21.2 мы выделили три основных типа соединений, в ко-
торых углерод образует три связи. Теперь мы приведем приме-
ры соединений каждого типа; для сравнения с наблюдаемыми
длинами связей в табл. 21.2 даны стандартные значения длин
ординарной, двойной и тройной связей. Можно подобрать при-
меры, иллюстрирующие существование простой зависимости
12 21. Углерод
Таблица 21.2.
Связь
с—с
С—N
С—0
Наблюдаемые величины длин связей, А
Ординарная
1 ,54
1,47
1,41
Двойная
1,34
[1,28]
1,22
Тройная
1,20
1,16
1,13
между типом связи и валентными углами, что приводит к ло-
гичной последовательности:
J20°
125°
120°
115°
0) (ш) (и)
СОС12 СОl~ (R . COO)~
Однако, как будет видно при рассмотрении циклических мо-
лекул, например С6Н6, не существует четких границ между
этими классами, в особенности между вторым и третьим. Из
дальнейшего изложения станет очевидным, что во многих мо-
лекулах связи нельзя описать каким-либо простым способом;
хорошей иллюстрацией этого служит молекула этилкарбамата,
в которой три связи С—О имеют различные длины [1]:
21.4.1. Конфигурация связей I типа ( = С ). Для атома угле-
рода, образующего одну двойную и две ординарные связи, уг-
лы между связями должны быть близки к следующим значе-
ниям:
125° 16' R2
Rl==C ) 109° 28'
125°16' R3
а длины связей C = Rb С—R2 и С—R3 должны соответствовать
значениям, ожидаемым для одной двойной и двух ординарных
связей соответственно. Наиболее симметричные молекулы этого
типа — изобутен (СНзJС —СНг, формальдегид Н2С = О, кето-
21.4. Углерод, образующий три связи
13
ны R2C = O, карбоиилгалогеииды Х2С = О и их серосодержа-
щие аналоги X2C = S. При исследовании плоских молекул
12С = С12 двумя методами (газовая электронография [2а] и
нейтронография порошка при 4 К [26]) найдено, что значения
длин связей составляют: С = С 1,363 и 1,295 А, С—I 2,106 и
2,114 А соответственно. К числу менее симметричных моле-
кул, содержащих такую конфигурацию связей, относятся моле-
кулы циклооктатетраена в форме ванны (а) [3] (здесь длина
связей указывает на сравнительно малое их взаимодействие
в кольце), а также молекулы фторформальдегида (б) [4] и
карбоновых кислот.
Н Н 6
а
126,5°
н
1,462 А
сн
1,334А
,сн
,1,34 А
ПО'
н н
Карбонилгалогениды и тиокарбонилгалогениды. Соединения
COF2 [5], СОС12 [6] и СОВг2 [7] были изучены в парообраз-
ном состоянии методами дифракции электронов и микроволно-
вой спектроскопии, а СОС12 (фосген), кроме того, исследован
в кристаллическом состоянии [8]. Длины связей С—X близки
к значениям, ожидаемым для ординарных связей, асвязиС = О
несколько короче, чем обычные двойные связи.
\!, 31 2 А
, /V 1,174 А
108 Г=^==(
\ 1,166 А
г-—'- о
[
/ /^1,746 А
F C1
Отсутствие признаков нарушения упорядоченности в кристал-
лическом фосгене не дает возможности объяснить величину
остаточной энтропии A,63 энтр. ед.), вычисленную из калори-
метрических и спектроскопических данных.
Электронографическое изучение тиофосгена CSC12 показало,
что длина связи C = S составляет 1,63 А, однако эти данные
получены давно и требуют проверки. Димер, образующийся
ci3c-o-c:
*о
С13С-О-С
р
O-CClj
14 21. Углерод
в процессе фотолиза CSC12, имеет структуру в [9], а соедине-
ния с эмпирическими формулами (СОС12J и (СОС12K изобра-
жены на схемах г и д [10].
Карбоновые кислоты и родственные соединения. Кислоты,
например муравьиная или уксусная, в парообразном состоянии
димеризуются. Электронографическое изучение паров муравьи-
ной кислоты привело к структурам мономера и димера, пока-
занным на схемах е и ж соответственно [11]. Эта кислота бы-
ла также изучена в кристаллическом состоянии [12].
Г-Н
1,361
0,984 А
Димеры этих кислот представляют собой почти плоские моле-
кулы [13]; можно предположить, что ?/?2-гибридизация атома
углерода вызывает я/Я-гибридизацию карбонильных атомов кис-
лорода. Вследствие этого две свободные электронные пары
карбонильного атома кислорода расположены под углом 120°
к связи С = О и находятся в одной плоскости с ней и другой
С—О-связью. Таким образом, фрагмент имеет плоское стро-
ение. Электронографическое изучение тиоуксусной кислоты
[14] дает следующие результаты (числа, заключенные в скоб-
ки, являются предположительными):
1,78 + 0,02 [1,34]
Были проведены многочисленные исследования щавелевой
кислоты (образующей две безводные полиморфные формы
[15]) и оксалатов (NH4JC2O4-H2O [16J, К2С2О4-Н2О [17],
КНС2О4 [18] и других. Хотя дигидрат этой кислоты не являет-
ся оксониевой солью, геометрические параметры молекулы
(СООНJ в (СООНJ-2Н2О (з) [19] и соответствующего иона
в солях щелочных металлов (и) отличаются довольно мало.
Особенно интересен следующий факт: молекула щавелевой
кислоты, содержащая связь С—С, которая по крайней мере не
короче, чем ординарная связь, имеет плоское строение, в то
время как у оксалат-иона существуют различные конформа-
21.4. Углерод, образующий три связи 15
ции: оксалат-ноп, будучи плоским в К2С2О4-Н2О, не явля-
ется таковым в КНС2О4 и (NH4JC2O4-H2O. В кристаллах
двух последних соединений угол между плоскостями СОО-
НОЧ
О
J12°
-'~Л 1,54 A
C_
121°
(COOHJ •
/1,21 A
\l,29 A
OH
2H2O
С,0
2-
групп равен 13 и 27° соответственно. Неплоская форма моле-
кул обусловлена образованием сильных водородных связей,
что в некоторых оксалатах влечет за собой небольшое измене-
ние длины связей С—О. Очевидно, что, хотя структура му-
равьииой кислоты близка к О—С.
Oil
с заметной разницей
в длинах связей С—О, структуру щавелевой кислоты лучше
описывать формулой
.такой же, которая предполагается
для карбоксилат-ионов. Сказанное верно и для оксамидов
[20], и для дитиооксамидов [21], молекулы которых имеют
плоскую форму и связи С—N в которых заметно короче орди-
нарных.
H,N4 125° О H2NV 125° ,S
115°l
Jl20°
1,542 А
X 1.315 А
U5°
I20°
1,537 А
41,323 А
1,243 А /^4^,31 5 А 1,649 К/
ОХ 4NH2 SX ХШг
Здесь же удобно рассмотреть два циклических иона. Это
плоский квадратный ион С4О42~ в калиевой соли 3,4-диоксо-
циклобутендиола К2С4О4-Н2О [22] и кроконат-ион С5О52-,
изученный в (NH4JCs05 [23]. Последний обладает почти пра-
О
2-
2-
! I
С—Г^
о^ ^о
16 21. Углерод
вильной пентагональной симметрией. В обоих ионах длины
связей следующие: С—С 1,46 А и С = О 1,26 А.
Литература. [1] Acta cryst., 1967, 23, 410, [2а] Acta Chem. Scand., 1967 21
2111. [26] Acta cryst., 1977, B33, 1765. [3] J. Chem. Phys., 1958, 28, 512 [41 j'
Chem. Phys., 1961, 34, 1847. [5] J. Chem. Phys., 1962, 37, 2995. [6] J. Chem. Phys.!
1953, 21, 1741. [7] J. Am. Chem. Soc, 1933, 55, 4126. [8] Acta cryst 1952 5
833. [9] Z. anorg. allg. Chem., 1969, 365, 199. [10] J. Chem. Soc, 1957 618*
[11] Acta Chem. Scand., 1969, 23, 2848. [12] Acta cryst, 1978, B34, 2188 [131 Acta
cryst., 1963, 16, 430. [14] J. Chem. Phys., 1946, 14, 560. [15] Acta cryst 1974
B30, 2240. [16] Acta cryst., 1965, 18, 410. [17] Acta cryst., 1969, B25 469'
[18] Acta Chem. Scand, 1968, 22, 2953. [19] Ada cryst., 1969, B25, 2423 [201 Acta
cryst, 1954, 7, 588. [21] J. Chem. Soc, 1965, 396. [22] J. Chem. Phys, 1964, 40
3563. [23] J. Am. Chem. Soc, 1964, 86, 3250
21.4.2. Конфигурация связей II типа ~c:'^
Карбоксилат-ионы. Ионы R—COO карбоновых кислот по-
строены симметрично и содержат две одинаковые связи С—О
A,26 А)^ Валентный угол О—С—О изменяется в пределах
125—130°. Согласно последним данным, длина связи С—О и
величина валентного угла О—С—О в формиат-ионе составля-
ют 1,24 Аи 126° [1].
Карбамат-ион. В ионе H2NCO2^ найдены следующие длины
связей: С—N 1,36 А и С—О 1,28 А [2].
Бензол. Многочисленные исследования дают значения дли-
ны связи С—С, близкие к 1,395 А.
Литература. [1] Acta cryst, 1980, В36, 1940. [2] Acta cryst, 1973, B29, 2317.
21.4.3. Конфигурация связей III типа -С . Ряд симметрич-
ных ионов (и один свободный радикал) в кристаллическом со-
стоянии оказались плоскими или почти плоскими. Они поме-
щены в табл. 21.3, где указано, в составе какой соли изучался
данный ион.
Карбонат-ион. Повторное определение длины связи С—О
в кальците и КгСО3-ЗН2О дало значение, близкое к 1,29 А, хо-
тя в сесквикарбонате натрия (разд. 8.5), который изучался как
рентгенографическим, так и нейтронографическим методами
была обнаружена более короткая A,25 А) связь С—О. В ко-
нечных ионах или молекулах СО3-группа ведет себя или как
монодентатный лиганд, например в [СоAМНзMСОз]+, или как
бидентатный лиганд, например в [Со(ЫНзLСО3]+ и в ионах
[М(СОзЫ6^ (М = Се, Th), приведенных в гл. 3 в качестве при-
мера соединений с координационным числом 10. Кроме того,
21.4. Углерод, образующий три связи 17
СОз-
CS32-:
C(CN)r:
C(SO2CH
C(n-C6H4
C(NH2K+
C(N3K+:
C(C6H5K
Таблица 21.3.
Ион
Ca2+ 1
K2+-3H2O j
K2+-H2O
NH4+
K+
3K-: NH4+
^О2K
: CO3-
SbCl6~
<•: СЮ4-, BF4~
C(C6H4NH2K+: C1O4-
Пленарные ионы
C-X, A
1,29 (C—0)
1,71 (C—S)
1,40 (С—С)
1,39 (С—С)
—
1,70 (C—S)
1,47 (С—С)
1,34 (C—N)
1,34 (C—N)
1,45 (С—С)
1,45 (С—С)
ZX32-, CX3- и СХ3+
Литература
J. Chem. Phys, 1967, 47, 3297
Acta cryst, 1970, B26, 877
Acta Chem. Scand, 1967, 21,
1530
Acta cryst, 1971, B27, 1835
Inorg. Chem, 1966, 5, 1193
Acta cryst, 1965, 19, 651
Acta Chem. Scand, 1967, 21,
2599
Acta cryst, 1974, B30, 2191
Acta cryst, 1970, B26, 1671
Acta cryst, 1965, 18, 437
Acta cryst, 1971, B27, 1405
СОз-группа координируется двояким образом в Sb2CO3(C6H5)8
(а) (разд. 20.2) и CuCO3(NH3J (б) (разд. 23.12.7) и еще од-
ним отличным способом в соединениях L2Cu2Cl2CO3 (б), где
L — это, например, (CH3JN(CH2KN(CH3J [1]. Последняя
[ ф - фенил')
молекула интересна также как пример диамагнитного комплек-
са меди, что является, по-видимому, результатом антиферро-
магнитного обмена через почти коллинеарные связи Си—О—Си
(координация Си здесь квадратно-пирамидальная).
Триазидокарбониевый ион. Для этого иона найдены геомет-
рические характеристики, приведенные на схеме г.
1,34 А
163°
H,N
H,N
,33 А
Трицианометанид-ион. Малые отклонения от плоской фор-
мы, наблюдаемые у этого иона в некоторых солях, объясняют-
ся влиянием кристаллического окружения. Этот ион может об-
разовывать интересные полимерные структуры с ионами метал-
лов. В соединении серебра эта группа ведет себя как 3-связан-
ная структурная единица в слоях, основанных на простейшей
2—1284
18 21. Углерод
3-связанной плоской сетке; эти слои попарно переплетены, как
описано в разд. 3.9.2.
Мочевина. Эта молекула (д) занимает промежуточное мес-
то между ионом СО32^ и ионом гуанидиния C(NH2b+. Иссле-
дования показывают, что атомы Н лежат в одной плоскости
с атомами С, N и О [2]; в молекулах формамида H2N—CHO
и N(SiH3K атом N также образует 3 компланарные связи.
Рис. 21.3. Кристаллическая структура графита.
Длины связей в тиомочевине составляют С—N 1,33 А и С—S
1,71 А [3].
Графит. Фрагмент кристаллической структуры графита по-
казан на рис. 21.3. Расстояние, разделяющее слои C,35 А), ве-
лико по сравнению с длиной связи С—С внутри слоя, равной
1,42 А, что указывает на относительно слабую связь между ато-
мами, принадлежащими различным слоям; поэтому слои могут
смещаться друг относительно друга, что обусловливает цен-
ные смазочные свойства графита. В структуре графита
(рис. 21.3) по вертикали проецируются друг на друга атомы
слоев, располагающихся через один; поэтому структуру можно
описать с помощью гексагональной ячейки (а = 2,456 А и с =
= 6,696 А). Структура других модификаций графита более
сложна [4]. На рис. 21.4 жирные и тонкие линии обозначают
чередующиеся слои в обычной структуре графита; видно, что
возможен третий способ расположения слоя (штриховые ли-
нии), симметрически связанный с двумя первыми. Таким обра-
21.4. Углерод, образующий три связи 19"
зом, возможна вторая структура графита, в которой чередуют-
ся эти три типа (три варианта расположения) слоев; для та-
кой структуры а = 2,456 А и с = C/2) • F,696) = 10,044 А. Были
обнаружены некоторые природные и искусственные графиты,
которые имеют частично эту новую и частично нормальную
структуру. Интересно отметить, что в нормальной структуре
графита не все атомы углерода кристаллографически эквива-
лентны в отличие от второй формы (рис. 21.4), где эквива-
лентны все атомы С. Эта новая кристаллическая структура
Рис. 21.4. Относительное расположение атомов в смежных слоях двух форм
графита (см. текст).
связана со структурой алмаза, из которой ее можно получить,
если расположить в одной плоскости атомы углерода, образу-
ющие гофрированные слои, параллельные плоскости A11),
и увеличить расстояние между этими слоями. Графит можно
превратить в алмаз при давлении, превышающем 125 кбар,
и температуре порядка 3000 К [5].
Большое различие между длинами связей внутри слоев
и между слоями графита приводит к образованию огромного
числа соединений, в которых между слоями внедрены те или
иные атомы или молекулы. Некоторые из них мы опишем ниже.
Литература. [1] Inorg. Chem., 1979, 18, 2296. [2] Acta cryst., 1969, B25, 404.
[31 J. Chem. Soc, 1959, 2251. [4] Proc. Roy. Soc, A, 1942, 181, 101; Z. Kristal-
logr., 1956, 107, 337. [51 J. Chem. Phys., 1967, 46, 3437.
21.4.4. Производные графита [1]. Строение древесного угля по
существу близко к строению графита, но характеризуется ма-
лой степенью упорядоченности. Благодаря большой внутренней
поверхности и ненасыщенным валентностям углерода древес-
ный уголь обладает замечательной способностью адсорбиро-
вать газы и пары, а также катализировать реакции, сближая
молекулы реагирующих газов. Кристаллический графит в зна-
20 21. Углерод
21.4. Углерод, образующий три связи 21
чительно меньшей степени адсорбирует газы и меньше влияет
па скорость реакции, так как валентность атомов углерода на-
сыщена и между слоями существует только слабое остаточное
притяжение. Тем не менее между слоями графита могут внед-
ряться молекулы самых разных элементов и соединений. Крис-
таллиты графита при этом не разрушаются, но растягиваются
в направлении, перпендикулярном плоскости слоев.
Оксид графита. Так называется слабоокрашенное непроводя-
щее вещество, которое получается при действии сильных окис-
лителей, например азотной кислоты или хлората калия, на
графит. Структура графита растягивается в одном направле-
нии; измерения расстояния между слоями в таких соединениях
показывают, что оно увеличивается от 3,35 А до величин, за-
ключенных в пределах 6-^11 А; это расширение соответствует
увеличению содержания кислорода. Состав соединения не яв-
ляется точно определенным, но предельное содержание элемен-
тов приблизительно соответствует формуле С4О(ОН). Структу-
ра оксида значительно разупорядочена, но результаты элект-
ронографического изучения дегидратированного вещества (рас-
стояние между слоями ~6,2 А) [2] дают возможность предпо-
ложить, что кислород может быть присоединен к гофрирован-
ным графитоподобным слоям двумя способами:
он оч
С или С-
В наложении слоев периодичность отсутствует [3].
«Соли» графита. Если приготовить взвесь графита в концен-
трированной серной кислоте, к которой добавлено небольшое
количество окислителя (HNO3, HCIO4 и т. д.), то объем графи-
та увеличивается, образец приобретает стальной блеск и си-
нюю или пурпурную окраску в проходящем свете. Эти продук-
ты реакции устойчивы только в присутствии концентрирован-
ной кислоты; они разрушаются под действием воды, что
приводит к восстановлению графита, который тем не менее
всегда содержит некоторое количество прочно связанного кис-
лорода. В «бисульфате» максимальные расстояния между сло-
ями составляют около 8 А. Кривая зависимости электродного
потенциала графита в ходе окисления или последующего вос-
становления в серной кислоте от состава имеет разрывы, со-
ответствующие соотношениям С+9б, С+48 или С+24 на HSO4~
[4]. Были описаны также другие «соли» графита: перхлорат,
селенат, нитрат и т. д.
Монофторид углерода. Если дегазированный графит нагре-
вать в атмосфере фтора при нормальном давлении, то газ
поглощается н образуются соединения, цвет которых меняется
от черного к серому и до белоснежного. Необходимо тщательно
контролировать температуру F27±3°С), чтобы получить бе-
лый фторид, который имеет предельный состав CFi,i2 [5]. Оче-
видно, слои атомов углерода выгибаются, и один атом F при-
соединяется к каждому (тетраэдрически связанному) атому С.
Избыточное содержание атомов F по сравнению с составом
CF объясняется образованием групп CF2 по краям очень ма-
лых кристаллитов. Из-за низкой кристалличности не предста-
вилось возможным детально исследовать структуру соединения
CFi,i2, которое устойчиво к нагреванию и является хорошим
твердым смазочным материалом в экстремальных условиях
(высокие температуры, большие нагрузки или окислительная
атмосфера). При нагревании до более высоких температур ,
в атмосфере фтора графит больше не присоединяет фтора, и
соединение в конце концов переходит в смесь сажи и различ-
ных фторидов углерода (ср. с последовательным окислением
«графитовой кислоты» в меллитовую кислоту С6(СООН)б).
Соединения графита с щелочными металлами и бромом.
При обработке расплавленными металлами или их парами гра-
фит образует со щелочными металлами следующие соединения
С„М [6]:
М п
Li 6 12 18
Na только 64
К 1
Rb 8 10 24 36 48 60
С >
При поглощении брома получаются С8Вг и С28Вг [7], и так
как соединения CsK и С8Вг с геометрической точки зрения,
по-видимому, подобны (содержат чередующиеся слои С и К
(Вг)), их удобно обсудить вместе. В отличие от графита, кото-
рый благодаря большой протяженности я-орбиталей обладает
сильно зависящими от температуры диамагнитными свойства-
ми, у соединения С8Вг наблюдается слабый, не зависящий от
температуры диамагнетизм (сравнимый с диамагнитными
свойствами металлических Sn или Zr), а соединение С8К обла-
дает относительно сильным не зависящим от температуры па-
рамагнетизмом (сравнимым с парамагнетизмом Са и более
сильным, чем у металлического калия). И СвК, и С8Вг лучше
проводят электричество, чем графит. Расстояние между слоя-
ми, которое у графита составляет 3,35 А, становится равным
7,76 А у С8К и 7,05 А у С8Вг. По-видимому, если бы эти со-
единения были ионными по характеру связи, то наблюдалось
бы большее расстояние между слоями углерода в соединении
22 21. Углерод
21.5. Оксиды и сульфиды углерода 23
С8Вг (так как радиус иона Вг~ составляет 1,96 А, а радиус
К+ равен 1,38 А); вместе с тем металлический радиус К не-
много больше ковалентного радиуса Вг. Поэтому возникло
предположение, что связи между К или Вг и слоями графита
по своему характеру являются «металлическими», причем в со-
единениях с К свободная электронная зона частично заполня-
ется, а в соединении с бромом заполненная зона частично ос-
вобождается. Тот факт, что Na не образует аналогичное
соединение, в то время как Rb и Cs образуют, можно объяс-
нить тем, что энергия ионизации Na выше энергии иониза-
ции К.
Комплексы графита с галогенидами. Кроме известных со-
единений с FeCl3 и А1С13 графит может образовывать комплек-
сы со многими другими галогенидами, например с СиС12, СгС13,
тригалогенидами 4/-металлов, МоС15 и также с фторидом и
хлоридом хрома. (Кристаллический BN также образует анало-
гичные соединения с А1С13 и FeCl3.) Система графит — FeCl3
изучалась электронографически [8]. Наиболее полно описан-
ная фаза в системе графит — M0CI5 образована слоями моле-
кул Мо2С1ю; между такими слоями располагаются по четыре
слоя графита [9]. Внутри слоя молекулы Мо2С1ю плотно упа-
кованы. С AsFs графит образует несколько соединений внедре-
ния, часть из которых интересна тем, что они обладают элек-
трической проводимостью, сравнимой по величине с электро-
проводностью меди, в направлениях, параллельных слоям.
К другим соединениям внедрения относятся голубой C8OsF6
и соединения CnSO3F, образуемые с S2O6F2, с расстояниями
между слоями, равными 7,86 и 11,3 А соответственно. Анало-
гично графитовому соединению C]2SO3F существует соединение
внедрения (BNLSO3F с расстоянием между слоями, близким
к 8,0 А [10].
Литература. [1] Quart. Rev. Chem. Soc, 1960, 14, 1. [21 Acta cryst., 1963, 16,
531. [3] Z. anorg. allg. Cbem., 1969, 369, 327. [4] Proc. Roy. Soc, A I960, 258,
329, 339. [51 J. Am. Chem. Soc, 1974, 96, 2628. [61 J. Chem. Phys., 1968, 49,
434. [7] Proc. Roy. Soc, A 1965, 283, 179. [81 Acta cryst., 1956, 9, 421. [9] Acta
cryst., 1967, 23, 770. [10] Chem. Comm., 1977, 389; 1978, 200.
21.5. Оксиды и сульфиды углерода
21.5.1. Моноксид углерода. В этой молекуле, дипольный момент
которой очень мал (возможно, равен нулю), длина связи со-
ставляет 1,131 А. Длина связи, силовая постоянная и энергия
связи (табл. 21.4) показывают, что для ее описания больше
всего подходит структурная формула С = О.
21.5.2. Диоксид и дисульфид углерода, карбонилсульфид.
Молекулы ОСО, SCS и OCS линейные. Длины связей даны
Таблица 21.4. Свойства связей кислород — углерод
Связь
С = 0 в Н-СЫО
о = с=о
Длина связи,
о
А
1,209
1,163
1 ,131
Силовая по-
стоянная,
Н/м
0,0123
0,0155
0,0186
Энергия свя-
зи, кДж/моль
686
803
1075
1
i
.Молекула
СО
СОС12
COSe
со.
COS
нхсо
!1,СО
¦СНзОН
НСОО—СН3
Таблица 21.5. Длины связей С
Длина
о
связи, А
1,131
1,166
1,159
1,163
1,164
1,184
1,209
1,427
1,437
Метод
Микроволновая спектро-
скопия
То же
» »
ИК-спектроскопия
Микроволновая спектро-
скопия
Рентгеноструктурный
анализ
Электронография
Микроволновая спектро-
скопия
» »
-О
Литература
Phys. Rev., 1950, 78, 140
J. Chem. Phys., 1953, 21,
1741
Phys. Rev., 1949, 75, 827
JRNBS, 1955, 55, 183
Phys. Rev., 1949, 75, 270
Acta cryst., 1955, 8, 646
Bull. Chem. Soc. (Japan)
1QRQ d9 9148
J. Chem. Phys., 1955, 23
1200
J. Chem. Phys., 1959, 30
1529
в табл. 21.5 и 21.6. В диоксиде углерода связь между углеро-
дом и кислородом промежуточная по длине между двойной и
тройной связью. Изучение СО2 и CS2 методом ИК-спектроско-
пии высокого разрешения представляет собой пример успеш-
ного применения этого метода для молекул, которые нельзя
исследовать с помощью микроволновой спектроскопии из-за
отсутствия у них постоянного дипольного момента. Структуры
молекул СО2 и CS2 были также изучены в кристаллическом со-
стоянии (С—О 1,155 А при 150 К [1], С—S 1,56 А [2]). Под
давлением 30 кбар CS2 полимеризуется, образуя черное твер-
дое вещество, для описания которого была предложена цепо-
чечная структура [3].
S
21.5.3. Субоксид углерода (диоксид триуглерода). Третий ок-
сид углерода, так называемый субоксид С3О2, при обычной
24
21. Углерод
21.6. Ацетилен и его производные
25
Таблица 21.6. Длины связей С—S
Молекула
HNCS
OCS
TeCS
SCS
(NH2-CSJ
SC(NH2J
CH3SH
(CF3JS
(CF3JS3
Длина
о
связи, А
1,56
1,56
1,56
1,55
1,65
1,71
1,81
1,83 1
1,85 J
Метод
Микроволновая спектро-
скопия
То же
» »
ИК-спектроскопия
Рентгеноструктурный
анализ
То же
Микроволновая спектро-
скопия
Электронография
Литература
J. Chem. Phys., 1953, 21
1416
Phys. Rev., 1949, 75, 270
Phys. Rev., 1954, 95, 385
J. Chem. Phys., 1958, 28
682
J. Chem. Soc, 1965, 396
J. Chem. Soc, 1958, 2551
Phys. Rev., 1953, 91, 464
Trans. Farad. Soc, 1954
50, 452
температуре является газом (/кип +6°С) и может быть получен
путем нагревания малоновой кислоты или ее диэтилового эфи-
ра с избытком оксида фосфора (V) при 300 °С. Его получение
из соединений, содержащих группировки —С—С—С— (а так-
же его превращение в подобные соединения), согласуется со
структурой О—С—С—С—О. Взаимодействие субоксида угле-
рода с водой вызывает регенерацию малоновой кислоты; реак-
ция с аммиаком приводит к образованию амида малоновой
кислоты, а реакция с НС1 — к образованию малонилхлорида:
,соон
-соон
сн,
с3о2
на
сн2:
сн-
_CO-NH2
-со • а
то • а
о
с-
н,с.
¦R
-R
о
R = ОН, NH2 umd
Субоксид углерода легко полимеризуется при температурах
выше ¦—78 °С. Электронографическое исследование указывает
на то, что это линейная молекула с длинами связей С—С
1,28 А и С—О 1,16 А [4]; однако нельзя исключить возмож-
ность небольших отклонений от линейности.
Оксиды С2О [5] и СО3 [6] были обнаружены в низкотемпе-
ратурных матрицах. Последний из них представляет собой
непрочное соединение, образующееся при реакции между ато-
мами О и молекулами СО2; был изучен его инфракрасный
спектр в инертной матрице и предложена циклическая структу-
ра молекулы I ^С=О . Две молекулы,структуры которых имеют
некоторое сходство с СО2 и CS2, примечательны тем, что связи,
образуемые атомом Q, не лежат на одной прямой [7]:
1,21 А 1,185 А ^
=С=^== „ 1.68 А,
г
1~46°
1,21 А 1,595 А
х.С, , , С- , --S
176°
178°
(ф- фенил)
Длина связи Q—С соответствует тройной связи, а длина связи
Р—С — двойной, так как длина ординарной связи Р—С со-
ставляет по крайней мере 1,85 А.
Литература. [1] Acta cryst., 1980, В36, 2750. [2] J. Chem. Phys., 1968, 48, 2974.
[3| Can. J. Chem., 1960, 38, 2105. [4] J. Am. Chem. Soc, 1959, 81, 285. [5] J. Chem.
Phys., 1965, 43, 3734. [6] J. Chem. Phys., 1966, 45, 4469. [71 J. Chem. Soc, A 1966,
1703; A 1967, 1913.
21.6. Ацетилен и его производные
Литературная ссылка для ацетилена дана в табл. 21.1. Все
молекулы вида R—С=зС—R линейные, и во всех случаях дли-
на связи С = С близка к значению этой величины для ацетиле-
на A,205 А). В соединениях, содержащих системы связей
—С = С—С = С—, центральная связь ненамного длиннее
A,37 А), чем двойная связь в этилене A,34 А). Аналогично
концевые связи в молекулах вида X—С = С—X существенно
короче нормальных ординарных связей. Например, в молеку-
лах Н3СС=СХ (Х = С1, Вг или I) длина связи Н3С—С при-
близительно равна 1,46 А, а С—X—1,64 А [1], 1,79 А [2] и
1,99 А [2] в отличие от типичных ординарных связей С—С
1,54 А, С—С1 1,77 А, С—Вг 1,94 А и С—I 2,14 А.
Очень короткие связи С—X обнаружены также в соедине-
ниях HCCF и НССС1 [3]:
-Н
С1-
1,637
1,204
—н
1,055 А
'.279 1,198 1,053 А
причем эти величины очень близки к длинам связей в цианога-
логенидах.
Литература. [11 J. Chem. Phys., 1955, 23, 2037. [2} J. Chem. Phys., 1952, 20,
735. [3] Trans. Farad. Soc, 1963, 59, 2661.
21.7. Дициан и родственные соединения
21.7.1. Дициан. Линейную молекулу дициана проще всего изоб-
разить формулой N = C—C = N. Однако длина центральной
связи A,38 А) такая же, как в диацетилене НС = С—С = СН,
26 21. Углерод
21.7. Дициан и родственные соединения
27
Таблица 21.7. Структурные данные для дициана и родственных соединений (А)
= C—C = N
N = C—C = C—C^
CsN
1
1
1
15
157
14
с
1
1
1
-с
38
,382
37
с=с
1,203
1,19
Литература
J. Chem. Phys., 1965, 43, 3193
J. Am. Chem. Soc, 1950, 72, 199
Ada cryst., 1953, 6, 350
что указывает на значительное л-связывание. Длина централь-
ной связи C = N такая же, как и в HCN. Длины связей в ди-
циане и родственных соединениях даны в табл. 21.7.
Дициан и его производные представляют особый интерес,
так как легко полимеризуются. Если получать дициан путем
нагревания (до 450 °С) цианида ртути, предпочтительно с при-
месью хлорида, то образуется некоторое количество твердого
полимера парациана (CN)n, который можно получить также
нагреванием оксамида в запаянной трубке до 270°С. Строение
этого очень прочного вещества неизвестно; было предложено
несколько структур, содержащих сопряженные кольца. О струк-
турах тримерных циануровых производных будет сказано
ниже.
21.7.2. HCN, цианиды и изоцианиды неметаллов. Известен
только один изомер HCN, однако существуют органические
производные двух типов: цианиды RCN и изоцианиды RNC.
Таблица 21.8. Структуры ковалентных цианидов и изоцианидов
Молекула
11CN
CI13CN
CH,NC
CF3CN
S(CNJ
P(CNK
As(CNK
C(CNL
C-N, A
1,155
1,58
1,167
1,15
с—м-с
96°
93
92
109,5
Другие дан-
ные, A
С—Н 1,063
С—С 1,460
И^—N 1,426
С—С 1,475
С—F 1,300
М-С, А
1,73
1,78
1,90
1,485
MC=N
177°
172
171
180
Литература
Trans. Farad. Soc. 1963, 59, 2661
Phvs. Rev., 1950, 79, 54
J. Am. Chem. Soc, 1955, 77, 2944
Rev. Modern Phys., 1948, 20, 668
J. Am. Chem. Soc. 1955, 77, 2944
J. Chem. Phys., 1952, 20, 591
Acta cryst., 1966, 21, 970
Acta crvst., 1964, 17, 1134
Acta cryst., 1963, 16, 113
Acta crvst., 1974, B30, 1818
Последние отвечают формуле R—N = C, но фактически длина
связи \ = С в CH3NC лишь немного превышает A,167 А) дли-
ну связи NC в CH3CN A,158 А), которая близка к соответст-
вующей величине в HCN A,155 А). Силовые постоянные CN-
связей в HCN, CH3CN и цианогалогенидах XCN близки
к 1800 Н/м, таким образом, цианиды удовлетворительно описы-
вают формулой R—C = N.
Результаты изучения строения в газовой фазе HCN и ряда
ковалентных цианидов и изоцианидов, содержащих линейные
фрагменты R(M)—С—N и R(M)— N—С соответственно, сум-
мированы в табл. 21.8. Существуют две кристаллические фор-
мы HCN: низкотемпературная ромбическая форма при
—102,8 °С обратимо переходит в тетрагональную полиморфную
модификацию. В структурах обеих модификаций молекулы об-
разуют бесконечные цепи [1]:
—№С-Н N=C-H—
^3,18А-*
Дипольный момент HCN равен 2,6 Д в бензоле и 2,93 Д в га-
зообразном состоянии. Аномально высокое значение диэлектри-
ческой проницаемости жидкого HCN можно объяснить полиме-
ризацией; инфракрасные спектры показывают, что в инертной
матрице при низких температурах образуются димеры [2].
Полимеризация HCN приводит к образованию темно-крас-
ного твердого вещества, которое при перекристаллизации пре-
вращается в почти бесцветные кристаллы (HCNL. Этот «тет-
рамер» на самом деле является диаминомалеонитрилом [3]:
1,44 А
1,36 А
N
Приблизительно линейная конфигурация М—C = N была
подтверждена для целого ряда молекулярных цианидов
(табл. 21.8). Межмолекулярные расстояния М---N в некото-
рых из этих цианидов меньше, чем сумма вандерваальсовых
радиусов; например, в S(CNJ два ближайших атома S лежат
в одной плоскости с атомами С, входящими в молекулу; на
этом основывается предположение, что межмолекулярные вза-
имодействия могут быть причиной небольших отклонений от
точной линейности в системах М—C = N.
Структуры цианидов металлов описаны в следующей главе.
Литература. [1] Ada cryst., 1951, 4, 330. [2] J. Chem. Phys., 1968, 48, 1685.
[31 Acta cryst., 1961, 14, 589.
28
21. Углерод
21.7.3. Цианогалогениды. Известны все четыре цианогалогени-
да. Газообразный при обычных температурах фторид синтези-
руется путем пиролиза (FCNK, который в свою очередь полу-
чается из (C1CNK и NaF в тетраметиленсульфоне. Хлороци-
ан — это жидкость, кипящая при 14,5°С, которая легко поли-
меризуется с образованием цианурхлорида CI3C3N3 и получает-
ся при действии хлора на цианиды металлов или HCN. Бро-
моциан и иодоциан, получающиеся также из галогенов и
цианидов щелочных металлов, образуют бесцветные кристал-
лы. Все четыре галогенида были изучены в парообразном со-
стоянии и все, кроме фтороциана, — в кристаллическом состоя-
нии (см. табл. 21.9).
Соединение
FCN
C1CN
BrCN
ICN
c—x.
A
1,26
1,63
1,79
2,00
Таблица
C-N
о
Л
1,16
1,16
1,16
A,16)
21.9.
c-x
в
1
1
1
2
о
Л
32
77
94
14
в
Структуры цпаногалогенндов
X---N
кристал-
ен
ле, А
—
3,01
2,87
2,8
Метод
Микроволновая
спектроскопия
То же
Рентген острук-
турный анализ
Микроволновая
спектроскопия
Рентгенострук-
турный анализ
Микроволновая
спектроскопия
Рентгенострук-
турный анализ
Литер::
Trans. Far
1963, 59,
J. Chem.
1965, 43,
Acta cryst.
889
Phys. Rev
74, 1113
J. Chem.
1955, 23,
Phvs. Rev
74, 1113
Rec. Trav
(Belg.),
448
rypa
ad. Soc.
2661
Phys.
2063
1956, 9
, 1948
Phvs.
779
. 1948
Chim
1939, 58
Молекулы линейны и в кристаллах образуют цепи:
--X--C=N--X- ON--
По-видимому, здесь осуществляется слабое ковалентное взаи-
модействие между атомами X и N соседних молекул, причем
этот эффект особенно сильно выражен в иодиде, где межмоле-
кулярное расстояние I—N составляет только 2,8 А, что значи-
тельно меньше, чем сумма вандерваальсовых радиусов (см.
разд. 7.1). Длины внутримолекулярных связей С—X такие же,
как в Н3С—Сн=С—X, и существенно меньше длин ординар-
ных связей в молекулах СХ4, но значение длины связи C = N
очень близко к ее значению в HCN.
21.7. Дициан и родственные соединения 29-
21.7.4. Цианамид H2N-CN. Это бесцветное твердое кристалли-
ческое вещество, образующееся из NH3 и C1CN, легко полиме-
ризуется, например, при нагревании до 150 °С, с образованием
меламина (см. ниже). Длины связей в молекуле следующие
[1]. n_c 1,15 А и С—NH2 1,31 А. Группа N—С—N несиммет-
рична также в производных тяжелых металлов, образующих
ковалентные связи, такие, как Pb(NCN) [2] (длины связей со-
ставляют около 1,17 и 1,25 А); это, по-видимому, объясняется
более прочной связью с металлом через один из атомов азота.
Производные более электроположительных металлов являют-
ся солями, содержащими линейный симметричный ион NCN2~
(изученный в CaNCN [3]); длина связи N—С, равная 1,22 А,
сравнима с аналогичной величиной для N—N 1,17 А в изо-
электронном ионе N3~. (В соединении Sr(NCN) длины связей
были определены только приблизительно [4].)
21.7.5. Цициандиамид NCNC(NH-2J. Димер цианамида образу-
ется при кипячении цианамида кальция с водой. Это тоже бес-
цветное кристаллическое вещество, молекула которого имеет
следующее строение [5]:
1,28 А
1.22
N
1,36 A
120°
21.7.6. Производные цианура. При стоянии цианогалогениды
полимеризуются, образуя галогениды цианура. Цианамид пре-
вращается в соответствующий тример, меламин, при нагрева-
нии до примерно 150°С. Однако изоциановая кислота полиме-
ризуется намного легче. При перегонке мочевины образуется
изоциановая кислота, но при этом она полимеризуется, пре-
вращаясь в циануровую кислоту (NCOHK, представляющую
собой кристаллическое твердое вещество, пары которого при
быстром замораживании обращаются в жидкую изоциановую
кислоту, полимеризующуюся выше 0°С со взрывом в циаме-
лид — белое, похожее на фарфор твердое вещество. Это ве-
щество при кипячении со щелочами превращается в соли ци-
ануровой кислоты. Упомянутые реакции представлены на схе-
ме 21.1. Производные цианура могут испытывать взаимные
превращения. Так, например, при нагревании цианурбромида
с водой образуется циануровая кислота. Под действием NaF
в тетраметиленсульфоне цианурхлорид переходит во фторид
(FCNK, пиролиз которого приводит к образованию чистого
FCN с хорошим выходом.
30 21. Углерод
Схема 21.1
цианамид
CN . NH,
HCN-^1* CN .<Z\{
при стоянии
150°
Ны
2 IN .
NH,
цианурхлорид
У. . IN И 2 циануровои
' кислоты
IN (мелсилип)
Cl
выпаривание
_^NHt аммониевой
Q=Q . соли
^NH2 ' HNCO
перегонка
(мочевина) изоциановая
¦.исшелид (ЫСОН)„
НО.
Н
. он ос"'1 чсо
или I I
HN^ .NH
он
циануровсся
кислота
о
Структура цианурового кольца изучалась на нескольких
производных, например на триазиде, триамиде (меламине)
и циануровой кислоте (рис. 21.5). Кольцо является почти пра-
Рис. 21.5. Конфигурация моле- Рис. 21.6. Слои молекул, связанных водо-
кулы циануровой кислоты в родными связями, в кристаллической циану-
кристалле. Штриховыми линия- ровой кислоте
ми показаны связи N—H---0
с соседними молекулами.
вильным шестиугольником с шестью равными связями С—N,
длина которых равна 1,34 А. В кристаллической циануровой
кислоте молекулы образуют слои [6]; при этом шесть связей
21.7. Дициан и родственные соединения 31'
М—Н...0 связывают каждую молекулу с четырьмя соседними,
как это показано на рис. 21.6.
Литература. [1] Soviet Physics Crystallography, 1961, 6, 147. [2] Acta cryst,
1964, 17, 1452. [3] Acta Chcm. Scand., 1962, 16, 2263. [4] Acta Chem. Scand., 1966,
20, 1064. [5] J. Am. Chem. Soc, 1940,62, 1258. [61 Acta cryst., 1971, B27, 134, 146.
21.7J. Изоциановая кислота и изоцианаты. Для кислот HNCO
п HNCS возможна таутомерия:
Н—О—C==N или Н—N=C==O (г/зо-форма)
(S) (S)
Можно было бы ожидать образования сложных эфиров двух
видов — нормальных и ызо-форм, хотя обе формы кислоты да-
ют один и тот же ион (OCN)~, изоэлектронный с азид-ионом.
В действительности соединения с серой и с кислородом ведут
себя по-разному:
О-сосдинения
Кислота существует полностью в изо-
(Ьорме HNCO
Сложные эфиры: наблюдается только
изо-форма RN = C = O
S-соединения
Кислота проявляет таутомерию (рас-
твор в СС]4, по данным КР-спект-
ров, содержит «зо-форму HNCS,
пары содержат по крайней мере
95% азо-формы)
Два вида сложных эфиров:
R—S—ChseN (нормальная форма)
R—N = C = S (изо-форма)
Предположение, что свежеприготовленная изоциановая кисло-
та может содержать следы НО—C = N, основано на том, что
в ее изобутиловом эфире, полученном из кислоты и диазобута-
на, присутствует немного изоцианатной формы, однако сущест-
вуют и другие объяснения этого факта [1].
Структура молекулы изоциановой кислоты была изучена
в парообразном [2] и кристаллическом [3] состояниях. Угол
Н—N—С близок к 128°; длины связей: N—Н 0,99 A, N—С
1,20 А, С—О 1,18 А. Найдены следующие значения валентного
угла R—N—С в сложных эфирах: 126° в раннем электроногра-
фическом исследовании H3C-NCO [4] и 150±3° для (CH3KSi-
•NCO [5]. Значение 180°, полученное для Si(NCOL, следует,
видимо, рассматривать как исключение.
Были проведены некоторые исследования ионных (изо)цн-
анатов. Тот факт, что соль натрия изоструктурна азиду, под-
тверждает линейное строение иона, но высокая точность значе-
ний длин связей N—С 1,21 А и С—О 1,13 А не гарантирована
16].
В соединении AgNCO [7] изоцианатные группы связаны по-
средством атомов серебра, которые образуют две коллннеар-
ные связи (Ag—N 2,12 А). Расстояния Ag—О, составляющие
¦32 21. Углерод
3,00 А, слишком велики для нормальных связей, например
2,05 А в Ag2O.
\
NCO
Ag
OCN
OCN
Ag
/
\
N-
Ag
1,20 1,18 A
-О
NCO
\
M
Существуют две кристаллические формы фульмината AgCNO,
одна из которых содержит цепи, похожие на цепи в изоциана-
те, а другая — кольца из 6 атомов серебра, связанных через
группы CNO [8]. В цепях расстояние между атомами серебра
Ag—Ag составляет 2,93 А и лишь немногим больше, чем в ме-
талле B,89 А); в кольцах оно равно 2,83 А.
О
О
\
N
N
,CNO
ONC :
2>23AAg
ONC
С
. :
\:
Ag
CNO
/
Ag ^Ap
ONC | CNO
Agv. ^Ag
\ "^ ,-' /
C-Ag'-C
N N
О О
Литература. [1] Acta Chem. Scand., 1965, 19, 1768. [21 J. Chem. Phys., 1950 18
990. [3] Acta cryst., 1955, 8, 646. [4[ J. Am. Chem. Soc, 1940, 62, 3236. [51 J. Am
Chem. Soc, 1966, 88, 416. [6] Memorial des Services chimiques de l'etat (Paris)
1943, 30, 30. [7] Acta cryst., 1965, 18, 424. [81 Acta cryst., 1965, 19, 662.
21.7.8. Изотиоциановая кислота, тиоцианаты и изотиоцианаты.
В газообразном состоянии 95% свободной кислоты, полученной
нагреванием смеси KSCN и KHSO4, находится в изо-форме, и
молекулы имеют структуру а [1]. Строение метилтиоцианата
[2], найденное с помощью микроволновой спектроскопии, изо-
бражается формулой б (значения в скобках предположитель-
N
0,99 А
21.7. Дициан и родственные соединения
33
ные). В кристалле Se(SCNJ [3], содержащем линейные фраг-
менты S—С—N, была обнаружена конфигурация в с двугран-
ным углом SSeS/SeSC 79°; длины связей S—С и С—N не были
определены точно.
Исследование молекулярных изотиоцианатов показало, что
в НзС-NCS угол R—N—С равен 142° (ранняя работа [4],
выполненная с помощью микроволновой спектроскопии), в
(CH3KSi-NCS 154° [5], а в H3Si-NCS [6] и Si(NCSL [7] 180°.
Литература. [1] J. Mol. Spectr., 1963, 10, 418. [2] J. Chem. Phys., 1965, 43,
3583. [3] J. Am. Chem. Soc, 1954, 76, 2649. [4] J. Am. Chem. Soc, 1949, 71,
927. [5] J. Am. Chem. Soc, 1966, 88, 416. [6] Trans. Faraday Soc, 1962, 58,
1284. [7] Spectrochim. Acta, 1962, 18, 1529 (см. комментарий к ссылке [5]).
21.7.9. Тиоцианаты и изотиоцианаты металлов. Как и в случае
цианидов металлов (гл. 22), можно выделить три основных ти-
па тиоцианатов:
1) ионные кристаллы, содержащие ион SCN^;
2) соединения, содержащие группировку NCS, связанную
только с одним атомом металла посредством атома серы (тио-
цианат) или через атом азота (изотиоцианат);
3) соединения, в которых группа —NCS— ведет себя как
мостик, соединяющий два атома металла.
Ниже мы приведем пример соединения второго типа, кото-
рое является одновременно тиоцианатом и изотиоциаиатом;
Ni(NH3b(SCNJ может служить примером соединения четвер-
того типа, в котором в одном и том же кристалле присутству-
ют как мостиковые, так и концевые группы NCS. В соединени-
ях первого и третьего типов отсутствуют различия между тио-
цианатной и изотиоцианатной группировками.
1) Ионные тиоцианаты. Межатомные расстояния в линей-
ном SCN- в NaSCN и KSCN: S—С 1,65 А и С—N 1,17 А [1].
(Приближенные значения длин связей в ионе SeCN~ в KSeCN
[2]: Se—С 1,83 А, С—N 1,12 А.)
2) Ковалентные тиоцианаты и изотиоцианаты. Переходные
металлы и металлы побочных групп (например, кадмий,
ртуть) образуют многочисленные молекулярные и ионные
комплексы, содержащие в качестве лигандов —SCN и —NCS.
Обычно металлы первого переходного ряда, кроме меди(II),
образуют изотиоцианаты со связями — М—N—С—S, тогда как
металлы конца второго и третьего переходных рядов образуют
тиоцианаты со связью —М—S—С—N или мостиковые соеди-
нения третьего типа. Однако для некоторых металлов (напри-
мер, палладия) на выбор между М—NCS и М—SCN влияет
природа других лигандов, связанных с М. Это было доказано
методом ИК-спектроскопии: частота валентных колебаний свя-
зи S—С дает возможность отличить тиоцианат от изотиоциа-
иата, например, Pd(PPh3J(NCSJ, но Pd(SbPh3J(SCNJ. Со-
3 — 1284
34 21. Углерод
общение о получении обоих изомеров Pd(AsPh3J(SCNJ не
было подтверждено структурными исследованиями [3]. Одна-
ко в плоском квадратном комплексе Pd (а) в качестве лпгап-
дов присутствуют как тиоцианат, так и изотиоцпанат [4].
Проведены ретгеноструктурные исследования ряда тиоциа-
натов. К их числу относятся следующие примеры [5]:
тетраэдрический [Co(NCSL]2~
октаэдрические |Cr(NH3J(NCSL] ', [Ni(NH3L(NCSJ]
плоский [Pt(SCNLJ2~
тетраэдрический fHg(SCNL12~
октаэдрические [Rh(SCNN]3-, [Cu(enJ(SCNJ]
6 Л
Изотиоцианаты
Тиоцианаты
а
178"
1,14 А.
'N'
1—Pd-
сн,
107"
,66 А
4N"
!40'
X
(_¦-" 1,64 А.
N-- п" а
2,15 л
СN"
2,1A А
1,15 A
Корреляции между величинами валентных углов и длин свя-
зей, вытекающие из вида формул М—N+=C—S~ или
N = C = S, по-видимому, не подтверждаются имеющимися
в настоящее время данными. Валентные углы М—S—С в тио-
цианатных комплексах, как правило, близки к 105° (например,
в комплексе а или в [ (NH3MCoSCN]2+ [6]). Значение угла
(80°), найденное в Cu(enJ(SCNJ [7], нетипично по причине
низкой прочности связей Си—S C,27 А), дополняющих коорди-
нацию меди до 4 + 2. Валентные углы М—N—С в изотиоци-
анатных комплексах обычно лежат в пределах 160—180°, на-
пример, в [Co(NCSb]2- A66°; разд. 27.7.1) и в
[Cr(NH3J(NCSL]- A80°), однако в [Ni(enJ(NCSJ] (б)
этот угол составляет 140°, а в [Fe(NCSN]3~ наблюдаются зна-
чения 145 и 179° [8]. Эти низкие значения валентных углов,
возможно, объясняются эффектами упаковки. Длины связей
и для тиоцианатов, и для изотиоцианатов близки к следующим
значениям: С—N 1,16 А и С—S 1,62 А. В пределах эксперимен-
тальных ошибок фрагменты —SCN и —NCS линейные.
3) Тиоцианаты, содержащие мостиковые группы
—S—С—N—. Изучение кристаллического AgSCN показало,
что эти кристаллы построены из бесконечных цепей, которые
21.7. Дициан и родственные соединения 35
имеют изгибы на атомах S, а возможно, и на атомах Ag (угол
N—Ag—S близок к 165°, но положение легких атомов установ-
лено недостаточно точно) [9]. О величинах валентных углов
при атоме серебра см. также разд. 25.5.1.
2,43
2,22 А
1,64 А
Мостиковые группы — S—С—N— встречаются в ряде со-
единений Cd, Mg, Pb, Co, Ni, Cu, Pd, Pt. Примером конечной
молекулы служит платиновый комплекс а [10], тогда как
Cd(etuJ(SCNJ [11] (изоструктурное соединение свинца б)
содержит бесконечные цепи. В Co(SCNJ-3H2O [12] реализу-
ются аналогичные цепи типа б, в которых лиганд etu замеща-
ется молекулой Н2О (третья молекула Н2О не входит в состав
внутренней сферы комплекса). Для ртути известны примеры
как двумерных, так и трехмерных комплексов (см. гл. 26).
п Рг3Р^. /S С N С1
С]
N
РРг3
Cd-
N"
..ОТ
-Cd-
-Cd-
HN
C NH
N ^СН
CH2
?ппгРо^тУРа- [1] Acta cryst- 1977' B33' 1534> 1542- [21 Inol"g- Chem., 1965 4
499. [3] Inorg. Chem., 1966, 5, 1632. [41 Inorg. Chem., 1970., 9, 2754. [5] См. ссыл-
ки, цитированные в: J. Chem. Soc, 1961, 4590; J. Am. Chem Soc 1967 89
,op ; ^la c/>'st- 19»75- B31' I72- W Acta «yst., 1972, B28, 1908. [7] Acta crvst.',
nm'r J-V254- ^ Acta cryst" 1977' B33- 2197- f9l Acta cryst., 1957, 10^29
7l n,o?raS°C" 1961' 1416- [1^ Acta cryst- 196°. 13> '25. [12] Acta cryst.,
JJ/b, Iio2, 1526.
22. ЦИАНИДЫ, КАРБИДЫ,
КАРБОНИЛЫ
И АЛКИЛЫ МЕТАЛЛОВ
В этой главе прежде всего рассмотрены соединения, образо-
ванные металлами и содержащие изоэлектронпые группы CN~,
С22~ и СО (HCN и цианиды неметаллов, а также и цианаты,
и тиоцианаты рассмотрены в гл. 21). Затем кратко описаны
соединения металлов с углеводородными радикалами или мо-
лекулами, за исключением олефиповых комплексов платины
и палладия (гл. 27), а также некоторых соединений меди и
серебра (гл. 25).
22.1. Цианиды металлов
В соответствии со структурной функцией циаиид-иопа или ци-
аногруппы можно различать три класса цианидов металлов:
а) простые ионные цианиды, содержащие ионы CN~;
б) молекулы или комплексные ионы, в которых группа
—CN присоединена только к одному атому металла (через
атом углерода);
в) соединения, в которых группа —CN— соединена с ато-
мами металла и через С, и через N, выполняя таким образом
мостиковую функцию, как и атомы галогенов, кислорода и
т. д.
В некоторых сложных цианидах присутствуют группы двух
видов (б) и (в), например в KCu(CNJ и K2Cu(CNK-H2O.
Структуры этих солей описаны в гл. 25.
а) Простые ионные цианиды. При обычных температурах
NaCN, KCN и RbCN образуют кристаллы со структурой типа
NaCl, a CsCN и TICN — со структурой типа CsCl. Такие струк-
туры оказываются возможными либо благодаря свободному
вращению ионов CN~, когда они уподобляются сферам с ради-
усом около 1,9 А, промежуточным между радиусами С1~"
A,81 А) и Вг^ A,96 А), либо благодаря статистическим (слу-
чайным) ориентациям ионов CN~ в плоскостях [111], что со-
гласуется с кубической симметрией. Результаты нейтроногра-
фического изучения KCN при комнатной температуре указы-
вают на свободное вращение иона CN~ (С—N 1,16 А) [1].
Все перечисленные цианиды щелочных металлов существу-
ют и в менее симметричных «низкотемпературных» формах.
22.1. Цианиды металлов 37
Таблица 22.1. Строение кристаллом цианидов щелочных металлов
NaCN 1
\
KCN I
RbCN
CsCN
NH4CN
LiCN
Низкотемператур-
ная форма
Ромбическая
(рис. 22.1)
Моноклинная?
Ромбоэдрическая
(рис. 22.2)
Тетрагональная
(рис. 22.3,6)
Ромбическая
(рис. 22.3,а)
Высо-
котем-
пера-
турная
форма
NaCl
CsCl
?
—
Точка перехода
+ 15,3°С
—108°С
Между 1
— 100 и 1
— 180°С ]
—55 °С? J
Непрерывный
переход
Переход отсут-
ствует
Литература
Z. Kristallogr., 1938,
100, 201
Rec. Trav. chim.
(Belg.), 1940, 59,
908
Stuct. Reports., 1942—
4, 9, 138—142
Rec. Trav. chim.
(Belg.), 1944, 63, 39
Rec. Trav. chim.
(Belg.), 1942, 61,
244
где ион CN ведет себя как эллипсоид вращения, длинная ось
которого составляет около 4,3 А, а максимальный диаметр —
около 3,6 А. Их строение тесно связано со строением «высоко-
температурных» модификаций, относящихся к структурным ТИ-
Рис. 22.1. Структура низкотемпературной модификации NaCN. Ионы CN~
обозначены короткими прямыми линиями.
пам NaCl и CsCl (табл. 22.1). Существуют также метастабиль-
ная ромбоэдрическая модификация NaCN, полученная охлаж-
дением кубической формы, нагретой до 200—300 °С, а также
еще одна низкотемпературная форма [2]. Вторая низкотемпе-
ратурная форма KCN устойчива только в области от —108 до
-П5°С [3].
Структура ромбической низкотемпературной модификации
NaCN (и изоструктурного KCN) изображена на рис. 22.1.
38 22. Цианиды, карбиды, карбонилы и алкилы металлов
Очевидна ее тесная связь со структурой NaCl (изображенная
часть структуры ограничена плоскостями (ПО)). Все ионы
CN~ параллельны, и координационное число как анионов, так
и катионов равно 6. Низкотемпературный RbCN также имеет
деформированную структуру NaCl, но в точности эта структу-
22.1. Цианиды металлов
39
Рис. 22.2. Кристаллическая структура низкотемпературной (ромбоэдрической)
модификации CsCN. а — элементарная ячейка (ионы Cs+ заштрихованы); б —
сечение элементарной ячейки, иллюстрирующее упаковку ионов Cs+ и CN4-.
Рис. 22.3. а — проекция кристаллической структуры LiCN на плоскость A00)
(более жирными кружками показаны атомы, которые лежат в плоскости, при-
приподнятой на 1,86 А); б — кристаллическая структура NH4CN (заштрихо-
ра неизвестна. Метастабильиая ромбоэдрическая модификация
NaCN родственна высокотемпературной форме (поскольку
а = 53,2°) и не имеет сходства со структурой CsCl в отличие от
низкотемпературной ромбоэдрической формы CsCN [4], кото-
рая имеет слегка деформированную структуру типа CsCl, изо-
браженную на рис. 22.2; здесь ионы CN~ расположены вдоль
осей третьего порядка. Координационное число равно 8, как
и в CsCl. Цианид лития во многих отношениях отличается от
цианидов остальных щелочных металлов. У него низкая тем-
пература плавления A60°С в отличие от 550°С для NaCN и
620°С для KCN), малая плотность A,025 г/см3) и рыхлая
кристаллическая структура, в которой каждый ион связан
только с 4 соседними ионами (рис. 22.3, а). Здесь можно раз-
личить атомы С и N в ионе CN~, чего нельзя сделать в осталь-
ных щелочных цианидах. Фурье-анализ проекций электронной
плотности показывает, что отрицательный заряд находится па
атоме N, и тетраэдрическии координационный многогранник вок-
руг Li+ состоит из одного атома С и трех атомов N, а ион CN~ ок-
ружен четырьмя ионами Li+, один из которых находится вбли-
зи атома С, а три — вокруг атома N. Изменение координаци-
онного числа от 8 до 6 и до 4 в CsCN, NaCN и LiCN, возмож-
но, является не просто следствием изменения размеров ионов,
так как небольшой ион Li+, по-видимому, значительно поляри-
зует ион CN".
В строении NH4CN, не проявляющего полиморфизма в ин-
тервале температур от +35 до — 80 °С, наблюдаются некото-
рые интересные особенности. Эта структура очень просто свя-
зана со структурой CsCl: в ней элементарная ячейка в одном
направлении удвоена, так как ионы CN~ ориентированы двумя
различными способами (рис. 22.3,6). Хотя каждый ион NH4+
окружен восемью эллипсоидальными ионами CN~, ориентация
последних такова, что только четыре из них непосредственно
контактируют с NH4+ (на расстоянии 3,02 А), а остальные бо-
лее удалены C,56 А).
Литература. [11 Acta cryst, 1961, 14, 1018. [2] J. Chem. Phys., 1968, 48, 1018
[3] Acta cryst., 1962, 15, 601. [4] J. Chem. Phys., 1949, 17, 1146.
б) Ковалентные цианиды, содержащие фрагмент —CN.
Следует отметить, что при рентгеноструктурном изучении ци-
анидов тяжелых металлов нельзя различить атомы С и N.
Вместе с тем нейтронографическое исследование КзСо(СКтN
[1] и K2Zn(CNL [2] (Zn—С 2,024 А и С—N 1,157 А) позволи-
ло сделать вывод, что с металлом связан атом углерода С—N-
группы, как это обычно и предполагалось.
Известен только один цианид, Hg(CNJ, имеющий молеку-
лярную структуру. Его кристаллы построены из почти линей-
ных молекул [3]:
N 1,186 А 1,986
N
Причиной отклонения валентного угла С—Hg—С от 180° мо-
жет служить образование двух слабых связей Hg---N, лежа-
щих в плоскости, перпендикулярной плоскости С—Hg—С.
40 22. Цианиды, карбиды, карбонилы и алкилы металлов
В ионах, к обсуждению которых мы переходим, связи С—N
коллинеарны со связями металл — углерод; система М—С—О
в карбонилах металлов также линейна.
Цианиды многих тяжелых металлов в присутствии избытка
ионов CN~ растворяются, образуя комплексы [M(CN)n]m".
Эти ионы представляют интерес преимущественно с точки зре-
ния стереохимии атомов металлов, и подробности их строения,
а также соответствующие ссылки на литературу приводятся
в других главах.
Расположение связей
Примеры
2 коллинеарные
4 компланарные
4 тетраэдрические
6 октаэдрических
8 додекаэдрических
8 антипризматических
K[NC—Ag—CN1 (а также Аи)
Ba[Pd(CNLl-4 Н2О (а также Ni и Pt)
KrC(CN)j
()j
K4[Fe(CNNl-3H2O
K4[Mo(CN)8]-2H20 (а также W, Re)
Na3fMo(CN)s]-4H2O (а также W)
Октаэдрическая структура некоторых ионов MIn(CNN3"
была установлена путем рентгеноструктурного исследования,
например, кислот H3Fe(CNN и H3Co(CNN [4], солей
K3[Co(CNN], r(NH3NCo][Cr(CNN] и {Co(NH3)8H2O][Fe(CN)e]
(кристаллы последних двух соединений имеют структуру
[Ni(H2ON][SnCl6]). Ион [Fe(CNN]4~ изучался в кислоте
H4[Fe(CNN] (Fe—С 1,89 А) [5] и в K4[Fe(CNN]. Строение
берлинской лазури и родственных соединений вкратце обсуж-
дается ниже.
Атомы Mo(IV) Mo(V), W(IV), W(V), Re(V), Re(VI) обра-
зуют комплексы с восемью группами —CN. Чаще всего они по-
строены как квадратные антипризмы (D4d, 8m2) или имеют до-
декаэдрическую (D2d, 4m2) конфигурацию; однако в соедине-
нии Cs3[Mo(CN)8]-6Н2О обнаружена конфигурация в виде
двухшапочной тригональной призмы [6]. Но лишь небольшое
число ионов имеет структуру, достаточно близкую к этим иде-
альным геометрическим многогранникам, что следует из рас-
смотрения величин углов, вычисленных для этих конфигураций
[7], хотя строение соединений, приведенных в табл. 22.2, до-
статочно хорошо описывается на основе антипризмы или доде-
каэдра.
С точки зрения химии наибольший интерес представляют
следующие факты: 1) один и тот же ион, например Mo(CN)83-,
может иметь различные конфигурации в разных солях; 2) оди-
наковую конфигурацию могут иметь такие ионы, как Mo(CN)83~
22.1. Цианиды металлов 41
Таблица 22.2. Строение октацианид-ионов
Додекаэдр D.ld
Mo(CN)83-[*-C4H9LN]3
\lo(CN)84-K4-2H2O
Mo(CN)8<-(C6H6NO2L
Антиприз.ма D.d
Mo(CN)
W(CN)S3
W(CN)84
i3-Na3-4H2O 1
-Na3-4H2O J
"H4-6H2O
Литература
Inorg. Chem.,
Acta cryst.,
684
J. Am. Chem
90, 3177
Acta cryst.,
1209
Acta cryst.,
2025
1970,
1970
Soc,
1970
1980,
9, 356
B26,
1968,
B26,
B36,
и Mo(CN)s4 , несмотря на присутствие в последнем дополни-
тельного электрона. Очевидно, различные конфигурации не
сильно отличаются по энергии, и геометрия этих ионов, по-ви-
димому, определяется не только такими факторами, как оттал-
кивание лигандов, я-связывание и т. д.; наиболее важным фак-
тором оказывается энергия кристаллической решетки. Ярким
примером, иллюстрирующим важность энергии кристалличе-
ской решетки, является ряд фторотанталатов Na3TaF8, K2TaF7
и CsTaF6, где размер катиона фактически определяет состав
соединения, кристаллизующегося из раствора.
Красная соль с эмпирической формулой K.2Ni(CNK интерес-
на тем, что она диамагнитна и в растворе, и в твердом состоя-
нии; возможно, здесь Ni(I) имеет один неспаренный электрон.
Восстановление приводит к образованию желтой соли
r\4Ni(CNL, которая, по-видимому, содержит тетраэдрический
ион .Ni°(CNL4", изоэлектронный молекуле №(СОL. В кристал-
лах красной соли присутствуют ионы Ni2(CNN4~, где атомы
Ni(I) непосредственно связаны между собой (Ni—Ni 2,32 А)
и два фрагмента Ni(CNK лежат в почти перпендикулярных
плоскостях [8]. Связи металл — металл наблюдаются также
в комплексах палладия(I) и платины(II), в частности в
[Pd2(NCCH3N]2+ [9] и [Pt2Cl4(COJ]2- [10], обладающих сход-
ной структурой.
Литература. [1] Acta cryst., 1959, 12, 674. [2] Acta cryst., 1966, 20, 910. [3] Acta
Chem. Scand., 1958, 12, 1568. [41 Acta cryst., 1972, B28, 2530. [5] Acta cryst,
1969, B25, 1685. [6] Acta cryst., 1980, B36, 1765. [7) J. Am. Chem. Soc, 1974,
96, 1748. [8] Z. Kristallogr., 1972, 136, 122. [9] Inorg. Chem., 1976, 15 535
ГЮ] J. Chem. Soc, D 1975, 1516.
в) Ковалентные цианиды, содержащие фрагмент —CN—.
В некоторых цианидах металлов группы CN выступают в качест-
ве мостиков между парами атомов металлов, образуя связи
42 22. Цианиды, карбиды, карбонилы и алкилы металлов
и через атомы С, и через атомы N, причем связи М—С—N—М
коллинеарны или почти коллинеарны. Простейшая островная
R
R
1,15 А
R-Au-C=N-Au-R
! I
N С
II! II!
С N
] |
R-a'u-N=C-a'u-R
молекула этого типа
ченная в кристаллах
Рис. 22.4. Структура,
предложенная для
Cd(CNJ и изоструктур-
ного ему Zn(CNJ.
взаимопроникающих
бой ни одной связью
R R
— (NH3MCo-NC-Co(CNM (a) [1], изу-
моногидрата. Более сложным примером
является циклическая молекула
[Аи(н-СзН7JСЫ]4 (б) [2]. Примеры
прочих основных типов структур: цепо-
чечные структуры AgCN и AuCN,
Ag3CN(NO3J (гл. 25); слоистые струк-
туры неизвестны для простых цианидов,
но обнаружены в Ni(CNJ- (NH3) -СбН6
[3] (разд. 1.5.2); трехмерные структуры
Zn(CNJ [4] и Cd(CNJ [51 со структу-
рой анти-Си2О (разд. 3.10.3); берлинс-
кая лазурь и родственные соединения,
которые обсуждаются в следующем раз-
деле. Структура антикуприта показана
на рис. 22.4. Так же, как и структура
Си2О, она состоит из двух одинаковых
каркасов, которые не связаны между со-
Cd—С или Cd—N (см. гл. 3).
Литература. [1] Inorg. Chem., 1971, 10, 1492. [2] Proc. Roy. Soc, A, 1939, 173,
147. [3] J. Chem. Soc, 1958, 3412. [41 Acta Physicochim. URSS, 1945, 20, 247
[51 Изв. АН СССР, 1941, 31, 350.
22.1.1. Берлинская лазурь и родственные соединения. Раство-
рение цианидов некоторых металлов, например Fe, Co, Мп, Сг,
в избытке раствора щелочного цианида приводит к образова-
нию комплексных ионов M(CNN. Щелочные и щелочноземель-
ные соли этих комплексов растворимы в воде и хорошо кри-
сталлизуются. Гексацианоферраты(П) и гексацианохрома-
ты(П) (например, K4Fe(CNN и K4Cr(CNN) бледно-желтого
цвета. Гексацианоферраты(Ш) и гексацианоманганаты(Ш),
например КзРе(СЫN и КзМп(СЫN более темного цвета и по-
лучаются окислением солей M(CNN4~. Ионы M(CNN4-, содер-
жащие марганец и кобальт в растворе, самопроизвольно окис-
22.1. Цианиды металлов 43
ляются на воздухе до солей M(CNN3~. При добавлении раство-
ров этих комплексных цианидов к растворам солей переходных
металлов или Си(II) во многих случаях образуются нераство-
римые соединения. Так, добавление гексациаиоферрата(П) ка-
лия к растворам солей Fe (III) вызывает выпадение осадка
берлинской лазури, а соли Си(II) дают коричневый цианофер-
рат(П) меди. Эти осадки обычно образуются в виде хлопьев
н при промывании могут образовывать коллоидные растворы.
В сухом виде они очень устойчивы к действию кислот, тогда
о
Fem
6
Fe
К Fe
1
;i
Fe
О
К
(CN)fi
a FeFe(CNN о К Fe Fe (CNN g K2FeFe(CNN
Рис. 22.5. Взаимосвязь между берлинской зеленью (а), растворимой берлинской
лазурью (б) и гексацианоферратом(П) железа(II)-дикалия I\2FeFe(CNN (e).
как цианоферраты(П) щелочных металлов под действием раз-
бавленной НС1 образуют кислоту H4Fe(CNN. Ясно, что по
своему строению эти соединения сильно отличаются от простых
растворимых цианоферратов(П).
Соединения железа были известны в течение нескольких
столетий и ценились как красящие вещества. Название «бер-
линская лазурь» дано соединению, образующемуся из раство-
ра соли Fe (III) и цианоферрата(П), в то время как комплекс,
который получается из соли Fe(II) и цианоферрата(Ш), был
известен как турнбуллева синь. По данным исследований у-
резонансных спектров, следует, что оба этих соединения явля-
ются гидратированным комплексом Fe4in[Fen(CNN]3 с высоко-
спиновым Fe (III) и низкоспиновым Fe (II) в отношении 4:3
[1]. Известна также «растворимая берлинская лазурь» со-
става KFe[Fe(CNN], которая также является цианоферра-
том(Ц). Большинство (если не все) соединения, которые мы
будем обсуждать, гидратированы; природу гидратиой воды мы
рассмотрим позже.
Рентгеноструктурное исследование [2] берлинской лазури
и родственных соединений показало, что в цианоферрате желе-
за (III) (берлинская зелень) FeFe(CNN, в растворимой бер-
линской лазури KFeFe(CNN и в белом нерастворимом комп-
44 22. Цианиды, карбиды, карбонилы и а;
пкилы металлов
лексе K.2FeFe(CNN атомы железа расположены в узлах куби-
ческой гранецентрированной решетки. На рис. 22.5 атомы
Fe(II) представлены заштрихованными кружками, а атомы
Fe(III)—светлыми. На рис. а все атомы железа находятся
в трехвалентном состоянии; на рис. б половина атомов — это
Fe (II), а другая половина — Fe (III); атомы щелочных метал-
лов обеспечивают электронейтралыюсть соединения. Они рас-
положены в центрах чередующихся малых кубов; предполага-
ется, что в гидратированных соединениях молекулы воды так-
же могут располагаться в пустотах основной сетки. Литий и
цезий, представляющие собой соответственно очень малый и
очень большой ионы, не дают соединений, имеющих такую
структуру. На рис. в все атомы железа находятся в двухва-
лентном состоянии, и внутри каждого малого куба находится
атом щелочного металла. Группы CN располагаются между
атомами металла вдоль сплошных линий на рис. 22.5, так что
каждый атом переходного металла находится в центре октаэд-
ра из 6 атомов С или 6 атомов N. Таким образом, в целом
комплекс состава M/M/'(CNN образует простую 6-связанную
трехмерную сетку. Структуру берлинской лазури имеют следу-
ющие соединения щелочных металлов: KCuFe(CNN,
KMnFe(CNN> KCoFe(CNN, KNiFe(CNN и KFeRu(CNN (руте-
ниевая пурпурная).
Многие цианоферраты(П) и цианоферраты(Ш) многова-
лентных металлов имеют кубическую структуру того же типа.
Элементарная ячейка, изображенная на рис. 22.5, содержит
4 атома М', 4 атома М" и 24 группы CN, причем атомы
М' расположены в вершинах и в центрах граней, а атомы
М" — в центре куба и на середине каждого ребра. Таким об-
разом, трехмерной сетке в целом соответствует формула вида
M'M"(CNN, но во многих из рассматриваемых комплексов
цианидов, включая берлинскую лазурь, отношение М' : М" не
равно 1:1. Возможны два варианта структуры этих комплек-
сов. Если в структуре присутствует целостный каркас из ато-
мов металла и групп CN (с 24 группами CN на элементарную
ячейку), то в некоторых из этих структур возникает избыток
атомов М' (группа А в левой колонке табл. 22.3). С другой
стороны, возможен и дефицит атомов М" (при этом требуется
менее 24 групп CN на элементарную ячейку), как в соедине-
ниях группы в правой колонке таблицы. Измерения плотности
позволяют сделать выбор между вариантами А и В для
Co3II[CoIII(CNN]2- 12Н2О [3] (а также для изоструктурных
гексацианокобальтатов (III) Cd и Мп [4]) и подтверждают ва-
риант В. Элементарная ячейка содержит 17з формульной еди-
ницы, т. е. имеет состав Со^'Соз/з111 (CN) !6- 16Н2О; таким обра-
зом, 7з позиций Со111 не занята, в то время как 7з позиций
22.1. Цианиды металлов 45
Таблица 22.3. Берлинская лазурь и родственные соединения
¦и
['¦]
[А]
груш
лг
3
4
!
6
8
ах CN h;i ячейку
л\"
л
4
4
4
4
П[I мер
Ti,[Fc-(C\)c|,
1ч'1ч-(СХ'N
Гч\,|Г1-с(СХN|:,,
Co.i[Cu(CN)i;
2
CuL.|F"e(CX)r;!
Числе
мои
IipiiM).
ма
5
4
3
2
2
) ато-
М",
-L
2
Чис.1
С
я
C2)
24
18
16
12
о групп
\ на
е 11 к у
ID]
[В]
групп CN занята 8 молекулами Н2О. Остальные 8 молекул
Н2О расположены в центрах октантов ячейки (позиции К+ па
рис. 22.5, в). Окружение атомов Со(П) в среднем имеет сос-
тав N4(H2OJ. В берлинской лазури Fe4in[Fe(CNN]3- 15H2O
(приготовленной медленным разбавлением раствора раствори-
мой берлинской лазури в концентрированной НС1) на элемен-
тарную ячейку приходится одна формульная единица (т. е.
4Fe[H), и замещение lU групп CN молекулами Н2О приводит
к среднему окружению атома Fe(III), имеющему состав
N4,5(H2O)i,5 [5]. Занято только 3Д позиций групп Fe(CNN, при
кубической симметрии распределение вакансий должно быть
статистическим. Нейтропографическое изучение [6] берлинс-
кой лазури с различной степенью гидратации показывает, что
есть два сорта и молекул Н2О: 6 молекул Н2О занимают сво-
бодные позиции атомов N и приблизительно 8 молекул Н2О ли-
бо находятся в центрах октантов элементарной ячейки, либо
связаны с первой группой молекул Н2О водородными связями,
т. е. расположены не случайным образом. В соединениях типа
Ti3[Fe(CNN]4 наблюдается ситуация, противоположная той,
которая характерна для берлинской лазури (см. вариант D в
табл. 22.3), и так как общее число групп CN на элементарную
ячейку не может превысить 24, по-видимому, реализуется ва-
риант С (если принять, что тип структуры в основном сохраня-
ется), но это предположение пока не проверено.
Литература. [11 J. Chem. Phys., 1968, 48, 3597. [2] Nature, 1936, 137, 577.
[31 Helv. Chim. Acta, 1968, 51, 2006. [4] Inorg. Chem., 1970, 9, 2224. [51 Chimia
(Switz.), 1969, 23, 194. [6] Inorg. Chem., 1980, 19, 956.
22.1.2. Смешанные цианидные и изоцианидные комплексы.
Кроме комплексных цианидов, содержащих связанные с ме-
таллом (через атом С) группы CN, существуют также комп-
46 22. Цианиды, карбиды, карбонилы и алкилы металлов
лексы металлов, в которых с атомами металла связаны моле-
кулы цианидов R—CN или нзоцианидов R—NC. В первом слу-
чае связь с металлом осуществляется только через атом N,
как, например, в соединении [Fe(NCHN] (FeCl4J> образую-
щемся при растворении FeCl3 в безводной HCN (расстояния
Fe—C1 1,89 A, Fe—N 2,16 А; валентный угол Fe—N—С 171°)
[1]. Изоцианиды присоединяются к металлу через атом С; пе-
реходные металлы образуют многочисленные соединения этого
типа. В изоцианидных комплексах группа CNR аналогична
группе СО; достаточно, например, сопоставить Сг(СМС6Н5)б
с Сг(СОN и Fe(,NOJ(CNRJ с Fe(NOJ(COJ. Так же, как и
СО, изоцианиды стабилизируют низшие состояния окисления
металлов, например, в диамагнитном комплексе [Mn'(CNR6]I
и желтом парамагнитном комплексе [CoI(CN-CH3M]ClO4
Катион этой соли имеет тригонально-бипирамидальную конфи-
гурацию с практически линейной группой Со—С—N—С и рас-
стоянием Со—С 1,87 А (ср. с 2,15 А для ординарной связи)
[2]. Другим примером является соль [Fe(CN-CH3N]Cl2-3H2O,
в которой наблюдается правильное октаэдрическое расположе-
ние шести молекул CNCH3 вокруг атома Fe с длинами связей:
Fe—С 1,85 А и С—N 1,18 А [3]. Существуют также смешан-
ные координационные группы, например в молекулах цис- к
транс-изомеров Fe(CNJ(CN-CH3L [4].
Органические дицианиды NC—R—CN могут вести себя как
мостиковые лиганды, присоединяясь к металлу через оба ато-
ма N; примеры структур такого типа были приведены в гл. 3
О нитропруссид-ионе [Fe(CNMNOp- см. разд. 18.9.
Литература. [1] J. Solid Slate Chem., 1970, 2, 421; Acta cryst 1975 B31 1838
f21_Inorg. Chem., 1965, 4, 318. [3] J. Chem. Soc, 1945, 799. [4] J. Chem'. Sot,
22.2. Карбиды металлов
Многие металлы образуют карбиды М.г-С„, получающиеся либо
прямым синтезом из элементов, либо при нагревании металла
в парах соответствующего углеводорода, либо при нагревании
оксида или другого соединения металла с углеродом. Химиче-
ские и физические свойства карбидов позволяют разделить их
па четыре класса:
1) солеподобные карбиды металлов первых групп периоди-
ческой системы;
2) карбиды 4/ и 5/-элементов;
3) промежуточные карбиды переходных металлов, в част-
ности металлов IV, V и VI групп;
4) менее четко определенный класс карбидов, включающий
карбиды металлов VII и VIII групп, а также некоторые карби-
22.2. Карбиды металлов 47
Be 2 С
CaCi
SrC2"
BaC2
~Карби
<if-u5i
\l;Cv
П1С2
и с
Кг
A1,,L
Класс
Таблица
3
/
1ьС
IiC
-элементов
МГ; Г
|
асе 2
YtC
ть2е
Но j С
22.4
V2C
V4C,
v,,cs
VSC7
Класс
Примеры
Сг2зС6
С г i СI
Cr.iC,
w2c
WC,_V
J
карбидов
Mn4C
Mn-> (Co
Mn',('
Mn,C\
MnCJ
we
метал
Fe,C
Fc2l,C,
Класс 4
Rue
JOB
Co,С Ni,C
Cn;C
OsC
ды элементов VI группы. Хотя карбиды МС2 первого и второго
классов имеют сходные структуры, по свойствам они различа-
ются довольно сильно, поэтому классификация, основанная
только на строении карбидов, оказывается неудобной. Кроме
того, нельзя четко провести разделительные линии в табл.22.4.
Например, ТЬ2С и Но2С (подобно Y2C) имеют структуру ан-
ти-CdCb, а при температуре выше 900 °С у карбида иттрия
наблюдаются переменный состав (YCr, 0.3<.v<0,7) и дефект-
ная структура NaCl [1]. Эти плотноупаковаппые структуры
характерны для промежуточных карбидов третьего класса.
С другой стороны, UC, как и многие промежуточные карбиды,
имеет структуру NaCl, но в отличие от них принадлежит
к группе реакционноспособных карбидов тяжелых металлов
(PuC, Pd2C3, CeC2, UC2 и т. д.), которые обладают металличе-
скими свойствами, но легко гидролизуются. Аналогично карби-
ды типа WCi-.,; имеют структуру NaCl с плотнейшей упаковкой
атомов металла, тогда как WC не обладает структурой с плот-
пейшей упаковкой.
Примеры, иллюстрирующие эту приблизительную классифи-
кацию, приведены в табл. 22.4. О структурах карбидов элемен-
тов побочных подгрупп, а также о карбидах М2С2, образуемых
щелочными металлами [2], по-видимому, имеется мало сведе-
ний.
Класс 1. Карбиды наиболее электроположительных элемен-
тов во многом близки по свойствам к ионным кристаллам. Они
образуют бесцветные прозрачные кристаллы, которые при
обычной температуре не проводят электричества, разлагаются
подои или разбавленными кислотами, а так как присутствую-
щие в них отрицательные ионы неустойчивы, то при этом вы-
деляются углеводороды. Эти карбиды по типу присутствующих
в кристалле ионов Схп~ можно разделить на две основные
группы:
а) карбиды, содержащие отдельные атомы углерода (или
ноны С4~);
48 22. Цианиды, карбиды, карбонилы и алкилы металлов
Рис. 22.6. Кристаллическая
структура СаС2.
б) карбиды, содержащие ионы С22~.
(Пока еще нет доказательства существования
более сложных углеродных анионов в ионных кар-
бидах, но то обстоятельство, что при гидролизе
Mg2C3 образуется главным образом метилацетилен (пропин)
СНз—С = СН, позволяет предположить существование ионов
Сз4~ в этом кристалле. Интересно,
что MgC2, получающийся при дейст-
вии ацетилена на Mg(C2H5J и выде-
ляющий ацетилен при гидролизе, не-
стабилен при высоких температурах
и превращается в Mg2C3 и углерод.)
Карбиды группы (а) при гидроли-
зе выделяют СН4. Примерами служат
Ве2С, имеющий структуру антифлюо-
рита, и А14С3. Структура последнего
значительно более сложна, и ее дета-
лей мы здесь касаться не будем [3].
Достаточно отметить, что каждый
атом углерода окружен атомами А1
на расстояниях от 1,90 до 2,22 А, а
самое короткое расстояние между
атомами углерода составляет 3,16 А.
Таким образом, так же как и в Ве2С,
здесь присутствуют отдельные атомы углерода, что согласует-
ся с образованием СН4 при гидролизе. Щелочноземельные кар-
биды группы (б) кристаллизуются при комнатной температуре
с образованием структуры СаС2, показанной на рис. 22.6.
Есть некоторые сомнения относительно структуры MgC2 [4].
В структуре СаС2 ионы М2+ и С22~ расположены по типу NaCl,
но симметрия понижается до тетрагональной из-за параллель-
ного расположения анионов. При гидролизе карбиды группы
(б) выделяют ацетилен (интересно сравнить с имеющим ту же
структуру ВаО2, при гидролизе которого выделяется Н2О2).
Класс 2. ^-элементы от La до Но образуют карбиды трех
типов [5]: М3С, в которых атомы С занимают случайным об-
разом '/з октаэдрических пустот в структуре типа NaCl; М2С3
со структурой Pu2C3; MC2 со структурой СаС2. В структуре
Ри2С3 [6] все атомы С входят в состав групп С2; в элементар-
ной ячейке, которая состоит из четырех формульных единиц.
Ри2С3, содержится 6 групп С2.
Структура ThC2 очень похожа на структуру СаС2, но имеет
более низкую симметрию (моноклинную). При использовании
обычных изображений ячейки аналогия со структурой NaCl не
22.2. Карбиды металлов 49-
вполне очевидна, однако она видна на рис. 22.7, где обозначено
направление моноклинных осей.
Хотя карбиды МС2 4/- и 5/-элементов кристаллизуются по
типу СаС2 или ThC2, они в отличие от карбидов щелочнозе-
мельных металлов не являются солеподобными. Например,
СаС2 не проводит электрический ток, a LaC2, ThC2 и UC2 об-
ладают металлическим блеском и проводимостью, сходной
с проводимостью металлов. В то время как СаС2 при гидроли-
A01]
¦(-—О
О
о.
\
о
о
V
S,
\
о
¦Q
Th
<ч
о
\
.-'%
>[ioi]
о
[010] ч
Рис. 22.7. Кристаллическая структура ThC2. Жирными штриховыми линиями-
показаны ребра ортогональной элементарной ячейки типа NaCl с ребрами 11,7,
11,7 и 10,3 А.
зе выделяет в основном С2Н2, ThC2 дает почти исключительно
СН4, что в интервале температур от 25 до 100 °С справедливо
и для UC. Отсутствие прямой связи между структурами карби-
дов тяжелых металов и продуктами их гидролиза хорошо пока-
зано на примере LaC2 и СеС2 [7]. При комнатной температуре
продукт реакции, хотя и представляет собой сложную смесь
углеводородов, состоит в основном из ацетилена, а при темпе-
ратуре 200 °С ацетилена в нем не содержится.
Различия в физических и химических свойствах карбидов
МС2 и М2С3, по-видимому, связаны с длинами связи С—С
в ионах С22~; к настоящему времени ряд этих величин опреде-
лен нейтронографически (табл. 22.5). В СаС2 это значение
близко к величине, ожидаемой для иона (С = СJ~, а в карби-
дах 4/- и 5/-металлов оно приближается к значению для двой-
ной связи; предположив, что один или несколько электронов
оказались в зоне проводимости, можно объяснить металличе-
4—1284
50 22. Цианиды, карбиды, карбонилы и алкилы металлов
Таблица 22.5. Длины связей в карбидах
с-с,
J , 19
¦1.24
1 ,276
1,28—1
1,295
1,34
1,35
1,30—1
о
А
.29
,35
СаС,
La,C
Се2С
МС2
и2с3
ис2
ис2
ThC,
Кристалл
з, Рг2С3, ТЬ2С3
3
(M = Y, La, Се и др.)
(кубический)
(тетрагональный)
Литература
J. Chem. Phys., 1961, 35, 1950
Ada Chem. Scand., 1962, 16
1212
J. Chem. Phvs., 1961, 35, 1960
J. Chem. Phvs., 1967, 46, 4148
J. Chem. Phvs., 1967, 46, 1891
Ada eryst., 1959, 12, 159
Acta cryst., 1965, 18, 291
J. Chem. Phvs., 1967, 47, 1188
Acta cryst., 1968, B24, 1121
скую проводимость. (Размеры элементарной ячейки ЕиСг со-
гласуются с предположением, что это соединение отвечает фор-
муле ЕипС2, но длина связи С—С неизвестна [8].)
Большинство двойных карбидов, относящихся к классам 1
и 2 (если не все они), имеют одну или большее число высоко-
температурных форм, в которых ориентация ионов С22~ не яв-
ляется жестко фиксированной. Такие соединения, как LaC2 и
UC2, которые при обычной температуре имеют тетрагональную
структуру СаС2, становятся кубическими, причем ионы С22~
ориентированы случайным образом вдоль направлений [111]
(неупорядоченные пириты или высокотемпературная модифи-
кация KCN). С другой стороны, ThC2 переходит сначала в тет-
рагональную структуру с анионами, ориентированными случай-
ным образом в базисной плоскости @01), а при температуре
1480 °С — в кубическую форму, в которой центры катионов и
анионов расположены так же, как в структуре NaCl. Как уже
было сказано при обсуждении KCN, трудно решить вопрос о
том, ориентированы ли ионы высокотемпературной кубической
формы совершенно случайно или, если один из ионов линей-
ный, предпочтительна ориентация вдоль одного id направлений
[111].
Класс 3. Карбиды промежуточного типа представляют со-
бой огнеупорные материалы с некоторыми характерными свой-
ствами металлов (блеск, металлическая проводимость) и, кро-
ме того, отличаются необычной твердостью и тугоплавкостью.
Атомы металла в них плотно упакованы, а атомы С занимают
октаэдрические пустоты, но следует отметить, что упорядоче-
ние атомов металла в карбиде не всегда такое, как в самом
металле. В таких случаях карбид МС нельзя рассматривать
как предельный твердый раствор углерода в структуре метал-
ла; наоборот, присутствие атомов С влияет на упорядочение
22.2. Карбиды металлов 51
атомов металла таким образом, что приводит к образованию
структуры типа NaCl. Поскольку атомы С занимают октаэдри-
ческие пустоты в плотноупакованной структуре металла, то су-
ществует нижний предел (около 1,3 А) для радиуса атома ме-
талла, способного образовать карбиды промежуточного типа;
металлы с меньшими радиусами образуют карбиды более
сложной структуры. Радиусы некоторых металлов (для коор-
динационного числа 12) указаны в таблице, приведенной ни-
же. Металлы, расположенные слева от вертикальной линии, за
исключением Th (который образует ТпС2), образуют промежу-
точные карбиды; расположенные справа дают карбиды, в ко-
торых атомы металла не плотно упакованы (класс 4).
Ti
Zr
Hf
Th
1
1
1
1
,47
,60
,59
,80
A
V
Nb
Та
1,35
1,47
1,47
A
Mo
w
1
1
40
,41
A
Cr
Mn
Fe
Co
Ni
1
1
1
1
1
,29 A
,37a
,26
,25
,25
a Кристаллические структуры карбидов Мп сложные (разд. 29.1.4).
Ниже мы приводим характеристику строения карбидов
промежуточного типа. Максимальное содержание углерода
в них зависит от чередования слоев в плотнейшей упаковке.
Две октаэдрические пустоты с обеих сторон слоя г расположе-
ны непосредственно одна над другой, и только одна из них бы-
вает занята. Это ограничение дает следующие предельные фор-
мулы:
Последователь-
ность слоев
Предельная фор-
мул й
Пример
г
мх
См. ниже
гкк
1 V 2
Мо3С2
ггк
М3С2
(Te2V)C2
ггкк
М4<з
V4C3
к:
МС
См. ниже
Известны многочисленные примеры структур, основанных
па двух простейших последовательностях слоев плотнейшей
упаковки. Структуры с гексагональной плотнейшей упаковкой
дают примеры различных способов заполнения половины всех
октаэдрических пустот (табл. 22.6); наиболее простые схемы
заполнения были приведены в гл. 4. В литературе имеется об-
зор этих структур [9]. (Опубликованные сведения об этих со-
единениях противоречивы. Многие карбиды при разных темпе-
ратурах имеют различное строение; разные формы были обо-
значены греческими буквами, но не все авторы последователь-
но пользовались этими обозначениями.) К числу структур с ку-
бической плотнейшей упаковкой относятся не только карбиды
МС со структурой NaCl, но также ряд структур с упорядочен-
ным расположением вакансий; характерной чертой некоторых
4*
52
22. Цианиды, карбиды, карбонилы и алкилы металлов
Таблица 22.6. Строение промежуточных карбидов
Гексагональная плотнейшая упа-
коика атомов металла
(заняты октаэдрические пустоты)
Половина пустот заполнена
статистически
Заполнены все пустоты между
чередующимися парами слоев
Занята половина пустот между
каждой парой слоев плотней-
шей упаковки
Заняты одна треть и две трети
пустот между соседними па-
рами слоев плотнейшей упа-
ковки
Кубическая плот-
нейшая упаковка
атомов металла
Заняты все октаэд-
рические пустоты
(структура
NaCl)
Структуры типа
NaCl с упорядо-
ченными дефек-
тами
Тип структуры
_
анти-Сс112
f антп-СаС12
{ ;-Nb2c
e-FcN
Примеры
HfC, TiC, ZrC, VC, NbC,
TaC. p-MoC.-x
V8C7
v6c5
SC2C, Ti2C, Zr2C анти-
CdCl2(Ho2C, У2Сидр.)
Примеры
P-V2C, 7-NboC
a-Ta,C, a-WX
Co,C
u-Mo2C '
t;-Nb2c
e-V2C, e-Nb,C, e-\V,C
Литература
Acta crysi, 1970, B26
1882
Phylosoph. Mag., 1968
18, 177
} Acta cryst., 1970, B26, 153
из этих структур является расположение вакансий по спирали
(V6C5 и V8C7). Как уже отмечалось ранее, расположение ато-
мов С в карбидах тяжелых металлов нельзя считать оконча-
тельно установленным, пока не проведено' их нейтронографиче-
ское исследование, как для соединений в табл. 22.6.
Класс 4. Карбиды этого класса не обладают особыми свой-
ствами, характерными для промежуточных карбидов. Напри-
мер, если карбид титана не взаимодействует с водой или НС1
даже при температуре 600 °С, то карбиды класса 4 разрушают-
ся разбавленными кислотами (Fe3C и №3С) или даже водой
(МпзС). Хотя углерод в них присутствует в виде отдельных
атомов, продукты реакции содержат, помимо водорода, слож-
ные смеси углеводородов.
Мы не будем приводить здесь обзор структур этих карби-
дов, которые часто достаточно сложны. При низком содержа-
нии углерода отмечено некоторое их сходство с боридами, но
когда содержание углерода возрастает, это сходство уменьша-
ется, так как углерод не проявляет присущей бору тенденции
к образованию протяженных систем со связями неметалл —
22.2. Карбиды металлов
53
неметалл. Существуют группы изоструктурных карбидов и бо-
ридов (с различными типами формул), в которых атом неме-
талла имеет сходное окружение, часто представляющее собой
тригональную призму с одним, двумя или тремя дополнитель-
ными соседями на некотором расстоянии от вертикальных гра-
ней призмы. В Сг3С2 атомы С имеют координацию F+1) и
F + 2) [10], а координация по трехшапочной тригональной
призме наблюдается в следующей группе родственных струк-
тур: Fe3C (цементит) [11], Mn3C, Co3B, Pd3P, Al3Ni; Mn5C2 и
Pd5B2; Cr7C3, Re7B3, Th7Fe3 [12]. Следует отметить, что некото-
рые из этих структур характерны не только для карбидов и
боридов, но и для металлических фаз. Структура WC, изобра-
женная на рис. 4,8, а (гл. 4), представляет собой еще один
пример структуры, свойственной не только карбидам, так как
кроме WC, RuC и OsC [13] она наблюдается и у МоР и WN.
Кроме двойных карбидов, о которых шла речь выше, суще-
ствуют также тройные карбиды, карбид-нитриды и оксид-кар-
биды. Поведение металлов в системах металл—углерод—азот
меняется в широких пределах: А1 образует «гомологический»
ряд соединений с определенными составами и структурами,
промежуточными между A1N и АЦС3 (а именно: A18C3N4,
AI7C3N3, A16C3N2 и AI5C5N) [14], в то время как Th образует
непрерывный ряд твердых растворов от ThC до ThN; существу-
ют также соединения ThC2 и Th3N4. ThCN — это карбид-ни-
трид, содержащий группы С2 (С—С 1,23 А) и атомы N, окру-
женные четырьмя атомами Th, расположенными в вершинах
тетраэдра. Атомы металла окружены четырьмя атомами N и
четырьмя атомами С [15]. Yb2OC уже упоминался в гл. 12 как
соединение, первоначально ошибочно принятое за моноксид.
Некоторые 4/-элементы образуют соединения типа МО2С2 [16]
или М4О3С [17]. Проводимость серебристо-серого Nd4O3C, име-
ющего структуру NaCl, близка к проводимости металлического
Nd; он гидролизуется с образованием главным образом метана
и может быть описан формулой Nd43+O32~C4~(eJ. Изучена
структура А14О4С [18]. Она представляет собой трехмерный
каркас, образованный тетраэдрами А1О3С, особенность которо-
го состоит в том, что некоторые тетраэдры объединены в пары
через общие ребра О---О.
Литература. [1] J. Chem. Phys., 1969, 51, 3862, 3872. [21 О карбиде Li2C2 см.
Acta cryst., 1962, 15, 1042. [3] Acta cryst., 1963, 16, 559. [41 J. Am. Chem. Soc,
1943, 65, 602, 1482. [5] J. Am. Chem. Soc, 1958, 80, 4499 [61 Acta cryst, 1952,
5, 17. [71 Inorg. Chem., 1962, 1, 345, 683. [8] Inorg. Chem., 1964, 3, 335. [91 Acta
cryst, 1970, B26, 153. [101 Acta Chem. Scand., 1969, 23, 1191. [11} Acta cryst.,
1965, 19, 463. [121 Acta cryst., 1962, 15, 878. [131 Acta cryst., 1961, 14, 200.
[141 Acta cryst., 1966, 20, 538. [151 Acta cryst., 1972, B28, 1724.' [161 Inorg. Chem.,
1966, 5, 1567. [17] J. Am. Chem. Soc, 1968, 90, 1715. [181 Acta cryst., 1963, 16.
54 22. Цианиды, карбиды, карбонилы и алкилы металлов
22.3. Карбонилы металлов
22.3.1. Получение и свойства. Структура соединений СО со
щелочными и щелочноземельными металлами полностью отли-
чается от структуры соединений СО с переходными металлами.
Соединение К2(СОJ, образующееся при действии СО на ме-
талл, растворенный в жидком NHs, является солью, содержа-
щей линейный ацетилендиолат-ион (ОС=СОJ~ с длинами
связей С—С 1,21 А и С—О 1,28 А [1]. Эта соль образуется
также из СО и жидкого металла при низкой температуре; при
высокой температуре (выше 180°С) продуктом реакции в ос-
новном является Сб(ОКN [2]. Так называемые карбонилы ще-
лочноземельных металлов, получаемые из металлов и СО в.
жидком NH3, являются смесями ацетилендиолатов и метилатов
металлов с карбонатом аммония [3].
Некоторые из солей металлов группы 1Б соединяются с СО
и образуют, например, CuCl(CO) -2H2O, Ag2SO4-CO и
AuCl(CO), последнее из которых является относительно устой-
Таблица 22.7. Карбонилы, карбонилгидриды, карбонилгалогениды
V(CON
3
4
5
6
Сг(СОN
Сг(СОMН2
Металлический
кластер
Треугольный
Ромб
Тетраэдр
Тригональная би-
пирамида
Тетрагональная
пирамида
Октаэдр
Центрированный
октаэдр
Трпгональная
призма
Центрированная
тригональная
призма
Двухшапочный
тетраэдр
Мп(СОMН
Мп(СОN1
Мп2(СОI0
Mn2(CO)sI2
Fe(COM
Fe(CO),II2
Fe(CO)nX2
(ra = 2, 4, 5)
Fc2(CO)9
Fe3(COI2
Os3(CO),2
[Re4(COI6r>-
Co4(COI2
Os5(CO);6, [Ni5(CO),2l-~
Rh6(COI6
[Co6(CO)m14-
Os6(COI8
Co(COLH
Co(CO)X,
Co2(CO)>,
Ni(COL
Ni2(CONH,
[Fe5(CO),,Hl-
[Re3(COI2H6l-
[Fe4(CO),3]2-
fOs5(COI5Il-
[Fe5C(COI5r
Rlie(COI5I
[Fcv,C(CO),e
2—
fCo6H(COI61-
[Rh6C(COI5
2—
[Co6N(COI5
~~
22.3. Карбонилы металлов
55
чивым летучим веществом. Структуры этих соединений неиз-
вестны, и здесь мы ограничимся рассмотрением карбонилов и
родственных им соединений переходных металлов.
Существует несколько типов многочисленных соединений
переходных металлов, содержащих СО. Некоторые простые
соединения З^-металлов приведены в верхней части табл. 22.7;
существует также большое число соединений более тяжелых
металлов VIII группы. Соединения, которые содержат только
лиганды СО, меняются по составу от моноядерных карбонилов
до молекул и ионов с большим числом атомов металла, обра-
зующих центральный металлический кластер. Существуют мо-
лекулы, получающиеся из карбонилов Мт(СО)„ замещением
части СО-групп другими донорными лигандами (например,
фосфинами), водородом или галогенами; известны и более
сложные молекулы или ионы, в которых атомы С, N или S вхо-
дят в состав металлического кластера. Ссылки на литературу
по многочисленным не упомянутым в тексте карбонилам можно
найти в обзорах, где делается попытка объяснить форму ме-
таллических кластеров на основе теории молекулярных орбита-
лей [4] или связать ее с расположением групп СО в координа-
ционном окружении [5]. Были тщательно рассмотрены коорди-
национные полиэдры, выгодные для молекул и ионов содержа-
щих 12 и 13—16 СО-групп. Существует также обзор, посвящен-
ный гидридным соединениям [6]. Далее будут описаны струк-
туры ряда характерных соединений, перечисленных в
табл. 22.7 в порядке возрастания числа атомов металла.
Карбонилы представляют собой большей частью летучие
соединения с самыми различными химическими свойствами,
для которых многие проблемы, касающиеся стереохимии и ва-
лентного состояния, остаются нерешенными. Некоторые из кар-
боннлов обладают значительной реакционной способностью и
образуют множество производных, как это показано на схеме
22.1 для соединений железа, в то время как другие относитель-
но инертны, например Cr(CON, Re2(CO)i0 и др. Соединение
рения, хотя и превращается при обработке газообразными га-
логенами в карбонилгалогениды, устойчиво к действию щело-
чей и концентрированных минеральных кислот. Некоторые кар-
бонилы можно получить прямым действием СО на металл при
атмосферном давлении (Ni(COL) или под давлением при повы-
шенной температуре (Fe(CO)s, Co4(CO)i2). Другие карбонилы
получаются из галогеиидов или, в случае Os и Re, из высшего
оксида. Многоядерпые карбонилы получают с помощью фото-
химического синтеза при нагревании простых карбонилов или
косвенными способами.
Карбонилгидриды получают или из карбонилов, как пока-
зано на схеме для Fe(COLH2, или путем восстановления
56 22. Цианиды, карбиды, карбонилы и алкилы металлов
Схема d'd.. 1
Некоторые реакции карбонилов железа
H2SO4
[HFe(COMr
1г(80 Г) phenan
> Fe(COJI2 > Fe(COJI2 (phenan)
-> Fe(COMI2
0°С
> Fe(COLI2
Fe(COM
HgSO4
¦ HgFe(COL
Fe(COJ(NOJ
длинно-
волновое
УФ-излучение нагрев
* Fe2(CO)9 > Fe(CO)s+Fe3(COI2
0H~
[Fe2(CO)8J
2-
NaOH(aq.)
Na[HFe(COL]
[Fe3(CO)nJ2-
Fe2(CO)8I2
Fe3(CO)nP03
MnO2(aq.)
Fe(COLH2
натрием в жидком NH3 для Ni2(CONH2, или непосредственно
действием смеси СО и Н2 на металл. Кобальт в этих услови-
ях образует Со(СОLН.
Производные соединений H2Fe(COL и НСо(СОL, содер-
жащие тяжелые металлы (так называемые смешанные карбо-
нилы металлов), весьма различны по своим свойствам.
HgFe(COL — устойчивое твердое соединение желтого цвета,
нерастворимое как в полярных, так и в неполярных раствори-
телях; эти свойства согласуются с полимерной структурой, на-
пример, типа а. В то же время производные НСо(СОL,
М[Со(СОL]2, где M = Zn, Cd, Hg, Sn или Pb, напоминают
многоядерные карбонилы, так как они растворимы в неполяр-
ных растворителях, нерастворимы в воде и не разлагаются при
ОС
-ОС
СО
СО
22.3. Карбонилы металлов 57
сублимации. В кристаллическом состоянии они построены из
простых линейных молекул (см. ниже).
Способность элементов к образовнию карбонилгалогенидов
не всегда совпадает со способностью к образованию карбони-
лов, как это показано в приведенной ниже таблице, где внут-
ри области, ограниченной сплошными линиями, находятся эле-
менты, образующие простые карбонилы или карбонил-ионы,
а внутри области, ограниченной штриховой линией, расположе-
ны металлы, образующие карбонилгалогениды:
V
1
Nb
Та
Сг
Мо
W
Мп
Тс
Re
Fe
Ru
Os
Co
Rh
Ir
i.NiJt
Pd
Pt
i
Cu
Ag
Au
Zn
Cci
Hg
Карбонилгалогениды можно получить непосредственно из га-
логенидов металлов при действии СО (например, из СО и без-
водного Со12 получается Со(СОI2) или, как в случае железа,
непрямым путем •— из карбонилов или карбонилгидридов.
Единственный хорошо изученный карбонилфторид имеет эмпи-
рическую формулу Mo(COJF4 [7]; для него предложена ди-
мерная структура с двумя мостиковыми атомами F. Соедине-
ния Pt(COJF8 и Rh(COJF3 описаны как продукты, образую-
щиеся при действии СО на тетрафториды. Простые карбонилы
Pd, по-видимому, неизвестны, но Pt образует ряд соединений
[Pt3(CON]n2-, где п = 2, 3, 4 или 5 (см. ниже). PdCl2 и PtCl2
присоединяют СО, образуя соединения с эмпирическими фор-
мулами PdCl2-CO, PtCl2-CO и PtCl2(COJ. Соединение
PtCl2(COJ— мономер, оно не является электролитом, диполь-
ный момент D,85 Д) показывает, что молекула имеет цис-
строение [8], а соединение PtCl2-CO, представляющее собой
твердое вещество с температурой кипения 195°С, обладает
димерной структурой, неполярно и является аналогом соеди-
нений PtCl2 с арсинами и фосфинами с общей формулой
Rxclxcl
a a ^r
Все карбонилгалогениды разрушаются водой, но их устойчи-
вость к действию воды растет от хлорида к иодиду.
Карбонилнитрозилы получаются при действии N0 на много-
ядерные карбонилы железа и кобальта. Как и карбонилы, кар-
бонилнитрозилы взаимодействуют с нейтральными молекулами,
такими, как органические азотсодержащие соединения и гало-
58
22. Цианиды, карбиды, карбонилы и алкилы металлов
гены, причем в подобных реакциях замещается группа СО,
а не N0. Так, при взаимодействии Fe(COJ(NOJ с иодом полу-
чается Fe(NOJI. Пока не наблюдалась реакция между N0 и
значительно более устойчивыми гексакарбоиилами Сг, Л\о и W.
Известно, что Mn, Fe и Сообразуют соответственно Мп(\0KС0,
Fe(NOJ(COJ и CoNO(COK, a Ni не образует карбонплпитро-
зилов этого типа (см. ниже) и реагирует с N0 только в присут-
ствии воды. В результате образуется голубое соединение
Ni(NO)OH, которое растворимо в воде и обладает восстанови-
тельными свойствами. Считается, что это соединение однова-
лентного никеля, и очевидно, что оно совершенно другого типа,
чем карбонилнитрозилы кобальта и железа.
Литература. [1] Helv. Chim. Acta., 1963, 46, 1121. [21 Helv. Chim. Acta., 1964, 47,
1415. [3] Helv. Chim. Acta., 1966, 49, 907. [4] J. Am. Chem. Soc, 1975, 95, 3802;
1978, 100, 5305; 1979, 101, 1979; Adv. Inorg. Chem. Radiochem., 1976, 18, 1;
Trans. Amer. Cryst. Assoc, 1980, 16, 1, 17. [51 Chem. Comm, 1976, 211- J. Chem.
Soc, D 1980, 1743. [6] Ace. Chem. Res., 1979, 12, 176. [7] Inorg. Chem., 1970, 9,
2611. [8] J. Am. Chem. Soc., 1954, 76, 4271.
22.3.2. Структуры карбонилов и родственных им соединений.
Для этих соединений характерны следующие основные особен-
ности:
1. Молекула СО связана с атомом (или атомами) металла
через атом С; это было доказано для Fe(COM и Сг(СОN,
и предполагается, что это справедливо для всех остальных мо-
лекул.
2. Молекула СО ведет себя как монодентатный лнгапд (а),
как мостик, соединяющий два атома металла (б) или (реже)
связывающий три атома металла (е).
а 6
М *- С =о м
о
о
чм
¦-;м
~ М -''
Предполагается, что единственная а-связь М—С (а), образо-
ванная неподеленной парой электронов лиганда, дополнена
я-связыванием между заполненными cf-орбиталями металла и
вакантной орбиталью лиганда, как это схематически показано
на рис. 22.8. Это «обратное (л-дативное) связывание» умень-
шает формальный отрицательный заряд на металле М, который
появляется в соответствии со схемой а М-^-С = О и объясняет
тот факт, что СО и другие образующие я-связь лиганды стаби-
лизируют низшие степени окисления переходных металлов.
В соединении Ni(COL формальная степень окисления Ni равна
нулю, и он образует тетраэдрические связи типа 4s4p3. Этот тип
связывания, реализующийся также в случае NO, изоцианидов,
22.3. Карбонилы металлов
о=> с
Рис. 22.8. Дативная
я-связь в Ni(COL.
замещенных фосфинов, сульфидов и т. д., в структурном отно-
шении отличается от связывания в я-комплексах, образованных
С5Н5~, С6Н6 и т. д., которые будут рассмотрены ниже. Узловые
плоскости я-орбиталей, используемых в дополнение к а-связы-
ванпю в карбопилах, должны включать ось о-связи, т. е. систе-
ма М—С—О должна быть линейной. В я-комплексах, где в
связывании участвуют только я-орбита-
ли лиганда, атомы металла лежат вне
плоскости молекулы С5Н5 или другого
лиганда.
3. Формулы большинства простых
карбонилов и родственных им соедине-
ний согласуются с точкой зрения, сог-
ласно которой во многих из этих соеди-
нений атом металла приобретает столь-
ко электронов, сколько нужно для до-
стижения конфигурации инертного газа.
Если предположить, что группа СО, свя-
занная по типу а, отдает 2 электрона, а
группа NO — 3 электрона, то во всех следующих соединениях
металл будет иметь электронную конфигурацию криптона:
Ni(COL, Fe(COM, Cr(CON
Co(COKNO, Fe(COJ(NOJ, Mn(CO) (NOK
Альтернативой «правилу благородных газов» является утверж-
дение, согласно которому общее число валентных электронов
равно 18; столько электронов требуется для заполнения 9 орби-
талей: пяти й-, одной s- и трех р-орбиталей. При этом простой
подсчет электронов объясняет образование одноядерных карбо-
нилов элементами с четными номерами (Cr(CON, Fe(COM и
Ni(COL) и двуядерных карбонилов марганца, железа и ко-
бальта, если предположить существование нормальных двух-
электронных связей между атомами металла. Это утверждение
согласуется также со стереохимией молекул, образованных за-
мещением группы СО другими донорными молекулами, напри-
мер, в комплексе Fe(COK(PR3h, имеющем, подобно Fe(COM,
вид тригональной бипирамиды, и в Mo(COMPF3, имеющем,
подобно Мо(СО)б, октаэдрическое строение, а также со струк-
турами Co(COLSiH3 (тригональиая бипирамида) и
Мп(СОMСН3 (октаэдр), причем атомам Со и Мп, не образую-
щим одноядерных карбонилов, лиганды дают 9 и 11 электро-
нов соответственно. Вместе с тем сформулированное правило не
выполняется для V(CON, для некоторых 16-электронных комп-
лексов платины, а также для молекул типа Ni(C5H5J
(разд. 22.4).
60
22. Цианиды, карбиды, карбонилы и алкилы металлов
В последние годы были достигнуты значительные успехи в
распространении этих идей на соединения, содержащие метал-
лические кластеры. Наибольший интерес представляют те из
них, которые содержат большие кластеры и являются проме-
жуточными между веществами, состоящими из обычных моле-
кул, и чистыми металлами. Для кластеров различных типов
были проведены вычисления энергий молекулярных орбиталей;
считалось, что орбитали с наиболее низкой энергией использу-
ются для связывания лигандов или образования связей ме-
талл — металл. Число этих кластерных валентных молекуляр-
ных орбиталей (КВМО) для некоторых типов кластеров таково:
мономер — 9, димер—17, тример — 24, тетраэдр — 30, триго-
нальная бипирамида — 36, двухшапочный тетраэдр — 42, окта-
эдр — 43 и тригональная призма — 45. Число валентных элект-
ронов кластера, разумеется, равно удвоенному числу КВМО и
для каждого конкретного соединения равно числу валентных
электронов атома переходного металла (и мостиковых атомов,
если они присутствуют), к которому нужно прибавить по
2 электрона для каждой группы СО или аналогичного лиганда
и заряд комплекса, если рассматривается анион. Для кластер-
ных молекул или ионов число валентных электронов класте-
ра—^то величина, соответствующая числу 18 для одноядерных
карбонилов. Значения этой величины согласуются со стехио-
метрией большинства известных соединений, например 86 для
Со6(СОI44- и Со6Н(СОI5- (октаэдры) и 90 для Co6N(COI5~
(тригональная призма). Так же как образование Ni(COL,
Fe(COM и Сг(СОN объясняется с помощью «правила 18 элект-
ронов», удается объяснить и образование октаэдрического комп-
лекса Co6(CO)i6 с 86 электронами. Однако для возникновения
соответствующего октаэдрического соединения Fe потребова-
лось бы 19 СО-групп, т. е. такое их число, из которого трудно
построить хотя бы приблизительно сферическую группу. Это
осложнение, заключающееся в недостатке валентных электро-
нов и, таким образом, проявляющееся тем сильнее, чем меньше
d-электронов у металла, можно нивелировать, если ввести мос-
тиковые атомы и (или) придать кластеру отрицательный заряд,
как, например, в Fe5C(CO) i62^. Проблема упаковки не столь
остра для кластеров большого размера, вокруг которых можно
разместить гораздо большее число лигандов; кроме того, здесь
возможно более компактное расположение атомов металла, что
приводит к увеличению их координационной оболочки и, сле-
довательно, уменьшает число КВМО, которые должны быть
заняты лигандами. Ниже мы еще вернемся к рассмотрению
крупных кластеров.
Карбонилы М(СО)п- Они имеют высокосимметричные струк-
туры, перечисленные в табл. 22.8.
22.3. Карбонилы металлов 61
\\олекула
\i(COL
IV(COM
('г(СО)в
Д\о(СОN
\V(COH
Таблица 22.8
Форма
Правильный
тетраэдр
Тригональная
бипнрамида
Правильный
октаэдр
. Строение i
1
1
1
1
2
2
м—с
,83
,806
,833
,918
,063
,058
о
(акс
(экв
карбонилов
)
)
о
С—О, А
1
1
1
1
1
15
145
141
145 |
|
148 J
М(СО)„
Литература
Acta cryst.,
Acta cryst.,
Acta Chem
23, 2245
Acta cryst.,
Acta Chem
20, 2711
1952, 5, 795
1969, B2J
Scand.,
1975, B31
Scand.,
), 737
1969,
2649
1966,
В тесном родстве с молекулами Fe(COM находятся комплекс
Fe(COL(PH(C6H5J), имеющий форму тригональной пирамиды
[1а], Ре(СО)з{Р(ОСН3)з}2 [16], где один или оба фосфина на-
ходятся в аксиальном положении, и л-комплекс C2H4Fe(COL
[2а], в котором связь С = С A,46 А) лежит в экваториальной
плоскости, а длина связи Fe—С составляет 2,12 А. Молекула
C2F4Fe(COL [26] имеет структуру того же типа, но, принимая
во внимание длины связей С—С и Fe—С A,53 и 1,99 А), можно
считать, что это псевдооктаэдрический комплекс.
Родственными по отношению к №(СОL и Fe(COM являют-
ся также мостиковые молекулы а [3] и б [4], в которых распо-
ложение связей вокруг атомов Fe и Ni такое же, как и в про-
стых карбонилах. В б аксиальная связь Fe—С оказывается
значительно короче A,71 А), чем экваториальные связи
A,79 А), а связь С—О длиннее A,29 А по сравнению с 1,16 А).
Во многих формулах на следующих страницах мы будем обо-
значать —СО просто штрихом (—).
-О
(С6П5J
\|
Fe
ч 2,26 A^P , 2,23 A Fe 1.7IA
Jve^ "P'' \ 1,79 a
6 (СНЗ>2 \1,16А
О
Карбонилы М2(С0)п- Раннее рентгеноструктурное исследо-
вание Fe2(CO)9 [5] показало, что эта молекула имеет структу-
ру, изображенную на рис. 22.9, а, с тремя мостиковыми группа-
ми СО. Недостаточная точность определения положения легких
атомов не позволяет детально сравнивать длины двух разных
связей Fe—С и С—О (см. ниже Со2(СО)8), но указывает на
82
22. Цианиды, карбиды, карбонилы и алкилы металлов
о с
t=o
/
Fe
С C0
0
0
1,79 А
с
Co
/ \7,2M
Co
Z.5ZA
;0s —
-С О
\
О О о
с с с
Со7
/о
с с
о о
R,P-Pt
Pi—
Рис. 22.9. Структуры карбонилов металлов, a —Fe2(CO)9- б —Со2(СО)8- в —
Os3(COI2; г-Со4(СОI2; д - [Fe4(CO)I3]2-; е — [Re4(COI6l2-; ж,' з-
Pt4(COM{P(C2H4CNK}4; u-Rh6(CO)ie.
существенно меньшую кратность мостиковых связей по сравне-
нию с концевыми. Расстояние Fe—Fe B,46 А), равное удвоен-
ному металлическому радиусу Fe с координационным числом 8,
показывает, что здесь существует связь Fe—Fe, приводящая
22.3. Карбонилы металлов 63
к диамагнетизму и придающая атому Fe завершенную электрон-
ную конфигурацию Кг.
Существует много соединений, в большей или меньшей сте-
пени родственных Fe2(CO)9, в том числе комплекс в с тройным
мостиком (CH3bGe [6], соединения типа г с двойными мости-
ками, где мостиковой группой служат, например, NH2 [7] или
SC2H5 (см. разд. 22.3.8), а также соединения д с одним мости-
ком (CO^Fe—R—Fe(COL, где R представляет собой Р(СН3J,
Ge(C6H5J и т. п. Соединения Ge интересны тем, что содержат
3-членные кольца GeFe2 (ср. с 5-члепным кольцом в соединении,
отмеченном в конце разд. 22.4.2).
\
Ре^2,40 А
Ge(CH3J
Fe
1,98 А
/ NH-
74°
2,40 А
Fe
Молекула Co2(CO)s [8] (рис. 22.9,6) имеет в сущности ту
же структуру, что и Fe2(CO)9, но одна мостиковая группа СО
отсутствует. Образуя связь металл — металл B,52 А), атом Со
приобретает такую же завершенную электронную конфигура-
цию, как Fe в Fe2(CO)g.
В Mn2(CO)io [9] и Re2(CO)io [9a] (а также в изоструктур-
ном Тс2(СО)ю) нет мостиковых групп СО, и молекула состоит
из двух фрагментов —М(СОM, соединенных связью металл—
металл. Каждый атом металла образует шесть октаэдрически
направленных связей (с пятью группами СО и атомом М),
н в кристаллическом состоянии два октаэдра повернуты при-
мерно на 45° относительно заслоненной конфигурации. (Как
показало электронографическое исследование в газовой фазе
[10], Re2(CO)io имеет заслоненную конфигурацию.) Большая
длина связи М—М (Мп—Мп 2,92 A, Re—Re 3,02 А и Тс—Тс
3,04 А) объясняется большим формальным отрицательным за-
рядом и отталкиванием между группами СО. Карбонилсодер-
жащие анионы [М2(СО)ю]2~ существуют в натриевых солях
(М = Сг, Mo, W), полученных путем восстановления гексакарбо-
нилов с помощью NaBH4, а ионы [(СО^М—М'(СОM]~ были
обнаружены в солях [N(C2H5L]+ (M = Mn, Re; M' = Cr, Mo, W)
[Юа]. Красная диамагнитная форма [Co(CNCH3M]2(ClO4L со-
держит димерные ионы, относящиеся к тому же типу структуры.,
что и Mn2(CO)io, с длиной связи Со—Со 2,74 А [11].
-64 22. Цианиды, карбиды, карбонилы и алкилы металлов
Карбонилы М3(СО)п. Молекула Fe3(CO)i2 в твердом веще-
стве может быть описана как результат замещения одной из
мостиковых групп СО в Fe2(CO)9 группой Fe(COL, причем
третий атом Fe находится на одинаковых расстояниях от пер-
вых двух [12]. Три атома Fe расположены в вершинах равно-
бедренного треугольника е, а 12 групп СО находятся в верши-
нах икосаэдра (так же как и в рассмотренном ниже случае
Co4(CO)i2)- Очевидное несоответствие инфракрасного спектра
ж
с,н
5П5
Rh;
С5Н5
ль
О
С,Н.
Fe3(CO)i2 в растворе и модели е может быть обусловлено пере-
группировкой, происходящей в растворе; эта точка зрения
подтверждается тем обстоятельством, что один изомер
Кпз(СО)з(СбН5)з имеет структуру, аналогичную е, а другой изо-
мер— симметричную структуру ж [12а].
Анион в [(C2H5KNH']([Fe3(CO)uH] [13], очевидно, имеет
структуру того же типа, что и Fe3(CO)i2, а в Fe3(CO)iiP(C6H5K
одна концевая группа СО замещена фосфином. Кристалл содер-
жит два структурных изомера з и и со слегка несимметричными
мостиками [14], причем отрезки а я b в среднем приблизитель-
но равны 2,04 и 1,87 А соответственно.
3 \\// it Р.
Fe
04 А
V
В противоположность Fe3(CO)i2 молекулы Ru3(COI2 [15]
и Os3(CO)J [16] (первоначально они считались содержащими
9 групп СО) имеют симметричную структуру с четырьмя
группами СО, присоединенными к каждому атому металла
(рис. 22.9, е). В равностороннем треугольнике, образованном
атомами металла, длины связей равны: Ru—Ru 2,85 A, Os—Os
2,88 А, и каждый атом металла образует четыре нормальные
и две «наклоненные» октаэдрические связи — ср. с аналогичны-
ми «наклоненными» связями в Со2(СО)8, Rh2(COLCl2 и др.
22.3. Карбонилы металлом G5
Аннон в [Re3(CO)i2H2][As(C6H5L] имеет отчасти похожую
структуру (к) [17]. Положение атомов Н не было определено,
по, вероятно, они образуют мостики на длинных сторонах тре-
угольника Re3. Как и в Ru3(CO)i2, здесь нет мостиковых
групп СО.
Карбонилы М4(СО)п. Для молекулы М4(СО) \2 наиболее сим-
метричная форма — это тетраэдр из атомов металла, к каждо-
му из которых присоединено по 3 группы СО, причем 12 лиган-
дов СО расположены по вершинам кубооктаэдра, как в соеди-
нении Ir4(CO)i2 [18]. Другими тетраэдрнческими комплексами
являются Ru4H4(CO)i2, о котором будет сказано позже, и анион
[Re4(CO) i2HG]2^ [19]. Логично предположить, что в этом ионе
атомы Н расположены вблизи ребер или непосредственно на
ребрах тетраэдра. Среднее расстояние Re—Re C,16 А) близко
к несколько большему значению в [Re3(CO)i2H2']- и сущест-
венно превышает расстояние Re—Re (около 3,0 А) в соедине-
ниях, не содержащих мостиковых связей, например в Re2(CO)iu.
Тетраэдрические молекулы Со4(СОI2 [20а] и Rh4(COI2
[206] менее симметричны (рис. 22.9, г); они содержат три мости-
ковые группы СО. Один атом металла образует октаэдрические
связи с тремя другими и с тремя группами СО; расположение
связей вокруг атомов металла, лежащих в основании тетраэдра,
близко к пентагональной бипирамиде. Из-за несовершенства
кристаллов (неупорядоченность и двойникование) длины свя-
зей точно неизвестны, средние значения расстояний металл —
металл равны соответственно 2,49 и 2,73 А.
Карбонильный анион [Fe4(CO) K]2~ имеет тетраэдрическую
структуру (рис. 22.9,C) совершенно другого типа [21]. Апикаль-
ная группа Fe(COK связана с основанием тетраэдра только
связями Fe—Fe, и характерной особенностью этой молекулы
является образующая 3 связи группа СО, лежащая под основа-
нием. (Существует очень слабое связывание между атомом С
каждой группы СО в плоскости основания и вторым атомом ме-
талла.)
Ион [Re4(CO)i6]2~ (рис. 22.9, е) имеет совершенно другую
форму [21]. Четыре атома металла лежат в одной плоскости,
все расстояния Re—Re близки к 3,0 А, а расположение связей
вокруг атомов Re октаэдрическое [22].
Мы упоминали в гл. 3 некоторые семейства тетраэдриче-
ских молекул, в том числе молекулы M4X4Y4 и M4X6Y4. Молеку-
ла Ре4(СОL(л-С5Н5L является тетраэдрической, причем над
каждой гранью тетраэдра находится тридентатиая мостиковая
группа СО, в то время как в молекуле №4(СО)б{Р(С2Н4С!Ч)з}4
группы СО образуют мостиковые связи вдоль каждого ребра,
а молекулы фосфина присоединены в каждой вершине (Ni)
[23]. Удаление одной из групп СО, образующих мостики вдоль
5 — 1284
66 22. Цианиды, карбиды, карбонилы и алкилы металлов
ребер в молекуле этого типа, ведет к превращению тетраэдра
в двугранную структуру («бабочка»), как в случае
Pt4(COM{P (СН3JС6Н5}4 [24], что показано схематически па
рис. 22.9, ж и з. Двугранный угол равен 83° вместо 109,5° у тет-
раэдра. Удаление одной мостиковой группы СО и отсутствие
одной связи металл — металл приводит к уменьшению числа
электронов до 16 для атомов металла с координацией 5, в то же
время два атома металла с координацией 7 сохраняют завер-
шенную электронную конфигурацию.
Карбонилы М5(СО)п. Изучение структуры Os5(CO)i6 [25]
показывает, что ядро из атомов металла представляет собой
тригональную бипирамиду, а все группы СО концевые: по три
около каждой из четырех вершин и четыре около одной из эк-
ваториальных вершин. Os5(CO)i5I [26] имеет в сущности ту
же структуру, только одна группа СО замещена атомом I.
Карбонилы М6(СО)п. Для кластеров М6 найдены три раз-
личные структуры. Наиболее симметричная из них — это струк-
тура [Co6(CO)i4]4- [27] (и [Co4Ni2(CO)i4]2-) с 6 концевыми,
группами СО (по одной на каждую вершину) и 8 тридентат-
ными мостиковыми группами СО (по одной над каждой
гранью). 14 лигандов СО расположены в вершинах центриро-
ванного по всем граням куба, т. е. приблизительно в вершинах
ромбододекаэдра. Черные кристаллы Rh6(CO)i6 [28] состоят из
октаэдрических молекул (рис. 22.9, и), в которых присутствуют
по две группы СО, связанные с каждым атомом Rh нормаль-
ными связями Rh—С, а также тридентатные мостиковые груп-
пы СО над четырьмя из граней октаэдра. Расстояние Rh—Rh
составляет 2,78 А, а так как число электронов в атоме Rh рав-
но 56, это соединение является исключением из «правила благо-
родных газов». Другими октаэдрическими кластерами являются
Rh6(CO)i5I и [Co6(CO)i5]2~. Октаэдрическая группа из 6 ато-
мов металла с центральным атомом С или Н обнаружена в
[Fe6C(CO)i6]2- [29] и в изоэлектронном [Co6H(CO)i5]- [30]
(число валентных электронов кластера равно 86). В изоэлект-
ронных анионах [Rh6C(CO)i5]2~ [31] и [Co6N(COI5]- [32]
атомы металла образуют кластер в виде тригональной призмы
с числом электронов, равным 96. Третий тип металлического
кластера обнаружен в Os6(CO)i8 [33], это двухшапочный тет-
раэдр; к каждому атому осмия присоединены три концевые
группы:
22.3. Карбонилы метал.юн Ь7
Литература, [la] J. Chcrn. Soc, Л 1969, 1906. [16] Acta cryst., 1974, ВЗО, 2798.
i>a] J Organomet. Chem., 1970, 21, 401. [26] Acta cryst., 1973, B29, 1499. [3] J.
Chem Soc, A 1967, 1744. [41 J. Chem. Soc, A 1968, 622. [5] J. Chem. Soc, 1939,
"86 [6J J. Am. Chem. Soc, 1968, 90, 3587. [71 J. Am. Chem. Soc, 1968, 90, 5422.
[si Ada cryst., 1964, 17, 732. [9] Acta cryst., 1963, 16, 419. [9a] Inorg. Chem.,
HN") 4 1140. [10] Ж. структ. хим., 1973, 14, 419. [10a] J. Am. Chem. Soc, 1967,
S9 539. [И] Phys. Chem. Soc, 1964, 175. [12] J. Am. Chem. Soc, 1969, 91,
];;51 |12:i] J. Organomet. Chem., 1967, 10 P3, 331. [13] Inorg. Chem., 1965. 4,
1373 114] J. Am. Chem. Soc, 1968, 90, 5106. [151 Inorg. Chem., 1977, 16, 2t>55.
|l'i| Inorg. Chem., 1977, 16, 878. [17] J. Am. Chem. Soc, 1968, 90, 7135.
[18 Inorg. Chem., 1978, 17, 3528. [19] J. Am. Chem. Soc, 1969, 91, 1021.
Г'Оа] Inorg. Chem., 1976, 15, 380. [206] Inorg. Chem., 1969, 8, 2384. [21] J. Am.
Chem Soc. 1966, 88, 4847. [22] Inorg. Chem. 1968, 7, 2606. [231 J- Am- Chem.
Soc , 1967, 89, 5366. [24] J. Am. Chem. Soc, 1969, 91, 1574. [25] Acta cryst., 1977,
B33, 173. [261 Acta cryst., 1978, B34, 3376. [271 J- Organomet. Chem., 1969, 16,
161. [281 J- Am- Chem- Soc, 1963, 85, 1202. [291 -J- Chem. Soc, D 1974, 2410.
[30] Angw. Chem. (Intern. Ed.), 1979, 18, 80. [31] J. Chem. Soc, D 1973. 651.
[32] J. Am. Chem. Soc, 1979, 101, 7095. [331 J- Am. Chem. Soc, 1973, 95, 3802.
22.3.3. Карбонилы, содержащие более крупные металлические
кластеры. Многие карбонилы тяжелых элементов содержат ме-
таллические кластеры более крупные, чем те, которые были опп-
Рис. 22.10. Металлические кластеры в комплексах: а — [RhnH--,,(COJ4l''~;
6-[Rh14(COJ5]J~; e_[Rh5(COJ7]3-; г-[Рг.15(СОЫ2-, д - [Pt
сапы выше. К таким соединениям относятся Os7(COJi,
Oss(COJ3, Pt9(CO)is2~\ а также комплексы, содержащие 12—
15 атомов металла, из числа которых мы приведем несколько
примеров. Те комплексы, которые в большей степени родствен-
ны уже описанным полиэдрическим молекулам и ионам, содер-
68 22. Цианиды, карбиды, карбонилы и алкилы металлов
жат компактные металлические группировки, по строению явно
напоминающие фрагменты металлических структур с высоким
координационным числом центрального атома. На рис. 22.10
изображены металлические кластеры некоторых комплексов:
Rh, содержащих 13, 14 и 15 атомов металла [1]. Совершенно
отличны от таких глобулярных кластеров представители семей-
ства карбонилов [Мз(СО)б]п"~, образуемые платиной и нике-
лем [2]. Эти кластеры образованы из треугольных субъединиц
22.3. Карбонилы металлпи 69
а
о
с
ОС
типа а, которые располагаются одна под другой, как показано,
на рис. 22.10, г. Комплексы Pt и № отличаются друг от друга..
Например, анион [Ni6(CO)i2<]2~ содержит искаженное октаэдри-
ческое ядро с расстояниями Ni—Ni, равными 2,38 А в треуголь-
ных субъединицах и 2,77 А вдоль других шести ребер, в то вре-
мя как ядро Pt6 является искаженной тригональной призмой.
Совершенно другой тип структуры обнаружен для аниона
[Pti9(COJ2]4~ (рис. 22.10,C), который был выделен в виде
трифенилфосфониевой соли [3]. На рис. 22.10 опущены много-
численные концевые и мостиковые группы СО и изображены
не все связи металл — металл. Их длины меняются в широких
пределах даже для данного иона; подробности читатель найдет
в оригинальных статьях.
Литература. [1] J. Am. Chem. Soc., 1978, 100, 7096. [21 J. Am. Chcm. Soc, 1974,
96, 2614, 2616. [3] J. Am. Chem. Soc, 1979, 101, 6110.
22.3.4. Карбонилгидриды. В ранних рентгеноструктурных рабо-
тах слабое рассеяние рентгеновских лучей атомами Н не поз-
воляло определять положение этих атомов; не удалось его за-
фиксировать в ранних электронографических исследованиях,
комплексов Fe(COLH2 и Со(СОLН. Прямое определение поло-
жения атомов водорода при рентгеноструктурном анализе стало-
возможным в некоторых случаях благодаря усовершенствова-
нию метода, но в большинстве рентгеноструктурных работ пози-
ции атомов Н рассчитывались исходя из расстояний металл —
металл. Например, в тетраэдрическом кластере RiuH^CO)^
(а) [Г] имеется четыре удлиненных ребра, что можно объяснить
присутствием мостиковых атомов водорода, тогда как в струк-
туре Os3H2(CO)io [2] одно из ребер треугольника короче двух
других (б), что согласуется с представлением о двойном водо-
родном мостике. С другой стороны, в кластере Os3H2(CO)u [3]
существует одна удлиненная связь, указывающая на существо-
вание одного мостикового атома Н и одного концевого (в).
Нейтронография позволяет непосредственно определять поло-
жение атомов водорода и в конце концов разрешает многие
сомнения в этом вопросе.
2,68 А
По-видимому, водород может вести себя по-разному:
1) как обычный лиганд, занимающий соответствующее ко-
ординационное место, например, в K2ReH9, HPtBr{P(C2H5K}2
и др. (см. гл. 8), в МпН(СОM, где 5 групп СО и атом Н рас-
положены в вершинах октаэдра (расстояние Mn—H 1,60 А) [4],
и в [Fe3H(CO)u']-. Атом водорода может также осуществлять
непосредственную связь между двумя атомами металла напри-
мер, в (COMCr-H-Cr(COM- [5J, где расстояние Сг-Сг
C,41 А) слишком велико для нормальной связи Сг—Сг, а вели-
чина 1,70 А вполне подходит для связи Сг—Н (ср с 1 68 А в
K2ReH9);
2) как мостиковый лиганд, соединяющий 2 или 3 атома ме-
талла в кластере. Выше мы привели примеры одинарного и
двойного водородных мостиков; тройные водородные мостики
обнаружены в Ru6H2(COI8 [6] над двумя большими гранями
октаэдра и в FeCo3H(CO)9{P(OCH3K}3 [7J, где атом водорода
расположен под гранью тетраэдра, образуемой тремя атома-
ми Со;
3) как мостиковый атом, расположенный внутри металличе-
ского кластера, например, в [Co6H(CO)i5]-, упомянутом ранее,
а также в [№12Н(СОJ1]3- и [№12Н2(СОJ1]2-.
Литература. [1] Inorg. Chem., 1978, 17, 1271. [2] Chem. Comm 1978, 7^3
HI Inorg. Chem., 1977, 16, 878. [41 Inorg. Chem., 1969, 8, 1928. [51 J Am Chem
Soc., 1966, 88, 366. [6] J. Am. Chem. Soc, 1971, 93, 5670. [71 Chem. Comm.,
l j / о, 684.
22.3.5. Карбонилгалогениды. Мы уже отметили, что Os5(CO)i5I
и Rh6(CO)i5I имеют структуры, аналогичные соответствующим
карбонилам. Были проведены также исследования строения не-
70 22. Цианиды, карбиды, карбонилы и алкилы металлов
которых наиболее простых соединений. Ru(COLI2 [1] образует
октаэдрическпе молекулы, где атом I находится в ^нс-положэ-
пии (расстояния Ru—С 2,01 A, Ru—I 2,72 А), и на основе дан-
пых ИК-спектроскопии [2] аналогичная структура была найде-
на для Fe(COLI2. Структура [Rh(COJClj2 оказалась более
сложной [3]. Это соединение является дпмером как в растворе,
так и в кристалле, причем в кристалле димеры соединены свя-
9
22.3. Карбонилы металлов 71
Рис. 22.11. Структуры: a — [Rh(COJCl]2; б —[Mn(COLBr]2; в — [RuBr2(COK]2.
зями Rh—Rh в бесконечные цепи, как показано на рис. 22.11, а.
Для объяснения диамагнетизма предположено, что в результа-
те перекрывания сB5р3-орбиталей под углом 56° образуются
изогнутые связи металл — металл.
Мп2(СО)8Вг2 [4] представляет собой симметричную мости-
ковую молекулу (рис. 22.11,6); молекулы типа М2(СО)8Х2 об-
разуют также Тс, Re, Mo и W, например Mo2(CO)8I2 [5J.
Им родственна молекула Ru2(CONBr4 [6], показанная на
рис. 22.11,0.
Литература. [1] Ada cryst., 1962, 15, 946. [2] Z. anorg. allg. Chem., 1956, 287,
223 [3] J. Am Chem. Soc, 1961, 83, 1761. [41 Acta cryst., 1963, 16, 611. [51 Acta
cryst., 1976, B32, 582. [61 Acta cryM., 1938, B24, 424,
22.3.6. Карбонилнитрозилы. В результате электронографическо-
го изучения [1] соединений Fe(COJ(NOJ и Co(COKNO
в 1937 г. было установлено тетраэдрическое расположение четы-
рех лигандов с длинами связей
Fe-
1,84 1,15
-О
Fe-
-N-
1,77 1.12А
О
и очень близкими к ним соответствующими величинами в сое-
динении кобальта, хотя маловероятно, что длины связей были
измерены с высокой точностью. Эти исследования не подтвер-
дили линейность системы —М—N—О, но впоследствии она бы-
ла доказана методом микроволновой спектроскопии для таких
молекул, как (C5H5)NiNO [2]. Марганец образует комплексы
Mn(NOKCO и Mn(COLNO, причем при облучении последний
превращается в Mn2(COO(NOJ (ср. с превращением Fe(COM
н Fe2(CO)9)- Молекула Mn(COLNO, подобно изоэлектронному
комплексу Fe(COM, имеет форму тригональной бипирамиды с
группой N0 в экваториальном положении и линейными связя-
ми М—N—О [3]. Длины связей таковы: Мп—С 1,89 А (акси-
альная) и 1,85 А (экваториальная); Мп—N 1,80 А.
Соединения Ru и Os, относящиеся к типу M3(CO)i0(NOJ
[4], интересны тем, что содержат двойные мостики N0. Два
коротких ребра равнобедренного треугольника соответствуют
нормальным связям металл — металл B,87 А) (а).
а
(СОL
Ru
(СО)з
ч2.87 Л
Ru (СО)з
О
Литература. [11 Trans. Farad. Soc, 1937, 33, 1233. [21 Trans. Farad. Soc, 1970,
66, 557. [3] Inorg. Chem., 1969, 8, 1288. [41 Inorg. Chem., 1972, 11, 382.
22.3.7. Смешанные карбонилы металлов. Получено много кар-
бонилов, содержащих атомы двух или большего числа элемен-
тов, некоторые из них содержат в качестве лигандов только
группы СО, другие — лиганды различных типов. Особый инте-
рес представляют связи металл — металл и стереохимия атомов
металлов. В табл. 22.9 мы приводим несколько простых при-
меров наиболее типичных молекул.
22.3.8. Смешанные карбонильные производные металлов. Суще-
ствует большое число разнообразных молекул, содержащих
Таблица 22.9. Структуры смешанных карбонилов
Молекула
(CH3KSn—Мп(СОM
(СОMМп—Fe(COL—Мп(СОM
(СОLСо—Zn—Со(СОL
(СОLСо—Ilg—Со(СОL
м—м
2,674
2,815
2,305
2,50
Стереохимия
металлов
Sn тетраэдриче-
ский, Мп окта-
эдрический
Мп и Fe октаэдри-
ческие
Со — тригональная
бипирамида; Zn
линейный
Со — тригональная
бипирамида; Fig
линейный
металлов
Литература
J. Chem. Soc.
А 1968, 696
Ada crvst., 1967
23, 1079
J. Am. Chem. Soc.
1967, 89, 6362
J. Chem. Soc.
A 1968, 1005
22. Цианиды, карбиды, карбонилы и алкилы металлов
группы СО и другие лиганды, начиная от простых молекул
и ионов, где все лиганды образуют обычное координационное
окружение атома переходного металла, и кончая такими, где
присутствуют более сложные циклические и полиэдрические
системы атомов металлов. Соединения, содержащие ненасыщен-
ные углеводородные лпганды, описаны далее, здесь же мы рас-
22.3. Карбонилы металлов
Рис. 22.12. Строение молекул: а — [Fe5(CO)i5C]; б — Со3(СО)9С(СН3); в-
[Со3(СО)9С]2СО; г — (CH3LSn3Fe4(COI6.
смотрим только некоторые молекулы, которые представляют
особый интерес.
При нагревании Fe3(CO)i2 в петролейном эфире с метилфе-
нилацетиленом образуется в небольшом количестве соединение
Fe5(CO)i5C. Его структура представляет собой тетрагональную
пирамиду, показанную на рис. 22.12, а, с атомом углерода, на-
ходящимся под основанием пирамиды [1]. В результате обра-
зования связей Fe—С атом Fe приобретает конфигурацию
криптона. Кобальт образует несколько соединений Co3(CO)9CR,
среди которых примечательно метальное производное
(рис. 22.12,6), в котором алифатический атом углерода служит
мостиком, соединяющим три атома Со. Это соединение диамаг-
нитно, у кобальта октаэдрическое окружение (три группы СО,
два атома Со и один атом С), длина связи Со—Со B,47 А)
близка к длине этой связи в металле B,51 А) [2]. Молекула
[Со3(СО)9С]2СО (рис. 22.12, е) состоит из двух тетраэдроз
Со3(СО)дС, соединенных через мостиковую группу СО [3].
Встречаются молекулы и ионы со структурой, аналогичной изоб-
раженной на рис. 22.12,6, у которых сера замещает атомы С
и мостнковые атомы водорода. К таким молекулам относятся
Со35Нз(СО)9, Os3SH2(CO)9 и [Os3SH(CO)9]^ — ион, который
изучен в его тетраметпламмопиевой соли [За]. В слиро-молекуле
(полициклической молекуле с общим атомом у соседних колец)
(CHaLSn3Fe4(CO)i6 [4] (рис. 22.12,г) три атома Sn лежат
почти па одной прямой и связаны через группы Fe(COL- В этом
соединении наблюдаются две различные длины связей Sn—Fe;
концевая связь 2,63 А и центральная 2,75 А. Расположение
связен вокруг атомов олова обоих типов тетраэдрическое' Fe—С
1,75 A, Sn—С 2,22 А.
(СН3}
}2
„S>lj!v9 1(,,5 ,,5П (СН3J
re
Существует большое число сложных карбонилов, содержа-
щих лиганды S или —SR; структуры некоторых из них анало-
гичны структурам уже описанных соединений. Например,
[ (C2FI5S)Fe(COKJ2 [5] (рис. 22.13, а), принадлежит к типу г
в разд. 22.3.2 «Карбонилы М2(СО)П», так как здесь отсутствует
связь между атомами S (расстояние S—S 2,93 А), в то время
как в родственной ему молекуле [SFe(COK]2 [6] (рис. 22.13,6)
атомы S связаны между собой (расстояние S—S 2,01 А). В мо-
лекуле S2Fe3(CO)9 присутствует более сложное ядро-
(рис. 22.13, б), которое было идентифицировано в молекуляр-
ном комплексе A:1) [S2Fe2(CON][S2Fe3(CO)9] [7]. Молекула
[CH3SFe2(CON]2S [8] (рис. 22.13, г) относится к другому типу
комплексов. В ней центральный атом S связан тетраэдрически
с четырьмя группами Fe(COK, которые в свою очередь связаны
попарно через мостиковые лиганды SCH3. Удобно рассмотреть
здесь и молекулу (C5H5LFe4S4 [9] (рис. 22.13,E). Ядро этой
молекулы представляет собой вытянутый тетраэдр из атомов
Fe (только два его ребра соответствуют связям Fe—Fe, осталь-
ные значительно длиннее C,37 А)), над гранями которого рас-
положены атомы S, причем каждый из пих связан с тремя ато-
мами железа. Длины связей Fe—S в этой и других молекулах..
изображенных на рис. 22.13, близки к длине, соответствуют^ "г
связи в пирите B,26 А).
Из многочисленных карбонилов Со, содержащих серу, мы
рассмотрим только несколько примеров. Молекула SCo3(COh,
[10] принадлежит к тому же общему типу, что и СН3С-Со3(СО)
(рис. 22,12,6), a [SCo3(COO]2S2 [11] состоит из двух одина-
ковых тетраэдров SCo3(COO, связанных группой S2, как это
показано па рис. 22.13, е. Каждая из следующих молекул со-
держит мостиковую группу — SC2H5: Co3(COL(SC2H5) ...
74 22. Цианиды, карбиды, карбонилы и алкилы металлов
Co5(CO)io(SC2H5M и SCo6(CO)n(SC2H5L, причем последняя
содержит фрагмент Co3S, напоминающий тот, что изображен
на рис. 22.13, е.
22.-I. C.ot'utiiti'Hun мс, lllkи: с !,\\11'Ч()()ородами 75
/I
\1/
Fe
X
Fe
\
а
Н,С
Fe
Рис 22.13. Строение молекул: а — [(C2H5S)Fe(COK]2; б — [SFe(COK"|2; в —
S2Fe3(CO)9; г — [CH3SFe2(CON]2S; д — (C5H5LFe4S4; e — [SCo3(COO]2S2.
Литература. [1] J- Am. Chem. Soc, 1962, 84, 4633. [21 J. Am. Chem. Soc, 1967,
89, 261. [3] Acta cryst, 1969, B25, 107. [3a] Acta cryst., 1978, B34, 3767. [41 Inorg.
Chem., 1967, 6, 749. [5] Inorg. Chem., 1963, 2, 328. [6] Inorg. Chem., 1965, 4, 1.
Г71 Inoro-. Chem., 1965, 4, 493. [81 Inorg. Chem., 1967, 6, 1236. [91 Inorg. Chem.,
¦:-;. о 892. [10] Inorg. Chem., 1967, 6, 1229. П 11 J. Am. Chem. Soc, 1967, 89,
3727. A21 J- Am- Chem. Soc. 10oQ, 90. 3960, 3969, 3971.
22.4. Соединения металлов с углеводородами
Встречается большое число соединений металлов, содержащих
углеводородные радикалы или молекулы. В состав самых прос-
тых из них входят только металлы и углеводородные радикала
(алкилы и арнлы .металлов) или ненасыщенные углеводородные
молекулы (например, Сг(С6Н6J), а более сложные соединения
содержат и другие лиганды, например галогены или СО. Мы
прежде всего рассмотрим соединения переходных металлов,
содержащие ненасыщенные углеводороды и СО-лиганды, так
как они ближе всего к карбонилам металлов, а затем обратим-
ся к алкилам непереходных металлов. Формулы большинства
простых соединений переходных металлов согласуются с тем
представлением, что металл присоединяет следующее число
электронов от лигандов:
НС -СИ
ПС=СН
< г
и таким образом приобретает электронную конфигурацию бла-
городного газа (ср. карбоннлы и карбонилпитрозилы). Во всех
перечисленных ниже диамагнитных соединениях Зй-элементов
металл обладает электронной конфигурацией криптона.
Атомп.
23 V(COL(C5H5)
24
25 Мп(СО)з(С5115)
26
27 Со(СОJ(С5Н5)
28
Ci-,COK(C6H6)
Ре;СОЬ(С.,Н4)
Сг(С,Н6),
Fe(CO)C3H5(C-,H-,)
Ni(C3H5)NO
Ясно, что в молекулах типа Ni(CsH5J имеется два избыточных
электрона по сравнению с конфигурацией благородного газа.
В соединении (COKFe(C8H8) молекула циклооктатетраепа
С8Н8 ведет себя как донор, отдающий 4 электрона; вместе с тем
она разбивается па две циклобутадиеновые части в молекуле
(COKFe(C8H8)Fe(COK (см. ниже).
Мы уже отметили различие в геометрии между связями, об-
разуемыми переходными металлами с СО, которые являются
настоящими я-связямн (перекрывание d-орбиталей металлов с
л-орбиталями СО в узловой плоскости), и связями с ненасы-
щенными углеводородами, где орбитали металла перпендику-
лярны узловой плоскости п-орбиталей. Для этого последнего
типа связи был предложен термин ,,[х-связь".
22.4.1. Ацетиленовые комплексы. Реакции между ацетиленом
и карбоиилами металлов можно подразделить на два основных
класса: 1) реакции, в которых не образуется новых связей
С—С, и ацетилен присоединяется к атому (атомам) металла
пли ^-связями, или «изогнутыми» о-связямп, или с помощью
комбинаций |.i- и а-связей; 2) реакции, в процессе которых воз-
никают новые связи С—С посредством присоединения СО к аце-
тилену с образованием циклического гидрокси-лигаида или лак-
тонового кольца.
1) Ацетилен замещает 2 группы СО в молекуле Со2(СО)8;
изучение кристаллического Со2(СО)б(дифенилацетилен) пока-
зывает, что молекула имеет конфигурацию, изображенную на
рис 22.14, а. Атом металла образует G окгаэдрическн направлен-
ных связей: одну с другим атомом металла, две с атомами угле-
рода в ацетилене и три с молекулами СО; связь С—С в ацетп-
702;'. Цианиды, карбиды, карбонилы и алкилы металлов
лене удлинена примерно до 1,46 А [1]. В Со4(СО) 10С2Н5ССС2Н5
[2J ацетилен образует две о-связи с двумя атомами Со и
|Х-связи с двумя другими атомами металла (рис. 22.14,6).
2) Представляет интерес реакция замещения двух групп СО
в двух молекулах карбонилгидридов железа или кобальта аце-
тиленом или другими ненасыщенными молекулами. Изучение
кристаллической структуры [3| комплекса 2-бутипа с ге(СОLН2,
имеющего формулу (OCKFe(C6H8O2)Fe(COK, показывает, что
молекула имеет структуру, изображенную на рис. 22.14, в. Все
а
он
о—с
Рис. 22.14. Строение молекул: а— (дпфенилацетилен)Со2(СОN'
б — Co4(CO)ioC2H5CCC2H5; в — (COKFe(C6H8O,)Fc(COK;
г— (СО)зСо(СО)(С4Н2О2)Со(СО)з."
атомы С1—С8 лежат в одной плоскости, а группа С9О перпен-
дикулярна этой плоскости. Три группы СО, связанные с атомом
FeB, расположены вокруг оси симметрии 3-го порядка, которая
перпендикулярна плоскости С6С3С2С5. Связь Fe—Fe ковалент-
ная, а я-связывание между атомом FeB и углеродным кольцом,
очевидно, аналогично л-связыванию в циклопентадиенильных
соединениях.
При действии СО под давлением на Со2(СОNС2Н2 получа-
ется соединение, которое имеет эмпирическую формулу
Со2(СО)9С2Н2. В этой молекуле (рис. 22.14, г) два атома Со
связаны через мостиковую группу СО и атом углерода лакто-
.нового кольца [4]. Каждый атом Со связан с пятью атомами С,
22.-1. С.осч'шнения метал.ion с углев<н)ородами
<оторые образуют квадратную пирамиду, а основания этих двух
квадратных пирамид имеют общее ребро; молекула согнута по
атому ребру так, что расстояние Со—Со составляет 2.5 А.
Структура молекулы очень похожа на структуру Со2(СО)ч.
Литература. [Г| J. Am. Chern. Soc. 1959, 81, 18. [21 J. Am. Chem. Soc, i!)!i2, 84,
2 151. [3| Ada cryst., 1961, 14, 139. |4| Proc. Chem. Soc., 1959, 156.
22.4.2. Циклопентадиенильные комплексы. Циклопентадиен
С-,Нб представляет собой бесцветную жидкость, которая легко
образует мопонатриевое производное.
НС СН
НС—СН
Последнее в свою очередь реагирует с безводными галогеппда-
ми переходных металлов и дает производные вида М(С5Н5)Л,
часть из которых можно получить непосредственно из углеводо-
рода и карбоиилов металлов при температуре примерно 300°С.
Некоторые из этих соединений, включая ферроцен Fe(C5H5)b
можно окислить до катионов. Были проведены исследования
структуры соединений следующих типов: M(C5Hs),i (я=1, 2, 3,
4), М(С5Н5JХ, М(С5Н5JХ2, а также многих более сложных
молекул и ионов. В большинстве рассмотренных ниже молекул
С5Н5 ведет себя как л-донор, отдающий 5 электронов атому
металла, равноудаленному от всех 5 атомов углерода. Образо-
вание одним или несколькими атомами С нормальных а-связей
(как, например, в C5H5SiH3) происходит в молекулах
Ti(C5H5K и Ti(C5H5L, а также в кристаллических Ве(С5Н5J ri
In(C5H5K.
Простые производные металлов типа M^CsHs) образуются
с участием In и Т1 [Г], причем молекула обладает симметрией
Crv (рис. 22.15, а). Наиболее многочисленны производные типа
М(С5Н5J, образуемые Be, Mg, Зй-металлами от V до Ni, Ru,
Rh, Sn и Pb. Из этих соединений первым был обнаружен и наи-
более полно изучен Fe^sHsb (ферроцен). В парах все такие
молекулы построены по типу «сандвича» (рис. 22.15,6), причем
молекула может иметь скошенную (Mn, Sn, Pb, Be, Ni [la])
пли заслоненную конфигурацию (Fe, Ru [16], Сг). Обычно
атом М расположен посередине между двумя кольцами,
но в Ве(С5Н5J [2] он осциллирует между двумя положениями,
отстоящими на 1,47 А от центров колец, расстояние между эти-
ми точками 3,375 А. В кристаллическом состоянии ситуация
усложняется. Существуют низко- и высокотемпературные фор-
мы твердого ферроцена. В первой из них конфигурация моле-
кулы приблизительно заслоненная, вместе с тем из-за непол-
22. Цианиды, карбиды, карбонилм и алкилы метал.юн
ной упорядоченности кристалла наблюдаемую рентгенографи-
чески центросимметричную (скощенную) конфигурацию моле-
кулы в высокотемпературной форме нельзя интерпретировать
как структуру каждой отдельной молекулы [3]. Длина связи
Fe—С B,06 А) приблизительно совпадает с ожидаемым значе-
нием для ординарной связи, в то время как в Fe(COM ее сред-
нее значение равно 1,84 Л. В рассматриваемом случае электрон-
9
j С.
T
?
X X
Y
д е ж з
Рис. 22.15. Простые молекулы, содержащие лиганды С5Н5.
пая конфигурация Fe такая же, как у Кг. Ион феррициния изу-
чали в (C5H5JFeI3 [4], но частичная неупорядоченность крис-
талла сделала невозможным точное определение строения иона.
Структура молекулы Ве(С5Н5J в кристалле, изученная при
—120 °С [5], сильно отличается от ее структуры в парах. Атом
металла связан я-связью с одним кольцом (расстояние Вс—С
1,94 А) и а-связью с атомом С другого кольца (расстояние
Be—С 1,81 А; боковая проекция изображена па рис. 22.15, в).
В И(С5Н5)з [6] два циклопентадиеновых кольца образуют
я-связи с атомом металла, а третье кольцо присоединено через
2 атома углерода, как это схематически изображено на
рис. 22.15,г. К числу простых молекул, содержащих больше
двух лигандов С5Н5, относятся также тетраэдрические молеку-
лы Ti(C5H5L [7] и (C5H5KUC1 [8]. В Ti(C5H5L атом Ti с дву-
мя кольцами С5Н5 образует я-связи, а с другими двумя —
0-СВЯЗН.
К молекулам типов д — з (рис. 22.15) относятся следующие:
<Э-СН3Ве(С5Н5) [9], С1Ве(С5Н5) [10], (NO)№(C5H5) [111;
е- (СНзJА](С5Н5)' [12]; ж- (СОKМп(С5Н5) [13], Cl3Ti(C5Hs)
22.4. Соединения металлос, с углеводородами
79
[14J; з—Х2М(С5Н5J, в частности дихлориды образуются с уча-
стием Ti, Zr, Nb(IV) и Mo(IV) [15]. В этих молекулах угол р
тежит в интервале 50—60°, а угол X—М—X в интервале
90—100°.
Кристаллические структуры, описанные выше, состоят из от-
дельных молекул или ионов. В некоторых кристаллических про-
изводных С5Н5 ведет себя как мостиковый лиганд. В кристалле
РЬ(С5Н5J [16] присутствуют цепи (рис. 22.16, а), в которых
2,24.4
<6^
Рис. 22.16. Структуры РЬ(С5Н5J (а); 1п{С5115)з (б)-
атомы металла связаны через кольца С5Н5, и, кроме того,
к каждому атому РЬ присоединен один концевой лиганд С5НЬ.
Угол между связями при атоме РЬ составляет приблизительно
120°. В цепях, присутствующих в 1п(С5Н5)з [17], In образует
а-связи с атомами углерода четырех лигандов С5Н5, причем
расположение этих атомов С представляет собой приблизитель-
но правильный тетраэдр (рис. 22.16,6).
Мы завершим этот раздел рассмотрением некоторых приме-
ров двуядерных молекул, содержащих лиганды С5Н5.
В результате взаимодействия Fe(CO)s с избытком С5Н6
сначала образуется мостиковое соединение, изображенное на
рис. 22.17,а, которое распадается при 200°С с образованием
ферроцена, но может быть выделено в интервале температур
100—200 °С. Длина связи Fe—Fe B,49 А) близка к длине этой
связи в Fe2(CO)9, очевидно также общее сходство молекул этих
двух соединений [18]. Согласно рентгеноструктурным исследо-
ваниям, Мо2(СО)б(С2Н5J [19] имеет структуру, изображенную
на рис. 22.17,6. Все атомы, нарисованные жирной линией, ле-
жат в одной плоскости. Расположение связей вокруг атома ме-
талла таково: если считать, что атом Мо находится в центре
куба, то кольцо С5Н5 лежит в центре одной из граней, а дру-
гие 4 связи (с атомом Мо и тремя атомами С) направлены к
вершинам противоположной грани куба. В этой молекуле внеш-
няя электронная оболочка Мо заполнена 18 электронами, и по-
этому соединение диамагнитно. Длины связей: Мо—С 2,34 А,
.Мо—Мо 3,22 А; валентный угол Мо—С—О ~175°.
80 22. Цианиды, карбиды, карботиы и алкилы металлов
Рис. 22.17. Строение молекул: а — Fe2(COL(C5H5J; б — Мо2(СОN(С5Н5J; в-
(С5Н5JТ1С12А1(С2Н5J.
(CO),, Fc
\
п
- Со
/О" -
с,н,
о Я.о
41/
RS7
У\\.
\\/
Fe
< „К,
с\н,
<•"'--¦&/
C\HS
Рис 22.18 Строение молекул: а — (COLFe(GeCl2J[Co(CO) (C5H<)]2;
Fe:,(RSJ(CON; й — [(Ph2P)Ni(C5H5)l2; г — [(Ph2P)Co(C5H5)]2."
В мостиковой молекуле (CsHsbTiCbAl (С2Н5J (рис. 22.17, в)
мостик между атомами металлов представляет собой почти
правильный квадрат со стороной 2,5 А [20]. Связи, образован-
ные атомами Ti и А1, направлены к вершинам тетраэдра, так
что по общему виду молекула похожа на молекулы АЬХб.
Молекула, изображенная на рис. 22.18, а, представляет со-
бой интересный пример образования пятичленного цикла из
атомов трех различных металлов [21].
Мы уже рассматривали ранее (разд. 22.3.2) соединения
типа изображенных на рис. 22.18,6, содержащие связь металл —
металл. Реальность этой связи (которую другим способом мож-
но описать как «изогнутую» связь) показана сравнением струк-
22.1. Соединении металлов с цг леводородами 81
тур днмерных комплексов [(Ph2P)Ni(C5H5)]2 и
[(Р112Р)Со(С5Н5)]2 [22]. Соединение Ni (рис. 22.18, в) пред-
ставляет собой плоскую мостиковую систему, а в соединении Со
(рис. 22.18, г) две плоскости СоР2 наклонены друг относительно
друга из-за образования связи Со—Со (расстояние Со—Со
2,56 Л, ср. с расстоянием Ni—N4 3,36 А). Подсчет числа элект-
ронов в предположении, что два лиганда PPh2 дают три элект-
рона, C5Hs — пять и связь металл — металл — по одному элект-
рону каждому атому металла, показывает, что во всех этих
молекулах атомы металла приобретают электронные конфигу-
рации благородных газов: Fe 26 + 9+1, Со 27 + 8+1, Ni 28 + 8.
Мы привели примеры молекул, в которых два атома метал-
ла связаны непосредственно или двумя мостиковыми лпганда-
ми, причем в последнем случае связь металл — металл может
присутствовать или отсутствовать. В качестве примера молеку-
лы и иона, в которых роль мостика играет атом кислорода.,
укажем
>5о
V. о
С,.!к \Ь 164° Nb С i
[2]
Литература. [1| J. Chem. Phys., 1964, 41, 717. [lal Acta cryst., 1980, B36. 2255.
1161 Acta cryst.. 1980, B36, 2946. [21 Acta Chem. Scand., 1968, 22, 3030. [3| Acta
crvst., 1979," B35, 1074, 2020. [41 "Acta cryst., 1968, B24, 1640. [51 Acta cryst.,
1972, B28, 1662. [61 Acta cryst., 1974, B30," 491. [71 J. Am. Chem. Soc, 1971. 93.
3592. [81 Acta cryst., 1965' 18, 340. [9| Acta Chem. Scand., 1972, 26, 3079.
[101 Acta Chem. Scand., 1972, 26, 3351. [Ill Trans, Faraday Soc, 1970, 66,
557. [121 Acta Chem. Scand., 1973, 27, 3735. [13] Acta crvst., 1963, 16. 118.
[141 Докл. АН СССР. 1969, 185, 1303. [151 Acta cryst., 1974, B30, 2290. [161 Acta
cryst., 1966, 21, 823. [171 biorg. Chem., 1972, 11, 2832. [181 Acta cryst,, 1958, 11.
620 [191 J Chem Phvs., 1957, 27, 809. [201 J- Am. Chem. Soc, J958, 80. 755
[211 J- Am. Chem. Soc, 1970, 92, 208. [221 J- Am. Chem. Soc, 1967, 89, 542.
[231 Acta cryst., 1980, B36, 1481. [241 Ada cryst., 1974, B30, 2290.
22.4.3. Комплексы, содержащие бензол или циклооктатетраен.
Мы рассмотрим здесь только несколько из числа наиболее
простых комплексов указанных типов. Родственный циклопен-
тадиенильным соединениям Сг(С6Н6J получается при нагрева-
нии до 150°С смеси СгС13, А1С13, порошка алюминия и бензолп.
Это — кристаллическое соединение (/пл 284°С), молекулы кото-
рого построены так, как показано на рис. 22.19, а, и образуют
плотную кубическую упаковку. Расстояние Сг—С составляет
2,15 А, а расстояние между бензольными кольцами — 3,23 А
[1]. Ион Сг(С6Н6J+ в соединении Cr(C6H6JI [la] имеет ана-
логичную структуру; атом Сг может также быть заключен
6-1284
•82 22. Цианиды, карбиды, гсарбонилы и алкилы металлов
между бензольными кольцами циклофанов, как в C,3-пара-
циклофан) Сг+13. Ион Ci8H2oCr+ состоит из двух слегка накло-
ненных бензольных колец, связанных в яарц-положениях мости-
.ковыми цепочками —СН2—СН2—СН2—, и иона Сг^, располо-
женного симметрично между ними.
Интересно сравнить с молекулой (СОKСг(С6Н ) [2]
(рис. 22.19,6) окружение иона Си+ в соединении
¦Cr.Hc-CuAlCU [3], изображенном на рис. 22.19, в. Это соедине-
Рис. 22.19. Строение молекул: а — Сг(СвМ6J; б — (СОKСг(С6Н6); в —
(С6Н6)СиА1С14;г—(COKFe(CsH8); д— (COKFe(C8H8)Fe(COK.
ние содержит тетраэдрические ионы А1С14~, а соседями атома
Си являются кольцо С6Нб и 3 атома С1, принадлежащих ионам
А1СЦ-.
В кристаллическом AgClCVC6H6 [4] присутствуют колонки
из молекул СбН6 и ионов Ag+, причем с каждым бензольным
кольцом связаны два иона Ag+, и каждый ион Ag+ удален от
атомов С ближайшей связи С—С на расстояния 2,50 и 2,63 А.
Энергия таких связей, обусловленных переносом заряда, при-
близительно равна 66 кДж/моль. В AgNO3-C8H8 [5] также
имеются колонки из ионов Ag+ и молекул углеводорода, между
которыми располагаются анионы, и так же, как в соединении
с С6Н6, каждый ион Ag+ наиболее сильно взаимодействует с
одной связью органического кольца (в данном случае это двой-
ная связь). Длина этих наиболее коротких связей Ag—С опять
близка к 2,5 А. Существуют две более слабые связи между
22.5. Алкилы металлов
83.
ионом Ag; и двумя другими атомами кольца (Ag—С ~2,8 А).
Еще более длинные связи Ag—С (~3,2 А) объединяют группы.
Agb-C8H8 в колонки.
В AgNCVCbHs кольцо С8Н8 имеет конформацию ванны, как
и свободная молекула, однако обнаружены также две другие
копформацпи этого кольца [6J, а именно ди'гдрпческая конфи-
гурация в (СОKГе(С8Нв) и конформация кресла в соединении,
(COKFe(C8H8)Fe(COK. В трикарбониле атом Fe связан с
частью кольца, которая ведет себя подобно бутадиену
(рис. 22.19, г); во второй молекуле таким же способом с ме-
таллом соединяются обе части кольца (рис. 22.19,C). В соеди-
нении Ti2(CsH8K также присутствуют две конформации углево-
дородного кольца. Молекула имеет структуру двойного «сандви-
ча» С8Н8—Ti—С8Н8—Ti—С8Н8 [7], причем внешние углеводо-
родные кольца плоские, а среднее имеет конформацию ванны.
Литература. [11 Acta Chem. Scand., 1965, 19, 41. [la] Acta cryst, 197! B30
838. [2] J. Am. Chem. Soc., 1959, 81, 5510. [3] J. Am. Chem. Soc, 1966, 88, 1877.
[41 J. Am. Chem. vSoc., 1958, 80, 5075. [5] J. Chem. Phys., 1959, 63, 845. pi| J.
Chem. Phys., 1962, 37, 2084. [7] Acia cryst., 1958, B24, 58'
22.5. Алкилы металлов
Простые алкилы типа М(алкил)„ образуются металлами сле-
дующих двух групп: 1) щелочные металлы, бериллий, магний,
щелочноземельные металлы и А1; 2) металлы побочных под-
групп; об алкильных производных переходных металлов изве-
стно очень мало. (О соединениях [Pt(CH3KX]4, одно из кото-
рых Х = ОН раньше принимали за Pt(CH3L, см. в разд. 27.9.8.)
Удобнее начать рассмотрение с комплексов второй группы, так
как, за исключением алкилов меди, серебра и золота (струк-
тура которых неизвестна), алкильные производные элементов
побочных подгрупп представляют собой нормальные ковалент-
ные соединения, например алкилы бора, углерода, кремния
и др., в которых атом углерода алкильной группы образует ор-
динарную связь с металлом.
22.5.1. Алкилы металлов побочных подгрупп. К алкилам метал-
лов первой побочной подгруппы AБ) относятся CuCH3 AgCH3,
AgC2H5 и триметилзолото. Последнее соединение было получе-
но при низкой температуре в эфирном растворе, где оно, веро-
ятно, существует в виде (CH3KAu0(C2H5J. Этот эфират реаги-
рует с эфирным раствором хлороводорода с образованием ди-
метилзолотохлорида, который, по-видимому, содержит мостико-
вые группы (CH3JAuCl2Au(CH3J.
Алкильные производные металлов второй побочной подгруп-
пы (ОБ) представляют собой обычные ковалентные соединения,
химическая активность которых падает от чрезвычайно реакци-
,У4 _':'. Цианш)ы, карбиды, карвонилы и алкилы металлов
онноспособного Zn(CH3J к Cd(CH3J и к относительно инерт-
ному Hg(CH3b- Спектры комбинационного рассеяния высокого
разрешения этих соединений показывают, что их молекулы име-
ют линейное строение; длины связей в этих соединениях равны
соответственно 1,99, 2,11 и 2,09 А [1].
Алкильные производные галлия, индия и таллия образуют
плоские молекулы Ga(CH3K и т. д. в противоположность
Ga2Cl6, Ga2H6 и димерпым метилгидридам галлия, что показано
с помощью спектроскопического исследования Ga(CH3K [2],
электронографического изучения 1п(СН3K в парах [3] и затем
рентгеноструктурным исследованием 1п(СН3K [4] и Т1(СН3K
[5]. Так как все эти молекулы плоские, то атом металла с необ-
ходимостью имеет соседей в направлении, почти перпендику-
лярном плоскости М(СН3)з> что приводит к тригоналыю-бипи-
рамидальному расположению ближайших и следующих за бли-
жайшими соседей. Внутримолекулярные и наиболее короткие
.межмолекулярные связи имеют следующие длины:
1п_С 2,1бА (три), 3,НА (одна) и 3,59А (одна);
Т1—С 2.29А (три), 3,1бА (одна) и 3,3lA (одна).
'22.5.2. Алкилы металлов I и II групп и А1. Алкилы Na, К, Rb
и Cs представляют собой бесцветные аморфные вещества, ко-
торые нерастворимы ни в одном растворителе, за исключением
жидких диалкилов цинка, с которыми они вступают в реакцию
и образуют соединения, подобные NaZn(C2HsK. Алкилы Li су-
щественно отличаются, так как они в различной степени раство-
римы в таких растворителях, как бензол, в котором они
полпмерпзуются. И метил-, и этиллптий представляют собой
при нормальной температуре бесцветные кристаллические ве-
щества.
Известны следующие алкилы металлов второй группы: кри-
сталлический Ве(СН3J, очень активный диалкилмагний и сое-
динения щелочноземельных металлов (диметильные производ-
ные кальция, стронция и бария [6]).
Было получено несколько алкилов алюминия: А1(СН3K (пе-
регонкой СН31 над А1 в атмосфере азота), этильное и изопро-
пильное соединения (нагреванием А1 с соответствующим
диалкилом ртути при 110 °С в течение 30 ч). При обычных тем-
пературах это водянисто-белые жидкости (триметилалюминий
плавится при температуре 15°С), химически очень активные и
самовоспламеняющиеся на воздухе. В бензольном растворе или
газовой фазе триметилалюминий существует в виде димера;
димеры этил- и м-пропилалюминия в этих условиях заметно
диссоциированы, а изопропилалюминий является мономером
[7]. А1(СН3)з очень похож на А1С13. Оба эти соединения в
.парообразном состоянии образуют димеры, причем их энергия
22.5. Алкилы металлов 85
ассоциации одного порядка, а именно 84 и 121 кДж/моль соот-
ветственно. Оба вещества взаимодействуют с аминами и эфа-
рами, образуя координационные соединения.
Так как структуры соединений тяжелых щелочных и щелоч-
ноземельных металлов неизвестны, мы ограничимся рассмотре-
нием алкилов Li, Be, Mg и А1. Это электроподефицитные моле-
кулы, в которых группы СН3 (часть или все) образуют 2 или
3 связи с атомом металла. Они описываются как трех- или
четырехцентровые связи, образованные перекрыванием sp3-op-
биталей углерода с соответствующими орбиталямп атомов ме-
таллов.
В кристаллическом состоянии метиллитий образует объемно-
центрированную кубическую решетку из молекул Щ(СН3L.
Атомы Li находятся в вершинах правильного тетраэдра с дли-
ной ребра 2,56 А, а группы СН3 расположены над центром
каждой грани (Li—С 2,28 А). Так как все атомы Li и С лежат
на объемных диагоналях ячейки, следующим из ближайших
¦соседей Li является группа СН3, принадлежащая соседней мо-
лекуле B,52 А). В молекуле Li находится на расстоянии 2,56 А
от трех других атомов Li и на расстоянии 2,28 А от трех групп
СН3 [8]. В кристаллическом Li4(C2H5L тетраэдрическая моле-
кула, очевидно, менее симметрична; расстояния Li—Li лежат
в пределах от 2,42 до 2,63 А [9], и три атома С расположены
на разных расстояниях от атома Li B,19, 2,25 и 2,47 А), причем
длина последней связи близка к расстоянию до ближайшего
атома С соседней молекулы B,53 А). Трудно объяснить эти
значения длин связей, особенно принимая во внимание сущест-
вование сильного связывания между атомами Li (Li—Li 2,67 А
в Li2 и 3,04 А в металлическом литии).
Диметилбериллий представляет собой белое твердое вещест-
во, сублимирующееся при 200 °С и бурно взаимодействующее с
водой и воздухом. Оно изоструктурно SiS2: кристалл построен
из бесконечных цепей а, в которых Be образует тетраэдрпче-
ские связи (Be—С 1,93 А) с четырьмя метальными группам.i
[10]. Mg(CH3J имеет такую же структуру (табл. 22.10). Цепь
такого типа обнаружена также в соединении LiAl(C2H5L, где
вдоль цепи чередуются атомы Li и А1, а СН3 замещен на С2Н,
(табл. 22.10).
66-
"CIL
"ве:
В III группе встречается третий тип структуры алкилов ме-
таллов, а именно мостиковый димер А12(СН3N" (б) с такой же
структурой, как и у молекул А12Хб. Встречаются также менее
86 22. Цианиды, карбиды, карОошиы и алкилы металлов
Таблица 22.10. Структуры ;mmi,iob мет;!.1.н.<в
Соединение
[МВ(СНзЫ-
fLiAl(C2H5L]co
А12(СН3N
MgAl2(CH3)g
A12(CH3MN(C6H5J
м-м.
А
2,72
2,71
2,60
2,70
2,72
\\-
0 1
2,24
2,02
2,30
2,14
2.10
> '>\
2,14
С (ММ-
нк). Л
(Л1)
(Li)
(А1)
У г ол
М—С—М
75°
77
75
78
79
J.
In
J.
.1.
J.
Лшерагур.,
Аш. Chem.
19G4, •>, 1*25;
ул.. -.чкч. С
1 , 2, 314
orK. Chem., 19
У 72
Am. Chem.
l'N7, 89, 3121
Am. Chem.
r969, 91, 2538
Am. Chem.
1969, 91, 2544
Soc
1. Or
hern.
i-l, 3
Soc.
Soc
Soc.
симметричные молекулы с данным типом структуры, например
(CH3)sAl2N (СбНбЬ, в которой роль мостика играют одна группа
СН3 (угол А1—С—А1 79°) и группа N(C6H5J (угол А1—N—A1
86°), а центральное четырехчленное кольцо неплоское (в отли-
чие от б). Смешанный алкил магния-алюминия MgAl(CH3)s,
75"
7S'
Н3С
1,97 А
хсн,
полученный растворением Mg(CH3J в А1(СН3K, имеет струк-
туру в, промежуточную между структурами метилмагния и ме-
тилалюминия. Некоторые особенности структур этих соедине-
ний представлены в табл. 22.10. Диэтилфторид алюминия
A1F(C2H5J [И] представляет собой вязкую жидкость, раствори-
мую в бензоле, причем в растворе существует в виде тетрамера.
Установлено, что [A1F(CH3J]4 [12] имеет циклическое строе-
ние (г), а электронографическое изучение [А1С1(СН3J]2 [13]
показало, что в структуре д присутствуют мостиковые атомы С1.
н,с Л. си,
(СН,J
м
AI
(СП3Ъ
А1
(СН3J
AI
>
(СН,
Н,С
22.5. Алкилы металлов
87
Литература. [1] Can. J. Phys., 1960, 36, 1516. [2] J. Chem. Soc, 1964, 3353.
[3| J. Am. Chem. Soc, 1941, 63, 480. [4] J. Am. Chem. Soc, 1958, 80, 4141.
[5] J. Chem. Soc, A 1970, 28. [6] J. Am. Chem. Soc, 1958, 80, 5324. [71 J. Am.
Chem. Soc., 1946, 68, 2204. [8] J. Organomet. Chem., 1964, 2, 197. [91 Ada cryst.,
1963, 16, 681. [10] Acta cryst., 1951, 4, 348. [11] Inorg. Chem., 1966, 5, 503.
[12| J. Organomet. Chem., 1973, 54, 77. [13] Acta Chem. Scand., 1974, A28, 45.
23. КРЕМНИЙ
23.1. Введение
Несмотря на то что у атома кремния строение внешней элект-
ронной оболочки такое же, как у атома углерода, в химии этих
двух элементов мало сходства. Действительно, хотя структура
элементного кремния такая же, как одной из модификаций угле-
рода— алмаза, а также соблюдается соответствие формул не-
которых простейших соединений кремния и углерода, однако в
химических и физических свойствах соединений этих элементов
редко наблюдается большое сходство. Поскольку кремний бо-
лее электроположителен, чем углерод, со многими металлами
он образует соединения, которые имеют строение, типичное для
сплавов (разд. 23.4), и некоторые из них имеют ту же струк-
туру, что и соответствующие бориды. Фактически кремний во
многом больше напоминает бор, чем углерод, хотя формулы
соединений кремния и бора обычно совершенно различны. Не-
которые из таких параллелей в химии кремния и бора рассмот-
рены в начале следующей главы. Силициды по своему строению
мало похожи па карбиды, ко весьма сходны с боридами; напри-
мер, это проявляется в образовании каркасов из атомов Si (В),
хотя немногие силициды и бориды действительно изострук-
турны.
В гл. 26 проведено сравнение кристаллохимии кремния п.
германия. Здесь же мы отметим черты сходства и различия
кремния и углерода. Отличительная особенность химии углеро-
да состоит в способности его атомов непосредственно связы-
ваться друг с другом. Число простых молекул пли ионов со
связями Si—Si относительно невелико. Сюда относятся спланы
(линейные и циклические, простые и замещенные, разд. 23.5),
ион SigTee6" (в KeSi2Te6 [1]) с этаноподобной структурой
(Si—Si 2,40 A, Si—Тс 2,51 А) и некоторые охсогалогепиды. Во
многих силицидах имеется система связанных друг с другом
атомов Si, но, за исключением этих примеров, в сложных соеди-
нениях кремния гораздо чаще реализуется соединение атомов
Si через атомы О.
В простых молекулах и ионах атом Si дает не менее четырех
ковалентных связей (возможное исключение ион енлила, см.
ниже). Кремний не способен образовывать небольшое число
кратных связей в отличие от углерода в таких соединениях.
23.1. Введение 89
как СО, СО2, —CN и т. д. При комнатной температуре устойчив
лишь один оксид кремния, для которого известны несколько
кристаллических модификаций. Во всех этих модификациях,
кроме стишовпта (разд. 23.11.1), каждый атом кремния имеет
четыре тетраэдрические связи, причем атомы Si и О образуют
бесконечный трехмерный каркас. Низший оксид SiO совершен-
но по похож па газообразный СО. Его получают нагреванием
SiO2 ч Si при температурах >1250°С; при медленном охлаж-
дении он диспропорционирует. Указывалось, что после закалл-
вания SiO может быть получен и при комнатной температуре,
но, по-видимому, не в кристаллическом состоянии [2]. Реактм
Si--SiCU—>2SiCU идет выше 1100°С [3]. При 1150°С SiFi
реагирует с Si, образуя газообразный SiF2 — вещество с перио-
дом полуразложепия при комнатной температуре около 150 с
(в то время как для CF2 1 с, а для СН2 — несколько сотых се-
кунды); см. также разд. 23.6 [4]. Устойчивого сульфида с фор-
мулой CS не существует, а продукт состава SiS может быть
возогнап из смеси SiS2 + Si. При комнатной температуре окра-
шенный сублимат не является кристаллическим; вероятно, про-
исходит его диспропорционирование до SiS2 и Si [5]. По строе-
нию кристаллический SiS2 совершенно отличен от молекуляр-
ного соединения CS2. Структура обычной модификации SiS>2
состоит из бесконечных цепочек тетраэдров S1S4, соединенных
через противолежащие ребра. При высоком давлении сущест-
вует модификация SiS2, имеющая кристобалитоподобную струк-
туру (угол Si—S—Si 109,5°) [б].
Во многих случаях отличия Si и С, как и Р и N, S и О или
С1 и F, могут быть объяснены тем, что атомы элементов вто-
рого короткого периода в отличие от элементов первого перио-
да могут использовать rf-орбнтали. В соединениях Si, P и S
с более электроотрицательными элементами ковалентность час-
то превышает четыре. Среди соединений углерода нет аналогов
фторосиликатов; не существует также азотсодержащего анало-
га для нона PFe~. Хотя силильные соединения с группой — SiH3
формально соответствуют метальным производным, их химиче-
ские свойства во многих отношениях существенно отличаются.
Для многих силильных соединений химическое поведение, воз-
можно, определяется наличием электроноакцепторных групп —¦
SiH3. Кремний — менее электроотрицательный элемент, чем уг-
лерод, однако группа—SiH3 — более сильный акцептор электро-
нов, чем ¦—СНз, что обусловлено л-связыванием, т. е. перекры-
ванием /?„-орбитали атома, присоединенного к кремнию
освязью, с вакантной йп-орбиталью атома Si (у атома С нет
Зй-орбиталей). (Как правило, л-связывание тем сильнее, чем
более электроотрицателен донорный атом.) Эти свойства си-
лильной группы проявляются, например, в том, что молекула
90 23. Кремний
N(SiH3K плоская (разд. 18.4.1), и в незначительной склонности
силильпых производных к дополнительной координации. Так,
N(SiH3K не образует четвертичных солей типа [N(SiH3L]X
или [N (SiH3KH]X, а его аддукт с BF3 намного менее устойчив,,
чем соответствующее соединение N(CH3K.
Наконец, следует отметить значительные отличия в устой-
чивости аналогичных соединений углерода п кремния к дейст-
вию кислорода и воды. В противоположность вполне устойчи-
вым ССЦ и CS2 соответствующие производные кремния разла-
гаются водой с выделением НС1 или H2S и образованием «крем-
невой» кислоты, как называют коллоидный SiO2 с различной
степенью гидратации. Возможно получение индивидуальных
ди-, три- и тетракремневых кислот при гидролизе и диспропор-
ционировании эфиров ортокремневой кислоты [7]. Кремний об-
разует ряд гидридов (силанов), которые, хотя и устойчивы к
действию чистой воды, гидролизуются слабыми растворами
щелочей. На соответствующие углеводороды такие растворы
совершенно не действуют. Ввиду легкости перехода соединений
кремния в оксид или другие оксосоединения неудивительно, что
в природе кремний встречается исключительно в виде своих
кислородных соединений. В связи с этим значительная часть
настоящей главы будет посвящена рассмотрению химии сили-
катов.
Литература. [1] Acta cryst, 1978, В34, 2390. [21 J. Phys. Chem., 1959, 63, 1119;
Z. anorg. allgem. Chem., 1967, 355, 265. [3] Z. anorg. allgem. Chcm., 1953, 274,
250. [fl J. Am. Chem. Soc, 1965, 87, 2824. [5| J. Am. Chem. Soc, 1955, 77, 904.
[6] Science, 1965, 149, 535. [7] Z. anorg. allgem. Chem., 1954, 275, 176; 276, 33.
23.2. Стереохимия кремния
В структурах кристаллического кремния и подавляющего
большинства его соединений, устойчивых при обычных условиях,,
атом кремния образует четыре тетраэдрические связи; простей-
шими примерами могут служить SiH4, SiX4, SiO4*~ и SiS44~.
Строение тиосиликатного иона исследовано в соединении
Ba2SiS4 [Г] (Si—S 2,10 А), изоструктурном одной из модифи-
каций K2SO4; строение «супертетраэдрического» иона Si4Sj04~
обсуждается в разд. 26.6. С сильными кислотами кремний не
дает солей; однако известен ацетат Si(acL, состоящий, веро-
ятно, из молекул с тетраэдрической координацией атома крем-
ния [2J. Следующее по важности координационное число (КЧ)
атома кремния — шесть; тенденции к образованию соединений с
еще большим КЧ не обнаружено. Так, известны соединения
кремния с ацетилацетоном (acac) [Si(acacK]AuCl4 и
Si(acacKCl-HCl (последнее соединение разделено на оптиче-
ские изомеры) [3], а соединений состава М(асасL, как это ха-
23.2. Стереохимия кремния 91
рактеппо для Ti и Zr, не обнаружено. Строение K3SiF7, полу-
чаемого нагреванием K2SiFe в сухом воздухе, соответствует
формуле K?,(SiF6)F |3]. В ряде комплексов с изолированными
группами установлена октаэдрическая координация атома крем-
ния: в ионе SiF62~ (например, в структуре K2SiF6, относящейся
к типу K2PtCl6), в анионе а (в его пиридиниевой соли) [4],
•? нейтральной молекуле б [5], а также, возможно, в трпсокса-
латных нонах (в соли (NR4J[M1V(C2O4K], где M — Si, Ge, Sn,
Ti) [G] и в производных фталоцианпна PcSiX2 [7].
6
Si
Ч)
2-
1,93 А I
-1,64 Л
Октаэдрическая координация кремния атомами кислорода
обнаружена во всех модификациях SiP2O7, устойчивых при
атмосферном давлении [8], в [Ca3Si (OHN-12H2O](SO4) (СО3)
[9] и в некоторых оксидных фазах высокого давления, в том
числе в одной из модификаций SiO2 (стишовите), в синтетиче-
ском KAlSi3Os и гранате [10]. Атом кремния координирован по
октаэдру и в модификациях высокого давления SiAs2 и SiP2.
В обычном SiP2 КЧ атомов Si и Р равны 4 и 3, но в модифи-
кации высокого давления (со структурой пирита) они становят-
ся равными 6 (октаэдр) и 4 CSi + P, тетраэдр) [11]. Представ-
ляет интерес то, что октаэдрическая координация сохпаняется
в высокотемпературной (кубической) модификации SiP2O7; эта
структура основана на том же типе F, 4)-связанной трехмер-
ной сетки, что и модификация высокого давления SiP2 (тип
пирита); из последней она может быть получена (топологиче-
ски) путем внедрения атомов О по всем связям Si—Р и Р—Р.
Кроме этого КЧ 6 для атома Si (и 4 для атома Р) обнаружено
в структуре (NH4JSiP4Oi3 [12], где двумерные анионы, т. е.
слои, образованы группировками P4Oi3, соединенными через
атомы Si (октаэдрическая координация).
Известно несколько соединений, в которых КЧ атома Si 5.
Можно было бы ожидать, что такая координация реализуется
в анионах SiX5^, например в солях (NR4) (SiF5) (где R — более
крупный радикал, чем СН3) [13], однако строение этих соеди-
92 23. Кремний
нений не изучено. Структурные исследования выполнены для
ряда хелатных соединений: анион в обнаружен в тетраметилам-
мониевой соли [14]; более симметричное строение имеет моле-
кула г [15]. Следует обратить внимание на очень большое
межатомное расстояние Si—N по сравнению с длиной связи
при тетраэдрической координации A,74 А). Можно предполо-
жить, что тригонально-бипирамидальная координация реализу-
ется также в циклической молекуле [ (CH3JN-SiH3]5 (д) с тре-
мя атомами Н в экваториальных и двумя атомами N в акси-
д
(СН3J
Si - S
\ '/
N-Si—N
-1,70 А
альных положениях [16] (хотя атомы водорода не были лока-
лизованы). Длина связи Si—N такая же, как в молекуле б
с КЧ 6.
При действии металлического калия на SiH4 или Si2H5
в апротоиных растворителях (например, в 1,2-диметоксиэтане)
образуется KSiH3, дающий бесцветные кристаллы со структу-
рой типа NaCl [17]. Положение атомов Н не установлено,
но в ионе SiH3~ атом кремния должен быть трехковалентным.
О малоустойчивых частицах SiF2 и SiCl2 уже упоминалось
ранее.
Данные о длинах связей в молекулах некоторых простых
соединений кремния включены в табл. 21.1.
Литература. [1] Acta cryst., 1974, ВЗО, 549. [2] Acta cryst., 1972, В28, 321.
[3] J. Am. Chem. Soc, 1959, 81, 6372. [4] J. Am. Chcm. Soc, 1969, 91, 5756
[51 Acta cryst., 1969, B25, 156. [6| J. Chem. Soc, A 1969, 363. [7] Inorg. Chem.,
1962, 1, 236; Inorg. Chem., 1966, 5, 1979. [81 Acta cryst., 1979, B35, 724. [91 Acta
cryst., 1971, B27, 594. [10] Acta cryst., 1970, B26, 233. [Ill Acta Chem. Scand.,
1967, 21, 1374. [12] Acta cryst., 1976, B32, 2957. [13] Inorg. Chem., 1969, 8, 450.
[141 J- Am- Chem. Soc, 1968, 90, 6973. [151 J- Organomet, 1975, 101, 11; 1976,
121, 333; J. Chem. Soc, D 1974, 2051. [16] J. Am. Chem. Soc, 1967, 89, 5157.
[17] J. Am. Chem. Soc, 1961, 83, 802.
23.3. Элементный кремний и карборунд
В гл. 22 были рассмотрены две кристаллические модифика-
ции углерода — алмаз и графит. Структура последнего уни-
кальна, тогда как в структурном типе алмаза кристаллизуются
23.3. Элементный кремний и карборцш
некоторые другие элементы IV группы: кремний, германий и
олово (серая модификация). В подгруппе IVB типичную ме-
таллическую структуру имеет только свинец (КПУ), а в под-
группе IVA все элементы кристаллизуются в плотпоупакован-
ных структурах.
При умеренном давлении Si и Ge переходят в более плотные
(плотность увеличивается на ~10%) модификации, в которых
реализуются различные типы 4-связанных сеток, отличных от
алмазной [Г]. При переходе к этим структурам длины связей
меняются мало, но угловые искажения существенны: при ато-
ме Si три угла по 99° и один 108°, углы при атоме Ge уклады-
ваются в интервал 88—135°. Структура Ge особенно интересна
тем, что тот же самый тип сетки характерен для структуры
одной из модификаций высокого давления SiO2 (кеатит), а так-
же для структуры льда III. Подробно эти 4-связанные сетки
были рассмотрены в гл. 3.
Исследованы также модификации Si и Ge высокого давле-
ния со структурой белого олова:
Структурный тип белого олова
Si 4 Si 2,430 А; 2 Si 2,585 А
Ge 4 Ge 2,533 А; 2 Ge 2,692 А
Структурный тип алмаза
4 Si 2,35 А
4Ge 2,45 А
При нагревании этой (кубической объемноцентрировапной) мо-
дификации высокого давления получен также кремний со струк-
турой типа гексагонального алмаза.
Большое число модификаций известно для карборунда SiC.
Кубический p-SiC имеет структуру цинковой обманки
(разд. 3.10.3), а многочисленные кристаллические модификации
со структурой, родственной типам цинковой обманки и вюртци-
та, в целом обозначаются как a-SiC. Позиции атомов в струк-
туре цинковой обманки такие же, как в алмазе, но атомы Zn
и S чередуются. Структуры цинковой обманки и вюртцита не
являются слоистыми в обычном смысле, по в этих структурах
можно условно выделить слои типа а и б, как показано на
рис. 23.1 (где чередующиеся кружки могут соответствовать ато-
мам Si и С или Zn и S). Видно, что структура цинковой обман-
ки построена только из слоев типа а, тогда как в вюртците слои
типа а и б чередуются. В модификациях a-SiC обнаружены более-
сложные последовательности слоев, например:
Цинковая обманка
Вюртцит
Карборунд III
Карборунд I
Карборунд II
Последовательность
слоев
а
а б
аа бб
ааа бб
ааа ббб
¦94 23. Кремний
Первые три структуры приведены на рис. 23.1.
Структуры карборунда, приведенные выше, составляют ос-
новную часть обычного материала; они представляют собой
наиболее простые примеры из очень большой группы структур
с постепенно усложняющейся последовательностью слоев; в не-
которых случаях повторение последовательности происходит
цинковая
обманка
вюртцагл
карборунд Ы
Рис. 23.1. Геометрические соотношения между структурами цинковой обман-
ки, вюртцита и карборунда III.
лишь через несколько сотен слоев. Тип последовательности ус-
тановлен более чем для 70 таких структур, которые называют
политипами, чтобы отличать их от обычных полиморфных мо-
дификаций. Для карборунда, образующегося при сублимации
в электрических печах, соблюдение закономерного чередования
слоев обусловлено механизмом роста кристаллов. Могут быть
предложены различные механизмы, но рост по винтовым дисло-
кациям, по-видимому, дает наилучшее объяснение очень боль-
ших периодов повторяемости в последовательности слоев [2].
Литература. \Ц Acta cryst., 1964, 17, 752. [21 Ada cryst., 1969, B25, 477; Ada
¦cryst., 1973, B29, 1548.
?3.4. Силициды
Силициды — это большая группа соединений, причем формулы
многих из них не соответствуют обычным валентностям входя-
щих в их состав элементов. Среди силицидов щелочных метал-
лов имеются, например, Li15Si4 и Li2Si, KSi и KSi6, CsSi и CsSib.
Тип связывания может быть самым разнообразным: от металли-
23.4. Силициды 95-
ческого или ионного до ковалентного, причем во многих силици-
дах осуществляются связи более чем одного типа. Ниже мы
ограничимся рассмотрением лишь самой общей геометрической,
классификации, поскольку для каждого соединения изучение
структуры должно предшествовать обсуждению: природы связы-
вания.
Крайний случай представляют структуры силицидов, содер-
жащие изолированные атомы Si: Ca2Si [1] со структурой типа
анти-РЬСЬ, Mg2Si со структурой антифлюорита (такую же
структуру имеют Mg2Ge, Mg2Sn и Mg2Pb) и разнообразные
соединения с типично металлическими структурами: V3Si, Cr3Si,.
Mo3Si (структура p-W), Cu5Si (структура p-Mn), Mn3Si (ста-
тистическая ОЦК-структура) и Fe3Si (сверхструктура к типу
Fe3Al). В подобных структурах не всегда просто интерпретиро-
вать межатомные расстояния (как и в структурах интерметал-
лических соединений, см. гл. 29). Например, в TiSi2 (см. далее)
атом Si окружен 2Si и 2Ti (на расстоянии 2,54 А) и еще 3Ti
и 3Si (па расстоянии ~2,75 А). В структурах других силици-
дов расстояние Si—Si близко к расстоянию в кристаллическом'
кремнии B,35 А). Чрезвычайно короткое расстояние Si—Si
B,18 А) найдено в структуре IrSi3 [2]. Атомы металла нахо-
дятся в позициях с девятерной координацией между плоскими;
4-связанными сетками из атомов Si (рис. 29.13,6). Если счи-
тать, что при расстояниях, меньших ~2,5 А, имеется сущест-
венное взаимодействие между атомами Si, то структуры, содер-
жащие связанные друг с другом атомы Si, можно классифици-
ровать следующим образом:
Тип группировки из атомов Si
Примеры
Группы Si2
Группы Si4
Цепи
Плоские гексагональные сетки
Гофрированные гексагональные сетки
Трехмерный каркас
U3Si2 (Si—Si 2,30 А)
MSi (M = Na, K, Rb, Cs)
[31
USi (Si—Si 2,36 A)
CaSi (Si—Si. 2,47 A)
(}-USi2
CaSi2
SrSi2, a-USi2 (ThSi2)
Интересно отметить, что силициды урана дают примеры струк-
тур всех основных типов силицидов [4], так как кроме соеди-
нений, перечисленных выше, существует U3Si (искаженный
структурный тип Cu3Au, гл. 29), в котором имеются «изолиро-
ванные» атомы Si, окруженные только атомами урана. Неко-
торые силициды кристаллизуются в тех же структурных типах,,
что и бориды, для которых характерно наличие бесконечных.
36 23. Кремний
систем связанных атомов бора. Однако из-за значительно боль-
шего размера и другой электронной структуры атома Si бори-
ды и силициды обычно не изоструктурпы.
Структурный тип FeB для моиосилицндов (USi и другие
силициды 4/- и 5/-элементов [5], а также TiSi и ZrSi) с беско-
нечными цепочками атомов Si и структурный тип А1В2 для
p-USi2 (и других диснлицидов 4f- и 5[-элементов) [6] с плоски-
ми гексагональными слоями атомов Si описаны в гл. 24. Поэто-
му здесь мы рассмотрим строение некоторых силицидов со
структурой сплавов, характеризующейся наличием дискретных
атомов Si, далее опишем структуру CaSi2 с гофрированными
слоями атомов Si и, наконец, SrSi2 и «-ThSi2 в качестве приме-
ров трехмерных каркасных структур.
TiSi-2, CrSi2 и MoSi2. Ромбическая структура TiSi2, изострук-
гурные CrSi2, VSi2, NbSi2 и TaSi2 (гексагональные структуры)
и нзоструктурные MoSi2, WSi2 и ReSi2 (тетрагональные струк-
туры) связаны между собой очень простыми соотношениями,
что трудно было ожидать при столь различной симметрии.
Структура TiSi2 состоит из слоев с плотнейшей упаковкой
(рис. 23.2,а), в которых Si:Ti = 2: 1. Однако эти слои не накла-
дываются друг на друга с образованием плотноупакованнои
структуры, в которой каждый атом имеет 12 равноудаленных
соседей. Вместо этого атомы титана последующих слоев рас-
полагаются над точками В, С и D соответственно (рис. 23.2, а).
В результате у каждого атома оказывается 10 ближайших сосе-
дей, причем вблизи атома Ti располагаются 10 приблизительно
одинаково удаленных атомов Si, а каждый атом Si также поч-
ти одинаково удален от 5 атомов Ti и 5 атомов Si. Структура
CrSi2 содержит слои с точно таким же типом плотнейшей упа-
ковки; более того, слои накладываются сходным образом, при-
чем для каждого атома возникает окружение, включающее
10 ближайших соседей: окружение атома Сг составляют 10 ато-
мов Si, а окружение атома Si — 5 атомов Сг и 5 атомов Si.
В этой гексагональной структуре повторение происходит через
каждые три слоя, причем положение атомов Сг в двух после-
довательных слоях соответствует точкам В и D на рис. 23.2,6.
Геометрически структура MoSi2 напоминает СаС2, что можно
видеть из сравнения рис. 23.2, в и 22.6, хотя атомы Si и не ассо-
циированы в пары, как атомы С в СаС2. (Обе структуры тетра-
гональные, для СаС2 а = 3,89 А, с = 6,38 А и параметр атома С
в позиции @0г) равен zc = 0,406; для MoSi2 a = 3,20 А, с = 7,86 А,
zSi«0,33. Объемноцентрированная элементарная ячейка выде-
лена на рис. 23.2, в штриховыми линиями.) Однако проекция
структуры на плоскость (ПО) (рис. 23.2, г) показывает, что
MoSi2 по строению очень близок с TiSi2 и CrSi2. В плоскости
A10) атомы располагаются по точкам гексагональной сетки
23Л. Си.шцш)ы
точно т.",кого же типа, как в последних двух структурах. Нало-
жение слоев происходит таким образом, что каждый атом так-
же оказывается окруженным 10 ближайшими соседями.
В структуре MoSi2 атомы в слоях через один расположены
точно друг над другом, тогда как в соседних слоях они смеще-
@ о о
ООС@ОО|
v..;
О © О О б О о
о т о о
о о © о о % о о
о о
D
е о
о о © о о
Рис. 23.2. а — плотноупакованный слой MSi2 в структурах некоторых днспли-
дпдов; б-—три последовательно расположенных слоя в структуре CrSi2; в —
кристаллическая структура MoSi2; г — проекция структуры MoSi2 на плоскость
A10), показывающая относительное расположение атомов Si (незаштрихован-
пые кружки) в двух соседних слоях. Заштрихованные кружки — атомы ме-
талла.
пи, причем атомы Мо соседнего слоя расположены над точка-
ми В на рис. 23.2, г. Таким образом, эти три структуры обра-
зуют интересный ряд: будучи построены из слоев плотнейшей
упаковки одного и того же вида, накладывающихся сходным
образом (что приводит к КЧ 10, а не 12), они отличаются друг
от друга лишь числом слоев в повторяющейся последовательно-
сти D для TiSi2, 3 для CrSi2 и 2 для MoSi2). Установлено, что
в кристаллах соединений состава, промежуточного между TiSi2
и MoSi2, осуществляется и промежуточный (трехслойный) тип
структуры CrSi2; то же справедливо для системы TiSi2 — ReSi2
7—1284
98
23. Коемний
CaSi2, SrSi2 и BaSi2. Строение этих соединений при нормаль-
ном давлении (НД) и давлении 40 кбар и температуре 1000°С
(ВД) сопоставлено ниже. (Вторая ВД-модификация BaSi2 по-
лучена при 600—800 °С и давлении 40 кбар.) Фазы ВД в тече-
ние нескольких месяцев устойчивы также при нормальных:
давлении и температуре в отсутствие воздуха и влаги; при на-
гревании до 400 °С они переходят в фазы НД. Эти соединения
дают примеры всех основных типов структур, возможных для
элементов, атомы которых образуют по три связи, что подчер-
Рис. 23.3. Кристаллическая структура CaSi2.
кивает сходство между ионом Si~ и изоэлектропным ему ато-
мом Р. В частности, системы связанных атомов Si в трех моди-
фикациях BaSi2 представляют собой простейший 3-связапный
многогранник, простейшую 3-связанпую плоскую сетку и одну
из двух простейших 3-связанных трехмерных сеток (рис. 3.28, о—
кубическая сетка). Трехмерные сетки такого же типа обнару-
жены в структуре SrSi2, а вторая простейшая трехмерная 3-свя-
занная сетка (тетрагональная A0, 3)-сетка) соответствует рас-
положению атомов Si в структуре a-ThSi2 (см. далее), осущест-
вляющемуся также в ВД-модификациях CaSi2 и SrSi2- Гексаго-
нальные слои, отвечающие структуре CaSi2, содержащего не-
большое количество Sr, показаны на рис. 23.3. Слои такого же
типа присутствуют в чистом CaSi2, менее гофрированные —
в слоистой модификации BaSi2- Углы между связями при ато-
ме Si меняются в пределах от 60° в группировке S14 (BaSi2),
105 и 112° в слоистых структурах CaSi2 и BaSi2 до величин,
близких к 120°, в трехмерных сетках. Интервал изменения длин
связей Si—Si небольшой B,40-^2,45 А). В работе [13] обсуж-
дается возможный механизм полиморфных превращений.
a-ThSi2. Многие дисилициды 4/- и 5/-элементов кристаллизу-
ются в структурном типе a-ThSi2 (реализуется и менее спммет-
2,'1.5. Силаны
99
CaSi;
SiSi2
BaSi2
Типы :pijnniij):>eo'.< Sir в On
НД-структурм
Двумерная гексагональ-
ная сетка |"8|
Кубическая трехмерная
A0, 3)-сетка [10]
Тетраэдрическпе группы
SU [8]
силицидах
ВД-с i ручтуры
Тетрагональная трехмер-
ная A0, 3)-сетка [9|
Дч1 мерная гексагональ-
ная сетка [11]
Трехмерная кубическая
сетка [12]
О
О
(ШЧНШ1 вариант этой структуры), а также в структурном типе
А!В2 [6J. В структуре a-fhSi2 атомы Si (КЧ 3) образуют очень
рыхлый трехмерный каркас (Si—Si
2,39 А, что близко к соответствующей
величине для элементного кремния).
Этот каркас, выделенный па рис. 23.4.
можно сравнить со слоем атомов бора,
также имеющих КЧ 3, в структуре
А1В2 (разд. 24.4). В полостях каркаса
расположены атомы Th, причем каж-
дый из них связан с 12 соседними ато-
мами Si на расстоянии 3,16 А. Бли-
жайшими соседями атома Si являются
6 Th (на таком же расстоянии). Тес-
ная связь между структурными типа-
ми ThSi2 и А1В2 подчеркивается тем
фактом, что дисилициды тория, урана
п плутония кристаллизуются в обоих
структурных типах, в то время как
дпеилициды легких редкоземельных
металлов (La—Но) имеют структуру
ThSi2 (в некоторых случаях искажен-
ную), в случае тяжелых РЗЭ (Er, Tm, Yb n Lu) реализуется
тип А1В2.
Литература. [1] Z. anorg. allgem. Chcm., 1955, 280, 321. [2] Inorg. Chem., !'J71,
10, 1934. [3] Z. anorg. allgem. Chem., 1964, 327, 260. [4] Acta cryst, 1949, 2, 94.
15] Acta cryst., 1966, 20, 572. [6] Inorg. Chem., 1967, 6, 842. [71 Acta cryst., 1964,
17, 450. [8] Z. anorg. allgem. Chem., 1970, 372, 87. [9] J. Solid State Chem.,
1977, 20, 173. [10] Acta cryst, 1972, B28, 2326. [11] Angew. Chcm., 1977, 89,
373. [12] Angew. Chcm., 1978, 90, 562. [13] J. Solid State Chcm., 1978, 24, 199.
23.5. Силаны
Гидриды кремния от SiH4 до Si7HiB (силаны) получают дейст-
вием 20%-ной НС1 на силицид магния в атмосфере водорода;
более совершенный способ состоит во взаимодействии ЫЩВ
О
Рис. 23.4. Кристаллическая
структура ThSk
100 23. Кремний
с силицидом магния в жидком аммиаке. Смесь выделившихся,
газов охлаждают жидким азотом и затем подвергают фракци-
онной перегонке, т. е. действуют так же, как при получены1.!
борапов. Таким путем были выделены все указанные выше
представители ряда силанов, причем количества веществ были
тем меньше, чем больше молекулярная масса. Два изомера
Si4H10 разделены методом газовой хроматографии и исследова-
ны методами ИК- и ЯМР-спектроскопни [1]. Смешанные гид-
риды Si и Ge (например, Si3GeHi0 и SisGeHu) были получены
путем гидролиза сплавов Mg—Ge—Si и при пиролизе смесей,
силанов и германов [2J. Термическая устойчивость силанов по-
нижается с ростом их молекулярной массы; высшие гомологи
разлагаются при нагревании, давая смесь низших гидридов,—
процесс, аналогичный крекингу углеводородов. Силаны не вза-
имодействуют с водой, по они подвергаются гидролизу под дей-
ствием разбавленных щелочей, что сопровождается выделением
водорода п образованием силикатов. Подобно углеводородам,
они вступают в реакцию с галогенами; процесс гидролиза про-
дуктов взаимодействия рассмотрен ниже.
Удобный общий способ синтеза простых и замещенных гид-
ридов элементов IV группы — действие гидрида лития-алюми-
ния па соответствующий галогенид в эфирном растворе:
4MRyX/K,y + D - у) LiAlH4 >- 4M.RyHt_y ~- D — у) LiX -j- D - у) А1Х,
где R — алкильная или арильная группа, X — галоген. Таким
путем осуществляются превращения SiCl4—*-SiH4, S12CIG—*¦
—>-Si2H6, Et2SiCl2—vEt2SiH2 и т. д. Этот же метод был исполь-
зован для получения GeH4, SnH4 и трех метилстаннапов.
Силапы очень легко окисляются; например, Si2H6 самовос-
пламеняется на воздухе. В противоположность углероду крем-
ний, по-видимому, не способен образовывать простые ненасы-
щенные гидриды, соответствующие олефинам, ацетиленам я
ароматическим углеводородам. Описаны твердые ненасыщен-
ные гидриды (SiH2)n неизвестного строения, хотя при исследо-
вании высших силанов ни на одной стадии не были обнаруже-
ны твердые продукты. По своему строению силаны должны быть
похожи на насыщенные углеводороды. Получены также многие
замещенные моносиланы (табл. 21.1) и галоген- и алкилпроиз-
водные дисилаиов, например F3SiSiF3, Si2Cl6 и Si2(CH3N.
Разнообразные полностью метилированные полисиланы (ли-
нейные и циклические) образуются при каталитической пере-
группировке Sie(CH3) 14, а циклические соединения [Si(CH3J]re
(я = 5-ь8) были получены при действии лития на Si(CH3bCl2
в тетрагидрофуране. В структурах Si4(CH3L(Bu3CL [3] и
Si4(C6H5)8 [4] кольца Si4 немного согнуты по диагонали (дву-
гранный угол 37 и 13° соответственно). Строение кольца Si&
L'3.6, Галпгениды кремния
10"
определено в соединениях SisHio [51] (электронограф.) и в
Sir"(C6Hs) ю [6]. В SisHio атомы кремния (кольцо Sis) не ле-
жат в одной плоскости (Si—Si 2,342 A, Si—Н 1,496 А, угол
Si—Si—Si 104,2°). В Si6(CH3I2 [7] кольцо имеет конфигура-
цию кресла (Si—Si 2,34 А). Бициклические и полиэдрические
полпеилапы Si8(CH3)i4, Si9(CH3)I6, SiiO(CH3) ie, Siio(CH3)i8 и
Siir,(CH3J2 синтезированы действием металлического натрия на
смесь (CH3JSiCl2 и CH3SiCl3 в тетрагидрофуране. Фотолиз,
соединения Sis (СН3) и приводит к образованию Si7 (CH3) 12-
Выше показано строение соединений, содержащих циклы Si7 (a)
и Si8 (б). В результате определения кристаллической структу-
ры для Sig(CH3)i6 установлено бициклическое строение (в)
(Si-Si 2,34 А) [8].
Литература. [1] Inorg. Chem., 19-64, 3, 946. [2] J. Chem. Soc, 1964, 1467; J.
Chem. Soc. A 1969, 2937. [3| Organomet. Chem., 1975, 91, 273. [41 Acta cryst.,
1978, B34, 883. [5] Acta Chem. Scand., 1976, A30, 697. [61 Acta cryst., 1978, B34,
3678. [71 Acta cryst., 1972, B28, 1566. [81 lncrg. Chem., 1976, 15, 524.
23.6. Галогениды кремния
Низшие галогениды SiF2 и SiCl2 уже упоминались выше. В SiF2
расстояние Si—F равно 1,591 А, угол F—Si—F ЮГ [1]. Было
также выполнено исследование этого соединения в твердых
матрицах (Ne и Аг) [2]. При конденсации газообразного SiF2
при низких температурах образуется пластичный полимер
(SiF2)n, самовозгорающийся во влажном воздухе и разлагаю-
щийся при нагревании с выделением всех возможных перфто-
росиланов от SiF4 до Sii4F3o- При конденсации в ловушке с
BF3 при температуре жидкого азота SiF2 дает соединения
Si2BF7, Si3BF9 и т. д., которые были идентифицированы масс-
спектрометрически. Вероятно, эти молекулы имеют линейное
строение F3Si—(SiF2)n—BF2 [3].
Электропографическое и спектроскопическое исследования
показали, что в газообразном состоянии молекулы галогенидов
SiX4 имеют тетраэдрическое строение. Для SiF4 и в твердом
состоянии (при —145 °С) рентгенографически была установле-
на простая молекулярная структура [4].
Высшие хлоросиланы удобно получать путем диспропорцио-
нирования Si2Cl6 в присутствии триметиламина, например
5Si2Gl6—^4SiCl4 + Si6Cli4 [5J. Было установлено, что кристал-
!02 2JL Кремний
23.7. Оксогалогениды и тиогалогениды
103
лическое вещество состава SieCli6 имеет молекулярное строение
Si5Clio-SiCl4 и содержит тетраэдрические молекулы (г) (Si—Si
2.34 A* Si—Cl 2,01 А; в SiCl4 Si--Cl 2,04 A) [6j.
SiCI,
С, Si
SiCi.
Процесс контролируемого гидролиза этих соединений рас-
смотрен ниже. При полном гидролизе галогенидов и других
хлорокремнневых соединений образуются оксосоединения, во
многих случаях формально сходные с производными углерода.
Однако в целом сходство физических и химических свойств
соединений кремния и углерода незначительно, и продукты гид-
ролиза представляют собой высокополимерные твердые вещест-
ва. Все хлоросиланы легко гидролизуются, например из SiH2Cl2
образуется «просилоксан» (H2Si0),,, который в зависимости от
метода гидролиза может давать различные полимерные моди-
фикации. В результате полного гидролиза Si2Cl6 получается
белое порошкообразное вещество с эмпирической формулой
(SiCbH)^, называемое кремнещавелевой кислотой. Несмотря на
такое название и формулу, у этого соединения нет никакого
химического сходства с щавелевой кислотой: оно нерастворимо
в воде и не проявляет кислотных свойств. Соли и эфиры крем-
нещавелевой кислоты неизвестны, при ее растворении в щело-
чах выделяется водород. По-видимому, это полимер со слож-
ным строением. Аналогичные свойства у продукта, получаемого
при выдерживании Si3Cl8 на влажном воздухе, «кремне-мезо-
щавелевой кислоты» (Si3O6H4)n. Другой полимер, (Si2H2O),,,
также неизвестного строения, получается при действии на CaSi2
спиртового раствора НС1 (разд. 23.4); при этом продукт повто-
ряет по форме кусочки исходного CaSi2, что несколько напоми-
нает поведение соединений графита, описанных в гл. 21. Веще-
ство самовоспламеняется на воздухе; оно является восстанови-
телем и быстро разлагается горячей водой.
Литература. \\] J. C'ncm. Pliys., 1967. 47, 5031. [2] J- Am. Chem. Soc, 1969, 91,
2536. [3] J. Am. Chmi. Soc, 1965, 87, 2824, 3819. [4] Ada cryst., 1954, 7, 597.
[51 J. Inorg. Nucl. Chem., 1964, 26, 421. 427, 435. [61 Ada crysi., 1972. B28,
1233.
23.7. Оксогалогениды и тиогалогениды
Оксогалогенид SiOCl2, аналогичный фосгену, неизвестен; в нем
должна была бы присутствовать двойная связь кремний — кис-
лород. Наиболее простой из полученных оксохлоридов—жид-
кий Si2OCl6, образующийся при пропускании смеси паров SiCl4
с воздухом через раскаленную трубку. В результате электроно-
гпафического исследования строения этого соединения получе-
ны следующие данные: Si—О 1,64D) A, Si—Cl 2,02C) А; угол
Cl —Si—C1 109B)с; величина угла Si—О—Si не установлена,
по, вероятно, близка к 130° [1].
Оксохлориды Si,,On-iCl2n-t-2 цепочечного строения были син-
тезированы при пропускании смеси О2 + 2С12 над раскаленным
кремнием, а также путем контролируемого гидролиза SiCl4
в эфирном растворе при —78 °С с последующей фракционной
перегонкой. Получены и охарактеризованы все члены ряда
вплоть до Si7O6Cl16 [2]. Это бесцветные маслянистые жидко-
сти; они не горючи, смешиваются с хлороформом, тетрахлори-
Х-,
С]—Si— О —Si— Cl;
ci xci
-сг
чг
о-
X2Si
О'
(SiOX2)n
I
^SiX-
дом углерода и сероуглеродом. Все соединения подвергаются
гидролизу, протекающему с наибольшей скоростью у низших
гомологов. При взаимодействии со спиртом образуются эфиры,
например Si6O5(OC2H5) i4. Синтезированы также циклические
оксохлориды (SiOCl2)n ( я = 3, 4 или 5) [3]. Известны цепочеч-
ные оксобромиды вплоть до Si6O5Brl4 и циклический (SiOBr2L
[4|. Кроме того, получены смешанные фторохлоросоединения,
в том числе Si2OF3Cl3 и Si2OF4Cl2 [5].
В отличие от SiCl4, контролируемый гидролиз которого при
—78 °С дает цепочечные оксохлориды Si«On—iCl2«+2, из SisCle
в аналогичных условиях образуются соединения состава
Si2«+2OraCl4n+6, в структуре которых содержатся попарно связан-
ные атомы Si, соединенные в цепочки атомами кислорода:
II II
Cl— Si—Si—О—Si—Si—П и т. д.
II II
Таким путем синтезированы Si4OCli0, Si6O2Clu и Si8O3CliS,
представляющие собой бесцветные жидкости [6].
Получены и тиохлориды, в том числе Si2SCl6 (а), цикличе-
ское соединение б и кристаллический (SiSCl2L-
а
SiCl-,
Cl2Si \iCl2
104 23. Кремний
23.9. Некоторые соединения со связями N—Si 105
Литература. [1| Л. Chcm. Phys., 1950, 18, 1414. |2| Л. Am. Chcm. Soc, 1941, 63,
2753. [3] Л. Chcm. Soc, 1960, 5088. [4| Л. Am. Chcm. Sue, 1937, 59, 261. [5| Л. Am.
Chem. Soc, 1945, 67, 1092. |li| Л. Am. Chcm. Soc, 1954, 76, 2091.
23.8. Циклические силтианы
Строение тетраметилциклодисилтиана (а) и гексаметилцикло-
трисилтпана (б) определено электронографически. Этим мето-
дом не удалось установить строение кольца Si3S3. Однако при
рентгеноструктурлом исследовании [Si(CH3) (С6Н5)]353 показа-
а
(СН3)
б
3J
105°
¦-с-
2,18C) А
(СН3J
'110°
115°
2,15C) А
Si(CH3J
(СН3J
но, что кольцо имеет скрученную (твист) конформацию [2]
(разд. 3.7).
Литература. [1] Л. Am. Chcm. Soc, 1955, 77, 4484. [2] Ada cryst., 1977, B33,
1730.
23.9. Некоторые соединения со связями N — Si
Рассмотрим лишь несколько особо интересных соединений. Ра-
нее уже упоминалось о плоской молекуле N(SiHsK- Плоское
строение имеют также молекула а (в одной плоскости лежат
4 атома N и 4 атома Si) [11 и молекула циклодисилазана (б)
\2\. Более крупные кольцевые молекулы со связями Si—N
имеются, например, в циклотетрасилазане (в) [3] (инте-
ресно, что в кристалле одновременно присутствуют молекулы с
конформацией «кресла» и «ванны») и в полностью метилиро-
<CH,),Si N
|1.27A
/4 А
Si(CH3)
. 1.S6 A
N"T/72 A
в н
^N^1,73 А
(CH3JSi^ ^Si(CH3J
HN 132°ГКН
V
1,71 A
\
Si
(CH3JSi,
V
,1,89 А
H
H,C
сн,
ванном производном fSi(CH3J-N (CH3) ]4 [4]. Строение второго
соединения довольно необычно: в ромбоэдрической элементар-
ной ячейке имеется 7 молекул, шесть из которых связаны
\
\
^
LN
1,72 A
LN-
Si
N
Si
\
!
N Si
\
Рис. 23.5. Схематическое изображение структуры Si2
осью 3, а одна статистически распределена по нескольким пози-
циям.
Тугоплавкое соединение Si2N2O [5] синтезировано путем
пропускания аргона, содержащего 5% N2, над смесью Si + SiO2
при 1450 °С; по строению оно близко к SiO2 и S13N4 [6, 7]. Обе
модификации Si3N4 близки к фенакиту (разд. 3.5.1): атомы Si
тетраэдрически окружены четырьмя атомами N, а каждый
атом N связан с тремя атомами Si (Si—N 1,74 А). Структура
оксонитрида Si2N2O (рис. 23.5) состоит из тетраэдров SiN-O,
соединенных в трехмерный каркас. Гофрированные гексагональ-
ные сетки, содержащие равное число атомов Si и N, соединены
ДРУГ с другом через атомы О, которые дополняют координа-
цию атомов Si до тетраэдрической. Половина атомов Si в ель ¦
связана со слоем, лежащим выше, а другая половина-—со
слоем, находящимся ниже. В построенной таким образом струч-
106 23. Кремний
23.10. Кремнииорганические соединения, силиконы 107
туре каждый атом кислорода связан с двумя атомами Si (как
в SiO2), а атомы N и Si имеют по 3 и 4 связи соответственно
(как б SiaN'4, рис. 3.16, a). Ge2N2O пзоструктурен Si2N2O [8j.
Литература. [1] Acta cryst., 1975, В31, 678. [2[ J. Chem. Soc., 1962, 1721.
|31 Acta cryst., 1963, 16, 1015. [41 Acta cryst., 1976, B32, 648. [5] Acta Chem.
Scand., 1964, 18, 1879. [6] J. Am. Ceramic Soc, 1975, 58, 90. [7] Acta cryst., li'SO,
B36, 2891. [8] Acta cryst, 1979, B35, 141.
23.10. Кр?мр
силиконовые полимеры
Кремнииорганические соединения весьма разнообразны. Не-
смотря на формальное сходство между ними п чисто органиче-
скими соединениями, химические свойства этих двух групп ве-
ществ сильно различаются. Исключение составляют лишь неко-
торые соединения, например SiR4, где R — алифатический ра-
дикал. В данном случае сходство обусловлено тем обстоятель-
ством, что атом кремния полностью экранирован органическими
группами. Некоторые из кремнпйорганических соединений отли-
чаются чрезвычайной устойчивостью. Так, Si(C6HsL, не разла-
гаясь, перегоняется в воздухе при 425 °С, что, однако, не позво-
ляет сделать заключение о повышенной устойчивости органиче-
ских производных кремния вообще. Можно выделить две отли-
чительные особенности в химии соединений кремния и угле-
рода.
1) Атом кремния обладает гораздо большим сродством к
кислороду, чем атом углерода. Например, SiCl4 моментально
гпдролизуется водой, тогда как ССЦ к воде устойчив, а раство-
рами щелочей гидролизуется медленно. Гидролиз гидридов
кремния приводит к выделению кремневой кислоты, причем ди-
сплан на воздухе самовоспламеняется, что резко контрастирует
с устойчивостью соответствующих углеводородов.
2) Соединения с кратными свилями у атома кремния неиз-
вестны. При гидролизе галогепндпых производи;..: х кремни;;,
обсуждаемом ниже, не образуются кремыийсодержащие анало-
ги кетонов и карбоновых кислот за счет отщепления воды о г
каждой молекулы. Вместо этого происходит отщепление воды
on двух или большего числа молекул, что приводит к образо-
ванию полимерных соединений.
Ни с. 107 схематически показаны основные методы синтеза
кремпийоргапнческих соединений.
Путем проведения последовательных реакций с различными
по составу реагентами Гриньяра (RMgBr) синтезировано, на-
пример, соединение (С6Н5СН2) (С2Н5) (С3Н7) Si(CH2C6H4SO3H).
Далее основное внимание уделяется реакциям гидролиза заме-
щенных хлороспланов.
Методы синтеза
кремнпйорганических соединений
Si(OEtL ——- GSi(OEtK и т. д.
ito:-i
x ZnF.t-
SiCl4 --<- SiEt4
C6HsSi(OEtK
\
fct.MgBA
N.SR
(c6HscH2xc2H5)Si
(E: ~~ <".;¦'- ¦ F; -
23.10.1. Замещенные хлоросиланы, силанолы и силоксаны. Впер-
вые хлоросиланы были синтезированы действием соединений
Грипьяра на SiCl4; их можно также получить непосредственно
!г> ткил- или арилгалогенидов и кремния. Пары галогепида
пропускают над предварительно спеченными таблетками крем-
п.тя, содержащего в качестве катализатора ~15% серебра пли
меди. После конденсации продуктов взаимодействия их подвер-
гают фракционированной перегонке. В техническом отношении
наиболее важны метплхлоросплачы CHsSiCl,, (CHnJSiCl2 и
(CH:;KSiCl. Этим путем были получены винильные, аллильпые
и феиильные производные; некоторые из них перечислены ниже:
CC,ll,),SiCb
|C,nri.SiC!.
Интенсивные исследования продуктов гидролиза замещенных
.хлороскланов и эфиров привели к возникновению новой ва:-ч-
ноп области химии. Многие кремнийорганпческие сосдппе?л:..1
впервые были получены в начале этого века Кипшшгом и ег >
школой. Обнаружено, что при гидролизе этих соединений часто
образуются клееподобные продукты, а также уже упоминав-
шиеся твердые вещества, изучение которых оказалось затрудни-
тельным. В ранних исследованиях изучением этих полимерныч
продуктов не занимались. В настоящее же время они — основа
химии силоксанов (силиконов).
По аналогии с соединениями углерода можно было ожидать,
что при гидролизе моно-, ди- и трихлоросилаиов можно полу-
108 23. Кремний
чнть кремнийеодержащие соединения, соответствующие спир-
там R3SiOH, кетопам R2Si = O (путем отщепления молекулы
воды от R2Si(OHJ) и карбоновым кислотам
ОН
(при уда-
ленип воды из тригидроксосоединения). На самом деле соеди-
нения со связью Si = 0 никогда не образуются, хотя общее на-
звание «силиконы» (по аналогии с кетонами) и используется
для обозначения разнообразных продуктов гидролиза дихлоро-
спланов.
Силанолы R3Si(OH) впервые получены в 1911 г. Эти соеди-
нения проявляют склонность к конденсации с образованием ди-
силоксанов
2R3Si(OH)
Si—О—
причем скорость реакции зависит от природы группы R. Кип-
пингом был выделен дициклогексилфенилсиланол; (С6Н5)з5ЮН
можно перегнать в вакууме (без образования дисилоксана),
но трналкилсиланолы выделить не удается. Название «дисилок-
саны» применяется ко всем соединениям с формулой R3Si—О—
—S1R3; сюда относятся H3Si—О—SiH3, ^HsbSi—О—БЦСгНзЬ
и оксогалогениды X3Si—О—SiX3. Первое из этих соединений
получено гидролизом SiH3Cl водой при 30 °С.
Силандиолы R2Si(OHJ. В более ранних исследованиях уда-
валось выделить лишь диолы, содержащие ароматические
группы R, но и они склонны к конденсации с образованием це-
02
02
О'
/ОН
"он
"о
и 02S;
(К
4 02 02
НО ^Si-О-Si-ОН
I
HO-Si-0-Si-C-Si-OH и т. д.
02 <h <h
02
III
почечных и циклических полисилоксанов. Соединения I, II и
III получены в 1912—1914 гг., причем II и III были первыми
23.10. Крсмнийорганичеаме соаНтени.ч, с и. / иконы
109
достаточно хорошо охарактеризованными представителями груп-
пы циклических силиконовых полимеров. Диалкилсилаидцол
впервые удалось получить в 1946 г. путем гидролиза
(CoHsbSiCb разбавленной щелочью; это устойчивое кристалли-
ческое соединение. Позднее при гидролизе (CH3J$i (OCH3J
был выделен кристаллический (CH3JSi(OHJ, чрезвычайно
чувствительный к действию кислот или щелочей, вызывающих
его конденсацию в полисплоксапы главным образом цикличе-
ского строения (тример и тстрамер). Среди других днолов сле-
дует назвать соединения с R —н-пропил, пзопроппл, я-бутил,
rper-бутл, а также 1,3-диолтетраметилдисилоксапAУ). Сн-
лаптрполы RSi(OHK получены не были.
НО.
ОН
H3C-Si-O-Si-CH3
н,сх чсн3
IV
23.10.2. Строение силанолов и силоксанов. В этих соединениях
кремний не обнаруживает каких-либо специфических стереохи-
мических особенностей: расположение связей у атома Si обыч-
ное тетраэдрическое. Однако в некоторых сплоксанах реализу-
ются интересные циклические системы.
Силанолы. Диэтилсиландиол Si(C2H5J(OHJ представляет
собой простую тетраэдрическую молекулу с углами О—Si—О
110°, С—Si—С 111° и расстояниями Si—ОН 1,63 A, Si—С
1,90 А [1]. О кристаллической структуре (НО) Si(CH3J-
CBH4Si(CH3JOH [2] см. разд. 3.9.4.
Дисилоксаны. Строение ряда дисилоксанов R3Si—О—SiR3
(R = H [3, 4], F, Cl, CH3 [4], С6Н5 [5]) исследовалось и в газо-
образном состоянии (методом электронографии), и в кристалли-
H,Si
S1H3
1,486 А
¦четком. Угол при атоме О обычно находится в интервале 142—
156е (Si—О 1,63 А); лишь в кристаллическом (CGH5KSi—О—
—Si(C6H5K по соображениям симметрии этот угол должен
быть равен 180°. В серном аналоге дпеилоксапа H3SiSSiH3 угол
при атоме S оказался гораздо меньше.
Циклические полисилоксаны. Строение молекул этих соеди-
нений представляет особый интерес, поскольку в соответствую-
щих им соединениях углерода (паральдегиде и метальдегпде)
кольца гофрированы. Кремнийсодержащий аналог паральдеги-
110
2'Л Кпсмний
да (триметплцпклотрисилоксап) хотя и получен, но его ел рое-
пне неизвестно.
При тщательном электропографическом исследовании гекса-
метилциклотрпсилоксапа установлено плоское строение кольца
Si3O3 при значительных тепловых колебаниях мстильных групп
[7]. Для плоского кольца Si4O4 углы при атомах О должны
быть увеличены до ~ 160°. Рентгеноструктурпый анализ лпзко-
О 115E Г
НЛС П13
Si-Г i.S8D) A
температурной модификации (CH3)8SJ4O4 показал [8|, чгс
кольцо Si4O4 гофрировано (угол Si—О—Si 142,5°). Копформа-
ция этого кольца изучалась и в производных с другими замес-
тителями, например в (CH3L(C6H5LSi404 [9].
Известны также кремнийсодержащпе аналоги тиранов; оп-
ределено строение кристаллов октаметилспироE,5)пентасилок-
сана {10]. Два плоских кольца взаимно перпендикулярны.
Согласно этим данным, метильные группы совершают либра-
ции относительно связей Si—О, как если бы у атомов Si, к ко-
торым они присоединены, была возможность движения по прин-
ципу шарового шарнира. Длина связей: Si—О 1,(>4±0,03 А,
Si—С 1,88±0,03 А: углы при атоме Si тетраэдрические; угол.
Si—О—Si 130°.
О
О
Литература. [1] J. Chem. Phys., 1953. 21, 167. [2] J. Phys. Chera., 1967. 71. 4298.
[3] Acta Chem. Scand., 1963^ 17, 2455. [41 Acta crysl, 1979, B35, 2093. [5] Acta
cryst., 1978, B34, 124. [6] J. Chem. Phys., 1958, 29, 921. [71 J. Chem. Phys.. 1950,
18, 42. [8] Acta cryst., 1955, 8, 420. [91 Acta Chem. Scand., 1978, B32, 171.
[101 Acta cryst., 1948, 1, 34.
23.10.3. Химия силиконов. При рассмотрении силиконов выде-
ляют четыре типа структурных единиц. Монофункциональная
группа (М) может образоваться, например, при гидролизе
(CH3KSiCl или (CH3KSi (OC2H5). При сочетании групп такого
23.10. Крсмнш'ю'рганические соединения, си.шконы 111
ища получаются iо.тько дпеплоксапы, а при их сочетании с
плтпмп группами (см. ппже^ группы типа М находя \\'Л на
к.пщач цепей. В приведенных ниже формулах спмнол О соо\т;ет-
.т.;\о: лишь поюнппе атома кислорода, так хак при хопдепса-
¦_i;iii одни атом О связывает два атома Si.
СН,
сн
I
О
I
о
H3C-Si-O- -О-Si-О- -O-Si-O-- -O-Si-O-
о
М
D
о
Бифункциональные группы (D) образуются из (CHsbSiCl,;
дли (CH3J,Si(OC2H5J. Соединение групп только этого типа
дасг циклические полисплоксаны. Трифупкциопальпые группы
G") образуются из смесей, содержащих CH3SiC!s; полный гид-
ролиз чистого метилтрихлоросилана приводит к выделению бе-
лого нерастворимого осадка (см. далее). Тетрафункциональная
группа (Q) получается, например, из SiCU. Полнсилоксаны
можно рассматривать как аналоги кремиекислородных ионов,
обнаруженных в силикатах. Так, бесконечный полимер типа а
напоминает цепочечный поп в структуре пироксена б
(разд. 23.12.6), а циклический полимер имеет сходство с ионами
SisOc,1"'" и Si6Ois12^, присутствующими в силикатах бенитоите и
берилле (разд. 23.12.5).
,0 о, ,Ov
/ \с,.^/ \,- / \ с ¦/ ¦'' Ч; чч-, ~'Si'
K2 K2 О OO 0 0 0
R-,
a
6
R R
\ /
.Si
О" 'О
R ! j .R
к
R
ср.
О О
о
,Sr
-О
о \
Следующий в принципе возможный тип представляет собой
двумерный полимер, где каждый атом Si соединен с тремя дру-
гими через атомы О; четвертой связью удерживается органиче-
ская группа R (или галоген). Состав таких слоев отвечает
формуле (Si2O3R9),,, а их строение соответствует слоям в струк-
112
Кремний
турах петалпта или апофиллита (рис. 23.13). Полимеры, проме-
жуточные между цепочечными и слоистыми, имен состав
(Si4O5Re)", должны были бы соответствовать лептам, например.
в структуре амфибола. Хотя эти «предельные» типы структур
силоксанов, за исключением цепочечных и кольцевых, пепзвест-
пы, двух- и трехмерное связывание групп типа Т и Q осущест-
вляется, по-видимому, в гелях и смолах. Были получены также
полимеры из соединений кремния, содержащих ненасыщенные
органические группы. Уже упоминавшиеся винил- и аллилхло-
росилапы при гидролизе дают алкнленовые полпснлоксапы, ко-
торые за счет ненасыщенных органических групп способны к
дальнейшей полимеризации.
Силиконы, используемые в технике, получают совместным
гидролизом соответствующих смесей хлоросиланов или эфнров,
которые дают группы двух или более типов М, D, Т или Q.
Продукт гидролиза (CH3JS!C12 представляет собой бесцветное
нелетучее масло, но он неустойчив, так как цепочки оканчива-
ются группами типа D, что делает возможной дальнейшую кон-
денсацию с образованием колец или цепочек большей длины.
Для стабилизации продукта необходимо ввести некоторое ко-
личество групп типа М, например путем совместного гидролиза
(CH3KSi(OC2H5) и (CH3JSi(OC2H5J или (CH3JSiCl2. Однако
при увеличении содержания диалкиленлапов возрастает доля
образующихся циклических соединений Dn; поэтому для полу-
чения нужной смеси более длинных линейных полисилоксанов
(для масел и смазочных материалов различной вязкости) ис-
пользуется прием, заключающийся в выдерживании смеси в
присутствии катализатора. Жидкая смесь метилполисилоксанов,
циклический тетрасилоксан или смесь (CH3KSi0Si (СН3)з с
любым источником группы типа D встряхиваются в течение не-
скольких часов с серной кислотой, что приводит к перегруппи-
ровке с образованием смеси соединений MDXM:
-Si-CH,
I
сн,
м
СН3
H3C-Si-O-
СН3
сн3
-Si-0
СН3
_
м
Прошедшие такую обработку силиконовые масла обладают ря-
дом ценных свойств: устойчивостью к нагреванию и окислению,
хорошими электроизоляционными и водоотталкивающими свой-
ствами. Они находят применение в качестве вакуумных масел
и смазок, водонепроницаемых материалов и растворителей для
23.10. Кремнииорганические соединения, силиконы 113-
красок. Из масел такого типа путем фракционированной ва-
куумной перегонки удалось выделить ряд соединений от M?Dr,
до AhDc,. Синтезированы в чистом виде соединения и других
типов: линейные М2 и соединения от M2D до M2D9, цикличе-
ские от D3 до D9. Последнее соединение удалось получить при
гидролизе (CH3JSiCl2, а также путем деполимеризации поли-
меров диметилсилоксапа большой молекулярной массы. Пере-
группировка в низшие циклические полимеры происходит при
нагревании высших полимеров до 230—240°С при пониженном
давлении и в присутствии NaOH в качестве катализатора. Раз-
деление продуктов осуществляют фракционной перегонкой в
вакууме.
При термическом разложении цепочечных разветвленных
полимеров получаются различные полициклические метилполи-
силоксапы. Ниже в качестве примера (а) приведено строение
молекулы Si5O6(CH3)8 (тип T2D3) [1]. Молекула обладает
приблизительной симметрией 3 (ось показана штриховой лини-
ей); угол Si—О—Si 146° (группы СН3 на схеме опущены).
6
R
Si 0-
-Si
R
О'
Si
О
-Si
О
R 6
¦ I О
'Si [О-
R
Si' o-
-Si
/0'
R
-Si
R
Путем совместного гидролиза можно получить и другие типы
полисилоксанов, например ТМЪ и QDn. Так, при перегруппи-
ровке продукта совместного гидролиза SiCU и (CH3JSiCl2,
протекающей в атмосфере азота при 400—600°С, образуются
спиросилоксаны, в том числе Si5O6(CH3)8 (тип QDi).
Комбинация групп типа Q и Т в соответствующем соотноше-
нии дает силиконовые смолы, способные затвердевать при тер-
мической обработке. Уже говорилось о том, что при полном
гидролизе трифункциональных силанов RSiX3, таких, как
CH3Si(ORK или CH3SiCl3, образуется нерастворимое вещество
(«7-гель») неизвестного строения. Напротив, при частичном
гидролизе, например CH3Si(OC2H5K в бензольном растворе,
выделяется смесь твердых продуктов, из которой путем фрак-
ционной сублимации были получены индивидуальные вещества
с высокими температурами плавления. К числу полиэдрических
силоксанов (О : Si = 1,5) с изученным строением относятся
8-1284
11 4 23. Кремний
(QHsbSigO-.— «кубическая» структура (б) [2], и (С6Н5) i2Sii2O18
[3], в котором атомы кремния располагаются в вершинах поли-
эдра (f4 = /5 = 4) (рис. 3.5).
В сплоксанах, как и в сложных силикатах, атомы кремния
соединены через атомы кислорода. Возможна также их связь
друг с другом через атомы углерода. Были синтезированы не-
которые соединения, в молекулах которых имеются кремпппуг-
леродпые цепочки, например:
) Cl3Si ^ ^С1-
(CH3KSi
(CH3KSk
(СН3J
"СН.
' СН-
,Si(CH3K
Метильные производные получены с помощью реакций типа
(CH3KSiCH2MgCl + (CH3KSiCI > (CH3KSiCH2Si(CH3K
а хлорпроизводпые — при пропускании метиленхлорпда над
сплавом Si—Си (ср. с получением замещенных хлоросилапов,
разд. 23.10.1).
При получении силоксанов из неорганических силикатов
частично сохраняется система связей Si—О исходного силиката.
Измельченный минерал обрабатывают смесью холодной кон-
центрированной НС1, изопропплового спирта и гексаметилдиси-
локсана. Силоксановын слой отделяют и анализируют методом
хроматографии. Тип образующихся триметпл с ил ил произвол пых
соответствует типу кремпекислородной постройки в исходном
силикате. Например, из оливина (ортосилнкат) 70% кремния
переходит в Si[OSi (CH3) 3]i, а из гемиморфита (пиросиликат)
78% кремния выделяется в виде (Me3Si0KSi0Si@SiMe3K и
(Me3Si0KSi0Si@H) @SiMe3J с частичным разрывом исход-
ной системы связей Si—О—Si. В зависимости от последователь-
ности атомов Si и А1 в каркасных алюмосиликатах возникают
различия в строении получающихся из них силоксанов [4].
Литература. [1] Acta cryst., 1975, В31, 1214. [2] Acta cryst., 1979, B35, 2258.
[3] Acta cryst., 1980, B36, 3162. [4] Inorg. Chem., 1964, 3, 574.
23.11. Кристаллические модификации кремнезема
При атмосферном давлении существуют три кристаллические
формы кремнезема, устойчивые в определенных температурных
интервалах:
>¦ 870 °С < ¦
кварц тридимит
1470°С <—
кристобалит
1710 "С (/пл)
23.11. Кристаллические модификации кремнезема 115
Кристаллизация жидкого кремнезема затруднена; обычно при
затвердевании образуется кварцевое стекло, имеющее большое
практическое значение из-за чрезвычайно низкого коэффициента
термического расширения и высокой температуры размягчения
(~1500сС). Стеклообразная форма кремнезема встречается в
природе в виде минерала обсидиана. Три полиморфные формы
кремнезема переходят друг в друга с трудом, на что указывает
сам факт обнаружения всех этих минералов, хотя по сравнению
с кварцем тридимит и крпстобалит встречаются реже. Кроме
того, каждая из трех форм существует в виде низко- и высоко-
температурной модификаций (соответственно а и р), переход
между которыми осуществляется при следующих температурах:
кварц (а—13) 573°С; тридимит (а—р) ПО—180°С, кристобалит
\j,— {•}) 2i8±2°C. Тот факт, что в последних двух случаях пере-
ходы между модификациями удалось изучить при температурах.
!!;>н которых сами полиморфные формы метастабпльны, еще раз
свидетельствует о том, что взаимопревращения трех кристалли-
ческих форм кремнезема затруднены. Структурные соотношения
между кристаллическими формами кремнезема уже обсуждались
i!pii рассмотрении сеток в гл. 3. Все три основные формы —
-згфц, трцдпмит и крпстобалит — построены пз тетраэдров SiOi,
соединенных между собой таким образом, что каждый агом кис-
лорода оказывается общим для двух тетраэдров (это отвечает
составу SiO2); однако взаимное расположение связанных '1етра-
¦-¦дрон в кристаллах трех форм совершенно различно. На рис. 23.20
г структуры представлены в виде упаковки тетраэдров. Раз-
• г;,;е между структурами тридимитп и крпстобалит а соответст-
i./ci различию структур дву.\. модификаций ZnS — вюртнпта п
цинковой обманки. При этом а- и р-модификацип каждой из
трех форм отличаются только в деталях, например небольшим
поворотом тетраэдров друг относительно друга без существен-
ного изменения способа их соединения. Превращение кварца
ii тридимит сопровождается разрывом связей Si—О—Si si воз-
никновением другого способа соединения тетраэдров, вследст-
вие чего этот процесс протекает очень медленно. Напротив, пе-
реход а—>-[5 для кварца, связанный лишь с незначительным'
искажением структуры без какой-либо радикальной перестрой-
ки, является обратимым и легкопротекающим процессом. Кварц
в отличие от других форм диоксида кремния оптически активен.
То обстоятельство, что кристалл левовращающего а-кварца ос-
тается таковым и после его перехода в р-модификацию, допол-
нительно подтверждает, что при этом превращении происходят
¦тишь небольшие изменения в структуре.
Высокотемпературные формы, тридимит и крпстобалит, по
сравнению с кварцем имеют более рыхлые структуры, что видно
"з сравнения их плотностей (г/см3): кварц 2,655, тридимит 2,26,.
8*
(> i'.'i. Кремний
крнстобалнт 2,32. Известны также формы кремнезема, сущест-
вующие при высоком давлении: коэзпт (для которого'обна-
ружены две модификации [1]), кеатит, устойчивый в области
промежуточных давлении между кварцем и коэзитом [2J, и етп-
шовит, образующийся при очень высоких давлениях. В послед-
ней модификации атом Si имеет КЧ 6 (структурный тип рутила-
Si—40 1,76 A, Si—20 1,81 A [3J), тогда как структуры коэзпта
Рис 23.6. Проекция структуры В-кварца. Маленькие темные кружки — атомы
Si. Атомы кислорода расположены на различной высоте над плоскостью ри-
сунка (находящиеся ближе всего к читателю обозначены наиболее толстыми
линиями). Каждый атом с определенной периодичностью повторяется вдоль
нормали к плоскости рисунка выше и ниже ее, поэтому кольца Si3O3 представ-
ляют проекции винтовых цепочек.
и кеатита основаны па 4-связанных каркасах, в которых в слу-
чае коэзита кольца наименьших размеров являются 4- и 8-член-
нымп, а для кеатита —5-, 7- и 8-члешшмн. О строении каркаса
в структуре кеатита см. разд. 3.10.4.
В [3-кварце (рис. 23.6) можно выделить спирали из связан-
ных друг с другом тетраэдров, причем эти спирали могут быть
или все левые, или все правые, и тогда кристалл является лево-
кли правовращающим. Некоторое представление о различиях
между структурами а- и C-модификацнй кварца можно полу-
чить из рис. 23.7, на котором в проекции показано расположение
атомов кремния. Видно, что а-модификация представляет собой
несколько искаженную E-модификацию, но общая схема соеди-
нения тетраэдров друг с другом одинакова.
На рис. 23.8 показаны структуры р-тридимита и |3-кристоба-
лпта, причем атомы кислорода размещены на серединах отрез-
ков, соединяющих пары атомов кремния. Реальное расположе-
ние атомов О отличается от изображенного на этом рисунке, так
что расстояния Si—О равны 1,61 А, а угол Si О Si —144°
23.11. Кристаллические модификации кремнезема 117
(такие же значения в структуре а-кварца [4J). Тетрагональная
структура а-кристобалита образуется при повороте тетраэдров,
показанных на рис. 23.8, б; угол Si—О—Si ~ 147е. Кубическая
симметрия р-кристобалита (в соответствии с которой размещены
Рис. 23.7. Схематическое изображение расположения атомов кремния в В-квар-
це (а) н а-кварце (б).
атомы О на рис. 23.8, б) является статистической, причем крис-
таллы состоят из доменов, в пределах каждого из которых
угол Si—О—Si равен 147° [5, 6].
Для тридимита ситуация более сложная. По-видимому, ме-
нее плотные структуры тридимита и кристобалита при высоких
Рис. 23.8. Идеализированные структуры В-тридимита (а) и Р-кристобалита (б).
Маленькие темные кружки — атомы кремния.
температурах существуют благодаря большой подвижности
атомов. Возможно, что их стабилизация при более низких тем-
пературах обусловлена присутствием атомов других элемен-
тов.
Природные тридимит и кристобалит часто, если не всегда,
содержат в заметных концентрациях посторонние ионы, в основ-
118 23. Кремний
пом щелочных и щелочноземельных металлов [7], что, вероятно,
и обусловливает возможность выделения этих фаз при значи-
тельно более низких температурах, чем соответствующие точки
перехода. По-видимому, из-за переменного состава этих мине-
ралов интервал температур, указываемых для перехода а—р,
довольно широк. Происхождение высокотемпературного триди-
мита, исследованного Гиббсом, неизвестно. Ясно, однако, что
моноклинная модификация, устойчивая при комнатной темпе-
ратуре, претерпевает некоторое структурное изменение при
~107°С. Структурные исследования были проведены для ряда
модификаций низкотемпературного а-тридимита, в том числе
для синтетической моноклинной модификации [8, 9] и для три-
клинной модификации с большой псевдоромбической элементар-
ной ячейкой, содержащей 320 формульных единиц SiCb [10]
(эта модификация, обнаруженная в вулканических породах, со-
держит 99% SiO2> 1% А1 и следы Na, К и Ti). Расстояние Si—О
в эгих структурах —1,61 А, среднее значение угла Si—О—Si
-~ 150°, хотя в обеих структурах встречаются и гораздо большие
значения углов (соответственно 176 и 173°). Выше 180°С три-
димит переходит в ромбическую модификацию, в структуре ко-
торой кажущаяся длина связи Si—О составляет 1.56 А, но после
введения поправки на тепловое движение получается значение
1,61 А [11].
Кроме уже описанных модификаций SiO2 существуют еще-
две каркасные структуры кремнезема, не являющиеся поли-
морфными модификациями в обычном смысле. Во многих к.тат-
ратах, например в клатратпых соединениях мочевины с углево-
дородами, клатратных соединениях р-гидрохинока или в
гидратах газов, определенное расположение молекул «хозяина»
осуществляется лишь в том случае, если во время кристаллиза-
ции присутствуют молекулы (атомы) «гостя», причем прочность
образующегося каркаса оказывается недостаточной для того.
чтобы он сохранялся после удаления «включенного» вещества
(«гостя»). Однако каркг.е из атомов Si и О в соединен'»;:., вклю-
чения, как и в обычных модификациях, обладает значительной
устойчивостью, и после удаления включенных атомов или моле-
кул сохраняется рыхлая структура состава SiO2. Минерал ме-
ланофлогит (черного цвета) был открыт больше векя. пя.'-ад в
серных обложениях, в известняках, насыщенных жидкими
битумными веществами (Сицилия). Исследования последних
двадцати лет [12] показали, что по строению этот минерал
имеет сходство с гидратом хлора (рис. 15.6). После нагревания-
до 1050 °С этот материал, характеризующийся высокой степенью
кристалличности, приобретает кубическую структуру (о=
= 13,4 А), а при комнатной температуре проявляется тетраго-
нальная сверхструктура с удвоенным параметром а. Возможно,
23.11. Кристаллические модификации кремнезема 119
что наличие сверхструктуры связано с присутствием включен-
ных молекул, поскольку нагретое вещество состава SiO2 имеет
к\Стческхю симметрию. Содержимое одной четвертой тетраго-
нальной элементарной ячейки, т. е. кубической «псевдоячейкн»,
.¦. .ответствует формуле 46SiCvC2Hi705 (со следами серы).
Образование подобных структур в природе из растворов SiO2
(KOiopufi довольно хорошо растворим в воде при температурах
>100СС) в присутствии углеводородов было воспроизведено
гидротермальным синтезом «силикалнта» из реакционпоспособ-
ион формы SiO2 в присутствии попов NR4+ (например,
[X (С3Н7L]'") п ОН" при температурах 100—200°С [13]. Это ве-
щество представляет собой форму кремнезема с каркасной
структурой, сходной со структурам;! синтетических цеолитов
7.SM-5 и ZSM-11 (рис. 23.29). В отличие от обычных силикатов
и цеолитов поверхность этого материала является гидрофобной;
по параметрам ячейки этот кристаллический материал очень
близок к цеолиту ZSM-5. Особенность его строения (как и ме-
такофлогпта) заключается в присутствии многочисленных колец
Si:,O-, которые не встречаются в структурах обычных модифика-
ций SiO2 и большинства силикатов. Однако такие кольца обна-
ружены в структурах кеатита и некоторых цеолитов (морденит
и эппстнльбит). В этой структуре из колец Sii0Oi0 формируются
крупные каналы, обусловливающие способность материала
функционировать в качестве молекулярного сита, а также его
каталитические свойства. Размер колец является промежуточ-
ным между размером колец Si8O8 в цеолите А и Sii2Oi2 в фожа-
зите.
•Литератора. П| Z. Kristailogr., 1977, 145, 108; Z. Kristallogr., 1979, 149, 315.
i-| Z. Kristallogr., 1959. 112, 409. Щ Acir: crvst., 1971, Б27, 2133. [41 Acta cryst.,
1976, B32, 2456. [5] Phiiosoph. Mag., 1975, 31, 1391. [6"| Acta crvst., 1976, B32,
2923. 17] Am. Mineral., 1954, 39, (JiK). |o] Acta crvst., 1976, B32^ 2486. [9] Am.
V\incr;'i!oo\, I97i,, Gl. 971. [10] Леи ;rv-i., 1978, B34, 39!. [11| Acta cryst., 1957,
<3, 617. |I2| S;-:c:;co, 1965, 148, 232: Am. Мчкта!., 1972,' 57, 779. [13] Nalurc,
[')'¦:¦. 27!, 512.
23.1 LI. Hano 'ненные структур;)! кремнезема. Это название от-
носится к структурам, в которых способ соединения тетраэдров
такой же, как в одной из модификаций кремнезема, по часть
атомов Si заменена атомами А1, а в пустотах находятся катионы
(обычно щелочных металлов), обеспечивающие электрическую
нейтральность. Пустоты в высокотемпературной модификации
кварца по размеру подходят лишь для размещения ионов Li+
(и, возможно, Ве'2+); однако пустоты в структурах высокотем-
пературных модификаций тридимита и кристобалита могут
включать крупные ионы щелочных металлов (табл. 23.1). Далее
будет рассмотрена обычная модификация LiAlSi2O6 (минерал
сподумен), в структуре которой имеются метасиликатные цепоч-
120 23. Кремний
Полиморф-
ная моди-
фикация
кремнезема
Кварц
Тридимит
Кристобалит
Кеатит
и кварц
Таблица 23.1. Заполненный стр\
Заполненная с i р\ к i ура
кремнезем.i
а- и (:S-LiAlSiO4 (эвкриптнт)
KAlSiO4 (калсилит)
KNa3Al4Si4016 (нефелин)
ВаА12О4
K(LiBeF4)
NaAlSiO4 (высокотемператур-
ный ка])негиит)
Na,BcSi2O6
CsLi\YO4
LiAlSi,O6
ктурь
Act a
217
Ada
Acta
Act a
ДАН
Acta
Acta
крем
cryst.
4
cryst.,
cryst.,
cryst.,
CCCI
cryst.,
cryst.,
ic.u'.Ma
Литература
, 1972, B28. 2168
1948, 1, 42
1972, B28, 12-11
1972, B28, 1383
\ 1956, 108, 1077
1980, B36. 657
1971, B27, 1132
kii; это один из пироксепов с моноклинной симметрией. При
термической обработке стекол с таким составом образуется
кристаллическое вещество со структурой заполненного (З-кварца
или кеатита. В сподумене, формулу которого следует представ-
лять в виде LiAl (Si2O6), ионы Li+ и А13+ находятся в позициях
с октаэдрической координацией между бесконечными цепочеч-
ными анионами. Формула заполненной формы кремнезема
L1 (AIS12O6) показывает, что атомы А1 и Si имеют тетраэдриче-
скую координацию в каркасной структуре, в целом похожей
по строению на кремнезем.
23.12. Силикаты
Земная кора почти полностью состоит из силикатов и кремне-
зема; эти минералы составляют основу всех горных пород и
продуктов их выветривания, почвы, песка и глины. Все неорга-
нические строительные материалы, начиная от горных пород
(например, гранит) и кончая искусственными материалами
(кирпич, цемент, строительный раствор), а также различная ке-
рамика и стекла являются силикатами. Руды металлов и дру-
гие несиликатные минералы составляют лишь незначительную
часть массы земной коры. В табл. 23.2 приведен средний состав
литосферы по Гольдшмидту; для сравнения указан и состав
гидросферы. Видно, что более чем 9/10 объема земной коры при-
ходится на долю кислорода. В структурах многих силикатов
осуществляется плотнейшая упаковка атомов кислорода (кото-
рая может быть искаженной), тогда как ионы более электропо-
ложительных элементов (почти все они меньше по размеру, чем
ионы кислорода) располагаются в пустотах этой упаковки.
23.12. Силикаты 121
Таблица 1
Литосфе
Элемен г
Si
\1
\ \ o-
С а
' \ :i
!¦¦
I'a.uiye aro-
c ..
ма. Ad
1,32
0,39
0,57
0,82
0,78
1,06
0,98
1 ,33
0,64
>3.2. Соста
в литосферы
ia
Содержа!!!
масс. %
46,59
27,72
8.13
5,01
2,09
3,63
2,85
2,60
0,63
ат. %
62,46
2! ,01
6,44
1,93
1,84
1 ,93
2 66
1,43
0,28
об. %
91,77
0,80
0,76
0,68
0,56
1 ,48
1,60
2,14
0,22
гидросферы
Ги.
Элемен г
О
it
а
\а
. . \ ц"
(.'.а
к
росфсра
Содержание,
масс. %
85,89
10,80
1 ,93
1,07
0,13
0,09
0,04
0,04
Все др\
Hi их
гпе элементы присутствуют в еще мень-
%о.шчествах
Содержание всех других
элементов составляет
< 0,0 По
а Величины ионных радиусов несколько отличаются от приведенных в гл. 7, по-
скольку Гольдшмидт в основу расчетов положил значение радиуса О2^, рашюе 1,32 А.
В гл. 7 уже обсуждалась взаимосвязь, существующая между
отношением радиусов и координационным числом. Здесь мы
приведем лишь наиболее часто встречающиеся координацион-
ные числа (по кислороду) ионов, обычно присутствующих в си-
ликатах (менее характерные координационные числа взяты в
скобки):
Ве2+ Li+ A13+ Mg2+ Fe2+ , Ti4+ Na+ , Са2+ К+
4 4 F) 4, 6 D) 6 6 6 (8) 6^-12
Поскольку имеется ряд близких по размеру ионов, которые
могут занимать пустоты одного типа (например, октаэдриче-
ские, К.Ч 6), а в расплавах или растворах, из которых крис-
таллизуются минералы, всегда присутствуют атомы многих
элементов, для силикатов характерно изоморфное замещение.
Поэтому силикаты редко имеют «идеальный» состав, соответст-
вующий индивидуальному химическому соединению. Наиболее
важным и широко распространенным видом замещения являет-
ся замена атомов Si в тетраэдрической координации атомами
А1, так что большинство природных «силикатов» на самом деле
являются алюмосиликатами. Этот вид замещения обязательно
сопровождается включением в состав минерала катионов с тем,
чтобы скомпенсировать заряд кремнекислородпого аниона. То
обстоятельство, что атомы А1 могут также занимать в алюмоси-
ликатах п позиции с октаэдрической координацией, затрудняло
в свое время интерпретацию полученных аналитических формул
минералов, пока это двойственное поведение атомов А1 не было
122 23. Кремний
установлено в результате рептгепоструктурных исследований.
Почти во всех природных силикатах анионы построены из
тетраэдрических групп (Si, A1)O4. В гидратированных силика-
тах кристаллизационная вода присутствует в виде молекул Н2О,
окружающих катионы. Существуют, однако, гидроксосиликаты.
в структурах которых имеются ионы [SiO3(OH)]3~ или
[SiO2(OHJ]2~. Структуры этих соединений обсуждаются ниже
перед рассмотрением строения важнейших классов силикатов.
23.12.1. Гидроксосиликаты. Кроме силикатов, содержащих анно-
ны, построенные из групп SiO4, известны также гидроксосплика-
ты щелочных и щелочноземельных металлов с аннонами
[SiO3(OH)]3~ или [SiO2(OHJ]2". Натриевые производные могут
быть получены кристаллизацией при комнатной температуре из
смесей Na2O, SiO2 и Н2О, помещенных в запаянные пластмассо-
вые сосуды. Эти соединения неустойчивы к действию СО2, не-
которые из них гигроскопичны, другие высокогидратированмые
соединения теряют кристаллизационную воду, образуя гидраты
с меньшим количеством гидратной воды. Серия гидратироваи-
ных натриевых производных с брутто-составом Xa2Si03- E, 6,
8 и 9)Н2О в действительности соответствует гидроксосиликатам
Na2SiO2(OHJ-D, 5, 7 и 8)Н2О. Во всех структурах этих соеди-
нений присутствуют ионы типа а [1]. В силыюгигроскоппчиом
Na3HSiC>4-2H2O [2] имеются цепочки из связанных водородными
связями групп SiO4H (б); в структуре Na3HSiO4-5Ho'o [3]
анионы соединены в пары водородными связями (см. строение
анионов SO4H^ в KHSO4, разд. 8.5.3). Ион SiO3(OHK~ при-
сутствует также в структурах NaCa[SiO>(OH)] [4]
Ca3[SiO3(OH)]2-2H2O [5] и Ca2[SiO3(OH)]OH [6]. По-видимо-
му, гидроксосиликаты играют важную роль при затвердевании
портланд-цемента (разд. 23.12.3).
Литература. [1] Acta cryst., 1976, В32, 705. [2] Acta crysl, 1979, B35 3024
[31 Кристаллография, 1973, 18, 173. [41 Ada cryst., 1974, B30, 864 [51 \cta
cryst., 1976, B32, 475. [6] Acta cryst., 1952, 5, 724.
23.12.2. Классификация структур силикатов. В структурах сили-
катов соединение групп SiO4 или (Si, A1)O4 осуществляется
только через вершины (лишь в случае волокнистого кремнезема
23.12. Силикаты 123
[1] предполагается соединение тетраэдрических групп ребрами,
однако такой тип соединения в силикатах не обнаружен). Длина
«обычной» связи Si—О —¦ 1,62 А, но в зависимости от числа и
типа катионов, связанных с атомами кислорода, возможны из-
менения в пределах 1,54—1,70 А. Предложено эмпирическое
уравнение [2]:
d(Si—О, А) = 1,44 + 0,09/;
где /' — суммарное валентное (электростатическое) усилие свя-
зен катионы — кислород (по Полипгу). Замещение атомов Si
па А1 приводит к удлинению связей в тетраэдрических группах
максимально до 1,72 А для А1О4.
Важным параметром в структурах кремнезема и силикатов
является величина угла Si—6—Si, которая может меняться
в широких пределах (до 180° в структурах тортвейтита
(разд. 23.12.4) и ряда других силикатов и в модификациях
кремнезема [3]), по типичное значение — 145°. (В коэзите боль-
шая часть углов Si—О—Si находится в интервале 137—150°, но
у некоторых атомов О координация линейная.) Поскольку ато-
мы О в структурах не всегда упакованы достаточно плотно,
а расстояния Si—Si во многих силикатах (и во многих других
соединениях, в которых атомы Si связаны через атомы О илиМ)
обычно близки к 3,06 А, возникло интересное предположение
о том, что особенности геометрии соединенных через вершины
групп SiO4 определяются в большей степени контактами Si—Si
и Si—О, чем контактами О—О [3, 4, 5].
В связи с тем что тетраэдры (Si, А1)О4 соединяются только
вершинами, удобно первую грубую классификацию структур
силикатов провести в зависимости от числа обобществленных
вершин. В ортосиликатах присутствуют изолированные ионы
(SiO4L~. При наличии дополнительных ионов О2" возможно
увеличение отношения О : Si до значений, больших чем 4. Такая
ситуация встречается, например, в структуре Sr3Si0s [6], кото-
рая по строению очень схожа с Cs3CoCl5. При наличии общих
атомов О между тетраэдрами SiO4 происходит понижение от-
ношения О : Si. Наиболее простые структуры получаются, если
все тетраэдры SiO4 обобществляют одинаковое число вершин.
Литература. [11 Z. anorg. allgcm. Chem., 1954, 276, 95. [21 Am. Mineral., 1971,
56, ]:,:?>. [3] Acta cryst., 1980, B36, 2198. [41 Acia cryst., 1977, A33, 924. [5] Acta
cry<;t., 1978, B34, 27. [61 Acta cryst., 1965, 18, 453.
а) У каждой группы SiO4 обобществлен один атом О, что
приводит к образованию пиросиликатного иона Si2O76~.
б) В каждой группе SiO4 обобществлены два атома О, что
отвечает формированию замкнутых колец или бесконечных це-
почек, например:
124 23. Кремний
(К
0"
"Si
0.
. о.
/
0
Si If"
i
,0
\
0
/0
о о
\ /
Si
о о
\ /
Si
о
о
а также более крупных колец и
Si
/ \
о о
Si
\
о
Формула таких комплексов—• EЮз)и2п~.
в) В каждой группе SiO4 обобществлены три атома О, что
приводит к составу (Si2O5)n2n~. Это могут быть конечные или
бесконечные в одном, двух или трех измерениях структуры, как
показано в гл. 3 для 3-связанных систем и в табл. 5.2 конкретно
для тетраэдров, соединенных через три вершины.
г) Обобществление всех вершин каждого тетраэдра SiO4
приводит к образованию либо бесконечных трехмерных карка-
сов, как это происходит в различных модификациях кремнезема,
либо двойных слоев. Если некоторые из aiомов Si замещены
атомами А1, каркас (всегда состава (Si, A1)O2) оказывается
отрицательно заряженным, что требует внедрения в пустоты
структуры положительных ионов. Позднее будут рассмотрены
структуры полевых шпатов и цеолитов — наиболее важных
классов алюмосиликатов с трехмерными каркасами. Другой
способ соединения тетраэдров (Si, A1)O4 через все вершины
приводит к образованию двойных слоев, например в гексаго-
нальных модификациях CaAl2Si208 и BaAl2Si208. Различная
степень замещения кремния алюминием иллюстрируется фор-
мулами следующих минералов:
Отношение Si: Al
Различные модификации кремнезема SiO2 со
Ортоклаз K(AlSi3O8) 3:1
Лнальцнт Na (AlSi2O6) • Н20 2 • 1
Патролит Na2(Al2Si3OI0)-2H2O 3:2
Анортит Са (Al2Si208) 1:1
Предложенная выше классификация силикатов включает
лишь те комплексы Si^Oy, для которых отношение обобщест-
вленных и необобществленных (т. е. мостиковых и концевых)
атомов кислорода одинаково для всех атомов Si, а именно:
3
2
1
концевых,
концевых,
концевой,
1
2
3
4
мостиковый
мостиковых
мостиковых
мостиковых
Si2O7
SiO3
Si2O5
SiO,
23.12. Силикаты 125
SiO4
Эта топологи-
может возникнуть
76~
ионы, промежуточные между Si2O76
за счет объединения цепочечных
Возможны и другие структуры, в которых соотношения конце-
вых и мостиковых атомов кислорода в координационном окру-
жении различных атомов кремния неодинаковы.
ческая неэквивалентность тетраэдров
в комплексах следующих типов:
1) полиядерные ионы, промежуточные между Si2O76~ и це-
почкой (SiO3Ol2™-;
2) ионы, образованные
ионов (ленты);
3) сложные слои;
4) каркасы, в которых тетраэдры SiO4 обобществляют раз-
ное число вершин.
Полиспликатные ионы первого типа, аналогичные Р3Ок'°~
и S3Oi02~, встречаются очень редко. Группы Si3Oi0 можно вы-
делить в ардениите — редком силикате мышьяка и ванадия [1],
а также вместе с ионами SiO44^ в H4(Si3Oi0) (SiO4) [2].
Группировки (Si5Oi6) из пяти тетраэдров SiO4, состоящие из
центрального тетраэдра, соединенного через вершины с четырь-
мя другими, обнаружены в сложной структуре зунпита
Ali3F2(OH, F)i6Si5O20Cl [3]. Эту структуру можно представить
как состоящую из групп SisOi6, группы А104 и комплекса из
А1-октаэдров, который при «вычленении» его из структуры
должен был бы иметь состав А112О16(ОНK0 (интересно, что КЧ
атома А1 6 — октаэдр). Однако в более простых силикатах изо-
лированная группа Si5Oj6 не встречается, хотя известен струк-
турно схожий ион (PCr4Oi6K^ (разд. 19.6.10). Попутно отметим,
что комплекс Ali2Oi6(OHK0, как и изомеры PWi2O4G
(разд. 11.6.2), можно составить из четырех групп, содержащих
по три сочлененных по ребрам октаэдра, но углубления, имею-
щие тетраэдрическую форму, направлены не наружу, а внутрь
комплекса. Поскольку каждая группа A3Xi3 имеет не по 6, а
по 3 общих с другими группами атома X, получается состав
А!2Х46 в отличие от изомерных структур Кеггииа с формулой
Ai2X4o.
Сложные цепи (ленты) второго типа могут образоваться при
объединении вершин тетраэдров двух или более приложенных
друг к другу простых цепей. Тип получающейся цепи зависит
от относительной ориентации соседних тетраэдров в простых
цепях, что показано на рис. 23.12, г—е. Например (рис. 23.12),
две простые цепи типа б дадут двойную цепь типа д, а при
соединении m простых цепей состав сложной цепи отвечает фор-
муле Si2mO5m+i. Предельный состав цепи — Si2O5, поскольку
такие цепи являются фрагментами гексагонального слоя состава
Si2O5. При т = 2 получаются цепи Si4On (рис. 23.12, д). Цепи
с т = 3, 4 и 5 соответствуют анионам соединений Ba4Sis0i6,
Ba5Si802i и Ba6Siio026 [4]. Двойные и тройные цепи такого типа.
126 23. Кремний
а также их комбинации обнаружены в ряде минералов [5]. Как
н в случае пироксепов и амфиболов с простыми и двойными це-
пями соответственно (разд. 23.12.6), существуют два ряда соеди-
нений (ромбической и моноклинной симметрии), у которых один
из параметров решетки зависит от ширины сложной цепи. На-
пример, в ряду ромбических соединений а~18 А, с~5,2 А,
тогда как параметр b меняется:
Тип цепи Ь, А Примеры
т= \ 9 Пироксен (энстатит MgSiO3)
Ш---2 18 Амфибол (антофиллит,
Mg7SisO,2(OHJ)
'«==3 27 (,\\g, Fc)io.Sii,(),,(OHL
m-2 и m-3 45 (Mg, FeI7SiooOS4(OH)e
Похожие сложные цепи были обнаружены при исследовании не-
фрита методом электронной микроскопии высокого разреше-
ния [6].
Ниже дан пример более сложного слоя третьего типа, в ко-
тором две трети тетраэдров SiO4 обобществляют по 3 вершины,
а остальные по 4, что приводит к формуле Si3O7 (разд. 23.12.7).
Каркас четвертого типа реализуется в структуре нептунита
(разд. 23.12.8).
Приступим теперь к описанию важнейших структур силика-
тов по группам:
1) ортосиликаты, содержащие изолированные ионы SiO44~
2) силикаты с ионами Si2O76~;
3) силикаты с циклическими ионами (SiO3),,2n-;
4) силикаты с цепочечными структурами (пироксены и ам-
фиболы) ;
5) силикаты со слоистыми структурами (глинистые минера-
лы и слюды);
6) силикаты с каркасной структурой (полевые шпаты и
цеолиты).
Здесь необходимо заметить, что хотя для удобства мы при-
нимаем классификацию, базирующуюся на рассмотрении крем-
некислородного мотива, в действительности во многих случаях
при классификации рассматриваются комплексы типа
(Al, Si)—О, т. е. алюмокремнекислородпый мотив. В особенно-
сти это касается слоистых структур, где обычно часть кремния
замещена на алюминий, и каркасных структур, в которых замена
части Si на А1 приводит к возникновению на каркасе некоторого
заряда. В связи с этим было бы логично рассматривать как
возможную часть комплекса не только алюминий, но и другие
ионы с тетраэдрической координацией, например ионы следую-
щих элементов:
Li Be В
(Na Mg) Al Zn Ga Ge
23.12. Силикаты \2Т
Например, тетраэдрическая координация как Si, так и Li
осуществляется в Li2Si03 [7] (сверхструктура ВеО или ZnO),
что отражает формула (Li2Si)O3. Аналогично тетраэдрическую
координацию в фенаките Be2Si04 имеет и Be и Si, и поэтому
более логично представлять это соединение как трехмерную'
каркасную структуру М3О4, а не как ортосилнкат (в пользу это-
го свидетельствует и тот факт, что такую же структуру имеет
Ge3N4). В структуре гемиморфита (разд. 23.12.4) содержатся
группы Si2O7, однако в результате тетраэдрической координации
и Zn, и Si образуется трехмерный каркас. Приведем также дру-
гие примеры, когда трехмерный каркас образуется с участием
кремния и ионов одного из вышеназванных элементов:
Rb2[Be2SioO7] (разд. 23.12.4); берилл Al2[Be3Si60i8] (разд. 23.12.5);.
мнларит (разд. 23.12.8); Na2[ZnSi308] (разд. 23.12.8); гельвпт и
гугтупит (разд. 23.12.8) и ларсенит Pb[ZnSiO4] [4].
В минералах семейства мелилита (разд. 23.12.4) имеются
слои, в которых тетраэдры ХО4 обобществляют все 4 вершины,
а тетраэдры YO4 — только 3, что дает состав слоя XY2O7, напри-
мер в Ca2(Si2Mg07) или в Ca2(Al2Si07). Наконец, один и тот
же тип слоев Х2О5 реализуется в минералах джиллеспите
BaFe(Si4Oio), датолите Ca(BSiO4OH) (разд. 24.7.6), гердерпте
Ca(BePO4F) и гадолините FeY2(Be2Si2Oi0) [9].
Следует также отметить, что в некоторых случаях тип крем-
некислородного комплекса не является наиболее существенной
характеристикой структуры кристаллического силиката. При
превращении монокристалла одного силиката в другой с близ-
кой структурой (например, при нагревании) иногда легко осу-
ществляется перестройка кремпекислородного комплекса без
изменения системы связей катионов с кислородом [10]. Так, при
переходе родонита (разд. 23.12.6) в p-CaSiO3 происходи!' пере-
мещение атомов Si, так что цепочки типа 57 преобразуются в
цепочки типа ЗТ, которые к тому же оказываются вытянутыми
в другом направлении. При этом смещение ионов большего раз-
мера (особенно О2~) невелико; оно даже меньше, чем смещение
цепочки типа ЪТ при скручивании вокруг собственной оси. Ана-
логичная ситуация наблюдается при превращении ксопотлита
в волластопит путем дегидратации; об этих структурах см.
разд. 23.12.6.
Литература. [11 Ada cryst., 1968, В24, 845. [2| Naturwiss., 1972, 59, 35. [31 Ada'
cryst., 1960, 13, 15. [4| Z. Kristallogr., 1980, 153, 3. [51 Science, 1977, 198, 359.
[61 Chem. Comra, 1977, 910. [7] Acta cryst., 1977, B33, 901. [8| Z. Kristallogr..
1967, 124, 115. [9] Кристаллография, 1959, 4, 324. [10] Acta cryst., 1961, 14, 8, 18.
23.12.3. Ортосиликаты. В структурах ортосиликатов содержатся
ионы SiO44~, а катионы занимают пустоты, причем число окру-
жающих ионов О2~ зависит от размера катиона:
128 23. Кремний
Bc2Si04 (фенакит)
(Мц, Fc):SiO4 (оливин)
ZrSiO., (циркон)
КЧ атома М
4
6
Структура фенакита обсуждалась в гл. 3 при рассмотрении
C, 4) -связанных сеток.
Гранаты — это группа ортосилпкатов с общей формулой
R,liKLv11(SiO4K, где Rn = Ca-+, Mg-';" или Fe- ¦', a RU1=AP-, Сг!/>-
О
Рис 23.9. Проекции струк-
тур Mg2Si04 (а) и Mg(OHJ
(б). Маленькие темные
кружки атомы Si, заштри-
хованные кружки — атомы
Mg, светлые кружки — ато-
мы О. а — тетраэдры SiO4
расположены на различной
высоте относительно пло-
скости рисунков (показано
линиями различной толщи-
ны); б — изображены связи
Mg—ОН (слева) и октаэд-
рпческая координационная
группа (справа).
или Fe:!+. Примерами могут служить гроссуляр Ca3Al2(Si04K
уваровит Ca3Cr2(Si04K, андрадит Ca3Fc2(Si0,),. Структура
граната, в которой R11 и R"i имеют КЧ по кислороду 8 и 6 со-
ответственно, подробно описана в гл. 13. Синтетический пироп
cociaea Mg3Al2Si30i2, образующийся при высоком чавлешш
интересен тем, что в его структуре осуществляется восьмерная
о°п°пР^ИНация Mg2+ (искажепный куб: 4 атома О на расстоянии
2,20 А и 4 атома О на расстоянии 2,34 А) [1].
Структуру оливина можно описать либо как совокупность
ионов SiO44- и Mg2+, либо как систему почти плотпоупакован-
ных атомов О с атомами Si в тетраэдрических пустотах и ато-
23.12. Силикаты 129
мами Mg (или Fe) в октаэдрических. Идеализированная (ГПУ)
структура показана в проекции на рис. 23.9, а. На рис. 23.9, б
приведена проекция слоя структуры Mg(OHJ. Благодаря сход-
ной упаковке атомов кислорода в этих двух структурах их
фрагменты могут «срастаться» друг с другом, образуя ряд ми-
нералов с общей формулой m[Mg2Si04J -n[Mg(OHJJ—так на-
зываемую группу хондродита. При сравнении горизонтальных
рядов атомов на рис. 23.9, а я б можно видеть, что они двух
типов — х и у, причем в ряду х содержатся атомы Mg и О,
а в ряду у —Mg, О и Si. В брусите Mg(OHJ все ряды типа х;
в оливине ряды типа х и у чередуются. В минералах группы
хондродита возможны различные последовательности рядов:
Повторяющиеся слои
хху
ху хху
ху ху хху
ху ху ху хху
Минерал
Норбергит
Хондроднт
Гумит
Клиногумит
Состав
Mg,SiO4-Mg(OH),
2MSiOM(OH
Kg()
3Mg2Si04-Msr(OH)o
4Mg2SiO4-MK(OH),
Для соединения состава Al2Si05 известны три полиморфные
модификации — кианит, силлиманит и андалузит. В структурах
каждой из этих модификаций одна половина атомов А1 имеет
КЧ 6, а другая — КЧ 4, 5 и 6 (соответственно в силлиманите,
андалузите и кианите). Последняя модификация является наи-
более плотной, причем атомы кислорода образуют кубическую
плотнейшую упаковку. Подобно тому как строение минералов
ряда хондродита тесно связано со структурами оливина и бру-
сита, более сложный по составу минерал ставролит с идеализи-
рованной формулой HFe2Al9Si4O24 близок по структуре к киани-
ту. На рис. 23.10 показаны в проекции две элементарные ячей-
ки структуры ставролита; штриховыми линиями выделены эле-
ментарные ячейки структуры кианита. Видно, что блоки струк-
туры кианита разделены за счет внедрения атомов Fe и А1 [2].
К соединениям со структурой типа хондродита относятся также
Mn5(SiO4J(OHJ [3] и А14Со(ВО4JО2 (модификация высокого
давления) [4].
Намного более высокое отношение О : Si обнаружено в
Fe7SiO10, извлеченном из заводской печи для плавления стали.
В кубической плотнейшей упаковке атомов О атомы Si занима-
ют тетраэдрические пустоты, 5/7 общего числа ионов железа
(Fe2+) находятся в октаэдрических пустотах, остальные ионы
железа (Fe3+) распределены поровну между тетраэдрическими
и октаэдрическими пустотами [5].
Портланд-цемент. Рассмотреть здесь портланд-цемент будет
весьма уместно, поскольку его важнейшей составной частью
являются ортосиликаты. Этот материал получают прокаливани-
ем смеси мелко размолотого известняка или мела с глиноземом
9-1284
130 23. Кремний
или глинистым сланцем, используя в качестве топлива для на-
гревания уголь, нефть или газ. В состав портланд-цемента вхо-
дят СаО F0—70%), SiO2 A7-25%), А12О3 C—8%) и в не-
больших количествах некоторые другие компоненты, которые
могут оказывать существенное влияние на его свойства. К наи-
более важным соединениям, образующимся в портланд-цементе,
относятся Ca2Si04, Ca3Si05 [6], Са3А12О6 и Ca2AlFe05. Изучение
фазовых диаграмм показало, что
трикальциевый силикат устойчив
только при температурах 1250—
1900°С, а вне этого интервала он
разлагается па СаО и Ca2Si04, хотя
иногда остается в метастабпльном
состоянии при быстром охлажде-
нии до комнатной температуры.
У Ca2SiC>4 имеются 4 полиморфные
модификации, из которых две высо-
котемпературные формы (а' и а)
изоструктурны C- и a-K^'SCU соот-
ветственно. Важным отличием меж-
ду полиморфными модификациями
является различная скорость их
гидратации. 7'Моднфикация со
структурой оливина [7] довольно
инертна к воде, поэтому ее присут-
ствие в цементе нежелательно
(прочность цемента обусловлена
взаимным прорастанием кристал-
лов продуктов гидратации). Напро-
тив, метастабильная при обычных
температурах E-модификация, будучи тонко размолота и сме-
шана с водой, превращается в твердую массу [8].
Структурные исследования соединений, содержащихся в
портланд-цементе, и продуктов их гидратации направлены на
выяснение механизма схватывания цемента (взаимодействия
с водой). p-Ca2SiC>4, Ca3Si05 и Са3А12Об наиболее активно
связывают воду и образуют устойчивые продукты гидратации.
Это могут быть гидратированпые силикаты, «алюминаты» и бо-
лее сложные соединения, содержащие ионы SO42~, которые воз-
никают в системе благодаря добавкам гипса (что позволяет
регулировать время схватывания). Среди гидроксосиликатов
следует назвать афвиллит Ca3(SiO3OH)-2Н2О [9] (разд. 23.12.1)
и а-гидрат дикальциевого силиката Ca2(SiO3OH)OH [10],
в структурах которых присутствуют тетраэдрические ионы
SiO3(OHK~~, где группа ОН непосредственно связана с ато-
мом Si.
23.12. Силикаты 131
Si
О
А1
©
Fe
О
О
Рис. 23.10. Связь между
структурами ставролита
HFe2Al9Si4O24 и кианита
AI2SiO5.
В структуре Са3Л12О6 [11] имеются кольца из шести тетра-
эдров А1О4 (А1—О 1,75 А), а в метастабильном Ca5Al6Oi4 [12]
присутствуют слои, состоящие из колец, образованных пятью
тетраэдрами А1О4 (см. структуру мелилита, разд. 5.2.1 и
23.12.4); однако продукты гидратации построены из октаэдри-
ческих групп А1(ОНN. Они могут присутствовать в виде изоли-
рованных групп (например, в Ca3Al2(OH)i2, разд. 14.2) в виде
пар, соединенных по ребру (в Ва2[А12(ОН)ю], разд. 14.2), или
в виде групп из четырех октаэдров, которые присутствуют в
Ba2[Al4(OH)i6] (рис. 5.8, з) [13]. Было отмечено, что для твер-
дого состояния эти группы не обязательно являются наиболее
устойчивыми структурами, реализующимися при определенном
отношении М^: А13+, хотя в растворах они действительно при-
сутствуют в виде частиц конечного размера. Так, в двух моди-
фикациях Ва[А1О(ОНJ]2 предпочтительными оказываются це-
почки, где отталкивание А13+—АР+ менее сильное [14]:
ОН ОН ОН ОН
AI
ОН ОН
\
Литература. [1] Am. Mineral., 1965, 50, 2023. [2] Acta cryst., 1958 11, 862.
[3] Z. Kristallogr., 1970, 132, 1. Щ Acta cryst., 1975, B31, 2440. [5| Acta cryst.,
1969, B25, 1251. [6] Кристаллография, 1975, 20, 721. [7] Acta cryst 1971, B27,
848. [81 Acta cryst., 1977, B33, 1696. [91 Acta cryst., 1952, 5, 477. [10] Acta cryst.,
1952, 5, 724. [11] Acta cryst., 1975, B31, 689, 1169. [121 Acta cryst., 1978, B34,
1422. |131 Acta cryst., 1972, B28, 519. [141 Acta cryst., 1972, B28, 760.
23.12.4. Силикаты, содержащие ионы Si2O76- (диортосиликаты).
Выше мы уже отмечали, что, основываясь на структурном под-
ходе, логично рассматривать одновременно все входящие в
структуру атомы с тетраэдрической координацией, а не ограни-
чиваться выделением группировок Si^O^, представляющих собой
чисто силикатные ионы. При втором способе рассмотрения к
простым пиросиликатам (т. е. диортосиликатам) относятся
только редкие минералы тортвейтит Sc2Si207 [1], барисилит
MnPb8(Si2O7K И и пиросиликаты 4/-элементов общей формулы
M2Si207 [3J. Пиросиликаты вызывали значительный интерес в
связи с тем, что в их структурах углы Si—О—Si меняются в
широких пределах. Пиросиликаты 4/-элементов в зависимости
от размера иона М3+ кристаллизуются в одном (пли несколь-
ких) из четырех структурных типов:
132 23. Кремний
23.12. Силикаты 133
(La) Се Ей
КЧ
Gd Tb Dy
Tm Yb Lu Sc
структурный тип
icpmBGU. тигле/-
В структурах этих соединений углы Si—О—Si меняются в ши-
роких пределах: 180° (Sc, Yb), 159° (Gd) и 133° (Nd). Очевид-
но, что строение иона Si2O76~ сильно зависит от его окружения.
Существуют также минералы, содержащие как ионы SiO44-r
так и Si2O76~ (ортодиортосиликаты):
Везувиан Ca10Al4(Mg, FcJ(Si2O7J(SiO4M(OHL [4|
Эпидот Ca2FeAl2(SiO4)(Si2O7)O(OH) [51
В структурах других минералов группы Si2O7 можно рас-
сматривать как часть более сложных тетраэдрических систем,
в которых крупные катионы имеют КЧ 8 (мелилит, данбурит):
Строение тетраэдриче-
ской системы
Тип мелилпта Ca2(MgSi207) Слои ЛяХ-
Гемиморфит [Zn4Si2O7(OHJlH2O Каркас Л,Х3
Данбурит Ca(B2Si208) Каркас ЛХ2
Несмотря на то что чисто формально некоторые минералы
группы мелилита можно отнести к пиросиликатам (так как в
их формулах имеются сочетания Si2O7), основной особенностью
их структур является наличие слоев состава А3Х7 (разд. 5.2.1).
В тетраэдрических позициях могут находиться атомы Si, Al, Be,
Mg и Zn в различных комбинациях, причем слои не всегда име-
ют состав MSi2O7, например геленит Ca2(Al2Si07), Y2(Be2Si07)
и Са2>5(А13О7) (разд. 5.2.1).
Гемиморфит, важная цинковая руда, представляет интерес
как пример установления правильной структурной формулы ми-
нерала в результате рентгеноструктурного исследования. Перво-
начально формулу этого минерала записывали в виде H2Zn2Si05.
Однако половина атомов водорода входит в состав молекул во-
ды, которые могут быть удалены из кристалла при умеренном
нагревании без потери его формы и прозрачности. Дальнейшее
удаление воды при температурах >500°С приводит к разруше-
нию кристалла. Все эти факты находятся в соответствии со
структурной формулой Zn4(OHJSi2O7-H2O [6]. Структуру можно
рассматривать как построенную из тетраэдров ZnO3(OH) и
SiO4, каждый из которых сочленяется через три вершины с об-
разованием слоев, показанных на с. 133.
Эти слои посредством связей Si—О—Si и Zn—ОН—Zn объ-
единяются в трехмерный каркас (Si—О—Si 150°). Здесь просле-
,0.
Zn'
,0.
/Zn
/ОН
4 Si'
I ¦
О
О,
-он
О
,0.
Zn
-он
О
1 -он
живается близкое сходство со структурой Si2N2O, что можно ви-
деть из сопоставления формул
Si4 Si2 N6
Zn4 Si2 06
О
о
o2
@HJ
и сравнения с рис. 23.5. Молекулы воды в структуре гемимор-
фита располагаются в каналах каркаса (см. также структуру
данбурита в разд. 23.12.8).
Структура Rb2Be2Si207 [7] интересна как пример плоской
треугольной координации атома Be, а также как пример кар-
каса, включающего и атомы Be, и атомы Si. Группы Si2O7
(Si—Омоет—Si 171°) соединены через атомы Be, каждый из
которых связан с концевыми атомами О трех различных групп
Si2O7; при этом образуется трехмерный каркас. Поскольку каж-
дый атом Be связан с тремя группами Si2O7, а каждая такая
группа имеет 6 концевых атомов О, состав каркаса отвечает
формуле Be2Si207. В этом каркасе ионы Rh+ заключены в круп-
ные пустоты; каждый из них окружают 13 или 14 атомов "о.
Литература. [1] Acta cryst., 1962, 15, 491; Кристаллография, 1973 17 749
l^lCryS1966' 20' 357- [31 Acta сгУз1' 1970' В26- 484- W Z kitll;
23.12.5. Силикаты, содержащие циклические ионы (SiO3)n2"~
(кольцевые силикаты). Существование в минералах ионов
S13O9 и Si6Oi812- было установлено давно. Первый из этих
ионов обнаружен в бепитоите BaTiSi3O9 и катаплеите
Na2zrsi3o9-2H2O, второй —в берилле (изумруде) Be3Al2Si60,s
14, Диоптазе Cu6Si6Oi8-6H2O [2] (первоначально его считали
ортосиликатом CuH2Si04) и турмалине (Na Ca)-
(Li, AlKAl6(OHL(BO3KSi6O18 [3]. Структуры бенитоита и
оерилла в целом сходны, в чем можно убедиться при сравнении
134 23. Кремний
23.12. Силикаты 135
проекций структур на рис. 23.11. В этих структурах циклические
ионы располагаются слоями, причем плоскости колец и слоев
параллельны. Однако структуры не являются слоистыми, как
можно было бы предположить из вида проекций, так как атомы
металла, находящиеся между слоями, объединяют анионы, ле-
жащие на различной высоте. В BaTiSi3O9 ионы Ti4+ и Ва2+
имеют КЧ 6 (расстояния Ва—О больше, чем Ti—О), тогда как
в берилле ионы Ве2+ занимают тетраэдрические, а ионы А13+
Рис. 23.11. Проекции структур бенитоита BaTiSi3Og (а) и берилла Be3Al2Si60i8
(б). Атомы, принадлежащие сложным ионам и находящиеся на различной вы-
соте над плоскостью рисунка, изображены с помощью окружностей разной тол-
щины, чтобы показать тип координационных групп ионов металлов, а ¦— из
сложных ионов, расположенных выше плоскости рисунка, показан только один;
б — для простоты многие атомы О опущены.
октаэдрические пустоты. Низкотемпературная модификация
кордиерита Al3Mg2(Si5Al)Oi8 по строению схожа с бериллом.
Поскольку в берилле и Be, и Si имеют тетраэдрическую ко-
ординацию, а расстояние Be—О A,65 А) близко к расстоянию
Si—О A,62 А) (тогда как А1—О 1,95 А), есть основание опи-
сывать эту структуру как трехмерную 4-связанную сетку
состава (Be3Si6Oi8)n6n~; эта формула показывает, что каркас
относится к структурам типа АХ2 с координацией 4 : 2. Ионы
А13+ (радиус 0,61 А) в берилле могут быть замещены ионами
Сг3+ (радиус 0,70 А) (до 0,3 масс. %), в результате чего обра-
зуется изумруд (при замещении А1 на Сг в А12О3 образуется
рубин).
В структуре синтетического метасиликата K4(HSiO3L [4, 5]
присутствует кремниевый аналог циклического иона P4Oi24~.
Ион Si4Oi28~ обнаружен также в сложном боросиликате акси-
ните, но его строение определено только приблизительно [6].
Возможно, этот же ион присутствует в минерале баотите [7].
Существенным вкладом в кристаллохимию метасиликатов было
недавнее обнаружение циклических ионов SisC^16" в мине-
рале мюирите Ваш(Са, Mn, TiLSi8024(C1, ОН, О),2-4Н2О [8] и
SigOzT-yiOtyy в сложном по составу минерале эвдиалите [9].
Таким образом, к настоящему времени известны циклические
метасиликатные ионы, содержащие 3, 4, 6, 8 и 9 атомов Si*.
Литература. [1] Acta cryst., 1972, В28, 1899. [2] Acta cryst., 1955, 8, 425.
131 Acta cryst., 1969, B25, 1524. [4] Acta cryst., 1964, 17, 1063. [5] Acta cryst.,
1965, 18, 574. [6] Acta cryst., 1952, 5, 202. [71 Кристаллография, 960. 5, 544.
[8] Science, 1971, 173, 916. [91 Tschermaks Min. Petr. Mitt., 1971, 16, 105.
23.12.6. Силикаты, содержащие цепочечные ионы (цепочечные
силикаты). Простые цепи, состоящие из тетраэдрических групп
МХ4, сочлененных двумя вершинами, могут принимать в крис-
а АААААА
А
S,2OS
>sio,
А
Рис. 23.12. Простые и двойные цепи, образованные из тетраэдров SiO4.
таллах различные конфигурации. Несмотря на то что число
тетраэдров в повторяющемся звене цепочек на рис. 23.12, а—в
разное, а именно 1, 2 и 3 (эти цепи обозначаются IT, 2T и ЗТ
и т. д.), во всех случаях состав отвечает формуле МХ3) так как
У каждого тетраэдра обобществлены две вершины. В двойной
цепи г каждый тетраэдр обобществляет три вершины; цепи д
и е различаются соотношением числа тетраэдров, обобществля-
ющих 2 и 3 вершины. Примеры цепей различного строения при-
ведены в табл. 23.3. Наиболее распространенный тип простых
цепей —тип б —обнаружен в синтетических метасиликатах ли-
тия и натрия и в минералах группы пироксенов, в которую вхо-
f,,/c3HnCTam MgSiO3 диопсид CaMg(SiO3J, жадеит
i\aAl(biO3J и сподумен LiAl(SiO3J. В различных структурах
Мя иЛВатни структуры силикатов с 12-членными кольцами, например в
^a5MSi40I2, где M=Ho^Lu, Y, Sc [ДАН СССР, 1973, 213 10721 или в мине-
рале траските [ДАН СССР, 1973, 229, 1101]. - Прим. перев L
136 23. Кремний
23.12. Силикаты 137
Таблица 23.3. Структуры, содержащие простые i
IT
2Т
ЗТ
4Т
5Т
6Т
7Т
8Т
9Т
ЮТ
12Т
Простая цепь (МОь);/
CuGeO3, КгСиС13
Пироксены, Li2Si03, Na2Si03
[1], RbPO3 [2], LiAsO3 [3],
SO3
Р-Волластонит [4], NaPO3 (вы-
сокотемпературный), соль
Маддрелла [5]. Ca2NaHSi309
(пектолит) [6]
Линейная: РЬ(РО3J [71
Винтовая: NaPO3 (соль Курро-
ля A) [81,AgPO3 [8]
CaMn4Sis0i5 [9] (родонит)
В12Рб0,8 [10], Ca2Sn?Si60,8 [11]
(Са, Mg)(Mn, FeNSi7021 (пи-
роксмангит) [12]
Na3H(PO3L [13]
Fe9Si9027 [141
LiPO3 [15], Ва2К(РО3M [16]
Pb12Si12036 [17]
M2O5 (г)
\14ОП (д)
М6О17 (е)
сложные цепочечные ионы
Сложная цепь (см. рис. 23.12)
Al2Si05 (силлиманит),
Na2Mg2Si6015 [18],
(Na, K)Fe2Si6O15-0,5II2O
[19]
Амфиболы
Ca6Si6017@HJ (ксонотлит)
[20]
Р5О14 (разд. 19.6.12)
Si6O16 )
Si8O21 > (разд. 23.12.2)
Siio026 J
[1] Acta cryst., 1967, 22. 37. [2] Ada cryst., 1964, 17, 681. [31 Acta cryst., 1956, 9. 87.
[4] Proc. Acad. Sci., 1961, 47, 1884. .[5] Acta cryst., 1955, 8, 752. [6] Z. Kristallogr., 1967,
125, 298. [7] Acta cryst., 1964, 17, 1539. [8] Acta cryst., 1961, 14, 844. [9] Z. Kristallogr.,
1963, 119, 98. [10] Acta cryst 1975, B31, 2281. [П] Mineral. Magazine, 1963, 33, 615.
[12] Acta cryst., 1959, 12, 177. [13] Acta cryst., 1968, B24, 992. [14] Science, 1966, 154, 513.
[15] Acta cryst., 1976, B32, 2960. [16] Z. Kristallogr., 1975, 141, 403. [17] Z. Kristallogr.,
1968, 126, 98. [18] Acta cryst., 1972, B28, 3583. [19] Science, 1969, 166, 1399. [20] Acta
cryst., 1956, 9, 1002.
упаковка параллельных цепочек осуществляется таким образом,
чтобы обеспечить подходящее окружение катионов — КЧ 6 для
Mg2+, КЧ 8 для Са2+ (в диопсиде).
Силикаты состава MnSi205 вместо образования двойных це-
пей типа г (рис. 23.12) предпочитают давать 3-связанные сло-
истые структуры (см. следующий раздел). Зигзагообразные це-
пи типа г присутствуют в Na2Mg2Si60i5. Однако половина ато-
мов Mg имеет тетраэдрическую координацию (а другая
половина — октаэдрическую), и с учетом этого следует конста-
тировать наличие каркаса типа М7О15 (MgSi6Oi5). В структуре
(Na, K)Fe2+(Fe3+SieOi5)-О.бНгО место тетраэдрически коорди-
нированного Mg в Na2Mg2Si6Oi5 занимают ионы Fe3+.
Строго говоря, силлиманит относится к ортосиликатам, так
как он содержит изолированные группы SiC>4. В то же время
поскольку половина атомов алюминия имеет КЧ 4, его можно
рассматривать как алюмосиликат, в котором атомы Si и А1
(КЧ 4) образуют двойную цепочку типа г. Атомы А1, коорди-
нированные по октаэдру, расположены между этими цепями;
формулу соединения можно записать в виде Al(AlSiO5).
Среди минералов наиболее важными соединениями с двойны-
ми цепями (лентами) являются амфиболы (типичный предста-
витель— тремолит Ca2Mg5(Si4O11J(OHJ).
Название «асбест» первоначально предназначалось для наи-
более волокнистых разновидностей амфиболов, например
тремолита, актинолита [1] и крокидолита [2]. Однако этот тер-
мин используется и для обозначения не относящихся к амфибо-
лам волокнистых минералов из группы серпентина, которые
ближе всего стоят к тальку и другим глинистым минералам.
Действительно, промышленный асбест почти па 50% является
хризотилом (его структура описана в разд. 23.12.7). Гидротер-
мальным синтезом удалось получить синтетические амфиболы
(Na—Mg, Na—Со, Na—Ni) в виде длинных гибких волокнистых
кристаллов [3].
Другой тип цепей, также состава Si4On, обнаружен в мине-
рале власовите Na2Zr(Si4On) [4]. Цепочки состоят из колец,
образованных четырьмя тетраэдрами, и содержат, как и в ам-
фиболах, равное число тетраэдров, сочлененных двумя и тремя
вершинами. В табл. 23.3 приведен пример цепи состава SieO17-
Там же можно найти примеры некоторых других метасолей,
содержащих цепочечные ионы, построенные из тетраэдров. Цепи
отличаются друг от друга не только числом тетраэдров в по-
вторяющемся звене AТ, 2Т и т. д.), но и взаимной ориентацией
тетраэдров в пределах звена. В табл. 23.3 мы различаем два
типа цепей 47: первые почти линейные (две пары тетраэдров),
другие — спиральные.
Литература. [1] Acta cryst., 1955, 8, 301. [2] Acta cryst., 1960, 13, 291 [3] Inorg
Cliem, 1964, 3, 1001. [4] CRURSS, 1961, 141, 958.
23.12.7. Силикаты со слоистой структурой (слоистые силикаты).
Слоистые силикаты можно подразделить на три основные груп-
пы:
1) Простые слои состава Si2O5 или (SiAlJO5, которые удер-
живаются вместе катионами. В наиболее простых слоях этого
типа каждый тетраэдр S1O4 имеет по три общие вершины с тре-
мя другими тетраэдрами, причем структура построена на осно-
ве одной из плоских 3-связанных сеток (гл. 3). Известны струк-
туры силикатов, основанные только на правильных 3-связанных
плоских сетках (б3), на двух (из трех) полуправильных 3-свя-
занных сетках D, 82) и D, 6, 12) и на более сложных сетках
(о. 82) D, 6, 8J (рис. 23.13, а— г). Структура минерала окени-
138 23. Кремний
23.12. Силикаты 139
Рис. 23.13. а-нд — слои из тетраэдров SiO4, имеющих по 3 обобщественные
вершины. Маленькие темные кружки — атомы Si, светлые кружки — атомы О.
Атомы кислорода, расположенные выше атомов Si, выделены более толстыми
линиями. На рис. в-^-е — атомы О опущены, е — слой Si4Og, построенный из
равного числа тетраэдров SiO4, обобществляющих по 3 и 4 вершины.
та основана на сетке, показанной на рис. 23.13, д. Ниже приве-
дены примеры минералов для каждого типа сеток:
а) сетка (б3)
б) сетка D, 82)
в) сетка D, 6, 12)
г) сетка F, 82) D, 6, 8J
д) сетка E, 82) E2, 8J
Li2Sb03 и изоструктурный H2Si205 [I], Na2Si205
[21, Ag2Si205 [3], LiAlSi4O,0 (петалит) [4]
I3aFeSi4Oio (джиллеспит) [5], CaCuSi4Oio (египет-
ская синь) [6], Са451?,О2с-КР-8Н2О(апофиллит) [7]
Mi6nSi,203o(OII, ClJo (марганцевый пиросма-
лит) [8]
Ki 7N-0 ',ZrSi6Oi3 (далиит) [9]
CaSi,O5-2H,O (окенит) [10, 11]
Интересной топохимическои реакцией является превращение
монокристалла a-Na2Si20r, при нагревании в расплавленном
AgNO3 в монокристалл Ag2Si205. Были получены также кисло-
ты H2Si205, имеющие структурное сходство с двумя дисилика-
тами щелочных металлов; джиллеспит, из которого путем «вы-
щелачивания» раствором 5 М НС1 удалены ионы металлов, дает
достаточно четкую дифракционную картину, что позволило
рентгенографически доказать сохранение при таком переходе
слоистой структуры в образующихся бесцветных кристаллах
состава H4Si4O|0-0,5H2O с плотностью 2.1 г/см3 (исходный
джиллеспит имеет плотность 3,4 г/см3 и окрашен в красный
цвет [12]).
Все слои на рис. 23.13 можно отнести к простым слоям в
том смысле, что они могут быть изображены на плоскости без
наложения и пересечения каких-либо связей. Более сложные
А А
а
Рис. 23.14. а — метасиликатный цепочечный ион (SiO3)n2n- (вверху) и его про-
екция (внизу); б —слой состава Si2O5, состоящий из цепочек SiO3, перпенди-
кулярных плоскости чертежа; в — слой состава Si3O7 с той же ориентацией
цепочек.
слои имеют несколько большую толщину (например, двойные
слои, см. далее). Промежуточный случай реализуется в струк-
туре Na2Si307 [13]. На рис. 23.14, а показан вид идеализирован-
ной метасиликатной цепочки в проекции сбоку и с торца цепи.
На рис. 23.14, б каждая пара тетраэдров, соединенных верши-
нами, обозначает цепочку, перпендикулярную плоскости рисун-
ка, так что на рисунке изображена проекция гофрированного
слоя, в котором каждая группа SiO4 обобществляет по 3 вер-
шины. Приблизительно такое же строение имеет слой Si2O3
в Li2Si205. На рис. 23.14, в тетраэдры в цепях Б имеют по три,
а в цепях А—по четыре общие с другими тетраэдрами верши-
ны. Слои подобного строения принадлежат к гомологической
серии SimCWi:
SiO3
цепочка
Si2O5 S13O7
слои
SiO2
трехмерный каркас
Все слои можно представить как срезы структуры кристоба-
лита, являющегося конечным членом ряда, а слой Si3O7 coot-
140 23. Кремний
ветствует аниону в Na2Si307. Этот слой А3Х7, в котором все
кольца состоят из 6 тетраэдров, можно сопоставить с простыми
слоями А3Х7 в мелилите и родственных ему соединениях, где
присутствуют только кольца из 5 тетраэдров. Слой такого типа
рассматривался выше в разд. 23.12.4 (см. также рис. 5.7, в).
В слоях А3Х7 обоих типов 2/з тетраэдров обобществляют по
3 вершины, а остальная треть — по 4. Слои, в которых содер-
жится равное число тетраэдров с тремя и четырьмя обобщест-
вленными вершинами, обнаружены в KaSi^g [14]; такой слой
изображен на рис. 23.13, е.
Необходимо подчеркнуть, что тип структуры (конечная или
бесконечная в одном, двух или трех измерениях) в общем слу-
чае нельзя вывести из соотношения О : Si. Если обобществление
только двух вершин дает лишь кольца или цепочки (О : Si = 3),
то обобществление трех или четырех вершин каждой группы
SiC>4 может привести к образованию комплекса любого типа
с отношением О : Si, равным 2,5 или 2,0. В гл. 5 было показано,
что обобществление четырех вершин порождает одномерные
цилиндрические, двух- и трехмерные структуры. Если присутст-
вуют одновременно тетраэдры с тремя и четырьмя обобщест-
вленными вершинами, то отношение О : Si может принимать
значения между 2,5 и 2,0; если же одновременно присутствуют
тетраэдры с двумя и тремя общими вершинами, то это отноше-
ние находится между 2,5 и 3,0.
Уже указывалось, что для состава Si2C>5 реализуются двой-
ная цепь (рис. 23.12, г) и слои различного строения
(рис. 23.13, а — д); однако силикаты с кремнекислородным
каркасом состава Si20s, по-видимому, неизвестны*. Еще одна
возможность состоит в закручивании участков плоских сеток в
виде цилиндра. Простой вертикальный фрагмент сетки D, 82)
на рис. 23.24, б имеет состав Si4On (как во власовите,
разд. 23.12.6). Вертикальные полоски шириной в два или более
четырехчленных кольца можно свернуть в цилиндр, причем
состав останется тем же, что и для плоской сетки,— (Si2O5)n,
так как у каждого тетраэдра по три обобществленные вершины.
Такой тип цилиндрического иона обнаружен в структурах
CuNa2Si40io [15] и ряда минералов.
Если у части тетраэдров обобществлены две вершины, а у
другой части — три или четыре, О : Si = 24-3. В качестве просто-
го примера можно указать на слои в минерале цеофиллите
[16], структура которых основана на плоской сетке (б3), но,
кроме того, имеются группы SiO4 (с двумя обобществленными
вершинами), внедренные по каждой из связей, что дает состав
StsO^. Рассмотренные выше примеры сведены в таблицу.
* Каркас состава Si2O5 обнаружен в структуре K2GeSi6Oi5 [Кристалло-
графия, 1977, 22, 382]. — Прим. перев.
23.12. Силикаты. 141
Формула
(Si ADO.
Si4O"
Si ¦•('
SbOri
Si4On
Si5Ol4
Отношение
О : Si
2,0
2,25
2,33
2,5
2,75
2,8
2,83
Тип структуры
1-, 2- или 3-мерная (гл. 5)
Слой на рис. 23.13,с
См. текст
Двойная цепь (лента)
(рис. 23.12,г)
Слои (рис. 23.13,0—5)
Цилиндрический ион (ем. текст)
Простая цепь (власовит)
Двойная цепь (амфиболы)
Слой (цеофиллит)
Двойная цепочка (ксоиотлит)
Число обоб-
ществлен-
ных вершин
4
3 и 4
з
3 и 2
2) Если свободные вершины всех тетраэдров в плоском слое
лежат по одну сторону слоя, то два таких слоя можно соединить
с образованием двойного слоя. Его состав отвечает формуле
(Si, A1)O2, поскольку обобществленными
оказываются все вершины всех тетраэд-
ров. Часть атомов кремния должна быть
замещена на атомы алюминия (или, воз-
можно, бериллия), так как в противном
случае слой был бы электронейтральным
и имел состав SiO2. Подобные двойные
слои, образованные из двух гексагональ-
ных слоев (таких, как на рис. 23.13, а),
присутствуют в гексагональных модифи-
кациях CaAl2Si208 [17] и BaAl2Si208
[18] (рис. 23.15).
Как было показано выше, простейшая
плоская 3-связанная сетка лежит в ос-
нове единичного слоя состава Si2Os (см.
выше первую группу силикатов), а также
двойного слоя (вторая группа силика-
тов со слоистой структурой). Такие сет-
ки встречаются в структурах силикатов
еще и в третьем варианте, который вы-
текает из примерного соответствия по
размерам между плоским гексагональ-
ным слоем SJ2O5 и слоями в А1(ОН)з и
Mg(OHJ.
3) Третья намного более важная группа слоистых структур
основана на составных слоях, включающих один или два крем-
некислородных слоя, соединенных через атомы Mg или А1 со
слоями из гидроксильных групп. Эти составные слои и служат
• Si(AI) О О
Са2
Рис. 23.15. Проекция
структуры гексагонально-
го CaAl2Si2O8, показыва-
ющая чередование двой-
ных слоев и ионов Са2+.
142 23. Кремний
основной структурой единицей, но прежде, чем обсуждать спо-
собы упаковки таких слоев в кристалле, необходимо рассмот-
реть детали их строения. На рис. 23.16, а показан фрагмент
слоя сочлененных тетраэдров SiO4, причем у каждого тетраэдра
Рис. 23.16. Образование составных кремний-алюминий-кислородных и кремний-
магний-кислородных слоев.
три вершины общие с другими, а все «свободные» вершины
расположены с одной стороны слоя. Рис. 23.16, б показывает
расположение групп ОН в слое структур Mg(OHJ или А1(ОНK.
Расстояния между верхними атомами О на рис. 23.16, а (пока-
заны сплошными линиями) и между соответствующими группа-
ми ОН на рис. 23.16, б приблизительно равны. Поэтому можно,
перевернув рис. а и наложив ее на рис. б, получить составной
слой, в котором эти атомы кислорода окажутся общими. Со-
ставной слой изображен (в разрезе) на рис. 23.16, в; кроме
того, он показан на рис. 5.46 как пример структуры, построен-
ной из тетраэдрических и октаэдрических координационных
групп. Таким же образом можно соединить простые слои через
23.12. Силикаты 143
атомы кислорода, расположенные с другой стороны слоя типа б,
и получить еще более сложный слой, показанный на рис. г.
При изображении структур, содержащих подобные бесконечные
в двух направлениях слои, мы в дальнейшем будем использо-
вать упрощенные схемы (предложенные Л. Полипгом), поме-
щенные справа на рис. в и г. В связи с тем что в слоях структур
iWg(OH); и А1(ОНK группы ОН расположены одинаково и они
отличаются (при чисто геометрическом подходе) лишь количе-
ством октаэдрических пустот, занятых атомами металла, со-
ставные слои могут содержать как ионы магния, так и алюми-
ния, а также подходящие по размеру ионы другого двух- или
трехвалентного металла. В предельных случаях идеализиро-
ванные слои имеют следующий состав:
Mg3@HLSi205
Mg3(OHJSi4O10
или Al2@HLSi205
или Al2(OHJSi4O,0
в зависимости от того, занимают ли октаэдрические пустоты
атомы Mg или А1. Дополнительное усложнение структурной
химии этих слоистых минералов обусловлено тем, что атомы Si
могут частично замещаться на атомы А1 (в тетраэдрической ко-
ординации), что приводит к образованию заряженных слоев.
Такие слои могут чередоваться в структуре с положительно
заряженными ионами щелочных или щелочноземельных метал-
лов (в слюдах), со слоями гидратировапиых ионов (в монтмо-
риллоните) или с положительно заряженными слоями состава
(Mg, A1)(OHJ (в хлоритах). Среди структур с составными
слоями можно выделить пять основных видов, причем в каждом
виде возможны вариации состава в пределах от Mg3 до А12.
Структуры, содержащие только слои типа в. Чисто магние-
вые слои присутствуют в хризотиле Mg3(OHLSi2Os, з котором
структурной единицей служит каолиноподобный слой указанно-
го состава вместо Al2(OHLSi2O5 (рис. 23.16). Из-за того что
размеры слоя брусита (Mg(OHJ), являющегося частью состав-
ного слоя, не совсем точно соответствуют размерам слоя Si2Os,
происходит скручивание слоев, так что более объемная брусито-
вая часть оказывается снаружи. Волокна хризотила построены
из скрученных лент, образующих цилиндры длиной в несколько
тысяч ангстрем с внешним диаметром в несколько сотен
ангстрем, стенки которых содержат около дюжины слоев [19];
тонкие детали строения хризотила, а также природа вещества,
заполняющего цилиндры, пока неизвестны.
В этой главе уже упоминалось о процессе силилирования си-
ликатов для получения триметилсилильных производных, сохра-
няющих систему связей Si—О—Si исходного минерала. Анало-
гичный метод был использован в работе [20]. Обработка хризо-
тила смесью НС1 и ClSi(CH3K приводила к удалению ионов
144 23. Кремний
Mg и ОН с внешней поверхности слоев и замещению их группа-
ми —О51(СНз)з- В результате получался гель, который после
обработки водой давал волокнистую массу, состоящую из лент.
При высушивании эти ленты скручивались, и образовывались
волокна, сходные по форме с волокнами исходного хризотила.
$ Щ ю-41 А1 ф Мд и А1
в октсидраческих позициях
О Мд
хриготил
тальк
флогопит хлориты dnucum
Mg3@H\Si205 Mg3(OHJS-4Olo KMg3COHJSi3AlOlo {см. текст) Мд(ОН2)
каолинит пирофиллит мусковит
А1г(ОН)^12О5 А12(ОН)г5цОго KAl2@HJSi3AlO10
Рис. 23.17. Схемы, показывающие строение некоторых минералов со слоистой
структурой.
Слой состава Al2(OHLSi2O5 является структурной единицей
минералов группы каолинита (рис. 23.17). Все три минерала —
каолинит, диккит [21] и накрит — имеют один и тот же состав
Al2@HLSi205; их структуры отличаются только числом слоев
(соответственно 1, 2 и 6) в периоде повторяемости. В наиболее
распространенном минерале группы каолинита — галлуазите —
реализуется беспорядочная последовательность слоев [22], в аме-
23.12. Силикаты 145'
зите с идеализированной формулой (Mg2Al) (SiAlOs) (OHL
замещение одного из трех атомов магния атомом алюминия
компенсируется замещением половины атомов кремния атомами
алюминия [23J.
Структуры, содержащие только слои типа г. Крайними чле-
нами этого ряда структур являются тальк Mg3(OHJSi4Oi0 и
пирофиллит Al2(OHJSi4O10 (рис. 23.17). Как и в структуре ми-
нералов группы каолинита, здесь слои электрически нейтраль-
ны, и между соседними слоями действуют лишь слабые силы
притяжения. Поэтому эти минералы мягкие, очень легко рас-
щепляются на чешуйки, и тальк (от франц. — мел), например,
применяется в качестве смазки.
Структуры, которые содержат заряженные слои типа г, че-
редующиеся с ионами. Замещение в тальке или пирофиллите
'Д атомов кремния на атомы алюминия дает отрицательно за-
ряженные слои, которые в структурах слюд — флогопита и мус-
ковита— чередуются с ионами К+ (рис. 23.17):
KMg3'(OHJSi3AlOl0 флогопит [241
KAl2(OHJSi3A10io мусковит [25]
Ионы калия занимают большие пустоты между 12 атомами
кислорода, так что электростатическое усилие связи К—О
составляет всего Vi2- Эти связи легко разрываются, благодаря
чему слюды обладают весьма совершенной спайностью, парал-
лельной слоям. В так называемых хрупких слюдах, ти-
пичным представителем которых может служить Маргарит
CaAl2(OHJSi2Al2Oio, имеет место дальнейшее замещение крем-
ния алюминием, в результате чего отрицательный заряд на
слоях оказывается вдвое больше, чем в флогопите и мусковите.
Слои удерживаются друг около друга двухзарядными ионами,
например Са2+. Увеличение силы связи между слоями (элект-
ростатическое усилие связи Са—О теперь равно i/5) приводит
к возрастанию твердости, что видно из сравнения значений,
твердости:
Твердость по шкале
Мооса
1—2
2—3
Тальк, пирофиллит
Слюды
Хрупкие слюды
3,5—5
Структуры, которые содержат заряженные слои типа г, че-
редующиеся с гидратированными ионами. Помимо безводных
слюд существуют очень важные минералы, иногда называемые
гидратированными слюдами. Они построены из составных сло-
ев, несущих меньший, чем в обычных слюдах, заряд на единицу
поверхности и чередующихся со слоями из гидратированных
10—1284
146 23. Кремний
ионов щелочных металлов или магния. Такие слабозаряженные
слои могут образоваться, например, при замене части атомов
алюминия в слоях пирофиллита на атомы магния:
[Mgo,33A1i,e7Si40io(OHJro>33NaM3 (монтмориллонит) [26]
в сумме 2 атома
или при замещении в слоях структуры талька не только ионов
в октаэдрических позициях, но и в тетраэдрических, как в вер-
микулите:
[(Mg2,3eFe»+0i4eAl0ile) (Si2j72Al]|28) 010(OHJ]-o,"[Mg0iM (HaOI>32l+o,e*
Как и следовало ожидать, при дегидратации этого минерала
образуется структура, сходная по строению с тальком. Сечение
этой структуры изображено на рис.
23.18, но в реальных кристаллах заня-
та лишь часть позиций Mg2+ и Н2О.
Глинистые минералы. Обычно к
этому классу относят несколько групп
минералов, обладающих рядом харак-
терных свойств: мягкостью, легкостью
гидратации, способностью к ионному
обмену с простыми и многими органи-
ческими катионами. Сюда входят ми-
нералы группы каолинита, группы
монтмориллонита — бейделлита, гид-
рослюды (иллнты), родственные вер-
микулиту. Помимо роли глин как ком-
понентов почв они находят также ши-
рокое промышленное применение.
Каолин применяют в гончарном и ке-
рамическом производствах, в качестве
наполнителя резины, а также как на-
полняющее и красящее вещество при
производстве бумаги. Монтморилло-
нит (бентонит) является важной составной частью фуллеровой
земли; он находит широкое применение благодаря его способ-
ности давать вязкие суспензии уже при содержании несколько
процентов. Например, легко набухающий в воде натриевый
бентонит используется как связующий материал в формовоч-
ных смесях и для приготовления вязких растворов при нефтя-
ном бурении; не набухающий кальциевый бентонит после кис-
лотной обработки применяется как адсорбент для очистки неф-
тепродуктов. Широко используется и вермикулит, в частности
в качестве материала для улучшения свойств почвы и в качест-
ве пористого наполнителя в производстве пластмасс и бетона.
Рис. 23.18. Проекция струк-
туры вермикулита.
23.12. Силикаты 147
Структуры, содержащие заряженные слои двух типов. В рас-
смотренных до сих пор слоистых структурах все слои (в каждой
отдельной структуре) были одного и того же типа. Существуют
и более сложные структуры со слоями двух типов; к ним отно-
сятся минералы группы хлорита. В структурах каолинита,
талька и пирофиллита незаряженные слои удерживаются друг
около друга сравнительно слабыми силами, а в слюдах отрица-
тельно заряженные слои скрепляются друг с другом положи-
тельными ионами. В хлоритах реализуется еще одна возмож-
ность— чередование отрицательно заряженных слоев (такого
же типа, как в слюдах) с положительно заряженными слоями,
так что в структуре имеются бесконечные в двух измерениях
противоположно заряженные ионы. Состав слюдоподобных
слоев может варьировать в пределах от [Mg3(AlSi3Oi0) (OHJ]"~
до [Mg2Al(Al2Si20io) (ОН)г]". Положительно заряженные слои
образуются в результате замещения '/з атомов магния в бру-
енте Mg(OHJ на атомы алюминия, что дает слой состава
Mg2Al(OHN+. На рис. 23.17 проведено сравнение последователь-
ности слоев в хлоритах, Mg(OHJ и флогопите. В связи с су-
ществованием значительного числа вариантов чередования,
слоев у хлоритов, как и у других слоистых структур, существу-
ют многочисленные политипы [28].
Литература. [1| Z. Kristallogr., 1964, 120, 427. [2] Ada cryst., 1968, В24 13
1077. [3] Ada cryst., 1961, 14, 537. [4] Ada cryst, 1961, 14, 399. [5] Am. Mineral
1913, 28, 372. [6] Ada cryst, 1959, {2, 733. [7] Am. Mineral, 1971, 56, 1222 1234
1243. [8] Acta cryst, 1968, B24, 690. [91 Z. Kristallogr, 1965, 121 349 [10] ДАН
СССР, 1958, 121, 713. [11] Mineral. Mag, 1956, 31, 5. [12] Am. Mineral, 1958
4.'5, 970. [13] Nature, 1967, 214, 794. [14] Acta cryst, 1974 B30 2206 [151 Acta
cryst, 1977, B33, 1071. [16] Acta cryst, 1972, B28, 2726. [IT] Acta cryst, 1959
12. 465. [18] Mineral. J. Japan, 1958, 2, 311. [19] Acta cryst, 1956, 9," 855 862
мм. [201 Inorg. Chem, 1967, 6, 1693. [21] Acta cryst, 1956, 9, 759. [22] Acta
cryst, 1975, B31, 2851. [23] Acta cryst, 1951, 4, 552. [241 Acta cryst, 1966, 20
Ь:-)8. [25] Acta cryst, 1960, 13, 919. [26] Trans. Faraday Soc, 1948, 44, 306 349
[27] Am. mineral, 1954, 39, 231. [28] Acta cryst, 1969, B25, 632.
23.12.8. Силикаты с каркасной структурой. В этой главе уже
упоминались возможные типы трехмерных структур:
1) все тетраэдры SiO4 сочленяются через три вершины; со-
став (Si2O5)n2n~, причем заряд каркаса повышается при замене
части кремния на алюминий (или бериллий);
2) тетраэдры сочленяются друг с другом через три или че-
тыре вершины;
3) все тетраэдры сочленяются через четыре вершины; состав
SiO2 или (Si, A1)O2, причем в последнем случае заряд каркаса
зависит от степени замещения кремния алюминием.
Модификации SiO2 уже были рассмотрены; упоминалось
также о некоторых минералах с близкой структурой, в которых
часть кремния замещена на А1 или Be. В каждом из названных
Ю*
148 23. Кремний
выше типов могут присутствовать дополнительные тетраэдры,
внедренные между тетраэдрами с тремя или четырьмя обоб-
ществленными вершинами. Это приводит к удлинению отдель-
ных связей в 3-, C, 4)- или 4-связашюй сетке. О структурах
первого и второго типов известно немного. Имеется интересный
пример каркаса, построенного из тетраэдров, обобществляющих
по три вершины, причем некоторые из таких тетраэдров соеди-
нены друг с другом через тетраэдры с двумя обобществленными
вершинами. В нептуните LiNa2K(Fe, Mg, MnJ(TiOJSi8O22 [1]
присутствует одинаковое число тетраэдров SiO4, сочлененных
двумя и тремя вершинами. Они образуют две взаимопроникаю-
щие 3-связанные сетки типа ThSi2 (рис. 3.15, д), в которых 7з
всех связей каждой сетки содержит дополнительные внедренные
тетраэдры с двумя обобществленными вершинами. У подобных
сеток отношение О : Si такое же, как у цепей в амфиболах:
OSi (Oi/2J (Si2O7) 1/2^Si4On. Эти сетки включают 9 из 11 ато-
мов кислорода, содержащихся в приведенной выше формуле.
Дополнительные два атома О не связаны с атомами кремния,
а вместе с другими атомами кислорода из каркаса образуют
октаэдрическую координационную группу атома титана.
Теперь перейдем к каркасным структурам, в которых все
тетраэдры сочленяются через 4 вершины. Во всех таких струк-
турах часть (нередко около половины) тетраэдрических позиций
занята атомами алюминия (реже бериллия); отрицательный за-
ряд каркаса (Si, A1)O2 нейтрализуется присутствующими в
структуре катионами. Рассмотрение таких каркасных структур
и объяснение их физических свойств в значительной степени
облегчаются при их классификации по признаку наличия или
отсутствия в структурах больших полиэдрических пустот или
каналов.
Ниже будут рассмотрены три группы минералов (и некоторых
родственных им синтетических соединений)—полевые шпаты,
цеолиты и ультрамарины. Структуры полевых шпатов относи-
тельно компактны, а в двух других группах имеются полиэдри-
ческие полости или каналы, в которых размещаются молекулы
воды (в цеолитах) или дискретные анионы (Cl~, SO42~, S2~
и др. — в ультрамаринах), разумеется, в дополнение к соответ-
ствующему числу катионов. Между полевыми шпатами и плот-
ными каркасными структурами, которые можно описать как
заполняющее пространство расположение полиэдров, находятся
¦структуры промежуточного типа. Например, структура милари-
та K2Ca4(Be4Al2Si2406o)-НгО [2] содержит плотную связь гекса-
гональных призм, построенных из 12 тетраэдров и соединенных
через отдельные тетраэдры в трехмерную сетку (рис. 23.19).
Состав призм отвечает формуле (Be0iioSio,9o)i203o, а отдельные
тетраэдры имеют средний состав (Beo,27Alo,33Sio,4oH4.
23.12. Силикаты 149
Более простой пример соединения со структурой миларита
дает K.2Mg5Sii203o [3]. Ионы К+ находятся в позициях с К.Ч 9
и 12; имеются также ноны магния двух сортов: 2Mg2+ имеют
КЧ 6 и 3Mg2+—КЧ 4. Ионы Mg2";" второго сорта участвуют в
связывании гексагональных призм и совместно с атомами Si
образуют каркас АХ2 состава (Mg3Sii203o)n6"~.
X на высоте j и
/// А на высоте 0 и
Рис. 23.19. Структура миларита. а — призмы Si12 сжаты, чтобы лучше пока-
зать способ их соединения в трехмерный каркас через атомы Be; б —показано
тетраэдрическое окружение атома Be атомами О, принадлежащим четырем
разным призмам Sii203o. Большие заштрихованные кружки (атомы О) относят-
ся к нижним 6-членным кольцам групп Sii203o, а светлые кружки — к верхним
кольцам призм, лежащих ниже. Если призмы Si12 представить в виде узлов со
связанностью 12, то получится трехмерная A2, 4)-связанная сетка состава АХ3
(е); г — ее проекция.
Полевые шпаты — наиболее распространенные породообразу-
ющие минералы; их доля в магматических горных породах со-
ставляет почти 2/3. Так, гранит состоит из кварца, полевых
шпатов и слюды. Полевые шпаты в зависимости от симметрии
кристаллической структуры подразделяют на две группы (ука-
заны типичные представители каждой группы):
1 Ортоклаз KAlSi3O8 [4]
Цельзиан BaAl,Si2Os
2 Плагиоклазы Альбит NaAlSi3Os
Анортит CaAl2Si208 [5]
150 23. Кремний
Как уже было сказано, и BaAl2Si2Oe, и CaAl2Si2Os имеют
гексагональные модификации, в структуре которых содержатся
двойные слои. В ортоклазе и анортите около "Л всех тетраэдри-
ческих позиций занята алюминием, и для компенсации заряда
на каркасе AlSi3O8 требуется однозарядный катион. В цельзиане
и анортите алюминием замещена половина кремния, и поэтому
здесь присутствуют двухзарядные ионы. Полевые шпаты группы
плагиоклаза—¦ альбит и анортит — представляют особый инте-
рес в связи с тем, что они практически изоморфны и известны
многочисленные минералы промежуточного состава. Например,
состав Лабрадора может меняться от АЬАп до АЬАп3, где АЬ—•
альбит, An — анортит. Такое изоморфное замещение (K+Si)
на (Ва + А1) или (Na + Si) на (Са+А1) характерно и для поле-
вых шпатов, и для других каркасных силикатов. В состав поле-
вых шпатов первой подгруппы входят крупные катионы К+
и Ва2+ (радиусы К+ 1,38 А, Ва2+ 1,35 А), а в плагиоклазах
присутствуют ионы меньшего размера-—Na+ A,02 А) и Са2+
A,00 А). Следует обратить внимание на то, что в полевых шпа-
тах обнаружены лишь относительно крупные катионы. Меньшие
по размерам ионы (Fe, Cr, Мп и др.), обычно присутствующие
в цепочечных и слоистых силикатах, в состав полевых шпатов
не входят, по-видимому, из-за того, что фрагменты этих карка-
сов недостаточно плотно окружают ионы небольших размеров.
Отличие в симметрии двух подгрупп полевых шпатов связано
с различиями размеров положительных ионов. Строение карка-
са во всех перечисленных выше полевых шпатах почти одина-
ково, но во второй подгруппе наличие меньших по размеру
ионов Na+ и Са2+ приводит к незначительному сжатию этого
каркаса.
В структурах полевых шпатов каркасы (Si, A1)O2 можно
также считать состоящими из слоев тетраэдров, размещенных
по точкам плоской сетки D, 82) (рис. 23.13, б). При этом чет-
вертая вершина каждого тетраэдра может быть направлена
либо вверх, либо вниз от плоскости рисунка. Такие слои соеди-
няются через выступающие вершины таким образом, что сосед-
ние слои оказываются связанными плоскостью симметрии. Бла-
годаря отличиям в относительном расположении вершин
тетраэдров, направленных вверх и вниз, образуются трехмерные
каркасы различного строения. Слои, показанные на рис. 23,22, а,
дают каркас структуры парацельзиана [6] — одной из модифи-
каций Ba(Al2Si2O8)—и изоструктурного данбурита Ca(B2Si2O8).
Каркас наиболее распространенных полевых шпатов состоит из
слоев более сложного строения (рис. 23.22, б). Идеализирован-
ный каркас структуры парацельзиана показан на рис. 23.21, а.
Соединение Ba(Al2Si2O8) дает один из наиболее ярких приме-
ров полиморфизма. Помимо двух полевых шпатов — цельзиана
23.12. Силикаты 151
8
Рис. 23.20. Стереоскопическое изображение структур трех модификаций кремне-
зема, представленных в виде системы связанных тетраэдров SiO4. а — кристо-
балит; б — кварц; в — тридимит.
и парацельзиана, структуры которых отличаются строением
трехмерных каркасов, основанных на сетках, изображенных на
рис. 23.22, — существует еще гексагональная форма, содержа-
щая двойные слои (разд. 23.12.7). Последняя в свою очередь
имеет низко- и высокотемпературные модификации, отличаю-
щиеся деталями строения гексагональных слоев и координаци-
онными числами ионов Ва2+, заключенных между слоями. Анион
152 23. Кремний
Рис. 23.21. Стереоскопическое изображение структур в виде системы связанных
тетраэдров (А1, Si)O4. а — парацельзиан Ba(Al2Si208); б — цеолит с волокни-
стым строением Na(AlSi2O6)-Н2О; в — ультрамарин Na8(Al6Si6024)S2.
в структуре Na2(ZnSi3O8) [7] имеет каркасное строение такого
же типа, как в парацельзиане, и является примером включения
в тетраэдрический каркас атомов цинка наряду с атомами
кремния.
По-видимому, еще более тонкие структурные различия по-
левых шпатов, принадлежащих к одному типу, могут быть свя-
заны со степенью упорядочения атомов Si и А1, распределенных
23.12. Силикаты 153
по тетраэдрическим позициям в каркасе, поскольку расстояния
А1—О и Si—О различаются довольно существенно. Для ряда
структур произведены оценки относительной доли Si и А1, за-
нимающих определенные наборы тетраэдрических позиций, хо-
тя при этом выявились некоторые расхождения относительно
точных значений расстояний Si—О и А1—О, которые следует
считать стандартными [8]. Для полевых шпатов наиболее при-
емлемыми можно считать величины, близкие к 1,605 А для рас-
а - 6
Рис. 23.22. Слои тетраэдров, образующие при дальнейшем связывании через
атомы О каркасы структур парацельзиана (а) и обычного полевого шпата (б).
Светлые и заштрихованные треугольники — тетраэдры, четвертая вершина ко-
торых расположена выше или ниже плоскости рисунка (соответственно).
стояний Si—О и 1,76 А для расстояний А1—О. Вероятно, отли-
чие низко- и высокотемпературной модификаций альбита
NaAlSisOs заключается в степени упорядоченности распределе-
ния атомов Si и А1 по тетраэдрическим позициям. В структуре
низкотемпературной модификации осуществляется упорядочен-
ное расположение атомов А1 в 'Д тетраэдров, а атомов крем-
ния— в остальных тетраэдрах; высокотемпературная модифи-
кация характеризуется статистическим распределением и
средним расстоянием Al(Si)—О 1,64 А [9]. Близкая величина
найдена для двух типов неэквивалентных тетраэдрических по-
зиций в структуре санидина, что соответствует статистическому
распределению V4 Al-f-3/4 Si для каждого типа тетраэдров [10].
Выше уже отмечался тот факт, что при высоком давлении
A20 кбар, 900°С) синтетический санидин (KAlSi3O8) превра-
щается в голландит, в структуре которого атом Si имеет
КЧ 6 [11].
Литература. [1] Ada cryst., 1966, 21, 200. [2f Acta cryst., 1952, 5, 209 f3] Acta
cryst, 1972, B28, 267. [4] Acta cryst., 1961, 14, 443. [51 Acta cryst., 1962, 15,
1005, 1017. [61 Acta cryst., 1953, 6, 613. [7] Acta cryst., 1977, B33, "l333. [81 Acta
cryst.. 1968, B24, 355. [91 Acta cryst., 1969, B25, 1503. [101 Ada cryst., 1949, 2,
280. [11] Acta cryst., 1967, 23, 1093.
Цеолиты. Как и полевые шпаты, цеолиты содержат каркасы
(Si, А1)„О2„, несущие благодаря замещению части Si в SiCb
на А1 отрицательный заряд, который компенсируется катионами,
154 23. Кремний
находящимися в пустотах. У цеолитов структуры гораздо более
рыхлые, чем у полевых шпатов, что объясняет характерное
свойство цеолитов — легко поглощать и отдавать воду, слабо
удерживаемую структурой. Кроме воды цеолиты могут адсор-
бировать многие другие вещества, в том числе газы (СО2, NH3
и др.), спирт и даже ртуть. Положительно заряженные ионы в
их структурах также могут быть замещены другими катионами
при простом выдерживании кристалла в растворе подходящей
соли. Пермутиты, используемые для понижения жесткости во-
ды, представляют собой натриисодержащие цеолиты. Они погло-
щают из жесткой воды ионы кальция, отдавая ей ионы натрия,
т. е. делают воду «мягкой». Пермутит регенерируют путем об-
работки «рассолом», что сопровождается протеканием обратно-
го процесса — замещением Са2^ на Na+—-и делает пермутит
снова готовым к применению. При замещении катионов их коли-
чество в кристалле может меняться, в то время как их общий за-
ряд остается неизменным. Так, в цеолите NaCa2(Al5Si502o) -6H2O
(томсонит) половина имеющихся ионов Са2+ может быть за-
мещена на двукратное количество ионов Na+, что приводит к
увеличению общего числа положительных ионов в формуле от
трех до четырех за счет наличия в исходной структуре незаня-
тых позиций для дополнительных ионов натрия.
В последние годы было синтезировано большое число новых
цеолитов, служащих не только адсорбентами и ионообменника-
ми, но и обладающими рядом других ценных свойств. Особен-
но следует отметить их использование в качестве молекулярных
сит и катализаторов. Описание почти 40 различных цеолитных
каркасов и их стереоскопические изображения можно найти в
атласе структурных типов цеолитов [Meier W. M., Olson D. П.,
Atlas of Zeolite Structure Types, 1978], опубликованном Струк-
турной комиссией Международной ассоциации по цеолитам.
У некоторых синтетических цеолитов строение каркаса такое
же, как у природных, структуры других намного сложнее. На-
пример, родственные цеолиты типов ZSM-5 и ZSM-11 отличаются
наличием в структуре большого числа пятичлепных колец и
каналов, образованных десятичленными кольцами; для них
характерна очень небольшая величина отношения Al : Si (на-
пример, Na3Al3Si93Oi92- 16H2O) [1, 2]. Эти цеолиты служат ката-
лизаторами превращения метанола в смесь воды и углеводоро-
дов, используемых в качестве моторного топлива. В большинст-
ве природных цеолитов отношение Al : Si меняется в пределах
от 1:1 до 1:5. Очень малая величина этого отношения, до-
стигнутая в ZSM-5 и ZSM-11, позволила предположить, что
могут существовать каркасы этого типа и для состава SiO2.
Для структуры типа ZSM-5 такая возможность была реализо-
вана (разд. 23.12.8).
23.12. Силикаты 155
с = 6.62 А
5/S \!,
3/8 V, -
'ингтпонит
Рис. 23.23. а — цепь связанных тетраэдров как общая структурная особенность
цеолитов волокнистого строения. Цепь соединена с соседними цепями верши-
нами V, и IV, б — в той же самой цепи показано расположение атомов Л1, Si
и О. Вершины Vi и V2 находятся на высоте 3/8 и 5/8 периода повторяемости
цепи; в — проекция вдоль длинной оси цепи; г — схематическая проекция
структуры эдингтонита (цифры 0, 3, 5 указывают высоту соответствующей вер-
шины).
Характерной особенностью цеолитов является наличие в их
структурах каналов (или систем сообщающихся полиэдрических
пустот). Три основных типа цеолитов различаются взаимной
ориентацией каналов: а) все каналы параллельны, что дает
кристаллы волокнистого типа; б) каналы деляется на две груп-
156 23. Кремний
пы: в каждой они параллельны, но соответствуют пересекаю-
щимся направлениям, так что кристаллы имеют слоистое (ла-
меллярное, пластинчатое) строение; в) каналы направлены па-
раллельно трем некомпланарным векторам, например осям
кубической решетки, благодаря чему у кристаллов должна
отсутствовать ярко выраженная волокнистость или слоистость.
Наиболее симметричные каркасные структуры обладают куби-
Рис. 23.24. Структура слоистого цеолита (филлипсита). Структурная единица,
состоящая из двух тетраэдров (а); на проекции (б) такие единицы представ-
лены в виде равносторонних треугольников.
ческой симметрией, а у ряда цеолитов строение каркаса соот-
ветствует расположению ребер в заполняющем пространство
расположении полиэдров.
а) Структура типичного волокнистого цеолита эдингтонита
Ba(Al2Si3Oio)-4Н2О [3] показана на рис. 23.23. В этой структуре
можно выделить характерные цепи, образованные повторением
группы из пяти тетраэдров. Такие цепи связаны между собой
через выступающие атомы О (па рис. 23.23, б заштрихованы).
Они находятся на высотах Зс/8 и 5с/8 (с — период повторяемо-
сти вдоль цепи) по отношению к атому Si, лежащему на оси
цепи. Хотя в целом структура является каркасной, наличие
цепей с повышенной «концентрацией» атомов придает кристал-
лу волокнистый характер. Такой же каркас имеет синтетический
цеолит K-F [4]. Структурное сходство с эдиигтопитом обнаружи-
вают также минералы томсонит NaCa2(Al5Si502o) -6H26 и
натролит Na2(Al2Si30io) -2H2O [5].
На рис. 23.21 структура волокнистого цеолита показана в
виде упаковки тетраэдров.
б) Слоистые цеолиты часто встречаются в виде важного
компонента осадочных горных пород, например филлипсита
23.12. Силикаты 157
(К, NaMSiiiAl5O32-10H2O [6]. На рис. 23.24, б каждый треуголь-
ник соответствует двум тетраэдрам, сочлененным через общую
вершину (рис. о). Направление, по которому происходит сочле-
нение пары тетраэдров, перпендикулярно плоскости рис. б, по-
этому часть треугольников на рис. б (более толстые линии)
соответствует изогнутой двойной цепочке (ленте) из тетраэдров.
Такие же двойные цепочки, показанные тонкими линиями, рас-
полагаются в плоскостях, лежащих выше и ниже плоскости ри-
сунка. В результате структура в целом представляет собой трех-
мерный каркас из тетраэдров, каж-
дый из которых сочленен вершинами
с четырьмя другими тетраэдрами. Па-
раллельно оси а (перпендикулярно
плоскости рис. б) проходят каналы с
сечением 12 А2, а параллельно оси
Ь — каналы с сечением ~9 А2, но нет
каналов, параллельных оси с.
Не все цеолиты удовлетворительно
вписываются в простую классифика-
цию. В югаваралите Ca2Al4Sii2032- рис. 23.25. Заполняющее
•8Н2О трехмерный каркас состоит из пространство расположение
4-, 5- и 8-членных колец; наиболее ши- усеченных октаэдров, кубов
рокие каналы образуют двумерную и Ученных кубооктаэдров.
систему (они параллельны осям а и
с), тогда как каналы меньшего сечения параллельны оси Ь [7].
в) Мы уже отмечали, что ребра некоторых заполняющих
пространство расположений полиэдров соответствуют основным
4-связанным каркасам структур ряда алюмосиликатов. Простей-
шее из таких расположений — упаковка усеченных октаэдров —
будет рассмотрено в связи со структурой ультрамаринов. Если
квадратные грани усеченных октаэдров раздвинуты за счет
внедрения кубов, как показано на рис. 23.25, получается другая
упаковка, включающая усеченные октаэдры, кубы и усеченные
кубооктаэдры. Возможны и другие подходы к описанию такой
упаковки. Так как каждый усеченный кубооктаэдр через вось-
миугольные грани сочленяются с шестью другими усеченными
кубооктаэдрами, в целом образуется система, бесконечная
в трех измерениях. Соответственно существуют каналы, парал-
лельные осям кубической решетки и проходящие через крупные
полости типа Б. Еще один способ описания этой же структуры
представлен на рис. 23.27, а (см. ниже).
Каркас, показанный на рис. 23.25, соответствует строению
синтетического цеолита, называемого «сито Л», который может
иметь различное отношение Si : А1 [8], как, например,
в Na2(Al12Sii204S) -27H2O и Na^AlgSiisC^g) -27H2O. Ионообмен-
ные свойства цеолитов известны и используются давно; проявив-
158 23. Кремний
шийся сравнительно недавно интерес к этим соединениям со
стороны промышленности обусловлен их применением в каче-
стве молекулярных сит. Диаметр каналов определяет тип моле-
кул газа, которые могут перемещаться по этим каналам. На
цеолитах можно проводить разделение смеси газов благодаря
тому, что через каналы цеолита проходят лишь молекулы, раз-
меры которых меньше, чем диаметр каналов. Кубам на рис. 23.25
Рис. 23.26. Кристаллическая структура фожазита. Атомы Si (A1) расположены
в вершинах усеченных октаэдров, при соединении которых образуется трех-
мерный каркас.
не соответствуют какие-либо пустоты в структурах алюмосили-
катов, поскольку каждый куб образован плотной упаковкой
восьми тетраэдров. Молекулы воды могут проникать как в
крупные полости (Б), так и в меньшие по размеру (Л), тогда
как молекулы Ог способны занимать только полости типа Б
(см. строение гидрата CHC13-2H2S- 17H2O, разд. 15.2.2).
При заполнении пространства усеченными октаэдрами каж-
дый усеченный октаэдр соприкасается с 14 другими. Если между
чередующимися шестиугольными гранями (параллельными
гранями тетраэдра) поместить гексагональные призмы, то мож-
но получить довольно рыхлую (не заполняющую пространство)
упаковку этих двух типов полиэдров (рис. 23.26). Эту же упа-
ковку можно построить, разместив усеченные октаэдры по точ-
кам алмазной сетки и соединив их через четыре (из восьми
имеющихся) шестиугольные грани. Такой тип каркаса (Si, A1)
имеет природный цеолит фожазит NaCao,5(Al2Si5Oi4) • 10Н2О [9].
По аналогии со структурами из усеченных октаэдров, соеди-
ненных через кубы и гексагональные призмы, строится другое
¦семейство структур, производных от усеченных кубооктаэдров.
23.12. Силикаты 159>
Соединение соседних усеченных кубооктаэдров может осущест-
вляться а) через 12 кубов (по квадратным граням), б) через
8 гексагональных призм (по шестиугольным граням) и в) че-
рез 6 октагональных призм (по восьмиугольным граням). Эти
структуры изображены на рис. 23.27. Первый вариант (а) —
это еще один способ описания структуры сита А. Второй ва-
риант (б) соответствует каркасу синтетического цеолита ZK-5
с примерным составом N3o(Al3oSi660i92) -98H2O [10]. В структу-
ре имеются две взаимопроникающие трехмерные системы ка-
налов, сообщающиеся через почти плоские восьмичленные коль-
а
Pik\ 23.27. Ллюлюсплнкатиые каркасы цеолитов, а — сито А; б— цеолит ZK-5;
в — цеолит RHO.
ца, с внутренним диаметром —3,8 А (в цеолите типа сита А име-
ется только одна трехмерная система каналов). В третьем слу-
чае (в) интерес представляет тот факт, что полиэдры,
показанные на рисунке, занимают ровно половину всего про-
странства. В соответствии с этим имеются две одинаковые
взаимопроникающие трехмерные системы каналов. Такой
каркас у синтетического цеолита RHO (Na, Cs) ^AlpSiseOne-
•44Н2О [11].
В родственных минералах гмелините и шабазиге (хабазите)
[12] присутствуют менее симметричные полиэдрические полости.
Кальциевый шабазит имеет примерный состав Са (Al2Si4) O12 •
¦6Н2О, но кальций может частично замещаться на натрии.
В структурах этих минералов присутствуют гексагональные
призмы (как в миларите и цеолите ZK-5) и более крупные по-
лости. Их структуры можно составить таким же образом, как
строится плотнейшая шаровая упаковка, если вместо шаров
использовать гексагональные призмы [13]. На рис. 23.28, а и б
каждое шестичленное кольцо обозначает гексагональную приз-
му. Последовательность слоев АВ... (ГПУ) соответствует струк-
туре гмелинита, а последовательность ABC... — шабазиту. Типы
160 23. Кремний
23.12. Силикаты 161
получающихся полиэдрических полостей показаны на
рис. 23.28, в и г.
Ранее уже отмечалось, что кольца SisOs и SiioO]0 обычно
в силикатах не встречаются, но они присутствуют в некоторых
Рис. 23.28. Структуры гмелинита и шабазита.
природных и синтетических цеолитах и в силикалите
(разд. 23.11.1), а в меланофлогите кольца Si5O5 играют основ-
ную роль в формировании структуры. Семейству каркасных
структур, включающему синтетические цеолиты ZSM-5 и
ZSM-11, силикалит и близкие
по строению природные цеоли-
ты, было присвоено общее
название «пентасилы». На
рис. 23.29 изображен слой, вы-
резанный из структуры этого
типа, так что хорошо видно
сечение каналов, ограничен-
ных 10-членнымп кольцами
[14].
Ультрамарины. В послед-
нюю из рассматриваемых
групп каркасных силикатов
входят вещества, называемые
ультрамаринами. Это окра-
шенные силикаты, производимые промышленностью и исполь-
зуемые в качестве красящих пигментов. К этому же типу отно-
сится ляпис-лазурь (лазурит); весьма сходную структуру име-
ют и некоторые неокрашенные минералы, например содалит.
Мы будем для простоты всю эту группу силикатов обозначать
термином «ультрамарины». Подобно' др'угим каркасным сили-
катам, их структуры основаны на каркасах (Si, A1)O2 с поло-
жительными ионами, находящимися в пустотах. Характерным
признаком кристаллов этой группы является присутствие в
структуре отрицательных ионов, например Cl~, SO42" или S2~.
Подобно полевым шпатам и в отличие от цеолитов ультрама-
рины не содержат воды. Ниже приведены формулы характер-
ных представителей этой группы:
Рис. 23.29. Слой структуры цеолита
из семейство «пентасилов».
Ультрамарин
Содалит
Нозелит (нозеан)
Гельвин
Тугтупит
Na8rAl6Si6O24l(S, Se, Те)
Na8[Al6Si6O24lCl2
Na8[Al6Si6O24lSO4
(Mn, Fe)8[Be6Si60,4lS,
Nas[Al,Be2Si80,4l(S, CU)
Все эти соединения имеют близкие по строению каркасы
из связанных друг с другом тетраэдров (рис. 23.21 и 23.30),
причем положение атомов Si (Al, Be) соответствует вершинам
Рис. 23.30. Похожий на корзину каркас из тетраэдров SiO4, лежащий в основе
структуры ультрамаринов. Атомы Si размещаются в вершинах полиэдра, пока-
занного слева. Кремнекислородный каркас распространяется бесконечно в трех
измерениях.
усеченных октаэдров, заполняющих пространство (по Федоро-
ву)*. Положительные и отрицательные ионы размещаются в
многочисленных полостях каркаса. В результате уточнения
структуры содалита [15] получены значения расстояний
Si—О 1,628 А и А1—О 1,728 А, что указывает на упорядоченное
чередование атомов Si и А1 в каркасе. Сходное расположение
атомов Si и Be обнаружено в гельвине [16]; более высокий заряд
каркаса компенсируется находящимися в тетраэдрической ко-
ординации ионами Мп2+ (высокоспиновое состояние, 3 расстоя-
ния Мп—О 2,08 А, расстояние Mn—S 2,43 А), которые могут
замещаться ионами Fe2+. Структура тугтупита дает пример за-
мещения атомов Si в каркасе одновременно атомами А1 и Be.
Как и в цеолитах, здесь возможно замещение ионов, находящих-
ся в пустотах, другими ионами. Например, содалит, содержащий
ионы С1~, при нагревании в расплавленном сульфате натрия
превращается в нозелит. Получено также большое количество
ультрамаринов, содержащих вместо Na+ ионы Li+, T1+, Са2+
и Ag+, вместо серы — селен или теллур. В результате такого за-
мещения достигаются широкие вариации цвета ультрамаринов;
* Речь идет о теории параллелоэдров Е. С. Федорова; в данном случае
пространство заполняется гептапараллелоэдрами. — Прим. перев.
П—1284
162 23. Кремний
они могут быть почти бесцветными, желтыми, красными, фио-
летовыми, синими. Необходимо отметить, чго приведенные выше
формулы ультрамаринов являются «идеализированными»;
в действительности возможны довольно значительные изменения
состава при сохранении баланса положительных и отрица-
тельных зарядов.
Литература, fl] Nature, 1978, 272, 437. [2] Nature, 1978, 275, 119. [31 Acta cryst.,
197G, B32, 1623. [4] Acta cryst., 1976, B32, 1714. [5] Z. Knstaliogr.. I960, 113,
430. [6] Acta cryst., 1974, B30, 2426. [7] Acta cryst., 1969, B25, 1183. |8| Acta
cryst., 1960, 13, 737; Inorg. Chem., 1966, 5, 1537, 1539; Z. Kristallogr., 1971, 133,
134. [9] Am. Mineral., 1964, 49, 697. [10] Z. Kristallogr., 1965, 121, 211. fill Adv.
Chem. Series, 1973, 121, 106. [12J Acta cryst., 1964, 17, 374. [13] Nature, 1964,
203, 621. [14] Chem. Soc. Special Publication, 1980, 33, p. 133. [15] Acta cryst.,
1967, 23, 434. [16] Acta cryst., 1972, B28, 114.
24. БОР
24.1. Введение
Бор имеет мало общего с другими элементами III группы. Бу-
дучи наиболее электроотрицательным из них, он по своим свой-
ствам больше похож на кремний, чем па алюминий и другие
металлы главной и побочной подгрупп. Бор — единственный
элемент III группы, образующий несколько рядов гидридов, ко-
торые в отличие от твердых ионных гидридов щелочных и ще-
лочноземельных металлов летучи при нормальных условиях
(подобно молекулярным гидридам неметаллов последующих
групп). Гидриды бора составляют уникальную группу электро-
иодефицитных соединений. В противоположность алюминию
бор не образует устойчивых кислородсодержащих солей (нит-
ратов, сульфатов и т. д). Кислый сульфат бора получают при
действии серного ангидрида SO3 на борную кислоту. Получен
также тетраацетатдиборат (CH3COOJBOB(CH3COOJ, но нор-
мальный ацетат неизвестен*. Соль (CH3LN[B(NO3L], обра-
зующаяся при действии избытка N2O4 при —78 °С на твердый
(CH3LN (BCI4), представляет собой белый кристаллический по-
рошок, устойчивый при комнатной температуре и нераствори-
мый в воде. Перхлораты В(СЮ4K, В(С1О4JС1 и В(С1О4)С12
получены из ВС13 и безводной НСЮ^ при температуре —78 °С.
3)то ннзкоплавкие соединения, чувствительные к влаге и разла-
гающиеся при нагревании. Для бора известны многочисленные
оксосолп, в которых атом бора связан с тремя или четырьмя
атомами кислорода, а также сложные оксиды ВРО4 и BAsC>4—¦
структурные аналоги SiO2.
Галогениды бора ВХ3 в газообразном состоянии мономерны, в
то время как галогениды алюминия (А1С13, Л1Вг3 и АП3) сущест-
вуют в парах в виде димеров А12Х6. Мопомсрные молекулы сохра-
няются н в кристаллической структуре галогенидов бора (в отлп-
чне от А1С13). Бор, кроме того, образует галогениды типа ВгХ4,
В4Х4, В8Х8 и ВдСЬ, причем последние три характерны только для
этого элемента. Монофторпд бора BF может быть получен с
•85%-ным выходом при пропускании BF3 над бором при темпе-
ратуре 2000 °С. Это соединение еще менее устойчиво, чем SiF2.
* В(СН:)СОО)з — бесцветные кристаллы с температурой плавления 149 °С
образуются, например, при взаимодействии B(ORK с СН3СООН (Некра-
сов В. В. Основы общей химии. — М.: Химия, 1973). — Прим. перев.
2 1*
164 24. Бор
Разнообразная стереохимия соединений бора (единственного из
III группы) обусловлена его способностью образовывать три
компланарные связи; во многих соединениях бор образует четы-
ре тетраэдрические связи. Например, в результате присоедине-
ния NH3 к В(СН3K образуется устойчивое твердое соединение
В(СН3)з-МН3, перегоняющееся без разложения. Аналогичные
соединения известны и для галогенидов бора. Галогениды алю-
миния взаимодействуют подобным образом с органическими ок-
сосоединениями; А1С13 реагирует со многими кетонами, в ре-
зультате получаются соединения типа R2C=O-A1C13. Алюми-
ний подобно бору образует летучие алкоголяты (эфиры), на-
пример А1(ОС2Н5K.
Отмеченная аналогия химии бора и кремния не распростра-
няется на структуры образуемых ими соединений. Галогениды
обоих элементов (в отличие от подобных соединений углерода)
легко гидролизуются с образованием кислот. При взаимодейст-
вии BF3 с водой образуется HBF4 (наряду с борной кислотой).
Из раствора борной кислоты и NaHF2 можно получить NaBF4.
В то же время SiF4 гидролизуется до SiF62-. Соли типа МВС14
получают в безводных растворителях, причем они устойчивы
только в случае достаточно крупных катионов К+, Rb+, Cs+,
N(CH3L+ или РС14+. Белые твердые очень гигроскопичные соли
М(СгН5LВВг4 и (РуН)В14 получают в среде жидких галогепо-
водородов. По количеству и разнообразию оксосолей бор мо-
жет конкурировать с кремнием. Как уже упоминалось, бор в
этих соединениях образует три компланарные или четыре тет-
раэдрические связи с кислородом. В структурах многих боратов
в одном и том же анионе осуществляется как планарная, так и
тетраэдрическая координации. Поскольку в растворе различ-
ные борат-ионы существуют в равновесии, невозможно пред-
сказать формулу бората, который будет кристаллизоваться из
него или образовываться в результате обменного разложения.
Поэтому для получения безводных боратов определенного со-
става сплавляют оксиды или карбонаты металлов с В2О3 в нуж-
ном соотношении. Как и силикаты, бораты, полученные таким
способом, при быстром охлаждении расплава переходят в стек-
лообразное состояние (подобно ВгО3). В то же время для бора
известна целая группа гидроксилсодержащих боратов, которые
не имеют аналогов среди силикатов. Борные кислоты и бораты
будут рассмотрены далее.
Чистый моноксид бора получают при нагревании элемеггтар-
пого бора с триоксидом до температуры 1350 °С. При обычной
температуре ВО представляет собой янтарно-желтое аморфное
стекло, активно реагирующее с водой и спиртом. В парах при-
сутствуют молекулы В2О2 [1]. Существует и вторая форма
ВО — рыхлое белое гигроскопичное вещество (с. 181).
24.1. Введение 165
0з нестабильных соединений бора с кислородом известны В2О
(см. схему 24.1, с. 181), ВО2 [2] (образующийся при нагрева-
нии ZnO + B2O3 в камере Кнудсена), а также ион ВО2~. По-
следний наряду с ионом В3О63- обнаружен при изучении
ИК-спектров КВН4 (использовались таблетки КВг —по-види-
мому, указанные оксо-ионы образуются при нагревании и взаи-
• в
OS
Рис. 24.1. Строение слоя в кристаллической структуре B2S3.
модействии КВН4 с кислородом, адсорбированным материалом
таблетки). ИК-спектр свидетельствует о линейном строении
иона ВО2~. Он неустойчив, и через несколько месяцев его кон-
центрация значительно уменьшается [3].
Сульфид бора B2S3 образуется при разложении HBS2 в ва-
кууме при температуре 300 °С. Последний получают при взаи-
модействии сероводорода с бором при температуре 700°С.
В масс-спектре B2S3 установлено присутствие большого числа
ассоциатов [4]. Как и В2Оз, сульфид бора обычно образует
стекла, однако в 1962 г. была изучена его структура в кристал-
лическом состоянии [5]. Кристаллический B2S3 построен из
слоев, образованных 4-членными (B2S2) или 6-членными (B3S3)
циклами, подобными молекулам (BSSHJ и (BSSHK. Эти цик-
лы, связанные друг с другом посредством общих атомов серы,
образуют более крупные кольца B16Si6 (рис. 24.1). Каждый
атом бора образует три компланарные связи, средняя длина ко-
торых равна 1,81 А. Интересными особенностями структуры яв-
ляются очень короткие расстояния S—S в фрагменте B2S2
B,88 А, в то время как расстояние между слоями ^3,8 А) и
компактная форма циклов B16Si6, что приводит к почти плот-
нейшей гексагональной упаковке атомов серы. Эта структура
166 24. Бор
весьма отличается от трехмерного каркаса в структуре В2О3,
образованного из колец ВюОю-
Очень обширна также химия борорганических соединении.
К числу простейших типов таких молекул относятся:
RB(OHJ
R2B(OH)
B-O-B'
(OHJB
-B(OHJ)
Соединения типа RB(OHJ полимеризуются только до цик-
лических тримеров (в отличие от R2Si(OHJ, образующих ли-
нейные полисилоксаны), аналогичных единственному цикличе-
скому метаборат-иону В3О63~. Важной особенностью химии
бора является образование 6-членных циклов, как, например,
в бороксине (разд. 24.7.7) и многочисленных его производных
(бороксолах), а также в B3N3 (б) и B3S3 (в).
а
RB''
I
1
0.
= H, F,
CH3l
1
I
R
OH,
OCH3
HB'
1
RN.
R
"" R x
H
BH
NR
HS.
X
:i, Br, sh
,,0о в
|30°
1,80 X
в^
1—1,81 X
SH
Шестичленный цикл В3О3 встречается и во многих более слож-
ных борат-анионах. Циклические соединения бора с азотом рас-
смотрены ниже. В паре над HBS2 при температурах ниже
100сС существуют в основном молекулы типа в (X = SU) [6J;
в то же время в кристаллическом состоянии для этого соедине-
ния структурной единицей является плоский цикл B3S3(SHK
(г) |7], очень близкий по строению B3S3Br3. В молекуле
B2S3C12 имеется 5-членный цикл B2S3 (д).
Литература. [\] J. Chem. Phys., 1956, 25, 498; J. Phys. Chem., 1958, 62, 490.
[2] Can. J. Phys., 1961, 39, 1738. [31 Inorg. Chem., 1964, 3, 158. [4] J. Am. Chem.
Soc, 1962, 84, 3598. [51 Angcw. Chcm., 1977, 89, 327. [6] J. Am. Chcm. Soc,
1966, 88, 2935. [71 Acta cryst., 1973, B29, 2029. [8] Ada Chem. Scand., 1973,
24.2. Стереохимия бора 167
2-1.2. Стереохимия бора
Стереохимия бора во многих его соединениях с галогенами
(исключая В„С1„), кислородом, азотом, фосфором довольно про-
ста. Как правило, он образует три компланарные или четыре
тетраэдрические связи. Более сложная стереохимия бора в элек-
тронодефицитных системах (элементный бор, некоторые бори-
ды и бораны) рассмотрена отдельно. Плоское расположение
трех связей атома бора наблюдается во многих соединениях
типа ВХ3 и BR3 (табл. 24.1), в циклических молекулах, подоб-
ных упомянутым ранее, во многих кислородсодержащих ионах
(см. следующий раздел), а также в кристаллах, например в
графитоподобной структуре BN (разд. 24.6.1) и в А1В2
(разд. 24.4).
Молекула
BF3
ВСЦ
В В г.
ВГ3
В13
I1BF2
В(СН3)з
B(CH3JF
13(ОСН3)з
Таблица
Расстояние
о
В—X, А
1,31
1,74
1,89
2.10
2,12
1,31
1,29
24.1. Строение п.
Другие данные
В—Н 1,19 А;
F—В—F 118"
В—С 1.58А
В—О 1,38 А
юекпх молекул ВХ3 и BR3
Литература
J. Chcm. Phys., 1968, 48, 1571
Bull. Chem. Soc. Japan., 1966, 39, 1134
Bui!. Chem. Soc. Japan, 1966,39, 1146
Inorsj. Chem., 1962, 1, 109 (кристалл)
Bull.' Chem. Soc. Japan, 1975, 47, 1974
(дифракция электронов; газовая
фаза)
J. Chem. Phys., 1968, 48, 1
J. Chem. Phys., 1965, 42, 3076
J. Am. Chem Soc, 1942, 64, 2686
J. Am. Chem. Soc, 1941, 63, 1394
Неплоское расположение четырех связей бора было установ-
лено методами классической стереохимии. При компланарно-
сти связей бора в салицилборате (а) у этого иона должна быть
плоскость симметрии; салицилборатные соли с помощью стрих-
нина удалось разделить на оптические изомеры. Хотя этот факт
а
Н
о
н,с
^
X
N(CH3K
был интерпретирован как свидетельство тетраэдрической, а не
плоской координации бора, полученные данные позволяют
168 24. Бор
лишь исключить строго компланарную конфигурацию иона
(или другую конфигурацию с симметрией п) (гл. 2). Впослед-
ствии кристаллы с оптически активным катионом б удалось
разделить «вручную», а структура аналогичного бромсодержа-
щего катиона была изучена в кристаллическом гексафторофос-
фате [1].
Простейшими группами, содержащими бор с четырьмя тет-
раэдрическими связями, являются ионы ВХ4~. Некоторые фто-
робораты изоструктурны кислородсодержащим солям с тет-
раэдрическими ионами. Например, NaBF4-—-структурный ана-
лог CaSO4, CsBF4 и T1BF4 — BaSO4, a (NO)BF4 — (NO)C1O4.
Длина связи В—F равна 1,41 А в NaBF4 [2] и 1,406 А в
NH4BF4 [3]. Интересно, что в соли аммония не образуются во-
дородные связи, кратчайшее расстояние N—Н—F равно 2,93 А
(в NH4F 2,69 А). В соединениях H(BF3OH) и (Н3О) (BF3OH),
которые раньше рассматривали как BF3-H2O и BF3-2H2O [4],
обнаружен ион [BF3OH]-, а в солях типа BaBOF3 — тетраэдри-
ческий ион BOF32- (В—F 1,43 А, В—О 1,435 А) [5]. Ион
В(ОНL~ и многочисленные структуры, содержащие тетраэдри-
ческие группы ВО4, рассматриваются далее в этой главе после
кислородных соединений бора.
Примерами простых тетраэдрических молекул являются
Н3В-Ы(СН3)з, Н3В-СО (б): многочисленные аддукты BF3 и не-
обычное соединение B4F6-PF3 (г) [7]. Последнее — очень реак-
ционноспособное бесцветное вещество, образуется в результате
конденсации высокотемпературной формы BF на холодной по-
верхности, покрытой PF3. Интересно, что в этой молекуле один
атом бора тетраэдрически связан с одним атомом Р (В—Р
1,83 А) и тремя атомами бора (В—В 1,68 А), причем эти три
атома В образуют по три компланарные связи (В—F 1,31 А;
6 „ г PF,
114°
н'
1,194 А
F,B'
В
F,
1,49 А
1,37 А
^О 0
-С1
"О
24.3. Элементный бор и бориды 169
Р—F 1,51 А). Другими примерами тетраэдрических комплексов
могут служить молекула д [8] и анион е в K[B(SO3C1L] [9].
Многие молекулы и кристаллы, содержащие равное коли-
чество атомов бора и азота (или фосфора), образуют струк-
туры, подобные структурам соответствующих соединений эле-
ментов IV группы. Например, BN и ВР образуют структуры
типа алмаза, упомянутый выше ВРО4 имеет структуру кристо-
балита, а молекулы, напоминающие замещенные циклогексаны,
в частности [H2B-N(CH3J]3, имеют, по аналогии с С6Н12, кон-
формацию кресла.
Литература. [1] Inorg. Chem., 1971, 10, 667. [2] Z. anorg. allgem. Chem., 1966
344, 279. [3] Acta cryst., 1971, B27, 1102. [41 Acta cryst., 1964, 17, 742 f51 Acta
crysi, 1957, 10, 199. [6] Phys. Rev., 1951, 78, 1482. [7] Inorg. Chem., 1969, 8,
836. [8] Acta cryst., 1972, B28, 1961. f9] Acta cryst., 1978, B34, 1771.
24.3. Элементный бор и бориды,
родственные ему по структуре
Примечательной особенностью бора является сложность струк-
тур его полиморфных модификаций; твердость некоторых из
них близка к алмазу. Ромбоэдрическая а-форма бора Bi2 (ин-
декс обозначает количество атомов В в элементарной ячейке)
образуется при разложении боранов или В13 при 800—
1200 °С. Эта форма считается термодинамически нестабильной
по сравнению с |5-ромбоэдрическим бором В105, который кри-
сталлизуется из расплава очень чистого бора или образуется
при отжиге других форм бора выше 1500 °С; это одна из легко-
доступных модификаций. Восстановление ВВг3 водородом на
танталовой нити при температурах 1200—1400 °С сопровожда-
ется образованием а-тетрагональной формы В50. Стеклообраз-
ный бор, а также тонкие нити из него, обладающие высокой
прочностью на разрыв, практически аморфны; на дифракто-
грамме присутствуют лишь два размытых кольца. В структу-
рах всех трех модификаций бора, а также некоторых боридов,
богатых бором, содержатся икосаэдрические группы В12, обра-
зующие основную часть каркаса, в некоторых случаях присут-
ствуют также дополнительные атомы В.
В структуре а-В[2 все атомы бора принадлежат икосаэдри-
ческим группам, расположение которых близко к кубической
плотнейшей упаковке. Этот тип упаковки может быть описан
с помощью ромбоэдрической элементарной ячейки с углом,
близким к 60°. Если икосаэдры В[2 расположены во всех узлах
ромбоэдрической решетки (рис. 24.2, а), то шесть атомов бора
каждого из них (атомы двух противолежащих граней) могут
образовать связи с атомами В других икосаэдров (В—В 1,71 А).
Эти связи направлены вдоль ребер элементарной ячейки и об-
разуют трехмерный каркас, в котором каждый икосаэдр связан
170 24. Бор
с шестью другими. Направления этих связей в идеальном слу-
чае соответствуют направлению одной из осей пятого порядка
в икосаэдре (рис. 24.2,6). Остальные шесть атомов бора каж-
дого икосаэдра, образующие вокруг его экватора гофрирован-
ный шестиугольник, не могут связываться таким же образом,
поэтому кратчайшие расстояния в экваториальной плоскости
Рис. 24.2. Кристаллические структуры a-Bi2 и p-B1Os- а и б — упаковка групп
В]2 в a-Bi2; в — проекция cc-Bi2 перпендикулярно оси третьего порядка; пока-
заны трехцентровые связи; г — группировки Bs4 в структуре {5-Вци; изображен
центральный икосаэдр и только шесть полуикосаэдров, каждый из которых со-
единен с одним из атомов В центрального икосаэдра.
ABC равны 2,03 А. Связывание атомов в этой плоскости осу-
ществляется при помощи 3-центровых связей (рис. 24.2, в).
Рассмотренный каркас лежит в основе структур и некоторых
боридов. Группы атомов YXY могут располагаться вдоль внут-
ренней диагонали ячейки (рис. 24.2, а), поскольку в центре
ячейки существует октаэдрическая пустота, окруженная икоса-
эдрами ABCDEF. В структуре В4С это линейные группы
С—С—С, причем вместо 3-центровых связей в экваториальной
плоскости образуются связи между шестью экваториальными
атомами бора групп Bj2 и концевыми атомами С цепочек. Та-
ким образом, половина атомов бора связана с шестью атома-
ми В (как в a-Bi2), а остальные — с пятью атомами В и одним
24.3. Элементный бор и бориды 171
атомом С. Единственный конгруэнтно плавящийся карбид бора
имеет состав Bi3C2, т. е. В,2-СВС (вероятно также, что В4С
представляет собой (ВИС)СВС, а не (В]2)С3. Однако этот во-
прос еще изучается.). В соединении А1С4В40, очевидно, присутст-
вуют цепи — линейные СВС и СВВ и нелинейные С(А1)В. (Ли-
тература по этим соединениям приведена в табл. 24.2.)
Существует множество структур типа В4С или типа ромбо-
эдрического В]2, хотя детали их строения не всегда ясны. Вме-
сто цепей С3 или СВС они содержат атомы серы (в структуре
B]2S), группы О—В—О в Bi3O или два атома Si (в B2,s9Si).
В связи с тем, что на месте трех атомов С могут поместиться
только два атома Si, вероятно, происходит статистическое за-
мещение некоторых атомов В в икосаэдрах на атомы Si. В ре-
зультате образуется соединение, близкое по составу к B31Sin
(т. е. B3ISisSi6 или B2ig9Si). В ранних работах по «Bi3P2» пред-
полагалось, что между икосаэдрами располагаются трехатом-
ные цепи Р—В—Р. Впоследствии оказалось, что здесь имеются
только пары атомов В и Р, статистически распределенные в
структуре Bi2(P1i36B0i64)- Каждый такой атом В(Р) образует
тетраэдрические связи с тремя икосаэдрами В]2 и другим ато-
мом, не входящим в состав икосаэдров. См. также литературу,
цитируемую в табл. 24.2 п относящуюся к соединению бора с
мышьяком.
Известна близкая по строению ромбическая фаза состава
Al2.iCsB5i (описываемая как А1В10, А1В12 или А1С4В24), в кото-
рой присутствуют искаженная гексагональная плотнейшая упа-
ковка икосаэдров В12 и линейные цепи СВС, причем В в этих
цепях частично замещен на А1. Как и в структуре В4С, в обсуж-
даемой здесь структуре каждая группа В12 связана с шестью
другими группами посредством связей В—В A,77 А) таким об-
разом, что шесть атомов бора каждого икосаэдра образуют
шесть связей В—В, а остальные связаны с пятью атомами В и
одним атомом С. Длины связей в этом соединении близки к
аналогичным значениям для структуры В4С:
Связь
В структуре В структу-
А2, iC8Br,i ре В4С
В—В (внутри икосаэдра)
В—В (межд-v икосаэдрами)
В„кос—С "
ВцС.г,—С
1,816
1 ,774
1,623
1,467
А
1,789 А
1,718
1,604
1,435
Родство этих двух структур подтверждается тем фактом, что со-
единение алюминия в результате топотактнческого перехода при
2000 °С теряет алюминий с образованием В4С. Этот процесс
172 24. Бор
Таблица 24.2. Полиморфные модификации бора; «
Структура
a-Bi2 (ромбоэдрический)
В4С
В13С2
В,3Р2
Bi2Asij7Bo,23
B2S9S1
AIC4B40
А12ЛС8В51
NaB,s
MrAIBm
а-Вбо (тетрагональный)
ВеВ12
Р-Вю5 (ромбоэдрический)
YB66
Структурная единица
Только Bi2 (КПУ)
ВцС; цепи СВС
В12; СВС
В,2; (В, Р)
См. текст
(B10,3Si1,7)(Si2K
В12; цепи СВС, СВВ,
CAIB
Bi2 (ГПУ); цепи СВС
(СА1С)
В12; 3 В, Na
В,2; 2 В, Mg, A1
(В12L; 2 В
В12; Be
(В84) (ВюВВю)
пкосаэдрпческне» бориды
Литера тура
Acta cryst.,
Ada cryst.,
1797
Ada cryst.,
1 i'i ^ i>
I UOi
Acta crvst.,
2549
i\cta cryst
972
Acta Chem.
16, 449
Acta cryst.,
Acta crvst
1223
1959, 12,
1975,
1979,
1974,
, 1976,
Scand.,
503
B31,
B35,
B30,
B32,
1962,
1970, B26, 315
, 1969,
J. Solid State Chem.,
1, 150
Acta cryst.,
B25,
1970,
1970, B26, 616
J. Am. Chem. Soc,
en 4Я07
Z. anorg.
1960, 306,
Acta cryst.,
1 Q^I
LoO 1
Acta cryst
237
1968,
allg. Chem.,
266
1977,
, 1969,
B33,
B25
сопровождается переходом гексагональной плотнейшей упаков-
ки икосаэдров Bi2 в кубическую плотнейшую упаковку.
В изоструктурных соединениях NaBi5 и MgAlB^ икосаэдры
В]2 образуют слои, расположенные друг над другом таким об-
разом, что реализуются только два прямых контакта между
икосаэдрами (перпендикулярно слоям) с пентагонально-пира-
мидальной координацией связующих атомов. В слоях каждый
икосаэдр Bi2 связан с четырьмя другими икосаэдрами одинако-
выми по длине связями A,75А), однако присутствуют также
связи через атомы Mg, Al и дополнительные атомы бора, не
принадлежащие икосаэдру (очевидно, играющие существенную
роль в стабилизации такого способа упаковки икосаэдров).
Характерной особенностью структур модификаций бора яв-
ляется большая доля атомов, которые образуют шестую связь
(пентагонально-пирамидальная координация), направленную
наружу вдоль оси пятого порядка икосаэдра. Они составляют
в структурах
ромбоэдрического В,2 50%
ромбоэдрического Вю5 80%
тетрагонального В5о 64%
24.3. Элементный бор и бориды 173
Если бы все атомы бора каждого икосаэдра имели шестую связь
с атомом бора другого икосаэдра, образовалась бы радиальная
непериодическая упаковка икосаэдров (гл. 4). Каркас ромбо-
эдрического Вю5 можно представить состоящим из структурных
элементов (В84) (ВюВВю). Фрагмент В84 образуется из икоса-
эдра, связанного с 12 полуикосаэдрами, которые присоединяют-
ся наподобие «зонтика» к каждой вершине (рис. 24.2,г). Эти
фрагменты расположены в узлах ромбоэдрической решетки
(рис. 24.2, а) таким образом, что шесть полуикосаэдров каждого
фрагмента В84 сходятся в серединах ребер ячейки, образуя до-
полнительные икосаэдры. Таким образом, основной каркас со-
стоит из икосаэдров, находящихся в узлах решетки (рис. 24.2, а)
и соединенных через икосаэдры, которые располагаются в сере-
динах ребер ячейки. Каждый из икосаэдров второго типа непо-
средственно связан только с двумя другими икосаэдрами. Ос-
тавшиеся шесть полуикосаэдров фрагмента Bg4 не участвуют в
образовании новых икосаэдров; вместе с фрагментами Вю они
образуют остальные связи в экваториальной плоскости (ср. с
3-центровыми связями в В[2 и связями с участием атомов С
в В4С). Вдоль диагонали ячейки (на месте цепи СВС в В4С)
располагаются группы В10ВВю. При этом отдельный атом бора
находится в центре ячейки.
Следует остановиться на чрезвычайно сложной структуре
YB66, в которой на элементарную ячейку приходится 1584 ато-
ма В и 24 атома Y; и тем не менее она обладает высокой (ку-
бической) симметрией. Большинство атомов бора A248) входят
в состав фрагментов, состоящих из 12 икосаэдров A56 атомов),
расположенных вокруг одного центрального. Эти фрагменты по-
средством связей В—В A,62—1,82 А) образуют трехмерный
каркас. Как уже говорилось, 12 икосаэдров, группирующихся
вокруг центрального, представляют собой исходный элемент ра-
диальной упаковки, которая не является периодичной в трех
измерениях. В упаковке фрагментов Bi56 остаются каналы, в ко-
торых располагаются остальные атомы В и Y.
Структура тетрагонального В50 сравнительно проста.
Из 50 атомов, приходящихся на элементарную ячейку, 48 обра-
зуют четыре почти правильных икосаэдра, которые связаны не-
посредственно друг с другом и через оставшиеся атомы бора.
Последние образуют тетраэдрические связи; атомы икосаэдров
связаны с пятью своими соседями по группе Bi2, а шестую
связь образуют с атомом другого икосаэдра или с отдельным
атомом В. Координация всех атомов В в икосаэдре соответству-
ет пентагональной пирамиде, но для 8 из 12 атомов В наблюда-
ется существенное отклонение B0°) внешней связи от направ-
ления оси пятого порядка икосаэдра. Длины связей в этой
структуре равны: 1,60 А для атомов В с КЧ 4, 1,68 А для связей
174 24. Бор
между группами В12 и 1,81 А внутри этой группы. Известно не-
сколько боридов, имеющих тот же структурный тип, что и тет-
рагональный Взо, например NiB25, ВеВ12. Атомы металлов, оче-
видно, занимают некоторые пустоты в структуре В5о.
24.4. Бориды металлов и карбиды бора
Здесь рассмотрены структуры боридов и карбидов бора, не со-
держащие икосаэдрические группы В^. Они, как карбиды и си-
лициды, могут быть получены непосредственным взаимодейст-
вием элементов при достаточно высоких температурах. В то же
время некоторые бориды и силициды образуются при восста-
новлении боратов или силикатов избытком металла. Как и в
случае силицидов, формулы боридов нельзя интерпретировать
Таблица 24.3. Кристаллические структуры боридов металлов
Тип группировок
из атомов В
Структура
Примеры
Ли юратура
Изолированные j Вс\(В
атомы В
Группы В2
Простые цепи
Двойные пени
Слон
Трехмерный
каркас
1'ОчС
CuAl,
CaFo
kh,B
М2\М"В ¦
СгЗ
i с В
МоВ
М,В:1
Ru,iB8
Та;,В,
А1В,
Е-.МО--В
СгВ4
ив,
CaBG
ив12
NbB, Со-В
Мц,В, Fe2B
С о,В, Ni2B
Мо2В, Та,В
Ве2В
(.Mo, Ti, Al)CrB
NbB, Та В, VB
СоВ, .МпВ, TiB
HfB
\YB
Сг3В4, Мп3В4
Nb-,B,
.M-Ti, Zr, \h
Та, V, Cr, Mo
U, Mg
е-фа.ча—\Y—В
.M==Y, La, 4/
элементы, Th
.M-Sr, Ва, \
La, 4/-эле
менты, Th, U
M = Y, Zr, 4[
элементы
Z. anorg. ailijem. Chem., 1962,
Jlis, oU4
Ada Chcm. Scand., 1958, 12, 658
Acta Chem. Scand., 1949, 3, 603
Ada Chem. Scand., 1950, 4, 146
ДАН СССР, 1955, 101, 97
Ada cryst., 1954, 7, 49
Ada cryst., 1958, 11, 607
Act:, cryst., 1965, 19, 214
Ada cryst., 1966, 20, 572
Ada Chem. Scand., 1947, 1, 893
Acta Chcm. Scand., 1959, 13,
1193
Ada Chem. Scand., 1960, 14,
2169
Ada Chem. Scand., 1961, 15,
1178
Acta cryst., 1953, 6, 870; Acta
Chem. Scand., 1959, 13, 1193
Ada Chem. Scand., 1947, 1, 893
Acta Chem. Scand., 1968, 22,
3! 03
Acta cryst., 1974, B30, 2933
Inorg. Chem., 1963,2,430; J. So-
lid State Chem., 1970. 2, 332
Acta cryst., 1965, 19, 1056
24.4. Бориды металлов и карбиды бора 175
на основе нормальных валентностей металлов. Например, из-
вестны NaB6, CaB6 и YB6; иттрий и хром образуют еще по че-
тыре борида: YB2, YB4, YB12, YB66 и СгВ, Сг3В4, СгВ2, СгВ4.
Рапсе обсуждались структуры некоторых боридов, богатых
бором, в которых присутствует трехмерная система связей В—В.
Другой крайний случай представляет собой бориды с низким
содержанием бора, в которых изолированные атомы бора пол-
ностью окружены атомами металла. С увеличением содержания
бора его атомы соединяются между собой, образуя сначала
фрагменты В2, затем цепи, слои или трехмерные каркасы во
всем объеме кристалла (табл. 24.3).
в
о
м
О
м
Рис. 24.3. а — слои атомов №_в структуре Ni3B; справа выделен участок слоя,
параллельного плоскости A011) в гексагональной плотнейшей упаковке; б—
слой атомов металла в борпдах со структурой типа СпА!2; в — структура бо-
ридов М2'М"В2.
К боридам, в структуре которых существуют отдельные ато-
мы бора, принадлежат Ве4В и Ni3B (или СозВ), относящиеся
к структурному типу цементита Fe3C. В этой структуре атомы
металла образуют слегка гофрированные слои (рис. 24.3, а),
а атомы В располагаются между слоями, причем шесть ближай-
ших к атому В атомов Ni образуют тригональную призму
(В—Ni 2,04 А). Эти слои атомов металла родственны слоям в
гексагональной плотнейшей упаковке, параллельным плоскости
A0П) (рис. 24.3).
Существует борид бериллия Ве2В со структурой типа флюо-
рита и многочисленные бориды М2В со структурой СиА12, кото-
рая описана в разд. 29.6.5. Атомы металла в них образуют слои
(рис. 24.3,6). Соседние слои повернуты друг относительно дру-
га на 45°, а атомы В находятся в центрах антипризм, образо-
ванных двумя квадратными группами из соседних слоев.
В структуре Fe2B атом В координирует восемь атомов Fe на
расстоянии 2,18 А и еще два атома В на расстоянии 2,12 А (но
это не связь В—В!).
176 24. Бор
Изолированные пары атомов бора встречаются в структу-
рах некоторых двойных боридов типа М2'М2"В2, где М' — атом
с большим радиусом (Mo, Ti, A1 или эти металлы в сочетании),
а М" — атом с малым радиусом (Cr, Fe, Ni). Крупные атомы
образуют 5-связанную сетку (рис. 24.3,6), а атомы М" и В ле-
жат между слоями, причем первые размещаются в центрах
тетрагональных призм, а атомы В — в центрах тригональных
призм, прилегающих друг к другу (рис. 24.3, в). Длина связи
В—В в группе В2 равна 1,73 А.
а , ^ 6
Ъ о о о
Рис. 24.4. Кристаллические структуры FeB (а) и А1В2 (б). Большие кружки —
атомы металла, маленькие кружки — атомы бора.
Две полиморфные модификации Ni4B3 представляют собой
промежуточное звено между структурами с отдельными атома-
ми бора (как №3В) и структурами, в которых атомы В объеди-
нены в цепи. В одной из модификаций 2/з атомов бора образуют
зигзагообразные цепи, а остальные находятся в виде отдельных
атомов. В другой модификации все атомы В образуют цепи.
В родственных структурах FeB, CrB и МоВ атомы В также
образуют зигзагообразные цепи. В FeB (и изоструктурном СоВ)
каждый атом бора окружен шестью атомами Fe, расположен-
ными в вершинах тригональной призмы (Fe—В 2,12-4-2,18 А),
но ближайшими соседями являются два атома В на расстоянии
1,77 А (рис. 24.4, а). Таким образом, атомы В соединяются в
бесконечные цепи.
В боридах типа М3В4 существуют двойные цепи из ато-
мов В, в которых связи между цепями значительно прочнее свя-
зей, направленных вдоль цепей (рис. 24.5, в). Структура Та3В4
в этом смысле занимает промежуточное положение между це-
почечной и слоистой.
В структуре А1В2 атомы В н А1 располагаются чередующи-
мися слоями, причем слой из атомов В имеет ту же структуру,
что и слой в графите (разд. 21.4.3). Каждый атом В находится
на одинаковых расстояниях от трех других A,73А), а следую-
щую координационную сферу составляют шесть атомов А1, об-
24.4. Бориды металлов и карбиды бора 177"
разующих тригональную призму (рис. 24.4,6). Большинство
«слоистых» боридов имеют структуру типа А1В2, однако в си-
стемах Мо—В и W—В существуют фазы с идеальным соста-
вом МгВ5. Очевидно, добавочные атомы бора занимают в гекса-
гональной сетке положения, отмеченные крестиком на
рис. 24.5, г. В системе Та—В образуются все четыре типа бори-
дов (рис. 24.5) (ср. с группировками атомов Si в силицидах
металлов).
\ 6
о
1 г,ю-г,ш
а
Ta2B
TaB
Щ'ЩА
ТаВ,
Рис. 24.5. Расположение атомов бора в боридах. а — изолированные атомы бо-
ра; б— простые цепи; а — двойные цепи; г — гексагональный слой.
Очень интересны трехмерные каркасы из атомов В в бори-
дах металлов с большим содержанием бора. Так, в СгВ4 реали-
зуется очень простой каркас из атомов В, в котором каждый
атом имеет по четыре связи, причем расстояния В—В между
квадратами В4, лежащими на разных высотах, равны 1,91 А,
а в самих группах В4— 1,68 А (рис. 24.6, а). Каждый атом В
образует по две связи каждого типа с другими атомами бора,
в то время как Сг имеет в ближайшем окружении два атома Сг
и 12 атомов бора. У СаВ6 (и многочисленных изоструктурных
соединений) каркас состоит из октаэдрических групп В6
(рис. 24.6,6). В то же время эту структуру можно представить
и как 5-связанную сетку, в которой ребра октаэдров и усечен-
ных кубов заполняют все пространство. В структуре имеются
большие пустоты, окруженные 24 атомами В, в которых распо-
лагаются атомы металла (Са—В 3,05 А). Расстояния В—В
близки аналогичным величинам для FeB и А1В2 и равны — 1,7 А.
Структура UB4 интересна геометрической близостью со
структурами боридов МВ2 и МВ6. В структуре А1В2 присутст-
вует плотная упаковка слоев атомов металла, в которых каж-
дый атом М имеет шесть равноудаленных соседей. Слои распо-
лагаются точно друг над другом так, что атомы металла обра-
зуют тригональную призму вокруг атомов В, расположенных
12—1284
Рис. 24.6. Кристаллические структуры СгВ4 (а) и СаВ6 (б).
OB (J U
Рис. 24.7. Кристаллические структуры боридов металлов, а — плотноупакован-
ный слой атомов металла в UB2 (А1В2) (атомы располагаются в тригонально-
призматических пустотах между слоями); б — слой атомов металла в UB4;
позиции между слоями имеют КЧ 6 и 8; о — слой атомов металла в структуре
СаВ6 (ThBr,); г~ структура UB4.
24.4. Борипы металлов и карбиды бора
в пустотах между слоями (рнс. 24.4,6 и 24.7, а). В структуре
СаВ6 имеет место простая кубическая кладка атомов М
(рис. 24.7, в), причем внутри групп из 8 атомов М, расположен-
ных в вершинах куба, существуют пустоты. Таким образом,
структура может быть описана как простая кубическая решет-
ка из атомов М, растянутая из-за внедрения в нее октаэдриче-
екпх групп В6. Последние соединяются между собой с образо-
ванием трехмерного каркаса из атомов В. В структуре L В4
атомы металла образуют слон (в которых каждый атом М
имеет пять соседей), а между слоями располагаются трпго-
падыю-прпзматичеекие и кубические пустоты (рис. 24.7,6).
В пустотах первого типа расположены отдельные атомы В,
в пустотах второго типа — группы В6. Поскольку имеются пары
смежных пустот первого типа, то группы В6 связываются в кар-
кас через два атома В (рис. 24.7, г). В этой структуре некото-
рые атомы В связаны с тремя другими атомами В, другие —
с пятью, а расстояния В—В находятся в пределах от 1,7 до
1,8 А. Хотя расстояния В—В в жестком каркасе атомов В со-
гласуются с гв = 0,86А, из расстояний металл — бор следуют
большие значения эффективного радиуса бора — от 0,80 до
1,10 А. Структуру СаВ6 можно описать как упаковку атомов М
и групп В6 по типу CsCl. В гл. 22 уже отмечалось, что характер
связей в карбидах типа МС2 может быть различным; это спра-
ведливо и для боридов МВ6. Металлы, входящие в их состав,
могут иметь различные степени окисления, а именно: 1 (КВб),
2 (бориды Са, Сг и Yb) и больше двух (бориды La и Th).
Электронные свойства КВб еще не изучены, соединения второй
группы являются полупроводниками, третьей — проводниками
металлического типа.
Каркас атомов В в структуре LJBi2 изображен на рис. 3.47, г
(т. 1) как заполняющее пространство расположение кубоокта-
эдров, усеченных октаэдров и тетраэдров, ребра которых обра-
зуют 5-связаниую трехмерную сетку. Атомы U занимают пози-
ции с координацией 24 в центрах самых больших полостей
(ср. со структурой СаВ6, в которой координационное число ато-
мов металла равно 24, а координационный полиэдр — усечен-
ный куб). В то же время эта структура может быть описана
как упаковка групп В[2 и атомов LJ по типу NaCl. Кубооктаэд-
рические группы ВJ можно сопоставить с икосаэдрическими
группами в полиморфных модификациях бора и родственных
боридах. Длина связи внутри группы Bi2 значительно короче
A,68 А), чем между группами A,78 А в ZrBJ; 1,80 А в UB.;;
1,81 А в YBi2).
Синтезировано большое число борокарбидов, например уже
описанный борокарбид алюминия, а также Мо2ВС [1]. В по-
следнем соединении углерод октаэдрическн координирован ато-
12*
180 24. Бор
мами Mo, а бор имеет тригонально-призматическую координа-
цию и образует цепи, как в структуре СгВ. Особый интерес
вызывают борокарбиды типа МВ2С2 (M = Sc, La и ^-элемен-
ты). Атомы металла расположены между плоскими 3-связан-
ными слоями, которые в случае соединений La и 4/-элементов
представляют собой сетки 4 : 8, а в ScB2C2 — сетки 5 : 7. В струк-
турах LaB2C2 (разд. 3.9.3) и ScB2C2 имеются пары связаннных
атомов В и С. Атомы Sc находятся в пентагонально-призмати-
ческих пустотах между слоями; однако найденные расстояния
Sc—Sc очень близки к соответствующим величинам в гексаго-
нальной плотнейшей упаковке металлического Sc. В результа-
те Sc имеет координацию A4 + 5) (С—С 1,45 А; В—В 1,59 А;
В—С 1,52-5-1,61 А) [2].
Литература. [1] Acta cryst., 1969, В25, 698. [2] Acta cryst., 1965, 19, 668.
24.5. Низшие галогениды и соединения,
содержащие группу В2
Еще одна группа соединений, в которых имеются связи В—В,
включает галогениды В2Х4 (X = F, C1, Вг, I), ненасыщенные га-
логениды В„Х„ и ряд других соединений. Например,
[(CH3LN]2B2C16 (полученное в жидком безводном НС1) и
(РС14JВ2С16 содержат ион В2С162~. Методы получения и пути
превращений некоторых соединений этого типа представлены
на схеме 24.1.
24.5.1. Галогениды В2Х±. Фторид бора B2F4 — газообразное
взрывчатое вещество. Молекула имеет плоскую симметричную
структуру как в кристалле (структура изучена при —120°С
[1а]), так и в газовой фазе (электронография) [16]. В послед-
нем исследовании получены следующие длины связей:
.XI
1.72С
120 + 2,5°
F
а
1,75/5
\1,73А
С1
Хлорид бора В2С14 образуется при пропускании паров ВС13 че-
рез электрический разряд между ртутными электродами. Это
бесцветная жидкость, разлагающаяся выше 0 °С с образовани-
ем смеси желтого кристаллического В4С14, красного BgCls и па-
рамагнитного Bi2Cln [2]. Известны эфиры состава B2(ORL и
производное этилена С12В-С2Н4-ВС12, рассматриваемое ниже.
В2Вг4 и В214 (желтое кристаллическое вещество) получаются
аналогичным способом.
24.5. Низшие га.югениды и соединения с группой В2 181
Схема 2k.1
Получение соединений, содержащих группу Вг
Me,N NMe,
\ высокодиспер - ^ Me^N
^^врасплаве No.
1350 X ,
„л, »_ стеклообразный
г°' СВО)„
B*,C+TiOz
дегидратация пары Hz°
B50 X)
(рыхлый.)(ВО)п
ВС13 (пары)
при Z00 X
гидролиз
LiBH,,
NMe4Cl
.безводном HCl
(Me4NJ
с12В-СНгСНг-ВС12
"a a"
Cl -B -EbCl
Cl
Cl
а См., например: J. Am. Chem. Soc, 1954, 76, 5293; J. Am. Chem. Soc, 1960,
82, 6242, 6275; J. Am. Chem. Soc, 1961, 83, 1766, 4750; Phys. Chem. Soc, 1964,
242.
Кристаллическая структура В2СЦ определена при —165°С.
Установлено, что молекула плоская, валентные углы близки
к 120° (б) [3]. Длина связи В—С1 обычная, а связь В—В
удлинена по сравнению с ожидаемой для ординарной связи
(—1,6 А) (ср. длинную связь в молекуле N2O4 и нормальную
ординарную связь в Р214). Однако в парах молекула В2С14 име-
ет скрученную конформацию, причем плоскости двух полови-
нок почти перпендикулярны (В—В 1,70 А; В—С1 1,75 А; угол
С1—В—С1 119°) [4]. Заслоненная конформация в кристалле
скорее всего связана с более плотной упаковкой молекул, по-
скольку квантово-химические расчеты по методу молекулярных
орбиталей показывают, что скрученная конформация более ус-
тойчива (по крайней мере на 4 кДж/моль) [5].
Молекула С12В-С2Н4-ВС12 также плоская (в пределах
182 24. Бор
ошибки эксперимента), хотя длины связей определены неточно
[6]:
С1.
Длина связи В—С в этой молекуле сравнима с аналогичной
(также приблизительной) величиной для C6HS-BC1" A52 +
±0,07А). ' V '
24.5.2. Ненасыщенные галогениды ВпХп. В отличие от галогени-
дов В2Х4 соединения ВпХп относятся к электронодефицитным.
Структуры В4С14, В8С18, В9СЬ изучены в кристаллическом со-
Рис. 24.8. Молекулярные структуры В4С14 (а), В3С18 (б) и В9С19 (в).
стоянии. В молекуле В4С14 почти правильный тетраэдр из ато-
мов бора окружен тетраэдрической группой DС1), также близ-
кой к идеальной (рис. 24.8, а) [8]. Связи В—С1 ординарные
A,70 А), а длина связей В—В (также 1,70 А) соответствует
кратности около 2/з, если принять для атома бора радиус 0,8 А
и использовать уравнение Полинга (разд. 29.3). Если предпо-
ложить, что на ординарную связь В—С1 каждый атом бора ис-
пользует один электрон, то на остальные шесть связей В—В
приходится 8 электронов D электронные пары). Схематически
это показано на рис. 24.8, а. Молекула В8С18 также содержит
полиэдр из атомов бора, к каждому из которых присоединен
атом С1. Этот полиэдр (рис. 24.8,6) ближе к додекаэдру (бис-
дисфеноиду), чем к квадратной антипризме, однако наблюдает-
ся значительный разброс в длинах связей В—В. Четыре более
длинные связи (рис. 24.8, а) находятся в интервале 1,93 ч-2,05 А,
остальные—1,68ч-1,84 А. Средняя длина связи В—С1 состав-
ляет 1,74 А [9]. Поскольку для образования связей В—В име-
2-1.6. Соединения бора с азотом 183
ется всего 8 электронных пар в полиэдре с 18 ребрами, четыре
из которых длиннее остальных 14, то простое описание харак-
тера связывания в этой молекуле невозможно. В B9C19 атомы В
расположены в вершинах трехшапочной тригоналыюй призмы
(рис. 24.8, в), а длины связей близки к соответствующим вели-
чинам для В8С18 (В—В 1,73ч-1,81 А; В—Cl l,72-:-"l,75 А) [10].
В2Вг4 — бесцветная жидкость, при нагревании разлагается
с образованием ненасыщенных бромидов В„Вг« {п — 7, 8, 9, 10,
12), из которых наиболее устойчив B9Br9. Это соединение при
сублимации образует большие красные кристаллы, неустойчи-
вые на воздухе [11].
Литература, [lal J. Chem. Phys., 1958, 28. 54. [161 J. Am. Chem. Soc, 1977, 99,
6484. [21 Inorg. Chem., 1963, 2, 405. [3] J. Chem. Phys., 1957, 27, 196. [41 J. Chem.
Phys.. 1969, 50, 4986. [51 J. Chem. Phys., 1965, 43, 503. [61 Ada cryst., 1956, 9,
668. [71 J. Phys. Chem., 1955, 59, 193. [8] Acta cryst., 1953, 6, 547. [91 Acta cryst.,
1966, 20, 631. [10] Nature, 1970, 228, 659. [11] J. Inorg. Nucl. Chem., 1975, 37,
1593; Inorg. Chem., 1980, 19, 3295.
24.6. Соединения бора с азотом
24.6.J. Нитрид бора. BN получают при взаимодействии азота
пли аммиака с бором при нагревании до белого каления, а так-
же другими способами. В кристаллическом состоянии это ве-
щество химически весьма инерт-
но, но при нагревании может раз-
лагаться кислотами, а около
3000°С под давлением плавится.
Кристаллическая структура од-
ной из форм близка к графиту
(рис. 21.3), поскольку состоит из
гексагональных слоев такого же
типа. Однако в BN слои распо-
ложены так, что атомы соседних
слоев находятся строго друг над
другом (рис. 24.9). Длина связи
В—N равна 1,446 А [1]. Несмот-
ря на структурное сходство с гра-
фитом, по физическим свойствам
BN сильно отличается от послед-
него. BN белого цвета, хороший
изолятор, диамагнитная воспри-
имчивость намного меньше, чем у графита. Подобно графиту
BN может быть получен в виде структуры с разупорядоченны-
ми слоями, которая при нагревании переходит в упорядочен-
ную гексагональную структуру [2]. Известны также кристалли-
ческие формы BN со структурами типа цинковой обманки и
Рис. 24.9. Кристаллическая струк
тура нитрида бора BN.
184 24. Бор
24.6. Соединения бора с азотом 185
вюртцита [3]. В кубическом BN длина ординарной связи В—N
составляет 1,57 А [4].
Соединение В2О также изоэлектронно графиту; оно получа-
ется при восстановлении В2Оз бором или литием при высоких
температуре и давлении (в камере высокого давления, в кото-
рой направления сжатия совпадают с осями тетраэдра, при
50—75 кбар и 1200—1800 °С). Позиции атомов В и О в структу-
ре ВгО определены неточно [5].
Литература. [1] Acta cryst., 1952, 5, 356. [2] J. Am. Chem. Soc, 1962, 84, 4619.
[31 J. Chem. Phys, 1963, 38, 1144. [4] J. Chem. Phys., 1960, 32, 1569. [5] Inorg.
Chem., 1965, 4, 1213.
24.6.2. Соединения бора с азотом — аналоги производных угле-
рода. Наиболее простые молекулы этого типа содержат группы,
а
''60А
которые соответствуют замещенным этилену и этану. В этиле-
ноподобной молекуле а оба атома образуют по три компланар-
ные связи, длина связи В—N 1,40-=-0,02 А. Это значение близко
к соответствующим величинам для группы циклических моле-
кул, которые будут кратко рассмотрены ниже, и соответствует
двойной связи. В молекуле б оба атома образуют тетраэдриче-
ские связи; длина ординарной связи В—N составляет 1,60 А.
Ниже приведены примеры молекул обоих типов.
В—К, А
Литература
a (CH3JN—ВС12
(СН3),К—В(СН3J
б (C113KN—ВХ3
1, 38 Inorg. Chem , 1970, 9, 2439
1 ,42 J. Chem. Soc, A, 1970, 992
1,58—1,64 Acta cryst., 1969, B25, 2338
Inorg. Chem., 1971, 10, 200
Исследованы все четыре галогенида типа б, но, поскольку
различия в длинах связи В—N, измеренных в кристалле и га-
зовой фазе, достигают 0,05 А, детальное обсуждение этих вели-
чин, по-видимому, преждевременно.
К циклическим молекулам с чередующимися атомами В и N
относятся «ароматические» 4, 6 и 8-членные циклы, а также на-
сыщенные молекулы с 4- и 6-членными циклами; для первых
длина связи В—N близка к 1,42 А, для последних — к 1,60 А.
Соответствующие примеры представлены на рис. 24.10. В мо-
лекуле а 4-членный цикл плоский, а три связи каждого атома N
компланарны, но сокращение экзоциклической связи В—N
A,44 А, как и в цикле) не согласуется с тем фактом, что пло-
скости групп NSi2 почти перпендикулярны циклу (В—N 1,45 А;
N—Si 1,75 A; Si—С 1,78 А) [1]. В число исследованных молекул
типа б входят симметричная, подобная бензолу молекула бора-
зина B3N3H6 (В—N 1,44 А) [2а], B3N3C16 [261 (В—С1 1,76 А,
N—C1 1,73 А), В-моноаминоборазин B3N4H7 (В—NUH™ 1,42 А,
В—NH2 1,50 А) [3] и В-трихлороборазин (В—N 1,41 А, В—С1
а
(CHj), Si
Si(CH,),
t
^n^:b-<
i
Si(CH,),
X R
B—N
RN
XB
H,
(CH,),N
H;B^
= H,CH,,CI
= H,F,CI
Ж
H,CN
R=C(CH,I,
X = NCS
= H,F,CI
У9А, (CH.l.N^
H,
!-4lA
|l,58A
нгс^ ch,
Рис. 24.10. Циклические молекулы, содержащие атомы В и N, В и Р, В и С.
1,75 А) [4]. (Последнее соединение получают при нагревании
смеси ВС13 и NH4C1 при температуре выше 110°С — ср. с
(PNCl2)n.) С литературой по многочисленным циклическим со-
единениям В—N можно познакомиться в работе [10].
Ряд производных типа (RN-BXL (в) был получен из ВС13
и первичных алкиламинов. В кристаллическом [(СН3KС-
•NB-NCS]4 оба атома В и N образуют по три компланарные
связи; в кольце, имеющем конформацию ванны, наблюдается
чередование слегка различающихся по длине связей В—N [51:
186 24. Бор
24.6. Соединения бора с азотом 187
Подобные этилену молекулы R2N-BX2 легко полимеризуют-
ся, а образующиеся дпмеры и тримеры являются аналогами за-
мещенных циклобутапов н диклогексанов. Молекулы типа г
имеют плоские 4-членные циклы [6, 7] с длиной связи В—N
1,60 А. Для молекул типа д характерна конформация кресла
[8]. Фосфорные аналоги .молекулы д имеют подобную конфор-
мацию с длиной связи В—Р 1,94 А [9а]. Примером структуры
типа е служит молекула [Н2В-Р(СН3J]4 [96]. Получены так-
же соединения мышьяка [ (СНзЬАэ- ВН2]« (где п = 3 или 4).
К смешанным циклическим соединениям бора относятся
структуры типа ж с 5-членным циклом N4B [10] и з с циклом
В3С3 и двойными связями бор — азот между циклом и группа-
ми N(CH3J [11].
Литература. [1] Ada cryst., 1969, В25, 2342. [2а] Inorg. Chcm., 1969, 8, 1683.
[261 Acta tryst- 1974 B30, 731 [3| J. Am. Chem. Soc, 1969, 91, 551. [41 J. Am.
Chem. Soc, 952, 74, 1742. |5| J. Chem. Soc, 1965, 6421. |ii] Ada crysl.. 1970,
B26, 1905. [71 J. Chem. Soc, A 1966, 1392. [81 Acta cryst., 1961. 14, 273.
[9a] Ada cryst., 1955, 8, 199. [96] J. Am. Chem. Soc, 1962, 84, 2457. [10| Inorg.
Chem., 1969, 8, 1677. [11] Ada cryst., 1969, B25, 2334.
24.6.3. Боразотные соединения — производные боранов. Строе-
ние простой молекулы H3N-BH3 рассматривается ниже. Изуче-
ны структуры (CH3KN-BH3 и родственного азиридинборана
(а) [1].
Аддукты аммиака. Соединению, образующемуся присоедине-
нием аммиака к В2Н6, согласно определению молекулярной мас-
сы (в жидком аммиаке), соответствует формула B2H6-2NH3.
Для этого соединения была предложена ионная структура
¦ 1,45 А
1,744
1 ,39~~~--j_j , -''1,23
NH4+[BH3-NH2-BH3]-, однако в настоящее время считается,
что более предпочтительно рассматривать его как борогидрид
[H2B(NH3J] + (BH4)~. Это хорошо согласуется с его химиче-
скими свойствами, например реакция с NH4C1 происходит сле-
дующим образом:
[Н„В(МН3J] (ВН4)
или
в
-f N'H
н_г +
4С1 -
NH4+
->• [H,B(NH3J]
>- Н3\.ВН
|+С1" -f
а + Н2
- H3N
•ВН3
+ н2
Кристаллический мономер H3N-BH3 имеет неполностью упоря-
доченную структуру, поэтому рентгеноструктурнос исследова-
ние привело только к приблизительному значению для связи
В—N (-1,60 А) [2]. Соединение [H2B(NH3J]C1 имеет типич-
но ионную кристаллическую структуру [3], построенную из
слоев катионов [H2B(NH3J]+ (б), между которыми располага-
ются анионы С1~. Спектры ЯМР высокого разрешения показы-
вают, что фосфорный аналог H3N-BH3 в жидкой фазе состоит
из мономеров Н3Р-ВН3, а ИК- и КР-спектры подтвердили, что
эта структура сохраняется и в твердом состоянии [4]. Н3В-
¦ P(NH2K, получаемый при действии NH3 Ha H3B-PF3, содер-
жит тетраэдрические молекулы, в которых длины связей Р—N
и Р—В равны 1,65 и 1,89 А [5].
При действии амальгамы натрия на диборан в этиловом
эфире образуется продукт состава NaB2H6, который в действи-
тельности представляет собой смесь NaBH4 и NaB3H8. Послед-
нее соединение может реагировать с NH4C1 в эфире при тем-
пературе 25 °С, при этом получается H3N-B3H7. Это белое кри-
сталлическое вещество, имеющее при температурах выше 25 °С
неполностью упорядоченную структуру, поэтому строение моле-
кул было изучено в низкотемпературной форме [6]. В молеку-
ле типа в основной каркас построен из треугольников В3, к од-
ной из вершин которых присоединен атом азота. Группу В3Н7
можно рассматривать как искаженный фрагмент тетраборапа,
образующийся в результате симметричного разрыва двойного
мостика. (Точность определения длин связей В—Н составляет
0,05 А, для других связей — 0,005 А.) Строение «В4Ню-2МН3»
рассмотрено ниже (после описания иона B3Hg~).
Аминодибораны — это продукты замещения в молекуле В2Н6
одного мостикового атома Н на группу NH2. Строение H2N-B2H5
Н3СЧ СН
\ 111,5°
Н2 \^>/1.48C)А
НЧ Х^Ьч1-56^ А I,55f3) A 'К
1,15 (9) А4
N _ X ' - X
Н7В
-1,92 А-
188 24. Бор
24.7. Химия кислородных соединений бора 1891
и (CH3JN-B2H5 установлено электронографически [7]. (Для
H2N-B2H5 получены также следующие значения расстоя-
ний и валентных углов: N—Н 1,02 А: В—НМ0Ст 1,35 A; HNH
109,5° и НВН 120°.) Длины связей В—N близки к соответствую-
щим величинам для аддукта с BF3, который рассматривается
ниже. Но расстояние В—В благодаря присутствию мостикового
атома N существенно увеличено по сравнению со значением в
В2Н6 A,77 А).
Литература. [1] J. Chem. Phys., 1967, 46, 357. [2] J. Am. Chem. Soc, 1956, 78,
502, 503. [3] J. Am. Chem. Soc, 1959, 81, 3551. [4] Inorg. Chem., 1966, 5, 723.
[5] Acta cryst, 1960, 13, 535. [6] J. Am. Chem. Soc, 1959, 81, 3538. [71 J. Am.
Chem. Soc, 1952, 74, 954.
24.7. Химия кислородных соединений бора
Бор, как и кремний, существует в природе исключительно
в виде кислородсодержащих соединений, в частности гидроксо-
боратов кальция и натрия. В боратах, где единственной струк-
турной единицей является группа ВО3, должна наблюдаться
простая связь между отношением О: В и числом атомов О,
обобществляемых каждой группой ВО3 (при условии что все
такие атомы О эквивалентны и каждый связан с двумя атома-
ми В):
Отношение
О : В
Примеры структур
Число об
щестплен-
ных ато-
мов О
о-
3 Ортобораты: изолированные ионы ВО33~ О
2,5 Пиробораты: изолированные ионы В2О54~ 1
2 Метабораты: циклические или цепочечные 2
ионы
1,5 Триоксид бора 3
Промежуточные отношения (например, 1,75) реализуются в
структурах, в которых различные группы ВО3 обобществляют
разное число атомов О, как, например, в цепи гипотетического
иона (В4О7)п2ге~ — структурного аналога амфиболов, образован-
ных группами SiO4. Все четыре варианта структур, приведенных
выше, реализуются в соединениях, в которых атомы В имеют
только КЧ 3. Однако есть два фактора, усложняющих химию
кислородсодержащих соединений бора. Во-первых, во многих
оксосоединениях осуществляется тетраэдрическая координация
бора, причем иногда в сочетании с КЧ 3. Поэтому только по от-
ношению О: В нельзя судить о структурах боратов. В даль-
нейшем будет показано, что, например, отношение 7:4 может
осуществляться различными способами, но не по типу упомяну-
той выше гипотетической цепи. Во-вторых, существует целый
ряд гидроксоборатов (в отличие от гидроксосиликатов, которые
встречаются редко), в которых группа ОН связана с атомом В,
имеющим КЧ 3 или 4. Известны примеры всех тетраэдрических
групп: ВО4, ВО3(ОН) и ВО2(ОНJ [последние две — в структу-
ре СаВзО4(ОН)з-Н2О], ВО(ОНK (в Mg[B2O(OHNJ) и
В(ОНL (в тетрагидроксоборатах, например NaB(OHL). Иссле-
дование строения боратов привело к необходимости пересмотра
многих структурных формул (как и в случае антимонатов,
разд. 20.4.2):
Колеманит Са2В6О1Г5Н2О = Са[ВзО4(ОН)з1-Н2О
БандилитСиС12-СиВ2О4-4Н2О = СиС1[В(ОНI4
Типлеит NaBO2-NaCl-2H2O = Na2Cl[B(OHLl
Химия боратов весьма сложна и в растворе, и в расплаве.
Данные спектроскопии ЯМР ПВ и других исследований пока-
зывают, что при растворении Na3B3O6 происходит гидролиз с
образованием ионов В(ОНL~. При низких концентрациях в рас-
творах тетраборатов присутствуют частицы В(ОНK и В(ОНL~,
а в более концентрированных растворах различные полиборат-
ные ионы находятся в равновесии. Из расплавов получено уже
довольно большое число боратов, причем состав образующейся
соли зависит от стехиометрии расплава, например:
О: В
Li3BO3
3
Li4B2O5
2,5
Li6B,O9
2,25
LiBO2
2
LiB3O5 Li2BRO,3 LiB5O8
1,66 1,625 1,6
Пока еще мало известно о структурах боратов с более высоким
содержанием металла. Ниже рассмотрены структуры некоторых
безводных боратов с отношением О : В, равным 1,75-М,55. Пе-
роксобораты обсуждались в разд. 11.3.7.
24.7.1. Триоксид бора* вплоть до 1937 г. был известен только
в стеклообразном состоянии. Однако его кристаллы все же
можно получить при дегидратации метаборной кислоты в тща-
тельно контролируемых условиях или же охлаждением рас-
плавленного оксида под давлением 10—15 кбар. Обычная его
форма (плотность 2,56 г/см3) представляет собой трехмерный
каркас из групп ВО3, связанных через атомы О (В—О 1,38 А)
[1]. Такой каркас, состоящий из колец ВюОю, уже был описан
в гл. 3. При давлении 35 кбар и температуре 525°С образуется
Другая модификация В2О3-П (плотность 3,11 г/см3) [2]. Эта
значительно более плотная форма построена из искаженных
* О структурах полиморфных модификаций В2О3 см. обзор [Thermochim.
acta, 1979, 28, № 1, p. 121]. — Прим. перев.
190 24. Бор
тетраэдров, у которых три вершины являются общими для трех
групп ВО4, а одна — для двух. Структура может быть описана
как состоящая из соединенных через вершины пар тетраэд-
ров (а). Macc-спектроскопические исследования показали, что
в парах этого соединения преимущественно существуют моле-
кулы В2О3. Уголковая структура б была зафиксирована в элект-
о—
1,51 А
(средн.)
ронографических исследованиях [3], хотя из-за больших ампли-
туд тепловых колебаний имеются некоторые сомнения относи-
тельно значения угла В—О—В.
Литература. [1] Acta cryst., 1971, В27, 1662. [21 Acta cryst, 1968, B24, 869.
[3] Ж- структуры, химии, 1972, 13, 972.
24.7.2. Ортоборная кислота и ортобораты. В структуре Н3ВО3
молекулы В(ОНK (В—О 1,36 А) связаны в плоские слои по-
средством связей типа О—Н—О, длина которых составляет
2,72 А, а валентный угол при данном атоме О равен 114°
(рис. 24.11). Рентгеноструктуриым исследованием было пока-
зано, что атомы Н находятся на расстоянии 1 А от атомов О.
Такой результат подтвержден нейтронографическим исследова-
нием D3BO3 (О—D 0,97 А, длина линейной группы О—D---0
2,71 А) [1].
Сравнительно мало изучены ортобораты щелочных металлов
из-за экспериментальных трудностей их получения. В структу-
ре а-ЫзВОз каждый катион Li+ окружен четырьмя атомами О
(на расстоянии 2,0 А), образующими сильно искаженный тетра-
эдр. Кроме того, 2/3 катионов имеют в своем ближайшем окру-
жении пятый атом О на расстоянии 2,5 А [2]. Ортоборат
Na3BO3 получается из Na3B3O6 при температурах выше 680 °С,
но не в чистом виде, поскольку в системе существует равнове-
сие Ыа3В3О6^=МазВО3 + В2Оз. По этой причине можно предпо-
ложить, что ортобораты некоторых щелочных металлов не су-
ществуют (разд. 7.6.7). Известны бораты М3п(ВОзЬ, где Мп =
= Mg, Ca, Ba, Cd и Со[3], а также их двойные соли NaCaBO3
и CaSn(BO3J (последнее вещество изоструктурно доломиту
CaMg(CO3J). Co структурной точки зрения наиболее простые
24.7. Химия кислородных соединений бора 19!
ортобораты — это МшВОз, среди которых есть примеры кри-
сталлов, изоструктурных всем трем модификациям СаСО3:
А1ВО3 (высокого давления) [4], ScBO3, InBO3 и FeBO3 (струк-
тура кальцита), YBO3 и LaBO3 (структура арагонита), SmBO3
(структура фатерита). Структура Т13ВО3 (рис. 24.11,6) обсуж-
дается в разд. 26.5. Другие соединения, содержащие дискретные
т
~о
Рис. 24.11. а — часть слоя в структуре П3ВО3. Штриховые линии — водородные
связи О—Н---О; б — проекция структуры Т13ВО3.
ионы ВО33~, рассмотрены в разд. 24.77. Новые данные по струк-
турам ортоборатов приведены также в работах [5].
Литература. [1] Ada cryst., 1966, 20, 214. [21 Acta cryst, 1971 B27 904
[3[ Acta Chem. Scand., 1949, 3, 660. [4| Acta cryst., 1977, B33, 3607. [5] Am "Mi-
neral., 1961, 46, 1030; Acta cryst., 1966, 20, 283;" J. Chem. Phys., 1969, 51, 3624.
24.7.3. Пиробораты. В солях магния и кобальта обнаружены две
совершенно разные конфигурации пироборатного иона.
В Со2В2О5 (а) [1] плоскости групп ВО3 повернуты па 7° в раз-
ные стороны относительно плоскости центрального фрагмента
а
О
О
О
153°
О
13Ц°
\ Bv^l^ .В.
В—0—В (среднее расстояние составляет —1,30 А). В Mg2B2O5
(б) [2] угол между плоскостями групп В03 равен 22°19/, а сред-
няя длина связи В—О 1,36 А. Валентный угол при атоме О
в структуре б близок к соответствующим величинам для мета-
боратов: 130° в СаВ2О4 и 126,5° в ионах В3О63- и В5О105-. Раз-
личия в длинах центральных и концевых связей В—О не обна-
ружены.
Структура иона (ОНKВ—О—B(OHK2~ рассматривается в.
разд. 24.7.6.
192 24. Бор
Литература. [1] Acta Chem. Scand., 1950, 4, 1054. [21 Acta cryst., 1952, 5,
574.
24.7.4. Метаборная кислота и метабораты. Строение молекулы
НВО2 в газовой фазе определено методом ИК-спектроскопии.
Такая же структура обнаружена электронографически у моле-
кул метаборатов таллия и щелочных металлов в газовой фазе
[2] (В—О и В = О такие же, как в В2О3) а угол М—О—В ра-
вен 100—105° для NaBO2 и КВО2 и 140° для CsBO2 и Т1ВО2).
24.7. Химия кислородных соединений бора 193
20 40 60 80 100
В2О3, мол. %
' в ОО
Рис 24.12. Фазовая диаграмма систе- Рис. 24.13. Расположение молекул
мы В2О3—Н2О. В3Оз(ОНK в слое в одной из кристал-
лических форм метаборной кислоты.
Метаборная кислота существует в трех кристаллических мо-
дификациях, которые являются хорошим примером монотропии
(рис. 24.12), а также и тенденции к увеличению плотности при
изменении КЧ атома В (от 3 к 4) (табл. 24.4). Моноклинная
форма легко получается путем дегидратации Н3ВО3 в откры-
том сосуде при 140 °С. Быстрое охлаждение расплава приводит
к образованию стекла, которое потом кристаллизуется с обра-
зованием ромбической модификации. Наиболее устойчивая ку-
бическая форма медленно кристаллизуется из расплава при
175 °С, в то время как при температуре около —230 °С в резуль-
тате полной дегидратации образуется В2О3.
Ромбическая модификация метаборной кислоты построена
из молекул В3О3(ОНK, которые объединены в слои водородны-
ми связями (рис. 24.13). Моноклинная форма, очевидно, пост-
роена из цепей состава [В3О4ОН(ОНJ], причем идентифика-
Таблица 24.4. Кристаллические модификации метаборной кислоты
Модифика-
ция
Ромбическая
Моноклинная
Кубическая
°с
176
201
236
: 1лот-
ность,
1,'СМЗ
1,784
2,045
2.487
КЧ атома В
3
3 и 4
4
Литература
Acta cryst., 1964, 17, 229
Acta cryst., 1963, 16, 385
Acta crvst., 1963, 16, 380
пня группы ОН и молекулы воды обоснована эксперименталь-
ной локализацией атомов Н. Непосредственная связь атома В
;.¦ молекулой воды представляется неожиданной. Кубическая
а.
Рис. 24.14. Метаборат-ионы. а — циклический (В3О6K-; б — бесконечный це-
почечный нон (ВО2),,"- в структурах СаВ2О4 и LiBO2-I. Маленькие черные
кружки — атомы бора.
модификация НВО2 имеет каркасную структуру из тетраэдри-
ческнх групп ВО4 с водородными связями между некоторыми
парами атомов О.
К метаборатам относятся безводные соединения типа
МЛ-(ВО2)„. Первоначально некоторые соединения, па самом деле
содержащие попы В(ОНL~, рассматривали как гидраты мета-
боратов. Например, NaBO2-4H2O в действительности представ-
ляет собой NaB(OHL-2H2O. Обычные структуры метаборатов,
устойчивые при атмосферном давлении, содержат циклические
попы В3О63- (рис. 24.14, а), например в Na3B3O6, К3В,О6 и
Ва3(В3О6J, или бесконечные цепи (ВО2),гп- (рис. 24.14,6), на-
пример в LiBO2, СаВ2О4 и SrB2O4. При высоком давлении не-
которые метабораты переходят в другие модификации (они обо-
значаются римскими цифрами II, III и т. д.); при этом все или
часть атомов В приобретают КЧ 4 (табл. 24.5). Например,
1ЛВО2-П является сверхструктурой к структурному типу цинко-
вой обманки, в которой атомы Li и В тетраэдрпчески окруже-
;'ь: атомами О на расстояниях 1,96 и 1,48 А соответственно.
В структурах модификаций III и IV метаборатов кальция,
стронция и европия атомы бора и кислорода образуют трехмер-
ные каркасы.
13—1284
194 24. Бор
Таблица
Метаборат
Са(ВО2J-1
Са(ВО2J-П
Са(ВО2J-Ш
Ca(BO2J-IV
24.5. Кристаллические модификации метаборатов
Давле-
ние,
кбар
12—15
15—25
25—40
Плот-
ность,
г/смз
2,702
2,885
3,052
3,426
Метаборат
Sr(BO2J-I ]
Sr(BO,J-IH
Sr(BO2J-IV j
Eu(BO2J-I, III, IV
Li(BO2)-I
LiBO2-II
Na3B3O6 )
КзВ3О6
Ba(BO2J J
Cu(BO2J
КЧ атома В
3 (для всех)
3 (для У2)
4 (для Уг)
3 (для >/з)
4 (для 2/3)
4 (для всех)
КЧ атома Са
8
8
8 и 10
(9 + 3
Типы структур
Изоструктурны соеди-
нениям кальция
То же
Бесконечные цепи
Сверхструктура к типу
цинковой обманки
Циклические ионы
Ьз^б
Трехмерный каркас из
тетраэдров
и 12
Ли i epa i у pa
Acta cryst., 1963
16, 390
Acta crvst., 1967
23, 44"
Acta crvst., 1969
B25, 955
Acta cryst., 19,;9
B25, 965
Литература
Acta crvst., 1964, 17, 314
Acta cryst., 19G9, B25
1001
Inorp-. CUem.. 19b'), 19
983
Acta crvst., 1964, 17, 749
J. Chem. Phvs., 1966, 44
3348
Acta cryst, 1963, 16, 591
Acta crvst., 1970, B26
1189 "
Ada cryst., 1966. 20, 8!9
Acta crvst., 1971, B27
677
Весьма удивительно различие в строении ионов В3О63~ в
структурах Na3B3O6 и КзВ3О6, которые были изучены очень де-
тально:
Na3B3Of
О.
1,280 А
1,433 А
О
о
К3В3О6
1,398 А
о
Поскольку соединения изоструктурны, эти результаты противо-
речат правилам Полинга, если предполагать, что соотношение
между энергией связи и ее длиной одинаково для обоих соеди-
нений.
Особенно интересно строение оксо-иона в структурах
CaB2O4-IV и СиВ2О4. Он представляет собой трехмерный кар-
24.7. Химия кислородных соединений бора 195
кас тетраэдров ВО4, вес- вершины которого образуют мостико-
ные гп'.'.мы О (ср. со структурами SiO2). Поскольку каркас со-
держит плоские никлы В3(.K, он .может быть также описан как
построенный из колец, образованных тремя тетраэдрами (по-
добно молекуле S3OV или иону Si3Oii'-;~), причем каждое такое
кол 1.по соединяется через атомы О, лежащие вне никла,
<- шестью другими кольцами. В соединении CaB2O4-IV подобный
каркас ооразован вокруг по
(') ¦ 5):
Са, 6 О 2,70 $
6 О 2,67
;ов Са--{-, которые имеют КЧ 12 или
Сап 3 О 2,39 А
3 О 2 48
3 О 2,60
3 О 3,14
В структуре СиВ2О4 каркас включает ионы Си2+, дополни-
тельно сшивающие его и имеющие плоскую четверную коорди-
нацию:
Си, 4 О 2,00 А Сип 4 0 1,94 А
(О 3,07)
Несмотря на то что координационные полиэдры катионов
в этих структурах очень разные, объемы их элементарных яче-
ек— кубической и тетрагональной — почти равны G31 и
741 А3)'.
Тетраэдрическая координация в метаборатах не ограничива-
ется только модификациями, существующими при высоких дав-
лениях. Интересное строение имеет цепь (ВОг)пп~ в структуре
AgBO2[3]:
0_
Здесь одинаковое количество атомов В с КЧ 3 и 4, но в отличие
от более простой цепи, показанной на рис. 24.14,6, каждая
группа ВО3 обобществляет только два атома О. Эти структуры
приводят к мысли о необходимости уточнения номенклатуры
подобных соединений.
Приставки орто-, пиро-, мета- в названиях кислот и солей
кремния, фосфора и мышьяка относятся к тетраэдрическим ио-
нам (или молекулам в случае кислот), которые содержат 0, 1
или 2 мостиковых атома 6 соответственно, т. е. к соединениям,
содержащим группы МО4, М2О7 или (МО3)„. Применительно
к боратам они обычно обозначают кислоты и ионы, в которых
атомы В имеют КЧ 3, т. е. орто — ВО33-, пиро — В2ОГL~ и
мета— (ВО2),г'!^ (циклические или линейные). Для тетраэдри-
13*
196 24. Бор
ческих ионов можно предполагать следующие, неизвестные до
сих пор типы структур:
орто—ВО45", пиро—В2О78- и мета—(ВО3)П3"-
Кроме того, возможны оксо-ионы, в которых все группы ВСЬ,
имеют 3 или 4 мостиковых атома О:
(B2O5)n4fl^—слои или трехмерные каркасы
(ВО2)„П-—двойные слои или трехмерные каркасы
Если группы ВО4 имеют два общих противоположных ребра с
соседними группами, то образуются цепи (ВО2)П"~, аналогич-
ные по структуре цепи SiS2. Три иона из тетраэдрического се-
мейства имеют такие же формулы, как в тригональном семей-
стве. В настоящее время известен только один тип боратного
оксо-иона, в котором все атомы В имеют тетраэдрнческую ко-
ординацию и все мостиковые атомы О связаны с двумя атома-
ми В. Это, как отмечалось выше, каркасный ион (ВО2)га"~ в
CaB2O4-IV и СиВ2О4. Последние также называют метабората-
ми. Действительно, CaB2O4-IV образуется при высоком давле-
нии из обычной формы, содержащей метаборат-ион, образован-
ный из групп ВО3. Если сохранить термин «метаборат» для всех
соединений М(ВО2)Х, утрачивается его исходный структурный
смысл, поскольку в этом случае он включает не только два
крайних типа структур (все атомы В имеют 1\Ч 3 или 4), но
также и промежуточные структуры (например, СаВ2О4-Н и
III), в которых присутствуют атомы В обоих типов.
Литература. [11 J. Chem. Phys., 1960, 32, 488. [2] Ж- структуры, химии. 1972, 13,
972. [31 Naturwiss., 1980, 67, 606.
24.7.5. Гидроксобораты и безводные полибораты. Рассмотрим
эти соединения вместе, поскольку их анионы содержат простые
циклические структурные единицы, показанные на рис. 24.15,
Таблица 24.6. Гидроксобораты п полибораты
Число
обобщест-
вленных
атомои О
0
2
4
Ци
а,
[В3О3(ОНM1Са-Н2О
» -2Н2О
» • 4Н2О
[В3О4(ОН)з1Са-Н2О
[В3О5(ОНIСаа
этические фрагменты (рис. 24.15)
6.
[B4O5(OHL]Na2-8H2O
[В4О6(ОНJ12-
[B4O7]Li26
[В5О6(ОНL1К-2Н2О
[В5О7(ОН),|М14-Н2О
[В5О8'1Кб
Слоистая структура.
Два взаимопроникающих трехмерных каркаса.
24.7. Химия кислородных соединений бора 197
либо полностью состоят из таких фрагментов. Число возможных
типов анионов в этом случае велико, так как:
1) существуют различные основные циклические системы,
три типа {а, б я в) представлены на рис. 24.15;
Рис. 24.15. Циклические системы В—О в гидроксоборатах и (или) полибора-
тах. Нижний индекс при буквах а, б, в означает число внециклических ато-
мов О. Формула относится к трехмерному аниону при условии, если эти ато-
мы О становятся мостиковыми.
2) число внециклических атомов О может в принципе уве-
личиваться до тех пор, пока все атомы В не станут тетраэдри-
ческими, как в ряду а3-^а6;
3) внециклическими атомами О могут быть атомы О из
групп ОН или атомы О, участвующие или не участвующие в
объединении двух фрагментов. Некоторые конечные структур-
ные мотивы (рис. 24.15), в которых все атомы О принадлежат
группам ОН, присутствуют в гидроксоборатах (табл. 24.6),
однако при этом может быть обобществлено различное число
таких атомов О и образуются ионы, бесконечные в одном, двух
или трех измерениях. Минимальное число общих атомов О рав-
но 2 для цепей и 3 для слоя или трехмерной системы (извест-
ны слои, построенные из 4- или 5-связных структурных единиц).
Во многих боратах, кристаллизующихся из водного раствора,
сохраняется некоторое количество групп ОН, т. е. образуется
гидроксо-ион. Если все внециклические атомы О обобществле-
198 2-1. Бор
пы, речь идет об анионе типа ВА-ОЬ-, характерном для безвод-
ных полиборачов, образующихся из расплава;
4) отдельный борат-нон может быть построен из элементов
одного вида (например, я.() или двух и более видов (например,
а4 и в4)¦
Рассмотрим возможности, отмеченные в пп. 2—4 более под-
робно.
Среди полностью гидроксилированных структурных единиц
типа а фрагмент а3 представляет собой циклическую молекулу
Рис. 24.16. а — бесконечный цепочечный ион [ВзО4(ОН)з]л2и в структуре
СаВзО4(ОН)з-Н2О; б — система водородных связей между ионами
[В4О5(ОНL]2~ в структуре буры; в — анион в структуре Na2[B4Os(OHJ]; г —
анион в структуре Na2[B4O6(OHJ]-3H2O.
В3Оз(ОНK, а4 —анион в Na3[B3O3(OHL], аъ встречается в ряду
гидратированных гидроксоборатов кальция [1]; этот ряд вклю-
чает минералы мейергофферит Са[В3О3(ОНM] -Н2О и ипиоит
(тетрагидрат). Можно предполагать существование конечных
ионов, которые содержат и внециклические атомы О, и группы
ОН, например промежуточные члены ряда
а3 В,О6=- В3О5(ОНJ- В3О4(ОНJ- В3О3(ОНK
Анион в соединении Na3[B3O.-,(OHJ] [la]—пример иона а4
такого типа. Обобществление двух атомов О A и 2) в струк-
Tvpnoii етншше а-, приводит к бесконечным цепям, как, напри-
мер, в колсмапите Са[В3О4(ОНK]-Н2О (рис. 24.16, а), а при
обобществлении всех четырех атомов О — к двумерному иону,
существующему, например, в структуре Са[В3О5(ОН)]. Трех-
мерную структуру CaB2O4-IV можно описать как построенную
из структурных единиц а6, в которых все концевые атомы О
стали мостиковыми.
24.7. Химия кислородных соединений бора 199
Островной гидроксо-ион б4 существует в структурах
К2[В4О5(ОНL]-2Н2О и буры Na2B4O7-10H2O [2], поэтому фор-
мулу последней следует записывать как Na2[B4O5(OHL]-8Н2О.
С помощью водородных связей такие структурные элементы об-
разуют цепи (рис. 24.16,6). Структура гидратированного ка-
тиона буры была рассмотрена в гл. 5 как пример бесконечных
цепей, образованных октаэдрпческпмп группами [Na(H2ON],
сочлененными через два общих ребра, в результате отношение
Н2О : Na равно 4:1.
Цепь типа о4 (рис. 24.16, в) образует анион в
Ха2[В4О6(ОНJ] [2а]. Необходимо заметить, что такой же со-
став реализуется совершенно другим способом (рис. 24.16, г)
в тригидрате Na2[B4O6(OHJ]-ЗН2О (минерал кернит) [26].
Тетрагидроксо-ион типа е4 присутствует в К[В5О6(ОНL] •
• 2Н2О [3], а из цепей, образованных мостиковыми атомами О
A и 2), построен анион в минерале лардереллите
NH4[B5O7(OHJ]-Н2О [4]. Промежуточный вариант реализует-
ся в структуре минерала аммониоборита (NH4K[B1502o(OH)8] •
•4Н2О [4а], в котором анион состоит из трех фрагментов
типа 04:
нс
13-
Образование трехмерного анионного каркаса требует обоб-
ществления по крайней мере трех атомов О в каждом элемен-
тарном звене, по обычно имеется 4 или 5 таких атомов. Самые
простые структуры получаются из фрагментов а4, б4 и в4, у ко-
торых четыре внециклических атома О располагаются в верши-
нах искаженного тетраэдра. Поэтому, как уже отмечалось в
гл. 3, эти фрагменты могут соединяться, образуя трехмерный
каркас, основу которого составляет алмазная сетка. Отметим
несколько интересных особенностей строения таких соединений.
В структуре CsB3O5 [5] фрагменты типа а4 образуют один кар-
кас, а более крупные фрагменты б4 и в4 объединяются в два
идентичных взаимопроникающих каркаса (например, в Li2B4O7
[6] и КВ5О8 [7]). Подобная картина наблюдается и в более
сложной структуре Ag2B8Oi3 [8], где каждый каркас состоит
из чередующихся фрагментов двух типов — а4 и ее B3Os-r
+ В5О8=В8О13. Во фрагментах аь и в5 имеется 5 внециклических
атомов О. В структуре ВаВ4О7 [9] чередующиеся фрагменты
200 24. Бор
этих типов образуют трехмерный 5-евязанный каркас, причем
обобществляются все атомы О: В3О5]5 + В5О8,5 = 2(В4О7). Еще
более сложной системой является анион в структуре CsBgOu
[10], который состоит из двух взаимопроникающих трехмерных
сеток, каждая из которых построена из фрагментов двух ви-
дов—аз и а4 (рис. 24.15)—в соотношении 2а3:1а4, так что
реализуется состав 2(В3О4,5) + B3O5 = B9Oi4.
В ряде структур обнаружены фрагменты в$ (рис. 24.15)
с двумя или четырьмя обобществленными внециклическими ато-
мами О; при этом образуются соответственно цепи состава
| В5О7(ОН)з]/г2"~ или слои (из плоских 4-угольных сеток) соста-
ва [В5О8(ОН)]„2"-. Первые обнаружены в минерале эзкуррптс
-\а2[В5О7(ОН)з]-2Н2О, а последние — в минералах гоуэрите,
витчите, а также назините Na2[B5O8(OH)]-2Н2О [11] и в изо-
структурной (синтетической) соли калия. Литература по струк-
турам других гидроксоборатов приведена в работе [11].
Фрагмент в6 (рис. 24.15) найден в виде гексагидроксо-иоиа
в структуре улексита NaCaB5O6(OHN-5H2O [12], в виде цепей
[В5О7(ОНL]3~ в пробертите и в виде слоев [В5О8(ОНJ]3^
D мостиковых атома О) в хейдорните и в Na3[B5O8(OHJ] •
•Н2О [12а]. В табл. 24.6 собраны примеры анионов, образован-
ных фрагментами а5, б4 и в4.
Одной из важных особенностей химии полиборатов является
чрезвычайно большое число различных способов комбинирова-
ния фрагментов (изображенных на рис. 24.15), которые приво-
дят к относительно простым формулам соединений. Выше уже
был упомянут трехмерный каркасный ион в структуре CsB3O5,
образованный из фрагментов а4. Два аниона значительно более
сложного строения обнаружены в двух формах NaB3O5. В струк-
туре a-NaB3O5 [13] два взаимопроникающих каркаса состоят
из равного числа фрагментов б4 и e4 (B5Os+ B4O7 = B9Oi5).
Хотя слоистые структуры не характерны для безводных поли-
боратов, в |3-NaB3O5 [14] существуют двойные слои, построен-
ные из одинакового числа фрагментов трех типов — тетраэдри-
ческого ВО4, аА и в4 (ВО2+В3О5 + В5О8 = В9О15).
Бораты, содержащие анионы В4О7, могут обладать совершен-
но различным строением. Выше обсуждались два разных кар-
каса в Li2B4O7 и ВаВ4О7; два других варианта реализуются в
структурах Na2B4O7 и К2В4О- (см. с. 201).
В первых четырех типах структур все атомы В имеют КЧ 3
или 4, а мостиковые атомы О связаны с двумя атомами.
В структуре SrB4O7 присутствует трехмерный анион, в котором
все атомы В имеют тетраэдрическую координацию, а 2/7 атомов
О КЧЗ. В структуре Eu2(B5O9)Br [14а] и изоструктурном со-
единении кальция катионы и ионы Br~ расположены в каналах
трехмерного каркаса, в котором 2/5 атомов В имеют КЧ 3, а ос-
24.7. Химия кислородных соединений бора —01
Литература
Li-,B4O7
ЛШ4О7 (M = Cd,
BaB4O7
Na,B.,O7
K,B4O7
SrB.,0, )
Mg, Fe и др
I41B4O7 J ИЗО1;|1'У'ЧУР"Ь1
* Фрагмент
i общую формулу
a4 только о
составляет В
1 б
s о4
ВОз, «5, б4
См. текст
Acta
Acta
Acta
Acta
Acta
Acta
Acta
cryst.
cryst.
cryst.
cryst.
cryst.
cryst.
cryst.
1968, B24, 179
1966, 20, 132
1965, 19, 297
1974, B30, 578
1972, B28, 3089
1966, 20, 274
1980, B36, 2008
тремя обобществленными атомами О; вклад и
С)-,, G ПОДООПО «5-
тальные—КЧ 4. Некоторые химические свойства боратов евро-
пия обсуждаются в разд. 28.2.1.
I
о о
О— В О В (
о о
I
о
0
1
0
1
1 — В О В О
о о
1
О
12-
4
Обнаружены и анионы с более сложной структурой, также
содержащие в качестве структурных единиц фрагменты, пока-
занные на рис. 24.15. В структуре РЬ6В10О21 [15] имеются дис-
кретные группы а, которые образованы двумя фрагментами б4,
связанными двумя треугольными группами ВО3. Связи РЬ О,
вероятно, имеют преимущественно ковалентный характер, так
как атом РЬ в качестве ближайших соседей имеет 3 или 4 ато-
ма О (все с одной стороны) на расстояниях 2,23—2,55 А (са-
мые короткие связи в структуре РЬО 2,18 А, а сумма ионных
радиусов равна 2,6 А). Структура аниона в К5В19О31 [16]
представляет собой трехмерный каркас, образованный из оди-
накового числа групп а4, в4, ВО3 и вдвое меньшего числа -гетр;:-
эдрических групп ВО4: (В3О5J f (B5O8J+B2O3 + BO2 = BUD-:
Очевидно, что добавление отдельных атомов В с КЧЗ или -!¦
устраняет необходимость образования двух взаимопроникаю-
щих каркасов, присутствующих в некоторых из рассмотрели
структур.
В заключение остановимся па примере структур, содер;к:
щих более сложные фрагменты. Трициклический фрагм.м
[В6О7(ОНN]2^ (рис. 24.17, о) имеет плоское строение, нео.ь
ря на то, что три группы ОН связаны с тетраэдрическими а:.;-
202 24. Бор
мами В; интересно, что центральный атом О связан с тремя
атомами В. Такое строение имеет островной анион в структуре
Mg2[B6O7(OHN]2-9H2O [17]. Обобществление атомов О, обо-
значенных черными кружками на рис. 24.17,6, приводит к об-
разованию слоя состава [В6О9(ОНJ]Л2"", в основе которого ле-
жит простейшая 4-связанная плоская сетка (гл. 3). Этот анион
обнаружен в минерале тьюнеллите SrB6O9(OHJ-3H2O [18].
В структуре (Ca,SrJB1402o(OHN-5H20 [19] этот трицикличе-
а 6
он
I
он
он
"ОН
он
в
I
он
он
НО'
„он
Рис. 24.17. Трициклические фрагменты из атомов В и О в гидроксоборатах
(см. текст).
ский фрагмент образует более сложные слои, структурная еди-
ница которых состоит из двух фрагментов В6, причем к одному
присоединена боковая цепь В2. Сложные фрагменты Ви объ-
единяются в слои путем обобществления шести атомов О, пока-
занных черными кружками на рис. 24.17,6. В структуре
Nag[Bi202o(OHL] [20] обнаружены полициклические ионы б,
содержащие 12 атомов В.
Литература. [1] J. Inorg. Nucl. Chem., 1964, 26, 73; Acta cryst., 1974, B30,
2194. [la] Acta cryst., 1975, B31, 1993. [2] Acta cryst., 1978, B34," 3502. f2a] Acta
cryst., 1978, B34, 1080. [26] Am. Mineral., 1973, 58, 21. [3| Acta cryst., 1978, B34,
24.7. Химия кислородных соединений бора 203
Г) | :| Ada crvsl., 1969, В25, 2204. |-Ь1 Science, 1971, 171, 377. |5] Actn crw..
1 if — i-, ИЗО. П7Й. |!i| Acta cryst., 19B8, t>24, 179. |7| Acta cryst., 1972, Б28. 'lOS.
I;,! Acta сгуЧ. 19Г>5, 18 ,; Acta сг-'si . !9li9, B25, 2153. [91 Acta cry-!.. !';05,
Si:' 297 |l"()| A; in cr\si. 1907, 2'S. 427. [HI Acta cryst., 1075, B.I!. 2 105.
l.;| Science, '19.; i, 145." 1295. [12;i| Aehi crv = t., 1977. B33." 3730. [13| Ac!,i c:"\-i..
19,"!. B:;0. 747. jit! -V i crv^L. ',972. B28. 1571. [14n] Inorg. Chem.. ;/>9. H\
:]bi'T. fi5| Acl;i crysi., j!.;;;, ii2f), 22'2. flii) Ac!:i cryst.. !974, ВЗО, !827. !!Г| '. -:
Л '.ccad. i:,iz. d. "Liucei, 1969, 47, t. [181 Ain. MiiHT;i!.. 1964, 49, 1549. |1'.; A.':
Mi,!, га!.. 1970. 55, 1911. [201 л--п cryst., 1979, B35, 2488.
2-1.7.6. Другие структуры боратов, содержащие тетраэдричеслис
(пчмь! бора. В б'.;-пт:'.х обнаружены координационные rpy-ni-
ч,')['К1!, сое: л Г! котрры:; ".;"К'яе;ся от ВО, до В(ОНL. Ниже о;'-
оуждаются пекспоп::"е i1; >¦ aiiП<чsее интересных структур, со-
держащие такие группировки.
Простейшее из структ">'р, где присутствуют группы ВО.:, что
ВРО4 и BAsO, (тш: S1O2). Сходство с кремнием обнаружива-
ется также в изоморфизме TaBOj 11 ZrSiO4. Оно проявляется и
в каркасной структуре Zn4B6O;3 [1]; атомы В в ней расположе-
ны в вершинах федоровской упаковки усеченных октаэдров,
причем тетраэдры ВО.} связаны также, как и группы SiO4 в со-
далите Na4Si3Al30i2Cl. Поскольку здесь имеется отдельный
атом О, не входящий в каркас B6Oi2, состав этого соединения
правильнее записать в виде Zn_;O(B3Oi2).
Группы ГВОз(ОН)] присутствуют в структурах мипепелов
датолкта CaBSiO4(GH) \2] п ко геманпта" СаВ3О4(ОКK- U-/J.
С,т|Э""ктура последнего ])ассматрнвалась в предыдущем разделе.
Датолпт состоит из слоев тетраэдров, похожих ка слои в апо-
ф]-ллпте, которые объсд;;няются ионами Са2+. В слое череду-
ются тетраэдрпчеекпе группы SiO; и ВО„ОН, причем кажди//
тетраэдр имеет три общие вершины с тетраэдрами другого сор-
та -¦¦ концевыми остаются атом О группы [S!O.:] н группа ОН
пл iBO3OH].
В результате слон иьччт cat;::- | ВОз/гОН- SiO- -\ -----
= BSiO4(OK) (рис. 24.18, а).
В структуре минерала пиппоптл Г3|, которому первоначаль-
но была приписана формула MgB:O,.-ЗН:О, содержатся ноны,
в которых атомы В образуют тетраэдрпческис связи.
Тстраэдрический ион В (ОН).- обнаружен в стр\к! vp;-. ч
LiB(OHL [За] (В—ОН 1,48 А), :\1аВ(ОН).-2Н26 "[41.
Ва j В |ОНL]2-НгО [о], а также минералов типлеп;::
Na2C!B(OHL [6] и бапдплнта CuClB(OH), [7]. В последе ¦ г
соединении интерес представляет также координация попа
204 24. Бор__
Си2 . В структуре можно выделить гофрированные слои изтет-
раэдрических групп В(ОНL, связанных атомами Си" которые
образуют четыре компланарные связи с группами ОН
А в°з0Н О
О а о он
Рис, 24.18. о —слой BSiO4(OH)8 в структуре датолита CaBSiO4(OH); б —
тип связывания искаженных октаэдрических [Си(ОНLС12] и тетраэдрических
[В(ОНL] координационных групп в бандилите СиС1В(ОНL; в — изображение
структуры бандилита (вид сбоку) (видно, как слои типа б связываются при
помощи длинных связей Си—С1).
(рис. 24.18,6). Слои соединяются длинными связями Си—С1
между атомами Си соседних слоев и атомами С1, расположен-
ными между ними (рис. 24.18, в). Координационный полиэдр
атома Си —искаженный октаэдр (Си—4ОН 1,98 А; Си—2С1
2.80 А). Длина связи В—ОН составляет 1,42 А.
24.7. Химия кислородных соединений, бора 205
Минерал гамбергит [8] Ве2(ВО3)ОН — это гидроксоортобо-
оат, содержащий плоские ионы ВОз3~ и ион ОН~, а не тетра-
элрпческие группы [ВО^ОН]4^. Аналогично флюоборит
М?з(ОН, FKBO3 [9] представляет собой совместную плотную
упаковку ионов О2", ОН~ и F~, в которой атомы В занимают
позншш с тригоналыюй координацией, а атомы Mg располага-
ются в октаэдрических пустотах. В общем случае отношение
О:В>4:1 необязательно предполагает тетраэдрическую коор-
динацию атомов В, поскольку часть атомов О может быть не
связана с этими атомами. Так, в структуре флюоборита ато-
мы В занимают лишь часть позиций с тройной координацией.
Аналогичная ситуация реализуется и в структурах «бороферри-
тов», например Mg2Fe2II1B2Os [10], варвнките Mg3TiB2O8 [11]
(разд. 13.5.4), Bi4B2Og [12] и Со4ре2шВ201о. В таких двойных
оксидах бора и металлов могут присутствовать тригональные
группы ВО3, например в Bi4B2O9, который правильнее пред-
ставлять как В14Оз(ВО3J, или тетраэдрические группы ВО4, на-
пример в Fe3BO6 [13], изоструктуриом норбергиту
Mg3SiO4(OH, FJ (разд. 23.12.3).
В минерале бораците Mg3B7O13Cl ионы Mg2+ можно заме-
стить на другие ионы М2+ (например, Ni2+) или Li+, и высоко-
температурные модификации этих синтетических борацитов
имеют кубическую симметрию, как и природный борацит. В ли-
тиевом бораците Li4B7O12Cl часть ионов Li+ замещает почти
полностью ионы Mg2+, располагаясь очень свободно в больших
октаэдрических пустотах. Остальные ионы Li+ занимают стати-
стически приблизительно '/з другой системы эквивалентных по-
зиций. Возможность движения ионов L'v по кристаллу обуслав-
ливает его ионную проводимость. Последняя возрастает при
частичной замене С1 на Вг, например в Li4B7Oi2Clo,68Bro,32 [14].
Литература. [1] Z. Kristallogr., 1961, 115, 460. [2] Z. anorg. allgcm. Chem., 1967,
125, 286^ Acta cryst., 1972, B28, 326. [3] Acta cryst., 1967, 23, 500. [3al Z. anortj.
allgem Chem., 1966, 342, 188 [4] Acta cryst., 1963, 16, 1233. [5] Acta cryst.,
1969, B25, 1811. [б] Ricerca scient., 1951, 21, № 7. [7] Acta cryst., 1951, 4, 204.
[81 Acta cryst., 1963, 16, 1144. [9] Acta cryst., 1950, 3, 208. f 101 Acta crvst., 1950,
3, 473. [11] Acta cryst., 1950, 3, 98. [12] Acta cryst., 1972, B28, 2007. [13] Acta
;ryst., 1975, BU, 1662. [14] Acta cryst., 1977, B33, 2767.
24.7.7. Длины связей В—О. Экспериментально определенные
длины связей В—О лежат в пределах от 1,21 А (для В = О
в газообразном В2О3) до 1,55 А. Среднее значение для триго-
налыюй координации атома В равно 1,365 А, а для тетраго-
нальной— 1,475 А, однако для обоих типов координации су-
ществует значительный интервал длин связей (А):
в-^о
1 ,20
1 ,28
ВО.,
< *¦ 1
1,365
,43
во4
-*—*¦ 1
1,475
,55
20S 24. Бор
24.7.8. Циклический Н2ВЮц, борпксин НЛВЯО3 и боранокарбо-
наты. Соединение Н2В2О3 образуется как интермедиа! при окис-
лении В5Н.>, В.(Н1(| и других боранов в виде неустойчивого про-
дукта с периодом превращения при комнатной температуре L1—
3 сут. На основании данных микроволновой спектроскопии для
молекулы этого соединения предложена структура а [1]. Бор-
окенн НзВ;,Оз получают при действии 1Ь на смесь В-т-В^О;:.
Хотя он образуется при высокой температуре, его можно сохра-
нять при 20 ?С в течение 1—2 ч при давлении 1—2 мм рт. ст. в
среде аргона. Он разлагается до В2О3 + В2Н6, по может окис-
ляться с образованием Н2В2О3. Молекула бороксипа имеет
¦структуру б ji;].
121 li.i
О О
ив в
¦ :
О., i 20 ^ 0
н
При взаимодействии Н3В-СО с КОН можно получить борано-
карбопат К2(Н3В-СО2) [3], где кислород в карбонат-ионе час-
тично замещен па ВН3.
Литература. [I] J. Cliem. Phvs.. 1967. 47, 4186; Ada eryst., 1969 B25, S07
[21 Ino!-. Chern.. 1969, 8, 1689.j3j Inorjj. Chom., 1967, 6. 817.
24.8. Бораны i! родственные соединения
24.8.1. Получение и свойства. Гидриды бора (бораны) первона-
чально получали при .т/м'ктвнп 10%-пой НС1 или, лучше 8 и.
фосфорной кислоты па борпд магния. Основным продуктом ре-
акции был В4Н1С, примесями — В5Н.., B6Hi0 и В10Н14. Смесь раз-
деляли путем фракционной перегонки. Диборан В2Н6 (в смеси
с BsHn и В41Н14) можно получить косвенным методом — нагре-
ванием В.;Н;„ до теу.ператупн 100 JC. Интересно отметить, что
при действии кислоты па jVi^Si образуется ряд сил а нов от
SiH4 до Si6Hn (их со;к-рж:м:!!о в смеси уменьшается в том же
направлении), впоследствии был предложен метод получения
гидридов бора, заключающийся в бьч'тпем пропускании паров
ВСЬ; с водородом при низком давлении через электрический раз-
ряд между медными электродамп. Основным продуктом этой
реакции является B2H5CI, который разлагается при 0 СС па ВоН6
и ВС13. Однако эти и другие известные методы получения ди-
борана удовлетворяли только до тех пор, пока продукт пред-
ставлял лишь теоретический интерес. В настоящее время дибо-
ран— это ценный полупродукт и реагент. В частности, с его по-
24.8. Бораны и родственные соединения 207
мощью можно получать борогидриды из алкильных производ-
ных металлов, восстанавливать альдегиды и кстоны до спиртов,
получать чистый бор разложением диборана при высоких тем-
пературах. Кроме того, в свое время предполагалось использо-
вать диборан как ракетное топливо, поэтому делались попытки
разработать лучшие методы его получения из легкодоступных
исходных продуктов. Очень чистый метилборат с выходом
>90% образуется при нагревании В2О3 с избытком метанола и
последующим удалением спирта из образующейся азеотропной
смеси с помощью LiCl. Далее метилборат превращается в
¦.\аВН(ОСН3K при кипячении с NaH при 68 °С, а в результате
следующей реакции получается диборан с почти теоретическим
выходом:
8(C2H6JO-BF3 + 6NaBH(OCH3K >
> В2Н6 Н- 6NaBF4 + 8(С„Н5),О + 6В(ОСН3K
Дпборап также можно получить прямо из В2О3 при нагревании
со смесью А1 + А1С13 при температуре 175 °С под давлением во-
дорода G50 атм).
Отличительная особенность химии боранов—многообразие
их превращений, что составляет предмет изучения целого на-
правления, препаративной химии (исходным материалом при
этом служит такое простое соединение, как диборан). На схе-
ме 24.2 отражена лишь в небольшой степени очень сложная хи-
мия боранов. При пиролизе В2Нб образуется ряд низших бора-
нов, включая, например, термически неустойчивый ВэНц, од-
нако это соединение проще получать по реакции
В2Н„ + 2В4Н]0 =f==> 2B,HU ~ 2H2
В присутствии катализаторов его можно превратить в B6Hi0'.
2B5HU > В6Н10 + 2В2Н6
а при взаимодействии с В4НШ образуется В5Н9:
В5Н11 -[- В4Н10 >- В5Н9 + 2В2Н9
Поп многократном возвращении в процесс продуктов отдель-
ной реакции можно получить с удовлетворительным выходом
целевой продукт (например, ВюН14 при пиролизе В2Н6 с добав-
лением Н2 или без него). Очень часто при получении боранов
синтез проводят в условиях тлеющего электрического разряда.
В некоторых аспектах химия гидридов бора аналогична хи-
мии углеводородов, а в других — напоминает химию силанов.
Например, бораны легко вступают в реакцию замещения (ато-
мы Н могут замещаться па галогены, CN и органические ли-
ганды). В результате из В10Ни могут быть получены B10Hi3I,
В10Н1212 и Bi0Hi2L2, где L — R2S, RCN, R3N и др. Мопоиододибо-
208 24. Бор
Схелтсх 24.2
Pea кц и и диООи а нон
NaH
CH,NH,
рапы реагируют с Na так же, как этилиодид (реакция Вюртца):
2B2H5I +2Na > B4Hl0-;-2NaI
ср.
2C2H5I +2Na > C4H10 + 2NaI
Однако в реакциях с галогенами и галогеноводородами бораны
ведут себя иначе, чем углеводороды. Например, диборан реаги-
рует с НС1 с образованием хлорпроизводного и Нг, а ВюНн, ко-
торый, согласно формуле, должен быть ненасыщенным соеди-
нением, образует с галогенами продукты замещения, а не при-
соединения, как в случае СгН4 или других ненасыщенных угле-
24.8. Бораны и родственные соединения 209
водородов. Можно отметить существенные различия и в терми-
ческой устойчивости отдельных борапов, например В5Н9 — ста-
бильное, а В5Нц — неустойчивое соединение. В целом низкая
стабильность борапов и легкость взаимодействия с водой ско-
рее сближает их с спланами, а не углеводородами.
Наряду с нейтральными боранами получено много борогид-
ридпых попов — от ВН4~ до B20Hi82~, включая интересный ряд
полиэдрических ионов В,гН„2~ (я = 6, 8—12). В отличие от бо-
ранов эти ионы имеют высокосимметричные структуры и пред-
ставляют собой борные аналоги ароматических углеводородов
В таких структурах наблюдается значительная делокализацня
небольшого числа электронов, в то время как в нейтральных
боранах имеются локализованные 3-центровые связи. Соли ще-
лочных металлов с анионами B10H102~ и Bi2H122~ именно поэто-
му чрезвычайно устойчивы. Усложнение химии борогидридных
попов вызвано и тем, что помимо полиэдрических ионов В„Н„2~
в этих соединениях могут встречаться, во-первых, замещенные
ионы (например, В12Нц0Н2-), во-вторых, ионы с одинаковым
составом, по разными зарядами (например, В8Н82~ и парамаг-
нитный BgHe"") и, в-третьих, ионы с одинаковым каркасом из
атомов В или В и С, но разным числом атомов Н и различны-
ми зарядами (например, BnHi32~ и ВцНн~, которые способны
к обратимым взаимопревращениям). Известны ионы, в которых
атомы Н полностью заменены на галоген, например B,2Bri22~
и В10С1ю2~; последний был обнаружен в свободной кислоте
(H30JBioClio-5H20. Кроме того, при окислении Bi0HI02~ обра-
зуется В2оН!82~, который содержит два фрагмента В10, связан-
ных двумя 3-центровыми связями (в отличие от борана B20Hi6).
Известны ионы, две части которых связаны через группу N0
или атом металла вместо 3-центровой связи (например,
B20H18NO3- и Fe(.T>B9C2HnJ2-).
Дикарбораны типа ВлС2Нга+2, изоэлектронные ионам ВПН„2-,
получают из соответствующих боранов и ацетилена. Они также
обладают ароматическим характером и способны к образова-
нию ,-т-комплексов, например, таких, как анион соли
[(C2H5LN]2[Cu(C2B9HnJ].
Таким образом, можно выделить три основные группы
структур:
1) бораны и их производные, включая высшие члены ряда,
образованные из двух простых фрагментов, связанных через
общую вершину (В10Н16), общее ребро (В,6Н20, B)8H22) или
общую грань (B20Hi6). Все они и большинство прочих боранов
образуют два гомологических ряда — В„Н„+4 и ВяНп+6, причем
соединения первого ряда обычно намного устойчивее, чем со-
единения второго ряда;
2) борогидридные ионы и борогидриды металлов;
14—1284
:210 24. Бор
24.8. Бораны и родственные соединения 211
Таблица 24.7. Бораны и их простые производныеа
BnH,.i + 4
в2н6*
"В5Н9*
-В6Н10*
BSH12
.B10Hu*
В^Нго
«-BISH22
ИЗО-В18Н22
в„Нп+6
в4н10*
в5н„*
в6н12
В9Н|5
ИЗО-ВдН^
BioHi6
В2Н2(СН3L
B5HSI
В5Н7(СН3J
В,оН131
ВюН^Ь
B10H12fS(CH3Jlo
Другие
соедине-
ния
в8н16
в8н,8
ВюН18
В2оН]6
Литература
J. Chem. Phys., 1968, 49, 4456
(в газовой фазе)
J. Chem. Phys., 1965, 43, 1060
(кристалл)
J. Am. Chem. Soc, 1953, 75, 4116
(в газовой фазе)
J. Chem. Phys., 1957, 27, 209
(кристалл)
J. Chem. Phys., 1954, 22, 262
(в газовой фазе)
Acta cryst., 1952, 5, 260 (крис-
талл)
J. Chem. Phys., 1957, 27, 209
J. Chem. Phys., 1958, 28, 56
Acta cryst., 1966, 20, 631
J. Chem. Phys., 1961, 35, 1340
Inorg. Chem., 1969, 8, 464 (ней-
тронограф.)
J. Chem. Phys., 1962, 37, 2872
Inorg. Chem., 1970, 9, 1452
Acta cryst., 1966, 20, 631
.1. Chem. Phys., 1963, 39, 2339
J. Chem. Phys., 1964, 40, 866
Inorg. Chem., 1968, 7, 219
Acta crvst., 1965, 19, 658
Inorg. Chem., 1966, 5, 1752
Inorg. Chem., 1967, 6, 1281
J. Am. Chem. Soc., 1957, 79
2726
Acta cryst., 1962, 15, 410
a Звездочкой отмечены соединения, полученные Штоком.
3) полиэдрические ионы ВПН„2~, изоэлектронные карбораны
В„С2Ня+2, и их производные, включая ионы сложного состава,
рассмотренные выше.
В табл. 24.7 представлены бораны и некоторые их простые
производные и цитирована соответствующая литература.
24.8.2. Молекулярная структура боранов. Не будем детально
рассматривать все структуры боранов и их производных ввиду
их сложности и большого количества. За исключением В2Н6,
большинство боранеш имеют каркас из атомов В, который луч-
ше всего представить как нкосаэдрический фрагмент. (Такое
описание вполне применимо и к открытым позднее карборанам
В,С.Н„+2, поскольку каркасы из атомов В и С в этих соедине-
ниях являются высокосимметричнымп полиэдрами с треуголь-
ными гранями (табл. 24.8), включая и икосаэдр.) Большой тео-
ретический интерес к борапам обусловлен недостаточным коли-
чеством валентных электронов в их молекулах для образования
:шр.\илы:ь:.\ двухэлектроппых связей между всеми атомами.
В --jт:: ¦¦; молекулах число а'юмпых орбпталей (одна для каждого
;г!ол>.; И и четыре для каждого атома В) больше, чем общее
число валентных электронов.
Ь;Н„,
с II...
Обгцсе чис-
.'п> атомных
орбиталеП
14
26
29
54
94
ООЩСС ЧИСЛО1
валентных
электронов
12
22
24
44
76
Чисти 3-uo'ii-
1>овы\ свя-
зей
9
4
5
10
18
Т2 результате структурны:" исследований было установлено.
¦Iiu ь: молекулах боранов существуют концевые атомы Н
(В—HK0..,j 1,2 А) и мостпкозые, расположенные между двумя
.ломами В (В—Н—-В). Такие мостики обычно симметричны
(В--Нмо,..1- 1,34 А), исключением является слегка несимметрич-
ный мостик в BhiHm, где В—НЛЮст равны 1,30 и 1,35 А. Ато-
мы В располагаются в вершинах полиэдра с треугольными гра-
пям и пли его фрагментов, длина с;:я:<п В—В обычно составляет
:.70 • !,84А, в редких случаях она может быть меньше A.60 А
,.!н с;зя.;еп В—В, лежащих в основе структуры В6Н,;) пли
больше A,97 А для двух связен в B10Hi4). В общем случае
к..;-:-, о>п атом В связан с одним или несколькими концевыми
;п:.>мамц Н, однако в некоторых борапа.х, которые состоят из
чнуч фрагментов, атомы В, участвующие в объединении этих
фрагментов, связаны только с атомами 3 или же с атомами В
п мостиковымп атмами Н:
BioIIiii 2 В связаны только с 5 В
к.-?о-В1йНо:, 1 В связан с 5 В и 2 Н,:,)Ст
I В снизан только с 7 В
w-Bii,H2; 2 В связаны с 6 В и 1 Н„Ост
Для того чтобы объяснить молекулярную структуру бора-
нов в терминах двухэлектронны.х связей, при избытке атомных
орбпталей было сделано предположение, что происходит объ-
14»
.212 24. Бор
24.8. Бораны и родственные соединения 213
единение трех или большего числа атомных орбиталеп с обра-
зованием одной связывающей молекулярной орбитали. Струк-
туры наиболее простых борапов можно описать с помощью
3-центровых связей трех типов (рис. 24.19). В случае централь-
ной закрытой связи (рис. 24.19, а) три атома В образуют гиб-
ридные орбитали и расположены по углам равностороннего
треугольника. В случае открытой 3-центровой связи (рис.
.24.19,6) они образуют треугольник с тупым углом, а сред-
CJ—'--*O ^/ Ч\, <2В
центральный открытый мастик В-Н-Б
Рис. 24.19. Типы 3-центровых связей в боранах.
ний атом В использует для связывания р-орбитали. В случае
мостиковой связи типа В—Н—В (рис. 24.19, в) эта связь обра-
зуется за счет Is орбитали атома Н и гибридных орбиталей
атомов В. В некоторых более сложных системах, например по-
лиэдрических ионах, для объяснения их «ароматического» ха-
рактера, вероятно, необходимо предположить полную делокали-
зацию некоторого числа электронов (с использованием большо-
го числа орбиталей) —ср. С5Н5~, С6Н6 и С7Н7+.
Диборан В2Н6- Строение этой (диамагнитной) молекулы ус-
тановлено недавно электронографическим исследованием (сек-
торная методика, микрофотометр):
Плоскость центрального фрагмента ВН2В перпендикулярна
плоскостям концевых групп ВН2 (рис. 24.20, а). Рентгенострук-
турное исследование кристаллической [5-формы (при 4,2 К)
дает такие же величины для длин связей В—В, но связи В—Н
оказываются более короткими (В—Нкогщ 1,09 А и В—НМОст
1,24 А), а валентные углы НКшщВНКонц и НМОСтВНмост равны со-
ответственно 124 и 90°. Отсутствием прямой связи В—В в ди-
п"тСт - ¦ Молекулярные структуры боранов и родственных соединений а —
В2П6; о-В4Н10; е-В5Н9; г-В5Н„; <?-В8Н12; е-В9Н15; ж-В10Н14: з-
BI0Hl2[S(CH3J]2.
борапе можно объяснить протекание следующих реакций:
ВаН„ + 2СО v 2ВН3-СО
В2Н6 + 2N(CH3K . v 2BH3-N(CH3K
ВаН6 + 2NH3 > NH4(H3B • NH2 ¦ BH3)
Из шести атомов Н в диборане только четыре могут замещать-
ся на группы СН3 —не более двух заместителей на каждый
В. Известно соединение В(СН3K, но не существуют
1(СН3J или ВН2(СН3), которые, очевидно, конденсируются
образованием В2Н2(СН3L и В2Н4(СН3J. В молекуле
1зJВН2В(СН3J найдены следующие расстояния- В—Н
1,36 А; В—С 1,59 А; В—В 1,84 А.
Тетраборан A0) В4Н10. Строение молекулы (рис. 24.20,6)
установлено в результате электронографического исследования
и рентгеноструктурного анализа. Атомы В располагаются по
214 24. Бор
24.8. Бараны и родственные соединения 215
вершинам двух треугольников, связанных общем] стороной B[B3
с двугранным углом BiB3B2/BiB;iB4, равным 124,5 , и углом
B2BiB4, равным 98°. Этот второй угол должен быть равен 90
или 108 . если группа из 4 атомов В составляет фрагмент окта-
эдра пли икосаэдра соответственно.
Пентаборан (9) В-0Нч- Каркас из атомов В в этой молекуле
имеет форму тетрагональной пирамиды (рис. 24.20, е) — ср. с
октаэдрическими группами В6 в СаВ6 и В6Н62^ (см. ш^ке)-
Среднее значение длины связи В—В
близко к 1,80 А в основании (В2В2) и
1,70 А для Bi—В2. Очень похожий
каркас В5 обнаружен в молекулах
В5Н81 (атом 1 присоединен к апи-
кальному атому Bi) и В5НТ(СН3J,
где группы СНз связаны с двумя со-
седними атомами бора в основании
пирамиды.
'Пентаборан A1) В5Ни. В этом гид-
риде скелет из атомов В (рис.
24.20, г) можно рассматривать как
фрагмент похожего на икосаэдр кар-
каса в молекуле В10Н!4 пли как кар-
кас, родственный тетрагональной пи-
рамиде В5Н9 (одна связь В—В в основании пирамиды -разорва-
на). Длины связей в этой молекуле имеют следующие значе-
ния (А):
Рис. 24.21. Длины сня.'ей в
молег.улс В6Н;(.
В,—В,:
В.;—В;
В;, —В,
В—Bi;
i ,72 (средн.)
1,76 (средн.!
1.77
1,87
В—Hs,
В—М-,.
i, 1 0 (Cj--
1.22
1,72 icji
Особенностью этой структуры является атом Hvn, связанный с
Bi A,09 А) и находящийся па расстоянии 1,72 А от двух ато-
мов Вш.
Гексаборан A0) В6//;п. Рендтеноструктурным исследованием
обнаружено, что л этом гидриде атомы В расположены в верши-
пач пептагональной пирамиды так, что и в этом случае скелет
из атомов В является фрагментом икосаэдра. Длины связей
приведены на рис. 24.21; стандартные ошибки определения со-
ставляют ~ 0,05 А для связен В—Н и -0,01 А для езязей В—В.
Следует отметить несимметричность основания пирамиды: одна
связь В—В короче других.
Октаборан A2) В&Н<2 — термически неустойчивое соедине-
ние; получается с очень незначительным выходом из смеси
В5Нд, В2Н6 и Н2 в условиях тлеющего электрического разряда.
Строение его молекулы очень похоже па В9Н]-: если в послед-
нем мостиковую группу ВН2 (обозначенную буквой е на
рис. 24.20, <?) заменить на моетпковый атом Н. Некоторые ато-
мы В на рис. 24.20, д и е обозначены буквами для облегчения
сравнения молекулярных структур боранов.
Нонаборан A5) Bsfli5. Менее симметричный каркас этого
гидрида (рис. 24.20, г) можно получить из икосаэдра удалени-
ем грех связанных атомов В, которые не образуют треугольной
группы, п последующим раскрытием структуры вокруг образо-
вавшейся пустоты.
Лскаборан A4) В1ОНЫ — твердое соединение, один из самых
устойчивых боранов. Атомы В занимают в этой структуре 10
из 12 вершин искаженного икосаэдра, а 10 концевых атомов Н
направлены наружу приблизительно вдоль осей 5-го порядка
икосаэдра, так что внешняя поверхность молекулы состоит пол-
ностью из атомов Н. Ранее уже отмечалось присутствие более
длинных, чем обычно, связей В—В A,97 А) в этой молекуле
(это связи В7—В8 и Bs— В10 на рис. 24.20,ж), а также неболь-
шая асимметрия водородных мостиков. Два изомера Bi0Hi3I
имеют подобную структуру. В молекуле B10Hi2I2 атомы иода
связаны с атомами В2 и В4. В то же время в структуре
BmHi2[S(CH3J]2 заместители связаны с атомами В6 и Вэ, и про-
исходит перераспределение водородных мостиков (рис. 24.20, з).
Декаборан A6) BWHW получается непосредственно из В5Н9
(в электрическом разряде) с отщеплением двух атомов Н. Его
молекула (рис. 24.22, а) состоит из двух фрагментов В5, таких,
как В5Н9, связанных ординарной связью В—В.
Бараны Bi6H2o, В\ЪН22 и B20Hi6. Молекулы ряда высших бо-
рапов состоят из двух икосаэдрических фрагментов, имеющих
общее ребро (Bi6H20 и два изомера Bi8H22), или из двух ико-
саэдров с двумя общими гранями (B20Hi6). Их строение пока-
зано па рис. 24.22, б—г.
24.8.3. Борогидридные ионы и карбораны. Существуют три типа
металлических производных боранов и родственных им соеди-
нений:
1) соли, содержащие ионы (от ВН4~ и В3Н8~ до полиэдри-
ческих ионов);
2) ковалентные молекулы и ионы, в которых группы ВН4 и
B3Hr связаны с атомами металлов водородными мостиками;
3) сандвичевые структуры я-типа, образуемые карборанами.
Далее эта классификация строго не соблюдается.
Ион ВНс- Многочисленные борогидриды М(ВН4)„ получе-
ны при действии галогенидов металлов на NaBH4 (который об-
разуется из В(ОСН3M и NaH при 250 °С или иными способа-
ми). В ряду соединений NaBH4, LiBH4, Be(BH4J и А1(ВН4K
наблюдается закономерное изменение химических и физиче-
216 24. Бор
Рис. 24.22. Структуры боранов. а — B!0H
В16Н20; в — Bi8H22; г —B20Hi6.
ских свойств. Например, увеличивается их летучесть и понижа-
ется устойчивость к воздуху и воде. Борогидрид натрия — кри-
сталлическое вещество, устойчивое к нагреванию в вакууме
вплоть до 400 СС, хотя и очень гигроскопичное. При комнатной
температуре NaBH4 (как и соединения калия, рубидия и цезия)
имеет структуру типа NaCl [1], но ниже —83 °С симметрия ре-
шетки понижается до объемноцентрированной тетрагональной
[2] (ср. с галогенидами аммония). LiBH4 плавится при 275 °С
и, очевидно, имеет структуру типа цинковой обманки или вюрт-
цита [3]. Эти соли, вероятно, содержат тетраэдрические ионы
ВН4~, подобные тетраэдрическим группам ВН4 в ковалентных
соединениях, которые кратко рассмотрены ниже.
24.8. Бораны и родственные соединения 217
Н-'
\хн
ЧА1 Сн-
//'
-Н—В
\,
I.20A
2.02 А
н н
©
^iZZ4-B
/ WO Л \
Н
ж
\ /
н —в—в — н
/ \
HJ03- NH
„-вн2
. ,н
ОС
Мп ¦
н —:
\
Н — Мп
Н Н
Ч /
Н — Мп
Рис. 24.23. Молекулярные стр\-кт ры борогидрндов н родственных соединений
а и о —Bc(BH,)j; я — А1(ВН.1 •.; г — \ (Сг,Н-,ЬР}.Си (ВП,); гЬ- М (ВН4)-•
•Х(СНя),; с — (В: II.-)-; »с--Г1СС;П.;ЬР!-.ги(В,Н,);1 я — [Сг(СОL3.1Н81- м —
H.Mi!,(C())!C(BH3)j.
А1(ВН4K — летучая жидкость с температурой кипения
44,5 °С, а борогидриды М(ВН4L, где M = U, Th, Hf и Zr, явля-
ются наиболее летучими из соединений этих металлов.
В более ковалентных борогидридах металлов группы ВН4
связаны с атомом металла водородными мостиками (это показа-
218 24. Бор
но для ряда молекул на рис. 24.23). Строение Ве(ВН4J изуче-
но методами электронографии в газовой фазе, ИК-спектро-
скопии (в матрице инертного газа), проведены также
неэмпирические расчеты. В результате получено множество!
структурных моделей. Было сделано предположение, что для
молекулы в газовой фазе имеется несколько выгодных копфор-
маций. Однако, по-видимому, наиболее предпочтительна линей-
ная структура (рис. 24.23, а) (предложенная еще в самом пер-
вом электронографическом исследовании), в которой атом Be
окружен октаэдрически шестью атомами Н [4а]. В кристалли-
ческом Ве(ВН4)г [46] имеются спиральные цепи (рис. 24,23, б),
в которых атомы Be также имеют КЧ 6. В молекуле А1(ВН4)з[5]
атом металла окружен шестью атомами Н по вершинам триго-
налыюй призмы (рис. 24.23, в), А1—В 2,14 А. Строение молеку-
лы Zr(BH4L было изучено электронографически в газовой фазе
[6а] и в кристаллическом состоянии при низкой температуре
[66]. Группы ВН4 расположены тетраэдрически вокруг атома
металла и связаны с ним тройными водородными мостиками.
-н-
-ВН
1\
Исследованы также структуры соединений [ (С6Н5KР]2-СиВН4
(рис. 24.23, г) [7а] и Al (BH4K-N(CH3K (рис 23.23,5) [76],
однако в модификации последнего, существующей при комнат-
ной температуре, положение атомов водорода определить не
удалось. Эта молекула имеет тетраэдрическое строение (А1—N
2,00 А; А1—В 2,19 А), но в низкотемпературной модификации
три группы ВН4 неэквивалентны. Одна из групп развернута та-
ким образом, что один атом Н (на рисунке Н*) занимает апи-
кальное положение в пентагональной бипирамиде вокруг ато-
ма А1.
Ион В3Н8-. Структура этого иона (рис. 24.23, е) установле-
на в соединении [H2B(NH3J] (В3Н8) [8], которому первона-
чально приписывали формулу В4Ню-2МН3, поскольку образу-
ется оно из В4Н10 и NH3 в эфире при —78 °С.
В ковалентных соединениях [ (С6Н5KР]2-Си(В3Н8) [9] и
[Сг(СОLВ3Н8]Ы(СНзL (рис. 24.23,ж и з) [10] группа В3Н8
связана с атомом металла посредством водородных мостиков.
Все атомы Н были локализованы при рентгеноструктурном
анализе НМп3(СО) ю(ВНзJ (рис. 24.23, и), в молекуле кото-
рого имеются мостики не только типа Мп—Н—В, но и типа
Мп—Н—Мп [11].
24.8. Бораны и родственные соединения 219
Питература. [1] J Am. Chem. Soc, 1947, 69, 987. [21 J. Chem. Phys., 1954, 22,
m i;;| ,1 \m ' Chem Soc 1947, 69, 1231. |4a| .1. Chcm. Phys., 1973, 59, 3777.
1461 Inorg Chcm., 1972, 11. 820. |5] Ada Chcm. Scand., 1968, 22, 328. [6a] Inorg.
hicin I'i71. 10. 590. [G6| J. Chcm. Soc, D 1973, 162. [7a] Inorg. Chcm., 1967, 6,
¦1023 |7<">| Inorg Chem., 1968, 7. 1575. |8| J. Am. Chcm, Soc, 1960, 82, 5758.
[9] Iiiorg.'Chem.. 196!), 8', 2755. [Щ Inorg. Cliem., 1970, 9, 367. [11] J. Am. Chem.
Soc. 1963, 87, 2753.
Таблица 24.8. Полиэдрические борогидридные ионы и карбораны
Конфигурация
Тр ичешльная бпгшра-
чи ш
Октаэдр
i
Пеитагональная бипи-
оамнда
Додекаэдр
Трехшапочная триго-
нальная призма
Двухшапочная квад-
ратная антипризма
Каркас из 11 атомов
Икосаэдр
Ионы со сложным
строением
Икосаэдрические
фрагменты
ВсИ-г"
ВаНз2"
В9Н92-
ВюНю2"
ВцНп2-
В|2Н122-
в20н182-
В20Н,82-
(фотоизо-
мер)
B2r,Hl8NO3-
В,,Н,з2-
в„-2С2Н„
или производные
В:.С:11з
2,3-В4С2Н6
,6-В4С,П6
В;С,П-
В6С,Н6(СН3J
В7С2Н7(СН3J
В9С2НЭ(СН3J
BioC2Hi2
B10C2H,oBr2
Б7С2Н„(СНзJ
в4с2н8
Литература
Inorg. Chem., 1973, 12,
2108
Inorg. Chem., 1935, 4,
917
, Chcm. Phys., 1970,
53, 1890
Inorg. Chem., 1973, 12,
2108
,. Chcm. Phys., 1965,
43, 2166
Inorg. Chem., 1969, 8,
2771
inorg. Chem., 1968, 7,
1070
Inorg. Chem., 1968, 7,
2260
Inorg. Chem., 1968, 7,
1076
J. Chem. Phys., 1962,
37, 1779
Inorg. Chem., 1966, 5,
1955
J. Am. Chem. Soc,
1966, 88, 4513
J. Am. Chem. Soc,
1960, 82, 4427
Inorg. Chem., 1971, 10,
350
Inorg. Chem., 1967, 6,
874
Inorg. Chem., 1971, 10,
151
Inorg. Chem., 1968, 7,
1085
Inorg. Chem., 1971, 10,
160
Inorg. Chem., 1967, 6
1199
Inorg. Chem., 1967, 6
113
Inorg. Chem., 1964, 3
1666
220 24. Бор
Со структурно-химических позиций наиболее простые поли-
эдрические ионы — это члены ряда В„Н,г2~ (известны соедине-
ния с л = 6 и 8-ь12), которые удобно рассматривать вместе с
изоэлектронными им карборанами Bn_2C2Hn. Эти ионы обычно
получают в виде солей щелочных металлов или замещенного
иона аммония. Структурными исследованиями таких ионов,
Рис. 24.24. Молекулярные структуры. а — В7С2Н7(СН3J; б — В7С,НП (СН,J;
в — BuHi32-; г —В9С2Нц; д и с — B20II,s2^; ж— (B20H18NOK-.
карборанов или замещенных карборанов (см. литературу, ци-
тируемую в табл. 24.8) установлено, что каркасы из атомов В
(или В и С) представляют собой высокосимметричные полиэд-
ры с треугольными гранями, которые перечислены в верхней
части табл. 24.8. На каждую вершину полиэдра Вп или В„_2С2
приходится один концевой атом Н, а мостиковые атомы отсут-
ствуют.
Наряду с соединениями, содержащими ионы В„Н,г2~, синте-
зированы многочисленные соединения с ионами, содержащими
большее число атомов Н (например, В5Н8~, В6Н9~, B9Hi4~,
ВюН122-, BioHi3-, B10H142-, B10Hi5- и ВИН132-). Структурными
исследованиями показано, что в ионах таких типов все атомы
24.8. Бороны и родственные соединения 22 Г
Н, не являющиеся концевыми, способны образовывать мостики,
в 'результате чего может происходить изменение каркаса из
атомов В. Такая же ситуация возникает и в карборанах. Так,
соединение В7С2Н7(СНзJ — замещенное производное борана
типа В„_2С2Н„, где полиэдр В7С2 представляет собой трехша-
почпую трпгональную призму, в которой два атома С распола-
гаются над гранями (рис. 24.24, а). В то же время это соедине-
ние можно рассматривать как производное B7C2Hi3, каркас ко-
торого—«раскрытый» икосаэдрическип фрагмент, в котором
присутствуют два мостиковых атома Ник каждому атому В
0
Рис. 24.25. Молекулярные структуры, а — [f
6-[B9C2HnRe(COK]-; в - Fe(C5H5) (B9C2HU).
Положение атомов Н не указано.
и С присоединено по одному концевому атому Н (рис. 24.24,6).
Аналогично В4С2Н6(СН3J построен в форме пентагоиальыой
пирамиды (а не октаэдра, как В6Н62~), a BnHi32~— икосаэдра
без одной вершины (два мостиковых атома Н) (рис. 24.24, в)
в отличие от В9С2Нп, который имеет более симметричную фор-
му (рис. 24.24, г), образованную путем добавления одного ато-
ма В к каркасу типа ВюНн. К карборанам с пентагонально-
пирамидальным расположением шести атомов В и (или) С от-
носятся и соединения В2С4Н6 [1а] с четырьмя атомами С в ос-
новании пирамиды, а также В5СН9 [16] с одним атомом С в ос-
новании.
В карборанах возможна изомерия. В табл. 24.8 приведены
цис- и транс-формы В4С2Н6; Bi0C2Hi2 имеет три изомера {орто-,
мета- и пара-карбораны).
К сложным ионам относятся два изомера B20Hi82~
(рис. 24.24,(9 и е) и ион B20Hi8(NOK~ (ж). Основной ион
В20Н182~ ((Э) образуется при окислении ВюНю2" ионами Fe3+
24. Бор
или Се4, а под действием ультрафиолетового излучения на рас-
тпор в ацстонитриле получается фотоизомер (е). При взаимо-
действии N0 п B2oHis2- образуется третий изомер (ж).
Металлические производные карбораиов. В заключение рас-
смотрим гг-комплексы ионов карборанов с атомами переходных
металлов. В результате образуется ион сложного состава пли
нейтральная молекула. Некоторые молекулы и ионы, изобра-
женные па рис. 24.25, а, содержат различные переходные метал-
лы (Xi, Co и т. д.), например NiIV(BsC2HiiJ [2a—2в], а также
попы, в которых атомы Н частично замещены. В структуре не-
которых соединении осуществляется зигзагообразная конфигу-
рация (рис. 24.25, о), например в анионе [Со(В9С2НиJ] ", изу-
ченном на примере соли цезия, а другие соединения имеют
«разрезанную» структуру, где атом М координирует три ато-
ма В каждого из колец В3С2. Это различие в структуре можно
попытаться связать с изменением числа d-электронов атомов
переходных металлов. К ионам со структурой данного типа от-
носятся [З.З'-МО.г-ВэСгНпЬ]"-, где п = 2 для Cu(II) и п=\
для Си (III) и Аи (III). В комплексном ионе, содержащем
Аи(III), расстояния Аи—ЗВ и Аи—2С равны 2,24 и 2,77 А [3].
Известны также «ионные пары», образованные анионом
В9С2Нц2^ и катионом металла; примером может служить
(Т1В9С2Нц)~, строение которого изучено на примере соли
(Р(С6Н5)зСН3)+ [4]. Структура, изображенная на рис. 24.25,6,
обнаружена в анионе соли Cs[B9C2HnRe(COK] [5] и молеку-
лы типа B9C2H11ReH(P(C6H5KJ [6] (катализаторе некоторых
гомогенных реакций гидрогенизации). На рис. 24.25, в изобра-
жена «саидвичеобразная» молекула Fe(n>C5H5) (я-В9С2Нц)
[61. В анионе соли Cs2[(B9C2H11)Co(B8C2H1o)Co(B9C2H11)] •
•Н20 [7] атомы металла связаны между собой мостиками из
10-атомного фрагмента икосаэдра и также присоединены к
11-атомным фрагментам [7].
Литература, [la] Chem. Comm., 1973, 928. [161 Inorg. Chem., 1971, 10, 1144.
¦[2a] J Am Chem. Soc, 1970, 92, 1173. [26] Inorg. Chem., 1967, 6, 1911. [2в] J.
\m Chem Soc, 1970, 92, 1187. [3] Ada cryst, 1977, B33, 3604. [4] Acta cryst.,
1978, B34, 2373. [5] Inorg. Chem., 1966, 5, 1189. [61 J. Am. Chem. Soc, 1965, 87,
:3988. [7J Inorg. Chem.. 1969, 8. 2080.
25. МЕДЬ, СЕРЕБРО И ЗОЛОТО
25.1. Валентные состояния
В периодической системе элементов каждый из рассматривае-
мых элементов с заполненной d-оболочкой следует непосредст-
венно за переходным металлом (соответственно Ni, Pd и Pt).
Можно было бы ожидать, что они будут вести себя как непере-
ходные металлы и образовывать ионы М+, отдавая единствен-
ный электрон с внешней оболочки или используя s- и р-орби-
тали внешней оболочки для образования коллинеариых sp- или
тетраэдрических 5р3-связей. На самом же деле, хотя и Си, и Ag;
действительно образуют ионы и связи обоих указанных типов,,
однако свободный ион Аи+ не известен, а для Au(I) координа-
ционное число 2 предпочтительней, чем 4. Более того, все эти:
элементы проявляют более высокую валентность либо в резуль-
тате потери одного или большего числа d-электронов (напри-
мер, Си2+), либо путем использования d-орбиталей предпослед-
ней оболочки вместе с s- и р-орбиталями внешней (валентной)
оболочки. В этих более высоких валентных состояниях данные
элементы проявляют некоторые характерные свойства переход-
пых металлов, например они образуют окрашенные парамаг-
нитные попы. Такое двойственное поведение сильно усложняет'
структурную химию этих металлов. Поскольку сведения о сте-
реохимии соединений этих элементов в некоторых состояниях
окисления довольно ограниченны, мы рассмотрим более деталь-
но структурную химию одновалентных меди, серебра и золота,,
двухвалентной меди и трехвалентного золота, а данные о комп-
лексах Си(III), Си(IV), Ag(II), Ag(III) и Au(V) включим:
лишь в вводный обзор.
Несмотря на общее сходство электронных конфигураций
атомов Си, Ag и Аи, их химические свойства очень сильно раз-
личаются. Во-первых, в обычных соединениях они проявляют
следующую валентность: Си 1 и 2; Ag 1 и Аи 1 и 3. Кроме того,
Си п Ag можно окислить до Си (III), Си (IV), Ag(II) и Ag(III)
соответственно, но простые соединения Аи(II) не известны.
Большинство кристаллических соединений, предположительно
содержащих Au(II), например CsAuCl3 и (C6H5CH2JS-AuBr2
[1], фактически состоят из эквимолекулярных количеств Au(I)
и Аи (III). Первым детально описанным парамагнитным соеди-
нением Аи (II) являлся [Aun(mntJ][H-C4H9LN]2 [2] (где
mnt — малеонитрилдитполат), устойчивый в отсутствие воздуха..
224 25. Медь
по моментально окисляющийся в растворе. Результаты иссле-
дования методом парамагнитного резонанса указывают па то,
что и фталоцианиновый комплекс серебра является производ-
ным Аи (II) [3]. Единственным примером комплекса Au(V)
служит (Xe2Fn) (AuF6) (разд. 8.6), который можно сопоставить
с комплексом Pt(V) в (XeF5) + (PtF6)-; длины связей М—F в
этих соединениях близки: Аи—F 1,86 A, Pt—F 1,89 А. Во-вто-
рых, наиболее устойчивым состоянием окисления меди являет-
ся Cu2r (гидратированный ион), а серебра—Ag+. В отличие от
меди п серебра химии ионных соединений золота в водных рас-
творах не существует, так как ноны Air" и Аи3+ не присутству-
ют в водных растворах солей золота по крайней мере в доста-
точно ощутимых концентрациях. Единственные водораствори-
мые соединения золота содержат Аи в составе комплексного
попа, как, например, в растворах K[Au(CNJ] или
Na3[Au(S2O3J]-2Н2О. Координационные соединения Аи значи-
тельно более устойчивы, чем соответствующие простые соли.
Например, AuCl просто разрушается горячей водой, которая не
производит никакого действия па [Au(etuJ]Cl-H2O (etu — эти-
лентиомочевина). Аналогичным образом нитрат золота(I) по-
лучить не удается, тогда как [Au(etuJ]NG3 вполне устойчив.
Нитрат золота (III) можно получить в безводных условиях; из-
вестны также комплексные нитраты золота(III), например
K[Au(NO3L].
Как уже было отмечено, наиболее устойчивые ионы меди в
водных растворах — это ионы Си2+. Кислородсодержащие соли
Си:, например C112SO4, разрушаются водой: 2Cu+->Cu + Cu2+,
а соединения CuNO3 и CuF вообще неизвестны. Хотя безвод-
ная соль Cu2SO3 неизвестна, можно выделить бледно-желтую
соль Ci;2SO3-72H2O, а также NH4CuSO3 и КаСиБОз-бНаО [4].
Далее будут рассмотрены соли, содержащие в своем составе
и Cu(I), и Си(II). Устойчивые соединения одновалентной меди
нерастворимы, связи в них носят преимущественно ковалент-
ный характер (галогениды, СигО, Cu2S); галогениды и циани-
ды Cu(I) даже более устойчивы в воде, чем соединения, содер-
жащие Си2+. Так, например, Cul2 и Си(СМ)г в растворе вос-
станавливаются до соединений медиA). Одновалентное состоя-
ние меди стабилизируется в результате координации атомов,
н комплексные производные, например [Си(ехиL]1ЧОз и
[Cu(cln).-j]2SO4, значительно более устойчивы, чем простые
оксосоли. В пиридине равновесие 2Cu+=f±Cu2H'-rCu сильно
смещено в левую сторону (Си+). В общем для двухва-
лентной меди устойчивы только соли сильных кислот, например
Cu(NO3b и CuSO4; соли Си2+ более слабых кислот легко раз-
лагаются, и обычно известны только «основные» соли; это спра-
ведливо для нитритов, сульфитов и т. д. Однако если образу-
25.1. Валентные состояния 225
ются комплексные ионы, например Cu(enJ2'", то возникают
вполне устойчивые соединения, например [Си (enJ] (NO2J,
f Си (en) о] SO3. Если в раствор соли меди добавлять мегилсуль-
фид, то в осадок будет выпадать соединение Си1", в то время
как если в раствор хлорида медиA) в присутствии КС1 добав-
лять угнлендиампн (в отсутствие воздуха), то образуется ион
Си(епJ2~, а в осадок выпадет металлическая медь. После этих
замечании становится гипятпым, что нельзя говорить об отно-
сительной устойчивости Cuf и Си2+, не принимая во внимание
окружение ионов, т. е. соседних атомов в кристалле, молекул
растворителя или координированных лпгандов, если образует-
ся комплексный ион. Реакция 2Си^(газ)^Си2+(газ) +Си(тз.)
сопровождается большим поглощением тепла: ДЯ =
= +870 кДж/моль. Если же мы хотим сравнить устойчивость
двух ионов в кристалле или растворенном состоянии, то важно
учитывать, что величина ДЯ может (сильно) измениться из-за
различия во взаимодействии Си+ и Си2+ с окружением, что от-
ражается на энергии решетки или энергии сольватации. Послед-
ние могут быть значительно выше для Си2, чем для Си~!", по-
этому величина ЛЯ' может стать отрицательной, т. е. ионные
соли Си~ будут менее устойчивыми, чем соли Си2+. С повыше-
нием степени ковалситности связи Си—X величина АЯ' опять
становится положительной, и в случае иодида и цианида соеди-
нения Си ' уже более устойчивы, чем Си2+. Для определения от-
носительной устойчивости соединений Си+ и Си2+ может ока-
заться существенной и конфигурация координирующей молеку-
лы. Иллюстрацией могут служить следующие цифры для
(Си11)/(Си1J в присутствии различных диаминов:
(Cu»)/(Cu'J
~105
~104
3-Ю-2
2-10-2)
Соединение
Этилендиамин
Тримети лен диамин
Пентаметплен диамин
(ср. с аммиаком
Если аммиак стабилизирует одновалентное состояние меди
по реакции 2Cu(NH3J"h^Cu(NH3L2++Cu, то первые два ди-
амина стабилизируют степень окисления +2. Эти соединения
могут образовать хелатные комплексы с Си11 (но, очевидно, не
с Си1), в то время как пентаметилендиамин, вероятно, может
присоединяться только посредством одной группы NH2 либо к
Си11, либо к Си1 и, таким образом, ведет себя подобно ам-
миаку.
Следует упомянуть и о некоторых особенностях химии со-
единений серебра в кристаллическом состоянии.
1) Координационное число Ag(I) изменяется от 2, 3, 4 в со-
единениях, где связи носят существенно ковалентный характер,
До 6, 7 и 8 в оксососдипсннях, в которых осуществляются ион-
15—1284
226 25. Медь
ные связи. Аналогичные закономерности проявляются и у со-
единений Hg(II), другого элемента подгруппы Б (гл. 26). Более
электроположительным элементам подгруппы А, например Са
в его обычных кристаллических соединениях, низкие координа-
ционные числа несвойственны, хотя в газообразном состоянии
в молекулах дигалогенидов этих элементов координационное
число по необходимости равно двум.
2) Расстояния между атомами Ag подтверждают существо-
вание взаимодействия вида металл — металл в следующих со-
единениях: в устойчивой ромбической модификации AgNO3
C,22 А) [5], Ag2HPO4 C,08 А) [6], в цепях атомов серебра три-
сульфимида Ag3(NSO2K-3H2O C,03 А) [7] и в фульминате
B,8—2,9 А) (разд. 21.7.7) (ср. с расстоянием Ag—Ag 2,89 А
в металле). Предельный случай этих взаимодействий — образо-
вание кластера из атомов серебра, что имеет место в соедине-
нии Ag(имидaзoлJClO4 [8]. В нитрате серебра присутствуют
изолированные линейные катионы и нет расстояний Ag—Ag
менее 5,0 А, в то время как в перхлорате имеются группы из
6 атомов серебра (а), в которых внешние связи Ag—Ag C,05 А)
заметно короче центральных C,49 А). Координационное число
Agi насыщается двумя атомами азота молекулы ьмидазола
(Ag—2N 2,08 А), а координационное число Ago — двумя N, на-
ходящимися на таком же расстоянии, и двумя О из С1О4~ на
расстоянии около ЗА. Октаэдрические кластеры Ag6 были обна-
ружены в дегидратированных Ag-замещенных цеолитах [9].
О мостиковых тетраэдрических комплексах серебра см. в
разд. 25.5.2.
-Ag-
—Ag— N
Ag Ag, N
--Ag N Ag,r-O
N О
\/
— Br Ag
\/
-Br-
- Ag-
-Br
Ag-
Ag Ag
/ \
-Ag-
-Br —
/\
3) Представляют интерес соединения с такими необычными
формулами, как Ag2ClNO3 [10] и изоструктурный ему бромид,
Ag2INO3 [11], Ag3I(NO3J [12], Ag3SNO3 [13], Ag4Te(NO3J
[14] и Ag7O8NO3 [15]. Характерной чертой строения некоторых
из этих соединений является образование трехмерного каркаса,
включающего атомы серебра и галогена или серы (теллура);
ионы NO3~ находятся в пустотах этого каркаса. Например,
25.!. Валентные состояния 227
v, Ag-jBrXO.i трехмерный каркас образован тригонально-бипи-
рампдальными группами BrAgs с двумя общими вершинами
и двумя общими ребрами; половина атомов серебра связана
с двумя атомами Вг, а другая половина — с тремя Вг. Тополо-
гическая диаграмма б показывает, как с данными координа-
ционными числами достигается состав Ag2Br. Ионы NO3~ рас-
положены в полостях, окруженных семью атомами серебра,
а координационное число Ag дополнено атомами О ионов NO3~:
О-—
Рис. 25.1. Элементарная ячейка Ag7O8NO3. Атомы серебра с КЧ 4 и 8 (показа-
ны только некоторые из них) изображены заштрихованными и светлыми круж-
ками. Пнтрат-ионы (не показаны) расположены в больших ромбокубооктаадрн-
ческих пустотах.
Ag—BВг + 6О) или Ag—(ЗВг + 40). Оба соединения Ag3SNO3
и Ag7O8NO3 имеют очень симметричные трехмерные каркасы
с кубической симметрией. В первом из них атомы S находятся
в узлах сетки с координационным числом 6 и связаны через
атомы серебра, имеющие координационное число 2 (S—Ag—S
157°); ионы NO3~ занимают полости этого каркаса. С другой
стороны, каркас этого необычного соединения, выделенного из
CS2 и концентрированного раствора AgNO3, может быть опи-
сан как построенный из групп SAg6, имеющих конфигурацию,
промежуточную между правильным октаэдром и тригоналыюй
призмой; его можно сравнить со структурой Ag2BrNO3, обра-
зованной группами BrAg5. В Ag-O8NO3 восемь атомов кисло-
рода занимают 6-связанные узлы трехмерной сетки (другого
типа), сочленения которой создают заполняющую простран-
ство совокупность ромбокубооктаэдров, кубов и тетраэдров
(рис. 25.1); эту сетку можно сравнить с близко связанным с ней
пространственным заполнением, показанным на рис. 3.47, д
15*
228 25. Медь
(т. 1). Мы еще раз рассмотрим это соединение в разд. 25.4.
Другой замечательный трехмерный каркас обнаружен в
|3-Ag4Te(NO3J и изоструктурпом ему перхлорате. Он построен
из групп TeAgs, также связанных через атомы серебра; анноны
находятся в пустотах каркаса. а-Форма этого соединения
имеет совершенно иное строение, которое мы рассмотрим в
разд. 25.2.
Лите.атура. [1] J. Chan. Soc, 1952, 3686. [2] J. Am. Chem. Soc, 1965, 87, 3534.
[3| J. Am. Chem. Soc, 1965, 87, 2496. [4] J. Inorg. Nuel. Chem., 1964, 26, 1122.
[51 Ada erysi.. 1978, B34, 1457. [61 Ada cryst., 1978, B34, 3723. [71 Acta cryst.,
1974, B30, 2721. |8"| J. Chem. Soc, D 1980, 1682. [9| J. Am. Chem. Soc. 1977, 99,
7055; 1978, 100, 175. [10] Acta cryst., 1979, B35, 1432. [Ill A-ta cryst., 1979, B35,
302. [121 Z. Kristallogr 1970, 132, 87. [13| Z. anorg. allg. Chem., '1959, 299, 328.
[14] Acta cryst., 1969, B25, 2645. [15] Ada cryst., 1965. 19, 180.
25.2. Соединения с высокой ионной проводимостью
Мы отметили в разд. 9.9.1, что a-Agl обладает высокой ионной
проводимостью. К другим относительно простым соединениям
серебра, обладающим тем же свойством, относятся a-Ag2Te и
a-Ag4Te(NO3J. В первом из них половина атомов серебра и
атомы Те образуют структуру типа сфалерита, внутри которой
статистически распределены оставшиеся атомы серебра; во
втором одна четверть атомов Ag и атомы Те образуют струк-
туру типа NaCl, а оставшиеся Ag и попы КОз~ распределены
случайным образом [1J. Ионная проводимость a-Agl обуслов-
лена тем, что ионы Ag+ могут двигаться сквозь довольно рых-
лую объемпоцептрироваппую кубическую упаковку легко де-
формирующихся атомов пода. В гл. 5 мы обсуждали структу-
ры, в которых тетраэдрнческне группы АХ* имеют общие
вершины п (или) ребра; грани не являются общими, так как
это потребовало бы слишком сильного сближения атомов А.
За последние годы были получены многочисленные соединения,
проявляющие в различной степени ионную проводимость; в этих
соединениях Agl сочетается с аминами или другими органи-
ческими молекулами. Они содержат фрагменты связанных по
общим граням тетраэдров 14, которые распространены по все-
му кристаллу, причем вершины тетраэдров заняты только ча-
стично. Проходя через центры граней, атомы серебра могут
двигаться по кристаллу через незанятые тетраэдры. Необходи-
мо, чтобы попов Ag было меньше, чем тетраэдрических пустот,
и чтобы существовали приемлемые пути для прохождения по
кристаллу. Примерами таких необычных соединений, получен-
ных в результате твердофазных реакций между Agl и, напри-
мер, аммониевыми солями, являются Ag2I4A, AgeleA, Ag3iI39A4,
25.3. Соединения Cu(IIl) и Cu(IV) 229
в которых А —это (СНз)зМ(СН2JЫ(СН3)з2+ [2] (иные приме-
ры и литературу см. в работе [3]).
К другим соединениям, проявляющим высокую ионную про-
водимость, относятся C-корунд (разд. 13.5.2), р-эвкриптит,
LiAlSiO4 [4], U5AIO4 [5], Li3N (разд. 18.10.1), Ag13I9(W04h
[6], интеркалаты (разд. 17.1.5) и группа соединении с «ико-
саэдрнческом» структурой. Для последних характерно то, что
их каркас состоит из взаимопроникающих икосаэдров. Атом,
находящийся в центре икосаэдра, образует вместе с атомами.
лежащими в вершинах его 20 треугольных граней, набор тет-
раэдров, одни из которых правильные, другие менее правиль-
ные и заняты только частично. Например, в Cu6PS5Br атомы
фосфора занимают вершины правильных тетраэдров каркаса
Sr,Br, а атомы меди — часть искаженных. Атомы меди мог\т
перемещаться по структуре, пересекая грани тетраэдров. Более
сложный пример — это Cd13P4S22I2 [7]. (Ссылки на аналогич-
ные структуры, например Ag8SiS6, см. в работах [3, 8].)
Литература. [1] Ada cryst., 1975, В31, 2837. [21 Acta cryst., 1976, B32, 1248.
[31 Ada cryst., 1978, B34, 71. [4] J. Solid State Chem., 1980, 34, 199. [5] J. Solid
State Chem., 1979, 29, 393. [6] J. Solid State Chem., 1977, 21, 331 [71 Acta cryst
1976, B32, 2825. [8] Acta cryst., 1978, B34, 64.
25.3. Соединения Cu(III) и Cu(IV)
Известно очень небольшое число неорганических соединений
Си(III). Такие соли, как Cs3CuF6, получаемые фторированием
смеси CsCI и CuCI2 при высоком давлении, содержат высоко-
епшювые ионы Си3+ и являются парамагнитными с ц,эфф, соот-
ветствующим двум иеспаренным электронам. Другие соедине-
ния Си(III) диамагнитны, и металл образует либо 4 компла-
нарных, либо 5 связей, направленных к вершинам квадратной
пирамиды. С оксидами щелочных металлов образуются комп-
лексные оксиды, например КСиО2 и Li6Cu206 [1], причем по-
следний изоструктурен соответствующему соединению золота
(разд. 25.9). Дипсриодато- и дителлурато-комплексы Си(III)
и Ag (III) имеют структуры типа а, состоящие из двух октаэд-
рических групп, связанных посредством атома Си (Си—О
1,9 А), который образует пятую связь с молекулой воды [2а].
Этим ионам первоначально приписывали заряды —7 и —9, но
химический анализ, ИК-спектры и кондуктометрические изме-
рения [26] показывают, что в состав этих ионов входят 2 и
4 протона соответственно, так что в действительности эти со-
единения имеют состав [М(НЮ6J]5- и [М(Н2Те06J]5". Были
получены многочисленные комплексы с органическими лиган-
Дамк. В фиолетовых кристаллах Br2CuS2CN(C4H9J (б) [3],
изоструктурных соответствующему соединению Аи(III), металл
230 25. Медь
25.4. Ag с более высокой степенью окисления 231
образует 4 компланарные связи; расстояния Си—Вг B,31 А),
Си—S B,19 А) короче, чем соответствующие связи с Си(II).
Другой пример образования квадратных компланарных свя-
зей— это ион о-фенилендибиуретмедь, где Си (III) образует
4 связи с N A,82—1,89 А) [4].
О
Вг.
Вг'
:CuC
;c-n:
Простейшим примером соединения Си(IV) является кирпич-
но-красный СэоСиРб, который, по всей видимости, имеет иска-
женную структуру типа K^PtCU [5] и получается, как и
Cs3CuF6, посредством фторирования при высоком давлении
смеси CsCl и СиС12. Такие оксиды, как ВаСиО2,бз, содержат
в основном Си(IV), а также Си с более низкой степенью окис-
ления [6].
Литература. [1] Naturwiss., 1976, 63, 387. [2а] Naturwiss., 1960, 47, 377.
[26] Inorg. Chim. Acta, 1977, 22, 7. [3] Inorg. Chem., 1968, 7, 810. [4] Inorg.
Chem., 1977, 16, 2478. [5] Angew. Chem. (Intern. Ed.), 1973, 12, 582. [6] J. Chem.
Soc, D 1975, 1061.
25.4. Ag с более высокой степенью окисления
Простой ион Ag2+ был получен в концентрированном растворе
азотной кислоты, но все соединения Ag(II), кроме фторида
AgF2, можно синтезировать только в присутствии молекул-ли-
гандов, которые присоединяются к металлу и образуют комп-
лексные ионы. Структура AgF2 [1], которая сильно отличается
от структуры CuF2, описана в разд. 6.9. Нитрат Ag(II) можно
получить в результате анодного окисления раствора AgNCb
в присутствии пиридина и выделить как rAg(pyL(NO3J]; пер-
сульфат образуется при реакции двойного обмена, при этом
выделяется соль [Ag(pyL] S2Os. Был выделен также ряд дру-
гих координационных соединений Ag(II); их магнитные момен-
ты (около 2 jib) соответствуют наличию одного неспаренного
электрона. Единственным доказательством компланарного раз-
мещения четырех связей, образуемых Ag(II) в изолированных
комплексах, служат результаты неполного рентгеноструктур-
ного исследования [2] изоструктурных солей Си(II) и Ag(II)
пиколиновой кислоты (а). Предварительное изучение AgL2-H2O
(Ь = пиридин-2,6-дикарбоксилат) указывает па искажеппо-окта-
эдрическое строение комплекса, в котором два лиганда обра-
зуют с металлом связи Ag—О и Ag—N различной длины
(Ag—О 2,20 и 2,54 A; Ag—N 2,08 и 2,20 А) [3].
О
о=с
:с=о
о
H
UN
2C^
HN
4c
HN
HN
H
Ag
H
XNH2
NH
\h
I
,.CN1I2
К диамагнитным соединениям, содержащим только Ag (III),
по-видимому, относятся желтые соли KAgF4 и CsAgF4 (кото-
рые легко разрушаются под действием влаги), соли
K5[Ag(HIO6J]-10H2O и Na5[Ag(H2TeO6J]-18H2O, структуры
которых, по-видимому, аналогичны структуре соединений
Си(III), а также чрезвычайно устойчивый окрашенный в крас-
ный цвет этиленбисдигуанидиновый (ebs) комплекс б с суль-
фат-, нитрат- и другими ионами во внешней сфере.
В (Agniebs)SO4(SO4H)-Н2О [4] присутствуют четыре более
прочные связи Ag—N A,98 А) и две значительно более сла-
бые связи с атомами кислорода анионов (Ag—О 2,94 А).
Оксид AgO получается при медленном добавлении раство-
ра AgNC>3 к раствору персульфата щелочного металла, он пред-
ставляет собой черный кристаллический порошок, который яв-
ляется полупроводником и диамагнетиком. Степень окисления
серебра в нем соответствует формуле AgIAg1II02, и его струк-
тура— это искаженная форма структуры PtS, другой вариант
которой — структура типа СиО (тенорит). В СиО все атомы
меди окружены четырьмя лежащими в одной плоскости ато-
мами, а в AgO атом Ag(I) координирует два коллинеарно рас-
положенных атома кислорода (Ag1—О 2,18 А), в то время как
два других атома первоначально плоскоквадратной координа-
ционной группы находятся на расстоянии 2,66 А, а атом Ag (III)
окружен четырьмя лежащими в одной плоскости соседними
атомами кислорода, расположенными на расстоянии 2,05 А [5].
В результате электролиза водного раствора AgNO3 с платино-
вым анодом получается соединение с эмпирической формулой
Ag7NOn, образующее черные кубические кристаллы с металли-
ческим блеском. Это соединение является оксонитратом
Ag(Ag6O8)NO3 [6], а соответствующий фторид Ag(Ag6O8)F
имеет очень похожую структуру, которая изображена на
рис. 25.1. Одна седьмая часть атомов серебра (предположи-
232 25. Медь
тельно Ag+) расположены внутри кубов и окружены восемью
соседними атомами кислорода на расстоянии 2,52 А, как
в AgC103. Все остальные атомы серебра эквивалентны н на-
ходятся в центрах тех квадратных граней ромбокубооктаэдров,
которые не являются общими с кубами и, таким образом, об-
разуют плоскоквадратные координационные полиэдры (Ag—О
2,05 А). Ясно, что для того, чтобы решетка Ag6O8 была нейт-
ральной, необходим обмен электронами между атомами сереб-
ра с более высокой степенью окисления, что ведет к появлению
окраски н полупроводимости (ср. с бронзами, разд. 13.8).
В результате анодного окисления (с платиновым электродом)
водных растворов солей серебра, содержащих в своем составе
более крупные анионы (СЮ4~", BF4", PF6~), получается Ag2O3
| 7], структура которого аналогична структуре Аи2О3 (разд. 24.9),
а длины связей Ag—О составляют 1,98 А (одна связь) и 2,04 А
(три связи).
Литература. [1] J. Phys. Chem. Solids, 1971, 32, 543. [2| J. Chem. Soc, 1936,
775. [3] J. Am. Chem. Soc, 1969, 91, 7769. [4] Ada cryst, 1975, B31, 131. |5| J.
Electrochcm Soc, 1961, 108, 819. [6] Acta cryst., 1965, 19, 180. [7] Angew. Chem.
(Intern. Ed.), 1985, 24, 118.
25.5. Структурная химия соединений Cu(I), Ag(I) и Au(I)
Простейшие возможности состоят в образовании ими двух кол-
линеарных (sp) или четырех тетраэдрических (sp21) связей.
Кроме того, Cu(I) и Ag(I) проявляют в некоторых кристаллах
координационное число три. Ниже мы приведем примеры со-
единений с подобным расположением связен после того, как
рассмотрим первые два более простых случая.
25.5.1. Образование атомами Cu(I), Ag(I) и ЛиA) двух кол-
линеарных связей. Образование только двух коллипеарных свя-
зей в соединениях Cu(I)—случай довольно редкий. Такие
связи встречаются только в комплексах с электроотрицатель-
ным атомом кислорода в Си2О (который изоструктурен Ag2O),
CuFeO2 и CuCrO2 (разд. 13.2) и, по-видимому, в КСиО, нзо-
C6HSN-Cu-NC6H3
N
N
C,H,N-Cu-N(\.Hc
структурном KAgO, CsAgO и CsAnO [iaj. двс коллинеарные
связи образуются также с атомами азота в соединении с диазо-
аминобензолом (а) (длина связи 1,92 Л), в котором расстояние
25.5. Структурная химии соединений Cu(l), Ag(I) и Аи(!) 233
между атомами меди B,45 А) меньше, чем в металлической
меди B,56 А), что, по-видимому, указывает на существование
взаимодействия между атомами металла [16]. Образование
связей металл—металл в дополнение к двум, трем или четырем,
связям с неметаллами, по-видимому, является характерной чер-
той структурной химии Cu(I) и Ag(I). Отсутствие у медпA)
тенденции к образованию только двух связей, лежащих на од-
ной прямой, ведет к появлению сильных различий в структур-
ной химии Cu(I), с одной стороны, и Ag(I) и Au(I) —с другой.
Например, если Ag(I) и Au(I) образуют две коллинеарные
связи в AgCN и AuCN, а также в ионах M(CNJ~, то СиС\т
имеет значительно более сложную (пока неизвестную) струк-
туру с тридцатью шестью молекулами CuCN в элементарной
ячейке [2], в соединении KCu(CNJ Cu(I) образует 3 связи
(см. разд. 25.5.3). С замещенными аминами, имеющими цепо-
чечное строение, галогениды медиA) образуют комплексы 1 : 1
и 1 : 2. Первые из них представляют собой тетрамеры, структура
которых, по-видимому, аналогична структуре [CuLAs(C2H5K]4
(разд. 25.5.2), в то время как комплексы 1:2 в бензольном
растворе образуют димеры и, возможно, являются мостиковы-
ми молекулами (RNH2JCu-X-Cu(NH2RJ. Соединения Cu(I)
и Au(I) типа P(N)—М—С, где P(N)—фосфин (амин), а С —
ацетилен, имеют совершенно разные структуры. Золото обра-
зует линейные молекулы, например [3]:
(U3o-C,H7)H2N Аи -С=С(СвН5)
2,03.\
1.94Л
в то время как комплекс медиA) с фосфином (СН3)зР—Си—
—С^С(СбН5) представляет собой тетрамер (разд. 25.5.2); од-
нако его структура существенно иная, чем структура (R3PCuIL.
Имеются многочисленные примеры соединений Ag(I), в ко-
торых присутствуют две коллинеарные (или приблизительно
коллинеарные) связи в изолированных комплексах, цепях и не-
которых трехмерных каркасах. Примерами изолированных
комплексов являются линейный анион в K[Ag(CNJ] и линей-
ный катион в [Ag(NHsJ]2SO4. В структуре AgCN имеются
бесконечные линейные цепи атомов металла, связанных через
группы CN (Ag—Ag 5,26 А); аналогичные цепи присутствуют
в соединении Ag3CN(NO3J [4], в котором ионы NO3- и Лрг
расположены между цепями. Приблизительно коллинеарны
связи A65—170°) атома Ag(I) в KAgCO3 (б) [5], в Na(AgSO3) •
•2Н2О (в) [6], где серебро связано с кислородом и cepoft
(Ag—О 2,19 A; Ag—S 2,47 А), в дицианамиде Ag[N(CNJ] (г.
[7], в AgSCN (разд. 21.7.9), а также в комплексном сульфиде
(прустите) Ag3AsS3 и пираргирите Ag3SbS3. В соединении, об-
разованном AgNO3 и пиразином AgNO3-N2C4H4 [8], серебро
234 25. Медь
25.5. Структурная химия соединений Cu(I), Ag(!) и Аи(I) 235
образует две связи с азотом и, кроме того, четыре слабые свя-
зи с кислородом (две длиной 2,72 А и две — 2,94 А) (д). Мы
уже отмечали, что Ag ведет себя как 2-связанное звено между
атомами серы в трехмерном каркасе Ag3SNO3. В бесцветных
кристаллах Ag2SO2(NHJ [9] атом Ag связан с двумя атомами
I Л /\ о о
Ад о О
/
170°
о
/
Т
о
N
173°
Ч2,/1А
Ч
N
159°
tZJA
азота разных ионов SO2(NHJ2^ и поэтому образует двойную
цепь, а темно-красное соединение Ag4SO2N2 [10] имеет значи-
тельно более сложную структуру. Она представляет собой
сложный каркас, содержащий четыре набора неэквивалентных
атомов серебра, каждый из которых связан почти коллинеар-
ными связями с двумя лигандами (либо 2N, либо О и N); но,
кроме того, имеется много коротких контактов Ag—Ag B,9—
3,0 А), близких к расстоянию в металлическом Ag B,88 А).
Для Au(I) координационное число 2 является преобладаю-
щим. Наиболее устойчивые аминопроизводные AuCl — это
H3N-AuCl и (H3N—Аи—NH3)C1, и если с лигандами типа тио-
ацетамида Cu(I) и Ag(I) образуют соли типа с, то Au(I) об-
C-S I Cu(/\g)|x
NHr
X=-S — Аи
,
разует только довольно неустойчивую соль ж. С триалкилфос-
финами и арсинами галогениды медиA) и серебра (I) образуют
тетрамерные молекулы [R3P(As) -Cu(Ag)X]4, в то время как
золото образует только R3P(As)-AuX. Примерами изолирован-
ных комплексов, в которых Au(I) образует 2 коллинеарные
связи, служат анион в K[Au(CNJ] f 11 ^, изоструктурный
с соответствующим соединением серебра, ион АиС12~ в
Cs2(AuICl2)(AuIiICl4) (разд. 10.1.9), С1—Аи—РС13 [12], раз-
-шчпые молекулы, содержащие фосфииы и арсины, такие,
как С1—Аи—Р(С6Н5K [13] (Аи—С1 2,28 А; Аи—Р 2,24 А),
3
(ф-фенил)
Н3С—Аи—Р(С6Н5K [14] (Аи—С 2,12 А; Аи—Р 2,28 А) и
Вг—Аи—As(C6H5K [15] (Аи—Вг 2,38 А; Аи—As 2,34 А),
а также мостиковые комплексы, такие, как з [16]. В AuCN,
изоструктурном AgCN, цепи линейные, а в AuCl [17] и Aul [18]
зигзагообразные:
2,36 А
Мы уже видели, что существуют доказательства наличия
значительного взаимодействия типа металл—металл в некото-
рых соединениях серебра; позже мы отметим, что и расстояния
Си—Си в некоторых соединениях медиA) ненамного больше
соответствующего расстояния в металле. В молекулах типа з,
как и в цепи AuCl, расстояния Аи—Аи относительно короткие
C,1—3,4 А), однако величина валентного угла при атоме хло-
ра (а следовательно, и расстояние Аи'—Аи) зависит от длины
связи Аи—С1. Тем не менее встречаются примеры осуществле-
¦7 03 03
р р
^ \ о / ®
Аи 3,24 А—Аи
03Р—Аи—S S-y-Au — Рф3
Аи 3,36 А Аи
Р Р
0з Фг
К
СН2— CHZ
Г
Г Т
Аи 3,05А Аи
С1
С1
@- фенил)
Л
Н7С3 \
НтСз^
о
2,28А
.S—Аи—S
>-сХ
\
2-76 Nc_N'
/
XS—Аи— S'
/С3Н7
^С3Н7
236 25. Медь
пия коротких расстояний между парами ;пол:ов золота, не яв-
ляющихся следствием геометрии молекулы и, по-видимому,
характерные для многих соединений АиA). В солях, содержа-
щих нон и [19], катионы ассоциируются в пары, а для соеди-
нения к [20] также не существует напряженности, которая
могла бы объяснить существование короткого расстояния
Ли—Аи. В мостиковоп молекуле л [21] плоскости фрагментов
S2CN(C3H7J расположены под углом 50°, и расстояние между
атомами золота короче, чем в металле B,88 А). В пределе
взаимодействия Аи—Аи ведут к образованию металлических
кластеров. В ионе [Au9(PR3)8]3+ центральный атом золота
окружен восемью атомами Аи, расположенными в вершинах
незавершенного икосаэдра [22]. В AuiiX3L7 [23], где L — фос-
фин и X—I или SCN, присутствует центральный атом металла,
связанный с десятью атомами Аи, находящимися в вершинах
многогранника, близкого к икосаэдру, в котором одна треуголь-
ная грань заменена одним атомом. Три лиганда I и семь ли-
гандов Р связаны с внешними десятью атомами золота.
Литература, [la] Z. anorg. allg. Chcm., 1968, 360, 113. [16] Ada cryst., 1961, 14,
480. [2] Anal. Chem., 1957, 28, 316. [3] Acta cryst., 1967, 23, 156. [4] Acta cryst.,
1965, 19, 815. [5] J. Chem. Soc, 1963, 2807. [6] Acta cryst., 1973, B29, 623. f7] Acta
cryst., 1977, B33, 697. [8] Inorg. Chem., 1966, 5, 1020. [9] Acta cryst., 1977, B33,
3595. [10] Acta cryst., 1980, B36, 1044. [11] Acta cryst., 1959, 12, 709. [121 Rcc.
Trav. Chim., 1962, 81, 307. [13] Acta cryst., 1976, B32, 962. [14] Acta cryst., 1977,
B33, 137. [15] Acta cryst., 1975, B31, 624. [16] Acta cryst., 1980, B36, 1486.
[17] J. Less-comm. Met., 1974, 38, 71. [181 Z. Kristallogr., 1959, 112, 80. [191 Acta
cryst., 1980, B36, 2777. [20] Ada cryst., 1980, B36, 2775. [211 Acta Chem. Scand.,
1972, 26, 3855. [22] Chem. Comm., 1971, 1423. [23] J. Chem. Soc, D 1972, 1481.
25.5.2. Образование атомами Cu(I) и Ag(I) четырех тетраэдри-
чески направленных связей. Структурные исследования еще не
позволили обнаружить ни одного примера Au(I), образующего
четыре тетраэдрические связи, однако подобные связи встреча-
ются г, многочисленных соединениях Cu(I) и Ag(I), простей-
шими из которых являются галогениды СиA) и Ag(I) со струк-
турой цинковой обманки (разд. 9.9.1).
К островным комплексам медиA) с такой конфигурацией от-
носится ион Cu(CNL3~ (среднее расстояние Си—С составляет
2,00 А) [1], тиоацетамидный комплекс [Cu{SC (NH2) (CH3)}4]C1
[2] (изоструктурныи аналогичному соединению серебра) и
группа молекул, представленных на рис. 25.2. В молекуле
СН3СООСи(Р(С6Н5)зJ [2а] бидентатиая ацетатная группа за-
мещает группу NO3 (рис. 25.2, б) *.
В димерном азидокомплексе наблюдается значительное ис-
кажение тетраэдрического валентного угла. В этом димере
* В настоящее время известно и много других соединений СиП) с одно-
ядерными комплексами того же строения. — Прим. ред.
25.5. Структурная химия соединений СиA), Л"A) и АиA) 237
группы \'з почти симметричны (среднее расстояние К X со-
ставляет 1,18 А) по сравнению с нормальной несимметричной
формой (N--N !,15 и 1,21 А) в комплексах переходных метал-
лов, в которых группа N3 связана с металлом только через
один атом азота. ЛУы включили в рассмотрение также и цп.<ло-
пентадиеинльный комплекс (рис. 25.2, б), так как в нем группа
а
Н Н 6
¦>>
@- фенил)
в
Р(
2,14 А I
122'
2,10 А
ФзР . W-N-Ny /р0з
N— N-N ХР03
, 2,9ь А
Рис 25.2. Молекулы некоторых соединений Cu(I). а — J. Am. Chem. Soc,
1967, 89, 3929; б — Inorg. Chem., 1969, 8, 2750; в — Acta cryst., 1970, B26, 515;
г —J. Am. Chem. Soc, 1970, 92, 738; д — J. Am. Chem. Soc, 1963, 85, 1009.
C5H5 отдает 5 электронов и у меди образуется электронная
конфигурация криптона, как и в тетраэдрическнх комплексах.
В СбНб-СиА1СЦ [3] атом меди связан с тремя соседними ато-
мами хлора различных ионов А1С14~ и кольцом С6Н6, искажен-
ным в сторону циклогексатриеновои структуры.
Чрезвычайно интересный островной комплекс — ион, обна-
руженный в [Co(NH3N]4Cu!5Cli7 [За]. Четыре расположенные
общей плоскости тетраэдрические группы СиСЦ имеют
. . 6
почти
а
Л/
\
Ч
"
\
("
("u
\
,cu;
общие атомы Cl с центральным ядром СиС14, образуя поли-
комплексный ион Cu5Cli6n~ (а) того же типа, что и ион
238 25. Медь
Таблица 25.1.
Природа комп-
лекса М—X
МХз-цепь
МХ2-цепь
М2Х3-цепь
Л\3Х5-цепь
MXL'-цепь
MXL''-цепь
М2Х2Ь"-слой
Рис.
25.3
а
б
в
г
д
е
комплексные галогенпды медпA) и
Примеры
K2CuCl3, Cs2AgCl3, Cs2AgI3,
(NH4JCuCl3, (NH4JCuBr3,
K2AgI3, Rb2AgI3, (NH4JAgI3
[,\4(cnJ]fAgBr2J
(pq)(CuCl2J
[(CH3KN(CH2JN(CH3K](AgI2J
CsCu2Cl3, CsAg2I3
(C6H3N2) (Cu2Br3)
(Cu3Cl5) (L2Cu")
CuCl-C6H5CN
CuI-CHNC
CuBr[(C2HsJP—P(C2H5J]
Cu2Cl2-N2(CH3J
серебра (I)
Литература
Z. Kristnllogr.,.
1973, 137, 225
Acta cryst., 1975>
R41 94<:tQ
DO 1, ZOjy
Acta Chem. Scand.,
1969, 23, 3498
J. Chem. Soc, A
1969, 1520
Acta cryst., 1975,.
R41 0441
UO 1 , iJI 1
Acta cryst., 1954, 7,
176
Chem. Comm., 19G5,
9QQ
Inorg. Chem., 1971,
10, 138
Acta cryst., 19/6,
B32, 1586
J. Chem. Soc, I960,
2303
Z. anorg. allg.
Chem., 1970, 372,
150
Acta crvst., I960.
13,28'
PCr4Oi63~ (разд. 9.6.1) или ион SisOi612^ в зуниите (разд. 23.12.2).
Пентаялерпые ионы упаковываются вместе с катионами и до-
полнительными ионами С1~, заполняющими полости в структу-
ре. Особый интерес представляет то обстоятельство, что обра-
зование данного комплекса оказывается предпочтительнее по*
сравнению с простым ионом СиСЦ3", существование которого
совместно с тригонально-бипирамидальными ионами Cu"Cl5:i~
зафиксировано в темно-коричневых и черных соединениях |3б].
промежуточных по составу между конечными членами ряда —
оранжевыми [Co(NH3N]4Cn5IClI7 и [Со(ЫНз)б]СипС15. Кри-
сталлы обоих этих соединений кубические с очень большими
параметрами элементарной ячейки (а = 2,18 А), содержащей
8 молекулярных единиц в соединении медиA) и 32 молекуляр-
ные единицы в соединении меди(II). Мы вкратце уже перечис-
лили некоторые островные многоядерные молекулы, в которых
присутствуют связи металл—металл.
В соединении хлорида медиA) с тиомочевиной
[Cu{SC(NH2J}3]Cl [4] присутствуют бесконечные цепочечные
ионы б, в которых одна из трех молекул мочевины образует
мостик, связывающий два атома меди.
25.5. Структурная химия соединений Cu(I), Ag(I) и ЛиA) 239
В некоторых комплексных галогенидах медиA) и серебра (I)
(см. табл. 25.1) цепочки тетраэдров СпХ4 образуют бесконечные
анионные комплексы. Наиболее простые из них — это цепи ти-
па МХ3 (пироксен) с общими вершинами и цепи МХ2, в кото-
рых тетраэдрические группы сочленяются по противоположным
ребрам (как в ВеСЬ и SIS2). В цепочечном анионе соли
т 6 I в
I !
L-CU--X
X---CU—L
/ /
L Си—X
\ \
х-си-ь
XX
,0^ tx
Си Си
* 1< ^/^CNCHj
XX,
(СгН5J (С2Н5J
/БГ\
Си
Си
Вг Р Р' Вг
(С2Н5J (С2Н5\
Рис. 25.3. Некоторые бесконечные комплексы медиA). а — цепь М2Х3 в CsCu2Cl3
и C6H5N2(Cu2Br3); б—нон (Си3С15)л2"~; в — цепь MXL'; г — линейные моле-
кулы (CuI-CH3NC)n; д — цепочечная структура в CuBr(Et2P-PEt2); e — часть
слоя структуры Си2С12-Кт2(СПзJ.
pq-+(CuCl2J, где pq2+—ион Ы^'-диметилЧД'-бипиридилий,
имеет место некоторое искажение углов тетраэдра СиСЦ. Ка-
тион pq2+ легко акцептирует электроны, и черный цвет веще-
ства, его полупроводимость и парамагнетизм заставляют пред-
положить, что в цепях существует обмен электронами между
С»A) и Си(II). Цепь М2Х3, обнаруженная в CsCu2Cl3 и CsAg2I3,
состоит из двойных рядов тетраэдров, в которых каждая груп-
па МХ4 имеет с другими такими же группами 3 общих ребра
и 2 вершины (рис. 25.3, а). Анионные цепи аналогичного типа
образуются в диазониевой соли (C6H5N2) (Cu2Br3), являющейся
промежуточным продуктом реакции Зандмейера. Наиболее
сложные цепи МзХ5, изображенные на рис. 25.3, б, обнаружены
в соединении (Ctb/Cls) (CunL2), где L — N-бензоилгидразпп.
240
25. Медь
Внутри цепи присутствуют искаженные тетраэдры СиСЦ, кото-
рые имеют общую вершину и либо 2, либо 3 общих ребра.
Каждый атом Cu(I) связан (через С1) с тремя или четырьмя
другими атомами Cu(I) цепи, а остальные атомы хлора (за-
штрихованы) завершают D +2)-координационную группу во-
круг атомов Си (II).
Самые простые цепи, содержащие кроме галогена другие
лигапды, представляют собой «лестничные» композиции состава
\-с/
1/1
7.47А
*<$¦
-Си-
\r
9 г,Б9А <f
\
Cu-C
i\ I
С -Сц
М
N
с;.;- с
I \ I
С-Си
i
Рис. 25.4. а — молекула Cu4I4[As(CH3K]4; б — [(СН3)зРСиС = С(С6Н5I4; в —
слои в структуре CuCN-N2H4; г — слои в структуре CuCN-NH3 (молекулы
NH3 не показаны).
CuXL' (рис. 25.3, в), где I/ — лиганд, образующий связь только
с одним атомом металла. К данному типу структур принадле-
жат соединения CuCl-C6H5CN и CuBr-CeHsCN, в то время как
соединение СиЬСНз1МС состоит из двойных цепей (рис. 25.3, г),
в которых находящиеся внутри атомы Си связаны с четырь-
мя I, как и в Cul, а внешние — с двумя I и двумя молекулами
CH3NC. Лиганд L", способный к связыванию на обоих концах,,
может образовывать цепи типа изображенных на рис. 25.3, д
или слои, как в Cu2Cl2-N2(CH3J (рис. 25.3, е).
Мы уже ранее отмечали, что Cu(I) помимо двух связей с N
в соединении [Cu(H5C6)NNN(C6H5)]2 образует также одну связь
типа металл—металл. Существуют и другие полимерные комп-
лексы, в которых Cu(I) и Ag(I) помимо трех или четырех со-
седних атомов неметалла, расположенных на обычных расстоя-
ниях, имеют в качестве близких соседей также и атомы метал-
ла. Тетрамерная молекула Cu4I4(AsEt3L построена следующим
образом. Центральный тетраэдр из атомов меди окружен тет-
раэдрами из атомов иода и молекул триэтиларсина (рис. 25.4, а).
25.5. Структурная химия соединений Cu(I), Ag(I) и АиA) 241
В этой молекуле кроме трех I и одного As, расположенных на
расстояниях, отвечающих ординарной связи, в окружение меди
входят три соседних атома Си на расстоянии 2,78 А (ср. с меж-
атомным расстоянием в металлической меди: 2,56 А) [5]. Медь
и серебро образуют много молекулярных соединений с фосфи-
нами и арсинами состава M4X4L4, но в случае атомов галогенов
большого размера и фосфор- и мышьяксодержащих лигандов,
имеющих большой объем, предпочтительнее не кубановая струк-
а
тура а, а структура б в форме кресла, например СщС^^
имеет структуру а, но Си4Вг4(Р(СбН5)зL, Си414(Р(СбН5)зL и
Ag4l4(P(C6H5hL имеют структуру б [5а]. Тетрамерные моле-
кулы (СН3)зР-Си-С=С(СбН5) относятся к соединениям совер-
шенно другого типа. В них осуществляется довольно сложная
система связей, включающая связи Си—С A,96—2,22 А) и свя-
зи Си—Си, имеющие две разные длины [6] (см. рис. 25.4,6).
Некоторые соединения медиA) образуют слоистые структу-
ры, в основе которых лежит простейшая плоская четырехсвя-
занная сетка. В гофрированных слоях, образуемых в CuCN-
•N2H4 [7] (рис. 25.4, в), связи имеют следующую длину: Си—С
1,93 А, Си—N 1,95 А и Си—2N (принадлежащие N2H4) 2,17 А;
валентные углы при атоме медиA) 99° (три), 113° (два) и 130е
(один). Нитрилы алифатических двухосновных кислот могут
служить мостиковыми лигандами —NC—(СН2)Л—CN—, обра-
зуя соединения типа (CuR2)X, где R — это нитрил, а X — это,
например, NO3~ или СЮ4~. Три соединения — Си(сукцинонит-
рилJС1О4 [8], Си(глютаронитрилJЫО3 [9] и Ag(aflnnoHHT-
рилJС1О4 [10]—образуют слоистые структуры, основанные на
плоских сетках с 4-угольными петлями. Структура Си(адипо-
нитрилJМО3 [П], состоящая из шести взаимопроникающих
идентичных трехмерных сеток кристобалитового типа, была
описана в гл. 3 (т. 1).
Аммин CuCN-NH3 построен из очень своеобразных слоев
CuCN (рис. 25.4, г), в которых к каждому атому меди присо-
единена группа NH3, причем связь Си—NH3 почти перпендику-
16-1284
242 25. Медь
лярна плоскости слоя [12]. Различия между атомами С и N
лежат за пределами достоверности, однако приведенная струк-
тура представляется наиболее правдоподобной. В плоских еди-
ницах С2Си2 (которые наклонены к плоскости рисунка) рас-
стояние Си—Си B,42 А) короче, чем в металле; медь образует
координационный полиэдр в форме искаженного тетраэдра с
длинами связи Си—N 1,98 А, Си—NH3 2,07 А, Си—С 2,09 А и
2,13 А. Связи Си—С аномально длинные, и природа их не ясна.
Ряд других примеров тетраэдрической координации Cu(I)
рассмотрен в разделе, посвященном соединениям, сочетающим
и Cu(I), и Си(II).
В данном разделе естественно рассмотреть также некоторые
примеры островных тетраэдрических комплексов серебра(I).
В анионном комплексе (NH4)9Cl2[Ag(S2O3L] [13] сереб-
роA) образует связи с атомами серы (Ag—S 2,58 А) четырех
лигандов S2O32~. В двух аналогичных по строению молекулах
{ф-фенил)
атомы серебра связаны двумя мостиковыми атомами галогена,
а также посредством семичленных цепочек, образованных мо-
лекулами органического лиганда (с донорной функцией) у ато-
мов фосфора [14, 15]. (Для простоты все атомы водорода
групп СН2 на схеме не показаны.)
Литература. [1] Acta cryst., 1968, В24, 269. [2] J. Chem. Soc., 1962, 1748. [2a] J.
Am. Chem. Soc, 1963, 85, 4046. [3a] Acta cryst, 1973, B29, 2559. [36] Acta cryst.,
1975, B31, 978. [4] Acta cryst, 1964, 17, 928, [5] Inorg. Chem., 1974, 13, 1899.
["Sal Inorg. Chem., 1977, 16, 3267. [6] Acta cryst., 1966, 21, 957. [7] Acta cryst,
1966, 20, 279. [81 Acta cryst, 1969, B25, 1518. [9] Bull. Chem. Soc. (Japan),
1959, 32, 1216. [10] Inorg. Chem., 1969, 8, 2768. [11] Bull. Chem. Soc. (Japan),
1959, 32, 1221. [12] Acta cryst., 1965, 19, 192. [131 Acta cryst., 1972, B28, 2079.
[14] Acta cryst, 1976, B32, 2521. [15] Acta cryst., 1975, B31, 1194.
25.5.3. Образование атомами Cu(I), Ag(I) и АиA) трех связей.
Выше мы привели ряд примеров соединений, в которых медьA)
¦образует четыре тетраэдрические связи с CN или с атомами серы
лигандов типа тиоацетамида или тиомочевины. В ряде других
соединений Cu(I) образует 3 компланарные связи с C(N) или S.
Как уже было отмечено, структура KCu(CNJ [1] очень сильно
отличается от изоструктурных друг другу соединений KAg(CNJ
25.5. Структурная химия соединений. Cu(I), Ag(I) и АиA) 243-
и KAu(CNJ, которые содержат линейные ионы (NC—М—CN)~.
В KCu(CNJ комплексные ионы образуют спиральные цепи
(рис. 25.5, а), связанные посредством лежащих между ними
ионов К+. В этих цепях связи атомы меди определенно не ком-
планарны, в то время как в аналогичных цепях в соединении
NaCu(CNJ-2H2O [2a], имеющем почти аналогичную структу-
ру, связи атома меди лежат в одной плоскости. В Na2Cu(CNK-
¦ЗН2О [26] присутствуют отдельные плоские ионы [Cu(CNK]2^
ось цепи
Си.-Ы 2,05А
б
\
N
с
N
Си.
С N
С N
Си
N н _
С Z
Си
N С
/С N С
Си
N
С
С N
Си
Н2О
Си
N С
\
Рис. 25.5. а — спиральный цепочечный ион в KCu(CNJ; б — слоистая струк-
тура аниона в КСиг(СЫ)з-Н2О.
(Си—С 1,94 А). Помимо безводных солей KCu(CNJ и
KsCu(CNL (содержащей тетраэдрические ионы [Cu(CNLp~,
разд. 23.11) известна также гидратированная соль KCu2(CNK-
•НоО [2в]. В этом кристалле каждый атом медиA) образует три
почти компланарные связи, как и в KCu(CNJ (углы между
связями составляют 112° (два) и 134° (один)), в гофрирован-
ных слоях наиболее простого из всех возможных типов
(рис. 25.5,6). Длины связей Си—С и Си—N очень близки к
длинам связей в KCu(CNJ, а самое короткое расстояние Си—Си
составляет 2,95 А (в KCu(CNJ 2,84 А). Молекулы Н2О не свя-
заны с атомами металла, а занимают в слоях пустоты, слои
удерживаются друг относительно друга ионами К+. Мы уже
отметили в предыдущем разделе, что в соединениях CuCN-N2H4
и CuCN-NH3 медьA) ведет себя совершенно иначе.
Хлорид медиA) образует кристаллические комплексы со
многими ненасыщенными углеводородами; один из них мы уже
рассматривали. В некоторых из них Cu(I) образует две связи
с хлором, а третью — с кратной связью углеводорода, причем
все три связи медиA) компланарны. В комплексе с 1,5-цикло-
октатетраеном СиС1-С8Н8 [За] атомы меди и хлора образуют
16*
244
Ме()ъ
бесконечную цепь (а), в комплексах с норборнадненом (CjHs)
[36] и 2-бутином (С4Нб) [Зв] присутствуют кольца C114CI4 (б).
Пунктирными линиями обозначены связи меди с кратными свя-
зями углеводородных молекул.
б ' в
а
CI
CI—Си
"Си CI
С.
С
Си — CI
Си'
Образование трех компланарных связей было установлено
при рептгеноструктурном исследовании молекулярных кристал-
лов ((С6Н5)зРJСиВг (см. ниже в этом разделе), соединений
с островными катионами, содержащими тиомочевину (tu) или
замещенные молекулы тиомочевины, например [Cu(tuK]H-o-
фталат [4], и кристаллов [Cu(tuJ]Cl [5], содержащих цепо-
чечный анион (в).
В полимерных комплексах с некоторыми серосодержащими
лигандами атомы Cu(I) и Ag(I) образуют связи с тремя ато-
мами серы и также 3 или 4 связи типа металл—металл. Ядро
а 6
Си-Си Z,83A
с3н.
Рис. 25.6. Фрагменты некоторых полимерных комплексов медиA) и серебра(I)
(см. текст). В комплексе б длинные связи Ag—Ag лежат вдоль ребер неза-
штрихованной и противоположной ей граней октаэдра Ag6.
молекулы Си4[(изо-СзН7ОJР52]4 [6] представляет собой тет-
раэдрическую группу Си4 с четырьмя более короткими B,74 А)
и двумя более длинными B,94 А) ребрами, к которой присоеди-
нены четыре молекулы лигандов, как показано на рис. 25.6, а
(для одного из лигандов). Ближайшими соседями каждого ато-
ма меди являются три атома серы и два атома меди. Тетраэд-
рическое ядро из атомов металла имеется также в
[(C2H5JNCS2Cu]4 [7a]. Тип полимера, по-видимому, определя-
ется геометрией лиганда; оба соединения [ (C3H7JNCOSCu]6
25.5. Стрцктцрния химия co/'ihincnuu Cu(l), Ag(I) и ЛиA) 245
[761 и [(C3II7JNCS2Ag]6 [7в] представляют собой гексамеры.
В октаэдре Си6 первого соединения расстояния Си—Си лежат
а пределах от 2,70 до 3,06 А (среднее 2,88 А). В гексамерной
молекуле дппропилдитиокарбамата серебра [ (C3H7JNCS2Ag]6
содержится искаженное октаэдрнчсское ядро Ag6 с шестью ко-
роткими ребрами B,9—3,2 А) и шестью длинными C,45—4,0 А),
причем последние принадлежат двум противоположным граням.
Лиганды ведут себя почти так же, как и в тетрамере а
(рис. 25.6): один атом S связан с одним атомом Ag, а другой
атом S — с двумя атомами Ag. В результате каждый атом се-
ребра связан с тремя атомами серы (Ag—S 2,43—2,58 А) и
имеет два соседних близкорасположенных атома серебра
(Ag—Ag 2,9, 3,0 А) и два более удаленных атома Ag C,45,
4,0 А) (см. рис. 25.6,6). В солях (Cu8L6) (As(C6H5LL, где L —
лиганд, имеющий формулу г, анион представляет собой кубиче-
ский кластер [8] из восьми атомов меди, расположенных в
г
С-с:
,CN
-CN
2-
вершпнах куба (с ребрами 2,83 А), окруженных двенадцатью
атомами серы шести лигандов, расположенных в серединах
ребер большого куба, окружающего группу Си8 (рис. 25.6, в).
Каждый атом меди образует шесть связей с ближайшими со-
седними тремя атомами серы и тремя атомами меди, причем
длины связей чрезвычайно близки к тем, которые существуют
в описанном выше тетрамере (Си—S 2,25 А).
Уникальная структура трицианометанида серебра Ag[C(CNK]
[9а] изображена на рис. 3.23,6 (т. 1, гл. 3). Она состоит из
двух взаимопроникающих гексагональных слоев, причем атомы
Ag лежат на расстоянии приблизительно 0,5 А над плоскостью,
проходящей через три присоединенных к нему атома азота.
Если бы слои имели плоское строение, то реализовалась бы
слишком открытая структура, чего не происходит, например,
в KCu2(CNK-H2O, в котором большие пустоты в слоях запол-
няются ионами К+ и молекулами Н2О. Разновидности той
же структуры представлены в Ag[C(CNJNO] [96] и
Ag[C(CNJNO2] [9в], но обе последние структуры более
сложные, чем структура трицианометанида. В каркасе первой
из них атом серебра связан с двумя атомами азота и одним
атомом кислорода лигандов, а также образует связь с атомом
азота группы NO, что приводит к появлению искаженно-тетра-
эдрической координации атома металла. Во втором соединении
группа NO2 мостиковая; она связана с Ag не только через атом
246 25. Медь
азота, но также через оба атома кислорода (с одним и тем же.
атомом серебра).
Атом медиA) образует три связи также в некоторых суль-
фидах (о характере этих связей см. последний раздел данной
главы), атом серебраA)—в некоторых серосодержащих соеди-
нениях; здесь также не всегда удается дать простую интерпре-
тацию картины связей. В Ag3AsS3 имеется как плоское, так
и пирамидальное расположение трех связей серебра [10],
а в соединении Ag(THOMO4eBHHaJCl [11] серебро имеет три
приблизительно компланарных соседних атома серы, а также
один атом С1, удаленный на довольно большое расстояние
B,95 А).
Хотя в ряде соединений структурная химия серебра(I) про-
ще, чем медиA), для многих комплексов с органическими ли-
гандами справедливо и обратное заключение. Например, строе-
ние C6H5-AgAlCl4 [12] значительно сложнее строения соответ-
ствующего соединения медиA) (разд. 22.43); Ag образует
четыре связи с атомами хлора B,59, 2,77, 2,80 и 3,03 А), а "пя-
тую—с одной из связей молекулы бензола. В (СбН5С =
= C)Ag[P(CH3b] [13] присутствуют два типа атомов серебра
с различным окружением. Атомы серебра одного типа образу-
ют две коллинеарные связи с концевыми атомами углерода в
С=ееС-С6Н5, а атомы Ag другого типа — две связи с молекула-
ми Р(СН3)з (Р—Ag—P 118°) и две с тройными связями моле-
кулы углеводорода.
Некоторые кислородсодержащие соли серебра, в частности
перхлорат, примечательны своей способностью к образованию
кристаллических комплексов с органическими молекулами.
О соединениях AgC104-C6H6 и AgNO3-C8H8 см. разд. 22.4.3. В со-
единении с диоксаном AgC104-3C4H802 [14] атомы серебра
расположены по простому кубическому мотиву, ионы С1О4~
находятся в центрах кубов, а молекулы диоксана располага-
ются вдоль их ребер. В результате ионы металла получают
октаэдрическое окружение из шести атомов кислорода (на рас-
стоянии 2,46 А); по всей видимости, связь металл—лиганд пред-
ставляет собой некоторую разновидность ион-дипольного взаи-
модействия. И перхлорат-ионы, и молекулы диоксана враща-
ются, причем, по-видимому, вполне свободно.
У золота (I) три компланарные связи обычной длины обра-
зуются в таких ионах, как [ ((С6Н5KР)зАи]+ [15], и в молеку-
ле ((С6Н5KРJАиС1 [16] с валентными углами, близкими к 120°;
аналогичную структуру имеет и молекула ((С6Н5)зРJСиВг
[17], причем угол Р—Си—Р равен 126°. Валентный угол между
связями, образуемыми бидентатным лигандом, значительно
меньше других, а образуемые им связи несимметричны: одна
связь прочнее, чем другая. Крайний случай представляет собой
25.6. Соли, содержащие СиA) и Си(П-> 247
диэтилдитиокарбонатный комплекс д [18], где две сильные
связи с Аи почти коллинеарны; встречаются также промежу-
точные случаи, например (С6Н5)зРАиB : 2'-бипиридил) (е) [19]
°
3.0ZA
~иг
SnC!
и [(СНзJР(СбН5)]2АиEпС1з) (ж) [20]. Строение комплексов
золота (I) с тремя связями обсуждается в статье [19].
Литература. [1] J. Phys. Chem., 1957, 61, 1388. [2а] Inorg. Chem., 1977, 16, 250.
[26} Inorg. Chem., 1978, 17, 1945. [2в] Acta cryst, 1962, 15, 397. [3al Inorg.
Chem., 1964, 3, 1529. [36] Inorg. Chem., 1964, 3, 1535. [Зв] Acta cryst., 1957, 10,
801. [4] Acta cryst., 1977, B33, 3772. [51 Acta cryst., 1970, B26, 1474. [61 Inorg.
Chem., 1972, 11, 612. [7a] Ark. Kern., 1963, 20, 481. [76] Acta Chem. Scand., 1970,
24, 1355. [7b] Acta Chem. Scand., 1969, 23, 825. [S] J. Am. Chem. Soc, 1968, 90,
7357. [9a] Inorg. Chem., 1966, 5, 1193. [96] Acta cryst, 1974, B30, 1117. [9в] Acta
cryst., 1974, B30, 147. [10] Acta cryst., 1968, B24, 77. [Ill Inorg. Chem., 1968, 7,
1351. [12] J. Am. Chem. Soc, 1966, 88, 3243. [13] Acta cryst., 1966, 20, 502.
[141 Acta cryst., 1956, 9, 741. [15] Acta cryst., 1980, B36, 3105. [16] Inorg. Chem.,
1974, 13, 805. [17] Inorg. Chem., 1973, 12, 213. [18] J. Chem. Mol. Struct., 1972,
2, 7. [19] Acta cryst., 1976, B32, 2712. [20] Acta cryst., 1978, B34, 278.
25.6. Соли, содержащие Cu(I) и Cu(II)
Позже в этой главе мы коснемся трудностей определения сте-
пени окисления атомов меди в сульфидах; в гл. 17 мы разобра-
ли структуру KC114S3. Кроме этих полуметаллических соедине-
ний известны обычные окрашенные соли, содержащие и Cu(I),
и Си(II) с совершенно разной стереохимией. В красной соли
Cu2'SO3-CuuSO3-2H2O [1] осуществляется тетраэдрическое
окружение медиA) (хотя длина связи Си—S 2,14 А очень близ-
ка к значению для Си—О 2,11—2,14 А), а медь(II) образует
нормальный D+ 2)-октаэдрическии координационный многогран-
ник. В бледно-фиолетовой соли Na4[Cun(NH3L] [CuI(S2O3J]2
[2] катионы Cu(NH3L2+ обладают плоским строением (Си(II)
не имеют каких-либо других близких соседей), а анион состоит
из цепей а, в которых вокруг Cu(I) расположены четыре со-
седних атома серы в вершинах тетраэдра на расстоянии 2,36 А.
В отличие от бледно-желтых а- и |3-форм CuNCS и голубого
Cu(NCSJ(NH3J соединение Cu2(NCSK(NH3K окрашено в зе-
леновато-черный цвет [3]. Тетраэдрический координационный
многогранник Cu(I) образован двумя атомами азота и двумя
248 25. Медь
атомами серы групп NCS, а координационный полиэдр меди(II)
представляет собой тетрагональную бипирамиду (б). Можно по-
лагать, что атомы Cu(I) и Cu(II) взаимодействуют через атом
а
SO,
6
s
J
2,95 A
NTS
N
С
I
SO3
H,N-^
2,00,
: 3,29 A
CuU''2,95.
серы (в). О голубом соединении (Cu'Cl3) [Си11 (OAs(C6H5KL]
см. разд. 25.7.1.
Представляет интерес структура гидратированного комп-
лексного цианида Cu3en2(CNL-H2O [4]. В ней атомы Cu(I)
связаны через группы CN и образуют алмазоподобный каркас,
а комплексы [Сипеп2Н2О]2+, имеющие квадратно-пирамидаль-
ное строение, занимают пустоты этого каркаса. Соответственно
его структурная формула имеет следующий вид:
[Cu2> (CNL] ^[Си^епгНгО] 2+.
Литература. [1] Acta Chem. Scand., 1965, 19, 2189. [21 Acta cryst., 1966, 21,
605. [3] Inorg. Chem., 1969, 8, 304. [4] Acta cryst., 1972, B28, 858.
25.7. Структурная химия соединений меди(П)
Стереохимия Си (II) представляет особый интерес, так как для
данной степени окисления меди характерно такое многообразие
структур, которое не встречается ни у какого другого элемента.
Перед тем как начать этот обзор, интересно отметить, что не-
которые простые соединения меди(II) либо очень трудно вы-
делить, либо они вообще неизвестны. Хотя можно, используя
некоторые специальные методы, получить кристаллический
Си(ОНJ (например, при действии водного раствора NaOH на
Cu4(OHNSO4 или же путем растворения гидроксида в концент-
рированном NH4OH при последующем медленном удалении
аммиака в вакууме над H2SO4), известно, что свежеприготов-
ленное соединение быстро разлагается. (Структуру Си (ОН) 2
см. в разд. 14.1.1.) Два гидроксокарбоната — лазурит
Си3(ОНJ(СОзJ и малахит Си2(ОНJСО3 — это известные ми-
нералы, но обычный карбонат СиСОз неустойчив при нормаль-
ных условиях (комнатная температура и атмосферное давле-
ние). Тем не менее его получают из СиО или из гидроксокар-
бонатов при взаимодействии с СО2 под давлением 20 кбар и
25.7. Структурная химия соединений меди(И) 249
при температуре 500°С; его структура описана в разд. 25.7.3.
Некоторые оксосоли, например нитраты и перхлораты, кристал-
лизуются из водных растворов, образуя кристаллогидраты, но
выделить из них безводную соль не удается. Однако как раз
Cu(NO3J и Си(СЮ4)г можно приготовить другими способами
(разд. 18.8.7). Оба эти соединения существуют в газовой фазе
без разложения и растворяются в некоторых полярных органи-
ческих растворителях. Структуры гидроксосолей частично опи-
квадратно-
плоскостная
конфигурации
. { )
„ октаэдр
сплющенный
три;.онамьния
iani-.DOA7u.da
тетраэар
Рис. 25.7. Стереохимия комплексов меди(П).
саны в других главах (Cu(OH)Cl и Си2(ОНKС1 — в гл. 10,
Си (ОН) Юз и Си2(ОН)зЖ)з —в гл. 14; см. также разд. 4.3
о связи структур Си2(ОНKС1 и NaCl). Соединения Cul2,
Cu(CNJ и Cu(SCNJ очень неустойчивы, a CuS — совсем не
простое соединение меди(II) (см. ниже). В связи с тем что ряд
соединений Си (II), содержащих менее электроотрицательные
лиганды, неустойчив или отсутствует вовсе, большая часть на-
шего обзора будет касаться структур соединений, в которых
металл связан с фтором, хлором, азотом или кислородом, при-
чем эти связи имеют существенно ионный характер.
Вся стереохимия соединений меди(II) показана на диаграм-
ме рис. 25.7. Четыре или пять связей имеют длины, соответст-
вующие нормальной ординарной связи. Четыре связи либо ком-
планарные, либо направлены к вершинам сплющенного тетра-
эдра; правильной тетраэдрической координации не наблюдается.
Пять связей, близкие по длине к обычной связи, направлены
к вершинам тригопалыюй бипирамиды; подобное расположение
связей встречается довольно редко. Наиболее часто встречаю-
щийся координационный полиэдр меди(II) состоит из четырех
соседей, лежащих в одной плоскости с атомом Си (II), и одного
или двух более удаленных лигандов. дополняющих полиэдр до
искаженной тетрагональной пирамиды или искаженного окта-
эдра. Во многих кристаллах, в которых координационная груп-
250 25. Медь
па меди(II) состоит из шести атомов фтора (хлора, брома) или
шести атомов кислорода, октаэдрическая группа искажена в
соответствии с эффектом Яна — Теллера, причем почти всегда
наблюдается D + 2)-координация: аксиальные связи примерна
на 12% длиннее экваториальных.
С геометрической точки зрения координационный многогран-
ник в виде плоского квадрата можно рассматривать как предел
октаэдра, вытянутого вдоль оси симметрии 4-го порядка; с дру-
гой стороны, его можно представить как предельный случай
тетраэдра, сжатого вдоль оси симметрии 2-го порядка (перпен-
дикулярной ребру). В первом случае из шести одинаковых
связей образуются две длинные и четыре короткие, а во втором
случае шесть одинаковых валентных углов с правильным тетра-
эдрическим расположением A09,5°) переходят в два больших
(в пределе 180°) и четыре меньших (в пределе 90°) угла:
шесть углов по 109,5°-> ( 2 одинаковых угла —*¦ 180°
правильный тетраэдр
( 2 одинаковых угла
(> 109,5°)
4 одинаковых угла
1 (> 109,5=)
сплющенный тетраэдр
90D
плоский квадрат
В табл. 25.2 приведены примеры этой промежуточной кон-
фигурации; более детально они описаны ниже; о соединении
CuCr2O4 см. в разд. 13.5.1.
По ряду причин в этой главе мы не будем придерживаться
строго систематической последовательности в соответствии с
разными способами размещения связей согласно рис. 25.7. Чис-
ло примеров образования только четырех связей, компланарных
или тетраэдрических, невелико; эти примеры будут приведены
далее в разных местах книги. Кроме того, не всегда можно
четко различить 4-, D+1)- и D + 2)-координации. Поэтому
Таблица 25.2. Конфигурации, промежуточные между квадратно-
плоскостной и правильной тетраэдричсской в соединениях меди (II)
Соединения
С квадратно-плоскостной координа-
цией
Хелаты
Си(имидазолJ
(СиСЦJ-
CuCr2O4
Правильный тетраэдр
Углы между связ^
четыре
90 =
93=
96 =
97 =
100°
103 =
Шесть углов по
ми
два
180 °
154°
14 Г'
140 =
130=
123 =
109,5°
25.7. Структурная химия соединений меди(П) 251
представляется более целесообразным рассматривать по от-
дельности различные виды размещения связей, объединяя в то
же время химически близкие группы соединения.
25.7.1. Образование связей 4, D + 1) и D + 2). По-видимому,
все имеющиеся в распоряжении данные указывают на то, что
после образования четырех сильных компланарных связей во
всех случаях, когда это возможно, атом меди(II) образует две
дополнительные более слабые езязи, перпендикулярные плоско-
сти четырех компланарных связей. В некоторых случаях (на-
пример, при образовании хелатных комплексов) по причинам
сгереохимического характера координационное число уменьша-
ется до 4 или D+1), и поэтому эти соединения мы рассмотрим
отдельно. Естественно, что кроме четырех находящихся в одной
плоскости лигандов всегда существуют дополнительные соседи
(над и под плоскостью квадрата), и, чтобы решить вопрос о
том, связаны они с медью(II) или нет, нужно определить рас-
стояния между ними и атомом металла. Альтернативой прояв-
ления D+1)- или D+ 2)-координации может служить пере-
группировка четырех близких соседей, в результате которой
образуется сплющенный тетраэдрический полиэдр.
То обстоятельство, что Ni(II), Pd(II) и Pt(II) образуют
четыре прочные компланарные связи, наводит на мысль о со-
поставлении соединений этих металлов с соединениями Си(II).
Тем не менее только фталоцианиновый и аналогичные ему комп-
лексы изоструктурны соединениям этих металлов VIII группы;
наибольшее сходство наблюдается между СиО и PdO, а также
между СиСЬ и линейными молекулами PdCl2 и PtCl2- Ниже мы
кратко остановимся на структурах этих соединений.
В действительности единственно известные простые соли,
которые изоструктурны солям меди(II) с электронной конфи-
гурацией dg, — это некоторые соли Сг(П) с конфигурацией dA,
как и следовало ожидать на основе теории поля лигандов. Тем
не менее эту аналогию нельзя распространить на все соедине-
ния меди и хрома в данной степени окисления. Например, струк-
туры СгВг2 и Crl2 сходны со структурами СиСЬ и CuBr2,
а СгС12 имеет искаженную структуру рутила (но искаженную
иным способом, чем у CrF2 и изоструктурного ему CuF2) в про-
тивоположность структуре СиС12, построенной по типу Cdl2.
В отличие от сложной структуры CuS сульфид CrS имеет строе-
ние, появление которого можно было бы ожидать у CuS
(и СиО); с атомом Сг связано четыре равноудаленных компла-
нарных соседних атома и еще два, дополняющих координацию
до искаженного октаэдра; хром здесь имеет координацию D + 2),
характерную для многих соединений меди(II). (Оксид СгО не-
известен.) Примерами изоструктурных пар соединении Си(II)
252 25. МеОь
и Сг(II) являются дифторпды и дибромиды, KCuF3 и KCrF3>
а также построенные в виде димеров ацетаты [М(СН3СООJ-
•Н2О]2 (разд. 25.7.3).
Кристаллический оксид меди СиО (минерал тенорит) [1]
является примером соединения меди(II), где металл образует
четыре компланарные связи. Образуемый центральным ионом
координационный полиэдр представляет собой искаженный ва-
риант структуры PdO (PtS), причем валентные углы О—Си—О
составляют 84,5° (два) и 95,5° (два). Атом меди координирует
четыре атома кислорода О' на расстоянии 1,96 А; более уда-
ленные атомы О" отстоят на 2,78 А. Отношение этих двух рас-
стояний значительно больше, чем для обычной искаженно-ок-
таэдрпческой координации меди(II), а линия О"—Си—О" от-
клонена на 17° от нормали к плоскости Си(О'L. Наиболее
короткое расстояние Си—Си составляет 2,90 А. По-видимому,
альтернативные структуры, такие, как искаженная структура
типа NaCl с D+ 2)-координацией атомов Си (II) и такой же
координацией кислорода, были бы менее устойчивы, чем на-
блюдаемая структура с плоским координационным полиэдром
у меди(II) и тетраэдрической координацией кислорода, но со-
ответствующие расчеты энергии решетки пока еще не были вы-
полнены.
Для минерала парамелаконпта, имеющего довольно стран-
ную формулу Ciii6Oi4 [2a], была предложена следующая струк-
тура. Она связана со структурой тенорита, но в ней содержатся
вакантные места кислорода, возникающие из-за перестройки
моноклинной структуры тенорита в более симметричную (тет-
рагональную). В этой предполагаемой структуре атомы Cu(I)
и Си (II) не различаются и имеют плоскоквадратную координа-
цию. Такую же координацию медь(II), по-видимому, имеет и
в СаСи2От, и в Sr2Cu03, структуры которых подробно не изу-
чены [26]. Кристаллическое производное имидазола Си(СзК2Н3J
НС=
-си
[3] содержит трехмерную сетку из атомов меди, связанных
моетиковыми имидазольными лигапдами а, в которых каждый
атом азота образует связь с атомом металла. Атомы меди двух
типов: одни имеют по 4 компланарных соседа (атомы N; ва-
лентные углы близки к 90°), причем других близкорасположен-
ных соседей у них нет; вокруг атомов меди второго типа четыре
атома N образуют сплющенный тетраэдр, (табл. 25.2). Очевид-
но, что вследствие особенностей упаковки колец имидазола к
25.7. Структурная химия соединений меди(П) 253
атомам Си(II) невозможно приблизить дополнительные атомы
азота.
В отличие от PdF2, имеющего нормальную структуру рути-
ла, структура CuF2 представляет собой искаженный вариант
той же структуры, с координацией Си2+ D + 2), причем четыре
более прочные связи объединяют Си и F в слои (т. I, рис. 6.7, а).
Длины связей Pd"—С1 и Си"—С1 одинаковы B,30 А); к одно-
му и тому же типу относятся и плоские цепи в СиС12, и в одной
из форм PdCl2:
Однако упаковка цепей в этих двух галогенидах совершенно
различная (рис. 25.8). В PdCl2 вторыми близкими соседями Pd
являются еще четыре атома хлора, расположенные па расстоя-
О Си штя
Pd
Cl
Отг о
а 6
Рис. 25.8. Кристаллические структуры СиС12 (а) и PdCL, (б). Вид вдоль на-
правления цепей. Видно, что цепи в двух кристаллах упакованы различным
образом. Лтомы при !/ = 0 и (/='/г изображены сплошными \\ штриховыми
кружками соответственно. Па рис. а штриховая линия ограничивает моноклин-
ную ячейку, а пунктирная выделяет псевдоромбическую ячейку.
ниях 3 85 А в вершинах прямоугольника, плоскость которого
перпендикулярна плоскости цепи; в СпС12 цепи упакованы па-
раллельно друг другу и образуют слои, подобные" слоям в Cdl2,
в которых Си(II) имеет два дополнительных соседних атома
хлора на расстояниях 2,95 А, дополняющих координационную-
группу до очень искаженного октаэдра (рис. 25.9).
254 25. Медь
25.7. Структурная химия соединений меди(П) 255
Островные комплексы, содержащие только монодентатные
лмганды, могут быть и катионами, и нейтральными молекулами,
и анионами, например:
,l!2+ l.
2-
2-
и соединениями другого типа (см. ниже, разд. 25.7.6). По-ви-
димому, цис- и r/шнс-изомеры в точности плоских комплексов
CuL2X2 еще не были описаны. Комплекс дихлородилутидина
Рис. 25.9. Окружение Pd в PdCl2 (а) и Си в СиС12 (б). Малыми кружками
изображены атомы металла.
существует в двух формах: зеленая плоская транс-форма и
желтый цис-азомер с несколько искаженной конфигурацией [4].
Состояние Си(II) в комплексах этих (вышеуказанных) типов
в растворах точно не установлено. Там, где это стерически воз-
можно, весьма вероятно дополнение координации до октаэдра
при растворении, ведь в твердом веществе образование только
четырех связей — случай довольно редкий, связанный с особен-
ностями геометрии комплекса. Так, например, в [Си (пиридин-
оксидL] (BF4J [5] и в перхлорате [6] атом меди связан с че-
(CH3J 3,00 A (CH3J
\2,O3
н,
(CH3)
3J
6
(CH3J
Вг,
тырьмя компланарными атомами кислорода на расстоянии
примерно 1,95 А; более удаленные соседи находятся уже на
расстоянии не меньше чем 3,35 А. Аналогичным образом в
(СиС13) [Си(ОАз(СбН5)зL] [6а] образование более чем четы-
рех связей невозможно из-за большого объема лигандов; голу-
бой цвет этого соединения указывает также на отсутствие взаи-
модействия между Cu(I) и Си(II). В двуядерном катионе со-
единения б [7] атом меди также образует только четыре ком-
планарные связи, а атомы следующей координационной сферы
расположены на расстоянии 4,78 А. С другой стороны, в моле-
куле в [7а] Си(II) образует пять связей, причем координаци-
онный многогранник имеет промежуточное строение между
в
Br
;u^—Br
С1
а
N" .S(CH3J
о „
Cl
квадратно-пирамидальным и тригонально-бипирамидальным.
В соединении г [76] атом меди образует также пять связей,
не здесь они направлены к вершинам правильной квадратной
пирамиды. Аналогичным образом в кристаллах соединений
Си(пиридиноксидJ(МОзJ [8] и Си(пиридинокснд)гСЬ [9]
комплексы объединяются в димеры, так как каждый атом меди
а
02N
Рис. 25.10. а — д
димеры в комплексе Си(пиридиноксид)г(МОзJ; б — цепи
в СиЬгХ2.
образует пятую более слабую связь с атомом кислорода моле-
кулы пиридиноксида (рис. 25.10, а). В случае подходящих лиган-
дов X и соответствующей геометрии мономера этот процесс
ведет к образованию бесконечной цепи, изображенной на
рис. 25.10,6. В некоторых случаях мостиковые «связи» имеют
слишком большую длину, и их можно рассматривать только
как вандерваальсово взаимодействие (например, 3,05 А в Си (пи-
256 25. Медь
ридинJС12) [Ю]. Обзор комплексов меди(Н) с ароматическими
\-оксидами дан в работе [11].
Литература. [1] Acta cryst., 1970, В26, 8. [2а] Acta cryst., 1978, В34, 22. [26] Z.
anorg. rillg. Chem., 1969, 370, 134. [31 Acta cryst., 1960, 13, 1027. [41 Inorg.
Chem 1969, 8, 308. [5] Acta cryst., 1969, B25, 1595. [61 Acta cryst., 1969, B25,
1378. [6a| Acta cryst., 1981, B37, 232. [7] Acta cryst., 1970, B26, 2096. [7a] Acta
cryst., 1972, B28, 126. [76] Acta cryst., 1975, B31, 2362. [8] Acta cryst., 1969,
B25, 2046. [9] Inorg. Chem., 1967, 6, 951. [10] Acta cryst., 1957, 10, 307.
| 111 biorg. Chem., 1969, S, 1879.
25.7.2. Структуры хелатных соединений меди(П). Получено до-
вольно много хелатных соединений меди(П), особенно с биден-
татпыми и тетрадентатными лигандами. В простых соединениях,
25.7. Структурная химия соединений меди(П) 257
Рис. 25.11. Строение хелатных комплексов медн(П) (см. текст).
например Cu(enJ(BF4J [1], ничто не препятствует образова-
нию двух дополнительных слабых связей Си—F B,56 А) с ато-
мами фтора, принадлежащих анионам. Если, однако, атом ме-
ди (II) расположен в центре большой тстрадептатной молекулы,
например фталоцианина, и образует четыре компланарные свя-
зи с атомами этой молекулы или если четыре атома, связанные
с медыо(П), принадлежат двум большим компланарным моле-
кулам, как, например, во многих хелатных соединениях C11R2.
то других связей, более коротких чем 3,4 А, медь не образует,
поскольку это расстояние соответствует минимальному ван-
дерваальсову взаимодействию двух параллельных молекул
(рис. 25.11, а). В комплексе биссалицилальдимината меди(П)
(а) [2] центральный атом образует только четыре компланар-
6
а
ные связи, но такие случаи встречаются редко, и в кристаллах,
относящихся к этому типу, реализуется целый ряд интересных
возможностей.
1. Если части лигандов могут выступать из плоскости цент-
рального атома меди и его четырех компланарных соседей, то
возможно образование двух дополнительных связей Си—N или
Си—О, имеющих длину порядка 2,5 А при сохранении расстоя-
ния — 3,4 А между смежными молекулами (рис. 25.11,6). Это
имеет место, например, в комплексе меди с фенилазо-р-нафто-
лом (б) [3].
2. В хелатных молекулах могут присутствовать и другие
атомы, с которыми медь может образовать две дополнительные
связи; это происходит, если плоские близлежащие молекулы
сдвинуты одна относительно другой, как изображено на
рис. 25.11,0. Кристаллы соединения меди с салицилальдокси-
мом (е) [4] имеют именно этот тип структуры. Подобные до-
полнительные атомы О присутствуют в молекуле диметилгли-
оксима (DMG), однако в случае с DMG присутствие объеми-
стых метальных групп препятствует этому: в кристаллах
Ni(DMGJ молекулы располагаются прямо одна над другой,
3 " /-л г си
/ \ V'3
/ С —NL
причем чередующиеся молекулы повернуты на 90°, что облег-
чает упаковку групп СН3 (рис. 25.11, г). Единственные межмо-
лекулярные связи, образуемые никелем(II), — это связи (дли-
17—1284
258 25. Медь
ной 3,25 А) с атомами никеля соседних молекул. Тот же тип
упаковки наблюдается в одной из кристаллических форм
бис(Ы-метилсалицилальдимината) медн(П) (г) [5], в которых
Си помимо четырех компланарных связей внутри молекулы не
образует никаких других связен, более коротких чем Cu---Cu
на расстоянии 3,33 А.
3. Кристаллы Cu(DMGJ [6] не изоструктурны аналогично-
му соединению никеля, хотя геометрическая структура
рис. 25.11, г была бы возможна. Упаковка молекул в бесконеч-
ные колонки, изображенные на рис. 25.11, в, здесь невозможна
из-за присутствия групп СН3, но такой же тип связи может
осуществляться между двумя молекулами, если они наклонены,
так что зазор между ними увеличивается. Кристалл Cu(DMGJ
состоит из димеров (рис. 25.11, д). Две молекулы DMG, свя-
занные с данным атомом меди, наклонены друг к другу под
углом 23°, и атом металла несколько приподнят над плоскостью
четырех атомов азота (на 0,3 А) и смещен в направлении атома
кислорода второй половины димера. Связи Си—N имеют обыч-
ную длину A,95 А), но пятая связь (Си—О 2,30 А) гораздо
длиннее, чем обычная связь A,9—2,0 А).
4. Димеры такого же типа образуют и хелатные комплексы
меди с 8-гидроксихинолином [7] и Ы,Ы'-этиленсалицилиденими-
ном, но соответствующее соединение с пропиленом существует
в виде моногидрата (рис. 25.11, <?), в котором присутствует пя-
тая связь с молекулой воды (Си—ОН2 2,53 А) [8]. Другими
мономерами с квадратно-пирамидальным строением этого типа
могут служить хелатные комплексы с о-гидроксоацетофено-
ном (Ь = 4-метилпиридин) [9] или trien (L = SCN) в
[Cu(trien)SCN]NCS [10] (рис. 5.11, ж). Во всех этих моле-
кулах пятая связь заметно длиннее, чем обычная ординарная
связь.
5. Если в хслатном комплексе CuL2 типа (д) алкильный
радикал большого объема замещает водород при азоте в сали-
цилальдиминато-группе, то это влечет за собой небольшой пе-
региб молекулы, и связи оказываются направленными к вер-
шине сплющенного тетраэдра. При R = C2H5 [11] четыре угла
R
I
C-N
\,
I
R
СООС2Н5
соос2н;
25.7. Структурная химия соединений меди(П) 259
между связями составляют 93°, а два — 154°; при R = 3
[12] четыре угла равны 96°, а два—141°. В дипиррометеновом
комплексе е взаимодействие между метальными группами двух
лигандов приводит к сильному искажению координационного
многогранника меди, который перестает быть плоским. Лиганды
сохраняют плоское строение, однако угол между ними стано-
вится равным 66° [13].
6. Выше (разд. 25.5.2) мы уже отмечали, что медьA) обра-
зует кубаноподобные молекулы, например Cu4X4(PR3L, где
Х = С1, Вг или I, a PR3 — замещенный фосфин. Образованные
медью(П) молекулы Cu4X4L4 (где L—алкиламинопроизводное
этилата R2N-CH2-CH2-O— в качестве лиганда, а Х = С1, Вг,
NCO, NCS) имеют различное полимерное строение [14]. В тет-
рамере атомы меди и кислорода размещаются по чередующим-
ся вершинам куба, причем лиганды связывают четыре ребра
куба, как показано на схеме ниже, где представлен только один
из четырех лигандов. Каждый атом меди образует связи с пятью
атомами лигандов (тремя О, одним N и одним X), но коорди-
национный полиэдр обычно не имеет четко выраженной формы.
Расстояния Си—Си (около 3,3 А) в этих соединениях значи-
тельно длиннее, чем в молекулах Cu4X4(PR3L B,8—2,9 А).
X
О -Си NR2
Си О == С
1— — О С
О Си —
Литература. [1] Acta cryst, 1968, В24, 730. [2] J. Chem. Soc, A 1966, 680.
[3] Acta cryst., 1961, 14, 961. [41 Acta cryst., 1964, 17, 1109, 1113. [5] Acta cryst.,
1961, 14, 1222. [6] J. Chem. Soc, A 1970, 218. [71 Acta cryst., 1967, 22, 476.
[81 J. Chem. Soc, I960, 2639. [9| Acta cryst., 1969 B25 2245 [10] Inorg. Chem.,
1969. 8, 2763. [[11] Acta cryst., 1967, 23, 537. [121 J. Chem. Soc, A 1966, 685.
|131 J- Chem. Soc, A 1969, 2556. [14] Acta cryst., 1977, B33, 1877.
25.7.3. Строение оксосолей. Среди соединений, содержащих
ионы СО32~, NO3~ или RCOO~, известно много примеров с мо-
стиковыми лигандами, связывающими атомы металла в остров-
ные комплексы, цепи, слои или каркасные структуры, в кото-
рых Си (II) имеет обычно координацию D+1) или D + 2).
Из перечисленных возможностей три реализованы в соедине-
ниях Na2Cu(CO3J-3H2O [la], Na2Cu(CO3J [16], Cu(NH3JCO3
Ив] и С11СО3 [1г]. В состав Cu(NH3JCO3 входят простые це-
17*
260 25. Медь
пи а с квадратно-пирамидальной координацией металла. В бо-
лее сложных цепях Na2Cu(CO3J-3H2O (б) координацию мож-
но описать как D+1) или D+1 + 1) в зависимости от того, как
интерпретировать шестую слабую связь. Структура безводной
соли 1Ча2Си(СОзЬ построена из гофрированных слоев, анало-
гичных изображенным на рис. 25.12, а, в их основе лежит пло-
ская сетка типа 44. Плоскость группы СОз наклонена к пло-
H,N
Xu.
0
А
о о
\\/
Си
NH,
NH,
О
он2 o с—о
z,3SAj \
Си'
^0 Си
<
о
Си
I
—С
\
ч. / ^
\ >ч //CU\ С
I
I
„Си
скости слоя. Помимо четырех компланарных атомов кислорода
(на расстоянии 1,92 А) атом меди образует дополнительную
пятую связь с атомом кислорода, находящимся на расстоянии
2,77 А и не являющимся мостиковым атомом группы СОз (в от-
личие от соединения б, где шестая связь образуется с атомами
кислорода, присоединенными к меди). В структуре СиСОз, опре-
деленной по порошкограммам, квадратно-пирамидальные груп-
пы CuOs образуют трехмерную структуру, в которой медь свя-
зана с атомами кислорода пяти различных групп СОз. Слои
типа г сдвинуты один относительно другого так, что каждый
атом меди образует пятую связь с атомом кислорода (заштри-
хованный кружок) следующего слоя.
Структуры одной из двух кристаллических форм безводного
Cu(NO3h и большого числа комплексов, образованных с орга-
ническими молекулами, представляют интерес не только в свя-
зи со стереохимией Си(II), но и как примеры различного по-
ведения лиганда NO3~. (Структура молекулы Cu(NO3h в па-
рообразном состоянии описана в разд. 18.8.7.) Молекула
Cu(enJ(NO3J (разд. 25.7.5) представляет собой пример соеди-
25.7. Структурная химия соединений меди(П) 261
нения, где NO3~ ведет себя как монодентатный лиганд; обе
группы NO3 присоединены к меди(II) посредством длинных
связей B,59 А) с образованием координационного полиэдра
D + 2). Основу каркаса структуры a-Cu(NO3J [2а] составляют
гофрированные слои (с четырехугольными петлями), в которых
каждая NO3-rpynna связывает два атома меди, как это пока-
зано схематически на рис. 25.12, а. Половина анионов (на
рис. 25.12,6 обозначены N*) образует также две слабые связи,
причем обе связи образует один и тот же атом кислорода. Бо-
лее длинная связь B,68 А) —это связь с одним из атомов ме-
ди, лежащим в том же самом слое, и вторая B,43 А) — с ато-
мом меди смежного с ним слоя. Следовательно, каждый атом
меди образует четыре более прочные связи, лежащие в одной
плоскости (Си—О 1,98 А), и две более слабые B,43 и 2,68 А)
(рис. 25.12,6). Гофрированные слои аналогичного типа найдены
в Cu(NO3J-CH3NO2 [26]. Как и в a-Cu(NO3J, все NO3~-rpyn-
пы являются мостиковыми; к каждому атому меди присоедине-
на молекула CH3NO2, которая связана с центральным ионом
через атом кислорода (Си—О 2,31 А); при этом образуется
координационный многогранник D+1) (рис. 25.12, в). (Кроме
того, атом Си участвует в еще более слабых взаимодействиях-
Си—N 2,74 А и Си—О 2,75 А.)
В Cu(NO3J-2,5H2O [3] четыре прочные связи меди образу-
ют комплекс Cu(NO3J(H2OJ (рис. 25.12, г); как и в безводном
нитрате, нитрат-ионы неэквивалентны. Оба нитрат-иона ведут
себя как «псевдохелатные лиганды»; но атом кислорода одного
из нитрат-ионов образует вторую связь, соединяющую плоско-
квадратные полиэдры в бесконечную цепь. Ближайшее окруже-
ние атома меди(II) напоминает то, которое реализуется в комп-
лексе с нитрометаном, а именно: Си—40 1,97 А; 10 2,39 А; 20
2,65 А и 2,68 А. Одна пятая часть молекул воды не связана
с атомом меди, но образует водородные связи с атомами кис-
лорода нитрат-иона и молекул воды.
В комплексе Cu(NO3J-2CH3CN [4] также присутствуют
ионы N03~ двух типов (псевдохелатные и мостиковые). Мости-
ковые нитрат-ионы несимметричны (рис. 25.12,(9) и связывают
квадратно-пирамидальные полиэдры в цепь. Более просто ведет
себя нитрат-ион в комплексе с пиразином Cu(NO3J-C4N2H4
[5], имеющем цепочечное строение (рис. 25.12, е). В этом слу-
чае все NO3-rpynnbi представляют собой несимметричные би-
дентатиые лиганды. Вследствие малого размера гТО3~-иона две
более слабые связи Си—О наклонены под углом 34° к нормали
к плоскости, в которой лежат четыре прочные связи.
Мы уже отмечали в гл. 18, что ЫО3~-группа может проявлять
свойства монодентатного, симметричного бидентатного и мости-
кового лиганда. Типы ]МО3~-лигандов, присутствующих в комп-
262 25. Медь
25.7. Структурная химия соединений меди(П) 263
лексах, приведенных на рис. 25.12, суммированы на рис. 25.13.
По-видимому, между размером иона и его поведением в каче-
стве лиганда существует корреляция, хотя нельзя с уверенно-
стью сказать, что точность определения координат легких ато-
мов во всех перечисленных структурах достаточна для того,
чтобы детально обсуждать эту закономерность.
CH,
—Cu-O'%-Cu —
i
°4N-0
о' 9
— Cu-0
I
о
;n-o
о
i
О-Си— "
~Ciu
\
O-N
Z,OA
%31'а
р -ll-
d .
\2,75A
0
Я
N-,
2,65A
о Си
Z,31A —~
9 ?
о о
2,0А "^
H3CCN
\/
NC CH,
o 3
19 A
0-
'1,30 А
Рис 25.12. Строение
в —Cu(NO3J-CH3NO2;
нитратокомплексов
;,_Cu(NO3h-2,5H2O;
е —Cu(NO3J-C4N2H4.
О . WA
U \IZ9A /
ЮГ N —¦ О
A,Z5A
-о
меди(П). а, б — а-Си(ЫОзJ;
д — Cu(NO3J-2CH3CN;
Соли меди(II) карбоксильных кислот иллюстрируют неко-
торые из возможных типов комплексов с мостиковыми группа-
ми —OC(R)O—. Безводный формиат меди(П) [6] образует
трехмерную каркасную структуру из плоскоквадратных комп-
лексов меди, связанных группами —О-СН-0—. Помимо этопэ,
группы СиО4 связаны между собой в пары, так что каждый
атом Си образует пятую связь длиной 2,40 А, так же как это
имеет место в Cu(DMGJ. Хотя формула соединения
[1\Н2(СН3J][Си(ООСН)з] [7] сложнее, чем Си(ООСНJ, струк-
тура его значительно проще — оно построено по типу простого
трехмерного каркаса. Идеализированная структура представля-
ет собой простую Р-решетку с 6-связанными атомами меди(II)
D0 1,97 А; 20 2,49 А), соединенными между собой мостико-
выми B-связанными) ООСН-группами, т. е. простейший тип
^ Си Си
О
2,7 А
Си
Z,k A
2,5-2,7/!
Си
Рис. 25.13. Поведение группы NO3~ в нитратных комплексах меди(II). (Жир-
ными линиями показаны связи Си—О с длиной, близкой к 2,0 А.) Наверху
(слева направо): симметричный мостик, несимметричный мостик (Си—6
2,0 А), мостики с прочными и слабыми связями и псевдохелатная функция.
Внизу: мостик со слабыми связями и псевдохелатная функция; певдохелатиая
функция.
трехмерных структур АХз. Катионы занимают все «кубические»
ячейки каркаса. Структура тетрагидрата формиата меди (И)
[8] содержит бесконечные цепи* состава Си(НСООJ(Н2ОJ,
в которых Си окружают четыре атома кислорода (на расстоя-
нии 2,0 А) и две молекулы воды (на расстоянии 2,36 А); цепи
соединены друг с другом водородными связями через две дру-
гие молекулы воды, как это показано на рис. 25.14, а. С другой
стороны, в моногидрате ацетата присутствуют димеры
С1ь(СНзСООL-2Н2О типа «фонариков» (рис. 25.14,6). Иска-
женно-октаэдрическую координацию меди создают четыре ле-
жащие в одной плоскости атома кислорода (ацетатных групп)
на расстоянии 1,97 А, молекула Н2О на расстоянии 2,20 А и вто-
рой атом меди димера на расстоянии 2,65 А [9]. Это последнее
расстояние близко к тому, которое наблюдается в металле.
Такое же строение имеют соответствующие соли хрома(II)
[Ю] и родия (II) Г11 ]; димеры того же типа образуются в
Cu2(HCOOL[OC(NH2J]2 [121 и в обеих кристаллических фор-
мах Си2(СНзСООL(С5Н5Г^J [13, 14], причем молекулы моче-
вины или пиридина замещают молекулы воды (рис. 25.14,6).
* Было бы правильнее сказать, что группы НСОО связывают атомы меди
не в цепи, а в слои с 4-связанными узлами. — Прим. ред.
264 25. Медь
Так же как и связь Си—Н20, связь Си—N B,19 А) заметно
длиннее обычной ординарной связи. В молекулах перечислен-
ных соединений атом меди несколько выступает из плоскости
(~0,2 А), в которой лежат четыре атома кислорода, в сторону,
противоположную второму атому меди.
а _ „ _ 6
Рис. 25.14. а — строение кристаллов Си(НСОО),-4Н2О; б — димерные фраг-
менты в структуре моногидрата ацетата меди(П); в — цепочечное строение ди-
гидрата сукцината меди.
В дигидрате сукцината меди (II) половина молекул воды
является кристаллизационной, а остальные входят в состав
таких же димеров, как Си2(асL(Н2ОJ [15]. Сукцинат-ионы иг-
рают роль не только мостиковых групп в димере, но и связыва-
ют эти единицы в бесконечные цепочки (рис. 25.14, в).
Несколько неожиданно те же самые димерные фрагменты
были обнаружены и в безводных солях кислот с длинными це-
почками углеродных атомов, например в деканоате
25.7. Структурная химия соединений меди(П) 265
Си[СНз(СН2)8СОО]2 [16]. Молекулы упакованы по типу «конец
к концу»; СОО-группы четырех молекул являются мостиковыми
и связывают два атома меди так же, как и в Cu2(acL(H2OJ.
Шестое координационное место (занимаемое молекулой Н2О на
рис. 25.14, б) в данном случае замещено атомом кислорода
близлежащей молекулы димера, так что атом меди связан с
пятью атомами кислорода и одним атомом меди*.
В заключение мы остановимся на двух примерах це-
почечных структур, характерных не только для оксосолей.
В Ы2Си(С2О4)г-2Н2О [17] плоские анионы Си(С2О4J сгруппи-
рованы в колонки, аналогичные изображенным на рис. 25.10,6;
здесь медь связана с четырьмя атомами кислорода, находящи-
мися на расстоянии 1,93 А, и двумя атомами кислорода — на
расстоянии 2,79 А. Кристаллическая структура бензоата меди
[18] построена из цепей СиХ2В типа представленных на
рис. 25.16,6 (см. ниже), где Х — Н2О, а В — бензоат-группа
—ОС(С6Н5)О—; остальные молекулы Н2О и С6Н5СОО~-ионы
распределены между цепями.
Интересно отметить, что координация Си(II) по типу D + 2)
найдена в a-Cu(NO3J, CuSO4 [19] (Си—40 1,9—2,0 А;
Си—20 2,4 А), а также в CuSO4-5H2O (см. разд. 15.2.5 в т 2)
тогда как в Cu(NH3),4SO4-H2O [20] (Си—4N 2,05 А; Си—ОНг
2,59 А), СиСОз и азурите Си3(ОН2) (СО3J [21] присутствуют
полиэдры D+1).
Литература. [1а] Acta cryst., 1975, В31, 1313. [16] J. Chem Soc D 1972 1913
[1b] Acta cryst., 1972, B28, 1607. [lr] Z. anorg. alig Chem '1974 410 138
[2a] J. Chem. Soc, 1965, 2925. [26] Acta cryst., 1966, 20, 210 [3] Acta cryst'
1970, B26, 1203. [4] Acta cryst., 1968, B24, 396. [5] Acta cryst, 1970 B26 979"
[6] J. Chem. Soc, 1961, 3289. [7] Acta cryst., 1973, B29, 1752 [81 Acta crvst'
!v5r'n7' ,4nC2o [9] Acta,"yst- 1953> 6> 227. [10] Acta cryst., 1953, 6, 501. [11] ДАН
Vq^-o 962' \АЬ 1102- [121 Inorg- Chem- 197°- 9> 1626- ИЗ] J. Chem Soc,
1961, s244. [141 Acta cryst., 1964, 17, 633. [15] Acta cryst., 1966 20 824 Г161 Acta
K« 'S a3?' 2912' [17fJ Acta Cryst' 1980' B36' 2145- П8Т Inorg. Chem., 1965,
cr-st 1958 и " 14> 321' [20] ACta °rySt"' 1955> 8> Г ] Act^
25">.?'А. Тригонально-бипирамидальная координация меди (II).
Простейшим примером координации такого типа служит
комплекс [Cr(NH3N](CuCl5) [1].То обстоятельство, что экватори-
альные связи атома Си (II) B,39 А) длиннее аксиальных
(АЗО А), показывает, что недостаточно учитывать обычное
* Более детальная информация по структурной химии карбоксилатов d-ме-
таллов имеется в работах: Порай-Кошиц М. Л., Кристаллохимия и стереохи-
мия карбоксилатов. Стереохимическая систематика одноосновных карбоксила-
тов и факторы, определяющие структурную функцию карбоксильных лиган-
Дов в комплексах переходных металлов. — В кн.: М., ИНТ изд ВИНИТИ
Кристаллохимия, 1981, т. 15, с. 3-129. См. также: Порай-Кошиц М А -
Ж. структ. хим. ,1980, т. 21, № 3, с. 146-180. - Прим. ред.
266 25. Медь
электростатическое отталкивание электронных пар соседних ли-
гандов; следует принять во внимание взаимодействие асиммет-
ричных d-электропов с электронными парами лигаидов.
Другим простейшим примером такого пространственного
расположения пяти монодентатных лигандов служит анион в
Ag[Cu(NH3J(NCSK] [2] (рис. 25.15, а). Тригонально-бипирами-
дальные комплексы иодид подобие B,2/-дипиридил) меди (II)
а
SCN
Рис. 25.15. Тригонально-бипирамидальная координация меди(П).
(рис. 25.15, б) [3], [Cu(tren)NCS]SCN [4] (рис. 25.15, в) и
[Cu(Me6tren)Br]Br [5] являются примерами ионов или молекул,
содержащих полидентатные лиганды. В последнем случае такое
строение не является чем-то присущим именно меди(II), но
проявляется и в аналогичных соединениях кобальта и никеля.
Обратим также внимание па квадратно-пирамидальное строе-
ние комплекса [Cu(trien) SCN]+ (разд. 25.7.2). В противополож-
ность комплексу fCr(NH3N]CuCl5 в соединении Co(enKCuCl5-
•Н2О [6] существует двуядерный ион Си2С184~ (рис. 25.15, г)
и, естественно, дополнительные хлорид-ионы. Формулу этого
соединения следует записывать как [Co(enK]2(Cu2Cl8)Cl2-2H2O.
Тригонально-пирамидально направленные связи меди (II)
присутствуют в тетраэдрической молекуле Си4ОСЦЬ4
(разд. 3.6.2), где L — это, например, пиридин, 2-метилпиридин
25.7. Структурная химия соединений меди(П) 267
[7] пли (С6Н5KРО (рис. 25.15,d) [8]. Центральный атом кисло-
рода имеет тетраэдрическое окружение DСи находятся на рас-
стоянии 1,90 А); каждая пара атомов меди связана мос-
тиковыми атомами хлора (Си—С1 2,38 А). Молекула
Си4ОС1б((С6Н5KРОL замечательна тем, что в ней представлен
сравнительно редкий пример атома кислорода, образующего две
коллннеарные связи . Расстояние Си—Си в этих молекулах
( — 3,1 А) существенно превышает значение, принятое для связи
металл — металл, а величина магнитного момента B,2 р,в) вы-
ше, чем интервал значений A,8—1,9 ц.в), характерный для
григонально-бипирамидальных комплексов Си(II) [9]. Комплекс
(Си4ОС1юL~~ в его соли с [N(CH3)y4]+ обладает близким значе-
нием магнитного момента. Этот комплекс имеет строение того
же типа, что и структуры, приведенные на рис. 25.15, д, где
L — это С1. Однако у комплексов Cu4L4 с кубаноподобной
структурой [11], образуемых тридентатными шиффовыми осно-
ваниями (а), где координация Си(II) также тригонально-бипи-
рамидальная, магнитный момент меньше A,84 (д,в). Результаты
магнитных измерений обсуждаются в работе [10].
н3с
(
с-о—м
о
с-с
н2н2
В Cu2O(SO4) [12], получаемой в виде коричневых кристаллов
при нагревании CuSO4-5H2O до 650 °С, половина атомов метал-
ла имеет октаэдрическое D + 2) окружение, а остальные —три-
гоналыго-бипирамидальное. Координационные многогранники
обоих типов обнаружены и в оливените Cu2(AsO4)OH [13]
(Си—40 1,99 А и Си—20 2,37 А или Си—20 1,95 А и Си—30
2,07 А). В Си3\УОб [14] у меди(II) также осуществляется триго-
нально-бипирамидальная координация, а у вольфрама — чрез-
вычайно искаженная октаэдрическая координация C0 1 79 А
30 2,09 А). '
Литература. [1] Inorg. Chcm., 1968, 7, 1111. [2] Acta Chim. Sinica, 1966 32
162. [3] J. Chem. Soc, 1963, 5691. [4] J. Am. Chem. Soc., 1967, 89, 6131 [5] Acta
cryst, 1968, B24, 595. [6] Inorg. Chcm., 1971, 10, 1061. [7] Inorg. Chem 1970 9
1619. [81 Inorg. Chem., 1967, 6, 495. [91 Trans. Faraday Soc, 1963, 59, 1055!
10]| Inorg. Chcm., 1969, 8, 1982. [1Ц Chem. Comm., 1968, 1329. [121 Acta cryst,
1963, 16, 1009. [13] Acta cryst., 1977, B33, 2628. [14] Acta Chem Scand , 1969
268 25. Медь
25.7.5. Октаэдрические комплексы. Комплексы Си(ОНN4 ,
Си(ЫН3)б2+, Cu(NO2N4~ и Си(Н2ОN2+ являются примерами
изолированных октаэдрических ионов или молекул CuL6 (a)
простейшего типа. В Ва2[Си(ОНN] [1], имеющем искаженную
структуру типа K2PtCl6, медь содержит 4ОН-группы на расстоя-
нии 1,97 А и 2 ОН-группы на расстоянии 2,81 А; при этом об-
разуется обычный вытянутый октаэдр. В тригональных моди-
фикациях Cu(NH3NX2 [2а]
6 X
(Х = С1, Вг, I) длины связей равны 2,1 и 2,6 А соответственно.
Аналогичный координационный полиэдр D + 2) найден в
Cu(enJX2 (б) [26] (X = SCN,NO3 и т. п.) и в СиС12 (пиразолL[2в]
(Си—4N 2,02 А; Си—2С1 2,84 А). В кубических модификациях
Си(ЫНзNВг2 и Cu(NH3Nl2 существует, вероятно, статистиче-
ская ориентация статически деформированных групп или тот
или иной вид динамического эффекта Яна — Теллера.
При рассмотрении солей A2B[Cu(NO2N], где А = К, Rb или
Tl, a B = Pb, Ca, Sr или Ва, возникает та же проблема. Дифрак-
ционное исследование [3] показало, что в высокотемпературной
кубической модификации этих соединений атом меди окружают
шесть равноудаленных атомов азота (на расстоянии 2,12 А).
В низкотемпературной (ромбической) соли с щелочноземель-
Z,31A
2,05А
2,05 А
Z.1ZA
2,05 А
fZ,17A
zjza
II
III
ными металлами во внешней сфере обнаружена обычная
D+ 2)-координация (вытянутый октаэдр I), тогда как в комп-
лексе, содержащем во внешней среде ион свинца, осуществля-
ется B + 4)-координация (сплющенный октаэдр II). Появление
последней конфигурации, по-видимому, связано с двумерным
25.7. Структурная химия соединений меди(П) 269
искажением вследствие динамического эффекта Яна-Телле-
ра — путем взаимной перестановки длинных и коротких связей
в экваториальной плоскости, что приводит в результате усред-
нения во времени к средним значениям длин экваториальных
связей, превышающим длину аксиальных связей. Взаимная
перестановка длинной и короткой связей вдоль всех трех осей
приводит к образованию шести связей одинаковой длины (III).
Различия в строении комплексов свинца и щелочноземельных
металлов обусловлены большей поляризующей способностью
иона РЬ2+; она приводит к большему искажению его (кислород-
ной) координации, чем в случае более жестких ионов щелочно-
земельных металлов, в результате чего перехода к статически
деформированной D +2)-координации не происходит. Опубли-
кован короткий обзор работ [4], посвященных исследованию эф-
фекта Яна — Теллера спектроскопическими (электронные
спектры, спектры парамагнитного резонанса) и магнитными
методами.
В двух солях обнаружено ромбическое искажение комплек-
са Си(Н2ОN2+. По своему строению медная соль Туттона
Cu(NH4J(SO4J-6H2O [5] в целом аналогична соединениям
магния и цинка (в которых наблюдается небольшое или вооб-
ще не наблюдается искажение октаэдра М(Н2ОN; однако в ней
с несомненностью установлено нететрагоналыюе искажение ок-
таэдра Си(Н2ОN2+; аналогичный эффект обнаружен и в
Cu(C104J-6H20[6]:
Cu(NIl4J(SO4J-6H2O
Cu(CIO4h-6H2O
20 20 20
на расстоянии, А
1,96 2,10 2,22
2,09 2,16 2,28
Установлено, что в соединениях Cu(enKSO4 [7] (Си—N
2,15 А) и СиВ3(С1О4J [8] (где В —лиганд д) присутствуют
(CH3JN
N(CH3J (CH3JN
,N(CH3J
комплексы типа в с симметрией 32 (?>3). Нейтральная молекула
СиВ2(С1О4J [9] имеет строение ожидаемого типа (а) с длинны-
ми связями B,55 А), направленными к атомам кислорода
СЮ4-лигандов, однако в СиВ3(С1О4J, изоструктурном соответ-
ствующим соединениям Со и Mg, центральный ион меди
окружен шестью равноудаленными атомами кислорода
(Си—О 2,07 А). В несимметричном комплексе, например
270 25. Медь
[Cu(bipyJNO2]NO3 [10], октаэдрический комплекс в силу раз-
личий в размере лигандов становится несимметричным (е);
отметим, что связи Си—N имеют попарно различную
длину: расстояния Си—О до атомов кислорода группы
NO2 также различаются между собой. Четко выражен-
ный эффект Яна — Теллера, по-видимому, проявляется в
Cu(bipy) (F3CCOCHCOCF3J [И], где различны длины связей
Си—О и, кроме того, искажен обычный симметричный лиганд
(см. схему ж).
,33 А
ось 2-го
порядка.
1,22 А
В Си(диэтилентриаминJAЧО3J, принадлежащем к типу г,
наблюдается тетрагональное искажение, причем две транс-свя-
зи Си—N более короткие B,01 А), а четыре — более длинные
(в среднем 2,22 А) [12].
Литература. [1] Ada cryst., 1973, В29, 1929. [2а] Inorg. Chem., 1967, 6, 126.
[26] Ada cryst., 1964, 17, 254, 1145. [2a] Ada cryst., 1975, B31, 2479 [31 Acta
cryst., 1976, B32, 326, 668, 1278, 2524. [4] J. Solid State Chem., 1979, 27, 71.
[5] Acta cryst, 1966, 20, 659. [6] Z. Kristailogr., 1961, 115, 97. [7] Inorg. Chem.,
1970, 9, 1858. [8] J. Am. Chem. Soc, 1968, 90, 5623. [91 Inorg Chem 1970 9
162. [101 J. Chem. Soc, A 1969, 1248. [11] J. Am. Chem. Soc, 1969, 91, 1859.
[121 J. Chem. Soc, A 1969, 883.
25.7.6. Простые и сложные (комплексные) галогениды меди(П).
Некоторые характеристики строения этих соединений приведены
в табл. 25.3. Структурные типы (вторая колонка) —это «иде-
альные» структуры с приблизительно октаэдрической коорди-
нацией; они все были описаны в предыдущих главах, а ранее
в этой главе мы уже касались и галогенидов меди(II). Следу-
ющие замечания дополняют таблицу.
1. Структура K2CuF4 не построена просто по типу структуры
NiF4; она имеет удвоенный период вдоль оси с. В каждом
L'5.7. Структурная химия соединений меди(П) 271
слое чередуются длинные и короткие связи, как показано на
схеме з, по в последующих слоях положения этих связей меня-
ются местами. Описание координации в этих соединениях как
тетрагональной D + 2) является, несомненно, приближением,
поскольку в KCuF3, NaCuF3, Ba2CuF6 и CsCuCl3 (низкотемпе-
ратурная форма) было обнаружено значительное орторомбиче-
ское искажение.
2. В низко- и высокотемпературной модификациях CsCuCl3
были обнаружены различные искажения структурного типа
CsXiCl3. В первой из них наблюдается приблизительная
D + 2)-координация, а во второй—C + 3)-координация.
3. Строение аниона в солях М2(СиС14) очень чувствительно
к природе катиона. Если катион малых размеров, то имеет
место координация D + 2), как, например, в случае солей
(NH4)+, (CH3NH3)+ и (C2H5NH3)+, но если катион большой,
как в случае солей Cs+, (CH3LNf, (C2H5KNH+ и N.N'-диме-
тил-4,4/-бипиридииий (DMBP), то наблюдается сплющенный
тетраэдр. Валентные углы близки к 130° (два) и 100° (четыре);
аналогичные валентные углы найдены в искаженной
шпипелевои структуре CuCr2O4. В этих ионах тетраэдр не только
сплющен, по и скручен. Двугранный угол СЬСиСУСЬСиСЦ в
правильном тетраэдре равен 90°, но этот угол изменяется от
примерно 74° в Cs2CuCl4 До 64° в [(CzHshNHkCuCL,. Тот же
тип искажения обнаружен и в полимерном анионе в
¦( (C6H5LAs)CuCl3. Размещение связей здесь промежуточное
между плоским квадратным и правильным тетраэдрическим
(большие углы равны 145°), а двугранный угол
С1КО1ЩСиС1КО1щ/С1МостСиС1Мост составляет 66° (см. также ниже
в этом разделе).
В сочетании с катионами несферической формы, такими, как
(C6H5CH2CH2NH2CH3)+, ситуация выглядит еще сложнее.
В желтой высокотемпературной модификации присутствуют не-
правильные тетраэдрические ионы СиСЦ2~ (большие углы 123
и 138°, Си—С1 2,23 А и 2,19 А), а в зеленой низкотемпературной
модификации — плоские централыюсимметричпые ионы СиС142~.
Таблица 25.3. Кристаллические
Соединение
CuF2 |
CrF2 j
Na2CuF4
CuF2-2H2O
KCuF3
NaCuF3
K2CuF4
Ba2CuF6
CsCuCl3 (низкотемперат. форма)
(высокотемперат. форма)
[(CH3JNH2]CuCl3
(NH4JCuCl4
LiCuCl3-2H2O
CuCl,(enJ-H2O
CuCl2-2H2O
структуры галогенсодержащих
Тип октаэдриче-
ской структуры
Рутил
Ка2МпС14
Перовскит
K2NiF4
CsNiCl3
CsNiCl3
!<2NiF4
СоС12-2Н2О
соединений меди(II)
Координационный много-
4F
4F
4F
2F
2О
2F
2F
2F
2F
4F
2F
2F
2С1
2С1
ЗС1
ЗС1
-ракник Си (или Сг)
о
IX, А
1,93
2,00
1,91
1,90
1,94
1,89
1,96
1,88
1,97
1,92
1,85
1,93
2,28
2,35
2,39
2,51
2,25—2,35
2,31
2,33
4N
2С1
20
2,00
2,29
1,96
2Х, А
2F 2,27
2F 2,43
2F 2,37
2F 2,47
2F 2,25
2F 2,20 )
2F 2,22 J
2F 2,32
2С1 2,78
2,73 (одна)
2,79
О 2,60
CI 2,90
О 2,62
С1 2,81
2,94
(или хрома)
Литература
J. Am. Chem. Soc, 1957, 79, 1049
Phys. Chem. Soc, 1957, 232
Z. anorg. allg. Chem., 1965, 336, 200
J. Chem. Phys., 1962, 36, 50
Ada cryst., 1979, B35, 1303
Ada cryst., 1980, B36, 1264
Z. anorg. alig. Chem., 1974, 409, 11
Solid. State Comm., 1979, 31, 398
Z. Naturwiss., 1977, 32b, 476
Inorg. Chem., 1966, 5, 277
Ada cryst., 1974, B30, 1053
J. Chem. Phys., 1966, 44, 39
J. Chem. Phys., 1964, 41, 2243
Acta cryst., 1963, 16, 1037
J. Chem. Phys., 1963, 39, 2923
J. Chem. Soc, A 1967, 1435
Acta Chem. Scand., 1970, 24, 3510
- K2CuCl4-2H2O
oo
I
ю Cu2OCl2
CuCl2
(C2H5NH3JCuCl4
KCuCl3
CuCl2py2
CuBr2
Cs2CuCl4
[(C2H5KNHl2CuCl4 1
[(CH3LN]2CuCI4
[СбН5(СН2JЫН2СНз
2CuCl4
(DMBP)CuCL,
{(C6H5LAs}2Cu2CI6
Cs2CuBr4
Cs3Cu2Cl7-2H2O
Cu3Cl6(Il2OJ-2C4H8SO2
Cu3Cl6(C6H7NOJ-2H2O
Cu3Cl6(GH3CNJ
Си5С110(СзН7ОНJ
Cu4Cl,0[(CH3KNHl5
Cdl2
NH4CdCl3
a-CoCl2py2
Cdl2
2C1 2,29
2O 1,97
2C1 2,29
20 1,94
2,30
2,28
2,29
2N 2,02
2C1 2,28
2,40
2,19—2,25
См. текст
2,21—2,32
2,39
См. текст
См. текст
2,90
2С 3,13
2,95
2,98
3,03
3,05
3,18
Ada cryst., 1970, В26, 827
Z. Naturwiss., 1977, B32, 380
J. Chem. Soc, 1947, 1670
Inorg. Chim. Acta, 1970, 4, 367
J. Chem. Phys., 1963, 38, 2429
Ada cryst., 1957, 10, 307
J. Am. Chem. Soc, 1947, 69, 886
I. Phys. Chem., 1961, 65, 50
Acta cryst., 1973, B29, 241
Acta cryst., 1975, B31, 289
Inorg. Chem., 1974, 13, 2106
Acta cryst., 1969, B25, 1691
Ada cryst., 1974, B30, 307
Acta cryst., 1960, 13, 807
Ada cryst., 1971, B27, 1538
Inorg. Chem., 1974, 8, 143
Inorg. Chem., 1968, 7, 2035
J. Chem. Phys., 1964, 40, 838
Acta cryst., 1976, B32, 2516
274 25. Медь
В обеих этих формах медь(II) не имеет более близких соседей,
чем отстоящие на 3,5 А. Низкотемпературная модификация —
это, по-видимому, единственный пример плоского квадратного
иона СиС142~, у которого медь не имеет дополнитель-
ных соседей па обычных расстояниях B,8—3,05 А). См также
IPt(NH3L][CuCl4] в разд. 27.9.5.
Описание анионов в соединениях с хлором зависит от интер-
претации двух удлиненных связей Си—С1. Описание в терминах
в
а
9
6
где В представляет собой:
6
0 Од
н
нс/ чсн
\\ //
N
\
Рис. 25.16. Бесконечные линейные ионы и молекулы, атомы металла с
рической координацией, а — АХ4; б — AX2L2 в СиС12-2Н2О; в — ЛХ^В в
•C,N,H, и CuClo-ONN(CH,U: г — (СпС.1,1 „"- r КГ.пГ.1, или ГпП„.'\ГГ
октаэд-
рической координацией, а — АХ4; б — AX2L2 в СиС12-2Н2О; в — ЛХ^В в СиСЬ-
•C2N3H3 и CuCl2-ONN(CH3J; г — (СиС13)„"- в КСиС13 или CuCi,-!VCCH:, (за-
штрихованные кружки обозначают N); д— [CuCl3(II2O)'|,/'^ в T.iCLiC!3-2II2O
(заштрихованные кружки обозначают молекулы Н2О).
искаженных октаэдрических координационных групп сближает
ряд структур, в основе которых лежат октаэдрпческие цепи,
описанные в гл. 5. Простые цепи октаэдров с общими ребрами
отвечают составу (АХ4)„2п-, если все большие круги на
рис. 25.16, а обозначают атомы галогена, либо составу AX2L2
(рис. 25.16,6), если заштрихованные круги обозначают ней-
тральные лиганды, например Н2О, NH3, пиридин, либо составу
АХ2В (рис. 25.16, в), если В — это лиганд, способный играть
роль мостика, соединяющего два атома меди. Ни в одном комп-
лексном хлориде меди пока не были обнаружены простые це-
почечные ионы (CuCl4)n2™-, однако цепи CuCl2-L2 являются
структурными единицами в СиС12-2Н2О и других соединениях,
приведенных в табл. 25.4. К примерам цепей СиС12В
25.7. Структурная химия соединений мсди(П) 275
Таблица 25.4. Семейства
Тип комп-
лекса
Одинарная
цепь
Рис. 25.16:
АХ42- (а)
AX2Lo (б)
АХ3В (в)
Двойная
цепь
АХ3- (г)
AX2L (г)
АХ4- (д)
AX3L- (д)
Правильная окта-
эдр и ческа я коорди-
нация
Na2MnCl4
СоС12-2Н2О
CdCl,(NH3J
а-СоС12(руJ
NH4CdCl3
TcCL,
октаэдрических цепочечных структур
Искаженно-окта-
эдрическая коорди-
нация
Na2CuF4
СиС12-2Н2О 1
CuF2-2H2O J
a-CuBr2(NlI3J
CuCl2(pyJ
СиС12(триазол)
CuCl2(Me2NNO)
KCuCl3
CuCl2(NCCH3)
LifCuCl3(H,O)l-
• H2O
Литература по соедине-
ниям меди
Z. anorg. allg. Chem.,
1965, 336, 200
См. табл. 25.3
Acta crvst., 1959, 12, 739
Acta crvst., 1975, B31, 632
Acta cryst., 1962, 15, 964
Acta cryst., 1969, B25
2460
См. табл. 25.3
J. Chem. Phys., 1964, 40
838
См. табл. 25.3
(рис. 25.16, e) относятся комплексы с 1 : 2 : 4-триазолом и
(CH3JNNO. В последнем из них длины связей следующие:
Си—4С1 2,29 А, Си—О 2,29 А и Си—N 3,00 А, так что здесь
скорее имеет место координация D+1) или D+1-4-1), а не
D + 2).
Двойная ионная цепь (СиС1з)л"~, изображенная на
рис. 25.16, г, — это ион соли КСиС13, которой изоструктурна и
соль KCuBr3; эта схема также изображает строение цепочечной
молекулы CuCl2-NC(CH3). В цепи АХ4 на рис. 25.16, а окта-
эдры АХ6 имеют общими противоположные ребра. В цепи,
изображенной на рис. 25.16, д и имеющей тот же состав, сопря-
жение октаэдров происходит по другим парам ребер, что при-
водит к зигзагообразному размещению пар октаэдров. Приме-
ром является анион в ЫСиС1з-2Н2О, причем заштрихованные
кружки обозначают молекулы Н2О. Состав цепи СиС13(Н2О);
вторая молекула Н2О и ионы Li+ расположены между цепями.
Все эти структуры представлены в табл. 25.4.
Описание строения этих соединений как цепочечных подчер-
кивает существование у меди(II) октаэдрического окружения
D+2). С другой стороны, можно описать эти системы на основе
только четырех более прочных связей Си—X. Такое описание
дает слои в CuF2, цепи в CsCuCl3 и СиС12, ионы Си2С162~ в
KCuCls и LiCuCl3-2H2O, молекулы СиС12(Н2ОJ в СиС12-2Н2О
18*
276 25. Медь
и КгСиС14-2Н2О. Структуру последнего соединения мож-
но, следовательно, представить как совокупность молекул
СиС12(Н2О)г, ионов К+ и ионов С1~; оно не содержит ионов
СиСЦ2-. Бесконечные спиральные цепи (СиС13)„п- в CsCuCl3
относятся к типу а, тогда как в СиС12 цепи образованы плос-
кими группами СиСЦ с общими противоположными ребрами б.
а
П\
Си
2.3,. А
Си'
2,28 А
( L1
,
"(Г
Строение иона СигСЬ2"", так же как и СиС142~, очень чувстви-
тельно к его окружению. В присутствии катионов большого
объема в [(C6H5LAs]2[Cu2Cl6] взаимодействие между анионами
[Си2С1б]2~ отсутствует и наименьшее расстояние С1—С1 состав-
ляет 6,76 А. Следующие цифры показывают, что степень иска-
жения координационного многогранника меди от плоского к
сплющенному тетраэдру возрастает по мере уменьшения взаимо-
действия с дополнительными ионами С1 (см. табл. 25.2).
LiCuCl3-2H2O
[(CH3JNH2]CuCl3
[(C6H5LAs]CuCl3
Расстояние до сосед-
них дополнительных
ионов С1
2,92 А
2,73 А
Угол между
7у>''носвязями
С1—Си—С1
180°
166°
145°
В этой связи представляют определенный интерес две струк-
туры. В [(CH3JNH2]CuCl3 плоские ионы Си2С162- связаны в це-
почку посредством пятой «связи» B,73 А), образуемой каждым
из атомов меди. Шестое место в октаэдре занято метильной
группой на очень большом расстоянии (Си—СНз 3,78 А), так
что медь(II) здесь проявляет координационное число 5 (тетра-
С, 2,32 А
а
25.7. Структурная химия соединений меди(П) 277
тональная пирамида, в). В комплексе с 2-пиколин-М-оксидом
СизС1б(СбН7МОJ-2Н2О димеры CU2CI4L2 связаны мостиками с
молекулами СиС1г(Н2ОJ посредством связей Си—С1 двух типов
с длиной 2,65 и 2,96 А; при этом образуются цепочки, в которых
содержатся как 5-, так и 6-координационные атомы Cu(II) (г).
Ион СигОб2" представляет собой фрагмент цепи СиС12;
встречаются некоторые соединения СиС12 с органическими мо-
лекулами, структуры которых тесно связаны с этими двумя
системами (в и г). Эти соединения можно получить при нагре-
вании путем растворения безводного СиС12, например, в ацетонит-
риле или н-пропаноле, с последующей кристаллизацией из полу-
ченного раствора. Желто-красное соединение CuCl2-CH3CN
построено из димерных молекул д, которые упакованы точно
так же, как ионы СигС1б2~ в КСиС13. Каждая молекула посред-
ством удлиненных связей Си—С1 соединяется с двумя другими,
в результате чего образуются цепи (табл. 25.4), причем моле-
кулы CH3CN проецируются с обеих сторон двойной октаэдриче-
ской цепи, как это показано на рис. 25.16, г (атомы азота обо-
значены заштрихованными кружками).
Н3С
Cl
Cl
NC-CH,
H3C-CN.
СГ
-Си'
-С1-
Молекулы Cu3Cl6(CH3CNJ (e) и Си5С110(С3Н7ОНJ, имеющие
большую длину, упакованы иначе: удлиненные связи Си—С1
соединяют атомы одной молекулы с атомами четырех смежных
молекул, так что образуются слоистые структуры. Строение
слоев в этих двух соединениях различно; структура слоя пер-
вого из них изображена на рис. 25.17.
Соль [(СНзKЫН]2Си4С11о содержит плоские ионы типа е,
причем лигандами служат только атомы хлора; ионы уложены
таким образом, что два внутренних атома меди образуют коор-
динационные многогранники типа D+1 + 1) DС1 2,29 А, 1С1
2,75 А и 1С1 3,23 А), тогда как внешние связаны только с одним
атомом хлора соседнего иона B,94 А) в дополнение к двум
концевым атомам CI B,24 А) и двум мостиковым атомам С1
B,29 А).
Мы уже упоминали о двуядерном ио-ле Си2С184^
(разд. 25.7.4) как примере комплекса меди(II) с тригонально-
бипирамидально направленными связями. Двуядерный ион
278 25. Медь
[Cu2Cl5(H2OJ], судя по всему, содержится и в соли
Cs3Cu2Cl7-2H2O. Однако D + 2)-координационная группа здесь
необычно асимметрична (ж), а длины связей лежат в настоль-
ж
Н20-
Cl"
-Си-
-С1
\ь'
-Си-
С1
•ОН,
ко широком интервале B,09—2,41 А), что было бы желательна
дальнейшее изучение структуры этого иона.
Рис. 25.17. Фрагмент слоя в структуре Cu:iCl6(CH3CNJ, показывающий, как
каждая молекула связана с четырьмя другими посредством удлиненных связен
Си—С1 (штриховые линии). Показаны только атомы N (жирные кружки) мо-
лекул CH3CN.
25.7.7. Гидроксосоли меди(П). Медь(П) образует необычайно
большое число гидроксо-оксосолей [1], многие из которых явля-
ются (вторичными) минералами, например Cu(OH)IO3,
Cu2(OHKNO3, Cu2(OHJCO, (малахит) [2], Cu2(OH)PO4 (либе-
тенит), Cu3(OHKPO4, Cu5(OHL(PO4J и Cu4(OHNSO4 (брошан-
тит). Структуры Си(ОН)Ю3 и Cu2(OHKNO3 были описаны
в гл. 14, где, кроме того, были рассмотрены общие черты струк-
тур некоторых гидроксосолей; СиВ(ОНLС1 (бандилит) рас-
смотрен в гл.24, а слоистая структура CuHg(OHJ(NO3J(H2OJ
[3] — в разд. 3.10.2. В большинстве этих соединений атом ме-
ди (II) координируется четырьмя компланарными атомами
кислорода и двумя более удаленными, дополняющими полиэдр
до искаженного октаэдра; в некоторых случаях шестой атом
кислорода может находиться на таком далеком от атома меди
расстоянии, что его координационную группу предпочтительнее
описывать как тетрагональную пирамиду (например, в клино-
клазе Cu3(OHKAsO4) [4].
Структуры двух форм Си2(ОНKС1, атакамита и боталлаки-
та, а также Cu2(OHKBr были описаны в разд. 10.5, где и при-
ведена вся литература. Структура атакамита принадлежит к
25.8. Сульфиды меди 279
каркасному типу и, в идеализированном виде, является произ-
водной от структуры NaCl, как показано на рис. 4.22 (т. 1).
Структуры боталлакита и Cu2(OHKBr слоистые типа Cdl2. Для
всех" этих структур характерно образование искаженного
D -2)-координационного многогранника.
Cu,(OHKCl Cu2(OHKBr
, 4ОН 2,02 А 4ОН 2,00 А ., ;4ОН 2,0 А 4ОН 2,0 А
2С1 2,76 А
ОН
С1
2,36 А
2,76 А
Си
3,0 А
ОН 2,3 А
Вг 2,8 А
Не все атомы металла в этих гидроксогалогепидах имеют
одинаковое окружение: половина из них связана с 4OH-I-2X,
а оставшиеся — с 5ОН+Х. Такой состав координационных групп
в соединении М2А3В является следствием относительного коли-
чества атомов А и В и координационных чисел атомов — МF),
АC) и ВC). В такой структуре все атомы М и не могут иметь
одинаковое окружение, но то обстоятельство, что атомы М
(в кристаллографическом отношении) принадлежат к двум
разным типам, не имеет значения для химии.
На рис. 25.18 схематически изображены структуры СиС12,
Си2(ОНKВг и Си2(ОНKС1. Хотя структура атакамита не отно-
сится к типу слоистых структур, ее приближенно можно рассечь
на плотноупакованные слои того же типа, что и в гидроксобро-
миде, описанном в разд. 22.1.1 и изображенном на
рис. 25.18, д и е.
Литература. [11 Fortchr. Mineral. 1961, 39, 59; Acta cryst., 1963, 16, 124. (В этих
статьях см. ссылки на более ранние работы.) [2] Acta cryst., 1967, 22, 146, 359.
[31 Acta cryst., 1969, B25, 800. [41 Acta cryst., 1965, 18, 777.
25.8. Сульфиды меди
Система Си—S довольно сложная, а структуры CuS и Cu2S
таковы, что эти соединения нельзя описать просто как сульфи-
ды меди(II) и медиA). Устойчивые при атмосферном давлении
фазы перечислены в табл. 25.5. Соединение CuSi,9 описано в
разд. 17.1.7.
Необычна уникальная структура ковеллина, который являет-
ся проводником и может быть измельчен в голубой порошок.
Одна треть атомов меди окружена тремя соседними атомами
серы (на расстоянии 2,19 А), расположенными в углах тре-
угольника, а вокруг оставшихся атомов меди размещено по че-
тыре атома серы, образующих тетраэдры (на расстоянии
2,32 А). Более того, две трети атомов серы объединены в груп-
пы S2, такие же, как и в пирите, так что если это соединение
рассматривать как соединение с нормальными ковалентными
о гс
Zc
Рис. 25.18. а—в — вертикальные проекции кристаллических структур СиС12,
Си2(ОНKВг, Си2(ОНKС1 (атакамит) соответственно; г—е — проекции фраг
ментов этих структур (включающие атомы, заштрихованные на рис. а—в),
изображающие слой атомов металла (самые малые кружки) в плоскости
рисунка и плотноупакованные слои атомов галогенов (или атомов галогенов
и ОН-групп) над и под плоскостью рисунка. Самые крупные кружки изобра-
жают атомы галогенов. Сплошные линии выделяют короткие связи Си—ОН
или Си—X, а жирные штриховые линии — удлиненные связи Си—ОН или
Си—X (см. текст).
25.8. Сульфиды меди 281
Таблица 25.5. Сульфиды меди
CuS (ковеллин) устойчив ниже 500 °С [1]
Cui.rsS (анилит) [1а]
Си.. 8S (дигенит) [2]
73°С
кубическая
метастабильная
низкотемператур-
ная форма
(двойниковая ромбоэдрическая
сверхструктура)
(джарлеит) [3]:
II
II
100°С
(сложная структура) метастабильная
тетрагональная
\ 128 атомов S на ячейку) [4]
Cu2S (халькозин)
104°С ., 470°С
кубическая высоко-
температурная
форма (КПУ
атомов S)
III
II
моноклинная [6]
гексагональная [7] )
связями, то его формулу следует представить как
Cu4ICu2II(S2JS2.
В апилите атомы меди расположены упорядочение» в пусто-
тах кубической упаковки атомов серы; три другие фазы с
формулами, близкими к CU2S, имеют практически одну и ту же
высокотемпературную форму, построенную также на основе ку-
бической упаковки атомов серы с атомами меди, распределен-
ными статистически, по всей вероятности по тетраэдрическим
пустотам. Эта фаза Cu2_xS устойчива при л: = 0,0—0,2. В высо-
котемпературном дигените в среднем на каждый тетраэдр S4
приходится 9/10 атомов меди, расположенных, однако, не в
центрах тетраэдров. В промежуточной метастабильной форме
некоторые атомы меди сдвинуты так, что часть тетраэдров S4
остается незанятыми, а в занятых атомы Си статистически рас-
пределены по четырем возможным эквивалентным сдвинутым
относительно центра тетраэдра позициям.
Необычайно сложная структура соединения Cui^S-III не
изучена, но в метастабильной тетрагональной форме осущест-
вляется почти идеальная кубическая плотнейшая упаковка ато-
мов серы, а атомы меди занимают тригональные пустоты
(Си—3S 2,31 А); атом серы окружен шестью атомами меди,
282 25. Медь
находящимися в вершинах тригоналыюй призмы. Атомы меди
немного смещены в сторону тетраэдрических пустот, и в допол-
нение к трем атомам серы в окружение меди входят два сосед-
них атома меди на расстоянии 2,64 А п еще два на расстоянии
2,97 А. В гексагональном халькозине-П атомы меди статисти-
чески распределены по трем типам полостей в гексагональной
плотнейшей упаковке атомов серы. В элементарной ячейке, со-
держащей 2 атома серы, в среднем наблюдается следующее
распределение атомов меди: 1,74 атома Си имеют КЧ 3 (Си—S
2,28 А), 1,42 атома Си располагаются в полостях с тетраэдри-
ческой координацией, причем Си расположен не в центрах
пустот (Си—3S 2,59 А; Си—IS 2,15 А), и 0,84 атома Си имеют
КЧ 2 и располагаются на ребрах тетраэдров S4 (Си—2S
2,06 А). Кроме того, расстояние между 3- и 4-координировапны-
ми атомами меди составляет всего 2,59 А.
Тщательное исследование строения низкотемпературной мо-
дификации халькозина, которую ранее относили к ромбической
сингонии с 96 молекулами Cu2S в элементарной ячейке, показа-
ло, что истинная его симметрия не выше моноклинной. В пред-
ложенной структуре, содержащей в элементарной ячейке 48 еди-
ниц Cu2S, все атомы меди имеют КЧ 3 и располагаются в
большинстве случаев в плоскости или вблизи плоскости тре-
угольных полостей гексагональной плотпейшей упаковки ато-
мов серы. Некоторые детали этой структуры, а именно два
больших расстояния Си—S B,88 А, ср. со средним 2,33 А)
приводят к мысли, что хотя предложенная структура и близка
к истинной, но и в ней могли сохраниться некоторые неточности
из-за наличия субмикроскопического двоиникования.
Физические свойства этих соединений (металлический блеск,
полупроводниковые свойства), в некоторых случаях пластич-
ность, малое расстояние между атомами меди в некоторых
фазах, а также большое разнообразие в количестве связей, об-
разуемых ими, указывают на то, что их следует рассматривать
как полуметаллические фазы, что также относится и к некото-
рым из многочисленных сложных сульфидов. Учитывая, что
структура халькопирита CuFeS2 [8] (со сверхструктурой цинко-
вой обманки) воспроизводится и в CuAlS2, и в CuGaSo, можно
приписать ему формулу CuIFeIIIS2 с тетраэдрической координа-
цией Си1; однако в штромейрите AgCuS [9] медьA) имеет уже
треугольную координацию. Приписать меди определенную сте-
пень окисления в многочисленных сложных сульфидах (напри-
мер, CuFe2S3, кубаните (разд. 17.2.3), Cu3Fe4S6, Cu5FeS4,
борните [10] и Cu9Fe9Si6 [11]) так, чтобы она согласовывалась
со стереохимией Cu(I) и Си(II), не представляется возможным.
Литература. [1] Am. Mineral., 1954, 39, 504. [la] Acta cryst., 1970, B26, 915.
f2] Am. Mineral., 1963, 48, 110. [3] Acta Chem. Scand., 1958,"l2, 1415. [4] Z. Kris-
25.9. Структурная химия соединений золотаAИ) 283
tallo<>T., 1967, 125, 404. [5] Acta cryst., 1964, 17, 311. [6] Nature (Phys. Sci.),
197f 232. 69. [7| Min. Soc. America Special Paper, 1 A963), 164. [81 Acta cryst.,
1973. B29, 579. [9] Z. Kristallogr., 1955, 106, 299. [10] Acta cryst., 1975, B31,
2268. fill Acta cryst., 1973, B29, 2365.
25.9. Структурная химия соединений золота(Ш)
В этом состоянии окисления золото образует четыре компланар-
ные (dsp2) связи; сведения о структурной химии золота(III)
можно получить в результате исследования а) соединений, со-
держащих только Аи (III); б) соединений, содержащих наряду
с Аи(III) и АиA); в) содержащих одновременно Аи(III) и
Образование оксо- или гидроксопроизводных (в любых из
его состояний окисления) не очень характерно; соединения
Au2O, AuOH и Au(OHK неизвестны, однако Аи2О3 подробно
описан; получены также многочисленные комплексные оксиды.
Определены структуры Au2O3 [la], AuOCl [16] и Na6Au206
[1в], а для других соединений получены данные по порошкограм-
мам [1г]. В Аи2О3 три из четырех, лежащих в одной плоскости
V
2,04 А
о-
1,93
-Аи-
-о;
о
АиОС!
Аи2О3
атомов О, окружающих каждый из атомов золота, связаны
с тремя атомами Аи, а четвертый атом кислорода является
концевым, так что образуется трехмерная C, 4)-связанная сет-
ка. Похожее распределение связей найдено в AuOCl; отличие
состоит только в том, что все атомы С1 являются концевыми.
Атомы кислорода и золота образуют трехмерную 3-связанную
сетку, состоящую из системы 4- и 12-членных колец [1д]. В со-
став соединений Na6Au206 входят ионы (Аи2О6N~ с плоскостной
структурой, аналогичной структуре молекулы Аи2С16, описы-
ваемой НИЖе (Аи—Оконц 2,12 А, Аи —Омоет 2,17 А).
Квадратно-плоскостное строение анионов [АиХ4]~ было под-
тверждено при исследовании K(AuF4) [2а] (Аи—F 1,95 А),
K[Au(NO3L] (разд. 18.8.7), (As(C6H5h) (АиСЦ) [26] (Аи—С1
2,27 A), K[Au(CNL]-H2O [2в] (Аи—С 1,98 А) и HAu(CNL-2H2O
[2г]. Последнее соединение — сильная кислота, получаемая про-
пусканием раствора KAu(CNL через смолу с обменом К+ на
284 25. Медь
Н+, и две молекулы Н2О присутствуют в кристалле в виде иона
Н5Ог+. Планарные ионы, содержащие Аи111, входят так-
же в состав Cs2(AuICl2) (АишС14) (разд. 10.1.9) и
K5[AuI(CNJ]4[AuIII(CNJl2]-2H2O [2д] — соединение черного цве-
та при обычных температурах и темно-красного при 77 К— и
в состав (гШ4)б(АиСЦ)з(А^2С15) [2е]. Последнее соединение
темно-красного цвета; оно содержит планарные ионы
и планарные мостиковые ионы Ag2Cl53~:
е
CI
С1
^,46 А
CI
2,69 А
CI
CI
Известно строение двух галогенидов золота(III). Кристалл
A11F3 имеет уникальную спиральную (цепочечную) структуру,
образованную планарными группами AuF4, сочлененными через
цис-атомы фтора (рис. 25.19) [За]. Длины связей• Аи—F в цепях
составляют 1,91 и 2,04 А (мостиковая
связь), а валентный угол при фторе
равен 116°. Более слабые связи длиной
2,69 А завершают октаэдрические
группировки вокруг атомов Аи(III).
Плотность хлорида золота (III) в па-
рообразном состоянии между 150 и
260 °С указывает на образование мо-
лекул Аи2С16, а повышение точки ки-
пения брома при добавлении бромида
означает, что это последнее соедине-
ние также существует в растворе в
виде димерных молекул Au2Br6. Рент-
геноструктурное исследование [36]
показало, что в кристаллическом
АиС13 сохраняются планарные ди-
меры:
Рис. 25.19. Спиральная мо-
лекула AuF3: поперечное се-
чение цепи.
90= ( Au. )86
CI
2,34 A
С1
2,24 А
С1
Из аналогичных плоскостных димеров с мостиковыми ато-
мами Вг состоит и Au2Br2(C2H5L [4]; компланарное расположе-
ние четырех связей золота (III) зафиксировано также в
АиВг3Р(СНз)з [5] и соединениях а — в.
25.9. Структурная химия соединений ао.юта(Ш) 285
По-видимому, в в имеются дополнительные слабые аксиаль-
ные связи (как в соединениях Ni и Pt, где расстояния М—I
составляют 3,21 и 3,50 А соответственно). Сумма «ковалентных
радиусов» дает для нормальной связи Аи—I длину 2,73 А.
Вг'
а
¦Аи:
-с4н9
(СН3J:(СН3)
As ; А
Ли
5^СЬ-з
VS:f,
6 [7]
(ф-фенил)
в
As ; As
(СН3J ; (СН3J
^—3,35 А
[8]
При действии AgCN на Au2Br2(C2H5L получается цианид
с молекулярной массой, отвечающей тетрамеру. Описанная вы-
ше димерная структура с мостиковыми атомами X вполне воз-
можна для соединения брома, поскольку валентный угол атома
галогена может быть близок к 90°, но у цианосоединения ана-
логичной структуры быть не может, так как атомы, связанные
CN-группами, должны лежать на одной прямой с атомами С
и N. В результате это соединение образует квадратную мо-
лекулу типа г, структура которой установлена для случая
R = h-C3H7 [9].
R
R—Аи—(
т
N
111
С
I
R— Аи<-
I
R
в
R
-*Аи—R
!
С
1!!
N
1
:-Au-R
I
R
C4H
;n-c:
4H9
-S
.,^-С4Н9
s с4н9
(Au'Br2)
Диметилзолотогидроксид [(CH3JAu0H]4 также представля-
ет собой циклический тетрамер (д), но здесь наблюдается
странная асимметрия общей конфигурации; валентные углы при
286 25. Медь
атоме золота(Ш) лежат в интервале 81 —106°; мало понятно и
большое различие в длинах [10] связей Аи—О: 1,87—2,40 А.
К примерам соединений, одновременно содержащих Au(I) и
Au(III), относятся Cs2(AuCl2)(AuCl4) и (CeHsCHzhS-AuBrs,
которые уже обсуждались выше, и соединение е [11]. Все эти
соединения содержат атомы Au(I), образующие по две коллине-
арные связи, и атомы Аи(III), образующие по четыре компла-
нарные связи. В отличие от черного Cs2(AuCl2) (АиСЦ) в соеди-
нении е, имеющем форму желтых иголок, нет взаимодействия
между Au(I) иАи(Ш).
В кристалле [Аи111 (диметилглиоксим^КАи'СЛг) атом Аи(Ш)
помимо четырех компланарных связей образует две дополни-
тельные слабые аксиальные связи. Этот кристалл состоит из
плоских ионов [Aum(DMGJ]+ и линейных ионов (А^СЬ)",
расположенных таким образом, что в кристалле возникают це-
пи из чередующихся атомов Au(I) и Аи(III) с расстоянием ме-
талл — металл 3,26 А [12].
Литература, [la] Ada cryst., 1979, В35, 1435 [16] Acta cryst., 1979, B35, 2380.
[1в] Naturwiss., 1976, 63, 387. |lr] Z. anorg. allg. Chem., 1968, 359, 36. [1д] АСА
Monograph No. 8 A979), p. 16. [2a] J. Chem. Soc, A 1969, 1936. [26] Acta cryst.,
1975, B31, 2687. [2в] Acta cryst., 1970, B26, 422. [2r] Acta cryst., 1972 B28,
1629. [2д] Acta cryst., 1972, B28, 2635. [2e] Acta cryst., 1975, B31, 2149. [3a] J.
Chem. Soc, A 1967, 478. [36] Acta cryst., 1958, 11, 284. [4] J. Chem. Soc, 1937,
1690. [5] J. Chem. Soc, 1946, 428. [6] Inorg. Chem., 1968, 7, 810,. [7] Inorg. Chem.,
1968, 7, 2636. [8] Inorg. Chem., 1969, 8, 1661. [9] Proc. Roy. Soc, 1939, A 173,
147. [10] J. Am. Chem. Soc, 1968, 90, 1131. [11] Inorg. Chem., 1968, 7 805.
fl2] J. Am. Chem. Soc, 1954, 76, 3101.
26. ЭЛЕМЕНТЫ ПОДГРУПП
ПБ, ШБ и IVB
26.1. Введение
Перед детальным обсуждением структурной химии этих элемен-
тов необходимо обратить внимание на одну особенность, прису-
щую многим из них. Уже отмечалось ранее, что элементы Си,
Ag и Аи могут использовать для связи d-электроны с главным
квантовым числом на единицу меньшим, чем у s- и р-орбита-
лей, причем медь может терять 1 или 2 Зй!-электронов и обра-
зовывать ионы Си2+ и Си3+. Однако некоторые элементы после-
дующих Б-подгрупп ведут себя совершенно иначе. Кроме обра-
зования обычного иона Млч~ с потерей всех N электронов внеш-
ней оболочки (N — номер группы в периодической системе) мо-
жет происходить потеря только р-электронов, а пара s-электро-
пов оставаться связанной с ядром в виде так называемой инерт-
ной пары. В случае одноатомного иона это означает, что М.
должен иметь по крайней мере 3 электрона в валентной обо-
лочке и, следовательно, необходимо искать подтверждения фак-
та существования ионов М* у металлов группы ШБ и ионов
М-:" в группе IVB. В состоянии одноатомного газа ртуть сохра-
няет структуру 78 B); тогда ион (Hg—HgJ+ (если бы такой
свободный ион существовал) сохранял такой же эффективный
атомный номер (к этому вопросу мы вернемся позже). Чрез-
вычайно низкую степень ионизации галогенидов ртути Сиджвик
рассматривал как доказательство инертности пары Gs-электро-
нов Hg, однако нет сомнения в том, что в кристаллическом
HgF2 (структура флюорита) присутствуют ионы Hg2+. Дока-
зательство существования ионов можно получить, изучая свой-
ства соединений в растворах или в расплавах, а также природу
их кристаллических структур.
26.1.1. Ga+, In+ и Т1+. В газовой фазе обнаружены все монога-
логениды галлия, причем их можно получить путем нагревания
смесей Ga+GaF2 в камере Кнудсена или путем испарения
GaCl2; однако только Gal (точнее Gali.oe) [1] был выделен в
твердом состоянии (его структура неизвестна). Восстановление
дибромида металлом идет только до стадии образования
GaBri,3o [2]. Синтезированы Ga2O и Ga2S, однако их структуру
также еще требуется определить. Известно, однако, что ионы
Ga~ существуют в кристаллическом «дихлориде» Ga+(GaCl4)~
290 26. Элементы подгрупп ЦБ, ШБ и IVБ
наблюдается совершенно другая картина. Устойчивой формой
оказывается РЬ-~г; он не обладает восстановительными свойст-
вами. Отсутствуют доказательства возможности существования
иона РЬ1г в водном растворе, однако он заведомо существует в
таких кристаллических соединениях, как РЬО2 (структура ру-
тила).
26.2. Структурная химия цинка
Структура многих простых соединений элементов группы ПБ
уже была описана в предыдущих главах. Кадмий, как и цинк,
проявляет единственное валентное состояние, и его структурная
химия не вызывает особого интереса; поэтому далее сосредото-
чим основное внимание на соединениях цинка и ртути.
При простом геометрическом подходе структурная химия
цинка кажется достаточно простой. Ведь для этого элемента
известно только одно валентное состояние Zn", причем в боль-
шинстве молекул и кристаллов этот металл образует четыре
тетраэдрических или шесть октаэдрических связей; две коллине-
арные связи образуются в газообразном состоянии в молекулах
ZnX2 и, по-видимому, — в Zn(CH3J; ниже будут упомянуты не-
которые примеры соединений с КЧ 5.
Сравнение структур соединений бериллия, магния, цинка и
кадмия позволяет выявить ряд интересных закономерностей;
ртуть не включена в этот ряд, поскольку структурная химия
цинка и ртути имеет мало общего, если не принимать во внима-
ние, что одна из форм HgS имеет структуру цинковой обманки,
а также то, что обе модификации Znl2 и одна из модификаций
Hgl2 построены из «супертетраэдров» М41ю (разд. 5.2.1). Среди
приведенных ниже соединений выделены (курсивом) соедине-
ния, где металл имеет тетраэдрическую координацию, в осталь-
ных случаях металл окружен шестью октаэдрически располо-
женными атомами.
BeO MgO ZnO CdO
BeS MgS ZnS CdS
BeF2 MgF2 ZnI-2 CdF2
BeCU MgCl, ZnCh CdCU
$-Be~(OHJ Mg(dll), Zn(OHJ Cd(OHJ
Соединения цинка и бериллия, за исключением галогенидов
(их строение обсуждалось в гл. 9), изоструктурны. Для цинка
октаэдрическая координация реализуется в ZnF2, а также в
ZnCOs, ZnWO4, ZnSb2O6, Zn(C104J-6H20 и ZnSO4-7H2O (каж-
дое указанное здесь соединение изоструктурно соответствующе-
му соединению магния). Сравнение этих соединений с соедине-
ниями бериллия и кадмия невозможно для всех солей рассмат-
риваемого ряда, поскольку бериллий либо не образует анало-
26.2. Структурная химия цинка 291
гичных соединений, либо их структура неизвестна. К соединени-
ям, в которых Zn, как и Be, координирует четыре тетраэдрическн
расположенных атома кислорода, относятся ZnO, Zn(OHJ,
Zii2SiO4 (в то время как магний имеет КЧ 6 в Mg2Si04), слож-
ные оксиды, например K2Zn02 (цепи тетраэдров ZnO4 с общи-
ми ребрами) [1] и SrZnO2 (слои тетраэдров с общими верши-
нами) [2]. Эти различия в координационных числах при коор-
динации кислорода не вызваны изменением относительных раз-
меров ионов в ряду Ве2+, Mg2+ и Zn2+, ведь у последних двух
гонов радиусы приблизительно равны; более того, Mg2+ в MgCb
образует 6 связей с С1~, тогда как цинк в ZnCl2 образует 4 свя-
зи. Тетраэдрическая направленность связей с С1 имеет место
также в ZnCl2- 1'/зН2О [3] и ZnCl2- '/гНСЬНгО [4]. В первом из
этих соединений все атомы хлора дают связи с 2/3 атомов цин-
ка с образованием тетраэдрических группировок ZnCl4, связан-
ных двумя общими вершинами и образующих цепочки (ZnCl3)n"~.
Оставшиеся атомы Zn располагаются между этими цепочками
и имеют октаэдрическое окружение из 2С1 и 4Н2О; следует от-
метить, что более электроотрицательный О (воды) входит в
состав октаэдрических координационных полиэдров. Структур-
ную формулу соединения можно записать в виде (ZnTeTpCl3J-
• [ZnOKT(H2OL], хотя такая запись и не отражает фактические
координационные числа двух типов атомов (ионов) Zn. Во вто-
ром соединении тетраэдры ZnCl4 имеют по 3 общие вершины и
образуют трехмерный каркас состава (Zn2Cl5)nn~, вокруг кото-
рого уже располагаются ионы (Н5О2)+, т. е. состав этого тет-
раэдра (Zn2Cl5)-(H5O2)+ (гл. 15).
По-видимому, тетраэдрические связи Zn—О имеют менее вы-
раженный ионный характер, чем октаэдрические. Понятно, что
характер связей Zn—О должен зависеть и от типа окружения
атомов кислорода, хотя удовлетворительное обсуждение этого
вопроса пока еще невозможно. В ZnO (а) атом О образует
а 6 |
-Zn
—Zn
Si;
Zn-
4 эквивалентные связи, в Zn2Si04 (б) он связан с 2 Zn и 1 Si,
а в ZnCO3 (в)—с 2 Zn и 1С (иона СО32~, в котором связи
С—О имеют ковалентный характер). Во многих кристалличе-
ских кислородсодержащих соединениях цинка осуществляются
оба типа координации атома цинка (и тетраэдрическая, и окта-
эдрическая); к таким соединениям относятся Zn2Mo3O8,
19*
292 26. Элементы подгрупп ЦБ, 111Б и IVE
Zn2(OHJSO4, y-z(PO4J, ZnMn3O7-3H2O, Zn5(OH)«Cl2-H2O
и Zn5(OHN(CO3J. Структуры гидроксосолей описаны в других
главах. В кристаллах некоторых соединений существует явное
различие в длине тетраэдрических и октаэдрических связей
Zn—О, например 2,02 и 2,16 А в Zn5(OH)8Cl2-H2O, 1,95 и
2,10 А в гпдроксокарбонате и 1,96 и 2,10 А в Zn3(PO4J-4H2O
[5]. В ZnMn3O7-3H2O в октаэдрический координационный поли-
эдр цинка входят три атома кислорода молекул Н2О (Zn—О)
-—-2,15 А) и три атома кислорода слоя Mn3O7 (Zn—О ~ 1,95 А);
в обращенной шпинели Zn(Sbo,67Zni,33H4 различие в длине
связей Zn—О двух типов, по-видимому, мало существенно (обе
величины близки к 2,05 А) [6]. По всей вероятности, нет смыс-
ла обсуждать этот вопрос более детально, пока не будет полу-
чена более точная информация о длинах связей.
Сходные различия в характере связей М—О наблюдаются и
для оксосоединений двухвалентного свинца. Многие безводные
оксосоли РЬ" имеют такую же структуру, как и соответствую-
щие соли бария (иногда также стронция и кальция):
КЧ атома металла
PbSO4) BaSO4 12
PbCO3, BaCO3 9
PbWO4, Ba\VO4 8
Отсюда можно сделать вывод, что в этих (неокрашенных) со-
единениях свинец присутствует в виде ионов РЬ2+, радиус ко-
торого близок к радиусам Ва2|~ и Sr2+. Интересно сравнить с
этими соединениями окрашенный РЬО (две формы), где РЬ
имеет только 4 ближайших соседних атома в противополож-
ность структуре бесцветных ВаО и SrO, построенных по типу
NaCl.
Литература. [1| Z. anorg. allgem. Chem., 1968, 360, 7. [2] Z. anorg. allgem.
Chem., 1961, 312, 87. [3] Acta cryst., 1970, B26, 1679. [41 Acta cryst., 1970, B26,
1544. [5] Acta cryst., B31, 2026. [61 Acta cryst., 1963, 16, 836.
26.2.1. Цинк с пятью ковалентными связями. К числу мономер-
ных хелатных комплексов с тригонально-бипирамидальной
структурой относятся [Zn(tren)NCS]SCN [1] и ZnCl2(terpy)
[2] (рис. 26.3, а). На стереохимию этих комплексов сильно
влияет строение полидептатного лиганда; однако известны и
другие соединения, для которых, подобно уже рассмотренным
выше соединениям двухвалентной меди, существенно учитывать
характер структуры в целом. Некоторые хелаты, например
8-гидроксихинолинат [3], образуют дигидраты, состоящие из
октаэдрических молекул (рис. 26.3,6), тогда как для других
известны моногидраты, конфигурация молекул в которых имеет
промежуточный характер между квадратно-пирамидальной и
26.2. Структурная химия
цинка
293
тригонально-бипирамидальной. В молекуле моноаквабисацетил-
ацетоната (рис. 26.3, в) [4] конфигурация приближается к пер-
вой из двух указанных, причем все расстояния Zn—О равны
2,02 А, а атом Zn приподнят над основанием пирамиды на
0,4 А. Однако, вернувшись к гл. 3, можно напомнить, что при
выборе описания координационных многогранников этого типа
следует допускать известный произвол. Конфигурация моногид-
ратного комплекса с М,]\"-дчсалицилиденэтилендиамшюм отно-
2ДЗА
Z,38A
г,звА
г
1.97А
\Z,10Aj
д е
Рис. 26.3. Молекулы, в которых цинк образует 5 или 6 связей.
сится к рассматриваемому общему типу, причем атом Zn при-
поднят над плоскостью квадрата N2O4 на 0,34 А [5]. Причина
предпочтительного образования этими хелатами моногидрата,
а не дигидрата, по-видимому, связана со способом упаковки мо-
лекул в кристалле. В кристаллах последнего соединения имеет-
ся сильная водородная связь между Н2О и двумя атомами кис-
лорода ближайшей молекулы (О—Н—О ~2,5 А), и именно
это обстоятельство может служить решающим фактором при
определении состава и структуры кристаллического соединения.
В предыдущих примерах, касающихся мономерных комп-
лексов, КЧ цинка достигает 5. В некоторых соединениях пятая
связь образуется в результате димеризации (рис. 26.3, г); этот
тип структуры уже упоминался в связи с некоторыми комплек-
сами Си". В диэтилдитиокарбамате (рис. 26.3, г) [6] одна из
четырех коротких связей Zn—S определенно относится к ато-
му S второй молекулы димера, тогда как одна из связей Zn—S
«своей» половины димера сильно ослаблена B,82 А). Несколь-
ко иначе построен бис-1М-метилсалицилалдиминат цинка (рис.
294 26. Элементы подгрупп ПБ, ШБ и 1УБ
26.3,5), где цинк также образует 5 связей, что приводит к би-
ядерному комплексу [7]; сответствующие соединения марганца
и кобальта изоструктурны этому комплексу. Несколько неожи-
данное строение имеет безводный Zn(acacJ. Как уже отмеча-
лось, олигомерные молекулы [Со(асасJ]4 и [Ni(acacJ]3 стро-
ятся соответственно из четырех и трех октаэдрических коорди-
национных групп. Соединение цинка также построено в виде
тримера, однако его структура не похожа на линейно построен-
ный комплекс никеля. Центральный атом Zn образует октаэд-
рически направленные связи, а концевые атомы Zn остаются
пятикоординационными (рис. 26.3, е), причем их координацион-
ные полиэдры близки к тригональной бипирамиде [8].
Литература. [1] J. Am. Chem. Soc, 1968, 90, 519. [2] Acta cryst., 1966, 20, 924.
[3] Acta cryst., 1964, 17, 696. [4] Acta cryst., 1963, 16, 748. [5] J. Chem. Soc,
A 1966, 1822. [6] Acta cryst., 1965, 19, 898. [7] Acta cryst., 1966, 5, 400,
[8] Acta cryst., 1968, B24, 904.
26.2.2. Координационные соединения цинка, образующие тетра-
эдрически и октаэдрически направленные связи. Такие лиганды,
как O2PR2, S2CR2 и S2PR2, могут вести себя и как простые мос-
а
С/С~
N[CH3)z
—Zn—s^
у
s
—Zn—Sv
5-f_
-Zn
4Zn-
-N-N
OC2H5
Рис. 26.4. Тетраэдрические связи цинка в Zn[S2CN(CH3Jl2 (а) и Zn(S2COC2H5J
(б) и октаэдрические связи в Zn(N2H4JCl2 (в).
тиковые группы, и как хелатные лиганды и, таким образом, со-
здавать большое число разных по строению островных и беско-
нечных комплексов. Диметилдитиокарбамат цинка образует ди-
26.3. Структурная химия ртути 295
мерные молекулы (рис. 26.4, а), в которых лиганды координи-
рованы обоими способами и создают вокруг Zn несколько не-
правильное тетраэдрическое окружение [1]. Диэтилтиофосфинат
образует димеры такого же типа (замена S2CN(CH3J на
S2P(C2H5J) [2]. Возможно, естественно, и образование метал-
лоциклов большего размера, как, например, в тетрамерном изо-
пропилксантате цинка [3]. В разд. 19.6.15 были приведены схе-
мы строения двух различных типов цепей в соединениях цинка.
Если все лиганды дают по две мостиковые связи, то может воз-
никать слой, в котором атомы Zn имеют по 4 связи, простейшей
моделью которого является плоская сетка 44 (рис. 26.4, б). Эта
структура осуществляется в этилксантатах цинка, кадмия и
ртути [4]. Тетраэдры S4, образуемые вокруг атома металла,
в ряду соединений Zn, Cd, Hg все более отклоняются от пра-
вильного многогранника, что можно увидеть из сравнения наи-
большего и наименьшего значений углов между тетраэдрически-
ми связями, составляющими 115, 121, 148 и 103, 94, 84 . В со-
единениях ртути длины связей, образующих наибольший угол,
составляют 2,42 А, а прилегающие к наименьшему углу имеют
в среднем длину 2,82 А.
В солях [Zn(N2H4JX2] молекулы гидразина соединяют ато-
мы Zn в бесконечные цепочки (рис. 26.4, в), а два лиганда X
дополняют координационное число цинка до шести (октаэдр).
В хлориде [5] расстояния Zn—СГ неожиданно велики B,58 А)
по сравнению со средним значением B,25 А) для тетраэдриче-
ского комплекса ZnCl42~ в (NH^ZnCl^Cl и т. д. Подобная же
длинная связь Zn—С1 B,53 А) оказывается в октаэдрической
молекуле комплекса хлорида цинка с биуретом, имеющем
транс-строение [6], причем H2N—СО—NH—СО—NH2 играет
роль бидентатного лиганда по аналогии с асас в Zn(acacJ(H2OJ
(рис. 26.3,6). Согласно данным работы [7], в бисгидразинизо-
тиоцианате длины всех 6 связей Zn—N одинаковы B,17 А).
Литература. [1] Acta cryst., 1966, 21, 536. [2] J. Chem. Soc, A 1970, 714.
[3] Ada cryst., 1972, B28, 1697. [41 Acta cryst., 1980, B36, 1367. [51 Acta cryst.,
1963, 16, 498. [61 Acta cryst., 1963, 16, 343. [7] Acta cryst., 1965, 18, 367.
26.3. Структурная химия ртути
Ртуть образует два ряда соединений формально одновалентной
и двухвалентной ртути; однако, строго говоря, первые не явля-
ются соединениями одновалентной ртути в том смысле, в ка-
ком, например, соединения медиA) являются производными
одновалентной меди. Многие элементы образуют соединения,
в которых присутствуют связи металл — металл, однако Hg
единственна в своем роде, поскольку она образует кроме Hg2+
и обычных соединений ртути(II) ряд соединений с группиров-
296
26. Элементы подгрупп 11Б, 1ПБ и IV Б
кой (—Hg—Hg—). Правда, в расплаве Zn/ZnCl2 был обнару-
жен нон Zn22+ [1], а в Cd2(AlCl4J, по-видимому, присутствуют
Cd22~ [2], однако только Hg22L устойчив в подкисленных вод-
ных растворах и простых солях.
26.3.1. Катионы ртути. Ртуть — уникальный элемент, поскольку
образует соли, содержащие линейные системы непосредствен-
но связанных между собой атомов металла. Эти соли, подобно
солям, содержащим в качестве катионов серу, селен и теллур,
образуются в сильнокислых неводных растворителях и устойчи-
вы в кристаллическом состоянии в соединениях с такими анио-
нами, как (А1С14)~ или (AsF6)~. Ртуть растворяется в HSO3F
с образованием желтого раствора, содержащего катион Hg32+;
структурно изучено соединение Hg3(AlCl4J [3], полученное при
взаимодействии Hg и HgCl2 в расплаве А1С13. Это соединение
состоит из молекул а; аналогичная линейная группа Hg32+ най-
AI
С
С1-
2,56 А
-Hg llg-
2,54 А
-Hg Cl
2,) 8 А
Al
дена в Hg3(AsF6J [4]. Темно-красные кристаллы Hg4(AsF6J
[5] содержат также линейную группу Hg42+ с несколько более
длинной центральной связью Hg—Hg B,70 А). Самое замеча-
тельное из соединений этой группы с эмпирической формулой
Hg3AsF6 получено при взаимодействии Hg и AsF5 в жидком
SO2. Золотые кристаллы Hg3AsF6 похожи по внешнему виду
на металлические и обладают анизотропной сверхпроводимо-
стью. Кристаллы содержат бесконечные линейные взаимно пер-
пендикулярные цепочки атомов Hg, внедренные в трехмерный
каркас ионов (AsF6)^. Цепочки расположены параллельно тет-
рагональным осям а, и, так как длина связи Hg—Hg B,64 А)
несоразмерна с а = 7,54 А, данной структуре отвечает формула
Hg2.s6AsFfi G,54:2,64 = 2,86) [6]. Хотя группы Hgra принято
рассматривать как катионы Hg32^ и Hg42 н, их «соли» содержат
ковалентные молекулы, как и соединения одновалентной ртути;
единственное соединение, не содержащее островных молекул, —
это Hg3AsF6, в котором Hg формально имеет заряд +7з-
Литература. [11 J. Chem. Soc, A 1967, 1122. [2] J. Am. Chem. Soc, 1961, 83,
76. [3] Inorg. Chem., 1972, 11, 833. [41 Inorg. Chem., 1973, 12, 1343. [51 Chem.
Comm., 1973, 723. [6] Inorg. Chem., 1978, 17, 646.
26.3.2. Соединения одновалентной ртути. В водном растворе ион
«одновалентной» ртути представляет собой не Hg+, a Hg22+
(вероятно, (Н2О—Hg—Hg—ОН2J+), и насколько известно, все
соединения одновалентной ртути содержат пару атомов Hg в
26.3. Структурная химия ртути 297
Таблица 26.1. Межатомные расстояния в соединениях ртути(I)
Соединения
I!g,>F,.
HgXL
Ilg2 В г,
H<j2I2
Hr2(i\O3J-2H2O
IIg,,(CIO4h-4H2O
Hg2(Br03J
Hg2SO4
Hg2(OOCCF3J
(Hg2K(As04J )
Расстояние. А
Hif—Il«
2,51
2,53
2,49
2,72
2,51
(средн.)
114-—X
2,14
2,43
2,71
2,68
Hg-2O
H(J-4X
2,72
3,21
3,32
3,51
2,14
(средн.)
Литература
Chem. Comm., 1971,
466
J. Am. Chem. Soc,
1926, 48, 2113
Acta cryst., 1975, B31,
2174
Acta Chem. Scand.,
1966, 20, 553
Acta Chem. Scand.,
1967, 21, 2834
Acta Chem. Scand.,
1969, 23, 1607
Acta cryst., 1974, ВЗО,
144
Acta cryst., 1973, B29,
1666
составе линейных фрагментов X—Hg—Hg—X, в которых обра-
зуются две коллинеарные sp-связи, как и в молекулах соеди-
нений двухвалентной ртути X—Hg—X. Правда, когда речь идет
о соединениях одновалентной ртути, связи ртути не всегда
строго коллинеарны; в нитрате угол Hg—Hg—ОН2 составляет
167,5°, а в безводном арсенате углы между связями лежат в
диапазоне 146—157°. Структурные данные для некоторых
простых соединений приведены в табл. 26.1; оксид и гидрокенд
ртути (I) неизвестны. Даже Hg2F2 имеет такую же линейную
молекулярную структуру, как и другие галогениды; (гидратиро-
ванные) нитрат и перхлорат содержат не ионы (Hg—HgJ+,
а линейные группы [Н2О—Hg—Hg—OH2]2h. Поскольку в бли-
жайшем окружении атома ртути в этих соединениях имеется
только два атома, ее координационная группа по необходимости
дополняется некоторым числом более удаленных атомов. Та-
ким путем в галогенидах Hg2X2 достигается искаженно-октаэд-
рическая координация ртути, однако число и расположение этих
дополнительных атомов в разных кристаллических соединениях
могут быть различными. В бромате, состоящем из линейных
молекул О3Вг—Hg—Hg—ВгО3, два более удаленных атома О
при включении их в координационную группу ртути дополняют
координацию атома Hg до сильно искаженной тетраэдриче-
ской. В арсенате более прочные связи Hg—О образуют цепоч-
298 26. Элементы подгрупп IIБ, IIIБ и IVБ
ки а, а две дополнительные связи B,4 ч-2,7 А) с атомами О
других цепочек завершают тетраэдрическую координацию рту-
ти. Сульфат построен из бесконечных линейных молекул б,
а более удаленными соседями атомов Hg являются три атома
О О— Hg-Hg—О о'
As As — 0^ О
2,24
О О—Hg —Hg —О О —Hg—Hg —О О —
\/
As
а
о
о —
О смежных цепочек, находящиеся на расстояниях 2,50, 2,72 и
2,93 А.
Наиболее интересная структура обнаружена у комплекса
[(Hg2bO2H]Cl3 [1], который был найден в минерале эглесто-
ните. Катион состоит из четырех взаимопроникающих кубиче-
ских A0,3)-сеток (разд. 3.9.4), в которых атомы О образуют по
три связи, причем между атомами кислорода находится пара
атомов Hg (>О—Hg—Hg—О<), расположенных вдоль каж-
дого звена сетки (Hg—Hg 2,52 A, Hg—О 2,17 А). Сетки со-
единены между собой связями О—Н—О B,6 А) и расположен-
ными в полостях ионами Cl~ (Hg—ЗС1 3,05 А).
Литература. [1] Tschermaks Min. Pctr. Mitt., 1976, 23, 105.
26.3.3. Соединения двухвалентной ртути. В большинстве своих
соединений Hg(II) образует или 2 линейные (sp), или 4 тет-
раэдрические (sp3) связи. Соединения с 6 эквивалентными ок-
таэдрическими связями неизвестны, хотя подобные связи могут,
вероятно, присутствовать в таких соединениях, как
[Hg(C5H5NON] (С1О4Ь [1а]. Плоский симметричный ион
Hg(SiMe3K~ [16] был найден в комбинации с очень сложным
полиядерным катионом [Д^^ОСНгСНгОСНзЫСНзОСНгСНг-
ОСН3Ы+; несколько примеров соединений Hg(II) с тремя и
пятью ковалентными связями приведены в разд. 26.3.4. Единст-
венным простым ионным соединением является HgF2 (структу-
ра флюорита), в котором ион Hg2+ окружен 8 равноудаленны-
ми ионами F~. Даже кислород обладает недостаточной электро-
отрицательностью, чтобы ионизировать Hg; найдено, что в обе-
их формах HgO атом Hg образует 2 короткие коллинеарные
связи с О. То же можно сказать и о кристаллах HgSO4-H2O
[2а], где вокруг Hg образуется искаженная октаэдрическая ко-
ординационная группа, состоящая из 5 О (анионов) и 1 Н2О
(а). Особенностью многих кристаллических гидроксосолей
26.3. Структурная химия ртути 299
Hg(OH)X (где X = F [26], СЮ3, ВгО3 или N03) является об-
разование плоских зигзагообразных цепочек б, в которых Hg
О 0 4 am. на рас-
\ I стоянии Е/51А
169
образует 2 коллинеарные связи (Hg—О ~2,10-^2,15 А), а 4 бо-
лее удаленных соседних атома достраивают координационную
группу до октаэдрической, как в HgSO4-H2O. (Можно также
описывать строение Hg(OH)F как структуру, родственную рути-
лу; см. разд. 6.3.1.)
В HgCN(NO3) [2в] линейные цепочки—Hg—CN—Hg—CN—
расположены параллельно друг другу, а координационные груп-
пы Hg(II) достраиваются тремя парами атомов О ионов NO3~.
Здесь атом металла образует 2 короткие коллинеарные связи
B,06 А) с С или N (которые не удалось идентифицировать)
и 6 связей Hg—О B,73 А) в экваториальной плоскости (ср. с
соединениями урана, гл. 28).
Было показано, что к числу молекул, имеющих линейное
строение (кроме дигалогенидов, которые рассмотрены ниже),
относятся Н3С—Hg—СН3, F3C—Hg—CF3, меркаптиды
RS-Hg—CR [За], C3H5S—Hg—Cl, Cl—Hg—SCN, Br—Hg-SCN
C6H5—Hg—CN [36] (Hg—C6HS 2,05 A; Hg-CN 2,09 А) и
C6H5—Hg—CeH5 (Hg—С 2,085 А) [Зв]. На основе длин связей в
H3CHgCl и H3CHgBr [4] (Hg—С 2,07 A; Hg—Cl 2,28 A;
Hg—Br 2,41 А) был определен радиус Hg с двумя ковалентны-
ми связями, равный 1,30 А. В соответствии со шкалой Полиига
для тетраэдрической Hg(II) был предложен радиус 1,48 А.
В некоторых кристаллах, в которых Hg(II) образует 2 проч-
ные связи, одновременно присутствуют две слабые связи с бо-
лее удаленными соседними атомами, достраивающими очень ис-
каженный координационный тетраэдр, а не искаженный октаэдр
B+4), как было рассмотрено выше. Эти случаи можно рас-
сматривать как промежуточные между коллинеарными и нор-
малы]ьши_ тетраэдрическими молекулами (ионами)*. Комбини-
* Автор не упоминает о еще одной характерной координации Hg(II), ко-
торую можно обозначить как 2Гракс+2ч„с+2ч„с: две самые короткие связи' под
большим углом (псевдоколлинеарные), две более длинные, дополняющие по-
лиэдр до искаженного тетраэдра, и две наиболее длинные, расположенные с
противоположной стороны и дополняющие полиэдр до искаженного октаэдра.
Этот тип координации характерен и для некоторых других элементов Б-под-
групп в высших состояниях окисления, в частности для Sn(IV) (см далее) —
Прим. ред.
300
26. Элементы подгрупп 11 Б. 111Б и IV Б
рованное рентгеноструктурное и нейтронографическое исследо-
вание Hg(CNJ [5] показало, что существуют 2 дополнитель-
ные слабые связи Hg—N, лежащие в плоскости, перпендикуляр-
ион плоскости, содержащей 2 связи Hg—С (в), угол между ко-
торыми равен 171 (±2)°. Чрезвычайно искаженная тетраэдри-
ческая структура связей с одним большим углом между двухМя
связями нормальной длины и малым углом (80—100°) между
двумя более слабыми связями образуется также в комплексе
ртути с дитизоном Hg(Ci3HiiN4SJ-2C5H5N [6] (S—Hg—S
155°; N-Hg—N 102°) и HgCl2[OAs(C6H5K]2 [7] (Cl-Hg—Cl
147°; O—Hg—О 93°).
(N
llg
m-
По-видимому, образование ртутью(II) обычных тетраэдри-
чески направленных связей более характерно для таких ли-
гандов, как S и I, чем для электроотрицательного О и других
(более легких) галогенов. Примерами соединений с трехмерны-
ми структурами, упоминаемыми ниже, могут служить Hgl2 и
HgS. Известны структуры, построенные из островных ионов или
молекул (HgI4J~, (HgS4N" (в KeHgS4 [8a]), анион в
[Hg(SCNL] [Cu (enJ] [86] и тиоксановый комплекс г [9].
В бесконечной цепочке д тритиановые молекулы играют роль
мостиков, связывающих группы HgCl2 [10]. Слоистая структу-
ра CoHg2(SCNN-C6H6 [11] —пример комплекса, в основе строе-
ния которого лежит плоская сетка с четырехугольными петля-
ми. Октаэдрические группы Co(SCNN соединены посредством
концевых атомов S с парами атомов Hg, связанных через мос-
тиковые атомы S (рис. 26.5); молекулы С6Н6 располагаются
между слоями. В алмазоподобной структуре CoHg(SCNL [12]
26.3. Структурная химия ртути 301
лигапды SCN соединяют Со и Hg в трехмерный каркас, в кото-
ром Со образует 4тетраэдрнческне связи с N, a Hg — 4 тетраэд-
рические связи с S.
(У
Рис. 26.5. Фрагмент слоя в CoHg2(SCNN.-C6H6.
•Литература. [ 1 а"| Inorg. Chem., 1962, 1, 182. [16] J. Am. Chem. Soc, 1978, 100,
7761. [2aI Acta crysl, 1980, B36, 23. \2G\ Acta cryst., 1979, B35, 949. [2в| Inorg.
Chem.. 1971, 10, 2331. [3a] J. Chem. Phys., 1964, 40, 2258. [361 Acia cryst., 1976,
B32, 2680. [Зв] Acta cryst., 1977, ВЗЗ", 587. [41 J. Chem. Phys., 1954. 22, 92.
Щ Acta Chem. Scand., *1958, 12, 1568. [61 J. Chem. Soc, 1958, 4136. [7] Acta
Chem. Scand., 1963, 17, 1363. [8a| Z. anorg. allgcm. Chem., 1978, 443, 201.
f86| Acta cryst., 1953, 6, 651. [91 J. Chem. Soc, A 1967, 271 fl0| .1 Chem Soc,
A 1966, 1190. [Ill Helv. Chim. Acta, 1964, 47, 1889. [121 Ada cryst., 1968,
B24, 653.
Га.югениды двухвалентной ртути (простые и комплексные).
В противоположность HgF2, кристаллизующемуся по типу флю-
орита, HgCl2, HgBr2 и желтая форма Hgl2 образуют линейные
молекулы X—Hg—X. Четыре атома галогена соседних молекул
достраивают координационный полиэдр ртути (II) до чрезвы-
чайно искаженного октаэдра. (Структуру HgBr2 можно описать
также как построенную из очень искаженных слоев типа Cdl2.)
Красная модификация Hgl2 имеет совершенно иное строение
слоев: каждый атом Hg координирует четыре атома I, распо-
ложенных в вершинах тетраэдра на равных расстояниях от
центрального иона. Интересная структура найдена для оранже-
вой формы Hgl2: группы, состоящие из четырех тетраэдров,
подобные молекуле Р4О10, заменяют одиночные тетраэдры в слое
красного Hgl2. Методом электронографии в газовой фазе опре-
302 26. Элементы подгрупп ПБ, 1ПБ и IV Б
Таблица 26.2. Межатомные
Соединение8
HgF2
HgCl2
HgBr2
Hgb (желтая моди-
фикация)
Hgl2 (красная моди-
фикация)
Hgb (оранжевая мо-
дификация)
NII4HgCl3
NH4HgCl3-H2O
K2IIgCl4-H2O
CsHgCl3
2X
2X
2X
2X
2X
2X
2X
расстояния
в соединениях ртути(П)
Число атомов Х, окружающих
атом Hg в кристалле, и расстоя-
ние, А
2
t 2
2
2
, 2
2
[ 2
28
48
62
,34
37
,29
,29
8Х, 2
2Х, 3
4Х,3
4Х,3
4Х, 2
4Х, 2
4Х,2
2Х, 2
2Х,2
4Х, 2
40
38
23
51!
78!
68
96
75
,80
,70
2Х, 3,46
2Х, 3,22
2Х, 3,15
Литература
Ada crvst., 1980,
В36, 2132
Z. Kristallogr.,
1931, 77, 122
Inorg. Chem., 1967
6, 396
Z. Kristallogr.
1968, 128, 97
Z. Kristallogr.
1938, 100, 208
Acta crvst., 1974
B30, 1603
ДАН СССР, 1955
102, 1115
аВ газовой фазе молекулы HgX2 линейны. Для них найдены следующие длины
связен: Hg—C1 2,25 Л [Bull. Chem. Soc. Japan, 1973, 46, 410]; Hg—Br 2,4-1 Л и Hg—I
2,61 A [Trans. Faraday Soc, 1937, 33, 852].
делено, что молекулы HgCl2, HgBr2 и Hgl2 имеют линейное
строение. Межатомные расстояния в этих галогенидах приведе-
ны в табл. 26.2.
Известны многочисленные комплексные галогениды ртути,
хотя о фторидах известно меньше, чем о соединениях с другими
галогенами. Тип координационного полиэдра Hg очень сильно
зависит от природы катионов, и соли катионов малых или чрез-
вычайно больших размеров часто имеют совершенно разные
структуры. Были найдены изолированные ионы следующих ти-
пов: HgX3~~, HgX42~, HgX53~ и HgXs4~, а также мастиковый ион.
HgI62~, обычно присутствующий в соединениях с крупными ка-
тионами. Тригонально-бипирамидальный анион обнаружен, на-
пример, в [Сг(МН3)б] (HgCl5) [1J; этот необычный тип коор-
динационного полиэдра найден также у ионов СиС153~ и
CdCl53~ в аналогичных солях [2]. Иодиды занимают несколько
обособленное положение по сравнению с другими галогенида-
ми; здесь проявляется предпочтительная тенденция к образова-
нию тетраэдрических связей; в частности, Hgb — единственный
бинарный галогенид с тетраэдрической координацией ртути.
26.3. Структурная химия ртути 303
В солях Tl4HgX6 [3] присутствуют дискретные ионы
с характерным искажением октаэдрического B+4) координа-
ционного полиэдра, наблюдаемым и в HgCb. В многочисленных
комплексных хлоридах такие же полиэдры образуют более
сложные конгломераты. Это относится к K^HgCU-HoO, постро-
С1
а
"CT""
¦:..!.:
С1
спному из цепочек октаэдров, сочлененных по ребрам (а), и к
NH4HgCl3, содержащему цепочки сдвоенных октаэдров (табл.
26.2). В структуре NH4HgCl3 обобществлены 4 экваториальных
ребра октаэдров; октаэдры образуют
слои, в которых связи Hg—С1 B,96 А)
настолько длиннее связей, перпенди-
кулярных слоям B,34 А), что этот
кристалл правильнее рассматривать
как совокупность молекул HgCl2 и
ионов С1~~ и NH4+ (рис. 26.6). Соль
CsHgCl3 имеет деформированную
структуру перовскита, в которой бли-
жайшее окружение Hg состоит из
2 атомов С1 на расстояниях 2,29 А и Q а
4 С! — на расстояниях 2,70 А.
В то же время в некоторых слоях,
содержащих катионы чрезвычайно
большого размера, Hg(II) образует
связи, направленные к вершинам тре-
угольника, как, например, в (СНзЬ-
N[HgCl3] и в изоструктурных ему
бромиде [4] и иодиде. В детально исследованном бромиде при-
сутствуют почти плоские группы HgBr3~ (Hg—Br 2,52 А), со-
единенные в цепочки посредством четвертой связи от каждого
атома Hg (Hg—Br 2,90 А), т. е. реализуется система, проме-
жуточная между дискретными ионами HgBr3^ и цепочками,
образованными тетраэдрическими нонами HgBr42~~, имеющими
по 2 общие вершины, как это наблюдается в метасиликатах с
цепочечным строением. В (CH3KS[HgI3] [5] у атома ртути
осуществляется почти плоская треугольная координация
(Hg—31 2,71 А), однако в этом случае группы Hgl3 соединены
в цепочки гораздо более слабыми связями (Hg—I 3,52 и
=} NH
Рис. 26.6. Кристаллическая
структура NH4HgCk
304 26. Элементы /ю<)групи II Б, III Б и IV Б
3,69 А), причем пять связей направлены к вершинам чрезвы-
чайно искаженной тригоналышй бипирамиды.
Тетраэдрическая координация Hg(II) атомов галогена реа-
лизуется лишь в одном из дигалогенидов (в красной модифика-
ции Hgl2), но она характерна для таких комплексных галоге-
нидов, как Ag2HgI4 и Cu2HgI4 (разд. 17.2.3). Однако островные
тетраэдрические ионы HgX42"~ (включая HgF42 ) встречаются
часто; они стабильны в комбинации с большими катионами, на-
пример в хлоромеркурате алкалоида перлолина (Hg—С1
2,50 A) [6J, в [N(CH3L]2HgBr4 [7] п l(CH3KS]2[HgI4]. Отме-
тим большое различие в длинах связей hg— Ci при образовании
двух коллинеарных связей B,3 А) и значением 2,5 А для тет-
раэдрически направленных связей. Связи обоих типов присут-
ствуют в C8Hi2S2-Hg2Cl4 [8], где некоторые из атомов Hg об-
разуют по две почти коллинеарные связи (Hg—С1 2,30 А;
CI—Hg—С1 168°), а оставшиеся атомы Hg дают по четыре
тетраэдрические связи (Hg—2С1 2,51 A; Hg—2S 2,53 А). Мос-
тиковый ион (Hg2leJ~ [9] структурно подобен молекулам
А12Х6.
Галогены ртути присоединяют третичные фосфины и арсины
(например, As(C4H9K) с образованием кристаллических про-
дуктов (R3As)m(MX2)n. Например, [ (C^bAs^HgB^b состо-
ит из биядерных молекул, в которых 2 атома Hg соединены
атомами галогена:
(C4H9KAs
Вг
Вг
Бг
r^ ^As(C4H9K
Таким образом, это соединение по типу структуры аналогично
соединениям золота (разд. 25.9) и мостиковым соединениям
палладия (разд. 27.9.4), однако связи, образуемые ртутью, на-
правлены при этом по тетраэд-
ру, а не компланарны. Установ-
лено, что вещество с более высо-
ким содержанием бромида ртути,
имеющее эмпирическую формулу
[(C4H9KAs]2[HgBr2]3, образует
смешанные кристаллы, построен-
ные из описанных выше мостико-
вых молекул [ (C4H9KAsh-
[Hg2Br4] и HgBr2. В этом кри-
сталле окружение атома Hg в
молекуле HgBr2 очень похоже
на окружение в кристаллах са-
мого HgBr2: оно включает два ближайших атома Вг и четыре
более удаленных атома Вг, принадлежащих биядерным моле-
Рис. 26.7. Окружение атома ртути
молекулы HgBr2 в соединении
[(C4H9KAsl2Hg2Br4-HgBr2.
26.3. Структурная химия ртути 305
кутам (рис. 26.7). Несимметричный мостик был найден в
Hg2CU(Se-P(C6H5KJ [10].
2,33 А
Hg
Литература, f 11 J. Chem. Soc, D 1975, 2591. \2\ J. Chem. Soc, A 1971, 3628.
[3| Z. anorg. allgem. Chem., 1973, 401, 217. [4] Acta cryst., 1963, 16, 397. |5| Ada
cryst., 1966, 20, 20. [6| Proc. Chem. Soc, 1963, 171. [7] Acta cryst., 1976, B32,
14-14. |8] J. Chem. Soc, 1965, 5988. [91 J. Cryst. Mol. Struct., 1972, 2, 183.
1101 J. Chcni. Soc, A 1969, 250.1. См. также литературу, цитированную в
т;шл. 26.2.
Оксохлориды и родственные им соединения. Как и многие
другие элементы Б-подгруппы, ртуть образует многочисленные
оксо- и тиосоли. В некоторых из этих соединений состояние
окисления индивидуальных атомов Hg неочевидно; это отно-
сится, например, к соединению Hg4O2Cl2 [1]. Различные оксо-
хлориды ртути(II) можно получить в ходе медленного гидроли-
за раствора HgCl2, содержащего мраморную крошку. Описано
по крайней мере 4 соединения в семействе оксохлоридов
nHgO-HgCl2: неокрашенный Hg3OCl4 (« = '/г) [2], черный
Hg3O2Cl2 (л = 2) [3], красный Hg6O4Cl4 (n = 2) [4] и желтый
минерал клейнит (я = 3). Оксобромид Hg5O4Br2 [5]—член се-
мейства бромидов (л = 4). Исследование структуры Hg3OCl4
показало, что это соединение ионное, содержащее катионы три-
хлормеркурооксония OHg3Cl3J~ и анионы С1~, причем сложный
* 6
ci
катион имеет форму уплощенной пирамиды (а). В черном
Hg3O2Cl2 атомы Hg имеют совершенно другое окружение. Ато-
мы Hg', образующие 3 связи (в уплощенно-пирамидальных
20—1284
306 26. Элементы подгрупп II Б, IIIБ и IV Б
группах HgO3), и атомы О, связанные с 3 атомами Hg, лежат
в чередующихся узлах плоской сетки 4, 82 (б). Эти сетки
(слои) соединены в трехмерный каркас атомами Hg", образую-
щими 2 коллинеарные связи с атомами О слоев. Ионы С1~ на-
ходятся в полостях катионного каркаса. Достаточно очевидно
топологическое подобие этой структуры со структурой Si2N2O2,
в которой атомы Si и N расположены по чередующимся узлам
плоской сетки б3, а слои соединены посредством атомов О, каж-
дый из которых образует по две связи:
КЧ 4 3 2
Si,, N, О
О' Hg' Hg"
Более сложная структура Hg6O4Cl4 содержит шесть типов не-
эквивалентных атомов Hg, и ее связь со структурой Hg3O2Cl2
не прослеживается.
Строение двух из трех полиморфных модификаций Hg3S2Cl2
•определено вполне надежно. В обоих структурах присутствуют
бесконечные сетки (Hg3S2)n2n^ из пирамидальных групп SHg3,
связанных общими атомами Hg (S—Hg—S 166°; Hg—S—Hg
92° (а-форма) и 95° (у-форма)). В а-форме сетка трехмерная
(разд. 3.9.4), а в у-форме — двумерная; ионы С1~ завершают
искаженно-октаэдрическую координацию атомов ртути (Hg—2S
-2,4 A; Hg—4C1 2,7ч-3,5 А) [6].
Строение кристаллических соединений элементов Б-подгруп-
пы, в которых металл образует небольшое число прочных свя-
зей, можно описать как упаковку молекул или ионов, ограни-
ченных этими связями. Строение NH4HgCl3 в виде совокупно-
сти молекул Hgd2 и ионов NH4+ и С1~ можно сравнить со
структурой 2HgO-NaI [7], содержащей бесконечные зигзаго-
образные цепочки HgO (такие же, как в ромбическом HgO),
а также ионы Na+ и 1~. Полиэдр, образуемый ртутью(II), до-
полняется до квадратной пирамиды тремя ближайшими иона-
180'
¦0^2,01 А
! 12°
—о
л
-Hg"
3.77 А
I-
ми 1~. Структура NH4Pb2Brs, представляющая собой еще один
пример соединения подобного же типа (NI"L+(PbBr2JBr,), рас-
смотрена в этой главе несколько позже.
Литература. [1] Ada Chem. Scand., 1968, 22, 2529. [2] Ark. Kemi, 1964, 22,
517, 537. [31 Acta cryst., 1974, B30, 1907. [41 Acta cryst., 1978, B34, 79. [51 Ark.
Kemi, 1968, 28, 279. [61 Acta cryst., 1968, B24, 156, 1661. [71 Acta Chcm. Scand.,
1964, 18, 1305.
26.3. Структурная химия ртути 307
Оксиды и сульфиды ртути(П). Хорошо известны две формы
HgO: стабильная ромбическая и метастабильная, гексагональ-
ная модификации. Первую из них можно получить, например,
нагревая на воздухе нитрат, а вторую — при очень медленном
добавлении NaOH к раствору K2HgI4 при 50 °С. Обе модифика-
ции образуют красные кристаллы, которые при растирании да-
ют желтый порошок, как и осажденная форма. Первая из этих
модификаций (ромбическая) построена из бесконечных плоских
зигзагообразных цепочек [1]:
J80"
107°
"О<!,05 А
Другие ближайшие соседи атома Hg — 4 атома О из различных
цепочек, находящиеся на расстояниях 2,81-^2,85 А. Гексаго-
нальная форма [2], изоструктурная киновари HgS, построена
из спиральных цепочек, в которых углы между связями и их
длины такие же, как в плоских цепочках ромбической модифи-
кации. Два других атома кислорода, находящихся на расстоя-
нии 2,79 А, и два — на расстоянии 2,90 А, дополняют полиэдр
вокруг Hg до очень искаженного октаэдра. Определение этих
структур — хороший пример совместного использования двух
методов: рентгеноструктурного и нейтронографического. Рент-
геноструктурным методом невозможно определить положение
атома О. Это можно сделать с использованием нейтронографи-
ческого метода. По-видимому, по крайней мере две другие фор-
мы HgO можно приготовить гидротермальным методом.
Сульфид ртути HgS существует в двух модификациях. Ред-
кий минерал метациинабарит кристаллизуется в структуре цин-
ковой обманки, в которой Hg(II) образует четыре тетраэдрн-
чески направленные связи (Hg—S 2,53 А) [3]. Более распро-
страненная модификация, киноварь, обладает структурой, не
имеющей аналогов среди моносульфидов, поскольку кристалл
построен из цепочек, расположенных по спирали, в которых два
ближайших к Hg атома S расположены на расстоянии 2,36 А,
два других — на расстоянии 3,10 А и еще два — на расстоянии
3,30 А. Углы между связями S—Hg—S составляют 172°, между
связями Hg—S—Hg—105°. Киноварь примечательна своей
необычайно высокой оптической активностью, что, разумеется,
характерно для нее только в твердом состоянии.
Здесь же можно упомянуть о двух других оксосоедннениях,
хотя детали их строения и не установлены. Соединения со ще-
лочными металлами типа Na2Hg02 [5J, по-видимому, содержат
линейные ионы (О—Hg—ОJ- (Hg—О -1,95 А), а одна из
20*
308 26. Элементы подгрупп II Б, IIIБ и IVБ
двух форм HgO2 [6] (полученная при обработке HgO перокси-
дом водорода при —15 °С) состоит из цепочек типа
-О'
.O-llg-0'
.о-
Сравнение структуры fi-HgO2 с PbS2 и AgF2 дано в разд. 6.9
Литература. [1] Ada Chem. Scand., 1964, 18, 1305. f2"| Acta Chem. Scand., 1958,
12, 1297. [3] Acta Chem. Scand., 1965, 19, 522. [4] Acta Chem. Scand., 1950, 4,
1413 [5] Z. anorg. allgcm. Chem., 1964, 329, 110. [6| Ark. Kcmi, 1959, 13, 515.
Соединения со связью металл — азот. При взаимодействии
солей ртути с аммиаком в водном растворе в зависимости от
условий можно выделить несколько соединений, например:
Диаммингалогениды
Амидогалогениды
Иминодигалогениды
Hg(NH3JX2
HgNH2X
Hg2NHX2
(Х = С1, Br)
(X = F*, Cl, Br)
(X = CI, Br)
* Это соединение, по-видимому, не является структурным аналогом хлорида и бро-
мида [1]. Оно образует трехмерную связь такого же типа, как и основание Миллона
с ионами NH4+ и F- в пустотах, т. с. может быть описано как (Hg2N)F-NTH4F.
а также Hg2NX — основание Миллона Hg2NOH-xH2O и его со-
ли (Х = С1, Br, I, NO3 и С1О4). Хлориды Hg(NH3JCl2 и
HgNH2Cl известны уже давно под названиями плавкий и не-
плавкий белые преципитаты соответственно.
Общее структурное свойство этих соединений — образование
ртутью(II) двух линейно направленных sp-связей и четырех
тетраэдрически направленных связей у атома азота, хотя в ими-
нодигалогениде Hg2NHBr2 у '/4 атомов ртути реализуется дру-
гая, необычная C+2)-координация.
Диамминогалогенид Ь^(ЫНз)гС12 (изоструктурный диброми-
ду) имеет очень простую кубическую структуру антиперовски-
тового типа (рис. 26.8, а) [2]; состав элементарной ячейки
72[Hg(\TH3JCl2], так что атомы ртути (статистически) заполня-
ют только 7б позиций, указанных на рис. 26.8, а. В каждой из
этих позиций к Hg присоединены две группы NH3 на равных
расстояниях; в свою очередь каждая молекула NH3 в среднем
связана с одним атомом Hg. Соответственно в кристалле при-
сутствуют статистически распределенные изолированные ионы
(H3N-Hg-NH3J4\ В HgNH2Br [3] положения атомов Hg, Br и
N те же, что и в Hg(NH3JBr2; однако атомов Hg вдвое боль-
ше, так что теперь каждый заштрихованный кружочек на рис.
26.8, а в сумме соответствует 7з атомов Hg. Поскольку каждый
атом ртути координирует два ближайших равноудаленных ато-
ма N, а число атомов Hg и N равно, то каждый атом N имеет
°
ООООО
GOGOO
ООООО
О
N
О
Cl
о О
N Hg
Рис. 26.8. Структуры азотных производных ртути, а — Hg(NHrJCl2; б — цепи
—Hg—NH2— в ромбическом HgNH2Cl; в — слои [Hg3(NIIJ] в Hg,NHBr2; г —
элементарная ячейка Hg2NHBr2; д — NHg2NO3; е — NIlg»Br; ж — слои в
Hg2N2H2Cl2.
310 26. Элементы подгрупп II Б, IIIБ и IVБ
в среднем по 2 соседних атома Hg. Должны, следовательно,
существовать цепочки
л'н:
однако они не являются линейными на больших отрезках, а изо-
гнуты у каждого атома N и нерегулярно распределены по кри-
сталлу.
Согласно независимо проведенным рентгеноструктурным ис-
следованиям, HgNH2Cl [4] и HgNH2Br [5] имеют ромбиче-
скую структуру (рис. 26.8,6), также образованную бесконечны-
ми катионными цепочками, связанными между собой анионами
галогена. В этой (регулярной) структуре зигзагообразные це-
почки располагаются в параллельных слоях. Выяснилось, одна-
ко [6], что описываемая структура нехарактерна для чистого
HgNH2X, а образуется только в присутствии малого количества
галогенида HgX2, дающего с HgNH2X твердый раствор. (Ха-
рактер ЯМР-спектра «неплавкого белого преципитата» согла-
суется с присутствием в нем групп NH2 [7] и исключает пред-
ложенные ранее формулы, согласно которым в веществе при-
сутствуют NH4+ или NH3.)
С увеличением отношения Hg : N становятся возможными
двух- и трехмерные комплексы. В Hg2NHBr2 [8] 3/4 атомов Hg
образуют гексагональные слои состава (NHJHg3, в которых
каждый атом N связан с тремя атомами Hg и одним Н (рис.
26.8, в); оставшиеся атомы Hg расположены между слоями и
окружены тремя лежащими в одной плоскости атомами Вг на
расстоянии 2,6±0,1 А, и двумя на расстоянии 3,08 А, дополня-
ющими координационный полиэдр Hg до тригональной бипира-
миды. Элементарная ячейка этой структуры изображена на
рис. 26.8, г.
Наконец, в основании Миллона NHg2OH-.vH2O (.v=l или 2)
и его солях [9] присутствуют трехмерные сетки NHg2, близкие
к сеткам в модификациях SiO2. Нитрат NHg2NO3 построен по
типу кристобалита; ту же кубическую структуру имеют и дру-
гие соли, полученные из этого нитрата (рис. 26.8,5); однако в
случае галогенидов, по-видимому, более стабильна гексагональ-
ная (тридимитоподобная) модификация (рис. 26.8, е). Гексаго-
нальная модификация самого основания Миллона, его бромида
и иодида может быть получена либо непосредственно, либо при
нагревании кубических модификаций. В этих структурах атом
азота образует 4 тетраэдрические связи, a Hg — две коллинеар-
ные связи (Hg—N ~2,07 А). Ионы ОН~, Х~ и др. находятся в
пустотах каркаса.
26.4. Структурная химия галлия и индия 311
Многие соли тяжелых металлов восстанавливаются гидрази-
ном до металла. Это справедливо и для оксосолей ртути. Хло-
рид и бромид, однако, образует соединения типа [Hg(N2H4)]X2,
[Hg(N2H4J]X2 и [Hg2N,H.,]Xo. Хлорид (Hg2N2H2)Cl2 струк-
турно очень близок к HgNH2Cl, однако в то время, как группы
H2N< могут образовывать только цепочки, фрагмент
>HN—NH< образует слои [10] (рис. 26.8, ж), между кото-
рыми расположены ионы С1~.
Итак, среди азотсодержащих соединений ртути известны
представители всех четырех типов комплексов со связями
Hg—N, а именно:
Островные ионы (H3N—Hg—NH3J+ в Hg(NH3JX2
Цепи —NH2—Hg—NH2—Hg— в HgNH2X
Слои Hg3(NHJB HgA'HBr,;
Hg2N2H2 в Hg2N2H,.Cl2
Трехмерные каркасы в Hg2\X
Литература. [1] Z. anorg. allgcm. Chem., 1956, 287, 24. [21 Z. Kristallogr., 1936,
94, 231. [3] Z. anorg. allgem. Chem., 1952, 270, 145. [41 Acta cryst., 1951, 4,
26fi. [51 Acta cryst., 1952, 5, 604. [6"| Z. anorg. allgem. Chem., 1954, 275, 141.
[71 J. Chem. Soc, 1954, 3697. [81 Acta cryst., 1955, 8, 723. [91 Z. anorg. allgem.
Chem., 1953, 274, 323; Acta cryst., 1951. 4, 156; Acta cryst., 1954, 7, 103. [101 Z.
anorg. allgem. Chem., 1956, 285, 5; Z. anorg. allgem. Chem., 1957, 290, 24.
26.4. Структурная химия галлия и индия
Приведенные выше замечания относительно низших валентных
состояний этих элементов здесь будут дополнены кратким из-
ложением структурной химии их соединений в состоянии окис-
ления +3. Многие соединения Ga (III) и In (III) (а также не-
Таблица 26.3. Координационное окружение трехвалентных галлия и индия
в простых соединениях
Тетраэдрическая координация
Октаэдрическая координация
Li(GaH4)
Ga2Cl6 и 1п2С1б (молекулы в парах)
GaPO4 (структура типа кристоба-
GaF3
InCi,
Т1С1з)
пита)
GaN, InN (структура типа вюртцита)
GaP, InP (структура типа цинковой
обманки)
GaShO4 (структура типа рутила со
статистическим распределением)
a-Ga2O3 (структура типа корунда; из-
вестна также структура типа
С-М2Оз, близкая к 1п2О3)
1п(ОН)з
В P-Ga2O3 и In2S3 оба типа координации (тетраэдрическая и октаэдрическая)
312
26. Элементы подгрупп II Б, IIIБ и IVБ
многочисленные соединения Т1(Ш)) имеют однотипные структу-
ры; существует также их несомненное структурное сходство с
соединениями алюминия (табл. 26.3). (Структуры большинства
соединений этих элементов описаны в других главах.)
Галлий, подобно алюминию, образует с атомами хлора и
кислорода как тетраэдрически, так и октаэдрически направлен-
ные связи. В p-Ga^Cb реализуются оба типа координации:
О Ga(CH3K и 1п(СН3)з (см. разд. 22.5.2).
К более сложным примерам соединений Ga(III) с тетраэдри-
ческой ориентацией связей относятся Na{Ga[OSi(CH3K]4} [1J
а
6
и циклическая молекула Ga4(OHL(CH3)8 (a) [2], строение
которой подобно соответствующему соединению золота — одна-
ко с тетраэдрическим, а не компланарным расположением свя-
зей атомов металла.
В [N(C2H5L]2lnCl5 [31 индий образует 5 связей, направлен-
ных к вершинам квадратной пирамиды, атом металла располо-
жен над ее основанием на высоте 0,6 А (ср. с подобной струк-
турой у Sb(C6H5M). Конфигурация иона 1пС152- (б) близка к
вычисленной из условия минимального отталкивания С1—С1 с
использованием простой обратно квадратичной зависимости.
В то же время изоэлектронный иону 1пС152 ион SnCl5~ имеет
тригоналыю-бипирамидальную структуру.
Чтобы закончить этот краткий очерк структурной химии
In(III), отметим, что кроме К.Ч 4, 5 и 6 индий(III) образует
также комплексы с КЧ 7 и 8. Цепочечный анион в
[4] состоит из пентагонально-бипирамидаль-
26.5. Структурная химия таллия 313
ных фрагментов, сочлененных через общие ребра. Такая цепь,
построенная из фрагментов типа РаС15 (в), типична для струк-
турной химии 5/-элементов. Одинарные кружки в схематической
структуре в обозначают молекулы Н2О, аксиальные связи
F--"ln—F перпендикулярны плоскости рисунка.
В анионе соли [N (С2Н5L] [In(NO3Ll [5], изоэлектронпом
Sn(NO3L, п0 всей вероятности, образуется 8 координационных
связен.
Литература. [11 J. Chem. Soc, 1963, 3200. [2] J. Am. Chem. Soc, 1959, 81, 3907.
|3| Inorg. Chem., 1969, 8. 14. [4] Acta cryst., 1976, B32, 948. [5] J. Chem. Soc,
A 1966, 1081.
26.5. Структурная химия таллия
Строение некоторых простых соединений одно- и двухвалентно-
го таллия обсуждалось в предыдущих главах. Галогениды
таллия удивительно сходны с галогенидами серебра (I) и по
цвету, и по растворимости, хотя они имеют различную кристал-
лическую структуру вследствие различий в размерах и степени
поляризуемости катионов. T1F, как и AgF, растворим в воде,
тогда как другие галогениды очень малорастворимы. TIOH,
как и гидроксиды щелочных металлов, — сильное основание,
растворимое в воде, a T12SO4 изоструктурен K2SO4.
Соединения, которые могли бы содержать Т1(П), фактиче-
ски содержат Т1A) и Т1(Ш). Например, как Т1С12, так и
Т12С13 диамагнитны, тогда как Т1(П) должен иметь один не-
спаренный электрон. Т1Вг2, вероятно, изоструктурен Ga2Cl4
[1], т. е. представляет собой Т11(Т1П1Вг4) и содержит такой же
тстраэдрический ион, как и CsTlBr4 (Т1—Вг 2,51 А). Сложная
структура Т12С13 еще не определена; по всей вероятности, его
строение отвечает формуле ТЬЧТР'Об), т. е. это соединение
содержит такие же октаэдрические ионы, как и КзТ1С16-2Н2О и
другие аналогичные соли. Соединение ТП3 — не иодид трехва-
лентного таллия, так как оно изоструктурно NH4I3 и, таким
образом, отвечает формуле Т1+13~. Опубликован обзор [3] га-
логенидных комплексов Т1(Ш).
К числу сульфидов таллия относятся T12S [4a], T1S [46],
T1S2, TI4S3 [4в] и T12S5 [4д], причем последний из них представ-
ляет собой пентасульфид T12^(S5J^. Как и Т12О (см. ниже),
T12S образует слоистую структуру типа анти-Сс112 (ср. Cs3O со
структурой aHTH-ZrI3). Оба сульфида, T1S и T14S3, одновремен-
но содержат и Т1 (I), и Т1(Ш), последний в тетраэдрической ко-
ординации. В T14S3 имеются простые цепочки TlniS3, построен-
ные из тетраэдров с общими вершинами (Tl—4S 2,55 А), между
314 26. Элементы подгрупп II Б, IIIБ и IVБ
которыми расположены атомы Т1 (I); наиболее близкие атомы S
находятся от них на расстояниях не менее 2,9 А. Структурная
формула, следовательно, имеет вид Tl3'(T1UIS3). В кристалли-
ческом T1S также присутствуют атомы металла двух типов,,
один с КЧ 4, другой с КЧ 8. Атомы первого типа находятся в
центрах тетраэдров, сочлененных общими ребрами в цепочку
(как в обычной форме SiS2), тогда как атомы второго типа рас-
положены между цепочками таким образом, что они образуют
по восемь связей. Большое расстояние между этими последни-
ми атомами Т1 и восемью окружающими их атомами S C,32 А)
по сравнению с расстоянием Tl—S в цепочках тетраэдров
B,60 А) указывает на то, что это соединение должно рассмат-
риваться как ионный сульфид одно- и трехвалентного таллия
Помимо тетраэдрической и октаэдрической координации
Т1 (III) (или Т13+) в галогенидных комплексах и других соеди-
нениях, например (С6Н5JЬ2Т1(Шз) (где L — ОР(С6Н5K). воз-
можно образование пяти связей, но структуры таких соедине-
ний еще неизвестны [5].
В своих ковалентных соединениях таллий не проявляет
склонности к использованию для образования связей двух
бя-электронов. Действительно, моноалкильные производные
TIAlk с валентной группой B, 2) неизвестны, тогда как триал-
килы (валентная группа 6) * известны, а самые стабильные ал-
кильные производные •— диалкилгалогениды, например
[Т1(СН3J]1. Это ионные соединения ([Т1(СН3J]ОН— сильное
основание), и в ионах Т1(А1кJ+ атом таллия имеет такую же
электронную конфигурацию, как и ртуть в СН3—Hg—СН3(.
а именно D). В соответствии с этим ион (СН3—Т1—СН3) +
имеет линейное строение, что и было показано для ряда солей
Т1(СН3JХ (где X = I, CN, N3 и т. д.) [6]. В соединениях с хе-
латообразующими анионами (Х = ОАс, асас) [7], где Т1 помимо
двух связей Т1—СН3 образует связи с двумя атомами органи-
ст . 6
2,67/1 О
О / /2,67А
2,45/1
С 5О°(Щ)ЮО-
(СН3JТЦОАс)
RO
Л
RO-
-Tl
—Т1
(TIORV
* В случае таллия валентная группа B, 2) означает: Tl—R, валентная
R
группа (G) — R—Т1< . валентная группа D)— R—T1+—R. — Прим. ред.
R
26.5. Структурная химия таллия 315
ческого радикала и две другие связи с атомами О соседних
молекул, группа Т1(СН3J несколько изогнута (~170°). В аце-
тате четыре связи Т1—О имеют приблизительно одинаковую
длину, когда как в ацетилацетонате эти связи значительно раз-
личаются по длине (а и б) (приведены проекции, перпендику-
лярные направлениям осей СН3—Т1—СН3):
Алкоксиды одновалентного таллия в растворе бензола су-
ществуют в виде тетрамеров; рентгеноструктурное изучение
(Т1ОСН3L [8] показало, что атомы металла тетрамера распо-
ложены по тетраэдру (в), но местоположение алкоголятных
групп установлено не было. В таких молекулах Т1 образует
пирамидально расположенные связи; его валентная группа
B, 6).
Чрезвычайно интересна с точки зрения стереохимии соедине-
ний Т1A) их стереоактивность или, иначе говоря, активность,
обусловленная присутствием свободной пары электронов. В раз-
личных оксосоединениях КЧ варьирует от 3 до высоких значе-
ний, характерных для обычных ионных связей больших катио-
нов. Низкое координационное число таллия(I) определенно
связано со стереоактивностью свободной пары: обычно три или
четыре короткие связи расположены по одну сторону от атома
Т1A), и сильно удлиненные вторичные связи (расстояния
Т1—X >3,1 А)—по другую. Известны соединения, в которых
вокруг атома Т1 равномерно распределены шесть или больше
связей, причем соответствующие атомы удалены на 2,9-^3,2 А.
Была сделана попытка связать эти факты с силой основности
аниона по Льюису. (Косвенный метод вычисления «силы основ-
ности», а также структуры многочисленных соединений Т1 (I)
обсуждаются в работе [9].)
Стереоактивность свободной электронной пары хорошо ил-
люстрируют три структуры: Т12О [10], Т13ВО3 [11] и T13FCO3
[12]. Структура Т12О представляет собой политип структуры
анти-Сс112 с двенадцатислойной последовательностью слоев
ккгг (разд. 4.1.9). В Т13ВО3 (рис. 24.11,6) колонки атомов Т1
создают пустоты канального типа, к которым направлены сво-
бодные электронные пары. В обеих этих структурах связи ато-
мов Т1 с тремя атомами О расположены пирамидально (на рас-
стояниях ~2,50 А), а в Т13ВО3 присутствует также три атома
металла на расстоянии 3,60 А. В Т12О атомы металла образуют
почти плотнейшую упаковку, и кроме трех атомов кислорода
вокруг таллия расположены 12 соседних атомов Т1 на расстоя-
нии 3,51-f-3,86 А; ср. с 3,36 и 3,46 А в модификациях металла с
кубической и гексагональной плотнейшими упаковками.
В T13F(CO3) координационный полиэдр Т1 создают четыре бли-
жайших атома B0 и 2F) по одну сторону и три более удален-
ных атома О — по другую; это окружение формирует полиэдр
316 26. Элементы подгрупп ЦБ, ШБ и IVБ
в форме искаженного одношапочного октаэдра:
?-0 Z'VA
Литература, [1] J. Chem. Soc, 1963, 3459. [2] Acta cryst., 1963, 16, 71. [3] Inorg-.
Chera., 1965, 4, 502. [4a] Z. Kristallogr., 1939, 101, 367; Кристаллография. 1970,
15, 471. [46] Z. anorg. allgem. Chem., 1949, 260, 110. [4в] Acta cryst.. 1973. B29,
2334. [4r] Acta cryst., 1975, B31, 1675. [5] J. Chem. Soc, 1965,107. [6| Acta
cryst., 1975, B31, 1922. [7] Acta cryst., 1975, B31, 1929. [8] J. Inorg. Nucl. Chem.,
1962, 24, 357. [9] Acta cryst., 1980, B36, 1802. [10] Z. anorg. allgem. Chem., 1971,
381, 266. [11] Сотр. rend., 1973, 276C, 177. [12] Acta cryst., 1973, B29. 498.
26.6. Структурная химия германия
Наиболее важные особенности структурной химии этого элемен-
та легче всего выявить, если провести сопоставление с кремни-
ем. Близость стереохимии Ge(IV) и кремния выражена" весьма
отчетливо. Германий и кремний изоструктурны не только в
обычных формах элементных германия и кремния. Изострук-
турны также Gel4 и Sil4, гексагональные GeO2 [1] и БЮг
(кварц), тетрагональный GeO2 и модификация SiO2 рутплового
типа (высокого давления), а также многие оксосоединения этих
двух элементов. Были выделены германиевые аналоги основных
типов силикатов и алюмосиликатов от структур, содержащих
островные ионы, до цепочечных, слоистых и трехмерных каркас-
ных структур [2]. Можно привести примеры германатов, со-
держащих различные типы комплексных ионов, изоструктурных
соответствующим силикатам, а именно Be2GeO4 (структура фе-
накита), Zn2Ge04 (структура виллемита), Sc2Ge20?, SC2S12O7,
BaTiGe3O9 (содержит циклические ионы того же типа, что и в
бенитоите), CaMg(GeO3J (содержит цепочечный ион, подоб-
ный иону в диопсиде). Степень структурного сходства германия
и кремния очевидна из того факта, что две кристаллические
модификации Ca2GeC>4 изоструктурны двум формам Ca2Si04,
a Ca3Ge05 образует кристаллы по меньшей мере четырех типов,
аналогических по строению Ca3Si0s.
Несколько меньшее сходство имеется между структурами
соединений со связями Si—S и Ge—S. Обычные модификации
SiS2 и GeS2 имеют различную структуру: первая построена из
цепочек тетраэдров, сочлененных посредством общих ребер,
тогда как вторая имеет уникальную трехмерную структуру, со-
26.6. Структурная химия германия 317
держащую кольца Ge3S3 (в сочетании с кольцами GeioSio и
GenSii), в которых обобществлены только вершины тетраэдров
[13]. Однако при высоком давлении и высокой температуре оба
этих сульфида переходят в форму с кристобалитоподобной
структурой [4]. В этой модификации GeS2 углы Ge—S—Ge
близки к тетраэдрическим, а координационные группы GeS4
сжаты вдоль оси 4, вследствие чего два угла S—Ge—S равны
по 118° и четыре — по 105°. Высокотемпературная модификация
GeS2 высокого давления построена из слоев, содержащих в оди-
наковом количестве тетраэдры GeS4, сочлененные по четырем
общим вершинам, и тетраэдры, соединенные с другими по двум
вершинам и одному ребру [5]. Как и в обычной форме GeS2,
такой слой, описанный более подробно в разд. 5.2.3, содержит
кольца из трех тетраэдров GeS4 (дополнительно к большим
кольцам). К комплексным ионам, образуемым тетраэдрами
GeS4, имеющими общие вершины, относятся островной ион
А2Х72~ в Na6(Ge2O7) [6] бесконечный цепочечный ион АХ3, на-
пример в Na2GeS3 и PbGeS3 [7], и островной анион Ge4Sio4~ в
Cs4Ge4Sio-4H20, Ba2Ge4Si0 и в изоструктурных Na4Ge4Sio и
Na4Si4Sio [8J. Этот ион имеет «супертетраэдрическую» структу-
ру А4Х10 (примеры см. в разд. 5.2.1). При обобществлении од-
ного ребра двух групп GeS4 образуется ион А2Х6, например
в солях Na4Ge2S6-14Н2О и Tl4Ge2S6 [9].
Синтезированы силаны вплоть до Si?Hi6; для германия оха-
рактеризованы германы вплоть до GegH2o. Восстановление гер-
мапатов в водном растворе с помощью КВН4 дает с хорошим
выходом GeH4, из которого в условиях искрового разряда мож-
но получить германы более высокого порядка. Некоторые про-
стые молекулы GeX4 включены в табл. 21.1, а молекулы
H3Ge—О—GeH3 и Ph3Ge—О—GePh3 — в табл. 11.3.
Наиболее существенные различия кремния и германия со-
стоят в следующем:
1) гораздо большая устойчивость Ge(II) по сравнению с
Si (II);
2) большая тенденция Ge(IV) к образованию шести свя-
зей;
3) образование солей Ge(IV).
1) При нормальных условиях двухвалентное состояние крем-
нию несвойственно, хотя оно может играть существенную роль
при высоких температурах (см. SiO, разд. 23.1); в то же вре-
мя, как уже было замечено (разд. 26.1.2), некоторые соедине-
ния Ge(II) стабильны при обычных температурах. Как и соеди-
нения Т1A), соединения Ge(II) представляют особый интерес,
так как содержат стереохимически активную свободную элект-
ронную пару. Предположение, что свободная электронная пара
ведет себя так, как если бы она занимала некоторый объем,
318 26. Элементы подгрупп II Б, IIIБ и IVБ
аналогичный объему лигандов О и F, по-видимому, подтверж-
дается тем, что она производит гораздо больший (и другого ти-
па) эффект в оксидах и фторидах, чем, например, в сульфидах
и иодидах. В структуре GeF2 [10] тригонально-пирамидальиые
Z.09A
Рис. 26.9. Кристаллическая структура GeF2. а — вид вдоль цепи; б — окруже-
ние Qe.
группы GeF3 объединяются в бесконечные цепочки через два
общих атома F (угол при атоме F 157°) (рис. 26.9). Длина свя-
зи с концевым атомом F заметно короче A,79 А), чем связи с
F, входящих в цепочку A,91 и 2,09 А); более слабые связи
B,57 А) соединяют цепочки в трехмерную структуру (ср. с рас-
положением связей Sn (II) в NaSn2F5 — разд. 26.7.3).
Связи (обо-
значения
см. на
рис. 2G.9)
GeF2
(Sn2F5)-
Угол между
связями
(рис. 26.9)
GeF2
(Sn,.F5)-
а
Ъ
с
d
1,79 А
1,91
2,09
2,57
2,08 А
2,07
2,22
2,53
ah
ей
ас
be
92°
163
86
85
89°
142
81
84
Для Ge с тремя пирамидально направленными связями ва-
лентная группа запишется как B, 6), если включить в рассмот-
рение гораздо более удаленный четвертый атом F, то как B, 8),
причем в соответствии с этой записью соединение следует рас-
26.6. Структурная химии германия 319
сматривать как производное тригопальной бипирамиды (рис.
26.9,о). (В газообразном состоянии GeF2 существует только при
высоких температурах в присутствии избытка металла, и пар
содержит полимерные частицы вплоть до Ge3F5;"; SnF2 ведет
себя аналогичным образом [11].)
Структура GeCl2, по-видимому, неизвестна, но в искажен-
ной перовскитовой структуре низкотемпературной формы
CsGeCl3 [12] присутствуют связи типа C+3); в случае GeBr2
также наблюдается искаженная октаэдрическая координация,
3 Вг находятся на расстоянии 2,60 А (средн.), а 3 других Вг —
па расстояниях 3,0-^-3,74 А. Структурный тип Cdl2, приписан-
ный Gel2 в раннем структурном исследовании, предполагает ок-
таэдрическую координацию Ge(II). Следует, однако, проверить,
находятся ли окружающие Ge шесть атомов S на равных рас-
стояниях. Искаженную октаэдрическую структуру типа C+3)
имеет GeS [13] (в разд. 26.7.3 эта структура сравнивается со
структурой SnS [13а]).
2) В начале гл. 23 говорилось о том, что число молекул, ио-
нов или кристаллов, в которых Si образует 6 связей, невелико.
Хотя структурная химия Ge(IV) в основном базируется на че-
тырехкоординированном (или четырехковалентном) Ge, приме-
ры его соединений с октаэдрической структурой более много-
численны, чем в случае кремния. В растворимой кварцеобраз-
ной модификации GeO2 германий образует четыре связи, а в
стабильной (тетрагональной) модификации — шесть связей
(Ge—40 1,87 A; Ge—20 1,90 А) [14].
Приведем несколько примеров соединений Ge(IV) с 6 свя-
зями: траксЧ}еС14Ру2 [15] (Ge—C1 2,27 А), ионы GeF62" и
GeCl62~, FeGe(OHN [16], имеющие такое же строение, как
FcSn(OHN и NaSb(OHN (Gc—6OH 1,96 А).
Тетраэдрически и октаэдрически координированный герма-
нии присутствует в K3HGe7Oi6-4H2O (обладает свойствами цео-
лита) [2], имеющем изящную каркасную структуру, образован-
ную группами GeO4 и GeO6 (рис. 5.47); то же относится к
Na.,Ge9b20 [17].
3) Более выраженный металлический характер Ge проявля-
ется в образовании таких солей, как Ge(SO4b, Ge(C104L и
GeH2(C2O4K, не имеющих аналогов [18] в химии кремния.
Литература. [1] Ada cryst., 1964, 17, 842. [21 Fortsch. Mineral, 1966, 43, 230.
[31 Acta cryst., 976, B32, 1188. [41 Science, 1965, 149, 535. [51 Acta cryst., 1975,
B31, 2060. [61 Rev. Chim. Mineral., 1974, 11, 13. Щ Rev. Chim. Mineral., 1972,
9, 757; Acta cryst., 1974, B30, 1391. [81 J. Solid State Chem., 1973, 8, 195.
[91 Acta cryst, 1978, B34, 2614. [101 J- Chem. Soc, A 1966, 30. [Ill Inorg. Chem.,
1968, 7, 608. [121 Acta Chem. Scanri., 1965, 19, 421. [131 Acta cryst., 1978, B34,
1322. [13al Inorg. Chem., 1965, 4, 1363. [141 Acta cryst., 1971, B27, 2133. Г151 J.
Chem. Soc, I960, 366. [161 Acta cryst., 1961, 14, 205. [171 Acta Chem. Scand..
1963, 17, 617. [181 Acta Chem. Scand., 1963, 17, 597.
320
26. Элементы подгрупп ПБ, ШБ и IVB
26.7. Структурная химия олова и свинца
Сравнение структурной химии этих двух элементов выявляет
как некоторые интересные черты сходства, так и существенные
различия. Атомы этих элементов имеют одинаковое строение
внешних электронных оболочек (два s- и два р-электрона),
и каждый из них может находиться в одном из двух состояний
окисления: 2 и 4. Более металлический характер свинца про-
является в структурах простых веществ (гл. 29) и в многочис-
ленных различиях между соединениями двухвалентных олова
и свинца. Удобно рассмотреть вначале Sn(IV) и Pb(IV), так
как особенности их структурной химии выражены более четко.
Лишь немногие соединения Sn(II) и РЬ(П) изоструктурны,
а соединения, содержащие металлы одновременно в двух сте-
пенях окисления для этих двух элементов, различны (напри-
мер, Sn2S3 и РЬ3О4).
26.7.1. Соединения олова (IV) и свинцаAУ). Известны соедине-
ния с тетраэдрическими, тригонально-бипирамидально- и окта-
эдрически направленными связями, в образовании которых
участвуют 8, 10 и 12 электронов (валентные группы (8), A0)
и A2)). Более высокие координационные числа эти элементы
проявляют в некоторых комплексах, образуемых хелатирую-
щими лигандами: для Sn(IV) К.Ч 7 и 8, для Pb(IV) КЧ 8; при
этом большинство связей или все связи образуются с атомами
кислорода.
Тетраэдрическая координация. Простейшие примеры — мо-
лекулы МХ4 и MX4-n-Y.T, многие из которых, как было показано,
имеют тетраэдрическое строение либо в парообразном, либо
кристаллическом состоянии:
SnCl4, SnBr4, Snl4, Sn(C6H5L [la] (кристаллические)
(CH3KSnX и т. д., РЬСЦ, Pb(CH3L и РЬ2(СН;1)б в парообразном состоянии
(см. литературу, цитируемую в табл. 21.1)
Подобно кремнию в (SiRLS6, олово(IV) образует молекулы
адамантанового типа, в основе строения которых лежит тетра-
эдрический скелет А4Х6 (рис. 3.18, е). Например, в структуре
[Sn(CH3)]4S6 [16] олово находится на расстоянии 2,15 А от
СН3-группы и 2,39 А от 3 атомов S. Молекулы (CH3KSnCl в
парах имеют тетраэдрическое строение, в кристалле они пре-
терпевают значительные искажения, и благодаря дополнитель-
ным слабым мостиковым связям Sn—С1 выявляется тенденция
к полимеризации с образованием октаэдрической цепочечной
структуры*:
См. примечание редактора на с. 299.
26.7. Структурная химия олова и свинца 321
сг
109
93
XI
сн
\
.Sn
3/'-..3,54 а /СН;\
¦Sn-
СТ
"¦-С1
\
2.40 А
Явное стремление к переходу от тетраэдрического мономер-
пого к полимерному строению с 5 или 6 связями атома Sn про-
является и у некоторых других соединении (CH3KSnX и
(CH;;hSnX2 (см. ниже).
.Мономерные соединения Sn"R2 обычно полимеризуются с
образованием соединений Sn(IV) либо с линейными (напри-
мер, Н!^п(С6Н5Ь]бН), либо с циклическими молекулами. Пои-
а
/74
2,33 А
CL 1J3 А
1.95А 145 А
Рис. 26.10. Стереохимия Sn(IV). а — циклическая молекула [Sn(C6H5Jl6 (фе-
нильныс группы не показаны); в — бесконечные цепи в (CH3KSnCN; ч — SnCl4-
•2РОС13; г — SnC!4-2Se0CU.
.мером последних служит jSn(C6H5J!6 (рис 26.10, а), строение
молекул!^! которого определено в кристаллическом го ;вате с
льксилолом 12]. Длина свя::п Sn — Sn в ко;'ьце B 78 Л) такая
же, как в сером олове B,80 А). Тетраздрическая система свя-
зей присутствует также в комплексах олова, содержащих фраг-
менты типа лиганд—SnCb, например в (C8H]2KPt3(SnCl3J
(разд. 9.10.4). В этих комплексах атом Sn связан с 3 атомами
С1 п 1 атомом Pt.
21 — 1284
322 26. Элементы подгрупп НЕ, ШБ и IVB
Существуют многочисленные молекулы, в которых олово об-
разует связи с атомами другого металла, к которым присоеди-
нены такие лпганды, как СО, С5Н5 и фосфнны. Четыре связи,
образуемые оловом в таких случаях, направлены к вершинам
тетраэдра с различной степенью искажения тетраэдрических
углов. Например, в Sn[Fe(COL]4 [3] искажение настолько
велико, что сближает попарно атомы Fe (Fe—Fe 2,87 А). Осо-
бый интерес в таких соединениях представляют связи металл —
металл:
(СО),
(СО),
»Fe'
s2,54A
/ X
/
Fe(C0L
';2,87 A
Fe(C0L
Тетраэдрическая координация Sn(IV) присуща и многим
тиостаннатам; однако в некоторых из них атом металла обра-
зует 5 или 6 связей (см. ниже).
Тригонально-бипирамидальная координация. Простейший
пример-—ион SnCl5" [4], изученный в соли с замещенным цнк-
лобутенил-катионом (а). В кристаллическом [(CH3JSnCl-
• (terpy)] + [ (CH3JSnCl3]~, содержащем одновременно ионы б
и в [5], налицо и пятерная, и шестерная координации оло-
ваAУ).
Кристаллические соединения (CH3KSnX не содержат тст-
раэдрическнх молекул, как, например, (CH3KGeCN [6]. пли ио-
нов Sn(CH3),y" и X". Они состоят из бесконечных лппош-шх
молекул с плоскими группами Sn(CH3K, объединенными через
атомы X. Группы СН3 находятся в экваториальной плоскости
трпгональноп бипирамиды — координационный полиэдр Sn(IV).
С1
Cl
I
Cl-Sn'
С1
в
"СН,
CF
N-
N-
Были исследованы многочисленные соединения этого типа с F
[7], ОН [8], CN [9], —О—С(СН3)—О [10] и дицианамидом
[10а] в качестве X. В зигзагообразной цепочке (CH3KSn0H
угол между связями при О составляет 138°; в слабо асиммет-
ричных мостиках связи Sn—О имеют длину 2,20 и 2,26 А.
26.7. Структурная химия олова и свинца 323
В (СН3)г,5п(дицианамид) изогнутый мостиковый лиганд имеет
следующие размеры:
N^28 A
(В противоположность (CH3JSn(NCNCNJ, где Sn имеет ок-
таэдрнческую координацию, такую же, как в Sii(CH3JF2)
структуру соединения с дицианамидом можно представить как
сетку с квадратными петлями из атомов Sn, соединенных мос-
тиковыми группами —XCNCN—, причем координация Sn(IV)
дополнена до октаэдра двумя аксиально расположенными груп-
пами СН3.) (СН3KРЬОН и (СНз)зРЬ(СНзСОО) изоструктурны
соответствующим соединениям Sn и представляют особый ин-
терес как редкие примеры тригонально-бипирамидальной коор-
динации Pb(IV).
Октаэдрическая координация. Строение кристаллических
SnF4 [11] и SnF2(CH3J [12] описано в гл. 5. Их структуры
построены из октаэдрических групп SnF6 или SnF4(CH3J, со-
единенных между собой атомами F, находящимися в экватори-
альной плоскости, с образованием бесконечных слоев:
Sn—F
(мостикопая)
Sn—F
(концевая)
Sn-C
SnF4
SnF2(CH3),
2,02 А
2,12 А
J ,88 А
2,08 А
И Sn, и РЬ образуют многочисленные октаэдрические ионы
МХ62~. Например, Rb2SnCl6 и Rb2PbCl6 кристаллизуются в
структурном типе K2PtCl6; в растворе были изучены [13] ионы,
промежуточные по составу между SnF62~ и Sn(OHN2^, в виде
солей выделены M2SnF5OH и M2SnF4(OHJ [14].
В кристаллических соединениях SnCl4-A2, где А, например,
РОС13 [15] или SeOCl2 [16], два атома О молекул А достраи-
вают координационный полиэдр Sn(IV) до октаэдра, при этом
образуется цме-изомер (рис. 26.10, в и г).
Аддукт с тетрагидротиофеном C4H8S [17] является исклю-
чением не только потому, что в кристалле молекулы имеют
транс-конфигурацию, свойственную молекулам с лигандами
большого объема, но также вследствие того, что is растворе он
проявляет высокий дипольный момент EД), что пока не име-
ет удовлетворительного объяснения. Другими примерами окта-
эдрнчеекпх комплексов Sn(IY) служат диметилоловобис-8-гндр-
оксихшюлппат (а) [18] и SnCl4[NC(CH2KCN] (б) [19]; в по-
следнем глутаронитрильные молекулы соединяют атомы Sn в
21*
324 26. Элементы подгрупп II Б, IIIБ и IV Б
бесконечные цепочки (обратите внимание на цис-положепие
атомов азота в координационной сфере олова).
6
а
-о.
,N
^N^
С)
i
С11,
В диоксидах олово и свинец образуют шесть октаэдрически
направленных связен; кристаллы имеют в значительной степени
ионный характер.
Структура Sn(OHL неизвестна. Из раствора SnCU при до-
бавлении NH4OH осаждается гелеобразный Sn(OHL, кото-
рый при высушивании (до постоянной массы) при 110сС дает
остаток состава 5пОзН2. Дегидратация последнего до S11O2 при
температуре >600°С, по-видимому, проходит через стадии об-
разования определенных кристаллических фаз состава Sn2O5H2,
Sn.-OgHs и SnsOiebb [20]. Примером двуядерной молекулы с
двойным гндрокенльным мостиком является соединение с эмпи-
рипеской формулой SnCl2(OH) (C2H5) (Н2О) [21]:
а
нги
а
с%н5
он
он
5 !
нго а
В SnS2 (структура Cdl2) олово связано с шестью октаэдри-
чески расположенными соседними атомами серы; сера образует
три связи, направленные к вершинам пирамиды. При атмосфер-
ном давлении свинец не образует дисульфида, однако при вы-
соком давлении были синтезированы две формы PbS2 [22j, од-
на из которых имеет, по-видимому, структуру Cdl2, как и SnS2.
Об октаэдрических комплексах Sn(IV) см. работу [23].
Sn(IV), образующий семь и восемь связей; Pb(lV), образу-
ющий восемь связей. Структурные исследования, достоверно
подтверждающие существование соединений, где координаци-
онные числа олова(IV) и свинца(IV) выше шести, немногочис-
ленн: , и в каждом таком случае все или большинство связен
атома металла образуются с парами атомов кислорода соот-
ветствующих хелатных лигандов.
В могогидрате SnY(H2O) [24] (где Y — анион этиленди-
амиг'Т'Тргук-'^ной ;.:ir"OT" СЭДТА)) Sn(IV) связан с тремя
26.7. Структурная химия олова и свинца 32.)
парами атомов кислорода лпганда п одной молекулой Н2О*.
Для геометрии координационного полиэдра Sn(IV), где послед-
jiiiIi имеет К.Ч 7, трудно предложить простое описание, она
близка к геометрии Д\п"ПУ(Н2О) (рис.27.3, г)**. С трополо-
пом (Т) (а) олово образует хелатные комплексы SnT3Cl и
ЬпТз(ОН), конфигурацию которых можно приблизительно
описать как пентагоналыю-ппрампдальную (б) [25]. В тропо-
лоне расстояние между атомами О равно 2,56 А; в бидентатном
ноне NO3^ оно составляет только 2,14 А, и в молекуле
с б
H
нг
4'-
Д).
-1
SI
О -i- -
Sn(NC>3L [26] четыре ЫОз~-группы располагаются вокруг ато-
ма олова (IV) по тетраэдру, дополняя КЧ Sn до 8. Тот же специ-
фический полиэдр возможен и в комплексе с ацетатными лнган-
дамн, в которых расстояние О—О такое же, как в NO3 '. Для
свинца (IV) КЧ 8 найдено в РЬ(асL, полиэдр в этом случае име-
ет форму уплощенного триангулированного додекаэдра [27].
Литература, [la] J. Chcm. Soc, A 1970, 911. [161 Acta cryst., 1972, В28, 2323.
|1н| J. Chcm. Soc, Л 1970, 2862. [21 Inorg. Chcm., 1963, 2, 1310, [31 J. Chcm.
Soc, A 1967, 382. [41 J. Am. Cliem. Soc, 1964, 86. 733. [51 J. Chcm. Soc, A 1968,
3019. [6) Inorg. Chcm., 1966. 5, 511. [71 J. Chem. Soc, 1964, 2332. [81 Acta cryst.,
1978, B34, 129. |9| Inorg. Chem., 1966, 5, 507. [101 Acta cryst., 1975, B31. 27-10.
|10a| Inorg. Chcm., 1971, 10, 1938. [11] Naturwiss., 1962, 49, 254. [12] Inorg.
Chcm., 1966, 5, 995. [13| Proc Chcm. Soc, 1964, 407. [141 Z. anorg. allgcm.
Chcm., 1963, 325, 442. [15] Acta Chem. Scant!., 1963, 17, 759. [161 Acta cryst.,
1960, 13, 656. |17| J. Chcm. Soc, 1965, 1581. [18] Inorg. Chem., 1967, 6, 2012.
119] Inorg. Chem., 1968, 7, 1135. |20] Inorg. Chcm., 1967, 6, 1294. [211 Acta cryst.,
1976, B32, 923. |22| Inorg. Chem., 1966, 5, 2067. [23] J. Chem. Soc, A 1970, 1257.
B4] Inorg. Chem., 1971, 10, 2313. |25| J. Am. Chcm. Soc, 1970, 92, 3636. [26] ,1.
Chcm. Soc, A 1967, 1919. [27] Acta cryst., 1963, 16, A34.
26.7.2. Структуры некоторых тиостаннатов. Не ставя своей
целью дать полный структурный обзор серосодержащих соедп-
* Автор допускает неточность: в координации Sn(IV) участвуют два ато-
ма N и четыре атома О гексадентатного ЭДТЛ (седьмое место занимает моле-
кула ноды). — Прим. ред.
** Координационный полиэдр Sn(IV) в SnY(IUO), как п полиэдр Мп(П)
в MnHY(HjO), — искаженная одношапочкая тригональная призма. Ее прин-
ципиальное отличие от искаженной пентагональноп бипирамиды заключается
в противоположной копформуипп этплендпаминового фрагмента ЭДТА при
совпадении взаимного размещения п копформанип всех остальных фрагментов
лигаида. — Прим. ред.
326 26. Элементы подгрупп 11Б, 1ПБ и IVE
пений, опишем лишь структуру нескольких тиостаннатов, рас-
сматривая это как введение в очень интересную область кри-
сталлохимии. В этих соединениях олово(IV) проявляет КЧ 4
(тетраэдр), 5 (тригональная бипирамида) и 6 (октаэдр); их
строение, таким образом, имеет общие черты со строением со-
единений германия и свинца. К тиостаннатам натрия относятся
следующие соединения (в порядке уменьшения отношения
S:Sn): Na4SnS4; Na2Sn2S7, NajSn2S6, Na2SnS3 [1] и
Na4Sns08 [2]. В первых трех образуются островные ионы с тст-
раэдрпческоп координацией Sn:
26.7. Структурная химия олова и свиниа 327
©
©
4-
S Si
Sn— S
Sn
Sn
Такие ионы были найдены и в безводных солях бария, и в гид-
ратнрованных солях, например Na4SnS4- 14H2O и Na4Sn2S6-
• 14Н2О. В Na2SnS3, как и в SnS2, координация олова(IV) ок-
таэдрическая; кристаллы можно рассматривать как сверхструк-
туру NaCl, в которой октаэдрические пустоты между слоями
1 2
плотпейшей упаковки атомов S заняты поочередно: -^-Na-f--^- Sn)
и (все Na). Мотив размещения пустот, занятых Sn в слое пер-
вого типа, совпадает с показанным на рис. 4.24,E; такой изоли-
рованный слой имел бы состав NaSn2S6. Подобные слои, пере-
межающиеся со слоями Na3, приводят к составу Na2SnS3.
В этой структуре каждый октаэдр SnS6 имеет три общих ребра
с остальными октаэдрами SnS6. В PbSnS3 (структурный тип
NH4CdCl3) каждая группа SnS6 соединена с другими четырь-
мя общими ребрами, а в SnS2 (структура Cdl2)—шестью об-
щими ребрами. К этому ряду соединений можно было бы от-
нести La2SnSs [3], построенный из цепочек рутилового типа,
в которых каждая группа SnS6 соединена с другими двумя об-
щими ребрами, а также дополнительными атомами S (разд.
5.3.4).
Наиболее интересную структуру имеет тиостаннат натрия
Na4Sn3S8, в котором присутствует два типа атомов олова:
1 3 атомов олова (Siii) находится в тетраэдрической, а 2/3
Eпц) —в тригоналыю-бипнрамидалыюй координации. Полиэд-
ры второго типа (а) имеют по два общих ребра (штриховые
линии) с другими такими же полиэдрами и по одной вершине —
с тетраэдрами SnS4- Группа SnS4 играет лишь роль мостиков,
связывающих две ближайшие группы SnSs", а последние обра-
зуют трехмерную 3-связанную систему, являющуюся простым
развитием сетки A0, 3)-b (рис. 3.29, а). В трехмерной структу-
ре кольца б из шести атомов Snri (и двух Sni) (изображена
проекция на плоскость) фактически представляют собой спи-
рали.
а 6 |
s *
-S — Sn — S — Sfk
— S-
-Sn
.Sn —
Sn S Sn ?
Sn
Средние длины связей в этих соединениях таковы: Sn—4S
(тетраэдрические) 2,40 A, Sn—5S (тригонально-бипирамидаль-
ные) 2,59 А (аксиальные) и 2,42 А (экваториальные), Sn—6S
(октаэдрические) 2,55 А. Относительно других упомянутых со-
единений можно обратиться к работам [1, 2].
Литература. [1] Acta crvsi.. 1974, ВЗО,
152. [3| Ada cryst., 1974-," 330, 22^3.
G2O. [2] J. SolM Stale Cliem.. 1975. 14,
26.7.3. Соединения олова(П) и свинца(Л). Примеры соедине-
ний Sn(II) и РЬ(П), имеющих одинаковые структуры, немного-
численны; к ним относятся тетрагональные модификации мо-
ноксидов, оксогидроксиды М6О4(ОЫL, CsSnI3 и CsPbI3.
HSn(II), и Pb (II) образуют ковалентные соединения, в кото-
рых спи проявляют низкие координационные числа; их строе-
ние указывает на то, что свободная электронная пара стерео-
химически активна, однако эффект свободной пары гораздо
заметнее в соединениях олова, чем в соединениях свинца, и он
тем сильнее, чем более электроотрицателен лиганд; в этом от-
ношении Sn (II) проявляет больше сходства с Ge(II), чем с
Pb(II). Правильно октаэдрическая координация РЬ(П) обнару-
жена в PbS (структура типа NaCl) и РЫ2 (структура типа
Cdl2), но является редкой в соединениях олова(II) (SnS и
Snl2).
В низкотемпературных модификациях CsPbI3 или CsSnI3,
а также в КРЫ3-2Н2О эффект неподеленной электронной пары
отсутствует, хотя в двойных октаэдрических цепочках, из кото-
рых построены эти соединения, следует ожидать некоторого
искажения координационного октаэдра [1]. В структурах не-
окрашенных Pt>F2, PbCl2 и РЬВг2 (в противоположность SnF;
328 26. Элементы по<)групп ПБ, 111 Б и IV Б
и SnCl2) ионы РЬ2: имеют высокие коорлнпацпоппые числа
[8 или G+2)] (разд. 9.9.2); высокие координационные числа
обнаружены также в оксосолях свинца(П) (разд. 26.2). Струк-
туры Sn\\'O4 и SnSO4 обсуждаются позже; SnCO3 n Sn(NO3b
до сих пор неизвестны. Детали строения галогенндов и оксосо-
лей свинца(II) рассмотрены в других главах. Здесь остановим-
ся более подробно лишь на соединениях олова(II), а в заклю-
чение приведем несколько примеров ковалентных соединении
РЬ(П).
Если структуры SnCl2 и SnBr2 сопоставимы со структурами
РЬСЬ и РЬВг2, модифицированными таким образом, чтобы атом
олова(II) имел невысокое координационное число, отвечающее
стереоактивпостп нсподеленпоп пары, то структуры SnF2 и
Snl2 совершенно отличны от структур соответствующих гало-
генидов свинца. Фторпд олова существует, по-видимому, в трех
полиморфных модификациях [1а]: в дополнение к обычной
(u-форме) имеет две метастабпльные формы, структуры кото-
рых подобны GeF2 и ТеО2 (парателлурит). Обычная а-форма
построена из тетрамерных молекул а, в которых средняя длина
связи Sn—F в кольце Sn4F4 составляет 2,18 А, а связей вне
кольца —2,05 А [16]. В структуре присутствуют атомы Sn(II)
с двумя разными расположениями лигандов. На схемах бив
штриховые линии изображают межмолекулярные связи, три
кратчайшие связи, образуемые каждым из атомов олова, отно-
сятся к внутримолекулярным в тетрамере Sn4F8; они направле-
ны к вершинам пирамиды, угол между связями равен 84°
(средн.). Таким образом, учитывая все лиганды, связанные с
а
Sn"
\
Sn
S.ZZ /
t
I
\г.ю
, F
67 A
либо
центральным ионом, строение комплекса можно описать
как тстраэдрическое SnF3E, либо как октаэдрическое
Где ? — неподелепная электронная пара, расположенная на
одной из орбиталей.
В SnF2-AsF5 (состав 1:1) присутствуют циклические ка-
тионы Sn3F33a~ (г), и структурную формулу поэтому следует
писать в виде (Sn3F3) (AsF6K [1в|. Здесь осуществляется ха-
рактеристическая «односторонняя» четырехкоординационная
группа д, которую можно описать как искаженную квадратную
26.7. Структурная химия о.юаа и свинпа 32f->
пирамиду пли как производную от трпгональнои бипирампды
SnX4H. В окружение Sn входят еще четыре атома фтора ;:;\
д
^ V
> w
S-v
-ci
Z,!OAS
2,10 b,59
CI
F Sn
/ / ^Cl
больших расстояниях: 2F на расстоянии 2,85 А и 2F на рас-
стоянии 3,05 А.
Известно много галогенндов Sn(II), содержащих разные
галогены. Структуру SnCIF [2] можно было бы описать как
очень искаженную структуру РЬС12; сокращение расстояний до
четырех соседних атомов (IF на расстоянии 2,18 A, 2F — 2,39 А
и 1 С1 — 2,52 А) приводит к изгибу цепей е, очень похожих па
цепи в L—SbOF (разд. 20,3.6). В Sn2ClF3 [3] атомы Sn n F
образуют трехмерную 3-связакную сетку из атомов олова, со-
единенных мостнкэзымп атомами F (кубическая сетка на рлс.
3.28, а, в которой атомь: олова образуют по три пирамидально
направленные связи; Sn—F 2,15 А; углы между связями ~80с).
Хлопнд-ноны занимают полости в трехмерной сетке Sn2F3',
наименьшее расстояние Sn—С1 составляет 3,14 А.
В Sn2IF3 [За] присутствуют слон Sn2F3-: с атомами Sn, обра-
зующими по четыре связи (Sn—F 2,20, 2,23 и 2,38 (дваж-
ды) А). Слои построены из цепочек, подобных цепочкам в
SnCIF; хлор замещается фтором, цепочки соединены мостико-
вымн атомами F. В Sn3BrF5 [3] присутствует двумерный кати-
он Sn3F5+, слой представляет собой 3-связанную сетку 4,82
(разд. 3.4.1) с дополнительными «двухсвязанными» атомами Sn
вдоль отрезков, общих для восьмиугольников; каждая пара
атомов олова, участвующих в формировании сетки, связана,
естественно, мостиковыми атомами фтора; третий концевой
атом F присоединен к каждому из «двухсвязанных» атомов Sn
(разд. 3.9.4). Такой слой можно описать и как образованный из
колец Sn4F4 структуры SnF2, соединенных вместе посредством
дополнительных групп SnF3, причем в последних только два
атома фтора мостиковые.
Германий, олово и свинец образуют фториды смешанной ва-
лентности. В Sn3F8 [36] пирамидальные группы SnF3 образуют
цепочки, перекрестно соединенные октаэдрическими группам-
SnIVF6.
В системе NaF—SnF2—Н2О обнаружены только NaSn2F- ч
Na4Sn3F10, тогда как в системе с KF найден еще
330 26. Элементы подгрупп И Б, III Б и IV Б
обратите внимание на отсутствие комплекса M2S11F4. BKSnF3-
•'/гНгО [4] бесконечный анион состоит из квадратно-пирами-
дальных групп SnF4, объединенных через общие противополож-
ные вершины (рис. 26.11, а); молекулы воды не присоединяют-
ся к атомам олова. В NaSn2F5 [5] пара пирамидальных групп
SnF3 связана мостпковыми атомами фтора с образованием ио-
нов в Sn2F.f, которые далее объединяются в цепочки более сла-
быми связями B,53 А) (рис. 26.11, г;)- Концевые и мостпковые
Z.05A
(среди.)
2.04A
NaSn2F5
Рис 26 11 Металл-галогепидные комплексы в соединениях олова, а-
[SnCl2(H2O)]H,O; б—KSnFs-'/sIbO; в — NaSn2F5; г — Na4Sn3F,0.
связи по своей длине не отличаются от соответствующих связей
в КБпРз-'/гНгО. В Na4Sn3F10 [6] присутствуют сложные остров-
ные анионы, образованные из трех квадратно-пирамидальных
групп SnF4. Диапазон длин связей Sn—F в анионе (рис.
26Л1, г) весьма значителен; в частности, удлинение внешних
мостиковых связей свидетельствует о наличии тенденции к рас-
щеплению этого аниона на центральный ион SnF42~ и 2 иона
.SnF3-
В SnOF2 найдены и расположение четырех связей Sn(II) по
типу SnX4E, и тригонально-пирамидальная координация [7].
Sn
/Z,8OA
:,14А
F
Структурные субъединицы ж, в которых свободная электрон-
ная пара н 2 атома О расположены в экваториальной плоскости
26.7. Структурная химия п.юна и свинца ."J31
трнгонально-бипирамидального координационного поли :>дра,
объединены в цепочки через дополнительные атомы олова, об-
разующие пирамиды з. На рис. 26.12 цепочки изображены в
проекции с торца. Упаковка цепочек выявляет важность нспо-
делепных пар: в то время как атомы Sn в структуре з коптак-
36—1
Рис. 26.12. Проекция структуры Sn2OF2 вдоль направления цепи.
тируют с еще двумя атомами F соседних цепей, атомы Sn в
структуре ж не имеют в своем окружении дополнительных ато-
мов F или О, а лишь атомы Sn на расстоянии 3,29 А; ср. с ато-
мами Sn (Pb) па внешних поверхностях слоен в моиокепдах и
атомы Т! (I) вокруг капало?, в Т13ВО3 (разд. 24.7.2).
Хотя структуру SnC!2 [8a] можно описать как очень иска-
женную структуру РЬС12, наиболее короткие связи Sn—Cl выде-
ляют в ней пирамидальные группы SnCl3 с углами между свя-
зями 80° (два) и 105° (один); одна связь имеет длину 2,66 А и
две--по 2,78 А. Более удаленные соседние атомы расположе-
ны па расстояниях 3,06 (два), 3,22 (один), 3,30 (один) и
3,86 А (два). Спектр комбинационного рассеяния расплавлен-
ного SnCl2 [86] похож на спектр твердого вещества, что может
означат;,, что жидкость также состоит из цепочек, связанных
вместе группами SnCl3.
Соединение, которое первоначально рассматривалось как
SnCl2-2H2O, фактически отвечает формуле [SnCl2(H2O)] -
•Н2О [9] и состоит из пирамидальных групп SnCl2(FI2O)
332
Элементы iioticpi/nn 11B, IIIБ и IV Б
(Sn—Cl 2,59 A, Sn—О 2,16 А, угол между связями —85°)
н обособленных молекул Н2О. Пирамидальные ионы SnCl3~
присутствуют в K2(SnCl3)Cl ¦ Н2О [10J, которому первоначаль-
но приписывали формулу K2SnCl4-H2O, и в CsSnCl3 [11].
(К другим пирамидальным анионам относятся анноны з
О\ вплоашсттО Sn 3 плоскости
рисунка рисунка
О \въпиг плос- О Sn шшептскос-
ности рисцн- ти рисунка
ка на 6/2 на b/Z
Рис. 26.13. Проекция половины элементарной ячейки Snl2. Цепи, содержащие
два сорта атомов олова, перпендикулярны плоскости рисунка.
K[Sn(O2CHK] [12а] и Sr[Sn(CH2ClCOOK]2 [126], где Sn—О
— 2,15 А, а угол между связями О—Sn—О 80н-90°.)
Структура SnBr2 [13] относится к тому же общему типу, что
и структуры РЬВг2 и SnCl2 с очень неправильными восьмивер-
шпнными координационными полиэдрами атомов Sn; ближай-
шие соседние атомы расположены на расстояниях 2,81 (один),
2,90 (два) и 3,11 (два) A. Snl2 [14] имеет уникальную структу-
ру АХ2, совершенно неожиданную по своей сложности (рис.
26.13). Треть атомов олова (Sn') находится в позициях с почти
правильной октаэдрпческон координацией в рутилоподобных це-
почках, которые пересекаются с двойными цепочками, содержа-
щими остальные атомы металла. Эти последние атомы (Sn")
образуют пять более коротких и две более длинные связи с ато-
мами I:
Sn"—I
а 3,00 А
2ft 3,20
%: 3,25
Id 3,72
3,18 Л
Sn'—6 I -3,16
Посредством связей типа Ь двойные цепи присоединены к рути-
лоподобным цепочкам с образованием слоев в направлении, ука-
занном стрелками на рис. 26.13. Эти слои соединены более сла-
быми связями d в трехмерную структуру. Все пять более корот-
ких связей лежат по одну сторону от атомов Sn", координаци-
онный полиэдр которого можно описать как одношапочпую три-
гоиальную призму. Две более длинные связи направлены к ато-
мам одного ребра. Такой координационный E ¦' ?';-голпчл'»
26.7. Структурная химия олова и свинца 333
можно сравнить с G + 2)-полиэдром у РЬ в РЬС12. Две более
длинные связи с электростатическим усилием связи '/б (вме-
сто 7а для остальных пяти связей) по существу заменяют ше-
стую октаэдрпческую связь, образуемую Sn'.
Простые дигндрокспды типа М(ОНJ для олова (пли свин-
ца) неизвестны. Вместо этого они образуют соединения
Л\,;О4(ОНL [15], по структуре сходные с и6О4(ОНL'- (рис.
14.15). Осторожным нагреванием Sn6O4(OHL можно получить
метастабильную красную модификацию SnO. Обычная сине-
черпая форма SnO изоструктурна тетрагональному РЬО, в ко-
тором металл образует четыре связи, направленные к вершинам
квадратной пирамиды (Sn—О 2,22 А) [15].
GeS и изоструктурный SnS имеют слоистую структуру, по-
добную структуре черного фосфора (разд. 3.9.2 и 19.2); ее
можно также описать как вариант сильнодеформированной
структуры NaCl, в котором атом металла образует связи с тре-
мя пирамидально расположенными соседними атомами серы;
ср. ближайшее окружение атомов металла в GeS, SnS и PbS.
[ 3S 2,44 A f IS 2,62 A Pb—6S 2,97 A
Ge { 2S 3,27 ,, 2S 2,68
1 IS 3,28 5n I 2S 3,27
V IS 3,39
Аналогично располагаются сульфид-ионы вокруг олова в
BaSnS2, [16а]; атом металла смещен из центра октаэдра, образо-
ванного атомами S C S находятся на расстоянии 2,57A, 3S —
3,59-4-3,79 А). Эту структуру можно рассматривать как иска-
женную сверхструктуру типа NaCl таким же образом, как струк-
туру SnS можно представить как искаженную обычную струк-
туру NaCl.
Структура SnP3 [166] сходна со структурой SnS. Она по-
строена из арсеноподобпых слоев (рис. 3.2), имеющих менее
гофрированную конфигурацию двумерной сетки 6:!, чем анало-
гичные сетки в черном фосфоре. Четверть атомов Р замещена
Sn (разд. 19.3). Sп A1) образует связи с тремя атомами Р на
расстоянии 2,66 А и имеет в качестве соседей еще три атома
фосфора соседнего слоя на расстоянии 2,93 А.
Структуры SnSO4 и SnWO4 — искаженные формы структур
PhSO.) и Pb\VO4 с высокими координационными числами РЬ.
В соединениях свинца вокруг металла симметрично расположе-
но 12 и 8 атомов О соответственно, причем свободная элект-
ронная пара, по-видимому, занимает s-орбиталь; в соединениях
олова свободная пара стереоактивна, а координационные груп-
п;.! искажены. В SnSO4 [17] Sn имеет 3 пирамидально распо-
ложенных соседних атома О на расстоянии 2,26 А и 9 других —
на расстоянии 2,95-4-3,34 А; всего 12 соседних атомов О. Высо-
котемпературная кубическая модификация SnWO4 [18а] со-
334 26. Элементы поОсрупн I Hi, III Б и IV Б
держит тетраэдры W04-~~; олово имеет искаженно-октаэдрпче-
скую координацию, причем три атома кислорода находятся на
расстоянии 2,21 А, а три остальных—па расстоянии 2,81 А, не-
поделеппая пара проектируется на большую грань октаэдра
(одношапочнып октаэдр). В низкотемпературной модификации
SnWOj (ромбический) | 186] оба элемента— и Sn, и W— име-
ют пскаженно-октаэдрпческую координацию (W—О 1,80 ч-
-:-2,14 А), однако координационный полиэдр Sn(II) отличен от
его координационного полиэдра в высокотемпературной моди-
фикации. Еосьмикоординационная группировка вокруг металла,
в шеелитовой структуре распадается на пары: два атома О на-
ходятся на расстоянии 2,18 А, два атома О — на расстоянии
2,39 А (с расположением, типичным для «одностороннего» че-
тырехвершшшого полиэдра), два атома О — на расстоянии
2,83 А т: два более удаленных атома О — на расстоянии 3,44 А.
Из сказанного можно сделать следующие выводы:
1. Если лпгандамн являются F или О, то координационное
число Sn (II) невелико (обычно 3 пли 4, по иногда 5). а коор-
динационный полиэдр несимметричен, и все лиганды лежат по-
одну сторону от атома металла. Эффект неподеленной пары ме-
нее выражен в случае больших по размеру (и менее электроот-
рицательных) атомов галогенов н халькогенов в качестве лп-
гандов п вообще не наблюдается в некоторых (Snl6 или SnTe6)
группировках; SnTe, как и PbS, PbSe и РЬТе, обладает струк-
турой NaCl.
2. По своему строению соединения олова(II) во многом
напоминают соединения других элементов с неподеленной элект-
ронной парой, а именно соединения Gc(II), Sb (III), Se(IY) и I (V).
3. Тип искажения координационного полиэдра, обусловлен-
ный присутствием неподелешюп пары, очень чувствителен к
геометрии и топологии всей структуры в целом, что подтверж-
дается тем фактом, что в одном и том же кристалле могут при-
сутствовать координационные полиэдры олова различных ти-
пов: двух типов в a-SnF2, Sn2OF2 и SnioWi304G [19] и трех -
is Sn3(PO4J [20J. В этом ортофосфате, как и в Sn2OF2 и Т1ВО3(.
свободные электронные пары располагаются внутри каналов
структуры. Геометрия таких структур в целом с учетом распо-
ложения ближайших соседей атома металла, а также вычисле-
ние молекулярного объема, занимаемого анионом в некоторых
оксидах, оксосолях и фторидах, показывают, что неподеленные
пары можно рассматривать как «группу», занимающую объем,,
приблизительно равный объему О2~ или F~. Было предложено
два способа систематизации кристаллохимии Sn (II) и других
элементов с неподеленной парой.
При электростатическом подходе [21а, 216] исходят из то-
го, что координационная группа «нормального» иона того раз-
26.7. Структурная химия олова и свинца 335
мера, который имеет Sn2+ (т. е. без учета свободной электрон-
ной пары), представляет собой правильный октаэдр, причем до-
полнительная энергия стабилизации может быть выиграна при
объединении основного состояния 5 s2 с первым возбужденным
состоянием 5 s1/?1, вследствие чего октаэдрический полиэдр пре-
терпевает искажения; ср. с теорие/i кристаллического поля в
нонах переходных металлов (разд. 7.6.5). Альтернативно этому
подходу лиганды вместе со свободной электронной парой рас-
сматриваются как занимающие некоторое число гибридных ор-
бпталей; например, тригонально-пирамидальное расположение
лпгапдов описывают как тетраэдрическое sp3 (SnX3E), а распо-
ложение четырех лигандов получают из трпгонально-бипира-
мидального расположения пяти орбиталей (SnX4E). В связи с
этим уместно отметить трудности, возникающие при описании
менее правильных координационных полиэдров (см., например
разд. 1.4 и 3.3.5).
В молекулах с высокой степенью ковалентности связи сви-
нец (II) образует 2, 3 или 4 связи. Молекулы РЬС12, РЬВг2 и
P'tlv (а также галогениды олова) нелинейны (разд. 9.11), одна-
ко углы между связями, по-видимому, еще не определялись.
Неправильный семи- или восьмикоординационный полиэдр Pb2-
обнаружен в моноклинной модификации NH4Pb2Cl5, одного из
представителей семейства изоструктурных соединении AB2XS
где А = К, Rb, T1 или NH4, B = Pb или Sr, а Х = С1 или Вг [24].'
В тетрагональной модификации NH4Pb2Br5 [25] свинец(Н)
образует неправильный восьмивершпнник с двумя атомами Вг
на более близких расстояниях B,89 А), чем остальные C,16ч-
ч-3,35 А); в [Со(ЫН3N][РЬ4С1ц] [26] трехмерный анионный
каркас построен из групп РЬС17, имеющих форму одношапоч-
"пых тригональных призм.
Несколько искаженное пирамидальное расположение трех
связей атома свинца наблюдается в Pb(N2S2)NH3 (a) [27], где
б
1,5 8 А
1,54 A (C2H5JN-C
1,72 А
.C-N(C2HSJ
фрагмент PbN2S2 имеет плоское строение; расстояния- Pb S
2,73 A, Pb—NH3 2,24 А и Pb-N 2,29 А. Координационный по-
лиэдр в форме квадратной пирамиды найден в молекулах ди-
этплтиокарбамата (б) [28] и родственных ему этилксантате
[29] и диэтилоксидитиофосфате [30]. Неплоские молекулы
комплекса свинца [31] с фталоцианином образуют колонки,
в которых атомы Pb расположены вертикально друг над другом
26. Элементы подгрупп 11Б, ШБ и IVБ
на расстоянии всего 3,73 А, что ненамного больше расстояния
РЬ—Р1) в металле, равном 3,48 А. Еще менее правильное рас-
положение семи или восьми соседних атомов в таких соедине-
ниях, как РЬ02(тпокарбампдJ [32] и РЬ (тпокарбампд) (аце-
тат); Pb[SC (ЛПгЫ (^НдОгЬ [33J, по-впднмом\, определяет-
ся заметной степенью ионного характера связен.
В отличие от бесцветных РЬР'г, РЬСЬ и таких оксосолеп. как
нитрат, сульфат и т. д., содержащих ионы РЬ- , оксиды имеют
интенсивную окраску. (Отметим также, что, хотя PbSO4 и
PbMoC>4 lie окрашены, а РЬСгС>4 окрашен в бледно-желты и цвет,
совместное осаждение твердых растворов этих соединении при
соответствующих соотношениях компонентов CrO4: SO4: MoO4
приводит к образованию осадков с интенсивной ярко-алой
окраской — так называемых багровых хромовых пигментов.)
В тетрагональных РЬО и Ag2Pb02 |34] атом РЬ координи-
рует 4 аюма кислорода, находящихся в вершинах основания
квадратном пирамиды, тогда как в РЬзО4, Pb2Ti04 и
PbCu(OHJSO4 [351 свинец(II) образует 3 связи; здесь можно
говорить об аналогии с сурьмой(III).
В структуре РЬ3О4 (рис. 12.15) присутствуют не только ок-
таэдры PblvO6, о чем упоминалось выше, но и цепи (Pb2!VO4) „''"",
в которых свинец(П) образует три связи, направленные к вер-
шинам пирамиды, подобно сурьме(III) в MgSb2O4. Как уже
отмечалось, PbS имеет структуру NaCl, но физические свойст-
ва галенита, например его непрозрачность, яркий металличе-
ский блеск, не отвечают свойствам обычных ионных кристаллов.
О РЬ(С-,Н5J см разд. 22.4.2, о РЬ4(ОНL^ и OPb2(OHN4i —
разд. 14.1, о РЬ6О4(ОНL и Sr,6O4(OHL — разд. 8.6.5.3.
Литература. [1| Ada Crysi., 1980, В36, 683. 782. |la] J. Solid Slate Chem., 1980,
33, 1. [1б| J. Solid State Chem., 1979, 30, 335. |1в] Ada cryst., 1977. B33, 232
[2] Acta cryst., 1976, B32, 3199. [3] J. Chem. Soc, D 1977, 865. [3a| Acta cryst.
1978, B34, 308. [361 Chem. Comm.. 1973, 944. [4] Acta crvst., 1968. B24, 803
[5| Acta cryst., 1964, 17, 1104. [6| Acta cryst., 1970. B26, 19. [7| Acta cryst., 1977,
B33, 1489."[8a| Ada cryst., 1962, 15, 1051. |8iT| J. Chem. Phys., 1967, 47, 1923
[91 J. Chem. Soc, 1961, 3954. [10| J. Inorg. Nucl. Chem., 1962, 24, 1039. [ 11] Acta
Chem Scand , 1970, 24, 150. |12al Acta Chem. Scand., 1969, 23, 3071. [1261 Acta
cryst., 1980, B36, 1935. [131 Ada Chem. Scand., 1975, A29, 956. [141 Ada cryst..
192, B28, 2965. fl5| Nature, 1968, 219, 372. [15a[ Acta cryst., 1980, B36, 2763.
|16a"| Acta cryst., 1973, B29, 1480. [166| J. Solid State Chem., 1972, 5, 441.
17| Acta cryst 1972 B28, 864 [18a[ Acta cryst., 1972, B28, 3174. [186| Acta
cryst, 1974," B30, 2088. [191 Ada cryst., 1980," B36, 15. f20| Acta cryst., 1977..
B33, 1812. [21al J. Chem. Soc, 1959/3815. [2161 J. Solid State Chem., 1974, 11,.
214 [221 J Solid State Chem., 1975, 13, 142. [231 -'¦ Solicl State Chem., 1979, 30,
23. [241 Acta cryst., 1977, B33, 259. [251 J. Chem. Soc, 1937, 119. [26] Acta cryst.,
1979 B35, 295. [271 z anorg. allgem. Chem., 1966, 343, 315. [281 Кристаллогра-
фия, 1956, 1, 514. [291 Acta cryst., 1966, 21, 350. [30] Acta cryst., 1972, B28,
1034. [311 Acta cryst., 1973, B29, 2290. [32] Acta cryst., 1959, 12, 727. [331 Acta
cryst., 1960, 13. 898. [341 Acta Chem. Scand., 1950, 4, 613. [351 Acta cryst.,
1961, 14, 747.
27. ЭЛЕМЕНТЫ VIII ГРУППЫ
И ДРУГИЕ ПЕРЕХОДНЫЕ МЕТАЛЛЫ
27.1. Введение
В этой главе подробно рассмотрена структурная химия в
основном островных комплексов железа, кобальта, никеля, пал-
ладия и платины. Строение наиболее простых соединений этих
и других переходных металлов (галогенидов, оксидов и др.)
рассмотрено в соответствующих главах. Группы соединений,
включающие гидридо-, оксо-, пероксо- и надпероксосоединения,
карбопилы и нитрозилы, описаны в предыдущих главах A1, 12
и 18 соответственно). Здесь мы рассмотрим несколько вопросов
общего характера.
Образование комплексов с определенными лигандамн пли
комплексов, имеющих особые типы или направленность связен,
по-видимому, характерно для небольшого числа переходных ме-
таллов. Например, в соединениях многих элементов присутству-
ют связи металл — металл (см. гл. 7), но образование кластер-
ных соединений с галогенами (т. 2, разд. 9.10.3) особенно ха-
рактерно для ниобия, тантала, молибдена, вольфрама, рении и
технеция; некоторые другие группы комплексов, содержащих
связи металл — металл, приведены в табл. 7.9 (т. 1). Образова-
ние комплексов, содержащих кроме прочих лигандов небольшое
число атомов кислорода, прочно связанного с металлом, явля-
ется важной характерной чертой химии четырехвалентного ва-
надия (см. разд. 15.2.6 и 27.2 о соединениях ванадила), а так-
же пяти- и шестивалентного молибдена*. Известны комплексы,
содержащие нейтральные молекулы, например СО, NO, NH3
и т. д.; недавно были получены соединения, содержащие N2
(с кобальтом и рутением) и SO2 (с иридием и рутением)**. Ока-
залось, что некоторые лиганды могут связываться с переходны-
ми металлами двумя совершенно различными способами, напри-
мер SO2 (т. 2, разд. 16.7.4), NO (т. 2, разд. 18.8.2), SCN"
(разд. 21.7.9)***. Существуют весьма примечательные различия
между комплексами с молекулярным азотом и кислородом.
В комплексах с молекулярным азотом присоединение последне-
* А также Re(V) и Os(VI). — Прим. ред.
¦*¦"'¦ И соединения rf-мсталлов, содержащие О2. — Прим. ред.
*¦"* Способность к различной координации характерна и для многих других
лигандов, в частности для NO2, BH4, большой группы полидентатных органи-
ческих лигандов и т. д. — Прим. ред.
22—1284
•!3"> 27. Элементы VIII группы и другие переходные металлы
27.1. Введение 339
го происходит через одни из атомов N, причем азот сохраняет
ту же структуру, что и в свободной молекуле N2; но если осу-
ществляется координация О2 иридием, то молекула Ог претер-
певает существенную перегруппировку. Более того, эта пере-
группировка отличается в IrCi (СО)О2(Р(С6Н5);,J. обратимо об-
разующемся в бензольном растворе из IrCl (СО) (Р(С6Н5)зJ,
от перегруппировки в аналогичном соединении с I вместо С1,
получающемся по необратимой реакции (т. 2, разд. 11.3.8).
Особый интерес представляют связи повышенной кратности,
образуемые атомарным азотом в некоторых соединениях Os и
Re. Например, в октаэдрическом анионе в K2[Osv'NCl5] (a)
[1] кратность связи с атомом азота формально равна трем;
то же относится к пятикоординационному комплексу
RevNCl2(P(C6H5KJ [2], который имеет конфигурацию, про-
межуточную между тетрагональной пирамидой и тригональной
бипирамидой. В молекуле б [3] связь Rev—N существенно
длиннее (двойная ?), а в комплексе в [4] еще длиннее. Этот не-
ожиданный результат позволяет предположить, что на длину
связи металл—азот могут влиять стерические факторы*.
Отметим, что в обоих комплексах — а и в — наблюдается удли-
нение связи М—С1, лежащей в гране-положении к М—N.
Анионы в (As(C6H5L)(RuNCl4) (г) [4а] и
(As(C6H5L) (OsNCl4) [46] служат примерами квадратно-пира-
а
1,61 А
C1 2,61 А
-2,36 А
С1
Рф2Е1
(ф -фенил)
С1
К и
CI С1
* Тем не менее нет никаких оснований полагать, что в б связь Re—N двой-
ная, а в в ординарная, как это изображено на схемах. Расстояние Re—N
в в значительно короче типичного для ординарной связи. — Прим. ред.
мидальиых комплексов с кратностью связи М—N, равной трем
(длины связи 1,57 и 1,60 А соответственно).
Некоторые типы координационных полиэдров металла в изо-
лированных комплексах явно связаны со спецификой лигандов.
Так, необычная тригоналыю-призматпческая координация ме-
таллом шести атомов серы, осуществляющаяся в дисульфидах
ниобия, тантала, молибдена, вольфрама и рения, наблюдается
п и хелатных комплексах некоторых из этих металлов с неко-
торыми S-содержащими лигандами. Примерами таких соедине-
на i'i могут служить Mo(SCHCHSK и изоструктурное соедине-
ние вольфрама [5], Re(S2C2(C6H5JK [6a], V(S2C2 (С6Н5Ь) з
и изоструктурный ему комплекс хрома [66]. Координационные
многогранники в виде додекаэдра в ковалентных комплексах
пока обнаружены лишь для очень ограниченного числа метал-
лов, например в октацианокомплексах молибдена и вольфрама
(разд. 22.1.2). Тригонально-бипирамидальная направленность
пяти связей найдена в многочисленных комплексах переходных
v галлов, включая следующие ^-комплексы более тяже-
лых элементов VIII группы: Os° (СО)з(Р(С6Н5)зЬ VI
Rh!H(CO)(P(C6H5Kb [81 и 1г1С1(СОJ(Р(СбН5)зJ [9]. В этих
соединениях обязательно присутствуют лиганды, стабилизиру-
ющие низкие состояния окисления, так же как это имеет место
в случае тетраэдрических комплексов Ni(COi4 и
Р[°СО("Р(С6Н5)з)з [Ю]; особенно интересно последнее соедине-
ние, так как платина не образует простых карбонилов.
Формальная степень окисления может быть определена как
: аряд, остающийся па атоме металла, если в состоянии завер-
шенной электронной конфигурации удалить лиганды, непосред-
ственно связанные с металлом, например молекулу NH3, Cl~,
N0+ * или Н~. Для марганца известны все степени окисления —
от -f7 (d&) в Мп2О7 до —3 (d10) в Mn(NOKCO; они также
многочисленны у хрома и железа, но их число быстро умень-
шается при переходе по ряду элементов (к началу и концу ря-
да) периодической системы. Все Зй-элементы от Ti до Ni про-
являют степень окисления 0, но эта и другие низкие степени
окисления возможны только в комплексах с определенными
лшандами, которые можно разделить на два типа. Лиганды
л-акцепторного типа (я-кислоты; например, СО, CN~, RNC,
PR-?, AsR3) не только содержат свободную пару электронов,
посредством которой они образуют с металлом о-связь, но име-
ют и вакантные орбитали с низкой энергией, с помощью кото-
рых металл может осуществлять дативное взаимодействие,
приводящее к перераспределению отрицательного заряда, воз-
Ситуация с нитрозильной группой неоднозначна; с равным правом за-
чшченную электронную конфигурацию можно приписать и NO~. — Прим. ред.
22*
340 IV. Элементы VIII rpi/ппы и <)pv.*ue переходные металлы
1
I
аблица
рулпы
III—VI
3—0
27.'!.
Ф
11.'i
п.р.1
Л\п
4
Тс
6
Re
7
ilSUCill
;; u
Г:О
3
Ru
6
Os
6
к.' с;
Co
3
Rli
6
Ir
6
c;iei
11 01
Xi
2
Pr
4
Pt
6
in osiiciciim
чепдах
fpV.'hibi
и;—vi
3—6
в Они
Оке
Мп
/
Тс
7
Re
7
арных
иды
Fe
3
Ru
8
Os
8
фтор i
Со
Rli
3
i!"
4
i;uix
\i
9
Pd
• )
Pt
4
никающего вследствие образования о-связей. я-Комплексы,
образуемые ненасыщенными органическими молекулами и ио-
нами (например, С5Н5, СбНб), в которых связеобразование
металл — лиганд целиком осуществляется за счет л-орбиталей
лиганда, описываются в гл. 22 и затем в этой главе (соедине-
ния платины и палладия). Наиболее высокая степень окисления
проявляется в соединениях с наиболее электроотрицательными
элементами О и F; но здесь следует обратить внимание на два
обстоятельства. Во-первых, в соединениях с фтором — наиболее
электроотрицательным элементом — наивысшая степень окисле-
ния реализуется не всегда, например для марганца и технеция
валентность, соответствующая номеру группы, осуществляется
в соединениях с кислородом Мп2О7 и Тс2О7, но эти элементы
не образуют гептафторидов. Рутений и осмий дают тетраокси-
ды, но для них неизвестны октафториды (табл. 27.1). Во-вто-
рых, ряд элементов проявляет более высокую степень окисления
в сложных, а не простых фторидах и оксидах (ср., например,
Cs2ColVF6 и Cs2NiIVF6 с CoF3 и NiF2 — наивысшими из извест-
ных в настоящее время фторидами Со и Ni). Аналогичное раз-
личие обнаружено и у кислородных соединений. Степень окис-
ления железа достигает шести в (FeO4J~~ по сравнению с
Ре (III) в высшем оксиде. Высший оксид кобальта — это СоО
(существование чистого Со2О3 не доказано), но в соединении
СозСч его степень окисления Со3+, а Со (IV) может существо-
вать в Ва2СоО4, хотя этот факт требует еще проверки. Единст-
венно известные соли Со3+ — это CoF3 (безводная и гидрати-
рованная), Со2 (SO4K- 18H2O и квасцы, а также Со(Г\Ю?,)з.
Последняя была получена в виде темно-зеленых гигроскопич-
ных кристаллов при действии N2O5 на CoF3. Она восстанавли-
вается водой [11]. Структуру этой соли см. в разд. 18.8.7 (т. 2).
27.','. Стереохимия 77G1) в острооных комплексах 341
Точно так же отсутствуют доказательства существования без-
водного МьСЬ, но N4i+" присутствует в LiNiO2. (В табл. 27.1
мы опустили соединение 1гО2.7, которое получается, как описа-
но в литературе, при спекании Ir с Na2O2.)
Последующие краткие разделы посвящены рассмотрению
изолированных комплексов Ti и V и комплексов, в которых
некоторые металлы проявляют необычно высокие координаци-
онные числа; далее мы более подробно рассмотрим структур-
ную химию Fe, Co, Ni, Pd и Pt.
Литература. |1{ Ir.or^. Chem., i9::9, 8, 709. |2| Inorpf Cr
|;»,| I.iortr. Clr: '
1975. В31, 26E7
19i;5, 87. 5798.
si., 19;i9. 3, 703. [41 Inor».;. Chem., 1967, 6, 197
п., 1907, 6, 204.
[4a] Ada crvsl.,
146 .1. Crvsl. Mo\ Struct..1975, 5, 83. |5| J. Am.' Chem. Soc,
¦>al luorg. Clioni., 196(>, 5, 411. j t;о; Inorg. Chem., 1967, 6, 1844.
f7| lii"!-;;-. Cliem.. 1969, 8, 419. |8| Ada cryst., 1965, 18, 511. [9| Inor»\ Chem.,
i;.i=0. К. 27М. 110J liiort;. С1кт., НКЮ, 8, 2109. fll| J. Chem. Soc, A 1969, 2699.
It.
fi(IV) в некоторых островных
комплексах
В изолированных комплексах у Ti (IV) встречаются координа-
ционные числа 4, 5, 6, 7 и 8, хотя два последних реализуются
лишь в комплексах с особыми бидентатными лигандами. Пра-
вильная тетраэдрическая координация осуществляется в TiBr4
н Til4; если С;;Н5 рассматривать как один лиганд, то несколько
искаженный тетраэдрическип многогранник реализуется в
Ti(C-,H:,b(NnJ [la], Ti2Cl40(C5HrjJ [16] (рис. 27.1, а) и цик-
лическом [ТЮС1(С5Н5)]4 [1в]. Чаще всего встречается КЧ 6,
особенно в соединениях с кислородом и кислородсодержащими
лигандами; КЧ 4 в кристаллических оксидах встречается редко;
примером такого соединения может служить f5-Ba2Ti04 [Ir].
Окт;ь)дрическая координация предпочтительна для Ti и в тет-
рагалогенидах, которые легко образуют аддукты с такими мо-
лекулами, как РОСl:i и этилацетат. В алкоксидах металл при-
обретает октаэдрическое окружение за счет образования тетра-
меров. С ацетплацетоном Ti образует октаэдрическую молекулу
Ti (ас-ас) 2С12 и, подобно кремнию, ион [Ti (асас) 3]+, но в отличие
от циркония не образует М(асасL. С такими специфическими
лигандами, как диарсин, S2CN(C2H5J и бидентатный нитрат-
ион, Ti образует 8-координационные комплексы. (О соединении
Ti(NO;L см. разд. 18.8.7 т. 2.) С диарсином титан образует
комплекс TiCl4 (диареип), имеющий, по-видимому, октаэдриче-
ское строение, а также комплекс TiCU (диарсипJ Г2а] в фопме
додекаэдра (рис. 27.1, б); Zr, Hf и Nb образуют аналогичные
комплексы. Атомы мышьяка занимают вершины типа А на
пне. 'Л.Т.а, а атомы хлора — вершины типа В: длины связен:
Ti—C1 2,46 А и Ti—As 2,71 А. Молекула Ti(S2CNEt2L тоже
342 27. Элементы VIII группы и другие переходные металлы
имеет конфигурацию додекаэдра, так же как и аналогичное
соединение ванадия [26] и близкое к нему соединение
V(CH3CS2L [2в].
К примерам 5-координационного полиэдра титана относятся
анион в (TiCl4O) (NEi4J [^1 (рис 27.1, в), имеющий форму
Cl 7,7SA Cl
Cl-5jiArO3-TL—Cl
с5нь
Рис. 27.1. Строение молекул и ионов, содержащих титан (см. текст i.
квадратной пирамиды и изоструктурный с соответствующим со-
единением ванадия, и мостиковая молекула г (рис. 27.1) [4] с
координационным многогранником, близким к тригопальной
бипирамиде. Обнаружено, что в родственном ему (красном)
феноксисоединении мостик (плоский) несимметричен и связи
Ti—-О имеют длины 1.91 и 2,12 А [5].
Тетрамерная молекула алкоксида состава [ТЦОСНз)^ [6]
была представлена на рис. 5.8, з (т. 1, гл. 5); она представляет
собой совокупность четырех октаэдров. В этом тетрамере име-
ются две пары неэквивалентных атомов титана с октаэдриче-
ской координацией; октаэдры имеют по два или три общих
ребра. Длины связей Ti—О изменяются от 1,8 до 2,2 А; некото-
рые из атомов кислорода связаны только с одним атомом тита-
на, другие — с двумя или тремя. В отличие от красных соеди-
'21'.Я. Стереохимия координационных соединений ванадия 3i3
нений типа г (на рис. 27.1) алкоксиды бесцветны. К Друго-
му типу мостиковых молекул принадлежит молекула
ТЪСЫСНзСООСгНбЬ [7] (рис. 27.1, д), в которой каждый из
двух этилацетат-ионов связан со своим атомом титана, а два
атома хлора образуют мостик, связывающий две октаэдриче-
ские координационные группы по общему ребру.
Выше мы уже говорили об ацетнлацетонатных комплексах
Ti(acacJCl2 и [Ti(acacKJ+. В оранжево-желтом соединении
Ti2Cl2O(acacL [8], которое кристаллизуется с одной молекулой
хлороформа, содержатся почти линейный мостик Ti—О—Ti и
короткие мостиковые связи Ti—О (рис. 27.1, е). Красная соль
Ш1К0Л1ПЮВ0Й кислоты Кг^гСК(CyHsOjXbJ • ЗНгО [9| содержит
строго линейный мостик Ti—О—Ti (где ОМОст лежит на оси 2-го
порядка), а координационный многогранник ж (рис. 27.1) ана-
логичен координационному многограннику вольфрама в соли
1\^А\ 2Оц-4Н2О (разд. 11.3.8), которая также содержит пероксо-
группы, связанные с атомами металла. На рис. 27.1, ж штрихо-
вые линии изображают связи, перпендикулярные плоскости
циклообразующих лигандов и пероксогрупп, так что координа-
ционный многогранник, образованный Ti, можно описать либо
как пентагональную бипирамиду, либо как октаэдр, если груп-
пу Oj представить как один лиганд.
Литература, [la] Acia cryst., 1977, ВЗЗ, 578. [1б| .1. Am. Chem. Soc, 1959, 81,
5510. \\ъ\ Act a crvsi., 1970, В26, 716. [1г] Ada cryst., 1973. B29, 2009. [2a] J.
CliLTii. Soc, 1962, 2462. |26|, Chem. Comra, 1971, 365. [2в] Acta cryst., 1972, B28,
1298. Щ Acta cryst., 1968, B24, 282. [41 Acta cryst., 1968, B24, 281. [51 Inorg.
Chem.. H)(i6, 5, 1782. [6| Acta cryst., 1968. B24, 1107. [7"| Acta cryst., 1966, 20,
739. |,sj Inor</. Chem., 1967, 6, 963" [91 Inorg. Chem., 1970, 9, 2391.
27.3. Стереохимия некоторых координационных
соединений ванадия
Структурная химия бинарных соединений ванадия в различных
степенях окисления (II—V) уже была описана в предыдущей
главе; особенно это касается необычной координации вана-
дия (V) атомами кислорода в оксидах и оксосолях, где кроме
тетраэдрического встречается квадратно-пирамидальный или
искаженно-октаэдрическии многогранники (см. разд. 12.7.2 и
13.7). В пяти- и шестикоординационных соединениях присутст-
вуют четыре или пять связей длиной 1,6—2,0 А и обычно (но
не всегда) одна более длинная связь, которая иногда бывает
настолько велика (например, 2,8 А в V2O5), что правильнее
описывать структуру как квадратно-пирамидальную, а не иска-
женно-октаэдрическую*. Такой неправильный шестикоордина-
"' С stum утверждением трудно согласиться. Расстояние 2,8 Л свидетель-
ствует лишь о резком ослаблении связи У—О из-за гранг-влияния кратной
связи О = у. - - Прим. ред.
344 27. Элементы VIII группы и другие переходные металлы
ционный многогранник найден и в метокенванадате УО(ОСН:!K
[1], который представляет собой цепочку октаэдрпчеекпх груп-
пировок, связанных между собой но двум (непараллельным)
ребрам. Эти октаэдрические группы очень искажены, они содер-
жат пять различных по длине связей V—О; из них две наиболее
короткие A,54 и 1,74 А) относятся к концевым атомам кнело-
О
рода (рис. 27.2, а). В структуре чередуются мостики V V
чо//
(среднее)
О О
Рис. 27.2. а — фрагменты цепи в VO(OCH3h; б — диванадпл-й/-тартрат-ион;
в —ион [VO(NCSL|2~.
симметричного (все четыре расстояния V—О составляют
~2,02 А) и несимметричного (расстояния V—О равны 1,85 и
2,27 А) строения; длины шести связей V—О любого атома
V(V) имеют следующие значения: 1,54, 1.74 185 2 02 иве-) и
2,27 А.
Во многих комплексах ванадила пять ближайших лигандов
находятся в вершинах квадратной пирамиды, причем апикаль-
ная связь V = O чрезвычайно коротка (близка к 1,6 А).
В табл. 27.2 приводятся некоторые примеры, иллюстрирующие
Таблица 27.2. Длины связен в комплексах ванадила
Комплекс
VOCl2(tmuJ
VOC12(OP(C6H5KJ
VO(acacJ
Na4[VO-d,/-TapTpaT]- 12H2O
(МН4L[\Ю-си-тартрат|-
¦2Н2О
Длины связей V—О, А
одна
1,61
1,58
1,57
1,62
1,60
две
2,00
1,99
1,97
1,91
1,86
дне
2,34
(V-C1)
2,31
(V-C1)
(четыре)
2,00
2,02
Литература
Acta crvst., 1970, В26,
872
Acta crvst., 1980, B36,
1198 "
J. Chcm. Phvs., 1965, 43>
3111
Inorg. Chem., 1968, 7r
356
J. Chcm. Soc, A 1967
1312
'7 3. Стереохимия координационных соединений ванадия
345
сказанное, например интересное соединение диванадил-d,/-
тартрат-ион, приведенный и на рис. 27.2, 6. Расстояния до че-
тырех атомов Отарт близки к расстояниям V—ОаСас A,98 А) в
Vni(acacK [2] — соединении, легко окисляющемся до
VO(acac),.
Однако во многих гидратированных солях ванадила присут-
ствует шестой атом кислорода на достаточно близком расстоя-
нии B,2 А), дополняющий полиэдр V до искаженно-октаэдри-
ч<чы;п). В частности, это относится к (N! IO2! VO (СоО4) >Н?О]
|3|, (NH4J[VO(SCNL]-5H2O [4] (см. рис. 27.2, в) и к неко-
торым гидратированным сульфатам ванадила, которые имеют
строение, удивительно напоминающее строение гидратирован-
ных сульфатов магния (т. 2, разд. 15.2.6).
квадратно-пирамидальным комплек-
и \/ОС12(тетраметилмочевнпаJ [5]
[6] имеет тригонально-бипирамидаль-
В противоположность
сам \'ОС12(ОР(С6Н5)ЯJ
VOCl2(NMe3J
молекула
а
NMe3
С1-
:V
IV
1,59 А
-о
С1<25 А
,18 А
NMe3
NMe,
VCl3(NMe3J (б)
уже упоминалось
призматической
ное строение (а), причем углы между связями в экваториальной
плоскости в пределах ошибки опыта составляют 120°. По-ви-
димому, этой конфигурации благоприятствует форма третичных
аминов: мстильные группы занимают скрещенное положение
относительно экваториальных лигандов. Это точка зрения под-
тверждается тем, что соединение трехвалентного ванадия
[7] имеет точно такое же строение. Выше
о малой распространенности тригонально-
координации, найденной в комплексах
МE2С2(СбНзJ)з, где M=V, Сг, Мо или Re. В комплексах
ванадия [8] расстояние V—S равно 2,34 А и угол S—V—S со-
ставляет 82° (в среднем), а наиболее короткое расстояние меж-
ду атомами серы различных лигандов близко к 3,1 А; комплек-
сы рения и молибдена по размерам почти идентичны комплексу
ванадия. Было высказано предположение, что стабилизируют
эту конфигурацию слабые взаимодействия между атомами се-
ры. Такая конфигурация найдена, однако, не во всех комплек-
сах с хелатными серосодержащими лигандами. В малеонитрил-
дитиолатокомплексс в [V(mnt) 3l(NMe4J [9] шестикоордина-
ционное окружение ванадия искажено (V—S 2,36 А), причем
наиболее короткие межлигандные расстояния S--S составляют
2,93 А. Координационный многогранник занимает промежуточ-
346 27. Элементы VIII ерцппы и другие переходные металлы
ное положение между октаэдром и тригональнои призмой, как
показывает измерение угла S—V—S для двух наиболее удален-
ных атомов серы. В случае правильного октаэдра этот угол
должен составлять 180° (или 173° для полиэдра, максимально
близкого к правильному октаэдру с учетом стерических напря-
жений, возникающих вследствие жесткости бидентатного ли-
ганда). В YfS^C^fCeHshh -'тот угол составляет 136° (коорди-
национный многогранник — тригональная призма), а в дитио-
лате—159°. Мы рассматриваем эти комплексы вместе с
соединениями четырехвалентного ванадия, хотя формальную
степень окисления металла здесь можно было бы принять и
равной нулю в зависимости от степени делокализации четырех
электронов по системе трех хелатных циклов.
Анион в K4V(CN) 7]-2Н2О [10] может служить примером
комплекса трехвалентного ванадия с пентагонально-бипирами-
дальным окружением.
Литература. [1] lr.or<,'. Ciur.i., I960, 5. 2П1. [2] Acta cryst., 1969. В25. 1354.
[31 Acta crvsL, 1976, B32, ?2. |4] j. Chem. Soc, 1963, 5745" [5| Acta crysr., 1970,
B26, 872. [6| J. Chcm. Soc, A 1968, 1СП0. [7j J. Chem. Soc, A 1969 1621.
[8j Inorg. Ch-m., 1967, (>, 184-1. [9] J. Am. Chcm. Soc, 1967, 89. 3353. Г10] J Am.
Chcm. Soc, 1972, 94, 4345.
27.4. Структурная химия комплексов Cr(IV), Cr(V) и Cr(VI)
27.4.1. Соединения Cr(IV). Кроме общеизвестного ферромагнит-
ного оксида СгО2 (со структурой рутила) были синтезированы
CrF4 и СгВг4; однако в настоящее время их строение еще не-
известно. Комплексный фторид КгСгР6 содержит октаэдриче-
ский ион CrF62~. Оливково-зеленый Ва2Сг04 с магнитным мо-
ментом 2,82}1в, соответствующим О (IV), изоструктурен
Ba2Fe04 и Ba2Ti04 (последний примечателен как один из не-
многих примеров соединений Ti4+ с тетраэдрической координа-
цией кислорода). Аналогичным образом Ва3Сг05 также явля-
ется соединением Cr(IV). Из сопоставления формы группировок
в Sr2Cr04 и в СгО2 (табл. 27.3) видно, что анионы СгО44~ в
первом из этих соединений искажены значительно больше, чем
тетраэдры во втором. При высоком давлении Sr2Cr04 образует
модификацию со структурой K2N1F4 (с октаэдрической коорди-
нацией Cr(IV). При высоком давлении были получены оксиды
Cr(IV) состава МСгО3 (М=Са, Sr, Ba, Pb).
27.4.2. Соединения Cr(V). Сюда относятся многочисленные сое-
динения, изоструктурные силикатам или фосфатам, например:
\(iCrO4, YCrO, — структура циркона
Сз5ОН(СгО,)з — структура апатита (Crv—О 1,66 А)
Са.2С1(СгО.,) — изоструктурен Са2С1(РО.)
27.4. Структурная химия комплексов
Сг 347
Таблица
27 3 Состннеипя хрома в высших степенях окисления"
J. Appl. Phys.. 1962, 33, 1193
4— 1,66—1,95; среднее 1,82
C;i.OiI;Cr04h
CaXUCrCM
Cr(VI)
CrO3
K2Cr207
(\H.)oCrO4
Сг(Ш) и Cr(VI)
СгД)-
KCr,-,Os
LiCr3Os
CsCr5O8
CnlV) и Cr(VI)
4 — 1,0.6
4 — 1,70 (
углы 105J
:реднее)
D), 119° B)
Cr-OM0CT СГ-ОКО1Щ Cr-O-Cr
1,75 1
1,79 1
— 1
Cr(III)— 60
1,97
1,97
2,05
1,96
Cr(IV)—GO
,60
,63
66
143°
126°
Cr(VI)—4O
1,65
1,60
I ,66
1,63
crivn- ;o
Ada Chcm.
177
Ada cryst..
Scand., 1965, 19,
1967, 23, 166
Acta cryst., 1970, B26, 222
Can. J. Chem., 1968, 46, 933
Acta cryst., 1970, B26, 437
Acta Chcm
165
Acta Chem
1965
Ark. Kem.,
Ark. Kem.,
Scand., 1965, 19
. Scand., 1958, 12
1966, 26, 131
1966, 26, 141
1 97 1,65 Acta Chcm. Scant!., 1969, 23,
1074
"~ С;роение ОКС.И.К.;), пол\ ченпых в условиях г.ысокого давления, описано в работе:
-Acta Chora. Scand., 1968, 22, 2565.
Атомы кислорода в этих соединениях координируют Cr(V) по
тетраэдру; радиус Cr(V) близок к радиусу Cr(VI). Полное
структурное определение кристаллов Са2С1(Сг04) показало,
что все ионы СгО43~ в нем эквивалентны, т. е. что соединение
348 27. Элементы VIII группы и <)pi/,'tie переходные металлы
не является смешанным производным Cr(IY) и Cr(Vl). Маг-
нитный момент соединения близок к ожидаемому значению
l,7jiB. СгО43~ имеет слегка искаженное тетраэдрическое строе-
ние.
27.4.3. Соединения Cr(VI). Структурная химия Cr(VI) во мно-
гом напоминает химию S(VI), и для ряда простых соединений
имеются структурные данные высокой точности.
Структура кристаллического триоксида представляет собой
бесконечную цепь тетраэдров СгО4, соединенных двумя верши-
нами:
О. О О
75
О
i43
о о
,60 А
о
Между цепями осуществляется только слабое вандерваальсово
взаимодействие, что согласуется с относительно низкой темпе-
ратурой плавления вещества A97°С).
В простых кристаллических хроматах существуют тетраэд-
рическис ионы СгО,г~, в которых расстояния Сг—О составляют
1,66 А (в аммониевой соли). Тетраэдричсский ион CrO3F~
(Сг—О 1,58 А) является аналогом SO3F-. Размеры атомов О
и F очень близки. I\CrO3F кристаллизуется по типу шеелита
(CaWO4) со статистическим распределением О и F.
126°
—О
О3Сг-
КСгО3С1 кристаллизуется в том же типе, но вследствие гораздо
большего различия в расстояниях Сг—О и Сг—С1 B,12 А)
структура существенно искажена. Полихромат-ионы образуются
путем сочетания по вершинам СгО4-тетраэдров; простейшим из
них является бихромат-ноп Сг2О72 (табл. 27.3). Проведено
структурное исследование трихромат-нона
1,83 А
э ч \ г.
-', 60 А
О
-О'
0
/
О
О о О
(в нем существуют три различные связи Сг—О, средние значе-
ния длины которых приведены выше [1], а также тетрахромат-
иона в Rb2Cr4Oi3 [2]. Известны также ионы аналогичного типа,
27.5. Высокие 1\Ч и изолипоианных комплексах .4-10
содержащие атомы Р или As; строение ионов РСгСЪ3" и
РСг4О|б!~ описано в разд. 19.E.10, а иона AsCr>OiA:! —
в разд. 20.4.1.
Строение тстраэдрических молекул CrO2F2 и СгО2С12 рас-
смотрено в табл. 10.12 (т. 2).
Литература. [1] ,\ci;i cryst., 1980, В36, 135. |2| Ас'.ч eryst., 1973, В29, 21-11.
27.4.4. Соединения, содержащие хром в двух степенях окисле-
ния. Структура Cr2F5, соединения, содержащего Сг(П) и
Сг(Ш), была описана в гл. 5. Здесь будут описаны соединения,
содержащие Cr(III) и Cr(IV) или Cr(IV)" и Cr(VI).
Получены многочисленные оксиды, представляющие собой
соединения с промежуточной степенью окисления между СгО2
и СгОз. Сюда относятся Сг2О3, Сг3О8, образующиеся при тер-
мическом разложении СгО3 под давлением кислорода вплоть
до 1 кбар в интервале температур 200—400°С, и оксид Сг5О]2,
образующийся при давлении кислорода до 3 кбар. Последний
оксид представляет собой Cr2IU (CrVI04K — соединение, в ко-
тором атомы Сг(П1) находятся в октаэдрических (Сг—О
Ь97 А), а атомы Cr(VI)—в тетраэдрических пустотах упаков-
ки из атомов кислорода, близкой к плотнейшей кубической.
Черный, похожий на металл КСг3О8, полученный при нагрева-
нии КоСггОу с СгОз в атмосфере кнсло]ю,1.?. под дав.шиием,
также представляет гобой соединение Сг(Ш) н Сг(\), а имен-
но KCrIU(CrVI04J. Октаэдры СгшО6 и тетраэдры CrVI04 со-
членены между собой так, что они образуют слои состава Сг3О8,
которые связаны между собой посредством ионов калия. Соот-
ветствующая Li-соль имеет совсем иную структуру, по существу
такую же, как структура многочисленных хроматов МСг'" :О4
(М = Со, Си, Zn, Cd), фосфатов (Сг, In, T1) и сульфатов
(Mn, Ni, Mg). Октаэдрические пустоты, образованные атомами
кислорода СгО4-групп, статистически заняты ионами Li+ и Сг!+.
(Эта структура также может быть описана как приблизительно
кубическая плотнейшая упаковка атомов О, где заполнены "R
тетраэдрических и ]/4 октаэдрических пустот.)
Красные кристаллы нерастворимых в воде соединений
М2Сг309 (M = Na, К, Rb) могут быть получены под давлением.
Структура содержит цепи октаэдров Сг1УОб рутилового типа,
связанные друг с другом тетраэдрами CrV]04.
27.5. Более высоте координационные числа металлов
в изолированных комплексах
В этом разделе мы обобщим материал, касающийся остров-
ных комплексов с полидентатными лигандами, в которых пере-
ходные металлы проявляют координационные числа от 7 до 10.
О хелатах 4/-металлов см. разд. 3.3.7.
350 27. Элементы VIII группы и другие переходные металлы
27.5. Высокие КЧ в изолированных комплексах
В гл. 10 мы упоминали, что существует два типа симметрич-
ных координационных многогранников с координационным чис-
лом 7, обнаруженных в оксо- и фторосоединениях переходных
металлов, а именно пептагональпая бнпирамида (ZrF7:i~) и одно-
шапочная тригональная призма (NbF72~). Ионы, образуемые
этилендиаминтетрауксусной кислотой и ее аналогом циклогек-
сандиаминтетрауксусной кислотой
Н2С'
Н,С\.
.сн.соон
"CHjCOOH
.CHUCOOH
Н2
СН2СООИ
ЛП:,СООП
~С:12СООИ
потенциально являются гексадентатными лигандами, где ато-
мом металла могут быть координированы четыре атома кисло-
рода и два атома азота. В этой главе в формулах и па рис. 27.3
мы используем аббревиатуры edta и cdta для обозначения этих
кислот или их отрицательных четырехзарядных ионов. Никель,
кобальт и железо образуют комплексы трех различных типов,
показанные па рис. 27.3, а—в. Комплексы Ni(II) и Со(Ш) име-
ют октаэдрическое строение, однако в первом (рис. 27.3, а)
.лиганд образует только пять связей с Ni, а координационное
число металла насыщается в результате присоединения моле-
кулы Н2О [1]. (Хотя только два протона edta замещены нике-
лем, лишь одна ацетатная группа остается несвязанной и, по-
видимому, протонированкой с образованием ОН. Локализация
другого протона не выяснена, однако на основании данных по
определению длины связи Ni—О можно считать, что он лока-
лизован так, как показано на рисунке*.)
В диамагнитном комплексе Со(III) (рис. 27.3, б) [2] edta
ведет себя как гексадентатный лиганд. С другой стороны,
в Rb[Fem(H2O) (edta)]-H2O [3] анион представляет собой
семикоординационный комплекс (рис. 27.3, в), причем шесть
связей с центральным ионом образует edta, а седьмая — реали-
зуется в результате присоединения молекулы Н2О. Координа-
ционный многогранник в первом приближении представляет
собой пентагональную бипирамиду, в экваториальной плоскости
которой расположены два атома кислорода, два атома азота
edta и одна молекула воды. В противоположность Ni(II) поп
Мп(П) образует соль с гидратированными акза-комплексами
Mr^+[MnI1(H2O)H(edta)]2-8H2O [4], где металл замещает
только три протона edta. В кристаллах ион Мп2+ образует
¦обычный октаэдр (в вершинах которого находятся четыре мо-
* Гораздо информативнее в этом отношении длины связен С—О (ср. С = О
и С—ОН). — Прим. ред.
лекулы FLO и два атома кислорода cdta), но комплекс содер-
жит 7-координированный Мп(П). Координационный многогран-
ник Д\п(П), однако, отличается от того, который образует же-
лезо (рис. 27.3, в); его можно рассматривать как искаженный
многогранник NbF72"~. Небольшое вращение грани ааа по ча-
Н,0
К-О
2,90А
Рис. 2/.3. Строение комплексов с высоким КЧ. а—¦ [Ni(edta)H2(H2O)]; б —
[Со (cdta) ]~; в — [Fe(edta)H.,O]~; г — координационный многогранник
[.\lriII(i4lla)H2O]-; д — [(H2O)LFe—О—L(H2O)]4+, где пятиугольником обозна-
чен лиганд L (см. текст).
совой стрелке и эквивалентное ему вращение грани ЬЬЬ против
часовой стрелки превращает этот координационный многогран-
ник в одношапочную тригональную призму (рис. 27.3, г). Ком-
плекс железа (III), с cdta имеет строение, близкое к строению
комплекса Мп, что было показано при изучении комплекса
Ca[FcIII(H2O)cdta]2-8H2O [5]*.
Понятно, что геометрия этих ссмикоординационных комплек-
сов сильно зависит от пространственных напряжений, обуслов-
ленных формой полидентатного лиганда. Еще более ярким при-
мером может служить искажение пентагопалыюй бипирамнды
при координации металла пентадентатным лигандом L, напри-
Г
/(сНз сн2
(H)N.
1
14 ГГ
3
\
СН2-СН2
мер в катионах солей [FeL(NCS) 2]С1О4 (NCS-группы занимают
* Детальный обзор соединений d- и /-металлов с edta и его аналогами см.
в работе: Коорд. химия, 1984, т. 10, № 6, с. 725—772. — Прим. ред.
352 27. Элементы VII! группы и Opt/cue переходные металлы
апикальные положения е длиной связи Fe—N 2,01А по сравне-
нию с 2,23 А для экваториальных связей) и [(HoO)LFe—О—
—FeL(H2O) J (С1О4L [в"|- Катион последней соли (рис. 27.3,E)
интересен как пример мостикового оксосоединепия железа(III)
с линейным мостиком Fe—О—Fc.
Иттрий и 4f-HOiibi меньшего размера образуют с бидентат-
ными лигандами типа RCOCHCOR многочисленные ссмикоор-
динационные комплексы, в которых седьмым липшдом служит
молекула воды. Это было отмечено в гл. 3 при обсуждении
семерной координации.
Хотя цирконий проявляет координационное число 6 в соеди-
нениях с F и О, в некоторых фторидах и оксидах отмечено пре-
имущественное проявление более высоких координационных чи-
сел. К семикоординационным комплексам относятся (NH4KZrF7,
моноклинная модификация ZrO2 и ZrOS. Ион Zr4+, очевидно,
представляет собой пограничный случай: в противоположность
вышеприведенным примерам известна также восьмикоордина-
ционная (додекаэдрическая) структура в KsZrFe и высокотем-
пературной модификации ZrO2, а также в многочисленных гид-
ратах и гидроксосолях (разд. 14.3.2). Основываясь на энерге-
тических соображениях, легко показать, что существуют очень
небольшие различия между двумя преобладающими типами
восьмнвершинннков, а именно между антипризмой и додека-
эдром. В структуре с непрерывным трехмерным мотивом энер-
гия кристалла может быть минимизирована путем регулирова-
ния формы всех различных координированных групп, и в
предельных случаях эти геометрические требования действи-
тельно определяют состав (и строение) солей, кристаллизую-
щихся из раствора, например Na3TaF8, КгТаГ7 и CsTaF6 или
(NH4):;ZrF7 и I\2ZrF6. В изолированных комплексах, содержа-
щих хелатные лиганды, выбор между двумя координационными
многогранниками, по-видимому, определяется невалентными
взаимодействиями между атомами лигандов. Это определяет
форму додекаэдра в:
N;4fZr(C2O4L|-3112O
K2^r(niaJ|-H2O*
Inorg. Chem., 19C3, 2, 250
J. Am. Chcm. Soc, 1965, 87, 1610
¦' nta — ни филотриацетат-ион.
антипризмы в:
Zr(aeacL
|Zr,(OHMH,O),f>|Cl,-r2H:,O
Ii'org. Chcm., 1963, 2, 243
(см. разд. 14.3.2)
В предыдущей главе были описаны как конечные, так и бес-
конечные трехмерные комплексы Li3^~ и 4/"-ионов большего раз-
мера с КЧ 9. Выше мы видели, что координация edta в качест-
27.5. Высокие КЧ о изолированных комплексах
3
ве гексадентатного лиганда возможна ионами М2+ и М3+ малого
размера. Даже наименьшие по размеру из 4/-ионов оказывают-
ся слишком крупными для того, чтобы с edta могла осущест-
виться октаэдрическая координация, и при координации ионов
большего размера этот лиганд занимает только часть коорди-
национных мест, остальные же могут быть заполнены другими
лигандами, например молекулами Н2О. Высокосимметричный
девятивершинный многогранник, обнаруженный в структурах
многочисленных соединений 4/-элементов, не соответствует гео-
метрии некоторых полидентатных лигандов. В таких случаях
мы обнаруживаем полиэдры, которые можно считать производ-
ными от восьмивершинного додекаэдра с дополнительными ли-
гандами, что приводит к образованию девятивершинного или
значительно реже встречающегося десятивершинного координа-
ционного многогранника. Так, в частности, в девятикоордина-
ционном анионе соли K[La(H2OK(edta)]-5H2O четыре атома
кислорода и два атома азота edta и одна молекула Н2О зани-
мают семь из восьми вершин триангулированного додекаэдра,
характерного для КЧ 8; известны изоструктурные соли,
образованные 4[-элементами: Nd, Gd, Tb и Eb [7].
В [La(FIedta) (H2OL]-3H2O [8] семь атомов координируемых
лнгандов (включая одну молекулу воды) располагаются вокруг
лантана аналогичным образом, а еще три молекулы воды до-
полняют полиэдр и завершают образование девятикоординаци-
ониоп группы. Следует, однако, отметить, что такой координа-
ционный полиэдр близок к двухшапочной квадратной анти-
призме*.
Проявление высоких координационных чисел возможно так-
же, если в качестве бидентатных лигандов выступают группы
типа \'О3~ или СН3СОО-. В гл. 18 мы отмечали, что в
[Co(N03) 4]2~ и Ti(NO3L с центральным ионом соединены во-
семь атомов кислорода (от четырех ионов NO3~), а в нитрато-
комплексах Ce(III), Ce(IV) и Th(IV) с металлом связаны 12
атомов кислорода (от шести бидентатных ЫО3~-ионов). В ком-
плексе La(NO3K(bpyJ с La связаны три бидентатных нитрат-
иона и две молекулы бипиридила, что приводит к образованию
десятивершинного координационного многогранника, который
можно описать как двухшапочный додекаэдр. Аналогичным
образом можно представить (описать) псевдооктаэдриче-
ский десятивершинный координационный многогранник в
П1A\О:!L(ОР(С6Н5)зJ (разд. 18.8.7). Литература, где рас-
сматриваются эти соединения, приведена в разделе о нитрато-
комплексах и нитратах металлов (разд. 18.8.7).
о ¦ И точно так же в анионе [La(H2OKedta]- полиэдр близок к одношапоч-
нои квадратной антипризме. — Прим. ред.
23—1284
354
27. Элементы VIII группы и другие переходные металлы
27.6. Структурная химия же 1еза 355
Литература. [\] J. Am. Chem. Soc, 1959, 81, 556. [2] J. Am. Chem. Soc, 1959,
81, 549. [31 Inorg. Chem., 1964, 3, 34. [4] Inorg. Chem., 1964, 3, 27. [51 J. Am.
Chem. Soc, 1966, 88, 3228. [61 J. Am. Chem. Soc, 1967, 89, 720. [71 J. Am. Chem.
Soc, 1965, 87, 1612. [81 J. Am. Chem. Soc, 1965, 87, 1611.
со связями металл — металл. Сравните, например, с
Nb
\Ь
\п
27.6. Структурная химия железа
Хотя формально известны степени окисления железа от —2 до
+ 6, практическое значение имеют только Fe(II) и Fe(III).
Степени окисления, более низкие чем +2, осуществляются при
взаимодействии с лигандами я-типа, а степени окисления —2,
— 1 и +1 реализуются в таких соединениях, как Fe(COJ(NOJ,
Fe(NOJX или ионе [Fe(H2O)sNO]2+, где смысл термина «сте-
пень окисления» несколько сомнителен. Диамагнитное соеди-
нение Fe(NOJI существует в виде димера а [1], чрезвычайно
1,67 А/
1,15 А/К
ОМ N
\/
96
ON
. \
N0
Т
6
ON
ON'
ОС х
ОС'
Fe
О
С
>
1
ле
с2н5 г)г'п
/Ъ^У /NO
с2н5
2,72 А
— As(CH3l2
/ \
Z.59A
б.:изкого по строению к б [2], однако с более длинным расстоя-
нием Fe—Fe у иодида. Если не рассматривать возможность
снерхобменного взаимодействия, включающего атомы иода в а,
то для объяснения диамагнетизма соединений следует постули-
ровать наличие прямого взаимодействия металл — металл и
предположить, что большее расстояние Fe—Fe в а по сравне-
нию с б связано с размером атома иода. Связи, образуемые
железом, направлены к вершинам тетраэдра. Co(NOJI в кри-
сталлическом состоянии построен в виде цепочки тетраэдров в
[1]. Низкое значение валентного угла при атоме иода в а яв-
ляется, по-видимому, характерной особенностью любой системы
«-3,31 \~- «-4,36 V*
В координационных соединениях железа @) реализуется (при
наличии пяти связей) только один координационный полиэдр —
трнгональная бипирамида; примеры: Fe(COM или Ре(СО)з(ди-
арсин) (г) [3].
Обычно железо(II) имеет октаэдрическую координацию.
Многие из ионных соединений, в которых Fe2+ связано с шестью
X или шестью О, изоструктурны соединениям, образуемым ио-
нами близкого размера:
МО (структура NaCl) M = Mg, Mn, Fe, Co, Ni
MF? (структура рутила) ¦)
MSO4-7H2O"
K2M(SO.,J-6H,O M==Mg, Mn, Fe, Co, Ni, Zn
M3Bi2(NO3h2-24H2O '
Структурная аналогия этих соединений М(П), однако, не рас-
пространяется на комплексы с более ковалентной связью. На-
пример, комплексные цианиды, образуемые Fe, Co и Ni, пред-
«?тавляют собой соединения, совершенно различных типов:
K4[Fe(CNN], K3[Co(CNM], K,[Ni(CNL] и K4Ni2(CNN (разд. 22.1)
(В более ранней литературе соединению кобальта приписана
неправильная формула К4[Со(СЫ)б].) Известны комплексные
тиоцианаты:
Na4[Fp(NTCS)(i]-12FI2O, Na2[Co(NCSL]-4H2O и Na4[Ni(NCSN]-12R.0
(Из них соединению никеля
Na2[Ni(NCSL]-8H2O.)
Октаэдрические комплексы железа (II) являются высокоспи-
новыми (ц«5(хв). за исключением диамагнитных комплексов
ранее приписывали формулу
с лигандами сильного
Fe(CNRN2+. Пример
Fe(NCSJ(pyL (д) [4].
поля, например Fe(CNN';
нейтральной молекулы —
или
транс-
1,14 А
с N у
Существование тетраэдрической координации у комплексов же-
^г?аЛ J "одтверждено в анионе кристаллической соли
FeCl4) (Mc4NJ [4a]_ (Fe-Cl 2,29 А) и предположено для
(^евг4)- и (Fel4J ; последнее следует из изоструктурпости
23*
356 27. Элементы VIII группы и другие переходные металлы
соответствующих соединений цинка, марганца, кобальта и ни-
келя. Эти высокоспиновые соединения с электронной конфигу-
рацией Fe(II) d6 имеют ожидаемый магнитный момент, равный
приблизительно 5цв, соответствующий четырем неспаренным
электронам. Известны также молекулы FeCl2L2 и ионы FeL42+,
образованные лигандами (С6Н5KРО. Подобно (NiCU)"", анио-
ны (FeCl4J~ устойчивы только в присутствии катионов боль-
шого размера.
Плоскоквадратная координация у иона железа(II) наблю-
дается в комплексе с фталоцианином ((х = 3,96цв), а также в
гиллеспите (разд. 23.12.7). В кристалле последнего соединения
Fe2+ координирует четыре атома кислорода на расстоянии
1,97 А (по сравнению с 2,14 А — длиной связи Fe—60 в окта-
эдре) и не содержит других лигандов на расстоянии, более
близком чем 3,98 А. И К- и видимые спектры поглощения об-
суждены исходя из высокоспиновой конфигурации Fe2+ [5].
Другие координационные числа наблюдаются в соединениях
с некоторыми особыми лигандами; сюда относится КЧ 5 в ком-
плексах FeLX+, где L — тетрадентатный лиганд, например
N(CH2CH2P(C6H5Jb [5а] или N (CH2CH2NH2) з (сокращенно
tren), и КЧ 8 (додекаэдр) в [РеA,8-нафтиридинL](С1О4) 2.
В основе структурной химии трехвалентного железа лежит
главным образом октаэдрическая координация; она характерна
для кристаллических галогенидов, Fe2O3, многочисленных ост-
ровных комплексов (Fe(enK3+, Fe(acacK, Fe(C2O4K3~ и т. д.),
тогда как тетраэдрическая конфигурация здесь встречается зна-
чительно реже, чем среди соединений железа(II). Так, в кри-
сталлическом FeCl3 реализуется октаэдрическая координация
металла и лишь в димере Fe2Cl6 (в газовой фазе) или в ионе
FeCl4~~ осуществляется тетраэдрическая конфигурация; в ком-
плексе FeCl3L2 (где L — диметилсульфоксид) реализуется как
октаэдрическая, так и тетраэдрическая координация. Это сое-
динение содержит равное число тетраэдрических ионов
(FeCl4)~ (Fe—Cl 2,16 А) и октаэдрических ионов транс-
(FeCl2L4)+ (Fe—Cl 2,34 A, Fe—О 2,01 А) [6].
Соли щелочных металлов MFeCl4 являются простейшими
солями, содержащими (FeCl4)~-Hon; в качестве внешнесферного
катиона соли могут содержать РС14+ или As((C6H5) 4)+.
В Fe3O4 (структура обращенной шпинели) присутствует ион
Fe3+ как с тетраэдрической, так и октаэдрической координаци-
ей; были получены многочисленные соли щелочных металлов,
содержащие анионы, аналогичные силикатам, например FeO45~,
Fe2O78" и другие, упомянутые в разд. 11.5.
Комплекс е, содержащий в качестве лигандов тио-/г-толуоил-
дисульфид и дитио-/г-толуат, интересен как пример соединения,
содержащего четырех- и пятичленные циклы FeS2C и FSC
27.6. Структурная химия железа 357
соответственно [7]. Как и в случае соединений железа (II)
магнитный момент комплексов железа (III) соответствует высо-
коспиновой конфигурации (d\ 5,9цв), за исключением "комплек-
сов типа [Fe(CNNp~ и [Fe(bpyKp+, содержащих лиганды
сильного поля.
Простейшим примером пятикоординационного комплекса слу-
жит (FeCl5J ; результаты спектроскопических исследований
(ИК-спектры, спектры комбинационного рассеяния) [8а] соеди-
нения (C8Hi8N2J+(FeCl5J- доказывают, что он имеет триго-
нально-бипирамидальное строение.
Квадратно-пирамидальное окружение Fe(III) обнаружено
Р H?^r1HwrH^ t0CTP°BHbix комплексах. За исключением
ген(ыизJ(СО)С5Н5 [86], в большинстве случаев они пред-
ставляют собой мономеры, содержащие два бидентатных ли-
ганда (ж), или димеры, в которых присутствует пятая более
слаоая связь (з). Атом металла расположен приблизительно
ж
358
27. Элементы VIII грцппы и другие переходные металлы
на расстоянии 0,5 А над центром квадрата основания пирамиды.
Димеризация молекул типа ж приводит к образованию комп-
лекса типа и, в котором атом металла имеет искаженно-окта-
эдрическую координацию.
Как и в случае железа(II), в комплексах с отдельными ли-
гандами могут проявляться и другие координационные числа.
Например, в комплексе Fe[N (SiMe3b]3, изоструктурном соот-
ветствующему соединению алюминия (разд. 18.4.1), присутст-
вует железо с плоским расположением трех связей, а ион
[Ре(\!О3L]~ содержит железо с КЧ 8 (додекаэдр) (разд. 18.8.7).
Ниже приведены другие примеры:
Дл:шы спяз:-м, Л
Ли i сратура
4S 2,32; С! 2,27 Inorg. Chem., 1967, 6. 712
20 1,88; 2N 2,08 J Chem Sot., A 1967,
Cl 2,24 1598
3) {Fe[S.-Co(CNL.b(H-Bu4NJ4S 2,23; S 2,46 Inorg. Chem., 1967, 6,
2003
2N 2,10; Cl 2,29 J. Слеш. Soc, A 1967,
30 1 ,90; 1,98; 2,18 1900
ж) Fe[S2CN(CoH5J]?Cl
Fe(salcn)Cla
u) [Ff(salcn)Clb1!
a salcn — Оисоалицилидениминат.
Структурные исследования немногочисленных соединений,
содержащих железо в более высоких степенях окисления, по-ви-
димому, ограничиваются следующими примерами.
ЖелезоAУ): Ba2Fe04 [9] изоструктурен Ba2Ti04 и p-Ca2Si04
(железо(IV) имеет тетраэдрическую координацию). В оксидах
BaFeO.s-x- х стремится к нулю и содержание Fe(IV) возрастает
с ростом давления Ог, что благоприятствует октаэдрической
координации железа(IV) [10]. Структура имеет плотпейшую
упаковку типа АВО:;, описанную в разд. 13.3.1.
Наиболее устойчивыми островными комплексами желе-
за (IV) являются трисдитиокарбамат-катионы, например трис-
пирролидилдитиокарбамат-ион к; их можно получить путем
окисления соответствующих соединений железа (III) и выделить
в виде солей с BF4~ или С1О4~. Структура, изображенная на
схеме к [11], очень напоминает структуру Fe(S2CNRK, где рас-
стояние Fe—S составляет 2,41 А.
Расположение шести лигандов при атоме Fe имеет проме-
жуточный характер между правильным октаэдрическим и три-
гонально-призматическим.
Железо(У1). K2Fe04 [12] изоструктурен K2SO4, a BaFcO4
изоструктурен BaSC>4. Магнитные моменты этих соединений
27.7. Структурная химия кобальта 359
близки к значению B,83цв), ожидаемому для системы с двумя
неспаренными электронами (d2).
\ \/ /
S Fe —S
S S
\/
с
В работе [13] описано восстановление под давлением сое-
динений Fe в высших степенях окисления, например
SrFeO3->SrFeO2,86.
Литература. [1] J. Am. Chem. Soc, 1969, 91, 1653. [2] Acta cryst., 1958, 11, 599.
[31 Acta cryst., 1967, 22, 296. [41 Acta Chem. Scand., 1967, 21, 2028. [4al Inorg.
Chem., 1975, 14, 348. [51 Inorg. Chem., 1966, 5, 1268. [5a] Inorg. Chem., 1978, 17,
810. [61 Acta cryst., 1967, 23, 581. [7] J. Am. Chem. Soc, 1968, 90, 3281. [8a| J.
Inorg. Nucl. Chem., 1979, 41, 469. [861 Inorg. Chem., 1970, 9, 447. [9] Z. anorg.
allg. Chem., 1956, 383, 330; J. Res. Natl. Bureau Standards, 1969, 73A, 425.
[101 J. Phys. Chem., 1964, 68, 3786. [Ill J- Am. Chem. Soc, 1974, 96, 3647.
[12] Z. anorg. allg. Chem., 1950, 263, 175. [131 J- Chem. Phys., 1969, 51, 3305, 4353.
27.7. Структурная химия кобальта
Мы рассмотрим в основном стереохимию островных соединений
Со(II) и обширную область химии октаэдрических комплексов
Со(III). В комплексах с я-связывающими лигандами, например
в [Co'-fCOhl- Co1-(COKNO (разд. 22.3.6), Со°(РМе3L [1а]
и Co1+X(PR3K, кобальт проявляет формальные степени окис-
ления — 1, 0 и -М, причем все соединения имеют тетраэдриче-
ское строение, а [Со1+(ЬруK]+ — по-видимому, октаэдрическое.
КобальтA). Тетраэдрическая координация была обнаруже-
на в кристаллах соединения а [16], а в ряде структурных работ
было установлено образование пяти связей. Молекула
Co[S2CN (СНзЬЪЬЮ имеет тетрагонально-пирамидальное строе-
ние, описанное в разд. 18.8.4, молекулы б и в — трипшалыю-
бипирамидальное строение. Особый интерес представляет мо-
лекула СоН(Р(С6Н5)з)зК2 (б) [1в], являющаяся примером
соединения, содержащего молекулу азота, связанную с атомом
металла. Длины связей в молекуле азота в координированном
3G0 27. Элементы VIII группы и dpi/cue переходные металлы
и свободном состояниях близки, а длина связи Со—N под-
тверждает ее повышенную кратность (ординарная связь Со—N
имеет длину 1,95 А). В fRu" (NH3MN2J2^ fir] характер коорди-
нации металлом молекулы N2, по-видимому, аналогичен только
что рассмотренному, но вследствие образования в кристалле ра-
а
{фО), Р
Р(Оф):
-Со
(ф-фенил)
6 N
1 7 8' ¦' N
:со
со
| 1 6 А
ос-
2-19 А
зупорядочепной структуры полученные результаты менее точны.
В нашем третьем примере Со(Р(С6Н5)з) (COK(CF2CHF2)
(s) [2] три лиганда СО занимают экваториальные положения.
Тригонально-бипирамидальный ион [Co(CNCH3M]+, найденный
в перхлоратной соли [3], уже упоминался в разд. 22.1.5.
Кобальт(III). За очень немногими исключениями, например
иона гетерополикислоты (C0W12O40M^ (разд. 11.6.1), все ком-
плексы Со(III) имеют октаэдрическое строение. Мы отдельно
рассмотрим примеры особенно многочисленных амминных ком-
плексов кобальта. Со(III) в высокоспиновом состоянии de
встречается чрезвычайно редко. Высокоспиновый Со(III) содер-
жится в КзСоР6, но не в Co(NH3KF3 или других амминных
комплексах кобальта.
КобальтAУ). Бледно-голубое соединение, которое раньше
принимали за K3C0F7, позднее оказалось гексафторидом
K3CoF6. Коричнево-желтый Cs2CoF6 имеет структуру хлоропла-
тината калия [4], а ВаСоОз — структуру Ва№03 с искаженной
гексагональной плотнейшей упаковкой Ва и О и расстоянием
Со—Со, равным 2,38 А в колонках октаэдров СоО6, сочленен-
ных по граням [5]. В противоположность октаэдрической коор-
динации, найденной в этих соединениях, в многочисленных ок-
сосоединениях Со(IV) и щелочных металлов осуществляется
тетраэдрическая координация; эти соединения содержат ионы,
подобные тем, которые образует кремний; дискретные ионы
СоО44~ в Na4CoO4 [6] и Li8CoO6 [7], изоструктурном L
27.7. Структурная химия кобальта 361
[8]; ионы Со2О76~ в красно-фиолетовом КеСоО7 [9] и цепи в
черном КгСоОз [Ю], имеющем структуру, аналогичную
Rb2Ti03 [11].
Литература. |laj J. Am. Ciiem. Soc, 1977, 99, 739. [161 Inorg. Chem., 1977, 16.
430 [IbI Inorg. Chem., 19G9, 8, 2719. [lr| Ada cryst., 1968, B24, 1289. [2| J.
Chcm Soc, A 1967, 2092. [31 Inorg. Chem., 1965, 4, 318. [4J Z. anory. ;i!lg.
Chcm., 1961, 308, 179. [5] Acta cryst., 1977, B33, 1299. [61 Z. anorg. allg. Chcm..
1975, 417, 35. [7] Z. anorg. allg. Chem., 1973, 398, 54. [81 Naturwiss., 1973. 60,
256. [91 Z. anorg. allg. Chem., 1974, 409, 152. [101 Z. anorg. allg. Chcm.. 1974.
408, 75. [Щ Z. anorg. allg. Chcm., 1974, 408, 60.
27.7.1. Стереохимия соединений кобальта(П)—d7. Нам следует
обсудить проблему возможного расположения четырех, пяти и
шести связей Со(II). В свое время ряд выводов о пространст-
венном строении был сделан на основе измерений магнитных
моментов, для которых можно было ожидать следующие (толь-
ко спиновые) значения:
низкоспиновые комплексы
плоские
о
:таэдрические
высокоспиновые комплексы тетраэдрические \
таэдрические J
1,73
3,87
Однако магнетохимия соединений кобальта (II) осложняется
спин-орбитальными взаимодействиями. Измеренные величины
магнитных моментов почти всегда больше, чем вышеприведен-
ные, и в течение некоторого времени предполагалось, что для
двух типов комплексов характерны интервалы 1,8—2,lj.iB и
4,3—4,6|1в. Позже для октаэдрических комплексов было найде-
но много промежуточных значений (например, 2,63 |iB для
Co(terpyJBr2-Н2О), и сейчас они перекрывают практически
весь интервал значений \i между 2 и 4jiB. Очевидно, что магнит-
ный момент чрезвычайно чувствителен к пространственному
окружению атома Со(II) и не может быть рассмотрен в каче-
стве надежного критерия его стереохимии. С открытием высоко-
спиновых плоскоквадратных комплексов с магнитным момен-
том, близким к 4цв, это свойство не может быть использовано
даже для распознавания плоскостного и тетраэдрического рас-
положения связей. Поскольку на основе химической формулы
не всегда возможно правильно судить и о самом координацион-
ном числе металла, мы ограничимся примерами лишь тех сое-
динений, для которых были выполнены дифракционные иссле-
дования.
Кобальт(П), образующий четыре связи. Чаще всего четыре
связи Со(II) направлены по тетраэдру. Такое расположение
связи было найдено в комплексных СоХ42~-ионах (Х = С1, Вг. т^,
устойчивых в солях с катионами большого размера (Cs2CoCU,
362 27. Элементы VIII группы и другие переходные металлы
(NBu4JCol4 и Cs3(CoCl4)Cl), в комплексе [Co(NCS) 4]2~, на-
пример K2Co(NCSL-3H2O [1], и в голубых формах соединений
с органическими аминами, например СоС12(руJ |2]. В розовой
или фиолетовой формах этих соединений существуют бесконеч-
ные цепи октаэдров, сочлененных по противоположным ребрам.
Имидазольное производное Co(N2C3H3J [3] служит примером
трехмерносетчатого комплекса, в котором каждый атом кобаль-
та связан с четырьмя другими посредством органического ли-
ганда (ср. с Cu(N2C3H3J; разд. 25.7.1). В Со3О4 существуют
тетраэдрические фрагменты Со (II) и октаэдрические фрагмен-
ты Со3+ (с расстояниями Со—О 1,99 и 1,89 А соответственно)
[За]. Для сравнения связь Со2+—О в СоО имеет длину 2,13 А.
Связи, лежащие в плоскости квадрата, образуются только
в комплексах с некоторыми полидеытатными лигандами или в
комбинации с такими лигандами, где стерические факторы ис-
ключают возможность тетраэдрической координации. Сюда
относятся низкоспиновый комплекс с фталоцианином, биссали-
цилальдегиддииминовый комплекс (а) [4] (в котором макси-
мальное отклонение атомов от плоскости комплекса составляет
0,6 А, а длина связи Со—O(N) равна 1,85 А) и, наконец ион б
в соли [Co(mntJ][N(C4H9) 4]2 [5]. Магнитный момент этой со-
ли C,92(хв) соответствует трем неспаренным электронам (d7).
а
с_с
б
>л
NC
.жг
-A
,.CN
Со Н
c
XN J
Ему изоструктурно соединение Ni(II). Трехвалентные Ni (III)
и Си (III) образуют комплексные пони fM(mntJ]~ [6]. Анало-
гичный ион, образуемый Со(III) и лигандом в, имеет магнитный
момент 3,18|1в, несколько более высокий, чем только спиновое
значение для конфигурации с двумя неспаренными электронами
(du). Это также плоский комплекс [7].
Молекула транс-Co (РЕ12РЬJ(мезитилJ (где Et — этил,
Ph — фенил) [8] служит примером плоскостной координации в
спин-спаренном комплексе d7 с монодентатными лигандами.
Литература. [1] Acta cryst., 1975, В31, 613. [2] Acta cryst, 1975, B31, 1543.
[3| Acta crysl.. 1975, B31, 2369. [3a] Acta cryst., 1973, B29. 362. [11 Acta cryst.,
1969, B25, 675. [5] Inorg. Chem.. 1964, 3, 1500. [61 Inorg. Chem., 1964, 3, 1507.
1'7! Inorg. Chem., 1968, 7, 741. [81 J. Chem. Soc, 1963. 3411.
27.7. Структурная химия кобальта 363
Кобальт(Л), образующий пять связей. Несколько произволь-
но примеры соединений Со(II) с КЧ 5 можно подразделить на
три группы (рис. 27.4): 1) тригонально-бипирамидальные ком-
плексы с монодентатными или «треножными» (триподными)
тетрадентатными лигандами; 2) комплексы, для которых харак-
терна квадратно-пирамидальная структура с атомом металла,
приподнятым на 0,3—0,6 А над центром основания; 3) димериые
комплексы, образующиеся из плоскоквадратных соединений
Рис. 27.4. Со(II), образующий пять связей (см. текст).
ML о, в которых каждый атом металла образует пятую (более
длинную) связь с центральным атомом второй половины диме-
ра. Многие комплексы обладают конфигурацией, промежуточ-
ной между тригонально-бипирамидальной и квадратно-пирами-
дальной; в некоторых случаях образование пятикоординацион-
ных соединений должно рассматриваться как вынужденное
из-за невозможности достигнуть координационного числа 6
вследствие большого размера лиганда. Эти промежуточные
структуры мы включим в группы 1 или 2.
1. Два упомянутых типа комплексов с тригонально-бипира-
мидальной координацией металла схематически изображены па
рис. 27.4Aа) и 27.4A6). Примерами комплексов типа а могут
служить: катион в [СоB-пиколин-Ы-оксидM](С1О4J [1] с ак-
сиальными связями B,1 А), несколько более длинными, чем
экваториальные A,98 А), а также менее симметричная молеку-
ла Co(COLSiCl3 [2]. В соединении [CoBr(Me6tren)]Br [3]
(рис. 27.4A6) Со лежит на 0.3 А ниже экваториальной плоско-
сти: углы N!—Co—N2 равны 81° и углы N2—Co—N3 — 118°-
аксиальная связь Со—N1 B,15 А) несколько длиннее, чем эк-
ваториальная Со—N2 B,08 А). Эти искажения, по-видимому
обусловлены геометрией лиганда. Большее искажение наблю-
дается в Co(QP)Cl [4], где углы между экваториальными свя-
зями составляют 109, 113 и 138° (QP является фосфорным
364 27. Элементы VIII группы и другие переходные металлы
аналогом QAS, разд. 27.9.6). Еще сильнее искажен координаци-
онный полиэдр в структуре СоВг2 (HP (CoHsbb [5], где углы
между экваториальными связями равны 98, 126 и 136°, а две
связи Со—Вг, обе экваториальные, имеют существенно разную
длину B,33 и 2,54 А). (В работе [5] во всех формулах атомы
водорода опущены.) Комплексы с аминами большого размера
имеют промежуточную конфигурацию, это относится, в частно-
сти, к высокоспиновым комплексам Co(Et4dien)Cl2 [6] и
Co(Me5dien)Cl2 [7], где в качестве лигандов присутствуют:
,(CH2JNEt2 ,(CH2JNMe2
HN4 (Et4dicn); MeN (Me6dien)
x(CH2JNEt2 \(CH2JNMe2
2. Примером мономерного квадратно-пирамидального комп-
лекса (рис. 27.4B)) может служить CoCl2(L3) [8], где L3 —
тридентатный лиганд а; по своему строению комплекс очень
похож на ZnCh(terpy) (см. разд. 26.2). Атом металла припод-
нят над основанием пирамиды на 0,4 А.
Cl
Т""
С1
в
а 6
3. Димеры того типа, который показан на рис. 27.4C), най-
дены в кристалле [Со(бJ]2 [9] и [Co(eJ]2(NBu4J [10], где
б и в — лиганды указанного выше типа. В обоих комплексах
атом металла слегка приподнят над плоскостью четырех экра-
нированных S-лигаидов @,37 и 0,26 А соответственно), а вер-
тикальная связь с пятым атомом S длиннее, чем четыре, на-
правленные к вершинам основания (приблизительно 2,40 и 2,18 А
соответственно).
В CoH(PF3L четыре атома фосфора занимают вершины
искаженного тетраэдра, причем углы между связями лежат в
пределах от 102 до 118°, но, так как Н, по-видимому, связан
с атомом кобальта, это соединение является примером пятикоор-
динационного атома кобальта. Координаты атома водорода при
структурном исследовании определить не удалось.
Литература. [1] Inorg. Chem., 1970, 9, 767. [21 Inorg. Chem., 1967, 6, 1208.
[3| Inorg. Chem., 1967, 6, 955. [41 Chcm. Comra, 1967, 763. [5] Inorg. Chem.,
1966, 5, 879. [6] Inorg. Chem., 1967, 6, 483. [7"f Inorg. Chem., 1969, 8, 2729.
[81 J. Chcm. Soc, A 1966, 1317. [91 Inorg. Chem., 1965, 4, 1729. [101 J- Am.
Chcm. Soc, 1968, 90, 4253. [Ill Inorg. Chem., 1970, 9, 2403.
Кобальт(П), образующий шесть связей. За единственным,
отмеченным ниже исключением, шесть связей направлены к вер-
27.7. Структурная химия кобальта 365
шинам октаэдра. Такое строение установлено в трехмерносет-
чатых комплексах, кристаллических бинарных соединениях
(СоО, СоХ2 и др.), слоистых структурах, например K2C0F4 и
BaCoF4, цепочечных структурах, например комплексах типа
CoCU (ру) 2, а также в многочисленных островных комплексах,
например гра«с-СоA\'С5Н5) 4CI2, Со(диметилглиоксим) 2С1г и
Co(acacJ(pyJ [1]. В комплексах с ацетил ацетоном координа-
н,о
— А
=4— В
а 6 в
Рис. 27.5. Строение молекул Со4(асас)8 (a), Co3(acacN-H2O (б),
Н2ОJ (е).
ционное число кобальта (II) всегда достигает шести. Безсоль-
ватный ацетилацетонат сублимируется в тетрамерной форме
Со4(асас)8 [2], однако из растворов в инертных растворителях,
содержащих небольшую примесь воды, могут быть выделены со-
единения с различной степенью полимеризации: Со3(асасN-Н2О
[3], Со2(асасL(Н2ОJ [4] и, наконец, мономер
Со(асасJ(Н2ОJ [5]. Это соответствует расщеплению тетраме-
ра [Со(асасJ]4 (рис. 27.5, а) по грани А с образованием б или
по граням Л и В с образованием в, т. е. Со2(асас) 2(Н2О) 2;
освобождающиеся координационные места замещаются молеку-
лами Н2О. В красной диамагнитной модификации
[Со2 (CNCH3)io](C104L [6] одной из шести октаэдрически на-
правленных связей является связь металл — металл. В этом
ионе Со(II) изоэлектронсн Мп@) и образует структуру того
же типа, что и в Мп2(СО)ю (скрещенная конфигурация с рас-
стоянием Со—Со 2,74 А). Голубой раствор этого соединения и
голубые кристаллы, по-видимому, содержат анионы
[Co(CNCH3M]2+; парамагнетизм соединения соответствует од-
ному неспаренному электрону.
Сильно искаженный шестикоординационный многогранник
кобальта (II) в соединении Co(NO3) 2[OP(CH3) з]2 [7] описан в
гл. 18.
Необычный тип изомерии проявляется в соединениях
Co(CNRLI2 [8], в которых R — это, например, С6Н5. Парамаг-
нитный изомер состоит из островных октаэдрических молекул
транс-конфигурации (с почти линейными фрагментами
366
27. Элементы VIII группы и другие переходные металлы
Со—С—N—R) и содержит кобальт(II) в низкоспиновом со-
стоянии. Другой изомер характеризуется диамагнетизмом, со-
держит димерные ионы а, в которых, по-видимому, существует
спиновой обмен по связям Со—I—Со.
\/
-Со-
/\
\/
-Со-
Со(Ш)
Со(П)
СоШП
Ион [Co3(OCH2CH2NH2N]2+ является единственным приме-
ром тригонально-призматическои координации кобальта(II)
атомами кислорода. В этом коне
(рис. 27.6) у концевых ионов ко-
бальта (III) осуществляется окта-
адрическая координация, тогда как
центральный ион кобальта (II) об-
разует координационный многогран-
ник в форме тригональной призмы
[9]. Возможно, что эта необычная
координация связана с геометрией
лигандов: при тригонально-призма-
тическои координации центрального
атома Со достигается лучшая упа-
ковка СНо-групп (которые не показаны на рис. 27.6), чем при
октаэдрической координации.
Литература. [1] Inorg. Chem., 1968, 7, 1117. [2] Inorg. Chem., 1965, 4, 1145
[3] J. Am. Chem. Soc., 1968, 90, 38. [4] Inorg. Chem., 1966 5 423 [51 Ada cryst
1959, 12, 703. [61 Inorg. Chem., 1964, 3, 1495. [7] J. Am. Chem. Soc 1963 85'
2402. [8] Acta cryst., 1975, B31, 40. [9] J. Am. Chem. Soc, 1969, 91, 2394.
a 6
Рис. 27.6. Схематическое
строение диамагнитного иона
[Co3(OCH2CH2NH2)el2+.
Рис. 27.7. Координация металлам четырех бпдентатных лигандов.
Кобальт(II), образующий восемь связей. В ряде комплексов
осуществляется координация четырьмя бидентатными лиганда-
ми, причем расположение четырех пар атомов кислорода можно
описать как тетраэдрическое. Примерами таких
27.7. Структурная химия кобальта 367
комплексов служат [Co(O2CCF3L] (As(C6H5Lh [1] '¦
JCo(NO3L] (As(Cc,H5LJ [2]. В комплексах этого типа восемь
атомов кислорода (от четырех бидентатных групп), располо-
женных вокруг металла, образуют две группы 4А + 4В, каждая
из которых определяет два взаимопроникающих неправильных
тетраэдра (рис. 27.7, а). Восемь атомов лежат в вершинах до-
декаэдра (рис. 27.7, б). В Ti(NO3L расстояния М—О до атомов
А и до атомов В одинаковы; в [Co(NO3L]2~ они существенно
различаются B,07 и 2,45 А), так что Со образует четыре более
прочные и четыре более слабые тетраэдрически направленные
¦связи D + 4, т. е. искаженный восьмивершинник). В трнфторо-
.ацетатном комплексе искажение додекаэдрическоп координации
выражено еще резче: два расстояния Со—О составляют 2,00 и
3.11 А, причем четыре атома типа В лежат в одной плоскости
с атомом Со, а углы Од—Со—Од составляют 97°, так что коор-
динация металла здесь значительно ближе к правильной тетра-
э.чрической. Магнитный момент обоих комплексов близок к
-i,6,Lii>, — значению, типичному для высокоспиновых комплексов
Со(И).
Литература. [1] Inorg. Chem., 1966, 5, 1420. [2] Inorg. Chem., 1966, 5, 1208.
27.7.2. Кобальт(ПГ), образующий шесть октаэдрически направ-
ленных связей: кобальтаммины. Известно очень большое число
островных комплексов, в которых кобальт(Ш) обпазует окта-
эдрически направленные связи. Лигакды могут быть моноден-
татными, например в [Co(NO2N]3~, [Co(CNN] [Co(NH3)s] [1]
пли [Со(СО')Ь(НоО)/,]"" [21, бндечтатными, например в Со(асасK
[3] и CoL3 [4], где L = S2CS(C2H5), S2CO(C2H5), S2CN(C2H5J,
или тридентатными, например в Co(N3(C6H5JK [5.] Структу-
ра диазоаминобензола A,3-дифенилтриазена), показанная на
рис. 27.8, а, представляет интерес в сопоставлении со структу-
рой димерного комплекса меди Cu2(N3C6H5L (разд. 25.5.1).
Наиболее распространенная группа комплексов кобальта — это
аммиачные комплексы кобальта, среди которых много примеров
соединений упомянутых выше типов. Название «кобальтамми-
ны» мы будем далее использовать для обозначения любых
¦октаэдрических комплексов кобальта (III), в которых все или
несколько координационных мест заняты аммиаком или моле-
кулами амина.
Именно открытие того, что СоС13 может образовывать устой-
чивые соединения с тремя—шестью молекулами NH3, и приве-
ло Вернера к выводу, что в таких молекулярных соединениях,
как CoCl3-6NH3, шесть молекул NH- образуют «округ а то мл
металла первую координационную сферу, а три атома хлора
368 27. Элементы VIII группы и другие переходные металлы
находятся но внешней координационной сфере. Это согласова-
лось с. химическими свойствами соединений, с числом ионов,
образующихся при диссоциации молекулы, и с числом изоме-
ров, образуемых комплексами со смешанными лигандами, на-
пример [Co(i\H3LCl2jT. Часть молекул аммиака в комплексе
[Co(NH:iNJ:iT (или все они) может быть замещена другими ли-
гандами, например Cl~, H2O, CO32~, NO2~, C2O4-",
NH2CH2CH2NH2 (en) и др. Из всех амминных комплексов.
СоС1з, содержащих от трех до шести молекул аммиака, первый
представляет собой неэлектролит, тогда как остальные — двух-,
трех- и четырехионные электролиты, так что их формулы можно
записать как Co(NH3KCl3, [Co(NH3LCl2]Cl, [Co(NH3MCl]Cl2
и [Со(ЫН3)б]С13. Поскольку существует много способов взаим-
ного расположения внутрисферных заместителей вокруг атома
кобальта, число таких комплексов очень велико. В этом отно-
шении соединения кобальта можно сравнить с комплексами
Сг(Ш), однако последние к настоящему времени значительно
менее изучены.
Многие кобальтаммины легко получить путем окисления ам-
миачных растворов солей кобальта(II) при пропускании тока
воздуха. Например, если такой раствор содержит СоС12 и NCb "
или СОз2-, то из него кристаллизуется коричневая соль Эрд-
мана NH4[Co(NH3J(NO2L] или красный [Co(NH3LCO3]Cl.
Из раствора Co(SCNJ с высокой концентрацией аммиака при
стоянии на воздухе выделяются кристаллы двуядерного комп-
лекса [(NH3MCo-O2-Co(NH3) s](SCNL. Такой способ синтеза
приводит к образованию в растворе смеси кобальтамминов (как
одно-, так и многоядерных); состав выделенного продукта га-
висит от различия в растворимости компонентов смеси. В каче-
стве иллюстрации устойчивости некоторых кобальтамминов мы
можем указать на действие концентрированной серной кислоты
на [Co(NH3N]Cl3, приводящее к образованию сульфата гекса-
амминкобальта, который не разрушается при реакции. Аквапен-
тааммип [Со(Гч'Н3MН2О]СЦ устойчив в водном растворе вплоть
до 100°С, и даже тогда комплекс не разрушается, а наблюда-
ется его перегруппировка в [Co(NH3MCl]Cl2.
Кобальтаммины, включая Co(NH3KF3 (кроме КзСоР6, маг-
нитный момент которого равен 5,3|iB) диамагнитны, за исключе-
нием некоторых особых случаев, когда неспаренный электрон
находится на лиганде, например О2~ (см. ниже). Их устойчи-
вость, по-видимому, связана с тем, что 12 электронов связи,
дополняющих с/6-электронную конфигурацию Со(III), создают
18-электронную оболочку для заполнения девяти имеющихся
орбиталей; в комплексах Сг(Ш) на /2г-орбиталях находится
по одному электрону (у Сг(Ш) отсутствует различие в магнит-
ных моментах для низко- и высокоспиновых комплексов).
27.7. Структурная химия кобальта 369'
С о
комплекс
высокоспиновъш
комплекс
1
2
1
Mi
~>
\
-)
¦)
2
4s
2
2
2
4р
2
-)
2
d2sp 3-связи
Литература. [1] Acta crysl, 1973, В29, 822. [21 Acta cryst , 1976 B32 466
131 Acta cryst., 1974, ВЗО, 822. [4| Acta cryst., 1972, B28, 2231. [51 J Am Chem
Soc, 1967, 89, 1530.
Изомерия кобальтамминов. К настоящему времени октаэд-
рическая координация кобальта установлена рентгеноструктур-
ными исследованиями очень большого числа кристаллических
кобальтамминов; однако когда такое строение было впервые
предложено, оно далеко не являлось общепризнанным. Тем не
менее оно хорошо согласовывалось с существованием и коли-
чеством изомеров многих комплексов. Например, октаэдриче-
ский комплекс СоА4В2 может существовать только в виде двух
изомеров (цис- и транс-), тогда как для гексагональной или
тригонально-призматической моделей их должно быть три. И то
обстоятельство, что многочисленные комплексы такого состава
были выделены только в двух изомерных формах, являлось
сильным косвенным доводом в пользу октаэдрической модели.
Демонстрация оптической активности КзСо(С2О4)з убедитель-
но подтвердила октаэдрическую направленность связей, обра-
зуемых атомом Со. В настоящее время хорошо известно, что
октаэдрический комплекс МА3, где А — бидентатная группа,
например С2О42~, en, энантиоморфен; однако следует помнить,
что успешное расщепление этого соединения на оптические изо-
меры оказалось неожиданным, поскольку ранее ему приписыва-
ли формулу двойной соли ЗК2С2О4-Со2(С2О4)з- Тем не менее
любопытен факт, что некоторые химики не считали расщепление
солей типа К3Со(С2О4K и fCo(NH2CH2CH2NH2K]Br3 на опти-
ческие изомеры доказательством гипотезы Вернера. Продолжало
существовать убеждение, что оптическая активность каким-то
образом зависит от присутствия в комплексе органического ра-
дикала. Последние сомнения были сняты, когда Вернер расще-
пил на оптические изомеры чисто неорганический комплекс —
амин кобальта [Co4(OHN(NH3)i2]Cl6. Тип структуры, предло-
женный для соединений, содержащих катион данного типа (см.
ниже рис. 27.8, е), был подтвержден для ряда солей, содержащих
[Co4(OHNen6]6+.
Некоторые представления о сложности химии аминов ко-
бальта можно почерпнуть из следующего факта: согласно опуб-
ликованным данным, было синтезировано не менее девяти
соединений с эмпирической формулой Co(NH3K(NO2K- На
24—1284
370 27. Элементы VIII группы и другие переходные металлы
последующих примерах будет показано, что существует много
разных типов изомерии и полиморфизма.
Изомеры имеют одну и ту же молекулярную массу, но раз-
личаются по физическим и (или) химическим свойствам. Можно
выделить следующие типы изомерии.
I. Стереоизомерия. Изомеры содержат строго одинаковые
наборы связей, в таких изомерах связаны между собой одни и
те же пары атомов.
а) Взаимное положение атомов одно и то же; единственное
различие между изомерами состоит в том, что они соотносятся
как объект и его зеркальное отражение (оптическая изомерия).
б) Атомы, образующие изомеры, расположены в пространст-
ве по-разному относительно друг друга (геометрическая изо-
мерия).
К оптически активным комплексам, расщепленным на изо-
меры, относятся [Со(С2О4)з]3 , [Coen3]i+ и [Соеп2С12]г. Если
хелатная группа несимметрична, ситуация осложняется, так как
на оптическую изомерию может наложиться стереоизомерия.
Для симметричной группы, занимающей два координационных
места (например, С2О4), которую можно представить в виде
А—А, существует только один стереоизомерA), который, естест-
венно, может находиться как в право-, так и в левосторонней
модификации. Если же группа несимметрична, то возможны две
формы (II и III), аналогичные двум стереоизомерам комплекса
СоА3В3, и каждая из них энантиоморфна. Обе формы получены
для хрис-глицинового комплекса Co(NH2CH2COOK.
А
-А
I
II III
Были выделены все три возможных изомера комплекса
|Codien2]3!- с тридептатным лигандом dien = H2N—СН2—СН2—
s-граневыи^
(неактивный)
и - граиевыи
ребрсаыи.
изомер
оптически активные
27.7. Структурная химия кобальта 371
•—NH—СН2—СН2—NH2 и определена структура s-граневого
изомера трнбромида [Со dien2|Br:i.
Интересные примеры энантиоморфизма дают некоторые дву-
ядерные комплексы с мостиковыми лигандами. Например,
[cn2Co(NH2) (NO2)Coen2]Br4 существует в й- и /-формах, а так-
же в лгезо-форме:
мезо- d- и {-формы
Оптические изомеры этого соединения были получены Вернером
путем расщепления d-бромкамфорсульфоновой кислотой.
Было получено много пар геометрических изомеров, напри-
мер «виолео»- и «празео»-ряды, цис- и гранс-комплексы
[Co(NH3LCl2[Cl*.
II. Структурная изомерия. Она включает все случаи изоме-
рии, когда в разных изомерах образуют связи различные пары
атомов. Они могут, следовательно, сильно отличаться по хими-
ческим свойствам. Мы можем выделить три простых типа струк-
турной изомерии.
а) Некоторые кобальтаммины, содержащие группы типа
NO2 или SCN, существуют в двух формах. Изомерия здесь воз-
никает вследствие возможности присоединения лиганда к атому
металла двумя разными способами: М—NO2 или М—ONO и
М—SCN или М—NCS соответственно. При обработке в соот-
ветствующих условиях хлорида аквапентаамминкобальта
[Co(NH3)sH2O]Cl3 азотной кислотой образуется красное соеди-
нение, которое при взаимодействии с разбавленными неоргани-
ческими кислотами выделяет оксиды азота и при обычных
температурах медленно (а при 60 °С быстро) переходит в ко-
ричневый изомер. Последний вполне стабилен по отношению
к разбавленным кислотам. Эти изомеры имеют формулы
fCo(NH3MONO]Cl2 и [Co(NH3MNO2]Cl2. Такие «связевые»**
изомеры были идентифицированы в структурных ис-
следованиях [Co(NH3MSCN]Cl2-H2O и [Co(NH3MNCS]Cl2,
пЭрЫ геометРических изомеров получаются в случаях комплексов соста-
ва МЛ2В4 или МА3Вз. Если состав комплексов более сложен то можно выде-
лить большее число геометрических изомеров. Например, для комплексов ти-
па МА2В2С2 выделено пять геометрических изомеров. — Прим. перев.
** В отечественной литературе изомеры такого типа называются солевы-
ми. — Прим. перев.
24*
372 27. Элементы VIII группы и Оругие переходные металлы
Таблица 27.4. Строение аммппных комплексов кобальта (литература)
Соединение
Литература
ГО>(\Н3N|С13
|Co(NH;iN|l3
JCo(CNN|[Crcn3l-6Il2O
|Co(N3Ph2)l3
|Co(NH3MNO2lBr2
fCo(NH3MNO2|Cl,
|Co(NH3MCO3|Br-H2O
|Co(NH3MN3|(N3J
]Co(NH3MSCNlCl2-H2O
и [Co(NII3NNCS]Cl2
[Coen2(N3J|NO3
[Coen2Cl2|Cl-HCl-2H2O
fCo(NH3LCO3lBr
fCo(NH3K(NO2Kl (ребровый)
rCo(NH,K(NO2K] (граневый)
fCo(NH3K(NO2JCl]
fCo(NH3KH2OCl2lCl
fCo(NH3J(NO2LlAg
[Co dien2]Br3
r(NH3MCoNCCo(CNMl-H2O
[(NH3MCoNH2Co(NH3Ml(N03M
Г oii\
(NllmCui (o(Nll,L ( 14 .4 112()
L 4on J
Г /(l^ 1
!N1I,L(,.. ^ CmNH,L П4.4Н:О
ч и,
f ./O1Kv 1
[iNHil)<"-[![!/'i"N"iliJil'
[(NH3KCo(OHJ(CH3COOJCo(NHjKl-
¦Brv3H2O
fen2CoNH2(SO4)Co en2lBr,
rCo3(NH3)8(OHJ(NO2J(CNJl(ClO4K-
•NaC104-2H20
ГСо4(ОНNеп616+
Acta cryst., 1978, B34, 915
^cta crysl., 1969, B25, 168
Inorg. Chem., 1968, 7, 2333
J. Am. Chem. Soc, 1967, 89, 1530
Acta crvst., 1968, B24, 474
Acta Chem. Scand., 1968, 22, 2890
J. Chem. Soc, 1965, 3194
\cta cryst., 1964, 17, 360
Ada cryst., 1972, B28, 1908
Acta cryst., 1968, B24, 1638
3u 11. Chem. Soc. (Japan), 1952, 25,
331
J. Chem. Soc. (London), 1962, 586
Acta Chem. Scand., 1963, 17, 1630
Inorg. Chem., 1971, 10, 1057
Acta cryst., 1979, B35, 1020
Bull. Chem. Soc. (Japan), 1953, 26,
420
Bull. Chem. Soc. (Japan), 1952, 25,
Ч9Х
u)ZO
Z. Kristallogr., 1936, 95, 74
Acta cryst., 1972. B28, 470
Inorg. Chem., 1971, 10, 1492
Acta cryst., 1968, B24, 283
J. Chem. Soc. (London), 1962, 4429
Acta Chem. Scand., 1963, 17, 85
Inorg. Chem., 1970, 9, 2131
Acta cryst., 1977, B33, 700
Acta cryst., 1977, B33, 3185
Acta cryst., 1971, B27, 1744
Acta cryst., 1970, B26, 1709
Acta crysl., 1978, B34, 807
[Co(NH3MNCCo(CNM]-H2O и [Co(NH3MCNCo(CNM] • H2O и
др. (см. разд. 22.1.3 и табл. 27.4).
б) Пары изомеров типа [Co(NH3MBr]SO4 и
[Со(ЫНз) sSO4]Br называются ионизационными метамерами.
Существуют более интересные случаи изомерии этого рода,
27.7. Структурная химия кобальта 373
например [Co(NH3MSO3jNO3 и [Co(NH3MNO2]SO4*. Для та-
ких пар (так же, как и в случае «в»), понятие изомерии при-
ложимо только к твердому состоянию, поскольку сами комп-
лексы имеют различный состав.
в) Так как многие октаэдрические комплексы являются ио-
нами и могут иметь заряды разного знака, как, на-
пример, в ряду [Co(NH3L(NO2JJ+, [Co(NH3K(NO2K],
[Со(.\Н3J(МО2L_Г, то можно, очевидно, синтезировать кри-
сталлические соли, в которых и катион, и анион представляют
собой октаэдрические комплексы. Следовательно, могут суще-
ствовать пары солей одинакового состава, содержащие два
различных металла, например [М'А6] [М2В6] и [М'В6] [М2А6].
В частности, были синтезированы пары солей
[Co(NH3NJ[Cr(CNN], [Cr(NH3N][Co(CNN] и
iCo(NH,L(H2OJUCr(CNN], [Cr(NH3L(H2OJj[Co(CNN]**.
III. Полимерия. Рассмотрим соль типа [MAnBS-n][MA6-7iBn],
в обоих комплексных ионах которой центральные атомы пред-
ставлены одним и тем же металлом*. Кристаллы этого соедине-
ния состоят из равного числа октаэдрических комплексных
лонов обоих типов, так что простейшая структурная формула
совпадает с приведенной выше. Эмпирическая формула, однако,
имеет вид МА3В3, соответствующий совершенно другому сое-
динению, в котором все структурные единицы идентичны.
-Именно так соотносятся соединения Co(NH3K (NO2K и
[Со(ХН3)б][Со(ЫО2N]. Другой, несколько более сложный при-
мер: соль [(Шз)зСо(ОН)зСо(Шз)з]С1з имеет тот же состав,
[Со{(ОНJСо(МН3L}з]С1(
* * *
Структуры амминных комплексов кобальта. Рентгенострук-
турные исследования позволили установить строение многих
амминов кобальта. При исследовании каждого отдельного сое-
динения особый интерес могут представлять разные аспекты
строения: длины связей, способ присоединения лигандов к ме-
таллу, их взаимное расположение (геометрическая изомерия)
Ю1^__об^1:ая стереохимия в случае более сложных (многоядер-
В советской литературе к ионизационным метамерам принято относить
изомеры, отличающиеся положением во внутренней и внешней сфере овдих и
тех же ионов (например, приведенные выше соединения с SO4 и Вг) Упомя-
лутые^сульфато- и нитритокомплексы служат примером так называемой сум-
марной изомерии. — Прим. перев.
__*¦* В советской литературе изомерия такого типа называется координацион-
ной. Ьсли изомеры отличаются между собой положением во внутренней и внеш-
Ir'rim6^ ?fT?aAbH0L м°лекУлы, например молекулы в [Сг(Н2ОN]С13,
[СгС1(Н2ОM]С12-Н2О и [СгС12(Н2ОL1С1-2Н2О, то такого рода изомерия назьь
вается сольватнои. Выделяют еще один тип изомерии координационных соеди-
нении—изомерию координационного положения, когда изомеры отличаются
между соооп природой мостиковых групп. — Прим. перев
"*\ В советской литературе полимерия такого типа называется координаци-
онной.— Прим. перев. '
374 27. Элементы VIII группы и оругие переходные металлы.
пых) соединений. Например, связь Со111—N в [Со(.\"Нз)б]Ь
имеет длину 1,94 А, а Со11—N имеет длину 2,11 А в
[Со(ЫНз)б]С12 (и 1,85 А в плоском комплексе).
В [Co(NH3LCO3JBr-H2O присутствует бндептатиый лиганд
СО32~. Расстояния Со—N приведены на рис. 27.8, б; удлинение
связи Со—N в тронс-положенни к бпдентатному лиганду,
по-видимому, действительно имеет место. С другой стороны,
[)
в [Со(ЫН3MСОз]Вг-Н2О группа СО32~
6
монодентатна и, по-ви-
1,34А
J,90A
©
(ф- фенил)
90° NH3
О
'U
©
0
¦NH,
NH3
3+-
но р
Хо,
О CN
~CN
Рис 27.8. Строение комплексов Со(Ш). a — Co(N3Ph2K; б — [Co(NH3LC03l+;
е_[Со(КтНзMСОз1+; г — [Co3(NH3)8(OHJ(NO2J(CNJ]3+; д — возможное
строение [Co4(OHN(NH3)i2"]6+ (разд. 5.3.2).
димому, образует водородную связь между одним атомом О и
одной из NH3-rpynn (рис. 27.8, е).
В случае комплексов СоА4В2 (а также комплексов других
типов) структурное исследование необходимо для того, чтобы
с определенностью установить относительное расположение
лигандов, например трансположение атомов С1 в
[Со(ЫНз)з(Н2О)С12]+ и<та двух молекул ХН-, в
[Co(NH3J(NO2L]-- Ранее этому последнему иону в соли Эрд-
мана на основе согласующихся между собой химических дан-
ных была приписана цис-конфигурация.
Существует три типа двуядерных кобальтамминов: с одинар-
ными, двойными и тройными мостиками между атомами метал-
ла; роль мостиков в большинстве случаев выполняют С1, ОН,
27.8. Структурная химия никеля 375
NH> и О2. О мостиковых цианосоединениях см. разд. 22.1.3 и
табл. 27.4.
Структуры красного диамагнитного пероксо- и зеленого па-
рамагнитного супероксосоединепин описаны в гл. 11. Примеры
двуядерных комплексов с мостиковыми лигандами приведены
в табл. 27.4; отметим некоторые детали строения мостиковых
групп:
н, „„„ s+ н
153°
4,97 А
100°
н
Со
О.
Н2
130,
'Со(епJ
-О
Особый интерес представляет ион [Co3(NH3)8(OHJ-
• (NO2J(CNJ]3+; он содержит не только мостиковые ОН-груп-
пы, но и ионы N02~, образующие мостики посредством атомов
О и N (рис. 27.8, г). В [en2Co(NH2) (SO4)Co en2]3+ присутству-
ет мостиковая SO4-rpynna (см. выше).
Примерами более сложных олигомерных комплексов с мо-
стиковыми лигандами могут служить
! (NH3KCo-OH-Co-OH-Co(NH3K
Вг3 и Со
[hc>(nh>4
второй из них (рис. 27.8, д), уже упоминался в связи с оптиче-
ской активностью кобальтамминов. Следует упомянуть, что
аналогичный ему по составу ион [Сг4(ОНNеп6]64- имеет иное
строение, показанное на рис. 5.10 (т. 1).
27.8. Структурная химия никеля
27.8.1. Стереохимия Ni(II)—d8. Как было установлено струк-
турными исследованиями, в островных ионах или молекулах
Ni(II) могут существовать следующие типы размещения связей
металл — лиганд:
Координа-
ционное
число
Низкоспинопое состояние
(диамагнитные комплексы)
Высокоспиновое состояние
(парамагнитные комплексы)
Копланарное Тетраэдрическое
Тригонально-бипирамидальное Тригонально-бипирамидальное
Квадратно-пирамидальное ' Квадратно-пирамидальное
Искаженно-октаэдрпческое Октамрическое
376 27. Элементы VIII группы и другие переходные металлы
В литературе возникло много путаницы по поводу коорди-
нации Ni(ll) вследствие излишнего доверия к результатам маг-
нитных измерении сомнительного качества, а также из-за не-
верных заключений о координационных числах, сделанных на
основе химических формул. К сожалению, только для малого
числа соединений было проведено одновременное тщательное
изучение и магнитных, и структурных свойств. Были установле-
ны следующие факты:
а) если известно, что координационное число равно 4, то
диамагнетизм соединения свидетельствует о плоской, а не о
тетраэдрической координации;
б) пятикоординационные комплексы могут быть как диамаг-
нитными, так и парамагнитными;
в) парамагнетизм свойствен как четырех-, так и пяти- и ше-
стикоординационным комплексам Ni(II). Чисто спиновый мо-
мент для <78-копфигурации составляет 2,83[хв, по спин-орби-
тальные взаимодействия в магнитно-разбавленных системах
приводят к повышению магнитного момента. По-видимому, мож-
но с уверенностью считать, что значение и.>3,4цв указывает
на тетраэдрическую координацию, а значения |i<3,2|iB соответ-
ствуют октаэдрической координации. Как интерпретировать
промежуточные значения, не всегда ясно. Ниже приведены
магнитные моменты некоторых соединений, для которых было
определено строение комплексов:
тстраэдрическое
тригонально-бипирами-
дальное
октаэдрическое
(NiCl4)[N(C2H5Ll2 3,90
NiCl3(H2O)[N(C2H4b\CH;tl 3,7
Ni(pyL(C104J 3,24
Как правило, координационное число атома металла в ком-
плексе нельзя установить по химической формуле, так как ли-
ганд может быть координирован двумя (или более) атомами
металла с образованием полимерных (островных или бесконеч-
ных) группировок и так как лиганды могут проявлять себя
по-разному, что иллюстрируется поведением молекулы ацетил-
ацетона в соединениях платины (разд. 27.9.8). Например, пара-
магнитный ацетилацетонат никеля является не тетраэдрической
мономерной молекулой, а тримером [Ni(acacJ]3, в котором ни-
кель образует шесть октаэдрически направленных связей, а со-
единение МХ2Ьг может иметь островное мономерное строение
(а значит, плоское или тетраэдрическое) или представлять со-
бой бесконечную цепочку октаэдров, связанных между собой
общими ребрами. Стереохимия никеля осложняется также и
тем, что различия в стабильности комплексов разной конфигу-
рации часто бывают очень небольшими. Это относится к сле-
дующим парам полиэдров:
1) квадратно-плоскостные D) и тетраэдрические D);
27.8. Структурная химия нике m
377
2) трнгоналыю-бипирамидальные E) и квадратно-пирами-
дальные E);
3) квадратно-плоскостные D) и октаэдрические F).
1) Многие соединения NiX2L2 существуют в двух формах.
Например, NiBr2(PEtPh2J из полярных растворителей выкри-
сталлизовывается в виде темно-зеленой парамагнитной моди-
фикации, а из сероуглерода выделяется в виде коричневого
диамагнитного соединения. Обе формы мономерны в растворе
и, по-видимому, являются тетраэдрическим и плоским комплек-
сами соответственно. (Голубая и желтая формы МЦхиноли11JСЬ
обе парамагнитны; они являются примерами островной тетра-
эдрической и октаэдрической цепочечной структур.) Изомерия,
связанная с образованием плоскоквадратной и тетраэдрической
координации, по-видимому, наблюдалась лишь в определенных
сериях комплексов никеля. Индивидуально оба изомера были
выделены только в случае комплексов с дифенилалкильными
лнгандами. В рядах комплексов NiX2(PRgJ, где Х = С1, Вг, I,
a Us меняется от (алкилK до (фенилK, изменение конфигу-
рации происходит вокруг NiBr2 (PRPh2J: соединения с хлором
преимущественно плоскостные, соединения с иодом обычно тет-
раэдрические, а соединения с бромом часто существуют в обеих
формах [1]. Кристаллы одной из форм г-ПВг^РРИгбепзнлЬ
содержат как плоские, так и тетраэдрические изомеры. Это со-
единение кристаллизуется в двух формах: диамагнитной и зе-
леной парамагнитной с магнитным моментом 2,7juB. В этой
второй форме одна треть молекул имеет квадратно-плоскостное
строение, а две трети — тетраэдрическое. Для кристаллов тако-
го типа, содержащих одновременно два геометрических изомера
с различной геометрией, было предложено название интерал-
логонные [2]. Примеры комплексов с координационными много-
гранниками промежуточного типа (между квадратно-плоскост-
ными и тетраэдрическим) приведены ниже.
2) Были исследованы многочисленные пятиковалентные диа-
магнитные комплексы, одновременно содержащие как моно-,
так и полидентатные лиганды (примеры приведены ниже),
и здесь также было обнаружено по две конфигурации комплек-
са в одном и том же кристалле.
Ион Ni(CNM3~ стабилен только в присутствии больших ка-
тионов (при низких температурах ион К+ оказывается доста-
точно большим), и конфигурация комплекса зависит от приро-
ды катиона. В [Cr(tnK] [Ni (CNM]-2H2O (tn — 1,3-пропандиа-
мин) все анионы имеют квадратно-пирамидальное строение (а),
а в [Cr en-] [Ni(CNMJ ¦ 1,5Н2О поисутствуют апишш обоих тиной
(а и б) [3].
378 27. Элементы VIII группы и другие переходные металлы
I 2,1 7 A
NC—Ni—r— CN
,//4\W
NC-^ \—CN
1,86 A ;
ближайший атом ни
расстоянии 3,99А
3) Соединение Ni(pyL(C104J, где ру — пиридин или за-
мещенный пиридин, существует в желтой диамагнитной и голу-
бой парамагнитной формах. Первое из этих соединений содер-
жит плоские ионы в, причем следующими ближайшими соседя-
ми никеля являются атомы кислорода, находящиеся на рас-
стоянии 3,34 А; второе соединение построено из октаэдрических
молекул (г) [4]. Первая модификация в исследовании была
в s осюэ
2+ Ь,1ЧА
пи »— DU N. [ -N
Ni
ру-
РУ
N—
N
представлена комплексом с 3,5-диметилпиридином, вторая —
комплексом с 3,4-диметилпиридином. Еще более интересны со-
единения, содержащие бидентатный лиганд жезо-стильбендиа-
мин С6Н5СН(ЫН2)—CH(NH2)C6H5 [5]. Голубая и желтая
формы в растворе взаимно переходят одна в другую, в то вре-
мя как гидратированная голубая форма (jj,=3,16jib) дихлоро-
ацетата содержит октаэдрические ионы д, желтая форма ([д =
= 2,58цв) содержит плоские ионы типа е и октаэдрические
молекулы ж в соотношении 1:2. Это то же соотношение диа-
магнитных и парамагнитных комплексов, что и у упомянутого
выше NiBr2(PPh2BzJ. Такому соотношению отвечают близкие
промежуточные значения р,Эфф.
Н,0
ж
,1.89 А
Ni / /
ОСОСНС12
-2,05 А
Н,0
следующий ближаишии й
атом на расстоянии 3,25А
| 2,1 2 л
6СО(НС12
27.8. Структурная химия никеля 379
В гл. 3 мы рассматривали клатратные соединения, в основу
которых положены слои комплексов состава Ni(CNJNH3.
В клатратных соединениях, содержащих С6Н6 или C6H5NH2,
слои положены друг на друга так, что молекулы NH3 разных
слоев направлены друг к другу, расстояние между слоями рав-
но 8,3 А и между слоями имеются большие полосги (рис. 1.9, а,
т. 1) [6]. В бифенильном клатрате Ni(NH3) 2-№(CNL-2Cil>Hi0
[7] расстояние между слоями увеличивается до 12,65 А. В гид-
рате и безводном соединении слои упакованы значительно плот-
нее (расстояние между слоями составляет 4,4 А); молекулы
\Нз одного слоя проецируются в центры колец соседних слоев
(пеевдообъемноцентрированных) [8].
Существуют аналогичные соединения, в которых октаэдри-
чески координированные атомы Ni замещены на Си, Cd или Мп
[9]. Примером является клатратное соединение с диоксаном
Cd(NH3J-Ni(CNL-2C4H8O2 [10].
Литература. [1] Inorg. Chem., 1965, 4, 1701. [2] J. Chem. Soc, A 1970, 1688.
C] Iuor<?. Chem., 1970, 9, 2415. [41 Acta cryst., 1968, B24, 745, 754. [51 Inorg.
Chem., 1964, 3, 468. [6] J. Chem. Soc, 1958, 3412. [7] Acta cryst., 1974, B30,
292. [81 Z. Kristallogr.," 1966, 123, 391. [9] Acta cryst., 1974, B30, 687. [10] Z.
Kristallogr., 1976, 144, 91.
Xi(II), образующий четыре связи,
лежащие в одной плоскости. К числу
плоских диамагнитных комплексов от-
носится ион Ni(CNL2~, изученный в
составе калийной [1] и других [2]
солей (Ni—С 1,85 А), а также моле-
кулы типов а [3] и б [4].
К многочисленным комплексам с
бидентатными лигандами относятся
тиооксалатнып ион в [5], молекулы
типов г [6] н 3 [7] и глноксчмат с
[8], особенностью которого является
образование коротких внутримолеку-
лярных водородных связен. Никель,
как и многие другие металлы, образу-
ет комплекс с фталоцианинами [9],
при этом М(П) замещает 2Н в
Q2HISN8 (рис. 27.9).
Известны также островные и цепочечные многоядерные
структуры. В NinL4 (где L - rbNCH2CH2S) (схем;) ж) [10]
три атома никеля находятся на одной прямой, причем вокруг
каждого атома никеля осуществляется плоское расположение
четырех связей. В результате симметричного расположения хе-
N Металл
Рис. 27.9. Строение фтало-
цианинового комплекса ме-
талла C32H16NsM.
380 27. Элементы VIII группы и другие переходные металлы
латов вокруг центрального атома Ni и цыс-конфигурации отно-
сительно концевых атомов никеля молекула в целом имеет не-
п 6 ^Сф
II ^Ni \-2,16A Ni 1,87 А
(ф-фенил)
фс-
/
Ni
D N, PR2
H H
N N-
V
RC
RC.
0--H-0
Ni
0--H--0
¦^2,45 A+
плоское теист-строение. Расстояния Ni—Ni в этом комплексе
равны 2,73 А.
ж
X
Меркаптопроизводные никеля представляют собой смеси не-
растворимых полимерных материалов и гексамеров. Молекула
[Ni(SC2H5J]6 [И] схематически изображена на рис. 27.10.
Шесть атомов Ni компланарны и соединены двенадцатью мер-
каптогруппами. Связи, образуемые никелем, направлены к вер-
шинам плоского квадрата. Все углы в циклах Ni2S2 составляют
83°, а длины связей имеют следующие значения: Ni—S 2,20 А,
Ni—Ni 2,92 А (в среднем). Комплекс с диметилпиразином
NiBr2L [12] (з) служит примером соединения цепочечного
3
Вг СН3 Вг
2,31 А
27.5. Структурная химия никеля 381
строения, где никель образует четыре связи с двумя атомами
Вг и двумя атомами азота мостиковых лигандов.
В несимметричных комплексах, например в соединениях, со-
держащих полидентатные лиганды, могут иметь место отклоне-
ния от точной компланарности Ni и четырех окружающих его
атомов. Слабое искажение (тетраэдри-
ческое, а не квадратно-пирамидальное)
наблюдается в (диамагнитном) комплек-
се и [13]; углы SiNiNi и S2NiN2 состав-
ляют 173°. Значительные отклонения от
плоской структуры, ведущие к появле-
нию парамагнетизма у тетраэдрических
комплексов, могут произойти из-за сте-
рических затруднений между атомами,
входящими в состав независимых лиган-
дов. В комплексе с тетраметилдипирро-
метеном к [14] такие затруднения воз-
никают между СН3*-группами, и угол
между плоскостями двух лигандов до-
стигает 76°; причины отклонения этого угла от 90° остаются не-
ясными. В этой связи представляют интерес комплексы 3-заме-
щенных бис-^изопропилсалицилальдиминатов никеля (л) [15],
так как они распадаются на две группы: тетраэдрические
Рис. 27.10. Схематиче-
ское строение молекулы
[Ni(SC2H5hl6.
Н3С
\
СН3
и
\ /
с-с
4
С N 94o p с
(|i~3,3jiB) и квадратно-плоскостные (диамагнитные) в зависи-
мости от природы заместителя в положении 3.
Стереохимия этих соединений во всех деталях до конца не
понята, поскольку соединение, содержащее в положении 3 ме-
382 27. Элементы VIII группы и dpi/гие переходные металлы
тильную группу, является плоским, тогда как комплексы, содер-
жащие в том же положении С2Н5 или атомы Н, имеют тетра-
эдрическое строение.
Литература. [1] Acta Chem. Scand., 1964, 18, 2385. [2] Acta Chcm. Scand., I960,
23, 14, 6!; Ada cryst., 1970, B26, 361. [3] Acta cryst., 1968. B24, 108. [41 J. Chcm.
Soc, A 1967, 1750. [5] J. Chem. Soc, 1935, 1475. [6] Inorg. Chem., 1968, 7, 2140,
2625; Acta cryst., 1969, B25, 909, 1294, 1939. [7] Z. anorg. allg. Chem., 1968, 363,
159. [8] Acta cryst., 1967, 22, 468; 1972, B28, 2318. [9] J. Chem. Soc, 1937, 219.
[101 !norg Chem., 1970, 9, 1878 [111 J Am- Chem. Soc, 1965, 87, 5251.
[12] Inorg. Chem., 1964, 3, 1303. [13] Inorg. Chem., 1965, 4, 1726. [141 borg.
Chem., 1970, 9, 783. [151 Acta cryst., 1967, 22, 780.
Ni(Il), образующий четыре тетраэдрически направленные
связи. Простейшими примерами таких комплексов служат
NiX42~, NiX3L-, NiX2L2 и NiL/, где L — монодентатный и L' —
бидентатный лиганды. Неудача попыток (вплоть до недавнего
времени) выявить существование галогенокомплексов NiX42~
вызвана не их природной нестабильностью, а их нестабильно-
стью в водных растворах, где X замещается более прочно ко-
ординируемой молекулой Н2О. Ион NiCl42~ существует в рас-
плавах и изучен в виде твердых растворов, например в твердом
растворе с Cs2ZnCl4, однако при охлаждении Cs2NiCl4 диссо-
циирует. С другой стороны, CssNiCU (аналогичный
Cs3(CoCI4)Cl) может быть синтезирован из расплавленных
солей и закален при комнатной температуре, но при медленном
охлаждении разлагается на смесь CsCl и CsNiCl3, в котором
осуществляется октаэдрнческая координация связей Ni. При
работе в спиртовых растворах можно приготовить соли с боль-
шими органическими катионами, например (Et4NJNiCl4 (го-
лубой, Цэфф = 3,9|Хв) и (AsPh3MeJNiI4 (красный, [хЭфф = 3,5|1в).
Для иона NiCl42~ характерно отсутствие искажений Яна — Тел-
лера. Этот ион имеет форму правильного тетраэдра в солях
(AsPli3MeJNiCl4 [1], по несколько сплющен (два угла по 107°
и четыре — по 111°) в соли с Et4N+ [2], что, по-видимому, яв-
ляется результатом влияния упаковки в кристалле. Были син-
тезированы комплексы, содержащие ионы NiX42~, где Х=С1,
Br, I, NCS и NCO [3]. Строение ионов NiX3L~ было изучено
в соляч [XiBr3(xiHKviHi[)]AsPh4 [4] и [NiI3(PPh3I [N (н-С4Н>,L]
[5]. В молекулах NiX2L2 могут наблюдаться значительные ис-
кажения тетраэдрических углов, например в NiBro(PPh3J угол
В г—Ni—Br равен 126° [6], а в NiCl2(PPh3J углы С1—Ni—C1
и Р—Ni—Р составляют 123 и 117° соответственно [7]. Мы уже
комментировали плоскую — тетраэдрическую изомерию молекул
NiX2L2, а также молекул NiL/, содержащих бндентатные лпган-
ды. Некоторые более экзотические примеры молекул, в которых
Ni образует тетраэдрически направленные связи, изображены
на схемах а—г.
27.8. Структурная химия никеля 383.
С4Н9
VT
.2,43 А
CU
LNi—
—NiL
L = цикпобутадиен [3]
\Ni/2,27A
L
., = циклопентадиен \_9\
CO
PNi —
\
ос-
CO
W
\-с-
\о
-Ni-
Р
Ni
CO
' = PCC2H4CNK
В случае Ni4(CON[P (C2H4CNK]4 можно говорить об образова-
нии вокруг Ni завершенной электронной оболочки, если при-
нять, что наряду со связями с четырьмя ближайшими соседями
(Ni—3C 1,89 A," Ni—P 2,16 А) никель образует три связи ме-
талл — металл (длина связи 2,57 А по сравнению с 2,49 А в ме-
таллическом никеле); поэтому, вероятно, следовало бы считать,
что в данном соединении никель проявляет КЧ 7, а не 4.
Сходная ситуация наблюдается в кубической молекуле
Ni8(CO)8(PPhN [11], если считать, что связи Ni—Ni B,65 А)
являются ординарными (на схеме г показаны не все лиганды).
Литература. [\] Inorg. Chem.. 1966, 5, 1498. [21 Acta cryst., 1967, 23, 1064.
[31 J. Inorg. Nucl. Chem , 1964, 26, 2035. [4] Inorg. Chem., 1968, 7, 2303. [5] Inorg.
Chem., 1968, 7, 2629. [6] J. Chem. Soc, A 1968, 1473. [7| J. Chem. Soc. 1963,
3625. [81 Helv. Chim Acta, 1962, 45, 647. [9] Inorg. Chem., 1968, 7, 261. [101 J.
Am. Chem. Soc, 1967, 89, 5366. [11] J. Am. Chem. Soc, 1976, 98, 5046.
Ni(II), образующий пять связей. Две наиболее симметрич-
ные конфигурации: тригонально-бипирамидальная и квадратно-
тетрагонально)-пирамидальная, геометрически близки между
собой, поэтому описание конфигураций, промежуточных между
этими двумя крайними случаями, может носить в значительной
мере произвольный характер. Тем не менее комплексы с гео-
метрией, очень близкой к каждой из вышеприведенных коифи-
384 27. Элементы VIII группы и (другие переходные металлы
гураций, были найдены как среди диамагнитных, так и среди
парамагнитных соединений Ni(II), а в одном случае (с. 377)
две легко отличимые конфигурации иона Ni(CNM3~~ найдены
внутри одного кристалла. Конфигурация комплекса зависит от
геометрии лиганда, если последний полидентатен. О структуре
ионов типа NiX53~ (за исключением Ni(CNM3~) ничего не из-
вестно. В таких солях, как Rb3Ni(NO2M, возможно наличие
мостиковых групп NO2 в цепи октаэдров подобно тому, как это
наблюдается в [Ni en2(NO2) ]+. К числу комплексов с моноден-
татными лигандами относится диамагнитная молекула а с поч-
ти идеальной тригонально-бипирамидальной конфигурацией
(хотя считается [1], что у комплексов с PPh(OEtJ реализуется
промежуточная конфигурация) и парамагнитный комплекс б
(р, = 3,7[хв) [2].
6 ОН2
2,10 А г, СН2-СН2
а
N
С
Ме2фР—
Р0Ме2
С
N
(ф- фенил)
а
2,28 А
Ni^2,34A N-CH2-CH2-NCH8(i)
C1 сн2-сн2
В комплексах с полидентатными лигандами реализуются
структуры типов в—е. Мы не будем отдельно обсуждать каж-
дый из этих случаев, так как конфигурация часто зависит от
деталей строения (органического) лиганда. Например, в про-
изводных шиффовых оснований RC6H3(OH)CH = NCH2CH2NEt2
(тип г) соединение NiL2 может быть диамагнитным планарным,
27.8. Структурная химия никеля 385
парамагнитным с К.Ч 5 или парамагнитным октаэдрическим в
зависимости от природы R [3]. Триподные («треножные») тет-
радептатпые лигапды (см. с. 363), например 1SP и ТАР, про-
являют тенденцию к образованию комплексов с тригонально-
бипирамидальной конфигурацией, как это имеет место в диа-
магнитных соединениях [Ni(TSP)Cl]C104 [4] и
(\;i(TAP)CN]C104 [5]. Ссылки на публикации о некоторых
квадратно-пирамидальных комплексах даны в работе [6].
н
(TSP)
Р[-(СН2KА<СНзЫз (ТАР)
As-(CH2K-As-(CH2)j-As^
СН3
(TAS)
Структура NiBr2(TAS) [7], в котором TAS — тридентатный
лиганд, описана в разд. 27.9.6, где проводится его сравнение
с пятикоординационным комплексом Pd с близкой геометрией.
Литература, fl] Inorg. Chem., 1969, 8, 1084, 1090. [2] Inorg. Chem., 1969, 8,
[3] J A Ch S 1965 87 2059 [41 I Ch 1969 8 1072
рур f] g , , , , [] g ,
2734. [3] J. Am. Chem. Soc, 1965, 87, 2059. [41 Inorg. Chem., 1969, 8, 1072.
[1 J. Am. Ch S 96 32 [6] I Ch 1969 1915 [7] Ph
Chem. Soc, I960, 415.
[] J. Am. Chem. Sc, 195, 87, 2059. [1 g ., 969, , .
[51 J. Am. Chem. Soc, 1967, 89, 3424. [6] Inorg. Chem., 1969, 8, 1915. [7] Phys.
h S 96 5
Ni(II), образующий шесть октаэдрически направленных свя-
зей. Простейшими примерами соединений N1 (II) с шестью окта-
эдрически направленными связями являются кристаллический
монооксид и дигалогенид. К уже упоминавшимся октаэдриче-
ским комплексам относятся катион в [Ni(H2ON]SnCl6, тример-
ный [Ni(acacJ]3 [la] и Ni6(CF3COCHCOCH3)lc(OHJ(H2OJ
[16]; их строение рассмотрено на рис. 5.9 и 5.11 (т. 1).
Было изучено много октаэдрических парамагнитных комп-
лексов Ni(II) (общие типы см. на схемах а—г).
В противоположность Ni(tuLCl2, образующему изолирован-
ные молекулы с (необъяснимой) асимметрией (длины двух
транс-связей Ni—С1 составляют 2,40 и 2,50 А) [2], тиоцианат
Ni(tuJ(NCSJ (д) состоит из бесконечных цепочек октаэдров,
имеющих общие ребра [3]; в противоположность Ni(enJ(NCSJ
(тип б), нитритокомплекс [Ni(enJONO]+ (e) построен из це-
почек октаэдров, имеющих общие вершины* [4].
* В работе [4] по [Ni(enJ0N0]C104 была допущена ошибка; как пока-
зало исследование изоструктурного [Ni(enJONO]BF4 [Chem. Comm., 1965,
477], мостиковая группа (ЖОсвязана с одним атомом Ni через О, с другим —
через N. Детальный обзор структурной химии этилендиаминовых и других
соединений никеля с родственными хелатными аминами (а также аналогичных
соединений Zn, Cd и Hg) см. в кн.: Швелашвили А. Е., Порай-Кошиц М. А.
Стереохимия координационных соединений некоторых металлов с циклообра-
зующими аминами. — Тбилиси: Мецниераба, 1979. — Прим. ред.
25—1284
386 :»7. Элементы VIII группы и другие переходные металлы
27.8. Структурная химия никеля 387
[Acta crysi., W69,
BZ5, 595]
Ni (асас)г(ру)г
\lnorg. Шт., 1Э68,
]_, 2316]
/ пцчпц (NCSJ
[Ada crysi.,
1963,15, 753]
[Ni(enK](N03)?
rArfa crust., Ж
13, 639]
N—
()(
[Acta Chem.
Scand.,1959,
./cs ^'
NCS
1,99,
NCS
2,55 A
SCN
Положение в области структурной химии диамагнитных ок-
таэдрических комплексов все еще оставляет желать лучшего.
Галогенокомплексы Ni (диарсинJХ2 в растворе CH3NO2 явля-
ются бинарными электролитами, но коричневые кристаллы
№(диарсинJ12 состоят из октаэдрических молекул типа б,
в которых расстояние Ni-—As равно 2,29 A, a Ni—I — 3,21 А [5].
Такую длину связи Ni—I можно сравнить с 2,55 А в [NiI3PPh3]~
(тетраэдрическом) и 2,54 А в Nil2[ (C0H5)P(C6H4SCH3Jj
(квадратно-пирамидальном) (см. работу [6] предыдущего раз-
дела).
Природа связи Ni—I точно не выяснена, так как в присутствии
метальных групп, располагающихся сверху и снизу от эквато-
риальной плоскости, возникают стерические препятствия, что
приводит к удлинению связи никель — иод. Изучение структуры
таких соединений, как [№(диарсин)з](С1С>4J, которые част©
рассматривают в качестве примеров спин-спаренных октаэдри-
ческих комплексов Ni(II), по-видимому, не проводилось. (Дан-
ные об электронной структуре парамагнитного комплекса
[№(диарсинJС12]С1, содержащего один неспаренный электрон,
малодостоверны [6].)
Литература, [la] Inorg. Chem., 1965, 4, 456. [16] Inorg. Chem., 1969, 8, 1304.
|9l J Chem Soc, 1963, 1309. [3] Acta crysi, 1966, 20, 349. [4] .1. Chem. Soc,
1962, 3845. [51 Acta cryst., 1964, 17, 592. [6] J. Am. Chem. Soc, 1968, 90,
1067.'
27.8.2. Другие степени окисления Ni
Ni@). Известны только тетраэдрические комплексы: К ним
относятся Ni(COL, Ni(PF3L, Ni(CNRL и Ni(CNL4- в солях
калия, имеющих желтый цвет. Структурная информация об этих
комплексах приведена выше в гл. 22.
Ni(I). Структура иона [Ni2(CNN]4- описана в разд. 22.1.2.
Ni(III). К соединениям Ni (III) можно отнести NiBr3(PEt3J,
полученный при окислении транс-№Вг2(РЕт.3J, и №(диар-
синJС1з, синтезированных путем окисления кислородом дихло-
росоединения в присутствии избытка ионов С1~. Оба этих сое-
динения имеют магнитные моменты, соответствующие наличию
одного неспаренного электрона, однако их структура пока еще
неизвестна. Значение магнитного момента первого из этих ком-
плексов указывает на тригонально-пирамидальное строение [1J;
эта конфигурация представляется наиболее вероятной, если
учесть данные по структуре №шВг3Р2'-0,5[№пВг2Р2') -С6Нб [2],
где Р' представляет собой (Р(С6Н5) (СН3J. Это соединение со-
держит плоские молекулы NiBr2P/ транс-строения и вдвое
большее число тригонально-бипирамидальных молекул NiBr3P2',
в которых Р занимает аксиальное положение (Ni—P 2,27 А;
Ni—Br 2,35 А). Молекулы несколько искажены: одна из эква-
ториальных связей приблизительно на 0,03 А длиннее двух
других, а угол против этой (самой длинной) связи составляет
133°. Длины связи Ni—Р существенно не отличаются от длин
аналогичных связей в квадратно-плоскостном комплексе Ni(II);
связи Ni—Br удлинены примерно на 0,05 А. Диарсиновый ком-
плекс, по-видимому, можно описать как [№(диарсинJС1г]С1 с
атомом Ni (III) в октаэдрической координации, хотя есть неко-
торые сомнения в том, что такие октаэдрические комплексы
нужно рассматривать как соединения Ni (III); в соответствии
со спектрами электронного резонанса их, возможно, следует
рассматривать как соединения Ni (II), в которых неспаренный
электрон находится большую часть времени у атома As [3].
Структурная информация по простым соединениям Ni (III)
ограничена соединениями, содержащими F или О. Известно,
что K3NiF6 имеет такое же строение, как и K3FeF6, и его маг-
нитный момент равен 2,5 цв, т. е. имеет значение, промежуточ-
ное по сравнению с ожидаемыми для низко- и высокоспиновых
комплексов [4]. Он содержит Ni (III) в октаэдрическом окру-
жении. Оксиды LnNiO3, образованные 4[-элементами, имеют
структуру перовксита [5], тогда как NiCrO3 обладает структу-
рой корунда со статистическим распределением атомов металла;
25*
388 27. Элементы VIII группы и другие переходные металлы
в результате изучения магнитных свойств было сделано заклю-
чение, что это соединение содержит Ni(III) в высокоспиновом
состоянии [6].
Ni(IV). Определенная информация о строении получена
только для солей красного цвета K2NiF6 [7] и Cs2NiF6 [8]. Они
диамагнитны и имеют структуру K2SiF6 с октаэдрической ко-
ординацией Ni(IV). В течение многих лет считали, что оксид
BaNiO3 также является примером соединения Ni(IV) [9], од-
нако до сих пор остаются сомнения относительно его состава
(Ва№02,5?) и интерпретации магнитных свойств.
Упомянутый катион, содержащий диарсин, можно окислить
до состояния [Ni (диарсинJС12]24; последний выделен в виде
перхлората темно-синего цвета, возможно, содержащего Ni (IV).
Литература. [1] Acta Chem. Scand., 1963, 17, 1126. [2] Inorg. Chem., 1970, 9,
453. [31 J. Am. Chem. Soc, 1968, 90, 1067. [41 Z. anorg. allg. Chem., 1961, 308,
179. [5] J. Solid State Chem., 1971, 3, 582. [61 J. Appl. Phys., 1969, 40 434.
[71 Z. anorg. allg. Chem., 1949, 258, 221. [8] Z. anorg. allg. Chem., 1956, 286,
136. [9] Acta cryst., 1951, 4, 148.
27.9. Структурная химия палладия и платины
Вначале мы обсудим соединения Pd(II) и Pt(II). Нуль-валент-
ное состояние ограничивается соединениями, содержащими ли-
ганды СО, PF3 или PR3. Сюда относятся, например, тетраэдри-
ческая молекула Pt(PF~L [J. Mol. Struct., 1976, 31, 73] и
молекулы типа PtCO(PPh3K, но не М(СОL. В карбонильных
металлических кластерах формальная степень окисления ме-
талла равна +1 (разд. 22.3.2).
27.9.1. Плоские комплексы Pd(II) и Pt(II). В 1893 г. Вернер
высказал предположение, согласно которому изомерию опреде-
ленных соединений двухвалентных Pd и Pt можно объяснить,
если принять, что четыре атома, присоединенные к атому ме-
талла, находятся в одной плоскости. Молекула Pta2b2 могла бы
иметь в этом случае цис- и гранс-изомеры, тогда как в случае
связей тетраэдрической направленности возможен только один
изомер. Аналогичным образом для плоской молекулы Mabcd
возможно существование трех изомеров по сравнению с един-
ственным соединением при условии тетраэдрического строения
комплекса. В эпоху до возникновения структурного анализа
единственный подход к решению этой задачи состоял в изуче-
нии геометрической и оптической изомерии, и требовалась осо-
бая изобретательность для удовлетворительного определения
строения молекулы. В настоящее время нет необходимости
обращаться к этой главе истории химии, поскольку компланар-
ность четырех связей Pd(II) и Pt(II) была продемонстрирована
для многих молекул и ионов, начиная с первого рептгенодифрак-
27.9. Структурная химия палладия и платины 389
ционного определения квадратно-плоскостного строения ионов
PdCl42~ и PtCl42- в их калиевых солях с 1922 г. Структуры
двойных соединений, галогенидов, оксидов, сульфидов и т. д.
описаны в других главах. Здесь мы рассмотрим примеры изо-
лированных молекул и ионов, представляющих особый интерес.
Из-за равенства эффективных длин связей Pd—X и Pt—X мно-
гие соединения Pd (II) и Pt (II) изоструктурны, однако, посколь-
ку существуют значительные различия в химических свойствах
этих металлов, мы будем рассматривать их отдельно друг от
друга. Вероятно, следует подчеркнуть, что мы приводим только
примеры тех комплексов, структурные исследования которых
были реально проведены; не все типы соединений, которые дает
Pd, могут быть образованы Pt, и наоборот.
27.9.2. Соединения Pd(II). С помощью дифракционных мето-
дов были определены структуры таких соединений, как КгРйСЦ
[1], [Pd(NH3L]Cl2-H2O [2]; многочисленных цианидных ком-
плексов (многие из которых изоструктурны аналогичным про-
изводным Ni и Pt), например Ca[Pd(CNL]-5H2O и
Na2[Pd(CNL]-ЗН2О; молекул, содержащих хелатные группы
(например, Pd(en)Cl2 [3]); комплексов с дитиооксалат-ионом,
глиоксимами, фталоцианином и родственных им молекул.
В разд. 10.1.3 уже упоминалось, что структура [Pd(NH3L]Cl2-
•Н2О имеет много общего со структурой КгРс1С14 (рис. 10.1);
позиции анионов и катионов чередуются, а молекулы Н2О рас-
положены в пустотах структуры. По всей вероятности, полости
в структуре несколько велики для молекул Н2О, и, по-видимо-
му, последние располагаются разупорядоченно вблизи центров
полостей. В [Pd(enJ][Pd(en) (S2O3J] [4] оба иона имеют
квадратно-плоскостное строение, и лиганд S2O3 присоединен
через атом S (а). При растворении Pd в HNO3 с последующей
обработкой раствора аммиаком образуется не [Pd(NH3L](NO3J,
что можно было бы ожидать, а светло-желтое соединение
[Pd(NH3KNO2]2[Pd(NH3L](NO3L, содержащее два типа плос-
ких ионов в отношении 2:1 [5]. О K2[Pd(SO3Jl-H2O и
Na6[Pd(SO3L]-2H2O см. в разд. 16.8.1.
В 2,2'-дипиридилиминокомплексе (б) [6], где возникают сте-
рические затруднения из-за контактов атомов Н*, квадратно-
плоскостное расположение четырех связей палладия сохраняет-
ся, но сами лиганды несколько искажаются в противополож-
ность комплексу никеля с дипиррометеном (разд. 27.8.1).
Существуют многочисленные двуядерные (мостиковые) сое-
динения Pd (II). В ранних рентгеноструктурных исследованиях
была выявлена плоская транс-конфигурация комплексов в и г;
из более поздних работ мы кратко рассмотрим следующие.
Ацетат [Pd(CH3COOJ]3 представляет собой тример [7] и
390 27. Элементы VIII группы и другие переходные металлы
N
н*
н*
N
Pd
N N
Н*
Н*
Вг
сн3KаГ
Вг
Pd'
'Pd'
As(CH3
Вг
.СН2-СН2
Pd
\
Pd
V
НгС
Н2С
н2с
-СН2
ген.
-Pd-
I
чсн,
"СН,
сн2
содержит три двойных ацетатных мостика, а молекула д имеет
форму «чаши» [8]. В разд. 9.9.2 мы упоминали о гексамере
Pd6Cli2; другим примером гексамерной молекулы служит ком-
плекс с н-пропилмеркаптидом [9], по структуре подобный со-
ответствующему соединению Ni (рис. 27.10).
Особый интерес представляет дитиоацетат, поскольку он мо-
жет существовать в двух кристаллических формах: одной, со-
стоящей из плоских мономеров и димеров, и другой, содержа-
щей только димерные молекулы. Димер представляет собой
тетракис-комплекс типа «фонарика» (тип б в табл. 7.9), в ко-
^ Ж у
,C1-Pd-Pd-Cr
—А1"
ay
_А1 — СГ
\ 1 27 А
А1—С!
Cl-Pd-Pd-СГ-
2,1 7 А
2,45 А
тором Pd образует пятую связь с другим атомом металла
(Pd—Pd2,75A).
Примерами редких соединений, в которых Pd (II) не имеет
квадратно-плоскостной конфигурации, служат комплексы
[PdAlCU(C6H6)]2 и [PdAl2Cl7(C6H6)]2, образующиеся при кипя-
чении в бензоле смеси А1С13, металлического А1 и PdCb [И]-
Строение этих молекул изображено на схеме е и ж. Их особен-
27.9. Структурная химия палладия и платины 391
ностыо являются чрезвычайно малая длина связи Pd—Pd, ко-
торая короче аналогичной связи в металле B,75 А), и удлине-
ние связи Pd—С1.
Литература. [1] Acta cryst., 1972, В28, 393. [21 Acta cryst., 1976, B32, 634.
[31 Acta cryst., 1975, B31, 1672. [41 Acta cryst., 1970, B26, 1698. [5] Inorg. Chem.,
1971 10, 651. [6] Acta cryst., 1965, 18, 845. [71 Chem. Comm., 1970, 658.
[81 Acta cryst, 1969, B25, 1659. [9] Acta cryst., 1971, B27, 2292. [10] Inorg.
Chem., 1979, 18, 2258. [11] J. Am. Chem. Soc, 1970, 92, 289.
27.9.3. Соединения Pt(II). В настоящее время отсутствуют до-
казательства образования платиной(II) более четырех компла-
нарных связей. Единственными исключениями являются соеди-
нения, упомянутые в разд. 27.9.6. Как и в случае Pt(IV)
(разд. 27.9.8), формулы некоторых соединений заставляют
предполагать иные координационные числа, однако структурные
исследования неизменно подтверждают наличие четырех связей.
В комплексе [Pt(acacJCl]K (a) [1] число связей не достигает
пяти, так как один из асас-лигандов координируется через атом
углерода; рентгеноструктурное исследование соединения, фор-
мулу которого записывали ранее в виде [Pt(NH3L(CH3CNJ]Cl2-
•Н2О, показывает, что оно не является примером шести-
координационного комплекса платины (II), а имеет вид
{Pt(NH3J[CH3C(NH2)NH]2}Cl2-H2O [2]. Платина образует
четыре компланарные связи с двумя молекулами NH3 и двумя
молекулами ацетамида (б).
а 6
гн, - ^Н2
С1
,о-с-
С
NH3
196 А 12'04А
н
,ХН,
"СН,
NH3
NH-,
Соединения Ni, Pd и Pt типа М(диарсинJХ2 являются
в растворе бинарными электролитами, что указывает на более
прочную связь одного из двух атомов галогена с металлом,
[М(диарсинJХ]+. В кристаллическом состоянии [3] они обра-
зуют сильно искаженные октаэдрические координационные мно-
X
392 27. Элементы VIII группы и другие переходные металлы
гогранники с длинами связи: Ni—As 2,3 A, Pd(Pt)—As 2,4 А
и связью М—X, гораздо более длинной, чем обычная ковалент-
ная. В РЦдиарсин) 2СЬ длина связи Pt—С1 составляет 4,16 А;
это указывает на то, что ионы С1~ покоятся на четырех группах
СН3, расположенных над экваториальной плоскостью двух ди-
арсиновых молекул. Меньшие расстояния М—1 C,2, 3,4, 3,5 А
в соединениях Ni, Pd и Pt соответственно) можно объяснить
сильной поляризацией ионов I"; эти расстояния имеют значения,
промежуточные между суммой ковалентных радиусов и суммой
вапдерваальсовых (или ионных) радиусов. В конце разд. 27.8.1
расстояние Ni—I в комплексе с диарсином сравнивается со зна-
чительно более короткими расстояниями Ni—I в парамагнитных
тетраэдрических и квадратно-пирамидальных молекулах.
Как и Pd(II), Pt(II) образует многочисленные квадратно-
плоскостные комплексы, например Pt(H)Br(PEt3J (разд. 8.2.5),
цыс-РтС12(РМе3J [4], цис- и rpaHC-PtCl2(NH3J [5],
[PtCl(CO)(PEt3J]BF4 [6] и [PtCl3NH3]K-H2O [7]. К комплек-
сам с бидентатнымн лигапдами относятся Pt(S2N2HJ [8J,
диметилглиоксимат [9] и диглицинат [10]. О K.3[Pt{(SO3JH}Cl2
см. разд. 8.3.3.
В некоторых комплексах наблюдается увеличение длины
связи Pt—X, находящейся в транс-положении к образующему
я-связь лиганду (транс-эффект) *. Это имеет место в
PtCl2(PMe3J (в), а также в мостиковой молекуле г [11], где
этот эффект приводит к несимметричности мостика (и различию
в -2'38А -™- а^А retl
^Pt 2,31 А
С1-
.,РМе3
^•-2,25 А
в противоположность
CV
~РМе3
ЕЬ
2,27 -
2,39 А
2 31 А
2,31 А
* Впервые вопрос о структурной характеристике транс-влияния был по-
ставлен Г. Б. Бокием в конце 40-х годов. Экспериментально тракс-удлинение
впервые было зафиксировано в соли Цейзе К[Р1С2Н4С1з]-Н2О и ее бромном
аналоге [Кристаллография, 1957, с. 400]. В первой из них расстояния Pt—С1
в транс- и цис-позициях к С2Н4 равны соответственно 2,39 и 2,28 А, во вто-
рой — аналогичные расстояния Pt—Br равны 2,52 и 2,42 А.
Детальный обзор структурного проявления транс-влияния см. в: [Коорд.
химия, 1978, т. 4, с. 842—866]. Общий обзор по кристаллическим структурам
соединений Pt и Pd и исчерпывающие на 1974 г. литературные ссылки см. в:
[Кристаллохимия: Ежегодник, Сер. ИНТ, т. 9, 10.— М.: ВИНИТИ, 1974].—
Прим. ред.
27.9. Структурная химия палладия и платины 393
длин трех связей Pt—С1). Аналогичный эффект наблюдается в
Pt2Cl4(PPr3J [12].
К. более сложным молекулам относятся: тетрамер
[Pt(CH3COOJ]4 в двух его кристаллических формах [13J,
молекула Pt4(CH3COON(NOJ [14], а также димер дитиоаце-
тата платины Pt2(S2CCH3L, имеющий ту же структуру, что и
соединение палладия (см. табл. 7.9, т. 1), в котором платина
образует четыре компланарные связи с S (Pt—S 2,32 А) и пя-
тую связь B,77 А) с другим атомом Pt. В молекуле
[Pt(CH3COOJ]4 атомы Pt расположены в вершинах почти пра-
вильного квадрата. Из восьми мостиковых ацетатных групп
четыре лежат в той же плоскости, что и атомы Pt, а оставшиеся
четыре — в плоскостях, перпендикулярных ей, чередуясь над
и под плоскостью квадрата. Атом металла, таким образом, ле-
жит в центре октаэдра, в вершинах которого находятся четыре
атома кислорода (два — на расстоянии 2,00 А и два — на
2,16 А) и два атома Pt (на расстоянии 2,495 А), что показано
на схеме д.
сн3
С другой стороны, в Pt4(acN(NOJ отсутствуют связи ме-
талл — металл. Атомы образуют прямоугольник со сторонами
2,94 и 3,31 А; в комплексе присутствуют шесть мостиковых
групп СН3СОО и две NO (е). Дихлорид образует гексамерную
молекулу Pt6Cl]2, аналогичную одной из форм кристаллическо-
го PdCl2.
Литература. [I] J. Chem. Soc, A 1969, 485. [2] J. Inorg. Nucl. Chem , 1962, 24,
801. [3] J. Inorg. Nucl. Chem., 1962, 24, 791, 797; Acta cryst., 1964, 17, 1517.
[4] Inorg. Chem., 1967, 6, 725. [5] J. Chem. Soc, A 1966, 1609. [6] J Am. Chem ,
Soc, 1967, 89, 3360. [7] Inorg. chem., 1970, 9, 778. [8] J. Inorg. Nucl Chem., 1958,
7, 421. [9| Acta cryst., 1959, 12, 1027. [10] Acta cryst., 1969, B25, 1203. [Ill J
Chem. Soc, A 1970, 168. [121 Acta cryst., 1969, B25, 1760. [13] Acta cryst., 1978,
B34, 1857, 3576. [14] J. Chem. Soc, D 1973, 1194.
27.9.4. Мостиковые соединения Pd и Pt. PtX42- и PdX42~ в раст-
воре реагируют с тетраметиламмониевыми солями с выделением
394 27. Элементы VIII группы и другие переходные металлы
веществ с эмпирической формулой (NR4)PdX3 или (NR4)PtX3
(Х=Вг или С1). Структурное исследование соединения
[N(C2H5L][PtBr3] [1] показало, что оно содержит двуядерный
ион и соответственно формулы солей этого типа следует запи-
сывать в виде (NR4J(Pt2X6). При взаимодействии PtCb с рас-
плавленным* L2PtCl2 или путем реакции i{uc-L2PtCl2 с I ~"
Pt
Br-
-Br-
Br
в растворе можно получить мостиковое соединение Pt2Cl4L2
(здесь L — нейтральный лиганд СО, С2Н4, NH3, P(ORK, PR3,
AsR3, SR2 и т. д.). Мы уже указывали, что Pd образует ана-
логичные соединения и что молекула Pd2Br4[As(CH3K]2 являет-
ся плоской, если не принимать во внимание расположение ме-
тильных групп, и имеет транс-конфигурацию I:
х\ /Х\ ^L X. ^Х X
Ш
Хотя теоретически возможно образование трех изомеров,
все соединения, в которых L — один из указанных выше ли-
гандов, а X — галоген, известны только в одной форме, в виде
транс-изомера I. Об этом свидетельствуют результаты измере-
ния дипольных моментов. Мостик между атомами металла мо-
жет быть также образован следующими группами:
Было выделено два изомера комплекса с этилтиолом
(Pr3PJPt2(SRJCl2, дипольные моменты которых равны 10,3 Д
(стабильная форма) и нулю, откуда следует, что стабильная
* Указание на взаимодействие PtCl2 с расплавленными комплексами
Pt (II) отличается неточностью, так как многие из перечисленных комплексов,
например 4«c-Pt(NH3hCl2, при нагревании разлагаются не плавясь. — Прим.
перев.
27.9. Структурная химия палладия и платины 395
форма является цис-изомером IV, а неустойчивая — изомером
V [2]:
С21
IV
с2н«
х\
:рг
С
с2н5
V
Интересно, что в Pt2Br4(SEt2J мостиковыми являются группы
S(C2H5J, тогда как в родственном ему комплексе
Pd2Br4(SMe2J роль мостиков выполняют два атома Вг [3]:
(C2H5J
Br
(CH3JS.
-Br-
"Pd'
~S(CH3J
Рентгеновское структурное изучение двух изомеров
Pt2Cl2(SCNJ(Pr3PJ [4] показывает, что они имеют строение
VI и VII.
VI
vil
Литература. [1] Acta cryst., 1975, B31, 2530. [21 J. Chem. Soc 1953 2363
[31 J. Chem. Soc, 1968, 1852. [41 J. Chem. Soc, A 1970, 2770.
27.9.5. Некоторые интенсивно окрашенные соединения Pt.
Целый ряд кристаллических солей состоит из плоских ионов
двух типов, имеющих противоположный заряд и расположен-
ных стопкой друг над другом. Анион «зеленой» соли Магнуса
[Pt(NH3L][PtCl4] придает раствору красный цвет, катион
раствор не окрашивает. Зеленый цвет и аномальный ди-
хроизм кристаллов связаны с образованием связей металл—
металл, имеющих ту же длину C,25А), что и у Ni—Ni в ди-
метилглиоксимате Ni. Многие соли с подобной структурой
гшши /ГВЫЙ цвет> напРИмеР [Pd(NH3L][PdCl4] и
[Ра(ЫН3L] [PtCI4]; необычные оптические свойства возникают
только в том случае, когда оба иона содержат Pt(II) и связь
Pt—Pt коротка. Именно поэтому [Pt(NH3L] [PtCl4] и
|Pt(CH3NH2L] [PtCl4] имеют зеленый цвет, а
[Pt(NH2C2H5L] [PtCl4]—розовый. В последнем соединении все
атомы катиона не компланарны, плоскости групп N4Pt и PtCl4
наклонены на 29°, расстояние Pt—Pt равно 3 62 А [1]
396 27. Элементы VIII группы и другие переходные металлы
Pt"
Ptl
О
Фиолетовая соль Миллоыа PtCl4[Cu(NH3L] [la] состоит
из двух типов плоских ионов, расположенных друг над другом,
как и в случае соли Магнуса (Си—Pt 3,22 А), а изомерная ей
зеленая соль (Бектона) Pt(iNH3LCuCl4 состоит из слоев такого
же типа, как и (NH^CuCU, между которыми расположены
плоские ионы [Pt (NH3L]2г. Искажение октаэдрического коор-
динационного многогранника Си(II) больше обычного D атома
С1 находятся на расстоянии 2,29 А, 2С1 —
3,26 А; ср. со значениями, приведенными в
табл. 25.3).
Интересными оптическими свойствами об-
ладают гидратированные цианокомплексы
платины. Соли щелочных металлов, напри-
мер K2Pt(CNL-3H2O, имеют желтый цвет,
однако соль MgPt(CN)i-7H2O окрашена в
красно-розовый цвет, причем для соли харак-
О NH3 терно зеленое отражение от некоторых гра-
ней; обе кристаллизуются из бесцветных рас-
творов. Вид и расположение плоских ионов
[Pt(CNL]2~ в этих соединениях с обычной
валентностью таковы, что межатомные рас-
стояния Pt—Pt оказываются существенно
большими, чем в металле B,78 А), например
3,3^-3,7 А в гидратированных солях Ва, К,
Na, Cs [2]. В последние годы большой инте-
рес проявляется к окрашенным соединениям, образованным при
частичном окислении K2Pt(CNL или частичном восстановлении
K2Pt(CNLX2, имеющих целочисленную формальную степень
окисления Pt. Атомы Pt эквивалентны между собой, комплексы
образуют колонки с короткими расстояниями Pt—Pt (<3 A).
Примерами могут служить Ki,75Pt(CNL- 1,5H2O (Pt—Pt 2,96 А)
и K2Pt(CNLBro,3-3H20 [3], подробно изученные как одномер-
ные проводники.
В солях другого типа интенсивная окраска возникает при
взаимодействии Pt (II) и Pt(IV). Темноокрашенная соль соста-
ва Pt(NH3JBr3 содержит плоские молекулы Pt11 (ЫНзJВг2 и
октаэдрические Ptlv(NH3JBr4 [4]. В кристалле плоские и окта-
эдрические молекулы чередуются между собой, образуя колонки
(рис. 27.11). Оказывается, что атомы Pt(II) образуют две до-
полнительные слабые связи C,03 А) с атомами Вг комплекса
PtIV(NH3JBr4 (ср. с расстоянием Pt—Вг во внутренней сфере
комплексов, равным 2,50 А). Другими солями этого типа явля-
ются [Ptn(en)Br2] [PtIV(en)Br4] [5] и красная соль Вольфрама
[Ptn(C2H5NH2L]2+[PtIV(C2H5NH2LCl2]2+Cl4-4 H2O. [6]. В по-
следней хлорид-ионы (и молекулы Н2О) располагаются между
цепями в целом такого же типа, как и изображенные на
Рис. 27.11. Фраг-
мент бесконечной
цепи в Pt(NH3J-
Br2-Pt(NH3JBr4.
27.9. Структурная химия палладия и платины 397
рис. 27.11. Была также определена структура (безводного)
бромного аналога соли Вольфрама [7].
Литература. [1] Acta cryst., 1971, В27, 480. [la] Acta cryst., 1975, B31, 2220.
121 Inorg. Chcm., 1976, 15, 74; Acta cryst., 1977, B33, 884, 1293, 1976. [31 Inorg.
Chem, 1976, 15, 2446, 2455. [41 Acta cryst., 1958, 11, 624. [51 J. Am. Chem. Soc,
1961, 83, 2814. [6] Acta cryst., 1961, 14, 475. [71 Acta cryst., 1966, 21, 177.
27.9.6. Pd(II) и Pt(H), образующие пять связей. Структурные
исследования комплексов, в которых эти элементы проявляют
КЧ 5, малочисленны. Судя по этим данным, конфигурация та-
ких комплексов Pd близка к тетрагонально-пирамидальной,
по с одной аномально длинной связью. Молекула Рс1Вг2Ьз [1],
где L — фосфин (рис. 27.12, а), имеет конфигурацию, близкую
к тетрагонально-пирамидальной, в которой, однако, аксиальная
связь Pd—Вг гораздо длиннее экваториальных связей. Кроме
того, Вг2 лежит под экваториальной плоскостью; в этом отноше-
нии такая структура напоминает структуру никелевого комплекса
NiBr2(TAS) (б) [2], где TAS — тридентатный лиганд, изобра-
женный в конце разд. 27.8.1. Отклонения от тетрагонально-пи-
рамидальной конфигурации в соединениях Ni гораздо больше,
структура приближается к тригопально-бипирамидалыюй (где
углы 95, 111 и 154° переходят в углы по 120°). У попа
[Pd(TPAS)Cl]+ [3], содержащего тетрадентатиый лиганд
(TPAS), по-видимому, пет искажений подобного типа, однако
и в нем одна из пяти связей (Pd—As 2,86 А) гораздо длиннее
нормальной (средней из трех других, 2,37 А).
Другим примером образования палладием четырех прочных
и одной слабой езязей служит кристаллический транс-
PdI2(PMe2PhJ [4]. Этот комплекс построен по типу плоского
квадрата (Pd—Р 2,34 A, Pd—I 2,36 А), причем молекулы рас-
положены таким образом, что с одной стороны от Pd находит-
ся атом I ближайшей соседней молекулы (на расстоянии
3,28 А), а по другую сторону — два атома водорода различных
С6Н5-групп. Этот случай, конечно, не является аналогом а и
в, где Pd образует пять связей внутри изолированной молеку-
лы или иона.
Как и Pd (II), Pt(II) не имеет тенденции к образованию пя-
ти связей, и немногочисленные примеры пятикоординационных
соединений Pt (II) являются скорее исключениями.
Первый из них —ион г на рис. 27.12 в [Pt(QAS)I] (BPh4)
[5], детальные сведения о строении которого отсутствуют; он
описан как тригоналыю-бипирамидальный комплекс с нормаль-
ными одинаковыми ковалентными связями. Можно ожидать,
что тетрадентатный лиганд обладает осью 3-го порядка, что
и приводит к тригонально-бипирамидальной структуре комп-
лекса. В другом предварительно изученном соединении
398 27. Элементы VIII группы, и другие переходные металлы
(Ph3PMeK[Pt(SnCl3M] пять лигандов присоединены к Pt по-
средством связи Pt—Sn [6]. Конфигурацию этого комплекса
можно также описать как тригонально-бипирамидальную, од-
нако деталей структуры не удалось определить из-за ее раз-
упорядоченности в кристалле.
г,93А
Ph1
:,5ZA \
As
I
As3_
J>
Z.33A
Ph=
( 0 - фенил)
г
As
(СН3)г
(TP/1S)
As
|\
Pt—As
| Фг As
I
Y^As02
02
(QAS)
Рис. 27.12. Пятикоординационные комплексы палладия, никеля и платины (см.
текст).
Литература. [11 J. Chem. Soc, 1964, 1803. [2] Proc. Chem. Soc , 1960 415
[31 J. Chem. Soc, 1967, 1650. [41 Chem. Comm., 1965, 237. [51 Proc Chem Soc
1961, 170. [61 J. Am. Chem. Soc, 1965, 87, 658.
27.9.7. Pd(II) и Pt(II), образующие шесть октаэдрически на-
правленных связей. Маловыраженная способность Ni(II) к об-
разованию низкоспиновых октаэдрических комплексов также
свойственна Pd(II) и Pt(II). Октаэдрический координацион-
ный многогранник Pd(II) присутствует в структуре PdF2
(структура рутила) и PdIJ(PdIVF6); однако образование шести
ковалентных связей потребовало бы использования одной
d-орбитали внешней оболочки в дополнение к одной (п—l)d-,
одной ns- и трем яр-орбиталям, например в форме комбинации
из четырех компланарных dsp2- и двух гибридных pd-связей.
Две связи, завершающие октаэдрическую конфигурацию в низ-
коспиновых комплексах этих элементов, определенно гораздо
длиннее нормальных ординарных связей. В описанных выше
примерах, например M(DASJX2 (где DAS — диарсин типа
R2AsCH2CH2AsR2), четыре атома As координированы металлом
27.9. Структурная химия палладия и платины 399
по квадрату. Было высказано предположение, что при плаиар-
иом расположении четырех атомов As вокруг М обратное до-
пирование электронов с металла на As (увеличивающее па
нем положительный заряд) дает возможность атому металла
образовывать дополнительные связи с наиболее высокополяри-
.чуемымн анионами, например иодид-ионом.* При связывании
Me
I
(СН3J:з,40А(снзJ
¦—As-
(СН3J ! (СН3J
1
металлом только двух атомов мышьяка существенная обрат-
пая передача электронов отсутствует, и в случае а [1] мы на-
ходим только четыре связи нормальной длины. В случае б
[2] связи Pd—I чрезвычайно слабые, хотя возможной причи-
ной этого является и то обстоятельство, что I экранирован че-
тырьмя метальными группами. В растворе в нитробензоле
Pt (диарсин) гЬ, по-видимому, ведет себя как бинарный элект-
ролит [Pt (диарсинJ1]1. Его строение очень близко к структуре
соответствующего соединения Pd, а расстояние Pt—I составля-
ет 3,50 A [3J. Тем не менее в дихлоросоединении РЦдиар-
синJС12 [4] расстояние Pt—C1 составляет 4,16 А, что можно
интерпретировать единственным образом—как указание на
ионную связь. Как сказано выше, у соединений Ni мы наблю-
даем подобную же картину.
* Однако недавно было показано, что координация по типу 4X2 (четыре
прочные связи в экваториальной плоскости и две слабые аксиальные) осуще-
ствляется и в соединениях, где обратное допирование маловероятно или вч-
обще невозможно. Примеры: i\4"B,3,2-tet)tebX, где 2,3.2-tet — тетрадентатнып
амин 1,4,7,11-тетраазаундекан, teb~ — тетраэтинилборат-анион В(С^СН4L~,
X=tcb~, Cl~, Вг~ или 1~ [Коорд. химия, 1986, т. 12, с. 1279; сб. Применение
рентгеновских лучей к исследованию материалов. — Кишинев: изд-во Штиинпа,
1986, с. 31—461, [AuIIIen2Cl2lCl05(N02)o5 [Коорд. химия, 1983, т. 9, с. 5661,
[Аи111сп2(СЮ4J1СЮ4-Н2О [Коорд. химия, 1986, т. 12, с. 1417]. —Прим. ред.
400 27. Элементы VIII гриппы и другие переходные металлы
Литература. [1] Лс1а cryst., 1970, В26, 1655. [2| J. Inorg. Nucl. Chem., 19C2, 24,
797. [3] J. Inorg. Nucl. them., 1962, 24, 791. [4| Acta cryst., 1964, 17, 1517.
27.9.8. Октаэдрическая координационная Pt(IV): триметилпла-
тинахлорид и родственные соединения. В предыдущих главах
мы уже рассматривали октаэдрическую координацию Pt(IY)
в островных ионах
PtCl62- и Pt(OHN2-), в цепо-
чечных структурах (PtCU и
Ptl4) и в каркасных структу-
рах (PtF4 и РЮг). Было пока-
зано, что ион [Pt(CNLBr2]2~
„„ -- в натриевой и рубидиевой со-
Л7' ата^лниТ лях также имеет октаэдриче-
скую конфигурацию [1].
Триметилхлорид Pt(IV) и
некоторые его производные
привлекают к себе повышен-
ное внимание, поскольку в со-
ответствии с их эмпирически-
ми формулами координацион-
ное число Pt(IV) в них долж-
но было бы быть равно 4, 5
и 7. Платина образует целый
ряд соединений РЧ(СН3)зХ,
где Х = С1, I, ОН или SH, ко-
торые существуют в форме
тетрамеров (рис. 27.13, а); ато-
мы Pt и X занимают в них
смежные вершины (искажен-
ного) куба. Эти соединения интересны тем, что ранее гидроксид
принимали за тетраметилплатину [2а], а иодид — за РЫСНз)е
[26].
Первоначально было найдено, что расстояние Pt—С1 в
[Pt(CH3KCl]4 составляет 2,48 А [За]; по-видимому, более на-
дежно значение 2,58 А, найденное в [Pt(C2H5KCl]4 [36]. При-
веденные ниже значения углов и длин связей для гидроксо-
комплекса показывают, что имеет место некоторое искажение
наивысшей (из возможных) кубической симметрии [4]:
Рис. 27.13. Триметилплатинагалогсни-
ды и родственные соединения.
О—Pt—О 7«°
С—Pt—С 87°
Pt—О—Pt 101°
Pt—С 2,04 А
Pt—О 2,22 А
Pt—Pt 3,43 А
Это соединение исследовано также [5] нейтронографическим ме-
тодом. Так как мостиковые группы ОН или атомы С6 постав-
ляют в валентную оболочку Pt суммарно 5 электронов A нор-
27.9. Структурная химия палладия и платины 401
мальная и 2 донорные ковалентные связи), платина обладает
такой же электронной конфигурацией, как и в PtCle2".
Комплекс с бппириднлом Pt(bipy)l4 (рис. 27.13., о) являет-
ся обычной мономериой октаэдрической молекулой Pt (IV), од-
нако в р-дикетонатах Pt(CH3K(RCOCHCOR) (в) [6] и
Pt(CH3K(bipy) (RCOCHCOR) (г) [7] в соответствии с эмпи-
рическими формулами координационное число металла должно
равняться 5 и 7 соответственно, так как р-дикетоиат-анионы, как
правило, образуют хелаты через оба атома кислорода. Факти-
чески соединение в представляет собой димер, в котором каж-
дый C-дикетонат-ашюн образует цикл с одним атомом Pt и при-
соединен к другому атому Pt через активный метиленовый
атом углерода. Эта связь Pt—СН намного длиннее B,4 А)
связей Pt—СН3 B,02 А) (шестичленное кольцо фактически
имеет форму ванны). В молекуле г использование для связи
обоих атомов кислорода дикетона привело бы к появлению
семикоординированной Pt(IV); вместо этого металл образует
связь только с группой СН, так что Pt имеет обычную октаэд-
рическую систему связей, такую же как в а, б и в. Связь с ме-
тиленовым атомом аналогична той, которая осуществляется
в 8, и ее длина составляет 2,36 А. В [(CH3KPt(acac)]2(en)
[8] acac присоединяется к Pt обычным образом через атомы О,
а этилендиаминовый мостик завершает октаэдрическую коорди-
нацию каждого атома Pt:
Н3С-
н3с-
-NH,
сн,
-сн,
СН,
г 1
О
-СН-,
Молекулы салицилальдегида (I) и 8-гидроксихинолина(П)
обычно образуют хелатные комплексы, в которых два атома О
или О и N присоединены к атому металла, так что соединения
в соответствии с эмпирическими формулами (С7Н5О)Р1(СН)
о-
\
и (С9Н6КЮ)РЦСНз)з должны были бы содержать пятикоорди-
нированную платину(IV). В кристаллах оба соединения ди-
мерны (рис. 27.13, д и е) [9, 10] и в обоих случаях содержат
26—1284
402 27. Элементы VIII группы и другие переходные металлы
мостики P
*1 , ы которых атом О лиганда образует связи
с обоими атомами Pt. В соединении е длины связей имеют
следующие значения: Pt—О 2,24 A; Pt—N 2,13 A; Pt—С
2,06 А.
Во всех этих соединениях Pt(IV) образует октаэдрический
координационный многогранник. Это достигается различными
способами в соединениях, в которых координационные числа
могли бы принимать значения 4, 5 и 7.
Литература [11 Ada cryst., 1977, ВЗЗ, 558, 887. [2а] Ada cryst., 1968, В24, 287.
|2б| Ada cryst., 1968, В24, 157. [За] J. Am. Chem. Soc, 1947, 69, 1561. [36] J.
Chem. Soc, A 1971, 90. [4] Inorg. Chem., 1968, 7, 2165. [5] J. Organomctall.
Chem., 1968, 14, 447. [6] Proc. Roy. Soc, A 1969, 254, 205, 218; J. Chem. Soc,
A 1969, 2282. [7] Proc Roy. Soc, A 1962, 266, 527. [81 J. Chem. Soc, 1965, 630.
]9j J. Chem. Soc, A1967, 1955. [10] J. Chem. Soc, 1965, 6899.
27.9.9. Олефиновые соединения. В ранних работах исходили
из предположения, что в координационных соединениях связи
образуются между атомом с одной или более свободной элект-
ронной парой и атомом металла, которому необходимы элект-
роны для создания стабильной группировки валентных элект-
ронов. Это, однако, не объясняет образования таких соедине-
ний, как, например, К[ (C2H4)PtCl3], содержащих олефин, не
обладающий свободной электронной парой, или не объясняет
отсутствия симбатности между изменением основности в рядах
лигандов и их донорными свойствами. Например, основность
быстро падает в ряду NH3, PH3, AsH3, SbH3, no PR3 и AsR3
образуют комплексы легче, чем NR3 (R — органический ради-
кал).
Металлы, образующие достаточно стабильные комплексы с
олефинами, обычно содержат заполненные d-орбитали, энергия
которых близка к энергии s- и р-орбиталей валентной обо-
лочки:
Ni
Rh1
Pd"
Pt"
Си1
Ag1
Аи
Zn
Cd
Hg"
Примерами таких комплексов служат: C2H4PtNH3Cl2,
C2H4CuCl, C6Hi0Ag+-aq, C2H4Hg2+ и мостиковые соединения
(dienJRh2ICl2, где dien обозначает, например, циклоокта-1 : 5-
диен. Кажется маловероятным, чтобы связь между С2Н4 и Pt
в K[C2H4PtCl3] была образована посредством передачи я-элек-
27.9. Структурная химия палладия и платины 403
тронов платине, так как С2Н4 не образует связей даже при
низких температурах с таким сильным акцептором, как
В(СН)з)з, тогда как амины легко это делают. Аналогичным об-
разом атом фосфора в PF3 не вступает во взаимодействие с
очень сильным акцептором BF3; это показывает, что свободная
электронная пара атома Р очень инертна; однако соединения
фосфора дают связи с Pt с образованием стабильных летучих
а 6
5d6s6p2
jz'Zp
—5
тс Zp
Ц С - связь g л - связь
Рис. 27.14. Связывание платиной лигандов: а — PF3; б — СО; в — С2Н4; г-
строение иона [Pt(C2H4)Cl3]~.
карбонилоподобных соединений (PF3JPtCl2 и (PF3PtCl2J.
Был также синтезирован комплекс Ni(PF3L, представляющий
собой летучую жидкость, похожую по свойствам на Ni(COL.
Эти факты указывают на то, что в соединениях, содержащих
СгН4, СО, PF3 и, быть может, другие лиганды, присоединенные
к Pt или подобным ей металлам, характер связей однотипен,
а также на то, что в образовании таких связей существенную
роль играют d-орбитали.
В свободных молекулах PF3 инертность свободной элект-
ронной пары проистекает из-за смещения электроной плотно-
сти к F, обладающему чрезвычайно высокой электроотрица-
тельностью. Предполагают, что в данном случае имеет место
26*
404 27. Элементы VIII группы и другие переходные металлы
взаимодействие между заполненными d-орбиталями Pt и ва-
кантными d-орбиталями Р (рис. 27.14, а) аналогично механиз-
му, предложенному ранее Полингом для взаимодействия СО
с Pt (рис. 27.14,6); этому ^-связыванию способствует высокая
электроотрицательность атомов F, присоединенных к Р. В то
же время этот процесс должен облегчить доступ свободной па-
ре электронов атома Р к образованию а-связи с Pt. Связь
Pt—СО можно описать как комбинацию, с одной стороны, ор-
динарной допорной (а) связи, возникающей вследствие пере-
крывания орбиталей атома углерода, содержащих сво-
бодную электронную пару, и свободной гибридной
орбитали 5d6s6p2 металла, и, с другой стороны, л-связи,
возникающей вследствие перекрывания заполненной орбитали
Pt и пустой р-молекулярпой орбитали СО. Рассматривая при-
роду заполненной орбитали, используемой для образования
л-связи, можно сделать вывод, что более предпочтительна не-
которая модификация гибридной 5с?6р-орбитали, чем простая
.5с?-орбиталь.
Можно утверждать, что похожая комбинация а- и л-связей
осуществляется и в случае связи С2Н4—Pt, за исключением то-
го, что обе орбитали С2Н4 являются орбиталями л-типа, а
именно 2рл-связывающая, содержащая два л-электроиа, и
2рл*-вакантпая антисвязывающая (рис. 27.14, в).
Особенностью этой связи является то, что в нее дает свой
вклад связывающая молекулярная орбиталь олефина. Харак-
тер инфракрасного спектра K[Pt(C3H6)Cl3] и (C3H6JPt2Cl4 по-
казывает, что связь С = С сохраняется, хотя частота ее валент-
ных колебаний оказывается пониженной на 140 см~' по срав-
нению со свободной молекулой олефипа С2Н4; эта связь ослаб-
лена из-за использования части ее электронной плотности па
образование связи с атомом Pt. В спектрах K[Pt(C2H4)Cl3] и
(C2H4)Pt2Cl4 интенсивность полосы поглощения связи С = С
очень слабая; это указывает на симметричный характер при-
соединения С2Н4 к Pt, как показано на рис. 27.14, г. На основе
значений дипольных моментов таких молекул, как транс-
C2H4PtCl2-NH2C6H4CH3 и rpaHC-C244PtCl2-NH2C6H4Cl, фор-
мальную кратность связи Pt—С2Н4 можно оценить как ~4/з-
Факт существования очень стабильных комплексов PtX2
с циклооктатетраеном (а) и СН2 = СНСН2СН2СН = СН2 (б)
находится в соответствии с представлениями о характере свя-
зи металл — олефин, так как л-связи этих цис-молекул долж-
ны использовать две различные d-орбитали атома Pt. С дру-
гой стороны, транс-(C2H4JPtCl2, в котором те же орбитали Pt
используются для связи обеих молекул этилена, по-видимому,
гораздо менее стабильно, чем г^ис-изомер. Была определена
структура «,ис-дихлоросоединения PtCl;C10Hi6 типа (б) [1].
27.9. Структурная химия паллаОия и платины 405
Гипотеза, что олефины присоединяются к Pt или Pd посред-
ством взаимодействия л-орбитали двойной связи С = С и
б/5р2-орбитали металла, находится в соответствии с характером
строения димерных комплексов стирол — PdCl2 [2J и этилен —
PdCl2 [3]. Обе эти мостиковые молекулы имеют транс-конфи-
гурацию (в), и плоскость молекулы этилена или Н2С = СН—С
в случае комплекса со стиролом [ (C6H5CH = CH2)PdCl2]2 пер-
6
н,с -сн
сн2
сн,
-С1
Pt'
Cl
Cl
олефин
Z,3ZA
'CU
, олерии
Pd
8в°Гр,
О С ci
2fi1А 2,27 А
все Pd-С-2,12А
пендикулярна (или приблизительно перпендикулярна) плоско-
сти, содержащей Pd, 2 атома С этилена и С1. "Интересно, что
и в этиленовом, и стирольном соединениях мостиковая система
асимметрична, а связи Pd—Cl, находящиеся в транс-положе-
нии к связям Pt — олефин, длиннее, чем две другие* В сим-
метричной молекуле Pd2Cl2(C3H5J [4] (г) все мостиковые свя-
зи Pd—Cl удлинены B,41 А).
Структуры молекулы PtCI2(C2H4)NH(CH3J [5] и иона в
соли Цензе K(PtCl3-C2H4)-Н2О [6] (см. также рис 27 14 г)
представлены на схемах д и е. Структура соли Цейзе геометри-
чески весьма близка к структуре K(PtCl3NH3)-Н2О. Внутри
См. прим. ред. на с. 392. — Прим. перев.
406 27. Элементы VIII группы и другие переходные металлы
двойных слоев осуществляются ионные связи между аннонами
и катионами и связи Н2О—С] C,28 А), а между слоями — ван-
дерваальсовы связи между молекулами С2Н4; в аммине между
слоями присутствуют связи N—Н...С1. В ионе е связь С —С
почти перпендикулярна плоскости PtCl3, и ее центр лежит на
расстоянии приблизительно 0,2 А над этой плоскостью. Длины
связей PtCl, находящихся в цис- и транс-положениях к С2Н4,
слабо отличаются друг от друга; возможно, транс-связь не-
д е
2.3ZA
а а /
,_ог_/^-nh(ch34z НгС ч ( ^а
—^pt!
"Ы1А
нгс
НХ'
1,37 А
'г, 13 а
^2,30 А
а
сколько длиннее, но разница между ними очень мала, и не ис-
ключено, что она лежит вне пределов точности определения
структуры.
Литература. [1] Acta cryst., 1965, 18, 237. [2] J. Am. Chem. Soc, 1955, 77, 4987.
[31 J. Am. Chem. Soc, 1955, 77, 4984. [4] Acta cryst., 1965, 18, 331. [5] Acta cryst.,
1960, 13, 149. [6] Acta cryst., 1971, B27, 366.
28. ЛАНТАНОИДЫ И АКТИНОИДЫ
28.1. Кристаллохимия лантаноидов
(редкоземельных элементов)
У 14 элементов (от Се до Lu), которые располагаются в перио-
дической системе после La, заполняется внутренняя оболочка
4/, тогда как внешние оболочки их атомов имеют конфигура-
цию 5d'6s2 или 5d°6s2. Поскольку многие из соединений самого
La структурно похожи на соединения редкоземельных элемен-
тов (РЗЭ), этот элемент будет включен в обсуждение наравне
с остальными.
Типичная валентность ряда лантаноидов равна трем, но
между отдельными РЗЭ проявляются интересные различия.
Для Се, Рг и ТЬ характерна также валентность 4, для Sm, Eu,
Yb и, возможно, Tin — валентность 2, т. е. элементы, следую-
щие за La и Gd, могут отдавать два 4[-электрона (в дополне-
ние к двум бе-электронам),
4 4 ? ^ 4
la: Се Pr Nd Pm Sm Eu Gd) Tb Dy Mo Er Tin Yb <Lu)
7 "> 2 '' "*
а элементы, непосредственно предшествующие Gd и Lu, могут
наряду с ионами М3+ образовывать ионы М2+. Радиусы 4/-
ионов М3+ постепенно уменьшаются в ряду РЗЭ (разд. 7.6.1),
по это лантаноидное сжатие не обнаруживается у Ей н Yb
в металлическом состоянии или в таких соединениях, как гек-
сабориды, где более низкая валентность этих двух элементов
проявляется вполне отчетливо в увеличении их радиусов по
сравнению с радиусами соседних элементов. Поэтому РЗЭ под-
разделяют па 2 группы с границей на Gd; обе группы характе-
ризуются одинаковой последовательностью проявляемых ва-
лентностей. У Gd па каждой из семи 4/-орбиталей располагает-
ся по одному электрону, так что следующие электроны должны
спариваться с уже присутствующими. Поэтому наблюдается за-
метное сходство между парами атомов, у которых одинаковое
число орбиталей заселено двумя электронами или одним элек-
троном. С Gd сравним Мп (средний элемент ряда Зо*-элемен-
тов).
28.1.1. Соединения трехвалентных лантаноидов. Особенность
кристаллохимии 4/-соедиыений заключается в том, что для каж-
дой группы соединений (например, галогенидов) вследствие
408 28. Лантаноиды и актиноиды
изменения ионных (или атомных) радиусов в ряду РЗЭ суще-
ствует несколько типов структур. Соединения легких ^"-элемен-
тов часто характеризуются высокими координационными чис-
лами (КЧ) ионов металла, которые понижаются с уменьшени-
ем ионных радиусов. Например, известны по меньшей мере
7 типов структур для тригалогенидов с девятерной (частично
нерегулярной) координацией атома М в структурах LaF3 и
YF3, с девятерной или (8+1)-координацией в других галогени-
дах легких 4/-элемептов и с шестерной координацией (структу-
ры типа YC13 или Bil3) в соединениях тяжелых РЗЭ. (Обоб-
щенные данные см. в табл. 9.19). Многие тригидроксиды 4/-
элементов имеют ту же структуру с КЧ 9 (тип UC13), что и
трихлориды легких РЗЭ (разд. 9.9.3). Оксогалогениды описаны
в гл. 10.
В оксидах М2О3 наблюдается шестерная и/или семерная ко-
ординация атома М. Структура ЬагО3 заслуживает особого
внимания из-за необычной координации атома М в форме од-
ношапочного октаэдра (рис. 12.7). Далее (рис. 28.9) эта струк-
тура описана другим способом, выявляющим ее взаимосвязь со
структурами таких соединений, как U2N2S и U2N2Te, а также
со структурами Ce2O2S и других 4/-оксосульфидов. Полуторные
сульфиды кристаллизуются в одной из трех структур, в кото-
рых КЧ атома М меняется от 8 до 6:
Ce2S3 a-QdoS3 iIo2S3 Yb2S3
К1! атома 8 8 и 7 7 и 6 6
Остальные соединения описаны в других главах (бориды см.
разд. 24.5, карбиды — разд. 22.2, гидриды — разд. 8.2.3, нитри-
ды—разд. 18.10.1).
28.1.2. Соединения четырехвалентных лантаноидов. Степень
окисления IV достоверно установлена только для Се, Рг и ТЬ,
хотя описаны синтезы комплексных фторидов, содержащих
Nd(IV) и Dy(IV). Из ионов лантаноидов М4+ устойчив в вод-
ных растворах только Се4+, и, вероятно, он всегда присутству-
ет в комплексах; примером может служить нитратный ком-
плекс в (NH4J[Ce(NO3N] (разд. 18.8.7). Известны только
следующие твердофазные бинарные соединения этих элемен-
тов с данной степенью окисления:
СеО2 РгО2 ТЪО2 (структура типа флюорита)
CeF4 TbF4 (структура типа UF4)
Были синтезированы также некоторые комплексные фтори-
ды и сложные оксиды, например соединения щелочноземель-
ных металлов состава МСеО3 со структурой типа перовскита
(разд. 13.3.2). Системы металл — кислород относятся к одним
28.1. Лантаноиды 409
из наиболее сложных; в них образуются различные упорядо-
ченные фазы, промежуточные между полуторными оксидами
(разд. 12.2.6 и 12.2.7) и диоксидами. В системе ТЬ—О [1] об-
наружены соединения TbOi,7i5 (Tb7Oi2), TbOi,8i и ТЬОьвз; од-
но из них или даже несколько получены и в системах Се — О
[2] и Рг — О [3]. Относительно Tb7Oi2 и Рг6Ои см. разд. 13.6.6.
Литература. [1] J. Am. Chem. Soc, 1961, 83, 2219. [2] J. Inorg. Nucl. Chem.,
1955, 1, 49. [3] J. Am. Chem. Soc, 1954, 76, 5239.
28.1.3. Соединения двухвалентных лантаноидов. Соединения со
степенью окисления лантаноидов II наиболее устойчивы у Ей,
значительно меньше устойчивость подобных соединений Yb и
Sm и исключительно нестабильны соединения двухвалентных
Тт и Nd. По-видимому, Ей — единственный лантаноид, образу-
ющий моноксид. Описанные ранее моноксиды Sm и Yb на са-
мом деле представляют собой Sm2ON и Yb2OC. Среди много-
численных соединений 4/-элементов состава MX, кристаллизую-
щихся по типу NaCl, только EuO, SmS, EuS и YbS содержат
М(П). Все другие соединения MS, например светло-желтый
CeS (а также LaS), очевидно, принадлежат к типу M3+S2~(e).
Размеры элементарной ячейки 4/-соединений MS с увеличени-
ем атомного номера редкоземельного элемента постепенно
уменьшаются (исключение составляют SmS, EuS и YbS, для
которых параметр решетки располагается гораздо выше кри-
вой) [1]. Все соединения MN, включая и соединения самария,
европия и иттербия, представляют собой нормальные соедине-
ния М(Ш). Европий образует оксид ЕизО4(Еи11Еи21ПО4), изо-
структурный с SrEu2O4 (разд. 13.5.4).
Известны все дигалогениды Eu, Sm и Yb; менее изучены ди-
галогениды Nd и Тт. Из структур дигалогенидов Yb, по-види-
мому, определена лишь структура Ybl2 (структура типа Cdl2).
Структурные типы дигалогенидов Ей и Sm указаны в табл. 9.15
(см. также текст, сопутствующий таблице, где подчеркивается
сходство этих дигалогенидов с соединениями щелочноземель-
ных металлов). Для La, Се, Рг и Gd [2], галогениды М12, по-
лученные путем взаимодействия металла с М13, не являются
соединениями М(П), поскольку они проявляют металлические
свойства. Их формулы можно записать как Мш12(е).
Ионный радиус Yb2+ близок к радиусу Са2+, радиусы Sm2+
и Еи2+ практически одинаковы с радиусом Sr2+. По этой при-
чине многие соединения этих трех 4/-металлов изоструктурны
с соответствующими соединениями щелочноземельных метал-
лов. Например, изоструктурны дигалогениды, EuO и MS изо-
структурны с сульфидами щелочноземельных металлов (струк-
тура типа NaCl), E11SO4 и SmSO4 с SrSO4 (и BaSO4), три мо-
дификации ЕиВ2О4 с тремя модификациями SrB2O4.
410 28. Лантаноиды и актиноиды
(разд. 24.7.4), ЕиВ4О7 — с SrB4O7. Бораты европия могут служить
иллюстрацией влияния кристаллической структуры па химиче-
ские свойства. С этой целью можно использовать температуры,
при которых начинается быстрое окисление (определены тер-
могравнметрически в окислительной атмосфере):
Еи3В2О6
Еи2В2О5
EuB,O4
EuB4O7
Тип иона бората
Ион ВО33-
IIон ВоО54-
Цепь (ВО2)„*-
Трехмерный
каркас*
Температура
окисления, °С
673
683
753
1033
* В структуре ЕиВ4О7 ионы Еп2+ расположены в полостях трехмерного каркаса В4О;,
имеющего более жесткую и термически устойчивую структуру, чем структуры Оопатов,
содержащих конечные или цепочечные ионы.
Литература. [1] Acta cryst., 1965, 19, 214. [2] Inorg. Chem., 1965, 4, 88.
28.2. Актиноиды
28.2.1. Введение. Точно так же как лантаноиды образуют ряд
родственных элементов, расположенных после La, для которых
типичны ионы М3+, содержащие от 1 до 14 4/-электронов, мож-
но было бы ожидать, что и ряд актиноидов включает 14 эле-
ментов, следующих за своим прототипом Ас (который, подобно
La, по праву «хозяина» занимает место в III группе); дополни-
тельные 1ч-14 электронов в актиноидах предпочитают разме-
щаться в оболочке 5f, а не в оболочке 6d. Однако на самом де-
ле у Th нет 5/-электропов, а их количество у Ра точно неиз-
вестно, и по своим свойствам эти два элемента являются в го-
раздо большей степени представителями IV и V групп (соот-
ветственно), чем соответствующие лантаноиды Се и Рг. Так,
например, химия тория по существу ограничивается химией
Th(IV), тогда как для церия в основном распространены со-
единения Се(III), для Се(IV) в твердом состоянии известны
лишь два бинарных соединения, оксид и фторид. В противопо-
ложность Ра с наиболее устойчивой степенью окисления V
соединения Pr(V) вообще неизвестны.
Благодаря близости энергий 5/-, Ы-, Is- и 7р-оболочек хи-
мия актиноидов значительно сложнее химии преимущественно
ионных трехвалентных лантаноидов. Общей для всех актинои-
дов является степень окисления III, однако для тория она на-
блюдается только в твердом состоянии и для Ра вообще не
существенна. За этим исключением свойства 4/- и 5/-элемен-
тов в степени окисления III сходны; это касается и их хими-
ческих свойств в водных растворах, и структур соединений
в твердом состоянии; так, трифториды AcF3 и UF3—CmF3 от-
28.2. Актиноиды 411
Таблица 28.1. Степени окисления актиноидов3
Ас
3
Th
3
4
Ра
3
4
5
и
3
4
5
6
Np
3
4
5
6
Pu
3
4
5
6
Am
3
4
5
6
Cm
3
4
Bk
3
4
Cf
3
Выделены наиболее устойчивые степени окисления.
носятся к структурному типу LaF3, а соответствующие трихло-
риды — к структурному типу LaCl3. (Соединения МО и MS,
образованные U, Np и Pu, не рассматриваются как соединения
М(П); согласно данным табл. 28.2, МС и MN имеют структу-
ру типа NaCl.) В то время как отдельные 4/-элементы прояв-
ляют и такие необычные степени окисления, как II и IV, для
актиноидов характерны все степени окисления от III до VI.
В ряду 4/-элементов не наблюдается параллелей ни с Th, пи
с Ра (а также с U, Np, Pu и Am, которые проявляют степени
окисления от III до VI) (табл. 28.1). Кроме того, актиноиды
в отличие от лантаноидов образуют ионы МО22+ (U, Np, Pu и
Am) и МО2+ (Np и Am; соответствующие ионы U и Pu очень
неустойчивы); актиноиды проявляют большую склонность к
комплексообразованию, а в виде металлов имеют более слож-
ные структуры (Am — первый актиноид, кристаллизующийся
в плотноупакованной структуре, подобно большинству ланта-
ноидов).
Радиусы ионов актиноидов М3+ и М4+ уменьшаются с рос-
том атомного номера, как это наблюдалось и для лантаноидов.
При этом радиус М3+ на —0,10 А больше радиуса М4+ (на-
пример, U3+ 1,03 А и U4+ 0,93 А). Эффект экранирования f-
электронами не полностью компенсирует растущий заряд ядра,
и поэтому для самой удаленной от ядра электронной оболоч-
ки сохраняется такое же уменьшение радиуса («лантаноидное»
и «актиноидное» сжатия). Этот эффект отчетливо прослежива-
ется в рядах изоструктурных соединений, таких, как диоксиды
(структура типа флюорита) или трифториды (структура типа
LaF3).
28.2.2. Кристаллохимия тория. По своим химическим свойствам
торий относится по существу к элементам IV7 группы периоди-
ческой системы. В большинстве соединений торий четырехва-
412 28. Лантаноиды и актиноиды
лентен, причем среди четырехвалентных элементов он наиболее
электроположителен и химически весьма похож на гафний. Од-
нако ионный радиус Th4 - ближе к радиусу Се4+, чем к радиусу
Ш4+, и кристаллохимия соединений Th(IV) имеет много обще-
го не только с U (IV), но и Се (IV). Напри-
мер, подобно Се(IV), торий не образует нормаль-
ных карбонатов, а только комплексные карбонаты типа
(МН4ЬМ(СОз)з-6Н2О; для обоих элементов известны комплек-
сные сульфаты K4M(SO4L и нитраты К2М(гЮз)б- Кроме того,
многие соединения тория изоструктурпы соединениям U(IV) и
трансурановых элементов (для некоторых бинарных соединений
этих элементов это следует из данных табл. 28.2). В то же время
ThF4 изоструктурен с CeF4, ZrF4, HfF4, а также с PaF4, UF4,
NpF4, PuF4 и AmF4. Некоторые комплексные фториды состава
M2ThF6 структурно подобны соединениям U (IV), однако структу-
ры комплексных фторидов другого состава MnThF4+ri отличают-
ся от структур соответствующих фторидов U (IV) (см. следующий
раздел). Своеобразный каркас в соединениях М7'М61УРз1
(разд. 10.1.13) образуют не только Zr и Ш, но и Pr, Pa, U,
Np, Pu, Am и Cm. В других главах описаны также соединения
тория: ThC2 (разд. 22.2) и Th3N4 (разд. 18.10.3). Некоторые
замечания относительно сульфидов сделаны в разд. 28.2.6.
Как упомянуто выше, состояние Th (III) известно лишь для
твердой фазы: ThCl3, ThBr3, Thl3 [1, 2], Th2S3 (табл. 28.2) и
оксофториды. К последним относятся ThOF (неупорядоченная
структура типа флюорита) [3] и ThO0,5F2,5 [4] (сверхструкту-
ра на основе структуры типа LaF3). Предполагается, что
ThO0,5F2,5 содержит равные количества ионов Th3+ и Th4+.
Свойства ТЫ2, структура которого описана в разд. 9.9.2, дают
возможность предложить для него формулу Thiyl2(eJ.
Литература. [1] J. Chem. Soc, 1964, 5450. [21 Ж- неорг. химии, 1966, 11, 1318.
[31 Сотр. rend., 1968, 266, 1056. [41 Materials Res. Bull., 1969, 4, 443.
28.2.3. Кристаллохимия протактиния. Хотя для этого элемента
наиболее устойчива степень окисления V, тем не менее извест-
но лишь немного примеров кристаллических соединений
Pa(V), изоструктурных с соединениями Nb и Та. Вероятно,
к ним относятся PaO2Br, NbO2Br, NbO2I и ТаО21, которые,
очевидно, имеют ту же структуру, что и UO2Br (см. ниже).
Обычно соединения протактиния изоструктурны с соединения-
ми U(V), но часто они имеют структуры, свойственные только
этому элементу, как это видно из примеров, приведенных в
табл. 28.3. КЧ Ра5+, как правило, выше, чем КЧ Nb5+ (или
Та5+), что согласуется с большим радиусом этого иона
(~0,9А) по сравнению с радиусами ионов V группы (~ 0,7 А).
Из недавно установленного факта — исключительной сложно-
ffl
Q
О
X
f-ч
га
=
о
5
сое
3
t
rpy:
О
сч
об
сч
ев
ч
сЗ
н
3
5
Стр:
й
ТО
|
3
Cl,
—
н
о
О
<П
X
CJ
О
и
и
га
Z
aCl
Z
и
га
Z
О
о
га
2
U
га
п
га
Z
и
га
z
Z
'О
2
aCl
2
и
га
2
О
га
2
и
га
2
у
2
и
га
2
О
С
7 2
о
^ =^
га
2
и
7.
С
J?
ел Н,
ю
ел
и
If?
ел
и
1—'
ел
о
ел
ел
ел
5"
1—
ел'
о*
¦о
¦ '
GJ
ел
Р-*
и
4:
и
га
о
г,"
га
О
рГ
га
^*-
1—'
Р- U
га -^
С ел
и к 8
га _^ —i
U H CQ
Ч '-О- 2
и и аз
у
Й
СЛ п
н Ьа
и ел О
^
и
р,
г—,
Г\
*~
^7
С1)
и
'^'
и
Он
, ,
iOC
СО
у
S
_^
и
а
и
О
.—.
и
(PbF
Cl)
Рн
О»
га
Jj
О
Рн
о"
—•
г .^ ч-
J D
^ [Л
_J D
СО
to
1- —^
Э D
to"
Р- п
Р D
р-
D
D
—'
'I' рГ
со
и
ID'
to"
1—¦
-
D
5"
г?
3
rD
D
п
и
D
и
1—1
_-?
^_}
D
п У
ел Е
о <;
CJ
I?
414 28. Лантаноиды и актиноиды
Таблица 28.3. Сравнение галогснидов Nb (и Та). Pa(V) и U(V)
КЧ атома М и координа-
ционный полиэдр
КЧ атома М и структур-
ные особенности
КЧ атома Л\ и координа-
ционный полиэдр
NbF-,
TaF5
Тетрамер M4F20
(октаэдр)
PaF5 7
Изоструктурен с |3-UF5
a-UF5 6 (октаэдр)
3-UF5 7 (рис. 28.2)
NbCl3
TaCi5
Димер М2С1ю
(октаэдр)
РаС15 7
Цепь из пентагональны.х
бипирамид
UC15 6
и2С1ш димер
RbNbF6 6
RbTaFe
Октаэдр, ионы MF6
RbPaF6 8
Цепь из ионных додека-
эдров
RbUF0
8
K2NTbF7
K2TaF7
Одношапочная триго-
нальная призма, ионы
F
K2PaF7 9
Цепь из трехшапочных
тригональных призм
K2UF7
Na3TaF8
Na,PaF8
8
8
Антипризма, ионы
MF83"
Na3UF8
Кубическая координация (сверхструктура на осно-
ве структуры типа флюорита)
сти структурной химии оксидов Nb2O5 и Та2О5 — вероятно,
следует, что прежние указания на аналогию Ра2С>5 с этими
оксидами необходимо проверить. Несомненно, нет сходства
между сложными оксидами, образованными Pa(V) с 4f-эле-
ментами, и аналогичными сложными оксидами Nb и Та. На-
пример, для протактиния не характерны соединения типа
MNb3O9 и МТа3О9, а вместо них образуются протяженные
твердые растворы М2О3 — Ра2О5 с флюоритоподобными струк-
турами [1].
Соединения Ра(IV) структурно похожи на соединения дру-
гих актиноидов (IV). Например, все соединения PaF4, PaCU,
LiPaF5 и (NH4LPaF8 изоструктурны с соответствующими со-
единениями U (IV) [2] (относительно РаО2 и PaOS см. также
табл. 28.2).
Структура РаОС12 [3] (и изоструктурных соединений Th,
U, Np) неожиданно сложная. Здесь имеются плотносвязанные
цепи состава РазОзСЦ(СЦ*), в которых атомы С1* являются
¦общими с другими аналогичными цепями, что приводит к обра-
28.2. Актиноиды 415
зованию трехмерной структуры состава РаОС12, где КЧ ато-
мов С1 2 и 3, атомов О 3 и 4 и атомов Ра 7, 8 и 9. Эта струк-
тура подтверждена последующим исследованием [4] изострук-
туриого UOC12.
Литература. [1] Acta cryst., 1967, 23, 740. [2] Inorg. Chem., 1967, 6, 544.
[31 Acta cryst., 1968, B24, 304. [41 Acta cryst., 1974, ВЗО, 175. По комплексным
галогенидам Pa(V) см. литературу, цитированную в табл. 28.6.
Информация о комплексных галогенидах Pa(V) приведена
в табл. 28.6.
28.2.4. Кристаллохимия урана. Структуры металлического ура-
на, его гидридов, карбидов, а также некоторых галогенндов
МХ3, МХ4 и МХ5 описаны в других главах. В этом разделе мы
рассмотрим структуры, свойственные некоторым галогенидам
урана, структуры комплексных фторидов тория и урана, окси-
дов урана, соединений уранила и уранатов, нитридов и родст-
венных им соединений, а также сделаем некоторые замечания
о сульфидах U, Th и Се.
Галогениды урана. Основная информация о структурах
большинства галогенидов 5/-элементов сосредоточена в
разд. 9.9.3 и 9.9.4 (там же приведена соответствующая лите-
ратура).
К галогенидам урана относятся следующие соединения:
U Ft
U C1,
UBr,
Ш,
1
I
Структурный
тип
LaF,
ЬС!3
PuBr-,
КЧ, атома
9-2
9
8
и
UF4
UC14
UB г 4
a-UF-, 1
P-UF; f
UCI5
UI-o 1
и с i, /
Структурны!'!
тип
ZrF4
тьсц
См. текст
См. текст
Димеры U2Clio
Молекулярные со-
единения
КЧ атома U
8
8
7
6
8
6
5
Структуры двух модификаций UF5 [I], U2F9 [2] мы обсу-
дим в этом разделе, а структуру UBr4 — в следующем разделе
вместе со многими оксогалогенидами, для которых установле-
на координация атома U в форме пеитагональной бипирамиды.
Структуры двух кристаллических модификаций пентафто-
рида (а и р) с различными КЧ атома U демонстрируют два
способа, которыми можно достичь атомного отношения 5F : 1U.
В a-UF5 (рис. 28.1, а) бесконечные цепи образованы из коор-
динационных октаэдров UF6, сочлененных парой BF) проти-
волежащих вершин. В p-UF5 координационный полиэдр атома
Лантаноиды и актиноиды
U имеет форму искаженной квадратной антипризмы, в которой
6 атомов F являются общими и для других таких же коорди-
национных полиэдров. |3-UF5: U—2F 1,96 A; U—6F
2,27 А (среднее), для обеих структур среднее расстояние U—F
-2,20 А.
В U2F9 (кристаллы черного цвета) все атомы U имеют
9 ближайших соседних атомов F B,31 А), и, поскольку все
атомы U кристаллографически эквивалентны (например, U4+
Рис. 28.1. Кристаллическая структура a-UF5. Маленькие кружки — атомы U.
и U5+), можно полагать, что между ионами, имеющими разный
заряд, происходит электронный обмен, что и объясняет необыч-
ную окраску этого соединения. В NaTh2F9 [2] те же самые по-
зиции металла и фтора заселены Th4+ и F~, но, кроме того,
2/з имеющихся октаэдрических полостей между шестью ионами
F- заселяют ионы Na+ (Na—6F 2,34 A, Th—9F 2,40 А — значе-
ния, весьма близкие к соответствующим расстояниям в
p2-N2ThF6).
Литература. [1] Acta cryst., 1949, 2. 296 (а-форма); Acta cryst., 1976, В32,
3311 (Р-форма). [2] Acta cryst., 1949, 2, 390.
Пентагоналъно-бипирамидальная координация атома U в
оксогалогенидах и оксогалогенидных ионах. Известно много
оксогалогенидов урана (в скобках указана средняя степень
окисления U): например, оксохлориды UOC1 C), UOC12 D),
28.2. Актиноиды 417
X :
7
6
е
6
5
5
5
4
4
4
3
3
Таблица 28.4. Пентагона л ьно-бпп пр амид а льна я
в оксогалогенпдах и оксогалогеппдн
М
,5
,5
Формула OKcora.ioi ечида
или оксогалогенидного
иона
UO2F53-
U:O4F84-
IMLCI2(OHJ(H2OL
[LIlO10Cl4(OHJ(H2OLp-
P-UOF4
UO2C12-H2O
UO3Cl0,90'9-
PaOBr3
UBr4
UO2C12
U.O0CI5
UO2Br
Тип структуры
С островными
ионами
То же
» »
» »
» »
Трехмерная
Цепочечная
Двойная цепочеч-
ная
Слоистая
Трехмерная
»
Слоистая
координация
ых нонах
Лптс|
Acta cryst.,
Acta cryst.,
768
Acta cryst.,
2011, 2617
Acta Chem.
23, 791
Acta cryst.
2477
Acta crvst.
1701
Acta crvst.
169
Acta cryst.
41
Acta crvst.,
1382
Acia crvst.
2664
Acta crvst.,
1073
атома U
а тура
954, 7, 783
1974,
1972,
Scand.,
1977,
1974,
1974,
1964,
1975.
1974,
1973,
J. Solid State С
1980, 32, 297
Ada cryst.,
2542
1977,
B30
B28
1969
B33
B30
B39
17
B31,
B30
B29
ют.,
B33,
U2O0CI, D,5) [1], UO2C1 E), UOC13 E), U2O4C13 E,5) и
UO2C12 F). Известно и много оксогалогеппдпых ионов. HoiibiUVI
в liOoCU2- [2] и UO2Br42- [3] имеют октаэдрическую (транс) -
структуру, но в трех оксофторидных ионах реализуется коорди-
нация атома U в форме пентагоналыгай бипнрамиды, как и во
всех соединениях, вошедших в табл. 28.4.
Другой общей особенностью некоторых структур, рассмат-
риваемых в этом разделе, является наличие характерной цепи
типа РаС15, образованной из координационных пентагопаль-
пых бипирамид, сочлененных между собой двумя ребрами.
Они построены либо как простые цепи, либо как более слож-
ные структуры, составленные из субъединиц.
Литература. [1] J. Solid State Chem., 1980, 32, 297. [2] Acta cryst 1976 B32
1541. [3] Acta cryst., 1974, B30, 840.
27—1284
418 28. Лантаноиды и актиноиды
Наряду с простым ионом UO2F53~~ [а) известны двухъядер
иые ионы U2O4F95- (б) и U2O4F84~ (в), построенные из двух
бипирамид, сочлененных одной вершиной или ребром. В
-О параллельны, а
28.2. Актиноиды 419
две оси
а о
О-
-и-
6
I
о
о о
\ 135
В U2O4Fg5~ ОНИ
О О
и
I
о
образуют угол A20°). Отметим, что формулы солей, содержа-
щих ион U4O4F84- (s), предпочтительнее записывать, например,
он.
Н,0
-CI
и,о
"ОН'
,н,о
С1'
-он-
-н ,о
Н,0
он.
о о
как Cs4U2O4F8-2H2O, но не как Cs2UO2F4-H2O. В противопо-
ложность этому Cs2UO2Cl4 содержит октаэдрический ион
UO2C142~. В то же время в дигид-
рате UO2C1(OH)-2H2O (г) молеку-
ла построена из двух сочлененных
ребром пентагональных бипирамид.
Примером более сложного
конечного комплекса, содержаще-
го те же самые лиганды, слу-
жит четырехъядерпый анион в
K2[(UO2LO2(OHJC14(H2OL]-2H2O
(д). В этом ионе имеются два раз-
личных по составу координацион-
ных полиэдра U: один состоит из
30 2С1, ОН и Н2О, а другой — из
АО, С1, ОН и Н2О.
Структура p-UOF4 (рис. 28.2),
очевидно, похожа на структуру,
первоначально приписанную p-UF5.
В координационном семивершинни-
ке атомы О занимают экваториаль-
ные позиции, а каждый из четырех
экваториальных атомов F служит
мостиком между двумя атомами U.
J
О и
Рис. 28.2. Проекция кристал-
лической структуры PUOF4.
Заштрихованные кружки —
мостиковые атомы F, свет-
лые кружки — концевые
атомы F, пары перекрываю-
щихся светлых кружков —
атомы О.
Структура UO2C12-H2O резко отличается и значительно
проще структуры безводного соединения. Она содержит цепи
типа РаС15
И,О
группировка 0"~ U ~ О,
пррпенди кулярноя
плоскости Duct/нка
11,0
с длинами связей U—О 1,72 A, U—0Н2 2,46 A, U—C1 2,78 А.
Анион в CsxUO3Clx (л-~0,9) состоит из двойной ' цепи
(рис. 28.3). Аналогичная цепь существует и в РаОВг3, где
группировки О—U—О за-
менены на Br—Pa—Br, a
три атома О в каждом ко-
ординационном полиэдре со-
става РаО3Вг4 занимают
экваториальные позиции
(Ра—О 2,18 А; Ра—Вгэкв
2,91 А; Ра—Вгакс 2,61 А).
Структуру UBr4 можно
представить построенной из
цепей типа РаС15, сочленен-
ных путем обобществления
одного (наклонного) ребра
каждого полиэдра UBr7 с
образованием слоя, осно-
ванного на плоской сетке б3
(рис. 28.4, а и б; жирные
линии — общие ребра; б —
вид сбоку слоя вдоль на-
правления, указанного стрел-
кой па рис. 28.4, а). В родственной структуре UO2C12 цепи из
полиэдров UO3CI4 (рис. 28.4, в) связаны между собой таким
образом, что каждый экваториальный атом О одновременно
служит апикальным О для другой цепи. Цепи составлены как
бы из отрезков, расположенных под углом друг другу (г); пер-
пендикулярно к плоскости рисунка привязана вторая цепь. При
этом обобществляется только один из уранильных атомов О.
В результате возникает алмазоподобная трехмерная структура,
построенная координационными пентагональными бипирамида-
ми, сочлененными двумя ребрами и двумя вершинами. С этой
структурой сравнима очень простая слоистая структура UO2F2
Рис. 28.3. Бесконечный цепочечный ион
Cs*(UO2)OCl*.
420 28. Лантаноиды и актиноиды
Ж
Рис. 28.4. Пентагонально-бипирамидальная координация атома U в галогенид-
ных соединениях урана, а и б — UBr4; в и г — UO2C12; д — |5-U3O6; e —
U2O2C15; ж — UO2Br.
(рис. 28.8, в), где атом U имеет КЧ8, и уже описанная простая
цепочечная структура UO2C12-H2O.
При боковом сочленении двух цепей типа РаС15 реализуется
слой (рис. 28.4, е), который затем соединяется с аналогичными
слоями посредством аксиальных атомов О в направлении, пер-
пендикулярном плоскости рисунка, образуя трехмерную струк-
туру состава U2O2Cl5. Если здесь все атомы неметалла одного
сорта, такой структурный мотив имеет состав А2Х7, как в
RbIn2F7, где ионы Rb заселяют позиции (отмечены крестиком)
в туннелях. Если в туннелях расположить дополнительные ато-
мы" М и О, как показано на рис. 28.4,C, таким образом, чтобы
28.2. Актиноиды 421
координация атома М оказалась октаэдрической, то мы полу-
чим структуру p-U3Os. Структура 1Ю2Вг строится из пентаго-
пальных бипирамид UO5Br2, которые образуют слои (на
рис. 28.4, ж слои расположены перпендикулярно плоскости ри-
сунка). В слоях образуются цепи О—U—О—U—О (U—О
2,05 А), также направленные перпендикулярно плоскости ри-
сунка. (Относительно UOCl? см. разд. 28.2.4.)
28.2.5 Сложные фториды 5f-элементов. Как уже указывалось
в гл. 10, наиболее тесная взаимосвязь между кристаллически-
ми структурами простых и сложных галогенидов имеет место,
если последний обладает структурой простого галогенида, но
со статистическим распределением двух или более сортов
ионов металла по катионным позициям. Например:
KLaF4 1 неупорядочен
a-K2UF6 } структура тш
доченная
типа CaF2
BaThFl5
BaUF6
I неупорядоченная
/ структура типа LaF3
Неупорядоченную структуру типа флюорита следует ожидать
для соединения AmBFn, если оба атома А и В достаточно ве-
лики для размещения вокруг них восьми атомов фтора. Для
меньших по размеру ионов А найдены уже другие структуры,
как, например, в случае NaLaF4 и Na2ThF6 со структурой
в плоскости рисунка
О
О
О F
ОF
вьаие плоскосгли
рисунка на ^Ь
Рис. 28.5. Проекция кристаллической структуры "f-\a2UF6.
p2-Na2ThF6, где реализуется КЧ 6 для ионов А и 9 для ионов
В (ее описание см. далее). Другие способы взаимосвязи более
сложной структуры со структурой АтХ„ иллюстрируются при-
мерами 7^а2иРб и Na3UF8 (сверхструктура на основе структу-
ры типа флюорита), Na3UF7 (ашюподефицитная структура ти-
па флюорита) и Na2UF8 (катионодефицитная структура типа
флюорита).
Структура Y-Na2UF6 представляет собой слегка искажен-
ную сверхструктуру на основе структуры типа флюорита, в ко-
торой оба сорта положительных ионов имеют восьмерную ко-
ординацию (рис. 28.5) и размещены упорядочение».
422 28. Лантаноиды и актиноиды
Структура Na^UFj также родственна со структурой типа
флюорита: тетрагональная решетка с параметрами а = 5,45 А,
с= 10,896 А. Проекция структуры (рис. 28.6) показывает, что
удвоение одной оси вызвано регулярным расположением ато-
мов U, занимающих !Д катионных позиций. Vs позиций F
выше
ц= 5,45/1
©и
л Г рисунка ~ I a6""t'
© NaJ Qj ? F плоскости только на 16
рисунка
о и] ет/игР OJ
J> плоскости
О N'a
-1 яа
в плоскости
Рис. 28.6. Проекция на плоскость @10) (тетрагональной) кристаллической
структуры Na3UF7 (слева) и проекция (кубической) структуры типа флюори-
та (справа; ср. с рис. 6.9); обозначения положений атомов относительно пло-
скости рисунка те же, что и для Na3UF7.
структуры флюорита не заселена (рис. 28.6, слева). Таким об-
разом, оба катиона, и Na+и U4+, имеют КЧ 7. Суммируя выше-
сказанное, можно сделать вывод, что следующие сложные
фториды урана имеют структуры, родственные со структурой
типа флюорита:
Статистическая
Сверхструктуры
Анионоде-
фицнтная
Катионодефи-
цитная
Высокотемпературный Y-Na2UF6
K2UF6 Na3UF8
Na3UF7
Na,UF8
В обсужденных комплексных фторидах реализуются высо-
кие КЧ атомов 4/- и 5/-элементов. Особый интерес представля-
ет, во-первых, случай сохранения этих высоких КЧ вплоть до
составов, характеризующихся небольшими атомными отноше-
ниями F : М, и, во-вторых, случаи неожиданных изменений КЧ
в некоторых группах соединений, особенно в комплексных
28.2. Актиноиды 423
Таблица 28.5
Соединение
LiUF5
Rb2UF6
|32-Na2UF6 I
Pi-K2UF6
fi-Na2UF6 I
Na3UF7
K3UF7
Li4UF8
(NH4LUF8
. Координация U(IV) в некоторых сложных фторидах
>
9
8
9
7
7
8(+1)
8
Координационный
полиэдр
Трехшапочная тригональ-
ная призма
Додекаэдр
Трехшапочная тригональ-
ная призма
См. рис. 28.4
Пентагональная бипира-
мида
См. текст
Искаженная антипризма
Литература
Acta cryst., 1966, 21, 814
Inorg. Chcm., 1969, 8, 33
Acta crvst., 1948, 1, 265
Acta cryst., 1969, B25,
О 1 CQ
zl63
Acta cryst., 1979 B35
1198
Acta cryst., 1948, 1, 265
Acta cryst., 1954, 7, 792
J. Inorg. Nucl. Chem.,
1967, 29, 1631
Acta cryst., 1970, B26, 38
фторидах тория. Первый отмеченный случай встречается
в структурах соединений U(IV) (некоторые приведены в
табл. 28.5). Оди. и тот же структурный тип с девятерной коор-
О F
_ в плоскости /Q. p I вьше
рисунка ^ !> mocmcma
? плоскост
© KJ рисунка
выше на 0,385 Ь
плоскости
рисунка на 0,675 Ь
Рис. 28.7. Кристаллические структуры p2-Na2ThF6 (о) и P!-K2UF6 (б).
динацией (трехшапочная тригопальная призма) найден в
LiUF5 и в двух модификациях K2UF6.
Структуры $2-Na2ThF& и Pi-/C2^6 очень тесно взаимосвяза-
ны. Их проекции на основание гексагональной элементарной
ячейки изображены на рис. 28.7. В обеих структурах ионы тя-
424 28. Лантаноиды и актиноиды
желых металлов имеют КЧ 9: шесть ионов фтора расположены
в вершинах тригональной призмы и три над центрами верти-
кальных граней призмы. Расположение атомов Th (или U) и F
такое же, как у Sr и Н2О в SrCl2-6H2O (рис. 15.4). Призмы
выстраиваются в цепь вдоль главной оси гексагональной ячей-
ки с обобществлением их треугольных граней. Ионы щелочных
.металлов расположены между
Структура fJ-AaL-7
Структура
26
;},-Na,LT6
32-K2UF6
NaPuF4
j5rK2ThF6
fJ..-K2UI:6
?>rKLaF4
этими цепями в позициях с шестерной и девятерной координа-
цией для p2-Na2ThFs и pVK2UF6 (соответственно). Поэтому
первая структура в целом предпочтительна для натриевых со-
лей п вторая — для калиевых. В изоструктурных соединениях
АВХ4 состав элементарной ячейки соответствует формуле
А3/2В3/2Х6 вместо, например, Na2ThF6 или K2UF6 (общее число
катионов остается, следовательно, неизменным), причем 1 В
заселяет позицию Th (или U), а 3/2 А+'/г В— позиции Na
(пли К) статистически. Интересно в этой связи обратить вни-
мание па структуры шпинелей, см. разд. 13.5.1. Структура
NaXdF4 (и изоструктурных солей Се и La) аналогична, т. е.
отличается от структуры C2-Na2ThF6, которая была им припи-
сана первоначально; 4/-иоп имеет здесь девятерную коорди-
нацию (трехшапочная тригональпая призма) [Inor^. Chem.,
1965, 4, 881].
Структуры соединений, приведенных в табл. 28.5, разделе-
ны на две группы (верхняя и нижняя) по признаку наличия
шскретных группировок UF7 пли UFa. Структура Na3UF7 уже
была описана. Одна модификация K3UF7 изоструктурна с
KjJJCbFr,; другая структурно похожа па K3ZrF7 или
'NH^sZrFz (разд. 10.1.13). В обеих полиморфных модифика-
циях 7 атомов F располагаются в вершинах пентагоналыюй
Гипирамиды (U—F 2,26 А).
Для U(IV) найдено много разных 8-координационных поли-
эдров, в то время как U(V) и U(VI) (в Na3UF8 и Na2UF8)
характеризуются кубической координацией. Интересно отме-
тить, что если в LiUF5 реализуется координационный полиэдр
урана в форме трехшапочной тригональной призмы (U—F
2,26-^-2,59 А), то многогранник атома урана в Li4UF8 представ-
25.2. Актиноиды 425
Таблица 28.6.
Соединение
RbTh3F,3
p,-Na2ThF6 1
li.-KjThFe }
(NH4KThF7
(.\H4LThF8
(NH4MThF9
K;Th6F31
RbPaF6 }
KPaF6
i\H4PaF6 J
K2PaF7
Na3PaF8
Koop
КЧ
9
9
9
9
8
8
8
9
8
динация металла в некоторых сложных фторидах
Th(IV) и Pa(V)
м
Координационный
полиэдр
Трехшапочные триго-
нальные призмы, со-
члененные по реб-
рам ц вершинам
Трехшапочные триго-
нальные призмы, со-
члененные по двум
граням
Трехшапочные триго-
нальные призмы, со-
члененные по двум
ребрам
То же
Додекаэдр
Антипризма
Додекаэдры, сочле-
ненные по двум реб-
рам
Трехшапочные триго-
нальные призмы, со-
члененные по двум
ребрам
Куб
Литература
Acta cryst., 1971.
1823
I См. разд. 28.2.4
Acta cryst., 1971.
2279
Acta crvst., 1969,
1958 "
Acta crvst., 1971,
829
Acta cryst., 1971,
2290
Acta cryst., 1968,
1675
B27
B27
B25
B27
B27
B24
Inorg. Chem., 1966, 5
659
J. Chem. Soc, A
1429
J. Chem. Soc, A
1161
1967
1969
ляет собой точно двухшапочную тригональную призму (U—8F
2,21^2,39 А). Девятый ближайший сосед (на расстоянии
3,3 А) расположен вне третьей грани призмы, и если включить
его в координационный полиэдр, структура уже не будет со-
держать дискретных ионов UF84~, поскольку этот более уда-
ленный F" является общим для двух полиэдров UFfl.
Как уже отмечено, комплексные фториды тория замечатель-
ны в нескольких отношениях (табл. 28.6). И (NFI4KThF7, и
(NH4LThFs содержат бесконечные линейные ионы состав;
(ThF7)n3n^, образованные из полиэдров в форме сочлененных по
двум ребрам трехшапочных тригопальных призм, хотя детали
строения цепей в обоих соединениях различны. Восьмой фтор
в (NH4LThF8 не связан с торием, т. е. представляет собой дп-
426 28. Лантаноиды и актиноиды
скретный ион F~. Для (NH4LThF8 скорее следовало ожидать
другой тип структуры, а именно дискретные ионы ThF84~ (фак-
тически присутствующие в (NFUbThFg) или цепь из трехша-
почных тригональных призм, сочлененных по двум вершинам.
Вместо любой из этих структур реализуются цепи состава
(ThF7)M3n~, похожие па цепи в КгРаР7 (трехшапочные триго-
пальные призмы, сочлененные по двум ребрам), и дополни-
тельно дискретные ионы F~. Еще более интересен (NH4MThF9,
для которого следовало ожидать структуру с дискретными
ионами ThF95~ или структуру с ионами F~ плюс цени
(ThF8)n4™^, построенные из полиэдров ThF9, сочлененных по
двум вершинам (и сохраняющих поэтому девятерную коорди-
нацию для атомов Th). На самом же деле этот кристалл со-
держит дискретные додекаэдрические ионы ThF84~ и ионы F~.
Таким образом, в (NH4MThFg КЧ Th ниже, чем в некоторых
соединениях с меньшим атомным отношением F : Th (напри-
мер, (NH4LThF8, (NH4KThF7 и RbTh3F13, где КЧ атомов Th 9),
по одинаково с КЧ Th 8 в соединении K7Th6F3i с промежуточ-
ным атомным отошением F : Th. Отметим, что 8-координацион-
ный полиэдр Th в (NH4MThF9 имеет форму додекаэдра, а в
K7TI16F31, который изоструктурен с Na7Zr6F3i, — форму анти-
призмы (разд. 10.1.13).
Оксиды урана. Химия кислородных соединений этого элемен-
та исключительно сложна, хотя для него и известны оксиды
с такими простыми формулами, как UO (структура типа NaCl),
UO2 и UO3. И диоксид, и триоксид урана имеют области гомо-
генности, протяженность которых зависит от температуры.
Описаны многочисленные промежуточные фазы с упорядочен-
ными структурами. Кроме этого, для UO3, как и для U3O8, ха-
рактерен полиморфизм. В табл. 28.7 обобщены сведения об ок-
сидах, существующих в интервале составов UO2 — UO3.
При обычных температурах UO2 имеет нормальную флюо-
ритовую структуру. При более высоких температурах некото-
рые из атомов О перемещаются в большие по размеру полости
ут) и т- Д-» и UO2 поглощает кислород до состава UO2,2r,.
При нейтронографическом исследовании неупорядоченного
твердого раствора промежуточного состава UO2,i3 установлено
существование трех типов атомов кислорода: Oi — вблизи по-
зиций флюоритовой структуры UO2, но слегка сдвинутых в па-
правлении больших полостей, Он и Ош — в положениях, уда-
ленных от этих больших полостей на ~ 1 А. При составе
UO2.25 (U4O9) эти три типа атомов О располагаются упорядо-
ченно, образуя сверхструктуру со значительно большей эле-
ментарной ячейкой F4 объема ячейки UO2).
Фаза UO2,6, обе модификации UO2,67 (U3O8) и ромбический
28.2. Актиноиды 427
Таблица 28.7. Высшие оксиды урана
Оксид
Модифика-
ция
КЧ атома U
Литература
UO2.,3
и4о9
UO2.6
и3о8
6(UO2,8)
Высокого
давления
См. текст
7 для всех U (пентаго-
нальная бипирамида)
7 для 2 U (пентагональ-
}1ая бипирамида); 6
для 1 U (искаженный
октаэдр)
Неизвестна
6 или 7 для всех U (три
сорта атомов U)
6 для всех U (искажен-
ный октаэдр)
6 (правильный октаэдр,
2,07 А, структура типа
Re-Оз)
7 для всех U (пентаго-
нальная бипирамида)
Nature, 1963, 197, 755
Ada cryst., 1972, В28,
785
J. Inorg. Nucl. Chem.,
1964,'26, 1829
J. Appl. Crystallogr.,
1970, 3, 94
Acta cryst., 1970, B26,
656
Rec. Trav. Chim. (Belgi-
que), 1966, 85, 135
J. Inorg. Nucl. Chem.,
1964, 26, 1829
Acta cryst., 1966, 21, 589
Acta cryst., 1963, 16, 993
J. Inorg. Nucl. Chem.,
1955, 1, 309
Acta cryst., 1966, 20, 292
(Z-UO3 (см. далее), по-видимому, имеют родственные структу-
ры, но не все эти структуры детально изучены.
Известны две модификации U3O8; об'ычио имеют дело с мо-
дификацией а. Их структуры родственны, но различаются в
следующем. В a-U3O8 все атомы U координированы семью
атомами кислорода. Шесть из них находятся на расстояниях
2,07—2,23 А, а седьмой удален па 2,44 А от '/з атомов U п на
2,71 А —от остальных атомов U. Проекция этой структуры
показана па рис. 12.8, в. В модификации р (получена нагрева-
нием модификации а до 1350°С па воздухе и медленным ох-
лаждением до комнатной температуры) реализуются и шестер-
ная (искаженно-октаэдрическая), и семерная координации
(пентагопально-бипирамидальная). В отличие от а-модифнкл-
ции в C-U3O8 имеется три сорта атомов урана с различным ти-
пом ближайшего окружения (в скобках указано число атомов О;
выделено расстояние в уранильной группировке):
U, 1,89 B) А 2,11 A) А 2,30 B) А 2 37 B) А
U,, 2,09 D) 2,28 B) ( '
Um 2,02 A) 2,08 B) 2,29 B) 2,40 B)
428 28. Лантаноиды и актиноиды
При атмосферном давлении 1Юз, по-видимому, имеет 6 по-
лиморфных модификаций, седьмая получена при высоком дав-
лении. Исходной для всех них является «гексагональный
а-ЬЮз», изученный Закариасеном; по-видимому, эта модифика-
ция представляет собой полисинтетическую двойниковую фор-
му ромбической фазы. Измерения плотности u-UO3 никогда
не давали значения, большие чем —7,3 г/см3, что сильно от-
личается от величины 8,4 г/см3, вычисленной из размеров эле-
ментарной ячейки. Такое различие обусловлено наличием од-
новременно и катионных, и анионных вакансий. Отсутствие
некоторых атомов U в сочлененных вершинами пентагоиаль-
пых бипирамидах, приводящее к образованию коротких связей
U—О, может быть причиной интенсивной полосы поглощения
— 930 см~! в ИК-спектре, которая характерна для иона
иО22т. Модификация б с кубической структурой типа ReO3
(с шестью равноудаленными октаэдрически расположенными
соседями на расстоянии 2,07 А) была найдена в кристалле со-
става иОгз- В модификациях р и у атом U окружен шестью
н/нли семью ближайшими соседними атомами О (~ 1,8-^2,4 А),
его координация нерегулярная; только в модификации высоко-
го давления имеются дискретные группировки UO2 с двумя
короткими коллинеарными связями A,83 А) и пятью связями
U—О B,20^2,56 А).
Уранильныв соединения. Интересной особенностью химии
U и некоторых других 5/-элементов является образование ионов
МО2- [для Pu(V) и Am(V)] и МО22+ [для U(VI), Np(VI),
Pu(VI) и Am(VI)]. Уранильные соединения содержат линей-
ную группировку О—U—О с короткими связями U—О A,7-:-
^-1,8 А) и экваториальную группировку из 4, 5 или 6 атомов
О, комплектующих 6-, 7- или 8-координационный полиэдры
атома U (табл. 28.8). Координационные числа урана, равные
6, 7 и 8, обнаружены даже в полиморфных модификациях одно-
го и того же соединения [например, UO2(OHJ].
К «гидратам» UO3 относятся Ь'Оз-'/гНгО, UO3-H2O и UO3-
¦2Н2О. Структура «полугидрата» неизвестна. По-видимому,
существуют 3 модификации «моногидрата», который фактиче-
ски представляет собой UO2(OHJ, и 2 модификации «дигид-
рата» UO2(OHJ-H2O. Последний известен как минерал ше-
пит, образованный слоями UO2(OHJ с размещенными между
ли ми молекулами Н2О. Этот слой аналогичен слою в
a-UO2(OHJ. Структуры всех трех модификаций UO2(OHJ оп-
ределены. Модификация |3 состоит из слоев октаэдрических
полиэдров иОг(ОНL, сочлененных всеми четырьмя экватори-
альными группировками ОН с образованием слоя, основанного
па простейшей 4-связанной плоской сетке (рис. 28.8, а). Поло-
жения атомов Н в обеих (а и C) модификациях UO2(OHJ
Таблица 28.8. Координация U в уранильных соединениях
Соединение
Расстояния
U--'O в
группе
UO2, A
Дополни-
тельные fi.iu-
жаГшлис соео-
ди и рисе гии-
чпе ;;о них. Л
Литерачл p;i
.u-UO,(OHj2
J>L:().(OH)o
V-U(),(OHK
V'.J{Q\\)-ytt20
iJ;;O,((JHJ
UO2F2
,UO2C12
.5-UO2SO4
UO2CO3
UO2(NO3J-6H2O
LJO2(NO3J-2H2O
Rb(UO2)(NO3K
UO2(HCOOJ-H2O
UO2(C2O4K-3H2O
UO2(C2O4K(\TH4L
UO2(QO4J(NH4J
{UO2J(C2O4K(NH4J
<иО2J(С2О4)зК2-4Н2О
(Ь'О2J(С2О4MКб-10Н2О
Na(UO2)(OOCCH3K
Cs2(UO2)(SO4K
{UO, (CH3COO) 2[ (C6H5) 3PO]}2
NpO2F2
KAmO2F2
KAmO2CO3
1
1
1
1
1
1
Cm.
2i
1
A
1,
1,
1,
1,
1,
1,
1,
1,
1,
1,
1,
A
A
,71
81
81
83
76
74
табл.
.4
77
,7)
76
76
78
76
63
69
77
76
76
82
71
,74)
,78)
6011 2,48
4011 2,30
4011 2,30
40
30 2OH
6F 2,43
50 2,38
60 из СОз5"
2,49
2Н2О, 40 из
2Н2О, 40 из
N03-
60 из N03-
2,48
50 2,41
50 2,49
60 2,43 2,57
50 2,37
50 2,38
60 2,45
50 2,38
60 2,49
50 2,37—
2,47
50 2,36
Ada crysl., 1971, B27
1088 "
Acta cryst., 1970, B26,
1775; Acta cryst.,
1971, B27, 2018
Acta cryst., 1972, B28,
3469
Am. Mineral., I960, 45,
1026
Acta cryst., 1872, B28,
117 (рентгеногр.)
Acta cryst., 1974, B30,
151 (нейтроногр.)
Acta cryst., 1970, B26,
1540 (нейтроногр.)
Acta cryst., 1978, B34
3734
Acta cryst., 1955 8
847
Acta cryst., 1965, 19,
536 (нейтроногр.)
Inorg. Chem., 1971, 10,
323 (нейтроногр.)
Acta cryst., 1965, 19,
205
Acta cryst., 1977, B33,
1848
Acta cryst., 1972, B28,
3178
J. Chem. Soc., D 1973,
1610
J. Chem. Soc D 1973
1614
J. Chem. Soc D 1973
1616
Acta cryst., 1975, B31,
2277
Acta cryst., 1976, B32,
2497
Acta cryst., 1959, 12,
526
J. Inorg. Nucl. Chem.,
I960, 15, 338
Inorg. Chem., 1969, 8
320
Acta cryst., 1949, 2
388
J. Am. Chem. Soc
1954, 76, 5235
Inorg. Chem., 1964 3
1231
430 28. Лантаноиды и актиноиды
были локализованы нейтроиографически, что подтвердило об-
разование связей О—Н—О между слоями B,76 и 2,80 А в мо-
дификациях аир соответственно). Структура y-UO2(OHJ
очень похожа на структуру модификации C. C-UO2(OHJ весь-
ма легко превращается под действием небольшого давления
^-^ группировка 0,-U-O,;
Щ>) ось У перпендикулярна
плоскости рисунка
_ Оц (или F) под
U плоскостью пис::::ка
q Оц (ими У) выше
плоскости рисунки
Г\ ОН под плоскостью
^ рисунка
Q ОН выше плоскости
рисунка
Рис. 28.8, Слои UO2(O2). а — «тетрагональный» слой в p-UO2(OIlJ и BaUO4;
б — «гексагональный» слой в UO2F2 и CaUO4; в — «гексагональный» слой в
a-UO2(OHJ. (а и б — группировки О—U—О перпендикулярны плоскости, со-
держащей атомы U, в — эта группировка наклонена под углом 70° к плоско-
сти атомов U.)
в модификацию а (при этом плотность повышается от 5,73 до
6,73 г/см3). В модификации а атом U окружен шестью ближай-
шими соседями (ОН) в плоскости, приблизительно перпендику-
лярной группировкам UO2. Этот слой изображен на рис. 28.8, в.
В U3Os(OHJ реализуется одновременно и октаэдрическая,
и пентагоналыю-бипирамидальная координация U, в каждом
случае с двумя короткими связями U—О A,83 и 1,76 А). По-
зиции атомов Н в 7-координациоппой группировке установлены
пейтронографическим исследованием U3O8(ODJ.
«Тетрагональный» (рис. 28.8, а) и «гексагональный» слои
(рис. 28.8. в), или более симметричный вариант последнего
(рис. 28.8,6), представляют собой основу структур многих
урапильиых соединений и уранатов.
28.2. Актиноиды 431
Кристаллический UO2F2 состоит из слоев такого типа, как
изображено на рис. 28.8, б; линейные группировки UO2 пер-
пендикулярны плоскости рисунка, а 6 значительно более уда-
ленных соседей (атомов F) образуют вокруг U гофрированный
гексагои (или уплощенный октаэдр). Связи между слоями не
возникают, и характерной особенностью этой структуры явля-
ется наличие дефектов упаковки, изученных позднее методом
дифракции нейтронов (табл. 28.8). NpO2F2 обладает аналогич-
ной структурой. Если U (VI) в этом слое заместить на Am(V),
получим двумерно-бесконечный ион AmO2F2~\ Такой ион был
обнаружен в K(AmO2F2). В этой структуре ионы К+ распола-
гаются между слоями. Структуры UO2C12 и UO2C12-H2O опи-
саны в разд. 28.2.4 (см. литературу, цитированную в
табл. 28.4).
Два исследования UO2(NO3J-6H2O привели по существу к
аналогичным структурам; они показали, что соединение явля-
ется тетрагидратом комплекса а. В последнем 2 молекулы Н2О
и 2 бидентатных иона NO3~ образуют плоскую экваториальную
группировку из шести атомов О вокруг атома U. Такова же
О
О
о
-о
2,40 А
о
—N-
о
-структурная единица и в дигидрате, в котором найдены очень
близкие расстояния U—О (U—20 1,76 A; U—ОН2 2,45 А;
U—ONO2 2,50 А). До некоторой степени похожая координация
атома U тремя бидептатными ионами NO3~ (б) формируется
в Rb(UO2) (NO3K. При исследовании иО2(МОзJ-2Н2О мето-
дом дифракции нейтронов была установлена та же длина свя-
зей U—О A,76 А) в уранильной группировке, как и найден-
ная тем же методом в гексагидрате.
Ион ацетата Н3С—СОО" (ас), подобно NO3~, может прояв-
лять свойства как бидептатного, так и мостикового лиганда.
сн.
о
432 28. Лантаноиды и актиноиды
Так, например, в случае UO2(acJL2 осуществляется октаэдрп-
ческая структура (а), в которой молекулы Н2О замещены па
L((C6H5K1JO или (C6H5KAsO), а в случае [UO2(acJL]2 —
мостиковая структура а, содержащая мостиковые и бидентат-
ные ацетатные группировки. Геометрия бндентатной группи-
ровки СНзСОО очень близка к геометрии бидентапюго иона
нитрата (разд. 18.8.7). Известно много комплексных оксала-
тов, содержащих группировку UO2, некоторые из них заслу-
живают внимания в связи с небольшой растворимостью в воде
и относительно высокой устойчивостью. Эти соединения много-
численны, поскольку лиганд С2О42~ может присоединяться не-
сколькими способами, иногда даже в одном и том же соеди-
нении:
м
-о-
„о-
—о
/
м
--о,
Кроме того, координационный полиэдр атома U может пред-
ставлять собой пентагональную или гексагональную бипирами-
ду. Если принять, что расстояние U—О для связей, дополни-
тельных к связям в уранильной группировке, близко к 2,4 А
и что минимальное расстояние между несвязанными атомами
О составляет 2,7^-2,8 А, тогда группировка UO2 может коор-
динировать дополнительно либо 5 компланарных атомов О
в экваториальных позициях с образованием пентагоналыюй
бипирамиды в качестве координационного полиэдра, либо
6 атомов О, если некоторые из них (или все) принадлежат
к таким бидентатным лигандам. как NO3~ или СНзСОО" с бо-
лее короткими расстояниями О—О B,1 -^2,2 А). В оксалатной
группировке наблюдается, конечно, большее расстояние
B,7 А) между атомами О, соединенными с различными атома-
ми С. Поэтому анион в (МН4L[1_Ю2(С2О4)з] содержит два
различных типа бидентатных оксалатных группировок (г)..
(Альтернативно может быть осуществлена координация шести
атомов О, если они располагаются поочередно выше и ниже
экваториальной плоскости, как в CaUO4 (рис. 28.8,6).) К про-
стым примерам оксалатных уранильиых комплексов относятся
островные одно- и диядерные ионы (г и д) и цепочечные ноны
(е и ж). При отношении C2O4:UO2 = 3:2 могут образоваться
3-связанные сетки в виде двойной цепи (лестничного типа)
(з) или в виде плоского слоя б3, образованного группировками
UO2, каждая из которых связана с тремя тетрадентатнымн ок-
салатными лигандами (и).
Уранаты и сложные оксиды урана. Судя по эмпирическим
формулам уранатов, они должны были бы представлять собой
обычные орто- и пиросоли, содержащие ионы UO42~ или U2O72'.-
28.2. Актиноиды 433
Однако все известные уранаты (щелочных и щелочноземель-
ных металлов и серебра, включая и Na2U2O7-6H2O) нераство-
римы в воде в противоположность растворимым хроматам, мо-
либдатам и вольфраматам. Это связано с тем, что фактически
уранаты M2'UO4 и MUUO4 содержат бесконечные двумерные
ионы, построенные по общему типу, такому, как тетрагональ-
ный или гексагональный слои (рис. 28.8):
Гексагональный слой
Тетрагональный слой
Na2UO4, K2UO4 [1], CaUO4 [2] (и ром-
боэдрический SrUO4)
S1-UO4 (ромбический), BaUO4 [2]
В этих «уранатах» присутствуют островные группировки UO2,
Однако такое строение наблюдается не во Есех сложных окси-
28—1284
434
28. Лантаноиды и актиноиды
дах U(VI), как это можно видеть из приведенных ниже дан-
ных (цифры в скобках указывают число ближайших соседних
атомов кислорода, расположенных па соответствующих рассто-
яниях вокруг атома U(A)):
CaUO4: 1,96 B), 2,30 F'
SrUO4: 1,87 B), 2,20 D)
BaUO4: 1,89 B), 2,20 D)
Ca2UO5: U, 2,02 D), 2,25 B)
U,, 1,95 B), 2,13 B) 2,21 B)
Ca3UO6: 2,03 C), 2,11 B) 2,18 A)
Различие между двумя ближайшими и остальными соседними
атомами еще можно зафиксировать в Ca2UO5 для половины
атомов U, но в СазиОб оно полностью исчезает.
Существенные различия между окружениями атомов U
лаблюдаются и в других сложных оксидах LJ(VI). В UTeOs
цепи типа PaCls состава UOs связаны атомами Те(IV), находя-
щимися в характерной «односторонней» четверной координа-
ции [2а]. Длина аксиальных связей U—О в координационных
пентагональных бипирамидах составляет 1,83 А, средняя дли-
на пяти экваториальных связей — 2,39 А. С другой стороны,
высокотемпературная модификация Bi2UO6 [26], которая слу-
жит катализатором конверсии толуола в бензол, имеет структу-
ру, более типичную для сложного оксида, которую можно
представить как искаженную гексагональную сверхструктуру
на основе структуры флюорита. Длина аксиальной связи рав-
на 2,1 А, длина шести приблизительно компланарных эквато-
риальных связей — 2,4 А.
В противоположность двумерно-бесконечным ионам в
SrUC>4 и BaUO4 в MgUO4 (сверхструктура на основе структуры
типа рутила) отмечается сочленение совершенно одинаково
искаженных октаэдров UO6 в бесконечные цепи: U—20 1,92 А;
U—40 2,18 А [За]. Вследствие образования атомом урана двух
более прочных связей вокруг атома Mg формируется анало-
гичное и необычно несимметричное окружение: Mg—20 1,98 А;
Mg—40 2,19 А.
Трехмерный октаэдрический каркас UO2(O4), который обра-
зует анион в BaU2O7 [36], описан в гл. 5 и представлен на
рис. 5.28.
Во всех уранильных соединениях и в некоторых из урана-
тов атом U имеет два ближайших соседних атома О и от четы-
рех до шести вторых за ближайшими соседей:
4 в BaUO4, MgUO4
5 в K3UO2FS, Cs2(UO2)(SO4K
6 в CaU04, UO2F2
Длины коротких связей U—О варьируют от ~1,7 до 1,96 А,
более длинных U—О обычно от 2,2 до 2,5 А. Каждой связи
U—О можно приписать валентное усилие связи s Bs равна
валентности, т. е. для Ва 2s = 2, для U 2s = 6 и т. д.). Валент-
28.2. Актиноиды 435
ное усилие вычислено по уравнению, предложенному Полин-
гом длл металлов: D,—J., = 2/elgs, где s — валентное усилие
связи, D]—длина ординарной связи, Ds — длина реальной свя-
зи, k — константа (в данном случае она равна 0,45) [4]. На
основании вычисленных по уравнению Полинга валентных уси-
лий связи U—О были получены соответствующие расстояния,
например: 1,75 A (s = 2); 2,05 A (s=l) и 2,45 A (s = 0,33). Хо-
тя эти вычисленные величины соответствуют усилиям электро-
статических связей в ионных кристаллах, из этого совершенно
не следует, что это простые ионные связи. Независимо от того,
имеет ли атом U два ближайших соседних атома О и группи-
ровку из 4, 5 пли 6 дополнительных экваториальных соседей,
геометрия координационных полиэдров позволяет считать, что
связи обладают определенным ковалентным характером. Шесть
вторых соседей атома U, следующих за ближайшими в UO2F2
и CaUO4, расположены только па 0,5 А выше или ниже эква-
ториальной плоскости (перпендикулярной оси группировки
UO2); в Rb(UO2) (ЫОз)з три пары атомов О бидентатных ионов
МОз фактически компланарны. Удовлетворительное описание
связей в этих кристаллах еще не разработано, однако возмож-
ность гибридизации /-орбиталей при формировании 2 + 6 связей
обсуждается в работе [5].
Литература. [1] Ada cryst., 1948, 1, 281. [2] Acta cryst, 1969, B25, 787. [2al Ada
cryst., 1973, B29, 1251. [261 Acta cryst., 1975, B31, 127. [За] Acta cryst., 1954, 7,
788. [36] J. Inorg. Nucl. Chem., 1965, 27, 1521. [4] Acta cryst., 1954, 7, 795.
[51 J. Chem. Soc, 1956, 3650.
28.2.6. Нитриды и родственны" соединения Th и U; структуры
типа La-,0:, и Cc2O2S. \Л тори;";, и уран образуют нитриды «внед-
рения» MN, а также МС и МО (все со структурой типа NaCl).
Кроме того, для тория известен типичный для элементов IV
группы нитрид Th3N4, тогда как для урана — UN2 (флюорито-
вая структура) и U2N3 (структура типа Мп2Оз). Структурно
родственны нитридам такие соединения, как Th2N2O и U2N2S —
представители большой группы соединений M2Y2X, образован-
ной 4/- и биметаллами. Некоторые примеры приведены в
табл. 28.9
Соединения, в которых Х = О, S, Se, P или As, имеют струк-
туру типа Л-М2О:! (или Ьа2О3), тогда как соединения, содер-
жащие атомы X большего размера (Те, Sb или Bi), кристалли-
зуются по другому типу— (Nai/4Bi3/4JO2Cl. В обеих структу-
рах имеется жесткий слой состава MY (M2Y2), построенный из
тетраэдров YM4. Последние в структуре типа La2O3 сочленены
по трем ребрам (рис. 28.9, а) и в структуре типа U2N2X
(рис. 28.9, б) — по четырем ребрам. Этот слой точно такой же,
как слои в структурах тетрагонального РЬО или LiOH..
28*
436 28. Лантаноиды и актиноиды
Таблица 28.9. Соединения со структурами типа La2O3 и U2N2X
Ce2O2Sb [2]
Bi
Th2N2(NH) [61
Th,(N,OJP [3]
As
Th2N2Sb [41
Bi
Ce2O2S fll
Se
Ce2O2Tc
Th2N2O \5]
S
Se
Th2N2Te
La.O.O
S
La2O:Ti?
U2N2P [3]
As
U2N2Sb [4]
Bi
U2N2S
Sc
U2N2Te
[1] Acta cryst., 1949, 2, 60. -[2] Acta cryst., 1971, B27, 853. [31 Acta cryst.. 1969, B23,
29-1. [4] Acta cryst., 1970, B26, 823. [5] Acta cryst., 1966, 21, 838. [61 Z. anorg. alls;.
Chem., 1968, 363, 245.
В структуре типа La2O3 третий атом О(Х) расположен между
слоями, октаэдрически окруженными шестью атомами М, в то
время как атом М (на поверхности «слоя») имеет 4 соседних
О (Y) внутри слоя и 3 соседних О (X) между слоями
(рис. 28.9, в). Атомы О (Y) внутри слоев имеют 4 соседних М
(La), расположенных в вершинах тетраэдра. Эта структура ти-
па La2O3 (Ce2O2S) с координацией 7 :'\ характерна для многих
полуторных оксидов М2Оз 4/-металлов и оксосульфидов M2O2S
(например, Ас2О3, Pu2O3) |3-Am2O3, Pu2O2S) и |3-AbS3. В La2O3
наблюдается различие в ~0,3 А между длинами расстояний
La—40 внутри тетраэдрического слоя и La—30 между слоями;
соответствующие различия, конечно, значительно больше в со-
единениях урана, где Y = N, X = P, As, S, Se, и в Ce,O^S, где
Y = O, X = S:
М—4Y
м-зх
La2O2O
U2N2S
U2N,As
Ce2O2S
2,38—2,45
2,28
2.27
2,36
2,72 A
2,87
2 97
3,04
В структуре U2N2X тетрагональные слои (рис. 28.9, б) упако-
ваны таким образом, чтобы обеспечить для более объемных
атомов X (Sb, Bi, Те) позиции между слоями с восьмерной ко
28.2. Актиноиды 437
разрез в направлении
стрелки
тетрагональный
слой U2N2
La La La -
0 0 0
\I/T\
.La Lit La—
0/0 '0
0/ \
— La La —
3
02 U2N2
-и и uu —
-и' и
z
.Рис. 28.9. Слой тетраэдров (La2O2)O (о) и U2N2X (б); в и г — схематические
разрезы показывающие координацию двух типов атомов О в La2O3 и атомов
N и Sb в U2N2Sb.
ординацией (кубической). Координационные полиэдры атомов
здесь построены из следующих элементов (рис. 28.9, г):
II: 4 N + 4 Sb (куб)
N: 4 U (тетраэдр)
Sb: 8 U (куб)
Литература. [1] Inorg. Chem., 1965, 4, 115.
.28.2.6. Сульфиды U, Th и Се. Многие из этих соединений пред-
ставляют собой высокоогнеупорные материалы с температура-
ми плавления >1800°С (CeS плавится при 2450±100°С). Не-
которые из них характеризуются интенсивной окраской: CeS
латунно-желтый, Ce2S3 красный, по Ce3S4 черный. Соединения
урана окрашены от серого металлического цвета до черного.
Известны следующие соединения:
CeS
Ce2S3
Cc3S4
ThS
Th?S3
ThS2
Th7S,,
(ThS,,71
-5-1,7б)
us
u2s3
us2
Хотя все моносульфиды имеют структуру типа NaCl, они, оче-
видно, не являются простыми ионными кристаллами. ThS, по-
добно всем сульфидам тория, диамагнитен, а величины магнит-
ной восприимчивости парамагнитных CeS и US соответствуют
438 28. Лантаноиды и актиноиды
наличию одного и двух песпаренных электронов. Предполагая,
что электроны, не участвующие в связях, могут оставаться пе-
спарепными па доступных орбиталях, и основываясь на маг-
нитных свойствах переходных металлов, указывающих, что d-
электроны должны спариваться с образованием металлических
связей, парамагнетизм этих соединений можно приписать не-
спаренным /-электронам. Тогда можно составить следующую'
диаграмму.
CeS ThS US Ce,S3 Th2S3 U;S3
d-Электроны, используе- 1 2 2 — 1 2
мые в металлических свя-
зях
Неспаренные /-электроны 1 — 2 1 — 1
Вычисленные значения энергий решеток (с использованием
в случае необходимости приближенных значений ионизацион-
ных потенциалов) увеличиваются в следующем порядке: BaS,
CeS, ThS, что соответствует возрастанию числа d-электронов,
участвующих в металлической связи, от 0 до 1 и затем до 2.
Длины связей М—S в соединениях MS и M2S3 укорачиваются
в том же самом порядке, хотя размер атома тория обычно
больше, чем атома церия:
BaS
3,17
(La2S3)
C,01)
CeS
2,88
Cc2S3
2,98
ThS
2,84
Th2S3
2,90
(US)
2,74 Л
U2S3
2,82 A
Это сравнение, вероятно, менее оправдано для полуторных
сульфидов из-за того, что не все они обладают одной и той же
структурой (см. литературу, цитированную в табл. 28.2). По-
луторные сульфиды Th, U и Np имеют структуру типа Sb2S3,
а аналогичные сульфиды La, Се, Ас, Ри и Am — дефектную
структуру типа ТП3Р4. Структура TI13P4 представляет собой
трехмерный каркас из атомов Th и Р, где атом Th связан
с восемью равноудаленными атомами Р и атом Р — с шестью
атомами Th. В этих полуторных сульфидах 102/з атомов ме-
талла статистически распределены по 12 позициям атомов ме-
талла, заселенных в TI13P4; в Сез54 заселены все позиции.
Сульфид Th7Si2 имеет неупорядоченную структуру [2], в ко-
торой атом Th окружен либо восемью, либо девятью атомами S,
a ThS2, подобно |3-US2, — структуру типа РЬС12.
Литература. [1] См. литературу, цитированную в табл. 28.2. [2| Ada cryst.,
1949, 2, 288.
29. МЕТАЛЛЫ И СПЛАВЫ
29.1. Структуры простых веществ
Строение ряда неметаллов рассмотрено в предыдущих главах.
В этой заключительной главе речь идет главным образом о
строении металлов и интерметаллических соединений*. Основ-
ное внимание уделено структурам металлов в твердом состоя-
нии, преимущественно модификациям, устойчивым при атмо-
сферном давлении. Из многочисленных полиморфных модифи-
каций высокого давления упомянуты лишь те, которые пред-
ставляют особый интерес. О строении жидких металлов
известно немного. В тех немногочисленных случаях, когда уда-
лось выполнить дифракционные исследования, информация о
строении ограничивается установлением числа соседей в опре-
деленном интервале расстояний. Число ближайших соседей
в жидких металлах составляет для К G0°С) 8, для Li B00°С)
9,8, для Hg и А1 8—9 [1]. В парах многих металлов присутст-
вуют двухатомные молекулы. Энергия диссоциации таких мо-
лекул приведена в разд. 7.5, где обсуждается прочность связей
металл — металл. В парах над некоторыми растворами метал-
лов друг в друге также обнаружены двухатомные молекулы,
например GeCr и GeNi [2].
Перед тем как перейти к рассмотрению систем, образован-
ных несколькими металлами, мы сделаем краткий обзор иссле-
дованных структур всех элементов в твердом состоянии. Для
этой цели удобно разделить элементы па классы (см. схему
29.1):
1) благородные газы;
2) водород, неметаллы двух первых коротких периодов
(за исключением бора) и их аналоги в группах;
3) бор, алюминий, элементы подгрупп ЦБ и ШБ, олово и
свинец;
4) переходные элементы, включая элементы подгруппы 1Б;
5) элементы подгрупп IA и ПА.
Строение интерметаллических соединений также обсужда-
ется в рамках групп Аь А2, В! и В2 (см. схему 29.1). В группы
Ai и А2 входят элементы А-подгрупп, триад VIII группы, а так-
* Подробное описание структур металлов и сплавов можно также найти
в монографии: Пирсон У. Кристаллохимия и физика металлов и сплавов.
Ч. 1_2. —М.: Мир, 1977. — Прим,, перге.
440 29. Металлы и сплавы
i A
К
Rb
Cs
Fr
, ]
Са
Sr
На
Ra
Li
Na
Sc
Y
Lj
Ac
Be
MB
Ti
2
r
" Hf
6
В
Al
V Cr Mn Fe
Nb Mo Tl Ru
Tj W Re Os
l A2 i
ч У
j? А также 4 f- элементы
А также 5 f-элементы
Схема 29.1
Co Ni
Rh Pd
Ir Pt
Cu
Ag
Au
Zn
C'd
"g
Ga
In
Tl
©
С
Si
Ge
Sn
Pb
N
P
As
Sb
Bi
(в
0
s
Se
Те
Po
V
H
F
Cl
1
, Br
' I
At
He
Ne
Al
Kr
Xe
Rn
же Cu, Ag и Аи; к группам В! и В2 отнесены элементы Б-под-
групп периодической системы с более выраженными металли-
ческими свойствами (за исключением элементов подгруппы
1Б). Смысл рассмотрения элементов подгруппы 1Б совместно
с переходными элементами, а не с остальными элементами
Б-подгрупп станет ясным ниже.
Литература. [1] Acta cryst., 1965, 19, 807. [2] J. Chem. Phys., 1968, 49, 3579.
29.1.1. Благородные газы (класс 1). В кристаллическом состоя-
нии изучены все эти элементы, кроме радона. Во всех агрегат-
ных состояниях они моноатомны (подробнее см. табл. 29.1).
Особенность гелия заключается в том, что в твердое состояние
он переходит только под давлением не ниже 25 атм. Преобла-
дание структур с КПУ не соответствует результатам расчетов
энергий решеток, согласно которым более предпочтительной
должна быть ГПУ.
29.1.2. Неметаллы и элементы IVE — VIIБ-подгрупп (класс 2).
Водород, кислород и азот в кристаллическом состоянии состоят
из двухатомных молекул. В структуре твердого Н2 (ГПУ) вра-
щение молекул, вероятно, сохраняется вплоть до абсолютного
нуля. В низкотемпературной а-форме № центры молекул раз-
мещены по узлам гранецентрированной кубической решетки,но
ориентация молекул различна — они параллельны разным на-
правлениям типа [111]. Модификация высокого давления {у)
исследована при давлении 4015 атм и 20,5 К- Изоструктурные
друг другу высокотемпературные модификации Ог и F2 имеют
интересную кубическую структуру с восемью молекулами в
элементарной ячейке, из которых две в результате неупорядо-
29.1. Структуры простых веществ 441
Таблица 29.1. Кристаллические структуры благородных газов. Но, N2, О2 и F2
Элемент
He
Ne
Ar
Kr
Xe
Кристаллические модификации
Три модификации у каждого из
илитонов 3Нс и 4Не. Превращения
при повышении давления ОЦК—*
-*ГПУ->КПУ
КПУ
КПУ и ГПУ (метастабильная)
КПУ
КПУ
Phys
J. Cl
Литература
. Rev. Lett., 1962, 8,
em. Phys., 1964, 41,
469
1078
Расчеты энергий решеток см.: J. Chem. Phys., 1964, 40, 2744
H2
№
o2
7-,
Обычно ГПУ, но при особых усло-
о
v
а
Р
V
С
(/
внях кристаллизации ГЦК
кубическая
гексагональная
тетрагональная
моноклинная
ромбоэдрическая
кубическая
уществуют также а'- и аморфная
модификации
моноклинная (ниже 45,6 К)
кубическая
J. Chem. Phys., 1966, 45, 834
Acta cryst., 1974, B30, 929
J. Chem. Phys., 1964, 41, 756
J. Chem. Phys., 1970, 52, 6000
J. Chem. Phys., 1967, 47, 592
Acta cryst., 1962, 15, 845
Acta cryst., 1964, 17, 777
Acta cryst., 1969, B25, 2515
J. Solid State Chem., 1970, 2, 225
J. Chem. Phys., 1964, 41, 760
чепности уподобляются сферам, а остальные шесть ведут себя
как сплющенные сфероиды. У молекул с неупорядоченностью
сферического типа (А на рис. 29.1) имеется 12 соседних моле-
кул F2 на расстоянии 3,7 А, а у молекул типа В — два соседа
на расстоянии 3,3 А, четыре — на расстоянии 3,7 А и восемь —
на расстоянии 4,1 А. Согласно расчетам для неподвижных мо-
лекул F2, вандерваальсовы расстояния должны составлять
2,7 А при боковом контакте молекул и приблизительно 4,1 А
для двух молекул, расположенных па одной оси. Кратчайшие
межмолекулярные контакты в структуре наблюдаются в преде-
лах «цепочек» из молекул, расположенных вдоль осей кубиче-
ской ячейки. Эта структура явно не содержит никаких димеров
(в свое время предполагали, что у-О2 состоит из димеров).
Низкотемпературная сс-форма F2, по-видимому, представля-
ет собой искаженную плотнейшую упаковку молекул, причем
каждый атом F кроме второго атома той же молекулы на рас-
442 29. Металлы и сплавы
стоянии 1,49 А имеет еще 12 ближайших соседей. Оси молекул
направлены почти перпендикулярно плоскости слоя; межатом-
ные расстояния в пределах молекулярного слоя оказываются
больше (9 расстояний F—F 3,24 А), чем между слоями C рас-
стояния F—F 2,84 А). Обратное соотношение характерно для
изоструктурных С12, Вг2 и 12 (разд. 9.3).
Как отмечалось в гл. 3, в структурах простых веществ рас-
сматриваемой группы, кристаллизующихся при атмосферном
давлении, число ближайших соседей у каждого атома равно
8—N, где N — номер группы в периодической таблице:
VII —двухатомные молекулы F2 и др.;
VI — кольца (S6, Se, S12, Se«) или цепи (пластическая сера, «металличе-
ские» Se и Те);
V — тетраэдрические молекулы в белом фосфоре и, вероятно, в метаста-
бильных желтых модификациях мышьяка и сурьмы; слоистые струк-
туры (красный и черный фосфор, As, Sb и Bi);
IV — структура алмаза (С, Si, Ge, серое олово).
Строение простых веществ этой группы описано в предыду-
щих главах. Особняком стоит структура графита; для более тя-
желых элементов подгрупп IVB—VIB характерно усиление ме-
таллических свойств. В подгруппе IVB у олова имеется также
белая модификация с более выраженными металлическими
свойствами, а свинец — типичный металл. В подгруппе VB
в слоистых структурах As, Sb
и Bi разница между расстоя-
ниями до трех ближайших и
до трех следующих наиболее
близких соседей постепенно
уменьшается. Для структур
элементов подгруппы VIB про-
веден анализ межатомных рас-
стояний, который показал, что
взаимодействие между отдель-
ными цепочками в кристалли-
ческих Se и Те сильнее, чем
обычное вандерваальсово
(разд. 7.1). Последний элемент
в подгруппе VIB— металл. При
рентгенографическом исследо-
вании металлического полония
(для получения порошкограмм
оказалось достаточно 100 мкг
металла) было установлено
наличие двух модификаций —
с примитивной кубической и с
ромбоэдрической решеткой [1].
3,3 А
Рис. 29.1. Кристаллическая структура
высокотемпературной модификации
F2. Две молекулы в позициях @ 0 0)
и (хк Уг Уг) сферически разупорядо-
чены. Остальные шесть молекул в по-
зициях ('АУгО) и т. д. характеризу-
ются распределением электронной
плотности в виде сжатых эллипсоидов.
Для этих молекул на рисунке пока-
заны большие оси эллипсоидов, ма-
лые оси лежат вдоль штриховых ли-
ний.
29.1. Структуры простых веществ
443
В обеих модификациях у атома Ро только шесть ближайших
соседей, расположенных на одинаковом расстоянии 3,37 А.
Литература. [Г] J. Chcm. Phys., 1957, 27, 985.
29.1.3. Алюминий, элементы подгрупп 11Б и 111 Б, олово и сви-
нец (класс 3). Эти элементы объединены по следующим сооб-
ражениям: а) некоторые из этих элементов образуют особые
структуры, не подчиняющиеся правилам, согласно которым
построены структуры в других группах принятой нами класси-
фикации; б) для тех элементов, которые дают типично метал-
лические структуры, наблюдаются определенные отклонения от
обычных структур, что не позволяет отнести их к «истинным»
металлам 4-й и 5-й групп нашей классификации. В подгруппе
НБ цинк и кадмий кристаллизуются с образованием искажен-
ной гексагональной плотнейшей упаковки, причем отношение
осей с : а составляет 1,9 вместо 1,63 для идеальной ГПУ.
У каждого атома — шесть ближайших соседей в плоскости, а
еще шесть (три выше и три ниже этой плоскости) находятся
на заметно большем расстоянии. Для структуры цинка эти
два типа расстояний равны 2,659 и 2,906 А соответственно, а
для структуры кадмия — 2,973 и 3,286 А. Было бы неоправдан-
ным упрощением рассматривать эту структуру в виде упаковки
вытянутых эллипсоидов. В плотноупакованной g-фазе системы
Си—Zn (разд. 29.6.4) отношение осей меньше чем 1,63. Это
заставило бы нас предположить, что в зависимости от состава
кристалла атомы ведут себя либо как вытянутые, либо как
сжатые сфероиды. С другой стороны, отмечалась тенденция к
образованию ковалентных связей (с?р2-гибридизация) в базисных
плоскостях, что объясняет укорочение межатомных расстояний
в этих плоскостях с плотной упаковкой атомов. Резкое умень-
шение отношения с : а в MgCcb — от 1,72 до 1,63 — в процессе
образования упорядоченной сверхструктуры при 80 °С (эта
сверхструктура состоит из одинаковых плотноупакованных сло-
ев, строение которых схематически показано на рис. 4.15, г)
было объяснено уменьшением числа контактов Cd—Cd в ре-
зультате упорядочения. (По-видимому, определенная направ-
ленность связей наблюдается и в структурах Sc, Y и в гекса-
гональных модификациях редкоземельных элементов с отноше-
нием осей, меньшим чем 1,63; например, с: а» 1,57 для Y, Но,
Ег и Тт.)
Совершенно другую структуру имеет обычная а-модифика-
ция кристаллической ртути. Эту ромбоэдрическую структуру
можно получить путем искажения простой кубической кладки,
при котором углы между осями уменьшаются от 90 до 70,5°.
У каждого атома шесть ближайших соседей па расстоянии
444 29. Металлы и сплавы
2,99 А и еще шесть — на расстоянии 3,47 А. К этой же струк-
туре можно прийти и другим путем — при сжатии КПУ вдоль
объемной диагонали, в результате чего получается ромбоэдри-
ческая решетка, которую можно описать двумя способами (ср.
с рис. 6.3 в разд. 6.1, т. 1):
Z=a\: a = 2,99A, a = 70,5°
или
Zt=4: а==4,58А, а. = 98°
Другую модификацию ртути (|3-форму) получают под дав-
лением; эта модификация устойчива ниже 79 К- Ее решетка —
объемноцентрированная тетрагональная — получается при сжа-
тии КПУ вдоль ребра куба, в результате чего ближайшими со-
седями каждого атома оказываются два атома на расстоянии
2,83 А; имеется еще восемь более удаленных соседей на расстоя-
нии 3,16 А [1]. Такую же структуру имеют сплавы Cd-Hg с со-
держанием ртути 37—74 ат. %.
При атмосферном давлении структура алюминия при всех
температурах представляет собой кубическую плотнейшую упа-
ковку. Сообщалось, что при повышенном давлении происходит
частичный переход структуры в ГПУ. Примечателен тот факт,
что /пл алюминия лишь на 8° выше, чем магния; обычно при
возрастании номера группы (для элементов второго периода и
элементов А-подгрупп) происходит более существенное повыше-
ние температур плавления (в °С):
Li Be В С
178 1285 2300 3500
Na Мд Л1 Si
97 650 658 1410
К
64
Са Sc Ti
845 1540 1675
Галлий, индий и таллий имеют совсем разное строение.
В обычной модификации галлия окружение каждого атома со-
ставляют атомы на расстояниях 2,47 А (один атом), 2,70 (два),
2,74 (два) и 2,79 А (два). Существуют также три модификации
высокого давления, но их структуры требуют уточнения [2].
Особенность галлия состоит не только в его низкой температуре
плавления (около 30°С), но и в ассоциации атомов в пары
(в структуре обычной модификации). Оказалось, что кривая
рассеяния рентгеновских лучей жидким галлием отличается от
таковой для жидкого металла с обычной плотной упаковкой
(например, для ртути), что заставляет предположить существо-
вание пар Ga2 и в жидкости. Кристаллический индий имеет тет-
рагональную структуру, лишь незначительно отличающуюся от
КПУ; каждый атом имеет четырех соседей па расстоянии 3,25 А
29.1. Структуры простых веществ 445
Таблица 29.2. Межатомные расстояния (до ближайших соседей)
в структурах простых веществ (А)
Си
2,55
Ag
2,SS
Аи
2,88
Zn Ga Ge As
2,66 2,70(°) 2,44 2,51 A
Cd
2,97
H?
2,99
соседей.
6
a Среднее значение для 7 (Ga), 12 (In) и 6 (белое Sn) расстояний до ближайших,
п.
Серое о.в.ово.
и еще восемь —на расстоянии 3,38 А. Структура таллия соот-
ветствует ГПУ (при высоких температурах, возможно, возникает
объемноцентрированная кубическая кладка), тогда как свинец
Рис. 29.2. Кристаллическая структура белого олова; координационный поли-
эдр атомов в виде искаженного октаэдра.
кристаллизуется с образованием КПУ, а при высоком давле-
нии— с образованием ГПУ.
Плотпоупаковапные структуры индия, таллия и свинца стоят
особняком среди других металлов с плотпейшей упаковкой ато-
мое. Как можно видеть из табл. 29.2, межатомные расстояния
в структурах этих трех металлов намного больше, чем в струк-
турах соседних с ними элементов. Увеличения расстояний мож-
но было бы ожидать в связи с возрастанием координационного
числа, по расстояния здесь намного больше, чем в плотноупако-
вапных структурах серебра и золота. В то же время интервалы
изменения межатомных расстояний в рядах от Си до As и от
Ag до Sb достаточно узки (если исключить индий и белое оло-
во). Значение 2,80 А для олова в табл. 29.2 относится к серой
446 29. Металлы и сплавы
модификации олова с алмазоподобной структурой. При обычных
условиях более устойчива белая модификация, имеющая менее
симметричную структуру, чем серая. В белом олове (рис. 29,2)
у каждого атома 4 ближайших соседа на расстоянии 3,02 А,
образующих сильно сплющенный тетраэдр, и еще 2 на расстоя-
нии 3,18 А. Четыре ближайших соседа находятся на большем
расстоянии, чем четыре ближайших соседа в сером олове
B,80 А); зато в структуре белого олова имеются еще четыре
атома олова па расстоянии 3,77 А и восемь атомов на расстоя-
нии 4,41 А, тогда как в серой модификации следующие по уда-
ленности соседи A2 атомов) находятся на расстоянии 4,59 А.
Поэтому белое олово, хотя и является высокотемпературной
формой, имеет более высокую плотность G,31 г/см3), чем серое
E,75 г/см3). О белом и сером олове [3] см. также в разд. 3.10.3
(т. 1). Подтверждением различия валентных состояний атомов
олова в двух модификациях служит тот факт, что после раство-
рения белого и серого олова в конц. НС1 из полученных раство-
ров выделяются различные соединения — SnCl2-2H2O и SnCl4-
• 5Н2О соответственно [4].
При высоком давлении A20 кбар) германий, являющийся
полупроводником, превращается в хорошо проводящую форму со
структурой белого олова [5]. После снятия давления при ком-
натной температуре происходит переход в другую (тетрагональ-
ную) модификацию высокого давления, строение которой пока-
зано на рис. 3.41, г (т. 1, разд. 3.10.4). Эта модификация при-
мерно на 11% более плотная, чем обычный кубический герма-
ний E,91 и 5,33 г/см3). Длина связи в этой модификации
B,48 А) почти такая же, как в кубическом Ge, но интервал из-
менения углов между связями довольно широк (от 88 до 135°)
[6]-
Вероятно, в структурах таллия, свинца (и, возможно, индия)
атомы ионизированы лишь частично, например с образованием
Т1+ и РЬ2 -. Особая устойчивость пары s-электронов во внешней
оболочке атомов этих элементов уже отмечалась в гл. 26.
Литература. [1] J. Chem. Phys., 1959, 31, 1628. [2] Ada crvst 1969 B24 995-
рь72' B?&i9ol: 'S Br29' 367- m РГОС- КоУ- Soc- 1963> A 272,'5O3. [4| J. Chem'.
Phys., 1956, 24, 1009. [51 Sci., 1963, 139, 762. [6] Acta cryst, 1964, 17, 752.
29.1.4. Переходные элементы и элементы IБ подгруппы (класс
4). В эту группу, содержащую более чем 50 элементов (вклю-
чая 4/- и 5/-элементы), входит большинство металлов. В то вре-
мя как для некоторых металлов, а именно для Mg, Zn, Cd, Sc,
Y, Ru, Rh, Pd, Os, Ir и Pt, известно лишь по одной кристалличе-
ской модификации, большая часть металлов претерпевает струк-
турные превращения при изменении температуры и (или) давле-
ния. Кроме того, остаются определенные неясности в отношении
29.1. Структуры простых веществ 447
Таблица 29.3. Кристаллические структуры металлов при комнатной температуре
Li (Be
К (Со.
Al
(ft) Г V Vcr J Mn* fFe
(jU^) ® © © (j^(Uo) @ (Ru
Fr I Raj Ac
4f-металлы
(Co)
Rh
Ir
Ni
Pd
Pt
Cu
Ag
Au
Се
(Gch (Tb) (Du) (HoWEr) (im)
5f-металлы: См. текст.
Эта таблица должна в первую очередь продемонстрировать широкую распро-
страненность ОЦК и плотноупакованных структур.
Плотноупакованные
структуры
оцк Q
гк
* Сложная структура, описанная в тексте. Некоторые металлы характеризуются
более сложным поведением, обсуждаемым в тексте (например, Мп, W, 4/- и 5/-метал-
лы, табл. 29.4); а) структура типа ГПУ, приписывавшаяся хрому, полученному электро-
осажденисм. как оказалось, относится к СгН (т. 2. разд. 8.2.3); б) Sm обычно кристал-
лизуется в виде плотнейшей упаковки с последовательностью слоев кгг; в) для La опи-
сана также структура типа КПУ; промежуточная ГПУ-форма Yb B60—720 °С), по-види-
мому, стабилизируется примесями. Литературу по структурам металлов с ОЦК и ПУ
см. в J. Am. Chem. Soc, 1963, 85, 1238.
структур особых форм металлов, например напыленных или
электроосажденных в виде тонких пленок. По этой причине
в табл. 29.3 указаны лишь структуры металлов, устойчивые при
обычных температуре и давлении; полиморфизм некоторых эле-
ментов обсуждается в тексте. За несколькими исключениями,
металлы кристаллизуются в одном (или более чем одном) из
трех структурных типов, представляющих собой гексагональную
и кубическую плотнейшую упаковку и объемноцентрированную
кубическую кладку.
448 29. Металлы и сплавы
Простейшие из плотнейших упаковок — гексагональная н ку-
бическая — были подробно рассмотрены в гл. 4. На рис. 29.3 эти
две упаковки, а также кубическая объемноцептрированная клад-
ка показаны в обычно принятой ориентации. В смежных элемен-
тарных ячейках изображена только часть атомов, необходимая
для того, чтобы показать полное окружение одного из атомов
ближайшими соседними. Объемноцентрированная кубическая
кладка имеет несколько меньшую плотность, чем ГПУ и КПУ:
а
Рис. 29.3. Три наиболее распространенные структуры металлов, а — кубиче-
ская плотнейшая упаковка; б — гексагональная плотнейшая упаковка; в —
объемноцентрированная кубическая структура.
эффективный объем, приходящийся на атом (с радиусом а),
для нее составляет 6,16 а3, а для плотноупакованных структур —
¦ 5,66 а3. В последних каждый атом окружен на равном расстоя-
нии двенадцатью ближайшими соседями, а расстояние до сле-
дующих соседей уже на 41% больше.
Обычно объемноцентрированную кубическую структуру име-
ют высокотемпературные модификации металлов, которые при
более низких температурах образуют плотнейшую упаковку.
Для многих металлов температура перехода лежит выше ком-
натной (Са, Sr, La, Се и др., Tl, Ti, Zr, Hf, Th, Mn) и лишь для Li
и Na она ниже G8 и 36 К соответственно). В объемноцептриро-
ванной кубической структуре у каждого атома восемь равноуда-
ленных ближайших соседей, но шесть следующих соседей нахо-
дятся на расстоянии, только на 15% превышающем ближайшее.
Если пренебречь этим небольшим различием или принять более
фундаментальное определение координационного числа, основан-
ное на полиэдрических областях атомов (т. 1, разд. 3.3.1), мож-
но считать координационное число в этой структуре равным 14.
Обратим внимание на то, что при сжатии или растяжении такой
структуры вдоль одной из осей 4-го порядка получается объем-
ноцентрированная тетрагональная решетка; при отношении
осей, равном ]/2/з или У2, число ближайших соседей становится
равным 10 или 12 соответственно (ср. со структурой Ра в
разд. 4.1.2, т. 1). В последнем случае решетка превращается
в гранецентрированную кубическую, т. е. возникает КПУ.
29.1. Структуры простых вещее гк
449
Остановимся на двух особенностях табл. 29.3. Во-первы.ч,
обращает на себя внимание центральная группа объемноцентри-
роваппых кубических структур, в которую входят V, Nb, Та, Сг,
Мо и W, а при учете высокотемпературных форм также Ti, Zr
и Hf (выше 882, 865 и 1995°С соответственно). При комнатной
температуре и высоком давлении Ti и Zr переходят в гексаго-
нальные модификации, в структуре которых одна треть атомов
имеет КЧ 14 (гексагональная призма с шапками над шести-
угольными гранями), а две трети — КЧ 11 (тригональная приз-
ма с шапками над всеми гранями). Во-вторых, одна и та же
последовательность типов структур наблюдается для ряда эле-
ментов от Zr до Ag и от Hf до Аи, а для Зё-элементов последо-
вательность более сложна. Сложный полиморфизм марганца
кратко рассмотрен ниже; железо также имеет свою особен-
ность. Обычно полиморфная модификация при данном давлении
устойчива только в одном интервале температур. В случае же-
леза объемноцентрировапная кубическая структура стабильна
по обе стороны температурного интервала, где устойчива моди-
фикация с кубической гранецентрировапной решеткой
(разд. 29.7). Еще более сложным образом ведет себя кобальт.
При температурах выше 500°С его структура соответствует
КПУ, но при охлаждении он становится частично гексагональ-
ным. Возникает случайная последовательность слоев (вместо
закономерного чередования АВАВ... или АВСАВС...). Так, в ти-
пичном образце «гексагонального плотноупакованного» кобаль-
та при комнатной температуре вероятность того, что слон по-
следовательности, взятые через один, относятся к одному типу
(А пли В), оказывается меньше единицы; для одного из образ-
цов это значение оказалось равным 0,90.
Марганец. Обычная а-форма марганца имеет сложную куби-
ческую структуру (Z = 58), которая рассмотрена ниже
(разд. 29.6.3). В 6-марганце (устойчив в интервале 727 —
1095 СС, по при быстром охлаждении структура может сохра-
няться и при комнатной температуре) присутствуют два сорта
атомов, отличающихся характером окружения, причем для ато-
ма любого сорта имеется 12 ближайших соседей па расстояниях
от 2,36 до 2,67 А.
При 1095°С появляется -у-форма. Быстро охлажденный обра-
зец имеет тетрагональную структуру (искаженная форма КПУ),
устойчивую при высокой температуре. При 1134°С происходит
очередное превращение и образуется кубическая объемноцентри-
рованная структура, устойчивая вплоть до температуры плавле-
ния A245°С).
Вольфрам. Обычно рассматривают кубическую объемноцент-
рированную а-форму этого металла, хотя уже давно известна
вторая форма — C-модификапия, которая, по-видимому, устойчи-
29—1284
450
29. Металлы и сплавы
ва при температуре 650°С. Ее приходится получать химически-
ми методами, например путем восстановления оксида при тем-
пературах ниже 650 °С, так как выше этой температуры она не-
обратимо, хотя и медленно, превращается в a-W. По мнению
некоторых исследователей, «p-W» в действительности представ-
ляет собой не полиморфную модификацию металла (разд. 12.7.3),
а оксид W3O [1]. С другой стороны, было показано, что можно
6
Рис. 29.4. а — структура «^-вольфрама». Показано координационное окруже-
ние атомов двух сортов. У атомов первого сорта (заштрихованные кружки)
имеется по 12 равноудаленных соседей, у атомов второго сорта (светлые
кружки)—по шесть ближайших соседей; б — расположение четырех ближай-
ших соседей в координационном окружении атомов в структуре металлическо-
го а-урана.
получить фазу p-W, содержащую менее 0,01 атома О па атом
W [2]. В любом случае удобно называть структуру, показанную
па рис. 29.4, а, структурой p-W. Такую структуру имеет ряд ип-
терметаллическнх соединений и силицидов, например NiVs,
GeV3, SiV3 и SiCr3.
4\-Металлы (редкоземельные элементы или лантаноиды).
Для всех этих металлов, за исключением Рт, известны поли-
морфные модификации (до четырех разных форм, устойчивых
в различных интервалах температур и давлений). При обсуж-
дении 4/-элементов в гл. 28 уже отмечалось необычное химиче-
ское поведение металлов, расположенных непосредственно перед
Gd и Lu. Металлические европий и иттербий также выпадают
из общей закономерности. Большинство структур 4/-металлов
при обычной температуре соответствует плотнейшей упаковке
типа г или г/с, однако Sm имеет девятислойную упаковку типа
/егг [3]. Ей имеет кубическую объемноцентрированпую структу-
ру, а структура Yb представляет собой КПУ.
Металлические радиусы атомов 4[-элементов в целом моно-
тонно уменьшаются от —1,82 А (Рг) до 1,72 A (Lu), но радиусы
29.1. Структуры простых веществ 451
Пи B,06 А) и Yb A,94 А) оказываются гораздо больше, вероят-
но, из-за перехода одного электрона па внутреннюю орбиталь.
Чрезвычайно интересно поведение Yb под давлением [4]. При
давлении 20 кбар металл превращается в полупроводник, а при
повышении давления до 40 кбар он снова становится металличе-
ским проводником. Этот последний переход сопровождается
структурным превращением (ГЦК переходит в ОЦК), т. е. ко-
ординационное число изменяется от 12 до 8 + 6 при одновремен-
ном уменьшении объема на 3,2%- Радиус атома Yb в ОЦК-
структуре 1,75 А (для ГЦК структуры 1,82 А) значительно
меньше, чем для обычной формы Yb(II) A,94 А), и укладывает-
ся на кривую для других 4/-металлов М(П1). Это показывает,
что переход при высоком давлении соответствует превращению
Yb (II) в Yb (III). При понижении температуры давление, не-
обходимое для осуществления этого перехода, возрастает. По-
другому ведет себя Се. Под действием высокого давления он пе-
реходит из одной ГЦК-структуры в другую, причем при пони-
жении температуры давление перехода снижается (при 109 К
давление равно 1 атм). Сопровождающее этот переход уменьше-
ние объема на 16,5% приписывают переходу 4/-электрона на
связывающую орбиталь. Обе ГЦК-фазы при низких температу-
рах могут сосуществовать; при 90 К параметры решетки равны
5,14 и 4,82 А [5].
5f-Металлы (актиноиды). Элементы от Th (КПУ) до Am
(плотнейшая упаковка типа ABAC.) в виде простых веществ
отличаются весьма сложным поведением. Для них обычен поли-
морфизм (у Ри шесть модификаций), но, кроме того, многие
элементы кристаллизуются в своем особом структурном типе.
Это справедливо для объемноцентрировапной тетрагональной
структуры протактиния (разд. 4.1.2), в которой у каждого атома
десять практически равноудаленных соседей, а также для
структур a-U, p-U, a-Np, |3-Np и y-Pu.
Для урана известны три модификации:
a-\J F60 °С) p-U G60 °С) у-U
ромбический тетрагональный ОЦК
Структуру a-U можно представить как сильно искаженную гек-
сагональную плотнейшую упаковку, в которой у каждого атома
лишь четыре ближайших соседа — два на расстоянии 2,76 А и
еще два на расстоянии 2,85 А. Окружение атома весьма необыч-
но: четыре соседа лежат па двух перпендикулярных плоскостях,
занимая четыре из пяти вершин тригоналыюй бнпирамиды
(рис. 29.4, б); дополнительные сведения об этой структуре см.
в разд. 29.3. По-видимому, у p-U структура типичного металла
с высоким КЧ A2 или больше), однако относительно деталей
структуры все еще имеются расхождения.
452
29. Металлы и сплавы
-b
^Ь
У нептуния наблюдается некоторое сходство с ураном:
a-Np B78 °С) (i-Np E40 °С) 7"NP
ромбический тетрагональный ОЦК C)
В a-модифнкацпп у каждого атома только четыре ближайших
соседа. У одной половины атомов расположение соседей такое
же, как в u-U, а у другой половины четыре соседа занимают од-
ну аксиальную и три экваториальные
^ вершины тригопальной бипирамиды. В-
структуре |3-модификации каждый атом
также образует по четыре сильные свя-
зи; однако в данном случае у половины
атомов ближайшие соседи располагают-
ся по вершинам деформированного тет-
раэдра, а у другой половины — по вер-
шинам основания сильно сплющенной
тетрагональной пирамиды.
Как уже отмечалось, особенностью
плутония является наличие у него шести
полиморфных модификаций. а-Форма
имеет сложную моноклинную структуру,.
содержащую 8 сортов неэквивалентных
атомов, каждый из которых образует ряд
коротких связей B,57—2,78 А) и ряд бо-
лее длинных C,19—3,71 А) (ср. со струк-
турами a-U, a-Np и p-Np), в результате
чего КЧ достигает 12—16. Три четверти
атомов имеют по 4 коротких и 10 длин-
ных связей, одна восьмая — по 3 корот-
ких и 13 длинных, а остальные атомы — по 5 коротких и 7 длин-
ных связей. У р-формы также сложная моноклинная структура
(Z = 34, имеется 7 сортов неэквивалентных атомов); координа-
ционные числа лежат в пределах 12—14; не прослеживается
явного сходства с а- или уФ°Рмами- В 7"Ф°Рме (рис. 29.5)
у атома Ри десять ближайших соседей: на расстояниях 3,026 А.
D атома), 3,288 А D атома) и 3,159 А B атома). Три высоко-
температурные модификации имеют намного более простые
структуры (табл. 29.4), причем структура б'-модификацин явля-
ется слегка искаженным вариантом б-формы.
По данным двух работ, металлический Am имеет структуру
с упаковкой типа гк, однако приведенные значения плотности
и параметров элементарных ячеек существенно отличаются друг
от друга (табл. 29.4). Хотя данные по менее плотной форме не
были воспроизведены в более позднем исследовании, не исклю-
чено, что, как и в случае Се, существуют две формы металла
с одним и тем же типом структуры. Для кюрия структура с
упаковкой типа гк также не была подтверждена дальнейшими.
Рис. 29.5. Кристалличе-
ская структура ч-плуто-
ния; показаны координа-
ционное окружение ато-
ма А и его проекция на
основание элементарной
ячейки.
29.1. Структуры простых веществ 453
Таблица 29.4. Кристаллические структуры 5/-металлов
Элемент
Кристаллическая структура
Литература
Ра
U
Np
Pu
Am
Cm
Bk
-16)
Объемноцентрированная тетраго-
нальная, КЧ 10: 3,21 А (8 ато-
мов) и 3,24 А B атома)
ГЦК (КЧ 12, 3,55 А)
Ромбическая (тип А20) I
Тетрагональная (Z= см. текст
-30) J
ОЦК (U—U 3,01 А)
Ромбическая |
Тетрагональная \ см. текст
Кубическая (ОЦК?)
Моноклинная (КЧ 12
Моноклинная (КЧ 12—14)
Гранецентрироианная ромбическая
(КЧ 10)
ГЦК (Pu—Pu 3,28 А
ОЦК (Ри—Ри 3,15 А)
Объемноцентрированная тетраго-
нальная
ГЦК и гк (плотность 13,67 г/см3,
г= 1,73 А)
гк (плотность 11,87 г/см', г =
= 1,82 А)
ГЦК (плотность 19,2 г/см3 г —
= 1,55 А)
гк (плотность 13,5 г/см', г=!,74А)
ГНК (КЧ 12, 3,53 А)
гк (КЧ 12: 3,416 А F атомов),
3.398 А F атомов))
Acta eryst., 1965, 18, 815
Inorg. Nucl. Chem. Lett.. 1971,
7, 977
Acta cryst., 1970, B26, 129
Acta cryst., 1971, B27, 1740
Acta cryst., 1952, 5, 660, 664
Acta crvst., 1963, 16, 777
Acta cryst., 1963, 16, 369
Acta cryst., 1955, 8, 431
J. Chem. Phys., 1955, 23, 365
TAIME", 1956, 206, 1256
J. Inorg. Nucl. Chem., 1962. 24.
1025
J. Am. Chem. Soc, 1956, 78. 2340
J. Chem. Phys., 1969, 50, 5066
J. Inorg. Nucl. Chem., 1964, 26,
271
J. Inorg. Nucl. Chem., 1971. 33,
3345
TAIME — Transactions of the American Institute of Mining and Metallurgical
Engineers.
исследованиями; различие плотности двух форм (с плотпоупа-
кованными структурами) представляется весьма неожиданным.
Литература. [1] J. Phys. Chem., 1956, 60, 1148. [2] Z. anorg. allg. Chem., 1957,
293, 241. [3] Acta cryst., 1970, B26, 1043. [4] Inorg. Chem., 1963, 2, 618. [51 J.
Chem. Phys., 1950, 18, 145.
29.1.5. Элементы подгрупп IA u IIА (класс 5). Структуры метал-
лов этого класса не нуждаются в подробном обсуждении.
В обычных условиях щелочные металлы имеют ОЦК-структуры.
При холодной обработке лития при низких температурах наблю-
454 29. Металлы и сплавы
дается переход с образованием КПУ; Li и Na самопроизвольно
превращаются в ГПУ при охлаждении ниже 76 и 36 К соответ-
ственно. У всех щелочных металлов, за исключением Na, име-
ются модификации высокого давления. При обычных условиях
структуры Be, Mg, Са и Sr представляют собой ГПУ, а Ва и Ra
имеют ОЦК-структуру. Для Mg полиморфизм не наблюдался;
Ва, Са и Sr при высоких температурах приобретают ОЦК-струк-
туры, а у Sr в промежуточном температурном интервале 213—
621 °С устойчива КПУ. Сообщалось о фазовых переходах Be,
Са и Ва под действием высокого давления.
29.2. Межатомные расстояния в металлах,
металлические радиусы
.Межатомные расстояния в металлах интересны не только са-
ми по себе, но и как источник значений металлических радиу-
сов, используемых при обсуждении структур сплавов. Посколь-
ку для металлов наиболее обычно КЧ 12, принято приводить
стандартный набор радиусов именно для этого координационно-
го числа. В структурах металлов с идеальной плотпейшей упа-
ковкой радиус вычисляется просто как половина расстояния от
атома до любого из двенадцати равноудаленных соседей. Од-
нако во многих структурах имеются небольшие отклонения от
идеальной гексагональной упаковки, так что расстояние до
шести соседей несколько больше, чем до шести других, напри-
мер:
Be
Y
a-Zr
Отношение
с : а
1,5848
1 ,588
1,589
G атомон
2,2235
3,595
3,166
Расстояние, Л
П атомов
2 2679
3,663
3,223
Среднее
2,25
3,63
3,19
В таких случаях берут среднее значение из двух расстояний.
(Это не относится к структурам цинка и кадмия, очень сильно
отличающимся от плотнейших упаковок, что видно из отношения
с/а 1,856 и 1,885 соответственно.) Если в структуре металла
координационное число оказывается меньшим, то радиус, соот-
ветствующий КЧ 12, получают другими способами. В результа-
те сравнения межатомных расстояний во многих металлах и
сплавах Гольдшмидт обнаружил, что для данного металла
кажущийся атомный радиус находится в определенной зависи-
мости от координационного числа. Получены следующие отно-
29.2. Межатомные расстояния в металлах 455
сительпые значения радиусов для различных координационных
чисел:
КЧ 12 8 6 D)
Радн;,с 1,00 0,97 0,96 @,88)
Например, чтобы вычислить радиусы атомов щелочных метал-
лов для КЧ 12, половину межатомного расстояния в ОЦК-струк-
туре умножают па 1,03. Этот коэффициент, равный 25/6/3! 2, вы-
водится из предположения, что при переходе КЧ от 8 к 12
изменения объема не происходит (см. разд. 29.1.4). Для некото-
рых элементов Б-подгрупп, в структурах которых реализуются
очень низкие координационные числа (например, Ge, Sn), си-
туация более сложна. В этих случаях в связи с резким измене-
нием КЧ использование коэффициентов, приведенных выше,
оказывается не совсем корректным, поскольку характер связи
также меняется (например, в структурах типа алмаза связи,
вероятно, по характеру ближе к ковалептпым, чем к чисто ме-
таллическим). Для таких элементов вычисление атомных радиу-
сов, соответствующих КЧ 12, осуществляют двумя методами.
Многие из этих элементов образуют сплавы с типичными ме-
таллами, причем в структуре сплавов оба элемента имеют вы-
сокие координационные числа. Для таких сплавов, используя
межатомные расстояния, оказывается возможным определить
радиус элемента Б-подгруппы, например радиус сурьмы из рас-
стояний Ag—Sb в сплаве Ag3Sb (ГПУ) или радиус германия из
расстояний Си—Ge в сплаве Cu3Ge (ГПУ). Ограничения этого
метода связаны с тем, что в подобных соединениях связи могут
иметь не чисто металлический характер, и, кроме того, предпола-
гается, что радиусы, например, атомов серебра в сплаве Ag3Sb и в
металлическом серебре одинаковы. Еще один метод определения
радиуса элемента Б-подгруппы основан па изменении парамет-
ров решетки твердых растворов этого элемента в типичном ме-
талле при изменении концентрации. В предположении линейной
зависимости между параметрами ячейки и концентрацией раст-
воренного элемента проводят экстраполяцию и получают пара-
метры ячейки гипотетической формы (с КЧ 12) элемента
Б-подгруппы (следовательно, и межатомное расстояние в ней).
К сожалению, указанная зависимость не всегда является ли-
нейной, что приводит к необходимости пользоваться эмпириче-
скими соотношениями. Кроме того, не исключено, что природа
металла-растворителя оказывает влияние на радиус атомов
растворенного элемента, так как степень ионизации атомов
элемента в его сплавах разного состава может различаться. Тем
не менее для многих элементов оказалось возможным получить
соответствующие КЧ 12 значения радиусов, которые использу-
456 29. Металлы и сплавы
Таблица 29.5. Металлические радиусы для КЧ 12 (А)
Li Be
1,57 1,12
Ха iMg Ai
1,91 1,60 1,43
К Са S_ V< V Cr Mn Fe Co Ni Cu Zn Ga Ge
2,35 1,97 1,6; 1/.7 1,35 1,29 1,37 1,26 1,25 1,25 1,28 1,37 1,53 1,39
Rb Si- Y Ъ \b Mo Tc Ru Rh Pd Ag Cd In Sn Sb
2,50 2,15 1,82 1,60 , 47 1,40 1,35 1,34 1,34 1,37 1,44 1,52 1,67 1,58 1,61
Cs Ba La Hf T;i W Re Os Ir Pt Au Hg Tl Pb Bi
2,72 2,24 1,88 1,59 1,4? ',4i 1,37 1,35 1,36 1,39 1,44 1,55 1,71 1,75 1,82
4?-элементы: Се A,82) — Lu A,72), но Ей B,06), Yb A,94)
Sf-элементы
Th
1,80
Pa
1,63
U
i .56
\b
1,56
Pu
1,64
Am Cm
(См. табл. 29.4)
ют при рассмотрении структур сплавов. Эти величины радиусов
приведены в табл. 29.5.
На рис. 29.6 по оси ординат отложены значения межатомных
расстояний в простых веществах, а по оси абсцисс—атомный
помер. Вид этой зависимости позволяет отметить ряд интерес-
ных моментов. В целом ясно видна периодичность; вместе с тем
оказывается, что по мере возрастания атомного номера не про-
исходит общего увеличения размеров атомов. Например, атом
Th (Аг = 90) не намного больше, чем атом Li (Лг = 3), и заметно
меньше, чем атом I\a (jV = 11); это следствие более сильного
притяжения электронов в атомах более тяжелых элементов из-
за увеличения заряда ядра. Вторая особенность состоит в том,
что, хотя атомы переходных элементов и элементов Б-подгрупп
второго длинного периода больше по размеру, чем атомы эле-
ментов первого длинного периода, аналогичного увеличения
размеров не происходит при переходе от второго к третьему
длинному периоду. Можно сравнить, например, атомные диа-
метры Си B,551 A), Ag B,883 А) и Аи B,877 А). Ранее мы уже
говорили о лантаноидном сжатии и о являющейся рпэ следстви-
ем чрезвычайной близости химических свойств пар элементов
Zr и Hf, Nb и Та. Атомные радиусы 4/-элементов по мер- запол-
нения 4/-оболочки уменьшаются от 1,82 А (Се) до 1,72 A (Lu)
(исключением являются имеющие гораздо большие радиусы
атомы Ей и Yb, см. «4/-Металлы» в разд. 29.1.4). Изменению
"-1 с
5 ^
% i
5j Q. 1, t
^. r< t-'- ?
f m
-л
is
H n-
1
к
1
458 29. Металлы и сплавы
атомных радиусов в длинных периодах с минимумом вблизи
триад VIII группы соответствуют максимумы или минимумы
ряда физических свойств — сжимаемости, прочности на разрыв,
твердости и температуры плавления. По мнению Полипга, если
в карбопилах, ферроцианидах и других комплексных ионах атом
такого элемента, как железо, может использовать незанятые
Зй?-орбитали наряду с орбиталями валентной оболочки, то ана-
логичная ситуация может осуществляться и в металле. В пред-
положении что у атомов элементов первого длинного периода
для образования связи доступны 3d-, 4s- и 4р-орбитали (всего
их девять), максимальное число связей должно образоваться
при наличии у атома девяти электронов. Такое число электронов
в первом, втором и третьем длинных периодах имеют атомы Со,
Rh и 1г соответственно. У атомов предшествующих им элемен-
тов число используемых электронов меньше девяти, а у атомов
последующих элементов число электронов больше числа до-
ступных орбиталей. Полинг подверг теоретическому анализу
природу связи во многих металлах и некоторых сплавах и ее
влияние на длины связей в кристаллах. Ниже кратко изложена
его теория резонанса в применении к структурам металлов.
29.3. Теории металлической связи*
В традиционной теории металлического состояния, развившейся
нз предшествующей теории электронного газа Друде и Лорен-
ца, методы волновой механики распространены на рассмотрение
поведения электрона в трехмерном периодическом поле, перио-
дичность которого соответствует кристаллической решетке.
Возможные состояния электронов описываются в терминах
разрешенных энергетических полос (зон), отделенных друг от
друга интервалами запрещенных энергий. Эта теория дает
удовлетворительную картину поведения обычных проводников,
полупроводников и изоляторов. Теория успешно применяется
при расчетах таких свойств ряда металлов, как размеры и энер-
гия решетки, сжимаемость (при задании только типа кристал-
лической структуры, например ГЦК). Однако она не дает объ-
яснения механических свойств вне пределов эластичности, по-
скольку в этом случае проявляется зависимость от вторичной
структуры (мозаичность, дислокации и т. д.). Мы не собираемся
более подробно излагать кваптовомеханическую теорию метал-
лов. Подчеркнем лишь, что в зонной теории совокупность
электронов рассматривается как целое первоначально в простом
* Общим вопросам физики и химии металлов и сплавов посвящено учеб-
ное пособие: Соколовская Е. М., Гузей Л. С. Металлохимия. — М: Изд. МГУ,
1986. — Прим. перев.
29.3. Теории металлической связи 459
трехмерном периодическом поле, а затем в поле, модифициро-
ванном в предположении, что в окрестности атома волновые
функции имеют ту же симметрию, что и функции (s, p и d)
свободных атомов. Волновая функция каждого электрона рас-
пространяется па весь кристалл, и в этом смысле зонную тео-
рию металлов можно сравнить с теорией молекулярных орби-
талей в применении к молекулам, хотя, как известно, практиче-
ски оказывается невозможно оперировать истинными
молекулярными орбиталями. Аналогией теории валентных свя-
зей была бы теория металлов, в которой связи атома металла
с его соседями рассматривались бы исходя из электронной
структуры атома, а кристалл в целом представлялся бы как
совокупность атомов, соединенных локализованными связями.
Полинг [1] придерживается точки зрения, согласно которой
между металлическими и обычными ковалентными связями пет
существенного различия (впервые эту мысль высказал Гольд-
шмидт в 1928 г.). Однако в металлических кристаллах в отли-
чие от обычных кристаллов с ковалентными связями, как
правило, реализуются очень высокие координационные числа.
Более того, в таких металлах, как натрий, для образования
8+6 связей в ОЦК-структуре доступны только четыре орбитали
(одна s и три р). Полинг предположил, что в образовании свя-
зей участвуют все или большинство внешних электронов атома,
включая d-электроны в случае переходных металлов, и что
существует особый тип резонанса (см. ниже). Из этих положе-
ний следует, что кратность связи и валентность могут быть
дробными величинами. Уменьшение размеров атомов в ряду К,
Са, Sc, Ti, V (аналогично от Rb к Nb и от Cs к Та) и пример-
ное постоянство размеров атомов для элемента V—VIII групп
в каждом ряду переходных металлов объясняется следующим
образом. При переходе от К к V происходят увеличение числа
связывающих электронов от 1 до 5 и постепенный рост числа
ковалентных связей, участвующих в резонансе, и, следователь-
но, монотонное уменьшение межатомных расстояний. Далее
предполагается, что у атомов элементов от Сг до Ni в связыва-
нии участвуют не все девять имеющихся орбиталей (одна s,
три р и пять d), а лишь 5,78 из них являются устойчивыми
связывающими spd-орбиталями, еще имеются 2,44 атомной пе-
связывающей (/-орбитали, а оставшиеся 0,78 металлической ор-
битали обеспечивают несинхронный резонанс между отдельными
валентными связями. Эти значения были вычислены из маг-
нитной восприимчивости (при насыщении) ферромагнитных
железа, кобальта и никеля. Электронные структуры Полингл
для ряда металлов приведены в табл. 29.6. У атомов Сг, Мл
и Fe число d-электронов меньше, чем число орбиталей, так что
спаривания спинов не происходит. Однако у атома Со на 3,12
460 29. Металлы и сплавы
Таблица 29.6. Электронные структуры металлов по Полпнгу
Металл
С Г
Г-"с
Со
Ni
Атомные
та
+
0,22
1 ,22
2 22
3,
(/-орби-
-
0
0
0
22
2,44 0,78
4,22
2,44 1,78
.Магнитный момент,
''в
расчет, j "жепор.
0,22
1,22
2,22
1,66
0,66
2,22
1,61
0,61
О ;")ЩС0 '(Hi'.IO
Э '1С1 К ГрОНОВ
на С1Г/13Ы-
тающих
5,78
5,78
5,78
5,78
5,78
(Хансе число
3t/- и 45-элек-
тронов
6
7
8
9
10
электрона приходится 2,44 орбитали, поэтому количество пар
электронов составляет 0,78, а магнитный момент понижается до
2,44—0,78=1,66 |1В.
Такое представление о постепенном формировании оболочки
За-электронов при переходе от Сг к Ni может объяснить разли-
чие (приводящее, например, к образованию сверхструктуры
в твердых растворах) между такими сходными элементами, как
Fe и Со или Со и Ni. Этот подход можно сравнить с обычно
принятым объяснением магнитных свойств переходных метал-
лов. Например, у атома Ni в среднем 9,39 из десяти внешних
электронов занимают З^-оболочку, а остающиеся 0,61 электрона
занимают 45-оболочку и ответственны за возникновение сил
сцепления. Наличие дефицита в 0,61 электрона в З^-оболочке
порождает магнитный момент такой же величины (в магнето-
нах Бора). В случае Со сцепление обеспечивают 0,61 s-электро-
иа каждого атома; для Fe и Си аналогичная величина составля-
ет 0,22 и 1,00; соответствующие магнитные моменты равны 2,22
для Fe, 1,61 для Со, а медь диамапштил. Различие между ре-
зонансом обычного и металлического типа можно понять на при-
мере серого и белого олова. В сером олове атомы образуют
обычные тетраэдрические 5р3-связи, используя только четыре из
девяти йг'5р3-орбиталей. Отсутствие доступных «металлических»
орбнталей проявляется в существенно неметаллическом харак-
тере кристалла. Предполагается, что в белом олове 14 внешних
электронов атома находятся на восьми из девяти орбиталей—
шесть пар на шести с?55-гибрндных орбиталях и два электрона
на двух остальных орбиталях, оставляя одну орбиталь незаня-
той. Две связи резонируют между шестью возможными поло-
жениями не обязательно синхронно, так как существует еще
металлическая орбиталь. В резонанс вовлечены двухковалепт-
ыый нейтральный атом олова, трехковалентпый ион Sn~ и од-
2.9.,!?. Теории металлической связи 461
поковалептный пои Sn+, и этот резонанс стабилизирует крис-
талл. Стабилизации способствует также энергия обмена одного
.электрона между s- и /7-орбпталямп.
Данные табл. 29.6 показывают, что для переходных метал-
лов Сг, Mn, Fe, Co и Ni валентность равна 5,78; та же величина
валентности предполагается для металлов в рядах Mo—Pel,
W—Pt и U—Ст. Труднее получить значения валентности 5,44,
4,44 и 3,44 для элементов Б-подгрупп I—III групп соответствен-
но. Эти значения найдены в результате интерпретации межатом-
пых расстояний в рамках по сути дела эмпирического уравне-
ния, которое связывает величину металлического радиуса R(n)
для связи порядка п (т. е. с участием п пар электронов) с ра-
диусом для ординарной связи R A):
R{\) —R(n) =0,300 lgn (l)
Для многих металлов значения R(\) были приведены в табли-
цах Полпнга [1]. Значение порядка связи п в общем случае
пецелочисленное. Для структуры с плотнейшей упаковкой, в
которой у каждого атома имеется двенадцать равноудаленных
соседей, n = v/\2, где v — валентность. Например, для формы
циркония со структурой ГПУ я=7з, а для формы
с ОЦК-структурой п=1/2 (без учета шести более удаленных
соседей). Для более сложных структур, в которых" имеются
связи различной длины, валентные усилия атома распределя-
ются по различным связям в соответствии с величинами меж-
атомных расстояний согласно уравнению ZNn = v. Ниже идея
этого метода иллюстрируется на примере урана.
Одна из форм металлического урана имеет ОЦК-структуру,
из которой в предположении и = 5,78 вычисляется R(l) = 1,421 А.
Тогда можно рассчитать порядок связей для отдельных' меж-
атомных расстояний в ромбической а-форме.
N п
2 атома па расстоянии
2,76 А
2,85 А
3,27 А
3,36 А
1,36
0,19 ( ~л
0,14
Подобные расчеты приведены и для FeSi [2] (ему изострук-
турны CrSi, MnSi, ReSi и CoSi). В структуре FeSi у каждого атома
7 соседних атомов другого сорта на расстояниях 2,29 А A атом),
2,34 А C атома) и 2,52 А C атома) и еще 6 соседних атомов
того же сорта па расстоянии 2,75 А (для Fe) пли 2,78 А (для
Si). Однако применение уравнения A) с использованием вели-
чин R{\), полученных для структур металлического железа и
кремния, дает значение валентности AЛ'л) для кремния 6,85
вместо ожидаемого 4. Для получения значения валентности
кремния, равной четырем, оказалось необходимым не учитывать
462 29. Металлы и сплавы
связи атома Si с шестью атомами Si па расстоянии 2,78 А (дли
которых уравнение A) дает порядок связи 0,19); кроме того,
приходится принять валентность железа равной 6 вместо пер-
воначальной величины 5,78, а для связей Fe—Si и Fe—Fe ис-
пользовать различные радиусы атома Fe(VI) па том основании,
что вклад J-электронов в эти связи различен. В дальнейшем
было показано [3], что уравнение Полиига не согласуется с
межатомными расстояниями при К.Ч 12 и 8 для большинства
тех металлов, у которых имеется переход из структуры с плот-
пейшей упаковкой в ОЦК-структуру (отношение расстояний в
этих структурах составляет 1,03 : 1). Поэтому остается неясным,
следует ли использовать это уравнение при обсуждении меж-
атомных расстояний в иптерметаллических соединениях.
В ходе дальнейшего развития теории Полипга были сделаны
попытки интерпретировать дробные валентности как среднее
целочисленных значений; в дополнение к этому была выдвинута
гипотеза об особой устойчивости связей с порядком, равным
простым дробям типа '/г, 7з и т. д. При критике этой теории
указывалось, что в ходе рассмотрения известных эксперимен-
тальных данных делаются допущения, которые не находят ка-
ких-либо независимых подтверждений, и что при наличии
большого числа предположений па основе этой теории до сих
пор не сделаны практически важные обобщения. Сейчас воз-
никла необходимость не в дальнейшем обсуждении различных
структур, а в возможности проводить вычисления физических
свойств фундаментальными неэмпирическими методами. Иными
словами, степень обобщения фактов должна быть достаточно
высокой при минимуме использованных допущений.
Другие авторы попытались развить теорию гибридных свя-
зей так, чтобы учесть частичную направленность металлической
связи. При этом использовалась не только концепция об изме-
няющемся вкладе d-орбиталей, но и представления о частичной.
заселенности гибридных орбиталей [4]. Четыре ориентированные
по тетрагональной пирамиде связи d4 можно рассматривать
как образующие восемь «делокализовапных» связей, направлен-
ных к вершинам куба, в системе с дефицитом электронов (что
сравнимо с л-электронными системами в молекулах с сопряжен-
ными связями). С другой стороны, восемь эквивалентных свя-
зей, направленных к вершинам куба, могут возникать за счет
гибридных тетраэдрических {sd3) или тетрагонально-пирами-
дальных (d4) орбиталей. Шесть более длинных связей в ОЦК-
структуре могут осуществляться за счет делокализованпых гиб-
ридных тригонально-призматических й-орбиталей.
Литература. [1[ J. Am. Chem. Soc., 1947, 69, 542; Proc. Roy. Soc, A 1949 196
343. [21 Ada cryst., 1948, 1, 212. [3] J. Am. Chem. Soc, 1963, 85, 1238 Г41 Proc'
Roy. Soc, A 1957, 240, 145.
29.4. Твердые растворы 463
29.4. Твердые растворы
Одним из характерных свойств металлов является способность
двух (или более) металлов, взятых в определенном соотноше-
нии, при совместном плавлении давать гомогенный раствор.
При охлаждении такой системы образуется твердый раствор, в
котором, как и в жидком растворе, атомы растворенного ве-
щества и растворителя (термин «растворитель» применяют к
металлу, присутствующему в качестве основного компонента)
распределены статистически. Такое распределение двух сортов
атомов металлов всегда получается при быстром охлаждении
расплава (при закаливании). В некоторых твердых растворах
с определенной концентрацией растворенного металла при мед-
ленном охлаждении или при последующей термической обра-
ботке расположение атомов оказывается упорядоченным; мы
кратко рассмотрим некоторые особенности образования таких
сверхструктур. Необходимо уточнить исходное утвержде-
ние этого раздела, так как 1) твердый раствор может дать не
любая пара металлов, 2) если твердые растворы и образуются,
то для каждой конкретной системы они существуют только в
определенном интервале составов; предельными случаями яв-
ляются полная смешиваемость и несмешиваемость. Следует
различать твердые растворы замещения — те, в которых атомы
растворенного вещества замещают некоторые атомы раствори-
теля в структуре последнего, и твердые растворы внедрения,
в структуре которых атомы некоторых легких неметаллических
элементов находятся в пустотах структуры металла. Второй
тип твердых растворов мы рассмотрим в последнем разделе
этой главы. В системах с тремя или более компонентами могут
образоваться структуры, представляющие собой комбинацию
твердых растворов замещения и внедрения. Например, марган-
цевая аустенитпая сталь является твердым раствором замеще-
ния марганца в железе и одновременно твердым раствором
внедрения углерода в структуру (Fe, Mn).
Для образования твердых растворов необходимо выполнение
следующих условий.
1. Склонность к образованию твердых растворов оказывает-
ся невысокой, если металлы химически несхожи. В целом мож-
но сказать, что образование твердых растворов в широком
интервале составов характерно для сочетаний металлов из
групп Ai и Аг (по нашей классификации; см. схему 29.1 в
разд. 29.1), хотя и здесь имеются некоторые ограничения, кото-
рые будут обсуждены ниже, и для сочетаний металлов из одной
и той же подгруппы периодической системы. Так, непрерывный
ряд твердых растворов образуют следующие пары металлов:
464
29. Металлы и сплавы
К—Rb, Ag—Аи, Си—Аи. As—Sb. Mo—W и Ni—Pd. Для эле-
ментов с существенно различающимися электроотрпца1елы1о-
стями, например металла А-подгруппы и элемента одной из
последних Б-подгрупп периодической системы, характерны со-
вершенно различные собственные структуры, и более предпочти-
тельным (благодаря разнице электроотрицательностей) оказы-
вается образование соединения, а не твердого раствора. По
этой причине мы и разделили элементы на группы Ai, Ао, Bi
и В2; ниже мы рассмотрим по очереди типы ннтерметаллических
соединений, образуемых парами элементов из различных групп.
2. При сочетании элементов из одной и той же группы (на-
шей классификации; см. разд. 29.1) ширина области твердых
растворов зависит от соотношения размеров атомов двух типов.
Это естес i г-спио, поскольку статистическое замещение атомов,
в структуре i:a атомы другого ;<аз?,;ерл еомрозож^сгл. иска-
жением структуры и по мере увеличения концентрации атомов
растворяемого вещества происходит изменение параметров ре-
шетки. В первом приближении это изменение параметров нахо-
дится в линейкой зависимости от концентрации (закон Вегар-
да). хотя во многих случаях этот закон соблюдается не очень
точно. В том случае, когда радиусы атомов двух металлов раз-
личаются более чем на 15% (по отношению к радиусу атомов
растворителя), не следует ожидать образования широких
областей твердых растворов. Способность давать твердые
р.'.створы несколько возрастает при повышении температуры,
но их выделение' (затвердевание) осуществляется путем закал-
ки.
галлов, крио
зующн:
л рас-
lera.'i-
структурных типах, применение этого размерного критерия,
осложняется различием координационных чисел в структурах
двух металлов. Однако нам пет необходимости подробно на
этом останавливаться, так как в дальнейшем мы займе-
смотрением твердых растворов металлов со структурами
лического типа, характеризующимися высокими координацион-
ными числами.
3. Между величинами взаимной растворимости металлов
друг в друге нет однозначного соответствия. Юм-Розер.п обна-
ружил, что при прочих равных условиях металл с более пилкой
валентностью растворяет в себе значительно больше металла
с более высокой валентностью, чем наоборот,— «эффект относи-
тельной валентности». Несмотря на то что из этого правила
возможны исключения, оно бывает полезно. Приведенные ниже
значения, являющиеся частью намного более полных данных
Юм-Розери, дают некоторое представление об относительно
резком различии растворимостей даже в тех случаях, когда
размерный фактор достаточно благоприятен.
29.5. Переходы порядок — беспорядок и сверхструктуры
465
Zn в Ag
Ag в Zn
7л\ в Си
Си в 7лл
Растворимость,
ат.%
37,8 (Zn)
6,3 (Ag)
38,4 (Zn)
2,3 (Си)
Теперь перейдем к рассмотрению изменений в структуре,
которые происходят в некоторых твердых растворах замещения
при медленном охлаждении или при отжиге.
29.5. Переходы порядок — беспорядок и сверхструктуры
Некоторые сплавы, выделяющиеся (при закаливании) из жид-
кого состояния в виде твердых растворов, при определенной
термической обработке пли в некоторых случаях просто при
достаточно медленном охлаждении подвергаются структурной
перестройке. Структурные изменения, часто начинающиеся при
температурах на несколько сотен градусов ниже температуры
io
О1
О
i с;
С ;
о i
iOi
•; Г-.
О
——ЧУ1—°—Су
о
О
О'
о
О Си
О Аи О Си
Рис. 29.7. Кристаллическая структура сплава CuAu. а — неупорядоченная; б —
упорядоченная.
плавления, приводят к переходу от статистического расположе-
ния атомов к расположению, характеризующемуся правильным
чередованием в структуре атомов различного сорта. Подобное
структурное изменение происходит, например, при переходе в
сплаве CuAu от статистического твердого раствора (рис. 29.7, а)
к упорядоченной сверхструктуре (рис. 29.7, б).
Упорядоченная структура, представляющая собой несколько
деформированную кубическую плотнейшую упаковку, имеет
более низкую (тетрагональную) симметрию, чем разупорядо-
ченная структура. Структуры, показанные на рис. 29.7, соот-
ветствуют температурам выше 420°С {а) и ниже 380°С (б).
30—1284
466 29. Металлы и сплавы
В промежуточном температурном интервале структура более
сложна — это сверхструктура с десятикратной по объему эле-
ментарной ячейкой. Кроме того, период идентичности сверх-
структуры можно изменить путем добавления третьего элемента
с другой валентностью, поскольку па сверхструктуру оказывает
влияние количество электронов, приходящихся на один атом.
Возможность перестройки с образованием сверхструктуры опре-
деляется тепловой энергией атомов, разницей потенциальных
'Со
0,10 -
200
300 400 500 "С
100 Z00 300 400 °С
Рис. 29.8. Зависимость удельной теплоемкости от температуры (при нагрева-
нии) для р-латуни (а) и сплава Cu3Au (б) (после охлаждения со скоростью
30°С/ч). В обоих случаях верхняя кривая построена по экспериментальным
данным, а нижняя соответствует ожидаемому изменению теплоемкости в от-
сутствие перехода «порядок — беспорядок».
энергий упорядоченного и неупорядоченного состояний и вели-
чиной энергетического барьера, который необходимо преодолеть
двум атомам для изменения своего местоположения. Образова-
ние сверхструктуры — процесс кооперативный, так же как по-
теря ферромагнетизма, происходящая в точке Кюри, или воз-
никновение вращения ионов или молекул в кристаллах. Для
таких процессов характерно, что на поведение отдельного атома
(или молекулы) оказывает влияние поведение его соседей.
Однажды начавшись, процесс ускоряется, в результате чего
получаются кривые, подобные показанной па рис. 29.8, а для
удельной теплоемкости [З-латуни (см. ниже). В кристалличе-
ском метане, например, вращение одной молекулы ослабляет
жесткость фиксации других молекул, так что происходит не
только облегчение возможности вращения для каждой последу-
ющей молекулы, но и по мере повышения температурц^возрас-
тает и тепловая энергия молекул. Несмотря на то что переход
порядок — беспорядок иногда пытаются сравнивать с плавлени-
ем, так как упорядоченное расположение атомов заменяется на
статистическое и, кроме того, происходит перемещение атомов
относительно друг друга, все же эти два процесса имеют су-
29.5. Переходы порядок — беспорядок и сверхструктуры 467
щественпые различия. При разупорядочепии в твердом состоя-
нии не наблюдается коренной ломки структуры в целом, и про-
цесс перехода осуществляется в широком интервале температур
(в этом отношении процесс сходен с плавлением стекла). В жид-
кости расположение центров атомов менее правильное (только
ближний порядок), чем в твердом теле, и, помимо этого, оно
подвержено постоянному изменению. В то же время и в неупо-
рядоченной, и в упорядоченной фазах данного сплава положе-
0 Си или Zn ф Си О Zn
Рис. 29.9. Структуры неупорядоченной и упорядоченной форм р-латуни.
ние центров атомов сохраняется или изменяется незначительно..
Если исходить из сплава с упорядоченной при низкой тем-
пературе структурой, то при его нагревании возможны два типа
переходов порядок — беспорядок:
а) разупорядочение происходит постепенно, проходя через
все промежуточные стадии. При критической температуре упо-
рядоченность полностью исчезает. Кривая удельной теплоемко-
сти имеет необычно крутой подъем при повышении температуры,
а при критической температуре резко спадает до величины, лишь
незначительно превышающей теоретическую;
б) развитие процесса такое же, как описано для случая
«а», за исключением того, что при достижении критической тем-
пературы еще остается некоторая степень упорядоченности,
так что последняя стадия перехода протекает очень резко.
В этом случае кроме аномальной удельной теплоемкости имеет-
ся еще скрытая теплота процесса.
Теперь перейдем к рассмотрению некоторых примеров пере-
ходов порядок —беспорядок, наблюдаемых в сплавах двух
типов XY и X3Y.
29.5.1. fi-Латунь. Строение упорядоченной и разупорядоченной
фаз показано на рис. 29.9. Атомы расположены в узлах ОЦК-ре-
шетки в одном случае упорядоченным образом, в другом —
статистически. Чтобы показать статистическое расположение
вместо изображения значительного фрагмента структуры, удоб-
нее использовать кружки с промежуточным типом штриховки,
30*
468 29. Металлы и сплавы
которые обозначают атомы любого из двух сортов. Вероятность
того, что такой атом будет атомом Си или Zn, равна '/г- В этом
сплаве переход происходит в температурном интервале, начиная
¦с ~300°С. Ниже 470 СС превращение протекает непрерывно и
а
О Q
Аи Си |Аи,?Си
© О ©
Al Fe iAl.^Fe
Рис. 29.10. Кристаллические структуры сплавов Cu3Au (а) и Fe3Al (б) в неупо-
рядоченном и упорядоченном состояниях.
обратимо, причем при критической температуре пе наблюдается
резкого изменения степени упорядоченности и поэтому отсутст-
вует скрытая теплота процесса. Кривая удельная теплоем-
кость— температура для перехода такого типа (CuZn) показа-
на на рис. 29.8, а. Для объяснения того факта, что и выше
критической температуры удельная теплоемкость имеет ано-
мальное значение, было сделано предположение, что, несмотря
на отсутствие дальнего порядка, еще сохраняется склонность
атомов иметь ближайшее окружение из атомов другого сорта.
29.5.2. Сплавы Х3У. Переходы типа порядок — беспорядок были
обнаружены у следующих сплавов: Cu3Au, Cu3Pd, Cri3Pt, Ni3Fe
и Fe3Al. Первые четыре из этих сплавов имеют грапецептриро-
вапную кубическую структуру; элементарные ячейки разупоря-
29.5. Переходы порядок — беспорядок и сверхструктуры 469
доченной и упорядоченной структур показаны на рис. 29.10, а.
Переходы в этих сплавах протекают медленно; их можно из-
бежать путем быстрого охлаждения (закалки) от высоких тем-
ператур. Для достижения высокой степени упорядоченности в
сплаве Ni3Fe необходим отжиг в течение нескольких месяцев.
Зависимость удельной теплоемкости от температуры для сплава
Cu3Au представлена па рис. 29.8, б. Изучение зависимости
электрического сопротивления сплава Cu3Au от температуры
О1
а
Рис. 29.] 1. Кристаллические структуры А1 (две элементарные ячейки) (а) и
Л10П (одна элементарная ячейка) (б). Па рисунке б выделена часть плотно-
;. пакованного слоя Al3Ti (атомы Ti — заштрихованные кружки).
показало, что и при критической температуре сохраняется за-
метная степень упорядоченности, так как при переходе через
эту температуру (при охлаждении) наблюдается резкое падение
сопротивления (на 20%). Соответственно этому для перехода
порядок — беспорядок в сплаве СщАи имеется скрытая теплота
процесса. Отсутствие скрытой теплоты в случае Ni3Fe, возмож-
но, обусловлено чрезвычайно низкой скоростью перестройки
структуры. Структуры неупорядоченной и упорядоченной фаз
для сплава Fe3Al показаны на рис. 29.10, б.
Некоторые другие сплавы X3Y дают интересные примеры
сверхструктур и плотноупакованных структур, построенных из
атомов двух типов. Структуры Al3Ti и Al3Zr являются сверх-
структурами кубической плотпоупакованной структуры алюми-
ния. Элементарная ячейка тетрагональной структуры Al3Ti,
а также соответствующая ей часть структуры алюминия пока-
заны на рис. 29.11. Одна четвертая часть атомов А1 упорядо-
ченным способом заменена па атомы Ti. Можно видеть, что
плоскость, соответствующая плоскости A11) в структуре алю-
миния, теперь представляет собой плотноупакованный слой
470 29. Металлы и сплавы
X3Y, который показан па рис. 4.15, в. Строение сплава AI3Zr
весьма похожее, но несколько более сложное, так как в струк-
туре присутствуют слои X3Y двух типов (рис. 4.15, в и г). Сле-
дует отметить, что соотношение структур Al3Ti и А1 сходно с
соотношением структур Fe3Al (и изоструктурного ему Fe3Si)
и Fe. Структура Al3Ti образуется при упорядоченном замещении
атомами Ti одной четвертой части атомов А1 в гранецептрпро-
вапной кубической структуре, а структура Fe3Al — при упоря-
доченном замещении одной четвертой части атомов Fe
атомами А1 в объемпоцептрированпой кубической структуре
(рис. 29.10, б). Для другой группы сплавов характерны сверх-
структуры к гексагональной и более сложным плотнейшпм
упаковкам. В структурах Ni3Sn (а также в изоструктурных
Mg3Cd и Cd3Mg) и Ni3Ti имеются слои такого типа, как на
рис. 4.15, г; отличие этих структур состоит в последовательности
чередования слоев (г в Ni3Sn, гк в Ni3Ti).
Примеры интерметаллических фаз состава X3Y с более
сложными последовательностями плотпоупакованпых слоев
можно найти в табл. 4.4 (т. 1). Интересно попытаться рассмот-
реть возможные причины, из-за которых в структурах этих
соединений реализуются различные последовательности слоев.
В кубической структуре Cu3Au все межатомные расстояния
одинаковы. В этом структурном типе кристаллизуются, напри-
мер, соединения с формулой А13М, где М — 4/-металл с атома-
ми меньшего размера (например, Ег). В гексагональных и ром-
боэдрических структурах появляется возможность существова-
ния в структуре двух разных межатомных расстояний, что и
требуется в случае более крупных атомов 4/-металлов и Y [1]:
АЬЕг
AhY (низкотемпе-
ратурная форма)
AhY (высокотемпе-
ратурная форма)
Последова-
тельность
слоев
А1
Ег—12 А1 2,
f 4 Ег
I 8 А1
А
2,98
А1
Y—12 Al
4 Y
8 Al
3,11 А
3,11
2,96
Y—12 А1
А1
3,07 A
4 Y 3,07
8 Al 2,98
Особенности полиморфизма А13Ри [2] указывают па то, что
относительные размеры атомов играют более важную роль при
более низких температурах. У этого соединения имеются по
крайней мере три полиморфные модификации с различной по-
следовательностью слоев:
1027 °С
9-слойная
кгг
э-слоиная
ккг
1210
3-слойная
к
1400 °С
29.6. Структуры сплаппв 471
Соединение WA15 служит интересным примером, когда для
плотпоупаковапной структуры получается более сложная фор-
мула за счет чередования слоев состава WA12 и А13 в последова-
тельности ABAC... [3].
Литература. [1] Ada cryst., 1967, 23, 729. [21 J. Nucl. Materials, 1965, 15, 1, 57;
Ada cryst., 1965, 19, 184. [31 Ada cryst., 1955, 8, 349.
29.6. Структуры сплавов
Теперь кратко рассмотрим структуры, характерные для сплавов,
ограничиваясь при этом бинарными системами. Используя
классификацию элементов, приведенную в разд. 29.1, можно
выделить три основных типа сплавов:
I. Сплавы двух металлов группы А
II. Сплавы металлов группы А с металлом группы В
АВ
A.2B,
AtB2
A..B,
III. Сплавы двух металлов группы В
В связи с тем что металлы группы А разделены нами на две
подгруппы Ai и А2, а металлы первых и последних Б-подгрупп
периодической системы обозначены как В[ и В2, второй тип (II)
сплавов подразделяется на четыре подтипа. В типах I и III мы
не проводим разделения па три возможных подтипа. При об-
суждении строения твердых растворов и сверхструктур в качест-
ве примеров выступали некоторые сплавы типа АА. Поэтому
для типа I будут рассмотрены другие примеры, а имен-
но некоторые фазы, образованные переходными металлами
(разд. 29.6.3).
В некоторых случаях довольно трудно провести четкую гра-
ницу между истинно металлическими сплавами, и гомеополяр-
ными соединениями, особенно если последние содержат элемен-
ты VB—VII Б-подгрупп (As, Sb, Se, Те). Оказывается также
не совсем удобно слишком жестко придерживаться деления
элементов на группы Аь А2, Bi и В2. Мы постараемся пользо-
ваться более гибкой классификацией, с тем чтобы рассматри-
вать сразу целые семейства структур с общими структурными
особенностями. Размерный фактор играет важную роль при оп-
ределении возможности образования так называемых фаз
Лавеса — структурно близких соединений MgZn2, MgCu2 и
MgNi2. Co структурной точки зрения эти фазы, по-видимому,
наиболее близки к а-фазам, образованным переходными эле-
ментами. Поэтому фазы Лавеса, образующиеся при сочетании
472 29. Металлы и сплавы
металлов, не являющихся типичными переходными (А2), ока-
зывается более удобно обсуждать совместно с о-фазами.
29.6.1. NaTl и родственные структуры. Для фаз состава А-В,
наиболее обычны две структуры — хлорида цезия и «галлида
натрия». В первом структурном типе кристаллизуются LiHg,
LiTl, MgTl, CaTl и SrTl. Этот структурный тип не нуждается
., _ в дополнительном описании, по мы
еще коснемся этих сплавов и разд.
29.6.4. В структурном типе NaTl
( к которому относятся также LiZn,
LiCd, LiAl, LiGa, Liln и Naln) ко-
ординаты атомов такие же, как в
структуре CsCl (т. е. они соответ-
ствуют ОЦК-кладке), но располо-
жение атомов двух сортов таково,
что ближайшими соседями каждо-
го атом;, оказываются четыре ато-
ма того же сорта и четыре атома
другого сорта (рис. 29.{'!). Меж-
атомные расстояния в сплавах со
структурой типа NaTl намного ко-
роче (в NaTl короче на 12%), чем
Рис. 29.12. Кристалличес!
структура XaTl.
определенных из структур чистых мо-
в рассмотрение соединения, образо-
сумма радиусов атомов,
таллов.
Здесь удобно включи:
ваплые металлами Б-подгрупп, лежащими на границе раздела
элементов групп В; и В; нашей классификации (разд. 29.1).
В структурах некоторых фаз состава X3Y в нелом положеиие
атомов такое же, как в структуре NaTl. по за счет заргаций
расположения атомов X и Y получаются весьма различные
структуры. У ьл'зВ1, LisSb и Li^Pb строение такое же, как у
упорядоченной формы Fe^Al (рис. 29.10, б). В структуре CssSb,
обладающего фотоэмпссионпыми свойствами, атомы С-- зани-
мают позиции А и С (на рис. 29.12), тогда как равное число
атомов Cs и Sb статистически распределено по позициям В и D.
Сочетание двух последних позиций соответствует алмазоподоб-
пому расположению атомов. Это позволило сделать предполо-
жение, что происходит ионизация по схеме 8Cs+Sb~<-2Cs+-i-
: Cs:: --- Sb', причем ионы Cs::""" н 'Sir'' образуют тетраздриче-
ские связи с гибридизацией 6s6p3 и 5s5p3 соответственно, а ионы
Cs+ занимают пустоты в алмазоподобном каркасе [1]. Структур-
ные особенности перечисленных соединений сведены в табл. 29.7,
н которую для полноты включены еще два ранее упоминавшихся
соединения (Bi2OF4 и NaY3F10 разд. 9.9.3).
Для многих соединений типа AiBj характерна склонность
2.9.6". Структуры сплавов 473
Таблица
CsCl
XaTl
C.-,Sb
I.i.Di
b..Al
(УПО])Я
Fc:iAl
(неупо
e;..of4
XaY3E10
29.7. (Структуры с(
дочепная)
рядоченная)
единений,
id—NaTl
Четирехкритн
4Bi
Ха, 3'
(Рис.
1 1
Cs
Ха
Cs
Bi
Al
Fe
9.7)
относящиеся
,iv позиции h;i
В
Cs
Ti
Cs, Sb
i. 1
Fe
Fe
ч
с
Ci
Ma
Cs
i.i
Fe
Ie,
- 20 -!-
к
иг.
Al
8F
10F -
семейству
29.12
D
Cl
TI
Cs, Sb
Li
Fe
Fe, Al
>,
—*-
атомов Bi образовывать обособленные группировки, тип кото-
рых зависит от относительных количеств атомов А[ и Bj. На-
пример, в системе Na—Hg, которая отличается большим числом
образующихся в ней фаз, среди прочих существуют три фазы
состава Na3Hg2, NaHg и NaHg2 (в порядке увеличения содержа-
ния ртути) [2]. В структуре первой из них имеются почти квад-
ратные группировки Hg4, окруженные со всех сторон атомами
Na. В структуре NaHg пары атомов Hg (Hg—Hg 3,05 А)
соединены несколько более длинными связями C,22 А) в беско-
нечные цепи, а в NaHg2 (структурный тип А1В2; разд. 10.4.4)
присутствуют слои из связанных атомов ртути. В структуре
NagTl можно выделить тетраэдрические группы Т14, являющиеся
частью координационного окружения атома Т1 в виде икосаэд-
ра (9 атомов Na+З атома Т1) [3]. Тетраэдрические группировки
атомов элементов IV группы присутствуют в структурах NaSi
и BaSi2, KGe, KSn и NaPb [4]. Структура NaHg и довольно
сложная структура NaPb представляют резкий контраст с
простой структурой NaTl (рис. 29.12).
Литература, fll Proc. Roy. Soc, A 1957, 239, 46. [2] Acta cryst., НИИ 7, 277
[3| Ada cryst., 1967, 22, 836. [4] Acta cryst., 1953, 6, 197.
29.6.2. Структуры ВаСи, CaCus, XYU и XY13. В этом разделе
рассмотрен ряд структур, образованных, как правило, более
крупными атомами Ai (в том числе La, Се и Th) и значительно
меньшими по размеру атомами Bi (например, очень небольшим
атомом Be и атомами переходных З^-металлов: Fe, Co, Ni и
474 29. Металлы и сплавы
Си). Особенность этих структур состоит в высоком К.Ч больше-
го по размеру атома, в то время как небольшие атомы Bi обра-
зуют каркасы, расположенные в промежутках между большими
атомами Ai или полностью охватывающие их. В структуре ВаСи
(а также в SrCu [1]) атомы Ва образуют плотноупаковаппые
слои, которые попарно расположены точно друг над другом,
а атомы Си размещаются в тригопалыю-призматических пусто-
тах между ними, что схематически показано на рис. 4.10 (т. 1).
Атомы Си образуют плоские сетки б3 и, таким образом, имеют
а 6 в СХа оси
Рис. 29.13. Кристаллическая структура СаСи5 (см. текст).
в качестве соседей 6 атомов Ва в вершинах тригоналыюй приз-
мы и 3 атома Си па расстоянии 2,60 А, которые дополняют
координационный полиэдр до трехшапочной тригопальной
призмы. У атомов Ва 6 соседних атомов Си и 10 атомов Ва на
расстояниях 4,17—4,73 А. В структуре СаСи5 [2] имеются че-
редующиеся слои двух типов, показанных па рис. 29.13, а и б,
так что каждый атом Са окружен 6 атомами Си в одной плос-
кости (на расстоянии 2,94 А) и еще двумя группами по 6 атомов
Си, находящимися в соседних плоскостях (на расстоянии
3,27 А), что дает КЧ 18. В структуре такого типа величина Rv
должна быть меньше чем 1,6 Rn; для изученных структур вы-
полняется соотношение RA = A,37-М,58) Rn. К этому структур-
ному типу относятся соединения CaNi5, CaZn5, LaZn5, ThZn5,
CeCo5 и ThCo5. Размеры атомов стронция и бария близки к
верхней границе устойчивости этих фаз, вследствие чего для
SrZn5 и BaZns обнаружены структуры несколько измененного
типа [3]. При упорядоченном замещении в структуре XY5 части
атомов X на пары из атомов Y получаются производные струк-
туры Th2Fel7 [4], ThMn12 и TiBe12 [5].
В структурах XYn [6] и XY13 атомы X занимают пустоты, в ко-
торых они окружены соответственно 22 и 24 атомами Y. Для
данного сорта атомов Y более мелкие атомы X дают фазы XYU,
а более крупные атомы X —фазы XY,3; при слишком крупных
атомах X даже фаза XY13 не образуется (табл. 29.8). Структура
29.6. Структуры сплавов 475
Таблица 29.8. Фазы состава XYn и XY13
Rb
К
В а
Sr
Са
Na
La
и
о
Радиус. А
2,72
2,50
2,35
2,24
2,15
1,97
1,91
1,88
1,56
ЬгВсз
СаВс,3
—
LaBc13
UBc,3
Известные
RbZn13
KZn,3
BaZnl;i
SrZn,3
CaZn,3
NaZn,3
LaZiin
фазы
CsCd13
RbCd13
KCd13
BaCd,,
SrCd,,
XY13 представляет интерес в связи с особенностями координаци-
онных полиэдров. 24 атома Y окружают атом X по вершинам
почти правильного «курносого» куба, являющегося одним из
наименее известных тел Архимеда; он имеет 6 квадратных гра-
ней, параллельных граням куба, и 32 равносторонние треуголь-
ные грани. В начале координат находится атом Y, имеющий
окружение в виде почти правильного икосаэдра из 12 атомов Y;
координационное окружение последних менее правильное, что
видно из следующих данных для структуры RbZrii3 [7]:
Rb-
Zni —
Zrin
1
\
24Zn,,
12Zn,,
lOZn, „
2Rb
3,62 A
2,68
2,61—2,96
3,62
(cp.
кратчайшее расстояние
Zn—Zn в металлическом
Zn —
-2,66 A)
Литература. [1] Ada cryst., 1980, B36, 1288. [21 Z. anorg. allg. Chem., 1940,
244, 17. [31 Acta cryst., 1956, 9, 361. [4| Acta cryst., 1969, B25, 464. [51 Acta
cryst., 1952, 5, 85. [6| Acta cryst., 1953, 6, 627. [7] Acta cryst., 1971, B27, 862.
29.6.3. о-Фазы переходных металлов и фазы Лавсса. Между
электронными соединениями (см. ниже) и соединениями с «нор-
мальной валентностью», для которых число структурных типов
сравнительно невелико, находится большая группа интерметал-
лических соединений, принципы строения которых менее понят-
ны. Для соединений, которые рассматриваются ниже, одним из
важных факторов, определяющих структуру, является геомет-
рический фактор. К особенностям этих структур можно отнести
высокие координационные числа, лежащие в пределах от 12
до 16.
В шаровых упаковках наименьшая по объему пустота, за-
ключенная внутри полиэдрической группы шаров, — это тетра-
476 29. Металлы и сплавы
эдрическая пустота. Поэтому наиболее плотный способ упаков-
ки шаров достигается в том случае, когда число таких пустот
оказывается максимальным. В трехмерной плотнейшей упаков-
ке, содержащей N равновеликих шаров, имеется 2N тетраэдри-
ческих и Л' октаэдрических пустот. Возможны и более плотные
упаковки — только с тетраэдрическими пустотами, по такие
упаковки распространяются бесконечно лишь в одном или двух
измерениях [1]. Локальная плотность, более высокая, чем в.
обычных плотпейших упаковках, достигается, например, при
размещении 20 шаров над гранями икосаэдра; такие группиров-
ки атомов встречаются в некоторых из структур, описанных в.
этом разделе. Однако подобный способ упаковки одинаковых
шаров не подходит для заполнения всего пространства, так
как появляются пустоты, которые делают среднюю плотность
упаковки более низкой, чем у обычной плотнейшей упаковки.
Если же для заполнения таких пустот, находящихся между ико-
саэдрическими группировками (и окруженных 14—16 шарами),,
используются шары большего размера, то в результате полу-
чаются весьма компактные упаковки, что служит по крайней,
мере частичным объяснением существования описанных ниже
структур.
Из того факта, что наименьшей пустотой между шарами,
находящимися в соприкосновении, является тетраэдрическая
пустота, следует, что для координационных полиэдров можно,
ожидать наличия лишь треугольных граней (в противополож-
ность этому, например, в кубической плотнейшей упаковке кро-
ме треугольных присутствуют и квадратные грани). Кроме того,
по-видимому, предпочтительны такие полиэдры, в которых пять
пли шесть треугольных граней (и, следовательно, пять или
шесть ребер) сходятся в каждой из вершин, так как в этом слу-
чае грани наиболее приближаются по форме к равностороннему
треугольнику. Из соотношения Эйлера (т. 1, разд. 3.3.2) следу-
ет, что для такого полиэдра справедливо соотношение v5 + 0-v6 =
= 12, где v5 и и6 — число вершин, в которых сходятся по пять
и по шесть ребер. Таким образом, начиная с икосаэдра (с!5 =
= 12), можно добавлять вершины 6-го порядка (в которых схо-
дятся по шесть ребер) и получать полиэдры с числом вершин
больше двенадцати.
Нетрудно показать, что среди таких полиэдров не существу-
ет ни одного с Z=13 и существует лишь один полиэдр с 2=14,
один с 2=15 и два с 2=16 (в одном из них имеется пара со-
седних вершин 6-го порядка). В полиэдрах с 2>16 присутствует
по крайней мере одна пара соседних вершин 6-го порядка.
Установлено, что в трех координационных полиэдрах для
КЧ>12, характерных для структур некоторых сплавов, 2 равно
14, 15 и 16, причем вершины 6-го порядка не являются смежны-
25.6'. Структуры
ми. Эти полиэдры показаны на рис. 29.14. Икосаэдр а можно
получить из иентагоналыюй аптипризмы путем добавления ато-
мов над серединами противоположных пятиугольных граней;
14-вершипник б получается таким же образом из гексагональ-
ной антипризмы. Отношение расстояния от центра правильного
икосаэдра до его вершины к длине ребра этого многогранника
равно —0,95, в связи с чем его можно рассматривать как воз-
можную координационную группу при отношении радиусов,
равном 0,90. В 14-вершиннике б двенадцать шаров, составляю-
Рнс. 29.14. Координационные полиэдры в структурах переходных металлов
(а—г см. текст).
щие антипризму, равны между собой, но отличаются по размеру
от центрального шара, а также от двух остальных шаров — ша-
пок гексагональных граней. 15-вершинпик в можно представить
как гексагональную антипризму, у которой над одной гексаго-
нальной гранью находятся один атом, а над другой — два.
В том случае, если полиэдр г с КЧ 16 состоит из 12 атомов
В (в вершинах усеченного тетраэдра), расположенных вокруг
центрального атома А, и четырех атомов А, лежащих над цент-
рами гексагональных граней (и расположенных по вершинам
тетраэдра), такой полиэдр иногда называют фриауфовским мно-
гогранником в связи с тем, что он встречается в «фазах Фриау-
фа» — MgCu2 и MgZn2 (эти фазы, а также MgNi2 обычно отно-
сят к «фазам Лавеса»). Ниже этот полиэдр будет рассмотрен
как одна из возможных координационных групп при отношении
радиусов 1,23.
В 14-вершининке отрезки, соединяющие центр полиэдра с
вершинами 6-го порядка, коллипеарпы, тогда как в 15-вершип-
нике они компланарны и расположены под углом 120°, а в
16-вершиннике они направлены к вершинам тетраэдра (ср. со
стереохимией углерода). Франк п Каспер установили, что ос-
новные особенности геометрии структур, в которых координа-
ционные числа всех атомов равны 12, 14, 15 и (или) 16, можно
описать очень изящным способом [2]. Позиции с КЧ>12 они
называют главными позициями, линии, соединяющие главные
S
a:
Я
p
r
E
X
о
in
-?
-
—
«a
IIOH1
X
?
7:
s
S
JZ
X
3
=i
я
ft,
Щ.
j=
'"¦'
12
—
N
QJ
Hl-
X
и
CO
00
LO
CO
CTi
u
<
1
Q,
O>
Ь
:HI
О
-^
144
120
I
I
CO
CO
и
,—1
0
Cu
L_O
U
s g
—r
0
0
rf~
ca
GC
CO
en
и
«—
о
§ &"<
CJ ^
ra
-3- c
LO
CN
00
116
b
00
CO
CM
¦*
CM
CO
Ю
*$)
Cl.
10
I-—
LO
CO
0
CD
CD
и
о
и
ОС
1
I
СО
га
га
ю
СО
об"
ей
о
см
О0
, "—
- га
Ы g
?~ -,
о>
тГ
СО
сч
as
0
<
*-,
СП _
» о
СО t^.
СП СП
О О
2 си
га 3
о ^
5 и
О о
S '
га ^*-
д -—-
00
о
см
1
1
-ф
О)
со
ю
-—^—ч
-—-
1
га "
га S
СП
оо
см
ел
СО
СИ
1ас,
к
дном
о
+
X
а.
S
га
ч
о
о
о
со
>¦
га
с
сО
о
гп
,АС,
см
о)
г—
ю
CM
са
ОС
СП
—-1
АС,
3
X
га
-связ
а.
О) К
S g
н
• ¦ ~
-Ф 00 00
1
1
[ |
| |
со со сс
(М -* -^
-4 (М (N
^ JT ^
G G 8
N U 2
ЬХ ti? tX
"""* I?" ?"
со
LO
ni
СП
1—'
AC,
Hbii
О
S
m
S"
(M
CM
i
со
0"
lO
en
и
^:
5
0
см
со
О)
см
со
N
Al,
я
fc. S —
^1 CD
с; с;
29.6. Структуры сплавов 479
позиции и проходящие через вершины 6-го порядка, — главны-
ми .шгандами, а систему главных лигапдов — главным скелетом.
Поскольку главный лигапд соединяет две точки с КЧ 14, 15
или 16 и проходит через вершину 6-го порядка, вокруг каждого
главного лиганда имеется кольцо из шести атомов. Главный
скелет в общих чертах однозначно определяет структуру (без
учета небольших смещений и искажений). Если из позиций с
КЧ>12 в структуре присутствуют только позиции с КЧ 14, то
главный скелет представляет собой просто набор непересекаю-
щихся линий, так как из каждой точки исходит только по два
главных лиганда. В структурах, где есть позиции с КЧ 15 и 16,,
главный скелет может быть плоской или трехмерной сеткой.
В а-фазе (см. ниже) главный скелет, соединяющий позиции с
КЧ 15, является плоской сеткой. В фазах Лавеса скелет обра-
зован линиями, соединяющими позиции с КЧ 16; он геометри-
чески соответствует структурам алмаза, вюртцита и карборун-
да-Ш.
В структуре сс-Мп имеется четыре типа кристаллографически
неэквивалентных атомов с КЧ, указанными в табл. 29.9, причем
расстояния Мп—Мп находятся в пределах 2,26—2,93 А. Долгое
время считалось, что сложность этой структуры обусловлена
присутствием атомов с различной степенью окисления, однако
такая интерпретация не является общепринятой. В сложных
а-фазах, образованных рядом переходных металлов, имеется
не менее пяти типов кристаллографически различных атомов
с КЧ от 12 до 15. Из 30 атомов, приходящихся па элементарную
ячейку, 10 атомов имеют координационные полиэдры в виде
икосаэдров (рис. 29.14, а), 16 атомов — в виде 14-вершинпиков
(рис. 29.14, б) и 4 атома — в виде 15-вершишшков
(рис. 29.14, в). Нейтропографическое исследование а-фаз в
системе N4—V(Ni9V2i, NinVig, Ni13Vi7) и a-FeV, а также рентге-
поструктурный анализ а-МпМо и a-FeMo показали, что наблюда-
ется определенная склонность одних атомов занимать позиции
с более высокими КЧ, а других позиции с низкими КЧ. Если
в ряду атомов от V до Ni атомы слева и справа от Мп обозна-
чить как (а) и (б)
( г
то окажется, что КЧ 15 имеют атомы типа (а), КЧ 14—атомы
типа (а) и (б), а КЧ 12 (икосаэдрическая координация) харак-
терно только для атомов типа (б). .
В (i-фазах Fe7W6, Fe7Mo6 и в соответствующих соединениях
кобальта атомы железа или кобальта имеют икосаэдрическую
480 29. Металлы и сплавы
координацию (К.Ч 12), тогда как у атомов Мо или W коорди-
национные числа более высокие A4—16) (координационные
полиэдры показаны на рис. 29.14). Другие примеры структур
¦с высокими координационными числами, а также ссылки па ли-
тературу включены в табл. 29.9. Интересно отметить, что из
га е
Рис. 29.15. Кристаллическая структура Mg32(Al, ZnL9 (см. текст).
трех фаз, существующих в системе Mg—А1, фаза с наиболее
простой формулой (Mg2Al3) имеет самое сложное строение;
структуру такой же степени сложности имеет и Cu4Cd3. Один
из способов описания подобных структур состоит в выделении
главного скелета структуры. Для структур, содержащих значи-
тельную долю атомов с КЧ 16, возможен другой способ описа-
ния— при помощи фриауфовских полиэдров, которые при сочле-
нении через все или некоторые из гексагональных граней
образуют жесткий каркас, построенный из усеченных тетраэд-
ров. Ссылки на работы, содержащие такое описание, можно
найти в табл. 29.9 (Z—-число атомов в элементарной ячейке).
Mg32(Al, ZnL9 служит прекрасной иллюстрацией важности
геометрических факторов для оп;лснения реализации данного
структурного типа, поскольку не ^дается найти четко выражен-
ную зону Бриллюэна, с которой можно было бы связать устой-
чивость этой структуры. Если начать с атома, окруженного
другими по икосаэдру (рис. 29.15, а), то над серединами гра-
ней икосаэдра можно разместить еще 20 атомов (в вершинах
23.6'. Структуры сплавов
пептагоналыюго додекаэдра, рис. 29.15, б). Помещая над гра-
нями последнего еще 12 атомов, получим икосаэдр большего
размера (рис. 29.15, в). С учетом 20 атомов из предыдущего
слоя имеем 32 атома, расположенных в вершинах ромботриа-
контаэдра C0-гранника). В этом многограннике имеется 30
ромбовидных граней. Атомы следующего слоя располагаются
над центрами 60 треугольников, полученных делением пополам
каждой ромбической грани 30-грапника. Эти 60 атомов занима-
ют вершины усеченного икосаэдра (г). Добавление еще 12 ато-
мов дает группу из 72 внешних атомов, расположенных на гра-
нях усеченного октаэдра (д). Такие группы можно теперь
путем сочленения через атомы, лежащие па их поверхности,
упаковать с заполнением всего пространства (е). Внутри каж-
дого усеченного октаэдра оказывается ядро из 45 атомов, и, по-
скольку каждый из 72 атомов внешней группы участвует в сочле-
нении с другой такой же группой, число атомов, приходящихся
на элементарную ячейку, оказывается равным 2D5 + 72/2) ==162.
В получившейся структуре атомы имеют следующие координа-
ционные числа:
98 атомов— КЧ 12
12 атомов —КЧ 14
12 атомов — КЧ 15
40 атомов —КЧ 16
Zn, A1
Mg32(Zn,AlL9
В фазах Лавеса АВг для трех близких структурных типов
(MgZn2, MgCu2 и MgNi2) атом А имеет координацию 12В + 4А,
что согласуется с представлением об определяющей роли в
этих структурах размерного фактора. Эти фазы образуются с
участием большого числа элементов периодической системы,
причем один и тот же элемент в различных соединениях может
относиться к типу А или к типу В. В некоторых тройных систе-
мах в различных областях составов могут существовать две
или более фазы, причем переход от одного структурного типа
к другому происходит при определенном числе электронов, при-
ходящихся на один атом. Это свидетельствует о том, что выбор
той или иной структуры из нескольких близких может быть
обусловлен более чем одним фактором.
Структуры некоторых кристаллов можно получить из плот-
нейших упаковок атомов, если удалить упорядоченным обра-
зом определенную часть атомов (например, в структуре ReO3
атомы О занимают три четверти позиций в кубической плот-
нейшей упаковке). Представляет интерес рассмотреть здесь
некоторые способы удаления половины атомов из плотнейших
упаковок различного типа. Из плотноупакованного слоя А мы
удаляем четвертую часть атомов, как показано на рис. 29.16, а,
31—1284
482 29. Металлы и сплавы
а из слоя В, находящегося выше, удаляем три четверти всех
атомов. Оставшиеся атомы образуют слой изолированных
тетраэдров. Ниже слоя А мы можем поместить любой слой
типа В (в этом случае образуются пары тетраэдров, соединен-
ных основаниями), либо слой типа С, что дает слой тетраэдров
с чередованием вершин, направленных вверх и вниз
(рис. 29.16, б).
Определенные последовательности слоев подобного типа
образуют заполняющие все пространство совокупности тетраэд-
6
Рис. 29.16. Структуры фаз Лавеса (см. текст).
ров и усеченных тетраэдров, как показано на рис. 29.16, в и г.
Особый интерес представляет система тетраэдров, сочлененных
только через вершины (рис. 29.16, г); ее можно получить и
другим способом — для этого нужно разместить атомы на се-
рединах всех связей в структуре алмаза и соединить эти атомы
так, чтобы вокруг узлов алмазной структуры сформировались
тетраэдры. Центры пустот в форме усеченных тетраэдров
(рис. 29.16, г) также соответствуют расположению атомов
в структуре алмаза; на рис. 29.16, в расположение таких пустот
соответствует структуре вюртцита. Число этих крупных пустот
вдвое меньше числа атомов, образующих каркас из тетраэдров.
Если в каждую из таких пустот поместить атом А (вместо тет-
раэдрической группы из четырех атомов В в исходной плотней-
шей упаковке), то получится соединение АВ2, в котором атом
А имеет окружение из 12 атомов В (в вершинах усеченного
тетраэдра) и 4 атомов А (в вершинах тетраэдра, лежащих над
гексагональными гранями усеченного тетраэдра). Такое строе-
ние имеют фазы Лавеса MgCu2, MgZn2 и MgNi2, структуры
которых лишь незначительно отличаются друг от друга, что
видно из следующего сопоставления:
29.6. Структуры сплавов 483
Последовательность плотно-
упакованных слоев
Тип каркаса, образуемого
атомами А
MgCib ABC... (к)
MgZn2 ABAC. .. (гк)
MgNb ABC ВАС ВС... (ккгк)
Алмаз
Вюртцит
Карборунд-Ш
Эти соединения являются прекрасными примерами применимо-
сти различных подходов к описанию структур: как наложения
сеток, в виде вязи полиэдров или упаковки полиэдров с запол-
нением всего пространства или, наконец, на основе плотнейших
упаковок одинаковых шаров.
Высказывалось мнение [3], что рассмотрение фаз Лавеса как
реализующихся только при отношении радиусов гА:гц= 1,225
было бы слишком упрощенным, поскольку в действительности
это отношение лежит в интервале 1,05—1,67. В простейшей из
этих структур — кубическом MgCu2 — относительные межатом-
ные расстояния (в долях от ребра ячейки а) составляют:
А —А 0,433; В —В 0,354; А —В 0,414
из чего следует невозможность одновременного осуществления
контактов всех трех типов в модели жестких шаров. Значения
радиусов г.\ и гв могут быть подобраны лишь так, что они согла-
суются с какими-либо двумя из трех типов контактов:
1,09
1,225
1,34
гА 0,216
г в 0,198
Контакты: А—А
А—В
Атомы В сжаты
0,216
0,177
А—А
В—В
Контакты А—В от-
сутствуют
0,237
0,177
А—В
В—В
Атомы А сжаты
У большинства соединений со структурой MgCu2 отношение
гА : гв больше чем 1,225. Отсюда можно заключить, что контак-
ты типа А—В обеспечиваются даже за счет сжатия атомов А.
При этом наибольшее отношение г к '¦ Гъ осуществляется при
наибольшей разнице электроотрицательностей атомов А и В.
Сходная ситуация возникает в структурном типе C-W (А 15,
рис. 29.4, а) для соединений с формулой А3В (атом В располо-
жен в начале координат), поскольку здесь осуществляется сле-
дующая координация атомов:
Г 2 А 0,500 а
А 4 В 0,559 о и В —12 А 0 559 а
I 8 А 0,613 а
где а —длина ребра кубической элементарной ячейки. Очевид-
но, что вдоль цепочек, параллельных кубическим осям, атомы А
31*
484 29. Металлы и сплавы
сжаты. Устойчивость и широкая распространенность этой
структуры у бинарных интерметаллических фаз могут быть
обусловлены наличием особого типа взаимодействия между па-
рами атомов А, что приводит к межатомным расстояниям, не-
совместимым с моделью жестких сферических атомов.
Литература. [1] Philips Res. Rep., 1952, 7, 303. [2] Acta cryst., 1958, 11, 184:
1959, 12, 483. [31 Acta cryst., 1968, B24, 7, 1415.
29.6.4. Электронные соединения. В системах типа А2ВЬ содер-
жащих переходный металл, Си, Ag или Аи и металл одной из
первых Б-подгрупп, обычно реализуется один (или более) из
трех структурных типов, представляющих собой C-, у- и е-струк-
туры; твердый раствор на одной из сторон фазовой диаграммы
обозначается как а-фаза. |3-, у- и е-Фазы не обязательно сохра-
няют свою устойчивость вплоть до комнатной температуры.
Например, в системе Си—А1 |3-фаза является неустойчивой при
температурах ниже ~540°С. Структуры этих фаз таковы:
\i «объемноцентрированная кубическая»*
Y сложная кубическая структура, содержащая 52 атома на элементарную
ячейку
е гексагональная плотноупакованная
* В этом разделе термин «объемноцентрированная кубическая» указывает лишь на
то, что все атомы в любой из субъячеек занимают позиции @00) и Gг '/г V;), т. е.
образуют кубическую объемноцентрированную кладку.
Несмотря на то что для этих фаз, часто называемых электрон-
ными соединениями по причинам, изложенным ниже, приводят-
ся определенные формулы, они оказываются устойчивыми в
значительном интервале составов. Более того, хотя мы и вправе
ожидать, что структура |3-фазы (с объемноцентрированной
кладкой) содержит по крайней мере приблизительно равное чис-
ло атомов двух сортов, иногда эта фаза появляется при совер-
шенно других составах. Таким образом, при одних и тех же
координатах занятых позиций распределение атомов данного'
сорта по этим позициям может меняться. В системе Ag—Cd
р-фаза является гомогенной при 50% Cd и имеет структуру
типа CsCl, однако в системах Си—Sn и Си—А1 она появляется
вблизи составов Cu5Sn и Си3А1 соответственно. В таких случаях
в объемноцентрированной структуре осуществляется статисти-
ческое размещение двух сортов атомов. Интересно отметить, что
в то время, как Си3А1 имеет структуру C-фазы, Ag3Al и Au3Al
кристаллизуются в структурном типе [З-Мп (разд. 29.1.4); такое
же различие обнаружено между CusSn (р-структура) и Cu5Si
(структура |3-Мп). Для сплавов с у-структурой формулы оказы-
ваются более сложными — AgsCd8, Си9АЦ, Fe5Zri2i и Cu3iSn8>,
что связано с большим числом атомов E2) в элементарной
ячейке. Можно видеть, что общее число атомов н перечислен-
29.6. Структуры сплавов 485
Таблица
29.10. Взнпмосви:
I) между отношением п ,/«.,
п кристаллической структурой
О гношение /ц //., а
3 :
Р
объемноцентри-
рованная
структура
СпВе
CuZii
Cu3Al
C115S11
CoAl
(о MgTl и ана-
логичных
структурах
см. ниже)
аЧисло элект
-
Р-Мп
кубическая
структупа
АЙЗА1
Аи3А1
CusSi
CoZii3
2! : 13
структура у-ла-
туни
Cu5Zn8
C119AI4
Fe5Zn2i
NisCd2i
Cu3iSns
Na3,Pb8
ронов, приходящихся па один атом.
7 : 4
e
гексагональная
плотнейшая
упаковка
CuZn3
Cu3Sn
AgZn3
Ag5Al3
Au3Sn
ных формулах составляет соответственно 13, 13, 26 и 39.
В системе Ag—Cd, где у-фаза устойчива в области составов от
57 до 65% Cd, что позволяет приписать этой фазе существенно
различные формулы, выбор формулы (Ag5Cd8) основан на
соответствии с кристаллической структурой. Ряд фаз, имеющих
Р-, у- и е-структуры, представлен в табл. 29.10.
В этой таблице обращает па себя внимание разнообразие
формул сплавов для одного и того же структурного типа. Юм-
Розери впервые дал объяснение этим формулам, предположив,
что существование определенной структуры обусловлено числом
валентных электронов, приходящихся на один атом. Так, если
принять обычное число валентных электронов для всех атомов
периодической системы (за исключением триад VIII группы),
то для формул в первых двух колонках отношение числа элект-
ронов к числу атомов по/па равно 3 : 2, для формул третьей
колонки — 21:13, а для четвертой — 7:4. Элементы триад
вписываются в общую схему лишь в том случае, если считать
их электронный вклад равным пулю, что можно зндоть :п сле-
дующих примеров:
СиВе A :-2)/2 ) Си,л!;, (.т-Ч6)/!3 s О'./ль {' " -0) /4 \ 7
Cu:iAl C i-3) /4 I 3 O.hAI, (i) + !2) /13
Cu-Sri E
CoAl (<> -
4) / G
Ph
@-42W26
C1-!-32)/39
I 21
13
)
4
32—1284
486 29. Металлы и сп.
Таблица 29.11. Сравнение экспериментальных и теоретических
значении отношения res/na
Система
Си—Л1
Си—Zn
Си—Su
Ag-Cd
Теоретическое
знамение
в а-фазе при
максимальной
растворимости
1,408
1,384
1,270
1,425
1,362
Отношение njt
на границе
3-фазы с наи-
меньшей элек-
тронной кон-
центрацией
1,48
1,48
1,49
1,50
1,480
а
н
1,
1,
1,
1,
1,
v-Ф
63-
58-
67-
59-
538
ашнуах
- 1,77
- 1 ,66
- 1 ,67
-- 1,63
Некоторые другие сплавы со структурой типа CsCl (MgTl,.
CaTl и др.), о которых уже говорилось ранее, иногда рассматри-
вают как исключения из правил Юм-Розери. Для них такое же,
как у других р-фаз, отношение пэ/па можно получить, лишь
предполагая, что Т1 предоставляет только один валентный
электрон. Однако в связи с тем, что радиусы атомов металлов
как в этих сплавах, так и в сплавах со структурой типа NaTl,
оказываются меньше обычных величин, представляется более
предпочтительным не относить их к электронным р-фазам.
Несмотря на то что сплавы, которые имеют состав, соответст-
вующий приведенным выше значениям пэ1па, обычно попадают
в область гомогенности отдельных фаз, впоследствии оказалось,
что точные значения этих отношений — 3/г, 21Лз и 7/4 — не имеют
особого физического смысла. Путем использования квантовой
механики для определения возможных энергетических состоя-
ний электронов в металлах удалось рассчитать теоретические
значения пэ/па па границах устойчивости а-, |3- и -у-фаз (а-фаза
представляет собой твердый раствор с шютноупакованной
структурой одного из чистых металлов). При сопоставлении
этих величин с экспериментальными значениями лэ/ла следует
помнить о том, что границы устойчивости фаз могут изменяться
при изменении температуры (т. е. линии, разделяющие области
устойчивости различных фаз на фазовой диаграмме, не обя-
зательно параллельны оси температур). В случае C-фаз область
составов, для которых фаза устойчива, всегда сужается при
понижении температуры. В табл. 29.11 приведены эксперимен-
тальные значения лэ/яа для четырех систем, в которых сущест-
вуют и р1-, и у-фазы. Во второй колонке даны пэ/яа в а-фазе
при максимальной растворимости, в третьей колонке — для гра-
ницы устойчивости E-фазы с наименьшей электронной концент-
рацией, в четвертой колонке указаны отношения для границ
29.6. Структуры сплавов 487
устойчивости у-фазы. Можно видеть, что в целом наблюдается
согласие с теоретическими значениями, особенно для данных
второй и третьей колонок, хотя все величины для границ у-фазы
больше теоретической величины лэ/яа.
29.6.5. Некоторые сплавы A2B{ с высоким содержанием алюми-
ния. Уже указывалось на то, что мы пока еще не совсем ясно
представляем факторы, которые определяют строение многих
фаз, образуемых переходными металлами. Ниже мы лишь
бегло коснемся некоторых особенностей ряда структур, подроб-
ное обсуждение которых можно найти в литературе [1].
Некоторые из этих соединений имеют простые структуры
с К.Ч 8 у атомов переходного металла, например:
Структурный тип Интерметаллическое соединение
CsCl FeAl, CoAl, NiAl
Ni2Al3 Pd2Al3 (также N'i2ln3, Pt2Ga3 и др.)
CaF2 PtAl2, AuAl2 и др.
[Структура ГмэАЬ представляет собой неупорядоченный вариант структуры CsCl, в ко-
торой одна треть позиций в центре ячейки (Ni) оказывается незанятой.]
В некоторых других структурах можно выделить 5-связанные
сетки (рис. 29.17, а) и (или) простые квадратные сетки. В за-
висимости от относительной ориентации и способа трансляции
а 6
/V'
"КЧ
"-V
Рис. 29.17. Структуры в-CuAL, и Со2А19. а —слой атомов А1 в структуре СиА12;
б — координация атомов Си (КЧ 8) в виде квадратной антипризмы между
двумя слоями типа «а»; в — координация атома Со в Со2А19 (КЧ9).
накладывающихся сеток этих двух типов (построенных из ато-
мов А1) образуются полиэдрические пустоты между восемью
или девятью атомами А1, в которых и размещаются атомы пе-
реходных металлов. Простым примером может служить 8-струк-
тура СиА12, в которой чередующиеся слои типа «а» связаны
трансляциями ас; атомы Си, расположенные между слоями,
окружены восемью атомами А1 по вершинам квадратной анти-
призмы (рис. 29.17, б). В структуре Со2А19 (рис. 29.17, в) осу-
ществляется следующая последовательность сеток: квадратная
сетка, сетка типа «а», квадратная сетка, повернутая и смещен-
32*
488 29. Металлы и сплавы
ная относительно первой, что приводит к появлению позиций
с девятерной координацией, в которых размещаются атомы Со.
Структуры Со2А15 и FeAl3 можно рассматривать как плот-
ноупакованные структуры, измененные таким образом, что К.Ч
б в
w ^^ w -w
m. Al на высоте 0,06с
© и ОМс
О А1 на высоте с/4
• Со на высоте с/4
Рис. 29.18. Структура Со2А15. a — проекция вдоль оси с слоя атомов, располо-
женных на высоте с^'Д; б — схематическое изображение элементарной ячей-
ки в проекции вдоль стрелки на рис. а; X и Y — атомы, «расщепляющие» пло-
скости типа «а» на два слоя; в — проекция того же типа, что и на рис. а,
для атомов, расположенных на высоте с«0.
атомов переходного металла становится равным 9 и 10
(вместо 12). В структуре Со2А15 (рис. 29.18) плотноупакованные
слои на высоте с='Д и 3U «расщепляются» за счет присутствия
атомов Со (X и Y) с КЧ 9, в результате чего образуются слои
Fe О А1
на высоте О
© Fe О Al
на высоте ~ А
Рис. 29.19. Кристаллическая структура FcAl3; показаны два типа слоев, кото-
рые можно выделить в структуре.
на высоте стаО и с«'/г (штриховые линии на рис. 29.18, б),
строение которых показано на рис. 29.18, в. Координационное
число атомов Со, расположенных между исходными плотноупа-
кованными слоями, равно 10. Весьма сложную структуру FeAl3
можно представить как состоящую из слоев двух типов — плос-
кие слои (рис. 29.19, а) чередуются с гофрированными слоями
(рис. 29.19, б). Плоские слои имеют участки с плотнейшей упа-
29.6. Структуры сплавов 489
ковкой и участки «разрывов»; треугольники в гофрированных
слоях находятся приблизительно над и под атомами Fe в слоях
типа «а». Эти атомы Fe имеют по десять соседей (А1), тогда
как атомы Fe в слоях типа «б» окружены девятью атома-
ми А1.
Литература. [1| См.. например, Ada cryst., 1955,
и«4; Ada Metall., 195G, 4, 172.
175; Acta Metall., 1954, 2,
29.6.6. Системы A\B2. Системы типов AiB2 и А2В2, содержащие
элементы последних Б-подгрупп, не нуждаются в подробном
обсуждении, поскольку строение многих арсенидов уже рас-
сматривалось в гл. 20, а строение сульфидов, селенидов и тел-
луридов — в гл. 17. Фазовые диаграммы систем типа A]B2
обычно имеют очень простой вид; для них характерно наличие
лишь небольшой области твердых растворов и одного, как пра-
вило, весьма устойчивого соединения с формулой, отвечающей
обычным валентностям элементов (Mg2Ge, Mg3As2, MgSe и др.).
Эти интерметаллические соединения, являющиеся изоляторами,
обладают простыми структурами, сходными со структурами
простых солей. Структурные типы некоторых из этих соедине-
ний указаны ниже.
Mg2Si
Mg2Ge
Mg2Sn
Mg2Pb
анти-CaF,
Mg3As2
Mg3Sb2
Mg3Bi2
1
анти-Мп2О3
| anTn-La2C)~
MgSe
MgS
MgTe Вюртцит
NaCl
To обстоятельство, что соединения ряда Mg2Si—Mg2Pb об-
ладают высоким электрическим сопротивлением и кристаллизу-
ются в структурном типе антифлюорита, не означает, что они
являются ионными кристаллами. Квантовомеханические расче-
ты показывают, что в этих кристаллах число энергетических
состояний электрона равно числу валентных электронов, при-
ходящихся на один атом (8/з), так что, как и у других изоля-
торов, электроны не могут стать свободными (т. е. достичь
зоны проводимости) и участвовать в переносе заряда. Тот факт,
что высокое электрическое сопротивление характерно лишь для
кристаллического вещества и не обусловлено ионным типом
связи между атомами, находит свое подтверждение, например,
в резком понижении сопротивления Mg2Sn при плавлении (оно
того же порядка, что у расплавленного олова).
Как указывалось выше, положение линии, разделяющей ме-
таллы Bi и Вг, несколько неопределенно. В настоящий раздел
включены некоторые соединения свинца, сурьмы и висмута;
ряд других фаз, содержащих эти металлы, рассмотрены совмест-
но с соединениями типа A[Bi (разд. 29.6.1).
490 29. Металлы и сплавы
В качестве примеров структур, обнаруженных в системах
типа А2В2, сначала мы рассмотрим структуры типа NiAs, а за-
тем строение некоторых фаз, содержащих висмут и переходные
элементы.
29.6.7. Фазы Л2В2 со структурой арсенида никеля. Металлы ти-
па А2 с элементами первых Б-подгрупп (Bi) образуют электрон-
ные соединения, обсуждавшиеся выше. С металлами последних
Б-подгрупп металлы типа А2 (так же, как Ai) склонны давать
интерметаллические фазы, приближающиеся по свойствам к
простым гомеополярным соединениям; структуры этих фаз
имеют мало общего со структурами исходных чистых металлов.
Для арсенида никеля, подобно типичным сплавам, характерно
существование областей гомогенности (твердых растворов) со
значительным избытком переходного металла. Из табл. 29.12
Таблица 29.12. Соединения с кристаллической структурой типа NiAs
Sn
Pb
As
Sb
Bi
Se
Те
Cu
CuSn
Au
AuSn
Cr
CrSb
CrSe
CrTe
Mil
MnAs
MnSb
MnBi
MnTc
Fe
FeSn
FeSb
FcSe
FcTe
Co
CoSb
CoSe
CoTe
NM
NiSn
NiAs
NiSb
N'iBi
NiSe
NiTe
Pd
PdSn
PdSb
PdTe
Pt
PtSn
PtPb
PtSb
PtBi
PtTe
можно видеть, что многие соединения А2В2 кристаллизуются в
этом структурном типе, показанном на рис. 17.1 (разд. 17.1.3,
там же см. детальное обсуждение структуры NiAs). Некоторые
из соединений этой группы кристаллизуются в структурном типе
пирита:
AuSb,
PdAs2
PdSb2
PtP2
PtAs2
PtSb2
u-PiBi2
29.6.8. Некоторые сплавы А2В2 с высоким содержанием висмута.
Структурная химия сплавов висмута с Ni, Pd и Rh отличается
сложностью в связи с тем, что, хотя атом висмута в некоторых
случаях склонен к образованию трех наиболее прочных пирами-
дально направленных связей (как в структуре металлического
висмута), существует также тенденция к достижению более
высоких координационных чисел, что характерно вообще для
29.6. Структуры сплавов 491
металлического состояния. Например, RhBi кристаллизуется в
искаженном структурном типе NiAs, причем КЧ атома Rh по-
вышается до 8, а атома Bi — до 12. Интересной особенностью
некоторых из этих сплавов является возможность описания их
структур как упаковки одношапочных тригональных призм
(рис. 29.20, а). В центре этих полиэдров находятся атомы пе-
Рис. 29.20. Строение некоторых сплавов с высо- Рис. 29.21. Кристалличе-
ким содержанием висмута, а — координационный
полиэдр атома переходного металла; б—г — упа-
ковка таких координационных полиэдров в струк-
турах сплавов a-Bi,Pd, BuNi и BiPd соответст-
венно.
екая структура Сг2А1.
реходного металла, которые, однако, образуют дополнительные
связи с такими же атомами соседних полиэдров. Так, в структу-
ре Bi3Ni (рис. 29.20, в) такие полиэдры объединены в колонки,
и каждый атом Ni связан с двумя другими атомами Ni из со-
седних полиэдров (на расстоянии 2,53 А), а также с семью
атомами Bi, что делает общее координационное число рав-
ным 9. На рис. 29.20, б и г показаны способы упаковки поли-
эдров Bi7 в структурах a-Bi2Pd и BiPd соответственно; в этих
492 29. Металлы и сплавы
упаковках, которые, разумеется, не могут заполнять всего про-
странства, между полиэдрами Bi7 имеются незапятые тетраэд-
рические и октаэдрические пустоты. В структуре a-Bi4Rh атомы
Rh окружены восемью атомами Bi (квадратная антипризма),
так что в ряде таких сплавов для атомов переходного металла
характерны КЧ 8 или 9 G атомов Bi + 2 атома переходного
металла), тогда как КЧ атомов Bi более высокие A1 —13).
В отличие от a-Bi2Pcl высокотемпературная р-форма имеет
более симметричную (тетрагональную) структуру, являющуюся
сверхструктурой к ГЦК-структуре, причем тип сверхструктуры
в целом такой же, как у Сг2А1 (рис. 29.21), в котором осущест-
вляется сверхструктура на основе объемноцентрированной ку-
бической кладки. Отметим, что несмотря на то, что структуры
Сг2А1 и p-Bi2Pd имеют одну и ту же пространственную группу
(F4/mmm), а атомы занимают одни и те же системы позиций
(а именно: Al(Pd) @00, V2V2V2); Cr(Bi) ± (ОО2, V2V2V2 + 2)),
для Сг2А1 отношение c:a«*3 B = 0,32), тогда как для p-Bi2Pd
c:a~3}'2 B = 0,36). Эти соединения не являются изоструктур-
ными (см. обсуждение этого вопроса в гл. 6).
29.6.9, Системы ВВ. Сплавы, содержащие элементы только пер-
вых Б-подгрупп, обладают типичными металлическими свойства-
ми. Сколько-нибудь широкие области твердых растворов суще-
ствуют лишь в системах, образованных элементами одной и той
же подгруппы, причем, разумеется, как и в других системах,
играет роль и размерный фактор. Так, Cd и Hg дают твердые
растворы в широкой области составов, а Cd и Zn— лишь в уз-
кой области, что согласуется со значениями атомных радиусов:
Zn 1,37 A, Cd 1,52 A, Hg 1,55 А. С другой стороны, кадмий и
олово практически нерастворимы друг в друге. Если оба метал-
ла принадлежат к последним Б подгруппам, в ряде случаев
образуются соединения состава 1 : 1 со структурой NaCl, напри-
мер SnSe, SnTe, PbSe и РЬТе. Наконец, структуры цинковой об-
манки или вюртцита обычно обнаруживаются для тех соединений
состава 1 : 1, в которых среднее число валентных электронов,
приходящихся на атом, равно четырем, т. е. в тех случаях,
когда атомы принадлежат к Л'-й и к (8 — Лг)-й подгруппам.
Примерами соединений этого типа могут служить сульфиды,
селениды и теллуриды цинка, кадмия и ртути, GaAs, GaSb и
InSb. (Такие соединения, как BeS и А1Р, также кристаллизу-
ются в структурном типе цинковой обманки, который распрост-
раняется не только на элементы Б-подгрупп.)
В отличие от InSb соединение TISb (а также TIBi) имеет
структуру типа CsCl. К исключениям относится InBi со струк-
турой типа В 10 (т. 1, разд. 6.7.1), в которой атомы In тетра-
эдрически окружены четырьмя атомами Bi, тогда как ближай-
29.6. Структуры сплавов 493
шими соседями атома Bi являются четыре атома In, располо-
женные с одной стороны — в вершинах основания квадратной
пирамиды.
29.6.10. Формулы сплавов. Твердые растворы замещения могут
иметь любой состав в пределах области смешиваемости взятых
металлов, причем в них осуществляется статистическое распре-
деление атомов по позициям в структуре металла-раствори-
теля. При определенных отношениях количеств атомов могут
возникать сверхструктуры. Два сплава одного и того же соста-
ва, по с различной структурой — упорядоченной и неупорядо-
ченной—могут заметно отличаться друг от друга по физиче-
ским свойствам. Таким образом, состав не может служить
исчерпывающей характеристикой сплава. Состав твердых раст-
воров внедрения также изменяется в определенных пределах.
Верхний предел количества внедренных атомов определяется
числом пустот подходящего размера, но, как мы увидим ниже,
этот предел достигается не всегда. Когда это позволяет отно-
шение числа внедренных к числу основных атомов структуры,
в ней осуществляется симметричное расположение двух типов
атомов. В промежуточных случаях расположение внедренных
атомов является статистическим.
Если теперь перейти к сплавам, называемым интерметалли-
ческими соединениями, которые обычно противопоставляют
твердым растворам, можно обнаружить, что в некоторых случа-
ях соотношение количеств атомов различного сорта, ожидаемое
для данного типа кристаллической структуры, практически ни-
когда не достигается. При рассмотрении электронных соедине-
ний нами было отмечено много случаев, когда в одном и том же
структурном типе кристаллизуются сплавы с совершенно раз-
личными формулами (например, CuZn, Cu3Al и Cu5Sn — все с
Р-структурами). Как мы знаем, в этих случаях состав определя-
ется величиной пэ/па. При определенной температуре электрон-
ное соединение так же, как твердый раствор, устойчиво в неко-
торой области составов, так что выбор определенной формулы
производится в соответствии с числом эквивалентных позиций
в кристаллической структуре (например, Си9А14, а не, скажем,
Си9А15) который также попадает в область устойчивости этой
фазы) или (и) простыми значениями п3/пЛ Юм-Розери. Уже
отмечалось, что точные значения этих соотношений 3/2, 21/i3 и
7U) не имеют теоретического обоснования. Структура сплава
Ag3Al полностью неупорядоченна; в элементарной ячейке име-
ется 20 атомов, которые занимают позиции двух типов: 12- и
8-кратную. Однако существуют сплавы, отличные от р-, у- и
е-фаз, состав которых никогда не отвечает составу идеальной
структуры. Например, в системе Си —А1 имеется 0-фаза с иде-
494 29. Металлы и сплавы
альной формулой СиА12, структура которой показана на
рис.^ 29.17. В этой тетрагональной структуре на элементарную
ячейку в соответствии с требованиями симметрии приходятся
четыре атома Си и восемь атомов А1. Если, однако, попытаться
приготовить сплав состава СиА12, то система окажется него-
могенной; она будет состоять из смеси сплавов, имеющих
структуры СиА12 и CuAl. Другими словами, структура СиА12
при отношении Си : А1, равном 1 : 2, является неустойчивой, но
приобретает стабильность при более высоком содержании алю-
миния. Таким образом, хотя эта 6-фаза и устойчива в некотором
узком ^интервале составов, сплав СиА12 лежит вне этого интер-
вала. Законы, которым подчиняются обычные химические соеди-
нения (хотя есть и исключения, см. FeS, разд. 17.1.3), оказыва-
ются неприменимыми к некоторым металлическим системам.
Особенности поведения сплава СиА12 становятся менее удиви-
тельными, если вспомнить, что приблизительный состав фаз
этой системы с р и ^-структурами отвечает формулам Си3А1
и Си9А14 соответственно. Аналогичное явление обнаружено в
Р-фазе системы Сг—А1. Твердый раствор А1 в Сг (с ОЦК-струк-
турой) при высоких температурах устойчив вплоть до -30% А1,
т. е. состав Сг2А1 в эту область не входит. Если, однако, сплав!
содержащий —25% А1, медленно охлаждают, то объемноцент-
рированная кубическая структура превращается в тетрагональ-
ную р-структуру, показанную на рис. 29.21. Как можно видеть
из схемы, р-структура близка по строению к ОЦК-структуре,
и ее идеальный состав отвечает формуле Сг2А1. Несмотря на то
что р-структура устойчива в довольно широком интервале со-
ставов, сплав Сг2А1 находится вне этого интервала. Поэтому
медленное охлаждение сплава с точным составом Сг2А1 приво-
дит к двухфазной смеси, состоящей из богатой алюминием фазы
со структурой Сг2А1 и твердого раствора с ОЦК-структурой.
29.7. Карбиды и нитриды со структурой фаз внедрения
В гл. 4 было показано, что с геометрической точки зрения
структуры многих неорганических соединений, особенно гало-
генидов и халькогенидов, можно рассматривать как совокуп-
ность плотноупакованных атомов (ионов) неметалла, в которой
атомы металла занимают тетраэдрические или октаэдрические
пустоты между четырьмя или шестью атомами неметалла.
Число таких пустот для совокупности из N плотноупакованных
шаров составляет соответственно 2N и N. При заполнении
части или всех пустот в гексагональной или кубической плот-
нейших упаковках образуются простые структуры следующих
типов: J
29.6. Структуры сплавов 495
Занятые пустоты
ГПУ
КПУ
Формула
Bi-e тетраэдрические
1 : тетраэдрических
Все октаэдрические
','; октаэдрических
Вюртцит
NiAs
( Г.аС!2 (рутил)
1 CdL
Лнтифлюорит
Цинковая об-
манка
NaCl
Атакамит
CdCl2
А2Х
АХ
АХ
АХ2
Описание этих структур в виде плотнейших упаковок гало-
генных или халькогенидных ионов является, с одной стороны,
удобным, а с другой — довольно правдоподобным для октаэд-
рических структур (т. 1, разд. 4.2), поскольку в большинстве
случаев эти ионы значительно больше по размеру, чем ионы
металлов. Возможен и другой предельный случай, когда в
структурах соединений металлов с неметаллами атомы неме-
талла небольших размеров занимают пустоты между атомами
металла, расположенными по принципу плотнейшей упаковки.
По причинам структурного порядка более удобно строение
гидридов (т. 2, разд. 8.2) и боридов (разд. 24.4) рассматривать
отдельно. У боридов важной особенностью многих структур
является наличие связей В—В; по составу и строению бориды
обычно сильно отличаются от карбидов и нитридов. Строение
карбидов МС2 было описано в гл. 22. В структурах LaCs и
ThC2 атомы углерода присутствуют в виде ионов Сг2~. Несмотря
на то что эти структуры можно рассматривать и как КПУ ато-
мов металла с ионами С22~ в октаэдрических пустотах, все же
имеется существенное отклонение от кубической симметрии бла-
годаря крупному размеру и несферической форме ионов С22~,
так что эти карбиды не относят к соединениям внедрения.
Совместно с карбидами и нитридами со структурой фаз внедре-
ния иногда рассматривают некоторые оксиды, о которых будет
сказано ниже. Поскольку карбиды и нитриды железа намного
активнее химически, чем другие описанные здесь соединения,
и отличаются от них строением, удобно рассматривать их от-
дельно.
Относящиеся к соединениям внедрения карбиды и нитриды
обладают многими свойствами, характерными для интерметал-
лических соединений: непрозрачностью (в противоположность
прозрачным солеподобным карбидам кальция и др.), хорошей
электропроводностью и металлическим блеском. Однако в отли-
чие от чистых металлов эти соединения, как правило, обладают
очень высокой твердостью и имеют высокие температуры
плавления. Структуры соединений с формулой MX обычно ос-
нованы на кубической плотнейшей упаковке, а соединений с
496 29. Металлы и сплавы
формулой М2Х — па гексагональной плотнейшей упаковке. Тем-
пературы плавления и твердость некоторых соединений внедре-
ния приведены ниже. Эти соединения могут быть синтезированы
при нагревании тонкоизмельченного металла с углеродом (при
~2200°С) или в токе аммиака (при 1100—1200°С). Другой
способ состоит в нагревании металла в виде проволоки в атмо-
сфере углеводорода или азота. Твердый раствор состава
4TaC + ZrC плавится при чрезвычайно высокой температуре
D215 К). Эти соединения весьма химически инертны, исключе-
ние составляет лишь действие окислителей. Они обладают зна-
чительной электропроводностью, которая, как и в случае метал-
лов, понижается при повышении температуры; некоторые соеди-
нения обнаруживают сверхпроводимость.
TiC
HfC
\Y2C
NbC
a
Т. „л..
3410
4160
3130
3770
Твердость yi;a
К
:mna no
Тг.ордос
8-9
9—iO
-™ M
тьа
носа.
Ti\
:-'rN
Ta."\
В Kf/I4
ipo:"i и-
i . IIЛ..
3220
3255
3360
,с,,дисть
к
;',лмаза
Твердость
8-9
8
равна 10.
Термины «соединение внедрения» и «твердый раствор внед-
рения» были введены потому, что, согласно первоначальным
представлениям, образование таких фаз связывали с внедрением
атомов неметалла в пустоты структуры металла без какой-либо
существенной ее перестройки. Справедливость такого подхода
к этим структурам подтверждалась их металлической проводи-
мостью, переменным составом многих из фаз, а также фактом
существования верхней границы размеров внедряющихся ато-
мов по отношению к размерам атомов металла. Теперь нам
известно, что атомы С и N действительно занимают пустоты
(обычно октаэдрические) в упаковках (обычно плотнейших)
атомов металла, однако само расположение атомов металла,
как правило, отличается от их расположения в структуре ис-
ходного металла, хотя первоначально при образовании твердого
раствора структура металла может и сохраняться. Например,
при растворении азота в титане до состава TiNo,2o эта фаза
представляет собой твердый раствор азота в структуре cc-Ti
(ГПУ). е-Фаза состава TiNo.so имеет структуру антирутила с
искаженной ГПУ атомов Ti. Однако у фазы TiNo.6o (при
900 °С) расположение атомов Ti уже соответствует КПУ (де-
фектная структура NaCl) [1], тогда как высокотемпературная
форма титана (выше 880 °С) имеет ОЦК-структуру.
29.7. Карбиды и нитриды со структурой фаз внедрения 497
Таблица 29.13. Структуры металлов и соединений внедрения MX
-Металл
Sc
La
Се
Рг
Nd
Ti
Zr
Hf
Th
V
Nb
Та
Cr
Mo
W
U(v)
Структура
металла а
A 1, A 3
Л 1, A 3
A I, A3
A3
A3
A 2, A 3
A 2, A3
A 2, A3
A 1
Л2
A 2
A 2
A2
A 2, A 3
.4 2
Л2»
Карбид
—
В 1
В 1
В 1
В 1
В 1
В 1
В 1
Геке?
WC
WC
В
Нитрид
В 1
В 1
В 1
В 1
В 1
В 1
в\
В\ (?)
В 1
В 1
В 1б
См. текст
в\
WC
WC
51
Оксид
—
—
—
В 1 (т. 2
разд.
12.7.1)
В 1
—
В 1
В 1
См. текст
—
В !
Обозначения: Л\ — кубическая плотнейшая упаковка, Л2 — объем-
н-^центрированная кубическая структура, A3 — гексагональная плотнейшая
упаковка, В\ — тип NaCl.
" Структура типа В\ установлена для состава NbN0i9O .
Существуют также а- и Р-фазы с более низкой симметрией.
В табл. 29.13 указаны известные к настоящему времени
структуры металлических карбидов (МС) и нитридов (MN).
Из всех металлов табл. 29.13, образующих карбид или нитрид
со структурой типа NaCl, лишь четыре имеют в чистом виде
плотноупаковаипую кубическую структуру. Во всех остальных
случаях расположение атомов металла в соединениях MX от-
личается от расположения атомов в структуре чистого металла.
(Это справедливо также и для многих гидридов, см. разд. 8.2.3).
Следует отметить также, что хотя многие из этих соединений
характеризуются переменным составом, некоторые имеют по-
стоянный состав, например UC, UN и UO. Во всяком случае,
наличие переменного состава присуще не только соединениям
внедрения (см., например, замечание по поводу нестехиометри-
ческих соединений в разд. 1.1).
Некоторые из соединений MX в табл. 29.13 имеют струк-
туру, отличную от типа NaCl, например WC, структура которо-
го схематически показана па рис. 4.8 (т. 1, разд. 4.1J), и e-TaN
(рис. 29.22). Кроме (З-фазы состава Ta2N (изострукту'рной фа-
зам p-Nb2N, p-V2N, e-V2C и e-Fe2N; т. 1, разд. 4.3) и 6-TaN —
высокотемпературной фазы со структурой NaCl — тантал обра-
зует еще e-TaN [2]. Особенность этой структуры состоит в квад-
498 29. Металлы и сплавы
ратно-пирамидальной координации атома N пятью атомами Та
(четыре атома на расстоянии 2,16 А и один — на расстоянии
2,04 А). Атом Tai имеет плоскую треугольную координацию
тремя атомами N (на расстоянии 2,04 А), и, кроме того, два
ближайших атома Та (на расстоянии 2,91 А), и еще 12 атомов
Та (на расстоянии 3,34 А), тогда как атом Тап находится в
центре тригонально-призматической группы из 6 атомов N (на
2,16 А), имея еще 11 соседних атомов Та B атома на расстоя-
- Q Та, на высоте О
СШ Та,, на высоте с/2
Q О N на высоте О
Ч
Рис. 29.22. Проекция четырех элементарных ячеек структуры ТаХ.
нии 2,91 А, 3 атома — на расстоянии 3,00 А, 6 атомов — 3,34 А).
Из предыдущего ясно, что эти соединения имеют следующие
отличительные особенности: а) кристаллизация в большинстве
случаев и независимо от структуры исходного металла в струк-
турном типе NaCl; б) высокая температура плавления и высо-
кая твердость; в) хорошая электропроводность. В связи с этим
Рандл [3] высказал предположение, что подобные свойства
указывают на наличие сильных связей металл — неметалл, при-
чем связи атома неметалла хотя и направлены октаэдрически,
но не локализованы (что объясняет электропроводность). Эти
соединения следует отнести к электронодефицитным, причем
атом неметалла может образовать шесть октаэдрических связей
двумя способами: 1) используя три 2р-орбитали (для трех пар
электронов), тогда как на 25-орбитали находится электронная
пара; 2) используя две гибридные sp-орбитали (угол между
связями 180°) и две р-орбитали, которые ориентированы пер-
пендикулярно гибридным орбиталям и друг другу. Шесть (ок-
таэдрических) связей становятся затем эквивалентными за счет
гибридизации. Если применить соотношения Полинга
(разд. 29.3), то в первом случае связи имеют порядок '/г.
во втором — 2/з- Использование 25-орбитали неподеленной парой
электронов становится вероятным, если неметалл является до-
статочно электроотрицательным по отношению к металлу (на-
29.7. Карбиды и нитриды со структурой фаз внедрения 499'
пример, в «субоксидах» МО), а также, возможно, в нитридах
более электроположительных металлов. Согласно этому, в нит-
ридах металлов группы IIIА и карбидах металлов группы IVA
в связях металл — неметалл используются все валентные элек-
троны, так что расстояния типа металл — металл определяются
прочностью связей М—X. В нитридах металлов IV группы и
карбидах металлов V группы на каждый атом приходится
по одному электрону, используемому для связи металл — ме-
талл, что в случае структуры типа NaCl означает порядок (уси-
лие) связи Vi2- В нитридах металлов V группы и в карбидах
металлов VI группы на атом металла приходится по два элект-
рона, что соответствует порядку (усилию) связи 7б- Такие связи
оказываются уже достаточно сильными для того, чтобы ока-
зывать влияние на устойчивость структуры типа NaCl. В соот-
ветствии с этим системы Nb — N и Та — N отличаются своей
сложностью, а в карбидах и нитридах Сг, Мо и W для соедине-
ний MX обнаружены структуры, отличные от типа 51. (Возмож-
но, что UC и UN являются исключениями из-за того, что атом LJ
в них не является шестивалентным).
Подобный подход к соединениям внедрения интересен еще
и тем, что он в некоторой степени объясняет, почему сюда от-
носятся лишь соединения типа МС и MN (иногда и МО) эле-
ментов ША—VIA-подгрупп. Устойчивость таких соединений
обусловлена выполнением следующих требований: 1) один из
элементов (М) должен иметь большее число устойчивых связе-
образующих орбиталей, чем число валентных электронов, и по-
этому должен относиться к металлам; 2) другой элемент должен
располагать относительно небольшим числом орбиталей, пригод-
ных для образования связей, и поэтому должен относиться к
неметаллам; 3) электроотрицательное™ этих двух элементов
не должны отличаться настолько сильно, чтобы характер связи
оказался существенно ионным (благодаря этому исключаются
фториды и многие оксиды). Бор, например, по этой классифи-
кации попадает в группу металлов, в соответствии с чем бори-
ды структурно сильно отличаются от карбидов и нитридов.
Только металлы, имеющие больше четырех устойчивых орбита-
лей, пригодных для образования связей, могут побудить атомы
С, N и О использовать одну орбиталь для образования более
чем одной связи. К таким металлам относятся металлы А-под-
групп. У металлов Б-подгрупп d-уровни, находящиеся ниже
валентной оболочки, заполнены полностью, как, например,
у атомов Ga, In и Т1, которые за счет тетраэдрических sp3-op-
биталей образуют нитриды с «нормальной структурой» (в про-
тивоположность структурам внедрения). Среди металлов
А-подгрупп щелочные и щелочноземельные являются слишком
электроположительными для того, чтобы дать существенно ко-
500 29. Металлы и сплавы
валентные связи с атомами С, N и О. Поэтому соединения внед-
рения характерны для металлов, начиная с III группы.
Литература. [1] Acta Chem. Scand., 1962, 16, 1255. [21 Acta cryst., 1978, B34,
261. [3] Acta cryst., 1948, 1, 180.
29.7.1. Железо и сталь. Обычная сталь представляет собой же-
лезо, содержащее небольшое количество углерода. Многие сор-
та стали, используемые для специальных целей, содержат так-
же легирующие добавки одного или нескольких металлов (Сг,
Mo, W, V, Ni, Mn), которые оказывают существенное влияние
на те или иные свойства стали. Мы ограничимся обсуждением
простой системы Fe—С. Полезные свойства таких материалов,
как различные сорта «железа» и стали, зависят от содержания
в них углерода и от способа его распределения в металле. Сис-
тема Fe-—С оказывается более сложной, чем только что
описанные системы металл — неметалл, содержащие соединения
внедрения, в силу двух обстоятельств. Во-первых, у железа су-
ществуют две аллотропные модификации. Модификация, устой-
чивая при обычных температурах, обладающая ферромагне-
тизмом и называемая а-железом, имеет объемноцеитрпроваппую
кубическую структуру. Эта структура устойчива до 906°С,
а также в интервале 1401—1530 °С (т. пл.). В промежуточном
интервале температур 906—1401 °С устойчива гранецентриро-
ванная структура у-железа, являющегося немагнитным. Точка
Кюри G66°С) лежит ниже перехода а—у, и в интервале
766—906°С железо существует в форме |3-Fe. В связи с тем что
в точке Кюри изменения положений атомов не происходит, мы
в дальнейшем исключим р-железо из рассмотрения. Вторым
осложняющим обстоятельством для системы Fe—С служит то,
что отношение радиусов С : Fe @,60) находится вблизи пре-
дельной величины для образования твердых растворов внедре-
ния. Поэтому в дополнение к фазе твердого раствора может
образоваться карбид железа Fe3C. Таким образом, углерод в
зависимости от его содержания и характера термической обра-
ботки материала может присутствовать в свободном состоянии
в виде графита, в фазе твердого раствора или в виде цементита
(Fe3C).
Железо получают выплавкой из смеси оксидной руды с кок-
сом, так что в расплаве имеется избыток углерода. Расплавлен-
ное железо растворяет до 4,3% углерода, при этом температура
затвердевания эвтектической смеси составляет 1150 °С. Поэто-
му чугун содержит около 4% углерода. За счет примеси глин
в рудах в железо переходит также до 2% кремния. Углерод в
чугуне в зависимости от содержания кремния может присутст-
вовать в форме цементита (белый чугун) или графита (серый
чугун). Наличие кремния благоприятствует разложению цемен-
29.7. Карбиды и нитриды со структурой фаз внедрения 501
тита и выделению графита; обычно в сером чугуне углерод
присутствует в обеих формах. Материал, затвердевший при
1150°С и содержащий 4,3% С, является смесью фаз, поскольку
максимальная растворимость углерода в у-железе при этой тем-
пературе (т. е. в гомогенном твердом растворе) составляет 1,9%..
При понижении температуры до 690 °С, при которой y-Fe в при-
сутствии углерода еще сохраняет устойчивость, растворимость
падает до 0,9%. (Железо можно стабилизировать в немагнит-
ной у-форме и при комнатной температуре путем введения до-
бавок таких элементов, как Мп и Ni, которые способны давать
твердые растворы лишь с у-железом, но не с а-железом.) При
удалении из чугуна всех примесей до уровня следов получают
наиболее чистое нз продажных сортов железа — сварочное же-
лезо. Сталь содержит до 1,5% углерода; в мягкой стали его
содержание составляет —0,1—0,5%. Поэтому производство
стали включает процесс контролируемого понижения содержа-
ния углерода в чугуне либо процесс контролируемого введения
углерода в сварочное железо (процесс цементации). Ниже мы
рассмотрим процессы, из которых складывается производство
стали.
Выше 906 °С сталь представляет собой немагнитный твердый
раствор углерода в у-железе (аустенит). Строение этого твердо-
го раствора характеризуется простым статистическим распреде-
лением атомов углерода (поскольку их количество недостаточно
для образования упорядоченной структуры). Надежно установ-
лено, что в аустепите атомы углерода занимают октаэдрические
пустоты в структуре у-железа. При медленном охлаждении
аустенита сначала происходит выделение избытка углерода в
виде цементита, так как растворимость углерода падает при
690°С до 0,9%. Ниже этой температуры a-Fe становится неус-
тойчивым и твердый раствор углерода в y-Fe превращается
в эвтектоидную смесь феррита и цементита. Феррит представля-
ет собой фазу почти чистого a-железа, содержащую в вече твер-
дого раствора лишь 0,06% углерода. Освободившийся углерод
входит в состав цементита. Эта эвтектоидная смесь, называемая;
перлитом, имеет тонкозернистую полосчатую структуру, облада-
ет перламутровым блеском и очень низкой твердостью'. Другой
крайний случай термической обработки состоит в закаливании
аустенита до температуры ниже 150°С, в результате чего обра-
зуется мартенсит, являющийся пересыщенным твердым раство-
ром углерода в a-железе и содержащий до 1,6% С. Он характе-
ризуется высокой твердостью, и именно его присутствием
объясняется твердость закаленной стали. (Исходная "у-струк-
тура твердого раствора может сохраниться при закаливании
лишь при наличии в стали других металлов, о чем сказано вы-
ше.) Твердую и хрупкую сталь, получающуюся в результате
502 29. Металлы и сплавы
закалки, переводят в материал, более пригодный для примене-
ния, путем отжига. Он заключается в повторном нагревании
мартенсита до температур 200—300°С, в результате которого
происходит контролируемое превращение закаленного твердого
раствора в феррит и цементит. Смесь фаз, получаемая при от-
жиге, имеет более грубую микроструктуру, чем перлит, и назы-
вается сорбитом. При отжиге твердость стали понижается, но
зато возрастает ее прочность. Таким образом, сорбит является
промежуточным звеном в ряду превращений: аустенит — мар-
тенсит—сорбит— перлит. Способы термической обработки ста-
ли удобно представить в виде схемы 29.2.
Сх е мо. 29. 2
(твердый, раствор С в у- Ve)
медленное
охлаждение
закалка
до < 150 X
{при 609Г) Перлит
(tpeppum + цементит)
\
закалка
(в присутствии
Мп, Ni)
Мартенсит
(пересыщенный
твердый раствор С
в a-Fe)
„ аустенитные "
типы сталей
(структура у-Те)
Сорбит
( феррит+цементит)
Интересно отметить, что структуру цементита нельзя свя-
зать простым путем со структурами а- или -у-железа. В струк-
туре v-Fe каждый атом Fe окружают 12 атомов С на расстоянии
2,52 А (значение, получаемое путем экстраполяции к комнатной
температуре), а в a-железе — 8 атомов на расстоянии 2,48 А.
В структуре цементита некоторые атомы имеют по 12 соседей
на расстояниях 2,52—2,68 А, тогда как другие атомы — по
11 соседей на расстояниях 2,49—2,68 А. К наиболее интересным
особенностям этой структуры следует отнести окружение атомов
углерода: шесть ближайших атомов железа находятся в верши-
нах искаженной тригональной призмы, но, поскольку интервал
изменения расстояний Fe—С довольно широк A,89—2,15 А),
к координационному окружению атома С можно отнести еще
два атома Fe на расстоянии 2,31 А. Причины, обусловливающие
наличие этого асимметричного окружения атома С (в отличие
от октаэдрического окружения в аустените), пока неясны.
29.7. Карбиды и нитриды со структурой фаз внедрения 503
Процесс поверхностной закалки стали представляет собой
ыггересный пример образования соединений внедрения. По
очном)' методу углерод и азот вводятся в поверхностные слон
стали за счет выдерживания в расплавленной смеси NaCX,
Гча^СОз и NaCl при ~870°С. Другой способ состоит в нагрева-
нии стали в атмосфере Н2, СО и N2, содержащих определенные
количества NH3 и СН4. При таких способах обработки проис-
ходит введение и углерода, и азота. Несмотря на то что железо
с молекулярным азотом не реагирует, поверхностная закалка
некоторых сортов стали все же может быть произведена дей-
ствием аммиака при температурах около 500°С. Фазовая диа-
грамма системы Fe—N довольно сложна; в ней образуются сле-
дующие фазы:
а — твердый раствор (—1,1 ат. % N при 500°С);
у —фаза, устойчивая только выше 600 °С, причем ее состав
при этой температуре приблизительно отвечает формуле
F10N;
у' — также ГЦК-фаза, состав Fe4N;
е ¦— ГПУ (при низких температурах интервал составов от FesN
до Fe2N, но пределы устойчивости сильно зависят от тем-
пературы) ;
? — Fe2N (ромбическая фаза, несколько деформированный ва-
риант Б-СТруКТуры) .
Перечисление этих фаз здесь приведено для того, чтобы еще
раз показать, что при увеличении концентрации внедряющихся
атомов происходит и изменение расположения атомов металла.
Кроме того, отличительной чертой этих нитридов, за исключени-
ем у-фазы (устойчивой лишь при высоких температурах и при
сравнительно низких концентрациях атомов N), является упо-
рядоченное расположение атомов N в октаэдрических пустотах
[Acta cryst., 1952, 5, 404].
формульный указатель
ЛсВгз 2, 101
АсС13 2, 101
AcF3 2, 101
Ас2Оз 3, 412, 436
AcOCl 3, 412
AcOF 2, 176
Ac2S3 3, 412
Ag 3, 447
Ag3Al 3, 484
Ag5AI3 3, 485
AgAlCl4-C6He3, 246
AgA102 2, 292
AgAlS2, 2, 535
Ag3AsS3 3, 233, 246
AgBr 2, 88, 125
Ag2BrNO3 3, 227
!(AgBr2J[Ni(enJ] 3, 238
AgCH3 3, 83
Ag(C2C6H3)(PMe3) 3,246
Ag(C6He)C1043, 82
Ag(C8H8)NO33, 82
Ag(C3H3N2JC104 3, 226
Ag(C4H4N2)NO33, 233
Ag(C5H5NL2+ 3, 230
Ag(C6H16N10K+ 3, 231
Ag(C4H802KC104 3, 246
Ag(C6H4NO2J 3, 231
[Ag(C5H10)Cl(P(C6H5JJl2 3, 242
r(AgC4H8S)I(P(C6H5JJ]2 3, 241, 242
AgCN 3, 233
TAg(CNJ]K 3, 233, 242
Ag[C(CNK]3, 245
AgfC(CNJNO]3, 245
Ag[C(CNJNO2]3, 245
Ag3CN(NO3J 3,233
AgCO3K 3, 233
Ag—Cd 3, 484
AgCl 2, 88, 125
AgCl32- 3, 238
Ag2Cl53- 3, 284
Ag2ClNO3 3, 226
AgCuS 3, 282
AgF 2, 88
AgF, 1, 329; 3, 230
AgF4K 3, 231
Ag7FO8 3, 231
AgFeO2 1, 324—325; 2, 292
Ag2HgI4 2, 534
Agl 2, 88; 3, 236
Agl32- 3, 238
Ag2I3- 3, 238
Ag2I(NO3) 3, 226
Ag3I(NO3J3, 226
Ag(HIO6J5- 3,229
Ag4I4(PR3L 3,241
Ag2I4N2(CH2J(CH3N 3, 228—229
Ag,3I9(WO4J 3,229
AgInS2 2, 532
Ag[NC(CH2LCNl2C104 3, 241
Ag(NH3J+ 3, 234
AgNO3 3, 226
Ag7NOi, 3, 227, 231
Ag3NO3S 3, 227
Ag4(NO3JTe 3, 226, 228
Ag3(NSO2K-3H2O 3, 226
Ag2(NHJSO2 3, 234
Ag4N2SO2 3, 234
AgO 3, 231
Ag2O 3, 232
AgOK 3, 232
Ag2Pb02 3, 336
Ag2S 2, 498
AgSCN 3, 34—35
Ag[SC(NH2J]2Cl 3, 247
rAg{SC(CH3)NH2}4]Cl 3, 236
[AgS2CH(C3H7J]e 3, 245
AgS3(CH2KNO3-H2O 1, 132
Ag(S2O3L7- 3, 242
Ag3Sb 3, 455
AgSbO3 2, 325
AgSbS2 2, 538
Ag3SbS3 3, 233
Ag(H2Te06J5- 3, 229
Ago 6sV2O5 2, 345
AgZn3 3, 485
Al 3, 444
AlAs 2, 599
AlAsO4 2, 308
AlAu3 3, 484
A!2Au 3, 487
A1B2 1, 185; 3, 176
A1B4OC4 3, 172
Формульный указатель 505
A1B3H123, 215
A1BO3 3, 191
Al2Be04 2, 310
A!Br3 2, 98—99, 129
AUBr7- 2, 156
AI4C3 3, 48
A1SC3N 3, 53
AI4CO4 3, 53
A1(CH3K3, 84
A1(CH3J(C5H6) 3, 78
Al(C2H5J(C5H5JCl2Ti 3, 80
[Al(CH3JCi]2 3, 86
[A1(C2H5JF]43, 86
[A1(C2H5NF]K2, 57
Al,(CH3)8Mg 3, 86
Al,(CH3MN(CeH5J3, 86
Al2(CH3)io02Si22, 194
Al,CdS4 2, 534
A!C1 2, 125
AICI3 2, 98—99, 129
A1C13-6H,O 2, 408
(AlCl4),Cd23, 296
(AiCl4JCo 1, 217
(AlCl4)SeCl32, 486
(AlCl4)->Se8 2, 444
AlCl4Cu(C6H6) 3, 82
A12C17- 2, 156
AICo 3, 487
АЦС02 3, 487
Al9Co2 3, 487
AlCr2 3, 491
Al2Cu 3, 487
AIC113 3, 484—485, 493
Al4Cu9 3, 485, 493
AI3Er 3, 470
A1F 2, 125
A1F3 2. 97, 129
AI(F,OHK-V8H2O 2, 325
(A1F4)T! 2, 161
(AlF,)Sr 2, 142
(A1F5)T122, 142, 162
(A1F5-H2O)K2 2, 144
(AIF6)M3 2, 151-153
AlF7MgNa2 2, 682
Al2F12Li3Na3 2, 160
Al3F,4Na5 2, 161
AlFe 3. 487
AlFe3 3, 468
Al3Fe 3, 488
A1H3 2, 8
A1H3-2N(CH3K 2. 10
A1H3-N2(CH2J(CH3L2, 10
AlH4Li 2, 18
AlH4Na 2, 18
AII3 2, 98—99, 129
AlLi 3, 472
AILi(C2H5L 3, 85
AlLiO2 2, 292
Al3Mg2 3, 478
Al,2Mg17 3, 478
Al30Mg23 3, 478
A1N 2, 599
Al(NH2LNa 2, 553
A1N(CH3KC132, 547
Al3N3(CH3N(C2H4b 2, 547
Al4N4(CeH5)8 2, 547
A1(NO3K 2, 583
[Al(NO3L]-2, 583
Al(N<W-2, 583
Al[N(SiMe3Jl32, 549, 552
AlNbO4 2, 332
AINi 3, 487
Al3Ni, 3, 487
а-А12О32, 251, 261
P-A12O32, 318
у-А12О3 2, 261
A12O4M 2, 312
AlOBr 2, 181
A1OC1 2, 181
A1OI 2, 181
A1(OHK 2, 261, 362
|А1(ОН)б12Са32, 364
a-AlO(OH) 2, 261, 367
¦Y-AIO(OH) 2, 261
|А1О(ОНJ]2Ва 3, 131
Л13Оз(СН3)9 2, 194
Al2O2(CH3L[Si(CH3Kl, 2, 194
ГА12(ОН)ю]Ва2 2, 364
[Al2(OH),(H2O)8](SO4b-2H2O 2, 376
[AI13O4(OHJ4(H2OI2f-2,228
[Al13O4(OHJ5(H2OI1f-2, 228
А12ОB-Ме-8-хинолниолL 2, 209
А13,Са3051 2, 317
A1P 2, 599
A1PO4 2, 627
Al3Pd2 3, 487
AU'f 3, 487
AW'ii 3, 470
AI0S3 2, 514; 3 436
Al2S4Zn 2, 527, 534
AlSb 2, 599
Al2Se3 2, 534
(AlSi3O8)K 3, 149
(AlSi3O3)Na 3, 149
Al2Si05 3, 129—1Я0, 136
(Al2Si208)Ba 3, 149
(Al2Si208)Ca 3, 149
AlTh2H4 2, 18
Al3Ti 3, 469
AlTiCl2(C2H5J(C,IL,b 3, 80
AI2Ti05 2, 324
AI5W 3, 471
A1\VO4 2, 309
AI2(WO4K 2, 327
A13Y 3, 470
Al2ZnS4 2, 534
33—1284
506 Формульный указатель
Формульный указатель 507
(Л1, ZnL9Mg32 3, 479
AI3Z1- 3, 469
Al3Zr4 3, 479
Am 3, 452—453
AmBr2 2, 94
АтВгз 2, 101
AmCI 2, 94
ЛтС!3 2, 101; 3, 412
AmCh-бНоО 2, 415; 3, 412—413
AmF3 2, 101; 3, 412—41o
A111F4 2, 107; 3, 412—413
(AmFs) (NH4L 2, 155
AraH2 2, 12
AmH3 2, 12
Aml2 2, 94
Aml3 2, 101
AmO 2, 243; 3, 413
AmO2 2, 247; 3, 413
Am,O3 2, 251; 3, 413, 436
AmOCl 3, 413
(AmO9CO3)K 3, 429
(AmO2F2)K 3, 429
Am(OHK 2, 356
Am2S32, 518; 3, 413
Ar 3, 440
Ar, гидрат 2, 395
ArClH 2, 47, 52
ArFH 2, 47, 52
ArO 2, 47
As 1, 86; 2, 646
AsBr3 2, 650
AsBr(C6H5J 2, 650
As(CF3K 2, 650
As(CF3L 2, 647
As(CH3K 2, 650
[As(CH3Ll+ 2, 649
(AsCHuh 2, 647
rAs(C6H5Ll+2, 650
As(C6H5M 2, 653
(AsC6H5N 2, 647
As(CH3)(CNJ 2, 650
As(CH3)I2 2, 650
As(CH3JO(OH) 2, 677
As2(CH3LS2 2, 686
rAs(CH3JMo4(V,H|2- 2, 234
As(CNK 2, 650; 3, 26
AsCl3 2, 650
(AsCl4) (NMe4) 2, 652
(As2Cl9)Cs3 1,225; 2, 157
As3Co 1, 317
As3Co(COK 2, 647
As2Co2(COM(P(CGH5K) 2,647
rAs4Co2W4oOi4o(H20J(NH4)]23- 2, 235
AsCr2Oio3- 2, 677
AsCr3Ol33- 2, 677
AsF3 2, 650
AsF5 2, 653
(AsF6)IFG 2, 69
(AsFJM 2, 147, 654
As,F6O22- 2, 655
As,F10C)"- 2, 654
As3F,,O33- 2, 654
AsH3 2, 650
Asl3 2, 650, 656
As4(NCH3N 2, 647
(AsN(C6H5Jb2, 647
(AsN(CaFI5JL 2, 647
As2O3 2, 620, 663
As2O4 2, 674
As2O5 2, 676
As2O3-NH4Cl-V2H2O 2, 667
(AsO2)Na 2, 667
(AsO3)Na 2, 676
AsO(OHJR 2, 677
(AsO4)CaFI-2H2O 2, 419
(AsO4)H3-1/2H2O 2, 676
(AsO4)KH22, 676
(AsO4)Na2H-7M2O2, 411
(AsO4)(OHKCu3 3, 278
AsO4Y 2, 676
AsO(OHK-'AH2O 2, 676
AsO2(OHJ-2, 676
AsO3OH2" 2, 676
As2O4Ni 2, 667
As2O6NaH 2, 677
As3O105- 2, 676
As4Oi,4- 2, 676
As4O148- 2, 677
AsO2S23- 2, 686
AsO3S3- 2. 686
AsS2- 2, 685
AsS33- 2, 685
AsS43- 2, 686
As2S, 2, 684
As2S3 2, 683
As4S3 2, 684
As4S4 2, 684
As4S5 2, 684
As4S62~ 2, 684
AsSbO4 2, 674
AsSbS3 2, 684
As(SiH3K 2, 650
As\V18O60H27- 2, 229
AtCH3 2, 60
AtH 2, 60
AtX 2, 60
Au 3, 447
ЛиВгз 3, 284
AuBrvP(CH3b 3, 284
AuBro-S(C6H5CH2J 3, 223
AuBr,-S2CN(C4H9), 3, 229, 285
Au,Br,(C2H,L 3, 284
Au(CH-,K3, 83
|Au(CH3JOHl.t 3. 285
Ли(СоС5Н4)(КтН,С;,Н7) 3, 233
Aib(C,H4)Cl,[P(C6H-,L, 3, 235
AuC^H,6N8 3, 223
Au[C6Fl4(As.McoJ},L, 3, 285
A11CN 3, 235
[Au(CNJ]K 3, 235, 242
|Au(CNLlK-H,0 3, 283
|AuCN(C3H7J"|, 3, 42, 285
AuCl 3, 235
A11CI-, 3, 284
(AuCU) (AuCl4)Cs2 2, 158; 3, 235
(АиС1,)[Аи(ДМГJ1 3, 286
AuCl(NH3J 3, 234
AuClO 3, 283
AuCl-P(C6H5K 3, 234
AuCl[P(C6H5Kl2 3, 246
Audi 3, 465
А11С113 3, 466, 468
A11F3 3, 284
AuF4- 3. 284
Aul 2, 88; 3, 235
rAu(mntJ][(C4H9LN], 3, 223
Au(NO3K, 583
Au(NO3L- 2, 583, 586; 3, 283
Au2O3 3, 283
AibCs6- 3. 283
AuOCs 3, 232
Au(OHL- 2, 353
Ah-PioI 2, 610
Au(P(C6H5KK+ 3, 246
Au9(PR3)s3+ 3, 236
Au:)(P(C6H3hKS+ 3, 235
Au,,(PR3O(SCNh 3. 236
Au(P(CeH5K)S2CN(C2H5J 3, 247
Au(P(C6H5K)(bpy) 3, 247
Au(PMe2(CeH5)bSnCl3 3, 247
Au,S 2, 498
[Au(S2C2CCF3J"|(P(C6Hr)KCl) 3, 285
Au2rs2CN(C3H7Jl23, 235
AuSb2 3, 490
AuSn 3, 490
At;3Sn 3, 485
В 3, 169—170
Bi2(a) 3, 170, 172
B50(a) 3, 173
B10-,(P) 3, 172—173
B,A1 3, 176
BIOA1 3, 171
B14AlMg 3, 172
BAs 2, 599
BAsO4 3, 203
B,,Be3, 175
BBr, 3, 167
(BBrSK3, 166
B,C2M 1, 135
B4C 3, 170
B,3C2 3, 171
В(СН,K3, 167
B(CH3),F 3, 167
В(СНз),-М(СН,), 3. 184
B,(CH3COOLO 3. 163
B,_,&>H., 3, 220
B3C3H6[N(CH3J13 3, 185
B4C2H6(CH3)" 3, 219
В7С,Н7(СНчЬ З, 219
В-С2Н„(СН3), 3, 219
[(B-AHnhCol- 3, 222
Г(В9С,Н,^е(СОK1- 3, 221-222
(B9C,H;i) (CsH^Fe 3, 221—222
Г(В9С2Н1,JСи1- 3, 222
(В9С2Ни)-№ 3, 222
HB9G>H,,bNi|2- 3, 222
f(B9C2H11J(B8C2H1n)C02]Cs2-H20
222
B6Ca 3, 177—179
BC13 3, 167
(ВСЦ)" 3, 163—164
B2C14 3, 182
(B,C16J- 3, 181
B4C14 3, 180—182
B8C18 3, 180—182
B9C19 3, 182
B12C1,, 3, 182
BC12-N(CH3J 3, 184
BC13-N(CH3K 3, 184
[ВС1НA\Ме3)(КС8Н.СНзI+ 3, 167
B2C14-C2H4 3, 180
B3C16N3 3, 185
B3C13H3N3 3, 185
BCl(OHLCu 3, 203
BCl(OHLNa2 3, 203
B(C1O4K3, 163
rB(ClSO3L]- 3, 169
BF3 3, 167
(BF4)" 2, 141; 3, !68
B,F4 3, 180
BF2H 3, 167
BF3-N(CH3K 3, 184
(BF4JM-6H,O 2, 411
B4F6-PF3 3, 168
(BF3O)Ba 3, 168
(BF3OH)- 3, 168
(BH4)- 3. 215
B2H6 3, 212
(B3H8)- 3, 218
B4H10 3, 214
B5H9 3, 214
B,H,, 3, 214
B6H,o 3, 214
B4H12 3, 214
39HI5 3, 215
Bl0H14 3. 215
3,
33*
508 Формульный указатель
Формульный указатель 509
В10Н163. 215
(ВИН13J- 3, 220
В|6Н,о 3, 215
В,8Но2 3, 215
В2ОН,6 3, 215
(В2„Н18J- 3,221
(ВПН„J-3, 219
BHN4(CH3J3. 185
ГЫЬ 3, 207
r(l4 3, 186
ГВН2(КН3J1С1 3, 187
ВНз-СО 3, 168
(ВН3-СО2)К23, 206
BH3-N(CH3K3. 186
BH3-NH3 3, 187
BH3-PF32, 611
ВНз-РН3 2, 611; 3, 187
BH3-P(NH2)S 3, 187
(ВН4KА1 3, 218
(BH4KA1-N(CH3K3, 218
(ВН4JВе 3, 218
(BH4)Cu-(P(C6H5KJ3, 218
(BH4)Li 3,216
(BH4)Na 3, 216
(BH4LZr 3, 218
ВзЩЩСНзНз 3, 185
B2H6N(CH3)o 3, 187
B2H5NH2 3, 187
B2H6Mn(CO),0H 3, 218
B2H6Na 3, 187
B2H7N 3, 187
B3H3N3(CH3K 3, 185
B3H3N3C13 3, 185
B3H6N3 3, 185
B3H7N4 3, 185
B3H7NH3 3, 186
(B3H8)[H2B(NH:!H 3, 218
ГВзН8Сг(СОL1[Кт(СНзЫ 3, 218
B3H8Cu(P(C6H5KJ3, 218
B4H8[P(CH3),]4 3, 185
B5H7(CH3J З", 214
(B20H,8NOK- 3, 221
BI3 3, 167
BN 2. 598; 3, 184
B2N4rSi(CH3K]6 3, 185
B15Na 3, 172
(ВО)„ 3, 181
BO2 3, 165
(BO2)- 3, 165
B2O 3, 184
B2O2 3, 164
B2O3 1, 141; 3, 190
B,3O 3, 171
BO2H 3, 192
BO33- 3, 190—191
B(OCH3K3, 167
B(OHK 3, 167
BO3(OH)Be2 3, 205
BO3(OH, FKMg33, 205
В (ОН) 4- 3, 189, 203
ВО4Та 3, 203
BO6Fe3 3, 205
В2О3Н2 3, 206
(В,О4)Са 3, 193
ГВ2(О2J(ОНL1Ка-.-6Н,О 3, 202
[B,O(OHN]Mg 3, 203
В«(ОНL 3, 181
(В..О-,)Со2 3, 191
(BsO5)MBl!3, 191
B2O8Mg2Fe, 3, 205
B2OsMg3Ti 3, 205
B3O3II3 3, 206
В3О3(ОНK 3, 192
ГВ3О3(ОНN1Са-Н..О 3, 198
ГВ3О3(ОНЫСа-4Н2О 3, 198
ГВзО4(ОН)з1Са-Л2О 3, 198
(B3O5)Cs 3, 199
(B3O5)Na 3, 200
В3О5(ОН)Са 3, 198
[B3O5(OHJlNa33, 198
ВзО6Кз 3, 193
B3O6Na3 3, 193
fB4O5(OHLlNa2-8H2O 3, 199
[B4O6(OHJlNa, 3, 199
(B4O7)Ba 3, 199
(B4O7)Cd 3, 201
(B4O7)Li2 3, 199
(B4O7)Sr 3, 201
ГВ5Ое(ОНL1К-2Н,О 3, 199
[B5O5(OHNlNaCa-5HoO 3, 200
rB5O7(OH),lNH.rH2O 3, 199
[B5O7(OHKlNa,-2H2O 3, 200
ГВ5О7(ОНL13- 3, 200
B5O,K 3, 199
[B508(OH)]Nao-2H,0 3 200
[B5O8(OHJ13- 3, 200
ГВвО7(ОН)в12Мя,-9Н,О 3, 202
rB6O9(OHJlSr-3H,O 3, 202
(B6O13)Zn 1, 170: 3, 203
(B8O13)Ag2 3, 199
(B9O14)Cs 3, 200
[B12O20(OHLl8- 3. 202
ГВ14О20(ОНN1«- 3, 202
[B,502o(OH)8l3- 3, 199
B7O12C!Li4 3, 205
B7Ol3ClMg3 3, 205
B10O21Pb6 3, 201
B,eO,,K5 3,201
BP 2, 598; 3, 169
B13P, 3, 171
BPO4 3, 203
B2S3 3, 165
B,S3(SHK 3, 166
B2S3CI, 3, 166
B289Si 3, 172
BSiO4(OH)Ca 3, 203
(B,Si2O8)Ca3, 150
BW12O40H23- 2, 226
B66Y 2, 172
Ba 3, 454
BaB6 3, 174
BaBr2 1, 328; 2. 94
BaC2 3, 47
Ba2CaWO6 2, 305
BaCd,, 2, 475
BaCdO2 2, 293
BaCeO32, 301
BaC!2 1, 328; 2, 94
BaCl2-2H2O 2, 418
BaCIF 2, 84, 184
BaClH 2, 75
BaCrO3 1, 196
Ba2Cr04 3, 346
Ba3Cr05 3, 346
BaCu 3, 473
BaF2 2, 94, 125
BaFeO3 2, 300
BaFe,2Oi9 1, 196; 2, 319
BaFei5O23 2, 319
BaFei8O27 2, 319
Ba2Fe04 3, 358
Ba2Ge04 2, 311
BaH2 2, 9
BaHfO32, 301
Bal2 1, 328; 2, 94
BaLiH3 2, 18
Ba2MnF6 2, 145
ВаМпОз 1, 196; 2, 296, 298
BaNiO2 2, 293
Ba№03 2, 299
BaO 2, 237, 243
Ba4OCl6 2, 185
Ba(OHJ 2, 356
BaP3 2, 606
Ba3PI4 2, 606
BaPb3 1, 196
Ba2Pb04 2, 324
Ba(Pb08Tl02K 1, 196
Ba4Re2Mg0i2 1, 196
BaRuO3 2, 296
BaS 2, 496
BaSe 2, 494
BaSi2 3, 98
BaSiF6 2, 147
BaSnO32,301
Ba2Sn04 2, 324
Ba3SrTa209 2, 305
Ba4Ta40,5 1, 159; 2,297
BaTe 2, 493
BaThF6 2, 144
BaTiO3 2, 296, 302
BaTis0ii t, 196
Ba2Ti04 3, 358
Ba6Ti17O40 1, 196
BaUF6 3, 421
BaUO4 3, 434
BaU2O7 1, 266; 3, 434
BaY2S4 2, 321
BaZn5 3, 474
BaZni3 3, 475
BaZnO2 2, 293
BaZrO3 2, 301
Be 3, 454
BeB,2 3, 174
Be2B 3, 175
Be4B 3, 175
Be2B2Hs 3, 218
Be2(BO3)OH 3, 205
Be2C 3, 48
Be(CH3J3, 85
Be(CH3)(C5H5) 3, 7B
Be(C5H5J 3, 78
Be(C5H5)Cl 3, 78
BeuCa 3, 475
BeCl2 2, 90, 125
BeCu 3, 485
BeF2 2, 90, 125
BeF3Cs 2, 138
(BeF4)Li22, 141
Be,F5Cs 2, 137; 2, 137
Be2F5Rb 2, 137; 2, 137
BeH2 2, 10
(Be2H2Et4)(NaOEt2J 2, 10
Be2H4(NMe3J2, 10
(Be2H2R4)Na22, 11
Be13La 3, 475
Be3N2 2, 597
Be(NH2KK 3, 553
Be(NO3J 2, 583
BeN2Si 2, 599
BeO 2, 245
Be(OHJ2, 361
Be4O(CH3COON 2, 195
Be,O(NO3N 2, 588
Be3P2 2, 598
BeS 2, 496
BeSO4-4H2O2, 408
BeSc 2, 494
(Be2Si07)Y2 3, 132
Be13Sr 3, 475
BeTe 2, 496
Be4Te07 2, 485
Bei2Ti 3, 474
Be,3U 3, 475
BeY2O4 2, 322
Bi 2, 646; 3, 456
Bi42- 1, 367
Bi4AlCl4 2, 648
Bi5(AlCl4K2, 648
510 Формульный указатель
Формульный указатель 511
Bi4BaTi40i5 2, 668
BiBr 2, 648
BiBr3 2, 651
BiBr4- 2, 661
BiBr52- 2. 661
BiBr63- 2, 660
Bi2Br104- 2, 660
Bi,Br93- 1, 225; 2, 157
Bi(CH3K 2, 651
В!(С6Н6)зС12 2, 653
BiCl3 2, 651
BiCle3- 2, 661
Bi,Cl93- 2, 157
Bi|2Cl14 2, 661
Bi(CrO4)OH 2, 666
BiF3 2, 100, 656
BiF4- 2, 661
BiF5 2, 109, 653
Bi2Ge05 2, 666
Bilo(HfC!6K 2, 662
Bil 2, 648
Bil:i 2, 656
Bil4- 2, 661
Bil63- 2, 661
BiJ93- 2, 157
Biln 1, 322; 3, 492
BiIn4S9 2, 684
BiLi3 1, 216; 3, 472
Bi,NbO5F 2, 668
Bi3NbTi09 2, 668
BiNi 3, 490
Bi3Ni 3, 491
Bi,O3 2, 663
Bi2O5 2, 667
BiOBr 2, 184
BiOCI 2, 182, 183
BiO.ClM 2, 672
Bi364Cl3M 2, 672
BiOF 2, 672
BiOoiF28 2, 100, 177. 672
Bi2OF42, 101, 672; 3, 473
Bi2O5Ge 2, 666
Bi12O20Ge 2, 665, 666
Bi6(OHI26+ 2, 352
BiOI 2, 184
Bi(OH)SeO4-H2O 2,666
Bi2O2SO4-H2O 2, 666
Bi4OI2Si3 2, 666
Bi,2O20Si 2. 664
BiPS4 2, 684
BiPd 3. 491
Bi,Pd 3, 491—492
BiPt 3. 490
Bi2Pt 3, 490
BiRh 3, 491
Bi4Rh 3, 492
BiS2 2, 505
Bi2S3 2, 515, 683
BiSCl 2, 170, 171
Bi(SCNL- 2, 652
BiSoNa 2, 527
Bi,STc2 2, 516
BiSbO3 2, 294
BiSbO4 2, 674
Bi2So3 2, 516
Bi3Se4 2, 516
BiSeCl 2, 171
Bi2Ta05F 2, 668
BiTa2O6F 2, 325, 680
Bi,Tc3 2, 516
Bi2Ti04F2 2, 668
Bi4Ti3Oi2 2. 668
BiTl 3, 492
ВШ06 1, 308
Bi,(WO4K 2, 310
Bk 3, 453
ВкСЦ 2, 101
ВкС13-6Н2О 2, 415
BkF4 2, 107
Bk2O3 2, 251
Br2 1, 340; 2, 61
Br2+ 2, 67
Br3" 2, 71
Br3(AsF6) 2, 68
Brr8,6H2O 2, 395
Br2(CH3CNJ 2, 62
Br2(CH3JCO2, 62
BrCN 3, 28
BrCI 2, 64
BrF 2, 64
BrF2+ 2, 67
BrF3 2, 65
BrF4" 2, 71
BrF4+ 2, 68
BrF5 2, 66
BrF6+ 2, 69
BrH 2, 75
BrI 2. 64
BrO2" 2, 79
BrO2+ 2, 78
BrO3" 2, 81
BrO4- 2, 82
BrO3F 2, 76
(BrOaKNd-9H2O 2, 408
(BrO3KSm-9H2O 2, 408
(BrO3JZn-6H2O 2, 408
Br2(Sb3F16) 2, 67
С (алмаз) З, 7
С (графит) 3, 18—19
CsBr 3,21
ССа 1, 289; 3, 48
С2М 3, 48
С2М3 3, 51
С3М4 3, 51
С6(СООНN3. 21
ОК 3, 21
СВг4 3, 9
CBrF3 3, 9
СВгН3 3, 9
CBr3NO, 2, 579
С(СбН5)з+ 3, 17
C(CH2NO3L2, 589
С2(СН3)Х 3, 25
ССЦ 3, 9
CC13F 3, 9
CC1F3 3, 9
СС1чН-17Н,0 2, 396
C(CNL 3, 26
С2С16 3, 9
С2С1Н 3, 25
(CF)n 3, 8
CF2 3, 7, 21
(CF2)n3, 11
C./Fo(!+2 3, 8
CF4 3, 9
CF3CN 3, 26
CFH3 3, 9
C2FH 3, 25
CFHO 3, 13
CF3I 3, 9
CF3NO2 2, 579
(CF3JS 3, 24
(СН,)„ 3, 11
C2H2 3, 25
C2H4 3, 9
C2H6 3, 9
C4H2 3, 25
С4(С4НэL 3, 8
C5H6 3, 77
C6H6 3, 16
C8H8 3, 8, 12
С8(С6Н5)« 3, 8
CioHie 3, 8
С,4Н20 3, 8
С22Н28 3, о
СН,0 3, 12, 23
CH,(SO3J2- 2, 468
CH3CN 3, 26
СН3СООН 3, 14, 23
CH3COSH 3, 14
CH3I 3, 9
CH3N3 2, 565
CH3NC 3, 26
CH3NO2 2, 579
CH3NO3 2, 589
CH3OH 3, 23
(CH3KCNH2-93/4H2O 2, 393
C2H4O 2, 199
C2H6O 2, 199
(C2H4ON4(H2OL62, 393
CH3SH 3, 24
(C4H,O)8(H2SO33-136H2O 2, 303
CsII4(OHJ 1, 43, 135, 142
C6H4(OCH3J2, 199
QH,..N4 2, 551
Col4 3, 13
C,,Mo2Cl,o 3, 22
(CN), 3, 25
CNAg 3, 42
CNAu 3, 42
CNX 3, 28
(CNJCd 3, 42
(CN)H 3, 26
(CNJHg3, 39
(CN)M 3, 38
(CN)NH, 3, 29
(CNJZn 3, 42
(CNKC- 3, 17
(CNJ2- 3, 29
C(N3K+ 3, 17
C(NH2K+ 3, 17
C,(CNJ(NH2J3, 27
C2N2(NH2J3, 29
C(NH2)HO 3, 18
(CNO)Ag3, 31—32
C3NH 3, 26
C3N3(N3K 2, 565
C3N3(NH2K 3, 30
C3N3(OHK 3, 30
C4N2 3, 26
CO 3, 22
CO2 3, 23
CO2- 3, 7
CO3 3, 24—25
CO32- 3, 16, 17
C2O 3, 24
C,O42- 3, 15
C3O2 3, 23—24
C4O42- 3, 15
C5O52~ 3, 15
COBr, 3, 13
COC12 3, 13, 23
(COC12J 3, 14
(COC12K3, 14
COF2 3, 13
COFH 3, 13
CO(NH2J 3, 17
(CONH2J 3, 15
(COOHJ 2, 45; 3, 14
(COOHJ-2H2O 2, 26, 432; 3, 15
СООН-СНз 3, 14
COOH-H 3, 14
COONH2- 3, 16
CO(NH2)OC2H5 3, 12
(COJK2 3, 54
C6(OKN 3, 54
(CO3)Ca 1, 291, 392; 3, 17
(CO3)Ca-6H2O 2, 414
(СО3)Си2(ОНJ 3, 248, 278
512 Формульный указатель
Формульный указатель 513
(СОзJСи3(ОНJ 3, 248
(СО3)НК2, 41
(СОз)НЫа 2, 41
(CO3)Na2-H2O 2, 419
(CO3)Na2-10H2O 2, 410
(CO3JHNa3-2H2O 2, 40, 431
(СОзMМ6- 3, 16
С2О[Р(С6Н5Ы 3, 25
С2О4К2-Н2О 2, 24; 3, 14
COS 3, 22—24
COSe 3, 23
CSo 3, 23
С S32~ 3, 17
CSC12 3, 13
(CSC12J 3, 13
CS(NH2J3, 18, 24
(CSNH2J 3, 15
C(SO2CH3K- 3, 17
CnSO3F 3, 22
C2S[P(C6H5K]3, 25
CSTe 3, 24
CSi 3, 93
Ca 3, 454
Ca(AlH4J 2, 18
Ca3Al206 3, 130
Ca3Al3205i 2, 317
Ca5Al6Oi4 3, 131
Ca3Al2(OHI2 2, 327, 364
Ca3Al2(Si04K2, 326
CaB6 3, 177—179
CaB,C2 1, 132
Cai2Ben029 2, 322
CaBr, 2, 94, 125
CaC, 1, 290; 2, 48
CaCl, 1, 206; 2, 94, 125
СаС1-2Н2О 1, 251; 2, 418
СаС12-4Н2О2, 422
CaCU-6H2O 2, 412
CaCl6rMg(H2ON]2 2, 423
CaCIF 2, 184
CaClH 2, 75
CaCr,O4 2, 321
CaCu5 3, 473
CaF2 1, 301; 2, 94, 125
CaFX 2, 184
Ca5F(PO4b2, 375
CaFeO3 2, 300
CaFe2O42. 311, 321
Ca2Fe205 2, 329
CaGeO3 2, 327
CaH2 2, 9
Cal, 2, 94, 125
Ca2Ir04 2, 311
Ca2Mn04 2, 324
Ca2N 2, 595
Ca3N2 2, 595, 597
Ca3N4 2, 595
Ca,iN8 2, 595
Ca(NH2J 2, 553
Ca(NH3N 2, 557
Ca2NHc 2, 557
Ca2NH 2, 169
Ca5N5Mo 2, 596
Ca(NO3J-2H2O 2, 425
Ca(NO3J-3H2O 2, 425
Ca(NO3).-4H2O2, 425
CaNaNb2O6F 2, 325, 680
CaNaSb2O6(OH) 2, 680
CaNi, 3, 474
CaO 2, 243
Ca(OHJ 2, 359
Ca5(OH)(PO4K 2, 375
CaP 2, 606
CaP3 2, 606
CaPbF6 2, 144
CaS 2, 496
CaSO4-2H2O 2, 418
CaSb2O6 2, 681
Ca2Sb2O7 2, 682
CaSe 2, 494
CaSi 1, 325; 3, 95
CaSi2 3, 98
Ca2Si 3, 95
CaTa2O6 2, 325
Ca2Ta207 2, 325
CaTe 2, 494
CaTiO, 2, 300
CaTi2O42, 311, 321
CaTl 3, 472
CaUO3 2, 290
CaUO4 3, 433—434
Ca2UO5 3, 434
Ca3UO6 2, 305
CaV2O4 2, 321
CaZn5 3, 474
CaZn13 3, 475
Cd 3, 445
Cd3As2 2. 598
CdBr2 2, 94, 128
Cd(CH,J3, 84
Cd(CNJ 3, 42
CdCl2 1, 207; 2, 94, 128
CdCl2(NH3J2, 189
(CdCls)NH4 1, 259; 2, 139
(CdCl3)Rb 2. 139
CdCl53- 2, 143; 3, 302
CdCl64- 2, 154
CdoCl62- 2, 156
CdCl(OH) 2, 186
Cdi3Cs 3. 475
Cd3Cu4 3, 478
CdF2 2, 94, 128
CdF(OH) 2, 185
CdGeAs, 2, 534
CdGeO3 2, 327
CdH, 2, 10
Cdb 1, 206, 310; 2, 94, 128
Cd13K 3, 475
CdLi 3, 472
CdMg3 3, 470
Cd3Mg 3, 470
Cd2Mn308 2, 263
Cd3N2 2, 598
Cd(NCSJ(eluJ 3, 35
Cd2Nb207 2, 325, 682
Cd2,Ni5 3, 485
CdO 2, 243
Cd(OHJ2, 358, 360
CdP2 2, 606
CdP4 2, 606
Cd3P2 2, 606
Cd,3Rb 3, 475
CdS 2, 496
CdS2 2, 505
Cd2Sb207 2, 682
CdSe 2, 494
Cd,,Sr 3, 475
Cd2Ta207 2, 682
CdTe 2, 494
CdTiO3 2, 305
CdZnSc2 2, 534
Ce 3, 447, 451
CeBr3 2, 101
CeC, 3, 49
Ce2C3 3, 50
CeCl3 2, 101
CeCo5 3, 476
CeF3 2. 101
CeF4 2, 107
CeF4K 3, 424
CeF4Na 3, 424
(CeF6)(NH4J2, 145, 165
(CeF7)(NH4K-H2O 2, 165
(CeF8)(NH4L2, 165
CeH2 2, 12
CeH3 2, 12
Ccl2 3, 409
Cel3 2, 101
CeA03L 1, 401
Cc(IO3L-H2O 1, 401
CeMo,2O42H62- 2, 232
CeN 3, 497
Ce(NO3M2- 2, 582
rCe(N63Nl(NH4J2, 582
[Ce(NO3Nl2Mg3-24H2O 2, 408
CcOo 2, 246
Ce,63 2, 251
Ce7O,2 2, 329
CeO3Ba 2. 301
Ce6O4(OHL(SO4N 2, 376
Cc2O2S 2, 542; 3, 435
Ce2O2Sb 3, 436
CeS 2, 496; 3, 409, 437
Ce2S3 2, 217; 3, 409, 437
Ce3S4 2, 217; 3, 437
Се\?10ОзбН26- 2, 232
CfBr3 2, 101
CfCl3 2, 101
CfF3 2, 101
Cf2O3 2, 251
Cl2 1, 340; 2, 62
Cl2+ 2, 67
С12-7'/4Н2О 2, 393
Cl3(AsF6) 2, 68
C1CN 3, 28
C1F 2, 64
CIF2- 2, 71
C1F2+ 2, 68
C1F3 2, 64
C!F4- 2, 67
CiF5 2, 66
C12F+ 2, 66
C1H 2, 75
C12H- 2, 75
СП 2, 64
C1O2 2, 76
C12O 2, 76
C12O6 2, 76
C12O7 2, 76
C1O2+ 2, 77, 78
C1O2- 2, 80
СЮ3- 2, 81
C1O4- 2, 81
C1OF3 2, 76
C1O2F2+ 2, 76
C1O2F3 2, 76
C1O3F 2, 76
C1O4H 2, 81
C104H-H,0 2, 430
C1O4H-2H2O 2, 431
С1О4Н-2'/2Н2О 2, 431
C1O4H-3H2O 2, 431
(C1O4)NO2, 571
(C1O4)NO2 2, 576
(C104)[Li(H20K12, 410, 411
(C104J[Mg(H20)el 2, 411
Cm 3, 453
CmBr3 2, 101
CmCl32, 101; 3,412—413
CmF3 2, 101; 3, 412—413
CmF42, 107; 3, 412—413
Cml3 2, 101
CmO 2, 412—413
CmO2 2, 247; 3, 412—413
Cm2O3 2, 251; 3, 412—413
514 Формульный указатель
Со 3, 449, 459
СоА12С16 1, 217
CoAl2Qs 2, 312
CoAs3 I, 317
CoAsS 2, 509
CoAs3(COK2, 647
Co2As2(COM[P(C6H=,K] 2, 647
CoB 3, 174
Co,В 3, 174
Co3B 3. 53, 174
CoBr» 2, 91
CoBr45- 3, 361
CoBr(OH) 2, 187
C02Br@HK2, 187
[CoBr(Me6tren)|Br 3, 363
СоВг2[НР(СеН5Ыз 3, 364
Co2C 3, 52
Co(C5H5J 3, 77
Со2(С5Н5J1Р(СбН5J]23, 80
Со(асаф(Н2ОJ З, 365
Co2(acacL(H2OJ 3, 365
Co3(acacN(H2O) 3, 365
Со4(асас)8 1, 244; 3, 365
Со(асасJ(руЬ 3, 365
Co(C3H3N2J 3, 362
ГСо(ЭДТА)! 3, 450—451
ГСо(епJС121С1-НС1-2Н2О 3, 372
rCo(enJCI(NO)"|ClO4 2, 573
rCo(enJ(N3h]NO32, 565
fCo2(enL(NH2) (OOH)]X4 2, 206
rCo2(enL(NH2) (SO4)]3+ 3, 375
rCo(CF3COOL]2- 3, 367
Co(C5H5NLCl2 3, 365
[Co(CNN]3- 3, 40
[Co(CNN]2Co3-12H20 3, 44
rCoj(CN)(NH3M(CNMl-H2O 3, 42, 372
fCo(CNCH3M]ClO4 3, 46, 360
rCo2(CNCH3)io](C104L 3, 63, 365
Co2(CO)8 3, 61
Co4(CO),2 3, 65
Co(COLH 3, 68
rCo(COLl2Hg3, 71
|Co(COLl2Zn 3, 71
Со(СО)з(С2НР4)ГР(С6Н5)з] 3, 360
Co(COKNO 3, 70
Co(COLSiCl3 3, 363
Co(COLSiH3 3, 59
Со2(СОN[С2(С6Н5J13,76
Co2(CON(Cr,H5JFeGe2Cl4 3, 80
Co6(CO)u4- 3, 66
Coe(COI5H- 3. 66
Co6(COI5N- 3, 66
Co4Ni2(CO)i42- 3, 66
Co2(COO(C4H2O2) 3, 76
Со2(СО)9С2Н2 3, 76
Co3(COL(SC2H5N 3, 73
Соз(СО)9ССН3 3, 72—73
Co3(CO)9S 3, 72
Co3(CO)9SH3 3, 73
Co4(COI0C2(C2H5J 3, 76
Co,(C()),0(SC2H5M 3, 73
Co.itCOI.S(SC2H5L3, 74
Co6(CO),4S4 3, 74
Co,(CO)lsC,(CO) 3, 72
|Со(С,О4)з|3- 3, 370
CoCi-. 2, 91, 126, 127, 390
CoClo-2H,O 2, 417; 3,275
CoCl,-6H2O 2, 409
(CoCl4J^ 3, 361
CoClr.Cs 2, 159
CoCl(NOJ 2, 572
CoCi(OH) 2, 186
CoCl(QP) 3, 363
СоСЬЬ, 3, 364
CoCMpvh 3, 362, 365
Со,С1(ОН)з 2, 186
CoF, 2, 91
CoF3 2, 97
CoF3Cs 2, 139
CoF42- 2, 140; 3, 365
(CoF6)Ba 2, 145
(CoF6)Cs2 2, 147; 3, 360
(CoF6)Ki 3, 360
Co3Fe(Cb)9H[P(OMeKl3 3, 69
CoH(PF3h 2, 20; 3. 364
CoH(N,)|P(C6H5Kl3 2, 545; 3, 359
|Co(FbONl(ClO4J2D11
CoH??(SCNL 1, 155
Cob 2, 91
CoI2-6H20 2, 408
CoI4=- 3, 361
Col (NO) 2 3, 354
Со413О24Н123~ 2, 230
СоМпОз 2, 284
Co7Mo6 3, 479
ГСо2Мо10О38Н4]6- 2, 230
Co2N 2, 600
Co[N3(C6H5Jl3 3, 374
rCo(N3)(NH3Mr+ 2,565
fCo(NCSLl2- 3, 34, 362
rCo(NH3J(NO2Ll- 3, 373
[Co(NH3KCl2(H2O)l+ 3, 374
rCo(NH3LCO3l+ 3, 373
rCo(NH3MCO3l+ 3, 374
rCo(NH3NNO2"|2+ 2, 578
[Co(NH3NlI3 2, !89; 3, 373
[Co(NH3NlCl2 2, 189; 3, 374
rCo2(NH3N(OHKT+ 3, 373
rCo2(NH3N(OH) (NO2J?+ 2, 579
rCo2(NH3)sCl(NH2)l4+ 3, 372
[Co2(NH3)sNH,(NO,)l4+ 2, 579
rCo2(NH3)sNH,(O;)iX4 2, 205, 206
ГСо2(ЫН3)8(ОНJ14+ 3, 372
rCo2(NH3),o(NOJ1X4 2, 572
rCo2(NH3I0C4X42, 205, 206
rCo,(NH3I0O2lX52, 205, 206
Формульный указатель 515
|Co3(NH3)s(OHJ(NO2J(CN)
374—375
rCo4(NH3I2(OHNl4+ 3, 374
Co(NO)[S2CN(CH3J]2 2, 573
[Co(NO2N|K32, 153
Co(NO3K 2, 583; 3, 340
|Co(NO3L]2- 2, 583; 3, 367
Co(NO3J(Me3POJ 2, 588; 3,
|Co3(OC2H4NH2N]2+ 3, 366
CoO 2, 244
CoO44- 3, 360
Со2О76~ 3, 361
Co3O4 2, 314; 3, 362
CoO3Ba 3, 360
CoO3K2 3, 361
CoO6Li8 3, 360
Co(OHJ 2, 358
CoO (OH) 2, 372
CoP 2, 606
C0P3 1, 319
Co2P 2, 606
Co(PMe3L 3, 359
Co2fP (O (C6H5)), |2[ (P (OC6H5
360
CoS 2, 500
CoS2 2, 505, 509
Co2S3 2, 514
Co3S4 2, 514
Co9S8 2, 514
Co[S2C2(CF3J]4 3, 364
Co(SCN)(NH3b2+ 3, 34
CoSb 3, 490
CoSb3 1, 319
CoSb2O6 2, 681
CoSc 3, 490
CoSe2 2, 510
CoSi 3, 461
CoTa2O6 2, 681
CoTe 2, 503; 3, 490
CoTe2 2, 503, 510
Co5Th 3, 474
С0ТЮ3 2, 294
CoVO3 2, 294
Co7W6 3, 479
[CoW,2O40l5- 2, 227
CoZn3 3, 485
Cr 3, 449, 459
CrB 1, 325; 3, 176
CrB2 3, 175
CrB4 3, 175
Cr3B4 3, 175
CrB2 2, 91—92
CrBr3 2, 98
Сг3Вг93- 2, 157
CrC 3, 497
Cr3C2 3, 53
2?+ 3, Cr7C3 3, 53
Сг(С5Н5J3, 77
Сг(С6Н6J+ 3, 81—82
Сг(С6Н6) (С0K 3, 82
Сг(С6Н6J1 3, 81
Cr(C5H5)Cl(NOJ 2, 573
Cr(C18H20)I3 3, 82
365 Cr(C5H5) (NCO) (NOJ 2, 573
Cr2(C5H5JNH2(NOK 2, 574
fCr(CNN][(Co(NH3N13, 40
fCr(CNMNO][Co(enKl-2H2O 2, 573
Cr(CON 3, 61
ГСг2(СОI0]2- 3, 63
ГСг2(СО)юН]- 3, 69
Cr4(enN(OHN6+ 3, 375
CrCl2 1, 297—299; 2, 91—92
CrCl3 2, 98
CrCl3-6H2O 2, 408, 409
(Cr2CI9)Cs32, 157
CrF2 1, 297; 2, 91—92- 3 272
CrF3 2, 97
CrF5 1, 249; 2, 109
,))з]4 3, Cr2F5 1, 269; 2, 85
CrF3K 2, 160
CrF4Cs 2, 141
CrF4Na2 1, 258; 2, 141
CrF5Ca 2, 142
CrF5Tl2 2, 142
CrF6Ba2 2, 145
CrF6M2 2, 151; 3, 346—347
CrFeO4 2, 309
CrGe 3, 439
CrH 2, 12, 17
CrH2 2, 12, 17
Crl2 2, 91—92
(CrIO6)K2, 83
CrK(SO4J-12H2O 2, 432
CrMo6O,4H63" 2, 230
CrN 3, 497
[Cr(NH3M0N01Cl, 2, 579
rCr(NCSL(NH3Jl- 3, 34
Cr(NO3K 2, 583
Cr(NO3JO2 2, 583
CrNbO4 2, 308
CrO2 2, 247; 3, 346—347
CrO3 2, 285; 3, 346—347
Cr2O3 2, 251
Cr2O5 3, 349
Cr3O 2, 284
Cr3O8 3, 349
CrviO12 3, 349
CrO,M 3, 346
CrO42" 3, 347
CrO43" 3, 347
CrO41" 3, 347
CrO4(NH3K 2, 204
CrO5Ba3 3, 346
(CrO8)K3 2, 204
516 Формульный указатель
(Сг2О7J- 3, 347, 348
(Сг3О8)М 3, 347, 349
(СгзО9I\2 3, 347, 349
Сг30,о2- 3, 348
Сг4О132- 3, 348
CrOCl 2, 186
СгО2С12 2, 179
(СгО3С1)К 2, 174
(CrOCl5)Cs22, 174
CrO2F2 2, 179
(CrO3F)K 2, 174
CrO(OH) 2, 372
CrO5(C5H5N) 2, 203
Cr05(C,oH8N2) 2, 203
fCr3O(ac)e(H2OK]+ 1, 232; 2, 194
ГСг4(еп)б(ОН)б]6+ 1, 244
CrS 2, 520
CroS3 2, 520
Cr3S4 2, 520
Cr5S6 2, 520
Cr5S8 2, 520
Cr7Ss 2, 520
(CrS2)Li 2, 531
(CrS2)Na 2, 530
Cr,S4Cu 2, 526
Cr2S4Fe 2, 526
CroS4Ni 2, 526
Cr[S2C2(C6H5J]3 3, 339
CrSb 3, 490
CrSb2 2, 510
CrSbO4 2, 309, 681
CrSe 3, 490
CrSi 3, 461
CrSi2 3, 96
Cr3Si 3, 95
CrTaO4 2, 309
CrTe 3, 490
CrVO4 2, 308
Cs 3, 483
CsBr 2, 87, 128
CsCl 1, 294; 2, 87, 128
CsCoF3 1, 196
CsF 2, 128
CsH 2, 8
Csl 2, 87, 128
CsLiF2 2, 138
CsMnFs 1, 196; 2, 298
Cs№Cl3 2, 159
CsNiF3 2, 298
CsO2 2, 198
Cs2O 2, 237, 242
Cs3O 2, 241
Cs4O 2, 240
Cs7O 2, 240
CsuO3 2, 240
Cs,,Rb7O3 2, 240
CsOH 2, 353, 361
Cs2S 2, 497
CsSH 2, 354, 361
Cs3Sb 473
CsSi 96
Cs*V,O5 2, 344
Cs,WO3 2, 337
Cu 3, 449
CuAgS 3, 282
CuAl2 3, -187
CuAlCl4-C0He 3, 82, 237
CuAlOo 1, 324; 2, 292
CuAlSo 3, 282
Ctb(AsO4)OH 3, 267
Cu3(AsO4)(OHK 3, 273
CuAsS i, 152; 2, 532
Cu3AsS3 2, 532, 535
Cu3AsS4 2, 535
СиВН4[Р(СоН5)з]23, 237
Cu[B(OHLlCl 3, 203
CuBr 2. 97, 128
CuBr, 2, 91—92; 3, 273
(CuBr3)K 3, 275
(CuBr3)(NH4J 3, 238
CuBr42~ 3, 273
CuBr2(NH3J 3, 275
Cu2Br(OHK2, 187, 380; 3, 278
СиВг[Р(С6Н5)з12 З, 2-1 b
CuBr[P2(C2H5Ll 3, 238
[CuBr(Me6tren)lBr 3, 266
CuBr2[S2CN(C4H9H 3, 229
(CuoBr?) (QH5N2) 3, 238
Си,Вг4ГР(С6Н5K14 3,241
Cu4Br4(OC2H4NR2L 3, 258
CuCH3 3, 83
Cu(C4H6)Cl 3, 244
Сн(С7Нз)С1 3, 244
Cu(C8Hs)Cl 3, 243
Cu,(C8H,2JCl2 3, 237
Cu(CH3COOJ-H2O3, 264
Cu2(CH3COOL(C5H5NJ 3, 263
Cu(C2H4C2O4)-2H2O 3, 264
Cu(C6H5COOJ-3H2O 3, 265
Си(СН3СОО)[Р(С6Н5)з12 3, 236
Cu[CH3(CH2)8COOl2 3, 265
Cu(C2H3N3)Cl2 3, 275—277
Cu(C2H8N2J(NO3J 3, 269
Cu(C2H8N2J(SCNJ 3. 268
Cu(C2H8N2K(SO4) 3, 268
Cu(C3H3N2J3, 252
Cu(C5H5NJCl2 3, 255
rCu(C,H4NsH4Jl(BF4J 3, 256
rCu2(dH4N2Me4),(OH),]Br, 3,254
Cu(C5H5NOJCl2 3, 255
Cu(C5H5NOJ(NO3h 3. 255
rCu(C5H5NOLl(BF4J3, 255
[Cu(C5H5N0L1(C104J 3, 255
Cu(C5H5)PEt3 3, 237
Формульный указатель 517
СиГ(СНзЬСзН3МО!;С12 3, 254
Cu(C6H4NO2J 3, 231
Cu(C7H,NOj2 3, 257
Cu4(C7H,,NO2L 3, 267
Cu(C8H,4N4O4) 3, 258
Cu(C10H8N2)(ONOJ 2, 579
<Ju(CioH8N2JI 3, 266
|Cu(C,oH6N2JON01N03 2, 570, 3, 270
Cu(C10H8N2)[CH(COCF3Jl2 3, 270
Си(С16НИЫ2ОJ 3, 257
Си(С2С6Н5)-Р(СНз)зЗ, 241
CtiCN 3, 233
CuCN-NHs 3, 241
CuCN-N2H4 3, 241
Cu(CNJ- 3, 243
Cii(CNK2- 3, 243
Cu(CNL3- 3, 235
Cu2(CNK- 3, 243
Cn3(CNL(enJ-H2O 3, 248
CuCO3 3, 248, 265
CuCO3(NH3J 3, 259
Cu(CO3JNa2 3, 260
Cu,CO3(OHJ 3, 248
Сиз(СО3J(ОНJ 3, 248, 265
Си (C2O4),Na-2H2O 3, 265
Cu4Ca(OHN(SO4J-3H2O 1, 314
CuCl 2, 87, 127, 128
CuCls2. 91; 3, 253
CuCU-C,H3N3 3, 275—277
CuCl2(C5H5NJ 3, 255, 275
CuCl2-(CH3JNNO 3, 275
CuCl2(C;HsN2J-H2O 3, 273
CuCl2-2H2O 2, 418 432; 3, 272
CuCl2-NCCH3 3, 275
(CuCI2J(pq) 3, 238—230
CuCl3[Cu(OAs(C6H5bLl 3, 255
(CuCl3)f(CH3JNH2l ;i, 276
(CuCyCs 1, 222- 3 271, 272
(CuCb)K 3. 271, 272
(CuCl3)K2 3, 238
(CuCl3)Li-2H,O 3 275 276
(СиСЦ)М2 3, 271
(СнСЦ)К2-2Н2О З, 276
СиС153- 3, 238. 265
Cu2CI2-N2(CH3), 3, 238
(Cu2Cl,)Cs 3, 238
ГС1ьС16)К2 3, 274, 277
(Cu2Cl7jCs3-2H2O 3, 278
Cu2Cl84- 3, 266
(CU3CI5) (CuL2) 3, 238
Cu3Cl6(CH3CNJ 3, 278
Cu3Cl6(C6H7NOJ-2H2O 3, 277
Cu4Cl4[P(C6H5K14 3,241
Cu4Cl4[OC2H4NR^4 3, 259
Cu4Cl10[(CH3KNHl23, 277 •
Cu4Cl10O4- 1, 120: 3, 267
(Си4С1,оО)Г(СбН5KР014 3, 266—267
Cu5Cl10(C3H7OH)o 3, 277
jH^h)^ 3, 237
CnXloO 3, 273
CuCl(OH) 2, 186
CuoCl(OHK2, 187; 3.279
Cu(C104J-6H20 3, 269
CuCrOj 1, 324; 2, 292
CuCr2O42, 315
CuCr2S4 2, 526
CuF 2, 87
CuF, 1, 297; 2, 87; 3, 253, 272
CuFo-2H20 2, 432; 3, 270, 272
(CuF3)K2, 160; 3, 272
(CuF4)K2 3, 272
(CuF4)Na2 1, 258; 2, 140; 3, 270
CuF63- 3, 230
CuFe2- 3, 230
Cu2Fe(CNN 3, 95
CuFeO2 1, 324; 2, 292
CuFe2O4 2, 315
CuFeS2 2, 533—535; 3, 282
CuFe2S3 2, 534
Cu,FeS4 3, 282
Cu2FeSnS4 2, 533
CuGaO2 1, 324
CuGaS2 3, 282
Cu-Ge 3, 455
CuH 2, 11
Cu(HCOOJ 3, 263
Cu(HCOOJ-4H2O 3. 264
[Cu(HCOOK]fNH,(CH3),l 3, 263
Cu2(HCOOL[OC(~NHo),], 3, 263
Cu(H2ON2+ 3, 269
Cu2HgI4 2, 534
CuHg(OHJ(OHob(N03), 1, 149; 3,
279
Cul 2, 87, 128
CuI-CH3CN 3, 238
Cu4I4(AsEt3L 3, 240
Cu2I(OHK2, 187
CuIO3(OH) 2, 377
Cu(HIO6),s- 3, 229
Cu,Mg 3, 479, 493
(CuMoS4)NH4 2, 527
Cu3N 2, 600
Cu,(N3J[P(C6M5Kl4 2, 565; 3, 237
rCu(N3)(C6H5Ji23, 232
CufNC(CH2JCN]2C104 3, 241
CurNC(CH2KCNl2NO33, 241
Cu[NC(CH2LCN|2NO3 3, 241
Cu2(NCSK(NH3K 3. 247
rCu(NCS)(tren)lSCN 3, 266
rCu(NCSK(NH3J1A<T 3, 266
[Cu(NH3LlSO4-H2O'1 265
rCu(NH3NlX2 3, 268
Cu(NH4J(SO4J-6H,O 3, 269
Cu(NO2)s4- 3, 268
Cu(NO3J 2. 584; 3, 260
Сп(ШзJ-СНз!ЧО, 3, 261
518 Формульный указатель
Формульный указатель 519
Cu(NO3),(CH3CNJ 3, 261
Cu(NO3),(C2HsN2b 2, 588; 3, 261
Cu(NO3)..(C4H4N,) 3, 260
Cu(NO,b(C5H5NO)., 2, 588
Cu(NO,b-272H,O 3, 261
CuNO3[P(C6H-,hb 2, 588; 3, 237
CuO 2, 246; 3, 252
Cu2O 1, 157; 3, 252
Cu16O,4 3, 252
CujOiCa 3. 252
CuOK 3, 232
CuO,K 3, 229
Cu2O6Li6 3, 229
Cu2OSO4 3, 267
CuO3Sr, 3, 252
Cu(OH), 2, 359; 3, 248
Cu(OHN4- 3. 268
Cu2(OHKNO3 1. 313; 2, 380
Cu2(OH)PO4 3, 278
Cu4(OHNSO43, 278
Cu|P20,(NMeoLl2(C104). 3, 269
Cu[P,O3(NMe2Ll3(ClO4J 3, 269
Cu4Pi0Sn 2, 607
Cu6Pb08 2, 328
Cu3Pd 3, 468
Cu3Pt 3, 468
CuS 3, 279
Cu2-*S 3, 281
Cu2S 3, 282
CuS2 2, 505
Cu4S3K 2, 527
Cu7S4(NH4) 2, 527
Cu(SCNJ(enJ 3. 34
rCu(SCN) (trien)INCS 3, 2En
{CuS2CN(CoH5J]4 3, 244
fCuSOCN(C3H7)>16 3, 245
[CuS2P(C3H7Obt. 3, 244
Cii8[S2C2(CN);ie-[As(C6H5Ll4 3. 245
Cu|SC(NH2J},Cl 3, 244
fCu{SC(NI-I,J}3lCl 3, 238
fCu{SC(CH3)NH2J4lCl 3, 236
CusSOa-'^HsO 3, 224
Cu3(SO3J-2H2O 3. 247
CuSO3Na-6H2O 3, 224
CuSO4 3, 265
CuSO4-?HoO 2, 415
CtiSO4-5H2O 2, 412, 438
ICu(S2O3Jl2[Cu(NH3LlNa4 2, 468;
247
CuSbS- 2, 536
Cu3SbS3 2, 535
CuSe2O5 2, 471
Cn5Si 3, 95, 485
CuSn 3, 490
Cu,Sn 3, 485
Cu5Sn 3, 485
Cu31Sn8 3, 485
CuSr 3, 474
CuTc.Cl 2, 448
CuTcO5 2, 471
Cu(H,Te(NJ5- 3, 229
Cib_rY,;O,9-r 2, 216
CiivWOi 2, 335
Cn\VO4 2, 309
Сщ\\'О, 3, 267
CuZn 3. 467, 485
CuZn3 3, 485
C115Z113 3, 485
DBr 2, 31
DC1 2, 31
D3N 2, 30
D2O 2, 383
Dy 3, 447
DyCl2 2, 94
DyCl208 2, 94
DyCl3'2, 101
DyF3 2, 101
Dyl3 2, 101
Dy2O3 2, 251
DyOCl 2, 184
Dy(OHK 2, 356
Dy2S3 2, 517
Er 3, 443, 447
ErCl3 2, 101
ErF3 2, 101
Erl3 2, 101
Er6I7 2, 121
Er2O3 2, 251
ErOCl 2, 184
Er(OHK 2, 356
Er2S3 2, 517
ErSF 2, 170
ErSi2 3, 99
ErTa3O9 2, 305
EsCl3 2, 101
Eu 3, 450
EuBr2 2, 94
EuC, 3, 50
EuC!2 2, 94
EuCl3 2, 101, 390
EuF2 2, 94, 126
EuF3 2, 101
EuH3 2, 8, 12
Eul2 2, 74
Eul3 2, 101
EuLiH, 2, 18
Eu(NH3N 2, 557
EuO 2, 243
Еи2Оч 2, 251
Eu3O4 2, 321
Eu(OH)o-H2O 2, 421
HuOCl 2, 184
F.11OF 2, 177
E11S 2, 496
]-;u.5S4 2. 518
E11SO4 3. 409
EuTiO3 2, 301
EuY2S4 2, 321
F-, 2, 58; 3. 441
FCN 3, 28
(FoH)M 2, 34
(F,H)NH4 2, 34
(F,H,)K 2, 34
(F5H4)K 2, 34
FNO3 2, 589
FO, 2, 201
F,6 2, 76, 199
F,O2 2, 201
F2S 2, 439
Fc 3, 460, 500
Fe3Al 1, 305
FeAl2O4 2, 312
FeAs2 2, 509
FeAsS 2, 509
Рс(диарспн) (COK 3, 354
FeB 3, 176
Fe,B 3, 175
FcBaSi4O10 3, 138
FeBr, 2, 91
FeBr3 2, 98
FeBr42~ 2, 141; 3 355
Fe3C 2, 52; 3, 174. 500—501
Fe(C5H5J 3, 77
Fe(C5H5)oI3 3. 78
Fe2(C5HG),(COL 3, 80
Fe4(QH5L(COL 3, 65
Fe4(C5H,LS4 3, 73
Fe(C5II5)(CO)H(SiCl3J 3, 357
Fe(C8H8)(COh 3, 83
Fc2(CsHs)(CON 3, 83
[Fe(dcla)(H,O)l2- 3, 351
[Рс(ЭДТА) A1,0I- 3, 351
[Fe(CN)f;|Ciu 3, 45
[Fe(CNN|Fe 3, 4'г, 45
[Fc(CNNlFcK 3, 43
rFe(CNNlH4 3, 40
rFe(CN)o][Co(NH3h(H20)l 3.
rFe(CNN],Fe/,-15HvO 3 46
!Fe(CNN]4Ti3 3, 45
[Fe(CNMNO]2- 2, 573
rFe(CNCH3N]Cl2-3H,O 3, 45
Fc(CNJ(CNCH3L 3, 46
Fc(COM 3, 60
Fe,(CO)9 3, 62—63
Fe3(COI23, 64
rFe4(C013l2- 3, 65
Fe(CO),(NOJ 3, 70
Fe(COK(PR3)-2 3, 59
Fc(COb[P(OMeKlo 3, 61
Fe(COLC2H4 3, 61
Fe(COLH2 3, 68
Fe(COLHg 3, 56
Fe(COLI2 3, 70
i-e(COL[Mn(COMl23, 71
Fc(COLPH(C6H5J 3,61
Ре.,(СОN-С6Н8О2 3, 76
Fc,(CON(GeMe2K 3, 63
Fc2(COb(NH2J 3, 63
Fe,(CONS2 3, 73
Fe2(CO)e(SCoI-b), 3, 73
Fe,(CO)8P(CH3J 3, 63
Fc,(CO)8P2(CH,L 3, 61
Fe3(CO)9S2 3, 74
Fe,(CO)HH- 3, 64, 69
Рсз(СОI1Р(С6Н5)зЗ, 64
Fc4(COI32- 3, 65
Fe4(CO)pS(SCH3b 3 74
Fe4(COI6Sn;(CH3L 3, 72
Fc5(COI5C 3, 72
Fe5(CObS4 3, 74
FeC32H16N8 3, 356
FeCl2 2, 91, 126, 127
FcCl2-2H2O 2, 417
FeCl,-4H2O 2. -114
FcCl3 1, 39, 2, 98, 129, 390
FeCl.r6H2O 2, 409
FeCl3- (графит) 3, 22
FcCb|(CH3),SOl, 3, 356
(FcCl4)- 3, 355, 356
(FeCl6)K3Na 2. 153
FeCl5(H,OJ- 2, 150
FeCl (salon) 3, 358
FcCoBO, 2, 322
FcCr2S4 2, 526
FeF, 2, 91
FeF,-4HoO 2, 415
FcF3 2, 97
FeF.r3H,0 2, 414
(FeF,)Ba 2. 143
FeF42- 2, 140, 162
FeF,,2" 2, 142
FeF63" 2, 153
FcF64- 2, 144
Fe2F73- 2, 161
Fe2F93" 1, 224; 2, 161
Fc3F145- 2, 162
Fc5Fi-2- 2, 162
Fcl2 2, 91
FeU2" 2, 141; 3, 355
FcI(NOJ 3, 354
FeMo 3, 479
Fe7Mo6 3, 479
Fe2N 3, 497
Fe4N 3, 503
rFe(NCH)el(FcCl4J3. 46
520 Формульный указатель
fFe(NCSN]3- 3, 34
Fe(NCSJ(py)« 3, 355
Fe4(NOLS4 1, 120
Fe(NO)(N2S2) 2, 573
[Fe4(NOOS3|Cs 2, 574
Fe2(NOLS2(C2H5J 2, 575; 3, 354
Fe(NO)lS2CN(CH3J]2 2, 573
Fc(NO3K 2, 583
[Fe(NO3L]-2, 583
Fe(NO3)O 2, 583
Fe[N(SiMe3Jl3 2, 552
FeNbO4 2, 308
FeNi3 3, 468
FeO 1, 289; 2, 244, 259
a-Fe2O3 2, 251
&-Fe2O3 2, 260
VFe2O3 2, 259, 317
Fe3O4 2, 259, 317
FeO33- 2, 215
FeO34-2, 213
FeO44- 3, 358
FeO45- 2, 215
Fe2O4M 2, 312
Fe2O5Ca, 2, 325
Fe2O54-2, 216
Fe2O66- 2, 214
Fe2O78- 2, 215
Fe6O1614- 2, 215
FeOCl 2, 182
FeOF 2, 176
(FeO3F)Cu2 2, 176
(FeO3F)Sr22, 176
Fe(OHJ2. 358
a-FeO(OH) 2, 367
P-FcO(OH) 2, 366
-T-FeO(OH) 2, 370
e-FeO(OH) 2, 366
Fe(OH)SO42, 377
Fe3O4_^Fl 2, 176
Fe5O12_,F.vY3 2, 176
FenOlgFBaCo 2, 176
rFe2O(H2OJ(C,5H21N5Jl(ClO4L 2, 209
ГРе2О(НЕДТАJ12- 2,209
rFe3O(SO4N(H2OK]5- 1, 233; 2, 194
FcuO,7Na 2, 318
FeP 2, 606
FeP2 2, 510, 606
FeP4 2, 606
FePb4Sb6S14 2. 5
FeS 2, 500—501
FeS2 (марказит) 1, 279;
FeS2 (пирит) 1 289
Fe3S4 2, 502
Fe7S8 2, 503
FcMSI2 2, 503
Fe16S32Ba9 2, 531
FeS2K 2, 528
{Fe[S2C2(CNJl2y- 3, 358
:9
) , ; 2, 502. 508
, 289; 2, 502, 508
rFe(S2CNLt,Jl+ 3, 358
Fe(S2CC6H4Ch3JlS3CC6H4CH3) 3, 357
FcSb 3, 490
FeSbo 2, 510
FcSbO4 2, 309, 681
FeSb,O6 2, 681
FoSbS 2, 509
FeSb.S, 2, 539
FcSe 3, 490
FeSeo 2, 510
FeSi 3, 461
Fe3Si 3, 95, 470
Fc7SiO10 3, 129
FeSn 3, 490
FcTaO., 2, 209
FeTa,O6 2, 681
FcTe 3, 490
FeTe2 2, 510
Fe3Th7 3, 53
Fe17Th2 3, 474
FeTiO3 1, 318; 2, 294
Fe2Ti05 2, 324
FeV 3, 479
FeVO3 2, 294
FeVO4 2, 308
Fe7W6 3, 478
FeWO4 2, 308
Fe5Zn2i 3, 485
Ga 3, 444
GaAs 2, 599
GaBr 2, 129
GaBr2 3, 288
GaBr3 2, 129
Ga(CH3K3, 84
rGa(CH3JOH]4 3, 312
GaCl 2, 129
GaCl2 3, 287
GaCl3 2, 98, 129; 3, 288
Ga2Cl7- 2, 156
GaF 2, 129
GaF3 2, 97
GaF5Tl2 2, 142
Ga2F9Cs3 1, 224; 2, 156
GaH3-N(CH3K2, 11
Ga2HgTe4 2, 534
Gal 2, 129; 3, 287
Gal3 2, 98
GalnSb, 2, 534
GaLi 3, 472
GaN 2. 599
Ga2O 3, 287
Ga2O3 2, 251
GaOCl 2, 181
GaO(OH) 2. Г67
[Ga(OSiMe,> ,|Na 3 312
GaP 2, 599
GaPS4 1, 205, 241
Формульный указатель 521
Ga-,Pt2 3, 487
GaS 3, 288
Ga,S 3, 287
Ga,S3 2, 513, 514, 534
GaoS5Pb2 2, 526
GaSb 2, 599
GaSbO, 2, 309, 681
GaSc 3, 288
G;i,Se3 2, 534
Ga2Te3 2, 534
Gd 3, 447
GdB4 3, 174
GdBe 3, 174
Gd5Br8 2, 123
GdCl 2, 123
GdCl3 2, 101
GdCI3-6H2O2, 415
Gd2Cl3 2, 121
GdF3 2, 101
GdFeO32, 301
GdH2 2, 12
GdH3 2, 12
Gdl2 3, 409
Gdl3 2, 101
Gd2O3 2, 251
GdOCl 2, 184
Gd(OHK 2, 356
Gd2S3 2, 517
GdSX 2, 170
Ge 1 161; 3, 93, 446
GeAs 1, 288
GeBr2 3, 319
GeBrH3 3, 10
GeC2H4 3, 10
Ge(CH3JH2 3, 10
Gc(CH3KCN 3, 322
Gc(C6H5L 3, 10
(GcCU)Cs 3, 319
GoClF3 3, 10
GeClH3 3, 10
GeCl4(pyJ 3, 319
GeF22, 129; 3, 318
(GeF6)M22, 149, 150
GeFH3 3, 10
GcH4 3, 10, 317
Ge,H6 3, 10
Ge3H8 3, 10
(GeH3KN 2, 549
ГСеНзЬО 2, 199
Gel, 3, 319
Gel4 2, 103; 3, 10
GcMoPO404- 2, 227
Gc3N4 1, 112; 2, 599
Ge2N2O 3, 106
GeNi 3, 438
GeO2 2, 246; 3, 316, 319
GcO3Cu 3, 136
GcO4Bc2 3, 316
GeO4Mn2 1, 258
GcO4Zn2 3, 316
GeO5Ca33, 316
GcoO7Sc2 3, 316
(Ge3O9)BaTi 3, 316
(Ge7O16)K3H-4H2O 1,283; 3, 319
Gc9Oo0Na4 3, 319
Gc(OHK2- 2, 365; 3, 319
GeP 1, 283; 2, 601
GcS 2, 500; 3, 389, 319, 333
GeS, 3, 317
GeS32~ 3, 317
Ge2Se4- 3, 317
Gc2S76- 3, 317
Ge4S104- 3, 317
GeSe 2, 500
GeSiH6 3, 10
GeTe 2, 500
GeV3 3, 450
H2 3, 441
HBr 2, 31, 75
HBr-4H2O 2, 429
(HBr2)~ 2, 36
HCN 3, 25
(HCO3)K2, 41
(HCO3)Na 2, 41
H(CO3JNa3-2H2O 2, 40
HC1 2, 31, 75
(HCb)- 2, 36
HC1-H2O 2. 429
HC1-2H2O 2, 429
HC1-3H2O 2, 429
HF 2, 30, 75
(HF2)M 2, 34
(HF2)NH4 2, 35
(HF2)Na 2, 25, 34
(H2F3)K2, 35
(H4F5)K2, 35
HI 2, 95
H2O (лед) 1, 155; 2, 382
H2O (вода) 2, 199, 382, 387
(H3O)+ 2, 426
H2O2 2, 199
H2Or2H2O 2, 200
H2O2-C2O4M2 2, 200
(H5O2)+ 2, 426
HOBr 2, 79
HOC1 2, 79
HOF 2, 79
H2S 2, 439
He 3, 441
Hf 2, 16; 3, 447—448
НГ(диарсииJСЦ 3, 341
34—1284
522 Формульный указатель
Формульный указатель
523
ШВ 3, 174
HfC 3, 52
HiCl 2, 123
(IIfCl6KBiio 2, 662
HfF4 3, 105
HfH,,s^li75 2, 16
HFH, 2, 12, 16
Hfl3 2, 99
Hfl4 2, 104
HfN 2, 596
HfO2 2, 247
Hf(OHJSO4-FbO 2, 378
HfP 2, 606
HfS2 2, 505
Hf,S 2, 498
HfS3M 2, 527
Fig 3, 444
Hg3(AlCl4J 3, 296
Hg3AsF6 3, 296
Hg3(AsF6J 3, 296
Hg4(AsF6J 3, 296
(Hg2K(As04J 3, 297
HgBr2 2, 128; 3, 302
Hg,Br2 3, 297
HgBr3K-H2O 2, 138
HgBr3[N(CH3L] 3, 303
(HgBr4J- 3, 304
HgBrCH3 3, 299
HgBr (NCS) 3, 299
Hg2Br4(AsBu3J 3, 304
Hg3Br6(AsBu3J 3, 304
Hg2(Br03J3, 297
Hg5Br204 3. 305
Hg(CF3J 3, 299
Hg2(CF3COOJ 3, 297
Hg(CH3J 3, 299
Hg(CNJ 3, 39, 299
Hg(CN)(NO3) 3, 299
rHg(C5H5NONl(ClO4J 3,298
Hg(C13H11N4SJ-2C5H5N 3, 300
HgCi2 2, 128; 3, 301
HgoCl2 2, 128; 3, 297
(HgC!3)Cs 3,302
(HgCb)NH., 3, 203
Hgci42- з, :-Q4
(HgCl4)K2-H,O 1, 47; 3, 302
HgCl-,3- 3, 305
HgCI(CHs) 3, 299
Hg3Cl202 3, 305
Hg3Cl40 3, 305
Hg4Cl202 3, 5
Hg4Cl,O3 3, 305
Hg6Cl404 3, 305
Hg3CLS2 1, 140; 3, 305
HgCl2[OAs(C6H5Kl2 3, 300
HgCl,(S,,C3H6) 3, 300
HgCl2(SC4HsO), 3, 300
Hg2Cl4(C8H12S2) 3, 304
Hg,Cl4|SeP(C6H5Kb 3. 305
Hg,(CIO4b-4H2O 3, 297
Hg|Co(COL]2 3,71
HgF, 3, 298
Hg,F2 3, 297
HgF (OH) 2, 185; 3, 299
HgFe(COL 3, 56
Hgl2 1, 201, 237; 2, 128; 3, 301
Hg,I2 3, 297
Hg,l62- 2, 156; 3, 304
(Hgi3)[S(CH3Kj3, 303
(HgU)*~ 3, 304
Hgl4Ag2 2, 535
HgLi 3, 472
HgNH,Br 3, 310
Hg(i\H3JBr2 3, 308
Hg2NHBr2 3, 310
HgNH,Cl 3, 310
Hg(NK3JCl2 3, 308
HgNH2F 3, 308
Hg2N(OH)-xH2O 3, 310
(Hg2N2H2)Cl23, 311
Hg2N(NO3) 3, 310
Hg(NO2L2" 2, 579
Hg(NO3J 2. 583
Hg2(NO3J-2H,O 3, 297
HgNa 3, 473
Hg,Na 3, 473
Hg2Na3 3, 473
Hg2Nb207 1, 160; 2, 325
HgO 3, 307
HgO, 1, 330; 3, 308
HgO/- 3, 308
(Hg,KO2HCl3 3, 298
(HgOJNaI 3, 307
HgS 3, 307
Hg(SRJ 3,299
]Hg(SCNLf- 3. 34, 300
Hg2(SCNNCo-C6II6 3, 300-301
Hg2SO4 3, 297
HgSO4-H2O 3, 299
HgSe 2, 494
Hg(SiMe,K~ 3, 298
HgTe 2, 494
Ho 3, 443
Ho2C 3, 47, 51
HoCl3 2, 101
HoF3 2, 101
Ho3F,0(NH4) 2, 101
HcFeO3 2 305
HoH2 2, 14
HoH3 2, 14
Но1л 2, 101
Ho,03 2, 251
HoOCl 2, 184
HoOF 2, 176
HoS 2, 496
HooS3 2, 517
HoSF 2, 170
HoSi2 3, 99
I, 1, 340; 2, 62—63
I> 2, 67
1> 2, 68
1,- 2, 71
1.,-+ 2, 68
14-- 2, 72
I-,r 2, 67
I5- 2, 72
I-- 2, 72
L'2~ 2, 74
19- 2, 74
IBr 2, 63
I.,Br- 2, 71
IBrCl" 2, 71
I(CH2NN4+ 2, 59
IC5H5N+ 2, 59
I(C6H5)C12 2, 59
1(C6H5)(OOCCH3), 2, 59
|I(C6H5J](IC12) 2, 59
1CN 3, 28
1C1 2, 62
ICU" 1, 323; 2, 71
ICI3 2, 63
1СЦ- 2, 72
ICrOe" 2, 83
1F4+ 2, 69
IF3 2, 66
IF6+ 2, 69
1F7 2, 66
!F5-XeF2 2, 48
IMo6O245- 2, 230
I(NO3L-2, 60
IO2+ 2, 78
Ю3- 2, 81
IO4- 2, 82
Ю5- 2, 82
IOF4- 2, 76
IOF5 2, 77
IO(NO3) 2, 60
IO2F2 2, 83
IO2F3 2, 77
(IO3LCe 1, 401
(IO4KCe-H2O 1, 401
IO3H 2, 42, 80
IO3(OHK3" 2, 82
IO4- 2. 82
IO4K 2, 310
IO6H5 2, 82
(IO6)Ht(NH4J2. 40, 45
IO6KNi 2, 83
1204 2, 77
1205 2, 77, 80
I,O2SO4 2, 60
I2O8(OHJ4-2,82
I,O9J- 2, 82
1;OSH 2, 80
14O9 2, 77
ISbCl» 2, 65
bSb2Fn 2, 67
I2SeC4H8 2, 62
In 3, 444
InAs 2, 599
InBr 2, 88
In(CH3K3, 84
InC5H5 3, 77
In(C5H5K3, 79
InCl 2, 88
InCl2 3, 288
InCl3 2, 98
lnCl4- 2, 141
InCl52- 3, 312
InCrO3 2, 300
InF 2, 129; 3, 288
InF3 2, 97
lnF2(OH) 2, 185
[InF4(H2O)lN2H5 3, 312
Inl 2, 88
Inl3 2, 99
InLi 3, 472
InN 2, 599
In(NO3K 2, 582
Г1п(Ш3L1- 2, 582; 3, 313
InNa 3, 472
In3Na2 3, 487
In2O3 2, 251
InOBr 2, 182
InOCl 2, 182
InOF 2, 176
InOI 2, 184
In(OHK 1, 254; 2, 362
InO(OH) 2, 367
In(OH)SO42, 377
InP 2, 599
InS 2, 519; 3, 288
In2S3 2, 513, 515
In3S4 2, 515
In5S4 2, 518
In6S7 2, 518
InSBr 2, 170
InSCl 2, 170
InS2Na 2, 526
InSb 2, 599
InSe 3, 288
InTc 3, 289
In2Tc3 2, 534
Ir 3, 447
IrAs3 1, 319
Ir4(CO),2 3, 65
rir(CO)Cl(NO)(P(C6H5KJl+ 2, 573
Ir(CO)CI(O2)(P(C6H5K).> 2, 204
34*
¦524 Формульный указатель
1г(СОJС1(Р(С6Н5)зJ3, 339
Ir(CO)Cl(P(CeH5KhSO,2, 456
|Ir(CO)I(NO)(P(C6H5KJl+ 2. 573
Ir(CO)I(O2)(P(C6H5KJ2, 204
JrF3 2, 97
IrF, 2, 105
IrFs 2, 109
IrF6 2, 129
(IrF6)M 2, 148
[Ir(NO2N]M32, 153
IrO2 2, 247
(lrO4)Ca2 1, 258
(IrO6)Sr4 2, 136
JrP3 2, 606
Ir2P 2, 606
IrS2 2, 505
Ir2S3 2, 513
JrSb3 1, 319
IrSi3 3, 95
К 3, 454
KB6 3, 179
KBr 2, 128
K2(COJ 3, 54
K6 (CO) 6 3, 54
KCeF4 3, 424
KC1 2, 128
KF 2, 128
KF-2H2O 2, 416
KF-4H2O 2, 411
KFenO,7 2, 317
KFeS2 2. 528
KH 2, 8
KI 2, 128
KLaF4 3, 424
KMgCl3 2, 139
K2MgF4 2, 324
KNbO3 2, 301, 305
KNiCl3 2, 139
KNiF3 2, 139
K2NiF4 1, 251; 2, 141
KO2 2, 198
КОз 2, 197
K2O 2, 239
K2O2 2. 197
KOH 2, 353, 390
KP 2, 606
KP,5 2, 606
K3P 2, 606
K2S 2, 496
KSH 2, 354
KSbO3 2, 679
K3Sb5014 2, 680
K2Se 2, 494
KSi 3, 95
KTaO3 2, 301
K2Te 2, 494
K2ThFe 3, 423, 423
K2UF6 2, 122, 144
K3UF7 3, 423
K*WO3 2, 337
KZn,3 3, 475
Kr 3, 440
KrF+ 2, 47, 56
KrF2 2, 56
KrF4 2, 47
Kr2F3+ 2, 56
La 3, 447, 450
LaB4 3, 174
LaB6 3, 174
LaB2C2 3, 180
La2Be205 1, 140
LaBr3 2, 99
LaC2 3, 49—50
La2C3 3, 50
|Ъа(ЭДТА)Н(Н2ОL1-ЗН2О 3, 353
|Ха(ЭДТА) (Н2О)з1-5Н2О 3, 353
LaCl3 2, 99
LaCrO3 2, 301
LaF3 2, 99
(LaF4)K3, 424
(LaF4)Na 2, 142; 3, 424
LaFeO3 2, 302
LaH2 2, 12
LaH3 2, 12
Lal2 3, 409
Lal3 2, 90
La7I12 2, 123
LaMnO3 2, 302
LaN 3, 497
LaNJV* 2, 169
La(NH2NK32, 553
La(NO3K(bpyJ2, 588
LaNb3O9 2, 305
La2O3 2, 251, 254; 3, 436
La(OHK 2, 102, 357
LaOBr 2, 184
LaOCI 2, 184
LaOF 2, 184
LaOI 2, 184
La2O2S 2, 542; 3. 436
LaP 2, 606
LaP5 2. 606
La2Re05 2, 329
La4Re6019 1, 269
LaS 2, 496; 3, 409
LaS2 2, 476
La2S3 2, 513; 3, 438
LaSi2 3, 99
La2SnS5 1, 258; 3, 326
LaTa3O9 2, 305
LaZn5 3, 474
LaZtin 3, 474
Формульный указатель 525
Li 3, 454
LiAKCilbh 3, 86
LiAlH4 2, 18
Li3AlH6 2, 18
LiAlO2 2, 292
LiAl5O8 2, 316
Li5A104 3, 229
LiBH4 3, 216
LiBO2 2, 292
LiBeH3 2, 18
Li2BeH4 2, 18
LiBr 2, 182
Li2Br, 2, 128
LbO 3, 47
L1CH3 3, 85
LiC,H5 3, 85
LiCl 2, 128
Li2Cl2 2, 128
LiC104-3H20 2, 411
LiCrGeO4 2. 313
LiEuOo 2, 292
LiF 2, 128
LiFeO, 2, 292
LiFe36s 2, 316
LiGaH4 2, 18
LiH 2, 8
Lil 2, 128
Li2I2 2, 129
LiInH4 2, 18
LiInO2 1, 293; 2, 292
LiMn2O4 2, 265
Li N 2. 593
Li(NH3L 2, 557
Li5N3Ti 2. 596
Li7N4Nb 2, 596
Li9N-,Cr 2, 596
Li NO* 2, 582
Li.\:bO3 1. 318; 2, 294
LiNiO" 2, 292
LiO 2, 237
Li2O 2. 237, 229
Li,O- 2, 237
LiOH 1, 146; 2. 357
LiOH-H2O 2, 419
LiP 2, 606
LiP5 2, 606
Li3P 2, 606
L13P7 2, 606
Li3Pb 3, 472
Li4RhH* 2, 18
Li2S 2. 496
LiSH 2, 354
Li3Sb 3, 472
LiSbF6 2, 147
LiSbO3 1,211; 2,294
LiScO2 2, 292
Li2Se 2, 494
Li2Te 2, 494
Li2Ti03 2, 291
LiTl 3. 472
Li4UO5 2, 328
LiVO2 2, 292
Li2V4O7 1, 293
LiAVO32, 337
Li2WO42, 311
LiZn 3, 472
Lu 3, 447, 450
LuCl3 2, 101
LuF3 2, 101
Lul3 2, 101
Lu2O3 2, 251
LuOBr 2, 184
Lu(OHK2, 362
Lu2S3 2, 517
LuSF 2, 170
LuSi2 3, 99
Mg 3, 447
Mg(AlH4J 2, 18
MgA!2O4 2, 312
Mg3Al2(Si04K 2. 327
Mg32(Al, Zn)«3, 480
Mg3As2 2, 598
MgB2 3, 174
Mg3Bi2 2, 598
MgBr, 2, 91
MgC2 2, 48
Mg2C3 2, 48
Mg(CH3J2, 86
Mg(C5H5J2, 77
MgCl2 2, 91
MgCl,-6H2O 2, 408
MgCl,-12H2O 2, 407
MgCl4K2 2, 136
MgClH 2, 76
Mg(C104J-6H20 2, 408, 411
MgF2 2, 113, 125
MgFe,O4 2, 313
MgGa,O4 2, 313
Mg,Ge 3, 95
iMgH2 2, 8
Mgl2 2. 113
Mg6Mn08 2, 328
Mg3N, 2, 598
Mp-,NC1 2, 169
MgoNF 2, 170
Mg3NF3 1 286; 2, 169
rMg(NH3Nl2Cl2 2, 409
MgNi2 3, 478. 481
Mg2NiH4 2, 18
MgO 2, 243
Mg(OHJ 2, 358
Mg(OH)Cl 2, 189
Mg2(OHKCl 2, 186
526 Формульный указатель
Mg2(OHKCl-4H2O 2, 188
Мк,Р, 2, 598
Mg(PO,CI,MPOCl3J 2, 616
Mg2Pb 3, 95, 489
MgS 2, 496
Msj-iSbo 2. 598
MgSb2OG 2, 601
MgSe 2, 494
Mg,Si 3, 95, 489
Mg2Sn 3, 95, 489
MgTa2O62, 681
MgTe 2, 494
Mg3TiB2O8 2, 324
MgTl 3, 472
MgWO4 2, 309
MgZn2 3, 478, 481
Mn 3, 449, 479
MnAl2O4 2, 313
MnAs 3, 490
MnB 3, 174
Mn2B 3, 174
Mn3B4 3, 174
MnBi 3, 490
MnBr2 2, 91
MnBr4- 2, 140
Mn3C 3, 52
Mn3C2 3, 53
Mn(C6H5J 3, 77
Мп(С5Н5)(СОK З, 78
Мп3(С5Н5)з(ЫОL 2, 574
[Мп(ЭДТА)Н(Н2О)]- 3, 351
Мп2(СО),о 3, 63
Мп(СОJЖ)(Р(С6Н5Ь), 2. 573
Mn(COLNO 3, 71
Мп(СОMН 3, 69
Mn(COMSn(CH3K 3, 71
[Mn(COM]2Fe(COL3, 71
Mn2(CO)8Br2 3, 70
Мп2(СО)8Н(Р(С6Н5J) 2, 20
МпС12 2, 91
МпС12-2Н2О 2, 417
МпС12-4Н2О 2, 415, 417
(МпС13)М 2, 136
(MnCl3) (NMe4) 2, 139
(MnCl3)Rb-2H2O 2, 422
(MnCU)Na, 1, 258; 2. 136
(МпС14)К2-2Н2О 2, 422
(MnCl5J- 2, 142
(MnCl6)K4 2, 154
Mn3Cl8Na2 2, 158
Mn8Cl3O10 2, 185
MnF2 2, 91
MnF3 2, 97
MnF4Ba 2. 140
(MnF5) (NH4J 2, 142
(MnF5)K2-H,O 2. 144
(MnF6)Ba2 2, 145
(MnF6)K2 2, 150
(.\lnFiSO4)K2 2, 465
Mill, 2, 91
MnMo 3, 479
MnMo9O326- 2, 230
Mn(NO3J 2, 583
[Mn(NO3L]2- 2, 583
MnNa6Cl8 2, 136
(MnNbiAseI2- 2, 230
MnO 2, 244, 263
MnO2 2, 247, 263, 265
Mn2O3 2, 251, 263
Mn2O7 2, 263
МП3О4 2, 263, 315
Mn5O8 2, 263
MnO3F 2, 179
(MnO4)- 2, 213
(MnO4)Ca 2, 324
Mn2O6Ke2, 214
Mn3O7Zn-3H2O 2, 266
Mn(OHJ 2, 358
a-MnO(OH) 2, 367
Ч-МпО(ОН) 2, 369
Mn2O(pyJ(C32Hi6N8J 2, 209
Mn,2Oi2(CH3COO)le(H,OL 2, 194
MnP4 2, 606
Mn(PO2Cl2J(CH3COOC,H-) 2, 616
MnS 2, 501
MnS2 2, 505, 509
(MnS3)Ba2 2, 526
MnSb 3, 490
MnSb2O6 2, 681
Mn3Si 3, 95
Mn15Si2S 2, 532
MnTe 3, 490
Mn,2Th 3, 474
MnWO4 2, 307
Mo 3, 447
MoB 3, 174, 176
MoB2 3, 174
Mo2B5 3, 174
Mo2BC 3, 179
MoBr2 2, 117
М0ВГ3 2, 98
Mo2Br93- 2, 157
MoC 3, 497
Mo,C 3, 52
Mo2(CH3COOL 1, 370
Mo(C5H5JCl2 3, 79
Mo(C5H5KNO 2, 573
Mo2(CsH5J(CON 3, 79—80
Mo2(C5H5JI203 3, 81
Mo(CN)83- 3, 40—41
Mo(CN)s4- 3. 41
Mo (CO) 6 3. 61
Mo2(CO)u,2- 3, 63
Mo(CO)oF4 3, 57
Формульный указатель 527
Мо(СОL(РС2Н5M 2, 640
Mo(CO) .(SOO'(dipyr) 2, 456
Mo, (CO) До 3, 70
MoCl, 2, 117
WoCl. 2 103, 104, 106
Mods'2, 109
M0CI5 (графит) З, 22
МоС16 2, 106
Mo»Cl8Iv-2H,O 2, ИЗ
Мо,СШ ; - 2, 111
(Mo.,C10Cl(NH4M-H20 2, 113
Mo,Ci9?- 2, 111, 157
(Mo,-,C!14)(NH4J-H.,O 2, 117
[(MoGCl8)(OHL(H20Jl-12H20 2, 115
M0F3 2, 97
M0F5 2, 109
MoF6 2, 110
(MoF6)M 2, 148
(MoF5)K3 2, 153
МоН,(С5Н5), 2, 20
Mol2 2, 117
MoN 3, 497
MoO, 2, 248
MoO, 2, 237, 285
MO3O 2, 284
Mo4On 2, 286
Mo5014 2, 286, 3:9
MosO,3 2, 286
Mo9O,6 2. 286
Mo,-04- 2, 286, 339
MoCVHoO 2, 222
MoO3-2H,O 2, 222
Mo03Mv 2, 341
MoO,-- 2, 310
Mo,Or2- 2. 219
MoAf,= - 2, 219
Mo',0,f- 2, 219
Mo6O,q-- 2, 220
Mo7O,4$- 2, 220
MojOJs*- 2. 220
Mo80,-6" 2, 220
Mo8O28H,s~ 2, 220
(MoO4)Mn 2, 7
MoO6Ba,Ca 2, 153
Mo@2L2- 2. 204
[Мо2Оз@2L(Н2ОЫ2- 2, 205, 208
ГМо2О4(О2L(ОНН2- 2, 208
МоОВгз 2, 180
MoOCl;, 2, 180
M00CI4 2, 179
МоО,С1о 2, 179
(MoOCK)Cs2 2, 174
МоОз-vFv 2, 177
M0OF4 2, 109, 180
Mo4O,,F 2, 176
(MoO3F,)(NH4K 2. 174
[MoO,(CNbl4^ 2. 207
MoO,Cl2f(CH3JNCHOl2 2, 207
MoO3-NH(C-H4NH2J 2, 207
|-Mo264(CoO4J"|Ba-5H2O 2, 209
ГМо2О5(С2О4J(Н2ОJ]К2 2, 209
Mo,O2S62~ 2, 476
Mo,O3(S2COC2H5L 2, 209
Mo;o3|S2P(OEtJl42. 209
rMo04(cysJ]2Na2-5HoO 2, 209
Mo,O5(OH) 2, 342
[Мо,О6(ЭДТАIЫа4-8Н2О 2, 208
MoP 3, 53
MOPO5 2, 345
MoPo08 2, 348
MoPO4(OHK2, 350
Mo2Re2S8M 2, 539
MoS, 2, 506
Mo2S3 2, 516
Mo2(S2)<32- 2, 476
Mo3S(S2N2- 2, 476
Mo,S4Al0 5 2, 539
Mo(S2C2H2K 3, 339
Mo9SnTl2 2, 540
MoSc, 2, 503
Mo6Se6K2 2, 541
MoSi2 3, 96
Mo3Si 3, 95
MoTe2 2, 506
N2 2, 543. 566; 3, 441
№- 2, 552, 595
N3- 2, 543, 564
NA1(CH3KC132, 547
ЫзЛ1з(СН3)б(С2Н4)з 2, 547
N<A14(C6H5)8 2, 547
NBr3 2, 556
NT(CH3K 2, 549
[N(CH3KV41H2O 2, 393
N(CH3JC1 2, 549
N(CH3JH 2, 549
N(C2H5JH-82/3H,O 2, 393
N(CH3I2-V2(niipiuim) 2, 556
N(CH3JI 2, 556
N(CH3KO 2, 548
[N(CHiKHlI 2, 25
N(CH3LF-4H2O 2, 393
N(CH3LOH-5H2O 2, 393
[N(CH,Ll,SiF6 2, 548
[N(C-,H,,LlF-38H,O 2, 393
N,CH2 2 561
N,CF, 2, 561
N2(CH:i), 2, 563
N2(C,,H,), 2, 562
(К12)СоН[Р(СбН5):,1з 2, 545
F(N2)Ru(NH3Ml2+ 2, 545
r(N2)Ru2(NH3),0l4+ 2, 545
r(N2)Ru(enJN3l+ 2. 546
N2C6H5+ 2, 545
N,CH3 2, 565
528 Формульный указатель
Формульный указатель 529
(N3JCu 2, 564
N4(CH2N (MT) 2, 551
N4(CH2N-6H2O I, 143; 2, 393, 551
(NCNJ~ 3, 29
NCNH2 3, 29
(NCNH2J 3, 29
(NCO)- 3, 31
NCS- 3, 33
NCSAg 3, 34
NCSCH33, 31
NCX 3, 27
NC13 2, 549
NF3 2, 549
NF3O 2, 548
(NF4) (AsF6) 2, 548
N2F+ 2, 563
N2F2 2, 562
N2F4 2, 560
N(GeH3K 2, 549
NH 2, 562
Nff- 2, 553
NHBa2 2, 553
NHCI2 2, 549
NHF2 2, 549
NHSO 2, 593
fNH(SO3J]2- 2, 468
fNH(OH)SO3]- 2, 554
NH2CH3 2, 549
NH2CN 3, 29
NH2C1 2, 549
NH2- 2, 552
NH2OH 2, 554
(NH2SO3)- 2, 466
(NH2),SO2 2, 466
NH3 2, 30, 549, 557
NH3-H2O 2, 556
(NH3J-H2O 2, 556
(NH3OH)C1 2, 25
(NH3OH)C1O4 2. 548
NH3SO3 2, 39, 465
NH4Br 2, 32
NH4C1 2, 32, 33
NH4F 2, 32, 33, 547
NHJ 2, 32
NH4I-4NH32, 557
N2H2 2, 562
N2H4 2, 558
N,H2(CH3J 2, 559
N2H4-H2O 2, 25, 558
N2H4-4CH3OH 2, 25
(N2H5)H2PO42, 560
(N2H5JSO4 2. 560
(N2H6)CI22, 34
(N2H6)F22, 32
(N2H6)(H2PO4J2. 560
(N2H6)(ZrF6) 2, 166
NI3-NH32, 556
(N3)H 2, 563
N3- 2, 564
NO 2, 567
N0+ 2, 570, 586
NO2 2, 568
NO2+ 2, 570, 577
NO2" 2, 577
NO22^ 2, 578
N2O 2, 566
N2O3 2, 568
N2O32- 2, 580
N2O4 2, 568
N2O5 2, 570
NOBr 2, 571
NO(CH3) 2, 571
NO(CH3KC122, 571
NOC1 2, 571
NOC12+ 2, 576
NOF 2, 571
NOF2+ 2, 576
NOF3 2, 548
NON(CH3J 2, 559
[NOfSOshl2- 2, 555
[NO(SO3J13- 2, 555
[N,O2SO,]- 2, 555
N2O,H2 2, 580
N2O3Na2 2, 580
N404S2Fe2(CoH5J 2, 575
(N7O7S3Fe4)Cs 2, 574
NO,CH3 2, 579
NO,C1 2, 576
NO2(C1O4) 2, 576
NO.F 2, 576
NO~2H 2, 577
(NO2) (HS2O7) 2, 576
NO2NH2 2, 580
NO2-N(CH3J2. 559
(NO2JNi 2, 578
(NO2JS3OI0 2, 576
[(NO2NM]4- 2, 578
(NO3)- 2, 581
(NO3)Ag 2, 582
NO3CH3 2, 589
NO3CI 2, 589
(NO3JCu 2. 584; 3, 260
NO3F 2, 589
NO3H 2, 581
NO,H-H2O 2, 430
NO3H-3H,O 2, 581
NO,M 2, 212
r(Nb3JH]- 2, 582
(NO3JPb 2, 582
[(NO3KH2]- 2, 41, 582
NP 2, 603
N5P3 2, 596
N(P(C6H5KJ+ 2, 561
N6P2(CH3)s 2, 644
N3(PC12)(SOFJ 2, 645
N3PO,S-,C14 2, 645
N3P2OSCI3 2, 645
N3PS,(NHSiMe3J2, 645
(NS), 2, 590
NS2+ 2, 589
No So 2, 589
N2S3+ 2. 590
N2S4 2, 589, 593
N0S5 2, 589
N3S3- 2, 590
N-,S4+ 2, 592
N4S4 2, 592
N4S42+ 2, 592
N5S4- 2, 592
N5S5+ 2, 592
N6S5 2, 594
N[S(CH,)o]2+ 2, 561
N(SClb+ 2, 561
N0S3CI+ 2, 590
N3S3C13 2, 591
N3S3C1,O3 2, 591
N3S0CI4PO. 2, 591
NSF 2, 593
NSF3 2, 593
N4S4BF, 2. 593
N4S4F4 2, 593
N4S4H4 2, 593, 594
N4S4HoNi 2, 594
N4S4-SbCl5 2, 592
N(S03b3~ 2, 468
N,SO5-. 555
N3S3O4- 2. 591
N4Se4 2. 593
N(SiH,j3 2, 549
N(SiH3)oCH32, 549
NfSiH^oH 2. 549
N2(SiH3L 2, 559
N2(SiMe,J 2. 563
Na 3, 454
NaAlH4 2, 18
Na3AlH6 2, 18
NaAlnOp 2. 318
NaBH4 3, 215
NaBeH, 2, 18
Na2BeH4 2. 18
NaBiO3 2, 294
NaBiS, 2, 527
NaBr 2. 128
NaBr-2H2O 2. 417
NaCeF4 3, 424
NaCl 1, 285; 2, 128
NaCl-5'/7NH32 557
NaCrS, 2, 525
NaErOo 2, 292
NaF 2, 128
NaFeOo 2 292
NaH 2f 8
Nal 2, 128
NaInO2 2, 292
NaLaF4 2, 142; 3, 424
Na3Li3Al,Fi, 2, 160
Na2MgAlF7 2, 682
NaXdF4 2, 142
Na,0 2, 239
NaOH I, 325; 2, 358
NaNbO3 2, 301, 305
NaP 2, 606
Na3P 2, 606
Na3Pn 2, 606
NaPb 3, 473
NanPb8 3, 485
Na*Pt3O4 2, 259
Na2S 2, 496
NaSH 2, 354
NaSbO3 2, 294, 679
Na2Sc 2, 494
NaSi 3, 95
NaTaO» 2, 305
Na2Te 2, 494
Na2ThF6 3, 424
NaTh2F93, 416
NaTl 3, 472
Na2UF6 3, 421, 422
Na3UF7 3, 421
Na4UO5 2, 328
NaxWO3 2, 334
NaY3Fio 2, 100; 3, 473
NaZni3 3, 475
Nb 3, 447
№(диарсинJС14 3, 341
NbB 3, 174
NbB2 3, 174
Nb3B4 3, 174
NbBr5 2, 129, 654
NbC 3. 52
Nb2C 3, 52
NbfCsH-.hCb 3, 79
Nb,(C5H5LCl2O 3, 81
NbCl4 2, 104
NbCI5 2, 129, 654
NbsCls 2. 115
Nb4Cl,r 2, 117
Nb6Cl14 2, 116
Nb6Cl182-2, 116
Nb6Cl,84- 2. 116
NbCI5-POCl3 2, 615
NbC!3(NCCHo,),O 2, 207
NbF3 2, 97
NbF4 2. 105
NbF-, 1, 243; 2, 109. 129
Nb6F,5 2, 116
(NbF7)K2 2, 166
(NbF6) (SeF3) 2. 485
(Nb2F,;)(SeF3) 2, 485
530 Формульный указатель
Формульный указатель 531
XbFvSeOF2 2, 487
NbH 2, 12, 17
NbHo 2, 12
Nbl4 2, 104
Nbl5 2, 109
Nbfjln 2, 116
NbelnH 2, 20, 116
NbN 2. 600; 3, 496, 497
Nb2N 3, 497
Nb(NO3KO 2, 581
NbO 1, 111, 289; 2, 244
NbO2 2, 248
Nb2O5 2, 255, 333
Nb6O174- 2, 217
Nb6O198- 2, 216
Nb,o0286- 2, 216
Xb12O29 2, 333
Nb22O54 2, 334
Nb25O62 2, 334
NbOsSr* 2, 335
Nb2O6(Fe,Mn) 1, 214
Nb2O6Pb 2, 339
Xb,O-Cd2 2, 682
Nbs03oBa6Ti2 2, 339
Nb1003oK6Li4 2, 338
NbOBr2 2, 172, 180
NbOBr3 2, 172, 180
NbOCU 2, 172, 180
XbOCl3 1, 266, 267; 2, 172, 181
(NbOCl3)Cs2 2, 174
NbO2F 2, 176
Nb3O7F 2, 332, 347
Nb17O4,F 2, 177
Nb31O77F 2, 177
(NbOF5)Li2 2, 149
(NbOF5)K2-H2O 2, 166
(NbOF6)K3 2, 166
(NbOF7)HK32, 166
NbO2FK 2, 176
NbO2FNa 2, 176
NbO,F2Na 2, 176
(NbO3F)K2 2, 175, 176
Nb2O5FK 2, 176
Nb2O6FCaNa 2, 680
Nb6OFlFLi 2, 339
Nb(A5FNa 2, 339
NbOI2 2, 180
[Nb(O2L]KMg-7H2O 2, 205
[Nb(O,K(C,2H8N2)|K-3H,O 2, 205
[Nb(O2J(C2O4Jl(NH4):rH2O 2, 205
NbPO5 2, 345
NbS 2, 501
NbS2 2, 506, 507, 522
Nb3S4 1, 278; 2, 522
Nb2lS82, 522
NbS2CI2 2, 170
NbSbO, 2, 675
Nb2Se32, 516
NbSU 3, 96
NbsW9O47 2, 339
Nd 3, 447
NdB6 3, 147
NdBr3 2, 101
Nd(BrO3K-9H,O 2, 408
Nd4CO3 3, 54
NdCl2 2, 94
NdCl2, 2, 94
NdCl2 3 2, 94
NdCl3 2, 101
NdF3 2, 101
NdF4Na 2, 142; 3, 424
NdH3 2, 12
Ndl195 2, 94
Ndl3 2, 101
NdN 3, 497
Nd2O3 2, 251
Nd(OHK 2, 356
NdS 2, 496
Nd2S3 2, 517
NdSBr 2, 170
Ne 3, 440
Ni 3, 460
NiAl2O4 2, 312
NiAs 1, 206; 2, 500; 3, 490
NiAs2 2, 510
NiAsS 2, 509
ЩдиарсинJХ2 3, 391
NiB,5 3, 174
Ni2B" 3, 174
Ni3B 3, 175
N14B3 3, 174
NiBr2 2, 91
NiBr,[C4H,N2(CH3Jl 3, 380
NiBr,(PElPb2J 3, 377
XiBr,(PPh3J 3, 382
NiBr2(PPh2BzJ 3, 377, 378
NiBr2(TAS) 3, 297
NiBr3(PEt3J 3, 381
[Х1Вгз(хинолин)]- 3, 382
Ni3Br8fPPhMe2V3, 387
Ni(C5H5J 3, 77
Ni(C5H5)NO 3, 70, 78
Nb(C5H-,),(PPh,J 3, 81
Ni,(C5HgKNC4H9 3, 383
Nif(CH3LN2(CH3Jl2(ONOJ 2, 578
Ni6(C5F3H4O2I0(OHJ(H2OJ 1, 245; 3,
385
[ЩасаеЫз 1, 243; 3, 385
Ni(acacJ(pyJ 3, 386
Ni(edta)H2(H2O) 3, 351
Г№(епЫ(КО3J 3, 386
Ni(C5H5NL(CIO4J 3, 376, 373
NiC8H14N4O4 2, 28
NiCoH.sNUOi 3, 380
Ni(C,3H15i\,), 3, 381
NiQv>H,eNs 3, 379
fNi(CNLf- 3, 379
[\4(CNL1K4 3, 41
[Ni(CNMj3- 3, 377, 378
[Ni,(C\'NlK4 3, 41
Ni(CN)o-NH3-C6H6 1, 43, 147; 3. 379
Ni(CNb-XH33. 379
Ni(CN)o(PPhMc2K 3, 384
Ki(CO). 3, 59, 61
Ni(CON-- 3, 64
Ni,(CON(PPh2J 3, 61
Ni4(CON[P(C,H4CKKl4 3, 65, 383
Ni8(CO)8(PPhN 3, 383
NiMCObH3" 3, 69
NiCl, 2, 91, 126, 127
NiCU-2HoO 2, 417
(NiCl3)Cs 1, 221; 2, 139, 140
(NiCl3)K 2, 139
(NiCl4J- 2, 141, 160; 3, 376, 382
ГГ\ЧС1,(диарс11нJ"|С1 3, 386, 387
Г№С12(диарсинJ]2+ З, 288
NiCI2(PPh3b 3, 381
NiCl2 (пиразолL 3, 386
NiCl3(H,O)(N(C2H4KNCH3] 3, 376
NiCrO, 3. 387
NiF2 2, 91
(XiF3)M2, 139, 298
(XiF4)!v 1, 252; 2, 323
(NiF6)Ba, 2, 145
(NiF6)Ko 2, 150; 3, 387
(NiF6)K3 3. 387
NiHos 2. 17
FNi(H,O),,lCd2CI6-6H2O 2, 422
rNi(H,ONl(SnCl6) 1, 295
Nil, 2, 91
r\ii3(PPh,)l- 3, 382
Ni2Mg 3, 478
NiMnOs 2, 294
NiMtioO, 2, 313
Ni(NCSJ(enJ 3, 34, ?85
Ni(NCS),(NH3K 3, 33
Ki(NCSJ(tren) 3, 386
NiXO(OH) 3, 58
NiO 2, 244
NiO2K, 2, 213
NiO3Ba 2, 388
NiOsLn 2, 387
Ni(OHJ 2, 358
Ni2(OHKCl 2, 186
NTiO,,FAl4Y, 2, 176
NiP, 2, 606
NiP3 1, 319
Ni(PF3L 3, 403
Ni(P3N3CH3(CeH5LSJ2, 644
XiS 2, 500
NiS, 2, 505, 509
[Ni(SCoII5)^6 3, 380
[Ni(S2C2O,h!,2- 3, 380
Ni3(SC,H4NH2L 3, 379
Ni(S2N,Hb 2, 594
Ni(S,PR,b 3, 380
NiSOV'H.O 2, 408
fNi(S,O3)(tuLl-H2O 2, 468
NiSb 3, 490
NiSb2 2, 510
NiSb2O6 2, 681
NiSbS 2, 509
NiSe 3, 490
NiSn 3. 490
Xi3Sn 3, 470
NiSnCl6-6H2O 1, 295
NiTa2O6 2, 681
XiTe 3, 490
Ni3Ti 3, 470
NiTiO3 2, 294
NiU2O6 2, 324
Ni-V 3, 478
NiVO3 2, 294
NiWO4 2, 309
NiZrH3 2, 18
Np 3, 452, 453
XpBr3 2, 101
NpC2 3, 413
NpCl3 2, 101; 3, 413
NpCl4 2, 107; 3, 413
XpF32, 101; 3, 413
NpF4 2, 107; 3, 413
NpF6 2, 129
(NpF8)(NH4L2, 155
XpH2 2, 12
NpH3 2, 12
Xpl3 2, 101
XpN 3, 413
NpO 2, 243; 3, 413
NpO2 2, 247; 3. 413
NpOC!2 3, 414
NpO2F, 3. 414
XpOS 2, 542; 3, 413
Np2S3 3, 413
NpSi2 3, 413
02 2, 196; 3, 440
O2+ 2, 196
O2- 2, 196
О,2" 2 196
O2Ca-8H,O 2, 198, 408
03 2, 197
O,(CF3), 2, 201
(O3)K 2, 197
(O.,)[N(CH,L12. 197
(O3)Cs, 2, 198
(O3)Rb2 2, 198
OC,H4 2, 199
532 Формульный указатель
Формульный указатель 533
О(СН3J 2, 199
(OCN)- 3, 31
@CN)Ag3, 32
OCNH 3, 31
OCN[Si(CH3bl3, 31
0С12 2, 76, 199
0F2 2, 76, 199
0,F 2, 201
O2F2 2, 200, 201
O2F2 2, 200, 201
O(GeH3J 2, 199
OH2 2, 199, 383
OH3+ 2, 426
O0H0 2, 196, 200
O2H2-Na2C2O4 2, 200
(OH)Cs 2, 353
(OH)K 2, 353. 355, 361
(OH) Li 1, 146; 2, 357
(OH)Li-H2O 2, 419
(OH)Na 2, 357, 361
(OH)Rb 2, 353, 361
(OHJM2, 355
(OHKLa 2, 357
(OHJSr-8H2O 2, 408
(ONC)Ag3, 32
O(SiH3J 2, 199
Os 3, 447
OsAs2 2, 510
OsC 3, 53
Os3(COI2 3, 64
Os5(COI6 3, 66
Os6(COI83, 66
Os3(COI0H23, 69
Os3(CO)uH2 3, 69
Os5(COI5I 3, 66
Os3(CO)I0(NOJ 3, 71
Оз(СО)з(Р(С6Н5)зJ 3, 339
Os3(CO)9SH- 3, 73
Os3(CO)9SH2 3, 73
OsCl4 2, 104
OsCl5 2, 109
(OsCl6)K2 2, 174
(OsCl4N)(As(C6H5L) 3, 338
(OsCl5N)K22, 169; 3, 338
OsF5 2, 109
OsF6 2, 129
OsF7 2, 111
(OsF6)M 2, 148
OsHBr(CO)(P(C6H5KK 2, 20
OsO2 2, 248
OsO4 2, 237, 250
OsOF5 2, 110
(OsO2Cl4)K22, 174
fOsO2(OHL]2- 2, 365
OsP2 2, 510, 606
OsS2 2, 505
OsSb2 2, 510
P (черный) 2, 603
P (моноклинный) 2, 604
P (красный) 2, 605
P (nap) 2, 603
P (белый) 2, 602
P3- 2, 605
Po-!- 2, 606
P73- 2. 608
Р„3- 2, 608
P,62- 2, 610
Р,(ВН3J(СНзL 2, 612—613
PBr, 2, 612, 657
PBr5 2, 617
PBr7 2, 71, 617
P(CF3)F42, 618
(PCF3L 2, 640
PCH 2, 611
P(CH3K2, 612
P(CH3)F42, 618
P(CH3JF32, 618
P(CH3)H22, 612
P(CH3KO 2, 616
Р(С6Н5)з 2, 612
P(C6H5M2, 618
(PC6H5M 2, 640
(РС6Н5N 2, 640
Po(CH3L[Fe(COhl, 2, 613
P2(CH3LS2 2. 613
РС1оСН32, 611
PClnF5-n 2, 619
PC1,F3 2, 619
PCI3 2, 612
PCUF 2, 620
(PCi4) (FeCl4) 2. 617
(РСЦ) (IC12) 2, 71, 617
(PCI4) (PF6) 2, 620
(РСЦ) (TeCIs) 2. 451
(РСЦ) (T12CI9) 2, 157
PCI5 (кристаллич.) 2, 617
РСЬ (пар) 2, 612
PC16I 2, 617
P2C12F2O3 2, 615
PCrO-3- 2, 629
PCr20,o3- 2, 629
РСг3О,з3- 2, 629
PCr4O,63- 2, 629
PF2H 2, 612
PF2HO 2, 616
PF32. 611
PF3-BH3 2, 611, 616
PF5 2, 612
PF6Cs 2, 148
PF6H-6H2O 2, 393
PF6M 2, 148
PF6Na-H2O 2. 618
PH2~ 2, 611
PH3 2, 612
P2H4 2, 612
P3H5 2, 612
P;Hj 2, 610
P,,Hi 2, 610
PH2CH3 2, 612
PHrBH3 2, 611; 3, 187
PH,I 1. 322; 2, 616
PI, 2, 612, 656
P2I4 2, 613
PoI4S2 2, 613
P.jLS3 2, 6Я8
РЛ1о9Оз4Нб3- 2, 228
P2MoO8 2, 349
P2Mo2On 2, 348
P2Mo5O236- 2, 333
P2Mo18O626- 2, 228
PN 2, 603
P3N5 2, 596
(PNBr,K 2, 642
(Р.\ТС1,)„ 2, 642
P,NCI6+ 2, 641
P5NSC1S 2, 643
PN3O2S2C14 2, 645
P2(NEtJS2(C6H5J2, 641
P2N6(CH3N 2, 644
(PNCH3C1J 2, 641
(PN(C6H5Jh2, 642
(PNC12K2, 642
(PNF2K 2, 642
P(NH2KO 2, 616
rPN(SCNJ]3 2, 642
P3(NHKO3(OHK 2, 644
Р.,(№:Нз)зОз(ОСНз)з2, 644
fPN(CH3J]4 2, 642
(PNC12L2, 642
(PNF,L 2, 642
P4NHLO84-2, 645
P4(NCH3NC18 2, 641
r(PNMe,LHlCuC132, 642
r(PNMc,LHl2CoCi42, 643
[PKT(NMe2Jl6 2, 643
|PN(OMeJ|8 2, 643
Pi2N,4S,26- 2, 645
P2O3 2, 620
P2O5 2, 620
P4O6 2, 620
P4O7 2, 622
P4OS 2, 622
P4O9 2, 622
P4O10 2, 621
P4O6-fNi(COK]42, 622
P4O6S4 2, 622
POBr3 2, 612, 614
PO(CH3JOH2, 633
РО(ОС6Н5)з2, 633
ГРО2(ОС2Н5J1- 2, 633
ГРО,(ОСвН6)р- 2, 633
РГОСН(СНзШС14Н8О2) 2, 610
{[РО2(С6Н5) (C4H9)]2Zn}n 2, 634
fPO2(C6H5J-Cr(acacJl, 2, 634
POCI3 2, 612. 614
POCl3-SbC!5 2, 615
(POCl3J-SnCl4 2, 615
fPOCl3-TiCl4h 2, 615
(PO2Cl2J(CH",COOC2H5JMn 2, 616
(PO2C12J (POCl3JMg2, 616
POF3 2, 612
(PO2F2)- 2, 632
PO2H(OCH2C6H5J 2, 39
PO2H(OC6H4C1J2, 39
PO2H,- 2, 624
(PO2NHK3- 2, 641
POS(NH,J- 2, 633
PO2S(NH2J- 2, 633
(PO3)nn- 2, 631; 3, 136
PO3F2- 2, 631
PO3H2~ 2, 624
(PO3NH2)HNa 2, 632
PO4A1 2, 627
PO4CaH-2H2O 2, 419
PO4H3 2, 39, 626
PO4H2K 2, 39, 47, 626
PO4HSn 2, 39
PO4Y 2, 627
(PO4JOPb4 2, 213
(PO4JOZr2 2, 213
(PO4JO2Cu5 2, 213
(PO4JO5Pb8 2, 213
(P2O5HK~ 2, 625
(P2O5H2J- 2, 623
(PcO6)H42, 625
(P2O6)H2(NH4J2, 39, 47, 625.
(P,O6H)Na3-4H2O 2, 626
P,O6CO4~ 2, 628
P2O6NH4~ 2, 628
P,O-4" 2, 628
Р,ОтМа4-10Н,О 2 407
P3O8Na5-14H2O 2, 625
P3O93- 2, 6J0
(P3O9NH2)K4-H,O 2, 629
P3O105- 2, 628
P4Or4- 2, 630
P5OFM- 2, 631
P6O,,6- 2, 625
P6OIS6- 2, 631
PS43- 2, 635
P2S62- 2, 635
P2S64- 2, 635
P2S74" 2, 635
P2S82- 2, 635
P4S3 2, 636
P4S5 2, 637
P4S^ 2, 637
P4S9 2, 637
P4S10 2. 637
P,S2(CH3L 2, 612—613
P2S4(CH3), 2. 638
534 Формульный указатель
Формульный указатель 53Ь
P2S4(C3H7OL 2, 638
P2S6Br, 2. 638
P2S8[(pyJHl2 2, 636
P4S3I9 2, 638
PS(O3C6H9) 2, 622
PS(OCH3)(C6H5J2, 616
fPS2(C3H7JlZn 2, 634
[PS,(C2H5bloZn 2, 634
PSCI3 2, 612
PSF3 2, 612
P4Se3I2 2, 638
P(SiH3K2, 612
PWO6Na 2, 348
P2W2OU 2, 348
(PW12O40K- 2, 225
(P2WI8O62) 6- 2, 229
Pa 3, 453
PaBr4 2, 107
PaBr5(=Pa2Br,o) 2, 109
РаСЦ 2, 107
РаС15 2, 109; 3, 414
PaF5 3, 414
(PaF6)K 3, 425
(PaF6)Rb 2, 145; 3, 414, 425
(PaF7)K2 2, 154; 3, 414, 425
(PaFs)(NH4L 2, 355; 3, 414
(PaF8)Na3 3, 414, 425
Pa6F31Na7 2, 166
PaH3 2, 12
PaO 2, 243; 3, 413
PaO, 2. 247; 3, 413
Pa2O5 3, 413
PaOBr, 3, 419
PaOCl2 3, 414
PaOS 2, 542
Pb 3, 443
PbBr2 2, 128; 3, 335
Pb2Br5NH4 3, 335
Pb(CH3L3, 10
Pb2(CH3N 3. 10
Pb(C5H3J 3, 77, 79
Pb(CH3COOL 3, 335
РЬ(СНзЬ(СН3СОО) 3, 323
Pb(CH,KOH 3, 323
РЬз(СОзJ(ОНJ 2, 382
PbCl2 1, 326; 2, 93, 128; 3, 335
PbCI4 3, 10
(PbCl6)Rb2 3, 323
Pb2Cl5NH4 3. 335
РЬ4С1,,ГСо(ЫНзN1 3, 335
PbCIF 2, 182
PbCl(OH) 2, 188
PbCu(OHJSO4 3, 336
PbF2 1, 327; 2, 95
PbF4 2, 105
(PbF6)Ba 2, 135, 144
(PbFG)Ca 2, 135, 144
(PbF6)K4 2, 154
(PbFG)Sr 2, 135, 145
(PbFs)K3H 2, 164
PbFe,,O,9 2, 319
PbH019 2, 11
PbHfO3 2, 301
РЫ, 2, 94, 128; 3, 327
PbI3Cs 3, 327
Pb(NH3)N,S2 3, 335
Pb(NO3J 1, 398
PbO 1, 322; 2, 267
PbO2 2, 247, 267, 269
Pb2O3 2, 255, 269
Pb3O4 2, 268
Pb,2O,9 2, 267
PbO2Ag2 3, 336
(PbO3)K2 2, 270
(PbO3)K4 2, 213
(PbO4)M2 1, 258; 2. 270
[Pb6O(OHNl4+ 2, 352
PbPt 3, 470
RbReO3 2, 295
PbRuO3 2, 295
PbS 2, 500; 3, 333
PbS2 3, 324
Pb(SCNJ(etuJ 3, 35
Pb[SC(NH2JlCl2 3, 336
Pb[SC(NH2J](C,H302b 3, 336
PbSO4 3, 333
PbSb2O6 2, 681
Pb2Sb207 2, 682
PbSe 2, 500
PbSnS3 3, 326
PbTcO3 2, 295
PbTe 2, 500
PbTiO3 2, 301
PbWO4 3, 333
PbZrO3 2, 302
Pd 3, 447
[PdAlCl4(C6H6)l2 3, 390
[PdAl2Cl7(C6H6)]23, 390
PdAs2 2, 509; 3, 490
Pd,(AsMe3JBr4 3, 390
[Рс1(диарсинJС11С1 3, 391
Pd5B2 3, 53
PdBr2 2, 91, 92
PdBr2L3 3, 397
Pd2Br4(SMe2J 3, 395
rPd(CH3COOJl3 3, Г89
Pd(CH3CS2J 3, 390
Pd2(C2H4JCl43, 405
Pd(cn)Cl2 3. 389
rPd(enJl[Pd(en)(S,O3Jl 3, 389
Pd2(C6H8),C!4 3, 405
fPd(CNLl2~ 3, ?89
Pd2(C2O4)Cl2[P(C4H9Kl2 3, 390
PdCl, 2, 91. 92, 116, 253
(PdCI.,)-'- 2, 142; 3, 389
PdCl(TPAS)+ 3, 397
PdCoO2 1, 324; 2, 292
PdCrOo 1, 324; 2, 292
PdF2 2, 91
PCIF4 2, 97
PdF4 2, 105
(PdF6)M2 2. 149, 151
PdHc 2. 12, 17
PdI,(PMc2PhJ 3, 397
Pd2(N3N2- 2, 565
Pd,(NCCH3N2+ 3, 41
Pd(NCSJ(PPh3J 3, 33
Pd(NH3JL 2, 189
rPd(NH3J(SO3JlNa2-6H2O 2, 464
Pd(NH3KSO3 2, 464
rPd(NH-,j3NO2l2[Pd(NH3L](NO3L 3,
389
rPd(NH3L"lCI2-H2O 2, 141; 3, 389
Pd(NO3J 2, 583
PdO 2, 245
PdP2 1, 163; 2, 606
РAРз 2, 606
Pd,P 3, 53
PdPS 2, 512
PdRhO2 I, 324; 2, 292
PdS 2, 510
PdS2 1, 28, 290, 328; 2, 505, 510
Pd,S 2, 510
Pd4S 2, 510
[Pd(SC3H7),l63, ."90
[Pd(SO3JlK2-H2O 2, 464
rPd(SO3L!Na6-2H2O 2, 464
rPd(S2O3J(en)}rPd(cn),l 2, 468; 3, 389
PdSb 3, 490
PdSb, 2, 509; 3, 490
PdSe, 2, 510
PdSn 3, 490
PdTe 3, 490
Pn-bSs 2, 517
Po 3, 442
PoO2 2, 247
Pr 3, 450
PrB4 3, 174
PrB6 3, 174
PrBl2 3, 174
PrB3 2, 101
Pr2C3 3, 50
PrCl3 2, 101
PrF3 2, 101
PrF4 2, 107
PrH3 2, 12
Prl2 3, 409
Prl3 2, 101
Pr7I,, 2, 123
PrN 3, 497
PrO, 2, 250
Pr.,63 2, 25!
Pr6O,, 2, 250
Pr7O,2 2, ;:29
Pr(OHK2. 356
Pr(OHJNO., 2, 381
PrP 2, 601
PrS 2, 496
Pr,S3 2, 517
PrSX 2, 170
Pt 3, 447
PtAs2 2, 509; 3, 490
Pt0uiapcHHJCl2 3, 391, 399
РЦдиарсинJ12 3, 391
PtBr2 2, 92
PtBr3 2, 103
Pt2Br62- 2, 156; 3, 396
PtBr2(CNL2- 3, 399
PtBrH(PR3J 2, 20; 3, 392
PtBr3(NH3J 3, 396
Pt2Br4L2 3, 394, 395
Pt2Br6[N(C2H5Ll23, 394
ГРЦСН3)з(асасI2(епK, 401
Pt(CH3K(C7H5O2) 3, 401
[Pt(CH3COOJ"|4 3, 393
Pt4(CH3COON (NOJ 3, 393
Pt,(CH3CS2L3, 393
Pt(C2H4JCl2 3, 404
(PtC2H4CI3)K 3, 405
Pt(C2H4)Cl2NH(CH3J 3, 405
ГРЦС3Н6С13IК 3, 404
Pt2(C3H6JCl4 3, 404
Pi(C6H,0)Cl23, 404, 405
Pt(C8Hs)I, 3, 405
Pt(CioH,e)Cl2 3, 404
Pt(C2H5NH,LCl3-2H2O 3, 396
[Pt(acacJCl]K 3, 391
Р(:(глпоксимJ 3, 392
Pt (глицин) 2 3, 392
rPt(CH3KCll4 3, 400
rPt(CoH5KCll43, 400
rPt(CH3KOHl4 3, 400
Pt(CNL2- 3, 389, 396
Pt(CNLKi75-l,5H2O 3. 396
Pt(CNLK2Br03-3H2O 3. 396
Pt(COJCl2 3, 57
Pt,(COJCl4 3, 57
Pt4COJCl42~ 3, 41
Pt (CO) (P(QH5) з)зЗ, 339
rPt(CO)CI(PEt3JlBF43, 392
Pt4(COM(PMe2PhL3, 66
Pt,5(COK02- 3,67
Pt,9(COJ24- 3, 67
PICb 2. 92, 116
PtCU 2, 104
536 Формульный указатель
Формульный указатель 537
(PtCl4)K2 2, 142
(PtCl4)[Cu(NH3L13, 396
(PtCl4)[Pt(NH3Ll 3, 395
(PtC!4)[Pt(NH2C2H5L] 3, 395
(PtCl6)Ko 2, 149
PtCiH(PR3J2, 20
PtCl2(NH3J2, 190; 3, 395
PtCl2(PF3J3, 403
PtCl2(PMc3), 3, 392
rPtCl,{(SO3JH}lK3 2, 29, 464
(PtCl3F3)K2 2, 150
fPtCl3(NH3)lK-H2O 3, 392
Pt2Cl2(PPr3J(SCNJ (Pr = C3H7) 3, 35,
395
Pt2CMPPr3J(SEtJ 3, 394
Pt,Cl4L, (L=AsMe3) 3, 392
PtCoO2 2, 292
PtF3 2, 97
PtF4 2, 105
PtF 2, 109
(PtF6)K22, 149, 151
Ptl4 2, 104
PtI(QAS)+ 3, 397
TPt(NH3L]CuCl43. 396
[Pt(NH3J(C2N2H6JlCl2-H2O 3, 391
РЮ 2, 246
PtO2 2, 247
Pt3O4Nax 2, 259
(PtO6)Sr4 2, 136
Pt(O2)(P(C6H5Kh2, 203
TPt(OHNIK2 2, 365
PtP2 2, 509, 606; 3, 490
TPt(P(C6H5K)(SO2)l32, 456
Pt(PF3L3, 388
PtPb 3, 490
PtS 1, 32, 163, 199; 2, 504
PtS2 2, 505
[Pt(S5Ki(NH4J-2H2O 2, 476
[Pt(SCNL-p- 3, ?4
Pt(S2N2HJ2, 594; 3, 392
PtSb 3. 490
PtSb2 2, 509; 3, 490
PtSn 3, 490
rPt(SnCl3M]((C6HsKPCH3K 2, 120; 3,
398
Pt3(SnCl3J(CsH12K 2, 120
PtTe 3, 490
Pu 3, 453
PuBr3 2, 101
PuC 3, 413
Pu2C3 3, 49
PuCl3 2, 101
(PuCl6)Cs2 2, 150
PuF3 2, 101; 3, 413
PuF4 2, 107; 3, 413
PuF6 2, 129
PuF7Rb2 2, 154
PuF8(NH4L2, 155
PuH2 2, 12
PuH3 2, 12
Pul3 2, 101
PuN 3, 413
PuO 2, 243; 3, 413
PuO2 2, 247, 250; 3, 413
Pu2O33, 413, 436
PuOCl 3, 413
PuOF 2, 176
Pu2O2S 2, 542; 3, 436
PuS 2, 496; 3, 413
Pu2S3 2, 518; 3, 413
PuSi2 3, 99
Rb 3, 447
RbBr 2, 128
RbCaF3 1, 223, 225
RbCl 2, 128
RbF 2, 128
RbH 2, 8
Rbl 2, 128
RbLiF2 2, 138
RbOj 2, 198
Rb2O 2, 239
Rb6O 2, 240
Rb9O2 2, 240
RbOH 2, 354, 356
RbP7 2, 606
Rb4P6 2, 606
Rb2S 2, 496
RbSH 2, 355, 361
RbSi 3, 95
RbTaO3 2, 301
Rb,WO3 2, 337
RbZnI3 3, 475
Re 3, 447
Re7B3 3, 53
Re3Br9 3, 129
[ReBr4O(H2O)lN(C,H5L 2, 174
(Re3Bru)Cs2 2, 113
(Re4Br15)(QnHJ2, 113
[Re2(CN)803l4- 2, 209
Re2(COI03, 63
|"Re4(CO)I6l2-3, 65
[Re3(COI2H2"|- 3, 65
[Re4(COI2H6l- 3, 65
Re2(CO)8X2 3, 70
ReCl4 2, 104, 113
ReCl5 2, 109
(Re2Cl8J- 2, 112, 113
(Re2Cl9)- 2, 113
Re2Cl10O3- 2, 210
Re2Cli0O4- 2, 210
ReCl3(NCH3) (PPh2EtJ 3, 338
Re2Cl6(PEt3J 2, 113
Re3Cl9(P(C6H5)Et2K 2, 113
(Re3Clil)(As(CGH5L)a 2. 113
(Re3Cl,2)Cs3 2, 113
ReC!,N(P(C6H5KJ 3, 338
ReF5 2, 109
ReF7 2, 111
(ReF6)M2 2, 151
(ReH9)=- 2, 20
Rc3I9 2, 113
Re(NO3)O3 2, 581
ReO2 2, 248
ReO3 1, 252, 316
ReO4- 2, 258
ReO53- 2, 213
ReO4Tl 2, 212
Re2O5 2, 255
Re,O7 2, 257, 258
Re2O7(H2OJ 2, 209, 258
ReOBr3 2, 180
RcO3Cl 2, 179
ReOCLr 2, 175
ReO3F 2, 179
ReOF4 2, 109, 180
Re6O19La4 1, 269
Re2P 1, 326
ReS2 2, 505
Re(S2C2(C6H5JK3, 339
ReSe2 2, 505
ReSi 3, 461
ReSi2 3, 96
Rh 3, 447
RhAs3 1, 319
Rh2B 3, 174
Rh(CH3COOJ-H2O 3, 263
Rh4(COI2 3, 65
Rh6(COI6 3, 66
Rh13(COJ4H5-nn-3, 67
Rh14(COJ54- 3, 67
Rh]5(COJ73- 3, 67
Rh6(COI5C2- 3, 66
Rli3(COK(C5H5K3, 64
[Rh(COJCl"|23, 70
Rh(CO)H(PPh3K2, 20; 3,339
RhF3 2, 97
RhF4 2, 103, 105
RhF5 2, 109
(RhF6)Na22, 149
Rh17Ge22 2, 532
rRh(NO2N]M32, 153
RhNbO4 2, 309
RhO2 2, 247
Rh2O3 2, 251
RhO6Sr4 2, 136
Rh(O2)FAs(CH3J(C6Hs)]4 2, 204
Rh(O2)[P(CH3J(C6H5)l42,204
RhP3 1,319; 2,606
Rh,P 2, 606
RhS2 2, 505
35-1284
Rh2S3 2, 512
Rh17S152, 514
[Rh(SCNNf- 3, 34
RhSb3 1, 319
RhSbO4 2, 309, 681
Rh2Si 1, 326
RhTaO4 2, 309
RhVO4 2, 309
Ru 3, 447
RuAs2 2, 510
RunB8 3, 174
RuC 3, 53
Ru(C5H6J 3, 77
fRu(CNN]FeK 3, 44
Ru3(CO)I2 3, 64
Ru2(CONBr43, 70
Ru4(CO)I2H4 3, 68
Ru6(COI8H2 3, 69
Ru3(CO)I0(NOJ3, 71
RuCl3 2, 98
(RuCl4N)(As(C6H5L) 3, 338
Ru2Cl4(P(C6H5)(C2H5JM 2, 158
Ru2Cl5[P(C4H9Kl42) 158
rRu2Cl8N(H2OJ]K32, 175
(Ru2Cl10O)K4-H2O2, 175, 209
RuF3 2, 97
RuF5 2, 109
(RuF6)M 2, 149
[RuN2(enJN3]+ 2, 546
rRuN2(NH3M]2+ 2, 545; 3, 360
rRu2N2(NH3),o]4+ 2,545
rRu(NH3LSO2CllCl 2, 456
rRu3(NH3),o(enJ02l6+ 2, 209
rRu3(NH3I402l6+ 2, 211
Ru(NOJ(P(C6H5KJ 2, 573
RuO2 2, 248
RuO4 2, 237, 250
(RuO4)K 2,310
Ru4O9Na3_x 2, 336
RuO3(OHJ2~ 2, 365
RuP2 2, 510, 606
RuP4 2, 606
Ru2P 2, 606
RuS2 2, 505
RuSb2 2, 510
S 1, 340; 2, 437
S2 2, 437
S6—S20 1, 340; 2, 438
S,2- 2, 476
S32" 2, 476
S42- 2, 476
S42+ 2, 443
S52- 2, 476
S5+ 2. 443
S62- 2. 476
S62+ 2, 445
538 Формульный указатель
S82+ 2, 443, 444
S192+ 2, 444
S2Br2 2, 472
S(CF3J 2,439; 3,24
S2(CH3J2, 472
S3(CF3J 2, 472; 3, 24
SC2H4 2, 445
SC4H4 2, 445
S(CH3J2, 439
rS(CH3K]I 2, 463
rS(CH3JC6H5]C1042, 463
[S(CH3KO]+ 2,467
S(CH3JO 2, 462
S(C6H5JO 2, 462
rS(C4H9KlF-20H2O2, 393
rS(C4H9KlF-23H2O 2, 393
S[C(NH2J1O22, 462
S(CH3)O-OH 2, 462
S(CH2OH)O2- 2, 462, 463
S2(CH3J2, 472
S2(C6H5J 2, 472
S,(C6H5CH2J 2, 472
S2C4H8 A,4-Дитиан) 2, 445
S2C4H8-2I, 2, 486
S3(CH3J2, 472
S3C3H6 A,3,5-тритиан) 2, 445
S3(C2H4IJ 2, 475
S6CH, 2, 445
S6(CHL 2, 445
SCN- 3, 33
S(CNJ 2, 439; 3, 26
(SCN)Ag 3, 35, 233
SCN-CH3 3, 33
SCNH 3, 24, 32
SCN-SiH3 3, 33
SCN-Si(CH3K3, 33
SCI, 2, 439
SC14 2, 446
S2C12 2, 472
S,,C14 2, 446
SF2 2, 446
SF4 2, 449
SF6 2, 452
S2F2 2, 448, 472
S,F,0 2, 452
SF5Br 2, 452
SF5C1 2, 452
SF6O 2, 453
S2F2O5 2, 453
S2F2O6 2, 453
S2FioO 2, 453
S2FI0O2 2, 453
S3F2O8 2, 453
S(GeH3J 2, 439
SH- 2, 354
SH2 2, 439
S2H2 2, 472
SH(CH3) 3,24
S2I, 2. 446
S2I42- 2, 446
S7I+ 2, 446
S,,(NH)ra (n=4 + 7,m = 4+l) 2,593
SO 2, 454
502 2, 455
503 2, 458
S2O 2, 455
S2O2 2, 455
S6O 2, 454
S7O 2, 454
S8O 2, 454
SOBr2 2, 462
SO(CH3J 2, 462
SO(C6H5J 2, 462
SOC12 2, 462
SOF2 2, 448, 453, 467
SOF4 2, 449, 453
SOF6 2, 449, 453
(SO2CH2OH)- 2, 463
SO2C12 2, 467
(SO2F)- 2, 463
SO2F2 2, 467
SO2(NH2J 2, 466
SO2(OHJ 2, 466
SO32- 2, 461, 464
SO3F- 2, 466
SO3F2 2, 453
SO3Fe-2,5H2O 1, 141; 2, 410
SO3H- 2, 463
(SO3NH2)- 2, 465, 466
SO3NH3 2, 39, 465
(SO3NHOH)- 2, 554
(SO3N2O2)- 2, 555
(SO3OC2H5)- 2, 466
(SO3OH)- 2, 466
SO3-ONH3 2, 467
SO42~ 2, 465, 466
SO4H- 2, 465, 466
(SO4)[Be(H2OL12, 408
(SO4)Ca-2H2O 2, 418
(SO4)Cd-8/3H2O 2, 416
(SO4)Cu 3, 265
(SO4)Cu-3H2O 2, 415
(SO4)Cu-5H2O 2, 412, 432
(SO4)H2 2, 39, 44, 466
(SO4)H2-H2O 2, 430, 431
(SO4)H2-2H2O 2, 431
(SO4)H2-4H2O 2, 431
SO4K2 2, 212
SO4KH 2, 41
SO4LirH2O 2, 419
SO4Mg-nH2O 2, 413, 425
SO4Na2-10H2O 2, 29, 410, 432
SO4Ni-6H2O 2, 426
SO4Ni-7H2O 2, 408
(SO4C2H5)K 2,465
S2O2CH3- 2, 468
Формульный указатель 539
SoO3=- 2. 468
(S»O4) = - 2, 470
(SoOs)-- 2. 471
S-65F0 2, 453
(SoOe)"-- 2, 478
(S2O6NHJ- 2, 469
(S.-.O:J- 2, 470
(S-.O7H)- 2, 469
(S,O8J- 2, 203
(S3O6J- 2, 478
(S:iO10J- 2, 470
(S4O6J" 2, 478
S4O4(CH3J2, 479
S,O62- 2, 479
(SshPt5" 2, 476
S5O162- 2, 469
S6O62- 2, 479—480
S(SiH3J 2, 439
S7TeCl2 2, 447
Sb 2, 646
SbBiO4 2, 674
SbBr3 2, 651
(SbBr6L(C5H5NHN 2, 656
(SbBr6J(NH4L2, 656
(Sb2Br9)Br2(C5H6NHM 2, 157, 661
Sb(CF3K 2, 651
Sb(CH3KCl22, 653
(SbC4H4O7)K-0,5H2O 2, 652
Sb(C6H5K(OCH3J2, 653
Sb(C6H5LOH2, 653
Sb(C6H5LOCH32, 653
Sb(C6H5M 2, 653
SbCl3 2, 651, 657
(SbCl4) (C5H5NH) 2, 659
SbCl5 2, 653
SbCl6- 2, 655
(SbCl5) (NH4J 2, 660
SbCl5-OCH-N(CH3 2 2, 653
SbCl5-P(CH3KO 2,615
SbCl5-POCl3 2, 615, 653
SbCl5-S4N4 2, 591, 655
SbF3 2, 650
SbF4- 2, 658
SbF5 1, 243; 2, 125, 652
SbF52- 2, 657
SbF6- 2, 147, 654
(Sb2F4)(SbF6J 2, 659
Sb2F7- 2, 658
Sb2Fu- 2, 68
Sb3F10- 2, 659
Sb3F16- 2, 67
Sb4F,3- 2, 658
SbF4(OHJ- 2, 679
SbF5-SO2 2, 653
Sb2F10O2- 2, 654
Sb3F12O33- 2, 654
SbH3 2, 651
Sbl3 2, 651, 656
(SbI4)n"- 2, 661
SbNbO4 2, 674
Sb2O3 2, 620, 662
Sb2O4 2, 674
Sb2O5 2, 677
Sb4O5Br2 2, 670
SbOC! 2, 670
Sb4O5Cl2 2, 670
SbOF 2, 670
SbO3Ag 2, 680
SbO3K 1, 269; 2, 295
SbO3Li 2, 679
SbO3Na 2, 294, 679
SbO4M 2, 681
Sb2O4M 2, 269, 667
Sb2O6M2, 681
Sb2O7M, 2, 682
Sb4OnK2 2, 680
Sb5Oi4K3 2, 680
Sb5O7I 2, 671
Sb(OHN- 2, 678
Sb2O5(OHJNa2 2, 680
Sb2O6(OH)CaNa 2, 680
Sb2O7FbNa2-5H2O 2, 678
Sb3O6OH 2, 325, 680
Sb8O,0(OHJCl2 2, 670
Sb2S3 2, 683
Sb2S5 2, 683
(SbS4)Na3-9H2O 2, 525
SbSBr 2, 171
Sb2(SO4K 2, 665
Sb2(SO4JO 2, 665
Sb6(SO4JO7 2, 665
Sb2Se3 2, 513, 684
SbSeBr 2, 171
SbTaO4 2, 675
SbTl 3, 492
Sc 3, 443
ScB2C2 3, 180
ScBiO3 2, 295
Sc2C 3, 52
ScCl 2, 123
ScCl3 2, 100
Sc5Cl8 2, 121 — 123
Sc7CI,02, 121 — 123
ScF3 2, 97, 100
ScH2 2, 12
ScLiO2 2, 292
ScN 2, 600; 3, 497
Sc2O3 2, 251
ScOF 2, 178
ScO(OH) 2, 367, 370
Sc(OHK 1, 254; 2, 362
Sc2Pt207 2, 325
Sc2S3 2, 513, 515
ScTe 2, 515
35 *
СО
со
1 *
<N со -""TotS"
"""СМ СОЮ ^ *?; г*ч г^ _ °"* со"
«S § • „ -2 2 „ 2 «g S^-—»
со —. ._; СО^Г-, СО _ ___ - .i. ^ СО „-
> _ О со ."оооо ,^ __ CN _со^,оо?нет2.'~'|^сосо j.«>
>__, ^Z._^m со" ?.Sg "._-" „соО ,этсо-0 .«2 - 5ют™,
;--:":"^ii§§si§§gif^:«-^d?5i°5B:-i3^<:t
о од о'РРд о о о о о о о 66 д*д о о о о о о ^>/- ¦- •- ° -™ -"
¦"?'« Й СЛ Й еЛ Й Й Й ел Й Й Й Й Й Й Й Й Й Й Й Й Й Й ¦
ел ел ^—*—^-~-^^^. ^ w^^ww_^^^-^^,wwco слслелслелслелсл-
слслелслооелййй \HZL\fL4Lti й^ййййййййййй wwwwK й ей й й й й й ЙЙ??;г Й? 2й й й й"й й Й*й й ?й
¦* сп см сп $. со
. со cnt^^co.
со
ю
СО
00
со'
СП
ю
со*
ю
1 а" о s з да " s ?2
: «1 О сч" —< о) со -<о
_______ 7 с? S S 3 .^.^й — ййййййЙййййй-^.^ййййййслелйслсл — елсл
елелелслслслелелелелелелсл слел ^ел —^^^^^---^__1___--'—¦—ел ел -^^---'^-•— —¦ •— — ^^-—^^сл ^^-—
Z
й й й й ^.ЙЙ й Й й
сОсЛелсЛелелслелеЛеЛ^
___,ОО
> ел ^ си ел си ел ел ^ "
- ^слел-—ел^ -"
542 Формульный указатель
Si9(O, ОН) 2?"- 3, 135
Si,203o(OH, ClJoMie 3, 138
SiP2 3, 91
SiP2O7 2, 627; 3, 91
SiS 3, 89
SiS2 3, 89
SiS44- 3, 90
Si4S,04- 3, 317
Si2SCl6 3, 103
Si2S2(CH3L 3, 104
Si3S3(CH3N 3, 104
5138з(СНз)з(СеН5)зЗ, 104
Si4S4Cl8 3, 103
Si(SiMe3L3, 9
Si2Te86- 3, 88
SiV3 3, 450
(SiW,204oHK- 2, 226
(Si3Zn08)Na22, 152
Sm 3, 450
SmB4 3, 174
SmB6 3, 174
SmBI2 3, 174
SmBr2 2, 94
SmBr3 2, 101
SmCl2 2, 94
SmCl3 2, 101
SmF2 2, 94, 126
SmF,+,r 2. 85
SmF3 2, 101
SmH2 2, 12, 243
SmH3 2, 12
Sml3 2, 101
SmO 2, 243
Sm2O 2, 243
Sm2O3 2, 251
SmOF 2, 176
SmOX 2, 184
Sm(OHK 2, 356
SmP 2, 606
SmS 2, 496, 518
Sm2S3 2, 517
Sm3S4 2, 518
SmSX 2, 170
SmSO4 3, 409
Sn t, 150; 3, 446
SnBr2 2, 128; 3, 332
SnBr4 2, 104; 3, 10
(SnBr6)K2 2, 149
Sn3BrF5 3, 329
Sn(CH3),H2 3, 10
Sn(CH3JF2 1, 251; 3, 323
Sn(CH3J(NCNCNJ3, 323
Sn(CH3J (8-гидроксихинолинат) 3,
323
rSn (CH3) 2Cl3l[Sn (CH3) 2C1 (terpy) ] 3,
322
rSn(CH3)]«S63, 320
3, 323
332
Sn(CH3KCH3COO 3, 322
Sn(CH3KCl 3, 320
Sn(CH3KOH 3,322
Sn(CH3K(NCNCN)
Sn(CH3K-Mn(COM3, 71
Sn3(CH3LFe4(CO)i6 3, 73
Sn(C5H5J 3, 77
Sn(C6H5L 3, 320
FSn(C6H5Jl6 3, 321
Sn(edta)H2O 3, 324
5п(трополонато)Х 3, 335
rSn(HCOOKlK 3, 332
SnCl2 2, 128; 3, 331
SnCl2-2H2O 2, 413; 3, 331
SnCl4 2, 104; 3, 10
(SnCl3)Cs 3, 332
(SnCl3)ClK2-H2O 3,
(SnCl5)- 3, 322
(SnCl6)Rb2 3, 323
(SnCl6)(NO2) 2, 571
(SnCl6)[Ni(H2ONl 1,295
Sn(C2H5)Cl2(OH)(H2O) 3, 324
(SnCl3JPt3(C8H12K 2, 120; 3, 321
ГEпС1зMРП((С6Н5)зРСНз)з2, 120
SnCl4-2C4H8S 3, 323
SnCl4-NC(CHjKCN 3, 323
SnCl4-2POCl3 2, 615; 3, 323
SnCl,-2SeOCl2 3, 323
SnCIF 3, 329
Sn2ClF3 3, 329
(SnCls03P2J 2, 615
SnF2 3, 327
SnF4 2, 104; 3, 323
Sn3F8 3, 329
(SnF3)K-0,5H2O 3, 329
(SnF6)Li22, 149
(SnF8)K3H 2, 164
(Sn2F5)Na 3, 329
(Sn3F3)(AsF6K 3,328
(Sn3F10)Na4 3, 330
rSnF4(OHJlM2 3, 323
rSnF5(OH)]M2 3, 323
Sn[Fc(COLl4 3, 322
SnH4 3, 10
Snl2 2, 128; 3, 332
Snl4 2, 104; 3, 10
(SnI3)Cs 3, 327
(SnI6)M2 2, 149
Sn(NH2NK22, 553
Sn(NO3L 2, 583; 3, 335
SnS44- 3, 326
Sn2S64- 3, 326
Sn2S76- 3, 326
Sn3S84- 3, 326
SnS2Ba 3, 333
SnS3Ba 2, 527
SnSO4 3, 333
SnSe 2, 500
Формульный указатель 543
SnTe 2, 500
SnWO4 3, 333
Sn,oW,6046 3, 334
SnZn2O4 2, 312
Sr 3, 454
SrBr2 2, 94
SrBr2-H2O 2, 420
SrC2 3, 47
SrCl2 2, 94
SrCl2-2H2O2, 418
SrCl2-6H2O 2, 412
SrCIF 2, 184
SrClH 2, 75
SrCl4K2 2, 137
Sr2Cl5K 2, 137
SrCrF4 1, 308
Sr2CuF6 1, 308
SrF2 2, 94, 125
SrFeO3 2, 300
SrH2 2, 8
SrHfO3 2, 301
Srl2 2, 94
Sr2IrH4 2, 18
SrMnO3 2, 298
Sr9N10Re3 2, 596
Sr(NH2J 2, 553
Sr2Nb207 2, 326
SrO 2, 237, 243
Sr(OHJ2, 356
Sr(OHJ-H2O2, 421
Sr(OHJ-8H2O 2, 408
SrP3 2, 606
SrS 2, 496
Sr2Sb207 2, 682
SrSe 2, 494
SrSi2 3, 98
SrSnO3 2, 301
Sr2Ta207 2, 326
SrTe 2, 494
SrTiO3 2, 301
Sr2Ti04 2, 323
Sr2Ti207 2, 136, 323, 326
Sr4Ti3Oio 2, 323
SrTl 3, 472
SrZn5 3, 474
SrZn,3 3, 475
SrZnO2 2, 293
SrZrO3 2, 301
Та 3, 447
TaB 3, 174
TaB2 3, 174
Ta2B 3, 174
Ta3B4 3, 176
TaBr5 2, 129, 654
Ta6Br16 2, 116
ТаС 3, 51, 497
Та2С 3, 52
ТаС14 2, 104
ТаС15 2, 109, 129, 654
Та6С1,5 2, 116
Та6С1,4-7Н2О 2, 116
(Ta6Cli8)H2-6H2O 2, 116
TaCl4F 2, 109
ТаС15-РОС13 2, 615
TaF5 I, 243; 2, 109, 129
(TaF6)M2, 148
(TaF7)K22, 166
(TaF8)Na3 2, 166
Tal4 2, 104
Tal5 2, 109
Ta6Iu 2, 109, 120
TaN 3, 496, 497
Ta2N 3, 497
TaNO 2, 250
TaO 2, 276
TaO2 2, 247, 276
Ta2O5 2, 256
Ta4O 2, 276
TaO2F 2, 176
ТаОзК 2, 301
TaO3Na 2, 305
(TaOF6) (NH4K 2, 164
Ta2O6M2, 681
Ta2O7M2 2, 326, 682
(Ta6O19)K8-16H2O2, 216
Ta2O6FBi 2, 680
Ta2P 2, 498
TaS2 2, 506, 507, 522
Ta2S 2, 522
Ta6S 2, 522
TaS3Ba 2, 527
TaSbO4 2, 675
TaSe2 2, 506
Ta2Se3 2, 517
TaSi2 3, 96
Tb 3, 447
Tb5Br8 2, 123
Tb6Br7 2, 121, 123
Tb2C 3, 47
Tb2C3 3, 50
TbCl 2, 123
TbCl3 2, 101
TbF3 2, 101
TbF4 2, 107
Tbl3 2, 101
Tb7I12 2, 123
TbO2 2, 250
Tb2O3 2, 251
Tb7OI2 2, 250, 329; 3, 409
Tb(OHK2, 356
TbS 2, 496
Tb2S3 2, 517
TbSX 2, 170
гогргогьгогогогогогогоо '"э а
о о о о о § <r r "^-^ a g
H H
ь_^ СП
in —1
CT
СЛ со
4
о
п
-0
о
X
со
СО
СО
р^со
СЛ to
Оо
to "со
to г-"
go
. --^
"ми
to со
О 4».
о ~
со
со
«"со
со
-~ слч
«СЛ
оо
О)
to со
CO"'
cp to
to to
- ~J
tocn
546 Формульный указатель
Ti(S2CNEt2L 3, 341
TiSi 3, 96
TiSi2 3, 96
TiTe3O8 1, 308
TiZn2O4 2, 313
Tl 3, 445, 446
T1BO3 3, 315
TIBr 2, 88, 89, 129
TlBr2 2, 92
ТЦСНзЬЗ, 84
TI(C5H5) 3, 77
T1(CH3JI 3, 314
Tl(CH3J(acac) 3, 314
Tl(CH3J(OAc) 3, 314
T1(CO3)F3, 315
T1C1 2, 88, 89, 129
TICI25 2, 92
TICI3 2, 98
T12C13 3, 313
(Т1С16)Кз-2Н2О 3, 313
(T12C19)CS2 1, 224; 2, 157
T1F 2, 89, 129
TIF3 2, 100
TIFeO3 2, 300
Til 1, 288, 325; 2, 88, 129
T1I33, 313
T12O 3, 315
T12O3 2, 251
(T1OCH3L 3, 315
T1OF 2, 176
T12OF2 2, 176
TIP5 2, 606
T!S 3, 313
T12S 3, 313
TI2S5 3, 313
TI4S3 3, 313
T12SO4 3, 313
Tm 3, 447
Tm 2, 101
TmF3 2, 101
TmH2 2, 12
TmH3 2, 12
Tml3 2, 101
Tm2O3 2, 251
Tm2S3 2, 517
TmSi2 3, 99
U 3, 451, 453, 461
UB2 3, 174
UB4 3, 174
UB6 3, 174
UB,2 3, 179
UBr3 2, 101
UBr4 1, 134; 3, 419
UC 3, 413, 497
UC2 3, 49, 50
U2C3 3, 50
U(C5H3);iCl 3, 78
LCI3 2, 101
UC14 2, 107
UCI5 2, 109
UCle 2, 110
(UC!6)Cs22, 150
UF3 2, 101
UF4 2, 107
UF5 2, 109
UF62, 110, 129
U2F9 3, 416
UF5Li 3, 423
UF6Ba 3, 421
UF6K, 2, 144; 3, 421, 422
UF6Na2 3, 421, 422
UF6Rb2 3, 423
UF7K3 3, 427
UF7Na3 3, 421
UF8(NH4L 2, 155; 3, 423
UF8Li4 3, 423
UFSM2 2, 155; 3, 421
UF8Na3 1, 308; 2, 155
U,F9K 2, 158
U(GeWnO39J12-2, 232
UH3 2, 12, 15
UI32, 101
UI4 2, 104
UM6O12 2, 329
UN 3, 413, 497
UN2 3, 435
U0N3 3, 435
UNC1 2, 169
U(NH)C1 2, 169
U2N2P 3, 435
U2N2S 3. 435
UO 2, 243; 3, 411
UO2 2, 247; 3, 426
UO213 3, 426
UO26 3, 426
UO3 3, 427
U3O8 2, 256; 3, 427
U4O9 3, 427
U04M" 3. 433, 434
иО4М2Т 2, 324; 3, 433
UO5Ca2 3, 434
UO5M4 2, 328
UO6Bi2 3, 434
UO6Ca3 2, 305; 3, 434
U2O7Ba 1, 266; 3, 434
UO2Br 3, 421
UOC12 3, 415
UOS 2, 542
U(OHJSO4 2, 378
UO2CO3 3, 429
fUO2(CH3COOKlNa 3, 429
иО2(СНзСООJ((С6Н5)зРОJ 3, 432
UO2C2O4-3H2O 3, 433
Формульный указатель 547
иО2(С2О4J2- 3, 433
UO2(C2O4K4- 3, 433
(иО2ЫС2О4)з2- 3, 433
(UO2J(C2O4M6- 3, 433
UO2C12 3, 419
UO2C12-H2O 3, 420
(UO2CLO)Cs* 3, 419
(UO2Cl4)Cs, 2, 174; 3, 418
UO2Cl@H)-2H20 3, 418
U2O2C15 3, 420
fU4O10Cl4(OHJ(H2OL]2- 3,418
UO2F2 3, 431
UOF4 2, 180; 3, 417, 418
UO2F53- 2, 174; 3, 418
U2O4F84- 3, 418
U2O4F95~ 3, 418
UO2(NO3J-6H2O 3, 429
[UO2(NO3K]Rb 2, 588; 3, 431
rUO2(O2KlNa-9H2O 2, 205
UO2(OHJ 3, 428
UO2 (OH) 2-H2O 3, 428
U3O8(OHJ 3, 430
[UO2(SO4KlCs2 3, 429
U6O4(OHL(SO4N 2, 376
UOS 2, 542
UP 2, 606
US 2, 496; 3, 413, 437
US2 3, 437
U2S3 3, 413. 437
US3Ba 2, 527
USi 3, 95
USi2 3, 95, 99
U3Si 3, 95
U3Si2 3, 95
UTeO5 3, 434
V 3, 447
VB 3, 174
VB2 3, 174
VBr2 2, 91
VC 3, 52, 497
VoC 3. 52
V4C3 3, 51
V6C5 3, 52
V8C7 3, 52
V(C5H5J3, 77
V(C5H7O2K (C5H7O2—acac) 3, 345
V(CNO4- 3, 346
V(CON 3, 59
VC12 2, 91
VC13 2, 98
VC14 2, 106
(V2Cb)Cs3 2, 157
VCl3(NMe3J 3, 345
VF2 2, 91
VF3 2, 97
VF4 2, 105
VH 2, 12
VH2 2, 12
VI2 2, 91
VI3 2, 98
V2MoO8 2, 332
V2Mo6O266- 2, 234
V3Mo1004o6- 2, 227
V5Mo8O407- 2, 234
V8Mo4O368- 2, 234
VN 3, 497
V2N 3, 497
V(NO3)O2 2, 583
VNCU 2, 169
VO015-0,25 2, 276
VO 2, 277; 3, 497
VO2 2, 248, 276
V2O3 2, 251, 276
V2O5 2,276, 280, 281
V3O5 2, 276
V3O7 2, 278
V4O7 2, 276
V4O9 2, 277
V6O13 1, 272; 2, 277, 333
VO2Li 2, 292
(VO3)K-H2O 2, 280
VO3Sc 2, 294
(VO3JSr-4H2O 2, 280
(VO4)M 2, 279, 308
VsOsNa* 2, 344
(V2O7)Zr 2, 279
(V3O8)K2, 279
V3O8Lii+x 2, 344
V5O14K3 2, 279
V6Oi5M2-x (M=Ag, Na) 2, 344
(V,o028N- 2, 216
VO(acacJ 3, 345
ГУ(Ж/-тартратI4- 3, 344
VOC1 2, 182
VOCl2(NMe3J 3, 345
VOCI3 2, 179
VOF 2, 176
VOF3 2, 105
VOF42- 2, 175
(VO2F3)K22, 175
(VO2F4)K2Na 2. 176
(VO2F4)Na32, 176
VOMoO, 2, 345
rVO(NCSLf- 3, 345
VO(OCH3K 3, 344
VO(OH) 2, 281. 367
VO(OHJ 2, 281
VO2(OH) 2, 281
V3O3(OHM2, 281
V3O4(OHL 2, 261
V4O4(OHN 2, 281
VOPO4 2, 345
VOSO4 2. 345
VOSO4-3H2O2, 425
VOSO4-5H2O 2,425
548 Формульный указатель
Формульный указатель 549
VOSO4-6H2O 2, 426
VP 2, 606
VS 2, 500
V3S 2, 522
V3S4 2, 522
V5S8 2, 520
VS3Ba 2, 527
(VS4)T132, 527
[V(mntK]2- 3, 345
V(S2C2(CeH5hK 3, 339, 346
V(S2CNEt2L 3,341
V(S2CCH3L 3, 342
VSi2 3, 96
V3Si 3, 95
V2W4O194 • 2, 216
W(a) 3, 449
W(P) 2, 284; 3, 449, 493
WB 3, 174
W2B53, 177
WBr22. 116
W6Br,62, 116
WC 1, 185; 3, 53
W.C 3. 51
¦*(CK),'- 3, 41
W(CO)B 3, 61
U4CO;3X2 ;}. 70
rW'OC!;,.!2" 3, CJ
WCi2 2, 116
WC132, 98, 116
WCU 2, 104
WCI5 2, 109
WCle2, 110
(W2C19)K3 2, 157
WF5 2, 109
WFe 2, 129
WI2 2, 116
WN 3, 53, 497
WO2 2, 248
WO3 2, 285
WO3-H2O 2, 222
WO3-2H2O2, 222
WO3M, 2, 335
WO42- 2, 308, 311
\VO4Cs2 2, 212
WO4Mg 2, 308
(WO4KBi2 2, 310
(WO4KEu22, 307
WO54- 2, 175
\VOSM 2, 153
W2O72- 2, 219
W3O 2, 284
W2O9Ba3 1, 225
W3O102- 2, 219
W4O132- 2, 219
W6O,92- 2, 220
WI0O32«- 2, 221
W18O49 2, 286, 339
W20O58 2, 286
\V24O70 2, 286
W25O73 2, 286
W40O118 2, 286
Wi2O40H,6- 2, 223
W,,04oH53- 2, 226
Wi2O4,Ho10- 2, 222
W,6O43Sn,0 2, 220
(W4O16)(\VO4KLi14-4H2O 2, 220
\VOBr3 2, 180
\VOBr4 2, 181
WOCb 2, 180
WOC!4 2. 181
WO2C!2 2. 181
(\VOCi5)Cs2 2, 174
(WO5Cl2)Ca32, 175
\VOF4 2. 109, 180
\VO3-,Fv 2, 176
(\VO,F4)K--H2O 2, 164
WP 2, 606
WS, 2, 506
(WS4)(NH4),2, 527
WSBr4 2, 171
WSCU 2. 171
W(S2C2H2K 3, 3:9
\VSe2 2, 506
WSi2 3, 96
\VTe2 2, 506
Xc 3. 440
Xe-53/4H2O 2. 395
XeF2 2, 48
XeF4 2, 48
XeF6 2, 49
XeF2-XcF4 2, 48, 49
(XeF)(SO3F) 2, 51
XeF2-IF5 2, 48
XeFrRuF5 2, 50
XeF2-2SbF5 2, 50
XeF2-WOF4 2, 50
XeF3+ 2, 51, 53
XeFs+2, 51, 53
XeF82- 2, 51, 53
Xe2F3+ 2, 51
Xe2F,,+ 2, 51
XeO3 2, 51, 54, 55
XeO4 2, 51
(XeO4)CsH2, 54
XeO64- 2, 52, 54
XeO3Cl22- 2, 52
XeOF4 2, 55
XeO2F2 2, 55
XeO3F- 2, 55
Xe(OSeF5J2, 51
Xe(OTeF6L 2, 51
Y 3, 443
YAIO3 2, 327
Y3A15O12 2, 327
YAsO4 2, 627
YB4 3, 174
YBC 3, 174
YB,, 3, 174
YBr 2, 123
Y2Br3 2, 123
YC2 3, 50
Y2C 3, 47
YC1 2, 123
YCI3 2, 98
Y,C!3 2, 123
YC1(OHJ 2, 182
YF3 2, 100
Y^FioNa 2, 100
YH2 2, 12
YH3 2, 12
YI, 2, 100
YN 2, 600
Y2O3 2, 251
Y,O4Be 2, 322
YOF 2, 181
Y7O6F9 2. 177
Y6O12Mo 2, 329
YO-OH 2, 356
V(OHK 2, 356
Y4O,2Zr3 2, 329
YPO4 2, 627
Y2Pl,O7 2, 325
Y2S3 2, 517
YSF 2, 170
YVO, 2, 307
Yb 3, 451
YbB4 3, 174
YbB6 3, 174
YbCl2 2, 94
YbCl-i 2, 101
YbF, 2, 126
YbF3 2, 101
YbH2 2, 8, 12
YbH2552, 13
Ybl, 2, 94
Ybl3 2, 101
YbMnO3 2, 305
Yb(NH3N 2, 557
Yb2O3 2, 251
Yb,OC 3, 409
Yb(OHK 2. 357
YbS 3, 409
Yb2S3 2, 517; 3, 408
YbSF 2, 170
YbSi2 3, 99
Zn 3, 443
ZnAl2O4 2, 312
Zn3As2 2, 598
Zn4B6O13 1, 170
ZnBr2 2, 91, 128
(ZnBr3)K-2Ho() 2, 139
Zn(BrO3J-6H,O 2, 404
Zn(CH3b3, 84
Zn(C5H7O2J 3. 294
Zn(C5H:O2J(H.,O) 3, 293
Zn(CN), 3, 42
[Zn(CNL|K2 3, 39
ZnCO3 2. 380
Zn5(CO;),(OHN 1. 316; 2, 380
ZnCl22, 9"l, 128, 390
ZnCb-l'/aHaO 2, 421; 3, 291
(ZnCl,JHCl-2H2O 1, 143; 2, 432; 3,
291
(ZnCI4)Cs2 2, 141, 160
(ZnCl6)K4 2, 154
(ZnCl4)Na2-3H2O 2, 160
(ZnCl5)Cs3 2, 160
(Zn2Cl5) (H5O2) 1, 144; 2, 432
ZnCl2(NH3J3, 189
ZnCl2(NH3L-H2O 2, 189
ZnCb(terpy) 3, 292
ZnCl(OH) 2, 186
Zn5C!2(OH)8-H2O 1, 316; 2, 188, 380;
3, 292
Zn[Co(COLl2 3, 71
ZnF22, 91, 128
(ZnF4)M2, 140
(ZnF4)M2 2, 140
(ZnF6)Ba2 2, 145
Zr.F(OH) 2. 186
ZnH2 2, 10
ZnI22, 91, 128
ZnMn3O7-3H2O 1, 315; 2. 266; 3, 292
Zn2Mo3O8 2, 328
Zn3N2 2, 598
Zn(NH3LCl2-H2O 2, 189
Zn(NH3)^(N3J 2, 565
Zn(N2H4JX2 (X = C1, СНчСОО. CNS)
2, 560; 3, 295
Zn(NO3)o2, 583
Zn5(N03J(OH)8-2IIo 2, 380
ZnO 2, 243
ZnO,Ba 2, 293
ZnO2K2 3, 291
ZnO2Sr 1, 237; 3 291
Zn(OH), 2. 360
Ггп(ОНL]г- 2. 351
Zn2(OHJSO4 2, 378
Zn4O(Br,Ol2) 1. 170
Zn4O(BO2N 1, 170
Zn4(OCH3L(CH3L2. 195
Zti4O(CH3COOH 1, 120
Zn-,P2 2, 598
ZnS 1, 149, 155
ZnS2 2, 505
(ZnS3)Ba2 2. 527
ZnS4Al, 2, 527 5Q4
550 Формульный указатель
Zn(S,CN(CH3hl2 3, 294, 295
ZnfSaCOCH-,), 3, 294
rZn(SCN)(tren)lSCN 3, 292
ZuSb2O6 1, 214
ZnSe 2, 494
ZnSnAs2 2, 535
ZnTe 2, 494
Zr 3, 449
ZrAs, 1, 326
гг(диарсин),С14 3, 341
ZrB2 3, 174
ZrB,, 3, 179
ZrBr 2, 121
ZrBr3 2, 98
ZrBr4 2, 100. 104
ZrBrN 2, 169
ZrC 3, 51, 497
Zr,C 3, 52
Zr(C5H5),Cl2 3, 79
fZr(C2O4LlNa4-3H2O 3, 352
Zr(C5H7O,L3, 352
ZrCl 2, 121
ZrCl3 2, 98
ZrCl4 2, 100, 103; 3, 10
Zr6Cl,5 2, 116
ZrCiN 2, 169
ZrF4 2, 107
ZrF6Ba 2, 165
ZrF6Cu-4H2O 2, 167
ZrF6K2 2, 145, 166
ZrF6Li2 2, 149
ZrF6N2H6 2, 166, 167
ZrF6Na, 2, 145, 165
ZrF7(NH4K 2, 168
ZrF7M 2, 154
ZrF8Cu2 2, 166
ZrF,2BeLi6 2, 166, 167
Zr2F12K2Cu-6H2O 2, 164
Zr2F13Na5 2, 166
Zr2F14Cu3-16H2O 2, 166
Zr4F21Rb5 2, 164
Zr6F31Na7 2, 166
Zr7F10O92, 177
ZrH2 2, 12, 13
Zrl2 2, 116
Zrl3 2, 98
Zrl4 2, 104
ZrIN 2, 169
Zr(IO3L 1, 401
ZrN 2, 596, 600; 3, 497
Zr3N4 2, 596
[Zr{N(CH2COOK},lK2-H2O 3, 352
Zr(NO3L 2, 583
Zr7N2On 2, 308
ZrO 2, 243
ZrO2 2, 249
(ZrO3)K, 2, 270
(Zr2O5)K2 J, 279
ZrOBr2-8H2O 2, 376
ZrOC!2-8H2O 2, 376
Zr(OHJSO4 2, 375
Zr2(OHJ(SO4K-4H2O 2, 375
rZr4(OH)s(H2O)I6lXs-12H2O 2, 376
ZrI308@CH3K6 2, 195
ZrOS 2, 542
ZrP 2, 606
Zr(PO4HJ-H2O 1, 312
ZrS 2, 501
ZrS2 2, 505
Zr,S 2, 498
Zr3S4 2, 514
Zr9S2 2, 498
Zr,,S8 2, 498
ZrS3Ba (Ca, Eu) 2, 527
Zr(SO4J 1, 402
Zr(SO4J-4H2O 2, 375
ZrSSi 2, 542
Zr3Sc4012 1, 308; 2, 329
Zr5Sc2013 1, 308
Zr3Y4O12 2, 329
предметный указатель
Адамаптан 3, 8
Азидоводородная кислота 2, 563
Азиды 2, 563
Азобензол 2, 562
Азометан 2, 563
Азурит 3, 248, 265
Акаптит 2, 498
Аксинит 3, 134
Актииолит 3, 137
Алкилы металлов 3, 83
Аллотропия 1, 20
Алмаз гексагональный 1, 152; 3. 8
— кубический 3, 8
— сетка 1, 152
Альбит 3, 150
Алюминия комплексные фториды 2,
160
Алюминия оксиды
а 2, 261
|3 2, 317
Y 2, 261
Амезит 3, 144
Амидосульфонат- (сульфамат-) ион 2,
465
Амиды 2, t>52
Аминоксиды 2, 548
Аммиак 2, 30, 548
гидраты 2, 556
Аммипы 2, 557; 3, 367
сравнение с гидратами 2, 433
Аммониоборит 3, 199
Аммония галогениды 2, 32, 547
Амфиболы 3, 126, 136
Аиатаз 1, 208, 212; 2, 247
Ангидрит 2, 307
Андалузит 3, 129
Анджс.т соль 2, 580
Андрадит 3, 128
Анилит 3, 281
Анортит 3, 150
Антиперовскит 1, 317
Антипризма 1, 91, 92, 97
двухшапочная 1, 99, 103
квадратная 2, 376
одношапочная 1, 97, 102
Антитетрамантан 3, 8
Антифлюорит 1, 199, 301
Антофиллит 3, 126
Апатит 2, 375
Апофиллит 3, 138
Арагонит 1, 392; 3, 191
Арденнит 3, 125
Арсенид никеля, структурный тип 1,
206; 2, 500
сплавы 3, 490
Арсенобензол 2, 647
Арсенолит 1, 132; 2, 663
Арсенометан 2, 647
Арсенопирит 2, 509
Архимедовы тела 1, 91, 92
Асбест 3, 137
Атакамит 1, 208, 209; 2, 187; 3, 278
Аустенит 3, 501
Афвиллит 3, 130
Ацетилен 3, 25
комплексы с металлами 3, 75
Бадделеит 2, 249
Байерит 2, 262, 362
Баидилит 3, 203
Баотит 3, 134
Барисилит 3, 131
Барит 2, 307
Бектона соль 3, 396
«Белый свинец» 2, 382
Бёмит 2, 262, 370
Бензол 3, 16
комплексы с металлами 3, 82
Бенитоит 3, 134
Бентонит 3, 146
Берилл 3, 134
Берлинская зелень 3, 43
Берлинская лазурь 3, 42
Бертьерит 2, 539
Биксбиит 2, 253
Бипирамида 1, 92
пентагональная 1, 98
Бисфеноид 1, 95, 100
Бифториды (гидрофториды) 2. 34
Благородные газы 3, 441
гидраты 2, 392
соединения 2, 47
552 Предметный указатель
Боразины 3, 185
Боразон 2, 598
Бораны 3, 206
Бораты 3, 188
Борацит 3, 205
Бориды 3, 173
Борнит 3, 282
Борогидридные ионы 3, 215
Бороксин 3, 206
Бороферрит 3, 205
Боталлакит 2, 187; 3, 278
Бравэ решетки 1, 57
Браннерит 2, 330
Бронзы 2, 334
Брошантит 2, 373; 3, 278
Брукит 2, 247
Брусит (бруцит) 1, 310
Брушит (брузит) 2, 419
Бура 1, 257
Валептинит 2, 663
Ванадила соединения 2, 424
Варвикит 2, 322
Веберит 2, 682
Вегарда закон 3, 464
Везуаиапит 3, 132
Вермикулит 3, 146
Винтовая ось 1, 44
Витчит 3, 200
Власовит 3, 141
Водородная связь 2, 22
в гидратах 2, 392, 432
— гидроксидах 2, 360
— льде 2, 385
— оксокислотах 2, 40
Волластонит 3, 136
Вольфрама соль 3, 397
Вольфрамит 2, 308, 309
Вольфсбсргит 2, 536
Вюртцит 1, 149; 2, 532
Вюстнт 2, 260
Габитус кристаллов 1, 63
Гадолинит 3, 127
Галенит 3, 336
Галлуазит 3, 144
Гамбергит 3, 205
Гексагональная плотнейшая упаковка
1, 188; 3, 448
симметрия 1, 58 и ел.
Гексаметилептетрамин 2, 551
Геленит 3, 132
Гельвин 3, 161
Гердсрит 3, 127
Герсдорфит 2, 509
Гетерополикислоты 2, 223
Гетсрополпсоединений ионы 2, 222
Гётит 2, 367
Гетчеллит 2, 684
Гиббсит 2, 261, 362
Гидразин 2, 558
Гидразшшя галогепиды 2, 32
Гидраргиллит 2, 261, 364
Гпдрид-галогениды металлов 2, 75
Гидрогроссуляр 2, 327
Гидроксид-оксиды 2, 365
Гидроксиламин 2, 554
Гндроксилапатит 2, 375
Гндроксония ион 2, 426
Гидросферы состав 3, 121
Гидрохинон Р 1, 43, 44, 142; 3, 118
— у 1, 135
Гидроцинкит 1, 316; 2, 373
Гипс 2, 29, 418, 420
Глинистые минералы 3, 146
Гмелшшт 3, 159
Голландпт 2, 264, 335
Гоуерит 3, 200
Гранаты 2, 326; 3, 128
Гранецептрпровапная кубическая
структура 1, 176; 3, 447
Графит 3, 18
комплексы с галогенидамн металлов
3, 22
оксиды 3, 20
соединения с калием 3, 21
соли 3, 20
Гроссуляр 3, 128
Грутпт 2, 367
Грэма соль 2, 630
Гуанндиния ион 3, 18
Гумит 3, 129
Далиит 3, 138
Данбурпт 3, 150
Датолит 3, 203
Даттопит 2, 281
Делафоссит 1, 324
Джарлсит 3, 281
Джемсопит 2, 539
Джпллеепит (гиллеспит) 3, 127 138
356
Диазирин 2, 561
Диазония ион 2, 545
Диамантам 3, 8
Диарснн 3, 399
Диаспор 2, 261, 367
Дигенпт 3, 281
Дпимид 2, 562
Днккит 3, 144
Диметнларсина дисульфид 2, 686
Димстиларсиновая кислота 2, 677
Диметилглноксимат меди 3, 257
— никеля 3, 379
Диоксигспила катион 2, 196
Предметный указатель 553
Диопсид 3, 135
Диоптаз 3, 133
Дирихле область (домен) 1, 88, 177,
218
Дитиооксамид 3, 15
Дифтородиазин 2, 562
Дициан 3, 25
галогениды 3, 27
Дициандиамид 3, 29
Дпэдрический (двугранный) угол в
пероксиде водорода 2, 200
— — ¦— соединениях серы 2, 472
Додекаэдр правильный 1, 90, 171
— ромбический (ромбододекаэдр) 1,
92
— с треугольными гранями 1, 95, 100
Додекаэдрапы 3, 8
Долоресит 2, 281
Египетская синь 3, 138
Жадеит 3, 135
Изобутен 3, 12
Изомерия 1, 69
кобальтамминов 3, 369
цис-транс 1, 72
Изонолисоединспий ионы 2, 216
Изотиоцианаты 3, 33
Изоцианаты 3, 31
Изоцианиды 3, 26, 45
Изумруд 3, 133
Икосаэдр 1, 90, 179; 3, 169, 477
Икосаэдрическая плотнейшая шаро-
вая упаковка 1, 179
Ильменит 2, 294
Имид 2, 552
Имидазол, производное меди 3, 252
Имидогеп 2, 562
Инертная пара s-электронов З, 287
Инертные газы см. Благородные газы
Интераллогонные кристаллы 3, 377
Интеркалация 1, 46; 2, 506
Иньоит 3, 198
Ионная проводимость в кристаллах 2,
265; 3, 205
высокая 3, 228
Ионная связь 1, 372, 391
Ионный радиус 1, 372
Кадмия иодид 1, 206, 207, 310
связь со структурой NiAs 2, 503
Кадмия хлорид 1, 209
Кальсилит 3, 120
Кальцит 1, 293, 392; 3, 17, 191
Каолинит 1, 283; 3, 144
Капрлактам 1, 136
Карбамат-ион 3, 16
Карбиды внедрения 3, 51, 494
— ионные 3, 47
Карбоксилат-ион 3, 16
Карбонилы, галогениды 3, 13, 69
— гидриды 3, 68
— металлов 3, 54
Карбораны 3, 219
Карборунд 3, 92
Карнегиит 3, 120
Касситерит 1, 295
Каталановы тела 1, 92, 93
Катаплеит 3, 133
Кварц 3, 114
Кеатит 1, 162; 3, 116, 120
Кернит 3, 199
Кетогруппа 3, 12
Кианит 3, 129
Киноварь 3, 307
Кислоты гидратированные 2, 426
— карбоновые 3, 14
— неорганические, классификация 2,
36
—¦ структуры 2, 40
Кислые соли 2, 38
Клатратные соединения 1, 43; 2, 392
Клаудетит 1, 132; 2, 663
Кленнит 3, 305
Клиногумит 3, 129
Клиноклаз 3, 278
Кобальтаммины 3, 367
Кобальтит 2, 509
Ковеллин 2, 500; 3, 279
Колеманит 3, 198
Колумбит 1, 214
Комплексы бесконечные двумерные 1,
43, 128, 146, 147
¦ одномерные 1, 47, 123
трехмерные 1, 42, 137, 149
— конечные в кристаллах 1, 49, 118
Координационное число 1, 17
и ионный радиус 1, 376
¦— металлический радиус 3, 454
— отношение радиусов 1, 376
Координационный полиэдр 1, 187
для 7-, 8- и 9-координации 1. 97
Корднерит 3, 134
Коронадит 2, 265
Корунд 1, 212, 232, 318; 2, 252. 2R!,
294
Коэзит 3, 116
Кремпещавелевая кислота 3, 102
Криолит 1, 317; 2, 151
Криолитиопит 2, 160
Криптанд 1, 366
Криптомелан 2, 265
Кристалл, габитус 1, 63
— ионный, комплекс 1, 391
-- системы 1, 62
36—1284
554 Предметный указатель
Кристаллического поля теория 1, 387;
2, 313
Кристобалит 1, 152; 3, 114
Крокидолит 3, 137
Кроконат-ион 3, 15
Ксенона соединения 2, 47
Ксенотлит 3, 136
Кубан 3, 8
Кубанит 2, 535
Кубическая плотневшая упаковка 1,
174, 188; 3, 448
симметрия 1, 58 и ел.
Кубооктаэдр 1, 92, 93
Куперит 2, 504
Куприт 1, 157
Курроля соль 2, 631; 3, 136
Лабрадор 3, 150
Лавеса фазы 3, 471, 475
Лантаноидное сжатие 1, 375; 3, 407
Лантаноиды 3, 407 и ел.
Лардереллит 3, 199
Ларсенит 3, 127
Латунь р 3, 467
— Y 3, 485
Лаурионит 2, 188
Лаутит 2, 532
Лед 1, 155; 2, 383
Лёллингит 1, 299; 2, 510
Лепидокрокит 2, 368, 370
Либетенит 3, 278
Литиофорит 2, 266
Литосферы состав 3, 121
Лондона энергия 1, 362
Лутидин, комплекс с хлоридом меди
3, 254
Луцонит 2, 535, 536
Ляпис-лазурь 3, 160
Магнетит 2, 260
Магнетоплумбит 2, 319
Магнуса соль 3, 396
Мадреллассль 2, 631; 3, 136
Маккиыавит 2, 502
Малахит 2, 374; 3, 248
Манганит 2, 370
Марганцевый пиросмалпт 3, 138
Маргарит 3, 145
Марказит 1, 299; 2, 508
Мартенсит 3, 502
Межгалогенные соединения 2, 63
Мейергофферит 3, 198
Меламин 3, 29
Меланофлогит 3, 119
Мелилит 1, 238; 3, 132
Меллитовая кислота 3, 21
Метациннабарит 3, 307
Миларит 3, 149
Миллерит 2, 501
Милона основание 3, 308
— соль 3, 396
Молибденит 2, 506
Молибденовые бронзы 2, 341
Моноклинная симметрия 1, 58 и ел.
Монтмориллонит 3, 143, 146
Монтрозеит 2, 281, 367
Мочевина 3, 18
Муравьиная кислота 3, 14
Мусковит 3, 144, 145
Мюирит 3, 135
Надпероксиды (супероксиды) 2, 197
Назинит 3, 200
Найлон 1, 135, 136
Накрит 3, 144
«Натрия таллид» 3, 472
Натрия хлорид, структурный тип 1,
205, 286; 3, 497
Натролит 3, 156
Нептунит 3, 148
Нефелин 3, 120
Ниобит 1, 214; 2, 324
Нитрамид 2, 580
Нитраты комплексные 2, 586
Нитридогалогениды 2, 169
Нитридогидриды 2, 552
Нитриды 2, 595
внедрения 2, 600
галогениды 2, 169
гидриды 2, 552
Нитроамин 2, 558
Нитрозильные соединения 2, 572
Нитрозометан 2, 571
Нитрозосоединения 2, 571
Нитроила (нитрония) соединения 2,
575
Нитроилгалогениды 2, 576
Нитрометан 2, 579
Нитросоединения 2, 579
Нозеан 3, 161
Норбергит 3, 129
Нордстрандит 2, 364
Обращенной шпинели структура 1,
312
Обсидиан 3, 115
Объемноцентрированная тетрагональ-
ная упаковка 1, 175
Озон 2, 197
Оксалат-ион 3, 15
Оксамид 3, 15
Оксид-сульфиды 2, 541
Оксимы 2, 562
Оксогалогениды 2, 172 и ел.
Предметный указатель 555-
Оксогидроксосоединения см. Гидрок-
сид-оксиды
Оксоионы 2, 212
Оксокислоты, классификация 2, 37
— структуры 2, 40
Оксофториды 2, 175
Октаэдр 1, 187 и ел.
усеченный 1, 92, 167
Октаэдрическая координация 1, 205,
276
Октаэдрические молекулы и ионы 1,
120, 242
структуры 1, 241 и ел.
Оливенит 3, 267
Оливин 2, 310; 3, 128
Олово белое 1, 150
Оптическая активность 1, 74
Орпимент (аурипигмент) 1, 132; 2, 683
Ортоклаз 3, 149
Орторомбическая симметрия 1, 58
и ел.
Парадаттонит 2, 281
Парамелаконит 3, 252
Парателлурит 2, 457
Парацельзиан 3, 152
Пектолит 3, 136
Пентасилы 3, 160
Пентаэритритнитрат 2, 589
Перлит 3, 501
Пермутиты 3, 154
Перовскит 1, 222, 318; 2, 152, 300
Пероксиды 2, 197
Пероксоборат 2, 202
Пероксокарбонат 2, 202
Пероксокислоты 2, 202
Петалит 3, 138
Пинноит 3, 203
Пираргирит 3, 233
Пирит 1, 30, 289, 328; 2, 508
Пироксен 3, 126
Пироксмангит 3, 136
Пиролюзит 2, 264
Пироп 3, 128
Пирофиллит 3, 145
Пирохлор 1, 307; 2, 325, 680
Пиррометен, комплекс с медью 3, 259
Пирротин (пирротит) 2, 502
Плагиоклазы 3, 149
Платоновы тела 1, 90
Плоскость скользящего отражения 1,
59
Плотпейшая упаковка гексагональная
(ГПУ) 1, 188; 3, 448
— кубическая (КПУ) 1, 174, 188; 3,
448
— номенклатура 1, 192
Полигалогениды 2, 69
Полииодиды 2, 72
Полиморфизм 1, 20
Полинга правила (для комплексных
ионных кристаллов) 1, 392
Полисилоксаны 3, 109
Полисульфиды 2, 475
Политетрафтороэтилен 3, 11
Политипы 1, 21; 3, 94
Полиэдрические домены (области) 1,
87, 217
Полиэдрические ионы и молекулы 1,
118
Полиэдры 1, 87
заполняющие пространство располо-
жения 1, 167
полуправильные 1, 91
правильные 1, 91
Полиэтилен 3, 9
Поля лигандов теория 1, 387
Поляризуемость 1, 362, 383
Портланд-цемент 3, 129
«Порядок — беспорядок» в сплавах 3,
465
Провертит 3, 200
Проводники металлические 1, 342
— с высокой ионной проводимостью
3, 228
Протактиний 3, 412
Просилоксан 3, 102
Пространственные группы 1, 57
Прустит 3, 233, 246
Псевдобрукит 2, 324
Псиломелан 2, 264
Реальгар 2, 684
Радиус ионый 1, 373
— ковалентный 1, 345
— металлический 3, 456
—¦ отношение радиусов 1, 376, 392
— слейтеровский 1, 347
Ральстонит 2, 682
Рамсделлит 2, 264
Распит 2, 308
Рацемизация 1, 75
Решетка Бравэ 1, 57, 58
—¦ гранецентрированная 1, 58
— объемноцентрированная 1, 58
— плоская (двумерная) 1, 53
— примитивная 1, 57
— энергия 1, 363
Родонит 3, 127, 136
Ромбоэдрическая симметрия 1, 58
Ромеит 2, 680
Руссена соль 2, 572
Рутениевая пурпурная 3, 44
Рутил 1, 25, 206, 232, 295; 2, 247, 275,
308
36*
556 Предметный указатель
Санидин 3, 153
Соли кислые 2, 38
— основные 2, 373
Сапфир 2, 262
Сверхоктаэдр 1, 245
Сверхструктура 1, 334; 2, 289 316; 3,
465 '
Сверхтетраэдр 1, 237
Связь, валентное усилие электроста-
тическое 1, 392
— вандерваальсова 1, 362
— водородная 2, 22
— длина 1, 345
— ионная 1, 372
— ковалентная 1, 342, 343
— кратность 1, 344
— — в металлах 3, 458
— металлическая 3, 458
— металл—металл 1, 363
— многоцентровая 3, 85, 170, 190,
211
— тип 1, 337
— трехцентровая 3, 170
— электроотрицательность 1, 345
Сенармонтит 2, 663
Сервантит 2, 675
Серпентины 3, 137
Серпиерит 1, 314
Сесквиоксиды (полуторные оксиды)
2, 197
Сетки взаимопроникающие 1, 117, 157
— однородные 1, 114
— плоские 1, 104, 129, 146
— трехмерные 1, 109, 116, 137, 149
Силазаны 3, 104
Силанолы 3, 107
Силаны 3, 99
Спликалит 3, 119
Силиконы 3, 110
Силлиманит 3, 129
Силоксаны 3, 107
Силтианы 3, 104
Симметрии элементы 1, 59, 60
Симметрия и энантиоморфизм 1, 75
— элементы 1, 52 и ел.
Системы кристаллографические 1, 62
Скуттерудит 1, 317, 319
Слоистая структура 1, 43, 129, 146,
206; 2, 266
и поляризация ионов 1, 380, 381
Слюда 3, 145
Содалит 3, 161
Соединения включения 3, 494
нестехиометрические 1, 14
электронно-дефицитные 1, 342; 3,
86, 182, 211
электронно-избыточные 1, 342
электронные 3, 484
Соли основные (гидроксосоли) 2, 185,
373
Сорбит 3, 502
Сореля цемент 2, 3/3
Сподумен 3, 119, 135
Ставролит 3, 129
Сталь 3, 500—501
Станнит 2, 533, 535
Статистическая структура 2, 289
Стереоизомерия 1, 70; 3, 370
Стишовит 3, 116
Структура (упаковка) объемноцент-
рированпая кубическая 1, 174; 3,
448
Структуры, бесконечно адаптируемые
2, 531
— сочлененные 1, 271
Сульфамат-ионы см. Амидосульфо-
нат-ион
Сульфамид 2, 467
Сульфимид 2, 644
Сульфоксид 2, 464
Сульфон 2, 467 ¦
Сульфурилгалогениды 2, 467
Сфалерит 1, 151, 532
Тальк 1, 314; 3, 145
Тапиолит 2, 681
Таутомерия 1, 72
Твердые растворы 3, 463
Твердые тела полуправильные 1, 91
правильные 1, 89
Теллурит 2, 457
Тенорит 3, 252
Тетрагональная плотпеншая упаковка
1, 178
Тетрагональная симметрия 1. 58 и ел.
Тетраэдрическая координация 1, 198,
216
Тетраэдрические молекулы и ионы 1,
118
Тетраэдрические структуры 1, 235—
241
Тиогалогениды 2, 170
Тиокарбонилгалогениды 3, 13
Тиопаты 2, 477
Тионилгалогениды 2, 464
Тиосульфаты 2, 464
Тиоуксусная кислота 3, 14
Тиоцианаты 3, 33
Типлеит 3, 203
Тисонит 2, 99
Томсонит 3, 154, 156
Тортвейтит 3, 131
Точечные группы симметрии 1, 54, 62
Тремолит 3, 137
Триазидокарбониевый ион 3, 17
Тригональная симметрия 1, 64
Предметный указатель 557
Триднмит 3, 114
Трпклпнная система 1, 58
Трирутпл 1, 214, 300; 2, 149, 681
Трисульфи.мид-ион 2, 591
Трптнац 1, 132
Трицпанометанид-ион 3, 17
Троилнт 2, 502
Тугтупит 3, 161
Турмалин 3, 133
Туттона соль 3, 202
Тьюнеллит 3, 202
Уваровит 3, 128
Уголь древесный 3, 19
Уксусная кислота 3, 14
Улексит 3, 200
Ульманпит 2, 509
Уранильные соединения 3, 429
Усеченный октаэдр 1, 90, 92, 167
Фазы внедрения 3, 494
Фармаколит 2, 419
Фатерит 3, 191
Фенацит (фенакит) 1, 113; 2, 310, 3,
127, 128
Фергусонит 2, 307, 310
Феррит 3, 501
Ферриты 2, 316
Ферроцен 3, 77
Филлипсит 3, 156
Флогопит 3, 145
Флюоборит 3, 205
Флюорит 1, 199, 301; 2, 246
дефектная структура 2, 328
сверхструктура 2, 177
Фожазит 3, 158
Формальдегид 3, 12
Фосген 3, 13
Фосфонитрильные соединения 2, 641
Фреми соль 2, 347
Фресонит 2, 347
Фриауфовский многогранник 3, 377
Фторидные комплексы с алюминием
2, 160
Фториды железа 2, 160
— углерода 3, 8
— элементов IVA- и VA-подгрупп 2,
163
— 5f-элементов 3, 421
Фульминат 3, 32
Хаггит (хеггит) 2, 281
Халькозин 3, 281
Халькопирит 2, 533
Халькофанит 1, 315; 2, 266
«fl-Хинол» см. Гидрохинон
Хиолит 2, 161
Хлорит 3, 147
Хондродит 3, 129
Хризоберилл 2, 310
Хризотил 1, 314; 3, 143
Хром (высшей валентности) 3, 347
Хлорид цезия (структурный тип) 1,
294
Цейзе соль 3, 405
Цельзиан 3, 149
Цементит 3, 53, 175, 501
Цеолиты 1, 43; 3, 153
Цепочечная структура 1, 47, 123
Циамелид 3, 30
Цианамид 3, 30
Цианиды ковалентные 3, 26, 39
— комплексные 3, 40
— простые ионные 3, 36
Цианоферраты 3, 42 и ел.
Циануровые соединения 3, 29
Циклические молекулы и ионы 1, 121
Циклооктатетраен 3, 13
комплексы с металлами 3, 81
Циклопентадиен, комплексы с метал-
лами 3, 77
Цинковая обманка 1, 151, 161
Циркон 2, 307; 3, 128
Цуниит (зуниит) 3, 125
Чугун 3, 501
Шабазит 3, 159
Шаровые упаковки плотнейшие 1, 178
Шеелит 2, 307, 310
Шепит 3, 428
Шомакера — Стевенсона уравнение 1,
345
Шпинель 2, 311
Штромейрит 3, 282
Щавелевая кислота 3, 14
дигидрат 2, 27, 432; 3, 14
Эвдиалит 3, 135
Эвкриптит 3, 229
Эглестопит 3, 298
Эдингтонит 3, 156
Эзкуррит 3, 200
Эйлера соотношение 1, 89,
Эквивалентные позиции в элементар-
ной ячейке 1, 66
Электронные соединения 3, 484
Электронный вклад 3, 485
Электронный дефицит 3, 85, 180, 211
Электронный избыток 1, 342
Электронов неподеленные пары, влия-
ние на стереохимию 1, 349
Электроотрицательность и тип связи
1, 345
558 Предметный указатель
Электростатическое валентное усилие
связи 1, 392
Элементарная ячейка 1, 22
Эльпасолит 2, 153
Энантиоморфизм 1, 70
Энаргит 2, 535
Энстатит 3, 135
Энтропия гидратов 2, 432
— льда 2, 387
— оксидов диазота 2, 567
Эпидот 3, 132
Эрдмана соль 3, 368, 374
Этилкарбамат 3, 12
Югаваралит 3, 157
Юм-Розери правила 3, 486
Яна — Теллера эффект
268—269
Ячейка, параметры 1, 65
1, 390; 3,
ОГЛАВЛЕНИЕ
Часть II (продолжение) 5
21. Углерод. Перевод Н. Н. Желиговской 5
21.1. Введение 5
21.2. Стереохимия углерода 6
21.3. Тетраэдрический атом углерода 7
21.3.1. Алмаз; насыщенные органические соединения ... 7
21.3.2. Фториды углерода (фтороуглероды) 8
21.4. Углерод, образующий три связи И
21.4.1. Конфигурация связей I типа = (Х' ) 12
21.4.2. Конфигурация связей II типа 16
21.4.3. Конфигурация связей III типа . 16
21.4.4. Производные графита 19
21.5. Оксиды и сульфиды углерода 22
21.5.1. Моноксид углерода 22
21.5.2. Диоксид и дисульфид углерода, карбонилсульфид . . 22
21.5.3. Субоксид углерода (диоксид триуглерода) .... 23
21.6. Ацетилен и его производные 25
21.7. Дициан и родственные соединения 25
21.7.1. Дициан 25
21.7.2. HCN, цианиды и изоцианпды неметаллов .... 26
21.7.3. Цианогалогениды 28
21.7.4. Цианамид H2N-CN 29
21.7.5. Дициандиамид NCNC(NH2J 29
21.7.6. Производные цианура 29
21.7.7. Изоциановая кислота и изоцианаты 31
21.7.8. Изотиоциановая кислота, тиоцианаты и изотиоциаиаты 32
21.7.9. Тиоцианаты и изотиоцианаты металлов 33
22. Цианиды, карбиды, карбонилы и алкилы металлов. Перевод
Н. Н. Желиговской 36
22.1. Цианиды металлов 36
22.1.1. Берлинская лазурь и родственные соединения ... 42
22.1.2. Смешанные цианидные и изоцианидные комплексы 45
22.2. Карбиды металлов . 46
22.3. Карбоиилы металлов 54
22.3.1. Получение и свойства 54
22.3.2. Структуры карбоиилов и родственных им соединений 58
22.3.3. Карбонилы, содер;кащие более крупные металлические
кластеры 67
22.3.4. Карбонилгидриды 68
22.3.5. Карбонилгалогениды 69
22.3.6. Карбонилнитрозилы 70
22.3.7. Смешанные карбонилы металлов 71
22.3.8. Смешанные карбонильные производные металлов . . 71
ОГЛАВЛЕНИЕ
Часть 11 (продолжение) 5
21. Углерод. Перевод Н. Н. Желиговской 5
21.1. Введение 5
21.2. Стереохимия углерода 6
21.3. Тетраэдрический атом углерода 7
21.3.1. Алмаз; насыщенные органические соединения ... 7
21.3.2. Фториды углерода (фтороуглероды) 8
21.4. Углерод, образующий три связи И
21.4.1. Конфигурация связей I типа = (Х' ) 12
21.4.2. Конфигурация связей II типа 16
21.4.3. Конфигурация связей III типа . 16
21.4.4. Производные графита 19
21.5. Оксиды и сульфиды углерода 22
21.5.1. Моноксид углерода 22
21.5.2. Диоксид и дисульфид углерода, карбонилсульфид . . 22
21.5.3. Субоксид углерода (диоксид триуглерода) .... 23
21.6. Ацетилен и его производные 25
21.7. Дициан и родственные соединения 25
21.7.1. Дициан 25
21.7.2. HCN, цианиды и изоцианпды неметаллов .... 26
21.7.3. Цианогалогениды 28
21.7.4. Цианамид H2N-CN 29
21.7.5. Дициандиамид NCNC(NH2J 29
21.7.6. Производные цианура 29
21.7.7. Изоциановая кислота и изоцианаты 31
21.7.8. Изотиоциановая кислота, тиоцианаты и изотиоциаиаты 32
21.7.9. Тиоцианаты и изотиоцианаты металлов 33
22. Цианиды, карбиды, карбонилы и алкилы металлов. Перевод
Н. Н. Желиговской 36
22.1. Цианиды металлов 36
22.1.1. Берлинская лазурь и родственные соединения ... 42
22.1.2. Смешанные цианидные и изоцианидные комплексы 45
22.2. Карбиды металлов . 46
22.3. Карбоиилы металлов 54
22.3.1. Получение и свойства 54
22.3.2. Структуры карбоиилов и родственных им соединений 58
22.3.3. Карбонилы, содер;кащие более крупные металлические
кластеры 67
22.3.4. Карбонилгидриды 68
22.3.5. Карбонилгалогениды 69
22.3.6. Карбонилнитрозилы 70
22.3.7. Смешанные карбонилы металлов 71
22.3.8. Смешанные карбонильные производные металлов . . 71
560 Оглавление
Оглавление 561
22.4. Соединения металлов с углеводородами
22АЛ. Ацетиленовые комплексы
22.4.2. Циклопентадиенильные комплексы . .
22.4.3. Комплексы, содержащие бензол ч:м циклоокта-.етраен
22.5. Алкилы металлов
22.5.1. Алкилы металлов побочных подгрупп
22.5.2. Алкилы металлов I и 11 групп и А1
23. Кремний. Перевод С. И. Тро.чнова
23.1. Введение
23.2. Стереохимия кремния
23.3. Элементный кремний и карборунд
23.4. Силициды
23.5. Силаны
23.6. Галогениды кремния
23.7. Оксогалогениды и тиогалогениды
23.8. Циклические силтианы
23.9. Некоторые соединения со связями N — Si
23.10. Кремнийорганические соединения, силиконовые полимеры
23.10.1. Замещенные хлоросиланы, силанолы и силоксаны
23.10.2. Строение силанолов и силоксанов
23.10.3. Химия силиконов
23.11. Кристаллические модификации кремнезема
23.11.1. Заполненные структуры кремнезема
23.12. Силикаты
23.12.1. Гидроксосиликаты
23.12.2. Классификация структур силикатов
23.12.3. Ортосиликаты
23.12.4. Силикаты, содержащие ионы Si2O76~ (диортосилл-
каты)
23.12.5. Силикаты, содержащие циклические ионы (SiOs).;2""
(кольцевые силикаты)
23.12.6. Силикаты, содержащие цепочечные ионы (цепочечные
силикаты)
23.12.7. Силикаты со слоистой структурой (слоистые силикаты)
23.12.8. Силикаты с каркасной структурой
24. Бор. Перевод Н. Н. Желиговской
24.1. Введение
24.2. Стереохимия бора
24.3. Элементный бор и бориды, родственные ему по структуре
24.4. Бориды металлов и карбиды бора
24.5. Низшие галогениды и соединения, содержащие группу П;
24.5.1. Галогениды В2Х4 "
24.5.2. Ненасыщенные галогениды В,,Х„
24.6. Соединения бора с азотом
24.6.1. Нитрид бора
24.6.2. Соединения бора с азотом — аналоги производных уг-
лерода
24.6.3. Боразотные соединения — производные борапов
24.7. Химия кислородных соединений бора
24.7.1. Триоксид бора
24.7.2. Ортоборная кислота и ортобораты
24.7.3. Пиробораты
24.7.4. Метаборная кислота и метабораты .....
24.7.5. Гидроксобораты и безводные полибораты ....
74
75
77
81
83
83
84
90
92
94
99
101
102
104
Ш4
106
107
109
ПО
114
119
120
122
122
127
131
133
135
137
147
163
163
167
169
174
180
180
182
183
183
184
186
188
189
190
191
192
196
24.7.6. Другие структуры боратов, содержащие тетраэдричс-
ские атомы бора 203
24.7.7. Длина связей В—О 205
24.7.8. Циклический Н2В2О3, бороксин Н3В3О3 и боранокарбо-
наты 206
24.8. Бораны и родственные соединения 206
24.8.1. Получение и свойства 206
24.8.2. Молекулярная структура боранов 210
24.8.3. Борогидридные ионы и карбораны 215
25. Медь, серебро и золото. Перевод Н. Н. Желиговской .... 223
25.1. Валентные состояния 223
25 2. Соединения с высокой ионной проводимостью .... 228
25.3. Соединения Си(III) и Си(IV) 229
25.4. Ag с более высокой степенью окисления 230
25.5. Структурная химия соединений Cu(I), Ag(I) и Au(I) . . 232
25.5.1. Образование атомами Cu(I), Ag(I) и Au(I) двух кол-
линеарных связей 232
25.5.2. Образование атомами Cu(I) и Ag(I) четырех тетраэд-
рически направленных связей ^Зо
25.5.3. Образование атомами Cu(I), Ag(I) и Au(I) трех связей j^J-
25.6. Соли, содержащие Cu(I) и Cu(II) jjy
25.7. Структурная химия соединений меди(П) zr~
25.7.1. Образование связей 4, D+1) и D+2) fM
25.7.2. Структуры хелатных соединений меди(II) .... 256
25.7.3. Строение оксосолей 259
25.7.4. Тригонально-бипирамидальная координация меди(П) ^65
25.7.5. Октаэдрические комплексы 268
25.7.6. Простые и сложные (комплексные) галогениды меди(II) 270
25.7.7. Гидроксосоли меди (II) 278
25.8. Сульфиды меди 279
25.9. Структурная химия соединений золота(III) 283
26. Элементы подгрупп МБ, ШБ и IVB. Перевод Н. Н. Желиговской 287
26.1. Введение 287
26.1.1. Qa+, In+ и Т1+ 287
26.1.2. Ge2+, Sn2+ и РЬ2+ 289
26.2. Структурная химия цинка 290
26.2.1. Цинк с пятью ковалентными связями 292
26.2.2. Координационные соединения цинка, образующие тетра-
эдрически направленные связи 294
26.3. Структурная химия ртути 295
26.3Л. Катионы ртути f9b
26.3.2. Соединения одновалентной ртути 296
26.3.3. Соединения двухвалентной ртути 298
26.4. Структурная химия галлия и индия 311
26.5. Структурная химия таллия 313
26.6. Структурная химия германия 316
26.7. Структурная химия олова и свинца 320
26.7.1. Соединения оловаAУ) и свинца(IV) 320
26.7.2. Структуры некоторых тиостаннатов 325
26.7.3. Соединения олова(П) и свинца (II) 327
27. Элементы VIII группы и Другие переходные металлы. Перевод
Н. Н. Желиговской 337
27.1. Введение 337
27.2. Стереохимия Ti(IV) в некоторых островных комплексах . . 341
562 Оглавление
27.3. Стереохимия некоторых координационных соединений ванадия 343
27.4. Структурная химия комплексов Сг 346
27.4.1. Соединения Cr(IV) 346
27.4.2. Соединения Cr(V) 345
27.4.3. Соединения Cr(VI) 348
27.4.4. Соединения, содержащие хром в двух степенях окис-
ления 349
27.5. Более высокие координационные числа металлов в изолиро-
ванных комплексах 349
27.6. Структурная химия железа 354
27.7. Структурная химия кобальта 359
27.7.1. Стереохимия соединений кобальта(П)—d7 .... 361
27.7.2. Кобальт(III), образующий шесть октаэдрически направ-
ленных связей: кобальтаммины 367
27.8. Структурная химия никеля 375
27.8.1. Стереохимия Ni(II)— ds 375
27.8.2. Другие степени окисления Ni 387
27.9. Структурная химия палладия и платины 388
27.9.1. Плоские комплексы Pd(II) и Pt(II) 388
27.9.2. Соединения Pd(II) 389
27.9.3. Соединения Pt(II) 391
27.9.4. Мостиковые соединения Pd и Pt 393
27.9.5. Некоторые интенсивно окрашенные соединения Pt 395
27.9.6. Pd(II) и Pt(II), образующие пять связей .... 397
27.9.7. Pd(II) и Pt(II), образующие шесть октаэдрическн на-
правленных связей 398
27.9.8. Октаэдрическая координация Pt(IV): триметилплатина-
хлорид и родственные соединения 400
27.9.9. Олефиновые соединения 402
28. Лантаноиды и актиноиды.Перевод Ф. М. Спиридонова .... 407
28.1. Кристаллохимия лантаноидов (редкоземельных элементов) 407
28.1.1. Соединения трехвалентных лантаноидов .... 407
28.1.2. Соединения четырехвалентных лантаноидов . . . 408
28.1.3. Соединения двухвалентных лантаноидов .... 409
28.2. Актиноиды 410
28.2.1. Введение 410
28.2.2. Кристаллохимия тория 411
28.2.3. Кристаллохимия протактиния 412
28.2.4. Кристаллохимия урана 415
28.2.5. Сложные фториды 5f-элементов 421
28.2.6. Нитриды и родственные соединения Th и U; структуры
типа La2O3 и Ce2O2S 435
28.2.6. Сульфиды U, Th и Се 437
29. Металлы и сплавы. Перевод С. И. Троянова . . .... 439
29.1. Структуры простых веществ 439
29.1.1. Благородные газы (класс 1) 440
29.1.2. Неметаллы и элементы IVB—УПБ-подгрупп (класс 2) 440
29.1.3. Алюминий, элементы подгрупп ПБ и ШБ, олово и сви-
нец (класс 3) . 443
29.1.4. Переходные элементы и элементы 1Б подгруппы
(класс 4) 446
29.1.5. Элементы подгрупп IA и ПА (класс 5) 453
29.2. Межатомные расстояния в металлах, металлические радиусы 454
29.3. Теории металлической связи 458
29.4. Твердые растворы 463
Оглавление 563
29.5. Переходы порядок — беспорядок и сверхструктуры . . . 465
29.5.1. Р-Латунь ' 467
29.5.2. Сплавы X3Y 468
29.6. Структуры сплавов 471
29.6.1. NaTl и родственные структуры 472
29.6.2. Структуры BaCu, CaCu5, XY,, и XY13 473
29.6.3. 0-Фазы переходных металлов и фазы Лавеса . . . 475
29.6.4. Электронные соединения 484
29.6.5. Некоторые сплавы АгВ, с высоким содержанием алю-
миния 487
29.6.6. Системы AiB2 489
29.6.7. Фазы АгВ2 со структурой арсенида никеля .... 490
29.6.8. Некоторые сплавы А2В0 с высоким содержанием висмута 490
29.6.9. Системы ВВ . . ' 492
29.6.10. Формулы сплавов 493
29.7. Карбиды и нитриды со структурой фаз внедрения .... 494
29.7.1. Железо и сталь 500
Формульный указатель 504
Предметный указатель 551
СОДЕРЖАНИЕ ДРУГИХ ТОМОВ
ТОМ 1
Предисловие редактора перевода
Предисловие
Часть I
1. Введение
2. Симметрия
3. Полиэдры и сетки
4. Шаровые упаковки
5. Тетраэдрические и октаэдрические структуры
6. Некоторые простые структуры АХ„
7. Химические связи в молекулах и кристаллах
ТОМ 2
Часть II
8. Водород. Благородные газы
9. Галогены. Простые галогениды
10. Комплексные оксо- и гидроксогалогениды
11. Кислород
12. Простые оксиды металлов
13. Сложные оксиды
14. Гидроксиды, оксогидроксиды и гидроксосоли
15. Вода и гидраты
16. Сера, селен, теллур
17. Сульфиды и оксосульфиды металлов
18. Азот
19. Фосфор
20. Мышьяк, сурьма, висмут
УВАЖАЕМЫЙ ЧИТАТЕЛЬ!
Ваши замечания о содержании книги, ее офор-
млении, качестве перевода и другие просим
присылать по адресу: 129820, Москва, И-110,
ГСП, 1-й Рижский пер., д. 2, издательство*
«Мир».
ЗАМЕЧЕННЫЕ ОПЕЧАТКИ
МОНОГРАФИЯ
Александр Франк Уэллс
СТРУКТУРНАЯ НЕОРГАНИЧЕСКАЯ ХИМИЯ
В 3-х томах
Том 3
Научные редакторы И. С. Беленькая, Т. И. Почкаева
Мл. редактор И. С. Ермилова
Художник А. С. Гейнце
Художественный редактор М. Н. Кузьмина
Технический редактор М. А. Страшнова
Корректор Т. П. Пашковская
ИБ Л» 6097
Сдано в набор 17.07.87. Подписано к печати 17.02.88.
Формат 60Х90'Лб. Бумага типографская № 1. Печать
высокая. Гарнитура литературная. Объем 17,75 бум. л.
Усл. печ. л. 35,50. Усл. кр.-отт. 35,50. Уч.-изд. л. 37,83.
Изд. № 3/4885. Тираж 6000 экз. Зак. 1284. Цена 6 руб.
ИЗДАТЕЛЬСТВО «МИР»
129820, ГСП, Москва, И-120, 1-й Рижский пер., 2
Московская типография № П Союзполиграфпрома при
Государственном комитете СССР по делам изда-
тельств, полиграфии и книжной торговли. 113105,
-Москва, Нагатинская ул., д. 1
Т. 1, с. 314, 14-я строка снизу
Т. 1, с. 279, 19-я строка сверху
Т. 2, с. 136, в левом столбце табл. 10.2
Т. 2, с. 153, 9-я строка сверху
Т. 2, с. 157, 12-я строка сверху
Т. 2, с. 179, в левом столбце табл. 10.12,
5-я строка сверху
Т. 2, с. 180, в среднем столбце
табл. 10.13, 3-я строка снизу
Т. 2, с. 319, 18-я строка снизу
Т. 2, с. 339, в табл. 13.17
Т. 2, с. 598, 5-я строка снизу
Т. 2, с. 645, 11-я строка сверху
Напечатано
хризолита
K2Zr05
Ва3МоО5
Sr4MoO6
K2MoF6
K2W2C19
MoO3F
TeOF4
PbF,2O19
Li6
боразан
N3(PC12)(SOF2)
Следует читать
хризотила
K2Zr2O5
Ba^MOs
Sr4MO6
K3MoF6
K3W2C19
MnO3F
TcOF4
PbFc,2Oi9
Li4
боразон
N3(PCl2)(SOFh