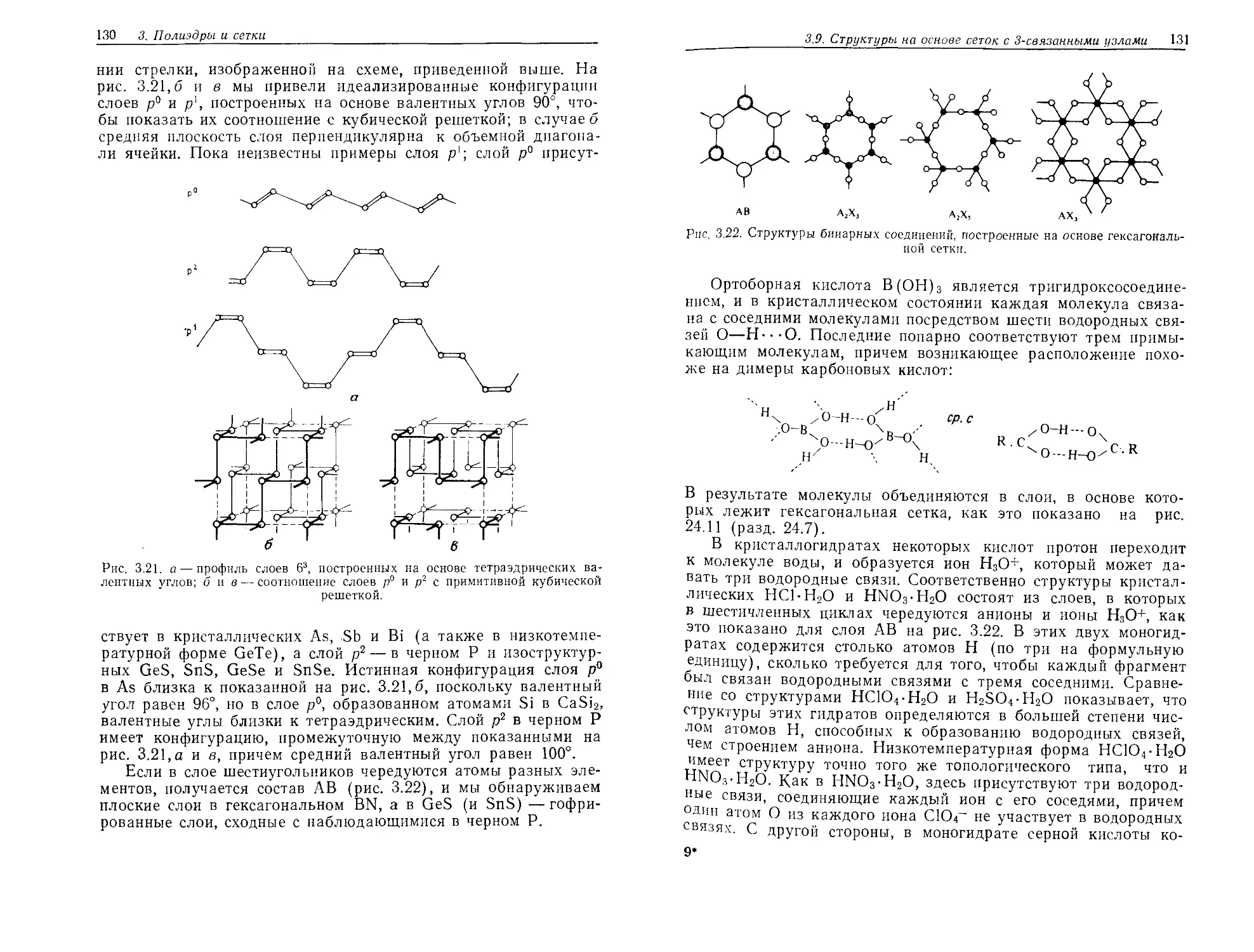
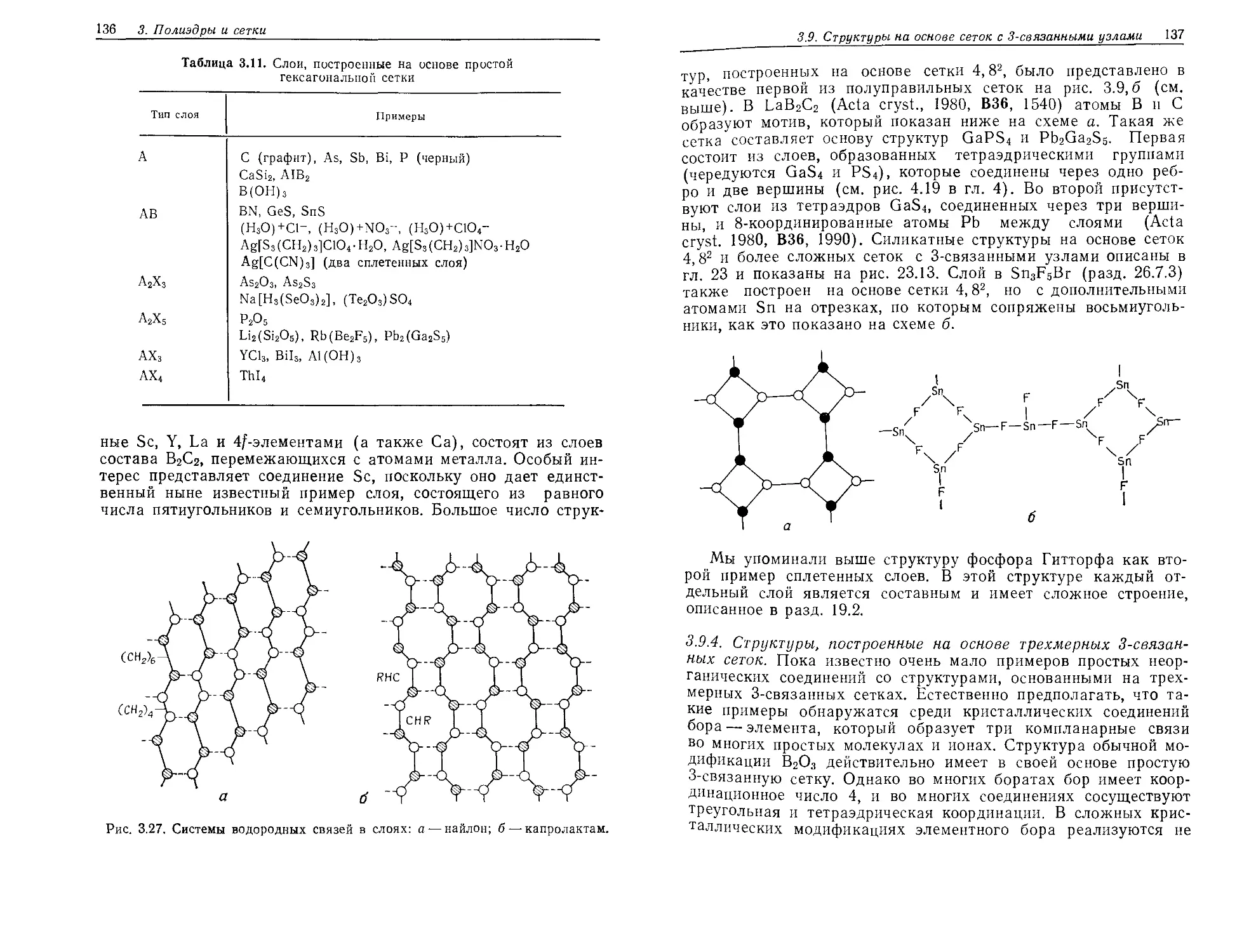
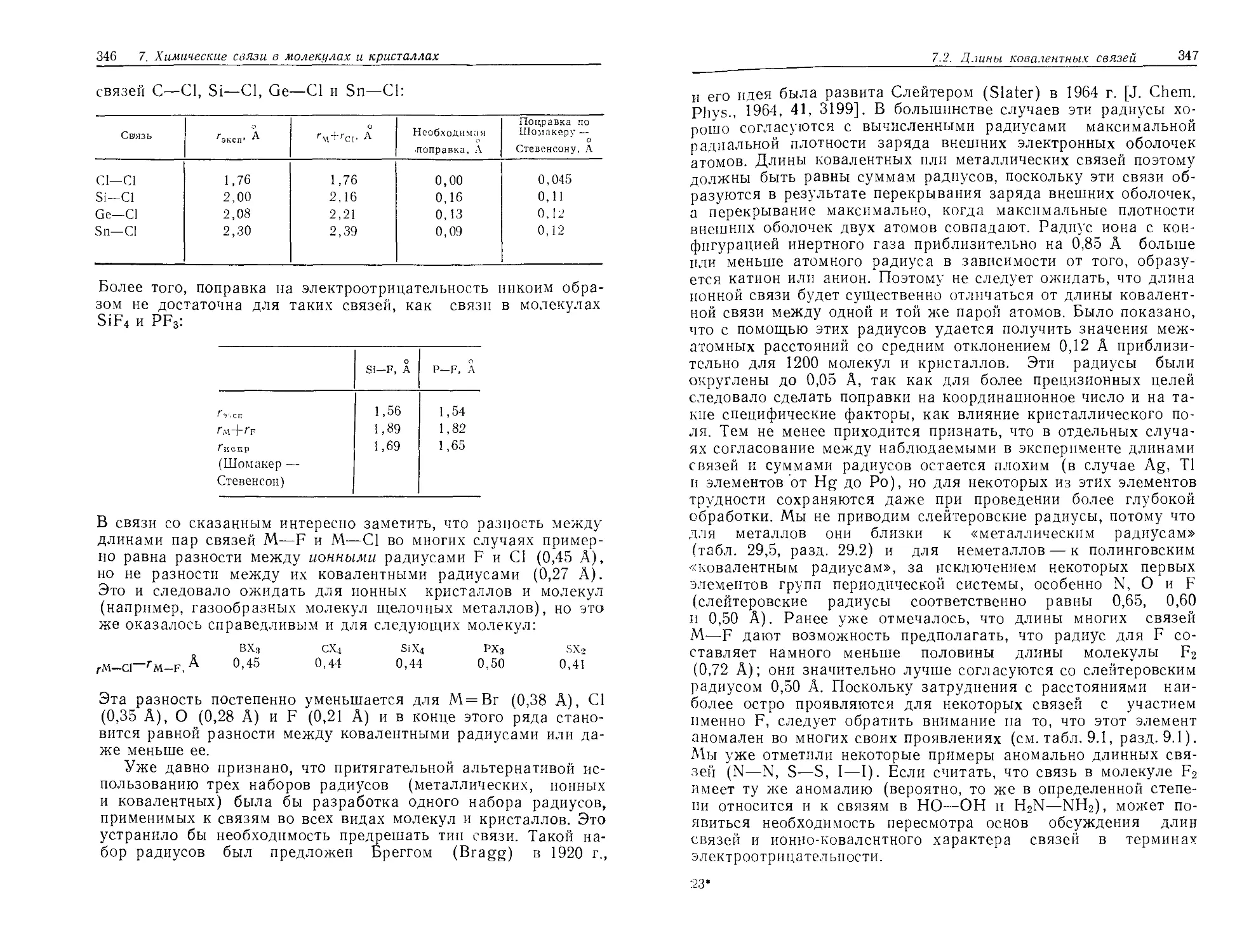
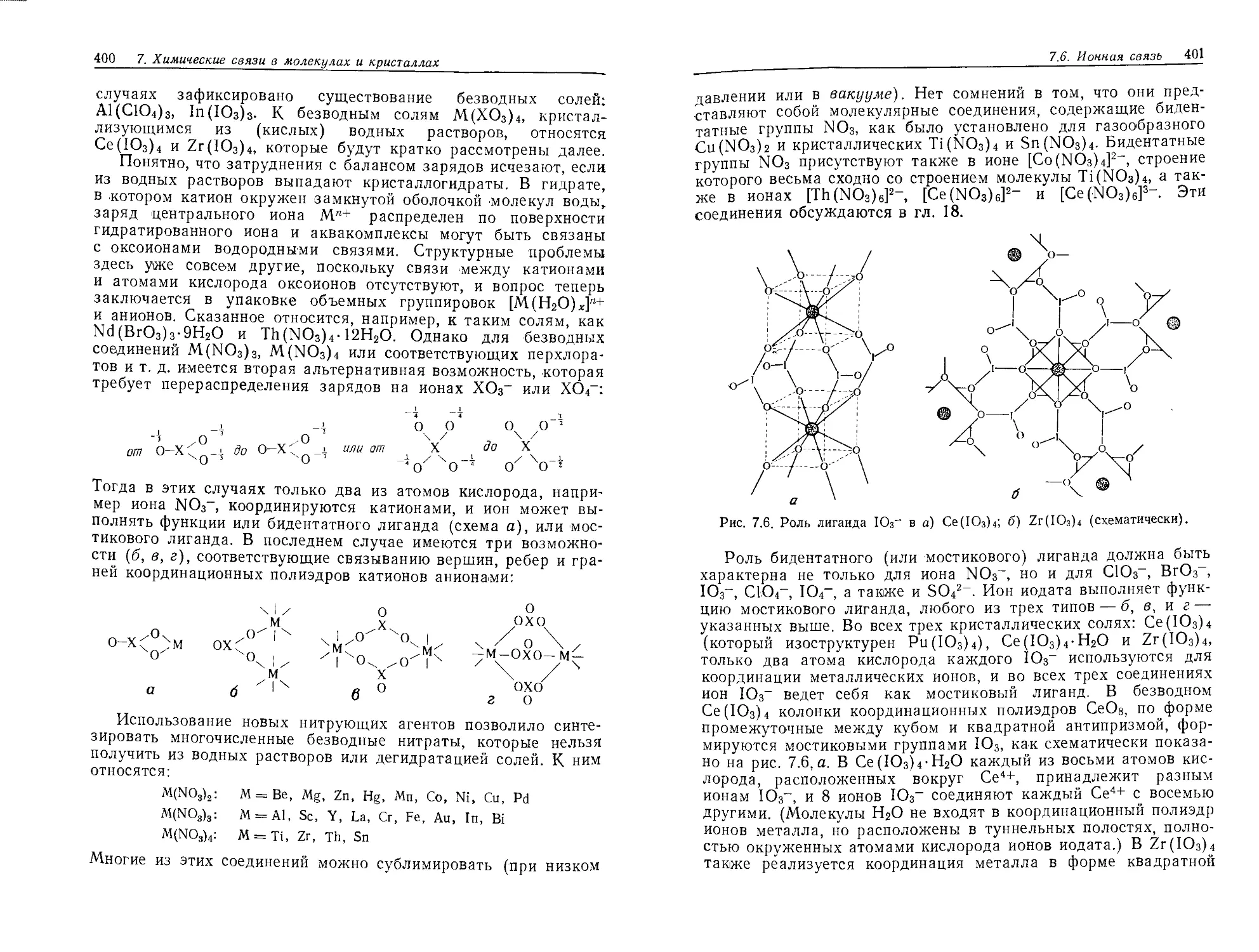
Текст
A. F. Wells
STRUCTURAL
INORGANIC
CHEMISTRY
Fifth Edition
А. Уэллс
СТРУКТУРНАЯ
НЕОРГАНИЧЕСКАЯ
ХИМИЯ
в 3-х томах
Том 1
Перевод с английского
д-ра хим. наук, проф. П. М. Зоркого,
канд. хим. наук Я- М. Нестеровой,
канд. хим. наук Ф. М. Спиридонова
и канд. хим. наук С. И. Троянова
под редакцией
чл.-корр. АН СССР М. А. Порай-Кошица
Clarendon Press ¦ Oxford
Москва «Мир» 1987
ББК 24.12
У 98
УДК 548
Уэллс А.
У 98 Структурная неорганическая химия: В 3-х т. Т. 1: Пер,
с англ. — М.: Мир, 1987. —408 с, ил.
Фундаментальный труд автора из Великобритании, выдержавший за рубежом
пять изданий, содержит наряду с общими принципами кристаллохимии неорга-
нических соединений конкретные данные о етруктуре огромного количества не-
органических соединений, что делает его ценным энциклопедическим изданием.
Большой фактический материал и современный теоретический уровень материа-
ла позволяют рекомендовать книгу как учебное пособие для студентов при изу-
чении неорганической химии, кристаллографии, минералогии.
В т. 1 русского издания вошла ч. I английского издания, посвященная изло-
жению теоретических основ структурной неорганической химии.
Для химиков-неоргаников, специалистов в области химии и физики твердого
тела, химической технологии, кристаллографов, а также студентов и аспирантов,
соответствующих специальностей.
1802000000—338
041@1)—87
'подписное издание
ББК 24.12
Редакция литературы по химии
МОНОГРАФИЯ
Александр Франк Уэллс
СТРУКТУРНАЯ НЕОРГАНИЧЕСКАЯ ХИМИЯ
Том 1
Научный редактор И. С. Беленькая. Младший редактор Н. П. Власова.
Художник Л. С. Гейнце. Художественный редактор М. Н. Кузьмина.
Технический редактор М. А. Страшнова. Корректор В. И. Киселева.
И Б № 6093
Сдано в набор 18.12.86. Подписано к печати 13.05.87. Формат бОХЭО'/ie. Бумага типограф-
ская имп. М> 1. Печать высокая. Гарнитура литературная. Объем 12,75 бум. л. Усл.
печ. л. 25,50. Усл. кр.-отт. 25,50. Уч.-изд. л. 25,57. Изд. № 3/4883. Тираж 6000 экз.
Зак. 752. Цена 4 р. 20 к.
ИЗДАТЕЛЬСТВО «МИР». 129820, ГСП, Москва, 11-110, 1-й Рижский пер., 2.
Московская типография № 11 Союзполиграфпрома при Государственном комитете СССР
по делам издательств, полиграфии и книжной торговли.
113105, Москва, Нагатинская ул., д. 1.
This book was originally published in the English lan-
guage by Oxford University Press, Oxford, England
© Oxford University Press, 1975, 1984
Reprinted (with corrections) 1986
© перевод на русский язык, «Мир», 1987
ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
В современной химии, особенно в неорганической, структурные
представления играют важнейшую роль. Ни разработка прин-
ципиальных проблем фундаментальной химии, ни решение боль-
шинства прикладных химических задач немыслимы вне углуб-
ленного познания всех аспектов строения вещества, и прежде
всего его геометрического строения, пространственного располо-
жения атомов. Все современные учебники и фундаментальные
книги по неорганической химии в том или ином виде использу-
ют результаты структурных исследований, накопленные за по-
следние десятилетия. Однако во многих (если не в большинст-
ве) случаях эти результаты остаются как бы «за скобками»:
они учитываются, но непосредственно не обсуждаются. Как
следствие этого многие аспекты и детали строения неорганиче-
ских веществ, в том числе иногда и те, которыми определяются
важные нюансы в их физико-химических свойствах, не доносят-
ся до читателя. Одна из главных задач книги А. Уэллса как
раз и заключается в восполнении этого пробела.
Хорошо известно, что наши сведения об атомно-пространст-
венном строении вещества мы получаем главным образом в ре-
зультате дифракционных и прежде всего рентгеноструктурных
исследований кристаллов. Систематизация этих данных, уста-
новление общих и частных закономерностей в строении кри-
сталлов, анализ зависимости строения кристаллов от их химиче-
ского состава и далее физико-химических свойств кристаллов
от их строения —это область кристаллохимии. Книгу А. Уэлл-
са, однако, нельзя рассматривать просто как фундаментальный
труд по кристаллохимии неорганических соединений. Термин
«структурная химия» значительно лучше передает его специфи-
ку. Дело не только и, пожалуй, не столько в том, что помимо
результатов рентгеноструктурных исследований автор привле-
кает данные электронографии газов, микроволновой и ИК-
спектроскопии, а эпизодически также и других физико-хими-
ческих методов, позволяющих делать предположительные за-
ключения о строении структурных единиц в группах соединений
«по аналогии». Важнее то обстоятельство, что монография
А. Уэллса написана в расчете на химика широкого профиля, не
имеющего специальной кристаллохимической подготовки.
Предисловие редактора перевода
Для того чтобы успешно использовать данные рентгено-
структурного анализа, читатель-химик, естественно, должен по-
лучить представление об общих концепциях, терминологии, ме-
тодах описания и интерпретации кристаллических структур,
применяемых в кристаллохимической литературе. Этим общим
вопросам автор посвящает первую часть своей книги, занимаю-
щую примерно одну четверть всего объема (эта часть целиком
составила т. 1 русского издания). При этом, однако, он стре-
мится по возможности ограничиться лишь самым необходимым
для последующего систематического описания и сопоставления
строения соединений различных химических классов, опуская
многие детали, общие положения и тем более математические
доказательства, относящиеся к теории пространственных групп
симметрии, топологии и геометрии сеток и полиэдров, теории
шаровых упаковок и другим общим концепциям кристаллохи-
мии. Некоторое увлечение автора «структурной топологией»
вполне объяснимо, поскольку ему принадлежат многочисленные
работы в этой области.
Вторая часть книги, двадцать две ее главы (т. 2 и 3 в рус-
ском переводе), содержит систематическое описание строения
молекул, молекулярных, олигомерных или бесконечно-полимер-
ных ионов и кристаллов соединений разных химических клас-
сов. Очередность изложения материала можно назвать класси-
ческой: это именно тот порядок, который принят в большинстве
учебников по неорганической химии. Просмотрев оглавление,
читатель убедится, что автор движется по группам периодиче-
ской таблицы Д. И. Менделеева: последовательно рассматрива-
ются соединения с участием водорода, галогенов, кислорода,
серы и других халькогенов, азота, фосфора и их аналогов по
группе и т. д. Такой порядок расположения материала делает
монографию, с одной стороны, очень удобным и нужным до-
полнением к учебникам по неорганической химии (особенно
полезным для аспирантов и соискателей степени кандидата на-
ук), с другой стороны, хорошим источником сведений о струк-
турных основах для научных работников — специалистов в той
или иной области неорганической химии. Каждая глава (или
группа глав) книги может служить фундаментом для разработ-
ки углубленных концепций о связи между реакционной способ-
ностью, строением и физико-химическими свойствами соответ-
ствующих классов соединений.
Вместе с тем монографию Уэллса было бы совсем непра-
вильно приравнять к «структурному справочнику с коммента-
риями». Пожалуй, лучше ее сущность отражает термин «струк-
турная энциклопедия».
Конечно, такой подход к изложению материала связан и с
известными издержками. Ведь однотипные кристаллические
Предисловие редактора перевода
структуры или даже просто одни и те же соединения, содержа-
щие несколько разных элементов, неизбежно попадают одно-
временно в несколько разделов книги, и автору приходится по
нескольку раз описывать одни и те же структуры или, в луч-
шем случае, давать многочисленные перекрестные ссылки.
Следует отметить и некоторую отстраненность автора от
современных теоретических концепций. Квантово-химические
представления он использует лишь на уровне теории поля ли-
гандов. Впрочем, такую позицию можно и понять: материал,
с которым А. Уэллсу приходится иметь дело, настолько широк,
что его детальное теоретическое обсуждение в рамках сущест-
вующих модельных концепций неизбежно привело бы к возник-
новению непреодолимых противоречий. Да и размер книги не
допускает ее дальнейшего «разбухания». Последнее относится
также к более детальному и последовательному отражению свя-
зи между строением и физико-химическими свойствами кри-
сталлических веществ.
Пятое издание «Структурной неорганической химии» опуб-
ликовано в 1984 г. В 1986 г. оно было переиздано с небольши-
ми поправками. Между тем экспрессность рентгеноструктурных
исследований за последние годы возросла в такой степени, что
общий объем информации в этой области за год возрастает
примерно на 30—40%. В этих условиях практически нереально
дать исчерпывающее дополнение о новом фактическом материа-
ле по кристаллическим структурам. В редакционных примеча-
ниях к отдельным главам книги мы ограничились ссылками на
советские обзорные работы, содержащие необходимые библио-
графические данные.
М. Порай-Кошиц
ПРЕДИСЛОВИЕ
Во введении к первому изданию книги A945 г.) мною было
высказано убеждение в том, что структурная сторона неоргани-
ческой химии до тех пор не будет иметь под собой твердой
почвы, пока сведения, получаемые при исследовании твердых
тел, не будут включаться в химию как ее неотъемлемая со-
ставная часть. Другими словами, далеко не достаточно просто
добавлять сведения о строении твердых тел к описанию свойств
элементов и их соединений, как это обычно делают при система-
тическом изложении неорганической химии. Поскольку резуль-
таты структурных исследований первоначально описываются на
языке кристаллографии, очень важно сделать их доступными
для широкого круга химиков. Именно эту задачу автор ставил
перед собой в первую очередь, и он надеется, что настоящее
издание книги даст возможность преподавателям химии позна-
комиться с рядом идей и с фактическим материалом, которые
могут быть использованы в процессе обучения. Однако несмот-
ря на то, что введение даже ограниченной по объему информа-
ции о строении твердых тел в курсы химии является весьма
желательным, настоящего понимания структур кристаллов и
взаимосвязи между различными структурами нельзя достичь без
освоения некоторых важных геометрических и топологических
представлений и концепций. Сюда относятся сведения о много-
гранниках, свойствах и симметрии периодических узоров, спо-
собах упаковки шаров одинакового или различного размера.
В связи с тем что для многих студентов составляет определен-
ную трудность представить трехмерные структуры по их дву-
мерным изображениям (и даже по стереоскопическим фотогра-
фиям), существенной частью обучения должно стать изучение
(а еще лучше изготовление) моделей.
Общий план изложения материала таков. В части I рас-
смотрены общие вопросы, в том числе те, о которых говорилось
выше. Эта часть задумана как введение к части II, составляю-
щей основную часть книги. Здесь систематическое описание
структурной химии элементов дано в соответствии с группами
периодической системы. По моему мнению, в результате много-
численных исправлений и добавлений изложенный материал
верно отражает состояние предмета на конец семидесятых го-
Предисловис
дов XX века. Разумеется, в книге с таким широким охватом
материала отдельные главы могли быть написаны и специали-
стами, более квалифицированными в данной области, чем ав-
тор. С другой стороны, многие из моих коллег неоднократно вы-
сказывались в пользу того, чтобы подобная книга была написа-
на именно одним автором, что обеспечивает единство стиля
изложения. Конечно, для некоторых читателей степень разрабо-
танности отдельных вопросов, получивших развитие в послед-
ние годы в связи с теоретическими или прикладными работами,
может показаться недостаточной. Так, например, для опреде-
ленных групп кристаллических неорганических веществ были
проведены тщательные исследования с целью установления
взаимосвязи между их структурой и физическими свойствами.
Некоторые типы кристаллических структур представляют инте-
рес в большей степени для кристаллографов, чем для химиков
(например, структуры сдвига, структуры несоразмерных фаз).
В книге, адресованной химикам, автор мог позволить себе лишь
бегло коснуться вышеупомянутых типов структур. Ведь в книге
сделана попытка составить обзор (в ряде случаев по необходи-
мости беглый) строения простых веществ и соединений не
только в твердом, но также и в газообразном и (очень кратко)
в жидком состоянии.
Настоящая монография — ни в коей мере не справочник по
структурам, хотя она и может быть использована на начальном
этапе поиска информации по определенному вопросу. Сущест-
венной составной частью процесса обучения студентов должно
стать развитие в них критического отношения к печатному сло-
ву (включая текст данной книги). Они должны научиться ра-
зыскивать оригинальную литературу и, работая с ней, уметь
оценивать справедливость выводов, сделанных на основании
экспериментальных данных. Многочисленные указания на ли-
тературу в части II отсылают, как правило, к последней работе
по данному вопросу. В целях экономии места для названий на-
учных журналов введены их общепринятые сокращения.
В формульном указателе систематический принцип соблю-
ден не полностью, поскольку для неорганических веществ,
в формулах которых должны сохраняться приемлемые с хими-
ческой точки зрения группировки атомов, такой способ не был
бы оптимальным. Содержание предметного указателя ограничи-
вается названиями минералов и органических соединений, а так-
же такими терминами и понятиями, которые затруднительно
отыскать по оглавлению книги.
В ходе написания этой книги, появление которой неизбежно
было связано с обращением к работам и идеям других исследо-
вателей, в том числе работающих в смежных областях знаний,
10 Предисловие
у меня состоялись плодотворные дискуссии с коллегами, из кото-
рых я бы особо отметил Б. Чемберлена. Хочется поблагодарить
Б. Бэгли и редактора журнала Nature (Лондон) за разрешение
воспроизвести рис. 4.3, а также X. Эванса и издательство
«Джон Уайли» за рис. 11.5, в, 11.7, 11.10, 11.11 и 11.13,6;
X. Шнеринга за рис. 19.4,(9; Г. Кокотайло и У. Мейера за
рис. 23.27. Считаю приятным долгом поблагодарить мою жену
за ее помощь и поддержку в течение многих лет.
Сторс, Коннектикут 1982
А. Уэллс
Часть 1
1. ВВЕДЕНИЕ
В этой вступительной главе мы намерены обсудить в общих
чертах ряд вопросов, выявляющих суть предмета книги, а так-
же причины, по которым именно этим вопросам уделено наи-
большее внимание в последующих главах.
Известно более ста химических элементов, и если бы каж-
дый элемент мог образовать бинарные соединения с любым
другим, то получилось бы приблизительно пять тысяч таких со-
единений. На самом деле не все элементы образуют соединения
друг с другом, но в то же время некоторые элементы образуют
более одного бинарного соединения. Это справедливо в отноше-
нии многих пар металлов; вот несколько произвольно выбран-
ных примеров:
YB2, YB4, YB6> YBI2 и YB66
CrF2> CrF3, CrF4, CrF5, CrF6 и Cr2F5
CrS, Cr7S8> Cr6Se, Cr3S4 и Cr2S3
Количество только бинарных соединений весьма значительно,
и существует бесконечно большое число соединений, построен-
ных из атомов трех и более элементов. Кажется логичным сна-
чала сосредоточить внимание на простых соединениях, таких,
как бинарные галогениды, халькогениды и т. д., поскольку едва
ли можно понять структуры более сложных соединений, если не
разобраться в строении более простых. Однако тут же следует
отметить, что простота химических формул может быть обман-
чивой; так, структуры многих соединений с простой химической
формулой оказываются весьма сложными и создают значитель-
ные проблемы для понимания природы химических связей в них.
В частности, структуры некоторых элементов (например, В или
красного Р) оказались неожиданно сложными. С другой сто-
роны, существуют соединения со сложными формулами, имею-
щие структуры, основанные по существу на очень простых моде-
лях; таковы, например, описанные в гл. 3 многочисленные струк-
туры, основой которых служит алмазная сетка, т. е. один из
12
1. Введение
простейших трехмерных каркасов. Мы будем исходить из про-
стых основополагающих структурных посылок, учитывая, что в
природе простоте отдается предпочтение перед сложностью,
а также исходя из того, что структуры легче понять, если све-
сти их описание к простейшим представлениям.
1.1. Важное значение твердого состояния
в неорганической химии
Поскольку первая часть книги в значительной мере посвящена
вопросам, непосредственно касающимся твердого состояния, це-
лесообразно отметить несколько общих положений (к некото-
рым из них мы вернемся позже в этой же главе).
1. Большинство элементов (почти 90%) при обычных темпе-
ратурах твердые; это справедливо также и для большинства не-
органических соединений. Известно, правда, что значительная
часть важных реагентов — это жидкости, газы или растворы, но
в целом они составляют малую долю неорганических соедине-
ний. Кроме того, хотя обычно химические реакции протекают в
растворе или в газообразном состоянии, в большинстве случаев
либо исходные реагирующие вещества, либо продукты, либо и
те и другие являются твердыми телами. Химические реакции
охватывают широкий круг взаимодействий: от реакций между
изолированными атомами или отдельными группами атомов
(молекулами или комплексными ионами) и реакций, в которых
твердое тело разрушается или возникает, до таких процессов,
как коррозия металлов, когда твердый продукт образуется пря-
мо на поверхности твердого реагента. Во всех случаях, когда
кристаллическое вещество образуется или разрушается, энерге-
тический баланс реакции включает энергию решетки кристалла.
Обычный цикл Борна — Габера для реакции между твердым
натрием и газообразным хлором с образованием твердого NaCl
дает простой пример взаимосвязи между теплотой диссоциации,
энергией ионизации и сродством к электрону, энергией решетки
и теплотой реакции.
2. Органические соединения (не полимеры) существуют как
конечные (по размерам) молекулы в любом агрегатном со-
стоянии. Из этого следует, во-первых, что структурная задача
здесь состоит только в выявлении структуры конечной молеку-
лы и, во-вторых, что она может быть решена путем изучения
структуры вещества как в твердом, так и в жидком или паро-
образном состоянии. Если не считать таких возможных геомет-
рических изменений, как вращение вокруг ординарных связей,
и небольших изменений размеров молекул из-за температурных
различий, основная топология и геометрия молекул могут быть
получены в любом агрегатном состоянии. Некоторые неоргани-
1.1. Значение твердого состояния в неорганической химии
13
ческие соединения также существуют в виде конечных молекул
и в твердом, и в жидком, и в газообразном состояниях, напри-
мер многие простые молекулы, образованные неметаллами
(НС1, СО2), а также некоторые соединения металлов (Snl4,
Сг(СО)б). Точную информацию о строении простых молекул,
органических или неорганических, дают исследования паров ме-
тодами спектроскопии и дифракции электронов, но эти методы
неприменимы к очень сложным молекулам. Поскольку кристал-
лические тела имеют периодическое строение, они действуют
как дифракционные решетки для рентгеновских лучей и нейтро-
нов, и в принципе дифракционным изучением твердого вещества
можно определить структуру любой молекулы какой бы то ни
было сложности.
В противоположность органическим и небольшому числу
вышеупомянутых неорганических соединений огромное большин-
ство твердых неорганических веществ имеет структуры, в кото-
рых атомы связаны в группы, бесконечно протяженные в одном,
двух или трех измерениях. Такие структуры характерны только
для твердого состояния и неизбежно должны разрушаться, ког-
да кристалл растворяют, плавят или испаряют. Это означает,
что изучение кристаллических структур расширило сферу
структурной химии далеко за пределы изучения конечных групп
атомов, которым ограничивалась классическая стереохимия,
включив все периодические расположения атомов, найденные в
кристаллических твердых телах.
Поскольку огромное большинство неорганических соедине-
ний является соединениями одного или более металлов с неме-
таллами и поскольку большинство из них при обычных усло-
виях находится в твердом состоянии, наибольшая часть струк-
турной неорганической химии относится именно к твердым те-
лам. О структурной химии соединений металлов, лежащей вне
пределов твердого состояния, можно говорить только по отно-
шению к молекулам и многоатомным ионам, которые не разла-
гаются при растворении, плавлении или испарении. При этом
маловероятно, что изучение жидкостей каким-либо методом мог-
ло дать достаточно точную структурную информацию, а изуче-
ние молекул в газовой фазе методами дифракции электронов
или спектроскопии возможно лишь в том случае, если молекулы
не слишком сложны. Тем не менее важно проводить различие
между твердыми соединениями, которые можно испарить без
разложения, и соединениями, которые существуют только как
твердые тела. Ведь это означает, что само их существование за-
висит от таких типов взаимодействия, которые возможны толь-
ко в твердом состоянии. Многие простые галогениды и оксиды
металлов были изучены в парах, так же как и некоторые соли
(например, LiBeF3, NaAlF4, LiBO2, Cu(NO3J и K2SO4). По-
14
1. Введение
скольку в большинстве случаев структурные единицы, присущие
пару, не присутствуют в кристалле, информация, полученная
таким образом, дополняет данные исследования твердого ве-
щества. С другой стороны, маловероятно, чтобы многие простые
соединения состава МтХ„ существовали в парообразном состоя-
нии, так как конкретное соотношение атомов металла и неме-
талла реализуется только при бесконечном множестве атомов,
между которыми осуществляется взаимодействие вполне опре-
деленного типа. Кристаллический Cs2O строится из бесконечных
слоев, но тем не менее его пары состоят из молекул Cs2O. Од-
нако для существования таких оксидов, как Cs3O и Cs7O, необ-
ходимо наличие протяженных систем связей металл — металл,
которые невозможны в молекуле конечных размеров.
Большие и важные группы соединений, которые могут су-
ществовать только в кристаллическом состоянии, включают
комплексные галогениды и оксиды, «кислые» и «основные» соли
и гидраты. В частности, один из важных результатов изучения
кристаллических структур состоит в признании того, что не-
стехиометрические соединения не являются редкостью, как это
некогда полагали. В самых общих чертах нестехиометрическое
соединение можно определить как твердую фазу, которая устой-
чива в определенной области (по составу). С одной стороны,
это определение охватывает все случаи «изоморфного замеще-
ния» и все виды твердых растворов, включая такие, состав ко-
торых покрывает всю область от одного чистого компонента до
другого. В качестве другого предельного случая можно ука-
зать на фосфоры (люминесцентные ZnS или ZnS—Си), которые
обязаны своими свойствами неправильному размещению и (или)
внедрению примесных атомов, действующих как «электронные
ловушки», а также окрашенные галогениды (щелочных и щелоч-
ноземельных металлов), в которых отдельные положения гало-
генидных ионов заняты электронами (F-центры); эти дефекты
присутствуют в очень малой концентрации, часто в пределах от
10~6 до 10~4. Для химика-неорганика больший интерес пред-
ставляет тот факт, что многим простым бинарным соединениям
свойственны диапазоны составов, зависящие от температуры и
способа приготовления. Нестехиометрия подразумевает струк-
турную неупорядоченность, а часто и присутствие того или ино-
го элемента более чем в одном валентном состоянии; она мо-
жет приводить к возникновению полупроводимости и каталити-
ческой активности. Примеры нестехиометрических бинарных со-
единений включают много оксидов и сульфидов, часть гидридов
и промежуточные твердые растворы внедрения атомов С и N
в металлы. Более сложными примерами могут служить различ-
ные комплексные оксиды со слоистыми и каркасными структу-
рами, такие, как бронзы (разд. 13.8). Существование зеленого
/./. Значение твердого состояния в неорганической химии
15
п черного NiO с совершенно различными физическими свой-
ствами, недавнее получение впервые стехиометрического FeO и
гот факт, что Fe6S7 представляет Fe не с избытком S, а с недо-
статком Fe (т. е. Fei_.vS), — все это вопросы, имеющие очевид-
ное значение для химика-неорганика.
Составы и свойства, а фактически и само существование не-
стехиометрических соединений могут быть поняты только исхо-
дя из их структур. Это особенно очевидно в тех случаях, когда
нестехиометричность является результатом включения примес-
ных атомов или молекул в кристаллическую структуру. Это мо-
жет происходить в кристаллах, построенных из молекул конеч-
ных размеров или содержащих крупные ионы конечных разме-
ров. Например, если Pd2Br4[As(CH3K]2 кристаллизуют из диок-
сана, кристаллы могут удерживать нестехиометрические коли-
чества растворителя в каналах между молекулами, и эти мо-
лекулы растворителя могут быть удалены без разрушения
структуры. В минерале берилле (разд. 23.12.5) крупные цикли-
ческие ионы (SieOisI2" упаковываются в колонки, и в каналах
может быть окклюдирован гелий. Некоторые кристаллы со
слоистыми структурами могут поглощать вещество между
слоями. Примеры включают слоистые соединения графита
(разд. 21.4.4) и глинистые минералы. Необычный тип слоистой
структуры представляет структура Ni(CNJ-NH3, в которой
между слоями могут располагаться молекулы Н2О, СбНб,
C6H5NH2 и т. д. (рис. 1.9, а). Структуры такого рода называют
клатратами; примеры их приведены в разд. 1.5.1.
3. Огромная по объему информация о расположении атомов
в кристаллах и в особенности подробная информация о длинах
связей и валентных углах, которую дает изучение кристалличе-
ских структур, представляют собой исходный материал для тео-
ретика, интересующегося проблемой химических связей и их со-
отношения с физическими свойствами.
Все элементы и соединения можно перевести в твердое со-
стояние при соответствующих условиях температуры и давле-
ния; свойства и структуры твердых тел показывают, что мы
должны выделять четыре предельных типа связи:
а) полярную (ионную) связь в кристаллических солях, та-
ких, как NaCl или CaF2;
б) ковалентную связь в таких молекулах, как, например, С12,
Sg и т. д., которые существуют и в кристаллах этих элементов,
и в их парах, и ковалентную связь в таких кристаллах, как ал-
маз, в которых длина связи С—С та же, что и в молекулах ти-
па Н,С—СН3;
в) металлическую связь в металлах и интерметаллических
соединениях (сплавах), которая является причиной типичных
для них оптических и электрических свойств;
16
/. Введение
г) гораздо более слабую вандерваальсову связь между хи-
мически насыщенными молекулами, подобными только что упо-
мянутым, о чем свидетельствуют значительно большие расстоя-
ния между атомами разных молекул по сравнению с расстоя-
ниями внутри таких молекул. В кристаллическом С12 длина
:вязи 1,99 А, а кратчайшее расстояние между атомами С1 раз-
ных молекул 3,34 А. Вандерваальсова связь ответственна за си-
лы сцепления в жидком и твердом аргоне или хлоре и вообще
между нейтральными молекулами, цепями и слоями в многочис-
ленных кристаллах, структуры которых описаны далее.
Хотя выделение четырех предельных типов связи является
удобным и общепринятым, следует понимать, что связи эти в чи-
стом виде (если даже принять, что термин «чистый» имеет яс-
ный физический или химический смысл) встречаются относи-
тельно редко; особенно это относится к первым двум типам.
Связи преимущественно ионного типа имеют место в солях, ко-
торые образуются при соединении самых электроположительных
элементов с наиболее электроотрицательными, например между
катионами и атомами О комплексного иона в солях типа NaNO3.
Ковалентные связи имеют место в элементах-неметаллах и со-
единениях, содержащих неметаллы, которые незначительно раз-
личаются по «электроотрицательности» (разд. 7.2). Однако гро-
мадное большинство связей в неорганических соединениях долж-
но, по-видимому, рассматриваться как промежуточные между
этими крайними типами. Например, большинство связей между
металлами и неметаллами имеет отчасти ионный и отчасти ко-
валентный характер, и в настоящее время нет достаточно удов-
летворительного способа описания таких связей.
Вполне очевидно, что во многих кристаллах присутствуют
связи двух или более типов, совершенно различных по своим
характеристикам. В молекулярных кристаллах, содержащих не-
полярные молекулы, связи внутри молекулы могут быть су-
щественно ковалентными (например, S6 или S8) или промежу-
точной ионно-ковалентной природы (например, SiF4), а связи
между молекулами являются вандерваальсовыми. В кристал-
лах, содержащих комплексные ионы, связи внутри комплексно-
го иона могут приближаться к ковалентным, в то время как
связи между комплексным ионом и катионами (или анионами)
имеют преимущественно ионный характер, как это имеет место
в уже цитированном случае NaNO3. В других кристаллах про-
являются дополнительные взаимодействия между некоторыми
атомами, не столь существенные для устойчивости кристалла,
как в рассмотренных выше случаях. Примером могут служить
связи металл — металл в диоксидах со структурой рутила —
структурой, которая во многих случаях устойчива и в отсутст-
вие таких связей.
1.1. Значение твердого состояния в неорганической химии 17
Необходимо также принять во внимание и некоторые другие
типы взаимодействий, которые, будучи более слабыми, чем ион-
ные и ковалентные связи, тем не менее важны как определяю-
щие строение или существенно влияющие на структуры больших
групп кристаллических соединений; таковы, например, водо-
родные связи (Н-мостнки) и связи с переносом заряда. Водо-
КЧ 2
КЧ 3
КЧ J
КЧ 4
КЧ 6
Рис. 1.1. Взаимные размещения одинакового числа атомов двух сортов КЧ =
= 2 (а), 3 (б), 2 (в), 3 (г), 4 (д), 6 (е).
родные связи распространены очень широко и обсуждаются бо-
лее детально в последующих главах.
4. Вероятно, здесь излишне подчеркивать, что в общем не
существует прямой связи между химической формулой твердо-
го вещества и его структурой. Например, только первый член
ряда
Ш
1
Aul
2
Cul
4
Nal
6
Csl
AX
(КЧАпо Х)*
при обычных условиях состоит из отдельных молекул. Все дру-
гие соединения при обычных температурах являются твердыми
веществами и состоят из бесконечных множеств атомов А и X,
в которых атомы металла связаны с двумя, четырьмя, шестью и
восемью атомами X соответственно. Рис. 1.1 демонстрирует не-
КЧ — координационное число.
2—752
18 /. Введение
которые примеры систем состава АХ. Две из них построены как
конечные группы: а — димер, б — тетрамер; остальные представ-
ляют собой бесконечные расположения: в — одномерное, г и д —
двумерные, е — трехмерное. Число способов реализации систем
\ /"
и
Л
d с
X
Рис. 1.2. Некоторые способы реализации отношения ЗХ : А в конечных и беско-
нечных группировках атомов, а—г — конечные группы АХ3, АХ2 и ЛХ4, А2Х6 и
А3Х9; д—ж— бесконечные линейные системы; з — бесконечная двумерная си-
стема; и — бесконечный трехмерный комплекс.
с заданным соотношением атомов может быть значительным;
на рис. 1.2 приводятся некоторые системы состава АХ3.
Конкретные примеры для всех систем, приведенных на
рис. 1.1 и 1.2, даны в последующих главах. В верхней части
табл. 1.1 перечислено семь разных способов, с помощью которых
в кристаллических пентагалогенидах достигается соотношение
F: М, равное 5:1; этот список может быть расширен, если
1.1. Значение твердого состояния в неорганической химии 19
включить анионы (МХ5)"~, как будет видно из структур комп-
лексных галогенидов в гл. 10. И наоборот, мы можем видеть,
как возникают различные формулы МХП при одном и том же
координационном числе атома М. Для тетраэдрической и окта-
эдрической координации этот вопрос рассматривается несколь-
Таблица 1.1. Структуры кристаллических пентагалогенидов
Галогеыиды
РВг5
РС15
NbCl5
MoF5
BiF5
РаС15
P-UF5
КЧ ме-
таллл
4
4 и 6
6
6
6
7
8
Структурные единицы в кристалле
(РВг4) + Вг-
(РС14) + (РС16)-
Nb2Cl10
Mo4F20
Цени (BiF5)n
Цепи (РаС15)п
Трехмерная ионная структура
Примеры трехшапочной тригонально-призматическои координации
АХэ (указаны обобщест-
вленные элементы
структуры)
_
2 ребра
2 грани
2 ребра, 4 вершины
2 грани, 4 вершины
2 грани, 6 ребер
2 грани, 12 ребер
(см., однако, разд. 6.8)
X : Л
9
7
6
5
4
3
2
Примеры
[Nd(H2O)9](BrO3K, K2ReH9
K2PaF7
[Sr(H,ON]Cl2
LiUF5
NII4BiF4, NnNdF4
UCI3
PbCl2
ко детальнее в гл. 5; примеры, приведенные в табл. 1.1, могут
представлять интерес как примеры менее обычного координа-
ционного числа — девять. Для правильного понимания смысла
формул неорганических соединений, очевидно, необходимо опе-
рировать в трех, а не только в двух измерениях и в понятиях
как конечных, так и бесконечных групп атомов.
5. Химик привык иметь дело с изомерией (разд. 2.3), т. е.
с различиями строения конечных молекул или комплексных ио-
нов, имеющих одинаковый химический состав. Если кроме ко-
нечных групп атомов возможны бесконечные расположения, ве-
роятность альтернативных атомных расположений, как это с оче-
20
1. Введение
видностью следует из рис. 1.1 и 1.2, увеличивается весьма зна-
чительно.
Элемент (или соединение) называют полиморфным, если он
(оно) образует две или более кристаллические фазы, разли-
чающиеся атомным расположением. Более ранний термин алло-
тропия используется и сейчас для того, чтобы обозначить раз-
личные «формы» элементов; но, за исключением особого слу-
чая О2 и О3, аллотропы являются просто полиморфными моди-
фикациями. Полиморфизм элементов и соединений — скорее
правило, чем исключение, и структурная химия любого элемен-
та или соединения включает структуры всех его полиморфных
модификаций, точно так же как понятие молекулы включает
структуры ее изомеров. Различия между структурами поли-
морфных модификаций колеблются от таких очень незначи-
тельных, как изменение ориентации молекулы или иона от фик-
сированной до произвольной (или полного вращения) в высо-
котемпературной форме вещества (примерами могут служить
кристаллический НС1, соли, содержащие NH4+, NO3~, CN-
и другие сложные ионы) или как «-р-изменения форм SiO2, до
таких больших различий, как перестройка всего кристалла (по-
лиморфные модификации С, Р, SiO2 и т. д.).
Первоначально единственной переменной при изучении поли-
морфных модификаций была температура; вещество называ-
ют энантиотропным, если имеет место полиморфный переход
при определенной промежуточной температуре, или монотроп-
ным, если при атмосферном давлении одна форма устойчива
при всех температурах. Обширная работа Бриджмена показа-
ла, что многие элементы (и соединения, например, лед) испы-
тывают структурные изменения и под давлением, причем эти
изменения были обнаружены по отсутствию непрерывности в та-
ких физических свойствах, как удельное сопротивление и сжи-
маемость. В некоторых случаях структуры, характерные при
высоком давлении, могут быть сохранены путем охлаждения в
жидком азоте и изучены при атмосферном давлении с помощью
обычных рентгеновских методов. В последние годы изучение по-
лиморфных модификаций при высоком давлении в значительной
степени продвинуто благодаря использованию новых приборов
(например, тетраэдрической наковальни), которые не только
увеличивают диапазон достижимых давлений, но позволяют
также проводить рентгенографическое (или нейтронографиче-
ское) исследование фазы непосредственно в процессе изменения
давления. Исследования галогенидов и оксидов в добавление к
изучению элементов дали много новых примеров полиморфиз-
ма; некоторые из них описаны в последующих главах.
Выше мы отмечали, что некоторые полиморфные модифика-
ции, возникающие при высоких давлениях, не возвращаются к
1.2. Структурные формулы неорганических соединений 21
своей обычной форме при понижении давления. Многие высо-
котемпературные модификации не возвращаются к низкотемпе-
ратурной фазе при охлаждении ниже температуры перехода,
о чем свидетельствует тот факт, что многие высокотемператур-
ные модификации найдены в качестве минералов. Необрати-
мость полиморфных изменений, по-видимому, является резуль-
татом того, что энергия активации, связанная с процессами,
включающими коренное изменение расположения атомов, мо-
жет быть значительной, несмотря на различие между энергиями
решетки двух полиморфных модификаций.
Члены семейства родственных структур, образование кото-
рых зависит от механизма роста кристаллов, называются поли-
типами. Они не являются обычными полиморфными модифика-
циями и возникают только у соединений, имеющих определен-
ные типы структуры. Наиболее известными примерами являют-
ся SiC, Cdl2, ZnS и некоторые комплексные оксиды и особенно
ферриты, которые в дальнейшем будут рассмотрены более
детально.
6. Когда атомы связываются вместе с образованием конеч-
ных или бесконечных группировок, могут возникать трудности
из-за несовместимости требований со стороны различных ато-
мов, обусловленных их размерами или предпочтительными ва-
лентными углами. Для конечных групп атомов существование
этой проблемы хорошо известно; она наглядно проявляется при
работе с масштабными моделями молекул и комплексных ио-
нов. Однако в трехмерных структурах возникновение аналогич-
ных, но более тонких геометрических и топологических ограни-
чений принимается во внимание гораздо реже, хотя именно с
такими ограничениями могут быть связаны некоторые пробле-
мы, на первый взгляд представляющиеся чисто химическими по
своей природе. В качестве примеров мы можем привести отно-
сительную устойчивость ряда оксосолей (например, ортобора-
тов и ортосиликатов щелочных металлов), кристаллизацию со-
лей из водных растворов в безводном состоянии или в виде
гидратов и поведение нитрат-иона в качестве бидентатного или
монодентатного лиганда. Мы вкратце еще вернемся к этой теме
позже в этой главе и рассмотрим ее более подробно в гл. 7.
1.2. Структурные формулы неорганических соединений
Элементный анализ дает относительное число атомов различных
элементов в соединении; он устанавливает «эмпирическую»
формулу. Простейший тип структурных формул указывает, как
атомы связаны друг с другом, и к этой простой топологической
картине может быть добавлена информация, описывающая гео-
метрию системы. Характер структурных формул зависит от сте-
22
1. Введение
пени связывания атомов. Если соединение состоит из конечных
молекул, необходимо знать молекулярную массу и затем опре-
делить топологию и геометрию молекулы:
HNO >- H2N2O2 >- НО—N=N— ОН
(элементный
анализ)
(молекуляр-
ная масса)
ш/хш <>кон<3 И] урация
(по данным ИК- и
КР-спектроскопии)
длины связей
и углы меж-
ду связями
Если атомы (в твердом теле) образуют бесконечные одно-, дву-
или трехмерную системы, термин молекулярная масса не имеет
смысла и структурная формула должна описывать некоторое
характерное расположение атомов, которое при повторении
воспроизведет расположение, найденное в кристалле. Повто-
ряющуюся единицу бесконечной одномерной системы легко най-
ти, отметив точки, в которых модель повторяется:
(—А-+-Х—
Повторяют, аясЯ
единица
АХ
АХ2
А :
Х2
"A'f
XV
А"
Х-,
Полное описание цепи требует такой же метрической информа-
ции, как и в случае конечных групп. Нелишне будет отметить,
что если учитывается геометрия цепи, т. е. точное пространст-
венное расположение атомов в кристалле, то повторяющаяся
единица (кристаллографическая) может оказаться крупнее, чем
простейшая «химическая». Кристаллографическая повторяю-
щаяся единица представляет расположение атомов, которое вос-
производит рассматриваемую структуру при повторении в той
же ориентации, т. е. с помощью простого переноса в одном, двух
или трех направлениях. Химическая повторяющаяся единица не
связана с ориентацией. Это различие показано на рис. 1.3, а
для цепи HgO. Химическая повторяющаяся единица состоит из
одного атома Hg и одного атома О; если же рассматривать гео-
метрическую конфигурацию (плоской) цепи, то выявляется по-
вторяющаяся единица, содержащая 2Hg + 2O. Дополнительны-
ми примерами могут служить формы АХ3-цепей, создаваемых
гетраэдрическими группами АХ4 с двумя общими вершинами
(Х-атомы) (разд. 23.12.5), одна из них включена в рис. 1.3,6.
Аналогичное рассмотрение применяется к структурам, про-
тяженным в двух или трех измерениях. Повторяющейся едини-
цей двумерной модели является элементарная ячейка, которая
1.2. Структурные формулы неорганических соединений
23
воспроизводит бесконечную модель в результате переноса в на-
правлениях двух (непараллельных) осей. Одна из кристалличе-
ских форм As2O3, построенная из бесконечных слоев, показана
на рис. 1.4, а; элементарная ячейка выделена прерывистыми ли-
ниями. Модель получается из групп AsO3, делящих свои ато-
мы О с тремя аналогичными группировками; иначе говоря, по-
вторяющейся единицей является As(Oi/2b- Эти единицы ориен-
, Химически!
роИторяющ,
¦ся единица
к
О
повторяли1сяс-л единица
Крастаплогрсфичеехоя
повторяющаяся еОичии, а
лоЗ/й'сюяющаяся
единица
Рис. 1.3. Повторяющиеся единицы в цепях.
тированы в двух направлениях с образованием бесконечного
слоя; в результате кристаллографическая повторяющаяся еди-
ница (которая должна воспроизводить модель путем простого
переноса в двух направлениях) содержит две такие единицы
As(Oi/2h, "ли As2O3.
Кристаллографическая повторяющаяся единица трехмерной
модели — параллелепипед, содержащий представительный на-
бор атомов, который при повторении в направлении его ребер
образует (потенциально бесконечный) кристалл. Как и в случа-
ях одно- и двумерной моделей, эта элементарная ячейка может
содержать и обычно содержит более чем одну базисную «хи-
мическую» единицу (соответствующую простейшей химической
формуле).
Здесь могут быть полезны следующие замечания (они рас-
ширены в последующих главах). В принципе выбор ячейки в
кристаллической структуре неоднозначен. Но если присутству-
ют элементы симметрии, то принимается определенная догово-
ренность относительно выбора осей (направлений ребер эле-
24
/. Введение
ментарной ячейки). Например, кристаллический NaCi имеет
кубическую симметрию (см. гл. 2), и поэтому структуру соот-
носят с кубической элементарной ячейкой. Эта ячейка содержит
4 NaCl, но структура может быть описана и с помощью ячеек,
содержащих 2 NaCl и 1 NaCl; эти возможные ячейки для струк-
туры NaCl иллюстрируются на рис. 6.3 (разд. 6.1). Иногда удоб-
но выбирать разное начало координат; это означает, что, пе-
ренося ячейку в направлении одной или большего числа осей,
ЛУ
о
As^
I
О
- - о —,
As.
О
As
C4s-°'
I
— О
А?
О
.As.
О
As
.As'
I
О
As
I
О
Рис. 1.4. а — различный выбор элементарной ячейки в слоистой структуре
A.s2O3; б — проекция элементарной ячейки структуры, содержащей четыре
атома.
необязательно помещать начало координат в атоме структуры.
Например, элементарная ячейка, проекция которой изображе-
на на рис. 1.4, а, не имеет атома в начале координат, но она
более удобна, чем ячейка, показанная пунктирными линиями,
так как для двух эквивалентных атомов А она дает координа-
ты (±'7з2/з), а не @ 0) и B/3 7з).
Если атомы располагаются в вершинах, на ребрах или гра-
нях элементарной ячейки, могут возникнуть затруднения при
увязке числа атомов, показанных на чертеже, с химической фор-
мулой (см., например, ячейку на рис. 1.4, а, контуры которой
нарисованы штриховыми линиями). Чтобы избежать эти труд-
ности необходимо лишь помнить, что содержимое ячейки вклю-
чает все атомы, центры которых лежат внутри ячейки, а ато-
мы, лежащие в вершинах, на ребрах или гранях, считают сле-
дующим образом:
Элементарная ячейка двумерной модели
атом в вершине принадлежит 4 ячейкам
атом на ребре принадлежит 2 ячейкам
Элементарная ячейка трехмерной модели
атом в вершине принадлежит 8 ячейкам
атом на ребре принадлежит 4 ячейкам
атом на грани принадлежит 2 ячейкам
1.2. Структурные формул/л неорганических соединений
25
С другой стороны, в каждом случае содержимое ячейки может
быть показано штриховкой той части каждого атома, которая
целиком лежит внутри ячейки (рис. 1.4,6).
Каждый атом, показанный на проекции, повторяется выше
и ниже плоскости рисунка на расстоянии с, где с — период по-
вторения в структуре вдоль направления проецирования. На
рис. 1.5 представлена проекция куба, содержащего атом в цент-
ре, на его основание (объемно-центриро-
ванная кубическая структура). Атом А
имеет 8 равноудаленных соседей в вер-
шинах куба, так как атомы с высотой 0
(т. е. в плоскости чертежа) повторяют-
ся на высоте 1 (в ячейках, отстоящих
на расстоянии с). Аналогичным обра-
зом атом В имеет такое же расположе-
ние восьми ближайших соседей.
Чтобы упростить изображение струк-
туры, обычно принято показывать сово-
купность ближайших соседей (коорди- Рис. L5. проекция струк-
национную группу) в виде полиэдра. туры с объемноцентриро-
Так, например, проекция одной из форм ванной решеткой (А и
ТЮг — структура рутила — может быть в — атомы одного и того
изображена как а или б на рис. 1.6. На же с°Рта)-
рис. 1.6, а сплошными линиями указаны
связи Ti—О, и из координат атомов можно заключить, что каж-
дый атом Ti имеет октаэдрическую координационную группу из
шести атомов О. На рис. 1.6,6 линии представляют ребра ок-
таэдрической координационной группы. Поскольку важно, что-
бы по крайней мере два самых типичных координационных по-
лиэдра было легко узнать при рассмотрении в разных ориента-
циях, мы иллюстрируем некоторые проекции тетраэдра и окта-
эдра в начале гл. 5.
Рис. 1.6. Проекция рутила (ТЮ2), демонстрирующая: а — атомы и их высоты;
б — октаэдрические координационные группы ТЮ6.
26
/. Введение
Рис. 1.7. Проекция вдоль
винтовой оси 4-го поряд-
ка. Атом на высоте 3U
связан с атомом, распо-
ложенным на единицу
выше по вертикали, чем
атом на высоте 0.
Атомы, расположенные вокруг винто-
вых осей 3, 4 или 6-го порядка, проеци-
руются вдоль оси как треугольник, квад-
рат или шестиугольник соответственно.
Для того чтобы показать, что совокуп-
ность атомов не образует замкнутый
цикл, а располагается по спирали, пер-
пендикулярной плоскости чертежа, мож-
но выделить разрыв парой линий (рис.
1.7).
Вероятно, излишне подчеркивать, что*
формула должна по возможности бли-
же соответствовать структуре соедине-
ния, т. е. молекуле или другой присутст-
вующей группировке, как, например,
Na3B3O6 для метабората натрия, кото-
рый содержит циклические ионы В3О63~.
В этой связи представляют интерес соединения, содержащие
атомы металла в двух степенях окисления. Если степени окис-
ления отличаются на единицу, формула не сводится к более
простой форме (например, Fe3O4; Cr2F5); но если они отлича-
ются на две единицы, может показаться, что формула соответ-
ствует промежуточной степени окисления:
Эмпирическая формула Структурная формула
GaCl2 Ga^Ga111^)
PdF3 Pdn(PdIVF6)
CsAuClg Cs^Au1^) (AumCl4)
(NH4JSbGe (NH4L(SbHiCIe) (SbVCle)
Исследования кристаллических структур уже привели к пере-
смотру многих химических формул путем перегруппировки ато-
мов в соответствии с реальными группами, присутствующими
в кристалле. Это, в частности, справедливо в отношении соеди-
нений, формулы которых первоначально выражали в виде гид-
ратов; некоторые примеры следуют ниже.
Гидрат
НС1-Н2О
NaBO2-2H2O
Na2B4O7-10H2O
FeCl3-6H2O
ZrOCl2-8H2O
Структурная формула
(Н30)+ С1-
Na[B(OHL]
Na2[B4O5(OHL].8H2O
[FeCl2(H2OL]Cl-2H2O
[Zr4(OH)8(H2OI6]Cls-12H2O
Формулы многих неорганических соединений на первый
взгляд кажутся несовместимыми с нормальными валентностя-
ми атомов, но на самом деле легко объяснимы в свете строения
1.2. Структурные формулы неорганических соединений
27
молекулы или кристалла. В органической химии мы привыкли
к тому, что отношение Н: С в насыщенных углеводородах
(в которых углерод всегда четырехвалентен) колеблется от мак-
симального значения четыре в СН4 до двух в (СН2)П из-за на-
личия связей С—С. Подобным же образом неожиданная фор-
мула P4S3 одного из сульфидов фосфора возникает из-за нали-
чия связей Р—Р. Если бы в соединении были представлены
только связи Р—S, то образование атомами Р(Ш) трех,
a S (II) двух связей дало бы формулу P4Se.
Связи между атомами одного и того же элемента встреча-
ются также и во многих кристаллических бинарных соединени-
ях и ведут к таким формулам, как CdP4, PdP2 и PdS2, которые
кажутся несовместимыми с обычными степенями окисления Cd
и Pd, если неизвестны их кристаллические структуры. Структу-
ры PdP2 и PdS2 описываются ниже; CdP4 — в разд. 19.3.
В отношении структурных формул твердых веществ следует
отметить, что в общем кристаллографы не стремились интер-
претировать структуры твердых тел так, как это требуется для
химиков. В результате значительная часть структурной химии
твердых тел выделилась в еще один самостоятельный подраз-
дел химии (кристаллохимию, или позднее химию твердого те-
ла), и у многих химиков все еще сохраняется тенденция делать
мысленное различие между структурами твердых тел и строе-
нием конечных (по размерам) молекул и комплексных ионов,
которые могут быть изучены в растворе или газообразном со-
стоянии. Вполне очевидно, что бесконечные слоистые структуры
черного и красного фосфора представляют собой лишь более
сложные примеры Р, образующего те же три связи, что и в ко-
нечной (тетраэдрической) молекуле Р4 белого фосфора, но
в равной степени и цепочечная структура кристаллического
PdCl2 является просто конечным членом ряда, начинающегося
ионами PdCl42- и Pd2Cl62~:
- 2-
X
2-
PdCll"
Pd2Cl|"
крисглаллический PdCl 2
28
1. Введение
В элементарных текстах часто приводятся схемы, имеющие
целью показать происхождение электронов, требуемых для раз-
личных связей, но это делается только для (конечных) молекул
и комплексных ионов, а не для твердых тел. Для таких твер-
дых тел, как, например, SnS (в котором каждый атом образует
три связи), положение можно облегчить использованием фор-
мул сиджвикского типа, если принять, что «правила», применяе-
мые к конечным системам, также применимы по крайней мере
к некоторым из бесконечного множества атомов в кристаллах:
Для многих соединений Pd (II) можно вполне последователь-
но считать, что атом металла принимает шесть дополнительных
электронов и образует компланарные dsp2-CBH3H. Из двух про-
стых возможностей а и б
а - "
первая позволяет нам выразить формулой строение бесконечной
цепи PdCl2 и иона Pd2Cl62~ (поскольку мостиковые атомы CI
представляют в виде в), тогда как формула б представляет си-
туацию в PdCl42~, хотя фактическое состояние иона (<?), по-ви-
димому, является промежуточным между «ионной» (г) и кова-
лентной (е) картиной:
XL+2 СГ
X
-а сг
-1/2(Г
ХГ1'2
-П-1/2
С1,
(Т
Л'\
В кристаллическом PdO (и подобным же образом в PdS и
PtS) атомы О образуют четыре тетраэдрические связи, а ме-
талл— четыре компланарные связи, и мы имеем следующую'
картину связей:
Ж « >d"
Соединения PdS2 и PdP2, которые, казалось бы, не могут быть
соединениями Pd(II), можно представить следующим образом.
Дисульфид состоит из слоев (рис. 1.8), в которых Pd образует
четыре компланарные связи с атомами S, связанными в пары
ковалентными связями, имеющими длину 2,13 А. Следователь-
1.2. Структурные формулы неорганических соединений 29
но, получаем такую картину связей:
>-< « X
Кристаллический PdP2 можно представить построенным из
слоев одного и того же общего типа, но каждый атом Р обра-
зует четвертую связь с атомом Р соседнего слоя, в результате
V
-\у.~-и--
;\
Pd-
/
i
Рис. 1.8. Часть слоя в кристаллическом PdS2.
чего возникают непрерывные цепи из атомов Р. Следовательно,
структура является не слоистой, подобно PdS2, а трехмерной
каркасной с ближайшими соседями
Pd—4P (в плоскости) и Р
Г2Р
l2Pd
(по тетраэдру)
и общая картина связей:
\ \
р-
\
и
\
Ж
Естественно спросить, можно ли распространить эту несколько
упрощенную трактовку на другие родственные соединения. Со-
единения, наиболее близкие к PdS2, — сульфиды аналогов палла-
дия NiS2 и PtS2. Все три соединения имеют различные структуры
(это, между прочим, справедливо также и для дихлоридов).
PtS2 кристаллизуется в структурном типе Cdb, в котором ато-
мы Pt образуют шесть октаэдрических связей и атомы S — три
пирамидальные связи в соответствии со схемой
и
1
¦30
/. Введение
Атом Pt, следовательно, принимает восемь дополнительных
электронов и образует октаэдрические d2sp3'-связи. NiS2 кри-
сталлизуется в структурном типе пирита (разд. 6.1), в котором
атомы Ni окружены шестью атомами S групп S2, причем атомы
Ni и группы S2 расположены подобно ионам в структуре NaCl.
Картину связей для структуры пирита FeS2 мы можем изобра-
зить в виде
\
S—S
, Is
а, следовательно, — re —
так что с учетом десяти дополнительных электронов Fe при-
обретает конфигурацию Кг. Кроме того, существуют соедине-
ния, содержащие группы As—S, As—As или Р—Р вместо S—S;
они имеют структуру пирита или очень близкую структуру. Эти
группы поставляют девять или восемь электронов вместо деся-
ти, даваемых группой S2. Как и ожидалось, структуру пирита
(или сходную структуру) имеют FeS2, CoAsS, NiP2 (при высо-
ком давлении), PtAs2, но, кроме того, ту же структуру находим
и у FeAsS и FeAs2. Последние не представляют особой пробле-
мы, поскольку имеют соответственно в rf-оболочке атома метал-
ла на один или два электрона меньше, чем в случае FeS2. Од-
нако существуют другие соединения с той же структурой пири-
та, но имеющие избыток электронов, а именно:
Избыточные электроны: 12 3 4
CoS2 NiS2
K'iAsS
CuS2* ZnS2*
(* фазы при высоком давлении)
и потому явно представляют проблему для трактовки связей в
них. Дальнейшее обсуждение пиритов и родственных структур
приводится в гл. 17*.
1.3. Геометрические и топологические ограничения
в структурах молекул и кристаллов
Этим общим заголовком мы хотим привлечь внимание к значе-
нию геометрических и топологических факторов, которые име-
ют прямое отношение не только к деталям молекулярных и кри-
* Представляется уместным обратить внимание читателя на унифициро-
ванный метод описания и классификации кристаллических структур неоргани-
ческих соединений с помощью условных формул, предложенный В. Н. Сереж-
киным. Метод позволяет определить координацию всех компонент структуры
как в ближайшей координационной сфере, так и в известных пределах во вто-
рой их координационной сфере, не прибегая к графическому изображению
структуры вообще. См. ежегодник «Проблемы кристаллохимии», 1986 г., т. 3.—
•М.: «Наука». — Прим. ред.
1.3. Геометрические и топологические ограничения
31
сталлических структур, по также к устойчивости и даже к са-
мому существованию некоторых соединений. Некоторые из фак-
торов ранее, по-видимому, игнорировались несмотря на то, что
они явно связаны со структурными проблемами.
В любой нелинейной системе из трех атомов X—М—X (а)
расстояния М—X (длина связи), X—X (вандерваальсов кон-
такт) и валентный угол X—М—X всегда взаимно связаны.
В правильной тетраэдрической молекуле ССЦ длина связи
С—С1 A,77 А) предполагает расстояние только 2,9 А между со-
седними атомами С1, а это расстояние гораздо меньше, чем нор-
мальное (вандерваальсово) расстояние между атомами С1
разных молекул (около 3,6 А). Если атомы X связаны со вторым
атомом М (б), образуется четырехчленный цикл, который мы
будем считать плоским параллелограммом, как в примерах, ко-
торые мы рассмотрим. Расстояния (невалентные) М—М и
X—X зависимы от длины связи М—X и угла X—М—X. В ди-
мере хлорида лития эти расстояния равны 2,5, 3,6 и 2,2 А; угол
,9 А
С1
М-Х'
:х-м
С1—Li—С1 составляет примерно 110°. Расстояние Li—Li, кото-
рое короче, чем межатомное расстояние в кристаллическом ме-
талле C,1 А), отдельно обсуждать, очевидно, нельзя, так как
это одна из нескольких взаимосвязанных величин. Циклы ти-
па б также встречаются в таких молекулах, как Fe2Cl6 и
Nb2Clio, образуемых путем объединения двух тетраэдрических
МХ4 или октаэдрических МХ6 групп через два атома X.
Теперь предположим, что каждый атом X связан с дополни-
тельными атомами М, как это бывает во многих кристаллах,
в которых атомы X и М образуют трехмерную систему. Углы
между связями при атоме X все еще связаны с валентными уг-
лами при атоме М. Схема е осуществляется в структуре рутила
(полиморфная модификация TiO2), в которой каждый атом Ti
окружен октаэдрически шестью атомами О и каждый атом О —
планарно тремя атомами Ti. Очевидно, если октаэдр TiO6 пра-
вильный, углы О—Ti—О равны 90°, и, следовательно, один из
углов при атоме О также должен быть равным 90°. Из этого
следует, что в соединении МХ2 со структурой рутила не может
быть одновременно правилыю-октаэдрической координации ато-
ма М и наиболее симметричного окружения атомов X (три ва-
лентных угла по 120°). В высокотемпературной форме ВеО ато-
мы Be имеют тетраэдрическую координацию из четырех ато-
мов О и тетраэдры ВеО4 связаны в пары общими ребрами,
¦32
Введение
причем эти пары связываются затем по общим вершинам с об-
разованием трехмерного каркаса. Структура изображена на
рис. 12.3 (разд. 12.2.5). Важной особенностью в данном случае
является наличие четырехчленных циклов. Здесь также невоз-
можна правильная (в этом случае тетраэдрическая) координа-
ция и атомов О, и атомов Be одновременно, и расстояние
Be—Be в цикле составляет только 2,3 А; оно такое же, как в ме-
таллическом бериллии.
1.3. Геометрические и топологические ограничения
33
/ \
о о-
\ /
:о
\ /
Be
Be
о:
\
Структура кристаллического PtS (см. рис. 17.3) трехмерно-
каркасная; ее можно представить как построенную из двух на-
боров плоских цепей, в которых атом Pt (II) образует четыре
компланарные связи. Два набора цепей лежат в плоскостях,
перпендикулярных друг другу, и каждый атом S является об-
"РГ
/\
\/
/\
"Pt;
хцим для одной из цепей одного набора и одной из цепей дру-
гого. Ясно, что невозможно одновременно иметь как правильную
тетраэдрическую координацию S, так и наиболее симметричное
расположение четырех компланарных связей вокруг Pt, посколь-
ку валентный угол а при атоме S является дополнительным к
валентному углу при атоме Pt. Фактически валентные углы при
атоме S представляют компромисс между значениями 90 и
109,5°; два из них составляют 97,5° и четыре—115°.
В этих примерах мы перешли от простой четырехчленной
молекулы ЫгСЬ к четырехчленным циклам, в которых атомы X
включаются в дополнительные связи с атомами М, и последние
три примера представляют кристаллические тела, в которых
связи М—X распространяются на весь кристалл (трехмерный
комплекс). До некоторой степени аналогичная проблема возни-
кает в конечных молекулах (или комплексных ионах), если
имеются связи между атомами X, присоединенными к централь-
ному атому. «Идеальную» стереохимию атома металла, обра-
зующего шесть связей, можно ожидать в тех случаях, когда он
связан с шестью идентичными атомами в конечную группу
МХ6. Если два или более атомов X составляют части полиден-
татного лиганда (т. е. они сами связаны вместе определенным
образом), то это вводит ограничения, которые могут изменить
углы X—М—X, а возможно, также и длины связей М—X. Мно-
гие случаи атипичной стереохимии атомов металла возникают
именно таким образом. Например, все атомы As в молекуле а
могут присоединяться к одному и тому же атому металла, как
это имеет место в ионе б, где тетрадентатность лиганда приво-
дит к расположению связей, необычному для двухвалентной Pt.
С другой стороны, если лиганд имеет достаточную гибкость,
предпочтительней может оказаться деформация его самого, а не
искажение в расположении связей вокруг атома металла. В слу-
чае тетраметилдипиррометиновых производных в возникновение
очень коротких расстояний между СН3-группами в модели, по-
строенной с обычными планарными связями Pd (II), могло бы
привести к заключению о тетраэдрической стереохимии метал-
ла. Однако в этом случае изгиб циклических систем оказывает-
ся предпочтительнее, чем искажение в расположении связей ме-
талл — лиганд.
-СН-
\
-As
As
As
/
-N
N-C
\
J
C-N
/ \
Pd
8
\
\
CH3
CH3
N-C
/ \
c. x
(здесь Ф — фенильная группа).
Углы при атомах X (обычно кислорода или галогена), об-
щих для двух координационных групп, могут дать полезную
информацию о природе связей А—X. Простые системы этого
типа включают «пиро»-ионы, в которых атомы А — это Si, P
или S, а X — атомы О. Если мы сделаем разумное предположе-
ние, что атомы X различных тетраэдров не должны сближаться
больше, чем внутри тетраэдрической группы, то можно рассчи-
тать нижний предел для угла А—X—А; верхний предел—180°.
Аналогичный расчет может быть сделан для октаэдрических
(или других) координационных групп с общим атомом X. Та-
кие простые геометрические рассмотрения, очевидно, вполне
уместны при обсуждении наблюдаемых углов между связями
А—X—А, но еще более интересны заключения, которые могут
быть сделаны относительно образования общих ребер между
октаэдрами в структурах комплексных оксидов. Эти вопросы об-
суждаются более подробно в гл. 5. Кроме того, аналогичные
3—752
34
/. Введение
1.4. Полная структурная химия элемента или соединения
35
рассмотрения, как будет видно, указывают на ограничение чис-
ла тетраэдрических АХ4, октаэдрических АХ6 или других коор-
динационных групп АХ„, которые могут сходиться в точке, т. е.
иметь общую вершину (Х-атом). В свою очередь такие ограни-
чения влияют на устойчивость и фактически на существование
кристаллических соединений типа солей оксокислот и нитри-
дов, как мы это покажем в гл. 7.
В противоположность этим ограничениям на структуры мо-
лекул и кристаллов, которые исходят из метрических соображе-
ний, существуют другие, которые могут быть описаны как огра-
ничения топологического характера. Например, отсутствие со-
единений А2Х3 (т. е. полуторных оксидов) с простыми слоисты-
ми структурами, в которых атомы А связаны с шестью X и ато-
мы X с четырьмя А, является вопросом не кристаллохимии,
а топологии; оно связано с невозможностью существования со-
ответствующих плоских сеток, как объяснено в разд. 3.4.1. От-
сутствие некоторых других структур для соединений АтХ„ ти-
па АХ2 с координационным соотношением 10:5 предположи-
тельно может являться результатом невозможности построения
соответствующих трехмерных сеток. С другой стороны, та же
проблема альтернативно может рассматриваться и как геомет-
рическая (из рода вышеупомянутых) в связи с количеством ко-
ординационных полиэдров разных видов, которые могут схо-
диться в точке; этот вопрос обсуждается далее в разд. 5.12.
По-видимому, граница между геометрией (т. е. метрически-
ми условиями) и топологией (связанностью) является почти
неуловимой. Хорошо известно, что невозможно поместить пять
эквивалентных точек на поверхности сферы, если мы исключим
тривиальный случай, когда они образуют пятиугольник по эква-
тору,— факт, очевидно относящийся к обсуждению координа-
ционного числа б или к образованию пяти эквивалентных свя-
зей. Самое общее (топологическое) доказательство этой теоре-
мы вытекает из рассмотрения анализа способов сочленения то-
чек в связанные системы многоугольников (в многогранник) и
показа, что это не может быть сделано с одним и тем же чис-
лом связей в каждой точке. С другой стороны, мы можем про-
демонстрировать невозможность существования правильного
твердого тела с пятью вершинами и на основе анализа метри-
ческих факторов. В гл. 3 мы выводим некоторые из возможных
трехмерных четырехсвязанных сеток в виде систем связанных
точек; при этом обнаруживается (исходя из числа точек в
наименьшей повторяющейся единице), что самой простой явля-
ется система шестиугольников, в своей наиболее симметричной
форме представляющая структуру алмаза. Хотя эта сетка вы-
ведена как «топологическая сущность» безотносительно к уг-
лам между связями, оказывается, что она не может быть по-
строена с любыми произвольными углами между связями, на-
пример с четырьмя пленарными связями, сходящимися в каж-
дой точке. По-видимому, геометрические ограничения такого же
рода относятся и к другим системам связанных точек; эта пока
пренебрегаемая область трехмерной эвклидовой геометрии за-
служивает более глубокого изучения.
1.4. Полная структурная химия элемента или соединения
После того как мы подчеркнули важность твердого состояния
в неорганической химии, рассмотрим, какое место оно занимает
в полной структурной химии вещества — элемента или соеди-
нения.
Схема 1.1
Полная структурная химия Вещества
0К
Структуры
полиморфны/,
модификации,
устойчивые при
разных темпера-
турах и давлении
Сублимация ^
-Жидкость *• Пар
Структурные
изменения В
жидкости
Структурные
изменения в
т. пл. и да. кип.
Структура в раство-
рителях (.структуры
сольбатоб)
низкотемпера-
турная форма
высокотемпера-
турная форма
Полная структурная химия вещества может быть представ-
лена суммарно в виде схемы 1.1. Она включает не только струк-
туру вещества в различных агрегатных состояниях, но и струк-
турные изменения, сопровождающие плавление, испарение жид-
кости или твердого тела или растворение в растворителе, а так-
же те изменения, которые имеют место в твердом, жидком или
парообразном состояниях. По сложности структурная химия
элементов или соединений варьирует в широких пределах. На
одном конце находятся благородные газы, которые во всех аг-
регатных состояниях существуют в виде отдельных атомов.
В этих случаях единственной записью в схеме были бы распо-
ложение атомов в твердом теле и относительно малые измене-
ния с температурой в структуре простой атомарной жидкости.
Затем идут газы, такие, как Н2, N2, O2, и галогены, которые
продолжают существовать в виде двухатомных молекул в твер-
дом, жидком и газообразном состоянии и диссоциируют на
единичные атомы только при более высоких температурах.
С другой стороны, сера в элементном состоянии имеет чрезвы-
чайно сложную структурную химию (см. гл. 16). К сожалению,
для многих соединений полной картины структурной химии нет
36
1. Введение
просто потому, что соответствующие структурные данные отсут-
ствуют. Большинство исследователей обычно ограничиваются
структурным изучением твердых тел или газов (реже жидко-
стей и еще реже твердых тел и газов); структурные исследова-
ния вещества более чем в одном агрегатном состоянии необыч-
ны. (Позднее на примере FeCl3 проиллюстрируем структурную1
химию относительно простого соединения.) Здесь мы лишь
кратко рассмотрим различные позиции схемы 1.1 и приведем
ряд примеров.
1.4.1. Структура в твердом состоянии. Структурная химия твер-
дого тела включает структуры его разных кристаллических
форм (если имеются полиморфные модификации) в температур-
ном диапазоне от О К до точки плавления, а также и под дав-
лением. В последние годы изучение веществ, подвергнутых вы-
сокому давлению, расширило сферу структурной химии в двух
направлениях. Во-первых, для многих элементов и хорошо из-
вестных соединений получены новые полиморфные модифика-
ции, в которых атомы упакованы более плотно, причем наибо-
лее высокая плотность часто (хотя и не всегда) достигается
благодаря увеличению координационных чисел (КЧ) атомов.
Например, структура ZnO с координационными числами обоих
атомов 4 при давлении 100 кбар переходит в структуру NaCl
с КЧ 6, однако в структуре коэзита (форме SiO2 при высоком
давлении) более высокая плотность достигается без увеличения
координационных чисел. Во-вторых, получены новые соедине-
ния, которые невозможно синтезировать при атмосферном дав-
лении, но однажды полученные, они могут сохраняться при
обычных условиях; это PbS2, CuS2, ZnS2 и CdS2. Стехиометри-
ческий FeO (соединение, обычно дефицитное по Fe) получен на-
греванием Feo.gsO с металлическим железом при 770 °С при
давлении 36 кбар. Не всегда принимается во внимание, что на-
ша «нормальная» химия (т. е. представления о связях между
атомами и структуре молекул и кристаллов) строго говоря, от-
носится только к «химии атмосферного давления». Уже в тече-
ние длительного времени мы имели возможность варьировать
температуру в значительном диапазоне, и различные случаи по-
лиморфизма были главным образом ограничены примерами,
проистекающими в результате изменения температуры. Широ-
кий диапазон давлений (неизбежно сопровождаемый изменени-
ем температуры), который теперь достижим, вполне может ока-
заться более продуктивным для структурных изменений, чем
вариация только температуры. Фазовая диаграмма воды (гл. 15)
хорошо иллюстрирует расширение структурной химии простого
соединения за пределы двух форм (гексагональный и кубиче-
ский лед), устойчивых при атмосферном давлении.
1.4. Полная структурная химия элемента или соединения 37
1.4.2. Структурные изменения при плавлении. Структурные из-
менения, происходящие при плавлении, простираются от про-
стого преодоления вандерваальсовых сил, связывающих атомы
(благородные газы) и молекулы (молекулярные кристаллы,
построенные из неполярных молекул), до полного распада бес-
конечных группировок атомов в случае кристаллов, содержащих
цепи, слои и трехмерные каркасы. При температурах слегка
ниже и выше точки плавления плотно упакованного металла в
непосредственном окружении атома металла, как правило, су-
ществует лишь небольшое различие, хотя дальний порядок сра-
зу исчезает. С другой стороны, при плавлении металлического
висмута происходит более значительная перестройка структу-
ры. Вместо обычного уменьшения плотности при плавлении, ко-
торое может быть проиллюстрировано поведением такого ме-
талла, как свинец, имеет место увеличение ее на 2,5% из-за
перехода весьма «открытой» структуры твердого тела в более
плотно упакованную жидкость:
Плотность твердого тела, г/см3
Плотность жидкости, г/см3
Bi B71 °С)
9,75
10,00
РЬ C28 °С)
11,35
10,68
Работы по исследованию структуры жидкостей столь немно-
гочисленны, что невозможно привести достаточное число при-
меров структурных изменений, связанных с плавлением. Кри-
сталлы, состоящие из трехмерных комплексов*, должны распа-
даться на более простые единицы, в то время как кристаллы,
построенные из молекул, образуют молекулярный расплав. Про-
стые ионные кристаллы, например NaCl, плавятся с образова-
нием смеси ионов, а кристаллы типа SiO2, которые построены
из групп SiO4 с общими атомами О, полностью не распадаются.
Тетраэдрические группы остаются связанными друг с другом
через общие атомы О; соответственно расплав является весьма
вязким и легко образует стекло, т. е. переохлажденную жид-
кость. Перестройка запутанных цепей и колец связанных тетра-
эдров — трудный процесс. Три кристаллические формы ZnCl2
также состоят из связанных тетраэдрических групп (ZnCl4),
образующих слои или трехмерные каркасы; расплав этого со-
единения тоже обладает очень высокой вязкостью. Поведение
А1С1з — промежуточное между поведением NaCl и ZnC^. Кри-
сталлы состоят из слоев, образованных октаздрическими груп-
пами А1С16 с тремя общими ребрами, как показано схематиче-
ски для FeCU в разд. 1.4.5. Эти конечные слои разрушаются при
плавлении (или испарении) с образованием димерных молекул
* О понятии «трехмерный комплекс» см. выше, в разд. 1.3.—Прим. ред.
38
Введение
А12С1б такого же типа, как димеры в парах FeCl3. Если кристал-
лический А1С13 нагревать, то (ионная) проводимость, обуслов-
ленная движением ионов А13+ по структуре, увеличивается по
мере приближения к точке плавления и затем резко падает
до 0, когда кристалл превращается в расплав, состоящий из (не-
проводящих) молекул А12С16. Кристаллическая структура SbF5,
по-видимому, состоит из октаэдрических SbFe-групп с общей
парой вершин (F-атомы), как в BiFs, CrF5 и других пентафто-
ридах. Спектр ЯМР весьма вязкой жидкости был интерпрети-
рован, исходя из систем групп SbF6, имеющих по два общих
атома F с соседними группами.
1.4.3. Структурные изменения в жидком состоянии. За некото-
рым важным исключением, таким, как элементная S и Н2О, из-
менения в структуре, имеющие место между точками плавления
и кипения, были исследованы довольно плохо. Температурные
изменения кривых радиального распределения простых атомар-
ных жидкостей выявляют лишь вариации в среднем числе со-
седей на различных расстояниях. С другой стороны, структур-
ные изменения в жидкой сере являются гораздо более слож-
ными и уже были предметом многих исследований. Полная
структурная химия элементной серы кратко описана в гл. 16;
она дает пример раскрытия циклических молекул (Se или Ss)
в цепи с последующей полимеризацией в более длинные цепи.
Замечания о структуре воды включены в гл. 15.
1.4.4. Структурные изменения при кипении или сублимации. По-
скольку о структурах жидкостей известно так мало, фактически
нам приходится ограничиться сравнением структур в твердом
и парообразном состояниях. В «доструктурной эре» знание
структур паров подтверждалось только молекулярной массой и
ее изменением в зависимости от температуры и давления. Бла-
годаря электронной дифракции и спектроскопическим исследо-
ваниям разного рода теперь стала довольно доступной богатая
информация, устанавливающая связь между межатомными рас-
стояниями и валентными углами в молекулах пара. Эта инфор-
мация ограничивается главным образом сравнительно простыми
молекулами не только потому, что невозможно установить боль-
шое число параметров, требуемых для того, чтобы определить
геометрию более сложной молекулы из ограниченных экспери-
ментальных данных, но также и потому, что геометрия многих
молекул становится промежуточной, если молекулы гибки.
(К тому же некоторые методы установления молекулярной
структуры подчиняются определенным ограничениям; например,
микроволновые спектры обычно возникают только от молекул
с постоянным дипольным моментом.) Информация о молекуляр-
1.4. Полная структурная химия элемента или соединения 39
ных массах парообразных образцов некоторых соединений мо-
жет быть получена из масс-спектрометрии, хотя этот метод до
сих пор еще очень мало применялся к неорганическим соедине-
ниям— см., например, галогениды щелочных металлов и Мо03.
Менее прямой источник информации — исследование отклонения
простых молекул в магнитном поле, которое показывает, в част-
ности, что одни молекулы галогенидов АХ2 являются линейны-
ми, а другие — уголковыми (см. гл. 9). Интересное развитие ин-
фракрасной спектроскопии состоит в конденсации частиц, при-
сутствующих в паре при высоких температурах, на (твердой)
матрице благородного газа при очень низких температурах,что
делает возможным исследование обычными методами молекул,
которые недостаточно стабильны.
Как правило, мы будем отмечать то, что известно о струк-
турной химии какого-либо вещества во всех агрегатных состоя-
ниях в тех местах книги, где это вещество систематически опи-
сывается. Однако следующее замечание о хлориде железа целе-
сообразно сделать сразу, с тем чтобы подчеркнуть, что даже та-
кое простое соединение, как FeCl3, может само по себе иметь
очень интересную структурную химию. В паре при низких тем-
пературах соединение находится в форме молекул Fe2Cl6. Когда
вещество конденсируется с образованием кристалла, имеет ме-
сто радикальная перестройка, и вместо конечной молекулы,
в которой к каждому атому железа присоединяются четыре ато-
ма хлора, образуется бесконечный двумерный слой, в котором
каждый атом железа связан с шестью атомами С1. Когда этот
кристалл растворяется в неполярных растворителях типа CS2,
молекулы Fe2Cl6 формируются снова, но в полярных раствори-
телях, например эфире, образуются простые тетраэдрические
молекулы (C2H5JO->FeCl3. Мы привыкли рассматривать про-
цесс, подобный растворению кристалла, как простой обратимый
процесс — в том смысле, что удаление растворителя приводит
к восстановлению исходного вещества. Это обычно справедли-
во в случае неполярных растворителей, но не для растворения
в таком весьма полярном растворителе, как вода. Когда кри-
сталл хлорида железа растворяется в воде, происходит его раз-
деление на ионы Fe3+ и С1~, и многие свойства водного раство-
ра FeCl3 являются свойствами этих индивидуальных ионов, а не
хлорида железа. Так, этот раствор осаждает AgCl из раствора
AgNO3 (свойство иона С1~); он же окисляет SnCb до SnCl4 или
TiCl3 до TiCl4; эти реакции являются результатом перехода
Fe3++e->-Fe2+. В водном растворе ион железа гидратирован,
и испарение при комнатной температуре приводит к кристалли-
зации гексагидрата; исходный безводный FeCl3 таким способом
из раствора извлечь нельзя. «Гексагидрат» состоит из октаэдри-
ческих ионов [FeCl2(H2OL]+, ионов С1~ и молекул Н2О, кото-
40
/. Введение
рые не присоединены к атомам металла. Структурную химию
FCb наглядно можно представить следующим образом:
-С!
Н2Ск
Н20'
V
CI
Л)Н2
Ч)Н2
а- /2Н2о
Кристаллический
гексагидрат
Кристаллический FeCI3
/ \ '
CI CI
\ /
С1-Ке-С1
\ / / \ \ /
-Fe-Cl Cl-Fe-
/ \ /\
СЬ
ск -сь
cKFe-ci "-а
/7ffy5 tf/7tf раствор
б неполярном рас-
творителе
Fe-Cl
ЧС1
При более
высоких тем-
пературах
Раствор в эфире
1.5. Классификация кристаллов
Мы видели, что в некоторых кристаллах можно выделить груп-
пы сближенных атомов {комплексы), связи внутри которых от-
личаются от связей между комплексами (и обычно гораздо ко-
роче, чем последние). Комплексы могут быть конечными или
бесконечно протяженными в одном, двух или трех измерениях;
они удерживаются вместе за счет ионных, вандерваальсовых или
водородных связей. Подразделение комплексов на эти три типа
дает общую основу для широкой геометрической классифика-
ции кристаллических структур, показанной на схеме 1.2. Правда,
с первого взгляда может показаться, что наиболее очевидным
способом классификации структур должно быть группирование
их в соответствии с типами связей между атомами (считая, что
существуют четыре предельных типа: ионный, ковалентный, ме-
таллический и вандерваальсов). Такое общее деление на ион-
ные, ковалентные, металлические и молекулярные кристаллы
делают довольно часто. Однако в действительности связи, при-
ближающиеся к чистым типам (особенно ионному или кова-
лентному), весьма редки, и, более того, в большинстве кристал-
лов имеются связи нескольких различных типов сразу. Следует
учитывать многочисленные промежуточные классы, и это при-
водит к тому, что классификации, основанные на типах связи,
становятся запутанными, не будучи исчерпывающими. Кроме
того, они имеют и тот недостаток, что переоценивают значение
«чистых» типов связи, тогда как связи промежуточного харак-
тера рассматриваются как отклонение от этих предельных ти-
1.5. Классификация кристаллов 41
Схема /. 2
Молекулярные
кристаллы
{конечные комплексы,
Трехмерные клатраты
{конечные молекулы в
полостях или кана-
лах)
Бесконечные трехмер-
ные комплексы
Трехмерные каркасные
ионы
(конечные ионы В
пустотах)
Кристаллы, содер-
жащие комплексные
ионы
Слои +
конечные
ионы
Цепи +
конечные
ионы
Слоистые струк-
туры (двумер-
ные комплексы)
Цепочечные
структуры С одно
мерные комплексы,
пов. Предпочтительнее обсуждать природу связей в конкретном
кристалле и не предрешать результата, классифицируя кри-
сталл, например, как ионный.
Конечно, можно найти структуры, которые не попадают
точно в одно из главных подразделений схемы 1.2. Например,
в кристаллических HgBr2 и СиСЬ наиболее короткие связи вы-
деляют конечные молекулы и цепи соответственно. Но эти еди-
ницы удерживаются вместе более слабыми связями металл —
галоген, что приводит к образованию слоев, между которыми
действуют еще более слабые вандерваальсовы связи. Такие
структуры находят свое место на той или иной из соединяющих
линий схемы; то же относится и к структурам, в которых моле-
кулы объединены в цепи, слои или трехмерные комплексы водо-
родными связями; соответствующие точки отмечены на схеме
буквой Н. Понятно, что в этом разделе мы вынуждены упомя-
нуть о многих структурах и темах, которые по существу отно-
сятся к последующим главам; поэтому, вероятно, будет полез-
но вернуться к вопросам классификации в последующих раз-
делах.
Четыре группы типов структур, заключенные на схеме внутри
прямоугольника из пунктирных линий, являются очень родст-
42
/. Введение
венными: все они ионные, каждый включает два различных
сорта заряженных единиц. Кроме дискретных ионов (обычно мо-
ноатомных) в них присутствуют конечные, одно- дву- или трех-
мерно-бесконечные ионы. В качестве примеров этих четырех ти-
пов структур можно указать K2SO4, KC11CI3, K2CuF4 и КВ5О8,
содержащие ионы Кг"" и соответственно конечные, цепочечные,
слоистые и трехмерно-бесконечные комплексные ионы. В каж-
дом классе структур, выделенных на схеме, могут быть откло-
нения от строго упорядоченной структуры, такие, как вращение
или произвольная ориентация комплексных ионов или молекул,
потеря или смещение отдельных атомов и т. д., словом, откло-
нения, наблюдаемые в разнообразных типах «дефектных» струк-
тур. Остановимся теперь коротко на четырех главных струк-
турных типах. Более подробно они будут рассмотрены в после-
дующих главах.
1.5.1. Кристаллы, содержащие бесконечные трехмерные комп-
лексы. Простейшие структуры, относящиеся к этой группе,—
это структуры: а) благородных газов, б) металлических и ин-
терметаллических соединений и в) многих простых ионных и ко-
валентных кристаллов, т. е. к этой группе относятся все те кри-
сталлы, в которых нельзя выявить группировки меньшей раз-
мерности. Не очень существенно, следует ли включать сюда или
относить к молекулярным кристаллы, содержащие такие не-
большие молекулы, как Н2, N2 и H2S. Типично ковалентные
кристаллы этого класса включают алмаз (и изоструктурные ему
Si, BN и т. д.) и родственные соединения, такие, как различные
формы SiC. Некоторые простейшие структурные типы бинарных
соединений, в которых бесконечные трехмерные комплексы рас-
пространяются по всему кристаллу, представлены в табл. 1.2.
Таблица 1.2. Простые структуры соединений состава АтХ„
Координа-
ционное чис-
ло атома Л
4
6
8
9
Координационное число атома X
2
SiO2
ReO3
1
3 1
тю2
LaF3
4
ZnS
A12OS
CaF2
6
NaCl
8
Csc;i
В кристаллах групп (а), (б) и (в) все атомы вместе образу-
ют трехмерный комплекс. Тесно связан с ними и несколько иной
тип структур, в которых присутствует не только трехмерный
каркас, распространенный по всему кристаллу, но и располо-
женные между ними дискретные ионы или молекулы.
1.5. Классификация кристаллов 43
г) Трехмерные каркасы могут быть электрически нейтраль-
ными или заряженными; в последнем случае заряд на каркасе
должен быть сбалансирован ионами противоположного знака,
помещенными в пустотах. Кристаллы, содержащие положитель-
но заряженные каркасы (трехмерные катионы), редки. Приме-
ры (все содержащие металлы Б-подгрупп), которые описаны в
последующих главах, включают: (NHg2)NO3; (Ag3S)NO3;
(Ag7O8)NO3; (Hg3S2)Cl2 и (Sn2F3)Cl. Водный каркас в HPF6-
•6Н2О также может быть рассмотрен как трехмерный катион,
так как протон кислоты связан с ним; некоторые другие гидра-
ты, упоминаемые ниже, являются примерами электронейтраль-
ных каркасов. Структуры, состоящие из отрицательно заряжен-
ных каркасов, окружающих катионы, чрезвычайно многочис-
ленны, особенно это относится к структурам, построенным из
тетраэдрических и октаэдрических групп. В цеолитах
(разд. 23.12.8) (группа алюмосиликатов) имеются жесткие
каркасы, построенные из тетраэдров (Si,Al)O4, и через эти кар-
касы проходят каналы, которые доступны с поверхности кри-
сталлов. Поэтому посторонние ионы и молекулы могут входить
или оставлять кристалл без разрушения структуры. К кристал-
лам этого типа применяют термин цеолит. С другой стороны,
некоторые кристаллы во время роста включают посторонние
молекулы в полости, из которых они не могут выбраться, пока
кристалл не растворят или не испарят. Такие кристаллы назы-
вают клатратными соединениями. Было бы точнее сказать, что
каркас «хозяина» образуется вокруг включенных молекул, по-
скольку характерная структура вообще не образуется в отсут-
ствие молекул «гостя». Клатратная структура остается неустой-
чивой до тех пор, пока не будет занята некоторая минимальная
часть полостей; структуры всех клатратных соединений на
рис. 1.9, а—в отличаются от структур чистых соединений «хо-
зяина». Клатратные соединения могут иметь слоистые структу-
ры (например, Ni(CNJ-NH3-nC6H6; рис. 1.9,а), но значительно
чаще они имеют трехмерные структуры; в большинстве случаев
это каркасы молекул, соединенных водородными связями.
В комплексах мочевины с углеводородом (рис. 1.9,6) молеку-
лы мочевины образуют каркас, содержащий параллельные ка-
налы, в которые входят линейные углеводородные молекулы,
так что плотность упаковки молекул мочевины здесь гораздо
меньше, чем в самой кристаллической мочевине. Структура
«р-хинола» (рис. 1.9, в) состоит из двух взаимно проникающих
систем молекул НО-С6Н4-ОН, объединенных водородными свя-
зями; в полостях размещаются молекулы воды или некоторые
газы, если таковые присутствуют во время роста кристалла
(см. также разд. 3.9.4). Льдоподобные гидраты содержат кар-
касы из молекул воды, объединенных водородными связями;
44
/. Введение
в простейших случаях эти каркасы образуются вокруг нейтраль-
ных атомов или молекул, таких, как молекулы благородных
газов, хлора, и т. д. Они описаны в гл. 15 и 3.
1.5.2. Слоистые структуры. Слоистыми принято называть не
только те структуры, в которых все атомы объединены в хоро-
6
Рис. 1.9. Включение посторонних молекул в кристаллы: a) Ni(CNJ-NH3-nC6H6;
б) комплекс мочевины с углеводородом; в) E-хинол.
шо выделяющиеся слои, но также и те, в которых между слоя-
ми находятся ионы или молекулы. Поскольку слои могут быть
электронейтральными (с вандерваальсовыми или водородными
связями между ними) или заряженными и так как они могут
быть построены идентично или иметь разное строение, возни-
кает схема слоистых структур, представленная на рис. 1.10. Из
всех семейств структур, приведенных на рис. 1.10, несомненно,
наиболее обширным является семейство аь в котором одина-
ковые слои удерживаются вместе вандерваальсовыми связями.
Структура самого слоя может варьировать от простейшей воз-
можной плоской сетки атомов (графит, белый BN) через As2O3
(моноклинный), многочисленные слои, образованные тетраэдри-
ческими или октаэдрическими координационными группами (га-
1.5. Классификация кристаллов
45
логениды АХ2 и АХ3), до составных слоев в тальке и родствен-
ных алюмосиликатах. (Следует отметить редкость слоистых и
цепочечных структур среди оксидов и фторидов металлов; эти
структуры более свойственны другим халькогенидам и галоге-
нидам.) В классах а2 и с2 идентичные слои расположены меж-
ду молекулами или ионами, и существует много пар структур,
в которых образуются слои одного и того же или очень близко-
го геометрического типа, но электронейтральные в а2 и заря-
Только слои
а,
Все слои
одинаковы
Слои + конечные ионы
или молекулы
О
Слои
двух видоб
©
0
0
Рис. 1.10. Типы слоистых структур (схема).
женные в с2. Некоторые примеры даны в табл. 1.3. Например,
слой (Si2O5)rt2"~ в ряде силикатов щелочных металлов M2Si20s
относится к тому же общему типу (тетраэдрические группы,
имеющие по три общие вершины), что и нейтральный слой в
полиморфной модификации Р2О5; такое же соотношение имеет-
ся между нейтральным слоем в PbF4 и двумерным ионом в
K2(NiF4) или между тальком, построенным из нейтральных сло-
ев Mg3(OHJSi4Oio, и слюдистым флогопитом KMg3(OHJ-
Si3A10io, в котором заряженные слои удерживаются вместе
благодаря ионам К+- Интересный пример структуры а2 пред-
ставляет клатратное соединение, в котором между слоями соста-
ва Ni(CNJ-NH3 заключены молекулы бензола или воды
(рис. 1.9, а).
Слоистые структуры типов bi и Ь2 гораздо менее распростра-
нены. Первый из них, где слои удерживаются вместе водород-
ными связями, включает А1(ОНK, HCrO2, y-FeO-OH и родст-
венные соединения. Помимо водородных связей непосредствен-
но между атомами соседних слоев возможны водородные связи
46
1. Введение
через промежуточные молекулы типа Н2О, расположенные
между слоями (класс Ь2). Структура гипса CaSO4-2H2O
(разд. 15.2.6) дает пример структуры этого типа.
Последняя группа структур (d) с чередующимися положи-
тельно и отрицательно заряженными слоями является тоже не-
большой и включает минералы группы хлорита (разд. 23.12.7)
и некоторые гидроксигалогениды, как, например, [Na4Mg2-
Cl12]4Mg7Al4(OHJ2p (разд. 6.5.4).
Свойство некоторых слоистых структур, о котором стоит
здесь упомянуть, состоит в захвате посторонних атомов, ионов
Таблица 1.3. Родственные структуры, содержащие соли
одинакового общего типа
ai
Графит
Р2О5
PbF4
Тальк
Пирофиллит
а2 или с2
Соединение внедрения в графит, на-
пример с8к, с16к
CaSi2
Li2(Si205)
K2(NiF4)
Флогопит "I
Мусковит )(СЛЮДЬ.)
или молекул между слоями с растяжением структуры только в
направлении, перпендикулярном слоям. Уже давно было из-
вестно, что это свойственно графиту (разд. 16.10) и глинистым
минералам (разд. 23.12.7), а в последние годы появился инте-
рес и к таким интеркалатам (соединениям включения), как, на-
пример, NbS2 и TaS2 (разд. 17.1.5).
В этом очень кратком обзоре мы не можем касаться деталь-
ной картины строения слоев, разные аспекты которой обсужда-
ются более подробно позже, в особенности строения базисных
двумерных сеток и структур, основанных на простейших 3- и
4-связанных плоских сетках (гл. 3), и слоев, образованных тет-
раэдрическими и октаэдрическими координационными группами
(гл. 5). Слой Cdl2 и более сложные структуры, производные от
этого слоя, обсуждаются в гл. 6. Мы увидим, что существуют
как гофрированные, так и плоские слои, а также сложные слои,
состоящие из двух переплетенных слоев (красный Р,
Ag[C(CNK]).
Между четырьмя основными типами нашей классификации
допускаются структуры промежуточных типов. Мы можем рас-
смотреть, например, структуры, в которых различия между свя-
зями (или расстояниями) атомов внутри слоев и атомов сосед-
1.5. Классификация кристаллов
47
них слоев не являются четкими, как это предполагалось выше.
С другой стороны, слои могут выявляться хорошо, но между
единицами, составляющими слои, могут быть связи различных
типов или различной силы, так что слой сам по себе можно рас-
сматривать как весьма свободно связанную систему цепей или
конечных молекул. Мы уже отмечали СиС12 и HgBr2 как приме-
ры структур этого рода, другие примеры будут приведены в
последующих главах.
1.5.3. Цепочечные структуры. В принципе возможные типы цепо-
чечных структур подобны типам слоистых структур, и некото-
рые из них показаны схематически на рис. 1.11 с теми же обо-
О О
о о
?) О
>--
©
0
©
©
0
©
© 0 ©
0 © 0
© 0 ©
d,
рассматриваемых
Рис. 1.11. Основные типы цепочечных структур (схема),
вдоль направления цепей.
значениями, что и слоистые структуры. Известны примеры всех
типов цепочечных структур, показанных на рис. 1.11, причем
наибольшее число их относится к классу с2, который включает
все соли оксокислот, содержащие бесконечные линейные ионы
(простейшие из которых — линейные метасоли), и все комплекс-
ные галогениды, содержащие цепочечные анионы. В некоторых
гидратных комплексах галогенидов молекулы воды также рас-
положены между бесконечными одномерными анионами; при-
мер — K2HgCl4-H2O (рис. 1.12).
Рис. 1.12. Структура K^HgCLi-I-^O, рассматриваемая вдоль направления бес-
конечных цепей. Ионы К+ (пары перекрывающихся кружков) и молекулы во-
ды (большие кружки) лежат на разных высотах между цепями.
48
1. Введение
Простой пример класса t>i — структура LiOH-H2O, в кото-
рой образуются водородные связи между ОН-группами и моле-
кулами Н2О соседних цепей (см. рис. 15.23), а структура буры
иллюстрирует редкий тип db В ней ионы Na+ и молекулы Н2О
образуют линейную цепь [Na(H2OL]«n+ (состоящую из окта-
эдрических Na(H2ON-rpynn с двумя общими ребрами), а анион
представляет бесконечную цепь из ионов [В4О5(ОНL]2~ с водо-
родными связями, как описано в разд. 24.7.5. Как и в случае
цепи (НСО3)я"~ в NaHCO3, этот боратный анион составлен из
субъединиц, которые связаны водородными связями вдоль цепи
и поэтому, строго говоря, не являются цепью простейшего типа.
Простейший тип цепочечной структуры гц состоит из одина-
ковых цепей, которые упакованы параллельно друг другу. Так
как основное требование для формирования цепи состоит в том,
чтобы структурная единица могла образовать связи с двумя
другими, то простейшая возможность-—это образование цепи,
состоящей из одинаковых атомов, как в пластической сере или
элементных Se или Те:
Очевидно, следующей по сложности является цепь, содер-
жащая чередующиеся атомы различных элементов, как в HgO
или Aul:
Более сложные двоесвязные единицы — группы АХ3, АХ4, АХв
и т. д., имеющие один или более общих атомов X, где АХ3 —
плоская группа (например, (BO2)n"~) или пирамидальная (как
в SeO2), AX4 — тетраэдрическая группа с двумя общими верши-
нами (SO3) или двумя общими ребрами (SiS2), АХ6 — октаэд-
рическая группа с двумя общими вершинами (BiF5) или двумя
общими ребрами (Nbl4) или двумя общими гранями (Zrl3)
и т. д. Эти цепи описаны более подробно при обсуждении тет-
оаэдрических и октаэдрических структур в гл. 5. Структура
ReCU дает пример более сложной цепи, в которой повторяю-
щаяся единица — пара октаэдров с общей гранью, соединен-
ных затем парой общих вершин:
С1Ч С1Х С1
Cl-Re-Cl-Re-Cl
1.5. Классификация кристаллов
49
Как и в случае слоистых структур, один и тот же тип струк-
туры может лежать в основе как бесконечных молекул, так и
бесконечных линейных ионов (табл. 1.4).
Мы не предполагаем обсуждать здесь геометрию цепей, но
можем отметить, что, в то время как цепи, построенные из тет-
раэдрических или октаэдрических групп с общей парой проти-
воположных ребер или октаэдрических групп с общей парой
противоположных граней, строго линейны, существуют много-
Таблица 1.4. Структуры, содержащие цепи
Тип цепи
—А—X—А—X—
X X
—А—X—А—X— (тетраэдрич.)
х2 х2
(плоская)
—А—X—А—X—
'х.
ЧА Ах
Нейтральная
молекула
SeO2
so3
AuF3
BiF5
Nbl4
Zrl3. CsO
одинакового общего
(ВО2)„
(SiO3)n
типа
Бесконечный ион
' в СаВ2О4
2"-, (РО3)ЛП-
в метасолях
(CuCl3)
(AlF5)n
(HgCl4
(NiCU)
метаионы
„""" в CsCuCl3
2"- в T12AIF5
)„2"- в K2HgCl4-H2O
п11- в CsNiCl3
численные конфигурации цепей, построенных из тетраэдров с
двумя общими вершинами (разд. 23.12.6), и найдены две кон-
фигурации для цепи АХ5, в которой октаэдрические группы АХ6
имеют по две общие вершины с цис- или транс-положением их
по отношению друг к другу соответственно. Вращение совместно
с поступательным движением дает спираль, простейшая форма
которой—плоская зигзагообразная цепь (например, HgO), по-
рожденная винтовой осью 2-го порядка. В другой полиморфной
модификации HgO цепь, подобная цепи в «металлическом» Se,
обусловлена винтовой осью 3-го порядка, а бесконечная цепо-
чечная молекула в кристаллическом AuF3 является результа-
том повторения плоской группы AuF4 вокруг винтовой оси 6-го
порядка.
1.5.4. Кристаллы, содержащие конечные комплексы. Конечные
(по размерам) комплексы включают все молекулы и конечные
4—752
50
/. Введение
комплексные ионы. Мы, следовательно, рассматриваем здесь два
основных класса схемы 1.2, а именно молекулярные кристаллы
и кристаллы, содержащие конечные комплексные ионы. Молеку-
лярные кристаллы включают многие соединения неметаллов, не-
которые металлические галогениды АХЯ и ряд полимерных га-
логенидов А2Х6 и А2Х10, карбонилы металлов и родственные со-
единения и многие координационные соединения, построенные
из нейтральных молекул (например, Co(NH3K(NO2K). В про-
стейшем типе молекулярных кристаллов одинаковые неполяр-
ные молекулы удерживаются вместе за счет вандерваальсовых
связей. Структуры этих кристаллов представляют наиболее эф-
фективную упаковку единиц заданной формы, связанных нена-
правленными силами. Когда молекулы являются приблизительно
сферическими, могут встречаться такие же типы структур, как
и в кристаллах, описанных как трехмерные комплексы с заме-
щением отдельного атома на группу атомов. Если форма мо-
лекулы отклоняется от сферической, структуры становятся по-
хожими на структуры кристаллов, состоящих из одно- и дву-
мерных комплексов. Более сложные типы молекулярных кри-
сталлических структур возникают, когда присутствуют молеку-
лы более чем одного сорта, как в случае AsI3-3S8, и когда не-
которые пары атомов различных молекул связаны водородными
связями.
Конечные комплексные ионы включают многочисленные ок-
соионы и комплексные галогенидные ионы, акваионы в некото-
рых гидратах (например, А1(Н2ОN3+), все конечные заряженные
координационные комплексы, не говоря уже о самых простых
ионах типа CN~, С22~, О2~, О22~, и многие другие. Кристаллы,
содержащие меньшие по размерам или более симметричные
комплексные ионы, часто имеют структуры, подобные структу-
рам соединений АтХп (см., например, разд. о структуре NaCl
в гл. 6).
1.5.5. Соотношения между кристаллическими структурами. На-
ша цель состоит в том, чтобы в первой части этой книги пред-
ставить основы геометрии и топологии, необходимые для по-
нимания трехмерных систем атомов, которые составляют моле-
кулы и кристаллы, и дать возможность описать наиболее важ-
ные структуры наипростейшим возможным способом. Ввиду
чрезвычайного разнообразия атомных расположений, найденных
в кристаллах, важно обратить внимание на любые принципы,
которые могут упростить нашу задачу. Поэтому здесь мы от-
мечаем некоторые соотношения между кристаллическими струк-
турами, которые будут полезны в дальнейшем.
а) Одинаковый основной каркас может быть использован
как для простых структур, так и для кристаллов с относительно
1.5. Классификация кристаллов 51:
сложными химическими формулами, как будет проиллюстриро-
вано для алмазной сетки в гл. 5.
б) Структуры могут быть отнесены к простой структуре
АшХд одним из следующих способов.
I. Структуры замещения: 1) упорядоченные (сверхструкту-
ры), 2) неупорядоченные.
II. Структуры вычитания и внедрения: 1) упорядоченные,
2) неупорядоченные.
III. Комплексные группы, замещающие атомы А и (или) X.
IV. Структуры с искажениями: 1) небольшое искажение,.
2) большое искажение. (Небольшое искажение предполагает,
что топология структуры радикально не изменилась, тогда как
дальнейшее искажение приводит к изменениям в координацион-
ном числе.)
Мы проиллюстрируем эти соотношения путем детального
рассмотрения некоторых простейших структур в гл. 6. Будет
также показано, как слой Cdl2 (рис. 6.14) используется в по-
строении структур ряда «основных солей», одни из которых име-
ют слоистые, а другие — трехмерные структуры.
в) Структуры некоторых оксидов и комплексных оксидов,
построенные из блоков или частей более простых структур.
Примеры, описанные в последующих главах, включают оксиды
Ti и V с формулами МлОгл-ь построенные из блоков структуры
рутила, и оксиды Мо и W (например, МпОзп-i), связанные по-
добным же образом со структурами МоО3 и WO3 (структуры
со сдвигом). Более сложные примеры включают оксиды
Srn+iTinO3n+i, образованные из частей структуры перовскита
(АВХ3), и структуры «р-алюмина» (NaAlnOn) и ферромагнит-
ного плюмбита (PbFei2Oi9), в которых части шпинелеподобной
(АВ2Х4) структуры удерживаются вместе ионами Na+ и РЬ24"
соответственно.
2. СИММЕТРИЯ
2.1. Элементы симметрии
Представления о симметрии в том или ином аспекте исполь-
зуются в искусстве, математике и других областях науки. Хи-
мик изучает симметрию распределения электронной плотности
в атомах и молекулах, а значит, и симметрию молекул как та-
ковых. Здесь мы намерены рассмотреть чисто геометрический
аспект симметрии, а именно симметрию конечных фигур, таких,
как полиэдры и повторяющиеся узоры. В той мере, в какой эти
фигуры и узоры отражают расположение атомов в молекулах
и кристаллах, они характеризуют и симметрию распределения
валентных электронов этих атомов. Симметрия в ограниченном
смысле (в котором мы будем использовать этот термин) свя-
зана с соотношениями между различными частями твердого
тела. Если имеется определенная связь между отдельными час-
тями фигуры, говорят, что она обладает определенными элемен-
тами симметрии.
Наиболее простыми элементами симметрии являются центр,
плоскость и оси симметрии. Куб, например, симметричен отно-
сительно собственного центра, т. е. каждой точке (xyz) его по-
верхности соответствует аналогичная точка {xyz). Это значит,
что он обладает центром симметрии* (является центросиммет-
ричным) в отличие от тетраэдра, который такой симметрией не
обладает. Отражение одной половины фигуры в плоскости сим-
метрии воспроизводит вторую половину фигуры (отсюда дру-
гое название плоскости симметрии — «зеркальная плоскость»).
Легко убедиться в том, что куб имеет девять плоскостей сим-
метрии. Наличие оси симметрии п-го порядка подразумевает,
что внешний вид фигуры сохраняется при повороте на угол
.3607"; куб имеет шесть осей симметрии 2-го порядка, четыре
оси — 3-го и три оси 4-го порядка.
Мы пока отложим дальнейшее обсуждение симметрии конеч-
ных фигур и используем более общий подход к симметрии по-
вторяющихся узоров, который в конечном счете приведет к рас-
смотрению симметрии и конечных групп точек.
* В русской литературе для этого элемента симметрии используется тер-
мин «центр инверсии». — Прим. ред.
2.2. Повторяющиеся узоры, элементарные ячейки и решетки 53
2.2. Повторяющиеся узоры, элементарные ячейки и решетки
Повторяющийся узор, воспроизводящий некоторую единицу с
постоянным интервалом вдоль одной, двух или трех (непарал-
лельных) осей, определяет решетку, на которой основан узор.
Для одномерного узора решеткой является линия, для двумер-
ного— плоская сетка, для трехмерного вводится третья ось, не
компланарная двум первым (рис. 2.1). Для определения трех
Рис. 2.1. Одно-, дву- и трехмерные решетки.
типов решеток в самой общей форме требуются следующие па-
раметры:
Решетка Трансляция решетки
(повторяющиеся расстояния)
одномерная а
двумерная а, Ъ
трехмерная а, Ь, с
Углы между
осями
У
Y, а,
Эти параметры определяют элементарную ячейку (повторяю-
щуюся единицу) узора, которая выделена на рис. 2.1. Любая
точка (или линия) в одной элементарной ячейке должна зани-
мать такое же относительное положение в каждой ячейке и,
следовательно, любой одно-, дву- или трехмерный узор пол-
ностью описывается, если установлено содержимое одной
ячейки.
Очевидно, что каждый узел решетки имеет одинаковое окру-
жение по всей решетке. Если вдоль какой-то линии решетки
имеются узлы, отстоящие на расстоянии х друг от друга, то
вдоль этой линии должны быть и другие узлы на тех же рас-
стояниях при неограниченном продолжении ее в обоих направ-
лениях. (Мы сошлемся на это свойство решетки при описании
плотнейших шаровых упаковок в гл. 4.) Отметим, что решетка
не имеет физической реальности; она не составляет часть
узора*.
* Узлы решетки —лишь математические точки; необязательно чтобы они
совпадали с центрами атомов. — Прим. ред.
54 2. Симметрия
2.2.1. Одно- и двумерные решетки; точечные группы. Строго-
одномерный узор представляет до некоторой степени академи-
ческий интерес, поскольку содержит только точки, лежащие
вдоль линии. Из элементов симметрии возможна только точка
инверсии (центр симметрии); соответственно узор одномерной
решетки —либо набор точек, повторяющихся с регулярным ин-
тервалом а (нет элементов симметрии), либо пары точек, свя-
занные точками инверсии (рис. 2.2, а). Несмотря на то что точ-
ки инверсии (на рис. 2.2, а маленькие черные кружки) перво-
начально были расположены только в узлах решетки (т. е. на
расстоянии а друг от друга), они появляются и посредине меж-
ду узлами. Это явление, состоящее в возникновении дополни-
Нет симметрии
I I I
-okx>k>~ok>-
Центр инверсии
в
*
Линия зеркаль -
nozo отражения
Линия скользя-
щего отражения
Рис. 2.2. Элементы симметрии в одномерном (а) и двумерных (б, е) узорах.
тельных элементов симметрии между элементами симметрии,
расположенными в узлах решетки, — важное свойство дву- и
трехмерных групп симметрии.
Рассматривая двумерные узоры, мы можем выявить две
важные особенности, характерные и для трехмерных узоров,
представляющих для нас наибольший интерес. Во-первых, точ-
ка инверсии (точка отражения) заменяется на линию зеркаль-
ного отражения (рис. 2.2, б) и помимо этого появляются еще
два новых элемента симметрии, включающие перенос и враще-
ние. Линия скользящего отражения сочетает операцию отраже-
ния от прямой с переносом на половину расстояния между уз-
лами решетки (рис. 2.2, е). Необходимо, чтобы перенос был ра-
вен именно половине трансляции, так как точка должна повто-
риться на расстоянии, равном трансляции решетки. Другой эле-
мент симметрии —я-кратный поворот — приводит к появлению
набора точек, связанных вращением на угол 360°/« и располо-
женных по вершинам правильного «-угольника. (При рассмот-
рении плоских узоров следует помнить, что двумерные образо-
вания могут перемещаться только в плоскости и не имеют
третьего измерения. Элемент симметрии, который приводит к
появлению набора я точек, симметрически связанных друг с
другом в плоскости, строго говоря, следовало бы назвать «точ-
кой поворота». Однако для трехмерного случая такую точку
поворота легче представить себе как пересечение оси симмет-
2.2. Повторяющиеся узоры, элементарные ячейки и решетки 55
рии п-то порядка с плоскостью, ей перпендикулярной.) Для ил-
люстрации элементов симметрии удобно использовать асиммет-
ричную фигуру в форме запятой; тогда на рисунке отражается
только желаемая симметрия. Например, рис. 2.3, а иллюстри-
рует только ось симметрии 4-го порядка, в то время как фигу-
ра на рис. 2.3,6 обладает также зеркальной симметрией. Ниже
а
i
Рис. 2.3. Изображение элементов симметрии (см. текст).
мы увидим, как важно различать симметрию простой поворот-
ной оси 4-го порядка (класс 4) и комбинацию ее с отражением
(класс 4mm) (пояснение символов — ниже в этой главе).
Теперь мы подошли ко второй особенности, касающейся
плоских узоров. Изолированная фигура (например, многоуголь-
ник) может обладать поворотной симметрией с любым п, но
для плоского повторяющегося узора в целом на порядок осей
вращения накладываются существенные ограничения. Присут-
ствие поворотной симметрии я-го порядка в двумерной решетке
приводит к образованию системы поворотных осей л-го поряд-
ка, перпендикулярных плоскости (или,
строго говоря, узора из точек поворо-
та п-го порядка в плоскости), по-
скольку двумерный узор состоит из
повторяющихся точек. Допустим, что
через точку Р на рис. 2.4 проходит
поворотная ось л-го порядка, перпен-
дикулярная плоскости чертежа, а че-
рез точку Q—другая поворотная ось
п-го порядка, ближайшая к ней. По-
ворот на 2л/я вокруг Q переводит Р
в Р'\ аналогичный поворот вокруг Р' переводит Q в Q'. Может
оказаться, что точки Р и Q' совпадут; в этом случае л = 6. Во
всех других случаях отрезок PQ' должен быть равен или це-
лочисленно кратен отрезку P'Q (поскольку Q выбрана как одна
из ближайших осей), т. е. га^4. Следовательно, допустимые
значения л равны 1, 2, 3, 4 и 6. Поскольку трехмерную решетку
можно рассматривать как совокупность плоских сеток, такое
же ограничение видов вращательной симметрии относится и к
Рис. 2.4. Осезая симмет-
рия, возможная в пло-
ских узорах (см. текст).
56 2. Симметрия
трехмерным решеткам, а следовательно, и к симметрии крис-
таллов.
На рис. 2.1 мы проиллюстрировали наиболее общую форму
двумерной решетки, но ясно, что, если узор имеет поворотные
оси 3, 4 или 6-го порядков, сама решетка также будет более
симметричной, чем на рис. 2.1. Было показано, что возможны
пять, и только пять, двумерных решеток, совместимых с допус-
тимой симметрией двумерных узоров (рис. 2.5).
90°
тл1
Рис. 2.5. Пять плоских решеток.
Теперь мы должны найти, какие комбинации элементов сим-
метрии совместимы с каждой из пяти основных плоских реше-
ток. Рассмотрим квадратную решетку. Прежде всего у нас мо-
жет быть просто поворотная ось 4-го порядка в каждом узле
решетки (рис. 2.6, а). Это автоматически приводит к появлению
оси 4-го порядка в центре каждой квадратной элементарной
ячейки и осей 2-го порядка на серединах сторон. Любая точка,
помещенная в плоскости, повторяется так, что образуются на-
боры четырех точек (запятых), расположенных вокруг каждого
узла решетки (если только точка не лежит на самой оси сим-
метрии; тогда повторения не будет). Мы можем также сделать
узор симметричным относительно каждой стороны ячейки, как
показано на рис. 2.6, б, ограничив ячейку линиями зеркального
отражения. Эта комбинация поворотной и отражательной сим-
метрии превращает каждую точку в группу из восьми точек,
расположенных вокруг каждого узла решетки. Находя все до-
пустимые (различные) комбинации симметрии с разными дву-
2.2. Повторяющиеся узоры, элементарные ячейки и решетки 57
мерными решетками, мы приходим в итоге к 17 плоским груп-
пам, которые образуют основу всех двумерных узоров.
Очевидно, что определенные точки элементарной ячейки име-
ют различную собственную симметрию. Например, на рис. 2.6, а
в вершинах и центре элементарной ячейки расположены пово-
ротные оси симметрии 4-го порядка, а в серединах ребер — по-
воротные оси 2-го порядка. Подобным же образом на рис. 2.6, б
через вершины элементарной ячейки проходят четыре линии от-
ражения и поворотная ось 4-го порядка, через середины сто-
рон— только две перпендикулярные линии отражения и ось
п ось 4-го порядка i ось 2-го порядка
Рис. 2.6. Поворотные оси симметрии 4-го порядка в плоских узорах.
2-го порядка. Совокупность элементов симметрии, присущих
точке в повторяющемся узоре, называется точечной группой
симметрии. Все элементы точечной фуппы симметрии проходят
через общую точку и порождают вокруг нее систему симметри-
чески связанных друг с другом (эквивалентных) точек. В дву-
мерном случае возможно всего 10 различных по симметрии то-
чечных групп.
2.2.2. Трехмерные решетки; пространственные группы. Как
в случае одно- и двумерных узоров, мы рассмотрим сначала
различные возможные решетки, на которых базируются узоры,
и затем возможные комбинации элементов симметрии, которые
могут сочетаться с решетками. Существует 14 трехмерных ре-
шеток, совместимых с типами поворотной симметрии, которыми
может обладать трехмерный повторяющийся узор. Это—14 ре-
шеток Бравэ (рис. 2.7 и табл. 2.1). Повторяющиеся расстояния
(единичные трансляции) вдоль осей определяют элементарную
ячейку, и на рис. 2.7 элементарная ячейка каждой решетки вы-
делена сплошными линиями.
В простой, или примитивной (Р), решетке узлы находятся
только в вершинах элементарной ячейки. Если узлы имеются и
58 2. Симметрия
в центре элементарной ячейки, решетка называется объемно-
центрированной (/-решетка); если узлы находятся в центрах
некоторых граней (помимо узлов в вершинах), решетка назы-
вается А-, В- или С-центрированной, а если центрированы все
грани, то .F-решеткой. Элементарная ячейка центрированной ре-
7 W
"' 121)
Рис. 2.7. 14 решеток Бравэ.
шетки содержит более одного узла (два в /, А, В или С и четы-
ре в F-решетках); вообще говоря, всегда можно выделить мень-
шую ячейку, содержащую только один узел, но такие ячейки
соответствуют решеткам более низкой симметрии, уже указан-
ным на рис. 2.7. Следует обратить внимание на то, что
на рис. 2.7 и в табл. 2.1 показано лишь ограниченное число
центрированных ячеек. Так, например, не упоминается моно-
клинная 5-центрированная ячейка, поскольку такая ячейка мо-
жет быть сведена к моноклинной Р-ячейке лишь с иным уг-
Триклинная
Моноклинная
Ромбическая
Р
Р
С
Р
С
I
F
Таблица 2.1. 14
(или А)
(В или А)
решеток Бравэ
Номер ячей-
ки на рис. 2.7
1
2
3
4
5
6
7
Гексагональная
Ромбоэдрическая
Тетрагональная
Кубическая
Р
R
Р
I
Р
I
F
Номер ячей-
ки на рис. 2.7
8
9
10
11
12
13
14
2.2. Повторяющиеся узоры, элементарные ячейки и решетки
59
лом р. Подобным образом в табл. 2.1 имеется С-центрирован-
ная ромбическая решетка, но нет С-центрированной тетраго-
нальной. Последняя тождественна Р-решетке с осями а и Ь, на-
правленными под углом 45° по отношению к осям С-решетки,
в то время как в случае ромбической решетки выбор наимень-
шей ячейки привел бы к углам между осями, не равным 90°.
Можно легко убедиться в том, что тетрагональная F-решетка
сводится к тетрагональной /. С кубической симметрией из цент-
рированных ячеек согласуются только объемно- и гранецентри-
рованная.
б
а
-О*
-®
У (xyz)
Рис. 2.8. Действие инверсионной оси (см. текст).
В трехмерных решетках присутствует гораздо большее чис-
ло элементов симметрии, чем в двумерных. Кроме инверсии
(центра симметрии), отражения (зеркальной плоскости) и про-
стой поворотной симметрии (простых поворотных осей n-го по-
рядка, где п=\, 2, 3, 4 или 6) могут присутствовать инверсион-
ные оси и два вида операций, включающих перенос, а именно
плоскости скользящего отражения и винтовые оси. Инверсион-
ная ось п сочетает операцию поворота на угол 360°/п с одновре-
менным отражением в центре инверсии. Например, ось 4 (пер-
пендикулярная плоскости чертежа) превращает точку (xyz)
в набор четырех точек, как показано на рис. 2.8, а, на котором
точки, расположенные выше и ниже плоскости чертежа, обозна-
чены заполненными и свободными кружками соответственно^.
Поворот на 90° по часовой стрелке_с последующей_инверсией
превращает А в В (yxz), В в С {xyz), а С в D (yxz). Следует
подчеркнуть, что две операции, которые включают в себя ось п,
неразделимы, т. е. ось 4 не эквивалентна наличию поворотной
оси 4 и центра симметрии. Такая комбинация образует набор из
8 точек, показанных на рис. 2.8, б, в то время как под действием
оси 4 получают только четыре точки^ Легко убедиться, что
ось! эквивалентна центру симметрии, 2 — плоскости симметрии
(обозначаемой также т), 3 — совокупности обычной поворотной
60 2. Симметрия
оси 3-го порядка и центра симметрии, 6 — поворотной оси 3-го
порядка и перпендикулярной к ней плоскости (рис. 2.9). Сим-
вол 3//л —просто удобный способ обозначения —и указывает,.
что плоскость симметрии перпендикулярна поворотной оси 3.
Символ Зт указывает, что плоскость параллельна оси симмет-
рии. Если обследовать конечные фигуры, например полиэдры и
модели кристаллов, обладающие разной симметрией, то легко
обнаружить, что инверсионная ось 3 порождает шесть граней
ромбоэдра, ось 4 — тетраэдр, ось 6 — тригональную бипирами-
ду. При описании симметрии полиэдра элемент симметрии дей-
ствует на грани, а не на точки, как на рис. 2.8 и 2.9.
Плоскость скользящего отраже-
ния является трехмерным анало-
гом линии скользящего отражения
двумерных узоров. Как следует из
названия, она сочетает операцию
скольжения с отражением. Если мы
представим точку А (рис. 2.10) по*
одну сторону зеркала сначала пе-
ремещенной в А', а затем отражен-
ной через зеркальную плоскость в
В, то можно сказать, что А перехо-
дит в В под действием операции
скользящего отражения. Такая же-
операция, совершенная над точкой
В, переведет ее в С, при этом пред-
полагается, что перенос всегда ра-
вен постоянной величине ]/г #, где-
а —¦ единичная трансляция решет-
ки. Как мы ранее отмечали в отношении линии скользящего
отражения, перенос вдоль плоскости скольжения должен со-
ставлять именно половину трансляции решетки, поскольку точ-
ка должна повторяться на расстояниях, равных трансляциям
решетки. Плоскость скользящего отражения более сложного ти-
па переводит А в D, включая скольжение, равное 72а+72С,.
с последующим отражением. Если единичные трансляции а и.
с кристаллической решетки не эквивалентны, могут существо-
вать три типа плоскостей скользящего отражения: с величина-
ми скольжения, равными 1/2 а, 7г с и '/гО+У
им отвечают символы а, с и d (для диагональной)
Рис. 2.9. 4 типа инверсионных
осей.
соответственно;
* Плоскость скользящего отражения со скольжением '/га+'/гС принято.
обозначать через п. Символ d означает плоскость со скольжением 'Дя+'Дс
(«алмазная» плоскость). Последняя возможна лишь в том случае, если ячейка
центрирована по грани ас: повторное применение операции d дает трансляцию
Уга+'/гС — Прим. ред.
2.2. Повторяющиеся узоры, элементарные ячейки и решетки 61
Винтовая ось получила свое название по аналогии с винтом.
Поворот вокруг оси в сочетании с одновременным переносом,
параллельным ей, вычерчивает спираль лево- или правосторон-
нюю в соответствии с направлением поворота. Вместо непрерыв-
ной линии на поверхности цилиндра можно выделить ряд от-
дельных точек, каждая из которых является результатом пово-
рота на 360°/«. Через п точек мы вернемся к начальной, но
сдвинутой на х, т. е. на шаг спирали, который в трехмерном
узоре соответствует трансляции решетки. В символе винтовой
Рис. 2.10. Действие плоскости скользящего отражения.
оси указывают порядок п (поворот на 360°/я) и в качестве ин-
декса перенос в единицах х/п, где х — шаг спирали. Перенос,
связанный с каждым поворотом винтовой оси я-ro порядка, мо-
жет иметь любое значение от х/п до (п—1)х/п, и, следователь-
но, в трехмерно-периодических узорах возможны следующие
типы винтовых осей: 2ь 3i и 32; 4Ь 42 и 43; 6Ь 62, 63, 64 и 6s-
Удобным способом демонстрации совокупности точек, связан-
ных винтовыми осями, является представление их набором
цифр, указывающих высоты точек над плоскостью чертежа в
единицах х/п:
4 |з
В каждом случае, начиная от верхней части диаграммы (высо-
та 0) и далее по часовой стрелке, каждая точка поднимается
на х/п при каждом повороте на 360°/п. При наличии оси 6i все
шесть точек, последовательно связанные осью, располагаются
вдоль одной трансляции решетки, перпендикулярной плоскости
чертежа, причем высоты составляют 0, '/б, 2/б, 4/б и 5/6. При на-
личии других винтовых осей 6-го порядка точки распределя-
ются по 2,3,4 или 5 элементарным ячейкам. Например, в случае
:62 2. Симметрия
оси 64 высоты последовательно расположенных точек составля-
ют 0, 4, 8, 12, 16 и 20 в единицах х/6. Однако, поскольку по оп-
ределению в каждой элементарной ячейке точки должны быть
расположены одинаково, мы можем отнять 6 или число, крат-
ное 6, от этих значений, что даст нам 0, 4, 2, 0, 4, 2, т. е. сово-
купность шести точек, лежащих внутри одной элементарной
ячейки. Как видно из приведенных выше диаграмм, оси 6i и 65
¦сводятся друг к другу при изменении направления поворота (по
часовой стрелке на противоположное); подобное же соотноше-
ние существует между осями 62 и 64.
Теперь остается согласовать элементы симметрии всех четы-
рех типов: простые поворотные оси, инверсионные и винтовые
оси и плоскости скользящего отражения — с соответствующими
решетками. С первой решеткой Бравэ на рис. 2.7 (триклинная
решетка) совместимы только оси симметрии 1 и 1; первая не
вносит в решетку какой-либо симметрии, вторая делает решетку
центоосимметричной. Наиболее высокая симметрия, совмести-
мая с решетками 2 и 3, имеющими два угла между осями по
90° и один угол р (отсюда название моноклинные), соответству-
ет наличию осей 2 или 2\, совпадающих с осью b решетки.
Вместо этого или в дополнение к оси симметрии возможна плос-
кость симметрии, перпендикулярная оси Ъ. Это может быть зер-
кальная плоскость (пг или иначе 2) или плоскость скользящего
отражения. Найдено, что всего существует 14 видов трехмерной
симметрии (пространственных групп), соответствующих этим
двум моноклинным решеткам. Стоит отметить, что чрезвычайно
важная проблема определения общего числа пространственных
групп, возникающих с участием всех 14 решеток Бравэ, была
решена независимо в один и тот же период A885—1894 гг.)
Федоровым в России, Шёнфлисом в Германии и Барлоу в Анг-
лии*. Было установлено, что существует всего 230 пространст-
венных групп.
2.2.3. Точечные группы; кристаллографические системы. Выше
мы видели, что различные точки в плоских узорах могут иметь
разную симметрию и что общее число точечных групп, возмож-
ных в двумерных узорах, равно десяти. Для трехмерных узо-
ров число точечных групп — 32. Эти точечные группы отвечают
возможной симметрии в расположении конечных групп точек
вокруг особых позиций в решетке, следовательно, они не мо-
гут содержать элементов симметрии, включающих переносы,
а именно винтовых осей и плоскостей скользящего отражения,
* Первым эту проблему решил Е. С. Федоров. Это обстоятельство было
признано Шёнфлисом. Пространственные группы симметрии кристаллов назы-
вают поэтому федоровскими группами. — Прим. ред.
2.2. Повторяющиеся узоры, элементарные ячейки и решетки
63
но могут включать инверсионные оси. Все сказанное означает,
что мы подошли к проблемам симметрии, исходя из анализа
повторяющихся узоров и решеток, что привело нас к общему
перечню типов симметрии трехмерных узоров B30 пространст-
венным группам) и лишь как следствие — к тем комбинациям
элементов симметрии, которые могут быть связаны с особыми
точками в решетке (т. е. 32 точечным группам).
Однако исторически развитие теории симметрии было совер-
шенно иным. Начало кристаллографии как науки было положе-
но в XVII веке изучением внешней формы кристаллов. Было за-
а
Рис. 2.11. Вариации в габитусе кристаллов. Различное относительное разви-
тие: а) граней куба; б) граней куба и октаэдра.
мечено, что имеются значительные вариации в общих очерта-
ниях кристаллов индивидуального вещества (или одной из его
полиморфных модификаций), но как бы ни отклонялся кристалл
от идеальной формы, например куба или правильной призмы,
выяснилось, что углы между соответственными парами граней
остаются постоянными для всех кристаллов данного вещества.
Поэтому кристаллограф всегда имеет дело с нормалями к гра-
ням, и под симметрией внешней формы кристалла (и, следова-
тельно, его точечной симметрией) подразумевается симметрия
набора нормалей к граням, а не фактически существующей (ча-
сто искаженной) внешней формы индивидуального кристалла.
Вариации в относительном развитии граней кристалла рас-
сматриваются как вариации в кристаллическом габитусе; они
не связаны с внутренним строением кристалла, а относятся к из-
менениям внешних условий, таких, например, как близость дру-
гих кристаллов или присутствие примесей в растворе или рас-
плаве. Такие примеры показаны на рис. 2.11.
Благодаря регулярному внутреннему строению кристалла
симметрия его внешней формы подчиняется тем же ограниче-
ниям, что и типы поворотной симметрии, которые относятся к
любому трехмерному повторяющемуся узору. Кроме того, все
элементы симметрии, описывающие внешнюю форму кристалла,.
<64
2. Симметрия
2.2. Повторяющиеся узоры, элементарные ячейки и решетки
65
должны проходить через одну общую точку и не могут вклю-
чать переносов, поскольку они описывают расположение гра-
ней конечного кристалла. Поэтому 32 класса симметрии кри-
сталлов, которые были выведены еще в 1830 г., идентичны
32 точечным группам, о которых мы упоминали выше. Они
Таблица 2.3. Кристаллографические системы:
элементарные ячейки и характеристическая симметрия
Тип решетки
Триклинная
.Моноклин-
ная
Ромбическая
Тетрагональ-
лая
Таблица 2
Герман —
1Моген
1
1
2
m
2/m
222
mmi
mmm
4
4
4/m
422
4mm
42m
4/mmm
.2. 32 класса
Шёйфлис
Ci, S2
c2
Ce, Cih
Cih
D2, V
С 2-0
Dzh, Vh
c4
S4
Cih
Di
»»
D2d, Vd
Dih
симметрии кристаллов
Тип решетки
Тригональ-
ная
Гексагональ-
ная
Кубическая
Герман —
Мог1ен
3
3
32
3/п
Зт
6
6
6/т
622
бтт
6т2
6/ттт
23
тЗ
432
43т
тЗт
Шёнфлио
Сг
C%i, S6
D3
D3d
с6
C3h
Ceh
D,
Ьби
D3h
D6h
T
Th
О
Tu
oh
сгруппированы в семь кристаллографических систем, как пока-
зано в табл. 2.2, в которой приводятся символы Германа—Мо-
гена, используемые кристаллографами, а также более ранние
символы Шёнфлиса, до сих пор предпочитаемые в спектро-
скопии.
Симметрия, характерная для точечных кристаллографиче-
ских систем, а также параметры, требуемые для определения
элементарных ячеек, приведены в табл. 2.3.
Из сравнения рис. 2.7 с табл. 2.3 можно видеть, что, хотя
среди кристаллографических систем мы поместили тригональ-
ную и гексагональную, рис. 2.7 включает ромбоэдрическую и
гексагональную решетки. Причина этого различия заключается
в следующем. Все кристаллы с единственной осью симметрии
3-го или 6-го порядка могут быть отнесены к гексагональной ре-
шетке (элементарной ячейке); это значит, что все точки, изо-
браженные на рис. 2.12 светлыми кружками, имеют одинаковое
Система
Трпклинпая
Моноклинная
Ромбическая
Тетрагональная
Тригоналы1аяа
и
гексагональная
Кубическая
Соотношение меж-
ду ребрами и уг-
лами элементар-
ной ячейки
афЬфс
¦лф$Фуф90°
аФЬфс
a=Y=90 ф$
аФЬФс
а=р=у=90°
а = Ьфс
а=C=7=90°
а=Ьфс
а =C = 90°
7=120°
а = Ь = с
a=p = Y = 90°
Независимые
параметры
решетки
(длины ре-
бер и углы)
a, b, с
а, Р, у
а, Ь, с
Р
а, Ъ, с
а, с
а, с
а
Характеристическая
симметрия
Только ось симметрии
1-го порядка (тождест-
во или инверсия)
Ось 2-го порядка B
или 2) только в одном
направлении (у-осьN
Оси 2-го порядка в
трех взаимно перпенди-
кулярных направлениях
Ось 4-го порядка толь-
ко вдоль г-оси
Ось 3-го или 6-го по-
рядка только вдоль г-оси
4 оси 3-го порядка, каж-
дая наклонена под уг-
лом 54°44' к осям ячей-
ки (т. е. параллельна
телесной диагонали эле-
ментарной ячейки)
в Никоторые тригональнне кристаллы также могут быть отнесены к ромбоэдриче-
ским '>сям, причем элементарная ячейка ромбоэдра определена ребром а и углом меж-
ду осями a (#=90D).
^ В настоящее время вдоль осп симметрии моноклинного кристалла часто направ-
ляют [,,-ь ? координатной системы; в этом случае а = Р=90'=Ау (независимый угол 7)- —
Прим. реи.
окружение. Но некоторые тригональные кристаллы обладают
также той особенностью, что и точки, отмеченные черными
кружками, имеют такое же окружение, как точки в вершинах
гексагональной элементарной ячейки. Такие точки являются
вершинами ромбоэдра (составляющего 7з объема гексагональ-
ной ячейки), и структура такого кристалла может быть, следо-
вательно, отнесена к ромбоэдрическим осям и описана ромбо-
эдрической элементарной ячейкой.
Вероятно, следует обратить внимание на допустимую на
первый взгляд возможность существования симметрии кубиче-
ской системы без осей 4-го (или 2-го) порядка или плоскостей
симметрии, а лишь с четырьмя осями 3-го порядка, параллель-
ными телесным диагоналям кубической элементарной ячейки.
5—752
66 2. Симметрия
Однако в действительности такая комбинация наклонных осей
3-го порядка неизбежно приводит к появлению трех взаимно
перпендикулярных осей 2-го или 4-го порядка, параллельных
кубическим осям. Помимо этого могут присутствовать и другие
оси и плоскости симметрии, но они не являются обязательными
для кубической симметрии и встречаются не во всех кубиче-
ских точечных или пространственных группах.
' ! ' ' --"' ! 1^
2.2.4. Эквивалентные позиции в про-
^_ странственных группах. Мы констати-
ровали, что расположение граней кри-
сталла (или более точно — нормалей
к граням) описывается его точечной
группой симметрии. Шесть треуголь-
ных граней правильной гексагональ-
ной пирамиды связаны осью 6-го по-
рядка, но грань, лежащая в основа-
нии пирамиды, не связана с ними,
так как ее нормаль совпадает с осью
симметрии. Подобным же образом
шесть вершин связаны осью симмет-
¦.—'Z Рии> а седьмая является особой точ-
кой, причем разница между ними со-
стоит в том, что шесть вершин грани
основания пирамиды лежат вне оси
симметрии, в то время как седьмая
вершина — на оси симметрии. Анало-
гичные ситуации наблюдаются и в
более сложных системах элементов
симметрии, составляющих 230 прост-
ранственных групп. Число эквивалентных точек (позиций) в
элементарной ячейке зависит не только от присутствующих ти-
пов симметрии, но, кроме того, и от местоположения точки
(атома) относительно элементов симметрии. Рис. 2.13 представ-
ляет проекцию элементарной ячейки кристалла. Плоскости сим-
метрии, перпендикулярные чертежу, пересекают плоскость про-
екции по сплошным линиям. Поскольку мы имеем дело с трех-
мерной решеткой, плоскости симметрии повторяются на рас-
стояниях, равных периодам решетки (на границах элементар-
ной ячейки); следует отметить, что, кроме того, возникают до-
полнительные плоскости посредине между ними. Точка (атом),
расположенная на пересечении плоскостей симметрии, не раз-
множается этими элементами симметрии, это — однократная
эквивалентная позиция. Точка, расположенная на одной из пло-
скостей симметрии (зачерненный кружок), размножается толь-
ко другой плоскостью (другими плоскостями), образуя дву-
2.2. Повторяющиеся узоры, элементарные ячейки и решетки
67
Рис. 2.12. Соотношение меж-
ду гексагональной и ромбо-
эдрической элементарными
ячейками.
О
кратную позицию, в то время как точка, которая не лежит ни
па одной из плоскостей (маленький пустой кружок), размножа-
ется обеими; это — четырехкратная позиция. Последняя назы-
вается общей позицией, одно- и двукратная позиции называ-
ются частными позициями.
Следовало бы оговорить два условия. Во-первых, согласно
классической структурной теории все эквивалентные позиции
дайной системы должны быть заняты, и более того, они должны
быть заняты атомами одного сорта. В последних главах мы
приведем примеры кристаллов, в которых одно или оба из этих
положений не удовлетворяются;
очевидным случаем является
твердый раствор, в котором ато-
мы разных элементов занимают
случайным образом одну или
более систем эквивалентных по-
зиций. Размещение атомов одно-
го и того же сорта по несколь-
ким различным системам эквива-
лентных позиций встречается
еще чаще и может приводить к
совершенно различному окруже-
нию химически сходных атомов.
Примеры включают множество
кристаллов, в которых атомы од-
ного и того же элемента, и при-
том в одинаковой степени окис-
ления, имеют как тетраэдриче-
скую, так и октаэдрическую координации (как отмечено в
гл. 5) или плоскую и тетраэдрическую координации в случае
о
о
о
о
о
о
-•-е
о
о
Рис.
О 1 - кратная, ф 2-кратная,
О 4-кратная эквивалентные
позиции
2.13. Эквивалентные позиции
в элементарной ячейке.
Cu(II) (разд. 25.7.1) или Ni(II) (разд. 27.8.1). Во-вторых, если
молекула (или комплексный ион) находится в одной из част-
ных позиций, она должна обладать точечной симметрией этой
позиции. Молекула, лежащая на плоскости симметрии, должна
иметь плоскость симметрии, а молекула, центр которой распо-
лагается на пересечении двух плоскостей симметрии, должна
обладать двумя взаимно перпендикулярными плоскостями сим-
метрии. Поэтому, если можно показать, что молекула распола-
гается именно в такой позиции, то это является доказательст-
вом соответствующей собственной симметрии молекулы. (На-
пример, если в элементарной ячейке, показанной на рис. 2.13,
содержится только одна молекула, о чем можно судить по
плотности кристалла, то молекула должна обладать двумя вза-
имно перпендикулярными плоскостями симметрии.) Конечно,
такое заключение несостоятельно, если возможны произвольная
ориентация или свободное вращение молекул. Кроме того, су-
68
2. Симметрия
ществует еще один повод для осторожности в применении та-
кого типа аргументации к неорганическим кристаллам.
Допустим, что мы хотим знать расположение атомов X во-
круг атома В в галогенидном комплексе А2ВХ4, содержащем
предположительно плоские или тетраэдрические ионы ВХ4. До-
пустим далее, что, согласно рентгенографическим данным, ато-
мы В располагаются в центрах симметрии. Если ионы ВХ42~
конечны, они не могут быть тетраэдрическими, так как тетра-
эдрическая группа не центросимметрична. Однако анион ВХ42~
может быть и бесконечным, а бесконечный линейный ион, со-
стоящий из октаэдрических групп ВХ6 с общими противополож-
ными ребрами, также соответствует наблюдаемой точечной
симметрии.
Отметим еще один момент, касающийся эквивалентных по-
зиций. На симметрию молекулы, занимающую общую позицию
в пространственной группе, ограничений не накладывается (та-
кова, например, четырехкратная позиция на рис. 2.13); поэтому
в принципе молекула может обладать и осью симметрии 8-го по-
рядка, и симметрией икосаэдра или симметрией любого другого
типа; она может быть и полностью асимметричной.
2.2.5. Примеры «аномальной» симметрии. Особый интерес при-
влекают к себе молекулы или кристаллы с симметрией выше
или ниже ожидаемой. Это утверждение требует пояснения.
В гл. 4, где обсуждается упаковка сфер одинакового размера,
мы увидим, что для большинства металлов характерны опреде-
ленные высокосимметричные структуры. Однако некоторые
металлы кристаллизуются в менее симметричных вариантах тех
же структур, и этот факт представляет очевидный интерес, по-
скольку более низкая симметрия, по-видимому, указывает на
какие-то особенности взаимодействий в таких структурах. Не-
которые кристаллы, содержащие только высокосимметричные
ионы (например, FeO), проявляют более низкую симметрию при
охлаждении. Особенный интерес представляет металлическое
олово, высокотемпературная форма которого имеет более низ-
кую симметрию, чем низкотемпературная. Существует ряд со-
единений, в которых осуществляется только искаженный вари-
ант высокосимметричной структуры. В некоторых случаях мо-
жет быть дано разумное объяснение понижения симметрии. На-
пример, в случае Nbl4 или V02 причиной понижения симметрии
может быть дополнительное взаимодействие между атомами
металла; в случае C11F2, имеющего искаженную структуру ру-
тила,— асимметрия ^-конфигурации двухвалентной меди.
В других случаях пока не удается найти очевидного объяснения
пониженной симметрии, что относится, например, к кристал-
лическому PdS, симметрия которого ниже, чем PtS.
2.3. Изомерия 69
Существует также много случаев, когда симметрия оказы-
вается более высокой, чем можно было бы ожидать. Многие
кристаллы, содержащие комплексные ионы, при комнатной или
более высокой температуре имеют структуры, в которых сим-
метрия комплексного иона выше известной или ожидаемой (на-
пример, сферическая симметрия 0Н~ или Ог2~). В таких слу-
чаях более высокая симметрия является результатом произволь-
ной ориентации или свободного вращения несферической груп-
пы. Мы уже отмечали, что в твердых растворах атомы более
чем одного сорта случайным образом занимают системы экви-
валентных позиций; случайное расположение вакансий в «де-
фектной» структуре может также приводить к сохранению сим-
метрии идеальной структуры.
Может показаться удивительным, что молекулы или ионы,
по-видимому обладающие собственной симметрией, не всегда
проявляют эту симметрию в кристаллах, т. е. занимают пози-
ции с более низкой точечной симметрией. Вполне очевидно, что
некристаллографическая симметрия (например, симметрия по-
воротной оси 5-го порядка плоского кольца или икосаэдриче-
ской группы) не может проявиться в кристалле. В лучшем слу-
чае группа с такой симметрией могла бы занять в кристалле
позицию в плоскости симметрии или на поворотной оси 2-го по-
рядка. Кроконат-ион в (NH4JC5O5 имеет точную (в пределах
точности структурного определения) симметрию оси 5-го по-
рядка, но в кристалле ионы должны упаковываться таким об-
разом, чтобы составить одну из 230 пространственных групп.
Подобным же образом, даже если молекулы обладают симмет-
рией кристаллографического типа (например, поворотными ося-
ми 4-го или 6-го порядков), основное требование состоит в том,,
чтобы они эффективно упаковывались, а это может оказаться
неосуществимым при параллельном расположении их осей, что
было бы необходимо в структурах с тетрагональной или гекса-
гональной симметрией.
2.3. Изомерия
Термин изомерия является весьма емким; он включает несколь-
ко типов структурных различий между молекулами (ионами),
имеющими одинаковый химический состав. Следовательно, он
тесно связан с полиморфизмом, поскольку оба касаются раз-
личий между пространственным расположением данной сово-
купности атомов, в одном случае образующих конечную груп-
ПУ, а в другом — бесконечное множество (кристалл). Струк-
турные различия между изомерами можно расположить в ши-
рокий ряд, начиная от различий между топологическими изоме-
рами, которые представляют разные способы связывания одной
70 2. Симметрия
и той же совокупности атомов и обычно рассматриваются как
различные химические соединения, до различий между парой
оптических изомеров, являющихся структурно и химически
идентичными во всех отношениях, за исключением того, что от-
носятся друг к другу как предмет и зеркальное изображение.
Поскольку оптическую активность могут проявлять и молеку-
лы, и кристаллы и так как молекулы или ионы, обладающие
этим свойством, необязательно проявляют изомерию других ви-
дов, мы обсудим оптическую активность отдельно. Между эти-
ми двумя крайними видами изомерии находятся разные типы
геометрической изомерии (стереоизомерии). В соответствии с
названием стереоизомерия включает все случаи, в которых мо-
лекула (ион) может быть получена в двух (или более) формах,
различающихся пространственным расположением составляю-
щих атомов, но не топологией. Это означает, что в принципе
один геометрический изомер может быть превращен в другой
просто путем относительных передвижений некоторых атомов
без разрыва и последующего восстановления о-связей.
Между парой геометрических изомеров всегда существует
энергетический барьер; он может быть обусловлен л-взаимодей-
ствием (например, в случае цис-транс-изошерии производных
этилена или заслоненной и скрещенной форм ферроцена) или
тем, что взаимное превращение происходит через промежуточ-
ную форму, отличающуюся по геометрии (например, переход
ф/с-плоскоквадратного комплекса к гранс-изомеру через про-
межуточную форму с тетраэдрической симметрией). Геометри-
ческие изомеры проявляют различия в физических свойствах,
и в некоторых (сравнительно редких) случаях их рассматри-
вают как разные химические соединения (например, фумаровая
и малеиновая кислоты — это транс- и цис-формы НООССН =
= СНСООН).
Проблема изомерии тесно связана с симметрией. В форму-
лах I—IV X означает атом (Н или галоген) или группу (напри-
мер, СН3), присоединенную ординарной связью. Формы типа I
характерны для атомов О и S, а II и IV — для атомов N и Р.
В I два атома X не компланарны с двумя атомами О (S); мо-
лекула энантиоморфна, т. е. не может быть совмещена со сво-
им зеркальным изображением; она существует в левой и пра-
вой формах. Описание геометрии молекулы требует знания
X'
I
,0
II
N.
N.
Ж
ш
X
с
II
III
с
X
X X
\ /
N
N
/ \
X X
w
2.3. Изомерия 71
двугранного угла ХОО/ООХ. С другой стороны, все атомы в II
компланарны, и такие молекулы существуют в цис- и транс-
формах. Четыре атома в III коллинеарны, молекула имеет сим-
метрию цилиндра, и изомеров вообще нет. Молекулы типа IV
присущи атомам азота и фосфора; они могут служить приме-
рами двух из трех предельных конфигураций, возможных для
подобных молекул. Ниже схематически представлены молеку-
лы вдоль оси N—N (Р—Р):
заслоненная (цис) скрещенная (транс)
гош
Примеры включают:
скрещенная
гош:
скрещенная и гош:
Р2Н4 (твердый), P2F4, P2C14, P2U
N2H4, P2H4 (газ)
NaF4
Дитионит-ион (S2O42") служит примером группы такого же ро-
да, но с заслоненной конфигурацией. Примеры более сложных
типов геометрической изомерии, присущих ионам гетерополи-
кцелот, описаны в гл. 11.
Количество и типы изомеров таких молекул, как Ма2&2 или
Ма2Ь4 и т. д., зависят от пространственного расположения (сим-
метрии) связей вокруг центрального атома. Большое число
«классических» работ по изомерии проводилось специально с
целью выяснить, каково истинное расположение связей при двух
или большем числе разных возможностей; например, располо-
жены ли в плоскости или тетраэдрически 4 связи, имеют ли 6
связей октаэдрическое или тригонально-призматическое распо-
ложение. Хотя определение расположения связей путем установ-
ления числа изомеров и расщепления оптически активных со-
единений заменено сейчас прямыми структурными исследования-
ми, более старые методы сыграли важную роль в развитии струк-
турной химии; несколько примеров будет упомянуто позднее.
2.3.1. Структурная (топологическая изомерия). Как уже отме-
чалось, структурные изомеры — обычно химически различные
соединения, как в случае NH4NCO и CO(NH2J, являющемся
первым примером пары соединений, для которой термин «изо-
меры» был применен. Этот тип изомерии типичен для органиче-
ской химии; самые простые примеры — углеводороды: нормаль-
ный бутан и изобутан, о-, м- и л-замещенные производные бен-
72 2. Симметрия
зола и т. д. Простейший пример особого случая топологической
изомерии (упоминаемой ниже в гл. 3) представляют два пере-
плетающихся я-цикла, изомерные 2/г-циклу. Если изомерия
включает только перемещение атомов Н, то используется тер-
мин таутомерия; такая изомерия в органической химии встреча-
ется также часто. Простым примером является кето-енольная
таутомерия ацетилацетона:
Н
о о о он
Для тиоциановой кислоты (а; см. ниже) также возможны
две таутомерные формы, но в основном (95%) она существует
в изоформе. Известны сложные эфиры обоих типов, RSCN и
SCNR; в некоторых координационных соединениях металлов
лиганд SCN присоединяется к металлу через S, а в других—¦
через N. С другой стороны, кислородный аналог, циановая кис-
лота, существует исключительно в изоформе и образует слож-
ный эфир только одного типа — RNCO. При нагревании смеси
сухих AgF и S в стеклянном сосуде в вакууме до 120 °С образу-
ются оба изомера S2F2 (б). «Симметричный» изомер FSSF имеет
диэдральную структуру, подобную структуре Н2О2, с гош-рас-
2.3. Изомерия 73
(изо) s=C=
h-n:
цис
"О—N^ транс
положением связей S—F (и является энантиоморфным), в то
время как структура SSF2 пирамидальна и по геометрии очень
похожа на структуру OSiF2. Хотя формулу азотистой кислоты
можно написать двумя способами в или г, доказательств су-
ществования формы в не имеется; газ представляет собой смесь
цис- и транс-изомеров (г).
Более сложными примерами изомерии могут служить карбо-
раны (с атомами С, входящими в полиэдрический каркас ато-
мов В) и такие соединения, как S,2(NH)8_n. Последние образуют
циклические молекулы, подобные молекуле Ss элементной се-
ры, но с замещением части атомов S на группы NH. Три из че-
тырех возможных изомеров S6(NHJ уже описаны; это 1,3-, 1,4-
и 1,5-изомеры.
1,4
-N
1,5
Многочисленные примеры структурной изомерии встречают-
ся в химии координационных соединений. Здесь можно выде-
лить следующие типы:
1) изомерию «связей»
[Co(NH,).-;ONO]C!2 и [Co(NH3MNO.,]Cl.,
2) «ионизационную» изомерию
[Pt(NH3LClo]Br, и [Pt(NH3LBr2]Cl2
3) «координационную» изомерию
[Co(NHsH] [Cr(CN)e] и [Co(CN)e];[Cr(NH,)e]
4) «полимеризационную» изомерию
[Pt(NH3L][PtCI4] и Pt(NH3JCU
2.3.2. Геометрическая изомерия. Две части молекулы, связан-
ные ординарной связью, могут свободно вращаться относитель-
но друг друга, однако изомерия возникает лишь в том случае,
если только две или большее число конфигураций отделены
энергетическими барьерами, достаточно значительными, чтобы
предотвратить их взаимный переход (см. разд. 18.4.1). Ион
S2O62~ в K2S2O6 найден в двух конфигурациях, в транс-конфи-
гурации (центросимметричной) и в почти заслоненной конфигу-
рации. Оксалат-ион С2О42~ является плоским в натриевых и ка-
лиевых солях и не плоским в аммониевой соли. Эти различия
обусловлены взаимодействием соседних ионов в кристалле и
характерны только для кристаллического состояния, но не со-
храняются в растворе.
Некоторые простые примеры и,ис-гранс-изомерии уже отме-
чались. Более сложные примеры включают такие циклические
молекулы, как креслообразные 6-членные циклы (а), в которых
следует различать «экваториальные» и «аксиальные» связи,,
а также мостиковые молекулы (б); последние могут проявлять,
кроме того, структурную изомерию, поскольку возможен и не-
симметричный изомер а6МХ2М62 (а/?МХ2МаЬ и а2МХ2Ь2 —
структурные изомеры).
Ж
{транс)
В прошлом большое внимание уделялось изомерии одно-
ядерных молекул и ионов из-за зависимости, существующей
между числом изомеров и геометрическим расположением свя-
зей вокруг центрального атома. Так, если тетраэдрическая мо-
74
2. Симметрия
лекула Ма2/J существует только в одной форме, то плоская
молекула или ион того же состава могут в принципе существо-
вать в цис- и транс-формах; в частности, для соединений Pt
были получены многие пары этого типа. До того как стало воз-
можным определять кристаллические структуры, существовал
значительный интерес к определению числа изомеров таких
комплексов, как Соаф2, Для которых при октаэдрической коор-
динации можно было бы ожидать наличия двух изомеров, а при
тригонально-призматической (или плоской) координации — трех
изомеров. В связи с проблемой установления геометрии распо-
ложения связей по числу изомеров следует отметить два момен-
та. Во-первых, неудача в получении ожидаемого ряда изоме-
ров может быть обусловлена большими различиями в раство-
римости или изомеризацией в растворе с последующей кри-
сталлизацией наименее растворимого изомера. Например, хотя
многие соединения Pta2fr2 известны в двух формах, цис-n транс:
соответствующие соединения Pd обычно известны только в
гране-форме (исключение составляют РсЦЫНз^СЬ и
Pd(NH3J(NO2J)- В растворах соединений (R3SbJPdCl2 обе
формы существуют в неустойчивом равновесии с преобладани-
ем транс-формы, но выкристаллизовывается гораздо менее рас-
творимая цыс-форма. Во-вторых, необходимо подтвердить, что
разные полученные формы действительно являются геометриче-
скими изомерами. Например, изомеры соединения с эмпириче-
ским составом Pt(NH3JCl2 являются не геометрическими,
а структурными изомерами, причем один из них представляет
плоскую молекулу Pt(NH3JCl2, а другой — соль [Pt(NH3L]-
[PtCU]. Весьма похожий случай, внесший в свое время пута-
ницу в стереохимию теллура, касается существования двух
форм Те(СН3J12, которые, как ранее считали, являются цис- и
гранс-изомерами плоскоквадратного комплекса. Через некото-
рое время было показано, что один из изомеров — соль
[Те(СН3K] + [ТеСН314]~. В двух формах существует и ряд со-
единений кобальта состава CoX2R2, но одна из них состоит из
конечных тетраэдрических комплексов, а другая — из бесконеч-
ных цепей, в которых атом металла координирован октаэдри-
чески.
2.3.3. Оптическая активность. Оптическая активность — способ-
ность вращения плоскости поляризации плоскополяризованного
света — может проявляться веществом во всех агрегатных со-
стояниях. При получении оптически активного соединения в ис-
2.3. Изомерия 75
ходном препарате обычно должно присутствовать равное коли-
чество d- и /-молекул. Обычно они могут быть разделены путем
образования соединения (например, соли) с й- или /-формой
другого активного вещества и использования различия между
физическими свойствами полученных соединений (d-A) (/-В) и
(/-Л) (/-В), т. е. путем процесса, называемого расщеплением; но
в некоторых случаях применяются и специальные методы (на-
пример, сортировка кристаллов вручную). Так, расщепление
трп-о-тимотида было выполнено [J. Chem. Soc, 1952, 3747] путем
образования молекулярного соединения с неактивным вторым
компонентом (бензолом): в отличие от несольватированного
препарата, кристаллизующегося (из метанола) в виде рацемата,
молекулярное соединение с бензолом выпадает в виде оптически
активных d- и /-антиподов, образующих достаточно крупные
кристаллы. Формы й- или /-соединения проявляют оптическую
активность как в кристаллическом, так и в жидком, расплав-
ленном или парообразном состояниях, хотя в последних трех
случаях активность не может существовать неограниченно дол-
го, коль скоро возможно взаимопревращение двух форм; при
таком превращении постепенно образуется неактивная смесь
двух форм (происходит рацемизация).
Для конечной (по размеру) группы атомов критерием энан-
тиоморфизма является отсутствие инверсионной оси симмет-
рии п. Такая группа описывается как диссимметричная в про-
тивоположность асимметричной группе, которая предполагает
отсутствие любой симметрии. Если п нечетное, инверсионная
ось включает центр симметрии; если п кратно двум, но не крат-
но четырем, имеется плоскость симметрии; если п кратно четы-
рем, нет ни центра инверсии, ни плоскости симметрии, но си-
стема может быть приведена в совмещение со своим зеркаль-
ным изображением. Из простейших осей этих трех типов ось 1
эквивалентна центру симметрии, 2— плоскости симметрии. Так
как инверсионные оси 4га встречаются в молекулах сравнитель-
но редко, для практических целей в качестве критерия энантио-
морфизма и оптической активности в конечной (по размеру)
молекуле или комплексном ионе можно принять отсутствие:
центра симметрии или плоскости симметрии.
Н,С
н,с
V6 2. Симметрия
Изомер катиона тетраметнл-сшфо-бппирролндиния представ-
ляет пример молекулы, имеющей симметрию 4. Каждая метиль-
ная группа может проецироваться выше или ниже плоскости
того цикла, к которому она присоединена, а сами циклы лежат
во взаимно перпендикулярных плоскостях. В соответствии с
этим существуют следующие четыре формы этой молекулы (мо-
лекулы рассмотрены вдоль направления, изображенного выше
пунктирной линией, толстые линии обозначают циклы):
2.3. Изомерия 77
цис/цис
(активная)
цис/транс
(акгпибная)
транс/транс
{активная")
транс/транс
(мезо)
Все четыре формы были получены, в том числе лгезо-форма,
имеющая симметрию 4 и, как следствие, неактивная [J. Am.
Chem. Soc, 1955, 77, 4688].
Некоторые замещенные циклобутаны также обладают этой необычной
¦осью симметрии 4. Пример показан ниже (см. формулу I). Однако эта моле-_
'кула имеет также и диагональные плоскости симметрии, параллельные оси 4;
поэтому отсутствие у нее энантиоморфизма не может быть приписано наличию
самой оси. Эти плоскости симметрии исчезли бы, если бы метильные группы
-были замещены на группы C(XYZ) с образованием молекулы Па. Для того
чтобы проиллюстрировать отсутствие диагональных плоскостей симметрии, на
проекции Пб мы показали только эти группы C(XYZ). Эта молекула не может
обладать оптической активностью, так как она идентична со своим зеркальным
.изображением, хотя содержит не менее восьми асимметрических атомов угле-
рода.
Н
11 а
Сложнее обстоит дело со связью между оптической актив-
ностью и энантиоморфизмом в кристаллах. Из 32 классов сим-
метрии кристаллов 11 являются энантиоморфными:
1, 2, 3, 4, 6, 23, 222, 32, 42, 62 и 432
"Конкретный кристалл, имеющий симметрию одного из этих
классов, является либо лево-, либо правосторонним, и если слу-
чайно развиваются соответствующие грани при росте кристал-
ла, возможен ручной отбор энантномеров. Помимо этого опти-
ческая активность теоретически возможна еще в четырех не-
эиаитно.морфиых классах:
2 ( = w), mm, 4 и 42ш
В -лих. классах направления лево- и правостороннего вращения
плоскости поляризации должны существовать в одном и том
же кристалле. Правда, раннее утверждение, что оптическая ак-
тивность действительно проявляется в кристалле с симметри-
ей класса т (.мезптплоксид метилового эфира щавелевой кис-
лоты), позднее было опровергнуто, но для классов 4
(GAGa,.S4) [Ada cryst., 1969, А25, 633] и l2w (A^GaS2)
[Ada cryst., 1968, A24, 676] наличие оптической активности
было экспериментально подтверждено.
Как правило, оптическая активность, проявляемая кристал-
лом, сохраняется в других агрегатных состояниях только в
том случае, если она обусловлена диссимметрией конечной мо-
лекулы или комплексного нона. При этом необходимо также,
чтобы энергия активации для рацемизации (обмена d+±l) пре-
вышала некоторое значение ( ~80 кДж/моль при комнатной тем-
пературе). Если это условие не выполняется, то оптическая ак-
тивность не может быть выявлена, пока нет способа расщепле-
ния (выделения d- и /-форм) или по крайней мере способа из-
менения относительных количеств двух изомеров. С другой сто-
роны, оптическая активность многих кристаллов (например,
кварца, киновари, NaC103) является результатом лишь способа
соединения атомов в кристалле; в таком случае это свойст-
во только кристаллического вещества.
Оптическая активность первоначально была изучена на со-
единениях углерода. В 1874 г. Вант-Гофф показал, как возни-
кает оптическая активность, если четыре связи атома углеро-
да направлены к вершинам тетраэдра. Независимо от него поч-
ти одновременно Ле Бель высказал примерно аналогичные
взгляды. Молекула Cabcd, в которой атом С присоединен к
четырем различным атомам или группам, должна существовать
в двух формах, относящихся друг к другу как предмет и зер-
кальное изображение. Центральный атом С был описай как
асимметрический атом углерода. Простои молекулой этого ти-
па является молекула молочной кислоты, СН(СН3) (ОН)СООН,
существующая в d- и /-формах. Третья форма такого соедине-
ния—рацемическая. Истинный рацемат имеет характерную
кристаллическую структуру, отличающуюся от структур актив-
ных форм, причем в элементарной ячейке оптически неактивно-
го кристалла содержится равное число d- и /-молекул. Впро-
чем, следует отметить, что неактивные кристаллические формы
оптически активных соединений не обязательно являются ра-
78
2. Симметрия
цемическими. Например, кристаллическая р-фсннлглицерпиовая
кислота (т. пл. 141 °С) не является рацематом, однако крис-
таллы построены из субмнкроскопических пластинок, которые
являются попеременно d- и /-вращающими. При медленной пе-
рекристаллизации образуются монокристаллы d- и /-форм
(т. пл. 164 °С) [Acta Chem. Scand., 1950, 4, 1020].
Молекула cbaC—Cabc, содержащая два аналогичных асим-
метрических атома С, существует не только в d- и /-формах (ко-
торые при соединении образуют рацемат), но также в неактив-
ной жезо-форме. Хотя для молекулы жезояблочноп кислоты в
принципе возможны конформации с симметрией 1 и 2 {in), в
действительности молекулы этой кислоты в кристаллическом
состоянии асимметричны, хотя и расположены парами, связан-
ными центрами симметрии [Acta cryst., 1967, 22, 522]:
2.3. Изомерия
79
соон
С ООН
соон
н но'
соон
"СООН Н
соон
рацемат
кристаллическая мезо- кислота ¦
Аналогичная конфигурация жезо-тартрат-иона найдена в солях
К и Rb; в диметиловом эфире поворот от скрещенной конфигу-
рации составляет 19° [Acta cryst., 1973, В29, 1278]. Любопыт-
но, что весьма близкая молекула жезо-эритрита в кристалле
центросимметрична [Proc. Roy. Soc, 1959A, 250, 301]:
СН2ОН
I
i
¦ с
он
НС"-"
сн2он
Из сказанного очевидно, что 1) наличие асимметрических
атомов С (или других атомов) необязательно приводит к оп-
тической активности и 2) оптическая активность может воз-
никать и в отсутствие асимметрических атомов. Критерием яв-
ляется симметрия молекулы как целого. Некоторые примеры
типа A) Уже были приведены; еще одним примером может
служить метплдпкетопиперазин. Это соединение образует цис-
п У/яжг-формы, каждая из которых содержит два асимметри-
ческих углеродных атома. г/;анс-Форма обладает центром сим-
метрии и, следовательно, оптически неактивна, в то время как
////(-форма разделима на оптические антиподы (d- и /-формы).
"NH-CO %CH3
транс
н-.
-Н
цис
Многочисленные примеры типа B) включают такие молекулы,
н. ,сн, хн2. \\
"С' "^С" Т^
НОО(Г ^СН,^ ^СН2^ ^
(связи, выделенные пунктиром и утолщенными линиями,
лежат в плоскости, перпендикулярной плоскости чертежа, соот-
ветственно за и перед этой плоскостью), а также многие моле-
кулы, которые не могут принять наиболее высокосимметричную
конфигурацию по стерическим причинам. В некоторых случаях
оптическая активность является результатом ограниченного
вращения вокруг ординарной связи С—С. Присутствие групп,
отклоняющихся от плоскости ароматических циклов в молеку-
лах 1—3, приводит к появлению энантиоморфных форм. Заме-
щение SOs"" в 3 меньшей по размеру группой СОО™ уничтожа-
ет оптическую активность.
('ООН
-NO2
< О
N СООН
О
1
К, R2
NO; V
..О
-О'
-О
При сохранении плоской конфигурации молекулы многих
ароматических соединений должны были быть высокосиммет-
ричными; однако, если плоская конфигурация предполагает
слишком короткие расстояния между некоторыми атомами, мо-
лекулы вынуждены принимать неплоские конфигурации, а по-
следние часто являются энантиоморфными. Примерами таких
80 2. Симметрия
«перегруженных» молекул могут служить
Н3СО ОСН,
Правое соединение (гексагелицен) представляет интерес так-
же потому, что оно было расщеплено при образовании кристал-
лического молекулярного комплекса с полинитросоединением
[J. Am. Chem. Soc, 1956, 78, 4765].
В заключение приведем несколько примеров молекул и
ионов, расщепление которых позволяет сделать вывод о рас-
положении связей вокруг центрального атома.
Три пирамидальные связи
o«-s:
,о . с2н5
L
. сн.
S-CH2.СООН
сн
з\ С3Н7
Sn
Четыре тетраэдрические связи
С—О О-т-С
НС Be СН
соон
хсоон
(диалогично для Си и Zn)
C2H5-N-O.
{аналогично для Р)
0
с,и5
C6HS CH2 Si-CH2 C6H4SO3H,
г н.. ,.сн2-сн2. ...сн2-сн2.. и 1
.( N. Г. I Вг
[^ ^си ^^ j
3. ПОЛИЭДРЫ И СЕТКИ
3.1. Введение
По ряду причин представляется целесообразным, прежде чем
обсуждать структуры и имеющиеся в них химические связи,
рассмотреть некоторые геометрические и топологические ос-
новы.
1. Принято обсуждать кристаллические и молекулярные
структуры, пользуясь другими уже описанными структурами.
В принципе возможные типы молекулярной или кристалличе-
ской структуры, состоящей из заданного числа атомов, сле-
довало бы выводить, исходя из известных требований образо-
вания химических связей, что позволило бы сопоставить реаль-
но наблюдаемые структуры со всеми мыслимыми (с точки зре-
ния геометрии и топологии) вплоть до некоторого заранее ус-
тановленного предела сложности, ибо очень важно знать, по-
чему те или иные принципиально возможные структуры никог-
да не встречаются в молекулах или кристаллах. Систематиче-
ские исследования возможных структурных типов не много-
численны; в этой и следующей главах мы рассмотрим наибо-
лее существенные элементы структурной геометрии — простей-
шие системы связанных точек и плотнейшие упаковки равных
сфер. Знание возможных типов трехмерных сеток уже проли-
вает некоторый свет на вопросы такого, например, характера:
почему алмаз представляет собой систему колец из 6 атомов
углерода и почему некоторые кристаллические формы В2Оз
и РгО5 состоят из колец, включающих 10 атомов В (или Р) и
10 атомов О? При анализе возможных сеток мы обнаружим,
что структура алмаза представляет собой простейшую трех-
мерную сетку с 4-координированными узлами и что упомяну-
тые оксидные структуры являются примерами простейших
структур, образованных из фрагментов (треугольников ВО3
или тетраэдров РО4), которые должны быть связаны с тремя
такими же фрагментами каждый.
2. В гл. 1 отмечалось, что многие молекулярные и кристал-
лические структуры являются результатом компромисса меж-
ду противоречащими друг другу требованиями упаковки (или
химического связывания) атомов разного сорта. Исследования
простейших типов структур соединений АтХ„ с плотноупако-
ванными атомами X (гл. 4) и способов соединения тетраэдров
6—752
82
3. Полиэдры и сетки
н октаэдров (гл. 5) позволяют наложить определенные ограни-
чения на валентные углы, что оказывается весьма полезным
при обсуждении таких простых структур, как рутил и корунд.
3. Описание структуры ионных кристаллов обычно начина-
ется с рассмотрения окружения отдельных ионов (соотноше-
ние между координационными полиэдрами и относительными
размерами попов). Однако координационный полиэдр, энерге-
тически предпочтительный для изолированного нона, может
быть геометрически неосуществим в трехмерной структуре.
Так, в двух простейших ионных структурах (CsCl и CaF2) мы
обнаруживаем кубическую, а не антипризматическую или до-
декаэдрическую координацию. Эти два менее симметричных
Рис. 3.1. Три способа изображения молекулы Р^Ою-
восьмивершинных полиэдра невозможны в трехмерных структу-
рах АХ или АХ2, но играют важную роль в более сложных
структурах, где геометрические ограничения менее жестки.
4. Кристаллические структуры можно изображать различ-
ными способами в зависимости от того, какую именно их осо-
бенность желательно подчеркнуть. Например, структура моле-
кулы Р4Ою может быть представлена в виде шарико-стержне-
вой модели (рис. 3.1, а), где атомы изображаются сферами
произвольного радиуса, что позволяет показать расположение
связен, образуемых атомами Р и О. С другой стороны, может
быть желательно подчеркнуть тетраэдрическую координацию
атомов Р (рис. 3.1,6) или привлечь внимание к группировке,
включающей десять плотноупакованных атомов О (рис. 3.1, в).
Аналогичные способы представления существуют и для крис-
таллических структур, и важно, чтобы читатель был знаком с
типами изображения, используемыми в кристаллографии.
5. Если одни структуры характерны только для связей оп-
ределенного типа (например, структура рутила для преимуще-
ственно ионных оксидов и фторидов АХ2), то другие простые
структуры АтХга могут реализоваться при разных типах связи.
Например, структура NaCl оказывается выгодной не только
3.2. Основные системы связанных точек
83
для ионных оксидов и галогенидов, но также для нитридов и
карбидов переходных металлов и для некоторых интерметал-
лических соединений. Физические свойства таких соединений,
как PbS, PbSe и РЬТе (структурный тип NaCl), указывают
на более сложный характер взаимодействия, чем преимущест-
венно ионная связь в галогенидах щелочных металлов; оксиды
RuO2 (тип рутила) и ReO3 обладают металлической проводи-
мостью. Структура цинковой обманки с тетраэдрнческой
координацией обоих сортов атомов пригодна как для ионной,
так и для ковалентной связи. Поэтому удобнее описывать про-
стые структуры АтХ„ как геометрические объекты, а не как ти-
пичные проявления ионного, ковалентного или металлического
характера связи.
По этим причинам эта и две последующие главы посвяще-
ны в основном тем топологическим и геометрическим аспектам,
которые служат основой для понимания кристаллических
структур. В настоящей главе рассмотрены способы соединения
точек, приводящие к образованию конечных или бесконечных
систем, а также некоторые особенности полиэдров и родствен-
ных систем, бесконечных в одном, двух или трех измерениях.
В гл. 4 мы рассмотрим упаковку шаров, в частности плотней-
шую упаковку равных сфер. Глава 5 посвящена двум наибо-
лее важным для неорганической химии координационным по-
лиэдрам — тетраэдру и октаэдру; здесь дано систематическое
рассмотрение структурных типов, которые могут быть построе-
ны из этих фрагментов при наличии общих вершин, ребер
и(пли) граней.
3.2. Основные системы связанных точек
Какими бы сложными ни были фрагменты, которые нужно со-
единить друг с другом, задача сводится к выводу систем точек,,
каждая из которых соединена с некоторым числом (р) других
точек. В простейших системах это число (связанность*) одина-
ково для всех точек (узлов) сетки:
/7=1: имеется только одно решение — пара связанных точек
р = 2: только две возможности — замкнутые циклы или бесконечная
цепь
р>3: здесь возможные системы могут быть конечными группами (на-
пример, полиэдрами) или расположениями, бесконечными в од-
ном, двух или трех измерениях (сетки с координацией р)
* У автора: connectedness. Для этого понятия мы не используем термина
"координация», поскольку точка (узел) сетки может символизировать не атом,
а сложную атомную группировку. С другой стороны, не следует путать тер-
мин «связанность» в данной книге с близким термином «связность» в теории
графов. — Прим. персе.
6*
3. Полиэдры и сетки
Нет необходимости включать в такие сетки точки со свя-
занностью 1 (р=1), так как они не играют роли в расширении
сетки. Точки со связанностью 2 можно разместить на соедини-
тельных отрезках сетки с более высокой связанностью (р>2)
без видоизменения основной системы связанных точек. Поэто-
му мы не будем рассматривать точки со связанностью 1 и 2
при выводе основных сеток, хотя может оказаться необходи-
мым добавить их, чтобы получить структуры конкретных со-
единений из основных сеток. Например, для того, чтобы полу-
чить молекулу Р4О6, дополнительные точки со связанностью 2
(изображающие атомы —О—) нужно разместить на ребрах
тетраэдрической группировки из четырех атомов Р со связан-
ностью 3, а чтобы получить Р4О10 — также и дополнительные
точки со связанностью 1, присоединив их к вершинам тетра-
эдров.
В цепочечных структурах повторяющейся единицей может
быть отдельный атом или группа атомов:
. Se.
Повторяющаяся
единица
Se
;Pd ,'
PdC1
оос) Ъ
Однако любая простая цепь может быть сведена к основной
форме
—А-А— (или О А О АО А и т.д.)
где каждая структурная единица связывается с двумя другими.
Сохраняя пока условие, по которому все точки имеют оди-
наковую связанность, мы приходим к определенным ограниче-
ниям в отношении возможных типов образуемых систем. На-
пример, не может существовать конечных полиэдров, в которых
все вершины имели бы связанность 6, и возможен только один
тип сеток с 6-связанными узлами. Эти ограничения представле-
ны в табл. 3.1, которую можно описать двумя способами.
1. Вместе с простыми линейными системами (р = 2) верти-
кальные графы табл. 3.1 соответствуют четырем основным
3.2. Основные системы связанных точек
85
кчассам кристаллических структур, а именно молекулярным
кристаллам, цепочечным, слоистым и трехмерным (макромо-
пекулярным) структурам. Подразделение на полиэдры, пло-
ские' и трехмерные сетки также полезно для последовательно-
го вывода этих систем.
'> С химической точки зрения, однако, более интересны го-
рнюнтальные графы табл. 3.1. Если мы хотим обсуждать
структуры, возможные для структурных единиц определенного
Таблица 3.1. Системы р-связанных точек
Полиэдр]-
Бесконечные периодические сетки
тре\ме,;1ные
(только одна)
типа, например для атомов или групп, которые должны быть
связаны с тремя другими, мы должны выделить в таблице си-
стемы с р = 3.
Скажем сначала немного о трех вертикальных графах табл.
3.1, сосредоточив внимание в основном на системах с р = 3 или
4. Координационные числа от 6 до 12 отмечаются преимущест-
венно в шаровых упаковках, а очень высокие координационные
числа A3—16 во многих сплавах переходных металлов, 22 и
24 в других интерметаллических соединениях, 24 в СаВ6 и
т. д.) будут рассмотрены особо. Здесь мы приведем примеры
полиэдрических, циклических и линейных систем и структур,
построенных на основе сеток с 3- и 4-связанными узлами, об-
ращаясь пока к трем наиболее важным сеткам, а именно плос-
кой гексагональной, плоской квадратной и трехмерной алмаз-
ной сеткам.
Уже отмеченные общие топологические соотношения хорошо
иллюстрируются структурами элементов: хлора, серы, фосфора
и кремния (рис 3.2). Здесь число имеющихся связей равно
86 3. Полиэдры и сетки
vJ О4.- [галогены)
(VII)
(VI)
Se,Te
(V)
алмаз
Si, Ge,
Sn (серое)
„_„„
т.
3.3. Полиэдры 87
Те же принципы определяют структуры оксидов и оксоио-
юв этих элементов в их высших степенях окисления со струк-
i\ иными единицами в виде тетраэдрических оксогрупп МО4Р":
Оксоионы
пиро
мета
бесконечная'дву-
мерная сетка
бесконечная трех-
мерная сетка
(P03)n
Молекула оксида
(SiOj),,
С1гО7 конечная
циклическая или
линейная
полиэдрическая (дву-
мерная или трехмерная)
бесконечная трехмерная
.5.3. Полиэдры
'1.3.1. Координационные полиэдры, полиэдрические домены.
Наиболее очевидная связь полиэдров с практической химией и
кристаллографией состоит, вероятно, в том, что кристаллы
гл'ычпо растут в виде выпуклых многогранников. Формы моно-
кристаллов подчинены ряду ограничений, вытекающих из того
факта, что в кристаллах допустимо лишь ограниченное число
тинсв аксиальной симметрии, как это было показано в гл. 2.
Мы не будем здесь касаться внешней формы кристаллов и
рассмотрим только те полиэдры, которые интересны в отноше-
нии внутреннего строения кристаллов, а при более общем под-
ходе — в отношении структуры молекул и комплексных ионов.
Существуют три очевидных способа описания простых трех-
мерных структур соединений АтХп. Их можно описывать как
упаковки шаров, обычно двух сортов, различающихся разме-
ром (такой подход развит в гл. 4). Если каждый атом (ион)
имеет одинаковое окружение ближайшими соседями другого
сорта и число таких ближайших соседей равно а и х соответ-
ственно (следовательно, та = пх), то эти числа попросту пред-
ставляют собой альтернативный способ указания числа связен
А—X в объеме кристалла. Чтобы упростить обсуждение, рас-
смотрим соединение АХ„, в котором атом А окружен шестью
атомами X. Если п<6, то некоторые из атомов X должны быть
общими для координационного окружения некоторого числа
атомов А. Тогда структуру можно описать, оперируя группами
АХ6 с общими атомами X. Такой подход достаточно подробно
описан в гл. 5 для тетраэдрических групп АХ4 и октаэдрических
групп АХ6.
В простейших и наиболее симметричных структурах АтХ,г
атомы А имеют координационное окружение, состоящее из оп-
ределенного числа атомов X (чаще всего 4 или 6), находящих-
ся на одинаковом расстоянии от атома А, вместе с тем в не-
которых кристаллах атомы А имеют менее правильное окру-
3. Полиэдры и
жение, и здесь необходимо уточнить, что означают понятия
координационного числа и координационного полиэдра. Это
можно сделать, описывая структуру с помощью полиэдрических
атомных доменов (областей Дирихле). Области Дирихле пред-
ставляют собой многогранники, ограниченные плоскостями, ко-
торые проведены через середины расстояний от данного атома
до каждого из его соседей и перпендикулярны соответствую-
щим отрезкам. Каждому атому соответствует его область Ди-
рихле, а структура в целом может быть представлена как сово-
купность заполняющих пространство полиэдров одного или не-
скольких сортов. Координационное число (КЧ) атома, таким
образом, определяется как число граней атомного домена, а
координационный полиэдр — как многогранник, вершины кото-
рого представляют собой зеркальное отображение центра об-
ласти Дирихле в каждой из ее граней; каждой грани области
здесь соответствует вершина координационного полиэдра. Та-
кой подход не очень полезен для простых структур, в которых
атомы (ионы) имеют хорошо выраженные совокупности при-
близительно одинаково удаленных соседей, но он оказывается
наиболее однозначным определением КЧ в кристаллах, в кото-
рых атомы имеют менее правильное окружение. Кроме того,,
это естественный путь описания структур, образованных ато-
мами, сравнимыми по величине, т. е. структур металлов и ин-
терметаллических соединений, где часто трудно определить ко-
ординационное число, пользуясь лишь расстояниями до бли-
жайших соседей. Простым примером является кубическая объ-
емноцентрированная структура, в которой каждый атом имеет
8 ближайших соседей на расстоянии d и еще 6 на несколько
большем расстоянии (\,\5d) в центрах шести примыкающих
элементарных ячеек. Атомный домен в этой структуре — это
усеченный октаэдр с 8 шестиугольными и 4 квадратными гра-
нями, соответствующими двум типам соседей; координацион-
ный многогранник — ромбододекаэдр с 14 вершинами. Кон-
цепция атомных доменов позволяет также определить понятие
пустот и таким образом дополняет описание некоторых струк-
тур в терминах шаровой упаковки (этот вопрос рассмотрен в
разд. 4.5).
Расположения полиэдров, заполняющих пространство, в ко-
торых каждая грань является общей для двух полиэдров,
представляют интерес и для сопоставления с полиэдрами, име-
ющими иной физический смысл. Если считать, что атомы нахо-
дятся в вершинах полиэдров и связаны по их ребрам (непо-
средственно или через 2-связанные атомы, такие, как кисло-
род), мы получим трехмерный каркас с полиэдрическими по-
лостями или туннелями. В некоторых структурах такого типа
полости или туннели достаточно велики, чтобы принять в себя
3.3. Полиэдры 89
какие-либо ионы или молекулы или же сделать возможным их
движение. Этот вопрос кратко обсуждается в конце главы.
3.3.2. Правильные тела. Еще древние греки имели глубокие зна-
ния о полиэдрах, но только около двухсот лет назад, после
опубликования в 1758 г. труда Эйлера «Элементы учения о те-
лах», началось систематическое изучение их свойств. Из эйле-
рова соотношения между числом вершин {No), ребер (Л/i) и
граней {N2) простого выпуклого многогранника*
можно получить уравнения, относящиеся к частным типам по-
лиэдров. Если в каждой вершине сходятся 3 ребра (полиэдр со
связанностью 3) и fn — число граней с п ребрами (или верши-
нами), то
3f3 + 2/4 + f5±0fe-f7-2f8-... = 12 A)
откуда следует, что, если все грани одного типа, то они долж-
ны быть треугольниками, четырехугольниками или пятиуголь-
никами и число таких граней должно быть равно 4, 6 или 12
соответственно. Аналогичные уравнения для полиэдров со свя-
занностью вершин 4 и 5 таковы:
2f3±0f4-2/6-4fe-... = 16 B)
fs-2f4-5f5-8fe-... = 20 C)
откуда вытекают частные решения /3 = 8 и f3 = 20.
В уравнении для полиэдра с 6-связанными вершинами ко-
эффициент при /з равен нулю, а все другие коэффициенты от-
рицательны. Следовательно, не существует простого выпуклого
многогранника, в котором в каждой вершине сходятся 6 ребер.
Полиэдры, где в каждой вершине сходится более шести ребер,
невозможны, поскольку все коэффициенты при fn отрицательны.
Частные решения уравнений A) — C) таковы:
/7 = 3: fs=i, f4 = 6, fb=\2
р = 5: f3 = 20
Они соответствуют полиэдрам, у которых все вершины и все
грани однотипны. Это доказательство существования только
пяти таких полиэдров является чисто топологическим, посколь-
ку приведенные уравнения не требуют правильности или каких-
:' Теорема Эйлера относится не к «простым», а к любым выпуклым много-
гранникам. — Прим. перео.
90
3. Полиэдры и сетки
либо иных свойств граней*. Разновидности этих полиэдров,
имеющие грани в форме правильных многоугольников, — это
пять правильных (платоновых) тел: тетраэдр, куб, пентагональ-
ный додекаэдр, октаэдр и икосаэдр. Символ "(«, р) или (п'')
описывает многогранник, где в каждой вершине сходятся р
л-угольных граней. Значения лир (табл. 3.2) показывают, что
существует особое (дуальное или обратное) соотношение в не-
которых парах этих тел: при постоянном числе ребер числа
граней и вершин меняются местами. Пары, связанные таким
образом, — это куб и октаэдр, пентагональный додекаэдр и
Таблица 3.2. Правильные (платоновы) тела
Тетраэдр
Октаэдр
Куб
Додекаэдр
Икосаэдр
п, р
3,3
3,4
4,3
5,3
3,5
Вершины
(ЛГо)
4
6)
81
20)
12)
Ребра
(A'i)
6
12
Грани
(Л'а)
4
8
6
12
20
Двугранный
угол;
70°32'
109°28'
90°
116°34'
138°12'
икосаэдр; дуальным по отношению к тетраэдру является дру-
гой (инвертированный) тетраэдр.
Мы отмечали выше, что область Дирихле некоторого атома
и его координационный полиэдр связаны следующим образом:
каждой вершине последнего соответствует грань первой. Сле-
дует отметить, что, несмотря на это соотношение, область Ди-
рихле и координационный полиэдр необязательно дуальны.
Они дуальны в случае гранецентрированнои кубической струк-
туры (кубическая плотнейшая упаковка), где представляют
собой ромбододекаэдр и кубооктаэдр, но они не дуальны, на-
пример, в объемноцентрированнои кубической структуре, где
область Дирихле — усеченный октаэдр, а координационный по-
лиэдр — ромбододекаэдр.
В структурной химии встречаются все правильные тела, но
особое значение имеют многогранники с треугольными гранями
(особенно тетраэдр и октаэдр). Координационный полиэдр с
треугольными гранями представляет собой наиболее компакт-
ное расположение соседних атомов, однако ниже мы увидим,
что имеются и другие причины широкой распространенности
* Кроме пяти выпуклых правильных многогранников существуют четыре
звездчатых многогранника, получаемых при продолжении до пересечения гра-
ней выпуклых многогранников.
3.3. Полиэдры 91
тетраэдрпческой и октаэдрнческой координации. В некоторых
простых структурах (для обоих типов ионов в CsCl и для
ионов Са2+ в CaF2) наблюдается координационный многогран-
ник в виде куба, но для конечных молекул и ионов, а также
для ионных кристаллов комплексных соединений более типич-
ны другие, расположения восьми соседей, описанные ниже.
II тетраэдр, и куб, и пентагональный додекаэдр часто реализу-
ются в углеродных скелетах молекул (разд. 21.3). Додекаэдр,
который имеет 20 вершин, не представляет интереса как коор-
динационный полиэдр, но некоторые заполняющие пространст-
во комбинации додекаэдров п других соответствующих им по-
лиэдров непосредственно связаны, как это описано ниже,
с гидратными структурами. Икосаэдрическая координация
свойственна упаковка сфер с пониженной плотностью (гл. 4);
она обнаружена в многочисленных структурах сплавов; по
вершинам икосаэдра, например, расположены 12 связанных с
металлом кислородных атомов в ионе Се (NO;
3N3~ и карбо-
нильные группы в Fe3(CO)i2 и Co4(CO)i2. Икосаэдрические
группы Bi2 присутствуют в элементном боре и некоторых борн-
дах. Кроме того, из икосаэдров или из их частей построен ске-
лет, состоящий из атомов бора, во многих боранах.
3.3.3. Полуправильные полиэдры. В правильных телах все вер-
шины эквивалентны, а все грани однотипны (т. е. эти тела яв-
ляются изогонами и изоэдрами). Если мы сохраним первое
условие, но допустим существование правильных многоуголь-
ных граней более чем одного типа, получится ряд полуправиль-
ных полиэдров, которые перечислены в табл. 3.3. Символы
указывают типы л-угольных граней, сходящихся в каждой вер-
шине, причем верхний индекс представляет собой число таких
граней. Эти тела включают в себя три группы. Первая состоит
из 13 полиэдров (архимедовы тела), получаемых из правиль-
ных тел симметричным срезанием их вершин (эта процедура
называется усечением)*; из них только первые пять представ-
ляют интерес применительно к кристаллам. Другие две груп-
пы — это призмы и антипрнзмы, имеющие в своей наиболее
правильной форме в качестве верхнего и нижнего оснований
пару параллельных граней в форме правильных л-угольников
и, кроме того, л квадратных граней (правильные призмы) или
2/г эквинаклонных треугольных граней (антипризмы). Вторая
призма в наиболее симметричном варианте представляет со-
бой куб, а первая антипризма — это октаэдр. Правильные тела
* Входящий в число 13 архимедовых тел ромбокубооктаэдр (табл. 3.3)
нельзя получить усечением какого-либо из правильных тел. Поэтому он оста-
вался неизвестным 2 тыс. лет и был описан только в 1957 г. — Прим. перев.
92
3. Полиэдры и сетки
и некоторые из полуправильных тел изображены на рис. 3.3.
Тот факт, что множество изогонов ограничено пятью пра-
вильными телами и полуправильными телами, имеет большое
значение в химии. Есть много молекул и комплексных ионов,
в которых пять атомов или групп окружают центральный атом.
Но невозможно расположить единообразно пять эквивалентных
точек на поверхности сферы (за исключением тривиального
Таблица
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
3,
3,
4,
З2,
4,
3,
З4,
3,
З2,
5,
4,
3,
З4,
п,
п,
3.3. Архимедовы полуправильные тела,
Символ
б2
82
б2
42
6, 8
43
4
102
52
б2
6, 10
4, 5, 4
5
42
З3
Название
Усеченный тетраэдр
Усеченный куб
Усеченный октаэдр
Кубооктаэдр
Усеченный кубооктаэдр
Ромбокубооктаэдр
Курносый куб
Усеченный додекаэдр
Икосододекаэдр
Усеченный икосаэдр
Усеченный икосододекаэдр
Ромооикосододекаэдр
Курносый додекаэдр
Правильные призмы
Правильные антипризмы
призмы
и антипрнзмы
Число
граней
8
14
14
14
26
26
38
32
32
32
62
62
92
п-'г2
2п-\2
вершин
12
24
24
12
48
24
24
60
30
60
120
60
60
2п
2я
ребер
18
36
36
24
72
48
60
90
60
90
180
120
150
'in
\п
случая, когда они образуют правильный пятиугольник), и это,
конечно, важно при обсуждении конфигурации молекул или
ионов АХ5 и вообще координации 5 в кристаллах. Аналогичные
соображения применимы и к координационным числам 7, 9, 10
и 11.
Известен также ряд полиэдров, которые дуальны по отно-
шению к архимедовым телам, призмам и антипрпзмам и соот-
ветствуют полуправильным полиэдрам, перечисленным в табл.
3.3. Эти многогранники называют телами Каталана, который
в 1865 г. первым описал их*. Из них нам нужно отметить толь-
ко ромбододекаэдр, который обратен кубооктаэдру, и семей-
ство бипирамид, которые аналогичным образом связаны с приз-
мами.
* Многогранники, дуальные к телам Архимеда, вывел в 1830 г. Гесссль.-
Прим. перев.
3.3. Полиэдры 9-3
а
Тетраэдр
(А)
Октаэдр
F)
Пентагондодекаэд
B0)
S
у
у^
Икосаэдр A2)
Усеченный
тетраэдр
('2а;
Усеченный октаэдр
B4)
Тригональная
призма
Fа)
Кубооктаэдр-
02 Ь)
Квадратная
антипризма
(в а)
Ромбододекаэдр
И)
Тригональная Лентагональная
бипирамида бипирсшида
E) G)
Рис. 3.3. Полиэдры: а — правильные тела; б — некоторые архимедовы полу-
пранильпые тела; в — некоторые полуправильные тела Каталана. (Цифры
указывают число вершин.)
94 3. Полиэдры и сетки
3.3.4. Полиэдры, родственные пентагоналъному додекаэдру и
икосаэдру. В уравнении A) для полиэдров с 3-связанными
вершинами (разд. 3.3.2) коэффициент при /6 равен нулю. Сле-
довательно, могут существовать и полиэдры, полученные из
более простых полиэдров с р = 3 добавлением некоторого про-
извольного числа шестиугольных граней. Хотя такие полиэдры
удовлетворяют уравнению A), из него прямо не следует, что
их можно всегда построить: тот факт, что совокупность граней
удовлетворяет одному из уравнений, полученных из соотноше-
ния Эйлера, не означает с необходимостью, что соответствую-
щий выпуклый полиэдр реально существует. Тем не менее три
из архимедовых тел действительно содержат шестиугольные
грани; они соотносятся с тремя правильными телами следую-
щим образом:
тетраэдр, /3 = 4 усеченный тетраэдр,
куб, /4 = 6 усеченный октаэдр,
додекаэдр, /5=12 усеченный икосаэдр
/«=4
/4 = 6
/в = 8
/5=12
Д, = 20
Кроме того, могут реализоваться все полиэдры, промежуточ-
ные между додекаэдром и усеченным икосаэдром, за исключе-
нием /5=12, /б=1, причем некоторые более чем в одной фор-
ме (разные расположения 5- и 6-угольных граней). Некоторые
из этих полиэдров представляют интерес в связи со структура-
ми клатратных гидратов (разд. 15.2.1), поскольку определен-
ные комбинации этих тел с
а -А~Т>ч б и~~>^ додекаэдрами дают запол-
няющие пространство рас-
положения, в которых в
каждой вершине сходится
по четыре ребра. Два из
этих полиэдров, тетракаиде-
каэдр и гексакаидекаэдр,
показаны на рис. 3.4.
Дуальные к ним полиэдры — это многогранники с треуголь-
ными гранями, в которых 12 вершин являются 5-связанными и
две или большее число — 6-связанными. Наряду с икосаэдром
они обнаруживаются в качестве координационных полиэдров
в многочисленных сплавах переходных металлов.
3.3.5. Некоторые менее правильные полиэдры. Из соотношения
Зйл ер а можно вывести и другие уравнения, относящиеся, на-
пример, к полиэдрам с заданным числом вершин или граней.
Рис. 3.4. а — тетракаидекаэдр, fs=12,
f,; = 2; б — гексакаидекаэдр, )з=12,
/б = 4.
3.3. Полиэдры
95
Первое требуется при обсуждении возможных координацион-
ных полиэдров центрального атома с определенным числом со-
седей, второе представляет интерес при заполнении полиэдра-
ми пространства. В случае координации 8 требуются много-
гранники с восьмью вершинами. Они должны удовлетворять,
уравнению I {п—2)/„= 12, или
f 2/ 3f
18
16
14
12
Здесь имеются следующие решения:
/з=12: додекаэдр с треугольными гранями,
или бисдисфеноид
/3=8, /4=2: квадратная антипризма
/3=4, h=4:
fi = 6: куб
Додекаэдр с треугольными гранями (рис. 3.7, а)—это третий
додекаэдр, с которым мы встретились (другие два — пентаго-
Рнс. 3.5. Восьмигранник с/4 = /5-4. Рис. 3.6. Семнвершшшые полиэдры: а —
одношапочный октаэдр; б — одношапоч-
ная тригональная пртма. Заштрихован-
ные кружки изображают молекулы НЮ
в Но(«*СОСНСО<*)з-Н20 и Yb(acacK-
•П2О соответственно.
нальнын додекаэдр и ромбододекаэдр с 5- и 4-угольными гра-
нями соответственно).
С другой стороны, для нас представляют интерес полиэдры
с восьмью гранями (8-гранники), которые должны удовлетво-
рять уравнению
где хр — число р-связанных вершин.
Для правильного октаэдра v4 = 6, и в настоящей книге тер-
мин «октаэдр» обычно используется именно для этого тела.
Кроме того, среди многочисленных 8-гранников имеются усе-
ченный тетраэдр, гексагональная призма и полиэдр, который
¦96 з. Полиэдры и сетки
3.3. Полиэдры 97
характеризуется значениями /3=12, /4 = /5 = 4 (рис. 3.5) и явля-
ется обратным по отношению к додекаэдру с треугольными
гранями, рассмотренному выше. Этот 8-гранник имеет свойство
упаковываться совместно с особого вида 17-гранником с плот-
ным заполнением пространства, и вершины такой упаковки
представляют собой позиции молекул воды в гидрате
(CH3KCNH2-9|-H2O (разд. 15.2.2). Два 8-гранника, представ-
ляющие интерес как 7-координационные полиэдры, — это од-
Таблица 3.4. Полиэдрические координационные группы
Верши-
ны
4
5
6
7
8
9
12
а
Полиэдр
Тетраэдр D)
Тригональная бипирами-
да E)
Октаэдр F)
Пентагональная бипира-
мида G)
Одношапочнын октаэдр
Додекаэдр
Трехшапочная триго-
нальная призма
Поксаэдр A2)
Грани
h
4
6
8
10
10
12
14
20
h
4
2
6
8
10
12
8
h
1
3
2
2
1
1
6
Полиэдр а
Квадратная пирамида
Тригональная призма
Fа)
Одношапочная триго-
нальная призма
Квадратная антипризма
(8а)
Двухшапочная триго-
нальная призма
Одношапочная антиприз-
ма
Кубооктаэдр A26)
а 11ифры в скобках даны для сопоставления с рис. 3.3. Полиэдры с 7—9 вершинами
13ибр;]>кены соответственно па рис. 3.G—3.8 (пснтагональш)я бипчрамида — па рис. 3.3).
ношапочный октаэдр и одношапочная тригональная призма
(рис. 3.6). Термин «одношапочная» означает, что есть атом,
расположенный приблизительно над центром грани более про-
стого полиэдра. В случае тригональной призмы (или антиприз-
мы из табл. 3.4) «центрированная» грань — это квадрат (или
прямоугольник), для октаэдра — это, естественно, треугольная
грань.
В табл. 3.4 перечислены полиэдры, наиболее часто встреча-
ющиеся в качестве расположения ближайших соседей в конеч-
ных молекулах (или ионах) и в кристаллах. Многогранники,
указанные в левой части таблицы, имеют только треугольные
грани; те, что указаны справа, имеют и треугольные, и четы-
рехугольные грани. Полиэдры, относящиеся к одной горизон-
тальной строке, имеют одинаковое число вершин и связаны
между собой следующим образом. Перегиб четырехугольной
грани порождает две треугольные грани и полиэдр из правой
части преобразуется в полиэдр, указанный слева. Лучший спо-
соб выявления подобных соотношений — это добавление допол-
нительных ребер к контурам исходных полиэдров, что дает по-
лиэдры с треугольными гранями. Такие соотношения важны
Таблица 3.5. Хелатные молекулы и ионы, содержащие асас
и родственные лиганды
кч
6
7
8
Координацион-
ный полиэдр
Тригональная
призма
Одношапочный
октаэдр
Одношапочный
октаэдр
Одношапочная
тригональная
призма
Додекаэдр
Аптипризма
Комплекс
Ег [ (СН3) 3ССОСНСОС (СН3) 3] 3
11о@СОСНСО|*)з-Н2О
У@СОСНСОСН3Ь-Н2О
Yb (СНзСОСНСОСН?.) з • Н2О
[Y(CF3COCHCOCF3L]Cs
[Y (CH3COCHCOCH3) з (Н2О) ] 2 • Н2О
Литература
Ada cryst., 1971,
В27, 2335
Inorg. Chem., 1969,
8, 2680
Inorg. Chcm., 1968,
7, 1777
Inorg. Chem., 1969,
8, 22
Inorg. Chem., 1968,
7, 1770
Inorg. Chem., 1967,
6, 499
при анализе геометрии менее симметричных координационных
группировок. Если наблюдается значительное отклонение от
наиболее симметричной формы одного из полиэдров из табл.
3.4 (например, тригональной бипирамиды или квадратной пи-
рамиды), описание координационного многогранника может
стать произвольным и сомнительным; в таких случаях следует
предпочесть точное описание геометрии.
Ввиду особой важности тетраэдрической и октаэдрической
координации мы посвящаем всю гл. 5 системам, построенным
из этих двух полиэдров. Координация по тригональной призме
в конечных комплексах встречается очень редко (примерами
могут служить хслаты M(S2C2R2b, где М = Мо, W, Re, V и Сг,
разд. 27.1, и хелаты Ег, перечисленные в табл. 3.5); она не ха-
рактерна и для трехмерных структур, за исключением NiAs,
MoS2, A1B2 и родственных структурных типов, а также не-
скольких ионных кристаллов. Координация по одно- и двухша-
почной призмам также не является вполне обычной; приведем
7—752
98 3. Полиэдры и сетки
примеры из числа
одношапочная
тригональная
призма:
двухшапочная:
трехшапочная:
химически
ЕиО-ОН
Еи(ОНJ-Н
Еи(ОНK
родственных
YO-OH
2о
Y(OHK
соединений:
Na5Zr2F,3
N2H6(ZrF6)
Теперь дадим краткие комментарии по поводу координации
5, 7, 8 и 9.
3.3.6. Координация 5. Наиболее симметричным полиэдрическим
расположением пяти лигандов является тригональная бипира-
мида, которая найдена в нескольких ионных кристаллах, в не-
которых ионах и молекулах, образованных непереходными эле-
ментами (см. «40-электронная группа» в разд. 7.3.4), и в мно-
гочисленных комплексах переходных металлов, примеры ко-
торых даны в последующих главах. Близкое к этому располо-
жение пяти лигандов по квадратной пирамиде должно быть
свойственно непереходным элементам, имеющим 42-электрон-
ную валентную группу, которая включает неподеленную пару
(разд. 7.3.5). Кроме того, по структуре некоторые комплексы
переходных металлов (они описаны в соответствующих разде-
лах) ближе к квадратной пирамиде, чем к тригональной бипи-
рамиде.
3.3.7. Координация 7. Примеры полиэдров с наиболее четко
выраженной координацией таковы:
Конечные комплексы
Бесконечные
'системы
Пентагональная бипира- KaZrF7 KsUF7 PaCl5
мида
Одношапочная триго- KgNbF7 KjTaF7
нальная призма
Одношапочный октаэдр Хелаты (табл. 3.5) Л-Ьаг
Переходные металлы, стоящие в левых частях рядов, дают
много примеров 7-координационных комплексов; в частности,
сюда относятся комплексы, содержащие галогены и такие би-
дентатные лиганды, как диарсин (а на схеме ниже). Однако не
всегда координация 7 действительно присутствует в комплек-
сах, которым первоначально приписывалась такая координация.
Так, ТаВг5 (диарсинJ состоит из додекаэдрических 8-коорди-
3.3. Полиэдры 99
национных и октаэдрических 6-координационных ионов
[ТаВг4(диарсинJ]+ и [ТаВг6]-. С другой стороны, иЮСЦ(ди-
арсин) состоит из пентагонально-бипирамидальных молекул
(б). В табл. 1.1 (в конце разд. 1.1) мы показали, как разные
способы обобществления атомов X, относящихся к смежным
OF
• In
9-координационным группам, порождают различные соотноше-
ния X : А. Соединения 5/-элементов, особенно урана, дают мно-
го примеров пентагонально-бипирамидальнои координации
(см. табл. 28.4, разд. 28.2.4); анион в N2H5[InF4(H2)] имеет
ту же форму, что и цепь РаС15 (на схеме выше в). К числу
других примеров координации этого типа относятся
Сг"(О2J(ЫН3)з и Сг(О2JО (дипиридил) (разд. 11.3.8).
Иттрий п меньшие по размеру 4/-ионы с бидентатными ли-
гандами типа R—СО—СН—СО—R образуют 7-координацион-
иые комплексы, в которых седьмым лигандом является моле-
кула воды. Применение термина «одношапочный октаэдр» ло-
гично ограничить только группами, в которых присутствует
точная или приблизительная ось третьего порядка с лигандом
над одной из гранен октаэдра; обычно эта грань несколько
расширена. Такую ось симметрии имеет комплекс Но(^СО—
—СН—СО0K-Н2О с тремя циклами, расположенными по типу
пропеллера. Шесть атомов О занимают вершины искаженного
октаэдра, а молекула Н2О центрирует («покрывает шапкой»)
одну из граней (рис. 3.6, а). На рис. 3.6,6 эта структура срав-
нивается со структурой Yb(acacK-Н2О, в которой молекула во-
ды не является центрирующим («шапочным») лигандом.
Если включить в рассмотрение связи металл — металл, то
КЧ 7 следует приписать Nb в Nbl4 и W в K3W2CI9 со связью
металл — металл, перпендикулярной ребру или грани октаэд-
ра, образованного атомами галогена. Семерная координация в
РЬС12 (разд. 6.8) может быть описана и как псевдодевятерная,
так как здесь имеются лиганды напротив трех прямоугольных
граней тригональной призмы, но расстояния до двух лигандов
намного больше, чем до остальных семи. Аналогично координа-
ция Са2+ в CaFe2O4 скорее должна рассматриваться как двух-
100 3. Полиэдры и сетки
шапочная тригональная призма с дополнительной вершиной
(8+1), чем как пример координации 9. Полиэдр с 7 вершина-
ми в моноклинном ZrO2 (разд. 12.2.5) близок и к одношапочной
тригональной призме, и к одношапочному октаэдру (см. Acta
cryst., 1970, В26, 1129, а также обсуждение координации 7 в
Can. of Chem., 1963, 44, 1632). Ряд ссылок на литературу при-
веден также в табл. 3.5.
3.3.8. Координация 8. Такая координация найдена во многих
молекулах и кристаллах. За исключением редкой кубической
координации в кубических структурах CsCl и CaF2 (они обсуж-
даются в гл. 7), координационный полиэдр обычно имеет фор-
му архимедовой антипризмы или додекаэдра с треугольными
гранями (бисдисфеноид). В нескольких кристаллах найдена
двухшапочная тригональная призма, например в CaFe2O4,
Sr(OHJ-H2O, N2H6(ZrF6) и NdP5O14. Эти три полиэдра тесно
связаны, как видно из их характеристик, приведенных в табл.
Рис. 3.7. Восьмивершинные полиэдры: а — тригондодекаэдр (бисдисфеноид);
б — антипризма.
3.4. Антипризма может быть последовательно преобразована в
двухшапочную тригональную призму путем соединения вершин
а и Ъ (рис. 3.7,6), а затем в додекаэдр добавлением диагональ-
ного ребра к другой квадратной грани. Додекаэдр, показанный
на рис. 3.7, а, называется также бисдисфеноидом, поскольку он
состоит из двух взаимопроникающих бисфеноидов (тетраэд-
ров), из которых один растянут (А), а другой сжат (В). При-
3.3. Полиэдры 10t
меры 8-координационного окружения в форме додекаэдра и ан-
типризмы:
Додекаэдр
Na4[Zr(C2O4L].3H2O
I<2ZrF6
К4[Мо(С.\)8]-2Н20
Ti(NO3L) Sn(NO3L
Т1С14(диарсинJ
Антнпризма
Zr(IO3L
Na3(TaF8)
H4[W(CN)8"|-6H2O
Ca(BF4b,CaCO3-6H2O
Rlr- в RbLiF2
Расчеты энергии отталкивания лигандов в 8-координациоипых
полиэдрах показывают, что оба этих многогранника более ус-
тойчивы, чем куб, для всех значений л от 1 до 12 (сила оттал-
кивания пропорциональна г~") и что антипризма несколько
стабильнее, чем додекаэдр. Очень небольшое различие в устой-
чивости подтверждается реализацией обеих конфигураций в;
парах химически сходных комплексов (как это показано выше
в табл. 3.5).
Следует подчеркнуть, что имеется важное различие между
додекаэдром с треугольными гранями и антипризмой. Оно за-
ключается в том, что существует «идеальная» антипризма, по-
скольку она является полуправильным многогранником, в то
время как для додекаэдра такая особенная конфигурация от-
сутствует. Максимальная симметрия D2т) этого полиэдра до-
пускает неравенство длин связей М—А и М—В, а также на-
личие четырех различных по длине ребер (два ребра а, четыре
ребра Ь, четыре ребра m и восемь ребер g). Поэтому энергети-
ческие расчеты приходится проводить для определенных осо-
бых конфигураций, таких, например, как конфигурация, зада-
ваемая моделью жестких сфер (a = m = g). Для этой конфигу-
рации отношение радиусов (разд. 7.6.2) равно 0,668, а для ан-
типризмы, построенной на основе модели жестких сфер (l = s
на рис. 3.7,6), эта величина составляет 0,645. Не будем под-
робно описывать геометрию этих полиэдров, поскольку уже яс-
но, что существует тонкий баланс между факторами, опреде-
ляющими выбор координационного полиэдра, и что детали их
геометрии зависят от размера и природы лигандов и от взаи-
модействия с более удаленными соседями в кристалле. Обсуж-
дение координации 8 см. в работах Chem. Phys., 1950, 18, 746;
Inorg .Chem., 1963, 2, 235; J. Chem. Soc. (London), A, 1967,
345; Inorg. Chem., 1968, 7, 1686; о комплексных фторидах Zr
102 3. Полиэдры и сетки
и октацианидных ионах* см. разд. 10.1.13 и 22.1.2 соответст-
венно.
3.3.9. Координация 9. Среди примеров координации по трех-
шапочной тригональной призме имеются конечный водный
комплекс Nb(BrO3K-9H2O и бесконечный цепочечный комп-
лекс SrCl2-6H2O (где такие полиэдры объединены в колонки
через общие базисные грани), а также многочисленные соеди-
нения 4/- и 5/-элементов (например, YF3 и соединения, отно-
сящиеся к структурному типу UC13 или Y(OHK), комплексные
фториды Th и U (гл. 28). Некоторые примеры координации 9
1,500 а
Рис. 3.8. Девятивершинные полиэдры: а — одношапочная тетрагональная анти-
призма; б— трехшапочная тригональная призма.
мы перечислили в табл. 1.1 (разд. 1.1), чтобы проиллюстриро-
вать, как различные формулы МХ„ могут реализоваться при од-
ном и том же координационном числе атома М. Менее типич-
ная одношапочная антипризма наблюдается в расположении
атомов Те вокруг атомов La в LaTe2, изоструктурном Fe2As
(структурный тип С38); соотношение между этим полиэдром
и трехшапочной тригональной призмой становится наглядным,
если соединить вершины а и & на рис. 3.8, а. Трехшапочная три-
гональная призма, построенная на основе модели жестких
сфер, показана на рис. 3.8,6; расстояние от центра до вершины
равно 0,86а, что соответствует отношению радиусов 0,732.
3.3.10. Координация 10 и 11. Такие бидептатпые лиганды, как
'NO3~ и СО32~, позволяют реализовать очень высокие коорди-
национные числа; это обусловлено малым расстоянием О—О,
близким к 2,15 А (в то время как в группах МОЛ обычное рас-
стояние 2,8А). Поскольку одни ребра такого координационно-
* См. также: Порай-Кошиц М. А., Асланов Л. А. — Ж. коорд. хим., 1972,
-.г. 13, № 2, с. 266. —Прим. перев.
3.3. Полиэдры ЮЗ-
ГО полиэдра короткие, а другие имеют нормальную длину, вы-
сокая симметрия для него не характерна. Иногда тип коорди-
нации проще описать, рассматривая бидентатную группу как
один лиганд. Например, в молекуле Тп(ШзL(ОР03J четыре
группы NO3 занимают экваториальные позиции в «октаэдриче-
ском» координационном окружении [Acta cryst., 1973, В29,
2687]. В образованных с участием Се и Th ионах [М(СО3M]6~
десять атомов О находятся в вершинах двух гексакаидекаэд-
ров, промежуточных между додекаэдром с треугольными гра-
нями и икосаэдром [Acta cryst., 1975, В31, 2607, 2612, 2615.
2620]:
Додекаэдр с треугольными гранями
Гексакаидекаэдр
Икосаэдр
Вер-
шины
10
12
Грани
12
16
20
Ребра
18
24
30
Однако эти гексакаидекаэдры искажены из-за наличия пяти ко-
ротких ребер, соответствующих бидентатным лигандам. В би-
дентатной оксалатной группе расстояние О—О (между атома-
ми О, связанными с различными атомами С) увеличено до
~2,8 А, и в К4ТЬ(С2ОL-4Н2О имеются цепи, в которых Th
связан с пятью группами СгО* (из них две тетрадентатные)
[Acta cryst., 1975, В31, 1361]:
Th
-V0'
•V0-
Th
Координационный полиэдр Th — почти правильная двухша-
почная антипризма; тот же полиэдр, но менее правильной фор-
мы, был найден в ацетате U(IV) [Acta cryst., 1964, 17, 758].
В La2(CO3K-8H2O присутствуют слои, состоящие из ионов
La3+, СО32" и молекул воды [Inorg. Chem., 1968, 7, 1340].
В пределах слоя оба сорта неэквивалентных ионов La3^ име-
ют координацию 10. В каждой координационной группе биден-
татные ионы занимают позиции Bi додекаэдра (рис. 3.7, а),
что приводит к образованию двух дополнительных ребер, па-
раллельных расположенному ниже ребру АА; другие шесть
L04 3. Полиэдры и сетки
соседей — это молекулы Н2О или атомы О монодентатных кар-
бонатных ионов.
11-вершинная координация Th4+ четырьмя бидентатными
нонами NO3~ и тремя молекулами Н2О осуществляется в
Th(NO3L-5H2O [Acta cryst, 1966, 18, 836, 842]; такая же ко-
ординация La3+ тремя бидентатными ионами NO3^ и пятью
молекулами Н2О найдена в La (ЫОз)з-6Н2О, фактически пред-
ставляющем собой [Ьа(ЫО3)з(Н2ОM]-Н2О [Inorg. Chem.,
1980, 19, 1207].
В ионах гексанитратов, образованных Се и Th, встречается
(икосаэдрическая) координация 12 (разд. 18.8.7). Кроме того,
это координационное число обнаружено в многочисленных
плотноупакованных структурах (гл. 4) разного рода соедине-
ний, а также в металлах и интерметаллических соединениях,
где наблюдаются и более высокие координационные числа
{гл. 29).
3.4. Плоские сетки
3.4.1. Вывод плоских сеток. Разбиение бесконечной плоскости
на многоугольники (полигоны) очевидным образом связано с
перечислением полиэдров, поскольку последние составлены из
многоугольников, заполняющих какую-нибудь простую замк-
нутую поверхность, например сферу. Действительно, уравнения
оказываются довольно похожими на уравнения для полиэдров,
.за исключением того, что вместо числа n-угольных граней fn
здесь фигурирует Фп, что обозначает долю и-угольников, по-
скольку теперь мы имеем дело с бесконечно повторяющимся
мотивом. Эти уравнения для сеток с р-связанными узлами та-
ковы:
E)
F)
4
10/3
3
Здесь есть три частных решения, соответствующих плоским
сеткам, в которых все многоугольники имеют одинаковое чис-
ло сторон (и одинаковое число отрезков, сходящихся в каждой
вершине), а именно:
при
при
при
04=1
Они представлены на рис. 3.9, а. Последний из них — это един-
ственная плоская сетка с 6-связанными узлами; очевидно, что
3.4. Плоские сетки 105
тоские сетки, в которых в каждой точке сходится более шести
отрезков, невозможны. Для сеток с р = Ъ, 4, 5 имеются и дру-
гие решения, соответствующие комбинациям многоугольников
двух пли большего числа сортов. Например, существуют сле-
o,v'iouine простейшие решения для сеток с р = 3: 05 = 07=1/2,
04 = 08=1/2, 03 = 09=1/2. Первое из них обсуждается ниже в
связи с конфигурациями плоских сеток; наиболее симметрич-
, X
X
' X
X
X
X
X
X
X
(
/
X
Рис. 3.9. Плоские сетки: а — правильные; б — полуправильные.
ная конфигурация, отвечающая второму решению, показана на
рис. 3.9,6, где она открывает ряд полуправильных плоских се-
ток. Примеры кристаллических структур, построенных на ос-
нове этих двух сеток, даны ниже (разд. 3.9.3).
Пяти правильным и тринадцати полуправильным (архиме-
довым) телам, имеющим равносторонние грани, соответствуют
три правильные плоские сетки (три перечисленных выше част-
ных решения) и восемь полуправильных сеток, в которых име-
ются равносторонние многоугольники двух или большего чис-
ла сортов (рис. 3.9,6). Дуальные отношения между плоскими
сетками аналогичны соотношениям между парами полиэдров;
так, например, соотносятся сетки F, 3) и C, 6), а сетка D, 4}
дуальна по отношению к себе самой (сравни с тетраэдром).
Сетки, дуальные по отношению к восьми полуправильным сет-
кам (рис. 3.9,6), можно изобразить, соединяя середины смеж-
ных (имеющих общие стороны) многоугольников; они пред-
106 3. Полиэдры и сетки
Рис. ЗЛО. Две плоские сетки, состоящие из пятиугольников.
ставляют собой разбиение плоскости на конгруэнтные много-
угольники— ср. с соотношением между каталановыми и архи-
медовыми телами. На рис. ЗЛО показаны две из этих дуальных
сеток, состоящих из пятиугольников; они упоминаются в табл.
3.7. Эти две сетки, дуальные по отношению к изображенным в
нижнем правом углу на рис. 3.9,6, дополняют ряд:
р 3 3,4 4 6
п-угольники 6 5 4 3
Однако в отличие от других трех сеток, входящих в ряд, они
не могут быть построены из правильных многоугольников.
Чтобы получить общее уравнение для сеток, содержащих
•одновременно 3- и 4-связанные точки, нужно предусмотреть
возможность изменения соотношения между этими двумя ви-
дами точек. Если отношение числа точек с координацией 3 и 4
равно R, легко показать, что система из N точек содержит
/VC.R+4)/2(i?-f 1) связей. С использованием того же метода,
что и для получения уравнений D)—F), устанавливается ра-
венство Ея0„=2C#+4)/(#+2). Величина ЪпФп меняется от 6
при R = oo до 4, когда R — 0, и имеет частное значение 5, если
точек с р=3 вдвое больше, чем точек с р = 4. Частным реше-
нием уравнения ~2пФп = 5 является 05=1, что соответствует
пятиугольным сеткам на рис. 3.10. Хотя плоские сетки со свя-
занностью C, 4) не представляют большого интереса для
¦структурной химии, трехмерные сетки такого типа составляют
юснову некоторых кристаллических структур (разд. 3.5.1).
Плоские сетки, в которых чередуются точки двух сортов (со
^связанностью р и q), представляют интерес в связи со слоисты-
ми структурами соединений АтХп, в которых координационные
1*гисла как атомов А, так и атомов X равны 3 и более. Напри-
мер, простой слой Cdl2 можно описать как плоскую сетку со
связанностью C, 6). Было показано (Acta cryst., 1968, В24,
50), что, кроме сеток, где р и q равны 3 и 4, 3 и 5 или 3 и 6,
ме существует других плоских сеток, в которых чередуются
3.4. Плоские сетки 107
вершины со связанностью р и q. Невозможность построения
тоской сетки с чередующимися 4- и 6-связанными узлами оз-
начает, в частности, что для соединения А2Хз, где А имеет ко-
ординацию 4, простая слоистая структура неосуществима. Та-
ким образом, отсутствие октаэдрических слоистых структур для
сесквиокспдов вызвано не кристаллохимическими факторами
(как их обычно понимают), а имеет очень простое топологиче-
ское объяснение.
3.4.2. Конфигурация плоских сеток. Два вопроса требуют не-
которых дополнительных разъяснений. Уравнения D)—F)
учитывают только соотношения числа многоугольников разного
сорта и совсем не отражают их относительного расположения.
Рис. 3.11. Формы плоских шестиугольных сеток.
Кроме того, все сетки были представлены как периодичные узо-
ры. Для частных решений Фп—\ вопроса о различных располо-
жениях многоугольников не возникает, поскольку каждая сетка
построена из многоугольников одного типа. Однако форма ше-
стиугольников в сетке с Фв=\ определяет, является ли сетка
периодической, и если да, то она определяет размер элементар-
ной ячейки. На рис. 3.11 выделены повторяющиеся участки пе-
риодических разновидностей этой сетки; очевидно, сетка, в ко-
торой шестиугольники искажены по случайному закону, не об-
ладает периодичностью или, иными словами, имеет бесконечно
большую элементарную ячейку. Ситуация усложняется, если
сетка содержит многоугольники более чем одного сорта. Рас-
смотрим сначала сетку Фц = Фв=Ч-2, которая представляет со-
бой одно из трех решений уравнения D), соответствующее сет-
кам из равного числа многоугольников двух сортов. В случае
правильных 4- и 8-уголышков имеется единственная форма сет-
ки, показанная на рис. 3.9, б. Отбросим требование правиль-
ности многоугольников, но сохраним то же относительное рас-
положение 4- и 8-угольников (каждый 4-угольник имеет общие
стороны с четырьмя 8-угольннками, и в каждом 8-угольнике
последовательно чередуются стороны, общие с 4- и 8-угольни-
ками). Если допустить чередование 4-угольников разного раз-
мера (рис. 3.12, а), содержимое ячейки удваивается до Z = 8..
108 3. Полиэдры и сетки
\
2=8
= 8
Рис. 3.12. а — не вполне правильная форма плоской сетки D,82); и —- не вполне
правильная сетка, состоящая из равного числа 4- и 8-угольников, но имеющая
точки трех сортов: 4,82, 42,8 и 83. Z — число точек в ячейке, ограниченной штри-
ховыми линиями.
Рис. 3.13. Конфигурации плоской сетки
С Р$= 9-7= '
Переходя к следующему этапу, не будем сохранять то же от-
гяосительное расположение 4- и 8-угольников, а рассмотрим
сетку просто как систему 3-связанных узлов с равным числом
многоугольников двух сортов; тогда мы получим бесконечное
множество сеток (в которых присутствуют 4-угольники с об-
щими сторонами). Пример показан на рис. 3.12,6.
В сетках с 05 = 07 = 72 и 0з = 0э = 7г многоугольники обоих
сортов не являются правильными, но здесь снова существует
3.5. Трехмерные сетки
109
бесконечно большое число способов расположения равного числа
многоугольников двух типов. Четыре из числа простейших спо-
собов расположения равного количества пятиугольников и се-
ыттолышков показаны на рис. 3.13. Два из них (а и г) род-
ственны друг другу, поскольку построены из одинаковых фраг-
ментов: полос А и их зеркальных отображений В. Интересно,
что сетка, реализующаяся в ScB2C2, представляет собой не
простейшую конфигурацию с восьмью точками в повторяющем-
ся фрагменте (рис. 3.13, а), а конфигурацию с 2=16 (рис.
3.13. г).
3.5. Трехмерные сетки
3.5.1. Вывод трехмерных сеток. В этом случае неизвестны
уравнения, аналогичные тем, которые определяют соотношения
.между многоугольниками (циклами) различного типа в поли-
эдрах и плоских сетках. Поэтому для вывода основных трех-
мерных сеток необходим другой подход.
Всякое расположение, периодичное в одном, двух или трех
измерениях, состоит из одинаковых связанных между собой
структурных единиц. Если они повторяются в одной и той же
ориентации, это означает, что все фрагменты идентичны и свя-
заны только трансляциями. Для образования одно-, дву- или
трехмерного расположения должна существовать возможность
соединять эти единицы с двумя, четырьмя или шестью други-
ми, поскольку одномерное расположение должно повторяться
в двух направлениях вдоль линии, двумерное — вдоль двух не-
параллельных линий, трехмерное — вдоль трех некомпланарных
линий (осей). Структурная единица может содержать лишь
одну точку или группу связанных точек, и она должна иметь
но крайней мере две, четыре или шесть свободных связен, спо-
собных соединиться с соседними фрагментами. Требование на-
личия не менее четырех свободных связей для двумерных рас-
положений может на первый взгляд показаться несовмести-
мым с существованием плоских сеток с 3-связанными узлами,
но можно убедиться (рис. 3.11), что даже в простейшей из та-
ких сеток @6=1) повторяющаяся структурная единица содер-
жит пару связанных точек и эта единица имеет минимальное
число (т. е. четыре) свободных связей.
Очевидно, простейшая единица, способная образовать трех-
мерное расположение, — это точка с шестью связями, но для
трехмерных сеток со связанностью 4 и 3 повторяющаяся едини-
ца должна содержать соответственно две или четыре точки,
как это показано на рис. 3.14. Этот ряд можно дополнить еди-
ницей промежуточного характера, содержащей одну 4-связан-
ную и две 3-связанные точки; такая структурная единица так-
по
3. Полиэдры и сетки
же имеет необходимое число (шесть) свободных связен. Эти
значения Z, характеризующие число точек, входящих в данный
фрагмент, дают нам возможность понять природу простейших
трехмерных сеток. Одинаково ориентированные единицы долж-
ны быть соединены свободными связями (каждая с шестью
другими). Следовательно, шесть свободных связей каждой еди-
ницы должны составлять три пары, причем в каждой паре они
должны иметь противоположные направления. Одинаково ори-
Р\ 3
3 и4
а б
Рис. 3.14. Структурные единицы трехмерных сеток (см. текст).
ентированные связи повторяются через каждые (Z+1) точек
так, что образуются циклы, включающие 2(Z+1) точек. Таким
образом мы получаем семейство основных трехмерных сеток,
перечисленных в табл. 3.6, где р — число связей, сходящихся
в каждой точке, п — число точек в наименьших циклах. Отме-
тим, что символы этих сеток имеют вид (п, р); например,
A0, 3) —сетка с 3-связанными точками, состоящая из десяти-
угольников.
Таблица 3.6. Основные трехмерные сетки
Рис. 3.15
а
б
в
г
р
3
3,4
4
6
п
10
8
6
4
h
4
3
2
1
Zc
8
6
8
1
X
15
13ia
12
12
//
10
8
6
4
ШСВ^ВеШенп
значение.
По аналогии с правильными многогранниками и плоскими
сетками можно ожидать, что обнаружится ряд правильных
трехмерных сеток, в которых все связи равны по длине и эк-
вивалентны, все циклы (определяемые как кратчайшие пути,
которые содержат в себе любые две неколлинеарные связи,
исходящие из любой точки) идентичны, и расположение свя-
3.5. Трехмерные сетки 111
«X
I
Рис. 3.15. Трехмерные сетки: а—г четыре сетки, фигурирующие в табл. 3.6;
д — сетка ThSi2; e — сетка NbO.
112 3. Полиэдры и сетки
зей вокруг каждой точки имеет максимальную симметрию. Три
из числа сеток, приведенных в табл. 3.6, удовлетворяют всем
этим критериям, а именно 3-связанная сетка A0, 3), алмазная
сетка F, 4) и простая кубическая сетка D, 6) (примитивная
кубическая решетка). Эти сетки, имеющие кубическую сим-
метрию, показаны на рис. 3.15, а, в и г. Имеются также вторая
3-связанная сетка A0, 3), где Z также равно четырем (рис.
3.15,(9), и вторая 4-связанная сетка F, 4) с менее симметрич-
ным (компланарным) расположением связей, исходящих из
каждой точки (рис. 3.15, е). Удобно называть сетки в, д и е
сетками алмаза, ThSi2 и NbO соответственно, поскольку они
наблюдаются в структурах именно этих веществ. Сетка NbO
имеет кубическую симметрию, сетка ThSi2, а также сетка б в
своей наиболее симметричной форме являются тетрагональ-
ными.
Необходимо пояснить обозначения Zt и Zc, приведенные в
табл. 3.6. Если сосчитать число точек в элементарных ячейках
на рис. 3.15, а—г, оно окажется равным 8, 6, 8 и 1 соответст-
венно. Во всех случаях, за исключением г (когда решетка при-
митивна), эти величины Zc кратны значениям Zt, приведенным
в таблице. Причина этого заключается в том, что на рис. 3.15
сетки изображены в своих наиболее симметричных конфигура-
циях, и структуру удобнее всего описывать с помощью эле-
ментарной ячейки, ребра которой соотнесены с имеющимися
элементами симметрии. Такая элементарная ячейка обычно
больше, чем наименьшая ячейка, которую можно было бы вы-
брать без учета симметрии; она содержит Z< точек (атомов).
Так, кубическая ячейка алмаза содержит 8 атомов, но структуру
можно также описать с помощью тетрагональной ячейки, со-
держащей 4 атома, или с помощью ромбоэдрической ячейки,
содержащей 2 атома (Zt в табл. 3.6). Сетка A0, 3) на рис. 3.30,
которая лежит в основе структуры В2О3, представляет собой
пример сетки, где Zc и Zt совпадают: простейшая топологиче-
ская ячейка имеет Zt = 6, и таким же является значение Z, для
наиболее симметричной (тригональной) формы этой сетки.
По-видимому, пока неизвестны примеры кристаллических
структур, построенных на основе простейшей трехмерной сетки
с сочетанием 3- и 4-связанных узлов (рис. 3.15,6), но две более
сложные сетки такого типа в структурах встречаются. Особен-
но интересное семейство сеток со связанностью C, 4) включа-
ет в себя сетки, в которых каждая З-связапная точка соеди-
нена только с 4-связанными точками, и наоборот. Для таких
систем Z должно быть кратно семи; две сетки, представленные
ниже, относятся к этому типу. Рис. 3.16, а изображает струк-
туру Ge3N4 (пустые кружки — атомы N, заштрихованные —
атомы Ge). По существу то же атомное располож нне обнару-
3.5. Трехмерные сетки 113
жено в Be2Si04 (фенаките), гдо два атома Be и один атом
Si замещают атомы Ge в нитриде. Эта структура удобна для
образования атомами четырех тетраэдрических связей (Ge, Be
и Si) или трех приблизительно компланарных связей (N и О).
Сетка на рис. 3.16,6 подходит для атомов с координацией А,
Inc. 3.16. Две трехмерные C, 4)-связанные сетки, а — сетка, присутствующая
в структуре Ge3N4; б — расположение атомов Pt и О в Na^Pt3O4 (заштрихован-
ные и пустые кружки соответственно).
образующих четыре компланарные связи (заштрихованные
кружки), и представляет собой решетку из атомов Pt и О в
Na.vPt304 — соединении, образующемся при окислении плати-
новой проволоки в присутствии натрия. Атомы Na располага-
ются в пустотах и на рис. 3.16,6 не показаны.
Однородные сетки. Некоторые сетки обладают следующим
свойством: кратчайший путь, начинающийся из всякой точки
вдоль^ всякой связи и возвращающийся в эту точку по любой
другой связи, представляет собой цикл из п точек. Такие сетки
можно назвать однородными сетками. Этому условию удовлет-
воряют три первые сетки из табл. 3.6, но в такой простой фор-
8-752
114
3. Полиэдры и сетки
ме оно не может реализоваться в сетках с р>4. Его можно
применить к 6-связанным сеткам, если исключить из рассмот-
рения циклы, образуемые с участием пары коллинеарных свя-
зей в каждой точке. Следовательно, мы можем причислить к
числу однородных сетки D, 6) с примитивной решеткой, а так-
же структуру пирита, поскольку сетка E, б) содержит 4-свя-
занные точки (атомы S) и 6-связанные точки (атомы Fe) и
состоит из пятичленных циклов. Пока неизвестно, сколько все-
го существует однородных сеток; выведены и построены одно-
родные сетки следующих типов:
3
3,
4
4,
6
р
4
6
12,
10,
9,
9,
а
8,
8,
7
7
6
5
4
Верхний предел для п в 3-связанных сетках, по-видимому, ра-
вен 12; однако, поскольку примеры таких сеток неизвестны,
они здесь не приводятся и не включены в табл. 3.7.
Исследования автора, посвященные трехмерным сеткам,
подытожены в книге «Трехмерные сетки и полиэдры»
(Wells A. F. Three-dimensional nets and polyhcdra, Wiley-Inter-
sciencc. New York, 1977), а также в монографии № 8 Американ-
ской кристаллографической ассоциации за 1979 год.
3.5.2. Дополнения к характеристике трехмерных сеток. Кроме
двух сеток A0, 3) на рис. 3.15, а и д, а также третьей сетки
A0, 3), рассмотренной выше, имеются более сложные сетки с
3-связанными узлами, также состоящие из 10-членных циклов.
Эти сетки не превращаются друг в друга без разрыва и воз-
никновения связей и, следовательно, представляют собой раз-
личные способы соединения 3-связанных точек в трехмерные
сетки, состоящие из 10-угольников. Ясно, что символ (п,р) не-
адекватен и не позволяет различить сетки с разной топологи-
ческой симметрией. В отличие от кристаллографической топо-
логическая симметрия не учитывает метрики сеток, она отра-
жает только способ соединения циклов. Мерой топологической
симметрии могут служить две величины: х—-число п-угольни-
ков (в данном случае 10-угольников), к которым относится
каждая точка, и у ¦— число я-угольников, к которым относится
каждая связь. Для плоской сетки х равно связанности р, а у
3.5. Трехмерные сетки 115
всегда равно 2. В трехмерных сетках хну могут приобретать
весьма высокие значения, и для очень симметричных сеток,
приведенных в табл. 3.6, у равно п. Для этих правильных сеток
х и у связаны соотношением х = ру/2; это выражение справед-
ливо и для сетки со связанностью C, 4), если использовать
средневзвешенные значения х и р. Во второй 3-связанной сетке
(ThSi2) имеются два сорта неэквивалентных связей, и средне-
взвешенное значение у равно 6 -j в отличие от значения 10 для
правильной сетки A0, 3). Сетка 10-угольников из В2О3 пред-
ставляет собой третий член ряда 10-угольных 3-связанных се-
ток, как это видно из значений х:
"t Максимальная симметрия
4 Кубическая
4 Тетрагональная
6 Гексагональная
15
10
5
Для второй сетки F, 4) с 4-связанными узлами, присутствую-
щей в NbO, у = 4. С химической точки зрения значения .г и у
не представляют интереса, однако, если модели изучаются тща-
тельно, а не просто подбираются и описываются, желательно'
определить эти величины.
Основные системы соединенных точек — полиэдры, плоские
н трехмерные сетки — сведены в табл. 3.7, которая показыва-
ет, что четыре плоские и четыре трехмерные сетки образуют
ряды с и = 6, 5, 4, 3 и с «=10, 8, 6, 4 соответственно. Все си-
стемы, находящиеся на одной горизонтали, образованы и-член-
ными циклами, а все системы, попадающие в одну вертикаль-
ную графу, имеют одинаковое значение р. В первом столбце
3-связанные системы начинаются тремя правильными телами с
« = 3, 4 и 5; продолжением этого ряда является плоская сетка
с п = 6 и трехмерные сетки с п = 7, 8, 9 и 10. Сетки с я = 7, 8, 9
ниже упоминаться не будут, поскольку кристаллические струк-
туры, построенные на основе таких сеток, неизвестны. На рис.
3.10 изображены две разновидности сетки E,4), а на рис.
3.15,6 — трехмерная сетка (8, i); последняя представляет
(опой промежуточное звено между алмазной F, 4) и сетками
(Ю, 3) с 3-связаннымн узлами. Имеются также трехмерные
C, 4)-связанные сетки, образованные 6-, 7- и 9-угольникамн,
которые не изображены, поскольку не встречаются в кристал-
лах. Система E, 4) со связанностью 4, состоящая из 5-угольни-
8*
i 1 б Л'. Полиэдры и сетки
Таблица 3.7. Соотношение между полиэдрами, плоскими
и трехмерными сетками
\
Р
3 и 4-
Тетраэдр
Тригональная
бипирамида
Октаэдр
Плоская C, 6)\
Куб
Ромбический
додекаэдр
Плоская Dt 4)
Р -решетка
8
10
Пенл?аганальный\
додекаэдр
Плоская
Плоская F, 3)
G, 3)
G
(8,3)
(9,3)
(9,2)
Кубическая(ю, 3.
E,4)
Алмазная
Шифры в кружках
значения Zt)
ков, в работе автора, которая цитируется первой в конце
разд. 3.5.1, была ошибочно описана как бесконечно модифи-
цирующаяся непериодическая сетка; в действительности это
так называемый политоп {5, 3, 3} Кокстера [Coxeter H. S. М.
Polytopes, Dover, New York, 1973] —конечная сетка из 600 то-
чек.
Пятое правильное тело, икосаэдр, и другие системы 5-свя-
занных точек не включены в табл. 3.7, так как в них нет пло-
ских или трехмерных сеток, состоящих из многоугольников
только одного типа. Для координационных чисел, больших 6,
возможны только трехмерные сетки. Ниже обсуждаются два
аспекта трехмерных сеток, важных для структурной химии.
3.5. Трехмерные сетки 117
у.5.3- Сетки с полиэдрическими полостями. В некоторых трех-
мерных сетках присутствуют хорошо выраженные полости и
существует альтернативный способ описания связей в сетках
как ребер полиэдров, заполняющих пространство. В такой сет-
ке в каждой точке должны сходиться по крайней мере четыре
связи, п важнейшие из таких сеток — это как раз 4-связанные
сетки. Поэтому расположения заполняющих пространство по-
лиэдров, приводящие к таким сеткам, описаны после заверше-
ния анализа простейших сеток с координацией 4.
3.5.4. Взаимопроникающие сетки. До сих пор мы предполага-
ли, что во всякой системе совокупность всех точек представля-
ет собой одну сетку связанных точек, так что можно, передви-
гаясь по связям, перейти от каждой точки к любой другой.
Имеется несколько очень интересных структур, в которых по-
следнее невозможно. Это структуры с двумя или большим чис-
лом взаимопроникающих (переплетенных) сеток (рис. 3.17).
а
Рис. 3.17. Взаимопроникающие системы: а — конечные; б—г— 1-, 2- и 3-мерные.
Простейшая из них — это пара сцепленных я-членных колец,
изомерная 2«-членному кольцу. По-видимому, некоторое число
молекул такого типа образуется во многих реакциях с замы-
канием цикла, если эти циклы велики по размерам. Среди не-
органических соединений примеры сплетающихся цепочек не-
известны, но обнаружен пример двух взаимопроникающих сло-
ев в кристаллическом трицианометаниде серебра Ag[C(CNK]
(разд. 3.9.2). Несколько примеров кристаллических структур,
построенных из двух или большего числа одинаковых взаимо-
проникающих трехмерных сеток, будут рассмотрены в связи
со структурой типа алмаза (разд. 3.10.3).
118 3. Полиэдры и сетки
3.6. Полиэдрические молекулы и ионы
119
Теперь дадим примеры молекулярных и кристаллических
структур, в основе которых лежат системы 2-, 3- и 4-связан-
ных точек. Хотя логически циклические и цепочечные системы
(для которых р = 2) должны предшествовать полиэдрическим
(р^З), мы сначала обратимся к последним, переходя при
этом от конечных к бесконечным группировкам атомов. Такой
подход не согласуется с химической классификацией молекул
и кристаллов, он также не дает возможности рассмотреть де-
тали структуры и является скорее топологическим, чем геомет-
рическим. Но он наглядно показывает, как небольшое число
очень простых расположений используется в огромном много-
образии структур элементов и соединений. Приведем основные
разновидности этого многообразия:
полиэдрические молекулы и ионы;
циклические молекулы и ионы;
бесконечные линейные молекулы и ионы;
структуры, основанные на 3-связанных сетках:
плоская 6-угольная сетка;
трехмерные сетки;
структуры, основанные на 4-связанных сетках:
плоская 4-угольная сетка;
алмазная сетка;
взаимопроникающие системы;
более сложные сетки;
полиэдрические решетки.
3.6. Полиэдрические молекулы и ионы
К настоящему времени проведены структурные исследования
ряда полиэдрических молекул и ионов, в том числе предста-
вителей обширного класса тетраэдрических комплексов.
3.6.1. Тетраэдрические комплексы. Большинство из них отно-
сится к одному из четырех типов (рис. 3.18,а—г), геометрия
которых передается наиболее наглядно, если тетраэдр пред-
ставлен четырьмя из числа вершин куба. Первый среди них —¦
простой тетраэдр А4 (без учета концевых лигандов Y) (рис.
3.18,а). К нему можно добавить либо 4 атома X, расположен-
ных над центрами граней (рис. 3.18,6), либо 6 могтиковых
атомов X по числу ребер (рис. 3.18, б). Эти атомы X, конечно,
полностью или в значительной мере обусловливают соединение
атомов в данной группировке. В случае б при наиболее сим-
метричном расположении атомы А и X образуют куб, но сле-
дует ожидать, что такая конфигурация будет несколько иска-
жена и это приведет к отклонению валентных углов при ато-
мах А и X от 90°. В случае в шесть атомов X располагаются
по вершинам октаэдра; наиболее типичным примером являют-
ся молекулы Р4О6 и Р4ОШ (см. рис. 19.8). В структурах типа г
в центре тетраэдра расположен атом кислорода, и в некото-
рых молекулах такого рода в роли X выступают бидентатные
хелатные группы.
Ко всем основным типам молекул А4, А4Х4, А4Х6 и ОА4Х6
можно добавить концевые атомы Y, присоединенные к ато-
A4X4(A4X4Y4) A4X6(A4X6Y4) 0A4Xs (UA4XsY4)
A6XI2(ASX,2Y6)
АЯХ,
Рис. 3.18. Полиэдрические молекулы и ионы: а—г — тетраэдрические; д—е —
октаэдрические; ж — кубические.
мам А. Обычно к последним добавляется лишь по одному та-
кому атому, поскольку атомы А уже связаны каждый с тремя
атомами X (в дополнение к любым возможным взаимодействи-
ям А—А), и четвертая связь с атомом Y завершает образова-
ние тетраэдрической группы. Так, в Cu4I4(AsEt3L X = I и Y =
=AsEt3> а в [Fe4S4(S0L]2- X = S и Y = S^. В других комплек-
сах, содержащих ядра А4Х4, к каждому атому А и X присоеди-
нен четвертый лиганд, что дает состав A4X4Y8) как в A14N408,
или же к каждому атому А присоединены 3 атома Y, дополняя
координацию до октаэдрической, как в Pt4I4(CH3) 12. В менее
симметричной тетраэдрической молекуле Со4(СО)!2 три группы
СО присоединены к атому Со, расположенному в вершине (ак-
сиальному атому Со), три группы СО играют роль мостиков на
ребрах основания и еще по две группы СО связаны с каждым
из атомов Со, лежащих в основании (базальных атомов Со).
120 3. Полиэдры и сетки
3.6.2. Октаэдрические молекулы и ионы. Компактные группи-
ровки, возникающие вокруг октаэдра из атомов металла, пре-
валируют в соединениях Nb, Та, Мо и W с галогенами, где та-
кие системы обнаружены в виде изолированных ионов или мо-
лекул, а также в качестве фрагментов, связанных через по-
Таблица 3.8. Полиэдрические молекулы и ионы
Тетраэдри-
ческие
Октаэдри-
ческие
Кубические
Рис.
3.18
а
б
в
г
д
е
ж
44
A4Y4
А4Х4а
A4X4Y4
A4X4Y8
\4X4Y12
44Х6
A4X6Y4
ОА4Х6
OA4X6Y46
A6Y6
A6X8
A6X8Y6
A6X12
A6X12Y6
A8X8
w.
P4, As4
B4C14
Li4(C2H5L, Tl4(OAlkL, Pb4(OHL4
Cu4I4(AsEt3L, Fe4S4(S^L2-
Pt4l4(CH3I2
P4O6> As4O6> Sb4O6) N4(CH2)G. (CHLS6
(CHL(CH2N, (SiRLS6
P4O10, Р4О6[№(СОK]4
OBe4(acN, OZn4(acN, OZn4(S2PR2N
OZn4(OSPR2N, OCo4[C(CH3KCOO]6
OMg4Br6(C4H10OL, OCu4Cl6(pyrL
(OCu4C!I0L-
B6H62-
Sn6O4(OCH3L
Mo6Cl142-, Mo6Br12(H2OJ
Pd6Cli2, PteClja, Bi6(OHI26+
W6C1,2C16, Nb6Cli84-, Ta6Cl,2CI2(H2OL
C8H8
Cu8[S2C2(CNJ]6
В дополнение к литературе, цитируемой в других главах см. также: Nature, 1970,
228, 648; 6Inorg. Chem., 1969, 8, 1982.
средство атомов Y в слои или трехмерные структуры. Два ос-
новных типа структурных единиц показаны в идеализированной
форме на рис. 3.18,<9 и е. Известно мало соединений, содержа-
щих простые единицы А6Х8, однако изучено большое число
комплексов общего типа АбХ8?6 (табл. 3.8). Структурная еди-
ница A6Xi2, показанная на рис. 3.18, е, отражает строение гек-
самерной молекулы в одной из полиморфных модификаций
3.7. Циклические молекулы и ионы 121
l; и PtCl2, а также структуру иона Bi6(OH)i26+ в гидроли-
зованных растворах солей висмута. Добавление еще шести ато-
мов галогена к составу A6Xi2 дает структуру гексамерной моле-
кулы трихлорида вольфрама W6Cli2Cl6 и иона Nb6Cli84"". Эти
сложные галогениды более подробно описаны в гл. 9. В каче-
стве родственных комплексов А6Х18 могут быть также названы
оксоионы M6Oi98~, образованные с участием V, Nb и Та, но
здесь появляется еще один атом О в центре, что дополняет ко-
ординацию каждого из атомов металла до октаэдрической. Эти
и другие сложные оксоионы металлов VA и VIA группы в
гл. 11 альтернативно описаны как совокупности октаэдров МО6.
Молекула Rri6(CO)i6 состоит из октаэдрического ядра Rhe,
причем к каждому атому металла присоединены по две груп-
пы СО, еще четыре группы СО находятся над четырьмя из гра-
ней октаэдра, и каждая из них является мостиковой по отноше-
нию к трем атомам Rh; эти четыре группы СО расположены по
вершинам тетраэдра.
3.6.3. Кубические молекулы и ионы. Простейший пример — мо-
лекула кубана С8Н8. На рис. 3.18, ж показан комплекс А8Х!2,
родственный комплексу A6Xi2 на рис. 3.18, е. Здесь наблюдает-
ся такое же кубооктаэдрическое расположение 12 атомов X, но
атомы А находятся в вершинах куба, а не октаэдра. Эта
структура реализуется в анионе [Си8'Ьб]4^ в солях с крупными
катионами [N(C6H5) (СН3K]+ или [As(C6H5L]+; здесь L — ли-
ганд состава
Роль 12 атомов X играют 6 пар атомов S.
3.6.4. Смешанные полиэдрические комплексы. К их числу от-
носятся анионы элементов В-подгрупп (разд. 7.5), многочис-
ленные соединения бора (гидриды, гидридные ионы, некоторые
галогениды) и силоксаны, к которым мы обратимся в последу-
ющих главах.
3.7. Циклические молекулы и ионы
В табл. 3.9 перечислены некоторые примеры гомо- и гетеро-
циклических молекул и ионов. Примеры циклов, содержащих
атомы более чем двух сортов, будут представлены при рас-
смотрении стереохимии N, Р и S. Четырехчленные циклы на-
122 3. Полиэдры и сетки
Число
атомов
в цикле
3
4
5
6
7
8
10
12
16
18
20
Таблица 3.9.
Циклические молекулы и ионы
Гомоциклические
Os3(COI2
(PCF3L, (AsCF3L,
(PCF3M, (AsCH3M
(AsC6H5)c,
(РбО12N-, S6, (Sns*
S7, S7O
S8, S82+, Se82+
Sis
S,8
S20
Se42+
(PQH5N,
2)б
Гетероциклические Ап\п с чередующи-
мися атомами Л и X
_
(SSiCl2J, (C1A1C12J, (С1ХЬС14J
—
(Si3O9N-, (РзО9K-, S3O9, B3N3H6,
(NSC1K, (PNC12K) Pd3[S3(C,H4J]3>
S3N3-
—
N4S4, (Si4O,2)8-, (P4O12L-, Se4O,2,
(BNC12L, (PNC12L, Mo4F20,
(OGaCH3L, [(ОН)Аи(СНзJ]4, S4N42+,
Sn4F8
(PNC12M> S5N5+
(Si6O18I2-, (P6O18N-, [PN(NMe2Jle
[PN(OCH3J]S
блюдаются в многочисленных ионах и молекулах с двойными
мостиками, где координационные полиэдры двух атомов А
имеют общее ребро или грань, и, разумеется, в больших циклах
со сдвоенными мостиками, таких, как а я б:
а
.011
Oil ОН ОН ОН
OiZ ¦'°"';Zr(H,Oi4
' ¦ *
•он-
RS-Ni-SR
/ / \ \
Ni-SR RS —Ni
RS/4SR RS ^S
Ni-SR SR-Ni
\ \ / /
, RS- Ni-SR
Чаще всего встречаются 6- и 8-членные циклы. Известны при-
меры плоских циклов (B3N3H6 и N3S3~), но чаще наблюдается
форма кресла — одна из двух характерных форм цикла, обра-
зованного из атомов с тетраэдрическими связями. Скрученная
ванна также встречается в Si3S3(CH3K03; соответствующие
значения диэдрических (торсионных) углов приведены в ра-
ботах, цитируемых в разд. 23.9.
3.8. Бесконечные линейные молекулы и ионы 123
Стереохимия восьмичленных циклов более сложна; такой
цикл обладает большей гибкостью, и поэтому различные кон-
фигурации обнаруживаются и в полиморфных модификациях
(например, кресло и ванна N4P4C18), и в близких по составу
солях (см. тетраметафосфаты, разд. 19.6.14), и даже в одном
кристалле, как это наблюдается в случае [ (CH3JSiNH]4. Не-
трудно построить модели четырех форм восьмичленного цикла,
образованного атомами с тетраэдрическими связями (эти ато-
мы нумеруются последовательно по ходу цикла).
Кресло. 1, 2, 4, 7 — компланарны, 3, 5, 6, 8 — компланарны,
лежат в параллельных плоскостях. Эта центросимметричная
форма аналогична форме кресла для шестичленного цикла; ее
максимальная аксиальная симметрия отвечает оси 2-го по-
рядка.
Ванна. 1, 2, 5, 6 — компланарны, 3, 4, 7, 8 — компланарны,
лежат в параллельных плоскостях. Максимальная аксиальная
симметрия 4.
Седло. 1, 3, 5, 7 — компланарны, 2, 4, 6, 8 образуют бисфе-
поид. Если пары плоскостей 1,2,3-5,6,7 и 3,4,5-7,8,1 параллель-
ны, то модель соответствует молекуле N4S4 с короткими рас-
стояниями 2-6 и 4-8. Молекулы N4P4F4(CH3L h_N4P4F6(CH3J
имеют максимальную из возможных симметрию 42т.
Корона. 1, 3, 5, 7—-компланарны, 2, 4, 6, 8 — компланарны,
лежат в двух параллельных плоскостях. Аксиальная симмет-
рия 8 (в кристаллическом S4N4H4 симметрия 4mm).
Примеры молекул с этими конфигурациями таковы:
Кресло
[(CH3JGa(OH)l4
!4CH3JSi(NH)l4
Ванна
(XSFL
N4P4C18 (форма К)
Седло Корона
N4S4 S8
N4P4F4(CH3L S4N4H4
3.8. Бесконечные линейные молекулы и ионы
Примеры наиболее важных типов цепей даны в табл. 3.10.
В простейшей цепи — А—А—А— в роли А может выступать
отдельный атом, как в пластической сере, или группа атомов,
как в анионе, присутствующем в Са[В3О4(ОНK]-Н2О (а). Во
гссех других цепях из табл. 3.10 атомы А связаны через атомы
другого элемента X. В большинстве примеров концевые атомы
X и мостиковые атомы X — это атомы одного сорта, но они мо-
гут быть и лигандами двух различных сортов, например в це-
124 3. Полиэдры и сетки
3.8. Бесконечные линейные молекулы и ионы 12&
Таблица
Тип цепи
ау-А—
(Ю-А-Х-
—А-Х—
—А-Х-
х2
—А-Х—
ХА
(ZZO>^Xvv-A^
^Х^ ^
XXX
\ /* ^. S*
Аналогично
Ч /х\ /Х^
' чх/ чх^
(Ю ^А^>А<^>
А Л
Гибридные цепи
Кратные цепи
3.10. Бесконечные линейные молекулы и ионы
А
АХ
АХ2
АХ3
АХ5 ¦
АХ2
АХ4
АХ5
АХ6
АХ7
АХ3
АХ4
Молекулы.
S (пластическая), Se,Te
AuI.AuCN, HgO,
In(C5H5),@SeO2)H
SeO2TPb(C5H5J,
S03,CrO3,AuF3;
PNCl2>Si0Cl2
(транс): BiF5,UF5
(цис): CrF5 г/ яг. й, МоОЕ,
(плоские): PdCl 2, CuCl 2
(тетраэдричесше): BeCl2,
S i S 2
NbI4,TcCl4
PaCl5
Zrl3 И/Г7. Й
U(«cL
?¦/«. текст
5bz03,Nb0Cl3
Ионы
(HCO3)"", (HS041""
(Ъ\О$гпп- и m.d.,(ZvlZ\*)%n~
(CuffCl3)""
(AlF5)n"". (PbFO"~
(S SrPbFg)
(НёС14)„гл-
(ZrF6^n- « K2IrFs
(PaF7)nn" 5 K2PaF7
(NiCl3)n~ в CsNiCi3
E(с4сГз)«(^С'з)
пи, представленной формулой б, в октаэдрическпх цепях AX2L2,
рассмотренных ниже.
а он
OH OH
-Sn-NC(CH2KCN-Sn-
(Cl4) (CI4)
\/
s s
p
EtO' NOF.t
s s
\ /
p
Линейная молекула Zn[S2P(OEtJ]2 (в) представляет собой при-
мер цепи, в которой лиганд является одновременно бидентатным
п мостиковым в отличие от цепи в Zn[O2P0 (m-C4H9)]2, описан-
ной ниже. Поскольку цепи класса II в табл. 3.10 состоят из
координационных групп АХ„, сочлененных через два атома X,
они могут быть названы «цепями с обобществленными верши-
нами».
Цепи класса III по аналогии можно назвать «цепями с
обобществленными ребрами». Этот класс включает в себя важ-
ную цепь, состоящую из сочлененных по ребрам октаэдрических
группировок. Ребра, участвующие в сочленении, могут быть
противолежащими (Nbl4) или не быть таковыми (ТсС14), как
это описано в гл. 5, причем цепи первого типа (транс) встре-
чаются чаще. Как и в классе II, концевые и мостиковые лиган-
ды могут быть различными, что дает составы АХ4 и AX2L2, где
L — лиганд, способный образовать только одну связь с А, как.
в примере г. Другие примеры перечислены в табл. 25.4 (см,,
гл. 25).
Более сложную цепь такого типа представляет собой цепо-
чечная молекула РаС15 (пентагонально-бипирамидальные груп-
пы РаС17, сочлененные по экваториальным ребрам), а также
анионы K.2ZrF6 (додекаэдрические группы ZrF8, сочлененные
по ребрам) и в K^PaF? (трехшапочные тригонально-призмати-
ческие группировки PaF9, сочлененные по ребрам).
Гораздо реже встречаются цепи, относящиеся к классам IV
и V, где координационные группы сочленены по граням. Для
октаэдрических групп получается формула АХ3, как в Zrl3 и
[Li (Н2О)г]С1О4, а для трехшапочных тригонально-призматиче-
ских групп — АХ6, как в [Sr(H2ON]Cl2. В этих цепях сопря-
женными являются треугольные грани координационных поли-
эдров; в относящемся к типу V U(OOCCH3L сопряжение осу-
ществляется через две противолежащие четырехугольные гра-
ни антипризм, а ацетатные группы —ОС(СН3)О— играют
роль мостиков.
126 3. Полиэдры и сетки
Термин «гибридная цепь» в табл. 3.10 обозначает цепь, в ко-
торой имеются мостики более чем одного сорта. Сюда относят-
ся
\/
\ V / \ / \
Zn[O2P0(*-C4H9)]2: -Zn -О ' xO-Zn—ОРО—Zn-
ОРО'
/ \
а
: -Cl-Re-Cl-Re^l-Re-Cl-
О
CI
/i
С] '
С1
которые являются примерами неожиданно сложных структур
для соединений с формулами простейших основных типов АХ2
и АХ4.
Подзаголовок «кратные цепи» в табл. ЗЛО объединяет си-
стемы связанных атомов, которые имеют бесконечную протя-
женность в одном измерении, но более сложную структуру, чем
простая последовательность —А—А—А— со связанностью 2
(р = 2). Мы видели, что при р^З имеется достаточное число
связей, чтобы образовать дву- и трехмерные системы (в добав-
ление к полиэдрам). Однако, если каждая точка дает более
двух связен, образующаяся система вовсе не обязательно бес-
конечна в двух или трех измерениях, и здесь мы кратко рас-
смотрим некоторые типы одномерных систем с р = 3 или 4,
причем ограничимся теми, в которых все точки эквивалентны.
Простая лестница на рис. 3.19, а.\ изображает цепь в ромбиче-
ской форме Sb2O3 (по одному атому О на каждой связи), а
также ион (Си2С1з)яя~, представляющий собой двойную цепь,
образованную тетраэдрическими группами с тремя общими
ребрами. Усложнение этой системы [рис. 3.19, а2 и аз] дает це-
почечную молекулу NbOCl3 (разд. 5.3.5), в которой октаэдри-
ческие группы NbO2Cl4 обобществляют одно ребро и две верши-
ны, а также цепочечный ион (Si4Oii)rt6", в котором часть групп
SiO4 делит с соседними по три, а другая часть — по две вер-
шины. Лента с 4-связанными точками [рис. 3.19,6,] представ-
ляет собой цепочечный анион в NH4(CdCl3), образованный ок-
таэдрическими группами CdCl6, каждая из которых соединена
с соседними через четыре вершины.
Скручивая полосы из двумерных сеток в цилиндры с соеди-
нением, например, по линиям АА и А'А' (рис. 3.19, а4 и as),
можно получить бесконечно большое число трубчатых систем.
3.9. Структуры на основе сеток с 3-связанными узлами_
127
Y
Г
х
б,
Рис. 3.19. Образование кратных цепей из точек с координацией 3 и 4 (см..
текст).
Примеры трубчатых цепей, построенных на основе простей-
шей плоской сетки со связанностью 3, как будто бы неизвест-
ны, по трубчатая сетка 4, 82, соответствующая случаю as, обна-
ружена в некоторых силикатах (разд. 23.12.7). Простейшая-,
трубчатая система, образованная из плоской сетки 44, тополо-
гически равна системе a2, но следующий член этого ряда —
трубка б2 — может быть построен из тетраэдров или октаэд-
ров, обобществляющих по четыре вершины, как это показано
на проекциях вдоль оси трубки [рис. 3.19, б3 и б4]. Пример
случая б4 дает ион (CrF4)n"~ (разд. 5.3.3).
3.9. Кристаллические структуры на основе сеток
с 3-связанными узлами
3.9.1. Типы структурных единиц. Простейшие единицы, приво-
дящие к структурам с 3-связанными узлами, показаны на рис.
3.20. В случае а один атом образует три связи, и из таких еди-
ниц можно построить структуру элементов или соединений, где
все атомы образуют по три связи. Если на всех отрезках, со-
единяющих узлы такой сетки, располагаются атомы X, как в
случае б, получается формула А2Х3. Такое расположение най-
128 3. Полиэдры и сетки
3.9. Структуры на основе сеток с 3-связанными узлами
129
дено во многих оксидах М2О3 и сульфидах M2S3. На рис. 3.20, в
показана тетраэдрическая группа АХ4, которая делит три из
своих вершин с другими подобными группами. Распростране-
ние такого строения по кристаллу приводит к составу А2Х5. На
рис. 3.20, г показано наиболее симметричное расположение,
при котором октаэдрические группы АХ6 соединяются с тремя
другими через ребра. Здесь каждый атом X принадлежит двум
октаэдрам, и получается формула АХ3.
Четыре структурные единицы а—г (рис. 3.20) представля-
ют собой основу для многочисленных структур неорганических
а 5 в г о
Рис. 3.20. Структурные единицы, образующие сетки с 3-связанпыми узлами.
соединений с ковалентными или ковалентно-ионнымн связями.
С помощью 3-связанных сеток удобно также схематически
представить структуры ряда кристаллов, в которых структур-
ные единицы (ионы или молекулы) образуют по три водород-
ные связи. В гидратах некоторых кислот ион Н+ ассоциирован
с молекулой Н2О с образованием иона Н3О+, который высту-
пает в роли структурной единицы типа а. В некоторых гидро-
ксисоединениях каждая группа ОН участвует в двух водород-
ных связях, и поскольку молекула соединения с двумя гидро-
ксильными группами может быть представлена, как на рис.
3.20,E, остается только указать атомы, вступающие в водород-
ную связь.
Структурные единицы, показанные на рис. 3.20, могут со-
единяться с образованием конечных группировок или располо-
жений, бесконечных в одном, двух или трех измерениях. Конеч-
ные (полиэдрические) и бесконечные линейные системы уже
ра:сматривались, причем единственным простым примером це-
пи оказалась двойная цепь в ромбической форме Sb2O3. Про-
стейшей плоской 3-связанной сеткой является сетка, состоящая
из шестиугольников. Эта сетка — наиболее важная для струк-
турной химии — будет нами детально рассмотрена. Прежде чем
перейти к трехмерным сеткам, мы дадим также примеры
структур, в основе которых лежат более сложные плоские сет-
ки с р = 3.
3.9.2. Плоская гексагональная сетка. Известны примеры струк-
тур, построенных на основе этой сетки, в которых участвуют
все пять типов структурных единиц, показанных на рис. 3.20.
В своей наиболее симметричной форме эта сетка в точности
плоская и состоит из правильных шестиугольников одинакового
размера. Такую структуру имеет слой в графите или располо-
жение атомов В в А1В2. Если валентный угол оказывается
меньше 120° (как в плоском правильном шестиугольнике), слой
становится гофрированным.
Известно, что валентные углы (подразумевается, что они
равны) не определяют форму изолированного шестичленного
цикла; формы «кресло» и «ванна» хорошо знакомы всем хи-
микам. Обычно меньше обращают внимание на то, что анало-
гичная «конформационная» задача существует и для сетки б3;
эту задачу можно проиллюстрировать, рассматривая сетки, где
все циклы имеют форму кресла и все валентные углы равны
109,5°. Для третьей связи каждого атома здесь имеются альтер-
нативные позиции, а именно позиция е приблизительно в сред-
ней плоскости кольца и позиция р, перпендикулярная этой пло-
скости :
а
Число возможных комбинаций связей е и р для цикла в целом,
очевидно, то же самое, что и число замещенных бензолов. Эти
числа таковы (число позиций р обозначено с помощью верхне-
го индекса):
р1 и рь (по одной комбинации) \
р2 и р4 (по три комбинации) 1 всего 11 комбинаций
р3 (три комбинации) j
Для расположений р° (или, иначе, е6), а также р6 имеется 13
различных способов размещения шести экзоциклических свя-
зей. Разобрав все способы, можно показать, что, если все цик-
лы имеют форму кресла с одинаковым расположением связей,
тогда только три из этих комбинаций приводят к периодиче-
ским двумерным сеткам. Три допустимых расположения свя-
зей— это р°, р1 и центросимметричная конфигурация р2, пока-
занная выше на клише. Профили трех слоев, построенных на
основе тетраэдрических валентных углов, показаны на рис.
3.21, а, где слои спроектированы приблизительно в направле-
9-752
130 3. Полиэдры и сетки
нии стрелки, изображенной на схеме, приведенной выше. На
рис. 3.21,6 и в мы привели идеализированные конфигурации
слоев р° и р1, построенных на основе валентных углов 90°, что-
бы показать их соотношение с кубической решеткой; в случае б
средняя плоскость слоя перпендикулярна к объемной диагона-
ли ячейки. Пока неизвестны примеры слоя р1; слой р° присут-
р
Рис. 3.21. а — профиль слоев б3, построенных на основе тетраэдрических ва-
лентных углов; б и в — соотношение слоев р° и р2 с примитивной кубической
решеткой.
ствует в кристаллических As, Sb и Bi (а также в низкотемпе-
ратурной форме GeTe), а слой р2 — в черном Р и изоструктур-
ных GeS, SnS, GeSe и SnSe. Истинная конфигурация слоя р°
в As близка к показанной на рис. 3.21,6, поскольку валентный
угол равен 96°, но в слое р°, образованном атомами Si в CaSi2,
валентные углы близки к тетраэдрическим. Слой р2 в черном Р
имеет конфигурацию, промежуточную между показанными на
рис. 3.21, а и в, причем средний валентный угол равен 100°.
Если в слое шестиугольников чередуются атомы разных эле-
ментов, получается состав АВ (рис. 3.22), и мы обнаруживаем
плоские слои в гексагональном BN, а в GeS (и SnS) —гофри-
рованные слои, сходные с наблюдающимися в черном Р.
3.9. Структуры на основе сеток с 3-связанными узлами 131
АВ А2Х, А2Х, ЛХ3
Рис. 3.22. Структуры бинарных соединений, построенные на основе гексагональ-
ной сетки.
Ортоборная кислота В(ОНK является тригидроксосоедине-
нием, и в кристаллическом состоянии каждая молекула связа-
на с соседними молекулами посредством шести водородных свя-
зей О—Н---О. Последние попарно соответствуют трем примы-
кающим молекулам, причем возникающее расположение похо-
же на димеры карбоновых кислот:
ср. с
R.C. ч
В результате молекулы объединяются в слои, в основе кото-
рых лежит гексагональная сетка, как это показано на рис.
24.11 (разд. 24.7).
В кристаллогидратах некоторых кислот протон переходит
к молекуле воды, и образуется ион Н3О+, который может да-
вать три водородные связи. Соответственно структуры кристал-
лических НС1-Н2О и HNO3-H2O состоят из слоев, в которых
в шестичленных циклах чередуются анионы и ионы Н3О+, как
это показано для слоя АВ на рис. 3.22. В этих двух моногид-
ратах содержится столько атомов Н (по три на формульную
единицу), сколько требуется для того, чтобы каждый фрагмент
был связан водородными связями с тремя соседними. Сравне-
ние со структурами НС1О4-Н2О и H2SO4-H2O показывает, что
структуры этих гидратов определяются в большей степени чис-
лом атомов Н, способных к образованию водородных связей,
чем строением аниона. Низкотемпературная форма НС1О4-Н2О
имеет структуру точно того же топологического типа, что и
HNO3-H2O. Как в HNO3-H2O, здесь присутствуют три водород-
ные связи, соединяющие каждый ион с его соседями, причем
один атом О из каждого иона С1О4~ не участвует в водородных
связях. С другой стороны, в моногидрате серной кислоты ко-
9*
132 3. Полиэдры и сетки
личество атомов Н достаточно для того, чтобы на каждый
структурный фрагмент (Н3О+ или HSO4~) приходилось в сред-
нем по четыре водородные связи, и мы обнаруживаем три водо-
родные связи, в которых участвует каждый ион Н3О+, и пять
связей, в которых участвует каждый ион HSO^r; в итоге
структура уже не имеет в своей основе гексагональную сетку.
Эти структуры описаны более подробно в гл. 15.
Тритиан 5з(СН2)з — подобная циклогексану молекула в
форме кресла — образует много комплексов с металлами. Два
соединения с серебром имеют слоистые структуры, в основе ко-
Рис. 3.23. Слои в структурах: а — Ag[S3(CH2b]NO3-H2O; б —Ag.[C(CNKl;
в — два сплетенных слоя из Ag[C(CNKl.
торых лежит гексагональная сетка. В обеих структурах атом
Ag координирован по тетраэдру, причем в роли четвертого ли-
ганда (X на рис. 3.23, а) выступает Н2О в Ag(TpHTHaH)ClO4-H2O
и атом О группы NO3~ в Ag (тритиан) NO3-H2O (J. Chem. Soc.
(London), A, 1968, 93). Очень интересную структуру имеет
трицианометанид серебра Ag[C(CNK]. Лиганд C(CNK образу-
ет с серебром (здесь дающим лишь по три связи) слой того
же основного типа, что и в тритиановом комплексе (рис.
3.23,6), однако слои попарно сплетены, как это показано на
рис. 3.23, в. Это один из двух примеров взаимопроникающих
двумерных сеток, известных в настоящее время; другой при-
мер— это гораздо более сложный кратный слой в фосфоре Гит-
торфа, к которому мы обратимся позже.
Если атомы А, расположенные в точках гексагональной сет-
ки, соединены через атомы X (рис. 3.22), возникает слой А2Х3..
Кристаллический AS2S3 (минерал аурипигмент) построен из
слоев именно такого типа (рис. 3.24,а); очень похожие слои-
стые структуры имеют и обе формы клаудетита As2O3. (Дру-
гая полиморфная модификация — арсенолит — построена из
молекул As4O6, имеющих такое же строение, как и молекулы
Р4О6.)
3.9. Структуры на основе сеток с 3-связанными узлами 133
Рис. 3.24. Слои в структурах: а — As2O3 (аурипигмент); б — Р2О5.
Много интересных примеров систем с водородными связя-
ми дают кислые соли; эти системы особенно просты, если от-
ношение числа атомов Н и анионов совпадает с тем, которое
требуется для сеток с 3-, 4- или 6-связанными узлами:
Соль
NaH3(Se03J
КН2РО4
(NH4JH3IO6
Отношение
Н : анион
3:2
2:1
3:1
Тип сетки
3-связанная
4-связанная
6-связанная
В NaH3(Se03J ионы SeO32~ расположены в точках плоской
гексагональной сетки, а атомы Н — на каждой связи, что да-
ет требуемое отношение Н : анион, равное 3 : 2.
В разд. 4.2 мы покажем, что плотноупакованный слой со-
става АХ2, основанный на сетке б3, можно построить из тетра-
эдрических групп АХ4, сочлененных по одному ребру и двум
вершинам. Примеры пока неизвестны, но там же (разд. 4.2)
описан родственный слой GaPS4.
Слои, образованные тетраэдрическими группами АХ4, кото-
рые соединены через три вершины, имеют состав А2Х5. Такой
слой, если он состоит из групп РО4, является электронейтраль-
ным; аналогичный слой, построенный из групп SiO4, представ-
ляет собой двумерный ион (Si2O5)n2"~. На рис. 3.24,6 показана
проекция атомов в слое одной из полиморфных модификаций
РгО5. Хотя на первый взгляд этот слой кажется довольно слож-
ным, удаление заштрихованных кружков, изображающих кон-
цевые атомы О, дает систему атомов Р и О, очень сходную с
системой атомов As и S в As2S3 (рис. 3.24, а). Заряженный
слой в Li2Si205 и в других силикатах аналогичного состава от-
134 3. Полиэдры и сетки
носится к тому же топологическому типу; однако он сильно
гофрирован, по-видимому, вследствие приспособления к опти-
мальному расположению катионов между слоями.
Четвертый структурный фрагмент показан на рис. 3.20, г —
это октаэдрическая группа АХ6 с тремя обобществленными
ребрами. Середины этих ребер и центральный атом А компла-
Рис. 3.25. Слой в кристаллическом ТЫ4.
нарны; поэтому октаэдры, соединяющиеся таким способом, об-
разуют плоский слой на основе гексагональной сетки. Такой
слой найден во многих соединениях АХ3, структуры которых
различаются способом наложения слоев, т. е. типом упаковки
атомов X. В структуре Bil3 наблюдается гексагональная, а в
структуре YC13 — кубическая плотнейшая упаковка атомов га-
логенов, описанная в гл. 4; в А1(ОНK более рыхлое наложе-
ние слоев обусловлено образованием связей О—Н---0 между
группами ОН смежных слоев.
В гл. 5 рассматриваются более сложные слои, образованные
сочленением всех свободных вершин тетраэдрического слоя
А2Х5 с частью вершин октаэдрического слоя АХ3 (в основе обо-
их этих слоев лежат гексагональные сетки). Из таких сложных
слоев состоят структуры минералов двух важных классов:
слоистых минералов (включая каолин, тальк и бентониты) и
слюд. Один из таких слоев представлен в виде совокупности
тетраэдров и октаэдров на рис. 5.44 (гл. 5).
Два совершенно неожиданных примера структур, в основе
которых лежит сетка б3, дают UBr4 и ТЫ4, где атомы металла
имеют координацию 7 и 8 соответственно. В UBr4 пентагональ-
но-бипирамидальные группы объединены по трем ребрам (см.
3.9. Структуры на основе сеток с 3-связанными узлами 135
с 28.4) так, что 6 из 7 атомов Вг являются мостиками меж-
ду атомами U A+6-2=4). В ТЫ4 каждая антипризматиче-
ская группа This обобществляет одно ребро и две грани, и в
результате каждый атом I связан с двумя атомами Th (Ъ—^ =
= 4). Эта структура показана на рис. 3.25.
Примером реализации структурной единицы, изображенной
на рис. 3.20,C, может служить структура одной из полиморф-
ных модификаций гидрохинона (я-дигидроксибензола). Каж-
дая группа ОН в связи О—Н---0 мо-
жет выступать и в роли донора, ив""'
роли акцептора, и простейшее распо-
ложение молекул в таком случае пред-
ставляет собой плоский слой, схемати-
чески показанный на рис. 3.26.
Рассмотренные выше структуры
сведены в табл. 3.11.
Описанный способ топологического
представления кристаллических струк- „
F r ^J Рис. 3.26. Слой молекул в
тур можно распространить и на более кристаллическом у.ГИдрОхп-
ж ж ж
ноне
(схематическое
бражение).
сложные соединения, если сосредото-
чить внимание на ограниченном числе
наиболее сильных связей, цементирую-
щих структуру. Найлон образуется при конденсации гексамети-
лендиамина с адипиновой кислотой и состоит из длинных моле-
кул, которые схематически можно представить так, как это сде-
лано на рис. 3.27, а. Молекулы соединены в слои посредством
водородных связей между группами СО и NH разных цепей, и,
если мы интересуемся в первую очередь системой водородных
связей, можно изобразить только группы СО и NH (светлые и
заштрихованные кружки соответственно) и опустить группы
СН2. Водородные связи показаны штриховыми линиями. Сведен-
ная к этой простой форме структура выглядит как гексагональ-
ная сетка. Тип 3-связанной сетки зависит от последовательности
пар групп СО и пар групп NH вдоль каждой цепочечной молеку-
лы. Если эти группы чередуются (—СО—NH—CO—NH—), как
в капролактаме, естественный способ соединения цепей посредст-
вом водородных связей будет тот, что показан на рис. 3.27,6;
это сетка 4,82 — представитель одной из последующих простей-
ших групп плоских 3-связанных сеток.
3.9.3. Структуры, в основе которых лежат другие плоские 3-свя-
занные сетки. Примеры кристаллических структур, основанных
на более сложных плоских 3-связанных сетках, не столь мно-
гочисленны, как для сетки б3. Борокарбиды МВ2С2, образован-
136 3. Полиэдры и сетки
Таблица 3.11. Слои, построенные на основе простой
гексагональной сетки
Тип слоя
А
АВ
А2Х3
А2Х5
АХз
АХ4
Примеры
С (графит), As, Sb, Bi, P (черный)
CaSi2, AIB2
В(ОНK
BN, GeS, SnS
(H3O)+C1-, (H3O)+NO3-, (H3O)+C1O4-
Ag[S3 (CH2K]C1O4• H2O, Ag[S3 (CH2) 3]NO3 ¦ H2O
Ag[C(CNK] (два сплетенных слоя)
As2O3, As2S3
Na[H3(Se03J], (Te2O3)SO4
P2O5
Li2(Si205), Rb(Be2F5), Pb2(Ga2S5)
YC13, Bils> A1(OHK
Thl4
ные Sc, Y, La и 4/-элементами (а также Са), состоят из слоев
состава В2С2, перемежающихся с атомами металла. Особый ин-
терес представляет соединение Sc, поскольку оно дает единст-
венный ныне известный пример слоя, состоящего из равного
числа пятиугольников и семиугольников. Большое число струк-
RHC
ССН2),
(СИ,).
а б
Рис. 3.27. Системы водородных связей в слоях: а — найлон; б — капролактам.
3.9. Структуры на основе сеток с 3-связанными узлами 137
тур, построенных на основе сетки 4,82, было представлено в
качестве первой из полуправильных сеток на рис. 3.9,6 (см.
выше). В LaB2C2 (Acta cryst., 1980, В36, 1540) атомы В и С
образуют мотив, который показан ниже на схеме а. Такая же
сетка составляет основу структур GaPS4 и Pb2Ga2S5. Первая
состоит из слоев, образованных тетраэдрическими группами
(чередуются GaS4 и PS4), которые соединены через одно реб-
ро и две вершины (см. рис. 4.19 в гл. 4). Во второй присутст-
вуют слои из тетраэдров GaS4, соединенных через три верши-
ны, и 8-координированные атомы РЬ между слоями (Acta
cryst. 1980, В36, 1990). Силикатные структуры на основе сеток
4,82 и более сложных сеток с 3-связанными узлами описаны в
гл. 23 и показаны на рис. 23.13. Слой в Sr^FsBr (разд. 26.7.3)
также построен на основе сетки 4,82, но с дополнительными
атомами Sn на отрезках, по которым сопряжены восьмиуголь-
ники, как это показано на схеме б.
—Sn
/\
\
Sn— F—Sn— F—Sn &r-
Г
Мы упоминали выше структуру фосфора Гитторфа как вто-
рой пример сплетенных слоев. В этой структуре каждый от-
дельный слой является составным и имеет сложное строение,
описанное в разд. 19.2.
3.9.4. Структуры, построенные на основе трехмерных 3-связан-
ных сеток. Пока известно очень мало примеров простых неор-
ганических соединений со структурами, основанными на трех-
мерных 3-связанных сетках. Естественно предполагать, что та-
кие примеры обнаружатся среди кристаллических соединений
бора — элемента, который образует три компланарные связи
во многих простых молекулах и ионах. Структура обычной мо-
дификации В2О3 действительно имеет в своей основе простую
3-связанную сетку. Однако во многих боратах бор имеет коор-
динационное число 4, и во многих соединениях сосуществуют
треугольная и тетраэдрическая координации. В сложных крис-
таллических модификациях элементного бора реализуются не
138 3. Полиэдры и сетки
простые ковалентные структуры, а электронодефицитные си-
стемы особого рода, которые кратко описаны в гл. 24.
Имеется две 3-связанные сетки A0,3) с четырьмя точками
в примитивной ячейке, но если эти сетки построены из равных
связей и с валентными углами в 120°, то их элементарные
а
Рис. 3.28. а — кубическая 3-связанная построенная из десятиугольников сетка
A0,3)-а; б — проекция двух взаимопроникающих сеток; в — конфигурация
сетки в Hg3S2Cl2.
ячейки содержат по восемь узлов сетки и имеют соответствен-
но кубическую и тетрагональную симметрию. Очевидно, что ку-
бическая 3-связанная сетка на рис. 3.28 является аналогом ал-
мазной сетки. Она соответствует расположению атомов Si в
SrSi2 (разд. 23.4). Хотя симметрия здесь ниже, чем для наи-
более симметричной конфигурации с точно компланарными
связями (пространственная группа Р 4332 вместо /4]3), сетка
сохраняет кубическую симметрию. Эта сетка присутствует так-
же в структуре кристаллического Н2О2. Если молекулы изобра-
зить так, как это показано ниже на схеме а, и атомы О распо-
3.9. Структуры на основе сеток с 3-связанными узлами 139
ложить в точках сетки, то две трети отрезков сетки будут соот-
ветствовать водородным связям
н.
-п.
между молекулами. Сетка реализуется не в виде наиболее
«открытой» конфигурации, показанной на рис. 3.28, а, где все
связи, исходящие из каждой точки, равны и компланарны, а в
наиболее компактной форме, соответствующей нормальным ван-
дерваальсовым контактам между атомами О, не связанными
водородной связью, и с расстояниями О—Н---0 и НО—ОН
(внутри молекулы), равными 2,70 и 1,47А соответственно. При-
мечательным свойством этой сетки является ее хиральность;
соответственно кристаллический Н2О2 оптически активен.
Примеры более сложных трехмерных 3-связанных сеток, об-
разованных дигидроксисоединениями, дают структуры а- и
6-резорцина (ж-диоксибензол) и НО—Si(CH3J—C6H4—
—Si(CH3J—ОН.
Проекция кубической сетки A0,3) на грань кубической
ячейки (сплошные кружки и линии на рис. 3.28, б) показыва-
ет, что сетка строится из спиралей с винтовыми осями четвер-
того порядка и одинаковым направлением вращения (против
часовой стрелки). Цифры обозначают высоты точек, выражен-
ные в единицах с/8, где с — длина ребра ячейки. В том же
объеме может быть расположена вторая сетка, и если она зер-
кально равна первой, то всегда расстояния между связанными
точками сетки короче, чем расстояния между точками разных
сеток. Во второй сетке на рис. 3.28, б (штриховые кружки и ли-
нии) спирали закручены по часовой стрелке. Такой тип струк-
туры, представляющей собой трехмерный рацемат, пока не-
известен, но ввиду ее сходства со структурой (З-гидрохинона,
описанной ниже, нет оснований отрицать возможность ее воз-
никновения в подходящем соединении. Еще более интересной
структурой обладает [(Hg2KO2H]Cl3 (разд. 26.3.3), где при-
сутствуют четыре взаимопроникающие сетки A0,3) данного
типа, причем атомы О расположены в точках сетки и связаны
через спаренные атомы Hg.
На рис. 3.21 мы показали родство слоев As и черного Р с
простой кубической структурой, из которой их можно вывести,
отбросив половину связей. Трехмерные 3-связанные сетки мож-
но получить аналогичным способом, удаляя различные совокуп-
ности связей. Рис. 3.28,8 показывает кубическую сетку A0,3) с
валентными углами 90°, изображенную именно таким способом,
сетка с такой конфигурацией близка к расположению атомов
140 3. Полиэдры и сетки
S в одной из форм Hg3S2Cl2. Атомы Hg лежат на связях сетки,
а ионы С1 располагаются в полостях каркаса Hg3S2.
Вторая сетка A0,3), показанная на рис. 3.29, а, дает распо-
ложение атомов Si в a-ThSi2 (крупные атомы Th размещены в
Рис. 3.29. а — тетрагональная 3-связанная построенная из десятиугольников
сетка A0,3)-Ь в a-ThSi2; б —конфигурация сетки в La2Be205; в — часть такой
же сетки из (Zn2Cl5) (Н5О2).
пустотах каркаса). Эта сетка присутствует также в структуре
третьей кристаллической модификации Р2О5, в которой тетра-
эдры РО4 расположены во всех точках сетки и соединены через
три общие вершины (атомы О). Можно ожидать, что эта по-
лиморфная модификация будет обладать наиболее высокой
температурой плавления из всех трех. Интересно, что одно со-
единение —Р2О5— имеет три кристаллические формы, которые
соответствуют трем из четырех главных типов кристалличе-
ской структуры, а именно: структуре с конечными (в данном
3.9. Структуры на основе сеток с 3-связанными узлами 141
случае полиэдрическими) группировками, слоистой структуре
и "трехмерной каркасной структуре. Аналогичная система тет-
раэдров составляет каркас структуры La2Be205, в которой круп-
ные ионы La3+ занимают позиции, окруженные неправильными
группировками из десяти атомов О; расстояние La—О B,42 А)
существенно отличается от среднего расстояния Be—О A,64А)
внутри тетраэдров. Как и в случае кубической сетки A0,3),
показанной на рис. 3.28, в, имеется кон-
фигурация сетки ThSi2 с валентными
углами, равными 90°. Такая конфигу-
рация (рис. 3.29,6) весьма близка к
расположению атомов Be в La2Be20s.
В качестве более сложного примера
этой сетки укажем Na4Sn3S8 (разд.
26.7.2).
Весьма сложным примером струк-
туры, в которой имеются две взаимо-
проникающие сетки ThSi2, является
нептунит (разд. 23.13.8).
Третья сетка со связанностью 3,
также состоящая из десятиугольников,
представляет собой основу структуры
обычной формы В2О3. В ячейке этой
сетки располагаются шесть точек, как
это показано на рис. 3.30. Она прос-
тым способом связана с сеткой ThSi2,
поскольку обе можно построить из зиг-
загообразных цепей, соединяя послед-
ние в трехмерную сетку. В тетрагональ-
ной сетке эти совокупности зигзагов связаны поворотами на 90°
относительно оси с, а в тригональной последовательные ряды
цепей повернуты на 120°.
Имеется бесконечно большое число более сложных сеток. Те
из них, в которых в каждой точке сходятся циклы одного типа,
можно обозначить символами, аналогичными тем, что исполь-
зовались для полиэдров (табл. 3.3 в разд. 3.3.3) и плоских се-
ток. Например, усеченный октаэдр обозначается 4, б2; полупра-
вильная сетка, состоящая из четырехугольников и восьмиуголь-
ников, обозначается 4,82, имеются также трехмерные сетки
4, 122 и 4, 142. Сетка 4, 122 представляет собой основу структу-
ры AuOCl (разд. 25.9); атомы Аи и О расположены в чередую-
щихся точках сетки. В FeSO3-2yH2O (разд. 15.2) атомы Fe и
S занимают чередующиеся точки сетки 4, 142. В этом несколько
неожиданном примере сетки со связанностью 3 каждый суль-
фит-ион связан с тремя различными атомами Fe и каждый
Рис. 3.30. Состоящая из
десятиугольников сетка
A0,3)-с, на основе кото-
рой построена структура
В2О3.
142 3. Полиэдры и сетки
атом Fe октаэдрически окружен тремя атомами О различных
сульфит-ионов (и тремя молекулами Н2О). На рис. 3.31 пока-
зана сетка 6,102. Эту сетку легко представить себе наглядно с
помощью куба (а в более общем случае — ромбоэдра), одна из
объемных диагоналей которого расположена вертикально; этот
куб показан штриховыми линиями. В центре куба имеется зна-
чительный незанятый объем. Действительно, вторая идентич-
Рис. 3.31. Трехмерная сетка молекул, связанных водородными связями, в Р-гид-
рохиноне.
ная сетка может быть вписана в первую со сдвигом на полови-
ну вертикальной объемной диагонали куба, так что цикл А
второй сетки занимает положение А'. Эта система двух взаимо-
проникающих сеток составляет основу структуры р-гидрохино-
на, в которой длинные наклонные линии на рис. 3.31 пред-
ставляют собой молекулы С6Н4(ОНJ, а кружки — концевые
группы ОН, которые посредством водородных связей объеди-
нены в шестичленные циклы. Эта структура не является истин-
ной полиморфной модификацией гидрохинона, как первона-
чально предполагалось, так как она образуется только в при-
сутствии инородных атомов (таких, как аргон) или молекул
(таких, как SO2 или СН3ОН). Они играют роль «заполните-
лей» пространства между циклами А и А', эта структура пока-
зана на рис. 1.9 (разд. 1.5.2) в качестве примера клатратного
соединения.
3.9. Структуры на основе сеток с 3-связанными узлами
143
Единичная (не сдвоенная) сетка такого же типа
(рис. 3.31) лежит в основе структуры N4(CH2N-6H2O. Шести-
угольники соответствуют циклам из шести молекул воды, а мо-
лекулы ^(СН2)б «подвешены» на трех молекулах воды, при-
надлежащих восьми шестичленным циклам, которые окружа-
ют каждую из больших полостей, т. е. они занимают положе-
ния, в р-гидрохиноне занятые циклами второй сетки. Эта струк-
тура показана на рис. 15.8 (разд. 15.2.2).
Коль скоро топология структур описывается в терминах
3-связанных (или иных) сеток, естественно возникает вопрос,
почему данная сетка оказалась предпочтительной среди беско-
нечно большого числа в принципе возможных. Клатратная
структура р-гидрохинона образуется только в присутствии не-
которого минимального количества инородных атомов или мо-
лекул, которые должны иметь размер, подходящий для того,
чтобы обеспечивать сосуществование двух каркасов. Выбор
данного конкретного трехмерного каркаса в N4(CH2N-6H2O,
очевидно, определяется размерами включенных молекул и об-
разуемыми водородными связями. Рост кристалла (что явля-
ется в данном случае синонимом образования гидрата) состо-
ит в построении подходящего каркаса, охватывающего вклю-
ченные молекулы воды и совместимого с требованиями гео-
метрии водородных связей молекул Н2О. Аналогично при
кристаллизации La2Be205 каркас Be2Os должен строиться во-
круг ионов La3H", и такая упаковка является фактором, опре-
деляющим выбор данной сетки, поскольку многие десятиуголь-
ники (и другие л-угольники 3-связанных сеток) должны быть
образованы из тетраэдров с тремя общими вершинами. Реа-
лизация очень простых сеток из десятиугольников в структурах
Н2Ог, Р2О5 и В2Оз также во многом обусловлена упаковкой, в
частности необходимостью компактного расположения в струк-
туре всех атомов О.
Хотя плотнейшая упаковка шаров будет рассмотрена лишь
в гл. 4, здесь стоит остановиться на сочетании требований то-
пологии и упаковки на нижеследующем примере структуры, в
основе которой лежит сетка ThSi2 (рис. 3.15, д). Из кислого
водного раствора ZnCl2 можно выкристаллизовать гидрат со-
става ZnCl2- 72HC1-H2O. Эти кристаллы содержат каркас из
тетраэдров ZnCl4, имеющий состав (Zn2Cl5)«"~ и топологиче-
ски идентичный каркасам P2Os или (Be2Os)nEn~ в La2Be205.
Каркас включает в себя пары молекул воды (Н5О2)+. Атомы С1
образуют искаженную гексагональную плотнейшую упаковку,
искажение которой обусловлено необходимостью включения
ионов Н5О2+. Рис. 3.29, в демонстрирует структуру в виде плот-
поупакованных слоев и показывает, что рост кристаллогидрата
состоит в построении подходящего каркаса Zn2Cl5 вокруг ионов
144 3. Полиэдры и сетки
Н5О2+; он показывает также, как сетка ThSi2 может быть при-
способлена для соединения A2Xs с одновременным образовани-
ем атомами X плотнейшей упаковки (вид структуры вдоль на-
правления стрелки, показанной на рис. 3.29,а).
Таблица 3.12. Структуры, построенные на основе трехмерных
3-связанных сеток
Сетка
Кубическая
A0, 3)-а
Тетрагональная
A0, 3)-Ь
Тригональная
A0, 3)-с
Более сложные
сетки
Номер
рисунка
3-28
3.29
3.30
3.31
Пример
SrSi2, H2O2, Hg3S2Cl2, CsBe2Fs, (Sn2F3)Cl,
t(Hg2KO2H]Cl3
a-ThSi2, SrSi2 (при высоком давлении)
P2O5) La2Be20s> (Zn2Cl5) (H5O2), RbH3(Se03J
B2O3
N4(CH2N-6H2O, р-гидрохинон, а- и р-резорцин,
AuOCl, FeSO3-2V2H2O,
HOSi (CH3) 2C6H4Si (CH3) 2OH
В табл. 3.12 дана сводка примеров, описанных выше для
структур, в основе которых лежат трехмерные сетки с 3-свя-
занными узлами.
ЗЛО. Кристаллические структуры,
основанные на 4-связанных сетках
3.10.1. Типы структурных единиц. Некоторые структурные еди-
ницы, способные образовывать 4-связанные сетки, показаны на
рис. 3.32; простейшая из них — атом, способный образовать
четыре связи. Не существует кристаллических элементов (про-
стых веществ), в которых атомы образуют по четыре компланар-
ные связи, однако, как мы отмечали, простейшая трехмерная
сетка, в которой каждая точка компланарна с четырьмя сосед-
ними (рис. 3.15, е), реализуется в структуре NbO. Более слож-
ные сетки, в которых часть точек имеет четверную плоскую ко-
ординацию, а остальные точки окружены четырьмя соседними
по тетраэдру, присутствуют в структурах PtS и PdP2. Простей-
шая трехмерная 4-связанная сетка, в которой все точки имеют
тетраэдрическую координацию 4, — это алмазная сетка, кото-
рую мы рассмотрим более подробно ниже. В число других
структурных единиц, которые можно встретить в системах с ко-
ординацией 4, входят: тетраэдрические группы АХ4, соединяю-
щиеся всеми своими вершинами (атомами X), что дает состав
3.10. Структуры, основанные на 4-связанных сетках
145
Рис. 3.32. Структурные единицы, образующие 4-связанные сетки.
Таблица 3.13. Структуры, построенные на основе 4-связанных сеток
Плоская 4-угольная сетка
Слои А:
SO2(OHJ, SeO2(OHJ, [В3О5(ОН)]Са, [B6O9(OHJ]Sr-3H2O
Слои АХ D:4):
PbO, LiOH, Pd(S2)
Слои АХ2 D : 2) :
Hgl2 (краен.), 7-ZnCl2) (ZnO2)Sr, 2n(S2COEtJ, Cu(CN)(N2H4)
Слои АХ2 с дополнительными лигандами, присоединенными к А:
AX2Y: [Ni(CNJ-NH3]C6H6
AX2Y2: SnF2(CH3J, UO2(OHJ
AX4: SnF4, (NiF4)K2, (A1F4)T1
Трехмерные сетки
Тетраэдриче-
ские
Алмаз (см. табл. 3.14)
Более сложные сетки:
ZnS (вюртцит)
Qe (при высоком давле-
нии)
р-ВеО
SiC (политипы)
Плоские
Плоские и тет-
раэдрические
Тетраэдриче-
ские
Производные D: 2)-струк-
туры
8Ю2(тридимит), лед-1
SiO2 (китит), лед-Ш
GeS2, P-ZnCl2
Другие формы SiO2 и Н2О
Алюмосиликаты
NbO
PtS, PdO, PdS, CuO, PdP2
Полиэдрические каркасы:
f Алюмосиликаты
1 Клатратные гидраты
10—752
146 3. Полиэдры, и сетки
АХ2; октаэдрические группы, соединяющиеся посредством четы-
рех вершин с образованием двумерных и трехмерных струк-
тур состава АХ4; молекулы типа Н2О и H2SO4 (или O2S(OHJ),
содержащие достаточное число атомов Н, чтобы образовать че-
тыре водородные связи с примыкающими молекулами.
В табл. 3.13 содержатся примеры структур, основанных на
двумерных и трехмерных сетках с 4-связанными узлами. Среди
слоистых структур встречаются только простейшие из таких
плоских сеток; в своих наиболее симметричных конфигураци-
ях они представляют собой одну из трех правильных плоских
сеток.
3.10.2. Структуры, основанные на плоской сетке четырехуголь-
ников. Простейшие типы слоев, в основе которых лежит эта
сетка, показаны на рис. 3.33.
Слои типа А. К. числу простых примеров относятся слоистые
структуры кристаллических H2SO4 и H2Se04 (разд. 8.5.3), в
которых каждая структурная единица связана водородными
связями с четырьмя другими; в противоположность этому то-
пологически идентичный ион Н2РО4~ в КН2РО4 порождает
трехмерную основанную на алмазной сетке структуру, к кото-
рой мы обратимся ниже. Два бората дают примеры более
сложных структурных единиц, образующих слои аналогичного
типа. В СаВ3О5(ОН) единицы, изображенные на рис. 3.34, а,
связаны через общие атомы О (заштрихованные кружки) с
образованием двумерных ионов; слои соединены через ионы
Са2+. В SrB6Og(OHJ-3H2O первичная структурная единица
представляет собой трициклический анион, показанный на
рис. 3.34,6; этот фрагмент аналогичным способом соединен
с четырьмя другими через четыре атома О.
Слои типа АХ. Слои, в которых все атомы А и X компла-
нарны, неизвестны. Кристаллический LiOH, построенный из
слоев АХ, показан на рис. 3.33. Маленькие кружки изображают
атомы Li в плоскости чертежа, а большие кружки — группы
ОН, лежащие в плоскостях, которые расположены выше и ни-
же атомов Li. Альтернативно этот слой описывается как со-
стоящий из тетраэдрических групп Li(OHL, соединенных с со-
седними через четыре общих ребра (для одного из тетраэдров
эти ребра показаны штриховыми линиями). Если заменить Li
на О, а ОН на РЬ, получается слой, образованный тетраэдри-
ческими группами ОРЬ4; атомы РЬ, располагающиеся на обеих
внешних поверхностях слоя, образуют по четыре пирамидаль-
ные связи с атомами О. Этот примечательный слой выступает
в роли структурной единицы в красной форме РЬО; такая же
структура реализуется в одной из полиморфных модификаций
SnO.
3.10. Структуры, основанные на 4-связанных сетках
147
О Li @)
ООН(РЬ)
AX2Y
AX2Y2
Рис. 3.33. Слои, структура которых основана на плоских сетках, состоящих из
четырехугольников: А —все структурные единицы одинаковы: АХ — чередуют-
ся единицы А и X; АХ2 — 4-связанные единицы А соединены через 2-связанные
единицы X, которые могут быть одноатомными или представлять собой более
сложные лиганды. В слое АХ2 атомы X не обязательно одного сорта (напри-
мер, Cu(CN) (N2H4)). Кроме того, к А могут быть присоединены 1-связанные
лиганды Y; они могут быть одинаковыми с X, как в K2NiF4, или другими, как
в (SnF2(CH3J).
б
НО
Рис. 3.34. Структурные единицы в слоях СаВ3О5(ОН) (а) и SrB6O9(OHJ-
•ЗН2О (б).
Часть слоистой структуры PdS2 показана на рис. 1.8 (см.
разд. 1.2); эту систему можно рассматривать как слой АХ,
построенный из 4-связанных единиц ^Рсг и \>—S .
Слои типа АХ2. Простейший слой АХ2, основанный на квад-
ратной сетке, содержит атомы А в точках сетки, соединенные
через 2-связанные атомы X, которые располагаются на связях
сетки. Слой, в котором все атомы А и X компланарны, неизве-
стен. Можно предположить, что слои такого типа образуются
в Ni(CNJ и Pd(CNJ, но точно структуры этих соединений не
установлены. Клатратное соединение Ni(CNJ-NH3-C6H6 по-
строено из слоев, в которых атомы Ni соединены через группы
CN с образованием квадратной сетки, а молекулы NH3 допол-
няют координацию половины атомов Ni (через один) до окта-
эдрической. Благодаря присутствию молекул NH3, выступаю-
щих из плоскости слоя, между слоями имеются полости, спо-
10*
148 3. Полиэдры и сетки
собные вмещать такие молекулы, как С6Н6. Эта структура
изображена на рис. 1.9, а (разд. 1.5.2).
Если ряды атомов X располагаются попеременно над и под
плоскостью атомов А, как это показано на рис. 3.33, слой со-
стоит из тетраэдрическпх групп АХ4, обобщающих все свои
вершины. Таким же способом на рис. 5.6 (разд. 5.2) изображе-
ны слои в красном Hgl2 (и изоструктурном y-ZnCb) и в
SrZnO2. Другие примеры слоев АХ2 реализуются в этилксанто-
генате цинка, медной и серебряной комплексных солях
М(нитрилJХ (X = NO3, CIO4), в которых роль мостиков игра-
ют лиганды а и б, а также в CuCN(N2H4) (в), где имеются
два типа лигапдов X. Нитрильные комплексы (б) дают приме-
;с-ог2н5
-NC-4CH2),,-CN-
6
I I
-Cu-N-N-Cu—
I ' I
С N
N
С
-Cu-N-N-Cu-
ры всех трех типов бесконечных систем АХ2:
п = 2 п = 3 п = 4
Си (нитрилJЫО3 цепь слой трехмерная сетка
Позднее мы рассмотрим адипонитрильный комплекс (п = 4).
Слои типа AXi. Плоские слои, состоящие из октаэдрических
группировок, соединенных через четыре экваториальные вер-
шины, встречаются в большом числе кристаллов. Если они об-
разованы из групп АХ6, получается состав АХ4; в таком виде
существуют бесконечные двумерные молекулы в кристалличе-
ских SnF4, PbF4 и NbF4 и двумерные анионы в кристаллах
T1A1F4 и K2NiF4. Такая структура реализуется в многочислен-
ных комплексных фторидах и оксидах; она изображена на
рис. 5.16 (разд. 5.3.3). Если необобществленные вершины окта-
эдра заняты лигандами Y, отличающимися от обобществлен-
ных атомов X, получается состав AX2Y2, как это имеет место
в бесконечных двумерных молекулах SnF2(CH3J и U(OHJO2.
В U(OHJO2 две короткие связи U—О, характерные для ура-
нил-иона, приблизительно перпендикулярны плоскому слою,
а атомы металла соединены через экваториальные группы ОН.
Интересная реализация октаэдрического слоя найдена в ос-
новной соли CuHg(OHJ(NO3J(H2OJ. Здесь в одном направ-
лении чередуются искаженные октаэдрические группы, окру-
жающие атомы Си и Hg и соединенные через общие ребра; со-
единение в слои осуществляется через общие вершины (атомы
О групп NO3~). Это один из редких примеров октаэдрического
ЗЛО. Структуры, основанные на 4-связанных сетках
149
слоя АХ3, показанного на рис. 5.26 (разд. 5.3.5). Слои объеди-
няются с помощью связей О—Н- • -О между необобществленны-
ми атомами О ионов NO3~ и молекулами Н2О.
/Н2О
Hg/
! О\\
ONO2
; 1'2O i
0N02 ONO,
3.10.3. Структуры, основанные на алмазной сетке. Алмазная
сетка (рис. 3.35, а) очень удобна для того, чтобы показать, как
совсем простой структурный мотив может послужить основой
строения ряда разнообразных все более и более сложных со-
О-
Рис. 3.35. Сетки с 3-связанными узлами: а — алмаз; б — цинковая обманка;
в — гексагональный алмаз; г ¦— вюртцит.
единений. Мы видели в разд. 3.5.1, что простейший трехмерный
каркас, в котором каждая точка соединена с четырьмя други-
ми, представляет собой систему гофрированных шестиугольни-
ков. Всякий атом или группу, которые способны образовать
четыре связи с такими же атомами или группами, можно со-
единить данным способом, если валентные углы таковы, что
150 3. Полиэдры и сетки
тетраэдрическое расположение ближайших соседей более пред-
почтительно, чем компланарное.
Простейшая структурная единица, которая может дать че-
тыре тетраэдрические связи, — это атом элемента IV группы
периодической таблицы, и соответственно такую сетку мы об-
наруживаем в структурах алмаза, устойчивых при атмосфер-
ном давлении форм кремния и германия и серого олова. Ал-
мазоподобная структура серого олова устойчива при темпера-
туре ниже 13,2°С; выше этой температуры происходит переход
в белое олово. На рис. 3.36 представлена структура серого оло-
ва, в которой выделена тетрагональная ячейка (ось а под уг-
Рис. 3.36. Структуры серого (а) и белого (б) олова.
лом 45° к соответствующей оси кубической ячейки). Сжатие
вдоль оси с приведет к структуре белого олова. В структуре
алмаза шесть валентных углов у каждого атома равны между
собой A09,5°). В белом олове два из этих углов, обозначен-
ные на рис. 3.36 как 6Ь увеличены до 149,5°, а другие четыре
угла 02 уменьшены до 94°. При этом ближайшее окружение ато-
ма меняется: вместо 4 соседей на расстоянии 2,80 А и 12 на
расстоянии 4,59А — 4 соседа на расстоянии 3,02 А, 2 на рас-
стоянии 3,18 А и 4 на расстоянии 3,77 А; таким образом, с уче-
том двух атомов на расстоянии 3,18 А в белом олове получа-
ется шесть соседей на приблизительно одинаковых расстояниях,
образующих искаженную октаэдрическую группировку. Это
структурное превращение примечательно не только тем, что на
26% увеличивается плотность (от 5,75 до 7,31 г/см3), но также
тем, что белое олово — это высокотемпературная форма. Обыч-
но же высокотемпературная полиморфная модификация имеет
меньшую плотность, чем модификация, стабильная при низкой
температуре. Это аномальное поведение обусловлено измене-
нием электронного состояния: серая форма состоит из атомов
Sn(IV)v а белая — из атомов Sn(II). (При растворении белого
ЗАО. Структуры, основанные на 4-связанных сетках
151
и серого олова в соляной кислоте из раствора кристаллизуются
соответственно SnCl2-2H2O и SnCl4-5H2O.) Более обычное по-
ведение обнаруживают Ge и InSb, которые имеют алмазную
кристаллическую структуру при атмосферном давлении, но мо-
гут быть превращены в модификации, имеющие структуру бе-
лого олова, при высоком давлении.
Электронный октет, необходимый для образования каждым
атомом четырех связей, вовсе не обязательно должен быть со-
ставлен из двух квартетов (как в алмазе, кремнии, SiC), но
может быть получен попарным сочетанием атомов из III и V,
II и VI, I и VII групп. Вследствие этого к числу бинарных со-
единений с алмазоподобной структурой относятся не только SiC
(карборунд), но также одна из форм BN и ВР, ZnS (сфале-
рит, цинковая обманка), BeS, CdS, HgS (последнее соедине-
ние имеет также другую форму — киноварь — с совсем иной
структурой, описанной в разд. 26.3.3), галогениды меди, Agl.
Процедура замещения атомов одного сорта равным числом ато-
мов двух сортов (Zn и S) (рис. 3.35,6) получает дальнейшее
развитие в минерале халькопирите CuFeS2. Благодаря правиль-
ному замещению период решетки в одном направлении удваи-
вается. Последующее замещение половины атомов Fe на Sn
дает Cu2FeSnS4.
Замена трех четвертей атомов металла в ZnS на Си и одной
четверти на Sb дает Cu3SbS4. Другие соединения имеют струк-
туры, связанные со структурой цинковой обманки не столь про-
стым способом. Например, в ZnsAsI3 заняты только три четвер-
ти позиций Zn, а позиции атомов S статистически занимают
3 I-f-As. Если в структуре ZnS заняты только две трети пози-
ций металла, получается формула X8/3Y4, или X2Y3, — такую
структуру имеет неупорядоченная высокотемпературная форма
Ga2S3. Альтернативное описание этой сесквисульфидной струк-
туры таково: атомы металла статистически занимают две тре-
ти тетраэдрических пустот в кубической плотнейшей упаковке
атомов S. Еще одна возможность заключается в том, что не-
которые позиции атомов S остаются вакантными. Если они
свободны на одну четверть, как в Cu3SbS3 и Cu3AsS3, то каж-
дый атом Sb или As имеет трех соседей (пирамидальная кон-
фигурация) вместо четырех тетраэдрически расположенных
атомов S. Эти структуры описаны более подробно в гл. 17,
где для многих из них приведены изображения (см. ссылки на
рисунки в табл. 3.14).
Структуры CuFeS2 и Cu3SbS4 получаются из структуры цин-
ковой обманки простым замещением половины или одной чет-
верти атомов металла на атомы другого сорта. Та же основ-
ная структура реализуется в соединениях с равным числом
атомов трех сортов, например в CuAsS. Ячейка алмаза (или
152 3. Полиэдры и сетки
Таблица 3.14. Структуры, построенные на основе сетки алмаза
Сверхструктуры
Случайное
(статистическое)
расположение атомов
Дефектные
структуры
в ^етые
Cu2FeSnS4
Cu3AsS4
(рис.17.4,разд.17.2.3)
Си Zn Se2
In Sb2
CuFeS2 __
(рис. 17.12 разд. 17.2.зТ~~~цинковая
обманка
АЛМАЗ
'C,Si,Ge,Sn (серое)
(In2Cd)Se4
(рис.17. И, разд.17.2.3)
неупорядоченные
<x-fAg2Hg]I4
Zn3[AsI3l
неупорядоченная
y-Ga2S3
упорядоченная
(Cu3As)S3
Sn (белое), InSb (при высоком давлении) •
Ge (при очень высоком давлении) CsB30s
jS-[Cu2Hg]I4
- Кристобалит
SiOo
|А1РО4
IBPO4
fNa[AlSiO4
lNa2[BeSiz06]
Лед-1С, SiS2 (при высоком давлении),
BeF2,Be@HJ,a-ZnCI2, Zn@HJ,
K(H2P041,(NHg2)N03, CoHg(NCSL
Куприт
B взаимопроникающие сетка)
Ag2O, Cu2O, лед-Ш
Zn(CNJ,Cd(CNJ
С 6 Взаимопроникающих сеток)
Cu[NC(CH2LCN]2NO3
Октаэдрические каркасы
АХ2 атакамит, анатаз
АХ3 пирохлор
АХ4 IrF4
Более сложные полиэдрические каркасы
UO2Cl2,UCl4, фожазит
Li2(B407)
Cs(B50g)
Ag,,(B8013)
ZnS) содержит восемь атомов, однако теперь требуется вы-
брать ячейку так, чтобы в ней было Зл атомов. Отношение
ячейки CuAsS к ячейке алмаза показано на рис. 3.37; из ри-
сунка видно, что размеры ячейки CuAsS таковы: a' = 3a/y2
и Ь = а/"[/2, а третий параметр (перпендикулярный плоскости
проекции) тот же, что и в структуре алмаза. Таким образом,
ячейка CuAsS содержит 12 атомов, по четыре атома Си, As и S.
3.10. Структуры, основанные на 4-свлзанных сетках
153
Структуры АХ2. Еще один способ, с помощью которого
можно осуществить такое же основное расположение, состоит
в том, чтобы разместить атомы другого сорта на связях ал-
мазной сетки. Возникающая структура АХ2 альтернативно мо-
жет быть описана как построенная из тетраэдрических груп-
пировок АХ4, обобществляющих все свои вершины (атомы X)
с другими такими же группировками. Для простоты на
а'=За//2
Рис. 3.37. Проекция структуры CuAsS, показывающая ее родство со структу-
рой алмаза (наверху).
рис. 3.38, а атомы X показаны лежащими на серединах связей.
Эта очень симметричная (кубическая) структура с углом Si—
¦—О—Si, равным 180°, первоначально была приписана высоко-
температурной форме минерала кристобалита, представляюще-
го собой одну из модификаций кремнезема (разд. 23.11). Те-
перь известно, что кристобалит имеет более сложное строение
и угол Si—О—Si равен 147°. В действительности соединения
АХ2 со структурой, показанной на рис. 3.38, а, отсутствуют, од-
нако каркас NHg2+ в Hg2NOH-2H2O имеет структуру «анти-
кристобалита» с коллинеарными связями атома Hg. Тем не
менее полезно иметь в виду структуру данного топологического
типа (рис. 3.38,а), т. е. совокупность соединенных через вер-
шины тетраэдров АХ4, расположенных по закону алмазной сет-
ки, как это имеет место в структуре кристобалита. Менее сим-
154 3. Полиэдры и сетки
метричные варианты с меньшим значением угла А—X—А по-
лучаются при поворотах тетраэдров относительно различных
осей, что приводит к более плотным упаковкам анионов, как в
высокотемпературных полиморфных модификациях SiS2, GeS2
и a-ZnCl2 (кубическая плотнейшая упаковка атомов С1). Эти
формы тетраэдрических структур АХ2 с обобществленными вер-
шинами [Acta cryst., 1976, В32, 2923] можно сравнить со струк-
турами АХ3, где через общие вершины соединяются октаэдри-
о1
Рис. 3.38. а — идеализированная структура кристобалита; б — две взаимопро-
никающие решетки типа а, образующие структуру СшО.
ческие группировки; эти последние структуры видоизменяются1
от ReO3 (угол —О— 180°) до гексагональной структуры RhF3.
с плотнейшей упаковкой (угол —F— 132°) (см. разд. 5.3.3 и
6.6).
Мы уже указывали, что по типу цинковой обманки кристал-
лизуется ВР. Замещая атомы Si в структуре кристобалита че-
рез один атомами В и Р, получаем структуру ВРО4; более то-
го, ВРО4 при кристаллизации дает все те структуры, которыми
обладают модификации SiO2, существующие при различных
давлениях.
Благодаря относительно рыхлой (ажурной) структуре крис-
тобалита и тридимита (см. ниже), существующих в качестве
минералов, эти вещества часто, если не всегда, содержат в зна-
чительной концентрации примесные ионы преимущественно-
щелочных и щелочноземельных металлов. Пустоты в структу-
рах высокотемпературных форм достаточно велики для того,
чтобы принять в себя эти ионы без большого искажения струк-
туры, но их включение возможно только тогда, когда часть
кремния замещена на другие тетраэдрически координирован-
ные атомы, такие, как А1 или Be. В этом случае каркас приоб-
ретает отрицательный заряд, который компенсируется зарядом
включенных ионов. Последнее мы обнаруживаем в таких ми-
3.10. Структуры, основанные на 4-связанных сетках
155
нералах, как карнегиит NaAlSiO4 с кристобалитоподобной
структурой и кальсилит KAlSiO4 со структурой, родственной
структуре тридимита. В Na2BeSi206 одна треть Si в структуре
кристобалита замещена на Be, тогда как в NaAlSiO4 на А1 'за-
мещена половина атомов Si.
В структурах кремнезема тетраэдрические группы SiO4 со-
единены через общие атомы кислорода. Мы отмечали выше
(рис. 3.32), что такими же топологическими возможностями об-
ладают молекулы Н2О, а также молекулы или ионы типа
О2М(ОНJ. Имеется несколько форм кристаллической воды
(т. е. льда). В добавление к формам, устойчивым только при
высоком давлении, которые описаны в разд. 1.5.1, существуют
две формы льда, стабильные при атмосферном давлении.
Обычный лед (лед-In) имеет структуру тридимита, но при тем-
пературе, близкой к —130°С, вода кристаллизуется со струк-
турой кристобалита. Тридимитовая структура подобна сетке,
изображенной на рис. 3.35, в, которая представляет собой
структуру гексагонального алмаза; здесь то же соотношение,
что и между кристобалитом и кубической алмазной сеткой, по-
казанной на рис. 3.35, а. Две структуры АХ, родственные сет-
кам на рис. 3.35, а и в, но с чередующимися атомами А и X —
это структуры цинковой обманки и вюртцита, которые изобра-
жены на рис. 3.35, б я г. Таким образом, и Н2О, и SiO2 крис-
таллизуются как в виде кубических, так и в виде гексагональ-
ных структур АХ2:
Сетка
Кубический алмаз
Гексагональный алмаз
Рве. 3.35
а
в
ZnS
Цинковая
обманка
Вюртцит
SiO2
Кристаболит
Тридимит
Н2О
Лед-1с
Лед-1ь
Далее мы отметим и другие аналогии между гидратными струк-
турами и силикатами.
Выше было показано, что кристаллическая H2SO4 имеет
слоистую структуру, причем расположение молекул, соединен-
ных водородными связями, имеет в своей основе простейшую
плоскую сетку со связанностью 4. В противоположность этой
слоистой структуре анионы О2Р(ОНJ~ в КН2РО4 представля-
ют собой тетраэдрические группы, связанные водородными свя-
зями и расположенные по точкам алмазной сетки с образовани-
ем трехмерного каркаса. Упрощенная проекция этой анионной
структуры представлена на рис. 3.39, где пунктирные линии
показывают направления осей в кубической алмазной структу-
ре. Ионы К+, которые размещаются в полостях каркаса, на
рис. 3.39, а опущены. Структура CoHg(SCNL дает другой
пример структуры, основанной на алмазной сетке (рис. 3.39,6).
156 3. Полиэдры и сетки
Здесь наблюдается тетраэдрическая координация всех атомов
металла, причем Со имеет в качестве ближайших соседей
4 атома N, a Hg — 4 атома S.
Алмазоподобные каркасы, построенные из октаэдров и дру-
гих полиэдров. В структуре кристобалита тетраэдрические-
группы АХ4, расположенные в узлах алмазной сетки, связаны
через вершины с четырьмя другими каждая. Алмазоподобные.
структуры могут быть образованы и из октаэдрических групп,
причем разными способами. Октаэдрические группы АХ6, обоб-
а
SCN
Рис. 3.39. Проекции алмазоподобных структур: о — анионы РО2(ОН)г~ в
КН2РО4; б —CoHg(SCNL.
ществляющие по четыре вершины, образуют искаженный кар-
кас такого типа в IrF4; необобществленными остаются по две
вершины в каждой группе в цмс-положении. Аналогичные
группы, обобществляющие все вершины и расположенные во-
круг октаэдрических полостей в точках алмазной сетки, состав-,
ляют каркас АХ3 структуры пирохлора (рис. 7.4,6), а группи-
ровки из четырех соединенных по ребрам октаэдров, охватыва-
ющие тетраэдрические полости с центрами в точках алмазной
сетки, дают структуру АХ2 (атакамит) (рис. 7.4,а). Строение
анатаза можно описать как структуру АХ2, образованную из
октаэдрических групп АХ6, обобществляющих по четыре ребра
(разд. 5.3.5). Структуры из октаэдрических координационных
группировок рассмотрены более детально в гл. 5.
Пентагонально-бипирамидальные группы UO3CI4, обоб-
ществляющие по два ребра D атома С1) и по две вершины
(атомы О), образуют алмазоподобную структуру UO2C12 (разд.
28.2.4), а додекаэдрические группы UC18 обобществляют по че-
тыре ребра в UCU. Более сложный пример дает структура цео-
лита фожазита, в которой присутствуют усеченные октаэдры,
3.10. Структуры, основанные на 4-саязанных сетках
157
соединенные через гексагональные призмы по четырем из вось-
ми граней; эта структура изображена на рис. 23.26 (разд.
27.9.7).
Структуры, основанные на системах взаимопроникающих
сеток. В структурах, которые мы описали, можно прочертить
путь от любого атома в кристалле к любому другому, напри-
мер, по связям С—С в алмазе, по связям Si—О—Si в кристо-
балите и т. д. В куприте Си2О каждый атом Си образует две
коллинеарные связи, а каждый атом О — четыре тетраэдриче-
ские связи, и эти атомы соединены точно так же, как атомы О
и Si в кристобалите. Однако расстояние О—Си—О C,7 А) су-
щественно больше, чем Si—О—Si C,1 А). В результате каркас
СигО имеет низкую плотность, или, иными словами, в нем
столько незанятого пространства, что в объеме, занятом первым
каркасом, остается место для второго такого же каркаса. Кри-
сталл состоит из двух одинаковых взаимопроникающих карка-
сов, которые не связаны между собой первичными связями
(Си—О) (рис. 3.38,6). Поскольку лед-1с имеет структуру кри-
стобалита, неудивительно, что одна из форм льда, существую-
щая при высоком давлении, имеет структуру куприта (разд.
15.1.1).
Если вместо единичных атомов X взять более длинные свя-
зующие фрагменты, точки алмазной сетки со связанностью 4
оказываются еще более удаленными, как это получается при
наличии групп или молекул, способных присоединяться к ато-
мам металла обоими концами. В роли лиганда такого типа во
многих цианидах металлов с малой электроположительностью
выступает группа CN. Четыре атома М—С—N—М коллинеар-
ны. Простейшую возможность представляет собой цепь в AgCN
и AuCN:
—Аи—CN—Аи—CN—Аи—CN—
Плоская квадратная сетка, возникающая при образовании ме-
таллом четырех компланарных связей, для цианидов M(CNJ
неизвестна, однако она является основой структуры уже упоми-
навшегося клатратного соединения Ni(CNJ-NH3-C6H6. В бер-
линской лазури и родственных соединениях группы CN связы-
вают атомы Fe или атомы других переходных металлов, рас-
положенные в точках простой кубической решетки (рис. 22.5).
Более прямое отношение к рассматриваемому вопросу имеет
кристаллическая структура Zn(CNJ и изоструктурного соеди-
нения Cd(CNJ. Оба вещества кристаллизуются по типу куп-
рита, причем атомы металла образуют тетраэдрические связи
(как О в Си2О), а —Си— заменяются на группы —С—N—.
Более длинный лиганд сходного типа, также способный свя-
зывать два атома металла, — это органический дицианид NC—-
158 3. Полиэдры и сетки
л—CN; здесь одна или большее число групп СН2
вставлено между двумя группами CN, которые присоединены к
атомам металла посредством своих концевых атомов азота.
В солях типа [Cu(NC—R—CNJ]NO3 эти дицианиды функцио-
нируют как нейтральные координированные молекулы. В глу-
таронитрильном комплексе [Cu{NC(CH2KCN}2]NO3 атомы ме-
талла расположены по точкам плоской квадратной сетки,
однако следующий член ряда — адипонитрильный комплекс
[Cu{NC(CH2LCN}2]NO3 — имеет иную, весьма примечательную
структуру. Если атомы металла расположены по точкам ал-
мазной сетки и соединены посредством молекул адипонитрила,
расстояние между атомами металла составляет приблизитель-
X
к
сн2
с
X
но 8,8 А, а плотность каркаса настолько низка, что в его объ-
еме остается свободное место для не менее чем шести идентич-
ных взаимопроникающих каркасов состава Си(адипонитрилJ.
Эти каркасы, разумеется, положительно заряжены, и ионы
ЫОз~ занимают пустоты структуры. Представляет интерес рас-
смотреть, как возникает эта уникальная структура.
Рис. 3.40, а изображает простую алмазную сетку, в которой
снова выделена тетрагональная ячейка (как в случае серого
олова на рис. 3.36). Точки В и D имеют координаты 0, '/2. 'А
и 7г, 0, 3Д, а точка С центрирует объем ячейки. Ясно, что есть
возможность перемещаться по линиям сетки от точки А после-
довательно к точкам В, С, D, Е и в конечном итоге к любой
другой точке трехмерной сетки. (Точка F — исходная точка
второй сетки, если имеются два взаимопроникающих каркаса,
как в Си2О.) Если, однако, вместо того, чтобы соединять точ-
ки указанным способом, взять точно такую же совокупность
точек и соединить их так, как показано на рис. 3.40,6 (верти-
кальная составляющая каждой связи равна трем четвертям вы-
соты ячейки вместо одной четверти), получается система линий
и точек с примечательным свойством. Точка А теперь не соеди-
нена с ближайшей расположенной над ней точкой, соответству-
ющей точке Е на рис. 3.40, а, и если на рис. 3.40,6 двигаться
по пути А—>~В—>С и т. д., мы не попадем в точку, лежащую
на той же вертикали, что и Л, и принадлежащую той же сетке,
что и А, пока не переместимся на высоту трех ячеек. Иными
словами, точки и отрезки на рис. 3.40,6 образуют не один, а
3.10. Структуры, основанные на 4-связанных сетках
159
три идентичных взаимопроникающих каркаса. Если добавить
точки, соответствующие пунктирным кружкам (например, точ-
ку, соответствующую F на рис. 3.40, а), и соединить их анало-
гичным способом, получится система из шести идентичных
взаимопроникающих сеток. Примечательно также, что эта
сложная геометрическая система так легко образуется. Доста-
точно только растворить нитрат серебра в подогретом адипо-
нитриле, добавить порошок металлической меди (если нежела-
тельно использовать металлическое серебро), охладить раствор,,
как кристаллизуется соль [Cu{NC(CH2LCN}2]NO3.
Рис. 3.40. а — алмазная сетка; б — система из трех взаимопроникающих алма-
зоподобных сеток.
Дополнительные примеры структур, основанных на двух
взаимопроникающих алмазных сетках, дают анионы в боратах
Li2B4O7, CsB5O8 и Ag2B8Oi3 (табл. 3.14), которые описаны в
гл. 24.
В только что описанных структурах взаимопроникающие
сетки идентичны. Можно также указать структуры, состоящие
из двух (или большего числа) взаимопроникающих сеток, имею-
щих разное строение. В структуре пирохлора (разд. 6.4.3), реа-
лизующейся в некоторых комплексных оксидах А2В2О7, можно
выделить трехмерный каркас октаэдрических групп ВО6, каж-
дая из которых обобществляет свои вершины с шестью сосед-
ними группами, что дает состав ВО3 (или В2О6). Этот каркас
(рис. 7.4) оказывается устойчивым без участия седьмого ато-
ма О (как в KSbO3) и может быть построен из октаэдров, рас-
положенных тетраэдрически вокруг точек алмазной сетки, или
же из октаэдров, помещенных на всех связях этой сетки. (Дру-
гой способ тетраэдрического размещения групп из четырех ок-
таэдров вокруг точек алмазной сетки состоит в построении
группировок с обобществленными ребрами, и это дает струк-
туру атакамита, также показанную на рис. 7.4). Структуру
160 3. Полиэдры и сетки
3.10. Структуры, основанные на 4-связанных сетках
161
Hg2Nb207 можно описать как такого типа каркас Nb2O6, спле-
тенный с купритоподобным каркасом состава Hg2O, имею-
щим то же строение, что и одна из двух взаимопроникающих
сеток в Си2О. Атомы Hg(II) имеют в качестве ближайших со-
седей два атома О из каркаса Hg2O и на гораздо большем рас-
стоянии шесть атомов О из каркаса Nb2O6.
3.10.4. Структуры, основанные на более сложных 4-связан-
ных сетках. В табл. 3.13 представлены три класса более слож-
ных трехмерных сеток со связанностью 4, а именно: 1) сетки,
в которых связи, исходящие из каждой точки, расположены
тетраэдрически; такие сетки подходят для элементов и соеди-
нений, аналогичных тем, в которых реализуется алмазная сет-
ка; 2) сетки, в которых связи, исходящие из части точек, рас-
положены тетраэдрически, а для другой части точек—-компла-
нарно; эти сетки подходят только для соединений АтВ„;
3) сетки, в которых имеются полиэдрические полости. Посколь-
ку чаще всего сетки третьего класса являются тетраэдрически-
ми, они составляют подкласс первого класса, но из-за некото-
рых специальных характеристик их удобнее описать отдельно.
Единственный пример сетки, в которой все атомы образуют по
•четыре компланарные связи (NbO), изображен на рис. 3.15, е.
A) Более сложные тетраэдрические сетки. Все прочие трех-
мерные сетки со связанностью 4 более сложны, чем алмазная
сетка, которая оказывается единственной содержащей мини-
мальное число точек B) в топологической элементарной ячей-
ке. Мы уже рассматривали родственную сетку гексагонально-
го алмаза. Как и обычный алмаз, она представляет собой со-
членение шестиугольников, но в своей наиболее симметричной
конфигурации она состоит из циклов, имеющих как форму
кресла, так и форму ванны в отличие от алмаза, где все циклы
¦относятся к первому типу. Позиции чередующихся точек в этих
двух сетках (т. е. позиции атомов S или Zn в цинковой обман-
ке и в вюртците) соотносятся между собой как кубическая и
гексагональная плотнейшие упаковки (гл. 4), и соответственно
имеется бесконечно большое число тесно связанных структур,
отвечающих более сложной последовательности плотноупако-
ванных слоев. Многие из этих структур обнаружены в кри-
сталлах SiC (см. политипы карборунда, разд. 23.3). Структура
высокотемпературного оксида ВеО (разд. 12.2.4) родственна
вюртцитоподобнои структуре низкотемпературной формы.
Помещая атомы X на каждую связь, из таких более слож-
лых тетраэдрических сеток можно вывести множество струк-
тур АХ2. К ним относятся структуры кварца и других модифи-
каций SiO2, неожиданно сложная структура GeS2, многие алю-
мосиликаты (некоторые из них будут рассмотрены ниже как
представители класса C)) и существующие при высоком дав-
лении формы Si, Ge и льда.
Среди образующихся под высоким давлением форм эле-
ментного Si имеется модификация с объемноцентрированной
кубической структурой, которая весьма интересным способом
соотносится со структурой алмаза. В алмазной сетке, показан-
ной на рис. 3.41, а в проекции вдоль направления связи С—С,
Рис. 3.41. а — проекция структуры алмаза вдоль связи С—С; б, в — структура
модификации Si, существующей при высоком давлении; г — структура Ge, су-
ществующая при высоком давлении.
слои из шестиугольников (выделенные сплошными и штрихо-
выми линиями) гофрированы. Чередующиеся атомы слоя со-
единены с атомами слоев, располагающихся выше и ниже, по-
средством связей, перпендикулярных плоскости чертежа (как
это показано парой кружков). Предположим теперь, что эти
связи разорваны, чередующиеся слои смещены относительно
соседних слоев (как это изображено на рис. 3.41,6) и возник-
ли новые связи, показанные стрелками. Такая стрелка указы-
вает на связь, соединяющую атом с соответствующим атомом
слоя, находящегося сверху. Теперь четвертая связь каждого
атома уже не перпендикулярна плоскости чертежа, и структура
(модификация элементного кремния) получается более плот-
ной, чем алмазоподобная структура, представленная на
рис. 3.41, а. Цифры на рис. 3.41, в обозначают высоты атомов
в единицах с/10, где с — период, перпендикулярный плоскости
проекции. Атомы 1, 4, 6 и 9 расположены по спирали, связь
9...1 приводит спираль к точке с высотой с относительно исход-
ной точки 1.
На рис. 3.41, г показана проекция структуры модификации
Ge, существующей при высоком давлении (здесь цифры указы-
вают высоту атомов над плоскостью чертежа в единицах с/4).
Примечательно, что циклы 0—1—2—3, проецирующиеся как
четырехугольники, в действительности соответствуют спиралям
11—752
162 3. Полиэдры и сетки
с четверными осями и что наименьшие циклы в этой трехмер-
ной сетке — это пяти- и семиугольники (в отличие от шести-
угольных циклов на рис. 3.41, б). Сетка, изображенная на
рис. 3.41, г, служит также основой структур китита (модифика-
ция кремнезема) и льда-Ш.
Структуры форм льда, существующих при высоком давле-
нии, описаны в гл. 15, но и здесь стоит указать, как возникают
некоторые наиболее плотные из этих структур. Известны сле-
дующие модификации Н2О с трехмерными каркасами:
Плотность, г/см3 0,92
II
1,17
III
1,16
V
1,23
VI
1,31
VII
1,50
В противоположность льду-Ш, структура которого имеет в ос-
нове ту же сетку, что и китит, лед-П и лед-V имеют структуры,
не обнаруженные среди полиморфных модификаций кремнезе-
ма, хотя структура льда-П имеет особенности, сходные со
структурой тридимита. Все эти три формы достигают своей по-
вышенной плотности в результате искажения тетраэдрического
расположения ближайших соседей и (или) путем образования
более компактной системы циклов; лед-V содержит четырех-
членные, а лед-Ш — пятичлегшые циклы. В результате вторые
по удаленности соседи расположены гораздо "ближе, чем в
структуре льда-1 D,5 А). Например, в структуре льда-V эти со-
седи находятся на расстоянии 3,28 и 3,64 А. Еще более плот-
ные формы VI и VII имеют структуры, состоящие из двух взаи-
мопроникающих каркасов со связанностью 4, внутри каждого
из которых молекулы соединены водородными связями; меж-
ду молекулами, относящимися к разным каркасам, такие свя-
зи отсутствуют. Расположение молекул в каждой сетке льда-VI
аналогично расположению тетраэдров SiO4 в волокнистом цео-
лите эдингтоните (разд. 23.12.8), в то время как лед-VII состо-
ит из двух решеток кристобалитового типа, которые сплетают-
ся с образованием псевдообъемноцентрированной кубической
структуры (рис. 15.2, разд. 15.1). Каждый атом О расположен
на равных расстояниях от восьми других, но он образует водо-
родные связи только с четырьмя из них, и каждая из двух
взаимопроникающих сеток оказывается подобной единственной
сетке, присутствующей в кубической структуре льда-1.
B) Сетки с плоской и тетраэдрической координацией. Два
простых соединения дают примеры сеток такого типа. В PtS
(рис. 3.42) количество атомов с компланарным и тетраэдриче-
ским расположением связей одинаково; менее симметричные
варианты этой структуры наблюдаются в PdS и СиО. Как ал-
мазную сетку можно расчленить на гофрированные, состоящие
3.10. Структуры, основанные на 4-связанных сетках
163
из шестиугольников 3-связанные слои, так и структуру PdP2
можно наглядно представить как совокупность гофрированных,
состоящих из пятиугольников слоев со связанностью 3 и 4
(рис. 3.43). 4-связанные точки соответствуют атомам металла,
образующим по четыре компланарные связи, а 3-связанные
точки — атомам фосфора. Атомы Р разных слоев соединяются
с образованием трехмерной структуры, причем межслоевые
связи направлены поочередно в одну или другую сторону от
слоя, как показано короткими вертикаль-
ными линиями в нижней части рис. 3.43.
В этой структуре каждый атом Pd связан
с 4 атомами Р, а каждый атом Р — с дву-
мя атомами Pd и двумя атомами Р, что
приводит к выделению в трехмерной
структуре бесконечных цепей связанных
атомов Р.
C) Сетки с полиэдрическими полос-
тями и каналами. Классификация точек
по связанности (р) удобна как основа
для вывода сеток и для выявления глав-
ных особенностей топологии структур.
Имеются, однако, другие общие черты
сеток, которые важны в связи с завися-
S — четыре тетраэдриче-
ски связи.
Рис. 3.42. Сетка со свя-
занностью 4 в структуре
щими от них физическими и химически- тыр^ К0МПЛ/наруные1 а
ми свойствами. Во всяком повторяющем-
ся орнаменте в каждой элементарной
ячейке обязательно имеется определенное
число одинаковых точек, и это обеспечивает однообразное рас-
пределение точек в пространстве. Однако распределение точек
внутри ячейки может быть таким, что наблюдается их скопле-
ние (и соответственно скопление связей) вокруг некоторых
центров, линий или в окрестности плоскостей. Если имеются
значительные скопления атомов вблизи определенных линий или
плоскостей при сравнительно небольшом числе связей между
такими скоплениями, можно ожидать, что кристалл будет ими-
тировать свойства цепочечной или слоистой структуры. В во-
локнистых цеолитах цепи тетраэдров (Si, A1)O4 соединены от-
носительно малым числом связей, вследствие чего, хотя имеется
трехмерный алюмосиликатный каркас, кристаллы обнаруживают
заметную спайность параллельно волокнам.
В гл. 1 мы предложили очень простую классификацию крис-
таллических структур, основанную на выделении четырех глав-
ных типов комплексов: конечные комплексы (острова, О), це-
пи (Ц), слои (С), трехмерные бесконечные комплексы (карка-
сы, К), смешанные системы, которые реализуются в кристал-
лах, содержащих комплексы более чем одного типа (например,
164 3. Полиэдры и сетки
цепочечные ионы и конечные ионы)*. Если расположить четы-
ре основных типа структур в вершинах тетраэдра, обнаружат-
ся шесть семейств A—6) промежуточных структур, соответст-
вующих шести ребрам тетраэдра. Эти структуры можно рас-
сматривать в качестве промежуточных между четырьмя основ-
ными типами одним из следующих двух способов.
Рис. 3.43. Структура PdP2.
а) Более слабые (более длинные) связи объединяют груп-
пировки меньшей размерности в группировки более высокой
размерности. Например, конечные молекулы (ионы) могут
быть объединены водородными связями в цепи (класс 1), слои
(класс 2) или в трехмерные комплексы (класс 4), цепи могут
быть объединены в слои (класс 3). Такова очевидная химиче-
ская интерпретация промежуточных групп; ее можно изобра-
зить следующей диаграммой:
* С целью приближения к терминологии, используемой в советской кри-
сталлохимической литературе, здесь введены отсутствующие в оригинальном
тексте термины «острова» и «каркасы» и соответственно обозначения О и К. —
Прим. перев.
3.10. Структуры, основанные на 4-связанных сетках
165
б) Чисто топологическая интерпретация должна основы-
ваться не на различиях в типе связи (т. е. в ее длине), а про-
сто на относительном числе связей внутри первичных структур-
ных единиц и между ними. Так, в промежуточном классе 1 от-
носительно мало число связей, объединяющих конечные груп-
пировки в цепи, что наблюдается в гипотетической цепи со
связанностью 4 на рис. 3.44, а. Эта структура цепочечная, но с
О)
Рис. 3.44. Структуры с неравномерным расположением атомов в пространстве
(см. текст).
очень неравномерным распределением точек вдоль цепи, как
это имеет место в цепях ReCl4 или [В3О4(ОН)з]ге2я-, рассмот-
ренных выше. Примером класса 2 является двумерный анион в
Sr[B6O9(OHJ], а класса 3 — слой в фосфоре Гитторфа, где
большинство связей Р—Р объединяют атомы в цепи, которые
в свою очередь соединены очень небольшим числом связей в
двойные слои, изображенные на рис. 19.2 (разд. 19.2).
И класс 2, и класс 3 объединяют в себе слоистые структуры, но
с очевидной концентрацией атомов в конечные группы или в це-
пи соответственно. Аналогично классы 4, 5 и 6 представляют
собой специальные типы трехмерных комплексов (каркасов).
Рассматриваемые здесь промежуточные классы соответствуют
структурам, отличным от тех, которые рассматривались в п. а.
На рис. 3.44 показаны примеры: D)—октаэдрическая груп-
па В6, которая связана с шестью другими такими же группа-
ми, расположенными в точках простой кубической решетки с
образованием каркаса из атомов бора, присутствующего в
166 3. Полиэдры и сетки
СаВв; E)—часть бесконечной цепи в волокнистом цеолите
(показаны только атомы Si), каждая цепь соединена с 4 дру-
гими; F) — часть слоя Si2N2O. Это интересное соединение об-
разуется при нагревании смеси Si и SiO2 до 1450 °С в потоке
аргона, содержащего азот, и является промежуточным между
SiO2 и SisN4 не только в отношении состава, но также и струк-
турно:
SiO,
Si2N2O
Координационные числа 4:2 4:3:2
Si3N4
4:3
Все связи атомов N и три четверти связей атомов Si лежат в
пределах слоев, которые соединяются только через атомы О
с координацией 2.
Вместо того чтобы концентрировать внимание на областях
с повышенной плотностью точек (атомов), можно рассмотреть
пустоты между ними. Последние образуют ряд от изолирован-
ных полостей до сложной трехмерной системы каналов. Кри-
сталлы, обладающие этими особенностями, представляют ин-
терес, поскольку способны к образованию клатратных соедине-
ний или к ионному обмену или же обладают свойствами
а
б
у
У
у
У
У
У
Рис. 3.45. Типы туннельных систем в кристаллах. Сплошные линии показывают
оси туннелей, а — система параллельных каналов; б — трехмерная система
непересекающихся каналов; в — трехмерная система пересекающихся каналов.
молекулярных сит. На рис. 3.45 показаны три простых распо-
ложения, обнаруженные в кристаллах. В случаях а и б каналы
не пересекаются, а в случае в они пересекаются в вершинах
примитивной кубической решетки. Пример типа а показан на
рис. 1.9,6 (разд. 1.5.2); здесь каналы получаются благодаря
образованию вокруг углеводородных цепей трехмерной сетки, в
которой соединенные водородными связями молекулы мочевины
образуют стенки каналов. Реальную систему каналов в случае
в можно мысленно представить в виде «раздутых» систем свя-
зей, что приводит к образованию трубок, внешняя поверхность
3.11. Заполняющие пространство расположения полиэдров
167
которых покрыта мозаикой связанных атомов; таким способом
удобно рассматривать некоторые структуры цеолитов.
Мы завершим рассмотрение сеток кратким описанием двух
типов структур, которые представляют особый интерес для
структурной химии, а именно тех структур, в которых присутст-
вуют хорошо выраженные полиэдрические полости или беско-
нечные каналы. Группы В6 в СаВ6 лучше не описывать как поли-
эдрические полости, поскольку они слишком малы, чтобы вклю-
чить в себя какой-либо атом, но большие пустоты, окруженные
24 атомами В, которые располагаются во всех вершинах усе-
ченного куба, вмещают атомы Са. Будем считать все связи в
сетке приблизительно равными по длине, поскольку общий ха-
рактер сетки может существенно измениться, если допускаются
значительные вариации в относительной длине связей.
3.11. Заполняющие пространство расположения полиэдров
Разбиение пространства на полиэдрические области аналогично
заполнению плоской поверхности многоугольниками. Один из
аспектов этой проблемы был изучен в 1904 г. Федоровым
(Z. Kristallogr., 1904, 38, 321), а именно заполнение пространст-
ва идентичными полиэдрами, имеющими одинаковую ориента-
цию. Он обнаружил, что это можно сделать с помощью пяти
типов многогранников, наиболее симметричные формы которых
представляют собой куб, гексагональную призму, ромбододе-
каэдр, вытянутый додекаэдр и усеченный октаэдр (рис. 3.46).
Рис. 3.46. Пять многогранников Федорова, заполняющих пространство, а —
куб; б— гексагональная призма; в — ромбододекаэдр; г — вытянутый додека-
эдр; д — усеченный октаэдр.
Третий федоровский способ заполнения пространства соответ-
ствует плотнейшей упаковке равных сфер, поскольку полиэдри-
ческим доменом (областью Дирихле) для кубической плотней-
шей упаковки является ромбододекаэдр; при равномерном сжа-
тии кубической плотнейшей упаковки шары превращаются в
ромбододекаэдры. Заполнение пространства усеченными окта-
эдрами соответствует кубической объемноцентрированной упа-
ковке равных сфер, в которой доменами являются усеченные
октаэдры.
Другой аспект проблемы был изучен Андреини [Andreini,
Mem. Soc. Ital. Sci., 1907 C), 14, 75], который рассмотрел за-
168 3. Полиэдры и сетки
полнение пространства правильными и архимедовыми полупра-
вильными телами одного типа или в комбинациях, но без при-
нятого Федоровым ограничения по ориентации. Применительно
к настоящему изложению это ограничение не требуется, так как
в ячейке, конечно, могут сосуществовать полиэдры одного типа,
но в разных ориентациях. Число полиэдров, имеющих общее
ребро, представляет собой предмет специального анализа, кото-
рый состоит в отборе комбинаций с суммой двугранных углов,
равной 2я. Например, ни правильные тетраэдры, ни правиль-
ные октаэдры сами по себе не заполняют пространства, но это
позволяет сделать комбинация, в которой на два тетраэдра при-
ходится один октаэдр. (Эти многогранники являются полиэдри-
ческими доменами ионов в структуре CaF2, которая, следова-
тельно, может быть представлена как заполняющая пространст-
во совокупность полиэдров этих двух типов.)
В заполнениях пространства полиэдрами по Андреини не
встречаются правильные и полуправильные многогранники с
осями симметрии пятого порядка. Невозможно заполнить про-
странство правильными додекаэдрами или икосаэдрами или ар-
химедовыми телами, полученными из них (или комбинациями
этих полиэдров), по причине неподходящих значений двугранных
углов. Однако существуют заполняющие пространство совокуп-
ности полиэдров, включающие неправильные пентагональные
додекаэдры и полиэдры семейства fs=12, /б>12, которые рас-
сматривались в разд. 3.3.5. В добавление к этим специальным
семействам заполняющих пространство полиэдров имеется бес-
конечное число способов заполнения пространства менее пра-
вильными полиэдрами (одного или нескольких сортов); приме-
ром является упаковка восьми- и семнадцатигранников, упомя-
нутая в разд. 3.3.5 в качестве основы гидратной структуры.
Во всяком заполняющем пространство расположении поли-
эдров в каждой точке (вершине) сходятся по крайней мере
четыре ребра. Это число необязательно одинаково для всех то-
чек; например, в расположении ромбододекаэдров в некоторых
точках сходятся по четыре ребра, а в некоторых — по восемь.
Особый класс заполнений пространства включает в себя те из
них, в которых в каждой точке встречается одинаковое число
ребер (например, 4, 5 или 6) и ребра образуют трехмерную
сетку со связанностью 4, 5 или 6. Каркас бора в СаВ6
(рис. 3.47, б) можно рассматривать как заполнение пространства
октаэдрами и усеченными кубами, в котором в каждой точке
соединяются по 5 ребер. Более сложная сетка с координацией 5,
соответствующая заполнению пространства усеченными тетра-
эдрами, усеченными октаэдрами и кубооктаэдрами (рис. 3.47,г),
представлена каркасом бора в UBi2. Здесь атомы урана разме-
щаются в наиболее крупных пустотах (характеризуемых усе-
3.11. Заполняющие пространство расположения полиэдров 169
Г
Рис. 3.47. Заполнение пространства правильными и полуправильными много-
гранниками (см. табл. 3.14).
170
3. Полиэдры и сетки
ченными октаэдрами). Некоторые заполняющие пространство
расположения полиэдров перечислены в табл. 3.15*.
Наибольший интерес для структурной химии представляют
те заполнения пространства, в которых в каждой точке сходятся
по четыре ребра. Такие структуры оказываются удобными для
Таблица 3.15. Заполнение пространства полиэдрами
Рис. 3.47
а
б
в
2-
д
е
р
4
4
5
5
6
8
Полиэдры
Усеченный октаэдр
Куб, усеченный октаэдр, усеченный кубооктаэдр
Октаэдр, усеченный куб
Усеченный тетраэдр, усеченный октаэдр, кубооктаэдр
Куб, кубооктаэдр, ромбокубооктаэдр
Октаэдр, кубооктаэдр
Н2О, образующей по четыре водородные связи, и для топологи-
чески идентичного тетраэдра (Si, А1)О4, соединяющегося через
вершины с четырьмя другими тетраэдрами; они относятся к
двум1 семействам, которые мы теперь рассмотрим более де-
тально.
3.11.1. Заполнение пространства правильными и архимедовыми
телами. Простейший представитель этой группы — это федоров-
ское заполнение пространства усеченными октаэдрами, показан-
ное на рис. 3.47, а. Оно соответствует каркасу атомов Si(Al) в
ультрамарине Na8Al6Si6024-S2, где ионы Na+ и S22~ занимают
пустоты, характеризуемые усеченными октаэдрами. При высоких
температурах ионы могут перемещаться из одной полости в дру-
гую через шестичленные циклы каркаса. Соответственно, если
минерал содалит (который имеет структуру ультрамарина с
двумя ионами С1~, заменяющими S22~) плавится с добавлением
сульфата натрия, он превращается в Na8Al6Si6O24-SO4, который
также встречается в качестве минерала. Структура оксометабо-
рата Zn4B6O13, т. е. OZn4(BO2N, также имеет в основе этот кар-
кас. Тетраэдрические группы ВО4 в вершинах каркаса из усе-
ченных октаэдров образуют трехмерный анион, а в пустотах
расположены тетраэдрические группы OZn4. Тот же каркас при-
* Существуют и другие способы представления кристаллического простран-
ства как заполненного определенными фигурами. В частности, заслуживает вни-
мания «сфеноидальное заполнение», см. статью Бакакина В. В. в ежегоднике
«Проблемы кристаллохимии», 1985, т. 2, с. 7—38. — М.: «Наука». — Прим.
ред.
3.11. Заполняющие пространство расположения полиэдров
171
сутствует в расположении молекул воды в HPF6-6H2O, где ионы
pFe" занимают полости, и модифицированной форме
N(CH3LOH-5H2O. Поскольку отношение числа вершин к числу
полостей равно 6:1, каркас в последнем соединении образован
молекулами Н2О и группами ОН~ EН2О+ОН~).
Заполнение пространства на рис. 3.47,6 происходит при раз-
мещении кубов между квадратными гранями усеченных октаэд-
ров в федоровской упаковке, что приводит к образованию зна-
чительно больших полостей (усеченных кубооктаэдров). На
рисунке два типа наиболее крупных полиэдров обозначены А
и В. Такой каркас присутствует в структуре синтетического
цеолита А, в котором тетраэдры Si(Al)O4 располагаются во
всех точках сетки. Этот каркас показан на рис. 3.47,6 в виде
заполняющего пространство расположения полиэдров трех сор-
тов. Если сосредоточить внимание на каркасе из усеченных ок-
таэдров и кубов, остающееся пространство можно рассматри-
вать как систему каналов, образованных усеченными кубоокта-
эдрами, соединенными своими восьмиугольными гранями. Эта
система каналов представляет собой важную особенность струк-
туры, определяющую свойства кристалла как молекулярного
сита: в обширных каналах (со свободным диаметром порядка
3,8 А) могут двигаться молекулы газа. Такие алюмосиликатные
структуры более полно описаны в гл. 23 (разд. 23.12.8), где
представлен также каркас состава (Si, A1)O2 минерала фожа-
зита NaCa0,5(Al2Si5Oi4) • 10Н2О. Этот каркас представляет собой
алмазоподобное расположение усеченных октаэдров, каждый из
которых соединен с четырьмя другими через гексагональные
призмы; но эта система не является заполняющим пространство
расположением полиэдров.
3.11.2. Заполнение пространства додекаэдрами и родственными
полиэдрами. Второе семейство полиэдрических заполнений про-
странства включает в себя те из них, которые образованы пен-
тагональными додекаэдрами в комбинации с одним или боль-
шим числом сортов полиэдров типа /5 = 12, /б>2. Среди них
представлены структуры гидратов соединений, образующих ряд
от неполярных молекул газов, таких, как хлор и метан, и жид-
костей, как хлороформ, до аминов и солей замещенного аммо-
ния и сульфония. Эти гидраты можно описать как усложнение
льдоподобных структур; они построены в виде полиэдрических
каркасов из соединенных водородными связями молекул воды,
окружающих молекулы и ионы «гостей». Последние почти всегда
занимают большие полиэдрические полости, из которых их мож-
но извлечь, только если кристалл разрушается путем растворе-
ния или испарения. Объемы полостей в этих клатратах таковы:
Додекаэдр 170 А3, 14-гранник 220 А3, 16-гранник 240 А3; макси-
172 3. Полиэдры и сетки
мальныи вандерваальсов диаметр неполярной молекулы, входя-
щей в гидраты такого типа, равен приблизительно 8 А (н-про-
пилбромид).
Такие гидраты содержат в своем составе большое число
кристаллизационных молекул воды. Отношение числа молекул
воды к числу молекул «гостей» равно отношению числа точек
(вершин) к числу больших полостей в каркасе и необязательно
является целым. Например, в СНС13-17Н2О молекулы хлоро-
форма занимают все большие 16-гранные полости, и, поскольку
имеется 8 таких мест в ячейке, содержащей 136 молекул Н2О,
отношение числа молекул Н2О к СНС13 равно 136/8 = 17. С дру-
гой стороны, элементарная ячейка (C2H5JNH-8gH2O содержит
104 молекулы Н2О, и имеется 12 больших 18-гранных полостей
(/5 =12, /б = 6) в добавление к некоторому числу менее правиль-
ных полостей. Отношение числа молекул воды и амина получа-
ется, таким образом, 104/12 или 8 д-.
В гидратированных солях, таких, как R4NF-mH2O и
RsSF-nH2O, положительно заряженные N+ или S+ вместе с
ионами F~ замещают часть молекул Н2О в каркасе. В таких
гидратах объемистые органические группировки R размещаются
в соответствующем числе полостей, примыкающих к атомам N
или S, с которыми они образуют ковалентные связи, т. е. груп-
пировки используют позиции, занятые молекулами «гостей» в
более простых гидратах. Эти структуры, а также структуры
гидратов, рассмотренные в предыдущем разделе, описаны более
подробно в гл. 15.
4. ШАРОВЫЕ УПАКОВКИ
4.1. Периодические упаковки одинаковых шаров
Любое расположение шаров, при котором каждый шар касается
по крайней мере трех других, может быть описано как шаро-
вая упаковка. Например, шары одинакового размера можно
расположить в виде сетки, в каждом узле которой осуществля-
ются три или четыре контакта (далее по тексту: «трех-» или со-
ответственно «четырехсвязанные точки»). Плотность таких упа-
ковок, определяемая как доля всего пространства, занимаемая
шарами, оказывается довольно низкой. Если поместить шары
по точкам алмазной сетки и считать, что они соприкасаются
друг с другом, то плотность составит лишь 0,3401. Кроме того,
структуры с небольшим числом соседей (с низкими КЧ) могут
быть устойчивы лишь при наличии направленных связей меж-
ду атомами. Поэтому структуры этого типа описаны как сетча-
тые (гл. 3). В этой главе рассматриваются только такие упаков-
ки, в которых каждый шар имеет контакты с шестью или более
соседями (табл. 4.1).
4.1.1. Простая примитивная кубическая упаковка*. При шестер-
ной координации наиболее симметричная трехмерная упаковка
получается при размещении шаров по точкам примитивной
кубической решетки; при этом шарами занято лишь немного
более половины пространства. Каждый шар касается шести дру-
гих, расположенных в вершинах октаэдра, причем направления
взаимных контактов соответствуют ребрам исходного куба
(рис. 4.1, а). В направлении диагоналей граней или пространст-
венных диагоналей контакты между шарами отсутствуют.
Из-за низких значений КЧ и низкой плотности такой упаков-
ки для большинства металлов она не подходит; такая структура
приписывается только а-Ро. Однако ртуть действительно кри-
сталлизуется в весьма сходной структуре, получаемой из прими-
тивной кубической упаковки при растяжении ее вдоль одной из
объемных диагоналей, так что из куба получается ромбоэдр с
углом между осями 70,5° вместо 90°. При этом атомы сохра-
няют шестерную координацию.
Структуры кристаллического As (Sb и Bi) и черного фосфора
Демонстрируют два различных способа искажения простой куби-
Такую упаковку называют также кубической кладкой. — Прим. перге.
174 4. Шаровые упаковки
ческой упаковки; в результате искажения каждый атом имеет
три ближайших и три более удаленных соседних атома. В обоих
случаях образуются слоистые структуры, и их можно альтер-
нативно описать как определенные типы плоских гексагональ-
ных сеток. Поэтому они рассматриваются и иллюстрируются в
разделе, посвященном строению плоских гексагональных сеток
(разд. 3.2.2).
4.1.2. Объемноцентрированная кубическая упаковка. К простой
гексагональной упаковке (КЧ 8, рис. 4.1,6), не имеющей боль-
шого значения для моделирования кристаллических структур,
Таблица 4.1. Плотность периодических упаковок
равновеликих шаров
Координа-
ционное
6
8
8
10
11
12
Упаковка
Примитивная кубическая
Примитивная гексагональная
Объемноцентрированная кубическая
Объемноцентрированная тетрагональ-
ная
Тетрагональная плотная
Плотнейшие
Плотность
0,5236
0,6046
0,6802
0,6981
0,7187
0,7405
мы еще вернемся позже. Более плотной является кубическая
объемноцентрированная упаковка, имеющая то же КЧ
(рис. 4.1, s). Шары расположены в центре и в вершинах куби-
ческой ячейки; контакты шаров осуществляются только вдоль
направлений объемных диагоналей. Такую структуру с плот-
ностью упаковки 0,6802 имеет целый ряд металлов (см. табл. 29.3
в т. 3, гл. 29). Кроме восьми ближайших шаров у каждого шара
есть еще шесть соседей на расстоянии, лишь на 15% превышаю-
щем кратчайшее. Так, у атома А эти шесть соседей находятся
в центрах шести соседних элементарных ячеек. Если координа-
ционное число определено в терминах полиэдрического домена
атома (разд. 3.3.1), то в данной структуре КЧ равно 14, при-
чем домен представляет собой усеченный октаэдр.
Поскольку различия в расстояниях до восьми ближайших и
до шести более удаленных соседей относительно невелики, то,
очевидно, возможны структуры с КЧ, промежуточными между 8
и 14. Шесть более удаленных соседей образуют октаэдр. При
сжатии структуры в вертикальном направлении можно достичь
такого расположения, при котором двое из этих соседей ока-
жутся на таких же расстояниях, как восемь в вершинах ячейки.
4.1. Периодические упаковки одинаковых шаров 175
Рис. 4.1. Типы шаровых упаковок, а —примитивная кубическая; б —прими-
тивная гексагональная; в — объемноцентрированная кубическая; г —объемно-
центрированная тетрагональная (К.Ч10); 5 —кубическая плотнейшая упа-
ковка.
176 4. Шаровые упаковки
И наоборот, путем растяжения структуры можно добиться того,
что на таких же расстояниях от центрального шара окажутся
четыре экваториальных соседа. Если принять высоту тетраго-
нальной ячейки равной с, а ребро квадратного основания рав-
ным а, этим двум случаям отвечают соотношения
а2/2 + с2/4 = с2, или с:а = У 2/[/3~ для КЧ10 (рис. 4.1,г),
и
а2/2 + с2/4=а2, или с:а = ]/2~для КЧ12 (рис. 4.1,5)
Известен лишь один металл (Ра), кристаллизующийся при
атмосферном давлении в структуре с КЧ 10; такое же КЧ най-
дено в структуре MoSi2 (т. 3, гл. 23). В кристаллическом протак-
тинии отношение с : а равно 0,825, т. е. очень близко и идеаль-
ному значению 0,816; соответственно этому каждый атом имеет
десять почти эквидистантных соседей. При дальнейшем сжатии
объемноцентрированного куба (ОЦК) два аксиальных соседа
приближаются к центральному еще больше (координация 2+8);
это имеет место в модификации ртути, образующейся при высо-
ком давлении; здесь отношение с: а равно 0,707. Упаковка с
КЧ 10, показанная на рис. 4.1,г, имеет плотность 0,6981, т. е.
несколько более высокую, чем ОЦК-упаковка. Но наиболее
важной из всех является упаковка с КЧ 12 с плотностью 0,7405.
Вследствие того что высота ячейки {а~]/2) в такой упаковке рав-
на диагонали квадратного основания, более удобен другой вы-
бор элементарной ячейки (рис. 4.1,д), представляющей собой
куб с шарами в вершинах и в центре всех граней; отсюда ее
название — гранецентрированная кубическая (ГЦК) структура.
Такое размещение — одна из форм плотнейшей упаковки шаров
одинакового размера.
Полезно рассмотреть вид ОЦК-шаровой упаковки вдоль на-
правления диагонали грани элементарной ячейки (рис. 4.2,а).
Пустыми кружками обозначены шары, лежащие в плоскости
рисунка, а заштрихованными — шары в параллельных плоско-
стях, но выше и ниже. Линиями соединены шары, находящиеся
в контакте. При небольшом изменении в структуре слоя и не-
значительном смещении слоев относительно друг друга а пере-
ходит в б — плотнейшую кубическую упаковку (ГЦК), изобра-
женную в проекции на плоскость слоя. Проиллюстрированная
здесь близость между ОЦК и ГЦК-шаровыми упаковками пред-
ставляет интерес в связи с тем, что обе они реализуются в
структурах многих металлов.
Можно также отметить то обстоятельство, что, хотя ОЦК-
упаковка менее плотная, чем ГЦК или другая плотнейшая упа-
ковка и поэтому в ней имеется больше незанятого пространства,
почти все без исключения структуры внедрения гидридов, кар-
4.1. Периодические упаковки одинаковых шаров 17/
Рис. 4.2. а — проекция объемноцентрированной кубической упаковки вдоль на-
правления диагонали грани; б — проекция гранецентрированной кубической
упаковки; в — маленькие черные кружки указывают расположение половины
всех пустот объемноцентрированной кубической упаковки, а небольшие неза-
черненные кружки — положение той четверти пустот, которые заняты в струк-
туре Ni3S2.
бидов и нитридов основаны на ГЦК, а не на ОЦК-упаковке
атомов металла (см., однако, гидриды V и Nb; т. 2, разд. 8.2).
Мы уже отмечали в разд. 3.3.1, что способ описания струк-
туры как совокупности заполняющих пространство полиэдриче-
ских доменов (областей Дирихле) открывает путь к выявлению
пустот в структуре. Из определения области Дирихле (J. Solid
State Chem., 1970, 1, 237) следует, что любая вершина домена
находится на равных расстояниях по крайней мере от четырех
некомпланарных атомов и поэтому является центром полиэдри-
ческой пустоты. В ОЦК-структуре расположение пустот соответ-
12—752
178 4. Шаровые упаковки
ствует вершинам усеченного октаэдра (рис. 4.2,в). По форме эти
пустоты ыс/сажемно-тетраэдрические в противоположность пра-
вильным тетраэдрическим и октаэдрическим пустотам в струк-
турах плотнейших упаковок (разд. 4.1.6). В упаковке N шаров
единичного радиуса имеется 6N таких пустот, способных вмес-
тить атомы с радиусом 0,291. Однако эти пустоты образуют
компактные группы по четыре пустоты в каждой; вследствие
того что они расположены очень близко друг к другу, заполнен-
ной может быть лишь половина пустот, что приводит к форму-
ле АХ3, где X — атом, расположенный в пустоте. Такое строение
имеет ОСг3 и, возможно, p-W (т. 3, разд. 29.1.4). Если занята
лишь четвертая часть пустот, образуется соединение с формулой
А2Х3. Такова структура S2Ni3 (Ni3S2), которая основана на очень
слабо искаженной ОЦК-упаковке атомов серы с атомами нике-
ля в пустотах (рис. 4.2,в) (Acta cryst., 1980, В36, 1179). В этой
структуре атом Ni окружен четырьмя атомами S па расстоянии
2,27 А и еще двумя атомами Ni на расстоянии 2,51 А (средняя
величина; ср. с расстоянием Ni—Ni в металле 2,49 А).
4.1.3. Тетрагональная плотная упаковка. Недавно появилось со-
рбщение (Materials Res. Bull., 1981, 16, 339), что существует
трехмерная шаровая упаковка, в которой шары симметрически
эквивалентны, каждый имеет 11 равноотстоящих соседей, причем
плотность этой упаковки лишь на 3% меньше, чем у плотней-
шей (табл. 4.1). Координационный полиэдр, приближающийся
к трехшапочной тетрагональной призме, образован двумя груп-
пами из пяти и шести шаров. Шары каждой группы занимают
часть вершин (двух различных) кубооктаэдров. Это соответст-
вует упаковке анионов в структурном типе рутила (разд. 6.3)
с с:а = 2—У2 и х = 112{2—^2). Эта упаковка очень близка к
гексагональной плотнейшей (разд. 4.3). Ниже (разд. 4.2) будет
показано, что, хотя число тетраэдрических пустот в гексагональ-
ной плотнейшей упаковке шаров равна 2N, заполнение более
чем N пустот приводит к образованию общих граней у тетраэд-
рически координированных групп. В тетрагональной плотной
упаковке можно заполнить 5jV/4 тетраэдрических пустот без
образования общих граней между ними. Этим способом упако-
ваны, например, анионы в L^GeO,}.
4.1.4. Плотнейшие упаковки равновеликих шаров. Модели плот-
нейших шаровых упаковок обычно получают из плотнейших
слоев, в которых каждый шар соприкасается с шестью другими.
Рассмотрим вкратце различные способы наложения таких
слоев. Плотнейшая упаковка получается в том случае, если каж-
дый шар касается трех других в каждом из соседних слоев и
4.1. Периодические упаковки одинаковых шаров 179'
имеет таким образом, контакты с 12 шарами. Однако не совсем
верно было бы полагать, что плотнейшая трехмерная упаковка
обязательно должна быть образована из плоских слоев, в кото-
рых каждый шар окружен компланарно шестью соседними. По-
пробуем подойти к этому вопросу несколько иначе.
Очевидно, что три шара наиболее плотно упаковываются при
треугольном их расположении, а четвертый шар дает наиболь-
шее число контактов (три), если он достраивает треугольник
до тетраэдра. Естественно было бы попытаться получить плот-
иейшую упаковку, продолжая помещать шары над центрами
треугольников, образованных тремя другими. При таком разме-
щении линии, соединяющие центры шаров, выявили бы систему
правильных тетраэдров. Однако упаковкой правильных тетраэд-
ров заполнить пространство невозможно, поскольку для диэдри-
ческого угла правильного тетраэдра G0°32') величина 360° не
является кратной.
Икосаэдрические плотнейшие упаковки. Предположим теперь,
что мы упаковываем шары одинакового размера вокруг одного
центрального шара. Максимально исходного шара могут ка-
саться 12 таких же шаров. В действительности вокруг цент-
рального шара имеется несколько больше места, чем требуется
для 12 шаров такого же размера, но его недостаточно для раз-
мещения тринадцатого шара.
Поэтому существует бесконечное число способов расположе-
ния двенадцати шаров, и наиболее симметричное из них — раз-
мещение шаров в вершинах правильного икосаэдра — единствен-
ного правильного многогранника с 12 вершинами. Длина ребра
правильного икосаэдра примерно на 5% больше расстояния от
центра до вершины, так что каждый из 12 шаров внешней обо-
лочки соприкасается только с центральным шаром. (И наобо-
рот, для того чтобы каждый из 12 шаров в икосаэдре касался
центрального шара и в то же время находился в контакте с
пятью соседними шарами, центральный шар должен иметь ра-
диус 0,902, если радиус внешних шаров принять за единицу.)
Икосаэдрическое расположение ближайших соседей вокруг цент-
рального не приводит к периодической трехмерной упаковке ша-
ров, но представляется достаточно интересным для того, чтобы
о нем упомянуть. Со структурной точки зрения интересны и
Некоторые другие упаковки шаров, которые хотя и не дают
периодичности в трех измерениях, но так же, как икосаэдриче-
ская, приводят к заполнению всего пространства. Описан целый
ряд таких некристаллографических упаковок шаров, в том чис-
ле бесконечная упаковка с плотностью 0,7236, близкой к значе-
нию для плотнейшей упаковки и имеющей единственную ось
симметрии пятого порядка (рис. 4.3) [Nature, 1965, 208, 674;
J- Cryst. Growth., 1970, 6, 323]. Известна также сходная с ней
180 4. Шаровые упаковки
Рис. 4.3. Упаковка шаров с осью симметрии 5-го порядка.
а
Рис. 4.4. а — соотношение между кубооктаэдром и икосаэдром; б — икосаэдри-
ческая упаковка равновеликих шаров: третья оболочка (третий слой п — 3)
[Acta cryst, 1962, 15, 916].
упаковка с еще более высокой плотностью @,7341) [Nature,
1970,225, 1040].
Представляется интересным отметить связь между икосаэд-
ром и кубооктаэдром (рис. 4.4,а). Если считать 24 ребра кубо-
октаэдра жесткими стержнями, соединенными с образованием
12 вершин, то при вращении треугольных граней вокруг норма-
лей к ним кубооктаэдр превратится в икосаэдр. При этом каж-
дый из стержней перемещается к центру полиэдра; в результате
4.1. Периодические упаковки одинаковых шаров 181
расстояние от центра до каждой из вершин сокращается при-
мерно на 5%. Если представить себе, что и в центре, и в вер-
шинах кубооктаэдра находятся шары единичного радиуса, то
при осуществлении той же операции не произойдет радиального
сокращения, но в получающемся икосаэдре внешние шары уже
не будут касаться друг друга. Если строить плотную упаковку,
начиная с кубооктаэдрической группы из 12 шаров вокруг цент-
рального шара, то вторая оболочка из шаров, упакованная во-
круг первой, будет состоять из 42 шаров (в общем виде из
10/г2+2 для оболочки с номером п). Вторая оболочка вокруг
икосаэдрической группы шаров также содержит 42 шара, при-
чем контакты между шарами осуществляются вдоль осей 5-го
порядка. Каждая последующая я-я оболочка, как и в случае
кубооктаэдра, содержит 10л2+2 шара. Получающаяся совокуп-
ность шаров не является периодической в трех направлениях, а
имеет радиальную структуру с единственным центром
(рис. 4.4,6). Она менее плотная, чем кубооктаэдрическая; пре-
дельная плотность равна 0,6882 [Acta cryst., 1962, 15, 916], т. е.
находится между плотностями объемноцентрированной @,6802)
и кубооктаэдрической @,7405) упаковки. В последнюю она мо-
жет быть превращена по способу, показанному на рис. 4.4,а.
Поскольку наиболее симметричное расположение 12 соседей
(с икосаэдрической координацией центрального атома) не при-
водит к наиболее плотной из возможных трехмерных упаковок,
возникает вопрос, какой из бесконечного числа вариантов рас-
положения 12 соседей ведет к более плотным упаковкам и ка-
кова максимальная плотность бесконечной шаровой упаковки.
В 1883 г. Барлоу показал, что существуют две координационные
группы, которые по отдельности или в комбинации друг с дру-
гом приводят к бесконечным шаровым упаковкам с одинаковой
плотностью 0,7405. Одна из этих двух координационных групп —
кубооктаэдр, а другая— родственный ему многогранник (скру-
ченный, или «гексагональный», кубооктаэдр), получающийся из
половины кубооктаэдра путем отражения в плоскости сечения
параллельной треугольному основанию (рис. 4.5). Такое распо-
ложение ближайших соседей в шаровых упаковках возникает
при наиболее компактном способе наложения плотных плоских
слоев, упомянутых в начале этого раздела. Интересно заметить,
что еще не доказана невозможность существования некоторой
неизвестной бесконечной упаковки шаров с плотностью выше
чем 0,7405. С другой стороны, Миньковскому удалось доказать
что упаковка, основанная на кубооктаэдре (кубическая плотней-
Шая упаковка), является плотнейшей решеточной упаковкой
одинаковых шаров. (Решеточная упаковка обладает следующи-
ми свойствами. Если на любой прямой линии находятся два ша-
Ра на расстоянии а, то шары находятся также во всех точках
¦*. шаровые упаковки
этой линии, отстоящих друг друга на расстоянии а. Заметим,
что гексагональная плотнейшая упаковка (разд. 4.1.8) не явля-
ется решеточной и поэтому кубическая плотнейшая-—единст-
венная плотнейшая решеточная упаковка.) Эта неопределен-
ность возникает в связи с тем, что, в то время как на плоскости
а б
Рис. 4.5. Координационные многогранники в гексагональной (а) и кубиче-
ской (б) плотнейших упаковках.
существует лишь единственный способ плотной упаковки шаров,
в пространстве имеется бесконечное число способов расположе-
ния 12 шаров, касающихся центрального шара того же радиуса.
4.1.5. Шаровые упаковки, построенные из плотноу'пакованных
слоев. В плотноупакованном слое шар соприкасается с шестью
другими (рис. 4.6,а). При наложении слоев друг на друга с
каждой стороны слоя возникают дополнительные контакты, чис-
ло которых равно 1, 2 или 3 в зависимости от того, выше или
\
(D'")
Рис. 4.6. Наложение слоев плотноупакованных шаров (см. текст).
ниже какой точки, Л, D или В (С), соответственно располага-
ются шары накладываемого слоя. Такие слои мы будем назы-
вать соответственно А-, D-, В- или С-слоями. У каждого шара
есть три D-позиции: D', D", D'"\ диаметрально противополож-
ные точки заняты другим шаром того же слоя; на рис. 4.6,6 они
отмечены скобками. Если между парами последовательных
4.1. Периодические упаковки одинаковых шаров 183
слоев устанавливается одно и то же векторное соответствие, то
безразлично, какого оно типа: AD', AD" или AD'". Однако ком-
бинация этих трансляций в последовательности слоев приводит
к различным структурам. Так, последовательности AD'AD' ...,
AD"AD" ... и AD'"AD'"... соответствуют одной и той же структу-
ре, но AD'AD"... и т. д. представляют собой уже другую структу-
ру. Имеются лишь две различные позиции типа Б или С, так как
все три В- (или С-) позиции на рис. 4.6,8 соответствуют положе-
ниям шаров в данном слое. В пределах двух соседних слоев по-
зиции В я С эквивалентны, поэтому последовательности АВАВ...
и АС АС... — это одна и та же структура, тогда как ABAC... и
другие последовательности, включающие слои типа В и С одно-
временно, представляют собой различные структуры.
Общее число контактов (координационное число) в зависи-
мости от способа наложения слоев может быть любой величи-
ной от 8 до 12, т. е. от 6+1 + 1 до 6+3 + 3. В кристаллах были
обнаружены лишь шаровые упаковки с координационными чис-
лами 8, 10 и 12.
КЧ 8 Последовательность слоев ЛАА... Эта упаковка, в которой слои рас-
полагаются вертикально друг над другом, представляет собой прими-
тивную гексагональную (решеточную) упаковку.
К 1 10 Такую упаковку можно получить двумя способами: а) контактами
типа D с обоими соседними слоями F+2+2) или б) контактами ти-
па А с одной стороны и типа В (или С) с другой F+1+3)
а) Последовательность слоев ADAD... может реализоваться бесконечным
числом способов, поскольку имеется выбор между позициями D' D" и D'" при
каждом наложении слоев. Среди структур этого типа с КЧ 10 и с несколько
деформированными плотноупакованпыми слоями можно указать на структуру
\-i-u (т. 3, разд. 29.1), в которой осуществляется координация 4 + 4+2. В ча-
стном случае, когда все пары соседних слоев связаны трансляциями одинако-
вого типа, например AD', в общей кладке образуется еще одна серия плотно-
упакованных слоев, перпендикулярных исходному плотноупакованному слою
Пересечение этих плоскостей с плоскостью чертежа (рис. 4.6, а) показано штри-
ховыми линиями. Этот случай соответствует объемноцентрированной тетраго-
нальной упаковке, описанной в разд. 4.1.2 и отмеченной в табл. 4.1.
б) Последовательность слоев сААС также имеет бесконечное число ва-
риантов в связи с тем, что необходимо различать позиции типа В и С Напри-
мер, наиболее простая последовательность АА ВВ АА ВВ при замене любой
пары слоев В на пару типа С даст последовательность АА ВВ АА ССУ т е но-
вую структуру. '
КЧ 12 Последовательность слоев может включать любую комбинацию А В
и С при условии, что два соседних слоя не могут быть одинакового
типа. Простейшими комбинациями будут АВАВ... и АВСАВС. Эти
плотнейшие упаковки будут рассмотрены более"подробно '
В структурах кристаллов с атомами, расположенными только в самих
плотноупакованных слоях, из этих четырех основных видов последовательно-
сти слоев были обнаружены лишь упаковки с КЧ 10(а) и 12 Металлы не кри-
. галлизуются в примитивной гексагональной решетке (АААА ) потому что
небольшое относительное смещение слоев дает более плотноупаков'анные струк-
184 4. Шаровые упаковки
туры с КЧ 10 и 12. Примеры 10-координационных структур ограничены несколь-
кими дисилицидами, а также металлическими Pa, Hg (вые. давл.) и Ри.
Большинство же металлов образуют ту или иную из наиболее плотных
последовательностей слоев (с КЧ 12). Исходя из общих соображений, не сле-
дует ожидать размещения атомов в соседних слоях точно друг под другом
(т. е. по типу АА), если нет особой причины для реализации такой малоэффек-
тивной упаковки. И действительно, ее обнаруживают лишь в тех случаях, когда
в пустотах (тригонально-призматических) между слоями находятся другие ато-
мы или если контакты между слоями осуществляются за счет атомов водоро-
да, занимающих позиции на линии А.. .А (см. ниже).
Особая важность плотнейших шаровых упаковок обусловле-
на тем обстоятельством, что в большинстве галогенидов, оксидов
и сульфидов анионы имеют значительно большие размеры, чем
атомы (ионы) металла, и именно они расположены по одному
из типов плотнейшей упаковки. При этом меньшие по размеру
ионы металлов занимают пустоты в плотнейшей упаковке анио-
нов. В другой большой группе соединений — боридах, карбидах
и нитридах — атомы неметалла занимают пустоты в плотнейшей.
упаковке атомов металла (структуры внедрения).
4.1.6. Типы пустот при наложении плотноупакованных слоев,
В самой плоскости плотноупакованного слоя имеются неболь-
шие пустоты, окруженные треугольными группами плотноупако-
сг ^—-^ _—_ g
Рис. 4.7. а — тригонально-призматические пустоты между двумя наложенными
друг на друга слоями типа А; б — тетраэдрические (маленькие белые кружки)
и октаэдрические (маленькие черные кружки) пустоты, образующиеся при
наложении друг на друга слоев типа А и В.
ванных атомов, а между слоями возникают пустоты, окружен-
ные полиэдрическими группами плотноупакованных атомов. Эти
пустоты можно обозначить буквами а, Ь или с, если они находят-
ся над позициями А, В или С (рис. 4.7,а). Возможны следующие
типы межслойных пустот:
Ь или с (тригонально-
призматические)
с (октаэдрические)
а или b (тетраэдрические)
-В-
4.1. Периодические упаковки одинаковых шаров 185
Аналогичным образом между слоями В и С образуются пус-
тоты типа а (октаэдрические) и Ь или с (тетраэдрические), а
между слоями А и С—пустоты типа Ь (октаэдрические) и а
или с (тетраэдрические). Ниже приведены максимальные значе-
ния радиусов шаров, которые можно поместить в пустоты упа-
ковки шаров единичного радиуса, а также количество таких
пустот в упаковке из N шаров. Между слоями типа АА число
тригонально-призматических пустот в два раза больше, чем чис-
ло октаэдрических пустот между слоями типа АВ.
Шаровая упаковка
Примитивная гек-
сагональная
Плотнейшая упа-
ковка
Тип пустоты
Тригонально-приз-
мэтическая
Тетраэдрическая
Октаэдрическая
пустот
2 N
2 N
N
Максимальное значение
радиуса шара, помещенно-
го в пустоту
0,528
0,225
0,414
4.1.7. Структуры с несколькими парами соседних слоев типа А.
Если все слои находятся точно друг под другом (например, все
типа А), то все пустоты занимают позиции Ъ и с и окружены
шарами, расположенными тригонально-призматически. В кри-
сталлах с преимущественно ионным типом связи такого типа
координация не должна осуществляться; в кристаллах других
типов она возможна по ряду причин: 1) атом может иметь со-
ответствующим образом направленные связи; 2) возможно су-
ществование определенного взаимодействия между шестью ато-
мами, образующими тригонально-призматическую группу, кото-
рое делает ее более устойчивой, чем обычная октаэдрическая
группа; 3) специфическое взаимодействие осуществляется меж-
ду атомами, расположенными в пустотах, и в результате коорди-
нация этих атомов подчиняется другим требованиям к типу
связывания или упаковки. Возможно, что именно это имеет мес-
то в структуре А1Вг. Очевидно, что довольно трудно (если вооб-
ще возможно) различить случаи A) и B). В двух структурах,
схематически представленных на рис. 4.8,а и б (структурные
типы WC и NiAs), между атомами соседних слоев осуществля-
ются связи металл — металл. NbS кристаллизуется в обоих
структурных типах. Другое, более привычное, описание струк-
туры NiAs дано в разд. 17.1.3 (т. 2).
Все пустоты бис, расположенные между двумя соседними
слоями А, не могут быть заняты одновременно, так как они рас-
положены слишком близко друг к другу. Такое заполнение воз-
186 4. Шаровые упаковки
можно лишь в том случае, если атомы в пустотах образуют
связи между собой. Так, в структуре А1В2 (рис. 4.8,в) атомы
бора образуют плоские шестиугольные сетки, занимая все по-
зиции b и с между находящимися друг над другом слоями ато-
мов алюминия, как это показано в проекции на рис. 4.9,о. В гек-
А —
Л
Л
b
ь
WC
а
w
с
ъ
с
NiAs
6
Ni
As
b и с
b и с
А!В2
в
— А1
В
Рис. 4.8. Схематические разрезы структур с тригонально-призматическои коор-
динацией.
сагональном M0S2 атомы металла занимают половину триго-
нально-призматических пустот между парами слоев атомов се-
ры (рис. 4.9,6), чередующихся по типу ААВВААВВ.
На рис. 4.10 схематически изображены некоторые другие-
структуры, основанные на чередовании пар слоев типа АА, при-
чем указаны типы координации атомов, расположенных между
слоями. Простейшая (слоистая) структура типа АЬА ВаВ с
тригонально-призматическои координацией всех атомов металла
а
Рис. 4.9. Положение атомов в тригонально-призматических пустотах (малень-
кие черные кружки) между двумя плотноупакованными слоями (более круп-
ные светлые кружки) в проекции на плоскость слоя, а — А1В2, атомы В обра-
зуют плоские шестиугольные сетки; б — слой в структуре гексагонального-
MoS2.
соответствует обычной форме M0S2, о которой только что гово-
рилось. В связи с тем что между двумя слоями А имеются пус-
тоты типа Ь и с, а между слоями В — пустоты типа а и с, воз-
можны еще две последовательности из четырехслойных пакетов
ААВВ, а именно АсА ВсВ и АЬА ВсВ. Первая из этих последо-
4.1. Периодические упаковки одинаковых шаров 187
вательностей осуществляется в одной из модификаций (гекса-
гональной) NbS2; структуру aHTU-NhS2 имеет также Hf2S. Для
другой последовательности примеры неизвестны. Читатель мо-
жет сам проверить, что для последовательности из трех пар
слоев ААВВСС возможны только две структуры:
АЬА ВсВ СаС (ромбоэдрическая форма NbS2 и MoS2)
И
АЬА ВсВ СЬС (примеры неизвестны)
тогда как повторение четырех пар слоев может осуществляться
уже 10 способами: ААВВААСС G структур) и ААВВААВВ
А
А
•Ti
А
TIP
-Ti
о
А
А
А
NbS,
А
А
А
А А
ВаСи
АК0НK Мо52
СгО(ОН) (гексагон.) (гексагоЮ неизвестны
S\ тригонально -призматические пустоты между слоями
Q октаэдрические пустоты между слоями
Рис. 4.10. Схематические разрезы структур с тригонально-призматическои и
октаэдрической координацией.
C структуры). Все три структуры типа АА ВВ и два типа
АА ВВ СС показаны в виде разрезов на рис. 4.11.
Понятно, что существует бесконечное число других, более
сложных последовательностей слоев, включающих как пары
соседних слоев одного и того же типа (например, АА), так и
разных типов {АВ и др.). Примером может служить структура
ТЫ2, в которой часть атомов Th занимает тригонально-призма-
тические (тр.-п.), а другая часть — октаэдрические (окт.) пусто-
ты, причем повторение последовательности происходит через
8 слоев:
...Л АС ВА АВ СА А...
тр.-п. окт. тр.-.п окт. тр.-п.
Такие структуры можно описать как состоящие из чередую-
щихся фрагментов со структурами типа Cdl2 и M0S2.
До сих пор нас интересовала координация атомов металла,
заключенных между плотноупакованными слоями. Очевидно,
что способ взаимного расположения двойных слоев в свою оче-
редь определяет координацию самих плотноупакованных атомов.
Для соединений с формулой МХ2 эта сторона дела не представ-
ляет особого интереса, поскольку по одну сторону от слоя кон-
такты обусловлены лишь вандерваальсовым взаимодействием.
188 4. Шаровые упаковки
4.1. Периодические упаковки одинаковых шаров 189
Например, в гексагональном M0S2 со структурой АЬА ВаВ....
каждый атом S имеет тригонально-призматическое ближайшее
окружение CMo+3S), но контакты S—S с химической точки
зрения не особенно интересны. Иная ситуация возникает в раз-
личных обращенных структурах этого типа, таких, как анти-2Н2-
структура Hf2S (рис. 4.11). Здесь ближайшее окружение Hf
составляют 3Hf+3S, причем атом Hf образует с тремя атомами.
Г)-,—г-Г)
о
_р)
-о-—
Рис. 4.11. Проекции (вдоль оси а) трех структур с последовательностью слоев
АА ВВ и двух структур с последовательностью АА ВВ СС. Структуры соеди-
нений с формулой МХг характеризуются тригонально-празматической коорди-
нацией атомов М.
Hf связи металл— металл. В трех простейших структурах, пока-
занных на рис. 4.11, координация атомов, образующих плотную-
упаковку, такова:
2 Н[ тригонально-призматическая
2 Н2 октаэдрическая
2 Т у половины атомов тригонально-призматическая,
у другой половины атомов — октаэдрическая
4.1.8. Гексагональная и кубическая плотнейшие упаковки рав-
новеликих шаров. Теперь рассмотрим шаровые упаковки, в ко-
торых плотноупакованные слои накладываются друг на друга
наиболее плотным образом. Если обозначить положения шаров
в слое буквой А (рис. 4.12), то над этим слоем можно располо-
жить точно такой же слой, так что центры шаров будут нахо-
диться над позициями, обозначенными как В. Очевидно, что не-
существенно, какую из позиций выбрать — В или эквивалентную
ей С (это видно из симметрии рис. 4.12). При наложении треть-
о То
о о о
О
О А
его слоя на второй (В) имеются
уже две возможности: центры
шаров могут находиться над по-
зициями типа А или типа С. Та-
ким образом возникают две про-
стейшие последовательности сло-
ев АВАВ... и ABC ABC..., однако
число более сложных последова-
тельностей бесконечно. Во всех
таких шаровых упаковках объем,
приходящийся на один шар ра-
диуса а, составляет 5,66 а3, а сред-
няя плотность равна 0,7405, если
принять, что плотность самих шаров — единица, тогда как в про-
странстве между шарами она равна нулю.
Последовательности АВАВ... соответствует гексагональная
элементарная ячейка (рис. 4.13); это гексагональная плотнейшая
Рис. 4.12. Три последовательных
слоя в кубической плотнейшей упа-
ковке.
или
о/ о/ о
/о /о
о/ ..о/ о
/л /о
000
3 3 4
Рис. 4.13. Гексагональная плотнейшая упаковка равновеликих шаров; различ-
ные варианты выбора элементарных ячеек; их проекции.
(На левом нижнем рисунке вместо 1/3 1/2 3/4 следует читать 1/3 2/3 3/4. — Ред.)
-'Ms
?
Ю
%¦/*
I ис. 4.14. a — гексагональная плотнейшая упаковка; б — кубическая плотней-
шая упаковка; в — кубическая плотнейшая упаковка, в которой часть атомов
Удалена, чтобы показать слой плотноупаковаиных атомов. Расположение тетра-
эдрических и октаэдрических пустот вокруг любого атома в гексагональной
плотнейшей упаковке (г и д) и в кубической плотнейшей упаковке (е и ж)
(стереопары).
192
Шаровые упаковки
упаковка (ГПУ). При таком расположении, показанном также
на рис. 4.14,а, 12 соседей размещаются по вершинам координа-
ционного полиэдра, изображенного на рис. 4.5,а (скрученный
или «гексагональный» кубооктаэдр).
Последовательность ABC ABC... обладает кубической сим-
метрией, т. е. имеет 4 оси 3-го порядка, направленные вдоль
объемных диагоналей куба; поэтому ее называют кубической
плотнейшей упаковкой (КПУ). Элементарная ячейка показана
на рис. 4.1,C, а сама упаковка изображена на рис. 4.14,6 и в.
Плотноупакованные слои на рис. 4.12 перпендикулярны любой
из объемных диагоналей куба. Поскольку атомы в КПУ разме-
щаются по вершинам и центрам граней кубической элементар-
ной ячейки, ее еще называют гранецентрированной кубической
(ГЦК) упаковкой. Двенадцать ближайших соседей каждого ато-
ма располагаются в вершинах кубооктаэдра (рис. 4.5,6).
4.1.9. Более сложные плотнейшие упаковки. В упаковке АВ... и
ABC... каждый шар имеет одинаковый тип окружения ближай-
шими соседями. Расположение более удаленных соседей в упа-
ковках ГПУ или КПУ также одно и то же для каждого шара.
Это условие не выполняется для более сложных упаковок. Мож-
но показать, что следующая по сложности группа упаковок —
с двумя (и только двумя) типами неэквивалентных шаров —
включает четыре различные последовательности.
Для сокращенной формы записи плотнейших упаковок пред-
ложены следующие обозначения: слой атомов, имеющий оба со-
седних слоя одного типа (т. е. оба А, оба В или оба С), обозна-
чается буквой г (гексагональный), а слой с соседними слоями
различных типов — буквой к (кубический). Тогда гексагональная
плотнейшая упаковка получает символ г (т. е. ггг...), а плот-
нейшая кубическая — символ к. Символы для более сложных
последовательностей содержат и буквы г, и буквы к. Как уже
отмечалось, шары в слоях гик имеют различное расположение
ближайших соседей (координационные полиэдры показаны на
рис. 4.5,а и б), в связи с чем любая более сложная последова-
тельность обязательно содержит два типа неэквивалентных ша-
ров, различающихся расположением ближайших соседей. Если
мы хотим, чтобы в упаковке было только два типа неэквивалент-
ных шаров, то необходимо обеспечить одинаковое расположение
также и более удаленных соседей для всех шаров в слоях как
типа г, так и типа к. Поэтому последовательность слоев гик
относительно любого слоя г или к должна быть одной и той же.
Беря за исходную последовательность гк, мы можем добавить
к или г. Добавив к, получим гкк, где центральный слой к окру-
жен слоями гик. Второй слой к должен иметь такое же окру-
жение, и поэтому следующий добавляемый символ должен
4.1. Периодические упаковки одинаковых шаров 193
быть г. Таким образом, добавление третьего символа к обуслов-
ливает выбор четвертого г. После этого можно прибавить г
или к. В первом случае получим гккгг и, следовательно, фикси-
рованное окружение слоя г (четвертый символ) слоями к и г.
Поэтому следующий добавляемый символ должен быть к. Легко
проверить, что получается последовательность ггкк.... Подобным
же образом можно показать, что, если пятый символ будет к
вместо г, то возникнет последовательность гкк.... Возвращаясь
к последовательности из двух символов гк, мы легко обнаружим,
что добавление третьего слоя г (вместо к) уже не определяет
того, каким должен быть четвертый символ, так что в результа-
те мы придем к еще двум возможным последовательностям: гк
и ггк. Из всего сказанного вытекает, что для упаковки с двумя
типами неэквивалентных шаров возможны только четыре раз-
личные последовательности:
- гкк
гккг
гкг
гккг гккг ...
гкк гкк гкк..
гк гк -гк...
2/1-2 гкг...
Очевидно, что символы типа г, к, гк и т. д. не указывают чис-
ло слоев, после которого вся последовательность повторяется,
например 2 для г (АВ...), 3 для к (ABC.) и 4 для гк (АВСВ...).
Число слоев, повторяющих последовательность, легко опреде-
лить, если вернуться к символам типа А, В, С я подставлять их
вместо гик, начиная произвольно с АВ..., до тех пор, пока пос-
ледовательность букв не станет повторяться:
гкг к г к или гккгккгкк
(В) А В С В А В... (В) А В С А С В...
(четырехслойная упаковка) (шестислойная упаковка)
Численные символы, приведенные в табл. 4.2, дают представ-
ление как о последовательности слоев, так и о числе плотноупа-
кованных слоев в периоде повторяемости в направлении, пер-
пендикулярном слоям. Порядок чередования А—>В—>-С обозна-
чается единичным вектором +1, а обратный порядок — вектором
— 1. Следующие друг за другом п положительных (или отрица-
тельных) единичных векторов записываются как п(п), так что
22 означает 1111... и, если начинать с А, дает последователь-
ность АВСВА... Символы третьего типа, приведенные в таблице,
указывают на число повторяющихся слоев в последовательности
и тип решетки (кубическая, гексагональная или ромбоэдриче-
ская).
13-752
194 4. Шаровые упаковки
Таблица 4.2. Плотнейшие упаковки равновеликих шаров
Число1 сортов
неэквива-
лентных
шаров
1
2
Обозначения
К
гк
гкк
кгг
ккгг
а
1 Г
3
2 2
3 3
A 2K
A 3),
б
2 Н
3 С
4 Н
6 Н
9 R
12 R
в не;)иоде
ло.втО|ряе-
мости
2
3
4
6
9
12
Обозначения Хегга (С. Hagg, Arkiv for Kemi, 1943 16В 1) —Прим
перев.
"Обозначения Рамсделла (L. S. Ramsdett, Am. Mencral., 1945, 30.
519). — Прим. перев.
Шесть последовательностей плотноупакованных слоев, ука-
занных в табл. 4.2, соответствуют упаковкам, наиболее часто
встречающимся в структурах кристаллов. Однако если не на-
кладывать ограничений на число типов неэквивалентных шаров,
го количество различных последовательностей для двенадцати-'
слойных (или менее) упаковок окажется намного большим
(табл. 4.3). Лишь последовательности с повторением 2, 3, 4 и
5 слоев имеют только по одному варианту упаковки.
Таблица 4.3. Число различных вариантов плотнейших упаковок
Число слоев в пе-
риоде повторяемости
2
3
4
5
6
7
Число различных
последовательностей
1
1
1
1
2
3
Число слоев в пе-
риоде повторяемости
8
9
10
11
12
Число различных
последовательностей
6
7
16
21
43
Простейшие примеры плотнейших упаковок одинаковых час-
тиц можно найти среди структур металлов, благородных газов
и кристаллов, построенных из молекул одного типа. В послед-
нем случае молекулы должны иметь приблизительно сфериче-
скую форму или играть роль эффективно сферических за счет
вращения или беспорядочной ориентации. Металлы дают много
примеров гексагональной или кубической плотнейших упаковок,
4.1. Периодические упаковки одинаковых шаров
195
е случаев и более сложных последовательностей (напри-
а в * ,^. l3i pr, Nd, Am; кгг: Sm). Кплотноупакованным молеку-
лярным кристаллам относятся благородные газы, водород, НС1,
H,S и СН4-
' Особое значение теории шаровых упаковок для структурной
химии связано с тем обстоятельством, что в структурах многих
галогенидов, оксидов и сульфидов анионы располагаются по мо-
тивам шаровых упаковок (часто с теми или иными отклоне-
ниями), а атомы металлов занимают пустоты в анионной упа-
ковке. Уже указывалось, что полиэдрические пустоты между
плотноунакованными атомами могут быть двух типов—тетра-
эдрическне и октаэдрические (Т и О на рис. 4.7,6). Число тетра-
эдрических пустот в два раза больше числа шаров, а число
октаэдрических пустот равно числу шаров. Наиболее важными
типами плотнейших упаковок являются две простейшие — гекса-
гональная и кубическая. Варьируя частичное заполнение тетра-
эдрических и (или) октаэдрических пустот этих упаковок, можно
вывести большое число разных структур. Некоторые детали та-
ких структур, основанных на двух- и трехслойных упаковках,
будут рассмотрены несколько ниже. В табл. 4.4 приведены при-
меры более сложных последовательностей в чередовании слоев.
В структурах сульфидов титана, включенных в эту таблицу,
осуществляются различные варианты чередования плотноупа-
кованных слоев (в дополнение к простой последовательности г
в структурах TiS и TiS2). В противоположность этому все суль-
фиды хрома Cr2S3, Cr5S6, Cr7S8 и Cr3S4 имеют простейшую —
гексагональную плотнейшую упаковку атомов серы с атомами
металла, различным образом и в разных пропорциях размещен-
ными по октаэдрическим пустотам.
4.1.10. Плотнейшие упаковки атомов двух сортов. При рассмот-
рении структуры KF (разд. 7.6) обсуждается вопрос, почему в
ней не реализуется КЧ 12, ожидаемое для упаковки шаров оди-
накового размера. Но вполне очевидно, что невозможно уложить
ионы двух сортов в плотноупакованном слое таким образом,
чтобы каждый ион был окружен только ионами противополож-
ного знака, ибо если шесть ионов X окружают ион А, то каждый
ион X будет иметь в своем окружении два иона X. Этого ослож-
нения нет, если все плотноупакованные атомы — анионы, как
это имеет место в гидроксогалогенидах. Одна из модификаций
Си(ОН)С1 содержит плотноупакованные слои, показанные на
рис. 4.15,а; во многих соединениях, имеющих в своем составе
близкие по размеру атомы двух видов, плотноупакованные слои
имеют состав АХ2 и АХ3. Слой АХ4 (рис. 4.15,(9) представляет
основу структуры MoNi4, а слой АХ6 (рис. 4.15,е) соответствует
расположению ионов К+ и F~ в структуре KOsF6.
Таблица 4.4. Примеры более сложны* последовательностей
плотноупакованных (ПУ) слоев
Число
слоев
в пери-
оде по-
вторяе-
мости
4
5
6
7
8
9
10
12
14
Обозначе-
ние
гк
ггккк
гкк
кгккккг
кккг
кгг
кггкг
ккггг
ккгг
^ггкггк
ПУ-слои ато-
мов X
La, Pr,
Nd, Am
HgBr2
Hgl2 (желт.)
Ti2S3
Cd(OH)Cl
Sm
M02S3
T14S5
Fe3S4
Ti5S8
ПУ-слои состав.-]
лх3 a
в. т.-ВаМпОз
TiNi3
Ba5Ta4015
VC03
CsMnF3
в. T.-K2(LiAl)F6
BaTiO3
BaTi5Oue
(см. текст)
Ti(Pto.g9Nio,,,K
Sr4Be2Sr0i2
BaPb3
в. т.-YAls
BaRuO3
CsCoF3
BaFelsO19B
BaCrO3
Ba4Re2Mg012
Ba6TiI7O40r
Ba(Pb08Tl0,2K
Л итература
Inorg. Chem., 1967, 6,
396
Acta cryst., 1962, 15, 179
Ada cryst., 1970, B26, 102
J. Chem Phvs., 1962, 37,
697
Acta cryst., 1954, 7, 33
Acta cryst., 1969, B25,
1444
Acta cryst., 1969, B25, 996
Inorg. Chem., 1965, 4.
zoo
Acta cryst., 1964, 17, 986
Acta cryst., 1967 23 729
. Solid Ctate Chem., 1970,
2, 188
Z. anorg. allg. Chem.,
1969. 369, 117
Z. Kristallogr., 1967, 125,
437
\mer. .Mineral., 1957 42,
309
Recueil des Travaux chi-
miques dcs Pays-Bas et
dc la Bclgique, 1966, 85,
ooy
Inorg. Chem., 1969 8,
286
Inorg. Chem , 1965 4,
235
\cta Crvst., 1970, B26,
1645
Acta crvst., 1970, B26,
653
ав. т. — высокотемпературная модификация. бДве трети слоев имеют состав ВаО7,
остальные — О8. в Каждый пятый слой имеет состав ВаОз, остальные — О, г Равное
число слоев ВаОц и Ва2О9 (в последнем случае — с вакансиями по О).
4.1. Периодические упаковки одинаковых шаров 197
На рис. 4.15,6 показан тот единственный вариант располо-
жения атомов в слое АХ2, при котором атомы А не касаются
друг друга. Слои такого типа обнаружены в структуре WA15, со-
держащей чередующиеся слои состава А13 и WA12, а также в
ряде силицидов с близкими структурами (т. 3, разд. 23.4).
На рис. 4.15,s и г изображены два простейших плотноупа-
кованных слоя состава АХ3, в которых атомы А не имеют взаим-
ных контактов. Они представляют основу трех типов соедине-
ний.
Рис 4 15 Плотноупакованные слон, образованные шарами двух типов: а —
АХ; б —АХ2; в и г — АХ3; д — АХ4; е — АХ6.
1. Интерметаллические соединения АХ3, например TiA'l3 и
ZrAl3, построенные на основе сверхструктуры от структуры А1,
содержащие соответственно слои типа в в T1AI3 и чередование
слоев в и г в ZrAl3. В структурах SnNi3 и TiNi3 имеются слои
типа г, причем закономерность чередования слоев выражается
символами г и гк соответственно.
2. Комплексные галогениды и оксиды с формулой А^ВДзх.
Образование многочисленных комплексных галогенидов, содер-
жащих ионы К+ и F" или Cs+ и С1~ в соотношении 1 : 3, обус-
ловлено тем фактом, что эти пары ионов имеют близкие разме-
ры и могут формировать плотноупакованные слои состава АХ3.
Аналогичным образом существует много комплексных оксидов,
в которых ион большого размера, например Ва2+, располагается
в плотноупакованных слоях МО3, тогда как меньшие по разме-
ру ионы второго металла занимают октаэдрические пустоты
между шестью атомами кислорода. Между двумя типами слоев
АХ3 на рис. 4.15 имеется существенное различие. При наложе-
нии слоев типа в нельзя добиться того, чтобы образовались
октаэдрические пустоты, окруженные шестью атомами X, и в то
же ^время чтобы атомы А не соприкасались друг с другом. По
этой причине слои типа в не встречаются в комплексных гало-
генидах и оксидах. Структуры соединений, основанные на плот-
198 4. Шаровые упаковки
4.2. ПУ-структуры с заполнением, тетраэдрических пустот
199-
ноупакованных слоях типа г, более подробно рассматриваются
в конце этой главы.
3. Гидроксогалогениды М2Х(ОНK. В структурах этих сое-
динений плотноупакованные слои содержат только анионы (га-
логен и гидроксил), так что ограничение на тип слоев, справед-
ливое для соединений, рассмотренных в п. 2, на гидроксогало-
гениды не распространяется. Более подробно эти соединения
описаны в гл. 10 (т. 2).
Рассмотрим теперь простые структуры соединений с форму-
лой МтХ„, в которых атомы X образуют плотнейшую упаковку,
а атомы М занимают часть тетраэдрических и (или) октаэдри-
ческих пустот. [Систематический обзор структур, построенных
из слоев АХ„, см. в Z. Kristallogr., 1967, 124, 104; Acta cryst.,
1968, В24, 1477.]
4.2. Плотноупакованные структуры с заполнением
тетраэдрических пустот
Прежде всего отметим два обстоятельства. Во-первых, обратим
внимание на то, что атомы, занимающие позиции плотнейшей
упаковки, не обязательно действительно плотно упакованы, т. е.
соприкасаются с 12 атомами того же сорта. Вообще одни лишь
координаты атомов в структуре МтХ„ описывают структуры не
полностью; дополнительно следует указывать, какие из атомов
кроме атомов А и X находятся в контакте друг с другом. Этот
вопрос более подробно обсуждается в гл. 6 на примере струк-
тур хлорида натрия и флюорита. Во-вторых, в галогенидах и
халькогенидах М.тХп с октаэдрической координацией ионов ме-
талла описание в рамках теории плотнейших упаковок дает
достаточно адекватное представление о структуре, тогда как
для «тетраэдрических» структур это не справедливо. Имеется
относительно немного соединений NlmXn с тетраэдрической коор-
динацией М и с плотной упаковкой атомов (ионов) X. Очень
мало, например, трехмерных структур МХ2. Тем не менее вполне
удобно описывать идеализированные структуры в терминах
плотнейшей упаковки атомов X с атомами М, занимающими
определенную часть тетраэдрических пустот (табл. 4.5). Общее
число тетраэдрических пустот вдвое больше, чем атомов в плот-
нейшей упаковке, вследствие чего заполнение всех тетраэдриче-
ских пустот отвечает формуле М2Х. В кубических плотноупако-
ванных структурах М2Х (структура антифлюорита) X окружен
¦8 атомами М, находящимися в вершинах куба (рис. 4.16,а). При
заполнении (упорядоченном) лишь 3/<ь '/г или '/4 всех тетраэдри-
ческих позиций координационное число атома X падает до 6, 4
или 2 соответственно. В этих случаях координационные группи-
ровки можно получить путем удаления соответствующего числа
атомов М из кубического координационного окружения на
рис. 4.16, а, переходя к группам, показанным на рис. 4.16,6—е.
Эти группы представляют расположение ближайших соседей:
а) анионов О~2 в Li2O (структура антифлюорита) или катионов
Са- в CaF2 (флюорит); б, в) двух сортов катионов Мп3+ в
Таблица 4.5. Плотпоупакованные структуры с заполнением
тетраэдрических пустот
Доля заня-
тых тетра-
эдрпчгскнх
пустот
Все
3А.
7-2
78
V3
7с
78
аСм.
Последовательность плотноупакованных слоев
Л В...
а
Вюртцит
Р-ВеО
Al2ZnS4
fS-Ga2S3
Y-ZnCl2
AI2B1-6
SnBr4
текст ниже.
ЛВС...
Li2O (антифлюорит)
O3Bi2 O6Sb4 O3Mn2
Цинковая обманка
PtS
PbO
Al2CdS4
Cu2HgI4
Y-Ga2S3
Hgl2 Znl2
SiS2
OCu2
ln2l6
Snl4
OsO4
Формула
M2X
M3X2
MX
M3X4
M2X3
MX2
MX3
MX4
КЧ
атомов
^v и л
4:8
4:6
4:4
4:2
4:1
Mn2O3; г) атомов Zn или S в ZnS (цинковая обманка); д) ато-
мов Pt в PtS; е) атомов РЬ в РЬО.
Это лишь чисто геометрическая трактовка по отношению к
катионам как плотноупакованным частицам (Са в CaF2 или Мп
в Мп2О3, Pt в PtS и РЬ в РЬО). Как отмечено в начале
разд. 6.4, описание структуры флюорита как кубической плот-
нейшей упаковки ионов Са2+ с ионами F~ в тетраэдрических
пустотах не дает реалистического представления о структуре,
поскольку F~ существенно больше по размеру, чем Са2+. Более
оправданно включение в табл. 4.5 соединений со структурой
антифлюорита, например соединений щелочных металлов с фор-
мулой М2Х (Х = О, S, Se, Те). В наиболее благоприятном случае
Li^Te положение атомов Те приблизительно соответствует плот-
нейшей упаковке, но в оксидах ионы О2~ отнюдь не упакованы
«лотнейшим образом. Достаточно сравнить расстояния О—О в
200 4. Шаровые упаковки
CaF,
Qo
Рис. 4.16. a—е-
Cu,0
-координационные группы в структурах, производных от
флюорита. Ниже — проекции структур.
1Л2О, Na2O и К2О C,27; 3,92 и 4,55 А) и удвоенный радиус иона
О2^ ( — 2,8А). Вполне очевидно также, что описание структуры
Мп2О3 как плотнейшей упаковки ионов Мп3+ так же нереалис-
тично, как для упаковки ионов Са2+ в CaF2; эта структура рас-
смотрена в разд. 12.2.8 (т. 2).
Перейдем теперь к разбору некоторых других особенностей
тетраэдрических структур.
4.2. ПУ-структцры с заполнением тетраэдрических пустот 205
1 В кубических структурах CaF2 (и Li2O) и ZnS позиции
атомов точно соответствуют расположению в кубической плот-
пейшей упаковке и положениям определенной части тетраэдриче-
ских пустот. В PtS и РЬО это не так. В «идеальной» структуре
PtS (PcIO) с КПУ атомов металла атомы S должны находиться
в тетраэдрических пустотах правильной формы, а четыре атома
серы должны координировать атом Pt в виде плоского прямо-
угольника с отношением сторон Y2: 1. При деформации струк-
туры до тетрагональной с отношением с: а = у2 координационная
группа вокруг металла становится квадратной. Реальная струк-
тура является промежуточной с отношением с:а=1,24. Анало-
гичным образом структура РЬО не содержит идеальной КПУ
атомов РЬ; она тетрагональная с с:а=1,25, что представляет
собой компромисс между кубической (с: а=1) и тетрагональ-
ной (с:а = У~2) структурами, причем в последней упаковка ато-
мов РЬ является объемноцентрированной кубической. Структура
РЬО и подобные ей структуры более подробно рассматриваются
в разд. 6.7.1.
На рис. 4.16 показаны геометрические соотношения между
структурами, получающимися из структуры флюорита при уда-
лении от 7г ДО 3А тетраэдрически координированных атомов,
причем во всех случаях расположение атомов представлено в
рамках кубической элементарной ячейки флюорита. Простей-
шая из возможных в этой группе слоистых структур МХ2 с ато-
мами, расположенными в каждой ячейке в позициях аа, неиз-
вестна. Однако ее разновидность с удвоенным параметром с и
занятыми в нижней половине ячейки позициями типа а, а в верх-
ней— типа Ь соответствует структуре красной модификации
Hgl2. Другой тип МХ2-структуры на рис. 4.16 —куприт (Си2О) —
характеризуется наличием линейной конфигурации связей ато-
ма меди (большие кружки). Для этой структуры обычно выби-
рается элементарная ячейка, показанная более жирной штри-
ховой линией. Среди структур неорганических соединений с фор-
мулой МХ2 она уникальна тем, что состоит из двух одинаковых
взаимопроникающих каркасов, не связанных между собой свя-
зями Си—О.
2. Обратим внимание на то, что структуры, отмеченные в
табл. 4.5 знаком сноски, реально не существуют. Гипотетическая
структура с заполнением всех тетраэдрических пустот в гекса-
гональной плотнейшей упаковке (ГПУ) показана на рис. 4.17, а.
Если атомы, образующие плотнейшую упаковку (ПУ), занимают
) то к00РДинаты атомов в пустотах будут
позиции —i "з~ ~з~~4~
I T T
3 з ~ '
±
2 1 \
jj ; эти атомы образуют пары на рас-
202 4. Шаровые упаковки
¦стоянии всего с/4, где с/2 соответствует расстоянию между
слоями ПУ. Другими словами, в этом случае в структуре суще-
ствовали бы пары тетраэдров с общей гранью, как это можно
видеть из рис. АЛА,г. Такое же чрезмерно близкое соседство
атомов в пустотах получилось бы и при упаковке типа ABAC....
¦Однако в КПУ структуры антифлюорита этого уже нет, как
видно из рис. 4.17,6, на котором выделена гексагональная эле-
ментарная ячейка этой кубической (трехслойной) структуры.
U Т |
Рис. 4.17. Тетраэдрические пустоты (маленькие кружки) в плотноупакованных
структурах (а, б— см. текст).
Чрезмерная близость атомов в пустотах в ГПУ сохраняется и
для соединений состава М3Х2, где заполняется 3/4 всех тетраэдри-
ческих пустот, но при заполнении '/г пустот ее можно уже избе-
жать, как, например, в структуре вюртцита. С другой стороны,
в случае четырехслойной упаковки ABAC... возможно заполне-
ние и 3/4 тетраэдрических пустот без того, чтобы обязательно
образовывались пары слишком близко расположенных атомов
(тетраэдры с общими гранями). Такая структура обнаружена
у высокотемпертурной модификации Be3N2 (см. т. 2, гл. 18,
разд. «Ионные нитриды»), в элементарной ячейке которого две
группы тетраэдрических позиций заняты полностью, а третий
атом бериллия рассредоточен по двум взаимоисключающим
тетраэдрическим позициям.
3. Теперь перейдем к тетраэдрическим слоистым структурам.
Две структуры на рис. 4.16—LiOH(OPb) и Hgl2 — являются
слоистыми, причем LiOH — просто часть антифлюоритной струк-
туры Li2O. Эти две структуры получаются из кубической плот-
нейшей упаковки путем заполнения соответственно 7г и lU
тетраэдрических пустот, но в обеих структурах плоскости слоев,
показанных на рис. 4.16, наклонены по отношению к плотноупа-
.кованным слоям. (Изображение слоев в Hgl2 дано на рис. 5.6.)
4.2. ПУ-структуры с заполнением, тетраэдрических пустот 203
Важные типы октаэдрических слоистых структур АХ2 и АХ3
образуются при заполнении всех или соответственно двух тре-
тей октаэдрических пустот, расположенных между ПУ-слоями
через один (далее по тексту: чередующимися парами ПУ-слоев).
По аналогии можно было бы ожидать, что существуют слоистые
структуры, в которых заняты часть или все тетраэдрические
пустоты, также расположенные между чередующимися парами
ПУ-слоев. Заполнение всех тетраэдрических позиций между
двумя ПУ-слоями дает двойной слой состава MX, в котором
(о; (о;, (р/
Рис. 4.18. а — два плотноупакованных слоя атомов X с атомами М во всех
тетраэдрических пустотах между ними (состав MX); б— два плотноупакован-
ных слоя атомов X с атомами М, занимающими половину тетраэдрических пу-
стот (состав МХ2).
каждый тетраэдр МХ4 имеет три общих ребра с тремя другими
тетраэдрами, кроме того, тремя вершинами он соприкасается
с еще шестью тетраэдрами (рис. 4.18, а). Однако для структур
LiOH и ОРЬ предпочтительным оказалось слоистое строение с
квадратными сетками, в которых каждый тетраэдр Li(OHL или
ОРЬ4 имеет по 4 общих ребра (разд. 3.10). В структурах
La2O3(Ce2O2S) и U2N2Sb (т. 3, разд. 28.2.5) обнаружены двой-
ные слои с частичным и полным заполнением тетраэдрических
пустот.
При симметричном заполнении половины пустот между пара-
ми ПУ-слоев образуются пакеты с составом МХ2. В таком па-
кете (рис. 4.18,6) каждый тетраэдр МХ4 имеет общие вершины
с тремя другими тетраэдрами, а четвертая вершина свободна,,
так что половина атомов X связана эквидистантно с тремя ато-
мами М, а другая половина — только с одним атомом М. Воз-
можно, что именно по этой причине галогениды и оксиды не
лают таких структур, но в молекулярных структурах, например
в А12Вг6, подобный тип неэквивалентности ПУ-атомов неизбе-
жен. В кристаллах этого соединения заняты пары соседних
тетраэдров, отмеченных квадратиками на рис. 4.17, а, что при-
водит к образованию дискретных молекул А12Вг6, состоящих из
204 4. Шаровые упаковки
0 W
Рис. 4.19. Два слоя АХ2, основанные на плоских сетках типа б3 (а) и 4, 82 (б),
полученные заполнением половины тетраэдрических пустот между двумя плот-
ноупакованными слоями атомов X. а — топологическое изображение, (слева) и
два кольца из шести тетраэдров (справа). Показаны (крупными кружками)
только атомы нижнего слоя плотнейшей упаковки. Атомы в тетраэдрических
пустотах на двух уровнях обозначены светлыми и темными малыми кружками;
жирные сплошные и штриховые линии на рис. а (слева) и б соединяют ато-
мы А верхнего и нижнего уровней соответственно.
двух тетраэдров А!1Вг4, соединенных по ребру. Одна треть
;ПУ-атомов Вг координирована двумя атомами А1, а две трети —
одним атомом (рис. 9.5, т. 2). Слои, очень сходные с показан-
ными на рис. 4.18,6, имеются в структуре А1ОС1 (и GaOCl), но
.здесь нет двух ПУ-слоев. Схема сочленения тетраэдров та же,
но половина вершин тетраэдров (концевых атомов X) находится
;по другую сторону от слоя ПУ-атомов X (см. рис. 10.16, т. 2).
Имеются, однако, еще два способа заполнения половины
тетраэдрических пустот между двумя шютноупакованными
4.3. НУ-структуры с атомами в октаэдрических пустотах 205
слоями, причем образующийся слой можно рассматривать как
т'етраэдрический аналог слоя в структуре Cdl2. Каждый тетраэдр
М\4 имеет одно общее ребро и две общие вершины, давая
структуру с координацией 4:2. Так как каждая группа МХ4
соединена с тремя другими, получается слой, основанный на
трехсвязной плоской сетке. По-видимому, единственно возмож-
ные типы слоев имеют сетчатое строение вида б3 пли 4,82; в
последнем случае это одна из трех возможных полуправильных
плоских сеток (рис. 4.19). Существуют слои сходного строения
с плоскими полуправильными сетками двух других типов 3, 122
и 4,0, 12, по в них занято соответственно только 2/з или 3/4 пози-
ций в ПУ-слоях атомов X. Для этих вариантов примеров, по-
видимому, нет, тогда как структура GaPS4 (рис. 4.19,6) содер-
жит слои типа 4,82. Интересно, что одна из модификаций GeS2
имеет тетраэдрическую слоистую структуру более сложного
вида; у половины тетраэдров GeS4 все вершины общие, а у
другой половины — общие две вершины и одно ребро; поэтому
такой слой построен на C,4)-связанной сетке и не является
слоем плотнейшей упаковки, что показано в разд. 5.2.1.
В заключение отметим, что в рамках гексагональной плот-
нейшей упаковки не может существовать аналога структуры
S1S2. Бесконечная цепочка тетраэдров МХ4, соединенных через
противоположные ребра (что соответствует формуле МХ2), не
может быть реализована в гексагональной плотнейшей упаков-
ке, потому что в ней нет тетраэдрических позиций, отмеченных
значком х па рис. 4.17, а. Такое расположение осуществляется
лишь в кубической плотнейшей упаковке, что видно из сравне-
ния рис. 4.17,6 и а. Заполнение '/4 тетраэдрических пустот в
КПУ атомов (как показано на рис. 4.17,6) приводит к образо-
ванию пепей тетраэдров, соединенных противоположными реб-
рами.
4.3. Плотноупакованные структуры с атомами
в октаэдрических пустотах
Наиболее важные структуры этого типа представлены в
табл. 4.6. Взаимосвязь между этими структурами можно проил-
люстрировать двояким образом: а) можно рассмотреть способы,
которыми из структуры MX, где заполнены все пустоты, удаля-
ется определенная часть атомов М, б) можно сконцентрировать
внимание на взаимном расположении позиций, занятых атома-
ми М между слоями плотнейшей упаковки.
а) Примерами структур с гексагональной и кубической плот-
пейшими упаковками являются NiAs и NaCl, в которых атомы М
имеют соответственно тригонально-призматическое и октаэдри-
ческое окружение атомами X. Особенность структуры NiAs сое-
206
4. Шаровые упаковки
Таблица 4.6. Плотноупакованные структуры с заполнением
октаэдрических пустот
Доля заня-
тых окта-
эдрических
пустот
Все
7з
726
7з
74
Последовательность плотноулановашш.х слоен
ЛВ...
NiAsa
а-А12О3
LiSbO3
Cdl2
ЛВС...
NaCl
*
Слоистые структуры
CdCl2
Каркасные структуры
CaCl2
Рутил Атакамит
NiWO4 Анатаз
а-РЬО2
а-АЮ(ОН)
Zrl3
Bil3
RhF3
IrF4
a-NbI4
Nb2Cll0
Ru4F2)
k-WC16
Цепочечные структуры
—
Слоистые структуры
YC13
Каркасные структуры
(каркасы.)
NbF4 (слоист.)
(цепочечн )
j (молекул.) ^2о р° J (молекул.)
UF5 (цепочечн.)
Форму-
ла
Л1Х
М2Х3
MX,
мх3
мх4
мх5
мх6
кч
атомов
М и X
6:6
6:4
6:3
6:2
[ 6:2
i 6:1
1 6:2
i 6:1
6:1
О структурах, промежуточных между NiAs и Cdl2 (С 6), см. т. 2, гл. 17 (структу-
ры сульфидов хрома и NiAs).
"О других структурах, в которых заполнена половина октаэдрических пустот в
слоях ПУ с формулой XY3, см. гидроксогалогениды МгХ(ОНЬ, а также табл. 10.13.
в Другие структуры, в которых заполнено '/,, Че или Vs октаэдрическич пустот
в ПУ-слоях АХз, см. разд. 4.6, а также табл. 4.10.
тоит в близком расположении друг к другу атомов Ni, что за-
ставляет предполагать наличие прямого взаимодействия между
атомами металла (по крайней мере в некоторых соединениях,
имеющих такую структуру и не являющихся ионными). В струк-
туре самого NaCl ионы С1" не соприкасаются, так как ионы Na+
слишком велики, чтобы занимать октаэдрические пустоты в
плотнейшей упаковке ионов С1~. Эти ионы соприкасаются в
4.3. ПУ-структуры с атомами з октаэдрических пустотах 201
структуре
LiCl;
сравним
С1—С1
С1-С1
в
в
NaCl
LiCl
3,
з,
99А
бзА
Поэтому более логично было бы назвать структуру MX с куби-
ческой плотнейшей упаковкой структурой типа LiCl, но посколь-
ку она уже широко известна как структура типа NaCl, то и мы
будем придерживаться этого названия.
При упорядоченном удалении из этих структур части ато-
мов М число соседей атома X становится меньше шести. Напри-
мер, если из структуры NiAs удалить половину атомов Ni, то
,Л
Рис. 4.20. Тригонально-призматическая и октаэдрическая координационные
группы.
каждый из плотноупакованных атомов (As) будет окружен тре-
мя соседними атомами (Ni); это можно сделать тремя различ-
ными способами (рис. 4.20, а), сохранив лишь атомы:
1) abc, пирамидальное окружение с углами между связями
90°,
2) abf, почти плоское окружение с углами между связями
90 и 132° (два угла);
3) abd, пирамидальное окружение с углами между связями
70, 90 и 132°.
Случай C) неизвестен; случай A) соответствует структуре
Cdl2 (С6). На рис. 4.21, а показана проекция структуры NiAs
(вдоль оси а), на которой меньшие по размеру кружки соответ-
ствуют рядам атомов Ni, перпендикулярным плоскости бумаги.
При удалении рядов, показанных пунктиром [что отвечает слу-
чаю B)], получается структура МХ2, в которой атомы X окру-
жены почти компланарно тремя атомами М. Такова структура
СаС12. Небольшое смещение положений плотноупакованных ато-
мов приводит к структуре рутила (рис. 4.21,6), в которой атомы
X имеют по три компланарных соседа. Структура спроектиро-
вана вдоль тетрагональной оси с, т. е. параллельно цепочкам
октаэдров, показанных на рис. 4.21, в.
Подобным же образом при удалении половины атомов М из
структуры NaCl атом X остается в окружении трех соседей,
Рис. 4.21. Соотношение между структурами NiAs и рутила (см. текст).
S
"$Т
Рис. 4.22. Структуры, геометрически связанные
со структурным типом NaCl: a) CdCl2, б) ата-
камит Си2(ОНKС1, в) анатаз ТЮ2. Ионы ме-
талла, удаляемые из структуры NaCl, показаны
пунктирными кружочками.
4.3. ПЬ'-структуры с атомами в октаэдрических пустотах 209
расположенных в трех вершинах октаэдра в одной из комбина-
ции lnm или klm на рис. 4.20, б. Наиболее простой способ полу-
чить пирамидальное окружение атома X соседями (lmn) —
удалить каждый второй слой атомов М, параллельный плоско-
сти A11), чт0 приводит к слоистой структуре типа CdCl2
(рис. 4.22,а). Другой путь — удалить чередующиеся ряды ато-
мов М, как показано на рис. 4.22, б. Интересно отметить тот
факт, что по этому типу не кристаллизуется ни один дигалоге-
нид, хотя окружение атомов М (октаэдрическое) и X (пирами-
дальное) точно такое же, как в структуре CdCl2. Рис. 4.22,6
соответствует, однако, идеализированной структуре атакамита
Си2(ОНKС1, в которой в трех четвертях позиций атомы X за-
мещены на ОН-группы.
Компланарное расположение соседей типа klm на рис. 4.20, б
получается при удалении половины ионов Na+ из структуры
NaCl способом, показанным на рис. 4.22, в, что вызывает необ-
ходимость в удвоении параметра с гексагональной ячейки. Кон-
фигурация ближайших соседей типа klm не очень подходит для
типично ионных кристаллов. Однако при небольшом смещении
позиций атомов окружение вокруг атома X становится почти
равносторонним треугольником. Гипотетическая структура с
КПУ имела бы с = 2а и 2=1/4; в анатазе, одной из модификаций
ТЮ2. г:а = 2,51 и zo = 0,21.
б) При другом подходе можно рассмотреть способы запол-
нения определенной части октаэдрических пустот в каждом ти-
пе плотнейшей упаковки. Имеются четыре варьируемых пара-
метра, которые, однако, не все независимы друг от друга (см.
ниже, в п. 4): 1) последовательность слоев плотнейшей упаков-
ки; 2) степень заполнения позиции между парами слоев; 3) раз-
личные мотивы' расположения позиций при заданной степени
заполнения; 4) возможность трансляции групп атомов М, рас-
положенных между парой ПУ-слоев относительно аналогичной
группы атомов М, расположенных между последующей парой
ПУ-слоев.
1) Последовательность чередования слоев плотнейшей упа-
ковки уже рассматривалась.
2) Определенный состав соединения обусловливает заполне-
ние некоторой части общего числа октаэдрических позиций, на-
пример половины для МХ2. Этого можно достичь путем запол-
нения всех позиций между чередующимися парами ПУ-слоев,
половины позиций между каждой парой слоев или чередова-
нием заполнения '/з и 2/з или lU и 3Д позиций между следующи-
ми друг за другом слоями и, разумеется, другими сложными
чередованиями заполнения.
Эти возможности схематически показаны на рис. 4.23 вместе
с некоторыми простыми схемами заполнения для составов М2Ха
14—752
210 4. Шаровые упаковки
1
2
7
2
1
2
I
2
1
3
2
3
7
3
2
3
7
4
4
7
4
3
4
7
3
1
3
1
3
7
3
2
3
n
2
3
Q
СсИ2(г) СаС1г(г) ?-Fe2N(a) Сиг@НKСКк) RhF3(s) 8il3 Сг)
CdCl2U)
YC13(K>
MX,
MX7
2
3
2
3
2
3
-Л/203(г) N
7
7
2
7
z"
Ti
МгХл
7
7
3
7
7
z e3 гг«
1
1
0
1
7
0
i2Se3
Рис. 4.23. Доля октаэдрических пустот, занятых между слоями плотнейшей
упаковки (ПУ) в соединениях с формулами МХ2, МХ3 и iM2X3. После каждой
формулы приведена последовательность чередования слоев ПУ.
и МХ3. Наверху рис. 4.23 представлены две простые слоистые
структуры, в которых атомы металла располагаются только
между чередующимися парами ПУ-слоев атомов X. Заметим,
что простая слоистая структура для плотноупакованной октаэд-
рической структуры M^M.V невозможна, если x:y>lj2 (напри-
мер, для М3Х4 или М2Х2), так как уже при отношении х : у, рав-
ном '/г, заполняются все октаэдрические пустоты между чере-
дующимися парами ПУ-слоев. Можно показать, что вообще
если атом М должен иметь КЧ 4, а атом X — К.Ч 6, то для соста-
ва М2Х3 невозможно построить двумерную периодическую систе-
му; простой октаэдрический слой М2Х3 представляет собой част-
ный случай более общих топологических ограничений. Bi2Se3
дает пример более сложной слоистой структуры.
4.3. ПУ-структуры с атомами в октаэдрических пустотах 211
3) На рис. 4.24 показаны различные способы заполнения
определенной части октаэдрических пустот между слоями плот-
нейшей упаковки.
В структурах СаС12 и рутила (искаженная ГПУ) заполнена
половина пустот между каждой парой слоев: между одной па-
рой в позициях а и между соседней парой'—в позициях а'; в
структурах а-РЬО2 (ГПУ) и анатаза (искаженная КПУ) анало-
гичным образом заполнены позиции Ь и Ъ'\ в |-Nb2C (ГПУ) —•
е'0/2)
Рис. 4.24. Мотивы заполнения октаэдрических позиций между двумя слоями
плотнейшей упаковки (см. текст).
позиции с и с'; в атакамите Си2(ОНKС1 (КПУ) —позиции d и
d'\ в e-Fe2N (ГПУ) —позиции е и е'.
Заполнение позиций d или е между чередующимися парами
слоев приводит к слоистым структурам d—Nb3Cl8 и е — Bil3
(ГПУ), OTi3 (ГПУ), YC13 (КПУ).
Позиции типа d' заняты между всеми парами слоев в струк-
туре IrF4; позиции е — в а-А12О3; позиции е' — в ряде структур
МХ3, обсуждаемых ниже; позиции / — в LiSbO3.
4) Очевидно, что сведения о чередовании слоев плотнейшей
упаковки и о двумерном мотиве занятых позиций (например,
одна из систем черных кружков на рис. 4.24) еще недостаточны
для описания структуры, поскольку остается неопределенным
взаимное смещение мотивов из атомов металла по отношению
к некоторой фиксированной системе отсчета. Например, комби-
нируя позиции типа е' между каждой парой слоев ПУ, можно
построить неопределенно большое число различных структур.
Но если ограничиться случаем одинакового смещения мотивов
14*
212 4. Шаровые упаковки
t
к
В —
О О
о о
_6 о
OAI
«-АШ,
Рис. 4.25. Разрез структу-
ры с ГПУ.
расположения атомов металла в соседних парах слоев, то полу-
чится всего три варианта простых структур. С использованием
моделей легко проверить, что в этих трех типах структур у ок-
таэдров МХ6 общими являются либо две противоположные гра-
ни (структура Zrl3), либо все вершины (структура RhF3), либо
ава противоположных ребра и две противоположные вершины.
В первых двух структурах реализуется гексагональная плотней-
шая упаковка атомов X, а в третьей—К.Г1У, что иллюстрирует
положение о зависимости между п. 1 и 4. В этой связи интересно
отметить, что не существует структур, топологически аналогич-
ных RhF3, но не с ГПУ, а с КПУ (в струк-
туре ReO3 атомы кислорода занимают
лишь 3/4 позиций кубической плотней-
шей упаковки).
Для более детального описания
структур с плотнейшей упаковкой удобно
давать схемы, подобные показанной на
рис. 4.25, где структура рассматривается
зо стороны стрелки, указанной на рис.
4.24, е. Отметим, что при этом сама плос-
кость схемы не перпендикулярна стрел-
ке, а пересекает плоскость чертежа рис.
1.24, е по линии ху. В корунде (а-А12О3)
мотив заполнения позиций атомами А1
соответствует черным кружочкам на рис. 4.24, е. Если между
некоторой заданной парой слоев заняты позиции, обозначенные
как 1 и 2 (и все остальные им эквивалентные, отвечающие всем
черным кружочкам), то позиции, занимаемые в соседних слоях
ГПУ, будут 2 и 3, 3 и 1 и т. д. Схема, показанная на рис. 4.25,
дает представление как о последовательности слоев, так и о мо-
тиве расположения атомов металла. Сверхструктура от структу-
ры корунда в соединениях FeTiO3 и LiNbO3 показана на рис. 6.19.
В гл. 5 рассмотрены способы конструирования структур из
октаэдрических групп путем их соединения через вершины, реб-
ра и грани (и их комбинации). В связи с этим полезно сопоста-
вить такой метод описания структур с их описанием в терминах
плотнейшей упаковки анионов. С этой целью на рис. 4.26 даны
оба типа представления структуры анатаза, которые следует
сопоставить также с рис. 4.22, в. Укажем, что на рис. 4.26, а дана
проекция в направлении, перпендикулярном слоям ПУ, которые
параллельны плоскости типа XYZ на рис. 4.22,6.
Наличие у октаэдров общих вершин, ребер или граней зави-
сит не только от мотива расположения занятых октаэдрических
позиций между двумя слоями ПУ, но также от взаимного рас-
положения занятых позиций между соседними парами слоев.
Так, например, заполнение позиций е' на рис. 4.24 в пределах
4.3. ПУ-структуры с атомами в октаэдрических пустотах 213
одной пары слоев дает изолированные октаэдры, но в трехмер-
ной структуре (RhF3), характеризующейся повторением подоб-
ного мотива заполнения пустот, октаэдры уже соединены через
вершины. С другой стороны, заполнение более чем одной трети
октаэдрических позиций между двумя слоями ПУ неизбежно
а
Рис. 4.26. Структура анатаза, представленная: а — в виде структуры с шгот-
исйшен упаковкой; б — как совокупность октаэдров, сочлененных по ребрам.
На рис. а числа слева указывают положение атомов О в нижнем A) и после-
дующих B, 3) слоях; числа около атомов Ti (обозначенных кружками меньше-
го размера справа) соответствуют слою ПУ, выше которого эти атомы рас-
положены.
связано с наличием у октаэдров общих ребер (в пределах этого
двойного слоя). Схемы по типу рис. 4.25 дают возможность сра-
зу же определить тип сочленения октаэдров друг с другом —
вершинами, ребрами или гранями, что поясняет рис. 4.27. За-
метим, что из-за наличия тригональной симметрии случаи а и б
а б в
Общая вершина Общее ребро
Общая грань
Рис. 4.27. Сочленение октаэдров через вершины, ребра или грани при изобра-
жении по типу схемы рис. 4.25.
на рис. 4.27 отвечают сочленению сразу через три вершины или
через три ребра.
4.3.1. Некоторые родственные структуры с формулами МХ2,
ММ'Х4 и МгМ'Хб. Любая из структур АтХ„, в которой атомы А
занимают некоторую часть октаэдрических пустот в совокупно-
214 4. Шаровые упаковки
сти плотноупакованных атомов X, потенциально является осно-
вой для описания более сложных структур, как мы уже убеди-
лись на примере структур FeTiO3 и LiNbO3, в которых атомы
двух типов занимают позиции атомов А1 в структуре корунда
(рис. 4.25). Существует очень много комплексных галогенидов
и оксидов, содержащих катионы двух или более типов с близ-
кими радиусами и поэтому способных занимать одинаковые (на-
пример, октаэдрические) пустоты в структурах с плотнейшей
упаковкой (табл. 4.7). Если атомы МиМ'в ММ'Х4 или М2М'Х6
Таблица 4.7. Соотношения между структурами с гексагональной
плотнейшей упаковкой
Мотив заполнения
октаэдр ичаских
пустот (рис. 4.24)
Доля заполненных
позиций между по-
следовательными
ПУ-слоями
МХ2
ММ'Х4
М2М'Х6
(а) (а')
V»
Рутил
MgUO4
Трирутил
ZnSb2O8
(Ь) (Ь;)
V*
а-РЬО2
NiWO4
Ниобит
(Fe,Mn)Nb2O6
'М (С)
2/з 7з
e-Fe2N
—
Li2ZrF6
Li2Nb0F5
—
4/95/S
Na2SiF6
NiU2O6
занимают те же позиции, что М в МХ2, то такие более сложные
структуры могут быть описаны как сверхструктуры от простой
структуры МХ2. Например, структуры MgUO4 и ZnSb2O6 оказы-
ваются родственными структуре рутила. «Трирутиловую» струк-
туру ZnSb2O6 и другие комплексные оксиды иллюстрирует
рис. 4.28, а, который очевидным образом соотносится с рис. 4.24, а.
Известно также несколько типов сверхструктур от структуры
а-РЬО2. В №WC>4 октаэдрические пустоты между чередующими-
ся слоями ПУ (как в а-РЬО2) занимают атомы Ni и W, а в
структуре колумбита (ниобита) осуществляется более сложный
тип замещения:
Pb; Pb; Pb; Pb Ni; W; Ni; W
Fe Fe
; Nb; Nb; ; Nb; Nb
Mn Mn
Различные типы сверхструктур от структуры сс-РЬО2 пред-
ставлены на рис. 4.24,6 — г. Такой способ изображения структур
с гексагональной плотнейшей упаковкой достаточен только в
том случае, если расположение атомов металла повторяется с
интервалом в два слоя. В NaNbO2F2 (в) период повторяемости
составляет четыре слоя. На рисунке показано строение двух
смежных слоев; в структуре двух последующих слоев атомы Na
4.3. ПУ-структуры с атомами в октаэдрических пустотах_
215
Zn,2Sb
Na Ti
Na Ti
NaNb
Рис 4 28 Структуры с гексагональной плотнейшей упаковкой: a) ZnSb2Cy,
б) XiWCV, в) "NaNbO2F2; г) Fe2WO6; д) a-NaTiF4; e) Li2ZrF6; ж) Na2SiFf,
Белые и черные кружки обозначают атомы М и М', находящиеся в октаэдри-
чеекпх пустотах гексагональной ПУ атомов X. Светлые и темные октаэдры со-
держат катионы на высоте 0 и с/2. Схемы, приведенные справа от каждого
рисунка, указывают тип атомов, находящихся между последовательными па-
рами слоев ПУ.
216 4. Шаровые упаковки
и Nb меняются местами. Другие способы заполнения половины
октаэдрических пустот, обнаруженные в структурах a-NaTiF4,
Li2ZrF6 и Na2SiF6, показаны на рис. 4.28,C — ж соответственно.
4.4. Плотноупакованные структуры с атомами
в тетраэдрических и октаэдрических пустотах
Мы уже отмечали, что в гексагональной плотнейшей упаковке
все тетраэдрические пустоты не могут быть заполнены из-за
того, что они расположены слишком близко друг к другу. В ку-
бической ПУ это возможно, и если заняты все тетраэдрнческие
и октаэдрические пустоты, то возникает расположение атомов,
показанное на рис. 9.7 (т. 2), на котором маленькие кружочки
соответствуют атомам ПУ, а большие кружочки, пустые и за-
штрихованные,— соответственно атомам в тетраэдрических и
октаэдрических пустотах. Этот способ заполнения реализуется в
структуре BiLi3 и в ряде других интерметаллнческих соединений.
Итак, одна треть атомов Li находится в октаэдрических пусто-
тах и две трети — в тетраэдрических пустотах кубической ПУ
атомов Bi, и, следовательно, атомы лития Lii имеют по 6, а
Lin — по 4 соседних атома Bi; однако эти атомы Bi не являются
ближайшими соседями или единственными из находящихся на
равных расстояниях от Li. В действительности каждый атом Li
имеет кубическое окружение восемью ближайшими соседями:
, • ( 8Lijj (куб) на расстоянии а 1/3/4
1 I 6Bi (октаэдр) на расстоянии а/2
DBi (тетраэдр) ) ,-
LiTT { > на расстоянии а 1/3/4
II\4LiI (тетраэдр) ) v '
Поэтому эта структура восьмикоординационная и рассматрива-
ется вместе с NaTl и сходными структурами в гл. 29 (т. 3).
Только в структурах, в которых заполнена лишь небольшая
часть пустот обоих типов, может оказаться, что атом в тетра-
эдрической (октаэдрической) пустоте имеет в качестве ближай-
ших соседей только 4 F) атома плотнейшей упаковки. Это спра-
ведливо, например, для структур шпинели и оливина (табл. 4.8).
Структура Co9S8 очень близка к структуре шпинели. Последняя
содержит в кубической элементарной ячейке 32 ПУ атома О.
В структуре Co9S8 имеются 32 ПУ-атома S, а также 4 атома Со
в октаэдрических и 32 атома Со в тетраэдрических пустотах.
Для сравнения укажем, что в кубической элементарной ячейке
C03S4 с несколько искаженной структурой шпинели также име-
ются 32 атома S, но в октаэдрических пустотах находится 16 ато-
мов Со, а в тетраэдрических — 8. Структура шпинели подробно
разбирается в разд. 13.5.1 (т. 2); структуру оливина см. в на-
чале разд. 13.5. В более полной форме часть табл. 4.8 можно
4.5. Другое представление плотноупакованных структур 217
Таблица 4.8. Тетраэдрическая и октаэдрическая
координации в структурах с плотнейшей упаковкой
Доля заполненных пустот
тетраэдри-
ческих
Ve
'/»
•А
V.
.V»
•А
октаэдри-
ческих
'/8
'/в
•А
Ч*
'А
'А
Кубическая ПУ
Сг5О12
MgAl2O4
(шпинель)
CrVO4
CogSg
P-Ga2O3
Гексагональная ПУ
А12СоС18
Mg2Si04
(оливин)
CrPS4
найти в разд. 17.1.7 (т. 2), где описан ряд структур сульфидов.
В гл. 5 мы перечисляем некоторые структуры (не обязательно
плотноупакованные), в которых атомы одного и того же эле-
мента имеют и тетраэдрическую, и октаэдрическую координа-
цию.
4.5. Другое представление плотноупакованных структур
До сих пор особое внимание при описании структур уделялось
координации атомов, занимающих пустоты в плотнейшей упа-
ковке. За исключением нескольких «тетраэдрических» структур
соединений М2Х и М3Х2 (табл. 4.5), в пустотах находились ато-
мы металла, тогда как плотнейшую упаковку образовывали
анионы. Как будет показано позже, для ряда структур опреде-
ляющим фактором является в большей степени окружение анио-
Рис. 4.29. Полиэдрические области для гексагональной (а) и кубической (б)
плотнейших упаковок; выделены шесть позиций с октаэдрической координацией,
окружающих шар плотнейшей упаковки. Остальные вершины области соответ-
ствуют тетраэдрическим позициям.
218 4. Шаровые упаковки
нов, чем катионов. Этому соответствует и другое представление
структур с плотнейшей упаковкой.
При описании ОЦК-структуры в разд. 4.1.2 мы указали, что
при представлении структуры с помощью полиэдрических обла-
стей Дирихле пустоты находятся в вершинах этих областей.
Областям Дирихле для гексагональной ПУ и кубической ПУ
соответствуют полиэдры, изображенные на рис. 4.29. Они и слу-
Таблица 4.9. Представление ПУ-структур с помощью
полиэдрических областей
Структуры с гексаго-
нальной ПУ (рис. 4.29,а)
Структуры с кубической
ПУ (рис. 4.29,6)
кч
ПУ-
атома X
6
4
3
2
6
4
3
2
Номер
заполненных
вершин
1 2
2
B
1
2
2
1 2
2
1
ll
(
U
3 4
3 4
4
4
3 4
4
4
4
4
5
5
5
5
5
5
5
5
5
6
6
6
6
6
6
6
6
6
6
Структура MX?i
NiAs
а-А12О3
CaCl2
Cdl2
RhF3
Zrl3
Bil3
NaCl
Sc2S3
CdCl2
TiO2 (анатаз)
YC13
ReO3
жат основой для другого представления относительно простых
ПУ-структур (особенно бинарных соединений). Восемь вершин,
в каждой из которых пересекаются три ребра, являются тетра-
эдрическими пустотами; шесть вершин, в которых пересекаются
по четыре ребра,-—октаэдрическими пустотами. В табл. 4.9 ука-
заны номера октаэдрических позиций, заполненных в некоторых
простых структурах; ПУ-структуры, в которых заняты тетраэд-
рические или одновременно и тетраэдрические, и октаэдрические
позиции, могут быть представлены аналогичным образом (см.,
например, J. Solid State Chem., 1970, 1, 279).
4.6. Структуры, построенные из плотноупакованных слоев АХ3
Выше уже указывалось, что пары ионов, имеющих близкие
размеры, могут совместно образовывать ПУ-слой состава АХ3
и что в комплексных галогенидах и оксидах АхВуХз* был обна-
ружен лишь один из двух возможных типов АХз-слоев, в кото-
рых атомы А не соприкасаются друг с другом. Эти слои
4.6. Структуры, построенные из плотноупакованных слоев АХ3 219
(рис. 4.15, г) могут быть уложены в плотнейшую упаковку, в
которой имеются октаэдрические пустоты Х6 и в то же время
ионы А не соприкасаются друг с другом. На рис. 4.30 показаны
два таких слоя и позиции с октаэдрической координацией, пред-
назначенные для атомов В, расположенных между слоями. Чис-
ло этих Х6-пустот равно числу атомов А в структуре. В струк-
турах комплексных галогенидов и оксидов все или часть этих
позиции могут быть заняты катионами В, несущими заряд, обес-
печивающий электронейтральность кристалла A.VBVX3A- (где А и
X могут быть, например, К+ и F~, ^ _.
Cs+ и С1-, Ва2+ и О2- и т. д.). © О © О ©
Формула соединения зависит от Ор^-рОр^рОгл
относительной доли занятых пози- в -г х • Sr W#У
ций типа В: '-^-'П^б^РпЧ^
аняты пустоты
все АВХ3
две трети А3В2Х9
половина А2ВХ6
°
оооо°сА
Рис. 4.30. Два плотноупакованных
слоя АХ3 (сплошные и пунктирные
кружки) и позиции атомов металла
между слоями (зачерненные круж-
ки меньшего размера) в октаэдри-
ческом окружении атомами X.
Эти доли, разумеется, состав-
ляют соответственно 'Д, '/в и 1/з
общего числа октаэдрических
пустот ПУ из атомов А и X.
В структурах А2ВХ6 имеются
дискретные октаэдрические группы; в АзВ2Хэ и АВХч, как видно
из отношения X : В, группы ВХ6 должны соединяться через ато-
мы X. Особенность этих структур, иллюстрируемая рис. 4.31,
состоит в том, что общими у октаэдрических групп ВХ6 являют-
ся только вершины или грани. Это представляет собой сущест-
венное отличие от структур многих оксидов и галогенидов, ха-
рактеризующихся наличием общих ребер октаэдров. Отсутст-
вие общих ребер является попросту следствием строения слоев
АХ3, в чем можно убедиться при анализе моделей. При наложе-
нии третьего слоя на пару слоев возможны лишь две ориента-
ции этого слоя; одна приводит к соединению октаэдров ВХ6 че-
рез вершины, а другая — через грани.
В принципе при наложении слоев АХ3 возможны самые раз-
личные последовательности, но чаще всего встречаются наиболее
простые из них, с эквивалентными шарами или только двумя
видами неэквивалентных шаров. Таковы последовательности с
периодом повторяемости, равным 2, 3, 4, 6, 9 или 12 слоев. При-
меры структур, содержащих ПУ-слои АХ3, можно найти в
табл. 4.4. Многие соединения могут образовывать кристаллы с
различными типами плотнейших упаковок, например, ВаМпО3
образует двух-, четырех- и девятислойные структуры. В некото-
рых случаях это явление, вероятно, точнее описывать как поли-
220
4. Шаровые упаковки
4 6 Структуры, построенные из плотноупакованных слоев АХ3
221
<
и
с
А
1
В
р
А
R
4
)
t
)
<
(
i
*
4
i
i
t
1
с
Li (
i
i
АН
С
1
>
г
i
1
i
{
i
t
(
с
>
—T
_ „,___ A
1 <
1
(
(
\
ж
1
(
1
1 )
! 4
Л-
—j——
a i
о
' A
A
s'
>
—¦
-
О
о
<
с
A
Д
4
i
Рис 4.31. Слева показаны (в плане) плотноупакованные слои АХ3. Даны по-
ложения только атомов X в позициях А, В и С. Маленькими черными круж-
ками обозначены позиции атомов металла типа В между слоями А и В, В и С,
С и А окруженные октаэдрически шестью атомами X. На схемах показаны
слои ('горизонтальные линии), спроецированные вдоль направления стрелки.
Схемы а—и относятся к ПУ-структурам АхВД3.г, в которых атом В октаэдри-
чески окружен шестью атомами X: а—г — АВХ3; д, е —низко- и высокотемпе-
ратурная модификации K2L1AIF6; ж—и — А3В2Х9; к—н — А2ВХ6.
типизм, а не как полиморфизм, по аналогии с многочисленными
политипами SiC и ZnS. Было установлено, например, что в
кристаллах ВаСгО3, полученных под давлением свыше 3000 атм,
имеются последовательности из 4, 6, 9, 14 и 27 плотноупакован-
ных слоев.
Если ионы В занимают все октаздрические пустоты Х6, то
каждой последовательности слоев ПУ отвечает лишь одна струк-
тура (АВХ3). Однако при заполнении части пустот возможны
различные способы расположения ионов В по доступным им
пустотам. Это в точности повторяет ситуацию с плотноупако-
ванными структурами бинарных соединений, где для каждого
типа плотнейшей упаковки, имеется только одна структура,
если заполнены все октаэдрические пустоты (NiAs, NaCl и т. д.),
но появляются варианты в расположении одного и того же чис-
ла катионов, если занята только часть пустот.
Мы коснемся здесь лишь структур с последовательностью из
2, 3, 4 и 6 слоев ПУ; для соединений A3B2X9 и А2ВХ6 рассмотрим
сначала только простейшие структуры, отвечающие каждой
последовательности ПУ-слоев. Вывод структур можно осущест-
вить следующим образом. По аналогии с номенклатурой, при-
нятой для ПУ-слоев с одинаковыми атомами, мы будем обозна-
чать АХз-слои буквами А, В, С — см. рис. 4.31 (ячейка слоя в
этом случае имеет больший размер, чем в слое из одинаковых
атомов). Все атомы сорта А, лежащие в некотором слое Л, рас-
положатся над точками типа Л, лежащие в слое В — над точка-
ми В других слоев; то же относится к С-слоям. Межслойная
трансляция d переводит слой А в В, В в С, а С в А. В любой
последовательности этих слоев, уложенных так, чтобы между
слоями образовались октаэдрические пустоты Х6, позиции ато-
мов сорта В в соединении АВХз также находятся над позиция-
ми Л, В или С. Между слоями А я В они находятся над пози-
цией С, между В и С — над позицией Л, между Л и С — над В.
Поэтому положение атомов В может быть показано на схемах
того же самого вида, который использовался ранее для бинар-
ных соединений с плотнейшей упаковкой.
4.6.1. Структуры АВХ3. В структурах этих соединений все окта-
эдрические пустоты Х6 ; заняты атомами В. На схемах
рис. 4.31, а — г показаны структуры, основанные на последова-
тельности слоев г, к, гк и гкк.
В простой структуре а с гексагональной плотнейшей упаков-
кой атомов А+ЗХ октаэдрические группы ВХ6 образуют колон-
ки за счет сочленения по двум противоположным граням. Это
структуры CsNiCl3, BaNiO3 и LiI-3H2O (или ILi(H2OK). Ва-
риант такой структуры обнаружен и в CsCuCl3. Но в этой струк-
туре гексагональная плотнейшая упаковка несколько искажена
222 4. Шаровые упаковки
за счет небольшого смещения слоев друг относительно друга.
В результате вокруг атома Си располагаются (компланарно)
только четыре ближайших соседа, а два более удаленных до-
полняют координацию до искаженно-октаэдрической. Атомы Си
расположены не точно друг под другом, как показано на
Рис. 4.32. Кристаллическая структура CsCuCl3.
рис. 4.31, а, но несколько смещены от оси цепочки октаэдров и
образуют спираль вокруг винтовой оси 6-го порядка (рис. 4.32).
Структура б (рис. 4.31) с кубической плотнейшей упаковкой
атомов A-j-З Х относится к структурному типу перовскита. Это
иллюстрирует рис. 4.33, где показана часть ПУ-слоя АХ3, при-
чем атом А находится в начале координат.
Более наглядно структуру можно показать как трехмерную
систему октаэдров ВХ6, соединенных через вершины с атомами
В в узлах кубической элементарной ячейки и атомами X
в серединах ребер, т. е. так же, как в структуре ReO3
(рис. 5.18,а), к которой добавлен атом А, расположенный в
центре ячейки. Идеальный (кубический) структурный тип пе-
4.6. Структуры, построенные из плот ноу пакованных слоев АХ3 2231
ровскита или его вариант с более низкой симметрией встреча-
ется во многих фторидах ABF3 и комплексных оксидах АВО3;
более подробно он рассмотрен в гл. 13 (т. 2).
Структура в (рис. 4.31) реализуется в высокотемпературной
модификации ВаМпО3. Октаэдры МпО6 сгруппированы по два
путем сочленения через общую грань; пары октаэдров объеди-
няются друг с другом через общие вершины.
Шестислойная структура (г) с изолированной парой октаэд-
ров, соединенных через грань, обнаружена в гексагональных
ВаТЮз и CsMnF3. Структуры а—г мо-
гут служить основой для соединений
с более сложными формулами. Комп-
леспый галогенид с эмпирической фор-
мулой CsAuCl3 в действительности
представляет собой CsaAu^u11^^
с сильно искаженной структурой
перовскита, в которой можно выделить
линейные (С1—Аи1—С1) и плоские
квадратные (АишСЦ) ионы; эта струк-
тура описана в гл. 10. Фторид состава
K2LiAlF6 имеет две энантиоморфные
модификации. В низкотемпературной
модификации ионы Lib и А13+ упоря-
доченным образом занимают позиции
В в перовскитной структуре; этот тип
сверхструктуры соответствует структу-
ре криолита. В высокотемпературной
модификации обнаружена сверхструктура от простой шестислой-
ной структуры типа г. Схематически эти сверхструктуры показа-
ны на рис. 4.31,(? и е. Упомянем также о значительно более
сложной разновидности шестислойной структуры, хотя она и
построена не только из ПУ-слоев АХ3. В BaTi5On имеются слои
двух типов: один содержит только атомы кислорода (О8 в эле-
ментарной ячейке), в других '/в атомов кислорода замещена на
Ва (что дает состав ВаО7). Между слоями ВаО7 и О8 располо-
жены 4 атома Ti, тогда как между двумя слоями ВаО7 имеются
только 2 октаэдрически координированных атома Ti. Структуру
можно представить следующей схемой:
ВаО7 \ ВаО7 О8 ВаО7 ВаО, О8 ВаО7 \ Ba4Ti20O«4
: Ti \ 4 Ti 4Ti 2 Ti 4 Ti 4 Ti 2 Ti \ =4(BaTis0,,)
Литературные источники к некоторым из упомянутых струк-
тур включены в сводную табл. 4.4.; для остальных ссылки со-
держатся в следующих главах.
Рис. 4.33. Структура RbCaF;
типа перовскита. Показаны
окружение ионов Са2+ (ма-
ленькие кружки) шестью
ионами F~, а также слой
плотноупакованных ионов
Rb+ и F^ (большие заштри-
хованные и пустые кружки
соответственно).
224 4. Шаровые упаковки
4.6. Структуры, построенные из плотноупакованных слоев 225
Рис. 4.34. Кристаллическая структура CS3TI2CI9 (см. текст).
4.6.2. Структуры А3В2ХЭ. В структурах этих соединений атомы В
занимают 2/з пустот Х6. Сечения структур с периодом идентично-
сти не более 6 слоев показаны на рис. 4.31, ж— к. Структуры ж
и к содержат комплексные ионы В2Х9, состоящие из пар октаэд-
ров ВХ6, сочлененных по общей грани. Наиболее простая из этих
структур — это гексагональная ПУ-структура Cs3Fe2F9 и
Cs3Ga2F9, получающаяся путем удаления из структуры а каж-
дого третьего атома В. Удаление атомов В через один приводит
к структуре типа K2GeF6 с изолированными ионами ВХ6; Cs3Tl2Cl9
имеет очень похожую ГПУ-структуру А+ЗХ, но с более равно-
мерным пространственным распределе-
нием ионов Т12С193л На рис. 4.34 штри-
ховыми линиями показана элементар-
ная ячейка, которая соответствует
схемам на рис. 4.31. В структуре типа
ж ионы должны были бы располага-
ться на линиях (перпендикулярных
плоскости бумаги), проходящих через
все маленькие черные кружочки, а на
каждой линии они должны были бы
быть на одинаковой высоте, как пока-
зано на схеме б (рис. 4.34). Более рав-
номерное распределение, показанное
Слой октаэдров на схем,е *• реализуется в структуре
Л2хя. CS3TI2CI9. Аналогичную структуру име-
ет Ba3\V2O9. Структуру типа к имеет K3W2CI9. Структура типа з
состоит из гофрированных слоев, показанных в плане на
рис. 4.35; слои образованы из октаэдров, связанных тремя вер-
шинами с тремя октаэдрами из другого слоя. К настоящему
времени известен только один пример такой структуры —
Cs3Bi2Br9.
В дополнение к этим типам структур АзВ2Х9, содержащим
изолированные или бесконечные двумерные ионы В2Х9, сущест-
вуют структуры третьего типа, в которых атомы В смещены из
центров октаэдров ВХ6, что приводит к образованию дискретных
молекул ВХ3. Примерами таких структур являются Cs3As2Cl9l
Cs3Fe9Cl9, Cs3Sb2Cl9 и Cs3Bi2Cl9; ссылки на эти структуры даны
в разд. 10.1.9.
4.6.3. Структуры А2ВХ6. Такой состав получается при заполне-
нии половины имеющихся Хб-пустот в плотнейшей упаковке
слоев АХ3. Проекции структур с последовательностью слоев г,
гк и гкк представлены на рис. 4.31, к — н. Во всех таких структу-
рах присутствуют изолированные ионы ВХ6. Многочисленные
Таблица 4.
Последователь-
ность слоев
АВ...
ABC...
ABAC...
АВСАСВ...
10. Структуры, построенные и:
Обозна-
чение
г
к
гк
гкк
плотноупакованных слоев
Доля октаэдрических пустот Х6, занятая атомами В
Все
АВХз
CsKiCl3
BaNiO3
CsCuCls
Оксиды АВО3
RbCaF3
CsAuCl3a
(б) (дN
в. т.-ВаМпОз
(в)"
BaTiO3 (гексаг.^
CsMnF3
(г) (еN
2/3
A3B2X9
Cs2Fe2F9
(жN
Cs3Bi2Br9
CN
В
K3W2C19
(лN
1/3
АгВХ4
K2GeF6
Cs2PuC!6
(лN
K2PtCl6
(м)°
K2MnF6
(и)e
(оH
Рис. 4.35.
Искаженная ПУ-структура. Буквы в скобках соответствуют обозначениям на
!'1К- ¦'¦¦Л. Структуры АзВ2Х9 с упаковкой типа ABAC... неизвестны.
15—752
226 4. Шаровые упаковки
примеры первых трех типов структур — тригональной
K2GeF6(Cs2PuCl6), кубической K2PtCl6 и гексагональной
KaMnF6— приведены в гл. 10 (т. 2), где даны также рисунки
к первым двум структурам. Структурные типы комплексных
галогенидов и оксидов с формулами АВХ3, А3В2Х9 и А2ВХ6 све-
дены в табл. 4.10.
Использованный здесь подход к этим структурам был осно-
ван на различном порядке наложения слоев ПУ. О другой воз-
можности описания, заключающейся в рассмотрении способов
соединения октаэдров ВХ6 друг с другом, см. гл. 5. Структуры,
основанные на кубической плотнейшей упаковке, обычно изобра-
жаются и описываются в кубической элементарной ячейке. Ра-
нее мы указывали, что структура криолита может формально
рассматриваться как сверхструктура от перовскита; соотноше-
ние между структурами перовскита, криолита и K^PtCU под-
робно рассмотрено в гл. 10.
5 ТЕТРАЭДРИЧЕСКИЕ
' И ОКТАЭДРИЧЕСКИЕ
СТРУКТУРЫ
5 1. Структуры как совокупности полиэдров
Изображение кристаллических структур, в которых атом X
связан более чем с одним другим атомом X, можно упростить,
показав, как группы АХ„ соединяются между собой через общие
атомы X. Два важнейших полиэдра — это тетраэдр и октаэдр,
и поскольку на чертежах структур они появляются в различных
ориентациях, важно уметь распознавать их вид. На рис. 5.1
показаны проекции тетраэдра и октаэдра, а также пары окта-
эдров с общим ребром или общей гранью. В настоящей главе
мы опишем наиболее важные структуры, которые можно скон-
струировать из этих двух типов полиэдров, соединенных по вер-
шинам, ребрам или граням, или же из каких-либо комбинаций
этих полиэдрических элементов. Примем два правила, касаю-
щихся обобществления атомов X, которые принадлежат разным
координационным группам АХ„. Первое заключается в том, что
если ребро обобществлено, то соединяемые им вершины не за-
считываются в число обобществленных вершин, и аналогично
три вершины и три ребра обобществленной грани не засчитыва-
ются в число обобществленных вершин и ребер. Второе правило
упрощает описание и классификацию полиэдрических структур.
Рассмотрим соединение тетраэдрических групп по ребрам. Если,
как это показано на рис. 5.2,а, где тетраэдр виден вдоль оси
^4 D), обобществлены два противолежащих ребра, каждый
тетраэдр соединен с двумя другими по ребрам и каждый атом X
является общим только для двух тетраэдров. Если же два обоб-
ществленных ребра имеют общую вершину, как в цепи на
рис. о.2,б, тетраэдр (например, заштрихованный тетраэдр на
рисунке) соединяется через атомы X не только с двумя други-
ми (Ь) по ребрам, но также еще с двумя тетраэдрами (V) через
общие вершины, и в результате три атома X от каждого тетра-
адрв принадлежат трем тетраэдрам (т. е. они связаны с тремя
атомами А). Такое соединение вершин играет роль первого эта-
па в соединении ребер и не влияет на топологию: как в случае а,
[;iK л в случае б получается 2-связанная цепь из атомов А.
1- другой стороны, можно отметить, что сочленение по ребрам
соответствует более коротким расстояниям А—А, а соединение
через вершины — более длинным расстояниям, как показано на
Рис 5.2,6 штриховыми линиями. Аналогичные соображения при-
Рис. 5.1. а — вид тетраэдра вдоль осей симметрии 3 и 4; б — вид октаэдра
вдоль осей симметрии 4, 2 и 3-го порядка; о — различные проекции пары окта-
эдров, соединенных по ребру; г — проекция и общий вид пары октаэдров, со-
единенных по грани.
Рис. 5.2. Соединение тетраэдрических координационных групп по ребрам и по
вершинам (см. текст). Топологические схемы на рисунках а—г, расположен-
ные справа, показывают, как соединены тетраэдры — по ребрам или вершинам
(сплошные и штриховые линии соответственно). Обобществленные ребра одного
из тетраэдров показаны жирными линиями.
5.1. Структуры как совокупности полиэдров 229
мы к структурам, в которых обобществлены более чем два
боа и конечно, к системам связанных октаэдров. К структу-
пам по ч'обным рассматриваемой (рис. 5.2, б), удобнее подходить
как к соединению через ребра, а не через вершины. Вместе с
тем если объединение вершин не везде порождает сочленение
по ребрам, как, например, в случае в, мы будем говорить, что
обобществляются вершины и ребра. Такое подразделение сдела-
но в табл. 5.2 для тетраэдрических структур и в табл. 5.4 для
октаэдрическнх структур.
В настоящей главе наша основная цель состоит в описании
известных структур. Рассматривая соединение тетраэдрических
и октаэдрических групп по вершинам, ребрам и (или) граням,
проще всего представить структуры в наглядном виде, и это
наиболее естественный путь построения моделей, изучение ко-
торых будет существенно для понимания структур. В частности,
важно знать, что данная структура геометрически возможна,
даже если соответствующие примеры и неизвестны, поскольку
мы хотим понять, почему некоторые структуры не удается обна-
ружить. Для общего обзора бесконечно большого числа воз-
можных тетраэдрических или октаэдрических структур наиболее
удобный подход дают координационные числа атомов X. Рас-
смотрим простейшие структуры, в которых все группы АХ4 (или
АХб) топологически эквивалентны, т. е. в них атомы X обобще-
ствлены одинаковым способом. Можно систематически вывести
все тетраэдрические структуры, исходя из решений уравнений
2\-Л- = 4 и 1.xx/x = n/m, где \х — число атомов X каждой группы
АХ4, общих для х таких групп в соединении состава АШХЯ, т. е.
х — это координационное число атома X. Например, для тетра-
эдрических структур АХ2 [Acta cryst., 1983, В39, 39] решения
таковы:
V|
Далее нужно посмотреть, как каждое из этих решений может
быть реализовано при объединении вершин, ребер и граней.
В случае v2 = 4, например, координацию 2 для каждого атома X
можно получить, если в сочленении участвуют а) все вершины,
соединяемые с разными тетраэдрами, б) одно ребро и две вер-
шины, в) два ребра, не имеющие общих вершин. Аналогичным
способом рассматриваются другие решения. Для октаэдрических
структур соответствующие уравнения имеют вид: 2\ч = 6 и
2/ /
230 5. Тетраэдрические и октаэдрические структуры
Анализ, проведенный на последующих страницах, по сути
является топологическим, т. е. мы прежде всего обращаем вни-
мание на способ соединения полиэдров, а не на детали геомет-
рии системы. Разумеется, межатомные расстояния и валентные
углы представляют значительный интерес для химика-структур-
щика, но обычно они обсуждаются безотносительно к некото-
рым фундаментальным геометрическим ограничениям, которые
мы рассмотрим в первую очередь.
При описании структуры ионных кристаллов обычно отмеча-
ют, что объединение координационных полиэдров АХп по ребрам
Рис. 5.3. Углы А—X—А для тетраэдров АХ4 (а) и октаэдров АХ6 (б), соеди-
ненных гранями (F), ребрами (?), вершинами (V); в — ограничение, налагае-
мое на расстояние между атомами X различных полиэдров (см. текст). Значе-
ния, данные для некоторых из этих углов, являются приближенными. Более
точные значения для тех из них, которые не определяются непосредст-
венно из геометрии полиэдров, таковы: ?' = 65°58'(cos 11/27); У'Тстр =
= 102°16' [cos-1 (-17/81)]; П,Кт= 13Г48' B sin-'ysTffjT
"и особенно по граням вызывает отталкивание между атомами А,
что приводит, например, к укорочению обобществленных ребер
и к тому, что в существенно ионных структурах такие сочлене-
ния фактически отсутствуют. Однако для обобществленных ато-
мов имеются также чисто геометрические ограничения в валент-
ных углах А—X—А, даже если в объединении полиэдров участ-
вуют только вершины, и это, несомненно, имеет прямое отноше-
ние к обсуждению таких углов в кристаллических трифторидах
со структурой ReO3 или RhF3, а также в циклических тетраме-
рах M4F20 некоторых пентафторидов.
5.1.1. Ограничения, накладываемые на валентные углы при
обобществленных атомах X. Удобно рассмотреть сначала угол
А—X—А при атоме X, через который соединяются два правиль-
ных тетраэдра или октаэдра. Этот атом может представлять со-
бой общую вершину или может принадлежать обобществленным
ребру или грани, и, таким образом, имеется шесть случаев, под-
5.1. Структуры как совокупности полиэдров 231
лежащих анализу. Если тетраэдр (или октаэдр) имеет обобще-
ствленную грань, возникает жесткая система и угол А—X—А
имеет значение F, указанное на рис. 5.3, а и б. Если же объедине-
ние полиэдров происходит по ребру или через вершину, имеется
максимальное значение угла А—X—А (точка Е и V соответст-
венно), соответствующее наиболее вытянутым системам с мак-
симальным удалением атомов А (центров полиэдров) друг от
друга. Действительно, имеется свобода вращения по отношению
к обобществленному ребру или вершине, что уменьшает это
Таблица 5.1. Расстояния А—А между центрами правильных группировок
АХ4 или АХб с обобществленными атомами X
Полиэдры
Тетраэдры
Октаэдры
В единицах X—X
Обобществленные
вершинаа
1,22
1,41
реброа
0,71
1,00
грань
0,41
0,82
В единицах А—X
Обобществленные
вершинаа
2,00
2,00
реброа
1,16
1,41
грань
0,67
1,16-
.Минимальное значение.
расстояние, а также расстояние х между атомами X разных
полиэдров (рис. 5.3, в). Поэтому минимальное значение угла
А—X—А зависит от нижнего предела, принятого для х. Если
положить, что расстояние х не должно быть меньше, чем рас-
стояние X—X в АХ4 (или АХ6), т. е. чем ребро /, можно вычис-
лить нижние пределы Е' и V, приведенные на рис. 5.3. В слу-
чае тетраэдра интервал ЕЕ' мал, и мы будем им пренебре-
гать.
Из углов А—X—А можно рассчитать расстояние А—А между
центрами полиэдров для случаев их соединения по граням, реб-
рам и вершинам. Эти расстояния выражаются либо в единицах:
X—X (длина ребра), либо в единицах А—X (длина связи); оба
ряда значений представлены в табл. 5.1. Они иллюстрируют
возрастающее сближение атомов А при обобществлении ребер
или граней; поэтому объединение тетраэдрических координаци-
онных полиэдров по граням не встречается вообще, а сочлене-
ние граней октаэдрических координационных групп ограничено
относительно узким кругом структур.
Угловой интервал А—X'—А на рис. 5.3, б непосредственно'
связан с наблюдаемыми валентными углами —F— в трифтори-
Дах переходных металлов со структурой типа ReO3 или RhF3 и
D циклических молекулах M4F20 пентафторидов переходных ме-
232 5. Тетраэдрические и октаэдрические структуры
СН,
таллов. В слое MnF4 в BaMnF4 для двух сортов неэквивалент-
ных атомов F (см. рис. 5.15, г в разд. 5.3.2) наблюдаются значе-
ния угла Мп—F—Мп, близкие к двум предельным величинам,
которые указаны на рис. 5.3,6, а именно 139° и 173°. Еще боль-
ший интерес представляет интервал от 90 до 132°, существова-
ние которого приводит к следующим заключениям.
1. В структуре рутила не могут сосуществовать правильная
октаэдрическая координация атомов А и плоская симметричная
координация атомов X, так как последняя требует, чтобы углы
А—X—А равнялись 120°.
2. В структуре корунда (а-
А12О3) не могут одновременно
реализоваться правильная ок-
таэдрическая координация А1
и правильная тетраэдрическая
координация О; величина 109,5°
попадает в интервал между Е
и V (рис. 5.3,6). Об этом см.
также в разд. 6.6.
3. Тот факт, что минималь-
ное значение угла А—X—А для
объединения по вершинам
больше 120°, означает, что,
если три (или больше) окта-
Рис. 5.4. Ион эдра соединяются в одной точ-
[ОСгз(ООССНз)б(Н2О)з]-'-. ке, у них должно быть общим
по крайней мере одно ребро
(или одна грань). Мы увидим, что обобществление ребер —
особенность многих октаэдрических структур, и оно возникает в
структурах соединений при п<.2 по указанной чисто геометриче-
ской причине; разумеется, сочленение октаэдров по ребрам мо-
жет встречаться и при л>2.
Нужно отметить, что справедливость третьего заключения
базируется на предположениях, что а) расстояние, соответствую-
щее наибольшему сближению атомов X, соединенных по верши-
нам октаэдров (х на рис. 5.3, в), не может быть меньше, чем рас-
стояние X—X внутри октаэдра, и б) октаэдры являются пра-
вильными. Структуры, в которых три октаэдра имеют общую
вершину, но не имеют общих ребер и граней, противоречат
предположениям «а» и (или) «б».
а) Если х меньше, чем длина ребра X—X, то соединение
трех октаэдров в одной точке с обобществлением только вершин
становится, разумеется, возможным. Такая ситуация возникает
в тримерном ионе оксоацетата хрома [ОСг3(СН3СООN(Н2ОK]
Cl-бНгО, где ацетатные группировки выступают в роли мости-
ков для шести пар вершин (рис. 5.4) [Acta cryst, 1970, В26,
5.1. Структуры как совокупности полиэдров
233
fi73l* Кратчайшие расстояния О—О в октаэдрических группах
Г О заключены в пределах 2,63—2,90 А, в то время как в аце-
-ноп группе это расстояние составляет только 2,24 А. В ионе
Fp (SCU)t;(H2OK]5~, имеющем аналогичную структуру, мости-
ками служат шесть ионов SO42- [Acta cryst., 1980,B36, 1278].
Схоаные" вопросы обсуждаются при описании ряда структур, где
октаэдрические координационные группы имеют общие грани
(разд. 5.3.5).
б) Можно было бы предположить возможность образования
трехмерной структуры АХ2, в которой октаэдры объединены
только по вершинам и каждая вершина является общей для трех
октаэдров — в отличие от структуры рутила, в которой каждая
группа АХя обобществляет ребра и вершины. Но если нет зна<
чителыюго искажения октаэдров и (или) сокращенных контак-
тов между вершинами разных октаэдров, такая структура не-
возможна.
5.1.2. Максимальное число полиэдров с общими вершинами.
Максимальное число правильных тетраэдров или правильных
октаэдров, которые могут соединиться в одной точке, равно 8
и 6 соответственно (в обоих случаях предполагается, что рас-
стояние между атомами X разных полиэдров не менее, чем дли-
на ребра полиэдра). Если при этом соединение ребер и граней
недопустимо, то эти числа становятся равными 4 и 2. Числа 8
и 6 — это числа соответственно тетраэдрических и октаэдриче-
ских пустот, окружающих шар в плотнейшей упаковке равных
сфер. Соответственно имеются два расположения шести пра-
вильных октаэдров АХ6 (и восьми правильных тетраэдров АХ4),
сходящихся в общей вершине, отвечающих гексагональной и
кубической плотнейшим упаковкам атомов X (рис. 4.14, г и д).
В кубической плотнейшей упаковке восемь тетраэдрических пус-
тот перемежаются шестью октаэдрическими пустотами, а в гек-
сагональной плотнейшей упаковке шесть из тетраэдрических
пустот образуют три пары, сочлененные по граням тетраэдра.
Эти три укрупненные «двойные» тетраэдрические пустоты дают
возможность вставить три дополнительных октаэдра с централь-
ным атомом X в качестве общей вершины; отсюда вытекает воз-
можность расположить девять соответствующим образом иска-
женных октаэдров так, чтобы они сходились в общей вершине.
Из девяти октаэдров шесть обобществляют по три грани и по
два ребра и три октаэдра обобществляют по четыре грани.
Эти рассуждения, в частности, относятся к структурам А2Х3
с координацией 9:6 и к структурам А3Х4 с координацией 8:6,
в которых соответственно девять и восемь групп ХА6 соединя-
в ••*¦
топ главе ссылки на литературу даны только для тех соединений.
которые не рассматриваются в других главах.
234 5. Тетраэдрические и октаэдрические структуры
ются в каждом атоме А (предполагается эквивалентность всех
атомов А и всех атомов X). Структуры первого типа неизвест-
ны, но ТП3Р4 дает пример второго типа. Ясно, что правильная
октаэдрическая координация атомов X здесь невозможна; кро-
ме того, в структуре этого типа имеется значительный вклад
соединения координационных групп ХА6 по граням. Соответст-
венно в TI13P4 половина искаженных октаэдрических групп PThe
обобществляет по две грани (и по три ребра), а другие обобще-
ствляют по три грани (и по одному ребру) с другими октаэдра-
ми, сходящимися в общем атоме Th. Следует отметить, что
указанные числа обобществленных ребер и граней относятся к
группировке из шести, восьми или девяти октаэдров, соединяю-
щихся в общей вершине; числа ребер и граней, обобществляе-
мых каждым октаэдром в кристаллической структуре, будут,
конечно, больше. Некоторые другие следствия этих теорем об-
суждаются в последующих главах. Они касаются устойчивости
(и, следовательно, существования) некоторых оксосолей
(разд. 7.6.7), нитридов (разд. 6.10) и оксидов, обогащенных ка-
тионами (разд. 7.6.7).
Рассмотрим теперь структуры, построенные из тетраэдров и
¦октаэдров. Способ анализа, принятый в настоящей главе, поз-
воляет выявить значительное число и многообразие структур,
возникающих при использовании таких простых структурных
единиц, как тетраэдры и октаэдры; кроме того, при этом вскры-
ваются следующие привлекающие внимание обстоятельства:
а) неожиданная сложность структур некоторых соединений,
для которых имеются геометрически более простые альтернати-
вы (например, уникальная слоистая структура МоО3 контрасти-
рует с топологически более простой структурой ReO3);
б) отсутствие примеров соединений, кристаллизующихся в
некоторых относительно простых структурных типах, которое
подчеркивает, что самое близкое окружение атомов не единст-
венный фактор, определяющий их строение (примечательно
¦отсутствие галогенидов АХ2 со структурой атакамита);
в) большое число геометрически возможных структур для
•соединений с данным типом формулы (например, АХ4), знание
которых необходимо для адекватного обсуждения некоторых
наблюдаемых структур;
/г) важность типа координации аниона.
Здесь целесообразно напомнить читателю общие типы свя-
занных систем, которые возможны, когда некоторая структур-
!ная единица (атом или координационная группа) соединена с
некоторым числом (р) других единиц:
р=1 только димер
р—1 замкнутый цикл или бесконечная цепь
,р>3 конечный полиэдр, одно-, дву- или трехмерные системы
5.2. Тетраэдрические структуры 235
В гл. 3 мы видели, что, хотя 3- или 4-связанные точки могут
образовать трехмерные структуры, они могут дать также и
системы, бесконечные только в одном или двух измерениях.
Некоторые из нетривиальных одномерных систем изображены.
на рис. 3.19 (разд. 3.8).
5.2. Тетраэдрические структуры
Наиболее многочисленны и важны те тетраэдрические структу-
ры, в которых объединение тетраэдров происходит только по
вершинам. Сочленение тетраэдрических групп АХ4 по граням
приводит к чрезмерному сближению атомов А (до 0,67 АХ или
0,41 XX, где XX — длина ребра тетраэдра) и очень малому зна-
чению угла А—X—А C8°56' для правильного тетраэдра), и по
этим причинам нет нужды его рассматривать.
5.2.1. Структуры с обобществленными вершинами тетраэдров-»
Если через общую вершину соединяются два тетраэдра, макси-
мальное значение расстояния А—А для коллинеарных связей
А—X—А равно 2АХ, однако возможна значительная вариация
углов А—X—А (от 102° 16' до 180°), ограниченная тем, что рас-
стояние между атомами X разных тетраэдров не должно быть
меньше ребра тетраэдра. В оксосоединениях наблюдаются глав-
ным образом углы в диапазоне 130—150°, хотя в ZrP2O7 и
SC2SJ2O7 встречаются практически коллинеарные связи.
В большинстве структур каждый атом X принадлежит толь-
ко двум тетраэдрам, и если все тетраэдры топологически экви-
валентны (т. е. одинаковым способом обобществляют одинако-
вое число вершин), получаются формулы А2Х7, АХ3, A2Xs и АХ2
в зависимости от числа обобществленных вершин A, 2, 3 или 4)
(табл. 5.2). Первая группа включает в себя С12О7 и пироиок
S2O72~ и т. д., а вторая группа содержит циклические и беско-
нечные цепочечные молекулы (АХ3)П, а также метаионы того
же типа. Цепь АХ3 показана на рис. 5.5, а. Если в объединении
тетраэдров участвуют три вершины каждого тетраэдра, среди
возможных структур оказываются конечные полиэдрические
группы, такие, как Р4Ою (рис. 3.1, разд. 3.1) и бесконечные
системы, из которых простейшая — это двойная цепь на
рис. 5.5,6. Цилиндрическая цепь, образованная из полосы плос-
кой сетки 4.82, обернутой вокруг цилиндра (см. разд. 3.8), най-
дена в CuNa2(Si4O10) (разд. 23.12.7). Примеры двумерных и:
трехмерных систем даны вгл.З при описании 3-связанных сеток.
Тетраэдры, обобществляющие четыре вершины, тоже могут об-
разовывать цилиндрические цепи, пример которых показан на
рис. 5.5, в, в дополнение к слоям, двойным слоям и трехмерным
структурам. Некоторые слоистые и каркасные структуры описа-
236 5. Тетраэдрические и октаэдричсские структуры
Число
общих
вершин
1
2
3
4
3
Число
общих
ребер
1
2
3
4
5
6
Таблица 5.2. Тетраэдрические
Ф о ;i м у л а
Сочленение ч
Тип комплекса
ерез вершины
Вершины принадлежат двум тетра-
эдрам
А2Х7
(АХз)„
(А2Х5)„
(АХ2)„
Конечная молекула или
пироион
Циклическая молекула
или метаион, бесконеч-
ная цепь
Конечный полиэдр
Двойная цепь
Цилиндрическая цепь
Слой
Трехмерная структура
Слой
Двойной слой
Трехмерная структура
Вершины принадлежат трем тетра-
эдрам
(АХ2)„
Бесконечный слой
Сочленение по ребрам
Ребра принадлежат двум тетраэдрам
А2Х6
(АХ2)„
(А2Х3)„
(ЛХ)„
(А4Х3)„
(А2Х)„
Сочленение
(АХ2)„
(АХ)„
Конечный димер
Бесконечная цепь
Бесконечная двойная
цепь
Бесконечный слой
Бесконечный двойной
слой
Трехмерная структура
через вершины и ребра
Слой
Трехмерная структура
структуры
I I}) ИМ С]) 1I
С12О7, S2O72~ и др.
S3O9, Se4O,2, (РХС12)„
(Р4О12L-, (Si3O9)G-
(SO3),,, (РО3)„л-
Р4О,„
Al(AlSiOs)
CiiNa2(Si4O10)
Р2О5, Li2(Si205)
Р2О5, La2(Be205)
Hgl2 (красный)
CaSi2Al208 (гексаг.)
Структуры SiO2, GeS2
А1ОС1, GaOCl
A12CI6; Fe2Cl6
BeCl2, SiS2, Be(CII3J
Cs(Cu2Cl3)
LiOII, PbO
KCn4Ss
Li2O, F2Ca
GaPS4
|3-BeO
5.2. Тетраэдрические структуры 237
ны в гл. 3 в числе плоских и трехмерных 4-связанных сеток. На
рис. 5.6 показаны две конфигурации простого слоя АХ2, обра-
зованного из тетраэдров, обобществляющих по четыре вершины.
В SrZnO2 (рис. 5.6,6) слой является анионом, а ионы Sr2+ рас-
полагаются между слоями.
В
V V"
АХ,
А2Х5
Рис. 5.5. Участки бесконечных цепей, в которых все тетраэдры обобществляют
две (а), три (б) или четыре (в) вершины. В случае в показана проекция вдоль
цепи.
Сложная структурная единица («сверхтетраэдр»), состоящая
из четырех тетраэдров, каждый из которых соединяется с сосед-
ними через три вершины, имеет состав А4Х.О. Она представляет
собой идеализированную структуру Р4Ою, а также других ана-
логичных молекул и ионов Si4S104~, Gc4Si04~ (разд. 26.6) и вы-
ступает в роли структурной субъединицы в нескольких других
структурах. Замена простых тетраэдров на рис. 5.6,а сверхтет-
Рпс. 5.6. Теграэдрические слои АХ2: а — Hgl2 (красный); б — SrZnO2.
238 5. Тетраэдрические и октаэдрические структуры
раэдрами дает слой состава А4Х8(АХ2), в котором каждый из
четырех внешних атомов X является общим для двух групп
А4Хю- Слои этого типа содержит одна из форм Hgl2- Такой спо-
соб соединения групп А4Хю может также дать трехмерный кар-
кас (сравни со структурой кристобалита), как это имеет место
в Znl2 (разд. 9.9.2). Если сверхтетраэдры Ве4Ою соединить та-
ким же способом, как тетраэдры ZnS4 в сфалерите, каждый из
четырех внешних атомов О становится общим для четырех та-
ких группировок и получается трехмерный каркас состава Ве4О7.
Здесь атомы О занимают 7/s позиций в кубической плотнейшей
упаковке, и если расположить атомы Те в некоторых из октаэд-
рических пустот, образуется структура Ве4Те07 (разд. 16.10).
Структуры SiO2 и алюмосиликатов описаны в гл. 23.
Примеры, приведенные в табл. 5.2, ограничены системами,
в которых все тетраэдры топологически эквивалентны. В конеч-
ных линейных системах, состоящих более чем из двух тетраэд-
ров, концевые группы АХ4 обобществляют только одну вершину,
в то время как промежуточные тетраэдры вступают в соедине-
ние двумя своими вершинами. В таких гибридных системах от-
ношение X: А лежит между 3,5 и 3, как, например, в ионах
Р.чОю^ и SsOio2^. Подобно этому, имеются цепи, в которых не-
которые тетраэдры обобществляют по две. а другие по три
вершины, как это происходит в ионах, представляющих собой
двойные цепи с отношением X : А, лежащим между 3 и 2,5; та-
кими являются цепи в некоторых силикатах (рис. 5.7, о и б) и
цепь (P5Oi4);i3"~ (разд. 19.6.11). Отношение X: А уменьшается
до величин, заключенных между 2,5 и 2, если некоторые тетраэд-
ры соединяются ссоседнимп тремя, а остальные — всеми своими
вершинами, как в слое, изображенном на рис. 5.7, а. Этот инте-
ресный слой состава А3Х7 обнаружен в нескольких соединениях,
изоструктурных мелилиту Ca2MgSi207 (Ca2SiAl207, Ca2BeSi207,
Y2SiBe207). Здесь тетраэдрически координированы атомы Si,
Al, Be или Mg, а более крупные ионы Са или Y занимают поло-
жения с координационным числом 8 (искаженная антипризма).
Этот слой имеет в своей основе одну из C,4)-связанных пяти-
угольных сеток, рассмотренных в разд. 3.4.1. Пример более
сложного слоя состава А3Х7 дает Na2Si307 (разд. 23.12.7).
Поскольку тетраэдр SiO4 может обобществлять любое число
своих вершин (от нуля в ортосиликат-ионе SiO44~ до четырех в
SiO2), обширная химия кислородных соединений кремния дает
примеры всех типов тетраэдрических структур. Их многообразие
существенно увеличивается благодаря тому, что А1 может заме-
щать Si в части тетраэдров; так возникают алюмосиликаты, ко-
торые составляют большинство породообразующих минералов
и почв. Единственный элемент, конкурирующий в этом отноше-
нии с кремнием, — это германий (по Менделееву, экасплиций),
5.2. Тетраэдрические структуры 239
А3Х7
Рис. 5.7. а и б — участки бесконечных цепей, в которых часть тетраэдров обоб-
ществляет две вершины, а другая часть — три вершины; в — участок слоя АзХ7
(мслилит), в котором некоторые тетраэдры обобществляют три вершины, а про-
чие— четыре вершины; г — участок слоя в высокотемпературном GeS4, в кото-
ром равные количества тетраэдров GeS4 обобществляют по четыре вершины
или по две вершины и одному ребру. Двойные кружки обозначают обобщест-
вленные ребра, перпендикулярные плоскости чертежа.
для которого известны соли кислородных кислот, аналогичные
всем семействам силикатов (или алюмосиликатов).
В рассмотренных выше структурах общая вершина всегда
принадлежит только двум тетраэдрам. Структура, где каждая
обобществленная вершина относится к трем тетраэдрам, — это
А1ОС1 (и изоструктурный GaOCl); такой слой показан на
рис. 10.16 (разд. 10.4.5). Если рассматривать структуры ZnS как
построенные из тетраэдров ZnS4, каждая вершина окажется
принадлежащей четырем таким группам, но проще прибегнуть
к описанию па основе 4-связанной сетки, как это указано в
гл. 3
240 5. Тетраэдрические и октаэдрические структуры
5.2.2. Структуры с обобществленными ребрами. Мы отмечали
в начале разд. 5.1, что кроме особого случая обобществления
двух ребер тетраэдра с образованием линейной цепи в таких
структурах имеются также вершины, общие с вершинами дру-
гих тетраэдров, что приводит к обобществлению ребер. При
объединении тетраэдрических групп АХ4 по ребрам максималь-
ное расстояние А—А равно 1,16 АХ (или 0,71 XX), и возможны
лишь небольшие вариации угла А—X—А F6°—70,5°), если счи-
тать, что атомы X разных тетраэдров не могут располагаться
ближе, чем внутри тетраэдра. В ионных кристаллах объединение
тетраэдрических групп по ребрам не встречается, кроме струк-
тур флюорита и антифлюорита, в которых присутствуют сопря-
женные по ребрам группы FCa4 и ЫО4. Здесь обобществление
ребер является неизбежным следствием геометрии структуры с
координацией 4 : 8. Примеры тетраэдрических структур с обоб-
ществленными ребрами приведены в табл. 5.2. Среди них при-
сутствуют димерные молекулы А2Х6 некоторых галогенидов
(кроме фторидов) в газовой фазе и в кристаллах, бесконечные
цепи, образованные обобществлением противолежащих ребер
каждого тетраэдра (ВеС12 и др.), двойные цепи в некоторых
комплексных галогенидах (CsCu2Cl3) и слои в кристаллических
LiOH и РЬО; последние структуры описаны в гл. 3 на основе
4-связанных сеток, а также в разд. 4.2 в качестве примеров плот-
ноупакованных тетраэдрических слоев.
Тетраэдрические структуры, где в соединении тетраэдров
участвуют от одного до шести ребер, можно рассматривать как
участки слоя, схематически показанного на рис. 5.2, д. Здесь
пара тетраэдров представляет собой молекулу А2Х6 (например,
А12С16), полоса из слоя — это цепь АХ2 (рис. 5.2, а), полоса ши-
риной в два тетраэдра — двойная цепь А2Х3 (рис. 5.2, г), тополо-
гическим представлением которой является 3-связанная лесенка.
В слое, изображенном на рис. 5.2, д, каждый тетраэдр обобществ-
ляет по четыре ребра; наложение таких слоев за счет сочлене-
ния по двум остальным ребрам приводит к трехмерной струк-
туре антифлюорита А2Х, в которой обобществлены шесть ребер.
Возможна и промежуточная структура, состоящая из спарен-
ных слоев, в которых в сочленении участвуют пять ребер каждо-
го тетраэдра. Такой двойной слой обнаружен в KCu4S3 [Inorg.
Chem., 1980, 19, 1945], соединении с высокой металлической
проводимостью («двумерный металл»), где спаренные слои
объединены посредством атомов (ионов) К. В слое А4Х3 внут-
ренний атом X связан с атомами А, а внешний — с 4 атомами А,
и имеется по два атома каждого сорта в каждом тетраэдре АХ4.
Есть и другой двойной слой, соответствующий рис. 5.2,6, если
считать плоскость слоя перпендикулярной к плоскости чертежа.
В этом слое каждый тетраэдр обобществляет по четыре ребра;
5.3. Октаэдрические структуры 241
внутренний атом X связан с 6 атомами А, а внешний — с 2 ато-
мами А. Поскольку имеется по три атома первого типа в каж-
дом тетраэдре, получается состав АХ. По-видимому, пока неиз-
вестны примеры этого двойного слоя, который более подходит
для состава А2Х'Х" (как состав А4Х'Х2" для слоя А4Х3).
5.2.3. Структуры с обобществленными вершинами и ребрами..
Обобществление одновременно и вершин, и ребер в тетраэдри-
ческих группах одной структуры встречается редко. В конце
разд. 4.2 мы отмечали структуру GaPS4 как состоящую из пар
илотноупакованных слоев атомов S, между которыми располо-
жены Ga и Р, занимающие половину тетраэдрических пустот.
Каждая группа GaS4 или PS4 обобществляет две вершины и
одно ребро с тетраэдром другого сорта. Пример трехмерной
структуры дает высокотемпературная форма ВеО, в которой
пары соединенных по ребрам тетраэдров связываются в каркас
путем обобществления остальных четырех вершин. В этих двух
структурах все тетраэдры топологически эквивалентны, и поэто-
му эти структуры включены в табл. 5.2. В Ba7Fe6Si4 [Inorg.
Chem., 1971, 10, 340] присутствуют цепи, постоянные из тетраэд-
ров двух типов; одна треть из них обобществляет пару проти-
волежащих ребер, остальные — одну вершину и одно ребро:
\
s s4 s
s
А
VVV
\
Высокотемпературная модификация GeS2 состоит из слоев, в
которых имеются равные количества тетраэдров, обобществляю-
щих либо четыре вершины, либо две вершины и одно ребро;
этот слой изображен на рис. 5.7, г.
5.3. Октаэдрические структуры
Большая часть обзора октаэдрических структур будет посвяще-
на системам, бесконечным в одном, двух или трех измерениях.
Однако в отличие от структур, построенных из тетраэдрических
групп, среди которых имеется очень ограниченное число типов
конечных комплексов, число конечных молекул и комплексных
ионов, образованных из октаэдрических структурных единиц,
вполне достаточно, чтобы посвятить им специальный раздел.
При описании бесконечных структур мы будем систематически
рассматривать структуры, где имеются обобществленные верши-
16—752
242
Г). Тетраэдрические и октаэдрические структуры
ны, ребра, грани либо комбинации этих элементов. Подразде-
лять таким же образом конечные структуры мы не будем, а
просто перечислим их в порядке возрастания числа входящих
в них октаэдров.
5.3.1. Некоторые конечные группы октаэдров. Некоторые срав-
нительно простые октаэдрическне комплексы изображены на
рис. 5.8; отдельные примеры даны в табл. 5.3. Здесь мы проком-
Рис. 5.8. Конечные группы октаэдров нл табл. 5.3.
ментируем лишь некоторые из этих комплексов. Интересный
пример комплекса типа а (рис. 5.8) представляет собой катион
в {Ca2[(CH3KAs0]9}4+ (C104L[Acta cryst., 1977, ВЗЗ, 931]. Ядро
этого катиона состоит из двух групп СаО6, соединенных через
грань, причем каждый атом О принадлежит молекуле (CH3KAs0.
Известны многочисленные примеры молекул и ионов типа б с
двойными мостиками; таковыми могут быть атомы галогенов
или группы ОН (например, в [А12(ОНJ(Н2О)8]4+ и в аммиака-
тах кобальта; см. разд. 27.8), атомы О (например, в [1гО8(ОНJ]4~
5.3. Октаэдрические структуры 243-
Таблица 5.3. Конечные группы октаэдров
Рп.- п.8
6
в
г
д
L>
ж
3
и
к
л
м
н
Формула
АоХ9
А,Х10
АоХП
АзХ12
А3Х,з
А3Х14
А3Х;5
А4Х16
А4Х!6
А4Х16
А4Х,7
А4Х18
А4Х20
Примеры
Fe2(CO)9, W2CI93", Т12С1Э3-, I2O94-, Fe2F93"
Nb2Cl|o, M02CI10, U2Clio
(Nb2F,,)-, [(NH3MCo-NH2-Co(NH3M]51
[КЦасасJ]з, CoL6 (см. текст)
Te;iCl13-
Nb3 F,5, Ta3FI5, Sb3F15 (nap)
[Ti(OC2H5Lk (Tel4L, [Al4(OH)I6]Ba2
fCo(acacJl4
Tc:Cl16, [Pt(CH3KCl]4
ГСо4(ОНN(Х1Нз),2]е"
M04F20, W4O4F16
Более сложные группы
Чи1сло
октаэдров
6
7
8
9
10
Примеры
Nb6Ol9s-
Мо7О246-
Мо8О264^
Мп9Оз26-
Vio0286-
Число
октаэдр о-в
12
13
18
Примеры
PWI2O403-, Н4Со2.\1о10Оз86-
MnNbi2O3812-, СеМо,20428-
p2w18cv-
и [Те2Об(ОНL]4"~), а также атомы и (или) галогены в комплек-
сах переходных металлов (таких, как Pd и Pt; см. разд. 27.9.4).
Комплексы А3Х12 и A4Xi6 присутствуют в структурах тример-
пого и тетрамерного ацетилацетонатов Ni и Со (рис. 5.9); коор-
динационные группы вокруг атомов металла здесь образованы
атомами О лигандов СН3СО-СН-СО-СН3. В комплексе Co3L5
из табл. 5.3 [Inorg. Chem., 1968, 7, 18] L представляет собой
лнганд (С2Н5ОJРО• СН• СО• СН3:
СИ
о
о
Комплекс А4Х!8 из табл. 5.3 состоит из центральной октаэдри-
ческой группы Со(ОНN) соединенной по трем ребрам с тремя
группами Co(OHJ(NH3L. Этот ион хирален и представляет осо-
16'
244 5. ТетраэОрические и октаэдрические структуры
[Ni(acac),]
обозначает
[Со(асас)г]4
Рис. 5.9. Молекулы [Ni(acacJ]3 и [Со(асасJ14.
бый интерес как первый чисто неорганический комплекс, кото-
рый можно разделить на оптические антиподы. Несколько не-
ожиданно ион [Сг4(ОНNеп6]6+ (где еп — этилендиамин H2N-
•CH2-CH2-NH2), который мог бы иметь ту же структуру, что
и ион [Co4(OHN(NH3)i2]6t, имеет совсем другое строение, по-
Рис. 5.10. Ион [Сг4(ОНN(епN]6+.
казанное на рис. 5.10 [J. Am. Chem. Soc, 1969, 91, 193], с окта-
эдрами, соединенными по ребрам и по вершинам. Интересно,
что простая структурная единица А4Х16 (рис. 5.8, к) не обнару-
жена в качестве конечного оксоиона в растворе или как моле-
кула. Эта единица тетраэдрической симметрии D3 т, Td); она
5.3. Октаэдрические структуры 245
получается добавлением четвертого октаэдра, располагающего-
ся под центром структурной единицы, показанной на рис. 5.8,E.
Здесь каждый октаэдр обобществляет по три ребра, и имеется
тетраэдрическая пустота в центре комплекса. Такая структур-
ная единица встречается в кристаллическом вольфрамите
(разд. 11.5.2).
Две структурные единицы типа д, состоящие из трех окта-
эдров, могут соединяться, обобществляя еще одно ребро (штри-
ховая линия на рис. 5.11), с образованием центросимметричного
О н'<;
Рис. 5.11. Молекула Ni6(CF3COCHCOCH3) ,о(ОНJ(Н20J.
комплекса из шести октаэдров, который в простейшем случае
имеет состав А6Х24. Вершины, показанные на рис. 5.11 заштри-
хованными кружками, являются общими для трех октаэдров.
Они представляют собой группы ОН, а светлые кружки — это
молекулы Н2О; остальные двадцать вершин заняты десятью би-
дентатными лигандами CF3-CO-CH-CO- CH3 (L) в комплексе
Ni6Li0(OHJ(H2OJ [Inorg. Chem., 1969, 8, 1304]. Это интерес-
ный пример довольно сложной формулы, возникающей из весьма
простой системы шести соединенных по ребрам октаэдров.
Особый интерес представляет собой «сверхоктаэдр» A6Xi9,
который изображен на рис. 11.3, а (разд. 11.5.2) как структура
ионов M6Oi9"~, где M = Nb, Mo или W. Сверхоктаэдры, соединен-
ные попарно атомами Мп, образуют ион МпЫЬ^Озв12"; они най-
дены в качестве структурных субъединиц в Си7 ,yV6Oi9-a- и
SrnoWi6048.
Некоторые элементы, особенно V. Nb, Та, Мо и W, образуют
сложные оксоионы, построенные из большего числа октаэдриче-
ских координационных групп. Примеры приведены в табл. 5.3.
В гетерополианионах, таких, как PW12O403~ и P2Wi80626 , ато-
246 5. Тетраэдрические и октаэдри
ческие структуры
мы Р занимают тетраэдрические пустоты в центрах комплексов.
Эти более сложные оксопоны описаны в гл. 11.
5.3.2. Бесконечные системы связанных октаэдров. Из бесконеч-
но большого числа структур, которые можно построить из окта-
эдров, соединенных по вершинам, ребрам и (или) граням, мно-
гие уже известны, и полный перечень октаэдрических структур
охватил бы значительную часть структурной химии галогенидов
и халькогенидов. Число октаэдрических структур велико, потому
что: 1) октаэдр имеет 6 вершин, 8 граней и 12 ребер, и разное
число этих вершин, граней и ребер может быть обобществлено;
2) имеются многочисленные способы отбора, например отбора
небольшого числа ребер из двенадцати возможных. Рис. 5.12'
5.3. Октаэдрические структуры 247
Рис. 5.12. Четыре способа выделения четырех ребер октаэдра.
показывает четыре способа выбора четырех ребер. Кроме того,,
необязательно, чтобы все октаэдры в структуре были топологи-
чески эквивалентны, т. е. чтобы они обобществляли одинаковое
число одинаково расположенных вершин, ребер и (или) гра-
ней. Можно было бы предположить эквивалентность октаэдров
в относительно простых системах, но мы покажем, что это не
так. (К числу сравнительно простых октаэдрических комплексов,
содержащих неэквивалентные октаэдры, относятся цепь
[Na(H2OL]n"+ в буре, в которой чередующиеся октаэдры
Na(H2ON обобществляют пару противоположных и непротиво-
положных граней, слой Al3Fi4 в Na5Al3F4, где некоторые окта-
эдры AlFa обобществляют по четыре, а остальные по две вер-
шины.)
Важно различать топологическую эквивалентность октаэдров
и эквивалентность или неэквивалентность атомов X (вершин).
В группе из четырех октаэдров на рис. 5.13, а есть два типа не-
эквивалентных октаэдров: А (обобществляющих по два ребра)
л В (обобществляющих по три ребра). И здесь имеются три ти-
па неэквивалентных атомов X, принадлежащих одному, двум и
трем октаэдрам соответственно. Если бесконечно продолжать
л\ группу в направлениях стрелок с образованием двойной
пони, показанной на рис. 5.13,6, все октаэдры станут эквива-
лентными, но здесь по-прежнему остаются три сорта неэквива-
лентных атомов X, принадлежащих одному, двум и трем окта-
эдрам. В некоторых из простейших структур (например, в рути-
ле, в ReO3) все атомы действительно эквивалентны, но в МоО3,
например, имеются три типа неэквивалентных атомов кисло-
рода.
Можно выделить в качестве особого ряда те структуры, в
которых все октаэдры эквивалентны и каждый атом X принад-
лежит одинаковому числу октаэдров (двум октаэдрам в струк-
турах АХ3 и трем октаэдрам в структурах АХ2). Простейшие
структуры данного типа — это те, в которых октаэдр обобществ-
ляет
1) 6 вершин с 6 другими октаэдрами АХ3
2) 3 ребра (рис. 5.14.Q) АХ3
3) 6 ребер (рис. 5.14,6 или е) АХ2
4) 2 противолежащие грани АХ3
Ниже мы покажем, что случаи 1 и 2 соответствуют семействам
родственных структур, а случаи 3 и 4 представлены единичны-
ми структурами каждый. В дополнение к этим структурам, в
Рис. 5.13. Топологическая эквивалентность октаэдров (см. текст).
Рис. 5.14. Выделение трех (а) и шести (б и в) ребер октаэдра.
которых октаэдры соединены только вершинами, или ребрами,
или гранями, имеются структуры, в которых обобществлены и
вершины, и ребра (все октаэдры и все атомы X эквивалентны).
Структура рутила дает простой пример такого рода, другие при-
меры будут описаны позже.
Октаэдрические структуры можно классифицировать по чис-
лу и расположению вершин, ребер и (или) граней, как это сде-
лано в табл. 5.4, включающей в себя только бесконечные струк-
туры. Наше обсуждение будет касаться главных классов, ука-
занных в табл. 5.4; в первую очередь мы рассмотрим структуры,
в которых обобществлены только вершины или только ребра,
<ч затем перейдем к более сложным структурам.
Таблица 5.4. Бесконечные структуры, построенные из
октаэдрических групп АХ6
Сочленение через вершины
2 АХ5 Цепи:
цис: VF5, CrF5
транс: BiF5, (CrF5J-, a-UF5
4 AX4 Цепь: (CrF4)Cs
Слои:
цис: (ZnF4)Ba
транс: SnF4, (NiF4)K2
Каркас: IrF4
6 AX3 Каркасы:
ReO3, Sc(OHK
RhF3 и др.
перовскит
W бронзы
пирохлор
Сочленение по ребрам
2 АХ4 Цепи: ТсС14, Nbl4, Zrl4
3 АХ3 Слой: YC13, Bil3
4 АХ3 Двойная цепь: NH4CdCl3
АХ3 Слой: NH4HgCl3
А3Х8 Слой: Nb3Cl8
6 АХ2 Слой: Cdl2, CdCl2
АХ2 Двойной слой: МоС1, -у-М
АХ2 Каркас: Си2(ОНKС1
3 А2Х9 Слой:
(Bi2Br9)Cs3
5 А2Х7 Слой:
(Ti2O7)Sr3
Сочленение через вершины и ребра
АХ3, А3Х8, А2Х5 Слои (оксогидрокси-
ды V)
АХ2 Каркасы:
Структура рутила
а-АЮ-ОН
Еи3О4
CaTi2O4
а-МпО2
(Табл. 5.5)
BeY2O4
АХ3 Слой: МоО3
АХ3 Каркас: СаТа2О6
Сочленение по граням
2 АХ3 Цепь: Zrl3, BaNiO3, CsNiCl3
Сочленение через вершины и грани
Структуры АВО3: гексагон. ВаТЮ3> высокотемп. BaMnO3, BaRuO3 (табл.
о.и)
Сочленение по ребрам и граням
Nb3S4
Сочленение через вершины, ребра и грани
а-А12О3 (корунд)
Y-Cd(OHJ
5.3. Октаэдрические структуры 249
5.3.3. Структуры с обобществленными вершинами. Мы уже от-
мечали, что число правильных октаэдров, которые соединены
через вершины без соединения по ребрам или граням, не превы-
шает двух, если считать, что расстояние между любыми двумя
несвязанными атомами разных групп АХ6 не меньше, чем длина
ребра X—X, принятая в качестве минимального вандервааль-
сова расстояния. Следовательно, здесь мы должны рассматри-
вать только структуры, в которых каждая обобществленная вер-
шина принадлежит двум октаэдрам. Для таких структур уста-
навливается простое соотношение между формулой и числом
обобществленных вершин (атомов X):
Число обобществлен- 1 2 3 4 5 6
ных вершин
Формула
АД,
АХ, АД,
АХ4 А2Х7
АХ,
На рис. 5.8, в показаны конечные группы А2Хц. Структуры, в
которых обобществлены по три или по пять вершин каждого
октаэдра, немногочисленны. Слой А2Х9 был представлен на
рис. 4.35 (разд. 4.6.2). Структуры с обобществленными вершина-
ми состава А2Х7 будет удобно рассмотреть после того, как мы
проанализируем гораздо более многочисленные структуры, в ко-
торых обобществлено четное число вершин.
Две вершины октаэдра могут быть либо смежными {цис),
либо противоположными {транс). Обобществление двух цис-вер-
шин каждого октаэдра приводит к циклическим молекулам
(ионам) или к зигзагообразным цепям (рис. 5.15, а и б). Обоб-
ществление транс-вершин может привести к циклам из восьми
или большего числа октаэдров (поскольку для соединенных вер-
шинами октаэдров минимальное значение угла А—X—А равно
132°), но такие циклы неизвестны. Более простая возможность
(А—X—А = 180°) состоит в образовании линейных цепей
(рис. 5.15,в).
Циклические татрамеры в кристаллах некоторых пентафто-
ридов металлов M4F20 бывают двух типов — с коллинеарными и
нелинейными связями М—F—М:
Валентный угол при ато- I 180°:
ме F I 132°:
= \Ъ, Та, Mo, W
= Rn, Os, Rh, Ir, Pt
Прочие пентафториды образуют один из двух типов цепей, по-
казанных на рис. 5.15:
цис-цеиь: \Т'5, CrF5, TcF5. ReF5, MoOF4; K2(VO2F3)
гранс-цепь: BiF5, «-'W5; WOC14; Ca(CrF5), T12(A1F5)
250 5. Тетраэдрические и октаэдрические структуры
Неясно, какие факторы обусловливают выбор циклического тет-
рамера или одного из двух типов цепей, и это относится также
к еще более тонкому различию (в углах—F—) между двумя ти-
пами тетрамерных молекул, которое аналогично различию,
наблюдающемуся между фторидами MF3. Различие между
MoOF4 (цепь) и WOF4 (циклический тетрамер)—это один из
многих примеров структурных различий между соединениями
Рис. 5.15. Октаэдры, соединенные через ^ис-вершины с образованием цикличе-
ского тетрамера (а) или цис-цепи (б); в — октаэдры, соединенные через транс-
вершины с образованием транс-цепи ReO3. б и в — это также вид сбоку цис-
п транс-слоев. Истинная конфигурация цис-слоя в BaMnF4 показана на рис. г,
где Fi и Fn — неэквивалентные атомы F, о которых говорится в разд. 5.1.1.
Валентный угол М—Fi—М равен 139°; связи атома Fn приблизительно пер-
пендикулярны чертежу (М—Fn—M 173°).
этих двух элементов (ср. структуры МоО3 и WO3, описанные ни-
же). Эти два типа цепей АХ5 {цис и транс) найдены также в
оксогалогенидах и комплексных галогенидах. Присоединяя че-
рез вершины дополнительные октаэдры к октаэдрам простой це-
пи АХ5, можно построить более сложные типы цепей того же
состава. Пример такой разветвленной цепи обнаружен (вместе
с простыми транс-цепями) в BaFeF5; он изображен на рис. 10.2
(разд. 10.1.3).
Наиболее важные системы, в которых октаэдрические груп-
пы АХ6 обобществляют по четыре вершины, — это слои АХ4, но
прежде чем описывать их, мы должны отметить, что обобществ-
ление четырех вершин может приводить и к трехмерным, и к
одномерным структурам. Пример трехмерной структуры дает
IrF4, строение которого описывается искаженной алмазной сет-
кой, а в CsCrF4 присутствует цилиндрическая цепь, проекция
которой вдоль оси цепи выглядит так, как это показано на
5.3. Октаэдрические структуры 251
рис 5.8, ж. В обеих этих структурах необобществленные верши-
ны являются смежными (цыс-расположение). Следующий член
семейства цилиндрических цепей (см. разд. 3.8)-—цепь, проек-
ция которой имеет вид, показанный на рис. 5.8, к. Подобно тому
как обобществление цис- и транс-вершин дает два типа цепей,
имеются слои, образованные с использованием четырех вершин
октаэдра, в которых необобществленные вершины находятся в
/(не- или транс-положении. Если считать, что каждый квадрат
на рис. 5.15,6 и в представляет собой цепь связанных вершина-
ми октаэдров, перпендикулярную плоскости чертежа, то эти
схемы показывают вид слоев сбоку. Рис. 5.15, г изображает бо-
ковую проекцию слоя, который является анионом в изострук-
турных солях BaMF4 (M = Mg, Mn, Co, Ni, Zn) и в триклинном
BiNbO4. В транс-слое обобществлены по четыре экваториальные
вершины каждого октаэдра. Этот слой АХ4 можно получить и
другим способом, помещая октаэдры АХ6 в точки плоской сет-
ки из четырехугольников с атомами X в серединах связей. При-
меры нейтральных молекул с такой структурой дают SnF4, PbF4,
Sn(CH3bF2 и UO2(OHJ- Такого типа слой в качестве двумер-
ного аниона присутствует в структурах T1A1F4 и K2NiF4
(рис. 5.16, а, б); последняя структура свойственна многочислен-
ным комплексным фторидам и оксидам (см. гл. 10 и 13). Иска-
женный вариант этой структуры реализуется в K2CuF4 и
(NFLbCuCU, в которых две из экваториальных связей (штри-
ховые линии на рис. 5.16, в) длиннее, чем другие четыре связи
Си—X. Четвертая структура, содержащая транс-слоя, — это
лзоструктурные соли Ba2MF6 (M = Co, Ni, Cu, Zn), в которых
присутствуют обособленные ионы F~, что приводит к структур-
ной формуле Ba2(MF4)F2 (рис. 5.17).
В слое АХ4, содержащемся в K2NiF4, две связи атома X
коллинеарны. Но существует и гофрированная конфигурация
чтого слоя, которая удобна для атомов X, образующих нелиней-
ные связи. Эта конфигурация изображена в двух проекциях на
рис. 5.16, г и д и представлена в слое СаС12-2Н2О (разд. 15.2.6),
где молекулы Н2О расположены в необобществленных вершинах
координационных групп СаС14(Н2ОJ.
Обобществление вершин достигает своего предела, когда
каждая вершина участвует в сочленении октаэдров, что дает
трехмерные структуры состава АХ3. Это первая из очень сим-
метричных октаэдрических структур, перечисленных в разд. 5.3.2.
Поскольку каждый атом А связан с шестью другими (через
атомы X), атомы А находятся в узлах трехмерной 6-связан-
ной сетки, и это приводит к семейству структур, среди которых
простейшая в своей наиболее симметричной конфигурации соот-
ветствует примитивной кубической решетке. Элементарная
ячейка этой структуры показана на рис. 5.18. Модель, построен-
252
5. Тетраэдрические и октаэдрические структуры
ная из жестких октаэдров, но с гибкими соединениями во всех
вершинах, может приобретать бесконечно большое число раз-
личных конфигурации. Самая симметричная из них имеет ку-
бическую симметрию и представляет собой структуру кристалли-
ческой ReO3; WO3 имеет такую структуру только при очень вы-
Рис. 5.16. Октаэдрический слой АХ4: а — структура K2NiF4; б — вид слоя в
K2NiF4; в — вид слоя в (NH4JCuCl4; г и д — вид слоя в СаСЬ-2НгО (сверху
и сбоку).
соких температурах, а при более низких температурах характе-
ризуется менее симметричными вариантами строения.
В структуре ReO3 атомы О занимают 3Д позиций кубиче-
ской плотнейшей упаковки, а позиции в центре куба остаются
свободными. (Использование этих позиций для размещения
крупных ионов В, по размеру сравнимых с О2", F~ или С1~~, дает
для соединений АВХ3 структуру перовскита, в которой ионы
В и X совместно образуют кубическую плотнейшую упаковку.)
Для наиболее вытянутой конфигурации сетки, показанной на
рис. 5.18, а, угол А—X—А равен 180°, но были найдены и ва-
5.3. Октаэдрические структуры 253
О О
о о
T1A1F4
K2iM.T4
BazNiF6
Рис. 5.17. Структуры, содержащие транс-слои АХ4, образованные октаэдриче-
скими группами, которые соединены через четыре свои вершины (схематиче-
ское изображение боковой проекции, где показано по одному октаэдру из каж-
дого слоя). Большие заштрихованные кружки соответствуют катионам, распо-
ложенным между слоями.
рианты структуры с меньшими углами. Наиболее компактна
структура, в которой атомы X находятся в позициях гексаго-
нальной плотнейшей упаковки. Эта структура встречается в не-
которых трифторидах переходных металлов (см. табл. 9.16.,
разд. 9.10.3).
Рис. 5.18. Кристаллические структуры ReO3 (а) и Sc(OHK (б).
Как a-Zn(OHJ и Ве(ОНJ кристаллизуются с образованием
простейшего трехмерного каркаса, возможного для соединений
АХ2 с координацией 4 : 2 (структура кристобалита) и искажен-
254 5. Тетраэдрические и октаэдрические
структуры
ного таким образом, что водородно-связанные группы ОН раз-
ных координационных группировок сближаются, так и Sc(OHK
и 1п(ОНK имеют простейшие трехмерные каркасные структуры
типа АХ3 (структура ReO3) с искажением, позволяющим обра-
зовать водородные связи между группами ОН разных октаэдров
М(ОНN- Характер этого искажения можно увидеть на рис. 5.18, б.
Группы ОН лежат не на отрезках, соединяющих атомы метал-
ла, а вне этих линий, и каждая из этих групп связана с двумя
другими. Гидроксильная группа, обозначенная А, связана с ато-
мом металла М и с таким же атомом, находящимся над М по
вертикали, кроме того, она соединена водородными связями с
гидроксильными группами В и С.
С точки зрения топологии структура ReO3 — это простейшая
из трехмерных каркасных структур для соединений АХ3, по-
строенных из октаэдров, поскольку она основана на простейшей
трехмерной сетке со связанностью 6. Известны и более сложные
структуры тога же общего типа, т. е. структуры, в которых
каждый октаэдр соединен через вершины с шестью другими ок-
таэдрами. Такого типа структуру имеют вольфрамовые бронзы,
описанные в гл. 13. Особенностью строения вольфрамовых бронз
является наличие каналов, параллельных осям 4-го и 6-го по-
рядков и проходящих только в одном направлении.
Известна и другая каркасная структура, построенная из окта-
эдрических групп, каждая из которых соединена через вершины
с шестью другими. В базисном каркасе ВХ3 структуры пирохло-
ра октаэдры, все вершины которых обобществлены, сгруппиро-
ваны тетраэдрически вокруг точек алмазной сетки. В этом кар-
касе имеются весьма обширные пустоты, центры которых тоже
расположены, как атомы углерода в алмазе, и в них могут
располагаться два более крупных катиона, а также один допол-
нительный анион X на каждую формальную единицу (ВХ3J
каркаса. Жесткий октаэдрический каркас устойчив и в отсут-
ствие крупных катионов А и дополнительных атомов X, и поэто-
му он служит основой структуры соединений нескольких типов.
Если все позиции А и X заняты, получается формула А2В2Х7
(как в оксидах, подобных Hg2Nb2O7), однако позиции катионов
А могут быть свободны, как в А12@Н, FN(H2OK/4, где непол-
ностью занята седьмая позиция X. Структура пирохлора изоб-
ражена на рис. 7.3 (разд. 7.6) и обсуждается в гл. 6 и 13.
Членом семейства структур, родственных ИеОз, является
структура, в которой обобществлены пять вершин каждого окта-
эдра. На рис. 5.19 показана проекция этой структуры вдоль
оси 4-го порядка; здесь каждый квадрат представляет собой
цепь октаэдров, соединенных противолежащими вершинами в
дополнение к четырем экваториальным вершинам, которые по-
казаны на проекции. Объемные слои, вырезанные из структуры
5.3. Октаэдрические структуры
типа а, имеют общую формулу А„Х3п+2; первый член ряда — это
ординарная цепь АХ5, прочие —это слои А2Х8( = АХ4), А3Хц,
А.;X11 (= А2Х7) и т. д. Примерами являются BaZnF4 и NaNbO2F2
\i\--2); Ca2Nb207 (л = 4); Ca4NaNb50i7 (п = 5). Слои типа б
имеют общую формулу А„Х3«+ь т. е. АХ4, А2Х7 и т. д. Примера-
ми могут служить K2NiF4 и Sr2Ti04 (п= 1), Sr3Ti207 (я = 2),
БгДЬОю (га = 3). Только первые два члена каждого семейства
образованы топологически эквивалентными октаэдрами, а имен-
но: цепь АХ5, два слоя АХ4 и слой А2Х7 типа б. В этом слое
п 1 2 3 л
I
IX
X
X
X
X
X
X
X
X
Рис. 5.19. Два семейства слоев, которые можно выделить в структуре RcO3.
каждый октаэдр обобществляет пять вершин, в то время как в
слое А2Х7 типа а равные количества октаэдров обобществляют
по четыре или по шесть вершин; представляет интерес сравнить.
это с трехмерным каркасом веберита (разд. 20.4.2), где октаэд-
ры MgF6 обобществляют по шесть вершин, а октаэдры A1F6 —
по четыре вершины.
5.3.4. Структуры с обобществленными ребрами. Выше мы отме-
чали, что из октаэдров, соединенных только ребрами, можно
построить бесконечно большое число структур, поскольку мож-
но менять от двух до двенадцати число обобществленных ребер,
I! сверх того имеется ряд способов выбора ребер, участвующих
в соединении. Нет необходимости рассматривать обобществление
более чем шести ребер, поскольку такая ситуация наблюдается
только в структуре NaCl, которую можно представить как со-
вокупность октаэдрическпх координационных групп NaCl6 или
С1Ха6, обобществляющих все двенадцать ребер.
Есть четыре разных способа выбора двух ребер октаэдра, а
именно: 1) цис-ребра (с общей вершиной), образующие угол
<>0°; 2) цис-ребра, расположенные взаимно перпендикулярно;
256 5. Тетраэдрические и октаэдрические структуры
3) скрещивающиеся ребра; 4) гранс-ребра (противолежащие).
Случаи 1 дает конечную группу из трех октаэдров (рис. 5.8,д),
а случай 2 приводит к конечной группе из четырех октаэдров
(рис. 5.8, л) или к зигзагообразной цепи (ср. с боковой проек-
цией слоя МоО3 на рис. 5.30, а; это цепь из белой формы
МоО3-Н2О (разд. 11.5.2). Примеры случаев 3 и 4 представлены
на рис. 5.20, где каждый октаэдр показан лежащим на грани.
5.3. Октаэдрические структуры 257
Рис. 5.20. Октаэдры, соединяющиеся по наклонно расположенным по отноше-
нию друг к другу (т. е. скрещивающимся) ребрам (а) и по транс-ребрам (б).
Две простейшие структуры, образованные соединением по скре-
щивающимся ребрам, изображены на рис. 5.20, а, а именно
цикл из шести октаэдров в ТеМО6О246" и плоская зигзагообраз-
ная цепь, присутствующая в ТсСЦ (и в других тетрагалогени-
дах); эта структура реализуется также в виде иона ТеО42~ в
солях \а и Са (разд. 16.10) и в виде иона (СиС13-Н2О)~~ в
LiCuCl3-2H2O. В этом последнем кристалле половина молекул
кристаллизационной воды входит в состав цепи, а остальные
молекулы воды вместе с ионами Li+ располагаются между це-
пями. Кроме этих простых структур можно построить бесконеч-
но большое число более сложных колец и цепей; примерами
служат спиральная цепь (с осью 4i) в Li2Te04 (разд. 16.10) и
цепи в кристаллических НИ4 и Zrl4. Некоторые простые приме-
ры приведены в книге «Модели в структурной неорганической
химии» [Clarendon Press, Oxford, 1970, p. 98, 148]; более сис-
тематический анализ выполнен в работе [Acta cryst, 1981, В37,
532J.
В более сложной цепи, которая представляет собой комп-
лекс катионов с водой в буре [Na(H2OL]2[B4O5(OHL], октаэд-
ры поочередно обобществляют пару противолежащих или пару
скрещивающихся ребер. По-видимому, в этом кристалле такая
конфигурация цепей способствует их совместной упаковке с це-
пями анионов, содержащими водородные связи, но менее понят-
но, почему сходные цепи обнаружились в Na2SO4- 10Н2О. В этом
кристаллогидрате только восемь из десяти молекул кристалли-
зационной воды ассоциированы с катионами с образованием
цепи, в которой отношение 4Н2О: Na то же, что и в буре.
Обобществление двух противолежащих ребер в каждом ок-
таэдре приводит к бесконечной цепи АХ4 (рис. 5.20,6), которая
наблюдается в виде бесконечной молекулы в кристаллическом
Nbl4 и в виде бесконечного аниона, например, в K2HgCl4-H2O.
В этой цепи АХ4 только четыре атома X каждой октаэдрической
группы АХ6 участвуют в соединении атомов А. Два других ато-
ма X связаны только с одним атомом А и могут быть лиганда-
ми другого рода, неспособными к образованию мостиков между
двумя атомами металла (что отражает формула AX2L2), или же
могут входить в состав бидентатного лиганда, что дает формулу
АХ2В. Таким образом, эта простая цепь оказывается удобной
для соединений трех типов:
АХ4: NBI4
AX2L2: РЬС12(С6Н5J> CoCI2-2H2O
AX2B: CuCl2-C2N3H3
Строение
разд. 25.7.6.
CuCl2-C2N3H3 и другие примеры описаны в
АХ2В
Существует также семейство структур, содержащих рутило-
подобные цепи, которые объединяются с помощью ионов второ-
го рода, причем цепочечные анионы располагаются так, что об-
17—752
258 5. ТетраэОрические и октаэдричсские структуры
разуются подходящие координационные группы вокруг этих ка-
тионов:
М 'MX,
КЧ атома М'
Литература
Sr2Pb04, Ca2Pb04
Ca2Sn04, Cd2Sn04
Na2MnCl4
Mn2Ge04 (при высоком давле-
нии)
Na2CuF4, Na2CrF4
Ca2Ir04
7
Naturwiss., 1965, 52, 492
Naturwiss., 1967, 54, 17
Acta cryst., 1971, B27. 1672
Acta cryst., 1968, B24, 740
Z. anorg. allg. Chem., 1965, 336',
200
6, 7, 9 Z. anorg. all". Chem., 1966, 347,.
282
0
Na1
О
Было несколько публикаций, свидетельствующих о том, что для
разных соединений обнаружена одна и та же ромбическая струк-
тура (рис. 5.21). Она интересна тем, что атомы М, расположен-
ные между цепями, здесь имеют тригонально-призматическую
координацию. Моноклинная структура Na2CuF4 представляет со-
бой вариант этой структуры, искаженной так, чтобы для Cu(II)
получилась координация 4+2; ион Na+ здесь имеет 7 соседних
атомов F на расстояниях 2,27—2,66 А.
В гексагональной структуре Ca2IrO,t
наблюдается несколько иное располо-
жение цепей, но по сути дела все три
структуры относятся к одному типу.
В K2HgCl4-H2O между рутилоподоб-
ными цепями (HgCl4)ra2"~" помимо ио-
нов К+ располагаются и молекулы
Н2О. Размещение на серединах ребер
ячейки (рис. 5.21) дополнительных
атомов S дает структуру La2SnS5 или
La2(SnS4)S, в которой ионы La3'r пме-
(трехшапочная тригональная призма).
Добавление еще двух атомов S между рутилоподобными цепя-
ми, а также третьего катиона порождает структуры Sm3InSs
или Sm3(InS4)S2, где атомы Sm имеют координацию 7 и 8.
Если цепь АХ4 расположена так, что лежит на некоторой
совокупности октаэдрических граней, она проецируется, как это
показано на рис. 5.22, а; вид вдоль цепи изображен рядом (спра-
ва). Две такие цепи могут соединяться своими боковыми по-
верхностями с образованием представленной на рис. 5.25, б двои-
Рис. 5.21. Проекция струк-
туры Na2MnCl4 вдоль на-
правления цепочечных
нов.
по-
ЮТ координацию 7+2
5.3. Октаэдрические структуры 259
Слой
Слой АХ •.
Гофрированный
слой МОС1
или МО(ОН)
(вид с торца)
структура атакомита
Рис. 5.22. Структуры, образованные из сочлененных
по ребрам октаэдров.
ной цепи состава АХ3, где каждый октаэдр обобществляет по
четыре ребра. Такую форму имеет анион в МН4Сс1С1з и КСиСЬ-
Удобно рассматривать цепи на рис. 5.22, а и б как рутилоподоб-
ную и двойную рутилоподобную. Проекции вдоль оси цепи
будут использованы ниже для представления более сложных
структур, которые получаются, когда эти цепи образуют гофри-
17'
260
5. Тетраэдрические и октаэдрические структуры
рованный слой, дополнительно соединяясь через ребра, или трех-
мерный каркас (с обобществлением вершин).
На рис. 5.12 мы показали четыре способа выбора четырех
ребер октаэдра. Ребра, выделенные на рис. 5.12, а, обобществля-
ются при образовании двойной цепи, изображенной на рис. 5.22, б,
а ребра, выделенные на рис. 5.12,6, — при образовании слоя
А3Х8 (рис. 5.22,2). Обобществление четырех экваториальных ре-
бер (рис. 5.12, в) приводит к слою состава АХ3, в котором 4 ато-
ма X каждой группы АХ6 являются общими для четырех окта-
эдров, а два атома X остаются необобществленными. Такой слой
найден в NH^HgCb), хотя октаэдрические координационные
группы здесь так искажены, что предпочтительным оказывается
другое описание структуры с выделением молекул HgCl2. Обоб-
ществление четырех ребер, выбор которых показан на рис. 5.12, гу
обнаружено в анатазе (TiO2). Однако здесь у октаэдра имеются
также вершины, общие с четырьмя другими октаэдрами, и, сле-
довательно, эта структура не относится к числу простых струк-
тур с обобществленными ребрами. Тем не менее имеет смысл
обратить внимание на обобществление этих ребер, потому что
они расположены тетраэдрически — факт, наиболее легко наблю-
даемый именно на этой модели. Обобществление данной сово-
купности ребер приводит к трехмерной алмазоподобной струк-
туре аналогично тому, как обобществление четырех вершин в
IrF4 тоже дает алмазоподобный каркас.
Продолжая боковое сочленение простых цепей АХ4, мы при-
дем к бесконечному слою (рис. 5.22,в), в котором обобществле-
ны шесть ребер каждого октаэдра и каждый атом X является
общим для трех октаэдров. Состав слоя: АХ2; таковы слои в струк-
турах СсПг и CdCl2 (об этих структурах говорится также в гл. 4
и 6). На рис. 5.22 представлен еще один способ выбора четырех
ребер, приводящий к слою АзХ8, который найден в кристалли-
ческом Nb3ls.
Мы видели, что при обобществлении разных пар ребер воз-
никают линейные и зигзагообразные цепи. Аналогично при обоб-
ществлении различных совокупностей из шести ребер получа-
ются плоские и гофрированные слои. Если обобществление очень
симметричного расположения шести ребер на рис. 5.22, в дает
плоский слой, то при обобществлении ребер, выделенных на
рис. 5.22, е, образуется гофрированный слой. Этот слой пред-
ставляет собой основу ряда структур оксохлоридов МОС1 и ок-
согидроксидов МО (ОН). Структуры пар соединений, таких, как
FeOCl и •y-FeO(OH) (минерал лепидокрокит), различаются спо-
собом упаковки слоев, причем в последнем соединении между
атомами О разных слоев возникают водородные связи. Инте-
ресным (и необъясненным) фактом является то, что в отличие
от прочих дигидроксидов Зй-металлов с простой слоистой струк-
5.3. Октаэдрические структуры 261
турой типа Cdl2 дигидроксид меди Си(ОНJ, по-видимому,
кристаллизуется с образованием гофрированных слоев, более
характерных для соединений МОС1 и МО (ОН). Гофрированный
слой лепидокрокита найден также в соединениях RbxMn^Ti2-.vO4
@ 60<О'<0,80), где замещение части Ti4+ в октаэдрах на Мп3+
дает заряженные слои, которые соединяются с помощью ионов
Rtr (P"c- 5.23). Таким образом, однотипные слои объединяются
посредством вандерваальсова взаимодействия в FeOCl, с по-
О О О ORb4
о о
Рис. 5.23. Вид сбоку на структуры КЬМпхИ2-хО4 (а) и Y-FeO-OH (б).
мощью связей О—Н—О в Y-FeO(OH) и через ионы Rb+ в сме-
шанном оксиде.
Сочленение шести ребер (рис. 5.22, ж) с шестью другими
октаэдрами порождает интересную трехмерную каркасную
структуру, которая родственна ряду кубических структур. Мож-
но видеть, что обобществление шести ребер, расположенных по
типу ж, оставляет шесть ребер, расположенных по типу в, не-
обобществленными, а участие в соединении октаэдров всех две-
надцати ребер дает структуру NaCl. Соответственно имеются
две очень простые структуры, выводимые из структуры NaCl
путем удаления половины ионов металла. Удаление через один
из слоев катионов, как показано на рис. 4.22, а (разд. 4.3), дает
слоистую структуру CdCl2, в которой октаэдры соединены по
ребрам (вариант в). С другой стороны, если удаляются другие
ряды катионов, показанные пунктирными кружками на рис. 4.22, б,
мы получаем структуру, в которой каждый октаэдр сочленен со
своими соседями через ребра в соответствии с вариантом ж.
Эта структура изображена в виде системы октаэдров на рис. 7.3.
Хотя ближайшее окружение ионов А и X в обеих этих струк-
турах (рис. 4.22, а и б)в точности одинаково, примечательный
факт состоит в том, что нет дигалогенида, кристаллизующегося
со структурой, отвечающей второму варианту (в то время как
262 5. Тетраэдрические и октаэдрические структуры
по типу CdCl2 кристаллизуется значительное количество дигало-
генидов). Однако искаженная форма этой структуры встречает-
ся в минерале атакамите, в одной из полиморфных модифика-
ций Си2(ОНKС1 (вторая модификация имеет слоистую структу-
ру типа Cdl2). Этот трехмерный октаэдрический каркас играет
роль каркаса ВХ2 в структуре шпинели, как показано на
рис. 7.3,а в разд. 7.6.3. Он также родствен алмазной структуре,
поскольку здесь октаэдры сгруппированы по четыре вокруг
яустых тетраэдрических полостей, располагающихся в узлах
Н,0
•алмазной сетки. Но топологическим представлением этой струк-
туры является 6-связанная трехмерная сетка на рис. 29.16, г
(разд. 29.6.3), образованная присоединением каждого атома А
к шести другим ближайшим соседям А с обобществлением шес-
ти ребер.
Мы выделили здесь структуры, образующиеся при обобще-
ствлении двух, четырех или шести ребер, поскольку они иллю-
стрируют переход от простой и двойной цепей к слоям и трех-
мерным структурам. Одна из наиболее важных структур с обоб-
ществленными ребрами — это слой АХ3 на рис. 5.22,E, в котором
каждый октаэдр сопрягается с соседними посредством трех ре-
бер. Такая структурная единица встречается в А1(ОНK, во
многих трихлоридах, в некоторых трибромидах и трииодидах.
Здесь можно также отметить бесчисленное множество вариан-
тов двойной цепи, показанной на рис. 5.22, б. Простейший из них
изображен на рис. 5.22, а; здесь половина октаэдров обобщест-
вляет по три ребра, а остальные — по пять ребер. Такова форма
цепи Cd2Cl5(H2O) в CdiNiCbo- 10H2O (разд. 15.2.6), где коорди-
национные группы CdCl5(H2O) и CdCl6 сочленяются с соседними
тремя и пятью ребрами соответственно. Существует бесконечное
число вариантов этой цепи, где октаэдры обобществляют по три,
четыре или пять ребер.
5.3.5. Структуры, в которых обобществлены вершины и ребра.
Многие сложные октаэдрические структуры удобно описывать
как построенные из субъединиц, которые могут быть, например,
конечными группами или бесконечными цепями, связанными
между собой через дополнительные вершины и (или) ребра с
образованием слоя или трехмерной каркасной структуры. Хотя
5.3. Октаэдрические структуры 265
Рис. 5.24. Структура рутила.
эТот способ часто оказывается полезным при изображении или
построении моделей многих сложных структур, следует помнить,
что субъединицы выделяются только для этой цели и вовсе не-
обязательно имеют какой-либо химический или физический
смысл. Мы встретимся со структурами, которые построены из
еоешпепных по ребрам и граням пар октаэдров и в очень мно-
гих'случаях могут быть описаны как образованные из цепей —
шбо из рутилоподобных цепей АХ4 с обобществленными ребра-
ми (рис. 5.22, а), либо из цепей АХ5 с обобществленными вер-
шинами, характерных для ReO3 (рис. 5.15,в). Структуры часто
изображаются в проекции вдоль на-
правления такой цепи, и в связи с
этим важно отметить, как атомы X
обобществлены в изолированной и
в составной цепях.
В изолированной рутилоподоб-
пой цепи АХ4 присутствуют атомы X
двух сортов, как это показывают
цифры в верхнем правом углу рис.
5.22. Часть из них принадлежит
только одному октаэдру, часть —
сразу двум октаэдрам. Аналогично
в двойной цепи АХ3 на рис. 5.22, б атомы X принадлежат одно-
му, двум или трем октаэдрам. Мы будем обозначать эти раз-
ные атомы X как Хь Х2 и Х3 соответственно. Очевидно, что есть
множество способов соединения таких цепей, приводящих в ре-
зультате обобществления атомов X к более сложным структу-
рам. Наиболее важная группа таких структур получается
при сцеплении атомов Xi одной цепи с атомами Х2 других,
цепеп.
Простейшая структура такого рода — это рутил, изображен-
ный в проекции на рис. 5.24. Поскольку атом Xi одной цепи это
и есть атом Х2 другой цепи, каждый атом X является общим для.
трех октаэдров, и соответственно получается формула АХ2. Бо-
лее подробно структура рутила описана в гл. 6. Этой структуре,,
построенной из ординарных цепей, соответствуют трехмерные
каркасы, полученные из двойной цепи, которая изображена на
рис. 5.22,6. Три из них представлены на рис. 5.25. Во всех этих
структурах каждая вершина является общей для трех октаэд-
ров, что дает формулу АХ2. На рис. 5.25,а показана структура
минерала диаспора а-АЮ(ОН). В структурах бив менее плот-
ная упаковка цепей оставляет место для дополнительных атомов
(катионов), и этот заряженный каркас (или трехмерный ион)
охватывает подходящие ионы, показанные кружками на
рис. 5.25, б и в. Примеры соединений с такими структурами:
даны в табл. 5.5.
264 5. Тетраэдрические и октаэдрические структуры
Имеется еще и другое семейство возможных структур, в ко-
торых роль обобществленных вершин играют либо атомы Xi
обеих цепей (которые могут быть ординарными или составны-
ми), либо атомы Х2 обеих цепей. Слой АХ3 на рис. 5.26, а пред-
ставляет собой простейшую структуру такого рода, состоящую
Рис. 5.25. Структуры, построенные из двойных рутиловых цепей.
из рутилоподобных цепей, перпендикулярных плоскости черте-
жа и соединенных через вершины Хь Аналогичный слой, обра-
зованный таким же способом из двойных цепей, показан на
рис. 5.26, в, а промежуточный вариант (из ординарных и двой-
ных цепей) — на рис. 5.26, б. В последнем случае отчетливо
различаются два типа октаэдров. Оксигидроксиды ванадия
(разд. 12.7.2) дают примеры таких слоев. В гл. 3 мы описали
слоистую структуру соединения CuHg(OHJ(NO3J(H2OJ в ка-
честве примера усложненной плоской сетки 4-угольников. Эта
структура фактически содержит слой АХ3, изображенный на
Таблица 5.5. Структуры, построенные из двойных октаэдрических цепей
Природа ос-
новной ор-
динарной
цепи
Сочленение
по ребрам
АХ4
Сочленение
через верши-
ны АХ5
Цепь
АХз
NH4(CdCl3)
АХ4
NbOCU
Тип структуры
Слой
АХ3
у-АЮ-ОН
АХз
СаТа2О6
, построенной из двойных
Трехмерный
АХ2
EihO4
а-ЛЮ-ОН
CaFe2O4
АХз
.ИоО3 —
цепей
каркас
сх-МпОй
(голландит)
—
5.3. Октаэдрические структуры 265
А2Х
2Х5
Рис. Г).26. Слои, построенные из ординарных и двойных октаэдрических цепей,
которые расположены перпендикулярно к плоскости чертежа: а — АХз; б-—
A3Xg; в — АгХ5; г — проекция слоя а.
рис. 5.26, а, что нагляднее всего видно из проекции слоя, перпен-
дикулярной его плоскости (рис. 5.26,г).
Возможны также трехмерные каркасные структуры, анало-
гичные тем, что представлены на рис. 5.25. Примером является
структура СаТЧгС^ (рис. 5.27,а), которую следует сравнить с
рис. 5.25, б. Дальнейшее обобществление ребер двойных цепей
дает структуру, показанную на рис. 5.27, б и реализующуюся в
Na.v-FexTi2-xO4 @,90>x>0,75). Структура NaTi2Al50i2 указы-
Рис. 5.27. Проекции структур CaTi2O4 (а) и Na^Fe^Ti2-^O4 (б).
вает на еще один способ использования двойной цепи; здесь
каркас, составленный из ординарных и двойных цепей, содержит
А1 в тетраэдрических пустотах и Na в октаэдрических пустотах
[Acta cryst., 1967, 23, 754].
Можно также рассмотреть структуры, построенные из других
типов составных цепей. Примеры нескольких таких структур
дает семейство минералов, родственных МпО2, и двойной оксид
BeY2O4, построенный из четверных рутилоподобных цепей. Эти
структуры описаны в гл. 12 и 13, где приведены также другие
примеры соединений с описанной выше структурой. Интересную
структуру, относящуюся к тому же общему типу (рис. 5.25,6),
имеет Nas-xRmOg [Acta cryst, 1974, ВЗО, 1459]. Здесь двойные
цепи поочередно замещены на ординарные и тройные.
266 5. Тетраэдрические и октаэдрические структуры
В структурах, которые мы описали как построенные из рути-
лоподобных цепей, все такие цепи параллельны. В BaU2O7 трех-
мерный каркас (рис. 5.28) образуют аналогичные цепи, вытяну-
тые в двух взаимно перпендикулярных направлениях. Атомы
О обобществленных ребер одной цепи через один являются так-
же атомами перпендикулярных цепей, так что в каждом октаэд-
ре UO,j Два атома О связаны с одним атомом U, два — с двумя
атомами U и два — с четырьмя атомами U. Отношение числа
Рис. 5.28. Каркас U2O7 в BaL^O?. Оси цепей v и h лежат соответственно в пло-
скости чертежа и перпендикулярно к ней. Группы U02 цепей v располагаются
перпендикулярно чертежу, а цепей h — параллельно. Заштрихованные круж-
ки — атомы О, связанные с четырьмя атомами U, а светлые кружки — ато-
мы О, связанные с двумя атомами U.
атомов 0:U в каркасе получается равным 7:2 B-1+2- '/г+
'/7
Теперь перейдем к структурам, построенным из цепей AXs,
которые составлены из групп АХ6, обобществляющих пару про-
тиволежащих вершин. Эту цепь удобно представить в виде про-
екции вдоль оси цепи, как и двойную цепь, образованную из
двух таких ординарных цепей путем сочленения октаэдров по
их ребрам (рис. 5.29). Такая двойная цепь играет роль беско-
нечной «молекулы» в кристаллическом NbOCls, где общими вер-
шинами являются атомы О (ср. с димерной молекулой Nb2Clio
в кристаллическом пентахлориде, образованной из двух октаэд-
ров, соединенных по ребру). Дальнейшее сочленение таких двой-
ных цепей по ребрам дает гофрированные слои, показанные в
¦боковой проекции на рис. 5.30, а и б. В обоих случаях три ато-
ма X каждого октаэдра связаны с тремя атомами А, два — с
5.1?. Октаэдрические структуры 267
NbOCW
Рис. 5.29. а —цепь ReO3 (АХ5); б —двойная цепь ReO3 (AX4); в — молекуле
Nb2Clio и цепочечная молекула NbOCl3.
а
Рис. 5.30. Слои состава АХ3, построенные из двойных цепей ReO3: а — МоО3-
б —слой в Th(Ti2O6).
двумя атомами А и один — с одним атомом А, так что состав
получается АХ3; 3- 7з+2- i/2+l =3. На рис. 5.30,а показан слой
в кристаллическом МоО3; сложность этой структуры можно со-
поставить с простотой структуры ReO3, где каждый атом кисло-
рода связан с двумя атомами металла. Слой АХ3, изображенный'
на рис. 5.30, б, в нейтральной форме неизвестен; в ThTi2O6 он'
представляет собой расположение октаэдров TiO6 (аналогичное'
строение —в изоструктурных соединениях UTi2O6 CdV2Ofi и
NaVMoO6).
Двойную цепь на рис. 5.29, б можно соединить через верши-
ны с такими же цепями с образованием семейства трехмерных,
структур, аналогичных тем, что представлены на рис. 5.25.
268 5. Тетраэдрические и октаэдрические структуры
В каркасах, изображенных на рис. 5.31, каждый атом X связан
с двумя атомами А, что приводит к формуле АХ3. Примеры
структур б и в неизвестны, но рис. 5.31,а соответствует структу-
ре CaTa2O6, если считать более крупные кружки ионами Са2+,
занимающими пустоты в каркасе.
1
О
О
О
Рис. 5.31. Три каркаса состава АХ3, построенные из двойных цепей ReO3. a —
проекция структуры СаТа2О6.
Не следует ждать, что будут обнаружены структуры, осно-
ванные на комбинациях цепей АХ5 с обобществленными верши-
нами и цепей АХ4 с обобществленными ребрами, построенных из
однотипных октаэдров, по той чисто геометрической причине,
что периоды повторяемости в этих цепях неодинаковы; они рав-
ны 2(АХ) и У2(АХ) соответственно, если АХ — это расстояние
от центра до вершины октаэдрической группы АХ6. Однако та-
кие структуры возможны, если октаэдры имеют различные раз-
меры, как, например, в случае, когда атомы А — это атомы раз-
5.3. Октаэдрические структуры 269
п i\ элементов или одного элемента в разных состояниях окис-
ления. Фторид хрома CrF2 имеет структуру рутила (искаженную
так что в координационной группе Сг(П) имеются четыре более
близких н два более отдаленных соседа), a CrF3 имеет структу-
ру типа ReO3, где октаэдрические группы CrF6 соединены только
через вершины. Благодаря тому что связи Cr(III)—F A.89 А)
короче, чем связи Сг(II)—F (четыре связи длиной 1,98 А и две
члшюй 2,57 А), период повторяемости в этих двух типах цепей
ОСг(Ш) ОСг(И)
Рнс._ 5.32. Проекция структуры Рис. 5.33. Каркас, построенный из соеди-
Сг21:5, показывающая два сорта ненных по ребрам пар октаэдров, кото-
октаэдрических цепей, соединенных рые связаны через общие вершины.
в трехмерный каркас через общие
вершины.
одинаков. Они, следовательно, могут сочетаться, как это схема-
тически показано на рис. 5.32, с образованием фторида Cr2F5.
Среди структур, в которых координационные группы сочле-
нены и по ребрам, и по вершинам, есть много значительно более
сложных, чем те, что перечислены в табл. 5.4. Относительно
простой пример представляет собой каркас АХ3, образованный
из соединенных ребрами пар октаэдров, которые связываются
с образованием трехмерной структуры, показанной на рис. 5.33.
Этот каркас является основой структуры одной из форм KSbO3
и КВЮ3, где ионы К+ располагаются в пустотах. Если только
в 7е части позиций, занятых ионами К+ в КВЮ3, расположены
группы OLa4 (состоящие из атома О, окруженного по тетраэд-
ру нонами La3f), а сам каркас построен из октаэдров ReO6, то
получается состав @La4)Re60i8 или La4Re60i9. В этом кристал-
ле имеется сильное взаимодействие атомов металла в паре
октаэдров, сопряженных по ребру (Re—Re = 2,42 А), и таким
270 5. Тетраэдрические и октаэдрические структуры
образом, есть физические основания для выделения в структуре
этих субъединиц.
Структуры двух молибденовых бронз отличаются от струк-
тур вольфрамовых бронз во многом так же, как МоО3 отлича-
ется от WO3; мы отмечали, что в МоО3 октаэдры соединяются
и по ребрам, и по вершинам в отличие от WO3, где обобществле-
ны только вершины. Подобно этому, в структурах вольфрамо-
вых бронз наблюдается только соединение октаэдров WOe по
Рис. 5.34. Участки слоев в бронзах: а — Ко.ззМо03; б — Ко,зоМо03.
вершинам, а две молибденовые бронзы с очень близким соста-
вом имеют слоистые структуры, построенные из субъединиц,
которые содержат соответственно шесть и десять октаэдров,
сочлененных ребрами. Эти субъединицы можно видеть на
рис. 5.34, который показывает, как они связываются в слон,
обобществляя восемь вершин с другими такими же структурны-
ми единицами. Оба слоя имеют состав МоСу, слои скрепляются
с помощью ионов калия.
Мы уже указывали на неадекватность современной теории
связи, неспособной отобразить сложность некоторых бинарных
систем, в которых возникают твердые фазы с неожиданными
формулами и (или) свойствами — например, оксиды цезия и
нитриды кальция. Некоторые переходные металлы, особенно Ti,
V, Nb, Mo и W, характеризуются удивительно сложной химией
оксидов, и, хотя, пользуясь схематическими изображениями,
трудно оценить все особенности их структур, именно эти соеди-
нения весьма важны, чтобы подтвердить высказанное сообра-
жение.
Обсуждаемые структуры построены из объемных слоев
(пластов) или блоков, имеющих относительно простое строение
5.3. Октаэдрические структуры 271
типа рутила или ReO3 и смещенных относительно друг друга
так, что образуются структуры с формулами, соответствующими
в некоторых случаях нормальным оксидам (например, Nb2O5),
а в других случаях — оксидам со сложными формулами, подра-
зумевающими нецелочисленные (средние) степени окисления
атомов металла. Если фрагмент рутилоподобной структуры сдви-
нут параллельно какой-либо закономерно расположенной пло-
скости, сочленение происходит по граням координационных
групп ТЮц, что дает семейство родственных структур состава
Ti,iO2«-i- Все члены этого семейства синтезированы и изучены
(оксиды титана с л = 4—10 включительно, оксиды ванадия с
>г-=-4—8); их составы Ti4O7, Ti5O9 и т. д. Сдвиг в структуре ReO3,
а/2
Рис. 5.35. Два способа соединения цепей ReO3 через ребра (цепи перпендику-
лярны плоскости чертежа).
где октаэдры соединены только по вершинам, приводит к обоб-
ществлению ребер октаэдрических координационных групп и к
гомологическому ряду структур с формулами WnO3n-2- Так как
структуры типа ReO3 изобразить легче, чем структуры, получен-
ные из рутила, мы опишем некоторые примеры первых. Будем
их проецировать вдоль направления цепей AX5(Re03), и каждый
квадрат будет соответствовать бесконечной цепи связанных че-
рез вершины октаэдров, перпендикулярной плоскости чертежа.
Прежде всего мы должны отметить, что цепи ReO3 можно соеди-
нить через ребра двумя существенно различными способами,
как показано на рис. 5.35. В случае а обобществлено «экватори-
альное» ребро (параллельное плоскости чертежа), т. е. две
непп связаны трансляцией а; в случае б обобществленное ребро
наклонено к плоскости чертежа и одна цепь смещена относи-
тельно другой на а/2+6/2+с/У2. Поскольку имеется трансляция
в направлении оси цепи (т. е. перпендикулярно чертежу), можно
считать, что в случае б цепи находятся на разных уровнях. Бло-
ки со структурой ReO3 могут соединяться путем обобществления
ребер (расположенных по периметрам блоков) одним из этих
Двух или обоими этими способами. В качестве примеров этих
Двух типов обобществления ребер мы опишем структуры еле-
272 5. Тетраэдрические и октаэдрические структуры
Рис. 5.36. Схема образования структуры со сдвигом.
Рис. 5.37. Примеры структур со сдвигом: а — Мо8О2з из ряда М„О3/!-!; б — ги-
потетический оксид МоцО31 из ряда М„О3„ ..,.
дующих оксидов:
Тип соединения по ребрам: а) Мо8О23
а,б) V0O13
б) WNb12O33 и высокотемпературная
форма Nb2O5
Дополнительные примеры приведены в гл. 12 и 13.
Первый тип соединения ребер (а) соответствует такому сдви-
гу в структуре ReO3, при котором цепи, показанные на
рис. 5.36, а в виде черных квадратов, смещены, как изображено
на рис. 5.36, б. Если такой сдвиг закономерно повторяется через
некоторый интервал, новая структура состоит из бесконечных
пластов ReC>3, цементируемых по сдвиговым плоскостям (стрел-
ка на рис. 5.36, б) сочленением ребер. Состав получающегося ок-
5.3. Октаэдрические структуры 273
си;1а зависит от числа октаэдров в группе с обобществленными
ребрами в месте сцепления пластов и от расстояния между сдви-
говыми плоскостями. Примеры, приведенные на рис. 5.37, изоб-
ражают структуры оксида Мо8О23 из ряда М„О3я-1 и гипотетиче-
ского оксида МоцО31 из ряда МяО3п-2 (здесь взят пример более
O)
простой, чем известный оксид ^oss)
Структура V6Oi3 обнаруживает оба показанных на рис. 5.35
типа сочленения по ребрам. Блоки структуры ReO3, состоящие из
Рис. 5.38. Кристаллическая структура V6On.
шести цепей CX2), соединены в слои через экваториальные реб-
ра, и второй тип сочленения по ребрам приводит к трехмерной
структуре, изображенной на рис. 5.38. Октаэдры, выделенные
более жирными линиями, смещены и в плоскости чертежа, и в
перпендикулярном направлении по отношению к октаэдрам,
обозначенным тонкими линиями. Каждый блок имеет бесконеч-
ную протяженность в направлении нормали к плоскости черте-
жа, но, как уже было сказано, удобно считать, что блоки нахо-
дятся на разных уровнях. Формула вещества зависит от разме-
ра блока, и для блоков, включающих в себя (ЗХ") октаэдров
на каждом уровне, общая формула имеет вид М3п08«-з:
Примеры
2 V6O13
3 TiNb2O7 (M9O21)
4 Ti2NbI0O23 (M12O29)
18—752
274
5. Тетраэдрические и октаэдрические структуры
На рис. 5.39 изображена структура WNbi2O33 в качестве при-
мера кристалла, в котором осуществляется только второй тип
сочленения по ребрам, т. е. отсутствует соединение блоков по
ребрам на одинаковом уровне. Эта конкретная структура пост-
роена из блоков ReO3, содержащих CX4) октаэдров. Данный
тип структуры имеет ту особенность, что здесь есть небольшое
число гетраэдрических пустот (занятых атомами W) в точках,
обозначенных черными кружками. Более сложная структура то-
Рис. 5.39. Кристаллическая структура \VNb12O33.
то же типа наблюдается в высокотемпературной форме Nb2O5
(разд. 13.7), где имеется одна тетраэдрическая пустота на каж-
дые 27 октаэдров, что приводит к структурной формуле
NbXb^CVo. Существование структур такого типа очень удобно
для выяснения характера связи в оксидах переходных металлов.
Например, TiNb24O62 — это нормальное валентное соединение с
одной тетраэдрической пустотой (занятой атомом Ti) на каждые
24 октаэдрические пустоты (занятые атомами Nb). Вместе с
тем та же структура реализуется в оксиде ниобия, но формула
Nb25O62 указывает на сосуществование разных степеней окисле-
ния или, что более вероятно, на присутствие делокализованных
электронов Aе на формулу ЫЬ^Обг).
5.3.6. Структуры с обобществленными гранями. Если каждый
октаэдр обобществляет две противолежащие грани, возможна
только одна структура. В этом случае образуется бесконечная
цепь состава АХ3. Из бесконечных молекул данного типа состоит
ряд кристаллических галогенидов, а цепочечные ионы того же
сорта существуют в Ва№03 и CsNiCb- В структуре ZrI3 атомы
металла занимают одну треть октаэдрических пустот в плотней-
5.3. Октаэдрические структуры 275-
шей упаковке, образованной атомами галогена, так что возни-
кают бесконечные цепи, перпендикулярные плотнейшим слоям:
— I — Zr— I — Zr — I—-Zr— I—
В BaNiO3 плотнейшую упаковку образуют Ва+30, а атомы Ni
занимают октаэдрические пустоты между шестью атомами О,
так что получается расположение, сходное с расположением
атомов Zr и I в Zrl3.
Структур, в которых обобществлены не противолежащие, а
какие-либо иные грани октаэдров, известно мало. Есть три спо-
5
а а'
Рис. 5.40. Три конфигурации группы октаэдров, соединенных гранями.
соба выбора двух граней октаэдра или, иначе говоря, три кон-
фигурации группы из трех сочлененных гранями октаэдров; все
они имеют состав M3Xi2 (рис. 5.40). Две грани, с помощью
которых центральный октаэдр соединяется с двумя соседними
октаэдрами, могут быть а) противолежащими гранями, б) граня-
ми с общей вершиной, в) гранями с общим ребром. Сочленение
по типу а, показанное на рис. 5.40, а, который представляет со-
бой другую проекцию группировки на рис. 5.8,г, обнаружено в
субьедннице Cs4Mg3Fio (рис. 5.42) и в некоторых основных фос-
фатах железа [Am. Mineralogist, 1970, 55, 135]. Примеры сочле-
нения по типу б как будто бы неизвестны, а случай в приводит
к ситуации, сходной с обобществлением вершины тремя правиль-
ными октаэдрами и обсуждавшейся в разд. 5.1.1. На рис. 5.40, в,
где октаэдры спроектированы по направлению общего ребра,
расстояние аа' составляет только 0,47 от длины ребра. Это за-
труднение можно преодолеть, искажая октаэдры так, чтобы
уменьшить зазор, как это происходит в группе O3Csn (рис. 12.1,
разд. 12.2.1) и в Nb3S4 (рис. 17.8,а, разд. 17.1.10), или путем сое-
динения точек ana' через анионный мостик, как на рис. 5.4
(разд. 5.1.1). В минерале симаните Mn3(OHJ[B(OHL]PO4
[Am. Mineralogist, 1971, 56, 1527] субъединицы типа в соединя-
ются через ребра с образованием цепей (рис. 5.41), и внутри
каждой субъединицы тетраэдрическая группа В(ОНL высту-
18*
'27E ,-). Тетра.чдрические и октаэдрические структуры
лает в роли мостика аа' (расстояние О—О 2,35 А). В Fe2(PC>4)Cl
[Acta cryst., 1976, В32, 2427] присутствуют цепи октаэдрических
координационных групп, состоящие из октаэдров, которые сое-
динены через грани как по типу а, так и по типу в.
5.3.7. Структуры с обобществленными вершинами и гранями.
.Хотя сочленение октаэдрических координационных групп по гра-
ням с образованием трехмерных структур встречается нечасто
(в отличие от такого же их сочленения с образованием цепей),
оно все же наблюдается в некоторых структурах с плотнейшей
упаковкой. Рассматривая структуры, построенные из плотноупа-
5.3. Октаэдрические структуры 277
Рис. 5.41. Участок цепи в симаните.
кованных слоев АХ3, между которыми расположены ионы В
меньшего размера (координирующие по октаэдру 6 атомов X),
мы видели, что могут обобществляться только вершины и (или)
грани октаэдров ВХ6. Соединение октаэдров по ребрам, которое
является особенностью столь многих оксидных структур, в струк-
турах АхВуХзх не может реализоваться по чисто геометрическим
причинам. Сочленение граней октаэдров сначала приводит к па-
рам (или более крупным группам) октаэдров, которые затем
объединяются через вершины с образованием семейства струк-
тур, родственных ReO3 и перовскиту. Линейная группировка
соединенных через грани октаэдров топологически сходна с еди-
ничным октаэдром, поскольку она, как и октаэдр, имеет с каж-
дой стороны по три вершины, через которые может происхо-
дить соединение с шестью другими группами или индивидуаль-
ными октаэдрами. Простейшие из этих структур перечислены в
табл. 5.6, а также в гл. 4 в качестве примеров некоторых
усложненных последовательностей плотнейших слоев, так как
во всех этих структурах атомы переходного металла занимают
октаэдрические пустоты между шестью атомами X плотноупа-
ковэнных слоев АХ3.
Интересную структуру совсем другого типа имеет Cs4Mg3Fm.
в котором группы из трех связанных гранями октаэдров MgF6
соединены с помощью четырех концевых вершин с образованием
слоев (рис. 5.42); между этими слоями располагаются ионы Cs+,
Таблица 5.6. Плотноупакованные структуры АВХ3, в которых
октаэдрические координационные группы соединены гранями и вершинамиа
1м\нлы, соединяющиеся
по граням
Г1ары + единичные окта-
эдры
Только пары
Группы по 3 октаэдра
Бесконечные цепи
ВаТГОз
ВаМпО:
BaRuO3
BaNiO3
ВаМпО
Структура
(гексагон.)
(высокотемп.)
(высокотемп.)
(низкотемп.)
Другие примеры
Cs-MnF3.
Ва№03
CsCoF3
CsNiCl3,
BaTiS3,
RbNiF3
(низкотемп.)
CsCuCl3
BaVS3, BaTaS3
aДругие примеры сложных оксидов со структурами этих типов см. в табл. 4.4
(!К1 i.i. 1.L10) н табл. 13.5 (разд. 13.3.1).
имеющие координацию 10 и 11. В связи с тем что все связи в
этом кристалле имеют существенно ионный характер, описание
структуры с использованием координационных групп меньших
по размерам катионов не предполагает, что это действительно
слоистая структура. В число изоструктурных кристаллов входят
соответствующие соединения Со, Ni и Zn. Примечательно, что
Рис. 5.42. Соединение октаэдров MgF6 в слои (Mg3Fi0)n4n~ в Cs4Mg3F10.
группы из трех сочлененных гранями октаэдров CoF6 в CS4C03F1Q
присутствуют также и в структуре CsCoF3 (табл. 5.6).
Конечные группы октаэдров (молекулы и комплексные ионы)
мы рассмотрели отдельно в начале этой главы, но и здесь целе-
сообразно обратить внимание на анион СеМо^СЧг8", поскольку
он тесно связан с некоторыми из только что описанных струк-
тур. Пара соединенных через грани октаэдров имеет четыре
вершины (обозначенные на рис. 11,13, а в разд. 11.6.5 буквами
278 5. Тетраэдрические и октаэдричес
кие стрцктцрь
А и В), которые соответствуют четырем вершинам икосаэдра.
Шесть пар октаэдров можно, следовательно, соединить через
эти вершины таким образом, что образуется икосаэдрнческая
группа из двенадцати октаэдров. Ион Се4+ занимает позицию с
координацией 12 в центре комплексного иона.
5.3.8. Структуры с обобществленными ребрами и гранями. При-
мер этого редкого феномена дает примечательная структура
Nb3S4. Если октаэдры модифицированы так, что двугранный
угол а становится равным 120°, три рутилоподобные цепи можно
срастить через грани октаэдров в тройную цепь. На рис. 5.43, а
обобществленные грани перпендикулярны плоскости чертежа и
о б
ъ -^-^
>АА
5.4. Структуры, построенные из тетраэдров и октаэдров
279
ее:
Рис. 5.43. Кристаллическая структура Nb3S4: a — идеализированная проекция
сложной цепи, образованной из трех рутиловых цепей, которые соединены по
граням, проецирующимся в виде жирных линий; б — проекция структуры Nb3S4.
имеют общее ребро (также перпендикулярное чертежу и проеци-
рующееся в центр диаграммы). Эти тройные цепи в свою оче-
редь могут соединяться друг с другом, обобществляя все ребра
(их проекции обозначены a, b и с), с образованием трехмерной
структуры, проекция которой показана на рис. 5.43, б. Если
структура построена из октаэдров МХ6, она имеет состав М3Х4.
Модель показывает, что пары вершин АА' и т. д., а также D, Е
и F составляют трехшапочную тригональную призму так, что
тройную колонку на рис. 5.43, а можно также рассматривать как
колонку трехшапочных тригональных призм, сочлененных по ба-
зисным граням (все атомы М и X внутри колонки не принима-
ются во внимание). При таком описании можно видеть сходство
со структурой иСЬ, которая построена из соединенных гранями
трехшапочных тригональных призм; последние через общие реб-
ра связаны в структуру по тому же общему принципу, который,
представлен на рис. 5.43, б. Это становится очевидно при срав-
нении рис. 9.8 (разд. 9.9.3) и 5.43, б. Мы описали здесь струк-
туру Nb3S4 с использованием координационных групп NbS6,
т. е. на основе связей Nb—S, но нужно отметить, что в этой
структуре, как и в некоторых других описанных выше структу-
рах, большую роль играют связи металл—металл (разд. 17.1.10).
5 3.9. Структуры с обобществленными вершинами, ребрами и
гранями. К числу структур этого типа относятся корунд (а-АЬОз)
и y-Cd(OHJ- В структуре корунда присутствуют пары октаэд-
ров с общей гранью и в дополнение к
этому есть сочленение координационных
групп, окружающих ионы А13+, через реб-
ра и вершины. Сложность этой структу-
ры (для соединения состава А2Х3), по-
видимому, обусловлена необходимостью
создания плотной упаковки анионов и
одновременно относительно симметрично-
го окружения этих ионов (см. также за-
мечания в разд. 6.6). В структуре у-
Cd(OH)o (рис. 5.44) пары рутилоподоб-
цепей соединены через общие грани, Рис-
ных
ем объединяются че-
5.41. Структура
V-Cd(OH),.
а двойные цепи
рез вершины.
К числу других структур этого класса относятся существую-
щая при высоком давлении форма Rh2O3 (разд. 12.28) и K^ZrOs
[J. Solid State Chem., 1970, 1 478].
5.4. Структуры, построенные из тетраэдров и октаэдров
Структуры, которые можно описать как объединение тетраэдри-
чеекпх и октаэдрических координационных групп, весьма много-
численны. Например, сюда относятся все оксосоли, в которых
катионы А занимают позиции с октаэдрической координацией, а
анноны представляют собой дискретные ионы ВО4 (как в Na2SO4)
или более сложные ионы, построенные из таких структурных
единиц (как в пиро- или метасолях). Во многих таких структу-
рах (например, в сложных оксидах) атомы О плотно упакова-
ны, что позволяет описывать их как плотнейшие упаковки с раз-
ной долей занятых тетраэдрических и октаэдрических пустот
(табл. 4.8, разд. 4.4). Альтернативно эти структуры можно опи-
сать в соответствии со способом соединения тетраэдров и окта-
эдров (через вершины, ребра и грани). Мы не пытаемся пред-
ложить детальную классификацию такого рода, однако пред-
ставляет интерес описать несколько простых примеров струк-
тур, относящихся к одному и тому же классу, для того, чтобы
показать соотношение между некоторыми структурами, рассмот-
ренными в последующих главах.
Мы уже приводили примеры структур, в которых тетраэдры
или октаэдры обобществляют различное число вершин. Некото-
рые простейшие структуры из этого обширного семейства пере-
числены в табл. 5.7; эти структуры описаны в последующих гла-
вах. В таблице приводятся число октаэдров (о), с которыми
соединен через свои вершины каждый тетраэдр (t), отношение
н
о
К
5
|
3 3
О. ?С
О О
g
CQ О
О
я я
CD
из
ее
a
s
ч
<о
я
X
с
а.
е
ст)
тек
•
о
о
га
а.
га
5S
атовьи
ран
и,
II
X
2.
to
см
X
о
-*?
11
ены
г;
о
бобщ
о
е вершины t n о
со
О м
о s-
X
PD
<С
СО
X
CQ
X
о
¦Л о
О
CJ
¦-JJ
и
X
X
CQ
X
о
s
О
а
'г.
х°
са
<
X
CQ
X*
О
II
ствл
I
VD
О
\о
о
о
ждый t и кажды
по 4 вершины
га н
СП
с
М.
.9)
О СО
s—->—1
--. .
30
о
о
S
а
со
X
са
<
X
са
-—.
X
о
in
О
О ^
О ^J
X
CD
X
са
X
о
^ о
¦I <М
обо
о
ршин
а d
|бобществляет 2
ствляет 4 вершш:
о ш
•« а"
о
X
СО
<
X
са
.—.
:xv)
о
^ Е
^ о
« чз
5.4. Структуры, построенные из тетраэдров и октаэдров 281
числа тетраэдров и октаэдров, вклады тетраэдров и октаэдров
в химическую формулу (обобществленная вершина считается
как половина X, а свободная — как целый X), формула, приме-
ры соединений с данной структурой.
Если каждый тетраэдр обобществляет р вершин с октаэдра-
ми, а каждый октаэдр столько же вершин с тетраэдрами, полу-
чаются структуры очень простых топологических типов, посколь-
ку в этом случае структура имеет в своей основе р-связанную
сетку. Для /? = 3 простейшие сетки — это двумерная сетка шести-
угольников и трехмерная сетка десятиугольников; для р = 4 —
это двумерная сетка четырехугольников и трехмерная алмазная
сетка. В этих двух случаях мы приходим к формулам АВХ7 и
ЛВХ3 соответственно. Пример структуры АВХ6 данного типа, но
основанной на более сложной трехмерной сетке, дает каркас
PW06 в NaPW06 (разд. 13.9); примеры более простого слоя
АВХб как будто бы неизвестны, но иллюстрацией такого слоя
может служить рис. 13.17, а (разд. 13.9), представляющий собой
проекцию трехмерной структуры ABXs, которая возникает при
сочленении свободных вершин октаэдров, содержащихся в слоях
ЛВХ6. Тот же рисунок изображает структуру родственного слоя
в Ха2 (SiTiOs) [Acta cryst., 1978, В34, 905], если считать, что
квадраты соответствуют тетрагонально-пирамидальным группам
TiO5, вершины которых поочередно выходят на противополож-
ные стороны слоя. В Na2SiTiO5(^OH соединены с помощью ионов
Na~, но если эти ионы удалить и сблизить слои так, чтобы воз-
никли сочлененные по вершинам октаэдрические координацион-
ные группы атомов В, формула трехмерной структуры будет
АВХ5; такую структуру имеют PNbC>5 и родственные соединения.
Рис. 24.18,6 (разд. 24.7.6) показывает, что структура бандилита
ВСи(ОНLС1 относится к тому же типу, но октаэдрические коор-
динационные группы искажены в этих двух структурах по-раз-
ному (см. длины связей, указанные в разд. 13.9 и 24.7.6). За-
метим, что в разд. 13.9 структура PNbOs описана на основе це-
пей октаэдров, перпендикулярных плоскости проекции
(рис. 13.17, а) и соединенных через тетраэдры; здесь мы выде-
ляем слои, состоящие из тетраэдров и октаэдров.
В структуре граната система связанных тетраэдров и окта-
эдров состава А3В2Х12 представляет собой заряженный трехмер-
ный каркас, содержащий в своих пустотах более крупные ионы С
(в позициях с. координацией 8). Общая формула имеет вид
С3А3В2Х12 или С3В2(АХ4)з, если желательно выделить тетраэд-
рические группы, например, в таком ортосиликате, как
Ca3Al2(Si04K. В некоторых гранатах один элемент занимает
позиции и с тетраэдрической, и с октаэдрической координацией
(например, когда формула упрощается до Y3Al5Oi2). Во всех
четырех последних примерах из табл. 5.7 один и тот же элемент
282 5, Тетраэдрические и октаэдрические структуры
Таблица 5.8. Структуры, в которых элемент имеет как тетраэдрическую,
так и октаэдрическую координацию
Структура
Элемент
Y-Fe2O3
C-Ga2O3, е-А12О3
XIIX2IIIO4 (правильная шпинель)
Y(XY)O4 (обращенная шпинель)
Na2Mo2O7, К2Мо3О10
H5As3Oio, As2Os
Re2O7
М2"Мо3О8
Zn5(OHN(CO3J, Zn5(OH)8Cl2-H2O
(Mg2Al) @HLSiA105, KAl2(OHJSi3AlO10
Na4Qe9O20, K3HGe7016
Y3Fe2(Fe04K, Y3A15O12 (гранат)
Nb25O62> Nb2O5 (высокотемп.)
Cr5O12, KCr3O8
Fe
Ga, Л1
Mn, Co
Fe в Fe3O4nFe(MgFe)O4,
Al в Al(NiAl)O4. Co в
Co(SnCoH4, Zn в
Zn(SnZn)O4
Mo
As
Re
Mg, Mn, Fe, Co, Ni, Zn,
Cd
Zn
Al
Ge
I-'e, Al
Nb
Cr (VI и III)
находится и в тетраэдрической, и в октаэдрической координа-
ции. Чтобы обратить внимание на это явление, мы собрали в
табл. 5.8 большее число разнообразных примеров, не ограничи-
ваясь структурами с обобщенными вершинами. Представляет
также интерес выписать элементы, которые обнаруживают эти
два координационных числа при одной и той же степени окисле-
ния (в порядке, соответствующем периодической таблице):
Fe3*- Co2+ Ni2+
Мо6+
Re7+
Mg Al
Zn Ga
Cd
Ge As
Обращаясь снова к последним четырем примерам из табл.
5.7, можно отметить, что Re2O7 имеет слоистую структуру (см.
разд. 12.2.10), в то время как в остальных трех наблюдается
цепочечная структура. В ординарной цепи на рис. 5.45, а топо-
логическая повторяющаяся единица состоит из одного тетра-
эдра и одного октаэдра. Такова форма аниона в Na2Mo2O7.
Наиболее сложная цепь, показанная на рис. 7.45, б, найдена в
К2М03О10, а родственная ей цепь (рис. 20.7) является струк-
Рис. 5.45. Цепи из тетраэдров и октаэдров, соединенных только вершинами.
Рис. 5.46. Составной каолиновый слой.
Рис. 5.47. Каркас из связанных групп GcO4 и GeO5 в K3HGc7Oi6-4H2O.
284 5. Тетраэдрические и октаэдрические с
структуры
турной единицей в H5As3Oio, промежуточном продукте дегидра-
тации As2O5-7H2O (о К2М03О2 см. также разд. 11.5.2).
Из структур, перечисленных в табл. 5.8, сесквиоксид, шпи-
нель и другие структуры сложных оксидов охарактеризованы
в гл. 12 и 13. Структуры двух основных цинковых солей
Zn5(OHN(CO3J и Zn5(OH)8Cl2-H2O более подробно описаны
в разд. 6.5.5. Составные слои с общей формулой Al2@HLSi205
(или Mg3@HLSi205) (рис. 5.46) и Al2(OHJSi4Oio (или
Mg3(OHJSi4Oio), которые являются основой структур многих
слоистых минералов и слюд, описаны в гл. 23. Германаты дают
примеры кристаллов, содержащих Ge как с тетраэдрической,
так и с октаэдрической координацией. Особенно изящный при-
мер представляет собой трехмерный каркасный ион Ge7Oi64+ в
K3HGe7Oi6-4H2O, изображенный на рис. 5.47. Выше мы уже
упоминали об оксидах (таких, как Nb2sO62 и высокотемператур-
ная форма Nb2O5), в которых очень небольшая доля атомов
металла заключена в тетраэдрических пустотах структур, в ос-
новном являющихся октаэдрическими.
6. НЕКОТОРЫЕ ПРОСТЫЕ
СТРУКТУРЫ АХ„
В гл. 4 было описано множество структур АтХп, в которых
атомы Л образуют по три или четыре связи. В этой главе
рассмотрим прежде всего четыре простые трехмерные структу-
ры, в которых атомы А имеют по шесть или восемь ближай-
ших соседей. Как это было сделано ранее для структуры алма-
за, мы покажем, каким образом эти структуры могут модифи-
цироваться для удовлетворения требований связывания раз-
личных сортов атомов А и X. Имеются в виду следующие
структурные типы:
АХ хлорид натрия F:6); хлорид цезия (8 : 8)
АХ2 рутил F:3); флюорит (8 : 4)
Основное внимание будет уделено геометрии именно этих
структур АХ и АХ2. [Причины реализации той или иной коор-
динации (октаэдрической в NaCl и рутиле, кубической в CsCl
и CaF2), а также структурные изменения в галогенидах и ок-
сидах, связанные с различием в относительных размерах ионов,
обсуждаются в гл. 7.] Затем рассматриваются структурные
типы
Cdl,
ReO,
и далее группы структур:
РЬО и РН41
LiNiO,, NaHF2 и CsICl2
СгВ, ТП (желтая модификация) и родственные структуры
РЬСЦ
PdS2, AgF2 и p-HgO2
Объединение структур в группы основано на следующих
признаках: структуры относятся к одной и той же пространст-
венной группе, атомы расположены по тождественным правиль-
ным системам точек, хотя различие в значениях одного или не-
скольких координатных параметров этих точек приводит к су-
щественно разной геометрии (и/или топологии) структуры. За-
ключительные замечания касаются взаимосвязи между струк-
турами некоторых нитридов и оксосоединений, сверхструкту-
рами и другими родственными структурами.
286 6. Некоторые простые АХп
6.1. Структурный тип хлорида натрия 287
6.1. Структурный тип хлорида натрия
В структуре этого типа (рис. 6.1, а) атомы А и X чередуются
в простой кубической сферической упаковке. Это единствен-
ная структура АХ с правильной октаэдрической координацией
обоих сортов атомов. Структура этого типа реализуется более
2,54%
\3,20&
LT
Рис. 6.1. Структура хлорида натрия и родственные структуры, а — NaCl; б-
же.тгал модификация ТП; в — тетрагональная модификация GeP; г — NbO; д-
Mg3NF3.
чем для 200 соединений весьма различных химических типов:
ионные галогениды и гидриды щелочных металлов, моноксиды
и моносульфиды магния и щелочноземельных металлов, ионно-
ковалентные соединения, такие, как моноксиды переходных ме-
таллов и полуметаллические соединения металлов Б-подгрупп
периодической системы (например, PbTe, InSb и SnAs), кар-
биды и нитриды внедрения (табл. 6.1). Поскольку в структуре
Таблица 6.1. Соединения АХ с кубической структурой
типа NaCl
Галогениды и гидриды щелочных металлов, AgF, AgClr
AgBr
Моноксиды
Mg
Са
Sr
Ва
Eu; Th,
Ti
Zr
Hf
Pa, U,
Моносульфиды
Mg
Са
у
N b
Np, Pu, Am
Mn
Mn Fe Co
Ni
Sr
Ba Pb
Ce, Sm, Eu; Th, U, Pu
Карбиды и нитриды внедрения
TiC, VC, ZrC, UC
ScN, LaN, TiN, ZrN, UN
Фосфиды и др.
InP, InAs, SnP (модификация высокого давления),
SnAs
NaCl позиции А или Х соответствуют позициям
плотнейшей упаковки, могут реализоваться две
конфигурации этой структуры:
1) плотноупакованные атомы А, атомы X
ских пустотах: rk~^>rr,
2) плотноупакованные атомы X, атомы А
скнх пустотах гх>гд.
Кроме того, возможно бесконечно большое число промежуточ-
ных конфигураций, в которых сохраняется правильная октаэд-
рическая координация из 6 X вокруг атома А и из 6 А вокруг
атома X. При реализации случая A) атом А должен был бы
касаться 12 других атомов А, как в TiC, TiN, ZrC и ZrN..
кубической
предельные
в октаэдриче-
в октаэдриче-
288 6. Некоторые простые АХп
В указанных соединениях титана расстояния Ti—Ti близки к
3 А, как в металлическом титане.
Другой предельный случай B) дожен осуществляться при
взаимодействии очень малых по размеру катионов и очень
больших анионов, как, например, Lil и MgTe среди галогени-
дов элементов I группы и халькогенидов элементов II группы
соответственно. В действительности же структурный тип NaCl
характерен для большинства соединений этих двух семейств.
Для них отношение ионных радиусов гА : гх изменяется в очень
широких пределах, и сюда входят даже такие соединения, как
K.F и ВаО, которые построены из катионов и анионов прибли-
зительно одинакового размера. Концепция ионных радиусов об-
суждается в гл. 7. Расстояния*между атомами X во фторидах
щелочных металлов составляют
LiF NaF KF RbF CsF
F—F, A: 2,84 3,26 3,77 3,98 4,25
Приведенные значения нужно сравнивать с величиной удвоен-
ного радиуса иона F~ B,7 А), соответствующей плотнейшей
упаковке анионов.
Аналогичные рассуждения справедливы и для моноксидов
магния и щелочноземельных металлов. Сравнение межатом-
ных расстояний О—О с величиной 2,8 А (удвоенный радиус
иона О2~):
MgO CaO SrO ВаО
О—О, А: 2,98 3,40 3,65 3,90
показывает, что только в случае MgO упаковку анионов можно
считать приблизительно плотнейшей.
При воздействии высоких давлений некоторые фосфиды и
арсениды металлов групп ШБ и IVB приобретают либо куби-
ческую структуру типа NaCl (например, InP, InAs), либо
структуру тетрагонального ее варианта (GeP, GeAs) (рис.
6.1, s), в котором наблюдаются 3 связи различной длины и ко-
ординационное число Ge снижается до 5. Соединения Ge и Sn
с общим числом валентных электронов 9 обладают металли-
ческой проводимостью. Данное свойство характерно не только
для искаженной структуры типа NaCl. Металлическая прово-
димость свойственна также кубической и тетрагональной моди-
фикациям SnP. [Inorg. Chem., 1970, 9, 335; J. Solid State Chem.
1970, 1, 143.]
Благодаря наличию неподеленной электронной пары моно-
галогениды металлов группы ШБ кристаллизуются в специфи-
чески искаженных вариантах структуры типа NaCl. Структура
желтой модификации ТП (рис. 6.1,6) построена из блоков
6.1. Структурный тип хлорида натрия 289
Рис. 6.2.
Структура FeS2
(пирит).
структуры типа NaCl, смещенных относительно друг друга та-
ким" образом, что ион металла окружен пятью ближайшими
соседями по 5 вершинам октаэдра и еще двумя парами пример-
но равноудаленных частиц, вторых за соседними (см. разд.
9.9.1). Такую же структуру имеет низкотемпературная моди-
фикация NaOH.
На рис. 6.1 изображены 2 другие структуры, в которых за-
селены только некоторые из позиций структуры типа NaCl,
а именно NbO (рис. 12.2.4) и Mg3NF3 (разд. 10.2).
Полный набор элементов кубической симметрии (тЗт)
структуры NaCl сохраняется в твердых растворах типа
(Mg, Ni)O или в высокотемператур-
ных модификациях сложных оксидов
со статистическим распределением ка-
тионов двух или более сортов (напри-
мер, LiFeO2, Na2Sn03, Li3Ta04). Ана-
логично может реализоваться стати-
стическое распределение вакансий в
дефектных структурах, таких, как не-
стехиометрический Fei-^O (разд. 12.3).
При более низких температурах в де-
фектной структуре может происходить
перегруппировка атомов или вакансий
в упорядоченную сверхструктуру (см.
TiO, разд. 12.7.1). В кристаллах, содержащих комплексные ио-
ны, тоже может сохраняться полный набор элементов симмет-
рии кубической структуры в случаях, если либо сами ионы обла-
дают таким набором, как в [Co(NH3N](TlCl6), либо имеет место
вращение или статистическая ориентация менее симметричных
группировок, как в высокотемпературных модификациях карби-
дов щелочноземельных металлов, в KSH или K.CN. Тем не ме-
нее атомные группировки S2 могут располагаться вдоль осей
3-го порядка более низкого класса кубической симметрии, как
в структуре кубического пирита FeS2 (рис. 6.2). Здесь оси 3-го
порядка направлены вдоль пространственных диагоналей октан-
тов ячейки и не пересекаются между собой. Эта структура ти-
пична для многочисленных халькогенидов Зй-металлов от Мп до
Си (в некоторых случаях только под давлением, см. гл. 17) и
для модификации SiP2 высокого давления. В этих кратко оха-
рактеризованных структурах типа пирита и СаС2 кристаллизу-
ются пероксиды щелочноземельных и надпероксиды щелочных
металлов (содержащие ионы О22- и 02~ соответственно)
(табл. 6.2). При более высоких температурах структуры некото-
рых из них (NaCb, K02) перестраиваются в структуру типа не-
упорядоченного пирита; с последней аналогична и структура вы-
сокотемпературной модификации KHF2, которая характеризует-
19—752
290 6. Некоторые простые АХп
ся статистической ориентацией ионов (F—Н—F) " вдоль на-
правлений четырех пространственных диагоналей куба.
Структура PdS2 выводится удлинением структуры пирита в
одном направлении таким образом, что атом Pd имеет только
4 ближайших соседних атома S, лежащих вместе с ним в одной
плоскости, по сравнению с 6 октаэдрическими соседями железа
в FeS2. Поэтому структуру PdS2 предпочтительно рассматри-
вать как слоистую; таким образом она была охарактеризована
в гл. 1. Другой способ описания структур PdS2 и пирита при-
веден в разд. 6.9.
Таблица 6.2. Кристаллические структуры
пероксидов и надпероксидов
Структура пирита
ZnO2
NaO,
CdO,
Структура типа
СаО2
КО,
SrO2
RbO,
BaO,
CsO,"
6.1. Структурный тип хлорида натрия
291
держащими 1 или 2 формульные единицы по сравнению с 4
для нормальной кубической ячейки, как показано на рис. 6.3, а
и б:
Элементарная ячейка
Кубическая
Ромбоэдрическая (а)
Ромбоэдрическая (б)
Ребро
а
а~\/2
ауз/У2
Угол а
90°
60°
33°34'
Za
4
1
2
ячейке.
Z —число формульных единиц (NaCl) в элементарной
Наименьшее ромбоэдрическое искажение структуры типа
NaCl найдено в низкотемпературных FeO и SnTe, тогда как их
высокотемпературные модификации кристаллизуются в нор-
мальной структуре типа NaCl. Ромбоэдрическая структура
низкотемпературного KSH представлена ячейкой, изображен-
Два типа искажения кубической структуры, при которых
сохраняется наивысшая аксиальная симметрия, — это растяже-
ние или сжатие куба параллельно его ребру или пространствен-
ной диагонали, что приводит к тетрагональным и ромбоэдриче-
ским структурам соответственно. Структура тетрагональной мо-
дификации СаС2 служит характерным примером подобной NaCl
структуры, в которой линейные ионы С22~" ориентированы па-
раллельно одной из осей куба (рис. 22.6, разд. 22.2), тогда как
в структурах некоторых моноалкилзамещенных галогенидов
аммония (например, NH3CH3I и NH3C4H9I) установлено исклю-
чительно сильное удлинение вдоль оси 4-го порядка. В этих
галогенидах предположительно имеет место статистическая
ориентация или вращение алкильных цепей. Параллельное рас-
положение ионов CN~ в низкотемпературной модификации
KCN (и в изоструктурном NaCN) приводит к ромбической
симметрии (рис. 22.1, разд. 22.1.1).
Взаимосвязь между элементарной ячейкой тетрагональной
структуры, основанной на NaCl, и кубической элементарной
ячейкой структуры самого NaCl обычно прослеживается легко,
как это имеет место, например, в случае СаС2 (рис. 22.6, разд.
22.2). Связь ромбоэдрической структуры, основанной на NaCl,
с кубической структурой NaCl лучше всего воспринимается на
моделях. Сама кубическая структура типа NaCl может быть
представлена ромбоэдрическими элементарными ячейками, со-
Рис. 6.3. Альтернативные ромбоэдрические элементарные ячейки в структуре
NaCl.
ной на рис. 6.3, а с углом а = 68° вместо идеального значения
60°. К другим типам ромбоэдрических структур, подобных
NaCl, относятся LiNiO2 и NaCrS2 (сверхструктуры на основе
структуры NaCl) и NaHF2, NaN3 и CaCN2. Все они обсужда-
ются ниже, в разд. 6.7.2. Плоские анионы в NaNO3 и СаСО3,
обладающие осью симметрии 3-го порядка, в структуре типа
19*
292 6. Некоторые простые АХп
кальцита этих и других изоструктурных с ними солей ориенти-
рованы своими плоскостями перпендикулярно к одной из осей
3-го порядка исходной кубической структуры. Катионы и цент-
ры анионов расположены точно таким же образом, как ионы
Na+ и С1~ в NaCl. Структура нестехиометрического Sc2S3 изо-
бражена на рис. 6.3,6 ромбоэдрической (а = 33°34') ячейкой,
содержащей 1 атом Sc в позиции @00); заселенность же по-
зиции 1/2 7г 7г составляет только 0,37 атома Sc.
В структуре SnS (GeS) искажение координационного поли-
эдра, октаэдра, таково, что 3 из шести ближайших исходных
соседей сближаются намного теснее, чем 3 оставшиеся. Поэто-
му альтернативно структуру можно описать как состоящую из
сильно изогнутых шестиугольных сеток, в которых чередуют-
ся атомы Sn и S (см. гл. 3).
6.1.1. Сверхструктуры на основе структуры хлорида натрия.
Известны структуры, в которых атомы А и (или) X более чем
одного сорта расположены закономерно в позициях Na и С1
структуры NaCl. Для простейшего случая соединения АВХ2
1гГ
, 2-
6.1. Структурный тип хлорида натрия
293
о
о
Рис. 6.4. Структура LiInO2.
(или A2XY) известны многочисленные примеры среди сложных
оксидов и сульфидов. Более сложные примеры представлены
соединениями Li2Ti03 и Li4UO5.
Здесь рассматриваются возможные структуры соединения
АВХ2, вокруг каждого атома X которого сгруппированы 6 бли-
жайших соседних атомов, 3 А и 3 В. Предложены 2 способа их
Стриктуры АХг
ТГ (Ш12
J атакамит
1 анатаз
Схема 6.1
Структура типа NaCl и родственные структуры
PdS2
Пирит Неупорядоченный
| пир/мл
Ромбоэдрические
ogpuawmi (FeO,
низкотемператур-
ный NaSH)
кальцит
галогениды и гидриды
щелочных, металлов
оксиды, сульфиды
щелочноземельных
металлов
соединения внедрения
МО, МС, мы
интерметаллиды,
SnSb, PbSe
высокотемпературные
модификации со статисти-
чески ориентированными
или вращающимися не-
сферическими ионами
СаС2 ,КОН, KSH
статистические (LijTiOj)
[ромбоэдри ческий
LiNiO2)
упорядоченные
{тетрагоне п
UInO2)
- Структуры вычитания и
внедрения Mg3NF3, Mn2SnS4
(Mg6Mn08, U2V4O7)
- Структура с_ «тпексными
ионами NaSDrb',JCo(NH3Nl[TiCI6]
1
Ромбический низко-
температурный КСН
Г
ОШВУШУРЛЗМ^ВШЗ-
(InBr, Гп1)(координация 5:5)
размещения по вершинам октаэдра вокруг атома X — ребер-
ное (а) или граневое (б)
и 5 сверхструктур со следующим окружением атомов X:
1 \ ,
1)
2)
3)
4)
5)
все (а):
все (б):
50% А, 50% В;
тетрагональная структура InLiO2 (рис. 6.4)
ромбоэдрическая структура NaFeO2 (разд. 6.7.2)
кубическая структура (Fd3m), LiVO2 высокого давления
моноклинная структура NaErO2
тетрагональная структура E-FeLiO2
294 6. Некоторые простые АХп
Структур типа C) и E) до сих пор известно немного, но сре-
ди соединений лантаноидов, оксидов NaLnO2 (разд. 13.2)
и сульфидов MLnS2 (M = Li, Na, К) много примеров структур
A), B) и D). Выше была отмечена связь структуры SnS со
структурой типа NaCl. Аналогичная C+3)-координация Sn(II)
наблюдается в BaSnS2 [Acta cryst., 1973, В29, 1480] и BaSn2S3
[Acta cryst., 1980, B36, 2940], которые также представляют со-
бой искаженные сверхструктуры на основе структуры типа
NaCl. Структуры, родственные структуре NaCl, показаны на
схеме 6.1.
6.2. Структурный тип хлорида цезия
В этой структуре АХ (рис. 6.5) каждый атом (ион) окружен
восемью равноудаленными ближайшими соседями по вершинам
координационного полиэдра — куба. По сравнению со структу-
рой типа NaCl эта структура встречается реже. Она характер-
на для некоторых интерметаллических соединений, например
упорядоченной р-латуни (CuZn), и таких фаз, как FeAl, TISb,
LiHg, LiTl и MgTl, но не встречается ни у каких соединений
внедрения МС, MN или МО. Только 3 из галогенидов щелочных
металлов и галогениды таллия (Т1С1, TIBr и ТП) при обычных
температурах и давлениях обладают структурой типа CsCl,
хотя некоторые галогениды К и Rb переходят в нее под давле-
нием. С другой стороны, галогениды со структурой типа CsCl
на подходящей подложке можно кри-
сталлизовать по типу структуры NaCl.
Среди гидроксидов, гидросульфидов и
цианидов щелочных металлов только
структуры CsSH и CsCN подобны CsCl;
структура CsOH пока не опреде-
лена. Известна только одна моди-
фикация CsSH с кубической структу-
Рис. 6.5. Структура CsCl. рой типа CsCl, в которой SH~ проявляет
себя как сферически симметричный ион
с тем же радиусом, что и у иона Вг~. Высокотемпературная мо-
дификация CsCN имеет кубическую структуру типа CsCl. Менее
симметричная низкотемпературная модификация CsCN обсуж-
дается ниже. Бифториды кристаллизуются в различных струк-
турных типах, причем для солей К и Rb более характерны
структуры, подобные CsCl. Соли аммония отличаются от соот-
ветствующих солей щелочных металлов, если реализуется воз-
можность образования водородной связи между катионом и
анионом. К примеру, хотя пространственное расположение ио-
нов в структурах низкотемпературной модификации KHF2 и
NH4HF2 такое же, как в CsCl (рис. 8.6, разд. 8.4), относитель-
6.3. Структурный тип рутила 295
ная ориентация ионов (F—Н—F) в этих двух кристаллах все
же различается, и поэтому в KHF2 ион К+ окружен восемью
равноудаленными ионами F~, тогда как в NH4HF2 ион NH4+ ок-
ружен только четырьмя ближайшими соседними ионами F~. Это
разбиение 8-координационной группировки на 2 набора по 4 ли-
ганда вызвано образованием связей N—Н—F. В NH4CN катион
находится в контакте только с четырьмя анионами (см. ниже).
Структура высокотемпературной модификации KHF2 типа не-
упорядоченного пирита была рассмотрена выше при обсужде-
нии структуры хлорида натрия.
Как и в случае структуры NaCl, два наиболее простых ви-
да искажения приводят к ромбоэдрической и тетрагональной
структурам. В низкотемпературной ромбоэдрической модифика-
ции CsCN (с 1 формульной единицей CsCN в элементарной
ячейке) все ионы CN~ ориентированы параллельно оси 3-го по-
рядка (рис. 22.2, разд. 22.1.1). Ребро тетрагональной элемен-
тарной ячейки структуры NH4CN (для которой полиморфизм
при температурах от —80 до 35°С до сих пор не изучен) удво-
ено в одном направлении, поскольку ионы CN~ имеют различ-
ные ориентации (рис. 22.3,6). Хотя каждый ион NH4+ окружен
восемью ионами CN~, благодаря ориентации последних 4 из
них располагаются на расстоянии 3,02 А и 4 — на большем уда-
лении C,56 А). К соединениям с упаковкой ионов, аналогичной
CsCl, принадлежат KSbF6, AgNbF6 и изоструктурные им соеди-
нения, а также [Be(H2OL]SO4 и [Ni(H2ON]SnCl6.
6.3. Структурный тип рутила
Эта тетрагональная структура (рис. 6.6,а) получила название
одной из модификаций TiO2. Ее можно также назвать структу-
рой типа касситерита (SnO2). В ней координаты атомов сле-
дующие:
Ti(Sn): @ 0 0), A/2 1/2 1/2)
О: ±(xiO), U/2 + A-', 1/2 —х, 1/2)
(В структуре антирутила позиции атомов металла и неметалла
взаимно обратные, как, например, в Ti2N.)
Структура состоит из цепей октаэдров TiO6, в которых каж-
дый октаэдр связан с соседними по двум противоположным
ребрам (рис. 6.6,6). В свою очередь между собой эти цепи
сочленяются вершинами октаэдров и образуют трехмерную
структуру с координацией 6 : 3, как показано в проекции на
рис. 6.6, в. В приведенных выше координатах каждый атом О
имеет 3 компланарных ближайших соседа B на расстоянии d
и 1 на^ расстоянии е), атом Ti — 6 октаэдрических ближайших
соседей D на расстоянии d и 2 на расстоянии е), все расстоя-
296 6. Некоторые простые АХ„
ния Ti — Ti (между центрами октаэдров вдоль цепи) одинако-
вые. Структура рутила описывается двумя независимыми па-
раметрами, с/а и х. Но если соблюдается соотношение между х
и cja: <9x=2-f-(c/a), то все расстояния Ti—О становятся одина-
ковыми (d = e) и число параметров сокращается до 1. Можно
OTi
О F"e на уровне О Q s на уровне О
О Fe на уробне с/2 Q s на уровне c/Z
Рис. 6.6. Структура рутила, а — элементарная ячейка; б — части двух колонок
октаэдрических координационных полиэдров TiO6; в —проекция структуры
на основание элементарной ячейки; г — соответствующая проекция структуры
марказита.
рассмотреть два крайних случая: 1) правильная октаэдриче-
ская координация Ti (c/a = 0,58 и х = 0,29); 2) координация ато-
мов кислорода в форме равностороннего треугольника (с/а =
= 0,817 и л:=0,33). В гл. 5 было показано, что одновременно
оба этих высоко симметричных ближайших окружения невоз-
можны. Для реализации случая A) углы между связями ато-
ма кислорода должны быть равны 90° и 135° (два угла). В ди-
оксидах и дифторидах с тетрагональной структурой типа рути-
ла обычно наблюдаются очень небольшие различия между дву-
6.3. Структурный тип рутила 297
мя расстояниями М — О или М — F, причем при значении х
около 0,30 структура существенно ближе к случаю A), чем к
B) Типичные данные следующие:
тю,
ZnF2
\TiF2
с
0,
0,
0,
:а
645
665
663
М—О или
о
4 связи, А
1,94
2,03
1,98
Ч— F
о
2 связи, А
1,99
2,04
2,04
В структурном типе рутила кристаллизуются только дифто-
риды Mg, Zn и некоторых 3 d-металлов, ряд диоксидов, неко-
торые оксофториды (FeOF, TiOF, VOF), MgH2. Он не типичен
для дисульфидов, других галогенидов или интерметаллических
фаз. Соединения MF2 и МО2, содержащие катионы большого
размера, как правило, принимают структуру типа флюорита,
и поскольку в этом смысле структуры рутила и флюорита до-
полняют друг друга, в табл. 6.3 сгруппированы соединения,
кристаллизующиеся в одной или другой из них. Некоторые ин-
тересные модификации структуры рутила показывают, каким
образом она может быть приспособлена к специфическим тре-
бованиям связывания определенных атомов (ионов).
В многочисленных диоксидах переходных металлов (V, Nb,
Mo, W, Тс и Re) расстояния в цепях между последовательными
атомами металла чередуются так, что имеют место взаимодей-
ствия металл — металл между близко расположенными пара-
ми атомов (подробнее см. в разд. 12.2.5).
В структурах CrF2 (и изоструктурном CuF2) и СгС12 про-
являются совершенно различные типы искажения структуры
типа рутила. В обеих структурах октаэдры МХ6 подвергаются
ян-теллеровскому искажению, приводящему к возникновению
четырех более коротких и двух более длинных связей. Из
рис. 6.7, а видно, что атом металла, расположенный в центре
ячейки CuF2, соединяется через атомы фтора более прочными
связями с четырьмя из восьми других атомов металла (связи
показаны сплошными линиями). Эти 5 атомов металла образу-
ют диагональную плоскость, проходящую через центр ячейки.
В предельном случае такой тип искажения должен был бы
приводить к слоистой структуре. Однако различия между дли-
нами двух разных связей М —F в этих фторидах слишком ма-
лы (см. выше), чтобы считать такое описание адекватным.
В СгС12 (рис. 6.7,6) установлено другое пространственное рас-
пределение коротких и длинных связей. Такой тип искажения
298 6. Некоторые простые АХп
Таблица 6.3. Диоксиды и дифториды со структурами рутила и флюорита
Диоксиды
Ti
Zr
Hf
Се
Th
Структура рутила.
Cr Mm
Nb Mo Tc I Ru Rh
Та ! W Re i Os Ir Ptc
l J
Si0
Ge
Sn
РЪ
PO
Структура флюорита
Pr Tb
Pa U Np Pu Am Cm
a Структура, модифицированная образованием, связей металл-металл.
" При кристаллизаиии под давлением.
Дифториды
Mg
Са
Sr
Ба
Структура рутила
CrD Mn Fe Co Ni Cu° Zn
Структура флюорита
Cd
Hg Pb
Искаженная (см. текст).
в пределе должен был бы приводить к образованию цепочек,
в которых 4 связи атома металла располагаются в одной пло-
скости, как в PdCb (разд. 9.9.2).
Характер искажения идеальной гексагональной плотнейшей
упаковки атомов X в тетрагональной структуре рутила можно
понять из сопоставления рис. 4.21, а и 4.21,6 (разд. 4.3).
В структуре гексагональной плотнейшей упаковки (ГПУ) атом
X должен был бы немного выступать из плоскости трех окру-
жающих его атомов М (углы между связями 90° (один) и 132°
(два), тогда как в рутиле они равны 90° (один) и 135° (два)).
К ГПУ-структуре весьма близки структуры СаС12, CdF(OH)
и InO(OH). В тетрагональной структуре рутила, построенной
из правильных октаэдров, расстояние между_ атомами X в
смежных цепях максимально; оно составляет УЗ/У2, т. е. в 1,22
раза больше длины ребра октаэдра. При развороте смежных
6.3. Структурный тип рутила 299
пей н противоположных направлениях на ~ 10° возникает
ГПУ-стр\ктура с меньшими расстояниями между атомами X
смежных цепей, как, например, в InO(OH), в котором образу-
ются водородные связи; его структура изображена в проекции
на рис. 14.11 (разд. 14.2.2). В марказите (FeS2) вследствие об-
разования связей S—S B,1 А) цепи развернуты еще сильнее,
как это показано на рис. 6.6, г. Примеры соединений со струк-
Рис. 6.7. а — искаженная рутиловая структура C11F2; б — проекция структуры
СгС12.
турами марказита и близких ему лёллингита и арсенопирнта
приведены в гл. 17.
В предыдущей главе были сопоставлены две простые окта-
эдрические структуры МХ2 с координацией 6 : 3; в одной из
них октаэдры связаны между собой только вершинами, в дру-
гой — три октаэдра, имеющие общий атом X, сочленяются
между собой только по одному ребру, и было показано, что в
первой из них сохранение правильной октаэдрической коорди-
нации маловероятно. Экспериментально обнаружены только
модифицированные структуры, как описано в разд. 6.9. Инте-
ресно провести их сравнение с модифицированными структура-
ми типа рутила, построенными из связанных общими ребрами
октаэдров:
Структура MXj
Соединение по
ребрам
Соединение по
вершинам
Правильные окта-
МО2, MF2
СаС12
InO(OH),
CdF(OH)
Искаженные октаэдры
D.+2)
CrF2, CuF2,
CrCl2
AgF*
B+4)
HgF(OH)
?-HgO2
Связи X—X
FeS2 (пирит)
FeS2 (мар-
казит)
300 6. Некоторые простые АХЛ
6.3.1. Соединения с рутилоподобными структурами (ABXit
А2ВХ6 и другие). Позиции катионов в структуре рутила могут
быть заселены катионами двух или более различных сортов
либо статистически (структура неупорядоченного рутила), либо
упорядоченно (сверхструктура). В первом случае структура
описывается нормальной элементарной ячейкой рутилового ти-
па. Элементарная ячейка сверхструктуры обычно, хотя и не
обязательно, больше по размеру, чем ячейка неупорядоченной
структуры. Фазы с неупорядо-
ченной структурой образуют-
ся, если заряды различных ка-
тионов равны или отличаются
не очень значительно. Если за-
ряды одинаковые, состав фазы
может быть переменным, как,
например, в твердых растворах
(Мп, Сг)О2, но если заряды
различные, то состав по
необходимости фиксируется
(CrNbO4, FeSbO4> AlSbO4
и т. д.).
Упорядочение катионов
проявляется в тех случаях, ког-
да: 1) заряды катионов отли-
чаются очень сильно или 2)
©Zn
Рис. 6.8.
Структура
ZnSb2O6.
должны быть удовлетворены
трирутила особые требования связывания
атомов отдельных сортов.
Случай A). Большое число
комплексных фторидов и окси-
дов А2ВХ6 (X = F или О) кристаллизуется в структуре трирути-
ла (рис. 6.8). Фториды A2+B22+F6 (например, FeMg2F6) имеют
неупорядоченную структуру типа рутила, но Li2+Ti4+F6 и одна
модификация Li2GeF6 — структуру трирутила. Возможны 3 типа
фторидов состава ABCF6, а именно:
A+B+C4+Fe,
а
A+B2+C3+Fe и A2+B2+C2+F6
Если все катионы двухвалентные (как в FeCoNiF6), реализу-
ется неупорядоченная структура типа рутила, но для соедине-
ний двух первых типов а и б характерна структура трирутила.
В соединениях первой группы это обеспечивает максимально
возможное удаление друг от друга ионов М4+ (Li2TiF6), в со-
единениях второй группы —ионов М+ (LiCuFeF6). Упомянутые
ионы занимают позиции Zn в структуре ZnSb2O6 (рис. 6.8)
[Z. Naturforsch., 1967, 22, 1218; J. Solid State Chem., 1969, 1,
6.4. Структуры флюорита (АХ2) и антифлюорита (А2Х)
301
mnl К группе оксидов со структурой трирутила принадлежат
VVeSboOe MgTa2O6, Cr2WO6, LiNbWO6 и VTa2O6 [J. Solid Sta-
te Chem.' 1970, 2, 295].
Случай B). В MgUO4, как и в многочисленных уранильных
соединениях, атом урана окружен двумя ближайшими (на
расстоянии около 1,9 А) и четырьмя более удаленными B,2 А)
соседними атомами кислорода. Внутри цепочки октаэдров ти-
па рутила располагаются только атомы U. Окружение атома
Mg2+ аналогично окружению U: 2 атома кислорода на расстоя-
нии 2,0 А и еще 4 — на расстоянии 2,3 А, что, очевидно, явля-
ется лишь следствием особых требований к координации ура-
на. С другой стороны, в CuUO4 атомы Си и U чередуются
вдоль каждой цепочки октаэдров типа рутила. Здесь структура
рутила модифицируется для обеспечения координации B+4)
для урана (средние расстояния U —О 1,9 и 2,2 А близки к
аналогичным расстояниям в MgUO4) и координации D+2)
атома Си (на расстояниях 1,96 и 2,59 А).
Гомологические серии оксидов, структурно родственных
структуре рутила. Ванадий и титан образуют серии оксидов
общего состава М„О2я+1 со структурами, родственными структу-
ре рутила. Блоки рутилоподобной структуры толщиной в п
октаэдров, но бесконечно протяженные в двух других измере-
ниях, сочленены между собой по плоскостям «сдвига». Эти
структуры можно геометрически вывести из структуры рутила
удалением части атомов кислорода из определенных плоско-
стей и последующим смещением рутильных блоков таким об-
разом, чтобы восстановить октаэдрическую координацию ато-
мов металла. Эта операция приводит к соединению разных
блоков по граням определенных пар октаэдров (в дополнение
к связыванию по вершинам и ребрам в самих рутильных бло-
ках), как в структуре типа корунда (разд. 4.3). Для сравнения
отметим, что структуры сдвига оксидов Мо и W выводятся
аналогичным путем из каркаса соединенных вершинами окта-
эдров в структуре типа ReO3. При этом возникают структуры,
в которых определенные октаэдры соединены по ребрам. Ли-
тература об оксидах Ti D^п^9) и V C^п^8) приведена
в гл. 12.
<>.4. Структуры флюорита (АХ2) и антифлюорита (А2Х)
В структуре флюорита (рис. 6.9) атомы (ионы) А окружены
восемью атомами X по вершинам куба и атомы X — четырьмя
атомами А по вершинам правильного тетраэдра. По этому ти-
пу кристаллизуются многочисленные дифториды и диоксиды
(табл. 6.3), некоторые дисилициды (см. ниже), интерметалли-
ческие соединения (например, GeMg2, SnMg2, PtAl2 и др.) и ди-
гидриды переходных металлов.
302 6. Некоторые простые АХп
Позиции ионов Са2+ в
структуре флюорита соот-
ветствуют позициям кубиче-
ской плотнейшей упаковки,
позиции ионов F~ — всем
тетраэдрическим пустотам.
Можно выделить две экс-
тремальные конфигурации
этой структуры:
1) атомы (ионы) А со-
прикасаются друг с другом
(кубическая плотнейшая
упаковка), атомы X распо-
ложены в тетраздрических
пустотах: гх<гА;
2) атомы X соприкаса-
ются друг с другом (простая
кубическая упаковка), атомы А размещаются в кубических
пустотах: гх>гА. Кроме того, возможно неограниченное число
промежуточных конфигураций, таких, как, например, BaF2) где
гх~гА. Предполагая сферы «несжимаемыми», эти структуры
различают по типам атомных контактов следующим образом:
Оса
Рис. 6.9. Структура флюорита.
A)
Промежуточные
структуры
B)
Контакты А
X
Примеры
12 А
8Х
4А
YH,
8Х
4А
BaF2, SrF2
8Х
4А
6Х
CaF,
В YH2 атом иттрия кроме своих ближайших соседних восьми
атомов Н окружен 12-ю атомами Y на таком же расстоянии
C,65 А), как в металлическом иттрии. В CaF2 расстояние меж-
ду ионом F~ и его ближайшими шестью соседними F~
B,70 А) равно его удвоенному ионному радиусу, поэтому струк-
тура служит примером конфигурации B). Здесь кратчайшее
расстояние между ионами Са2+ C,8 А) сравнимо с удвоенным
радиусом Са2+ B,0 А).
В структуре типа антифлюорита (А2Х) позиции катионов
и анионов взаимно обратные, поэтому для нее тоже возмож-
ны две предельные конфигурации:
3) плотноупакованные атомы X; атомы А расположены в
тетраэдрических пустотах;
6.4. Структуры флюорита (АХ2) и антифлюорита (А2Х) 303
4) атомы А соприкасаются друг с другом; атомы X распо-
ложены в кубических пустотах.
Типы контактов между атомами представлены выше, те-
перь необходимо только поменять местами атомы А и X. При-
мерами служат:
C)
Li2Te
Промежуточные
структуры
к2о
D)
Во2С
Наибольшее приближение к плотноупакованной структуре
C) найдено для комбинации самых малых по размеру щелоч-
ных металлов с самыми большими халькогенами. В Li2Te
каждый атом Те окружен 12 ближайшими соседними атомами
Те на расстоянии 4,6 А, близком к величине удвоенного радиу-
са Те2г D,4 А). В оксидах щелочных металлов М2О упаков-
ка ионов О2^ по большей части не соответствует плотнейшей:
для наглядности нужно сравнить расстояния О—О в Li2O
C,3 А) и в Na2O C,9 А) с величиной удвоенного радиуса иона
О--- B,8 А). Структуры Li2O и Na2O промежуточные между
конфигурациями C) и D). Примером конфигурации D) слу-
жит Ве2С, где атом Be окружен шестью ближайшими сосед-
ними атомами Be на расстоянии 2,2 А, —¦ такие же межатомные
расстояния найдены в металлическом бериллии. Структура ти-
па антифлюорита реализуется у оксидов (М2О) и сульфидов
(M2S) Li, К и Rb. О соединениях цезия, Cs2O и Cs2S, см. разд.
12.2.3 и 17.1.2 соответственно. Отметим, что в К2О и Rb2O ка-
тионы сравнимы по размеру с О2^, тем не менее здесь сохра-
няется четверная координация катионов. Это явление будет
обсуждаться в гл. 7. К структуре типа антифлюорита принад-
лежат также Mg2Si, Mg2Ge и аналогичные соединения.
Существует значительное число фторидов, оксидов и оксо-
фторидов со структурами, более или менее родственными
структуре флюорита. Наиболее близки соединения с отноше-
нием катион : анион, равным 2: 1, и со статистическим распре-
делением катионов или анионов. Эти структуры имеют неис-
каженную кубическую элементарную ячейку. Примерами слу-
жат высокотемпературные модификации NaYF4 и K2UF6 и ок-
софториды АсОН и НоОН. Как и в случае структуры NaCl,
известны тетрагональные и ромбоэдрические сверхструктуры
на основе структуры флюорита (см. гл. 10). К ним относятся
многочисленные оксофториды:
Тетрагональные YOF, LaOF, PuOF
Ромбоэдрические YOF, LaOF, SmOF и др.
304 6. Некоторые простые АХп
Сверхструктура на основе структуры флюорита для
Y-Na2UF6 изображена на рис. 28.3 (разд. 28.2.4). Слабоиска-
женная кубическая координация иона М5+ установлена в
Na3UF8 (и в изоструктурном Na3PuF8). Благодаря соответст-
вующему расположению катионов в этой структуре (рис. 6.10)
О
О
о
о
О
о
о
О
SrCrF,
Sr
Sr2CuF6
О
О
о
о
Те
О
О
о
о
о
о
О
Na
вакансия
TiTe3O8
Рис. 6.10. Позиции катионов в структурах, родственных флюориту.
Na3UFfi
О О
элементарная ячейка удвоена в одном направлении и становит-
ся объемноцентрированной тетрагональной.
Связь структур двойных фторидов SrCrF4 (и изоструктур-
ных CaCuF4, CaCrF4 и SrCuF4) и Sr2CuF6 с флюоритом менее
тесная. Размеры их ячеек соответствуют увеличенной в одном
направлении в 2 и 3 раза ячейке типа флюорита. Позиции
катионов также близки к позициям катионов в структуре
флюорита, как, например, у SrF2 (рис. 6.10). Однако происхо-
дит значительный сдвиг ионов F~ из «идеальных» позиций для
6.4. Структуры флюорита (АХ2) и антифлюорита (А2Х) 305-
обеспечения подходящего окружения для ионов переходных ме-
таллов. Ионы Sr2+ сохраняют кубическую координацию 8, но
окружение ионов Cr2+ (Си2+) анионами имеет форму удлинен-
ных тетраэдров (два угла по 94°, четыре — по 118°). В семей-
стве двойных оксидов МТе3О8 (M = Ti, Zr, Hf, Sn) позиции ка-
тионов близки к их позициям в структуре флюорита (субъ-
ячейка показана на рис. 6.10), но истинная элементарная
ячейка удвоена во всех направлениях, и атомы кислорода сме-
щены так, что образуют вокруг М и Те сильно искаженную ок-
таэдрическую координацию, например, расстояния Те—О со-
ставляют 2,04 А D связи) и 2,67 А B связи).
Существует интересный пример деформации структуры
флюорита, приводящей к образованию слабых взаимодейст-
вий металл ¦— металл, который напоминает искаженные струк-
туры рутилового типа для некоторых диоксидов. В то время
как CoSi2 и NiSi2 кристаллизуются в кубической структуре
флюорита, в p-FeSi2 структура искажается: здесь у каждого
атома Fe по 2 ближайших соседних атома Fe, атомы металла
расположены по квадратам со стороной 2,97 А (для сравнения:
в металлическом железе с 12-координированным Fe межатом-
ные расстояния равны 2,52 А). Атом металла окружен еще
восемью соседними атомами Si по вершинам искаженного ку-
ба. Такое искажение структур типа флюорита можно рассмат-
ривать как частичный переход к структуре типа СиА12 (разд.
29.6.5), в которой координационный полиэдр меди представля-
ет собой квадратную антипризму и в которой образуются цепи
связанных между собой атомов Си [Acta cryst., 1971, В27,
1209].
6.4.1. Дополнительные анионы в структуре флюорита: структур-
ный тип FesAl. В многочисленных системах металл — неметалл
кубические флюоритоподобные фазы устойчивы в широком ин-
тервале состава. У гидридов легких 4/-металлов (La — Nd)
этот интервал простирается приблизительно от MHi,9 до со-
става, близкого к МН3. [Область устойчивости фазы «дигидри-
дов» тяжелых 4/-металлов более узкая и отделена от аналогич-
ной области фазы «тригидридов», имеющих другую (LaF3)
структуру.] Для дополнительных анионов доступны только уз-
лы, расположенные на серединах ребер и в центрах флюорит-
ных ячеек (заштрихованные кружки на рис. 6.11). Получаю-
щуюся структуру АХ3 иногда описывают как структуру типа
BiF3, поскольку ранее ошибочно полагали, что одна из моди-
фикаций этого соединения имеет именно такую структуру
(разд. 9.9.3). Предпочтительнее называть ее структурой типа
F3AI (или LiaBi), поскольку она характерна для многочислен-
ных интерметаллических фаз.
20—752
306 6. Некоторые простые АХп
В структуре типа Fe3Al все атомы имеют кубическую ко-
ординацию 8, и если ее формулу записать в виде АХ2Х', то
получим следующую координацию ближайшими соседями:
А: 8Х, X: 4А и 4Х', X': 8Х
Это значит, что дополнительные атомы X' окружены полиэд-
ром из 8 X, удаленных на расстояние 0,433 а (а — длина реб-
ра ячейки), а их ближайшие соседние атомы А образуют окта-
9^-
Л
О
Fe
Рис. 6.11. Структура Fe3Al.
эдр из 6 атомов А, находящихся на расстоянии 0,5 а от цент-
рального атома X'. Хотя такое окружение характерно для ин-
терметаллического соединения, оно маловероятно для аниона,
и хотя соединения МН2+;С и UO2+A; образуют флюоритоподоб-
ные фазы, вероятно, в этих структурах осуществляется опре-
деленная перегруппировка анионов. По-видимому, образование
идеальной структуры с полным набором атомов X' (рис. 6.11)
в каких-либо других фазах, кроме интерметаллических соеди-
нений, невозможно. Соединения с этим типом структуры под-
робно обсуждаются ниже: гидриды 4/-металлов (разд. 8.2.3),
Bi2OF4 (разд. 9.9.3), оксиды урана UO2+* (разд. 28.2.4); см.
также табл. 29.7 (разд. 29.6).
6.4.2. Структуры дефектного флюорита. Структуры типа флюо-
рита, дефектные по катионам, по-видимому, встречаются ред-
ко. Примером служит Na2UF8 (ранее ему приписывали состав
6.4. Структуры флюорита (АХ2) и антифлюорита (А2Х) 307
NasUFtj), в котором существуют дискретные группировки UF8.
расположение ионов Na+ здесь такое же, как у 2/3 ионов Nah
в Na3UF8 (рис 6.10). В соединении Li9N2Cl3 с дефектной
структурой типа антифлюорита наличие 10% вакансий Li^ обу-
словливает ионную проводимость. В то же время известны мно-
гочисленные фазы (по большей части оксиды) со структурами,
которые можно получить из флюоритовой путем удаления ча-
сти анионов. Составы соединений с такими структурами приве-
дены в табл. 6.4.
Структуру С-М2О3 (разд. 12.2.8) можно вывести из флюо-
рита удалением 'Д части анионов и небольшой перегруппиров-
кой остальных анионов. Все атомы М координированы окта-
эдрнчески, координация 'Д части этих атомов более правиль-
ная. Твердые растворы 1Ю2+Х— Y2O3 образуют дефектные гра-
нецентрированные кубические структуры, степень анионной де-
фектности в которых определяется содержанием урана и пар-
циальным давлением кислорода. Когда дефицит по кислороду
становится слишком большим, происходит перестройка с об-
разованием ромбоэдрической фазы MVIM6IHOi2 (M=Mo, W, U)
с координацией MV| и Мш 6 и 7 соответственно. Такие фазы
известны также для оксидов типа M4inM3IVOi2 (например,
Sc4Zr30i2) и для оксидов состава M7Oi2 тех элементов, кото-
рые одновременно образуют ионы М3+ и М4+ (например, Се,
Рг, ТЬ). Фаза Zr5Sc2Oi3 является промежуточной между этой
фазой и диоксидом; по составу она соответствует потере лишь
'/м части атомов кислорода из структуры флюорита вместо ]/7
части для фаз M7Oi2. В этих дефицитных по кислороду фазах
атомы кислорода сохраняют свое тетраэдрическое окружение,
тогда как координация ионов М понижается:
Дефицит кисло-
рода
Состав
Координация М
О
МО,
8 "
1/14
М,0
6,7,
13
,8
1/7
М,О12
6, 7
1/4
м2о3
6
Другие дефектные структуры типа флюорита с промежуточ-
ными степенями дефицита анионов обсуждаются ниже: Рг6Оц
(разд. 12.2) и Na3UF7 (разд. 28.2.4).
6.4.3. Структура пирохлора. Эта структура (рис. 7.3, разд. 7.6.3)
представляет собой связующее звено между дефектными флюо-
ритовыми структурами, которые мы только что рассмотрели, и
служит темой для обсуждения в конце данной главы. При пол-
ном заселении атомами эта кубическая структура содержит
8 формульных единиц А2В2Х6Х' в элементарной ячейке. В за-
20*
Таблица 6.4. Структуры, родственные структуре флюорита
Избыток катионов
Структура Fe3Al
(МН3)
Неупорядо-
ченный флю-
орит
Высоко-
темпера-
турные
модифи-
кации
NaYF4 и
AcOF
Сверхструкту-
ры LaOF
другие
Na2UF6
Na3UF8 [21
SrCrF4 [31
Sr2CuF6 [31
Bi2UO6 [3al
TiTe3O8 [41
Структура дефицита по катио-
нам
Na2UF8 [1]
Li9N2Cl3
(антифлюорит)
Структура
флюорита
Анионный
дефицит [6]
1/14
1/12
1/8
1/7
5
1/4
Структура дефицита по анио-
нам
Zr5Sc2O13, Zr7O,,N2 [51
Рг6О„
Na3UF7
(пирохлор А2В2Х7)
М7О12 (Се, Pr, Tb)
Zr3Sc40I2, Zr7O8N4 [51
структура С-М2О3
Литература:
1. Inorg. Chem, 1966, 5, 130
2. J. Chem. Soc, 1969, A, 1161
3. J. Solid State Chem, 1970, 2
262
3a. Acta cryst, 1975, B31, 127
4. Acta cryst., 1971, B27, 602
5. Acta cryst. 1968, B24, 1183;
о других соединениях см. по-
следующие главы
6. О систематическом рассмот-
рении гомологических серий
МпО2п-.2 см. Z. Kristallogr,
1969, 128, 55
6.4. Структуры флюорита (АХ2) и антифлюорита (А^Х) 309
висимости от величины единственного переменного параметра
(параметр х для 48 атомов X в позиции (х, У8, Ve) и т. д.)
структуру можно описать двояко:
1) х = 0,375; координация атомов А кубическая, координа-
ция атомов В очень сильно искаженная октаэдрическая (упло-
щенный вдоль оси 3-го порядка октаэдр). Это дефектная сверх-
структура А2В2О7 ? (П—вакансия) на основе структуры
.флюорита.
2) х = 0,3125; координация А — очень сильно искаженная
кубическая (т. е. гофрированный шестиугольник-f 2), координа-
A) X =0,375 B)х = 0,3725
Рис. 6.12. Координация атомов А в структуре пирохлора А2В2ХеХ'.
ция В правильная октаэдрическая. При таком описании каркас
правильных октаэдров (каждый из них соединен вершинами с
шестью другими октаэдрами), основанный на алмазной сетке,
содержит большие пустоты, в которых размещаются атомы X'
и 2 А. Последние в свою очередь образуют купритоподобную
сетку А2Х', которая встраивается в октаэдрический каркас, как
это было показано в гл. 3. Вследствие жесткости октаэдриче-
ского каркаса состава В2Х6 эта структура может сохраняться
при удалении некоторых атомов; это происходит, например, в
сложных оксидах, рассматриваемых в гл. 13.
Координационные полиэдры атомов А для случаев A) и B)
изображены на рис. 6.12. В действительности не известно ни
одного соединения с параметром х = 0,375. Максимальное значе-
ние х составляет 0,355, а в некоторых случаях, когда октаэдры
ВХ6 удлинены, величина х становится меньше 0,3125 (напри-
мер, в Ca2Nb207 x = 0,305). Тем не менее соотношение между
граничной (пока неизвестной) структурой, отвечающей случаю
A), и флюоритом представляет вполне определенный интерес,
ибо некоторые соединения обнаруживают способность к перехо-
ду от структуры пирохлора к структуре дефектного флюорита.
310 6. Некоторые простые АХ„
6.5. Структурный тип Cdl2 и родственные структуры
Модель простой структуры типа Cdl2 (C6), называемой также
структурой брусита Mg(OHJ, изображена на рис. 6.13. В пре-
дыдущих главах она была описана двумя другими способами:
как гексагональная плотнейшая упаковка ионов 1~, в которой
ионы Cd2+ занимают все октаэдрические пустоты между чере-
дующимися парами плотноупакованных слоев (это составляет
половину всех октаздрических
пустот), и как построенная из
слоев октаэдров Cdl6, где каж-
дый октаэдр соединен по ребру с
шестью смежными полиэдрами.
Эти 3 способа изображения одно-
го слоя показаны на рис. 6.14.
Qy^( A I ' | \ у-* Из описания по способу плот-
i | 4v]N| / i /\ ноупакованной структуры следу-
ет, что возможно бесконечно
большое число родственных
структур, построенных из плотно-
упакованных слоев I—Cd—I
(рис. 6.14), но с разной последо-
вательностью слоев в пространст-
ве. Три наиболее простые струк-
туры этого семейства часто обоз-
начают символами г и к, соот-
ветствующими принятым в
справочнике «Strukturbericht»
{h — гексагональная, с — кубиче-
ская).
Последовательность плотноупакованных слоев:
С6 г(АВ...) 2Н
С19 /с (ABC.) ЗС
С27 гк(АВАС) 4Н
Непосредственно Cdl2, смешанные кристаллы CdBrI, РЫ2 и
другие соединения кристаллизуются более чем в одной из этих
структур и также в структурах с более сложными чередования-
ми слоев. К настоящему времени охарактеризовано более
80 политипов Cdl2. Для нас они не представляют особого ин-
тереса, поскольку довольно очевидно, что их образование свя-
зано с механизмом роста, и все они построены из одних и тех
же базисных слоев. Важнее показать, каким образом этот
очень простой слой участвует в построении структур разнооб-
разных соединений. И мы не будем здесь детально анализиро-
вать способы упаковки слоев. Ниже будут описаны 5 типов
Рис. 6.13. Части двух слоев струк-
туры Cdh. Кружки меньшего диа-
метра изображают атомы металла.
6.5. Структурный тип Cdh и родственные структуры 311
Рис. 6.14. Три способа изображе-
ния слоя структуры типа Cdl2.
структур, начиная с такой, которая содержит слои наиболее
простого типа, т. е. со структуры соединений МХ2 или М2Х, где
все атомы М или все атомы X одинаковые.
6.5.1. Структуры МХо и М2Х. Многочисленные соединения с
этой простой слоистой структурой описаны в других главах.
К ним относятся:
структурный тип С 6:
структурный тип С 19:
структурный тип С 27:
многие дибромиды и дииодиды, дигидроксиды и
дисульфиды
многие дихлориды
p-TaS2, некоторые дигалогениды
Следующие соединения кристаллизуются в той или иной из
структур типа анти-С(Л2 или aHTH-CdCl2; здесь атомы неметал-
ла заселяют октаэдрические пустоты между слоями атомов ме-
талла:
Ag2F, Ag2O (под давлением), Cs2O, Ti2O, Ca2N, Ti2S и W2C
В ромбоэдрической модификации СгО(ОН) [и изострук-
турном СоО(ОН)] слои типа Cdl2 накладываются непосредст-
венно друг на друга и удерживаются короткими связями
О—Н—О.
Структуры солей Zr(HPO4J-H2O [Inorg. Chem., 1969, 8,
1] и Y-Zr(SO4J-H2O [Acta cryst, 1970, B26, 1125] родствен-
312 6. Некоторые простые АХп
ны и базируются на слоях типа С6; роль 3-связанной структур-
ной единицы выполняет тетраэдрический оксоион, мостиковый
между тремя ионами металла. В Zr(HPO4h-H2O катионы Zr4+
шестикоординированы атомами кислорода из ионов ОзР(ОНJ^,
располагающихся поочередно выше и ниже плоскости ионов ме-
талла (рис. 6.15). Связи Р—ОН перпендикулярны этой плос-
V3
OZr"+ Т Р03@И) выше
О плоскости рисунка
Р03@Юниже
плоскости рисунка
Рис. 6.15. Слой структуры Zr(HPO4J-H2O. Аналогичное связывание анионов
и катионов наблюдается в ¦y-Zr(SO4h-H2O.
кости, молекулы воды занимают полости между слоями. Суль-
фат циркония содержит аналогичный набор Zr4+ и мостиковых
оксоионов, но здесь с Zr4+ связаны также и молекулы воды, что
приводит к повышению координации Zr4+ до 7.
6.5.2. Катионы или анионы более чем одного сорта в каждом
слое МХч. Известны многочисленные типы гидроксогалогени-
дов М(ОН)С1, М2(ОНKС1 и M(OH)Xb-.v. Для некоторых из
них характерно статистическое расположение ОН и С1(Вг), для
других — их упорядоченное распределение в каждом плотно-
упакованном слое [Со(ОН)С1, Си2(ОНKС1]; в Cd(OH)Cl че-
редующиеся плотноупакованные слои целиком состоят из нонов
ОН- или С1-.
В комплексных гидроксидах, таких, как K2Sn(OHN, 2/3 по-
зиций Mg в слое Mg(OHJ заселены калием, остальные — оло-
вом; структура содержит дискретные ионы Sn(OHN2~.
6.5. Структурный тип Cdl2 и родственные структуры 313
6.5.3. Замещение катионов с образованием заряженных слоев.
Если в электрически нейтральном слое MgCl2 часть Mg2+ за-
мещена на Na+, слой становится отрицательно заряженным.
Напротив, при частичном замещении Mg2+ в слое Mg(OHJ на
ДГ+ слой заряжается положительно. Слои таких двух типов
совместно могут образовать структуру, в которой чередуются
отрицательно и положительно заряженные слои (см. ниже схе-
му а). Слои распространяются по всему кристаллу, химическая
формула которого просто соответствует составу повторяющихся
слоев. Другая возможность — чередование заряженных слоев
с противоположно заряженными дискретными ионами (а так-
же и молекулами воды, если необходимо заполнить остаточное
свободное пространство), как это изображено на схемах бив:
[Na4Mg2CI12]n*«-
СО32-(Н2ОL
[Mg6Fe2ln(OHI6]n2"+
[Са4А1,
S04*
[Ca4Al2
(OHI2]n2«+
'1НД,
@НI2]„»+
[Mg7Al4(OHJ2]n""+
а б в
Обратим внимание на то, насколько более информативны
«структурные» формулы этих соединений по сравнению с обыч-
ными аналитическими:
Аналитические формулы Структурные формулы
а) 4NaCl-4MgCl2-5Mg(OHJ-4Al(OHK [Na4Mg2Cl12] [Mg7Al4(OHJ2]
б) MgCO3-5Mg(OHJ-2Fe(OHK-4H2O [Mg6Fe2(OHI6]CO3-4H2O
в) 3CaO-Al2O3-CaSO4-12H2O [Ca4Al2(OH)j2]SO4-6H2O
(Подробности см. в работах: Nature, 1967, 215, 622; Z. Kristal-
logr., 1968, 126, 7; Acta cryst., 1968, B24, 972).
Устойчивости этих структур, вероятно, способствуют водо-
родные связи между молекулами воды и оксоанионами.
6.5.4. Замещение некоторых ионов ОН~ в слое М(ОНJ атома-
ми кислорода оксоионов. Если в слое состава М(ОНJ один из
ионов ОН~ замещается на атом кислорода нитрат-иона, то слой
остается электрически нейтральным. При этом остальные атомы
иона NO3~ располагаются вне слоя. Гидроксонитрат
Cu2(OHKNO3 содержит нейтральные слои именно такого вида;
в слое типа С6 на атомы кислорода анионов NO3~ замещена
'Л часть ионов ОН", как схематически показано на рис. 6.16, а.
Между атомом кислорода ионов NO3~ и ОН соседних слоев
осуществляется водородная связь. Если в слое типа С6 состава
Си(ОНJ '/4 часть ионов ОН~ замещается на атомы О сульфат-
ных ионов, то возникает необходимость во введении дополни-
тельных катионов. Остающийся объем заполняется молекулами
314 6. Некоторые простые АХ„
Н20 (рис. 6.16,6). Именно такова структура CaCu4(OHN(SO4J-
•ЗНгО; в этой структуре относительное количество Си, ОН и
оксоионов точно такое же, как и в Cu2(OHKNO3. (В минерале-
серпиерите [Acta cryst., 1968, В24, 1214] происходит также за-
мещение приблизительно '/з части Си на Zn.)
Более сложные атомные расположения найдены в некото-
рых силикатах и алюмосиликатах. Если 7з часть групп ОН на-
одной стороне слоя Mg(OHJ замещается атомами кислорода
групп SiO4, остальные 3 атома кислорода каждой такой груп-
6.5. Структурный тип
и родственные структуры 315
6
Рис. 6.16. Слои, родственные слою типа Cdl2: а — Си2(ОНI\Юз; б —
[Cu4(OHN(SO4J]n2»-; e-Mg3@HLSi205.
пы SiO4 могут выполнять мостиковые функции между смеж-
ными группировками SiO4 (рис. 6.16, в). Состав такого слож-
ного электрически нейтрального слоя описывается формулой
Mg3(OHLSi2O5 (см. гл. 23). Если слои связанных между со-
бой групп SiO4 располагаются с обеих сторон слоя Mg(OH)y
(способом, показанным на рис. 6.16,в), то общий состав соот-
ветствует уже Mg3(OHJSi4Oio. Из таких нейтральных слоев
строятся кристаллы хризолита и талька. При замещении неко-
торого количества атомов Si алюминием образуются отрица-
тельно заряженные слои, представляющие собой струк-
турные блоки в слюдах, например KMg3(OHJ[Si3AlO10].
В KAl2(OHJ[Si3A10io] ионы Mg2+ слоев Mg(OHJ заменены
на ионы А13+ (в количестве 2/з общего числа позиций Mg2+).
В хлоритных минералах отрицательно заряженные слюдоподоб-
ные слои перемежаются с положительно заряженными слоями
типа брусита, в которых Mg частично замещен алюминием; это
относится, в частности, к [Mg3(OHJSi3AlO10]~[Mg2Al(OHN]+.
Для сравнения см. слои на схемах для случаев (а) — (в)
в разд. 6.5.3.
6.5.5. Присоединение дополнительных атомов металла к по-
верхности слоя. Поскольку атомы X в слое состава Сс1Х2 плот-
Но упакованы, для дополнительных ионов металла доступны
2 вида позиций с обеих сторон такого слоя: над (заселенной)
октаэдрнческой пустотой или над незаполненной тетраэдриче-
скон позицией (рис. 6.14,6). С энергетической точки зрения ни
одна из этих позиций (независимо от того, координирована ли
а б \ I /
2 +
Zn
Рис. 6.17. а — присоединение иона металла к слою типа Cdl2. Схематическое
изображение структур: б— ZnMn3O7-3H2O; в — Zn5(OH)8Cl2-H2O; г —
Zn5(OH)e(CO3J.
она тетраэдрически или октаэдрически, рис. 6.17, а) не пригод-
на для размещения дополнительных ионов М вследствие чрез-
мерно близкого расположения этих позиций к одному или трем
катионам слоя. Однако в первом случае такого тесного сбли-
жения ионов металла можно избежать путем удаления иона
металла, находящегося внутри слоя (темный кружок на
рис. 6.17,а). Минерал халькофанит ZnMn3O7-3H2O состоит
из слоев типа С 6, образованных ионами Мп4+ и О2~, из ко-
торых удалена У7 часть ионов металла, что приводит к составу
Мп3О7 вместо МпО2. С каждой стороны такого слоя, непосред-
316 6. Некоторые простые АХп
ственно выше и ниже незанятой позиции Мп4+, присоединяют-
ся ионы Zn2+, а между (незаряженными) слоями располагают-
ся слои молекул воды. Три из них завершают октаэдрическую
координацию вокруг Zn2+ (рис. 6.17,6).
Основу структуры Zn5(OH)8Cl2-H2O составляют заряженные
слои. Из слоя Zn(OHJ У4 часть ионов Zn2+ удалена; взамен
каждого удаленного из слоя иона на поверхностях слоя добав-
ляются по 2 иона Zn2+. В результате состав слоя соответствует
Zn5(OH)82+. Заряд уравновешивается ионами С1~, расположен-
ными между слоями. Остающееся пространство занимают мо-
лекулы воды (рис. 6.17,в). Координация ионов Zn2+ на внеш-
них поверхностях слоев тетраэдрическая в отличие от октаэд-
рической внутри слоев. Другой пример слоистой структуры то-
го же общего типа представляет Zn5(OH)8(NO3J-2H2O (разд..
14.3.4).
В качестве последнего примера рассмотрим гидроцинкит.
Zn5(OHN(CO3J — продукт коррозии цинка, который сопутст-
вует подвергшимся выветриванию цинковым рудам. Его струк-
туру можно описать на основе комбинации случаев D) и E).
Как и в предыдущем примере, 'Д часть ионов Zn2+ из слоя
Zn(OHJ удалена и заменена удвоенным количеством тех же
ионов, распределенных поровну по обе стороны от слоя. В до-
полнение к этому 'Д часть ионов ОН^ замещается атомами кис-
лорода из ионов СО32~ таким образом, что состав изменяется
от Zn4(OH)8 до Zn2[Zn3(OHN] (СОзJ- Второй атом кислорода
каждого иона СОз2~ связан с «дополнительными» атомами Zn,.
что приводит к их тетраэдрической координации, как в гидрок-
сохлориде. Схематически это изображено на рис. 6.17, г. Хотя
структура в целом не слоистая, так как связи между атомами
Zn и кислорода распространяются по всему кристаллу, тем не
менее плотноупакованные слои атомов кислорода вокруг окта-
эдрически координированных атомов Zn остаются важнейшей
особенностью структуры и могут служить матрицей для роста
кристаллов. Следует учитывать (что не всегда делается), что
в такого рода соединениях, которые существуют только в твер-
дом состоянии и могут образовываться на поверхности друго-
го твердого вещества (металлического цинка, ZnO и т. д.),
рост кристаллов равнозначен действительному образованию хи-
мического соединения.
6.6. Структурный тип ReO3 и родственные структуры
Кубическая структура ReO3 была описана в гл. 5 как простей-
шая трехмерная структура, образованная из связанных по вер-
шинам октаэдров. На примере Sc(OHK был рассмотрен также
ее искаженный вариант. Кубическая или менее симметричная
6.6. Структурный тип ReO3 и родственные структуры 317
структура характерна для NbF3 и некоторых триоксидов и ок-
софторидов (табл. 6.5), но она невозможна для ионных три-
нитридов, поскольку для этого потребовались бы катионы М9+.
Однако структура типа анти-1?еО3 установлена для Cu3N. Ана-
логично в структуре перовскита, которая выводится из ReO3
путем введения 12-координированного иона в центр элементар-
ной ячейки (рис. 13.3, разд. 13.3.2), кристаллизуются многие
комплексные фториды и оксиды (часто с более низкой симмет-
Таблица 6.5. Структура ReO3 и родственные структуры
Сбермтруктуры,
например криолит
\
Статистическая
Re03-структура
ГПУ
Структура
перовскита
KNiF3 и т.д.
SrTiO3 и т.д.
Структура
антиперовскита
GaNCr3
AlCSc3
(кубическая Т.
Na- бронза) '
-*— ReO3 - структура
lrF3
(Sc(OHK
lln@HK
Структура
Структура анти-КеО3 скуттерудита
Cu3N СоР3 , CoAs3 и т.д.
(Примеры ИеОз-структуры: NbF3, WO3, UO3.)
рией по сравнению с кубической), а по антиперовскитовому ти-
пу кристаллизуются многочисленные тройные нитриды и кар-
биды, в которых атомы N или С занимают позиции с октаэд-
рической координацией. Альтернативно эти нитриды и карбиды
можно описать как кубическую плотнейшую упаковку атомов
металла с заселением атомами С и N 'Д части октаэдрических
пустот. Такое описание более наглядно в случае одного сорта
атомов металла в соединении (например, для Fe4N, Mn4N,
Ni4N). Поскольку в структуре типа ReO3 атомы кислорода за-
селяют 3/4 позиций кубической плотнейшей упаковки, возмож-
на ее перестройка в более плотную структуру, приводящая в
пределе к ГПУ-сверхструктуре, найденной в RhF3 и некоторых
Других трифторидах (гл. 9).
Связь между структурами ReO3 и RhF3 легко прослеживает-
ся на модели, построенной из двух октаэдров с общей верши-
ной (рис. 6.18, а). Здесь вершины а, Ь, с и d расположены в
одной плоскости и октаэдры соединены между собой по типу
ReO3. Угол АсВ равен 180 °С. Если совершить разворот октаэдра
В на 60° против часовой стрелки вокруг вершины с, сохраняя
при этом развороте компланарность вершин, то октаэдр В зай-
мет положение, показанное на рис. 6.18,6, угол АсВ станет
318 6. Некоторые простые АХп
равным 132° и атомы X расположатся в позициях, отвечающих
гексагональной плотнейшей упаковке. Именно такова взаимо-
связь между смежными октаэдрами в ГПУ-структуре RhF3.
Можно отметить, что расположение октаэдров RhF6 здесь по
существу такое же, как и октаэдров LiO6 или ЫЬОб в LiNbO3 —¦
d Ь
А-с-В=180
А-с-В= 132'
Рис. 6.18. Взаимосвязь между октаэдрами с общей вершиной, а —
RhF3.
сверхструктуре на основе структуры корунда. Это обстоятель-
ство схематически иллюстрирует рис. 6.19, где схемы а, б и в
соответствуют (приблизительно) ГПУ-структурам (углы М—
—О—М в интервале 120—140°), а схема г — КПУ-структуре
типа перовскита с аналогичным объединением октаэдров по
вершинам, но с углом М—О—М 180°. (Представление плотно-
О А!
Корунд а-41гО3
ов
ПероЬскит
г
г
Рис. 6.19. Разрезы плотноупакованных структур, содержащих трехмерные си-
стемы сочлененных октаэдров.
упакованных структур с помощью схем, показанных на рис. 6.19,
описано в гл. 4; см. рис. 4.25 и 4.27 и поясняющий их текст.)
Интересно отметить, что структура корунда и сверхструктуры
на основе структуры корунда иллюстрируют ограничения, на-
кладываемые на значения углов А—X—А в октаэдрах, выде-
ленных на рис. 5.3, так как в этой структуре октаэдры МОб
6.6. Структурный тип ЯеОз и родственные структуры 319
сочтенены между собой по вершинам, ребрам и одной из гра-
ней [J. Solid Slate Chem., 1973, 6, 469].
Октаэдры соединены между собой
гранью .ребрами
Углы в структуре а-А12О3 85° 94° (два) 120° и 132° (два)
«Идеальные» значения углов для 70,5° 90° (два) 132—180° (три)
правильных октаэдров (разд.
5.1.1)
Поскольку приведенные значения соответствуют углам между
связями, сходящимися на атоме кислорода, они указывают так-
же и на значительные отклонения от правильной тетраэдриче-
ской координации этого атома.
Хотя тринитриды MN3 переходных металлов пока не найде-
ны, аналогичные соединения более тяжелых элементов груп-
пы VB хорошо известны. К ним относятся:
СоР3 №Р3
RhP., PdP,
CoSb3
RhSb,
IrSb,
CoAs3
RhAs3
IrAs3
Все они кристаллизуются в структуре скуттерудита (по назва-
нию минерала CoAs3). Особый интерес к этой структуре обу-
словлен наличием в ней дискретных группировок As4.
Взаимосвязь между структурой скуттерудита и структурой
типа ReO3 достаточно проста. Неметаллические атомы, распо-
ложенные в структуре ReO3-Tnna на четырех параллельных
ребрах элементарной ячейки, здесь смещены внутрь ячейки
и образуют квадратную группировку, как показано для двух
смежных ячеек на рис. 6.20, а. Учитывая направления смеще-
ния различных наборов атомов X, легко установить, что
'Д часть исходных ячеек типа ReO3 не будет содержать груп-
пировок Х4. На рис. 6.20,6 изображена кубическая элементар-
ная ячейка структуры CoAs3, размеры которой по сравнению со
структурой типа ReO3 удвоены во всех направлениях; нижний
октант справа и верхний октант слева вакантны (элементарная
ячейка содержит 8 атомов Со и 24 атома As, последние состав-
ляют 6 группировок As4). Каждый атом As расположен внутри
почти правильного тетраэдра из ближайших 2Co+2As,.
а атом Со — в слегка искаженном октаэдре из шести соседних
атомов As. Плоские группировки As4 не образуют правильный
квадрат: длины сторон прямоугольника составляют 2,46 и
2,57 A [Acta cryst., 1971, В27, 2288]. Причина значительной ре-
320 6. Некоторые простые ЛХ„
ориентации октаэдров, превращающей структуру типа ReO3 в
структуру типа CoAs3, заключается в том, что это позволяет
каждому атому As образовать две связи As—As такой же дли-
ны, что и в молекуле As4. Если бы CoAs3 имел структуру типа
ReO3 (с тем же межатомным расстоянием Со—As 2,33 А), каж-
дый атом As должен был бы быть окружен восемью соседними
атомами As, удаленными на расстояние ~3,3 А (наличие от-
носительно небольших искажений идеально квадратной груп-
пировки As4 и идеально правильных октаэдров обусловлено
6.7. Структуры с аналогичными аналитическими описаниями
321
Рис. 6.20. Структура скуттерудита CoAs3. а — взаимосвязь со структурой ReO3;
б — элементарная ячейка. На рис. б нанесено только такое число линий для
связей Со—As, которое достаточно для изображения квадратной группировки
атомов As в шести из восьми октантов кубической элементарной ячейки. Пол-
ная шестерная координация показана только для атома Со, находящегося в
центре ячейки.
тем, что в высокосимметричной кубической структуре CoAs3
геометрически невозможно удовлетворить оба эти требования
одновременно. Поэтому существующая структура представляет
взаимный «компромисс»). В фосфидах, имеющих такую же
структуру, различия в длинах связей Р—Р еще меньше (напри-
мер, 2,33 и 2,31 А), причем более короткая из этих связей со-
ответствует нормальной одинарной связи Р—Р [Arkiv Kem.,
1968, 30, 103].
Выше отмечалось, что структура типа перовскита выводится
из структуры типа ReO3 заполнением больших кубооктаэдри-
ческих пустот, которых на каждый октаэдр ReO3 приходится
по одной. В CoAs3 эти пустоты A на каждые 4 атома Со или
2 на ячейку, содержащую 8 атомов Со; рис. 6.20,6) становятся
икосаэдрическими. «Заполненная» структура CoAs3 поэтому
описывается формулой АВ4Х12. Такое строение имеют соедине-
ния LnFe4Pi2, где Ln — это La, Се, Рг или Nd [Acta cryst.,
1977, ВЗЗ, 3401].
Наличие в соединениях (например, СоР3) циклических груп-
пировок Р4 наводит на мысль, что было бы интересно попы-
таться приложить к ним формулы такого же вида, которые бы-
ш использованы в гл. 1 для FeS2, PdS2 и PdP2. Там было по-
казано, что группировки S2, связанные с шестью атомами ме-
талла в структуре пирита, могут рассматриваться как источник
десяти электронов, так что атом железа в FeS2 приобретает
электронную конфигурацию Кг. Каждому атому Р в цикличе-
ской группировке Р4 необходим дополнительный электрон; он
может быть приобретен либо как ионный заряд (схема а), ли-
бо путем образования нормальной ковалентной связи (схе-
ма б). Поэтому следует записывать формулу СоР3 или как
е-1
-Р:
• в
\
а б
(Со3~L(Р44^K, или как ковалентное соединение Со4(Р4K. В по-
следнем случае каждый атом металла должен был бы приобре-
сти в общее пользование 9 электронов, поскольку каждая груп-
пировка Р4 предоставляет 12 электронов. Атом Со в СоР3 дол-
жен был бы поэтому принять электронную конфигурацию Кг
подобно Fe в FeS2. Подобно тому как у CoS2 со структурой ти-
па пирита имеется один избыточный электрон на атом метал-
ла, то же должно было бы быть справедливо для Ni в NiP3 и
обусловливать металлическую проводимость и парамагнетизм
типа Паули в последнем соединении.
6.7. Структуры с аналогичными аналитическими описаниями
Этот раздел касается некоторых вопросов, трактовка которых
иногда встречает затруднения в кристаллографической литера-
туре. Речь идет о том, что одно и то же аналитическое описа-
ние часто используют по отношению к кристаллическим струк-
турам с совершенно различными геометрией и топологией. На-
глядным примером служит структура, описываемая ромбоэдри-
ческой элементарной ячейкой с атомами М в позиции @00)
и атомами X —в Gг '/2 Уг). Так описываются структуры типа
CsCl (8-координация М и X), если « = 90°, и типа NaCl F-ко-
ординация М и X), если а = 60°. Такое разночтение появляется,
если имеется (по меньшей мере) один переменный параметр,
который может влиять либо на форму элементарной ячейки
(например, на величину угла а в ромбоэдрической ячейке, на
отношение осей гексагональной или тетрагональной ячейки),
либо на позицию атома в элементарной ячейке. Ниже приве-
дены соответствующие примеры.
21—752
322 6. Некоторые простые АХп
6.7.1. Структуры РЬО и PHJ. Множество соединений MX име-
ют тетрагональные структуры, в которых два атома одного сор-
та занимают позиции @00) и (V2 7г 0), а два атома другого'
сорта — позиции ('/г 0 и) и @ '/г п). Характеристики структуры
зависят от значений двух переменных параметров, и и отношения
осей с : а. При с : а = ']/2 и u=1U атомы в позициях A/20и)
и (О'/г") кубически плотно упакованы, при этом заселенные
6.7. Структуры с аналогичными аналитическими описаниями
323
Рис. 6.21. Структуры РЬО (а) и PHJ (б).
атомные позиции @00) и ('/г 7г 0) соответствуют тетраэдриче-
ским пустотам. При с:а=\ и u=xU упаковка первых из ука-
занных атомов становится объемноцентрированной. Структуры
РЬО и LiOH занимают промежуточное положение между этими
двумя предельными случаями. Это слоистые структуры с кон-
тактами только типа РЬ—РЬ (ОН—ОН) между слоями
(рис. 6.21,а). Если с : а = "[/2/2 и м=7г, структура превращается
в структуру типа CsCl, в которой каждый ион одного сорта
окружен восемью ионами другого сорта по вершинам куба.
Структура PHJ (рис. 6.21,6) близка к структуре типа CsCl.
Таблица 6.6. Соединения со структурами РЬО и РН41 (В 10)
РЬО
LiOH
InBi
N(CH3LC1, Br, I
PH4I
Идеальная струк-
тура CsCl
NH4SH
с : а
1,414
1,26
1,22
1,00
0,95
0,71—0,72
0,73
0,707
0,667
U
0,25
0,24
0,20
0,25
0,38
0,37—0,39
0,40
0,50
0,34
@00),
О
Li
In
N
P
N
Атомы в позициях
(т то)
'т°.«),(
РЬ
он
Bi
Cl, Br, I
I
SH
°т «)
-Текоторые соединения с такими структурами сведены в табл.
5 6 За исключением InBi (c:a = 0,95), они подразделены на
овё группы с величинами с : а, близкими к 1,25 и 0,70.
J.7.2. Структуры LiNiO2, NaHF2 и CsICl2. В каждой из этих
грех ромбоэдрических структур атомы М заселяют позиции
@00), атомы X— ('/г 7г 7г) и 2 атома Y — позиции ± (и и и),
расположенные вдоль пространственной диагонали ячейки. Ес-
ли u=lU n а=33°34', это соответствует атомным позициям, изо-
браженным на рис. 6.3,6; в структуре NaCl половина атомов
Na замещена на М, остальные — на X, а ионы С1 замещены
на Y. Этот структурный тип характерен для многочисленных
комплексных оксидов МХО2 и сульфидов MXS2, которые явля-
ются сверхструктурами на основе структуры NaCl (группа «а»
в табл. 6.7). Однако такое же аналитическое описание прило-
жимо к двум другим совершенно разным структурам, NaHF2
и CsICl2 (группы «б» и «в» в табл. 6.7). У всех соединений со
Таблица 6.7. Данные о структурных
параметрах некоторых соединений MXY2
Соединение
a) FeNaO2
NiLiO2
Cr\aS2
CrNaSe^
6) CrCuO2 )
FeCuOi J
NaHF2 1
NaN3
CaCN2 J
в) CsICl2
a
~30°
~30°
~40c
j 70'
~0,25
~0,40
0,31
структурой типа NaHF2 углы а лежат в интервале 30—40 ,
а hW0,40 (или 0,10 в случае обмена местами атомов М и А),
в то время как в структуре CsICl2 a=70°, и = 0,31.
Если спроецировать эти структуры вдоль тригональнои оси
ромбоэдра, как показано стрелкой на рис. 6 22 а все атомы
проецируются на точки типа А, В и С (рис. 6.22, б) - позиции
плотнейшей упаковки. Последовательность слоев зависит от
параметра и, дискретные группировки XY2 образуются только
в том случае если расположенные в смежных слоях атомы X
и пары ближайших к ним атомов Y оказываются в точках од-
ного типа т е все А, все В или все С. На рис. 6.22, в — d по-
казаны различия в чередовании слоев вдоль вертикальной оси
21'
324 6. Некоторые простые АХп
рис. 6.22, а. На рис. 6.22, в последовательность слоев кислорода
(штриховые линии) соответствует КПУ, все ионы металлов
(Li и Na) расположены между слоями в позициях с октаэд-
рической координацией. На рис. 6.22, г и д можно выделить
линейные ионы HF2~ и 1С12~, но, в то время как в NaHF2 ионы
Na+ окружены шестью ближайшими соседними F~ по верши-
нам искаженного октаэдра, в CsICl2 ионы Cs+ имеют 6 ближай-
ших соседних С1~, расположенных с ним приблизительно в од-
6 7 Cip!JKTUPbl c аналогичными аналитическими описаниями
325
if
8
А&-<
8
CS 1
-i
С1
/ft
Рис. 6.22. Взаимосвязь между структурами LiNiO2, NaHF2 и CsICl2 (см. текст).
На рис. в—д горизонтальные штриховые линии изображают слои атомов кис-
лорода или галогена.
ной плоскости на расстоянии 3,65 А, и еще 2 С1~, несколько
более удаленных C,85 А). Сопоставляя соединения FeCuCb
и NaFeO2, оба имеющие а«30°, легко видеть, что разные зна-
чения и @,39 и 0,25 соответственно) приводят к совершенно
различным последовательностям слоев. В FeCuO2 атом Си
имеет только 2 ближайших соседних атома кислорода, тогда
как в NaFeO2 и для Na, и для Fe устанавливается правильная
октаэдрическая координация.
Основываясь на межатомных расстояниях и физических
свойствах, соединения группы «б» в табл. 6.7 можно, по-види-
мому, подразделить на 2 класса (рис. 6.22,г). Это относится
К многочисленным оксидам с такой структурой, иногда называе-
мой структурой делафоссита по названию минерала CuFeO2:
PtCoO,
CuIFeI"O2
Со
Cr
Al
Ga
AgFeO2
Co
Cr
Al
Ga
AgRhO2
In
Tl
PdCo02
Cr
Rh
Хотя обычно такую структуру имеют оксиды состава WWUO2,
'¦ ней относятся несколько оксидов, содержащих Pd11 или Pt11.
В оттичис от CuFeO2 и AgFeO2 с полупроводниковыми свойст-
вами" чля некоторых оксидов, содержащих Pd или Pt, харак-
терна'металлическая проводимость. Металлическая проводи-
мость сильно анизотропна: в направлении, перпендикулярном
вертикальной оси на рис. 6.22, а (т. е. параллельно слоям ато-
мов Pd пли Pt), она значительно выше и лишь немного усту-
пает проводимости металлической меди. В плоскости металли-
ческих атомов каждый Pd (Pt) окружен шестью компланар-
ными соседними атомами металла на расстоянии 2,83 А, ко-
гочое очень близко к межатомным расстояниям в металле. На-
против, в CuFeO2 расстояние Си—Си равно 3,04 А, тогда как
в металлической меди оно составляет 2,56 А. С учетом этих
контактов металл — металл координацию меди можно принять
равной 6+2 (гексагональная бипирамида). Литературу см. в
разд. 13.2.
6.7.3. Структуры СгВ, желтой модификации 77/ (В 33) и род-
ственных соединений. Все структуры, приведенные в табл. 6.8,
описываются в пространственной группе Cmcm с атомами в по-
зициях 4(с): @,i/, VO, @,i/,3Ы, G2,72+у,74) и G2,72-г/,3/4).
Таблица 6.8. Структуры СгВ, ThPt и ТП (В 33)
PiSi
ThPt
NaOH
TU
\x.
(ромбич.)
a,
9
4
3
3
4
97
59
,90
,40
,57
b.
1
t
10
11
11
12
л
.86
.79
,09
,38
,92
С
2
о
4
3
5
A
,93
,91
,45
,40
,24
у
0,
0,
0,
0,
0
15
14
14
16
11
«X
0,44
0,43
0,41
0,37
0,37
Расстоя
X—2Х
(в цепи)
1 ,74
2,47
2,99
3,49
4,32
о
пия, А
Л—X
ШУЮ)
2,19
3,11
2,99
2,30
3,36
а Более полный список см. в [Ada cryst., 1965. 19, 214], включающий ранние дан-
ные по NaOH и КОП. .
Их не следует описывать как одну и ту же структуру, посколь-
ку имеются 4 переменных параметра B отношения осей, ух
и ух), и природа координационных группировок вокруг атомов
X в разных кристаллах совершенно различна. В СгВ атом в
расположен внутри тригональной призмы из шести атомов U",
22—752
326 6. Некоторые простые АХп
кроме того, около него находятся еще 2 соседних атома В на
расстояниях, отчетливо свидетельствующих о наличии связей
В—В. В СгВ и CaSi цепочки —В—В— и —Si—Si— представ-
ляют собой основные элементы структуры. В ThPt и в много-
численных изоструктурных интерметаллических фазах разли-
чие между расстояниями X—X и А—X сглаживается: ближай-
шие соседи атома Pt в ThPt расположены на расстояниях
2,99 А B Pt и 1 Th), 3,01 А D Th), 3,21 А B Th) и т. д. В жел-
той модификации ТП присутствуют цепочки I—I (длина кова-
лентной связи I—I равна 2,76 А). Ее структура описывается в
терминах E+2)-координации таллия иодом и пода таллием.
В ромбическом NaOH со структурой типа ТП кратчайшие меж-
слоевые расстояния ОН—ОН C,49 А) и позиции атомов Н
исключают возможность связывания между ионами ОН (в дан-
ном случае — водородной связью). Относительные величины
расстояний X—X и А—X, приведенные в двух последних колон-
ках табл. 6.8, показывают, что одно и то же аналитическое опи-
сание справедливо для трех совершенно различных структур.
6.8. Структура РЬСЬ
Мы обращаем внимание на эту структуру не только для того,
чтобы подчеркнуть, как мало структурной информации содер-
жится в ее аналитическом описании, но и для того, чтобы по-
казать, что один и тот же структурный тип может встречаться
в соединениях с совершенно различными химическими связя-
ми (эта сторона дела уже обсуждалась в связи с рассмотрени-
ем структуры NaCl). Ромбическая элементарная ячейка струк-
туры РЬС12 содержит 3 группировки из четырех атомов, все они
располагаются в 4-кратных позициях (х, 'Д, z) и т. д. (прост-
Класс
А
В
С
D
Таблица 6.9.
а : с
от 0,90
до 0,80
0,75
0,74, 0,66
0,55
Соединения
(a + c)Jb
от 4,0
до 3,3
4,3
3,1; 3,3
5,3
со структурой типа РЬС12а
Примеры
ВаХ2, PbX2, Pb(OH)Cl, EuCI2, SmCl2,
СаН2 и др., YbH,
Mg2Pb, ThS,, US2, Co2P
Тройные силициды, фосфиды и др.
TiP2, Zr.<\s2
Rh2Si, Pd,Al
Re2P
1 Другие примеры и литературные источники
[Acta cryst., 1968, В24, 930].
6.5. Структура PbCh 327
нияя группа Рпта). Поэтому имеется 8 переменных:
^отношения осей, 3 параметра х и 3 параметра г. Известна
1 " 100 соединений АХ2 или AXY, кристаллизующихся по ти-
РЬС12 Их можно разделить на 4 группы с различными зна-
чениями отношения осей (табл. 6.9).
Ботьшинство соединений попадает в класс А, включающий
сочеобразные дигалогениды и дигидриды, а также некоторые
# РЬ на уровне b/4
О РЬ на уровне 3Ь/4
QC! на у род не Ь/4
(J) C1 на уровне ЪЬ/4
Рис. 6.23. Проекция кристаллической структуры РЬС12 на плоскость @10).
Атомы на уровнях Ь/4 и 3&/4 над плоскостью рисунка изображены соответст-
венно жирными и тонкими кружками. Штриховыми линиями показаны связи
РЬ2+ с его более удаленными соседями.
сульфиды, фосфиды, силициды, бориды и интерметаллические
соединения Mg2Pb и Са2РЬ. В таблице приведены также при-
меры соединений из меньших по численности классов В и С и
единственный представитель класса D.
Хотя, возможно, эта структура имеет координацию 9: ъ (ко-
ординационный полиэдр большого по размеру иона РЬ2" —
трехшапочная тригональная призма), девять окружающих М
атомов X никогда не находятся от него на равных расстояниях.
Например, в PbF2 и РЬС12 координационный полиэдр катиона
состоит из 7 ближайших и двух более удаленных соседних.
анионов, причем в обеих структурах отмечается заметный раз-
брос в межатомных расстояниях:
PbF2: 7F на расстоянии 2,41—2,69А (среднее 2.55А); 2F — З.ОЗА
РЬС12: 7С1 на расстоянии 2,80—3,09А (среднее 2.98А); 2С1 — 3,70А,
22'
328 6. Некоторые простые АХп
Два более удаленных соседа располагаются в двух вершинах
тригональной призмы, как показано на рис. 6.23. Такая G-J-2)-
координация характерна также для структур ВаС12, ВаВг2 и
Ва12, но в смешанных галогенидах РЬХ'Х" расстояния А—X не
укладываются в рамки полиэдров G+2) (например, в PbBrI
имеется только одна связь значительно большей длины, чем
остальные). Для многочисленных тройных фаз со структурой
шпа «антп-РЬС12» (например, TiNiSi, MoCoB, TiNiP и т. д.)
также можно выявить координацию \ '¦ 9; реальное число со-
седних атомов, расположенных в узком интервале длин связей,
здесь больше, что является характерной особенностью интер-
металлических соединений. К примеру, в структуре МоСоВ
число ближайших соседей каждого из атомов, находящихся на
расстояниях до 1,15 (гд+^в) (где гА и гв — радиусы для коор-
динации 12, см. разд. 29.2), следующее:
Мо
Со
В
5
4
4
6
5
Со
6
2
4
Общее число
ближайших
соседей
15
12
9
6.9. Структуры PdS2, AgF2 и p-HgO2 и их связь
со структурой типа пирита
Структуры соединений АХ2 с октаэдрической координацией
атома А интересны в связи с «теоремой», сформулированной в
разд. 5.1.1: если три правильных октаэдра АХ6 имеют одну об-
щую вершину, то для того, чтобы сохранить приемлемые рас-
стояния между атомами X различных полиэдров АХ6, эти окта-
эдры должны иметь по меньшей мере одно общее ребро (или
грань). Известно, правда, что в ОСг3(ООССН3)б-ЗН2О три ок-
таэдра обобщают одну вершину. Это возможно только потому,
что определенные пары атомов кислорода различных октаэдров
принадлежат к мостиковым ацетатным группировкам, в кото-
рых расстояние О—О B,24 А) намного короче, чем обычные
.вандерваальсовы расстояния. Однако анализ геометрии трех-
мерной структуры, в которой 3 октаэдра АХ6 объединяются на
каждой вершине без связывания по ребрам, заслуживает все
же внимания.
Рассмотрим изогнутый слой, построенный из квадратных
плоских координационных группировок АХ4 (рис. 6.24, о). Та-
жим способом изображается слой структуры PdS2. Если слои а
6.9. Стр.
иктиры PdSb AgF2 и fi-HgO2 и их сзязь со структ. типа пирита 329
(транслированные) слои б па рис. 6.24 чередуются в направ-
лении перпендикулярном к плоскости рисунка, то с помощью
томов Е и F слоев б, расположенных выше и ниже слоя а на
расстоянии с/2, вокруг атома металла может быть укомплекто-
ван октаэдр ABCDEF. В образующейся трехмерной структуре
OF • Ag
Рис. 6.24. а и б — последовательные слои структуры PdS?; в — слой структуры
AgF2.
каждый атом X служит общей вершиной для трех октаэдров,,
которые не соединены по ребрам. Структура, построенная из
правильных октаэдров с сохранением нормальных вандервааль-
совых расстояний между атомами X различных полиэдров, по
приведенным выше причинам не реализуется, но ее искаженные
варианты проявляются в структурах PdS2, AgF2 и |3-HgO2.
Геометрические затруднения здесь преодолеваются либо одним
из двух, либо сразу обоими способами, а именно: 1) искажени-
ем координационных полиэдров АХ6 или 2) образованием не-
посредственных связей между парами атомов X (таких, как Е
и F) в каждом «слое». В AgF2 наблюдаются умеренные иска-
жения анионных октаэдров (Ag—4F 2,07 А и Ag—2 F 2,58 А)
и нормальные расстояния F—F между атомами различных ко-
330 6. Некоторые простые АХп
ординационных полиэдров (самые короткие расстояния F—F
2,61 А) —случай 1. На рис. 6.24, в показан один «слой» струк-
туры AgF2. В PdS2 атомы S связаны попарно (расстояние S—S
2,13 А), и октаэдры PdS6 вытянуты настолько, что структура
превращается в слоистую (Pd—4S 2,30 A; Pd—2S 3,28 А).
В C-HgO2 атомы кислорода соединены попарно (О—О 1,5 А),
но здесь октаэдры сжаты (Hg—20 2,06 A; Hg—40 2,67 А), так
что вместо слоистой структуры образуются цепочки —Hg—О—
•—О—Hg— в направлении оси с (перпендикулярно к плоскости
слоев на рис. 6.24). В этих структурах, следовательно, прояв-
ляются оба фактора, 1 и 2. Таким образом, эти три тесно свя-
занные структуры все выводятся из гипотетической структуры
АХ2, построенной из правильных октаэдров, которая в своей
«идеальной» форме не реализуется. Все они относятся к одной
и той же пространственной группе (РЬса) с заселением одних
и тех же позиций: @00) и т. д. для атомов М и (xyz) и т. д.
.для атомов X. Они имеют сравнительно близкие параметры
атомов X, но весьма отличаются по величине периода с элемен-
тарных ячеек (табл. 6.10).
PdS2
•AgF2
,3-HgO2
5
b
6
Таблица 6.10
a
,46 A
,07
,08
5
5
6
b
54 A
53
01
7
5
4
Структуры PdS
с
,53 A
,81
,80
0
0
0
X
11
18
08
0
0
0
2, AgF2
у
,11
,19
,06
0,
0,
0,
и p
43
37
40
-HgO2
Литератур
Acta cryst.,
10, 329
J. Phys. Chem
lids., 1971,
543
Arkiv Kcm.,
13, 515
i
1957
. So-
32,
1959,
Мы рассмотрели эти структуры как примеры структур с оди-
наковыми аналитическими описаниями. Выше отмечалось, что
структуру PdS2 можно описать как структуру типа пирита,
удлиненную в одном направлении до превращения ее в слои-
стую. В свою очередь структуру пирита можно представить как
трехмерный каркас октаэдров FeS6, в каждой вершине которых
объединяются по 3 октаэдра. Каждая вершина, кроме того, рас-
положена близко к вершине другого октаэдра, FeS6. Эти близ-
кие контакты соответствуют группировкам S—S и дополняют
координацию атома S до тетраэдрической. Поэтому структура
пирита входит в состав группы структур одинакового топологи-
ческого типа, в основе которых лежат оптимальные решения,
в.10. Взаимосвязи некоторых нитридов и оксосиединений 331
^условленные невозможностью построения трехмерной струк-
°vDbi ^Х2 из правильных октаэдров, соединенных только вер-
шинами, при сохранении нормальных вандерваальсовых рас-
стояний'между атомами X разных полиэдров:
ОктаэОрическис структуры АХ2, в каждой октаэдрической вершине которых
объединяются 3 других октаэдра и в которых октаэдры соединены только
вершинами
Правильные октаэдры и Искаженные октаэдры с Искаженные октаэдры
близкие контакты X—X D+2)-координацией: с B+4)-координацией:
близких контактов X—X близкие контакты X—X
Структура пирита
Структура PdSi
Сильно искаженные ок-
таэдры, образующие
плоскую 4-координацию
и близкие контакты
X—X
Структура AgFz
Структура fi-HgO2
Г). 10. Взаимосвязи между структурами некоторых нитридов
и оксосоединений
Тесная взаимосвязь между структурой, составом и простыми
геометрическими соображениями хорошо иллюстрируется не-
которыми двойными и тройными нитридами. Во многих из них
реализуется тетраэдрическая координация небольших по раз-
меру ионов металлов; в частности, известно, множество трой-
ных нитридов, содержащих тетраэдрически координированные
ионы Li+. Из простой теоремы об объединении в одной точке
не более восьми правильных тетраэдров (разд. 5.1.2) следует,
к примеру, что в Li3N невозможна тетраэдрическая координа-
ция Li"'" атомами N. Это особенно интересно в связи с неожи-
данной (и уникальной) структурой этого соединения и очевид-
ной неустойчивостью нитридов типа M3N у других щелочных
металлов. Из теоремы также вытекает, что максимальное за-
мещение бериллия на литий в Be3N2 ограничивается составом
BeLiN. Например, не может существовать соединение BeLi4N2
с тетраэдрически координированными ионами металла.
Эти соображения воспринимаются проще при записи фор-
мулы нитридов с четырьмя атомами N в молекуле, ибо если все
атомы металла 4-координированы и все атомы азота имеют
одинаковое КЧ, то последнее равно общему числу атомов
металла в формуле. Это число п\ соответствует количеству тет-
раэдров MN4, сочленяющихся на каждом атоме N, и поэтому
332 6. Некоторые простые АХп
оно не может превышать восьми:
3
4
5
6
/
8
Соединение
Ge3N4
AI4N4(A1N)
(Al2Be3N4)
Ca6N4(Ca3N2)
(Be5Li2N4)
Be.Li4NT4 (BeLiN)
Структурный тип
Фенакит (Be2Si04)
Цинковая обманка или
вюртцит
Анти-Мп2О3
AHTH-CaF2
Примеры структур, где в каждой точке объединяются 5 или 7
тетраэдров, по-видимому, не известны, но хорошо изучены
структуры с flt = 3, 4, 6 и 8. Выше упоминалось, что замещение
в BeeN4 бериллия на литий должно ограничиваться составом
Be4Li4N4(BeLiN), поскольку дальнейшее замещение должно
было бы приводить к сочленению на каждом атоме азота более
восьми тетраэдров.
Границы возможного замещения металла М'"+ на тетраэд-
рически координированный Li+ в нитридах можно установить
следующим общим способом. При записи формулы тройных
нитридов в виде (Li^MmKNy мы получим два уравнения:
= у и 3(x
Первое из них соответствует балансу электрических зарядов,
тогда как второе постулирует, что КЧ азота не должно превы-
шать восьми при сохранении тетраэдрической координации
всех атомов металла. Отсюда следует, что х не может стать
больше Bт—3). Поэтому граничные значения отношения
Li : М в тройных нитридах составляют
Li:M 13 5 7 9
Эти величины соответствуют известным соединениям
LiMgN, Li3AlN2, Li5SiN3, Li7VN4 и Li,,CrN5
которые все кристаллизуются по типу антифлюорита. Понятно,
что для замещения более высоко заряженных ионов на ионы
с зарядом ^2 аналогичного предела не существует, поскольку
конечными членами ряда являются бинарные нитриды Ca3N2,
A1N и др. Вышеупомянутые ограничения, в своей основе чи-
сто геометрические, приложимы только к случаям замещения
на Li+ или на другие однозарядные ионы.
6 10. Взаимосвязи некоторых нитридов и оксосоединений 333
Структуры Ge3N4, A1N, Ca3N2 и многочисленных тройных
нитридов со структурой типа антифлюорита характеризуются
общей особенностью —тетраэдрической координацией атомов
металла. КЧ для азота здесь 3, 4, 6 и 8 соответственно. По-ви-
димому,'определяющим фактором в этих структурах является
тин координации ионов металла.
Такую же таблицу, как для нитридов можно составить
и для оксидов, по для последних не существует геометрических
ограничений замещения катионов на Li+ (в предположении
тетраэдрнческой координации последнего), поскольку предель-
ный случай (Li2O) соответствует восьми тетраэдрам LiO4, со-
членяющимся на каждом атоме кислорода. Некоторые соеди-
нения характеризуются интересной особенностью — «неудоб-
ным» числом октаэдров, объединяющихся в одной общей точке-
E в Li4Si04 и 7 в Li6Be04):
3 Be2Si04. LiAlSiO4
4 BeLi2Si04, Li3PO4
5 Li4Si04
Li5A104
Li6Be04
Li2O
Ограничения по составу должны были бы возникать для
оксидов с октаэдрической координацией всех атомов металла,
так как в одной точке могут сочленяться не более шести пра-
вильных октаэдров, хотя их число, конечно, может быть уве-
личено в случае достаточно сильного искажения октаэдров (см.
замечания о структуре Th3P4 в гл. 5). Октаэдрические структу-
ры можно перечислить аналогично тетраэдрическим структу-
рам:
"о
2
3
4
5
6
ReO3
AbRcOr,
Mg:,Re06
Na2Mg2Re06. Mg4TiO6
Xa4MgRe06
Известный или воз-
можный структур-
ный Т1ИП
ReO3
Рутил?
Корунд и т. д.
¦}
NaCl?
При сохранении правильной октаэдрической координации всех
атомов металла структуры с по = 6 (например, Na6Re06) не-
должны были бы существовать вообще, а структура Mg4Ti06
¦334 6. Некоторые простые АХ„
.должна была бы содержать 5-координированный атом кислоро-
да E октаэдров, объединяющихся в одной точке).
Таблииа 6.11. Структуры с тетраэдрической и октаэдрнческой
координацией
Тетраэдрические структуры
АХ2
А3Х4
АХ
А3Х2
А2Х
Структуры SiO2
Ge3N4 (фенакит)
Структуры ZnS
Анти-М2О3
AnTH-CaF2
Октаэдрические структуры
ЛХз
АХ2
А2Х3
АХ
Л4Х3
ReO3
Рутил
Корунд
NaCl
См. разд. 5.1.2
Возможно, заслуживает внимания перечень более простых
структур в порядке увеличения числа тетраэдров или октаэд-
ров, объединяющихся на каждом атоме X (табл. 6.11).
6.11. Сверхструктуры и другие родственные структуры
В твердом растворе замещения АА' реализуется статистическое
распределение атомов А и А' по эквивалентным позициям
кристаллической структуры. При соответствующей термообра-
ботке неупорядоченный твердый раствор перестраивается
в структуру, где атомы А и А' занимают один и тот же набор
позиций, но с закономерной периодичностью — в таком случае
структура описывается как сверхструктура. В данной книге
термин «сверхструктура» используется для описания соотно-
шений следующего вида:
АХ *- (АА')Х2 или А,Х3 >• (АА')Х3
безотносительно к тому, образуется ли сверхструктура из не-
упорядоченного твердого раствора и существует ли такой твер-
дый раствор вообще. В сверхструктуре позиции, занимаемые
атомами А и А', становятся, конечно, неэквивалентными. Взаи-
мосвязи между исходной структурой и сверхструктурой
Исходная структура Сверхструктура
Весь набор эквивалентных позиций Тот же самый набор позиций засе-
заселек атомами А лен с закономерной периодичностью
атомами двух или более сортов А и
А'
соответствуют пары структур, связанных следующим образом:
«Нормальная структура» «Вырожденная структура»
Атомы А и А' заселяют различные Оба набора эквивалентных позиций
наборы эквивалентных позиций заселены атомами А
6.11. Сверхструктуры и другие родственные структуры 335
В своей формулировке эта взаимосвязь аналогична взаимосвя-
зи между исходной структурой и сверхструктурой, за исключе-
нием того, что теперь мы имеем дело с соотношением
(АА')Х2—А2Х2 вместо А,Х2—(АА')Х2
Некоторые пары структур, связанных указанным способом,
перечислены в табл. 6.12. В колонку 1 помещены нормальные
структуры, и примеры представлены только такими соединения-
ми," которые изоструктурны с соединениями из колонок 2 или 3.
Существование структур 2 можно было предвидеть, поскольку
ноны одного и того же металла, несущие различные заряды,
Таблица 6.12. Некоторые родственные кристаллические структуры
Различие между разными
наборами эквивалентных
позиций
а) Различные КЧ
б) Одинаковые КЧ, но
различные окружения
ближайшими соседними
атомами
в) Одинаковые КЧ и
практически одинаковая
координация
Различные наборы
1) атомами различ-
ных металлов
GeY3, NiV3
Ba2CaWO6
K2N'aAlF6
Ca3Al2Si3012
Na3KAl4Si4016
CaFe2O4
ZnSb:A
Cd2Mn308
ScTiO3
Fe2Ti05
ULa6Oi3
BFeCoO4
эквивалентных
2) атомами
одного ме-
ных степенях
окисЛ|ени|я
Eu-A
Pb3O4
Мп5О8
Ti3O:,
ГЬ7О12
полиций заселены.
3) атомами одного
металла в одной
ч той же степени
окисления
P-W
Ba3WO6
K3A1F6
Y3A12A13O12
Na4Al4Si4016
C-Mn,O3
3eY2O4
имеют различные размеры и требования связывания друг с дру-
гом и со структурной точки зрения похожи на ионы разных
элементов. Однако структуры из колонки 3 можно описать
и как «вырожденные», поскольку химически неразличимые ато-
мы занимают позиции с различными окружениями. Для хими-
ков в табл. 6.12 особенно интересен постепенный переход от
336 6. Некоторые простые АХп
структур «а» к «в». В соединениях, отнесенных к группе За,
окружение атомов одного и того же элемента в одной и той же
степени окисления существенно различно. В соединениях груп-
пы 36 различие становится меньше, а в соединениях Зв — сов-
сем небольшим. В первом приближении в структурах Зв вооб-
ще не имеется различий между ближайшими окружениями хи-
мически аналогичных атомов, хотя они и заселяют кристалло-
графически неэквивалентные позиции. В BeY2O4 оба набора
неэквивалентных атомов У заселяют позиции с 6-координацией
в октаэдрическом каркасе, который построен из четырехчлен-
ных лент, состоящих из рутилоподобных цепочек (разд. 13.5.4).
Любая такая лента, состоящая из трех или более единичных
цепочек, содержит (топологически или кристаллографически)
неэквивалентные октаэдры:
лг
В пределе переход по группам а—*б—»-в в табл. 6.12 должен
был бы приводить к одинаковым окружениям для всех атомов
данного химического индивида, т. е. атом каждого сорта дол-
жен был бы заселять свой собственный набор эквивалентных
позиций. Структура из колонки 1 поэтому должна была бы
быть сверхструктурой по отношению к структуре из колонки 3.
Поскольку любые из перечисленных в колонке 1 реальных
структур принадлежат к «нормальным» структурам, в принци-
пе возможны производные от них сверхструктуры и неупорядо-
ченные твердые растворы. Приведенные ниже схемы для окси-
дов, принадлежащих к структурным типам B(FeCo)O4
и (BeY2O4), поясняют взаимосвязи между обсуждаемыми
структурами:
Сверхструктура
fl]
N. I Og
т7
, Исходная структура "
Fe11
М1
..IV
„ Вырожденная
структура "
04
м1
Fe.Mg
Ti
п Неупорядоченный
U/1 твердый раствор
Символы атомов металла, расположенные на разных линиях,
обозначают наборы атомов в различных эквивалентных пози-
циях. Приведенные здесь примеры, за исключением MY2O4,
чисто гипотетические. Было бы интересно изучить распределе-
ние ионов различных металлов в B2Mg3Ti08 и родственных ми-
нералах, образующих серию близких соединений, содержащих
В111 вместо Мп.
7. ХИМИЧЕСКИЕ СВЯЗИ
В МОЛЕКУЛАХ
И КРИСТАЛЛАХ
7.1. Введение
При обсуждении понятия химической связи для химиков при-
вычно ограничиваться связями в конечных по размерам моле-
кулах и ионах, а для кристаллографов и тех, кто изучает хи-
мию твердого состояния, — рассматривать прежде всего связи
в кристаллах. Более того, внимание исследователей, естествен-
но, концентрируется на определенных группах соединений, ко-
торые либо представляют теоретический интерес, либо облада-
ют технологически важными физическими свойствами. В ре-
зультате для изучающего структурную химию становится за-
труднительным составить целостное, общее представление об
этом предмете. Обычная трактовка ионных и ковалентных свя-
зей со ссылками на металлические, вандерваальсовы и другие
взаимодействия приводит к весьма неадекватному описанию
связей во многих обширных группах неорганических соедине-
ний. Поэтому здесь будет предпринята попытка представить
более общий обзор проблемы с целью скорее подчеркнуть слож-
ность предмета, чем использовать сильно упрощенный подход,
игнорирующий многие интересные факты. Понятно, что сбалан-
сированный обзор химических связей в ограниченном объеме
книги представить невозможно, и, кроме того, для этого требу-
ется предварительное знание по крайней мере основных струк-
турных деталей (в идеальном случае) всех конечных группи-
ровок атомов и всех кристаллов. Поэтому правильнее ограни-
чить количество вопросов в надежде, что более детальная ин-
формация, приведенная в последующих главах, даст пищу для
дальнейших размышлений.
При взгляде на периодическую систему очевидна трудность
разработки приемлемых общих правил для объяснения связей
в многочисленных неорганических соединениях. В табл. 7.1
сплошными линиями окаймлены элементы, которые образуют
ионы, устойчивые в водных растворах. В крайнем правом ряду
анионов расположены только ионы галогенидов; О2~, соединяясь
с Н2О. образует B)ОН~, а Н+, соединяясь с Н2О, образует
Н3О~. Однако О2~ как анион существует в многочисленных
кристаллических оксидах, S2~, N3" (и, возможно, также Р3~) —
в соответствующих соединениях наиболее электроположитель-
ных металлов. Далее следует несколько элементов, которые не
338 7. Химические связи в молекулах и кристаллах
образуют ни катионов, ни анионов (В, С, Si: однако отметим
образование конечного иона С22~ во многих карбидах и беско-
нечного двумерного аниона Sin"^ в CaSi2). Для удобства в эту
группу включены и соседние по периодической системе элемен-
ты Ge, Sn(IV), As и Sb. Связь Si—О обычно рассматривают
как промежуточную между ковалентной и ионной; Ge следова-
ло бы объединить с Si ввиду чрезвычайно похожей кристалло-
химии этих двух элементов, хотя связи Ge—О, вероятно, бли-
же к ионным, чем к ковалентным.
К металлам, образующим катионы М"+, относятся наиболее
электроположительные элементы из левой части периодиче-
7.1. Введение 339'
Таблица 7.1.
катионы
+1 +2 +3
аи ион ь!
Li
Na
К
Rb
Cs
Be
Mg
Ca
Sr
Ba
I
Al
Sc
Y
La
V
Nb
Та
Cr
Mo
W
Mn
Tc
Re
Fe
Ru
Os
Co
Rh
Ir
Ni
Pd
Pt
Cu
Ag
Au
Zn
Cd
Hg
В
;Ga
¦In
Til
С
Si
Ge
Sn"
Pb11
\
P
As
; Sb
i Bl
0
s
Se
i Те
-1
H"
F
a
Br
Ti
Zr
Hf
ской системы и группа Зс?-металлов в их низких степенях окис-
ления (обычно 2 и 3) вместе с некоторыми из металлов преды-
дущих подгрупп Б, Т1A) и РЬ(И). Отметим, что РЬ4+ известен
только в кристаллических оксидах и оксосоединениях. В цент-
ральной части периодической системы снизу расположена груп-
па металлов, ионы которых не играют существенной роли в хи-
мии растворов, а тенденция к образованию ионов в кристалли-
ческом состоянии, по-видимому, невелика, хотя все же в неко-
торых оксо- и фторосоединениях их связи могут иметь ощути-
мо ионный характер (например, в таких диоксидах, как МоО2,
и в таких низших фторидах, как MoF3, и т. д.).
Для металлов IVA группы значение ионов в химии водных
растворов также невелико, но эти металлы образуют ионы
в кристаллических оксосоединениях. Висмут можно, вероятно,
объединить с Ti, Zr и Hf. Он весьма склонен к образованию
гидроксокомплексов, но в таких солях, как Bi(NO3K-5H2O,
М3п[ВЦШз)б]2-24Н2О и Bi2(S04b, возможно, содержатся
ионы Bi3+. Кажется разумным присоединить к этой группе
Ga (III), In (III), TI (III) и Sn(II). Сложная структурная химия
этих элементов обсуждается в гл. 26.
Связи в соединениях одного неметалла с другим можно
рассматривать как существенно ковалентные. С другой сторо-
ны, вследствие ограниченного числа реально существующих
анионов (см. табл. 7.1) очевидно, что к преимущественно ион-
ным бинарным соединениям можно отнести только многочис-
ленные соединения металлов с кислородом или фтором, суль-
фиды и т. п. наиболее электроположительных элементов
групп IA, ПА и IIIА, остальные моногалогениды этих метал-
лов, а также серебра и таллия, галогениды МХ2 или МХ3 дру-
гих металлов, обведенных сплошными линиями в табл. 7.1.
Очевидно, что вне этого перечня остаются большие группы со-
единений (среди них даже бинарные), которые также должны
быть учтены в любом достаточно детальном обзоре химических
связей в неорганических соединениях. Следует признать, что
удовлетворительное и общепринятое описание связей для мно-
гих из этих групп не разработано. В соединениях этих метал-
лов с более электроотрицательными неметаллами связи имеют,
вероятно, промежуточный характер между ионными н кова-
лентными, но при переходе к элементам подгрупп Б более вы-
раженные металлические свойства «полуметаллов» свидетель-
ствуют о наличии в их соединениях связей, по характеру про-
межуточных между ковалентной и металлической. Возникают
значительные проблемы при описании связей даже в структу-
рах самих свободных элементов этих подгрупп.
В группе IVB происходит переход от преимущественно ко-
валентной 4-координированнон структуры алмаза, Si, Ge и се-
рого Sn(IV) к структуре белого олова Sn(II) и далее к РЬ
с плотноупакованной структурой, характерной для многих ме-
таллов. V группа начинается с нормальной молекулярной струк-
туры N2 и белого Р(Р4), но фосфор, помимо этого, кристалли-
зуется в глубоко окрашенных черной и красной модификациях,
имеющих слоистые структуры, в которых Р 3-координирован
(структура красного фосфора единственная в своем роде и не-
объяснимо сложная). За ними следуют As, Sb и Bi со струк-
турами, которые можно представить либо как простые куби-
ческие структуры, искаженные с образованием C+3)-коорди-
нации, либо как слоистые структуры, в которых происходит
последовательное уменьшение различия между двумя наборами
ближайших соседних атомов по мере усиления металлического
характера элементов:
Рас
As
Sb
Bi
стояние до
из двух
трех
ближайших
наборов соседей,
2,
2,
3,
,51
91
10
соседей
А
3
3
3
,15
,36
,47
340 7. Химические связи в молекулах и кристаллах
7.1. Введение 341
В VI группе кристаллический кислород существует в виде мо-
лекул О2, и сера также образует нормальные молекулярные
кристаллы, содержащие молекулы S6 или другие циклические
молекулы Sn. Однако сера образует также и волокнистую мо-
дификацию, построенную из цепочек уникальной конфигурации,
совершенно отличающейся от конфигурации цепочек в Se (ме-
таллическая модификация) и Те. Селен в отношении полимор-
Таблица 7.2. Межатомные расстояния (А)
в кристаллических S, Se и Те
Sg (ромбическая)
Se8(P)
Se (металличес-
кий)
Те
Внутримоле-
кулярное
2,04
2,34
2,37
2,84
Кратчайшее
межмолеку-
3,37
3,35
3,44
3,50
Вандерва-
альсово (по
Полипгу, т. и.
2Г..-2 Ь Т. Д.)
3,6
) 39
J '
4,4
Межатомные расстояния (А) в кристаллических галогенах
С!2
Внутримоле-
кулярное
1,98
2,27
2,72
Межмолекулярное
в слое
3,32
3,31
3,50
между
слоями
3,74
3,99
4,27
2'х-
3,6
3,9
4,3
физма занимает промежуточное положение между S и Те. Его
три красные модификации, все построенные из молекул Se8,
структурно аналогичны молекулам S8, и еще одна, «металличе-
ская» модификация содержит спиральные цепочки. Единствен-
ная модификация Те изоструктурна с металлическим Se. Во
всех этих кристаллических структурах S, Se и Те образуют, как
и ожидалось, по 2 связи. Однако анализ межатомных расстоя-
ний (табл. 7.2) показывает, что только ромбическую серу мож-
но адекватно описать как состоящую из молекул Ss, удержи-
ваемых вместе вандерваальсовыми связями; в случаях же Se
и Те такая трактовка была бы чрезмерно упрощенной. Напри-
мер, в fl-Se контакты между атомами различных молекул Se8
характеризуются такими же межатомными расстояниями, как
и кратчайшие межмолекулярные расстояния в ромбической се-
ре. Аналогично кратчайшие расстояния между атомами различ-
ных цепей в Те лишь немного больше соответствующих рас-
стояний в металлическом селене. Нечто похожее происходит
и в VII группе. В кристаллических С12, Вг2 и 12 молекулы рас-
положены слоями, причем кратчайшие межмолекулярные рас-
стояния внутри слоев заметно короче, чем расстояния между
слоями (табл. 7.2). Последние близки к ожидаемым вапдер-
ваальсовым расстояниям.
Данные табл. 7.2 ясно показывают, что даже для кристал-
лов некоторых элементов невозможно дать простое описание
химических связей. Становится очевидным, что характер свя-
зей следует считать промежуточным между четырьмя «пре-
дельными» типами. Среди них в неорганической химии наибо-
лее важны связи, промежуточные между ионными и ковалент-
ными.
Дальнейшее усложнение заключается в присутствии в одном
и том же кристалле или, что еще менее привычно, в одной
и той же молекуле связей более чем одного типа. Это неиз-
бежно в любых кристаллах, содержащих комплексные ионы.
Например, в NaNO3 связи между Na+ и атомами О из ионов-
NO3^ по своему характеру совершенно отличны от связей N—О'
в ионе Ш3-. В некоторых кристаллах можно различить связи
трех или четырех различных «сортов». Такое усложнение воз-
никает также и в гораздо более простых кристаллах; например,
в RuO2 электронное взаимодействие атомов Ru приводит к ме-
таллической проводимости в дополнение к связям металл —
кислород, хотя в таком кристалле, как TiO2, имеющем очень
сходную структуру, можно выделить связи только одного ти-
па—связи металл — кислород. Во многих других случаях
один (или несколько) валентных электронов отличаются по
своему поведению от остальных; для удобства мы будем это
отмечать, применяя формулы типа Cs3O2~ (е) или Th4+I2~ (eJ.
Первое широкое подразделение типов связывания, приве-
денных в табл. 7.3, можно провести на основе того, происходит
или нет обобществление электронов между атомами. В систе-
мах без ощутимого перекрывания электронной плотности реа-
лизуются следующие взаимодействия: ион — ион, ион — диполь,
Диполь — диполь, ион — наведенный диполь, диполь — наве-
денный диполь, наведенный диполь — наведенный диполь
(вандерваальсовы связи). В системах, в которых электроны
обобществлены между атомами, образуются ковалентные свя-
зи с различными степенями делокализации отдельных или всех
связывающих электронов, что в пределе приводит к металли-
ческой связи. Последняя определяет электронные свойства ме-
таллов и интерметаллических соединений. Эти свойства лишь
до известной степени характеризуют металлическое состояние.
342 7. Химические связи в молекулах и кристаллах
С одной стороны, следует подчеркнуть, что металлическая про-
водимость не является свойством одних только металлов; она
проявляется и в структурах, где взаимодействие металл — ме-
талл не является самым сильным типом связи (SmO, RuO2,
ReO3), и даже в соединениях, вообще не содержащих атомов
металла (графит, (SN*)). С другой стороны, и ковалентные
Таблица 7.3. Типы связей
Нет перекрывания
электронных обла-
ков
Перекрывание элект-
ронных облаков
Усиливающаяся дело-
кализация некото-
рых или всех ва-
лентных электронов
Валентные электроны
локализованы на от-
дельных атомах
Обобществленные элект-
роны локализованы на
отдельных связях
Частичная делокализа-
ция некоторых валент-
ных электронов
Сопряженные системы
(—С = С—С = С-ит.д.)
«резонансные» системы
(СОз2-, С6Н6, P3N3X6)
металлические класте-
ры конечного размера
кристаллические полу-
металлы
твердые тела с «из-
бытком электронов»
Полная делокализация
определенной части ва-
лентных электронов
Вандерваальсова связь
связи с переносом за-
ряда
водородные связи
Ионная связь
связи между поляри-
зованными ионами
ионно-ковалентные
связи
Ковалентная связь
Локализованные и дело-
кализованные связи в
одной и той же систе-
ме
Металлическая связь
связи могут быть образованы атомами самых различных эле-
ментов — от неметаллов до типичных металлов. По-видимому,
нет достаточных оснований рассматривать связи между атома-
ми металла во многих молекулах (разд. 7.5) как отличающиеся
в каких-либо существенных моментах от прочих ковалентных
связей. В частности, как показал Полинг, обсуждение опреде-
ленных особенностей структур металлов вполне возможно на
основе теории валентных связей (см. гл. 29). Существует класс
электронно-дефицитных молекул и кристаллов; их особен-
ностью, так же как и металлов, является наличие у атомов
большего числа доступных орбиталей, чем электронов. Может
оказаться полезным обособление и электронно-избыточных си-
стем, в которых имеется больше валентных электронов, чем
7.2. Длины ковалентных связей
343
необходимо для построения основных связей. Этим общим тер-
мином можно описать множество групп весьма различных со-
единений, например «субсоединения» Cs3O, Ca2N и Thl2, ионы
и молекулы с «инертными парами» электронов (разд. 7.3), со-
единения переходных металлов, такие, как расположенные
справа от вертикальных линий на схеме:
WO3
ReO3
FeS,
CoS2
CoP,
NiS2
NiP3
В таких соединениях могут осуществляться локальные взаи-
модействия между небольшим числом атомов металла (как
в МоОг, Nbl4) или делокализация ограниченного числа элект-
ронов, приводящая к металлической проводимости. Используе-
мый в последующей части книги термин «связь -т — т» охваты-
вает все те различные виды взаимодействий между атомами
металла, которыми характеризуются примеры, перечисленные
на схеме 7.1 (разд. 7.5.1).
7.2. Длины ковалентных связей
С самого начала развития структурной химии значительный
интерес привлекало обсуждение длин связей в терминах радиу-
сов, приписываемых элементам. Стало привычным использовать
три набора радиусов, разных для металлических, ионных и ко-
валентных кристаллов. Расстояния между несвязанными ато-
мами сопоставлялись с суммами «вандерваальсовых радиусов»,
которые принимались близкими к ионным радиусам. Самые
первые «ковалентные радиусы» для неметаллов были приняты
равными половине расстояний М — М в молекулах и кристал-
лах*, в которых атом М образует 8—N связей (где N— номер
группы периодической системы), т. е. они брались из таких мо-
лекул, как F2, НО—ОН, H2N—NH2, P4, S8 и из кристаллов эле-
ментов IV группы со структурой алмаза. Это включает Н
и 16 элементов периодической системы, лежащих в блоке С—
—Sn—F—I. Первоисточник для вычисления ковалентных ра-
диусов металлов был совершенно другим из-за отсутствия дан-
ных для молекул, содержащих связи М—М. «Тетраэдрические
радиусы» были выведены из длин связей М—X в соединениях
MX со структурами типа ZnS, «октаэдрические радиусы» — из
данных для кристаллов со структурами типа пирита и родст-
венных с ним структур в предположении аддитивности радиу-
* Во избежание путаницы подчеркнем, что символом М автор обозначает
любой элемент (чаще всего электроположительный), символом m — только атом
металла. —Прим. перев.
-344 7. Химические связи в молекулах и кристаллах
сов и с использованием системы (8—N) радиусов, принятой
для неметаллов. Как в свое время заметил Полинг, представля-
ется неправдоподобным, чтобы такая связь, как Zn—S, явля-
лась ковалентной в том же смысле, что и связь С—С или S—S;
тем более трудно оправдать последующее использование таких
радиусов для обсуждения ионного характера других связей, об-
разуемых цинком. К тому же непонятно, на каком основании
длину связей S—О в SO42~ (где атом серы образует 4 тетраэд-
рические связи, атом кислорода — одну связь) можно сравни-
вать с суммой радиуса rs (выведенного на основании S8 — се-
ры, в которой атом S образует две связи) и г0 (выведенного
на основании НО—ОН — пероксида водорода, в котором атом
О тоже образует две связи).
Длины гомоядерных связей М—М, как правило, равны или
меньше длины стандартной ординарной связи в молекулах или
кристаллах, упомянутых выше. Исключения составляют: связи
N—N в N2O3 A,86 А) ив N2O4 (по результатам двух определе-
ний 1,64 и 1,75 А), которые намного длиннее, чем связь в N2H4
A,47 А); связи S—S в S2O52~ B,17 А) и в S2O42- B,39 А),
которые следует сопоставить со связью в Se B,06 А); связи
в 13~ и в других ионах полииодидов, обсуждаемые в гл. 9. Бо-
лее короткие связи рассматриваются как кратные. В определен-
ных случаях для связей М=М и М^М имеются очевидные
¦стандарты, например:
Н3С—СН3 Н2С=СН2 HCsCH
1,54 А 1,35А 1,20А
Многочисленным связям промежуточной длины приписываются
нецелочисленные порядки связей. В других случаях (например,
N = N) имеются большие разночтения в отношении принимае-
мых значений из-за отсутствия данных по подходящим молеку-
лам или ионам либо вследствие неустойчивости последних. Для
многих связей с участием О, S, N, Р и т. д. следует ожидать
укорочения из-за я-связывания; предположительно именно оно
является основной причиной вариаций в длине отдельных свя-
зей, таких, как S—О. Это согласуется с различиями в часто-
тах валентных колебаний связи:
Молекула
SO
C12SO
so2
F2SO
Частота
банин
валентных коле-
связи S—О, см—1
1124
1239
1256
1312
о
1,49
1,45
1,43
1,41
7.2. Длины ковалентных связей
345
Тем не менее самое большое зафиксированное расстояние S—О
равно 1,65 А (если не считать связей в S3Oi02~~ и S5Oi62-, точ-
ность определения которых сомнительна), а это меньше суммы
ковалентных радиусов A,77 А). В других случаях (например,
SiCl4), где нет причин предполагать заметный вклад я-связы-
вания (хотя и нельзя его полностью исключить), связи намного
короче (Si—Cl 2,00 А), чем сумма ковалентных радиусов
B,16 А). Часто расхождения между наблюдаемыми длинами
(предположительно) ординарных связей и суммами радиусов
Таблица 7.4. Обычные ковалентные радиусы и электроотрицательности
Электроотрицательности
н
2,1
С
2,5
Si
1,8
Ge
1,7
Sn
1,7
Ni
3,0,
P*
2.1 !
As J
2,0:
Sb ¦
1,8
0
3,5
S
2,5
Se
2,4
Те
2,1
F
4,0
Cl
3,0
Br
2,8
I
2,4
Обычные
H
0,37
с
0,77
Si
1,17
Ge
1,22
Sn
1,40
ковалситныс
N
0,74
P
1,10
As
1,21
Sb
1,41
радиусы
о
0,74
S
1,04
Se
1,17
Те
1,37
, A
F
0,72
Cl
0,99
Br
1,14
I
1,33
становятся тем сильнее, чем больше разность между электроот-
рицательностями участвующих атомов, и сейчас считается об-
щепризнанным, что «ионный характер» связей укорачивает их
длину по сравнению с длинами гипотетических ковалентных
связей. Из этого следует, что само введение электроотрица-
тельности является следствием допущения аддитивности радиу-
сов. Здесь не предполагается обсуждать способы вычисления
электроотрицательности, для которых нет прочных теоретиче-
ских оснований, но поскольку благодаря Шомакеру и Стевен-
сону (Schomaker, Stevenson) при сравнении длин связей с сум-
мами ковалентных радиусов широко используется уравнение,
в которое входят электроотрицательности, в табл. 7.4 приведе-
ны как электроотрицательности, так и ковалентные радиусы не-
которых элементов. Эмпирическое уравнение имеет вид:
ГАЪ = ГА + Гв— 0,09 (ХА ~ Хв)
(отдельные авторы предлагают меньший численный коэффици-
ент: 0,06). Это уравнение действительно устраняет некоторые
из наибольших расхождений, которые возникают для связей
с участием элементов N, О и F, но нижеследующие данные по-
казывают, что они не могут даже качественно объяснить разли-
чия между наблюдаемыми и оценочными длинами для серии
23—752
346 7. Химические связи в молекулах и кристаллах
связей С—Cl, Si—Cl, Ge—Cl и Sn—Cl:
Связь
Cl—Cl
Si—Cl
Ge-CI
Sn—Cl
1,76
2,00
2,08
2,30
r^ + rci, A
1,76
2,16
2,21
2,39
Необходим:! я
поправка, Л
0,00
0,16
0,13
0,09
Поправка по
Шомакер\- —
Стевенсону, Л
0,045
0,11
0,12
0,12
Более того, поправка на электроотрицательность никоим обра-
зом не достаточна для таких связей, как связи в молекулах
SiF4 и PF3:
Гм-\-гР
fucnp
(Шомакер —
Стевенсон)
о
Si—F, А
1,56
1,89
1,69
о
P-F, А
1,54
1,82
1,65
В связи со сказанным интересно заметить, что разность между
длинами пар связей М—F и М—С1 во многих случаях пример-
но равна разности между ионными радиусами F и С1 @,45 А),
но не разности между их ковалентными радиусами @,27 А).
Это и следовало ожидать для ионных кристаллов и молекул
(например, газообразных молекул щелочных металлов), но это
же оказалось справедливым и для следующих молекул:
—Cl~rM~F, rt
ВХ3
0,45
сх4
0,44
0,44
РХ3
0,50
sx2
0,41
Эта разность постепенно уменьшается для М=Вг @,38 А), С1
@,35 А), О @,28 А) и F @,21 А) и в конце этого ряда стано-
вится равной разности между ковалентными радиусами или да-
же меньше ее.
Уже давно признано, что притягательной альтернативой ис-
пользованию трех наборов радиусов (металлических, ионных
и ковалентных) была бы разработка одного набора радиусов,
применимых к связям во всех видах молекул и кристаллов. Это
устранило бы необходимость предрешать тип связи. Такой на-
бор радиусов был предложен Бреггом (Bragg) в 1920 г.,
7.2. Длины ковалентных связей
347
и его идея была развита Слейтером (Slater) в 1964 г. [J. Спет.
Phvs., 1964, 41, 3199]. В большинстве случаев эти радиусы хо-
рошо согласуются с вычисленными радиусами максимальной
радиальной плотности заряда внешних электронных оболочек
атомов. Длины ковалентных или металлических связей поэтому
должны быть равны суммам радиусов, поскольку эти связи об-
разуются в результате перекрывания заряда внешних оболочек,
а перекрывание максимально, когда максимальные плотности
внешних оболочек двух атомов совпадают. Радиус иона с кон-
фигурацией инертного газа приблизительно на 0,85 А больше
или меньше атомного радиуса в зависимости от того, образу-
ется катион или анион. Поэтому не следует ожидать, что длина
ионной связи будет существенно отличаться от длины ковалент-
ной связи между одной и той же парой атомов. Было показано,
что с помощью этих радиусов удается получить значения меж-
атомных расстояний со средним отклонением 0,12 А приблизи-
тельно для 1200 молекул и кристаллов. Эти радиусы были
округлены до 0,05 А, так как для более прецизионных целей
следовало сделать поправки на координационное число и на та-
кие специфические факторы, как влияние кристаллического по-
ля. Тем не менее приходится признать, что в отдельных случа-
ях согласование между наблюдаемыми в эксперименте длинами
связей и суммами радиусов остается плохим (в случае Ag, T1
и элементов от Hg до Ро), но для некоторых из этих элементов
трудности сохраняются даже при проведении более глубокой
обработки. Мы не приводим слейтеровские радиусы, потому что
для металлов они близки к «металлическим радиусам»
(табл. 29,5, разд. 29.2) и для неметаллов — к полинговским
«ковалентным радиусам», за исключением некоторых первых
элементов групп периодической системы, особенно N, О и F
(слейтеровские радиусы соответственно равны 0,65, 0,60
и 0,50 А). Ранее уже отмечалось, что длины многих связей
М—F дают возможность предполагать, что радиус для F со-
ставляет намного меньше половины длины молекулы F2
@,72 А); они значительно лучше согласуются со слейтеровским
радиусом 0,50 А. Поскольку затруднения с расстояниями наи-
более остро проявляются для некоторых связей с участием
именно F, следует обратить внимание на то, что этот элемент
аномален во многих своих проявлениях (см. табл. 9.1, разд. 9.1).
Мы уже отметили некоторые примеры аномально длинных свя-
зей (N—N, S—S, I—I). Если считать, что связь в молекуле F2
имеет ту же аномалию (вероятно, то же в определенной степе-
ни относится и к связям в НО—ОН и H2N—NH2), может по-
явиться необходимость пересмотра основ обсуждения длин
связей и ионно-ковалентного характера связей в терминах
электроотрицателыюсти.
23*
348 7. Химические связи в молекулах и кристаллах
7.3. Формы простых молекул и ионов непереходных элементов
Пространственное расположение связей в большинстве молекул
и ионов АХ„, образованных непереходными элементами (и пе-
реходными элементами в состояниях d°, d5 и d10), где X — га-
логен, О, ОН, NH2 или СН3, может быть определено по общему
числу валентных электронов в системе. Если это число (У)
кратно восьми, то конфигурация связей соответствует одному
из следующих высокосимметричных случаев:
V= 16: две коллинеарные связи
24: три компланарные связи
32: четыре тетраэдрические связи
40: пять тригонально-бипирамидальных связей
48: шесть октаэдрических связей
56: семь пентагонально-бипирамидальных связей
При промежуточных значениях V пространственную конфи-
гурацию можно определить, выразив V в форме уравнения
8п-{-2т (или 8п-{-2т—1, если V нечетное), и тогда расположе-
ние п лигандов и т неподеленных электронных пар соответ-
ствует одной из приведенных выше симметричных конфигура-
ций, например:
n-t-m
Расположение связей
32
26
20
Тетраэдрическое
Пирамидальное
Угловое
Соединения непереходных элементов, содержащие нечетное
число электронов, немногочисленны, однако их можно вклю-
чить в данную схему, так как нечетный электрон, подобно
электронной паре, занимает одну из орбиталей. Поэтому
17-электронная система имеет точно такую же угловую фор-
му, как и 18-электронная, что описано ниже.
Естественно считать, что слагаемое 8/г подразумевает
укомплектование октетов лигандов X (обычно атомы кислоро-
да или галогена), а не центрального атома А, поскольку X
обычно более электроотрицателен, чем А. Об этом свидетель-
ствуют 16-, 18-, и 24-электронные системы, в которых А имеет
неполный октет валентных электронов, а также существование
молекул О—S—О и S—S—О и отсутствие S—О—S и S—О—О
в природе. Каждому лиганду здесь соответствует одна элект-
ронная пара в валентной группировке А. В случае таких ли-
гандов, как галоген, ОН, NH2 или СН3, один электрон для
каждой связи предоставляется атомом X и один — атомом А,
7.3. Простые молекулы и ионы непереходных элементов 349
но в случае О требуется уже два электрона от А (или от А
и ионного заряда). Использование части электронной плотно-
сти кислорода для усиления связи А—О (которая неизменно
близка к двойной) понижает его формальный отрицательный
заряд. При этом использование других электронных пар кис-
лорода на стереохимию существенно не влияет и для ее опре-
деления нет необходимости отличать =0 от —X. Например,
24-электронные системы включают не только тригалогениды
бора, но также карбонил- и цианогалогениды, оксоионы ВОз3~,
Рис. 7.1. Альтернативные способы расположения двух неподеленных пар по
двум вершинам октаэдра.
СО32~, NO3~ и нейтральную молекулу БОз, которые все имеют
форму плоского треугольника. Конечно, образование равносто-
роннего треугольника следует ожидать только в том случае, ес-
ли все лиганды одного сорта. В менее симметричных молеку-
лах (СОС12 и O2NF) наблюдаются отклонения в углах между
связями от 120°.
В этом разделе книги мы не будем делать различий между
кратными и ординарными связями в структурных формулах
простых молекул и ионов.
В рассмотренных выше примерах стереохимия вытекает не-
посредственно из значения V B0, 26 или 32), поскольку имеет-
ся только одна возможная конфигурация двух или трех свя-
зей, вытекающая из расположения четырех пар электронов по
правильному тетраэдру. Однако при наличии большего числа
электронных пар возможно несколько способов расположения
меньшего числа связей. Например, возможны 2 способа разме-
щения двух неподеленных пар по двум вершинам октаэдра
(рис. 7.1). Поэтому с расположением электронных пар по ок-
таэдру совместима не только плоская структура иона 1СЦ~, но
и структура б на рис. 7.1. Аналогично конфигурация неправиль-
ного тетраэдра для ТеС14, Т-образная конфигурация для C1F3
и линейная-—¦ для 1С12~ являются не единственно возможными
среди производных от тригональной бипирамиды с одной, дву-
мя или тремя неподеленными парами. Высокосимметричные
350 7. Химические связи в молекулах и кристаллах
конфигурации различного числа поделенных электронных пар,
как и следовало ожидать, совпадают с расположениями груп-
пы одинаковых ионов вокруг заданного иона. Более того, дей-
ственность «правила» 8п-\-2/п означает, что электронные пары,
безразлично — поделенные или неподеленные, стремятся распо-
ложиться в пространстве по возможности дальше друг от дру-
га. Однако для объяснения размещения лигандов в случаях,
где возможен различный выбор структуры (как в случае 1СЦ~),
а также для объяснения более тонких деталей структур менее
симметричных молекул (таких, как ТеСЦ или C1F3), было не-
обходимо ввести дополнительные, по возможности простые
правила. Поскольку неподеленные пары находятся ближе к яд-
ру, чем связывающие пары, было предположено, что отталки-
вание между электронными парами в валентной оболочке убы-
вает в следующем порядке:
неподеленная пара : неподеленная пара > неподеленная пара : связывающая
6
пара
связывающая пара : связывающая пара
Вполне очевидно, что структура а на рис. 7.1 характеризу-
ется минимальным отталкиванием типа неподеленная пара:
неподеленная пара и предпочтительна, если считать, что 6i>62.
В ТеС14 с одной неподеленной парой отталкивание между не-
поделенной парой и связывающими парами благоприятствует
структуре, в которой неподеленная пара занимает экваториаль-
ную, а не аксиальную позицию. Такие же аргументы можно
применить к C1F3 и другим молекулам.
Связи с участием атомов, обладающих только одной парой
несвязывающих электронов, привлекают особый интерес. Такая
ситуация имеет место в молекулах МХлг-2, образованных эле-
ментами в степенях окисления, на 2 единицы меньших номе-
ра группы периодической системы: от SiF2 до XeF6. Они име-
ют структуры, ожидаемые для 18-, 26-, 34-, 42-электронных
группировок; однако 50-электронные молекулы и ионы ведут
себя аномально, см. разд. 7.3.5. Одна электронная пара, пред-
положительно в валентной оболочке, остается и на ионах
щы-2)+ элементов, расположенных в Б-подгруппах III—
V ррупп.
N III IV V VI VII VIII
мх«
Xe
Ga
In
Tl
М+
мх2
(Si)
Ge
Sn
Pb
M"
MX3
p
As
Sb
Bi
M3*
MX4
s
Se
Те
MX
C\
Br
I
7.3. Простые молекулы и. ионы непереходных элементов 351
Сиджвик (Sidgwick) назвал такую электронную пару «инерт-
ной парой». Однако в многочисленных кристаллических соеди-
нениях с наиболее электроотрицательными элементами F и О
присутствие этой неподеленной пары четко проявляется в рас-
положении ближайших соседей. В таких соединениях она опи-
сывается как «стереохимически активная пара». С другой сто-
роны, в отдельных структурах, например в октаэдрических
50-электронных молекулах и ионах, атомное окружение атома
элемента Б-подгруппы остается высокосимметричным (стерео-
химически неактивная пара). Структурная химия этих элемен-
тов более детально обсуждается в дальнейших главах.
Рассмотрим теперь строение ионов и молекул с числом
электронов У^ 16, а затем кратко обсудим строение ионов
и молекул с 10—14 и далее с 17 и 19 электронами.
7.3.1. Линейные 16-электронные молекулы и ионы. В эту груп-
пу входят линейные молекулы и ионы серебра и золота (на-
пример, Ag(NH3J+, Au(NH3J+, H3N-AuCl, AuCl2-), галогениды
ртути и группа молекул и ионов, содержащих С, N, О (отметим
Таблица 7.5.
Длины связей,
О—С—О
N—N—О
(О—N—О) +
(N—С—0)-
(N—N—N)-
(X—С—NJ-
1,
1,
1,
1,
1,
1,
О
А
16
13
15
21
15
22
Длины
1,
1,
1,
1,
1,
1,
связей в линейных молекулах
и ионах
16
19
15
13
15
22
Длины ординарных с
С—С
С—N
С—0
N—N
N—0
0—0
с
вязей, А
1,54
1,47
1,43
1,46
1,41
1,47
неустойчивость линейного иона В02~; о метаборатах см.
разд. 24.7.4). У последних элементов (табл. 7.5) все связи
очень короткие; они значительно короче ординарных связей,
и, если не считать CN22~, общая длина молекулы или иона
близка к 2,3 А.
Для того чтобы распределить 16 электронов в трехатомной
системе А—В—С таким образом, чтобы вокруг атомов всех
трех сортов сохранялись октеты и все связи содержали чет-
ное число электронов, существуют следующие возможности:
А=В=с
4 4 4 4
А—В=С
6 2 6 2
А=В—С
2 6 2 6
352 7. Химические связи в молекулах и кристаллах
Из данных, приведенных в табл. 7.5, видно, что все вышеука-
занные молекулы и ионы приближаются к симметричной форме
А—В = С, однако исключительно короткие длины большинст-
ва связей в этих компактных линейных молекулах свидетельст-
вуют о том, что в них осуществляется дополнительное элект-
ронное взаимодействие.
Молекулы NCX служат примерами структуры Ае==В—С. Все
молекулы NCF, NCC1, NCBr и NCI линейные с расстоянием
N—С 1,16 А; связи С—X неизменно на ~0,14 А короче, чем
соответствующие расстояния в тетрагалогенидах углерода.
Газообразные молекулы дигалогенидов щелочноземельных
металлов, также принадлежащие к 16-электронным молеку-
лам, вероятно, являются скорее ионными, чем ковалентными.
Некоторые из них линейные, как и ожидалось, другие, очевид-
но, нелинейные (разд. 9.11).
7.3.2. Треугольное расположение трех электронных пар
18 электронов - 4 электрона
18-электронная группировка. Удобно расположить примеры
в соответствии с группами периодической системы. Отметим,
что таких соединений нет у углерода и что только галогены
образуют соединения АХ2 с элементами IV группы. (Такая во-
дородсодержащая молекула, как HFC = O, должна считаться
не 18-, а 24-электронной молекулой. Если желательно включить
водород, он должен считаться несущим 7 электронов подобно
галогену.) В C102(AsF6), образующемся из ClO^F и AsF5, со-
гласно ИК-исследованиям, существует ион С1О2+.
IV группа У группа VI группа VII группа
Si
F''" ~^F
101°
также
GeF2 (94°)
TiF2 A30°)
SnX2
PbX2
N
0/ M)
] 1 S
N
1 10'
также
N0A A16°)
N0BrA17Cl)
N0@H)(ll f)
Q
(K >0
1 1 7°
1 1 7°
также
SSO A18°)
OSO(.120°)
Cl +
о/ ч0
(NO2 имеет заряд—1.)
Следует отметить удивительную близость углов между связя-
ми во всех соединениях N, О и S, несмотря на значительные
различия в кратностях связей.
7.3. Простые молекулы и ионы непереходных элементов 353
24-электронная группировка. Эта потенциально обширная
группа на самом деле насчитывает не очень много примеров
(см. ниже). Фактически единственная причина для перечисле-
ния этих ионов и молекул в таком порядке, как показано
(с оксосоединениями в верхней строке и соединениями галоге-
нов в нижней), заключается в привлечении внимания к «отсут-
ствующим» соединениям:
во,*-
вх,
OCX,
N03-
02NX
(N0F2)+
SO3
Например, известна, по-видимому, только одна из ионных
группировок, содержащая в качестве лигандов атомы галогена
или галогена и кислорода. Речь идет о катионе (NOF2)+, об-
наруженном в солях типа (NOF2)BF4 и (NOF2)AsF6, образую-
щихся из NOF3 и соответствующего галогенида. ИК-спектр сви-
детельствует о структурной аналогии с плоской молекулой
COF2.
Все три оксоиона образуют равносторонние треугольники,
как и SO3. Отметим отсутствие плоских ионов SiO32~ и РО3~;
как известно, ионы метасиликата и метафосфата основаны на
тетраэдрических группировках SiO4 и РО4 соответственно. (Вы-
ше уже отмечалось, что аналогичное предпочтение более высо-
ких КЧ характерно и для метаборатов.) Нейтральные молеку-
лы, расположенные на схеме по диагонали от SO3 до BF3)
включают нитроилгалогениды (O2NF и O2NC1) с углом О—N—
—О около 130° и карбонилгалогениды COF2 (F—С—F 112°)
и СОС12 (С1—С—С1 111°). Все эти молекулы плоские. Верти-
кальные столбцы схемы укомплектованы соединениями с кис-
лородными или галогеиидными лигандами не полностью, но
замена галогена на изоэлектронную ему группу NH2 дает ряд
/NH,
NH2+
;c-nh2-
0—C.
H2N-C
карбонат-ион карбамат-ион карбамид ион гуанидиния
Было показано, что все эти группы плоские.
7.3.3. Тетраэдрическое расположение четырех электронных пар
' А" А А
/ \ / | \ / \
20 электронов 2Ьэлектпо,чов 32 электрона
354 7. Химические связи в молекулах и кристаллах
20-электронная группировка. Эта небольшая группа вклю-
чает ионы и молекулы, образованные элементами V—
VII групп:
NT О
HX ХН F^ 4F
103°
s 2- ci -
/ Ч / ч
S S О О
103" 111°
О S Cl •
/ Ч / Ч / Ч
Cl Cl Cl Cl F F
111° 100° 96°
А /в\*
F -F FMl,F
98°
9з;~°
(Отметим, в частности, отсутствие SO22~, SOC1" и OC1F.) SF2
представляет собой неустойчивое соединение, полученное и ис-
следованное при пропускании SF6 через радиочастотный раз-
ряд, проведении реакции продуктов с COS во время истечения
из зоны разряда и последующей прокачке через микроволно-
вую ячейку. Ион C1F2+ существует в таких соединениях, как
ClF2-AsF6, ион BrF2+ — в BrF2-SbF6. В последнем угол F—Вг—
—F составляет 93,5°, но наблюдаются еще 2 более слабые свя-
зи, компланарные с двумя остальными, что свидетельствует
о промежуточном положении этой структуры между BrF2+
и BrF4~. Ион FC12+ несимметричный (Cl—Cl—F)+. О катионах
галогенов и межгалогенных соединений см. разд. 9.5.
26-электронная группировка. Пирамидальные комплексы АОз
включают ионы SO32~, SeO32~, СЮ3~, ВгО3~ и Ю3~ и молекулу
ХеО3. Отметим отсутствие пирамидального иона РО33~
(и ЫОз3~). К менее симметричным пирамидальным молекулам
относятся тионил- и хлорилгалогениды (SOX2 и С1О2Х). Белое
кристаллическое вещество, иодилфторид IO2F, устойчивое в су-
хом воздухе, вероятно, структурно отличается от весьма реак-
ционноспособного ClOaF:
SO32- СЮ3- ХеО3
SO2F" C1O2F
SOCU C1OF2+
SnCl3- NF3 PX3 SX3+(?)
Возможно, что в SC14 может существовать ион SC13+. Исследо-
вания SeCl4, SeBr4, TeBr4 и Tel4 в дальней ИК-области приво-
дят к заключению, что галогениды следует рассматривать как
(SeX3)X и (ТеХз)Х. Пирамидальная структура (SeF3)+ уста-
новлена для (SeF3) (NbF6) и (SeF3) (Nb2Fn), разд. 16.10.2.
О структуре кристаллического ТеС14 см. в разд. 16.5.3. Пира-
7.3. Простые молекулы и ионы непереходных элементов 355
мидалыюе строение изоэлектронного иона [(СН3)зТе]+ выяв-
лено в кристаллическом [(СН3KТе](СН3Те14). К этой же груп-
пе можно отнести и ион SnCl3~, существующий в соединении
K2(SnCI3)Cl-H2O, которое прежде трактовалось как КгБпСЦ-
•Н2О.
32-элсктронная группировка. В эту очень обширную группу вхо-
дят ионы: от тетраэдрических оксоионов Si, P, S и Cl (элемен-
ты второго периода — С, N и F — таких ионов не образуют)
до галогенидов МХ4, образованных многими непереходными
элементами. Сюда включены также многочисленные промежу-
точные оксогалогенидные ионы и молекулы. Ниже приведены
соединения фосфора, поскольку они составляют более полные
ряды, чем соединения его аналога азота. Известны NF^
и NOF3) но высшим оксофторидом является NO2F, хотя синте-
зирован и NS3F:
В(ОНL" Si(y- Р04з- SO4°- C1O4- ХеО4
РО3Х2" SO3X-
C1O3F
SiX4
ро2х2- so2x2
POF3
PXd+
BF4"
ВеС!42- А1С14~
Отметим укомплектованность вертикальной колонки комплек-
сов фосфора и полный ряд нейтральных молекул (по диагона-
ли) от SiX4 до ХеО4.
7.3.4. Расположение пяти электронных пар в форме тригональ-
ной бипирамиды
I
] д
I
22электрона 2Ъэлектронов Мэлектрона 40электронов
Системы с 22, 28 и 34 электронами привлекают особый интерес
из-за неэквивалентности аксиальных и экваториальных пози-
ций при тригонально-бипирамидальнои координации, поскольку,
кроме компланарного расположения в виде пятиугольника, не
существует иного пространственного расположения пяти связей
вокруг атома, при котором они были бы эквивалентны друг
другу.
22-электронная группировка. Здесь примеры ограничиваются
линейными ионами, образованными тяжелыми галогенами
(С1Вг2~, ВгС12~, многочисленные ионы 1Х2~ и AХ'Х")~, Вг3~
и 13~), и молекулами KrF2 и XeF2.
356 7. Химические связи в молекулах и кристаллах
28-электронная группировка. Для C1F3 и BrF3 установлена
Т-образная конфигурация. Такие ионы, как SC13~, должны, ве-
роятно, иметь аналогичное строение.
34-электронная группировка. Ожидаемая структура, произ-
водная от тригональной бипирамиды, была подтверждена для
всего перечисленного ниже набора молекул и ионов:
IO2F2- XeO2F2
IOF3
SF4 BrF4+
и также для SeF4 и для молекул типа Se(C6H5hBr2
и Те(СН3JС12.
40-электронная группировка. Единственные комплексы этой
группы с полным набором элементов симметрии тригональной
бипирамиды представлены пентагалогенидами элементов
V группы и ионом SnCl5~. В SOF4 атом О занимает экватори-
альную позицию, что, естественно, приводит к понижению сим-
метрии. Интересно, что ион 1пС152~, изоэлектронный SnCl5~,
имеет форму тетрагональной пирамиды, в которой атом метал-
ла выступает на 0,6 А над основанием. Аналогично построен
и ион Ю53~. Ион SnCl3(CH3J~, подобно SnCl5~, имеет форму
тригональной бипирамиды.
7.3.5. Октаэдрическое расположение шести электронных пар
36электронов 42 электрона 48электронов
36'-электронная группировка. Плоскоквадратная конфигура-
ция установлена для ионов BrF,r, 1С14~ и для молекулы XeF4.
42-электронная группировка. Расположение пяти лигандов
по пяти вершинам октаэдра доказано структурными исследова-
ниями для следующих молекул и ионов:
C1OF4" XeOF4
TeF," IF.,
XeF5+
и также для IOF4 , CIF5 и BrFs. Можно отметить, что не найде-
но ни одного случая конфигурации в форме тетрагональной пи-
рамиды с расположением центрального атома А в основании
пирамиды. Этот атом либо выступает на ~0,5 А над основа-
нием (как в 40-электронном ионе 1пС152~ с пятью поделенными
электронными парами и в многочисленных комплексах переход-
7.3. Простые молекулы и ионы непереходных элементов 357
ных металлов, где возможны два разных, но родственных друг
nrrv распоЛожения связей ¦— в форме тригональной бипира-
мит,ь1 и в форме квадратной пирамиды), либо опускается на
а з' 0,4 А ниже основания пирамиды. Последнее справедливо
' всех пентафтороионов, для BrFs и SbCl52^ и также для
Ион или
мошекула
(TeF5)-
(TeF4)«
<XeF5) +
(SbF5J"
(SbCl5J-
BrF5
IF5(XeF2)
Таблица 7.6
M-X
1,
1,
1,
2,
2,
1,
1,
Ионы и
молекулы
непереходных элементов, ,
имеющие форму квадратной пирамиды
85
80
79
00
36
68
88
М-ХЬ. Аа
1,96
2,036
1,85
2,04
2,62
1,81
1,88
ха-м-хь
79°
82°
79°
83°
85°
84°
81°
Литература
Inorg. Chem., 1970, 9, 2100
J. Chem. Soc. (London), A, 1968
2977
Inorg. Chem., 1973, 12, 1717
Inorg. Chem., 1970, 9, 2100
Acta Chem. Scand., 1955, 9, 122
J. Chem. Phys., 1957, 27, 982
Inorg. Chem., 1970, 9, 2264
Xa — атом в вершине пирамиды, Xb — атом в основании пирамиды.
5Среднее из расстояний 1,90—2,26 А (несимметричная мостиковая группировка.
см. разд. 16.5.3).
TeF4, который построен из пирамид TeFs, соединенных между
собой по двум общим атомам F (о последнем соединении см.
разд. 16.5.3). Детальные данные и литературные источники
приведены в табл. 7.6.
48-электронная группировка. Октаэдрические молекулы
и ионы этой группы более многочисленны, к ним относятся:
Те(ОН)„ Ю(ОНM
IOF5
A1F,*- SiFB2- PFe" SFG IF6+
и другие ионы Те, приведенные в гл. 16.
7.3.6. Расположение семи и девяти электронных пар. Сначала
удобнее рассмотреть 56-электронную группировку, поскольку
известна единственная молекула АХ„, в которой валентная
группа состоит из семи поделенных электронных пар, а именно
молекула IF7. Ее структура вызвала множество дискуссий, но,
по всей видимости, эта молекула имеет ожидаемую конфигура-
цию пентагональной бипнрамиды.
358 7. Химические связи в молекулах и кристаллах
50-электронная группировка охватывает следующие молеку-
лы и ионы, образуемые путем присоединения иона Х~ к рас-
смотренной выше 42-электронной системе:
Степень окисления атома А на две единицы меньше максималь-
ной валентности элемента данной группы, так что в дополне-
ние к шести связывающим парам у него имеется не-
поделенная пара электронов. Структура иона IF6~ пока
не известна. Тщательное исследование кристаллических струк-
тур (NH4L(SbIIIBr6)(SbvBr6), (NH4JTeCl6 и К2ТеВг6 показа-
ло, что, несмотря на наличие 7-й электронной пары, обсуждае-
мые ионы образуют неискаженные октаэдры. Поэтому эта пара
не локализуется в определенной позиции, а выступает в роли
«стереохимически неактивной» пары.
О конфигурации молекулы XeF6 в газообразном состоянии
до сих пор не сделано определенного заключения, кроме того,
что она не имеет форму ни правильного октаэдра, ни правиль-
ной пентагональной бипирамиды. Структуры ее кристалличе-
ских модификаций очень сложные. Весьма специфические по
строению циклические полимеры можно описать как построен-
ные из тетрагональных пирамид XeFs" и ионов F~, но харак-
тер связывания в них далеко не очевиден.
Много лет назад Полинг обсуждал аномально длинные свя-
зи М—X в SeIVX62~ и TelvX62~, сравнивая их с суммой тетра-
эдрических ковалентных радиусов, которые для Se и Те соот-
ветствуют М(П). Для более прямого сопоставления длин свя-
зей М—X можно было бы использовать следующие пары:
М-Х, А
M-X, A
2,80 SbBiy5" SbBr0- 2,56
? TeFfJ- TeFc 1,82
Но, к сожалению, такое сопоставление в настоящее время
возможно только для Sb—X, ибо известен лишь один гекса-
галогенид теллура TeF6, а точные данные имеются лишь для
ионов ТеС162~ и ТеВг62~; для IF6~ и IF6+ таких данных нет во-
обще. Оказывается, что, хотя в SbBr6~ пара 25-электронов сте-
реохимически неактивна, она увеличивает длину связи, играя
роль сферически симметричной оболочки и тем самым увеличи-
вая размер M(IV) по сравнению с M(VI).
7.3. Простые молекулы и ионы непереходных элементов 359
Для иона XeF82~ возникают до определенной степени ана-
логичные проблемы; он содержит 9 электронных пар: 8 связы-
вающих и 1 неиоделенную, — и тем не менее его форма лишь
незначительно отклоняется от квадратной антипризмы. Это
единственный представитель 66-электронной группировки.
7.3.7. Ю—14-электронные группировки. Образование электрон-
ных октетов вокруг каждого из двух атомов двухатомной мо-
лекулы с общим числом электронов от 10 до 14 возможно лишь
при следующих симметричных конфигурациях:
10 11 12 13 14
2:6:2 3:5:3 4:4:4 5:3:5 6:2:6
По мере увеличения количества электронов в системе число
связей уменьшается от шести до двух, связи ослабевают и уд-
линяются:
10
(N2)
Длина связи, А 1,10
Энергия диссоциации, кДж/моль 941,4
Силовая постоянная, Н/м 2290
и
О2 +
1,12
12
О2
1,21
493,7
1180
13
14
1,33 1,48
154,8
383
(Поскольку данные для О22+ отсутствуют, в качестве предста-
вителя 10-электронной группировки в перечень включена мо-
лекула N2.) Согласно теории молекулярных орбиталеи, порядки
связей в соединениях приведенного ряда равны 3; 2,5; 2; 1,5
и 1 соответственно. Факт удлинения связей при последователь-
ном добавлении электронов к О22+ обусловлен перегруппиров-
кой электронов и аналогичен такому же явлению в другом изо-
электронном ряду:
10 электронов 12 электронов 14 электронов
НСеенСН Н2С=СН2 Н,С—СН3
1.20А 1.35А 1.54А
Хотя эта простая трактовка качественно объясняет длины свя-
зей, все факты она объяснить не может. Парамагнитны не
только О2+ и О2~, как этого и следовало ожидать для ионов
с нечетным количеством электронов, но и молекула О2. Эта
трудность преодолена в рамках теории МО размещением не-
спаренных электронов на двух «антисвязывающих» орбиталях.
Рассматриваемые системы с четным числом электронов
включают некоторые важные молекулы и ионы. В группу
10-электронных систем входят N2, высокотемпературные моле-
кулы PN и Р2 и следующий ряд:
С22- CN" CO NO+
1,20 1,17 1,13 1.06А
360 7. Химические связи в молекулах и кристаллах
12-электронная группировка включает в себя NO~, O2, SO
и S2; 14-электронная — молекулы галогенов, межгалогенных
соединений XX' и оксоионы галогенов ХО~. Известны немного-
численные примеры 11- и 13-электронных группировок:
11 электронов: N0, О2+;
13 электронов: О2~, Вг2+
Отметим, что использованный здесь простой арифметический
подход позволяет предсказать такие факты, как линейность
связей в М—Се=О или М—(N = 0)+ для 10-электронных ли-
гандов, связанных с металлическими атомами, в противопо-
ложность нелинейному расположению в случае 12-электронно-
го лиганда, М—(N = 0)~.
7.3.8. Системы АХ2 с нечетным числом электронов и их димеры
ХъА—АХ2. 17- и 19-электронные системы особенно интересны
в связи с возможностью их димеризации в 34- и 38-электрон-
ные молекулы с устранением неспаренных электронов.
17 электронов
i электронов
hi-
о ''-МА
134"
F'
Н
31°
н
0 1,49 А
[SOЛ
(а В матрице Хе [J. Chem. Phys., 1969, 51, 4710]. б В газо-
вой фазе [Ргос. Roy. Soc, 1967, А298, 145].)
X"
;в-в.
34 электрона
о ,о"~
~"с с:'
о ¦ " О
О 1,18 X О
О 1,75 А О
1; ч 1 ,зч k F
1O3°CN—N '
[¦' 1,48 Л F
38 электронов
О, Л~)~
Влияние добавления сначала нечетного электрона и затем не-
поделенной пары на стереохимию системы хорошо демонстри-
руется серией: NO2+ (линейный), NO2 и NO2~ (оба угловые).
В частности, он сказывается в том, что 17-электронная молеку-
ла NO2 по длине связей и величине угла между ними занимает
7.3. Простые молекулы и ионы непереходных элементов 361
промежуточное положение между 16- и 18-электроннымп систе-
мами:
o-N-o+ N N
оУ хо о о
Угол 1 so" 134° 115°
O-N-o
N-0 1,15 Л 1,20 А 1,24 А
Большой интерес представляла бы детальная структура С1О2+,
поскольку вместе с С1О2 и С1О2~ она составляет другой ряд,
включающий молекулу с нечетным числом электронов (то же
относится и к ряду SO2+, SO2 и SO2-):
Cl
''О 1,49 A
"'Cl'"
1,57 А
о
чо о и7°о
опго
Если каждому концевому атому О или X приписать по
8 электронов, то в случае образования 34-электронной днмер-
ной системы остаются только два электрона, необходимые для
образования ординарной связи А—А, тогда как в случае
38-электронной системы на каждом атоме А локализуется еще
и по одной неподеленной паре:
/Л-АГ и Х-А.
В первом случае три связи вокруг атома А располагаются
компланарно, во втором — в форме пирамиды. В С2О42~
и В2Х4 длина центральных связей соответствует ожидаемой для
ординарных связей, но в N2O4 связь N—N аномально длинная.
Отметим, что в случаях NO2 и N2O4 и NF2 и N2F4 мономеры
и половины димеров имеют в точности аналогичные структуры.
Интересным свойством этих систем является плоское строение
N2O4 и B2F4 (о В2С14 см. в разд. 24.5.1), тогда как С2О42~
в одних солях имеет плоскую конфигурацию, в других — не
плоскую (разд. 21.4.1). Молекула щавелевой кислоты плоская,
с аномально короткими связями С = О A,19 А) и С—ОН
A,29 А). Особенности связей в молекулах А2Х4, образуемых В,
N и Р, обсуждаются в работах [J. Am. Chem. Soc, 1969, 91,
1922; Inorg. Chem., 1969, 8, 2086].
В отличие от NO2 у С1О2 нет тенденции к димеризации,
в то время как изоэлектронный SO2~ можно выделить только
в виде S2O42^ (в дитионатах), хотя получены определенные до-
казательства существования равновесия между мономером
и димером в растворе. Известна лишь одна 19-электронная мо-
24—752
362 7. Химические связи в молекулах и кристаллах
лекула (NF2), содержащая галоген. Группа димеров состоит из
N2F4, P2F4, РгСЦ и P2I4. Свободный радикал NF2 вполне устой-
чив и в газовой фазе в равновесии с N2F4 может существовать
бесконечно долго. Он образуется при реакции NF3 с металли-
ческой медью при 400 °С и димеризуется при охлаждении. Из-
вестна интересная реакция между NF2 и N0 — другой молеку-
лой с нечетным числом электронов, приводящая к образованию
ON-NF2 — соединению глубокого красного цвета, которое при
комнатной температуре и атмосферном давлении быстро диссо-
циирует на NF2 и N0 (бесцветная смесь).
Все галогенсодержащие соединения Р2Х4 существуют, оче-
видно, в центросимметричной транс-форме (в отличие от гош-
формы Р2Н4). Ион дитионита привлекает внимание своей за-
слоненной конфигурацией и исключительно большой длиной
связи S—S B,39 А по сравнению с 2,06 А для обычной орди-
нарной связи в различных модификациях элементной серы).
7.4. Вандерваальсовы связи
При подходящих условиях температуры и давления в жидкое
и твердое состояние можно перевести все элементы, включая
инертные газы, и все соединения, в том числе и состоящие из
неполярных молекул (СН4, ССЦ и т.д.). Существование универ-
сального притяжения между всеми атомами и молекулами при-
вело Ван-дер-Ваальса к включению в свое уравнение состояния
величины a/V2. Кисом (Keesom) вычислил среднюю энергию
взаимодействия молекул с постоянным дипольным моментом
(ц), находящихся на расстоянии г друг от друга:
Ек = — 2\хЧЗга1гТ
К этому выражению Дебай прибавил энергию взаимодействия
между постоянным диполем и моментами, наведенными им
в соседних молекулах:
где а —• поляризуемость. Первое выражение, требующее обрат-
но пропорциональной зависимости вандерваальсова фактора а
от абсолютной температуры, не согласуется с эксперименталь-
ными данными и, более того, приводит к слишком малому зна-
чению суммы ?к и Ео (см. табл. 7.7). Ни одно из этих выра-
жений, конечно, не учитывает взаимодействие между неполяр-
ными молекулами — тип взаимодействия, впервые рассчитан-
ный Лондоном и поэтому называемый энергией Лондона или
дисперсионной энергией. Этот (квантовомеханический) расчет
7.5. Связи металл — металл 363-
-\г
СО
HI
НВг
НС1
П2О
Таблица
H(D)
0,00
0,12
0,38
0,78
1,03
1,50
1,84
7.7. Энергия
а. К)-11 см3
1,63
1,99
5,40
3,58
2,63
2,21
1,48
решетки (кДж/моль)
?К
0,000
0,000
0,025
0,686
3,31
13,31
36,36
0,000
0,008
0,113
0,502
1,004
1,26
1,92
EL
8,49
8,74
25,86
21,92
16,82
14,73
9,00
Полная
энергня
8,49
8,74
25,98
23,10
21,13
29,58
47,28
дает для одинаковых частиц с потенциалом ионизации / вели-
чину
EL = — 3/a2/4r6
или для разносортных частиц величину
Относительные величины этих трех типов взаимодействия
для нескольких простых случаев можно сравнить по табл. 7.7.
Для неполярной молекулы энергия Лондона по необходимости
является единственным вкладом в энергию решетки. Даже для
полярных молекул, таких, как NH3 и НгО, для которых Ец до-
стигает ощутимых значений, Еь составляет важную часть энер-
гии решетки. Отметим, что указанные энергии решетки по вели-
чине на 1—2 порядка меньше, чем энергия решетки для ионных
кристаллов; например, энергия решетки «постоянных» газов со-
ставляет лишь ~1% от энергии решетки NaCl (приблизитель-
но 753 кДж/моль). Но в солях с ионами, обладающими высокой
поляризуемостью (например, ТП), взаимодействие по Лондону
может достигать порядка 20% общей энергии решетки.
7.5. Связи металл — металл
При обсуждении связей металл—металл (т—т) химик чаще
всего ограничивается конечными молекулами и комплексными
ионами. Здесь будет предпринята попытка рассмотреть этот ас-
пект химического взаимодействия в его перспективе как часть
значительно более общего явления.
Как уже отмечалось в конце разд. 7.1, мы включаем в поня-
тие «связь m—m» все типы взаимодействия между атомами ме-
талла, переходя последовательно от обычных ковалентных свя-
зей через различные типы взаимодействия в соединениях пере-
24*
•364 7. Химические связи в молекулах и кристаллах
лодных металлов к металлическим связям в некоторых субгало-
генидах и субхалькогенидах.
Образование химического соединения подразумевает связы-
вание между атомами различных элементов, и для простоты мы
начнем рассмотрение с бинарных соединений. В некоторых би-
нарных соединениях АтХп (например, в простых ионных кри-
сталлах) все первичные связи (между ближайшими соседями)
представляют собой связи между атомами А и X, но это спра-
ведливо далеко не во всех случаях. Связывание атомов одного
элемента (А—А или X—X) следует ожидать в тех соединениях,
которые содержат преобладающее число атомов одного сорта
независимо от того, состоит ли оно из молекул (например,
S7NH) или представляет собой кристаллическое соединение с
высоким содержанием неметалла, такое как фосфид (CdP4),
силицид (CsSie), борид (ВеВ12), или с высоким содержанием
металла, такое, как Lii5Si4, Cs3O, Ta6S. Особый интерес при-
влекают соединения, в которых связывание осуществляется пре-
имущественно между атомами А и X, но имеет место также и
определенное взаимодействие между атомами А и А, X и X.
Безотносительно к другим связям, образуемым атомами А и X
(которые могут составлять часть трехмерного каркаса кристал-
ла), это можно изобразить в виде диаграмм:
7.5. Связи металл — металл 365
X
в
X
Случай а иллюстрируется структурой NiAs, в которой Ni окру-
жен шестью соседними атомами As, но, кроме того, связан еще
с двумя атомами Ni. Случай б представляет «нормальное» би-
нарное соединение со связями только типа А—X, тогда как в
случае в, примером которого служит борид FeB, атом X (бор)
окружен шестью атомами А (железо), но дополнительно связан
еще с двумя атомами X (бор).
На схеме 7.1 приведены основные типы структур (молеку-
лярных и кристаллических) со связями m—m. Ниже будут
кратко обсуждены различные их классы.
7.5.1. Класс I. Молекулы (ионы), содержащие непосредственно
связанные между собой атомы металла без мостиковых лиган-
дов. Простейшие молекулы этого сорта представлены двухатом-
ными молекулами многочисленных металлов в газообразном со-
стоянии (I—III группы, Со и Ni). Энергии диссоциации связей
меняются в широких границах: от —170—210 кДж/моль для
Со2, Ni2, Сиг, Ag2, Au2 (очень близких к соответствующим энер-
гиям для СЬ, Вг2 и 12) и несколько меньших величин для ще-
Схема 7.1
Типы структур со связями металл — металл
Класс I
связи m—m
кет мостиковых атомов
.конечные: Си2 и т. д.
Мл2(СО)ю,
Cl4Re= ReCl4
Hg32+, Hg42+
Sn52-, Sb73-, Sn94-, Bi95+
.цепочечные: Hgm в Hg3AsF6
K2|Pt(CNLlX0j3-3H2O
Гибриды I—II,
например Co4(CO)i2
Класс II
связи m—m и мостиковые связи
или М — X— '
(NiAs) (ReO3)
конечные: кластерные соединена
металлов Си, Ag, Nb
Та, Mo, W
карбонилы
Os3(COI2, Re4(CO)I62"
карбоксилаты (Cr, M
Re, Cu)
одномерные: AgCNO, AgNCO
двумерные: PtCoO2
трехмерные: ReO3, RuO2
Класс la
системы со связями m—m, соеди-
ненные через атомы X в более
протяженные системы (без связей
m—m)
группиров-
ки m—m
конечные: см. текст
цепочечные: GcbCb,
ТагБ, ТэбЭ
слоистые: ZrCl
Класс Па
структурные единицы класса II,
дополнительно связанные мостико-
выми связями М—X—М в более
сложные системы, например
-м —
-M—м- (x)—m;
цепочечные: Nbl4, ReCl4, Reb,
W6Br16
слоистые: ReCb, M0CI2, WCI2,
Nb6ClH, Ta6li4
трехмерные: Nb6ln, NbeF^, Ta6Cli5,
MoO2, WO2 и др.
Класс III
конечные структурные единицы,
цепи и слои, связанные друг с
другом связями m—m: «анти»-це-
почечные и слоистые структуры.
конечные: Rb9O2, Rb6O, Cs7O
цепочечные: Cs3O
слоистые: Ag2F, PbO, T12O, Ti3O
лочных металлов (от 109 для Li2 до 42 кДж/моль для Cs2) до
очень небольших значений для Mg2 B9 кДж/моль) и Zn2, Cd2,
Hg2 D—8 кДж/моль). Следующие за ними простейшие системы
со связями m—m — это соединения, образованные несколькими
элементами подгрупп Б. Среди них наиболее важны соединения
ртути, содержащие группировки X—Hg—Hg—X, соединения
элементов IV Б группы, в частности Ge2H6, Sn2H6 и (СН3)зРЬ—
РЬ(СН3)з.
366 7. Химические связи в молекулах и кристаллах
Некоторые из металлических элементов подгрупп Б образу-
ют полиядерные катионы, структуры которых описаны в после-
дующих главах: катионы Hg (разд. 26.3.1); катионы Bi.
(разд. 20,2; 20,3). Более известны в настоящее время структуры
анионов, образованных элементами подгрупп Б. Группировки:
таких атомов обнаружены во многих сплавах со щелочными и
щелочноземельными металлами. Примерами служат:
квадраты Hg4 в Na3Hg2, Bi4 в CanBi10
тетраэдры Т14 в Na2Tl, Ge4, Sn4 и Pb4 в KGe, KSn и NaPb
плоские циклы Ge5 в LinGee
полиэдры As, в Ba3As14
Много типов анионов металлов существуют в жидких ам-
миачных растворах сплавов Pb, Sn и Bi со щелочными метал-
лами. Но интенсивно окрашенные продукты, выделенные из та-
ких растворов, представляют собой аморфные соли, содержа-
щие катионы Na(NH3)n+ и теряющие NH3 прежде, чем удается
их перекристаллизовать. При этом они снова превращаются
в интерметаллические соединения. Однако с помощью комплек-
сообразования с лигандом типа криптанда («crypt-222»)
удается предотвратить делокализацию электро-
нов и повторное образование сплава, как это
впервые было продемонстрировано синтезом
|[Na (crypt) ]+Na~ [J. Am. Chem. Soc, 1974, 96,
7203], при действии этого лиганда в растворе
зтилендиамина на такие интерметаллические сое-
динения, как КбВц и NaSb3, в кристаллическом
состоянии было изолировано множество много-
атомных анионов. Примерами могут служить
[K(crypt)]2Bi4 и [Na(crypt)]3Sb7. Другие примеры
приведены в табл. 7.8.
7.5. Связи металл — металл 367
Лиганд «crypt-222»
N(C2H4 О С2Н4 О C,H4JN
Связи в этих анионах обычно того же типа, что и связи в ио-
нах и молекулах, образованных легкими элементами под-
групп Б. Например, структура аниона Sb73~ аналогична струк-
туре ионов Р73~ в Ва3Рн или ионов As73~ в Ba3Asi4 или моле-
кул P4S3, P4Se3 и As4Se3 (рис. 19.10, в, разд. 19.8). Очень инте-
ресный момент заключается в том, что некоторые из этих анио-
нов изоструктурны с изоэлектронными катионами других эле-
ментов подгруппы Б. Например, структура нелинейного иона
Те32~ (угол между связями 113°) аналогична структуре 13+
(угол 97°), a Bi42~ представляет плоский квадрат подобно Те42+.
С тпугой стороны, структура Sn94" совершенно отличается от
BlA который изоэлектронен с РЬ94~ и поэтому, как ожидалось,
должен был быть изоструктурен с анионом олова. Темно-крас-
ный [K(crypt)]6Ge92-Ge94- содержит анионы Ge9 двух сортов,
один из которых имеет форму одношапочной антипризмы, т. е.
весьма похож на Sn94". Второй же, менее симметричный анион
с конфигурацией, близкой к альтернативному 9-координацион-
ному полиэдру, изображен на рис. 3.8,6 (разд. 3.3).
Таблица 7.8. Многоатомные анионы элементов Б-подгрупп
Анион
Те32-
Bi42'
Sn52- 1
Pb52^ >
Sb73"
Ge94- /
Sn94~
Форма
Угловая
Плоский квадрат
Тригональная би-
пирамида
Рис. 19.10,s
См. текст
Одношапочная ан-
типризма
2
3
3
3
2
2
2
М-М, А
2,70
2,94
,89(Х6)
,Ю(ХЗ)
,ОО(Х6)
,23(ХЗ)
,69—2,88
,53-2,80
,93—3,31
Inorg.
Inorg.
Inorg.
J. Am
3313
J. Am
7234
J. Am.
J. Am
3313
Литература
Chcm., 1977, 16,
Chem., 1977, 16,
Chem., 1977, 16
. Chem. Soc,
. Chem. Soc,
632
2482
903
1977,
1976,
Chem. Soc, 1977, 99,
Chem. Soc,
1977
99,
98,
7163
99,
Бесконечные линейные системы связанных между собой ато-
мов металла представляют особый интерес в связи с тем, что
их образование приводит к металлической проводимости.
В Hg3AsF6 (разд. 26.3) цепочки атомов Hg параллельны тетра-
гональным осям а, что обеспечивает «двумерную» проводи-
мость. Иного типа связи металл — металл присутствуют в «од-
номерном» металле [K2Pt(CNL]Br0,3-3H2O (разд. 27.9.5). Ионы
Pt(CNL2~ сочленены в колонки своими параллельными плоско-
стями, вдоль цепи происходит перекрывание dz2 -орбиталей.
В случае (гипотетического) отсутствия ионов Вг~ делокализо-
ванная зона йгъ должна была бы быть заполненной, но ионы
Вг~ удаляют в среднем 0,3 электрона из каждого комплекса.
Поэтому зона заполнена только на 5/б, что и приводит к метал-
лической проводимости вдоль цепей.
Молекулы или ионы, содержащие пары однократно связан-
ных атомов металла без мостиковых лигандов, характерны для
различных переходных металлов в низших степенях окисления,
когда к атомам металла присоединены я-связывающие лиганды.
Таковы [Ni2(CNN]4-, [Pd2(NCCH3N]2+, [Pt2Cl4(COJ]2-,
368 7. Химические связи в молекулах и кристаллах
Мп2(СОI0, Re2(CO)i0, Tc2(COI0 и [Со2(ЫССН3)ю]4-. В этих
комплексах расстояния m—m довольно велики B,09—3,0 А),
вероятно, из-за отталкивания между лигандами, связанными с
различными атомами металла. Промежуточными между соеди-
нениями этого типа и указанными выше молекулами элементов
группы IV Б являются многочисленные молекулы, содержащие
несколько непосредственно связанных атомов металла, из кото-
рых часть — это атомы Си, Аи, Hg, In, Tl, Ge или Sn, а часть —
переходные металлы Мо, W, Mn, Fe, Co, Ir, Pt. Примерами мо-
гут служить
(CeH6KSn-Mn(COM
(C6H6KSn-Fe(COJC6H5
[Cl3Sn-Pt-SnCl3] [N(CH3L]2
Cl,
(C6H5)Mo(COK
I
C5H5(COJFe-Sn-Fe(CO),C5H5
i
(C6H5)Mo(COK
Существует небольшая группа ионов и молекул, в которых осу-
ществляется кратное связывание атомов металла. Такой тип
связывания возможен только для переходных металлов. В эту
группу входят, в частности, ионы Re2Cl82~, Tc2Cl83~ и МогОв*"
с расстояниями m—m 2,24, 2,13 и 2,14 А соответственно. Эти
связи описываются как четырехкратные (ая28), компонента Ь
служит причиной образования заслоненной конфигурации как
указанных ионов, так и аналогично построенной молекулы
Re2Cl6(PEt3J.
Класс 1а. Можно выделить системы (субъединицы) связан-
ных между собой атомов металла, которые далее соединяются
друг с другом лигандами X, причем взаимодействие металл —
металл между различными субъединицами отсутствует. Цикли-
ческую молекулу, показанную ниже, можно описать как состоя-
С6Н„
НМо(С5Н5J
(С5Н5JМоН
С2Н5JО
щую из двух субъединиц Mg—Mo—Mg, соединенных между со-
бой парами мостиковых атомов Вг [Acta cryst., 1975, В31, 852].
Более сложные примеры соединений этого класса включают
Gd2Cl3, Ta2S, Ta6S и ZrCl.
7.5. Связи металл — металл
369
7.5.2. Класс П. Молекулы (ионы), содержащие непосредствен-
но связанные атомы металла и мостиковые лиганды. Этот об-
ширный класс включает все соединения, в которых непосредст-
венное взаимодействие между парами атомов металла дополня-
ется связыванием их другими мостиковыми лигандами. Функ-
ции таких лигандов могут выполнять атомы галогенов, NH2, CO,
SR, PR2, карбоксильные группы или другие хелатные органиче-
ские лпганды. Примерами конечных систем с галогенидными
мостиками служат ионы М2С193~, образованные парой сочленен-
ных по грани октаэдров, в которых короткие расстояния М—М
указывают на взаимодействие поперек общей грани; многочис-
ленные кластерные соединения Nb, Та, Mo, W, Re и также Ag
и Си. О полиядерных карбонилах, в которых часть лигандов СО
выполняет мостиковые функции между атомами металла, и со-
единениях [(COKFe(NH2)]2 и [(C5H5)Co(PPh3)]2 см. гл. 22. По
два карбоксильных мостика присутствуют в таких соединениях,
как Re2(O2CC6H5Jl4, и по четыре мостика— в Мо2(О2ССН3L,
в молекулах Re2(O2CRLX2 и в моногидратах ацетатов Сг(П)
и Си(II)'.
Особенно интересны молекулы или ионы с очень короткими
связями m—m, многие из которых включены в табл. 7.9. Про-
стейшие комплексы представлены типом M2L4, класс б. В ионе
[Mo2(SO4L]3~ присутствуют 4 мостиковые группы SO4, и рас-
стояние Мо—Мо в K3[Mo2(SO4L]-3,5H2O и в K4[Mo2(SO4L]Cl-
•4Н2О соответствует связи с кратностью 3,5. Четырехкратные
связи образуются в молекулах M2L4, где L — это, например,
2,4-диметил-6-гидроксипиримидин (DHMP в табл. 7.9). Их
длины составляют Сг—Сг 1,91 А; Мо—Мо 2,07 А и W—W 2,16 А.
Яиганд ПНМР
8 W2(DHMPL
•сн.
М i55 M
Структуры цианата и фульмината серебра представляют
примеры простых цепочечных структур, в которых реализуется
взаимодействие m—m вдоль цепей:
OCN
ONC
Ag.
NCO
Ag,
Ag'
CNO
OCN'
onc:
370 7. Химические связи в молекулах и кристаллах
Таблица 7.9. Некоторые молекуль
а
а)
б)
в)
г)
Д)
е)
R 6
м^-м' -м—м-
/ \ / \ С ! -¦ [
/ 1 -^ 1 44——
R
ххГ>
м
/|\
Молекула
Re2(O2CC6H5JI4
Cu2(O2CCH3L(H2OJ |
Cu2(O2CCH3L(pyrJ j
Cr2@2CCH3L(H2OJ
Rh2(O2CCH3L(H2OJ
Mo2(O2CCH3L
[Mo2(SO4L13-
W2(DHMPL
Pd2(S2CCH3L
Pt2(S2CCH3L
Re2(O2CC6H5LCI2
Re2OCl3(O2CC2H5J(PPh3J
Re2OCl5(O2CC6H5)(PPh3J
(COKFe(COKFe(COK
(COKFe[Ge(CH3Jl3Fe(COK
(COKCo(COJCo(COK
[Cl3Mo(Cl2)MoCl3lRb3
(COKFe(SC2Hr>JFe(COK
аДругие примеры см. в гл. 9 и
у
, содержащие
г
1
е
х'
М-М, А
2
,20
см. раздел 20
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
22.
,36|
,39j
,09
,17
,16
,75
,77
,24
,51
,52
,46
,75
,52
,38
,54
h
t—Re^
J
\i/
M.
/ i *-,
X .'
/I4
3
Inorg.
связи
г
Ph
металл -
i
зР (Р-
^Re-
Cl 1 Vi
Cl °
Литература
Chem.,
1969, 8,
Acta cryst., 1971, B27,
Acta cryst., 1974, B34,
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Inorg.
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
Chem.,
J. Chem., Soc
286
Inorg.
Chem.,
1979, 18
1979, 18
1979, 18
1980, 19
1968, 7,
1969, 8,
1968, 7,
— ыеталла
^ PPhj
-Re'4
/\ Cl
C!
1299
1664
2768
1159
1152
2258
3632
1570
950
1784
:. (London), 1939,
1969, 8,
1424
Acta cryst., 1964, 17, 732
Inorg.
Inorg.
Chem.,
Chem.,
1969, 8,
1969, 8,
1060
2709
В этот класс входят такие оксиды, как ReO3 и R11O2, в ко-
торых реализуется не только «нормальное» связывание атомов
металла через атомы О, но также определенный вид косвен-
ного взаимодействия («сверхобменное») с участием орбиталей
кислорода.
7.5. Связи металл — металл 371
Класс Па. Этот класс включает все те структуры, в которых
химические единицы класса II соединены дополнительно меж-
ду собой в более объемные ансамбли, но без участия связей
m—гл. Примерами служат: простая цепочка связанных по реб-
рам Nbl4 с чередованием коротких и длинных расстояний
Nb—Xb, цепочечные молекулы в кристаллическом ReCl4, по-
строенные из субъединиц Re2Clg, еще более сложные цепи в
Rel3 (субъединицы Re3lg) и W6Bri6. В весьма необычной струк-
туре последнего соединения кластеры (W6Br8)Br4 объединяют-
ся в бесконечные цепи линейными группами Вг4. Бесконечные
двумерные структуры этого класса включают ReCl3 (построен-
ные из треугольных субъединиц Re3Clg, аналогичных Re3l9, но
дополнительно соединенных не в цепи, а в слои), а также мно-
гочисленные галогениды, состоящие из кластеров двух основных
типов М6Х8 и M6Xi2. Последние могут объединяться также и в
трехмерные системы, что иллюстрируется следующими приме-
рами:
Тип класте-
ра металла
М.Х.
м6х12
Двумерные структуры
МоС12, WC12
Nb6Cl14, Ta6I14
Трехмерные структуры
Nb6I,,
Nb6F15, Ta6ClI5
Более детально структуры этих галогенидов описаны в гл. 9.
Сюда же можно включить диоксиды с искаженными структура-
ми типа рутила, в которых вдоль каждой из «цепей» чередуют-
ся короткие и длинные расстояния m—m (например, 2,5 и 3,1 А
в МоО2 и WO2); фактически же дискретные пары близко рас-
положенных атомов металла объединяются мостиковыми кисло-
родными атомами в трехмерную структуру.
7.5.3. Класс III. Кристаллы, содержащие конечные, одно- или
двумерно-бесконечные комплексы, объединенные связями ме-
талл—металл. В классах I и II были рассмотрены субъедини-
цы, в которых реализуются связи m—m; в случае дополнитель-
ного связывания мостиковыми атомами X их относят к клас-
су II. В классах 1а и Па эти группировки дополнительно свя-
зываются атомами X, но без образования дополнительных свя-
зей m—m. Теперь необходимо обособить следующий класс
структур с многочисленными связями металл — металл (т—т)
между конечными или одно- или двумерно-бесконечными субъ-
единицами. Внутри этих группировок также может осуществ-
ляться m—m-связывание, но не обязательно. Данный класс
372
7. Химические связи в молекулах и кристаллах
включает галогениды и халькогениды (обычно «субсоединения»
с высоким содержанием металла) со структурами, геометриче-
ски похожими на структуры нормальных галогенидов или халь-
когенидов, в которых позиции атомов металла и неметалла вза-
имно обратные. Точно так же как существуют полярные ионные1
структуры, где между атомами галогенов на внешних поверх-
ностях цепей или слоев реализуются только вандерваальсовы
связи, найдены «антицепочечные» и «антислоистые» структуры
таких же геометрических типов, в которых взаимодействие
между цепями (слоями) осуществляется путем связывания
между атомами металла, расположенными на их внешних по-
верхностях. Оксиды металлов с высоким содержанием Rb и Cs
(разд. 12.2.1) могут служить примерами структур, построенных
исключительно из конечных субъединиц, объединенных связя-
ми m—m (Rb9O2), а также и структур, которые можно описать-
как построенные из конечных группировок, внедренных в металл,
причем атомы металла добавляются к аналогичным атомам
субъединиц, как в Rb6O(Rb9O2-Rb3) и Cs7O(CsnO3-Csi0).
7.6. Ионная связь
Ионная связь образуется между заряженными атомами или
группами атомов (комплексными ионами). Она относится к од-
ному из четырех основных типов связи, который можно удов-
летворительно описать в классических (неквантовомеханиче-
ских) терминах. Одноатомные ионы, образованные легкими эле-
ментами подгрупп А, и такие ионы, как N3L~, О2- и т. д., F~
и т. д., обладают конфигурациями инертного газа. Однако кон-
фигурации многих переходных металлов и ионов, содержащих
по два s-электрона (например, Т1+ и РЬ2+), имеют менее сим-
метричное строение. Здесь не будут рассматриваться многочис-
ленные менее устойчивые ионы, существующие в газовой фазе.
Наиболее простые системы с ионными связями представле-
ны газообразными молекулами галогенидов или оксидов щелоч-
ных металлов, структуры которых обсуждаются в гл. 9 и 12.
Важность ионной связи подчеркивается тем обстоятельством, что
именно она определяет существование при обычных температу-
рах в виде устойчивых твердых веществ многочисленных
(и простых и сложных) оксидов и галогенидов металлов, неко-
торых сульфидов и нитридов, огромного числа кристаллических
соединений, содержащих комплексные ионы, в особенности ок-
соионы. Последние могут быть конечными (СО32~, NO3~, SO42""
и др.) или бесконечными в одном, двух или трех измерениях.
Адекватность чисто электростатического описания ионных
кристаллов АтХп продемонстрирована согласованием между ве-
личинами энергий кристаллической решетки, найденными пря-
7.6. Ионная связь 373
мыми расчетами из цикла Борна — Габера и в нескольких слу-
чаях экспериментальными измерениями.
7.6.1. Ионные радиусы. Для вычисления электростатического
вклада в энергию решетки NaCl (или каких-либо других струк-
тур) необходимо знать только относительные позиции атомов и
расстояния между ними. Обе эти характеристики непосредст-
венно определяются из дифракционных данных. Сведений об
относительных размерах ионов не требуется. Если бы ионы
можно было рассматривать как приблизительно несжимаемые
сферы различных размеров со сферически симметричным рас-
пределением заряда, то в принципе мы имели бы возможность
связать способ упаковки ионов с их относительными размерами,
или, иначе говоря, установить взаимосвязь между координа-
ционными числами атомов в различных структурах и их ионны-
ми радиусами. Поскольку экспериментально измеряется только-
сумма радиусов, для этого необходимо принять за отправную
точку один ионный радиус; как правило, выбирают радиус О2~.
Ионные радиусы, приведенные в табл. 7.10, были выведены
путем критического рассмотрения межатомных расстояний в су-
щественно ионных кристаллах (исключение составляют прибли-
зительные значения радиусов для ионов Р3~, As3~, NH4+ и SH~).
Эти радиусы основаны на величине 1,40 А для иона О2~ в 6-ко-
ординации [Acta. cryst., 1976, А32, 751]. В альтернативном на-
боре радиусов [J. Phys. Chem. Solids, 1964, 25, 31, 45], выве-
денном специально для галогенидов щелочных металлов на ос-
нове величины 1,19 А для иона F~, радиусы катионов па —0,14 А
больше и радиусы анионов и а —0,14 А меньше, чем приведен-
ные в табл. 7.10. Очевидно, что увеличение гл и сокращение гх
значительно сказывается на отношении радиусов (см. разд. 7.6.2).
По этой причине мы предпочитаем обсуждать многие структур-
ные аспекты ионных кристаллов не в связи с отношениями ра-
диусов, а в терминах количественно измеряемых межатомных
расстояний. (Вероятно, для некоторых читателей будет интерес-
но узнать, что межатомные расстояния в галогенидах металлов
групп IA и ПА можно точно воспроизвести, используя набор ра-
диусов для «мягких сфер» [J. Chem. Soc. (London), 1978, D,
1631], в котором радиусы М+ и М2Н для 6-координащш точно
равны металлическим радиусам для 12-координации. Межатом-
ные расстояния d вычисляются из этих радиусов по уравне-
нию: d&/3 = M5/s + X5''3. ) Что касается вывода набора ионных ра-
диусов, необходимо отметить, что существует сравнительно не-
много структур, даже среди фторидов и оксидов, в которых
ионы были бы симметрично окружены равноудаленными бли-
жайшими соседними атомами. Для металлов, которые не обра-
зуют бинарных соединений со структурами этого типа, средние
374 7. Химические связи в молекулах и кристаллах
—3
N
1,46
[ Р 1
Li.soJ
ГАз
1.2,20J
[NH4+1
I'.50 J
—2
Ов
1,40
S
1,84
Se
1,98
Те
2,21
он-
1,37
Низкоспиновое
состояние
Высокоспино-
вое состояние
Низкоспиновое
состояние
Высокоспино-
вое состояние
Таблица 7.1С
—1
Fr
1,33
С1
1,81
Вг
1,96
I
2,20
SH-
2,00
Ti2*-
0,86
Ti3+
0,67
+1
Lia
0,76
Na*
1,02
К
1,38
Rb
1,52
Cs
1,67
V2+
0,79
V3+
0,64
. Ионные радиусы, А
+2
Веб
0,45
Mg
0,72
Ca
1,00
Sr
1,18
Bae
1,35
Cr2+
0,73
0,80
Cr3+
0,62
Al
0,54
Sc
0,75
Y
0,90
ЬаД
1,03
Mn2+
0,67
0,83
Mn3 +
0,58
0,65
+4
Ti
0,61
Zr
0,72
Fe2 +
0,61
0,78
pe3t-
0,55
0,65
Agt-
1,15
Zn2+
0,74
Cd2+
0,95
Hg2+
1,02
Co2+
0,65
0,75
Co3<-
0,55
0,61
T1+
1,50
№2+
0,69
Ni3+
0,56
0,60
Pb2+
1,19
Cu2+
0,73
(Gas+)
0,62
aK4 4, 0,59 А. бКЧ 4, 0,27 A. BK4 2, 1,35 А; КЧ 8, 1,42 А. гОтметим, что pac-
o
стояние M—F по меньшей мере на 0,1 А длиннее, чем М—О в ScOF и YOF (разд. 7.6.2).
д КЧ 8, 1,16 А; КЧ 9, 1,22 А.
р О О „,
LK4 8 1,42 А; КЧ 12, 1,61 А. Для Na- л соединении [Na (crypt)]+Na- (разд. 7.5.1)
был предположен радиус, близкий к радиусу иона I—.
межионные расстояния приходится определять из таких струк-
тур, как С-Мп2О3 или LaF3, в которых группы «ближайших со-
седей» располагаются на несколько разных расстояниях, или из
комплексных фторидов или оксидов, содержащих высокосим-
метричные координационные группы. В некоторых структурах
искажение идеальных координационных полиэдров (например,
вокруг Ti4+ или V5+) может указывать на частично ковалентный
характер связей, так что информативность выведенных из этих
7.6. Ионная связь 375
структур «ионных радиусов» довольно сомнительна. Поправки
на КЧ катиона вносились всегда; кажется обоснованным (см.
табл. 7.10) предусмотреть аналогичные поправки и на КЧ анио-
на и, по-видимому, использовать разные радиусы также и для
З^-металлов в низко- и высокоспиновых состояниях.
Мы не будем обсуждать различия между предложенными
наборами ионных радиусов, отметим лишь следующие общие
положения:
а) Размеры положительных ионов существенно меньше, чем
нейтральных атомов того же элемента, благодаря избыточному
заряду ядра по сравнению с зарядом орбитальных электронов.
В то же время радиусы анионов намного больше, чем ковалент-
ные радиусы:
Li
1.5А
0,7А
ср.
С1-
С1
1.8А
1,оА
б) В рядах изоэлектронных ионов радиусы быстро уменьша-
ются при увеличении положительного заряда. Однако сравни-
мого увеличения размера при повышении отрицательного заряда
не происходит (см. значения в горизонтальном ряду табл. 7.10).
в) Большинство ионов металлов по размеру меньше, чем
анионы. Сопоставимые размеры некоторых 'пар катионов и анио-
нов приводят к специфическим семействам плотноупакованных
структур, которые уже были рассмотрены выше. Ниже обсуж-
даются отдельные структуры, содержащие исключительно боль-
шие по размеру ионы Cs+, T1+ и РЬ2+. В структурах галогенидов
и оксидов очень малые ионы Li+ и Ве2+ обычно находятся в
тетраэдрической координации, А13^ и в 4-, и в 6-координациях.
Многочисленные ионы М2+ и М3+ с радиусами в интервале 0,7—
1,0 А в таких структурах обычно координированы октаэдриче-
ски, тогда как самые большие ионы располагаются в позициях
более высокой координации (до 12-координации в сложных
структурах).
г) В противоположность закономерному увеличению радиу-
сов элементов при движении по группе периодической системы
сверху вниз радиусы ионов М3+ 4/-элементов последовательно
уменьшаются при возрастании их атомного номера. Например,
расстояния М—О (для 6-координации) укорачиваются от
La—О B,44 А) до Lu—О B,23 А). В результате этого «ланта-
нидного сжатия» некоторые пары элементов одной группы пе-
риодической системы обладают практически одинаковыми ион-
ными (и атомными) радиусами: например, Zr и Hf, Nb и Та.
Хорошо известно исключительное сходство химических свойств
таких пар элементов. Эффект, аналогичный лантанидному сжа-
тию, наблюдается также и у 5/-ионов.
376 7. Химические связи в молекулах и кристаллах
д) Следует отметить отсутствие простой зависимости радиу-
сов 3<i-HOHOB M2+ и М3+ от числа eg- и /г^-электронов
(разд. 7.6.5).
7.6.2. Отношение радиусов и форма координационного полиэдра.
Рассмотрим случай окружения иона А тремя ионами X. Усло-
вие устойчивости заключается в контакте каждого иона X с А,
поэтому предельный случай реализуется, когда ионы X сопри-
касаются также и друг с другом. Между гА и Гх (радиусы А и
X соответственно) соблюдается следующее соотношение: гА//"х =
2 —
= 0,155. (Если радиус X равен а, тогда гА=-тг"|/За—а = 0,155а.)
Если отношение гА : г% становится меньше этой величины, тогда
все ионы X больше не могут касаться центрального иона А и
данное атомное расположение становится неустойчивым. Если
/"а возрастает, ионы X более не соприкасаются друг с другом,
и когда отношение г а : гх достигает значения 0,225, появляется
возможность расположить вокруг А 4 атома X по вершинам
правильного тетраэдра. В общем случае для симметричных по-
лиэдров критическое минимальное значение отношения гА: гх
равно расстоянию от центра полиэдра до вершины минус длина
половины ребра. Интервалы величин отношений радиусов для
некоторых высокосимметричных координационных полиэдров
¦следующие:
7.6. Ионная связь 377
0,155-
кч
рабносгпоронний
треугольник
-0,255-
правильный
тетраэдр
-0,414-
правильньш
октаэдр
-0,732-
8
куб
Если предполагается плотнейшая упаковка ионов X вокруг А,
то следует ожидать образования координационных полиэдров
с отношением радиусов, отвечающим граням в форме равно-
сторонних треугольников. К примеру, для 8-координации следу-
ет ожидать образования не куба, а додекаэдра с треугольными
гранями или по крайней мере промежуточного полиэдра —
квадратной антипризмы, которая для конечных группировок
АХ8 более устойчива, чем куб. Аналогично для 12-координации
следовало бы ожидать преимущественно существования икоса-
эдра, а не кубооктаэдра, который часто встречается в многочис-
ленных сложных ионных кристаллах. По этой причине
в табл. 7.11 включен ряд координационных полиэдров с тре-
угольными гранями. Для информации о геометрии 7- и 9-коор-
динационных полиэдров читатель отсылается к гл. 3, где при-
ведены примеры 7-, 8- и 9-координаций. Для 5-координации,
будь то в форме тригональной бипирамиды или тетрагональной
пирамиды, величина отношения радиусов не является характе-
ристичной' поскольку для первой из них минимальное отноше-
ние радиусов должно быть то же, что и для конфигурации (в
форме равностороннего треугольника @,155) и, таким образом,
его нельзя считать промежуточным между аналогичными отно-
шениями для тетраэдрической @,225) и октаэдрической
@,414) координации, в то время как для конфигурации в форме
Таблица 7.11. Отношения радиусов
Координа-
ционное
число
4
6
7
8
9
12
Минимал'Ь-
нос отноше-
ние ради-
усов
0,225
0,414
0,528
0,592
0,645
0,668
0,732
0,732
0,902
1,000
Координационный полиэдр
Тетраэдр
Октаэдр
Тригональная призма
Одношапочный октаэдр
Квадратная антипризма
Додекаэдр (бисдисфено-
ид)
Куб
Трехшапочная триго-
нальная призма
Икосаэдр
Кубооктаэдр
тетрагональной пирамиды отношение радиусов должно совпа-
дать с отношением радиусов для октаэдрической координации.
Для комплексных фторидов и оксидов и для кристаллов, со-
держащих комплексные оксо- и фтороионы, соответствие между
относительными размерами ионов и их КЧ в целом можно счи-
тать удовлетворительным. По-видимому, разумно предполо-
жить, что в кристаллах, содержащих комплексные ионы, рас-
положение катионов в позициях с соответствующей координа-
цией реализуется с большей вероятностью, чем в случае очень
простых структур. И действительно, для очень простых струк-
тур АХ и АХ2 возникает множество проблем. Среди галогени-
дов щелочных металлов с отношением радиусов, превышающим
0,732, только CsCl, CsBr и Csl кристаллизуются по типу CsCl.
Такое же преобладание структуры типа NaCl найдено для мон-
оксидов, хотя для SrO, BaO и РЬО можно было бы ожидать
структуру типа CsCl. Моноксиды со структурой типа CsCl фак-
тически не известны. КЧ не превышают шести, хотя пары ио-
25-752
378 7. Химические связи в молекулах и кристаллах
нов К'1" и F~, Ва2+ и О2~ обладают практически одинаковыми
радиусами.
В разд. 6.1 было отмечено, что для структуры типа NaCl
геометрически возможны все конфигурации, лежащие между
двумя предельными случаями: структурой I с плотноупакован-
ными ионами А и структурой II с плотноупакованными иона-
ми X. Аналогично для структуры типа CsCl граничные случаи
соответствуют контактам либо ионов А, либо ионов X. Интерва-
лы величин отношений радиусов для двух предельных конфигу-
раций этих структур следующие:
Структура NaCl
Структура CsCl
0,41
Л ¦*-
0,73 A,00) 1,37
2,4
- I
Каждая из этих структур геометрически возможна в очень ши-
роком интервале отношений радиусов, и при обычных темпера-
турах величины энергии решетки, очевидно, благоприятствуют
устойчивости структуры NaCl для всех галогенидов щелочных
металлов, за исключением CsCl, CsBr и Csl.
Причина реализации кубической координации, а не более
предпочтительных антипризматической или додекаэдрической,
носит чисто геометрический характер. Оба менее симметричных
типа координации часто встречаются в комплексных ионных
кристаллах, в большинстве 8-координированных молекул и ио-
нов, в структурах АХ4 с координацией 8:4 (Thl4, ZrF4, ZrCl4).
Кубическая координация в CaF2 реализуется потому, что невоз-
можно построить трехмерную структуру АХ2 с антипризматиче-
ской или додекаэдрической координацией А и тетраэдрической
координацией X. В структурах АХ4 геометрические ограничения
гораздо менее строгие, чем в АХ2, так как на каждом атоме X
сочленяются только по два 8-координационных полиэдра, а не
четыре, как в структуре АХ2. Этот аргумент с еще большей оп-
ределенностью приложим к структурам АХ, где каждый атом
должен служить общей вершиной для восьми координационных
полиэдров АХ8. КЧ 12, ожидаемое при отношении радиусов,
близком к 1, в структурах АХ и даже шире —в структурах
АтХ„ — не наблюдается, хотя в комплексных галогенидах и ок-
сидах щелочных и щелочноземельных металлов 12-вершинная
координация встречается. Это также чисто геометрическая про-
блема, которая обсуждается далее.
В противоположность моногалогенидам и моноксидам струк-
туры дифторидов элементов II группы выявляют ожидаемое по-
7.6. Ионная связь 379
вышение КЧ с увеличением радиуса катиона:
КЧ элемента А\ 4 16 18
Г.\
Структура
BeF2
0,27
&Ю2-подобная
MgF2
0,72
Рутил
CaF2—BaF2
1,00—1,35 А
Флюорит
о
хотя, как уже указывалось, КЧ и здесь не превышает восьми.
Диоксиды металлов четко подразделяются на структуры с 6- и
8-координациями: меньшие по размеру ионы М4+ (Ti, V, Cr и
Мп) образуют структуру типа рутила, большие по размеру ио-
ны (Ш, Ро, 4/- и 5/-элементы)—структуру типа флюорита.
В гл. 6 было показано, что структура флюорита геометрически
возможна для определенного интервала отношений радиусов
между двумя предельными значениями так же, как это имеет
место и в случаях структур NaCl и CsCl: то же справедливо и
для антифлюоритовой структуры. В последней, типичной для
всех оксидов М2О щелочных металлов, кроме Cs2O (со слоистой
структурой типа анти-CdCb), 4-координация Na+, K+ и Rb+
ионами О2~ явно не соответствует их относительным размерам.
Но для осуществления более вы-
сокой координации М+ в М2О о
должны были бы потребоваться
структуры (вероятно, геометри-
чески невозможные) с координа-
цией, например, 6 : 12 или 8 : 16. ИапраВлЕ1ие,
Во фторидах MF2 отчетливый оси с тетра-
переход от 6-координации в зональной ф
структуре рутила к 8-координа- теики
ции в структуре флюорита замет-
но контрастирует с устойчивостью
6-координации во "фторидах MX.
Выше было показано, что и для
структуры типа NaCl, и для
структуры типа CsCl существуют
две граничные конфигурации и что обе они устойчивы в широ-
ком интервале отношений радиусов. То же относится и к флюо-
ритовой структуре: в предельных структурах соприкасаются
ДРУГ с другом атомы А (случай I) или атомы X (случай II).
В структуре типа рутила может реализоваться только случай II
с приблизительно (гексагональной) плотнейшей упаковкой ато-
мов X и с атомами А, расположенными в октаэдрических поло-
стях. Структура типа I для ионных кристаллов невозможна, так
О
Рис. 7.2. Разрез структуры I, род-
ственной структуре рутила (см.
текст).
380 7. Химические связи в молекулах и кристаллах
как атомы А в окружении каждого атома А находятся на раз-
ных расстояниях: 2 расположены ближе, чем 8 других. Отноше-
ние этих двух расстояний А—А соответствует приблизительно
1,4:1. Такая структура, как видно на рис. 7.2, должна пере-
строиться в 10-координированную сферическую упаковку
(рис. 4.1, г) с парами атомов X в смежных треугольных полостях.
7.6.3. Окружение анионов. Представление об определяющей ро-
ли отношения радиусов привело к недооценке важности учета
координации аниона. В многочисленных структурах оксидов
обеспечение удовлетворительного окружения аниона по мень-
шей мере столь же важно, как и координации катиона. Струк-
туры оксидов металлов обычно принято описывать в терминах
координационных полиэдров катионов. Это удобно, поскольку
их КЧ обычно выше, чем у анионов, и структуры легче пред-
ставлять в терминах полиэдров более высокой координации.
Однако заострение внимания на координации ионов металла
может приводить к недооценке важности расположения ионов
вокруг анионов. Такая информация, к сожалению, часто опуска-
ется во многих в остальных отношениях превосходных описани-
ях кристаллических структур. Образование неожиданно слож-
ной структуры корунда (с октаэдрическими группировками АО6,
соединенными по вершинам, ребрам и граням), вероятно, свя-
зано с трудностью построения плотноупакованной структуры
М2Х3 с октаэдрической координацией М и таким окружением
4-координированных атомов X, которое было бы достаточно
близким к правильно-тетраэдрическому. Аналогичным образом
два вида искаженной октаэдрической координации ионов Мп3+
в кубическом Мп2О3, вероятно, способствуют достижению под-
ходящей 4-координации вокруг ионов О2~. Выбор тетраэдриче-
ских пустот, заселенных атомами А в шпинели АВ2О4 (Vs часть
от общего числа), таков, что обеспечивает тетраэдрическоерас-
положение ЗВ + А вокруг О2^.
Хорошо известная особенность октаэдрических слоистых
структур АХ2 и АХ3 — сильно асимметричное окружение анио-
нов с расположением соседних катионов (трех в АХ2 и двух в
АХ3) по одну сторону от аниона. Однако такое асимметричное
окружение свойственно не только слоистым структурам.
В табл. 7.12 представлены простейшие структуры соединений
АХ2 и АХ3, в которых атом А октаэдрически координирован
шестью атомами (ионами) X. В таблице вместе сгруппированы
структуры тетрагонального рутила и СаС12; в обеих координа-
ция X приблизительно плоская в противоположность координа-
ции в форме пирамиды (с углами между связями 90° для пра-
вильного октаэдра) в структурах АХ2 со связанными по реб-
рам полиэдрами. Простейшие структуры со связанными по реб-
7.6. Ионная связь 381
рам полиэдрами как для АХ2, так и для АХ3 могут быть двух
типов, а именно трехмерными структурами (примеры которых
изображены на рис. 7.3) и слоистыми структурами (в случае
ДХ3 реализуется также и цепочечная структура). Ни одного
примера простых галогенидов с каким-либо из двух типов трех-
мерных структур, отмеченных в табл. 7.12 знаками сносок «а»
Таблица 7.12. Простейшие структуры с октаэдрической координацией А
в соединениях АХ2 и АХ3
Тип структу-
ры АХг
Сочленение
октаэдров
Координация X
Сочленение
октаэдров
Тип структу-
ры АХз
Трехмерная:|
рутил \
СаС12 J
ребра и
6 вершин
Треугольная
Пирами-
дальная
Линейная
Нелинейная
6 вершин
6 вершин
Трехмерная:
ReO3, RhF3
Трехмерная:
атакамита
Слоистая
(Cdl2, CdCl2)
6 ребер
6 ребер
Пирами-
дальная
Пирами-
дальная
Нелинейная
Нелинейная
Нелинейная
3 ребра
3 ребра
2 грани
Трехмерная"
Слоистая
(Bib,
YC1.)
Цепочечная
(Zrls)
аДля простых галогенидов АХ2 примеры не известны (рис. 7.3а).
Структуры основаны на трехмерных 3-связанных сетках; примеры не известны
(рис. 7.3в и г).
и «б», не известно, хотя идеализированная структура одной мо-
дификации Си2(ОНKС1 (атакамит) является структурой этого
типа. С другой стороны, синтезировано множество соединений
со слоистыми структурами. Важно, однако, подчеркнуть, что
несимметричное окружение атомов X не является особенностью,
присущей только слоистым (и цепочечным) структурам. Оно мо-
жет возникнуть и в трехмерных структурах при связывании ко-
ординационных полиэдров по ребрам и граням и найдено, в част-
ности, в РЬС12 и UC13 — трехмерных структурах с более высо-
кими КЧ для атомов А. Не вполне понятно, почему трехмерные
структуры, обозначенные знаками сносок «а» и «б» в табл. 7.12,
не встречаются ни в одном из галогенидов АХ2 или АХ3, но
представляется обоснованным предположить, что слоистые
структуры образуются благодаря высокой поляризуемости круп-
ных ионов галогена. Слоистые структуры характерны также для
382 7. Химические связи в молекулах и кристаллах
а
Рис. 7.3. а — трехмерный октаэдрический каркас состава АХ2, выведенный из
структуры типа NaCl путем удаления чередующихся рядов ионов металла, как
показано на рис. 4.22, б. Хотя каждый атом X образует три пирамидально
расположенные связи (как в слоях CdCb или Cdl2), эта структура не реали-
зуется ни в одном соединении АХ2, но представляет идеализированную струк-
туру одной модификации минерала атакамита Cu2(OHKCl. При введении до-
полнительных атомов (В) в позиции с тетраэдрической координацией образуется
структура типа шпинели для соединений А2ВХ4. Показаны позиции ограни-
ченного числа атомов В.
Рис. 7.3. б — октаэдры ВХ6, сгруппированные по тетраэдру вокруг точек ал-
мазной сетки, образуют связанный по вершинам каркас ВХ3 (В2Х6) структуры
пирохлора для соединений А2В2Х6(Х); седьмой атом X не принадлежит окта-
эдрическому каркасу. В Hg2Nb207 седьмой атом О и атомы Hg образуют кар-
кас типа куприта (Си2О), в котором четыре связи атома О расположены тетра-
эдрически, две связи атома Hg — коллинеарно.
7.6. Ионная связь 383
Рис. 7.3. виг — две (неизвестные) структуры АХ3, в которых октаэдрические
группировки АХ6 обобществлены по трем ребрам, как в слоях СгСЬ или Bil3.
Здесь атомы А расположены в точках трехмерной 3-связанной сетки (вместо
плоской шестиугольной сетки в слоистых структурах). В структуре в, основан-
ной на кубической A0,3)-сетке рис. 3.28, атомами X заселены 3Д позиций куби-
ческой плотнейшей упаковки (ср. со структурой ReO3). Сферами показаны по-
лиции удаленных атомов плотнейшей упаковки. В структуре г, основанной на
A0,3)-сетке рис. 3.29, атомами X заняты все позиции кубической плотнейшей
упаковки.
большинства ди- и тригидроксидов, поскольку поляризуемость
ионов ОН~" промежуточная между поляризуемостями F~ и С1~.
В этих структурах отрицательные заряды анионов должны ло-
кализовываться вблизи катионов, в результате чего внешние по-
верхности слоев становятся нейтральными (рис. 7.4, а). В цепо-
чечной структуре АХ3 (табл. 7.12) цепи сочлененных по граням
октаэдров перпендикулярны плоскостям плотноупакованных
атомов X (рис. 7.4,6). Малое различие в устойчивости слоистых
и цепочечных структур галогенидов АХ3 объясняется большим
вандерваальсовым вкладом в энергию решетки, обусловленным
тем, что плотная упаковка атомов X обеспечивает максималь-
384 7. Химические связи в молекулах и кристаллах
ное число контактов X—X между слоями или цепями. Многие
из этих галогенидов (TiCl3, ZrCl3, RuCl3) кристаллизуются в
обоих типах структуры.
7.6.4. Ограничения координационных чисел. Выше уже упомина-
лось, что среди ионных соединений АтХ„ отсутствуют структу-
ры с координационными числами атомов А, превышающими 8
или 9. Если вывести двумерные сетки, в которых А окружен не-
которым числом (р) ближайших соседних атомов X, а X —
числом (q) атомов А, то выяснится, что из всех (р, <?)-связан-
Ионные связи
Вандерваальсобы
связи
7.6. Ионная связь 385
Рис. 7.4. а — схематический разрез слоистой структуры АХ3 (слои перпендику-
лярны плоскости рисунка); б —цепочечная структура АХ3 в разрезе, перпен-
дикулярном направлению цепей.
ных сеток (р и <7^3) с чередующимися р- и ^-связанными точ-
ками возможны только сетки C,4), C,5) и C,6). Поскольку
значения р и q в плоских сетках имеют верхние пределы, резон-
но предположить, что это же справедливо и для трехмерных се-
ток. Насколько нам известно, данная проблема пока не изуче-
на. Однако существование или отсутствие кристаллических
структур с высокими КЧ не является просто предметом тополо-
гии (связанности); необходимо учесть и размерные факторы.
В структурах аАт*Хп, где а и х — это КЧ атомов А в окру-
жении X и атомов X в окружении А соответственно, каждый
атом А служит точкой сочленения а полиэдров ХА* и каждый
атом X — точкой сочленения х полиэдров АХа (в предположе-
нии одинакового окружения всех атомов каждого сорта).
В гл. 5 было показано, что с учетом размеров атомов X в одной
точке могут сочленяться, т. е. иметь общую вершину (атом X),
не более шести правильных октаэдров АХ6, хотя при достаточ-
ном искажении октаэдров (разд. 5.1.2) их число и может повы-
ситься до восьми (в ТЬзР-О, а возможно, и до девяти. Поэтому
можно сконструировать каркас состава АХ2, в котором каж-
дый А соединен с 12 атомами X и каждый X —с шестью А, т. е.
структуру типа А1В2. Но в такой структуре атомы В не могут
иметь октаэдрическую координацию. Такую структуру можно
построить лишь из координационных полиэдров В в форме три-
гональных призм, поскольку 12 тригональных призм действи-
тельно могут сочленяться в одной точке, хотя при этом некото-
рые атомы В очень сильно сближаются друг с другом: расстоя-
*ния в—В равны 1,73 А, тогда как А—В = 2,37А; А—А=3,01 и
3,26 А. С повышением К.Ч и увеличением числа координацион-
ных полиэдров, сочленяющихся в данной точке, не только сни-
жается многообразие типов координационных полиэдров (в од-
ной точке могут сочленяться 6 правильных октаэдров, 8 кубов
или тетраэдров или 12 тригональных призм), но и возрастет
число общих ребер и граней, по которым соединяются между
собой эти координационные полиэдры. В результате расстоя-
ния между атомами одного сорта укорачиваются. В структуре
А1Вг, представляющей собой предельный случай, очень корот-
кие расстояния В—В (ковалентные связи) соответствуют рас-
стояниям между центрами тригональных призм ВА16 поперек их
общих прямоугольных граней. Хотя эта специфическая структу-
ра с координацией 12: 6 существует, возможны не все структу-
ры с координацией 12:6 — это становится очевидным при изуче-
нии следующего специального набора структур.
В структуре AuCu3 с координацией 12:4 каждый атом Аи
окружен 12 равноудаленными соседними атомами Си, каждый
атом Си —четырьмя соседними Аи и восемью Си*. Эту струк-
туру можно считать представителем семейства кубических плот-
ноупакованных структур АтХ„, в которых каждый атом А окру-
жен 12 ближайшими соседними атомами X. Соседями атома X
в этих гипотетических структурах должны быть 12т/я ато-
мов А плюс дополнительные атомы X в количестве, необходи-
мом для укомплектования 12-координационного полиэдра:
I (АХ) А3Х4 А2Х3 АХ2 I АХ3 АХ4 АХ6 (AXi2)
Координационный
полиэдр X
A2
А)
9
3
А
X
8
4
А
X
6
6
А
X
4
8
А
X
3
9
А
X
2
10
А
А
(А)
A1 X)
Две первые структуры можно отбросить сразу, так как очевид-
но, что атом X в любом случае соприкасается с четырьмя X,
находящимися в координационной сфере атома А (в вершинах
кубооктаэдра), но можно пойти и дальше и показать, что все
Относительно другой A2,4)-связанной сетки см. рис. 23.19, разд. 23.12.8.
386
7. Химические связи в молекулах и кристалл.
структуры, расположенные слева от центральной вертикальной
линии, невозможны. В кубической плотнейшей упаковке коор-
динационный полиэдр атома представляет собой кубооктаэдр,
и в перечисленных выше структурах координационный полиэдр
атома X укомплектован определенными наборами атомов А и X.
Поскольку А окружен исключительно атомами X, нельзя поме-
щать атомы А в смежные вершины кубооктаэдра, окружающе-
го атом X. Поэтому проблема заключается в нахождении мак-
симального числа вершин кубооктаэдра, которые можно засе-
лить атомами А, не размещая их в смежных вершинах. Легко
показать, что это число равно 4 и что возможны только дваспо-
Рис. 7.5. Координация атомов X в плотноупакованных структурах АХ3 и АХ4
(см. текст).
соба расположения, изображенные на рис. 7.5, а и б. (Здесь
же, на рис. 7.5, в, показано решение для случая ЗА+ 9Х —комп-
ланарного расположения трех атомов А, которое могло бы осу-
ществляться в структурах АХ4.) Конфигурация типа а найдена
в структуре AuCu3. Очевидно, что плотноупакованные структуры
для таких соединений, как KF A2: 12) и BaF2 A2:6), с 12-ко-
ординированными катионами невозможны. В тех немногочис-
ленных тригалогенидах, в которых ионы М3+ сравнимы по раз-
меру с ионами галогена (например, в трифторидах La3+ и еще
больших по размеру ионах 4/- и 5/-металлов), структура типа
AuCu3 с координацией атома Си четырьмя атомами Аи в форме
плоского квадрата не обнаружена. Предположительная причи-
на этого заключается в том, что в реализуемых структурах ко-
личество контактов X—X меньше, а энергия решетки выше. Ни-
триды Rb3N и Cs3N, по-видимому, не известны. Эта структура
не характерна и для триоксидов из-за отсутствия ионов М6+,
сравнимых по размеру с ионом О2~. Впрочем, не стоит делать
вывод об устойчивости или неустойчивости структуры, исходя
лишь из относительного числа атомных контактов А—X, X—X
и А—А, ведь контакты анион — анион реализуются во многих
ионных структурах, например в ВеО (О—О 2,70 A), LiCl
(С1—С1 3,62 А) и CaF2, где F окружен четырьмя соседними ато-
7.6. Ионная связь 387
мами Са и дополнительно к этому соприкасается еще с шестью
атомами F (F-F2.73A).
7 6 5. Теория поля лигандов. Хотя во многих ионных кристаллах
расположение ближайших соседей вокруг ионов каждого сорта
характеризуется высокой симметрией, известно множество
структур и с менее симметричными координационными поли-
эдрами. В структурах некоторых простых соединений, напри-
мер La2O3 или моноклинного ZrO2, само КЧ катиона предоп-
ределяет значительно менее симметричное расположение (семи)
соседей, чем это возможно для КЧ 4 или 6. В других случаях
координационный полиэдр лишь незначительно отклоняется от
высокосимметричного окружения и понижение симметрии* имеет
чисто геометрическую основу, как, например, в структурах рути-
ла или корунда, хотя и другие факторы (такие, как частично
ковалентный характер связей) во всех случаях исключить нель-
зя. Можно упомянуть здесь также очень небольшие искажения
кубической структуры у MnO, FeO, CoO и NiO ниже их тем-
ператур переходов, связанные с процессами магнитного упоря-
дочения, и искажения кубической симметрии в ВаТЮ3, KNbO3
и других структурах перовскитового типа, связанные с сегнето-
электрическими эффектами. Они рассматриваются в гл. 12 и
13. Иную причину имеет искажение координационных полиэд-
ров, характерных для определенных ионов переходных метал-
лов, таких, как Сг2+, Си2+ и Мп3+.
Естественно ожидать, что свойства иона, плотно окружен-
ного другими ионами противоположного заряда, должны зави-
сеть не только от их размеров и поляризуемости, но и от струк-
туры их внешних электронных оболочек. Необходимо различать
между собой: а) ионы с заполненными 8- и 18-электронными
оболочками, б) ионы с незаполненными внешними оболочками
с двумя s-электронами (In+, T1+, РЬ2+), в) ионы переходных
металлов с незаполненными d-оболочками. Теоретическое изу-
чение взаимодействий ионов переходных металлов с окружаю-
щими ионами проливает свет на природу несимметричных коор-
динационных полиэдров некоторых из этих ионов.
Электростатическая теория, или, иначе, теория кристалличе-
ского поля, была первоначально разработана Бете, Ван Флеком
и др. в период 1929—1935 гг. для учета магнитных свойств со-
единений переходных и редкоземельных металлов, в которых
имеются несвязывающие d- или [-электроны. Альтернативный
метод молекулярных орбиталей был предложен Ван Флеком
тоже в 1935 г. После периода относительного забвения начиная
с 1950 г. обе теории начали широко использоваться для объяс-
нения спектроскопических, термодинамических и стереохимиче-
ских свойств конечных комплексов переходных металлов и не-
388
7. Химические связи в молекулах и кристаллах
которых аспектов строения кристаллических соединений. Элек-
тростатическая теория и теория МО представляют собой два
подхода к проблеме, имеющие дело с влиянием несвязываю-
щих й- или /-электронов на поведение переходных элементов
(включая 4/ и 5/-элементы), и их можно рассматривать как
аспекты общей теории поля лигандов. В противоположность
теории валентных связей, которая в первую очередь относится
к связывающим электронам, теория поля лигандов рассматри-
вает воздействие электрического поля, создаваемого окружаю-
щими лигандами, на энергетические уровни всех электронов во
внешней оболочке центрального атома. Поскольку из-за огра-
ниченного объема книги нет возможности привести адекватное
описание теории поля лигандов и поскольку в книге не рассмат-
риваются такие специальные разделы физической химии, как
оптические спектры комплексов переходных металлов, мы огра-
ничимся лишь теми моментами, которые касаются геометрии
строения молекул (и комплексных ионов) и кристаллов.
а) Предпочтение тетраэдрической или октаэдрической коор-
динации. Когда ион переходного металла окружен правильной
тетраэдрической или октаэдрической группировкой ионов (или
диполей), пять его d-орбиталей более не характеризуются оди-
наковой энергией, а расщепляются на две группы — дублет es
и триплет tzg. Лиганды можно расположить в ряд по их способ-
ности расщеплять rf-орбитали (спектрохимический ряд): 1~<<
<Br-<Cl-<F-<OH-<C2O42-~H2O<NCS- < руг « NH3 <
<;en-<NO2~<CN^. Здесь разность между средними энергиями
двух групп орбиталей eg и ^g(A) увеличивается слева направо.
Если разность А велика (сильное поле лигандов), максимально
возможное число электронов располагается на орбиталях с
меньшей энергией. В случае октаэдрического окружения — это
орбитали t2g, в случае тетраэдрического — орбитали eg. Если же
величина А мала, электроны распределяются так, чтобы макси-
мальным было число электронов с параллельными спинами. Это
показано в табл. 7.13, из которой исключены низкоспиновые
(сильное поле лигандов) тетраэдрические комплексы, посколь-
ку ни один из них не известен. В соответствии со сказанным
цианидные и нитритные комплексы характеризуются низкоспи-
новой конфигурацией, а аква- или галогенидные комплексы —
высокоспиновой конфигурацией*. Основными факторами, при-
водящими к спариванию спинов, по-видимому, являются высо-
кая электроотрицательность металла (т. е. большой атомный
* Это утверждение не вполне правильно. Выбор спинового состояния в
большой степени зависит от природы и валентного состояния металла. Напри-
мер, комплексные галогениды Со(III) являются низкоспиновыми, а нитриты
Ni(II) —высокоспиновыми. — Прим. ред.
7.6. Ионная связь 389
помер и высокая валентность) и низкая электроотрицательность
лпганда, который должен обладать легкополяризующейся непо-
делешюй парой электронов и быть способным образовывать
связи dn—Рп или dn—dn путем перекрывания своих вакантных
орбиталей рл или d^ с заполненными ^г-орбиталями металла.
В правильном октаэдрическом поле энергия орбиталей ее
выше энергии орбиталей /2g на Докт и простой электростатиче-
ский подход дает для иона с конфигурацией {t2g)m{ee)n величи-
Таблица 7.13. Электронные структуры ионов переходных металлов
Число
электронов
1
2
4
5
6
7
9
а- бСиль
Октаэдрическое окружение
Слабое поле
1
t t
t t
t t
t *
ii t
11 ii
ii ii
ii ii
t
1
1
t
t
ii
ii
t
t
t
t
»
1
1
лигандов
г
-
a
t
*
t
t
t a
Сильное поле
t
T
1
u
11
11
11
11.
11
ное тетрагональное искажение
Сильное тетрагональное искажение (с
t ;
* t
и t
u u
11 11
11 11
11 11
(обычно
: a<\).
лигандод
-
—
-
t
t t
11 t
с : а>\,
Тетраэдрическое
окружение
слабое поле
eg f4
t
t t
t t t
t 1 t T
t t t ! t
11 t t t t
г 11. t 1 t
ii г u 1 t
и г u u t
io см. разд. 20.3).
6
6
6
в
ну энергии стабилизации в кристаллическом поле, равную
ДоктD/л—6я)/10. Из табл. 7.13 следует, что среди высокоспино-
вых конфигураций (слабое поле) максимальной энергией ста-
билизации характеризуются следующие ионы: ds(V2+, Cr3+,
Мп4+) и <i8(Ni2+). В правильном тетраэдрическом поле относи-
тельные энергии двух наборов орбиталей взаимно обратные,
и соответствующая энергия стабилизации кристаллическим по-
лем для конфигурации (eg)p(t2gL равна ДтетрFр—4^)/10 и
максимальна для ионов d2(Ti2+, V3+) и d7(Co2+). Из этого сле-
дует, что в преимущественно ионных комплексах Со(II) должна
преобладать тенденция к тетраэдрической, а в комплексах
Ni (II)—к октаэдрической конфигурациям. В структуре нор-
мальной шпинели сложных оксидов АВ2О4 атомы А заселяют
тетраэдрические, атомы В — октаэдрические позиции, но в не-
которых («обращенных») шпинелях ионы распределяются по
двум типам узлов по-другому. Вполне очевидно, что эти энергии
стабилизации имеют прямое отношение к обсуждению пробле-
мы распределения ионов различных переходных металлов по по-
зициям структуры шпинели (см. гл. 13).
390 7. Химические связи в молекулах и кристаллах
б) Искаженные координационные полиэдры. При несиммет-
ричном заполнении подгрупп орбиталей, в особенности подгруп-
пы с более высокой энергией, искажение правильного октаэдри-
ческого или тетраэдрического полиэдра приводит к более устой-
чивой конфигурации по сравнению с исходной (искажение по
Яну — Теллеру). Из табл. 7.13 следует, что для октаэдрических
комплексов слабого поля этот эффект должен быть наиболее
выражен в случае конфигураций d4(Cr2H, Mn3+) и d9(Cu2+).
В результате происходит тетрагональное искажение октаэдра;
обычно его растяжение (с:а>1) соответствует удлинению двух
связей по обе стороны от экваториальной плоскости—D + 2)-
коордииация. Примерами служат искаженные структуры типа
рутила CuF2 и CrF2 (ср. с правильной октаэдрической коорди-
нацией Сг3+ в СгРз); D+2)-координация найдена и во многих
других соединениях двухвалентной меди. Структурная химия
соединений Си(II) [и изоструктурных соединений Сг(Н)] де-
тально описана в гл. 25. Для Мп(Ш) имеется меньше данных,
но оба типа искажения октаэдра выявлены (в дополнение к пра-
вильной октаэдрической координации в Мп(асасK — особом
случае комплекса с тремя бидентатными лигандами, связанны-
ми с атомом металла):
MnF3a
K2MnFs-H2O
(разд. 10.1.4)
K2MnF3(SO4)
(разд. 16.8.2)
Mn(acacK
Межатомные
2 F—1
о р 1
^ г — *
4 F—1
2 F—1
79 А
Q1 А
У1 /Л
83 А
82 А
6 0—
расстояния М—X
2
2
2
2
1,!
F-2,
F—2,
F—2,
0-2
39 А
09
07
04
01
А
А
А
А
Литература
Ada cryst., 195
J. Chem. Soc.
A, 1971, 2653
J. Chem. Soc.
A, 1971, 3074
Inorg. Chem.,
1994
7, 10, 345
(London),
(London),
1968, 7,
Из рентгенографических порошковых данных; существенным может быть факт,
что среднее по четырем коротким длинам связей близко к наиболее коротким расстоя-
ниям Mn—F, найденным в других соединениях.
В тетраэдрическом поле орбитали t2g приобретают более высо-
кую энергию; в этом случае сильное искажение по Яну — Тел-
леру ожидается для конфигураций d3, d4, ds и d9. Искажение
может реализоваться в форме удлинения или уплощения тетра-
эдров, как показано в табл. 7.13. Уплощенный тетраэдрический
ион СиС142~ описан в гл. 25, но интересно отметить, что
H (разд. 27.8.1) ион №С142^ не искажен.
7.6. Ионная связь 391
Известны многочисленные кристаллические структуры, являю-
щиеся вариантами более симметричных структур с искаже-
ниями характерного ян-теллеровского типа. К ним относятся
следующие структуры (в скобках указаны их исходные неиска-
женные прототипы): CrF2 и CuF2 (рутил); СиС12-2Н2О
(СоС12-2Н2О); CuCl2 (Cdl2); MnF3 (VF3) и 7-MnO-OH
(у-АЮ-ОН). Это структуры с октаэдрической координацией
ионов металла. Примеры искаженной тетраэдрической коорди-
нации, приводящей к понижению симметрии, включают шпинели
CuCr2O4 и NiCr2O4, содержащие Cu2+ (d9) и Ni2+ (ds) соответ-
ственно.
Если шесть лигандов в искаженном октаэдре неодинаковые,
то возникает вопрос: какие из них будут расположены на нор-
мальных расстояниях от иона металла и какие будут более уда-
ленными в D+2)-координации? Например, в кристаллах
СиС12-2Н2О и К2СиСЦ-2Н2О в координации Си участвуют:
2С1 на расстоянии 2,зА я
„ _ о и 2С1 на расстоянии 2,95А
. 2Н2О на расстоянии 2,0А
а не четыре С1 или четыре Н2О в качестве ближайших соседей.
Аналогичные вопросы возникают для структур гидратов галоге-
нидов переходных металлов (к примеру, структура FeCl3-6H2O
фактически соответствует [FeCl2(H2OL]Cl-2 Н2О), как показано
в гл. 15. По-видимому, в настоящее время удовлетворительные
ответы на эти более тонкие структурные вопросы еще не могут
быть даны.
7.6.6. Структуры комплексных ионных кристаллов. Термин
«комплексный ионный кристалл» приложим к твердым фазам
двух классов. В MgAl2O4 или KMgF3 связи между всеми парами
соседних атомов преимущественно ионного характера, так что
такие кристаллы должны рассматриваться как трехмерные набо-
ры ионов. Анионами являются О2"", F~ или реже S2~ или С1~.
Структуры многих из этих комплексных («смешанных») окси-
дов или галогенидов родственны со структурами простых окси-
дов или галогенидов и выводятся из более простых структур
А„,Х,, упорядоченным или статистическим замещением атомов А
ионами различных металлов (см., например, табл. 13.1,
разд. 13.2), хотя известны также и структуры, характерные
только для комплексных оксидов или галогенидов. Они описаны
в гл. 10 и 13. Во втором большом классе кристаллов можно раз-
личить прочно соединенные группы атомов, внутри которых
в определенной степени реализуется обобщение электронов;
общий заряд группы распределяется по периферическим ато-
мам. Такие комплексные ионы могут быть конечными либо бес-
конечно простирающимися в одном, двух или трех измерениях.
392 7. Химические связи в молекулах и кристаллах
Структуры многих одноядерных комплексных ионов были уже
рассмотрены при обсуждениях простых молекул и ионов. Струк-
туры многоядерных кохмплексных ионов описываются ниже, при
рассмотрении химии соответствующих элементов.
Ниже для простоты обсуждаются только комплексные окси-
ды и комплексные оксосоли, но те же принципы применимы
и к комплексным фторидам и ионным оксофторидам. Комплекс-
ный оксид представляет собой набор ионов О2~ и катионов раз-
личных сортов, радиусы которых изменяются от примерно поло-
вины радиуса иона кислорода до величин, намного его превосхо-
дящих. В этой связи обычно ссылаются на определенные обоб-
щения, касающиеся структур комплексных ионных кристаллов
и часто называемые «правилами» Полинга. Первое из них свя-
зывает КЧ элемента Мт+ с соотношением радиусов гм : г0. Общее
повышение КЧ с увеличением отношения радиусов настолько
хорошо известно, что не требует здесь дополнительного обсуж-
дения. Для простых ионных кристаллов взаимосвязь между КЧ
и размером ионов осложнена такими факторами, как невозмож-
ность образования альтернативных структур и различная поля-
ризуемость ионов. Но для кристаллов, содержащих комплекс-
ные ионы, установлена приемлемая корреляция между КЧ
катионов и их размерами. Например, множество солей МХОз
кристаллизуется в одной из двух структур (или в обеих):
в структуре типа кальцита, где атом М окружен шестью атома-
ми кислорода, и в структуре типа арагонита, в которой атом М
имеет КЧ, равное 9. (Арагонит — одна из трех фаз высокого
давления СаСО3. Эта модификация устойчива при давлении
до 15 кбар и при обычных температурах [Acta cryst., 1975, В31,
343].) Тип структуры определяется размером катиона.
Структура кальцита: LiNO3, NaNO3;MgCO3, CaCO3, FeCO3; InBO,, YBO3
Структура арагонита: KNO3; CaCO3, SrCO3, LaBO3
(Для таких солей, как RbNO3 и CsNCb, содержащих ионы еще
большего размера, ни одна из этих структур не реализуется.)
Второе «правило» постулирует, что заряды по возможности
нейтрализуются локально. В более точной форме этот принцип
выражается через понятие электростатического валентного уси-
лия связи и формулируется следующим образом. Если катион
с зарядом -\-ze окружен п анионами, усилие связей катиона
с его соседним анионом равно z/n. В координационном откаэдре
MgOe валентное усилие связи Mg—О равно 7з! в октаэдре AlOs
усилие связи А1—О равно ]/г- Если О2^ образует часть некото-
рого координационного полиэдра, сумма валентных усилий свя-
зей, сходящихся на О2~, должна быть равной 2 — численному
значению заряда аниона. Если катион окружен различными
количествами неэквивалентных анионов на неодинаковых рас-
7.6. Ионная связь 393
стояниях, то валентные усилия связей различаются. В моноклин-
ном ZrO2' катион Zr4+ 7-координирован тремя d на расстоянии
2,07 А и четырьмя Он на расстоянии 2,21 А. У этих анионов КЧ
равно 3 и 4 соответственно. Приписав валентным усилиям свя-
зей значения 2/з и 1/2 (для более коротких и более длинных свя-
зей соответственно), получим точный баланс зарядов у всех
ионов.
Во многих кристаллах, преимущественно ионного характера,,
координационные полиэдры сочленяются по вершинам и (или)
по ребрам и значительно реже по граням. Третье правило
Полинга постулирует, что наличие общих ребер и особенно
общих граней между координационными полиэдрами понижает
устойчивость структуры, поскольку вследствие этого катионы
сближаются друг с другом. Этот эффект особенно велик для
высокозаряженных катионов с небольшими координационными
числами. Из этого правила следует, что в кристаллах, содержа-
щих разносортные катионы, катионы с высоким зарядом
и небольшим КЧ стремятся не иметь друг с другом общих эле-
ментов координационных полиэдров, т. е. проявляют тенденцию
располагаться в структурах максимально далеко друг от друга..
Эти обобщения, берущие начало от эмпирических «правил»,
были разработаны при ранних исследованиях структур (глав-
ным образом минералов, особенно силикатов). Они непримени-
мы к структурам простых ионных кристаллов, в которых сочле-
нение ребер (и иногда граней) координационных полиэдров
необходимо по чисто геометрическим причинам. Например,
в структуре NaCl октаэдры NaCb (или ClNa6) сочленены каж-
дый всеми своими 12 ребрами, в структуре CaF2 тетраэдры
FCa4 — всеми шестью ребрами. В структуре рутила каждый
октаэдр TiO6 соединен по двум ребрам, в а-А12О3 сочленяются
вершины, ребра и грани координационных полиэдров АЮ6.
В гл. 5 было показано, что обобщение ребер (и граней) коорди-
национных октаэдров в этих простых структурах имеет простое
геометрическое объяснение. Однако этой же особенностью отли-
чается множество более сложных структур, построенных из коор-
динационных октаэдров. И действительно, многие комплексные
оксиды переходных металлов (V, Nb, Mo и W) характеризуются
широкой распространенностью довольно компактных групп
сочлененных по ребрам октаэдров. Между собой эти группы
часто соединяются по вершинам в дву- или трехмерные ансамб-
ли, как описано в гл. 5 и 13. Даже в некоторых простых окси-
дах, например в МоО3, установлено значительное связывание
по ребрам, которое, однако, отсутствует в химически сходном
WO3. Так как эти соединения образованы переходными метал-
лами в высших степенях окисления, можно полагать, что эта
особенность их структур служит указанием на частично кова-
26—752
394 7. Химические связи в молекулах и кристаллах
лентный характер связей; и действительно, в таких структурах
часто наблюдается значительное искажение октаэдрической
координации (точнее следовало бы сказать: «значительный
интервал длин связей М—О», поскольку октаэдры из кислород-
ных атомов могут быть почти идеально правильными, но ато-
мы М смещены из их центров).
Покажем теперь, что рассмотрение обоих факторов, размер-
ного и принципа локальной компенсации зарядов, приводит
к определенным интересным выводам применительно к солям,
содержащим комплексные ионы.
7.6.7. Структура и устойчивость безводных оксосолей Мт(ХОп)Р.
В течение многих лет основное внимание уделялось той части
электронной плотности комплексных ионов, которая относится
к связям внутри ионов, поскольку именно этим определяются
детали их строения. В данном разделе главное внимание будет
обращено на ту часть заряда, которая находится на периферии
иона. Именно она служит прямым указанием на возможность
или невозможность построения кристаллов солей, содержащих
эти ионы, а следовательно, и на такие чисто химические пробле-
мы, как устойчивость (или существование) безводных ортосолей
(в противоположность гидратированным солям и кислым
солям), как способность NO3~ и других ионов выступать в роли
бидентатных лигандов. При этом обратим внимание на важ-
ность чисто геометрических факторов, которые, до некоторой
степени неожиданно, никогда не рассматривались в сочетании
с «правилами» Полинга для комплексных ионных кристаллов.
Рассмотрим кристалл, построенный из катионов и оксоионов
ХОЯ, и для простоты предположим, что заряд аниона ХО„ рас-
пределен симметрично по всем кислородным атомам (так что на
каждом из них он составляет: —1 в случае SiO44~, —3U в РО43~,
—7г в SO42^, —lU в СЮ4-) и аналогично для ионов ХО3. Эти
атомы кислорода образуют координационные полиэдры вокруг
катионов, которые должны быть расположены соответствующим
образом для локальной компенсации зарядов. Например,
в структурах NaNO3, СаСОз, 1пВОз, относящихся к типу каль-
цита, катионы имеют октаэдрическую координацию, и, следова-
тельно, силы электростатических связей М—О равны -f-'/e, -f-'/з
и +72 соответственно. Они компенсируются в том случае, если
каждый атом кислорода принадлежит к двум координационным
полиэдрам О
7.6. Ионная связь 395-
О.
О'
;N —О
О
:с-о;
ск
В--0
В следующей группе солей заряд на атомах кислорода повы-
шается в указанном порядке:
Заряд на каждом ато-
ме кислорода
NaClO4
-1/4
i\a,SO4
-1/2
Na3PO4
-3/4
Na4Si04
— 1
При октаэдрической координации Na+ сила электростатиче-
ской связи Na—О равна 7б- Поэтому в Na4Si04 каждый кисло-
родный атом должен принадлежать одному тетраэдру (SiO4)
и шести октаэдрам (ЫаОб), или, другими словами, 1 тетраэдр
и 6 октаэдров должны сочленяться в одной общей вершине
(атом О). Но число полиэдров, которые могут сочленяться
в одной точке так, чтобы вершины различных полиэдров распо-
лагались одна от другой не ближе чем длина ребра полиэдра,
имеет определенный предел, как это было показано в гл. 5
для тетраэдров и октаэдров. Систематического изучения допу-
стимых комбинаций полиэдров различных видов, которые могут
иметь общую вершину (подчиняясь указанному выше условию),
по-видимому, еще не проводилось, но разумно предположить,
что, как правило, это число будет уменьшаться при увеличении
размера полиэдров. В настоящем случае факторами, которые
усиливают эти чисто геометрические затруднения, являются уве-
личение размера и(или) числа координационных полиэдров,
которые (в дополнение к самому оксоиону) должны сочленяться
на каждом атоме кислорода. Проблема поэтому становится
особенно острой, если:
заряд аниона высокий (точнее, высокий заряд на атомах О
аниона);
заряд катиона невысокий;
КЧ катиона велико (объемный катион).
В качестве примера был взят тетраэдрический оксоион.
Понятно, что та же проблема возникает и для других оксоионов
ХО3, ХО6 и т. д. Цифры в табл. 7.14 соответствуют просто числу
связей М—О, необходимых для уравновешивания заряда на ато-
ме кислорода из оксоиона. Нецелочисленные величины, которые
в качестве средних значений должны получаться для неэквива-
лентных атомов кислорода, опущены. По всей видимости, струк-
туры, расположенные в табл. 7.14 ниже и справа от ступенча-
тых линий, геометрически просто невозможны. При использова-
нии этой информации применительно к конкретным соединениям
следует принять приемлемые координационные числа для катио-
нов. Например, при тетраэдрической координации Li+ ни одна
из литиевых солей не создает никаких геометрических проблем.
То же относится к солям натрия в предположении его 6-коор-
26*
396 7. Химические связи в молекулах и кристаллах
7.6. Ионная связь 397
динации; исключение составляет Na6Te06. Рассматривая соеди-
нения, расположенные в вертикальных колонках табл. 7.14, лег-
ко видеть, что при трактовке нитратов и перхлоратов щелочных
металлов проблем не возникает. Однако это не относится
к солям, содержащим более высоко заряженные анионы и более
объемные катионы. Следует, конечно, учитывать, что, хотя
табл. 7.14 предсказывает неустойчивость, например, ортоборатов
и ортосиликатов тяжелых щелочных металлов при сохранении
Таблица 7.14. Число координационных полиэдров, к которым должен
принадлежать атом О в солях щелочных металлов
(в дополнение к полиэдру-иону ХОз, ХО4 или О)
Заряд атома О оксоиона
КЧ(М+)
4
6
8
12
1
NOJ
2
4
а,
— з
со|-
4
8
ВОз"
4
6
8
12
i
1
2
3
х
SO4"
2
3
4
- 6
-\ -1
РО4~ SiC>4~ .
3 4
6
6 8
9 12
Л -i
ЮГ ТеО66~
4
5 ( 6
: 8
10 ' 12
их нормальных координационных чисел по кислороду (в интер-
вале от 8 до 12), существование отдельных таких соединений
с аномально низким координационным числом катионов не
исключено, например, в высокотемпературной фазе. Понижение
КЧ катиона компенсирует возрастающую нехватку атомов кис-
лорода, которая имеет место в ряду MNO3, M2CO3 и М3ВОз-
Конечно, несущественно, рассматривать ли такое соединение,
как МбТеОб, как соль, содержащую ионы ТеОб6", или как слож-
ный оксид М6+Те6+Об2~. В любом случае заряд —1 на каждом
атоме кислорода должен быть скомпенсирован связями М—О.
Систематические исследования оксидов М„М'О6 (М — щелоч-
ной металл) с высоким содержанием катионов уже привели
к интересным результатам. К таким оксидам относятся LisReOe,
Li6Te06, Li?SbO6 и LisSnOe. Распределению катионов по прибли-
зительно правильным тетраэдрическим и(или) октаэдрическим
полостям благоприятствует плотная упаковка атомов кислорода,
в которой на одну формульную единицу содержится 12 тетра-
эдрических и 6 октаэдрических позиций. Одна из октаэдриче-
ских позиций занята М', поэтому при значениях я^5 структур-
ных проблем не возникает. И действительно, плотноупакованная
структура Li5Re06 очень похожа на структуру a-NaFeO2. Все
катионы заселяют октаэдрические полости, литий заменяет Na,
а смесь катионов Li и Re — атомы Fe в позициях между чере-
дующимися парами плотноупакованных слоев:
Na Fe O2
Li (Li2/3Re1/3) O3 = LijReO,-
Ни для одного литиевого соединения структурных проблем
не в( шать тетраэдрические
пустс всех указанных ниже
структурах (которые все типа плотноупакованных):
Тетраэдри- Октаэдриче-
ческие ские
Литература
LisReO6
Li6Te06
Li7Sb06
Li8Sn06
—
Lie
Lie
Lie
Li3Re
Те
LiSb
Li2Sn
Z. Naturforsch.,
Z. Naturforsch.,
Z. Naturforsch.,
Z. Anorg. allg.
248
1968, 23b, 1603
1969, 24b, 647
1969, 24b, 252
Chem., 1969, 368
Известно много соединений Na, но лишь немногие из них
сопоставимы с соединениями Li: это Na5Re06 (также I, Тс, Os),
Na6Am06 (также Те, W, Np, Pu), Na7Bi06 и Na8Pb06 (также Pt).
Например, известны 11 соединений LisM.06, 2 соединения натрия
и ни одного, содержащего К, Rb или Cs. Для больших по разме-
ру щелочных металлов при п>5 не хватает октаэдрических пустот,
и для соединений Na поэтому остаются две возможности: а) тет-
раэдрическая координация или б) сильно искаженная октаэдри-
ческая координация в неплотноупакованной структуре (ср.
с ТП3Р4, разд. 5.1.2, в котором 8 искаженных 6-координирован-
ных полиэдров сочленяются в одной точке). Тетраэдрическая
координация всех щелочных металлов, кроме Cs, найдена
в оксидах М2О (структура типа антифлюорита), но ионы О2~
ни в одном случае, даже в Li2O, нельзя считать плотноупакован-
ными. Это легко видеть из анализа расстояний О'—О (А):
Li2O
3,27
Na2O
3,92
К2О
4,55
Rb2O
4,76
Будет интересно рассмотреть, каким образом преодолеваются
геометрические затруднения в оксидах с высоким содержа-
нием Na.
Альтернативой образованию нормальных солей является
образование кислых солей. Например, в случае 8-координиро-
ванного К+ каждый атом кислорода в К3РО4 должен был бы
принадлежать шести координационным полиэдрам КО8 в допол-
398 7. Химические связи в молекулах и кристаллах
нение к собственному иону РО43~. Но в КН2РО4) с другой сто-
роны, на каждый атом кислорода приходится заряд, равный
лишь —'Л, и, более того, атомы Н могут связывать группы
РО4Н2~ в трехмерный каркас водородными связями. В этом
случае нетрудно создать размещение, при котором у каждого
атома О было бы (помимо Н) по два ближайших соседних К+,
расположенных в полостях каркаса.
Совершенно другие проблемы возникают при понижении
заряда на атомах кислорода оксоиона, например при переходе
от СаСО3 к Ca(NO3J, и (или) при увеличении заряда на М,
например в ряду: M(NO3J, M(NO3K и M(NO3L. В кальците
и арагоните, двух модификациях СаСО3, ион Са2+ 6- и 9-коор-
динирован соответственно. Октаэдрическая координация М2+
в M(NO3J предполагает, что кристалл состоит из полиэдров
МО6, связанных через атомы азота ионов NO3~, причем каждый
атом кислорода аниона связан только с одним атомом М, как
показано ниже, на схеме а. Повышение КЧ до 12 приводит
к схеме б, где заряд О компенсируется таким же образом, как
и в NaNO3 (см. в начале разд. 7.6.7). Такова ситуация в куби-
ческом Pb(NO3J, где РЬ2+ окружен шестью NO3~, а нитрат-ион
\ /
-Си-
/ V
о
а рь
~Т т \ /
N О — Cd-
о.
О'
ть
связан с тремя ближайшими соседними РЬ2+, как показано
на схеме в. Эти структуры легко приспосабливаются к ионам
различных размеров, поскольку разворот анионов в их плоско-
стях позволяет изменить координацию М до 6+6:
Cd(NO,J Ca(NO3h Pb(NO3J
(низкотемпе-
ратурный)
Координация 6 О 2,34 А 6 0 2,50 А 12 О 2 81 \
М
6 О 3,12 А 6 0 2,93 А
Теперь рассмотрим предельный случай соединения, такого,
как Ti(NO3L, содержащего маленький ион Ti4+, который обыч-
но имеет координацию 6 по кислороду. Валентные усилия связи
Ti—О в этом случае были бы равны 2/3, т. е. вдвое превышали
бы заряд кислорода в N03~, так что достичь баланса заря-
7.6. Ионная связь 399
дов было бы невозможно. Для того чтобы понизить валентные
усилия связей Ti—О до '/з, пришлось бы повысить КЧ Ti4+ до
немыслимо высокого значения 12. Вполне очевидно, что эта
трудность проявляется наиболее отчетливо, если
заряд аниона низкий;
заряд катиона высокий;
КЧ катиона невелико.
Формулируя это более определенно, можно сказать, что
заряд каждого атома О в оксоионе должен быть равен или пре-
вышать заряд катиона, деленный на его КЧ (электростатиче-
ское валентное усилие связей М—О). Эти величины (табл. 7.15)
Таблица 7.15. Электростатические валентные усилия
связей М—О
КЧ (М)
4
6
8
9
12
М +
5
1
12
м2+
Til
1
6
м3+
h
\
м4+
1
2
3
1
Предел для нормального ионного
М (X 03)г > ^
показывают, что данное условие не может выполняться для
многих безводных солей, содержащих ионы ХО3~ и ХО4~. Для
этих ионов в предположении равномерного распределения ион-
ного заряда по всем атомам кислорода валентные усилия связей
М—О равны —'/з и —74 соответственно. По всей видимости,
единственными нитратами, которые можно получить из водных
растворов в виде безводных кристаллов, являются нитраты
щелочных и щелочноземельных металлов, Cd и РЬ. (Структуры
безводных нитратов Be, Mg, Zn и Hg пока, по-видимому, не
определены.) Известен целый ряд безводных хлоратов, брома-
тов, иодатов и перхлоратов (например, Са(С1О3J, Ва(ВгО3J,
Са(Ю3J, Ва(Ю3J и М(СЮ4J, где M = Cd, Ca, Sr, Ba). Весьма
вероятно, что они являются нормальными ионными солями, но,
к сожалению, об их кристаллических структурах мало что
известно. Из соответствующих солей, содержащих ионы М3+
и М4+, лишь очень немногие, если вообще таковые имеются,
можно получить из водного раствора в безводной кристалличе-
ской форме. Большинство из них сильно гидратированы, напри-
мер, А1(С1О4K-«Н2О с 6, 9 и 15 молекулами Н2О, Ga(C104KX
ХпН2О с 6 и 9 Н2О, Cr(NO3K-9 H2O. Лишь в очень немногих
400 7. Химические связи в молекулах и кристаллах
случаях зафиксировано существование безводных солей:
А1(СЮ4)з, 1п(Юз)з- К безводным солям М(ХО3L, кристал-
лизующимся из (кислых) водных растворов, относятся
Се(ЮзL и Zr(IO3L, которые будут кратко рассмотрены далее.
Понятно, что затруднения с балансом зарядов исчезают, если
из водных растворов выпадают кристаллогидраты. В гидрате,
в котором катион окружен замкнутой оболочкой молекул воды,
заряд центрального иона М"+ распределен по поверхности
гидратированного иона и аквакомплексы могут быть связаны
с оксоионами водородными связями. Структурные проблемы
здесь уже совсем другие, поскольку связи между катионами
и атомами кислорода оксоионов отсутствуют, и вопрос теперь
заключается в упаковке объемных группировок [M(H2O)Jn+
и анионов. Сказанное относится, например, к таким солям, как
Nd(BrO3K-9H2O и Th(NO3L-12H2O. Однако для безводных
соединений М(ЫОз)з, M(NO3L или соответствующих перхлора-
тов и т. д. имеется вторая альтернативная возможность, которая
требует перераспределения зарядов на ионах ХОз~ или ХС
' /О О
от 0-Х^ ¦ до О-Хх ' или от
О О
до
1
4 О
Ч -!
О *
О О !
\ /
X
оу 4o"i
Тогда в этих случаях только два из атомов кислорода, напри-
мер иона NO3~, координируются катионами, и ион может вы-
полнять функции или бидентатного лиганда (схема а), или мос-
тикового лиганда. В последнем случае имеются три возможно-
сти (б, в, г), соответствующие связыванию вершин, ребер и гра-
ней координационных полиэдров катионов анионами:
хо^
i
м
\
М
а
в
О
X
о
о
Ъхо'
г о
Использование новых нитрующих агентов позволило
зировать многочисленные безводные нитраты, которые
получить из водных растворов или дегидратацией солей.
относятся:
M(NO3J: M = Be, Mg, Zn, Hg, Мп, Со, Ni, Cu, Pd
M(NO3K: M = A1, Sc, Y, La, Cr, Fe, Аи, In, Bi
M(NO3L: M = Ti, Zr, Th, Sn
Многие из этих соединений можно сублимировать (при
синте-
нельзя
К ним
низком
7.6. Ионная связь 401
давлении или в вакууме). Нет сомнений в том, что они пред-
ставляют собой молекулярные соединения, содержащие биден-
татные группы NO3, как было установлено для газообразного
Cu(NO3J и кристаллических Ti(NO3L и Sn(NO3L- Бидентатные
группы NO3 присутствуют также в ионе [Co(N03L]2^, строение
которого весьма сходно со строением молекулы Ti(NO3L, а так-
же в ионах [Th(NO3N]2- [Ce(NO3N]2- и [Ce(NO8)e]3-. Эти
соединения обсуждаются в гл. 18.
Рис. 7.6. Роль лиганда Ю3~ в а) Се(Ю3L; б) Zr(IO3L (схематически).
Роль бидентатного (или мостикового) лиганда должна быть
характерна не только для иона NO3~, но и для СЮ3~, ВгО3~,
Ю3~, СЮ4~, Ю4~, а также и SO42~. Ион иодата выполняет функ-
цию мостикового лиганда, любого из трех типов — б, е, и г —•
указанных выше. Во всех трех кристаллических солях: Се(Ю3L
(который изоструктурен Pu(IO3L), Ce(IO3L-H2O и Zr(IO3L,
только два атома кислорода каждого Ю3~ используются для
координации металлических ионов, и во всех трех соединениях
ион Юз~ ведет себя как мостиковый лиганд. В безводном
Се (Ю3L колонки координационных полиэдров СеОв, по форме
промежуточные между кубом и квадратной антипризмой, фор-
мируются мостиковыми группами Юз, как схематически показа-
но на рис. 7.6, а. В Се(Ю3L-Н2О каждый из восьми атомов кис-
лорода, расположенных вокруг Се4+, принадлежит разным
ионам Юз", и 8 ионов Ю3~ соединяют каждый Се4+ с восемью
Другими. (Молекулы Н2О не входят в координационный полиэдр
ионов металла, но расположены в туннельных полостях, полно-
стью окруженных атомами кислорода ионов иодата.) В Zr(IO3L
также реализуется координация металла в форме квадратной
402 7. Химические связи в молекулах
и кристаллах
антипризмы, но здесь Zr4+ окружен восемью ионами Ю3~,.
выполняющими роль парных (двойных) мостиков, как схемати-
чески показано на рис. 7.6,5. Пары атомов кислорода, участ-
вующих в каждой мостиковой группировке, соответствуют чере-
дующимся наклонным ребрам антипризмы, и структура в целом
Таблица 7.16. Взаимосвязи между безводными и гидратированнымн
сульфатами циркония. [Более подробно см. J. Solid State Chem., 1970, 1, 497.1;
I 1
a-Zr(SO4J
равновесие с парами S03 или Н2 S 0«
гидратация
водой
a-Zr(S04J-5H20
гидратация парами воды
равновесие
контролируемым
давлением паров
воды
гидратация
водой при 0°С
дегидратация
вакууме
гидратация
водой при 0°С
Zr(S04J-7H2O
*>"¦¦»
и его гидратов. Это соединение
7.6. Ионная связь 403
имеет неожиданно сложную структурную химию: в дополнение
к трем модификациям безводной соли известны многочисленные
гидраты, которые отнюдь не представляют собой обычный ряд
гидратов. Здесь невозможно увеличить содержание воды путем
простого повышения давления паров воды над безводной солью.
Например, над 5- и 7-водными гидратами давление насыщенных
паров воды ниже, чем над 4-водным гидратом, и поэтому их
нельзя приготовить гидратацией последнего парами воды. Взаи-
\ I/
— Zr —
О О О О
si/
— Zr —
\ I /
Zr —
о о
S /
— Zr —
S
/ \
о о
Рис. 7.7. Структура a-Zr(SO4h. Ато-
мы О (один на каждую линию Zr—S)
опущены.
Рис. 7.8. Связывание ионов Zr4+ и
SO42~ в слой Zr(SO4J-4H2O (молеку-
лы воды опущены).
мосвязи между некоторыми из этих фаз охарактеризованы
в табл. 7.16.
Помимо нормального распределения заряда в ионе сульфа-
та а возможны распределения б я в:
-О"
О"
"О"
6
а б
Для соли M(SO4J баланс зарядов может быть осуществлен
в нормальной структуре а, поскольку валентные усилия связей
М4+—О для 8-координации равны '/г- Однако если М4+ коорди-
нирован меньшим числом атомов кислорода ионов сульфата
либо по причине меньшего КЧ (например, 7), либо из-за того,
что его координационный полиэдр частично укомплектован
молекулами воды или другими нейтральными молекулами, кото-
рые не нейтрализуют никакого катионного заряда, то возникает
необходимость перераспределения заряда в виде б или в:
КЧ М4+ по кислороду
из SO42-:
форма аниона:
6
б
404 7. Химические связи в молекулах и кристаллах
Реализация промежуточного КЧ, например 7, потребовала бьь
смеси распределений а и б.
Приведем наиболее простые структурные возможности, выте-
кающие из распределений а—в:
М
м
О 0
X
ж х
М
М
м хм
ь,
м
.м
м
м
В a-Zr(SO4J координационный полиэдр вокруг Zr4+ целиком
формируется атомами кислорода ионов сульфата. Металл 7-ко-
ординирован, и в структуре присутствует равное число групп SO4
типов а\ и Ь\, т. е. групп, связанных с четырьмя или тремя иона-
ми М4+ (рис. 7.7). Роль иона SO42~~ в этой соли весьма похожа
на роль иона 02~ в 7:| -координированной структуре моно-
клинного ZrO2.
Моногидрат представляет собой пример формы б. В обеих
модификациях катион 7-координирован F 0+1 Н20). В струк-
туре 7-модификации все группы S04 типа Ь\\ каждая выполняет
мостиковые функции между тремя катионами, образуя очень
простой слой, который изображен на рис. 6.15 (разд. 6.5.1) для
иллюстрации его взаимосвязи со слоем типа Cdb. Структура
a-модификации тоже слоистая, но в ней представлены группы
S04 обоих типов, Ъ\ и Ь2. При усилении гидратации происходит
переход к типу в: фактически координационный полиэдр Zr4+
в 4-водном гидрате, в обеих модификациях 5-водного гидрата
и в 7-водном гидрате один и тот же, а именно образован из
4 0+4 Н20. Очень простая слоистая структура тетрагидрата
основана на тетрагональной сетке. Здесь все группы SO4™na Сь
как схематически показано на рис. 7.8. Обе модификации 5-вод-
ного гидрата и 7-водный гидрат имеют биядерное молекулярное
строение. Группы S04 представлены здесь двумя типами: с\ и с2-
Додекаэдрический 8-координационный полиэдр вокруг Zr4+
7.6. Ионная связь 405
остальные
Глекулы воды с ионами металла не связаны. Поэтому их струк-
т формулы записываются следующим образом:
^укомплектовывается четырьмя молекулами Н20, о
Глекулы воды с ионами металла не связаны. Поэтому
турные следующим
:so,
0,
[Zr2(SO4L(H2O)8]-2H2O и [Zr2(SO4L(H2O)8]-6H2O. (Более под-
робную информацию см. в Acta cryst, 1959, 12, 719; 1969, В25,
1558, 1566, 1572; 1970, В26, 1125, 1131, 1140).
Обобщая вышеизложенное, можно заключить, что проблемы
баланса заряда приводят к геометрическим затруднениям
в двух различных классах солей:
Заряд на О из
аниона
Размер катио- Заряд катиона
на
высокий
низкий
большой
маленький
низкий
высокий
Ситуация а была обсуждена применительно к предельным
случаям CS3BO3, Cs4Si04 и СэбТеОб, но та же проблема, хотя
и в менее острой форме, существует и для пиросолей, таких, как
M6Si207 и М4Р2О7. Как и в случае КзРО4 и КН2РО4, она может
быть преодолена образованием таких солей, как Na2H2P2O7.
В другом предельном случае — б — затруднения возникают
не только для ионов Х03~ и Х04~, как уже обсуждалось, но так-
же и для ионов типа S2O72~, если они сочетаются с высокозаря-
женными катионами. Поэтому нормальные ионные дисульфат
и дихромат Ti4+ и даже соли большего по размеру иона Th4+
не были бы возможными, если бы анионный заряд был распре-
делен по всем (или даже по шести) атомам кислорода. Для
семейства пироионов затруднения возникают на обоих концах
ряда
Cs6(Si207) Th(S2O7J
случай а случай б
точно так же, как это имеет место и для более простых ионов
Х03-:
Cs3BO3 Ti(NO3L
Оглавление 407
ОГЛАВЛЕНИЕ
Предисловие редактора перевода 5
Предисловие. Перевод С. И. Троянова 9
Часть I И
1. Введение. Перевод Я. М. Нестеровой 11
1.1. Важное значение твердого состояния в неорганической химии 12
1.2. Структурные формулы неорганических соединений .... 21
1.3. Геометрические и топологические ограничения в структурах мо-
лекул и кристаллов 30
1.4. Полная структурная химия элемента или соединения ... 35
1.5. Классификация кристаллов 40
2. Симметрия. Перевод Я. М. Нестеровой 52
2.1. Элементы симметрии 52
2.2. Повторяющиеся узоры, элементарные ячейки и решетки . . 53
2.3. Изомерия 69
3. Полиэдры и сетки. Перевод П. М. Зоркого 81
3.1. Введение 81
3.2. Основные системы связанных точек . 83
3.3. Полиэдры 87
3.4. Плоские сетки 104
3.5. Трехмерные сетки 109
3.6. Полиэдрические молекулы и ионы 118
3.7. Циклические молекулы и ионы 121
3.8. Бесконечные линейные молекулы и ионы 123
3.9. Кристаллические структуры на основе сеток с 3-связанными уз-
лами ... 127
3.10. Кристаллические структуры, основанные на 4-связапных сетках 144
3.11. Заполняющие пространство расположения полиэдров . . . 167
4. Шаровые упаковки. Перевод С. И. Троянова 173
4.1. Периодические упаковки одинаковых шаров 173
4.2. Плотноупакованные структуры с заполнением тетраэдрических
пустот 198
4.3. Плотноупакованные структуры с атомами в октаэдрнческих пу-
стотах 205
4.4. Плотноупакованные структуры с атомами в тетраэдричсскнх и
октаэдрических пустотах 216
4.5. Другое представление плотноупакованных структур . . . 217
4.6. Структуры, построенные из плотноупакованных слоев АХ3 . . 218
-5. Тетраэдрические и октаэдрические структуры. Перевод П. М. Зоркого 227
5.1. Структуры как совокупности полиэдров 227
5.2. Тетраэдрические структуры 235
5.3. Октаэдрические структуры , 241
5.4. Структуры, построенные из тетраэдров и октаэдров . . . 279
6 Некоторые простые структуры АХ„. Перевод Ф. М. Спиридонова 285
С) 1. Структурный тип хлорида натрия 286
6.'2. Структурный тип хлорида цезия 294
6 3. Структурный тип рутила 295
6.4. Структуры флюорита (АХ2) п антифлюорпта (А2Х) . . . 301
6.5. Структурный тип СсП2 и родственные структуры .... 310
ti.fi. Структурный тип ReO3 и родственные структуры .... 316
6.7. Структуры с аналогичными аналитическими описаниями . . 321
6.8. Структура РЬС12 326
6 9. Структуры PdS2, AgP2 и |3-HgO2 и их связь со структурой типа
пирита 328
6.10. Взаимосвязи между структурами некоторых нитридов и оксо-
соединений 331
6.11. Сверхструктуры и другие родственные структуры . . . 334
7. Химические связи в молекулах и кристаллах. Перевод Ф. М. Спири-
донова 337
7.1. Введение 337
7.2. Длины ковалентных связей , 343
7.3. Формы простых молекул и ионов непереходных элементов . . 348
7.4. Вандерваальсовы связи 362
7.5. Связи металл — металл 363
7.6. Ионная связь 372
СОДЕРЖАНИЕ ДРУГИХ ТОМОВ
ТОМ 2
Часть II . ¦
8. Водород. Благородные газы
9. Галогены. Простые галогениды
10. Комплексные оксо- и гидрок-
согалогепиды
11. Кислород
12. Простые оксиды металлов
13. Сложные оксиды
14. Гидроксиды, оксогидроксиды и
гидроксосоли
15. Вода и гидраты
16. Сера, селен, теллур
17. Сульфиды и оксосульфиды ме-
таллов
18. Азот
19. Фосфор
20. Мышьяк, сурьма, висмут
ТОМ 3
Часть II (продолжение)
21. Углерод
22. Цианиды, карбиды, карбонилы
и алкилы металлов
23. Кремний
24. Бор
25. Медь, серебро, золото
26. Элементы ПБ, ШБ и 1VB груп-
пы
27. Элементы VIII группы и дру-
гие переходные металлы
28. Лантаноиды и актиноиды
29. Металлы и сплавы
Формульный указатель
Предметный указатель