Автор: Кудряшов И.В. Каретников Г.С.
Теги: химия физическая химия химическая физика задачи по химии
ISBN: 5-06-000660-3
Год: 1991
Текст
И. В. Кудряшов, Г.С.Каретников
СБОРНИК
ПРИМЕРОВ
И ЗАДАЧ
по
ФИЗИЧЕСКОЙ
ХИМИИ
Издание шестое,
переработанное и дополненное
Допущено
Государственным комиггтом СССР
по народному образованию
в качестве учебного пособия
для студентов химико-технологических специальностей
высших учебных заведений
МОСКВА
.ВЫСШАЯ ШКОЛА"
1991
ББК 24.5
К 88
УДК 541.1
Рецензент: проф. Г. А. Добреньков (Казанский хнмнко-технологнческнй
институт им. С. М. Кирова)
Кудряшов И. В., Каретников Г. С.
К88 Сборник примеров и задач по физической химии: Учеб. по-
пособие для хим.-технол. спец. вузов.— 6-е изд., перераб. и
доп. — М.: Высш. шк., 1991. — 527 с: ил.
ISBN 5-06-000660-3
Пособие содержит задачи и примеры по всем разделам физической химии и
соответствует программе для химических вузов и отражает современное развитие
физической химии. В каждую главу включены перечень основных уравнений, реШе-
нйя типовых задач, задачи без решения, миоговариантиые задачи.
Настоящее издание сборника E-е —1983г.) дополнено задачами, требующими
применения микрокалькуляторов и ЭВМ.
1708000000D309000000)—415 ББК 24 5
К 001@1)—91 Ю2—91 54,
ISBN 5-06-000660-3 © И. В. Кудряшов, Г. С. Каретников, 1991
ПРЕДИСЛОВИЕ
Инженер-химик и химик-технолог должны не только знать физи-
физико-химические законы, но и уметь применять их для решения конкрет-
конкретных задач. Решение задач помогает усвоить и глубже понять теорети-
теоретические положения курса. Авторы стремились подобрать задачи, ох-
охватывающие практически все теоретические вопросы программы кур-
курса физической химии и представляющие интерес для различных спе-
специальностей.
Для привития навыка работы со справочной литературой авторы
исключили из большей части задач величины, которые могут быть
найдены в доступных справочниках. Сборник задач разделен на три
части: «Теоретические основы физико-химических расчетов», «Равно-
«Равновесное состояние систем» и «Кинетика и катализ». Каждая глава со-
содержит перечень основных уравнений и символов, задачи с решениями,
задачи для самостоятельного решения, многовариантные задачи. Мно-
Многовариантные задачи составлены так, чтобы дать индивидуальное за-
задание каждому студенту академической группы. Эти задачи рекомен-
рекомендуются для самостоятельной работы. Многовариантные задачи могут
быть использованы и как одновариантные, причем наличие 15—25 ва-
вариантов открывает возможность подбора объекта расчета с учетом спе-
специализации студента.
При подготовке этого издания были учтены основные изменения в
программе курса физической химии и тенденции ее развития. Было
учтено также стремление усилить общую теоретическую подготовку
инженера-химика и химика-технолога. Последовательность глав соот-
соответствует более строгой логической структуре курса: изучение геомет-
геометрических параметров и энергетических характеристик молекул (гл.
I—V), далее изучение свойств веществ в идеальном газообразном состо-
состоянии, от идеального газообразного состояния сделан переход к реаль-
реальному газообразному состоянию и к конденсированному состоянию
индивидуального вещества (гл. X—XII). После ознакомления со
свойствами индивидуального вещества сделан переход к системам
многокомпонентным однофазным и многокомпонентным многофаз-
многофазным (гл. XIII—XVII). Более сложные системы, в которых происхо-
происходят химические превращения, рассмотрены и в условиях равновесия
(гл. XIX—XXI) и в динамике (гл. XXIII—XXXI). Вновь введенные
главы отражают современное развитие физической химии.
В связи с общей тенденцией уменьшения числа часов занятий пред-
предметом в аудитории и переноса центра тяжести познания на самостоя-
самостоятельную внеаудиторную работу студента произведено изменение ак-
акцентов в главе. Значительно уменьшены теоретические введения. В этом
отношении сборник не должен подменять учебник. Главное внимание
обращено на задачи с решениями, так как студент, выполняющий са-
самостоятельно практическое задание, встретив затруднения в приемах
решения, должен найти помощь в виде таких задач с решениями.
В сборник включены задачи, для решения которых необходимо
применение счетно-решающей техники. Эти задачи отмечены звездоч-
звездочками. В конце каждой части приведены комплексные задачи, для ре-
решения которых требуется знание нескольких разделов курса. Эти за-
задачи могут быть предложены в качестве курсовых работ.
В задачах и ответах величины даны в СИ, а также в наиболее рас-
распространенных внесистемных единицах.
При подготовке 6-го издания были учтены замечания и пожелания
преподавателей кафедры физической химии МХТИ им. Д. И. Менделе-
Менделеева: Л. Н. Ивановской, Е. П. Старостенко, А. М. Абоимова, В. В. Бе-
лик, В. Д. Кочеткова, Н. М. Кулешовой, В. В. Федорова, Л. Б. Фе-
дяниной, И. А. Поповой, В. Д. Жигулевой, В. А. Ефремова, Т. Д. Ан-
Антоновой и др. Особую благодарность выражаем доц. А. М. Мерец-
кому и Н. И. Кудряшову, принявшим активное участие в написании
ряда глав задачника, составлении и подборе вновь включенных в
сборник задач.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РЕШЕНИЮ
МНОГОВАРИАНТНЫХ ЗАДАЧ
Многовариантные задачи делятся на два основных типа:
1) задачи, объединяющие весь основной материал раздела,
требующие построения графиков и использования справочни-
справочников. Этн задачи рекомендуется выполнять после ознакомле-
ознакомления с теорией н решенными задачами; 2) задачи, посвящен-
посвященные отдельным вопросам данного раздела, решающиеся без
сложных вычислений н графиков, онн могут быть использо-
использованы в качестве контрольных работ.
Многоварнантные задачи состоят нз 25 заданий. Там, где
отсутствуют экспериментальные данные, одному заданию
приписывают два-три варианта. Для решения задач рекомен-
рекомендуется ознакомиться со следующими пособиями, которые
в тексте сокращенно обозначаются начальными буквами фа-
фамилий авторов: [К.] — Киреев В. А. Курс физической хи-
химии. М., 1975; [Г.] — Герасимов Я- И. ндр. Курс физической
химии. Т. I—II. М., 1971, 1972; [Д. А.] — Даниэльс Ф., Аль-
берти Р. Физическая химия. М., 1967; [М.] — Краткий спра-
справочник физико-хнмическнх величин / Под ред. А. А. Равделя
и А. М. Пономаревой. Л., 1983; [С. X.] — Справочник хими-
химика. Т. I—IV / Под ред. Б. П. Никольского. М., 1965, 1966.
Физическая химия / Под ред. К. С. Краснова. М., 1982.
Стромберг А; Г., Семчеико Д. П. Физическая химия. М., 1988.
МЕЖДУНАРОДНАЯ СИСТЕМА ЕДИНИЦ
Метрическая система единиц длины, массы, силы и других физиче-
физических величин разработана в период французской революции 1789—
1794 гг. Благодаря удобству и простоте единицы метрической системы
стали применять всюду. В научных исследованиях вместо ранее суще-
существующих единиц измерения стали применять метрические единицы из-
измерения. Более широкая и усовершенствованная форма метрической
системы, называемая Международной системой (иногда просто СИ от
французского названия Systeme International), была официально при-
принята Генеральной конференцией по мерам и весам в 1960 г.
За единицу массы СИ принят килограмм, определяемый как мас-
масса международного эталона, изготовленного из платино-иридиевого
сплава и хранящегося в Международном бюро мер и весов в Париже.
(Обычно в метрической системе при записи дробей деятичные^доли не
разделяют на порядки.) В настоящее время в СИ есть*одна непоследо-
непоследовательность, заключающаяся в том, что название единицы массы
имеет приставку «кило» (килограмм). Эта непоследовательность бу-
будет сохраняться до тех пор, пока не будет достигнуто соглашение о но-
новом названии и символе единицы массы. Пока следует помнить, что
1 миллиграмм, обозначаемый 1 мг, а не 1 мккг, равен одной миллион-
миллионной единицы массы, а не одной тысячной, как показывает приставка
милли.
Единицей длины в СИ является метр (м). Ранее метр определяли
как расстояние между двумя насечками на стандартном платино-ири-
диевом эталоне, хранящемся в Международном бюро мер и весов в Па-
Париже; в 1960 г. по международному соглашению метр получил опре-
определение как расстояние, равное 1650763,73 длины волны оранжево-
красной линии спектра криптона-86.
За единицу времени в СИ принята секунда (с). Секунду определяют
как интервал времени 9 192 631 770 периодов излучения, соответству-
соответствующего переходу между двумя сверхтонкими уровнями основного со-
состояния атома цезия-133 при длине волны, равной приблизительно
3,26 см. Прежде секунду определяли как 1/86 400 часть средних сол-
солнечных суток.
За единицу объема в СИ принят кубический метр (м3). В химии ши-
широко используют единицу объема литр (л), которая равна 1/103 м3.
Миллилитр, 1-Ю л, равен одному кубическому сантимеру: 1 мл =
= 1 см3.
Единица силы в СИ — ньютон (Н), определяемый как сила, сообща-
сообщающая телу массой 1 кг ускорение 1 м-с~2 в направлении действия силы.
Ньютон равен 105 дин (дина — единица силы в системе СГС, равная
силе, придающей массе 1 г ускорение, равное 1 см-с~2).
Единица энергии в СИ — джоуль (Дж) — это работа силы 1 Н при
перемещении ею тела на расстояние 1 м в направлении действия силы:
1 Дж = 1 Н-1 м = 10' эрг = 10' дин-см.
Ранее в химии широко использовали калорию как единицу энергии.
Термохимическая калория, определяемая как 4,184 Дж, приблизи-
приблизительно равна количеству энергии, необходимой для нагревания 1 г во-
воды на Г С. Большая калория (ккал) равна 103 кал. Очень полезно
запомнить следующие коэффициенты пересчета: 1 кал — 4,184 Дж,
1 ккал — 4,184 кДж.
Значения некоторых физических и химических констант
Постоянная Авогадро #А = 0,60229-1024 моль-1
Скорость света с = 2,997925-108 м/с
Масса электрона /я = 0,91083-Ю-30 кг
Заряд электрона е = 0,106206- Ю-18 Кл
Постоянная Фарадея f~na e = 96490 Кл/моль
Дальтон D=l ,66033-10~2? кг
Постоянная Планка /г = 0,66252-10~33 Джс
Квант момента количества движения ft = ft/2ji = 0,105443-Ю-33 Дж-с
Масса протона /лр = 1,67239-10~27 кг
Масса нейтрона ша = 1,67470 • Ю-2' кг
Постоянная Больцмана ? = 13,805-10~24 Дж/град
Молярная газовая постоянная R = NA 6 = 8,3146 Дж/(моль-К)
Газовая постоянная #=0,08206 л-атм-град-^моль-1
Объем моля идеального газа при нор- 22,415-Ю-3 м^моль-1
мальных условиях
Температура Цельсия t°C = ТК—273,15
Атмосферное давление 1 атм=101,325 кН-м~2
Электрический момент диполя 0,1602-Ю-28 Кл-м D,8029 D)
Электрои-вольт 1 эВ = 96,4905 кДж/моль
Использование СИ приводит к появлению непривычных единиц
лишь в двух случаях. Во-первых, в качестве,единицы длины молекул
Применяют пм (пикометр, 10~12 м или 0,01 А); при этом размеры моле-
молекул и длины связей будут порядка 100 пм, что удобно, поскольку про-
пропадают десятичные дроби, или нм (нанометр, 10~9м или 10 А). Во-вто-
Во-вторых, в качестве единицы объема используют дм3 A000 см3 или 1 л) вме-
вместо см3 или м3. Замена литра на дм3 может показаться не так уж необ-
необходимой, однако это упрощает числовые расчеты.
Ниже приведены некоторые соотношения между единицами:
1 л = 1 дм3 =1000 см3=10 м3;
1 М=1 моль/л = 1 моль/дм3;
100 пмн1,00А = 10"8 см = Ю-10 м;
1 атм = 760 Торр=760 мм рт. ст. = 1,01325- 10s Па.
ГЛАВА I
ЭЛЕМЕНТЫ КВАНТОВОЙ ХИМИИ. ТЕОРИЯ
ХИМИЧЕСКОЙ СВЯЗИ, МЕТОД МО ЛКАО
Основные уравнения и символы
[Км с. 54—67, 720—728]
Согласно методу в приближении линейной комбинации атомных
орбиталей (МО ЛКАО) волновая функция описывается уравнением
где г|) — молекулярная волновая функция; СА и Св — коэффициен-
коэффициенты; г|)А и г|зв — атомные волновые функции атомов А и В. Потенци-
Потенциальная энергия системы из атомов Аи В выражается уравнением
Е
ГАВ ГА ГВ
где Z — заряд ядра атома; е — заряд электрона; гАВ — межъядерное
расстояние; гА и гв — расстояния между ядром и электроном.
Уравнение Шредингера
Hi|)=?i|), A.3)
где Н = — 8-jpjjj V2 + ^пот — оператор Гамильтона; ?пот — по:
тенциальная энергия электронов и ядер; V2 — оператор Лапласа,
" Для двухатомной молекулы А — В
("АА-Е5М) са + (^Ав -^ав) Св = 0,
4*°° ^^ "Ь00 ^^
где //дв — ^ва = J ¦фдНфвсЬ = J^eH^Adf — обменный интеграл;
— со —со »
-{-со -{-со
| dy = j i|jb Нг|?в dy — кулоновский интеграл;
+-
= 5вд = J i|)Ai|)b dy — интеграл перекрывания; v — объем.
— со
8
Для многоатомных молекул метод в приближении МО ЛКАО дает
систему из п уравнений (п — число атомов в молекуле):
2(Я„-?%)С,=0, A.4)
где i — номер уравнения; / — номер члена в уравнении.
Отличные от нуля корни системы уравнений A.4) будут при усло-
условии, если определитель равен нулю:
\HU-ESU\=O. A.5)
Распространение метода ЛКАО на гомоядерные двухатомные мо-
молекулы второго периода периодической системы элементов Д. И. Мен-
Менделеева дает атомные орбитали (АО) 2s, 2рх, 2ру и 2рг. Условимся
Рис. 1. Относительное расположение молекулярных орбиталей по
энергиям гомоядериых двухатомных молекул без взаимодействия
<т„- и ПуПг-МО (а) и с взаимодействием (б)
за ось х принимать ось, совпадающую с осью молекулы. У обоих ато-
атомов А — А она направлена навстречу. Атомная орбиталь ^-электрона
имеет сферическую симметрию, перекрывание 2s- и 2рх-АО симметрич-
симметрично относительно оси молекулы. Такие МО называются ст-молекуляр-
ными орбиталями. Перекрывание 2ру- и 2pz-AO дает л-МО. л-Молеку-
лярные орбитали несимметричны относительно оси молекулы. При по-
повороте л-МО вокруг оси молекулы на 180° знак МО меняется на про-
противоположный. Различают связывающую ст-МО и разрыхляющую сг*-
МО, связывающую л-МО и разрыхляющую л*-МО. Порядок связи
Яр). A.6)
где псв — число электронов на связывающих МО; nv — число элект-
электронов на разрыхляющих МО.
Последовательность энергий молекулярных орбиталей ct1s < ct|s <
2p
л
2P,
= л
2Pr
= Лр2 <СТ2р МО СТ
2Р-с>
Л,
и л2р. близки по энергиям, они могут меняться местами в последова-
последовательности возрастания энергии. На рис. 1 представлена энергети-
Рис. 2. Относительное располо-
расположение молекулярных орбита-
лей по энергии гетероидерных
двухатомных молекул
ческая диаграмма без взаимодействия
(а) и с взаимодействием (б) 2s- и 2/?-
-АО для гомоядерных двухатомных
молекул. Для гетероядерных двухатом-
двухатомных молекул АВ при условии, что атом
В более электроотрицательный, энергии
АО и МО представлены на рис. 2.
Вклад атома В в связывающие МО боль-
больше, чем атома А, и соответственно вклад
в разрыхляющие МО меньше.
Электронные состояния молекул
классифицируют по значениям момента
количества движения и спина. Разным
типам МО соответствуют определенные
значения квантового числатг (табл. 1).
Терм электронного состояния запи-
записывают так:
2S+i\ML\, A-7)
где 5 — суммарное спиновое квантовое число; Ml — абсолютное
значение проекции общего орбитального момента на ось симметрии
Таблица 1. Квантовые числа, соответствующие определенным МО
Атомные орбитали
5, Рх, dl
Pv < dxy i dxz
dyz,dy2-z*
Молекулярные орбитали
a
Л
S
0
±1
±2
молекулы. Символы суммарного момента количества движения приве-
приведены ниже:
Символ состояния
2'
О
л
±1
±2
ЗАДАЧИ С РЕШЕНИЯМИ
1. Определите энергию МО иона HJ на основании метода МО в
приближении ЛКАО.
Решение. Из уравнения A.3) определим энергию МО:
Г i|)Hi|)d v
10
Подставим в это уравнение^ из A.1):
(CA?A+CBi|>B)H(CAi|>A+CBi|>B)dt,
Е —
После преобразования под интегралами в числителе и знаменателе и
замены символами обменного, кулоновского и интеграла перекрывания
получим
Так как при образовании химической связи энергия должна быть ми-
минимальной, то согласно вариационному методу возьмем производную
дЕ/дС\ и приравняем ее нулю. Аналогично возьмем производную
дЕ/дСь и также приравняем ее нулю:
дЕ
2С Я+ 2С #-? BСА 5АА+ 2СВ
2СВ
= Ж а нав + 2Св
+ 2СВ 5ВВ) = О
или получим два уравнения:
("аа-?5аа) са+ (яав-
св=0.
Для определения коэффициентов СА и Св в уравнении A.1) решим си-
систему уравнений. Решения, корни которого не будут равны нулю, по-
получим при условии, если определитель равен нулю:
Нкк~Е H\B~ES
HAB—ES HBB — E
= 0.
Решение этого определителя будет
Запишем полученное уравнение в виде
?2A_52)_2(яАА-ЯАВ5)?
Квадратное уравнение имеет два корня:
Е - ("
__
11
Е -
1
1—52
_ ЯДАA+5)~ЯАВA+5) = ЯАА-ЯАВ
2 1—52 1—5
Получены две разные энергии молекулярных орбиталей.
2. Определите коэффициенты СА и Св в уравнении A.1) для иона
щ.
Решение. Из уравнения A.4) с учетом того, что 5АА = Sbb =
= 1, так как волновая функция нормированная, находим
-?5Ав) Св = 0, (а)
-?5вв)Св = 0. (б)
Подставим значение Еъ полученное в задаче 1, в уравнение (а):
I И "АА I "АИ \Г , и "AA i "АО g r — П
^ AA 1+5 / ' I AB i i_ с / B
Разность в первых скобках равна
АА 1+5 / 1+5
Разность во вторых скобках равна
1+5 I 1+5
Отсюда коэффициенты перед СА и Св равны между собой, но обратны
по знаку. Следовательно, СА = + Св- Подставим Ех в уравнение
(б):
Разность в первых скобках равна
Разность во вторых скобках равна
вв
) Г+5
откуда вытекает, что СА = + Св. Подставим в уравнение (а) энергию
Е2, полученную в задаче 1. Разность в первых скобках равна
н
Яаа
Разность во вторых скобках равна
—ЯАВ о^- ЯАВ— ЯАА5
Sj-
12
Величины в скобках равны между собой, следовательно, СА = — Св •
Подставим энергию Е2 в уравнение (б). Разность в первых скобках рав-
равна
.« —п .
АВ Л_
Разность во вторых скобках равна
(lj ^АА ^АВ\_ ^АВ ^ВВ ^
Явв j^5 )~ Г=5
Отсюда следует Сд = — Св. Таким образом получены две волновые
функции:
+ »
Волновая функция должна быть нормированной, т. е. f |1|з|2 dv = 1,
b
так как во всем пространстве у иона HJ должен быть всего один элект-
электрон. Подставим полученные уравнения волновых функций под интег-
интеграл:
J |t|*do= J (Сд^д-Сд^Ч^ J CAi|.Adi;-
0 0 0
-2 I I
Но коэффициент С\ не равен нулю:
J tAdy = I 4>bdo=l; 2 J
0 0 0
откуда
J" f di-=l-0+1=2.
о
В результате получили, что молекулярная волновая функция ненорми-
ненормированная. Чтобы молекулярная волновая функция была нормирован-
нормированной, ее следует разделить на У^2. В результате получим две нормиро-
нормированные молекулярные волновые функции:
¦ 1 1
13
а коэффициенты Сд и Св будут равны:
СА=-(
и С. = '
3. Изобразите графически функции i|)x, т|>2, i|>? и i|>|, приняв, что
tyt — е 'А — е гв и 1|з2 = е ГА+е Лв, где гА и гв — расстояния от ядра А
или В до электрона. Исходя из зависимостей я|з? и я|?г от г, установите,
какая из молекулярных орбита-
д J лей -фх и 1|з2 более устойчива,
В
в
в
?
в
в
в
Рис. 3. Разрыхляющая (а) и связываю-
связывающая (б) иолновые функции гомоядериой
двухатомной молекулы
т. е. обладает меньшей энергией.
Решение. В молекуляр-
молекулярной волновой функции -фх знаки
У ¦фл и 1|зв разные. Эти функции
располагаются по разные сторо-
стороны относительно оси абсцисс
(рис. 3, а); 1|з| и 1|з? — плотности
вероятности нахождения элек-
электрона в пространстве. Вероят-
йл-й |А^а ность нахождения электрона в
Г1 Л к г /Ч->\ пространстве между ядрами А
\у \J \ | ^/ \^ и В равна нулю (рис. 3, а), по-
поэтому химическая связь между
атомами А и В не образуется,
так как положительно заряжен-
заряженные ядра атомов отталкиваются.
Такая молекулярная орбиталь
называется разрыхляющей.
В молекулярной волновой функ-
функции i|J знаки у \}зА И1|зв одинаковые. Эти функции располагаются по
одну сторону относительно оси абсцисс (рис. 3, б); г|з| — плотность
вероятности нахождения электрона в пространстве между ядрами
атомов А и В не равна нулю. Отсюда положительно заряженные
ядра атомов притягиваются к отрицательно заряженному простран-
пространству между ядрами. Такая молекулярная орбиталь называется свя-
связывающей. Для перевода электронов со связывающей на разрыхляю-
разрыхляющую молекулярную орбиталь требуется затрата энергии. Следова-
Следовательно, энергия связывающей молекулярной орбитали меньше
энергии разрыхляющей молекулярной орбитали.
4. Постройте энергетические уровни молекулярных орбиталей моле-
молекулы бора В2. Определите порядок связи. Молекула бора обладает
магнитными свойствами.
Решение. У каждого атома В атомные орбитали: Is2, 2s2, 2px.
Магнитные свойства молекулы В2 указывают на то, что у молекулы
есть неспаренные электроны. Заполнение молекулярных орбиталей
электронами подчиняется правилу Хунда. Тогда электронную конфи-
конфигурацию молекулы В2 можно записать так:
14
Электроны 2s воздействуют на распреде-
распределение энергии между яж-, пу- и яг-элек-
тронами. Только таким расположением
электронов на энергетических уровнях
можно объяснить магнитные свойства мо-
молекулы В2. Относительное расположение
энергетических уровней показано на
рис. 1. Относительное расположение элек-
электронных уровней молекулы В2 и заполне-
заполнение их электронами показано на рис. 4.
Порядок связи определим по уравнению
A.6):
ЗАДАЧИ
1. Запишите молекулярные орбитали
молекулы О2 и ионов OJ и 0^~. Вычисли-
Вычислите порядок связи в каждой частице. Распо-
Расположите энергии связей в возрастающей
последовательности.
2. Нарисуйте энергетическую диаграм-
диаграмму для молекулы Li2. Расположите элек-
электроны на энергетических уровнях. Опре-
Определите порядок связи. Установите, обла-
обладает ли молеула Li2 магнитными свойст-
свойствами.
3. Чем можно объяснить, что у молекулы Н2 равновесное межъя-
межъядерное расстояние 0,74Ы0~8 см, а у молекулы Li2 2,672-10"8 см?
4. Нарисуйте энергетическую диаграмму для молекулы 02. Опре-
Определите порядок связи. Молекула 02 обладает магнитными свойст-
свойствами.
5. Запишите МО молекулы Ве2. Определите порядок связи. Сде-
Сделайте заключение относительно межъядерного расстояния и энергии
химической связи.
6*. Нарисуйте энергетическую диаграмму молекулы BN. Опреде-
Определите порядок связи в молекуле. Молекула BN обладает магнитными
свойствами. Электроотрицательность атома N больше электроотри-
электроотрицательности атома В.
7. Запишите МО иона С0+ и молекул ВО и CN. Определите по-
порядок связи в каждой частице. Определите терм основного электрон-
электронного состояния всех частиц.
8. Исходя из электронных структур молекул BN, ВО и СО, рас-
расположите их по возрастанию энергии химической связи.
Рис. 4. Относительное рас-
расположение электронных
уровней молекулы В2 и за-
заполнение АО и МО элек-
электронами
15
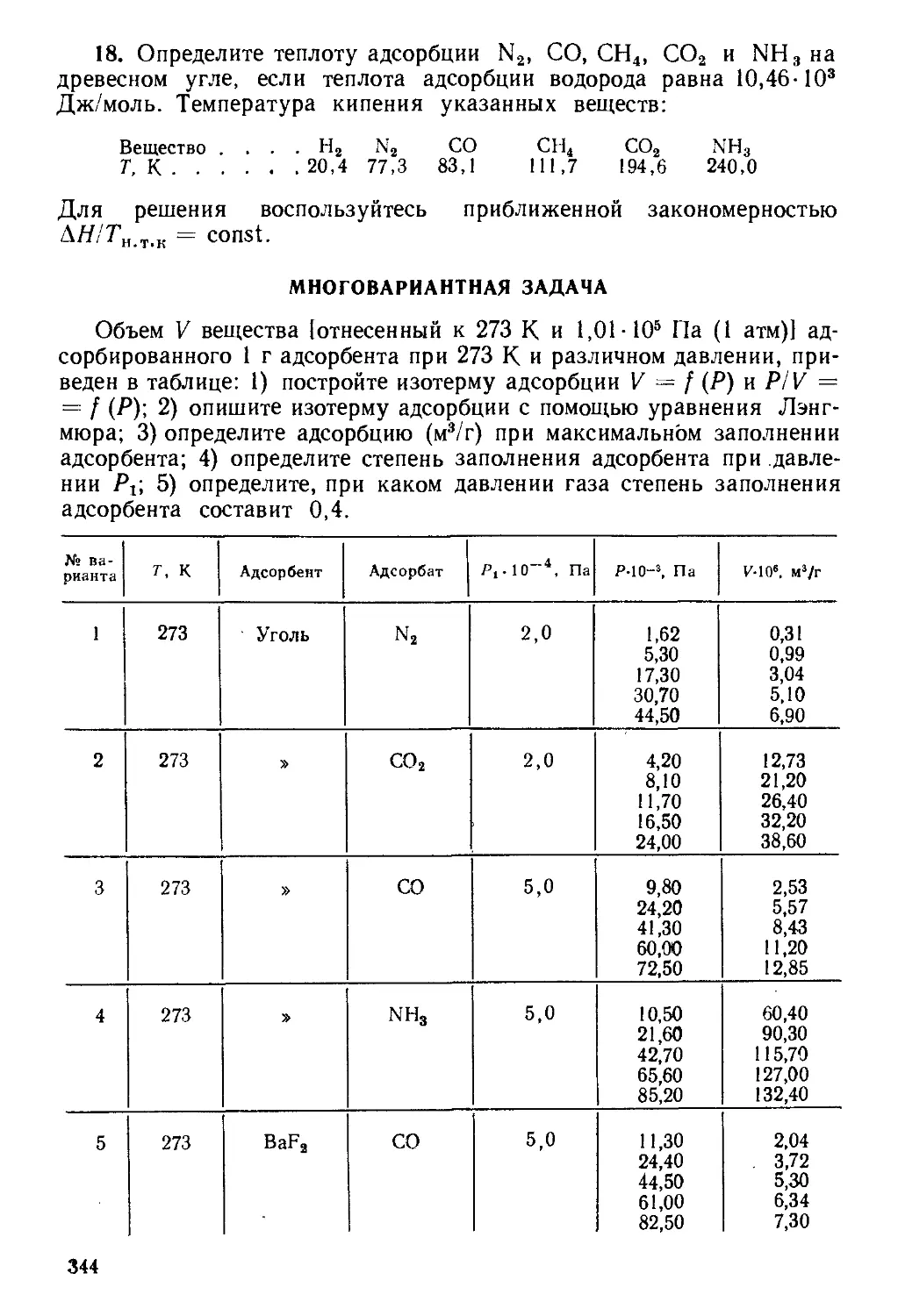
МНОГОВАРИАНТНАЯ ЗАДАЧА
Запишите МО соединения, определите терм основного электроь
ного состояния. Определите порядок связи. Установите, обладает ли
соединение магнитными свойствами?
№ варианта
1
2
3
4
5
6
7
8
Соединение
ВН
BF
ВС1
ВВг
ВеН
BeF
BeCl
BrCl
№ варианта
9
10
11
12
13
14
15
16
Соединение
BrF
НВг
НВг+
со
C1F
НС1
НС1+
HF
№ варианта
17
18
19
20
21
22
23
24
25
Соединение
HI
1Вг
IC1
HF
NH
NO
N0+
OH
OH+
ГЛАВА II
ЗАКОНОМЕРНОСТИ ГЕОМЕТРИЧЕСКОЙ КОНФИГУРАЦИИ
АТОМОВ В МОЛЕКУЛАХ. ЭЛЕМЕНТЫ
ТЕОРИИ СИММЕТРИИ МОЛЕКУЛ
Основные понятия и символы
[К., с. 77-86]
Геометрическая конфигурация атомов в молекуле зависит от на-
направлений химических связей каждого атома в пространстве. Направ-
Направление же химических связей определяется типом АО и МО. На рис. 5
приведены ожидаемые равновесные геометрические конфигурации мо-
молекул в зависимости от числа связывающих электронных пар и числа
неподеленных электронных пар. Для определения равновесной геомет-
геометрической конфигурации молекулы следует установить число а- и л-
связей, число свободных пар электронов, не участвующих в химиче-
химических связях. Пользуясь рис. 5, можно установить равновесную геомет-
геометрическую конфигурацию атомов в молекуле.
Под симметрией молекул понимают симметрию расположения ядер
ее атомов в равновесном состоянии. Молекула считается симметрич-
симметричной, если имеется линейное ортогональное преобразование координат,
которое приводит к конфигурации, не отличимой от первоначальной.
Преобразование координат, приводящее к идентичному расположе-
расположению ядер атомов молекулы, называют операцией симметрии. Элемен-
Элементы симметрии — это вспомогательные образы (точка, прямая линия,
16
Число непо-
оеленных
злекшрон-
ныхпар
Число связь/бающих электронных пар
Линейная
Booh
А
Нелинейная
Нелинейная
Плоский
треугольник
О
Л-
Тригональная
пирамида
Т- образная
тетраэдр
Га
Искаженный
тетраэдр
Плоский
кбадрат
Таигональная
дипирамида
C
КЬадратная
пирамида
С
Октаэдр
О/,
НепраЬильныи
октаздр
Рис. 5. Ожидаемые равновесные геометрические конфигурации моле-
молекул в зависимости от числа связывающих и иеподелениых электрон-
электронных пар
плоскость), с помощью которых обнаруживается симметрия фигуры
(или пространства), табл. 2.
Главная ось симметрии — это ось вращения, имеющая наивысший
порядок п. Плоскость симметрии, содержащую ось наивысшего поряд-
порядка, условились обозначать символом av. Плоскость симметрии, перпен-
перпендикулярную главной оси, условно обозначают символом ah.
Кроме элементов симметрии и операций симметрии, приведенных
в табл. 2, следует указать на тождественное преобразование Е. Тож-
Тождественное преобразование равносильно тому, что система из равно-
Таблица
и
Элемент симметрии
Плоскость
Ось вращения
Центр симметрии
Ось зеркальио-поворот-
иая
2. Условные записи операций симметрии
символы элементов симметрии
Символ
элемента
симметрии
а
Сп
i
Sn
Операция симметрии
Отражение в плоскости
Поворот на угол 2я/л
Отражение в точке
Поворот вокруг оси и
отражение в плоскости,
перпендикулярной оси
Условная
запись
операций
симметрии
S(o)
S(Cn)
sf
S(Sn)
17
весной конфигурации ядер атомов вообще не подвергалась'преобра-
зованию.
Совокупность нескольких операций симметрии записывают как
«произведение»* соответствующих символов элементов симметрии.
Символ операции симметрии, выполняемой позже, записывается сле-
слева от оператора 5 той операции, которая выполняется раньше.
Над каждой молекулой можно произвести ряд операций симмет-
симметрии, преобразующих молекулу до состояния, не различимого с тем,
которое было до преобразования. Полная совокупность таких опера-
операций симметрии представляет группу симметрии. Число операций сим-
симметрии в группе называют порядком группы. Группа операций, напри-
например а, Ь, с, ..., определяется как совокупность, удовлетворяющая ус-
условиям: 1) произведение двух операций группы эквивалентно какой-
либо операции этой же группы (ab = с); 2) система содержит тождест-
тождественную операцию Е (аЕ = Еа = а); 3) для каждой операции имеется
обратная операция, которая является операцией этой же группы
(аа~1 = а~га = Е); 4) произведение нескольких операций обладает
свойством ассоциативности a (be) = (ab) с.
Все перечисленные операции симметрии оставляют хотя бы одну
точку в пространстве без изменения. Комбинацию операций симмет-
симметрии, при которой по крайней мере одна точка остается без изменения,
называют точечной группой. Число возможных точечных групп ог-
ограничено. Любая молекула должна относиться к какой-либо одной
из этих точечных групп. Все точечные группы делят на три основных
типа: 1) группы низшей симметрии содержат только оси второго по-
порядка и плоскости симметрии; 2) группы средней симметрии содержат
одну ось не ниже третьего порядка; 3) группы высшей симметрии со-
содержат несколько осей не ниже третьего порядка. Каждая точечная
группа имеет свой вполне определенный набор элементов и операций
Точечная
группа
Сг
Сз
с20
c3v
Coop
Сзп
D3d
Е
Е,
Е,
Е,
Е,
Е,
Е,
Т
а б л и ц а 3. Точечные группы
Операции симметрии,
элементы симметрии
Сз
Сз,
с3,
Соо
Сз.
зс2
2а„
За0
ооа„
Oh, i
Si, 2od
3C2, Se, i, 3a,j
Точечная
группа
D2h
D3h
Dih
Dih
Daoh
Td
Oh
симметрии
Операции симметрии.
элементы симметрии
Е, ЗС2, За», (
Е, С3, ЗС2, За0, а/[
?,C4,4C2,4ao,ah,C2,S4, i
а; , Cg, ос2, оа^, а/1,с2,Сз,*Ъв>'
?, Соо, обС2, ооа0, а^, ('
?, ЗС2, 4С3 6а, 3S4
?, ЗС4, 4С3, 3S4, 3C2,6C2,
За, 4Se
Здесь и ниже понятие «произведение» не аналогично действию умножения
18
симметрии. В табл. 3 приведены точечные группы, их символы и
перечень всех операций симметрии, составляющих группу.
Пользуясь табл. 3, можно установить все элементы симметрии, ко-
которыми обладает молекула в равновесном состоянии.
ЗАДАЧИ С РЕШЕНИЯМИ
1. ЗапишитеМО молекулы О2 и ионов OJ иО2". Расположите час-
частицы в ряд по увеличению равновесного межъядерного расстояния на
основании порядка связи.
Решение. Запишем электронные конфигурации и определим
порядок связи:
О2 (alsJ(°isJ K5J(°2SJ К",J {ЩРуУ (W {я'2Ру) (яу 2,
и = 1/,(Ю-6)=2;
О2+ (°lsJ(afsJ (<%J(^SJ (°2РХУ (ЪРуJ (Щ1>2У [Я}„у),
u = i/2 A0—5) = 2,5;
u = i/2A0—7) = 1,5.
Зная порядок связи, можно сделать вывод о том, что межъядерные
расстояния будут возрастать в ряду О^, О2, Oj.
2. Исходя из электронных структур частиц BN, ВО и СО, распо-
расположите их в порядке возрастания равновесного межъядерного рассто-
расстояния.
Решение. Запишем электронные конфигурации в частицах и
рассчитаем порядок связи:
BN (ox,)» (a;sJ (oM)« (ay* (n№yf (n2Vzf (а2Рж),
и = V2(8-4)-2;
ВО (ox,)» (a'uf (oM)» (OS,)» (n2Pyy (n2Pzy (o2l>Jt),
u=i/2(9—4) = 2,5;
СО (ox,)» (a;sJ (a2sJ (a^s
Определив порядок связи, можно сделать вывод о том, что равно-
равновесные межъядерные расстояния будут возрастать в ряду СО, ВО, BN.
3. Определите равновесную геометрическую конфигурацию моле-
молекулы ВеН2 с точки зрения метода МО. Установите точечную группу
симметрии.
Решение. Всего в молекуле ВеН2 четыре электрона, участвую-
участвующих в образовании a-связей. Связывающих электронных пар две. Не-
поделенных электронных пар нет. Из схемы, приведенной на рис. 5,
видно, что равновесная геометрическая конфигурация молекулы ВеН2
линейная. Молекула относится к точечной группе симметрии С,,,.
19
4. Некоторая точка L имеет координаты х, у, г. Запишите уравне-
уравнения преобразования, описывающие операцию симметрии S (<т2).
Решение. Операция симметрии S (<т2) есть отражение в плоскос-
плоскости ху. Изобразим точку до операции симметрии L и после операции
V (рис. 6). Уравнениями преобразования будут:
§(az)x = x] S(az)y = y', § (az) z=—z.
5. Некоторая точка имеет координаты х, у и г. Напишите уравне-
уравнения преобразования, описывающие операцию симметрии S (<тж).
Решение. Операция симметрии S (ах)
(см. табл. 2) есть отражение точки в плоско-
плоскости уг (рис. 6). Точка L после операции отра-
отражения будет L". Отсюда уравнения преоб-
преобразования запишутся так:
S(ax)x=— х\
= yn S(ax)z =
Рис: 6. Преобразование
S (ах) точки ' в плоско-
плоскости
6. Проведите анализ элементов и опера-
операций симметрии молекулы NH3.
Решение. Молекула аммиака NH3
имеет структуру трехгранной пирамиды с яд-
ядром атома азота в вершине. Через ядро атома
азота проходит ось симметрии третьего по-
порядка С3, имеются три плоскости симметрии
av. Отсюда, согласно табл. 3, молекулу NH3
можно отнести к точечной группе CSv.
7. На примере молекулы NH3 проверьте соблюдение первого ус-
условия группы, согласно которому произведение двух элементов сим-
симметрии есть элемент симметрии.
Решение. Отразим все возможные произведения операций сим-
симметрии NH3 в форме таблицы произведений. Для этого в первой стро-
строке и в первом столбце запишем все символы элементов симметрии мо-
молекулы NH3.Ha пересечении строки и столбца поместим символ соот-
соответствующего произведения элемента симметрии, стоящего в первом
столбце, на элемент симметрии, стоящий в первой строке.
Элементы симметрии, стоящие во второй строке и во втором
столбце, не отличаются от элементов, стоящих соответственно в пер-
первой строке и в первом столбце, так как они представляют произведе-
произведение на элемент тождественности Е. Для формирования третьего столб-
столбца сначала мысленно произведем операцию, стоящую в первом столбце,
затем произведем операцию, стоящую в первой строке. Например,
Сз^1' = <#"• Из таблицы видно, что все произведения двух элементов
есть элемент симметрии.
20
Е
с3
с%
О(.)
?
?
с3
с%
о<»)
С3
с3
С1
Е
o«t)
а<з)
?
С3
о»)
а»>
"У»
о«»)
?
С3
<2)
о«»)
о»)
?
С3
«<s>
о»)
а<*>
С3
?
ЗАДАЧИ
1. На основании метода МО определите равновесную геометриче-
геометрическую конфигурацию молекулы СО2. Установите точечную группу сим-
симметрии и перечислите элементы симметрии.
2. Определите равновесную геометрическую конфигурацию иона
NOjf • Установите точечную группу симметрии и перечислите элементы
симметрии.
3. Определите равновесную геометрическую конфигурацию моле-
молекулы NH3. Установите точечную группу симметрии и перечислите эле-
элементы симметрии.
4. Определите равновесную геометрическую конфигурацию час-
частицы PF5. Установите точечную группу симметрии и перечислите эле-
элементы симметрии.
5. Определите равновесную геометрическую конфигурацию IF5.
Установите точечную группу симметрии и перечислите элементы сим-
симметрии.
6. Какой порядок имеет ось симметрии, проходящая через два ато-
атома углерода молекулы бензола, находящихся в пара-положении?
7. Какой порядок имеет ось симметрии, проходящая через центр
тяжести перпендикулярно плоскости молекулы бензола?
8. Напишите уравнения преобразования координат при операциях
симметрии S (Cn) x, S (Сп) у и S (Cn)z.
МНОГОВАРИАНТНАЯ ЗАДАЧА
Определите точечную группу симметрии, равновесную геометричес-
геометрическую конфигурацию и перечислите элементы симметрии у соединения
А.
21
№ варианта
1
2
3
4
5
6
7
8
9
Соединение
А*
Н2О
PtClj-
NH3
SiHFs
SiCl4
HCN
SiHsF
SiH4
СНнСН
№ варианта
10
11
12
13
14
15
16
17
18
Соедлненне
A*
co§-
caof-
soa
sos
PC1S
CeHe
SbFs
NC1O2
NFS2
№ варианта
19
20
21
22
23
24
25.
Соединение
A*
NaO
o3
Pis
SO|~
SbCls
CH4
CHC13
• Если возникает сомнение относительно структуры соединения, то обратитесь к [С. X.,
т. 1, с. 3431.
ГЛАВА III
ВРАЩАТЕЛЬНОЕ ДВИЖЕНИЕ И ВРАЩАТЕЛЬНЫЕ
СПЕКТРЫ ДВУХАТОМНЫХ МОЛЕКУЛ
Основные уравнения и символы
[К., с. 96—100; Д., с. 557—560]
Энергию вращательного движения двухатомных молекул можно
определить по уравнению
где Bv — вращательная постоянная (см, м) для данного колеба-
колебательного состояния v; I — момент инерции, кг-м2; h — постоянная
Планка; / — вращательное квантовое число, принимающее значения
О, 1, 2, 3, 4, .... Если принять, что при вращении молекулы (для моде-
модели жесткого ротатора) ее параметры остаются постоянными: ге =
= const и /е = const, то уравнение (III.I) для термов вращательной
энергии можно записать так:
Е,
F(l)=*-r!-~ = Bej(j+l), (III.2)
he
где Ве =h/{8n2cle) — вращательная постоянная, относящаяся к мини-
минимуму потенциальной энергии; с — скорость света.
По правилу отбора для спектров поглощения в микроволновой и
дальней ИК-области А/ = )' — /" = +1. Положение линий во враща-
вращательном спектре может быть записано в виде
Е"
'- ¦¦¦ ¦¦ (III.3)
li-
like
he
где v — волновое число, см, м.
22
Разность волновых чисел двух соседних линий:
Д\^=2Ве, (Ш.4)
где Ве — вращательная постоянная, см, м; если подставить по-
постоянные величины, то получим численные значения констант:
2,79905-Ю-»
Момент инерции молекулы в общем виде равен
i
1
Для несимметричных двухатомных молекул
(IH.5)
При свободном вращении молекулы тлгх — т2г2, тогда
/е = (гг| (III.8)
где \х, — приведенная масса;
12 Аг+Аг > \ /
где At — атомная масса i-ro атома; /Пс — масса атома углерода, кг;
/пс/12= 1,6604- Ю-27 кг;
A- ¦/ h = i/ h , . (ШЛО)
Поглощение квантов света молекулами вещества возможно только тог-
тогда, когда молекула обладает постоянным электрическим моментом ди-
диполя.
Вращательные энергетические уровни вырождены. Вырождение
gj определяют по уравнению
gj = 2j+l. (III.И)
ЗАДАЧИ С РЕШЕНИЯМИ
1. В дальней ИК-области спектра 1Н35С1 поглощает излучение с
волновыми числами:
№ линии ... 1 2 3 4 5 6 7
V, м-1 . . . . 8538,4 10673,0 12807,6 14942,2 17076,8 19211,4 21346,6
Определите среднее значение момента инерции и межъядерное расстоя-
расстояние.
Решение. На основании волновых чисел линий поглощения,
связанных с изменением энергии вращательного движения, определя-
определяем Avcv. Для этого определим разность волновых чисел соседних линий
23
и найдем Av"op = 2134,6 м. По уравнениям (III.4) и (III.5) найдем мо-
момент инерции
Б,5ВВ1.1О-« д
е 2134,6
Равновесное межъядерное расстояние рассчитываем по уравнению
(ШЛО); для этого необходимо знать приведенную массу, которую оп-
определим по уравнению (II 1.9):
1 35
и = — 1,6604.10-"= 1,6143.10-" кг,
1 -j-35
1,6143-10*'
2. Рассчитайте волновое число линии во вращательном спектре по-
поглощения 19F9Br, которая соответствует переходу молекулы с уровня
/ = 1 на вращательный квантовый уровень j = 2, если равновесное
межъядерное расстояние ге = 1,7555-10~10 м.
Решение. Волновое число линии поглощения определяем по
уравнению (III.3). Для этого по уравнению (III.9) находим приведен-
приведенную массу:
19-79
1,6604.10-2' = 15,3-1,6604-10-2' = 25,4-10-2' KFi
Р 19 + 79
а момент инерции молекулы по уравнению (II 1.8):
/ = 25,4-Ю-2' A,7555-Ю-10) =78,355-Ю-4' кг-м2.
Тогда
~ 6,6256- 10-за A + 1)
4-3,142-3-108-78,355-Ю-4'
= 0,714-10S-2=1,428-102 M~-i.
3. Определите энергию вращательного движения 19F79Br на враща-
вращательном квантовом уровне / = 1, если равновесное межъядерное рас-
расстояние ге = 1,7555- Ю-10 м.
Решение. Зная межъядерное расстояние и определив приведен-
приведенную массу молекулы, находим момент инерции /. Отсюда энергия вра-
вращения, согласно уравнению (III.1), будет
F,6256- ю-34J
Ч' + ') 00709610-22.1.2 = 0,1419-10-22 дж.
8я2-78,355-10-*'
4. На какую величину будут отличаться волновые числа линий по-
поглощения во вращательных спектрах ^^Cl и WCl.e^n линия отра-
жаешереход молекулы с вращательного квантового уровня / = 6 на
вращательный квантовый уровень / = 7. Равновесное межъядернре
расстояние у обеих молекул одинаково и равно 1,2746-10~10 м. -.
24
Решение. Определим моменты инерции молекул 1Н35С1 и 1Н37С1
1-35
!HS5Cl/e = г— 1,6604-Ю-2' A,2746-Ю-"»J = 2,6226-Ю' кг-м2;
1 -{-Зо
1 37
Ie = 1,6604- Ю-27 A,2746- 10-1оJ= 2,6265-10'4' кг-м2;
1 —{— О/
~ 5,5981 Ю-44
для ^^'
~ 5,5981-Ю-44
для iH3'Clv= —' 7= 14,9197-Ю3 m~i.
2,6265-Ю-4'
Линия поглощения ^''Cl смещена относительно линии в сторону
меньших волновых чисел на 221,92 м.
ЗАДАЧИ
1. Рассчитайте момент инерции молекулы Щ121 I [M.], если из-
известно равновесное межъядерное расстояние этой молекулы.
2. Определите энергию вращения молекулы 1Н12' I на десяти первых
вращательных квантовых уровнях и волновые числа девяти первых
линий во вращательном спектре поглощения, если момент инерции мо-
молекулы /е = 4,295- К)-47 кг-м2. Молекула 1Н12'1—жесткий ротатор.
3. Во вращательном спектре поглощения некоторого вещества НХ
в дальней ИК-области спектра наблюдается несколько линий поглоще-
поглощения с волновыми числами (м): 13649,4; 15355,6 и 17061,8. Равновес-
Равновесное межъядерное расстояние ге = 1,4146-10~10 м. Определите атомную
массу атома X.
4. Сопоставьте энергии вращения молекул HF на десяти первых
вращательных квантовых уровнях со средней кинетической энергией
поступательного движения молекул при температурах (К):300, 500
и 1000. Значение момента инерции возьмите из справочника [M.j.
5. Определите волновые числа первых десяти линий в спектре по-
поглощения 1H19F в дальней ИК-области. Момент инерции молекулы возь-
возьмите из справочника [М.].
6*. Определите соотношение Nj/N0 (Nj и No — число моле-
молекул на /-м и на нулевом вращательных квантовых уровнях молекулы
^"F) на десяти первых вращательных квантовых уровнях при 300К.
7*. Определите 2 —и> пренебрегая числом молекул 1H"F, заселя-
/=о No
ющих вращательные уровни с / > 9 при 300 К, рассчитайте число
молекул на девяти первых вращательных квантовых уровнях, если взят
1 моль *HleF.
- 8*. На основании данных, полученных при решении задач 4,5 и 7,
нарисуйте энергетические уровни, переходы молекул прн поглощении
электромагнитного излучения и спектр поглощения с учетом того, что
вероятность поглощения не зависит от энергий квантового уровня, с
которого происходит переход.
25
9*. В спектре 12С1вО, снятом на приборе с высокой разрешающей
способностью, обнаружены линии:
/
0
1
2
3
4
5
6
7
8
9
V. СИ
3,845
7,690
11,534
15,379
19,222
23,065
26,907
30,748
34,588
38,426
/
10
11
12
13
14
15
16
17
18
19
20
V. СИ"'
42,263
46,098
49,939
53s763
57,593
61,420
65,245
69,068
72,888
76,705
80,519
/
21
22
23
24
25
26
27
28
29
30
V, СИ
84,330
88,138
91,943
95,744
99,541
103,334
107,124
110,909
114,690
118,467
Определите средний момент инерции и равновесное межъядерное
расстояние в молекуле 12С16О.
10. На основании данных, приведенных в таблице задачи 9, оп:
ределите энергию вращения (Дж) молекулы 12С16О на вращательном
квантовом уровне / = 30.
11*. На основании данных, приведенных в задаче 9, определите из-
изменение межъядерного расстояния в молекуле 12С16О при переходе
ее с нулевого на 30-й вращательный квантовый уровень. Покажите,
что молекула 12С1вО не является жестким ротатором.
12. Определите разность волновых чисел линий поглощения во
вращательном спектре молекул 1Н35С1 и2Н35С1 при переходе молекулы
с вращательного квантового уровня / = 6 на уровень j = 7. Равно-
Равновесное межъядерное расстояние у обеих молекул одинаковое и равно
ге = 1,2746-Ю-10 м.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. По разности волновых чисел соседних линий поглощения в даль-
дальней ИК-области спектра рассчитайте момент инерции и равновесное
межъядерное расстояние в молекуле А.
№ варианта
1
2
3
4
5
6
7
Молекула А
2Н35С1
*н**а
ХН«С1
2Н37С1
3Н37С1
!Н'»ВГ
Av, си-'
21,35
10,97
7,51
21,32
10,94
7,48
17,06
№ варианта
8
9
10
11
12
13
14
Молекула А
2Н'»Вг
WBr
1H«F
2Н1вр
3Hl»F , ,
Ш^Вг
2H*iBr
Av, си-'
8,64
5,83
42,22
42,17 .
15,48
17,06
8,64
26
Продолжение
№ варианта
15
16
17
18
19
20
Молекула А
sH8lBr
36Ql8p
S7C119F
S5C179Br
35С1"ВГ
s'Cl'»Br
Av, см 1
5,83
1,03
1,01
0,195
0,194
0,188
№ варианта
21
22
23
24
25
Молекула А
s'Cl8lBr
1H127 I
2H127!
SH12'I
12Cl4N
Av, см 1
0,187
13,13
6,61
4,44
3,80
2. На основании равновесного межъядерного расстояния в частице
А рассчитайте волновые числа десяти первых линий во вращательном
спектре поглощения, считая частицу жестким ротатором.
№ варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
Частица А
"С1 Н
i2CleO
12Q9F
12С35С1
12С31р
28SilH
28SileO
28Sil8F
28Si35C1
"N1 H
14N16O
"O'H
16Q2H
relO-», и
1,120
1,128
1,267
1,645
1,558
1,521
1,509
1,600
2,058
1,038
1,151
0,971
0,971
№ варианта
14
15
16
17
18
19
20
21
22
23
24
25
Частица А
S2S1H
325160
12C2H
12CS7Q
28Si2H
28SiS7Cl
14N2H
1вОзн
S2S2H
12CSH
28SSH
S2S3H
re-10-1; и
1,341
1,481
1,120
1,645
1,521
2,058
1,038
0,971
1,341
1,120
1,521
1,341
ГЛАВА IV
ВРАЩАТЕЛЬНОЕ ДВИЖЕНИЕ И ВРАЩАТЕЛЬНЫЕ
СПЕКТРЫ МНОГОАТОМНЫХ МОЛЕКУЛ
Основные уравнения и символы
[К., с. 96—100; Д., с. 557—560]
Моменты инерции вращения молекулы вокруг главных осей, прохо-
проходящих через центр тяжести молекулы, равны:
(IV.l)
27
где mt — массы ядер атомов; rix, riy и riz — равновесные расстояния
ядер атомов от осей вращения. За начало координат принимают центр
тяжести молекулы, ординаты которого определяют по уравнениям:
Многоатомные линейные молекулы имеют две степени свободы вра-
вращательного движения вокруг осей, перпендикулярных оси молекулы.
Нелинейные многоатомные молекулы имеют три степени свободы вра-
вращательного движения.
Рассмотрим три типа молекул: 1) сферический волчок I x = 1У=
= Iz. Молекулы имеют несколько осей симметрии порядка ц, > 3;
2) асимметричный волчок 1хф1уф1г. Молекулы не имеют осей сим-
симметрии порядка п ~> 3; 3) симметричный волчок. Два из трех момен-
моментов инерции равны между собой: Iх = 1у ф Iz или Iхф 1У = /2.
Общей характеристикой вращательных энергетических уровней мно-
многоатомных молекул являются значения квантовых чисел / и mf.
(IV.3)
где МРх, Мр и МРг — моменты количества движения. Одновременно
квантуется проекция момента количества движения на ось неподвиж-
неподвижной системы координат:
где rrij — квантовое число, принимающее значения целых чисел от
—/ до +/', включая ноль. Отсюда /п;- принимает 2/ + 1 значений. Для
сферического волчка 1Х = 1У = Iz\
(iv.6)
Квантованные значения энергии будут такие же, как и у двухатомных
молекул [см. уравнение (III. 1)]. Однако многоатомные молекулы типа
сферического волчка имеют три степени свободы, отсюда для полной ха-
характеристики движения кроме j и /и/ необходимо еще одно квантовое
число k, определяющее значение проекции момента количества движе-
движения на одну из подвижных осей, вращающихся вместе с молекулой:
MPx=(h/2n)k. ' , (IV.7)
Квантовое число k принимает значения от —/ до +/, включая и ноль.
Отсюда вырождение /-уровня определяется выражением
28
Распределение молекул по вращательным квантовым уровням
Для вытянутого симметричного волчка Ix<i Iy = 1г, соотношение
вращательных постоянных будет А > В = С. Энергию вращения оп-
определяют из уравнения (VI.5) и значений моментов инерции для вытя-
вытянутого симметричного волчка:
После введения буквенных обозначений для вращательных по-
постоянных уравнение (IV. 11) принимает вид
EJh=(A-B)k* + Bj(j+l). (IV. 12)
Для сплющенного симметричного волчка /х = Iy < Iг соотноше-
соотношение вращательных постоянных будет А = В > С. В соответствии с
этим
. (IV. 13)
В уравнениях (IV.11) и (IV.12) второй член зависит только от враща-
вращательного квантового числа /. Первый член зависит от квадрата кван-
квантового числа k, определяющего проекцию момента количества движе-
движения на главную ось симметрии, проходящую через центр тяжести мо-
молекулы. Каждый энергетический уровень 2B;- + 1) раз вырожден,
за исключением нулевого уровня, где k — 0 и вырождение 2/ + 1.
При поглощении квантов электромагнитного излучения во вращатель-
вращательном спектре наблюдают переходы молекул А/ = + 1, Д& = 0.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Определите межъядерное расстояние гес_0 в молекуле СО2,
если момент инерции / = 71,758-10~47 кг-м2. Молекула СО2 имеет
симметрию Dooh.
Решение. Так как молекула СО2 линейна, то имеется только две
степени свободы вращательного движения вокруг оси, перпендикуляр-
перпендикулярной оси молекулы. Оба момента инерции одинаковы. Вращательное же
движение молекулы вокруг собственной оси невозможно, поскольку
момент инерции такого вращения равен нулю, отсюда энергия враще-
вращения, определенная по уравнению (III.1), будет бесконечно большой.
29
Равновесное межъядерное расстояние находим по уравнению (IV. 1):
71,758-10-4' .
2. Определите момент инерции и вращательную постоянную (м)
молекулы OCS, если в микроволновой области спектра в спектре по-
поглощения наблюдаются максимумы поглощения (м): 81, 143; 121,
714; 126, 686; 202, 886. Молекула OCS линейная, тип симметрии С.„.
Решение. Определим среднюю разность волновых чисел со-
соседних линий в спектре поглощения (м): Av1 = 40,571; Av2 = 40,572;
Av^ = 40,600; Avcp = 40,581. Так как молекула OCS линейная, то
она имеет только две степени свободы вращательного движения.
Оба момента инерции равны между собой. Момент инерции находим
по уравнению
h 5,5981-Ю-44
/= =.; /=—¦ = 137,949-10~4? кг-м*.
4n2cAv 40,581
Вращательная постоянная будет
h Av
^ 20291
3. Определите произведение моментов инерции 1а I в 1с молекулы
воды на основании равновесных межъядерных расстояний гео_н =
= 0,957-Ю-10 ми равновесного угла НОН 104°ЗГ. Молекула Н2О
имеет симметрию С2„.
Решение. За начало координат примем центр тяжести молеку-
молекулы, который определим по уравнениям (IV.2). Моменты инерции 1Х, 1У,
и /г определяем по уравнениям (IV. 1). Произведение главных момен-
моментов инерции молекулы может быть рассчитано из векового уравнения
"Т 'хх — 'ху 'х
— lxy-\-Iyv — h
Величины ftj вычисляют по уравнениям:
1 1
м м
1
м
30
= 'Zmtxiyi
mi
1
1хг=2тгхг гг———
1
M
где М = 2/и,-. Решением векового уравнения
третьего порядка будет
— Ixy Uxy hi—
) — Ixz Uxy
hy }xz)-
н,
Рис. 7. Равновесная гео-
геометрическая конфнгура-
цня молекУлы воды
Полученные результаты целесообразно свести
в таблицу. Молекула воды, координаты ядер
атомов, равновесные межъядерные расстояния, равновесный угол и
оси координат представлены на рис. 7.
Атом
О
н,
н2
m-W, кг
2,656
0,166
0,166
2т,-=2,988-Ю-2в кг
*10", м
0
-0,586
—0,586
у-Юю, м
0
0,757
-0,757
г-Ю", м
0
0
0
Атом
Х2-102°
у2 -1020
ху- 10го
mx-lQsi
ту-Юм
тху 10«
т(х2+у2)-Ю*
mx2-10«
my2-10«
О
0
0
0
0
0
0
0
0
0
н,
' 0,343
0,573
—0,444
—0,097
0,126
-0,074
0,152
0,057
0,095
Н,
0,343
0,573
0,444
—0,097
—0,126
0,074
0,152
0,057
0,095
—0,194
0
0
0,304
0,114
0,190
5 = 0,190-10-46,
0,038
2,988
10-4в=0,10Ы0-«,
31
10-48=0,291-10-",
/rr = O,3O4-lO«_o,O38
2,988
4y = 0, Ixz = 0 и Ivz = 0.
Тогда
/A/B/c= 0.i90.10-«.0,101-10-«.0,291-lO-4* = 55,84-10-!« (кг-м2K.
ЗАДАЧИ
1. Определите равновесное расстояние между ядрами атомов С и
S в молекуле CS2 по значению момента инерции / = 94,507-107
кг-м2. Молекула CS2 имеет симметрию ?>„/,.
2. Средняя разность волновых чисел соседних линий во вращатель-
вращательном спектре поглощения HCN составляет 2,977-102 м. Определите
момент инерции и вращательную постоянную В' (м).
3. Определите произведение моментов инерции IaIbIc молекулы
SO2 на основании равновесного межъядерного расстояния res_o =
= 1,432- Ю-10 м и равновесного угла OSO 119°2Г. Молекула SO3 име-
имеет симметрию С2в.
4. Определите произведение моментов инерции IaIb^c молекулы
СН35С13, если равновесные межъядерные расстояния ге = 1,073 х
X 10-10 и ге =1,763- Ю-10 м и угол С1СН 108°32'. Молекула СНС13
С—С*
имеет симметрию С3в.
5. По моментам инерции молекулы воды 1а = 0,996-10~47, /д =
= 1,908-10~47 и /с = 2,981 • 107 кг- см2 определите равновесное межъ-
межъядерное расстояние ге и угол НОН.
о—н
6. Докажите, что для нелинейных трехатомных молекул 1а ф I' вф
Ф1С и 1А + /в = /с-
7*. Определите главные моменты инерции молекулы 81PXHS по рав-
равновесному межъядерному расстоянию ге = 1,4206-10~10 м и углу
НРН 93°5'. Установите, является ли молекула РН3 сплющенным или
вытянутым симметричным волчком.
8*. Определите энергии десяти первых вращательных квантовых
уровней молекулы 31Р1Н3, если главные моменты инерции молекулы
имеют значения: 1А = 1в = 6, 237-10-47 кг-м2; /с = 7,111-10"*'
кг-м2. Вычертите энергетические уровни в условном масштабе
и покажите стрелками возможные переходы при поглощении квантов
света в дальней ИК-области спектра.
9. Момент инерции молекулы NH3 вокруг главной оси симметрии
/= 1,085-10~47 кг-м2. Определите отношение числа молекул NH3,
находящихся на вращательном уровне / = 5, к числу молекул, нахо-
находящихся на нулевом вращательном квантовом уровне, при 1000 К.
10. Определите главные моменты инерции и произведение глав-
главных моментов инерции молекулы бензола, если ге = 1,084 х
С—Н
X Ю0, ге = 1,397-Ю-10 м. Молекула бензола плоская и имеет
симметрию Deh.
32
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
Молекула XY4 имеет симметрию Td. На основании данных о равно-
равновесном межъядерном расстоянии X — Y вычислите; 1) момент инер-
инерции молекулы; 2) вращательную постоянную Ве (в джоулях); 3)
энергию вращения молекулы на вращательном квантовом уровне
/ = 10; 4) отношение числа молекул на уровне / = 10 к числу молекул
на нулевом вращательном квантовом уровне при 300 К; 5*) энергию
вращения молекулы XY на 20 первых вращательных квантовых уров-
уровнях; 6*) Nj/N0 для 20 первых вращательных квантовых уровней при
300 К; 7*) 2—;' при 300 К; 8*) число молекул, находящихся на нулевом
вращательном квантовом уровне, если взять 1 моль вещества XY4,
считая, что N/No для уровней / > 20 незначительно; 9*) долю моле-
молекул, находящихся при 300 К, на уровне / = 5.
№ варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
XY,
12С!Н4
12С2Н4
"СИ.
28SiiH4
28Si2H4
28Si3H4
'2GexH4
'2Ge2H4
'2Ge3H4
U9SniH4
"»Sn2H4
lleSn3H4
i2Ci9p4
fXylO», м
1,093
1,093
1,093
1,480
1,480
1,480
1,527
1,527
1,527
1,701
1,701
1,701
1,322
№ варианта
14
15
16
17
18
19
20
21
22
23
24
25
XY,
28Sii»F4
2»Sii»F4
aosjiep
72Gel»F4
neSn^F,
48TJ18F4
91Zri»F4
l78Hfl8F4
20'Pb1»F4
2»Si!H4
2»Si2H4
29Si3H4
rx—Y-10"- M
1,540
,540
,540
1,670
1,840
1,740
,850
,890
2,020
,480
,480
,480
ГЛАВА V
КОЛЕБАТЕЛЬНОЕ ДВИЖЕНИЕ АТОМОВ В МОЛЕКУЛАХ.
КОЛЕБАТЕЛЬНЫЕ И КОЛЕБАТЕЛЬНО-ВРАЩАТЕЛЬНЫЕ
СПЕКТРЫ
Основные уравнения и символы
[К., с. 100-104; Д., с. 567-571]
Колебания двухатомных молекул при малых амплитудах прибли-
приближенно описывают уравнением
f=-ke(r-re), (V.I)
где / — сила взаимодействия между ядрами атомов, Н; ke — силовая
постоянная молекулы, Н/м; г и ге — межъядерное расстояние, м.
Зак. 767
33
Для модели гармонического осциллятора решение уравнения A.3)
имеет вид:
Ч) J^
Ч—*¦)¦=¦ J^
где Ev — энергия колебательного движения атомов; v — колебатель-
колебательное квантовое число, принимающее значение 0,1, 2, ..., итах; ц — при-
1 ч /"k~
веденная масса. Величина j- у — = ve, где ve—частота колебаний,
с. Если принять, что ve = ше, то уравнение (V.2) преобразуется к
виду:
Ev = \v +— )hca>e, (V.3)
где юе — колебательная постоянная или собственная частота, см,
м. Уравнение (V.1) не может удовлетворительно описать колебатель-
колебательное движение при больших амплитудах колебания. Потенциальная
энергия более или менее удовлетворительно описывается уравнением
Морзе
Ur=De [l— e ~a ('""'"e)]2, (V.4)
где Ur — потенциальная энергия; De и а — постоянные величины;
ixe; (V.5)
= У 8яа с ynaexelh , (V.6)
где (HgXe — коэффициент ангармоничности колебания, см, м; хе —
коэффициент ангармоничности колебания (величина безразмерная).
Для модели ангармонического осциллятора энергия колебательного
движения выражается уравнением
Чсщхе; (V.7>
для термов
Gn =
Ev ( 1 \ / 1 у
he
В колебательных спектрах наблюдается поглощение квантов
/icv = ?c— ?„, v = GD—G0 = {(Be — e>exe(v+l)]v, (V.8)
где v — волновое число максимума полосы поглощения; Ev — энер-
энергия колебательного движения на и-м колебательном квантовом уровне;
Ео — энергия колебательного движения на нулевом колебательном
квантовом уровне. С учетом того, что при комнатной температуре боль-
большинство молекул находятся на нулевом уровне, волновые числа пере-
34
ходов, согласно правилам отбора Аи = v' — xf = ±1, ±2, ±3
могут быть определены по формулам:
(V.9)
^з<-о = 3ме— 12(вехе. (V. 11)
В спектре наблюдаются полосы:^ — основная полоса (основной тон);
v2 — первый обертон; v3 — второй обертон.
Максимальное значение колебательного квантового числа
Максимальная энергия колебательного движения — энергия диссоци-
диссоциации De, отсчитываемая от минимума потенциальной кривой;
Для перевода молекулы с нулевого на максимальный колебательный
квантовый уровень итах необходима энергия
где Do — экспериментально определяемая энергия диссоциации.
Если вещество находится в газообразном состоянии, то вместе с воз-
возбуждением колебательного движения возбуждается также и враща-
вращательное движение молекулы. Энергия вращательно-колебательного
движения равна
При переходе молекулы с нулевого колебательного на первый колеба-
колебательный квантовый уровень изменяется вращательное состояние моле-
молекулы. Тогда изменение энергии будет
vr.B=
Если А/ = + 1, то в спектре появляется R-ветвь:
которая расположена со стороны больших волновых чисел от vB. Если
же А/ = — 1, то в спектре появляется Р-ветвь с меньшими волновыми
числами:
v = e>e(l-2xe)-2Bvj. (V.18)
2* 35
У-Г
¦ 6
¦ s
щ
о
J
На рис. 8 показаны энергетиче-
энергетические уровни, переходы молекул
при поглощении квантов электро-
электромагнитного излучения и вид спект-
спектра поглощения двухатомных моле-
молекул. Уравнения (V.17) h(V.18) вы-
выведены с учетом того, что враща-
вращательная постоянная Bv зависит от
энергии колебательного движения.
Вращательная постоянная В„
уменьшается с ростом энергии ко-
колебательного движения, что выра-
выражается уравнением
"Г" • (V.19)
7
л
4
Р-Йетвь
R-бетЬь \/
О
j
2
С учетом (V.19) для /?-ветви по-
получим
v'—aie — 2(BexP+2Se (/+1) —
-1.5о(/+1)(/ + 2); (V.20)
для Р-ветви'
v=a>e—
e — 2Se/— 1,5а (/ —!
(V.21)
UJ--1 AJ=+1 —~)>
Рис. 8. Вращательно-колебательные
энергетические уровни, переходы мо-
молекулы при поглощении света и вра-
щательно-колебательный спектр двух-
двухатомных молекул
Разность волновых чисел двух со-
соседних полос во вращательной
структуре
Av = 25e. (V.22)
ЗАДАЧИ С РЕШЕНИЯМИ
1. В спектре поглощения 19F79Br, растворенного в неполярном раст-
растворителе, обнаружены основная полоса поглощения, более интенсив-
интенсивная, и первый обертон, менее интенсивный. Их волновые числа соот-
соответственно равны 663,6-102 и 1318,2-102 м. Определите частоту ко-
колебания атомов в молекуле и коэффициент^ангармоничности.
Решение. Подставим значения sx и v2 в (V.9) и .(V.10) и решим
оба уравнения:
663,6- 1012 = (ве —2(вехе 3we—6(Bexe= 1990,8-Юг
1318,2- 102 = 2<ве-6й>ехе 2(ве—6(йехе=1318,2-10г
oje =672,6-102 M-i
2o>t дге= 672,6-102—663-102 = 9,0-102; иехе = 4,50-102 м-1;
хе = 4,50-Ю2/F72,6-102) =6,69-Ю-».
36
2. Определите максимальное колебательное квантовое число для
19F'9Br, если ©„ = 672,6-102 м и хе = 6,69- Ю-3.
Решение. По уравнению (V.12) определяем итах:
ymax = (l— 6,69-10-s)/B-6,69-10-3) =74,23.
Так как колебательное квантовое число может принимать значения
только целых чисел, то необходимо округлить полученное значение до
W = 74-
3. Определите энергию колебательного движения атомов в молеку-
молекуле 19F79Br на нулевом и на максимальном колебательных кванто-
квантовых уровнях. Определите энергию химической связи, если юе =
= 672,6-102 м-1, хе = 6,69- Ю-3 и итах = 74.
Решение. Энергию колебательного движения вычислим по
уравнению (V.7), подставив вместо v ноль:
?кол = 0",5-6,62.10-3*.3-108-672,6-10-2_
— 0,25-6,62.10-34-3-108-672,6-102 = 0,66-10-й> Дж.
Энергию колебательного движения на максимальном колебательном
квантовом уровне получим по уравнению (V. 13):
?max = 6,62.10-S4-3-108.672,6-102/D-6,69-10-s) =49,89-10-го дж.
Энергия химической связи есть разность энергии колебательного дви-
движения на максимальном колебательном и нулевом колебательном уров-
уровнях, умноженная на постоянную Авогадро:
?Х-Св= D9,89-10-2°—0,66-10-20) 6,02-1023= 296,36-10s Дж/моль.
4. Определите энергию колебательного движения атомов в моле-
молекуле 19F79Br на колебательных квантовых уровнях v = 0, 1, 2, 3, 5, 8,
12, 20, 30, и 74, если юе = 672,6-102 м~\ хе = 6,69-10~3, umax = 74,
и оцените вклад второго члена в уравнении (V.7), характеризующего
отклонение колебания реальной молекулы от колебания гармониче-
гармонического осциллятора.
Решение. Зная юе и ' <аехв, вычислим ксше = 133,58-10~22
Дж, hcWgXg = 0,89-10~22 Дж. Полученные результаты сведем в табли-
таблицу, отдельно записывая первый и второй члены уравнения (V.7):
V
0
1
2
3
5
8
12
20
30
74
66,78
200,34
333,90
467,45
73457
1135,24
1669,48
2737,94
4073,52
9950,07
11. Д«
1 х \2
\о+~) hcaexe-10", Д,ж
0,22
2,00
5,56
10,90
29,92
64,30
139,11
374,07
827,97
4939,50
?-10", Дж
66,56
198,34
328,34
456,55
707,65
1070,94
1530,37
2363,87
3245,55
5010,57
37
С увеличением колебательного квантового
числа вклад ангармоничности возрастает.
На нулевом и первом колебательных кван-
квантовых уровнях колебания молекулы можно
считать практически гармоническими.
5. Определите минимальное и макси-
максимальное расстояния между атомами 19F
и 79Вг на колебательных квантовых уров-
уровнях' v = 0, 1, 2, 3, 5, 8, 12, 20, 30 и 74.
Постройте график ?кол = / (г).
Решение. Решим совместно уравне-
уравнения (V.4) и (V.7):
'Л 1,6re 2,0 Z.Z 2A ?.,6r-10%
Рис. 9. Энергетические уров-
уровни и амплитуды колебаний _ q U g—а {г~ге)\г
молекулы ^F^Br e
Энергии колебательного движения на всех колебательных квантовых
уровнях приведены в задаче 4. Вычислим константы De и а по уравне-
уравнениям (V.5) и (V.6):
?>е= 133,58-10-22/D.6,69- Ю-3) = 0,5- Ю-i8 Дж,
_
, 142-25,4-10-27-672,6-10^-3-
,69-
6,62-Ю-34
.Qlo
Уравнение (V.4) преобразуем к виду 1 — еу — YEK0JDe, где у =
= —а (г— ге). Значения каждого сомножителя в преобразованном
уравнении для всех заданных колебательных уровней приведены в
таблице на с. 39. По данным строим график ?кол = / (г) (рис. 9).
6. Определите волновые числа полос поглощения во вращательно-
колебательном спектре поглощения 19F79Br, если сое = 672,6- 102m-1
0
1
2
3
4
5
6
7
8
9
ю-
Д-ветвь
В'е (/+D-10-2, м-1
0,714
1,428
2,142
2,856
3,570
4,284
4,998
5,712
6,426
7,140
7,854
iT.10-2, „-1
664,31
665,03
665,74
666,46
667,17
667,88
668,60
669,31
670,03
670,74
671,45
Р-ветвь
В'е /-Ю-2, м-1
0,714
1,428
2,142
2,856
3,570
4,284
4,998
5,712
6,426
7,140
V- Ю-2, „-1
662,89
662,17
661,46
660,74
660,03
659,32
658,60
657,89
657,17
656,46
38
и шехе — 4,50- 10г м-1. Значение вращательной постоянной Be =
= 0,714-10* м-1, сое — 2ыехе = 663,6- 10* м-1.
Решение. Волновые числа полос поглощения в ^-ветви оп-
определим по уравнению (V.20), в />-ветви — по уравнению (V. 21).
ЗАДАЧИ
1. Определите силовую постоянную &е(Н/м) для молекулы XH19F,
если сое — 4,141-105 м-1.
2. Определите сое для 2Н19 F, если для WF сое = 4,141-105 м-1.
3. По волновым числам максимумов поглощения основной полосы
и первого обертона молекулы 12С1вО B,142-105 и 4,258-105 м соот-
соответственно) определите собственную частоту колебания (м~х) и коэффи-
коэффициент ангармоничности молекулы.
4. На основании значений частоты колебаний и ангармоничности
сое и (HgXe, взятых из справочника [М.], для молекулы СО определите
энергию колебательного движения на нулевом и первом колебатель-
колебательном квантовых уровнях.
5. Определите максимальное колебательное квантовое число, энер-
энергию колебаний на нулевом и максимальном колебательных квантовых
уровнях и энергию химической связи, отнесенную к молю вещества
6. На основании справочных данных сое и coexc, [M.] для Н2 опре-
определите отношение числа молекул на первом колебательном квантовом
уровне к числу молекул на нулевом колебательном квантовом уровне
при 300 и 1000 К.
7. На основании справочных данных сое и coexe [M.] для 12 опреде-
определите относительную заселенность молекул на первом колебательном
квантовом уровне при 300 и 1000 К.
8*. Для молекулы ГН2Н на основании значений r,,=0,7413-100 м,
юе = 3817,1-Ш* м-1 и (HgXg = 94,96-102 м-1 определите энергию ко-
колебательного движения на нулевом, пятом, десятом, двадцатом и
максимальном колебательных квантовых уровнях. Вычислите г—ге
по уравнению (V.4) и постройте кривую Морзе.
V
0
1
2
3
5
8
12
20
30
74
?„-Ю',
Дж
66,56
198,34
328,34
456,55
707,65
1070,94
1530,37
2363,87
3245,55
5010,57
Е" Ю-
D
133,12
396,68
656,68
913,10
1415,30
2141,88
3060,74
4727,74
6491,10
10021,14
±A-е»)
0,1153
0,1992
0,2562
9,3022
0,3762
0,4628
0,5533
0,6875
0,8057
1,0000
еУ1
0,8847
0,8008
0,7438
0,6978
0,6238
9,5372
0,4467
0,3125
0,1943
0,0000
еУ>
1,1153
1,1992
1,2562
1,3022
1,3762
1,4628
1,5533
1,6875
1,8057
2,0000
fee"»
Т.9468
1,9035
Т.8715
Т,8437
Т.7951
1,7302
1,6500
1,4949
1,2885
0,0532
0,0965
0,1285
0,1563
0,2049
0,2698
0,3500
0,5051
0,7115
39
Продолжение табл.
V
0
1
2
3
5
8
12
20
30
74
—г/i
0,1225
0,2222
0,2959
0,3599
0,4718
0,6212
0,8059
1,1630
1,6383
lg еУ'
0,0474
0,0788
0,0990
0,1146
0,1386
0,1652
0,1913
0,2272
0,2567
0,3010
Уг
0,1091
0,1814
0,2280
0,2939
0,3191
0,3804
0,4405
0,5232
0,5911
0,6931
(г,-г.) 10"
0,0607
0,1102
0,1467
0,1784
0,2339
0,3080
0,3996
0,5766
0,8123
г,1010, м
1,8162
1,8657
1,9022
1,9339
1,9894
2,0635
2,2551
2,3321
2,5678
-(гг-г„) Ю'»
0,5409
0,0899
0,1131
1,1309
0,1583
0,8870
0,2185
0,2595
0,2932
0,343.6
гг- ю1», м
1,7014
1,6656
1,6424
0,6246
1,5972
1,5668
1,5370
1,4960
1,4623
1,4119
9. Вычислите волновые числа трех первых линий в />-ветви вра-
щательно-колебательного спектра поглощения 1H19F. Необходимые
для расчета величины найдите в справочнике [М.].
10. Определите волновые числа трех первых линий в ^-ветви вра-
щательно-колебательного спектра поглощения 1H19F. Необходимые
для расчета величины найдите в справочнике [М.].
11. В спектре поглощения газообразного 1Н35С1 при 298 К и нор-
нормальном давлении в R-ветви вращательно-колебательной полосы об-
обнаружены 13 заметных максимумов, волновые числа и оптические
плотности которых приведены в таблице:
/
0
1
2
3
4
«е, см—'
2906,3
2925,8
2944,8
2963,2
2980,9
D
0,155
0,418
0,567
0,583
0,497
/
5
6
7
8
<0е, СМ-1
2997,8
3014,3
3030,9
3044,9
D
0,362
0,231
0,129
0,065
/
9
10
И
12
<ае, см-1
3059,1
3072,8
3085,6
3098,4
D
0,029
0,011
0,005
0,001
Определите долю молекул, находящихся на каждом вращательном
квантовом уровне, если коэффициент погашения молекул не зависит
от энергии вращения.
12*. Вычислите волновые числа 13 полос поглощения в ^-ветви
вращательно-колебательного спектра 1Н36С1, с учетом изменения
вращательной постоянной Вв, сое — 2990,95 см, ыехе — 52,8185 см.
Определите а в уравнении (V.19) по известной v-линии /—12 (см.
данные задачи 11). Сопоставьте полученные значения волновых чисел
с экспериментальными, приведенными в задаче 11 или в справочни-
справочнике [М.].
13. В />-ветви вращательно-колебательного спектра метана полу-
получены линии с волновыми числами (см-1): 3032,30; 3043,15; 3054,00;
3064,85; 3075,70. Определите момент инерции молекулы метана. Моле-
Молекула метана имеет симметрию Td. Определите равновесное межъядер-
межъядерное расстояние и сопоставьте его со справочным значением [М.].
40
14. Определите число колебательных степеней свободы линейной
молекулы CS2 (симметрия ?>«>&), нелинейной молекулы SO2 (симметрия
С2с), молекулы NH3 (симметрия C3v) и молекулы СН4 (симметрия Td).
15. В ИК-спектре поглощения MgF2 обнаружены три полосы:
240, 447 и 870 см-1. Последняя полоса имеет максимальную интенсив-
интенсивность, средняя — минимальную. Молекула MgF2 имеет симметрию
C2v. Сделайте отнесение полос поглощения к определенным типам ко-
колебаний.
16. В ИК-спектре поглощения SnCl4 обнаружено три полосы в раз-
разными интенсивностями: 104 (ел), 129 (ср), 403 (с) см. (В скобках ел —
слабая, ср — средняя и с — сильная.) Сделайте отнесение колеба-
колебаний к определенному типу и определите вырождение каждого колеба-
колебания.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. По собственным частотам колебаний атомов в молекуле А и ан-
ангармоничности (ое и (HgXg определите: 1) волновое число v и частоту
v максимумов поглощения, соответствующих переходам молекул с уров-
уровня с квантовым числом v = 0 на уровень и'= 1 и с уровня и = 0 на
уровень v = 2 при неизменном электронном состоянии; 2) в каком
участке спектра — инфракрасном, видимом или ультрафиолетовом —
расположены полосы поглощения, соответствующие указанным пере-
переходам; 3) максимальное значение колебательного квантового числа
итах; 4) энергию колебательного движения на нулевом и на максималь-
максимальном колебательных квантовых уровнях (Дж); 5) энергию химической
связи в молекуле А (Дж/моль); 6) энергию колебательного движения
на 2—3 колебательных квантовых уровнях в интервале от уровня с и=0
до итах; 7) долю молекул, находящихся на нулевом и на первом коле-
колебательных квантовых уровнях при 300 и 1000 К; 8) постройте график
зависимости энергии колебательного движения от колебательного
Xs ва-
варианта
1
2
3
4
5
6
7
8
9
10
И
12
13
Молекула
А
ХН35С1
2Н35С1
3Нз5С1
1Н37С1
2Н3'С1
3Н3'С1
~iH'»Br
2Н?»Вг
3Н">Вг
iHi»F
2Н19р
3HX»F
o>e, cm~'
2990,95
2144,77
1775,86
2988,70
2140,95
1770,35
2649,40
1885,33
1550,17
4141,03
3001,01
2507,87
2649,03
aexe-
см-"
52,82
26,92
18,36
52,74
26,89
18,25
45,25
22,73
15,37
90,44
47,97
31,98
45,25
№ ва-
варианта
14
15
16
17
18
19
20
21
22
27
24
25
Молекула
A
2H81Br
3H«Br
36QlSp
3'C11!>F
»*Cl'»Br
35Cl81Br
«Cl'»Br
37C181Br
1H127I
2H12'I
3H127I
12C14N
0)g, CM
1884,76
1548,14
787,50
777,99
443,10
441,42
434,72
433,01
2308,09
1640,14
1345,50
2028,62
aexe>
i
CM '
22,91
15,45
7,00
6,83
1,80
1,79
1,77
1,76
38,98
20,16
13,57
13,11
41
квантового числа на основании рассчитанных выше энергий колеба-
колебательного движения.
2. На основании данных, приведенных в задаче 1, для молекулы А
определите: 1) волновые числа трех первых линий поглощения в Р-
ветви вращательно-клебательной полосы; 2) волновые числа трех
первых линий в #-ветви вращательно-колебательной полосы.
ГЛАВА VI
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Основные уравнения и символы
[К., с. 237—272; Г., т. 1, с. 22—33, 49—55, 72—76]
Для конечного изменения состояния системы первый закон термо-
термодинамики выражается уравнением
Q = AU+W, (VI.1)
где Q — теплота, подведенная к системе или отведенная от системы;
\U — изменение внутренней энергии; W — работа. За положитель-
положительную работу принята работа расширения системы. Изменение внутрен-
внутренней энергии равно
AU=Ut—Ult (VI. 2)
где их и U2 — внутренняя энергия системы в начале и конце процесса;
H = U + PV, (VI.3)
где Н — энтальпия системы;
AH = AU + A(PV). (VI.4)
Для идеальных газов
AH = AU + Av(RT), (VI.5)
где Av — изменение числа молей газообразных веществ;
Ду = 2(у,)кон-2^)И0Х = 2у,. (VI.6)
Работа изобарного процесса (Р = const)
Г = Р(Уг —Vx), (VI.7)
где Vx и У2 — объемы системы в начален конце процесса. Для идеаль-
идеальных газов
~W=nR{Tt-T1), (VI.8)
где 7\ и Т2 — температура газа в начале и конце процесса; R —
молярная газовая постоянная.
42
Если 1 моль идеального газа нагревать при постоянном давлении
на 1°, то работа процесса будет
W=R. (VI.9)
Работа изохорного процесса (V = const)
W = o. (VI.10)
Работа изотермического процесса (Т = const) расширения идеаль-
идеального газа
W=Q = nRTln(V2/Vl)=nRTln(P1/P2), (VI. И)
где п — число молей газа; Рх и Р2 — давление газа в начале и конце
процесса.
Работа адиабатического процесса (Q = 0)
W=-AU, (VI.12)
W = nCv[Tt-Ti), (VI.13)
W=(P1V1-P3V2)/(y-l), (VI. 14)
nRT I VV-I ,
1-7^-r • (VI. 15)
где Cv — изохорная теплоемкость газа; у = CplCv; Р1 и Р2 — на"
чальное и конечное давление; Ср — изобарная теплоемкость газа; 7\ и
Т2 — начальная и конечная температура; Vt и V2 — начальный и ко-
конечный объем. Давление и объем в начальном и конечном состояниях
системы связаны уравнением адиабаты
P1VX=PiV\. (VI. 16)
Тепловой эффект химической реакции в изохорном процессе (V =
— const)
QV = AU = U2-U1. (VI.17)
В изобарном процессе (Р = const)
QP = AH = H2—H1. (VI.18)
Первое следствие из закона Гесса описывается уравнением
A//°r = 2(viA<r)K0H-2(viA<r)HCX, (VI. 19)
1 I
i i
гдеу*—стехиометрический коэффициент; 2(у*Д#",г)кон> ^ (у*А#?.г)ИСх—
суммы стандартных тепловых эффектов образования конечных и ис-
исходных веществ реакции; Д#°, г — тепловой эффект образования
вещества из простых веществ в стандартных условиях при темпера-
температуре Т. За стандартные условия принято состояние вещества в чистом
виде при давлении 1 атм. Стандартное состояние вещества отмечается
верхним индексом «°».
43
Второе следствие из закона Гесса описывается уравнением
А Я» =2 (v, Д Яс°г, г)исх -2 (v, ДЯС°Г, г)кон) (VI.20)
i i
где 2 (vt^Hcr, г)исх. 2 (vt\Hcr, т)коя — суммы стандартных тепловых
эффектов сгорания исходных и конечных веществ.
Зависимость теплоемкости веществ от температуры выражается
уравнениями:
для истинной теплоемкости
*-if- <,-jf- <«¦•¦>
для идеальных газов
Cp=Cv+R. (VI.22)
Уравнение для средней теплоемкости Су в интервале температур Т2 —
~ Tt имеет вид
-Гг). (VI. 23)
Средняя и истинная теплоемкости связаны уравнениями
Cv= J С„ dr.; Ср= J CpdT. (VI.24)
2 х г, - 2 х г,
Зависимость теплоемкости от температуры выражается уравнениями:
для неорганических веществ
(VI.25)
для органических соединений
° *, (VI.26)
для а, Ь, с, с' и d — коэффициенты, определяемые эмпирически или
на основании молекулярно-статистических расчетов. Данные коэффи-
коэффициенты приводятся в справочниках.
Зависимость энтальпии вещества от температуры выражается урав-
уравнениями:
т
Hfj.-H°0= JC°d7\ (VI.27)
г
ЯГ-#298 = J CPdr- (VI.28)
298
44
где #о — энтальпия вещества при абсолютном нуле; Я? — #298 —
приращение энтальпии при нагревании вещества от 298 до Т К. Если
в интервале температур Т-г-298 происходят фазовые превращения, то
уравнение (VI. 28) имеет вид:
пер ""
Я0 r/O — f /->Q/ л т i а г? i Г лО" ,1т | д и
Т— 298 — J ЬраУ-(~Д "перп" J Р га":
a]i
Гкнп
+ J С0/dT+AHacn+ Г Cp"'dT, (VI.29)
т т
J
т т
пл 'кнп
где А#пер, ДЯПл. ^#нсп — теплоты перекристаллизации, плавле-
плавления и испарения; С%', С°'Р', С°'р", С°р'" — теплоемкости вещества в
низкотемпературном кристаллическом состоянии, в высокотемпера-
высокотемпературном кристаллическом состоянии, в жидком и газообразом состоя-
состояниях. Полная энтальпия вещества (условная) при температуре Т
•/°=ДЯ°1298+(Я°-Я°98), (VI. 30)
где Jj — полная энтальпия вещества при температуре Т и при стан-
стандартном давлении для того фазового состояния, которое устойчиво при
температуре Т; АЯ^, 298 — стандартная теплота образования вещества
при 298 К.
Зависимость теплового эффекта химической реакции от темпера-
температуры выражается уравнением
TT = >;(viC°)K0H-2(vi^)Hcx=AC°! (VI.31)
1 1
i i
где 2 (yiC$)Koa, 2 (VjC#)HCX — суммы теплоемкостей конечных и ис-
исходных веществ; &Ср — изменение теплоемкости в ходе химической
реакции
p /T*. (VI.32)
Уравнение (VI. 31) в интегральном виде будет
т,
АН°г^,АН°1 + \ ACpdT. (VI.33)
При фазовых превращениях некоторых веществ, участвующих в хими-
химической реакции, уравнение (VI.33) преобразуется к виду
пер пл
(ACp)"dT +
1 » гпер
Гкнп 7",
+ ДЯПЛ+ ^ (ДС5,)"'AГ + АЯнсп4- \ (AC°p)""dT. (VI.34)
гпл Гннп
45
При расчете тепловых эффектов химических реакций при заданной
температуре можно воспользоваться приводимыми в таблицах средни-
средними значениями теплоемкостей в температурном интервале от 298 до Т
ДС° AГ=Д#°98+ДС° (Г— 298). (VI.35)
298
Если в заданном температурном интервале происходит фазовое пре-
превращение одного или нескольких веществ, то удобно тепловой эффект
рассчитывать на основании таблиц полных энтальпий или таблиц
функций (Я» — Щ98):
ДЯ»=2(^-/')кон-2(^-/.?)исх=Д^298+Д(^-^2°98)г, (VI.36)
1 1
д ("°-°98)г =2^(Яо-Я°298)Гкон-2^ (Я»-Я»98)Гисх. (VI.37)
1 1
При наличии фазовых превращений в интервале температур от 298 до
Т удобно воспользоваться значениями (Нт — H§9S), приведенными в
приложении для температур от 298 до 1000 К.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Определите работу изобарного обратимого расширения 3 моль
идеального газа при его нагревании от 298 до 400 К.
Решение. Работу изобарного расширения определяем по урав-
уравнению (VI. 8):
Г= 3-8,3143 D00 —298) = 2,544-103 Дж.
2. Определите работу испарения 3 моль метанола при нормальной
температуре кипения.
Решение. Нормальная температура кипения — это темпера-
температура кипения при внешнем давлении, равном 1,0133-108 Па. Нор-
Нормальную температуру кипения находим в справочнике [М.]. Тн-Т.к =
= 337,9 К- Работу определим по уравнению (VI.7), так как испарение
происходит при постоянном давлении. Конечный объем приближенно
можно определить по закону идеального газообразного состояния
В первом приближении объемом жидкости Vx можно пренебречь, так
как объем жидкости при температурах, далеких от критической, зна-
значительно меньше объема пара. Тогда
37,9 = 8,428-103 Дж.
.46
Для более точного решения находим [С.Х., т.1] при температуре
Тн.т.к плотности жидкой фазы и пара: dm = 0,7510-103, d,, =
= 0,001222- 10s кг/м3. По плотностям находим объемы трех молей ве-
вещества в жидком и газообразном состояниях:
пМ 3-33-10-3
У, = = =0,128- Ю-3 м3,
AЖ 0,7510-Ю3
пМ_.= 3-32-10-3 =
2 dn 1,222
Поскольку плотность выражена в кг/м3, молекулярная масса будет
ЛМ0-3. Тогда
Г=1,0133-Ю5 G8,560—0,128) 10 = 7,9475-103 Дж = 7,9475 кДж.
3. Определите работу изотермического обратимого расширения 3
моль водяного пара от 0,5-105 до" 0,2-105 Па при 330 К. Водяной
пар при таких параметрах подчиняется закону идеального газообраз-
газообразного состояния.
Р е ш-е н и е. Работу определим по уравнению (VI. 11):
30 ln[0,5-10<7@,2.105)] = 7,542-103 Дж = 7,542 кДж.
4. Определите работу адиабатического обратимого расширения 3
моль аргона от 0,05 до 0,50 м3. Начальная температура газа 298 К.
Решение. Для определения работы адиабатического расшире-
расширения воспользуемся уравнением (VI .15). Величину у определим из Ср
и Су- Аргон — Одноатомный газ. Следовательно, его изохорная тепло-
теплоемкость на основании молекулярно-кинетической теории идеальных
газов равна Cv=3/2 R = 1,5-9,3143 = 12,4715 Дж/(моль К):
Cp=Cv+R = 12,4715 + 8,3143 = 20,7858 Дж/(моль-К),
V = 20,7858/12,4715= 1,667,
отсюда
8,3143-298 / _ 0,05о.ев, \
1,667-1 \ 0,50».»»' /
5. Определите тепловой эффект реакции
при 298 К и нормальном давлении.
Решение. Определим A//J по уравнению (VI. 19). Тепловые
эффекты образования исходных и конечных веществ в стандартном-со-
стандартном-состоянии при 298 К находим в справочнике [М.]:
2Al+3S(poM6)+6O2 = A
= Д#?—A#S> —ЗД#? = — 3434 + 1675 + 3-395,2=— 573,4 кДж.
47
6. Определите тепловой эффект реакции
если реакция протекает при 298 К в автоклаве при постоянном объеме,
а тепловой эффект при Р = const равен — 573,4 кДж.
Решение. По тепловому эффекту реакции при постоянном дав-
давлении определим тепловой эффект при постоянном объеме по уравне-
уравнению (VI .5) (изменение числа молей газообразных продуктов реакции
Av = — 3, так как А12О3 и Al2 (SO4K — твердые вещества):
в8+3.8,3143-298=—573,4.103 +
+ 7,433-103= — 566,0-103 Дж= —566,0 кДж.
7. Определите тепловой эффект реакции образования ацетальдеги-
да из гликоля по уравнению
СН2(ОН)СН2(ОН)Ж = СН3СНОГ + Н2ОЖ + Д Н°
при 298 К и стандартном давлении.
Решение. В данном случае удобнее рассчитать тепловой эф-
эффект реакции по тепловым эффектам сгорания. В справочнике [М.]
находим тепловые эффекты сгорания всех веществ, участвующих в ре-
реакции. Следует обратить внимание на фазовое состояние продуктов ре-
реакции сгорания. Так как для реакций
(ж) + Д//0
тепловой эффект сгорания воды равен нулю, то АЯ° = 0. По уравне-
уравнению (VI. 20) рассчитываем
Д#° = Д#?—Д//?—ДЯ3°=—1192,86+1192,44=— 0,42 кДж.
8. Вычислите тепловой эффект образования аммиака из простых ве-
веществ при стандартном давлении и 298 К по тепловым эффектам реак-
реакций:
= 2Н20(ж) + Д#о A)
Н2О(ж)+2Ы2 + ДЯ^ B)
Д#°= — 571,68 кДж, Д#?=—1530,28 кДж.
Решение. Запишем уравнение реакции, тепловой эффект кото-
которой необходимо определить:
V2N2+3/2H2=NH3 + Atf° C)
Н2ОЖ и О2 не входят в уравнение C), поэтому, чтобы исключить их из
уравнений A) и B), умножим уравнение A) на 3 и вычтем из него урав-
уравнение B):
6Н2О(ж)-2Ы2-ДЯ!! D)
48
После преобразования уравнения D) и деления его на 4 получим
/ = (ЗДЯ1 — Д#2)/4 = [3~ E71,68) —
— ( —1530,28)]/4=— 46,19 кДж/моль.
9. Теплоты растворения 1 моль натрия и оксида натрия в воде при
стандартных условиях и 298 К' соответственно равны — 183,79 и
— 237,94 кДж/моль. Вода в обоих случаях берется в большом избытке.
Вычислите тепловой эффект АЯ°, 298 образования оксида натрия из
простых веществ при стандартных условиях и 298 К.
Решение. Запишем уравнение реакции, тепловой эффект кото-
которой следует определить, и уравнения вспомогательных реакций:
° A)
B)
2Оизб=2№ОН(р) + ДЯ° C)
Чтобы исключить из уравнений B) и C) NaOH(p) в избытке воды, ко-
который не участвует в реакции A), из уравнения ракции B), умножен-
умноженного на 2 , вычтем уравнение реакции C):
2Na + 2H2O — Na2O— H2O = 2NaOH (p)+ H2 +
+ 2A#°-2NaOH(p) — Д #° D)
После преобразования уравнения D) получим
2№+Н2О = №2О + Н2+2Д#° — Д#°
Чтобы исключить из уравнения D) Н2О и Н2 и ввести О2 сложим урав-
уравнение D) с уравнением реакции образования воды из простых веществ:
Н2+1/2О2=Н2О + ДЯ3° E)
В справочнике [М.] находим АН' = — 285,84 кДж/моль,
ДЯ°. 298 = ДЯ° = 2ДЯ?— АЯ°+АЯ° = 2( —183,79) —
— ( — 237,94)+ (—285,84) ==—415,48 кДж/моль.
10. Определите тепловой эффект разбавления 30,8%-ного водного
раствора NaOH до концентрации 0,442 % при 298 К.
Решение. В справочнике [М.] находим интегральные теплоты
растворения. Так как в справочнике концентрации выражены в молях
Н2О на 1 моль NaOH, то пересчитаем концентрации:
30,8 69,2
моль NaOH растворено в моль Н2О
40,0 r r 18,0
1 » NaOH » в *! » Н2О
69,2-40,0
*,= = 5 моль Н2О на 1 моль NaOH.
1 18,0-30,8
49
Аналогично
0,442 хт 99,557
моль NaOH растворено в —— моль Н2О
40,0 18,0
1 » NaOH » в х2 » Н2О
99,558-40,0
х2 = = 500 моль Н2О на 1 моль NaOH.
Интегральные теплоты растворения NaOH для начальной и конечной
концентрации растворов находим в справочнике [М.]:
Число молей Н2О на 1 моль NaOH 5 500
АН°т, кДж —37,76 —42,36
Д Н°азб = —42,36— (—37,76) = —4,6 кДж/моль.
Разбавление раствора NaOH сопровождается выделением теплоты.
11. На основании изобарных теплоемкостей метана при нескольких
температурах
Г, К 300 400 500 600 700 800 900 1000
С°р, Дж/(моль-К) . . . 35,80 40,74 46,56 52,50 58,07 63,27 67,27 72,06
выразите зависимость уравнением вида СР = / (Т).
Решение. Так как каждое опытное значение теплоемкости со-
содержит ошибку измерения, то для описания зависимости уравнением
т.е. для определения коэффициентов а, Ъ и с, воспользуемся методом
наименьших квадратов:
где п — число известных значений теплоемкости (в данной задаче оно
равно 8);
Для упрощения решения задачи введем новые переменные:
х=(Т—300)/100, у=С°р.
50
т. к
300
400
500
600
700
800
900
1000
2
у
35,80
40,74
46,56
52,50
58,07
63,27
67,91
72,06
436,91
X
0
1
2
3-
4
5
6
7
28
х'
0
1
4
9
16
25
36
49
140
X'
0
1
8
27
64
125
216
343
784
X1
0
1
16
81
256
625
1296
2401
4676
XV
0
40,74
93,12
157,50
232,28
316,35
407,46
504,42
1751,87
xlv
0
40,74
186,24
472,50
929,12
1581,75
2444,76
3530,94
9186,05
dX
x+Zx2,
—22 (у— X— Yx—Zx*)=O,
dY
d2 (y —X— Yx—
= —22 (у—X— Yx—Zx*)x = 0,
dZ
-=— 22((/— X— Yx—
2 ((/—X — Y x—Z*2)=0,
2 (y—X—Yx—Zx*)x = Q,
2(y—X—Yx—Zx*)x2 = 0,
(a)
F)
x*. (в)
Подставив в уравнения (а), (б) и (в) значения Sx2y, 2х2, Sx3 и Sx4, полу-
получим:
436,91 =8X+28K+140Z, (a')
9186,05= 140X + 784K + 4676Z. (в')
Решая совместно уравнения (а') — (в'), находим X, Y и Z:
3058,37 = 56Х + 196К + 980Z
3503,74 = 56X+280K+1568Z
445,37= 84K + 588Z
8759,35= 140X+700K + 3920Z
9186,05 = 140X + 784K + 4676Z
426,80
84K=756Z
51
445,37 = 84K + 588Z
426,80 = 84K+756Z
— 18,67 168Z Z=—0,111
у = 44Д,37+ба8.0,1И =6079)
3058,37—196.6,079 + 980.0,111
X = — : = 35,279,
56
T— 300 / Г—300 \2
790...()
,079-10-2r—18,237—0,111-10-4Г2+0,666-10-2Г—
—0,999= 16,043+67,45-10-3Г—11, Ы0-»Г2.
Полученная зависимость имеет вид:
С°р = 16,043+67,45- 10-3Г— 11,1-10-» Т\
12. Вычислите среднюю теплоемкость аммиака Ср в интервале тем-
температур от 298 до 1000 К-
Решение. Среднюю теплоемкость вычисляем по уравнению
(VI. 24). Уравнение Ср — f (Т) возьмем из справочника [М.]:
„ 1,67-10е
Ср ==29,80+25,48-10-3Г — -L— .
Это уравнение справедливо в интервале температур от 298 до 1800 К:
= 0,001425129,80A000—298)+ 12,74-lO-^lOOO2—2982) +
+'-67-'°6I ~^ ^) =29-81 +16,54—0,56 = 45,79 Дж/(моль-К).
\ 1000 298 /J
13. Вычислите изменение энтальпии при нагревании AgCl от 298
до 1000 К при стандартном давлении (#°000 — Ягэв) и полную энталь-
энтальпию AgCl при 1000 К. При 728 К происходит плавление AgCl, АЯПЛ
при температуре плавления 13,21 кДж/моль. Зависимость теплоемко-
теплоемкости AgClTB от температуры возьмите из справочника [М]. Теплоемкость
жидкого AgCl в интервале температур от 728 до 1000 К остается прак-
практически постоянной и равной 66,99 Дж/(молЬ'К).
Решение. По уравнению (VI.29) определим теплоту нагрева-
нагревания. AgCl с учетом единственного фазового превращения в заданном
интервале температур:
728 100 ()
М—Н%я= \ С°р dT + \Hnn+ \ С°р AT,
Jtb J ж
298 728
52
С°р =62,26 + 4,1810-3Г —
'тв
62,26 + 4,1810Г ^
тв Г2
298
1000
+ 13,21-103+ \ 66,99d Г = 62,26 G28—298)+2,09-Ю-3 G282—2982) +
728
+ 11.30-106 ( )+13,2Ы03+66,99 A000—728) =
\ 728 298 /
= 56,88-103 Дж/моль = 56,88 кДж/моль.
Полную энтальпию вычисляем по уравнению (VI. 30), AHfi298
находим в [М.]:
^1ооо = — 126,8+56,88=— 69,92 кДж/моль.
14. Определите тепловой эффект химической реакции при 500 К
СН3ОН (г)+3/2О2=СО2 + 2Н2О (г)
Теплоемкости всех веществ, участвующих в химической реакции, пос-
постоянные и раВНЫ Ср. 298-
Решение. Тепловой эффект находим по уравнению (VI.33), где
ДС$=ДС|, 298 = const.
Необходимые величины теплового эффекта реакции при 298 К и изме-
изменение теплоемкости найдем по теплотам образования всех веществ и по
теплоемкостям в справочнике [М]:
Вещество " ... СО2 Н2ОГ О2 СН3ОНГ
АЯ°298' кДж/моль —393,51 —241,84 0 —201,2
СР,298> Дж/(моль-К) .... 37,13 33,56 29,36 43,9
ДЯ»98 = (—393,51)+2 (-4241,84)—(—201,2) = —675,99 кДж,
3
АСР, 298 =37,13+2-33,56—43,9 29,36=16,31Дж/К,
ДЯ»00 = —675,99-103 + 16,31 E00—298) = —672,7-103 Дж.
15. Определите тепловой эффект химической реакции
СН3ОН(г)+3/2О2 = СО2 + 2Н2О(г)
при 500 К и стандартном давлении. При расчете воспользуйтесь сред-
средними теплоемкостями веществ в интервале температур от 298 до 500 К-
Решение. Для определения Л#5оо воспользуемся уравнением
(VI.35). Тепловой эффект реакции при 298 К равен =—675,99 кДж.
Значения средних теплоемкостей Ср для интервала температур от
298 до 500 найдем в справочнике [М.]:
^Вещество СО2 Н2О (г) О2 СН3ОН (г)
Ср, Дж/(моль-К) ..... 42,05 34,48 30,29 52,21
53
Откуда АСР = 13,365 Дж/(моль-К), АЯЕоо = — 675,99-103+13,365X
XE00—298)= — 673,29-103 Дж = —673,29 кДж.
16. Выразите уравнением зависимость теплового эффекта химиче-
химической реакции
СН3ОН (г)+3/2О2=СО2 + 2Н2О (г)
от температуры, которое справедливо для интервала 298Ч-Ю00 К.
Решение. Для получения уравнения- Д#т- = / СП воспользу-
воспользуемся выражением (VI. 33). Сначала установим зависимость изменения
теплоемкости от температуры. Эта зависимость выражается уравне-
уравнением (VI. 32). Коэффициенты в уравнениях (VI.25) и (VI.26) а, Ь, с и
с' найдем в справочнике [М.]:
Вещество
со2
Н2О(г)
СН3ОЩг)
о2 ~-
ЧП С°Р)коя
2(v2 Cp)ucx
Ср = НТ), Дж/(моль-К)
а
44,14
30,00
15,28
31.46
104,14
62,47
Ь-10'
9,04
10,71
105,2
3,39
32,46
110,29
—8,64
0,33
0
—3,77
—7,88
—5,66
с -10«
0
¦О
—31,04
0
0
—31,04
Температур-
Температурный
интервал
298—2500
273—2500
298—1000
273—2000
298—2500
298—1000
Отсюда для данной реакции для интервала температур от 298 до
1000 К уравнение зависимости изменения теплоемкости от температу-
температуры будет
ДС», = 31,67—77,83-10-3Г + 31,04-Ю-»?2—2,22-lOVT4;
ДС°, = 43,67;—77,83; —2,22; 31,04; 298 — 1000.
Подставляем под знак интеграла зависимость &Ср =/ (Т) и проводим
интегрирование в пределах от 298 до Т, Т < 1000:
т
//»в8+ ^ /41,67—77,83-1
298
=—675,99-10з+41,67(Г—298)—0,5-77,83-Ю-3 G^—2982) +
= F75,99—9,44+3,46—0,27—0,74) 103+41,67Г—38,91
+ 10,35-10-в Г3
=— 682,98-103+41,67Г—38,91-10~3
10,35-10-вГ3+
2,22-Ю5
54
Таким образом, получено уравнение зависимости теплового эффекта
реакции от температуры, справедливое в интервале температур от 298
до 1000 К:
ДЯ?=— 682,98-103+41,677" — 38,9Ы0-3 Г2 +10,36-10-" Г3 + 2,22-105/7.
17. Определите тепловой эффект реакции SO2 + С12 = SO2C12
при 800 К и стандартном давлении.
Решение. Воспользуемся таблицей значений (Я? — Ягэв)
для веществ, участвующих в химической реакции. Тепловой эффект
химической реакции при любой температуре может быть рассчитан по
закону Гесса:
где Л#298 —тепловой эффект реакции при 298 К; (#г — ЯЦдв)— из-
изменение энтальпии при нагревании вещества от 298 до Т К- В справоч-
справочнике находим значения ЛЯ", 298:
Л#°в8 = (— 358,7 + 296,9—0) 103= — 61,8-103 Дж=—61,8 кДж
и значения (Я? — Ягэв) для веществ, участвующих в реакции:
г, к
298
300
400
500
600
(я?—Н%9а) 10~3, Дж/моль
so.cu
0,000
0,167
8,248
16,874
25,834
so8 | cis
0,000
0,084
4,271
8,793
13,566
0,000
0,064
3,538
7,109
10,748
г, К
700
800
900
1000
(«Т— Я29в) Ю~' Дж/моль
SO,CI2
35,087
44,466
53,970
63,559
SO,
18,590
23,740
29,058
34,459
CI,
14,424
18,134
21,860
26,604
Д #»„„ = (— 61,8-103+44,466— 23,740 —18,134) 103 =
= —59,208-Ю3 Дж=—59,208 кДж.
= Na2CO
18. Определите тепловой
+ Н2О при 700 К и
Решение. Выбор метода
эффекта химической реакции, в
фазы, зависит от того, меняется
данном интервале температур,
необходимо по справочнику [С,
фазовых правращений:
эффект реакции 2NaOH + СО2 =
стандартном давлении,
решения задачи по расчету теплового
которой участвуют конденсированные
ли фазовое состояние веществ в за-
Для выяснения фазового состояния
. X., т. 1,2 ] определить температуры
, Вещество
a-NaOH
a-Na2CO3
Температура пере-
перекристаллизации
а->р, К
572
629
Т. пл., К
593
700
Т. кип.. К
700
55
a-Na2CO3
—1129
—57,612
co2
—292,51
17,782
H2O(r)
—241,84
14,226
Оба твердых вещества в интервале температур от 298 до 700 К меняют
фазовое состояние. В результате этого применение уравнения (VI.34)
сильно усложняет расчет. Поэтому расчет целесообразно провести по
уравнению (VI.36) (см. приложение):
Вещество a-NaOH
АЯ° 299' кДж/моль —426,6
(Я?оо—Я^98), кДж/моль . . 42,748
Д #»98 = —1129—241,84+2-426,6+393,51 = —124,13 кДж,
(tf%0— Я»98) =57,612 + 14,226 — 2-42,748 —17,782=— 31,440 кДж,
Д#%0= —124.13—31,440= —155,570 кДж.
19. Вычислите At калориметрического опыта с учетом поправки на
теплообмен: а) графически; б) аналитически.
При вычислении использовать следующие результаты наблюдений:
Начальный период
№ отсче-
отсчета
1
2
3
4
5
6
7
8-
' 9
10
11
t, °С
2,357
2,360
2.363
2,367
2,371
2,372
2,376
2,380
2,383
2,384
2,387 = ^о
Главный период
№ отсче-
отсчета
12
13
14
15
16
17
t, "С
2,900
3.420
3,570
3.600
3,635
3,633 = tn
Конечный период
№ отсче-
отсчета
18
19
20
21
22
23
24
25
26
27
t, °С
3,632
3.632
3,631
3,631
3,631
3,630
3,630
2,629
3,628
3,628
Примечание. Температура дана в условных градусах
Бекмана).
(термометр
Решение, а) Графический метод. В проведенном опыте из-
изменение температуры составляет примерно 1,5°, что осложняет графи-
графическое определение At с точностью до 0,001°, поэтому при построении
графика зависимости температуры от времени используем три разных
шкалы ординат (рис. 10). Масштаб по оси абсцисс для всех трех графи-
графиков однаков A мин — 10 мм), масштабы же по оси ординат разные.
Кривую ABCD построим в масштабе оси ординат / A°—100 мм). Для
построения прямой АВ используем ось ординат ///, для построения
прямой CD — ось ординат //. Масштабы осей ординат // и /// одина-
одинаковы @,01°—10 мм). Проекции точек В и С на ось ординат / дают точки
пит соответственно. Точку К получим, разделив отрезок тп попо-
пополам. Через току К проводим линию, параллельную оси абсцисс КР.
При пересечении прямой КР с кривой A BCD получаем точку /, через
которую проводим линию FE, параллельную оси ординат. Экстрапо-
56
i
HI
3,0
К
A\
A'
??
-
_
J
-
:—¦*-
i
3,630
f
3,620
I
1 I 1 1
;
11
B
-
Ш
-
--
P.
2,390
2,380
2,370
2,310
2,350
1
I
-о—о
At
1
-O-OL^X.
3,63*°
2,391'
-- 1,243'
t f
В
ъ'
-o—o
1
0 1
7 8 9
мин
II 12 13 Й
Рнс. 10. Определение изменения температуры в ходе калориметрического опы-
опыта при больших тепловых эффектах
лируем прямые АВ и CD до пересечения с линией FE. По точкам пере-
пересечения ta и ?к находим Л? с учетом поправки на теплообмен:
At=th — ta = 3,m — 2,391 = 1,243°.
б) Аналитический метод. В этом случае используем уравнение
где б — поправка на теплообмен, вычисляется по уравнению Реньо —
Пфаундлера — Усова
~пщ в--в-1 2 Г " 7
где п—число отсчетов в главном периоде опыта; ^—средний ход тем-
температуры за один отсчет в конечном периоде опыта; v0 — то же, в на-
начальном периоде опыта; 60 — средняя температура калориметра в на-
начальном периоде (сумма I и II отсчетов, деленная на 2); 6П— то же,
57
для конечного периода; tn — последний отсчет главного периода; t0—
л— 1
последний отсчет начального периода; Xt—сумма температур всех
отсчетов главного периода, кроме последнего отсчета, т. е. tt + ?2+
{tn-2 + ?П-1-
Вычисляем поправку на теплообмен б:
3,633 — 3,628
„ =—
1 10
=0,0005°,
2,357—2,387
= —0,0030°,
= 0,0005 — (—0,0030) = 0,0035°,
е 3,633+3,628 збзо0
-.2,372°,
вп—в0= 3,630 — 2,372=1,258°,
vt— u0 0,0035
ТГ — = ——Г~ =0,00278,
©п— в0 1,258
in — to 3,633—2,387
=— ^ = 3,010^,
2 ^
п— 1
2 ^ = 2,900+3,420 + 3,570 + 3,600 + 3,635= 17,125°
1
л-во = 6-2,372= 14,232,
л V0 = 6 ( —0,0030) = —0,0180,
отсюда
б=— 0,018+0,00278C,010 + 17,125 —14,232)=— 0,0016°.
Следовательно,
Дг = 3,633—2,387+ (—0,0016) = 1,246—0,002=1,244°.
20. Определите теплоту растворения (q) KC1 массой 2 г в 100 г во-
воды по интегральным теплотам растворения КС1 при 298 К-
Решение. Вычислим моляльную концентрацию т получен-
полученного раствора КС1:
2/74,5— 100 г Н2О
т —1000 » Н2О
2-10
т = — = 0,269 моль/1000 г.
74,5
Найдем в [М.] интегральную теплоту растворения КС1 в воде при
298 К (А#т = 17,56 кДж/моль) и вычислим теплоту растворения 2 г
КС1:
g-AHm 2 A7,56-Ю3)
4 = МКС1 = 74>5 =2830 Дж = 2,83 кДж.
58
21. Рассчитайте At процесса разбавления 5 мл насыщенного раст-
раствора LiCl в 200 мл воды при 298 К, если суммарная теплоемкость ка-
калориметрической системы W = 1248 Дж/град.
Решение. Моляльность раствора (mi), насыщенного при 298 К,
находим в справочнике [М.], тг = 19,9 моль/1000 г. Молекулярная
масса LiCl равна 42,4. Вычисляем содержание LiCl в насыщенном
растворе:
/п.АМОО 19,9-42,4-1000
Р= —1 = =46 % (по массе).
lOOO + z/ijAf 1000+19,9-42,4 '
В справочнике находим плотность насыщенного раствора d =
= 1,290 г/см3.
Количество молей LiCl (л), содержащихся в 5 мл насыщенного
раствора, составляет:
5dP-10-2 5-1,29-46-Ю-2
М 42,4
= 0,0697.
Моляльность раствора (т2), полученного в результате разбавления
5 мл насыщенного раствора 200 мл воды, равна
/1-1000 0,0697-1000
т*~ 200 dHj0 -f Edp-pa/iAl) ~ 200-1 +E-1,29—0,0697-42,4) ~
= 0,341 моль/1000 г.
Находим по справочнику [М.] теплоты растворения LiCl для раст-
растворов с моляльностью тх и т2: АН? = — 19,35 кДж/моль, АН™ =
= —36,14 кДж/моль.
Вычисляем по закону Гесса теплоту разбавления АН, выделяющую-
выделяющуюся при разбавлении раствора от концентрации 19,9 до 0,341
моль/1000 г на 1 моль растворенного вещества:
—АЯ7 = —16,79 кДж/моль.
Теплота разбавления 0,0697 моль LiCl составляет
— ? = Д Н л = (—16,79H,0697=—1169 Дж=—1,17 кДж.
Определим А^ для заданной суммарной теплоемкости калориметри-
калориметрической системы:
22. Вычислите теплоту образования 1 моль твердого раствора
KBr-KCl из индивидуальных веществ при 298 К- Состав твердого
раствора: 8 моль КС1 на 1 моль КВг. Теплота растворения 2 г твердого
раствора в 100 мл воды 460,0 Дж, а теплота растворения 2 г механи-
механической смеси в 100 мл воды 466,0 Дж.
Решение. Рассчитаем теплоту растворения КВг в КС1 при об-
образовании 2 г твердого раствора заданного состава:
? = 466,0 — 460,0 = 6 Дж.
59
Масса 1 моль раствора составит (средняя молекулярная масса М)
М= Ш*вг +8%с, =79>4-
Отсюда число молей Bлг) твердого раствора в 2 г: =^- = =jr-=- =
2л?%1 /9,0
= 0,0251. Вычислим теплоту образования 1 моль твердого раствора
ЗАДАЧИ
1. Рассчитайте изменение внутренней энергии при испарении 20 X
X 10~3 кг этилового спирта при нормальной температуре кипения, если
его удельная теплота испарения 837,38-103 Дж/кг, а удельный объем
пара при этой температуре 607-10~3 м3/кг. Объемом жидкости пре-
пренебречь.
2. Определите изменение внутренней энергии при испарении 1 кг
воды при нормальной температуре кипений, если теплота испарения
равна 2258,7 Дж/кг. Считать пар идеальным газом и пренебречь объе-
объемом жидкости.
3. При 273 К и 1,0133-105 Па нагревают 5-10~3 м3 криптона до
873 К при постоянном объеме. Определите конечное давление газа и теп-
теплоту, затраченную на нагревание.
4. В резервуаре вместимостью 5-10 м3 при 200 К и 0,5-10"
Па содержится азот. Определите теплоту, которую необходимо пере-
передать газу, чтобы его давление стало бы 2-105 Па. Считать азот в ука-
указанных условиях идеальным газом. Необходимые для решения данные
возьмите из справочника [М.].
5. При 298 К Ы0" кг кислорода сжимаются адиабатически от
8-10~3до 5-10~3 м3. Определите конечную температуру, работу про-
процесса сжатия, изменение внутренней энергии и изменение энтальпии,
если Cv = 5/2 R.
6. В резервуаре при 298 К находится неизвестный газ. Предпола-
Предполагается, что это азот или аргон. При внезапном расширении 5-10~3
м3 этого газа до объема 6-10~3 м3 его температура снизилась примерно
на 0°. Какой газ — аргон или азот — содержится в резервуаре?
7. Определите конечную температуру газов Аг, Н2 и Н2О, если при
адиабатическом сжатии давление увеличить (или' объем уменьшить) в
10 раз. Начальная температура 298 К. Считать, что газы находятся в
идеальном состоянии.
8. При 298 К одноатомный газ в идеальном состоянии изотермиче-
изотермически и обратимо расширяется от 1,5-103 до 10-103 м3, при этом поглоща-
поглощается 966-103 Дж теплоты. Рассчитайте число молей газа, участвующего
в процессе.
60
9. В сосуде при 273 К и 1,01 • 105 находится 103 моль одноатомного
газа в идеальном состоянии. Рассчитайте конечную температуру, дав-
давление газа и работу процесса расширения газа до объема, в 2 раза
превышающего первоначальный: а) при медленном изотермическом рас-
расширении в цилиндре с поршнем, двигающимся без трения; б) при адиа-
адиабатическом расширении в аналогичных условиях; в) при мгновенном
удалении перегородки между сосудом и вадуумированным пространст-
пространством того же объема. Объясните различие результатов, полученных
в трех процессах.
10. Рассчитайте теплоту, необходимую для нагревания 3-Ю3 моль
аммиака от 273 до 473 К при постоянном давлении. Необходимые дан-
данные возьмите из справочника [М.].
11. Рассчитайте изменение энтальпии при нагревании 2 кг
a-SiO2 от 298 до 800 К, если зависимость теплоемкости от температу-
температуры выражается уравнением
С? =46,94+34,31-Ю-3 Г— 11,3-106/Я.
12. Определите изменение энтальпии при нагревании 10 кг газооб-
газообразного метанола от 400 до 700 К при давлении 1,0133-105 Па. Зависи-
Зависимость теплоемкости от температуры возьмите из справочника [М.].
13*. По зависимости теплоемкости твердого гептана от температу-
температуры найдите методом графического интегрирования изменение энталь-
энтальпии (#?82,5 — Но) для твердого гептана. Определите изменение эн-
энтальпии в процессе С7Н]втв> ок ~>-QHi6H<%]82,5K> если теплота плавле-
плавления гептана при 182,5 К равна 14,05Ы03 Дж/моль.
т, к
15,14
17,52
19,74
21,80
24,00
26,68
30,44
34,34
Дж/(моль-К)
6,28
8,83
11,43
14,25
17,22
20,66
25,45
30,85
г. к
38,43
42,96
47,87
53,18
65,25
71,86
79,18
сР,
Дж/(моль-К)
36,55
41,95
47,56
53,59
65,69
71,34
77,58
г, к
86,56
96,20
106,25
118,55
134,28
151,11
167,88
Ср,
Дж/(моль-К)
83,02
90,35
97,22
105,05
113,67
123,68
133,81
14. Вычислите в уравнении Дебая Су = AT3 коэффициент А для
гептана, если при 15,14 Су = 6,28 Дж/(моль- К). Определите (#?5,и —
—Но) по уравнению Дебая. В интервале температур 15,15—182.5К
определите графически изменение энтальпии, пользуясь данными зада-
задачи 13. Вычислите изменение энтальпии твердого гептана в интервале
температур 0—182,5 К-
61
15. Рассчитайте разность (АН0 — At/0) при 1,0133—105 Па в
следующих процессах:
H2+V2O2-H2O (при 298К) (а)
СНЭСООС2НВ + Н2О = СНЭСООН+С2НВОН (при 298 К) (б)
1/2N2 + 3/2H2 = NH3 (при 673К) (в)
С + 2Н2 = СН4 (при 1073 К) (г)
16. Воду довели до температуры кипения при давлении 1 атм. Ког-
Когда через сопротивление, находящееся в тепловом контакте с ней, про-
пропустили электрический ток в 0,5 А от 12-вольтового источника в тече-
течение 5 мин, было обнаружено, что отогналось, а затем сконденсирова-
сконденсировалось 0,798 г воды.
Рассчитайте изменение молярной внутренней энергии и молярную
энтальпию испарения воды (А(УИСП и АЯИСП).
17. Определите тепловой эффект реакции
СН=СН+СО+Н2О (ж) =СН2=СНСООН (ж)
при стандартном давлении и 298 К, если известны теплоты сгорания
веществ:
Вещество СН=СН СО Н20(ж) СН2=СНСООН(ж)
Аясг, 298- кДж/моль . —1299,63 —283,18 0 —1368,03
Определите тепловой эффект реакции при постоянном объеме.
18. Рассчитайте теплоты образования метана из простых веществ
при 298 К и стандартном давлении и при V = const на основании сле-
следующих данных: для Н2О (ж) &Hft 298 = — 285, 84 кДж/моль; для
CO2A#f, 298 = — 393,51 кДж/моль; теплота сгорания СН4 АЯ?Г, 298 =
= — 890,31 кДж/моль.
19. Теплота образования Fe2O3 из простых веществ равна при
298 К и стандартном давлении — 821,32 кДж/моль, а А12О3 =
= 1675,60 кДж/моль. Рассчитайте тепловой эффект реакции восста-
восстановления 1 моль Fe2O3 металлическим алюминием.
20. Определите теплоту образования As2O3 из простых веществ
при 298 К и стандартном давлении, если известны следующие термохи-
термохимические уравнения:
As2O3 + 3H2O (изб) = 2H3AsO3 (раств)+31,61 кДж (а)
As + 3/»Cl2 = AsCl, (г)—270,3 кДж (б)
AsCl3 (r)+3H2O (H36)=H3As03 (раств)+ЗНС1 (раств)—73,60 кДж (в)
1/2Н2+1/2С12 = НС1 (г)—92,37 кДж (г)
НС1 (г) +Н2О (изб) = НС1 (раств)— 72,49 кДж (д)
Н8 + 1/2О8 = Н8О (ж) —285,84 кДж (е)
21. Вычислите тепловой эффект реакции при 298 К и стандартном
давлении:
CaQs (тв)+2Н2О (ж)=Са(ОНJ (tbJ + QsH.,
Данные о теплотах образования возьмите из справочника [М.]
62
22. Определите теплоту образования из простых веществ при стан-
стандартном давлении и 298 К следующих соединений: а) жидкого бензола
СвНв; б) жидкого гликоля С2НвО2; в) твердой щавелевой кислоты
(СООНJ; г) жидкого анилина CeH5 NH2. Для решения воспользуйтесь
справочными данными о теплотах сгорания [М.].
23. Вычислите тепловые эффекты следующих реакций при 298 К
и стандартном давлении:
(СООНJ (тв) = НСООН (ж) +СО2 (а)
С2НВОН (ж)+О2 = СН3СООН (ж)+Н2О (ж) (б)
2СН3С1 (r)+Mg (тв)=С,Н, (r)+MgCla (в)
ЗС2Н2(г)=С,Н, (ж) (г)
CH4+4SO2C12 (ж) = СС14 (ж)+45О2+4НС1 (д)
24. При сгорании нафталина в калориметрической бомбе при 298 К
с образованием воды и диоксида углерода тепловой эффект равен
— 5152,96 кДж/моль. Вычислите теплоту сгорания нафталина при по-
постоянном давлении, если водяной пар,, образующийся при сгорании
нафталина: а) конденсируется; б) не конденсируется.
25. Генераторный газ имеет объемный состав (%): СО — 21,85;
СО2—7,12; Н2—13,65; СН4—3,25; О2—0,90 и N2 — 53,23. Определите
теплоту, выделяющуюся при сгорании 1 м8 генераторного газа, при-
приведенного к условиям Р = 1,0133-105 Па и Г = 298 К, если сгорание
газа происходит полностью. Водяной пар не конденсируется.
26. Определите тепловой эффект разбавления водой 100 кг
77,76 %-ной азотной кислоты до концентрации 25,91 %. Для расчета
воспользуйтесь справочными данными [М.].
27. Определите теплоту, которая выделится при добавлении к
0,3 кг воды 0,1 кг 50%-ной серной кислоты. Данные о теплотах раст-
растворения возьмите из справочника [М.].
. 28. Рассчитайте тепловой эффект процесса смешения 0,5 кг 20 % -
ной серной кислоты и 1 кг 60%-ной серной кислоты. Для расчета вос-
воспользуйтесь данными справочника Ш.].
29. Тепловой эффект растворения безводного сульфата лития
—26,71 кДж/моль. Тепловой эффект растворения кристаллогидрата
Li2SO4H2O —14,31 кДж/моль при 298 К- Вычислите тепловой эф-
эффект образования Li2SO4-H2O из безводной соли и воды. Опреде-
Определите процентное содержание воды в частично выветренном кристалло-
кристаллогидрате сульфата лития, если тепловой эффект растворения 1 кг этой
соли равен —0,146-10s кДж.
30. Вычислите тепловой эффект реакции нейтрализации соляной
кислоты гидроксидом натрия в бесконечно разбавленном растворе из
следующих данных:
HCb46>5H2O + NaOH.1065>5H2O = NaCM112,0H2O—57,903 кДж
НаО^НСЫПг.О-НаО—1,462 кДж
2О + огН2О=НС1-ооН2О—0,419 кДж
NaOH • 1065,5HaO + оо HaO = NaOH • оо Н2О—0,376 кДж
NaCl-1112,0HaO + ooH2O = NaCl-ooH,O—0,292 кДж
63
31. Определите теплоту образования кристаллической аминоуксус-
ной кислоты NH2CH2COOH при 298 К и стандартном давлении на
основании ее теплоты сгорания, равной — 976,72 кДж/моль. Полу-
Полученную величину сопоставьте со справочной [М.].
32. Определите теплоту сгорания кристаллического и-нитрофенола
CeH5NO3 при 298 К, если теплота образования Д#°, 298 = — 191,66
кДж/моль. Полученную величину сопоставьте со справочником [М.].
33. Определите тепловой эффект реакции SO2 + С12 = SO2C12
(ж) при 340 К, если принять, что теплоемкости всех реагирующих ве-
веществ не зависят от температуры и равны теплоемкостям при 298 К.
Значения теплоемкостей возьмите из справочника [М.].
34. Определите тепловой эффект реакции Na (тв) + V212 (тв) =
= Nal (тв) при 370 К. Зависимость теплоемкостей от температуры
возьмите из справочника.
35. Составьте уравнение зависимости молярной теплоты сго-
сгорания водорода при постоянном давлении от температуры; образу-
образующийся водяной пар не конденсируется. Установите предел темпера-
температур, для которых справедливо полученное уравнение. Вычислите теп-
тепловой эффект реакции при 800 К.
36. Составьте уравнение зависимости теплового эффекта химиче-
химической реакции С (графит) +Н2О = СО + Н2 от температуры. Рассчи-
Рассчитайте Д#?ооо-
37. Тепловой эффект сгорания графита при 298 К ра-
равен — 393, 795 кДж/моль, а алмаза при той же температуре — 395,
692 кДж/моль. Удельные теплоемкости для этих веществ соответ-
соответственно равны 720, 83 и 505,58 Дж/(кг-К)- Рассчитайте теплоту
перехода графита в алмаз при 273 К.
38. Теплота испарения метанола при 298 К равна 37,5 кДж/моль.
Определите теплоту испарения метанола при 320 К- Теплоемкости
жидкого и газообразного метанола возьмите из справочника [М.].
39. Вычислите тепловой эффект образования А1С13 из простых ве-
веществ при 423 К и стандартном давлении. Тепловой эффект при 298 К
и завимимости теплоемкостей от температуры возьмите из справочни-
справочника [М.]
40. Определите тепловой эффект реакции
2a-NaOH + a-SiO2 = a-Na2SiO2 + H2O (r)
при стандартном давлении и 800 К- Необходимые данные возьмите из
справочника [М.]. Теплота плавления NaOH при 595 К составляет
6,36 кДж/моль.
41*. Определите тепловой эффект реакции S + О2 = SO2 при
390 К и стандартном давлении. Необходимые данные возьмите из спра-
справочника [М.]. Сера при 390 К находится в моноклинной кристалличе-
кристаллической модификации. Температура фазового превращения 368,6 К.
42. Вычислите тепловой эффект реакции SO2 + С12 = SO2C12
при 500 К. Для решения воспользуйтесь значениями {Щ — Я)
приведенными на с. 55.
64
43* Теплоемкости н-пропана при различных температурах:
Г, К
Дж/(моль-К)
300
73,8
400
94,6
500 600
112,9 129,0
700
143,1
800
155,3
900 1000
165,3 175,1
Выведите аналитическую зависимость СР — f (T) в виде степенного
ряда СР = а + ЬТ + сТг.
44. Платье, в котором вы вымокли, впитало 1 кг воды и холодный
ветер высушил его. Какое количество потерянной теплоты необходимо
возместить организму? Сколько глюкозы нужно потребить, чтобы вос-
восполнить эту потерю? Предположим, что ваш организм не возместил по-
потерю теплоты. Какова будет ваша температура после высыхания одеж-
одежды (предположите, что теплоемкость вашего тела равна теплоемкости
воды).
45. Одним из факторов, учитываемых при выборе холодильных
жидкостей, является их энтальпия испарения. Небольшое количество
фтороуглерода с М = 102 помещено в сосуд с электрическим нагре-
нагревателем. При давлении 650 мм рт. ст. жидкость кипит при 351 К. При
пропускании через нагреватель, помещенный в кипящую жидкость,
тока в 0,232 А от 12-вольтного источника в течение 650 с получилось
Г,871 г дистиллята. Определите молярную энтальпию и внутреннюю
энергию испарения фтороуглерода.
46. Поршень, оказывающий давление 1 атм, находится на поверх-
поверхности воды при 100° С. При уменьшении давления на бесконечно ма-
малую величину испарилось 10 г воды. На этот процесс израсходовано
22,2 кДж теплоты. Определите Q, W, All, АН и Д#тдля процесса ис-
испарения.
47. Определите графически с точностью 0,001° действительное из-
изменение температуры при калориметрическом измерении температуры
через каждые 30 с по термометру Бекмана:
Номер
отсчета
0
1
2
3
4
5
6
7
8
9
Температура
2,299
2,300
2,303
2,305
2,307
2,308
2,311
2,313
2,315
2,317
Номер
отсчета
10
11
12
13
14
15
16
17
18
19
Температура
2,319
2,050
1,800
1,658
1,638
1,639
1,641
1,653
1,662
1,671
Номер
отсчета
20
21
22
23
24
25
26
Температура
1,683
1,700
1,708
1,718
1,727
1,738
1,747
48. Вычислите изменение температуры калориметра и раствора при
растворении 2 г NH4NO3 в 100 мл воды. Тепловая константа калори-
калориметра К = 52,3 Дж/К-
3 Зак. 767
65
49. Теплота растворения 2 г смеси кристаллогидратов сульфата
меди — различного состава равна нулю. Установите, какие формы
кристаллогидратов смешаны и в каком массовом соотношении. Рас-
Рассчитать процентное содержание воды в системе.
50. Вычислите интегральную теплоту растворения при 298 К 1 моль
КС1 в воде при образовании насыщенного раствора, если теплота
разбавления 10 мл насыщенного раствора в 100 мл воды q =
= — 87,86 Дж. Теплоту растворения для полученного раствора
взять из справочника.
51. Рассчитайте истинную теплоемкость Ср кристаллического
Ba(NO3J при 700 К по средним теплоемкостям в интервале темпера-
температур от 298 К до Г:
Т.К. 500 600 700 800
Ср, Дж/(мольК) 174,01 183,38 192,73 200,66
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Вычислите тепловой эффект реакции А при 298 К: а) при Р =
= const ; б) прн V = const. Тепловые эффекты образования веществ
при стандартных условиях возьмите из справочника 1М.].
№ ва-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
Реакция А
2Н2 + СО = СН,ОН(Ж)
4НС1 + О2 = 2Н2О(ж) + 2С12
NH4C1(tb) = NH8+HC1'
2Ы2 + 6Н2О(ж) = 4ЫН8+ЗО2
4NO + 6Н2О(ж) = 4NH, + 5О2
2NO2 = 2NO + O2
N2O4 = 2NO2
Mg( OHJ = MgO + Н2О( г)
СаСО3 = СаО + СО2
Са(ОНJ = СаО + Н2О(г)
S(poM6) + 2Н2О(ж) = SO2 + 2Н2
S(pom6) + 2СО2=SO2 + 2CO
2SO2 + O2 = 2SO8
№ ва-
варианта!
14
15
16
17
18
19
20
21
22
23
24
25
Реакция А
SO2 + C12 = SO2C12
СО + ЗН2 = СН4 + Н2О(ж)
2СО + SO2 = S(poM6) + 2СО2
СО + С12 = СОС12(г)
СО2 + Н2=СО + Н2О(ж)
СО2 + 4Н2 = СН4 + 2Н2О(ж)
2СО2 = 2СО + О2
v^H* ~4~ (^CJe ^— *\j\J ~т~ 2Нп
С4 ХЛ (~\\л1>зг\ С4 ХЛ i т т (~\il-ar\
СН8СНО(г)+Н2 = С2НвОЩж)
2. Вычислите тепловой эффект образования вещества А из простых
веществ при 298 К и стандартном давлении, если известна его теплота
сгорания при этой температуре и стандартном давлении {С. X., т. 1].
Сгорание происходит до СО2 (г) и Н2О (ж).
66
№ ва-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
Вещество А
Уксусная кислота
1,1 -Этнленхлорнд
Этиленхлорид
Этиленглнколь
Диметиламин
Ацетон
Пропиламин
Изопропиловый спирт
Пропнловый спнрт
Глицерин
Бутнроннтрил
Бутиловый спирт
грег-Бутнловыя спнрт
Днэтиловый эфнр
Пирндни
Амиловый спнрт
Днхлорбензол
Нитробензол
Фенол
Гидрохинон
Анилин
Цнклогексанол
Бензойная кислота
Бензнловый спирт
Гептанол-1
Формула
С,Н4О2
С,Н4С12
С,Н4С12
с,н«о2
C,H7N
с,н«о
C,HBN
С8Н8О
с8н8о
с,н8о
C4H7N
с4н10о
с4н10о
CBHBN
СВН12О
С,Н4С12
CeHBO2N
с.нво
с«н«о2
QH7N
С,Н12О
с7н«о2
С7Н8О
С7Н1вО
Состояние
ж
ж
г
ж
ж
ж
ж
ж
ж
ж
ж
ж
ж
ж
ж
ж
ж
ж
ТВ
ТВ
ж
ж
ТВ
ж
ж
3. Вычислите выделяющуюся или поглощающуюся теплоту при
разбавлении а кг водного 6%-ного раствора вещества А в с кг воды
при 298 К. Для расчета воспользоваться справочными данными об ин-
интегральных теплотах растворения IM.].
№ ва-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
Вещество А
НС1
на
НС1
H2SO4
H,SO4
H2SO4
H2SO4
на
NaOH
NaOH
NaOH
NaOH
KOH
a
1
2
3
4
5
1
2
3
4
5
1
2
3
b
26
38
30
90
80
70
60
34
30
25
40
35
50
с
2>
3
4
1
2
3
3
1
1
2
3
4
2
№'ва-
№'варианта
14
15
16
17
18
19
20
21
22
23
24
25
Вещество А
KOH
KOH
KOH
HNO,
HNO8
NH,
LiCl
LiBr
NaBr
KI
NaCl
Nal
a
4
5
1
2
3
4
5
1
2
3
4
5
b
45
40
35
50
40
30
30
45
40
50
26
30
с
3
1
2
4
5
10
3
2
6
6
10
10
3*
67
4. Выведите аналитическую зависимость теплового эффекта (Дж)
реакции А от температуры, если известен тепловой эффект этой реак-
реакции при 298 К. Уравнения зависимости Cj> = f (Г) возьмите из спра-
справочника [М.]. Вычислите тепловой эффект реакции при температуре Т.
Постройте графики зависимости
-f(T) и
в том интервале температур, для которого справедливо выведенное
уравнение зависимости ЛЯ? = / (Т). Определите графически ,-•
при температуре Тг. Рассчитайте ДС# при этой температуре.
N» вари-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
Реакция А
2H2 + CO = CHsOH(r)
4НС1 + О2 = 2Н2О(г] + 2С12
2N2 + 6H2O(r)t=4NH,+3O2
4NO + 6Н2О(г) = 4NH, + 5О2
2NO2 = 2NO + O2
MgFHJ = MgO + H,O(r)
СаСО, = СаО + СО.
Са(ОН)а = СаО+Н2О(г)
ViS,(r) + 2Н2О(г) = SO2 + 2Н2
1/&(г) + 2СО. = SO2 + 2CO
SO2 + Cl2 = SO262(r)
СО + ЗН2 = СН. + Н2О(г)
2СО+SO2 = %S»(r) -f 2C О2
СО + С12 = СОС12
СО2 + Н2 = СО+ HjjO(r)
СО2 + 4Н. = СН4+2Н2О(г)
2СО» = 2СО -\- О2
/^1_т 1 f* (~\ f)C^t~\ 1 ОН
^,П« —I— v*i_J2 ss ?\*i(J —j— ^Г>2
(^ 1ч (^ 1-1 | t у
С2НвОН(г) = CgH! + Н2О(г)
СН,СНО(г) + Н2 = С2НвОН(г)
С,Н,(г)+ЗН2 = С,Н1а(г)
т, К
800.
750
455
1300
1000
700
400
500
1000
500
1000
900
700
400
1000
900
400
1200
1000
700
900
400
400
500
600
Л, К
350
650
450
1000
900
500
350
310
700
340
900
850
600
300
900
700
.350
1000
900
500
320
350
300
450
500
5. Определите тепловой эффект химической реакции А при темпера-
температуре Т. Для расчета воспользуйтесь таблицей функций (НЩ)
из приложения.
68
Ni ва-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
Реакция А
СО + С lj,= СОС12
СО + %О2 = СО2
NH,+2HC1=NH4C1
2NaOH -)- СО2 =
= Na.CO, + H2O
Н2 -)- yiSj = H2S
СО + Cl2 = СОС12
СО -\- /4Оа = СО2
Н,+ /4О. = Н2О
NH,+ HC1 = NH4C1
2NaOH+CO2 = NagCO8+
+Н2О
co+ci2=c6gi,
г, к
500
500
500
400
500
500
600
600
600
500
600
600
700
№ ва-
варианта
14
15
16
17
18
19
20
21
22
23
24
25
Реакция А
со+йо,=со,
Н2 -)- ^О2 = Н2О
NH8+HC1 = NH4C1
2NaOH + CO2 =
= Na,CO8 + H2O
Н2 + ViSs = H2S
CO -\- Cj = COC12
H2 -)- У2О. = H.O
l\rij~|~ ПЫ ^= 14114^1
2NaOH + CO2 =
= Na.CO,+ H,O
it 1 \/ с 1 XJ С
Пц —j— 72Og ~t~ rigO
CO + CI2 = COC12
со -f- /4o 2=co2
г, к
700
700
600
700
700
800
800
700
800
800
900
900
ГЛАВА VII
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Основные уравнения и символы
[К., с. 273—281; Г., т. 1, с. 75—131]
Взаимосвязь между теплотой и работой в процессе, осуществляемом
по циклу Карио, описывается уравнением
Ti-T,
W
(VII.I)
где ц — КПД цикла; Qt — количество теплоты, сообщенное при тем-
температуре Тг системе, совершающей данный цикл; Q2 — количество теп-
теплоты, отданное системой при температуре Т2; W — работа, совершен-
совершенная системой.
Основные свойства энтропии: в обратимом процессе при переходе
системы из состояния 1 в состояние 2 изменение энтропии определяет-
определяется по уравнению
—г-, (VII.2)
Т
где 6Q — элементарное количество теплоты.
В изолированной системе (V, U = const) энтропия является кри-
критерием направленности самопроизвольного процесса и состояния рав-
равновесия:
AS>0. (VII.3)
69
Изменение энтропии при нагревании (охлаждении) от Тх до Г, при
постоянном объеме или постоянном давлении определяют по уравне-
уравнениям:
^S = \cv~~, (VII.4)
ГР' dT
д5=\С/>-——. (VII.5)
г. Т
Изменение энтропии при поглощении теплоты при постоянных тем-
температуре и давлении или объеме рассчитывают по формулам:
bS = QPiT, (VII.6)
bS = Qv/T. (VII.7)
Изменение энтропии при изотермическом расширении п моль идеаль-
идеального газа можно определить по формуле
AS = rt^ln(K2/Kx) (VII.8)
или
Д S = л/? In (Рх/Р.,). (VII.9)
Изменение энтропии при поглощении теплоты п моль идеального газа
выражают
при Р = const ЛS=nCv In (Ta/Ti) + nR In (VJVrf, (VII.10)
при V=const Л S = n Cp In (TjTJ—nR In (PJP{). (VII.11)
Изменение энтропии при адиабатическом расширении идеального
газа определяют по формуле
ЛS = nCv in(Pivy/P1Vf). (VII. 12)
Для химической реакции изменение энтропии ASpeaK рассчитывают
по уравнению
Л SpeaK = 2 (V, S»)Koh-2 (Vi S»)Ha4, (VII. 13)
где 2 (v,-S°)KOH, 2 (ViS°)KSL4 — суммы абсолютных энтропии конечных
и исходных веществ:
г,
5 -y^-dT. (VII. 13а)
Изменение энтропии для фазовых переходов AS,j,.H будет
Л5ф.п=ЛЯф.п/Г. (VII. 14)
Абсолютную энтропию Sf рассчитывают по уравнению
70-
где первая сумма выражает изменение энтропии в процессе нагрева-
нагревания, вторая сумма—изменение энтропии при фазовых переходах;
R In Pa — изменение энтропии при расширении (сжатии) насыщенного
пара от равновесного давления до 1 атм.
Основные свойства термодинамических потенциалов: энергия Гиб-
Гиббса G и энергия Гельмгольца А:
P,r = const, — AG = W, (VII.16)
— AA = W, (VII.17)
где AG и АЛ — изменения энергий Гиббса и Гельмгольца в каком-
либо процессе; W — полезная работа. Энергии Гиббса и Гельмголь-
Гельмгольца являются критериями направленности самопроизвольного процесса
и состояния равновесия:
при Р и Г= const AG<0, (VII.18)
при V и T = const ДЛ<0, (VII.19)
ДЛ = Д?/—TAS, (VII.20)
AG = A# —TAS, (VII.21)
где АЛ, &U, AS, AG, АН — изменение соответствующих функций в
любом физико-химическом процессе; при Т = const
AG = A/1 + A(PIO- (VII.22)
Для идеальных газов при Т = const
AG=A>4+Aw/?r, (VII.23)
где An — изменение числа молей газообразных веществ в ходе физи-
физико-химического процесса.
Изменения энергий Гиббса и Гельмгольца при нагревании (охлаж-
(охлаждении) от Тх до Тг при постоянном давлении или объеме выражаются
в дифференциальной форме уравнений:
и в интегральной форме:
т, т.
GTt—GTi=l —SAT; AGri —AGri=J —ASdT;
т\ ' r,
т. t,
ATt—ATi =J —SdT; АЛГ — А Лг =f —ASdT.
1 r, ' ' Г,
71
В небольшом интервале температур, если С/> = const, то
(VII.28)
Изменения энергий Гиббса и Гельмгольца при сжатии или расшире-
расширении, когда Т = const, выражаются в дифференциальной форме урав-
уравнениями:
(f)—'- (V"-29)
-V. , (V.I.30,
dAG ' =AV, (VII.31)
где AV — изменение объема в ходе физико-химического процесса;
и в интегральной форме: для 1 моль идеальных газов
А,—ЛХ = Д A=RTIn (VJVz), (VII.32)
G2-G1 = /?Tln(P2/P1); (VII.33)
для конденсированных систем при умеренных давлениях
G1-G1=VK.t(P1-P1), (VII.34)
где Ук.ф — объем конденсированной фазы; для химических реакций
(Т = const)
— 2 (v* Д °/«*)нач. (VI 1.35)
где 2 (v*AG/,i)koh. 2(vi^/,j)Ha4 — суммы энергий Гиббса образова-
образования для конечных продуктов и исходных веществ;
А О?еак = 2 (А Ом)кон — 2 <Д °м)наЧ. (VII.36)
= Atf° — TAS\ (VII.37)
где AG0, АЯ°, AS0 — изменение соответствующих функций в стан-
стандартных состояниях при температуре Т.
Изменение энергии Гиббса для фазовых переходов
ДОф.п=0, (VII.38)
для испарения и возгонки.
дЛф.п=-/?Г, (VII.39)
для плавления и полиморфных превращений
АЛф.п=0. (VII.40)
72
ЗАДАЧИ С РЕШЕНИЯМИ
1. При начальной температуре 373 К 1 моль кислорода совершает
цикл в идеальной машине Карно. Сначала он расширяется изотерми-
изотермически до двукратного объема, затем расширяется адиабатически до
трехкратного объема (по сравнению с первоначальным), затем сжимает-
сжимается изотермически до такого объема, чтобы в результате последующего
адиабатического сжатия вернуться к первоначальному состоянию. При-
Приняв у = Cp/Cv = 1,4, рассчитайте работу, совершенную газом в
каждой части цикла; работу, произведенную за счет теплоты в цик-
цикле, и КПД цикла.
Решение. 1. Для первой стадии цикла — изотермического
процесса — работу определяем по уравнению
откуда
1Р1 = 8,314-373.2,3lg BVi/V1) = 2146,06 Дж.
2. Для второй стадии цикла — адиабатического процесса — работу
определяем по уравнению
температуру Т2 определяем по уравнению
V, \v-i / 2 \о>4
' г«=373(т) =317'2К-
Следовательно,
Г 8314:
0,4
= 1159,8 Дж.
3. Для третьей стадии цикла работа будет отрицательна, так как
происходит сжатие газа W3 = — nRT In (V3/V4), где по условию V3—
= 3Vt, а объем V4 должен быть получен согласно указанию о том, что
после адиабатического сжатия газ должен вернуться в исходное со-
состояние, следовательно, должно выполняться равенство
откуда
Таким образом,
Ц73=—8,314-317,2-2,3lg C^/1,5^) = —1824,86 Дж.
73
4. Для четвертой стадии цикла работа адиабатического процесса
будет отрицательна и численно равна работе во второй стадии, так как
в результате адиабатического расширения газ возвращается к перво-
первоначальной температуре:
Wt = ~nR Tl~Ti =1159,8 Дж.
V —1
Суммарная работа за весь цикл W = Wt -\- W2 + W3 + Wt будет
равна
W = 2146,06— 1824,86 = 321,2 Дж.
КПД цикла: ц = W/Qv где Qx = Аг;
321,2
1
К этому же результату придем, если определим ц из равенства (VI 1.1):
JW^ 373-317.2
1 Гх 373
2. В двух сообщающихся сосудах, разделенных перегородкой, на-
находятся 1 моль азота и 2 моль кислорода. Перегородку вынимают, газы
смешиваются. Рассчитайте изменение энтропии ASCMem, если исход-
исходные температуры и давления одинаковы, а объемы различны; Vn2 =
= 1 л; Vo2 = 2 л. Конечное давление смеси равно исходному давле-
давлению газа.
Решение. Процесс смешения газов необратим, и изменение
энтропии выражается неравенством AS > 1 •=¦"• Но если необратимый
и обратимый процессы проводятся в одних и тех же граничных усло-
условиях, то ASo6p = ASueo6p. Всякий необратимый процесс можно мыс-
мысленно провести обратимо в несколько стадий в тех же граничных ус-
условиях и подсчитать энтропию для каждой обратимой стадии. Тогда
сумма изменений энтропии этих стадий будет равна изменению энт-
энтропии необратимого процесса. В данной задаче общее изменение
энтропии можно заменить суммой изменения энтропии за счет расши-
расширения каждого из газов по отдельности, т. е. принять, что ASCMem=
- ASn2 +ASOl.
Согласно уравнению (VI 1.8)
Д SN, = R In (V/VUi); A SOt = R in (V/VOi);
=-2,3-8,31 (lgV3-21g2/3)==15,876 дж/(моль.К)
(*n2 = 1/3, хог = 2/3 — молярные доли азота и кислорода).
3. Смешали 1 моль аргона, взятого при Тдг=293 К, с 2 моль азота,
взятого при 7n2 = 323 К. Исходные давления компонентов и конеч-
74
ное давление смеси одинаковы. Вычислите температурную со-
составляющую энтропии смешения. Теплоемкость аргона Срт = 20,8
Дж/(моль-К) и азота Срг = 29,4 Дж/(моль-К).
Решение. Процесс смешения газов необратим, поэтому вычисля-
вычисляем общее приращение энтропии системы как сумму изменений энтро-
энтропии компонентов за счет увеличения температуры и за счет уменьшения
давления, т. е.
А Зсмеш = (A SN, + Д SAr)H3M. т + (Д SNj + A SAr)H3M. P.
Слагаемое (ASn2 + Д5аг)изм.г является температурной составляю-
составляющей общего приращения энтропии в результате смешения. Соглас-
Согласно уравнению (VI 1.5)
N A), A)
Т — конечная температура смеси, вычисляется по уравнению тепло-
теплового баланса
где пАг, ппг — количества молей аргона и азота. Подставляем числа в
уравнение B):
20,8-1 (Г—293) =29,4-2 C23—Г).
После преобразования уравнения B) и вычислений находим Т =
= 315 К- Подставляем числа в уравнение A):
Д S = 29,4-2-2,31g C15/323)+ 20,8-2,3lg C15/293) =
= —1,458+1,504=0,033 Дж/(моль-К)-
4. Вычислите изменение энтропии в процессе затвердевания 1 моль
переохлажденного бензола при 268 К, если при 278 К АЯплС,н, =
= 9956 Дж/моль, (СР)?н, = 127,3 Дж/(моль-К)> (Ср)?,н, = 123,6
Дж/(моль-К); Р = const = 1,0Ы05Па.
Решение. Этот процесс необратим, поэтому мысленно прово-
проводим его обратимо в три стадии (см. пример 2):
СвНв(ж), 268 AS=? - CeHe (тв), 268
t
Д S,
AS,
* AS,
С6Нв(ж), 278,5 СвН6(тв), 278,5
Тогда AS = AS! + AS2 + AS3-
Вычисляем ASX и AS3 по уравнению (VII.5); AS2 — по уравнению
(VII. 14). Тогда
AS C?2,31g+ C2,3lg,
р h 268 278,5 ^ р Щ 278,5
278,5 9956 268
AS=127,3-2,31g— ——+123,6-2,31g—-—=35,61 Дж/(моль-К).
ZOO ЛЬ,О i/O,O
75
5. Рассчитайте стандартную энтропию этилена, если температуры
и теплоты фазовых превращений этилена соответственно равны:
Тпл = 103.9К; АЯПЛ = 3363 Дж/моль; Гннп = 169,4 К; АЯНСП =
= 13595,4 Дж/моль. Зависимость теплоемкости от температуры см. в
таблице:
Т, к
15
20
25
30
35
40
45
50
55
60
65
Дж/(моль-К)
2,864
6,380
10,655
14,948
19,664
23,793
27,476
31,055
34.486
37,476
40,123
г, К
70
75
—
80
85
90
85
98,1
100
101,4
102,3
ф
Дж/(моль-К)
42,756
45,486
48,510
51,87
55,82
61,87
67,33
71,61
75,47
78,01
Г, К
103,0
103,6
—
105
ПО
—
120
130
140
150
—
Дж/(моль-К)
82,40
86,44
—
69,47
69,13
68,54
68,08
67,70
67,49
—
т, к
160
—
179,6
192,8
210,8
231,4
250,9
272,1
293,9
—
—
Дж/(моль-К)
67,37
—
36,90
36,99
37,51
38,54
39,75
41,68
43,42
—
—
Решение. Определяем стандартную энтропию по уравнению
15 /?0\тв 103,9 f?O\TB
~ Т J. T 103,9
J
о
169,4 />0\ж
103,9
J
15
13595,4
29 8 />0\г
J
169,4
Пересчитав приведенные значения С% на С$/Т и построив график
Cj>/T=f(T) (рис. 11), находим энтропию для каждого интервала темпе-
температур:
1) методом графической экстраполяции или по уравнению Дебая
С°р = 1943,5 (-г-) =аЯ,
где 9 — характеристическая температура:
015 50 100 150 200 250 300 Т,К
Рис. 11. Зависимость &р/Т от температуры
для этилена
S°5 0-5° = 0,966Дж/(моль-К);
2) графически для интер-
интервала 15,0—103,9 К
с0 тв с0 тв
°103,9 °I5.0 —
= 51,28 Дж/(моль-К);
3) для фазового перехода
А СО _ О0 Ж РОТВ _
а ^пл— ° 103,9~° 103,9 —
3363,4
103,9
= 32,34 Дж/(моль-К);
76
4) графически для интервала 103,9—169,4 К
s?69,4-s?o3.9 = 33'22 Дж/(моль-К);
5) для фазового перехода
^ 4
cnV9>6^. f^ =80,26 Дж/(моль.К);
6) графически для интервала 169,4—298 К
S29r8-Si69,4 = 21-50 Дж/(моль.К);
7) сумма изменений энтропии во всех интервалах температур будет
равна S^8 = 219,62 Дж/(моль-К).
6. Вычислите энтропию хлорида серебра при 870 К-
Решение. Согласно уравнению (VI 1.15)
S870, AgCI— S298, AgCI +^^
¦!¦?¦
Выписываем из справочников [М.], [С. X., т. 2] необходимые данные
Гпл=--728 К; АЯПЛ= 12886,7 Дж/моль; C*gC, = 66,94 Дж/(моль • К)
SVi.298 = 96,07' Дж/(моль-К); С1* = 62,26 + 4,18 Т — 11,30 X
X 10в/Г2. Подставляем числа в уравнение
7 2 R
со „п7, Г /62,26 | 4,18-Ю-2 11,30-1
SAgCl. 870 = 96,07+ ^ — 1 —
298 V
870 , 12886,7
+ 66,94.2,3.g— + -J5—
После интегрирования получаем
Sg70 = 96,07+55,55+1,80—5,309+17,70+11,92=177,70 Дж/(моль-К).
Приращение энтропии AgCl за счет нагревания составит
' (S»?0—S»98) =81,63 Дж/(моль-К) и S°^CI> 870= 177,70 Дж/(моль-К).
7. Определите изменение энтальпии, внутренней энергии и энтро-
энтропии при переходе 2,7 кг воды, взятой при Рг = 1,0133-105 Па и 7\ =
= 298 К, в пар при Р2 = 0,50665-105 Па и Т2 = 373 К, Cf~Cv =
= 4.187-103 Дж/(кг-К), удельная теплота испарения 2260,98'Ю3
Дж/кг. Считать пар идеальным газом.
Решение. Изменение свойств системы не зависит от пути про-
процесса, а определяется только начальным и конечным состояниями сис-
системы. Выбираем любой путь, состоящий из отдельных обратимых
стадий, и тогда изменение свойств в данном процессе будет равно сум-
сумме изменений свойств в каждой стадии. Пусть рассматриваемый про-
процесс состоит из следующих обратимых стадий: 1) нагрев воды при Рг=
= 1,0133-105 Па от 7\ = 293 К до Тг = 373 К; 2) превращение
воды в пар при Рг = 1,0133-10э Па и Т2 = 373 К; 3) изотермическое
77
расширение водяного пара при Т2 = 373 К от Рг = 1,0133-106 Па
до Р2 = 0,50665-105 Па. Рассчитаем изменение энтальпии:
373
AH1 = m f C*d Г = 2,7-4,187-10s C73—293) =904,392-103 Дж,
293
ДЯ2 = т/ = 2,7-2260,98-103 = 6104,646103 Дж,
ДЯ3 = 0.
Согласно закону Джоуля энтальпия и внутренняя энергия идеального
газа при постоянной температуре не зависят от давления или объема.
Следовательно,
Д Я = 904,392-103+6104,646-103 = 7009,038-103 Дж,
так как С* ~ С%,
то
Д?/1 = ДЯ1 = 904,392-103 Дж,
Д?/2=ДЯ2-рД У = ДЯ-Р(УЦ-УШ).
Если пренебречь объемом жидкой фазы, то
Д?/2=ДЯ2— рУп = ДЯ,— n/?V2 = 6l04,646-103—
2,7
— 8,315-103.373 = 5639,419-103 Дж,
18
Изменение внутренней энергии данного процесса At/ = 904.392X
X 103+5639,419-103 = 6543,811 • 103 Дж, а изменение энтропии:
373 сжйТ т
~Т = mC,3031g-*- =
293 1
373
= 2,7-4,187-10*-2,3031g—— =3,525-103 Дж/К,
ДЯ„ 6104,646-103
AS^'16,366-103 Дж/К,
2,7 1,0133-10»
83151О32ЗО31
Д53 = ^1п^ 8,3151О
AS = 3,525-103+16,366-103 + 0,865-103 = 20,756-Ю3 Дж/К.
8. Установите, осуществима ли при V = const и 298 К реакция
Ag+nCl2 = AgCl (тв) + (п — Va) Cl2, использовав свойства энтро-
энтропии.
Решение. Энтропия является критерием направленности про-
процесса только в том случае, если процесс протекает в изолированной сис-
78
теме, поэтому мысленно проводим исследуемую реакцию при V =
= const и отсутствии теплообмена с окружающей средой. Чтобы рассчи-
рассчитать AS процесса, принимаем: реакция проходит мгновенно и до кон-
конца при 298 К; выделившаяся теплота идет на нагревание избытка С12
и твердого AgCl; реакционный сосуд теплоту не поглощает; тогдв об-
общее изменение энтропии складывается из энтропии реакции (ASpeaK>298)
и энтропии нагревания AgCl и Cl2 (ASHarp):
Д S = Д Spean~t~ А ^яагр-
Вычисляем ASpeaK при 298 К по уравнению (VII. 13):
А СО СО СО 1/
Slgci =96,07 Дж/(моль-К); S°Ae = 42,69 Дж/(моль-К); S?,2 =
= 223,0 Дж/(моль-К) ([М.], табл. 6; [С.Х. т. 1, 2]). После подстанов-
подстановки чисел и вычислений получаем ASpeaK, 298= —57,90 Дж/(моль-К).
Для вычисления ASHarp сначала по уравнению теплового баланса
определяем конечную температуру AgCl (ж) и С12 (г). Составляем
уравнение теплового баланса, предположив, что конечная температу-
температура системы выше температуры плавления AgCl:
Д "реак. 298 = 3?ci (Гпл-298) + Д Япл + С?,с, (Т-Тпл) +
Принимаем, что избыток С12 составляет nci, = 5 моль. Из справочни-
справочников [М.], [С.Х., т. 1, 2] имеем АЯпл>АеС1 = 12886, 7 Дж/(моль-К);
СAgci = 66,94 Дж/(моль-^К); АЯ°еак = — 127068 Дж/моль; СдвеС1 =
= 58,99 Дж/(моль-К); СР,с;2 = 36,36 Дж/(моль-К). Определяем
теплоемкость при постоянном объеме:
Су, ci, =Ср, С1г —/? = 36,36—8,314 Дж/(моль-К).
Вычисляем конечную температуру, а затем рассчитываем изменение
энтропии при нагревании:
= Д S^f., + Д SC|t,
,67 Дж/(моль.К);
AS?i, вычисляем по уравнению (VII.4) и соотношению Су = СР —
; d.
870 870 870
298 298 298
Рассчитываем интегралы:
870 р , j,
\ = (S»?0-S2°98) =38,28 Дж/(моль-К);
70
\
«J
298
«J
298
R7 П
7 П
С R 870 870
\ -— d Г = 2,3/? Ig ——- = 2,3-8,314 lg —-- = 8,895 Дж/(моль.К).
Jg T 298 298
79
Подставляем полученные числа в уравнение для расчета ASHarp
ASHarp = 81,67+38,28+8,895 = 228,6 Дж/(моль-К),
отсюда общая энтропия процесса
AS =—57,91+228,6=170,70 Дж/(моль-К).
Таким образом, AS > 0. Реакция в принятых условиях FQ =0;
Тнач = 298 К; V—const) осуществима.
9. Определите изменение энтропии для реакции
Cd + 2AgCI=CdCl2+2Ag
если проводить ее в гальваническом элементе при 1,0133-105 Па и
298,2 К, ЭДС элемента компенсируется приложенной извне и равной
0,6753 В. Стандартные теплоты образования хлоридов кадмия и сереб-
серебра соответственно равны — 389,0 и —126,8 кДж/моль.
Решение. Тепловой эффект реакции в соответствии с законом
Гесса равен
Д //•„ =(ДЯ/»> 298)ссс12-2(Д Щ, 298)AgCl =
= —38 900—2 (-126800)=-135400 Дж.
Так как реакция необратима, то ASP.C > — 135400/298,2.
Для расчета ASP.C необходимо реакцию провести обратимо. Если же
осуществить эту реакцию в помещенном в термостат гальваническом
элементе, в котором поддерживаются неизменными температура и дав-
давление, и если ЭДС элемента Е компенсируется ЭДС, приложенной из-
извне, то процесс будет практически обратимым. При этом будет произ-
произведена работа Wmax = nFE, а тепловой эффект Q будет равен TAS:
или
Подставляя в последнее уравнение значения АЯоэв (изменение энталь-
энтальпии не зависит от пути процесса, поэтому оно будет одинаковым как
в необратимом, так и в обратимом процессах) и п = 1, Е — 0,6753 В и
F = 96 487 Кл, получаем
Q=—135 400 + 2.0,6753-96 487=—5084,7 Дж.
Следовательно, ASP.C = — 5084,7/298,2=—17,05 Дж/(моль-К). Из-
Изменение энтропии изолированной системы в целом (т. е. рабочая систе-
система плюс термостат) при фактическом процессе будет равно
235 400
ASh.c=—17,05+ =437,0 Дж/(моль-К),
что подтверждает необратимость процесса.
10. Используя энергию Гиббса, решите, осуществима ли реакция
Ag + V, С1.2 = AgCl при Р = const = 1,013-105 Па и 298 К.
80
Решение. Для ответа на вопрос следует определить знак AG
реакции. Согласно уравнениям (VII. 13) и (VII. 37)
AG° = AH° —T AS0,
АН° = АН°и 298= —127,068 кДж/моль,
AS« = S°AgCl — S%g -V2S»l2=-57,97 Дж/(моль-К) (см. пример 7),
AG°= — 127 068—298 (—57,91) = — 109804,9 Дж/моль =
= — 109,805 кДж/моль, AG°<0.
Следовательно, реакция осуществима.
П. Вычислите Абгэв для реакции С (графит) + 2Н2 (г) = СН4(г).
Определите АЯгэв из следующих термохимических уравнений:
СО2 (г) =С (графит) + О2 (г) -Д Я°98,
2Н2О(ж)=2Н2(г) + О2)г)-2ДЯ»98.
2(J() + 2))98
Значение ASj^e вычислите с помощью постулата Планка.
Решение. Энергию Гиббса рассчитываем по уравнению
AG?29S=AH«9e-TAS«9S.
Из термохимических уравнений вычисляем АЯгэв образования метана:
ДЯ° 8=ДЯ° +2ДЯ» — ДЯ?.Н
298 Сср^ Н2(;г СН4СГ-
Если известно Sok для каждого компонента реакции, то при абсолют-
абсолютном нуле А5§к Для реакции будет равно
. Д ^0 К~ SCH4~SC (графит) ~2SH2-
аж
гпл (с°)тв
5 ±Zf±
Рассчитываем изменение энтропии для каждого компонента от 0 до
298 К
4(тв> Гвд) 4(ж> Гпл); 2 тпл
>п (ОДн4
тил
- 'кип) (г- 'кип) '
1 КИП
298 (г°\п
СН4([--гкип) -сн*(г'^>; AS5-J
а
81
т
кип
OK
2Н2(тв,
= 2Н2
тв. OK)".
пл
пл
2(С0)ж
Za Пи
- гкип):
298
г -Г л 50 _ С (Ср)С (графит)
Чграфит, 298) — '-(графит.О К)'. Al3ii— } т
28 9
С(графит, 298
Г, 298)
> 298)i
12. Для реакции Ag + V2C12 = AgCl вычислите теплоту обрати-
обратимого процесса. Сведя данные справочника и результаты вычислений
в таблицу, покажите, что AG и АН не зависят от пути процесса, а
работа W' и количество выделяющейся теплоты Q зависят. Макси-
Максимальная полезная работа W = 109804,9 Дж/моль = 109,805
кДж/моль.
Решение. Согласно уравнению (VII. 6) Q06p = TAS; исполь-
используя справочные данные, получаем AS0 = —57,91 Дж/(моль-К),
Qo6p= —57,91-298= 17,263 Дж/моль.
Объединив уравнения (VII.37), (VI 1.6) и (VII.16), для Р и T=const
получим АН — Qo6p — W. Подставив числа, находим
Д Я = — 17 263— 109804,9 = —127 068 Дж/моль.
Работа W необратимого процесса равна нулю. Составим таблицу:
Процесс
Необратимый
Обратимый
ДНреак.
Дж/ моль
127 068
127 068
W, Дж/моль
0
109 805
Q, Дж/моль
127 068
12 263
Из приведенных данных видно, что работа W и теплота Q, выделя-
выделяющаяся в ходе реакции, зависят от условий проведения реакции, а из-
изменение энтальпии не зависит.
82
13. Благоприятствует ли протеканию реакции Ag+VaCla = AgCl
повышение температуры?
Решение. Температурный коэффициент энергии Гиббса реак-
реакции выражается уравнением dAG°/dT = — AS0. Изменение энтропии
реакции находим по энтропиям участников реакции, AS0 = — 57,91
Дж/моль. Отсюда (dAG°/dT)p = 57,91. Таким образом, энергия Гиб-
Гиббса с ростом температуры увеличивается, т. е. повышение температуры
не благоприятствует реакции.
14. При 298 К смешали 2 моль кислорода и 1 моль азота. Исход-
Исходные давления газов Р™*, Р™* и давление смеси Р одинаковы и равны
1,0133- 10в Па. Парциальные давления газов в смеси Рог и Рцг состав-
составляют 0,668-105 и 0,334-105 Па соответственно. Вычислите AG, AS и
АН смешения.
Решение. Так как процесс смешения газов необратим, заменя-
заменяем его суммой обратимых процессов, протекающих в тех же условиях
(граничных): AG = AG! + AG2, где AGi и AG2 — изменения энергии
Гиббса азота и кислорода за счет изменения давления от Pif исх до
Pi в процессе смешения. Согласно уравнению (VII. 33)
AG1 = AGNi = RT\n (PNJP™*)\ AG2^AGOt = RT\n (POt/P'?*).
Поскольку исходные давления газов равны конечному давлению сме-
смеси, согласно уравнению Дальтона можно записать:
= _^=Л. N=o,33;
пИСХ
РК,
После подстановки чисел и вычислений получаем
AG = RT2,3 (lg*Nt + 21gxO2) =
= 8,314-2,3-298 (l? 0,33+21gO,67) = — 4800 Дж/моль.
Вычисляем AS по уравнению (VII.26):
dAG
\
=—R\nxN —2R \пх0 =16,10 Дж/(моль-К).
/р, х * г
AS= —
д Т
Для вычисления АН используем уравнения (VII.21):
15. Вычислите At/ и АЛ для реакции
Ag+o,5Cl2 = AgCl
при 298К и 1,0133-108 Па, если А//^ = — 127,159 кДж/моль,
Af 1954 Д/ А 5
р ^
AGf = — 109,54 кДж/моль и А/г = — 0,5.
Решение. Подставив числовые значения АН = — 127,159
кДж/моль; А/г = — 0,5; R = 8,314 Дж/(моль-К) в уравнение (VI.5),
получим
AU=—127,159 + 0,5-8,314-298 = — 125,92 кДж/моль.
83
Подставляя в уравнение (VII. 23) числовые значения, получаем
Д/4=—109,54+0,5-8,314.298-10-3= 108,27 кДж/моль.
16. Вычислите изменение AG0 для 1 моль NH;, в процессе изобари-
изобарического нагревания (Р = 1,013-10s Па) от Г, = 300 до Т% = 400 К,
если С% = const.
Решение. Для вычисления AG0 используем уравнение
(VI 1.29):
ДС = (С»-S°29e) D00 — 300) -Cj? 400-2,31g D00/300).
Подставив в это уравнение данные для аммиака при 298 К ([М.], табл. 6;
[С.Х., т.2]) S0 = 192,59 Дж/(моль-К); СР =35,65 Дж/(моль-К),
получаем
Д G»= C5,65— 192,50) D00 — 300) —35,65-400-2,31g D00/300) =
= —17;467 кДж/моль.
17. Определите АН0, At/0, АЛ0, AG°, AS0 при стандартных усло-
условиях и 298,2 К для реакции
СаН2+ 2НаО (ж) = СН„СООН (ж) + Н2
Решение. Данные энтропии и теплот образования веществ,
участвующих в реакции, выписываем из справочника:
Вещество
С2На(г)
НаО(ж)
СН3СООН(ж)
на
&Hft 298' Дж/моль
226,75-103
—285,84-103
—484,9-103
0
Дж/(моль-К)
200,8
69,96
159,8
130,6
— T&SO , Дж/моль
209,25-103
—334,46-103
' —576,64-103
0
Тепловой эффект реакции, согласно закону Гесса, равен
= (—484,9) —( — 2-285,84 + 226,75) 108= 139,97-10» Дж/моль;
Д ?/»„„ = Д Я»98-Р Д У = Д Я»в8-Дя ЯГ.
При расчете А/г учитывают стехиометрические коэффициенты толь-
только газообразных веществ: А/г = Пн, — «с,н, = 1 — 1=0. Следова-
Следовательно, AU$gg = А//§98- Энергия Гиббса для реакции равна
Д G»98 =2 (Д Gft 298)np.p-S (Д °f. «в)исх. в =
= ( — 576,64) —( — 2-334,46 + 209,25) 103= — 116,97-Ю3 Дж/моль,
Для данной реакции PAV = 0. Следовательно, AG[>98 = АЛ298-
Энтропия реакции равна
= A30,6+159,8) —B00,8+2.69,96) 10»=—50,32 Дж/(моль-К).
84
. 18. Рассчитайте AG° при 400 К для реакции V2N2 + 3/2Н2 = NH3,
если AG298= — 16,496 Дж/моль. Недостающие данные возьмите в
справочнике [М.]. Принять AS0 = const.
Решение. Изменение энергии Гиббса реакции рассчитываем
по уравнению (VII.25):
т
AG?-AG°98 = — AS» J dr.
298
Вычисляем AS0 по уравнению (VII.13):
J
298
S^ = 130,6 Дж/(моль-К);
тогда AS0 = — 99,15 Дж/(моль-К). После подстановки чисел и вы-
вычислений получаем
AG200 = —16,496+99,15-100-Ю-3 =—6,581 кДж/(моль-К).
19. Рассчитайте AG0 при 400 К для реакции V2N2 + 3/2 Н2 = NH3,
учитывая зависимость AS от температуры.
Решение. Вычисляем AG0 по методу Темкина — Шварцмана,
согласно которому, объединяя уравнения (VII.37), (VII.33), (VII.13а)
и (VI 1.32), получаем:
т т
дса
—L&t.
298
298
После подстановки степенных рядов АС% = / (Т) уравнение преобра-
преобразуется; множители, зависящие только от температуры, обозначают сим-
символами Мо, Mlt M2, М_2 и находят по справочнику:
Д G? = Д Я»98 — Т Д Site — Т (Д а Мо+\ Ь Afx + Д с М2+ Д с' М-я) .
Для расчета записываем необходимые данные: AH$9g = —46,19
кДж/моль [МЛ; AS§98 = —99,15 Дж/(моль-К); Мо = 0,0392;
Mi = 13; М_2 = — 3,65- Ю-7 ([М.], табл. 6, 19).
Газ
N,
н2
NH3
а
27,87
27,28
. 29,80
Ь-Ю3
4,27
3,26
25,48
с
—
С-10-5
0,502
—1,67
Аа = —25,05; АЬ = 18,46-10; Ас' = — 2,42-10Б. После подста-
подстановки чисел получаем
Д G%0 = — 46 190—400 (—99,15)—400 (—25,05-0,0392+ и
+ 18,46-Ю-3-13 + 0,502-106-3,65-10-') = —6,819 кДж/моль.
85
20. Вычислите изменение AG° для 1 моль NH3 в процессе изобари
ческого нагревания (Р = 1,013- 10в Па) от 7\ — 300 до Т2 = 400 К
если С% = f (T),
Решение. В общем случае зависимость теплоемкости от тем
пературы передается уравнением
Для индивидуального вещества это уравнение принимает вид
С°р = а + ЬТ + сТ2 или Ср = а + ЬТ + с' Г~2.
Получим уравнение, выражающее зависимость S — f G1)
2Г*
Г, Г, Г, Г
J.=a In Г—a In Тг + bT—b 7\ +— Г2 —— Г
+ г"
2 2Г2
Изменение энергии Гиббса с температурой определяется соотноше-
соотношением
^) S
2 , с ,
J
r,
ЬТ\ с Т\
-yi -^
+ _?_ II с-—|—с- /So _alnr1_6r1—с-1+ —
2 3 2Т2 2Г, I Г1 Х Х 2 2Т\
По справочнику [М.] находим a-29,80; 6 =25,48-10~3; с = 0;
с' = —1,о7-105 Дж/(моль-К). Тогда изменение" энергии Гиббса от
температуры будет равно
Gr2—G7-,= — 29,80-2,31g 400 + 29,80-300-2,31g 300+
+ 29,8-^00-29,8.300 - 2Ь'^ 4002+ JE^L 3002_
86
1,67-10»
2-400
2-300
_A92>5—29,8-2,31g 300—25,48-10-3-300 +
1,67-10»
+ 2-3002 )D0°—300) = — 71341,2 + 50928,2+ 11 910—8940—2040+1147—
— 209 + 279 —A92,5—169,5—7,44 + 0,928) 100=—19916 Дж/моль.
21. Рассчитайте давления, при которых графит и алмаз находятся
в равновесии для интервала температур 298—4000 К- При расчете ис-
используйте следующие данные для равновесия С (графит) =*± С (алмаз):
Т. К
298
1400
дя°.
Дж/моль
18 967,3
AS0,
Дж/(гК)
—3,364
—4,853
AG°,
Дж/моль
2903,7
ДСР,
Дж/(г-К)
2,602
0,418
&V, см3
— 1,92
— 1.90
Решение. Отрицательные значения AS0 и AV показывают, что
изменение температуры не благоприятствует, а повышение давления
благоприятствует превращению графита в алмаз. Для расчета равно-
равновесных давлений при высоких температурах используем зависимость
Д^превр = / (Р, Т). Для этого представим AGp,r как сумму трех сла-
слагаемых:
AGPT =AG°i + AG2+AG3,
где AG?-, — изменение энергии Гиббса при переходе графита в алмаз
при 1,0133-10в Па и температуре 7\; AG2 — изменение AG за счет
повышения температуры от Tt до Т2 при 1,0133-105 Па; AG3— измене-
изменение AG за счет повышения давления от 1,0133-106 Падо/3 при Т =
= Т2. Приведенные данные относятся кГ< 1400 К, поэтому прини-
принимаем 7\ = 1400 К и вычисляем AG?4oo- Для этого используем уравне-
уравнение (VII. 21);
A#°98 — 1400Д Sg98 — НООДаМ,
= ДС°_298; Af = 0,7595
AG»= 1896,6— 1400 ( — 3,364) — 14000,7595 (-2,602) =*9372,16 Дж/моль.
Значение AGp вычисляем по уравнению (VII.25), допустив, что
AGp = AGp, i4oo=const. Тогда
ДО2 = (ДСр—AS?400) (T —1400) — Дѻà 2,31g (Г/1400).
Значение AG3 вычисляем по» уравнению (VII.31), приняв AV =
= const = АУ1400. Тогда AG3 = AV(P — 1) 0,10133-10~2 и зависи-
зависимость AG = / (Р, Т) принимает вид
ДОЛ т = ДО?400+ (ДСД-ASUoo) (Г—1400) -
— ДСрГ 2,3 lg
1400
+ 0,10133-10-2 AV
87
После подстановки чисел получаем
&GPT =9372,16+4,435 (Г— 1400) + 0,962 Т lg Т —19,20-10-* Р.
При равновесии AGp,t = 0; это условие используется для расчета рав-
равновесного давления Р. Объединим результаты расчета AGt и Р:
Г, К 298 1400 2400 3400 4000
AG°, Дж .... 2903,7 9372,2 14346,9 19501,6 22656,4
Р- 10-е, па ... 15,3 49,35 75,7 102,90 119,57
Таким образом, алмаз более устойчив, чем графит, в области низ
ких температур и высоких давлений.
ЗАДАЧИ
1. Идеальная машина Карно, работающая в интервале температур
от1200 до 300 К, превращает в работу теплоту, равную 83,8 Дж. Какое
количество теплоты отдано резервуару при 200 К?
2. Какое количество теплоты будет превращено в работу идеаль-
идеальной машиной Карно, работающей при температуре между 200 и 100 К,
если она получит при 200 К столько же теплоты, сколько получает ма-
машина в задаче 1 при 300 К? Объясните причину различной величины
работы идеальной машины.
3. При начальной температуре 348,К 1 моль Н2 по циклу Карно сна-
сначала расширяется до двойного объема изотермически, затем расширя-
расширяется до учетверенного первоначального объема адиабатически, затем
сжимается изотермически до такого объема, чтобы при последующем
адиабатическом сжатии вернуться в исходное положение. Вычислите
работу каждой части цикла и КПД цикла (у = 1,4).
4. Вычислите изменение энтропии при нагревании 16 кг О2 от
273 до 373 К: 1) при постоянном объеме; 2) при постоянном давлении.
Считайте кислород идеальным газом.
5. Рассчитайте изменение энтропии при нагревании 58, 82 кг В2О3
от 298 до 700 К, теплоемкость В2О3 ѰР= 36,5525 + 106,345-10~3 Т
Дж/(моль-К).
6. Бромбензол кипит при 429,8 К, его теплота парообразования
при этой температуре 241,9-103 Дж/кг. Рассчитайте изменение энтро-
энтропии при испарении 10 кг бромбензола.
7. Под давлением 19,6-10* Па B кг/см2) нагревают 2-10~3м3 ар-
аргона до тех пор, пока объем его не увеличится до 12-10~3м3. Каково
изменение энтропии, если начальная температура 373 К?
8. Вычислите изменение энтропии при охлаждении 12-10~3 кг
A2 г) кислорода от 290 до 233 К и одновременном повышении давления
от 1,01 • 105 до 60,6-105 Па, если С% = 32,9 Дж/(моль-К).
88
9. Рассчитайте изменение энтропии в процессе смешения J3 кг
воды при 7\ = 353К с 10 кг воды при Т2 = 290 К. Теплоемкость
воды считать постоянной и равной 4,2 Дж/(моль-К).
10. Рассчитайте общее возрастание энтропии при смешении 100 х
X Ю-6 м3 кислорода с 400-10~6 м3 азота при 280 К и 1,01 • 10в Па, V =
= const.
11. Определите изменение энтропии при смешении 1 моль аргона,
взятого при ТАг = 293 К я Р°аг = 1,0133 • 105 Па с 2 моль азота, нахо-
находящегося при Рхг = 1,0133-105 Па и TNj = 323 К. Давление смеси
равно Рсы = 1,0133-105 Па. Принять аргон и азот идеальными газа-
газами, а теплоемкость каждого газа — величиной, постоянной в указан-
указанном интервале температур и равной для азота Су = 20,935
Дж/(моль-К), для аргона Су = 12,561 Дж/(моль-К).
12. В одном из сосудов одинаковой вместимости 3 м3 находится
28 кг азота, а в другом 32 кг кислорода при одной и той же температу-
температуре. Вычислите изменение энтропии при диффузии в результате сопри-
соприкосновения содержимого этих сосудов. Принять кислород и азот иде-
идеальными газами.
13. Твердый хлороводород претерпевает фазовый переход при
98, 36 К, при этом энтальпия изменяется на 1,19 кДж/моль. Рассчитай-
Рассчитайте молярную энтропию и внутреннюю энергию перехода. Этот обра-
образец приведен в контакт с бруском меди при термической изоляции от
окружающей среды. Каково изменение энтропии меди при фазовом
переходе и каково изменение энтропии окружающей среды?
14. Определите изменение энтропии, если 100-10~3 кг воды, взя-
взятой при 273 К, превращается в пар при 390 К- Удельная теплота ис-
испарения воды при 373 К равна 2263,8-103 Дж/кг; удельная теплоем-
теплоемкость жидкой воды 4,2 Дж/(кг-К); удельная теплоемкость пара при
постоянном давлении 2,0-103 Дж/(кг-К).
15. Молярная теплоемкость газообразного метана выражается
уравнением СР = 17,518 + 60,69-10~3 Т Дж/(моль-К). Стандартная
энтропия метана при 298 К равна 167,73 Дж/(моль-К)- Определите
энтропию 1 • 10~3 м3 метана при 800 К и 1,01 • 105 Па.
16. Рассчитайте энтропию этилового спирта в парах при 351 К и
5,05-103 Па, полагая АН = 40 950 Дж/моль. Зависимость молярной
¦теплоемкости от температуры выражается уравнением
Ср= 19,07 + 212,7-Ю-3 Т~ 108,6-10—в Г2 + 21,9 Г3.
17. Смешаны 2-10-3 м3 гелия и 2-10~3м3 аргона при 300 К и 1,01 х
X 105 Па; после изотермического смешения полученная газовая смесь
нагрета до 600 К при постоянном объеме. Вычислите общее возраста-
возрастание энтропии, учитывая, что Су — 12,6 Дж/(моль-К) и не зависит от
температуры.
18. Рассчитайте изменение энтропии в процессе Pb + 2AgCl —
=PbCl2+2Ag, если проведению этой реакции в гальваническом эле-
элементе при 298,2 К отвечает Е = 0,4900 В, а теплоты образования
РЬС12 и AgCl соответственно равны — 357 732 и — 126775,2 Дж/моль.
89
Чему равна энтропия свинца при 298,2 К, если S^gci = 96,23
Дж/(моль-К); Sft,ci, = 136,4 Дж/(моль-К); Sig=--42,68 Дж/(моль-К).
Вычислите изменение энтропии при проведении этой реакции в
изолированной системе.
19. Найдите изменение энтропии при изотермическом (Т = 353,2
К) сжатии паров бензола от Рх = 4,0532-10* Па до Р2 = 1,0133- 10в
Па с последующими конденсацией и охлаждением жидкого бензола до
Т = 333,2 К, если АЯпар = 30877,92 Дж/моль и (СР)с,н, =
= 1,80 Дж/(г-К). Пары бензола считать идеальным газом.
20. Определите стандартное изменение энтропии при 298 К для сле-
следующих реакций:
g A)
С + СО2 = 2СО B)
+ O2=2SO3 C)
D)
Для решения воспользоваться данными справочника [М.].
21. В термически изолированный сосуд, содержащий 5 кг воды при
303 К, внесли 1 кг снега при 263 К. Определите возрастание энтропии,
если теплота плавления снега 334,6-103 Дж/кг, теплоемкость снега
2,024-103 Дж/(кг-К), а теплоемкость воды 4,2-103 Дж/(кг-К).
22. Хлористоводородный метиламин существует в нескольких крис-
кристаллических модификациях. Вычислите теплоту фазового перехода
CH3NH2HC1, если это вещество при 220,4 К из {1-формы переходит в
у-форму; при 19,5 К Ср = 5,989 Дж/(моль-К); теплоемкость {1-формы
при 12 К Cl = 8,48 Дж/(моль-К) и
220,4
= fcjj din Г = 93,769 Дж/(мольК),
12
220,4
|'CLr) din Г= 100,3 Дж/(моль-К).
Гэ,5
При расчете учесть, что теплоемкость CH3NH2HC1 в интервале тем-
температур 0—20 К подчиняется уравнению Дебая СР — 464,5 (Т /0K.
23. Теплоемкость SO2 при различных температурах имеет следую-
следующие значения:
Г, К 15,20 25,67 34,87 47,16 60,85
Ср, Дж/(моль-К). 3,612 12,028 20,248 29,106 36,653
Г, К 76,98 98,30 120,37 140,92 162,03
Ср, Дж/(моль-К) 42,462 47,71 52,164 55,944 60,732
Г, К 192,03 201,74 240,09 260,86
Ср, Дж/(моль-К) 67,872 88,074 87,318 86,898
90
Для S02 Tnjl = 197,64 К, теплота плавления 7,4298-103 Дж/моль,
Ттп = 263,08 К, теплота испарения 24,9336-103 Дж/моль. Вычисли-
Вычислите энтропию газообразного SO2 при 263,08 К и 1,01-Ю6 Па.
24. Вычислите графически энтропию серебра при 473 К по следу-
следующим данным: ч
Г, К 13,5 17,0 26,9 35,0 39,1 42,9
Cv, ДжДмоль-К) 0,462 0,882 3,517 .6,657 8,039 9,295
Г, К 45,5 51,4 53,8 77,0 100 200 273
Cv, Дж/(моль-К) 10,174 11,756 12,435 17,04 19,62 23,446 24,158
Г, К 535 589
Су, Дж/(моль-К) 24,702 24,786
Сравните энтропию серебра при 298 К с величиной, приведенной,
в справочнике [М.].
25. Твердое тело при температуре плавления превращается в жид-
жидкость; при этом необратимо переносится некоторое количество теплоты
q. Правильно ли предположение, что для этого процесса AS = <?/Тпл?
Если это предположение правильное, то почему и на каком основа-
основании был отвергнут тот факт, что процесс необратим? Если предположе-
предположение ошибочно, то как можно получить правильное выражение для AS?
26. Два одинаковых сосуда (объем каждого сосуда V) соединены
трубкой с запорным краном. Материал, из которого собрана аппарату-
аппаратура, является совершенным термоизолятором. Сначала я моль одноатом-
одноатомного газа Ван-дер-Ваальса были помещены в один из сосудов при тем-
температуре То, а другой сосуд оставался пустым, затем запорный кран
был открыт до установления равновесия. Теплоемкость газа принять
равной Cv = 3/2 R, как для идеального газа. Определите Q, W и At/,
АЛ и AS через п, V, То, постоянные Ван-дер-Ваальса а и Ь и универ-
универсальные постоянные.
27. Почему при использовании энтропии в качестве критерия само-
самопроизвольности процесса необходимо предположение, что А5И.С =
= ASp.c — AS0Kp.cp, а для энергии Гиббса рассматривают только
AGp.c (но не AG = AGP.C — AG0KP.Cp)?
28. Вычислите изменение энергии Гиббса при сжатии 0,7-10~2 кг
N2 при 300 К и давлении от 5,05-104 до 3,031 • 106 Па (считать азот иде-
идеальным газом).
29. Рассчитайте AG, если температура кипения 351 К (пары спир-
спирта считать идеальным газом) для процессов:
С2Н„О (ж, Р=1,0110вПа) = С2Н6О(г, Р = 9,09-10* Па), A)
С2Н„О (ж, Р=1,0Ы0вПа) = С2Н6О (г, /» = 1,01-10sПа), B)
(ж, P=l,01105na) = C2HeO (г, Я= 1,1Ы0вПа). . C)
Какие выводы можно сделать о направлении процессов на основании
полученных результатов?
91
30. Вычислите АЛ и AG для 2 моль бензола при следующем изо-
изотермическом процессе испарения:
С,Нв (ж, Р=1,0133.10«Па)=С,Н,(г,Ра = 0,9120105Па).
Нормальная температура кипения Тн.т.к = 353,3 К.
31. При 268,2 К давление насыщенного пара твердого бензола
2279,8 Па, а над переохлажденным бензолом (жидким) 2639, 7 Па. Вы-
Вычислите изменение энергии Гиббса в процессе затвердевания 1 моль
переохлажденного бензола при указанной температуре (пары бензола
считать идеальным газом).
32. Теплота плавления льда при 273 К равна 334,7-103 Дж/кг.
Удельная теплоемкость воды 4,2-103 Дж/(кг-К), удельная теплоем-
теплоемкость льда 2,02-103 Дж/(кг-К). Определите AG, АН и AS при превра-
превращении 1 моль переохлажденной воды при 268 К в лед.
33. При 298 К энтропия ромбической серы 32,04 Дж/(моль-К), а
энтропия моноклинной серы 32,68 Дж/(моль-К). Теплоты сгорания
соответственно равны — 297 948 и —298 246 Дж/моль. Рассчитайте
AG для реакции S(poM6) = S(MoH). Пренебречь в первом приближении
различием плотностей ромбической и моноклинной серы. Какой вывод
можно сделать из полученного результата?
34. Вычислите W, АН, At/, AS, АЛ, AG для изотермического
сжатия 1 моль идеального одноатомного газа при 773 К и давлениях
от5,06-103до 1,01 -10* Па.
35. В изолированной системе при 273,16 К 1 моль газа обратимо и
изотермически расширяется от 1,0Ы07 до 1,01- 10е Па. Вычислите
значения W, Q, AU, АН, AS, AA и AG (считать газ идеальным): 1)
для газа и для всей изолированной системы в целом; 2) при свободном
расширении газа (расширение в вакууме необратимо), для газа и для
всей изолированной системы в целом. Результаты расчета представьт<
в виде таблицы.
36. При 298,2К и 1,01 • 10Б Па молярная энтропия алмаза равна
2,457, а графита 5,73 Дж/К. Теплота сгорания алмаза 387,9, а графита
382, кДж/моль. Плотности алмаза и графита соответственно равны
3,513-103 и 2,26-103 кг/м3. Рассчитайте АН0 перехода алмаза в графит
при 298,2 К и 1,01 • 10Б Па. Какая форма — графит или алмаз — явля-
является стабильной при этих условиях? Может ли быть получена другая
стабильная форма при повышении давления? Если да, то каким долж-
должно быть давление?
37. Определите стандартное изменение энергии Гиббса при 298 К
для реакции ZnO + СО = Zn + СО2. Величины АЯгэв и ASgge
найдите по справочнику [M.J.
38. Выведите зависимость AGf от Т для реакции
Значения А//!>98> AG<>98 и зависимости Ср = f (T) найдите по справоч-
справочнику [M.J.
92
39. Определите АН0, At/0, АЛ0, AG° и AS0 при 298,2 К Для реак-
реакции
С2На+2НаО (ж) + СНЯСООН (ж) + На
Необходимые данные возьмите из справочника [M.J.
40. Вычислите AG<>98 для реакции С (графит) + 2Н2 (г) = СН4(г),
причем АЩд8 определите из следующих термохимических уравне-
уравнений:
СН4 (г>+2Оа (г) = СОа (г)+2Н,0 (ж) + ДЯ»98,
СО2 (г) = С (графит) + Оа (г) -ДЯ°97,
2НаО(ж) = 2На (г) + Оа (г)-2ДЯ§98.
Значения ASgge вычислите с помощью постулата Планка.
41. Вычислите AG?oo для следующих реакций:
2СО2 = 2СО + Оа A); СО + НаО=СОа + На B);
2Н1 = На+12 C); СО + 2На = СНяОН D); 3Ha + Na = 2NH, E)
Величины АЯгэв, She и СР = / (Т) найдите по справочнику [M.J.
42. Определите изменение Ц, Н, S, А и G и конечные значения V и Т
при адиабатическом расширении до 1,013-ШБ Па Ы0~3 мя кислорода,
взятого при 298,2 К и 5,065-10* Па. Молярная теплоемкость кислорода
при постоянном давлении 20,63 Дж/(моль-К), молярная энтропия при
298,2 К и 1,013- 10s Па составляет 206 Дж/(моль-К).
43. Покажите, будет ли взаимодействовать этилен с водой при 298 К
и 1,013-10Б Па.
44. Покажите, будет ли взаимодействовать водород с кислородом
при 180 К и 1,013-10Б Па.
45. Покажите, будет ли взаимодействовать азот с водородом при
700 К и 1,013-10Б Па.
46. Для реакции Va N2 + 3/2 Н2 = NH3 дано:
= 43540+29,7 lgr+15,87.10-37T
Вычислите для этой реакции AS^e и сопоставьте полученное значение
с данными справочника [M.J.
47. Для реакции 2Н2 + S2 = 2H2S дано
Д0?= 168 300+30,35 Tig Г — 5,07-10-» Г».
Вычислите AS<>98 и сопоставьте с данными справочника [М,].
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Рассчитайте изменение энтропии при нагревании (охлаждении)
при постоянном давлении в интервале температур от 7\ до Т% g кг ве-
вещества А, если известны его температуры плавления и кипения, теп-
теплоемкости в твердом, жидком и газообразном состояниях, теплоты
плавления и испарения*.
№ ва-|
рианта|
1
2
3
4
5
6
7
8
9
10
И
12
13
14
15
16
17
18
19
20
21
Вещество А
Вг2 (бром)
Н2О (вода)
Hg (ртуть)
ССЦ (тетрахлорид углерода)
СН2О2 (муравьиная кислота)
СгНСЬОз (трихлоруксусная кислота)
СН4О (метанол)
С2Н3С1О2 (хлоруксусиая кислота)
С2Н4О2 (уксусная кислота)
СгН6О (этанол)
С3Н6О (ацетон)
С(Н10О (этиловый эфир)
С6Н,2 (н-пеитаи)
С6Н6 (бензол)
С6Н12 (циклогексаи)
С6Нц («-гексаи)
С7Н8 (толуол)
C6H6NHCH3 (п-метиланилин)
СюНв (нафталин)
СюН8О (а-нафтол)
СвЮю (о-ксилол)
е, кг
25
45
40
80
10
15
80
15
8
50
10
50
35
1
100
10
50
40
25
75
60
т„ к
373
421
193
323
393
160
303
423
423
373
173
143
323
383
373
173
423
423
328
579
423
т„ к
173
223
673
373
273
350
473
313
223
143
373
323
133
273
273
373
173
303
523
323
223
2. Определите AS, AU, АН, АА, AG при смешении VA м3 газа А
и Ув м3 газа В; Т = 298 К. Начальное давление газов равно 1,01 X
Х108 Па. Конечный объем смеси Vk=Va + Vq. Газы А и В и их объе-
объемы приведены в таблице на с. 95 (принять, что данные вещества под-
подчиняются законам идеальных газов).
3. Вычислите возрастание энтропии при смешении Уд м3 газа А
при температуре ТА и Ув м3 газа В при температуре Тв- Процесс осу-
осуществляется при V = const. Принять, что данные вещества подчиня-
подчиняются законам идеальных газов, начальное давление 1,013-105 Па, ко-
конечное давление смеси Р (табл. на с. 95).
* Средние теплоемкости веществ во всех агрегатных состояниях, теплоты
плавления и испарения иайдите по справочнику [С. X., т. 1]. Теплоты переходов
из одной модификации в другую не учитывать. При отсутствии данных принять,
что теплоемкости не зависят от температуры. Значения теплоемкостей, отсутст-
отсутствующие в справочной литературе, вычислить приближенно, использовав данные
справочника [М.].
94
№ вари-
аита
1
2
3
4
5
6
7
8
9
10
И
12
13
14
15
16
17
18
19
20
21
22
23
24
25
Газ А
н2
н2о
Не
Не
СН4
СН4
СО
со2
со2
со2
с2н,
с2нв
N2
N2
о2
о2
о2
F2
Ne
ci,
Cl,
Ar
Kr
Kr
Xe
VA-W.
M3
1
5
7
1
7
2
3,3
6
7
2
3
8
7
4
6
1
1
4
1
5
1
1
2
2
3
TA. К
303
388
275
277
268
298
268
280
258
303
268
313
280
293
333
333
303
281
278
243
Э08
276
276
278
263
Газ В
N2
o2
co2
H2
CaH2
Ne
C2He
N2
CO
CH4
Xe
CH4
Cl,
H2O
N2
Нг
Ar
Cl2
N2
N2
Ar
He
co2
CO
F2
va-io«,
M»
2
6
8
5
9
3
4
7
9
4
6
9
9
7
8
4
3
5
8
7
7
6
6
7
6
тв- К
290
310
290
303
288
283
300
310
278
289
296
289
299
383
297
290
298
292
296
278
292
29!
288
308
286
P, Па
101 325
101 325
131 722
303 975
172 252
303 975
70 927
141 855
40 530
810 060
206 450
151 987
192517
101 325
506 625
101 325
101 325
182 385
50 662
50 662
253 312
151 987
121 590
40 530
172 252
4. Вычислите AS для процессов перехода 1 моль газа А из состоя-
состояния 1 (Рх = 1,013- 10Б Па, Тг = 298 К) в состояние 2 (Р2, Т2).
вари- I
га |
SS
1
2
3
4
5
6
7
8
9
Газ А
на
н2о
Не
Не
СН4
СН
СО
со2
соа
*Па
1,33
13,0
133,0
1330
1,33
13,3
133
1330
1,3
т,, к
250
350
400
450
500
550
600
650
700
вари- 1
та 1
10
и
12
13
14
15
16
17
Газ А
соа
с«н«
сан,
N2
оа
о2
оа
Р.-Ю-2.
Па
13,33
133,30
1333
1,33
13,33
133,3
1333
1,33
т„ к
750
800
850
900
950
1000
250
350
вари-
та
18
19
20
21
22
23
24
25
Газ А
F2
Ne
Cl,
Cl2
Ar
Kr
Kr
Xe
Р.-Ю-2,
Па
13,33
133,3
1333
1,33
13,33
133,3
1333
1,33
тг, к
400
450
500
550
600
650
700
750
5. Определите изменение следующих функций: 1) AS и AG при
Р — const; 2) AS.и АЛ при нагревании газа на 100° (V = const).
Данные для газов см. в задаче 3.
6. Имеются два сосуда, изолированные от внешней среды. В одном
находится пх моль твердого, гц моль жидкого вещества А при темпера-
95
туре плавления, в другом пх моль твердого и п% моль жидкого вещества
В при температуре плавления. Оба сосуда приводятся в соприкоснове-
соприкосновение. Определите, в каком направлении будет проходить процесс в си-
системе; какое вещество — А или В — будет плавиться или затверде-
затвердевать. При каких условиях система придет в равновесие (Т, пъ я2)?
Вычислите изменение энтропии системы при переходе из исходного со-
состояния в равновесное. Обратим или необратим данный процесс? Для
расчета воспользуйтесь следующими данными и справочником [С.Х.].
N» Bapi
аита
1
2
3
4
5
6
7
8
9
10
И
12
13
Вещество
А
н2о
н2о
н2о
н2о
н2о
с„н6
с,н,
С.Н,
с6н,
с6н,
я-С6Н4(СН3J
С3НВ(ОНK
С3НВ(ОНK
В
СН3СООН
QHB(OHK
(СН2N
НСООН
C6H5NH2
Н2О
СН3СО ОН
(СН2N
С3НВ(ОНK
НСООН
СН3СООН
я-С,Н4(СН3J
(СН2K
«1
0,7
0,6
0,2
0,4
0,3
0,5
0,7
0,6
0,3
0,4
0,3
0,2
0,3
пг
0,3
0,4
0,8
0,6
0,7
0,5
0,3
0,4
0,7
0,6
0,7
0,8
0,7
я
№ Bapi
аита
14
15
16
17
18
19
20
21
22
23
24
25
Вещество
А
С3НВ(ОН3)
нсоон
нсоон
нсоон
СН3СООН
С3Н,СООН
С3Н,СООН
С3Н,СООН
с,н,соон
С3Н,СООН
QHjCOOH
С3Н7СООН
Б
СН3СООН
С3Н5(ОНK
СН3СООН
(СН2N
(СН2),
ra-QH4(CH3J
СН3СООН
(СН2N
нсоон
с6н6
С3Н5(ОНK
С6Н6СООН
«1
0,4
0,4
0,3
0,7
0,4
0,3
0,4
0,2
0,6
0,7
0,5
0,1
0,6
0,6
0,7
0,3
0,6
0,7
0,6
0,8
0,4
0,3
0,5
0,9
7. Вычислите W, AU, АН, AS для процессов перехода идеального
газа из состояния 1 (Ръ 7\) в состояние 2 (Р2, Т2):
1) при изотермическом расширении и изобарическом нагревании;
2) при изотермическом расширении и изохорическом нагревании;
3) при адиабатическом расширении и изобарическом нагревании;
4) при адиабатическом расширении и изохорическом нагревании.
№ ва-
варианта
1
2
3
4
5
Состояние 1
Р,, Па
101 325
101 325
84 060
121 590
151 987
Г,. К
273
273
285
298
280
Состояние 2
Р„ Па
506 625
60 795
40 530
70 927
81060
тг. к
540
5Б0
600
590
600
№ ва-
варианта
6
7
8
9
10
Состояние 1
Р„ Па
202 650
243 180
263 445
172 252
162 120
7\, К
300
300
285
298
300
Состояние 2
Р*. Па
121 590
162 120
182 385
162 120
81060
Тг. К
700
600
700
500
400
96
8. Рассчитайте АН, &U, AS, AG для следующих процессов:
№ вари-
варианта
Процесс, условия протекания
9
10
И
12
13
14
Н2О (ж, 273 К, Р=
Н2О (тв, 273 К, Р=
Н2О (ж, 263 К, Я=
Н2О (тв, 263 К, Р
Н2О (ж, 298 К, Р=
Н2О (ж, 373 К, Р=
1,01 105 Па) = Н2О (тв, 273 К, Р=1,01Ю5 Па)
1,0110s Па) = Н2О (тв, 263 К, Р=1,01-106 Па)
1.01-106 Па) = Н2О (ж, 273 К, Р=1,01105 Па)
= 1,01 - 10s Па)=Н2О (ж, 263 К, Р=1,0Ы05 Па)
1,01 - 10s Па)=Н2О (ж, 273 К, Р=1,01105 Па)
1,01 - 10s Па) = Н2О (г, 373 К, Р=1,01-106 Па)
К, Р=1,01-107 Па)=Идеальный газ B98 К,
Идеальный газ B98
Р=1,0Ы06Па)
Идеальный газ B98 К, Я=1,01105 Па) =Идеальный газ B98 К,
Р=1,01-106 Па)
Н2О (ж, 298 К- Р =
С6Н6 (ж, 353,1 К, Р
QHe (ж, 353,1 К, Р
С6Н6 (ж, 353,1 К, Р
Н2О (ж, 373 К, Р=
Н2О (ж, 298 К, Р=
--1,01 • 10» Па) = Н2О (г, 298 К.Р = 3,03-10' Па)
= 1,01105Па)=С6Н6 (г, 353,1 К, Я==1,01 105 Па)
= 1,01 - 10s Па)=С6Н6 (г, 353,1 К, ^=0,9-105 Па)
э=1,0Ы06 Па)=С6Н6 (г, 353,1 К, Р=1,1 105Па)
И.ОЫО5 Па) = Н2О (г, 373 К, Р=0,8-105 Па)
= 1.1 -10s Па) = Н2О (г, 298 К, Р=1,1-106 Па)
Из полученных результатов сделайте вывод о направлении процесса.
9. При переходе вещества (пары этого вещеста подчиняются зако-
законам идеального газа) из жидкого состояния в газообразное при темпера-
температуре Т и давлении 1,0Ы0в Па расходуется теплота парообразования.
Принять, что теплота испарения не зависит от температуры. Вычисли-
Вычислите изменение энтропии, энергии Гиббса, энергии Гельмгольца, внутрен-
внутренней энергии, энтальпии и работу расширения 1 моль вещества в этом
процессе. Определите изменение перечисленных функций, если пары
1 моль вещества А нагреваются от температуры Т до Т + 25°: а) изо-
хорически, б) изобарически. На сколько градусов поднялась бы тем-
температура вещества, если бы изменение внутренней энергии при перехо-
переходе из жидкого состояния в газообразное выражалось в повышении тем-
температуры? Необходимые данные возьмите из справочника [С. X., т. 1].
eg
-I
"Z.O.
1
2
3
4
5
6
7
8
9
т, к
20,4
283
293
202
189
190
236
81
194
Вещество
н2
н2о
HCN
H2S
HC1
HBr
HI
CO
co2
я н
n s
10
11
12
13
14
15
16
17
т. к
283
273
251
73
239,7
121 /
184
85
Вещество
cs2
C2N2
CNC1
N2
NH,
NO
N2O
o2
Я H
Я S
Ж a.
18
19
20
21
22
23
24
25
T, К
20
4
262
231
85
210
122
165
Вещество
Ne
He
so2
Cl2
F2
Br2
Kr
Xe
4 Зак. 767
97
ГЛАВА VIII
ЭЛЕМЕНТЫ СТАТИСТИЧЕСКОЙ ТЕРМОДИНАМИКИ
Основные уравнения и символы
[Г., с. 327—343; Д. с. 582—602]
Статистическая механика объясняет свойства веществ на основании
свойств составляющих эти вещества молекул атомов, ионов, молекул
комплексов и свободных радикалов. Как термодинамические свойств*!
веществ, так и их реакционную способность можно рассчитать с помочь
щью статистической механики при условии, что имеются сведения
о молекулах вещества.
Связь между энтропией и термодинамической вероятностью выра-
выражается уравнением Больцмана
S = k\nW. (VIII.1)
Термодинамическая вероятность системы W — число микросостоя;-1
ний, которые соответствуют данному макросостоянию при неизменном
равновесном состоянии, определяемом параметрами Р, Т и V.
Внутренняя энергия вещества складывается из энергии поступав
тельного ?/пост, вращательного t/Bp, внутреннего Um движения №
энергии молекулярного взаимодействия UB3;
Если же система находится в идеальном газообразном состоянии, то
энергия движения каждой молекулы складывается из составляющих:
вР + ?вн.вр
где ?пост—энергия поступательного движения молекулы; ?вр —
энергия вращательного движения молекулы; ?вн.Вр — энергия внут-
внутреннего вращения (энергия вращения одной группы атомов относи-,
тельно другой внутри молекулы); ?Кол — энергия колебательного
движения атомов в молекуле; ?Эл — энергия движения электронов'
в атомах; Еяд — энергия внутриядерного движения.
Внутренняя энергия вещества может быть записана так:
где Ni — число молекул на t-м энергетическом уровне; Et — энергия
t-ro энергетического уровня. Число молекул, заселяющих все энерге-
энергетические уровни для 1 моль вещества, равно постоянной Авогадро;
Определение внутренней энергии начинают с расчета энергии на нуле-
нулевом энергетическом уровне. Внутренняя энергия нулевого энергети-
ческрго уровня состоит из энергии внутриядерного движения, элект-
98
ронной энергии, энергии колебательного движения на нулевом коле-
колебательном квантовом уровне:
г + ^вр+^ви.вР + (^-^о)иол.
Заселенность каждого возможного энергетического уровня находят
по уравнению
.. .. ? fkT (F-=zE Е \ (VIII 7^
где No — заселенность нулевого энергетического уровня; Et — энер-
энергия t-ro энергетического уровня; k — константа Больцмана. Энергети-
Энергетическому уровню соответствует определенная энергия.
^ Некоторые энергетические уровни вырождены, т. е. энергетическо-
энергетическому уровню может соответствовать несколько различных состояний с од-
одной и той же энергией:
N
Nt = — g> e ~EtfkT, (VIII.8)
go
где g0 — степень вырождения нулевого энергетического уровня; gt—
степень вырождения t-ro энергетического уровня. Для двухатомных
молекул поступательное движение не вырождено, каждый вращатель-
вращательный уровень вырожден B/ + 1) раз, где / — вращательное квантовое
число; колебательное .движение не вырождено, каждый электронный
уровень вырожден BS + 1) раз, где S — суммарный спин молекулы.
Q учетом вырождения энергетических уровней
ЛГА= -^«- 2g,/</М\ (VIII.9)
где
Q = Sgie~E'/*r— (VIII. 10)
молекулярная сумма по состояниям (представляет собой сумму множи-
множителей Больцмана, записанных для всех возможных энергетических со-
состояний молекулы).
В развернутом виде сумма по состояниям для отдельной молекулы
(молекулярная сумма по состояниям) записывается так:
Сумму по состояниям можно записать несколько иначе, если при-
принять состояние молекулы с наиболее низкой энергией за нулевое, а со-
соответствующую энергию нулевой энергии Ео и вырожденность нулевого
уровня обозначить go'.
тогда суммирование может быть распространено на все возможные
энергетические состояния молекулы.
4* 99
Надо помнить, что для расчета термодинамических функций необ-
необходимо ввести более широкое понятие суммы по состояниям системы
(Z). Рассматривая состояние системы в целом как функцию состояния
составляющих ее частиц (молекул), необходимо различать два случая.
1. Свойства системы зависят от того, какие именно отдельные час-
частицы обладают теми или иными характеристиками, т. е. частицы счита-
считаются различимы одна от другой.
2. Свойства системы зависят только от числа частиц, распределен-
распределенных в группы по признаку обладания упомянутыми характеристика-
характеристиками. Сами же частицы в этом случае неразличимы.
Для различимых частиц. В системе, состоящей из N одинаковых
молекул, каждая молекула может обладать одинаковым рядом энер-
энергетических состояний.
Если обозначить индексами tj, i2, ..., iN состояния N индивидуаль-
индивидуальных частиц, то при отсутствии взаимодействия между ними энергия
системы выразится соотношением
При этом каждое заданное значение индексов tx, t2. *з> •••> 1"л/ соответ-
соответствовало бы отдельному состоянию системы в целом. Сумма по состоя-
состояниям системы запишется в виде
QN, (V1H.14)
где Et — энергетическое состояние молекулы; Q — молекулярная
сумма по состояниям.
При записи уравнения (VIII. 14) имеется в виду суммирование по
i отдельным уровням. В случае учета вырождения, когда несколько
уровней обладают одинаковой энергией, можно записать
(VHI.15)
где gi — степень вырождения (статистический вес).
Таким образом получено выражение для суммы по состояниям си-
системы, состоящей из N различных невзаимодействующих частиц (клас-
(классическая статистика Максвелла — Больцмана).
Для неразличимых частиц. Рассмотрим систему, состояние кото-
которой определяется просто указанием числа частиц, находящихся в воз-
возможных энергетических состояниях. В отличие от статистики Максвел-
Максвелла — Больцмана здесь безразлично, какие именно частицы находятся
в том или ином состоянии. Иными словами, частицы считаются нераз-
неразличимыми и здесь применяется квантовая статистика (Бозе — Эйнш-
Эйнштейна и Ферми — Дирака).
Сумму по состояниям идеального газа, состоящего из N одинаковых
молекул, можно представить в виде
тй(?«.'"'"Т-гг«"'- (vuue)
100
Здесь суммирование произведено по всем уровням энергии, а не по
каждому индивидуальному состоянию.
¦ Сравнивая выражения суммы по состояниям для систем различи-
различимых и неразличимых частиц, видим, что условие неразличимости час-
частиц ведет к появлению в сумме по состояниям системы дополнительного
множителя 1/ЛП. Сумму по состояниям системы называют также боль-
большой суммой по состояниям.
Для вычисления внутренней энергии системы продифференцируем
большую сумму по состояниям по температуре при постоянном объеме:
N n-i/ 6Q \
Умножаем производную на kT2 и делим на Z:
дТ jv \ дТ
+ J&_e-B./№ + ^+ Ml ,-*,'». . (V1IU8)
—EJkT
Согласно уравнению —~ = ——^ для 1 моль газа
\ дТ )v [ дТ ) \ дТ j
i
Внутреннюю энергию удобнее рассчитывать по отдельным состав-
составляющим видам энергии движения:
где и1<вр — составляющая внутренней энергии вращательного движе-
движения для одной степени свободы вращения.
Двухатомные и линейные многоатомные молекулы имеют две степе-
степени свободы вращательного движения, нелинейные многоатомные моле-
молекулы— три степени свободы вращательного движения. Колебатель-
Колебательная составляющая внутренней энергии
hlS>i С ЛО); С 0;
kT kT Т
-Z7Z , (VIII.22)
¦).
eh(o.C/kT _j
где 8; — приведенная температура.
Функция (—~~ ° ) для определенных значений 8г/Т для линейного
\ Т /кол
гармонического осциллятора рассчитана и приводится в таблицах тер-
термодинамических функций Эйнштейна. Для многоатомных молекул ко-
колебательную составляющую внутренней энергии рассчитывают для
101
каждой степени свободы колебательного движения отдельно и сумми-
суммируют по всем степеням свободы колебательного движения. Для двух-
двухатомных и линейных многоатомных молекул число колебательных сте-
степеней свободы
Зи-5, (VIII.23)
для нелинейных многоатомных молекул
/кол = 3«-6, (VIII. 24)
где п — число атомов в молекуле. При наличии степей свободы внут-
внутреннего вращения у многоатомных молекул для одной степени свободы
Теплоемкость Су для каждого вида движения рассчитывают по уравне-
уравнению
Для газов, состоящих из двухатомных молекул, изохорную тепло-
теплоемкость определяют по уравнению
. d ((/-(/,) = _d_ RTQ/T
v= AT AT 2'5RT+ ee'T-l - (VIII.27)
Теплоемкость удобнее рассчитывать по отдельным составляющим:
CV = CV, пост +Свр+С«ол. (VIII.28)
2.5«' (VIII.29)
?-\ ев/т
(VIII.30)
В таблицах термодинамических функций Эйнштейна для линейного
гармонического осциллятора функции
'(г)'"
(Viii.3i)
даются для определенных значений в/Т. Для многоатомных молекул
колебательная составляющая теплоемкости равна сумме Се по всем
степеням свободы колебательного движения. При наличии у многоатом-
многоатомной молекулы степеней свободы внутреннего вращения следует учиты-
учитывать еще Су, вн.вр — теплоемкость, приходящуюся на внутреннее
вращение. Согласно (VIII.21) и (VIII.27) имеем
CV.bh.bP=°.5*. (VIII.32>
102
Термодинамическая вероятность связана с суммой по состояниям
системы следующим уравнением:
(VIII.33)
Уравнение (VIII.33) содержит все основные сведения, которые термоди-
термодинамика может дать относительно свойств системы и обеспечить логиче-
логическую основу для всех термодинамических анализов. Сумма состояний
Z определяется энергетическими уравнениями, абсолютной температу-
температурой и общим числом частиц, составляющих систему; величина W оп-
определяется видом распределения энергии системы среди различных час-
частиц, т. е. числом частиц на каждом дискретном энергетическом уровне.
Из уравнения (VIII.33) следует
S = k {In Z + T(d In Z/dT)v]. (VIII.34)
Поступательная составляющая энтропии идеального газа может
быть вычислена с помощью определения Z для неразличимых частиц
и поступательной суммы по состояниям для молекулы идеального
газа. Для неразличимых частиц
Z = QN/N\. (VIII.35)
Используя приближенное соотношение Стерлинга для 1пМ при
больших N; \п N1 = N \п N — N, найдем
= iVInQ—NlnN+N. (VIII.36)
Подставляя уравнение (VIII.36) в уравнение (VIII. 34), получаем
S = Nk[\nQ—\nN+\-\-T(d\nQ/dT)v]. (VIII.37>
Поступательную сумму по состоянию для молекулы можно рассчи-
рассчитать по уравнению
. (VIII. 38)
Зная массу частиц, давление и температуру, получаем поступательную
составляющую молярной энтропии идеального газа.
Если объем выражать через Р и Т по уравнению Менделеева — Кла-
Клапейрона, то поступательная составляющая суммы состояний будет
BnkK'2.,.. . .
*¦*»/« e- (VIH-39>
V/
Натуральный логарифм поступательной составляющей суммы состоя-
состояний
Bпk) Re 3
in QnocT = 2,3026 Ig h3'N5/2 + — 2,3026
—2,3026 IgT—2,3026 lgP. (VIII.40)
103
Выражая все постоянные величины в международной системе единиц
(СИ), уравнение (VIII.40) принимает вид
InQnoCT = 3,4539 1gM + 5,7565 lg Г—2,3026 lgP + 8,8612. (VIII.41)
Вращательная составляющая молярной энтропии для жесткой линей-
линейной молекулы может быть получена с помощью определения Z для
различимых частиц и суммы состояний для жесткого ротатора.
Для различимых частиц Z = QN, поэтому для энтропии
S = N k [In Q-i-T (din Q/dT)v]. (VIII.42)
Сумма по состояниям для линейного жесткого ротатора имеет вид
где / — момент инерции молекулы; а — число симметрии; Ве — враща-
вращательная постоянная. Гомоядерные двухатомные молекулы имеют сте-
степень симметрии а = 2, гетероядерные — а = 1. После подстановки
в уравнение (VIII.43) постоянных величин и логарифмирования полу-
получим
lnQBp = 2,3026 lg/+2,3026 lg Г—2,3026 lg a+ 104,5265. (VIII.44)
Вращательная составляющая суммы состояний для многоатомных
молекул:
для сферически симметричного волчка
для симметричного волчка
8я* / 2я/,йГ \i/2 2я/„ кТ
для асимметричного волчка
(VHI.45)
(vni.46)
Логарифмируя уравнения (VIII.45) — (VIII.47) и подставляя постоян-
постоянные величины в СИ, получаем
а
+ 0,5-2,3026 lg(/A/B'c)+—lgr=0,5.2,3026Ig(/A/B/c
+ 3,4539 lg Г—2,3026 lg(T+157,3621. (VIII.48)
Произведение главных моментов инерции /д/в/с может быть рассчи-
рассчитано из векового уравнения (см. гл. VI)
+ 'хх 'ху — 'xz
(VIII.49)
104
Для многоатомных молекул, в которых имеются группы атомов, спо-
способные свободно вращаться одна относительно другой, составляющую
суммы состояний свободного внутреннего вращения вычисляют по
уравнению
/ 8я3Й77ппив \1/2 1
<?в„.вр=( j-T822-) V (VIII.50)
где а — число симметрии группы атомов; /прив — приведенный мо-
момент инерции внутреннего вращения;
/dPbb=/1/|/(/1 + /i). (VIII.51)
После подстановки в уравнение (VIII.51) постоянных величин, выра-
выражаемых в СИ, и логарифмирования получим
8п k
lgQBH.Bp = 0,5-2,3026 1g—^—+2,3026.0,5
+ 0,5-2,3026 lg/прив—2,3026 lga, (VIII.52)
In QBH.ep= 1,1513 lg/пРив—2,2026 lga+1,1513 lgT + 52,8356. (VIII.53)
Колебательная составляющая суммы состояний для двухатомных мо-
молекул, обладающих одной степенью свободы колебательного движе-
движения, равна
,,= ,_]-в/Г ' (VHI.64)
где сое — частота колебательного движения, м; 8 -^ характеристи-
характеристическая температура,
6= (Ac//s) toe= 1,4387- 10-а <»е. (VIII.55)
Колебательная составляющая суммы состояний для многоатомных мо-
молекул, обладающих несколькими степенями свободы колебательного
движения, равна:
Зп-6<5) •
<?нол= П T7F (VIII.56)
или
Зп-6E)
Подставляя это значение в уравнение для колебательной составляю-
составляющей энтропии, получаем
Г -^*r)]. (VIH.58)
Электронная составляющая суммы состояний для двухатомных моле-
молекул
(VIII.59)
105
где ?0,эл — вырождение нулевого электронного уровня; S — суммар-
суммарный спин электронов в молекуле. Терм электронного состояния моле-
молекулы определяется по уравнению A.7).
Энтропия электронной составляющей равна
(VII 1.60)
Энтропия газа выражается через сумму состояний:
(VIII.61)
Энтропию газа, состоящего из двухатомных молекул, следует рассчи-
рассчитывать как сумму энтропии составляющих:
57. = 5пост + 5Вр + 5Кол + '5эл- (VIII.62)
Для расчета поступательной составляющей энтропии SUOCT пред-
, л / dlnQ \ I dlnQ \ 1,50
варительно вычисляют In Q и производную —— 1: —— = .
Тогда
st. пост =*lnZnocT + l,5000* N. . (VI 11.63)
Объединив уравнения (VIII. 44) и (VIII.34), получаем выражение для
расчета вращательной составляющей энтропии:
Sr>ip=:/?lnQBp+/?. (VIII.64)
Колебательная составляющая энтропии находится по таблицам термо-
термодинамических функций Эйнштейна.
Энергия Гельмгольца равна
A— A0 = U — TS=— kTlnZ, (VIII,.65)
а энергия Гиббса
Так как энергия Гиббса равна
G=A+PV=U — TS + РУ, . (VIII.67)
то для 1 моль идеального газа получим
G—H0=A — Ut+RT=—kT\n Z+RT=— RTln — . (VIII.68)
Следует еще раз обратить внимание на то, что во всех формулах,
содержащих газовую постоянную R, расчет ведется на 1 моль, а при аб-
абсолютном нуле термодинамические потенциалы равны, т. е.
Ua=H0=At = Gt. (VIII.69)
106
Энтальпия равна
[(?fMEf)J
При расчете энтропии многоатомных молекул статистическим мето-
методом поступательную составляющую энтропии вычисляют аналогично
поступательной составляющей для двухатомных молекул. Вращатель-
Вращательную составляющую энтропии рассчитывают в зависимости от типа мо-
молекул. Колебательную составляющую энтропии для каждой степени
свободы колебательного движения находят по таблице термодинами-
термодинамических функций Эйнштейна и суммируют по всем колебательным сте-
степеням свободы. При наличии внутреннего вращения составляющую
энтропии SBK.Bp определяют по уравнению (VIII.64) для каждой сте-
степени свободы внутреннего вращения и затем составляющие суммируют.
Электронную составляющую энтропии вычисляют по уравнению
(VIII. 60).
Функцию [—=—-) рассчитывают по уравнению
(VIH.72
[ A~—Uo\
Функцию I——= 1 рассчитывают как сумму составляющих по
( AT-U0\
всем видам движения. Функцию = 1 вычисляют по уравне-
V ' /пост
нию (VIII.41) для газов, состоящих из двухатомных и многоатомных
/ Ат - Uo \
молекул. Функцию ( = 1 для двухатомных газов находят по
уравнению (VIII. 44), для многоатомных газов в зависимости от типа
молекул — по уравнениям (VIII.45), (VIII. 46) или (VIII.47). Функ-
/ Ат — Uo \
цию ——* 1 для двухатомных молекул находят по таблицам
\ I /кол J
термодинамических функций Эйнштейна. Для многоатомных молекул
следует сложить составляющие функции по всем степеням свободы ко-
i Ат — Ut \
лебательного движения. Функцию —~ 1 вычисляют по уравне-
нию (VIII. 59). Для многоатомных молекул при наличии степеней сво-
свободы внутреннего вращения функцию [ —] определяют по
\ Т /вн.вр
уравнению (VIII.53). Функцию ( ——— j вычисляют из функции
107
ЗАДАЧИ С РЕШЕНИЯМИ
1. Определите поступательную составляющую суммы состояний
СО при 1,0133-105 Па и 500 К.
Решение. После подстановки молекулярной массы, давления
и температуры в уравнение (VIII. 39) получим
1п(?пост = 3,4539 lg28 + 5,7565 lg 500 —2,3026 lg 1,0133.10» + 8,8612 =
= 4,9983+15,5365 — 11,5263+8,8612=17,8669,
lgQnocT = 7,7607, QnoCT = 5,764.10'.
2. Определите вращательную составляющую суммы состояний СО
при 500 К. Момент инерции СО равен 14,49- Ю7 кг-м2.
Решение. Вращательную составляющую суммы состояний оп-
определим по уравнению (VIII.44). Молекула СО гетероядерная, следова-
следовательно, а = 1:
In QBp = 2,3026 lg 14,49-10'+2,3026 lg 500—2,3026 lg 1 + 104,5265 = —
—105,5487—6,2146+104,5265 = 5,1924,
= 2,2550, QBp= 179,9.
3. Определите колебательную суммы состояний СО при 500 К, если
частота колебательного движения составляет 2,170-106 м.
Решение. Определим характеристическую температуру по
уравнению (VIII. 55):
8=1,4387-10-2-2,170.10* = 3123,
8 3123
Колебательную составляющую суммы состояний вычислим по уравне-
уравнению (VIII. 57):
!
4. Определите сумму состояний СО при 1,0133-10* Па и 500 К.
Решение. Электронная составляющая суммы состояний СО
равна единице (g0, эл = 1), так как суммарный спин электронов ра-
равен нулю. У двухатомных молекул только одна степень свободы коле-
колебательного движения и отсутствует внутреннее вращение. По урав-
уравнению (VIII. 60) получим
Q= 5,764.10'. 179,9-1,0019= 1,0389- 10»°.
5. Определите долю молекул СО, находящихся на вращательном
квантовом уровне / = 5, по отношению к нулевому колебательному
уровню при 500 К, QBp = 179,9.
Решение. Из соотношения Больцмана получим
., -В 5E+1)*Г
QBp
108
Ве найдем по уравнению (III.5):
F,6256- Ю-"*)» 5,5593- 10-«»
?~ 8яМ4,49-10-4' ~ 14,49-Ю-4' ~ ' ' ДЖ>
N. .-30-0, 3837-10-»V( 1.38054-1O~12-500)
., =11
179,9
е-О, 16879
179,9
- = 0,0518.
6. Определите долю молекул СО, находящихся на колебательном
квантовом уровне у=1 при 500 К, если ZKOn = 1,0019; сое — 2.170Х
X 10* м-1; и>ехе = 13,37-102 м-1.
Решение. Для этого рассчитываем показатель степени экспо-
экспоненты:
?кол _ 1,5/1сме—2,25/icmgxe _ 64,6537-Ю-—0,597510-и
kT ~ 1,38054-Ю-23-500 ~~ 6,927-101 =9> 3"
Долю молекул СО на колебательном уровне определяем по
уравнению Больцмана
Nk 2к0л 1.0019
7. Определите поступательную составляющую внутренней энергии
СО при 500 К.
Решение. Внутреннюю энергию поступательного движения
определяем по уравнению (VIII.20):
Упост = 1.5-8,3143-500 = 6,2357- Ю3 Дж/моль.
8. Определите вращательную составляющую внутренней энергии
СО при 500 К.
Решение. Вращательную составляющую внутренней энергии
находим по уравнению (VIII.21). Молекула СО обладает двумя степе-
степенями свободы вращательного движения:
(УЕр = 20,58,3143-500 = 4,1571-103 Дж/моль.
9. Определите колебательную составляющую внутренней энергии
СО при 500 К, если в/Т = 6,245.
Решение. Величину (———— |Кол найдем по таблице термо
динамических функций Эйнштейна как функцию в/Т [М.]:
в/Г 6,00 6,40
. . . 0,1243 0,1050
1Л
109
Линейной интерполяцией находим
0,40—0,0193
0,245-, * = 0
/ и—U, \
Г-^- =0,1243—0,0118 = 0,1125 Дж/(моль-К),
\ Т /кол
(U—Ut)KoB = 0,1125.500 = 0,0562- 10s Дж/моль.
10. Определите внутреннюю энергию СО при 500 К.
Решение. Электронная составляющая внутренней энергии
равна нулю, степеней свободы внутреннего вращения у молекулы СО
нет, отсюда
(U—и„)ш = 6,2357- 10s+4,1571- 10s+0,0562.10s = 10,4490-10» Дж/моль.
И. Определите поступательную составляющую теплоемкости СО
при 500 К при постоянном объеме.
Решение. Изохорную поступательную составляющую тепло-
теплоемкости СО определим по уравнению (VIII. 20):
Cv,nocT= 1,5-8,3143 = 12,4715 Дж>(моль-К).
12. Определите вращательную составляющую теплоемкости СО
при 500 К.
Решение. Вращательную составляющую теплоемкости рассчи-
рассчитаем по уравнению (VIII.21). Молекула СО обладает двумя степе-
степенями свободы вращательного движения, отсюда
С„р = 2.0,5-8,3143 = 8,3143 Дж/(моль-К)-
13. Определите колебательную составляющую теплоемкости СО
при 500 К, если в/Т = 6,245.
Решение. Колебательную составляющую теплоемкости най-
найдем по таблице термодинамических функций Эйнштейна для гар-
гармонического осциллятора:
в/т 6,00 6,40
СЕ . 0,745 0,569
Линейной интерполяцией находим
СЕ = 0,745—0,108 = 0,637 Дж/(моль-К).
14. Определите теплоемкость С?,5оо СО при 1,0133-105 Па и 500 К-
Решение. Согласно уравнениям Ср = Су + R и (VI.22) най-
дем
С% = 12,4715 + 8,3143+0,637 + 8,3143 = 29,7371 Дж/(моль-К).
15. Установите зависимость Cj> от температуры. Уравнение за-
зависимости представьте в виде Ср = а+ ЬТ + СР в диапазоне тем-
температур от 298 до 1000 К-
НО
Решение. По уравнению
вычислим Ср для температур от 298 до 1000 К через 100. Методом на-
наименьших квадратов рассчитаем коэффициенты а, Ь и с.
Т. К
298
300
400
500
600
700
800
900
1000
2
-ft
Ср=у
29,1297
29,1295
29,3073
29,7369
30,3511
31,0574
31,7541
32,4170
33,0056
246,7589
Г-300
100 =Х
0
1
2
3
4
5
6
7
28
X1
0
1
4
9
16
25
36
49
140
х'
0
1
8
27
64
125
216
343
784
X*
_
0
1
16
81
256
625
1296
2401
4676
XV
0
29,3073
59,4738
91,0533
124,2296
158,7705
194,5020
231,0392
888,3757
х'у
0
29,3073
118,9476
273,1599
496,9184
793,8525
1167,0120
1617,2744
4497,0721
Находим коэффициенты X, Y и Z сначала в уравнении типа
Из таблицы подставляем соответствующие значения в эту формулу и
получаем систему уравнений:
246,7589 = 8X+28K+140Z
888,3757 = 28Х + 140Г+784Z
4497,0721 = 140X+784K+4676Z
Решаем совместно два первых уравнения:
1727,3123 = 56*+ 196K+980Z
49,4391= 84У-+ 588Z
Решаем совместно два последних уравнения:
4441,8785 = 140Х + 700Y + 3920Z
4497,0721 = 140Х+784K+4676Z
55,1936= 84K + 756Z
49,4391 = 84K+588Z
55,1936 = 847+7562
Z= 0,03425
5,7545= 168Z
49,4391—588.0.03425
Y =
84
¦= 0,3488,
til
246,7589—140-0,03525—28-0,3488 ,
= 29,0247+0,3488*+0,03425жа = 29,0247+
+ 0,0034887"—3-0,3488+0.03425Г2-10~4 —600-10~4Г—9.
Окончательно уравнение зависимости имеет вид:
С? = 28, ?866 +1,433- 10-3Г + 2,426- 10~вГ2.
16. Определите внутреннюю энергию метанола при 1,0133-106 Па
и 500К.
Решение. Расчет поступательной составляющей внутренней
энергии многоатомных молекул не отличается от расчета для двухатом-
двухатомных молекул. Согласно уравнению (VIII.20)
(/пОСТ=1,5/?Г= 1,5-8,3143-500 = 6,2357.10» Дж/моль.
Молекула метанола имеет три степени свободы вращательного движе-
движения. Следовательно, вращательная составляющая внутренней энер-
энергии будет
(Увр = 3-0,5ЯГ= 1,5-8,3143-500 = 6,2357-103 Дж/моль.
Молекула метанола обладает одной степенью свободы внутреннего
вращения. Составляющую внутренней энергии внутреннего вращения
определяем по уравнению (VIII.25):
^вн.вр = 0,5-8,3143-500 = 2,0785-103 Дж/моль.
Для определения колебательной составляющей внутренней энергии не-
необходимо суммировать 11 слагаемых, которые находим по экспери-
экспериментальным значениям частот колебаний и вырождений колебаний в
таблицах термодинамических функций Эйнштейна для гармоническо-
гармонического осциллятора:
0)е ¦ 10—5, м-'
3,683
2,976
2,845
1,455
1,340
1,116
1,031
Вырождение11
2
2
2
е/5оо
10,598
8,564
8,187
4,187
3,856
3,211
2,967
С и~и° \
Л т )•
Дж/(моль-К)
0,0025
0,0145
0,0193
0,537
0,693
1,121
. 1,338
Дж/(моль-К)
.0,025'
0,118
0,158
2,285
2,730
3,751
4,186
• В отличне от двухатомных молекул, у которых колебательное движение атомов не
вырождено, у многоатомных молекул при наличии симметрии возможно совпадение не-
нескольких частот по величине. Такие колебания называются вырожденными:
500=6,7281-500=3,3640-103 Дж/моль.
112
У веществ, состоящих из многоатомных молекул, в отличие от ве-
веществ, состоящих из двухатомных молекул, колебательная составля-
составляющая внутренней 'энергии вносит заметный вклад в общую величину
внутренней энергии даже при невысоких температурах:
((У—(У0M00 = 6,2357-103 + 6,2357-103+2,0785-103 +
+ 3,3640-Ю3= 17,9139-103 Дж/моль.
17.Определите изобарную теплоемкость метанола при 1,0133•1О6
Па и 500 К.
Решение. Поступательную составляющую теплоемкости для
многоатомных молекул рассчитываем по уравнению (VII 1.26):
Супост= 1,5-8,3143=12,4715 Дж/(моль-К)-
Молекула метанола имеет три степени свободы вращательного движе-
движения, следовательно, вращательная составляющая теплоемкости будет
CVt Bp =1,5-8,3143=12,4715 Дж/(моль-К).
Молекула метанола имеет одну степень свободы внутреннего вращения,
следовательно, составляющая теплоемкости внутреннего вращения бу-
будет
CV, вн.вр =0,5-8,3143 = 4,1571 Дж/(моль-К) ¦
Колебательную составляющую теплоемкости получим суммированием
11 слагаемых, которые находим по таблице термодинамических функ-
функций Эйнштейна для каждого значения б/Г. Величины 8/Т при-
приведены в таблице на с. 112, в которой также приведены значения Се
для всех 11 степеней свободы колебательного движения:
и
cv кол = 2 се =Э3,578 Дж/(моль-К).
/ = 1 '
Изохорная теплоемкость будет равна сумме составляющих:
Cv< 500 = 12,4715+12,4715+4,1571 + 23,578=52,678 Дж/(моль-К).
Изобарная теплоемкость
С?>5оо= 52,678 + 8,314 = 60,992 Дж/(моль-К).
18. Определите функцию (Н° — #0M00 Для метанола, если (U —
— ^o)soo = 17,9139-103 Дж/моль.
Решение. Для идеального газа, согласно уравнению (VI.3),
(Яв-Я§) = 17,9139-103 + 8,3143-500 = 22,0711-103 Дж/моль.
19. Определите энтропию СО при 1,0133-105 Па и 500 К-
Решение. Энтропию определяем по уравнению (VIII.61). По
уравнению (VIII.40) находим In Qn0CT> отсюда находим производную —
она равна 1,5 \1Т. Тогда по уравнению (VIII.61) получаем
C,4539 lg 28+5,7565 lg 500—2,3026 lg 1,0133-Ю6 +
+ 8,8612+1,5000)8,3143=161,0472 Дж/(моль-К) •
113
По уравнению (VIII.43) рассчитаем In ZBp и производную (—п вр
т V дТ
Тогда
5вр= B,3026 Ig 14,49-10-4'+2,3026 lg 500+104,5265—
—2,3 Ig 2+1,0000) 8,3143 = 51,4854 Дж/(мольК).
Колебательную составляющую энтропии находим на основании в/Г
по таблице термодинамических функций Эйнштейна для гармоническо-
гармонического осциллятора:
в/Г
6,00
0,146
6,40
0,100
Линейной интерполяцией находим
0,40—0,046
0,245—х
л: = 0,028.
Следовательно, SKOa = 0,118 Дж/(моль-К). Электронная составляю-
составляющая энтропии СО равна нулю, так как суммарный спин электроиов ра-
равен нулю. Энтропия СО равна сумме составляющих поступательной,
вращательной и колебательной энтропии:
5»0„ = 161,0472+51,4854+0,118 = 212,6506 Дж/(моль-К).
20. Определите энтропию метанола при 1,0133-10* Па и 500 К.
Решение. Энтропию метанола определяем суммированием со-
составляющих энтропии поступательной, вращательной, внутреннего
вращения и колебательной.
Рис. 12. Проекция и геометрические параметры молекулы
СН3ОН для вычисления произведений моментов инерции
Поступательную составляющую энтропии вычисляем по уравнению
(VIII. 34), предварительно определив In фПост> и затем находим
производную ( а1п9пост \ . Тогда
5Пос»= C,4539 lg 32+5,7565 lg 500—2,3026 Ig 1,0133-10» +
+ 8,8612+1,5000) 8,3143=162,7142 Дж/(моль-К).
114
Вращательную составляющую энтропии рассчитываем по уравнению
(VIII.34). Для вычисления вращательиой суммы состояний необходи-
необходимо знать произведение главных моментов инерции. Для определения
произведения главных моментов инерции необходимые величины све-
сведем в таблицу. Выберем за начало координат ядро атома углерода.
Ось х совпадает с направлением связи С — О. На рис. 12 показаны
равновесные межъядерные расстояния и углы между направлениями
связей и представлены две проекции в плоскостях хг и уг.
Атом
С
О
Нх
а
н4
m-IO". кг
1,992
2,656
0,166
0,166
0,166
0,166
х-10", м
0
1,43
1,43+0,96 cos 70°= 1,76
1,11 cos 109°28'=—0,37
-0,37.
-0,37
у-101#, м
0
0
0
0
1,11 cos
240°=—0,96
0,96
Z-10", М
0
0
0,96 sin 70°=0,90
1,11 sin 70в32'= 1,05
1,11 sin 240°=—0,56
-0,56
/П|=5,312-10-а« кг.
Атом
с
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
о
2,045
0
0
0
0
0
3,798
0
0
0
0
0
5,432
5,432
0
н,
3,098
0
0,810
0
1,584
0
0,292
0
0,149
0
0,263
0
0,514
0,649
0,134
н,
0,137
0
1,103
0
—0,389
0
—0,061
0
0,174
0
—0,065
0
0,023
0,206
0,183
Н,
0,137
0,922
0,314
0,355
0,207
0,538
—0,061
—0,159
—0,093
0,059
0,034
0,089
0,176
0,075
0,205
н.
0,137
0,922
0,314
—0,355
0,207
—0,538
—0,061
0,159
—0,093
—0,059
0,034
—0,089
0,176
0,075
0,205
хМО
„2.Ю2О
MO*»
zMO
х«/-10ао
хг- Ю20
уг-10ао
lO3
mxlO
mj/-10s»
тг- 10s»
тху-10«
тхг-104«
туг-10й
B+J/2)
3,907
0
0,137
0
0,266
0
6,321
6,437
0,727
Решение векового уравнения (см. гл. IV) дает следующие моменты
инерции:
0+0 019-10~7*
/,* = 0,727-10-4«— ~—' =0,727-10-"—0,004-10-"= 0,723-Ю-4»;
5,312-10-ав
/„„ = 6,437-10-*«—
15,265-10-»+0,019-10-'*
5,312-10-*
= 6,437-10-4«—2,877-10" = 3,560- Ю-4»;
115
15,265-10-"+0
5,312-10"а
О
1гг = 6,321 -10-4»— ' ^_J~ =6,321-Ю-4»—2,874-10-4° = 3,447-
\
5,312-10-ав
==0;
/жг = 0,266-10"»8 — ' 3 ' ^- = 0,266-10-48—0,101 -10-48 = 0,165- 10в;
0
yz= ~ 5,312-10-'2 = "
Произведение главных моментов инерции будет равно:
'а'в 'с = ^хх (lyy Izz — hz lyz)—?xy (Ixy ^zz+ lyz Ixz) —
/A /B /c = 0,723- 10-4e C,560-10-46-3,447- 10e—0-0) —
—0,165- 10-4e @-0+3,560- 10e-0,165- 10-»e) =
==0,723-3,560-3,447-Ю-"8—0,165-3,560-0,165-10-138 = 8,775-1038.
Подставляем произведение главных моментов инерции в уравнение
(VIII.43) и находим In QBP и ( dlnQ™ ) . Молекула СН3ОН несим-
\ дТ Iv
метричная. Подставив полученные значения в (VIII.34), получим
5Вр= A,1513 lg 8,775-1038+3,4539 lg 500—2,3026 lg 1 +
+ 157,3621 + 1,5000)8,3143=10,3907-8,3143 = 86,3914 Дж/(моль-К).
Составляющую энтропии внутреннего вращения рассчитываем по урав-
уравнению (VIII.42). В молекуле метанола группа атомов СН 3 вращает -
ся относительно группы ОН. Можно считать, что вращение этих групп
происходит свободно, так как С — О обладает а-связью. Отсюда энер-
энергия вращения превышает энергию потенциального барьера. Найдем
приведенный момент инерции:
^Нз^З^н Cc-Hsin70°3l'J =
= 3-0,166-10-«A,11.10-100,943J = 5,454-10-4' кг-м2;
/он = 1-0,166- 10в @,96- Ю-10 sin 70°)* =
= 1 -0,166- Ю-2» @,96-0,940-10-1°J= 1,351 ¦ 10' кг/м";
5,454-10-«-1,351 -Ю-47 , „ , л
/ 1083107 ""'
Число симметрии равно произведению степени симметрии групп СНЭ
и ОН: а = 3-1 — 3. Тогда
5BH.Bp=(l,1513 1g 1,083-Ю-4'—2,3026 lg 3+1,1513 lg 500+
+ 52,8356+0,5000) 8,3143= @,7731+0,5000) 8,3143 =
= 1,2731 -8,3143 = 10,5849 Дж/(моль-К)-
116
Колебательную составляющую энтропии находим по значению 8/Т
для всех 11 степеней свободы колебательного движения. Значения ча-
частот колебаний, вырождений, 6/Т и найденные в таблице термодинами-
термодинамических функций Эйнштейна для гармонического осциллятора энтро-
энтропии приведены ниже:
сое - Ю-5, м-1 . . 3,683 2,976 2,845 1,455 1,340 1,166 1,034 1,031
Вырождение ... 2 2 2
в/Г . ... 10,598 8,564 8,187 4,187 3,856 3,211 2,975 2,967
5Кол ...-..' 0,000 0,015 0,021 0,663 0,872 1,465 1,767 1,779
/=11
5кол= S 5г, кол= 8,725 Дж/(моль-К).
i=l
Суммированием составляющих энтропии получим энтропию при за-
заданных условиях:
S°oo= 162,7142+86,3914 + 10,5849 + 8,725 = 268,416 Дж/(моль-К).
Электронная составляющая энтропии равна нулю, так как суммарный
спин электронов равен нулю.
21. Определите функцию -^ для метанола при 500 К и
1,0133-10» Па.
Решение. Для определения функции ( ———) вычислим сна-
/ Ат — Uo \
чала функцию I—= I по уравнению (VII 1.65), суммируя все со-
составляющие по всем 18 степеням свободы движения:
( T~~U" ) =—8,3143 C,4539 lg32 + 5,7565 lg500—
\ Т /пост
— 2,3026 lg 1,0133-105+8,8612)=— 8,3143-18,0704= —150,2427 Дж/(моль-К);
(¦ т~ ") =—8,3143A,1513 lg8,775-10-138 + 3,4539 lg500—
V Л /вр
—2,3026 lg 1 + 157,3621)=— 8,3143-8,8907= — 73,9199 Дж/(моль-К);
( т~ " ) = -8,3143 A,1513 lg 1,083-10-«-2,3026 Ig3 +
\ Т /ви.вр
+ 1,1513 lg 500+52,8356) = -8,3143-0,7731 = —6,4278 Дж/(моль-К) -
д ц
Колебательную составляющую функции ——<—^- находим по значе-
значениям 8/Т для всех степеней свободы колебательных движений:
сйе-10-s, м-1 3,683 2,976 2,845 1,455 1,340 1,116 1,034 1,031
в/Г 10,598 8,564 8,187 4,187 3,856 3,211 2,975 2,967
Вырождение 2 2 2
( Т~ ° ) 0,000 0,000 0,0010,128 0,179 0,343 0,438 0,411
\ Т /кол
117
Тогда
( At~U° ) =-2,001 Дж/{моль.К);
)
Т /кол
»^-150,2427-73,9199-6,4278-2,001 = -232,591 Дж/(моль-К);
/ Ggoo— Щ j = _232,591+8,3143=—224,277 Дж/(моль-К).
22. Определите функцию (Я §оо — #298) Для метанола.
Решение. Воспользуемся табличным значением величины
(#298 — #8) из справочника [М.]: (#298 — #8) = 11,435 кДж/моль.
Тогда
—11,435- 10s= 10,636- 10s Дж/моль.
23. Система состоит из десяти частиц, распределенных на четырех
энергетических уровнях, имеющих относительные величины энергии
1, 2, 3 и 4 и общую относительную энергию, равную 20. Определите,
какое из различных распределений может быть осуществлено наиболь-
наибольшим числом способов.
Решение. Одно возможное распределение десяти частиц на
энергетических уровнях таково, что все десять частиц располага-
располагаются на энергетическом уровне 2. В этом случае общая энергия систе-
системы составит 20.
Согласно уравнению
получим только один способ, которым это распределение можно осу-
осуществить, т. е. обмен частиц на том же уровне не дает нового состоя-
состояния системы.
Второе распределение может быть получено перемещением одной
частицы с уровня 2 на уровень 1 и другой частицы с уровня 2 на уровень
3. Общая энергия равна 20. Расчет по уравнению дает значение W,
равное 90.
Таким образом, это распределение можно осуществить 90 различ-
различными способами.
Если в первоначальном распределении две частицы перемещаются с
уровня 2 на уровень 1, а две другие частицы—с уровня 2 на уровень
3, то общая энергия составит 20. При этом W равно 1260. При пере-
перемещении трех частиц с уровня 2 на уровень 1 и трех частиц с уровня 2
на уровень 3 общая энергия останется равной 20, но W возрастет до
4200.
Для этой системы значения W могут быть вычислены для всех рас-
распределений, имеющих общую энергию 20. Результаты приведены в таб-
таблице.
118
Распределение частиц дли #=10, ?=4 и общей энергии Е--
=20
№ п/п
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
0
1
5
2
6
6
2
4
4
3
3
5
5
4
Уровни
2
10
8
0
7
1
0
6
2
4
4
5
1
2
3
энергии
3
0
1
5
0
0
2
2
4
0
3
1
3
1
2
4
0
0
0
1
3
2
0
0
2
0
1
1
2
I
V7
1
90
252
360
840
1260
1260
3150
3150
4200
5040
5040
7560
12 600
Число со-
состояний, %
0,2
0,6
0,8
1,9
2,8
2,8
7,0
7,0
9,4
11,2
11,2
17,0
28,1
В задаче отмечено 44803 способа осуществления заданных условий.
Из них около 28 % принадлежит одному конкретному распределению.
ЗАДАЧИ
1. Определите поступательную составляющую суммы состояний F2
при 298 К и 1,0133-10* Па.
2. Определите вращательную составляющую суммы состояний F2
прн 298 К. Необходимые данные возьмите нз справочника [М.].
3. Определите колебательную составляющую суммы состояний при
298 К. Необходимые данные возьмите из справочника [М.].
4. Определите электронную составляющую суммы состояний F2.
Необходимые данные возьмите из справочника [М.].
5. Определите сумму состояний F2 при 298 К и 1,0133-105 Па. Не-
Необходимые данные возьмите из справочника [М.].
6. Определите сумму состояний F2 при 298 К и 0,5- 10е Па. Необхо-
Необходимые величины возьмите из справочника [М.].
7. Определите сумму состояний F2 при 1000 К н 1,0133- 10е Па.
Необходимые данные возьмите из справочника [М.].
8. Определите сумму состояний HI при 100 К и 1,0133- 10е Па. Не-
Необходимые данные возьмите из справочника [М.].
9. Определите поступательную составляющую суммы состояний
метана при 1000 К н 1,0133-108 Па. Необходимые данные возьмите из
справочника [М.].
10. Определите вращательную составляющую суммы состояний
метана при 1000 К и 1,0133-108 Па. Необходимые данные возьмите из
справочника [М.].
11. Определите колебательную составляющую суммы состояний
метана при 1000 К, если вырождения колебаний vs ~ I, ves ~Ъ
119
6g — 2 и баз = 3. Необходимые частоты колебаний возьмите из спра-
справочника [М.1.
12. Определите электронную составляющую'суммы состояний ме-
метана при 1000 К.
13. Определите сумму состояний метана при 1000 К и 1,0133 х
X 105 Па, Необходимые данные возьмите из справочника [М.].
14. Определите сумму состояний СН3Вг при 298 К и 1,0133-105 Па,
если межъядеркые расстояния С — Н 1,09; С — Вг 1,91 • 10~8 см; углы
между направлениями химических связей < HCN 111°, < ВгСН
107°57'. Числе симметрии равно 3. Частоты колебаний и вырождения
(указаны в скобках): 618 A), 953 B), 1290 A), 1453 B), 2965 A) и 3082
B). Вырождение нулевого электронного уровня равно единице.
15. Определите поступательную составляющую внутренней энер-
энергии О2 при 1000 К.
16. Определите вращательную составляющую внутренней энергии
О2 при 1000 К.
17. Определите колебательную составляющую внутренней энергии
О2 при 1000 К. Необходимые данные возьмите из справочника [М.].
18. Определите внутреннюю энергию (U — Uo) и энтальпию
(Н° — Н°о) О2 при 100С К и 1,0133-105 Па. Необходимые данные возь-
возьмите из справочника IM.].
19. Определите внутреннюю энергию и энтальпию О2 при 1000 К
и 1,0133- iO5 Па. Рассчитаете (Я0 — //<>98)iooo- Необходимые данные
возьмите из спрвочника [М.]. Результаты сопоставьте со справочной
величиной [М.].
20. Определите теплоемкость С% кислорода при 1,0133-105 Па и
и 298 и 1000 К. Необходимые данные возьмите из справочника [М.].
Результаты сопоставьте со спрасочными данными [М.].
21. Определите внутреннюю энергию и энтальпию метана при 298 К
и 1,0133-105 Па. Необходимые данные возьмите из справочника [М.].
Полученные величины сопоставьте со справочными данными [М.].
22. Определите внутреннюю энергию и энтальпию СН3Вг при
298 К и 1,0133- 10s Па. Частоты колебаний (см) и вырождения (ука-
(указаны в скобках): 618 A), 953 B), 1290 {1), 1453 B), 2965 A), 3082 B).
23. Определите поступательную составляющую изохорной теплоем-
теплоемкости метана при 1000 К-
24. Определите вращательную составляющую теплоемкости метана
при 1000 К-
25. Определите колебательную составляющую теплоемкости мета-
метана при 1000 К. Значения волновых чисел колебательного движения в
молекуле метана возьмите из справочника [М.]. Вырождения колеба-
колебаний vs ~ 1; vM- - 3; б, - 2; 8as ~ 3.
26. Определите теплоемкость Ср метана при 1000, К, если вырож-
вырождения колебаний v3 ~1; vas ~ 3; 63 ~ 2; 6as ~ 3. Значения волновых
чисел колебаний в молекуле метана возьмите из справочника [М.].
27. Определите теплоемкость метана Ср при 298 К. Необходимые
частоты колебаний возьмите из справочника [М.]. Вырождения коле-
120
баний v3 ~ 1; vas ~ 3; 6S ~ 2; 6as ~ 3. Полученную величину сопо-
сопоставьте со справочной [М.].
28*. Определите теплоемкость СС14 в состоянии идеального газа
в интервале температур от 300 до 1000 К через 100 К- Необходимые
данные о частотах колебаний и вырождения возьмите из справочника
[М.]. По методу наименьших квадратов выведите зависимость теплоем-
теплоемкости СС14 от температуры в виде уравнения Ср = а + ЬТ + сТг.
29. Вычислите теплоемкость Ср водяного пара при 1000 К. Необхо-
Необходимые данные о частотах колебаний возьмите из справочника [М.].
30. Вычислите теплоемкость С% диоксида углерода при 1000 К.
Необходимые данные о частотах колебаний возьмите из справочника
[М.].
31. Определите, сколькими способам можно расположить систему
из девяти различных частиц в трех сосудах так, чтобы в первом сосу-
сосуде было две, во втором — три и в третьем — четыре частицы.
32. Вычислите, при какой температуре атомная, энтропия аргона
при 1,0133-105 Па будет равна 179,9 Дж/(моль-К), если электронная
составляющая суммы состояний аргона равна единице.
33. Вычислите, при каком давлении атомная энтропия атомарного
иода при 2000 К равна 208, 718 Дж/(моль-К), если статистический вес
нулевого электронного уровня равен четырем.
34. Оксид углерода и азот — двухатомные газы с одинаковыми мо-
молекулярными массами. При 298 К и 1,0133- Ю5 Па они имеют теплоем-
теплоемкости 29,15 и 29,10 Дж/(моль-К) соответственно. Межъядерные рас-
расстояния С — О и N — N 1,128-Ю-10 и 1,098-Ю-10 м. Энтропия СО
197,4, а N2 191,5 Дж/(моль-К). Объясните столь значительное рас-
расхождение значений энтропии.
35. СО2 и SO2 — трехатомные газы. Колебательная составляющая
теплоемкости СО2 при 300 К больше колебательной составляющей теп-
теплоемкости SO2 при той же температуре на 1,47 Дж/(моль- К). Теплоем-
Теплоемкости этих газов Ср при 300 К: СО2 37,13, SO2 39, 87 Дж/(моль-К).
Сделайте вывод о структуре молекул этих газов.
36. Вычислите атомную теплоемкость СУ, внутреннюю энергию я
энтропию криптона при 298 К и 1,0133-105 Па. Электронная составля-
составляющая суммы состояний криптона равна единице.
37. Рассчитайте вращательную составляющую энтропии кислоро-
кислорода при 500 К, если межъядерное расстояние равно 1,207-Ю0 м.
38. Составьте колебательную составляющую энтропии СО при 298,
1000 и 3000 К, если частота колебаний 2,170-105 м.
39. Вычислите энтропию NO при стандартном давлении и 298 К,
если межъядерное расстояние 1,15-10~10 м и частота колебаний
1,9165-105 м. Электронная составляющая суммы состояний равна
четырем.
/ГО HQ \
40. Вычислите функцию I -$-) для С12 при 1,0133-105 Па и
298 К. если межъядерное расстояние равно 1,988-10~10 м, а часто-
121
та колебаний 0,5649-108 м. Электронная составляющая суммы состо-
состояний С12 равна единице.
— 1 хлороводорода при 298 К
и 1,0133-106 Па, если межъядерное расстояние 1,2715- 10~1п м, а часто-
частота колебаний 2,9897-108 м~х. Электронная составляющая суммы состоя-
состояний равна единице. Определите также (Gggs — #29в)-
42. Покажите, что при температуре абсолютного нуля, когда все
частицы находятся на нулевом энергетическом уровне, молярная энт-
энтропия определяется уравнением S0 — R\n g0, где g0 — статистический
вес нулевого электронного уровня.
43*. Определите энтропию водяного пара, находящегося в идеаль-
идеальном газообразом состоянии при 298 К и 1,0133-108 Па. Молекулярные
константы возьмите из справочника [М.]. а — 2.
44*. Определите молярную энтропию этилена при 298 К и стан-
стандартном давлении. Молекулярные константы возьмите из справочника
[М.]. Электронная составляющая суммы состояний равна единице.
45. Определите долю молекул N0, находящихся при 300 К на
20-м вращательном квантовом уровне. Молекулярные константы возь-
возьмите из справочника [М.].
46*. Определите долю молекул ЧтРО, находящихся при 300 К на
первых 15 вращательных квантовых уровнях с точностью до 0,00001.
Определите вращательное квантовое число уровня, на котором нахо-
находится максимальное'число молекул 1Н38С1 при заданных условиях.
Вычертите вращательный спектр при 300 К.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1 *. Для вещества А, находящегося в состоянии идеального газа при
температурах 7\, Т2 и Т3 и при давлении 1,0133-105 Па, определить:
1) составляющие суммы состояний: поступательную, вращательную,
колебательную; 2) сумму состояний; 3) составляющие внутренней
энергии: поступательную, вращательную и колебательную; 4) внут-
внутреннюю энергию U — Uo; 5) составляющие теплоемкости: поступа-
поступательную, вращательную и колебательную; 6) теплоемкость С?; 7) вы-
вывести уравнение зависимости С$ = f (T) в виде ряда Ср = а + ЬТ-\-
+СТ2, справедливое в интервале температур от Тх до Т3. Для решения
используйте три значения теплоемкости при трех температурах;
8) составляющие энтропии: поступательную, вращательную и колеба-
АU\
) р уу, ру
(Ат—Uo\
тельную; 9) энтропию Sr\ 10) составляющие функции I —f— I; поступа-
[ AT-Ub\
тельную, вращательную и колебательную; 11) функцию I j 1;
12) функцию (—°~ ° ]. Данные о частотах колебаний и межъядер-
122
ных расстояниях, необходимые для расчета, возьмите из справочника
1С, X., т. 1]. Учтите, что основное электронное состояние Х2.
JA ва-,
рианта|
1
2
3
4
5
6
7
8
9
10
11
12
13
Вещество
'»Вг'»Вг
7»Bri»F
М(Ж>
1SC1»O
»6С1»6С1
35Cli»F
ирир
WH
WH
2Н»Н
WH
»Н»Н
*Н'»Вг
300
300
200
300
400
300
200
200
300
300
400
300
400
т,
500
600
400
600
800
600
500
400
600
500
600
500
600
т,
1000
900
800
1000
1000
1000
1200
900
1000
900
1200
1000
1200
№ ва-
варианта
14
15
16
17
18
19
20
21
22
23
24
25
Вещество
!Н88С1
iH"F
iHi«I
14N14N
ЗфЗф
1271127]
1271 85С1
з»к»»к
*3Na23Na
'Li'Li
"ВШ
"В*Н
г,
300
200
300
200
400
400
300
600
600
500
600
500
т,
500
400
600
500
600
600
500
800
800
700
800
700
т.
1000
800
1200
1000
1200
800
1000
1000
1000
900
1000
900
2. Для вещества А определите при температуре Т и давлении
1,0133-106 Па: 1) внутреннюю энергию U — Uo ; 2) энтальпию Я0 —
—Н8; 3) теплоемкость СД; 4) энтропию Sf; 5) функцию I—^-j,——I; 6)
/ G» - Н% \
функцию I 1. Данные о геометрических параметрах молекулы
А, частотах колебаний и степенях вырождения возьмите из справочни-
справочника [M.L
Si
п
1
2
3
4
5
6
7
8
9
Вещество А
СО,
CS,
N,0
N0,
Н,0
H.S
SO,
NH,
PCI,
т. к
300
400
300
250
400
300
300
400
300
<о S
«в
10
11
12
13
14
15
16
17
Вещество А
с,н,
сна.
сн3с1
СС14
со.
CS,
NaO
NOa
т, к
200
400
300
400
1000
900
700
1000
• ев
<В Е->
И
18
19
20
21
22
23
24
25
Вещество А
Н,0
H,S
so,
NH.
PCI,
с»н.
CHCI.
СН,С1
т. к
1000
900
1000
700
1200
1000
1200
900
3. Для двухатомного гомоядерного вещества вращательная сум-
сумма по состояниям Q = 50. Вычислите для t-ro уровня: 1) отношение
числа молекул на i-u уровне к числу молекул на нулевом уровне; 2)
долю (от общего числа) молекул, находящихся на i-u уровне; 3) долю
молекул, находящихся на нулевом уровне.
№ варианта , .
1
1
2
2
3
3
4
4
5
5
6
6
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
15
15
123
4. Установите характер всех химических связей в молекулах,
участвующих в химической реакции: 1) определите геометрическую
конфигурацию атомов в равновесном состоянии молекул, участвующих
в химической реакции; 2) установите по справочнику [М.] молекуляр-
молекулярные константы молекул, участвующих в химической реакции; 3) опре-
определите внутреннюю энергию V — Uo всех веществ, участвующих в ре-
реакции, в диапазоне температур от 300 до 1000 К через 100 К и при
298 К; 4) определите теплоемкость С? при 298 К в диапазоне от 300 до
1000 К через 100 К для всех веществ, участвующих в реакции; 5) уста-
установите уравнение зависимости С% = f (Г) в виде
на основании данных, рассчитанных в п. 4 методом наименьших квадра-
квадратов для всех веществ, участвующих в реакции; 6) определите тепло-
тепловой эффект реакции при 298 К и при постоянном давлении 1,0133-108
Па; 7) выразите уравнением
д //о = д _|_ вТ _|_ cji _|_ Dj3
зависимость теплового эффекта химической реакции от температуры;
8) вычертите зависимость теплового эффекта реакции от температуры;
9) определите (Я0 — Щ) для всех веществ, участвующих в реакции,
при 298 К и в диапазоне температур от 300 до 1000 К через 100 К; 10)
определите (Я0 — Ягэв) в диапазоне температур от 300 до 1000 К через
100 К; И) определите абсолютные энтропии всех веществ, участвую-
участвующих в реакции, при 298 К и в диапазоне температур от 300 до 1000 К;
/ Ат — Uo \
12) определите функции I = 1 для всех веществ, участвующих в
реакции, при 298 К и в диапазоне температур от 300 до 1000 К через
— для всех веществ, участвую-
участвующих в реакции,при 298 К и в диапазоне температур от 300 до 1000 К че-
через 100 К; 14) определите функции (G0 — Ягэг) Для всех веществ, участ-
участвующих в реакции, при 298 К и в диапазоне температур от 300 до
1000 К через 100 К; 15) определите изменение энтропии в ходе химиче-
химической реакции при 298 К. и в диапазоне температур от 300 до 1000 К через
100 К.; 16) определите AG? в ходе химической реакции при 298 К и в
диапазоне температур от 300 до 1000 К через 100 К; 17) возможно ли
самопроизвольное протекание химической реакции при стандартных
условиях в диапазоне температур от 298 до 1000 К?
№ вари-
варианта
1
2
3
,, № вари-
Химическая реакция ант||
СН4+Н,О^:СО + ЗНг 4
СН4 + 2Н,О^:СО,+4Н, 5
СО+Н2О^:СО2+Н, 6
Химическая реакция
2СН4 + О,^:2СО + 4Нг
2СН4^:СНееСН + ЗН2
СН4+СО2^2СО+2Н,
124
ГЛАВА IX
ГАЗЫ
Основные уравнения и символы
[ К., с. 125—129, 131 — 136, 149—156]
Свойства идеальных газов описываются уравнением Менделеева—
Клапейрона
PV=nRT, (IX.1)
где Р — давление; V — объем, занимаемый п молями газа; п — число
молей газа; R — молярная газовая постоянная; Т — абсолютная тем-
температура.
Свойства смеси идеальных газов описываются уравнением Дальтона
при Т = const:
i
2 Pt. (IX.2)
где P — общее давление газов; Pi — парциальное давление i-ro ком-
компонента; xt — молярная доля i-ro компонента; и уравнением Амага
i
V=V1+V2 + V3+... + Vi=%Vi, (IX.4)
Vt = Vxt, (IX.5)
где V — общий объем смеси газов; Vt — парциальный объем компонен-
компонента; хг — молярная доля t-ro компонента;
где tii — число молей t-ro компонента;
ViP^PtV. (IX.7)
Уравнения (IX. 1) — (IX.6) применимы к реальным газам при высо-
высоких температурах и низких давлениях. При расчетах свойств газов до-
допустимо применять законы идеальных газов для условий, при кото-
которых молярный объем не менее 5 л для одно- и двухатомных газов и не
менее 20 л для более высокомолекулярных газов при 298 К.
Свойства реальных газов описываются уравнением Ван-дер-Вааль-
са. Для 1 моль газа:
^) V~b)-RT> (Iх-8)
125
для я молей:
(Р + —) (V-nb)~nRT; (IX.9)
р==т5—"ТГ* AХЛ0)
где а — постоянная, учитывающая взаимное притяжение молекул;
Ь — постоянная, учитывающая собственный объем молекул,
\1,- (IX. 12)
где Тк — критическая температура газа; Рк — критическое давление
газа; JVa — постоянная Авогадро; а — кинетический диаметр атомов
и молекул газов.
Уравнение Ван-дер-Ваальса достаточно точно описывает состояние
газа, если газ находится при температуре выше критической и 1 моль
его занимает объем не менее 0,3 л.
Другое широко применяемое уравнение, которое описывает свойст-
свойства реальных газов,
z^PV/nRT, (IX.14)
где z — коэффициент сжимаемости. Для идеальных газов z = 1. Фу-
гитивность / может быть рассчитана по формуле:
f-РЧРшя, (IX. 15)
где Р — давление реального газа; Рвд — давление, которым обладал
бы газ при данном объеме и температуре, если бы он подчинялся зако-
законам идеальных газов. Уравнение (IX. 15) применимо только для срав-
сравнительно небольших давлений (Р < 50 атм). Коэффициент фугитив-
ности Y/ выражается соотношением
Т/-//Л (IX. 16)
Для идеальных газов yf — 1. Коэффициенты г и yf для заданных тем-
температуры и давления вычисляют приближенно графически (рис. 13,14).
Данные коэффициенты представляют собой функции приведенного
давления я и приведенной температуры т:
т=77Г«.
Уравнение состояния в вириальной форме:
PV В С
где В и С — второй и третий вириальные коэффициенты соответствен-
соответственно.
126
127
20 JO 40 50
О 0,1 02 0,3 04
Q/ "" 0,2 0,3 0,4 0.S 0,8 1,0 2 4 6 8 W 20 30 W 50
Phc. 14. Зависимость коэффициента сжимаемости г от приведенного давления л и приведенной температуры т
Из молекулярнокинетической теории газов следует зависимость
диаметра сг атомов и молекул от температуры:
<т = 2/\ AХ.19)
где г — кинетический радиус атомов и молекул: а^, С — константы;
средняя длина свободного пробега
(IX.20)
где N — число молекул в единице объема;
средняя арифметическая скорость молекулы газа
п = У 8RT/{nM) ; (IX.21)
коэффициент вязкости газа
¦П = .Мм/(Зяа2#А); (IX. 22)
число столкновений одной молекулы в 1 с в единице объема
Z = y~T ntfuN; (IX.23)
число двойных соударений одноименных молекул за 1 с в единице
объема
Z' = Щ-na^mZ, (IX.24)
где ясг2 — поперечное сечение соударений атомов и молекул; число
столкновений 2" между разноименными молекулами в единице объема
за 1 с
гх ,/ g7lRT _^j -\N1Ni , (IX.25)
V 2 )y \ mxm2 }
где Л'! и N2 — число молекул первого и второго газов в данном
объеме; Мх и М2 — молекулярные массы первого и второго газов; аг
и о2 — кинетические диаметры;
общее число ударов молекул, приходящихся на единицу поверх-
поверхности стенки сосуда за 1 с,
Z'"=Ny RT/BnM) . (IX.26)
Уравнение Клапейрона — Менделеева можно применять и для си-
систем, в которых происходит термическая диссоциация газов. Если число
молей газа до диссоциации обозначить п. степень диссоциации придан-
приданных условиях а, число молекул или атомов, на которые распадается
одна молекула исходного вещества, v, то в состоянии диссоциации чис-
число молей исходного вещества, подвергнувшихся распаду, будет равно
an, а число нераспавшихся п — а п = п (I — а). Так как каждая мо-
молекула, претерпевшая диссоциацию, дает v новых молекул, то при рас-
5 Зак. 767 129
паде an молей исходного вещества образуется avn молей продуктов рас-
распада. Следовательно, общее число молей в состоянии диссоциации рав-
равно
/t(l — a)+a/tv = /t(l— a+av)=n[l+a(v —1I. (IX. 27)
Обозначив через i число, показывающее, во сколько раз возросло
число молей вследствие диссоциации, получим
Общее число молей в состоянии диссоциации
* = ¦
Число молей исходного вещества до диссоциации
л [l+a(v—1I
= LJL_i ii- = l+a(v-l). (IX.28)
Если каждая молекула исходного вещества расщепляется на две
новые (v = 2), то
j=l+a. (IX.29)
Из выражения (IX.28) следует, что общее число молей в состоянии
диссоциации равно первоначальному, умноженному на i. На основании
этого уравнение (IX. 1) в применении к газу, находящемуся в состоя-
состоянии диссоциации, преобразуется к виду:
PV = inRT. (IX. 30)
ЗАДАЧИ С РЕШЕНИЯМИ
1. При 473 К и 0,999-Ю8 Па 0,716 г органического вещества, ис-
испаряясь, занимают объем 0,246 л. Вычислите молекулярную массу со-
соединения и определите его формулу, если С:Н:О = 2,25: 0,375:1.
Решение. Молекулярную массу вещества вычисляем по урав-
уравнению
n = PV/(RT)=m/M,
где т — масса исследуемого вещества; М — молекулярная масса ис-
исследуемого вещества;
8,314-473.0,716
М= 0,999-10*-2,426-10- = '18-
Записав формулу соединения в общем виде СжНвОг и используя
данные о его молекулярной массе и массовом соотношении входящих
в него элементов, составляем три уравнения:
г 16+Z16-0,375 + г16-2,25=116,18, A)
(/1=216-0,375, B)
*12 = zl6-2,25 C)
«
A6, 1,12 — атомные массы О, Н и С соответственно). Решение уравне-
уравнений дает: г = 2, у = 12, х = 6 и СЯН,О, = СвН12О2.
130
2. Приведите к нормальным условиям газ (вычислите объем V,
который занимает данное количество газа при 273 К и 1,0133-105 Па),
если при 373 К и 1,333- 10s Па его объем равен 3-10~2 м3.
Решение. По уравнению (IX.1) определяем объем газа:
Р1У1 1,0132- Ю» V
7\ ~ 273
l,333-103-3-10-*-273
V=—¦ =2,89-10-* м3.
373-1,0133-10»
3. Вычислите парциальные объемы водяного пара, азота и кисло-
кислорода и парциальные давления азота и кислорода во влажном воздухе.
Общий объем смеси 2- 10~3м3, общее давление 1,0133-108 Па, парци-
парциальное давление паров воды 1,233-10* Па. Объемный состав воздуха
21 % О2 и 79 % N,.
Решение. Вычисляем парциальный объем паров воды Кнао по
уравнению (IX.7):
2- 10-М ,233-104
V«>*= 1,0138-10» =2'41ОМ-
Вычисляем парциальные объемы О2 и N2:
кО,+ кмг =v— кнао ==0,002—0,00024 = 1,76-10-8 м8,
Отсюда
VOt= 1,76-10-8-0,21 =0,37-Ю-8 м3;
KNf=l,76-10-3-0,79= 1,39-10-8 м8.
Вычисляем парциальное давление О2 по уравнениям (IX.3), (IX.5):
Ро, = 1,0133-108-0,184 = 1,866-10' Па, а так как Р = Ро, + Ры,+
+ Рнго, то
PNj = 1,0133-Ю5—1,866-10*—1,233-104 = 7,033-10* Па.
4. Вычислите объем 1 моль хлора при 473 К и 2,0267-108 Па.
Решение. Вычисляем объем С12 по уравнению (IX. 14). Для это-
этого находим приведенные давление я и температуру т, используя урав-
уравнения (Х.15) и (Х.16): 7К = 417К; Рк = 77,09-105 Па [М.]; т =
= 473/417 =1,13, я = 2,0267-108/7,709-106 = 26,3; рассчитываем
Коэффициент сжимаемости г из рис. 14 : г = 2,7;
К = 2,7-8,31.473/B,027-108) =5,239-10-5 м3.
5* 131
5. Вычислите давление 1 моль водорода, занимающего при 273 К
объем 0,448-10~3 м3.
Решение. Вычисляем давление по уравнению (IX.1):
Р = 8,31-273/@,448-Ю-8) =50,663-Ю5 Па.
Однако этот результат ненадежен, так как V С 5 л. Поэтому повторя-
повторяем расчет, используя уравнение (IX.10):
v—ь к* ¦
Для водорода а = 0,244 л2-атм/моль2; b = 0,027 л/моль;
0,082-273 0,244
р = —)Ll : = 51,9 атм E2,65-105 Па).
0,448—0,027 @.448J
6. Вычислите объем 1 моль насыщенного водяного пара при 485 К
и Рн.о = 2,052 МПа B0,25 атм).
Решение. Расчет выполняем методом подбора с помощью
уравнения (IX. 10):
г_ RT ±_
v—ь v* ¦
Для воды а = 5,464 л2-атм/моль2; b = 0,03 л/моль. Ориентировочно
принимаем
_
Р 20,25
Подставляем полученное значение в приведенное уравнение:
0,082-485 5,464
19Л4а
Р "
1,96-0,03
Вычисленное давление ниже данного, следовательно, истинный объем
меньше, чем 1,964 л/моль.
Принимаем V" = 1,75 л/моль и повторяем расчет:
0,082-485 5,464
р"= 1,75-0,03 -таг*21-34'™-
Откуда Р" > Рн,о- Так как Р" > Рцго> Р', предполагаем, что
объем V" лежит в пределах 1,954-1,75 л/моль и принимаем V'" =
= 1,85 л. Тогда
0,082-485 5,464
рт _ _ = 20,26 атм.
1,85—0,03 1,852
Полученное значение давления отличается от заданного менее чем на
0,05 %, поэтому останавливаемся на последнем результате. Откуда
ут = у = 1,85 л/моль A,85-10-3м3/моль).
7. Вычислите давление 1 моль аммиака, находящегося в сосуде
вместимостью 100 мл, при 500 К.
132
Решение. Для данных условий (V < 0,3 л) уравнения (IX. 1)
и (IX.8) неприменимы, поэтому для вычисления давления используем
уравнение (IX.17). Вириальные коэффициенты для аммиака при 500 К
находим интерполяцией из приведенных ниже данных:
Г, К .... 300 400 500 600 800 1000 2000
В —15,7 0,03 8,53 13,91 20,06 23,33 28,30
С 1115 1000 954 928 894 867 758
В —4,85 9,31 17,05 21,84 27,26 29,96 33,81
С . ¦ . . . 1428 1332 1288 1258 1210 1167 1000
В 12,34 14,36 14,98 15,66 16,68 16,72 16,06
С ..... 297 283 271 260 242 227 181
В — —332,33—163,47—98,83 —47,22 —26,19 —1,47
С — — — 4650 2170 1090 319
В —285 —120,11 —68,30 —45,97 —29,83 —10,19 5,37
С — 3317 237 1438 714 461 196
В —94,03 —49,07 —25 —9,89 7,92 17,70 34,44
С 3116 2499 2173 2005 1852 1786 1622
В 11,12 10,94 10,72 10,51 10,13 9,81 8,72
С 98,29 89,48 82,90 77,63 69,65 63,85 48,09
В = второй вириальный коэффициент, см8/моль; С—третий вириальный коэффи
циент, смв/моль2 (В=—68,3 см8/моль; С=2397 см»/моль2).
8,31-500-10-в / 68,3 2397 \ п
р= 0,1-ю-з (' —1^-+A5Ь7)=23'13 МПа-
8. Рассчитайте кинетический радиус г и длину свободного пробега
Я, для 0,0416 моль гелия, занимающего при 293 К объем 1 л.
Решение. Кинетический радиус атомов гелия вычисляем по
уравнению (IX. 18). Значения а^ и С для гелия берем из справочника
(Ьо = 1,82.10-м м; с=173;
a*=l,822/l + -^-) = 5,266.10-го м2;
a =2,295-10-1° м; /¦ = — = 1,147- Ю0 м.
2
Длину свободного пробега X вычисляем по уравнению (IX.20), для это-
гоопределяем N — число молекул в 1 м3:
nN. 0,0416-6,002- 102S
Л' = i. = —: =2,506-1023 молекул/м3
и
к =1.706-10 'м.
к= УТ-3,14-5,266-10-20-2,506-Ю25
9. Вычислите для гелия, находящегося в условиях, приведенных
в задаче 8, среднюю арифметическую скорость молекул и и коэффици-
коэффициент вязкости г\.
133
Решение. Среднюю арифметическую скорость вычисляем по
уравнению (IX.21):
8-8,314-293 \Чг
3,14-4,003.10-
= 1244,86 м/с.
Коэффициент вязкости вычисляем по уравнению (IX. 22):
4,003-1244,86-102
п = ¦ ¦ — = 1,668-10-* г/(смс), или 166,8 мкП.
1 3-3,14-5,266- 10-1в-6,002- 102S v
10. Вычислите число столкновений 2 одной молекулы гелия, об-
общее число соударений 2' за 1 с в 1 см3 и число ударов 2" , приходящих-
приходящихся на 1 см2 площади стенки сосуда за 1 с, если 0,146 моль Не при 293 К
занимает объем 1 л.
Решение. Число столкновений Z одной молекулы за 1 с в 1 м:
вычисляем по уравнению (IX. 23), используя данные справочника [М.]3
4г2 = а2 = 5,266-10-20м2; п= 1244,86 м/с;
iV = 2,506-1025 молекул/м»;
Z = 2-5,266-10-2o-1244,86-2,506-1025-10-e = 2,32-10s.
Общее число столкновений 2' в 10~в м3 за 1 с вычисляем по уравнению
(IX.24):
Z'=(V~/2) 3,14-5,266-Ю-20 B,50бJ1050-1244,86-10-е = 9,14-Ю28.
Число ударов 2'" в 1-10~* м3 о поверхность вычисляем по уравнению
(IX.26):
/ 8,314-293 V/,
—-1 io-4=7,87-io2S.
V 2-3,14-4,003-10-»/
11. Определите число столкновений молекул азота и аргона друг
с другом в объеме 1 м3 и число ударов молекул газа о стенку сосуда
площадью 1м2 за 1 с при 373 К. и парциальных давлениях азота
1,0132-108 и аргона 2,0264-108 Па, если аЫг = 3,64 и <тАг = 3,5-100 м.
Решение. Вычисляем средний кинетический радиус сталкива-
сталкивающихся молекул:
- °м, + °Аг _ 3,64+3,51 _1П_Иц.
° 2 2
число молекул азота и аргона в 1 м3 вычисляем по уравнению
Nt = (PtV/RT)NAt
1,0132-105-1-6,022-102s
N = 1.97-10» молекул/м».
NNi =8 3l4.373
2,0264-1-6,022-1023
iVAr= 8 314;373 =3,934-1025 молекул/м».
134
Общее число соударений Z" за 1 с в 1 м3 вычисляем по уравнению
(IX. 25):
Г / Мьг+Мы_ \ ['
Z"= 1,97-1025-3,93.1025 C,58- Ю""J X
Число ударов 22'" молекул газа о стенку сосуда площадью 1 м2 за
1 с вычисляем по уравнению
Z'nt и 2а'г' вычисляем по уравнению (IX. 26):
2-3,14-28- Ю-3
8,314-373
2-314-39,9-Ю-3
2 Z™ = B,61 +4,38) 1027 = 6,99-10а'.
12. При 945° С и 1 атм 1,7 г H2S занимает объем 5,384 л. Вычислите
степень диссоциации сероводорода, если реакция протекает по урав-
уравнению
H2S ^zt H2 + o,5S2 (п)
Решение. Воспользовавшись уравнением (IX.30) и приняв
i=l+ 0,5а согласно уравнению реакции, после подстановки соот-
соответствующих числовых значений получим
PV 1-5,384
2 ~2==0'156-
а 0,5я^Г2= 0,5-0,05.0,082-1218
или а=15,6%.
ЗАДАЧИ
1. Приведите к нормальным условиям газ, занимающий при 373 К
иР = 13,33-102 Па объем 3-10 м3.
2. Определите молекулярную массу и установите формулу вещест-
вещества, если плотность его пара при 373 К. и 1,013> 106 Па равна 2,55 г/л.
Массовое соотношение элементов в этом соединении С:Н = 12:1.
3. Какое количество диоксида углерода при 5,066> 106 Па и 323 К
занимает одинаковый объем с 1 г гелия при 1,013-10* Па и 273,15 К?
Чему равны плотности этих газов?
4. Наивысшая температура в газгольдере летом 315 К, наинизшая
зимой 243 К- Рассчитайте, насколько больше (по массе) метана может
вместить газгольдер вместимостью 2000 м3 зимой, чем летом, если дав-
135
ление постоянно и равно 0,104 МПа (изменением объема газгольдера с
температурой пренебречь).
5. Барометр дает неверные показания вследствие присутствия не-
небольшого количества воздуха над столбиком ртути. При давлении
755 мм рт. ст. барометр показывает 748 мм рт. ст., а при 740 мм рт. ст.
истинного давления — 736 мм рт. ст. Каково действительное давление,
если барометр показывает 750 мм рт.ст. при Т = const?
6. Для газовой смеси массового состава (%): С12 — 67; Вг2 — 28;
О2 — 5, вычислите: 1) объемный состав; 2) парциальные давления
компонентов; 3) объем 1 кг смеси. Общее давление 1,013-108 Па. Тем-
Температура 373 К.
7. Из кислородного баллона вместимостью 8 л кислород при давле-
давлении 120 атм вытек в резервуар вместимостью 7,5 м3, наполненный воз-
воздухом под давлением 740мм рт. ст. и 298 К. Вычислите общее давление
в резервуаре и парциальные объемы азота и кислорода. (Объемный
состав воздуха (%): О2 — 21 и N2 — 79.)
8. Какое количествоСО2 может вместить стальной сосуд вместимо-
вместимостью 0,5- Ю-3 м3 при 473 К, 162,1 МПа?
9. Вычислите по уравнению Ван-дер-Ваальса температуру, при
которой объем 1 кг метана станет равным 0,1 м3 при 2,026 МПа.
10. Вычислите для СО2 постоянную b в уравнении Ван-дер-Ва-
Ван-дер-Ваальса: 1) из критических параметров [М.]; 2) из данных о кинетиче-
кинетическом диаметре молекулы диоксида углерода при 273 К (о —
= 3,34-10~10 м). Сравните вычисленные величины и объясните, поче-
почему они близки, но полностью не совпадают.
11. Вычислите объем 1 кг метана при. 298 К и давлении 3,039 МПа.
12. До какой температуры можно нагреть стальной сосуд вмести-
вместимостью 0,01 м3, содержащий 5 кг газа А (О2, N2, H2, H2O, NH3, CO2,
Не), если предельно допустимое давление 15,2 МПа. По какому из
уравнений состояния следует вести расчет? Оцените погрешность рас-
расчета по уравнению Ван-дер-Ваальса (относительно расчета по уравне-
уравнению в вириальнои форме). Почему величины погрешности для различ-
различных газов не совпадают?
13. При температуре Т 1 моль газа А занимает объем 0,1-10~3 м3.
Вычислите коэффициент сжимаемости по уравнению в вириальнои фор-
форме и по методу соответственных состояний. Сравните результаты и
рассчитайте погрешность расчета по методу соответственных состоя-
состояний. Вычислите коэффициент фугитивности yf газа А при Г К и
10 атм, использовав данные рис. 13.
№ варианта .1 2 3 4 5 6 7
Газ А .... О2 N2 H2 Н,0 NHS СО, Не
Т, К 300 300 300 700 500 400 300
14. Вычислите фугитивность аммиака, если его молярный объем
равен 3,109-10 м3/моль при 473 К и 100 атм. Для приближенного
расчета используйте уравнение (IX. 12). Результат сравните с точным
значением / = 82,2 атм. Вычислите коэффициент фугитивности yf.
136
15. Вычислите среднюю арифметическую скорость молекул кисло-
кислорода при 873 К. При какой температуре такую же скорость будут иметь
молекулы гелия?
16. При 293 К и 1,013- 10Б Па вязкости азота и неона равны 175 и
311 мкП соответственно. Вычислите: 1) кинетические диаметры моле-
молекулы этих газов и сравните с данными справочника 1М.]; 2) температу-
температуру, при которой вязкость азота станет равной вязкости неона при 293 К.
17. Вычислите среднее число столкновений одной молекулы, об-
общее число столкновений и число ударов о стенку сосуда площадью 1 м2
за 1 с молекул кислорода, находящегося под давлениями 1,013-106 и
1,013 Па при 323,ЬК- Объем кислорода 0,5 м3. При каких условиях
(давление) длина свободного пробега молекул О2 станет равной
1-10-2м?
18. Вычислите степень диссоциации фосгена, если 2 г фосгена, на-
нагретые до 500° С, занимают при 1 атм объем 1,985 л.
19. При 1 атм и 250° С степень диссоциации РС15 равна 80 %.
Вычислите, какой объем займет 1 г РС15, если его нагреть до 250° С при
1 атм.
20. При 2500° С и 1 атм Н2О частично диссоциирует на Н2 и О2.
При этих условиях 10 л Н2О, частично распавшейся и находящейся в
равновесии с Н2 и О2, весят 0,7757 г. Вычислите степень диссоциации
Н2О при указанных условиях.
21. При 627° С и 1 атм SO3 частично диссоциирует на SO2 и О2; 1 л
равновесной смеси при этих условиях весит 0,94 г. Вычислите пар-
парциальные давления газов в смеси.
22. Молекулярная масса паров иода при 1 атм и 800° С равна 241, а
при том же давлении, но при 1027° С она равна 212. Вычислите степень
диссоциации а и коэффициент i для разных давлений.
23. При 70° С и атмосферном давлении N2O4 диссоциирует на
65,6 % по уравнению N.2O4 =^ 2 NO2. Вычислите кажущуюся молеку-
молекулярную массу N2O4 при этих условиях.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Неисправный барометр, содержащий воздух, показывает давле-
давление Р1 мм рт. ст., в то время как действительное давление Рг мм рт. ст.
Длина вакуумного пространства / мм, температура 7\. Вычислите ис-
истинное давление, если барометр показывает Р3ммрт. ст. при темпе-
температуре Г2.
2. Для газообразного вещества А, находящегося в условиях, близ-
близких к критическим, вычислите объем и плотность при температуре Т и
внешнем давлении Р. Коэффициент сжимаемости определите с помо-
помощью рис. 14.
3. В сосуде вместимостью Ум3 смешиваются gA, gu, gc кг газов А,
В и С при температуре Т. Вычислите парциальные объемы и давления
компонентов и общее давление газовой смеси.
137
X
ex
со
ля
1
2
3
4
5
6
7
8
9
10
И
12
13
is
«СЁ.
745
745
755
730
745
725
725
740
730
725
755
740
735
is
«сё.
750
765
770
750
760
740
745
745
735
730
760
750
745
s
s
35
35
25
50
35
55
55
40
50
55
25
40
45
к
s-T
283
293
288
298
291
273
283
291
288
291
293
298
283
IS
оГо.
760
750
760
735
755
740
750
745
750
755
770
755
750
*
293
283
298
288
273
291
291
283
291
288
298
283
273
вари-
та
14
15
16
17
18
19
20
21
22
23
24
25
is
«СБ.
750
740
735
735
735
740
730
725
750
730
745
750
is
«Сё.
765
755
755
750
740
766
745
735
755
740
755
760
i
~
30
40
45
45
45
40
50
55
30
50
35
30
к
s-T
283
273
293
288
298
293
291
273
288
291
293
298
Is
«СБ.
760
750
740
745
755
745
740
730
755
745
755
765
*
273
283
288
293
293
298
273
291
291
282
298
293
№ ва-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
Вещество А
H2O
H2O
H2O
H2O
H2O
H2O
NH8
NH3
NH8
NH8
CC14*
CC14
т, к
598
593
588
583
578
573
345
335
325
523
513
503
P. МПа
11,75
11,0
10,3
9,6
8,95
8,36
3,2
2,5
2,0
1,5
2,9
2,5
№ ва-
варианта
13
14
15
16
17
18
19
20
21
22
23
24
Вещество А
CC14
CC14
CHgCOOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CeHe
CeHe
CeHe
CeHe
т. к
493
483
593
573
553
503
483
463
558
543
533
523
P, МПа
2,23
1,5
5,6
3,2
2,5
3,8
3,0
2,0
4,3
3,3
2,5
2,5
№ вари- 1
анта
1
2
3
4
5
6
7
8
9
10
11
12
А
N2
N2
N2
N2
o2
H2O
H2O
H2O
H2O
H2O
co2
co2
в
o2
H2O
CO
NH.
CO
N2
О
CO,
NH8
CO
N2
N2
с
H2
H2
co2
H2
o2
H2
CO
o,
o2
Q.
CO
«A- !"• ,
КГ
1
4
7
10
3
6
9
2
5
8
9
3
КГ
2
5
8
1
4
7
10
3
6
9
7
1
8C-1"',
кг
3
6
9
2
5
8
1
4
7
10
5
9
т. к
290
300
310
320
340
290
300
310
320
340
290
300
V- 10»,
M»
2
3
4
5
2
3
4
5
2
3
4
5
138
Продолжение табл.
№ вари- |
аита 1
13
14
15
16
17
18
19
20
31
22
23
24
25
А
со2
со2
со2
со
со
со
со
со
со
со
NH8
NH8
NH3
в
Н2О
Н2О
СО
Н2О
н2
о2
со2
со
со
со
NH8
NH8
NH,
с
о2
N2
о2
N2
N2
н2
о2
со2
N2
со2
н2
N2
N2
8А-Ч>'.
кг
7
1
5
10
4
8
2
6
3
6
9
4
5
йв-10',
кг
5
9
3
8
2
6
10
4
6
9
3
8
10
ее-1".,
кг
3
7
1
6
10
4
8
2
9
3
6
1
2
т, к
310
320
340
290
300
310
320
330
290
300
310
320
340
V-I0»,
м»
2
3
4
5
2
3
4
5
. 2
3
4
5
2
ГЛАВА X
КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
Основные уравнения и символы
[К, с. 167—234]
Поляризация вещества описывается уравнением
где Рор — ориентационная поляризация; Рат — атомная поляриза-
поляризация; Рэл — электронная поляризация;
D—\ M
' (Х-2)
где Рд = Рат + Рэл — деформационная поляризация; D — диэлект-
диэлектрическая проницаемость; М — молекулярная масса; d — плотность
вещества;
Р = */з яЛ/А(аор + аат + аэл)=4/з яЛ/Аа, (Х.З)
где N\ — постоянная Авогадро; а — поляризуемость;
(Х.4)
где ц — электрический момент диполя; k — константа Больцмана;
D— 1 М
D+2 Т
4 nN,
(Х.5)
139
или
P = aJrb/T, (X.6)
где
*ат + аэл), (Х.7)
4 и2
/ 9kb
«* = 1/-4^Г- (Х-9)
В единицах СИ электрический момент диполя неполярных или слабо
полярных веществ выражается уравнением
ц = 4,274-10-2» У~Т, (Х.10)
где Ь — коэффициент, который выражается в м3-К/моль; во внесис-
внесистемных единицах электрический момент диполя выражают в дебаях:
ц = 0,012813 УТ. (Х.11)
Молярная поляризация совершенного идеального раствора
12~ ?>i2+2 dlt
где Р12 — молярная поляризация раствора; D12 — диэлектрическая
проницаемость раствора; d12 — плотность раствора; xt и х2 — моляр-
молярные доли растворителя и растворенного вещества; М — молекулярная
масса. Для двухкомпонентного раствора получаем
Молекулярная рефракция равна электронной поляризации вещества
я2— 1 М 4
7?+Т~=ТяЛ/Ааэл=^' (ХЛ4)
где RM — молекулярная рефракция, м3/моль; d — плотность веще-
вещества; кг/м3; М — молекулярная масса; п — показатель преломления.
Удельная рефракция г равна молекулярной рефракции, деленной на
молекулярную массу:
М п* + 2 d К '
Если раствор содержит т, кг растворенного вещества в т% кг раство-
растворителя, то
п\ — \ ту п\-\
tn = i
n2 — 1 m
mr=
n2+l d
(X.16)
140
откуда
\
m
п\ — \ mi , п\ — \ тг _ n*—l m
TtlT ^= ' ' ~т~ ——^—— — ^—— i 1 Л . X /I
* + 2 rf n| + 2 d n* + 2 d
Рефракцию можно рассчитать по правилу аддитивности:
i j k
где ^?ат — рефракция атома; i?CB — рефракция связи; Rn — рефрак-
рефракция цикла.
Если пренебречь атомной поляризацией, то
Т-тг11' (ХЛ9)
Отсюда момент диполя молекулы будет
ц = 4.274.10-2»|/( Р—RM)T . (Х.20)
Для веществ, находящихся в жидком или твердом состоянии,
ц = 4,274.10-2» |/" (Р —RM)T . (Х.21)
В уравнениях (Х.20) и (Х.21) поляризация и рефракция выражены в
м3/моль. Плотность жидкости для неширокого интервала температур,
далеких от критической, выражается уравнением
^ = ^78[1-а(Г-273)], (Х.22)
где йт — плотность при температуре Г; d273 — плотность при 273 К;
а — коэффициент объемного термического расширения;
где V — объем жидкости. Если принять, что в узком интервале тем-
температур а = const, то
. (Х.24>
где АV — изменение объема жидкости при нагревании ее на Г. По-
Поверхностное натяжение жидкости а соответствует изменению энергии
Гиббса AG при образовании единицы площади поверхности;
а = ЛО, (Х.25)
o = C(dm-dnV, (X.26)
где С — коэффициент пропорциональности; dm — плотность жидко-
жидкости; dD — плотность пара. Зависимость поверхностного натяжения
жидкости от температуры выражается уравнением
(Х'27)
141
Вязкость жидкости выражается через собственный объем молекул и ее
удельный объем:
r\ = CI(v— со), (Х.28)
где г\ — вязкость; С и со — постоянные величины, не зависящие от тем-
температуры; v — удельный объем жидкости. Зависимость вязкости жид-
жидкости от температуры выражается равенством
где E^ — энергия активации вязкого течения.
Теплота испарения жидкости для температур, далеких от критиче-
критической, описывается уравнением
т
ДЯисп7. = ДЯИСп, ,и+ J ACd7\ (X.30)
298
где АЯисп, т и А#исп2д8 — теплота испарения при температуре Т и
298 К; АС — разность теплоемкостей пара и жидкости.
Теплоту возгонки твердого тела рассчитывают по уравнению
т
Д^возг, 7-=Д#возг>2в8+ J ACd7\ (X.31)
298
где АЯвозг. т, АЯВОЗГ,2В8 — теплота возгонки при температуре Т и
298 К; АС — разность теплоемкостей пара и твердого вещества.
Энергия кристаллической решетки Е для атомных и молекулярных
кристаллов может быть определена по уравнению
Я=ДЯнозг. (Х-32)
где АЯВозг — теплота возгонки.
Энергия кристаллической решетки металлов определяют из сот-
ношения:
? = ДЯВ0зг + /. (Х.ЗЗ)
где / — потенциал ионизации.
Для ионных кристаллов
МА^,МА+Возг,М + дисс,А+М + А, ()
где A#f ma — теплота образования твердого вещества МА из простых
веществ; АЯВОзг, м — теплота возгонки металла М; /м — потенциал
ионизации М; Е — сродство А к электрону. По уравнению Капустин-
ского
t
MA= 1072,24-10-' —^— ^
где Zi, zs — заряды ионов; rlt r% — радиусы ионов.
142
(X.35)
ЗАДАЧИ С РЕШЕНИЯМИ
I. Определите поляризацию молекул нитробензола при 293 К на
основании диэлектрической проницаемости и плотности.
Решение. Диэлектрическую проницаемость и плотность нит-
нитробензола при 293 К находим в справочнике [М.]: D2B3 = 35,97; d2B3 =
= 1,2003-103 кг/м3. По уравнению (Х.2) рассчитываем
35,97—1 123.10~3
Р= ! =94,143.10-' м'/моль.
35,97+2 1,2033.10»
л 2. По значениям диэлектрической проницаемости и плотности рас-
растворов нитробензола в бензоле при нескольких концентрациях при
298 К:
xc,h,no, • • • 0,0312 0,0704 0,1028
D' '. .'.... 2,98 3,86 4,64
d-10-з, кг/м» 0,885 0,901 ^ 0,914
определите поляризацию нитробензола при бесконечном разведении
Рос
Решение. Поляризацию раствора Ра2 определяем по уравне-
уравнению (Х.12):
_ 2,98—1 G8-0,9688+123-0,0312) 1Q-3
х2-0,0312, РJ=
0,885-10»
= 35,673-10-' м3/моль;
3,86—1 G8-0,9294 + 123-0,0704I0-3
2 = 0,0704, Pi, = -5^2 0,90.-10»
х2 = 0,1028, Р12 =
= 39,614-10-' м3/моль;
4,64-1 G8-89,72+123-0,1028) 10-»
4,64 + 2 0,914.10s
= 45,295-10-' м3/моль.
Поляризацию нитробензола при каждой концентрации определяем по
уравнению (Х.13). Предварительно необходимо вычислить поляриза-
поляризацию Рх чистого растворителя (бензола), которую определяем по уравне-
уравнению (Х.2). Диэлектрическую проницаемость бензола и его плотность
находим в справочнике [М.]: D298 = 2,27; <4В8 = 0,874-103 кг/м3;
2,27—1 78-10-»
P 26544Л0в3/мь
, = 0 0312 Г _ C5,673-26,544-0,9688) 1Q-*
= 319,140-10-' м3/моль;
C9,614 — 26,544-0,9296I0-'
= 212,197.10-' м»/моль;
D5,295—26,54-0,8972) 10-'
= 0,1028, P2 = L-: ' " — = 208,947.10-'
0,1028
143
Так как каждое значение Р2 содержит некоторую ошибку, то зависи-
зависимость Р2 = / (х2) в виде уравнения Р2 = а + Ьх2 найдем используя ме-
метод наименьших квадратов.
хг
0,0312
0,0704
0,1028
2х2 = 0,2044
Р2- 10«
319,140
212,197
208,947
2Р2 = 740,284- 10-е
0,000973
0,004956
0,010568
2x1=0,016497
х2 Р2-10«
9,9572
14,9387
21,4798
2х2 Р2 =
= 46,3757-10-в
Нормальные уравнения будут иметь вид:
За+ 0,2044 6 = 740,284-10-*;
0,2044 а + 0,016497 6 = 46,3757-10-'.
Решение этих уравнений дает: а = 354,435- ЮЛ Ь = — 1580, 336 х
X 10~6, а уравнение зависимости будет иметь вид
Р2 = 354,435-Ю-6 —1580,336-Ю-6 х2.
При х2 ->- 0 Р2 -+ Р^ = а; Р2>оо = 354,435- Ю-6 м3/моль.
3. Определите поляризуемость нитробензола при 298 К, если
поляризация при бесконечном разведении равна 354,435- 10~6м 3/моль.
Решение. Поляризуемость вычисляем по уравнению (Х.З):
3 Р2 оо 3 354,435-Ю-6
— Т ^7 = Т 4я6,02252-10*з=14'050-10-29 "'•
4. Определите молекулярную рефракцию нитробензола при 298 К
на основании справочных данных о его показателе преломления и плот-
плотности .
Решение. Показатель преломления и плотность находим в
справочнике [M.]:nD = 1,5522, d29S = 1,1985-103 кг/м3. Молекуляр-
Молекулярную рефракцию вычисляем по уравнению (Х.14):
1,55222 — 1 123-Ю-3
Д =32,802.10-' м3/моль.
м 1,55222+1 1,1985- Ю3
5. Определите электронную поляризуемость нитробензола при
298 К, если молекулярная рефракция его рана 32,803- 10~в м3/моль.
Решение. Электронную поляризуемость вычисляем по уравне-
уравнению
3 32,802. Ю-6
аэл=Т
= 1,3003.10-*» м3-
яб.02252-1023
6. Определите электрический момент диполя молекулы нитробен-
нитробензола, если поляризация нитробензола при бесконечном разведении рав-
равна 354,435-10~6 м3/моль, молярная рефракция — 32,802-10"" м3/моль.
144
Решение. Электрический момент диполя рассчитываем по
уравнению (Х.21), предполагая, что атомная поляризация мала по
сравнению сРми #м:
ц = 4,274- 10-29УC54,435- 10-в — 32,802- 10~в) 298 = 132,099-101 Кл-м,
или в единицах Дебая
ц = 0,01281 УC54,435 —32,802) 298 =3,96 Д.
7. Показатель преломления и плотность пропилового эфира хлор-
муравьиной кислоты при 298 К равны 1,4035 и 1,090-103 кг/м3. Опре-
Определите молекулярную рефракцию и сопоставьте ее с рассчитанной по
правилу аддитивности.
Решение. Молекулярную рефракцию вычисляем по уравне-
уравнению (Х.14):
1,40352 — 1 122,5
Дм= —; — =27,455-10-' м3/моль.
от 1,40352 + 2 1,090
Значение (л2 — 1)/(п2 + 2) можно взять из справочника [С.Х., т. 1
с. 398]. Для расчета молекулярной рефракции по правилу аддитив-
аддитивности (Х.18) воспользуемся таблицей атомных рефракций [М.]:
Атом С1 4С 7Н Окарбонил Оэфир С1СООСН2СН2СН3
а, см3/моль . . .5,967 4-2,418 7-1,100 2,211 1,643 27,193
Величина молярной рефракции, рассчитанная по показателю прелом-
преломления и плотности, хорошо совпадает с величиной, полученной по пра-
правилу аддитивности.
8. При 293 К показатели преломления и плотности равны: хлоро-
хлороформа nD = 1,4457; d= 1488 кг/м3 и хлорбензола nD = 1,5248; d =
= 1110 кг/м3. По показателю преломления раствора хлороформа в хлор-
хлорбензоле и плотности раствора определите концентрацию хлороформа:
nD = 1,4930; d= 1260 кг/см3.
Решение. Обозначим массовую концентрацию хлороформа х %.
Тогда концентрация хлорбензола будет A00 — х) %. Подставим дан-
данные в уравнение (Х.17):
1 49302 —1 100 1,44572—1 х 1.52482— 1 100—х
¦ + . - _ .
1,49302 + 2 1260 1,44572 + 2 1488 ' 1,52482 + 2 1110
Решая это уравнение относительно х, находим х = 46,8. Следователь-
Следовательно, концентрация хлороформа 46,8 %, а хлорбензола 53,2 %.
9. Определите молекулярную рефракцию глицерина С3Н5 (ОНK
в воде при 293 К, если показатель преломления 10 %-ного раствора
1,34481, его плотность 1,0221-103 кг/м3. Показатель преломления воды
1,33303, плотность воды 1,0006-103 кг/м3.
Решение. Удельную рефракцию определяем по уравнению
(Х.17):
1,34481»—! 1_ 1,33303»—! 0,9 -
' Г*~ 1.3448Н + 2 1,0221 ~~ 1,333032 + 2 1,0006-103 ~
= 0,20770- Ю-3 — 0,18503-10^3 = 0,2267-10~3.
145
Молекулярную рефракцию определяем по уравнению (Х.15):
0,02267-Ю-3
Дм = ~ — 92.10-3 = 20857-10-e м3/моль.
10. Зависимость объема ацетона от температуры выражается урав-
уравнением [С.Х., т.1, с. 586]:
VT=Vi7a [1 + 1,3240-Ю-3 (Г—273)+3,8090-10-' (Г—273J —
— 18,7983-10-" (Г — 293K.
Молярный объем его при 273 К равен 71,3846 см3/моль. Определите
коэффициент объемного расширения и плотность ацетона при 315 К-
Решение. Определяем коэффициент объемного термического
расширения по уравнению (Х.23). Для этого вычисляем объем ацетона
при 315 К:
V3i5 = 71,3846 A +1,3240-10-3-42 + 3,8090-10-«-422 —
— 18,7983-10-»-423) = 75,7344 см3/моль.
Плотность есть обратная величина от молярного объема, умножен-
умноженная на молекулярную массу:
58-Ю-3
V =0,7658-Ю-3 кг /см3,
(—) = 71,3846-l,3240-10-3 + 2-71,3846-10-e-3,8090 (Г—273) —
V дТ }р
— 3-71,3846-18,7983-10-е (Т — 273J =0,2460 +2,7418-10~3 Т— 4,0257-10—в Т*,
d3i5= 3,2481-10-3 +11,4038-Ю-3 —5,2744-10-3 = 9,3775-Ю-3.
11. Плотности жидкого бензола при 273 и 304 К соответственно
равны 0,9001-10~3 и 0,8685-10 кг/см3. Определите плотность жид-
жидкого бензола при 323 К-
Решение. Воспользуемся уравнением (Х.22):
0,8685-10-3 = 0,9001 -10~3 A—аЗО); а= 1,1702-10~3;
0-3 A — 1,1702-10-3-50) = 0,8474-Ю-3 кг/см3.
12. Определите работу образования поверхности 1 моль бензола
при переводе его в капельно-жидкое состояние с диаметром капель
0,1 мм при 293 К-
Решение. Определяем сначала общую площадь поверхности 1
моль бензола в капельно-жидком состоянии. Плотность находим в
справочнике [М.]: <493 = 0,8790- 10~8 кг/см8. Объем 1 моль 78/0,8790 =
= 88,7372 см3/моль. Объем одной капли
V=i/Sn @.005K = 0,5236-10—« см3.
Площадь одной капли s = 4я @.005J = 0,314-10~3 см2. Общая
площадь поверхности 1 моль бензола в капельно-жидком состоянии
88,7372
S= ' ¦ 0,314-10-3 = 53,2355-10" сма/моль.
146
Поверхностное натяжение бензола находим в справочнике [М.]: а =
= 28,88-10~3 Н/м. Если пренебречь площадью поверхности бензола
до распыления, то работа распыления будет
ДО = 5а = 28,88-10-3-5,3236= 153,746-Ю-3 Дж/моль.
13. Определите поверхностное натяжение С6Н5Вг при 323 К.
Решение. В справочнике [М.] находим значение а = 35,09X
X 10~3 Н/м при 293 К. Поверхностное натяжение при заданной тем-
температуре вычисляем по уравнению (X. 26). Плотностью пара можно
пренебречь по сравнению с плотностью жидкости. Плотность С6Н5 Вг
при 293 К находим в справочнике [М.]. Тогда по уравнению (Х.26)
рассчитываем коэффициент С:
С = 35,09-10-3/A,4948-103L = 7,0283-10~15.
При 323 К плотность С„Н5 Вг равна 1,4546-103. Тогда
а323 = 7,0283-Ю-15 A,4546-103L = 31,46-10—3 Н/м.
14. Поверхностное натяжение н-бутилового спирта при 273, 283
и 293 К соответственно равно 26,2-Ю-3, 25,4-10~3 и 24,6-10~3 Н/м.
Определите изменение энтропии при образовании 1 м2 площади поверх-
поверхности н-бутилового спирта и тепловой эффект в интервале температур
от 273 до 293 К-
Решение. Воспользуемся уравнением (Х.27). Для небольшого
интервала температур можно записать
[дТ )р~ ДГ '
Отсюда
= 48,04. Ю-3 Дж/м2.
Так как (J^L) = (J°-\ = — AS, то AS = — 0,08 • 10
\ дТ )p \ дТ Jp
Дж/(м2.К).
15. Установите зависимость вязкости н-пропилового спирта от
удельного объема. Определите вязкость н-пропилового спирта при
353 К-
Решение. Воспользуемся уравнением (X. 28) в преобразо-
преобразованном виде:
J \_ _со_
ц ~ С ~ С '
В общем виде это уравнение будет у = а + Ьх, где а/С = а и 1/С —Ь.
Уравнение линейное, в координатах Vr| = / (V). Вязкость при несколь-
нескольких температурах найдем в справочнике [М.]. Для этих же температур
находим плотности:
147
г, к
т}. 103, н.с.м-1
d-10-з, кг/м3 .
273
3,883
0,8193
293
2,234
0,8035
313
1,400
0,7875
333
0,921
0,7700
По вязкости вычислим текучести, а по плотности — удельные объемы.
Так как каждое значение вязкости и плотности содержит некоторую
ошибку, то коэффициенты а и b найдем по методу наименьших квадра-
квадратов:
V' Ю* м*/кг
X
1,2206
1,2446
1,2698
1,2987
2^=5,0337-10-3
1/Л-10-3, м»/(Н-с)
у
0,2575
0,4476
0,7143
1,0858
2— =
=2,5052-103
о1-10«
X1
1,4899
1,5490
1,6124
1,6866
2 *2=6,3379х
xio-e
1
о
П
ху
0,3143
0,5571
0,9070
1,4101
2 ху=8,1885
Нормальные уравнения будут:
4о + 5,0337- Ю-3 Ъ =--2,5052 -10»,
5,0337-Ю-з а +6,3379.10-е 6=3,1885.
Решение системы уравнений дает а = — 12,1374- 10s; b = 10,1428х
X 106. Отсюда С = 0,8592- Ю-8; со = + 2,1967-10~3. Искомое урав-
уравнение будет
9,8592- Ю-8
n~V — 1,1967- Ю-з -
При 353 К d = 0,7520-103 кг/м8, тогда v = 1,3298-10-8м8/кг, ц =
= 0,7407-Ю-8 Н-с-м-2.
16. Определите энергию активации вязкого течения хлорбензола.
Определите вязкость хлорбензола при 343 К-
Решение. Энергию активации вязкого Течения Е^ определяем
по уравнению (Х.29):
или у = а-\-Ьх,
2,3026 RT
где у — \gf\; a = \gk и b = ?"т|/2,3026 RT. Значения вязкости при не-
нескольких температурах найдем в справочнике [М.]:
т, к
Ti-103,
(l/f).
Н-с-м2
10» . .
273
1,056
—2,9763
. 3.663
283
0,915
—3,0386
3,534
293
0,802
—3,0958
3,413
303
0,708
—3,1500
3,300
313
0,635
—3,1972
3,195
323 -
0,573
—3,2418
3,096
333
0,520
—3,2840
3,003
148
Так как каждое значение вязкости х\ содержит некоторую ошибку, то
определение энергии активации вязкого потока Еп проведем по методу
наименьших квадратов. Решение представим в виде таблицы:
1
— .ю»
X
3,663
3,534
3,413
3,300
3,195
3,096
3,003
2х=23,204-10-3
ign
у
-2,9763
-3,0386
3,0958
-3,1500
—3,1972
-3,2418
—3,2840
2 у-=—21,9837
1
'7Г •1Ов
х'
13,418
12,489
11,649
10,890
10,208
9,585
9,018
2г>= 77,257-10-'
1
~f~ lg t) • 10»
ХУ
— 10,902
-10,738
-10,566
— 10,395
-10,215
-10,037
-9,862
2*(/=—72,715-Ю-3
7а+23,204-Ю-3 Ь=— 21,9837;
23,204-Ю-3 а+77,254-10-в 6=—72,715-Ю-3;
а + 3,315.10-3 6= —3,1405; 6 = 485,714; а = —4,7506.
а + 3,329-10-3 6= —3,1337;
Уравнение зависимости вязкости от температуры для хлорбензола бу-
будет иметь вид
lgti=— 4,7506 + 485,714-1/7\
Ец = 485,714-2,3026-8,3143 = 9,2988-103 Дж/моль.
Вязкость при 343 К будет
lgt]=—4,7506 + 485,714-1/343=—3,3344,
ti = 0,463-Ю-3 Н-с-м-2.
17. Определите теплоту испарения 1 мольСС14 при нормальной тем-
температуре кипения на основании АН*,29в жидкого и газообразного
СС14-
Решение. Значение AHf,m находим в справочнике [М.]:
Д#исп, 2в8 = ( —106,7 + 139,3) 103 = 32,6-103 Дж/моль.
Без большой ошибки можно принять, что АН не зависит от давления.
Воспользуемся уравнением (Х.ЗО). Так как Гн.т.к значительно ниже
критической температуры, то можно принять, что АС не зависит от тем-
температуры и равно АСт:
HTH
АНТ
Т
н.т.к
149
Нормальную температуру кипения находим в справочнике [М.] —
Гн.т.к = 349,7 К:
А Нт =32,6-103+(83,4 —131,7) C49,7—298) =30,1-103 Дж/моль.
н.т.к
18. Теплоты образования Lil при 298 К в газообразном и твердом
состояниях составляют — 67,0 и —271,3 кДж/моль соответственно.
Зависимость теплоемкости твердого Lil от температуры выражается
уравнением
С°р =51,50+ 10,22- Ю-8 Т.
Теплоемкость газообразного Lil
С°р =36,68 + 14,24 • Ю-з т.
Определите теплоту возгонки Lil при 680 К.
Решение. Теплоту возгонки определяем по уравнению (Х.31):
680
ДЯв80=(—67,0-103 + 271,3-103)+ \ [C6,68—51,50) +
298
+ A4,24 — 10,22) 10-3 Г] d Г = 204,3-Ю3— 14,82F80—298) +
4 02-10-3
_| : F802—2982) =199,39-103 Дж/моль.
19. Рассчитайте энергию ионной кристаллической решетки -хлори-
-хлорида магния по термодинамическому циклу и по уравнениям Капустин-
ского. Сравните полученные величины со справочной [М.].
Решение. В справочниках [М.] и [С.Х., т. 1] находим необхо-
необходимые для расчета величины: A#f>298,Mgcis = 641,83 кДж/моль;
A#BO3r.Mg = 1505,5 кДж/моль; A#^298i Ci — 121,3 кДж/моль,
/Mg = 2187 кДж/моль (потенциал ионизации); Е = — 363 кДж/моль
(сродство С1 к электрону).
?MgCI2 = F41,83+150,5 + 242,6 + 2187,0—726,0) 103 =
= 2495,9-103 Дж/моль.
По уравнениям (X. 35) рассчитаем энергию решетки ионного кристал-
кристалла. Для этого подставляем в (X. 35) заряды ионов гх = 2; гг = 1 и
2/г = 3; гЩ2+ = 0,74-10-10м; га- = 1,81-Ю-10 м. Тогда
2-1
= 1072,2-10-' = i:520• 103 Дж/моль
@,74+1,81) '"-'"
или
2-1
=1202,5-10-' X
@,74+1,81I0-и
х,, 0,345.10-1»
Г
I1 ~
@,74+1,81) 1Г
Справочное значение ЕщС1, = 2493-10s Дж/моль.
150
9,77
2,2508
1,0279
35,67
2,3744
1,0276
ЗАДАЧИ
1. Определите поляризацию хлороформа при 293 К по справочным
данным о диэлектрической проницаемости и плотности [М.].
2. На основании значений диэлектрической проницаемости
и плотностей растворов анилина в диоксане при 298 К определите
поляризацию анилина при бесконечном разведении:
*с.н,ын2-10в1 мол- Д°ля • • • 0
D 2,6037
d, г/см3 1,0280
3. По поляризации хлороформа при бесконечном его разведении в
неполярном растворителе при нескольких температурах определите
электрический момент диполя молекулы СНС13.
4*. По справочным данным [М.] о поляризации ацетона при беско-
бесконечном его разбавлении в неполярном растворителе при нескольких
температурах определите электрический момент диполя молекулы аце-
ацетона.
5. Показатель преломления и плотность пропилового эфира хлор-
муравьиной кислоты при 293 К соответственно равны 1,4053 и 1090
1090 кг/м3. Определите молярную рефракцию и сопоставьте ее с рас-
рассчитанной по правилу аддитивности.
6. Определите молярную рефракцию пиррола C4H5N, если показа-
показатель преломления 1,5034 и плотность 929 кг/м3. Сравните полученную
величину с рассчитанной по правилу аддитивности.
7. Укажите структуру соединения с эмпирической формулой
C5HSO2:
О
и
СН3-С — О--СН»— СН=--СН2
или
о о
II II
СН3 — С— СН2— С —СН3
если при 298 К его показатель преломления 1,4045, а плотность
928 кг/м3.
8. По диэлектрической проницаемости и плотности бензола при
температурах 283, 293, 303 и 313 К [М.] определите молярную по-
поляризацию и его электрический момент диполя.
9. Определите объем, который будет занимать 1500 кг амилово-
амилового спирта A-пентанола) при 390 К- Плотность и коэффициент объемного
расширения возьмите из справочника [С.Х., т. 1 и 2].
10. Зависимость объема диэтилового эфира щавелевой кислоты от
температуры в диапазоне от 273 до 414 К выражается уравнением
VT = V27S [I + 1.06031 • Ю-3 (Г—273) + 1.0983- Ю (Г—273J +
+ 2,6657-10-9G—273K].
151
Определите плотность диэтилового эфира щавелевой кислоты при
443 К, если плотность его при 293 К равна 1,0785-103 кг/м3.
11. Зная поверхностное натяжение и плотность СС14 при темпера-
температурах 273, 283, 293, 303, 313, 323 и 333 К [М.], покажите, что вели-
величина o'f'M/d не зависит от температуры. Вычислите эту величину.
12. Среди возможных структур соединения с эмпирической форму-
формулой С5Н7О2 предполагаются следующие:
сн2 ,л оо
1 о и и
н2сх ^.сн—с' сн3—с—сн2—с—сня
I И
Установите структуру соединения, если при 298 К его поверхностное
натяжение 0,0433 Н/м, а плотность 1,1094-103 кг/м3, пользуясь табли-
таблицей инкриментов парахора, приведенной в приложении.
13. Эмпирическая формула соединения QH5N. Установите струк-
структурную формулу соединения, если при 293 К плотность его 969 кг/м3,
а поверхностное натяжение 37,52-10~3 Н/м.
14*. Выразите уравнением зависимость поверхностного натяжения
от температуры на основании справочных данных [М.] о поверхност-
поверхностном натяжении при нескольких температурах. Выведите уравнение
вида а = а + ЬТ методом наименьших квадратов.
15. Определите изменение энтропии при образовании 1 м2 поверхно-
поверхности жидкого хлорбензола по данным справочника [М.].
16. Определите изменение энтальпии при образовании 1 м2 по-
поверхности жидкого хлорбензола при 293 К- Необходимые данные возь-
возьмите из справочника [М.].
17*. Выведите уравнение зависимости текучести 1/г| нитробензола
от удельного объема методом наименьших квадратов. Воспользуйтесь
данными справочника [М.]. Определите вязкость нитробензола при
373 К, если плотность его при этой температуре 1,1245-103 кг/м3.
18*. Определите энергию активации вязкого течения бензола на ос-
основании справочных данных [М.] о вязкости при нескольких темпера-
температурах. Выведите уравнение зависимости вязкости бензола от темпера-
температуры методом наименьших квадратов.
19. Определите теплоту испарения сульфурилхлорида SO2C12 при
нормальной температуре кипения. Необходимые данные возьмите из
справочника [М.].
20. Выведите уравнение зависимости теплового эффекта испарения
TiCl4 от температуры, справедливое в диапазоне температур от 298 до
400 К. Зависимостью А# от давления можно пренебречь. Необходимые
данные возьмите из справочника [М.].
21. Теплота образования нафталина в твердом состоянии и в состо-
состоянии идеального газа при 298 К соответственно равна 78,073 и 150,959
кДж/моль. Теплоемкости С% твердого и газообразного нафталина при
152
298 К соответтвенно равны 693,289 и 132, 549 Дж/(моль-К)- Опреде
лите теплоту возгонки нафталина при 340 К и изменение энтропии при
этой температуре.
22. На основании данных справочника [М.] определите энергию
кристаллической решетки 12 при 298 К-
23. Определите энергию кристаллической решетки дифенила
С12Н1С при 298 К, если теплота образования его в газообразном состо-
состоянии 182,09 кжД/моль. Недостающие для расчета данные возьмите
из справочника [М.].
24. Определите энергию кристаллической решетки калия при 298 К.
Необходимые данные возьмите из справочников [М.] и [С.Х., т. 1].
25. Определите энергию кристаллической решетки КВг при 298 К,
Л#возг,к = ^' ^^ кДж/моль. Необходимые данные возьмите из
справочника [М.].
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Вычислите электрический момент диполя молекул вещества А
на основании данных о поляризации при бесконечном разведении в не-
полярнрм растворителе при нескольких температурах [М.]. Рассчитай-
Рассчитайте молярную рефракцию по известной плотности и показателю прелом-
преломления при одной температуре и определите приближенно электриче-
электрический момент диполя по поляризации при бесконечном разведении и
молярной рефракции при одной температуре.
№ ва-
варианта
1
9
3
4
5
6
7
8
9
Вещество А
СНС13
С2Н5ОН
СН3СОСН,
С2Н5ОС2Н5
С„Н5Вг
СвН5С1
CeH5NO2
СНС1,
С2Н5ОН
N° ва-
варианта
10
11
12
13
14
15
16
17
Вещество А
СН3ОСН3
С2Н5ОС2Н5
CeH5Br
СвН5С1
CeH5NO2
CHCI3
С2Н5ОН
СН3СОСН3
* ва-
рна и та
18
19
20
21
22
23
24
25
Вещество А
С2Н5ОС2Н,
CeH5Br '
СвН5С1
CeH5NO2
CHCIa
С2Н5ОН
СН3СОСН3
С2Н5ОС2Н5
2. При 293 К плотность а %-ного раствора вещества А в раство-
растворителе В равна d, показатель преломления раствора п. Вычислите мо-
молярную рефракцию вещества А, если при 293 К плотность растворите-
растворителя В равна d0, а его показатель преломления п0.
№ варианта
1
2
3
а. %
20
31
30
А
НС1
на
H2SO4
в
СН3ОН
н2о
н,о
d-Ю-3, кг/м3
0,915
1,157
1,220
л
1,374
1,407
1,370
153
Продолжение табл.
№ варианта
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
а, %
40
17 .
35
24,5
12,5
9
50
44
90
22
29
50
50
45
42
52
25
40
37
66
3,6
44
А
нею.
LiBr
LiCl
NaCl
Na2SO4
K2SO4
SnCl4
CO(NH2J
C2H4Br2
CClgCOOLi
CH.COOH
CHgCOOH
CH3COCH3
ССЦСООН
CClgCOONa
SCNC3H5
SCNC3H5
C5H10NH
CeH5SO3H
CeH5NH2
CeH5COOH
Ci2H22Ou
в
H2O
H2O
H2O
H2O
H2O
H2O
CHgCOOQiHs
H2O
C3H7OH
H2O
H2O
CeHe
CeHe
H2O
H2O
C5H10NH
o-CeH4(CH3J
SCNQ,H5
H2O
C2H5OH
CeHjCHg
H2O
d-10-3,
кг/м"
1,293
1,129
1,174
1,187
1,116
1,075
1,487
1,121
1,866
1,128
1,038
0,947
0,839
1,255
1,295
1,075
0,968
1,085
1,135
0,959
0,856
1,191
n
1,367
1,362
1,414
1,377
1,352
1,345
1,476
1,400
1,503
1,365
1,353
1,434
1,428
1,395
1,397
1,580
1,551
1,582
1,406
' 1,516
1,493
1,406
Показатель преломления
Растворитель В
н2о
сн3он
С2Н5ОН
СН3СООС2Н5
СН3СН2СН2ОН
кг/м3
1,000
0,805
0,808
0,903
0,807
"о
1,333
1,329
1,364
1,375
1,386
и плотность растворителя В
Растворитель В
SCNC3H5
• C5H]0NH
С,Не
CeHsCH3
o-CeH4(CH3J
rf0- 10~8,
кг/м»
1,019
0,863
0,885
0,867
0,881
1,530
1,461
1,504
1,497
1,505
3. Вычислите парахор вещества А, если известны поверхностное
натяжение и плотность при температуре Т. Полученную величину со-
сопоставьте с рассчитанной по правилу аддитивности. См. приложение
или справочник [М.].
№ ва-
варианта
1
2
3
4
5
Вещество А
СНС1.
СН3СНО
С1СН2СН2ОН
СН3СН2ОН
СН3СОСН3
040% Н/м
27,28
21,2
42,2
22,75
23,7
d-10-3, кг/м3
1,489
0,783
1,213
0,789
0,791
Г, К
293
293
293
293
293
154
Продолжение табл.
№ ва-
варианта
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
Вещество А
СН3СООСН3
сн3сн2сн2он
СН.СООС,Н5
CjH6OCaH5
сн3сосан5
свн.
«-с,н14
«-С5НЦОН
СвН6Вг
СвН5С1
CeH5NH2
С.Н5СН3
СН3СОС«Н5
CeHsCH2CH3
C9H,N
СН„ОНСН2ОН
СН2(СН2LСН2
С,НвСН(СН3J
(СН3KС-СН(СН3)(СН2JСН3
С.Н5СООСН3
(Т-103,
Н/м
24,6
23,78
23,9
16,6
24,6
28,89
18,43
21,6
36,34
33,2
42,9
39,8
38,7
29,2
45,0
46,1
24,95
28,20
31,27
37,3
d- 10-3.
кг/м3
0,924
0,804
0,901
0,708
0,810
0,879
0,659
0,815
1,508
1,107
1,022
0,885
1,033
0,867
1,095
1,109
0,779
0,862
0,894
1,088
Т. К
293
293
293
298
293
293
293
293
283
293
273
288
293
293
293
293
293
293
293
ГЛАВА XI
ФАЗОВОЕ РАВНОВЕСИЕ ОДНОКОМПОНЕНТНЫХ СИСТЕМ
Основные уравнения и символы
[К. с 326—340; Г. т. 1, с. 138—151]
Условия фазового равновесия выражаются равенствами:
/°=/^, (Х1-2)
где fi°, (if — химические потенциалы i-го компонента в фазах а и Р,
находящихся в равновесии; /° и /? — фугитивности.
В гетерогенной системе связь между числом степеней свободы, чис-
числом фаз и числом компонентов выражается правилом фаз Гиббса:
/ = К-Ф+2, (XI.3)
где К — число компонентов, К = R — Я', R —*число веществ; q —
число независимых реакций; Ф — число фаз; / — вариантность сис-
системы (число термодинамических степеней свободы).
Связь между основными термодинамическими параметрами одно-
компонентной двухфазной системы, находящейся в состоянии равнове-
155
сия, выражается уравнением Клапейрона — Клаузиуса. Дифферен-
Дифференциальные формы уравнения:
йР А Я* л d P
ЧГ^ТХ^Г'' Д"ф.п=г —д.т, (xi.4)
где АЯф,п — теплота фазового перехода в условиях равновесия фаз
(испарение, плавление, возгонка, превращение модификаций);
dPIdT— температурный коэффициент давления насыщенного пара;
AVm — разность молярных объемов фаз, находящихся в равновесии.
Для равновесий: твердое вещество ч=* пар и жидкость ч* пар в об-
области температур, далеких от критической, при условии, что Упар =
= RTIP,
dlnP _ ДЯФ.П
AT RT* • (XL5)
После интегрирования уравнения (XI.5) при условии А#ф.п = const
получаем:
lgP^A-B/T, (XI.7)
Р2 ДЯф.„ T2-Tt
lg Pt~ 2,3 R T,Tt ¦ (ХК8)
Значение АЯф.п в уравнениях (XI.6) и (XI.8) является средней вели-
величиной, справедливой для интервала температур 7\ — Г2.
Уравнение Трутона (для неполярных веществ)
АЯисп =88,66, (XI.9)
Тн.т.к
где ТИ т „—нормальная температура кипения при давлении 1,0132х
X 105 Па.
При равновесии фаз в тройной точке.
^.Ф = ^в.ф, (XI-Ю)
где Рж.ф, ^тв.ф — давление насыщенного пара вещества над жидкой
и твердой фазами. В тройной точке теплоты возгонки, плавления и
испарения связаны уравнением
ДЯвозг = ДЯисп + ДЯпл- (XI.11)
Зависимость теплоты фазового прехода от температуры описывает-
описывается уравнением
где С° и С* — теплоемкости находящихся в равновесии фаз аир.
В небольшом интервале температур АСф-п = const, тогда
ДЯГ)ф. п =ДЯО+ДСФ.ПГ (XI.13)
156
или
Л-„ф.п = ЛЯг,.ф.п + ЛсФ.пG12-711)- • (XI.14)
Уравнение зависимости давления насыщенного пара от температуры
для твердых и жидких фаз) с учетом (XI.5) и (XI. 13) принимает вид
ИЛИ
\gP = A-— +D\gT, (XI.16)
где АЯ0 — константа интегрирования; А, В, D—константы.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Плотность твердого фенола 1072 кг/м8, жидкого 1056 кг/м8, теп-
теплота его плавления 1,044- 10е Дж/кг, температура замерзания 314,2 К.
Вычислите йР/dT и температуру плавления фенола при 5,065-107 Па.
Р е ш е н и е. По уравнению Клапейрона — Клаузиуса (XI.4)
рассчитываем dP/dT:
dP _ ДЯпл „ J 1
dr T(Vm-VTB) ' dm dTB '
dP _ 1,044-10»
dr " 314,2.0,014-Ю-» -2'373-107Па/К.
—— =4,214- Ю-» К/Па.
Чтобы вычислить температуру плавления при заданном внешнем дав-
давлении, принимаем, что d77dP в интервале давлений 1,0132-10е —
— 5,065-Ю7 Па — величина постоянная, равная 4,214-10~8 К/Па.
Тогда
т, р,
f dT = 4,214-Ю-» J dP
т, Р,
И
Г2 = 314,2+4,214-10-в.5,065-10'= 316,33 К.
2. Вычислите среднюю теплоту испарения СН4 в интервале тем-
температур от 88,2 до 113 К. используя следующие данные:
Т, К ...
Р-Ю-», Па
88,
8
2
92,
13,
2
31
98
¦26
,2
,62
104
52,
,2
24
112
101
,2
,3
Решение. Расчет можно провести двумя путями:
1) по уравнению (XI.8).
112 2 88 2 1013 1
238314''18 '
= 8,62 кДж/моль.
157
2) по уравнению (XI.7), из которого следует, что зависимость igP
от 1/Т выражается прямой линией (рис. 15). Теплоту испарения можно
определить по тангенсу угла наклона прямой, который равен: tga =
= — ЛЯИСП/2,3 R. Вычисляем для приведенных данных IgP и 1/Т:
Т, К . . •
Р-10-3, Па
103 .
88,2
8
11,37
3,903
92,2
13,31
10,89
4,124
98,2
26,62
10,21
4,425
104,2
53,24
9,62
4,726
112,2
93,40
8,94
4,972
Строим график IgP = / A/Г), из которого следует
0,96
tga= —— =
2,22-10-
¦=-432,
д #/ = 432-2,3-8,314 = 8,27 кДж/моль.
Этот результат более точен, чем предыдущий, так как вычислен на ос-
основании пяти опытов (истинное значение теплоты испарения метана
при нормальной температуре кипения 8,19 кДж/моль).
3. Вычислите теплоту испарения диэтилового эфира по уравнениям
Клапейрона — Клаузиуса и Трутона, если при нормальной темпера-
температуре кипения C07,9 К) dP/dT = 3,53 X
X 10s Па/К. Полученную величину срав-
сравните со справочной.
Решение. Вычисляем теплоту испа-
испарения по уравнению (XI.5), приняв, что
пары подчиняются закону идеальных газов
5,0
48
4.5
4,2
4.0
J.8
и AV
пар-
|_
А Яисп = 3,53-103.8,314-307,92 •
1
85 9
10
U 1/Т- Ш3
1,013-105
= 2,74-10* Дж/моль.
Рис. 15. Зависимость
насыщенного пара СН4 от
обратной температуры
По уравнению (XI.9) находим -"ИСП
= 307,8-21,00 = 6470 кал/моль или
ДЯисп = 6470-4,187 = 2,72-Ю4 Дж/моль.
По данным справочника [С.Х., т. 1, с. 960] АЯИСП = 2,67-104
Дж/моль, т. е. отклонение от истинного значения при расчете Л#исп
по приближенным уравнениям составляет 5,5 %.
4. Зависимость давления пара (мм рт. ст.) от температуры для
жидкого металлического цинка выражается уравнением
lgp=
6697
- — 1,2 lgT+12,247.
Вычислите теплоту испарения (Л#исп) цинка при температуре плавле-
плавления F92,7 К).
158
Решение. Теплоту испарения цинка при 692,7 К рассчитаем
по уравнению (XI.5), преобразовав его к виду
dlnP
1 Нисп — I
RT*.
dT
Дифференцируя уравнение зависимости давления пара жидкого ме-
металлического цинка от температуры
6997-2,3
1пР= — —: — 1,21п Г+12,247-2,3,
получаем
dlnP 6997-2,3 1,2
dT Т2 Т
Вычисляем Л#исп при 692,7 К:
Д#исп = 6997-2,3-8,314 — 1,2-8,314-692,7= 126,887 кДж/моль.
5. Зависимость давления насыщенного пара муравьиной кислоты
(мм рт. ст.) от температуры выражается уравнением:
3160
для твердой фазы lgP= 12,486—-
для жидкой фазы lgP = 7,884—-
Т
1860
Т
Вычислите координаты тройной точки (тр.т).
Решение. Поскольку для равновесия фаз в тройной точке
справедливо условие Р» = Р?в, приравниваем друг к другу приве-
приведенные уравнения и вычисляем Гтр.т и Р?р.т:
3160 1860
12,486—— =7,884 , откуда Гтр.т = 282,6 К;
'тр.т Ттр. т
lgPTp,T = 7,884- nong =1,302,
1860
282,6
откуда
Ртр.т = 20 мм рт. ст B,666-Ю3 Па).
6. Вычислите теплоту возгонки металлического цинка, если тепло-
теплота плавления (АЯПЛ) при температуре тройной точки F92,7 К) рав-
равна 6,908 кДж/моль, а зависимость теплоты испарения от температуры
описывается уравнением
ДЯИСП= 133738,66—9.972Г (Дж/моль).
Решение. Согласно уравнению (XI.11)
А #возг = А Нисп + А Япл.
Вычисляем АЯИСП:
Д#исп= 133738,66—9,972-692,7= 126,825 кДж/моль.
159
Вычисляем АЯВОзГ:
ДЯВ03Г = 126,825 + 6,908= 133,73 кДж/моль.
7. Вычислите теплоту фазового превращения для a-FeS —>- (i-FeS
при 298 К. Считайте, что АС = const в интервале температур
Гпр + 298 К- Средняя теплоемкость (}-FeS Cp.Fes = 53,845 Дж/моль.
Недостающие данные возьмите из справочника [М.].
Решение. Согласно уравнению (XI. 14)
Д Япр,298 = л япр_ гпр+д с B98-Гпр),
Гпр = 411 К, Са = 54,85 Дж/(моль-К),
ДС = Ср—Са = 53,84 —54,85= —1,01 Дж/(моль-К).
ЛЯПр,ш = 4396,35 Дж/моль,
ДЯПр, 898 = 4396,35 —1,01 B98 — 411) =4510,78 Дж/моль.
8. Через метиловый спирт барботирует воздух и насыщается его па-
парами. После того как через СН3ОН пропустили 1л воздуха, масса
СН3ОН уменьшилась на 0,201 г. Общее давление в системе неизменно и
равно 1,0132-105 Па. Рассчитайте давление насыщенного пара метано-
метанола при 294,5 К.
Решение. Составляем два уравнения:
1/Р = 1/'(Р-Р».НзОН); Ы = ГA-Р?Нзон), О
тСН,ОН \
где V — объем воздуха до пропускания его через СН3ОН; V — общий
объем воздуха и паров СН3ОН после пропускания; Р—давление воз-
воздуха до барботирования, Р = 1 атм; (Р — Рсн3он) —- давление воз-
воздуха после барботирования.
Делим уравнение A) на уравнение B) и решаем относительно
Рси^он'-
(т/М) RT _ @,201/32H,082-294,4 =
С
CH,OH i + (m/M)RT 1 + @,201 /32) 0,082-294,4
= 0,1315 атм A,146-10* Па).
9. Вычислите 5?н2о,пJ98, если 5?н2о,жJ98 = 69,96 Дж/(моль-К)-
Решение. Для расчета представим себе процесс превращения
жидкой воды в пар под давлением 1,0132-105 Па, который состоит из
двух стадий: 1) равновесное испарение под давлением, равным давле-
давлению насыщенного пара, А5ИСП; 2) равновесное сжатие А5С!К насыщен-
насыщенного пара до давления 1 атм. Тогда
АС — АС I Д С ( \ \ • Со СО
а о — а оиСП-Г-^ ^сж Mb jh20 (п) — ^Н,
Согласно уравнениям (VII. 14) и (VII.9)
Д 5.иСп = —zr5—; Д 5сж = — R In
160
Для определения Л#исп по справочнику (М.1 находим теплоты обра-
образования воды для разных агрегатных состояний при 298 К:
ДЯИСП =ДЯЙгО(п)-Д#ДгО(ж} = -241,84-(-285,84)=44,00 кДж/моль
и давление насыщенного пара Рн.о ~ 3,167- !03 Па. После подстанов-
подстановки чисел и вычислений получаем
44 000 760
AS =——-——8,314-2.31R—-—•— = 118,87 ДжДмоль-К)
298 29,16
и абсолютная энтропия пара составит
SH2o (п) = 69,96+ US,37-= 188,83 Дж/(моль-К) •
10. При 268,2 К, давление насыщенного пара твердого бензола
2279,8 Па, а над переохлажденным бензолом (жидким) 2639,7 Па, Вы-
Вычислите изменение энергии Гиббса в процессе затвердевания \ моль
переохлажденного бензола при указанной температуре (пары бензола
считать идеальным газом) и укажите, обратимый или необратимый
процесс.
Решение. Поскольку изменение энергии Гиббса AG не зависит
от пути процесса, принимаем, что процесс затвердевания состоит из
трех стадий: S) обратимое испарение жидкого бензола при давлении
2639,7 Па; 2) обратимое расширение паров до давления 2279,8 Па; 3)
обратимая конденсация паров в твердую фазу. Тогда
Так как 1-я и 3-я стадии протекают при Р и Т = const обратимо, то
AGi = AG3 = 0, а
ИЛИ
79 8
AGa = AG = 8,314-268,2-2,3 1^-^—^-^—326,18 Дж/моль.
2639,7
Результат указывает на необратимость данного процесса.
П. Давление насыщенного водяного пара при 428,2 К равно
54,3-10* Па, а удельный объем пара 0,3464 м3/кг. Рассчитайте фугитив-
ность воды, находящейся при 428,2 К в равновесии со своим насы-
насыщенным паром.
Решение. Согласно уравнению (XI.2) фугитивность жидкости
равна фугитивности ее насыщенного пара, а так как давление отно-
относительно невелико, фугитивность насыщенного пара можно вычислить
по уравнению (IX. 15):
f ^! pS JL = E4,3-10* Па)Ъ<
"ид
КI
Х 0,3464 (м/,г) 18^2
8,315 [Дж/(моль.К)] 428,2 (К)
Зак. 787 151
ЗАДАЧИ
1. Может ли при температуре 386,5 К (температура превращения
фаз) находиться в равновесии ромбическая, моноклинная, жидкая и га-
газообразная сера?
2. Представьте график в координатах Р — Т для вещества, су-
существующего в двух твердых модификациях Q и R, жидком и газооб-
газообразном состояниях. О фазовом состоянии системы имеются следующие
данные:
Точка
1
2
3
t, "С
10
30
50
Р, атм
1
10
100
Фазы
Q, R, пар
R, жидкость, пар
Q, R, жидкость
3. Теплота плавления и плотности жидкой и твердой ртути
при температуре тройной точки B34, 29К) равны соответственно
11,8-103 Дж/кг, 13, 690, 14 193 кг/м3. Вычислите давление, при кото-
котором температура плавления станет равной 235,29 К.
4. Вычислите двумя способами теплоту испарения воды при 273,2
и 573,2 К, используя следующие данные:
1-й способ
Г, К 273,16 573,16
va, л/г 206,3 0,0215
я», см»/г 1,000 1,400
дР/АТ 0,333 мм рт. ст./К 1,201 атм/К
2-й способ
Г, К 273,2 274,2 572,7 574,3
Р. 4,579 мм рт. ст. 4,924 мм рт. ст. 88,14 атм 90,17 атм
Объясните, почему при 273,2 К результаты совпадают, а при 573,2 К
расходятся.
5. Определите температуру кипения хлорбензола при 266,6 Па,
если его нормальная температура кипения 405,4 К, а при 5,332-10*
Па он кипит при 382,2 К= Вычислите теплоту испарения, изменение
энтропии, внутренней энергии, энергий Гиббса и Гельмгольца при ис-
испарении 1 моль хлорбензола при нормальной температуре кипения.
6. Вычислите коэффициенты А и В в уравнении \gP = А — BIT,
выражающем зависимость давления насыщенного пара жидкого алюми-
алюминия от температуры. Проверьте полученные данные, вычислив темпе-
температуру кипения при нормальных условиях (Гн.т.и =2600 К), если из-
известно давление паров алюминия, при следующих температурах:
т, к
Р, Па
1734
89,3
1974
1333
2093
3972
2237
1,341 10*
162
7. Вычислите количество теплоты, необходимое для нагревания
1 кг TiCl4 от 298 до 423 К. Данные о теплоемкости возьмите из справоч-
справочника [М.]. Зависимость давления пара (Па) над жидким TiCl4 от тем-
температуры выражается уравнением
lgP = 8,56—1450/7".
8. Вычислите теплоту испарения хлора при Р = 0,1013 МПа, если
уравнение зависимости давления (Па) насыщенного пара от температу-
температуры над жидким хлором имеет вид
Р = 3,58-10»— 3,37-10^+80, ИГ2.
9. Зависимость давления (Па) насыщенного пара от температуры
для фреона CC12F2 выражается уравнением
2406,1.
lg Р=34,5 — :——9,26 lg 7" + 0,00377".
Определите давление насыщенного пара, теплоту испарения, изменение
энтропии, энергии Гиббса и ЛСФ п при испарении 1 моль фреона при
298 К.
10. Для 1,4-диоксана С4Н8Оа определите координаты тройной точ-
точки (Р и Т), теплоту возгонки, испарения и плавления в этой точке,
если
твердое состояние жидкое состояние
Т,К 260,35 272 298,16 307,0
Р, мм рт. ст. 4,18 10 41,55 60
11. Вычислите температуру плавления, давление насыщенного па-
пара при этой температуре и теплоту плавления серебра по данным зави-
зависимости давления насыщенного пара (Па) от температуры, если:
для твердого серебра
lg р= 13,892— 1,402-104/7\
для жидкого серебра
lg Р= 13,347—1,334-КУ/Г.
12. Определите молекулярную массу уксусной кислоты в парах по
данным зависимости давления насыщенного пара от температуры и по
значению найденной колориметрически удельной теплоты испарения
д#исп = 406,83 Дж/г:
Г, К 363 383 403
Р. мм рт. ст. . . 293 583 1040
13. Вычислите разность между давлением пара воды и льда при
272 К. Теплота плавления льда равна 334 Дж/г. Рл = Ръ = 610,48
Па при 273,16 К.
14*. Температура кипения бензола при 0,1013 МПа 353,3 К. Рас-
Рассчитайте давление при температуре тройной точки 278,66 К, восполь-
воспользовавшись уравнением Трутона со следующими допущениями: теплота
6» 163
испарения не зависит от температуры; теплота испарения зависит от
температуры, но
ДС = СП— C,K = const, Сп = 81,67 Дж/(моль-К);
Сж = 136 Дж/(моль-К) (при 278,73 К и 4,812-103 Па).
15. Давление насыщенного пара вещества 12-102 Па при 408 К.
,При какой температуре оно будет перегоняться, если в системе под-
поддерживается давление 2,666-103 Па? При расчете можно использовать
уравнение Трутона и принять, что теплота испарения — величина
постоянная.
16. Вычислите АЯИСП хлорида таллия при температуре тройной
точки G04 К). Недостающие данные возьмите из [М.]. Теплота плавле-
плавления Т1С1 при 704 К АЯПЛ равна 15,564 кДж/моль.
17. Зависимость температуры плавления калия от давления (атм),
по Бриджмену, выражается уравнением
7 = 335,65+1,56-10-2 р—6,786-10-' Р*+1,55- 10-и Р3.
Определите температуру плавления и теплоту плавления при давлени-
давлениях 1,6000 и 12 000 атм, если AV = 0,0268 — 0,000174 (Т — 335, 65).
18. Вычислите фугитивность жидкого аммиака при 362 К- При рас-
расчете использовать данные [М.].
19. Вычислите фугитивность жидкого аммиака при 238 К- Давле-
Давление насыщенного пара аммиака Ps = 0,95 атм. Удельный объем пара
v = 1,215 л/г.
20. При плавлении белого фосфора зависимость температуры плав-
плавления и изменения объема от давления выражается следующими дан-
данными:
Р, а
AV,
тм . . . .
мл/кг . .
1
44,2
19,3
1000
73,8
17,9
2000
101,0
16,6
3000
126,8
15,4
4000
151,3
14,2
Рассчитайте Д#пл путем графической обработки экспериментальных
данных при Р = 2500 атм. Можно ли считать эту величину в интерва-
интервале Р = 1 -4- 2500 неизменной, если (АНПЛ}Р.\ = 648,52 Дж? .
21. Определите расход теплоты в процессе изобарного нагревания
1 кг гексана от tt — 20 до t2 = 100° С. Теплоемкость гексана не зави-
зависит от давления. Для расчета воспользоваться следующими данными:
(Ср)с,Н„ (Дж/г) =2,07317 + 3,9170-Ю-з^;
(ср)с.н„ (Дж/г) = 1,2254 + 4,5655-10~3/;
1322,65
igP (мм рт. ст.) = 7,1584 —-
240,40 +
22. Зависимость давления пара водорода от температуры между
1 атм и Ркр можно выразить следующим уравнением:
р= —-^— + 3,8015—6,104587"+0,003321777*+ 0,0432197Г».
164
При Т = 27',47 К Л#„ = 375, 3466 кДж/кг; 4 = 0,00613 кг/л;
dm = 0,06050 кг/л. Согласуются ли эти данные друг с другом?
23. Зависимость давления пара никотина Ci0Hi4N2 от температуры
выражается данными:
t, "С 170 185 190 200 209 221 228
Р, мм рт. ст.. 100 160 180 240 300 400 500
Постройте график Р = f (t) и определите Д#п и ASn при 200 °С.
24. На основании приведенной температурной зависимости давле-
давления пара жидкого висмута
(, °С 470 515 575 580 610 630 705
Р, мм рт. ст . . . 0,003158 0,003521 0,00492 0,00502 0,01203 0,0204 0,0832
выведите линейное уравнение зависимости \gP — / A/Г)(пользуясь
методом средних значений) и вычислите Л#п.
25. Какое количество воздуха необходимо пропустить через серо-
сероуглерод при 730 мм рт. ст. и 313,2 К Для извлечения 30 г сероуглерода,
если Д#п сероуглерода при Гн тк — 319,7 К равно 355, 765 Дж/г?
26. Давление пара жидкого брома изменяется с температурой по
уравнению
2210
lgP (мм рт. ст.)= —————4,08^7+19,82.
Выведите уравнение зависимости теплоты испарения брома от темпера-
температуры и рассчитайте изменение энтропии при испарении 1 моль брома
при температуре кипения C31,2 К).
27. Молярная теплота испарения тетрахлорида углерода изменяет-
изменяется с температурой по уравнению Д# = 10 960—10,53 Т. Определите
давление насыщенного пара СС14 при 333,2 К, если СС14 кипит при
348,2 К под давлением 1 атм.
28. Зависимость давления насыщенного пара этилового эфира от
температуры представлена данными:
/, °С , —10 0 10 20 30
Р, мм рт. ст. . . 114,8 184,4 286,8 432,8 634,8
Постройте график зависимости \gP от 1/Г и определите по нему мо-
молярную теплоту испарения эфира и его нормальную температуру кипе-
кипения.
29. Зависимость давления пара хлороформа от температуры пред-
представлена данными:
t.
р.
"С
мм рт.
ст. ...
20
161
30
248
40
369
50
535
60
755
Постройте график Р = f (T) и рассчитайте теплоту испарения хло-
хлороформа при 40 °С.
165
30. Зависимость давления насыщенного пара алюминия от темпе-
температуры представлена данными:
Г, К 1734 1974 2093 2237
Р, мм рт. ст. . . 0,67 10,00 29,8 100,6
По графику зависимости \gP от МТ определите температуру кипе-
кипения алюминия при 560 мм рт. ст. и выведите линейное уравнение за-
зависимости \gP от \1Т.
31. Воздух насыщен парами воды при 25 °С. При какой температуре
при неизменном содержании водяных паров относительная влажность
воздуха будет равна 80 %, если при 25 °С давление водяного пара рав-
равно 23,76 мм рт. ст. и удельная теплота испарения воды — 280090,8
Дж/г?
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. По зависимости давления насыщенного пара от температуры и
плотности данного вещества А с молекулярной массой М в твердом и
жидком состояниях (dTB и йж в кг/м3) в тройной точке (тр.т): 1) пост-
постройте график зависимости lg P от 1/Т; 2) определите по графику коор-
координаты тройной точки; 3) рассчитайте среднюю теплоту испарения и
возгонки; 4) постройте график зависимости давления насыщенного па-
пара от температуры; 5) определите теплоту плавления вещества при тем-
температуре тройной точки; 6) вычислите ATI АР для процесса плавле-
плавления при температуре тройной точки; 7) вычислите температуру плав-
плавления вещества при давлении Р Па; 8) вычислите изменение энтро-
энтропии, энергий Гиббса и Гельмгольца, энтальпии и внутренней энергии
для процесса возгонки 1 моль вещества в тройной точке; 9) определите
число термодинамических степеней свободы при следующих значениях
температуры и давления: а) Гтр.т, Ртр.т б) ТНшТшК, Р = 1 атм; в)
^н т к! ^*тр т- Необходимые для расчета данные возьмите из таблицы
(см. "с. 167)"
2. Для вещества А даны: теплота испарения, теплота возгонки,
плотности твердой и жидкой фаз dTB, dm при температуре тройной точ-
точки Гтр.т. На основании этих данных: 1) вычислите температуру кипе-
кипения вещества А по уравнению Трутона; 2) составьте уравнение lg.P,K=
= -у +b (а и Ь—константы) для равновесия жидкость =р* пар; 3) вы-
вычислите по полученному уравнению давление насыщенного пара А в
тройной точке; 4) составьте уравнение lg Ртв — -=г-\-Ь' для равновесия
твердая фаза *± пар; 5) вычислите APIAT для равновесия твердая
фаза ч± жидкость; 6) постройте график зависимости равновесного дав-
давления от температуры фазового перехода для трех фазовых состояний
в интервале давлений от 0 до 1,013-105 Па. В данном интервале давле-
давлений зависимость давления от температуры для равновесия твердая
фаза ч* жидкая фаза выражается прямой линией, т. е. API AT — const.
166
с
ъ
00 Ж
in со* со со о oi о
1П 1П 1П CD t~O)CD
Old «N С* Ol^Ol
О* OI СО* IO 00 СО 00*
SololololSol
с
о
soooo
СЧ0ХСО1Ф
CO — 00 Ol О)
oi oico ¦*¦*
ooooo
- -o-oo-oj
CD _ _ __
OIOI OIOI
с
oo
I
Ol t^Olt^ — O>
— — OIOI CO CO
0 0.0 00 0 0
о ч'со r~*O)*—
CO CO CO CO CO r^
03
с
13
Oi CO 00 t*«" 1П CO
Ol IO CO 1П CO IO
CO CD t^co ¦* О
t^Ol^OO COCO
— CNCOCO'* 1П
1ПО1 ¦* 1П CD t~
о — — — — —
С
&
i
13
COlONCOClOO
Р*ч СО CO CO Ol CO
CO* Ol* 00* CD* Ol CD
с
Ofl Г^ Ю CD CD "Ф
^-. CD CD Oi "Ф CO
«OOCDlOOlb-
coco ¦* iocdK
03
с
— О •* •* t^OI
in oo oi — со oi
f,-<f 00 —' СЧ t--
oi oo -*inin —
CT1 ¦* t^OCDCO
incDCDOO —
— Ol <MCO ¦* *
СЧО1О1О1 Ol Ol
с
a.'
b
OIOI OIOICO
— tCin r~*co*
00 О Ю Ю t^
OiOOiO>Ofl
OiCOOiOJCO
F"— CO t*4 Ol CO
— — — СЧ
CO OS t-* CO Oi
COOlOiCDOfl
CO &) Oi CD CO
oi —coin t^co
CO CO CD СЛ CD 1П
iococbcoco
300HH)
ЭО tO
in — Q
Ol O)CO
СО^СО
— OOl
00H-
*0H"—*of
со t^ r^ t^
l OIOI OIOI
od ^*ao oT
¦* 1П1О 1П C
OIOI OIOI
in op О) со-*
1П Ю 1П CD CO
Ol О OOlOl
Ol OIOI OIOI
CO 00 CO ¦*©
t^ t- 00 00O)
CO
CO COCO<
0H —С
— OIOIC
оо
СО
4* 4* 4». СО CO CO CO
Oi^Sfc ~ to *4 СЛ M
о от to
1333
1999,5
2666
3999
5332
7998
9997,5
СЛ ^. ^. *. * Ы
—• tO 03 СЛ ¦— -J
^ S tC 00 ~4 Cft
<?> C» i» Cft CO Ci
Ф ^ УЭ № U O)
- О Си *Ч 4a ^— Qi
~сл?д"сл
183,2
188,0
196,2
199,2
' 203,7
-
ел со >— S5 c*s
COO 00 ОО С*5
СП О О щ со
201
203,7
214
216
230,2
244,0
4665,6
5305
7198
7998
13 328
21 728
§!
§§!
Ю — КЗ Ю SO SO
яг оо ^j ел сл rf».
ВО- СО_6О|С
о to soooV—
CO CO CO CO CO I
»—_ _ о О I
Ci СЛ СП rfk W ЬЭ
со а» ~ oi ~J a>
OOOOOO-IS
¦^J CO ~ 00 СП
ы_сяроооо
l i l 1 "
^O _CO VO
so so so кг to № to
tocnuoswo
О СЛ ^O
to
3
Ш
О "- СП 00 СЛ (j3 Is»
со to ~
0SO00
en *- со to
S000SO00
00 CD СЛ rf^ OJ О-Ч SS2
O3CT> OOOtO — CT>
ffi Ol СП "О Ф ^ 1С
слоямово
Ю Ю Ю to M
ОТ СЛ 4ь. ^. ^. CO
со so to оо а*- ст>
СЛ Ф О Ю О W
О *- * a 4
a «
О ?з ?f
Ji.ft.-tiV
от if •
СЛ
00
00 0u "*3 '-J ^4
-oiooeoi
4* Ю Ю NSO5
Ю SO— — ~
ЫОООЧА.
S O? 3 S 0J
N5 бОбОбОЮ ЬЭ
00 ОО 00 00 ~4 -^
05 C^ CO >— У? -^
~~J En3 tO 4^ Ю NO
со io кг so ю •—
bS <.?> Сз аз О 00
t?> КГ Oi ^ Ю С7Э
Si. Й. *^2 ^
°o о
я
CO
ант
Л
31
>
да
•
g
8
о
г*
3
да
S
о
3
%
к
g
X
л
со оз со со gj О->
СП СП *. 4к СО OJ
СО СО 00 СО 00 *•
-J SO SO SO *> О")
SO Q ~4 СЛ СО Si
CT> CO ОЭ СО ОЧ CD
O5 to CO CO *чЗ ^J
O2 CO CO
~*3 O5 Оэ СП СЛ *
CO 00- W 00 СлЗ GO
00 00 00 ti --8 to
SO »?
..... sggg
ks ^ solo "ьэ
tO 00 —1 03 СЯ
О5 COOJ COCO
'J Ю ОО О1 ^- SI
оовспохощ
«:¦ — re so он 01
to to to so tv>
en w~
to
l
¦ *o so so
s- *x» -4 iyi со so
"¦~j"^k"cn
49 W О <O <O 00 Ст. С» ел ix) so
••¦ КЭ O> tO Ю
00 to
г ffi № (Г
> ст> <J> to
Ш
ОЭ 00-^1 О5 4ПСЛ
4 C CnO5tO СЛ
—a -~» 00 сп оа —
tn re — О СП «С
ш
-^1 00
— "•— 00 O>
f-3b7*
to
Ol
a.
Ш
^3 Qj 03 t
«} Э1 УЗ t
. СО
' ел z
lS
*- О О О О '
СП^-J ^ C^^p- <
- '-O CTi
tO Ю N5 tO to tO
c» 00 00 00 00-^1
j-^a pi \js ^- о ел
СЛ SO OJ --J "Ю "--1
00 00 GO 00 -~3
_сл *, to о -ча
-^J O5 O3 СП СЛ 4*-
-^J t?) -— ^J Ol 00
C*j CO to to to -^J
~~ 00 00 00 00
•^. U*. O5 O3 C?s 00
to to oo "^i en —
00 06 -4. .
•о ьа ч кэ oo w
~л ei <o "~> a> to
¦— *. Ou 00 -& O3
— О Q W '^ ^
W5 О
Ю СЛ ^ i:.O <S>
ю to *¦ en 01
to to to 00 00 00
O5 4k .— 00 OlO
СЛ ^. -b ^ CO Ю
to — со -a f-э en
tO to *» О «5 0»
(Ж OO OlOi » С»
СП --1 СЗ "ч N3 О
К) ЬЭ SOts» (О
tO SO tC КЗ tO (s3
to Э) Ч *^ N ^.!
jD Qt^i QfJ CTipl rf>=
г.
Продолжение табл.
Л6 вари-
энтэ
91
00
АА
04
0А
Твердое
Г, К
423,5
433,2
437,7
441,2
444,2
448,2
223,2
237,2
246,2
252,2
253,2
418,0
446,5
460,2
474,9
490,5
377,2
381,2
383,2
386,2
389,7
392,2
состояние
Р. Па
23 994
31325
35 324
39 323
43 322
47 454
133,3
466,5
799,8
'1213
1319
133,3
667,0
1333,0
2666,0
5332.0
7 064
8 531
9 331
10 397
11997
13 997
Жидкое
Т. К
446.4
448.2
451,2
460
470
480
244,2
253,2
270,1
282,5
285,7
490,5
504,8
523,0
552,0
583,2
612
373,2
388,2
392,2
393,2
397.2
401,2
состояние
| Р. Па
47000
47 454
49 987
55 986
63 317
71345
1200
1319
2465
3865
4398
5332,0
8020,0
13300
26 600
53 320
101 308
10 662
12 397
13 997
14 796
16 929
19 462
Условия
Л* = 152
Р = 6ОО-1О5 Па
dTB = 985
dm = 977
Л1=154
Р=60,8-105Па
dTB = 1680
da, = 1650
Л* =174
Р=220-105 Па
dTB = 954
d«=948
Л* = 254
Р=2Ш-105Па
dT8 = 3960
dw=3900
№ вари-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
Вещество А
Zn
Си
Ag
К
Bi
Hg
KF
NH8
снхоон
г. К
692,6
1356,1
1234,1
336,65
644,15
234,35
1159,1
386,7
266
199,15
256,4
Теплота
испарения
10-Л
Дж/моль
12,84
32,09
25,54
8,77
17,42
6,45
18.04
4,53
3,22
2,41
2.97
Теплота
возгонки
Ю-4,
Д ж/моль
12,84
33,39
26,67
8,99
18,50
6,68
20,68
' 6,08
4.27
3,18
4,12
dTB-lo-3,
кг/м3
6,914
8,41
9,68
0,851
9,350
14,19
2,43
4.820
3,14
0,810
1,266
кг/м*
6,920
8.37
9,32
0,830
10,240
13.69
1,914
3,970
2,93
0,664
1,053
3. Вещество А испаряется при температуре Т. Вычислите удельную
теплоту испарения при этой температуре. Составьте уравнеиие зависи-
зависимости теплоты испарения вещества А от температуры. Теплоемкости на-
насыщенного пара и жидкости возьмите из справочника, приняв, что в
170
данном интервале температур они постоянны. Теплоты, испарения при
нормальной температуре кипения приведены в таблице.
№ вари-
варианта
1
2
3
4
5
6
7
8
9
10
!1
12
13
14
!1
12
13
14
15
16
17
!8
19
20
21
22
23
24
25
Вещество А
TiCU
HNO3
Вг2
Н2О
CS2
ССЦ
Hg
СН2О2 (муравьиная кис-
кислота)
СНчО (метаиол)
СгНчОг (уксусная кисло-
та)
С2НеО (этанол)
С3Н6О (ацетои)
С6Н6 (бензол)
С7Н8 (толуол)
к-С6Нц (гексаи)
ГН.Т.Н> К
409
357
331,5
373.2
319,5
350
630
373,6
338
391
351,5
329,3
353,2
384
342
ДНИС11 "Р"
'"h.t.hi
кДж/иоль
35.75
38,2
29,6
40,7
26,8
30,0
59,3
22,3
35,3
45,0
39,5
98,3
30,8
33,2
28,9
г. К
309
300
270
300
250
300
550
320
300
320
300
280
300
320
290
460
400
400
450
370
400
700
400
400
450
400
370
400
450
4. Сухой воздух, занимающий при температуре Tt и давлении Р
объем V, пропущен над веществом А при температуре Т2 и насыщен
парами этого вещества. Насколько изменится масса вещества после
пропускания воздуха? Давление паров вещества А при температуре Т2
взять из таблиц [М.]. При расчете учтите, что общее давление в систе-
системе в течение всего процесса остается неизменным и равным Р.
вари-
га
1
2
3
4
5
6
7
8
9
10
1!
12
13
s-Г
283
285
287
289
291
299
295
297
299
301
285
287
289
р.Ю-*,
Па
9,91
9.97
10,05
11,12
9,71
9,78
9,85
9,91
9,97
10,05
10,12
9,71
9,78
N
S
ьГ
3
4
5
6
7
8
9
10
2
3
4
5
6
Вещество
А
н2о
н2о
нао
нао
нао
СС!4
СС14
СС14
СС14
СС14
СНдОН
CHSOH
сн„он
тг. к
363
353
343
333
323
333
318
313
308
303
308
303
298
вари-
та
*§
14
15
16
17
18
19
20
2!
22
23
24
25
г,. К
191
293
293
295
297
299
301
283
285
287
289
291
1
О
о. С
9,85
9,91
10,05
10,12
9.71
9,78
9,85
9,71
9,78
9,85
9,91
9,97
N
S
ь:
7
9
7
8
9
10
2
2
3
4
5
6
Вещество А
СНдОН
сн„он
СНяСОСН,
СН3СОСН3
СН3СОСН3
снасосн3
CHsCOCHg.
с6н6
с6н6
с6н6
с6нв
с6н6
т„ к
293
288
323
318
313
308
303
343
333
323
313
303
5. В сухом воздухе при Т при диспергировании вещество А испари-
испарилось, превратилось в насыщенный пар при неизменном общем давле-
давлении 1 атм и охладило воздух. На сколько градусов понизилась темпера-
171
тура воздуха? Для расчета принять, что в исследуемом интервале тем-
температур: 1) Na, O2, пары А являются идеальными газами; 2) тепло-
теплоемкость N2, О2 и паров А постоянна; 3) теплоту испарения А вычис-
вычислите по зависимости давлеиия насыщенного пара от температуры [М.].
s
о.
1
2
г, к
303
298
Вещество А
Н,0
СС14
№ варк- 1
анта
3
4
Г, К
286
283
Вещество А
сн,о,
муравьииаи
кислота
СН>0 метило-
метиловый спирт
№ вари-
анта
5
6
г, к
293
308
Вещество А
С4НМО диэти-
ловый эфир
СзН6О ацетон
Задача решается графически; ответ к варианту № 1: АГ = (—19±
±1)К.
6. По зависимости давления насыщенного пара от температуры (см.
условие многовариантиой задачи № 1), методом наименьших квадра-
квадратов опишите экспериментальные данные с помощью уравнения \gP --
= —r + b, составьте программу для микрокалькулятора или в случае
затруднения воспользуйтесь готовой программой, которая приведена
в конце пособия.
ГЛАВА XII
ТЕРМОДИНАМИЧЕСКИЕ ХАРАКТЕРИСТИКИ РАСТВОРОВ
И ПРОЦЕССОВ ИХ ОБРАЗОВАНИЯ
Основные уравнения и символы
[Г., т. 1, с 168—161, 169—178]
Способы выражения концентраций двухкомпонентных растворов:
массовое соотношение
Wf = tnf/tnt (XII, 1)
где т% — масса /-го компонента в растворе; т — масса раствора. Мас-
Массовая доля, выраженная в процентах,
= m, 100/m;
молярное соотношение
172
(XII.2)
где rii — число молей растворителя; пг—число молей растворенного
рещества;
молярная доля
(XII.3)
молярная доля соответствующего компонента, выраженная в процен-
процентах,
Моляльность т — число молей (пг) растворенного вещества, приходя-
приходящееся на 1000 г растворителя. Молярная концентрация с—число мо-
молей растворенного вещества (п2), содержащееся в 1 л раствора.
Среднюю молекулярную массу раствора М рассчитывают по урав-
уравнению
М=х1М1+х,Мг. (XII.4)
Парциальные молярные величины L; определяют по соотношению
' \ dnt jP.T.n/ х
где Lo6n, = общее (среднее) экстенсивное свойство раствора; П] со-
соответствует nlt п2, п3, ..., пк.
Парциальными молярными величинами могут быть объем, энталь-
энтальпия, энтропия, энергии Гиббса и Гельмгольца:
dH
dnt Jp-T-n/ \ dnt JP.T. я
dnt /Р.т.п/ \ dnt )p-r-nj
где Vt, Ht, Si, Gi — парциальный молярный объем, энтальпия, энт-
энтропия, энергия Гиббса. Парциальная молярная энергия Гиббса /-го
компонента соответствует его химическому потенциалу:
Ог = цг. (XII.6)
Производная химического потенциала /-го компонента по температу-
температуре соответствует его молярной парциальной энтропии:
dT
где fi — химический потенциал.
где \i — химический потенциал.
Парциальные молярные функции смешения Д/.Г (относительные
парциальные молярные величины) определяют по формуле
Д Lf = It — L,°, (XII.8)
173
где Ц — экстенсивная функция L /-го компонента в стандартном со
стоянии. К парциальным молярным функциям смешения относятся:
bV? = Vt — V°t; ДЯ^=Я( — Н\; ASJ" = Sf —S°t; &.G™ = G,—G°;
ЛЯ" — энтальпия смешения /-го компонента, называемая дифферен-
дифференциальной теплотой растворения. Энергию Гиббса смешения опре-
определяют по формуле
ДО^ = Дцг = цг-ц?; (XII.9)
ц? — химический потенциал /-го компонента в стандартном состоянии,
а энтропию смешения вычисляют по формуле
Соотношение между парциальными молярными величинами описы-
описывается уравнениями Гиббса — Дюгема:
(XII.11)
Xt, (XII. 12)
x%, (XII. 13)
p,t,Xi
) (*•). (XII. 14)
/р. Г, хг
AL^T = ALyin1 + AL:f л„, (XII.15)
где Д/.?нт — интегральная функция смешения;
Д L
инт -,ALm==ALmJCj + ALB,je (XII.16)
Lm )
пг /P. г. в,
(XII.17)
Так, например, для энтропии смешения и теплоты смешения уравне-
уравнения имеют вид
где Д#т — интегральная энтальпия смешения (интегральная теплота
растворения, или относительная интегральная энтальпия);
. (ХПЛ8)
р,т
174
— интегральная теплота растворения для предельно разбавлен-
разбавленного раствора (вычисляют экстраполяцией); L2 — парциальная моляр-
молярная теплота разбавления от данной концентрации до концентрации в
предельно разбавленном растворе.
Кажущееся молярное свойство L второго компонента фЛ2 опреде-
определяют по уравнению
*.общ = Я1 *-? + «*ft,; У|..= *-°6вд~П1*-' .„ (XII.19)
Свойства идеальных растворов описываются уравнением Рауля
Pi = P°t*?, (XII.20)
где Pi — парциальное давление насыщенного пара /-го компонента в
растворе; Р? — давление насыщенного пара чистого /-го компонента
раствора; х? — молярная доля /-го компонента в жидкой фазе.
Соответственно функции смешения идеальных растворов имеют зна-
значения:
Д17 = 0; Atf^=0; & S? = -R Inxt; (XII.21)
ДС? = Дцг = Я7Ч|игг, (XII.22)
а химический потенциал компонента идеального (совершенного) рас-
раствора будет
цг= ц? + RT In xt. (XII.23)
Для неидеальных растворов уравнение Рауля (XII.20) непримени-
неприменимо, так как Pt Ф P\xf и функции смешения неидеальных растворов
не равны: AV? Ф 0; &.Н™ Ф 0. Для описания свойств реальных
растворов вводят понятие активности
(XII.24)
AS{"=—~ -Я In a,- (XII.25)
где at — активность (эффективная концентрация) /-го компонента в
растворе. Активность at определяют по соотношению a* = ftlf\ (при
Р и Р° < 1,0133-10» Па).
a/ = Pf/P» (XII.26)
ИЛИ
a( = *fYf, (XII.27)
где ft, ft — фугитивность /-го компонента в растворе и в стандартном
состоянии; Yf — рациональный коэффициент активности. Химиче-
Химический потенциал компонента неидеального раствора определяк>т по
уравнению
j. (XII.28)
175
Активность (коэффициент активности) зависит от температуры. Эта
зависимость выражается уравнениями:
~~'~ ., (XII.30)
" aur,) Уцтг) 2,3^,7-!
Теплоты растворения, разбавления и смешения раствора рассчиты-
рассчитывают по уравнению
?=ДЯ1-иС (XII.31)
где АЯтон, ДА^нач — интегральные теплоты растворения для конеч-
конечного и исходного растворов. При расчете учитывают количества раст-
растворов.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Вычислите молярную долю метилового спирта в 60%-ном водном
растворе.
Решение, Согласно уравнению
СН»ОН
исн.он 1с_н?9н1^ сн»он
/n
CHsOH
/jMCH,
Если взято 100 г раствора, где т, — массовая доля /-го компонента в
растворе, выраженная в процентах, то
•*сн,он = 60/32 + 40/18 -0>458)
или молярная доля СН3ОН будет х100=45,8 %.
2. Вычислите молярную долю Хна в 1 М водном растворе НС1.
Решение. Согласно уравнению (XI 1.3)
oi8
HCI ~ пнс1 +mHta!MH,o m+100°/!8 So.SS
лнс!=т=1; тн>о=1000г; 1000/18 = 55,55.
3. При 293,2 К плотность 60%-ного водного раствора метилового
спирта 0,8946 г/мл. Вычислите объем 1 моль раствора.
Решение. Вычисляем объем I г раствора:
у=-—=- ¦— = 1,118 мл/г.
х 0,8946
Вычисляем среднюю молекулярную массу раствора М по уравне-
уравнению (XII.4). Определяем молярную долю СН3ОН по уравнению
___60/32
хсн,он - 60/32+40/18 ~ '4 '
176
а Хцг0 = 1—0,458 = 0,542. Тогда
Рассчитываем объем 1 мояь раствора У72я,- = V7W,
У,.л=—^-— = ! ,118-24,41=27,29 мл/моль.
4. Объем раствора как функция состава для системы Н2О — NaCl
определяется уравнением
16,4/n4-2,5m*—1,2/п3,
где т — моляльная концентрация растворенного вещества. Определи-
Определите парциальный и кажущийся молярные объемы 0,5 М раствора NaCl.
Решение. Согласно уравнению (XII.5)
v / dv
пн,о = 1000/18 = 55,55 ~ const; пклс. — т- Продифференцировав
исходное уравнение, выведем уравнение для парциального молярного
объема
^ am j
Так как т = 0,5, то V2 = 18,0 мл/моль.
Определим кажущийся молярный объем по уравнению (XII. 19):
«нгО VKso)/«NaCb
Из уравнения условия задачи вычисляем Кобщ = 1008, 575. Подстав
ляя значение 1/общ в (XII. 19), получаем
<JV = A008,575— 55,55-18)/0,5= 17,35 мл/моль.
KNaCI
5. Вычислите методом пересечения парциальные молярные объемы
воды и метилового спирта для 60 %-го раствора метанола при 293,2 К.
Для расчета используйте данные о зависимости плотности растворов
метанола от концентрации:
Спирт, % ... 0 20 40 60 §0 90 100
d, г/мл . . . 0,9982 0,9666 0,9345 0,8946 0,8469 0,8202 0,7917
Решение. Пересчитываем массовые доли, выраженные в прс-
центах, з массовые соотношения, а плотности •— в удельные объемы
и получаем
CHSOH, % „
а>сн,он
V, мл/г , .
0
0
. 1,002
20
0,2
1,035
40
0,4
1,070
60
0,6
1,118
80
0,8
1,181
90
0,9
1,219
100
1
1,263
177
Строим график зависимости V = f (а>сн,он) (рис. 16). Проводим
касательную к кривой в точке, соответствующей 60%-ной СН3ОН.
Отрезки на осях координат дают парциальные удельные объемы V,-:
V'ch.oh = 1,244 мл/г; Vh8o = 0,931 мл/г. Парциальные молярные
объемы V» находим по уравнению V,- = VjM,-:
VCHiOH =1,244-32 = 29,8 мл/г;
FHjO = 0,931-18=16,78 мл/г.
6. Вычислите относительный AVch.oh и кажущийся еру
CHjOH
парциальные молярные объемы метанола в водном 60 %-ном растворе.
Для расчета используйте зависимость удельных объемов растворов
СН3ОН от концентрации:
сн,он,
^CHsOH
V, мл/г
% . .
. , , .
• *
0
0
1,002
20
0,2
1,035
40
0,4
1,070
60
0,6
1,118
80
. 0,8
1,181
90
0,9
1,219
100
1
1,263
Решение. Относительный парциальный молярный объем Усн.он
вычисляем по уравнению
д ^сн.он = ^сн, он~~ ^сн, он ^сн.он •
АК™н,он = 39,36 — 1,263-32 =— 0,786 мл/моль.
Кажущийся молярный объем фу вычисляем по уравнению
CHjOH
ИСН„ОН JfGH.OH
V
Vm = =27,90 мл/моль;
2 tii
VfoiO = 18,02 мл/моль; xCHi0H =0,458; xHjO=0,542.
После подстановки чисел и вычислений получаем 4VCH Он ~
= 39, 60 мл/моль.
7. Для водных растворов метанола при 298 К получены значения
парциального молярного и кажущегося парциального объемов мета-
метанола:
*CHj0H . 0,123 0,272 0,458 0,692 0,835
*7(«1+и»Ь мл/моль 20,4 23,3 27,3 32,7 36,3
рснгон , мл/моль . „ 37,8 39,0 39,8 40,4 40,4
Йн,о» мл/моль ......... 18,0 17,5 16,8 15,4 15
<р,,' , мл/моль 37,25 37,4 38,3 39,2 39,9
G8
Какие выводы можно сделать из приведенных значений?
Решение. Парциальные молярные объемы тем больше отлича-
отличаются от объемов компонентов в чистом состоянии, чем более разбавлен
раствор. Кажущиеся объемы тем меньше отличаются от парциальных
молярных, чем более разбавлен раствор.
цмф
1,30
15
10
О 0,2 0,4 0,6 Ofi 1,0
А
/А
«**
iff
л
Рис. 16. Зависимость
объема раствора СН3ОН
в НгО от молириой доли
Рис, 17. Зависимость интег-
интегральной теплоты растворения
H2SO.} в воде от соотиошешш
молей воды и кислоты
8. Вычислите дифференциальные теплоты растворения серной кис-
кислоты Qh,so4 и воды Qh2o Для 84,5 %-ного раствора. Используйте
данные о зависимости интегральной теплоты растворения от концент-
концентрации при 298 К:
__ " Q
пн so
-ДЯт, кДж/моль ... О
0,5 1 1,5 2 3 4 6
15,73 27,8 35,90 41,45 48,92 53,89 60,23
Решение. Концентрации выражены таким образом, что число
молей растворенного вещества пг остается постоянным, а число молей
растворителя изменяется. Значение А#т соответствует теплоте образо-
образования раствора, содержащего 1 моль H2SO4 и г моль воды. Поэтому
целесообразно без дополнительных пересчетов, построив график
А#т = / (г), найти А//нго методом касательных, a A#h,so« вы"
числить по уравнению Гиббса — Дюгема. Выражаем концентрацию
84,5 %-ного раствора как молярное соотношение
Г —
"н.о _
" ™
"h.so. 18-84,5
—— ! .
179
Строим график АНт = f (r) (рис. 17). В точке кривой, соответст-
соответствующей г = 1, проводим касательную. Согласно уравнению ^
= tga
а 13,56
tga = — =—-—=4,52,
о о
д ян,О =Qh,O= -'8.92 кДж/моль,
значение Qh2so4 рассчитываем по уравнению (XII.15):
или
27,8=1 (-18,92) + l(QH,so.).
QHjSOl =46,72 кДж/моль.
9. Вычислите дифференциальные теплоты растворения серной кис-
кислоты и воды для 84,5 %-ного раствора методом пересечений, если при
298 К зависимость интегральной теплоты растворения от концентра-
концентрации выражена значениями:
г, = -М. О 0,5 1 1,5 2 3 4 5
—ДЯт, кДж/моль ... 0 15,73 27,8 35,90 41,45 48,92 53,89 60,23
Решение. При использовании метода пересечений концентра-
концентрации выражают или в молярных долях х, или в процентах wt. Интег-
Интегральную теплоту растворения относят к 1 моль раствора, по-
этоМу значения г и АНт пересчитывают на Xh,so4 — 1/(г + 1) и
ДЯт/(п1 + п2) = &НтХн?о,- Исходные данные и результаты расче-
расчета запишем в виде:
г .0,5 1 1,5 2 3 4 6
*HjSOi 0,666 0,5 0,4 0,33 0,25 0,20 0,15
—hi, кДж/моль . . . 15,73 27,8 35,90 41,45 48,92 53,89 60,23
—\Нт *h,so4 • кДж/моль 10,47 13,89 13,93 13,80 12,23 10,82 9,03
Д//т
Строим график в координатах —— ^h,so4 (рис. 18). Мо-
Молярное соотношение 84,5 % -ного раствора г = 1; молярная доля
¦*h,so4 = 0,5. В точке кривой, соответствующей абсциссе 0,5, проводим
касательную. Точки пересечения касательной с осями ординат дают
значения дифференциальных теплот растворения: а—воды, Ь — сер-
серной кислоты; AtfS,so4 = — 8,87 кДж/моль, А#на0 = — 18>91
кДж/моль.
180
0,091
70,9
0,
69
130
,5
0
72
,200
,7
0,259
82,6
10. Определите парциальные молярные теплоемкости НС1 и Н2О
в растворах, для которых молярные доли и теплоемкости приведены
ниже:
хНС1 0,000
Теплоемкость раствора, содер-
содержащего 1 моль Н2О, Дж/К 75,3
Решение. Сначала определим парциальные молярные теплоем-
теплоемкости второго компонента (НС1), так как приведенные теплоемкости от-
относятся к растворам, содержащим постоянное количество первого ком-
79'5\—
-ал"
кДж/моль
4
Л
0,5
1 X,
Рис. 18. Зависимость теплоты раство-
растворения серной кислоты в воде от мо-
молярной доли раствора
0 3.05 010 015 0.20 025 пЗО 0,35 п
Рис. 19. Зависимость теплоемкости
водного раствора НС1 от содержа-
содержания НС1 в растворе
ионента (Н2О). Таким образом, искомыми будут произодные f-^-)
для всех растворов. Каждая из этих производных может быть получе-
получена графически (рис. 19) как тангенс угла наклона касательной к кривой,
описывающей зависимость С от п2. Рассчитаем необходимые для по-
построения графика значения п2 для всех растворов, воспользовавшись
выражением, определяющим молярную долю:
4 = —•
пх + пг
По условию пх = 1, тогда п2 =- хг1хъ п'% = 0,0; п = 0,091/0 909 =
= 0,1; «Г = 0,130/0,870 - 0,149; п'{" - 0,200/0,800=0,250; п =
- 0,259/0,741 = 0,350.
По графику определяем производные, соответствующие парциальным
молярным_ теплоемкостям НС1: С[ = — 12,9; С? = — 8,2; С'2" —
= 1,5; С2'" = 11,5; С'г"" = 18,6. Парциальные молярные тепло-
теплоемкости воды вычисляем по уравнению
C=nlCi+ni~Ct или ^^С—п^Ся,
С: = 18;
С* = 16,93 + 0,182-0,1 = 17,75;
181
CJ* = 16,65 + 0,149-1,5= 16,87;
C'^"= 17.36—0,25-11,5= 14,48;
C\"" = 18,75—0,35-18,6= 12,24.
11. Вычислите активность и рациональный коэффициент активности
ацетона в водном растворе, если хаЦетон — 0,318, Рацетон — 152 мм
рт.ст., Рацетон = 229 мм рт. ст. Дайте заключение о характере отклоне-
отклонения раствора от идеальности.
Решение. Активность вычисляем по формуле (XII.26):
аацетон= 152/299 = 0,664.
Коэффициент активности — по уравнению (XI 1.27):
7ацетон = 0,664/0,318 = 2,09;
Уацетон > 1 • Отклонения от закона Рауля положительные.
12. Вычислите химический потенциал и изменение химического по-
потенциала при растворении ацетона в воде, если хаЦетон = 0,318,
^"ацетон = 152 мм рт. ст., Р°цетон = 229 мм рт. ст. Остальные дан-
данные возьмите из справочника [М.].
Решение. Изменение химического потенциала при растворении
вычисляем по уравнению (XII.28):
А Цацетон = Цацетон — ^ацетон = RT 'паацетон =
= 8,31-2,3-298 lg 0,664 = 0,013 кДж/моль.
Так Как (Аацетон == ^Сацетон, ВЫЧИСЛЯеМ АСацетон ПО уравнению
(VII. 37), необходимые данные берем из справочника [М.]. Откуда
Дбацетон = — 155,50 кДж/моль, и по уравнению (XII.9) получаем
Цацетон = —155,50+1,01 =—154,4 кДж/моль.
13. Зависимость давления (Па) насыщенного пара чистого серебра
и серебра над твердым раствором Ag — Аи с молярной долей Ag 30 %
от температуры описывается уравнениями:
16350
+12,805,
15 250
+11,118.
Выведите уравнения зависимости относительного химического по-
потенциала серебра для 30%-ного раствора Ag—Аи от температуры
Решение. Из уравнений (XI 1.9), (XI 1.26) и (XI 1.28) следует;'
А^Аг = ^Ag — V%g, Ац = RT 2,3 lg PAg — RT 2,3 lg P°Ag. Подстав-
Подставляем в это уравнение lg P = / (Т) и получаем
15250 16350 \
т + П, 118+-^--12,805],
# = 8,314 Дж/(моль-К) и ^—^ = 21024—32,267.
182
14. Вычислите относительную парциальную молярную энтропию
серебра Д5дг для раствора Ag — Аи с молярной долей серебра 30 %,
если зависимость давления (Па) насыщенного пара чистого серебра и
серебра над твердым раствором от температуры выражается уравне-
уравнениями:
Решение. Относительную парциальную молярную энтропию
серебра определяем по уравнению
Для этого находим производную j—— L х , дифференцируя урав-
уравнение Дц.Аг = / (Т),
( —)рх =—32,26 Дж/моль, Д S? =32,26 Д ж /коль.
V дТ I • Ag ^
15. Вычислите относительную парциальную молярную энтропию
воды А5н,о для 84,5 %-ного раствора серной кислоты при 25 °С.
Давления насыщенных паров воды над водой и над раствором равны
3,167-103 и 5,198 Па соответственно.
Решение. Относительную парциальную молярную энтропию
воды вычисляем по уравнению (XII.25). Для расчета активности во-
воды используем уравнение (XII.26). ДЯн.о = — 18,912 кДж/моль.
Подставляем числа в уравнение (XII.25):
38 912 5 198
АS =238314 lg 102
АSH.° i982>38'314 lg 3,167-103 ~10'2
16. Вычислите теплоту растворения ?раств H2SO4, массой 40 г
в 160 г воды. Используйте данные о зависимости интегральных теплот
от концентрации, приведенные в справочнике [М.].
Решение. Процесс растворения можно представить схемой
tii (H2O) -f n2 (Нг5О4) =раствор.
Теплоту растворения ?растн вычисляем по уравнению (XII.31)
?раств = ЛЯтп2 (теплоты растворения для чистых веществ равны
нулю), где АНт — интегральная теплота растворения, отнесенная
к 1 моль серной кислоты. Значение А#т находим в справочнике [M.L
Так как в справочнике концентрации выражены в молярных соот-
соотношениях г, то
183
По значению г находим в справочнике [МЛ интегральную теплоту
растворения, равную—-71,71 кДж/моль. Затем определяем число
молей H2SO4:
40/98 = 0,408
и вычисляем <?'рас,,,-
</раетв==0,403{ — 71,71) = —29,25 кДж.
17. Определите тепловой эффект разбавления ^разб раствора
NaOH, содержащего 30,8 % NaOH, до содержания его 0,443 %.
Решен»*, е. lliia s условии задачи количества растворов не
указаны, то рас;-;' ' - , ~ \ - <¦ -ь растворенного вещества по урав-
уравнению (XI!.31.), Г,г. . --, ^йя можно описать схемой
раствор 1 C0,80о)+«(НгО)=раствор 2 @,443%).
Тогда
щ — ^Н^ (раствора 2) — Д//J" (раствора 3).
Пересчитаем массовую долго NaCl, выраженную в процентах, на мо-
молярные соотношения г. Согласно уравнению (XII,2) г = яи,О''«ыаон:
69-2-40 ¦ 99,55-40
, _ —. „ 5; г _ _—! __.500,
д 18-30,8 * i8-0,443
и по справочнику [M.J найдем интегральные теплоты растворения:
АН? = 37,76 а ДЯ? ~ — 42,36 кДж/моль. Вычисляем ^разб:
9разб= —42,36-' ( —37,76) = —4,6 кДж/моль.
18. Определите тепловой эф^^хт растворения 0,1 кг газообразного
хлороводорода при 298 К и 1,013-10s Па в 3 кг 10 %-ного водного
раствора НС1.
Решение. Процесс растворения можно представить схемой
раствор l-j-HCl (г) = раствор 2.
Теплоту растворения драств вычисляем по уравнению (XII.31):
</раств =(% + «!!) A Hf— пг Д Я«,
где пх — число молей соляной кислоты в растворе 1; я2 — число мо-
молей газообразного НО, растворенного в 10%-ном водном растворе
НС1.
Вычисляем Пн,о, ni> пъ-
3000-0,9 г 3000-0,1
«н,О=-"~^^-=150; %=—15J—-8.219;
2739
Выражаем концентрации растворов как молярные соотношения гъ
r1==^L = -^- = 18,26;
и, 8,2!9
По справочнику [МЛ находим интегральные теплоты растворения, а за-
затем линейной интерполяцией (при расчетах, требующих высокой сте-
степени точности, лучше применять графическую интерполяцию) полу-
получаем
д#ст = 71,6; Aff»=-70,6 кДж/моль.
Вычисляем qpaers:
<7pacTB=(8,2!9-f2,739) ( —70,6)—8,2!9 (-7! .6) = - 185,2 кДж.
ЗАДАЧИ
1. В Ы0~3 м3 раствора бромида натрия содержится 0,3219 кг
NaBr. Плотность раствора при 293 К равна 1233,2 кг/м8. Выразите кон-
концентрацию раствора: 1) в молях соли в Ы0~* м* раствора; 2) в мо-
молях соли на 1 кг воды; 3) в молярных долях; 4) в процентах; 5) в мо-
молях воды на 3 моль NaBr.
2. Плотность 60%-ного раствора ортофосфорной кислоты при 293 К
равна 1426 кг/м3. Определите количество молей Н3РО4: 1) в 1 л раст-
раствора; 2) в 1000 г растворителя. Чему равна молярная доля кислоты
в растворе?
3. Плотность 5,18%-ного раствора фенола в воде равна 1,0042 г/см3.
Плотность воды равна 0,9991 г/см3. Выразите состав раствора в молях
фенола на 1 моль воды и в молях фенола в 1л раствора. Чему равен
удельный объем фенола в растворе, если считать, что удельный объем
воды не изменяется при образовании раствора.
4. При 80°С плотность 12 %-ного раствора фенола в воде равна
0,9775 г/см3. Какое количество воды приходится на I моль фенола?
Чему равен удельный объем фенола, если удельный объем воды равен
1,029 см*/г и образование раствора происходит без изменения объема?
5. Плотность CS2 при 293 К равна 1,264 г/см3, плотность С2Н5ОН—
0,8040 г/см3. Чему равна плотность смеси, содержащей 80% CS2.
если удельный объем ее является аддитивной функцией состава?
6. Плотность 10%-ного раствора NH4C1 равна 1,029 г/см3, плот-
плотность твердого NHjCl — 1,536 г/см*, плотность воды — 0,9974 г/см3.
Определите изменение объема при образовании 100 г 10%-ного раство-
раствора.
7. При 283 К плотность С2Н5ОН равна 0,7936 г/см8, плотность во-
воды — 0,9991 г/см3, плотность 50%-кого раствора сгшрта в воде —
0,9179 г/см8. Определите величину сжатия при смешении 50 г спир-
спирта с 50 г воды, если удельный объем воды при этом изменяется. Срав-
!85
ните удельный объем чистого спирта с его удельным объемом в раст-
растворе.
8. Определите графически парциальный молярный объем 0,4 т
раствора FeCl3, используя следующие данные:
0,0000 0,0126 0,0257
Число молей FeCU в 100 г воды
Объем раствора, содержащего
100 г воды, см3 100,13
0,0394 0,0536
100,58 100,98 101,38 101,73
9. Определите графически парциальный молярный объем 0,3 т
раствора CuSO4, если известны следующие данные:
CuSO4 в растворе, % .... 1,912 3,187 4,462 5,737
Плотность раствора, г/см . . !,0190 1,0319 1,0450 1,0582
10. Зависимость удельного объема v водного раствора пероксида
водорода от массовой доли w H2O2 выражается уравнением
v = 1,003 A — w) -}-О,6935оу—0,036и) A — w).
Рассчитайте парциальные молярные объемы Н2О и Н2О2 для раствора,
в котором w ~ 0,4.
11. Определите парциальный молярный объем метилового спирта
(СН3ОН), если плотность 60%-ного водного раствора спирта при 293 К
равна 0,8946 г/см3, парциальный молярный объем воды в этом растворе
16,8 см3/моль.
12. Определите молярный объем раствора, если в 20 %-ном вод-
водном растворе метилового спирта парциальные молярные объемы воды и
спирта равны 18 и 37,8 см3/моль соответственно.
13. Определите массу 1 моль раствора, полученного смешением
1 моль СС14 с 3 моль SnCl4.
14. Определите молярный объем. сплава, содержащего 62% Си,
считая объем аддитивной функцией состава. Плотность меди
8,9 г/см3, а цинка 7,1 г/см3.
15. Зависимость объема раствора хлорида натрия от количества
молей соли я2, растворенной в 1000 г воды, выражается уравнением
V=1000+16,4n2 + 2,5«l — 1,2п».
Определите парциальный молярный объем 0,5 т раствора NaCl (см3).
16. Определите плотность 40%-ного водного раствора метилового
спирта, если парциальные молярные объемы воды и спирта в этом
растворе соответственно равны 17,5 и 39 см3.
17. Определите парциальную молярную теплоемкость КОН в 10,
20 и 30%-ных растворах, используя следующие данные:
Число молей
в 100 г Н2О
0,0000
0,0940
0,1985
0,3152
0,4465
Удельная теплоем-
теплоемкость раствора,
КОН, Дж/(гК)
4,176
3,896
3,699
3,524
3,337
Число молей
в !00 г Н2О
0,5951
0,7652
0,9636
1,1910
Удельная теплоем-
теплоемкость раствора
КОН, Дж/(г-К>
3,235
3,110
3,001
2,905
186
18. Определите парциальные молярные теплоемкости HNO3 и
Н2О в 0,5; 1,0; 2,0 т растворах. Удельные теплоемкости растворов
азотной кислоты приведены ниже:
0
1
2,5
10
15
20 25
CHNO, • /о
Удельная теплоемкость,
Дж/(г-К) 4,18 4,117 4,034 3,908 3,712 3,545 3,373 3,219
19. При 298 К интегральная теплота растворения некоторой кисло-
кислоты в воде выражается формулой
ДЯ = 8,36п|/2 + 12,54п?/2+ 16,72п?/2,
где Пу — чило молей Н2О на 1 моль кислоты. Оцените А#2 [т. е.
(dAH/dn2)p,TnJ раствора, молярное содержание которого составляет
10% кислоты.
Число молен на 1 кг
Д Н, Дж/моль
. . 0.0624 0,2001 0,4003 0,7504 1,0058
. . 7716,3 7440,4 6897,0 6399,6 6015,0
Число молей на 1 кг Н2О . . 1,9457 3,1064 4,0012 4,9966 6,0004
ДЯ, Дж/моль 4961,7 3954,3 3206,1 2587,4 1897,7
20. По интегральным теплотам растворения NaCl в воде при 275 К
рассчитайте количество теплоты, которое будет поглощено при этой
температуре, если к 100 г 10%-ного раствора NaCl прибавили 126 г
Н2О.
21. Используя интегральные и дифференциальные теплоты раство-
растворения 1 моль H2SO4 в воде при 298 К,
Число
молей
Н2О
0
0,50
1
2
3
4
6
10
ДЯ, Дж
0
—15925,8
—28507,6
—41632,8
—49700,2
—54841,6
—61613,2
—67883,2
Д#ц,О> Дж/моль
—28215,0
—28173,2
—19771,4
—9697,6
—6186,4 .
-4347,2
—2382,6
—973,9
AWHjSO4' Дж/моль
0
—1830,8
—8736,2
—22237.6
—22781,0
—37452,8
—47317,6
—58143,8
определите: а) общее количество выделяющейся теплоты при прибав-
прибавлении 4 моль Н2О к раствору, содержащему 6 моль Н2О и 1 моль H2SO4;
б) общее количество теплоты, выделяющейся при смешении 3 моль
Н2О с 6 моль H2SO4.
22. При исследовании растворимости диметилглиоксима никеля в
воде при нескольких температурах получены следующие результаты:
298
303
308
313
318
Г, К
Растворимое тьХ
ХЮ5, моль/л . . 0,105±9% 0,139±4% 0,184±2% 0,240±2% 0,307±2%
187
а) оцените энтальпию растворения диметилглиоксима никеля в воде
Д//° (кДж/моль); б) что означает индекс «°» в А#°?
23. По данным о зависимости теплоты смешения меди с серебром от
состава при 1428 К определите графическим методом теплоты раство-
растворения компонентов в растворах следующего состава: xAg — 0,10;
0,30; 0,50; 0,70; 0,90. Представьте график зависимости теплоты раст-
растворения от состава, если
xAg 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
ЛЯ, кДж/моль . 1,38 2,41 3,14 3,60 3,81 3,77 3,46 2,81 1,78
24. При смешении 125,4 г висмута с 9,73 г магния выделилось
16200 Дж теплоты. Определите парциальную молярную теплоту раст-
аорения висмута, если парциальная молярная теплота растворения
магния в этом растворе — 34 900 Дж/моль.
25. Парциальные молярные теплоты растворения кремния и марган-
марганца в растворе Si — Мп с молярным содержанем 70% Si равны — 3800 и
— 83 500 Дж /моль соответственно. Определите количество теплоты, вы-
выделяющейся при образовании 1 кг раствора этого состава.
26. Парциальная молярная энтропия растворения серебра в твер-
твердых растворах Аи—Ag зависит от состава и описывается уравнением
ASAg=-R Ш хАг-5,ОЗх|ц дж/(МОль.К).
Выведите зависимость AS от состава и вычислите AS"» для 75%-
ного раствора золота.
27. Зависимость парциальной молярной теплоты и энтропии раст-
растворения y-Fe °т состава раствора y-Fe — Ni описывается уравнения-
уравнениями:
Д Ну. Fe = -2095^1 Дж/моль; Д Sy. Fe = -R In *v.Fe .
Определите зависимость химических потенциалов от состава раствора-
28. Вычислите активность воды в растворе, если давление водяных
паров над ним 0,9333- !0в Па и 373 К.
29. При 308 К давление пара ацетона 0,459- 10в, а давление пара
хлороформа 0,391 • 106 Па. Над раствором с молярным содержанием
36 % хлороформа парциальное давление паров ацетона 0,2677-10в, а
хлороформа 0,0964-105 Па. Определите активность компонентов и
сравните их с молярными долями этих веществ.
30. Вычислите коэффициент активности брома в растворе тетрахло-
рида углерода, над которым парциальное давление брома соответствует
10,27 мм рт. ст. Состав раствора (мол. доли): Вг2 — 0,0250 и ССЦ —
0,9750. Давление пара чистого брома при той же температуре
213 мм рт ст. За стандартное состояние брома примите чистый жидкий
бром.
31. Если 1,046 г кадмия растворить в 25,23 г ртути, то давление
пара образующейся амальгамы при 305,2 К будет составлять 0,920 от
давления насыщенного пара чистой ртути. Определите активность и
коэффициент активности (мол. доли) ртути в амальгаме.
188
32. Хлорид ртути Hg2Cl2 распределяется между бензолом и водой;
при 298 К получены следующие концентрации (моль/л):
В С6Н6 . . . , 0,000155 0,000310 0,000618 0,00524 0,0210
В Н2О 0,001845 0,00369 0,00738 0,0648 0,2866
Рассчитайте активность соли в водном растворе при концентрации
0,2866 моль/л, если раствор его в бензоле остается идеальным до с —
= 0,03 моль/л.
33. Определите коэффициент активности сахара в растворе, если
температура замерзания 0,8 т водного раствора сахара 271,4 К. Кри-
оскопическая константа воды 1,86°.
34. Зависимость давления пара (Па) от температуры над жидким
«-бутаном в интервале температур от 272,66 до 348,16 К выражается
уравнением Антуана
203 8 / 1030,3
N
Рассчитайте летучесть н-бутана при 289,16 К, если при этой температу-
температуре плотность его насыщенного пара 4,9 кг/м3. Можно ли пренебречь раз-
различием между летучестью и давлением насыщенного пара, если пред-
предполагаемая точность определения приведенного уравнения равна при-
примерно 1 %?
35. Определите летучесть NH3 в условиях, если при давлении
4,05-10е Па и 423 К 1 моль NH3 занимает объем 0,7696 л.
36. Давление пара воды при 293 К составляет 2337,80 Па. Вычис-
Вычислите давление пара раствора Ы0~2 кг хлорида аммония в Ы0 кг
воды и химический потенциал воды в данном растворе, если коэффици-
коэффициент активности воды у = 0,976, приняв, что AG0 воды в интервале 293—
298 К не зависит от температуры, а ц° равно ДО0 образования дан-
данного компонента.
37. Давление пара воды при 273 К равно 610,48 Па, а давление пара
10%-ного раствора NaNO3 589,28 Па. Определите активность и хими-
химический потенциал воды в указанном растворе.
38. Давление пара брома над чистым бромом при 298 К составляет
28371,00 Па, а давление пара брома в 0,1т водном растворе —1,7-10*
Па. Определите химический потенциал брома при 298 К. За стандарт-
стандартное состояние примите состояние чистого брома.
39. Хлорид ртути HgoCl2 распределяется между бензолом и водой.
При 298 К получены следующие концентрации (моль/л):
В С6Н6 .... 0,000155 0,000310 0,000618 0,00524 0.02S0
В Н2О 0,001845 0,00369 0,00738 0,0648 0,2866
Рассчитайте химический потенциал ц в обеих фазах как функцию кон-
концентрации и представьте в виде графика.
40. При 1250 К давление насыщенного пара серебра над раствором
Ag — Аи с молярным содержанием 62,0 % Ag и над чистым серебром
189
равно соответственно 2,1 Ы0~1 и 4,83-Ю Па. Определите относи-
относительный химический потенциал серебра в растворе.
41. Давления насыщенных'паров над чистым свинцом, серебром и
раствором Ag — Pb с молярным содержанием 95 % Ag при 1358 К
равны: Pig = 8,67-Ю-1 Па; P9Ag = 8,40-10 Па; Ph = 5,59-102 Па,
РРЬ = 9,60-10 Па.
Определите изменение энергии Гиббса для 1 моль раствора при об-
образовании раствора заданного состава, считая это изменение на 1 моль
раствора.
42. Зависимость давления (Па) насыщенного пара чистой жидкой
чеди от температуры описывается уравнением
lg ръ= —16050IT+10,666.
Определите парциальную молярную теплоту растворения меди при
1823 К. в растворе Fe — Си (концентрация меди 89,5 %), если давление
насыщенного пара меди над данным раствором 6,73-10 Па.
43. Давление (Па) насыщенного пара магния над раствором Mg—
Pb, содержащим 4,2 % магния, зависит от температуры и описыва-
описывается уравнением
и над чистым магнием
6560
SgjPe=:____+9>723.
Определите парциальную молярную теплоту растворения и энтропию
растворения магния при 298 К.
44. Газовая фаза Н2О — Н2, равновесная при 1873 К с раствором
кислорода в железе (объемная доля кислорода 0,1200 %), содержит
72,1 % Н2. Определите изменение химического потенциала кислорода
при переходе из газовой фазы, в которой Pos = 10е Па, в раствор ука-
указанного состава, Константа равновесия реакции Н2 + /г О2 = Н2О
•при 1873 К
45,, Смешали 400 г воды со 100 г 100%-ной серной кислоты. Выде-
Выделившаяся теплота пошла на обогрев раствора. Вычислите изменение
температуры раствора AT, допустив, что сосуд, в котором находится
раствор, теплоту не поглощает. Теплоемкость раствора постоянная
и равна 3,427 Дж/(г-К). Недостающие данные возьмите из справочни-
справочника [М.1.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Раствор веществ А и В данной концентрации; плотность этого
раствора при температуре Т равна d: 1) определите молярную концент-
концентрацию — число молей растворенного вещества в 1 л раствора; 2) опре-
190
делите молярную концентрацию —. число молей растворенного веще-
вещества на 1 кг растворителя; 3) рассчитайте молярную долю вещества А в
процентах; 4) определите число молей растворителя, приходящееся на
1 моль растворенного вещества.
№ вари-
варианта
1
2
3
4
5
6
7
8
9
10
11
!2
13
14
!5
16
17
18
19
20
21
22
23
24
25
Массовое
содержа-
содержание А, %
97
94
91
87
80
73
63
45
72
66
61
80
62
57
50
43
37
30
28
17
!2
80
60
40
20
Вещество
А
СВг3СНО
СВг3СНО
СВг3СНО
СВгаСНО
СВг3СНО
СВг3СНО
СВг3СНО
СВгзСНО
C,H8(SO3H)
C,H5(SO3H)
C,H8(SO3H)
С,Н3(ОН)з
(СН2LО2
с1Он8
с10н8
С На
^10 g
с10н8
C«Hii
с,н14
в
н2о
н2о
н2о
н2о
н2о
н2о
н2о
н2о
н2о
н2о
н2о
н2о
н2о
СН3СОСН3
СН3СОСН3
СН3СОСНз
СН3СОСН3
СН3СОСН3
СН3СОСНз
СН3СОСНз
СН.СОСНз
СНзСОСНз
СН3СОСН3
СН3СОСНз
CH3COCHS
Т W
' • *х
323
3!3
313
3!3
3!3
3!3
3!3
3!3
298
298
298
293
293
293
293
293
293
293
293
293
293
293
293
293
293
«мол
кг/м*
2,628
2,566
2,485
2,340
2.106
!,938
1,725
1,476
1,28!
!,256
!,235
1,208
1,04!
0,992
0,968
0,945
0,921
0,900
0,875
0,850
0,835
0,765
0,74!
0,719
0,692
2. По зависимости интегральных теплот смешения Л#смеш от кон-
концентрации в жидкой фазе xf при 298 К и 1,0133- 10s Па и данных о со-
составе пара х" и общем давлении при Т, К: 1) постройте график зависи-
зависимости А#смеш = / (xf); 2) определите интегральную теплоту смеше-
смешения компонентов для 1 г смеси; 3) определите всеми возможными спо-
способами парциальные теплоты смешения /-го компонента при концент-
концентрации mi и xf; 4) определите кажущуюся молярную теплоту сме-
смешения t-ro компонента концентрации xf; 5) определите парциальное
давление i-то компонента для заданных смесей; 6) вычислите актив-
активность t-ro компонента для заданных смесей; 7) определите относитель-
относительный химический потенциал t-ro компонента для заданных смесей; 8)
определите коэффициент активности t-ro компонента для заданных
смесей; 9) определите энтропию смешения при заданных концентраци-
концентрациях, приняв, что теплота смешения не зависит от температуры.
В каждом варианте необходимо провести расчет для двух составов.
Ш
г
| № вариан'
1
2
3
4
5
6
7
8
9
10
!1
12
13
14
15
16
17
18
19
20
21
22
23
24
i
25 S
Молярное
содер-
содержание
первого
компо-
компонента
*г. %
3,32
96,49
9,83
89,92
17,14
81,26
30,24
73,23
35,69
64,96
43,24
57,00
50,12
73,23
9,83
64,96
17,14
96,49
3,32
57,00
6,84
71,74
28,03
5!,51
28,03
81,54
6,84
89,02
51,51
95,45
6,84
71,74
10
90
20
80
30
70
40
10
50
90
60
20
70
30
80
10
90
20
Л
н
о
о
МОЛЯЛЫК
раствора
А 1
U) i
0 1^
*J у Id
А 9
U ; ?
0,5
А Л
и,4
A ?
0,о
Г\ Т
0,7
А О
0,о
л с
0,5
0 1
V * I
0,2
ft 1
К! , i3
0 4
0,5
0,6
л о
0,3
л 1
U, 1
П 7
1/, /
0 8
\J , О
A Q
1 1
1,1
1 О
1,2
1 Q
1 tO
Молярная
доля
первого
компо-
компонента
в парах
* %
?,98
99,14
21,59
94,68
34,37
90,00
52,79
85,54
58,05
80,53
64,52
75,15
70,00
85,54
21,59
80,53
34,37
99,14
7,98
75,15
45,56
58,28
53,44
54,96
58,28
62,82
45,56
71.16
54,96
89,68
45,56
58,28
16,48
36,64
20,90
27,40
22,08
24,47
22,46
36,69
22,83
36,69
23,2!
20,90
24,47
22,08
27,40
16,48
36,69
20,90
Давление
насы-
насыщенного
пара над
смесью.
мм рт.
ст.
146,7
304,1
159,8
295,4
!74,0
282,4
198,7
27!, 7
207,4
256,9
220,7
244,7
232,3
271,!
159,8
256,9
174,0
304,1
140,7
244,7
103,6
119,6
117,7
119,9
119,6
117,0
103,6
111,3
119,9
97,1
103,6
П9.6
156,0
109,3
158,4
138,3
157.6
150,0
157,2
109,3
156,4
109,3
154,7
158,4
150,0
157,6
!38,3
156,0
109,3
158,4
Система А—В
i ,
СС14A)-С7Н„B)
(Г=323 К;
мм рт, ст.
ро =308,5
ММ р 1 • L 1 . I
С,Н,ОНA)-
С?Н1вB)
(Т = 303 К;
Р»С7н,в=58,2
мм рт, ст.;
РСНОН = 78'2
мм рт- ст.)
С2Н6ОНA)-
С,Н14B)
(Г=298 К:
^с,н14=140,3
мм рт. ст.;
^Лан-78,2
мм рт, ст.)
в ¦
Ч о Ж
ас и
Молярная
второго к(
нента в ci
ж
*2 • Доли
0
0,1
0,2
0,3
и..4
0,5
0,6
0,7
0,8
0,9
0
0
0,1
0.2
0,3
0,4
0,5
0,6
0,7
0
0,!
0,2
0,3
0,4
0,5
0,6
0,7
0,8
Теплота
смешения
на 1 моль
смесн для
системы
А-В, Дж
0
—110,876
—200,832
! —277,399
! —327,189
—347,272
-326,352
—271,960
— 194,556
— 100,416
0
0
—259,400
—401,664
-595,801
-959,801
-633,876
-614,211
-560,656
0
-255,224
-380,744
-460,24
—517,142
—558,146
—566,00
—556,472
—510,448
192
ГЛАВА XIII
РАЗБАВЛЕННЫЕ РАСТВОРЫ
Основные уравнения и символы
[К., с. 852—363, Ш, 40Х, 403—405; Г., т. 1, с. 158—248]
Зависимость давления насыщенного пара над раствором твердых
веществ в летучих растворителях выражается законом Рауля (относи-
(относительное понижение давления пара растворителя над раствором):
Р9 — Pi АР
(XIII.
где Pf — давление пара над чистым растворителем; Pt — давление
пара растворителя над раствором данной концентрации; &Р/РУ — от-
относительное понижение давления пара растворителя; тг2 — число мо-
молей растворенного вещества; пх — число молей растворителя.
Уравнение Рауля, учитывающее диссоциацию (ассоциацию) раст-
.воренного вещества, имеет вид
.А^=-^- *-**-. (XIII.2)
Р1 /Ij + Й* Я,
где i — коэффициент ВантТоффа;
Общее чясло молей прк диссоциации
*==- — — —~l-\-a (v—l); (XIII.3)
Общее число молей д& диссоциации
Число распавшихся молекул
а—степень диссоциации = ;
Исходное число молекул
v — число частиц, на которые диссоциирует молекула.
Зависимость повышения температуры кипения (АГКИД = Г — Г°)
разбавленного раствора от моляльной концентрации m выражается
уравнением для недиссоширующих веществ
&Tmu = KBm (XIII.4)
и уравнением для диссоциирующих веществ
ATmm^iKsm, (XIII.5)
где Т°, Т — температура кипения растворителя и раствора; К3 —
эбуллиоскопическая постоянная (молярное повышение температуры
кипения);
RT*
K3^-~-±UL, (XIII. 6)
1000/ис1
Тн-Т.к — нормальная температура кипения чистого растворителя;
4гсп — удельная теплота испарения растворителя.
7 За*. 767 193
По повышению температуры кипения раствора можно определить
молекулярную массу вещества
где Мг — молекулярная масса растворенного вещества; т2 — масса
растворенного вещества; тх — масса растворителя.
Зависимость понижения температуры замерзания (ЛТ3 = Т% —Т)
разбавленного раствора от моляльной концентрации m выражают для
недиссоциирующих веществ уравнением
АГ3 = /(„р/п, (XIII.8)
для диссоциирующих веществ — уравнением
ЬТ3=1Ккрт, (XIII.9)
где ККр — криоскопическая константа растворителя (молярное пони-
понижение температуры замерзания);
где Tl, T — температура замерзания чистого растворителя и раство-
раствора; / — удельная теплота плавления растворителя.
По понижению температуры замерзания раствора можно опреде-
определить молекулярную массу вещества:
тх Д ™3
Зависимость осмотического давления от молярной концентрации
раствора (Вант-Гоффа) описывают уравнением:
для недиссоциирующих веществ
n=cRT (XIII.12)
и для диссоциирующих
n=icRT, (XIII.12а)
где я — осмотическое давление; с — концентрация раствора, моль/л
(моль/м8).
Интегральную теплоту растворения АНт для разбавленных раство-
растворов определяют по равенству
А//« = йгДй« (XIII.13)
Химический потенциал компонентов предельно разбавленного раст-
раствора определяют по уравнениям
(XIII.14)
(XIII.15)
где (i| — химический потенциал второго компонента в гипотетическом
растворе с моляльностью т = 1 моль на 1000 г и свойствами предель-
предельно разбавленного раствора.
194
Зависимость растворимости газов в жидкостях от давления выража-
выражается уравнением Генри:
xf=KrPt, (ХШ.16)
P2=Krx*t (XIII.17)
где х* — концентрация газа в насыщенном растворе; Kb, Кг — кон-
константы Генри, Kb = У Кг', Р% — парциальное давление газа.
Зависимость растворимости газа от температуры выражают уравне-
уравнением в дифференциальной форме
(-*?&-) =_^L (XIII.18,
\ ОТ /Р.нас.р RT*
или уравнением в интегральной форме (для интервала температур, в
котором ДЯ? = const)
1 1 \
——)¦
где ДЯ™ — дифференциальная теплота растворения газа в насыщен-
насыщенном растворе. Уравнения (ХШ.16) и (XIII.18) применимы для иде-
идеальных и предельно разбавленных растворов.
Для данной температуры отношение концентраций третьего компо-
компонента в двух равновесных фазах есть величина постоянная, не завися-
зависящая от абсолютных количеств всех веществ, участвующих в распреде-
распределении:
ci/ct=K, (XIII.20)
где Ci — равновесная концентрация распределяющего вещества в пер-
первой фазе; с2 — равновесная концентрация распределяющегося веще-
вещества во второй фазе; К—константа (или коэффициент) распределения.
В некоторых системах распределяющееся вещество вследствие дис-
диссоциации его молекул обладает неодинаковым средним размером час-
частиц в разных растворителях! При этом соотношение (XIII.20) непри-
неприменимо, а уравнение закона распределения принимает вид
сп/с2=К, (XIII.21)
где п = М"/М' (М' — средняя молекулярная масса распределяющего-
распределяющегося вещества в первой фазе; М" — средняя молекулярная масса рас-
распределяющегося вещества во второй фазе). При распределении третье-
третьего вещества между двумя несмешивающимися жидкостями возможен
случай, когда степень диссоциации распределяющегося вещества в раз-
разных растворителях отличается. Обозначим степень диссоциации распре-
распределяющегося вещества в первом растворителе аь а во втором — а2.
Тогда закон распределения примет вид
7* • 195
В уравнении (XIII. 20) закона распределения для концентрирован-
концентрированных растворов концентрации следует заменить активностями
а1/аг = К, (XIII.23)
где сх и а2 — активности распределяющегося вещества в первой и во
второй фазах. Если известна зависимость активности от концентрации
распределяющегося вещества' в одном из растворителей и коэффици-
коэффициент распределения, то можно установить ту же зависимость для сопря-
сопряженного раствора.
Закон распределения широко используется при экстрагировании
вещества из раствора. Обозначим: т0 — начальная масса экстрагиру-
экстрагируемого вещества; Vi — объем раствора, в котором находится экстра-
экстрагируемое вещество; V2 — объем растворителя, употребляемый для
одного экстрагирования; п — общее число экстрагирований; тъ т2,
..., т„ — масса вещества, остающаяся в первоначальном растворе пос-
после 1,2, ..., я-ro экстрагирований; К — коэффициент распределения
экстрагируемого вещества условились обозначать отношением концен-
концентрации раствора, из которого экстрагируется распределяющееся веще-
вещество, к концентрации раствора, которым производится экстрагирова-
экстрагирование. Пусть после первого экстрагирования в исходном растворе оста-
осталось тх кг растворенного вещества в объеме Vu а экстрагируется
Щ — Щ — Щ кг, причем эта масса заключается в объеме V%. По за-
закону распределения (XIII.20)
v -К, (ХШ.24)
(m0— mO
откуда
ml^m0KV1/(KVl + V2). (ХШ.25)
После второго экстрагирования
При совместном решении уравнений (XIII.25) и (XIII.26) получим
После я экстрагирований в исходном растворе останется т кг раство-
растворенного вещества:
(ХШ'28)
ЗАДАЧИ С РЕШЕНИЯМИ
1. Давление водяного пара раствора, содержащего нелетучее раст-
растворенное вещество, на 2 % ниже давления пара чистой воды. Опреде-
Определите моляльность раствора.
196
Решение. Используем уравнение
(P4-Pl)/P\=xt.
Приняв за 100 давление пара чистого растворителя Р° и подставив
98 вместо Ръ получим
A00—98)/100=0,02 или ха = 0,02.
Для определения моляльности т рассчитаем число молей растворен-
растворенного вещества на 1000 г воды по уравнению
*t = "»/(«»+«О.
где tti — число молей воды; ^ = 1000/18 — 55,55; п2 — т. После под-
подстановки значений в уравнение получаем
0,02 = m/E5,55+m),
откуда т =- 1,134.
2. Как изменится соотношение давлений пара над раствором и раст-
растворителем, если растворенное вещество диссоциировано на 80% и рас-
распадается на два иона и если это вещество не диссоциировано. Давление
водяного пара раствора, содержащего нелетучее растворенное веще-
вещество, на 2 % ниже давления пара чистой воды.
Решение. Вычисляем относительное понижение давления над
раствором, в котором вещество диссоциирует, и сравниваем с относи-
относительным понижением давления при отсутствии диссоциации. Соглас-
Согласно уравнению (XIII.2)
АРitii
р\
я2 = т = 1,134 моль на 1000 г; ях = 55,55.
Величину i вычисляем по уравнению (XII 1.3):
( = 1+0,8B—1) = 1,8.
После подстановки чисел получаем
1,8-1,134
• =0 035
Р\ /дисс 55,55+1,8-1,134 ' '
Находим соотношение относительных понижений давления при на-
наличии и при отсутствии диссоциации растворенного вещества:
АР'\ 0,035 _17;,
дисс \ Ро } 0,02
3. Вычислите эбуллиоскопическую постоянную /С» Для воды. Теп-
Теплота испарения Л#исп = 40,685 кДж/моль.
Решение. Эбуллиоскопическую константу вычисляем по урав-
уравнению (ХШ.6):
Я7! т. км - 8,314C73,16K-18
197
4„ Определите температуру кипения водного раствора, содержаще-
содержащего 0,01 моль нелетучего вещества в 200 г воды. К9 = 0,512 град/моль.
Решение. Вычисляем моляльность раствора
т = 0,01 -5 = 0,05 моль иа 1000 г воды.
По уравнению (ХШ.4) вычисляем температуру кипения раствора:
Д Г = 0,512-0,05= 0,0256;
= 373,16+0,0256=373,186 К-
5. Вычислите молекулярную массу вещества, если температура за-
замерзания раствора, содержащего 100 г бензола и 0,2 г исследуемого
вещества, на 0,17 К ниже температуры замерзания бензола. Криоско-
пическая константа ККр = 5,16 град/моль.
Решение. Молекулярную массу М вычисляем по уравнению
(ХШ.11):
М=-1000-5,16-0,2/A00-0,17) =60,23.
6. Понижение температуры замерзания водного раствора иссле-
исследуемого вещества составляет 1,395 К, а бензольного— 1,280 К. Чем
объясняется различие в AT, если моляльности растворов одинаковы?
Какие величины, характеризующие состояние вещества в растворе,
можно получить из этих данных? Для бензола ККр = 5,16, град/моль;
для воды Ккр = 1.86 град/моль.
Решение. Различия в температурах замерзания можно объяс-
объяснить тем, что вещество в водном растворе дисссоциирует, а в бензоль-
бензольном не диссоциирует. Используя уравнения (XIII.8) и (XIII.9), можно
вычислить коэффициент Вант-Гоффа i. Зная числовое значение I, можно
сделать, согласно уравнению (XIII.3), предположение о числе частиц v,
на которые распадается молекула растворенного вещества, и о степени
диссоциации а. Согласно сделанным предположениям:
A7*CiHi = 1,28=5,16m; Д 7*Hj0 = 1,395 = i 1,86m;
ДГНО Ь395 П.86 5,16-1,395
"»u .. ¦__ =3 02
дгс,н. !>28 5,16 ' 1,28-1,86
Если молекула, распадаясь, дает две частицы (v = 2), то даже
при а = 1 i = 2. Полученное значение i > 2 показывает, что v > 2.
Вычисляем степень диссоциации а по уравнению (XII 1.3), предполо-
предположив, что v = 3; тогда 2,52 = 1 + а C — 1), откуда а = 0,76.
Если v = 4, а = 0,50 и т. д.
7. Раствор, содержащий 0,8718 моль/л тростникового сахара, при
291 К изоосмотичен с раствором хлорида натрия, содержащего 0,5
моль/л NaCl. Определите кажущуюся степень диссоциации и коэффи-
коэффициент Вант-Гоффа для хлорида натрия.
Решение. Для раствора сахара осмотическое давление опреде-
определяем по уравнению я — ClRT, где с± — концентрация сахара в раст-
растворе. Для раствора хлорида натрия осмотическое давление рассчиты-
рассчитываем по уравнению я = ic%RT, гдес2—концентрация NaCl в растворе.
198
Так как осмотические давления этих растворов равны, то c^RT =
= ic2RT. Откуда
или (=0,8718/0,5=1,743.
nHtO = Г77~—=0,0554 моль.
По уравнению i = 1 + a (v — 1) определяем кажущуюся степень
диссоциации. Так как молекула хлорида натрия в растворе разлага-
разлагается на два иона, то v = 2 и
а= A,743—1)/B—1) =0,743.
8. Вычислите константу Генри Кг Для азота при 298 К и
760 мм рт. ст.- Коэффициент Бунзена а = 0,0143 (а — число объемов
азота, приведенных к нормальным условиям, поглощенных одним
объемом воды). Плотность воды 0,997 г/см8.
Решение. Вычисляем число молей азота, поглощенного 1 см8
воды, по уравнению (XII.3):
Ям =—— — =6,38-10-' моль;
Nl 0,082-273
1-0,097
18
Молярную долю азота х^г вычисляем по уравнению (XII.3):
nN 6,38-10-'
*N'= »н.о+»„. = 5.64-10- =1'15-1°-Е-
Значение Кг получаем, подставив значения давления и концентрации
в уравнение
Ям 760
К' =—— = = 6,61 • 10'.
г *Nl 1,15. Ю-5
9. При 295 К и 51 987 Па растворимость Н2 в анилине составляет
10,6 кг/м8, а при 154 628 Па и той же температуре — 31,6 кг/м8. Соб-
Соблюдается ли при этих условиях закон Генри?
Решение. Если закон Генри соблюдается, то отношение давле-
давления к равновесной концентрации газа в жидкости — величина по-
постоянная, пропорциональная константе Генри Кг- Вычисляем значе-
значения отношений давления к концентрации:
51987/10,6 = 4904,4; 154628/31,6=4893,3.
Сравнение полученных величин позволяет ответить на поставленный
вопрос положительно.
10. Вычислите теплоту растворения азота в воде (Рц, = 760 мм
рт. ст.), использовав данные о зависимости константы Генри от темпе-
температуры:
Г, К • 273 283 293 303
/ег-10-', мм рт. ст . . . . • 4,02 5,08 6,12 7,02
199
Решение. Решим уравнение (XIII. 17) относительно молярной
доли и, подставив найденную величину в уравнение (XIII. 19), полу-
получим
N N* " *^2 3 9. ~ ! t
или
Подставляем в уравнение значения Кг для двух температур
, , 4,02 _ Afff 30
lfe 7,02 ~" 2,3-8,314 273 303
и получаем ЛЯ'/' = 12,728 кДж/моль.
11. Водный 0,02 М раствор пикриновой кислоты находится в рав-
равновесии с 0,07 М раствором пикриновой кислоты в бензоле. Вычислите
коэффициент распределения пикриновой кислоты между бензолом и
водой, если в бензольном растворе пикриновая кислота имеет нор-
нормальную молекулярную массу, а в воде частично диссоциирована,
причем степень диссоциации равна 0,9.
Решение, Для определения коэффициента распределения пик-
пикриновой кислоты между бензолом к водой следует концентрацию кисло-
кислоты в бензоле разделить ка концентрацию кедиссоциированной части ее
в воде:
/С = 0,7/[0,02 (!~0,9I = 35.
12. При распределении салициловой кислоты между бензолом и
водой при 298 К были получены следующие данные:
сх ....... 0,0363 0,0668 0,0940 0,126 0,210
с2 ....... 0,0184 0,0504 0,0977 0,146 0,329
с,-. ...... 0,283 0,558 0,756 0,912
с2 ....... 0,553 0,650 2,810 4,340
где сх — концентрация салициловой кислоты в водном слое, моль/л
сг — концентрация салициловой кислоты в бензольном слое, моль/л.
Графически определите значения п и К и напишите уравнение распре.
деления.
Решение. Вычислим по уравнению (XIII.20) значения К'-К—
= 1,97; 1,33; 0,96; 0,86; 0,64; 0,53; 0,34; 0,27; 0,21. Так как соотно-
соотношение d/ca не остается постоянным, то наблюдается изменение молеку-
молекулярной массы распределяющегося вещества. Применяем закон распре-
распределения в общем виде. Прологарифмировав выражение (XIII. 21);
получим
«Igc,— igCz — lgK или lgc, = «)gci—Ig/C.
200
Последнее уравнение — уравнение прямой, тангенс угла наклона ко-
которой равен п, а отрезок, отсекаемый от оси ординат, есть Ig К- При-
Приведенные з условии данные прологарифмируем:
Ig ct ... . .• —1,4401 -1,1752
1° сг ..... —1,7352 —1,2976
lg с,, ...... -0,5482 —0,2534
lg c2 ...... —2,2738 +0,2S75
—1,0269 —0,8996 —0,6778
—1,010! —0,8356 —0,4828
-4,1215 —0,0400
+0,4487 +0,6375
На основании этих данных строим график lg с2 — / (lg ct) (рис. 20).
По графику определяем тангенс угла наклона прямой к оси абсцисс:
0,66
-i,66, « = 1,66;
ig/f=T,34, /C = 0,219.
Закон распределения для данной
системы выражается уравнением
13. Коэффициент распределения
иода между водой и сероуглеродом
равен 0,0017. Водный раствор иода,
содержащий 10~4 кг иода в 10~4 м3,
взбалтывают с сероуглеродом. Какое
количество яода останется в водном
растворе, если S0""9 эд3 водного раст-
раствора взболтать с 5-10~в м3 сероугле-
сероуглерода и !0~4 м8 водного раствора взбол-
взболтать последовательно с пятью отдель-
отдельными порциями сероуглрода по
IQ-6 м» каЖдая?
Решение. Массу, оставшуюся
определим по уравнению (ХШ.25):
, „ 0,0017-10-*
-tfi -0,8 -0,6
Рис. 20. Зависимость логарифма
концентрации с2 бензольного рас-
раствора салициловой кислоты от ло-
логарифма концентрации С\ салици-
салициловой кислоты в воде
после одного экстрагирования,
^ !0 0,0017.10-4 + 5.
Масса экстрагированного иода равна
10-*—3,3-10-1» = 0,967- ю-
Определяем массу иода, оставшуюся
уравнению (XIII. 28)"
« кг, или 96,7%.
после пяти экстрагирований, по
Щ = 1
0,0017. Ю-4
0,0017
КН7-10--* у
• lO-M-SO11»"/
=6,5-10-» кг.
201
Масса экстрагированного иода после пяти экстракций равна
Ю-4—6,5-10-10 = 0,999935-Ю-4 кг, или 100%.
ЗАДАЧИ
1. Определите относительное понижение давления пара для раство-
раствора, содержащего 0,01 моль нелетучего растворенного вещества в 0,5 кг
воды.
2. Давление пара воды при 313 К равно 7375,4 Па. Вычислите при
данной температуре давление пара раствора, содержащего 0,9206-10~2
кг глицерина в 0,360 кг воды.
3. Вычислите давление пара эфира над 3 %-ным раствором анили-
анилина в этиловом эфире (С2Н5JО при 293 К- Давление пара эфира при
этой температуре равно 5,89-104 Па.
4. Давление пара серного эфира при 293 К равно 0,589- Ю5 Па, а
давление пара раствора, содержащего 0,0061 кг бензойной кислоты в
0,05 кг эфира при той же температуре, равно 0,548- ^Па. Рассчитай-
Рассчитайте молекулярную массу бензойной кислоты в эфире и относительную
ошибку опыта в процентах по сравнению с величиной, приведенной
в справочных таблицах.
5. Водный 7,5%-ный раствор хлорида кальция кипит при нормаль-
нормальном атмосферном давлении 1,0133-105 Па и 374 К. Вычислите коэффи-
коэффициент i. Давление пара воды при 374 К равно 1,05-105 Па.
6. Определите процентную концентрацию водного раствора глице-
глицерина, если давление пара этого раствора равно давлению пара раст-
раствора, содержащего 0,0089 г кг NaNO3 в 1 кг воды. Кажущаяся степень
диссоциации NaNO3 в указанном растворе воды 64,9 %.
7. Давление пара раствора, содержащего 2,21 • 10~3 кг СаС1г
и 0,1 кг воды при 293 К, равно 2319,8 Па, а давление пара воды при
той же температуре 2338,5 Па. Вычислите кажущуюся молекулярную
массу и кажущуюся степень диссоциации СаС12.
8. В 0,1 кг эфира (М = 74) содержится 0,01 кг нелетучего вещест-
вещества. Давление пара этого раствора равно 426 мм рт. ст. при 293 К, а дав-
давление пара чистого эфира при 293 К—442 мм рт. ст. Рассчитайте мо-
молекулярную массу растворенного вещества.
9. В 1 кг воды растворено 0,0684 кг сахара (М = 342). Вычислите
давление пара этого раствора при 373 К. Рассчитайте температуру
кипения его, если теплота испарения воды при температуре кипения
равна 2256,7-Ю3 Дж/кг.
10. Температура кипения бензола 353,36 К- Его молярная теплота
испарения при температуре кипения 30 795Дж/моль. Определите
эбулиоскопическую константу бензола.
11. Температура кипения чистогоС52319,2К- Раствор, содержащий
0,217- Ю-3 кг серы в 1,918-10~2 кг CS2, кипит при 319,304 К. Эбулио-
скопическая константа сероуглерода 2,37°. Определите число атомов,
которое содержится в молекуле серы, растворенной в сероуглероде, ес-
если атомная масса серы 32.
202
12. В 0,0106 кг раствора содержится 0,40-10~3 кг салициловой кис-
кислоты, растворенной в этиловом спирте. Этот раствор кипит при темпера-
температуре на 0,337° выше чистого спирта. Молекулярное повышение тем-
температуры кипения этилового спирта 1,19°. Определите молекулярную
массу салициловой кислоты.
13. Чистая вода кипит при 373,2 К и атмосферном давлении. Опре-
Определите температуру кипения раствора, содержащего 3,291 -10~3 кг
хлорида кальция в 0,1 кг воды. Кажущаяся степень диссоциации СаС12
в указанном растворе 68 %. Эбулиоскопическая константа для воды
0,516°.
14. Определите кажущуюся степень диссоциации НЮ3 в растворе,
содержащем 0,506-10~3 кг НЮ3 в 22,48-10~3 кг этилового спирта.
Раствор кипит при 351,624 К, чистый этиловый спирт кипит при
351,46 К- Молярное повышение температуры кипения спирта 1,19°.
15. Температура замерзания чистого бензола 278,500 К, а темпера-
температура замерзания раствора, содержащего 0,2242-10~3 кг камфоры
в 3,055-10~2 кг бензола, 278, 254 К. Молярное понижение температуры
кристаллизации бензола 5,16°. Определите молекулярную массу кам-
камфоры.
16. К очень слабым водным растворам для предотвращения замер-
замерзания в зимнее время обычно прибавляют глицерин. Допустив, что за-
закон Рауля применим к растворам такой концентрации, вычислите коли-
количество глицерина, которое должно быть прибавлено, чтобы раствор, со-
содержащий 0,1 кг воды, не замерзал до 268,16 К.
17. Раствор, содержащий 1,632-10 кг трихлоруксусной кислоты в
0,1 кг бензола, кристаллизуется при температуре на 0,350° ниже, чем
чистый бензол. Определите, происходит ли диссоциация или ассоциация
трихлоруксусной кислоты в бензольном растворе и в какой степени.
Молярное понижение температуры кристаллизации бензола равно 5,16°.
18. Раствор, содержащий 0,001 моль хлорида цинка в 1 кг воды, за-
замерзает при 273,1545 К, а раствор, содержащий 0,0819 моль хлорида
цинка в 1 кг воды, — при 272, 7746 К. Вычислите коэффициент I. Кри-
оскопическая константа для воды 1,86°.
19. Температура плавления фенола 314 К. Раствор, содержащий
0,77-10~3 кг ацетанилида (С8Н9О) N в 1,254-10~2 кг фенола, кристал-
кристаллизуется при 310,25 К- Вычислите криоскопическую константу для фе-
фенола и теплоту плавления (Дж/кг) фенола, если молекулярная масса
ацетанилида, растворенного в бензоле, соответствует его формуле.
20. Определите концентрацию водного раствора глюкозы, если этот
раствор при 291 К изоосмотичен с раствором, содержащим 0,5 х
X 103 моль/м3 СаС12, причем кажущаяся степень диссоциации послед-
последнего при указанной температуре составляет 65,4 %.
21. В 1-10~3 м3 морской воды в основном содержатся соли (кг):
NaCl — 27,2- Ю; CaSO4 — 1,3- Ю-3; MgCl2 — 3,4-10-»; СаС12 —
0,6-10~3; MgSO4 — 2,3-10~3. Вычислите осмотическое давление мор-
морской воды при 298 К и сравните его с величиной, рассчитанной по дан-
203
ным об осмотическом коэффициенте, считая, что указанные соли пол-
полностью диссоциируют.
22. Давление пара раствора тростникового сахара в 1 кг воды сос-
составляет 98,88 % от давления пара чистой воды при той же температуре.
Вычислите температуру кипения и осмотическое давление этого раство-
раствора при 373 К; плотность раствора 1 • 10* кг/м3.
23. Вычислите температуру замерзания раствора, содержащего
7,308* 10~* кг хлорида натрия в 0,250 кг воды, если при 291 К осмоти-
осмотическое давление этого раствора 2,1077-10* Па, плотность ЫО3 кг/м3,
/пл = 333,48-10» Дж/кг.
24. Температура замерзания разбавленного, водного раствора тро-
тростникового сахара 272,171 К. Давление пара чистой воды при этой же
температуре 568,6 Па, а теплота плавления льда 6029 Дж/моль. Вычис-
Вычислите давление пара раствора.
25. Вычислите температуру замерзания водного раствора, если
давление его пара составляет 90% от давления пара чистой воды при
той же температуре. Теплота плавления льда 6029 Дж/моль.
26. Рассчитайте концентрацию водного раствора вещества в молях
на 1 кг воды и температуру кипения, если прн 373,58 К давление его
пара 1,0109- 10s Па. Молярная теплота испарения воды 40 193 Дж/моль.
Рн.о = 1,0264-10s Па при 373,58 К.
27. При давлении 1,01-10* Па температура кипения эфира 308 К-
Раствор, содержащий 0,01094 кг анилина в 0,1 кг эфира, имеет давление
пара 0,444-10» Па при 288,46 К. Теплота испарения эфира 375,70 х
X 103 Дж/кг. Вычислите молекулярную массу анилина в растворе.
28. Определите процентный состав и молекулярную массу углево-
углеводорода на основании следующих данных: из 0,2-10~3 кг вещества об-
образуется 0,687-10~8 кг СО, и 0,1125-10"8 кг Н,О; температура замер-
замерзания раствора, содержащего 0,0925-10~3 кг вещества в 0,01 кг бензо-
бензола, ниже температуры замерзания бензола на 0,354°. Криоскопиче-
ская постоянная К для бензола 5,16°.
29. Водный раствор замерзает при 271,5 К. Определите его темпера-
температуру кипения и давление при 299 К. Криоскопическая константа воды
1,86°; эбулиоскопическая константа воды 0,516°; давление пара воды
при 298 К равно 3168 Па.
30. Давление пара воды при 293 К равно 2338,5 Па, давление пара
раствора 2295,8 Па. Определите осмотическое давление при 313 К,
если плотность раствора при этой температуре 1010 кг/м3. Молекуляр-
Молекулярная масса растворенного вещества равна 60.
31. Температура замерзания раствора, содержащего 2,6152 х
X 10~3 кг эфира этиленгликоля в 0,1 воды, ниже температуры замер-
замерзания воды на 0,5535°. Определите молекулярную массу эфира, если
теплота плавления воды 6029 Дж/моль.
32. Через 2,5-10~3 м8 воды продувают сухой воздух при 283 К и
1,01 • 10е Па. Определите концентрации азота и кислорода в воде по до-
достижении равновесия, считая раствор идеальным. Коэффициенты Ген-
204
ри при 283 К равны для азора 677,14-10' Па, для кислорода 331,44 X
Х107 Па.
33. Растворимость газообразного бромоводорода в бензоле при
303 К характеризуется следующими данными:
Молярная доля . .0,000612 0,005459 0,01149 0,2335 0,02913 0,04713
Р, Па 1016,29 8460,64 25771,00 39053,77 46832,41 75537,79
Представьте графически зависимость растворимости НВг от давления
и рассчитайте среднее значение константы в уравнении Генри.
34. Сколько сероводорода растворится в 0,004 м3 воды при 283 К
под давлением 50,66-10* Па? Растворимость сероводорода в воде при
283 К равна 5,16 кг/м3 при нормальном давлении.
35. Воздух имеет объемный состав (%): О2 — 20,96; Na — 78,1;
Аг — 0,9 и СО2 — 0,04. Растворимость этих газов в воде при нормаль-
нормальном давлении (м3/м3): О2 — 0,0429; N2 — 0,0209; Аг — 0,057; СО2—
1,424 (газ приведен к условиям 10,132-10* Па, 278 К). Рассчитайте
процентное соотношение компонентов воздуха, растворенного в воде
при 278 К и давлении 10,132-10* Па.
36. В сосуде вместимостью 0,01 м3 при 292 К и 105 Па находится
кислород. Какой объем бензола следует добавить в сосуд, чтобы давле-
давление кислорода повысилось на 10,132-10* Па? Растворимость кислоро-
кислорода в бензоле при 292 К и нормальном давлении 0,233 кг/м3.
37. Коэффициент Генри для кислорода в воде 273,2 и 282,2 К ра-
равен 0,04889 и 0,03802 атм соответственно. Вычислите энтальпию раст-
растворенного кислорода в воде.
38. Сколько граммов СО2 растворится в 1 л воды при 293 К, если
над водой находится воздух с содержанием 0,03 % СО3, а объем газа
(приведенный к 273 К и 1,01 -105 Па), растворенного при данной тем-
температуре в 1 л воды и Р = 1,01 -10* Па, равен V = 0,878.
39. Константы Генри для кислорода и азота при растворении их в
воде при 273,2 К равны соответственно 1,91-10' и 4,09- Ю7 Па. Рассчи-
Рассчитайте понижение температуры замерзания воды, вызванное растворе-
растворением воздуха (80 % N2 и 20 % О2) при 1,0133-10* Па.
40. При 288 К водный раствор янтарной кислоты, содержащий
12,1 г/л кислоты, находится в равновесии с эфирным раствором, содер-
содержащим 2,2 г/л кислоты. Какова концентрация эфирного раствора ян-
янтарной кислоты, который находится в равновесии с водным раствором,
содержащим 4,84 г/л кислоты? Янтарная кислота имеет нормальную
молекулярную массу и в воде, и в эфире.
41. При распределении уксусной кислоты между тетрахлоридом
углерода и водой были получены следующие концентрации (кг/м3):
В СС14
В Н2О
2,
48
92
,7
3,63
54,2
7,25
76,4
10
93
,7
,0
14,1
107,0
Уксусная кислота в водном растворе имеет нормальную молекулярную
массу. Определите молекулярную массу уксусной кислоты в растворе
СО4 и коэффициент распределения.
205
42. При распределении фенола между водой и бензолом получены
следующие данные (моль/л):
В Н2О 0,0316 0,123 0,327 0,750
В С6Н6 0,077 0,159 0,253 0,390
Вычислите коэффициент распределения К и показатель степени п в
формуле, описывающей закон распределения.
43. Фенол имеет нормальную молекулярную массу и в воде, и в
амиловом спирте. При 298 К раствор, содержащий 10,53 г г/л фенола
в амиловом спирте, находится в равновесии с водным раствором, со-
содержащим 0,658 г/л фенола. Определите массу фенола, полученную из
0,5 л водного раствора концентрации 37,6 г/л двукратным экстрагиро-
экстрагированием амиловым спиртом. Для каждого экстрагирования берется по
0,1 л амилового сирта.
44. Коэффициент распределения иода между водой и тетрахлори-
дом углерода при 298 К равен 0,0117. В обоих растворителях иод име-
имеет одинаковую молекулярную массу. Какой объем тетрахлорида угле-
углерода следует взять, чтобы однократным экстрагированием извлечь из
0,5 л водного раствора 99,9; 99,0; 90,0 % содержащегося в нем иода?
45. Сколько иода остается в 1 л водного раствора, который был на-
насыщен при 291 К, после взбалтывания его с 0,1 л сероуглерода? Раство-
Растворимость иода в воде при 291 К составляет 1 г на 3,616 л. Коэффициент
распределения иода между водой и сероуглеродом 0,001695. Молеку-
Молекулярная масса иода в обоих растворителях одинакова.
46. Каково должно быть атмосферное давление, если раствор, со-
содержащий 5,35 г NH4C1 на 2 л воды, кипит при 373,2 К?
47. Сколько граммов нафталина надо растворить в 120 г бензола,
чтобы давление пара бензола при 323,2 К было 0,352-105 Па.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. При температуре Т давление пара раствора концентрации с не-
неизвестного нелетучего вещества в жидком растворителе равно Р Па;
плотность этого рствора d. Зависимость давления насыщенного пара
от температуры над жидким и твердым чистым растворителем приведе-
приведена в таблице (с. 167—170): 1) вычислите молекулярную массу растворен-
растворенного вещества; 2) определите молярную и моляльную концентрации
раствора; 3) вычислите осмотическое давление раствора; 4) постройте
кривую Р — f (T) для данного раствора и растворителя; 5) определите
графически температуру, при которой давление пара над чистым раство-
растворителем будет равно Р Па; 6) определите графически повышение тем-
температуры кипения при давлении Р раствора данной концентрации с;
7) вычислите эбуллиоскопическую постоянную всеми возможными
способами и сравните эти величины между собой при нормальной тем-
температуре кипения (ТИтЧшК); 8) определите понижение температуры за-
замерзания раствора; 9) вычислите криоскопическую постоянную.
206
№ варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Массовое со-
содержание не-
нелетучего ве-
вещества, %
0,5
8
5
8,5
5
9
8
7
5
4,5
5
6
3
Э
6
5
Молекуляр-
Молекулярная масса
растворителя
18
27
28
30
32
34
44
46
52
52,5
58
64
68
78
81
83,5
Р. Па
1598
38 714
31740
33 841
16 106
55 000
650000
2375
91912
776
35896
7328
12 420
5807
49 431
84 990
г, к
288,2
278
69
114
306,7
207
223
283,2
252,5
1991
303
216
149
283,2
194
119,6
кг/м1'
1,000
0,750
0,850
1,300
1,590
1,985
1,500
1,210
2,900
6,800
3,560
1,590
1,780
0,750
1,210
2,160
2. На основании данных о растворимости газов в воде при различ-
различных температурах и при общем давлении (газа и паров воды) 1,01 • Ю5
Па (см. таблицу на с. 208) рассчитайте среднюю теплоту растворения
газа в воде и сравните последнюю с теплотой конденсации растворен-
растворенного газа. Установите графически зависимость растворимости газа в
воде от температуры и давления. Вычислите интервал давления, в ко-
котором растворимость подчиняется закону Генри.
ГЛАВА XIV
ГЕТЕРОГЕННОЕ РАВНОВЕСИЕ В БИНАРНЫХ СИСТЕМАХ,
СОДЕРЖАЩИХ ЖИДКУЮ И ПАРОВУЮ ФАЗЫ
Основные уравнения и символы
[К., с. 363—394; Г., т. 1, с 185—204]
Для идеальных растворов концентрация t-ro компонента в ndpe и в
жидкой фазе связана уравнениями
•*?;
г" =
*В
(XIV.1)
тде х\ и л:в — молярные доли компонентов А и В в паре; ^ и^ —
молярные доли компонентов А и В в жидкой фазе; Р% и Р& — давле-
давления насыщенного пара над чистыми компонентами А и В; Р — общее
давление над раствором.
207
К
1
о.
i
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Газ
Азот |
i
Оксид азота (II)
Ацетилен
Водород
Гелий
Кислород
Метай
Диоксид серы
Сероводород
Диоксид углерода
Оксид углеводл
Хлор
Хлороводород
Этан
Этилен
273
2,94
9,83
0,200
1,92
—
6,95
3,95
22,8
0,707
0,336
4,40
1,46
82,5
1,32
0,0284
Растворимость газа в воде (г/100 г)
283
1
1
2,31
7,56
0,150
1,74
3,75
5,37
2,96
16,2
0,511
0,232
3,48
0,997
77,2
0,870
0,0200
293
1,89
6,17
0,П7
1,30
1,74
4,34
2,32
11,3
0,385
0,169
2,84
0,723
72,1
0,620
0,149
303
1,62
5,17
0,094
1,47
1,72
3,59
1,90
6,80
0,298
0Л25
2,41
0,572
67,3
0,468
0,0158
313
1,39
4,39
—
1,39
1,70
3.09
1,59
5,41
0,236
0,097
2,08
0,459
63,3
0,366
—
при температуре, К
323
1,21
.3,76
—
1,29
5,69
2,66
1,38
—
0,S8«
0,076
1,80
0,396
59,6
0,294
—
333
1,05
3,24
—
1,18
—
2,26
1,14
__
0,148
0,058
1,52
0,329
56,1
0,239
—
353
0,660
1,98
—
0,79
—
1,38
0,695
—
0,077
—
0,980
0,223
—
0,134
—
373
0
0
—
0
—
0
0
—
0
—
0
0
_
0
—
Коэффи-
Коэффициент для
q в СИ
103
103
— '
10*
10<
103
10^
_..
.--
—
ю2
—
Теплота испарения смеси описывается уравнением
где АЯИСП —¦ теплота испарения I моль раствора; АЯнсп,а —¦ теп-
теплота испарения 1 моль вещества А; Л//исп.в —¦ теплота испарения
1 моль вещества Б.
Для реальных ргсторов концентрация /-га компонента в паре
связана с активностью этого компонента в жидкой фазе;
*а=-~-«а; *в" = 4— Яв- (XIV-3)
где йд и аъ —¦ активности компонентов в растворе.
Соотношение массы пара и массы жидкости при заданных услови-
условиях, если система гетерогенная, определяется по правилу рычага. Если
на диаграмме кипения на оси абсцисс отложить массовую долю, то
^ /п"//я=(«иж— w) (ш* — ша), (XIV.4)
где т" — масса пара; т — масса системы; w — массовый состав си-
системы, %; wn — массовая доля пара, %; w* — массовая доля жидкости,
%. Если же на оси абсцисс отложить молярную долю в процентах, то
па/п={хж~х) (хж~~Xя). (XIV.5)
Давление насыщенного пара в области существования гетерогенной си-
системы, компоненты которой ограниченно растворимы друг в друге, бу-
будет равно
где Рд и Рв — парциальные давления; Р — общее давление пара.
В гетерогенной области Рд — const, рв — const. Давление насыщен-
насыщенного пара над гетерогенной системой, компоненты которой взаимно
нерастворимы, будет равно
(XIV.7)
где Рд и Рв — давления насыщенного пара над чистыми компонентами
А и В. Составы пара и конденсата одинаковы:
, (XIV'8>
где Ид и «в —¦ число молей компонентов А и В. Из уравнения (XIV.8)
видно, что соотношение чисел молей компонентов А и В в паре и в кон-
конденсате независимо от их соотношения в исходной смеси. Массовые со-
соотношения компонентов в конденсате
"W'»b = МкРЦ(МъР%), (XIV.9)
Если при перегонке с водяным паром одним чз компонентов яляется
вода, то
, (XIV.10)
209
где w?H2o — расход водяного пара на перегонку тв кг вещества В.
Если в уравнении (XIV. 10) т& = 1 кг, то
Пн,о=18РКо/(мвР°в), (XIV. II)
где тн,о —¦ расходный коэффициент водяного пара на перегонку 1 кг
вещества В.
ЗАДАЧИ С РЕШЕНИЯМИ
1. При 313 К давления паров дихлорэтана и бензола равны 2,066 х
X 10*и 2,433* 30* Па соответственно. Какие можно сделать выводы на ос-
основании следующих экспериментальных парциальных давлений ди-
дихлорэтана и бензола при нескольких значениях концентраций:
*с,н, 0,130
Рг н п •№-«, Па 1,791
с.н,
• Ю-*, Па
0,293
0
I
0
,257
,507
,648
0
0
I
,560
,933
,347
0
0
I
,695
,664
,663
0
0
I
,972
,429
,933
0
0
2
,875
,247
,140
Определите состав смеси, которая будет кипеть при давлении 2,267 х
X 104 Па, и давление, при котором закипит смесь с молярной долей бен-
бензола 40 %.
Решение. Построим диаграмму зависимости давления от со-
состава системы при температуре 313 К (рис. 21). На оси абсцисс отло-
отложим молярную долю дихлорэтана в %. На осях ординат отложим дав-
давления паров чистого дихлорэтана Р?8н, ci8 и чистого бензола Р<?,н,.
Затем соединим прямой точки Рс.н. и Рс,н4а8 и проведем прямые линии,
соединяющие начала координат с точками Рс,н4а8 и Рс,н,- Эти ли-
линии показывают зависимость
общего давления и парциаль-
парциальных давлений насыщенного
пара над бинарной системой
от состава при условии под-
подчинения раствора закону Рау-
Рауля. Нанесем на этот график
точки, соответствующие экс-
экспериментальным значениям
парциальных давлений ком-
компонентов, и суммы парциаль-
парциальных давлений. Из графика
видно, что в пределах оши-
ошибок опыта раствор можно
считать подчиняющимся за-
О.в 0.6
0,2 Ofi
Молярная
Об
доля
0,2
03
%
0
1,0
о
Рис. 21. Зависимость парциальных и обще-
общего давления пара от состава системы
С6Н6—СбН4С12 при 313 К
кону Рауля, или совершен-
совершенным раствором. По графику
находим, что при давлении
Р = 2,267-10* Па кипеть бу-
будет раствор с молярной долей
210
дихлорэтана 62 %, а раствор с молярной долей бензола 40 % закипит
при давлении 2,200-10* Па.
2. При 323 К получены следующие парциальные давления над
системой дихлорэтан — этиловый спирт:
*с,н,он
0,1
0,2
0,3
0,4
0,5
яс,н,онх
Х10~4, Па
1,139
1.773
1,953
2,025
2,085
ЯС,Н4С1,Х
X1O~4. Па
2,860
2,740
2,686
2,652
2,585
*с,н,он
0,6
0,?
0,8
0,9
^СН.ОНХ
Х10"~*. Па
2,155
2,260
2,417
2,672
яС,н4а,х
Х10~*. Па
2,464
2,249
1,843
1,147
Давление насыщенного пара над чистым этиловым спиртом при этой
температуре 2,960-Ю4 Па, а над чистым дихлорэтаном 3,113-10* Па.
Вычислите общее давление над системой при всех заданных концент-
концентрациях. Постройте диаграмму зависимости парциальных и общего дав-
давления насыщенного пара от состава системы. Сделайте вывод относи-
относительно характера растворов, коэффициентов активности компонентов
раствора, изменения объема при смещении и тепловом эффекте смеше-
смешения.
Решение. На основании парциальных давлений вычисляем об-
общее давление над системой:
*CjH§0H 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
Р-10-4, Па 3.999 4,513 4,639 4,677 4,670 4,619 4,509 4,260 3,819
Зная парциальное и общее давление насыщенного пара при всех
заданных концентрациях, строим график Р = / (*с8н»он) (рис. 22).
Как видно из рис. 22, зависимости парциальных давлений С2Н5ОН и
С2Н4С12и общего давления нелинейные. Значения опытных давле-
давлений для всех составов больше давления, рассчитанного по закону Ра-
Рауля. Отсюда можно сделать заключение, что раствор состава С2Н8ОН—
— С2Н4С1$ несовершенный, имеет положительное отклонение от зако-
закона Рауля. Коэффициенты активности компонентов раствора при всех
концентрациях больше единицы. Следовательно, при образовании та-
такого раствора объем раствора больше суммы объемов его компонентов;
тепловой эффект Л#см положительный, теплота поглощается системой
при образовании раствора.
3. При изучении равновесия системы хлороформ — диэтиловый
эфир при 298 К были получены следующие парциальные давления насы-
насыщенного пара:
РС,н.ОС,н.-1°-*. Па
Ю-*, Па .
0
0,000
1,933
0,2
0,460
1,480
0,4
1,287
0,920
0,6
2,666
0,460
0,8 1,0
4,093 5,333
0.165 0,000
21!
Постройте графики зависимости парциальных и общего давления
насыщенного пара от состава раствора. Сделайте заключение относи-
относительно характера отклонения от закона Рауля, о коэффициентах ак-
активности компонентов раствора при всех концентрациях, изменении
объема при образовании раствора и о тепловом эффекте смешения.
Решение. На основании приведенных парциальных давлений
вычислим общее давление и построим графики Рсн а, = / (х),
^с,н»ос,н, = f(x),P^f (x), где х —
молярная доля эфира (рис. 23). По ха-
характеру кривых видно, что растворы
при всех концентрациях не подчи-
подчиняются закону Рауля. Наблюдается
отрицательное отклонение от закона
Рауля. Отрицательное отклонение от
о,о
0,6 т
ОА 0,6 o,s
Молярная Золя, °/„
Рис. 22. Зависимость парциаль-
парциальных и общего давления пара
от состава системы C2H4CI2—
С2Н5ОН при 313 К
СНС13/.0 0.6 0.6 ОМ 0.2 О
Qp 0.2 ОМ 0.6 0.6 iOi
Молярная доля, */„
Рис. 23. Зависимость парциальных и об-
общего давления пара от состава системы
ЧСгНвЬО при 298 К
линейной зависимости уменьшается и стремится к нулю при прибли-
приближении концентрации компонента раствора к единице. Коэффициенты
активности компонента раствора при всех концентрациях меньше еди-
единицы. Следовательно, при образовании растворов объемы их меньше
суммы объемов компонентов; при образовании рстворов выделяется
теплота (Л#см < 0).
4. Постройте график зависимости состава пара от состава жидкой
фазы для системы дихлорэтан — бензол при 313 К, если известны сле-
следующие экспериментальные данные:
212
хс н< 0,130 0,257 0,560 0,695 0,792 0,875
PQH4W!°4' Па ¦ • • !'79! !'507 °'933 0>664 0>429 0>247
'Pqh'-IO*, Па 0,292 0,648 1,347 1,663 1,933 2,140
При 313 К давления паров дихлорэтана и бензола равны 2,066 X
X 104 и 2,433-104 Па соответственно.
Решение. По уравнению (XIV. 1) вычислим состав пара, зада-
задаваясь определенным составом жидкой фазы. Общее давление над систе-
системой рассчитаем по уравнению Дальтона как сумму парциальных дав-
давлений:
** 0,130 0,257 0,560 0,695 0,792 0,875
о,н,
*"' 0,152 0,290 0,598 0,727 0,816 0,89;
Р-10-*, Па 2,083 2,155 2,280 2,327 2,362 2,387
На осноьании полученных данных строим график зависимости состава
пара от состава жидкой фазы *с,н, = / (*с,н.) (рис. 24). Из графика
видно, что в парах концентрация бензола больше, чем в жидкой фазе.
На различии составов жидкой фазы и пара основано разделение двух
компонентных растворов.
0,2 0,4 0,6 Ofi 1,0
Молярная доли CfcHj (.
жидкой фазе,'/с
Рис. 24. Зависимость состава
пара от состава жидкой фазы
для системы CeHe—C2H4CI2
при 313 К
350
340
330
1 /
зго[1/
f
300
t t
f (<
fl 20 W 60 BO 100 ССЦ
(СгН5)г0 tOO SO 60 ЬО 20 0
о Молярная доля, °/t
Рис. 25. Диаграмма кипения системы
(С2Н5JО—СС1, при 1,0133-!06 Па
5. Проанализируйте фазовое состояние системы СС14 — С2Н8ОС2Н5
на основании диаграммы кипения (рис. 25). Проведите анализ процес-
процесса нагревания системы с молярной долей СС14 50 %.
Решение. Выше кривой* abc состава насыщенного пара все сис-
системы находятся в состоянии пара. Системы гомогенные, однофаз-
213
ные. Ниже кривой adc состава кипящей жидкости все системы находят-
находятся в жидком состоянии. Системы гомогенные, однофазные. Между
кривыми abc и adc система гетерогенная, две фазы, жидкость и пар.
Для определения состава равновесных фаз через точку заданного со-
состояния необходимо провести изотерму, так как фазы, находящиеся в
равновесии, должны иметь одинаковую температуру. Пересечение изо-
изотермы с кривой adc состава кипящей жидкости дает состав жидкой фа-
фазы, который определяется по оси абсцисс. Пересечение изотермы с кри-
кривой abc насыщенного пара дает состав пара. Так, система с молярным
содержанием СС14 40% при 338 К — гетерогенная (точка е). Она со-
содержит две фазы, находящиеся в равновесии. Одна фаза — кипящая
жидкость с молярным содержанием СС14 50%, другая — насыщенный
пар с молярным содержанием СС14 24 %. Если жидкую систему с мо-
молярным содержанием СС14 50 % (точка /) нагреть до 338 К, то начнет-
начнется кипение системы. Молярный состав пара, находящегося в равнове-
равновесии с кипящей жидкостью, будет 24 % СС14. Состав пара беднее тетра-
хлоридом углерода, чем жидкость. Из жидкой фазы в пар преимущест-
преимущественно уходит диэтиловый эфир. Отсюда жидкая фаза обедняется
С2Н5ОС2Н5 и ее состав меняется, как это показано стрелками на
рис. 25. Вместе с изменением состава кипящей жидкости меняется и со-
состав пара, находящегося в равновесии с ней. Изменение состава пара
показано стрелками на кривой abc. При 342 К в равновесии будут на-
находиться пар и жидкость. Молярные составы жидкой фазы СС14 65 % и
пара СС14 35 %. Изменение состава жидкости и пара и температуры
фазового равновесия будет происходить до тех пор, пока состав пара
не станет равным составу исходной жидкости /. При 345,4 К моляр-
молярный состав пара будет 50% СС14, вся жидкая фаза превратится в пар.
Система станет гомогенной. Молярный состав последней капли жидко-
жидкости 84 % СС14. При дальнейшем нагревании состав пара меняться не
будет.
Процесс охлаждения системы с молярной долей СС14 50 % будет
обратным разобранному. Пусть исходная система имеет молярный сос-
состав 50 % СС14. При 350 К эта система (точка g) находится в состоянии
пара. При охлаждении ее до 345,4 К система станет гетерогенной, по-
появится первая капля жидкой фазы. Ее молярный состав 84 % СС14.
Так как из пара в жидкую фазу преимущественно уходит СС14, то пар
обедняется СС14 и его состав изменяется по кривой abc. Вместе с изме-
изменением состава пара меняется и состав жидкой фазы, находящейся с
паром равновесии. Изменение состава кипящей жидкости происходит
по кривой adc. Изменение составов жидкой и паровой фаз приводит к
изменению температуры конденсации. При 338 К состав жидкой фазы
станет равным составу исходного пара. При этой температуре система
станет гомогенной, исчезнет последняя порция пара. При дальнейшем
охлаждении состав жидкой фазы не изменяется.
6. Определите массу СС14 и С2Н5ОС2Н5 в жидкой фазе и в парах
(рис. 25), если 1 кг системы с молярным содержанием СС14 50 % нагреть
до 342 К.
214
Решение. Рассчитаем количество веществ,находящихся в жид-
жидкой и паровой фазах, по правилу рычага. Так как на диаграмме
(рис. 25) молярный состав выражен в процентах, то необходимо вос-
воспользоваться уравнением (XIV. 5). Сначала определим количество мо-
молей вещества, которое содержится в системе массой 1 кг. Для этого
вычислим среднюю молекулярную массу:
,5 +74-0,5 =!!4.
В
1 кг системы содержится
!000/!!4 = 8,772СС!4'и С2НвОСаН5.
Молярные составы сосуществующих фаз при 342 К (%): жидкая СС14 —
61; С2Н5ОС2Н5 — 39; парообразная СС14 — 35, С2Н5ОС2Н5 — 65. По
уравнению (XIV.5) находим
яп=8,772@,6!~0>50)/@>6!— 0,35)=3,7П моль,
яж = 8,772—3,7!! = 5,06! моль.
По составам фаз определим число молей компонентов в каждой фазе и
массу компонента в базе:
Фаза
Жидкая
Пар
п
5,06!
3,7!!
"ecu
3,087
!,299
тСС14- кг
0,475
0,200
"CjH.OC.H,
1,974
2,412
mCjH,OC,H,- кг
1,146
0,179
В сумме получим: 0,475+0,200+0,1464-0,179=1,000 кг.
7. Проанализируйте фазовое состояние системы CS2 — СН3СОСН3
на основании диаграммы кипения (рис. 26) и процесса нагревания систе-
системы с молярной долей СН3СОСН3
80 %.
Решение. Система CS2 —
СН3СОСН3 характеризуется поло-
положительным отклонением от закона
Рауля. В этом случае коэффициенты
активности компонентов раствора
больше единицы, при образовании
раствора объем увеличивается, теп-
теплота поглощается, A VCM > 0,
АЯСМ > 0.
Выше кривой abode состава насы-
насыщенного пара система гомогенна, фаза
одна — пар. Ниже кривой agcfe со-
составов кипящей жидкости система го-
гомогенна, фаза одна—жидкая. Между
кривыми abode и agcfe система гете-
рогенна. В равновесии находятся
310
о
CS, 100
20 <№ 60
80 60 40
Молярная доля,
80
20
Рис, 26. Диаграмма кипения си-
системы CS2—CH3COCH3 при
1,0133-10» Па
215
flpoc
CHSCOC
Op?; 317
CH 3COC
елза об*
:лед»п
:к, г >
¦.5 f rj
-Но i )
жидкость и пар. Состав пара определяется по кривой abcde, состав
жидкой фазы определяется по кривой agcfe. Точка с — азеотропная
смесь. Эта точка характеризуется одинаковым составом жидкой фазы
к «ара.
Г^- гния системы с молярной долей
I > И7,5 К система жидкая, гомогенная.
"^ ! пени.; системы. Молярный состав пара 62 %
i f * "> "^роуглеродом. чем жидкость, то жидкая
ф • с ». ее состав изменяется. Вместе с изме-
изменением состава читкой i|a u меняется и температура кипения. Изме-
Изменение состава жкиг'" jia~\> г;едет и к изменению состава насыщенного
пара. ш.>одя1ц°п~ !i • -г.1 • :мидкой фазой. На диаграмме изме-
пап'.и с ^п -* т.[ч, доказаны стрелками. При 323,7 К
cociaBi,. с сч ¦ со -ву исходной жидкой системы. При
ji-ой тем "Vi/ре исчелает по лелп^я капля жидкой фазы. Ее молярный
состав 94 % СН3ОС>СНа. Далее система становится юмогемкой и про-
происходит нагревание лара. Состав системы при этом меняться не будет.
Охлаждение кааекы на диаграмме кипения отражается изменением
фазового состоявши системы б обратной последовательности. При
323,7 К начинается козденсадк? системы. Молярный состав первой кап-
капли конденсата 94 % СН3О0СН3. Из яара преимущ,естз.ймво з жидкую
фазу переходит ацетон. Отсюда вмдио, что пар обогащается сероуглеро-
сероуглеродом. Состав пара и температура конденсация меняются. Вместе с изме-
менмем состава пара меняется и состав жидкой фазы., находящейся в
равновесии с паром. При 317,5 К. состав жидкой фазы становится таким
Ж€, как к состав исходного пара. Конденсация заканчивается. Система
становится гомогенной.
8, Определите, какой компонент и в каком количестве следует до-
добавить к системе CSa — CH3CO0Hs с молярной долей СН3СОСН5 80%,
чгобь? получить азеотрошгую смесь, молярный состав которой 37 %
СН3СОСН3. Масса системы I кг.
Р е ш е н и е. Исходная смесь беднее сероуглеродом, чем азеотрон-
ная. Следовательно, необходимо добавлять к системе сероуглерод, что-
чтобы получить из исходной системы азеотропную. Сначала рассчитаем ко-
количество молей в 1 кг исходной системы, Для этого определим среднюю
молекулярную массу исходного раствора:
/ЛСр = 76.0,2 + 58-0,8 = 61,6.
В S кг раствора содержится 1000/61,6 = 16,234 моль. В 1 кг раствора
16,234-0,8 = 12,99 моль СН3 СОСН3 и 16,234-0,2 = 3,247 мольС52.
Так как добавлять следует сероуглерод, то количество молей аце-
ацетона в системе останется без изменения и в азеотропном растворе
12,99 моль ацетона составят 37 %. Остальные 63 % должен составить
сероуглерод:
12,99 моль— 37%
х= 12,99-63/37 = 22,12 моль сероуглерода.
х моль—63%
В растворе имеется 3,247 моль сероуглерода. Следовательно, добаш.ть
необходимо 22,12—3,247=18,873 моль, или 1,43 кг CS2.
9. Определите, какой компонент к сколько его может быть выделе-
выделено из 1 кг системы с молярной долей СК3СОСН3 80 % (рис. 26) ректи-
ректификацией в чистом виде.
Решение. Количество молей ацетона и сероуглерода в 1 кг си-
системы.с молярным содержанием ацетона 89 % определяем по рис. 26:
моль;
«
сн.сосн,
¦~ 12.989 моль.
Так как данный состав находится справа от азеотропной точка, то выде-
выделить ректификацией в чистом виде можно только ацетон. Весь сероуг-
сероуглерод C,247 моль) перейдет в азеотропную с^гсь с молярным содержа-
содержанием 63 %. Остальные 37 % в азеотропном растворе составит ацетон:
3,247 моль-
X МОЛЬ -
-63%
-37%
х = 3,247.37/63 — 1,907 моль.
Следовательно, в азеотроп перейдет 1,907 моль гцс-.гонз, а в чистом ви-
виде можно .выделить 12,98—1,097 =---=11,08 моль, или 11,08-58- I0~ri=
= 0,643 кг ацетона.
10. Определите активность и коэффициент активности сероуглеро-
сероуглерода и ацетона в растворе CS2 —СН3СОСН,, в котором молярная доля
СН8СОСН3 80 % (рис. 26) при 3!7]5 К.
Решение. Активность обоих компонентов определим по урав-
уравнению (XIV.3). Общее давление постоянно и равно 1,0133-105 Па. Дав-
Давление насыщенного пара над чистыми веществами определяем по урав-
уравнению (XII.8):
g
Pl 2,3026/? \ Г, Г2
По известным значениям давлений насыщенного пара ври двух тбмне-
ратурах рассчитаем теплоту испарения:
АЯИСП = ТхТг J\ _
Тх—Т.г "g Pi '
2,3026#
Давление насыщенного пара находим по справочнику [М.]. Определяем
давление насыщенного пара чистого вещества при третьей температу-
температуре:
ЛЯ„™ /1 1 \ UjT^-Tj) , PS
— i = i,i p* = —-—? — If -
cn_(J L)
6R I Г, Т%)
2.3026R
Полученные значения сводим в таблицу:
Вещестао
СН3СОСН3
cs2
Я0-!0~5, Па
0,5333
0,5333
г,, к
312,5
301,0
Я*- 10~5. Па
1,0132
1,0132
Тг. К
32»,2
319,2
г,, к
317,5
317,5
Я в . 1 0~", Пл
0,6406
0,9425
217
Состав пара определяем по диаграмме кипения (рис. 26):
ас$г = 0,38-1,0132- №6/@,9425-106) = 0,409;
Vcs> = 0,409/0,200 = 2,045;
«сн.сосн, = °-6--! -0!32- Ю5/@,6406- Ю5) =0,981;
Тсн.сосн, =0,981/0,800= 1,226.
11. Бутиловый спирт ограниченно растворим в воде. Проанализи-
Проанализируйте фазовое состояние системы С4НЙОН — Н2О на основании ди-
диаграммы фазового состояния (рис, 27) при постоянном давлении, пре-
превышающем давления насыщенного пара над чистыми компонентами и
над системой. Проследите изменение фазового состояния при охлажде-
охлаждении системы с массовым содержанием
С4Н9ОН 68 %.
Решение. Так как внешнее
давление превышает давление насы-
насыщенного пара над системой, то не бу-
будет наблюдаться кипения системы.
Рассмотрим сначала фазовое со-
состояние систем. Выше кривой аКЬ
все системы гомогенные, одна фаза—-
жидкий раствор, состоящий из воды
и бутанола. Системы внутри кривой
аКЬ гетерогенные, две жидкие фазы.
Кривая аК показывает составы раст-
растворов бутанола в воде, кривая ЬК—
растворов воды в бутаноле. Для оп-
определения составов сосуществующих
в равновесии жидких растворов через
точку, соответствующую заданному
составу при заданной температуре,
следует провести изотерму. Пересечение изотермы с кривыми аК и ЬК
дает составы растворов.
При охлаждении системы с массовым содержанием С4Н9ОН 68 %
до 370 К — система гомогенная. При 370 К появится вторая жидкая
фаза и система расслоится на два раствора. Массовый состав появив-
появившейся новой фазы 10 % С4Н9ОН. При охлаждении системы раствори-
растворимость понижается. Составы разновесных фаз изменяются, как это по-
показано, стрелками на диаграмме. При 350 К массовые составы фаз 6%
и 74 % С4Н9ОН.
12. Проверьте применимость к системе бутанол — вода (рис. 27)
правила прямолинейного диаметра Алексеева.
Решение. Если отрезки, отсекаемые от изотерм 350 и 370 К кри-
кривыми аК и ЬК, разделить пополам и через центры си/ провести пря-
218
Рис. 27. Диаграмма фазового со-
состояния системы Н2О—С4Н8ОН с
ограниченной растворимостью ком-
компонентов
мую линию, то эта прямая пройдет через все аналогичные центры е, d
и т. д. и пересечет кривую фазового равновесия в критической точке К..
13. Определите массы Н2О и С4Н9ОН в растворах бутанола в воде
и воды в бутаноле, если 1 кг системы с массовой долей С4Н9ОН 68 %
охладить до 350 К-
Решение. Число сосуществующих фаз определяем по правилу
рычага. Так как на оси абсцисс отложена массовая доля в процентах,
то правило рычага выражается уравнением (XVI. 4). Составы сосущест-
сосуществующих фаз при 350 К определим по рис. 27:
mi/m=G4—68)/G4—6),
где тх — масса 1-й фазы; т — общая масса системы; т — 1 кг;
mi = 0,088 кг; т2 = 1 — 0,088 = 0,912 кг. Отсюда масса воды и бута-
бутанола в 1-й и 2-й фазах будет:
Фаза
!-Я
2-Я
Кривые
аК
ЬК
Массовая доля, %
НгО
94
26
С4Н„ОН
6
74
Фаза
2-я
Масса, кг
С4Н„ОН
0,088-0,06=0,0053
0,9! 2-0,74=0,6749
НгО
0,088-0,94=0,0827
0,9!2 0,26=0,2371
Общая-масса системы: 0,0053+0,0827+0,6749+0,2371 = 1,000 кг.
14. Постройте приближенно диаграмму давление насыщенного па-
пара — состав системы С4НВОН—Н2О при 350 К на основании диаграм-
диаграммы фазового равновесия (см. рис. 27). Вычислите активность и коэффи-
коэффициент активности Н2О в сосуществующих фазах при 350 К.
Решение. По уравнению Клапейрона — Клаузиуса (XII.8)
на основании справочных данных [М.] определяем давление насыщен-
насыщенного пара над чистым бутанолом при 350 К:
Г, К ....... 343,! 357,3
Р?<Н(ОН-10-5, Па 0,!333 0,2666
igp°3=igp;+ T:Z*~T:\ ч п -
= 4,,248+
р;
357,3C50—343,1) 0,2666-!06
350C57,3—343,!) 'g 0,1333-106
Pg= 1,5845- !04 Па.
Давление насыщенного пара воды определяем по справочнику [М.1
при 350 К Р° = 1,5845-104 Па.
219
Пересчитаем массовые доли фаз гетерогенной области при 350 К
на молярные доли: для водного слоя 6 % С4Н9ОН соответствуют
*с4н,он = 0,0153; для спиртового слоя 74,0 % С4Н9ОН — *с4н,он =
= 0,4091. Отложим на оси ординат (рис. 28) *с4н,он = '» Рс„н,он =:
= 1,8370-10* Па. Соединим эту точку с началом координат *c<h,oh =
=0 пунктирной линией. Эта прямая выражает зависимость парциаль-
парциального давления бутанола от состава и подчиняется закону Рауля.
Аналогично отложим на оси ординат для *c4h,oh — 0 Рн2о =
= 4,2064-10* Па. Соединим эту точку с началом координат *с,н,он =
= 1 пунктирной линией. Эта
прямая описывается законом
Рауля и выражает зависимость
парциального давления воды от
состава. Так как по первому ус-
условию выбора стандартного со-
состояния 7~* ПРИ х-*-\, то
приближенно можно принять,
Л) 0,2 0,5 0,4 0,5 0.6 0J 0,8 0,S f,0?4H,OH
Молярная доля . %
Рис. 28. Зависимость парциальных и об-
общего давлении от состава системы
HjO—С4Н»ОН с ограниченной раствори-
растворимостью при 350 К
что в гомогенных областях зави-
зависимости Pi = f (xt) совпадают
с зависимостями, определяемы-
определяемыми по закону Рауля. Это соот-
соответствует на рис. 28 отрезкам
Рнго а и Р?,н.он Ь. Так как
парциальные давления компо-
компонентов над гетерогенной обла-
областью не зависят от концентрации, то из точек а и b проведем горизон-
горизонтальные прямые ас и bd. Далее зависимости парциальных давлений в
гомогенной области носят сложный характер, но они должны быть вы-
выпуклыми вверх. Проведем приближенно эти кривые de и с/.
Общее давление равно сумме парциальных давлений. Проведем ли-
линию зависимости общего давления над системой от состава системы
Pfi,o пгп- Рс,и,он. Над гетерогенной системой общее давление будет
постоянным и равным 4,894> 10* Па. Это означает, что составы от 0,0153
до 0,4091 С4НВОН при давлении 4,894-10* Па будут кипеть при 350 К.
При концентрации Н2О 1—0,0153 = 0,9847 активность воды рав-
равняется концентрации, т. е. ай,о = 0,9847 и раствор подчиняется зако-
закону Рауля. Коэффициент активности воды у' — 0,9847/0,9847 = 1. Так
как химический потенциал воды в равновесных фазах одинаков, то
Тогда коэффициент активности воды в растворе с концентрацией воды
A-0,4091) - 0,5909 будет Vh.o = 0,9847/0,5909 = 1,6664. Коэффи-
Коэффициент активности больше единицы, наблюдается положительное от-
отклонение от закона Рауля: ДУСМ > 0; Л#см > 0.
15. Для очистки толуола его перегоняют с водяным паром при внеш-
внешнем давлении 9,932>10* Па. При какой температуре будет происхо-
220
дить кипение системы, если толуол практически не растворим в воде?
Для расчета воспользоваться следующими данными:
Г, К
PHiO-№-*, Па
333
2,058
343
3,219
2,698
353
4,893
2,862
363
7,244
5,394
. 373
10,469
7,429
Решение. Строим график зависимости давления насыщенного
пара воды (/) и толуола B) от температуры (рис. 29). Суммируя давле-
давления Рнго и /'с.НзСНз, согласно уравнению (XIV.6), получим общее
давление насыщенного пара над гетероген-
гетерогенной системой C). По графику находим тем-
температуру, при которой давление насыщен-
насыщенного пара над гетерогенной системой станет
равным внешнему давлению 9,932-104 Па.
Система закипит при 358,3 К.
16. По зависимости давления насыщен-
насыщенного пара от температуры (рис. 29) опре-
определите расход водяного пара на перегонку
1 кг толуола при внешнем давлении
9,932-104 Па.
Решение. По графику находим дав-
давления насыщенного пара толуола и воды
при 358,3 К. Они составляют для толуола
4,800-104, а для воды 6,200- Ш4 Па. Соглас-
Согласно уравнению (XVI. 11) на перегонку 1 кг
толуола будет израсходовано
mHtO^6,200.104-18/D,800- !0«-92) =0,253 кг.
ЗАДАЧИ
Рис. 29. Зависимость давле-
давления насыщенного пара от
температуры для CeHsCHs
(J), Н2О B) и системы
Н2О—СвН5СН3 C)
1. Раствор бензола в толуоле можно
считать совершенным. При 300 К давление
насыщенного пара над бензолом равно
1,603-104 Па, а над толуолом — 0,489-104 Па. Постройте график за-
зависимости парциальных давлений бензола и толуола и общего давле-
давления над системой бензол—толуол от состава раствора, выраженного
в молярных долях. Определите давление пара над системой с моляр-
молярной долей бензола 30 %. Чему будут равны парциальные давления
и общее давление над раствором, содержащим по 0,1 кг каждого ве-
вещества? Вычислите изменение энтропии, свободной энергии в процессе
образования 1 моль раствора с молярной долей бензола 30 % при
300 К.
2. Экспериментально определены парциальные давления над систе-
системой ацетон — хлороформ при 308,2 К в зависимости от состава:
221
ясна, 0.0 0,2 9,4 0,6 0,8 1,0
PCHCIj-10-*, Па .... 0 0,453 1,093 1,973 3,000 3,906
РСНСОСНз-10-4, Па . . 4,586 3,600 2,440 1,360 0,650 О
На основании этих данных постройте график зависимости парциаль-
парциальных и общего давлений над системой от состава. Сопоставьте получен-
полученные зависимости с зависимостями для растворов, подчиняющихся зако-
закону Рауля. Определите, при каком общем давлении начнет кипеть сис-
система с молярной долей хлороформа 50 % при 308, 2 К. При каком дав-
давлении она кипела бы, если бы раствор был совершенным?
3. Экспериментально определены парциальные давления над сис-
системой ацетон — сероуглерод при 308,2 К при разных составах:
xCSt 0 0,2 0,4 0,6 0,8 1,0
pcs,g!0~4' Па 0 3-733 S-040 5,666 6,133 6,826
PCHjCOCHj-10-*, Па . . 4,586 3,866 3,400 3,066 2,533 0
Постройте график зависимости парциальных и общего давления над
системой от состава, выраженного в молярных долях. Сопоставьте
зависимость с зависимостью, полученной по закону Рауля для совер-
совершенных растворов. Определите, при каких составах системы общее
давление пара над ней при 308,2 К. будет 8,5-104 Па. Какое давление
наблюдалось бы над этими системами, если бы раствор был совершен-
совершенным?
4. Вычислите общее давление паров над системой, содержащей
0,078 кг бензола и 0,076 кг сероуглерода, при каждой из температур,
если раствор считать совершенным:
Г, К 293 313 353
рс.н,-!0~4' Па 1,020 2,466 10,066
P&S 10-«, Па 3,960 8,226 27,064
Экспериментально определенные общие давления при этих темпера-
температурах соответственно равны 2,746-104; 5,760-10* и 19,655-10s Па. Вы-
Вычислите отклонения давления от давления над идеальным раствором для
каждой температуры. Когда поведение раствора ближе к идеально-
идеальному — при более высокой или при более низкой температуре?
5. Постройте график зависимости содержания бензола в паре от со-
содержания бензола в жидкой фазе. Определите содержание бензола в
паре, если в жидкой фазе его молярная доля 40 %. Бензол и толуол
образуют растворы, близкие по свойствам к идеальным. При 293 Кдав-
ления паров бензола и толуола соответственно равны 1,020-10* и
0,327-10* Па.
6. Давления паров веществ А и В при 323 К соответственно равны
4,666-104 и 10,132- iO4 Па. Вычислите состав пара, равновесного с раст-
раствором, считая, что раствор, полученный при смешении 0,5 моль А
и 0,7 моль В, идеальный.
222
7. Вычислите в молярных долях состав раствора, кипящего при
373 К и 10,133-104 Па, если СС!4 и SnCl4 образуют идеальные растворы.
Давления паров СС14 и SnCl4 при 373 К соответственно равны 19,332х
X Ю4 и 6,666-104 Па. Определите состав в молярных долях первого пу
зырька пара. Какой состав будет иметь последняя капля жидкости, ес-
если раствор полностью перевести в пар?
8. Рассчитайте состав пара над раствором, содержащим по 0,5 моль
бензола и толуола, по зависимости давления насыщенного пара от тем-
температуры для бензола и толуола:
Г, К
330
5,2
1 6
350
9,3
3,8
380
2!,3
9,3
420
55,5
25,8
Дайте заключение о применимости первого закона Вревского. При
расчете раствор считать идеальным.
9*. Считая раствор н-гептана и н-октана идеальным, постройте ди-
диаграмму кипения, используя справочные данные о теплотах испарения
и температурах кипения [С.Х., т. 1].
10. Определите массу пара и жидкой фазы, которые будут нахо-
находиться в равновесии, если 1 кг раствора С2Н5ОС2Н5—СС14 с молярной
долей СС14 30 % нагреть до 333 К. Молярная доля жидкой фазы 37 %
СС14, пара 16 % СС14. Диаграмма кипения приведена в справочнике [МЛ.
11. Какой компонент и сколько его следует добавить к 1 кг системы
HNO3 — Н2О с молярной долей HNO3 60 %, чтобы получить азеот-
ропную смесь. Диаграмма кипения приведена в справочнике.
12. Парциальное давление СН3ОН над раствором СН3ОН в Н2О с
молярной долей хсн3он = 0,25 при 313,1 К составляет 12,5-10s Па,
а при 332,6 К — 30,5- 10s Па. Определите парциальную молярную теп-
теплоту испарения СН3ОН из раствора Хсн3он = 0,25.
13. Определите парциальную молярную теплоту растворения СН3ОН
в растворе СН3ОН — Н2О с хсн„он = 0,25 при 332,6 К, если парци-
парциальная молярная теплота испарения СН3ОН из раствора СН3ОН в
Н2О с молярной долей Хсн,он = 0,25 при 332,6 К равна 39,6 кДж/моль,
теплоту испарения чистого метанола см. в справочнике [М.].
14. Докажите, что в азеотропном растворе ya = Р1Р\ и ув =
= Р/Рв, где Р — общее давление над системой, значения Ya, ?в,
Р% и />в соответствуют температуре кипения азеотропного раствора.
15. Определите коэффициенты активности и активности СС14 и
С2Н8ОН в растворе с хСа, = 0,63 при 337 К. Общее давление 10,133 х
X 104 Па/Необходимые данные возьмите из справочника [М.]. Диаграм-
Диаграмма кипения системы СС14 — С2Н8ОН приведена в справочнике [М.].
16. Муравьиная кислота и вода образуют азеотропный раствор при
*н,о = 0,467 и 380,8 К. Общее давление 10,133-10* Па. Определите
Коэффициенты активности и активности муравьиной кислоты и воды в
азеотропном растворе. Теплота испарения АЯнсоон = 22,24 кДж/моль
223
при Гн,т.к = 373,9 К. Теплота испарения воды при Тн.ТсК Л#н2о =
= 40,66 кДж/моль. Определите, положительное или отрицательнее
отклонение от закона Рауля имеет эта система?
17. При перегонке бромбензола с водяным паром кипение начинает-
начинается под давлением 10,133-10* Па при 368,3 К. Бромбензол практически
не растворим в воде, а парциальные давления воды и бромбензола при
указанной температуре соответственно равны 8,519-10* и 1,613-10* Па.
Вычислите массу бромбензола, которая переходит в дистиллят совмест-
совместно с 1 кг воды.
18. Давление пара над системой из двух несмешивающихся жидкос-
жидкостей анилин — воаг равно 9,999- Ю* Па при 371 К. Давление пара воды
при этой температуре равно 9.425- 10* Па. Сколько воды надо взять
для перегонки 1 чг анилина при внешнем давлении 9,999-10* Па?
19. Давление насыщенного пара над системой из двух несмешиваю-
несмешивающихся жидкостей диэтиланилин — вода равно 10,133-10* Па при
372,4 К. Сколько пара потребуется для перегонки 0,1 кг диэтиланилина,
если давление пэра воды при указанной температуре 9,919-104 Па?
20. Определите массу водяного пара, необходимую для перегонки
0,1 кг нафталина с водяным паром при нормальном давлении. При ка-
какой температуре будет происходить перегонка? Для расчета воспользо-
воспользоваться зависимостью Р ~ f G);
368
8,451
0,203
369
8,767
0,211
370
9.094
0,221
371
9,430
0,233
372
9,775
0,245
373
10,132
0,260
Г, К ........
РНго-Ю-«, Па ...
Ро -ю-*. Па ...
Нафталин практически не растворим в воде.
21. Зависимость давления (Па) насыщенного пара фурфурола со
температуры выражается уравнением
lg Р= 10.084 — 2209/Г.
Определите температуру, при которой будет происходить перегонка
фурфурола с водяным паром при нормальном давлении. Определите
количество пара, необходимого для перегонки 1 кг фурфурола. Дан-
Данные о зависимости давления насыщенного пара воды от температуры
возьмите из справочника. Фурфурол очень слабо растворим в воде.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
I. Дана зависимость составов жидкой фазы и находящегося с ней
в равновесии пара от температуры для двухкомпонентнои жидкой систе-
системы А — В при постоянном давлении. Молярный состав жидкой фазы
х и насыщенного пара у выражен в процентах вещества А. По приве-
приведенным данным: 1) постройте график зависимости состава пара от со-
состава жидкой фазы при постоянном давлении; 2) постройте диаграм-
диаграмму кипения системы А—В; 3) определите температуру кипения систе-
224
№ ва-
варианта
1
2
3
4
Система
A—HNO3
в—tiao
A—HNO3
В—СН3СООН
A—HF
В-Н2О
А-Н2О
В-С,Н4О2
(фурфурол)
Р10-*, Па
10,133
10,79
10,133
10,133
Молярная
х — жидкая
фаза
0,0
8,4
12,3
22,1
30,8
38,3
40,2
46,5
53,0
61,5
100,0
0,0
10,0
20,0
33,3
40,0
50,0
60,0
100,0
4,95
9,2
18,9
22,8
27,9
33,8
34,4
35,8
39,7
44,4
50,3
52,2
56,0
58,2
61,7
79,8
87,9
100,0
0,0
2,0
4,0
6,0
8,0
10.0
20,0
30,0
50,0
90,8
доля А, %
у — пар
0,0
0,6
1,8
6,6
16,6
38,3
60,2
75,9
89,1
92,1
100,0
0,0
3,0
8,0
34,0
' 47,0
82,0
96,0
100,0
0,8
1,8
6,4
10,6
17,8
30,5
32,1
35,8
47,5
63,3
81,0
86,2
92,2
95,8
98,9
99,2
99,5
100,0
0,0
10,0
19,0
36,0
68,0
81,1
89,0
90,5
90,8
90,8
т. к
373
379,5
385
391,5
394,6
394,9
394,0
391,0
385
372
357
391,1
395,1
399,5
401,6
400,3
393,3
378,0
358,3
374,6
375.8
379,8
381,4
383,3
384,7
385,0
385,4
384,4
381,7
374,7
371,9
365,9
359,6
352,0
318,1
306,5
292,4
435,0
431,8
427,8
419,0
395,5
382,5
373,6
371.7
370,9
370,9
8 Зак. 767
225
Продолжение табл.
Ni ва-
варианта
5
6
7
Система
А—НаО
В-С4НИО
(«-бутиловый спирт)
А—НаО
В—С4Н10О
(иэо-бутиловый
спирт)
А—НаО
В—С4Н„О
B-метил-З-бутил-
2-ол)
Р-\0~*, Па
10,133
10,133
*
10,246
Молярная
* — жидкая
фаза
96,0
98,0
99,0
100,0
3,9
4,7
5,5
7,0
25.7
27,5
29,2
30,5
49,6
50.6
55,2
57,7
97,5
98,0
98,8
99,2
99,4
99,7
99,9
13,5
15,0
15,9
17.2
39.7
40,5
56,4
60,5
67,0
97,5
97,8
98,6
99,1
99,8
0.0
18.9
34,2
53.8
66,7
75,7
82,4
87,5
доля А, %
у — пар
90,8
92,0
94,5
100,0
26,7
29,9
32,3
35,2
62,9
64,1
65,5
66,2
73,6
74,0
75,0
75,0
75,2
75,6
80,8
84,3
88,4
92,9
98,1
40,1
. 42,0
43,7
44,6
62,6
63,3
66,0
66,7
67,0
67,2
67,3
71,4
78.2
95,7
0,0
42,7
55,3
63,4
65,7
66,9
67,5
68,1
Г, К
370,9
371,1
371,6
373,0
384,5
383,6
382,6
381,8
370,9
370,2
369.7
369,3
366,5
366,4
365,9
365,8
365,7
366,0
366,7
368,4
369,8
371,7
372,5
370,8
370,1
369,6
369,0
363,3
363,2
362,5
362,4
362,2
362,5
363,1
3643
366,4
371,9
377,5
367,8
365,3
364,3
364,1
364,2
364,25
364,3
226
¦ <о*еп со
«D<DtD<D t^
со со со со со
" со" <D en
СО СО СО СО СО СО СО СО СО СО СО СО СО СО
en о? ю о" of ю cn" о" q en ocf ао" t^ ао en Ы о>" о" — cn* со"
«^¦^¦"reocoeocococgeNe)<N<Nc^cccocoeoc
«от
Ю"Ч"ео со
со го со со
о
ОПЮ —MOO'COtlN—ЮОШО
о соаа ю ¦*о"|^' en cjto о" «о ао"о"
-П^ЮЮЮ!в<ОЬ№00
О1Л — t
с" «-"о" с
—¦• СО
СП Сл О)
О СПаО0 ^ <О, О 00 <О СО^О^О^
о —" ^ со оо" of og" ¦*" со" ю оо" t»
«о
осд '*¦ со t^ О,— t^^" оо, —со o^sdic ^ео соео^ао ао en со о
о" о" о" •— •— со" ю" о сд ¦*" о" ю ю «о cj «о —< со" op* •— V t»" о> о
сд^г^юю ttooaoooenoieneno
O
OQ
on
XX
j:
CO
CO
g
b
-J Ю •—
E Ol
bbbb'oioob
ОУЭЮ0С0СЦЭЧ — ООЧЭОО
oo о>сл 4^ со»
О СЛ _j— _K5 ~• ^ О
¦13
о
I
ti,
«I
43
I
CO CO CO CO CO CO CO
Ю t*5 CO CO CO CO ОЭ
00 COO •—СОСЛ 4
coco cococococo coco coco со
сосососососососососососооэсососо
cococococococpcococococoWco4^cn
О> йЛ СО ЬЗ —• —• О О О ~ КЗ 4^.00 tO JO СО
" " " " Ъ "" V V
~ 4* 00 ЫО^"O 00 СП СЛ ЬЭ*00
CO CO CO 03 CO CO CO CO С
o>-** кзоо to <
ICO CO
>coco
ю о
^ ^ КЗ "(О «О "•— Ъ> "—5 00 О "о 4^
"—• "ю "o> CO "o> "tO 4^ ~4* 00 CO Vi
2
Продолжение табл.
№ ва-
варианта
14
15
16
Система
А—СН3СОСН3
В— CHClj,
А-СН8СОСН3
В-СНС1з
A—CsHeO
В—НаО
Р-10~*, Па
9,760
10,000
10,133
Молярная
х — жидкая
фаза
90,0
99,0
100,0
0,0
7,9
14,3
18,6
26,6
39,4
46,2
53,6
61,8
71,5
77,0
82,1
91,5
100.0
0,0
18,6
34,0
46,8
57,8
67,3
75,5
82,7
89,2
94,9
100,0
0,0
1,0
2,0
4,0
6,0
10,0
20,0
30,0
40,0
50,0
60,0
70,0
80,0
85,0
90,0
96,0
100,0
доля А, %
у —пар
94,0
97,0
100,0
0,0
6,0
11,6
16,0
23,5
39,4
52,0
59,8
69,8
79,2
84,8
У0 1
9^4
100,0
0,0
10,3
31,8
51,5
65,2
75,7
83,2
89,0
93,6
97,3
100,0
0
11,0
21,6
32,0
35,1
37,2
39,2
40,4
42,4
45,2
49,2
55,1
64,1
70,4
77,8
90,0
100,0
г, к
328,8
329,1
329,5
332,9
333,3
334,2
334,8
335,2
335,4
335,0
334,3
333,3
331,9
331,2
330,2
329,0
328,2
334,3
336,0
336,8
336,4
335,2
334,0
332,9
331,8
330,8
330,0
329,0
373,0
368,0
365,0
363,5
362,3
361,5
361,1
360,9
360,8
360,9
361,3
362,0
363,5
364,5
365,8
367,0
370,3
229
Продолжение табл.
Л» ва-
варианта
17
18
19
20
2i
Система
А—С4Н,0О
(диэтиловый эфир)
В-С,ННО,
(бутилацетат)
А—С4Н10О
(диэтиловый
эфир)
В—СвН12О2
(бутилацетат)
А-С4Н10О
(диэтиловый эфир)
В-С,НИО,
(бутилацетат)
А—СНС13
В—СН3ОН
А—СС14
В—СН3СН,ОН
Р-10~*, Па
0,668
2,200
10,133
10,100
9,930
Молярная
х — жидкая
фаза
0,0
18,0
28,2
35,5
37,0
43,5
59,1
76,5
86,8
92,1
100,0
0,0
16,1
31,3
47,4
61,3
77,7
87,3
100,0
0,0
21,9
37,2
5S.4
66,4
72,2
77,9
84,7
89,6
100,0
0,0
2,9
6,3
10,3
15,2
21,2
28,7
38,5
51,8
70,72
84,7
100,0
0,0
3,2
7,0
11,4
доля А, %
if —пар
0,0
22,5
32,2
36,3
37,0
41,6
50,4
64,5
75,2
83,3
100,0
0,0
21,0
37,5
47,9
57,8
70,5
80,7
100,0
0,0
33,4
48,2
58,0
69,2
74,1
78,6
84,4
88,0
100,0
0,0
8,3
16,1
24,0
32,3
41,2
48,8
54,2
58,9
67,8
82,3
100,0
0,0
16,6
26,5
35,4
т, К
325,6
324,5
324,1
323,8
323.7
323,8
324,2
325,3
326,5
327,7
329,1
353,6
351,2
349,9
349,4
349,5
350,2
351,3
353,3
399.0
394,2
391,9
390,9
390,1
389,9
389,8
390,0
390,1
390,5
337,9
337,!
335,4
333.7
332,1
330,5
328,9
327,5
326,7
326,7
330,0
334,4
350,9
347,8
345,4
343,3
230
Продолжение табл.
N> ва-
варианта
22
23
Система
А—СС14
В—С4Н„О,
(этилацетат)
А-СвНвСН3
В—изо-С4Н100
(«зо-бутиловый
спирт)
Р-Ю~*. Па
9,140
10,133
Молярная
х—жидкая
фаза
16,6
23,0
31,0
41.1
55,67
63,0
72,9
89,0
100,0
0,0
0,5
7,3
15,9
28,0
35,2
42,9
51,3
57,2
58,8
61,3
69,3
79,2
89,4
100,0
0,0
6,6
11.4
15,0
21,1
33,3
35,5
44,1
55,0
58,8
63,8
68,2
76,2
80,3
84,4
87,0
89,7
96,5
100,0
доля А, %
У—пар
43,5
49,8
53,6
56,9
59,7
63,0
66,9
84,0
100,0
0,0
0,8
10,0
20,2
32,4
38,9
45,9
52,8
57,7
48,7
61,0
67,5
76,5
87,1
100,0
0,0
13,1
21,8
20,7
33,4
42.1
44,2
48,0
53,6
54,4
57,0
59,8
64,1
67,4
71,2
73,6
77,3
87,0
100,0
г, к
341,4
339,6
338,3
337,4
336,9
336,6
337,3
343,0
348,9
347,1
347,0
346,3
345,8
345,2
344,9
344,7
344,6
344,6
344,6
344,6
344,8
345,1
345,6
346,4
381,0
378,2
376,6
375,8
374,9
374,2
374,1
373,8
373,5
373,6
373,4
374,4
374,9
375,5
376,3
376,8
377,7
380,2
383,4
231
I
%
жид
фаз
1
j—_qqoo>nqqo|n—_xo_n
со сососбёчйчечеч—¦ — —¦ — — — — —¦—¦ — Jn
cococococococococococococococococococo
о юсо" to о* ю оо"со* о* ю* op* cn" to" to" of со о •"*>" о*
'¦^""lOtOtONNNSOOOlOO
Ot~0000.eN
о о о* еч ю —
—¦
0 t^CltOlOt tOO
о со" «о оо" ю об* of cf
ttooiooo
33
о
X
5
|
4
icnooeoooios- «о^оооюоосоо^сооосо
t^r<D"'i"co"—• О)" Of t^." to to'lOIOlO ¦<•'*¦ 'tinirf'
сососососоечечечечечечстсдечсдечсд
t
со
со
сосососоечечечечечечстсдечсдечсдечечеч
со со со со со со со со со со со со со со со со со со со c
oojs *Л •"¦"I'*'.'*' °* о» «о en ¦t-iooooon en о
о оо* со" оо со" t>." оГ ю о"со" из" t>* о со i^" ю о "^"^"t со о
—¦—¦cococo¦^¦ю^ftiSю^
о о^оо o^to^oi to^o^-^« ю о to^co^*— —• ic, о со to to оо о
О" CN* ¦** t*T CO" tO* СЛ Ю ~ to" С? cj —• t" 1Л О* Ю" ' ОО" О" СЭ>" О*
¦ — сМсосо^^ю
33
Is
V re
№ ва-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
г,
388
398
383
372
368
365
367
317
333
331
335
345
329,25
а
55
60
65
50
50
35
25
25
25
80
10
75
60
ь
81
61,2
67,4
15,8
19,6
68,8
6,4
30,4
27,1
62,2
4,4
64
73
с
19
38,8
32,6
84,2
80,4
31,2
93,6
69,6
72,9
37,8
56,4
36
27
№ ва-
варианта
14
15
16
17
18
19
20
21
22
23
24
25
г,
334,5
336
365
325
350,5
390,25
330,3
343
345,5
377
320
339
а
55
55
80
65
75
65
25
25
25
80
25
25
ft
37,2
37,2
93
54,2
65,5
54,2
55,5
36,8
52,7
83,4
50,5
50,5
с
62,8
62,8
7
45,8
34,5
45,8
44,5
63,2
47,3
16,6
49,5
49,5
мы с молярной долей а % вещества А. Каков состав первого пузырька
пара над этой системой; при какой температуре закончится кипение
системы; каков состав последней капли жидкой фазы? 4) определите
состав пара, находящегося в равновесии с жидкой фазой, кипящей при
температуре 7\; 5) при помощи какого эксперимента можно установить
состав жидкой бинарной системы, если она начинает кипеть при тем-
№ вари-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
Система
HNOs-HaO
HNO3—CjH4O,
HF-H,0
HaO-C2H4Os
H2O-C4H10O
H2O-C4H10O
HaO—C5HiaO
CSa—C,HeO
CH.OH—CC14
CHsOH-QHe
CH3OH-CeHe
CaHeO—QHe
CeHeO—CHgOH
QHeO—CHC1S
QH.O-CHCl,
C3H8O-HaO
C4H10O-CeHl2O2
QH10O-CeH]aOa
QH10O-C,H12O2
CCl4-C8HeO
CC^-QHgO
CO.— QHeO2
C7H g—СлН|лО
CjHaaa-cHa0H
CjHaCl,—CHSOH
P-10-4, Па
10,133
! 0,079
10,133
10,133
10,! 33
10,! 33
10,246
10,133
10,133
9,670
10,133
10,000
10,133
9,769
10,00
10,133
0,668
2,200
10,133
10,100
9,930
9,140
10,133
10,133
10,133
Молярная
доля А, %
53,0
69,0
61,7
8,0
25,7
17,2
!8,9
!3,4
3,0
5,9
90,2
4,0
!7,6
. 77,0
18,6
4,0
28,2
16,1
21,9
6,3
7,0
28,0
11,4
2,8
4,8
г. к
385,0
378,0
352,0
395,5
370,9
369,0
367,8
319,6
335,0
330,7
332,9
348,2
333,!
331,2
336,0
363,5
324,1
351,2
394,2
335,4
345,4
345,2
376,6
333,5
334,8
233
пературе 7\ при наличии диаграммы кипения системы? 6) какой ком-
компонент и в каком количестве может быть выделен из системы, состоя-
состоящей из b кг вещества А и с кг вещества В? 7) какого компонента и
сколько надо добавить к указанной в п. 6 смеси, чтобы получилась азе-
отропная система? 8) какая масса вещества А будет в парах и в жид-
жидкой фазе, если 2 кг смеси с молярной долей а % вещества А нагреть до
температуры 7\? 9) определите вариантность системы в азеотропной
точке.
2. На основании общего давления и состава пара, находящегося в
равновесии с кипящей жидкостью, приведенных на с. 225, определите
активность и коэффициент активности в жидкой фазе компонента А
при заданном составе жидкой фазы и заданной температуре. Рассчи-
Рассчитайте по уравнению Клапейрона — Клаузиуса на основании справоч-
справочных данных давление насыщенного пара Р% над компонентом А. Опре-
Определите изменение химического потенциала при образовании раствора
при заданной концентрации и температуре.
ГЛАВА XV
ГЕТЕРОГЕННОЕ РАВНОВЕСИЕ В БИНАРНЫХ СИСТЕМАХ,
СОДЕРЖАЩИХ ЖИДКУЮ И ТВЕРДУЮ ФАЗЫ
Основные уравнения и символы
[К., с. 410—420, 423-426]
Зависимость растворимости компонента в совершенном растворе
от температуры выражается уравнением Шредера
где xt — молярная доля растворенного вещества в насыщенном раст-
растворе (растворимость); AHnjltt — молярная теплота плавления раство-
растворенного вещества; Гпл>г — температура плавления чистого растворен-
растворенного вещества; Т — температура начала кристаллизации насыщенно-
насыщенного раствора концентрации х{.
Уравнение Шредера для предельно разбавленных растворов имеет
вид
ДЯпл, 1 Д7"
К' пл, 1 A—Аа)
где AT — понижение температуры кристаллизации раствора (распла-
(расплава) концентрации х%;
ЬТ = ТПЛЛ-Т; (XV..3)
234
теплота плав-
плавГпл>1—температура плавления растворителя;
ления растворителя; Кя = x\*lxf; х\* — концентрация растворенного
вещества в твердом растворе; xf — концентрация растворенного ве-
вещества в жидком растворе (расплаве).
Для неизоморфно кристаллизующихся систем х™ = 0 и /Са = 0.
ЗАДАЧИ С РЕШЕНИЯМИ
1. По кривым охлаждения системы золото — платина (рис. 30, а)
постройте диаграмму состав — свойство и определите: 1) при какой
температуре начнет отвердевать расплав с массовой долей Pt 75%;
2) при какой температуре расплав затвердевает полностью; 3) состав
первых выпавших в твердую фазу кристаллов; 4) массу золота и пла-
платины в твердом и жидком состояниях при охлаждении 3 кг системы с
массовой долей Pt 75 % до 1833 К; 5) состав последней капли расплава.
j—4-.fl—
Время Аи 100 80 SO 40 20 0
О 20 40 60 80100 Pt
Массовая доля, %
а 5
Рис. 30. Кривые охлаждения изоморфной системы Аи—Pt (а) и
диаграмма плавкости этой системы (б)
Решение. На основании кривых охлаждения строим диаграм-
диаграмму плавкости (рис. 30, б). Кривая / соответствует охлаждению чистого
золота. При 1337 К на кривой охлаждения наблюдается температурная
остановка; она соответствует температуре плавления золота. Чистые
вещества кристаллизуются при постоянной температуре. По правилу
фаз Гиббса (XI.3) число компонентов К = 1, число фаз Ф = 2, п =1;
235
так как давление не оказывает влияния на систему, число термодина-
термодинамических степеней свободы /усл = 0.
Кривая 2 соответствует охлаждению системы, содержащей 20 % Pt.
При 1567 К наблюдается уменьшение скорости охлаждения. Это объ-
объясняется тем, что происходит процесс, сопровождающийся выделени-
выделением теплоты. Таким процессом является кристаллизация твердого раст-
раствора. При кристаллизации теплота выделяется, что и снижает скорость
охлаждения системы. На этой же кривой при 1405 К наблюдается вновь
увеличение скорости охлаждения. При этой же температуре закончи-
закончилась кристаллизация твердого раствора, и дальнейшее охлаждение сис-
системы не сопровождается выделением теплоты. Происходит охлаждение
твердого раствора. На оси ординат, соответствующей составу 20% Pt,
откладываем температуру начала и конца кристаллизации 1567 и
1405 К. Аналогично находим точки начала и конца кристаллизации
расплавов с концентрациями 40, 60 и 80 % Pt. Соединив все точки на-
начала кристаллизации, получим кривую ликвидуса; соединив точки кон-
конца кристаллизации, получим кривую солидуса. Обе кривые сходятся
в точках кристаллизации чистых компонентов Pt и Аи.
Таким образом, выше кривой NmM все системы находятся в жид-
жидком состоянии. Фаза одна, компонентов два, условных термодинамиче-
термодинамических степеней свободы две. Можно менять и состав и температуру в ог-
ограниченных пределах, и при этом не будут меняться ни число, ни вид
фаз. Ниже кривой NkM все системы находятся в состоянии твердого
раствора, состав которого может менятся непрерывно. Фаза одна —
твердая, компонентов два, условных термодинамических степеней сво-
свободы две. Между кривыми NmM и NkM все системы гетерогенные.
В равновесии находятся две фазы — твердый раствор, состав которого
определяется но кривой NKM, и расплав, состав которого определяет-
определяется по кривой NmM. Фазы две, компонентов два, п = 1, число условных
термодинамических степеней свободы /усл = 1. Можно менять состав.
Кристаллизация системы, содержащей 75 % Pt, начинается при
1925 К, а заканчивается при 1688 К. Составы сосуществующих фаз оп-
определим по точкам пересечения изотермы с кривыми NmM и NkM.
Состав первого кристалла будет 92 % Pt. При 1833 К в равновесии на-
находятся твердый раствор и расплав. Масса твердого раствора так от-
относится к массе жидкого расплава, согласно правилу рычага (XIV.4),
как плечо тп относится к плечу nk. Если общая масса 3 кг, то массу
твердого раствора обозначим х, массу жидкого расплава — 3 — х,
Измеряем длины плеч или отсчитываем составы в процентах:
Масса твердого раствора 1,75 кг, масса жидкого расплава 1,25 кг.
Масса платины в твердом растворе будет 1,75-0,88= 1,535 кг, золота—
1,75-0,12 = 0,215 кг. В расплаве находится 1,25-0,57 = 0,712 кг
236
платины и 1,25-0,43 = 0,538 кг золота. Для проверки полученных зна-
значений сложим массы Pt и Аи:
масса Аи 0,215 + 0,538 = 0,753 кг'
масса Pt 1,538 + 0,712 = 2,247 кг
Всего 3,000 кг
0.753 „ я„ __ __ я„ п/ 2,247
= 0,25, нлн 25%; -j—^- = 0,75, нлн 75%.
3,000 ' ' 3,00
Состав последней капли расплава найдем по пересечению изотермы
конца кристаллизации с кривой NkM. Последняя капля расплава
будет содержать 34,5 % Pt. Процесс кристаллизации расплава, сос-
состав которого 75 % Pt, показан на рис. 30, б стрелками.
2. Определите теплоту плавления Pt на основании данных диаграм-
диаграммы плавкости системы Pt — Аи (рис. 30).
Решение. Для расчета АЯплР4 воспользуемся уравнением (XV.2).
Определим молярную долю платины в расплаве, содержащем 25 %
золота:
„» -"'*•"'" =0 247-
Pt /ЛР / t Л<4 Л\ Г /It? I t ЛР 1 \ ' '
25/197,0
B5/197,0) + G5/195.1)
TB 8/197,0
*pt= (8/197,0)+(92/195,0) " ' *
kPt = 0,085/0,247 = 0,345; Д7" = 2054 —1833 = 221 К;
8,3143-2054a
AffnjlPt=247 A—0,345) = 25,679-10» Дж/моль.
Полученная величина приближенная, так как раствор взят не предель-
предельно разбавленным.
3. На основании кривых охлаждения системы алюминий — крем-
кремний (рис. 31, а) постройте диаграмму плавкости. По диаграмме опреде-
определите: 1) при какой температуре начнется кристаллизация системы,
содержащей 60 % кремния; 2) какое вещество будет кристаллизовать-
кристаллизоваться из расплава, содержащего60 % кремния; 3) какое количество твер-
твердой фазы будет при 1073 К, если общая масса системы, содержащей
60 % кремния, 2 кг; 4) при какой температуре закончится кристалли-
кристаллизация системы; 5) состав последней капли жидкого расплава.
Решение. На основании кривых охлаждения (рис. 31, а) строим
диаграмму плавкости в координатах состав — температура плавления
(рис. 31, б). При охлаждении чистого кремния (кривая охлаждения /)
наблюдается температурная остановка при 1693 К. Эта температурная
остановка связана с выделением скрытой теплоты кристаллизации
кремния при его температуре плавления. Эту температуру откладыва-
откладываем на оси ординат (рис. 31, б), отвечающей чистому кремнию.
237
На кривой охлаждения системы, содержащей 80 % кремния (кри.
вая 2), при 1593 К наблюдается уменьшение скорости охлаждения-
При этой температуре из расплава начинает кристаллизоваться чистый
кремний: так как система AI — Si неизоморфная, то растворимость ком-
компонентов в твердом состоянии равна нулю (скорее она не равна нулю,
но пренебрежимо мала). При выделении в твердую фазу кремния жид-
жидкая фаза обогащается алюминием, что приводит к снижению тем-
температуры плавления системы. На кривой охлаждения 2 наблюдается
Время А1Ш
0
ВО
20
60
?1
40 20
60 60
Массокя доля, "/.
5
О
WO Si
Рис. 31. Кривые охлаждения иеизоморфиой системы AI—Si (о)
и диаграмма плавкости этой системы (б)
температурная остановка при 845 К (горизонтальная площадка аб).
При данной температуре вся система переходит в твердое состояние.
Температурная остановка связана с тем, что из расплава кристаллизу-
кристаллизуется и алюминий и кремний одновременно. Составы жидкой и твердой
фаз при этом не изменяются. При этой причине остаются неизмен-
неизменными температуры плавления и кристаллизации.
При охлаждении системы, содержащей 40 % кремния (кривая 4),
изменение скорости охлаждения уже при 1219 К, а горизонтальная
площадка наблюдается при той же температуре, что и при охлажде-
охлаждении расплава, содержащего 80 % кремния, при 845 К. При 1219 К на-
начинается кристаллизация кремния из расплава, расплав обогащается
алюминием, температура кристаллизации снижается, при 845 К кри-
кристаллизуется эвтектика. Длина горизонтального участка на кривой
охлаждения пропорциональна теплоте, выделяющейся при кристал-
кристаллизации эвтектики. Так как состав эвтектики постоянный, то длина го
238
ризонтальной площадки пропорциональна массе кристаллизующейся
эвтектики. Если проводить охлаждение одной и той же массы расплава
различных составов, то масса эвтектики будет различна, что и проявля-
проявляется в разной длине горизонтального участка на кривых охлаждения.
Если охлаждать систему, содержащую 10 % кремния (кривая 5),
то изменения скорости охлаждения на кривой не происходит, а наблю-
наблюдается лишь температурная остановка при 845 К. Состав, содержащий
10 % кремния и 90 % алюминия, эвтектический. Длина горизонталь-
горизонтальной площадки на кривой охлаждения 5 максимальная. При охлаждении
чистого алюминия наблюдается температурная остановка при 932 К,
соответствующая температуре плавления алюминия (кривая 7).
Продолжая построение диаграммы плавкости по всем кривым ох-
охлаждения, получим две кривые нэ и оэ и горизонтальную прямую лм.
Три линии пересекаются в эвтектической точке. В этой точке расплав
насьГщен как кремнием, так и алюминием. Выше кривых нэ, оэ в облас-
области / все системы гомогенные, одна жидкая фаза. Термодинамических
степеней свободы две. В области // системы гетерогенные,в равновесии
находятся кристаллы алюминия и расплав, состав которого определя-
определяется по кривой нэ. В области /// все системы гетерогенные. В равно-
равновесии находятся кристаллы кремния и расплав, состав которого опре-
определяется по кривой эо. Термодинамических степеней свободы у систем
в областях // и /// — одна. В области IV все системы находятся в
твердом состоянии, системы гетерогенные, две твердые фазы — кри-
кристаллы алюминия и кремния. Термодинамическая степень свободы— од-
одна. В точке э в равновесии находятся кристаллы алюминия, кристаллы
кремния и расплав; система гетерогенная, фазы три, число термоди-
термодинамических степеней свободы ноль.
Так как на кривых охлаждения длина горизонтальной площадки,
соответствующей кристаллизации эвтектики, пропорциональна коли-
количеству эвтектики, то это можно использовать для определения концент-
концентрации компонентов в эвтектической точке. Для этого строится тре-
треугольник Таммана. Длины горизонтальных площадок аб, вг, де, жз и
ик (рис. 31, а) откладывают вертикально вниз от изотермы эвтектики
в точках, отвечающих составам систем (рис. 31, б), и пересечение ли-
линий, проведенных через точки м, б, г, е, з, и, л, к, з, дает состав эвтек-
эвтектики.
Процесс охлаждения системы, состав которой 60 % кремния, пока-
показан на диаграмме плавкости (рис. 31, б) стрелками. Кристаллизация
системы начинается при 1408 К.. В твердую фазу переходит кремний,
расплав при этом обогащается алюминием. При охлаждении системы
До 1000 К некоторое количество кремния выделилось в виде кристал-
кристаллов. Для определения жидкой и твердой фаз, находящихся в равнове-
равновесии, применяется правило рычага. Масса кристаллов кремния так от-
относится к массе жидкой фазы, как длина отрезка пр относится к длине
отрезка рс. Если масса системы 2 кг, то
239
Масса кристаллов кремния 0,90 кг, масса расплава 1,1 кг, состав ко-
которого 24 % кремния. Кристаллизация системы, содержащей 60 %
кремния, закончится при температуре эвтектики 845 К.. Состав по-
последней капли расплава соответствует эвтектическому, 10% кремния.
4. Определите теплоту плавления Л#пл кремния с помощью диа-
диаграммы плавкости алюминий — кремний (рис. 31, б).
Решение. Система Al — Si неизоморфная. Для неизоморфной
системы К в уравнении (XV.2) равно нулю. Температура на-
начала кристаллизации системы, содержа-
содержащей 20 % А1, 1593 К. Температура кри-
кристаллизации чистого кремния 1693 К.
Понижение температуры кристаллиза-
кристаллизации
ДГ= 1693 —1593=100 К.
Определим молярную долю А1 в системе:
20/27
*А1 =
100
0
80
20
Массовая
ЬО
1,0
к ля,
40
60
7с
20
80
0
ША
Рис. 32. Диаграмма плавкости
бинарной системы с ограничен-
ограниченной растворимостью компонен-
компонентов в твердом состоянии
20/274-80/28
По уравнению (XV.2)
0,206-8,3143.16932
АНпл= ш
= 49,091-103 Дж/моль.
= 0,206.
Полученная теплота плавления прибли-
приближенная, так как концентрация кремния
достаточно высокая.
5. Проанализируйте диаграмму плавкости системы с ограниченной
растворимостью компонентов В — А в твердом состоянии (рис. 32).
Проследите за изменением фазового состояния при охлаждении систе-
системы, содержащей 90 % компонента А.
Решение. Рассмотрим фазовое состояние систем, характеризу-
характеризующихся точками в разных областях диаграммы. В области / все систе-
системы гомогенные, одна жидкая фаза. Фаза одна, компонентов два, термо-
термодинамических степеней свободы / с учетом того, что давление не влияет
на фазовое равновесие (п = 1), будет
^уСЛ = К — Ф+п=2 —1 + 1=2.
Можно менять как состав, так и температуру. В областях //и ///сис-
///системы гетерогенные. В равновесии находятся две фазы, твердый раствор
и расплав. Состав жидкого раствора определяется по верхней кривой
ликвидуса, состав твердого раствора — по нижней кривой солидуса:
Можно менять только состав системы (в известных пределах). В об-
областях IV и V системы гомогенные. Фаза одна, твердая, твердый раст-
240
вор. В области IV — раствор А и В, в области V — раствор В в А;
/усл == *•
В области VI система гетерогенная, две твердые фазы находятся в
равновесии, /усл = 1. Однако следует учитывать, что равновесие в
твердых фазах устанавливается медленно, поэтому обычно кривые со-
составов твердых растворов на диаграммах плавкости вычерчивают
пунктиром. В точке э в равновесии находятся две твердые фазы, два
твердых раствора и жидкий расплав. Система гетерогенная, фазы три,
/усл = 0.
Проследим процесс охлаждения системы, содержащей 90 % А, и
изменение фазового состояния системы в процессе охлаждения. При
охлаждении системы до температуры 7\ фаза одна — жидкий расплав.
При температуре 7\ появляется первый кристалл твердого раствора,
состав которого определяется точкой с. Из расплава в твердую фазу
преимущественно уходит компонент А, состав твердого раствора бога-
богаче компонентом А, чем расплав. Отсюда состав расплава меняется по
кривой аЬ. Вместе с изменением состава жидкого расплава меняется и
температура кристаллизации и состав твердого раствора. Состав твер-
твердого раствора меняется по кривой cd. Кристаллизация закончится,
когда состав твердого раствора будет соответствовать составу жидкого
расплава исходного состава системы при температуре Т.2. Состав по-
последней капли жидкого расплава определяется составом точки Ь. Далее
происходит охлаждение твердого раствора. При температуре Ts по-
появляется вторая твердая фаза, состав которой определяется точкой е.
При дальнейшем охлаждении системы происходит изменение составов
твердых растворов, как это показано стрелками на диаграмме. Измене-
Изменение составов твердых растворов происходит чрезвычайно медленно.
Кривые на диаграмме плавкости соответствуют равновесным концент-
концентрациям.
6. Проанализируйте фазовое состояние неизоморфной системы, ком-
юненты которой образуют устойчивое химическое соединение. Диа-
рамма плавкости приведена на рис. 33. Проведите анализ процесса
нагревания двух бинарных систем: А — АЖВУ и кхЪи — В.
Решение. Эту диаграмму плавкости можно рассматривать как
две независимые диаграммы плавкости двух бинарных систем: А —
— АЖВУ и АЖВУ — В. Закроем сначала полоской бумаги часть диаграм-
диаграммы плавкости от АЖВУ до В и мысленно сопоставим ее с диаграммой
плавкости неизоморфной системы с простой эвтектикой (см. рис. 31,6).
Повторим операцию, закрыв полоской бумаги часть диаграммы от А до
А«В„.
В области / (рис. 33) все системы гомогенные. Фаза одна, жидкий
расплав; /усл = 2. В области // — системы гетерогенные. В равнове-
равновесии находятся две фазы: расплав и кристаллы компонента А; / = 1.
В областях /// и IV системы гетерогенные, в равновесии находятся две
фазы: жидкий расплав и кристаллы химического соединения АЖВ9;
/усл = 1- В области У системы гетерогенные. В равновесии находят-
находятся две фазы: жидкий расплав и кристаллы В; /„сл = 1. В области VI
241
системы гетерогенные. В равновесии находятся две фазы, кристаллы
А и кристаллы химического соединения АЖВУ; fycn = 1. В области
VII системы гетерогенные. В равновесии находятся две твердые фазы,
кристаллы химического соединения A^Bj, и кристаллы В; /усл = 1.
В точках 3i и э2 системы гетерогенные. В равновесии находятся три
фазы. Две твердые и одна жидкая; /усл = 0.
Проанализируем процесс нагревания системы состава ах. При на-
нагревании системы до температуры 7\ изменения фазового состояния не
наблюдается. Нагревание кристаллов А и кхВу отражено на диаграм-
V
3,
Ш
Л
ш
Л/г
т
АЮО ВО 60 iO 20 0
0 20 <,0 60 80 100В
МассоНая доля, %
Рис. 33. Диаграмма плавкости
иеизоморфиой двухкомпоиеит-
иой системы; вещества образу-
образуют устойчивое химическое сое-
соединение
А100 80 60 40АЛ, 20 О
О 20 40 60 80 1008
Массобая доля, "/„
Рис. 34. Диаграмма плавкости
иеизоморфиой двухкомпоиент-
иой системы; вещества образу-
образуют неустойчивое химическое
соединение
ме плавкости стрелками на ординатах А и A^-Bj,. При температуре Т
начинается плавление системы. На кривой нагревания должна наблю-
наблюдаться температурная остановка, так как эвтектика плавится. Состав
твердой и жидкой фаз не меняется, температура остается постоянной,
пока не расплавится вся эвтектика. Далее происходит плавление кри-
кристаллов химического соединения AJBj,. При этом происходит измене-
изменение состава жидкой фазы. Состав твердой фазы остается неизменным:
A^Bj,. В связи с изменением состава жидкой фазы меняется температу-
температура плавления. При температуре Т2 состав жидкой фазы становится
равным аь т. е. равным составу исходной системы. При этой темпера-
температуре расплавится последний кристалл A^-Bj,. Далее будет происходить
нагревание жидкого расплава без изменения фазового состояния
системы.
По характеру максимума, отвечающего температуре плавления хи-
химического соединения, можно судить о его устойчивости при температу-
температуре плавления. Смещение равновесия реакции AJBj, ч^= хк -\- г/В впра-
вправо ведет к снижению температуры плавления, и максимум на диа-
диаграмме плавкости становится менее острым. Наоборот, при условии, ког-
242
да равновесие смещено в сторону образования химического соединения,
максимум на диаграмме плавкости получается острым.
7. Проанализируйте фазовое состояние системы, состоящей из
двух неизоморфно кристаллизующихся компонентов, образующих не-
неустойчивое химическое соединение (рис. 34). Проследите изменение фа-
фазового состояния системы в процессе нагревания.
Решение. Определим сначала фазовые состояния систем в раз-
различных областях диаграммы. В области / все системы гомогенные. Од-
Одна жидкая фаза, расплав; /усл = 2. В области // системы гетероген-
гетерогенные. В равновесии находятся кристаллы компонента А и расплав;
/уел — 1. В области /// системы гетерогенные. В равновесии находят-
находятся расплав и кристаллы неустойчивого химического соединения АЖВУ;
/усл = 1. В области IV системы гетерогенные. В равновесии.находят-
равновесии.находятся кристаллы В и расплав; / сл = 1. В области V все системы гетеро-
гетерогенные. В равновесии находятся две твердые фазы, кристаллы компо-
компонента В и кристаллы химического соединения кхВу. При температурах
ниже 7\ химическое соединение становится устойчивым; /усл = 1.
В области VI все системы гетерогенные. В равновесии находятся кри-
кристаллы А и Aa-Bj,; /усл = 1. В точке э сосуществуют в равновесии три
фазы. Две твердые, кристаллы А, кристаллы кхВу и расплав; /усл=0.
В точке р в равновесии три фазы, кристаллы В, кристаллы соедине-
соединения АХВУ, которое становится устойчивым при температуре плавления
7\, и расплав; /усл = 0.
Проследим процесс нагревания системы, состав которой ах. До
температуры Т2 система находится в кристаллическом состоянии.
•В равновесии находятся кристаллы А и кристаллы химического соеди-
соединения АХВУ. При температуре Т2 происходит плавление эвтектики со-
состава э. Составы жидкой и твердой фаз остаются неизменными, пока не
расплавится вся эвтектика. Отсюда температура на кривой охлажде-
охлаждения не меняется. Далее начинается плавление кристаллов AJBg,. При
этом состав жидкого расплава меняется. Состав твердой фазы остается
неизменным. При температуре Т^ химическое соединение становится не-
неустойчивым. Оно разлагается на кристаллы В и расплав. Так как си-
система становится при температуре Тх безвариантной, то на кривой на-
нагревания наблюдается температурная остановка. После исчезновения
последнего кристалла химического соединения АжВг начинается плав-
плавление кристаллов компонента В. Состав расплава вновь начинает ме-
меняться, меняется и температура плавления системы. При температуре
Т3 состав расплава становится таким же, как и состав исходной сис-
системы ах. При этой температуре исчезает последний кристалл компонента
В, система становится гомогенной и при дальнейшем нагревании ее
фазовое состояние не меняется. Процесс нагревания и связанный с ним
процесс изменения фазового состояния системы на диаграмме плавкости
показаны стрелками.
8. Определите фазовое состояние системы и соотношение масс фаз,
если 1 кг системы состава а2 (рис. 34) нагреть до температуры Т4. Ве-
Вещества А и В —элементы с атомными массами 197 и 121,8. Неустой-
243
чивое химическое соединение АВ3 содержит 80 % В (состав, соответ-
соответствующий точке а2).
Решение. Система гетерогенная. Она состоит из кристаллов хи-
химического соединения и кристаллов В. Соотношение масс твердых фаз
определяем по правилу рычага. Для этого сначала определим состав
АВ3 в процентах:
м-АВз =3.121,8/A97,0 + 3.121,8) 100 = 64,97% В.
По правилу рычага
mB/mABj =rtft/tfm = A00 —80)/(80—64,97) =1,33.
Так как общая масса системы 1 кг, то данное соотношение преобразует-
преобразуется:
х 1 33
-— = 1,33; ттв = *=-^- = 0,57 кг; mABj = 0,43 кг.
ЗАДАЧИ
1. По характерным точкам на кривых охлаждения вычертить диа-
диаграмму плавкости системы медь — никель:
Ni, % 0 20 40 60 80 100
Температура начала кристалли-
кристаллизации, К ........ 1373 1467 1554 1627 1683 1728
Температура конца кристалли-
кристаллизации, К 1373 1406 1467 1543 1629 1728
На диаграмме плавкости обозначьте точками: а — чистую твердую
медь в равновесии с расплавом меди; б — жидкий расплав, содержа-
содержащий 45 % Ni в равновесии с твердым раствором; в — твердый раствор,
содержащий 65 % Ni в равновесии с жидким расплавом; г — жидкий
расплав, содержащий 50 % Ni при температуре 1670 К. Определите
для системы, содержащей 30 % Ni, температуру начала кристаллиза-
кристаллизации, состав первого кристалла твердого раствора, массу Ni в жидком и
твердом состояниях при охлаждении 0,24 кг смеси, содержащей 30 %
Ni, до 1470 К; температуру кристаллизации последней капли жидкого
расплава, состав последней капли жидкого расплава.
2. Вычертите диаграмму состав — температура плавления для сис-
системы хлорид серебра — хлорид натрия по характерным точкам на кри-
кривых охлаждения:
Молярная доля AgCl, % . . 0 20 40 60 80 100
Температура начала кристалли-
кристаллизации, К 1073 1004 941 869 788 7?8
Температура конца кристалли-
атур
и, К
зации, К 1073 952 848 735 742 728
На диаграмме обозначьте точками следующие состояния системы:
а — чистый твердый хлорид серебра, находящийся в равновесии с рас-
расплавом хлорида серебра; б — жидкий расплав с молярной долей AgCl
244
55 % при 1000 К; в — жидкий расплав с молярной долей AgCl 70 %,
находящийся в равновесии с твердым раствором; г — твердый раствор
с молярной долей AgCl 45 %, находящийся в равновесии с жидким
расплавом; д — твердый раствор с молярной долей AgCl 30 % при
750 К.
3. По кривым охлаждения системы кадмий — висмут (рис. 35)
постройте диаграмму плавкости. Обозначьте точками состояния си-
систем; а — чистый висмут в равновесии с расплавом висмута; б — жид-
жидкий расплав при 573 К, содержащий 30 % Cd; в — расплав, со-
5 В
Время
Рис. 35. Кривые охлаждения
системы <Dd—Bi:
1 — 0% Bi; 2 — 20% Bi: 3-40% Bi;
4-60% Bi; 5—80% Bi; «-100%
Bi
О 20
AgWO 80
Массодая доля, "/„
40
60
60
40
в0 Ю0 Си
20 0
Рис. 36. Диаграмма плавкости двух-
компоиентиой системы Ag—Си с ог-
раиичеииой растворимостью компо-
компонентов в твердом состоянии
держащий 15 % Cd в равновесии с кристаллами Bi; г — равновесную
систему, состоящую из твердого Cd и расплава, в котором содержится
4/5 Cd и 1/5 Bi; д — жидкий расплав, содержащий оба металла в рав-
равновесии с твердыми Cd и Bi.
4. По характерным точкам на кривых охлаждения постройте диа-
диаграмму плавкости для системы хлорид серебра — хлорид калия:
AgCl, % . 0 20 40 60 80 100
Температура начала кристалли-
кристаллизации, К 1055 958 837 688 630,6 728
Температура конца кристалли-
кристаллизации, К 1055 584 584 584 584 728
Сколько хлорида калия надо добавить к 1,7 кг хлорида серебра, что-
чтобы понизить температуру начала плавления до 650 К?
5. По диаграмме плавкости системы серебро — медь определите,
в каком фазовом состоянии находятся системы, обозначенные на рис.
36 точками а, б, в, г, д, е, ж, з.
6. По характерным точкам на кривых охлаждения постройте диа-
диаграмму плавкости для системы иодид натрия — фторид натрия, ис-
245
пользуя данные из справочника [М.]. Что будет происходить с твер-
твердой системой, которая содержит 0,4 кг NaF и 0,6 кг Nal, если ее на-
нагреть до 670, 899, 950, 1033 и 1200 К?
7. Постройте диаграмму фазового состояния системы фенол — вода
по массовой доле равновесных фаз:
1) вода насыщена фенолом до концентрации сь фенол насыщен
водой до концентрации с2:
280
7,9
75,1
300
8,8
70,5
320
11,4
64,0
335
15,5
58,3
335
18,5
54,0
338
22,0
49,5
341,8
35,9
35,9
Г, К
cj, % ...
с2, % ...
2) твердый фенол в равновесии с раствором:
Г, К 280 290 300 314
с, % 84,0 91,5 95,3 100
Первая инвариантная точка около 272,1 К: лед, фенол, раствор. Вто-
Вторая инвариантная точка 274,5 К: фенол, два раствора. Поясните по-
полученную диаграмму. Определите фазовое состояние систем в каждой
области диаграммы. Определите состав и число фаз в смеси, содержа-
содержащей 0,03 кг фенола и 0,07 кг воды при 300 К- Обозначьте точками: а—
гомогенный раствор, содержащий 80 % фенола при 320 К; б — систе-
систему, содержащую 50 % фенола, разделяющуюся на два несмешивающих-
ся раствора, содержащих один 9,5, другой 69,0 % фенола; в — гомо-
гомогенный раствор, содержащий 5 % фенола при 320 К- Что будет проис-
происходить с каждой из указанных систем, если к ним постепенно добавлять
фенол? Растворы, содержащие один 20, а другой 60 % фенола, имеют
температуру 340 К- До какой температуры надо охладить каждый из
них, чтобы вызвать расслоение системы?
8. Определите число условных термодинамических степеней свобо-
свободы систем при заданных температуре и составе. Диаграммы плавкости
приведены в справочнике [М.].
Система .... AgCl—NaCl AgCI—NaCl AgCl—NaCl A1—Si Al—Si
T, К 1073 873 — 973 1373
Состав, % ... 50 50 — 30 50
Точка на диаграм-
диаграмме а с
Система КВг—CuBr Na—К
Г, К - -
Состав, % — —
Точка на диаграмме .... е с
9. По диаграмме плавкости системы КВг — CuBr, приведенной в
справочнике [М.], определите количество твердой и жидкой фаз, если
систему с молярной долей CuBr 20 % нагреть до 773 К. Общая масса
системы 2 кг. Определите массу CuBr и КВг в жидкой и твердой фа-
фазах, если 2 кг системы с молярной долей CuBr 20 % нагреть до 773 К-
246
Определите количество компонента, который следует добавить к систе-
системе, чтобы она изотермически расплавилась.
10. Представьте кривые охлаждения для системы Na — К, исполь-
используя диаграммы плавкости в справочнике [М.], если молярная доля
CuCl (%): 0; 21; 40; 60; 80; 100.
МНОГОВАРИАНТНАЯ ЗАДАЧА
На основании температур начала кристаллизации двухкомпонент-
ной системы: 1) постройте диаграмму фазового состояния (диаграмму
плавкости) системы А — В; 2) обозначьте точками: /—жидкий расплав,
содержащий а % вещества А при температуре 7\; // — расплав, со-
содержащий а % вещества А, находящийся в равновесии с кристаллами
химического соединения; /// — систему, состоящую из твердого ве-
вещества А, находящегося в равновесии с расплавом, содержащим Ъ %
вещества А; IV — равновесие фаз одинакового состава; V — равно-
равновесие трех фаз; 3) определите состав устойчивого химического соеди-
соединения; 4) определите качественный и количественный составы эвтек-
тик; 5) вычертите все типы кривых охлаждения, возможные для дан-
данной системы, укажите, каким составам на диаграмме плавкости эти
кривые соответствуют; 6) в каком фазовом состоянии находятся систе-
системы, содержащие с, d, e % вещества А при температуре 7\? Что про-
произойдет с этими системами, если их охладить до температуры Г2?
7) определите число фаз и число условных термодинамических сте-
степеней свободы системы при эвтектической температуре и молярной до-
доле компонента А 95 и 5 %; 8) при какой температуре начнет отверде-
отвердевать расплав, содержащий с % вещества А? При какой температуре
он отвердеет полностью? Каков состав первых кристаллов? 9) при ка-
какой температуре начнет плавиться система, содержащая d % вещества
А? При какой температуре она расплавится полностью? Каков состав
первых капель расплава? 10) вычислите теплоты плавления веществ
А и В; 11) какой компонент и сколько его выкристаллизуется из сис-
системы, если 2 кг расплава, содержащего а % вещества А, охладить от
Тг до Т2?
№ вари-
варианта
1
Системы
А—КС1
В—SnCl2
Молярная
доля А, %
0
5
10
15
20
25
30
35
Температура
начала кри-
сталлиза-
сталлизации. К
512
507
496
479
477
481
478
473
Молярная
доля А. %
40
45
50
52,5
55
70
80
100
Температура
начала кри-
сталлиза-
сталлизации, К
460
481
497
583
658
853
952
1050
247
Продолжение табл.
№ вари-
варианта
2
3
4
5
6
7
(_.и(.темь1
A—KCI
В—РЬС1а
A-KCI
В—MnCI,
A—LiCO,
В-К2СО3
A — MgSO4
В—Cs2SO4
A—Li2SO4
В—Cs2SO4
A—KI
В—Cdl2
Молярная
доля А, %
0
10
20
25
30
33,5
40
0
8
15
25
34
36
38
40
0
9
20
33
39,5
44,2
0
10
20
30
40
45
47
50
0
10
20
25
31
35
40
50
55
0
10
30
45
47
49
Температура
начала кри-
сталлиза-
ции, К
769
748
713
701
710
713
707
923
895
865
815
745
722
735
747
1133
1055
955
765
773
778
1294
1241
1193
1116
1013
953
969
999
1293
1216
1113
1063
953
963
1003
1011
1007
658
643
596
520
470
468
Молярная
доля А, %
45
50
55
65
75
90
100
50
60
65
66
75
85
100
50
54,5
62
66,6
83,5
100
55
60
63
65
70
80
90
100
65
75,5
77,5
30
85
89,5
90
95
100
53
55
60
65
80
100
Температура
начала кри-
сталлиза-
сталлизации. К
693
703
733
811
893
1003
1048
769
731
705
701
705
925
1047
788
778
765
798
911
983
1048
1053
1098
1113
1163
1238
1323
1397
983
903
906
910
905
893
910
1055
1129
504
515
575
656
833
951
248
Продолжение табл.
JV« вари-
варианта
. 8
9
10
11
12
13
Системы
A—CsCl
В—CsCI2
A—CsCl
В—SrCl2
а—ка
В—СаС12
A—CuCI
В—CsCl
A—CdCI2
В—TIC1
A—SrBr2
В—КВг
Молярная
доля А. %
0
10
15
20
25
35
40
0
10
20
30
40
45
50
0
5
10
18,5
20
25
35
0
10
20
35
45
50
60
0
10
20
28
30
36,5
47
0
10
25
29
33,3
40
50
Температура
начала кри-
сталлиза-
сталлизации, К
1147
1124
1089
1059
1102
1155
1166
1147
1089
1004
906
964
975
978
1043
1023
978
911
828
980
1022
912
868
814
645
571
549
533
702
656
604
572
. 589
645
694
1003
972
872
829
832
826
807
1
Молярная
доля А, %
50
60
70
80
85
95
100
55
65
70
75
80
90
100
40
45
55
Ь7
70
90
100
65
66,6
70
75
80
90
100
50
57,5
67,5
80
85
95
100
57
66,7
75
82
85
95
100
Температура
начала кри-
сталлиза-
сталлизации, К
1180
1158
1071
877
862
875,8
876,8
696
896
827
853
879
960
999
1027
1015
961
873
899
1021
1049
542
547
541
521
541
623
695
699
697
673
754
777
823
841
832
847
843
835
851
897
916
249
Продолжение табл.
th вари-
варианта
14
15
16
17
18
19
системы
A-FeCI3
В —NaCI
A—FeCU
В —Т1С1
A—NiF2
В—KF
A—KI
В—РЫ2
A—SrBr2
В —LiBr
A—NiNO3
В—RbNO3
Молярная
доля А, %
0
13,3
22,2
35.8
37.6
40
47
50,6
0
10
22
26
29
33
0
4,9
9.2
13,4
15,2
18,4
21.8
0
10
20
25
30
31
35
40
0
5
20
30
34
40
0
10
20
22
32,5
36
40
Температура
начала кри-
сталли-
сталлизации, К
1073
1052
1033
989
975
983
999
1003
702
658
598
535
549
563
1121
1099
1060
1120
1141
1168
1193
685
668
640
622
579
594
603
610
825
813
772
736
720
744
585
535,5
489
479
424
438
449,5
Молярная
доля А, %
53
61,6
66.8
74,6
80.6
81,6
84,8
100
35
37
45
52
62
100
23,8
26
30,3
37,9
46,7
50,5
58
45
50
55
60
70
80
90
100
50
54
66.6
85
100
50
60
65
70
80
90
100
Температура
начала кри-
сталли-
сталлизации, К
983
753
680
641
622
642
697
859
525
506
533
553
560
585
1212
1224
1289
1359
1397
1403
1391
618
622
651
695
773
858
914
959
768
773
803
865
916
464
457.6
449
567
598
519,5
527
250
Продолжение табл.
Jfe ва-
варианта
20
21
22
23
24
Системы
A—MgCI2
В—TiCI
A-MgCl2
В—RbCl
A—MnCI2
В—RbCI
A—MgSO4
В—K2SO4
! *
A—PbCI2
В-Т1С1
Молярная
доля А, %
0
5
15
28
33,3
0
17,5
22,7
23,7
25,9
28
29
30,4
33,1
35,5
0
15
22
27
30
32
35
40
0
10
20
30
40
50
0
10
15,5
20
25
30
, 36,5
40
Температура
начала кри-
сталли-
сталлизации, К
708
698
682
635
685
991
868
800
764
746
736
732
743
749
754
999
879
813
749
741
733
713
767
1349
1308
1236
1123
1019
1103
708
679
661
675
680
676
650
658
Молярная
доля А, %
50
66,6
75
90
100
36,2
37,5
43,8
50
58,1
65
68,3
78,7
100
45
50
55
65
68
70
80
100
63,9
66,8
71
75,3
82,3
100
50
60
66,6
70
75
80
90 -
100
Температура
начала кри-
сталли-
сталлизации, К
767
796 ,
658
950
991
759
784
816
823
809
783
821
898
984
793
799
797
755
733
743
803
923
1200 ,
1203
1193
1177
1247
1397
680
705
708
707
700
720
752
773
251
Продолжение табл.
Jft ва-
варианта
25
Системы
A—NaCI
B-ZnCI2
Молярная
доля А. %
0
5
10
15
25
27
30
Температура -
начала кри-
сталли-
сталлизации, К
595
589
577
573
543
535
569
Молярная
доля А, %
35
46
52,5
58
67,7
100
Температура
начала кри-
сталли-
сталлизации, К
623
683
769
813
882
1073
№ ва-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
г,, к
493
753
873
923
1173
1173
723
1173
1073
1023
773
773
973
а
45
30
40
40
55
40
55
35
35
25
55
42
60
Ь
75
75
80
75
90
85
75
90
85
75
80
80
90
с
5
5
10
10
10
10
10
10
5
5
10
10
10
d
25
25
40
40
40
40
40
50
35
35-
25
40
50
е
75
75
80
86
72
95
70 >5
75
85
85
60
90
75
Т„ К
463
703
733
768
1123
973
. 503
1093
923
923
533
643
833
№ ва-
варианта
14
15
16
17
18
19
20
21
22
23
24
25
Г,,К
1033
673
1273
773
873
523
923
873
873
1273
723
723
а
45
30
15
40
50
40
50
40
30
50
50
35
Ь
95
50
75
80
75
80
90
95
90
85
60
S
10
5
5
10
10
10
10
10
10
10
10
10
d
45
30
20
40
50
40
50
50
40
30
50
20
50
е
75
50
40
80
90
95
85
75
60
85
75
60
т2, к
983
543
1113
603
753
443
703
793
733
1073
673
583
ГЛАВА XVI
ГЕТЕРОГЕННОЕ РАВНОВЕСИЕ В ТРЕХКОМПОНЕНТНЫХ
СИСТЕМАХ, СОДЕРЖАЩИХ ЖИДКУЮ И ТВЕРДУЮ ФАЗЫ
Основные уравнения и символы
[К., с. 400—402,405 — 407, 420—423]
Точка на плоскости равностороннего треугольника отражает сос-
состав трехкомпонентной системы. Если из точки Р (рис. 37, а) опустить
перпендикуляры на стороны треугольника, то сумма этих отрезков рав-
равна высоте треугольника, которая принимается за 100 % (метод Гиб-
бса). Точка на плоскости равностороннего треугольника отражает со-
состав трехкомпонентной системы. Если из точки Р (рис. 37, б) провести
прямые, параллельные основаниям треугольника, то сумма их равна
252
стороне треугольника, которая принимается за 100% (метод Розе-
бума). Вершины треугольника соответствуют чистым компонентам
(характерные точки).
Двухкомпонентные системы отражаются на соответствующих сторо-
сторонах равностороннего треугольника. Линии, параллельные стороне тре-
треугольника, являются геометрическим местом точек, соответствующим
системам с постоянным содержанием компонента, против которого ле-
лежит сторона треугольника. Прямые, проведенные из вершины треу-
треугольника до пересечения с противоположной стороной, являются гео-
Рис. 37. Изображение составов трехкомпонентнон системы ме-
методом Гиббса (а) н методом Розебума (б)
метрическим местом точек, соответствующих системам, в которых отно-
отношение двух компонентов остается постоянным и равным отношению от-
отрезков, на которые делится сторона треугольника (характерные ли.
нии).
Пусть общий состав двухкомпонентной системы отражается точкой
Р (рис. 37, а), состав первой фазы (I) отражается точкой М, состав вто-
второй (II) фазы —* точкой N. Тогда, если массовый состав выражен в про-
процентах, то
(XVI.I)
где /П[ и Шц — масса первой и второй фаз. Если молярный состав вы-
выражен в процентах, то
nI/nu=zNP/PM, (XVI.2)
где rtj и пи — число молей первой и второй фаз.
ЗАДАЧИ С РЕШЕНИЯМИ
I. Проанализируйте фазовое состояние неизоморфной трехкомпо-
нентной системы ABC (рис. 38), а также процесс охлаждения системы
состава, отраженного на диаграмме точкой /.
253
Решение. Выше поверхностей adgf, bdge и cfge все системы го-
гомогенные— жидкий расплав. Поверхность adgf отражает состав расп-
расплава, находящегося в равновесии с кристаллами компонента А. Поверх-
Поверхность bdge отражает состав расплава, находящегося в равновесии с кри-
кристаллами компонента В. Поверхность cfge отражает состав расплава,
находящегося в равновесии с кристаллами компонента С. Линии пере-
пересечения поверхностей dg, fg и eg отражают составы расплавов, находя-
находящихся в равновесии с кристаллами двух
компонентов. Линия dg — в равновесии
находятся расплав и кристаллы А и В,
линия eg — в равновесии находятся
расплав и кристаллы В и С, линия
fg — в равновесии находятся расплав и
кристаллы А и С. В точке g пересече-
пересечения линий dg, eg и fg в равновесии
находятся расплав и кристаллы трех
компонентов А, В и С. Точки d, e и /
эвтектики двухкомпонентных систем.
Ниже точки g — тройной эвтектики —
все системы гетерогенные, три твердые
фазы.
Проследим изменение фазового со-
состояния системы при ее охлаждении.
При охлаждении системы до температу-
температуры 7\ система гомогенная, одна жидкая
фаза. При температуре 7\ начинается
кристаллизация компонента А (точка 2).
Так как из расплава в твердую фазу вы-
выделяется только компонент А, то соот-
соотношение концентраций компонентов В
и С в жидком расплаве не меняется.
На плоском треугольнике основания
призмы такой процесс отражается ли-
линией /'—3'. Состав расплава меняется по линии 2—3. В точке 3
Расплав становится насыщенным не только компонентом А, но и компо-
композитом В. Точка 3 соответствует температуре Та. При этой темпе-
Ратуре из расплава начинает кристаллизоваться совместно с компо-
компонентом А компонент В. Состав расплава меняется по линии 3—g.
На плоском треугольнике этот процесс отражается также линией
$ — g\ Тройная эвтектика (точкам) находится при температуре 7'4.
При температуре Тх вся система кристаллизуется и будет гетероген-
гетерогенной, трехфазной. При дальнейшем охлаждении системы охлаждаются
кристаллы компонентов А, В и С, что отражено на диаграмме стрел-
стрелками на ребрах призмы. Весь процесс охлаждения системы на рис. 39
отражен стрелками.
2. Определите массу компонента А (рис. 38, точка l)j который вы-
выделится в твердую фазу из 1 кг системы, если ее состав' охлажден до
Рнс. 38. Диаграмма плавкости
неизоморфной трехкомпснент-
иой системы
U54
NaCl1
температуры Т2. Проекция изотермы Т2 на основание призмы делит
отрезок /' — 3' в соотношении 13<4. Массовый состав выражен в про-
процентах.
Решение. Для определения соотношения массы жидкой и твер-
твердой фаз применим правило рычага:
mTB A—ттв) =4/13 = 0,308; тГв = 0,308— 0.308 mTB; mTB = 0,235 кг.
Так как из системы состава, изображенного точкой /, в твердую фазу
выделяется только компонент А, то масса кристаллов компонента А при
температуре Т2 будет 0,235 кг. Масса
оставшегося расплава будет 0,765 кг.
3. Система NaCl — KCl — Н2О
неизоморфная. Между компонентами
не образуется химических соединений.
Исходная система состоит из 10 кг
КС1, 20 кг NaCl и 70 кг Н2О. Раство-
Растворимости в воде при 373 К КС1 —
56,2 кг, NaCl — 39,4 кг в 100 кг раст-
раствора. Совместная растворимость
27,39 кг NaCl + 35,16 кг КС1 в
100 кг раствора. 1. Постройте диа-
диаграмму фазового состояния системы,
считая линии растворимости прямы-
прямыми. 2. Определите массу испарившей-
испарившейся воды и состав раствора до начала
кристаллизации. 3. Какая соль, NaCl
или КС1, начнет кристаллизоваться из раствора при изотермическом
испарении воды из исходной системы? 4. Какое количество воды ис-
испарится до начала кристаллизации обеих солей? 5. Сколько килограм-
килограммов NaCl и КС1 выделится из системы в твердую фазу, если из систе-
системы испарить 95 % воды, содержащейся в исходной системе?
Р е ш е н и е. На основании заданных составов исходной системы,
двойных эвтектик NaCl — Н2О и КС1 — Н2О и тройной эвтектики
NaCl — KCl — Н2О и на треугольную плоскую диаграмму наносим со-
соответственно точки ръ ег, е2 и е3. Соединим прямыми ех и е3, е2 и es
(рис. 39). Так как из раствора, состав которого на диаграмме фазового
состояния отражен точкой ръ испаряется только вода, то соотношение
NaCl и КС1 в системе остается при этом без изменения. Процесс испаре-
испарения отражается продолжением линии, соединяющей точку рх с верши-
вершиной треугольника Н2О, т. е. линией /?х — р2. В точке р2 раствор стано-
становится насыщенным NaCl и начинает кристаллизоваться. Определим,
сколько воды испарится в процессе, отраженном на диаграмме
линией рг — р2. Определим состав точки р2Л6,5 % КС1, 33,5 % NaCl
и 50% Н2О. Рассчитаем массу воды в системе, соответствующей
точке р2: для состава р2(\0 + 20) кг соли составляют 50% ,
а х кг воды составляют остальные 50 %. Откуда х = 30 кг.
Таким образом, в системе состава р2 после испарения во-
255
HjO ег кс!
Рис. 39. Изотермическое сечение
диаграммы фазового состояния
системы NaCl—KCI—Н2О
ды останется 10 кг КС1, 20 кг NaCl и 30 кг Н2О. Из системы испари-
испарилось 40 кг воды до начала кристаллизации NaCl. Так как из системы в
твердую фазу будет выделяться NaCl по мере испарения воды, то состав
системы будет обогащаться КС1. Этот процесс изобразится линией р2—
р3, В точке е3 начнется совместная кристаллизация и NaCl, и К.С1.
Определим массу воды, испарившуюся из системы до начала кристал-
кристаллизации обеих солей. Так как из раствора кристаллизуется только
NaCl (линия рг — р.,), то весь КС1 остается в растворе. В точке
е3 массовая доля NaCl —27,39 %, КС1 —35,16 % и Н2О —37,45 %.
10 кг K.CI в растворе состава е3 составляют 35,16 %
х ¦» Я„О » » » е3 » 37,45 %
Отсюда д¦-= 10,65 кг Н2О останется в растворе. Испарится воды
70—10,65 --= 59,35 кг.
Чтобы определить массы NaCl и КС], которые выкристаллизуются
из системы при испарении из нее 95 % воды, рассчитаем состав полу-
полученной системы. Общий состав будет 10 кг К.С1, 20 кг NaCl и 70-0,05=
= 3,50 кг Н2О, а массовая доля будет (%): КС1 —29,85; NaCl —59,70;
Н2О — 10,45. На диаграмме этот состав изобразится точкой р3.
Соединим линией точку е3 с р3 и продолжим эту линию до пе-
пересечения с основанием треугольника NaCl — K.C1. Получим
точку г. Масса солей, выделившихся в твердую фазу, так относится
к массе всей системы, как длина отрезка p^e3 относится к длине отрез-
отрезка ге3, что соответствует 0,702. Общая масса системы составляет
33,5 кг. Масса твердой фазы 33,5-0,702 = 23,52 кг, масса оставшегося
раствора 33,5 —23,52 = 9,98 кг.
Состав твердой фазы определяется на диаграмме точкой г, соответ-
соответствующей 73 % NaCl и 27 % КС1. В твердой фазе будет 17,17 кг NaCl
и 6,35 кг КС1. Раствор имеет состав тройной эвтектики. Масса раство-
раствора 9,98 кг. Он содержит 2,80 кг NaCl, 3,68 кг К.С1 и 3,50 Н2О. При ис-
испарении всей воды, содержащейся в исходном растворе, состав системы
будет отражаться на диаграмме точкой s.
ЗАДАЧИ
1. Система состоит из солей S( и SM с одноименным ионом и воды.
Состав системы (%): S, — 20; SA — 25; Н2О — 55. Составы эвтектики:
S| H2O, Su Н2О содержат 60 % и 50 % S соответственно. Состав
тройной эвтектики (%): S, — 50; Su — 25; Н2О — 25. Начертите
изотермическое сечение диаграммы фазового состояния при темпера-
температуре выше температуры кристаллизации воды, но ниже температуры
кристаллизации двойной эвтектики соль — соль. Проследите процесс
изотермического испарения воды из системы.
2. Проследите на диаграмме фазового состояния системы, состоя-
состоящей из двух солей с одноименным ионом S^ Бц и Н2О, изотермическое
испарение воды из раствора, содержащего 15 % Sb 25 % Su и 60 %
Н2О. Растворимость соли S, в воде 45%, а соли SM 50 %. Совместная
растворимость солей Si и Si{ 40 и 25 % соответственно. Изображая ли-
256
нии растворимости прямыми, определите, какая соль начнет кристал-
кристаллизоваться первой из системы при изотермическом испарении воды,
какое количество воды надо испарить из 1 кг указанной системы до на-
начала появления первого кристалла, какое количество воды надо ис-
испарить до начала совместной кристаллизации солей Sn и S2?
3. На основании изотермического сечения диаграммы фазового сос-
состояния системы Т12С12 — Tl (NO3J — T12SO4? которая приведена в
справочнике [М.], определите массу T12SO4, выкристаллизовавшуюся
из системы, состоящей из 20 % Т12С12, 20% Tl2 (NO3J и 60% T12SO4,
при охлаждении ее до 400° С.
МНОГОВАРИАНТНАЯ ЗАДАЧА
Трехкомпонентная система Н2О — А — В, где А и В — соли, не
образующие химических соединений между собой и с водой.
1. По заданным значениям концентраций эвтектик соль — вода и
сройной эвтектики вычертите диаграмму изотермического сечения
тистемы при температуре выше температуры плавления воды, но ниже
температуры эвтектики соль — вода.
2. Нанесите на диаграмму точку р, соответствующую составу ис-
исходной системы.
3. Какая соль и в каком количестве выделится из 1 кг системы при
изотермическом испарении воды в чистом виде?
4. Определите массу солей Аи В, которая будет выделена в твердую
фазу при испарении из системы 90 % воды, содержащейся в исходной
системе?
5. Рассчитайте соотношение солей А: В в твердой фазе после испа-
испарения из системы 90 % воды.
s
1
2
3
4
5
6
7
8
9
10
11
12
13
Массовая доля
системы
в точке р, %
А
30
20
10
20
20
20
10
10
10
30
20
10
20
в
10
10
10
30
20
10
30
20
40
10
10
10
30
Массовая
доля эв-
эвтектик, %
А
70
80
60
50
70
40
60
50
70
80
60
50
70
в
50
60
80
70
50
50
80
70
50
60
80
70
50
Массовая доля
тройной
эвтектики, %
А
40
40
30
20
20
40
30
30
30
30
50
40
40
в
30
30
30
50
30
30
30
40
30
40
30
30
30
н,о
30
30
40
30
50
30
40
30
40
30
20
30
30
№ вари-
варианта
14
15
16
17
18
19
20
21
22
24
24
25
Массовая доля
системы в
точке р, %
А
20
20
10
10
10
30
20
10
20
20
30
10
в
20
10
30
20
40
¦ 10
10
10
30
20
10
20
Массовая
доля эв-
эвтектик, %
А
80
60
50
70
80
60
50
70
80
60
50
70
в
60
80
70
50
60
80
70
50
60
80
70
50
Массовая доля
тройной
эвтектики, %
А
30
40
40
40
40
30
40
50
50
30
50
50
в
40
30
20
40
40
40
40
30
30
30
20
20
н2о
30
30
40
20
20
30
20
20
20
40
30
30
Зак. 767
257
ГЛАВА XVII
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Основные уравнения и символы
[К-, с. 429—437, 446—451; Г., т. 1, с. 261—326]
Закон действующих масс для реакции, записанной в общем виде
E (a)
и протекающей в газовой фазе, при условиях, для которых применимы
законы идеального газообразного состояния:
CDcE/cvACVB, (XVIL1)
D Е А В
где Ci — равновесная молярная концентрация 1-го компонента;
ct = Pi/RT, (XVII.2)
где Pt — равновесное парциальное давление 1-го компонента:
KP==plDplE/plAplB' (XVII.3)
Pi = xiP, (XVII.4)
X^'xLE vri + v_-vA-vn xlPxlE
KP= D E P D E A B= D E p*\ (XVII.5)
V V V V
где Xt — равновесная молярная доля i-ro компонента в идеальном газо-
газообразном состоянии; Р — общее давление равновесной смеси; Av—
разность стехиометрических коэффициентов веществ;
Av=2(v*)K0H-2(v«)Ha,, (XVII.6)
i
где V; — стехиометрический коэффициент компонента химической ре-
реакции;
(XVII.7)
где пг — количество молей j-ro компонента в равновесной смеси; пт—
количество молей инертного газа (газа, не участвующего в химиче-
химической реакции).
Связь между константой равновесия, выраженной через парциаль-
парциальные давления, и константой равновесия, выраженной через концен-
концентрации, описывается уравнением
v. (XVII.8)
258
Константу равновесия можно выразить через степень превращения
а. Так, например, для реакции
A + 2B = 2D (б)
Кр= [а* C-а)]/A -а)» Р, (XVII.9)
аА = ДпА/пА; ав = Дпв/п|, (XVII. 10)
где ад, ав — доля исходного вещества, претерпевшего превращение
(степень превращения); ДпА, Дпв — количества молей компонентов
А и В, претерпевших превращение;
АпА = П1 — ПА> АпВ = П&~~ПВ>
п%, "в — количества молей веществ А и В в исходном состоянии сис-
системы; Па, «в — количества молей вещества А и В в равновесном состо-
состоянии системы. Если вещества А и В взяты в стехиометрическом соотно-
соотношении, то
ng = 2rtA (XVII. 12)
ав--=2(ДпА)/2пА = аА. (XVII. 13)
Мера протекания реакции (глубина реакции)
|=— Л/п/Vj. (XVII. 14)
Для реакции (б)
Длв/2, (XVII. 15)
отсюда
? = а. (XVII.16)
Уравнение изотермы химической реакции Вант-Гоффа для реакции (а)
PVD pVE
AGpT=RT\n ° 1 —RT\nKp, (XVII.17)
V V
С D с Е
°1
— RT\nKc, (XVII.18)
где Рд, Pb, Pd, Ре — произвольные парциальные давления исход-
исходных веществ и продуктов реакции; сА, ев, cd, ce — молярные концент-
концентрации начальных веществ и продуктов реакции;
ДЛу, г =AGP7. (XV11.19)
— AGr = — 2vj(Xj — химическое сродство.
Для стандартного состояния системы
ДО°=— RT\nKP, (XVII.20)
(XVff. 21)
(XVII.22)
259
где — AGt = — Svj(x" — стандартное химическое сродство. В СИ
уравнение (XVII.20) принимает вид
AGT{cii) =AGT (arM)-{-AvRTln 1,0133.10s, (XVII.23)
где индексы (СИ) и (атм) указывают, что равновесные давления выра-
выражены в паскалях и атмосферах соответственно.
Расчет энергии Гиббса AG§98 для реакций при стандартном состоя-
состоянии и 298 К
ДО§98 = ДЯ^98— 298 Д Sj!98, (XVII.24)
где A#298—энтальпия реакции при стандартных условиях и при 298 К;
AS!>98 — энтропия химической реакции при стандартных условиях
и 298 К.
Расчет энергии Гиббса AGf Для реакции квантовостатистическим ме-
методом
до». / ег—я«\ дя°
-^Г- = А ' " ) + -=Г' (XVI1.25)
—Я«
где I—у;—I — приведенная энергия Гиббса; ДЯ8 — гипотетиче-
гипотетический тепловой эффект реакции при абсолютном нуле в идеальном га-
газообразном состоянии;
= ДЯ? — Д Щ—Я»). (XVif.26)
Величины (Яг — Щ) вычисляются квантовостатистическим ме-
методом.
Расчет энергии Гиббса AGt Для реакции термодинамическим мето-
методом (методом Темкина — Шварцмана):
I ДСР
ДО«! = ДЯ298—TAS§98+ J ACpdr—Г J —- d Г. (XVII.27)
298 298 '
После подстановки зависимости АСр от температуры, выраженной
уравнением
в уравнение (XVII. 27) получим
Ас'
(XVII.28)
Ас'). (XVII.29)
Коэффициенты Мо, Мъ М2, М3 и Л1_2 вычислены и приводятся в спра-
справочниках для ряда температур.
260
Зависимость константы равновесия реакции от температуры выра-
выражается уравнением изобары (изохоры) Вант-Гоффа в дифференциаль-
дифференциальном виде:
d In K
P _
Д Я»
dT
. din Kc A№
dT
RT*
(XVII. 30)
(XVII.31)
Уравнения (XVI1.30) и (XVI1.31) можно проинтегрировать для сле-
следующих условий:
Д #°
l)AW« = const; ДС«=0; lg КР = — 2 3026дГ + const: (XVII.32)
2) ДЯ«=^ const; ДС^ = const; ДСр = Да; lg tfP =—+В lgT+C (XVII. 33)
или
3)
или
A
T
(XVff.35)
Да298 +
2982
2,3026^
4)
Дс'
(XVff.37)
Равновесие в газовой фазе при средних давлениях рассчитывают сле-
следующим образом.
Константа равновесия-для реакции (а) будет
Kt = /VD /vE/fvA fvB = KXKvPAv, (XVff.38)
где
(XVff.39)
(XVI 1.40)
(xvn.41)
261
//—фугитивность j-ro компонента в равновесной смеси. Без большой
погрешности можно принять
li=f°ytXi, (XVII.42)
где/? —фугитивность чистого 1-го компонента при давлении равновес-
равновесной смеси, или
fi = Pytx,\ (XVII.43)
коэффициент активности уг определяют по методу соответственных со-
состояний.
ЗАДАЧИ С РЕШЕНИЯМИ
I. Вычислите степень превращения а исходных веществ реакции
А + 4В = D, глубину реакции ? и равновесный выход конечного про-
продукта реакции D (хо 100), если начальные количества исходных ве-
веществ: п% = 1,000 моль, пв = 12,000 моль. При достижении равно-
равновесия яд = 0,025; «в = 8,100; nD — 0,975 моль.
Решение. Согласно уравнению (XVII.10) степень превращения
будет
1,000 — 0,025 12,000-8,100
аА= j =0,975; ав= ^ =0,325.
Глубину реакции вычислим по уравнению (XVII. 14):
"д—«А _ "в""в _ 1,000—0,025 _ 12,00—8,100
?= . _ j - =0,975.
Равновесный выход вещества D определим по молярной доле этого ве-
вещества в равновесном состоянии системы:
nD 0,975
0,025 + 8,100+0,975
Равновесный выход вещества D составит 0,107-100=10,7 %.
2. Рассчитайте константу равновесия Кс реакции А + 4В = D,
если объем реакционного сосуда V = 0,05 м3.
Решение. Согласно уравнению (XVII. 1)
cD nD/V 0,975-50*
Кс= = = = • = 5,66-10* (моль/л)-*.
сАсв nklv{4lvf 0,025.8,100* 1 '
3. Константа равновесия реакции Н2 + 1г — 2HI при 693 К
Кс = 50,25. Вычислите массу образующегося иодида водорода,
если в сосуд вместимостью 10~3 м3 введено 0,846-10~8. кг 12 и
0,0212-Ю-3 кгН2.
262
Решение.. Определим количество молей исходных веществ:
0 103=0,0106 моль Н2,
0 846-10~3
nf =-—: 103 = 0,00333 моль 12,
Н2 + Is =2Н1
10,6-10 3,33-10 0 —число молей в исходном состоянии системы
10,6-Ю—х 3,33-Ю—х 2х —число молей в равновесном состоянии си-
системы
По уравнению (XVII. 1) находим Кс-
_J^L = /() =50 25.
(nH,/v)(nh/v) [(Ю,6-Ю-3— х)/10-з] [C,33-Ю-з—х)/Ю-3]
Решение этого уравнения дает
46,25х2— 0,7015а+1,7737-10-3 = 0.
Откуда
0,7015 ± Л/ 0,70152—4-1,7737- 10-«-46,25 _
х1л = -__ .
0,7015 ±0,4049
92,50
^=11,961-Ю-3; д:2 = 3,206-10-з.
Первый корень х1 не имеет физического смысла, так как величина х
не может быть больше пи2', х^ = 3,206-10~3 моль. Масса HI, получен-
полученная в результате установления состояния равновесия, составит mm =
=2xA1hi = 2-3,206-10-3 -128-Ю-3 = 0,82Ы0-3 кг.
4. В закрытом сосуде вместимостью 0,05 м3 находится 1 моль веще-
вещества А и 12 моль вещества В. В результате реакции А + 4В = D ус-
установилось равновесие. Общее давление в равновесном состоянии сис-
системы составляет 4,51 • 105 Па. Вычислите равновесные концентрации
всех реагентов при 298 К. Система подчиняется законам идеального
газообразного состояния.
Решение. Согласно уравнению реакции приведем количество
молей в начальный момент и в состоянии равновесия:
А + 4В =D
1 12 0 —количество молей в исходном состоянии системы
1 —л: 12—Ах х —количество молей в равновесном состоянии системы
. 2лг = 1— л:-f 12—4л:-f х=13— Ах.
263
По уравнению Менделеева — Клапейрона PV = ^ti
„ 4,51-105-0,05
^„134х
83143,298
моль,
13—9-10
х = = 0,975 моль.
4
Равновесные концентрации определим по уравнению
1 — 0,975
с —
12—4.0,975
= 0,5 моль/мл,
= 162 моль/м3,
0,975
cD= 0 05 =19,5 моль/м3.
5. При 693 К водород и иод находятся в закрытом сосуде. В исход-
исходном состоянии системы парциальные давления Рнг = 0,4521 • 105 и
Р\г = 0,1682-105 Па. Равновесное парциальное давление HI Phi —
= 0,3222-105 Па. Вычислите равновесные парциальные давления Н2
и 12 и константу равновесия.
Решение. Убыль парциальных давлений водорода и иода рав-
равна между собой (ДРнг и &Pi,)'
Р' =р —др ¦ р: = р. _др.
где Рн2 и Р\, — равновесные парциальные давления водорода и иода.
Парциальное давление образовавшегося HI равно удвоенной убыли
пациального давления водорода:
Рн, = 2ДРН2 = 2ДРь; ДР = 0,3222.105/2 = 0,161Ы0в Па.
Тогда
Р^а = 0,4221 • 10^-0,1611 • 105 = 0,2910.10» Па,
Р; = 0,1682-105—0,161Ы05=0,007Ы05 Па.
Вычислим Кр по уравнению (XVII.3):
(РН1J @,3222-105J
Р{, Р\ 0,2910-105.0,007Ы05 =50-25-
6. Процесс получения хлора окислением хлороводорода протекает
по уравнению реакции
При смешении 1,000 моль НС1 с 0,480 моль О2 образуется 0,402 моль
С12. Вычислите Кр, если система находится при Р = 1,0133-105 Па
и 659 К.
264
Решение. На образование 0,402 моль С12 расходуется
0,804 моль НС1 и 0,201 моль О2. В равновесном состоянии будет:
"ci ~пн о = 0>402 моль,
пна = 1,000—0,804 = 0,196 моль,
nOf =0,480 —0,201=0,279 моль,
2 лг = 0,196+0,279 + 0,402+0,402=1,279 моль.
Отнесем рановесные парциальные давления к давлению 1 атм:
PHf0 = 0,402/1,279 = 0,314,
Pclf =0,402/1,279 = 0,314,
Рнс, = 0,196/1,279 = 0,153,
Ро =0,279/1,279 = 0,218,
тогда
0,3142-0,3142
КР = —¦ ¦ = 81,376 [атм-1].
р 0.1534-0,218 '
7. При 823 К и 1,0133* 105 Па степень диссоциации фосгена на ок-
оксид углерода и хлор равна 77 %. Определите Кр и Кс-
Решение. Процесс диссоциации можно записать: СОС12 =
= СО + С12. Равновесное парциальное давление равно общему давле-
давлению, умноженному на равновесную молярную долю:
СОС12 = СО + С12
1 0 0 —исходное количество молей
1 — а а а —равновесное количество молей
S л; = 1 — а+а + а= 1 +а.
Отсюда равновесные парциальные давления, отнесенные к давлению
1 атм, будут:
а 1 —а
РР Р Р Р
ci, j_|_a coci, j_|_a
— а) а? 0,772
='-456 атм,
Ке=Кр (^r)-Av=l,456^8,3143.823)-i = 0,02157 моль/л,
8. В реакции, протекающей по уравнению
3Fe + 4Н2О = Fe3Ot + 4Н2
при исходном давлении водяного пара 1,3325-105 Па после достиже-
достижения равновесия при 473 Крановесное парциальное давление образую-
образующегося водорода составляет 1,2717-108 Па. Определите выход водоро-
265
да, если в сосуд вместимостью 2-10~3 м3, содержащий металлическое
железо, введен водяной пар под давлением 3,0399-105 Па при 473 К.
Решение. Так как концентрации металлического железа и ок-
оксида железа Fe3O4B газовой фазе практически постоянны, то константа
равновесия реакции может быть записана так:
где К'р = Кр'2Ь- Реакция идет без изменения объема, поэтому при до-
достижении равновесия Рн,о = 1,3325-108— 1,2717-106= 0,0608-108Па =
'=0,0600 атм.
1 2550
Рн, = • -2717-10» Па= 1,2550 атм; КР = о'обОО =20'917 •
Количество молей образовавшегося водорода определим по уравне-
уравнению Менделеева — Клапейрона
Рн, = Рн,о Кр = C.0399.10»-Ян,) Кр,
3,0399-10» 3,0399-10в-20,916 „ „,„ ,Л _
Р„ = , , „,— = —: ¦ = 2,9012.105 Па.
н' 1+Кр 21,916
Количество водорода будет
9. Вычислите равновесный выход NO2 по реакции N2O4 ч=ь 2NO2
при 1,0133-108 Па и 298 К.
Решение. Для определения равновесного выхода необходимо
знать константу равновесия реакции. Воспользуемся данными справоч-
справочника [М.] и рассчитаем энергию Гиббса по уравнению
ДО«98=ДЯ«98—298AS«98.
Вещество NO2 N2O4
Л#° 298 > кДж/моль 33,89 9,37
Si!98, Дж/(моль-К) 240,45 304,3
Д Н%8 =58,41 кДж; Д S»98 = 176,6 Дж;
ДО«98 =58,4Ы03-298.176,6 = 5,78.103 Дж.
По уравению (XVI 1.20) вычислим Кр
leKD = — — =-1,0131=2,9869; Л'Р = 0,0970;
ё р 2,3026-8,3143-298 р
Pxl0
Кр = , ' =0,0970; *ft0 =0,0970-0.0970XNO,;
266
2 +0,0970*NO2-0,0970 = 0.
Решение уравнения второй степени дает два корня, один из них не
имеет физического смысла. Тогда Хдаг = 0,2667; молярная доля в рав-
равновесии составляет xno2 • 100 = 26,67 %.
10. Определите константу равновесия Кр при 1000 К реакции
окисления аммиака:
NH3 + 3/A = V2N2 + 3/2H2O
Для расчета использовать константы равновесия реакций образования
аммиака и воды из простых веществ при 1000 К:
2 = NH3, KPi =5,69-10-*,
H,0 (г) Яр, = 1,16.101»
(давление выражено в атмосферах).
Решение. Выведем уравнение, связывающее искомую величи-
величину Кр с известными значениями Кр, и Крг:
где Ш^1 — стандартное изменение энергии Гиббса при образовании
данного вещества из простых веществ; AG0 — стандартное изменение
энергии Гиббса реакции окисления аммиака,
— RTlnKp= —— RT\n KPi + RTIn KPl
или
^=^ 5,69-10-* 2'196'0-
11. Константа равновесия реакции Н2 -f I2 = 2HI при 693 К
равна 50. Образуется ли иодид водорода при идеально обатимом прове-
проведении процесса, если исходные концентрации (моль/л): Н2 — 2; 1,5;
1,0; 12 — 5; 0,25; 2,0; HI —10; 5; 10. Вещества в реакционный сосуд
поступают из бесконечно больших емкостей. Иодид водорода выводит-
выводится из реакционного сосуда в емкость бесконечно большого объема, где
его концентрация сщ.
Решение. Воспользуемся уравнением изотермы Вант-Гоффа
и вычислим AG или АЛ. Установим знак этой величины. Для этого рас-
рассчитаем ттПгТТ и сопоставим эти величины с Кс-
1) для первых произвольных концентраций
102
= 10<50, ДО<0;
2*5
реакция будет протекать самопроизвольно в прямом направлении;
267
2) для вторых произвольных конценраций
52
1,5-0,25
- = 66,66>50, ДС>0;
реакция в прямом направлении самопроизвольно протекать не будет;
3) для третьих произвольных концентраций
102
= 50; ДО=0;
система находится в состоянии равновесия.
12. Выразите константу равновесия /Ся-реакции Н2 + 1/2О2 —
= Н2О (г) через общее давление Р и степень диссоциации водяного
пара а.
Решение. Если исходить из 1 моль Н2О (г) («нго = 1), то при
степени диссоциации а в равновесной смеси останется A — а) моль
Н2О (пнго) и образуется а/2 моль О2 (по,) и а моль Н2 (пн,)- Общее
число молей в равновесной смеси газов составит
2«г = а + а/2+1— а=(а+2)/2.
I
Равновесные парциальные давления тогда будут:
а 2а
р __ р — == р
н» (а + 2)/2 а + 2 '
р =р «/2 = р a
1—а 2A—а)
р р р. ->— '
н»° (а + 2)/2 ' а + 2
а константа равновесия реакции
РН,0 _ Р2A-а)(а + 2)(а+2)'/2 _ A -а) (а+2)
к
Р~ РР'2 Р21<21'2 Р./2а3/2
13. Определите стандартное сродство оксида кальция к диоксиду
углерода, находящегося под давлением 1,0133-105 Па при ИЗО К,
если давление диссоциации СаСО3 при этой температуре 0,560-105 Па.
Решение. Вычислим константу равновесия реакции СаО +
+ СО2 = СаСО3 по соотношению
= _8,3143.1130.2,30261gA:P.
Константу равновесия рассчитаем из парциального давления CO2Pcof,
выраженного в атмосферах, так как за стандартное состояние принято
давление 1 атм:
Д0}130 = 8,3143-1130.2,3026lg 1,8095= -5,5718-103 Дж.
268
14. Определите константу равновесия реакции
AI2O3+3SO3=Al2(SOtK
при 298 К.
Решение. Вычислим тепловой эффект реакции изменение энт-
энтропии при стандартном давлении и 298 К, используя справочные дан-
данные [М.] о тепловых эффектах образования и об абсолютных энтропиях:
Вещество A12(SO4K A12O3 SO3
Ая° 298- кДж/моль —3434 —1675 —395,2
S», Дж/(моль-К) 239,2 50,94 256,23
Для реакции получаем
ДЯ«98 = — 573,4 кДж; Д S»98=—580,43 Дж/К-
По уравнению (XVII.24) определяем стандартное сродство:
Д G«98 = —573,4-103— 298 (—580,43)= -400,43-103 Дж.
Константу равновесия определяем по уравнению (XVII.20):
ДО«98 _ 400,43-103
g р= 2,3026^298 ~ 2,3026-8,3143-298 ~ ' °' р ~ '
15. Определите константу равновесия реакции SO2 + 4tOt =
= SO3 при 700 К, если при 500 К Kv = 588,9 (давление выражено в
Па), а тепловой эффект реакции в этом диапазоне температур равен
—99,48 кДж.
Решение. Воспользуемся уравнением (XVII.32) при Д#г=
= const:
>,500 = 2,3026-8,3143-500 I"S>
2,3026-8,3143-700
, 700 О ОППС С, ОНО 7ЛП Г"'
ДЯ^. / 1 1 \
КР, 700 = fg Кр, 500 — 2,3026-8,3143 [~Ш "i5o"J
99,48-103 I \
KPi 700 =0,632.
16. Выразите зависимость \gKp реакции СО+Н2О = СО2+Н2
от температуры. Установите, в каком интервале температур зависи-
зависимость будет справедливой. Вычислите Кр при 700 К.
Решение. Установим зависимость lg Кр = f (T). Для этого вы-
выразим зависимость АСр от температуры. Решение удобно провести в
форме таблицы:
Вещество
Hg*
СО
H2O(r)
.„0
a"f, 298'
кДж/моль
-393,51
0
-110,5
-241,84
S298'
Дж/(моль.К)
213,6
130,6
197,4
188,74
a
44,14
27,28
28,41
30,00
(Г), Дж/(моль К)
b. 10'
9,04
3,26
4,10
10,71
CIO"»
—8,53
0,502
-0,46
0,33
Температур-
Температурный интер-
интервал, К
298—2500
298—3000
298-2500
298-2500
Для реакции получаем
Д Я»98 = —41,17- Юз Дж; Д S«98 =41,94 Дж/К,
Да= 13,01; Д6=—2.5Ы0-3; Д с' = —7,90-Ю5.
Температурный интервал, в котором справедливы вычисленные
значения, 298—2500 К. Рассчитаем \g Кр при 298 К по уравнению
(XVII.20):
-41,17-103—298.41,94
'g Кр = - 2,3026-8,3143.298 =
Установим зависимость теплового эффекта от температуры по за-
закону Кирхгофа (VI.31):
AT
= Д С°р = 13,01 —2,51 • Ю-3 Г—
7,90-10»
+13,01 (Г—298)—
2'51'10
—2982) +
+ 7,90- Ю6(— —]=—41,17-103—13,01-298 +
-., 255-10-
= —47,586-103+13,017—1,255-1
Подставим полученную зависимость в уравнение изобары Вант-Гоффа
(XVII.30) и интегрируем от 298 К до Т:
7,90-10»
—47,586-103+13,01Г—1,255-10-sr2+-L—
1 AT,
In
298
5,723-IP3
Г?
0,950-10»
]dT=ll,
572+5,723-Юз
298
,5651пГ—
270
5,723 ,
= 11,572—19,205 — 8,916+0,045+0,535+—— \-
0,475.10s
+ 1,5651пГ-0,15Ы0-3Г—¦
7-2
Окончательно получим уравнение вида lg Kp — f (Т):
5,723-103 0 47.10s
In КРшТ = —15,969 + —— +1,5651пГ-0,151.10-зГ ^
ИЛИ
0 206-10s 2 485-103
In KPtT = ———— 1 '¦ -6,935+l,565Igr—0,066-Ю Г.
Это уравнение справедливо в интервале температур от 298 до 2500 К-
Для определения lg KP при любой температуре в интервале от 298
до 2500 К подставляем температуру в уравнение
-0,066-Ю-3-700=—0,042+3,550-6,935 + 4,453-0,046 = 0,980;
Кр, 700 = 9.55.
17. Зависимость константы равновесия от температуры для реак-
реакции Н2 + С12 = 2 НС1 выражается уравнением
lg ка= 94^!'7 -1,312Ig Г+0,128- Ю-3 Т + °'Г^10 +4,9.
Уравнение приведено в справочнике [М.]. Определите тепловой эффект
реакции при 1000 К.
Решение. Преобразуем десятичный логарифм в 'натуральный:
21,671.103 , 0,253.10s
\К —1,3121л Г+0,295-10-»ГН — +11,28.
\пКа 1,3121л Г+0,29510ГН
По уравнению (XVII.26)
Яо , RT* (_
AT
1.312 ,_ ,n_. 0,506.10»
4,207.10s
= —180.179.103—
Дя;000 = —180,179-103—10,908-103 + 2,453-103—0,421.103= — 189,055-103 Дж.
18. Определите при 800 К константу равновесия реакции
H'Q.JtiiQ'^ 1,3-C4Hg + 2H2
271
(QO H°\
—=—-у и АН о, приведенны-
приведенными в справочнике [М.].
Решение. Рассчитаем Gsoo по уравнению (XVII.25) и по стан-
. v D /Ggoo-H|}\ „
дартному сродству вычислим др. Величины I =——I и Нй найдем
в справочнике [М.]:
Вещество 1,3-С4Н6
f%, кДж-моль
Для реакции находим
125,95
н2
130,482
0
н-С410,о
-333,17
-97,981
Т
'(атм) =
:—225,864 Дж/К, ДЯ8 = 223,931 кДж,
1
1
19,1445
— 225,864+
2,3026#
223,931-103
800
Т ! Т
= —2,8233; /(р = 0,0015.
19. Определите равновесный выход СН3ОН при 523 К и давлении
1,0133-107 Па для реакции СО + 2Н2 = СН3ОН (г), если исходная
смесь стехиометрическая; /C052s = 2,235-10~3 (давление выраже-
выражено в атмосферах).
Решение. По уравнению (XVII.38) рассчитаем Ка'
к — ^сн,он _ *сн,он Усн.он
f~ fcofh, ~ хсо4г YcoYft,
Значения уг находим по методу соответственных состояний. Зави-
Зависимость v = / (я> т) приведена в виде графиков в справочнике [М.]:
Вещество
СН.ОН
со
н
79,54
34,96
12,96
я
1,27
2,90
7,82
ГКР> К
513,2
132,9
33,3
т
1,02
3,94
15,71
V
0,55
1,05
1,06
0,55
1,05.1,Об2
¦=0,466,
, = 2,235-Ю-3 = СН|ОН 0,466-100-',
272
откуда
*ch, он
= 47,96.
*со хн,
Согласно уравнению реакции количество молей в начальный момент
и в состоянии равновесия составляет:
со -f 2Нг ^±сн3он
1 2 0 —исходное количество молей
1 — х 2—2х х —равновесное количество молей
х C-2*)° *C-2«)« _47 д6
C—2х) A-хK 4 4A—л:K
Для определения х необходимо решить уравнение третьей степени.
Найдем х методом подбора. Величина х не может быть больше
единицы и отрицательной: 1 > х >0. Из соотношения находим
у /о 9*Л2
— __ г-з—' = 191,84. Если вместо х подставить корень уравнения, то
(I X)
левая часть будет равна 191,84. Если же вместо х подставить произ-
произвольное значение, то левая часть будет отличаться от 191,84. Обозна-
чая выражение — — через А и задаваясь произвольным зна-
значением х, получим различные значения А. Так, например, если х =
= 0,900, то А = 1296; если х = 0,950, то А = 9196. Отсюда следует,
что увеличение значения х ведет к росту А. Если х = 0,800, то А =
= 196,0, а если х = 0,790, то А — 172,0. Линейной интерполяцией
между последними близкими значениями А найдем корень уравне-
уравнения:
A96,0-172,0)-0,01
A96,0-191,84)-»
Для х = 0,7983
0,7983.1,40342
= 192,6,
0,20173
что отвечает выходу метанола из 1 моль СО и 2 моль Н2:
0,7983/C —2-0,7983) =0,57
20. Определите состав равновесной смеси при условии протекания
сложной реакции в газовой фазе при 600 К:
2О=СН3ОН4-НС1 (I)
НзОСН3 + Н2О (П)
Константы равновесия реакций Крщ = 0,00154, Кр(щ = 10,6.
273
Решение. Метанол, образующийся в результате реакции (I),
вступает в реакцию (II) с образованием диметилового эфира и воды.
Обе реакции протекают без изменения количества молей, отсюда
К
р, A)
Кс
*СН,ОН *НС1
*СН,С1 *Н,О
*сн,осн, *н,о
*сн,он
= 0,00154,
= 10,6.
Обозначим через х количество молей НС1, если исходная смесь состо-
состоит из 1 моль СН3С1 и 1 моль Н2О. Обозначим у количество молей
СН3ОСН3. Тогда в равновесном состоянии в системе будет содержаться
СН3С1 A — х); Н2О A — х + у); СН3ОН (х — 2у); НС1 х; CHsOCHgi/.
Так как количество молей газообразных продуктов реакции не изменя-
изменяется, то количество молей равно молярной доле:
К
р. (О = '
х (х-2у)
= 0,00154; /СР>A1) =
уA-х
(х-2у)*
= 10,6.
Для нахождения х и у необходимо совместно решить эти два уравнения.
х 2»
Для облегчения решения выразим из второго уравнения — =
— - и подставим в первое уравнение:
10,6 (х—2у)
0,00154=-
\—х 10,6 (л:
Решение уравнений
х{х-2у)
2у)
1—X
= 0,00154,
= 0,016324.
A-х)(х-2у)
t0,0016324
(а)
(б)
проведем методом подбора. Найдем сначала пределы допустимых зна
чений х и у: 0 < х<. \\2у <. х; у <. 0,Ьх; у <. 0,5. Задаваясь значе-
значениями х, получим значения у по уравнениям (а) и (б):
X
0,1
0,05
0,04
0,04346
0,01094
0,00222
у(б)
0,02060
0,00957
0,008786
Вывод
у (а) значительно отличается от у (б)
у (а) близкое к у (б)
у (а) значительно отличается от у (б)
Точное решение можно получить, построив графики у (а) = / (х) и
у (б) = / (х). Координаты точки пересечения линий будут решениями
уравнений х = 0,048, у = 0,009. Состав равновесной смеси тогда бу-
274
дет (моль): СН3С1—0,952; Н2О—0,961; СН„ОН— 0,030; СН„ОСН3 —
— 0,009; НС1 — 0,048.
21. Определите константу равновесия Кр реакции диссоциации мо-
молекулярного водорода при Т — 5000 К, используя молекулярные по-
постоянные молекулы Н2: сов = 4396, 55 см, /е = 0,459-10~47 кг-м2.
Энергия диссоциации при Т = 0 равна D = 431,9 кДж/моль. Основ-
Основное электронное состояние молекулы Н2 и атомов Н невырожденное,
число симметрии для Н2 равно а = 2.
Решение. Запишем уравнение реакции Н2 = 2Н. Для этой ре-
реакции Д#8 = 431,9 кДж/моль.
Атомарный водород не совершает колебательного и вращательного
движений. Если не принимать в расчет возбужденные электронные
состояния, то для атомарного водорода
Bл MHkTf/> ^
Чн =
для молекулярного водорода
BnMHikTK'* 8пЧщ,
а Аа 1 —exf
Следовательно, отношение Qfa к Qh2 составляет
Qh, A3 N3'2
откуда
= BЯ^Г) / Щ 3/2
-дяо/яг
e о/ =
з/2 Г / АсШех1 _
1,438-4396.55 \ 431,9-10'
500 } е 8.314500
~ 2BяI/2-6,62610-24F,02.Ю2«K/2-0,459-10-«'
/ 1 \3/2
X/— j = 12,5737-10в [Па],
ИЛИ
12,5737-106
^ 1241
1,01325-106 '
275
22. Определите константу равновесия реакции изотопного обмена
при Т = 300 К, если известна частота колебания coHd = 3770 см-1.
Расстояние между атомами и энергию связи для молекул Н2, D2 и
HD считать одинаковыми и > 1, аНг = 2, aDf = 2, аНо = 1-
RT
Решение. В рассматриаемом случае
Svi = 2—1 — 1=0,
тогда в соответствии с соотношением
Энергия связи представляет энергию молекул в равновесной конфигу-
конфигурации. Минимальная энергия молекулы будет больше энергии связи на
величину энергии нулевого колебательного уровня, т. е.
N he
д Но =._ Bu)HD-u)Hi-d)Dt).
Соотношение между частицами найдем из условия, что при заданной
силовой постоянной частоты относятся как щ/ы2 = VVi/na, где ^1 —
приведенная масса. Следовательно,
1.2-2
WHD V VH, V A+2) 1
WHD V ^D, V A+2J V 3
и тогда
ЛЯ» = yVftCcoHD/ _2
R 2R \ 3 Г 3
6,02-1023.6,626-10-34-3-102-3770-102
2-8,314
V3/2
/Hf/Df
y
«THtaDt (i-
276
Поскольку см' > 1, можно считать 1 — е hccoi/kT ~ 1, и послед-
последит
ний множитель приравнять единице. Так как межъядерные расстоя-
расстояния приняты одинаковыми, отношение моментов инерции можно заме-
заменить отношением приведенных масс и тогда
Qhr, I 32 W2 22-2.2 2.2
HD ' * =4,243.
2-4 J (l-f2J.1.2 1
При Т = 300 К, Кр = 4,342 е-78,15/300 = 3,270.
ЗАДАЧИ
1. При смешении 1 моль уксусной кислоты и 1 моль этилового
спирта реакция протекает по уравнению
СН3СООН+С2Н6ОН = CH3COOC2HS + Н2О
При достижении равновесия в реакционной смеси находится V3 моль
кислоты, V3 моль спирта, 2/3 моль эфира и а/3 моль воды. Вычисли-
Вычислите количество молей эфира, которое будете реакционной смеси при до-
достижении равновесия, при следующих условиях: 1) 1 моль кислоты и
2 моль спирта; 2) 1 моль кислоты, 1 моль спирта и 1 моль воды; 3)
1 моль эфира и 3 моль воды; 4) 1 моль кислоты, 1 моль спирта, 1 моль
эфира и 1 моль воды.
2. Константа равновесия реакции СО + Н2О = СО2 -f H2 при
800 К равна 4,12. Смесь, содержащая 20 % СО и 80 % Н2О, нагрета до
800 К. Определите состав смеси при достижении равновесия и выход
водорода, если взят 1 кг водяного пира.
3. Константа равновесия реакции Н2 + I2 = 2HI при 717 К рав-
равна 46,7. Определите количество разложившегося HI при нагревании
1 моль HI до 717 К.
4. Определите константы равновесия Кр и Кс реакции диссоциа-
диссоциации 12 при нагревании 1,513-10~3 моль иода до 1073 К, если его пары
займут объем, равный 249,3- 10~"вм3 при давлении 5,81 - Ю4 Па.
5. Вычислите давление и степень диссоциации N2O4, если при 323
К 1 моль N2O4 находится в сосуде вместимостью 0,075 м3. Определите
исходное давление N2O4 (N2O4 разлагается по уравнению реакции
N2O4 = 2NO2), если 1 моль N2O4 при 323 К находится в сосуде вмести-
вместимостью 0,125 м3. При достижении равновесия в сосуде установилось
давление 3,485-10* Па.
6. Вычислите константы равновесия Кр и Кс реакции V2 N2O4 =
= NO2, если а = 0,533, а давление 5,49-104 Па при Т = 323 К-
7. При 500 К константа равновесия реакции РС15 = С12 + РС13
Кр = 3,374-104 Па. Определите степень диссоциации РС15 при этой
температуре, если при достижении равновесия устанавливается давле-
давление 8,0106-104 Па. При каком общем давлении в системе степень дис-
диссоциации РС15 будет равна 70 %?
8. При 900 К константа равновесия реакции Н2 + С12 = 2НС1
Кс = Ю"-51. Степень диссоциации водяного пара при этой темпера-
температуре и давлении 10,133-104 Па равна 10~7>б75. Рассчитайте для этой
277
температуры константы равновесия Кр и Ке реакции 4НС1 + О2 —
- 2Н2О + 2С12.
9. При 767 К и 9,899-104 Па диоксид азота диссоциирует на 56,5%
но уравнению 2NO2 = 2NO+O2. Определите Кр и Кс и давление, при
котором NO2 при этой температуре диссоциирует на 80 %.
10. При 375 К константа равновесия реакции SO2 + С12 = SO2C12
/Сс ~ 9,27. Определите концентрацию SO2C12 при равновесии, если ис-
исходные концентрации SO2 и С12 имеют следующие значения: 1) Cso, =
— ecu = 1 кмоль/м3; 2) cSof = cti, = 2 кмоль/м3; 3) Cso, =
= 1 кмоль/м3; Cci2 = 2 кмоль/м3.
П. При 525 К для реакции РС1Р = РС13 + С12 Кр = 1,780. Под
каким давлением нужно взять эквимолекулярную смесь С12 и РС13,
чтобы в состоянии равновесия давление РС1 было бы 5,00-104 Па,
V = const?
12. Если в сосуд вместимостью 1 м3 ввести 0,03 моль водорода и 0,01
моль азота, то при 1000 К в нем установится давление 18,127-104 Па.
Определите Кр и Кс реакции ЗН2 + N2 = 2NH3, которая будет про-
протекать в реакционном сосуде.
13. Смесь 1 моль этилового спирта и 0,091 моль ацетальдегида в
равновесном состоянии при 298 К занимает объем 63-10~3м3. При
том вступает з реакцию 90,72 % ацетальдегида:
2С2Н6ОН +СН3СНО = СН3СН (ОС2Н6J 4- Н2О
Рассчитайте константу равновесия Ке этои реакции.
14. Определите константу равновесия реакции 12 = 21 и степень
диссоциации при 973 К, если поместить т кг иода в объем 10~3 м3, в
котором устанавливается равновесное давление:
т-
Р-
103,
10-5
кг . . .
, Па . .
0,1835
0,0632
0,914
0,3021
1,515
0,4963
1,900
0,6209
15. Баллон вместимостью 3,4-10м3, в котором находится
5-10~3 кг фосгена, нагрет до 673 К. Давление в баллоне при этом уста-
установилось 10,133-104 Па. Рассчитайте степень диссоциации фосгена по
уравнению реакции СОС12 = CO+CL и константу равновесия Кр и
Кс при этих условиях.
16. Вычислите степень диссоциации фосгена при 673 К, если
2,5-10~3 кг его поместить в баллон вместимостью 3,4-103 м3 и добавить
1-10~3 кг хлора. Какое давление при этом будет в баллоне? Констан-
Константа равновесия Кр = 4,99-10~2 (атм).
17. Рассчитайте давление газа после диссоциации фосгена при
673 К, если 2,5-10~3 кг его поместить в баллон вместимостью 3,4X
X 10~3 м3 и добавить 1 • 10 азота. Константа равновесия Кр = 4,99 X
X Ю-2 (атм).
18. Определите степень диссоциации диоксида углерода по уравне-
уравнению реакции 2СО2 = 2СО+О2 при 2273 К и 10,133-10* Па, если
константа равновесия при таких условиях Кр = 24,93 Па.
278
19. Железо и водяной пар реагируют по уравнению
При 1000 К и 1,0133-105 Па парциальное давление водорода Рнг =
= 6,526-104 Па. Вычислите константу равновесия.
20. Определите стандартное сродство реакции С2Н4 + Н2 = С2Н„,
если при 873 К Кр = 2,86-10~4 (Па).
21. При 633 К и 10,133-104 Па степень диссоциации HI равна 20 %.
Рассчитайте стандартное сродство газообразного иода к водороду.
22. Будет ли происходить разложение РС15 в газовой смеси, содер-
содержащей РС13, РС15 и С12 при 298 К, при следующих парциальных дав-
давлениях (Па): Ppci, —1,0133-104; PPCi5— 0,5066-104; PPci2 — 2,0266-104.
Константы равновесия вычислите из AG°,298 fM.).
23. Рассчитайте сродство железа к кислороду воздуха Рог =
= 2,0266-104 Па при 1000 К, если константа равновесия реакции
2Fe + О2 = 2FeO при этой температуре равна 2,450-1020 Па.
24. Газы СО, С12 и СОС12 находятся в резервуарах вместимостью
10 м3 каждый под давлением 2-104, 3-104 и 0,5-104 Па соответственно.
По 10~5 моль СО и С12 переведено в сосуд такой же вместимости с рав-
равновесной смесью и из сосуда с равновесной смесью выведено 10 моль
СОС12. Все процессы проведены идеально обратимо при 700 К. Констан-
Константа равновесия реакции при этой температуре равна 10,826. Определите
изменение энергии Гиббса при протекании реакции СО + С12 = СОС12.
25. Определите изменение энергии Гиббса в процессе СО+С12 =
= СОС12, описанном в задаче 24, если из сосуда с равновесной смесью
фосген не выводится. Общее давление равновесной смеси 105 Па.
26. Константа равновесия реакций 2Н = Н2 может быть выраже-
выражена уравнением
22 570
\gKP (Па)= — 1,5041§Г—0,767.
Определите тепловой эффект реакции при 800 К и выведите уравнение
д// /(Г)
27. Константа равновесия реакции 2Н2 + О2 = 2Н2О может быть
выражена уравнением
24 900
\gKc= — 1,3351g Г+9,65.10-6 Г—1,37-10-'Г2+ 1,08,
а для реакции образования хлороводорода Н2 + С12 = 2НС1
9586
lg*c=-p— 0,441gr+2,16.
Рассчитайте /Сс для реакции 4НС1+О2 = 2Н2О + 2С12 при 700 и
800 К, а также At/ при 800 К-
28. При 369 К давление диссоциации Pnh, соединения LiCbNH3
равно 4,893-104, а при 382,2 К — 8,613-104 Па. Вычислите тепловой
эффект реакции LiCl-NH3 = LiCl+NH3 при постоянном давлении в
диапазоне температур 369-7-382,2 К.
279
29. Давление пара над системой CuSO4-5H2O — CuSO4-3H2O
при 303,2 К равно 1,453- 10а, а при 299,3 К — 1,076-103 Па. Вычисли-
Вычислите тепловой эффект реакции
CuSO4-3H2O + 2H2O = CuSO4-5H2O
30. Тепловой эффект реакции 2С + Н2 = С2Н4 в зависимости от
температуры меняется примерно линейно и при 700 К равен 225,20-103
Дж/моль. Температурный коэффициент теплового эффекта этой реак-
реакции равен — 6.573 Дж/(моль-К). Определите константу равновесия
реакции при 1500 К, если Kpjoo = 1,353-10-'.
31. Степень диссоциации РС15 при 473 К и 1,0133-103 Па равна
0,485, а при 523 К и том же давлении—0,800. Рассчитайте средний теп-
тепловой эффект реакции РС13 + CL = РС15 при Р = const в интервале
температур 473-7-523 К.
32. Давление диссоциации MgCO3 при 813 К равно 9,959-104, а
при 843 К—17,865-104 Па. Вычислите тепловой эффект реакции
MgCO3 = MgO + CO2. Рассчитайте, при какой температуре давление
диссоциации MgCO3 станет равным 1,0133-10* Па.
33. Константа равновесия реакции H2+I2 = 2HI при 633 К рав-
равна 61,6, а при 718 Кона равна 41,7. Сравните среднее значение тепло-
теплового эффекта реакции и сродство при 718 К. Вычислите изменение
энтропии.
34*. Составьте уравнение вида lg Кр = f (T) для реакции окисле-
окисления аммиака
4NH3 + 5O2=2NO+6H2O
если при 1000 К Кр = 44,351. Вычислите констануту равновесия ре-
реакции при 1400 К.
35. Определите температуру, при которой давление СО2 надСаСО3
будет 1 • 105 Па, если при 1035 К давление 13 332 Па. Тепловой эффект
реакции СаСО3 = СаО+СО2 при 1035 К равен 167,91 -103 Дж/моль.
Считайте, что в узком температурном интервале тепловой эффект реак-
реакции не зависит от температуры.
36*. Напишите уравнение зависимости константы равновесия реак-
реакции СаСО3 (кальцит) = СаО + СОа от температуры. Определите дав-
давление СО2, над СаСО3 при 1200 К, если при 1035 К давление СО2
13,332 Па. Для определения зависимости теплового эффекта реакции от
температуры воспользуйтесь данными справочника [М.].
37. Воспользовавшись данными справочника [М.], вычислите кон-
константу равновесия реакции Н2 + С12 = 2НС1 при стандартном давле-
давлении и 298 К. Рассчитайте изменение энергии Гиббса для этой реакции
при 298 К, если начальные давления (Па): Н2 — 2,026-10*С12 —
— 1,013-105; НС1 — 0,103-105. Учтите, что процесс проводится
идеально обратимо.
38. Для реакции 12 = 21 приводятся константы равновесия при не-
нескольких температурах:
Г, К ... 950 1050 1150 1250
/СР-103 ..1,134 7,316 33,833 127,122
280
Постройте график \gKp = / (Т'1), определите графически тепловой
эффект реакции в изученном диапазоне температур. Составьте уравне-
уравнение вида lg Кр — / (Т*1) в температурном интервале 950-7-1250 К.
39. Определите константу равновесия реакции 2СвН5СН3 =.
= Л-С4Н4 (СН3J + QHe и состав равновесной смеси в молярных
долях при 298 К и 1,0133-105 Па. Для расчета воспользуйтесь даннны-
ми справочника [М.].
40. По методу Темкина — Шварцмана для реакции в газовой фазе
2CeH5CH3=^-CeH4 (СН3J+ СвНв рассчитайте АС0, Кр и состав в мо-
молярных долях рановесной смеси при 800 К и 1,0133-105 Па.
41. Определите константу равновесия реакции А + 2В = АВ2,
если при некоторой длине волиы коэффициенты погашения веществ
А и В равны нулю. Оптические плотности равновесных смесей при
этой длине волны равны:
св, моль/л 0,1 0,2 0,3 0,4 0,6 0,8 1,2 2.0
D 0,165 0,385 0,533 0,608 0,682 0,712 0,750 0,750
Концентрации вещества А во всех опытах 0,01 моль/л. Длина кюветы
5-Ю-2 м.
42. Определите константу рановесия реакции А + ЗВ = АВ3,
если при некоторой длине волны коэффициенты погашения А и В рав-
равны нулю. Интенсивность света, прошедшего через кювету с раствори-
растворителем а; интенсивность света, прошедшего через кювету с раствором
Ь3 при этой длине волны для равновесных смесей:
св, моль/л ....'.... 0,1 0,2 0,3 0,4 0,6 0,77 1,2 2,0
а ш 21,3 21,3 21,3 21,3 21,3 21,30 21,3 21,3
Ь 14,4 5,36 3,15 2,50 2,23 2,18 2,13 2,13
Концентрация вещества А во всех опытах 0,01 моль/л, длина кюве-
кюветы 1-10-2 м.
43. Некоторое количество SO3 нагрето в закрытом сосуде до 727 К.
В результате термической диссоциации образовались SO2 и О2. Вычис-
Вычислите: 1) исходное давление SO3; 2) общее давление равновесной смеси,
если Кр реакции SO3 = SO2 + V2O2 равна 0,539. Равновесное давле-
давление SO2 4,05-10* Па.
44. Вычислите константу диссоциации ВаО по уравнению реакции
ВаО (г) = Ва (г) + Ч2 О2 при 4000 К, если константы равновесия ре-
реакций:
ВаО (г)=Ва (г)+О, /^ = 0,0156;
О2 = 2О, /С2 = 2,1842.
45. Вычислите константу равновесия реакции S + О2 = SO2 при
4000 К, если известны Кр для реакций
SO2 = S + 2O, /^ = 0,63;
О2 = 2О, /С2 = 2,184.
281
46. Для реакции С5Н5С2Н5 (г) + ЗН2 = СвНпС2Н5 (г) в интерва-
интервале температур 485-г565 К получено уравнение
lf>KP(Tla) =-^--33,058.
Рассчитайте температуру, при которой эта реакция станет осуществи-
осуществимой, если первоначальная газовая смесь состоит из 10 моль этилбензо-
ла, 50 моль водорода и 40 моль этилциклогексана. Общее давление
первоначальной смеси газов 1,0133-105 Па.
47*. Вычислите константу равновесия реакции V2 H2 + V2 C12=
= НС1 при 900 К и 1,0133-105 Па, используя значения моментов инер-
инерции вращения молекул и частот колебаний:
Вещество . . .
/•Ю4', кг-м2 .
ше-10-5, м-1 ,
HCI
. 2,612
2,9894
С12
116,3
0,5649
н2
0,459
4,3966
Тепловой эффект реакции в идеальном газообразном состоянии при
абсолютном нуле равен — 92,140-103 Дж/моль.
48*. Вычислите константу равновесия Кр реакции термической
диссоциации иода 12 = 21 при 1274 К и 1,0133-105 Па, если Д#8 ре-
реакции равен 148,766-103 Дж/моль, частота колебания молекулы 12
сое = 214,25-102 м-1, момент инерции 750, Ы0~47 кг-м2. Статисти-
Статистический вес нулевого электронного уровня атома иода 4, а нулевого
электронного уровня молекулы 12 единица.
49*. Рассчитайте константу равновесия Кр реакции NO = X/2N2+
+V2 О2 при 1000 К и 1,0133-105 Па, если моменты инерции молекул,
частоты колебаний и статистические веса нулевых электронных уров-
уровней имеют следующие значения:
Вещество
/•10«, кг-
ше-10-5, м
0п п тт •
. ч
м2 .
— 1
NO
16,43
. 1,9165
. 4
2
1
N*
14,01
,3564
о*
19,34
1,5798
3
Тепловой эффект реакции, протекающей в идеальном газообразном
состоянии при абсолютном нуле, —90,761 • 103 Дж/моль.
50*. Рассчитайте константу равновесия Кр реакции Н2 + 1/2S2=
= H2S, протекающей при 1000 К и 1,0133-105 Па, если моменты инер-
инерции молекул, частоты колебаний и статистические веса нулевых элект-
электронных уровней имеют значения:
Вещество .... Н2 H2S2 Sj H2 S2
/•10*', кг-м2 . * 2,6674 3,1513 0,7187 0,459 94,88
Ше-10-5, м-1 . . 2,7219 2,7394 1,2145 4,3966 0,7257
^о.эл 1 1 1 1 3
Молекула H2S нелинейная, симметрия C2yV, о = 2. Для H2S Д#о =
= —82,061 кДж/моль.
282
51*. Определите константу равновесия реакции СО + Н2О =
= Н2 + СО2 при 1000 К и 1,0133-105 Па, если.известны моменты инер-
инерции молекул, частоты колебаний и теплоты образования при абсолют-
абсолютном нуле в идеальном газообразном состоянии:
Вещество
со2
н2
Н2О
со2
МО", кгм2
67,8336
0,459
1,0296
1,9674
2,9970
14,49
й)е!0-6, м-|
1,3512
2,3964
0,6722
4,3966
3,8354
3,9387
1,6476
2,1700
Д#о. кДж-моль
—393,229
0
—238,906
-113.880
У молекулы СО2 колебание с частотой 0,6722-105 м~х дважды вырож-
вырождено.
52. Определите Кр реакции Н2 + I2 = 2HI при 1000 К, если ста-
статистические суммы состояний Qh, = 3,5539-107; Qi2 = 3,2346-1014;
Qhi = 3,6320-10" и АЩ = — 8,292 кДж.
53*. В реакторе, работающем при постоянном давлении, находят-
находятся 1 моль СН2С12 и 1 моль Н2. При 600 К протекают реакции
A); CH3Cl-fH2 =
B)
Константы равновесия реакции при 600 К равны Kpt = 1,156-108,
Кр, — 8,8716- 10е. Определите состав равновесной смеси.
54. При 3500 К и давлении 1,013-105 Па в системе протекают ре-
реакции:
A)
B)
C)
Исходная смесь состоит из 0,5 моль азота и 1 моль углекислого газа.
Используя справочные данные [M.J, рассчитайте состав смеси в состо-
состоянии равновесия.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Газообразные вещества А и В реагируют с образованием газооб-
газообразного продукта С: а) выразите Кр и Ке через равновесное количество
вещества С, равное х, если исходные вещества А и В взяты в стехиомет-
рических количествах при общем давлении равновесной системы Р и
температуре Т, К; 2) рассчитайте Кр и Кс при 300 К, если Р —
— 7,5-104 Па, х = 0,45; 3) вычислите равновесное количество веще-
вещества С при давлении в равновесной системе 3-104 Па и 300 К; 4) рас-
рассчитайте степень превращения вещества А и В при 300 К-
283
№ ва-
варианта
1
2
3
4
5
6
7
8
9
Уравнение реакции
А+В=УгС
У2А+В = С
ЗА+В = 2С
2А + ЗВ = ЗС
2А+1/2В = 2С
ЗА+ИВ=С
А+2В = С
А+В = ЗС
У2А + В = 2С
№ ва-
варианта
10
11
12
13
14
15
16
17
18
Уравнение реакции
1/2А-4-В = ЗС
2А+ИВ = ЗС
2А+ЗВ = 2С
ЗА+У2В = ЗС
ЗА+1ЛВ = 2С
!4А+1/2В = ЗС
У2А+У2В = С
А + ЗВ = ЗС
ЗА + В = С
№ ва-
варианта
19
20
2!
22
23
24
25
Уравнение реакции
А + 2В = 2С
А +2В = ЗС
А+В = 2С
2А+2В=С
2А+2В = ЗС
3A-f3B = 2C
У2А+В=У2С
2. Гетерогенная реакция протекает при постоянной температуре Т:
1) определите стандартное сродство веществ А и В при 298 К; 2) вы-
вычислите константы равновесия реакции %Р и /Сс; 3) определите мас-
массу прореагировавшего твердого вещества А, если объем системы V м3,
а исходное давление газа В равно Ръ объемом твердой фазы можно пре-
пренебречь; а) определите изменение энергии Гиббса, отнесенное к нача-
началу реакции, если исходные давления газообразных веществ В и С со-
соответственно равны Р2 и Ра, реакция протекает при температуре Т, К
идеально обратимо.
№ ва-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
12
14
15
16
17
18
19
20
21
22
23
24
25
Реакция
С+2Н2 = СН4
С-|-2Н2 = СН4
С+2Н2 = СН4
С+2Н2 = СН4
2С+2Н2 =С2Н4
2C-j-2H2 = G2H4
2C-j-^H2=C2H4
2С+О2 = 2СО
2С+О2 = 2СО
2С+О2 = 2СО
2СиС 1 + Н2 = 2НС14- 2Си
2СиС 1 + Н2 = 2НС1 + 2Си
Sn + 2Н2О = 2Н2 + SnO2
SnO2 + 2H2 = 2Н2О + Sn
SnO2 -f-2H2 = 2Н2О+Sn
SnOa -j- 2CO = 2СО2 + Sn
SnS + H2 == H2S -f- Sn
SnS -j- H» = H S Sn
PbS+H2= H2S + Pb
PbS -L. H2 = H2S -f- Pb
til С i i_j it с i DK
Pl)j —1— tin f]nJ —t~ Г 0
PbS-fCO = COS-fPb
PbS+CO = COS+Pb
PbCl2+Ha = 2HCl + Pb
PbCl2 + H2 = 2HCl+Pb
т. к
600
700
800
500
1000
2000
1800
773
873
973
673
773
1073
1073
973
1173
783
1196
783
973
1273
1081
1370
873
1073
/vio-2.
Па
600
700
700
600
68 400
68 400
68 400
10
100
300
500
500
50
500
400
700
10
50
5
10
50
2
10
200
300
'ha
186
84
37
250
480
2050
1290
705
572
293
361
215
690
152
167
580
745
670
755
745
654
758
747
284
350
*Па
100
50
25
200
300
1000
800
800
500
300
500
400
800
200
200
100
900
700
900
800
700
800
800
400
500
V-IO>
M'
8
10
3
5
7
11
9
2
4
6
4
6
3
8
6
2
5
7
8
3
5
7
9
11
2
284
3. Вещество А массой g кг помещено в закрытый сосуд вместимо-
вместимостью V м3. При температуре Т, К, часть кристаллизационной воды вы-
выделилась в газовую фазу и в сосуде установилось давление Р, Па: 1)
определите массу воды, связанную с веществом А; 2) рассчитайте аб-
абсолютное количество твердой фазы в равновесном состоянии системы
3) вычислите Кр, /Сс. &М и AG? реакции при температуре Т, К.
№ ва-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
g. кг
0,047
0,659
0,068
0,258
0,057
0,128
0,019
0,890
0,500
0,210
0,612
0,035
0,254
0,018
0,856
o.oei
3,010
0,622
1,495
0,416
1,174
0,183
0,208
0,257
1,190
А
LiBr-2H2O
Lil-H2O
Na2HPO4-12H2O
Na2HPO4-12H2O
NaCOOCH3-3H2O
Na2CO3-10H2O
NaCOOCH2-3H2O
Na3CO3-10H2O
Na2CO3-10H2O
NaCOOCH3-3HaO
Na2HPO4-12H2O
Na2SO4-10H2O
Na2SCyi0HaO
Na2SO4-7H2O
MgCl2-6H3O
FeSO4-7H2O
CoSO4-7HaO
CoCl2-6H2O
NiCla-6H2O
CuSO4-5HaO
ZnSO4-7HaO
SrCl2-6H2O
BaCl2.2H2O
BaCl2-2H2O
BaCl2-2HaO
V, m'
6
7
5
6
3
7
6
8
9
4
7
8
9
4
10
4
10
8
9
3
8
5
4
3
5
T, К
130
403
273
288
298
273
273
298
288
313
298
273
293
297
343
298
298
313
309
298
303
298
288
298
313
p. Па
133,3
866,5
354,6
1190,4
851,8
358,6
120,0
2399,4
1161,0
2492,7
2538,0
373,2
1767,6
2439,4
1999,5
1940,8
2210,4
2826,0
2999,3
1037,1
2852,6
1135,7
377,2
733,2
2103,5
4. Зависимость константы равновесия реакции (А) от температуры
выражается уравнением
lgKP =-^- +blgT+cT+d;
коэффициенты а, Ь, с и d приведены в таблице на с. 287, давление выра-
выражено в Па: 1) определите константу равновесия реакции (А) при Т,
К; 2) постройте график lg К = f (T~l) в пределах температур от
(Т — 100) до (Т + 100) К; 3) укажите, как изменяется константа рав-
равновесия при повышении температуры; 4) определите тепловой эффект
реакции (А)АНт при Т К; 5) сопоставьте тепловой эффект, вычислен-
вычисленный в п. 4, с тепловым эффектом, вычисленным по закону Кирхгофа
при температуре Т, К; 6) определите стандартное сродство реагирую-
реагирующих веществ при температуре Т, К.
285
№ ва-
зиаита
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
Реакция (Л)
2H2+CO^tCHgOH
4НС1+ O2^i2H2O+2Cl2
P-NH4Cl^±NHg+ HC1
2N2 + 6H2O^zt4NHg+3O2
4NO+6N2O^it4NHg+5O2
2NO2^±2NO + O2
N2O4^2NO2
Mg(OHJ^±MgO+H2O
Ca(COg)^CaO+CO2
Са(ОН)г^±СаО+H2O
S2 +4H2O^=t2SO2+4H2
S2 + 4CO2^2SO2+4CO
2SO2+ O25=±2SOg
SO2+C12^SO2C12
CO+3H2^CH4+H2O
4CO+2SOa±=; S2+4CO2
COC12^±CO4-C12
ЛР —
KP-
KP =
KP—
Kp-
IS
I\p —
KP-
Kp-
Kp
Kp-
KP=
is
KP—
IS
tip—
KP-
Kp —
IS
Ap —
if
KP-
K
Рсн.он
Рн,Pco
PkoPci,
P&ciPc\,
Рын, Phci
PiiN, Pb,
Pn, Ph.o
PtiH, Pi,
Pko Ph,o
PnoPo,
"Йо,
Pho,
Pn,ot
= Ph,o
=Pco,
= Ph,o
Ph, ph,o
Ps, Pft.o
Pso, Pto
Ps, Pco,
Pso,
Pso, Pa,
Pso, ci,
Pso, Po,
Рсн, Ph,o
Pco Рн,
Ps, Pto,
Pto Plo,
Pco Pa,
''coci,
г. к
800
750
455
1300
1000
700
400
400
1000
500
1000
900
700
400
1000
900
400
286
Продолжение табл.
№ ва-
варианта
18
19
20
21
22
23
24
25
Реакция (Л)
СО2 + Н2^СО + Н2О
СО2+4Н2?±СН4 + 2Н2О
2СО2^2СО+О2
2СО+2Н2^СН4+СО2
CjHj^ iCaH4-)-H2
QH5OHzztC2H4 + H2O
снсно+н нон
CeH,+3H2^ztCeHJ2
к
Рсо Рн,о
Кр —
''со, ^н,
Рсн, Рн.о
Р Рсо, Рн,
''сн, Рсо,
Р~ РсоРн,
[QH4] [HJ
с [С2нв]
Рс,н, Рн,о
Кр~~
^с.н.он
^сн.сно Рн,
к рс,н„
Р~ Рс,н,Рн,
т, к
1200
1000
700
900
400
400
500
600
№ варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
а
3 724
5750
-9,650
-66250
—47 500
-5 749
-2 692
-4 600
-9680
-5 650
-13810
-2 300
10 373
2 250
9 874
2 300
6
—9,1298
-2,136
1,83
-1,75
-1,75
1,75
1,75
0,623
-1,385
0,67
-0,877
4,34
1,222
-1,75
-7,14
-4,34
с
0,00308
—0,000857
—0,00324
0
0
-0,0005
-0,00483
-0,00102
-0,000219
0,000414
0,00267
-0,00162
0
0,000455
0,00188
0,0000002
d
3,401
-4,710
28,239
—10,206
—13,706
7,809
1,944
17,776
17,756
9,616
8,386
2,567
-18,806
-7.206
-1,371
-2,576
287
Продолжение табл.
№ варианта
17
18
19
20
21
22
23
24
25
а
5 020
—2 203
7 674
—29 500
11088
—6 365
-1485
1522
9 590
ь
1,75
0
—6,23
1,75
3,113
2,961
7,54
5,42
—9,9194
с
0
—0,0000516
0,000906
-0,001215
-0,0028524
—0,000766
—0,00425
-0,00229
0,002285
d
—3,748
2,3
—1,291
—3,29
—1,483
—2,344
, 7,006
—2,810
-6,452
5. Для данной реакции, используя справочные данные [М.], опре-
определите: 1) стандартное сродство при температуре Т, К; 2) равновес-
равновесный выход вещества D при общем давлении 1,0133-105 Па и Т, К, если
газообразные вещества Аи В введены в реакционный сосуд в стехио-
метрических количествах; 3) изменение энергии Гиббса для начально-
начального момента реакции, если исходные парциальные давления газов в ре-
реакционной смеси равны РА, Ръ, Рс, Ръ и реакция протекает идеально
обратимо при температуре Т, К.
it
в *
to.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
Реакция
Н2+У2О2^Н2О
И» -f- !4O2zztH2O
Н2+С12^±2НС1
CyTjf^l i /~\ >Г^1 1 T—I (~Л
ЛП\ы*1 ~г" *^2<——¦ 2 "Т~ ^2
ftijpi | /~\ J*f4 | тт /~*
y2N2 -f- 3/2H25^±NH3
>/2N _j_ 3/2H2^ztNH3
^4No-f~ /4O2^z^NO
N 4- O<H *2NO
NO2jrlNO-f- У2О2
NOoZltNO -f- У2О2
N2O4j^2NO2
SO2 4- y2O2^iiSO3
SO2 -f- NO2^±SO3 -)- NO
PC13 4-Cl2^ztPCl5
CO + H»O^iCO2 -f- H2
CO -)- cf2^ztCOCl2
CO +2H2^±CH3OH
CO 4- y2O2jziCO2
CH4 + НгО^СО^-3H2
n/-1 it y^ тт |_ OIJ
C2H4 -)— H 2j__i\>2 ri e
с2н4 4- h2o^z±c2h5oh
CeHe + 3H2?iCeH12
A
н2
H2
H2
HC1
HC1
N2
N2
n62
NO2
N2O4
N2O4
so2
so2
PC13
CO
CO
CO
CO
CH4
с2н4
с2н4
C2H4
CeH,
В
o2
o2
Cl2
o2
o2
H2
o2
o2
—
—
o2
NO2
Cl2
H2O
Cl2
Hi
o2
H2O
—
H2
H2O
H2
с
_
—
—
CL
Cl2
—
—
—
NO
NO
—
—
—
so3
co2
—
—
—
CO
CeHe
—
—
D
H2O
H2O
HC1
H2O
H2O
NH3
NH3
NO
NO
O»
o2
NO2
NO2
SO3
NO
PC15
H2
COC12
CH3OH
co2
H2
H.
C2He
C2H5OH
CeH12
f
A
7
2
4
4
1
10
20
2
4
6
3
5
2
3
6
3
5
2
4
4
2
2
7
3
6
•Ю-4, Па
В
6
1
3
3
4
15
20
1
1
2
1
3
6
2
3
3
6
3
—
8
2
4
С
1,5
2
2
3
2
_
1,5
0,7
0,8
0,7
—
—
D
3
2
1,5
1,5
1
10
10
0,3
1
3
3
2
2
1,5
1,2
2
1,6
0,5
1,6
3
0,7
3
3
1,2
2
т, к
1000
700
900
1000
700
600
800
2000
1000
460
400
340
320
900
700
500
1000
900
570
1000
500
700
780
480
600
288
—J и АЯ§ [МЛ опре-
определите константу равновесия Кр реакции при температуре Т, К.
JVs ва-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
Реакция
Н24-С12=2НС1
H24-Br2 = 2HBr
H24-l2 = 2HI
Н24~ тЮ2 = Н2О
СО 4- Уг О2 = СО,
СО4-С12=СОС.2
С(гр) 4- S2 = CS2
N 2-X-O2 = 2NO
NO2?=±NO4- УгО.2
SO24-1/2O2=SO3
т, к
600
800
800
1000
1500
1000
800
1000
500
800
1200
800
1000
№ ва-
варианта
14
15
16
17
18
19
20
21
22
23
24
25
Реакция
H,+ y,S,= H,S
pci3+ci2=pci5
Vt \ 1 014 C\A
CgHg ~\~ Hg ^ C2H4
C3He -f- H2 — C3Hg
L4n8 = L4ne-j- M2
pit lit Л тт
CgHg + ЗН2 = CeH12
С-О ~р 2ri2 ^= CHgOH
НСНО+Н2 = СН3ОН
СН3с! 4- 2С12 = СНС13 4-2НС1
г, к
500
1000
1500
500
800
1500
1000
500
800
500
1000
800
7. Применяя принцип Ле Шателье и уравнения (XVI 1.3) и
(XVII.30), определите, как будет меняться равновесный выход конеч-
конечных продуктов реакции при: а) повышении температуры; б) пониже-
понижении температуры; в) повышении давления; г) понижении давления; д)
добавлении инертного газа.
№ ва-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
Реакция
С + О2=СО2
С4-2Н2=СН4
4Н2 4-2SO2 = 4Н2О(ж) 4- S2(t)
2С -[- 2Н» = С0Н4
СОС12=СО4-С12
2Н1=Н24-12
СО24-С12 = СОС12
N2O4 = 2NO2
№ ва-
варианта
14
15
16
17
18
19
20
21
22
23
24
25
Реакция
С2Н44-Н2О=С2Н5ОН(ж)
2Н2+СО2=4СН3бн(ж)
С2Н8ОН(ж) = С2Н4 4-Н2О(г)
4НС14- О2 = 2Н2О(г) 4- 2С12
2СО4-2Н2=СН44-СО2
2Н26('г) +2С1»2=в4НС14-О2
NH4C1(t) = NH34-HC1
СН3СНО(г) 4- Н2 = С2Н5ОН
8. Вычислите константу равновесия Кр реакции при заданной тем-
температуре Т. Для расчета воспользоваться методом Темкина — Шварц-
Шварцмана [M.J.
Зак. 767
289
1
2
3
4
5
6
7
8
9
10
И
12
13
Реакция
2C,H5OH=CHgCOCHs+3H2+CO
CH4+2PCl5=2PClg+CH2Clj+2HCl
CH4 + CO2 = CHgCOOH
2H2 +CO2 = HCHO+ H2O
CO2+H2=HCOOH
СО+Н2О = НСООН
СОа+ЗН. = CHgOH + Н2О
С2Нв+СО = СН.СОСН3
QsH. + Н2О = СН3СН2ОН
СН4+4РС15 = СС14+4РС13+4НС1
SOa+Cl2 = SO,Cl2
СО+С12 = СОС1а
SiO2+4HF = SiF4+2H2O
400
500
400
500
400
400
500
400
400
400
500
600
900
Реакция
С2Н в = С2Н4 + Н2
CjHe = CgHe -f- Н2
СОа+4На = СН
СН4+СО2 =
QH+3H
Qe+2ei2
2SO2+Oa = 2SO3
СО + 2Н2 = СН3ОН
Са(ОНJ = СаО + Н2О
СаСО3 = СаО+СО2
NH4C1 = NH3 + HC1
Mg(OHJ = MgO + H
S + 2CO2 = SOa+2C
у.
к
800
700
500
700
400
500
600
800
900
500
500
700
9.. Определите равновесные парциальные давления всех компонен-
компонентов реакции и исходное давление вещества А, если известна константа
равновесия термической диссоциации вещества А при температуре
Т, К и общее равновесное Давление смеси Р. Реакция протекает в за-
закрытом сосуде при температуре Т, К.
№ вари-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
Вещество
н2о
н2о
нао
SOg
SOg
SOg
FNO
FNO
FNO
SOF2
SOFa
SOF2
SOF2
SOF2
SOF2
QH2
C2H2
C.H,
SiF4
; SiF4
SiF4
BjOg
B2O3
B2Og
B2O3
Реакция
H2O = 2H+O
HaO = 2H + O
HaO = 2H+O
SOg = S + 3O
SOg = S+3O
SO3 = S+3O
FNO = F + N + О
FNO = F + N + O
FNO = F -f- N -j- О
SOF2 = S + O+2F
SOF2 = S+O+2F
SOF2 = S+O+2F
SOF2 = S + O+2F
SOF2 = S+O-f2F
SOF2 = S+O+2F
C2H2 = 2Cfr) + 2H
v-^Hg ^= *^*v) ~т~ 2Н
Г* 14 Ol^"lt«\ 1 OI4
SiF4=Si(r)+4F
SlF4 = Si(r) + 4F
SiF4 = Si(r) + 4F
D /~\ О И | Qf^
O«Uq — ^D ~t~ O\J
B2Og = 2B+3O
B2O3 = 2B + 3O
B2Og=2B + 3O
KP
2,096-10'°
0,991-10'°
4,271-1010
0,257-10'5
1,200-1015
5.119-1015
0,720-1010
1,715-1010
8,266-1010
1,031 1015
13,632.1015
3,82-1015
0,478-1015
4,235-1015
11,726-1015
0,477-1015
3.808-1015
25,596-1015
2,699-10м
11,281-10™
44,281-10»
0,542-10м
2.066-1O80
7,486-1020
25,830-1020
p-io-; Па
1,0133
2,0266
3,0399
4,0532
5,0665
6.0800
7,0931
8,1064
9,1197
10,133
1,0133
2,0266
3,0399
4.0532
5,0665
6.0798
7,0931
8,1064
9,1197
10,133
1,0133
2,0266
3,0399
4,0532
5,0665
T, К
4000
3900
4100
3300
3400
3500
3500
3600
3800
3500
3700
3600
4200
4400
4500
4300
4500
4700
4400
4500
4600
4900
5000
5100
5200
290
ГЛАВА XVIII
ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ. РАВНОВЕСИЕ
В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Основные уравнения и символы
[К-, с. 508—557; Г., т. 2, 389—517]
Электрическая проводимость — величина, обратная электрическо-
электрическому сопротивлению IIR. Электрическая проводимость выражается че-
через удельное сопротивление р:
— = 4--Г- (XV1H.1)
р Rx S
где
— = х. (XV111.2)
р
где / — длина проводника; 5 — сечение проводника; % — удельная
электрическая проводимость.
Эквивалентная электрическая проводимость к выражается через
удельную проводимость:
где V — разведение (или разбавление) раствора; с — концентрация,
г-экв/л. Разведение — объем, в котором содержится 1 г-экв раство-
растворенного электролита.
Уравнение Кольрауша (закон независимости движения ионов)
Я0=Я++Я_. (XV111.4)
где к0 — эквивалентная электрическая проводимость при бесконеч-
бесконечном разведении; к+, А,_ — электрические проводимости (электроли-
(электролитические подвижности) катиона и аниона:
где и°, vt — абсолютные скорости движения ионов, см2/(с-В); F —
постоянная Фарадея.
Скорости движения ионов v+, o_ зависят от потенциала поля:
где г|з// — напряженнрсть поля.
Абсолютные скорости движения ионов различны. Доля количества
электричества, переносимого ионами данного знака, равна числу пере-
переноса t+ или /_:
Я~ rXVHl
U= v%+vL Я+ + Я_ Я. ' '— v%+vL
10* 291
Число переноса иона выражается через изменение концентрации
электролита в катодном Дск или анодном Аса пространствах:
t A?*-. ^_ = A?a_> (XV111.7a)
Ас Ас
где Ас — общая убыль концентрации электролита.
Уравнение Кольрауша описывает зависимость электрической про-
проводимости от концентрации:
Я = Я0—АУ~с~, (XV111.8)
где А — константа.
При диссоциации бинарного слабого 1 — 1-валентного электролита
АВ ч* А+ + В~ константа равновесия будет
Если степень диссоциации равна
с с Яо
то константа диссоциации будет
Kt = a2c/A—a). (XV1I1.11)
Для /Сс < Ю~5 или а <^ 1 можно принять К.е — а2с
Подстановка в уравнение (XVIII.11) а из уравнения (XVIII.10)
приводит к выражению
Кс= Я (Я -Я) ' (XVIII. 12)
Зависимость константы диссоциации от температуры описывается урав-
уравнением
d In Кс А Ндисс
интегрирование которого приводит к соотношению
(XV11L14)
где АЯДИСС — теплота диссоциации. Работу диссоциации IF определя-
определяют по уравнению изотермы ВантТоффа
где AG0 — изменение энергии Гиббса при диссоциации.
Для сильных электролитов вместо концентрации в термодинамиче-
термодинамические уравнения следует подставлять активности. Активности электро-
электролитов выражают через моляльности и среднеионные коэффициеиты ак-
активности (табл. 4).
292
Таблица 4. Соотношение между молялыгостью т,
средней ионной моляльиостью т±, активностью а
и средним иоииым коэффициентом активности у± для различных
электролитов
Тип валеитиости
электролита
1 — 1, 2—2,
3—3
2—1, 1-2
3-1, 1-3
3—2
Электролит
КС1, ZnSO4, LaFe(CN)e
СаС12, Na2SO4
А1С13, K3Fe(CN)e
A12(SO4K
Активность
электролита
т*у*±
4m3 7з±
108m» vj.
Средняя
активность
к
иона 0^= у~^
ту±
3
V 4 mYT
4
V27mY±
V~№my±
Зависимость средней ионной моляльности т± от моляльиости элект-
электролита выражается уравнением
m±=m(vV++vl-I/V, (XV111.16)
где v+, v_ — число катионов и число анионов; v — общее число ио-
ионов; V = V+ + V_.
Средний ионный коэффициент активности у± выражается через
ионные коэффициенты активности:
Средняя ионная активность будет
Общая активность электролита со средней ионной активностью связа-
связана соотношением
a=(a±)V = aV++al-, (XVII1.19)
где а+, а_ — активности ионов;
а+=у+т+; а-=ч-т-. (XV111.20)
Ионные моляльности связаны с моляльностью электролита соотноше-
соотношениями:
m+=mv+, m-=mv-. (XVI11.21)
Предельное уравнение Дебая и Гюккеля зависимости среднеионного
коэффициента от ионной силы / раствора имеет вид
lgY± = — 0,509г+ г_ V .
где z+, z_ — заряды катиона и аниона;
(XV111.22)
293
/ = 1/22/пгг?; (XV111.23)
— моляльность t-ro иона в растворе; Zi — заряд t-ro иона.
Для 1—1-валентного электролита уравнение (XVIII.22) будет
lgT±= —0,509
(XV111.24)
Уравнение (XVIII.22) применимо при значениях / < 0,001. Если ион-
ионная сила раствора не превосходит 0,1, то коэффициенты активности
отдельных ионов одинакового заряда приблизительно одинаковы (см.
табл. 5).
Таблица 5. Коэффициенты активности иоиов
Коэффициенты активности иоиов при ионной силе растворов /
Иовы
0,001
0,005
0,01
0,02
0,05
0,10
Одноразрядные
Двухразрядиые
Трехразрядиые
0,98
0,77
0,73
0,
о,
о,
95
65
55
0,
0,
0,
92
58
47
0
0
0
,89
,50
,37
0,85
0,40
0,28
0,80
0,30
0,21
Активности веществ, растворенных в неводных растворителях
(амальгамы, сплавы), рассчитывают по уравнениям:
at — '
атм),
(XV111.25)
(XVI И. 26)
где xt — молярная доля i-то вещества; 7г — рациональный коэффи-
коэффициент активности; Pt — давление насыщенного 1-го вещества над раст-
раствором (расплавом амальгамой); Р? — давление насыщенного пара над
чистым 1-м веществом.
Для реакции гидролиза Ме+ + Н2О — МеОН + Н+ константа
равновесия
аМеОНаН +
а
Ме+ "Н2О
или (так как ан,о = const)
Лг=
аМеОНаН +
Иначе можно записать
V(l-x)
где х — часть распавшихся молекул соли; A —х) — часть молекул
негидролизованной соли; V — объем раствора в литрах.
294
Для вычисления константы гидролиза соли, образованной сла-
слабым основанием и сильной кислотой используют соотношение
К ^w
Косв
где /Сш — ионное произведение воды; /(осн — константа диссоциации,
образующегося при гидролизе основания.
Степень гидролиза, т. е. отношение числа гидролизованных молей
соли к общему числу растворенных молей соли,
["число гидролизованных молей „ 1
= 1 00 At .
|_ общее число молей J
ЗАДАЧИ С РЕШЕНИЯМИ
1. Для 0,01 н. КС1 удельное сопротивление р = 709,22 Ом-см.
Вычислите удельную % и эквивалентную электрические проводимости.
Решение. Удельную электрическую проводимость вычисляем
по уравнению (XVIII.2):
Х= = 1,4Ы0-3 Ом-1-см-1 = 0,141 Om-i.m-i.
Эквивалентная электрическая проводимость, согласно (XVIII.3),
выражается уравнением
0,141-Ю-3
Я=_: =0,0141 Ом-Ьг-экв^-м2.
0,01
2. Вычислите эквивалентную электрическую проводимость уксус-
уксусной кислоты, при бесконечном разведении, при 298, К, если электри-
электрические проводимости НС1, ЫаСООСНз, NaCl равны 0,0426; 0,0091;
0,0126 Ом~1-г-экв~1м2 соответственно.
Решение. Составляем систему уравнений согласно (XVIII.4):
Vhci = *o.h+ + 4ci- =0,0426, A)
^¦0, CH,COONa =^0. Na++^0, СН.СОО- = 0,0091, B)
*o.n.ci=Vn.+ +*o. el- =0,0126. C)
Согласно (XVIII.4) складываем уравнения A) и B), вычитаем из них
уравнение C) и получаем
^0, НС1 + ^0. CH,COONa ~^0, NaCl =^H++^C
= Ао, сн,соон = 0,0426+0,0091 —0,0126 = 0,0391 Om-it-skb-Lm2.
3. Для бесконечно разбавленного раствора NH4C1 при 298,2 К чис-
число переноса катиона /+ = 0,491. Вычислите электролитическую под-
подвижность и абсолютную скорость аниона Cl~; kQi nh4ci —
= 0,0150 Ом-^г-экв-^м2.
Решение. Согласно уравнению (XVIII.7)
Я_ = Я0A— /+)=0,015A -0,491)=0,00763 Ом-ь.-экв-^м2.
295
Абсолютную скорость vt рассчитываем по уравнению (XVIII.5):
0,00763
Р1 9,65-10^ 7,91Ю
4. При электролизе раствора AgNO3 на катоде выделилось
0,5831 г серебра, убыль AgNO3 в катодном пространстве составила
2,85-10~3 моль. Определите числа переноса /_ и /+ для AgNO3.
Решение. Убыль серебра в катодном пространстве Лск и об-
общая убыль AgNO3 в растворе АС, соответствующая количеству сереб-
серебра, выделившегося на катоде, должны быть выражены в одних и тех
же единицах. Находим число молей серебра, выделившегося на катоде:
т 0,5831
Дс = д„=_.==__г = 5,4.10-з.моль.
Подставляем в уравнение (XVIII.7а) и получаем
2,85-10
'-= 5,4-Ю-з =°'528; <+ = '-/- = М72.
5. Для 0,1 М раствора Cr2 (SO4K вычислите среднюю ионную мо-
ляльность, активность, общую активность электролита и активности
ионов SO!" и Сг3+ при 298 К-
Решение. Среднюю ионную моляльность вычислим по уравне-
уравнению (XVIII. 16):
т± = B2.33I/5-0,1=0,255.
Среднюю ионную активность вычисляем по уравнению (XVIII. 18):
Y± = 0,0458 [M], о± = 0,255-0,0458 = 0,0177.
Общую активность электролита а вычисляем по уравнению
(XVIII. 19):
а=@,0177N = 2,17-1010.
Ионные моляльности тСг8+ и rnso2- рассчитаем по уравнениям
(XVIII.21): 4
/п =0,1-3 = 0,3; mSO2_ =0,1-2 = 0,2;
активности аниона и катиона определяем по уравнениям (XVIII.20):
а 3+ =0,3-0,0458 =0,0137; а ^2_ = 0,2-0,0458 = 0,0092.
Сг SO4
6. Определите ионную силу / раствора, содержащего 0,001 моль
H2SO4 и 0,002 моль MgSO4 на 1000 г воды при 298 К-
Решение. Согласно уравнению (XVIII.23)
Моляльности ионов определяем по уравнениям (XVIII.21). Тогда
ионная сила будет
/ = i/2 B0,001-12 + 0,001-22+0,002-22+0,002-22) =0,011.
296
7. Вычислите средние ионные коэффициенты активности у± для
0,01 и 0,0001 М растворов NaCl, сравните полученные велиины с опыт-
опытными [М.].
Решение. Вычисляем средние ионные коэффициенты активно-
активности по уравнению (XVIII.24):
lgY±=— 0,509 У 0,01 = —0,0509; y± = 0,888;
lg Y±= -0,509 Vo, 001 =—0,016; y± = 0,963.
m 0,01 0,001
Y±pac4 0,888 0,963
Y±on 0,903 0,965
Полученные данные показывают, что предельное уравнение
(XVIII.22) дает надежные результаты лишь при / < 10~3.
8. Вычислите степень диссоциации воды при 298 К, используя
удельную электрическую проводимость воды, плотность и подвиж-
подвижности ионов.
Решение. Удельную электрическую проводимость воды и экви-
эквивалентные электрические проводимости ионов Н+ и ОН~ при беско-
бесконечном разведении находим в справочнике [М.]:
Х = 6,33-10-8 Om-1-cm-I;
Я . =394,8 Ом-'моль-^см2; Я _= 198 Ом-1-моль-»-см*.
Н"*" ОН
Концентрацию воды определяем по плотности [МЛ:
rf-1000 0,997
сн2о = —^ = —^— =55,39 моль/л.
Степень диссоциации воды определяем по уравнению
X 6,33-10-8
а = -л п г- = = 2 09- 10-е.
с{ н + + он-) 55,39-Ю-3 C49,8+198,3)
9. Вычислите степень диссоциации и рН 1,6-10~4 МСН3СООН при
298 К. Константа диссоциации СН3СООН Кс = 1,75- Ю.
Решение. Степень диссоциации СН3ССОН рассчитаем по урав-
уравнению (XVIII.11):
а21,6-10-*
1,75-10-»= ' ¦ .
С-а)
Составляем квадратное уравнение
1,6«2 + 0,175а—0,175 = 0,
решив которое, получаем а = 0,28. Концентрацию иона водорода на-
находим по уравнению (XVIII. 10):
[Н+] = са=1,6-10-*-0,28=4,48-10-6,
откуда
pH=-lg4,48-10-5=4,34.
297
10. Константа диссоциации гидроксида аммония при 298 К рав-
равна 1,77-10~5. Вычислите концентрацию ионов ОН~, Н+ и рН 0,1 М
NH4OH.
Решение. Концентрацию ионов ОН~ рассчитаем по уравнению
(XVIII.9). Принимаем, что концентрация NH4OH практически равна
исходной (при Кс ^ 10~5). Тогда
-] = [КЩ]=ас=У Ксс =У 1,77-10-6-0,1 = 1,33-10"» моль/л.
Концентрацию ионов водорода определяем из ионного произведе-
произведения воды:
Kw=a , а =1,008-10-14 [М]
Принимаем, что активности ионов Н+ и ОН" равны их концент-
концентрациям:
1,008-10-"
н+ н+ 1,33-
Вычисляем рН:
=0.76-10-" жш,/л.
PH=-lgcH+=-lg7,6-lO-io=ll,12.
11. Вычислите концентрацию ионов ОН~ в 0,1 М растворе NH4OH,
содержащем 1 моль/л NH4C1. Покажите, как изменится рН раствора
NH4OH при добавлении к нему NH4C1. Соль NH4C1 полностью диссо-
диссоциирует.
Решение. Вычисляем концентрацию ионов ОН" по уравне-
уравнению (XVIII.9). Принимаем, что концентрация NH4OH практически
равна исходной [NH4OH1 = 0,1 моль/л и концентрация иона NH|
равна концентрации NH4C1, так как aNH4ci = 1- Отсюда [NH4] =
= 1 моль/л. Константу диссоциации NH4OH найдем из [M.J. Подстав-
Подставляем числовые значения в уравнение (XVIII.9):
1,77-10-5= [°Н ] ' ; [ОН-]=1,7710-«.
В результате добавления NH4C1 концентрация ионов ОН" умень-
уменьшилась и, следовательно, значение рН раствора также уменьшилось.
12. Для 0,005 и 0,05 М водных растворов серной кислоты при 298 К
определены значения рН 2,10 и 1,2 соответственно. Вычислите водород-
водородный показатель этого раствора, используя данные о средних ионных и
ионных коэффициентах активности.
Сравните расчетные величины и опытными и сделайте выводы.
Решение. Для вычисления рН необходимо определить актив-
активность иона водорода. Вычисляем ионную силу раствора по уравнению
(XVIII.23): / = V, B-0,005-12 + 0,005-22) = 0,015. Находим у±
в справочнике [M.J. Вычисляем активности а± и ан+ по уравнениям
(XVIII.18) и (XVIII.20). Исходные данные и результаты расчета сво-
сводим в таблицу:
298
т.
моль/1000 г
0,005
0,05
Рноп
2,1
1,2
0,639
0,34
0,015
0,1
VH +
0,905
Рнвыч
— lgV± т±
2,19
1.10
— lgV+m +
20,04
Сопоставление вычисленных значений рН с опытными показывает,
что расчет дает лишь приближенные величины. Лучшее совпадение вы-
вычисленной и опытной величин наблюдается для более разбавленного
раствора.
13. Вычислите произведение растворимости Са (ОНJ при 298 К-
Растворимость гидрооксида кальция 0,155 г/100 г воды.
Решение. Активности ионов вычисляем по уравнению
(XVIII.20). Моляльность насыщенного раствора
0,155-10
М
1,55
74,1
=0,0209 моль/1000 г.
Средние ионные коэффициенты активности вычисляем по уравне-
уравнению (XVIII.22). Для этого по уравнению (XVIII.23) находим ионную
силу раствора:
/=i/2 @,0209-22-f 2-0,0209-1) =6,27-10-2.
Подставляем полученную величину в уравнение (XVIII.22):
lgY±=—0,509-1-2 У 6,27-10-2= —0,255 и y± = 0,556.
Вычисляем произведение растворимости:
ПР =
=4 @,0209K 0,5163 = 6,28- 10-е (МОль/лK.
2+у±Bт _ у±J = 4
14. Вычислите растворимость CuCl при 298 К в чистой воде и в
0,025 М растворе MgSO4. Используйте данные о произведении раство-
растворимости CuCl.
Решение. Растворимость CuCl в воде вычисляем, допустив,
что концентрация электролита очень мала, так как CuCl полностью
диссоциирована и коэффициенты активности ионов равны единице.
Отсюда
= [Cu+]=y~nF,
ПР=3,2-10-' (моль/лJ [М.],
[CuCl] = У 3,2-10-' = 5,65- Ю-4 моль/л.
При расчете растворимости CuCl в растворе MgSO4 нельзя принимать
коэффициенты активности равными единице, так как [MgSO4] =
= 0,025. Тогда
299
Коэффициенты активности вычисляем по уравнению (XVIII.22).
Ионную силу раствора вычисляем по (XVII 1.23):
/ = i/2 @,025-22-f 0,02S.22) = 0,l.
Коэффициенты активности для двухзарядных ионов находим в
табл. 5: YMg2+ — VSo2~ = №• Рассчитаем растворимость CuCl:
[CuCl] = У 3,2-10-'/0,3-0,3 = 5,96.10~4 моль/л.
15. Вычислите теплоту нейтрализации при 298 К, используя дан-
данные таблицы стандартных термодинамических величин для ионов в вод-
водных растворах электролитов [М.].
Решение. Теплота нейтрализации равна теплоте реакции
Н (aq) + ОН (aq) = Н2О (ж), протекающей в гипотетическом пре-
предельно разбавленном растворе. Значение Д//Нейтр рассчитаем по урав-
уравнениям:
/ ; АИ1
н+ —Л///. он-; АИ1, н+ =
ДЯ° он"= —229,94 кДж/моль; Д Н° НгО= —285,84 кДж/моль [М.];
ДЯнейтр =—285,84—(—229,94) = —55,94 кДж/моль.
16. Вычислите ионное произведение воды K.w = ан+ «он- при
298 К, используя данные таблицы стандартных термодинамических
величин для ионов в водных растворах электролитов AGh2o —
= — 237,25 кДж/моль.
Решение. Для реакции диссоциации воды Н2О (ж) *± Н+ +
+ ОН~ константа равновесия выражется через активности
к ан+аон- Kw
ан,о ан2о
Так как концентрация ионов Н+ и ОН~ в воде исчезающе мала, то
*нго = 1 = анго или Kw = Ка- Константу диссоциации находим
по уравнениям:
Л G°HCC = -RT in Ка, Л 0°исс = A G°H+ + Д G°OH— A G^o;
Д0н+ = 0; Д0он~=-—157,30 кДж/моль [М.],
Л Одисс= — 157,30— (—237,25) =79,950 кДж/моль;
lg Ка= -79,95- Юз/2,3-8,314-298,15=—14,023;
д-а = д-и) = 0,9510-14.
17. Для реакции диссоциации муравьиной кислоты (HCOOH)aq =
= Н+ + НСОО~ дана зависимость константы диссоциации от темпера-
температуры:
1342,85
lg Ка=- ~ +5,2743-0,01527-.
Вычислите теплоту диссоциации Д//дисс и теплоту нейтрализации
Д//Нейтр муравьиной кислоты в разбавленном водном растворе.
300
Решение. Теплота диссоциации может быть рассчитана по
уравнению
дисс
RT-
Умножая обе части исходного уравнения на 2,3, получаем:
1пК„=— 2,3.1342,85/7+2,3.5,2743—2,3-0,01527
и возьмем производную
—г- =2,3-1342,85/72-2,3-0,0152.
Умножим производную на RT2 и получим
ДЯдисс = 2,3/?-1342.85—2,3/?-0,0152Г2,
откуда
Д ЯдИСС= — 133,15 Дж/моль.
Термохимическое уравнение реакции нейтрализации муравьиной кис-
кислоты
НСООН + ОН- = НСОО- + Н2О + ДЯ A)
можно представить как сумму двух уравнений реакций:
реакции диссоциации НСООН = Н+ + НСОО + Д ЯДисс B)
и
реакции нейтрализации Н+ +ОН~= Н2О +Д Янейтр C)
Суммирование уравнений реакций B) и C) дает реакцию A) и
показывает, что АН = АНтсс + Д//нейтр, поскольку ДЯДИСС =
= —133, 15 Дж/моль, ДЯнейтр = — 55,94 кДж/моль. Отсюда тепло-
теплота нейтрализации муравьиной кислоты в разбавленном водном раство-
растворе будет АН == — 56, 072 кДж/моль.
18. Вычислите энтропию реакции диссоциации Д5ДИСС при 298 К
и энтропию иона НСОО~, если энтропия НСООН в разбавленном вод-
водном растворе 5нсоон<аЧ) = 163, 8 Дж/моль, а засисимость констан-
константы диссоциации муравьиной .кислоты от температуры выражается урав-
уравнением
1342,85
lg Ка=— : -0,01527 + 5,2743.
Решение. По уравнению (XVIII. 15) вычисляем ДОДИСС:
Л Одисс=+1342,85-2,3/? —5,2745-2,3/?7 + 0,0152-2,3/?72 =
= 2 560492- 100,577+0.29172.
Затем, взяв производную по температуре, находим Д5ДИСС:
] =—100,57 + 2-0,2917
301
и при 298 К
Л 5Дисс= 100,57 — 2-0,291-298 = —72,87 Дж/(моль-К).
Энтропию иона НСОО" вычисляем по формуле
0 L С0 СО
С
НСООН (aqf
Так как 5н+ = 0, то
5нсосг = 5нсоон + л 5дисс = 163,29— 72,87 = 90,42 Дж/(моль- К)-
19. Определите температуру, при которой диссоциация муравьи-
муравьиной кислоты в водном растворе максимальна. Уравнение зависимости
константы диссоциации НСООН от температуры имеет вид
1342,85
lgKa= — = + 5,2743—0,0152Г.
Решение. Находим координаты экстремума на кривой
кктсс = / (Т),
— " =3098,55/7^—0,035.
а Т
Отсюда следует, что в точке экстремума (максимум, так как—.,„, " <
Гтах=У 3098,55/0,035 = 297 К-
Диссоциация муравьиной кислоты максимальна при 297 К.
20. Вычислите произведение растворимости ПР для Ag2CO3. Для
расчета используйте значение стандартных термодинамических свойств
неорганических веществ, приведенных в справочнике [М.].
Решение. Согласно условию гетерогенного равновесия
(XVIII. 19),
AGAg,CO, (нас. p-p) = AGAgjCO, (т)- О
Из справочника [М.] находим:
AGAg,CO, (т) =-437,79 кДж/моль,
А GAg,CO, (нас. р-р)= А GAg,CO, (p-P)j cc + RT 'п ^.СО,- B)
л GAg,co. ,p.p). co=2AGV + A Gcol-; C)
ДОде+ = 77,21 кДж/моль; Д Gco23- = —528,48 кДж/моль [М.].
Подставляя числа в уравнения A) — C), получаем:
— 437,79=2-77,21— 528,48 + 2,3-8,314-2981g ПР,
— 63,73-10»
'§ПР- 2,3.8,314-298 =-"''6;
ПР = 6,92-10-12 (Моль/лK.
302
21. Вычислите парциальное давление 6М соляной кислоты при
298 К, используя данные о стандартных значениях энергии Гиббса и
среднеионных коэффициентах активности.
Решение. Согласно условию гетерогенного равновесия
(г)= МНС1 (p)i О
(р) = ^НС1 (р) ее + № '" аНС1 (р),
аНС1(г) =
анс1,Р)='Г|. E)
Согласно уравнениям A) — E)
lg Рна = ^
(р-р), сс = Л°НС1 (р-р), »=Л0Н+ + Л0С1- =
= 0 + ( — 131,5) = — 131,35 кДж/моль [М.[,
(г)=лонс1 (г) = -95,36 кДж/моль [M.J,
Y±=3,22 [M.].
131,35 + 2,3-8,314-298^62-3,22а—95,36
hc 2,3-8,314.298 = ~3'715;
/>нс, = 1,93-Ю-4 атм, или 1,93-10-4-760 = 0,147 мм рт. ст.
22. Вычислите /^г, аон-, ан+, рН и степень гидролиза в 0,1 М раст-
растворе Na2CO3 при Т = 298 К- Вторая константа диссоциации уголь-
угольной кислоты К2 = 5,61-Ю-11, Kw = 1,27-Ю-14.
Решение. Определяем /Сг- Гидролиз Na2CO3 практически идет
по реакции первой ступени
Согласно этому уравнению
ансог°он-
acol~ aco,2-aH+ K*
где /С2 — вторая константа диссоциации угольной кислоты,
НСО5"
Таким образом,
1,27-Ю-14
303
Определяем аон-. Так как /Сг = 2,265- Ю", то вычислять [ОН~]
необходимо по уравнению
Так как —?~ н L. малы по сравнению с /Сг с, то последнее уравне-
уравнение упростим:
откуда
2,265-10-* .
[ОН-]=-—' Н 1/2,265-10-*.0,1 =
= —1,13-10-4-4,76-10-8 = 4,65- Ю-з г.Ион/л.
Определяем
/=—(l2-0,2-f220,l) = 0,3, v± = 0,66,
а _ = 0,66-4,65-10-3 = 3,07-Ю-3,
он
откуда
рН = р Kw—pOH-= 13,90-f lg C,07- Ю-з)._ 11 383.
Определяем ан + :
Kw 1,27- Ю-1*
V=T~T= 3,07.10-3 =4.14.10-».
он
Степень гидролиза
ah =]/—*? 100 = 4,76%.
ЗАДАЧИ
1. Рассчитайте электрическую проводимость A/r) 1M раствора
AgNO, прн 291 К, еслн расстоянне между электродамн 5 см, площадь
каждого электрода 2 см2. Эквивалентная электрическая проводи-
проводимость этого раствора X — 94,3 Ом~1-см2/г-экв.
2. Молярная электрическая проводимость 0,5 М раствора K2SO4
прн 298 К равна 162,7 Ом-1-см2/моль. Определите удельную и эквива-
эквивалентную электрическую проводимость прн этой температуре.
3. При электролизе раствора AgNO3 серебряными электродами уве-
увеличение массы солн в анодном пространсте составнло 0,0625 г. Чему
равна убыль солн (в граммах) в катодном пространстве?
304
4. Раствор нитрата серебра, содержащий 0,18475 г AgNO3 на 25 г
воды, подвергали электролизу с серебряным анодом. После электролиза
анодное пространство содержало 0,2361 г нитрата серебра на 23 г во-
воды. За данный промежуток времени на электроде выделилось 0,0780 г
серебра. Определите числа переноса Ag+ и N05".
5. Абсолютные скорости движения ионов Sr2+ и С1~ в разбавлен-
разбавленном растворе прн 291 К равны соответственно 5,2-10~8 н 6,8-10~8
м2/(с-В). Определите эквивалентные электрические проводимости и
числа переноса ионов в растворе SrCl2.
6. Эквнвалентня электрическая проводимость КС1О4 при бесконеч-
бесконечном разбавлении прн 291 К равна 122,8 0м-1 •см2-г-экв~1. Число пере-
переноса нона ClOi" 0,481. Определите подвижности нонов К+ н ClOf.
7. Рассчитайте эквивалентную электрическую проводимость
0,001 н. раствора LiCl н сравните с опытной величиной
96,6 Ом~1-сма-г-экв~1. Эквивалентные электрические проводимости
0,001 н. растворов LiNO3, NaNO3 и NaCl прн 291 К равны соот-
соответственно 92,9; 102,9; 106,5 0м-1 ¦см2-г-экв~1.
8. Построив график зависимости X отУ^с, рассчитайте Хо для КС1 н
сравните с табличными данными [М.]. Для 291 К дана зависимость
с, моль/л 0,000! 0,0002 0,00! 0,002 0,01 0,02 0,1 0,2 I
Я, Ом-^см^г-экв-1 129,1 128,8 127,3 126,3 122,4 120,0 112,0 108,8 98,3
9. Установите область концентраций, для которой, применимо урав-
уравнение Кольрауша (для растворов КС1), если для 291 К дана зависи-
зависимость к = / (с) :
с, моль/м 0,0001 0,0002 0,001 0,002 0,01 0,02 0,1 0,2 1
Я, Ом-^-см^г-экв-1 129,1 128,8 127,3 126,3 122,4 120,0 112,0 108,8 98,3
10. Определите молярность раствора соляной кислоты, если прн
кондуктометрнческом титровании 100 мл раствора НС1 8 и. раствором
NaOH получены следующие результаты:
VNaOH- мл
0
м-1 ... 3
,32
,20
0
2
,60
,56
0
1
,92
,86
1,56
1,64
2
2
,00
,38
2
2
,34
,96
П. Рассчитайте эквивалентную электрическую проводимость прн
298 К и бесконечном разбавлении для монохлоруксусной кислоты, ес-
если константа диссоциации /(„= 1,55-10~3 (моль/л), а эквивалентная
электрическая проводимость прн разбавлении V = 32 л/моль равна
77,2 Ом-1-см2тэкв1.
12. Эквивалентная электрическая проводимость 1,59-10"* М ук-
уксусной кислоты прн 298 К равна 109, 78 Ом~1-см2-г-экв~1. Вычислите
контанту диссоциации и рН раствора, данные о подвнжностях нонов
возьмите из справочника [М.].
13. Вычислите константу диссоциации NH4OH, если прн данной
температуре 0,1 н. раствор имеет рН 11,27. Ионное произведение воды
прн этой температуре Kw = 0,71- 10~u.
305
14. Рассчитайте концентрацию ионов водорода в растворе, содер-
содержащем в 1 л 0,1 моль уксусной и 0,1 моль хлоруксусной кислоты
при 298 К. Константы диссоциации этих кислот возьмите из спра-
справочника [М.].
15. При 291 К удельная электрическая проводимость % насыщен-
насыщенного раствора хлорида серебра равна 1,374-10~4 Ом~1-м~1 (См- м),
удельная электрическая проводимость воды, определенная в тех же
условиях, 4-10~8 Ом~1-см~1. Вычислите молярную концентрацию AgCl
в насыщенном растворе. Значения подвижностей возьмите в справоч-
справочнике [М.].
16*. Растворимость Ва (Ю3)г при 25°С равна 8-10~4 моль/л. Оп-
Определите растворимость этой соли: 1) в 0,1 М растворе KNO3; 2) в
0,03 М раствора Ва (NO3J- Зависимость коэффициентов активности
ионов от ионной силы раствора приведена в табл. 5.
17*. Рассчитайте эквивалентные электрические проводимости
5-10~4 и 0,1 М растворов NaCl по уравнению Кольрауша — Онзагера
для 298 К. Сравните полученные величины с табличными. Данные о
нодвижностях ионов при бесконечном разбавлении, вязкости и ди-
диэлектрической постоянной воды возьмите из справочника [М.].
18. Вычислите активность Na2SO4, HC1, Pb (NO3J в растворах с
концентрацией данного электролита т — 1 моль/1000 г по данным о
среднем коэффициенте активности, взятом из справочника [М.].
19. Вычислите ионную силу, коэффициенты активности отдельных
ионов и среднеионные коэффициенты для растворов смеси электроли-
электролитов при 298 К, если в растворе содержатся (моль на 1000 г воды)
следующие соли: Ip.p: MgSO4 — 0;005; LaCl3— 0,010; Na2SO4 —
0,006; Нр.р: MgSO4 — 0,01; LaCl3 — 0,002; Na2SO4 — 0,005.
20. Вычислите по уравнению Дебая — Гюккеля и по данным, при-
приведенным в табл. 5, средний коэффициент активности ионов соли ВаС12,
если / = 0,02 при 298 К.
21. Отнршение парциальных давлений хлористоводородного газа
при 298 К над растворами соляной кислоты с т1 = 4 и т2 = 8
равно 0,02253. Определите отношение среднеионных активностей а±
этих растворов. Сопоставьте результат с данными справочника [М.].
22. По данным зависимости /(,„ от температуры [М.] вычислите
теплоту реакции Н+ + ОН~ = Н2О. Сравните полученный результат
с теплотой нейтрализации, найденной калориметрически: Д#иейтр =
--= 5,60-103 Дж/моль.
23. Теплота нейтрализации уксусной кислоты 0,005 н. раствором
NaOH при 18° С равна — 56105,8 Дж/моль, а для соляной кислоты
она составляет—57571,25 Дж/моль. Чему равна теплота реакции
CH3COONa + НС1 = NaCl + СН3СООН
24. Для реакции
HNOj+NHj (r)=NH4NO3 (аЧ)+Д'Я
306
протекающей при 298 К в разбавленном растворе, определена теплота
реакции АН =—86, 671 кДж/моль. Вычислите A#°NH+, если
AtffNfMr)^—46,224 кДж/моль.
25. Константа диссоциации слабой кислоты НА — Н+ +
+ А~ в зависимости от температуры изменяется в соответствии со сле-
следующим уравнением:
3000
l ^" + 2lg T + 2.
Определите при температуре 300 К AS, АН0, AG0 диссоциации.
26. Определите AG0, АН0, AS0 и АѰРпри 298 К для реакции
HSO4 = Н+ + SOj- по зависимости lg /( = -Щ? +5,0435—0,0182 Т
и сравните полученные результаты с данными таблиц стандартных
термодинамических величин [М.].
27. Вычислите произведение растворимости Са (ОНJ 7при 298 К,
использовав данные о термодинамических свойствах индивидуальных
веществ и ионов в водных растворах.
28. Для раствора, содержащего 0,9 моль КС1 и 0,01 моль НС1 на
1000 г воды, вычислите водород«ый показатель рН. Опытное значение
рН 2,078.
29. Рассчитайте средние ионные коэффициенты активности ком-
комплексной соли диаминодинитрооксалаткобальтиата тетрааминоокса-
лата кобальта (III)
[Co(NH3LC2O4]+[Co(NH3J(NO2JC2O4]~
в водных — растворах хлорида натрия при 15°С:
cNaCl> моль/л 0 0,0003 0,001 0,005 0,01 0,02
Растворимость соли,
моль/л 0,4900 0,4935 0,500 0,5220 0,5936 0,5646
30. Вычислите растворимость иодида серебра в воде при 25° С ис-
исходя из величин стандартных энергий Гиббса для образования Agl(Kp),
Ag+ и 1~ из простых веществ.
31. Вычислите стоксовый радиус иона лития в водном растворе при
бесконечном разведении при 298 К. Сравните полученное значение с
кристаллографическим радиусом Li+, по Бокию, 0,68-10~8 нм.
32. Вычислите коэффициенты активности иодата серебра в раство-
растворах нитрата калия разной концентрации, если
cKNO3-'°2' моль/л 0 0,1301 0,3552 0,6503 1,4100 7,0500 19,9800
Растворимость
Ag Ю3-104,моль/л 1,771 1,828 1,870 1,914 1,999 2,301 2,665
Растворимость иодата серебра приведена при 25°С в чистой воде и в
присутствии различных количеств нитрата калия.
Постройте график зависимости логарифма коэффициента активно-
активности от корня квадратного из ионной силы раствора. Определите,
307
в какой мере полученные результаты согласуются с предельным за-
законом Дебая — Гюккеля.
33. Рассчитайте рН 10~8 М НВг в воде при 25° С. При расчете уч-
учтите диссоциацию воды на ионы.
34. Зависимость ионного произведения воды Kw от температуры
описывается уравнением
5242 39
lgKw= — : +35,3944—0,00853Г— Il,82611g7\
Выведите уравнение зависимости теплоты диссоциации воды от тем-
температуры. При какой температуре ионное произведение воды достиг-
достигнет максимального значения?
35. Удельные электрические проводимости х растворов труднораст-
труднорастворимой одноосновной кислоты НА при различных концентрациях рав-
равны для 8,1 • Ю~3 М НА х = 3,24-10~4 Ом-1-см-1, а для насыщенного ра-
раствора х = 6,00- Ю'Юмсм. Эквивалентные электрические проводи-
проводимости Хо (Ом~1-см~2-г-экв~1) при бесконечном разведении для калие-
калиевой соли КА, хлорида калия и соляной кислоты соответственно рав-
равны: Хо.ка = 124; Х0,кс1 = 150; X0,Hci = 426. Вычислите константу дис-
диссоциации и растворимость кислоты.
36. Определите растворимость бромида серебра в 0,001 М при
25°С. Произведение растворимости бромида серебра возьмите из спра-
справочника [М.]. Воспользуйтесь предельным законом теории Дебая —
Гюккеля.
37. Рассчитайте растворимость хлорида серебра в 0,01 М водном
растворе NHO3 при 25° С. Воспользуйтесь справочными значениями
ПР хлорида серебра и предельным законом Дебая — Гюккеля. Влия-
Влиянием концентрации хлорида серебра на ионную силу раствора можно
пренебречь.
38. Сравните табличное значение среднего ионного коэффициента
активности хлорида кальция в 0,01 МСаС12 при 25° С с величинами,
рассчитанными по первому и второму приближениям теории Дебая —
Гюккеля.
39. Определите тепловой эффект реакции Н2О (ж) ->- Н+ -f OH~
(ионы Н+ и ОН" гидратированы) при 298 К на основании теплот
образования Са (ОНJ, СаС12, НС1, теплот растворения и ДЯ^ при
бесконечном разведении; Д#2 для Са (ОНJ равно—7,5 кДж.
40. Определите растворимость CaSO4 при 298 К в 0,1 М водном раст-
растворе Са (NO3J. Сопоставьте с растворимостью CaSO4 в чистой воде.
41. Определите молярную электрическую проводимость водного
раствора КС1 при бесконечном разведении при 323 К. Для расчета вос-
воспользуйтесь зависимостью вязкости воды от температуры [М.].
42. Определите молярную электрическую проводимость 0,01 М
КС1 при 323 К, К = 244,0 Ом-1-г-экв-1- см2.
43. На основании данных об интегральной теплоте растворения
H2SO4 в Н2О при 298 К и стандартном давлении 1,0132-105 Па при не-
308
скольких концентрациях определите парциальную молярную теплоту
растворения 35 М H2SO4 (A#h2soJ- Определите парциальную моляр-
молярную теплоту растворения воды в этом растворе Д#н,о-
44. На основании теплоты испарения воды при 298 К [М.] н пар-
парциальной молярной теплоты растворения воды в 35 М растворе H2SO4
определите парциальную молярную теплоту испарения воды из 35 М
раствора H2SO4.
45. Определите активность Н2О при 298, К, если давление насы-
насыщенного пара над чистой водой [М.] и над 35М раствором H2SO4
при этой температуре равно 32,4 Па.
46. Определите изменение химического потенциала Н2О (^н2о —
—Мн2о) прн образовании раствора Н2О в 35 М H.2SO4 при 298 К, если
парциальное давление пара воды 32.4 Па, а давление паров над чистой
водой возьмите из [М.].
47. Определите Кг, ан + , рН н а,г 0,05 М раствора CH3COONH4
прн 298 К. Данные для расчета взять из таблиц.
48. Определите степень гидролиза соли 0,2 н. раствора NH4C1
прнгЭвК-^ = 1,27-10-14;A:nh4oh = 1,79-Ю"8.
49. Вычислите степень гидролиза 0,2 и. уксуснокислого аммония
прн Т = 298 К, если Кын.ои = 1,79-Ю, Ксн3соон = 1,76-10.
Kw = 1,27-10~14. Сколько свободных уксусной кислоты и аммиака
содержится в 1 л раствора?
50. Определите концентрацию водородных ионов децинормаль-
ного раствора NH4C1, если константы диссоциации равны: ^Cnh4oh =
= 1,79 • Ю-5 и Kw = 1,27 - Ю-14.
МНОГОВАРИАТНЫЕ ЗАДАЧИ
1. Используя данные о свойствах растворов вещества А в воде:
1) постройте графики зависимости удельной и эквивалентной элект-
электрических проводнмостей растворов вещества А от разведения V\
2) проверьте, подчиняются ли растворы вещества А в воде закону
разведения Оствальда; 3) вычислите для вещества А по данным зави-
зависимостям эквивалентной электрической проводимости от концентрации
эквивалентную электрическую проводимость при бесконечном разве-
разведении н сопоставьте результат со справочными данными.
№ варианта . .
Вещество А .
№ варианта . .
Вещество А . .
Зависимость
ции с при 298
•
• (СН,J
1
НС!
6
AsOOH
2
HNO2
7
CeH5OH
3
НОС!
8
СвНБСООН
4
НСООН
9
NH4OH
сопротивления г раствора вещества А от
К:
5
CHgCOOH
концентра-
309
с.
моль/л
0.1
0.05
0,03
0,01
0,005
0,003
0,001
HCN
3,10-10'
4,37-10'
5,84-10'
10,1-10»
14,3-10'
18,3-10»
31,9-10'
HNO,
4,32
5,7
7,5
13,4
20,4
26,8
52,7
г
НОС1
927
1390
1810
3120
4560
5560
10000
Ом-м,
нсоон
6,06
8,91
10,3
18,2
25,9
35 8
68,5
для вещества А
СН,СООН
19,6
27,6
34,8
61,0
87,0
103
185
(СН,),
AsOH
131
280
235
402
582
796
1310
с,н„он
7,46-10'
10,80-10'
14,50-10'
23,5-10'
32,7-10'
41,50-10»
74,60-10'
С.Н,
соон
9,75
14,1
18,5
31,4
48,8
57,9
10,4
NH4OH
2,55
10,3
14,5
25,8
100
143
251
2. Рассчитайте молярную электрическую проводимость "кт ве-
вещества А, используя эквивалентные электрические проводимости Хо
при бесконечном разведении для следующих веществ при 298 К:
Вещество
AgCNS
Ag2SO4
ВаС12
СаС12
LaCI,
La(CNSK
La (IOS),
MgSO4
Ом—!-м'Х
Хг-экв—1
1,285
1,419
1,40
1,36
1,46
1,36
1,10
1,33
Вещество
PbCI2
PbCjjO4
Pb(CNSJ
PbSO4
La2(SO4K
MgBr2
Mg(BrO,J
MgCl2
Ом-1-м'х
ХГ-ЭКВ—1
1,46
1,43
1,36
1,10
1,50
1,31
1,08
1,29
Вещество
Mg(CNSJ
MgF2
Mgl2
SrCI2
TINO. '
T12SO4
Om-1-m»X
Хг-экв—1
1,19
1,08
1,30
1,36
1,51
1,55
,4s варианта
Вещество А
№ варианта
Вещество А
№ варианта
Вещество А
1
SrC2O4
7
СаС2О4
13
2
AgCl
8
CaF2
14
3
AgIO3
9
BaC2O4
15
4
BaSO4
10
T1C1
16
5
TIBr
11
PbF2
17
18
6
PbSO4
12
Pb(IO,J
19
MgC2O4 AgBr AgBrO3 T1CNC TIBrO, Til TIIO,
3. Удельное сопротивление насыщенного раствора труднораство-
труднорастворимой соли А (см. таблицу на с. 311) при 298 К равно р. Удельное
сопротивление воды при той же температуре рн,о = 1 • 10* Ом • м.
Вычислите: 1) растворимость соли А в чистой воде; 2) произведение
растворимости вещества А, приняв, что коэффициенты активности
ионов у± = 1 (растворы сильно разбавлены); 3) растворимость ве-
вещества А в растворе, содержащем 0,01 моль вещества В; 4) раствори-
растворимость вещества А в растворе, содержащем 0,01 моль вещества С. Ве-
Вещества А, В, С полностью диссоциированы.
310
Удельное сопротивление растворов вещества А при 298 К:
№ варианта
1
2
3
4
5
6
р- 10~4, Ом-м
0,0141
0,333
0,0550
0,330
0,0038
0,0248
Вещество
А | В
SrC2O4
AgCl
Ag!O3
BaSO4
TIBr
PbSO4
H2C2O4
HCl
' HIO3
Na2SO4
KBr
Li2SO4
С
NaaSO,
Na2SO4
Na2SO4
KBr,,, ,
Na2SO,
KBr
4. По данным о моляльности т и среднем ионном коэффициенте
активности у± электролита А вычислите среднюю ионную концентра-
концентрацию т±, среднюю ионную активность а± и активность а.
¦ от
ОТ ?"
в я
31
1
2
3
4
5
6
7
8
9
10
11
12
13
Вещество А
СаС12
Ca(NO,J
Mgl2
MgBr2
Sr(C!O4J
COI2
HCl
НСЮ4
LiBr
NaOH
A1C13
LaC!3
SnCl2
m, моль/
1000 г
1
2
3
4
5
6
7
8
9
10
0,5
1,5
3,5
v±
0,500
0,347
7,81
12
10,09
1,99
4,37
11,83
12,92
3,46
0,331
0,515
1,504
ifs ва-
варианта
14
15
16
17
18
19
20
21
22
23
24
25
Вещество А
Th(NO3L
Cd(C104J
K3Fe(CN)e
Znl2
Cr2(SO4),
Th(NO,L
Ba(C104J
A12(SO4),
K4Fe(CN)e
Na2HPO4
K2HAs04
H2SO4
m. моль/
1000 г
4,5
5,5
1
2
0,3
0,4
5
0,6
0,7
0,8
0,9
10
0,722
41,3
0,128
1,012
0,0238
0,192
2,13
0,014
0,051
0,217
0,301
0,559
5. Вычислите химический потенциал электролита А в водном раст-
растворе при 298 К и концентрации т.
№ ва-
варианта
1
2
3
4
5
6
7
8
9
Электролит А
NaOH
H2SO4
H2SO,
LiF
Ba(OHJ
Ba(OHJ
NH4NO.
UO2(C1O4J
UO2(C!O4J
m,
моль/
1000 r
1
1
0,1
1
0,1
0,05
1
0,1
1
№ ва-
варианта
10
11
12
13
14
15
16
17
Электролит А
CH3NOOCs
Ba(NO,J
Ca(NO,J
HCl
A!2(SO4K
A!2(SO4),
Csl
AICI3
m,
моль/
1000 г
1
1
0,5
0,5
0,1
1
1
1
№ ва-
варианта
18
19
20
21
22
23
24
25
Электролит А
А1С13
InSO4
Pb(NO,J
H2SO4
HNO.
HNO3
MgSO4
NH4C1
tn,
моль/
1000 г
0,5
0,1
0,1
0,5
0,5
0,1
1
1
311
6. Разбавленный водный раствор МеС12 насыщен газообразным во-
водородом при 298 К и 1 атм. Определите для реакции
Н2 (г)+МеС12=Ме + 2Н+д-| 2С!-Д
1) тепловой эффект при Р = const; 2) изменение энтропии; 3) стандарт-
стандартное изменение энергии Гиббса; 4) логарифм константы равновесия;
5) установите, будет ли протекать реакция самопроизвольно при ука-
указанных условиях:
№ варианта ... I 2 3 4 5 6
МеС!2 FeC!2 NiC!2 SrC!2 CuCl2 MgCl2 CdC!2
7. На основании справочных данных о зависимости электрической
проводимости слабого электролита А от разведения при 298 К [М.],
постройте график зависимости X = /(с) и определите X при с = 6 X
X 10~3 моль/л. Рассчитайте степень диссоциации а электролита А
при концентрации 6 • 10~~3 моль/л. Сравните найденную величину с
рассчитанной по закону разведения Оствальда (константу диссоциа-
диссоциации электролита А возьмите из [М.]). Определите концентрацию ионов
Н+ и рН в растворе электролита А при концентрации 6 • 10~3 моль/л:
№ вари-
варианта . . ' J 2 3 4 5 6
Электро-
Электролит А ... «30-C3H<jCOOH h-C3H,COON* НСООН СгН5СООН СН3СООН NH4OH
ГЛАВА XIX
ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ. ЭЛЕКТРОДНЫЕ
ПОТЕНЦИАЛЫ
Основные уравнения и символы
[К., с. 560—626; Г., т. 2, с. 517—561]
ЭДС гальванического элемента ? равна разности условных элект-
электродных потенциалов его полуэлементов Ег и ?2, если величиной диф-
диффузионного потенциала можно пренебречь:
Е = Е1 — Ег (XIX.!)
(индекс «2» относится к более положительному электродному потен-
потенциалу).
Электрохимические реакции, протекающие на электродах, и
электроды разделяют на следующие типы.
Электроды 1-го рода, обратимые по катиону, Ме"+ + пе = Ме°,
где Ме"+ и Ме° — окисленная- и восстановленная формы вещества;
312
е — электрон. Потенциал электрода 1-го рода рассчитывают по урав-
уравнению Нернста:
RT RT
Е Е" + ' (/) ? ? + '
где ?— потенциал электрода; ?° — стандартный потенциал электро-
электрода; п — число электронов, участвующих в элементарной реакции;
F — постоянная Фарадея; aRe(i и а<эх — активности восстановленной
и окисленной форм вещества, вступающего в реакцию. Множитель
2,3RT/F при Т = 298 К и R = 8,31 Дж/(моль • К) равен 0,059 В.
Электрод 1-го рода можно схематически представить в виде Ме"+/Ме.
К электродам 1-го рода относятся: а) серебряный электрод
Ag+|Ag; Ag+v+e = Ag°; я=1; aOx = aAg + ; aRed = aAg+ = '> (XIX.3)
0,059
б) амальгамный электрод
Me"+|Mem, Hg; m Ме"++я/ие = Мет (Hg)
PCd
0,059
где Eacd2+ j (Cd)Hg — потенциал амальгамного электрода при активности
кадмия в амальгаме; аы — 1;
в) газовый электрод
H+IH2|Pt; H++e = i/1HI;n==l; аО* = *н+; «Red = «H. = РП,\
? = ?о +A^_lg^_. {Х]Х.5)
н+|н, 1 ё рч, к '
н»
Электроды 2-го рода обратимы по аниону. Они представляют собой
металл, покрытый труднорастворимой солью этого металла, погружен-
погруженный в раствор соли, содержащий анион одноименный с анионом труд-
труднорастворимой соли. Схематически электрод 2-го рода можно предста-
представить А"- |МеА|Ме, а протекающую в нем реакцию МеА + пе = Me +
+ А"-. Например:
+-fC!-; я=1; aOx = aAgC, = l; aRed = aCI-;
= ?§--—%acp, (XIX.6)
(XIX-7)
313
где ?д +|А — стандартный потенциал серебряного электрода, обра-
обратимого по катиону; ПРдеа = aAg+ aC] произведение раствори-
растворимости хлорида серебра. К электродам 2-го рода относятся:
а) газовый электрод
б) каломельный электрод Cl-|Hg2Cl2, Hg, на котором идет электрод-
электродная реакция Hg2Cl2 + 2е~ = 2Hg + 2С1~;
_ о 0,059
Еа~ |Hg, i ci, i»Hg = ?ci-| Hg, icu, Hg"~ 2
в) хлоридсеребряный электрод Cl-|AgCl|Ag, на котором идет элект-
электродная реакция AgCl + е = Ag + С1~:
0,059
ЕС1 - | AgCl | Ag = Еа~ | AgCl I Ag — j '8 aCl~ •
Окислительно-восстановительные электроды (редокси-электроды)
представляют собой инертный металл, опущенный в раствор, содер-
содержащий окисленную и восстановленную формы. Уравнение Нернста
для данных электродов имеет вид
aRed
где аох — активность окисленного иона; а^^ — активность восста-
восстановленного иона.
Простой редокси-электрод записывается в виде схемы: Red,Ox|Pt
реакция Ох + пе = Red. Например:
с со 0>059 aFes+
? = ^Fe3+, Fe2++ lg ~~; (XIX. 10)
I °Fe2 +
МпО4-+е=МпО|-; л=1; oRed=«MnO4-; flOx=°Mnoi-;
о 0,059
?=?MnOr, MnO}-+ — lg (°Мп0,~/аМп0Г). (XIX.11)
Для сложного редокси-электрода схема записывается в виде Red, Ох, Н+| Pt:
МпОГ+8Н++5в-Мп»++4Н1О; «=5; aRed=aMn2+; aOx=a
0,059 oMnO-
= ?мп+2|Мп04-Н lg *—. (XIX. 12)
5 °2+
Хингидронный электрод
СвН4О2+2Н++2е=С„Н4(ОНJ
хинон гидрохинон
314
^ = ?°. rx-0,059pH. (XIX. 13)
Связь константы равновесия химической реакции и стандартных
электродных потенциалов выражается соотношением
/ро ро\
~ (Г 298Ю (Х1Х.14)
где ?§>.??.
Для концентрационных цепей уравнение Нернста (при условии
отсутствия диффузионного потенциала) для электродов типа
Си | Си2+ || Си2+ | Си; Ag, Ag C11 НС! || НС! | Ag, AgCl
Oi а2 ax a2
а2 > ai о2 > аг
имеет вид
? = _2^5?, (fli/ei)i (XIX.15)
п
где ах и а2 — активности ионов Си2+ и С1~ соответственно.
Для газового элемента типа
Pt | Н21 НС! | Н21 Pt
Рх Рг
уравнение (XIX. 15) преобразуется:
0,059
\(PIP), (XIX. 16)
где Рх и Р2 — давления водорода; Рх > Рг.
Для амальгамного элемента типа
Hg (Cd)Cd^ | (Cd) Hg
a, a,
уравнение Нернста будет
0,059
(XIX. 17)
где ах и а2 — активности металлического кадмия в амальгаме.
Для элемента типа
Cd (жидкий, чистый)! CdCl2B расплаве I (расплав) Cd—Sn|Cd
п!= 1 [щелочных хлоридов! а2
уравнение (XIX. 17) принимает вид
0,059
? = —r—lgo2, (XIX.18)
где а2 — активность кадмия в расплаве Cd — Sn.
315
Если диффузионным потенциалом в концентрационной цепи пре-
пренебречь нельзя, то ЭДС цепи
Ag | AgNO, || AgNO, | Ag
a, a,
рассчитывают по уравнению
? = - "-^2 0,059!g , (XIX. 19)
*4). Ag+ + ^0, NO3 «l
где ах и a2 — активности ионов серебра; аг> a{, ^0NO-, VAg+ ~
подвижности аниона и катиона.
Термодинамические функции AG, AS, АН для электрохимических
реакций рассчитывают по уравнениям:
AG=-nFE, (XIX.20)
(XIX-21)
(XIX.22)
(XIX. 23)
-~~, (XIX.25)
Ki
где n — число электронов, участвующих в реакции; F — постоянная
Фарадея; Е — ЭДС.
ЗАДАЧИ С РЕШЕНИЯМИ
1. По данным о стандартных электродных потенциалах меди и цин-
цинка рассчитайте ЭДС элемента, составленного из полуэлементов:
Zn | Zn2+ (aZn2+ =0,02) и Cu2+ | Cu (aCu2+ = 0,3).
Решение. Рассчитаем ЭДС по уравнению
RT aOx
nF «Red
2,3RT 2,3-8,314-298
F 96 487
316
= 0,059 В.
Значения стандартных электродных потенциалов находим в спра
вочнике [М.1: ??u2+|Cu = 0,337 В; ??n2+|Zn = —0,763 В. Так как
медный полуэлемент более электроположителен, то
0,059 аСи2+
? + '
Е = ?си2+ | си — ?zn2+ i zn
g а 2+
0 059 0 3
? = 0,337 + 0,763 + —¦ !g —; ?=1,135В.
2. Для реакции Zn + 2НС1(р-р) = Н2 + ZnCl2(p-p) установите
направление реакции в стандартных условиях по данным о стандарт-
стандартных электродных потенциалах и дайте схему соответствующего элект-
электрохимического элемента.
Решение. Записываем уравнение одной из предполагаемых
электродных реакций
2Н+ + 2е=Н2 (!)
и вычитаем его из общего уравнения, записанного в ионной форме:
Zn+2H+=Zn*++H2
2Н++2е=Н2
Zn2++2e=Zn
Стандартные электродные потенциалы электродных реакций A) и B)
находим в справочнике [М.]: ?х = 0; Е2 = —0,763 В. Так как ?? >
> ?1>. то, согласно (XIX. 1), из уравнения реакции A) вычитаем урав-
уравнение реакции B) и получаем: 2Н+ + Zn = Н2 + Zn2+. Записываем
схему элемента согласно значениям электродных потенциалов:
Pt, Zn | ZnCl21| НС! | H21 Pt
3. Дана схема гальванического элемента
Pt|H2|NaOH|PbO, Pb
Напишите уравнение соответствующей реакции.
Решение. Из схемы следует, что потенциалы электродов Е,
составляющих элемент, определяются следующими веществами: 1) РЬ,
РЬО, ОН~, 2) Н2, ОН~. Выписываем из [М.) уравнения соответствую-
соответствующих электродных реакций и стандартных потенциалов:
РЬО+Н2О+2е=РЬ+2ОН-; ??=—0,758В (электрод 2-го рода), A)
2Н2О+2е=Н2+2ОН~; ?§=—0,828 В (редокси-электрод). B)
Так как Е° > El, из уравнения реакции A) вычитаем уравнение
реакции B) и получаем РЬЮ + Н2 = РЬ + Н2О.
4. Дана схема газового элемента
Pt|H2| HCl|Cl2|Pt
m=0,l />ci
Y±=0,796
317
Вычислите при 298 К потенциал хлорного электрода E^-icl и
ЭДС элемента в целом.
Решение. Потенциал ?С1 ,С|- вычисляем по уравнению
(XIX.8):
*С1. | Cl-=*?r ,ci,-0.059(!gacr-й !gPcli); ?СГС1/=1,358В [М];
?с,г |сг=1,358—0,059 (IgO,1-0,796—1/2 !g2) = l,440B.
Рассчитаем потенциал водородного электрода по (XIX.5):
?н+| н^0- ?н+1н2=°'059(|Й 0,1-0,796)=-0,065В.
После подстановки полученных величин в (XIX.1) вычисляем ЭДС
элемента: ч
?==1,440-(-0,065) = 1,505В.
5. Вычислите ЭДС гальванического элемента
PtlH2iNaOHHH2SO4lH2.pt
m=0,l m=l
при Т = 298 К, Рн2 = 1 атм.
Решение. Записываем уравнения электродных реакций и на-
находим по справочнику соответствующие стандартные потенциалы Е°.
и средние ионные коэффициенты активности у±:
2НгО+2е=Н2+2ОН, ??=— 0,828В; A)
Н++е=1/2Н2, ?§=0 В. B)
По среднеионным коэффициентам активности и концентрациям ионов
рассчитаем их активности:
0-1<0'766=0,0766, aHto=|:
для раствора NaOH пг = 0,1; у± = 0,766; для раствора H2SO4 tn =
= 1; v± = 0,132;
Вычисляем потенциалы электродов Е2 и ?х по уравнениям (XIX.5)
и (XIX.2):
0,059
Е2 = Е«Н+ |На+—|- 0ван+-й '8Ян,);
?H+IH,—0; ?2=°>059(lg 0,21)=0,04В;
?i= Еон~ | н,о | нг = ?он- | н.о | н,-~7~~ (lg аон—У* '8 ^н.) "•
[М.];
318
?1== —0,828—0,059 !g 0,0766= —0,762 В.
Подставляя полученные значения ?х и Е2 в уравнение (XIX. 1),
получаем
?=—0,04+0,762-0,758 В.
6. Рассчитайте ЭДС и напишите схему гальванического элемента,
в котором обратимо протекает реакция по уравнению
2Fes++HAsO2-j-2H2O=2Fe2++H3AsO4+2H+
при 1 атм и 298 К. Активности ионов, участвующих в реакциях:
aFe2+ = 0,005; aFeS+ = 0,02; аНзд5о4 = 0,2; aHAso, = 0,1; ан+ =
= 0,01; аНгО=1 ан,о=1.
Решение. Определим уравнения электродных реакций. Для
этого из уравнения реакции, приведенной в условии, вычитаем урав-
уравнение одной из предполагаемых электродных реакций:
2Fe'+-fHAsO2+2H2O=2Fe2++H3AsO1+2Hl-
2F3++2F2+
H3AsO4+2H++2e=HAsO2+2H2O
В справочнике [М.) находим соответствующие стандартные электрод-
электродные потенциалы: Е\ = E^>AsOt 2H+HAsO = 0,560 В; Е°2 =-- ?рез+>ре2+ "=
= 0,771 В.
Вычисляем электродные потенциалы по уравнению (XIX.2):
0,059 он Д<;О ah+
?Г~ ?H,AsO.,2H+, HAsO,+ 'g" ~2 ;«=2;
" aHAsO2 °H2O
0,059 0,2-0,012
?1=0,560+-^— lg -0,45! В;
Z, U j 1
0,059 aKps+ 0,059 0,02
Подставляя значения ?х и ?2 в уравнение (XIX. 1), получаем Е =
= 0,789 — 0,451 = 0,338 В.
Схема элемента
Pt|H+, H3As04, HAsO2||Fe»+, Fe2+, H2O|Pt.
7. Дана схема гальванического элемента
Pt (T!) Hg | Т!С!О4 || КС11 Hg2C!2 | Hg | Pt
00628 m=0,l m=O,l
при 298 К ЭДС элемента Е = 0,610 В. Вычислите нормальный по-
потенциал амальгамного электрода ??,+ mimer
Решение. Согласно уравнению (XIX.1) для каломельного элек-
электрода Е2 = 0,282 В [М.]. Тогда
?i=?ti + , [Ti] Hg+0,059 lg.
оТ|=шт±=0,1-0,73=0,073.
319
Подставляем полученные значения в уравнение (XIX.1):
0,61=--0,281—?Т1+МТМ —0,059 Ь-^-^
Ti |(TI), Hg • ёо,О628
и вычисляем
0,073
0333В
8. Нормальный потенциал амальгамного натриевого электрода
при 298 К ^Na+|(Na),Hg =—^'^ ^- Нормальный потенциал натриевого
электрода ^a+lNa = —2,714 В. Чем можно объяснить такое большое
различие этих величин?
Решение. Обозначим разность потенциалов
^Na+l(Na), Hg ^Na+|Na = ^S> С)
Es = —0,85 В. Используем диаграмму состояния Hg — Na, из кото-
которой видно, что разбавленные амальгамы натрия (жидкие) представляют
собой раствор интерметаллического соединения Hg4Na в ртути. На
основании этого составляем уравнение электродной реакции Na+ +
Ц-е~ = (Hg4Na)Hg. Заменяем эту реакцию следующими процессами:
Na++e=Na (a); Na+4Hg=Hg4Na (б);
HglNa+nHg->[Hg4Na] (Hg) (В)
Так как изменение энергии Гиббса на зависит от пути процесса,
а только от начальных и конечных состояний системы, то
B)
Поделив уравнение A) на nF, получим
^Na+I (Na) Hg=^Na+ | Na"T^°+^3- C)
•Сопоставление уравнений A) и C) дает
J7S POl /TO
где Е° — мера химического взаимодействия металла и ртути.
9. Для электрода
ОН-, Н2О / На | Pt
ЯНг=1 атм
стандартный потенциал Е\ — —0,828 В. Вычислите, использовав
эту величину, ионное произведение воды Kw при 298 К, если уравне-
уравнение Нерста имеет вид
?, = ?!-0,059 !goOH-. A)
Решение. В любом водном растворе содержатся ионы Н+ и
для водородного электрода уравнение Нерста имеет вид
320
Но поскольку схема приведенного электрода показывает, что ЭДС
зависит от концентрации ионов ОН", то выразим ан+ через а<эн- и
ионное произведение воды К^:
он+=Л:и,/аон-. C)
Тогда, после объединения уравнений B) и C), получим
?1 = ?н+ |нг+°-05918^ - °.°59 '8 «он- D)
Из сопоставления уравнений A) и D) следует
?? =?н+1н2+0-05918^ = -°-825в-
Так как ?H+|Ht = 0, то
0,825
lg Kw =5^592 = 14>014; Kw "'>03' 10~Ч
10. Для электрода С1~ |СиС1, Си стандартный потенциал ф§ =
= 0,137 В. Вычислите произведение растворимости flPcuci при 298 К.
Решение. Согласно уравнению
?»=?2+0,059 lgllP,
где Е° — нормальный потенциал медного электрода, обратимого по
катиону Cu+|Cu, E\ = 0,521 В, получаем
0,137—0,521
lgnP = —-1 =—6,486; ПР = 3,19-10-' (моль/лJ.
0,059 *
11. Рассчитайте константу равновесия реакции Cd2+ + Zn =
= Zn2+ + Cd, если -f °d2+,Cd = —0,403 В; Евгп*+Ы = —0,763 В.
Решение. Константу равновесия вычислим по уравнению
(XIX.14):
[__0,403 — (—0,763I 2
\gK=J ¦ * : = 12,16;
S 0,059
К= 1,45-10-12.
12. Рассчитайте константу равновесия для реакции Cd2+ + Zn =
= Zn2+ + Cd no стандартным термодинамическим величинам для
ионов, приведенным в справочнике [М.].
Решение. Рассчитаем константу равновесия данной реакции
по уравнениям
lgtf=-AG»eaK/2,3/?r и AO^ACS^-G^.
Находим из справочника [М.] ДC° для ионов Zn2+ и Cd2+:
Д0§п2+ = —147,30 кДж/моль; ^G0C|i2 + =—77,794 кДж/моль.
Тогда
И Зак. 767 321
Д0»еак =—147,30 — G7,794) = 69,504 кДж/моль,
отсюда
69 504
lgK=s 2,3.8,314-298 =' >l?'
13. Вычислите ЭДС элемента
Pb| PbSO4||Pbl2|Pb
насыщ. р-р. насыщ. Р-Р
при 298 К, используя данные о произведении растворимости PbSO4
и РЫ2 [M.J.,
Решение. Вычислим ЭДС по уравнению
Средние ионные активности находим из произведения активностей:
nPpbIj =8-10-» (моль/лK; ПРРЬ504 = 1,6- Ю-» (моль/лJ;
0,059
?=—1«
14. Дана схема элемента
Cd (ж)
КС1, LiCl, CdCl2
расплав
Cd—Bi (расплав)
*cd = 0,423
Т = 773 К; ЭДС элемента Е = 0,0329 В. Вычислите для кадмия:
активность Оси', коэффициент активности vc<j; парциальное давление
Р^. Давление насыщенного пара чистого кадмия P«.d = 14,84 мм
рт. ст. (LiCl — это добавка для понижения температуры плавления).
Решение. Элемент — концентрационный. Активность кадмия
в расплаве Cd — Bi находим по уравнению
2.3-8.314-773
? 1в
2.96487 1вво»;
0,0329-2-96487
2,3.8,314-773 =-°'430;
lgacd=T,57; acd = 0,372.
Коэффициент активности кадмия в расплаве вычисляем по уравне-
уравнению
Vcd =acd/*cd = 0.372/0,423 = 0,879.
322
Парциальное давление кадмия рассчитываем по уравнению
pcd = 14,84 • 0,372 = 5,22 мм рт. ст. G,36 • 102 Па).
15. Вычислите полезную работу W реакции Ag + V2CI2 = AgCl,
используя стандартные электродные потенциалы, если Рс\г = 1 атм,
Т = 298 К.
Решение. Полезная работа реакции при Р и Т — const бу-
будет W — —AG. Для электрохимической реакции в стандартных ус-
условиях Л<3° = — tiE<>F. ЭДС элемента равна ?» = ??— ?§, где ?jj и
?? — стандартные потенциалы электродов, составляющих элемент.
Рассматриваемая реакция осуществляется в элементе по схеме
Ag|AgCl | С1- | С12, Pt
"С1- =1 ЯС12 = 1
v ?"=1,360—0,220= 1,14 В; и Г'= л?»/г= 1,14-96 487 = 109,99 кДж/моль.
16. Дана схема элемента
Pb, PbSO4 | Na2SO4 | Hg2SO4| Hg
насыщ. p-p
Уравнение общей реакции электрохимической системы
• Hg2SO4+Pb = PbSO4+2Hg
(ri f*\
ВТ! ' ИС"
пользуя данные таблиц стандартных термодинамических величин.
Решение. Для расчета используем следующие уравнения:
/—)
*S = nF[dTJp'
Atf _/дЕ
Из справочника [М.] находим значения энтропии и теплот образо-
образования для участников реакции:
Соединение ВДж) PbSO, Hg2SO4 Pb .
S», Дж/(моль-К) ... 76,1 148,67 100,83 64,85
Д#?р кДж/моль ... 0 —918,1 —742,0 0
Энтропия реакции
11* 323
будет равна
AS» = 35,19 Дж/(моль.К);
температурный коэффициент ЭДС
35'19 =1,85.10-*В.К;
дТ ]р 2.96487
теплота электрохимической реакции
= —918,1—( — 742,0)= —176,11 кДж/моль.
Тогда ЭДС гальванического элемента будет
(~^°~3) >85' 10==0'968 В
17. По данным о зависимости ЭДС элемента Вестона от температу-
температуры
Е = 1,018—0,041 • Ю-з (/_20) — 9,5-10-' (/—20J+ Ю8 (/ — 20)»
для реакции
Cd + Hg2SO4 (т) + в/3Н2О = 2Hg (ж) + CdSO4-<</3Н2О (т)
вычислите АСр при 298 К.
Решение. Вычисляем (д2Е/дТ)р, дважды дифференцируя урав-
уравнение Е = /(Г). Для 298 К (д2Е/дТ2)Р = —16 • 10~7 В/К. По урав-
уравнению (XIX.23) рассчитываем
ДС^= — 1610-е- 2-9,65-10*. 298 = 92,1 Дж/моль.
18. Температурный коэффициент элемента, работающего за счет
реакции
Pb+Hg2Cl2 = PbCl2+2Hg
(дЕ1дТ)р = 1,45 • 10~4 В/К. Определите количество теплоты, вы-
выделяющейся (поглощающейся) при работе элемента, и сопоставьте
полученную величину с тепловым эффектом реакции при 298 К.
Решение. Согласно уравнению Q = nFT(dE/dT)P теплота об-
обратимого процесса равна Q = 2 • 96487 • 298 • 1,45 • 10~* =
= 8,338 кДж/моль.
Теплота необратимого процесса равна тепловому эффекту химичес-
химической реакции
°, PbCi, = ~359,1 кДж/моль; ДЯ,« HgjC,2 =
= 264,85 кДж/моль и ДЯ^ак =—94,25 кДж/моль.
Сопоставление теплоты обратимого процесса с теплотой необра-
необратимого процесса дает 8,338 • 100/94,25 = 8,85%.
Таким образом, теплота, выделяющаяся при работе элемента, со-
составляет 8,85% от общей убыли энтальпии.
324
19. Дана схема концентрационного элемента
Т1 | Т1С1О, | (Tl) Hg | Pt
ЭДС этого элемента при 298 К равна 0,071 В. Температурный коэффи-
коэффициент элемента (дЕ1дТ)р — 1,8 • 10~4 В/К. Вычислите относительную
молярную энтальпию AHji растворения таллия в амальгаме, если
хт\ = 0,085.
Решение. Вычисляем АН™\ по уравнению
ДЯ™, = 96487 [W—) -Е 1=96 487 B98-1,8-10-*—0,071) =
= —1686 Дж/моль-
20. Вычислите парциальную молярную теплоту разбавления НС1
,Д#на от концентрации /пх = 0,1 до концентрации в предельно раз-
разбавленном растворе пг2. Для расчета используйте данные зависимости
среднеионного коэффициента активности соляной кислоты от темпера-
температуры.
Для раствора с m - 0,1: г
Т, к 293,16 303,16
Y± 0,7985 0,7940
Решение. Подставляя числовые значения в уравнения
,од 1 л 1 i
2.3/?
получаем
АЯнс1 / Ю
/0,794 у А"нс1 /
g(o,7985/ ~ 2,3-8,3141
293,15-303,15
ДЯНС, = —832,62 Дж/моль.
21. Вычислите ЭДС для свинцового аккумулятора при 298 К,
массовая доля серной кислоты 21,4%; mH,so4 = 2,78 моль/1000 г.
Уравнение реакции, протекающей в элементе,
PbO.2 + 2H2SO4+Pb==2PbSO4 (т)+2Н2О
Энергии Гиббса образования веществ, участвующих в реакции, будут
AG? (кДж/моль): Н20(ж) — 234,40; PbSO4 — 814,38; PbO2 — 218,
H.SO^p-p),, — 746,15.
Среднеионный коэффициент серной кислоты: у± = 0,138, давление
пара воды над раствором 21,35 мм рт. ст.
Решение. ЭДС вычисляем по уравнению Е = —AG/nF.
325
Для этого рассчитаем AG по уравнению
ДО = 2 AGf< Н2О + 2 ДО,», Pbs04-AGf», рьо,-2^,, H2SO4-
Вычисляем AGHjO и AGh,so4 по уравнениям:
РН,0 21,35
Н'О = ^о = 23-76 =
Д0НгО=—234,40 + 8,314-298 1пО,897=—237,67 кДж/моль.
Прн расчете AGh,so«(p-p) за стандартное состояние принимаем состоя-
состояние предельно разбавленного раствора (т = 1). Тогда [М.]
н^ю. Й,5О.. (mY±K =
= — 746,15 + 8,314-298 In 4 @,138-3,78K = —749,84 кДж/моль.
Находим AG = 2( — 237,67) + 2 (—814,38) + 218 + 2 • 749,84 =
= —386,42 кДж/моль. Вычисляем Е:
— 386 420
? = — =2,002 В.
2-96 487
22. Вычислите температурный коэффициент (дЕ/дТ)р для свинцо-
свинцового аккумулятора, если массовая доля H2SO4 21,4%; /nH!so4 =
= 2,78 моль/1000 г.
Уравнение реакции, протекающей в элементе,
PbO2 + 2H2SO4+Pb = 2PbSO1(T) + 2H2O
Энтропии участников реакции равны S0 [Дж/(моль • К): Н20(ж) —
69,96; PbSO4 — 148,67; РЬОа — 71,92; Pb — 64,80; HjSO^p).—
18±1.
Парциальная молярная теплота растворения воды Д#н,о ~
-= 196,65 Дж/моль. Парциальная молярная теплота разбавления qep-
ной кислоты AWH,so4 = —2824,5 Дж/моль. Среднеионный коэффи-
коэффициент активности H2SO4 У± = 0,138, давление пара воды над раст-
раствором PHta = 21,35 мм рт. ст.
Решение. Рассчитываем (дЕ1дТ)х по уравнению
дЕ \ AS
где л =2.
дТ }р л 96 487'
Вычисляем AS по уравнению
326
Согласно уравнению
298 ^lneH,SO4'
195,65
SH2O = 69,96+-r-:— 8,314-2,3 lgO,897 = 72,27 Дж/(моль-К),
2824,5
SHiSOt=\8+——¦ 8,314-2,3 Ig4 @,138-2,78K =80,87 Дж/((моль-К)
н тогда
AS = 2-148,69+2-72,27—71,92— 64,80—2-80,87 =
= 143,42 Дж/ (моль- К),
143,42
7410-
23. Определите прн Т = 298 К Е° цепи
Pt|, H,(r) ;;HBr|AgBr(T)|Ag
Р — 1 атм
для которой получены следующие значения потенциалов:
m 0,0056125 0,010021 0,015158 0,02533 0,03006
Е 0,34594 0,31265 0,29225 0,26718 0,25901
Решение. В гальваническом элементе протекает реакция
y2H2(r)+AgBr(T)-Ag (т)+Н++Вг~
Уравненне Нернста для приведенной цепи
=Е«-— ln(a_a+)=?o_-JL_.ln(Y±mJ=?o___lnY±__
2/?У
так как пг ->- 0, а у± ->- 1, то -^— lnv± ->- 0 и
Пересчитаем приведенные данные в условин задачн н запншем в виде:
m 0,0056125 0,10021 0,015158 0,02533 0,03006
У~т 0,0715(9 0,1001 0,12312 0,15915 0,17338
E+{2RTF) In m . . 0,0749 0,0762 0,0771 0,0782 0,0790
327
Построим_график зависимости Е + BRT/F) In m от Ут и, экстраполи-
экстраполируя к Vm — О, получаем для данной цепи Е° — 0,0722 В. Можно по-
построить также график зависимости
2RT 2RT
?° = ? + —— lnm+ —— \ау'±,
где у'± вычисляют из предельного уравнения Дебая — Гюккеля. В
данном варианте Е° — Е" Ф 0, поэтому наблюдается отклонение от
предельного закона. В этом случае строят график зависимости от т, а
не от У^пг, так как liry' (и, следовательно, ?° — Е') приблизительно
линейно зависит от т.
ЗАДАЧИ
1. Напишите уравнения реакций, протекающих в следующих эле-
элементах :
Си, zn|ZnSo4 •:; Cuso41 си (i)
Си|СиС12 ;•: А1СЦА1С1 (т) | Ag, Си B)
Pt I Cd I CdSO4:: Hg2SO41 HgSO4(T) | Hg | Pt . C)
Pt | H, | H2SO4:; Hg2SO4 f Hg2SO4(T) | Hg | Pt
Си, Си (ОНJ(т) | NaOH(p-p) | H2 | Pt D)
H2O
2. Как должны быть составлены элементы и полуэлементы, чтобы
в них протекали реакции:
Cd+CuSO4=CdSO4+Cu A)
2Ag++H2=2Ag+2H+ B)
Ag+ + I--AgI(T) C)
Ag(T) + I(T)=Agl(p-p) D)
H2+C12=2HC1 E)
Zn+2Fe8+=Zn2++ Fe2+ F)
H++OH-=H2O G)
Li+l/2F2=Li++F- (8)
H2+»/2O2=H2O (9)
3. Рассчитайте ЭДС элемента
4. Напишите уравнение реакции для элемента
Pb!Pb(NO3J;;AgNO3|Ag
Вычислите ЭДС. Необходимые данные возьмите из справочника [М.].
328
5. По данным стандартных электродных потенциалов установите,
осуществима ли практически в стандартных условиях при 298 К в
водном растворе реакция
Ag(T)-|-Fe3+=Fe2++Ag+
Рассчитайте константу равновесия реакции.
6. Вычислите ЭДС элемента
Pt|Ti4+, Ti3+ ::Sn4+, Sn2+1 Pt
*l 3l 4+—' aSn2+=1
Напишите уравнение реакции элемента; установите, самопро-
самопроизвольна или нет данная реакция, если Е^*+ т,з+ = 0,04 В, а
7. Элемент составлен из нормального каломельного и ферроферрит-
ного электродов:
Pt, Hg, HtjaCl3 | KCl •: FeCl2, FeCl3, HC1 | Pt
mKCI=0.1 реС12=таРеС1з=0-01
mHCl=0-1
ЭДС этого элемента при 298 К равна 0,446 В. (Соляная кислота до-
добавлена для предотвращения гидролиза.) Принимая коэффициенты
активности ионов Fe2+ и Fe3+ равными соответственно 0,75 и 0,87, рас-
рассчитайте ?° для ферроферритного электрода, содержащего 0,1 М НО.
8. Определите потенциал электрода
Pt, Н„| Н+-
Рцг=1 атм ан+=0,1
9. По данным о стандартных электродных потенциалах [М.] для
элемента
Мп|МпС12|С12, Pt
РС1г=1 атм
вычислите ЭДС элемента в стандартных условиях: установите, какой
из п'олуэлементов электроотрицателен; определите, можно ли за счет
изменения концентраций ионов или давления газа изменить знак ЭДС
полуэлементов; определите, чем характеризуются полуэлементы, на-
направление ЭДС которых зависит от концентрации раствора и давления
газа, насыщающего электрод.
10. Определите ЭДС при 298 К:
для элемента
Pt | Н2 / Н+ ;•: хингидрон, Н+ | Pt
РНг=2 атм aH+=Q,l (насыщ. р-р) ан +=2
для элемента
Pt| хингидрон, СН3СООН •:• KCl |Hg2Cl2(T), Hg / Pt
(насыщ. р-р) ССН3СООН=0-1 аСГ='
Стандартный электродный потенциал хингидронного полуэлемента
равен 0,6994 В. Константа диссоциации уксусной кислоты К — 1,75 X
X 10~5.
329
Определите рН соляной кислоты, если для элемента
Pt|Hg, Hg2Cl2| KC1 :• хингидрон |Pt
m=0,l (насыщ. p-p)
HC1 е=0,1 моль/л
E = 0,301 В; Т = 298 К.
11. Рассчитайте стандартный электродный потенциал полуэлемента
Ag|Ag(T)|Kl
ar=l
по данным о произведении растворимости Agl [M.] и стандартном элект-
электродном потенциале Ag, Ag+.
12. По ЭДС элемента
Cd|CdI2|Ag|(T)|Ag
при 298 К определите активность иодида кадмия в растворе (Е =
= 0,286 В).
13. Стандартная ЭДС элемента
Pt, H2| HC11 Hg2Cl2 (т) | Hg | Pt
рн„ m- v±
при 298 К равна 0,2680 В. Вычислите ЭДС при следующих услови-
ях:РНг (атм) — 0,01; 0,1; m — 1 • 10-» (моль/1000 г); у± — 0,809;
0,966 соответственно.
14. По стандартным электродным потенциалам рассчитайте при
298 К константы равновесия реакций:
Pu3++3Li+-Pu»+3Li + ; Fe2++S2-=Fe»+S»
15. Вычислите при 298 К стандартные электродные потенциалы
полуэлементов
Fe3+|Fe, T13+|T1, Cu+|Cu
если известны [М.] стандартные электродные потенциалы для электро-
электродов Fe2+ |Fe; Fes+ |Fe2+; T1S+|T!+; T1+ |T1; Cu2+ |Cu и константа равно-
равновесия реакции Си + Си2+ = 2Си+
/Са=4и+/аСи2+ = 6'31-10~'-
16. ЭДС элемента
Zn|ZnSO4 •;•; ZnSO4 |Zn
m,=0,01 моль/1000 г m,=0,\ моль/1000 г
при 298 К равна 0,0235 В. Можно ли в данном случае пренебречь диф-
диффузионным потенциалом? (Сравните вычисленную ЭДС с приведенной
и сделайте соответствующий вывод.)
17. Для элемента
Zn/ZnSO4 ;; ZnSO4 |Zn
mi=0,05 тг=0,005
при 298 К Е = 0,0185 В. Вычислите у± в концентрированном раст-
растворе, если в разбавленном растворе у± = 0,477.
330
18. Рассчитайте для 298 К ЭДС элемента
Pt | Н2 | СН3СООН | NH4OH, Н20 | Н2 | Pt
Рн = 1 атм е=0,1 моль/л е=0,01 моль/л Рц =1 атм
Данные о константах диссоциации уксусной кислоты и гидроксида
аммония возьмите из справочника [М.].
19. Определите коэффициент активности для 1 М H2SO4, если
для 0,05 М H2SO4 средний коэффициент активности ионов равен 0,34,
плотность 1 М раствора равна 1,060 г/см3 и ЭДС элемента
Pt | Н, | H2SO4, Hg2Pt |Hg2SO4(T),
Р^г = 1 атм с = 0,05 моль/л
имеет следующие значения: для 0,05 М H2SO4 Е = 0,7546 В; для 1 М
H2SO4 E = 0,6744 В.
20. Элемент составлен из амальгам цинка разных концентраций.
Вычислите ЭДС, приняв, что azn = czn- Укажите направление пере-
перемещения ионов Zn2+ в растворе, если при 298 К сг = 0,00337 моль/л и
с2 = 0,00011 ммоль/л.
21. Для элемента
Pt | Hg (Pb), PbSO41 H2SO41 H2 | Pt
00192 m = 0,02 PHj=l атм
при 298 К ЭДС равна 0,1238 В. Стандартный потенциал амальгамного
электрода ^so'2~|pbso (рьше = —0,353 В. Вычислите активность и ко-
коэффициент активности свинца в амальгаме.
22. Для элемента
Pt (Tl)Hg| Т1С1О4 ;•: КО / Hg2Cl2> Hg, Pt
л:т] = 0,085 m=0,l " m = 0,l
при 298 К ЭДС равна 0,61 В. Активность таллия в амальгаме а-п =
— 0,0628. Вычислите стандартный потенциал амальгамного электрода.
23. Для элемента
Ag | Zn | ZnCl | AgCl (t), Ag
m=0,555 моль/1000 г НгО
используя стандартные электродные потенциалы, напишите уравнение
реакции и вычислите при 273 К изменение энтальпии АН, количество
теплоты Q, выделяющееся при обратимом протекании реакции в галь-
гальваническом элементе, и Е° элемента, если при 273 К Е = 1,125 В,
(дЕ/дТ)Р = —0,0004 В/К.
24. Для гальванического элемента
Ag (т) | AgCl (т) | НС1 | Cl2> Pt
а= 1 Pci= ' атм
ЭДС как функция температуры определяется уравнением
?=0,977 + 5,7-10-* C50—/) —1,48-10-' C50—/)*.
Вычислите АСр, сравните полученную величину с найденной в спра-
справочнике [M.J.
331
25. Напишите уравнение реакции, протекающей в гальзскшческом
элементе
Ag J Ag Br (т) | КВг | Hg2 Br2 | Hg | Pt
насыщ. p-p
По данным
Г, К 293 298 303
Е, В 0,0663 0,0684 0,0705
и стандартным термодинамическим величинам [М.] вычислите теплоту
при обратимом и необратимом протекании электрохимической реакции.
26. Для элемента, в котором протекает реакция по уравнению
Vi H2(r) + AgCl (T) = Ag
существует следующая зависимость ЭДС от температуры:
Г, К 273 283 293 298 303 313 323 333
Е, В 0,236 0,2310,225 0,222 0,219 0,212 0,204 0,196
Представьте схему элемента; вычислите графическим дифферен-
дифференцированием при 298 К (дЕ/дТ)Р; AG0; АН0, AS0; АЛ, AU°, W и Q
обратимой реакции; сведите полученные данные в таблицу; проверьте
полученный результат с помощью уравнения
? = 0,2224— 645-10-» (Г—298)— 3,284-10-» (Г—298)*.
27. Дана схема концентрационного элемента
Tl / T1C1O, / (Tl) Hg
m = 0,l jcT] = 0,085
ЭДС этого элемента при 298 К равна 0,071 В. Температурный коэффи-
коэффициент элемента (дЕ/дТ)Р = 1,8 • 10~4 В/К. Вычислите для таллия,
растворенного в ртути, а<т1), Y(tu, АОть AS™, и дайте заключение о
типе отклонения раствора Tl — Hg от закона Рауля.
28. Дана схема концентрационного элемента
Pt | Hg (Tl) / T12SO4 / (Tl) Hg | Pt
молярная доля Tl 10,02% раствор молярная доля Tl 4,93%
При 7\ = 298 К ?i = 0,02948 В, при Т2 = 303 К?, = 0,02997 В.
Вычислите дифференциальную теплоту разбавления A#Ti таллия при
293 К.
29. В гальваническом элементе
Cd (т) | CdCl2 (расплав), КС!, NaCl.LiCl | (расплав) Cd— Sn | Cd
ХЫ = 0.258
при 756 К ЭДС равна 0,0324 В, P?d = 9,2 мм рт. ст. Вычислите:
а) активность кадмия в расплаве; б) давление пара кадмия над рас-
расплавом; в) установите характер отклонений от закона Рауля.
30. Собран электрохимический элемент, в котором одним из элект-
электродов служит жидкий таллий, другим — сплав таллия и свинца. Элект-
Электролитом является смесь расплавленных солей LiCl — КС1 — Т1С1.
332
При 711 К, когда молярная доля таллия в сплаве достигнет 0,20,
ЭДС элемента станет равной 0,115 В. Вычислите активность, коэффи-
коэффициент активности и давление пара для сплава. Давление насыщенного
пара чистого таллия Pxi — 5 • 10~5 мм рт. ст.
31. Для элемента
РЬ (ж) / PbCI, (LiCl, KC1) / (жидкий расплав) Pb— Bi /Pb
расплав
при 700 К получено хРЪ = 0,23; Е = 59,76 • 10~3 В; dEldT = 64,4 X
X 10~в В/К; Ррь = 5,Ы0~5 атм. Вычислите активность, коэффициент
активности, давление пара над расплавом для свинца, а также AGpt>,
А//рь, ASpb.
32. Вычислите ЭДС элемента
Pt | Н, | НС1 :: КС1 | Hg2Cl2 | Hg | Pt
Рцг=\ атм /п=1 насыщ. р-р
для 298 К с учетом диффузионного потенциала. Необходимые данные
возьмите из справочника [М.] и таблицы в Приложении.
33. Рассчитайте константы равновесия следующих реакций:
(ж)
при 298 К на основании стандартных электродных потенциалов.
34. ЭДС гальванического элемента при 298 К
Pt / На | НС1 / С12 | Pt
1 атм т = 0,01
зависит от давления С12
Я, атм 1 50 100
Е, В 1,5962 1,6419 1,6451
Определите фугитивность С12 и коэффициент фугитивности при
50 и 100 атм.
35. В топливном элементе протекает химическая реакция Н2 +
+ Ю2 = Н20(ж). Какое максимальное значение электрической энер-
энергии будет получено на 1 моль Н2 и каково значение максимальной
ЭДС?
36. При Т = 298 К для цепи
Zn (т) / Zn SO4 :•• PbSO4 (т) / Pb
р-р Н,0
были получены следующие данные:
RT
m
У~т — lnm, В Е, В
0,001000 0,03162 —0,17745 0,59714
0,005000 0,07071 —0,13611 0,56598
333
1) напишите химические уравнения реакций, протекающих в цепи;
2) напишите уравнение Нерста для цепи, включающее т и средний
коэффициент активности ZnSO4 .у± (примите, что PbSO4 нерастворим);
3) линейной экстраполяцией, графически или численно, определите
Е° цепи; 4) определите у± в 0,005 м растворе по известной ЭДС.
37. Укажите условия, при которых справедливо каждое из следую-
следующих уравнен™: 1) Е = 0; 2) Е° = 0; 3) К = Ко + const c\ 4) lg y± =
= —0,509]/"/; 5) t+ = U+/(U+ + ?/_); 6) as± = 4т*у3±; 7) с =
= 1000 (хД0); 8) ЛЯ = —nF[E — г(|?)р ]; 9) t. = EJE.
38. При потенциометрическом титровании 10 мл раствора урана
(III) 0,09064 н. К2Сг207 получены следующие данные:
^КгСг,О7' мл
0,0
0,05
0,15
0,25
0,30
0,35
0,40
Е, мВ
—570
-565
—560
—490
—440
—70
50
^К,Сг2О7, мл
0,50
2,5
4,4
6,5
8,7
10,3
10,4
Е, мВ
65
90
ПО
120
130
140
150
^К,Сг,О,- мл
10,5
10,6
10,8
10,9
11,1
11,55
Е. мВ
170
350
370
390
420
440
Постройте графики зависимости Е от V и -гт> от V (среднее между по-
последующими объемами) и определите общий объем К2Сг207, прибав-
прибавленного в точках эквивалентности U (IV) и U (VI).
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Для концентрационного элемента, составленного из металла А
в растворах электролита В с концентрациями mi и т2 моль/1000 г,
рассчитайте ЭДС при 298 К. Активность вычислите по среднему ко-
коэффициенту активности, взятому из справочника [М.], или (для раз-
разбавленных растворов) по ионной силе. Для элемента, составленного
из водородного электрода в растворе электролита С с концентрацией
т3 моль/1000 v и каломельного полуэлемента с концентрацией КС1
/п4 моль/1000 г, вычислите ЭДС и рН раствора, содержащего электро-
электролит С. Диффузионную ЭДС не учитывайте. При 298 К стандартный
потенциал каломельного электрода (аа- = 1) равен 0,2812 В, а
ионное произведение воды 1,008 • 10~14. Константы диссоциации сла-
слабых электролитов найдите в справочнике [М.].
334
ва-
шта
«I
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
Вещество
А
Со
Со
Ni
Ni
Си
Си
Си
Си
Си
Си
Zn
Zn
Zn
Zn
Zn
Zn
Ag
Ag
Ag
Ag
Cci
Cd
Cd
Cd
Pb
в
CO(NO3J
CO(NO3J
NiSO4
NiSO4
CuCl2
CuCl2
CuCl2
CuCl2
CuSO4
CuSO4
ZnCl2
ZnCl2
ZnCl2
ZnCl2
ZnSO4
ZnSO4
AgNO3
AgNO3
AgNO3
AgNO3
Cd(NO3J
Cd(NO3J
CdSO4
CdSO4
Pb(NO3J
0,1
0,02
0,1
1,5
1
0,2
2
0,02
0,1
0,01
0,005
0,5
0,5
1
0,01
3
0,1
0,2
0,1
1
0,2
2
0,005
1
0,002
0,7
0,7
0,7
0,2
2
0,05
0,06
0,6
0,5
1
1
0,01
0,02
3
0,1
0,002
1
2
3
0,5
0,6
0,7
2
0,2
0,02
с
NH4OH
NH4OH
HCOOH
NH4OH
HC1
HC1
NaOH
NaOH
HBr
HBr
CeH6OH
CeH6OH
H2O
H2O
CeH5OH
CeH6OH
CH3COOH
CH3COOH
CH3COOH
HCOOH
NaOH
NaOH
H2SO4
H2SO4
HCOOH
0,5
1,0
0,3
1
0,01
3
2
8
0,95
1
0,9
0,1
0,3
0,7
0,1
1
0,3
0,1
1,4
0,1
0,5
17
1
ni.
0,35
0 4
0,03
0,3
0,1
0,5
1,5
4
0,45
0,2
0,25
3
3,5
1
1,5
4
0,2
0,3
0,7
2
2,5
3
3,5
2,5
PH
атм
0,50
1,00
0,50
0,50
0,20
2,00
2,00
2,00
0,20
0,20
0,50
1,00
1,00
1,00
0,50
0,50
0,10
0,10
2,00
2,00
3,00
3,00
3,00
0,10
2,00
2. Для окислительно-восстановительного элемента типа
Pt | А, В Л С, D | Pt
по стандартным электродным потенциалам полуэлементов [М.] напи-
напишите уравнение и вычислите константы равновесия реакции окис-
окисления — восстановления. Вычислите ЭДС элемента при 298 К. Ука-
Укажите, можно ли практически изменить направление реакции за счет из-
изменения концентраций компонентов. Считайте, что яно= 1> вн =
= 0,2.
№ ва-
варианта
1*
2*
3*
4*
5
6
7
8
9
А
МпО4-
MnOf
МпОг
MnOjT
МпОг
Fe3+
Fe(CN)S"
Сг3+
Со3+
в
Мп2+
Мп2+
Мп2+
Мп2+
Мп2+
Fe2+
Fe(CN)|~
Cr2Of
сУ+
с
Сг3+
H3As04
МпО2
Sn«+
уз+
Сг3+
Со»+
Т13+
Fe(CNKe-
D
Сг2+
HAsOj
Мп2+
Sn2+
Сг2+
Со2+
Т1+
Fe(CN)J~
аА
0,10
0,005
0,009
0,02
0,018
0,005
0,06
0,006
0,04
ЙВ
0,02
0,015
0,014
0,01
0,005
0,15
0,06
0,1
0,009
ЙС
0,01
0,001
0,001
0,08.
0,1
0,1
0,04
0,08
0,06
0,01
0,03
0,07
0 15
0,15
0,001
0,005
0,002
0,001
335
Продолжение табл.
№ ва-
эианта
10*
11*
12
13*
14
15*
16
17*
18
19
20
21
22
23*
24*
25*
А
Со3 +
Со3 +
Си2+
Си2+
H3As04
H3As04
V3+
Sn4 +
Sri4-
Sn4+
Ce4+
Ce4+
T13+
UO2+
UO|"
PU4 +
В
Co2 +
Co2 +
Cu+
Cir
HAsO2
HAsO2
V2+
Sn2+
Sn2+
Sn2-
Ce3+
Ce3+
T1 +
U4+
U*+
риз +
С
MnO4
Cr3+
UOf +
Sn4 +
MnO2
V3+
T13 +
H3As04
pu4 +
T13+
Co3 +
Co3+
Ce4 +
Fe3+
Fe3+
UO1 +
D
Mn2+
Cr2 +
U4+
Sn2 +
Mn' +
V2 +
T1 +
HAsO2
риз+
T1 +
Co2 +
Co2+
Ce3+
Fe2+
Fe2+
U4 +
aA
0,1
0,012
0,007
0,14
0,08
0,15
0,016
0,06
0,08
0,1
0,08
0 01
0,009
0 012
0,04
0,02
aB
0,006
0,01
0,016
0,009
0,04
0 005
0,007
0,008
0,06
0,05
0,007
0,02
0,04
0,1
0,08
0,10
aC
0,01
0,005
0,002
0.002
0,02
0,005
0 001
0,04
0,007
0,02
0 02
0,01
0,02
0,01
0 06
0,08
0,007
0,06
0,05
0,08
0,007
0,01
0,1
0,003
0,005
0,01
0 005
0,04
0,02
0,1
0,003
0,001
•В реакции участвуют Н+ и Н2О.
3. Для реакции, протекающей обратимо в гальваническом элемен-
элементе, дано уравнение зависимости ЭДС от температуры. При заданной
температуре Т вычислите ЭДС Е, изменение энергии Гиббса AG, из-
изменение энтальпии АН, изменение энтропии AS, изменение энергии
Гельмгольца АЛ и теплоту Q, выделяющуюся или поглощающуюся
в этом процессе. Расчет производите для 1 моль реагирующего ве-
вещества.
X
Q,
га
а га
tl
1
3
5
7
9
11
13
15
17
19
21
23
24
25
S-,"
273
343
278
273
273
303
293
273
273
333
273
363
353
298
вари-
та
2
4
6
8
10
13
14
16
18
20
22
323
363
313
298
363
273
323
363
353
353
298
Реакция
CeH4O2 + 2Н+ = CeH4(OHJ + 2е
Zn-j-2AgCl = ZnO2 + 2Ag
Zn + Hg2SO4 = ZnSO4 + 2Hg
Ag + Cl- = AgCl+e
Cd + Hg2SO4 = CdSO4 + 2Hg
Cd+2AgCl=CdCl2 + 2Ag
Cj _j_ pbCL = CdCl 2 + Pb
2Hg+ZnCl2 = Hg2Cl2 + Zn
2Hg + SO j ~ = Hg2SO4 + 2e
Pb + 2AgI ¦-= Pbl2 + 2Ag
,2Hg+2Cl-=Hg2Cl2 + 2e
2Ag + Hg2Cl 2 = 2 AgCl + 2Hg
Hg2CI2+2K0H=Hg20+2KCl +
+H2O
рь 4-Hg2a 2=Pbd2+2Hg
Уравнение E=!O)
? = 0,6990—7,4-10~4(Г—298)
?=1,125-4,02-10-4Г
?=1,4328—1,19-10-3(Г—228)
? = 0,2224—6,4-10- ЦТ— 298)
?=1,0183—4,06-10-5G'—293)
? = 0,869-5,5-Г0~4Г
? = 0,331—4 8-10-4Г
f=- 1+9,4- 10-5(Г—288)
? = 0,6151—8,02-10-4(Г—298)
? = 0,259— 1,38-10-4Г
? = 0,2438— 6,5- 10-4(Г—298)
? = 0,556 + 3,388-10~4Г
? = -0,0947 + 8,37-10-4Г
? = 0,5353+1,45-10~4Г
336
4. Для
элемента
Cd (т) |
(жидкий) Cd—Sb | (Cd)
CdCl2) ZnCl2
расплав
при 753 К получены значения ЭДС для различных концентраций Cd
в сплаве. Вычислите активность, коэффициент активности Cd и давле-
давление его паров над расплавом. Давление пара чистого кадмия Р° —
= 9,01 мм рт. ст.
1
О
3
4
5
варианта
11
12
13
14
15
21
22
23
24
25
0,796
1,818
0,750
0 676
0,588
Е-\03, В
3 31
7,20
11,56
18,96
29,69
№ варианта
6
7
8
9
10
16
17
18
19
20
*Cd
0,559
0,434
0,401
0,375
0,344
Е- 10', В
33,85
52,00
56,51
59,90
63,95
5. Для гальванической цепи
Me | МеС1п | Cl2, Pt
Вычислите ЭДС при температуре Т. При расчете используйте дан-
данные таблиц стандартных термохимических величин [М.]
№ ва-
варианта
1
2
3
4
5
8
7
8
Me
Ag
Cd
Са
Со
Cs
Ва
К
Li
МеС1п
AgCl
CdCl2
СаС12
CoCl2
CsCl
BaCl2
KC1
LiCl
т. к
700
800
1000
1000
900
1200
1000
800
№ ва-
варианта
9
10
11
12
13
14
15
Me
Mg
Na
Pb
Sn
Cr
Tl
La
MeCln
MgCl2
NaCl
PbCl2
SnCl2
CrCl3
T1C1
LaCl3
т. к
900
1000
700
500
1300
700
1100
ГЛАВА XX
АДСОРБЦИЯ
Основные уравнения и символы
[К., с. 504—508; Г., т. I, с. 443—446, 484]
Адсорбция газа при Т = const описывается уравнением изотер-
изотермы адсорбции Лэнгмюра
(XX.1)
1-\-ЬР '
337
где а — количество газа, адсорбированного 1 г адсорбента или 1 см2
его поверхности; ах — максимальное количество газа, которое может
адсорбировать 1 г адсорбента (или 1 см2 его поверхности) при данной
температуре; Ь — константа адсорбционного равновесия; Р — равно-
равновесное давление газа. Уравнение (XX. 1), выраженное через степень
заполнения 0, имеет вид
Q = bP/(l+bP). (XX.2)
Степень заполнения определяют по соотношению
Q = a/aaB. (XX.3)
Изотерма адсорбции Лэнгмюра может быть выражена через объем по-
поглощенного газа:
V = VmbP(l+bP). (XX .4)
Константы в уравнении Лэнгмюра вычисляют по соотношениям
— = — + — Р (ХХ.5)
a (Woo (Zoo
или
T = 7~+tV' (XX-6)
где V — объем адсорбированного газа; Vm — объем адсорбированного
газа, полностью покрывающего поверхность 1 г адсорбента; объемы
V, Vm приведены к нормальным условиям (Т = 273 К, Р = 1 атм).
Площадь поверхности S 1 г адсорбента
5'
где s — площадь, которую на поверхности адсорбента занимает одна
молекула адсорбата.
Адсорбция из раствора описывается уравнением Лэнгмюра вида
a = aacbc/(l+bc), (XX.8)
где с — равновесная концентрация адсорбированного вещества в раст-
растворе.
Более строгим уравнением адсорбции служит уравнение
Р= ft(i-в) A+W) ' (ХХ>9)
где Ъ — константа, учитывающая силы притяжения между молекула-
молекулами адсорбата.
Для средних заполнений поверхности адсорбента используют урав-
уравнение изотермы Фрейндлиха
x/m=bcn (XX. 10)
или
lg*/m = lgft = n lgc, (XX. 11)
338
где х — количество адсорбированного вещества; т — масса адсорбен-
адсорбента; b и п — константы. ч
Предполагая многослойную адсорбцию, Брунауэр, Эммет и Теллер
вывели уравнение изотермы адсорбции (БЭТ):
(xx. i
V (Р.-Р) VmC ^ VmCPs
где V — общий объем адсорбированного газа; Vm — объем адсорби-
адсорбированного газа, если вся поверхность адсорбента покрыта сплошным
мономолекулярным слоем; Р — равновесное давление адсорбирован-
адсорбированного газа; Ps — давление насыщенного пара; С — константа при
данной температуре. Согласно уравнению (XX. 12) зависимость
Р Р
m от р~ на графике дает прямую линию с тангенсом угла накло-
P) P
s) s
на v~c-
Дифференциальную теплоту адсорбции Qa вычислите по уравнению
• (ХХЛЗ)
Q. = R^~r^^-. (XX.I4)
I 1 — I 2 Г\
где Pi, P2 — равновесные давления для двух состояний при двух тем-
температурах Т1 и Т2 при одном и том же количестве адсорбированного
вещества а или при одной и той же степени заполнения.
ЗАДАЧИ С РЕШЕНИЯМИ
1. При адсорбции аргона коксовым углем при 194,7 К получены
следующие результаты:
Я, Па Э1.Э-108 130,5-103 290-103
Р, мм рт. ст 24 98,4 218
а, мг/г 5 15,4 24
Рассчитайте постоянные в уравнении Лэнгмюра.
Решение. Согласно уравнению Лэнгмюра а/ах является уг-
угловым коэффициентом прямой зависимости между Р/а и Р, a \lbax —
отрезком, отсекаемым этой прямой на оси ординат. Вычисляем величи-
величины Р/а:
Р, Па 31,9-103 130,5-103 290-1-03
Р/а 6,4 • 103 8,7-103 12,1 • 103
По полученным данным строим график, отложив на оси абсцисс Р,
а на оси ординат — PJa. Как видно из графика (рис. 40),
1/о = A1 — 7)/B40—60) = 0,0222.
Отсюда а = 45,1/fta^, = 5,7 • 103. Следовательно, Ь = 1/5,7 • 45 =
= 0,004.
339
10
то
200 300
Р-Ю'3,Па
Рис. 40. Зависимость Р/а от Р
>. h В 8 10 12 И 16 1820722tt?628P/Ps-l0z
Рис. 41. Зависимость P/[V(P.—P)\
от Р/Р.
2. Объем газообразного азота Vm при 1,04 • 10* Па G50 мм рт. ст)
и 273 К, необходимый для покрытия образца силикагеля мономоле-
мономолекулярным слоем, 129 мл/г. Вычислите площадь поверхности 1 г
силикагеля, если молекула азота занимает площадь 16,2 • 10~20 м2.
Решение. Площадь вычисляем по уравнению
@,129 лт-1) F,02.1023 моль-») A6,2-10~
—
S =
=560
22,4л-моль-1
3. При 77,5 К на серебряном катализаторе была снята изотерма ад-
адсорбции криптона, которая характеризуется следующими данными:
Р, мм рт. ст 0,0992 0,1800 0,3686 0,5680 0,6843
Объем адсорбированного газа
1 кг катализатора, см3/г . . 0,0127 0,0150 0,0176 0,0190 0,198
Рассчитайте постоянные в уравнении БЭТ, удельную поверхность
катализатора, приняв площадь одной молекулы криптона S^r —
== 19,5 • 10~20 м2, плотность криптона do°c = 3,739 г/л, давление
насыщенного пара криптона Ps = 2,57 мм. рт. ст.
Решение. Экспериментальные данные сведем в таблицу:
Р, мм рт. ст.
0,0992
0,1800
0,3686
0,5680
0,6843
V. см»/г
0,0127
0,0150
0,0176
0,0190
0,0198
PIP,
0,0385
0,0700
0,143
0,220
0,2660
Рв~Р
0,4708
2,3900
2,2014
2,0020
1,8857
На основании полученных данных строим график в координатах
Р Р
-р- (рис. 41). Из графика находим tga:
vm-c
=68;
(о)
340
отрезок, отсекаемый на оси ординат, равен
7^ = 0,5. (б)
Решая совместно уравнения (а) и (б), получаем С = 136; Vm =
- 0,0146 см3/г. Чтобы вычислить удельную поверхность, отнесем
Vт к 1 моль:
0,0147-3,739. Ю-3
Vm = 0,0146cM3/r = — — =6,5-10-' моль/г;
83,6
тогда удельная поверхность будет равна
ЗАДАЧИ
1. Количество К азота (отнесенное 273 К и 1,01 • 105 Па), адсор-
адсорбированное 1 г активированного угля при 273 К и различном давлении,
следующее:
Я, Па 51,8-102 16,0-103 33,0-103 45,3-103 74,2-103
V, см3-!--1 . . . 0,987 3,04 5,08 7,04 10,31
По приведенным данным постройте изотерму Лэнгмюра и вычислите
константы.
2. Какой объем (л) аммиака при 298 К и 1,01 • 105 Па может ад-
адсорбироваться на поверхности 45 г активного угля, если вся поверх-
поверхность полностью покрыта NH3? Поверхность 1 г активированного
древесного угля 1000 м2. Дламетр молекулы NH3 равен 3 • 10~8 см.
Молекулы касаются друг друга в плоскости так, что центры четырех
соседних сфер расположены в углах квадрата.
3. Вычислите площадь поверхности катализатора, 1 г которого при
образовании монослоя адсорбирует 103 см3 азота (при 1,01 • 105 Па
и 273 К). Адсорбция измеряется при 78 К, эффективная площадь, за-
занятая молекулой азота на поверхности, 16,2 • 10~20 м2.
4. Вычислите константы в уравнении Лэнгмюра и х/т при 23,8 х
X 10* Па (опытное значение х/т — 30,8 мм3), если зависимость адсорб-
адсорбции азота на слюде от давления следующая:
Я, Па 2,8-10-' 6,1-10-' 17,3-10"'
х!т 12,0 19,0 28,2
соотношение х/т выражено в мм3 газа при 293 К и 1,01 • 10s Па;
газ адсорбирован 24,3 г слюды, площадь поверхности которой
5750 см2).
5. Удельная поверхность активированного угля 400 м2/г. Плот-
Плотность метанола при 288 К 0,7958 г/см3. Определите максимальное ко-
количество метанола, адсорбированное 1 г угля при 288 К. если спирт
адсорбируется с образованием мономолекулярного слоя.
341
6. Определите постоянные в уравнении Лэнгмюра, если известны
значения Р и а при 273 К:
Р, Па 1,35-10* 2,63-10* 3,98-10* 5,30-104
а, моль/г 0,150 0,275 0,380 0,470
Р, Па 6,63-10* 7,94-10* 9,25-10* 1,06-105
а, моль/г 0,550 0,620 0,685 0,745
7. Определите постоянные в уравнении Лэнгмюра и адсорбциюСО2
на слюде при 7 Па, если при 155 К Р и а имеют значения:
Я, Па 4,8-10-' П,9-10-' 20,6-10 ' 41,0-10-' 98,0-10-'
а-1010, моль/см3 . 1,22 1,95 2,55 3,24 3,62
8. Оксид углерода СО адсорбируется на слюде при 90 К. Давление
и объем адсорбированного газа при нормальных условиях имеют зна-
значения:
Я, Па 75 139 600 727 1050 1400
а-103, см3 10,8.2 13,39 17,17 17,60 18,89 19,60
Площадь поверхности слюды равна 6,24 • 103 см2. Определите пло-
площадь, приходящуюся на одну молекулу СО.
9. Оксид магния адсорбирует кремнезем из воды. Постройте гра-
график в логарифмических координатах по данным:
MgO, ч. на 1 млн
SiO2 остаток, ч. иа 1 млн. . .
SiO2 {удельный), ч. иа 1 мли.
Вычислите константы в уравнении Фрейндлиха. Определите коли-
количество оксида магния (части на 1 млн.), которое необходимо, чтобы
уменьшить остаток кремнезема до 2,9 ч. на 1 млн.
10. Вычислите количество водорода (измеренного при стандартных
условиях), которое адсорбируется 100 мл адсорбента, если его пло-
площадь поверхности 850 м2, причем 95% поверхности является актив-
активной. Диаметр молекулы водорода 27 нм. Адсорбированные молекулы
касаются друг друга в плоскости так, что центры четырех соседних
сфер расположены в углах квадрата.
11. Газы А и В стремятся занять места на поверхности адсорбен-
адсорбента. Покажите, что для поверхности, занятой молекулами газа, степень
заполнения равна
0
26,2
0
75
9,2
17,0
100
6,2
20,0
200
1,0
25,2
12. Рассчитайте удельную поверхность катализатора, если адсорб-
адсорбция криптона при 77,5 К характеризуется следующими данными:
Р, мм рт. ст 0,447 0,645 0,159 0,450
Объем адсорбированного газа
1 г катализатора, см3/г . . 0,4185 0,4619 0,5234 0,6313
342
Масса катализатора 13,03 г. Площадь, занимаемая одной молеку-
молекулой криптона, Skt = 19,2-10~20 м2, плотность криптона do°c =
= 3,739 г/л, давление насыщенного пара криптона Ps = 2,57 мм
рт. ст. = 342,65 Па.
13. При температуре 298 К на активированном угле была снята
изотерма адсорбции бензола. Получены данные:
Р/ Р*
0,1 0,2 0,3 0,4 0,5 0,6
0,19 0,23 0,35 0,42 0,5 0,6
Плотность бензола ^20°с = 0,878 г/л, площадь, занимаемая одной
молекулой бензола в монослое, Sc,h4 = 30,3-100 см2. Рассчитайте
удельную поверхность активированного угля.
14. При 77,5 К на платиновом катализаторе была снята изотер-
изотерма адсорбции криптона. Получены данные:
Р, мм рт. ст
Объем адсорбированного газа
1 г катализатора, см3/г . .
0,149
0,2763
0,200
0,3040
0.308
0,3524
0,491
0,4098
Рассчитайте постоянные в уравнении БЭТ и удельную поверхность
катализатора, если площадь, занимаемая одной молекулой криптона,
Skt = 19,2-Ю" м2, плотность криптона do°c = 3,739 г/л, давление
насыщенного пара криптона Ps = 2,57 мм рт. ст. = 342,65 Па.
15. Давление при адсорбции некоторого количества NH3 одним
граммом угля составляет 1,4- 104Па при 303 К и 7,44-10* Па при 353 К-
Вычислите теплоту адсорбции при данной степени заполнения.
16. При нормальных условиях 40 см3 СО2 адсорбируются 1 г уг-
угля при 303 К под давлением 8-10* Па и при 273 К под давлением
2,27-104 Па. Определите теплоту адсорбции.
17. Определите теплоту адсорбции оксида азота на фториде бария
по следующим данным:
233 К
Р, Па
3,53-103
4,65-103
6,70-103
8,55-103
12,5-103
17,3-103
18,6-103
30,3-103
35,3-103
47,3-103
¦ а, см3
3,17
3,70
4,40
5,09
6,14
6,70
7,35
8,48
9,07
9,92
273 К
Р, Па |
7,51 -103
11,15-103
17,3-103
23,9-103
33,9-103
44,0-103
53,0-103
59,0-103
60,7-103
82,0-103
а, см'
1,81
2,40
3,01
3,73
4,24
5,30
5,86
6,16
6,34
7,30
343
18. Определите теплоту адсорбции N2, CO, СН4, СО2 и NH3 на
древесном угле, если теплота адсорбции водорода равна 10,46•I03
Дж/моль. Температура кипения указанных веществ:
Вещество
Т, К . .
н2
20,4
N2
77,3
СО
83,1
СН4
111,7
СО2
194,6
NH3
240,0
Для решения воспользуйтесь приближенной закономерностью
АН/Т„[Т,К = const.
МНОГОВАРИАНТНАЯ ЗАДАЧА
Объем V вещества [отнесенный к 273 К и 1,01 -105 Па A атм)] ад-
адсорбированного 1 г адсорбента при 273 К и различном давлении, при-
приведен в таблице: 1) постройте изотерму адсорбции V = f (Р) и PIV =
= / (Р); 2) опишите изотерму адсорбции с помощью уравнения Лэнг-
мюра; 3) определите адсорбцию (м3/г) при максимальном заполнении
адсорбента; 4) определите степень заполнения адсорбента при давле-
давлении Pi, 5) определите, при каком давлении газа степень заполнения
адсорбента составит 0,4.
М> ва-
варианта
1
2
3
4
5
т, К
273
273
273
273
273
Адсорбент
Уголь
»
»
BaF2
Адсорбат
N2
СО2
СО
NH3
СО
Я,.10~, Па
2,0
2,0
5,0
5,0
5,0
Р-10-3, Па
1,62
5,30
17,30
30,70
44,50
4,20
8,10
11,70
16,50
24,00
9,80
24,20
41,30
60,00
72,50
10,50
21,60
42,70
65,60
85,20
11,30
24,40
44,50
61,00
82,50
У-106. М3/г
0,31
0,99
3,04
5,10
6,90
12,73
21,20
26,40
32,20
38,60
2,53
5,57
8,43
11,20
12,85
60,40
90,30
115,70
127,00
132,40
2,04
3,72
5,30
6,34
7,30
344
Продолжение табл,
Л« ва-
варианта
6
7
8
9
10
1!
12
т. к
273
194,5
194,5
194,5
194,5
273
293
Адсорбент
Уголь
»
Адсорбат
н2
N,
сн4
со
Аг
с,н4
с2н4
Р,. 10-*, Па
2,0
2,7
5,0
0,5
3,0
5,0
2,0
Р-10-3, Па
27,60
43,30
57,40
72,20
86,10
1,67
8,83
20,00
36,30
52,00
25,6
36,7
47,8
60,5
77,0
4,00
5,34
9,65
16,65
19,80
3,22
7,25
13,15
17,25
39,50
9,35
12,45
22,5
42,6
82,5
2,0
4,27
10,57
29,5
91,5
V-W. м3/г
0,447
0,698
0,915
1,142
1,352
3,47
13,83
23,00
27,94
33,43
15,2
19,1
22,3
25,3
28,4
15,8
19,05
27,7
34,1
39,95
5,09
10,02
15,56
18,81
29,14
39,5
42,8
49,9
56,5
64,5
10,4
20,8
30,5
42,4
55,2
КОМПЛЕКСНЫЕ ЗАДАЧИ
1. Определите константу равновесия Кр реакции (А) при 298 К
и в диапазоне температур от 300 до 1000 К через 100 град.
№ вари-
варианта
1
2
3
Химическая реакция (А)
СН4 + Н2О = СО + ЗН2
CH4-t-2H2O = CO2 + 4H2
со+н2о=со2+н.2
N° вари-
варианта
4
5
6
Химическая реакция (А)
2СН4+О2 = 2СО + 4Н2
2СН4 = СН = СН + ЗН2
СН4+СО2 = 2СО+2Н2
345
2. Начертите график Кр = f (T) в диапазоне от 198 до 1000 К.
3. Начертите график в координатах lg/О — A/Г) для диапазона
температур от 298 до 1000 К.
4. Для заданной реакции начертите график зависимости выхода
конечного продукта х-от константы равновесия при условии, что ис-
исходная смесь стехиометрическая.
5. Определите выход продукта реакции в диапазоне температур от
298 до 1000 К, если давление равновесной смеси 1,0133-10* Па, и по-
постройте график зависимости выхода продукта реакции от температуры
при указанном давлении.
6. Сделайте заключение о смещении равновесия, если к исходной
смеси добавлен азот, который не участвует в химической реакции.
7. Определите коэффициенты активности всех веществ, участвую-
участвующих в реакции, при давлении 2,0-107 Па и температуре максимально-
максимального выхода продуктов реакции, если равновесное давление 1,0133- 105Па.
8. Вычислите К.у при температуре максимального выхода продук-
продуктов реакции и давлении 2,0-107 Па.
9. Вычислите равновесный выход продуктов реакции при давлении
2,0-107 Па.
10. Определите тепловой эффект процесса перехода из исходного
в равновесное состояние при температуре в диапазоне от 300 до 1000 К
и постройте график Qp = f (T).
11. Определите парциальные давления газов в равновесном со-
состоянии системы при условиях максимального выхода продуктов ре-
реакции при равновесном давлении 2,0-105 Па.
12. Определите температуру, до которой необходимо охладить рав-
равновесную систему, с тем чтобы из нее начало конденсироваться одно
из реагирующих веществ.
ГЛАВА XXI
ФОРМАЛЬНАЯ КИНЕТИКА
Основные уравнения и символы
[К., с. 626—637; Г., т. 2, с. 13—25, 38—41]
Химическая кинетика рассматривает скорости химических реак-
реакций и параметры, от которых эти скорости зависят. Наиболее важны-
важными параметрами являются концентрация, температура и давление. При
кинетическом исследовании прямым или косвенным способом изме-
измеряют изменение концентрации веществ во времени. Порядок реакции —
строго экспериментальная величина, показывающая характер зависи-
зависимости скорости реакции от концентрации.
346
Для реакций, описываемых стехиометрическим уравнением
VA,Al + VA2A2 + VAjA3+ ... — V^Bi+V^Bg + V^B-.,,
истинная скорость w выражается соотношением
VA, d' VA2
vB At vB d/ '
где vA>, vb. — стехиометрические коэффициенты; А—исходные ве-
вещества; В — продукты реакции.
Зависимость скорости реакции от концентрации исходных веществ
(кинетическое уравнение в дифференциальной форме) выражается за-
законом действующих масс
«=*#,<?. (XXI.2)
где k — константа скорости реакции: пь п2, ... — числа, указываю-
указывающие частный порядок реакции по компоненту Аь А2, соответственно.
Полный порядок реакции п равен
л = л1-1-лг. (XXI.3)
Средняя скорость реакции w
ш /i), (XXI.4)
где (^2 — *i) — интервал времени, за которое в течение реакции кон-
концентрация реагента изменяется от сх до с2. Для различного типа ре-
реакций закон действующих масс будет выражаться различным образом.
Для реакции нулевого порядка дифференциальная форма кинетиче-
кинетического уравнения имеет вид
=k, (XXI.о)
at
dx
— =k, (XXI.6)
а интегральные формы кинетического- уравнения будут:
* = (';о.а|-са|)//- (ХХ1-7)
k=x/t, (XXI.8)
cA.=cOt д. — kt, (XXI.9)
/1/2 =0,5c0i KJki, (XXI.10)
где Co.a. — исходная концентрация реагента А;; сд. — концентра-
концентрация реагента Аг в момент времени t; x — число молей вещества А, про-
прореагировавшее к моменту времени t, х — co,\i — с\ ; t\/2 — время
347
полураспада (время, в течение которого исходная концентрация веще-
вещества уменьшается вдвое).
Для реакций первого порядка (А-+- продукты) дифференциальная
форма кинетического уравнения имеет вид
—3T = kcA' (xxi.ii)
¦^7=*(CO.A-*). (XXI-12)
а интегральные формы кинетического уравнения:
2,3 cOiA
, 2-3 , со,а
T (ХХ1Л4)
С0. А~Х
,°*М' (XXI. 15)
/%=0,693/й. (XXI. 16)
Для реакций второго порядка (Aj + А.г -*• продукты), если началь-
начальные концентрации реагентов одинаковы со,а, = со,д2, дифференциаль-
дифференциальные формы кинетического уравнения принимают вид
^у- = *Ф (XXI. 17)
*(J
(XXI. 18)
а интегральные формы кинетического уравнения:
1/1 1 \
*=—— — - , (XXI.19)
(XXI.20)
IF7v
0, А (С0, А~Х)
С0А . 21)
С0, А Ы
348
Для реакций второго порядка (Ах -j- A2-> продукты), если началь-
начальные концентрации реагентов неодинаковы: cS.a, Ф со,а, то дифферен-
дифференциальные формы кинетического уравнения принимают вид
i^_=fccAiCAf, (XXI.23)
-^7-=й(с0,А1-^)(с0.А2-^). (XXI.24)
а интегральные формы кинетического уравнения будут:
2,3 1 с, с. ,
Jlg Al °'А' , (XXI.25)
g
' С0. А, ~С0, А. СА, С0, А,
2,3 1 (с0 . —х)с
g
C0,A,~"c0,A2 (с0, А2~*)С0, А,
(XXI.26)
Для реакций третьего порядка (Ах + А2 + А3->- продукты), если
начальные концентрации реагентов одинаковы: со,а, = со,д2 =с0)Аз, то
дифференциальные формы кинетического уравнения принимают вид
^A_=feA, (XXI.27)
*(K
(XX 1.28)
а интегральные формы кинетического уравнения будут:
(XXI.29)
(XXI.30)
(XXI.31)
Определение порядка реакции методом Оствальда—Нойеса (инте-
(интегральный метод):
*g ('%/'%) +1> (XXI.32)
где ^i'/2 — период полураспада, соответствующий начальной концен-
концентрации с0I, t'{/2 — период полураспада, соответствующий начальной
концентрации c0j2 (вместо времени, за которое реагирует половине ве-
вещества, брать время, за которое реагирует 1/3 (^i/з), 1/5 (U/,) исход-
исходного вещества й т. д).
* Иногда начальные концентрации с0 А обозначают буквой а, а с0 А —
буквой Ь.
349
Определение порядка реакции методом Вант-Гоффа (дифференци-
(дифференциальный метод):
llll), (XXI.33)
где wlt w2 — истинные скорости реакции, соответствующие начальным
концентрациям сод и с0>2; пг — частный порядок по компоненту, на-
начальная концентрация которого с0.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Превращение пероксида бензоила в диэтиловый эфир (реакция
первого порядка) при 333 К прошло за 10 мин на 75,2 %. Вычислите
константу скорости реакции.
Решение. Напишем уравнение первого порядка и подставим
в него соответствующие значения:
2,303 / а \ 2,303 100
k lg =—! lg =0,^303 lg 4,03 =0,2303-0,606 =
\ а х j 10 248
k lg=lg
/ \ а —х j 10 24,8
= 0,140 мин.
2. Тростниковый сахар (биоза) в присутствии ионов Н+ гидроли-
зуется водой, распадаясь на две монозы (глюкозу и фруктозу) по
уравнению
Cl2H22Oii+H2O=C6H12O6+C6H12O6
Раствор тростникового сахара вращает плоскость поляризации
света вправо, а смесь глюкозы и фруктозы —¦ влево. Угол вращения
в обоих случаях пропорционален концентрации растворенных веществ.
При 298 К в 0,5 н. растворе НС1 при большом избытке воды изменение
угла вращения а плоскости поляризации раствора тростникового
сахара во времени t было следующее:
/, мин 0 176 с»
а, град 25,6 5,46 —8,38
Рассчитайте константу скорости реакции и количество сахара (%,)
которое инвертируется в течение 236 мин. Определите угол вращения
к моменту времени t = 236 мин.
Решение. Обозначим угол вращения в начальный момент а0,
после окончания инверсии а^ и наблюдаемый в данный момент аг.
Так- как от начального до конечного момента угол вращения изменит-
изменится на а0 — аЯ1 то эта величина пропорциональна начальной концен-
концентрации сахара с0.д. концентрация же сахара в данный момент со. а — х
пропорциональна изменению угла вращения от данного момента at до
конца инверси ам, т. е. пропорциональна at — ах. Реакция инверсии
сахара в присутствии большого избытка воды идет по первому поряд-
порядку. Рассчитываем константу скорости реакции по уравнению (XXI.14),
заменив со,д и со.д — х пропорциональными величинами а0 —¦ ах
и Щ — а«:
2,3 ао-а„
350
Подставив в это уравнение заданные значения t, a0, ах и at, по-
получим
2,3 25,16—(—8,38) 2,3 33,54
^-[F 'g 5,46-(-8.38) == In 'g -ГЗТ4-0'005028-
Определяем количество сахара, которое инвертируется в течение
236 мин. Для этого, подставив в уравнение (XXI.14) вместо kx и t со-
соответственно 0,005028 и 236 мин, получим
с0 А 0,005028-236
lgr^=—п—=0'5152-
Откуда получаем количество гидролизованного сахара
——=3,275 и jc=0,6948 с0> А или х=0,6948-100=69,48 %.
со, \~~х
Определяем угол вращения, соответствующий t = 236 мин.
Когда все начальное количество сахара проинвертирует, изменение
угла вращения составит 25,16° — (—8,38°) = 33,54°. Так как при
t = 236 мин остается 30,52 % сахара, не подвергшегося гидролизу,
то изменение угла вращения, вызванное превращением этого количе-
количества, будет соответственно меньше. Обозначим его через г, тогда
z 30,52 33,54-30,52
=¦ , z= ¦—= 10 23°.
33,54 100 100
Так как г = at — (8,38°), то щ = г — 8,38° = 10,23° — 8,38° =
= + 1,85°, т. е. реагирующая смесь спустя 236 мин после начала ре-
реакции будет иметь правое вращение, равное 1,85°.
3. Для реакции А = В + С + D, протекающей в газовой фазе
при V = const, определено общее давление в начальный момент
t = 0 Р = Ро и по прошествии времени t = t' P = Р\ Выразите кон-
константу скорости через общее давление, приняв, что реакция первого
порядка.
Решение. По уравнению идеальных газов сд = PJRT, тогда
Выражаем парциальные давления РА вещества А через общее
давление Р. Для этого записываем, согласно уравнению Дальтона,
Р = Ра + Рв + Рс + Pd; вводим величину х (убыль давления ве-
вещества А в ходе реакции),- тогда Рд = Р0,а — х. Начальное давление
в системе равно давлению вещества А: Р0,а = Ро- Обозначим Р% —
— Рс = Pd = х. Тогда общее давление в момент времени t будет
Р = Ро — х + Зх = Ро + 2лг. Выражаем х через Р и Ро: х —
= (Р — Ро)/2. Подставляем значение х в уравнение Рд = Ро — х и
выражаем парциальное давление реагента А через общее давление:
А 2 t 8 ЗР„-Р
351
4. В течение реакции СН3СООСН(г) -» С2Н4 + Н2 + СО общее
давление изменяется следующим образом:
/, мин О 6,5 13,0 19,9
Р, Па 41589,6 54386,4 65050,4 74914,6
Покажите, что реакция является реакцией первого порядка, и вычисли-
вычислите среднее значение константы скорости при температуре опыта
298 К (V = const).
Решение. Если реакция относится к реакциям первого поряд-
порядка, то константа скорости, вычисленная по уравнению k = l/t\n (c0—с)
для любого момента времени, должна оставаться постоянной. В мате-
математическом уравнении концентрации исходного вещества в начальный
и данный моменты можно заменить парциальными давлениями этого
вещества в те же моменты времени, так как давление газа пропорцио-
пропорционально его концентрации (при Т = const). Приведенные давления (за
исключением первого) — это суммарное давление всех четырех газов,
а для вычисления константы скорости необходимо знать только дав-
давление ацетона.
Пусть в момент t Рс2н. = х, тогда РНг = РСо = х и Р(Сн3)гсоо -=
— Ро — х, где Ро — начальное давление ацетона. Общее давление в
любой момент Р = Ро — х + Зх = Ро + 2х, откуда
2 " ° 2
Заменяем соотношение концентраций соотношением давлений:
с0 = ftp ^ 2Р0
с Рр-л ЗРр-Р '
тогда
2,3 2Р0
lg
k =
ЗЯ0— Р
Подставляем значения давления в системе для данного времени и рас-
рассчитываем константу скорости:
2 3 2-41589,6
k = —:— lg : = 0,025986;
6,5 К 3-41589,6-54386,4
2,3 2-41589,6
k=—:— lg : =0,02569;
13,0 3-41589,6—65050,4
2,3 2-41598,6
k =—:—lg : = 0 02590;
19,9 6 3-41589,6—74914,6
kcv = 0,02586.
Константа скорости постоянна в пределах неизбежных ошибок опыта
Следовательно, эта реакция является реакцией первого порядка.
352
5. Скорость реакции (C2H5KN + CH3I -+¦ [(C2H5KCH3N] I в нит-
нитробензоле определялась при 298 К, причем получены следующие дан-
данные:
t, с 1200 1800 2400 3600 4500 5400
х, моль/л 0,00876 0,01065 0,01208 0,01392 0,01476 0,01538
где t — время; х — количество триэтиламина и метилиодида, проре-
прореагировавших за время t. Начальные концентрации амина и йодистого
алкила равны 0,0198 моль/л. Рассматриваемая реакция — второго по-
порядка. Определите константу скорости.
Решение. Для реакции второго порядка, в которой реагируют
два вещества с одинаковыми концентрациями,
х 0,00876
~ tco(co—х) ' ~~ 1200-0,0198-0,01104 ~" '
k = 0,0334; 0,0327; 0,0329; 0,0332; 0,0328; 0,0325. Среднее значение
k = 0,0329 л-моль-^с-1.
6. Константа скорости реакции омыления этилацетата едким на-
натром при 283 К равна 2,38, если концентрацию выражать в моль/л,
а время — в минутах. Вычислите время, необходимое для омыления
50 % этилацетата, если смешать при 289 К: 1 м3 0,05 н. раствора эти-
этилового эфира уксусной кислоты с 1) 1 м3 0,05 н. NaOH; 2) с 1 м3
0,1 н. NaOH; 3) с 1 м3 0,04 н. NaOH. Реакция — второго порядка.
Решение. Концентрации эфира и щелочи равны, поэтому ис-
используем уравнение (XXI.20):
kc0Ai (со, а,~х)
Так как объем смеси равен 2 м3, то сА, = 0,025 г-экв/л, а х = 0,0125
г-экв/л. Подставив эти величины и ? в выражение для t, получим
0,0125 1 0,0125
~~ ¦ := 16,8 мин.
0,025@,025—0,0125) 2,38 0,025-0,0125
Концентрация эфира не равна концентрации щелочи, т. е. реаги-
реагирующие вещества взяты не в эквивалентных количествах, поэтому
воспользуемся соотношением (XXI.26):
(_ 2'3 ' l (cq,a-*)cq,a,
* с с (с*)с
*2 с0. А,~с0,А, (с0,Аг~*)с0, А,
Обозначив через со,а, начальную концентрацию эфира, а через
со.а, — начальную концентрацию щелочи, получим со,а, = 0,025
г-экв/л, со,а2 = 0,05 г-экв/л, х = 0,0125 г-экв/л. Подставив эти дан-
данные в выражение, полученное для t, находим
2,3 1 @,025—0,0125H,05
2~ 2,38 0,025—0,05 g @,05—0,0125H,025 ~ ' МИН'
12 Зак. 767 353
Концентрация эфира со,а, = 0,025 г-экв/л, х = 0,0125 г-экв/л,
а концентрация щелочи со.а, = 0,02 г-экв/л, тогда
2,3 1 @,025—0,0125H,02
/ 1 1я - ' ¦ - ' =24 2 мин
* @0200125H025
* 2,38 0,025—0,02 @,02—0,0125H,025
7. Для химической реакции А -+¦ В константа скорости к = 0,5,
исходная концентрация со.а = 1 моль/л. Вычислите степень превра-
превращения вещества А за время t = 1 ч, если реакция идет по нулевому,
первому, второму порядку. Как зависит степень превращения от по-
порядка реакции?
Решение. Для реакции, протекающей по нулевому порядку,
согласно уравнению (XXI.7)
1,5=—^-; а = 0,5.
Для реакции, протекающей по первому порядку, согласно уравнению
(XXI.14)
2,3 1 0,5
0,5=—— lg- ; ——=—lg(l—а); а=0,39.
1 1 —а ?,л
Для реакции, протекающей по второму порядку, согласно урав-
уравнению (XXI.20)
' ^ "- ' с = 0,33,
1 \ соA-а) с„ Г '1-а'
Чем выше порядок, тем меньше степень превращения, тем медленнее
идет реакция,
8. Раствор уксусноэтилового эфира при c0>i= 0,01 г-экв/л 293 К
омыляется 0,002 г-экв/л (сол) раствором едкого натра за tt — 23 мин
на 10 %. За какое время (ti, t% и т. д.) тот же раствор эфира омыляет-
омыляется на 10 % растворами NaOH концентрации с0K = 0,004, с0>4 = 0,006,
с0>5 = 0,008 и св1„=0,1 г-экв/л?
Решение, Обозначив а = сод, Ь — с02, х = 0,1сод и восполь-
воспользовавшись уравнением (XXI.26), получим
1_ 2,3
? lg
e,j—O,lcOll)cOll
_ 2,3 @,01—0,1.0,001H,002
~ 23@,01-0,002) 'g @,002-0,1.0,001) 0,01 ~3' '9 л/(г"эк
Подставляя в уравнение для к его значение, а вместо со,а значения
Со,з> Am. c0<s, и сол, вычисляем t%, ta, tt и tt:
2^3 @,01—0,1-0,01H,004
3> = /2 <0,01 — 0,04) g @,004—0,1.0,01H,01 '
/2 = 9,5 мии и т. д.
354
9. Кинетику реакции взаимодействия тиосульфита с «-пропил-
бромидом S2O!~ + RBr-v RSSO3" + Вг~ изучали при 310,5 К- Кон-
Концентрацию иона S2O§~ определяли через различные интервалы вре-
времени t титрованием. Для титрования использовали V мл 0,02572 н.
раствора 12 на одну порцию A0,02 мл) реакционной смеси. Начальная
концентрация тиосульфата, присутствующего в избытке, составляла
0,100 моль/л. Получены следующие данные:
/, с . . . . 1110 2010 3192 5052 7380 11232 78840
К, мл 35,20 33,63 31.00 29,86 28,04 26,01 22,24
Вычислите константу скорости реакции второго порядка.
Решение. Для реакции второго порядка
*2_ 0, At (,c0, At х)
где со,а, — концентрация S2O*i" при t = 0;
V0,02572 37,62-0,02572
10,02
= 0,0967 моль/л.
К моменту времени t = 0 некоторое количество S2O3~ уже было из-
израсходовано, так что концентрация S2C>3~ станет меньше исходной
концентрации @,100 моль/л). Рассчитаем начальную концентрацию
«-С3Н7Вг, приняв, что при t = 78 840 с достигнуто равновесие:
Общее количество S2O|~, израсходованное на я-С3Н7Вг _
C7,63—22,24H,02572
= 1^02 = 0,0395 моль/л.
Рассчитаем концентрацию реагентов в момент времени t= 1110 с:
Количество S,O|~, израсходованное на н-С3Н7Вг _
(с0, А,-х) = '- р——
C5,20—22,24) 0,02572 12,96-0,02572
моль/л;
10,02 10,02
Количество иода, израсходованное на S2O§~ _
у
ЧоГ
35,20-0,02572
моль/л,
10,02
(со,а, — х) — концентрация «-С3Н7Вг в момент времени t; (со,а,— х) —
концентрация S2O3~ в момент времени t. Тогда
0,0395 C5,20-0,02572)/10,02 _ 0,0395-35,20
~ 0,0967 A2,96-0,02572)/10,02 ~~ 0,0967-10,96 ==1'110'
12* 355
Разность начальных концентраций реагентов будет
с0,А,— с0,А, =0,0967—0,0395 = 0,0572 моль/л.
Отсюда константа скорости реакции будет
fe = 0,0363 lg 1,110 = 0,0363.0,0453 = 0,001644;
^ = 0,001644; ft2 = 0,001644; fes=0,001649, fe4 = 0,001536;
ft5 = 0,001618; fte = 0,001618.
Среднее значение k = 0,001635 л-моль^-с-1.
10. Пероксид водорода в водном растворе разлагается по уравне-
уравнению 2Н2О2->-2Н2О + О2. Кинетику этой реакции исследовали ти-
титрованием проб одинакового объема перманганатом калия. Определи-
Определите порядок реакции всеми возможными способами и вычислите сред-
среднее значение константы скорости этой реакции, пользуясь приведен-
приведенными данными:
Время от начала опыта, мин 0 5 10 25 20 30 40
Объем 0,0015 М КМпО4, израс-
израсходованный на титрование
2- 10-е мз ПрОбы, см' . . . .23,6 18,1 14,8 12,1 9,4 5,8 3,7
Решение. Определяем порядок реакции и вычисляем констан-
константу скорости интегральным графическим методом, предположив, что
здесь возможен первый или второй порядок. Объем раствора перман-
ганата, израсходованный на титрование, прямо пропорционален кон-
концентрации пероксида водорода сн,о2 « Укмпо4- Данные для построе-
построения графиков:
/, мин 0 5 10 15 20 30 40
К, см» 23,6 18,1 14,8 12,1 9,4 5,8 3,7
A / И) -102 4,3 5,5 6,7 8,3 10,6 17,0 27,0
lg(K0/K)-10 1,15 2,03 2,90 3,99 6,09 8,05
На рис. 42, й представлены зависимости (MY) = / (t) (кривая 2)
и lg (VOIV) = f (t) (кривая /). To, что lg (Vo/V) = f (t) выражается
прямой, дает основание заключить, что исследуемые реакции — пер-
первого порядка.
Константу скорости вычисляем по уравнению k = 2,303 tg a =
= 1-2,3/50 = 0,046 мин. Дополнительно подтверждаем результат,
найдя производную dV/d? на графике (рис. 42, б) V = f (t) и вычислив
константу скорости по уравнению (XXI. 1) dWd? = kV. Для t =
= 20 мин объем перманганата калия составляет V = 9,4 см3. По ки-
кинетической кривой для этого объема находим производную:
d V 0 439
t 0439 kj
0 439
=tga = 0,439, отсюда k=—j- = 4,64.10-!
94
=tga = 0,439, отсюда k=j
d / 9,4
356
мин
1
0,4
OX
V
ojs
0,1
0,1
'25l
20
15
10
5
Ч\
«
10
40 ?,
О Ю 30 Г.мин
5
Рис. 42. Зависимость количества перманганата калия, израсхо-
израсходованного на титрование, от времени реакции
11. Для изучения разложения щавелевой кислоты в концентри-
концентрированной серной кислоте при 323 К приготовили 1/40 М раствор ща-
щавелевой кислоты в 99,5%-ной серной кислоте. Через определенные
промежутки времени t из смеси отбирали пробы и определяли объем
раствора перманганата калия V, необходимый для титрования 10 мл
Н2С2О4. Получены следующие данные:
t, мин . ... 0 120 240 ¦ 420 600 900 1440
V, мл 11.45 9,63 8,11 6,22 4,79 2,97 1,44
Определите порядок реакции и константу скорости.
Решение. Предположим, что реакция имеет первый порядок:
я — -—"" in ;
t с
, —0,00144; fea = 0,00145; fe4 = 0,00145; ^ = 0,00150; k6 = 0,00140.
Среднее значение: 0,00145 мин-1.
12. Для изучения взаимодействия между ионами Вг~ и СЮ~:
СЮ- + Br~ -v ВгО- + CI- при 298 К смешивали 100 мл 0,1 н.
NaCIO, 48 мл 0,5 н. NaOH и 21 мл дистиллированной воды. К сме-
смеси добавляли 81 мл 1 %-ного раствора бромида калия. Через опреде-
определенные промежутки времени t отбирали пробы и определяли в них со-
содержание иона ВгО". Результаты анализов:
/, мин
Концентрация
ВгО- -10-», моль/л
0 3,56 7,65 15,05 26,00 47,60 90,60
0 0,0560 0,0953 0,1420 0,1800 0,2117 0,2360
Концентрации NaCIO и КВг в реакционной смеси при t = 0 были рав-
равны 0,003230 и 0,002508 моль/л соответственно, рН раствора 11,28.
Определите порядок реакции и константу скорости.
357
Решение. Предположим, что реакция имеет второй порядок:
k = Tie '~с Гlg ?'A'J°'A'-v) ;
cOiAi =[NaClO]0= 0,003230; cOiAj = [KBr]0 = 0,003230;
2,3 2,508-Ю-3 @,003230—0,000560) _
= 3,56-7,22-Ю-4 g 3,230-Ю-3 @,002508—0,000560) ~
= 23,42 л-моль • мии-1;
^ = 23,42; fe2 = 23,30; ?3=23,52; ?4 = 23,90; Д:5 = 23,80; fte = 23,80.
Среднее значение 23,62 л-моль~1-мин-1. Как показывает вычисление
констант k, реакция имеет второй порядок.
13. Для изучения кинетики реакции
Н,с—сн, + н,о ——~- н,с—сн,
2\/ 2 II
о но он
готовили раствор с исходными концентрациями 0,007574 моль/г хлор-
хлорной кислоты и 0,12 моль/л окиси этилена. Ход реакции контролиро-
контролировали дилатометрически (измерение объема раствора как функция вре-
времени). При 293 К получены следующие данные:
t, мии 0 30 60 135 300 оо
Показания дилато-
дилатометра .... 18,48 18,05 17,62 16,71 15,22 12,29
Определите порядок реакции по этилену и константу скорости реакции.
Решение. Предположим, что реакция имеет первый порядок:
cOAi = 18,48—12,29 = 6,19;
cOiAt_*= 18,05—12,29 = 5,76;
2,3 с„ , 2,3 6,19
*- —'* -'g-i^''o'o-'''--';
COtA|-, irgi^.;
fe! = 2,40; fea = 2,46; fe3=2,49; fe4 = 2,49.
Среднее значение 2,46-10~3 мин. Отсюда следует, что реакция имеет
первый порядок.
14. При взаимодействии брома и этилового спирта были получены
следующие данные:
t, мии 0 4
с,, моль/л 0,00814 0,00610
с2, моль/л 0,00424 0,00314
Определите порядок реакции.
358
Решение. Определяем порядок реакции согласно уравнению
lg(ACl/A/)-lg(Aca/A/)
Ig^i—!gc8
Подставляем необходимые данные. Так как Ac/At = w — средняя ско-
скорость реакции, то и концентрации сх и сг также необходимо взять
средние:
0,00814 + 0,00610
С2 =0,00369;
0,00814—0,00610 0,00424—0,00314
lg
n= lg 0,00712 —lg 0,00369 =0,964 wl.
Следовательно, изучаемая реакция первого порядка.
15. Вычислите порядок реакции для стадии, определяющей ско-
скорость пиролиза диборана В2Нв (г) при 373 К из следующих данных по
скорости увеличения давления в системе как функции концентрации
диборана:
cBfH<-108, моль-л 2,153 0,433
Скорость увеличения давле-
давления-104, моль/(л-ч) .... 7,4 0,73
Решение. Запишем для реакции n-го порядка
dc
kc, lg( ^
at \ a t
Откуда
;t_lg(-dc/d/I-ig(-dc/d/J
Igci — lgc2
Скорость увеличения давления пропорциональна dc/dt. Тогда
lg7,4-lg0,73 44~ —
П ' ~ 2 '
44
П Ig2,153—lgO,433 ' ~ 2
16. При 298 К взаимодействуют эквивалентные количества иода и
натриевой соли фенилпропиловой кислоты CeH5C = CCOONa по урав-
уравнению
C,HBCsCOONa + l8 —* C,HelC = ClCOONa
За ходом реакции следили по убыванию концентрации иода, оттитро-
вывая его периодически раствором гипосульфита натрия.
359
Были проведены два опыта и получены следующие результаты:
Опыт I Опыт 2
Время, с О 29 0 34,5
Объем Na2S2O3, израсходован-
израсходованный на титрование 250 см3
пробы, см3 24,96 8,32 21,00 7,00
Определите порядок реакции и константу скорости реакции.
Решение. Поскольку реакция протекала между эквивалент-
эквивалентными количествами исходных веществ и к концу обоих опытов концен-
концентрация иода уменьшилась ровно в 3 раза, порядок этой реакции можно
определить по методу Оствальда—Нойеса:
Подставляя в это уравнение числовые значения, получаем
1° C4,5/29) 0,0754
" lg B4,96/21,00) + 0,0751 + ~ "
Таким образом, реакция между иодом и натриевой солью фенил-
пропиловой кислоты — реакция второго порядка. Рассчитываем кон-
константу скорости этой реакции по уравнению (XXI 20). Для первого
опыта
1 16,64
29 24,96-8,32
Для второго опыта
__1 14
2~ 34,5 21-00-7,00
= 2,756-Ю-3.
= 2,76Ы0-з.
Полученные результаты подтверждают порядок реакции, так как
совпадение значений констант полное.
ЗАДАЧИ
1. Концентрация атомов трития в воздухе приблизительно
5-10~15 моль/л. Период полураспада трития около 12 лет. Через сколь-
сколько лет распадается 90 % трития, содержащегося в воздухе? Пополне-
Пополнение содержания трития в воздухе за счет реакций синтеза не учитывать.
2. Раствор B0 %-ный) тростникового сахара, имевший правое вра-
вращение 34,50°, инвертируется в 0,5 н. молочной кислоте при 298 К.
Вращение раствора по истечении 1435 мин достигает +31,10°, после
11 360 мин оно составляет +13,98° и, наконец, после полной инвер-
инверсии равно —10,77°. Раствор тростникового сахара вращает плоскость
поляризации вправо, а смесь продуктов инверсии влево. Угол враще-
вращения в обоих случаях пропорционален концентрации растворенных
веществ. Реакция протекает по уравнению первого порядка, вычисли-
360
те константу скорости инверсии и определите, сколько времени по-
потребуется, чтобы инверсии подвергалось 90 % сахара.
3. Пероксид водорода в водном растворе разлагается по уравне-
уравнению 2Н2О2 -*¦ 2Н2О + О2. Кинетику этой реакции исследовали ти-
титрованием проб одинакового объема перманганатом калия. Определи-
Определите порядок реакции всеми возможными способами и вычислите сред-
среднее значение константы скорости этой реакции, пользуясь приведен-
приведенными данными:
Время от начала опыта, мии 0 5 10 15 20 30 40
Объем 0,0015 М КМпО4, из-
израсходованный на титрова-
титрование 2 см3 пробы, см3 ... 23,6 18,1 14,8 12,1 9,4 5,8 3,7
4. При нагревании раствор дибромянтарной кислоты распадается
на броммалеиновую кислоту и НВг по уравнению
СООН — СНВг — СНВг—СООН —> СООНСН — СВгСООН + НВг
При титровании раствора стандартным раствором щелочи через t
мин титр ее в объеме раствора изменялся следующим образом:
t, мин 0 214 380
Ущ, см3 .... 12,11 12,44 12,68
Вычислите константу скорости реакции. Через сколько времени раз-
разложится V3 дибромянтарной кислоты?
5. Определите порядок реакции А (г) -*¦ В (г) + С (г) + D (г) по
изменению давления в ходе реакции. Вычислите среднее значение
константы скорости реакции (V = const, 298 К), если
t, мин 0 6,5 13,0 19,9
Р10-3, Па ... 41,6 54,5 63,7 74,2
6. Бимолекулярная реакция, для которой с\ = Св, протекает за
10 мин на 25 %. Сколько потребуется времени, чтобы реакция прошла
на 50 % при той же температуре
7. Константа скорости рекомбинации ионов Н+ и ФГ~ (фенил-
гликсинат) в молекуле НФГ при 298,2 К равная = 1011>ис~1-моль~1-л.
Рассчитайте время, в течение которого реакция прошла на 99,999 %,
если концентрации ионов Н+ = ФГ~ = 0,001 моль/л.
8. Скорость окисления бутилового спирта хлорноватистой кисло-
кислотой не зависит от концентрации окисляемого вещества и пропорцио-
пропорциональна концентрации НСЮво второй степени. Вычислите время, в те-
течение которого реакция окисления бутилового спирта хлорноватистой
кислотой пройдет на 90 % в растворе, содержащем 0,1 моль/л НС1О
и 1 моль/л спирта при 298,2 К. Константа скорости реакции при 298,2 К
равна 24 мин^-моль-л-1.
9. Константа скорости реакции ,
CH8COOC2H5 + NaOH —> CH3COONa 4- С2Н5ОН
361
равна 5,4 мин-моль-1-л. Вычислите количество (%) эфира, которое
прореагирует за 10 мин: 1) если исходные концентрации щелочи и
эфира 0,02 моль/л; 2) если концентрация щелочи 0,02 моль/л, а эфира
0,01 моль/л.
10. При определенной температуре 0,01 н. раствор уксусно-этило-
вого эфира омыляется 0,002 н. раствором NaOH за 23 мин на 10 %. Че-
Через сколько минут он будет омылен до такой же степени 0,005 н. раст-
раствором NaOH, если реакция омыления эфира — реакция второго по-
порядка, а щелочи диссоциированы полностью?
11. Рассчитайте константу скорости (см3/(моль-с); л/(моль-с) и
л/(моль-мин)], если скорость реакции второго порядка 4,5-10~7
моль/(см3-с) при концентрации одного реагента 1,5-10~2 моль/л и
другого 2,5-10~3 моль/л.
12. Скорость реакции распада (А -> продукт) подчиняется урав-
уравнению второго порядка —-d [A] dt = k [А]2. При изучении изменения
концентрации во времени получены следующие результаты:
( (±1 с), с . . . 0 200 400 600 800
А (±1%), мг/см» 16,4 15,0 13,4 12,8 11,5
Для каждой пары точек рассчитайте константу скорости реакции вто-
второго порядка и оцените точность каждого определения. Какие из ве-
величин определены с наименьшей и какие с наибольшей точностью?
13. В результате реакции формальдегида с пероксидом водорода
образуется муравьиная кислота (реакция второго порядка): НСНО +
+ Н2О2 = НСООН + Н2О. Если смешать равные объемы молярных
растворов Н2О2 и НСНО, то через 2 ч при 333,2 К концентрация му-
муравьиной кислоты становится равной 0,215 моль/л. Вычислите констан-
константу скорости реакции и определите, через сколько времени прореаги-
прореагирует 90 % исходных веществ. Сколько времени потребуется, чтобы
реакция дошла до той же глубины, если исходные растворы Н4О2 и
НСНО разбавить в 10 раз, а затем смешать.
14. Реакция димеризации бутадиена в газовой фазе — реакция вто-
второго порядка по бутадиену. Кинетика этого процесса может быть изу-
изучена при помощи измерения в определенные моменты времени давления
реагирующей системы при постоянном объеме. При 599,2 К для реак-
реакции димеризации бутадиена по уравнению
CHg—CHg—CHg
I сн2
2НгС=НС-СН = СНг —> CHS = C
снг-сн3
были получены следующие данные:
t. мин 0 3,25
Я-Ю-3, Па 84,2 82,4
t, мии 29,18 36,38
ЯК)-3, Па 71,4 69,5
t, мии 77,57 90,05
Я-Ю-3, Па ........ 62,0 60,4
362
6,12
80,9
49,50
66,4
103,58
59,0
10,08
78,9
60,87
64,4
119,00
57,7
14,30
76,8
68,05
63,3
135,72
56,4
20
74
,78
,2
Графически и аналитически вычислите константу скорости.
15. Окисление FeCl2 при помощи КСЮ3 в присутствии НС1 — ре-
реакция третьего порядка. Если время выражать в минутах, а концентра-
концентрации — в моль/л, то константа скорости этой реакции равна приблизи-
приблизительно единице. Вычислите концентрацию FeCl2 через 1,5 ч после на-
начала реакции, если начальные концентрации всех реагирующих ве-
веществ равны 0,2 моль/л.
16. Вещество А смешано в равных количествах с веществами В
и С, с0 = 1 моль/л. По истечении 1000 с половина вещества А про-
прореагировала. Определите количество вещества А, которое остается по
истечении 2000 с, если соответствующая реакция: 1) первого порядка;
2) второго порядка; 3) третьего порядка; 4) нулевого порядка. Ка-
Какое количество вещества прореагирует за 1000 с во всех случаях, если
константа скорости реакции k = 1?
17. Фенилдиазохлорид разлагается по уравнению
При 323 К и начальной концентрации 10 г/л были получены следую-
следующие результаты:
Время, мии . . . 6 9 12 14 18 22 24 26 30 оо
Выделено N2, см3 19,3 26,0 32,6 36,0 41,3 45,0 46,5 48,3 50,4 58,3
Обработайте приведенные данные дифференциальным и интеграль-
интегральным методами и определите порядок и константу скорости реакции.
18. Реакция разложения аммиака на горячей вольфрамовой прово-
проволоке протекает по стехиометрическому уравнению 2NH3 = N2 -j 3H2-
Во время реакции в различные моменты времени давление повышалось
следующим образом:
Время, с 100 200 400 600 800 1000
Повышение давления, Па . . 1466,3 2945,9 5865,2 8837,8 11717,0 14663,0
Выразите эти результаты графически и определите по графику по-
порядок реакции. Если начальное давление равнялось 200 мм рт. ст.,
рассчитайте константу скорости (концентрации выразите через дав-
давление в Па) и укажите размерность константы скорости.
19. Исследовали кинетику каталитического распада аммиака на
простые вещества при 1373 К- Время, необходимое для разложения
половины всего количества аммиака (причем вначале азот и водород
отсутствуют), зависит от начального давления аммиака следующим об-
образом:
Яо, мм рт. ст. ...... 265 130 58
U/%, мии 7,6 3,7 1,7
Определите порядок и константу скорости реакции.
363
20. Определите порядок реакции 2СО = СО2 + С при 583,2 К,
если давление за 30 мин уменьшилось с 1,049-106 до 0,924-106 Па, а
затем за тот же промежуток времени с 0,714-106 до 0,624-106 Па (V =
= const).
21. При взаимодействии эквивалентных количеств оксида углеро-
углерода (II) и хлора согласно уравнению СО + С12->-СОС12 при 300 К. в
присутствии катализатора наблюдалось следующее уменьшение обще-
общего давления системы:
t,
я
мии
¦ ю-5,
Па . .
0
0
,965
0
5
,900
0
10
,829
0
15
,779
0
21
,735
Определите порядок реакции (V = const).
22. Определите порядок для реакции конверсии пара-водорода
в ор/по-водород при 923 К, пользуясь зависимостью между временем
полупревращения и давлением. Давление Р и время полупревращения
пара-водорода в op/по-водород при 923 К следующие:
Я-10-5, Па ... 0,067 0,133 0,267 0,533
t,/t, с 648 450 318 222
23. Определите порядок реакции разложения окиси этилена
«
2—СН2 (г) = СН4 (г) + СО (г)
и вычислите константу скорости (V = const), если при 687,7 К общее
давление реакционной смеси изменяется со временем следующим
образом:
t, мии 0 4 7 9 12 18
Я-Ю-6, Па . . . 0,155 0,163 0,168 0,172 0,178 0,188
24. Скорость инверсии тростникового сахара в присутствии соля-
соляной кислоты изменялась следующим образом:
Времи, с . . .
а, град . .
Время, с . . ,
а, град . .
Определите порядок реакции и константу скорости.
25. При 583,2 К AsH3 (г) разлагается с образованием твердого
мышьяка и газообразного водорода. Во время реакции давление из-
изменялось следующим образом (давление паров мышьяка во внимание
не принимается):
0
11,20
32640
— 1,10
1035
10,35
76969
—3,26
3113
8,87
—3,37
4857
7,64
9231
5,19
12834
3,61
18520
1,60
26320
—0,16
t, ч 0 5,5 6,5 8
Я-Ю-5, Па . . . 0,978 1,074 1,091 1,114
364
Определите порядок реакции разложения AsH3 (г) и вычислите
константу скорости (V = const).
26. Монохлоруксусная кислота при 298 К взаимодействует с во-
водой (вода в большом избытке):
СН3С!СООН + Н2О = СН2( ОН) СООН + НС1
За ходом реакции следили посредством отбора проб, которые оттит-
ровывали щелочью. Результаты титрования проб одинакового объема
раствором щелочи:
t, мин О 600 780 2070
V, см3 12,9 15,8 16,4 20,5
Определите порядок реакции, вычислите константу скорости и рас-
рассчитайте, сколько времени после начала реакции необходимо, чтобы
все три кислоты присутствовали в эквивалентных количествах.
27. Реакция гидролиза метилуксусного эфира протекает по урав-
уравнению
сн„соосн„+н2о=сн„соон+сн3он
Кинетику этой реакции исследовали титрованием проб смеси одинако-
одинакового объема щелочью. Определите порядок реакции всеми возможными
способами и вычислите среднее значение константы скорости этой
реакции на основании следующих данных:
Время от начала опыта, мнн 0 30 60 90 120 150
Объем 0,05 и. щелочи, израс-
израсходованный на титрование
2 см3 пробы, см» 12,70 13,81 16,73 15,52 16,80 20,22
28. Восстановление оксида азота (II) водородом протекает при
298 К по стехиометрическому уравнению
Если исходные газы взяты в эквивалентных количествах при
0,454-106 Па, то давление их уменьшилось вдвое в течение 102 с, если
же начальное давление было 0,384-106 Па, то оно уменьшилось вдвое
по истечении 140 с. Определите порядок реакции (V = const), поль-
пользуясь зависимостью между временем расхода половины исходного ве-
вещества и начальной концентрацией.
29. Реакция омыления метилуксусного эфира щелочью при 298 К
протекает по уравнению
СН„СООСН„ + NaOH = CH3COONa + СН3ОН
Для этой реакции при 298 К получены следующие результаты:
t, мин " 3 5 7
cNaOH, г-экв/л 0,00740 0,00634 0,00550
t, мин 10 15 25
cNaOH- г-экв/л 0,00464 0,00363 0,00254
365
Исходные концентрации щелочи и эфира одинаковы и равны
0,01 г-экв/л. Определите порядок реакции омыления эфира и усред-
усредненную константу скорости.
30. Реакция омыления этилуксусного эфира щелочью при 298 К
протекает по уравнению
СН3СООС2Н5 + NaOH = CH3COONa + QHBOH
Кинетику этой реакции исследовали титрованием проб смеси одинако-
одинакового объема кислотой. Определите порядок реакции всеми возможны-
возможными способами и вычислите среднее значение константы скорости этой
реакции на основании следующих данных:
t, мии 0 4,9 10,4 28,2 оо
Объем 0,01 и. НС!, израсходо-
израсходованный на титрование 0,1 см3
смеси, см3 61,95 50,59 42,40 29,35 14,9
31. В некоторой реакции при изменении начальной концентрации
от 0,502 до 1,007 моль/л период полураспада уменьшается от 51 до
26 с. Вычислите порядок этой реакции и константу скорости.
32. Реакция разложения пентаоксида азота протекает по уравнению
N2O5 -*¦ 0,5О2 + N2O4. Кинетику этого процесса изучали при помощи
измерения в определенные моменты времени давления реагирующей
системы при постоянном объеме. При 328,1 К для этой реакции были
получены следующие данные:
t, мии 3 4 5 6 7 8 9 10
Увеличение давления-Ю-3, Па 8,7 12,7 15,5 18,1 20,1 22,4 24,4 26,3
t, мии 12 14 16 18 22 26 30 38
Увеличение давления-Ю-3, Па 29,1 31,4 33,6 35,5 38,5 39,9 41,2 42,6
Вычислите порядок этой реакции, среднее значение константы ско
рости реакции и период полураспада.
33. Константа скорости реакции, имеющей порядок 3/2 при 303 К,
равна 3,0-10~5 л^-моль"^ -с. Определите константу скорости:
а) в (см^-моль'^-мин и б) в (см3I/* • молекула1/' • с-1. Рассчитай-
Рассчитайте начальную скорость расходования и время полураспада в се-
секундах для начальной концентрации вещества с0 = 0,042 моль/л.
Определите время, за которое концентрация реагирующего вещества
достигает 0,002 моль/л.
34. Реакция разложения некоторого газа подчиняется уравнению
порядка 3/2; в начале опыта концентрация реагента была 5,2-10~4
моль/л. Если 55 % его прореагирует за 50 мин, то какова будет раз-
размерность константы скорости?
МНОГОВАРИАНТНАЯ ЗАДАЧА
Определите порядок и константу скорости реакции, протекающей
при заданной температуре Т, К, пользуясь данными о ходе процесса
во времени t (с начала реакции).
366
№ вари-
варианта
1
2
3
4
5
6
7
Реакция
2NC1,(jk)—>N24-3C12
а—объем N,-10~6, ms;
С12 поглощается
2HgCl8 + HCOONa—>Hg2Cl2 4-
NaCl + HCl+CO2
a — концентрация HgjClg, моль/л;
b — концентрация HCOONa, моль/л
C«H5C = CCOONa 4-12 —>
—>C5H»lC = ClCOONa
Исходные концентрации эквивалент-
эквивалентны:
a—объем 0,1 н. Na2S2Os, израсходо-
израсходованный на титроваиие 25-10~7 м3
пробы, см3
Ru—>-RaA
а — объем газа Ra • 10"', м8
2С2Н5ОН4-2Вг2—¦
—*СН8СООС2Н5 4- 4НВг
Спирт в большом избытке
а — концентрация брома- 10s, моль/л
2Н2Оа«=О2+2Н,О
В водном растворе:
а — объем КМпСи, иарасходоваииый
иа титроваиие пробы-10-', м8
KjSaO. 4-2KI—>2К^О4 + 1г
а — объем 0,01 и.
NajSsO3, израсходованный иа титро-
титрование 25-10-' м3 пробы, см*
Время,
мин
4
6
32
оо
0
3
0
3
0
1
0
2,2
0
29
0
34,5
0
70
ПО
140
165
200
250
360
450
600
750
0
4
6
10
15
0
4
10
15
0
11,5
27,1
42,6
9
16
52
оо
Результат контроля
за ходом реакции
0
0
0
0
0
0
а
10
13
1 V
26
28,5
а
,1034 0,
,0679
,0503 0,
,0316
,1028 1,
— о.
,1028 0,
— о,
24,29
8,32
21,00
7
0,102
0,062
0,044
0,033
0,025
0,019
0,016
0,007
0,003
0,002
0,000
4,24
3,14
2,49
2,24
1,78
8,14
С 1 Л
0,1 U
4,45
3,73
23,89
19,30
14,50
10,95
а
.4,52
7,80
14,19
20,05
Ь
1734
—
1734
0227
9579
3790
3279
Г, К
298,2
298,2
298,5
293,5
298,!
303,
298,
367
Продолжение табл.
№ вари -
анта
8
9
10
11
12
13
Реакция
Раствор N2O5 в СС14 разлагается
выделением О2;
о — объем О2, см3
Н2Ог в присутствии коллоидально»
платины разлагается с выделением
О2;
о — объем Ог, см3
CHsCOOC,He + NaOH =
а и Ь — начальные коицеитрацш
CH3COOQH5 и NaOH моль/л; х —
убыль исходных веществ, моль/л
С12Н22О22+Н2О =
= СвН12О6+С6Н12О6
с — концентрация сахара в дайны»
момент, моль/л;
с0 — начальная концентрация —
0,65 моль/л
CH3COOC2H5+NaOH =
= CHjCOONa -f QjHsOH
0 = 6 начальные концентрации
СНзСООС2Н6 и NaOH, моль/л; х —
убыль исходных веществ, моль/л
N2O5—*N2O4 + 1/гО2
о -концентрация N2O5, моль/л
¦
Время,
мин
20
40
60
80
100
оо
10
30
оо
0
178
273
531
866
1510
1918
2401
0
1435
4315
7070
1! 360
14 170
16 935
19815
29 925
0
300
900
1380
2100
3300
7200
0
184
319
526
867
1198
1877
2315
3144
Результат контроля
за ходом реакции
11,4
19,9
23,9
27,2
29,5
34,75
3,3
8,1
15,6
а—х Ь—х
0,00980 0,00486
0,00892 0,00398
0,00864 0,00370
0,00792 0,00297
0,00724 0,00230
0,00646 0,00151
0,00603 0,00109
0,00574 0,00080
Со/С
1
1,081
1 ЛСО
1,266
1,464
1,830
2,117
2,466
2,857
4,962
а—х
0,0200
0,0128
0,00766
0,00540
0,00422
0,00289
0,00138
а
2,33
2,08
1,91
1,67
1,36
1,11
0,72
0,55
0,34
Т V
' » К
313,2
303,2
291,2
298,2
293,7
298,2
368
ГЛАВА XXII
СЛОЖНЫЕ РЕАКЦИИ
Основные уравнения и символы
[К., с. 637—643; Г., т. 2, с. 27—38]
В гл. XXI были рассмотрены только простые кинетические реак-
реакции, в которых реагенты переходили непосредственно в продукты.
Однако чаще встречаются реакции, протекающие более чем в одну ста-
стадию.
*_,
Для мономолекулярных обратимых реакций типа А ^ В диффе-
ki
ренциальные формы кинетического уравнения:
d A-
MlAb)* <№]*). (XXII. I)
dA
—¦— = —^[AJ + ^IB]. (XXII.2)
При равновесии -— = 0, и если при t — О [В] = 0, то
[В]равн ^1 „ /vYii ъ\
—— =— = А, (XXII.3)
1А]равн я-1
[В]равн=[А]„-[А]равн, (XXII.4)
Аравн^ . "' [А]о, (XXII.5)
fei + R-i
где [А], [В] — текущие концентрации веществ А и В; [А]о — кон-
концентрация А при t = 0; и kt fc_x—константы скорости прямой и обрат-
обратной реакций; [А]равн и [В]равн — концентрации А и В при равновесии;
К — константа равновесия.
Интегральные формы кинетического уравнения:
t g fti([AJo-*)-ft-i([BJo+) ^ '
k+k^= 2'3 lg feit^b —fe-iIB]0 (ХХП.ба)
При условии, что в момент времени t = 0 [В]о = 0,
fe1 + fe_1 = -glL|g 1АЬ-[А]равн (XXII.7)
^ / g [А]-[А]равн 1 '
Для мономолекулярных параллельных реакций типа
аГВA)
AUcB)
369
дифференциальные формы кинетического уравнения
(ft4ft
(ft14ft-1)([A]0x), (XXII.8)
~--~~- = (*i + *-i)[A]. (XXII.9)
Интегральные формы кинетического уравнения:
l
fti + *2 = rIgn7, (XXII.II)
где kt, k2 — константы скорости первой и второй реакций. Констан-
Константы скоростей отдельных стадий для реакций данного типа определяют
по соотношению
(XXII. 12)
где xt и х2 — количества молей веществ В и С, образовавшихся к мо-
моменту времени t, или приращеиие концентраций веществ В и С. Теку-
Текущая концентрация исходного вещества выражается формулой
Для мономолекулярных последовательных реакций типа
аДвЛс
A) B)
дифференциальные формы кинетического уравнения имеют вид
dx
dt
d (х—^)
(XXII.13)
«=*i(IA].—х)—*,(дс—у), (XXII. 14)
~---ftilA], (XXII.15)
p=*i[Al-*IlB]I (XXII.16)
d TCI ' ,
-^p-MB]. (XXII.17)
Интегральные формы кинетического уравнения:
(XXII.19)
tAol-jc=[A]oe~*1', (XXII. 1.8)
370
y=l
[В] =
[Aj=IAJ,e
-ft,
-ft,
(XXII.20)
(XXII.21)
(XXI 1.22)
ft2 — ftj
[C]=[A]0-[A]-[B], (XXII.23)
где [A], [B], [C] — текущие концентрации веществ А, В, С; [А]о —
концентрация вещества А при t = 0; kt и k2 — константы скорости
первой и второй реакций: [А] = ([А]о — л:); [В] = х — у; [С] = у.
Рис. 43. Зависимость концентра-
концентрации исходного вещества А, проме-
промежуточного вещества В и конечно-
конечного вещества С от времени для по-
последовательной реакции первого
поридка
Точка максимум на кривой [В] = / (t) характеризуется уравнения-
уравнениями (рис. 43):
=0,
[A]
max
'mav —
2,3 (Ig^—
ft, — К
(XXI 1.24)
(XXII.25)
(XXI 1.26)
где tmax — время, соответствующее максимальной концентрации ве-
вещества В.
ЗАДАЧИ С РЕШЕНИЯМИ
1. у-Оксимасляная кислота при 293 К в водном растворе в при-
присутствии кислот (например, НС1) распадается с образованием лакто-
на и воды по уравнению
CH2(OH)CH2CH2COOH^=±CH2CH2CH2CO+H2O
I О 1
Приготовлен 0,176 н. раствор у-оксимасляной кислоты. В начале опы-
опыта на 10 см3 кислоты при титровании с фенолфталеином израсходова-
израсходовано 18,23 см3 0,1 н. раствора Ва (ОНJ: через 21 мин после начала опы-
371
та на то же количество кислоты израсходовано 15,84 см3, а через
45 ч — 4,95 см3 "барита. Последняя величина остается постоянной и
при дальнейшем титровании. Через какое время после начала опы-
опыта на титрование кислоты будет израсходовано 6,67 см3 барита?
Решение. Обозначим через а начальную концентрацию кисло-
кислоты, а через а' — начальную концентрацию лактона и через х — ко-
количество лактона, образовавшегося за время t. Тогда
k()k{')
где kj, и k2 — константы скорости реакции;
Для начального момента реакции t = 0 и х — О, откуда
COnst =— ; In (ftjO—ft2o'),
«1— «2
1 kxa— V
Умножая числитель и знаменатель уравнения A) на k2, переводя
натуральный логарифм в десятичный и заменяя kt/k2 константой рав-
равновесия ,КС, получим
_ — lg .
2,303 t s (Kca—a') — (l+Kc)x
Величина (&х + ?2)/2,303 должна быть постоянной при данной темпе-
температуре в течение реакции. Так как а = 0, то •
о чпо = ~Г '2 7Г~ Т. „ . • B)
&, oUo i Ac^ —' у ^ — Ас ^ ¦*
Выразим начальную концентрацию кислоты а в см3 раствора барита.
Тогда а = 18,23 см3; количество образовавшегося лактона х за время
t — 21 мин, также выраженное в см3 раствора барита, составит
х = 18,23 — 15,84 = 2,39 см3.
Чтобы рассчитать „» » , необходимо определить константу рав-
равновесия Ке = лактона Концентрацию лактона опреде-
су-°ксимасляиой кислоты
ляем по разности между объемами раствора барита, израсходованны-
израсходованными на титрование у-оксимасляной кислоты в начале реакции и по-
после достижения равновесия. Концентрацию у-оксимасляной кислоты
372
определяем по объему раствора барита, израсходованному на титро-
титрование того же количества раствора при достижении равновесия. Отсю-
Отсюда
A8,23-4,95) =_13^ =
4,95 4,95
Подставляя в уравнение B) значения Кс< t, я и х, получаем
** + *> =-Llg B.68-18,23) =0 0041
2,303 21 S 2,68-18,23—A+2,68J,39
Значения Кс и о. в ходе реакции не меняются; величина х изме-
изменится: х = 18,23 — 6,67 = 11,56, отсюда
1 2,68-18,23
*~ 0,0041 g 2,68.18,23—A+2,68) 11,56 -217мин-
2. Реакция разложения изопропилового спирта протекает в при-
присутствии катализатора триоксида ванадия при 588 К по схеме
С3Н7ОН-
*С3Н
*С3Н
3Н6
>С„Н8
Концентрации веществ реакции, измеренные через 4,3 с после нача-
начала опыта, следующие (ммоль): сс,н,он = 27,4; сс„н,о = 7,5; сс,н, =
= 8,1; сс,н, = 1,7. Определите константу скорости каждой реакции,
если в начальный момент в системе присутствовал только С3Н7ОН.
Решение. Определим начальное количество С3Н7ОН:
ммоль/л.
Вычислим сумму констант скоростей реакций:
d х d xl . d x2 , d x3
At ~ At At At '
1 [A]
= —In \ J" ,
/ [A]o—x
2 3 44 7
Определим константу скорости (с1) каждой реакции:
d х. хл ki А Хо х, k2
j k([A]x) = ~; - *(fAJ*) -J-=
j = kl([A]0x), ; T7 = *i(fAJ»*)' T
At x2 к2 A t x3 ks
373
Xl _ Zk-(k, + k,) 7,5 ^ .0,115-(
x2 k2 ' 8,1 k2 '
7,5*2 = 0,935—8, lfta —8,1Аз; 15,6 *2 = 0,935—8,1 fe8; k2= °-935—8>1 ks
15,6
Так как *2/x3 = k^jk^ то
8,1 _ 0,935—8, \k3
1,7 ~ 15,6*,
74,3ft8 = 0,935—8, lk3; 82,4fe8 = 0,935; fes = 1,135-10-*;
0,935—0,01135-8,1 _ 0,935—0,092 _ 0,843 _
*2=" 15,6 ~~ 15,6 ~ 15,6 = '4 -1° C '
fei = 0,115— 1,135-10-2—5,42-10-2= 4,95-10~2 c~i.
3. Последовательная реакция первого порядка протекает по
схеме:
А -А. Р _А. В
При 298 К ^i =0,1 ч; k2 = 0,05 ч-1; начальная концентрация исход-
исходного вещества [А]о = 1 моль/л. Вычислите: 1) координаты максиму-
максимума кривой [Р] = / (t); 2) время достижения концентрации [А] <
< 0,001 моль/л, продолжительность t& реакции А-»- Р; 3) концентра-
концентрации [Р] и [В] в момент окончания реакции А -»- Р; 4) время, за которое
концентрация В станет 0,01 моль/л, продолжительность индукцион-
индукционного периода /инд; 5) координаты точки перегиба кривой [В] = / (t); 6)
точку пересечения кривых [А] = f (t) и [Р] = / (t).
На основании полученных данных постройте график [В] = / (t).
Решение. Рассчитаем время, которому будет соответствовать
максимальная концентрация промежуточного продукта:
!пйг — In*! _ 2,303—2,997
' ^Z^ Г^ =13'6 ч-
Обозначим концентрацию А при /тах через [А]тах. Тогда
ГД] ГД1 о — ^l' о—0»1'13,6„л nCQ u-n, /„
I^jlmax — l^Jo " — " ~~ **"" миль/л,
максимальная концентрация промежуточного продукта будет
[P]max=(ft1/ft2)Amax= @,1/0,05) 0,249 = 0,498 моль/л.
Примем [А]с = 0,001 моль/л; тогда 0,001 = [А]ое~"*1<А;
0,001 = е~°'"А; /Д = 69 ч.
Рассчитаем концентрацию Р при t = 69 ч:
,р] = Ы / -0.1.69 -0.05.69)=0061 моль/л
1 0,1—0,005
374
Рассчитаем концентрацию продукта [В] через 69 ч:
{В] = [А]„—[Р]— [А]=1— 0,061— 0,00Г=0,938 моль/л.
Вычислим время ?инд, за которое устанавливается концентрация В,
равная 0,01 моль/л, по уравнению
[B] = [A]0[l + l_k (*1е~*|'и«-М~*''И|1Д)'[:
[В] = 1@,05е0,1е);
0,05
0,990-0,05==0,05е~°'"иВД—0,1е~°'05'иид- A)
Уравнение A) решаем относительно tHHR методом подбора:
<иия. ч 1 2 2,5 3 4
[В], моль/л .... 9,000 0,008 0,014 0,018 0,032
Принимаем ?ИНд = 2 ч. Точку перегиба кривой [В] = / (t) находим,
используя условие --L-! — 0. После дифференцирования и преобра-
преобразований уравнения
[В].= [A], fl + ' (к, е^Ь'-Ь е~к>')] B)
получим для точки перегиба
где ta — координата точки перегиба, которую находим методом под-
подбора для значений индукционных периодов гтл 5, 15, 10, 20 ч. Строим
график зависимости х = f (t):
х = 2е-0>и — е-0'051, откуда х=0,00 при /=13,6 ч.
Концентрацию [В] в точке перегиба находим по уравнению B):
[В] = 0,243 моль/л.
4. Установлено, что скорость реакции деформилирования 2,6-ди-
хлорбенза льдегида:
+ НСОО-
не соответствует ожидаемому на основании стехиометрии уравнению
— -J—I = k [А] [НРО~], но при меньшей концентрации ионов гидро-
ксила (по сравнению с [А]) выражается уравнением
375
Несоответствие стехиометрического уравнения экспериментально оп-
определенному порядку реакции свидетельствует о многоступенчатом
протекании реакции:
О-
kx быстро |
1) Аг—СНО + НО- ~ Аг — С—ОН
<А> ft, I
н
(В)
о- о-
2) Аг-С-ОН + НО- А^!?!1 А НС
I
I II
н о
(В) (С)
3) Аг~+Н2О *' быстр°-, АгН + НО-
Докажите, что скорость реакции определяет стадия 2. Выведите урав-
уравнения скорости реакции для случаев, когда самой медленной стадией
является стадия 1, 2 или 3.
Решение. 1) Если скорость реакции определяется стадией 2, то
На основании условия равновесия находим [В1:
К [А] [ОН-]
= ft_1[BJ; IB]=-
тогда
ft. ft, IA} [НО-]2
а>= 2 U / — = ft [А] [НО-]2.
ft_!
2) Если скорость реакции определяется стадией 1, то
K» = ftiIA][OH-] — ft_iIBl, но k_!<ki и ui = ft1[A][OH-J.
3) Если скорость реакции определяется стадией 3, то
ш = ?8[Аг-][Н2О] и k3<ki<:k2.
Из условий равновесия kt [A] [HO~] = fe_x [В]. Методом стационар-
стационарной концентрации определяем [С1:
d FBI
¦ = ft1[A][OH-]-ft_1[B]-ft2[B][OH-l = 0; (a)
At
d[C]
At
376
F)
Сложив уравнения (а) и (б), получаем:
ka[C] [Н2О1 = ^ [А] [ОН-]-А_! [В],
1С]=
Заменив в уравнении (а) вещество В на А, получим
fci![A][OH-]
[BJ = -
5. Метанолизация диэтилацеталя является двухстадийным процес-
процессом, в котором две этоксигруппы замещаются метоксигруппами со-
согласно уравнениям:
CW8CH(OEtJ + MeOH ^z± CHsCH(OMe) (OEt) + EtOH (I)
CH3CH(OMe) (OEt)+MeOH ^± CH3CH(OMeJ + EtOH (II)
где Me и Et — метил- и этилгруппы.
Введем обозначения: СН3СН (Me) (OEt) — метилэтилацеталь
(Me—Et—Ac); CH3CH(OEtJ — диэтилацеталь; СН3СН(ОМеJ — ди-
метилацеталь.
Метилэтилацеталь в этой реакции является промежуточным продук-
продуктом, соляная кислота служит катализатором. Хроматографическим
анализом установлено, что прямая и обратная реакции каждой стадии
имеют первый порядок по ацеталю и по кислоте и не зависят от концен-
концентрации спирта. Результаты анализа стадии 1 при Т = 298 К и кон-
концентрации НС1 = 17,3-10~6 моль/л приведены ниже:
/, мин О 10 20 30 40 50 60 оо
h, см 17,7 9,74 6,3 4,77 4,16 3,86 3,72 3,65
h — высота хроматографического пика, пропорциональная концен-
концентрации Du—Et—Ac.
Определите эффективную константу скорости этой реакции (&1>Эф =
Эффективная константа скорости стадии 2 (?2.Эф) при тех же ус-
условиях равна 1,07-10~2 мин. На основании этих данных рассчитай-
рассчитайте максимальную концентрацию Me—Et—Ас и время ее достижения.
Исходное содержание вещества Du—Et—Ас в пробе 0,03 г.
377
Решение:
2,3
V эф =
Яиз—Л
2,3 Ло—Лиз 2,3
lg
Ло—Лиз 2,3
lg = lg
/цЛ h\h /
lg=lg;
/ /ц,—Лиз — ht-\-ht / ht — Лиз
2,3 17,7—3,65 2,3 14,05
• a* = TTlg 9.74-3.65 1*ТЖ-
2,3 17,7-3,65 2,3 14,05
к, Эф = —— lg = lg = 0,0834 мин-1;
2' ф 20 ё 6,3—3,65 20 ё 2,65
2,3 14,05 2,3 14,05
*1» =^
*>.«—Эр1» 4,77-3,65 10^ТТГ =
2,3 14,05 2,3 14,05 л ^
к. 3* = —— lg : ¦= lg = 0,0829 мин-1;
*-эФ 40 ё 4,16—3,65 40 ё 0,51
2,3 14,05 2,3 14,05 л ппл
^^Т" 3,86-3,65 =-^-lg^T = 0-084M"H;
2,3 14,05 2,3 14,05
3,75-3,65
_ = 0.128;
эф 8,34-Ю-8
Ш0.128 _ -2,0534
A,07—8.34I0-2 7,27-10-г
[Me — Et— Ac]max = [B]max = a ——\e '""' —er~l)~
0,128In0,l28 InO.128
0,2631328 2,0557251
= 0.03—^—(e~°-30l76-e-2'3575)^0,03 °'64486 =0,0222 r.
0,872 v 0,872
378
6. Гидролиз метилгалогенидов в водных щелочных растворах проте-
протекает одновременно с водой по мономолекулярному, а с ионами — по
бимолекулярному механизмам в соответствии со схемой:
СН8С1 + Н2О-^СН3ОН + Н + -f С1-
(а — х)
СН3С1 + ОН1 Д.С
(а — х) (Ь-х)
Напишите дифференциальное уравнение гидролиза метилхлорида.
Рассчитайте степень превращения СН3С1 через 65 мин от качала
реакции, а также количество СН3С1 (в % мольн. от исходного количе-
количества), претерпевшее превращение за счет взаимодействия с ОН". Для
решения используйте следующие экспериментальные данные:
ГОП=333,05К; ft1 = 2,16-10-«c-»; ft2=4,88- 10-*с (моль/л)-*.
(а-х)
(Ь-х)
1, мии
¦ 10',
103,
моль/л
моль/л
0
35,
102,
3
5
2
35,
102,
1
3
30
32,0
99,2
65
29,
96,
4
6
109
25,5
92,7
214
18,
86,
9
1
1160
2
69
1
3
оо
0
67,2
Решение:
их
—
a t
(а— х) {Ь—х);
2) а = 35,3'-10-» моль/л; а—д: = 29,4-10-8;
35,3. Ю-3 — * =29,4-10-*; jt = 35,3-10-»—29,4-10-8 = 5,9- Ю-8 моль/л.
Степень превращения СН3С1
_х_ 5,9-Ю-3
о = 35,3-Ю-з
= 0,166, т. е. 16,6%.
3) Если бы имела место только первая реакция, то k2 = 0, kr =
1 '--^-; а-х = ое-«;
Т
)-3»— 2,16.10-'-3900;
Л—8,424-1 О".
35,3.10-s-jc = 35
35,3-10-8-д: = с
^ = 35,3- Ю-3— 3,5-10-2 = 0,3-10-8=3- Ю-* моль/л;
а—а: = 35,3-10-3—0,310-3==3510-3 моль/л.
Столько молей осталось бы непрореагировавшими через 65 мин, если
бы шла только первая реакция.
379
Из экспериментальных данных видно, что во второй реакции про-
прореагировало х2 = 35-10~3 — 29,4-10 = 5,6-10~3 моль/л, или
5,6-Ю-3
! 100 = 0,159,
35,3-10-»
т. е. во второй реакции реагирует 15,9 % от исходного количества,
а всего через 65 мин прореагирует 16,6 % вещества.
7. Равновесие реакции Н2О ±^: Н+ + ОН~ релаксирует за 37 мкс
при 298 К. Найдите константы скорости прямой и обратной реакций.
Решение. Находим выражение для времени релаксации* т,
зная kx (прямая реакция первого порядка) и k.x (обратная реакция
второго порядка):
н2о±^н++он-
Скорость изменения концентрации Н2О
d [H2O]
где [Н2О]е, *Щ+]е и [ОН"]е — концентрации Н2О, Н+ и ОН~ при
равновесии. Если система находится в равновесии, то
d [Н,О]
" — " ^= и и к л I neVJJe^^ /v_2[rlTJg|\Jri|g. \^J
При изменении состояния системы (например, повышение температуры)
константы скоростей изменяются. Новые равновесные условия опреде-
определяются следующим образом:
ft1[H2O]e = ft_1[H+]e[OH-]e. B)
Обозначим отклонение [Н2О] от нового положения равновесия через
х, тогда
При / = 0 (сразу же после изменения условий) [Н2О]0 = [Н2О]е,
следовательно, концентрация Н2О изменяется следующим образом:
Считая отклонение от равновесия очень малым, пренебрегаем xt и,
учитывая уравнение B), получаем
* Время релаксации (т) — это время возвращения системы к состоянию рав-
равновесия после смещения равновесия под действием некоторого внешнего воздей-
воздействия (например, изменение температуры). Это время, в течение которого кон-
концентрация изменяется в е раз.
380
или после разделения переменных и интегрирования имеем:
или
х,=л:оехр(_--у-), где —= *! + *_! ([Н+]в+[ОН-]в).
Константа равновесия реакции равна
К= [Н+1[0Н ] =1,0- 10-i*/55,5 =1,8-10-1».
При равновесии kr [H2O]e = k_x [H+]e [ОН-]е, и поэтому kx = k_xK
(моль/дм3). Отсюда
Поэтому
ft_!= 1/C7- 10-вJ-10-'= 1,4-10» моль-1-дм8-с-».
Из этого следует, что
*!= 1,4-10»-1,8- 10-1в= 2,4- ю-5 с-1,
ЗАДАЧИ
1. Превращение роданида аммония NH4CNS в тиомочевину
(NH2JCS — обратимая мономолекулярная реакция. Рассчитайте кон-
константу скорости прямой и обратной реакций при 425 К, используя сле-
следующие данные:
t, мин . . 0 5 12 19 28 38 48 60 78 80 оо
(NH4)NCS,
% 2,0 3,8 6,2 6,1 8,2 10,4 12,3 13,5 14,5 21,2 21,2
При достижении состояния равновесия 21,2 % роданида аммония
превращается в тиомочевину.
2. При смешении раствор содержал 73,2 % этилового спирта,
0,677 моль НСООН и 0,0261 % НС1 (вода не учитывается). Для иссле-
исследования кинетики реакции образования этилформиата прн 298 К от-
отбирали в различное время пробы объемом 5 мл и оттитровывали
Ва(ОНJ. Результаты титрования:
/, мии . . . 0 50 100 160 290 > оо
V, мл ... 43,52 40,40 37,75 35,10 31,09 24,28
Вычислите константы образования kx и разложения Лг х этилфор-
этилформиата в этом растворе и константу равновесия обратимой реакции К,
если концентрации воды, этанола и НС1 постоянны.
381
3. Образование этилового эфира муравьиной кислоты при 303 К
протекает по уравнению реакции первого порядка
О О
ОН О-С2Н5
Были получены следующие результаты:
/, мин 0 1700 10000 14000 20000 40000 .
Объем кислоты в
данный момент,
см3 29,44 28,59 24,77 23,05 21,28 16,80
Концентрацию кислоты определяли титрованием. Константа об-
обратной реакции k_x = 1,15-10—6 мин. Концентрация продукта пря-
прямой реакции в начальный момент равна 0. Определите константу
прямой реакции.
4. При 300 К протекает реакция по уравнению
СН3-С=СН-СООС2Н5ч-СН3-С-СН2-СООС2Н5
I . II
ОН О
Получены следующие результаты:
/, мин 0 4,25 6,50 9,17 12,0 14,17
Коэффициент пре-
преломления систе-
системы 1,4450 1,4440 1,4430 1,4420 1,4410 1,4400
Еиольиая форма,
% 88 84 80 76,3 72,5 69
/.мни 17,5 20,83 24,25 27,5 31,5 оо
Коэффициент пре-
ломлеиня систе-
системы 1,4390 1,4380 1,4370 1,4370 1,4360 1,4230
Енольная форма,
% 65 61 57 53 49 2
Покажите, что превращение енольной формы в кетонную представ-
представляет собой обратимую мономолекулярную реакцию. Вычислите кон-
константы скоростей прямой и обратной реакций.
н4с6н3с снэ
СНзС6Н4М(СНзI + СН31 —— N—СН3
I СН3
5. Для реакции между метилиодидом и раствором диметилпарато-
луидина в нитробензоле получены следующие данные:
/, мни . . . , , 10,2 26,5 36,0 78,0
х/с0 ...... 0,175 0,343 0,402 0,523
382
Константа равновесия реакции равна 69,8. Начальные концентрации
обоих реагентов равны 0,05 моль/л, продукт в процессе реакции отво-
отводится. Определите кинетическое уравнение, описывающее кинетиче-
кинетическую кривую, и рассчитайте константу скорости реакции.
в. Реакции
С,Н4+НСЦ-НСЮ-]
-^+С1СаН4ОН+НС1
A)
B)
при температуре Т протекают параллельно. Этилен взят в избытке.
Вычислите константу скорости каждой реакции. Концентрации
(моль/л) исходных веществ в одном из опытов изменялись следующим
образом:
[НСЮ]°-103, моль/л
[HCIj-IO3, моль/л .
начало опыта
8,675
0,612
конец опыта
3,695
0,532
7. Реакция термического крекинга нефти относится к консеку-
тивной реакции, причем бензин является промежуточным продуктом,
распадающимся на газообразные вещества. Определите максимальную
концентрацию бензина и время ее достижения при крекинге 1 т не-
фт"и, если при 673 К константа образования бензина kx = 0,283 ч,
а константа распада бензина ks = 0,102 ч-1.
8. Покажите, что для реакций
*• *i
А~*В; А—*С
время, за которое образуется половина количества В (по сравнению
с его количеством при t = оо), и время, за которое образуется полови-
половина количества С, одинаковы, хотя константы kx и k2 имеют разные зна-
значения.
9. Алкилирование изопропилбензола м-бутилецом осуществляет-
осуществляется в присутствии HF по уравнению
сн
сн,—сн—сн,—сн,
н
СНз
СНз—С—СН
Н,С CHj—СН,
или
383
где А — изопропилбензол; В — н-бутилен; С — изопропил-втор-бу-
тилен; D — конечный продукт. Соотношение скоростей образования
промежуточных конечных продуктов равно 1,665. Массовый состав
смеси к данному моменту (%): А 11,7; В 68,6. Определите отношение
kx и k2.
10. Определите периоды полураспада RaB(Pb*) и RaC(Bi*), свя-
связанные генетическим рядом
RaB --^-RaC --RaC
если существует зависимость изменения концентрации радиоактивных
ядер RaB от времени:
Число ядер WRaB 100 70 50 34 17 5 4 2,5
т, мии 0 10 20 40 50 80 90 100
и время, при котором концентрации накопленных RaC, RaC будут
максимальны, ттах = 35 мин. (Опыт проводили с чистыми ядрами
RaB).
11. Для последовательных реакций первого порядка
вычертите кривые зависимости концентраций А, В и С от времени.
12. Реакция 2А + В -*- 2D протекает через образование промежу-
промежуточного вещества С по механизму
Обе реакции смешанного второго порядка. Напишите уравнение для
вещества С как функции вещества В (выразите концентрацию веще-
вещества С через концентрацию В), используя граничные условия с = 0
при / = 0 и уравнение для d[B]/d/, в которое должны войти концен-
концентрации [А]„, [В], [В]о и константы kx и кг.
13. Для реакции 2А + В -*¦ D, протекающей по схемам 2А + В -*¦
-*¦ С; С + A-»- D, рассчитайте стационарную концентрацию вещест-
вещества С. Совпадает ли эта концентрация с максимальной концентрацией
вещества С? Рассчитайте массу вещества В, расходуемого в момент,
когда концентрация вещества С достигнет 95 % от стационарной, если
[А]о = [В]о, / = 0 и k2 ~ 25fej. Сколько вещества D образуется к это-
этому времени? Определите время, за которое будет получено 95 % ве-
вещества С от стационарного, если [А]о = 0,02 моль/л и kx — 3,0 х
X 10 моль/с.
14. Составьте кинетические уравнения, если реакция протекает по
следующему механизму:
А^±В; В+С—*D
кг
384
Покажите, что при высоких давлениях реакция может протекать
по первому порядку, а при низких давлениях — по второму порядку.
15. В герметический сосуд вместимостью 1 см3 заключен 1 г ра-
радия. Каково будет давление радона при О °С при наступлении веково-
векового равновесия, если kx= 1,37-101 с, Й2 = 2,ЫО~6 с.
16. Радон, распадаясь, превращается в RaA, который испыты-
испытывает а-распад. Рассчитайте время /шах. по истечении которого накопит-
накопится максимальное количество RaA, если вначале был чистый радон.
Рассчитайте максимальное количество RaA (в граммах), если началь-
начальное количество радона занимает при нормальных условиях объем
0,65 см3 и xj/2 = 3,82 дня и xi'/2 — 3,05 мин. Определите число атомов
радона и RaA через 5 ч.
17. Радиоизотоп 118Cd испытывает превращения по схеме
Ту=30 мин Ti/=4.5 мин
used— -»8 In— -«8Sn (стабилен)
Считая, что в начальный момент препарат содержал 0,1 г только пер-
первого радиоизотопа, определите: а) массу стабильного изотопа через
1 ч; б) во сколько раз уменьшится активность данного препарата че-
через 1 ч.
18. Изотоп 134Sb испытывает {5-радиоактивные превращения по
схеме
Ti/=50c Ту=44 мин Ту2 = 54 мин
w*Sb— -133 Те— -134 I— >i34Xe (стабилен)
Определите относительное число ядер 134Те и 1341 через 1 ч, полагая,
что в начальный момент препарат содержал только первый изотоп.
19. Определите константы скоростей прямой и обратной реакций
транс-СНС\=СНС1^ч«с-СНС1 =СНС1
при 573 К на основании данных о концентрации транс СНС\ = СНС\
к моменту времени /:
/, с 0 600 1080 оо
с, % 95 82,88 75,24 41,89
20. Реакция изомеризации кислоты в трамс-форму протекает через
образование промежуточного продукта С. За кинетикой реакции сле-
следили по изменению оптической плотности D раствора:
МО-2, с 0 5,88 11,58 20,88 38,88 91,50
D 0,126 0,128 0,133 0,142 0,172 0,230
/•Ю-2, с 132,50 177,60 266,80 оо
D 0,263 0,300 0,340 0,421
ki
21. Для обратимой реакции А -^± В начальные концентрации
k-i
веществ А и В: [А]о = 1,33-10* Па и [В]о = 0. Через 10 мин после на-
начала реакции [А] = 5,3-103 Па и [В] = 8,0-103 Па. Определите [А]
через 20 и 40 мин после начала реакции, если fej/^-i — 3.
13 Зак. 767 385
22. В системе идут две параллельные реакции по уравнениям:
А+вДс; вЛ-D
Исходные концентрации веществ А и В равны [А]о = [В]о =
= 1,33-10* Па. Ниже приведена зависимость давления от времени:
Время, с ...
ЛЯ, Па ....
0
0
20
213
40
427
60
640
90
960
120
1226
В момент времени, когда АР = 5,2-103 Па, реакция была приостанов-
приостановлена. При этом [В] = 3,7-103 Па. Определите kx и й2.
23. Гидрат лактозы в присутствии воды превращается в лактон со-
согласно уравнению
Зная зависимость угла вращения от времени
/, мин О 15 60 120 180 240 300 оо
а, град .... 8,98 8,77 8,23 7,67 7,18 6,63 6,58 5,65
покажите, что превращение гидрата лактозы в лактон в присутствии
избытка воды представляет собой обратимую мономолекулярную ре-
реакцию.
24. Гидролиз метилгалогенидов в водных щелочных растворах
протекает одновременно с водой по мономолекулярному, а с ионами —
по бимолекулярному механизмам в соответствии со схемой:
сн3.с+н2оЛсн3он+н++а-
(«—х)
СН3+
(а-х) (Ь-х) . ...
Напишите кинетическое уравнение относительно / и рассчитайте вре-
время полупревращения СН3С1 (в мин).
25. Получите уравнение для расчета степени превращения СН3Вг
и определите по нему долю молекул СН3Вг, прореагировавших по
истечении 900 мин от начала реакции. Полученный результат сравните
с экспериментальными данными. !
При расчете используйте экспериментальные данные, полученные
при 297,62 К (Ах = 3.2Ы0-7 с, kt = 1,373-10~4 (моль/л)-*):
/, мин 0 290 500 900 1400 2000 3000 «?
а—х).10-3, моль/л 57,2 48,4 38,5 29,0 21,1 15,2 8,9 0
ft—х)- Ю-з, моль/л 105,0 96,2 86,3 76,8 68,9 63,0 56,7 47,8
(
(
При расчете кинетики щелочного гидролиза СН3Вг используйте
выражение
{_ 1 1п Г а кг + к2(Ь~х
kt—k2(b—a) la—г fei + fe2ft
386
где kx — константа скорости реакции взаимодействия с Н2О (реак-
(реакция 1-го порядка); k2 — константа скорости реакции взаимодействия
СН3Вг с ОН"; b — исходная концентрация ОН'; а — исходная
концентрация СН3Вг.
26. Дифенилхлорметан взаимодействует с этиловым спиртом с об-
образованием хлороводородной кислоты и эфира по схеме:
Н Н
I I
(СвН4J С+С2Н6ОН:гНС1+(СвН6J С-О-С2Н6
[А]о = 0,09966 моль; [В]о = 21 моль.
Проверьте предполагаемую схему реакции и определите константы
скоростей прямой и обратной реакций, используя следующие экспери-
экспериментальные данные:
Л мин 13 119 142 162
НС1, моль 0,00346 0,02680 0,0309 0,0343
МНОГОВАРИАНТНАЯ ЗАДАЧА
182
0,0375
212
0,0418
Последовательная реакция первого порядка протекает по схеме
аЛрДв
При 298 К удельная скорость реакции А -*¦ Р равна къ а реакции
Р -+¦ В — k2 начальная концентрация исходного вещества [А]о. Вы-
Вычислите: 1) коэффициенты максимума кривой [Р] == / (/) (максималь-
(максимальную концентрацию промежуточного продукта Р и время ее достиже-
достижения); 2) время достижения tt концентрации исходного вещества [Ah;
3) концентрации [Р] и [В] в момент времени ^; 4) время, за которое
концентрация промежуточного вещества станет равной [Р]х; 5) коор-
координаты точки перегиба кривой [В] = f'(t); 6) точку пересечения кри-
кривых [А] = / (/) и [Р] = / @; 7) на основании полученных данных по-
постройте график [Р] =/(/).
ва-
ватта
*&
1
2
3
4
5
6
7
8
9
10
11
12
[А].,
моль/л
1
1
1
1
1,5
2
2
2
1,5
1,5
1,5
1,5
[А],,
моль/л
0,001
0,02
0,0015
0,002
-0,001
0,001
0,001
0,001
0,015
0,015
0,015
0,015
[P]i.
моль/л
0,01
0,01
0,01
0,01
0,01
0,02
0,015
0,012
0,02
0,01
0,015
0,012
мии
0,1
0,1
0,1
0,1
0,1
0,1
0,1
0,1
0,1
0,1
0,1
0,1
мии"
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
0,05
SE
S! о.
13
14
15
16
17
18
19
20
21
22
23
24
[А]„,
моль/л
1
1
1
1
2
2
2
2
1,2
1,2
1,2
1,3
[А],,
моль/л
0,001
0,001
0,001
0,001
0,002
0,002
0,002
0,002
0,015
0,015
0,015
0,015
[PL,
моль/л
0,01
0,02
0,015
0,10
0,02
0,02
0,01
0,01
0,01
0,01
0,01
0,01
мин *
0,12
0,12
0,12
0,1
0,12
0,12
0,12
0,1
0,1
0,1
0,1
0,1
мии
0,07
0,07
0,07
0,07
0,05
0,05
0,05
0,07
0,08
0,08
0,08
0,08
13*
387
ГЛАВА XXIII
ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
Основные уравнения и символы
[К., с. 644—654; Г., т. 2, с. 41—45]
Изучение зависимости скоростей реакции от температуры особен-
особенно важно потому, что температурная зависимость лежит в основе тео-
теоретического обоснования вывода для вычисления скорости химиче-
химического процесса, поскольку температура является молекулярным свой-
свойством реагирующей системы. Именно по этой причине такой подход
к изучению скорости реакции называют молекулярной кинетикой.
Зависимость скорости реакции от температуры приближенно выра-
выражается правилом Вант-Гоффа
kT г.-г,
-^ = 7 10 • (ХХ1П.1)
где кт1 и kTt — константы скорости при температурах 7\ и Т2; у —
температурный коэффициент скорости реакции (коэффициент Вант-
Гоффа); у = 2 -т- 4.
Если температура реакции изменяется в арифметической прогрес-
прогрессии Т.г — 7\= Юп, то скорость реакции будет изменяться в геометри-
геометрической прогрессии kTt — k^y", например при 7 = 2 kT, — кт^".
Зависимость скорости реакции от температуры выражается урав-
уравнением Аррениуса, которое в дифференциальной форме имеет вид
d In k Eon
(XXFFF.2)
AT RT*
а в интегральной форме
k, Е„п I Та 7\ \
lg—— = —9S- — -), (XXIII.3)
\ak ——+cons t, (XXFFI.4)
2,3
k0 — постоянная (предэкспоненциальный множитель); Еоп — энергия
активации (экспериментальная энергия активации). Энергия актива-
активации и температурный коэффициент связаны уравнением
) lgYy/Ю. (XXFIF.6)
где ут — коэффициент Вант-Гоффа при температуре Т.
388
Рис. 44. Зависимость lgfe от 1/Г для 1
реакции окисления меди -
Зависимость lg k - / A/7) может ~
быть представлена прямой (рис. 44), .,
тогда '
?=-2,3*tga, (XXFIF.7) ''*" ^ 3.1 3,2 3,3
где a — угол наклона прямой.
ЗАДАЧИ С РЕШЕНИЯМИ
1. В присутствии ионов CN~ бензальдегид превращается в бензо-
ил. Определите энергию активации этого превращения, если извест-
известны следующие данные:
Г, К 313,2 323,1 333,2
к, мин-1 .... 0,026 0,048 0,089
Решение. Находим энергию активации по уравнению
S К = 2,303-8,314 Тг 7\ '
откуда
' 2,303-8,314 r2rt k2
Eq, :=== 1 ?J """"' ~ ,
Для 313,2 и 323,1 К
2,303-8,314-313,2-323,1 0,048
Еа= — lg "q-02618785'2 Дж/моль-
Для 333,2 и 323,1 К
2,303-8,314-333,2.323,1 0,089
Еа = lg =54643,04 Дж/моль.
10,1 0,048
Для 313,2 и 333,2 К
_ 2,303-8,314-313,2.333,2 0,089
58785,2+54643,04 + 60040,1
?ср = :—! -1 ! =-=57822,88 Дж/моль.
О
2. Определите энергию активации реакции
Си + (NH4) а S2O8^-CuSO4+ (NH4) 2 SO4
Значения констант скоростей реакции для различных температур:
Г, К 293,2 313,2 333,2
1<-1<Р, л/(моль-мии) .... 9,6 18,16 39,96
389
Решение. Определяем энергию активации Еа графическим ме-
методом, используя уравнение
1? *=lg Л,- 2,303-8,3147 ¦
Представим экспериментальные данные в следующем виде:
~- \03 3,41 3,19^ 3,005
lg k —2,018 —1,741 —1,475
и на их основании строим график (рис. 44). Откуда
—2,02—1,50
tg а= 3,41-3,02 103'
Определяем энергию активации по уравнению (XXIII.7):
/_2 02—1 50\
Еа=—2,303-8,314tga=—2,303-8,314 —^ :—¦ • 103=25522,4 Дж/моль.
3. Раствор уксусно-этилового эфира при сг = 0,01 г-экв/л и
293 К омыляется 0,002 н. раствором NaOH (c2) в течение 23 мин на
10 %. Реакция — второго порядка. Как изменится это время, если
уменьшить концентрации реагирующих веществ & 10 раз; увеличить
температуру на 15°?
Решение. Воспользуемся кинетическим уравнением
*ln
t (а-Ь) {Ь—х)а
и, подставив t = 23 мин, а — сх = 0,01 г-экв/л, Ь = с2 ^= 0,002 г-экв/л,
х = 10 % от съ т. е. х = 0,001 г-экв/л, получим
1 1 @,01—0,001H,002
= ~23 0,01—0,002 2> 'g @,002—0,001H,01 =ЗЛ9>
При уменьшении всех концентраций в 10 раз будем иметь сх =
= 0,001 г-экв/л, с2 = 0,0002 г-экв/л, х = 0,0001 г-экв/л. Подставляя
эти значения в кинетическое уравнение для k = 3,19, получаем
J 1 @,001—0,0001H,002
¦"" t 000100002 ' g
t 0,001—0,0002 ' g @,0002—0,0001H,001 '
Отсюда t = 230 мин. Полагаем, что при повышении температуры на
10е скорость реакции увеличивается вдвое: kT+i0 = 2kT. Следователь-
Следовательно, /гг+15 = кт 21>5 = 3,19 У8"= 3,19-2,83 = 9,04. В случае омы-
омыления 10 % эфира при Г и Т + 15 kt = k^. Отсюда время будет
3,19
9,6
390
¦23 = 8,1 мин=486с.
ЗАДАЧИ
1. Для реакции термического разложения этана получены следую*
щие константы скорости реакции первого порядка:
Т, К . . . . 823 833 843 853 863 873 883 893 903
ft-10-5, с-1 ... 2,5 4,7 8,2 12,3 23,1 35,3 57,6 92,4 141,5
Постройте график зависимости k от Т и lg k от 1/7\ Рассчитайте энер-
энергию активации и предэкспоненциальный множитель,
2. Константы скорости реакции разложения органической кисло-
кислоты в водном растворе следующие:
Г, К 273,2 293,2 313,2 333,2
ЫО5, мин-1 . . 2,46 47,5 576 5480
Постройте график зависимости lg k от 1/7 и определите энергию ак-
активации. Вычислите константу k0 в уравнении k = koe~Ea/RT, период
полураспада для этой реакции при 373,2 К, если эта реакция первого
порядка,
3. Две реакции одинакового порядка имеют равные предэкспонен-
циальные множители, но их энергии активации различаются на
41,9 кДж/моль, Рассчитайте соотношения констант скоростей этих
реакций при 600 К.
4. Щелочное омыление этилового эфира уксусной кислоты характе-
характеризуется следующими константами скоростей при различных темпера-
температурах:
Г, К , 273 293 298
k, мин-1-л-моль-' 1,17 5,08 6,56
Вычислите энергию активации и время протекания половины реакции
при 298 К, если: 1) взаимодействуют 0,025 моль/л, 2) 0,0125 моль/л
раствора эфира и щелочи.
5. В спиртовом растворе для реакции
C2HsX+OH-= С2Н6ОН+Н+
где X — С1, Вг или I, константы скорости могут быть рассчитаны по
уравнениям:
для хлорида:
^ = 0,793- 10Ю г%-9б23б/лг;
для бромида
k2= 1,28- 101" ГУ2 е-87868/ЯГ.
для иодида
fe3 = 2,70-1010^ е-87868/КГ.
Рассчитайте константы скорости и соотношение констант скоростей
при 298 К, характеризующее зависимость подвижности галогена от
его природы.
391
6. Разложение некоторого вещества является реакцией первого
порядка с энергией активации 231 кДж/моль. При 300 К разложение
этого вещества проходит со скоростью 95% в 1 ч. Вычислите температу-
температуру, при которой это вещество разлагается со скоростью 0,1 % в
1 мин.
7. Соль диазония разлагается по уравнению
CH3CeH4N2CI+H2O=CH3CeH4OH+X2+HCI
Процесс разложения представляет реакцию первого порядка. Кон-
Константы скорости реакции при 297,9 и 303,2 К соответственно равны
9-Ю^3 и 13-10~3 мин. Вычислите константу скорости при 308,2 К
и время, в течение которого распадается 99 % соли диазония при этой
температуре.
8. Константа скорости разложения ацетондикарбоновой кис-
кислоты
СО (СН2СООНJ-*СО (CH3J-f 2СО2
(реакция первого порядка) при 7\ = 273,2 К равна kt — 2,46-10~5
мин, при Т2 — 313,2 К k.2 = 5,76-10~3 мин. Вычислите время,
в течение которого реакция пройдет на 70 % при Т — 323,2 К.
9. Период полупревращения вещества в реакции первого порядка
при 323,2 К составляет 100 мин, а при 353,2 К — 15 мин. Вычис-
Вычислите температурный коэффициент константы скорости этой реак-
реакции.
10. Константа скорости омыления уксусно-этилового эфира едким
натром при 282,6 К равна 2,37, а при 287,6 К —3,204. При какой тем-
температуре константа скорости будет равна 4?
11. В растворе содержится 0,1 моль этилацетата и 0,1 моль NaOH.
При 283,2 К в течение 15 мин омыляется 10 % эфира, а при 298,2 К
за тот же промежуток времени — 20 %. Вычислите количество эфира,
которое омылится в течение 5 мин при 313,2 К.
12. Разложение пербората натрия
NaBO3+H2O4-NaH2BO3+1/2O2
реакция первого порядка. Константы скорости реакции при 7\ =
= 303,2 К и 72 = 308,2 К соответственно равны 2,2-10 и 4, МО
мин. Вычислите энергию активации реакции и время, в тече-
течение которого при Т3 = 313,2 К разложится 99,99 % пербората
натрия.
13. Изопропиловый эфир в парообразном состоянии изомеризуется
в аллилацетон, и скорость реакции подчиняется уравнению первого по-
порядка. Зависимость константы скорости (с) от температуры описыва-
описывается уравнением й = 5,4-1011е~122597/'лг . За какое время при
423 К парциальное давление аллилацетона достигает 300 мм рт. ст.,
если начальное давление изопропилового эфира 760 мм рт. ст.?
14. Константы скоростей реакции второго порядка при 328,2 и
392
298,2 К. соответственно равны 10~2 и 10~3 мин-^моль^-л. Вычисли-
Вычислите скорость этой реакции при 343,2 К в начальный момент реакции,
если начальные концентрации обоих веществ одинаковы и равны
0,01 моль/л.
15. Реакция второго порядка (At -f A2 -*¦ продукты) протекает на
90 % при [AjJo = [А2]0 = 0,1 моль/л и 300,2 К за 200 мин, а при
320,2 К — за 40 мин. Вычислите время, когда реакция пройдет на
99 % при 330 К и [АхЬ = [А2]0 = 0,01 моль/л.
16. Обратимая реакция протекает по стехиометрическому урав-
уравнению
i
2At + A2 ^zt 2C — 84 кДж/моль (экзотермическая реакция)
кг
При 473 К прямая реакция подчиняется закону скорости
— d [AJ/ctt — kt [Ail2, а зависимость скорости от температуры вы-
выражается так:
lg *! = 10,42—19700/Т
[kr имеет размерность л/(моль-с)]. Выведите закон, которому подчи-
подчиняется скорость обратной реакции. Определите энергию активации
обратной реакции. Вычислите изменение энтропии реакции и k2 при
температурах 473 и 573 К, если константы равновесия при 473 К Кр —
-— 6,2-103 атм. Скорость реакции нулевого порядка зависит от кон-
концентрации вещества At. Для всех ли концентраций веществ Ах и А2
будет соблюдаться такая зависимость?
17. Скорость расходования индивидуального вещества А подчиня-
подчиняется уравнению — d [A]/dt = k [А]3. При Тг = 333 К k = 4,20-10~6
(концентрация вещества А выражена в мм рт. ст.), а при Т2 — 473 К
k = 1,4-10~4 (концентрация выражена в мм рт. ст.). Рассчитайте
энергию активации и фактор Аррениуса (предэкспоненциальный мно-
множитель), константы k при 333 и 473 К, если концентрация вещества
А выражена в моль/л. Вычислите энергию активации и предэкспонен-
предэкспоненциальный множитель, если скорость реакции выражена в моль/(л-с).
Объясните, будет ли данная энергия активации истинной энергией ак-
активации реакции.
18. Реакция изомеризации А *± В проходит до конца при 338 К.
Для двух начальных концентраций вещества A cOil и cOii = 2c0>1 был
измерен период полупревращения для реакции и найдено, что реакция
имеет порядок 4/3 по компоненту А. Точность определения концентра-
концентрации А составляет ±2 %, ошибка в определении времени пренебрежи-
пренебрежимо мала, температура поддерживается с точностью ±0,1°, энергия
активации 840 кДж/моль. Какова точность определения времени полу-
полупревращения? Достаточна ли точность измерений, чтобы отличить ре-
реакцию порядка 3/2 от реакции порядка 4/3?
393
19. Для димеризации бутадиена lg k = 7,673 — 5680/Г, где k име-
имеет размерность л-моль-с. Какая доля молекул бутадиена, присутст-
присутствующих в системе, имеет энергию, достаточную для взаимодействия
при 573 и 723 К?
20. Для разложения фосфина, протекающего по уравнению реак-
реакции 4РН3->- Pt + 6H2, имеется следующая зависимость константы
18 953
скорости от температуры: lg k = ^ Ь 2 lg T + 12,130.
По этим данным определите зависимость энергии активации от тем-
температуры и энергию активации при 800 К.
21. Кинетику пиролиза этилбромида исследовали в газовой фазе
при использовании толуола как газоносителя при различных темпе-
температурах. Было установлено, что пироли протекает как реакция пер-
первого порядка. Для констант скорости были найдены следующие зна-
значения:
Т, К 800 833 877 900
klt с-1 0,0361 0,141 0,662 1,410
Г, К 794 806 855 881
к-к с-1 .... 0,110 0,192 1,126 2,708
где kx — константа прямой реакции; fe_r — константа обратной ре-
реакции. Из приведенных данных определите графически: а) энергию
активации и предэкспоненциальный множитель обеих реакций;
б) выведите зависимость константы скорости от температуры в анали-
аналитической форме.
k\
22. Для реакции 2HI ^ 12 + Н2 константы скорости имеют
к-1
следующие значения: при 666,8 К К = 0,259; при 698,6 К V= 1-242;
при 666,8 К fe_i = 15,59; при 698,6 К fe_i = 67,0 см^моль^-с-1. На
основании этих данных определите: а) температурную зависимость
константы скорости прямой и обратной реакций; б) температурную
зависимость константы равновесия диссоциации HI; в) константу рав-
равновесия при 553 и 763 К, а результаты сравните с эксперимен-
экспериментальными: /Сс = 1,173-Ю-2 при 553 К, Кс = 2,182-Ю-2 при
763 К.
МНОГОВАРИАНТНАЯ ЗАДАЧА
По Значениям констант скоростей реакции при двух температурах
определите энергию активации, константу скорости при температуре
Т3, температурный коэффициент скорости и количество вещества, из-
израсходованное за время t, если начальные концентрации равны с0.
Учтите, что порядок реакции и молекул яр ность совпадают.
394
X
а.
со
Ю СО
•^ со
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
Реакция
Hj+Bi-j—+2HBr
Н2+Вг—>2НВг
Н2+ 12—>2Н1
Н2+ 12—>2Н1
2HI—>Н,+ 12
2HI—+Н2+12
2NO—^N2 + Oa
2NO2—>2N2+Oa
N2O5—^NjOi+^O,
PH3-^P(r) + 3/aH2
SQaCl2—>SO2+C12
KCIO2 + 6FeSO4 + 3H2SO4—>KC 1+
+ 3Fea(SO4)s+3H2O*
CO+H2O—>COa+H2
COClj—>CO+Cta
C2H5ONa+ CH3I—*C2H5OCH3 + Nai
CH2OHCH2CI+ KOH—+CH2OHCH2OH + KCI
CH3CICOOH+ H2O-^-CH2OHCOOH + HCI
СН3СОаС2Н5+ NaOH-->-CH3COaNa+C2H5OH
CH3CO2CH3+H2O—*CH3CO2H + CH3OH
(в водном р-ре катализатор—0,1 н. HCI)
CH3CO2CH3+H2O-^CH3CO2H + CH3OH
СНзСОгСаИбЧ- Н2О—>СН3СО2Н+ С2Н6ОН
2СН2О + NaOH—+HCO»Na + СН3ОН
(CHSJSO4 + NaI-^CH3I + Na(CH3)SO4
CeH6CHaBr+ CaHjOH—>CeH6CH2OC2H5 +
1 UDi-
+ nor
C12H2SOn + H2O—ЛвН12Ов+ CeH12Oe
т,, к
574,5
550,7
599,0
683,0
456,9
628,4
0525,2
986,0
298,2
953,2
552,2
283,2
288,2
655,0
273,3
297,7
353,2
282,6
29&. 2
298,2
273,2
323,2
273,2
298,2
298,2
*t
ыии-'Х
X ыоль-'-л
0,0856
0,0159
0,00146
0,0659
0,942-10-е
0,809-Ю-4
47 059
6,72
0,00203
0,0183
0,609- Ю-4
1,00
0,00031
0,53-10-2
0,0336
0,68
0,222-Ю-4
2,307
0,653- Ю-3
16,09-Ю-3
2,056-Ю-5
5,5-Ю-3
0,029
1,44
0,765
т„ к
497,2
524,6
672,0
716,0
700,0
780,4
1251,4
1165,0
288,2
918,2
593,2
305,2
313,2
745,0
303,2
3!6,8
403,2
318,1
308,2
308,2
313,2
358,2
298,2
338,2
328,2
ыин-'Х
Хиоль—'-л
0,00036
0,0026
0,0568
0,375
0,00310
0,1059
1073
977,0
0,475-Ю-3
0,0038
0,132-10-2
7,15
0,00815
67,6-10-2
2,125
5,23
0,00237
21,65
1,663- Ю-3
37,84-Ю-3
109,4-Ю-5
294,0-Ю-3
1,04
2,01
35,5
та, к
483,2
568,2
648,2
693,2
923,2
976,2
1423,2
1053,2
338,2
988,2
688,2
383,2
303,2
698,2
288,2
303,2
423,2
343,2
313,2
323,2
298,2
338,2
285,8
318,2
313,2
t, мни
60
10
28
27
17
18
45
65
32
80
35
35
89
104,5
10
18
26
15
25
80
67
5
100
90
15
с.,
мол ь/л
0,09
0,1
2,83
1,83
2,38
1,87
2,83
1,75
0,93
0,87
2,5
1,67
3,85
0,8
0,87
0,96
0,50
0,95
1,60
2,96
3,55
0,5
3,89
2,67
1,85
* Реакция подчиняется уравнению реакции первого порядка.
ГЛАВА XXIV
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАСЧЕТА КОНСТАНТЫ
СКОРОСТИ РЕАКЦИИ
Основные уравнения и символы
[К., 654—658; Г., т. 2, с. 119—130, 139—155]
Скорость взаимодействия w одинаковых газообразных молекул рас-
рассчитывают по уравнению
w = ZAAe~E°n/RT , (XXIV. 1)
если Еоп — энергия активации; ZAA — число столкновений между
молекулами газа А в 1 см3 за 1 с;
гАА = ~-У*™2«Ъ (xxiv. 2)
Zaa e~Eon!RT — число активных столкновений в 1 см3 за 1 с;
п — число молекул в 1 см3; и — среднеарифметическая скорость дви-
движения молекул.
Для реакции типа
А + В —> Продукты
скорость взаимодействия w неодинаковых молекул А и В будет
w^Z'Aue~E°n/RT, (XXIV. 3)
где ZAB e~E°n/RT — число активных столкновений А и В в 1 см3
за 1 с;
где аА, ав — газокинетические диаметры молекул А и В; МА, УИв —
молекулярные массы веществ А и В; Zab — число столкновений мо-
молекул А и В в 1 см3 за 1 с. Величину я ( А 2 в ) [сечение соударений
в (XXIV.4)] для газов определяют по вязкости вещества. Для индиви-
индивидуального газа сечение соударений будет равно:
Я(т2 = _^!«_. (XXIV.5)
Злг\пА
Отсюда диаметр молекул будет
Мп
<т=— . (XXIV. 6)
396
Для бинарной смеси газов сечение соударений будет:
^ '+ \/ ™*U* ]• (XXIV.7)
Для химической кинетики достаточно точно можно оценить величину
сечения соударений, считая, что в жидкости или в твердом теле про-
происходит плотная упаковка молекул. Объем, занимаемый 1 моль (мо-
(молярный объем), равен M/d, где d — плотность вещества, г/см3. При
плотной упаковке шарик радиусом г занимает объем 8r3l\^2. Следо-
Следовательно,
1 3/ ЛГ /ЛП1/3
г = — Л/ 1,41 • 1,66 • Ю-24 — = 0,665 • Ю-» —
2 V d [а I
(XXIV'8)
[/ М. \ 1/3 /Л). \ 1/31 2
/ А_ 1 -L I 2. I
Для взаимодействия одинаковых и неодинаковых молекул константа
скорости выражается уравнениями:
где fe имеет размерность см3/(молекула-с);
* = Z0-l03nAe~?°n/;?r, (XXIV. 10)
где Zo — фактор соударений; k в (XXIV. 10) имеет размерность
л/(моль-с). Фактор соударений при столкновении одноименных моле-
молекул рассчитывают по уравнению
Zo= -J- Vs"™2 l/^I, (XXIV.ll)
где Zo имеет размерность см3/(молекула-с). 1
Фактор соударений при столкновении разноименных молекул опре-
определяют по уравнению
где Zo имеет размерность см3/(молекула-с).
Уточненное уравнение для расчета константы скорости
k = pZue~~E°*IRT', (XXIV. 13)
где р — стерический фактор.
Предэкспонеициальный множитель в уравнении (XXIII.5), соглас-
согласно теории бинарных столкновений, выражается так:
ko = pZo. (XXIV.14)
397
Согласно теории активированного комплекса (переходного состояния)
константу скорости реакции определяют по уравнению Эйринга (для
бимолекулярных реакций)
к=к-*1 ^-e=E,/RTi (XXIV.15)
где Ео — энергия активации при абсолютном нуле; QaK, Qa, Qb —
молекулярные статистические суммы (молекулярные суммы по состоя-
состояниям) для активированного комплекса и исходных веществ А и В.
Квази-термодинамическая форма уравнения Эйринга
Eon'R\ (XXIV. 16)
h
где х — трансмиссионный коэффициент; для мономолекулярных ре-
реакций х = 1; для бимолекурных реакций х — 2; AS* — энтропия ак-
активации; Еоп — экспериментальная энергия активации;
?оп=ЛГ + ЛЯ*, (XXIV.17)
где S.H* — энтальпия активации. Размерности констант: для моно-
мономолекулярных реакций — время, для бимолекулярных реакций —
объем-масса-время. Предэкспоненциальный множитель в уравне-
уравнении (XXIII.5), согласно теории переходного состояния, выражается
уравнением
ko = xex — e&s*'R, (XXIV. 18)
h
где k имеет размерность объем-масса-время.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Разложение иодида водорода является бимолекулярной реакци-
реакцией, энергия активации которой Е = 1848-102 Дж/моль. Реакция
протекает при 566,2 К. диаметр молекулы HI, вычисленный по вяз-
вязкости, равен 3,5-10~10 м, концентрация иодида водорода 1 моль/л.
Определите константу скорости при 566,2 К.
Решение. Константу скорости при 566,2 К вычисляем через
число соударений. Определяем среднюю скорость иа по уравнению
Рассчитаем число молекул HI в 1 см3. Так как концентрация иоди-
иодида водорода 1 моль/л, то число молекул п в 1 см3 составит
6,02-1023
п= =6,02-102» молекул.
398
Тогда число соударений будет равно
Л/2
/
= —3,14 C,5-10-8J.4,33-10* х
X F,02-
Определяем число молекул, находя-
находящихся в активном состоянии:
_ g-E/RT =
1848-Ю8
"8,314-566 _
= 8,42-10-18.
Рис. 45. 3 тисимость \g k от 1/7"
для
реакции CeH5N+CH3I=
= [C6H5NCH3]+I-
Число сталкивающихся молекул pZ0 в 2 раза больше числа столкно-
столкновений Z, поэтому
pZ0 = 4,25-1031-2 = 8,5-1031 МОЛекул/см3.
Чтобы выразить число столкновений молекул через число молей в
1 см3 за 1 с, разделим полученную величину на постоянную Авогадро:
pZ0 = 8,5-1031/F.02- 102з) = 1,41-10'.
Подставляя рассчитанную величину в уравнение k — pZoe~-E/RT,
получаем
fe= 1,41 • 1О'-8,42- Ю-" = 11,9. Ю-" смЗ/(моль-с).
2. При исследовании кинетики реакции взаимодействия метилио-
дида с пиридином в тетрахлорэтане
CeH»N + CH3I -> [CeH6NCH3]+I-
бь)Ли получены следующие данные:
Г, К 293,3
fe-102, л-моль-1-мин"
0,713
303,1
1,50
313,1
3,5
323,2
5,89
Реакция необратима, относится к реакциям второго порядка. Вы-
Вычислите энергию активации и стерический фактор, если плотность пи-
пиридина dn — 0,98 и метилиодида dM = 2,28 г/см3.
Решение. Выразим графически зависимость k от температуры
Т в аррениусовских координатах (рис. 45). По тангенсу угла наклона
полученной прямой определим энергию активации:
Е = 2,ЗЯ tga = 2,3-8,314-1,43-2000 = 54689 Дж,
где tg a — соотношение приращений по оси абсцисс и оси ординат с
учетом масштабов. Запишем уравнение прямой линии:
lgfe = lg(pZ0)-|tga|Sl/r.l0»=lg(pZ0)—2,86/Г-Ю».
Отсюда по координатам любой точки, взятой на прямой, например
fe.= 3,88 при 1/7-103 = 3,40, рассчитываем
\g(pZ0) =3,88 + 2,86-8,40 = 388 + 9,73 = 7.61,
4,1-10?
pZ9 = 4,1-10'л•моль-1-мии-1= пп „ пп lna cm»/c = 1,13.10-"cmVc
dO-6,02-1023
8*Г\1/2
По уравнению
вычисляем Zo. Рассчитав из опытных данных значения pZ0, определим
стерический фактор реакции. Так, молекулярная масса пиридина
Мп — 79, плотность dn = 0,98 г/см3; молекулярная масса иодида
пиридина Ми = 142, плотность dn — 2,28 г/см3. Приведенная масса
М* будет
МИМП 79-142
М* = iLJ1- = = 50,7.
М + М 211
С достаточной точностью можно оценить величину сечения соударения
в жидкости или в твердом теле, если существует плотная упаковка мо-
молекул. Объем, занимаемый 1 моль (молярный объем), равен Mid.
На один шарик радиусом г при плотной упаковке приходится объем
8r3/V2, следовательно,
1 з
г = — У1,4Ы,66-10-мЛ*/<* =0,665.10-8
и сечение соударения равно
2
Отсюда получаем
-) = 1,39-10-1в[(^I/3 + №1/3Г.
/ . IWh/ Wn/ 1
1^0,98/ ' \2,28
\1/312
) j =9,6-10-»с-.
Средняя относительная скорость молекул для температуры 308 К
будет
Тогда
( <Ти + (Тп Jп = 3,58-Ю4-9,5-10-15 = 3,4-10-Ю См3/с
Следовательно, стерический фактор
р= 1,13-10-"/C,4- Ю-10) = 3,3- 10-е.
400
3. На основании теории соударения и теории переходного состоя-
состояния покажите, что k0 = Zo. Используя справочные данные, рассчи-
рассчитайте по указанным теориям предэкспоненциалькый множитель для
реакции Н + С1 ->- НС1 при 298 К.
Решение. Для реакции двух атомов у исходных частиц враща-
вращательная составляющая статистической суммы отсутствует, а активи-
активированный комплекс представляет собой двухатомную частицу. Момент
инерции / активированного комплекса относительно центра тяжести
равен
где хн и хС\ — расстояние от центра атомов Н и С1 до центра тяжести
молекулы (рис. 46). Согласно определению центра тяжести
= tnc\Xc\. Учитывая, что хн + хс\ = гн+ + гсь
после преобразования получаем: и
т.
а
f\*r8
хс\— (rH"brci)t
mH~rmci Рис. 46. Определе-
Определение коордяиат
mH mC] центра тяжести
/_ (rH + rciJ = m*(rH + rciJ- молекулы НО
Для двухатомной частицы, имеющей две вращательные степени сво-
свободы,
®Р (j2 ti2 \ Н 01/ 1,2 \ Н * С*/ •
Отсюда по теории переходного состояния при условии, что для этой
реакции колебательная статистическая сумма равна единице,
°
Л2 8л kT
" Bя)•/.*%(„.)•/.ГИ
Если р = 1, то
8кТ V/,
)
401
Таким образом, для реакции между двумя атомами предэкспоненци-
альный множитель, вычисленный по методу активированного комплек-
комплекса, совпадает с фактором соударений. Из справочника находим, что
гн — 2,08-1С)-8 см и гс\ = 1,81-Ю"8 см и, следовательно,
,j = 3,14 A.81 +2,08)>- Ю-»
3,14
= 1,36-10-» см=>/с
. 4. Рассчитайте . предэкспоненциальный множитель и стернческий
фактор для реакции С2Н4 + С1-^-С2Н4С1, протекающей при 298 К,
используя модель активированного комплекса н исходных частиц,
приведенных на. рис. 47 и 48.
Решение. Для расчета предэкспонеициального множителя и
сферического фактора необходимо определить молекулярные статисти-
статистические суммы поступательного, вращательного и колебательного дви-
движений для реагирующих веществ и активированиого комплекса. Опре-
Определение вращательных статистических сумм требует знания моментов
инерции, для чего необходимо иметь Представление о конфигурации
исходных частиц и активированного комплекса. Вращательные стати-
статистические суммы для активированного комплекса можно вычислить
лишь при определенных предположениях о его строении. Это можно
сделать с достаточной точ-
точностью, поскольку активиро-
активированный комплекс является про-
промежуточным состоянием между
исходными частицами и части-
частицами продуктов реакции.
При построении модели ак-
активированного комплекса допу-
допускаем следующие предположе-
предположения: 1) связь С—С имеет длину,
среднюю между длиной связи
Рис. 47. Определение координат центра С—С в этилене н в образующем-
р рд ц
тяжести молекулы CHj=CHj
Рис. 48. Предполагаемая структура ак-
тивпроваииого комплекса
ру
ся свободном радикале С2Н4С1;
2) углы HAQ, H2dC2> HAH,
(рис. 48) равны и составляют
115° (среднее между 120° в эти-
этилене и 109° в С2Н4С1); 3) атом
С1 подходит к молекуле этилена
в направлении, перпендикуляр-
перпендикулярном плоскости молекулы, и в
активированном комплексе угол
С1С,С2 (рис. 48) равен 100° (сред-
(средний между прямым углом и 109°
в образующемся свободном ра-
радикале). Расстояние от атома
С1 Д° Сг Принято равным
2-10~8 нм (несколько больше,
402
чем в С2Н4С1). Предполагаемая конфигурация активироваиного ком-
комплекса приведена на рис. 48.
Для вычисления моментов инерции этилена и активированного ком-
комплекса удобно выбирать систему координат с осью Ох, направленной
по связи С—С; осью Оу, лежащей в плоскости молекулы этилена и пер-
перпендикулярной связи С—С; осью Oz, перпендикулярной плоскости
молекулы этилена и началу координат, проходящему через середину
связи С—С. Для этилена начало координат находится в центре тяже-
тяжести молекулы, а оси координат направлены по осям симметрии моле-
молекулы. Так как этилен имеет три взаимно перпендикулярные оси сим-
симметрии, то они же являются главными осями инерции и, таким образом,
задача сводится к вычислению моментов инерции относительно трех
координатных осей:
Координаты атомов равны:
Vl ¦ ¦ ¦ ¦
г, . . . .
Мн = 1, Мс= 12. Отсюда
с,
0,67
0
0
с,
-0,67
0
0
н,
— 1,20
0,93
0
н,
— 1,40
-0,93
0
н,
1,20
—0,93
0
н«
1,20
0,93
0
= 4-l (l,20s+0,93s)-f-2-12-0,67* = 20,0;
/А /А /А _ /А /А /А
'А'В'С —'ж V 'г-
При вычислении произведения моментов инерции относительно глав-
главных осей инерции для активированного комплекса воспользуемся
формулой
'х — ' ху ' xz
III
— 'ху 'у 'уг
— 'xz —1уг —1г
где I х, Iу, 1г — моменты инерции относительно любых трех взаим-
взаимно перпендикулярных осей, проходящих через центр тяжести моле-
молекулы; 1ХУ, 1хг и 1Уг — так называемые произведения инерции;
/,г = 2 Miytzi.
403
Координаты атомов Cl, H3, H4, Q н С2 вычисляем по принятым
Длинам связей и углам. Координаты Hi (х, у, z) и Н2 (х, — у, г) рас-
рассчитываем следующим путем. Длина / отрезка между точками с коор-
координатами х0, у0, г0 и хъ уъ zr равна
1* = V (^1-^оJ+(У1-УоJ+(г1-гоJ ,
а угол ф между двумя отрезками с общим началом в точке (х0, у0, г0)
и концами в точках (хъ уъ zt) и (х2, уг, гг) может быть определен по
формуле
(xl—x0) (х2—х0) + (у1—у0) (уг — i/o) + (?i—г0) (г2—z0) = /1/2cosf.
Применяя это выражение к отрезкам CtHi, QH2 и QO, получаем
для искомых координат х, у, г атомов Hi и Н2
(х—0,72J + 1/2 + г2=1,072;
(^_0,7 J—у + г2= 1,07-0,72cos 115°;
_(*_.(),72) 0,72= 1,07-0,72cos 115°.
Решение этих уравнений дает координаты Ht и Н2- Таким образом
координаты атомов равны:
н, н, н, н« с, с, ci
х: 1,17 1,17 —1,25 —1,25 0,72 —0,72 1,07
у, -0,86 0,86 0,93 —0,93 0 0 0
z; ...... 0,45 0,45 0 0 0 0-1,97
Координаты центра тяжести находят при помощи соотношений
Z,= 1^L=O,,K, = J%L=O;
2 Mt ' 2 Mi
Отсюда в системе координат, связанной с центром тяжести,
н, н, >, н, н4 с, а
xi 0,57 0,57 —1,85 —1,85 —1,32 0,47
У1 —0,86 о.86 0,93 —0,03 0 0
zt . . —1,55 1,54 1,09 1,09 10,9 —0,88
Отсюда получаем If = 66,3; If = 99,4; If = 39,5; Ify = 1+г = 0;
Ift = - 32,7;
66,3 0 32,7
ftftfc= ° ">4 ° =1,54-10'.
32,7 0 ¦ 39,5
Подставив значение для вращательных статистических сумм в урав-
уравнения
404
после сокращения получим
°
отсюда k0 = 4,8- Ю-12 см3/с.
Чтобы определить стерический фактор, нужно знать фактор со-
соударений. Для вычисления сечения соударений можно воспользовать-
воспользоваться данными вязкости С12 и С2Н4: t|Ci, = 1,33-10 Па-с, г|Сзн4 -
= 1,01-10~3 Па-с. По формуле (XXIV.6) рассчитаем радиус:
Л/ Ми , vc, =-2,63-10-8; гги =2,4-10-8 см.
Если предположить, что объем, приходящийся на один атом С1. ра-
равен объему молекулы С12, то линейные размеры атома С1 должны быть
в \^2 раза меньше, чем молекулы С12:
гС1 =2,63-lO-e-j/2 =2,08-10-8 см,
и, следовательно,
Zo = 3,14 B,43 + 2,08J-10-и l/^Mili°ll??L = 4,45-10-1» см3/с.
" 3,14-15,6
Отсюда стерический фактор равен р — kJZ0 --= 1,08- Ю.
5. Для реакции разложения оксида азота 2NO з=? N2 + O2 кон-
константы скорости kx — 0,0108 моль/(л-с-атм) при 1620 К и k2 —
= 0,030 моль/(л-с-атм) при 1572 К- Рассчитайте кнф и AS^ при тем-
температуре 1572 К.
Решение. Энтропию и теплоту активации вычисляем по урав-
уравнению теории абсолютных скоростей реакции, выраженному в лога-
логарифмической форме:
k 1 / д/у?
1,3805.10-"
1,3805-Ю-23
lg =lgB,5398-10») = 11,4048.
6,6238-10-84-0,08206 K '
Записываем уравнение для lg k при Т — 1620 К:
lg 0,0108=- 1,96658= И,4048+ щщ- ,9 ,47.1620 , A)
для Т = 1525 К
180,0030^-2,52288=11,4048+^- Х9™*525 ¦ • B)
405
Для определения AS* и АН*, решая совместно уравнения A) и B),
\Н* \S*
31018,4 —19,147=13>37138;
Откуда АН* = 276993,62 Дж/моль; AS* = — 85,038 Дж/(моль-К).
Полагаем, что значения AS* и АН* для средней температуры реакции
A572 К) остаются теми же, что и для 1620 и 1525 К.
ЗАДАЧИ
1. Азот находится в сосуде при 1,01-10* Па и 298 К- Рассчитайте:
1) число ударов о стенки сосуда в 1 с/см2; 2) число соударений между
молекулами за 1 с в 1 см3; 3) средний свободный пробег молекул.
2. Термическое разложение газообразного ацетальдегида — би-
бимолекулярная реакция. Энергия активации Е равна 1911 • 103 Дж/моль,
а молекулярный диаметр молекулы ацетальдегида 5- Ю~8 см. Рассчи-
Рассчитайте число молекул, реагирующих в I -10~в м3 за 1 с при 800 К и
1,01-10* Па, и сравните с экспериментальной величиной 7,3- 10м,
а также период полураспада для этой реакции.
3. Термическое разложение диоксида азота 2NO2 -*¦ 2NO -f O2
является гомогенной бимолекулярной реакцией. При 627 К констан-
константа скорости реакции равна 1,8] -103 см'-моль^-с. Стерический
множитель равен 0,019. Вычислите энергию активации Е, приняв ди-
диаметр молекулы NO2 равным 3,55-10~8 см. Определите долю молекул,
обладающих при 627 К энергией, большей Е.
4. Константа скорости мономолекулярной реакции разложения
азоизопропана C3H7N = NC3H, -*- N2 + CeHu выражается следую-
следующим уравнением: fci = 5,71- мр^е-40 900?RT. Подсчитайте макси-
максимально возможное с точки зрения теории столкновений значение пред-
экспоненциального множителя, приняв Oc,h7n=nc,h7 = 5-10~8 см,
cc,h7n=nc,h7 = 1 моль на 22,4 л. Температура опыта 563 К- Срав-
Сравните полученное значение с опытными.
5. Энергия активации для реакции разложения ацетона
СН3СОСН3 = С2Н4 + СО + Н2 равна 286,6 кДж/моль. Приняв ди-
диаметр молекулы ацетона равным 5,0-10~8 см, вычислите константу
скорости этой реакции при 835 К. и 760 мм рт. ст. Вычисленное значе-
значение сравните с опытной величиной ki = 1,5-10~3 с.
6. Опытное значение константы скорости реакции между метил-
иодидом и этилатом натрия CH3I -f C2H5ONa -*-CH3OC2H5 + Nal,
протекающей в растворе этилового спирта при 291,К 4,96-10~*
л-моль-с. Приняв радиусы молекул равными соответствен-
соответственно 2,64-10~8 и 2,74-10~8 см, вычислите с помощью уравнения теории
столкновений энергию активации этой реакции (р = 0,8).
406
7. Для реакции Н2 + 12 —*- 2HI получено значение в уравнении
Аррениуса:
Вычислите стерический фактор р и энергию активации Е, сравните
с табличными данными (р = 0,14; Е — 162,758 кДж/моль), если при
700 К средняя константа скорости равна 6,4- 10~а л/(моль-с) и вяз-
вязкость лн, = 1,83-Ю-3 Па-с, щг = 3,6-10~3 Па-с.
8. При исследовании кинетики взаимодействия триэтиламина с
этилбромидом в бензоле (C2H5KN-fC2H5Br _> были получены следую-
следующие данные:
Г, К ' 273,12 283,2 293,2 303,2
к-108, см-ч-моль-^с-1 .... 0,28 0,558 1,17 2,22
Реакция необратимая и относится к реакциям второго порядка..Вы-
порядка..Вычислите энергию активации и стерический фактор, если плотности
4c,h.).n = 0,723 и dc,H,Br = 1,456 г/см3.
9. При исследовании кинетики взаимодействия диметилбензилами-
на с метилиодидом в нитробензоле CeH5(CH3JN -f CH3I были получе-
получены следующие данные:
Т.
к.
, К
Юз,
смэ
•моль-1
•с-1 . .
273,2
. . 0,922
283,2
1,64
293,3
4,615
303
9,65
Реакция необратима и относится к реакциям второго порядка. Вычис-
Вычислите энергию активации и стерический фактор, если платности dn =
= 0,956 и dM = 2,28 г/см3.
10. При исследовании кинетики взаимодействия этилиодида с ди-
метилбензиламином в ацетоне CeH5N(CH3J -f C2H5I были получены
следующие данные:
Г, К 273,2 283,2 293,2 303,2
к-10', см'-моль-i.c-1. .• . 0,27 0,677 1,518 3,398
Реакция необратима и относится к реакциям второго порядка. Вычис-
Вычислите энергию активации и стерический фактор, если d_ = 0,956;
d3 = 1,933 г/см3.
11. Рассчитайте сумму состояний для линейного активированного
комплекса Н---Н---Вг, если: а) расстояние Н---Н равно 1,50-10~8
см, расстояние Н---Вг • 1,42-10~8 см; б) молекула имеет три коле-
колебательные частоты: 2340, 460 и 460 см (четвертая частота соответст-
соответствует колебанию вдоль барьера и не требуется для расчета).
12. На основе теории абсолютных скоростей реакции определите
температурную зависимость предэкспоненциального множителя для
следующих типов превращений: а) бимолекулярная реакция между
атомом и двухатомной молекулой, приводящая к образованию линей-
линейного активированного комплекса; б) тримолекулярная реакция между
двумя атомами и двухатомной молекулой, приводящая к образованию
407
нелинейного активированного комплекса, лишенного степеней свободы.
Колебательная сумма состояний не зависит от температуры.
13. Для элементарной реакции Н + О2 ¦= ОН -+- О известны сле-
следующие данные: а) разность нулевых энергий в активированном и ис-
исходном состояниях равна 62,76 Дж; б) го-о ~ 0,12 нм; активиро-
активированный комплекс Н—О—О имеет линейное строение с параметрами
гн-о =0,1 нм и Ло-о = 0,14 нм; в) частоты колебаний для
О2 v = 1580 см, для Н—О—О валентные колебания отсутствуют,
кроме дважды вырожденного деформационного колебания с v =
= 300 см-1; г) трансмиссионный коэффициент х = 1. Электронные
суммы по состояниям не учитываются. Рассчитайте константу скоро-
скорости реакции при 800 К.
14. Для реакции Н + НС1 = Н2 + С1 известны следующие дан-
данные: а) разность нулевых уровней энергии в исходном и активирован-
активированном состояниях 18,828 кДж; б) конфигурации молекул /н-н =
= 0,13 нм; в) все частоты колебаний достаточно велики и QK0JI = 1;
г) трансмиссионный коэффициент х = 1. Электронные суммы по со-
состояниям не рассматриваются. Рассчитайте константу скорости реак-
реакции при 600 К.
15. Для реакции О -f CO -*¦ О • • • С • • • О -*¦ СО2 известны сле-
следующие данные: а) разность нулевых уровней энергий в исходном
и активированном состояниях 83,68 кДж, б) лС-о = 0,112 нм; ак-
активированный комплекс ло-с-о = 0,12 нм имеет линейное строение
с указанными размерами; в) все частоты колебаний достаточно велики
(QKOjl — 1), кроме дважды вырожденного деформационного колеба-
колебания активированного комплекса с v = 200 см; г) трансмиссионный
коэффициент х = 1. Электронные суммы по состояниям не рассматри-
рассматриваются. Вычислите константу скорости этой реакции при 500 К-
16. Вычислите константу скорости при 600 К для реакции
Н . . . Н
Н2 4- 12 = . . = 2HI, если: а) активированный комплекс име-
I ... I
ет плоское строение, его три главных момента инерции соответственно
равны: /А = 920- Ю0 г-см2, /в = 7- 100 г-см2, /с = 930- Ю0
г-см2; б) для молекул исходных веществ лн-н = 0,07 нм, ri_i =
= 0.25 нм; в) для всех колебательных степеней свободы фкол = 1,
кроме одного колебания в активированном комплексе v = 100 см;
г) трансмиссионный коэффициент х = 1. Электронные суммы по со-
состояниям не рассматриваются; д) энергия активации ?оп =
= 167,36 кДж/моль.
17. Две реакции одинакового порядка имеют равные энергии ак-
активации, но их энтропии активации различаются на 42 Дж/(моль-К.)-
Рассчитайте соотношения их констант скоростей при 300 К-
408
18. Вычислите константу скорости димеризации этилена 2С2Н4->-
->- С4Н8 при 673 К, если для 1-бутена АН = 147 466 Дж/моль; AS* =
¦== — 147 Дж/(моль-К)-
19. Для реакции пиридина с этилиодидом
C6H5N+C2H5I^C7Hi0NI
при 303 К k = 1,72-Ю-6 л/(моль-с), AS* = — 118,5 Дж/(моль-К).
Рассчитайте теплоту активации АН* и энергию активации Е.
20. Для реакции бромироваиия бутеи-2-дисульфоната-1,4
СН—СН,—SO,Ni
на основании следующих данных:
Т, К 293 298 303
/МО-3, мии-1 . . 8,9 11,0 13,7
рассчитайте теплоту и энергию активации при 298 К, если коэффи-
коэффициент трансформации равен единице и AS* и АН* не зависят от тем-
температуры.
21. Константа скорости k для реакции 2NO -г О2 «=t 2NO2 при
600 К равна 6,63-105, а при 645 К — 6,52- 10ь моль, л. Для обратной
реакции k при этих же температурах равна соответственно 83,9 и 407.
Вычислите: 1) константы равновесия для этих температур; 2) энергию
активации Е прямой и обратной реакций; 3) теплоту активации
АНf прямой и обратной реакций.
22. Для реакции разложения оксида азота 2NO -»- N2 -L O2 кон-
константы скорости: при 7\ — 1620 К kx — 0,0108 моль'(л-с-атм2); Т.г ¦=-
---= 1525 К k ¦= 0,0030 моль/(л-с-атм2). Рассчитайте АН* и AS* при
температуре 1527 К, используя уравнение теории абсолютных скоро-
скоростей реакций.
23. Для гомогенных газовых реакций первого порядка энтропия
активации часто бывает незначительной и ею можно пренебречь. По-
Полагая, что ASf==0, определите константу скорости и время полупре-
полупревращения исходного вещества при комнатной температуре C00 К), если
для реакции теплота активации: а) 63-Ю3 Дж'моль; б) 84-Ю3
Дж/моль; в) 105- 10s Дж/моль.
24. Изучалась скорость реакции
*i
SO2 lo,5 O.2 ji: SO3
Получены константы скоростей прямой и обратной реакций при раз-
различных температурах:
Г, К 873 879 898 933 938 947
h, мин-1 .... 82,5 92,0 132,0 196,0 209,0 279
kt, мин-1 .... 9,95 11,8 23,8 52,3 58,25 85,60
409
Вычислите теплоту активации и энтропию активации для прямой и
обратной реакций. Проверьте применимость теории переходного со-
состояния в этих температурных пределах.
25. Определите константу скорости димеризации этилена 2С2Н4->-
-vCH2 = СН — СН2 —СН3 при 300 К, если стандартные энтропии
этилена и активированного комплекса (при Р = 1 атм), определяе-
определяемые поступательным, вращательным и колебательным движениями
молекул, даны в таблице:
Вещество
2С2Н<
QH8
Энтропия, Дж/(моль-К)
йпост
302,63
160,094
°вращ
132,92
136,69
°кол
5,52
18,39
AS^. Дж/(моль-К)
P=const
—125,82
V=const
-41,80
Опытная энергия активации равна ?оп = 146,30 кДж.
26. Частотный фактор для диссоциации димера циклопентадиена
в газовой фазе равен 1,3-1013 с, энергия активации 146,30 кДж. Вы-
Вычислите: а) константу скорости при 373 К; б) энтропию активации.
27. Для гидролиза сульфамидной кислоты константа скорости ре-
реакции k= 1,16-10~3 л/(моль-с) при 363 К, энергия активации
Е = 127,49 кДж/моль. Рассчитайте \А^, \Н^ и А5^ реакции.
28. Соединение двух молекул бутадиена приводит к образованию
3-винилциклогексана:
хн,
сн
с
с»,
11
сн—сн=сн2
с
сн
сн3
сн^сн
сн,
¦ СН=СН,
Предполагается, что активированный комплекс имеет структуру би-
радикала СН2—СН = СН—СН2—СН2—СН—^СН = СН2, который за-
замыкается в кольцо соединением двух свободных валентностей. Вычис-
Вычислите константу скорости димеризации бутадиена [см3/(моль-сI при
600 К, если опытное значение энергии активации равно ?оп = 99,024
кДж/моль. Стандартные энтропии даны в таблице:
Вещество
2С4Н6
СвН,!
°пост
339,42
182,67
Энтропия, Дж/(моль'К
°вращ
270,86
214,85
°кол
132,09
183,92
AS^, Дж/(моль-К)
P=const
—119,13
V'=const
—71,06
410
29. Покажите, что при расчете скорости димеризации этилена
2С2Н4 -*¦ C4HS энтропийный член близок к значению стерического мно-
множителя в теории столкновений. Опытное значение энергии активации
равно Еои = 146,30 кДж/моль, эффективный диаметр молекулы эти-
этилена при 300 К о = 4,9- Ю"8 см, а опытное значение константы ско-
скорости димеризации k = 1,08-10~u см3/(моль-с). Стандартная энтропия
этилена и активированного комплекса при давлениях, равных единице,
приведена в таблице:
Вещество
2ОД
с,н,
Энтропия, Дж/(моль-К)
°пост
302,63
139,20
S0
°вращ
132,92
136,69
°кол
5,52
18,39
AS^, Дж/(моль-К)
P=const
— 125,82
V=const
—41,80
30. Рассчитайте константу скорости для реакции рекомбинации
метильных радикалов при 473 К (реакция второго порядка), если
энергия активации равна нулю, диаметр столкновения — 2,03-10~8 см
по теории столкновений неупругих шаров, энтропия активации —
8,4 Дж/(моль-К) по теории абсолютных скоростей реакций. За стан-
стандартное состояние принять 1 моль/см3.
31. Реакция A -f В + С->- D протекает по механизму
А + В ^± АВ (П
АВ+С^=± D (II)
Стадия (I) представляет собой обратимую реакцию. Покажите, что за-
зависимость константы скорости от температуры выражается уравнением
где АН — изменение энтальпии в стадии (I).
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
1. Химическая реакция протекает в условиях, указанных в таб-
таблице (см. с. 412). Определите с помощью теории столкновения ту ки-
кинетическую характеристику реакции, которая отсутствует в соответст-
соответствующем варианте.
2. Определите энергию активации Еа реакции, для которой по
опытным данным при Т, К и парциальном давлении 1,01-10* Па из-
известна константа скорости реакции k. Стерический фактор принять
равным 1. Полученную энергию активации и диаметр молекул сравни-
сравните со значениями, приведенными в справочниках. (Считайте диаметр
атомов равным диаметру молекулы, диаметр молекул считайте исходя
из критических или кинетических данных.)
411
к
№ sap
анта
i
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
Реакция
2NO2-+2NO + O2
H2+I2—+2H[
CH3I + C2H5ONa—>СН,ОС2Н5+
i-Nai
(в этиловом спирте)
СН3СОСН3 = С2Н4 + СО + Н2
Р — 760 мм рт. ст.
СН3ОСН3—+СН4 + Н2 + СО
Р = 550 мм рт. ст.
C2H5Br+(C2H5KN->
—>-(C2H6LNBr(B ацетоне)
^2*4 ~Т 1*2 ^ЦПй
CH3NNCH3—>-С2Н8-Ь N2
Р = 487 мм рт. ст.
N2O—>N2+ l/2O2
Р = 810 мм рт. ст.
C3H7I + (CH3JNH— >
—*(CH3JC3H7NHI
(в этиловом спирте)
2N2O—->2N2 + 62
2NO2—>-2NO + О2
2С12О—^-2С12 + О2
Ot-JI ^t-J 1 I
Zril >l~l2 ~T *2
SO2Cl2-^-SO2-f С12
С2Н2 + Н—>С2Н3
сн3со—сн3—>с2н4+со + н2
Р = 760 мм рг. ст.
Г, к
627
700
291
835
1050
333
787
603
1085
333
1440,2
627
384
716
552,3
277,5
835
Константа скорости
1,81-10s
см3/(моль-с)
?
4,96-10-"
л/(моль-с)
¦>
0,54-10-3 с-'
¦j
1,77-10-2
л/(моль-с)
2,96-10-3 мнн-'
5,7-10-4 с-1
2,75-10-3
л/(моль-с)
V
1.81-103
см3/(моль-с)
-J
-J
2,742-10-3 мнн-'
2,19-Ю-'4 см-мо-.
лекул-'-с-'
1,5- Ю-3 с-'
Энергия
активации
В.
кДж/моль
111,2
165,44
. ?
286,3
50,32
?
219,199
629,93
100,32
?
91,86
186,43
?
?
286,33
Стерический
фактор р
0,019
0,47
0,8
3,4-10-5
2-10-5
4,9-Ю-8
0,05
р
1
2,5-10-5
1
0019
1
1
1
4,47-10-*
3,4810-6
Диаметр
реагирующих
частиц о, .
ср
см
2,0-10—в
2,0-Ю-8
2.64-10-8
2,74-Ю-8
5,0-10-8
4,5-10-8
5-Ю-8
5-Ю-8
2,0-10-8
2,0-10-8
3,98-10-8
3,3-Ю-8
Oi=a2
3,5-10-"
3,55-10-8
4,8-10-8
3,5-10-8
3,8-10-8
2,72-10-»
9
Ответ
3,12-10-8 см
70,24 см3/(моль-с)
80,75 кДж
5.21 -Ю-9 с-'
255,96 кДж
177,6 кДж
p=z 14,2-106
256,75 кДж
7,84 -10-8 см
3,47-10-7
л/(моль-с)
127,63 кДж
93,43 см3/(моль-с)
2,50-10-3
л/(моль-с)
__
5-Ю-8 см
№ ва-
варианта
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
H + HD-
H + HD-
H+D2-
H2+I2-
H2 + Br2
H2+Bi\,
2HI—»-H
2HI—»-H
2HI—>H
2H.—>-H
D+H2-
D + H2-
D + DH-
T+H,-
T + D2-
Реакция
->HD+H
—»-H2 + D
-»-HD 4-D
->2HI
-»-2HI
—»-2JHBr
—>2HBr
2-)-I2
2-j- I2
2+I2
2-)-I2
->-DH-)-D
-»-DH + H
-»-D2 + H
-+HT + H
¦+DTJ-D
2NO—»-N2+O2
2NO—Л
j +0»
2NO—>N2+O2
2NO—^
2NO—>1*
N2O6-+
N2O5—1
NaO6—>1
2N2O—>
2N2O—>
j2-)-O2
J2-J-O2
2NOS+ УгОг
S[2O4-4- /4O2
V2O4+!4O2
2N2 + O2
2N»+O2
т, К
1000,2
1000,2
1000,2
647,2
629,2
847,7
771,2
829,2
556,2
666,2
683,2
1000,2
1000,2
1000,2
1000,2
1000,2
1893,2
1628,2
1473,2
1235,2
1259,2
571,2
611,4
581,4
1351,2
1441,2
*
0,68-10-9 л/(с-моль)
0,95-10-9 л (/с-моль)
1.2-Ю-12 л/(с-моль)
0,0140 л/(мии-моль)
0,00676 л/(мии-моль)
8,56-10'2 л/(мии-моль)
3,6-10-* л/(мии-моль)
2,11-Ю-5 л/(мии-моль)
0,942-10-» л/(мии-моль)
0,588-Ю-3 л/(мии-моль)
0,00137 л/(мии-моль)
1,0-10-9 л/(с-моль)
2,5-10-9 л/(с-моль)
0,79-10-9 л/(с-моль)
2,2-10-9 л/(с-моль)
1,2 10-9 л/(с-моль)
19,18-10-' л/(смоль)
38,43-10' л/(с-моль)
62,46-103 л/(с-моль)
39,82-103 л/(с-моль)
6,72-103 л/(с-моль)
2,03- Ю-3 л/(мии-моль)
286-Ю-3 л/(мии-моль)
7,9 л/(мии-моль)
110.9-103 л/(мии-моль)
977,0 л/(мии-моль)
3. Для реакции (А), протекающей по л-му порядку, известны кон-
константы скорости при различных температурах. [Для реакции л = 1
k имеет размерность с, а для л = 2 размерность k будет см3/(с- моль).]
Рассчитайте: а) энергию активации; б) предэкспоненциальный мно-
множитель; в) теплоту активации; г) энтропию активации; д) температур-
температурный коэффициент скорости реакции.
№ ва-
варианта
1
2
Реакция (А)
CI
1
Гидролиз (Ш2)вС в 80%-ном этаноле
С1
п= 1
N2O—^NA+'/zOs
я = 1
т, К
273
298
308
318
273,1
288,1
283,1
298,1
308,1
313,1
¦ 318,1
1,06-10-5
О 1Q,1Л—4
О, Ij* i\j
9,86-10-*
2,92-Ю-3
7,87-Ю-7
1,05-10-5
1,76-10-5
3,38-10-5
1,35-10-*
2,47-10-*
4,98-10-*
413
Продолжение табл.
М ва-
варианта
3
4
5
6
7
8
9
10
Реакция (А)
Разложение ацетодикарбокснльной кис-
кислоты в водном растворе, п = 1
С2Н6Вг—>С2Н4 + НВг
л = 1
CjHjBr—*С,Н4 +HBr
я=1
NjO4—>2NO2
я = 1
Ч«/сло-(СН,СНО),—>3CH8GHO
п~\
СН,СН = СНСН8 + HBr—>
—>CH8CH2CHBrCH,
n = 2
Hj+C^—vQHe
я = 2
H2 + I2—>2HI
n = 2
г. К
323,1
328,1
338,1
273,2
293,2
333,2
273,2
298,2
308,2
318,2
328,2
338,2
750
760
770
780
790
800
300
310
320
330
340
ooO
500
510
520
530
540
550
300
310
320
330
340
350
360
600
610
620
630
640
650
660
500
510
520
530
540
550
560
k
7,59-10-4
1,50-10-8
4,87-10-3
2,46-10-6
47,5-10-6
5480-10-s
7,67-10-7'
3,46-10-s
1,46 10-*
4,98-10-*
1.50-10-'
4,87-10-3
4,539-10-8
7,194-10-8
1,125-10-2
1,741 -10-8
2,667-10-2
4,140-10-2
3,288-10»
6,652-106
1,259-107
2,398-107
4,295-107
7 Л Л*7 1Л7
/,447-10
5,175-Ю-5
1,238-10-4
2,345-10-4
6,455-10-*
1,404-10-8
2,994-10-8
7,638-10-7
2,055-10-»
6,309-10-»
1,888-10-6
5,188-10-6
5,902-10-*
3,020-10~4
7,413-10-8
1,343-10-2
2,38-10-2
4,149-10-2
7,145-10-2
7,586-10-'
1,995-10-'
7,834-10-*
1,714-10-8
0,243-10-8
7,48-10-3
1,503-10-2
2,930-10-2
5,610-10-2
414
о
я
а "О
II ||
МП
СО
я
к
II
з п_п—
н Я
II ^
t*o 1
n
я
II
II
n
я
к*
1
I
? -
п
II
я
в| Я
й-
1 Я
:? 1
(растворите;
о- а
Я II
о
•1
Z
1
J
Z.
ю
(растворите;
СГ
ъ
=?о
i
a a jl
«+Z
в» ГС
О 1
Z
о
к
X
аГ
II .+ .
X
+
п
Я
* 5
s
_ _ СЛСЛСЛСЛСЛСЛСЛ COCOCOCOtOtO COCOCOCOtOtO •**-*кСОСОСОСОСОСЛСЛСЛСЛСЛСЛС- .— -^^ „--^-^-.
O-J О1 *»СО N5 N5"— О СО Ю — О <О 00 СО to — ОЮК ¦—O«O00-gg5&0>C71*>.C0N5'—О Сэ СЛ •*» W (О ¦— Q
О>00 СлОО-JCOCOCO ОООООО ОООООО ОООООООООООООО ООООООО
O.OJ3
So So о S
|45 00 .4k^*.~~l N3 ¦— 4» — CO ¦— 00 CO^- -J N5
gJgtO SSlScoOoIS OOOOtOtD— С0«-О*.00С0СЛС0С0
5 — О • Слсл " - " ¦' S- Coa>^0<BtOOtOa>N5^NSN50?00
oio) СОСЛСО —^.^. ?5^Sa5SS"— — — — — — ~~ — Z.J-.~~C. ^C-~ — ~~~
"—"- со|чЭ|ч:мт>оо titoooaiao ooooeooooooooo ooooooo
ill ill 1 i I i I I I I
ГЛАВА XXV
КИНЕТИКА ФОТОХИМИЧЕСКИХ И ЦЕПНЫХ РЕАКЦИЙ
Основные уравнения и символы
[К., с. 658-680; Г., т. 2, с. 183—254]
Изменение интенсивности светового потока, прошедшего через
слой раствора толщиной /, выражается законом Ламберта—Бугера—
Бера
/^V~'""> (xxv.i)
где / — интенсивность светового потока после поглощения в слое раст-
раствора толщиной / см; /0 — интенсивность светового потока до прохож-
прохождения поглощающего слоя; k — молекулярный коэффициент поглоще-
поглощения; п — число поглощающих молекул в 1 см3.
Энергия, поглощенная средой, выражается законом Вант-Гоффа
? = /„A—«-*"'), (XXV.2)
где Е — количество энергии, поглощенной за единицу времени.
Количественной характеристикой фотохимических реакций явля-
является квантовый выход у реакции, т. е. число прореагировавших моле-
молекул на один поглощенный квант светового потока (закон Штарка—
Эйнштейна). Этот закон постулирует, что на один поглощенный квант
света приходится одна претерпевшая превращение молекула, т. е.
с точки зрения этого закона у = 1- Однако у учитывает число превра-
превращенных частиц, полученных и во вторичных, чисто химических актах
превращения:
(XXV.3)
где у — квантовый выход; лр — число молекул в единице объема,
которые прореагировали в результате поглощения кванта светового
потока за единицу времени; ла — число квантов светового потока, по-
поглощенных в единицу времени тем же единичным объемом раствора,
ла = E/hv.
Кинетическое уравнение (для первичного фотохимического акта
или для нецепного фотохимического процесса)
Скорость цепной реакции по какому-либо компоненту равна ско-
скорости той стадии продолжения цепи, в которой образуется или расходу-
расходуется рассматриваемый компонент. Так, если звено цепи состоит из
двух элементарных реакций, в каждой из которых расходуются исход-
исходные вещества и образуются продукты реакции
416
где Ri —свободные радикалы, то скорость цепной неразветвленной
реакции описывается уравнением
d[Ax] d[Bd , ,„., ,,,
At. At
«1 [A,] d [B2]
[Ri] [A], (XXV.5)
At - At — [RiHA.].
При написании дифференциальных уравнений для концентраций сво-
свободных радикалов следует учитывать скорости процессов зарождения
и обрыва цепей. Как правило, в результате зарождения образуется
какой-либо один из свободных радикалов, участвующих в цепном про-
процессе, например R[. Обозначив скорость зарождения через до0, ско-
скорости гибели свободных радикалов — через wn и wrt, можно напи-
написать
dIRl1 - *• r4;][A1]+ft1]R;][Ai]-Bvt, (XXV.6)
At
d[R,]
At
(XXV.7)
где w0 представляет собой функцию концентрации исходных веществ
или каких-либо инициирующих добавок и не зависит от концентра-
концентрации свободных радикалов; wri и шГз — функции концентраций сво-
свободных радикалов. Поскольку свободные радикалы являются высоко-
высокоактивными промежуточными частицами, их концентрацию практиче-
практически на всем протяжении процесса можно считать стационарной, т. е.
i rt (XXV.8)
В стационарном режиме скорость зарождения цепи равна скорости
гибели цепи. Если принять, что обрыв цепи идет только на одном из
свободных радикалов при достаточно длинных кинетических цепях,
т. е. v > 10, то соотношение (XXV.8) преобразуется:
», = »,.; (XXV.9)
для линейного обрыва цепи
«, = *,№]. (XXV. 10)
Скорость цепной неразветвленной реакции для линейного обрыва
цепи будет
w = kl(w0/ka)[Ai],
а для квадратичного обрыва цепи
шо = 2*8 [Rr-]3 (XXV.11
и
w = kt Vwo/2k3 [A|],
где k3 — константа скорости реакции обрыва цепи,
14 зак. 767 417
Стадия продолжения цепи, протекающая с участием свободного
радикала, на котором происходит основной обрыв цепи, является ли-
лимитирующей стадией звена цепи и индекс i относится к лимитирующей
стадии продолжения цепи. Длина цепи v цепной неразветвленной ре-
реакции равняется скорости цепной реакции, деленной на скорость об-
обрыва цепи (или на скорость зарождения цепи). Поэтому для линейно-
линейного обрыва цепи
(XXV.12)
а для квадратичного обрыва цепи
к,
[А,]. (XXV.13)
Порядок цепных реакций по отдельным компонентам и эффектив-
эффективную константу скорости можно определить по данным кинетики на-
накопления продуктов или по расходованию исходных веществ. Эффектив-
Эффективная константа представляет собой комбинацию константы скоростей
зарождения, продолжения и обрыва цепей. Зависимость эффективной
константы скорости от температуры описывается уравнением Арре-
ниуса. При этом для линейного обрыва цепей измеряемая эффектив-
эффективная энергия активации определяется по уравнению
?efl* = ?.+?i-?.. (XXV.14)
где Ео — энергия активации зарождения цепи; ?х — энергия акти-
активации реакции продолжения цепи, протекающей с участием менее ак-
активного свободного радикала; Е3 — энергия активации обрыва цепи.
Аналогично для квадратичного обрыва цепей будет
?эфф=1/2?0 + ?1-1/2?3. (XXV.15)
Скорость разветвленной цепной реакции может быть описана урав-
уравнением
=шо-|-фл, (XXV.16
d t
где п — суммарная концентрация свободных валентностей; w0 —
скорость зарождения цепи; ср — разность скоростей разветвления и об-
обрыва цепи. Если оба эти процесса первого порядка по концентрации
свободных радикалов, то скорости их могут быть записаны в виде
fn и qn, тогда
-^- =ш„-(<?-/) п. (XXV.17)
at
В таком виде уравнение (XXV. 17) описывает разветвленные реакции.
Если q > /, то в системе устанавливается стационарная концентрация
свободных радикалов:
n--=wa/(q-i). (XXV.18)
418
Наличие реакции разветвления приводит лишь к увеличению стацио-
стационарной концентрации, что эквивалентно уменьшению скорости обры-
обрыва при / = 0. Тогда в системе протекает стационарная цепная реак-
реакция, по своим кинетическим закономерностям не отличающаяся от
цепных неразветвленных реакций. Если f>q, f — q = ф > 0, то
интегрирование уравнения (XXV. 16) дает
или при ф^ >• 1
(XXV.19)
(XXV.20)
Из уравнения (XXV.20) видно прогрессивное нарастание концентра-
концентрации свободных радикалов, а следовательно, и скорости цепной реак-
реакции. Через каждые 1/<р с концентрация свободных радикалов, а следо-
следовательно, и скорость цепной реакции возрастают в е раз и за время не-
нескольких интервалов 1/<р практически полное отсутствие реакции сме-
сменяется взрывным протеканием процессов. Для разветвленных цепных
реакций характерно наличие двух резко различающихся режимов
протекания процесса. Если скорость обрыва больше скорости развет-
разветвления цепей, то обеспечивается стационарный режим процесса, при-
причем скорость процесса неизмеримо мала. Если скорость обрыва мень-
меньше скорости разветвления, то развивается нестационарный автоуско-
ряющийся процесс, заканчивающийся цепным воспламенением смеси.
Переход от условия q > / к условию f ~> q может произойти при не-
незначительном изменении одного из параметров, определяющих ско-
скорости обрыва или разветвления цепи: давления, температуры, состава
смеси, размера реакционного сосуда, состояния стенок сосуда. Таким
образом, незначительное изменение одного из параметров может вы-
вызвать переход от неизмеримо медленной стационарной реакции к бы-
быстрому взрывному процессу или наоборот. Такие явления в химиче-
химической кинетике называют предельными или критическими. Параметр,
при котором происходит переход от одного режима к другому, назы-
называют пределом воспламенения.
ЗАДАЧИ С РЕШЕНИЯМИ
1. На основе следующих данных оцените квантовый выход разло-
разложения уранилоксалата для каждой длины волны:
Длина
волны, нн
365,5
365,5
435,8
435,8
Доля разложив-
разложившегося
оксалата
0,0592
0,0498
0,0242
0,0208
Число разло-
разложившихся моле-
кул-10-18
6,18
4,32
2,10
1,79
Число погло-
поглощенных фото-
НОВ-10-"
10,58
8,93
3,64
3,10
14*
419
Решение. Рассчитаем квантовый выход по уравнению (XXV.3)
при 365,3 нм:
Т
Число разложившихся молекул
Число поглощенных фотонов
6,18-10"
= 0,584.
Ю,58-Ю1»
Для остальных измерений у равен 0,483; 0,576; 0,577 соответствен-
НО.
2. Фотохимическое бромирование толуола протекает по следую-
следующему брутто уравнению:
Вг,
+ НВг+С2Н5СН2Вг
Реакция протекает по цепному механизму, на что указывает вы-
высокий квантовый выход. Напишите схему механизма цепной реакции,
если обрыв цепи происходит на свободном радикале бензила, а сво-
свободные радикалы образуются при фотохимическом распаде Вг2. На-
Напишите стехиометрическое уравнение цепной реакции, если длина
цепи v. Определите, сколько молекул Вг2, СвН5СН3 расходуется и
сколько молекул CeH5CH2GH2CeH5, НВг и СвН5СН2Вг образуется в
одной цепи, если ее длина v = 50.
Решение. Цепные реакции являются сложными реакциями и,
строго говоря, не могут быть описаны одним стехиометрическим урав-
уравнением. Это объясняется тем, что часто обрыв цепей приводит к по-
появлению некоторых побочных веществ. Реакция бромирования толу-
толуола протекает по следующему механизму:
Вг2 + hv
2Вг* ( реакция зарождения )
/"Л
Вг2
СН, + НВг
СН2Вг + Вг"
(продолжение цепи)
Согласно условию обрыв цепи происходит на радикале бензила
сн.
СН,—СН
(обрыв цепи)
Так как длина цепи v, то (v + l)-e звено окажется неполным. В ре-
результате этого на последнем звене израсходуется молекула толуола,
образуется молекула НВг, но не образуется бензил бромида и не
израсходуется молекула Вг2. Если еще учесть, что половина молекулы
420
Вг2 была израсходована в процессе зарождения цепи, то полное урав-
уравнение процесса можно записать в виде
CeH8CH3 - V, CeH5CH2CH2CeH5 +
HBr + vCeH5CH2Br
Это уравнение можно рассматривать как стехиометрическое уравнение
цепной реакции. В отличие от обычиых стехиометрических уравнений
величина v зависит от условий протекания реакции. .
Определяем число молекул, образовавшихся и израсходованных
при v = 50:
50-У2Вг2; 51С6Н5СН3;
51 НВг; 50С6Н5СНВг
3. Кинетика фотохимического хлорирования муравьиной кислоты
в газовой фазе описывается дифференциальным уравнением
at
[НСООН].
Реакция цепная, на что указывает высокий квантовый выход. Со-
Составьте дифференциальное уравнение, если реакция идет по следую-
следующей схеме:
С12 + Л v —* 2С1 • (зарождение цепи),
С1 ¦ + НСООН X НС1 + -СООН J (продолжение цепи)
С12 + .СООН -+ НС1+СО2+С1- I
С1' + стенка —>• С1 (обрыв цепи).
3 ДС
Решение. Скорость данной цепной реакции определяем по
формуле
w = kt-&- [A,-].
k3
Так как цепь обрывается на атоме С1, то можно считать, что kt = klt
[А,] = [НССЮН]. Так как w0 = k0 [Cl2], то
w= -^-1 [С12] [НСООН].
Отсюда
k = k9ki /k3.
421
4. Фотохимическое окисление 5 М дибензилового эфира (СвН5СН2JО
в жидкой фазе молекулярным кислородом развивается по следующей
схеме:
RH ¦ +/iv-A- R" (зарождение цепи),
К + О2 * ! (ПрОдолжение цепи),
RO-2+RH -Л ROOH + R- 1
RO'j + RO'j -Л (обрыв цепи).
Реакция идет с энергией активации Е = 28,5 кДж при интенсивно-
интенсивности светового потока 10~' Е-л'1-^1 и со скоростью w = 9,5-10-'
моль-л-1-c-1. Скорость зарождения цепи, измеренная методом ин-
ингибиторов, дао = 9-1О-8 моль-л^. Реакция окисления дибензи-
дибензилового эфира при инициировании азо-ызо-бутиронитрилом имеет
энергию активации Е = 93,6 кДж. энергия активации распада азо-
ызо-бутиронитрила 128,9 кДж. Рассчитайте длину цепи и энергию акти-
активации каждой стадии.
Решение. Кинетика цепной неразветвленной реакции описы-
описывается уравнением
» = *, V5J72MA|1.
Так как [AJ = [RH], kt = k2, то w = —— Ущ tRH]. Отсюда
= 8,9-10-3 моль -'/.-л'/.-с-1/..
-\/k3 УЭ-10-8-5
Длина цепи реакции будет v = w/w0 = 105. Энергия активации
Е = V2 Ео + Е2 — х/2?з- ^ак как фотохимическое инициирование
является элементарной фотохимической реакцией, то ее энергия акти-
активации равна нулю. Следовательно,,
Е,-Ч, ?3 + 28,5 кДж.
Так как
Е2— 0,5 Е3 = Е— 0,5 ?„ = 9?,0—0,5-128,9 = 28,9 кДж.
Поскольку энергия активации процессов рекомбинации и диспропор-
ционирования свободных радикалов близка к нулю, то полученная
величина Е2 — 0,5?3 да Е2.
5. В цилиндрическом кварцевом сосуде диаметром 4 см, заполнен-
заполненном стехиометрической смесью 2Н2 + О2, под давлением 10 мм рт. ст.
и при температуре 788 К протекает цепная реакция. Рассчитайте кон-
константу скорости гибели атомов Н, если эффективность захвата атомов
Н кварцем составлет <?н = 1,3-10~3. Диаметр атомов водорода
он + 1,90-10~8 см, молекул водорода аНг = 2,40-10~8 см, молекул
кислорода ао, + 2,98- Ю-8 см.
422
Решение. Для цилиндрического сосуда константа скорости
обрыва цепей равна
где г — радиус сосуда; D — коэффициент диффузии; S — эффектив-
эффективность захвата; и — относительная скорость движения атомов.
Коэффициент диффузии рассчитываем по формуле молекулярно-
кинетической теории газов
где и — скорость движения частиц; X — длина свободного пробега;
>„ = и/2 а,- И; itf,
где at — сечение соударений свободного радикала с i-й частицей из
числа всех частиц, присутствующих в реакционном сосуде; щ — число
i-частиц в 1 см3; и — относительная скорость движения свободных ра-
радикалов и 1-х частиц. Для данной системы
D=T
1 п2
относительные скорости движения Н и Н2
относительная скорость движения Н и О2
Число молекул Н2 и О2 в 1 см3 будет:
2 0,97-101»
nt=P ¦ = 8,2-1016Р;
1 0,97-101»
п2= Р : = 5,Ы016Р.
Относительная скорость одной молекулы
i=4,15.10* см/с.
3,14
Сечения соударений атомов Н с Н2 и О2 равны:
= я @,95+1,20J 10-"= 1,45-10-16 см2,
2
= я @,95+1,49J 10-"= 1,89-10-15 СМ2
423
Следовательно,
l D,l5._io*)»_
3 60Р + 61.51Р
тогда
г2 _ 4Р
8О 8-6,2-103~
1 17,22-10" 6.2-103
— см3/с;
2г 4
= 7,4-Ю-3 с.
<§и 1,3- Ю-з-4,15- Ю6
Отсюда
k ! = ! = 122 с-1.
8-10* + 7,4-10-» 8,2.10-3t
ЗАДАЧИ
1. Кварцевый реактор, содержащий бензол, насыщенный 10 %
хлора, облучали световым потоком (% = 313 нм). Продолжительность
облучения 35 мин. В результате реакции был получен гексахлорцикло-
гексан. Определите квантовый выход реакции, если энергия, прошед-
прошедшая через кварцевый реактор с чистым бензолом, 46,81 Дж, а энергия,
прошедшая через реактор во время реакции, 4,25 Дж. Выход С6Н6С1
составил 1,8 г.
2. При прохождении светового потока с % = 400 нм через реактор,
в котором протекала реакция по уравнению СО + С12 = СОС12, было
получено 100 г фосгена; количество поглощенной газом энергии элек-
электромагнитного излучения ?абс = 3-102 Дж. Рассчитайте квантовый
выход.
3. Определите для образования 1 моль озона при квантовом вы-
выходе 7 = 2 количество энергии электромагнитного излучения к =
= 207 нм, которое поглотит кислород, превращаясь в озон: ЗО2 = 2О3.
4. Термическое разложение ацетона происходит при 578 К на
25 % за 90,9 с, при 601 К — за 31 с. Фотохимическое разложение
осуществляется при длине волны 313 нм с квантовым выходом у = 2.
Рассчитайте константу скорости мономолекулярного термического
разложения ацетона, энергию активации этого процесса и расход
энергии электромагнитного излучения (Дж/моль) в фотохимическом
процессе. Будет ли общий расход энергии электромагнитного излуче-
излучения соответствовать вычисленному?
5. Вычислите энергию активации для реакции, протекающей по
уравнению
СН2С1СООН + Н2О = СН2(ОН)СООН + НС1
424
по &з5зк = 2,22-10~5 и &4озк = 2,37-10 3 мин-1 и сравните с энер-
энергией, которую получает система при фотохимическом активировании
от освещения с длиной волны 253,7 нм, при квантовом выходе у = 1.
Как изменяется валентность хлора в этой реакции? Как и почему будет
изменяться электрическая проводимость во времени?
6. Составьте систему уравнений зарождения и развития цепи в га-
газовой смеси Н2 + Clg при фотохимическом процессе. Достаточно ли
светового потока от источника с длиной волны Я, = 0 475,8 нм для
инициирования цепи? Каковы тепловые эффекты в элементарных актах?
Рассчитайте количество поглощенной лучистой энергии при образова-
образовании 1 моль НС1 и квантовом выходе у — 105. Свободные радикалы от-
отметьте точкой.
7. Кинетика фотох .мического хлорирования тетрахлорэтилена в
растворе СС14 описыьается уравнением
Реакция цепная, на что указывает высокий квантовый выход, а так-
также дробный порядок реакции. Получите приведенное дифференциаль-
дифференциальное уравнение, если реакция идет по следующей схеме:
Cl2-f-ftv —--+ 2С1- (зарождение цепи),
С1'+С2С14 —li-> 'CjClj (продолжение цепи),
•С2С16+С12 _^_> С1-+.С2С1в
•С3С16 + -С2С15 —-+ С2С1в+С2С14 (обрыв цепи).
8. Кинетика термического распада дихлорэтана в газовой фазе
описывается уравнением первого порядка
Получите приведенное дифференциальное уравнение, если реакция
протекает по следующему механизму:
С2Н4С12 > #CjH|Pl+Cl- (зарождение цепн),
С2Н4С124-С!* > 'Cjl^gC^+HCl (продолжение цепи),
•c2H3ci2 _iu c2h3ci+ci-
С2Н3С124-стенка —!-> (обрыв цепи).
425
9. Для термического разложения окиси этилена был предложен
следующий механизм:
к *
СН2—СН2 ^- СН2—СН + Н (зарождение цепи)
(продолжение цепи)
СН2—СН2 + СН2 —'^-*- СН2—СН + СН4
\/ \>/
СН2 — СН + СН3 •- (устойчивые продукты)
Предполагая, что концентрации радикалов стационарны, покажите
что реакция разложения имеет первый порядок по окиси этилена.
10. При 300 К распад циклопропана (С) с образованием пропиле-
пропилена (Р) идет через промежуточное образование триметиленового бира-
дикала (Т):
С ~ Т + 226,8 кДж; Д S» л> 42,0 Дж/(моль-КI
к,
Т —.+ Р—258,2 кДж; Д S° = 8,4 Дж/(моль-К);
С —>¦ Р —31,4 кДж/моль; AS° = 33,6 Дж/(моль-К).
Выразите скорость изомеризации через константы klt k2, k3 (изме
пением давления пренебречь). Вычислите общую энергию активации
изомеризации, если для к3 энергия активации равна 46,2 кДж/моль,
а Е2 — 16,8 кДж/моль. Рассчитайте среднее время жизни частицы
Т в системе, если ?02 = 1 • 1014 с. Вычислите константу скорости для
суммарного распада, если предэкспоненциальный множитель k03 =
= 2-Ю13 с.
11. Реакцию окисления СН4 кислородом
СН4 + О2 —¦»• СО2 + Н2О
проводили при помощи фотосенсибилизации:
Hg JLL^ Hg*
СН4 + Hg* —»¦ Hg* + -CH3 + -H
Радикалы 'CH3 реагируют с О2 с образованием смеси продуктов
О
II
СО2, СО, НС- Основной продукт реакции диоксид углерода СО2. Ко-
Н
426
личество прореагировавшего СН4 6,1- Ю4 молекул/с. Энергия электро-
электромагнитного излучения 8,7-10~и Дж/с, температура опыта 298 К,
X = 253,7 нм. Определите квантовый выход реакции.
12. Фотосенсибилизированная реакция брома с водородом в из-
избытке Н2 при 423 К представляет собой цепной процесс, протекающий
по схеме:
Br2 + /tv —> 2Вг (зарождение цепи),
1
Br-f-H2 ^Zl HBr + H (реакция смешанного второго порядка),
2
H-f-Br2 у НВг + Вг (реакция смешанного второго порядка)»
Br-[-Br-j-H2 у Вг2 + Н3 (реакция смешанного третьего порядка).
Пользуясь методом стационарных концентраций, выразите стацио-
стационарные концентрации атомов Н и Вг через концентрации других про-
продуктов, константы скоростей и скорость реакции инициирования. На-
Напишите дифференциальное уравнение для стационарной скорости об-
образования НВг. Вычислите квантовый выход образования НВг. При
каких условиях квантовый выход будет наибольшим? Каков физиче-
физический смысл этого явления?
13. Цепная реакция распада О3 в газовой фазе, катализируемая
N2O5, протекает по механизму
NA ~~* NO2 + NO3 *i,,«l A,2)
кг
NO2 + O3 —.* NO3 + O2 C)
2NO3 —.» 2NO2 + O2 D)
Предполагая, что реакция A) первого порядка, а все остальные
реакции — реакции второго порядка, напишите уравнения для ско-
скорости расходования исходных веществ и накопления конечных и про-
промежуточных продуктов. Примените метод стационарных концентраций
к частицам NO2 и NO3 и подсчитайте их стационарную концентрацию.
Выразите скорость расходования Оз через концентрации О3 и N2O5
(N2O5 в реакции не расходуется). Напишите уравнение для скорости
расходования О3, если в схему вместо реакции D) ввести реакцию
k3
О3 + NO3->- 2О2 + NO2. Можно ли экспериментально установить
различие между полученными уравнениями скоростей?
14. Реакция термического разложения озона протекает по меха-
механизму
О3 + М " " О2+О + М
О+О, -JU 2О2
427
где М — валентнонасыщенная молекула. Используя метод стационар-
стационарных концентраций, получаем уравнение для скорости разложения
озона:
d[O3] _ 2k1k3[O3]HM)
dt k2[O '
По этому уравнению и энергиям активации Е1 = 103,0 кДж/моль;
Е2 — 0 кДж/моль; Е3 = 12,6 кДж/моль вычислите эффективную
энергию активации для реакции разложения озона: а) при полном от-
отсутствии кислорода; б) в избытке кислорода.
15. При помощи метода стационарных концентраций выведите вы-
выражение для скорости реакций хлора с водородом по схеме
—-* 2С1+М
С1 + Н2 -
Н+С12 -
н+о2
ci+os
С1 + Х
к,
г
—>
i
к,
к.
HCl-j-H
НС1+С1-
- но2
¦ сю2
- С1Х
где М — некоторое вещество (которым может быть и поверхность ре-
реакционного сосуда), влияющее на диссоциацию молекул хлора; X —
некоторое вещество, связывающее атомы хлора. Скорость образования
хлороводорода можно принять равной ka [HHC1J; так как k2<^ k3, то
можно пренебречь членами с [Н] [О2]2.
Получите выражение для скорости: а) при полном отсутствии кис-
кислорода; б) в присутствии кислорода. Используя значения Ех =
— 117,4 кДж/моль; Е2 = 25,2 кДж/моль; Е3 = 8,4 кДж/моль; ?4 =
— 0 кДж/моль; Е5 = 0 кДж/моль, вычислите эффективную энергию
активации в обоих случаях.
16. Механизм реакции Н2 + Вг2 = 2НВг:
2Вг
Переносчиками цепей служат атомы водорода и брома. Скорость
образования бромоводорода выражается уравнением
d [HBr]
dt
428
= *• [Brj JH2] + h [H] [Brj - kt [H] [HBr].
После некоторых преобразований и замен получаем уравнение
d[HBr] 2ki(k1/kiI/> [Н2][Вгг]'^
dt - 1+(*./*,)/([НВг1/[Вг,1) "
Используя это уравнение и следующие значения энергии активации:
Ех — 189,5 кДж/моль, Е2 = 740 кДж/моль, Е3 = 5,04 кДж/моль,
?4 = 5,04 кДж/моль, Cs^O кДж/моль, рассчитайте эффективную
энергию активации реакции брома с водородом: а) в начале процесса
и б) в присутствии большого избытка бромида водорода.
17. Вычислите энергию активации для реакции зарождения цепи
при окислении бутана, если по истечении 100 с от начала реакции по-
получены следующие данные:
Т, К . . 540 543 553
ф. с-1 2,5-Ю-2 2,3-10-2 2,0-10~2
п, смз-с-1 2,16-10» 1,98-10е 1,86-10е
Реакция окисления бутана — цепная, разветвленная.
18. При изучении цепной реакции окисления изопропилбензола
были получены следующие данные:
t, ч
1,00
2,00
2,83
3,67
моль/(л-ч)
0,20
0,417
0,556
0,750
моль/(л-ч)
0,106
У [ROOH]
0,630
[RH], моль/л
10
Определите длину цепи и выведите выражение скорости разветвления
цепи.
19. На рис. 49 приведена область воспламенения для системы
СО -f O2. Опишите зависимость интервала воспламенения от темпе-
температуры и состава газовой смеси и объясните нижний и верхний пределы
воспламенения. Какие радикалы могут снизить температуру воспла-
воспламенения при наличии влаги в этой газовой смеси?
429
20. Сферический кварцевый со-
сосуд диаметром 10 см заполнен сте-
хиометрической смесью 2Н2 + О2
под давлением 20 мм рт. ст. и
515 К, где протекает цепная реак-
реакция. Рассчитайте константу скоро-
его- 6<*o • 660 г; к сти гибели атомов Н, если эффек-
эффективность захвата атомов Н кварцем
Рнс. 49. Область воспламенения прн СОСтавляет /н= 1,3-10-». Диаметр
различном содержании О2: атомов н д _ Mq ^J
'-90-г-ЗЗА Н, - 2,40 • К)-», О2-298-10-8.
21. Определите энергию поглощенного света 1 кДж/моль при
протекании фотохимической реакции Вг2 + С6Н12 -> С6НиВг + НВг,
если за время освещения прореагировал 1 моль Вг2. Длина волны мо-
монохроматического света 470 нм. Квантовый выход у = 1.
22. Определите энергию поглощенного света 1 кДж/моль при
hx
протекании фотохимической реакции СН3СООН —> СН4 + СО2, если
за время освещения прореагировал 1 моль уксусной кислоты. Длина
волны монохроматического света 230 нм. Квантовый выход у = 0,5.
23. Определите, пользуясь справочными данными [М.], энергию
поглощенного монохроматического света при разложении 1 моль
hx
СН3СОСН3 по уравнению реакции СН3СОСН3 —> С2Н6 + СО, про-
протекающей в газовой фазе при 333 К-
24. Какой коэффициент поглощения имеет 0,25 М раствор с по-
поглощающим слоем 10 см и пропусканием 90 %?
25. Сколько лучистой энергии необходимо, чтобы Na молекул
ацетона возбудить светом с длиной волны 253,7 нм? Сравнимо ли это
количество с энергией связи С = С?
26. При облучении паров HI УФ-светом с длиной волны 207 нм
образуются Н2 и 12. При энергии излучения 1 Дж распадается 0,00044г
HI. Определите квантовый выход.
27. В реакционном сосуде вместимостью 1 л находятся водород Н2
(парциальное давление V2 атм) и С12 (парциальное давление V2 атм).
Эта газовая смесь облучается при комнатной температуре светом с
длиной волны 400 нм. При этом поглощается 6,28 Дж энергии и дав-
давление увеличивается на 9013 атм. Каков квантовый выход?
28. Натриевая лампа A000 Вт) излучает большую часть энергии
при длине волны 589 нм (D-линия). Как долго следует облучать пробу
из Л^д/ЮОО молекул этой лампой, с тем чтобы по крайней мере полови-
половина молекул прореагировала ?
МНОГОВАРИАНТНАЯ ЗАДАЧА
Реакция Ах + А2 = Вх + В2 протекает по цепному не развет-
разветвленному механизму. Зарождение цепи происходит в результате вза-
взаимодействия кванта света с одним из реагирующих компонентов или
430
№ варианта
1
2
з-
4
5.
6
7
8
9
10
11
12
13
14
15
Реакция
С12 + НСООН-^-НС1+СО2
С2Нв+С12—¦С2С1,
Термический распад С2Н4С12
С12 + Н2-^2НС1
С12+Н2Д-2НС1
СвН6-СН3+ Вг2-^НВг+
+ СвН5СН2Вг + СвН6СН2 = СН2—СвН5
СО+С12-^СОС12
CO-f С12-^>СОС12
Пиролиз метана СН4
Пиролиз метана СН4
Н2-}-Вг2-^2НВг
На + Вг^2НВг
203-^>302
Термический распад СН2СОСН3—>
—>СН4 + С2Н6—>СОСН8
Термический распад СН3ОСН,—*¦
—>СН4 + СО + Н2
Вещество,
с которым
взаимодей-
взаимодействует квант
света или
происходит
термический
распад
С12
С1„
С2Н4С12
С12
С12
Вг2
cl2
С12
сн4
сн4
Вг2
Вг2
О3
СН3ОСНз
Длина
цепи v
30
45
50
35
45
20
500
300
100
80
70
50
10
30
50
Свободный
радикал,
на котором
происходит
гибель цепи
С1-
•с2н6
¦ С2Н3С1 л
¦С2Н3С12
ci-
н-
СдНбСНг
С1
ci
н-
н-
сн3
Вг.
•н
о-
СНз
Молекула,
которая
распада-
распадается
НСООН
С12
С2Н4С12
С2Н4С12
С12
н2
CeH6CHs
ci,
со
сн4
сн4
Вг2
н2
CH3OCH3
Молекула,
которая
образуется
НС1
c2cie
НС!
НС1
НС1
НС1
НВг
СОС12
СОС12
с2нв
Н2 '
НВг
НВг
о2
сн4
г,к
298
298
298
300
300
300
300
300
300
1000
1000
¦300
300
87
500
500
посредством термического воздействия. Предполагая, что реакция про-
продолжения цепи идет через две элементарные стадии, а гибель цепи
происходит на одном из участвующих в процессе свободном радикале,
запишите:
1) схему предполагаемого механизма цепной реакции; 2) стехио-
метрическое уравнение цепной реакции с использованием значения
длины цепи v; 3) кинетическое уравнение для изучаемой реакции на
основании предложенного механизма. Покажите, что в зависимости от
природы свободного радикала, на котором происходит гибель цепи,
реакция описывается различными кинетическими уравнениями; 4) ка-
какое количество молекул Ах расходуется и какое количество молекул
В! образуется в цепи, если длина цепи v (см. табл. на с. 431).
ГЛАВА XXVI
ДИФФУЗИЯ. КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ
Основные уравнения и символы
[К., с. 681—684; Г., т. 2, с. 295, 296]
Процесс диффузии описывается уравнениями Фика. Дифференци-
Дифференциальные формы 1-го уравнения
~:=-Dfs, (XXVi.i;
at ал;
2-го уравнения
|-»--Н . (XXVL2,
где dn — количество вещества, проходящее за время cU через площадь
поверхности S, моль: (dc/dx) (grad с) — градиент концентрации. Гра-
Градиент концентрации зависит от концентрации [dc/dx = / (с)]. При ста-
стационарном потоке
— = const =
= const ,
ах Дх
(dcldt)x — изменение концентрации диффундирующего вещества в
данной точке системы от времени; D — коэффициент диффузии;
D = Doe-E«'RT, (XXVI.3)
где Do—константа; Ео — энергия активации диффузии. Уравнения
Фика в интегральных формах имеют вид:
1-е уравнение для стационарного потока
Ji(x) = -j-=~D^S; (XXVI.4)
432
2-е уравнение для нестационарного потока, если диффузия в бесконеч-
бесконечно-протяженном теле (л: изменяется от — оо до + оо), имеет решение
г=—A-erfZ). (XXVI,5)
Тогда
• Jt (x-o>= -~r 1/-7- - -7 • (XXVI.6)
/я V t t
Если диффузия в полубесконечном (полуограниченном) теле (л: изме-
изменяется от 0 до + оо), то решение приобретает вид:
с = соA— erfZ), (XXVI.7)
-,,-.,, . ¦ (XXVI.8)
Т/я
где erf Z — гауссовский интеграл ошибок. Значение erf Z приводит-
приводится в справочниках как функция значения Z:
Z = —— . (XXVI.9)
2 К О/
Некоторые предельные значения Z и соответствующие им значения
erf Z:
Z О >2,8 <0,7
erf Z ... О 1 2
Уравнения (XXVI.5)—(XXVI.8) применимы при условии
/ > 5,бУШ, ' (XXVI. 10)
где / = л:тах — толщина слоя вещества, в котором происходит диф-
диффузия;
5,6/57=1, (XXVI. 10а)
L — расстояние, на которое за время t продвигается фронт диффузии
Коэффициент диффузии можно выразить через коэффициент тре-
трения по уравнению Стокса—Эйнштейна
RT
где г\ — коэффициент вязкости; г — радиус диффундирующих ча-
частиц, имеющих сферическую форму.
Скорость растворения при постоянном перемешивании описывает-
описывается уравнением Фика, дифференциальная форма которого имеет вид
?-¦?<»-<..
433
где D — коэффициент диффузии растворяющегося вещества; S —
площадь поверхности растворяющегося вещества; V — объем раство-
растворителя; б — толщина приповерхностного слоя; с0 — концентрация
насыщенного раствора, моль/л; с — концентрация раствора;
DS/V6 = ?pacTB. (XXVI.13)
Если с = const, то процесс растворения становится стационарным,
приэтом(с0 — с)/б — const и интегральная форма уравнения (XXVI. 12)
принимает вид
Дя = DS/V6 (со—с) t, (XXVI. 14)
где Ал — количество вещества, растворившееся за время t.
Если при растворении концентрации с меняется, то
2,3 . co-ci (XXVI.15)
Для скорости гетерогенной мономолекулярной реакции типа
Лтв+5(газ или жидкость) -> раствор
(скорость перемешивания постоянна) эффективная константа скорости
(XXVI.16)
где k — константа скорости собственно химической реакции первого
порядка; р — константа скорости диффузии (скорость переноса веще-
вещества в зону реакции на единицу площади поверхности),
p = D/6, (XXVI. 17)
б — расстояние, на которое переносится реагент.
Для реакции, протекающей в диффузионной области (k* — Р),
кинетические уравнения принимают вид:
дифференциальная форма
-^¦=№{с-с0), (XXVI.18)
где с, с0 — концентрации реагента В в объеме раствора и у поверх-
поверхности реагента А соответственно. При сл — О
±==^±с. (XXVI 19)
аг V
интегральная форма
(XXVI'20)
Для реакций типа А(ТВ) + В(Г) — АВ(ТВ) , когда слой продук-
продукта реакции АВ пористый и не затрудняет контакта исходных веществ
А и В и реакция протекает в кинетической области, порядок может
434
быть нулевым, первым, вторым и дробным. Для реакций нулевого по-
порядка кинетическое уравнение в интегральной форме имеет вид
An
-— = k't, (XXVI.21)
где Д/n — приращение массы исходного реагента А за счет образова-
образования на нем слоя АВ; S — реакционная площадь поверхности,
S = const; k — константа скорости.
Если контакт реагентов А и В осуществляется через плотный слой
АВ, реакция, как правило, лимитируется диффузией, тогда кинетиче-
кинетическое уравнение в интегральной форме является уравнением параболы:
Дт \2
— =k"t, (XXVI.22)
¦-> /
где k" — константа скорости, которая пропорциональна коэффициен-
коэффициенту диффузии D реагента А или В через слой конечного продукта АВ.
Скорость испарения описывается уравнением
Ps
/
(XXVI.23)
где /исп — число молей жидкости, испарившихся в единицу времени
с единицы площади поверхности (скорость испарения); Ps —давление
насыщенного пара.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Образец сплава металла А и В длиной 0,5 см и образец метал-
металла В длиной 0,5 см спаяны друг с другом. Определите время, за кото-
которое в результате диффузии А из сплава в чистый слиток В на расстоя-
расстоянии от спая 0,01 и 0,2 см установится относительная концентрация
А (са1с0), равная 0,2, и D — const = 2-10~9 см2/с.
Решение. Для определения времени диффузии используем
уравнения Фика (XXVI.5) и (XXVI.9). Вначале вычисляем t для
х = 0,01 см, предварительно определив Z по уравнению
l'2(l — erfZ); 0,2 = 1/2A —erf Z);
Затем вычисляем время по уравнению
Z2T/D 0,6-21/2 10-»
Проверяем надежность полученных результатов и применимость урав
нения (XXVI.5). Для этого подставляем найденные величины в урав-
уравнение (XXVI. 10):
0,5 > 5,6 /2-10-»-9,6-3600 > 0,046.
435
Условия применимости уравнения (XXVI.5) выполняются, так как
/ (w) > bfiVDi.
Повторяем расчет и вычисляем t для х = 0,2 см:
о 2
Z=o,6= : г = 3875ч.
2 У2-10-»
Проверяем применимость уравнения (XXVI.5) для х = 0,2 см:
0,5Ss5,6/2-10-"-3875.3600 >0,93.
Условие применимости уравнения не выполняется: / (хтах) •<
Последний результат не надежен.
2. Рассчитайте время, за которое ширина диффузионной размы-
размытой зоны между сплавом АВ и металлом В станет равной 0,1 см и
D = const = 2-Ю-9 см2/с.
Решение. Ширина диффузионной размытой полосы б при диф-
диффузии в бесконечно протяженном теле (расстояние между фронтами диф-
диффузии) равна 2L или
6 = 21=2-5,6 УШ; 2,56 У2-10-»г =0,1; ^=11 ч.
3. На дно цилиндрического сосуда, залитого водой, помещен слой
сахара. Сахар, растворяясь, диффундирует в объем раствора. Над
сахаром раствор насыщен и концентрация его с0 постоянна. Высота
столба жидкости 20 см. Вычислите, на каком растоянии х от границы
раздела сахар—раствор относительная концентрация с/с0 станет рав-
равной 0,8 через 16 сут; D = 0,25 см2/сут. Учтите, что для данных условий
(t, D), согласно уравнению (XXVI. 10), / = 11,2 см при 298 К.
Решение. Поскольку происходит нестационарная диффузия
в полубесконечном пространстве, то для расчета используем уравнения
(XXVI.7) и (XXVI-9):
0,8 = A—erfZ); erfZ = 0,2 Z = 0,2;
0,2 = x/2~l/0,25-16; х =
Уравнение (XXVI.7) применимо для данных условий, так как / > х
A1,2 > 0,8).
4. На дно цилиндрического сосуда, залитого водой, помещен слой
сахара. Сахар, растворяясь, диффундирует в объем раствора. Над
сахаром раствор насыщен и концентрация его с0 постоянна. Высота
столба жидкости 20 см и D = 0,25 см2/сут. Рассчитайте количество са-
сахара, которое перейдет в раствор с 1 см2 поверхности за 16 сут, если
с0 = 2,565 моль/л.
Решение. Число молей сахара, растворившегося за 16 сут,
рассчитываем по уравнению (XXVI.8):
»¦>¦
Дп = Л = 2,61-10-4-16 = 5,776-10-3моль-см2,
'"сахара = 5,776-10-3-342,3= 1,977 г/см2.
436
5. Рассчитайте радиус молекулы белка, если его коэффициент диф-
диффузии в растворе сахара D — 6,39-10~7 см2/с, Т = 298 К. Считайте,
что молекулы белка имеют сферическую форму.
Решение. Радиус молекулы белка рассчитываем по формуле
RT
' '°
где л = 1,227-Ю-3 Па-с [М.];
(8,314 Дж/(моль-К)) B98 К)
Г~ F,39-10-»м2/с) F,02• 1033 моль-1) 6-3,14 A,227-Ю-3 Па-с)
6. Таблетка бензойной кислоты с площадью поверхности S =
= 2 см2 помещена в раствор бензойной кислоты. Объем раствора 20 л,
концентрация 0,003 моль/л. Раствор размешивали, в результате чего
за 5 мин растворилось 0,001 моль СвН5СООН. Можно принять, что
практически концентрация раствора при этом не изменилась. Кон-
Концентрация кислоты в насыщенном растворе cs = 0,024 моль/л B98 К)-
Коэффициент диффузии бензойной кислоты D — 0,75 ем2/сут. Вычис-
Вычислите константу скорости растворения k, скорость диффузии р, толщи-
толщину приповерхностного слоя 6.
Решение. На границе приповерхностного слоя и поверхности
таблетки концентрация постоянна и равна cs. Концентрация в массе
раствора в течение рассматриваемого времени тоже постоянна, поэто-
поэтому поток вещества через приповерхностный слой можно считать стацио-
стационарным и
dc _Дс cs—-с
dx Ах б
Для стационарного потока уравнение (XXVI.12) принимает вид
An An DS
_ = _ = _ (Cf_c).
Константы скорости рассчитываем по уравнению (XXVI. 13), для чего
находим DS/S:
DS An ft, 0Щ -60-24
—- = = = 13 714 см3/сут.
б t{c—c) 5@,024—0,003) у
Подставляем числа в (XXVI.13):
13714 „ D 13714
* = 2oTTo =:0-6857 сут~1; р= Т^-Т"857 см/сут:
DS 0,75-2
б = =•— = 1,09-Ю-4 см.
13714 13714
7. Концентрация кислоты в насыщенном растворе cs = 0,024 моль/л
B98 К). Коэффициент диффузии CeH5COOH D = 0,75 см2/сут. Концен-
Концентрация раствора в ходе растворения изменялась. Таблетка бензойной
кислоты с площадью поверхности 5 = 2 см2 помещена в раствор бен-
437
зойной кислоты. Объем раствора 20 л, концентрация 0,003 моль/л.
Раствор размешивали, в результате чего за 5 мин растворилось
0,001 моль С„Н5СООН. Определите время, за которое концентрация
раствора станет равной 0,012 моль/л.
Решение. Поскольку концентрация раствора в рассматривае-
рассматриваемом отрезке меняется, меняется и градиент концентраций в припо-
приповерхностном слое, т. е. процесс диффузии не стационарен. Используем
уравнение (XXVI.15). Так как
*! = (); с,=0,003. то k=— lg c-^i. .
Подставляем числа и решаем относительно t:
2,3 0,024—0,003
•'.,= lg = 0,815 сут, или 19,55 ч.
0,6857 0,024 — 0,012 J
8. Металлический цинк площадью 20 см2 при 298 К растворяли
в 700 см3 серной кислоты по уравнению
Zn+H2SO4=ZnSO4+H2
Вычислите скорость диффузии р и соотношение толщины диффузион-
диффузионных слоев (бг/б2) в опытах 1 и 3, используя следующие данные:
Скорость перемешивания 400 об/мин.
Опыт 1 2
t, ч 0 0,5 1
сн so , г-экв/л . 0,153 0,118 0,090
Скорость перемешивания 216 об/мин.
Опыт 3
t, ч 0 0,5
с.
H2SO,
г-экв/л .... 0,080 0,069
Решение. Определяем константу скорости растворения по
уравнению (XXVI.20). При t = 0
Определяем скорость диффузии р для опыта 1:
2 3 0,153
/г1 = — lg =0,519 ч-»;
0,5 s0,118
Vk 700-0.519
Р'=Т = —^— = 18,27 см/ч;
для опыта 3:
. 2,3 0,080
438
По полученным значениям E рассчитаем толщину диффузионного
слоя 6:
D
i = T" и б» =
10,32
18,27
Толщина диффузионного слоя при изменении числа оборотов умень-
уменьшилась почти двое.
9. Над углем пропускают воздух под постоянным давлением, в ре-
результате чего происходит реакция С + О2 = СО2. Данные измерений
позволили определить эффективную константу k* при различных тем-
температурах. Результаты измерений и вычислений:
Г, К 777 873 973 1073 1173 1273
A/ТI03 .... 1,290 1,145 1,026 0,930 0,85 0,785
к*, см/с 0,073 0,447 2,15 6,81 13,72 19,49
lg k* —1,137 —0,35 0,332 0,832 1,137 1,29
1373 1573
0,728 0,636
23,40 26,90
1,369 1,429
вычислите
Установите, в какой области протекает реакция, и
энергию активации.
Решение. Строим график в координатах lg k* -— \1Т (рис. 50).
Отрезок Ас соответствует кинетической области, т. е. скорость реакции
лимитируется собственно кинетикой при .
Т < 1100 К, к СР, к = к*. При Т > 1100 К
отрезок сЬ — переходная область, т. е. кон-
константы скорости диффузии р и собственно
кинетики к соизмеримы. Связь между к*,
к и р описывается уравнением (XXVI. 16).
Энергию активации Еа находим по уравне-
нию
о
X
1 \A/T)-WS
\
?а=—2,3 R tga,
где tg а определяется по рис. 50,
tga = 5,573103.
Вычисляем энергию активации
?a = 5,573103-2,3.8,314 = 106,97 кДж/моль.
10. Над углем пропускают воздух при
Р — const. В результате протекает реакция
С + О2 = СО2. Эффективную константу k*
определили при различных температурах, Результаты измерений и
вычислений:
Рис. 50. Зависимость
lg к от \/Т для реакции
окисления угля кислоро-
кислородом воздуха
т,
(•/¦
к*.
к
к , . , ,
Т).10-ч . ,
см/с , , .
к* . . , ,
. , 777
, , 1,290
0,073.
—1,137
873
1,145
0,447
—0,35
;
1,
2
0,
O3
,026
,15
,332
1073
0
6,
0,
,930
,8!
,832
1173
0,85
13,72
1,137
1273
0,785
19,49
1,29
1373
0,
24
1,
,728
1,40
,369
1673
0,636
26,90
1,429
Составьте уравнение типа
439
Решение. Сопоставив уравнение lg k = AIT + const с урав-
уравнением (XXIII.4), получим
Е — 25.47103
А= — = = — 1,33-Ю3.
2,3 R 2,3-8,31
Для вычисления const подставляем в исследуемое уравнение значения
lg k и \1Т, относящиеся к кинетической области протекания реакции
для 973 К:
0,332=— 1,33-103/973+ const,
откуда const = 0,244. После подстановки чисел получим
lg А; = 0,244 — 5573/Г.
11. Над углем пропускают воздух под постоянным давлением.
В результате протекает реакция С + О2 = СО2. Эффективная кон-
константа k* определена при различных температурах:
7\ К 777 873 973 1073 1173 1273 1373 1573
к*, см/с 0,073 0,447 2,45 6,81 13,73 19,49 23,40 26,90
Зависимость константы скорости химической реакции выражается
уравнением
!g 6 = 6,06 —5573/Г.
Вычислить константу скорости диффузии Р при 1373 К.
Решение. Константу Р вычисляем по уравнению (XXVI.16).
Для этого используем k* = 23,40 см/с при 1373 К- Кинетическую кон-
константу вычисляем по уравнению
lg* =6,Об—E573/1373) = 2,00; 6=100 см/с.
После подстановки чисел в уравнение (XXVI. 16) и вычислений
получаем
23,40 = Р-100/A00+Р); р = 30,8 см/с,
12. При исследовании кинетики реакции бромирования серебра
Ag -j- 1/2Вг2 == AgBr получены следующие данные E00 К, ^>вг2 =
= 170 мм рт. ст.):
t, с 1000 2000 3000 4000 6000
(Am/S)-102, г/см2 1 1,34 1,61 1,84 2,24
(Am/SJ104, г2/см* 1 1,8 2,6 3,4 5
Какие выводы о типе реакции можно сделать на основании результатов
опыта? Вычислите константу скорости реакции.
Решение. Поскольку на металлическом серебре в ходе реакции
образуется бромид серебра, можно предположить, что скорость ре-
реакции лимитируется скоростью диффузии Ag или Вг через слой AgBr.
Для проверки предположения строим графики зависимостей Am!S =
440
Рис. 51. Зависимость —гг и -?г
Am
Ат\2
от t для реакции окисления тория
= / (f) A) и (Am/SJ = f (f) B).
Прямая в координатах (Am/SJ — t
подтверждает предположение о
том, что реакция протекает в диф-
диффузионной области. Константу ско-
скорости k* находим из графика как
тангенс угла наклона прямой:
tg а = /г = 8,0-10~8 г2/(см4-с).
13. Для реакции окисления тория Th + О2 = ThO2 получены сле-
следующие данные при 598 К:
t, мин . 1 4
(Am-S)-W, г/см* 3 5,5
(Am/SJ-1012, г2/см4 9 18,28
Какие сведения о механизме реакцин можно получить из этих данных?
Вычислите константы скорости.
Решение. Поскольку на частицах тория в ходе реакции обра-
образуется слой оксида, можно предположить, что реакция будет опреде-
гяться скоростью диффузии. Для проверки предположения строим
лрафики в координатах Am/S — t и (AmlSJ — t (рис. 51). Зависимость
(Am/SJ = f (t) выражается прямой, т. е. реакция лимитируется диф-
диффузией. Отсюда константа скорости будет
625—9
' ' Ю-12 Г2/(СМ4МИН).
9
9
81
16
12
144
25
15,5
240,25
36
19
361
64
25
625
ЗАДАЧИ
1. При исследовании скорости растворения алебастра CaSO4 в во-
воде при 298 К были получены следующие данные:
№ опыта
I
Время раст-
растворения, ч
0
0,083
0,167
0,200
Концентра-
Концентрация CaSOi
в 50 см3
раствора, г
0,004
0,0274
0,0492
0,0566
№ опыта
II
Время раст-
растворения, ч
0,
0,083
0,167
0,250
Концентра-
Концентрация CaSO,
в 50 сма
раствора, г
0,0270
0,0480
0,0632
0,0736
Скорость перемешивания 2235 об/мин. Объем жидкой фазы равен 1 л;
в 50 см3 насыщенного раствора при 298 К содержится 0,1047 г CaSO4;
площадь поверхности куска CaSO4 31,55 см2. Толщина поверхностно-
поверхностного слоя, окружающего твердый кусок, 5-10~6
имеет концентрацию
441
равную концентрации насыщенного раствора. Определите константу
растворения и коэффициент массопереноса.
2. В кювете, заполненной водой, находится таблетка бензойной
кислоты. В верхней части сосуда вода все время течет и концентрация
СвН5СООН в потоке равна 0. Концентрация в насыщенном растворе
cs — 0,024 моль/л. С6Н5СООН растворяется и диффундирует к проте-
протекающей воде. Температура опыта 298 К, площадь SK10BeTb[ — 2 см2, рас-
расстояние от таблетки до потока 5сми масса таблетки т = 1 г, коэффи-
коэффициент D -- 0,75 см2/сут. Объясните, является ли этот процесс стацио-
стационарным? Какое количество бензойной кислоты в указанных условиях
растворяется за сутки?
3. Кусок мрамора с постоянной площадью поверхности растворя-
растворяется в 1 л 1 н. НС1, причем в течение первой минуты скорость раство-
растворения равна 5 г/мин. Раствор перемешивают с постоянной скоростью.
Определите объем СО2 (измеренный при н.у.), выделяющийся в те-
течение 20 мин, а также время, необходимое на выделение такого же объе-
объема газа при погружении идентичного куска мрамора в 2 л той же кис-
кислоты.
4. Скорость растворения куска мрамора с постоянной площадью
поверхности в 1 н. НС1 равна 0,091 мг-экв/с в тот момент, когда титр
кислоты понизился на V4 его первоначального значения. Сколько вре-
времени потребовалось, чтобы произошло такое падение концентрации?
5. Гипс CaSO4-2H2O растворяется в воде при 298 К. Скорость
перемешивания постоянная. Объем жидкой фазы 1 л. Площадь по-
поверхности S неизменна и равна 31,55 см2. Коэффициент диффузии
D = 1,45 см2/сут. Результаты опытов:
/, мин 0 5 10
Концентрация раствора
в 50 см3, г 0,027 0,048 0,063
Установите тип потока. Вычислите концентрацию насыщенного раство-
раствора (г) в 50 см3; k = DS/8V.
6. Медный шар вращают в азотной кислоте и время от времени
взвешивают. В течение первой секунды масса уменьшилась от 4,3465
до 4,0463 г, в течение второй —от 4,0463 до 3,7673 г. Средняя площадь
поверхности за эти интервалы времени была соответственно равна
289,93 и 276,40 см2. Полагая, что объем кислоты очень велик и концен-
концентрация ее остается практически постоянной, рассчитайте, сколько меди
растворится в течение шестой секунды, если средняя площадь поверх-
поверхности за это время будет равна 225,15 см2.
7. Сплавленная бензойная кислота, имеющая площадь поверхно-
сти 18 см2, погружена в воду, перемешиваемую с постоянной скоро-
скоростью. Через известные промежутки времени из раствора отбирали
20 см3 пробы и титрованием определяли концентрацию бензойной кис-
кислоты. Толщина поверхностной пленки б оставалась постоянной. Кон-
Концентрация насыщенного раствора бензойной кислоты равна
442
24,3 ммоль/л. Коэффициент диффузии D = 0,5-10~3 см2/мин. Резуль-
Результат титрования приведен ниже:
Время между отбором проб,
мии . 12 15 13,3
Концентрация раствора до и
после отбора пробы, ммоль/л 0,75 2,05 3,05 5,05
Объем жидкой фазы, см3 . . 1020 1000 980
Определите среднюю константу скорости процесса растворения и
толщину поверхностного слоя.
8. Пробирка с водой внесена в помещение с идеально сухим возду-
воздухом, температура которого 293 К. Вода испаряется, но уровень ее
поддерживается постоянным. В пробирке отсутствует конвективное
перемешивание. Сечение пробирки S = 0,05 см2. Давление насыщенно-
насыщенного пара Рн2о — 0,023 атм. Вычислите коэффициент диффузии водяных
паров в воздух, если расстояние до края пробирки 1,85 см, за 87,5 ч
испарилось 1,94-10~3 моль воды. Проверьте полученную величину
D, используя соответствующее уравнение молекулярно-кинетической
теории.
9. В пробирку с водой, уровень которой поддерживается постоян-
постоянным, на расстоянии 20 см от поверхности воды помещают на сетке
прокаленный сульфат меди. Сечение пробирки 0,05 см2. Пары воды
диффундируют от воды к сульфату. Температура системы 293 К- Дав-
Давление насыщенных паров воды Рнго = 0,023 атм. Коэффициент диф-
диффузии воды в воздух ?>н2о = 0.24J см2/с. При давлении паров воды у
поверхности сульфата 6-10~2 мм рт. ст. начинается реакция
CuSO4-bH2O = CuSO4-H2O (P = const)
Вычислите: а) время, в течение которого концентрация паров воды
на расстоянии 10 см от поверхности станет равной концентрации над
поверхностью сульфата; б) массу воды, которую поглотит сульфат за
10 мин.
10. Реакционный сосуд разделен диафрагмой-катализатором на
две части. По обе стороны диафрагмы-катализатора поступал при од-
одном и том же давлении газ разного состава. Так как давление в обеих
частях сосуда постоянно, то обмен веществ между частицами совер-
совершался только путем диффузии через диафрагму. С одной стороны диа-
диафрагмы подавали газ, содержащий в 1 см3 0,008 см3 ацетилена, с дру-
другой стороны — чистый воздух. Диффундирующий сквозь диафрагму
ацетилен вымывался чистым воздухом и его определяли аналитически.
Определите эффективный коэффициент диффузии D*, если толщина
диафрагмы б = 1,34 см, сечение ее S = 4,52 см2, скорость потока чис-
чистого воздуха v = 10 см3/с, скорость диффузии 2,6-10~3 см3/с.
11. Определите аналитически и графически зависимость коэффи-
коэффициента диффузии водорода в азот от температуры, используя следую-
следующие данные:
443
т,
D,
к
см
2/с
2 73
. . . 0,647
288
0,743
289,2
0,737
293
0,80
373
1,05
435
1,61
483
1,92
12. Этиловый спирт испаряется в воздух, коэффициент диффузии
при 303 К равен 0,4673 см3/с, а при 323 К—0,5465 см2/с. Определите
коэффициент диффузии этилового спирта в воздух при 313 К.
МНОГОВАРИАНТНАЯ ЗАДАЧА
Растворимость вещества А в Н2О при Тг = 298,2 К равна саг,
а при Г2 = 333,2 К — Csz- В течение времени при постоянной скоро-
скорости перемещения D00 об/мин) и постоянной площади поверхности
(горизонтальная поверхность) в постоянном объеме V растворяли пх
моль вещества А за время /1( а за время tz в тех же самых условиях —
пг моль. При температуре Тх определите среднюю константу скорости
растворения соли А; время, необходимое, чтобы насыщение раствора
веществом А достигло 35, 70 и 90 %. Вычислите приближенно теплоту
растворения по данным растворимости при двух температурах, при-
приняв ф — 1.
о.
S-
2г§
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
Вещество А
NaCl
NaCl
MgSO4-7H2O
КС1
КВг
KI
K2SO4
K4Fe(CN)e-3H2O
CaSO4-2H2O
CaSO4-2H2O
FeBr2
FeBr2
.FeCl2
FeSO4-7H2O
CoSO4-7H2O
NiSO4-7H2O
CuSO4-5H2O
ZnSO4-7H2O
ZnSO4-7H2O
CdSO48/3H2O
BaCl2-2H2O
PbBr2
PoBr2
PbBr2
PbBr2
Растворимость
при 298.2 К
с.., г/100 г
Н,О
35,92
35,82
38,3
36,32
67,75
146,45
12,04
32,0
0,210
0,21
0,257
0,257
0,385
29,7
37,8
39,6
22,29
57,9
57,9
77,0
36,9
0,947
0,974
0,974
1,08
при 333,2 К
cs2. моль/
/1000 г Н,О
6,33
6,33
4,50
6,15
7,24
10,35
1,04
1,498
0,0072
0,0072
0,0436
3,69
3,32
3,65
2,38
5,27
5,27
3,92
1,94
0,0642
0,0642
0,0642
0,0697
X
%
20
20
15
15
10
5
20
15
45
45
9
9
30
4
15
10
9
12
12
17
25
35
35
35
35
II,, МОЛЬ
5,39
26,9
5,94
17,3
9,3
15,6
3
1,6
0,015
0,0746
0,0084
0,0224
0,080
0,38
10,8
1,2
4,96
7,35
4,5
11,60
14,5
0,247
0,0247
0,173
0,25
X
Я
65
65
35
55
40
15
40
35
75
75
15
15
12
10
45
40
27
48
24
51
50
70
70
70
70
п2, моль
6,15
30,3
10,1
19,5
11,4
25
3,4
2,5
0,0193
0,0965
0,0114
0,0302
0,065
0,9
20,2
3,0
10,4
17,0
8,08
24,6
15,7
0,264
0,0264
0,185
0,268
ч
йГ
1
5
10
4
2
3
5
4
20
100
6
16
5
2
15
3
12
11
8
14
19
10
1
7
7
444
ГЛАВА XXVII
КИНЕТИКА РЕАКЦИИ В РАСТВОРАХ. ГОМОГЕННЫЙ
И ГЕТЕРОГЕННЫЙ КАТАЛИЗ
Основные уравнения и символы
[К., с. 671—699; Г., т. 1, с. 170—183, 255—346, т. 2, с. 276—346]
Зависимость константы скорости реакции в разбавленном растворе
от ионной силы раствора выражается уравнением
g go+ABV (XXVII. 1)
A = l/e''T3''; (XXVII.2)
при 298 К Для водного раствора А = 0,509; г\ и ?в — числа зарядов
реагирующих ионов; k0 — константа скорости при бесконечном разве-
разведении (у = 1); / — ионная сила раствора; е — диэлектрическая по-
постоянная.
Зависимость константы скорости реакции от электростатической
составляющей энергии Гиббса активизированного комплекса выража-
выражается уравнением
гАегве zAzBeW
lnfc=ln*o— > 1п? = 1п*о— — . (XXViI.3)
АН ЛИ
где k0 — константа скорости в среде, в которой е = оо;
AGfc= __, , tXXVII.4)
"АВ
AG^c. — электростатическая составляющая энергии Гиббса активи-
активированного комплекса; d\B — расстояние между центрами ионов сфе-
сферической формы, составляющих активированный комплекс; где,
2ве — заряды ионов.
Электростатическую составляющую энтропии активированного ком-
комплекса определяют по уравнению
dine
дТ
Скорость бимолекулярных гомогенно-каталитических реакций вы-
выражается уравнением
(XXVIL5)
где kx и k-i — константы скорости прямой и обратной реакций образо-
образования промежуточиого комплекса между исходным веществом А и ка-
катализатором; &2 — константа скорости распада промежуточного ком-
445
плекса до продуктов реакции; [А], [В], [KJ — концентрации исходных
веществ А, В и катализатора.
Для &_1> &1— случай Аррениуса
w=^kT[А] [В] [К1 = КсКг [А] [В'[К]- (xxvii.6)
Для /г_х < &! — случай Вант-Гоффа
w = k,[A][K]. (XXV11.7)
В сильнокислых растворах некоторые реакции катализируются
только ионами гидроксония, и выражение для скорости может быть
записано в следующей форме:
w = kH+ [H3OT][S], (XXVI1.8)
где kn+—константа скорости кислотного катализа; [Н3О+] — кон-
концентрация катализатора; [S] — концентрация субстрата. Каталитиче-
Каталитическую константу &н+ Для этих ионов определяют изменением скоро-
скоростей реакций в кислых растворах при различных концентрациях Н3О
и S.
В сильнощелочных растворах
w = бон_ [ОН-] [S]. (XXV1I.9)
Каталитическую константу /гон- определяют измерением скоростей
реакций в щелочных растворах при различных концентрациях ОН~
и S. Если катализ может осуществляться обоими ионами Н+ и ОН"
и если реакция одновременно идет по двум направлениям, скорость
реакции может быть записана так:
w = kolS] + kH+ [H3O+][S] + *OH_ [OH-][S], (XXVII.10)
где k0 — константа скорости некатализируемой реакции. Поэтому
константу скорости первого порядка можно выразить в виде
Кислотная каталитическая константа скорости реакции k связана
с константой диссоциации Ко уравнением Бренстеда
k = GaK%, (XXV11.12)
где Ga и а — константы, значения которых обычно меньше единицы.
Для основного катализа уравнение Бренстеда записывается в виде
k = GbK$=G'bK%, (XXVI1.13)
где G6, Gi,, P — константы.
Любая реакция между газообразными веществами, которая проте-
протекает на поверхности катализатора, может быть расчленена на пять
последовательных стадий: 1) подвод вещества к поверхности катализа-
катализатора; 2) адсорбция вещества; 3) реакция на поверхности катализато-
катализатора; 4) десорбция продукта реакции с поверхности катализатора;
446
5) отвод продуктов реакции от поверхности в объем газовой фазы.
Общая скорость процесса определяется наиболее медленной его
стадией.
Для гетерогенно-каталитических реакций промежуточное соеди-
соединение реагирующего вещества с катализатором образуется на поверх-
поверхности твердого катализатора вследствие хемосорбции. Если реакция
не имеет транспортных ограничений и адсорбция протекает быстро,
то механизм реакции объясняет теория Лэнгмюра—Хиншельвуда и
скорость реакции может быть представлена уравнением
= /(*,. К;. Pt). (XXV11.14)
dt-ds
где w — скорость реакции прореагировавшего вещества на поверх-
поверхности за время t, моль; ks — константа скорости поверхностной реак-
реакции; К, — константа адсорбционного равновесия t-ro компонента;
Pt — парциальное давление реагирующего компонента.
Для поверхностной реакции первого порядка скорость определя-
определяется уравнением
А А
(XXV11.15)
w ksCAs ksa«, .
1 "Г ЙА ИА
При /СдРА « 1
P (XXV1I.16)
kgu^KA, где а^ — максимальное количество адсорбирован-
адсорбированного реагента; /Сд — константа адсорбционного равновесия этого ком-
компонента; РА — его парциальное давление; /гэфф — константа скорости
катализируемой реакции.
Для реакции первого порядка зависимость /гэфф от температуры вы-
выражается уравнением
кэфф = Ае~В«-к^/КТе'Ш^-ЩТ, (XXVII.17)
где ^н.к.р — энергия активации некатализируемой реакции; АЯадс —
теплота адсорбции реагирующего вещества; А —постоянная, А Ф
?'н.р = ?'н.н.р+АНадс- (XXVII.18)
Согласно принципу энергетического соответствия А. А. Баландина
гетерогенная каталитическая реакция может быть представлена схемой
А„сх + К —> АК —>• Р +К,
катализатор мультнплетиый
комплекс
(XXVII. 19)
447
где ?f. дк — энергия образования мультиплетного комплекса; pK
энергия его распада; q — адсорбционный потенциал, равный сумме
энергий взаимодействующих атомов, составляющих молекулы реаги-
реагирующих веществ с катализатором.
Энергия активации процесса равна
; - — 4 Ef, AK-
(XXVII.20)
Изменяя адсорбционный потенциал (т. е. применяя различные катали-
катализаторы), можно достигнуть равенства
1 „ _
Lf,AK — Ераси. АК-
Катализатор, на котором достигнуто это равенство, будет самым эф-
эффективным.
Согласно Н.И. Кобозеву носителем каталитической активности ад-
адсорбционного катализатора является атомная (докристаллическая)
фаза катализатора. Для каждого процесса активным центром являет-
является ансамбль из определенного числа атомов (п)
— Na
(XXVII.21)
где jVm, Л/™ — число молекул катализатора, при котором достигает-
достигается максимальная общая и удельная активности. Соответственно число
областей миграций равно
7 Л/А л/а fXXVII 22Ъ
Абсолютная активность г0 одного n-атомного ансамбля определяется
по уравнению прямой
lg — =/(#), (XXVII.23)
0,5
0,2
0.1
или
N
(XXVI1.24)
Для мономолекулярных реак-
реакций в потоке при постоянном дав-
давлении уравнение (XXVII. 14)
имеет вид
0,1
Oj vy
v In
1
1-
i/</, (XXV1I.25)
Рис. 52. Зависимость Лп от vy
дли реакции каталитической дегидра-
дегидратации этилового спирта
где v — скорость подачи исходно-
исходного вещества в молях на единицу
времени, отнесенная к единице
448
объема катализатора; у — степень превращения; а — постоянная,
прямо пропорциональная общей площади поверхности катализатора
и константе скорости поверхностной реакции; Р — постоянная, ха-
характеризующая адсорбционные коэффициенты вещества. Коэффициен-
Коэффициенты а и р являются кинетическими характеристиками реакции.
Уравнение Фроста—Баландина (XXVI 1.25) _можно представить
графически (рис. 52). Откладывая на оси абсцисс vy, а на оси ординат
v In A/1 — у), получим прямую линию. Тангенс угла наклона прямой
к оси абсцисс определяет значение р, а отрезок на оси ординат, отсекае-
отсекаемый прямой при значении у = 0, — величину а.
ЗАДАЧИ С РЕШЕНИЯМИ
1. При изучении кинетики реакции
Со (NH3M NO^++OH-—>-Co (NH3M OH2++NO7
получена следующая зависимость константы скорости k от ионной си-
силы раствора /:
/ 2,34 5,61 8,10 11,22 11,73 16,90
E+Ig k) 1,7640 1,7130 1,6800 1,6467 1,6418 1,5990
Вычислите константу скорости k0 при ионной силе, равной нулю.
Решение. Построим график зависимости lg k от УI и прове-
проведем экстраполяцию к У1 = 0 (рис. 53):
E+lg *) 1,7640 1,7130 1,6800 1,6467 1,6418 1,5990
У~Т 1,53 2,37 2,85 3,35 3,42 4,11
Значение, полученное экстраполяцией: E + lg Дг0) = 1,858; kb —
= 7,21-Ю-4.
2. Используя метод стационарной концентрации, выведите урав-
уравнение, определяющее скорость гомогенно-каталитической реакции
А + В + К-»-С +'К. Гомогенно-каталитическая реакция протекает
по следующему механизму: 1) образо-
образование промежуточного продукта АК
в результате обратимого взаимодей-
взаимодействия между катализатором и одним
из исходных веществ:
1.9
А + К
АК,
2) образование активированного
комплекса в результате взаимодей-
взаимодействия образовавшегося промежуточ-
промежуточного продукта со вторым компонен-
компонентов реакции:
АК + В Д. (АВ*) К,
15 Зак. 767
1,5
0
5 VI
Рис. 53. Зависимость lg* от У\
для реакции CoDH3MNO.? + 4-
+он-- - -— —- '
449
3) образование конечных продуктов и регенерация катализатора:
(АВЧ К Д. С + К.
Решение. Согласно теории активированного комплекса ско-
скорость реакции определяется скоростью его распада на конечные про-
продукты:
d [С]
—^ = k3 [(AB») К]. A)
Определяем методом стационарной концентрации содержание акти-
активированного комплекса (АВ*)К. Через некоторое время после начала
процесса скорость накопления активированного комплекса будет
d [(АВ«) К
откуда
[В]. C)
Концентрацию промежуточного продукта выражаем через концентра-
концентрацию исходных веществ. Согласно рассматриваемой схеме реакция на-
накопления промежуточного продукта АК обратима, тогда
d [AK] =kt [А] [К] - ^ [Ак]-*а [АК] [В]=0. D)
d t
Откуда находим
Подставляя E) в C) и полученное выражение в A), получаем
d [С] Л, Л_, [А] [В]
t „ [К].
At fe_, -f Ag [В]
Из полученного уравнения видно, что скорость реакции прямо пропор-
пропорциональна концентрации катализатора.
3. Разложение С2Н5ОН на этилен и воду происходит при 653 К
на 10 см3 катализатора А12О3. Расход 64 %-ного раствора спирта
п и объем Von газа, образовавшегося за 3 мин, в результате реакции
будут следующими:
я, см" 0,144 0,65 0,937 1,15 2,37
Коп. см» ... 30,3 85,7 119 131,5 217
Барометрическое давление 100121,63 Па, комнатная температура
300 К. Вычислите коэффициенты а и Р в уравнении (XXVII.25) и на-
напишите эмпирическое уравнение.
Решение. Коэффициенты а и Р в уравнении Фроста
и In [1/A — у)] = $vy + а получим графически. Для этого вычислим
450
значения v, у, vy, In 1/A —у) и построим график в координатах
v In -j vy (см. рис. 52). Для одного опыта рассчитаем
1 —у
—_ mCjH,OH
tv
кат
где тсгнвон = ndb/M\O0 — масса спирта; b — содержание спир-
спирта, %; й?сгн,он = 0,9 г/см3— плотность спирта; t — время подачи;
У кат — объем катализатора. Тогда
0,144-0,9-64
т,= = 0,0018 моль-
46-100
- 0,0018
v = =0,006 ммоль/(см3мии).
Приведем объем выделившегося газа к н. у.:
" 'коми)
(Рнго = 3212,63 Па — давление насыщенного пара воды при данной
температуре.)
Для данного опыта получим объем С2Н2 при н.у.
30,3-10012.273
760.296-133,3 2/'/см-
Откуда число молей этилена будет
Тогда
-= т„ С2Н4 = ^^^ = и - 0060.66 7.10_2 = 0040
т,,С2Н5ОН 0,0018 ' .
^"тт^0-0060 1п -dUr0'0060 In ii-=
= 0,0060 In 3 = 0,0060-1,0986 = 0,0066.
Для всех опытов скорость подачи и степень превращения будут:
п 0,0060 0,0272 0,0392 0,0482 0,0995
у-Ю-2 66,7 41,7 40,2 36,5 26,6
vy 0,0040 0,0114 0,0157 0,0176 0,0264
Fin . . . 0,0066 0,0146 0,0200 0,0218 0,0306
1-У
Построив график, находим а = 0,012, р ^ 1. Уравнение будет
иметь вид v In 1/A — у) = vy + 0,012.
15* 451
ЗАДАЧИ
1. Определите константу скорости реакции СН3Вг + КЛ =
= СН31 + КВг в воде при 298 К, если предэкспоненциальный множи-
множитель 1,7-Ю13 см3/(моль-с) и энергия активации 76,6 кДж/моль.
2. Определите константу скорости реакции СН3Вг + КЛ = СН31
в СН3ОН при 298 К, если предэкспоненциальный множитель 2,3-1013
см3/(моль-с) и энергия активации 76,2 кДж/моль. Сопоставьте скорость
реакции, протекающей в воде, если предэкспоненциальный множи-
множитель 1,7-1013 см3/(моль-с) и энергия активации 76,6 кДж/моль, и в
метаноле.
3. Определите константу скорости реакции, протекающей по
уравнению
Св Н5 (СНэJ N+CH3 I —» [Ce H5 (CH3K NJ++I-
в нитробензоле, дихлорэтане и бензиловом спирте при 353 К, исполь-
используя значения предэкспоненциальных множителей и энергий, активации
из справочника [М.]. В каком из растворителей реакция протекает с
наибольшей скоростью?
4. На основании данных о скоростях омыления эфиров в водных
растворах [М.] сделайте вывод, омыление какого из эфиров при
323 К СН3СООС2Н5 или СН3СООСаН7, или СН3СООС4Н9, про-
происходит быстрее. В каком соотношении находятся константы скоро-
скорости омыления этих эфиров?
5. Определите время полупревращения при омылении 0,05 М этил-
ацетата при 298 К 0,05 М водным раствором LiOH на основании
данных о константе скорости омыления [М.].
6. Определите время полупревращения при омылении этил-
ацетата при 298 К водным раствором NaOH, содержащим NaOH
0,0500; 0,0250 и 0,0125 моль/л и одинаковые концентрации этил-
ацетата. Константы скорости возьмите из справочника [М.].
7. Сопоставьте начальные скорости реакции омыления 0,05 М
этилацетата при 298 К 0,05 М водными растворами LiOH, NaOH и
КОН.
8. Определите, во сколько раз изменится константа скорости
реакции
С2 Н5 Вг COO-+S2Of- —> C2H4S2O3COO2-+Br-
если ионную силу раствора изменить от 0,01 до 0,04.
9. Константа скорости реакции между персульфатом натрия и
иодом зависит от ионной силы следующим образом:
/, моль/л 0,00245 0,00365 0,00445 0,00645 0,00845 0,01124
к, л/(моль-с) 1,05 1,12 1,16 1,18 ! ,26 1,39
Представьте эти данные графически, используя уравнение
(XXVII. 1), и рассчитайте 2А2в. Какой заряд имеет ион персульфата,
если стадией, контролирующей скорость реакции, является реакция
452
между ионами персульфата и иода? Объясните, почему произведение
зарядов 2д2в не равно целому числу.
10. При изучении кинетики реакции
Co(NH3M NO^+OH- —> Co(NH3MOHi!++NO2-
получено, что при ионной силе раствора 5,61 константа скорости этой
реакции равна 5,164-10~4. Определите константу скорости этой ре-
реакции при ионной силе, равной нулю.
11. Какое влияние на скорость реакций
S2O|"+2I- —>
Со (NH3M Br2++NO2" —> Со (NH3M
CH3 Вг+2 Н2О —> СН3ОН+Н3О++Вг-
СН3Вг+ОН- —> СН3ОН+Вг-
окажет повышение: а) диэлектрической проницаемости; б) ионной си-
силы раствора; в) гидростатического давления. Определите знак эн-
энтропии для каждой реакции.
12. Рассчитайте электростатический вклад в AG^, А#^ и TAS"^
(кДж/моль), если ZAZB = — 2; е = 80; (din г/дТ)Р = — 0,0046;
dAB = 25 нм, при Т = 298 К.
13. Константа скорости реакции гидролиза диазоуксусного эфира
N2CH СООС2Н5+Н2О —> НОСН2 COOC2H5+N2
изменяется с концентрацией ионов Н+ следующим образом:
н;
к.
(О+, МОЛЬ/Л . .
л/(моль-с) . .
0
0
,00046
,0168
0
0
,00087
,0320
0
0
,00158
,0578
0
0
,00323
,1218
Представьте эти данные графически и определите константу катализа
реакции ионами водорода k»+.
14. Реакция мутаротации глюкозы имеет первый порядок по кон-
концентрации глюкозы и катализуется кислотами (А) и основаниями (В).
Константу скорости первого порядка можно выразить с помощью
уравнения такого же типа, какие встречаются для реакций, протекаю-
протекающих по параллельным путям:
где k0 — константа скорости первого порядка в отсутствие каких-
либо кислот и оснований (кроме воды). Для этой реакции при 291 К
в среде, содержащей 0,02 моль/л ацетата натрия и различные концен-
концентрации уксусной кислоты, получены следующие данные:
СН3ООН, моль/л 0,020 0,105 0,199
А-10', мин-1 1,36 1,40 1,46
Рассчитайте k0 и &а- Член, содержащий &н + , при этих условиях пре-
пренебрежимо мал.
453
15. Константа скорости реакции гидролиза диазоуксусного эфира
изменяется с концентрацией ионов Н+ следующим образом:
сн+, моль/л 0,00046 0,00087 0,00158 0,00323
k, л/(моль-с) 0,0168 0,0320 0,0578 0,1218
(реакция по эфиру имеет первый порядок). Определите среднюю кон-
константу скорости катализа ионами Н+.
16. Мутаротация глюкозы катализируется кислотами и основа-
основаниями и имеет первый порядок по концентрации глюкозы. Если в ка-
качестве катализатора используется хлорная кислота, то концентрацию
ионов Н+ можно считать равной концентрации хлорной кислоты, а
влияние перхлорат-иона можно не учитывать, так как он является
очень слабым основанием. Были получены следующие значения кон-
констант скорости первого порядка:
1НС1О4], моль/л
fc10* 1
*, мин
0,0010 0,048 0,0099 0,0192 0,0300 0,040
1,25 1,38 1,53 1,90 2,15 2,59
Определите константы k0 и &н+-
17. Приготовлен раствор, содержащий 0,5 моль/л уксусной ки-
кислоты и 0,3 моль л ацетата натрия. Константа диссоциации уксусной
кислоты 1,8-10~5, а показатель степени а в уравнении Бренстеда для
реакции кислотного катализа равен 0,9. Рассчитайте глубину реакции
в процентах по ионам водорода, уксусной кислоте и воде.
18. Ниже приведены значения констант диссоциации кислот и
каталитических констант для реакции разложения нитроамида неко-
некоторыми основными ионами.
Ион
Ко
Ион
Гидроксил
Три мети лацетат
Пропиояат
Ацетат
Фенилацетат
1.1 -10—1в
9,4-10
1,4-Ю-5
1.0-10-5
5,3- Ю-5
Ы0«
0,822
0,649
0,504
0.232
Бензоат
Формиат
Монохлорацетат
о-Нитробензоат
Дихлорацетат
6,5-10-5
2,1-Ю-4
1,4-Ю-3
7,3-Ю-3
5,0-Ю-2
0.189
0,082
0,016
0,0042
0,0007
Представьте эти данные графически таким образом, чтобы показать
применимость соотношения Бренстеда, и определите константы урав-
уравнения.
19. Реакция между ацетоном и иодом протекает согласно урав-
уравнению
СН3СОСН3+12 —* СН3СОСН21+HI
Реакция может рассматриваться как идущая через предварительную
енолизацию ацетона
ОН
I
СНдСОСНз —>¦ СНз—С—СН2
454
с последующим присоединением иода и отцеплением молекулы иодида
водорода:
ОН
ОН
сн3—с—сн21
I
СН3СОСН2
Подтверждением этого механизма служит то, что скорость реакции
не зависит от концентрации иода и не изменяется при замене иода на
бром. Поэтому енолизация является стадией, определяющей скорость
реакции, а последующее присоединение галогена происходит в быстрой
стадии. Используя константы скорости иодирования ацетона, приве-
приведенные в таблице
Катализатор
Дихлоруксусная
кислота
а, Р-Дибромпропи-
оновая кислота
Монохлоруксус-
ная кислота
Гликолевая кисло-
кислота
5,7-Ю-2
6,7-Ю-3
1,41-10-»
1,54-10-4
л/(ноль-с)
220
63
34
8,4
Катализатор
а-Хлорпропионо-
вая кислота
Уксусная кислота
Пропионовая кис-
кислота
Триметилуксусиаи
кислота
1,01-10-4
1,75-10-5
1,34-10-5
9,1-Ю-3
Л/(МОЛЬ-С)
5,9
2,4
1,7
1,9
рассчитайте усредненные коэффициенты в уравнении Бре'нстеда и ка-
каталитические константы всех кислот.
20. Для реакции иодирования ацетона в присутствии кислот, у ко-
которых р = q = 1 (q — число положений в катализирующем основа-
основании, способном присоединять протон, а р — число протонов, способ-
способных отцепляться в сопряженной основанию кислоте), уравнение Брен-
стеда имеет вид: /г == 7,90- 10~*/Са"в2. Рассчитайте каталитическую
константу скорости k в присутствии монохлоруксусной кислоты и срав-
сравните ее с опытной koa = 34 л/(моль-с). Константа диссоциации моно-
монохлоруксусной кислоты Ка = 1,41-10".
21. Во сколько раз увеличится скорость (воображаемой) газовой
реакции при 400 К, если в кинетическую систему ввести твердый ката-
катализатор. Энергия активации реакции без катализатора Ег равна
29 824 Дж/моль, а с катализатором (?г-к) — 26 000 Дж/моль. Пред-
экспоненциальные множители уравнения Аррениуса в обоих случаях
одинаковы: kor = &or-к.
22. Каталитический обмен между дейтерием и аммиаком идет по
уравнению реакции
V2Ds-fNH3-e —> NH2D+»/2H2
455
Pt
21,6
518
Ni
39,0
483
Pd
38,0
481
Fe
51,0
456
Ag
60,0
438
Cu
58,0
437
Ниже приведены значения энергии активации реакции на разных ка-
катализаторах и работы выхода электрона из металла-катализатора:
Металл
Энергия активации Еа,
кДж/моль
Работа выхода электрона из
металла ф, кДж/моль . . .
Выведите уравнение, связывающее энергию активации приведенной
реакции с работой выхода электрона из металла, и покажите, во сколь-
сколько раз изменяется скорость реакции на приведенных металлах по
сравнению с платиной. Предэкспоненциальный множитель уравнения
Аррениуса для всех металлов одинаков.
23. Реакция разложения аммиака 2NH3—>- N2 -jv 3H2 без катали-
катализатора протекает с энергией активации Еа = 326 кДж/моль, а при
той же температуре на катализаторах W, Mo, Fe, Os с энергиями ак-
активации ?\v = 163 кДж/моль, ?мо = 121,3 кДж/моль, Е?е =
--= 125,5 кДж/моль и ?os = 197 кДж/моль. Покажите, как связана
«истинная» энергия активации гетерогенной реакции с теплотой ад-
адсорбции исходных веществ и чему равна теплота адсорбции активиро-
активированного комплекса на катализаторе.
24. Разложение этилового спирта на катализаторе А12О3 проте-
протекает по уравнению С2Н5ОН ->-С2Н4 + Н2О. При 650 К эффективная
константа скорости равна 0,234 с. Зависимость константы скорости
поверхностной реакции от температуры выражается уравнением
lg /е = 6,06 — 4230/Т. Определите энергию активации поверхностной
реакции и константу скорости диффузии.
25. Кинетика разложения муравьиной кислоты НСООН —>- Н2О +
+ СО на различных катализаторах при 473 К характеризуется сле-
следующими данными:
Катализатор Стекло
Энергия активации, кДж/моль 103
Относительная скорость ... 1
Скорости процесса отнесены к равным площадям поверхности катали-
катализатора. Объясните различие в скоростях.
26. Олеиновая кислота, растворенная в уксусной кислоте в при-
присутствии платинового катализатора при 320 К, гидрируется. Скорость
гидрирования в зависимости от массы катализатора изменяется сле-
следующим образом:
w. мг/мин 3,7 7,4 11,3 14,9
Масса катализатора, г .... 0,025 0,05 0,0625 0,10
Интенсивность встряхивания 600 качаний/мин. Определите, к какой
области гидрирования относится протекающая реакция.
27. Зависимость скорости реакции гидрирования спирта в при-
присутствии платинового катализатора в ледяной уксусной кислоте при
456
Аи
98
40
Ag
130
40
Pt
92
2000
Rh
146
10 000
интенсивном встряхивании E00—600 качаний/мин) при 290 К от мас-
массы катализатора имеет линейный характер, что свойственно кинетиче-
кинетической области. На основании данных
Масса катализатора, г . 0,03 0,06 0,06 0,09 0,15 0,23 0,30 0,40 0,50
w, см3/с !,56 3,83 3,75 6,04 9,75 13,5 18,2 22,7 37,6
выразите графически зависимость константы скорости реакции от мас-
массы катализатора (в расчете на металлическую платину в граммах).
Содержание Pt в катализаторе 6 %.
28. Реакция С2Н5Вг -*¦ С2Н4 + НВг* при 693 К протекает на А12О3.
Степень заполнения катализатора исходным веществом в зависимости
от давления приведена ниже:
Степень заполне-
заполнения 0,0715 0,1334 0,1876 0,235 0,278
Давление,
мм рт. ст. . . . 0,1 0,2 0,3 0,4 0,5
Степень заполне-
заполнения 0,316 0,350 0,381 0,409 0,435
Давление,
мм рт. ст. . . , 0,6 0,7 0,8 0,9 1,0
Рассчитайте эффективную и истинную константы скорости реакции,
если продукты реакции не тормозят процесс.
29. В результате исследования кинетики гомомолекулярного обме-
обмена кислорода на оксиде гадолиния в интервале температур 78—
500 °С были определены константы скорости реакции при различных
температурах:
Г, К 223 273 300 473 673
M0s, с-1 0,177 0,0224 0,9055 4,48 27,16
Постройте график зависимости \gk = f(\/T), определите энергию
активации в области температур 573 — 300 и 300—223 К. Объясни-
Объясните смысл отрицательной энергии активации.
30. Выведите уравнение для дегидратации этилового спирта (в по-
потоке) над оксидом алюминия, которая протекает при 653,2 К, если
v 0,060 0,152 0,272 0,331 0,392
?-102 66,7 55,0 41,7 42,8 40,2
v 0,423 0,482 0,542 0,995 1,464
I/.102 40,1 36,5 37,1 26,6 22,1
31. При дегидратации этилового спирта С2Н5ОН -»- С2Н4 + Н2О
на катализаторе А12О3 при 653 К через каждые 3 мин измеряли рас-
расход 75 %-ного водно-спиртового раствора п и объем образовавшегося
газа Von в газовой бюретке:
п-10«, м3 . . . . 0,2 0,31 0,41 0,62 0,82
Коп-10«, м3 . . . 61 84,2 107,5 143 177
л-10«, м3 .... 10,6 1,37 1,66 1,95
Von-Юв, м3 ., . . 218 263 283 302
457
Вычислите а и {$ в уравнении Фроста для данной реакции в указанных
условиях, если объем катализатора 15 см3, температура опыта 293,2 К,
барометрическое давление 99641,7 Па G47,5 мм рт. ст.).
. 32. Реакция окисления тиосульфата пероксидом водорода катали-
катализируется ионом 1~ и протекает по следующему механизму:
I-+HsOj Д Ю-+НаО
Выведите кинетическое уравнение для этой реакции. Определите,
во сколько раз изменится скорость реакции, если концентрацию уве-
увеличить в 3 раза.
33. Гомогенно-каталитическая реакция протекает по схеме
Е+К
ЕК
К+Р.
В качестве катализатора используется вещество [RhCl(PRh3K]. Оп-
Определите эффективную константу скорости и энергию активации про-
процесса, если Се = 1,5 моль/л, а концентрации катализатора и скоро-
скорости реакций приведены в таблице:
Ск-10-', ноль/л
1
2
3
ш-10"*! моль/(л-с)
22
• 37
44
25,5
42
, 48
30
47
52
Т.К.
288
298
303
288
298
303
288
298
303
34. Реакция дегидратации изопропилового спирта протекает на
алюмосиликатном катализаторе по схеме:
A-f ( + ) —>• Аадс,
Аа+дс+(-) Д -Аа+дс,
_Аа+дс Л ( + ) + (-)+Р.
Здесь А — изопропиловый спирт; (+), (—) — положительные и от-
рицателные адсорбционные центры иа поверхности катализатора. Оп-
Определите скорость реакции, если &1 = 2,7-10~4 молекул/активного
центра, с-Па; Р{
спирта
= 0,01 Па.
458
,35. Реакция каталитического превращения бутилового эфира про
текает по схеме:
СН3 ОС (СН3K аде —> СН3 ОНадс+1-С4 Н8 адс
з з«дс-г 8 аде 1_^_с6 нв+СНз ОН
Определите селективность катализатора относительно i-C5H10, если
скорость образования i-C5 Hlo в 2 раза больше скорости образования
QH
36. При изучении реакции алкилирования бензола этиленом на би-
бифункциональных катализаторах на основе цеолитов было показано:
Св Н5 С4 Нд
Св Н5—С4 Нд-|-Св Н8—С2 Н5
Св Н5—С4 Нд+С4 Н8
Н4
Определите селективность катализатора относительно С4Н8, если в
результате конверсии С2Н4 через 0,6 ч получено С4Н8 — 8,7 % этил-
бензола — U6 %, emo/7-бутилбензола — 48,7 %.
37. При изучении каталитического окисления водорода на оксид-
оксидных катализаторах были получены теплоты сорбции кислорода в за-
зависимости от количества десорбированного кислорода:
^^^^ % десорбироваииого
^^^^ О2 от моиослоя
— лНаДС> ^^^v.
кДж/моль ^"^
СгаО3
Со3О€
NiO
0
26
15,3
19,5
0,5
26
19
21
26
23
23
1,5
26
26
26
3
26
34
30
5
26
40
34
лн
По полученным данным: построить: 1) график зависимости
/ (9), где 9 — степень заполнения; 2) график зависимости
аде
энергии активации каталитической реакции от степени заполнения,
если ?к-р — 11 кДж/моль при монослойном заполнении поверхности
на Со3О4.
38. Используя теорию мультиплетов А. А. Баландина, определите
энергию образования и распада мультиплетного комплекса, адсорбци-
адсорбционного потенциала, энергию активации для реакции гидрирования
связи С—С, С—N над Ni-катализатором, если энергия связи </h-n =
= 229,4 кДж; ^C-Ni = 58,4 кДж; ^N_Ni = 112,6 кДж; qC-c =
= 344,4 кДж. Сравните эти энергии связи с приведенными в справоч-
справочнике [М.].
459
39. При исследовании кинетики реакции синтеза аммиака на же-
железе, нанесенном на алюмогель, получено, что максимальная удельная
каталитическая активность имеет место при ЛСах = 6, ЫО18, а мак-
максимальная общая активность при Nmax = 8,8-1018. Определите число
атомов, входящих в активный ансамбль, и число областей миграции
МНОГОВАРИАНТНАЯ ЗАДАЧА
При исследовании кинетики конверсии оксида углерода статически
циркуляционным методом было получено кинетическое уравнение для
скорости прямого процесса:
и a0-5 (ti — аH> 5
где v — скорость входа в циркуляционный контур парогазовой сме-
смеси, см3/(г-с); а — степень превращения; ц—соотношение пар/газ
в искомой смеси; kf — константа равновесия. Определите удельную
каталитическую активность катализатора, энергию активации катали-
каталитической реакции. Постройте зависимость удельная каталитическая
активность — порядковый номер металла оксида, если известно, что
с
с
1
1
2
3
4
б
6
Оксид
2
TiO2
TiO2
VA
V2O3
Сг2О3
т, к
3
713
773
798
823
848
798
713
748
773
798
823
848
623
648
673
673
713
748
v, см'/(г-с)
4
0,08
0,08
0,08
0,08
0,08
0,08
0,37
0,37
0,35
0,26
0,26
0,27
0,27
•
5
4,0
4,0
4,0
4,0
4,0
4,0
4,8
4,8
4,8
4,4
4,7
4,7
4,8
4,8
а
6
0,0005
0,0016
0,0024
0,0042
0,0061
0,0024
0,021
0,066
0,141
0,294
0,456
0,597
0,1
0,164
0,250
0,250
0,504
0,695
Масса
катализа-
катализатора q, г
7
2
2
3
3
3
3
(количество
адсорбированного
Кг на монослой)
8
0,73
0,73
1,33
1,33
17
17
460
Продолжение
п/п
;S
7
8
9
10
11
12
Оксид
МпО
МпО
Fe3O4
Fe3O4
ZnO
ZnO
т, к
773
748
773
798
823
848
623
648
673
673
713
748
713
748
773
798
823
773
V, СМ3/(Г.С)
0,37
0,34
1,39
1,39
1,37
1,37
1,39
1,43
0,29
0,29
0,28
0,28
0,30
0,28
д
5,0
5,0
5,0
5,0
4,9»
4,9
5,0
5,2
5,0
5,0
4,8
4,9
5,2
4,8
a
0,161
0,107
0,173
0,259
0,360
0,458
0,140
0,275
0,396
0,396
0,613
0,748
0,037
0,075
0,111
0,195
0,372
0,111
n .
sis
2
2
4
4
3
3
V CMI
(количество
адсорбированного
Кг на нонослой)
2,61
2,61
10,4
10,4
0,98
0,98
ГЛАВА XXVIII
КИНЕТИКА ЭЛЕКТРОХИМИЧЕСКИХ РЕАКЦИЙ
Основные уравнения и символы
[К., с. 602—625, Г., т. 2, с. 572—619]
Количество электричества, необходимое для разложения 1 г-экв
электролита, равное 96 450 Кл, называют постоянной Фарадея. Мас-
Массу вещества т, подвергшегося разложению, выделившегося на элек-
электродах или образовавшегося в растворе в результате электролиза,
вычисляют по уравнению
zlt
(XXVIII.1)
где г — эквивалентная масса, г; / — сила тока, A; t — время, с;
F — постоянная Фарадея.
461
При проведении электролиза часть тока уходит на побочные про-
процессы и поэтому степень полноты электролиза всегда меньше теорети-
теоретической. Обычно вычисляют величину выхода по току:
Масса выделившегося при электролизе вещества
Вт= .
Рассчитанная масса вещества, которая должна выделиться при электролизе
Многие реакции электролиза не являются обратимыми. Наблю-
Наблюдаемый потенциал разложения превышал величину, вычисляемую из
термодинамических данных. Этот избыточный потенциал, называемый
потенциалом перенапряжения, зависит от площади электродов и со-
состояния их поверхности, наличия примесей в растворе и плотности
тока, протекающего через раствор.
Для многих электрохимических процессов плотность тока i и пере-
перенапряжение т] связаны между собой уравнением Тафеля
t) = a+61g«, (XXV1II.2)
где а и b — некоторые параметры, характеризующие данную систему.
Большинство электрохимических реакций с участием органи-
органических веществ протекает через стадию предварительной адсорбции
их на поверхности электрода. Скорость адсорбции органических ве-
веществ описывается уравнением Рогинского—Зельдовича
a['e^)t (XXVIII.3)
где k — константа скорости адсорбции; с — концентрация органиче-
органического вещества; а — константа; /' — коэффициент неоднородности по-
поверхности электрода.
Зависимость адсорбции от времени подчиняется уравнению
in t, (XXVIII.4)
где 9r — степень заполнения поверхности электрода органическим
веществом.
ЗАДАЧИ С РЕШЕНИЯМИ
1. Через раствор CuSO4 пропущено 5 А-ч электричества. При
этом на электроде (катоде) выделилось 5,6 г меди (m,ip = 5,6). Опре-
Определите выход по току.
Решение. Эквивалентная масса меди 63,57/2 = 31,785; израс-
израсходовано 5/26,8 = 0,1865 F (96 540-0,1865 =18000 Кл). Следователь-
Следовательно, теоретически, согласно закону Фарадея, должно выделиться меди:
/птеор=31,785-0,1865=5,92 гСи.
Отсюда выход меди по току составит
Вт = —^22—100 = 5,6/5,92-100 = 94,7%.
ттеор
462
2. При пропускании электрического тока через слаборазбавленную
серную кислоту выделяется на катоде в течение 5 мин 40 см8 водорода,
измеренных при 288 К и 748 мм рт. ст. Определите силу тока, проходя-
проходящего через электролит.
Решение. Определяем массу выделившегося водорода (на ка-
катоде) по уравнению т = MPV/RT. Имеем: М = 2,016; Р = 748/760
атм; V = 0,04 л D0 см3); R = 0,082 л/атм/(моль-К); Т = 288 К.
Отсюда
2,016.748-0,04
/п = — — = 0,00336г Н~.
760-0,082-288 г
Силу тока определяем по уравнению (пг = 0,00336 г, z = -1,008»
t = 5-60 = 300 с)
m- 96 540 0,00336-96 540
zt = 1,008-300 =1'08А-
3. Железный лист, общая площадь поверхности которого 1000 см4,
используют в качестве катода при электролизе соли цинка. Какой
толщины достигает слой цинка, выделившегося на катоде, за 25 мин, ес-
если средняя плотность тока равна 2,5 А/дм2. Плотность цинка 7,15 г/см3.
Решение. Определяем массу выделившегося на Fe-электроде
цинка по уравнению
m = zlt/F.
Для этого рассчитаем эквивалентную массу цинка
65,38
г = ¦ =32,69 г.
2
Определяем силу тока по уравнению / = iS:
/ = 2,5.10=2,5А
и продолжительность электролиза
Масса выделившегося цинка составит
32,69-25-1500
Зная массу и плотность выделившегося цинка, находим его объем:
V=-^~= 1,776 см3.
463
Рассчитаем толщину слоя цинка, выделившегося на электроде:
1 J76
1000
-=1,776-Ю-3 см3.
4. При исследовании кинетики адсорбции малеиновой кислоты на
гладком родиевом электроде при 293 К и потенциале ц>Р = 0,2 В с
помощью электрохимических импульсных методов были получены сле-
следующие данные:
Время, с
5
10
20
30
50
100
200
300
500
1000
Ю -г
0,06
0,13
0,19
0,23
0,27
0,34
0,42
0,43
0,44
0,45
0^ при
5-10-3
0,03
0,06
0,12
0,17
0,21
0,28
0,34
0,37
0,39
0,39
концентрации, моль/л
2-Ю-3
0,01
0,02
0,03
0,07
0,14
0,20
0,26
0,30
0,33
0,32
ш-3
0,01
0,01
0,02
0,02
0,04
0,11
0,18
0,23
0,28
0,30
Постройте кинетические
применимость уравнения w
0,2
0.1
1
Рис. 54. Зависимость степени
заполнения поверхности малеи-
иовой кислотой различной кон-
концентрации от времени адсорб-
адсорбции, моль/л:
/ — с=10-2; 2 — с = 5-10-3: 3 — с =
= 2-10-3; 4-с=10-3
кривые адсорбции (9R—lg t), проверьте
= kc exp (— c/'Qr) для описания кинети-
кинетики адсорбции и определите константу
скорости адсорбции.
Решение. На рис. 54 представ-
представлена зависимость степени заполнения
(9r) поверхности хемосорбированными
органическими частицами малеиновой
кислоты от логарифма времени адсорб-
адсорбции lg t. Для растворов всех концен-
концентраций наблюдается хорошо выражен-
выраженный линейный участок, т. е. зависи-
зависимость, адсорбции от времени может быть
описана уравнением
¦in*,
где постоянная а/' есть функция концентрации. Величину а/' опреде-
определяем как тангенс угла наклона прямой, который равен 1/а/'. Для
концентрации малеиновой кислоты с = 5-10~3 получаем
2,3-1
B)—6r A)
0,275—0,06
= 10,7.
464
Аналогично рассчитаем а/' для всех концентраций малеиновои кисло
ты. Величина а/' практически не зависит от концентрации и является
характеристикой процесса адсорбции данного вещества на родии:
10,2-1-10,7+10,4-1-9,6
<х/ср=т : ± ! =10, 2.
Рассчитываем скорость адсорбции малеиновои кислоты на родии для
растворов различной концентрации (например, для с = 10~2 моль/л
и 9r = 0.09):
tt,_A8R_ 8rB)-8rA) _ 0.13-0,06 _t _x
\t t2 — t, 5
и сводим полученные данные: для с = 10~2 моль/л
9R 0,09 0,16 0,21 0,25 0,30 0,38
w 1,4-Ю-2 6-Ю-3 4-10—3 2-Ю-3 1,4-Ю-3 8-10-4
—lg »¦ 1,84 2,22 2,4 2,7 2,86 3,1
для с = 5-10~3 моль/л
9R 0,09 0,15 0,19 0,25 0,32 0,35
w 7-Ю-3 5-10—:! 2-Ю-3 1,4-Ю-3 6-Ю-4 3-Ю-4
—Ig w 2,15 2,3 2,7 2,86 3,2 3,5
для с = 2-Ю моль/л
9R 0,05 0,11 0,17 0,23 0,28
w . ' 4-Ю-3 3,5-Ю-3 1,2-Ю-3 6-Ю-4 4-Ю-4
—lg w 2,4 2,45 2,92 3,2 3,4
для с = 10~3 моль/л
9R 0,03 0,07 0,14 0,20 0,26
w 10~3 1,4-Ю-3 7-10—4 5-Ю-4 2,5-Ю-4
— Ig w 3 2,86 3,15 3,3 3,6
На основании рассчитанных величин строим зависимости lg w =--
— f (9r) для растворов указанных концентраций (рис. 55). Из полу-
полученных зависимостей рассчитываем а/':
2,3AйИ)г-1яш,)
ОС I а А )
DRA) D(R2)
Ha основании полученных зависимостей lg w = f (9r) строим гра-
график в координатах lg w — lg с при 9R = const (рис. 55, а). Логариф-
Логарифмируя уравнение w = kc" exp (— «/r9r), получаем
In w=\n k-\-n In с — a /' 9R)
465
-tgur
C,HO/lb//t
-2,5
-2
0,1 0,2 0,3
Рис. 55. Зависимость скорости адсорбции малеиновой кислоты
на родии от концентрации (а) н степени заполнения поверх-
поверхности (б)
откуда при 6r = const
n=(lgtt)s —lga»!)/(lgcs—lgCi);
лх = 94; л8=1,01; п3^=0,99; п4=1,05; п5 = 0,97;
пср=0,99±0,05.
Таким образом, показатель степени при концентрации в кинетическом
уравнении скорости адсорбции примерно равен 1. Рассчитаем кон-
константы скорости адсорбции
W
?_- Прн д^ __о и п_ 1
Определяем скорость адсорбции шв=о экстраполяцией зависимостей
lg w от 9r (рис. 55, б) до 9R = 0. Сведем полученные экстраполяцией
значения скорости адсорбции, константы скоростей адсорбции при
различных концентрациях малеиновой кислоты:
с, моль/л ЬЮ-2 5-Ю-3
w , 3,16-Ю-2 1,7-Ю-2
k, 1/(моль-с) 3,16 3,40
?ср = 3,25±0,15.
2-Ю-3
6,3-10-*
3,15
10~3
3,6-Ю-3
3,16
Таким образом, общее кинетическое уравнение процесса адсорб-
адсорбции малеиновой кислоты на родии имеет вид
m> = 3,25 cexp( —10,26r).
5. При исследовании адсорбции малеиновой кислоты на родиевом
электроде при различных температурах были получены следующие
данные:
466
Время, с
10
20
30
50
100
200
300
500
60
0,07
0,17
0,20
0,27
0,27
0,42
0,42
0,44
9^ при температуре
50
0,06
0,12
0,16
0,25
0,25
0,39
0,39
0,41
40
0,04
0,09
0,14
0,19
0,19
0,35
0,38
0,38
°с
30
0,03
0,06
0,12
0,17
0,17
0,33
0,34
0,36
20
0,02
0,03
0,07
0,14
0,20
0,27
0,31
0,32
Определите энергию активации процесса адсорбции малеиновой ки-
кислоты на родии при различном заполнении поверхности адсорбиро-
адсорбированным водородом и установите зави-
зависимость энергии активации адсорбции вя
от степени заполнения поверхности.
Решение. Строим зависимость
6r = / (lg t) при различных темпера-
температурах (рис. 56). Затем определяем ско-
скорость адсорбции:
6^ = 0,2; г = 60°С,
0,23—0,17
= 4,68-Ю-3,
34,7—21,9
Ig ay =,67= —2,33.
Результаты расчета сводим в таблицу:
Рис. 56. Кинетические кривые
адсорбции малеииовой кисло-
кислоты при различных температу-
температурах; "С;
/ — 60; 2 — 50; 3 — 40; 4 — 30;
5-20
Темпера-
Температура. °С
60
50
40
30
20
ig w при е^
0,10
—1,98
—2,14
-2,25
-2,41
—2,55
0,15
—2,17
-2,30
-2,43
—2,60
—2,76
0,20
-2,33
-2,47
-2,62
—2,78
—3,00
0,25
—2,49
—2,65
—2,80
—2,98
—3,18
0,30
—2,65
—2,79
-2,99
—3,21
—3,40
Строим зависимость lg w от \1Т при % = const (рис. 57), исполь-
используя полученные результаты, из которых определяем энергию актива-
активации процесса адсорбции:
A lg w
где tga = -
Л1/Г
467
-з
3,0
Рис. 57. Зависимость скорости ад-
адсорбции от обратной температуры
при различных степенях заполне-
заполнения
Еа.
кДж/ть
зг
28
0,1
0,2
0,3
Рис. 58. Изменение энергии акти-
активации от степени заполнения по-
поверхности
Построить зависимость энергии активации от степени заполнения
поверхности 9r (рис. 58). Эта зависимость носит линейный характер
и описывается уравнением Еа = Ео + afRTQ^, где Ео = 23,9 кДж.
ЗАДАЧИ
1. Через раствор сульфата меди проходит ток силой 1,5 А. Опре-
Определите теоретический выход меди в течение 1 ч.
2. При помощи электролиза воды требуется получить 0,6 л грему-
гремучего газа при 293 К и 740 мм рт. ст. Сколько для этого потребуется
времени, если сила тока 2 А?
3. Металлический предмет требуется покрыть слоем никеля тол-
толщиной 0,3 мм. Площадь поверхности покрываемого предмета равна
100 см2. Плотность никеля 9,0 г/см3. Сколько времени требуется про-
пропускать ток силой 3 А, если выход по току составляет 90 %?
4. Определите расход электроэнергии на получение 1 т меди при
выходе по току 96 %.
5. При электролизе 20 %-ного раствора ацетата калия при 290 К
наряду с другими продуктами на аноде получается этан по уравнению
реакции
2СН3СОО-=С2Н,,+2СО2+2 е.
Отношение числа молекул этана, полученного на аноде, к числу моле-
молекул водорода, полученного на катоде, равно 0,8. Определите выход
этана по току.
6. Для восстановления нитробензола до анилина в катодное про-
пространство поместили 20 г CeH5NO2 30 см3 спирта, 250 см3 воды, 11 г
НО и 1 г SnCl2-2H2O. После пропускания 26,5 А-ч через электроли-
электролизер со свинцовым катодом было получено 12,76 г анилина. Определи-
Определите выход по току.
468
7. Ток последовательно проходит через сосуды с водными раство-
растворами AgNO3, CuSO4, KI и НС1О4. Какие вещества и в каких количе-
количествах выделяются. на платиновых электродах в растворах CuSO4,
KI и НС1О4, если в сосуде с раствором AgNO3 на катоде осадилось
0,1079 г серебра?
8. При прохождении тока через раствор сульфата никеля на като-
катоде выделяются никель и водород. Определите выход по току никеля,
если после пропускания 0,5 Ач выделилось 17,4 см8 Н2 (при н. у.).
9. Если при электролизе раствора поваренной соли отделить ка-
катодное пространство от анодного, то в катодном пространстве получают
едкий натр, а на анод. — хлор. Напишите уравнения реакций, проте-
протекающих на электродах, и определите выход по току щелочи, если в
70,5 л катодного раствора после электролиза в течение 6 ч при силе то-
тока 1000 А содержалось 118 г едкого натра на каждый литр раствора.
10. При электролизе концентрированного кислого раствора суль-
сульфата аммония на аноде при низкой температуре образуется персуль-
персульфат аммония. Напишите уравнение протекающей на аноде реакции и
определите количество электричества, израсходованное на полу-
получение 1 кг персульфата аммония, если выход продукта по току состав-
составляет 75 %. Какой побочный продукт и в каком количестве выделится
на аноде?
11. Постройте график зависимости сдвига потенциала от плотно-
плотности поляризующего тока при электролизе раствора, содержащего
0,01 моль/л CuSO4 и 1 моль/л H2SO4. Коэффициент диффузии ионов
Си2+ равен 1-Ю м'2/с, толщина диффузионного слоя б = 10 мкм,
298 К-
12. При выбранных условиях перемешивания раствора плотность
предельного тока осаждения меди [пр из 0,02 М CuSO4 составляет
20 мА/см2. Рассчитайте потенциал медного электрода (относительно
н. в. э.) при катодных плотностях тока 5, 10, 15, 18 и 19 мА/см2, если
наблюдается чисто концентрационная поляризация (YiCi^o, = 0,317
при 298 К)-
13. Потенциал кадмиевого катода (<р1( = —0,535 В) измерен в
0,01 М растворе CdSO4 (y± =0,399). Определите, какую долю от
предельного тока составляет ток при данном потенциале, если поляри-
поляризация при осаждении кадмия чисто концентрационная. Найдите от-
отношение тока к предельному току для потенциалов <рк = —0,505;
— 0,490; —0,485; —0,480 В B98 К).
14. Сплав серебро—медь осаждают на цианистых электролитах,
содержащихся в виде ионов Си (CN)J и Ag (CN)J 8 г/л меди и 2 г/л
серебра (в пересчете на металлы). Определите массовый состав сплава
(%), если осаждение обоих металлов ведется при предельных токах и
константы диффузии ионов одинаковы.
15. Электролит содержит 10 г/л никеля и 5 г/л кобальта в виде
сульфатов. Определите выход по току сплава, массу осадка и его со-
состав, если электролиз ведется при плотности тока 20 А/дм2 в течение
20 мин на электроде с площадью поверхности 10 см2 и оба металла вы-
469
деляются на предельном токе. Коэффициенты массопереноса D/б ио-
ионов Ni2+ и Со2+ считать одинаковыми и равными 1,6-10~8 см/с.
16. На монокристалле Ni с гранью (III) в 0,1 М КОН, рН 13,15,
при 293 К изучали кинетику выделения водорода. Были получены
следующие данные:
Ч, В 0,075 0,114 0,150 0,190 0,225 0,265 0,300
lg i, А/см2 . . —4,00 —3,80 —3,60 —3,40 —3,20 —3,00 —2,80
Рассчитайте постоянные a, b в уравнении Тафеля.
17. При изучении кинетики выделения водорода на монокристал-
монокристаллах в сильнокислом растворе были получены следующие данные:
Ч, В 0,3 0,35 0,40 0,45 0,50 0,55 0,60 0,65
i20oC, А/см2 0,0115 0,0190 0,044 0,11 0,305 0,77 1,65 3,0
'зсс А/см2 0,0162 0,29 0,073 0,195 0,535 1,28 2,55 4,25
«40оС, А/см2 ..... . 0,022 0,044 0,11 0,29 0,75 1,72 3,15 5,2
«50°С- А/см* °-0'37 °'072 °-19 °-51 • 1>15 2'5 4-3 6-6
Определите постоянные а и Ь в уравнении Тафеля при всех темпе-
температурах. Представьте экспериментальные данные на графике в коорди-
координатах lg i — \1Т при r\ — const. Определите эффективную энергию
активации.
18. Рассчитайте выход по току никеля при электролизе раствора
сульфата никеля с а^\г + = 0.1 при рН 3 и рН 6, если потенциал катода
относительно стандартного водородного электрода <р = — 0,80 В.
Эффекты деполяризации и сверхполяризации в системе никель — во-
водород отсутствуют; константа а в уравнении Тафеля перенапряжения
выделения водорода на никеле при рН 0 равна 0,62 В; стандартный
ток обмена никелевого электрода i0>NI = 3-10~8 А/см2; коэффициенты
переноса для процессов разряда ионов Н+ и Ni24" равны: ан+ = 0,5;
aNi2+ --= 0,29; bwt+ = 2,3RT/(azF) = 0,100 В; <pfti2 + /Ni = — 0,25 В;
Т = 303 К.
19. При изучении адсорбции малеиновой кислоты на.платине при
293 К и фР = 0,4 В было установлено, что степень заполнения поверх-
поверхности адсорбированным веществом 9r = 0,3 для растворов с концен-
концентрацией с — 10~4; 5-10~5; 2,5-10~4 моль/л достигается соответственно
через 10, 25, 47 и 170 с, а степень заполнения 9^ = 0,35 — за время
16, 37, 74 и 107 с. Определите показатель степени при концентрации
в кинетическом уравнении Рогинского—Зельдовича.
20. При исследовании адсорбции 0,1 М раствора метанола на пла-
платине при 293,2 К было получено
470
0,
0
,5
,09
0
1
,2
-0
2
,32
0
5
,44
10
0,56
20
0,69
50
0,77
100
0,8
200
0,82
. Проверьте выполнимость уравнения ©r = Р + [l/(a/')J In t, для
описания кинетики адсорбции метанола постройте график зависимо-
зависимости- 9R = / (lg t)\ на платине и рассчитайте константу скорости процес-
процесса, если адсорбция подчиняется уравнению Рогинского—Зельдовича.
21. При исследовании адсорбции метанола на платиновом электро-
электроде при температурах 284, 296, 308, 319 и 345 К было найдено, что
увеличение степени заполнения поверхности от 9R = 0,35 до 9R = 0,4
происходит соответственно за 5,0; 3,0; 2,0; 1,3 и 0,6 с. Рассчитайте
среднюю энергию активации адсорбции метанола на платине при
9r з* 0,375.
МНОГОВАРИАНТНЫЕ ЗАДАЧИ
¦X. Определите константы а и b.в уравнении Тафеля, если при из-
измерении потенциала катода из данного металла против каломельно-
каломельного электрода (ц> = 0,281 В) в растворе заданного состава при плотно-
плотностях тока [' и Г получены соответственно величины ц>' и ц>".
№ ва-
варианта
1
2
3
4
5
6
7
8
Материал
электрод^
Цинк
Кадмий
Свииец
Кобальт
Никель
Тантал
Родий
Олово
Электролит
2,0 Н. H2SO4
1,3 н. H2SO4
1,0 н. H2SO4
1,0 и. НС1
1,0 н. НС1
1,0 н. H2SO4
2,0 н. H2SO4
2,0 и. H2SO4
с,
vA/cm2
5
0,4
0,2
0,1
0,05
0,02
5,0
0,1
t",
мА/см2
0 2
8,0
0,8
1,5
2,5
5,0
34,0
5,0
Ф', В
1,325
1,372
1,360
0,356
0,476
0,753
0,380
1,097
ф", В
1,157
1,528
1,432
0,533
0,646
1,065
0,478
1.294
2. Определите константы а и b в уравнении Тафеля для перена-
перенапряжения выделения водорода на цинковом электроде с площадью
поверхности 5 = 4 см2 из 2 н. раствора H2SO4. При потенциале цин-
цинкового электрода ц> относительно 1 н. каломельного электрода, равном
— 1,267 В, на катоде медного кулонометра за 60 мин выделилось
9,5 мг меди, а при потенциале — 1,279 В за 30 мин — 5,94 мг меди.
В условии задачи дан первый вариант, другие сведены в таблицу;
№ вари-
варианта
2
3
4
5
6
Материал
электрода
Кадмий
Олово
Свинец
Никель
Тантал
Раствор
1,3 н. H2SO4
2,0 н. H2SO4
1,0 н. H2SO4
1,0 н. НС1
1,0 н. H2SO4
S, см2
5
2
3
5
1,6
/, мии
50
20
100
10
10
6
50
60
60
10
/«, мг
9,90
11,88
4,76
9,90
5,94
5,35
9,50
57,01
4,76
7,92
Ф, В
(
,453
,511
,223
,375
,554
1,576
3,635
3,705
,026
,156
471
КОМПЛЕКСНЫЕ ЗАДАЧИ
1. Превращение С2Н4 по уравнению реакции С2Н4 = С2Н2 + Н2
происходит со скоростью 50 % за 10 ч при 1073,2 К- Рассчитайте энер-
энергию активации прямой реакции (конечные продукты удаляются из
сферы реакции).
2. Для реакции С2Н4 = С2Н2 + Н2 энергия активации Еа ~
= 252-103 Дж. Вычислите температуру, при которой выход С2Н2 за 1 ч
равен половине теоретически возможного при достижении равнове-
равновесия. Рассчитайте время, за которое указанная концентрация будет
достигнута при 1573 К-
3. Рассчитайте равновесный выход в реакции С2Н4 + Н2 — С2Нв
при 1,01 -105 Па, 673,2 К и время, за которое может быть достигнут
выход С2Нв, равный 90 % от равновесного. Энергия активации Еа =
= 182,7-10^ Дж, концентрации С2Н4 и Н2 1 моль/л.
4. Водород и иод взаимодействуют между собой согласно урав-
уравнению Н2 + I2 = 2HI. Поступающий на синтез газ имеет массовую
долю (%): Н2 — 32; 12 — 48, инертный газ — 20. Определите, при ка-
какой температуре в равновесной смеси будет содержаться 30 % Н2
при давлении 1,01- 10s Па, если известна зависимость AG0 = 246,0 —
— 2,30 lg T + 10,7 Т. Вычислите время после смешения, если степень
превращения Н2 при рассчитанной температуре будет равна 30 и 18 %,
реакция второго порядка, константа скорости прямой реакции k при
Тг = 556,2 К равна 0,000119, а при Г2 = 781,2 К k = 3,58. Покажи-
Покажите графически, как меняются равновесный выход и скорость этой реак-
реакции от температуры.
ПРИЛОЖЕНИЕ
Таблица 1. Парахоры атомов, связей и циклов
Атомы
Углерод
Водород при:
углероде
кислороде
азоте
Кислород
» перекисиый
Азот
Фосфор
Мышьяк
Сурьма
Сера
Селей
Фтор
Хлор
Бром
Иод
Бор
Кремний
Олово
Ртуть
Р. 10'
Дж'/4.мБ/гх
Хмоль~~
16,36
27,39
17,79
22,23
35,56
37,87
31,11
72,01
96,01
120,90
88,01
112,01
45,34
97,79
122,68
160,02
38,23
55,12
114,68
122,68
Инкременты связей,
циклов
Связь:
простая
двойная гомеополяр-
ная
тройная
семиполярная
Цикл:
трехчленный
четырехчленный
пятичленный
шестичленный
семичленный
Р. 19'
Дж'/|.м'/,Х
Хмоль
0
33,78
67,56
0
22,23
10,67
5,33
1,42
—7,11
Примечание. Присоединение двух или более отрицательных групп X (CI, CN,
COOR, OR н т. п.) к одному и тому же атому С, N, S уменьшает парахор в среднем для
СХ2 на 5,33-Ю-7; для CXS на 10,67-10-' и для СХ« иа
16,00-10—7 единиц.
473
Таблица 2. Функции (Н°т—Н298) для некоторых веществ, кДж/моль
Т. К
300
400
500
600
700
800
900
1000
Н2О
0,084
3,743
6,945
10,544
14,226
18,033
21,966
26,024
Н,
0,054
2,958
5,883
8,812
11,749
14,703
17,673
20,677
О,
0,054
3,025
6,084
9,242
12,502
15,841
19,246
22,707
СО,
0,084
4,017
8,326
12,929
17,782
22,803
28,033
33,388
СО
0,084
3,012
5,941
8,953
12,050
15,188
18,410
21,714
COCI,
0,126
6,234
12,845
19,790
27,029
34,434
42,007
49,706
HCI
0,084
2,971
8,889
8,870
11,841
14,853
17,949
21,046
Продолжение табл. 2
т, к
.300
400
500
600
700
800
900
1000
0,084
3,807
7,824
12,217
16,862
21,840
27,112
32,635
HN.CI
0,159
9,68
23,47
33,09
43,82
—
—
—
Na,CO3
0,205
11,996
26,295
40,593
57,612
74,630
91,251
107,872
NaOH
0,109
6,350
13,300
34,200
42,748
51,296
59,727
68,157
s2
0,042
4,640
8,565
12,150
15,498
73,341
75,174
77,019
H2S
0,084
3,556
7,196
11,046
15,021
19,205
23,514
28,033
Таблица З. Диффузионный потенцнал прн 298 К
Электролит
1М НС1-КС1иасыщ
0,1М НСЬКОнасыщ
0.01М НС1-КС1„асыщ
0.01М НС1+0.09М
№ОН-КС1„асыщ
Ф-Ю», В
14,1
4,6
3,0
2,!
Электролит
0,1 М КС1/КС1иасыщ
0,01 М HCl/0,1 M KC1
0,01 М НС1/0,1 М КС1
0,1 М NaOH/0,1 M KC1
0,01 М NaOH/0,1 M KCI
ф- 10», В
1,8
26,9
9,1
-19,2
—4,5
Таблица 4. Молекулярные константы двухатомных молекул
о)е—собственное волновое число; хе — коэффициент аигармоничности;
Ве — вращательные постоянные; ге — равновесное межъядерное расстояние;,
^298 — энергия диссоциации
Молекула
Br2
ВгС!
Cl2
C1F
СО
е>е. см *
325,3
444,27
559,75
786,15
2169,81
3,31
4,15
4,81
7,84
6,11 .
ве, см
0,0821
0,152
0,244
0,516
1,931
VA
2,28
2,13
1,987
1,63
1,128
кДж/моль
192,9
215
242,3
252,5
1075
474
Продолжение табл. 4
Молекула
DF
DI
F2 ¦
FO
н2
НВг
HCI
HF
HI
Ii
10
к2
N2
NO
о2
ОН
Р2
ше. см х
2998,19
1639,6
917,55
1060
4400,4
2648,97
2990,9
4138,7
2309,01
214,55
681,47
92,96
2358,03
1904,4
1580,19
3737,9
780,69
15,3
12,1
12,9
14,6
27,4
17,1
17,65
21,7
17,2
2,87
6,3
3,82
6,00
7,45
0,76
29,7
3,61
ве. см~1
11,00
32,84
0,89
1,104
60,86
8,465
10,59
20,95
65,11
0,037|
0,340
0,056
1,998
1,704
1,445
18,895
0,303
0,818
1,61
1,41
1,32
0,741
1,414
1,274
0,917
1,61
2,66
1,868
3,92
1,098
1,151
1,207
0,969
1,893
Dm.
кДж/моль
273,2
298,5
159,0
215,7
435,9
366,5
431,4
566,1
298,4
151,0
222
53,14
945,6
631,0
498,7
428,0
489,1
Программы для решения некоторых задач
на микрокалькуляторах «Электроника МК-54». «Электроника
МК-46», «Электроника МК-61»
Для перевода микрокалькулятора в режим программирования следует в
указанной последовательности нажать клавиши: в/о F ПРГ. При этом на табло
справа загорится 00 — адрес первой операции программы. После ввода програм-
программы необходимо перейти в режим автоматической работы, для чего следует нажать
клавиши F АВТ.
Затем вводят исходные даиные следующим образом: набирают значение како-
какого-либо параметра, нажимают клавишу х -*¦ П и затем нажимают ячейку па-
памяти, соответствующую по программе этому параметру.
Приведенные ниже программы могут быть также использованы для микро-
микрокалькулятора «Электроника БЗ-ЗК» с соответствующим переводом:
tg. = arctg
sin~1 = arcsin
cos = arccos
b=B.
1. Программа для расчета энергии вращения двухатомной молекулы как же-
жесткого ротатора:
v В я2 /
Ь
8 я2 т1 т2 та г2
475
Введите в ячейки памяти необходимые для
Адрес
00
01
02
03
04
05
06
07
08
09
Операция
П—*х1
П—*х2
+
Я—*х3
Fx2
X
8
-1-
Fn
Fx*
Код
61
62
10
63
22
12
08
13
20
Адрес
10
11
12
13
14
15
16
17
18
Опернцня
Я—**1
Я—>г>
/7—**«
П—+х*
Fx2
работы величины:
Код
13
61
13
62
13
60
13
64
22
Адрес
19
20
21
22
23
24
25
26
27
Операция
Х-^-ПЬ
П—+Х*
1
+
X
П—+Х5
X
с/п
КОД
13
41
65
01
10
12
65
12
50
№ ячейки памяти
Величины
0
та
1
т1
2
3
h
4
Г
5
/
где / — квантовое число; г — межъядерное расстояние [М.]; h — постоянная
Планка, 6,62-10-34 Дж-с; т1 и тг — атомные массы в у.е.; та — атомная
единица массы, 1,66-10~27 кг.
Пуск программы иа счет реализуется клавишами: в/о с/п. На индикаторе —
значение ?вр; для получения Ве нажать клавиши Я -*¦ xb.
Проверка программы: / = 10; г = Ю0 м; тх = 5; т2 = 10.
Правильное значение: ?вр = 1,10339-1О-гоДж, Ве = 1,003-10~22 Дж
2. Программа длн определения долн молекул N;-/No иа j-м вращательном
квантовом уровне:
Nn
Е.=
8пЧ
¦I (/+•)•
Адрес
00
01
02
03
04
05
06
07
08
Операция
П—+Х1
Fx2
Я—>Х3
8
Fn
Fx2
-i-
Код
61
22
63
13
08
13
20
22
13
Адрес
09
10
11
12
13
14
15
16
17
Операция
П—+Х5
1
+
X
П—*Х5
X
П—+х2
_^-
Я—*х*
Код
65
01
10
12
65
12
62
13
ч-
?Адрес
18
19
20
21
22
23
24
25
26
Операция
1 — 1
Fex
П—+Х5
2
X
1
+ '
X
с/п
Код
OL
16
65
02
12
01
10
12
50
476
Введите в ячейки памити необходимые длн расчета величины:
№ ячейки
Величина
1
h
2
k
3
/
4
т
5
/
где / — квантовое число; Т—температура, К; /—момент инерции, кг-м?
k — постоянная Больцмаиа, 1,38-10-?* Дж/К; Л — постоянная Планка,
6,6262-10-3« Дж- с.
Проверка программы: / = 0,459-10~« кг-м2; / = 5; Т = 300 К.
Правильное значение: NjlN0= 1,69-10~3.
3. Программа для вычисления колебательной составляющей теплоемкостн и
изобарной теплоемкости двухатомного вещества в идеальном газообразном со-
состоянии:
в/г
(e97r_!)i
Адрес
00
01
02
03
04
05
06
07
08
Операция
Я—*Х°
П—+х»
X
Я—ч-х2 .
х—>Я4
Fxa
Я—+х*
Fe*
Код
60
63
12
62
13
44
22
64
16
Адрес
09
10
11
12
13
14
15
16
17
Операция
х—*Я5
д:
Я—+Х1
X
Я—>х5
1
-г
Код
45
12
61
12
65
01
11
22
13
Адрес
18
19
20
21
22
23
24
25
Операция
Х-+Я4
Я—>х1
7
X
2
-I.
+
с/п
Код
44
61
07
12
02
13
10
50
Введите в ячейки памяти необходимые для расчета величины:
№ ячейки памяти
Величина
0
he
т
1
R
2
т
3
he
где -j = 1,43879 см-К; /? = 8,3143 Дж; Г — температура, К; ше — частица
см-1. На индикатор выводится зиачеиие С*, Для вывода иа индикатор значения
СЕ нажать клавиши Я -»- д: 4.
Проверка программы: ше = 214,248 см~1; Г= 298 К.
Правильные ответы: СЕ = 7,61096; С° = 36,71101,
477
4. Программа для вычисления колебательной составляющей энтропии
двухатомной молекулы или одиой колебательной степени свободы многоатомной
молекулы:
= -R In (l-
Адрес
00
01
02
03
04
05
06
07
08
09
Операция
Я—-кс 0
Я—>* 3
д:
Я—+* 2
*—>77 4
У—Л
Fex
*—-с/75
П—+х 4
Код
60
63
12
62
13
44
16
45
64
Адрес
10
11
12
13
14
15
16
17
18
19
Операция
X
П—ух 1
X
П--+Х 5
1
4-*-
•1-
х—-уП 4
Я—-+х 5
Код
12
61
12
65
01
14
11
13
44
65
Адрес
20
21
22
23
24
25
26
27
28
29
Операция
1
4-*-
F In
Я—ух 1
X
П—*х 4
4-*-
с/п
Код
01
14
11
18
61
12
64
14
11
50
he
где -г = 1,43879 см-К; R = 8,3143 Дж; Т — температура, К; ше — частота,
см~1.
Введите в ячейки памяти необходимые для расчета величины:
№ ячейки памяти
Величина
0
he
k
1
R
2
Г
3
На индикатор выводится значение 5кол. Для вывода иа индикатор значения
нажать клавиши Я -*- х 4.
Проверка программы: ше = 214,248 см-1; Т = 298 К.
Правильные значения: 5К0Л = 8,3939657 Дж/(моль-К);
U —U,
= 4,7425372.
5. Программа для вычисления поступательной составляющей энтропии
вещества в идеальном газообразном состояиии:
Адрес
00
01
02
03
04
05
06
07
Операция
Я—>х 4
F 1п
3
X
2
Я—'ух 2
F 1п
Код
64
18
03
12
02
13
62
18
Адрес
08
09
10
11
12
13
14
Операция
5
X
2
_^
+
Я—-ух 3
F In
Код
05
12
02
13
10
63
18
Адрес
15
16
17
18
19
20
Операция
П—ух 0
+
Я—ух 1
X
с/п
Код
11
60
10
61
12
50
478
Введите в ячейки памяти необходимые для расчета величины:
№ ячейки
памяти
Величина
0
10,3612
1
R
2
Г
3
Р
4
М
где R = 8,3143 Дж; Т — температура, К; Р — давление, Па; М — молекуляр-
молекулярная масса.
Проверка программы: Т= 298 К; Р= 1,0132-105 Па; М = 143.
Верное значение: S?0CT = 170, 6274 Дж/(моль-К).
6. Программа расчета суммы состояний:
In z,= 1,5 In
In гГ = 1п
~- In Г —In P+ 19,222;
п Г— In а+104,52712;
ZV=
Адрес
00
01
02
03
04
05
06
07
08
09
10
11
12
13
14
15
16
17
18
19
20
21
22
Операция
Я—+х С
F In
3
X
2
П—>х Ь
F In
*—>-Я b
5
X
2
—
+
Я—ух а
F In
—
Я—>* 9
+
Fex
х—+П 9
П—ух 4
Я—>* 5
Код
6[
18
03
12
02
13
6L
18
AL
05
12
02
13
10
6—
18
11
69
10
16
49
.64
65
Адрес
23
24
25
26
27
28
29
30"
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
Операция
+
F Мх
Я—>* 4
X
П—>х 5
X
Л—>* 3
X
П~-+х d
F х*
X
F In
П—>х b
+
Я—-ух 1
F In
—
Я—-ух 8
+
х—*П 8
Я—-ух 7
Я—-ух 2
Код
10
23
64
12
65
12
63
12
6L
22
12
18
6
10
61
18
11
68
10
16
48
67
62
Адрес
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
Операция
X
П—ухЬ
Fex
1—1
Fex
1—1
1
_)_
F l/x
х—*П 7
П—ух 8
Я—>* 9
X
X
х—уП 6
с/п
Код
12
6L
16
13
OL
16
OL
01
10
23
47
68
69
12
12
46
50
Введите
№ ячейки
памяти
Величина
в ячейки памяти
а
Р
ь
Т
с
м
d
d
1
а
необходимые
2
3
1,6610-2'
ДЛЯ
4
Щ
расчета значения:
5
6
1,43879- Ю-2
7
104,52712
8
19,222
479
где Р — давление, Па; Т — температура, К; М — молекулярная масса; d —
межъядерное расстояние, м; о — степень симметрии; ше — частота, см; т1 и
тг — относительные массы атомов. В ячейку 3 заносится атомная единица мас-
массы, в ячейку 7 — (hclk).
После окончания счета для вывода результата проделать следующие опера-
операции:
поступательная составляющая Zt — Я -*¦ *9;
вращательная составляющая ZT = Я -*¦ х&; колебательная составляю-
составляющая Zv = Я ->- х 7;
сумма состояний Z = Я -*¦ х 6.
Проверка программы: Я = 1,0132- Ю-5 Па; Г = 400 К; Л1 = 80-!0-3;
d = !,414-Ю-10 м; о = 1; ше = 2649,683-Ю2 м; тх = 1; т2 = 79.
Правильные значения: Zt = !,5925-108; ZT = 32, 59536; Zv = 1,0000726;
Z = 5,1914-10».
7. Вывод [коэффициентов уравнения Ср = а-\-ЬТ+сТг для трех известных
зиачеинй теплоемкости и температуры.
Для расчета коэффициентов используют три программы, которые следует
вводить в машину в приведенной последовательности не выключая (!) из сети
микрокалькулятор.
Программа I
Адрес
00
01
02
03
04
05
06
07
08
09
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
Операция
П—уХ
П—уХ
П—УХ
_|_
_|-
х—уП
П—ух
F*2
1
2
3
4
1
П—ух2
F*2
_|_
П—УХ
F*2
_j_
х—уП
П—ух
Fx*
П—УХ
X
П—ух
F*2
X2
X
_|-
П—УХ
Fx*
3
5
1
1
2
3
Код
6!
62
63
10
10
44
61
22
62
22
10
63
22
10
45
61
22
61
12
62
22
62
12
10
63
22
Адрес
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
Операция
я
х-
П
Я
я
X-
П-
П-
П-
х-
П
Я
Я
—ух 3
X
—уП 6
—УХ 1
F*2
F*2
—ух 2
F*2
Рхг
-|-
—ух 3
Fx*
F*2
-j-
-уП 7
—ух а
—УХ Ь
—-УК С
+
+
—уП 0
—ух а
—УХ 1
X
—*х 2
Код
63
12
10
46
61
22
22
62
22
22
10
63
22
22
10
47
6-
6L
61
10
10
40
6—
61
12
62
Адрес
52
53
54
55
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
75
Операция
Я-
Я-
п-
X—
П-
1
П-
п-
--ух Ь
X
_i_
-ух 3
—У* С
X
_|_
-уП 8
-УХ 1
-у* а
X
—УХ*
F*2
П-
П-
1
П-
X—
—УХ 6
X
_|_
-ух 3
7хг
-уд: с
X
_|_
-уП 9
с/п
Код
6L
12
10
63
6L
12
10
48
61
22
6—
12
62
22
6L
12
10
63
22
6[
12
10
49
50
Введите в ячейки памяти необходимые для расчета величины:
№ ячейки
памяти
Величина
сР2
480
После набора программы и ввода данных нажать клавиши в/о и с/п. После окон-
окончания расчета перейти в режим программирования, для чего нажать клавиши
в/о Fnpr и ввести в микрокалькулятор программу II.
Проверка программы I
Ввести: Г, = 400; Г2 = 600; Т3 = !200; Ср1 = 29,!54; Ср2 = 29,685;
Срз = 32,9!!.
Примечание. После окончания расчета по программе I в ячейках памяти
3 3 3 3
4, 5, 6, 7 будут находиться соответственно S Tr, S Г?; S Г?; S Tf и в ячейках
i = \ * = i ' i=\ ' t=i.
0, 8, 9 соответственно 2СР|; 2 (СР.Г;); 2 (Cp.Tf).
f=i W=i ' f=i '
При правильной работе программы в ячейках памяти должны находиться
следующие значения:
№ ячейки
памяти
Величина
2200
1,96-10е
2,008.10»
2,2288-1012
91,75
68965,8
62743080
Программа
Адрес
00
0!
02
03
04
05
06
07
08
09
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
II
Операция
П—ух
П—ух
3
X
X
П—ух
П-+х
П—ух
X
X
+
FBx
+
П—+х
Fx*
П—ух
X
—
П-+х
Fx*
3
X
П—ух
Fxi
П~ух
X
—
х—сЯ
П-+х
7
5
4
6
5
5
5
6
4
7
d
5
Код
67
65
03
12
12
64
66
65
12
12
10
0
10
65
22
65
12
11
66
22
03
12
11
64
22
67
12
11
4Г
65
Адрес
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
Операция
Я
Я
Я-
X-
П
Я
Я-
Я-
Я-
X-
П
П-
П-
п-
х-
п
—КС
X
—УХ
Fx*
—УХ
-+П
—УХ
—УХ
X
—УХ
—УХ
X
—УХ
-^я
—УХ
—УХ
X
—УХ
Fx2
—УХ
-+я
УХ
3
7
6
d
1
4
7
6
5
d
2
4
6
5
d
3
7
Код
67
12
66
22
11
6
13
41
64
67
12
66
65
12
11
6
13
42
64
66
12
65
22
11
6Г
13
43
67
03
Адрес
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
75
76
77
78
79
80
81
82
83
84
85
Операция
Я
Я
X-
П
Я
Я
Я
X-
П
Я
Я
X
X
—+х 5
Fx*
.
—ух d
-и
—уП а
—>х 6
3
X
—ух 5
—>* 4
д.
—ух d
_=_
-+Я Ь
—>* 5
3
X
—>* 4
Fx2
—ух d
-+ПС
с/п
Код
12
65
22
11
6Г
13
4—
66
03
12
65
64
12
11
6Г
13
4
65
03
12
64
22
11
6Г
13
4
50
16 Зак. 767
481
Для проверки правильности программы использовать данные программы I.
После окончания расчета в ячейках 1, 2, 3, а, Ь, с, d должны быть следующие
значения:
№ ячейки
памяти
Величина
36,50,105
6,25-10-»
3,087-10-*
1,857-10-'
1,128 Ю-""
9,21610»
Программа III
Адрес
00
01
02
03
04
05
06
07
08
09
10
11
12
13
Операция
П-+х 1
П-+х 0
X
П-+х 2
К-Л
П-+х 8
X
+
П-+х 3
П-+х 9
X
+
х^-П 4
П-+х 2
Код
61
60
12
62 ¦
0
68
12
10
63
69
12
10
44
62
Адрес
14
15
16
17
18
19
20
21
22
23
24
25
26
27
Операция
К-Л
П-+Х 0
X
П-+х а
П—х 8
X
+
П-+х 9
П-+х b
К-Л
X
+
П-+х 5
П-+х 3
Код
0
60
12
6—
68
12
10
69
6
0
12
10
45
63
Адрес
28
29
30
31
32
33
34
35
36
37
38
39
40
Операция
П-+Х 0
X
П-+х 8
П-+х b
К-Л
X
+
П-+х с
П-+х 9
X
+
х-+П 6
с/п
Код
60
12
68
6L
0L
12
10
6L
69
12
10
46
50
Коэффициенты уравнения Ср=а+67"+сГ2, а, Ь и хранятся соответствен-
соответственно в 4, 5,6, ячейках памяти.
Для извлечения из памяти нажать клавишу П -*¦ х и номер нужной ячейки.
Проверка программы III.
с =
Правильные значения коэффициентов: а= 28,9085; Ь— 4,602-10"
= 4,8454- 10-в.
8. Программа вычисления факториала nl = 1. Если принять заранее, что
п Ф 0, то я! можно вычислить по следующей программе;
Адрес
00
01
Оператор
1
П-+х О
Код
01
60
Значение п вводите в s
грамме
Адрес
00
01
02
03
-
Оператор
ВП
Х-+П0
1
П-+х 0
Код
Of
40
01
60
Адрес
02
03
Оператор
X
FLO
Код
12
5Г
шейку 0. Для любого л J
Адрес
04
05
06
07
Оператор
X
FLO
03
с/п
Код
12
5Г
03
50
Адрес
04
05
Оператор
01
с/п
Код
01
50
s 0 вычисляют я! по про-
Адрес
Оператор
Код
482
Проверка программы: л = 6; л!= 720; л = 0; л! — !.
9. Программа для вычисления корней квадратных уравнений вида ах*-\-
+ 6* + с = 0.
В ячейку «а» вводится а, в «6» — значение Ь, в «с» — значение с.
Если корни уравнения действительные, то по окончании расчета на индикато-
индикаторе высвечивается значение хг и в ячейках памяти ! и 2 хранятся соответственно
x-l и хг. Если корни уравнения мнимые, то по окончании расчета на индикаторе
высвечивается [0]. В ячейках памяти 0 н 9 хранятся соответственно действитель-
действительная и мнимая части корней.
N
Адрес
00
01
02
03
04
05
06
07
08.
09
!0
Операция
П-*х Ь
П-+х а
_^-
2
.j-
1 — !
Х-+ПО
Fx1
П-+х С
П-+х а
-7-
Код
6L
6—
13
02
13
01
40
22
6[
6-
13
Адрес
11
12
13
14
15
16
17
18
19
20
21
Операция
Fx^O
25
F Y~
х-+П d
П-+х 0
+
х-+П 1
П-+х 0
П-+х d
—
Код
11
59
25
21
4Г
60
10
41
60
6Г
11
Адрес
22
23
24
25
26
27
28
29
Операция
Х-*Л 2
БП
29
1 — 1
F V—
х-+П 9
С х
с/п
Код
42
51
29
0
21
49
ОГ
50
Проверка программы: 1) 5*2 + 2х—3=0; хх = 0,6; х% =
2х + 10= 0; хг = 1 + »3; хг = 1 — t3.
Статистическая обработка непосредственных измерений
— 1; 2) х2 —
После ввода программы и перехода в режим автоматической работы ввести в
ячейки памяти 1, 2 и 3 соответственно лх> пг н пя. В ячейку а вводится критерий
Стьюдента /ц (л), где а — доверительная вероятность, л — число измерений.
В ячейку d вводится точность прибора.
Принцип работы программы. Сначала вычисляют среднее значение л, за-
затем (л — л). Если (л — n)<.d, то (л— л) отбрасывают и в дальнейшем рас-
рассчитывают доверительный интервал d. Если (л — л) d, то в расчет доверитель-
доверительного интервала идет это значение.
По окончании расчета л хранится в ячейке 0, Дл — в ячейке с.
Все вышеуказанное относится ко всем программам статистической обработки
непосредственных измерений, с той лишь разницей, что для 4, 5, 6, 7, 8 и 9-го из-
измерений соответственно л4 -> 4, л5 -»¦ 5, лв -*¦ 6, л7 -*¦ 7, лц -*¦ 8, л8 -*¦ 9 ячейки.
Значения критерия Стьюдента для доверительной вероятности при а =
= 0,96:
л
ta(n)
3
4,303
4
3,182
5
2,776
6
2,571
7
2,447
8
2,365
9
2,306
16*
483
Программа для
Адрес
00
01
02
03
04
05
06
07
08
09
10
11
12
13
14
15
Оператор
П—Х 1
П—Х 2
П—Х 3
+
+
3
-J-
х—ПО
П—х 1
ПП
25
П—х 2
ПП
25
П—х 3
ПП
i=3
Код
61
62
63
10
10
03
13
40
61
53
25
62
53
25
63
53
Адрес
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
Оператор
25
6
_=_
FV-
П—х
X
х—ПС
ЬП
42
П—х 0
Fx*
F Y~
х—ПЬ
П—х d
Код
25
06
13
21
6—
12
41
51
42
60
11
22
21
\L
6Г
Адрес
31
32
33
34
35
36
37
38
39
40
41
42
Оператор
Fx<S>
36
П—х d
х—П b
П—х b
Fx*
П—х С
+
х—ПС
в/о
с/п
Код
11
51
36
6Г
6L
6L
22
6[
10
4[
52
50
Проверка программы: лх = 6,3; л2 = 6,7; л3 = 5,9.
Точиость прибора d = 0,25.
Правильный ответ: л±Дл; л= 6,3; Дл = 1,08645.
Программа для
Адрес
00
01
02
03
04
05
06
07
08
09
10
11
12
13
14
15
16
Оператор
П—х 1
П—х 2
П—х 3
П-+х 4
+
+
+
4
-1-
Х-+П0
П-+х 1
ПП
31
П-+х 2
ПП
31
П-+х 3
»=4
Код
61
62
63
64
10
10
10
04
13
40
6!
53
31
62
53
31
63
Адрес
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
Оператор
ПП
31
П—х 4
ПП
31
1
2
f'y~
П-+х а
X
х—ПС
ЬП
48
П—х 0
—
Код
53
31
64
53
3!
01
02
13
21
6—
12
4[
51
48
60
11
Адрес
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
Оператор
F х
F V~
х—П b
П—х d
—
Fx<0
42
П—х d
х—П Ь
П—х Ь
Fx2
П—х С
+
х—ПС
в/о
с/п
Код
22
21
4L
6F
11
5[
42
6F
4L
6L
22
6[
10
4[
52
50
Проверка программы: лх = 5,2; ла = 5,3; л3 = 5,4; л4
Точиость прибора d = 0,25.
Правильный ответ: л±Дл; л=.5,45; Дл = 0,57364.
= 5,9.
484
Программа для
Адрес
00
01
02
03
04
05
06
07
08
09
10
11
12
13
14
15
16
17
18
Оператор
П-+Х 1
¦П-+Х 2
П-+Х 3
П-+Х 4
+
+
П-+х 5
+
5
Х-+П0
П-+х 1
ПП
36
П-+х 2
ПП
36
П-+х 3
(=5
Код
61
62
63
64
10
10
10
64
10
05
13
40
61
53
36
62
53
36
63
Адрес
19
20
21
22
23
24
25
26
. 27
28
29
30
31
32
33
34
35
36
37
Оператор
ПП
36
П-+х 4
ПП
36
П-+х 5
ПП
36
2
0
—
F у-
П-+х а
X
Х-+ПС
ЬП
53
П-^х 0
—
Код
53
36
64
53
36
65
53
36
02
00
13
21
6-
12
4[
51
53
60
11
Адрес
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
Оператор
Fx*
F V~
х-*ПЪ
П-+х d
Fx<0
47
П-+х d
х-+П b
П-+х b
Fx*
П-+х С
+
Х-+ПС
в/о
с/п
Код
22
21
4L
6F
11
5[
47
6Г
4L
6L
22
6
10
Ч
52
50
Проверка программы: лх = 3,3; л2 = 3,8; л3 = 3,5; л4 = 3,!5; пь —
Точность прибора d = 0,25.
Правильный ответ:~й ±Дл;~л= 3,42; Дл = 0,39493.
Программа для
Адрес
00
01
02
03
04
05
06
07
08
09
10
11
12
13
14
15
16
17
18
19
20
Оператор
П-+Х 1
П-+х 2
П-+Х 3
П-+х 4
+
+
+
П-+х 5
П-+х 6
+
+
6
-и.
Х-+П0
П-+х 1
ПП
41
П-+х 2
ПП
41
П-+х 3
»=6
Код
61
62
63
64
10
10
10
65
66
10
10
06
13
40
61
53
41
62
53
41
63
Адрес
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
Оператор
ПП
41
П-+х 4
ПП
41
П-+х 5
ПП
41
П-+х 6
ПП
41
3
0
j-
F \'~
П-+х а
X
Х-+ПС
ЬП
58
Код
53
41
64
53
41
65
53
41
66
53
41
03
00
13
21
6—
12
4[
51
58
Адрес
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
Оператор
П-+Х 0
Fx*
F Y~~
х-+П b
П-+х d
—
Fx<0
52
П-+х d
х-*П b
П-+Х b
Fx*
П-+х С
+
х~+ПС
в/о
с/п
Код
60
и
22
21
4[
6Г
11
5[
52
6Г
AL
6L
22
6[
10
4
52
50
485
Проверка программы: лх = 2,1; п% = 2,2; л3 = 2,3; л4 = 2,8; ns = 3,0;
лв = 2.35.
Точиость прибора с(= 0,25.
Правильный ответ: л~± Дл; л = 2,45833; Дл = 0,40113.
Программа для
Адрес
00
01
02
03
04
05
06
07
08
09
10
11
12
13
14
15
16
17
18
19
20
21
Оператор
П-+х 1
П—Х 2
П—х 3
П—х 4
+
+
+
П—х 5
П—х 6
Я-** 7
+
+
+
i
х—ПО
П—х 1
ПП
46
П—х 2
ПП
46
»=7
Код
61
62
63
64
10
10
10
65
66
67
10
10
10
07
13
40
61
53
46
62
53
46
Адрес
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
Оператор
П—х 3
ПП
46
П—х 4
ПП
46
П—х 5
ПП
46
П—х 6
ПП
46
П—х 7
ПП
46
4
2
f'v~
П—х а
X
Код
63
53
46
64
53
46
65
53
46
66
53
46
67
53
46
04
02
13
21
6—
12
Адрес
43
44
45
46
47
'48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63
Оператор
Х—ПС
ЬП
63
П—х 0
—
Fx*
F Y~
х—ПЬ
П—х d
'
Fx<Q
57
П—х d
х—ПЬ
П—х Ь
Fx*
П—х'С
-+-
*-*гтс
в/о
с/п
Код
4[
51
63
60
11
22
21
4L
6Г
11
5[
57
6F
М
6L
22
6[
10
4[
52
50
Проверка программы: лх = 1,3; л2 = 1,7; л3 = 1,5; л4 = 1,4; л6 = 1,7;
лв = 1,5; л, = 1,6.
Точность прибора d = 0,25.
Правильное решение: л ± Дл; л = 1,52857; Дл = 0,24974.
Программа для
Адрес
00
01
02
03
04
05
06
07
08
09
10
Операция
П—Х 1
П—х 2
П—х 3
П—х 4
+
+
+
П—х 5
П—х 6
П—х 7
+
t = 8
Код
61
62
63
64
10
10
10
65
66
67
10
Адрес
24
25
26
27
28
29
30
31
32
33
34
Операция
П—Х 3
ПП
' 51
П—х 4
ПП
51
П—х 5
ПП
51
П—х 6
ПП
Код
63
53
51
64
53
51
65
53
51
66
53
Адрес
48
49
50
51
52
53
54
55
56
57
58
Операция
х—ПС
ЬП
68
П—х 0
—
Fx*
F Y~
х-ПЬ
П—х d
—
F х<0
Код
4[
51
68
60
11
22
21
М
6F
И
5[
486
=3 =Эх =3=3 -.-.-. .,__
еэ 4 ел Еэ 4 4 .г. „4-4- 4 4 4-4-4- 4444-4-4-4444
ю —О
елелсп
fflW-
елспелелсп*^Осп
UlOfflW- OWCOOOCO
^-»"—"~всп ел en en
— "¦
со oo -j en ел ¦*>¦
о
1;Г
О О З-
со =3-3
~спьасп*.спспел —
o-^^эtt¦J—- —
Г: i
I
W
¦о 9 ~"о
а 5 а ш
s о « о
ь Q „-о
ЕЯ*-.
О OV
I -
H- "
U> о
D3
' а
•о
о
-а
ш
2
JO
ел
ел
О
II
"w
о
а
II
J"?
а
fl
II
W
а
to
"ел
=3 =ЭХ U5
-Wks-w-owooooooo
° | 00 -J
¦—cftto — ооелслслелелслел
N3 1 — W О>СП — оооо — W-J —
ssssssesss
1 ? ?4?
^ Г) о--о-а
1
Операция
Код
Адрес
Операция
Код
Адрес
Операция
Код
Проверка программы: tii = 1,2; л2 = 1,3; л3 = 1,4; л4 — 1,3; л6 = 1,2;
лв = 1,4; л7 = 1,0; л8 = 1,35; л„ = 1,6.
Точность прибора d = 0,25.
Правильный ответ: л±Дл; я = 1,30555; Дл = 0,213566.
Для статистической обработки непосредственных измерений для любого {
можно использовать программу, состоящую из двух частей.
Коэффициент распределения Стьюдеита для различных уровней значимостн
(доверительных вероятностей) можно взять из книги В.Е. Гмурман «Руководство
к решению задач по теории вероятностей и математической статистике», прило-
приложение 6, с,393. Следует учесть, что число степеней свободы k = i — 2.
После ввода программы в ячейку 0 — число измерений, в ячейку 9—/„(я),
в ячейку d — точность прибора. По окончании расчета в ячейке а — л в ячейке
с — Ал.
Правила работы с программой. После ввода всех зна-
значений нажать на клавиши в/о, с/п. На индикаторе загорится 1. Это значит, что
необходимо ввести первую точку. Набрать на клавиатуре значение первой точки и
нажать клавишу с/п. Через несколько секунд загорится цифра 2, следовательно,
необходимо ввести вторую точку и т. д. После ввода последней точки на индика-
индикаторе вновь загорится цифра 1. Это значит, что среднее значение рассчитано и
для вычисления доверительного интервала необходимо вновь ввести все точки,
нажимая после ввода каждой точки клавишу с/п.
Когда все точки введены — на индикаторе и в ячейке с — значение Дл,
в ячейке а — значение л.
Программа для
Адрес
00
01
02
03
04
05
06
07
08
09
10
11
12
13
14
15
16
17
18
19
20
Оператор
1
Х—П6
П-*-х6
с/.п
П-*ха
+
х-+Па
КП-+х6
КП-+хЪ
FLO
02
П-*ха
П-*~хЬ
-j-
х-*-Па
П-+хЬ
х-*-ПО
1
Х-+П6
П-+Х&
с/п
любого
Код
01
46
66
50
6—
10
4—
Г6
Г5
5Г
02
6—
65
13
4—
65
60
01
46
66
50
1
Адрес
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
Оператор
П-*-ха
Fx*
FY~
х-*~ПЬ
n-+xd
Fx<0
32
n-+xd
х-+АЪ
П-*хЬ
Fx2
П-+хС
+
Х-+ПС
КП-+х6
FLO
19
П-+хС
П-+хЬ
Код
6—
11
22
21
AL
6F
11
5
32
6F
AL
6L
22
61
10
4[
F6
5F
19
61
65
Адрес
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
Оператор
1
—
П+хЬ
X
—
FY~
П~+х9
X
Х-+ПС
с/п
Сх
х-+Па
Х-+П5
Х-+ПС
ЬП
00
Код
01
11
65
12
13
21
69
12
4[
50
OF
А—
45
4[
51
00
Проверка программы по любым предыдущим значениям.
Программа линейной интерполяции. Часто случается так,что необходимо
определить табличный параметр, находящийся между известными точками. На-
Например, пусть дана зависимость давления от температуры:
488
Р, МПа
т, к
0,1
271,5
0,2
280
0,3
289
0,4
298,5
0,5
308,5
0,6 1 0,7
319 330
0,8
341,5
0,9
353,5
Нам необходимо определить температуру прн давлении 0,417 МПа. Для
этого, учитывая, что зависимость P=f (T) нелинейная, предполагаем, что ин-
интересующий нас участок осн — линейный. Вводим программу:
Адрес
00
01
02
03
04
05
06
07
Оператор
Х-+ПА
FO
х^-ПЗ
FO
X-W72
FO
х-+П\
с/п
Код
44
25
43
25
42
25
41
50
Адрес
08
09
10
11
12
13
14
15
Оператор
х-*-ПЬ
П-+Х2
П^-хХ
—
П-*-х4
П-+хЪ
_—
ч-
Код
45
62
61
11
64
63
11
13
Адрес
16
17
18
19
20
21
22
Оператор
П-+хЬ
Л-+хЗ
X
П-+х\
+
с/п
Код
65
63
11
12
61
10
40
Предположим, что есть некая общая зависимость / = f (Y). В этом случае, если
необходимо определить Yх, лежащее между Kj и Y2, которому соответствует из-
известный параметр /", ввод производится в следующем порядке:
Yi, B2\;Y2; В \ ; /х; В \ ; 12.
Нажимают клавиши в/о и с/п. После остановки программы /" вводятся в ре-
регистр X (т. е. просто набирают значение) и нажнмают клавншу с/п. По оконча-
окончании расчета на индикаторе горнт значение Yx
Г
¦ Y,
В общем случае расчет производится по формуле
YX=Y1 +
1ц—h
В нашем примере при правильном
вводе программы и исходных данных дав-
давлению 0,417 МПа соответствует температу-
температура Г = 300,2 К.
Программа вычисления интеграла (пло-
(площади подынтегральной кривой) с исполь-
использованием сумм Дарбу. Пусть есть некото-
некоторая кривая / (х) (рис. 59), необходимо оп-
определить / (х) dx, т. е. рассчитать площадь
подынтегральной кривон отточки а до точ-
точки Ь. Отрезок ab разбиваем по п равных ча-
частей. Величину h — шаг разбиения и t —
число разбиений введем в ячейки памяти
соответственно h -*¦ d, i -*¦ 0. После ввода
программы нажимаем клавиши в/о и с/п. На
Рис. 59. Зависимость у—Ь(х)
489
Рис. 60. Зависимость b(x) от х
индикаторе загорается цифра 1, следова-
следовательно, необходимо ввести значения /*(*)
«по недостатку» и «по избытку» для первой
точки (а). Ввод производится следующим
образом: f (х) недостаток В | f (x) избыток
с/п. Далее загорается цифра 2 и т. д., При-
Причем для каждого элемента разбиения не-
необходимо вводить сначала недостаток, по-
потом избыток. Это следует помнить, если
функция имеет экстремум на исследуемом
отрезке, если функция монотонная — за-
задача упрощается-
Перед началом работы в ячейку 6 вве-
ввести число 1. После окончания расчета в
ячейке А -*¦
п
2
W>ct;
Адрес
00
01
02
03
04
05
06
07
08
09
10
11
Оператор
П-+хЬ
с/п
Х-+П2
FO
х-+П\
П-+х<1
X
П-+ха
+
х-*-Па
П-^хЬ
П-+хЧ.
Код
66
50
42
25
41
6Г
12
6—
10
4
&F
62
Адрес
12
13
14
15
16
17
18
19
20
21
22
23
Оператор
X
П-+хЪ
л-
х-^ПЬ
КП-+х6
FLO
00
П-*хЬ
П~*-ха
—
2
Код
12
6L
10
AL
F6
5F
00
6L
6—
11
02
13
Адрес
24
25
26
27
28
29
30
31
32
33
34
Оператор
П~*ха
+ -
Х-+ПС
с/п
Сх
х-+Па
х-+ПЬ
вп
х-+Пв
ЬП
00
Код
6—
10
4[
50
OF
4—
и
О[
46
51
00
Площадь вычисляют по формуле (рис. 60)
=S кв
'недост
где Sj — площадь одного прямоугольника.
Проверка программы:
'_("/(*) =39.45; S
= 50,4.
Программа метода наименьших квадратов. Предлагаемые программы МНК
позволяют определить все характеристические параметры линейиой регрессион-
регрессионной зависимости у = а + Ьх.
После ввода программы и перехода в режим автоматических вычислений
ввести число экспериментальных точек (j) в ячейку 0, нажать клавиши в/о;
490
Программа 1
Адрес
00
01
02
03
04
05
06
07
08
09
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
i
Оператор
1
Х-+П6
П-*-х6
с/п
Х-+-П 1
FO
Х-+П1
П-+-хА
+
х-*-П4
П~*-х1
П-*-хЗ
_|_
Х-+ПЗ
П-*-х1
Fx2
П-*-х8
+
х~*~П8
П~*-х 1
П-*-х2
X
П-*-х9
_|_
х~*-П9
КП-*-х%
КП-*-хЪ
FLO
02
П-*х9
П-*-хЬ
X
П-+х\
Код
01
46
66
50
41
25
42
64
10
44
61
63
10
43
61
22
68
10
48
61
62
12
69
10
49
6
5
5
02
69
65
12
64
Адрес
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48 •
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63
64
Оператор
П-+хЗ
X
—
П-*-х8
П-*-х5
X
П-+хЗ
Fx*
—
х-*-ПЬ
П-*-хЗ
X
П-*-х4
—
П-*-хЬ
-^
х-+Па
П-*-х5
Х-+П0
1
Х-+П6
П-+х6
с/п
х-*-П 1
FO
Х-+П2
П-*х\
fj-t-xb
X
П-*ха
Код
63
12
11
68
65
12
63
22
11
13
4
63
12
64
14
11
65
13
4—
65
40
01
46
66
50
41
25
42
61
&L
12
6—
Адрес
65
66
67
68
69
70
71
72
73
74
75
76
77
78
79
80
81
82
83
84
85
86
87
88
89
90
91
92
93
94
95
96
Оператор
+
П~*-х2
—
Fx*
П-+х7
_|_
X-W7 7
КП-+Х&
FLO
56
П~*-х7
П-*-х5
2
—
•1-
х-*-Пd
П~*-х5
X
П-*х8
П-*-х5
X
П-*~хЗ
Fx*
—
х-*-П 1
П~*-х8
X
П-*-х5
_^-
Х-+П2
с/п
Код
10
62
11
22
67
10
47
F&
5F
56
67
65
02
11
13
4F
65
12
68
65
12
63
22
11
13
41
68
12
65
13
42
50
с/п. На индикаторе загорится цифра 1. Ввести yfixi с/п, на индикаторе загорится
2. Ввести вторую точку и т. д. После того как все точки введены, иа индикаторе
вновь загорится цифра 1. Повторить ввод всех точек. По окончании расчета в
ячейках памяти будут содержаться следующие значения:
ячейка значение d S2
А — а аА
В — Ь 1 _
4 — 2i/t
3 — 2*г 2 —
8 _ 2х*
9 — Ъх1У%
7 — (квадратич-
(квадратичный крите-
критерий рассо-
рассогласований)
Выписать все значения, так как оии пригодятся в дальнейшей обработке, и очи-
очистить все ячейки памяти и регистры стека. Перейти к программе 2, чтобы оце-
оценить статистическую значимвсть.
Ч
ч
491
Программа 2
Адрес
00
01
02
03
04
05
06
07
Оператор
Я->-*4
П-+хС
X
Х-+ПС
П-^хЬ
—
F*>0
10
Код
64
6[
12
11
6L
11
59
10
Адрес
08
09
'0
11
12
13
14
15
Оператор
1
с/п
П-+х\
П-^xd
X
x-+Tld
П-^ха
—
Код
01
50
64
6F
12
4F
6—
11
Адрес
16
17
18
19
20
21
Оператор
F*>0
20
2
с/п
П-+х9
с/п
Код
59
20
02
50
69
50
Ввести в ячейки памяти следующие значения:
значение
а
Ь
10ВП99ВП6В
ячейка
С
D
А
В
9
td («) -»• 4, где ta (т) — критерий Стьюдента; d — доверительная вероятность
(уровень значимости) для одиосторонней критической области; т—число экспе-
экспериментальных точек (т = i).
Нажать клавиши в/о, с/п. Если на индикаторе загорается 1, то Ь < Д6, сле-
следовательно, его необходимо отбросить. Если загорится 2, то а < Да. Если за-
загорится Е 000000, то оба коэффициента имеют статистическую значимость; Д6
находится в ячейке С, а — в ячейке D.
Для проведения дальнейших расчетов вновь очищают регистры памяти и
стека.
Программу 3 используют для регрессиоиного анализа.
Программа 3
Адрес
00
01
02
03
04
05
06
07
08
09
10
11
12
13
14
15
16
17
18
19
Оператор
1
*->-Яб
П-+Х6
с/п
П^-хЬ
X
П-*ха
+
Х-+П9
1
*-W75
Я-кс5
с/п
Я-кс9
—
Fx2
Я-кс8
+
х-* Я8
КП ^ х5
Код
01
46
66
50
6L
12
6—
Ю
49
01
45
65
50
69
11
22
68
10
48
F5
Адрес
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
Оператор
FLX
11
Я-кс5
1
—
*-W7l
КП+хб
FLO
02
Я-ке8
Я-** 6
1
-^
Я-кс1
1
4-
*->Я8
Я + х1
Код
ы
11
65
01
11
41
F6
5F
02
68
66
01
11
13
61
01
11
13
48
62
Адрес
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
Оператор
*-W72
1
—
Fx<0
51
Я-кс2
Fl/x
Х-+П2
П-^хС
x-^nd
П-^xd
П->-х2
—
F*>0
58
Я-кс4
с/п
Я-»*7
• с/п
Код
13
42
01
11
51
51
62
23
42
61
4F
6F
62
11
59
58
64
50
67
50
492
Ввести в регистры памяти следующие зиачеиия:
ячейка —
А —
В —
0 —
1 —
•j
4 —
2 —
? _
А —
значение
а
Ь
т
п
10ВП99ВП1
10ВП99ВП6
^(Р К /а)
F (В, L к).
где F — критерий Фишера — Сиедекора; Р — доверительная вероятность; ft=
= п — 2; /2 = т — 2; т. — число точек в эксперименте; п — число параллель-
параллельных ОТКЛИКОВ уц ОТ *;.
После ввода программы и всех значений нажать клавиши в/о, с/п. На инди-
индикаторе загорится 1, ввести *ь нажать клавишу с/п, на индикаторе загорится 2,
нвести у12, с/п и так далее до у1П; после ввода у1П, с/п, иа индикаторе загорит-
загорится 2, ввести х2, с/п, загорится 1, ввести уги с/п, 2—уг,%\, с/п и так далее по всем
циклам.
После ввода последнего значения программа выдает ответ. Если на индика-
индикаторе загорится Е 00 — значит уравнение неадекватно, если Е 000000 — адек-
адекватно. В регистре 8 хранятся значеиия Sy2. В регистре 2 — F экс. 1.
Таблица значений критерий Фишера — Снедекора есть в учебнике
В. Е. Гмурман «Руководство к решению задач по теории вероятностей и мате-
математической статистике» (с. 394, приложение 7).
Для дальнейших расчетов вновь проводится очистка регистров памяти и
стека.
Программа расчета «коридора ошибок»
Адрес Оператор | Код [ Адрес | Оператор | Код | Адрес | Оператор [ Код
45
25
46
6—
11
6L
13
65
11
22
10
11
12
13
14
15
16
17
18
00
01 FO Ж И *
02 *-»-Я6 46 12 Я-ксЗ
03 П-*х а
04 — II 14 х
05 Я-кс&
06 ч- 13 16 F^2
07
08
09
После ввода программы ввести следующие значения:
62
12
63
62
12
64
22
11
13
19
20
21
22
23
24
25
26
27
Fl/x
FY~
П-+х\
х
П^-хО
х
с/п
62
23
10
21
61
12
60
12
50
ячейка
А —
В —
0 —
j
2
3 —
4 —
значение
а
Ъ
q 1^C2™"
*ЗДД у Яп
г яд
у.
493
Ввести узкеп, В\, хэтп, в/о, с/п. На ин-
индикаторе появится значение Ау. Расчет
повторить по всем экспериментальным
точкам. По полученным результатам ст-
строятся две гиперболы, образующие «ко-
«коридор ошибок», т. е. у ± Ау.
Пояснение к программе МНК. Про-
Простейшее уравнение линейной зависимо-
зависимости у от фактора х:
у = а-\-Ьх.
Коэффициеиты регрессии можно вычис-
вычислить по формулам:
1—^1 xi
Рис. 61. Зависимость y=b(x)
ь=-
В этих выражениях коэффициеиты регрессии определяют иа основании измере-
измерений, проведенных в т экспериментальных точках (т > 2), т. е: по т уравнени-
уравнениям.
Дисперсия адекватности модели S| характеризует меру отклонения дан-
данных yi (рис. 61), рассчитанных по уравнению регрессии, от экспериментальных
результатов yt для t'-аст точки, в которой проведено измерение:
т—2
при числе степеней свободы f — т — 2
ч- 2
Доверительиые интервалы Ла и Л6:
Коэффициенты уравнения значимы, если выполняется условие а > Да и
Г> Л*.
494
Выборочная дисперсия S* определяется по формуле
т n
Zi Zi ууи—уО
где 1= 1,2,3, ..., т — число точек на линии регрессии; /= t, 2, 3 п — чис-
число параллельных измерений в каждой точке.
«Коридоры ошибок» строят на основании вычислений по формуле
Расчет свойств электролитов иа микро-ЭВМ ДВК-ЗМ2
(диалого-вычнслительиом комплексе)
В настоящее время для увеличения эффективности учебного процесса все ча-
чаще используют компьютерную технику. В частности, широкое применение на-
нашли микроЭВМ, с помощью которых можно осуществить диалог учащийся —
компьютер: иа дисплей выдаются вопросы, а клавиатура используется учащим-
учащимся для ввода ответов. В зависимости от полученного ответа программа, которую
выполняет компьютер, переключается иа одну из нескольких возможных аль-
альтернатив, обеспечивая подходящее реагирование на данный ответ и дальней-
дальнейшее продолжение диалога.
Диалог учащегося с компьютером получается предельно простым и лаконич-
лаконичным. На проведение диалога учащийся затрачивает минимум времени.
Учебный материал организован в виде последовательности проиумерован-
иЫх разделов (секций). Как правило, секции посвящена отработке определен-
определенного вопроса и начинается его сжатым изложением (текст), после чего следует
ряд упражнений и, если это необходимо, справочио-иллюстративный материал.
Учащийся в ходе диалога может использовать информацию с дисплея или полу-
получать распечатку даииых и результатов иа печатающем устройстве. Следователь-
Следовательно, с помощью компьютера можно управлять учебной деятельностью учащихся
и протоколировать процесс обучения.
Рассмотрим пример применения компьютера в учебном процессе для выпол-
выполнения расчетов по теме «Растворы электролитов» в диалоговом режиме.
Программа написана на языке QHASIC, предназначенном для миии- и микро-
ЭВМ в малых конфигурациях. Язык QUAS1C применяется иа ЭВМ, программно
совместимых с микроЭВМ «Электроиика-60», имеющих память 8—28К слов и
необязательно имеющих магнитные диски или ленты. Такие ЭВМ получили ши-
широкое распространение, а средства программирования для них недостаточно раз-
развиты. QUAS1C совмещает в себе преимущества языка низкого уровня —Ас-
—Ассемблера (большое быстродействие) и языка высокого уровня — БЭЙСИКА
(удобство программирования и диалоговый режим работы).
Все этапы разработки программы: редактирование текста, трансляция, вы-
выполнение и отладка осуществляются без обращений к внешним носителям ин-
информации. Система может использоваться автономно (иа машине без операцион-
операционной системы) или в рамках стандартной операционной системы (RT-11/SF)-
РАФОС или RSX -ИМ (ОСРВ).
Программа, приведеииаи ниже, составлена для микроЭВМ ДВК-ЗМ2 для
выполнения задания по теме «Растворы электролитов» в диалоговом режиме.
1. Постановка задачи. В работе рассматривают круг задач, которые отно-
относятся к разделу курса «Физическая химия» с названием «Растворы электролитов».
Выделено три типа задач: сильные электролиты; слабые электролиты; гидро-
гидролиз солей.
495
Задачи сформулированы следующим образом: а) раствор содержит КОН с
концентрацией с-1 моль/л и NajSO4 с концентрацией с-2 моль/л. Вычислите рН и
рОН раствора, коэффициент активности /, солесодержание этого раствора и оп-
определите влияние изменения концентрации электролитов на эти параметры;
б) раствор содержит NH4OH с концентрацией с-3 моль/л. Вычислите рН,
рОН и степень диссоциации раствора а, если константа диссоциации К* =
= 1,75- Ю-6;
в) раствор содержит соль CH3COONa с концентрацией с=4 моль/л. Вычис-
Вычислите рН, рОН и степень гидролиза, если константа диссоциации СН3СООН рав-
равна 4,5-10-'.
2. Формализация задачи, а) Растворы сильных электролитов диссоцииру-
диссоциируют иа ионы:
кон—>-к++он-
Na, SO4—+2 Na++SO|~
Для определения активности иона ОН- необходимо рассчитать ионную силу
раствора:
Ионная сила раствора связана с коэффициентом активности следующим соотно-
соотношением:
AZiZ, Л/Т
6=lR/a= 1— +0.1 /,
1 + V 1
где ги г% —заряды иоиов; А — коэффициент, равный 0,514; fa = 10е.
Определим активность ионов ОН—:
aOH~ ^=fa сон~-
Определим рОН и рН раствора:
р ОН=—lg aOH-t
pH=-lg A0-i«)-pOH=14—рОН.
Содержание солн раствора равно
+^, SO4 cNa2 SO4,
где М^оН = 39 + 16 + 1 = 56 — молекулярная масса гидроксида калия;
AfNaSO = 2-23+32 + 4-16 = 142 — молекулярная масса сульфата натрия,
б) Для раствора слабого электролита
Степень диссоциации равна
концентрация ионов ОН- в растворе составляет
496
Так как для слабых электролитов fa ж 1, то Oqh- ~ сон- = cnh Он а>
тогда
рОН=—lgaOH-; pH = 14 —pOH.
в) При гидролизе соли
CH3COONa+HOH^±CH3 COOH+Na+-f OH"
степень гидролиза определяется по уравнению
-ш /
— У
АД '"СНз COONa
Концентрация ионов ОН— в растворе равна
СОН~ — Р ССН3 COONa-
Так как степень гидролиза — малая величина, коэффициент активно-
активности fa з= 1 и
аОН~ ~ СОН~ = Р ССН3 COONa,
рН = - lgaH + ; pOH = - lgaOH_; рН = 14 - рОН.
3. Текст диалога. После запуска программы на выполнение на экране
дисплея появляется текст:
Начало работы программы «Растворы электролитов». Вы работаете с про-
программой вычисления рН и F в растворах сильных электролите», степени гидро-
гидролиза и рН в растворах солей.
А. Сильные электролиты.
Задание получить у преподавателя. Электролит 1 — щелочь нли кислота,
электролит 2 — соль.
Введите фамилию и номер группы. Введите исходные данные:
Молекулярная масса 1-го электролита, начальная концентрация 1-го элект-
электролита. Заряд катиона для 1-го электролита, заряд аниона для 1-го электролита,
число изменений концентрации для 1-го электролита.
Молекулярная масса 2-го электролита, начальная концентрация 2-го элект-
электролита, изменение концентрации 2-го электролита, заряд катиона 2-го элек-
электролита, заряд аниона для 2-го электролита, число изменений концентрации
для 2-го электролита.
Пользователь последовательно вводит требуемые данные через клавиа-
клавиатуру.
Затем система запрашивает пользователя:
Желаете лн повторить или исправить ввод?
Ответ пользователя ДА или НЕТ.
Если ответ ДА, то система возвращается к началу задания, если ответ НЕТ,
то производится расчет и печатающее устройство выдает следующую таблицу
результатов:
497
Таблица используемых данных и вычисленных результатов
Математическая
величина
М он
^Na,SO4
г1
"г
ci
С2
сз
Дсх
Лс3
Дг,
#Д1
/V
рОН сильного
электролита
рН сильного
электролита
La
СС
а
рН слабой кис-
кислоты
рОН слабой
кислоты
Р
рОН соли
рН соли
Имя
МС1
МС2
гК1
гА1
гК2
гА2
cl
с2
сЗ
с4
ДС1
ДС2
дез
ДС4
Д1
Д2
/V
М
Р1
Р2
F
f
СС
SIR
РД1
РД2
STG
PQ1
PQ2
Струк-
Структура
Пере-
Переменная
То же
»
»
»
ФпзмческпА смысл
Нолекуляриаяя масса
кон
Молекуляриая масса
Na2SO4
Заряд катиона +К
Заряд аииоиа ОН~
Заряд катиона Na+
Заряд аииоиа SO}~
Концентрация КОН
Концентрация Na2SO4
Концентрация NH4OH
Концентрация NaHCOs
Изменение коицеитрации
Изменение концентрации
Na2SO4
Изменение концентрации
NH4OH
Изменение коицеитрации
ЫаНСОз
Константа диссоциации
NH4OH
Константа диссоциации
CHsCOONa
Количество молей С1
Количество молей С2
Характеристика среды в
растворе
То же
Коэффициент активиости
иона
Солесодержаиие в раст-
ЙППР
Степень диссоциации
КИСЛОТЫ
Характеристика среды в
растворе
То же
Степень гидролиза
Характеристика среды в
растворе
То же
Начальное
56
142
1
1
1
2
СЮ
С20
СЗО
С40
1,75- Ю-5
4,5- Ю-7
Примечание
Исходные
данные
начальных
значений
задаются
путем
ввода
Петров И. И. Н-22
Молекулярная масса 1-го электролита 56.000
Начальная концентрация 1-го Электролита 0.005
Изменение концентрации для 1-го электролита 0.005
Заряд катиона для 1-го электролита 1
Заряд аииоиа для 1-го электролита 1
Число изменений концентрации для 1-го электролита 5
Молекулярная масса 2-го электролита 142.000
498
Начальная конецнтрация 2-го электролита 0.000
Изменение концентрации для 2-го электролита 0.050
Заряд катиона для 2-го электролита 1
Заряд аниона для 2-го электролита 2
Число изменений концентрации для 2-го электролита 4
Концентра-
Концентрация 1-го
электроли-
электролита, моль/л
0,005
0,005
0,005
0,005
0,010
0,010
0,010
0,010
0,015
0,015
0,015
0,015
0,020
0,020
0,020
0,020
0,025
0,025
0,025
0,025
Концентра-
Концентрация 2-го
электроли-
электролита, моль/л
0,000
0,050
0,100
0,150
0,000
0,050
0,100
0,150
0,000
0,050
0,100
0,150
0,000
0,050
0,100
0,150
0,000
0,050
0,100
0,150
рОН сильно-
сильного электро-
электролита
2,334
2,424
2,448
2,459
2,046
2,125
2,148
2,158
1,878
,950
,972
,983
,761
,826
,848
,858
,670
,731
1,751
,761
рН сильного
электролита
11,666
11,576
11,552
11,541
11,954
11,875
11,852
11,842
12,122
12,050
12,028
12,017
12,239
12,174
12,152
12,142
12,330
12,269
12,249
12,239
Коэффици-
Коэффициент активно-
активности иоиа
0,926
0,753
0,713 .
0,695
0,900
0,751
0,712
0,695
0,882
0,748
0,711
0,694
0,868
0,746
0,710
0,694
0,856
0,744
0,709
0,693
Солесодер-
жаиие
в растворе,
г/л
0,280
7,380
14,480
21,580
0,560
7,660
14,760
21,860
0,840
7,940
15,040
22,140
1,120
8,220
15,320
22,420
1,400
8,500
15,600
22,700
Далее на экране дисплея появляется текст:
Переходим к разделу слабые электролиты. Имеем раствор электролита 3.
Задание получить у преподавателя. Введите исходные даииые: Начальная кон-
концентрация 3-го электролита, изменение концентрации для 3-го электролита,
константа диссоциации для 3-го электролита.
После введения требуемых данных система запрашивает пользователя:
Желаете ли повторить или исправить ввод?
Если пользователь отвечает ДА, система возвращается к началу задания по
разделу «Слабые электролиты». Если ответ НЕТ, то ЭВМ переходит в режим сче-
счета и по окончании счета печатающее устройство выдает следующую таблицу резу-
результатов:
Начальная концентрация 3-го электролита 0,050
Изменение концентрации для Зто электролита 0,010
Константа диссоциации для 3-го электролита 0,18Е-04
Концентрация сла-
слабого электролита
0,0500
0,0600
0,0700
0,0800
0,0900
Степень
диссоциации
0,0190
0,0173
0,0160
0,0150
0,0141
рН слабой
кислоты
3,0229
2,9833
2,9498
2,9208
2,8952
рОН слабой
кислоты
10,9771
11,0167
11,0502
11,0792
11,1048
499
Затем на экране появляется текст:
Переходим к разделу «Гидролиз солей». Имеем раствор электролнта 4. Зада-
Задание получить у преподавателя. Введите исходные данные. Начальная концент-
концентрация 4-го электролнта, изменение концентрацнн для 4-го электролнта, кои-
станта, диссоциации для 4-го электролнта, число изменений концентрацнн
для 4-го электролнта.
После ввода исходных данных система запрашивает пользователя:
Желаете ли повторить или исправить ввод?
Если пользователь отвечает ДА, то система возвращается к началу раздела
«Гидролиз солей», если ответ НЕТ, то производится счет и, по его Окончании
печатающее устройство выдает следующую таблицу:
Начальная концентрация 4-го электролита 0.050
Изменение концентрации для 4-го электролита 0.0500
Константа диссоциации для 4-го электролита 0.45Е-06
Число изменений концентрации для 4-го электролита 10
Концентрация соли
0,050
0,100
0,150
0,200
0,250
0,300
0,350
0,400
0,450
0,500
Степень гидролиза
0,000667
0,000471
0,000385
0,000333
0,000298
0,000272
0,000252
0,000236
0,000222
0,000211
раствора
рОН
4,477
4,327
4,239
4,176
4,128
4,088
4,055
4,026
4,000
3,977
ОН
раствора
9,523
9,673
9,76!
9,824
9,872
9,912
9,945
9,974
10,009
10,023
После этого система возвращается к началу первого раздела «Сильные
электролиты» и готова к работе со следующим пользователем.
4. Структурная схема алгоритма расчета к заданию по теме
«Растворы электролитов»
/Ввод: МС1.МС2, ZKl, ZAI.ZK2, ZA2, М, N, С10, /
С20,С30,С40, ДС1,ДС2,ДСЗ,ДС4, Д1, Д2 /
/= 1
С1 =С10
3.
4.
5.
6.
7.
8.
9.
10.
/ = I
С2 = С20
/ = 0,5 * (C1*ZK12 +C1 *ZA12 +C2 *ZK22 +C2*ZA2n
G= lg/ = 0,1 * /-0^14 * ZK1 * ZA1 * /7/A + VT)
F= IO**G
CV = F^C1
PI = -lgcU
P2= 14- PI
CC = MCI • Cl + MC2 • C2
Вывод: С I, C2, P1,P2, F, CC
50!
и.
12.
13.
14.
15.
Вывод: С3,а, РД1.РД2 /
Р = т/Д3/(Д2*С4)
PCl = -lg(p*C4)
PG2= 14-PCI
/ Вывод: С4, р, PG1.PC2 /
502
10 BYTT RQD:1775ee\HOD=16B\INT XXXF) ,NAHEB0)\OPXN 5 "LF"
20 RIAL MC1,MC2,C10,C20,C30,C4,D10,DC1.DC2,DC3,DC4
30 RIAL Cl,C2,C3,Q,H,e,F,CU,Pl,P2,CC,Xl.X2,Dl,n2,D3
40 RIAL STD,CD,PDl,PD2,C40.STG,CG,Pai,Fa2
100 POT ////, "РАСЧЕТ RH РАСТВОРОВ ЭЛЕКТРОЛИТОВ ",//.'
110 POT" А СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ
120 POT" ЗАДАНИЕ ПОЛУЧИТЬ У ПРЕПОДОВЙТЕЛЯ
130 РОТ" ЭЛ1КТРОЛИТ 1 ЩВ-ТСЧЬ ИЛИ КИСЛОТА
140 РОТ" ЭЛЕКТРОЛИТ 2 СОЛЬ "
150 РОТ -L '• ИСХОДНЫЕ ДАННЫЕ: КСЛЕКУЛЯРНЙЯ МАССА ЭЛЕКТРОЛИТА, -
180 РОТ" НАЧАЛЬНАЯ КОНЦЕНТРАЦИЯ,"
170 РОТ" ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ, ЭАРЯД КАТИОНА, ЗАРЯД АНИОНА.'
180 РОТ" ЧИСЛО ИЗМЕНЕНИЙ КОНЦЕНТРАЦИЙ ЭЛЕКТРОЛИТА 1 И 2 ".///
190 РОТ" ВВЕДИТЕ ФАМИЛИЮ И НОМЕР ГРУППЫ "\ GET NAKKA:BU
200 i=i\*moDM\aET Mci
210 WWODCMJET C10
220 WWODD\(JET DC1
230 WWODKMJET ZK1
240 VfWODA\OET ZA1
250 ИЖЛЖЧОЕТ N
320 POT\I=2\*mODM\GET MC2
330 WWODCMJET C20
340 ИМОЮЧОЕТ DC2
3S0 WWODK\(JET ZK2
360 HWODAVOET ZA2
370 VfWODHXOKT M
400 POT -L" ЖЕЛАЕТЕ ЛИ ПОВТОРИТЬ ИЛИ ИСПРАВИТЬ ВВОД"
410 DANET\IF PR=1 THEN OoTO 2004ENBI
500 РОТ 5/,HAHIrA:SU
510 I = 1\WYWM\POT 5 MC1:F7.3
520 WYWC\PUT 5'С10:Гв.З
530 WYTO\PUT 5 DCl:Fe.3
S40 WYWK\PUT 5 2K1:I2
550 WYWA\POT 5 ZA1:12
660 КУУНЧРОТ 5 N:I2,//
570 I=2\WYVM\POT 5 MC2:F7.3
560 WYWC\PUT 5 C20:F6.3
590 WYTO4PUT 5 DC2-.F6.3
600 Vm«K\POT 5 ZK2:I2
610 WYWA\P0T 5 2A2:I2
620 WYWI\POT 5 M:I2
890 PUT 5 //
900 IL=73\LIHE
930 POT -L 5 ":КОНЦЕНТРА-; КОНЦЕНТРА-: РОН СИЛЬНО-: РН СИЛЬНОГО:"
Я40 РОТ 5 ' КОЭФФИЦИЕНТ: СОЛЕСОДЕР-:"
850 РОТ -L 5 ":ЦИЯ 1 ЭЛ-ТА:ЦИЯ 2 ЭЛ-ТА: ГО ЭЛ-ТА: ЭЛ-ТА :л
503
960 PUT 5 - АКТИЙЮСТИ: ХАН. В Р-РЕ:"
97Й PUT -L 5 •:МОЛЬ/Л : МОЛЪ/Л :
98И PUT 5 - ИОНА : Г/Л :"
990 LINE
1000 С1=С10
1010 FOR J=l TO N
1020 С2=С20
1030 FOR 1=1 ТО М
1040 Q=0.5*(C1*ZK1*ZK1+C1*ZA1*ZA1+C2*ZK2*ZK2+C2*ZA2*ZA2)
1060 H=SQRT(Q)
1070 G=-0.514*ZK1*ZA1*H/A+H)+0.1*Q
1030 F=EXP (Q*LOG A0.0))
1090 CU=C1*F
1100 Pl=-(LOG(CU))/LOQA0.e)
1110 P2=14-P1
1120 CC=MC1*C1+MC2*C2
1130 PUT -L 5":".C1:F11.3.":-, C2 : Fll. 3 , " : " , Fl tFll. 3 , " : " ,P2:m . 3 ,
1140 PUT 5 F:F11.3,":", CCtFl1.3,":".
1150 C2=C2+DC2
1160 ENDF\LINE\C1=C1+DC1
1170 ENDF
1200 PUT 5 ///
1210 VEL
1230 IF PR=0 THEN GOTO 100\ENDI
1240 PUT /," ПЕРЕХОДИМ К РАЗДЕЛУ СЛАБЫЕ ЭЛЕКТРОЛИТЫ "
1250 PUT -L1J ИМЕЕМ РАСТВОР ЭЛЕКТРОЛИТА 3. ЗАДАНИЕ ПОЛУЧИТЬ У "
1260 PUT - ПРЕПОДАВАТЕЛЯ."
1270 PUT -L" ИСХОДНЫЕ ДАННЫЕ: КОНЦЕНТРАЦИЯ ЭЛЕКТРОЛИТА, ИЗМЕНЕНИЕ "
1260 PUT1 КОНЦЕНТРАЦИИ."
1280 PUT-КОНСТАНТА ДИССОЦИАЦИИ, ЧИСЛО ИЗМЕНЕНИЯ КОНЦЕНТРАЦИИ
1300 PUT /," ЗАПИШИТЕ УРАВНЕНИЕ ДИССОЦИАЦИИ ЭЛЕКТРОЛИТА",/
1310 i=3\wwoDC\aKT сз0
1320 WWODDMJET DC3
1330 PUT -L-ВВЕДИТЕ КОНСТАНТУ ДИССОЦИАЦИИ"\GET Dl
1340 PUT -L-ЖЕЛАЕТЕ ЛИ ПОВТОРИТЬ ИЛИ ИСПРАВИТЬ ВВОД1 \ DANET
13S0 IF PR=1 THEN GOTO 13104ENDI
1360 WWC\PUT 5 C30:F6.3
1370 . WYTO\PUT 5 DC3:F6.3
1360 WYWCD\PUT 5 D1:K6.2
1390 PUT 5\IL=60\LINE
1400 PUT -L 5": КОНЦЕНТРАЦИЯ : СТЕПЕНЬ : РОН СЛАБОЙ :"
1410 PUT 5" РН СЛАБОЙ:"
1420 PUT -L 5":СЛАБОГО : ДИССОЦИАЦИЯ : КИСЛОТЫ :*
1430 PUT 5" КИСЛОТЫ :"
1440 PUT -L 5-.-ЭЛЕКТРОЛИТА:
1450 PUT 5"
1460 LINE
504
1Б00 C3=C30\FOR L=l TON
151И STD=SQRT(D1/C3)
1520 CD=STD*C3
1530 FD1=-(LOG(CD))/LOGA0.0))
1540 FD2=14-FD1
1550 POT e":".CS:FlS.4.":".3TD:F14.4.":".FDl:F14.4,":".FD2:F14.4>":*
1560 C3=C3+DC3
1S70 ENDF
1560 LIME4FUT 5
1600 VEL\IF PR=0 THIN GOTO 1004ENDI
1610 PUT" ПЕРЕХОДИМ К РАЗДЕЛУ ГИДРОЛИЗ СОЛЕЯ"
1620 PUT" ИМЕЕМ РАСТВОР ЭЛЕКТРОЛИТА 4. ИСХОДНЫЕ ДАННЫЕ:'
1630 PUT1' КОНЦЕНТРАЦИЯ СОЛИ,ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ СОЛИ, "
1640 PUT" СТЕПЕНЬ ДИССОЦИАЦИИ,
1650 РОТ" ЧИСЛО ИЗМЕНЕНИЯ КОНЦЕНТРАЦИЯ."
1660 РОТ/,"ЗАПИШИТЕ УРАВНЕНИЕ ГИДРОЛИЗА ПО 1-Я СТУПЕНИ "./
1670 I=4\WWODC\aKT C40
1660 WWODD\QET DC4
1680 WWODKDVJET D2
1700 WWODNVQET N
1702 POT -L "ЖЕЛАЕТЕ ЛИ ПОВТОРИТЬ НЛИ ИСПРАВИТЬ BBoAADANIT
1704 IF FR=1 THEN GOTO 16704ENDI
1710 WYWC4P0T 5 C40:F6.3
1720 WYTO\PUT 5 DC4.-F6.4
1730 WYWKP\POT 5 D2.-E6.2
1740 VfYWI\POT 5 N:12
1750 IL=60\LINE
1760 PUT -L 5":КОНЦЕНТРАЦИЯ : СТЕПЕНЬ : РОН РАСТВОРА :*
1770 PUT 5" РН РАСТВОРА:"
1760 РОТ -L 5":СОЛН : ГИДРОЛИЗА
1780 РОТ 5" :"\LINE
1600 C4=C40\FOR L=l TO N
1610 STQ=SeBT(lE-14/(D2*C4))
1620 CG=STG*C4
1630 PG1=-(LOG(CG))/(LOGA0.0))
1640 PG2=14-PG1 f
1850 POT 5":",C4:F13.3,"t',STQ:F14.6,": ",PQl:F14.3,":",Pa2:FU.3,*:*
1660 C4-C4+DC4
1870 ENDF
1660 LINE
1680 PUT 5 ////
1800 PUT ////\aOTO 100
8888 STOP
10000 FROG DANET
10010 PUT -Ь'ЧДА ИЛИ HETJ'AOET XXX-A:NN\XXX@) =XXX@).BIC177600B
10020 IF XXX@J = 144B THEN FR:1\HITURN\ENDI
10030 IF XXX@1=156B THEN PR=0\HITURN\ENDI
10040 PUT'0ШИБКАЛ0ОТ0 100104ENDF
505
11000 PHOC WWODM
11010 PUT -L"ВВЕДИТЕ МОЛЕКУЛЯРНУЮ МАССУ",I:II,"-ГО ЭЛЕКТРОЛИТА"
11020 ENDP
11100 PROG WWODC
11110 PUT -[/"ВВЕДИТЕ НАЧАЛЬНУЮ КОНЦЕНТРАЦИЮ1 , I." II."-ГО ЭЛЕКТРОЛИТА"
11120 ENDP
11200 PROG WWODD
11210 PUT -[/'ВВЕДИТЕ ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ДЛЯ", I: II,"
11220 PUT -L'-ГО ЭЛЕКТРОЛИТА" \ENDF
11300 PROQ WWODK
11310 PUT -L-ВВЕДИТЕ ЗАРЯД КАТИОНА ДЛЯ",I:II,"-ГО ЭЛЕКТРОЛИТА"
11320 ENDP
11400 PROG WWODA
11410 PUT -L"ВВЕДИТЕ ЗАРЯД АНИОНА ДЛЯ",I:II."-ГО ЭЛЕКТРОЛИТА"
11420 ENDP
11500 PROG WYVM
11510 PUT -L 5"ИОЛЕКУЛЯРНАЯ HACCA" , I." II, "-ГО ЭЛМТРОЛИТЙАЮЮГ
11800 PROG WYWC
11610 PUT -L.5"НАЧАЛЬНАЯ КОНЦЕНТРАЦИЯ,I:II,"-ГО ЭЛЕКТРОЛИТА"\ENDP
11700 PROG WYWK
11710 PUT -L 5"ЗАРЯД КАТИОНА ДЛЯ" , I: II, "-ГО ЭЛЕКТРОЛИТАЛЮОР
11800 PROG WYWA
11810 PUT -L 5"ЗАРЯД АНИОНА ДЛЯ ", I: II, "-ГО ЭЛЕКТРОЛИТА"\ENDP
11800 PROG WYWD
11810 PUT -L 5" ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ДЛЯ",I:II,"-ГО ЭЛЕКТРОЛИТА"
11820 ENDP
12000 PROG WWODN
12010 PUT -L " ВВЕДИТЕ ЧИСЛО ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ДЛЯ ", I." 12
12020 PUT -L'-ГО 9AEKTPOAHTA"\ENDP
12100 PROG WYWI
12110 PUT -L " ЧИСЛО ИЗМЕНЕНИа КОНЦЕНТРАЦИИ ДЛЯ",I:I2
12120 PUT -L-'-ГО ЭЛЕКТРОЛИТ А "\ENDP
12200 PROG LINE
12210 FOH 11=1 TO IIAPUT -L 5 ""-" \ ENDF\PUT 5\ENDP
12300 FROC VEL
12310 PUT" ЖЕЛАЕТЕ ЛИ ПРОДОЛЖИТЬ РАБОТУ С РАЗДЕЛОМ ДЛЯ ПОЛУЧЕНИЯ"
12320 PUT rL" НОВЫХ ДАННЫХ ? ADANETNENDF
12400 PROG WWODKD
12410 PUT -L" ВВЕДИТЕ КОНСТАНТУ ДИССОЦИАЦИИ ДЛЯ",I: 12
12420 PUT -Ь"-ГО ЭЛЕКТРОЛИТА"\ENDF
12500 FROG WYWKO
12510 PUT -L б "КОНСТАНТА ДИССОЦИАЦИИ ДЛЯ" , I." 12 ."-ГО ЭЛЕКТРОЛИТА'
12520 ENDP
506
ОТВЕТЫ НА ЗАДАЧИ
ГлАва
1. О2
of,)»
О2+
(°J»)*
8 ("груI: .и = 2.5; Of (ou)«
Jjm = 1,5. 2. 1, не обладает.
4. 2. 5. (а1,J(а1,.J(а28)г(а'5)г;«=0; re=oo, 8=0. 6. 2. 7. СО+, ВО и CN;
(<*isJ (°isJ (<*2вJ (аа«)? ("зри) (Л2рг)а (я^ряI; «=2,5;2 2. 8. BN, ВО. СО.
ГлАва И
1. Лииейиая Dcah (E, С^, „С?, „a^, an, i). 2. Плоский треугольник,
Dfh. (Е, С,, ЗС2, Зар, а„). 3. Тригональная пирамида, C3V (?, С3, За„)"
4. Тригоиальная бипирамида, С3(, (?, С3, За(,). 5. Квадратная пирамида, Civ
(С4, С2, aD, а). 6. 2. 7. 6. 8. S (Cn) x=x cos-^IL
= —«sin
2«
; S(Cn)z = z.
ГлАва 111
1. 4,265-10-*' кг-м2.
2.
/
0
1
2
3
е-
10". Дж
0
2,607
7,822
15 643
1312,
2625,
3937,
5250,
1
1
7
3
/
4
5
5
6
е-10", Дж
26,072
39,108
39,108
54,751
V, М ]
6562,
7875,
7875,
9188,
8
4
4
0
/
8
9
10
.....
93
117
143
. Дж
,858
,323
,395
V, М ]
11813
13125
14438
,1
,7
,3
3. 79.
507
4,
/
0
1
2
3
Кг | '
0
8,387
25,161
50,322
4
5
6
Г. К
5.
/
СО Ю-О
юстЮ»2, Дж
V, м-1
4222,4
8444,9
12667,3
16889,7
Дж
83,870
125,805
176,127
300
62,12
/
4
5
6
500
108,54
V , М 1
21112,2
25334,6
29557,0
/
7
8
9
В Дж
234,836
301,932
377,415
1000
207,10
/
7
8
9
7, и'1
33779,5
38001,9
42224,0
в.
0
1
2
3
N./N.
1
2,4384
2,7240
2,0768
<
4
5
6
Nj/N. I j
1,1877
0,5275
0,1849
7
8
9
Nj/N.
0,0517
0,0116
0,0021
7.
/
0
1
2
3
Nj-10-"
0,5902
1,4391
1,6077
1,2257
/
4
5
5
лу ю-"
0,7010
0,3113
0,1091
/
7
8
9
ЛГ,-10~"
0,0305
0,0068
0,0012
508
9. 14,652-Ю-4' кгма; 1,1344.10-" м. 10. 352,96- 10~аа Дж. II. 0.2787Х
X Ю-и м. 12. 43,580-10» м~1.
Глава IV
1. 1,540-Ю-10 м. 2. 18,80-Ю-4'кг-м2; 297,7 м. 3. 107, 155. Ю» (кг-ма)«.
4. 3,093-Ю-134 (кг-м3K. 5. 0,9433-10-10м; 106°29', 7. /А=/в=6,237-10~4'кг-м2;
7,111-Ю-41. Симметричный волчок сплющенный.
8.
/
0
1
1
2
k
0
0
1
0
е-10", Дж
С
1,782
1,671
5,346
/
2
2
3
k
1
2
0
е.Ю", Дж
5,235
4,902
10,692
/
3
3
3
k
1
2
3
е-10". Дж
10,581
10,248
9,694
9. 39,16, 10. /А= /в= 147,317. Ю-4' кг-м2; /с = 294,634-10-4' кгм»;
6,394-Ю-136 (кг-м2)*,
Глава V
1. 9,597. Ю-14 Н/м, 2. 3,0004-106 м~1. 3. 0,0060. 4. е„ = 2,148-10-и Дж;
ех = 6,406- 10s2 Дж. 5. 22; 4,0677-10-** Дж; «w^ = 94, 154-10-*» Дж, Ех.сь -
= 542,54-10» Дж/моль, в. 5,9-10-6; 5,334-10-». 7. 0,359; 0,736.
8.
ь
0
5
10
20
е-10", Еж
3,744
35,995
58,796
76,098
(г-ге)-10". м
0,6368
0,4714
0,4160
0,3839
0^706
1,3411
1.8288
4,5689
9. 3915,93; 3837,71; 3831,49 см-1. 10. 4000,37, 4042,59, 4084,81 см-1.
11.
/
0
1
2
3
4
NJ/NA
0,051
0,137
0,186
0,191
0,163
/
5
6
7
8
NJ/NA
0,119
0,076
0,042
0,021
/
9
10
11
12
0,009
0,004
0,002
0,0003
509
12.
/
0
1
2
3
4
V, СМ 1
2906,01 '
2926,00
2945,27
2963,82
2981,65
/
5
6
7
8
v", см 1
2998,76
3015,15
3030,82
3045,77
/
9
10
11
12
~, см
3060,00
3075,51
3086,30
3098,37
13. 5,:59510-47 кгм2; 1,079- Wm. 14. 4; 6; 9. 15. vas = 870; vs = 447;
б = 240 см-1. 16,"vas = 403 C); 6as = 129 C); 6S = 104 см-1 B).
Глава VI
1. 15,52-103 Дж. 2. 2085,4 кДж/кг. 3 3,24-105 Па; 1670,2 Дж. 4. 18,7498
кДж; 5. 359, 637 К; — 400,37 Дж; 400,34 Дж; 1,335 кДж. 6. N2. 7. Аг; 1389,19
К;Н2-748,42К; НгО — 637,11 К. 8.205,51.9. а) 273 К; 0,505-105 Па; 1573,3
кДж; б) 172 К; 0,636-105 Па; 1259,9 кДж; а) 273 К; 0,505-105 Па; 0. 10. 98Х
Х10" Дж. 11. 1.0212-10е Дж. 12. 5,9547 10е Дж. 13. (//,%8#5 — Н^в =
= 14,375 кДж/моль; (Я?8, э— Я§)ж = 28,426 кДж/моль. 14. А = 0,0018095
Дж/(моль-К4), (Н°э I4 _Я§)=23,8 Дж/моль; (Я?82 ь—На0) = 14,356 кДж/
/моль. 15. а) — 3,716 кДж; 6H; в) — 5,596 кДж;' г) — 8,921 кДж. 16.
д//0208 = —214,78 кДж Д?/м8 = —209,82 кДж. 17. ДЯ°„8 =214,87 кДж;
А1/2»8 = — 209, 82 кДж. 18. ДЯ°/ 2>8 = — 74,88 кДж; MJf 2в8= —72,40 кДж.
19. —854,28 кДж. 20. — 1070,07'кДж. 21. — 125,07 кДж.'22. а) 83,01 кДж;
б) —451,68 кДж, в) — 826,84 кДж; г)ч34,70 кДж. 23. а) 10,49 кДж; б)
— 493,14 кДж; в) —562,50 кДж; г) —631, 21 кДж; д) — 64,85кДж; 24.
а) —5156,78 кДж/моль;б) —5149,14 кДж/моль. 25. —5061,06 кДж. 26.— 231,18
кДж. 27. —6.98 кДж. 29. — 12,40 кДж/моль; 14,70%. 30. —55,938 кДж/моль.
31.-524,90 кДж/моль. 32.-2884,0 кДж/моль. 33.-89,76 кДж. 34.
—643,06 кДж. 35. ДЯ? = —237,644-103—13,01 Г+2,883- 10-3Г— A,713- 10»)/5;
— 246, 421 кДж; от 298 до 2500 К. Зв. ДЯ? = 131,99.103 + 8.54Г — 3,81х
10-3^2 _ (8,502-106)/Г; 135,87 кДж. 37. 1,962 кДж/моль. 38. 36,70 кДж/моль.
39 — 694,91 кДж//моль. 40. —78,87 кДж. 41. —298,26 кДж. 42. — 60,826 кДж.
43. ОД = 2,08+269,27-10~3 Т — 36,61 • 10-вГ2. 47. ДГ = — 0,732°. 48. ДГ =
= — 1,348. 49. 32 % Н2О. 50. Q = — 15447.3 Дж/моль. 51, 226,65 Дж/моль.
№ ва-
варианта
1
2
3
4
5
6
ля»
Ale'
кДж/ноль
—128,04
—202,42
175,97
1531,22
1166,18
114,14
Миоговариаитиая :
ДУ» 8,
? а о »
кДж/моль
—120,01
—194,99
171,01
1518,87
1153,79
111,66
№ ва-
варианта
7
8
9
10
11
12
ЛЯ2»8.
кДж/ моль
57,27
81,36
178,23
108,22
274,76
260,06
1адача № 1
ЛС/2В8,
кДж/моль
54,79
78,88
175,75
105,74
267,33
266,58
№ ва-
варианта
13
14
15
16
17
18
ЛЯ2»8.
кДж/моль
— 197,9
—66,27
—260,15
—269,06
—108,97
—2,85
лс/а»8.
кДж/моль
— 195,42
-63,79
—242,72
—266,58
—106,49
—0,37
510
Главв VII
1. - 167,6 Дж. 2. - 125,7 Дж. 3. 2005,5; 1752,0; 1519,8; -1752,0 Дж
4. 3242,46; 4539, 40 Дж/К. б. 62369,9 Дж/К. в. 5628 Дж/К. 7. 2,44 Дж/(мольХ
ХК). 8,-15,16 Дж/(моль-К). 9, Г5.340. 10. 9,0-10~2 Дж/(моль-К). П.
15,341 Дж/моль. 12. 11525,65 Дж/моль. 13. 12,1 Дж/кмоль; — 12,1 Дж/кмоль;
0. 14. 142 Дж/(моль-К). 15. 3,52 Дж/(моль-К). 1в. 302 Дж/(моль-К). 17. 1,2
Дж/(моль-К). 18, 1) AS= — 32,56 Дж/(моль-К); 2) S=61,55 Дж/(моль-К);
3) AS =317,10 Дж/(моль-К). 19. AS = —103,182. 20. 1) —54,96 Дж/
(моль-К); 2) 175, 7 Дж/(моль-К); 3)— 187, 8 Дж/(моль-К); 4)—17, 49 Дж/
/(моль-К). 21. 103,8 Дж/(мольК). 22. ASP = 93,769 Дж/моль; ASV =
= 100, 3 Дж/моль. 23. 246,6 Дж/(моль-К). 24. 56,87 Дж/(моль-К). 2в. Изо-
2V — пЬ
термическое расширение ASt = nR In — —; изохорическое охлаждение
V по
^ 1,) 2* Ш6>7 Дж/моль' 29>
1) 307, 46 Дж/моль; 2) 0; 3) 275,5. 30, - 619,72 Дж; 5875,38 Дж; 6495,1 Дж.
31. АО, = 0; А02 = — 328,02 Дж/моль. 32. АО = = — 108 Дж/моль; ДЯ=
= — 5840 Дж/моль; AS = — 21,3 Дж/(моль- К). 33. 107,28 Дж/(мольК).
34. W= -4454,66 Дж; AU = 0; ДЯ = 0; AS = = - 5,76 Дж/(моль-К);
АО = 4454,66 Дж/моль; АА = 4454,66 Дж/моль. 35. W = 5229, 29 Дж;
\U = 0; АН = 0; АО = — 5229,29 Дж/моль; AS = = 19,14 Дж/(мольК);
АА = —5229,29 Дж/моль. Зв. a) AS = 3,27 Дж/моль; АЯ = 5700 Дж/моль;
AG = 4724 Дж/моль; б) графит; в) да, при давлении не менее чем 2500 атм.
37. АС = — 535,3 кДж/моль; АЯ°=631 кДж/моль; AS» = 14,23 Дж/(мольК).
38. д? - -21 755+0,74 In T — 7.5Г - 7- Ю Я. 39, АЯ° = -
— 139,18 кДж/моль; АЯ = AU; AS = -50,37 Дж/моль; АО0 = АА° =
= — 124,1 кДж/моль; АСр = 42,27 Дж. 40. 1) 890,31 кДж/моль; 2)
393,51 кДж/моль; 3) 571,66 кДж/моль; 4) 105, 358; 5) 55, 168 кДж/моль.
41. 1) AG«= 443,899 кДж/моль; 2) АО" = —24,366 кДж/моль; 3) Д0°=
= 57 650 Дж/моль. 42. AU = — 469 Дж/моль. 43. Да; —5,06 кДж/моль; — 7,49
кДж/моль. 44. Да. — 521,064 кДж. 45. А0%0 = — 60,7 кДж/моль; да, будет.
46. AS!j9g = 96,588 Дж/(моль-К). 47. AS§98 = 80,2 Дж//(моль-К).
Глава VIII
1. 2,4993-107. 2. 1,1733-10». 3. 1,0117. 4. 2.5. 5,9335• 108, в. 1,2025-1010.
7. 5,5216-1011. 8. 6,5424-10». 9. 1,4086-108. 10. 220,4288. 11. 2,1926. 12. 1. 13.
680,7935-108. 14. 2,5857-10". 15. 12,4715 кДж/моль. 1в. 8,3143 кДж/моль. 17.
2,173 кДж/моль. 18. (L/Ioeo - {/„) = 22,959 кДж/моль; (Я1%00 - Hi) = 31,273
кДж/моль; (Я»вв0—Я2,,) = 22,591 кДж/моль. 20. С° 298 = 29,3368 Дж/(моль X
X К); Су> 1000 = 34,6000 Дж/(моль-К). 21. 7,5534 кДж/моль; 10,0311 кДж/
моль. 22.'8,1233 КДж/моль; 10,6010 кДж/моль. 23. 12,4715 Дж/(моль-К)
24. 12,4715 Дж/(мольК). 25. 38, 819 Дж/(моль-К). 2в. 72,076 Дж/(моль-К)
27.35,639 Дж/(моль-К). 28. Cj, — 60,356+97,754-10-3 Т — 54,09- 10-в Г2.
29. 40,524 Дж/(моль-К). 30, 53,909 Дж/(моль-К). 31. 1260. 32. 999,6.
33. 1,0135-10* Па. 35. СОа молекула линейная, SOa молекула нелинейная.
Зв, Cv= 12,4715 Дж/(моль-К); ({/ам — Ut) = 3,7166 кДж/моль; S»ee =
= 163,962 Дж/(моль-К). 37. 48,1261 Дж/(моль-К).
38. Г, К 298 1000 3000
5кол • - - ' . • 0,0014 1,572 8,363
Зв. 210,884 Дж/(моль-К). 40, — 192,1023 Дж/(мольК). 41. — 157,1403 Дж/
/(моль К); —4,683 кДж/моль. 43. 188, 721 Дж/(моль-К). 44. 219,4. 45. 0,0108.
511
46.
'
0
1
2
3
4
5
0,05119
0,13862
0,18826
0,19386
0,16550
0,12124
i
6
7
8
9
10
NJ/NA
0,07752
0,04369
0,02183 -
0,00971
0,00385
11
12
13
14
15
0,00137
0,00044
0,00012
0,00003
0,00000
4 7. 1260.
5.
Глава IX
1. 0,288 л. 2. 78, С„//„. 3.0,465 кг; 8,3 кг/м3; 0,0179 кг/м3. 4. На 376,7 кг
757 мм рт. ст. 6. С12 74, 1 %; Вг2 13,7 %, О2, 12,2 %, РЪт, = 0,137 атм
Рсх = 0,74,
VNj = 58,44
РОг = 0,123 атм,
Nj м3. 8.4,53 кг.
= 427,7-10-' м3/моль. 11.
= 3,64-10-10 м; 750 К- 17.
18. 55%. 19. 0,37 л. 20.
5
18. 55%. 19. 0,37 л. 20. 4.4
19,8%; 1,054; 1,198. 23. 55, 55.
V = 0,39 м3. 7. 0,987 атм; VOi = 16,56 м3;
9.396 К. 10. Ь = 469,7-10-' *м3/моль; 6=
= 47,8 л. 14. у/= 0,801. 15. 7,6-102м/с. 16. ffMj =
Z = 8,05-1011; Z' =9,ЫО32; Z"= 1,18-1026; 0,26l' а'тм.
4.4 %. 21. 0,4986; 0,2676; 0,1338 атм. 22. 5,4 %;
Глава X
1. 18,22 10-* м3/моль. 2. 96,3576-10-« м3/моль. 3. 1,17 D. 4.2,77 D; 0,92х
XlO-2» К-м. 5. 27, 453-10-» м3/моль; 27,193-10~в м3/моль. 6.21,334-10-»;
21,140-10-» м3/моль. 7. СН3СООСН2— СН=СН2. 8. 0. 9. 2.0183. 10. 0,8995 х
Х10-3 кг/см3. 11. 0,0390
сн=снч
'•с-1'2 кмоль-1. 12. 1. 13. I Л
СН=ОГ
(пиррои). 14. аТ= 0,6988 — 0,12377-Ю-3 Т; —0,12377-10~3 Дж/(м2К). 15.—
-12377-Ю-3 Дж/(м2-К). 16. 69,76-Ю-3 Дж/м2. 17. —= 16,5-10«/d-13,226 X
Х103; Т)= 0,1877-Ю-3. 18. Ец= 10,4895 кДж/моль; ц = 9,8145-10"» х
хеЮ489,5/«г ,9 28ДO4 кДж/М0ЛЬ 20. Яисп= 51,87- 10s—50,4 Г+0,5-10~3Х
ХГ2 + (9,87-106)/Г. 21. АНШ = 49,335 кДж/моль; AS340=145 Дж/(моль-К).
22. 62, 24 кДж/моль. 23. 85, 44 кДж/моль. 24. 508,690 кДж/моль 25
440,718 кДж/моль.
Глава XI
1. Нет. 3.1,947-10' Па. 4. ДЯ273,2= 44,991 кДж/моль; ЛЯ67,,, =
= 94,326 кДж/моль; ЛЯ273.2 = 46,312 кДж/моль; ДЯ$72 , = 36,727 кДж/моль
5- ДЯИСП= 35,82 кДж/моль; AS = 88,36 Дж/(моль-к'); ДЛ = — 3,369 кДж/
моль; ДО = 0; Д{/ = 32,452 кДж/моль; Г= 260,2 К.. 6. А — 11,628; В =
512
= 16,78104; Г=2537 К. 7. АН = 239,119 кДж/кг. 8. ДЯиспС1 =21,706
кДж/моль. 9. Я2в8= 4,159 104Па; ДЯИСП = 29,337 кДж/моль; ' Д0„сп =
= 0; ДСфп = - 34 Дж/(моль-К); AS = 98,446 Дж/моль. 10. Тгтв =
= 276, 46 К; Яттр= иЗ-^Па; ДЯВ93Г = 45,250 кДж/моль; ДЯИСП =
= 33,894 кДж/моль; ДЯПЛ = 11,356 кДж/моль. П. Гпл = 1247,7 К; Рт тр =
= 452,9 Па; ДЯИСП = 12,997 кДж/моль. 12. 95 — истинная молекулярная
масса СН3СООН 100, 24. Полученная величина указывает, что в парах
СН3СООН частично ассоциирована. 13. 5,998. 14. 1) Р = 7,13-103 Па; 2)
Р= 33, 56-103 Па. 15. Т= 430,65 К. 16. ДЯ7М исп = 113,303 кДж/моль.
17. ТПл.1,в= 335,67; Гпл,1200 = 451,9 К; ДЯПЛ = 476,67 Дж/моль; АЯПЛ =
= 497, 2 Дж/моль. 19. /?Hj = 9,76-10'. 21. АН = 519,068 кДж/кг. 22. Не со-
согласуются. 23. ДЯИСП ='43,367 кДж/моль; ASHcn= 91,68 Дж/(моль-К).
24. \пР = 17,55—1,484- 10*/Т; ДЯпар = 120,873 кДж/моль. 25. К = 0,88 л;
A,79 10—2 л). 26. Д#исп = 42240—39,9 Т Дж/моль; AS3.,i,2,HCn = 93,64 Дж/
/моль. 27. Р= 606,5 мм рт. ст. 28. Д#исп = 28,67 кДж/моль; Тн т к = 307,6 К.
*°=34,6°С. 29. ДЯИСП= 33,02 кДж/моль. 30. Гкип 5в0 мм рТ с'т = 2475 К;
Р = 10,86 — 1685/Г. 31. <= 28,8° С.
Глава XII
1. 3,128 моль/л; 3,414 моль/кг; 0,058; 26 %. 2. 8,732 моль кг; 15,31 моль/кг,
0,216. 3. 0,0105 моль/моль Н2О; 0,5534 моль/л; 0,9016 см3/г. 4. 789,3 г;'0,98 см3/г.
5. 1,134 г/см3. 6. 0,44 см3. 7. 4,16 см3; 1,17 см3/г; 1,260 см3/г. 8. 27,3 см3/моль.
9. 8,75 м3/моль. 10. 19, 93; 23,14 см3/моль. 11. 39,72 см2/моль, 12. 20, 44 см3/
/моль. 13.234 г. 14. 7,918 см3/моль. 15. 18 см3/моль. 17. —0,421; —0,231; —
— 0,148; —1,730; —0,986;—0,619. 1^_—0,0765; —0,052; — 0,047; —0,3198;
—0,217;—0,196. 19. 4430, 86 Дж; АНХ = 1188, 26 Дж/_моль; ДЯ2 = 6263,45
Дж/моль._20. 6351,31 Дж/моль; АН = 230,96 Дж. 21. Д#1 = — 28200, 16 Дж/
/моль; ДЯ2 = — 1832,59 Дж/моль; АН = —95596,03 Дж. 22.ДЯ = 41798,16
Дж/моль. 24. 3740 Дж/моль. 25.—718 кДж. 26. AS,n = R (*Ag+*AuIn;tAu) —
- 5,03 J^gJtAu; 4,34 Дж/(моль-К). 27. цРе = ц?е + RTxFe - 2095 х;
HNi = ngjj + RT In ^Ni = 2095 *$,. 28. 0,903. 29. 0,583; 0,246. 30. 1,93. 31. a =
== 0,920; v = 0,989. 32. 0,2499. 33. 1,52. 34. 161. 35. 35,41. 36. 16,89 Дж/моль.
38.. 1903,72 Дж. 40.—8600 Дж/моль. 41. — 1330 Дж/моль. 42. 660 Дж/моль,
43. 9,68 Дж/(моль-К). 44. Дц = — 157500 Дж/моль 45. AT = 42°С.
Глава XIII
1. 0,00036. 2. 7330 Па. 3. 5,75-10* Па. 4. 123; 0,82 %. 5. 1,87. 6. 0,6 %.
7.61 %.8. 198. 9. 1,0096-105 Па. 10.2, 637. 11. 8 атомов. 12. 138,8. 13.373,56.
14. 0,08. 15. 153, 8. 16. 24,0 17. » = 0,324; ассоциация. 18. t = 2,52. 19, К=
= 8,245; 99,37 кДж/моль. 20. 1,154-103 моль/м3. 21. 27, 25-105 Па. 22. 373,
295 К; 1, 94-10е Па. 23. 271, 39. 24. 564 Па. 25. 271,963 К. 26. 0,936 моль/л.
27. 62 9. 28, 6,25 %; М = 128; 93,7. 29. 3122,4 Па. 30. 2,56-10е Па. 31. 72,3.
32. XN = 1,49-Ю-4; ХОг= 3,0-10~4; по =0,0165 моль/л. 33. 15,810эПа.
34.0,1032 кг. 35. O2=22,7%, Na = 1,35* %, Аг = 3, 69%, СО2 = 92,2 %.
36. 0,00233 кг. 37. 16192,08 Дж/моль. 38. 5,16-103 г; 4,81 • 103 г. 39. АТ3 =
= 0,48.40. 0,88 г/л. 41. 117; 0,03558. 42. К = с? 5i5/c2=2,192; 0,515. 43. 17,27.
44. 5,85 л. 44. 5,85; 0,579; 0,0527 л. 45. 4,61 • 10~3 г. 46. 1,008-105 Па. 47. 2,973 г.
17 Зак. 767 513
Миоговариаитиая задача № 1
рианта
?2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Р, Па
1598
38 714
31740
33 841
16108
55 000
¦ 650 000
2 375
91912
776
35 896
7 328
12 420
5 807
49431
84 990
т, К
288,2
278
69
114
306,7
207
223
283,2
252,5
1991
303
216
149
283,2
194
119,6
Р°. Па
1600
40 290
31 992
34 738
16 396
55 986
674 824
2 626
96942
800
37 724
7 998
12 663
6 050
51987
87 711
72,27
57,67
185,6
105,14
94,2
187,57
100,18
32,76
50
80
60
44,36
107,5
57,65
100
137,27
ш,
моль/1000 г
0,07
1,5
0 28
0,88
0,558
0 527
0,'86
2,29
1 05
0,589
0,877
1,428
0,287
0,536
0,638
0 38
с,
моль/л
0,07
1,04
0,23
1,05
0,84
0,952
1,197
2,58
2,9
4,82
2,96
2,13
0,496
0,39
0 726
0,786
Я-Ю,
Па
1 677
23,344
1,319
9,95
21,419
16,384
22,192
60,747
60,879
632,331
74,566
38,251
6,144
9,183
11,710
7,815
Глава XIV
1. 0,823-104; 0,867-104; 0,224-104; 1,092-104 Па; AS = 12,88 Дж/моль;
Дц = 408,9 Дж/моль. 2. 3,38-104; 4,24-104 Па. 3. 0,43 н 0,85 % CS2; 5,5 104 н
6,5-104 Па.
Г, К ....
(ДР/Р) 100,%
293
--9.32
5. 67,6
6. 0,248. 7. *?с,4 = 0,521;
*?с,4
313
-7,19
= 0,143.
353
—5.59
Г, К
330
0,765
1
350
0,710
380
0,696
420
0,682
1
10. Пар 0,295 кг; жидкость 0,05 кг. 11. Н2О 0,223 кг. 12. 39,6 кДж/моль.
13. —3,4 кДж/моль. 15. Ycci4 = 1,555; 0^,^=0,9799; ТСгн8он = 1-876;
асгн8он= °.6940- 16- Yh,o=°'692°; анго= °-3204; Yc2h5oh=0-8777; ансоон =
= 0,4716; отрицательное отклонение. 17. 0,84 кг. 18. 3,18 кг. 19. 0,567 кг. 20.
0,555 кг. 21. 1,29 кг
Глава XV
1. 1515 К; 53 % Ni; /пж = 0,024 кг; /птв= 0,048; 1435 К. 4. 0,348 кг.
7. 8,8 %; 70,5; 0,066 кг; 0,034 кг; 336,5 К; 327,6 К. 9. лтв=6,92 моль; лж =
= 9,22 моль; убылен 3,72 моль.
Глава XVII
1. 0,845; 0,543; 0,465; 1,333. 2. СО—1,447% Н2О—59,858 %; СО2—37,013% ;
Н2—1,68%. 3. 0,2264 моль. 4. 0,01113; 0,1264. 5. 5,496-Ю4 Па; 0,535. 6.
514
0,932;0,0352.7. 0,542; 3,516-104 Па. 8. 1,014; 1,871-Ю-2. 9.0,363; 5,768 моль/м3,
0,632-10* Па. 10. 0,721; 1,586; 0,910. 11. 28, 99 10* Па. 12. 2527,5; 17,02. 13.
72,35-10~3. 14. 0,00164. 15. 0,219; 0,0504; 0,912. 16. 0,148; 7,0866-104Па. 17.
1,1255 105 Па. 18. 0,083 19. 1,809. 20. —24,436 кДж. 21. —21,888 кДж. 22.
Не будет. 23.-472,77 кДж. 24. — 148,48 Дж. 25. —27,02 Дж. 26. —442,095
кДжг АНТ =— 432,092—12,505-10~3 Т (кДж). 27.4454,08 м3/моль; 387,81
м3/моль; —114,19 кДж. 28. 50,232 кДж. 29. —116,226 кДж. 30. 1,0402. 31.
— 71,170 кДж. 32. ПО, 997 кДж; 813,9 К- 33. — 17,345 кДж; — 22,270 кДж;
0,859 Дж/К- 34. lg Кр = - 52,3444-°**?™+ «'Щ™ + 2,6244 lg T -
—1,0241-10—» Г; 7,614-Ю9. 35. 1154,25 К- 36. lg f(p = @,273- \№)IT2 —
— (9,6356- 103)/Г — 1,2905 lg T + 12,5205 — 0,2183 ¦ 10~3 Т; 1,879. 37.
177,455 кДж; 2,463-1033. 38. 73,633 кДж; igKp = — C,846-103)/Г- 0,3904.
39. 200 кДж; хс<н< = *с.н4<сн.>, = °.086; *С.Н5СН, = °.828- 40.
5,2518; *С>Н<=*С;Н4(СН = 0,8217; хСвНвСНэ = 0,1783. 41. 29,97. 42. 247,5.
43. 3,36-104 Па; 9,44-10* Па. 44. 1,059-10-2. 45. 3,293. 46. 492,2 К 47. 8 357-X
Х105. 48. 0,173. 49. 2,532-105. 50. 4,116-104 51. 1,2787. 52. 31 109. 53 СН2С1,—
—0,090; С12—0,001; СНС13—0,320; НС1 — 0,499; СС14 — 0,090. 54. Выход N0-
-3,5 %.
Миоговариаитиая задача № 1
№ ва-
варианта
1
о
Q
4
С
7
а
IS
Ар -
ts
КР-
ts
Кр 4
КР =
Кр —
A— 2хJР3/2
х(З-х)'/2
16х2 D-хJ
27 B-х1) Р2 '
81 х3
, 1/2
/2—хM/2 Р|/2 '
108 A-хO/5 Р5'2
- C-хJ F+х) '
Kc=KP(RTK'2;
Kc=KP(RTf'2;
17* 515
10
6!/2.3.23/2.рЗ/2хЗ
20,78*»
(9-^)
3/2 '
27л3Я|/2
12
A0—За:)»
v-S /у) х\ !/2
1
54
2*
it
х3 A2—л-)
to
D—Зд:)
20
21
Многоварнантная задача № 6
№ ва-
варианта
1
2
3
4
5
КР
1,928-1048
9,757 -1012
5,557-107
42.127
1,157-10"
№ ва-
варианта
6
7
8
9
10
КР
1,656- Ю'°
0,912
7,896
2,24-10—IS
1,43
№ ва-
варианта
11
12
13
14
16
Кр
3,726-Ю-7
4,196-1039
2,217
5,65-106
9,74-10-2
№ ва-
варианта
17
18
19
20
Кр
1,654 1012
3,152-10-4
1,268-Ю-2
2,028
Миоговарнантная задача № 7
№ ва-
варианта
1
2
3
4
5
6
7
8
9
10
Повышение
Р
увелич.
умеиьш.
»
увелич.
»
»
уменьш.
не изм.
увелич.
уменьш.
Понижение
Р
уменьш.
увелич.
»
уменьш.
»
увелич.
ие изм.
уменьш.
увелич.
Давление
инертного
газа
уменьш.
увелич.
»
уменьш.
>
»
увелич.
не изм.
уменьш.
увелич.
№ ва-
варианта
11
12
13
14
15
16
17
18
19
20
Повышение
Р
увелич.
уменьш.
»
увелич.
»
уменьш.
увелич.
уменьш.
увелич.
»
Понижение
Р
уменьш.
увелич.
»
уменьш.
»
увелич.
уменьш.
' увелич.
уменьш.
»
Давление
инертного
газа
уменьш.
увелич.
»
уменьш.
»
увелич.
уменьш.
увелич.
уменьш.
»
Глава XVIII
1. 1//?= 0,0377 См. 2. х= 8,135 См1-м-1. 3. 2,28-10~2 г. 4. t+ = 0,418;
г_ = 0,582. 5. к+~ 5,02-Ю-3 См-м2/моль; кг = 6,56 10~3 Смм2/моль; t+ =
= 0,185; t- = 0,815. 6ДСЮ_= 59,07 См-м2. 7. Х=96,5 (совпадает с опытным
значением 96,6). 8Лка = 129,5 См.см2. 9.0,22. 10.0,101 моль/л. 11. Хо =
= 390 См-1 см2; а=0,198. 12.4,35; Ка = 0,173-10-4. 13. 1,74-10-5. 14. [Н+]=
= 1,175-10-2,[Н+]= 1,324- Ю-3. 15. 9,939-10-4. 16. /.,= 0,87-10-3; Z.2=7,81 X
X Ю-4 моль/л. 17. А,! = 112,9; Я2 = - 65,26. 18. 3,25- Ю-2; 0,654; 5,32- 10-3.
19.
Соль
с,
моль/1000
0
0
0
005
010
006
0
,098
у±
0
0
0
230
333
4W
II
Соль
моль/1000
с.
MgSO4
LaCl3
Na2SO4
MgSO4
LaCl,
Na2SO4
0,01
0,002
0,005
0,059
0 320
0,426
0,565
517
20. у± = 0,718. 21. а±11а±г =0,15. 22. ДЯ = — 574 92 Дж/моль. 23. 1465,45
Дж/моль. 24. ДЯ?°ын + = —132,9 кДж/моль. 25. AG!}00= —97, 382 кДж; ДЯ%0=
= —52, 453 кДж;4 AS = 149,76 Дж. 26. ДС = 11, 227 кДж; AS0 =
— ПО, 8 Дж. 27. ПР = 5,07-10-в. 28. рН = 2,16. 29. 0,980; 0,964; 0,920;
0,889; 0,847. 30. ПР = 7,33. 31. 238-10~10 М. 32. 0,865; 0,845; 0,826; 0,791;
0,687; 0,593. 33. рН = 6,9. 34. Т = 353,3 К. 35. Кл = 0,072 • Ю-3; С =
-=27,0-Ю-3. 36. а =7,33-Ю-7. 37. /. = 1,48-10-3. 38. у± = 0J07. 39.
55,94 кДж. 40. C=7,910~2. 41. 250,7. 42.211A36,3). 43 Д//Н>5О4 =
= 18,57 кДж/моль; ДЯНгО= 14,7. 44. 56, 5 кДж/моль. 45. 0,01023. 46. Дц= 1 Гз21
Дж/моль. 47. ал = 5,16!-10-3. 48. 6-10-3. 49- ал = 0,00633; ал=0,00122. 50.
0,74-10-3.
Глава XIX
1. Zn + CuSOj = Си + ZnSO4; Cu2+ + 2Ag+2Cl- =2 AgCl+Cu; Cd+
-f Hg2SO4= 2Hg+SOi-+Cd2+; H2+Hg2SO4=Hg+2H + + SOI~; Си (OHJ +
+ H= Cu+2 H2O. 2. Cd|Cda+:;Cu2+|Cu; Pt|H2|H+ :i Ag+ | Ag; Ag |Ag Ц Agl |
PtJH| HCI |CI Pt Z Z2 F3 |F2Pt PtH|OHf! H |HJ Pt P
2 2 || |2| g | g g |g Ц g |
Ag; PtJH2| HCI |CI2| Pt; Zn |Zn2+ :¦ Fe3+ |Fe2+|Pt; Pt|H2|OH-f! H+ |H2J Pt; Pt
|H2| OH-|O2|Pt. 3. 0,43648 B. 4. 6,925 B. 5. 2,65. 6. 0,11 B-. 7. 0,7763 В. 8.
—0,059 В. 9. 2,54 В. 10. ?i = 0,7846; ?2= —0,2479 В; рН= 1,083. 11.-0,15 В.
12.0,065.13. ?i=0,337 В; ?2=0,594 В. 14. Ki = 6,8-1085; АГ2= 1,313. 15. ?» =
== — 0,0363 В; ?» = 0,721 В; ?» = 0,519 В. 16. 0,01735 В. 17. у± = °.2О2.
18. 0,459 В. 19. 0,1317.20. 0,0438 В. 21. арь = 5,7-10~3; урь =0,297. 22. —О.ЗЗб
В. 23. ДЯ= —238,175 кДж/моль; <?= 21,07 кДж/моль; ?»98= 0,985 В.
24. ACJ,i298 = 12,59 Дж/(моль-К). 25. <? = 24,153 кДж. 26. 6,45-10~4. 27.
a(T1)Hg = 0,0626; у = 0,736; AGm = — 6,865 Дж/моль; ASm = 17,36 Дж/
/(моль-К). 28. ДЯТ1 = —1,459 кДж/моль. 29. a(Cd) Sn =0,0797; P(Cd)Sn =2,37 мм
рт. ст. 30. ат, =0,0112; у=0,0562. 31. ат,—0,00432; у = 0,0188; AGm= —13,489
кДж/моль; ДЯт= —2,832 кДж/моль; ASm = 12,43 Дж/(моль-К). 32. ?=
= 0,261 В. 33. ATi = 1,98-Ю14; К2 =¦ 1,645-Ю24; АГ3 = 2,78-10-«. 34. /с,г =
= 35,41 атм; у = 0,708; /с,2 = 45,45 атм; у = 0,4545. 35.237 кДж/моль;
1,229 В. 36. ?°= 0,41146 В;2 у± = 0,488. 37. 1) Равновесие; 2) КР = 1 или
АГо = 1 в зависимости от того, как определялось ?°. Другой ответ: концентра-
концентрационная цепь; 3) очень разбавленный раствор сильного электролита; 4) очень
разбавленный раствор; 5) без ограничений; 6) только для соли 1:2 или 2:1; 7)
очень разбавленный раствор; 8) обратимая реакция в цепи; 9) ?; = ЭДС той
же цепи без переноса. Число переноса зависит от концентрации.
Глава XX
1. а == 7,1 -10—» мм рт. ст.; К = 36 мл-г-1. 2. а = 18,6. 3. S = 449 м2.
5. а= 0,129 г. 6. асо = 1,706, К = 9,56-10~4. 7. Яоо = 4,33- 10-10; АГ=0,07:
а=310-10 моль/см2. 8. S = 12,22 А2. 12. Sva = 0,21 м2/г. 13. Syi, =-
= 199,5 ма/г. 16. ДЯ = 28,5-103 Дж/моль. 17. ДЯ = 22,2-103 Дж/моль.
Глава XXI
1. 43,2 года. 2. 5,3-10~5; 4,35-104 мин. 3. 0,0515 мин-1. 4. 2,65-Ю-4;
1530 мин. 5. Первый 2,7-10~3 мин-1. 6. 30 мин, 7. 2,55-10~8 с. 8. 3,75 мин. 9.
52 % 10. 7,36 мин. 13. 0,7544; 23,8 ч; 238,5 ч. 14. 0,86 моль-^мин-^л. 15.
518
0,07 моль/л. 16. 25 %; 33,3%; 38%; 100%. 20. Первый. 21. Первый 22. Полу-
Полуторный. 23. Первый; 0,0123 мин-1. 25. Первый; 0,040 чА 26. Первый;
4,19-10-4 мин-1. 27. 5,31-Ю-3 мин-^г-экв-1 ¦ л. 28. Третий. 29. Второй;
11,6 мин-1-г-экв-1л. 30. Второй; 2,35 мин-1г-экв-1-л. 31. Второй;
ООЗвЗ^-^г-эквл. 32. Первый; 1,5-10—2 с-1; 460 с.
Глава XXII
1. ?i = 0,00314 мин-1; А_х=0,0104; Кс = 0,302. 2. А\,ав„ = 0,79242; Ai=
= 0,0017045; k_x = 0,002151. 3. kx = 1,495-10~5 A,84-10—s) мин-1. 4. kx =
= 0,01637 мин-1; ?_i = 0,000334 мин-1; АГравн=49. 5. л = 2; /С=0,412 моль X
X мин-1-л. 6. kt = 0,035 мин-1; А2 = 5,72-10~6 мин-1. 7. ттах =
= 5,67 ч; [В]тах=595 к, 8. х,'/2 = ^^[in f - in (p?"^)
но V*a = V*2- 9. V*2 = 6>94' I0- ATcp = 0,0346995 мин-1 (через 35 мин
CRaC = CRaB )- П. А, = -J 1п Г-^Г ; ') а - ^ = ае~*''; 2) 'В1 =
— X
*i . -k.t -kJ, 3) [С] = a [l - k\
L A2 — kt
Г (««); 3) [C]aflв+
«1 L «2 — «1 «2 — «1
X e-*«'J. 12. [CJ = J5L ^* ' ^
J
- [BJ) - А» [В]). 13. [С]стац =-ЦЖ . ттах = 7,45 мин; [С]с-тац=[С]тах;
^ = ~у^--1= оо -1 при ^-^0; [А]= [А„]; [B] = [B,J; [CJ-*O по-
последовательные; л=[Ао]-[Во)-[В) м w ^ *ltA][Cl
3 A_i + 3[]
больших Р A_j > А3[С]; Г = АГэф [А] [С]; 2) При малых Р ?_j < Й3[С]. W =
= fej[A]; л=1. 15. Р = 66,73 Па. 16. ?2 = 3,79-10~3 с-ь ттах= 1979,51 с;
*,=2,Ы0-«с-ь [RaA]max = 7,22.10-11 г; [Rn]T_54 =3,41-10»; [RaA] = l,93x
X Ю11 атм. 17. Sn118 = 0,07 г. 18. 'NTl /NSb = 0,396; ^,/^Sb = 0,6. 19. kj =
= 2,41-10-<c-1;A_i=l,9-10-4c-1.20. fej=4,74-10-5c-1;fe2=5>70-10-6c-1. 22. Ai=
=3,6-10-8 па-ь A2 = 3,2-10-*c-i. 23. kt + k, = 0,00187. 24. <= X
k4k(b—a)
i2(
Г a A, -I-A, F—л-) 1 1 a
xIn T , ¦ ¦ ; 236,9 мин. 25. t= . . . ,. Г In X
L A4A6 J AffeF)
Г a A, -I-A, F—л-) 1
T , ¦ ¦ ; 236,9
La—* Aj4-A26 J
!
Г In
—а) а— х
X *» + *¦<»*> ; i. = 4!z±: ^3,5.10-c-1; P = 0,33; x/e = 0,459.
26. A_j=9,47.10-3; kt =2,659-10~3.
Глава XXIII
1. 311,8 кДж/моль C08,8 кДж/моль), ?„ = 1,029-Ю25. 2. 97,25 кДж/моль
<96,9 кДж/моль), АО = 8,21-1013; т,/2 = 0,308 мин. 3. A^Aj = 4444,78 @,0002).
4. 46,65 кДж/моль; т(/2 = 6,1 мии; т"/2 = 12,2 мин. 5. k1: k2: ?= 1:47,3:99,7.
6.291,3 К. 7, 18,2-Ю-3 мин-1; * = 253 мин. 8. 65 мин. 9. у =1,882.
10.7-3=291,4 К. П. АГ28з 2= 7,05-Ю-3, Кпз 2 = 29- Ю-3; /С2„, 2 =
= 14,9-10-3; *= 12,477 % ='0,01248 моль эфира. 12.96,747 кДж/моль;
519
А3=7,49-10-3 мин-1; t= 1230 мин. 13. 122,597 кДж/моль; t= 1274 с. 14
№з4з,2 = 2,72- Ю-6; К343.2 = 0,0272 мин-1-моль-1-л. 15. ^ = 2147,5 мин;
?3=4,61 мин-1-моль-л. 17. 32,805 кДж/моль; kB=Q,587 с-1-мм рт. ст.-2; АГе,ззз=
= 1811,32 с-1-моль-2-л2; АГС,473= 121'871 с-1-моль-2-л2; 39,37 кДж/моль;'kt~
= 2,71 • 109 с-1 моль-2-л2. 18. Точность определения времени полупревращения
зависит от точности термостатирования. Точности измерений недостаточно, что-
чтобы отличить реакции порядка 3/2 от реакции порядка 4/3; (Д^/т,^2). 100=+8,46%.
19. 573 К-» 1,22-10-10; 723 К-^1,39-10-8. 20. Еа = 362895,78+16,628 Т Дж/
/моль; Е = 376, 198 кДж/моль. 21. 217, 73 кДж/моль; 60 х=6,08-1012 с~1; 213,
223 кДж/м-оль; ?0j2= 1,18-10" с-1; lg?,= 12, 784—A1371,4/Г); lg?2=13,073—
A1136/Г) 22. lgA1=14,37-(9973/r); lg?2= 15,104 — (9276/7); Кс в»8 в =
= 0,018573; Кс, ввв, в к = 0,01661132; АН = 13348, 846 Дж/моль; Кс' 55з к ~
= 1,013- Ю-2; Кс 71з к"" 2,25-Ю-2.
Многовариантная задача № 1
1. 16,8 кДж/моль; 63 = >1,108-105 мин-1-моль-1-л; у = 2,029; схз =
= 0,537- Ю-4 моль/л.
2. 166,672 кДж/моль; k3 = 0,0488 мин-1- моль-1.л; у = 2,001; сж> —
= 0,00465 моль/л.
3. 167,87 кДж/моль; 63=0,0188 мин-1-моль-1-л; у= 1,65; cKj = 1,695
моль/л.
4. 214,267 кДж/моль; 63=0,1148 мин~1-моль-1.л; у= 1,69; cXj = 1,556
моль/л.
5. 88,213 кДж/моль; k3 = 0,1209 мин-1-моль~1.л; у= 1,39; cKj= 1,976
моль/л.
6. 192,549 кДж/моль; ?3=40,699 мин-1-моль-1.л; у= 1,603; cKj =
= 1,868 моль/л.
7. 219,168 кДж/моль; ?-,= 13638,6 мин~1-моль-1-л; у= 1,148; сх> =
= 2,83 моль/л.
8. 265,714 кДж/моль; *3=53,138 мин-1-моль~1.л; у=1,32; сх = 1,7497
моль/л.
9. 103,8 кДж/моль; *3=0,287 мин-^моль-^л; у=4,274; сж =0,832 моль/л.
10. 326, 864 кДж/моль; 63=0,0788 мин-1-моль~1-л; у= 1,567; сж> =
= 0,7359 моль/л.
11. ? = 204,366 кДж/моль; 63=0,402 мин-моль-1-л; у= 2,117; cXg =
= 2,431 моль/л.
12. 64,265 кДж/моль; k3 = 1238,09 мин-^л; у == 2,445; сх = с0 =
= 1,67 моль/л.
13. 98,153 кДж/моль; 63 = 0,00235 мии-^моль-^л; у = 3,697; сЖз =
= 1,718 моль/л.
14. 218,6 кДж/моль; *3 = 0,0635 мии-^моль-^л; у= 1,714; сх =
= 0,673 моль/л.
15.95,570 кДж/моль; *3 = 0,295 мин^-моль-^л; у = 4,003; сх =
= 0,626 моль/л.
16.83,765 кДж/моль; *3= 1,256 мии-1 ¦ моль-1 • л; у = 2,910; cXf =
= 0,918 моль/л.
17. 110,618 кДж/моль; fe3 = 0,011 мин-1-моль-1-л; у = 2,545; cXi =
= 0,064 моль/л.
\
520
18. 47,148 кДж/моль; k3 = 79,724 мии-^моль-1-л; у=1,88; сх = 0,949
моль/л.
19. 71,441 кДж/моль; k3 = 0,00259 мин-^моль-^л; у = 2,547; сх -
— 0,150 моль/л.
20. 65,355 кДж/моль; ka=0A23 мин-1-моль-л; у = 2,352; с^ =
= 2,862 моль/л.
21. 70,694 кДж/моль; ?., = 0,000289 мин-^моль-^л; у =2,701; сх —
= 0,221 моль/л.
22. 109,439 кДж/моль: &„= 0,0335 мин-1-моль-1 л; у =3,117; сх ¦=
— 0,0386 моль/л. =
23.97,002 кДж/моль; 63 = 0,190 мин~1-моль-л; у =- 4 186- cv =
= 3,838 моль/л.
24. 6,992 кДж/моль; fe., = 1,719 мин-1-моль-1-л; у= 1,087; сг =
~ 2,66 моль/л.
25. 104,1 кДж/моль; fe3 = 5,713 мин-^моль-1-л; у= 3,593. сх — 1,838
моль/л.
Глава XXIV
I. Z0=29,41022; Z0=9,581028; / = 61.4-10-7 см. 2. ZaKT = 184-Ю16; <,, =
= 0,00104 мин. 3. Еа = 128030,4 Дж/моль. 4. Z0=4,78-109. 5. k = 7,8-109 с-1.
7. р = 0,205; ?„=165953,9 Дж/моль. 8. р = 5,3-10-10; ?„=46818,96
Дж/моль 9. р = 5,3- Ю-8; Ео = 54475,68 Дж/моль. 10. р=63-10-8; Еа =
= 57237,12 Дж/моль. 13. * = 9,3-10-9 см3 молекула-1-с-1. 14. ?= 1,25-10-12
см3 ¦ молекула-1,,-1. 15. k= 4,12- Ю-21 см3 • молекула-1 -с-1. 16. k =
- 0,298 см^моль-^с-1. 17. 152,9. 18. 7-10-3ч-1. 19. Д//^ =^ 72174
Дж/моль; Еа -¦= 74709,5 Дж/моль. 20. \НФ = 36149,76 Дж/моль; AS* =
68,032 Дж/(моль-К). 21. Кр = 7,76-10-3; ?„= 1112,9 Дж/моль; Кр =
--= 1,63-103; Д//# = —10794,7 Дж/моль. 22. АНФ =~ 10836 Дж/моль; AS* =
- 84,010 Дж/моль; АН* = —280196,3 Дж/моль. 23. a) k = 74 с-1; <,.=¦
/2
- 9,4103с; б) *=1,7-10-2с-1; ^ = 41 с; в) k = 3,8- 10-вс-1; <% = 50 ч. 24
АН~= 121 336 Дж/моль; ?„=233467,2 Дж/моль. 25. ?= 1,28-10~14 см3-моль-1.
26. k= 4,0-10-8c-1; AS* = —3,347 Дж/(моль-К). 27. 1105457, 6 Дж/моль;
124683,2 Дж/моль; 39,33 Дж/(моль-К). 28. 6=45,3 см3-моль-1-с-1. 29.
р= 0,5-Ю-3.
521
Многовариантная задача № 3
СО
н
13
О.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
кДж/моль
88,875
103.000
98,195
103,592
226,343
54,95
187,556
89,621
172,985
175.464
133,791
191,13
113,168
42,373
77,541
98,461
242,496
ЬНт .
кДж/моль
Г-298; 86,399
298,1; 100,523
293,2; 95,759
298,2; 101,114
750; 222,111
300; 52,457
500; 183,401
300 К; 84,635
600 К; 163,013
500 К: 167,154
400 К; 127,143
500 К; 182,82
350 К; 107,351
280 К; 37,719
280 К; 72,887
503 К; 90, 101
973 К; 226,325
А.,
м'/(с-моль)
1,27 Ю5
4,25-107
1,512-10»
5,19-107
3,855- \У
1,259-1010
8,03-108
3,258-103
8,99-10*
1,799-10»
3,147-10'
2,938-10»
9,243-106
2,014-103
2,588- 10г
9,27-103
2,534- 10s
Asf,
Дж/моль
Г-298; -155,26
298,1; —107,01
293,2; —96,341
298,2; —105,36
750; —115,481
300; —59,826
500; —86,913
300 К; —194,04
600 К; —172,254
500 К; -88,53
400; —120,263
500 К; -103,57
350; —129,32
280 К; -197,458
280 К; -118,925
503 К; -189,649
973 К; -229,167
V
3,09
3,22
4,39
3,47
1,55
1,87
2,27
2,88
1,86
2,02
2,61
2,23
2,71
1,74
2,84
1,47
Глава XXV
1. 55,35. 2.10я. 3. 281,9 кДж/моль. 4.Еа = 287,7 кДж. 5. 105,6 кДж.Х
Хмоль-1; 1 Эйнштейн = 112,5 ккал/моль. 6. Достаточно; в одном звеие — 46,2;
во втором Ч 186,06 кДж; на моль НС1 поглощается при фотоимпульсе 2,5 Дж/
/моль. 7. да = кг (V2?.i)Cl3/2. 8. w = кг(к'01к3) С2Н4С12. II. у=0,55. 17. 24,6
кДж/моль. 18. у= 7,5; k = 6,3- 10-3с-1. 21. 254,7 кДж/моль. 22. 1041 кДж/моль.
23. 1912 кДж/моль.
Глава XXVI
1. kcv =- 3,86, D = 6- Ю-2 см2/ч. 2. 7,2-10-6 моль или 8,8-10-4 г. 3. V
9,84 л; t= 10,98 мии. 4. t = 39 мин 38 с. 5. cs = 0,1031 г/50 см3: k =
¦--= 6.45-10-? мин-1; 6= 4,95-Ю-4 см. 6. 0,23 г. 7. kcv = 5,0- 10-з „ин-1; 6 =
- 19-10—в м. 8. D = 0,24 см2/'с. 9. г=24; ет=6,2-10-3 г. 10. D = 0,10 см2/с.
12. D - 0,545 см2/с.
Глава XXVII
1. 0,636 смя/(мольс). 2. 1,012 см3/(моль-с). 3. А-^2,32-10-4 см3/(моль-с):
*2=1,18-10-5см3/(моль-с); ?3= 8,65- 10-3 см8/(моль-с). 4. 1.1,17:1,11. 5. 3130 с.
6. 3145; 6329; 12882 с. 7 1,60-10—5; 1,59-10-5; 1,66-10-& моль/(л-с). 8. 1,585.
14, яо== 1,34- 10-* мин-1; *А=5-10-5 моль^-мин. 19. Ga=7,90-10-*; a=0,62.
522
20. 32 л-мол*-1-с-1. 21. 2,72 раза. 22. Еа= 161 — 0,284 ер. 23. Д/Zj* = 163 кД ж;
Л//^о= 205 кДж; Д//^ = 200,9 кДж; A//gs = 129 кДж. 24.. kD = 3,1 с-1;
?а=35,2 кДж/моль. 28. ?эфф = 0,0025 с-1; kncT = 0,0032 с-1. 29. Ег = 41,8
кДж/моль; Ег,= 20,9 кДж/моль. 30. у0 In 1'A — у) = у0 г/+ 0,012. 31. Р=1;
а ¦= 0,048.
Глава XXVIII
1. 1,779 г. 2. t = 1560 с B6 мин). 3. t = 32906 с (Э ч 8 мин 25 с). 4. 6,34 х
Х109 Дж. 5. 80%. 6. 83, 25%. 7. 5,6 см3 О2; 31,77 мг Си; 126,9 мг 12; 11,2 см3
Н2. 8. 92,7%. 9. 92,9%. 10. 313 А-ч; 21,8 л О2.
11. (, А/см2 .... 0,01 0,015 0,018 0,019 0,0193
Дер, В 0,0092 0,0189 0,0340 0,0524 —
12. /, А/см2 5 10 15 18 19
Дер, В 0,269 0,264 0,255 0,244 0,235
13. epft, В —0,535 —0,505 —0,490 —0,485 —0,480
(/(Пр 0,99 0,92 0,74 0,62 0,42
14. 70,2 % Си; 29,8 А. 15. 66,6 % N4; 33,4 % Со. 16. а = 0,840 В; Ь ==
0,190 В; а = 0,305. 19. п = 1,0. 20. а/' =¦ 6,4; А = 0,2; * = 2 л/(моль-с). 21.
Еа = 42 кДж.
ОГЛАВЛЕНИЕ
Предисловие 3
Методические указания к решению многовариантных задач 5
Международная система единиц 6
Глава I. Элементы квантовой химии. Теория химической связи, метод
МО ЛКАО . 8
Задачи с решениями , 10
Задачи 15
Многовариантная задача 16
Глава П. Закономерности геометрической конфигурации атомов в мо-
молекулах. Элементы теории симметрии молекул 16
Задачи с решениями 19
Задачи 21
Многовариантная задача 21
Глава III. Вращательное движение и вращательные спектры двухатом-
двухатомных молекул 22
Задачи с решениями 23
Задачи 25
Многовариантные задачи 26
Глава IV. Вращательное движение и вращательные спектры много-
многоатомных молекул 27
Задачи с решениями 27
Задачи 32
Многовариантные задачи 33
Глава V. Колебательное движение атомов в молекулах. Колебатель-
Колебательные и. колебательно-вращательные спектры 33
Задачи с решениями 36
Задачи 39
Многовариантные задачи 41
Глава VI. Первый закон термодинамики 42
Задачи с решениями 4h
Задачи 60
Многовариантные задачи 66
524
j л а в а VII. Второй закон термодинамики 69
Задачи с решениями 73
Задачи , 88
Многовариантные задачи 94
Глава VIII. Элементы статистической термодинамики 98
Задачи с решениями 108
Задачи 119
Многовариантные задачи 122
Глава IX. Газы 125
Задачи с решениями 130
Задачи 135
Многовариантные задачи 137
Глава X. Конденсированное состояние вещества 139
Задачи с решениями 143
Задачи 151
Многовариантные задачи 153
Глава XI. Фазовое равновесие однокомпонентных систем 155
Задачи с решениями 157
Задачи 162
Многовариантные задачи 166
Глава XII. Термодинамические характеристики растворов и процес-
процессов их образования 172
Задачи с решениями 176
Задачи 185
Многовариантные задачи 190
Глава XIII. Разбавленные растворы 193
Задачи с решениями 196
Задачи 202
Многовариантные задачи 206
Глава XIV. Гетерогенное равновесие в бинарных системах, содержа-
содержащих жидкую и паровую фазы 207
Задачи с решениями 210
Задачи 221
Многовариантные задачи 224
Глава XV. Гетерогенное равновесие в бинарных системах, содержа-
содержащих жидкую и твердую фазы 234
Задачи с решениями 235
Задачи -. 244
Многовариантная задача 247
Глава XVI. Гетерогенное равновесие в трехкомпонентных системах,
содержащих жидкую и твердую фазы 252
525
Задачи с решениями 253
Задачи 256
Многовариантная задача 257
Глава XVII. Химическое равновесие 258
Задачи с решениями 262
Задачи 277
Многовариантные задачи 283
Глава XVIII. Электрическая проводимость. Равновесие в растворах
электролитов 291
Задачи с решениями 295
Задачи 304
Многовариантные задачи 309
Глава XIX. Электродвижущие силы. Электродные потенциалы . . . 312
Задачи с решениями 316
Задачи 328
Многовариантные задачи 334
Глава XX. Адсорбция 337
Задачи с решениями 339
Задачи 341
Многовариантная задача 344
Комплексные задачи 345
Глава XXI. Формальная кинетика 346
Задачи с решениями 350
Задачи 360
Многовариантная задача 366
Глава XXII. Сложные реакции 369
Задачи с решениями 371
Задачи 381
Многовариантная задача 387
Глава XXIII. Зависимость скорости реакции от температуры . . . . 388
Задачи с решениями 389
Задачи 391
Многовариантные задачи 394
Глава XXIV. Теоретические основы расчета константы скорости ре-
реакции 396
Задачи с решениями 398
Задачи „ 406
Многовариантные задачи 411
Глава XXV.. Кинетика фотохимических и цепных реакций 416
Задачи с решениями 419
Задачи 424
Многовариантная задача 430
526
Глава XXVI. Диффузия. Кинетика гетерогенных процессов .... 432
Задачи с решениями 435
Задачи 441
Многовариантная задача 444
Глава XXVII. Кинетика реакций в растворах. Гомогенный и гетеро-
гетерогенный катализ 445
Задачи с решениями 449
Задачи 452
Многовариантная задача 460
Глава XXVIII. Кинетика электрохимических реакций 461
Задачи с решениями 462
Задачи 468
Многовариантные задачи 471
Комплексные задачи 472
Приложение 473
Ответы на задачи , 507
Учебное издание
Кудряшов Игорь Владимирович
Каретников Герман Сергеевич
Сборник примеров и задач
по физической химии
^ав. редакцией С. Ф. Кондрашкова. Редактор Г. С. Костян. Мл. редакторы Л. С. Макар-
кина, В. Н. Бораненкова, Е. Н. Хорошева. Художник А. И. Шавард. Художественный ре-
редактор Т. А. Коленкова. Технический редактор Т. Д. Гарина. Корректор Р. К. Косинова
ИБ .V 8195
Изд. № Хим-872. Сдано в набор 09.01.91. Подп. в печать 18.09.91. Формат 60X88'/ie Бум.
газетная. Гарнитура литературная. Печать офсетная. Объем 32,34 усл. печ. л. +0.12 усл.
печ. л. форз. 32,46 усл. кр.-отт. 31,49 уч.-изд. л. +0,14 уч.-изд. л. 'форз. Тираж 25 000 экз.
Зак. № 767. Цена 2 р. 20 к.
Издательство «Высшая школа», 10U30, Москва, ГСП-4, Неглинная ул., д. 29/Н.
Московская типография № 4 Государственной ассоциации предприятий, организаций н объ
единений полиграфической промышленности «АСПОЛ».
129041, Москва, Б. Переяславская ул., 46