Автор: Каретников Г.С. Атанасянц А.Г. Белевский С.Ф.
Теги: химия физическая химия химическая физика задачи
Год: 1979
Текст
.-г.'£;С»е "ВТ
СБОРНИК
ВОПРОСОВ
И ЗАДАЧ
ПО ФИЗИЧЕСКОЙ
&■■ .ч«к_.• seFTScjr-v.sa:.;- *i_a —
ХИМИИ
для самоконтроля
,. >^ав!ъ
^7
• "J
Л\:'Ж
- V
Й I s 1
S*** ,»'
\
Учебное пособие
для ВУЗОВ
/
>,-.
ББК 24.5
С23
УДК 541.1(076)
А. Г. Атанасянц, С.'Ф. Белевский,
Г. С. Каретников, К. Н. Никитин, Е. П. Старостенко
Рецензенты:
кафедра физической и коллоидной химии Воронежского поли>
технического ин-та (зав. кафедрой проф. В. Н. Перелыгин)
и проф. В. Н. Никулин (Казанский химико-технологический
ин-т им. С. М. Кирова)
Сборник вопросов и задач по физической химии
С23 для самоконтроля: Учеб. пособие для вузов/
А. Г. Атанасянц, С. Ф. Белевский, Г. С. Каретников
и др^Дод-ред. С. Ф. Белевского.— М.: Высш. шко-
^"^ла, 1979.— 119 с, ил.
20 к.
Книга представляет собой учебное пособие по курсу физической
химии. Пособие состоит из 15 глав, охватывающих все важнейшие
разделы курса физической химии. Каждая глава содержит вопросы
различного характера» качественные и количественные задачи. Вопросы
н задачи соответствуют программе для химико-технологических
специальностей вузов. Пособие предназначено для самоконтроля и контроля
самостоятельной работы студентов при изучении теоретических основ
курса физической химии и приобретения навыков физико-химического
расчета.
20503—117
С 58—79
001(01)—79
1805000000
541
ББК 24.5
© Издательство «Высшая школа», 1979
ПРЕДИСЛОВИЕ
Физическая химия служит теоретической основой
повседневной практической деятельности современного
химика. Сформировать физико-химическое мышление,
привить навыки решения конкретных физико-химических
задач, научить доводить решение до конечного числового
результата, воспитать ответственность за результат
расчета — вот важнейшее и, возможно, самое трудное в
преподавании физической химии. Успех в этом не может
быть достигнут без систематической самостоятельной ра-
боты студентов. Предлагаемое пособие предназначено
для организации самостоятельной деятельности
студентов, контроля усвоения материала и навыков
физико-химических расчетов.
Прослушав лекции, изучив раздел по учебнику,
выполнив определенные практические расчеты, студент должен
иметь возможность самостоятельно поработать над
«контролирующей программой», которая позволила бы
ему, с одной стороны, познакомиться с характером
вопросов по данной теме, с другой — проверить свои
знания и навыки практических расчетов.
Каждая глава пособия соответствует определенному
разделу физической химии и содержит вопросы
различного характера, качественные и количественные задачи.
Для самоконтроля на все вопросы и задачи приведены
ответы, иногда с кратким к пояснениями. Вопросы и
задачи сгруппированы в задания, состоящие из 6 пунктов
(4 вопроса и 2 задачи). Все задания внутри главы
примерно равноценны как по трудности, так и по объему
вычислительной работы. Поэтому они могут служить
набором заданий при индивидуальной работе на
практическом занятии или стать содержанием заданий для
проведения контрольной работы по теме.
Недалек тот день, когда результат решения может
быть введен в ЭВМ, которая, имея в своей памяти пра*
вильные ответы, оценит знания и навыки студента. Одна»
э
ко контроль может быть организован и без ЭВМ, если кИ
правильному ответу на каждый имеющийся в пособии.!
вопрос или задачу добавить ряд неверных ответов, Тог-Л
да сборник может служить .методическим обеспечением |1
для машинного или безмашинного сопоставительно-вы<Я
борочного контроля. щ
Задания каждой главы составлены таким образом,!
что для решения качественных и количественных задач 1
предусматривается использование «Краткого справочни-Я
ка физико-химических величин» под ред. К. П. Мищенко!
и А. А. Равделя, «Химия», 1975. Большинство величин в I
сборнике дано в Международной системе единиц (СИ).Я
Однако в некоторых случаях авторы сочли целесообраз-j
ным использовать и внесистемные единицы, которые
встречаются в учебной, справочной и научной литерату-
ре и на шкалах измерительных приборов. \
В задачах на определение количественных характе- 1
ристик индивидуальных веществ или химических н фа*
зовых превращений, как правило, ответы даны в расчете I
на 1 г-моль вещества или на грамм-моли реагирующих I
веществ. I
Сборник охватывает практически все разделы физи* 1
ческой химии, причем авторы постарались уделить вни- 1
мание и таким важным разделам современной физиче* 1
ской химии, которые еще недостаточно освещены в за* J
дачниках по физической химии (статистическая термо-» у
динамика, термодинамика растворов, кинетика гетеро* *
генных процессов).
Настоящее пособие является результатом многолет- /л
них усилий коллектива преподавателей кафедры физи«
ческой химии МХТИ им. Д. И. Менделеева по
совершенствованию форм самостоятельной работы студентов и I
контроля текущей успеваемости. Авторы взяли на себя 1
труд лишь обобщить этот опыт.
Авторы заранее признательны всем, кто выскажет
свои замечания по поводу данного пособия.
ГЛАВА I. МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ
1.1. Чем можно объяснить различие в характере
спектра поглощения одного и того же вещества в различных
областях спектра (микроволновая, ИК-, видимая и
УФ-области)?
1.2. В КР-спектре двухатомного газа наблюдаются
3 линии: классического рассеяния (сок), стоксова (сос)
и антистоксова (соа). Укажите последовательность
расположения этих линий по шкале возрастающих волновых
чисел.
1.3. Выведите уравнения для вращательных максиму*
мов в Р- и /?-ветвях основной колебательно-вращатель*
ной полосы поглощения двухатомного газа (в единицах
волновых чисел со) при условии, что при изменении коле-»
бательного состояния величина вращательной постоянной
В не меняется (/ — вращательное квантовое число не-
возбужденного колебательного состояния, со« —
собственное волновое число внутримолекулярных колебаний, ~
хе — коэффициент ангармоничности).
1.4. Частоты собственных колебаний Н35С1 и Н87С1
различаются, а межъядерное расстояние в обеих
молекулах одинаково. Будут ли различия: а) в положении
полос колебательного спектра и б) в положении линий
вращательного спектра этих веществ? Дайте объяснение.
1.5. Вращательная постоянная молекулы 127135С1
равна 2,27-10-24 Дж. Рассчитайте межъядерное расстояние
Б этой молекуле.
1.6. На основании справочных данных определите
волновые числа основной полосы и первого обертона в
колебательном спектре поглощения газообразного НВг.
Укажите область спектра, в которой расположены эти
полрад,
|Др Объясните причину -тощ, что Вг£ не обнаруживает
поглощений и Шггпбяшп* а Щт &Ш птщ яоглщв*
пщпри2669т~К ""*и: '" " """'
2.2. Напишите формулу, связывающую частоту
гармонических колебаний ядер в двухатомной молекуле vc
с приведенной .массой \х и силовой константой k.
2.3. Выведите уравнение co=f(t>) для колебательной
серии полос в ИК-спектре поглощения двухатомного
газа, если все переходы при поглощении совершаются с
нулевого квантового уровня (v— квантовое число
возбужденного колебательного состояния).
2.4. Фтористый водород поглощает излучение с
волновым числом 41,90 см-1. Какие виды движения
возбуждаются у молекул HF?
2.5. Межъядерное расстояние в молекуле 35С1160
равно 1,546-10-10 м (1,546 А). Рассчитайте волновое число
(см~1) первой линии во вращательном спектре
поглощения этого вещества.
2.6. Собственные волновые числа молекул Ня и СЬ
соответственно равны 4396,6 и 564,9 см-1, 'а
коэффициенты ангармоничности составляют соответственно 0,0268
и 0,00707. Какая из этих молекул прочнее и на сколько
(в расчете на 1 г-моль)?
3.1. Напишите выражение для вращательной энергии
двухатомной .молекулы и укажите, на какую величину
может меняться вращательное квантовое число при энер«
гетических переходах вследствие взаимодействия с элект*
ромагнитным излучением.
3.2. В каких областях спектра можно наблюдать элек-»
тронные полосы поглощения молекул?
3.3. Сколько пар симметричных линий должно
наблюдаться в КР-спектре С2Н4 при условии, что в
комбинационном рассеянии активны все внутримолекулярные ко-
лебания?
3.4. Для какого из веществ — NO или HF — разность
волновых чисел соседних максимумов поглощения во
вращательном спектре больше и почему?
3.5. Волновые числа основной полосы и первого обер-
гона в спектре поглощения ^F^Cl соответственно равны
773,5 и 1533,0 см-1. Рассчитайте собственное волновое
число и коэффициент ангармоничности.
3.6. Пользуясь справочными данными, найдите
изменение энергии (в джоулях на молекулу) вращательного
движения при переходе молекулы HF с вращательного
уровня /=1 на/=2.
6
4.1. Каково математическое выражение условия
активности молекулярного колебания в ИК-спектре
поглощения (ji — дипольный момент, а — электронная
поляризуемость, q — координата колебаний)?
4.2. В КР-спектре двухатомных молекул
наблюдаются 3 линии: линия классического рассеяния, стоксова
линия и антистоксова линия. В какой последовательности
возрастает интенсивность этих линий?
4.3. Для какой из следующих молекул: Р2, HF, СО,
СЬ — в газовой фазе энергия вращения на уровне с /==1
наибольшая?
4.4. Выведите формулу для расчета межъядерного
расстояния в двухатомной молекуле с массами ядер Ш\
и Ш2 на основании данных микроволнового спектра
поглощения газа (Асо — средняя разность волновых чисел
соседних линий спектра).
4.5. Определите энергию вращения (в джоулях на
молекулу) N2 на десятом (/=10) вращательном квантовом
уровне, если известно значение момента инерции (взять
из справочника).
4.6. Для молекулы ВгО ше = 777,8 см-1, а а)€хе—
= 6,8 см-1. Рассчитайте максимальное колебательное
квантовое число и энергию диссоциации (кДж/моль) ВгО.
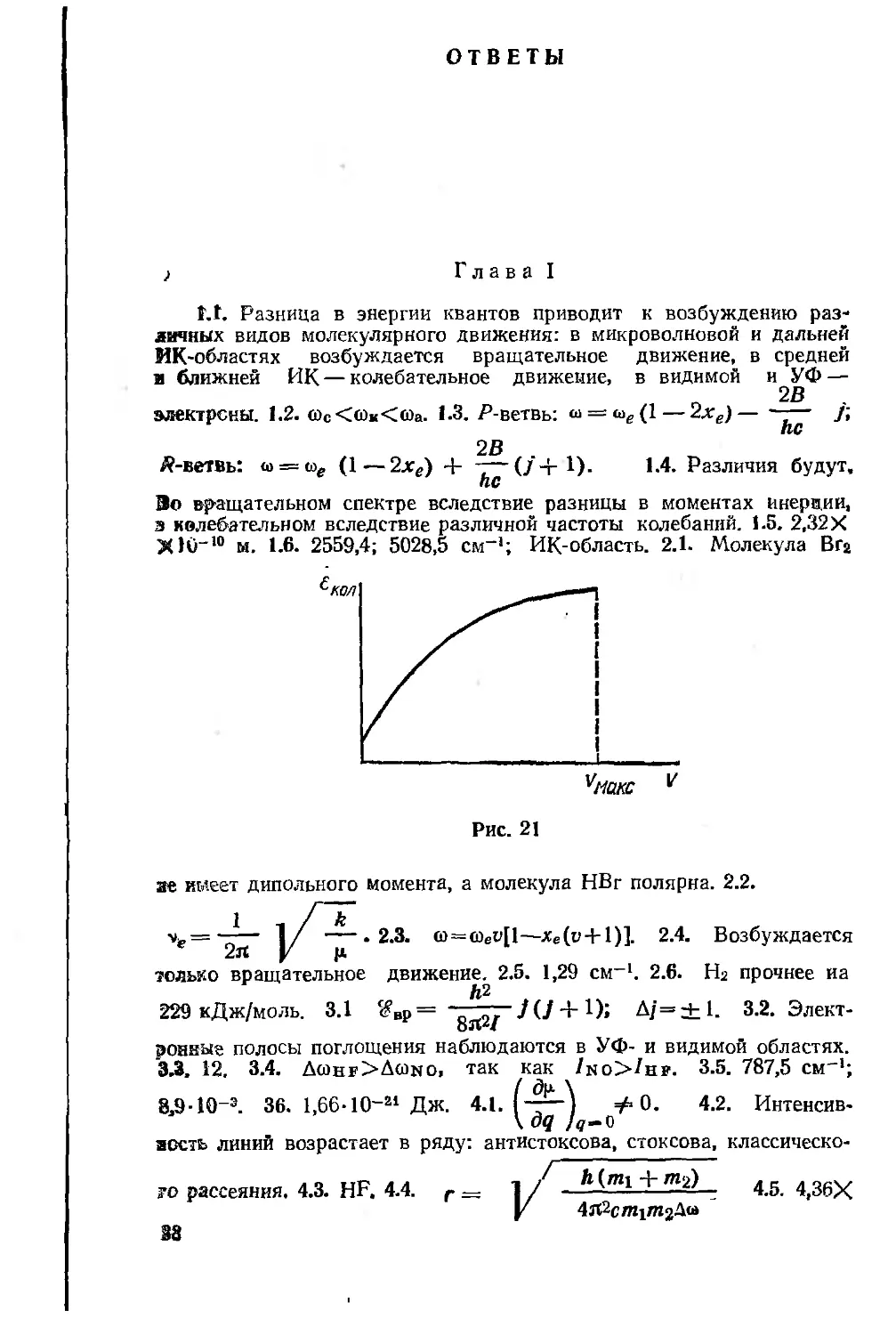
5.1. Начертите график, показывающий характер
зависимости энергии колебательного движения ядер в
двухатомной молекуле от колебательного квантового числа
(в диапазоне от v = 0 до ^Макс)-
5.2. Какие константы двухатомных молекул можно
рассчитать, зная положение колебательных полос в
спектре поглощения?
5.3. Выведите уравнение, описывающее вращательный
спектр двухатомной молекулы (в шкале волновых
чисел), если / — вращательное квантовое число нижнего
вращательного уровня, а В — вращательная постоянная.
5.4. Сколько различных частот собственных
колебаний имеет молекула HCN, если одно из колебаний
дважды вырождено?
5.5. Момент инерции некоторой двухатомной
молекулы равен 16,43-Ю-47 кг-м2. Рассчитайте разность
волновых чисел (см-1) соседних максимумов поглощения во
вращательном спектре.
7
5.6. Рассчитайте собственное волновое число (см-*)'
молекулы, если максимальная колебательная энергия
1,115-106 Дж/моль, а максимальное квантовое число 157.
6.1. Напишите выражение для энергии колебательно^
го движения двухатомной молекулы согласно квантовой
теории и укажите, в каких пределах могут лежать зна*
чения колебательного квантового числа v.
6.2. В ИК и микроволновой областях исследуется по*
глощение газообразных веществ: Вг2, ССЦ, СбНб, НгО.
Укажите, для каких из этих веществ будет наблюдаться
колебательный -и для каких — вращательный спектр.
6.3. Какой физический смысл имеет силовая
константа двухатомной молекулы?
6.4. Чем объясняется наличие только двух ветвей
(Р и /?) в полосе колебательно-вращательного спектра
двухатомного газа?
6.5. Определите расстояние (м) между атомами
водорода в молекуле СН4, если .момент инерции относительно
оси вращения, проходящей через атом углерода и один
из атомов водорода, равен 5,30* 10~47 кг-м2. Молекула
СН4 представляет собой правильный тетраэдр с углом
между связями 109°28'.
6.6. Рассчитайте энергию диссоциации Ът2 (кДж/моль),
если коротковолновая граница сходимости полос в
электронном спектре поглощения наблюдается при 19 575 см-"1,
а энергия возбуждения одного атома брома равна
7318-Ю-23 Дж.
7.1. Какие молекулярные константы можно рассчи- I
тать по данным чисто вращательного спектра? J
7.2. Напишите формулу для расчета энергии химиче- •
ской связи в двухатомной молекуле, если известны ве^ г
ЛИЧИНЫ Шс И Хеш Г
7.3. При переходе от газа к жидкой фазе того же ве- ]
щества вид электронного спектра поглощения заметно I
меняется. Что это за изменения? В чем их причина? I
7.4. Сколько пар симметричных линий должно наблю- t
даться в спектре комбинационного рассеяния молекулы ]
NH3, если два ее собственных колебания дважды вырож- j
дены (при условий, что в спектре комбинационного рас- j
сеяния активны все колебания в этой молекуле)? [
7.5. Волновое число первой линии во вращательном I]
спектре поглощения НВг равно 16,94 см*-1. Вычислите \{
длину волны (см) линии поглощения, обусловленной
переходом с 3-го на 4-й вращательный квантовый
уровень.
7.6. Вычислите разность волновых чисел (см-1)
между 1-м и 2-м обертонами в колебательном спектре
поглощения НВг. Воспользуйтесь справочными данными.
8.1. Что представляет собой чисто вращательный
спектр поглощения двухатомной молекулы как жесткого
ротатора и в какой области он проявляется?
8.2. Выведите соотношение между волновыми числа*
ми основных полос поглощения в ИК-спектре изотопиче-
ски замещенных молекул НЗБС1 и D35C1.
8.3. В ИК-спектре поглощения смеси С12 и Вгг при
нормальном давлении наблюдается полоса с волновым
числом 440 см-1. Чему можно приписать появление этой
полосы?
8.4. Собственные волновые числа молекул HI и N2
близки, а коэффициент ангармоничности HI примерно в
2,5 раза больше коэффициента ангармоничности N2. Ка^
кая из этих молекул более прочная?
8.5. Определите момент инерции .молекулы 19F79Br,
если во вращательном спектре поглощения этого веще*
ства обнаружено семь линий поглощения в интервале
волновых чисел от 71,3 до 570,4 м™1.
8.6. Пользуясь справочными данными, вычислите
разность энергий (Дж) между первым возбужденным и
нулевым колебательными уровнями молекулы Вгг.
9.1. Межъядерное расстояние в молекулах Н2, HD, Ds,
НТ одинаково. Расположите эти .молекулы в порядке
возрастания их момента инерции.
9.2. Что меняется во вращательном движении молекул
лы как жесткого ротатора, если она переходит на более
высокий вращательный уровень?
9.3. Получены колебательно-вращательные полосы
поглощения газообразных хлористого водорода и йодисто*
го водорода. Для какого из этих веществ разность
волновых чисел между двумя соседними линиями тонкой
вращательной структуры будет больше? Почему?
9.4. Для четырех двухатомных молекул известны ча*
стоты колебаний и коэффициенты ангармоничности:
А Б В Г
500 1000 500 1000
0,025 0,250 0,250 0,025
Молекула
0)е, СМ-1
%е «...
9
В какой из этих молекул химическая связь наиболее
прочная?
9.5. Определите .межъядерное расстояние (м) в
линейной симметричной молекуле XY2, если вращательная
постоянная (выраженная в волновых числах) этой моле*
кулы равна 11,2 м-1, а атомная масса Y равна 32.
9.6. Пользуясь справочными данными, рассчитайте
энергию С12 на нулевом колебательном уровне (Дж/моль).
10.1. Что меняется в колебательном движении
молекулы при ее переходе на более высокий колебательный
уровень?
10.2. Что называется основной полосой в
колебательном спектре поглощения?
10.3. Энергия вращения молекулы как жесткого
ротатора увеличилась в пять раз. Во сколько раз увеличилась
ее угловая скорость вращения?
10.4. Почему в спектре комбинационного рассеяния
СС14 наблюдаются 4 стоксовы и 4 антистоксовы линии,
в то время как число внутримолекулярных колебаний
для ССЦ равно 9?
10.5. В колебательно-вращательной полосе Н37С1
измерены волновые числа (см-1) тонкой вращательной
структуры: 2796,9; 2819,6; 2841,6; 2863,0 (Р-ветвь) и
2904,2: 2923,7; 2942,7; 2961,1 (#-ветвь). Рассчитайте
межъядерное расстояние в молекуле Н37С1, считая, что
взаимодействие колебания с вращением отсутствует.
10.6. Для растворов оксигемоглобина в буферном
растворе с рН 7 при 576 им в кювете толщиной 1 см
получены следующие данные:
С-103, кг/ЮО см3 . . . 0,03 0,07 0,12
Г (пропускание), % . . 53,5 23,0 8,2
Рассчитайте: а) молярный коэффициент погашения,
если М = 7300; б) процент пропускания раствора, содер«
жащего 9-10~5 кг оксигемоглобина на 100 см3 раствора,
считая, что система подчиняется закону Беера.
Г Л А В А П. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ.
ТЕРМОХИМИЯ
1.1. Напишите математическое выражение первого за*
кона термодинамики для бесконечно малого и конечного
изменения состояния системы.
10
1.2. Изменение теплоемкости в ходе реакции в
некотором интервале температур меньше пуля. Как изменяется
тепловой эффект этой реакции при повышении темпера-
) урьг в данном интервале?
1.3. Два газа — одноатомный и двухатомный —
адиабатически расширяются. Для какого из этих газов
работа расширения будет больше, если число молей обоих
газов одинаково, а температура того и другого газа
понизилась на одинаковую величину?
1.4. Энтальпия какого из следующих газообразных
веществ — метана или ацетилена — возрастет больше,
если одинаковое число молей того и другого вещества
нагреть от 296 до 300 К при постоянном давлении?
1.5. Рассчитайте изменение внутренней энергии при
испарении I кмоль муравьиной кислоты при 373 К,
пользуясь данными справочника.
1.6. Рассчитайте (Дж) разницу между тепловыми
эффектами при постоянных давлении и объеме (Qp—Qv)
реакции СН3СНО(г) +И2=С2Н5ОН(ж), протекающей
при 298 К. Чему будет равна эта разница, если
температуру поднять до 400 К и спирт перевести в газообразное
состояние?
2.1. Сформулируйте закон Гесса.
2.2. Стандартная теплота образования жидкого
бензола при 298 К равна 49,04 кДж/моль. Напишите уравнение
реакции, к которой относится этот тепловой эффект.
2.3. В каком из следующих четырех процессов работа
расширения наибольшая:
а) 1 кмоль С02 расширяется изотермически при 300 К
от 10 до 100 м3;
б) 1 кмоль Н2 расширяется изотермически при 1000 К
от 10 до 100 м3;
в) 4 кмоль С02 расширяются изобарически при
нагревании от 300 до 550 К;
г) 2 кмоль Н2 расширяются изобарически при
нагревании от 300 до 1300 К?
2.4. Температурная зависимость теплоты образования
сульфида ртути выражается уравнением
АЯ= —10393 — 4,627Г 4- 15,9-10-3^2 — 18,49-10-6. Гз.
Выведите уравнение зависимости ДСР=/(Г) для этой
реакции.
2.5. Рассчитайте тепловой эффект реакции CuS04+
+ 5H20 = CuS04-5H20 при 291 К, пользуясь данными
П
справочника об интегральных теплотах растворений
солей.
2.6. При 298 К и давлении 1,0133-105 Па испаряются
1 г воды и 1 г метанола. Рассчитайте, для какого из этих
веществ и на сколько потребуется больше теплоты на
испарение, пользуясь справочными данными.
3.1. Что называется тепловым эффектом химической
реакции?
3.2. В идеальном состоянии 1 моль газа изобарически
нагревается от Т\ до 7V На-
АН пишите формулу для расче-
VTa изменения энтальпии
газа в этом процессе, если
теплоемкость в данном
интервале температур постоянна.
3.3. При 298 К сера
сгорает до SO3. Какая величина
больше для этой реакции —
~ изменение внутренней
энергии &U или изменение эн-
Рис. 1 тальпии ЛЯ?
3.4. На рис. 1 приведена
зависимость теплового эффекта некоторой химической
реакции от температуры. Каков вид и взаимное
расположение кривых зависимости теплоемкости конечных
продуктов и исходных веществ в данном интервале
температур от температуры?
3.5. При 373 К конденсируется 0,430 кг водяного пара.
Теплота испарения воды 2253 кДж/кг. Вычислите рабо-*
- ту, тепловой эффект и изменение внутренней энергии при
конденсации данного количества водяного пара, считая,
что пар подчиняется закону идеального газообразного
состояния.
3.6. Рассчитайте тепловой эффект реакции СО+ЗН2=
^СН4 + Н20(г), протекающей при 1200 К и постоянном
объеме, пользуясь справочными данными. Считать, что
теплоемкость всех веществ в интервале от 298 до 1200 К
постоянна.
4.1. Напишите уравнение (в дифференциальной
форме) зависимости теплового эффекта химической реакции
при постоянном давлении от температуры.
12
4.2. В изолированной системе протекает реакция
сгорания водорода с образованием жидкой воды. Изменятся
ли внутренняя энергия и энтальпия системы?
4.3. Если 2 моль гелия нагреть на 1° в закрытом
сосуде объемом 1 м3, то чему будет равна работа этого про*
цесса?
4.4. Теплоты испарения D20 п Н20 при 298 К
соответственно 45,41 и 44,00 кДж/моль. Можно ли ожидать, что
при некоторой температуре Т (298<Г<7кр) теплоты
испарения этих веществ станут равными?
Аргументируйте ответ.
4.5. При 300 К газ в идеальном состоянии
изотермически и обратимо расширяется от 10~2 до 10-1 м3. Количе*
ство поглощенного при этом тепла 17,26 кДж. Сколько
молей газа участвует в этом процессе?
4.6. Рассчитайте тепловой эффект образования AIF3
из простых веществ при 500 К и 1,0133* I05 Па. В
интервале 298 — 500 К величину ДСР можно принять
постоянной.
5.1. Как рассчитать теплоту сгорания органического
соединения, располагая данными по теплотам
образования различных веществ?
5.2. Как зависит тепловой эффект химической реакции
от температуры и чем определяется характер этой зави-*
симости?
5.3. Согласно первому закону термодинамики теплота
есть функция процесса. Закон Гесса утверждает, что
тепловой эффект химической реакции не зависит от пути
процесса. Дайте объяснение этому противоречию.
5.4. Одинаковое число молей двух газов X и Y в иде«
альном состоянии изотермически сжимается от Vi до Vz-
Температура обоих газов одинакова, но теплоемкость
газа X в 1,5 раза меньше теплоемкости газа Y. Напишите
формулу для расчета работы этого процесса и укажите,
для какого из этих газов работа расширения А будет
больше.
5.5. Определите работу, совершаемую одним молем
одноатомного газа в идеальном состоянии при
адиабатическом расширении, если температура газа понизилась
при этом на 50°.
5.6. Определите изменение энтальпии при нагревании
0,064 кг газообразного метилового спирта от 300 до 700 К,
13
пользуясь данными справочника. Проведите наиболее
точное решение. 1
• 6.1. В интервале температур 273—298 К удельная теп«
лоемкость графита больше удельной теплоемкости алма
за на 215 Дж/кг-град. Как изменится тепловой эффект
реакции перехода графита в алмаз при повышении тем*
пературы от 273 до 298 К?
6.2. В каких случаях для химической реакции можно
пренебречь разницей между АН и AU?
6.3. Для некоторой химической реакции изменение
теплоемкости как функции температуры выражается
уравнением АСР = Аа+АЬТ+АсТ2. Величины Да, АЬ и Ас
больше нуля. Как будет выглядеть график зависимости
теплового эффекта этой реакции от температуры (в том
температурном интервале, для которого справедливо
данное уравнение)?
6.4. Для какого из следующих веществ — Н20 или
D20 — температурный коэффициент теплоты испарения
при 298 К больше?
6.5. Рассчитайте тепловой эффект {АН) реакции
СН4+С12 = СН3С1 + НС1, если при данной температуре
известны тепловые эффекты (ЛЯ) следующих реакций:
СН4 4- 202 = С02 -Ь 2Н20 — 892,0 кДж
СН3С1 + 3/202 = С02 + Н20 (ж) + НС1 — 687,0 кДж
Н2 -Ъ 1/202 а Н20 (ж) — 286,0 кДж
1/2Н2 + 1/2С12= НС1 — 92,5 кДж
6.6. Рассчитайте молярную теплоту испарения
бензола при 353 К, если при 273 К она равна 32645 Дж/моль.
Средняя удельная темплоемкость газообразного бензола
в этом интервале температур равна 1,25 кДж/кг-град, а
жидкого— 1,72 кДж/кг-град.
7.1. Напишите формулу, показывающую, в каком
соотношении находятся энтальпия и внутренняя энергия
данной термодинамической системы?
7.2. Что называют теплотой сгорания нитрофенола?
7.3. Необходимо как можно более точно рассчитать j
тепловой эффект реакции А + В = С при определенной
температуре. А, В и С — горючие вещества. Имеются
данные по теплотам образования и данные по теплотам
сгорания этих веществ, причем и те, и другие данные
14
приведены с одинаковой степенью точности (например,
:±:50/о). Какими данными следует воспользоваться и
почему?
7.4. Один моль одноатомного газа и один моль
двухатомного газа изобарически нагреваются на 100° С. Для
какого из этих газов работа расширения будет больше?
7.5. Подсчитайте изменение энтальпии при
изобарическом нагревании одного моля газообразного циклогек-
сана от 400 до 500 К. Для решения воспользуйтесь
справочными данными о зависимости теплоемкости от
температуры с учетом коэффициентов а, & и с.
7.6. Рассчитайте тепловой эффект (Дж/кмоль) реак»
ции разложения глюкозы C6Hi206(tb) =2С2НбОН(ж)+
-f 2С02(г) при 298 К и 1,0133-105 Па, пользуясь данными
справочника.
8.1. Один моль газа изобарически охлаждается от Т\
до Т2. Напишите наиболее общее выражение для изме«
нения этальпии газа при этом
переходе. ^/у
8.2. Напишите формулу,
показывающую, в каком
соотношении находятся
величины АН и AV для
химической реакции?
8.3. В каком из процессов
расширения газа в
идеальном состоянии от объема Vi
до объема V2 работа будет
больше: в изотермическом, Рис. 2
адиабатическом или
изобарическом?
8.4. На рис. 2 приведена зависимость теплового
эффекта химической реакции от температуры. Изобразите
графически зависимости сумм теплоемкостей конечных
и исходных веществ этой реакции от температуры.
8.5. Определите стандартную теплоту сгорания дифе-
иила (СбН5)2 при 298 К, пользуясь справочными дан*
ными.
8.6. Рассчитайте, пользуясь справочными данными,
тепловой эффект АН реакции 2С12 + 2НдО(г) -=4НС1 + 02,
протекающей при 798 К в стандартных условиях, сбитая,
что теплоемкости всех веществ — участников реакции в
интервале 298—798 К остаются постоянными.
15
2.2. В каком из следующих процессов:
изотермическом, адиабатическом, изохорическом, изобарическом —
при обратимом их протекании не происходит изменения
энтропии системы?
2.3. В каких случаях термодинамические функции
приобретают свойства термодинамических потенциалов?
%&> При обратимом изотермическом сжатии
некоторого количества газа в идеальном состоянии от давления
Рх до давления Р2 энергия Гиббса G изменилась на
200 Дж. Каково по сравнению с этой величиной будет
изменение энергии Гиббса при подобном же, но
необратимом переходе от Pi до Рг?
2.5. Рассчитайте при помощи данных справочника
Д5° для реакции 2S02 + 02^2S03 при 298 К и сделайте
вывод о направлении самопроизвольного протекания
реакции в этих условиях.
2.6. В результате расширения 20 кг водорода при
300 К объем газа увеличился в 1000 раз. Вычислите
изменение энергии Гиббса (изобарно-изотермического
потенциала) в этом процессе, считая водород идеальным
газом.
3.1. За счет чего совершается максимальная полезная
работа химической реакции при постоянных давлении и
температуре?
3.2. Напишите математическое выражение второго за-*
кона термодинамики для бесконечно малого изменения
состояния в обратимом и необратимом процессах,
протекающих в изолированной системе.
3.3. Как зависит от температуры изменение энергии
Гиббса AG химической реакции? Аргументируйте ответ.
3.4. При изобарическом нагревании 6 моль
одноатомного газа в идеальном состоянии температура
повысилась от Т\ до jT2. В другом случае при изохорическом
нагревании 10 моль одноатомного газа в идеальном
состоянии температура повысилась также от Т\ до Г2.
Укажите, в каком из этих процессов изменение энтропии
больше.
3.5. Нагревают 14 кг азота N2 при 273 К и постоянном
объеме до тех пор, пока его температура не станет
равной 373 К. Рассчитайте изменение энтропии в этом
процессе, считая азот идеальным газом. Зависимость
теплоемкости азота при постоянном объеме от температуры
выражается уравнением
18
Cv= 19,56 + 4,27- 10-эГ (Дж/моль-град).
3.6. Рассчитайте величину AG0 при изобарическом
нагревании 1 моль газообразного хлороформа от 310 до
360 К, пользуясь справочными данными и считая
температурный коэффициент энергии Гиббса (изобарно*
изотермического потенциала) величиной постоянной.
4Л. Процесс протекает в условиях постоянства тем*
пературы и давления. Какой термодинамический
потенциал следует выбрать в качестве критерия протекания
самопроизвольного процесса в этих условиях?
4.2. Напишите математическое выражение
зависимости энергии Гиббса (изобарно-изотермического
потенциала) от давления в дифференциальной форме (при
условии, что температура остается постоянной и система
не совершает никакой работы, кроме работы
расширения) .
4.3. Между некоторым исходным состоянием I и
конечным состоянием II осуществляются два перехода.
Один из них протекает обратимо, другой — необратимо.
Известны тепловые эффекты этих процессов: Q06p и
<2необР, причем <2обр><2необР. Каково соотношение между
изменением энтропии AS в том и другом процессе? Что-
больше?
4.4. Жидкость превращается в пар при определенной
температуре и давлении. Каково соотношение между AG
и &F для этого процесса? Напишите соответствующую
формулу.
4.5. Рассчитайте абсолютную энтропию 1 моль воды
при 473 К и 1,0133* 105 Па, пользуясь справочными дан-*
ными. Теплоемкость газообразной воды Ср=
=34,4 Дж/моль*град.
• 4.6. В результате сжатия 16 кг 02 при 400 К давление
увеличилось в 100 раз. Вычислите изменение энергии
Гельмгольца (изохорно-изотермического потенциала),
считая кислород идеальным газом.
5.1. Какие параметры системы необходимо поддержи*
вать постоянными, чтобы по знаку изменения энтропии
можно было бы судить о направлении
самопроизвольного протекания процесса?
5.2. Как изменяется энтропия изолированной системы,
в которой обратимо "кристаллизуется вещество?
19
5.3. В каких случаях можно рассчитать изменение
термодинамических функций (AS, AG, AF, At/, Atf) для
необратимых процессов, используя уравнение для
обратимых процессов?
5.4. Укажите, для какой из систем: I моль Hg; 1 моль
Ь(г); 1 моль N2; 1 моль Ог — энергия Гиббса G быстрее
изменяется вследствие роста температуры вблизи 300 К
при постоянном давлении.
5.5. Рассчитайте изменение энтропии AS для
100-кратного обратимого расширения 1 моль газа в идеальном
состоянии при постоянной температуре. Изменится ли и
как величина AS, если расширение провести
необратимо?
5.6. Рассчитайте стандартные изменения энтропии и
энергии Гельмгольца (изохорно-изотермического потен-*
циала) при 298 К для реакции 4Ж)+6Н20(ж) =
=4NH3 + 502, пользуясь справочными данными.
6.1. Напишите уравнение, связывающее
максимальную работу, температурный коэффициент максимальной
работы и тепловой эффект процесса при постоянном
давлении.
6.2. Равновесная система состоит из трех частей,
каждая из которых обладает определенной энтропией: Su
S2, S3. Как можно выразить энтропию системы в
целом?
6.3. При изотермическом расширении 1 моль идеаль*
ного газа в первом опыте объем увеличился от 2 до 4м3,
а во втором опыте — от 500 до 1000 м3. Укажите, в каком
из опытов изменение энтропии больше?
6.4. В условиях постоянства температуры и давления
стремление системы к равновесию определяется
величиной и знаком AG. В то же время процессы могут быть
как экзотермическими, так и эндотермическими, а
энтропия может увеличиваться или уменьшаться. Что с этой
точки зрения будет способствовать полноте протекания
самопроизвольного процесса при постоянных
температуре и давлении?
6.5. Рассчитайте абсолютную энтропию 1 моль
жидкой воды при 274 К и 1,0133-105 Па, пользуясь справоч*
ными данными. Теплоемкость воды в интервале 274—
298 К считать постоянной.
6.6. При температуре кипения 329,7 К и давлении
1,0133-105 Па испаряется 1 моль ацетона, а затем изо-
20
1ермич6ски расширяется До Давлений 1,0133 -104 Па.
Рассчитайте, величину AG в этом процессе.
7.1. К какему значению стремится энтропия
правильно образованного кристалла при приближении
температуры к абсолютному нулю?
7.2. Какой термодинамический потенциал следует
выбрать в качестве критерия направления реакции, если
она протекает в закрытом автоклаве при постоянной
температуре? Каково условие самопроизвольного
течения процесса, выраженное при помощи этого потенциала?
7.3. Укажите, чему равно изменение энергии Гиббса
AG и энергии Гельмгольца AF при равновесном
испарении 1 моль жидкости при температуре Т, если
образующийся пар подчиняется законам идеальных газов.
7.4. Для какой цели вводится понятие о
термодинамических потенциалах?
7.5. Рассчитайте изменение энтропии при нагревании
8 кг метана от 300 до 500 К при постоянном давлении.
Воспользуйтесь справочными данными, считая, что
зависимость теплоемкости метана от температуры
выражается уравнением Cv=a+bT.
7.6. Рассчитайте изменение энергии Гиббса AG при
298 К в стандартных условиях для реакции Щкр) +
+ 02(г) =иОг(кр), пользуясь справочными данными.
Возможно ли принципиально получение U02 (кр) по
этой реакции в указанных условиях?
8.1. Как энергия Гельмгольца (изохорно-изотермиче-
ский потенциал) системы зависит от ее объема при
постоянной температуре (если единственный вид работы —
работа расширения)? Напишите математическое
выражение этой зависимости.
8.2. При каких постоянных термодинамических
параметрах изменение энтальпии АН может служить
критерием направления самопроизвольного процесса? Какой
знак АН в этих условиях указывает на
самопроизвольный процесс?
8.3. Какой знак будет иметь величина AG для
процесса перехода жидкого бензола пои 273 К в твердое
состояние при той же температуре? Температура
плавления бензола равна 278,5 К. Какое состояние бензола —
жидкое или твердое — является более устойчивым при
273. К?
21
8.4. При изотермическом расширении 1 моль
идеального газа объем изменился от V\ до V%. Укажите, у какой
из перечисленных термодинамических функций: энергии
Гиббса (изобарно-изотермического потенциала),
энтропии или внутренней энергии — в этих условиях будет
наблюдаться максимальное изменение.
8.5. Под давлением 1,96-105 Па нагревают 2-10~3 м3
аргона до тех пор, пока его объем не увеличится до
12* 10~"3 м3. Каково изменение энтропии в этом процессе,
если начальная температура была 400 К?
8.6. Для реакции Н2 + С12^2НС1 (все вещества
газообразные) изменение энергии Гиббса при 298 К AG
равно — 190,5 кДж. Рассчитайте величину AG для этой
реакции при 348 К, пользуясь справочными данными и считая,
что изменение энтропии в ходе этой реакции не зависит
от температуры.
9.1. Какие условия необходимо соблюдать, чтобы
максимальная работа в системе совершалась за счет убыли
энергии Гиббса G?
9.2. Как изменяется энергия Гельмгольца (изохорно-
изотермический потенциал) при изотермическом сжатии
газа в идеальном состоянии?
9.3. Укажите, для какой из приведенных систем в
идеальном газовом состоянии свободная энергия быстрее,
изменяется при увеличении объема при постоянной
температуре:
А Б В Г
I МОЛЬ Н2 1 М0ЛЬН9 1 МОЛЬ 02 1 МОЛЬ 02
Р -100 Па Р=ШПа Р=-1 Па Р^ОД Па
9.4. Укажите, в каких процессах и при каких условиях
изменение энтропии может быть равно работе процесса.
9.5. Определите изменение энтропии в процессе
перехода 1 кмоль FeS из а- в р-кристаллическую
модификацию, если переход совершается при 411 К, а теплоты
образования a-FeS и p~FeS соответственно равны —95,4
и —91,0 кДж/моль.
9.6. Рассчитайте величину AF при изобарно-изотерми-
ческом испарении 1 моль Н20 при 373 К и давлении
1,0133-105 Па.
ЮЛ. Как энергия Гиббса G системы зависит от
температуры при постоянном давлении (при условии, что
22
единственный вид работы — работа расширения)?
Напишите математическое выражение этой зависимости.
10.2. Изменится ли и как величина AG процесса, если
при переходе от начального состояния к конечному сна-»
чала провести его обратимо, а затем необратимо?
10.3. Как изменяется связанная энергия системы TS
при нагревании газа и при его конденсации?
10.4. В каком из обратимых процессов с 1 моль
идеального газа изменение энтропии будет наибольшим:
1) изобарическое нагревание от 300 до 400 К; 2) изохо-
рическое нагревание от 300 до 400 К; 3) изотермическое
расширение от 300 до 400 м3; 4) адиабатическое
расширение от 300 до 400 м3?
10.5. Определите изменение энтропии при смешении
2,3 г этилового спирта при 343 К и 5,75 г этилового
спирта при 163 К. Теплоемкость спирта считать постоянной
и равной 111,4 Дж/моль-град. Принять, что изменение
объема в процессе смешения равно нулю.
10.6. Определите изменение энергии Гиббса (изобар*
но-изотермического потенциала) при равновесной
конденсации 1 кмоль водяного пара при 373 К и давлении
1,0133-105 Па, если теплота испарения воды равна
40,7-106 Дж/кмоль, а изменение энтропии воды при
испарении 109 • 103 Дж/кмоль-град.
ГЛАВА IV. МОЛЕКУЛЯРНАЯ СТАТИСТИКА.
СТАТИСТИЧЕСКАЯ ТЕРМОДИНАМИКА
1.1. Напишите формулу, связывающую внутреннюю
энергию идеального газа (U—U0) с суммой состояний Z.
1.2. Нарисуйте в координатах NifN~f(j) график,
показывающий характер распределения молекул по враща*
тельным квантовым уровням /.
1.3. Молекулы РС13 и NH3 имеют сходную пирами*
дальную структуру и одинаковое число
внутримолекулярных колебаний. Однако при 298 К теплоемкость Cv РСЬ
на 36,4 Дж/моль-град больше теплоемкости аммиака.
Объясните причину этого.
1.4. При нагревании двухатомного газа его изохор*
ная колебательная теплоемкость растет и достигает клас*
сического предела, равного величине /?. Теплоемкость
какого из следующих газов: С12, 0% и F2 — при нагрева*
23
нии растет быстрее, т. е. достигает классического преде*
ла при более низкой температуре?
1.5. Определите долю двухатомных молекул, находя*
щихся на низшем колебательном уровне при 1000 К, если
характеристическая колебательная температура для
этой молекулы равна 500 К.
1.6. Вращательная постоянная молекулы НВг равна
1,68-10~22 Дж, Рассчитайте вращательную сумму
состояний молекулы НВг, вращательные составляющие
внутренней энергии и теплоемкости 1 моль НВг при 300 К
и постоянном объеме.
2.1. Напишите формулу, связывающую теплоемкость
газа в идеальном состоянии при постоянном объеме Cv
с суммой состояний Z.
2.2. Какие молекулярные константы необходимо знать
для вычисления колебательной составляющей энергии
Гельмгольца (F—F0) двухатомного газа при данной
температуре и давлении статистическим методом?
2.3. Пользуясь справочными данными, оцените, какая
из следующих молекул имеет наибольшее значение
вращательной составляющей суммы состояний при 400 К:
СО, НВг, НС1, N2.
2.4. Теплоемкости при постоянном давлении D2, HD,
Н2 и НС1 при 1000 К соответственно равны 31,66; 30,71;
30,59 и 31,24 Дж/моль-град. Расположите эти вещества в
порядке возрастания характеристической температуры 6.
2.5. Пользуясь справочными данными, определите
U—и0 (кДж/моль) газообразного иода при 342 К, если
характеристическая температура иода равна 308 К.
2.6. Определите долю молекул HI (%), находящихся
на нулевом вращательном уровне при 300 К, пользуясь
справочными данными.
3.1. Напишите формулу, связывающую энтальпию
идеального газа (Я—Я0) с суммой состояний Z.
3.2. Напишите формулу, связывающую вращательную
составляющую суммы состояний с параметрами
состояния и молекулярными константами двухатомных моле^
кул.
3.3. Волновые числа внутримолекулярных колебаний
сероводорода равны 2722, 2739 и 1214 см-1. Какое из
этих колебаний будет давать больший, а какое —
меньший вклад в величину колебательной составляющей теп-
84
Лоемкости при 1000 К? Расположите воЛновые Числа В
порядке убывания вклада.
3.4. При сравнении вращательных составляющих теп*
лоемкости газообразных 12 и HF обнаруживается, что
для 12 она постоянна, начиная уже с нескольких граду*
сов абсолютной шкалы температур, а для HF растет и
достигает предельного значения лишь около 100 К. В чем
причина этого?
3.5. Волновое число одного из деформационных
колебаний молекулы РС13 равно 189 см-1. Пользуясь
справочными данными, рассчитайте вклад этого колебания в
сумму состояний и в теплоемкость 1 моля РС13 при 544 К.
3.6. Определите долю двухатомных гомоядерных
молекул, находящихся при 1000 К на десятом вращательном
уровне (/=10), если вращательная составляющая
суммы состояний равна 55, энергия вращения молекулы на
этом уровне равна 1,38- Ю-20 Дж.
4.1. Нарисуйте в координатах Ni/N=f(v) график, по-
казывающий характер распределения молекул но коле-
бательным квантовым уровням v.
4.2. Напишите формулу для расчета доли молекул на
вращательном уровне с квантовым числом / (ZBp —
вращательная составляющая суммы состояний, В — враща-
тельная постоянная).
4.3. Характеристическая температура газообразных
Кг и 12 соответственно равна 134 и 308 К. Какой из этих
газов даст больший вклад колебательной энергии в
общий запас внутренней энергии при 298 К?
4.4. Молекула N20 линейная, а молекула N02
изогнутая. Колебательная составляющая теплоемкости N20
больше из-за дополнительной степени свободы
колебательного движения. В то же время молярные
теплоемкости обоих газов при 254 К равны. В чем причина этого?
Оцените величину разности колебательных
составляющих теплоемкостей N20 и NO2.
4.5. Определите общую сумму состояний для
молекулы F2 при 500 К и 1,0133-105 Па, если ZnocT = 3,16-107,
£Кол=1,07, статистический вес основного электронного
состояния £оэл = 2, а вращательная постоянная равна
1,75-Ю-23 Дж.
4.6. Для некоторой двухатомной молекулы сумма
состояний определяется уравнением
lnZ*=20,94- 1пР + 3,51пГ.
25
Рассчитайте энтальпию (Н—//п) 1 моль данного
двухатомного газа при Р= 1,0133-10s Па и Г=1000 К.
5.1. В чем главный недостаток классической теории
теплоемкости?
5.2. Зависит ли и как сумма состояний от
температуры?
5.3. Почему доля молекул, расположенных на коле^
бательных уровнях, падает с ростом колебательного
квантового числа от 0 до v> а доля молекул,
находящихся на вращательных уровнях, проходит через максимум
с ростом вращательного квантового числа от 0 до /?
5.4. Сопоставьте величины вращательной составляю-;
щей теплоемкости газообразных С2Н4 и Н20 при 298 К.
Что больше?
5.5. Определите величину ое (см-1) молекулы Li*2,
пользуясь справочными данными, если эксперимент дает
величину Cv этого вещества в газообразном состоянии
при 1010 К 28,924 Дж/моль-К.
5.6. Для некоторой двухатомной молекулы сумма
состояний при 1000 К равна 1010. Рассчитайте энергию Гиб-
бса (G—G0) 1 моль данного двухатомного газа.
6.1. Напишите формулу, связывающую энергию Гиб-
бса (G—Go) с суммой состояний.
6.2. Зависит ли и как характеристическая
колебательная температура от температуры газа?
6.3. Молекулы СС14 и СН4 имеют одинаковое строение
(правильный тетраэдр) и одинаковое число
внутримолекулярных колебаний. Однако при 298 К теплоемкости
этих веществ в газообразном состоянии сильно
отличаются. Укажите, какое из этих веществ обладает большей
теплоемкостью и объясните причину этого.
6.4. Для молекулы окиси углерода при 278 К
вращательная составляющая суммы состояний равна 4-Ю4, а
наибольшее число молекул (8,57%) находится на
вращательном уровне с квантовым числом 7. Как изменятся
сумма состояний и число молекул на этом уровне при
повышении температуры?
6.5. Определите ZEp для F2 при 300 К, если при 500 К
ZBP= 197,4.
6.6. Определите колебательные составляющие
внутренней энергии и энтропии (в расчете на моль) газооб-
26
разной серы S2 при 500 К, пользуясь справочными
данными.
7.1. Какие из термодинамических функций: U—С/о,
Н—Но, S, F—F0i G—G0 — можно рассчитать, если извест*
на только величина суммы состояний для данных
условий, но отсутствует уравнение зависимости суммы состоя*
ний от температуры?
7.2. Как изменяется число молекул на нулевом
колебательном уровне при повышении температуры?
7.3. Вращательные составляющие суммы состояний ге-
тероядерной молекулы (1) и гомоядерной молекулы (2)
равны при одинаковой температуре. В каком
соотношении находятся их вращательные постоянные?
7.4. Пятиатомная молекула XY4 имеет 4 типа колеба*
ний, характеристические температуры и степени
вырождения которых приведены ниже:
Колебание . . v\ v2 v3 v4
6, К . 650 300 1150 400
Степень вырождения . . 1 2 3 3
Оцените, какое из этих колебаний дает наибольший вклад
в теплоемкость газа XY4 при 1000 К. Воспользуйтесь
таблицей термодинамических функций Эйнштейна.
7.5. Доля невращающихся молекул НС1 при 300 К
составляет 0,051. Определите долю невращающихся
молекул НС1 при 510 К.
7.6. Рассчитайте Ср и U—С/о 1 моль кислорода при
1510 К, пользуясь справочными данными о молекулярных
константах кислорода.
8.1. Напишите общее математическое выражение для
суммы состояний,
8.2. Какой вклад (Дж/моль-К) в общую изохорную
теплоемкость газа дает согласно классической теории
одна степень свободы молекулярного движения?
8.3. При сравнении теплоемкости двуокиси углерода
и двуокиси серы при 300 К обнаружено, что колебатель*
ная теплоемкость С02 превышает таковую для БОг. В то
же время общая теплоемкость при этой температуре для
SO2 больше, чем для СОг. В чем причина этого?
8.4. Почему для двухатомных молекул СО и N2 при
почти равных моментах инерции (различие менее 5%)
27
и при одной и той же температуре вращательная
составляющая суммы состояний отличается почти в два раза?
8.5. Пользуясь справочными данными, определите
Ое (см-1) молекулы DI, если (U—(/0)кол этого вещества
в газообразном состоянии при 1180 К равна
3,075 кДж/моль.
8.6. Рассчитайте
энтропию 1 моль двухатомного
газа, занимающего объем
4,15 м3 при 500 К, если
сумма состояний в этих
условиях равна 1010, а тангенс угла
наклона касательной к
кривой зависимости \gZ = f(T)
(рис. 3) при этой температур
Рис 3 ре и постоянном объеме ра*
вен 5,55-10~3 град-1.
9.1. Укажите, какими свойствами вещества и пара*
метрами состояния определяется поступательная
составляющая суммы состояний для газа в идеальном состоя*
НИИ.
9.2. Чему равна электронная составляющая суммы
состояний, если электроны не возбуждены?
9.3. Зависит ли и как колебательная составляющая
суммы состояний от частоты колебаний атомов в молеку*
ле при данной температуре?
9.4. Молекула HI, находящаяся на вращательном
уровне с /=7, и молекула СО, находящаяся на враща*
тельном уровне с /=13, имеют одинаковую энергию вра*
щения. В каком количественном соотношении находятся
степени вырождения g для этих молекул на указанных
уровнях?
9.5. Рассчитайте теплоемкость S02 при постоянном
объеме и 433 К, пользуясь справочными данными.
9.6. Какая доля (%) общего числа двухатомных ге«
^ероядерных молекул при 1000 К будет находиться на
первом колебательном уровне (а = 1), если молекулу рас-»
рматривать как гармонический рсщцл.ятор с частотой
колебаний 4,7» Ш18 С""1?
ЮЛ, В кшш количественном соотношении вводятся
величины электронной, поступательной, вр&щетельной и
колебательной КОДЗДЯкнщгх руцц тстдтий доя дауу*
. атомной молекулы при комнатной температуре, если ос-*
I новной электронный уровень не вырожден?
i 10.2. Напишите формулу, связывающую энтропию га-
i за с суммой состояний.
I Ю.З. Объясните, почему при 298 К темплоемкость С„
| РС13 равна 68,74, а теплоемкость Cv C2H2 равна
i 35,62 Дж/моль«К, хотя оба газа четырехатомные.
I 10.4. Вращательная постоянная молекулы НС1 равна
I 10,6 см~!, а та же величина для молекулы СО составляет
i 1,93 см-1. Для какой из этих молекул вращательная со-:
I ставляющая энергии Гельмгольца (F—F0) при одинаков
I вой температуре будет больше?
| 10.5. Пользуясь справочными данными, рассчитайте
i колебательные составляющие теплоемкости Cv и энергии
Гельмгольца (F—Fq) 1 моль двухатомного газа при 300 К,
если собственное волновое число для молекул этого газа
равно 2775-102 м"1.
10.6. Определите вращательную составляющую суммы
состояний молекулы С02 при 500 К, если межъядерное
расстояние в этой молекуле rc-o=U13«10~!0 м.
ГЛАВА V. ФАЗОВОЕ РАВНОВЕСИЕ
В ОДНОКОМПОНЕНТНЫХ СИСТЕМАХ
i
! 1.1. Что называется насыщенным паром жидкости?
5 1.2. Чему равно число термодинамических степеней
[" свободы С однокомпонентной системы, содержащей жид*
I кую и твердую фазы в состоянии равновесия?
(1.3. Что такое тройная точка на диаграмме состояния
однокомпонентной системы?
, 1.4. Под давлением 26,6-103 Па циклогексан и этил-
Ц ацетат кипят при одинаковой температуре. Почему при
U нормальном давлении температура кипения циклогекса*
Г на выше температуры кипения этилацетата на 3,6°?
[ 1.5. Вычислите теплоту испарения хлора при нормаль*
■ ной температуре кипения (взять из справочника), если
давление насыщенного пара над жидким хлором опре*
делается уравнением
[ Р (Па) ~3§58.306 - 3.37-1043Г + 80,ИИ,
I
я
1.6» При 1,01 «lO6 Па и температуре плавления S34.3IE
жидкая ртуть имеет плотвость 13,63 г/ем3, а твердая***
> И|Ш г1щК Р|.сещтайте- температуру щщцпрая ртути
при давлении 3,78-107 Па, если теплота плавления равна
9,74 Дж/г.
2.1. Что называется «составляющей» системы?
2.2. Каково общее термодинамическое условие
фазового равновесия?
2.3. Как зависит давление насыщенного пара над
твердым телом от температуры?
2.4. Требуется графически рассчитать теплоту
испарения жидкости при заданной температуре. Нарисуйте
график, которым необходимо пользоваться, и напишите
соответствующую расчетную формулу.
2.5. Давление насыщенного пара над H2SO4 при
451 К равно 666 Па, а при 485 К — 2666 Па. Чему равно
давление насыщенного пара над серной кислотой при
473 К?
2.6. Рассчитайте изменение энтропии при
изотермическом испарении 0,0332 кг СВг4 при нормальном
давлении, если зависимость давления насыщенного пара от
температуры выражается уравнением
\g P (Па) = 10,89 — 2665/Г.
3.1. Что называется компонентом системы?
3.2. Представьте диаграмму состояния воды (диаграмм
му равновесия фаз) в координатах Р=!{Т).
3.3. Чему равно число термодинамических степеней
свободы С однокомпонентной системы в тройной точке?
3.4. При изменении внешнего давления температура
кипения жидкости меняется. Какой из записей
а) Д//нсп = 62,5-103 — 12,5Г (Дж);
б) Д//исв = 36,61Г + 19,14 lg T (Дж);
в) Д//„сп=89,12Г (Дж)
можно выразить зависимость теплоты испарения от
температуры кипения и почему?
3.5. Зависимость температуры плавления нафталина
от давления выражается уравнением
t (°С) = 79,8 + 3,7- 10-7Я -1- 1,88.10-пра
(давление выражено в Паскалях). Разность удельных
объемов жидкого и твердого нафталина равна 0,146 см3/г.
Рассчитайте теплоту (Дж/г) плавления нафталина при
давлении 5,07* 106 Па.
30
3.6. До Какого значения нужно снизить давление, что-
бы температура кипения диэтиланилина упала до 463 К,
если в нормальных условиях он кипит при 489 К, а сред-»
няя теплота его испарения 48,5 кДж/моль?
4.1. Что называется фазой?
4.2. Какими точками начинается и кончается кривая
зависимости давления насыщенного пара жидкости от
температуры?
4.3. Нормальные температуры кипения бензола,
нафталина и четыреххлористого углерода соответственно
равны 353,3, 491,1 и 349,9 К. В каком соотношении нахо-^
дятся для этих веществ молярные величины ASHCn при
нормальной температуре кипения?
4.4. Зависимость давления насыщенного пара ртути
от температуры выражается уравнением
IgP(na)= —3276/Г — 0,652 IgT + 12,1.
Выведите уравнение зависимости теплоты испарения
ртути (Дж/моль) от температуры.
4.5. Определите среднее изменение внутренней энер-»
гии при испарении 0,0179 кг хлороформа в интервале
313—333 К, если нормальная температура его кипения
равна 334,5 К, а при давлении 5,33-104 Па он кипит при
315,9 К.
4.6. Определите молярный объем (м3/кмоль) жидкого
дейтерия при 18,65 К, если при этой температуре dPjdT—
=4,1-106 Па-град-1, теплота плавления АЯПл =
= 196 Дж/моль и молярный объем кристаллического
дейтерия ККр=2,05-10-2 м3/кмоль,
5.1. Что называется числом термодинамических сте-<
пеней свободы системы?
5.2. Представьте график температурной зависимости
теплоты испарения жидкости вплоть до критической тем*
пературы.
5.3. Как изменяется температура плавления вещества
с ростом давления?
5.4. Объясните при помощи уравнения Клапейрона —
Клаузиуса, почему давление насыщенного лара над
жидкостью растет при увеличении температуры.
5.6. На какую величину изменится энтропия 1 моль
хлорпикрина CC13N03 при его испарении при 303 К, если
в 1 л воздуха при 303 К содержится 262,6 мг, а при
31
288 К содержится 127,4 мг хлорпикрина в виде насыщен*
ных паров? Теплоту испарения в интервале 288—303 К
считать постоянной.
5.6. Определите температурный коэффициент давле--
ния насыщенного пара dP/dT над жидким толуолом
при 305 К, пользуясь справочными данными. Теплоту
испарения в интервале 298—305 К считать постоянной.
6.1. Что называется температурой кипения?
6.2. Объясните при помощи уравнения Клапейрона —
Клаузиуса, почему давление насыщенного пара над
твердой фазой всегда растет при увеличении температуры.
6.3. Объясните, почему при нагревании на воздухе
лед плавится, а кристаллический иод возгоняется.
6.4. При нормальном давлении температуры кипения
трифторхлорметана и циклогексана почти одинаковые.
Теплота испарения циклогексана вдвое больше теплоты
испарения трифторхлорметана. Будут ли эти жидкости
кипеть при одинаковой температуре при перегонке под
вакуумом, если создать одинаковое разрежение? Если
температуры кипения будут разные, то для какого
вещества /кип будет выше?
6.5. Зависимость давления насыщенного пара фреона
CCI2F2 от температуры выражается уравнением
Ig Р (Па) = 34,5 - 2406,ЦТ — 9,26 lg Г + 0,003774
Рассчитайте при 298 К давление насыщенного пара и из*
менение энтропии при испарении 1 моль фреона при этой
температуре.
6.6. Определите, на какую величину надо повысить
давление, чтобы ртуть плавилась при 236,3 К, если при
температуре тройной точки (234,3 К) теплота плавления
А#пл = 2266 Дж/моль, а молярные объемы твердей и
жидкой фаз соответственно равны 14,14 и 14,65 см3/моль.
ГЛАВА VI. ИДЕАЛЬНЫЕ РАСТВОРЫ
(РАЗБАВЛЕННЫЕ* И СОВЕРШЕННЫЕ)
1.1. Имеется разбавленный раствор летучего вещест^
ва в жидком летучем растворителе. По какому закону
* Считать, что разбавленные растворы подчиняются законам
бесконечно разбавленных растворов и растворенное вещество, если это
особо не оговорено, не летучее.
32
изменяется давление насыщенного пара растворенного
вещества как функция его концентрации в растворе?
1.2. Напишите математическое выражение для
общего давления насыщенного пара над двухкомпоиентным
совершенным раствором, если N\ и iV2 — молярные доли
компонентов, Рх° и Р2° — давления насыщенного пара
над чистыми компонентами.
1.3. Укажите, какими свойствами растворителя или
растворенного вещества определяется величина
эбуллиоскопической постоянной.
1.4. В каком соотношении находятся величины
осмотического давления двух водных 0,005 М растворов
глюкозы и сульфата натрия?
1.5. Рассчитайте абсолютную энтропию совершенного
раствора, образованного смешением 0,092 кг этилового
спирта и 0,096 кг метилового спирта при 298 К и
нормальном давлении. Воспользуйтесь справочными
данными.
1.6. Понижение давления насыщенного пара над
водным раствором нитрата натрия по сравнению с чистой
водой при 293 К равно 0,963 Па. Давление насыщенного
пара воды при этой температуре 2338 Па. Раствор
содержит 0,0849-10~3 кг нитрата натрия в 0,1 кг воды.
Рассчитайте понижение температуры замерзания
раствора, если при 273 К теплота плавления льда 6,0166
' кДж/моль.
2.1. Как определяют константу Генри в уравнении
P2=kN2 при данной температуре?
2.2. В каком соотношении находятся молярные
энтропия, энтальпия и энергия Гиббса (изобарно-изотермиче-
ский потенциал) индивидуальных веществ, с одной
стороны, и соответствующие парциальные молярные
величины компонентов совершенного бинарного раствора-—
с другой?
2.3. При 315 К давление насыщенного пара над этил-
ацетатом и над циклогексаном одинаково.
Одинаковое количество молей нелетучего вещества растворено
в одинаковом по массе количестве циклогексана и этил-
ацетата. Будут ли и как отличаться понижения давления
насыщенного пара АР над этими растворами?
2.4. Как изменяется энергия Гиббса (изобарно-изо-
I термический потенциал) системы при растворении
сахара в воде при постоянных температуре и давлении?
2—786 33
2.5. Определите, пользуясь справочными данными, на
какую величину понизится давление насыщенного пара
над 1 кг воды при 298 К, если в ней растворить
17,1-10-8 кг А12(504)з. Кажущуюся степень диссоциации
соли принять равной 0,5.
2.6. Раствор, содержащий 10~3 кг нелетучего
вещества с молекулярной массой 186 в 0,1 кг воды, замерзает на
0,10° ниже температуры замерзания растворителя. Крио-
скопическая постоянная воды равна 1,86. Определите
степень диссоциации растворенного вещества, учитывая,
что каждая его молекула в растворе может распадаться
иа три частицы.
3.1. Имеются два раствора одинаковой концентрации
в летучем растворителе. В одном растворе растворенное
вещество летучее, в другом — нелетучее. Различается ли
и как давление насыщенного пара над этими растворами?
3.2. Как изменяется величина понижения давления
насыщенного пара (APi) разбавленного раствора
нелетучего вещества в летучем растворителе при повышении
температуры?
3.3. Различаются ли молярная энтропия
индивидуального вещества SJ и парциальная молярная энтропия его
(Si) как компонента совершенного раствора? Какая
величина и насколько больше?
3.4. Как влияет ассоциация растворенного вещества
на давление насыщенного пара над разбавленным
раствором нелетучего вещества в летучем растворителе?
3.5. Определите изменение энергии Гиббса (изобарно-
изотермического потенциала) А(3См при образовании
совершенного раствора смешением 0,234 кг бензола с
0,368 кг толуола при 300 К.
3.6. Температура замерзания чистого бензола выше
температуры замерзания раствора, содержащего
0,2242- 10-3 кг камфоры и 30,55-10~3 кг бензола, на
0,246°. Теплота плавления бензола при температуре за-»
мерзания равна 9,8 кДж/моль. Определите молекулярную
массу камфоры.
4.1. Имеются летучий растворитель, разбавленный
раствор нелетучего вещества и разбавленный раствор
летучего вещества с той же концентрацией. Какая из этих
систем будет иметь наибольшую температуру кипения и
почему?
34
4.2. Криоскопическпе постоянные воды, бензола и
камфоры соответственно равны 1,86; 5,16; 40,00. Какой
из этих растворителей предпочтительнее для наиболее
точного определения молекулярной массы нелетучего
вещества криоскопическим методом и почему?
4.3. В каком соотношении находятся молярные объем,
внутренняя энергия и энергия Гельмгольца (изохорно-
изотермический потенциал) индивидуальных веществ, с
одной стороны, и соответствующие парциальные
молярные величины компонентов совершенного бинарного
раствора — с другой?
4.4. Как зависит растворимость газов в жидкостях от
температуры?
4.5. Гексан и гептан при любых концентрациях
образуют раствор, подчиняющийся закону Рауля,
Рассчитайте парциальные молярные энтропии гексана и гептана
в растворе, образованном смешением 0,080 кг гептана и
0,100 кг гексана при 298 К и нормальном давлении.
Воспользуйтесь справочными данными.
4.6. Удельная теплота испарения воды при
нормальной температуре кипения равна 2255 кДж/кг.
Определите повышение температуры кипения водного раствора,
■ содержащего 0,005 моль растворенного нелетучего веще-
f ства в 0,200 кг воды.
5.1. Как зависит давление насыщенного пара
разоренного летучего вещества от температуры?
5.2. Как влияет диссоциация растворенного вещества
\ на давление насыщенного пара над разбавленным
раствором нелетучего вещества в летучем растворителе?
5.3. Какие из следующих утверждений:
а) закон Рауля соблюдается для каждого компонента
| раСТВОра: Pi = Pi°Ni; б) AVcNCiucinui===0; в) Д5смешешш = 0;
г) А (^смешения=0; д) ДЯСМсшсшш = 0 — справедливы для
совершенного бинарного раствора при постоянной тем-
f, пер ату ре?
5.4. Кажущиеся степени диссоциации водных 0,01 М
'= растворов хлорида калия, нитрата меди, сульфата алю-
¥ миния и трихлорида лантана одинаковы. Расположите
J» растворы этих веществ в порядке увеличения темпсрату-
( ры кипения при атмосферном давлении.
5.5. Подсчитайте осмотическое давление 0,05 М
раствора Na2S04 при 300 К, если кажущаяся степень
диссоциации сульфата натрия а—0,8.
| 2*
•А'
35
5.6. Бензол и толуол образуют совершенный раствор.
При 303,2 К Давление насыщенного пара бензола равно
1,602-104 Па, а толуола —0,486-104 Па. Определите
давление насыщенного пара раствора, если он получен
смешением 0,100 кг бензола с 0,100 кг толуола.
ГЛАВА VII. РЕАЛЬНЫЕ РАСТВОРЫ
1.1. Приведите математическое выражение
парциальной молярной величины в общем виде, используя
обозначения: L — экстенсивное свойство раствора; L — интен-
Рис. 4
снвное свойство раствора; rti — число молей данного
компонента в растворе.
1.2. Какова связь между коэффициентами активности
компонентов бинарного раствора в соответствии с
законом Гиббса — Дюгема? Напишите соответствующее
математическое выражение.
1.3. Общий вид зависимости парциального молярного
объема ацетона от молярной доли хлороформа в
бинарном жидком растворе ацетон — хлороформ представлен
на рис. 4. Изобразите графически характер зависимости
парциального молярного объема хлороформа от
молярной доли его при постоянных Р и Т.
1.4. В одном сосуде находится летучий растворитель,
в другом — концентрированный раствор нелетучего
вещества в этом растворителе. Оба сосуда накрыты общим
колпаком, изолирующим их от внешней среды, и термо-
статированы. Изменится ли концентрация раствора по
прошествии достаточно большого периода, например
через сутки? Почему?
36
I 1,5- Давление насыщенного пара 10%-ного раствора
NaN03 в воде при 273 К равно 589,3 Па. Определите ак-
| тивность и относительный химический потенциал воды в
растворе при данной температуре. Воспользуйтесь
справочными данными.
1.6. Для системы Н2О—NaCl зависимость общего
объема от состава выражается уравнением
Гобщ- 55,511^0 + lM«NaCi +2,5*4ct — 1 -2«NaCi •
где Уияо—молярный объем воды, см3; т — моляльносгь
раствора. Вычислите парциальные молярные объемы
NaCl и Н20 в растворе с концентрацией 3 моль NaCl на
1,000 кг Н20.
2.1. Что называется парциальной молярной энергией
Гиббса d компонента раствора?
2.2. Каким уравнением может быть выражена (прпб-
| лиженно) летучесть газа при сравнительно невысоких
давлениях (5-1О6Ла)?
2.3. В 20%-ном водном растворе метилового спирта
парциальный молярный объем и парциальная молярная
энтропия метилового спирта имеют следующие значения:
Fch8oh=38 см3/моль; £сн3он = 143,9 Дж/моль-град. Как
■ меняется с ростом температуры химический потенциал
метилового спирта в этом растворе при постоянном
давлении? Напишите соответствующее уравнение и дайте
краткое объяснение.
2.4. Каково термодинамическое условие
самопроизвольного образования истинного раствора при постоян-
;: ных Р и 7?
2.5. Для раствора ацетона в эфире с молярной долен
t ацетона Л/(сн3)асо=0,4 при 303 К парциальное давление
У ацетона составляет 1,973-104 Па, а давление над чис-
I тым ацетоном — 3,772* 104 Па. Константа Генри для это-
К го раствора равна 7,838-104 Па. Рассчитайте коэффиин-
I; ент активности ацетона в этом растворе, считая стандарт-
в ным: а) состояние ацетона в чистом виде (условие 1);
ж б) состояние ацетона в бесконечно разбавленном раство-
Щ ре (условие 2).
I 2.6. Относительные химические потенциалы хрома и
К никеля в растворе Сг—Ni, содержащем 26,8 масс.% Сг,
ж при 1473 К соответственно равны —13 000 и —65000
f Дж/моль. Определите максимальную полезную работу
Ж образования 1 моля этого раствора.
I- 37
64000
1д<х^-804Дж/моль
Рис. 5
3.1. Укажите, какие значения (положительные,
отрицательные или равные нулю) может принимать
парциальный молярный объем компонента раствора.
3.2. Что называют молем раствора?
3.3. Каков термодинамический смысл коэффициента
активности компонента в растворе?
3.4. Как меняется активность компонента раствора
при повышении общего давления? Напишите
соответствующее математическое выражение.
3.5. На рис. 5 представ-
-АН,Дж лены зависимость
интегральной теплоты
растворения H2SO4 в воде от
числа молей воды при
291 К и тангенс угла
наклона касательной к
кривой зависимости при
ящо—Ю. Определите
парциальную молярную
теплоту растворения
кислоты для раствора,
содержащего 1 моль кислоты в
10 моль воды.
3.6. Давления насыщенных паров над чистыми
кадмием и цинком и над раствором Cd—Zn, содержащим
16,3 масс.% Zn, при 955 К равны P°d-0,374-105 Па;
^0zn=6,21.103 Па; PCd=0,305.105 Па; Рип=3,88-103 Па.
Определите максимальную полезную работу образования
1 моля этого раствора.
4.1. Что называется активностью компонента
раствора?
4.2. Приведите математическую запись
термодинамического условия равновесия в многокомпонентной
системе при постоянных Р и Т, пользуясь обозначениями: |х —
химический потенциал; П — термодинамический
потенциал; G — энергия Гиббса; 5 — энтропия.
4.3. Зависимость химического потенциала компонента
А в растворе А—В от состава выражается уравнением
^A-^ + /?Tlni\rA-i-ciV2B.
Выведите уравнение зависимости относительной
парциальной молярной энтропии этого компонента от состава
раствора.
38
4.4. Зависит ли и как активность компонента
раствора от температуры? Напишите и проанализируйте
соответствующее уравнение.
4.5. Зависимость давления насыщенного пара (Па)
от температуры чистого магния и магния над раствором
Mg—Ni с концентрацией никеля 23,6 масс.%
описывается уравнениями:
6560
Ig/»-—^+9.723;
lgP=_^ +9,599;
Рассчитайте парциальную молярную энтропию
растворения магния.
4.6. Парциальные молярные энтропии и теплоты
растворения компонентов в твердом растворе Ni—Au,
содержащем 80 мол.% Ni, равны Д#ш=2390 Дж/моль; ASm=
= 2,86 Дж/моль-град; Д#Аи=28150 Дж/моль; ASau=
= 28,30 Дж/моль-град. Определите максимальную
работу образования 1 моля раствора этого состава и
укажите, возможно ли образование раствора этого состава при
873 К.
6.1. Напишите уравнение Гиббса — Дюгема,
связывающее общее свойство L с парциальными свойствами L%
компонентов раствора и числом молей каждого
компонента Пи
5.2. Зависит ли активность от принятого способа
выражения концентрации?
5.3. Зависимости парциальных молярных теплоты и
энтропии растворения Fe от состава раствора Fe—Ni
описываются уравнениями:
AtfFe = — 2095JV§, (Дж/моль);
A5Fe = — Я 1л NFe (Дж/мол ь • град) -
Выведите уравнение зависимости химического
потенциала железа от состава раствора.
5.4. Может ли активность компонента бинарного
жидкого раствора быть меньше его рациональной (т. е.
выраженной через мольную долю N{) концентрации?
Почему? Дайте объяснения. (В парах компоненты образуют
идеальную газовую смесь.)
39
5.5. Плотность водно-спиртового раствора,
содержащего 60 масс.°/о СН3ОН, равна 894,6 кг/м3, а
парциальный молярный объем воды в нем— 16,8 см3/моль.
Вычислите парциальный молярный объем спирта в этом
растворе.
5.6. На рис. 6 представлена зависимость теплоты
образования растворов Au—Sn от состава при 873 К.
Касательная к кривой в точке при Л^п = 0>6 отсекает на
АН,
кДж/моль
8,8
Аи 0,6 Sn
Рис. 6
правой оси ординат отрезок, соответствующий
5,6 кДж/моль. Рассчитайте теплоту растворения Аи в
данном растворе, если теплота образования раствора
составляет 8,8 кДж/моль.
ГЛАВА VIII. РАВНОВЕСИЕ ЖИДКОСТЬ — ПАР
В ДВУХКОМПОНЕНТНОЙ СИСТЕМЕ
1.1. Определите состав пара, находящегося в
равновесии с жидкостью, содержащей 30% пентана (рис. 7).
1.2. Сформулируйте первый закон Коновалова.
1.3. Выведите формулу, показывающую соотношение
между составом жидкости и составом равновесного пара,
считая, что данная система (рис. 7) подчиняется закону
Рауля во всем диапазоне концентраций (Nc6ult и М?вн14 —
молярные доли гексана в жидкости и в паре;
Рсвн14—Давление насыщенного пара над чистым гексаном; Р —
общее давление в системе).
1.4. Каков характер отклонения от закона Рауля для
системы, приведенной на рис. 7?
40
1.5. Рассчитайте количество молей жидкости и пара,
находящихся в равновесии при 60° С, если система
содержит 6 моль С5Н12 и 14 моль СеНн (рис. 7).
1.6. Определите температуру начала кипения
раствора, содержащего 172 кг СбНи и 216 кг С5Н12 (рис. 7).
2.1. Укажите температуры начала и конца
конденсации системы, содержащей 80% Н20 (рис. 8). Каков
состав первых капель жидкости в начале конденсации?
70
60
50
40
JO
ы,
w4 t»
' . ^ к
^ ■ ч §S
•ц ™»S^
^ Ч
S. ^ ^
*> ^ ь-
Ц. гЧ
s Nl
Ч L
"^Jj 'k
4 s?V
ч
—'••' ' 1 *■-*' '—i-l 1 1 { 1 Li-L.
О 20 40 60 80 100
C6!lt4 Соста6,мол. % C5Ht2
О 20 40 60 80 100
Н20 Состоб, мол.% CHjCOOH
Рис. 7
Рис. 8
2.2. Какие фазы и какого состава находятся в
равновесии, если система, состоящая из 2 моль СНзСООН и
2 моль Н20, нагрета до 105°С (рис. 8)?
2.3. Как изменится состав пара над жидкостью,
содержащей 20% Н20, если к ней прибавить некоторое
количество СНзСООН (рис. 8)?
2.4. Сколько степеней свободы имеет система,
содержащая 100% СНзСООН при 118° С? Какие параметры
состояния можно менять, не нарушая фазового
равновесия в этой системе (рис. 8)?
2.5. Вычислите в массовых процентах состав раствора
(рис. 8), который начинает кипеть при 105,7° С.
2.6. Нагреты до 107° С 15 моль парожидкостной смеси,
общий состав которой 55 мол.% СН3СООН и 45 мол.%
Н20 (рис. 8). Определите, сколько граммов уксусной
кислоты будет содержаться в жидкости при этой
температуре.
41
3.1. В каком фазовом состоянии находится система,
содержащая 40% эфира при 66° С (рис. 9)?
3.2. При какой температуре начнется кипение систе*
мы, содержащей 60% ССЦ (рис. 9)? Каков при этом
будет состав пара?
3.3. Пользуясь одним из законов Вревского,
определите, как изменится состав пара над жидкостью
определенной концентрации, если повысить давление над системой
(рис. 9). Считать, что парциальная молярная теплота
испарения каждого компонента пропорциональна его
температуре кипения.
J0
0 2040 60 80 W0
с2н50С2н5 Состав, мол % ссц
Рис. 9
tt°C
60
75
70
65}
60
—
\
!
(-
|.
*
'Л
0 20 40 60 80 100
CzH50H Состо6,мол.% ССЦ
Рис. 10
3.4. На основании приведенной диаграммы (рис. 9)
дайте заключение о тепловом эффекте взаимодействия
С2Н5ОС2Н5 с ССЦ.
3.5. Определите массу пара и массу жидкости, если
1 кг жидкости, содержащей 30 мол.% СС14, нагрет до
60°С (рис.9).
3.6. Определите, какое минимальное количество и
какого компонента нужно добавить к 1 кг системы,
содержащей 40 мол.% ССЦ при 50°С (рис. 9), чтобы началось
кипение без изменения температуры.
4.1. При какой температуре полностью исчезнет
жидкая фаза в процессе нагревания системы, содержащей
15 мол.% ССЦ (рис. 10)?
4.2. Сформулируйте второй закон Коновалова.
4.3. Смесь спирта и четыреххлористого углерода
неизвестного состава начинает кипеть «при 70° С (рис. 10).
42
Определите ее состав, если при добавлении к ней
нескольких миллилитров спирта температура начала
кипения понизилась до 67° С.
4.4. Укажите число компонентов К, фаз Ф и степеней
свободы С для системы, содержащей 62,5% СС14 при
63,5° С (точка минимума на рис. 10).
4.5. Сколько молей спирта перейдет в пар, если
систему, содержащую 20 моль спирта и 20 моль четыреххло-
1 истого углерода, нагреть до 65° С (рис. 10)?
4.6. Какой компонент и в каком количестве (кг)
можно выделить в пределе в чистом виде при ректификации
50 кг смеси, содержащей 20 масс.% спирта (рис. 10)?
130
125
120
115
110
т
100
05 \
00
85
Г"
/!
1
_
/
L
|—
ш
А
*
L
?
L
г-
/
_
"
?
л
U
—
1-
"
э
'
^
k
L
1
■
f
и
г-
d
>
—
^
и
\
L
...
•т
V,
^
_
г-
tf
-
1
\
__
-
S
L
/»
*
ц
w
л
_
■
<
^
,
\
.j
г
[>
\
—
-
Р,
L
П
*
Ч|
N
—
к
у
\
\
\
\
О
tizo
20 40 60 80 WO
Состод, мол. % HNOj
Рис. II
5.1. Укажите на
диаграмме точки (запишите их коор- t,cC
динаты), где в равновесии
находятся две фазы
одинакового состава (рис. 11).
5.2. Каков будет в
пределе состав дистиллята и
кубового остатка в результате
ректификационной
перегонки раствора, содержащего
85% Н20 (рис. 11)?
5.3. Пользуясь законами
Вревского, определите,
изменится ли и как состав азеот-
ропной смеси и состав пара
над жидкостью, содержащей 60% HNOs (рис. 11), если
давление над системой повысить, например, от 105 до
10 Па, Считать, что парциальная молярная теплота
испарения каждого компонента пропорциональна его
температуре кипения.
5.4. Исходя из данной диаграммы кипения (рис. 11),
сравните величину сил взаимодействия между
одноименными и разноименными частицами в растворе
HNO3 + H2O.
5.5. Рассчитайте количество пара (кг), которое
получится при нагревании 10 кг раствора, содержащего
30 мол. % Н20, до 115°С (рис. 11).
5.6. Какого компонента и какое количество (кг)
нужно добавить к смеси, содержащей 2 моль HN03 и 8 моль
Н20, чтобы получить азеотропную смесь (рис. 11)?
43
ГЛАВА IX. РАВНОВЕСИЕ ТВЕРДОЕ ТЕЛО — ЖИДКОСТЬ
В ДВУХКОМПОНЕНТНОЙ СИСТЕМЕ
1.1. По диаграмме плавкости (рис. 12) сделайте
заключение о взаимной растворимости данных веществ в
твердом и жидком состояниях.
1.2. Какие фазы находятся в равновесии в условиях,
обозначенных точками /, 2, 3, 4 на рис. 12? Укажите их
состав.
1.3. Чему равно число степеней свободы в точках 1
2, 3, 4 на рис, 12?
1.4. Каковы температуры начала и конца кристалли-
0 20 40 60 80 100
Слна Состаб, мол.% изо~£5Ип
Рис. 12
i Op
L. L
500
400
300
WO
wo
•N
„J
T z г
\ ■
~4~1 -
I
L_l__ jt
j \
S r-,i- - ~C -
TV J\ Г Г Г Г "Ntf
- -4- - -
. _ Л)
— — ' '
О 20 40 60 80 fit?
А Состаб, мо/1. % b
Рис. 13
зации, если систему, содержащую 70% С3Н8, охлаждать
от 20 до —50° С (рис. 12)? Каков состав первых
выпавших кристаллов?
1.5. Нарисуйте в координатах температура — время
общий вид кривой охлаждения для системы, содержащей
50 мол.% C5Hi2 (рис. 12), в температурном интервале от
20 до —40° С. Отметьте наиболее характерные точки. *
1.6. Смесь массой 0,55 кг, содержащая 40 мол.% С5Н12,
находится при —5° С (рис. 12). Сколько килограммов
жидкого раствора и сколько килограммов твердого
раствора находится в этой смеси?
2.1. По диаграмме плавкости (рис. 13) сделайте
заключение, изоморфно или неизоморфно кристаллизуются
компоненты А и В. Уточните ответ, указав диапазон
концентраций.
44
2.2. Какие фазы находятся в равновесии в условиях,
обозначенных точками /, 2, 3,4 и 5 на рис. 13?
2.3. Система в твердом состоянии, содержащая 4 моль
В и 6 моль А, нагревается от 100 до 600° С (рис. 13).
Укажите, при каких температурах система гомогенна.
2.4. Система, содержащая 80% А, нагревается,
начиная с 100° С (рис. 13). Укажите температуры начала и
конца плавления, а также состав первых капель
жидкости. При каком содержании компонента А (%) система
имеет наиболее низкую температуру плавления?
2.5. Нарисуйте в координатах температура — время
общий вид кривой охлаждения для системы, содержащей
80 мол.°/о В (рис. 13), в температурном интервале от
500 до 100° С. Отметьте наиболее характерные точки.
2.6. Определите, какой компонент и в каком
количестве выделится в твердом состоянии при охлаждении
0,500 кг смеси, содержащей 80 мол.% В (рис. 13), от
400 до 250° С; AfA« 100; AfB= 120.
3.1. Приведите полное название диаграммы,
изображенной на рис. 14.
3.2. Укажите температуры начала и конца плавления
систем, содержащих: а) 20% В; б) 50% В; в) 55% В;
г) 60% В (рис. 14).
3.3. В каких из обозначенных на диаграмме фазовых
областях или точках существует твердая эвтектика
(рис. 14)? Укажите качественный состав твердой
эвтектики.
3.4. Жидкий расплав, содержащий 60% А,
охлаждают, начиная с 900°С (рис. 14). При какой температуре
начнут выпадать кристаллы химического соединения, и
при какой — кристаллы компонента В?
3.5. Определите число степеней свободы в точках /,
2, 3, 4 на рис. 14.
3.6. Какое минимальное количество (кг) и какого
компонента нужно добавить при 400° С к системе,
содержащей 200 моль и имеющей состав 60 масс.% В (рис.
14), чтобы она полностью расплавилась без повышения
температуры? МА—80, Мв=40?
4.1. Из анализа диаграммы (рис. 15) сделайте вывод
об устойчивости химического соединения, образованного
CaSi03 и BaSi03. Укажите его состав и верхний
температурный предел существования в твердом состоянии.
45
4.2. Укажите температуры начала и конца плавления
системы, содержащей 50% BaSi03 (рис. 15). Каков
состав первых капель расплава?
4.3. Какие фазы находятся в равновесии в условиях,
обозначенных точками /, 2, 3, 4 и 5 на рис. 15?
4.4. Укажите, при охлаждении каких по составу
расплавов можно получить чистую кристаллическую соль
СЯ$Ю3 (рис. 15).
и°с-
С 20 40 60 SO W0
А Состав, месс. % б
О 20 40 60 SO W0
Casi03 Состав,масс. % 6oSLD3
Рис, 14
Рис. 15
4.5. Нарисуйте в координатах температура — время
,06Щнп ©ид кривой охлаждения для системы, содержащей
§0 маос.% ВаЗЮз (р'ис. 15), в температурном интервале
of H40 до 1200° С. Отметьте наиболее характерные
Т(1ЧКИ.
4.6. Какое максимальное количество (кг) CaSi03 мож-
{10 прибавить к 246 моль расплава, содержащего
4(1 Масс.% BaSiOs, при 1480° С, чтобы система осталась
0днофазной (рис. 15)? MCaSi03=H6, MBasio,=213.
5.1. На основании диаграммы температура — состав
для системы Bi—Pb (рис. 16) сделайте заключение о
рзаимной растворимости компонентов в твердом и
жидком состояниях.
5.2. Какие фазы находятся в равновесии в условиях,
обозначенных точками 7, 2, 3, 4 на рис. 16?
5.3. Укажите температуры начала н конца плавления
системы, содержащей 95% свинца (рис. 16). Каков состав
[(ервых капель жидкости?
^
№
5.4. При каких концентрациях висмута в системе,
нагретой до 113° С, можно получить твердый раствор
Bi—Rb (рис. 16)? Как изменяется растворимость в
твердом состоянии при понижении температуры?
5.5. Покажите на диаграмме (рис. 16) стрелками
изменения составов фаз при охлаждении системы,
содержащей 95 масс.% висмута, от 300 до 25° С.
О
ы
20 40 60 80 100
Состой,масс, % РЬ
- Рис. 16
5.6. Какие фазы находятся в равновесии в системе,
содержащей 80 масс.% свинца, при 50°С и каково их
количество (кг), если общее число молей в системе 242
(рис .16)? Аш = 209, Арь = 207.
ГЛАВА X. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
1.1. Какие факторы влияют на константы равновесия
Ар и /Сс, если реагирующую систему рассматривать как
идеальную?
1.2. Как влияет температура на константу равновесия
Ар? Что является мерой этого влияния? Напишите
соответствующее уравнение.
1.3. КР есть константа равновесия реакции 3/гИ2 +
+ /2N2 = NH3, а Кр—константа равновесия реакции
3H2+N2 = 2NH3. Будет ли различие в величинах К? и
Л'р при одинаковой температуре? Напишите
математическое соотношение между К'р и /<р.
47
1.4. Выразите в общем виде /СР и /Сс для реакции
СО + 2Н2==СН3ОНгаз, если при данной температуре Т и
общем давлении в системе Р равновесное количество
молей метанола равно х, а начальные количества
компонентов, взятых для реакции, составляют 1 моль СО и 3 моль
Н*
1.5. Диссоциация четырехокиси азота протекает по
уравнению N204 = 2N02. При 298 К и Р=1,0-105 Па
N2O4 диссоциирована на 18,5%. Определите степень
диссоциации при той же температуре, если Р = 0,5-105 Па.
1.6. Пользуясь справочными данными о приведенном
изобарно-изотермическом потенциале
С
и
и значе-
•J
нии ДЯо, рассчитайте константу равновесия реакции
N2+02=2N0 при 1000 К.
2.1. Как изменится равновесный выход водорода по
уравнению реакции CH4+2H2S==CSH-4H2 при повыше-
2»Л !
с
LgKp
Т
1/Т
Рис. 17
Рис. 18
нии общего давления в системе, если все вещества
находятся в идеальном газовом состоянии?
2.2. Напишите уравнение изотермы для реакции
Н2+Вг2=2НВг (все вещества в идеальном
газообразном состоянии).
2.3. Для некоторой химической реакции зависимость
энтальпий исходных веществ и конечных продуктов от
температуры представлена графически на рис. 17. Как
влияет повышение температуры на константу равновесия
этой реакции? Аргументируйте ответ.
2.4. Выразите в общем виде величину Кс для реакции
2S03=:2S02+02j если диссоциации подвергаются п моль
SO3. Общий объем равновесной смеси V, а степень
диссоциации S03 равна а.
48
2.5. Для реакции N204 = 2N02 при 328 К Kv =
= 1,38-105 Па. Сколько молей N204 следует поместить в
сосуд емкостью 1 м3, чтобы при наступлении равновесия
концентрация N02 в нем была 0,1 моль/м3?
2.6. Для реакции 2S03 = 2S02+02 AG6gok=82,1 кДж.
Определите степень диссоциации S03 при 600 К, если
общее давление равновесной смеси 0,5-105 Па (0,5 атм).
(При расчете принять, что сс<С1.)
3.1. Зависимость lg/Cp некоторой реакции от обратной
температуры представляет прямую линию (рис. 18).
Экзотермическая или эндотермическая эта реакция?
3.2. Что является мерой стандартного сродства
химической реакции при постоянных Р и Г?
3.3. Газообразные вещества реагируют по уравнению
1/2А+2В = С. Выразите для этой реакции /(р через
равновесное количество вещества С, равное х моль, если
для реакции было взято 2 моль А и 1 моль В при общем
равновесном давлении Р.
3.4. Теплота образования РС15(тв) в стандартных
условиях при 298 К равна —463,5 кДж/моль. Как нужно
изменить давление и температуру, чтобы увеличить
равновесный выход пентахлорида фосфора в реакции его
образования?
3.5. Рассчитайте константу равновесия реакции
2Ag(TB) + V202=Ag20(TB) при 298 К, если давление
диссоциации Ag20 при этой температуре равно 5,-Ю-9 Па.
3.6. На основании уравнения зависимости константы
равновесия реакции Н2+С12 = 2НС1 от температуры
(взять из справочника) вычислите тепловой эффект этой
реакции при 1000 К.
4.1. Зависит ли и как константа равновесия
химической реакции Кс и /(р, протекающей в идеальном
газообразном состоянии, от концентрации реагирующих
веществ?
4.2. Для каких реакций константа равновесия Кр
равна равновесному давлению в системе при данной
температуре?
4.3. В какую сторону сместится равновесие в реакции
СОС12 = СО + С12 при добавлении к равновесной системе
инертного газа при постоянном общем давлении?
4.4. Для реакции ,N2+02=2NO зависимость
константы равновесия от температуры выражается уравнением
49
9490,7 т _
lg/<P= — —^ 0,02 lg Г + 1,43.
Выведите уравнение зависимости теплового эффекта
этой реакции от температуры.
4.5. В вакуумированный сосуд объемом 1 л помещено
5,96-10~3 моль твердого иода. При нагревании иод возог-
нался и частично диссоциировал. При 973 К в сосуде
установилось давление 0,497» 105 Па. Рассчитайте
константу равновесия Кр реакции 12(газ) =21 (газ) при этой
температуре.
4.6. Определите, пользуясь данными справочника,
степень превращения углекислого газа по уравнению
реакции С02 + Н2=СО + Н20, если в сосуд постоянного
объема при 298 К было введено 44 кг С02 и 2 кг Н2.
5.1. В каком соотношении находятся величины Kv н
Кс для реакции S2(tb)+4Н20(газ) =2Б02(газ) +
+4Н2(газ)?
5.2. Зависит ли и как константа равновесия /Ср
химической реакции, протекающей в идеальном газообразном
состояний, от количества молей веществ, участвующих
в ней?
5.3. При 1000 К протекают реакции диссоциации:
2hci:£h2 + ci2 (1)
2Н20 5t 2H2 + 02 (2)
Изменятся ли и как степени диссоциации HCI и Н20
при повышении общего давления? Почему?
5.4. Общее давление в равновесной системе
NH4C1(tb) =NH3(ra3) +НС1(газ) равно Р, Выразите
константу равновесия /Ср этой реакции через общее
давление.
5.5. Константа равновесия Кр реакции Са(ОН)2=
= СаО + Н20(газ) при 772 К равна 0,4-105 Па, а при
807 К — 0,8*105 Па. Считая величину теплового эффекта
реакции постоянной в интервале температур от 750 до
810 К, рассчитайте КР этой реакции при 750 К.
5.6. Для реакции РС15(газ) =РС13(газ) 4-С12(газ) при
523 К ^р = 1,80-105 Па. Чему равна степень диссоциации
PCI5 при этой температуре и общем давлении в системе
1,80-105 Па?
ЦП
6.1. Напишите математическое соотношение между
величинами Кр и Кс для химической реакции. Какая из
этих величин больше?
6.2. Напишите уравнение, связывающее стандартное
о
сродство AGt и константу равновесия Кр при
постоянных Р и Т, если давление выражено в паскалях.
6.2. Как скажется на равновесном выходе веществ С
и D разбавление реакционной смеси инертным газом с
одновременным увеличением общего давления в системе,
где протекает следующая
реакция в газовой фазе: igfy
VsA+B-VeC+D?
"6.4.*Зависимость lg Д'р=
=/(1/Г) представлена на
рис. 19 прямой линией.
Какое заключение можно
сделать о знаке и характере
температурной зависимости „__
АН в данном интервале тем- //г
ператур? Как при помощи
графика определить величи- Рис° ,9
ну ЛЯ? Напишите
расчетную формулу.
6.5. Рассчитайте, пользуясь справочными данными,
стандартное сродство AG m для реакции 2NO+02=2N02
и определите направление ее самопроизвольного
протекания в стандартных условиях.
6.6. При некоторой температуре общее равновесное
давление в системе NH4C1 (тв) = NH3 (газ) + НС1 (газ)
равно 0,50-103 Па. Рассчитайте Кр этой реакции при
данной температуре (Па2).
7.1. Для некоторой химической реакции в газовой
фазе при постоянных Р и Т AGT>0. В каком
направлении самопроизвольно протекает эта реакция?
7.2. Изменится ли и как значение константы
равновесия /Ср реакции А + 2В = АВ2, если общее давление в
системе увеличить, например, в 2 раза? Все вещества
находятся в идеальном газообразном состоянии.
7.3. Зависимость константы равновесия реакции
2С12+2Н20(газ) =4НС1 + 02 от температуры можно
выразить следующим уравнением: Ig/(p = —6007/Г+5,407.
Выделяется или поглощается тепло в этой реакции?
51
7.4. Имеются экспериментальные данные о значениях
константы равновесия /\р при разных температурах.
Укажите, какой график нужно построить и какой формулой
воспользоваться, чтобы рассчитать истинный тепловой
эффект реакции при определенной заданной
температуре Гь
7.5. Рассчитайте, пользуясь справочными данными,
константу равновесия Хр (Па-1) реакции SO2+CI2—
= S02C12 при 298 К- Все вещества в идеальном
газообразном состоянии.
7.6. Определите, пользуясь справочными данными,
значение температурного коэффициента константы
равновесия dlnKp/dT для реакции СО+СЬ = СОС12 при
298 К.
8.1. Выразите константу равновесия /Ср реакции
2S02-f02=2S03 через равновесные парциальные
давления реагирующих веществ.
8.2. Укажите, какие из факторов: Р, Т, присутствие
инертного газа, природа реагирующих веществ,
парциальные давления Р{ — взятых для реакции веществ
влияют на константу равновесия реакции /Ср, если она
протекает между веществами в идеальном газообразном
состоянии.
8.3. Степень диссоциации НВг не зависит от давления,
но в то же время увеличивается с ростом температуры.
Объясните эти факты.
8.4. Сопоставьте равновесный выход продуктов двух
химических реакций, протекающих в одинаковых
условиях (Р и Т) в газовой фазе А+В=АВ (1) и C + D = CD
о о
(2), если AGi первой реакции больше Д62 второй
реакции.
8.5. Рассчитайте, пользуясь справочными данными, по
методу Темкина — Шварцмана значение стандартного
сродства AG° реакции Н2=2Н при 1000 К. В какую
сторону пойдет эта реакция в стандартных условиях при
данной температуре?
8.6. При смешении 1 моль вещества А с 1 моль
вещества В в результате химической реакции А + 2В = АВ2
в равновесной смеси образовалось 0,2 моль вещества
АВ2. Рассчитайте константу равновесия Кр этой реакции
при общем давлении 105 Па, если все вещества
находятся в идеальном газообразном состоянии.
52
9.1. Какая из констант равновесия /Ср или Кс больше
для реакций в газовой фазе Н2+С12=2НС1 и СО+С12=
«сось?
9.2. Укажите условие, при котором для расчетов
можно пользоваться уравнением
К2 LH ( \ 1 \
9.3. Для некоторой эндотермической реакции тепловой
эффект с ростом температуры увеличивается. Каков
общий вид графической зависимости lg/Cp от Т для этой
реакции?
9.4. Водяной пар (1 моль) диссоциирует по уравнению
НгО^Нг+УгОг. Выразите константу равновесия 7(р
через степень диссоциации а и общее давление в системе
Р. Изменится ли и как константа равновесия, если общее
давление реагирующей смеси увеличить вдвое (система
идеальная) ?
9.5. После того как некоторое количество молей
газообразного NOC1 было введено в сосуд при 500 К, в
системе установилось равновесие: 2NOCI^2NO + Cl2.
Общее давление в сосуде 105 Па, а парциальное равновес-
о
ное давление NOC1 равно 0,64-105 Па. Определите ДОбоо
для указанной реакции.
9.6. Для реакции С6Н5С2Н5(газ) +ЗН2=
= С6НцС2Н5(газ) в интервале температур 450—600 К
справедливо уравнение
lg /Ср = 9620/Г — 18,041 (КР в атм-2).
Рассчитайте температуры, при которых эта реакция
может быть осуществимой, если исходная смесь имеет
состав (мол.%): С6Н5С2Н510, Н2 50 и СбНцСгНЬ 40, а
общее давление 1 атм.
10.1. Зависит ли и как константа равновесия 7(р
реакции С02=СО + 7202 от давления и температуры, если
система идеальная?
10.2. Можно ли и в каких случаях по знаку изменения
энтальпии в ходе химической реакции судить о
возможности ее протекания при постоянных Т и Р?
10.3. Суммы состояний веществ, участвующих в
реакции С0 + 2Н20 = СН30Н(газ), при стандартном давлении
и некоторой температуре Т равны Zco, Zh2 и 2сн,он.
Тепловой эффект гипотетической реакции при 0 К равен
53
Д#о- Выведите формулу для расчета константы
равновесия реакции Kv.
10.4. При 298 К теплота образования СН3С1(газ)
равна —82,0 кДж/моль, а теплота образования
СН3Вг(газ) составляет —35,6 кДж/моль. Укажите: а) как
зависит от температуры константа равновесия той и
другой реакции, б) для какой из этих реакций константа
равновесия сильнее изменяется при изменении
температуры вблизи 298 К.
10.5. Стандартное сродство AGg73 химической,
реакции СО+Н20=С02+Н2 равно *— 25,6-103 Дж/моль.
Определите константу равновесия этой реакции при
373 К.
10.6. При 767 К и общем давлении 0,99-105 Па
двуокись азота диссоциирована по уравнению 2N02=
= 2NO+02 на 56,5%. Определите давление, при
котором степень диссоциации двуокиси азота будет
равна 80%.
ГЛАВА XI. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
1.1. Что называется числом переноса иона?
Напишите связь между числами переноса катионов и анионов и
скоростями их движения.
1.2. Какие два свойства разбавленных растворов
сильных электролитов типа 1—1 изменяются
пропорционально корню квадратному из моляльной концентрации (а,
а, X, Хсо, lg у» к, п) ?
1.3. Выразите константу полной диссоциации угольной
кислоты Н2С03 через степень диссоциации а и общую
концентрацию электролита С.
1.4. Какие ионы обладают наибольшей подвижностью
в водных растворах и почему?
1.5. Рассчитайте среднюю ионную моляльность т±
водного раствора LaBr3, если моляльность солп в воде
т = 0,2.
- 1.6. Раствор слабой кислоты НА при 298 К и
разведении 32 л имеет эквивалентную электропроводность
9,2 Ом-1-см2-г-экв"1, а при бесконечном разбавлении она
равна 389 Ом"1-см2-г-экв-1. Рассчитайте концентрацию
ионов водорода в этом растворе и константу диссоциации
кислоты.
54
2.1. Напишите формулу, связывающую удельную
электропроводность к, константу ячейки ф и
сопротивление раствора электролита Rx.
2.2. Меняется ли и как константа диссоциации
электролита с ростом диэлектрической проницаемости
растворителя, если сравнивать растворители, близкие по
свойствам?
2.3. Эквивалентная электропроводность при
бесконечном разведении раствора уксусной кислоты в 1,5
раза больше такой же электропроводности гидроокиси
аммония. Растворы 0,1 н. СНзСООН и 0,05 н. NH4OH
имеют одинаковую эквивалентную электропроводность.
Каково соотношение степеней диссоциации этих
электролитов в данных растворах? (Что больше: си —
степень диссоциации кислоты или с*2— степень диссоциа-
г\ ции основания?)
* 2.4. Какой объем 0,15 н. раствора нужно залить в со-
# суд с электродами на расстоянии 1 см, чтобы измеренная
электропроводность была эквивалентной
электропроводностью этого раствора?
* 2.5. Зависимость константы диссоциации масляной
кислоты С3Н7СООН от температуры выражается
уравнением
Lg/C= _^^ —0,0137+2,52.
Рассчитайте теплоту диссоциации кислоты при 298 К-
2.6. При 291 К удельная электропроводность
насыщенного раствора хлорида серебра в воде равна
1,37-Ю-6 Ом-1-см-1. Удельная электропроводность воды
при этой температуре равна 4-10-8 Ом-1-см-1.
Вычислите концентрацию хлорида серебра в чистой воде, считая
раствор предельно разбавленным и у±=1-
Воспользуйтесь данными справочника.
3.1. Нарисуйте график зависимости эквивалентной
электропроводности от разведения для сильных и слабых
электролитов.
3.2. Сформулируйте правило ионной силы
(предельный закон Дебая — Гюккеля).
3.3. Какое свойство растворителя является
определяющим в его способности ионизировать растворенное
вещество (помимо его способности к химическому
взаимодействию с этим веществом)?
55
3.4. Меняется ли и как степень диссоциации слабого
электролита в водном растворе с ростом температуры?
Кратко аргументируйте ответ.
3.5. Произведение растворимости AgCl в воде при
298 К равно Ю-10. Какова растворимость этой соли в
воде и до какой величины она изменится при растворении
хлорида серебра в 0,01 т водном растворе КС1?
Воспользуйтесь предельным законом Дебая — Гюккеля.
<j- 3.6. Рассчитайте при 308 К эквивалентную
электропроводность при бесконечном разведении для уксусной
кислоты в воде, если при этой температуре для водных
растворов NaG, HC1 и CH3COONa эквивалентные
электропроводности при бесконечном разведении соответственно
равны:
14,80; 48,75; 10,98 Ом-1-м2-кг-экв~1.
4.1. Напишите уравнение зависимости эквивалентной
электропроводности раствора сильного электролита от
концентрации.
4.2. Какова главная отличительная особенность
электрической схемы для измерения электропроводности
растворов электролитов по сравнению со схемой для
измерения электропроводности проводников первого рода? Чем
вызвано различие в схемах?
4.3. Каковы причины диссоциации электролитов в
растворе на ионы?
4.4. Что такое AS гидратации ионов? Каков знак AS
гидратации и как его можно объяснить?
4.5. Произведение растворимости Ag2Cr04 при 298 К
равно 44- Ю-12. Определите растворимость этой соли при
той же температуре: а) в воде; б) в 0,001 М водном
растворе Na2S04. Для расчета воспользуйтесь уравнением
предельного закона Дебая — Гюккеля.
4.6. Эквивалентная электропроводность раствора мо-
нохлоруксусной кислоты с разведением 512 л/моль при
298 К равна 219,4 Ом-|-см2-г-экв~1. Определите степень
диссоциации кислоты в этих условиях, если
эквивалентная электропроводность монохлоруксуснокислого
натрия при 298 К и бесконечном разведении равна
89,8 Ом_1-см2-г-экв""1. Предельные подвижности ионов
натрия и водорода соответственно равны 50,1 н
349,8 Ом"1-см2т-экв-1.
56
5.1. Как связаны между собой удельная (в Ом-1-см-1)
и эквивалентная (в Ом_1-см2*г-экв-1)
электропроводности-раствора электролита? Напишите формулу.
5.2. Напишите два закона, выведенные Кольраушем
для электропроводности растворов электролитов.
. 5.3. Какие данные об электропроводности раствора
слабого электролита необходимо иметь, чтобы
рассчитать теплоту диссоциации этого электролита?
5.4. Изменится ли и как константа диссоциации
слабого электролита, если в качестве растворителя вместо
воды взять метиловый спирт (при условии, что
химическое взаимодействие между растворенным веществом и
растворителем отсутствует). Дайте объяснение.
-*■ 5.5. Эквивалентная электропроводность циануксусной
кислоты в воде при 298 К при разных концентрациях
равна:
С, моль/л 0,0073<35 0,001856 0,000466 0
Я, Ом-1-см2т-экв-» ... 193,9 282,6 347,0 386,1
Рассчитайте среднее значение константы диссоциации
5.6. Константа диссоциации уксусной кислоты в воде
при 298 К равна 1,8-10~5. Чему будет равна концентрация
ионов водорода и рН раствора, если к 1 л 1 н. раствора
уксусной кислоты добавить 8,2-10~3 кг ацетата натрия?
Считать раствор идеальным; принять, что объем раствора
при введении соли практически не изменится.
6.1. Напишите математическое выражение
предельного закона Дебая — Гюккеля для раствора А1С13.
6.2. Начертите график зависимости удельной
электропроводности электролита от разведения.
6.3. Как изменятся термодинамическая константа
диссоциации Ка и степень диссоциации фенола С6Н5ОН,
если в раствор ввести сильное основание?
6.4. Нарисуйте график зависимости
электропроводность— объем щелочи при кондуктометрическом
титровании смеси муравьиной и соляной кислот. Приведите
электрическую схему установки, которая используется
при кондуктометрическом титровании.
6.5. Определите, пользуясь справочными данными, на
сколько изменится рН раствора НСЮ4 в воде при 298 К,
если концентрацию изменить от 0,1 до 0,5 моль/1000 г
коды.
Б7
6.6. Скорости движения ионов Ыа+иС1-вО,1н.
растворе хлорида натрия в воде при 298 К соответственно
равны 42,6-Ю-5 и 68,0-Ю-5 см2-В"1-с-1. Рассчитайте
удельную электропроводность этого раствора.
7.1. Напишите уравнение, связывающее среднюю
ионную активность а± электролита СиВг2 с активностью
этого электролита а.
7.2. Как изменяется удельная электропроводность
водного раствора слабого электролита с ростом концент*
рации раствора?
7.3. Две одноосновные органические кислоты при не*
которой концентрации имеют разные степени
диссоциации: первая — 0,2, вторая — 0,5. Константа диссоциации
какой кислоты больше и во сколько раз?
7.4. Какие из следующих факторов влияют на
эквивалентную электропроводность электролита: концентрация
С, степень диссоциации а, температура Т, вязкость
раствора т), постоянная сосуда для измерения
электропроводности ф, радиус иона г, площадь электродов S?
t 7.5. Определите средний ионный коэффициент
активности Cdl2 в 0,002 m водном растворе при 313 К, если
при той же температуре и 0,005 m он равен 0,506.
\ 7.6. Удельная электропроводность 1%-ного (по массе)
водного раствора пропионовой кислоты С2НбСООН при
298 К составляет 4,79*10-4 Ом™1-см-1. Считая, что
плотность раствора равна Ю-3 кг/см3, определите рН этого
раствора. Данные о предельных подвижностях ионов
возьмите из справочника.
8.1. Сформулируйте закон разведения Оствальда.
8.2. Величины р/С для хлорной и азотной кислот в
уксусной кислоте как растворителе соответственно
равны 4,95 и 9,38. Какая из этих двух кислот является в
данном растворителе более сильной?
8.3. Как экспериментально найти уменьшение
электропроводности, обусловленное электрофоретическим
торможением?
8.4. Как изменится радиус ионной атмосферы при
переходе от водного (диэлектрическая проницаемость
равна 81) раствора сильного электролита к спиртовому
(диэлектрическая проницаемость равна 24) той же
концентрации при той же температуре? Дайте
объяснение.
58
•+ 8.5. Рассчитайте рН 0,01 М раствора муравьиной
кислоты, пользуясь данными справочника.
8.6. Эквивалентная электропроводность 0,002 и.
раствора иодида калия в воде при 298 К равна
146,7 Ом-1*см2-г-экв"!. Чему будет равна эквивалентная
электропроводность 0,001 н. раствора иодида калия?
Данные о предельных подвижностях ионов возьмите из
справочника.
9.1. Зависит ли и как радиус ионной атмосферы от
концентрации сильного электролита?
9.2. Как зависит средний ионный коэффициент
активности от концентрации сильного электролита (в широком
диапазоне концентраций)?
9.3. Объясните причину увеличения эквивалентной
электропроводности в электрическом поле высокой
частоты (эффект Дебая — Фалькенхагена).
9.4. При нагревании от 273 до 293 К степень
диссоциации бинарного слабого электролита I в водном
растворе увеличилась вдвое, а степень диссоциации
бинарного слабого электролита II той же концентрации в водном
растворе — вчетверо. Для какого электролита теплота
диссоциации больше? Аргументируйте ответ.
Tf 9.5. Эквивалентная электропроводность раствора КС!
при бесконечном разведении и 298 К равна 149,9 Ом-1 X
см2*г-экв-1. Число переноса К+ в этом растворе равно
0,497. Определите абсолютную скорость движения
(см2/В-с) иона С1~ в данном растворе.
9.6. Рассчитайте ДЯ°, AS°, AG° для диссоциации
муравьиной кислоты в воде при 298 К, пользуясь
справочными данными о термодинамических величинах
соединений и ионов в водных растворах.
ЮЛ. Начертите графики зависимостей KmCc=f{T)
н ДЯДИСС=/(Г) для водных растворов слабых
электролитов. Покажите эти графики в сочетании друг с другом.
10.2. Известны кристаллографические радиусы
следующих катионов:
Катион К* *5*7 Rb+ Na+ Cs+
'-Ю-1'", м 2,27 J:Jl2,47 1,89 2,65
Расположите эти катионы в порядке возрастания их
подвижности в водном растворе и кратко объясните свое
решение.
59
10.3. Сопоставьте ионные силы двух растворов при
одинаковой концентрации: а) раствора AgN03 и б)
раствора Со(СЮ4)2« Для какого раствора ионная сила
больше, во сколько раз?
10.4. Как экспериментально определить уменьшение
эквивалентной электропроводности, обусловленное
электрорелаксационным торможением ионов?
10.5. Определите константу и стандартную работу
диссоциации 1 моль слабой кислоты НА при 300 К, если
при этой температуре и концентрации 1,8-10~2 моль/л
раствор имеет удельную электропроводность 7,2-Ю-4, а
при концентрации 4,0-10~4 моль/л — 8,0-Ю-5 Ом-1-см-1.
т 10.6. Определите, пользуясь данными справочника, во
сколько раз изменится средняя ионная активность а±
КС1 в воде при 298 К, если моляльная концентрация
возрастет от 0,01 до 1,0.
ГЛАВА XII. Э. Д. С. ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ
И ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
1.1. Какая реакция (окисления или]в^Йановлещя)
протекает на положительном электроде гальванического
элемента?
1.2. Что называется условным электродным
потенциалом? Ч&С ?,<е ^-c/fx:с* ^Щ> ,г'* [J л
1.3. Напишите уравнение химической реакции (указав
ее направление), протекающей в гальваническом
элементе в стандартных условиях при 298 К:
Pt | Мп2+, MnOj", Н+ В Со*+, Со2+ | Pt
1.4. Обратимо работающий гальванический элемент
выделяет теплоту в окружающую среду. Зависит ли и
как э. д. с. этого элемента от температуры? '\.% * V*5 F
1.5. Рассчитайте растворимость хлорида серебра в
воде при 323' К, если при этой температуре э. д. с.
гальванического элемента . . .
Ag
AgCl
насыщ.
раствор
0,05 т
Ag
равна 0,199 В, а коэффициент активности иона Ag+ в
0,05 т растворе нитрата серебра при 323 К равен 0,9.
60
1.6. Э. д. с. цепи, составленной из насыщенного
каломельного электрода (слева) и хингидронного в
исследуемом растворе, равна 0,274 В при 298 К. Определите рН
исследуемого раствора. Диффузионным потенциалом
пренебречь. Значения потенциалов насыщенного
каломельного и стандартного хингидронного электродов взять из
справочника. t/^ ; ,, ^? ,■к ^ ,; г/ zx tfJPi
2.1. Какая реакция (б1ш'сления1 или восстановления)
протекает на отрицательном электроде гальванического
элемента?
2.2. Какую роль при измерении э.д. с. гальванических
элементов выполняет элемент Вестона? эталон 9 ?*£~.
2.3. Составьте элемент, в котором протекает
следующая химическая реакция: Па\ &.*-:Л;\}> *■
l/2Hg2Cl2-bl/2H2 = Hg + HCl [-i \\-( //^
2.4. Гальванический элемент совершает электрическую
работу без изменения внутренней энергии. В каком
соотношении (что больше) находятся при этом величина
электрической работы nFE и величина теплоты qy кото^
рой элемент обменивается с окружающей средой? Какой
знак в этом случае имеет температурный коэффициент
э. д. с? <f "~- и F E J В /:.,т ■> о
2.5,. Рассчитайте при 298 К константу равновесия ре*
акции
МпОг -Ь 4Н+ -ь 2Fe2+ .., Мп2+ + 2Fe3+ + 2Н20
пользуясь данными справочника о стандартных
электродных потенциалах.
2.6. Э. д. с. следующего элемента при 298 К равна
1,45 В:
Zn|ZnS04, Hg2S04 fHg'LZn
раствор тв
m =--= 1,48 '
Рассчитайте средний ионный коэффициент активности
у± ZnS04 в данном растворе при 298 К, пользуясь
данными справочника о стандартных электродных
потенциалах.
3.1. Каково термодинамическое условие образования
положительного заряда на поверхности металла,
опущенного в раствор соли этого металла?
61
3.2. Существуют ли гальванические элементы, для
которых величина э. д. с. не зависит от величин
стандартных электродных потенциалов? Если существуют, то
укажите тип этих элементов. /^ ^ >;,.,
3.3. Какой из членов правой чисти уравнения Йернста
, яг f
для электрода первого рода <р = <ро ч -- in д+ дает наи-
больший вклад в величину электродного потенциала при
данной активности иона? •
3.4. Можно ли измерить э. д. с. гальванического
элемента при помощи вольтметра? Дайте ответ с
обоснованием. '-£ '.'> '- -- ,; - ' : '»."'». -
3.5. Э. д. с. элемента Cd|CdCl2, AgCl|Ag|Cd при
раствор тв.
298 К равна 0,675 В, а температурный коэффициент
э. д. с. этого элемента равен —6,5-10~4 В/град. Напишите
уравнение реакции, протекающей в этом элементе, и
вычислите AG, AS и АН для этой реакции при 298 К.
3.6. Рассчитайте коэффициент активности серебра в
амальгаме серебра с мольной долей Л^=0,5, если э. д. с.
элемента
Hg-Ag
при 298 К равна 0,156 В.
AgN03
раствор
Ag-Hg
aAg -0,0005
4.1. Каково термодинамическое условие отсутствия
заряда на поверхности металла, опущенного в раствор
своей солн?^ с г,^ *к - - о'- ,( V- '>^cJ;
4.2. Напишите уравнение Нернста для хлорсерсбряно-
го электрода, f '• ■ • -, *
4.3. Начертите график потенциометрического
титрования смеси соляной и уксусной кислот щелочью (с
потенциалом индикаторного электрода по оси ординат) и
электрическую схему установки. Какие электроды
можно при этом применять в качестве индикаторных?
4.4. Определите знаки электродов амальгамного
концентрационного элемента, если а,\>йг:
Hg —Cd|CdS04lCd^Hg
а\ раствор a<i
4.5. Рассчитайте произведение растворимости
бромида серебра при 323 К, если при этой температуре стан-
62
.г
дартные потенциалы бромсеребряиого и серебряного
электродов соответственно равны 0,046 и 0,749 В.
4.6. Определите, пользуясь данными справочника, при
298 К стандартные изменения свободной энергии и
энтропии реакции
2MnO^ + 5РЬ2+ + 2Н20 - 2Mn2+ + 5Pb02 + 4H+
если для элемента, в котором протекает эта реакция,
rf£°/dr=2-10~4 В/град.
5.1. Напишите уравнение Нернста для электрода
первого рода (а+ — активность катиона, а-—активность
аниона, а — активность соли в растворе электролита).
5.2. Стандартный электродный потенциал никелевого
электрода при 298 К равен —0,25 В. Как будет заряжена
(положительно или отрицательно) поверхность
металлического никеля, если его опустить в раствор сульфата
никеля?
5.3. Э. д. с. гальванического элемента как функция
температуры выражается уравнением Е = а+ЬТ.
Выведите уравнения для расчета AS, AG и АН при
температуре Т.
5.4. Пренебрегая диффузионным потенциалом,
сделайте вывод о том, у какого из следующих двух элементов,
взятых при одинаковой температуре, э. д. с. больше:
Си 1 CuS04 LC11SO4 \ Си ЕХ
а±=0,1 а±== 1,0
Zn J ZnS041| ZnS041 Zn E2
e±=0t01 a±=0,l
5.5. Рассчитайте э. д, с. гальванического элемента без
переноса:
Сц | CuS04, Hg2S041 Hg I Cu
раствор tb
/n = l
при 298 К, пользуясь данными справочника.
5.6. Температурный коэффициент э. д. с. обратимого
гальванического элемента с одноэлектронным переходом
равен —0,0004 В/град. Определите, выделяется или
поглощается теплота при работе этого элемента и чему
равна эта теплота при 300 К.
6.1. Напишите уравнение Нернста для окислительно-
восстановительного электрода, на котором протекает
реакция с участием ионов водорода рОК+<7Н++/ге~~=гВ
(яок, авиа н+ — активности окисленной и
восстановленной форм и иона водорода в растворе соответственно).
6.2. Какие гальванические элементы называют
химическими?
6.3. Влияет ли и как присутствие посторонних
индифферентных ионов на потенциал электрода первого рода в
растворе малой и умеренной концентрации?
6.4. В гальваническом элементе протекает реакция в
сторону образования газообразных продуктов из
конденсированных исходных веществ. Влияет ли и как
увеличение внешнего" давления на величину э. д, с?
6.5. Рассчитайте стандартный электродный потенциал
полуэлемента Ag|AgI тв, KJ при 286 К, если при этой
температуре произведение растворимости иодида серебра
0,32- Ю-16, а стандартный электродный потенциал
серебряного электрода 0,944 В.
6.6. Температурный коэффициент э. д. с.
гальванического элемента с одноэлектронным переходом равен 0.
Чему равен тепловой эффект АН реакции, протекающей
в этом элементе, если э. д. с. равна 1,1 В?
7.1- От чего зависит величина стандартной э. д. с.
химического гальванического элемента (природа реакции,
концентрация растворов, температура, число переноси*
мых электронов)?
7.2. В каком случае знак э. д. с. элемента считается
положительным?
7.3. Влияет ли и как присутствие посторонних ионов
в растворе малой и умеренной концентрации на
потенциал каломельного электрода? Почему?
7.4. Для гальванического элемента, работающего в
обратимых условиях, э. д. с. при 298 К больше, чем при
273 К. Работает этот элемент с выделением или
поглощением тепла?
7.5. Пользуясь справочными данными, рассчитайте
при 298 К э. д. с. следующего элемента:
Рн — 1 атм
Pt, H2 NH4OH
раствор
0,01 моль/л
СН3СООН
раствор
0,1 моль/л
Н2, Pt
Рн = 1 атм
6*
7.6. Рассчитайте тепловой эффект Д# химической
реакции
210- + 2Н+ + 5Н202 = 12 -Ь 6Н20 + 502
если эта реакция протекает в гальваническом элементе
при 298 К, а э. д. с. и ее производная по температуре
соответственно равны 0,513 В и 0,00067 В/град.
8.1. Что называется стандартной э. д. с?
8.2. Напишите уравнение Нернста для хингидронного
электрода в кислых и слабощелочных растворах.
8.3. Составьте электрод второго рода, если имеются
Ag (металл), AgN03, K2Cr04, AgN02, Pt (металл), HN03,
К2СГ2О7, Ag2Cr04. Напишите уравнение электродной
реакции и уравнение Нернста для этого электрода.
8.4. Меняется ли и как внутренняя энергия
гальванического элемента, если его э. д. с. не зависит от
температуры? Почему?
8.5. Рассчитайте второй температурный коэффициент
стандартной э. д. с. (d2E°/dT2) в В/град2 при 298 К
следующего элемента;
Ag | AgCl (тв), КС1, Hg2Cl2 (тв)) Hg I Ag
раствор
если при этой температуре атомные теплоемкости Ag(TB)
и Hg(>K) соответственно равны 25,48 и 27,82 Дж/г-атомХ
Хград, а молярные теплоемкости AgCl(TB) и Hg2Cl2(TBj
соответственно равны 50,78 и 101,67 Дж/моль-град.
8.6. Рассчитайте при 298 К э. д. с. элемента:
Н2, Pt
Рн = 1 атм
К какому типу можно отнести этот элемент
(концентрационный, химический, с переносом, без переноса)? При
расчете воспользуйтесь справочными данными.
9.1. Какие константы .и экспериментальные данные
необходимо иметь, чтобы подсчитать электрическую
работу, совершенную гальваническим элементом?
9.2. К какому типу элементов относится элемент Be-
стона (концентрационный, химический, с переносом, без
переноса)?
рн,-
Pt, н2
= 1 атм
НС1, AgCl (тв)
раствор
0,01 т'
Ag
AgCl (тв), НС1
раствор
0,1 т
/ 3—786
65
9.3. Составьте гальванический элемент, в котором
протекает реакция по уравнению
5РЬ02 -Ь 12 + 8Н+ + 5SO^- — 5PbS04 -Ь ?IOJ" + 4Н20
9.4. По какому закону изменяется равновесный
потенциал электрода первого рода с увеличением
расстояния от поверхности электрода в глубь раствора, когда
толщина диффузной части двойного электрического слоя
равна нулю?
9.5. По данным справочника рассчитайте при 298 К
константу равновесия реакции
5РЪ02 -Ы2 + 8Н+ -Ь 5SC£- = 5PbS04 + 2Ю~ + 4Н20
9.6. Под каким давлением поступает водород в левый
электрод, если э. д. с. элемента
Pt. Н2
НС1
раствор
0,01 т
Н2. Pt
Рн = 1 атм
при 298 К равна 0,0059 В?
ЮЛ. Как изменяются электродные потенциалы
водородного и хлорного электродов при увеличении давления
соответственно водорода и хлора?
10.2. Из двух электродов: никеля, опущенного в
раствор сульфата никеля; и кадмия, опущенного в раствор
сульфата кадмия, — составлен гальванический элемент.
Какой из этих электродов образует при 298 К
отрицательный полюс гальванического элемента, если
активность ионов никеля в растворе и активность ионов кадмия
в растворе равны 1?
10.3. Зависит ли и как толщина диффузной части
двойного электрического слоя от ионной силы раствора,
в который погружен металл?
10.4. Изменится ли и как э. д. с. водородно-кислород-
ного топливного элемента с ростом внешнего давления?
Почему?
10.5. Осуществима ли «в водном растворе при 298 К
реакция по уравнению Ag+Fe3+=Fe2++Ag+, если
aAg+ = l, aFe3+ =0,1, aFe2+=0,01? Чему равна константа
равновесия этой реакции при 298 К? Воспользуйтесь
справочными ланными
66
. 10.6, Рассчитайте при 298 К э, д. с. амальгамного
элемента *
Hg — Zn I ZnS04
a\ J раствор
Zn —Hg
a2
при следующих значениях активностей цинка в
амальгаме: ai = 0,003, а2=0,0001.
ГЛАВА XIII. ФОРМАЛЬНАЯ КИНЕТИКА. ЗАВИСИМОСТЬ
СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
■ - 1.1. Как связана скорость реакции взаимодействия
водорода с кислородом (2Н2+02=2Н20), выраженная
по водороду, со скоростями этой реакции, выраженными
по другим компонентам?
1.2. Напишите уравнение зависимости константы
скорости реакции от температуры в дифференциальной
форме.
1.3. Как изменяется коБцентрация продукта реакций
со временем, если реакция имеет нулевой порядок?
1.4. От чего зависит время достижения максимальной
концентрации промежуточного вещества В в
последовательной реакции первого порядка А Ь^ В ^ С?
Напишите соответствующую формулу.
^<1.5. Определите энергию активации реакции, для
которой при повышении температуры от 295 до 305 К
скорость реакции удваивается.
*-" 1.6. Пользуясь, зависимостью между временем
полураспада и начальным давлением, определите порядок
реакции конверсии пара-водорода в орто-водород при
923 К:
Л Па-Ю-2 66,65 133,3 266,6 533,2
*/. , с №М . ., .- 648 450 318 222
2.1. Реакция нитрования фенола протекает с
образованием о-нитрофенола и п-нитрофенола. Константы
скоростей этих реакций kD и kn. Исходные концентрации Со,ф
(фенола) и С0,к (кислоты). Как запишется уравнение
[скорости этой реакции, если обозначить через х
изменение концентрации фенола?
2.2. Какой вид имеет график зависимости логарифма
[константы скорости реакции от Т~1?
67
2.3, Сопоставьте константы скоростей двух реакций
второго порядка,* если исходные концентрации обоих
реагирующих веществ одинаковы. Значения исходны*
концентраций и периоды полупревращения для этих
реакций: 1-я реакция—1,5 моль/л; 200 мин; 2-я реакция —
2,0 моль/л; 300 мин.
2.4. Чем определяется максимальное количество
промежуточного вещества В в последовательной реакции
первого порядка А %. В Ъ* С?
"Х2.5. Рассчитайте предэкспоненциальный множитель в
уравнении Аррениуса при 393 К, если при этой
температуре константа скорости реакции равна 4,02-18~4 с-1, а
при 413 К—19,83-Ю-4 с-1.
2.6. Определите порядок реакции ЗА(газ) =А3(тв).
Давление исходного вещества в одном опыте упало от
0,252-105 до 0,205-105 Па за 31 ч, а в другом опыте,
который проводился в том же сосуде при той же
температуре,—от 0Д05-105 до 0,102-105 Па за 20 ч.
ЗЛ. Как зависит от исходных концентраций
реагирующих веществ период полупревращения для реакции
2-го порядка?
3.2. Что называется экспериментальной энергией
активации сложной реакции?
3.3. Реакция А ^ В 1^С первого порядка.
Представьте график изменения концентрации веществ А, В
и С с течением времени, если k\>k2.
3.4. Каковы ограничения в применении метода
стационарных концентраций?
Т 3.5. При 583 К AsH3(ra3) разлагается с
образованием As(tb) и Нг. Во время реакции при постоянных
объеме и температуре общее давление в системе
изменяется следующим образом:
г, ч 0 5,6 6,5 8,0
Р, Па-10-3 ... V, - . 97,75 107,41 109,05 111,35
Покажите, что реакция разложения AsH3 является
реакцией 1-го порядка, и вычислите константу скорости этой(
реакции. н
3.6. При помощи правила Вант-Гоффа вычислите, щн;а
какой температуре реакция практически закончится че.ь
рез 15 мин, если при 293 К на это требуется 2 ч. Темпера*
турный коэффициент для этой реакции у=3.
68
4.1. Что называется молекуляриостью химической
реакции?
4.2. Как зависит от исходной концентрации
реагирующего вещества период полупревращения для реакции
1-го порядка?
4.3„ Какая из односторонних реакций заканчивается
быстрее при одинаковых исходных концентрациях и одн-
шаковых'константах скорости: реакция 1-го, 2-го или 3-го
порядка?
4Л. Какие экспериментальные данные
свидетельствуют о влиянии промежуточных веществ и конечных
продуктов на скорость реакции?
4.5. Зависимость константы скорости разложения фос-
фина 4РНз-^Р4+6Н2 от температуры выражается
уравнением
18 963 пш п лп
lg*=- г +2Igr + 12,130.
Рассчитайте энергию активации этой реакции при 800 К-
у" 4.6. Константа скорости реакции омыления уксусно-
этилозого эфира щелочью при 283 К равна 2,38 мин-'Х
Xмоль-1-л. Рассчитайте время половинног© разложения
эфира, если 1 л 0,05 н. раствора эфира смешать с 1 л
<0,1 н. раствора щелочи. Реакция омыления эфира
подчиняется кинетическому уравнению 2-го порядка.
5.1. Что называется порядком химической реакции>
5.2. Имеет ли размерность и какую константа
скорости реакции?
5.3. Как экспериментально определить
концентрационный (истинный) порядок реакции по данному
компоненту?
5.4. Энергия активации реакции (1) больше энергии
активации реакции (2). При температуре Т\ константы
скорости этих реакций равны. Каково соотношение
между константами скорости этих реакций при T2>Ti?
-Т5.5, Скорость реакции второго порядка равна,
4,5-10~7 моль/л -с при концентрации одного реагента
1,5- Ю-2 и другого 2,5- Ю-1 моль/л. Рассчитайте
константу скорости в см3/моль-с.
■ «^5.6. Реакция термического разложения этана
является реакцией 1-го порядка. При 823 К константа скорости
згой реакции равна 2,5-105 с-1, а при 903К— 141,5-105
с-1.
m
Рассчитайте период полупревращения для этой реакции
при 873 К.
6.1. Напишите -выражение для константы скорости.
реакции 1-го порядка.
6.2. Какое специфическое условие необходимо
соблюдать при использовании химических методов анализа для
изучения скорости реакции по сравнению с
физико-химическими методами анализа?
6.3. Как графически определить значение ионстантьзь
скорости реакции 2-го порядка при равных исходных
концентрациях реагирующих веществ?
6.4. В чем сущность метода стационарных
концентраций?
-^6.5. В некоторой реакции при изменении начальной
концентрации от 1 до 3 моль/л период полупревращение
уменьшается с 3 ч до 20 мин. Каков порядок этой реакции,
и чему равна константа скорости?
^ 6.6. Время полупревращения веществ в реакции 1-го
порядка при 323 К составляет 100 мин, а при 353 К —
.15 мин. Вычислите температурный коэффициент
скорости реакции у.
7.1. Что называется лимитирующей стадией сложной
химической реакции?
7.2. Укажите размерность константы скорости
реакции 2-го порядка?
^ 7.3. Выведите выражение для периода
полупревращения исходных веществ по реакции 3-го порядка, если
исходные концентрации реагирующих веществ одинаковы.
7.4. В каких случаях скорость реакции определяете»
изменением концентрации реагирующих веществ в
единицу времени?
7.5. В результате взаимодействия формальдегида е
перекисью водорода образуется муравьиная кислота
(реакция 2-го порядка):
НСНО + НаОз = НСООН + Н20
Если смешать равные объемы 1 М растворов Н2О2 n
НСНО, то через 2 ч при 333 К концентрация муравьиной
кислоты становится равной 0,214 моль/л. Вычислите
константу скорости реакции и определите, через сколько
времени прореагирует 90% исходных веществ.
ТО
;,f?7.6. Константа скорости реакции при 298 и 323 К
соответственно равна 0,0093 «и 0,0806 мин-1. Определите
, энергию активации этой реакции.
• 8.1. Напишите уравнение зависимости истинной
скорости обратимой реакции первого порядка А^В от
концентрации, если в начальный момент времени
концентрация исходного продукта Со,а, концентрация продукта
£о,в, константа скорости прямой реакции k\, константа
скорости обратной реакции &2, изменение концентрации
«сходного вещества х.
■' 8.2. Представьте график зависимости скорости
реакции от температуры, если энергия активации — величина
шоложительная.
^ 8.3. Сопоставьте константы скоростей двух реакций
1-го порядка k\ и Аг, если период полупревращения
первой реакции в пять раз больше, чем второй.
8.4. Какие экспериментальные данные необходимы
для определения порядка реакции?
"f-8.5. Реакция А+В = С 2-го порядка. Если исходные
концентрации равны, то за 500 с реакция проходит на
20%. За какое время она пройдет на 60%?
«4- 8.6. Разложение некоторого вещества является
реакцией 2-го порядка с энергией активации 23,1 кДж/моль.
При 300 К разложение этого вещества проходит со
скоростью 95% в Л ч. Вычислите температуру, при которой
это вещество разлагается со скоростью 77,5% в 1 мин.
9.1. Какие из следующих факторов влияют на скорость
химической реакции: природа реагирующих веществ,
^концентрация реагирующих веществ, катализатор,
растворитель, температура?
9.2. Графическим выражением какой зависимости
является кинетическая кривая?
9.3. При каком соотношении констант скоростей
отдельных стадий последовательной реакции 1-го порядка
д Л В i С период индукции будет наибольшим?
^ 9.4. Реакция разложения изопропилового спирта в
присутствии катализатора триоксида ванадия идет по
следующей схеме:
/С3Н60
CsHjOH-^-CsHg
CSH8
71
По какому уравнению можно рассчитать сумму констант
скоростей этих реакций &|+&2+£з» если каждая из
реакций кинетически 1-го порядка? Обозначения: а —
начальная концентрация С3Н7ОН; х— убыль концентрации
С3Н7ОН ко времени т; хж — убыль концентрации
С3Н7ОН к моменту наступления равновесия. Чему равна
концентрация С3Н7ОН, если через 4,3 с при температуре
опыта 588 К концентрации веществ в реакционной смесл
следующие (ммоль/л): Сс,н¥он =27,4; Сс8н#о =7,5;
Сс8н. =8,1; Сс,нв = 1»7?
Ч* 9.5. Две реакции одинакового порядка имеют
одинаковые предэкспоненциальные множители, но их энергии
активации различаются: £2—Е\ = 83,196 кДж/молъ.
Рассчитайте отношение их констант скоростей ki/k2 при?
434 К.
-J-9.6. Реакция разложения аммиака на горячей
вольфрамовой проволоке протекает при 1129 К по уравнению
2NH3=N2-f 3H2. За скоростью реакции следили по
повышению общего давления АР = РХ—Ро. С течением
времени давление в системе при постоянном объеме и
температуре повышалось следующим образом:
т, с . 100 200 400 600 800
ДР, Па-10-2 14,66 29,33 59,70 89,60 117,21
Начальное давление в системе равнялось 266,6* 102 Па.
Определите порядок реакции и рассчитайте константу
скорости (вместо концентраций можно брать давления)-
10.1. Какие из следующих факторов влияют на
константу скорости химической реакции: природа
реагирующих веществ, концентрация реагирующих веществ,
катализатор, растворитель, температура?
10.2. Какой основной принцип используется при
составлении кинетических уравнений сложных реакций?
10.3. Какой минимум экспериментальных данных
необходим для расчета энергии активации реакции?
10.4. Сумма констант скоростей обратимой реакции*
первого порядка рассчитывается по уравнению
1 ш D
Имеет ли какой-нибудь физический смысл величина D?
72
-f-10.5. Реакция первого порядка проходит на 30% за
35 мин. Какова скорость реакции (моль/л«ч) при
концентрации реагирующего вещества 0,01 моль/л?
«Н0.6. При одной и той же концентрации реагирующих
веществ скорость реакции при 303 К вдвое выше, чем
при 293 К. Вычислите величину производной dlhk/dT
ари 300 К.
ГЛАВА XIV. ТЕОРИИ КИНЕТИКИ. ФОТОХИМИЧЕСКИЕ,
ЦЕПНЫЕ РЕАКЦИИ И РЕАКЦИИ В РАСТВОРАХ
1.1. Напишите математическое выражение
объединенного закона светопоглощения Ламберта — Бугера — Бе-
ера, если /о — интенсивность падающего света,
L—интенсивность прошедшего света, е — коэффициент погашения,
С —концентрация поглощающего вещества, I — толщина
поглощающего слоя.
1.2. Как связаны между собой теплота активации АНф
и экспериментально определяемая энергия активации Е&
для реакции 1-го порядка при постоянных р и Т согласно
теории абсолютных скоростей реакций?
1.3. Некоторую цепную реакцию осуществляют при
одинаковых условиях в двух реакторах, равных по
объему, но разных по форме: сферическом и цилиндрическом.
Будут ли и как различаться скорости реакций в этих
сосудах при условии, что обрыв цепи происходит
преимущественно на стенках, а реакторы изготовлены из
одинакового материала?
]1А. Сказывается ли и как ионная сила раствора на
скорости реакциии между ионами в растворе?
1.5. Две реакции одинакового порядка имеют равные
энергии активации, но при 573 К энтропия активации
7^рвой реакции на 41,8 Дж/моль-град больше энтропии
активации второй реакции. Рассчитайте отношение
констант скоростей этих реакций kjk2 при данной темпера-
гУре.
1.6. Реакция термического разложения этана протека-
"т по радикальному механизму в соответствии со
следующей схемой:
C2H6i^2CH3 инициирующая стадия (1>
СН3-ьС2НеДсН4-ЬС2Н5 . (2)
73
С^Н54-С2Н4 + Н (3)
H + C2H6itH2-rC2H5 (4)
2СзН5 % C4Hi0 реакция обрыва цепи (5)
Реакции (2) — (4)—реакции продолжения цепи.
Используя метод стационарных концентраций, выведите
кинетическое уравнение реакции разложения СгНб, если
реакция (1) является мономолекулярной и при обычных
условиях, т. е. при невысоких давлениях, протекает по
2-щ порядку.
2.1. Напишите уравнение для расчета скорости
разветвленной цепной реакции, если вероятность
разветвления больше вероятности обрыва цепи. При записи
уравнения пользуйтесь обозначениями: v — скорость реакции;
/ — вероятность разветвления цепи; gr~ вероятность
обрыва цепи; т — время от начала реакции; ф — константа
нарастания (ф=/—g); A — постоянная величина.
2.2. Что называется оптической плотностью раствора?
2.3. Сформулируйте главную задачу, которую ставит
перед собой теория абсолютных скоростей химических
реакций.
2.4. Различаются ли число сталкивающихся молекул
и число вступающих в реакцию молекул для
бимолекулярных реакций в газовой фазе?
2.5. Энергия активации реакции разложения
йодистого водорода равна 184 кДж/моль, Рассчитайте долю
активных молекул при 500 и 1000 К.
2.6. При некоторых условиях эксперимента реакция
разложения ацетальдегида может протекать по
следующей схеме:
СН3СНО ^ СН3 н- Сно инициирование цепи (i)
СН3 + СН3СНО it CH4 -Ь СН^СО (2)
CHgCOitCHa + CO (3)
2СН*СО_^СН3СОСОСНз обрыв цепи (4)
Реакции (2) и (3) — реакции продолжения цепи.
Выведите кинетическое уравнение реакции разложения СНзСНО
на основе приведенного механизма с использованием
метода стационарных концентраций.
74
3.1. Какие из факторов: концентрация, толщина
поглощающего слоя, температура, природа поглощаюшей
среды, длина волны, время — влияют на коэффициент
поглощения света раствором?
3.2. Что учитывает трансмиссионный множитель к в
уравнении теории переходного состояния?
3.3. Какова связь между опытной и истинной
энергиями активации согласно теории бинарных столкновений?
3.4. Скажется ли и как на скорости реакции между
Fe2+ и [Со(С204)з]3~ прибавление к водному раствору
этих веществ сульфата калия?
3.5. Определите теплоту активации (АНФ) гидролиза
карбамида при 338 К, если константы скоростей этой
реакции при 323 и 353 К соответственно равны 0,58- 1(У~*
и 0,26-10-* мин-1.
3»6. При освещении газовой смеси СО + С12 источником
с длиной волны 400 нм было получено по уравнению
реакции СО + С12=СОС12 0,1 кг фосгена. Количество
поглощенной газом лучистой энергии 300 Дж. Рассчитайте
квантовый выход этой реакции.
4.1- В чем состоит закон фотохимической
эквивалентности Эйнштейна?
4.2. Чем определяется скорость химической реакции
4 по теории бинарных столкновений?
4.3. Что является основной причиной протекания
«медленных* реакций в растворе (реакций Меншуткина)?
4.4. Можно ли и как уменьшить нижний предел
давления, начиная с которого разветвленная цепная реакция
развивается со скоростью взрыва?
4.5. Для димеризации бутадиена lg £ = 7,673—5680/7,
где k имеет размерность л*моль-1-с-1. Какая доля
молекул бутадиена, присутствующих в системе, имеет
энергию, достаточную для вступления в реакцию при 723 К?
4.6. Реакция разложения перекиси водорода
2Н202-^2Н20+02 в кислой среде и в присутствии ионов
брома как катализатора протекает по следующему
механизму:
Н202 -Ь Вг- -Ь Н+ X НВгО -Ь Н20 (1)
Н202 4 НВгО ±1 Н20 + Вг- -ь Н+ + 02 (2)
Используя метод стационарных концентраций,
определите, каков порядок этой реакции по перекиси водорода.
75
5.1. Напишите уравнение, при помощи которого
можно раесчитать число двойных соударений между
молекулами в единицу времени в единице объема, если
столкновения происходят между однородными молекулами.
При записи пользуйтесь обозначениями: а —диаметр
молекулы; w — средняя арифметическая скорость
движения молекул; п — число молекул в единице объема.
5.2. Что включает в себя предэкспоненциальный
множитель А в уравнении Аррениуса по теории соударений?
Запишите в общем виде уравнение для его расчета,
пользуясь следующими обозначениями: Р — стерический
фактор; Zq — фактор соударений.
5.3. Может ли и в каком случае фотохимическая
реакция иметь 1-й порядок, если первичная фотохимическая
активация является лимитирующей стадией?
5.4. Каково влияние растворителя на энергию
активации, если данную реакцию можно провести и в газовой
фазе и в растворе?
5.5. Константа скорости некоторой мономолекулярной
газофазной реакции при 473 К 62,8 с-1, а
предэкспоненциальный множитель 2,5-10~13 с-1. Рассчитайте теплоту
активации этой реакции при указанных условиях.
5.6. Термическое разложение озона протекает по
следующему механизму:
03Д02 + 0(1) 0+02_ZLo3 (2) 0-ЬОз4!202 (3)
Используя метод стационарных концентраций, получите
уравнение для скорости распада 03, включающее
константы k\9 k-u &2 и концентрации 02 и Оз.
V 6.1. Влияет ли и как температура на скорость
фотохимической реакции?
6.2. Напишите основное уравнение теории переходного
состояния (выраженное через суммы состояний) для
реакции
АВ + С-^А+ВС
6.3. В каком случае константа скорости ионной
реакции в растворе kv больше константы скорости
соответствующей реакции в газовой фазе &г?
6.4. По какому порядку протекают мономолекулярные
реакции в газовой фазе при малых давлениях?
Приведите объяснение.
76
6.5. Хлористый сульфурил SO2CI2 при высокой
температуре необратимо разлагается по реакции 1-го порядка
на двуокись серы и хлор. При 552 К константа
скорости диссоциации равна 6,09-10~5 мин-1, а при 602 К она
составляет 2,74-Ю-3 мин-1. Определите предэкспонен-
циальный множитель А в уравнении Аррениуса.
6.6. Для разложения фосфина, протекающего по
реакции 1-го порядка 4РН3-^Р4 + 6Н2, зависимость константы
скорости от температуры выражается уравнением
18 963 п
Ig*= —-у—+21gr + 12f130.
На основании этих данных рассчитайте энтропию
активации указанной реакции при 800 К. Трансмиссионный шкь
житель и=1.
7.1. Какие из указанных признаков: а) большая
величина энергии активации; б) малая величина энергии
активации; в) большой квантовый выход; г) малый
квантовый выход; д) резкая зависимость скорости реакшш
от способа ее инициирования; е) уменьшение скорости
реакции с течением времени; ж) увеличение скорости
реакции с течением времени; з) малый температурный
коэффициент скорости реакции; и) большой температурный
коэффициент скорости реакции; к) экспериментальное
обнаружение свободных атомов и свободных радикалов
в реакционной смеси; л) малая чувствительность к
присутствию посторонних примесей — свидетельствуют о
цепном механизме реакции?
7.2. Существуют ли и какие химические реакции, экс*
периментальная энергия активации которых
отрицательна?
7.3. Представьте график зависимостиlg(k/k0) ~ f{]/T$
для реакции взаимодействия [Со (NH3) sBr]2+ с ОН- в
разбавленном водном растворе при 298 К (/ — лонная сила
раствора; k и k0 — константы скорости этой реакции в
данном и в бесконечно разбавленном растворе
соответственно). Укажите, чему равен тангенс угла наклона этой
зависимости к оси абсцисс.
7.4. Что такое энтропия активации и как ее можно
рассчитать?
7.5. Для реакции Ы02С1-*Ы02+72С12 предложен
следующий механизм:
77
N02C1^N02 + C1 (1)
N02CI + CI ^V N02 + CI2 (2)
Пользуясь методом стационарных концентраций,
выведите уравнение скорости разложения N02C1 на основе
указанного механизма.
7.6. При фотобромировании коричной кислоты до
дибромкоричной кислоты реакционная смесь облучалась
синим светом с длиной волны 435,8 нм и интенсивностью
14-10~"4 Дж/с. За время экспозиции 1105 с количество Вг2
уменьшилось на 0,075 ммоль. Раствор поглощал 80,1%
света, проходящего через него. Вычислите квантовый
выход.
8.1. Напишите основное уравнение теории
переходного состояния в термодинамической форме для процесса,
протекающего при V=const и r=const, если
AS^=—энтропия активации, AU^— теплота активации.
8.2. За счет чего происходит активация молекул в
мономолекулярных реакциях?
8.3. В чем заключается основной недостаток теории
бинарных столкновений?
8.4. Может ли и в каком случае квантовый выход
фотохимической реакции быть больше единицы?
8.5. Сосуд объемом 0,100 м3, содержащий водород и
ллор, облучали светом с длиной волны 400 нм.
Измерения показали, что хлор поглощает 11«10~7 Дж/с световой
энергии. Во время облучения в течение 1 мин
парциальное давление хлора уменьшилось с 273,3-102 до
207,9-102 Па (давление приведено к Г=273 К). Чему
равен квантовый выход (в молях НО на 1Э поглощенной
энергии)?
8.6. При изучении кинетики реакции SiH4(r)->-
~-vSi+2H4(r) было найдено, что разложение SiH4 можно
оредставить следующей схемой:
SiH4fvSiH2-hH2 (1)
SlH2^Si-f H2 (лимитирующая стадия) (2)
SiH2 + H2^SiH4 (3)
Выведите кинетическое уравнение суммарной реакции
разложения SiH4, считая, что концентрация радикала
18
SiH2 после очень короткого времени от начала реакции
становится постоянной.
9.1. Напишите уравнение зависимости константы
скорости реакции между ионами от ионной силы раствора.
9.2. Какие реакции называются цепными?
9.3. Каков смысл стерического фактора согласно
теории абсолютных скоростей химических реакций?
9.4. Можно ли и как изменить порядок
мономолекулярной реакции, если в данных условиях она протекает
по первому порядку?
9.5. Предэкспоненпиальный множитель
мономолекулярной газофазной реакции равен 1,0-1017 с-1 при 473 К.
Рассчитайте энтропию активации этой реакции,
воспользовавшись уравнением теории переходного состояния.
9.6. Для реакции в газовой фазе Нг+Ь-^Ш до 1967 г.
•являлся общепринятым следующий механизм (I):
Н2 + Ь4Л2Н1
В 1967 г. было показано, что реакция идет, вероятно, по
механизму (II):
I2^V2I (1) 21 t^}l2 (2) 21 + НД.2Ш (3)
Используя метод стационарных концентраций, выведите
« (d lHU \
уравнения для скорости образования I——-1,
соответствующие механизму (I) и механизму (II).
ЮЛ. Напишите уравнение, по которому можно
рассчитать константу скорости реакции в растворе £р по
значению константы скорости той же реакции,
протекающей в газовой фазе kr> если уф, уав и ^с—коэффициенты
активности соответственно активированного комплекса
и исходных веществ.
10.2. Что называется энергией активации
элементарного акта химического превращения?
10.3. Может ли и в каких случаях энтропия активации
быть меньше нуля?
10.4. Представьте график зависимости скорости
разветвленной цепной реакции от давления и объясните его.
10.5. Фотохимическая реакция димеризации
антрацена (А) 2 СнН10==С28Н2о в растворе под действием
излучения с длиной волны 366 нм протекает по следующему
79
механизму:
■i
A -f kv _-> А* фотоактивация (1)
А* + аД.А2 димеризация (2)
А* + А ^. А -Ь А дезактивация без излучения (3)
А* ^ А -Ь Лу^ дезактивация с излучевием (флуоресценция) (4)
Пользуясь методом стационарных концентраций,
выведите кинетическое уравнение для реакции димеризации,
если Nhv — число поглощенных в 1 с квантов, или число
образующихся в J с электронно-возбужденных молекул
А*.
10.6. Приняв средний диаметр молекул Н2 и h равным
2,0-Ю-8 см, вычислите константу скорости реакции
H2+l2->-2HI при 700 К (см3-моль-1-с-"1)» если
экспериментальная энергия активации равна 166,2 кДж/моль?
а стерический фактор Р = 0,47.
ГЛАВА XV. ГЕТЕРОГЕННАЯ КИНЕТИКА.
ДИФФУЗИЯ. АДСОРБЦИЯ. КАТАЛИЗ
1.1. Напишите уравнение изотермы адсорбции Лэнг-
мюра, если Г — количество вещества, адсорбированное
единицей поверхности; Гто — количество вещества,
адсорбированное единицей поверхности при полном ее
заполнении мономолекулярным слоем; Ъ — адсорбционный
коэффициент; Р — давление.
1.2. Каков физический смысл коэффициента
диффузии?
1.3. При повышении температуры на 10° и прочих
равных условиях скорость 1-й гетерогенной реакции
увеличилась в 3,8 раза, а 2-й — в 1,4 раза. В какой области»
диффузионной или кинетической, протекает каждая из
этих гетерогенных реакций? Кратко аргументируйте свой
этвет.
1.4.-Какие из стадий гетерогенного каталитического
взаимодействия могут быть лимитирующими согласно
тредставлениям Баландина?
1.5. Энергия активации гомогенно-каталитической
реакции разложения перекиси водорода в присутствии ио-
гов I- как катализатора равна 56,5 кДж/моль, а без ка-
;о
тализаторг — 75,4 кДж/моль. Определите, во сколько раз
скорость каталитической реакции при 350 К больше
скорости реакции в отсутствие катализатора.
1.6. Одинаковое количество С02 (40 см3, измеренных
при нормальных условиях) адсорбируется 1 г угля в
одном опыте при 303 К и 799,8-102 Па, а в другом — при
273 К и 230,6-102 Па. Определите, под каким давлением
(Па) адсорбируется это количество СОг при температуре
293 К.
2.1. Напишите математическое выражение 1-го закона
Фика, пользуясь следующими обозначениями: п —
количество диффундирующего вещества, моль; D —
коэффициент диффузии; С — концентрация; х— расстояние, на
котором происходит диффузия; S — поверхность
диффузии; х—время.
2.2. В чем заключается основная причина увеличения
скорости реакции при гетерогенном катализе?
2.3. Как зависит константа адсорбционного
равновесия Ъ от температуры при адсорбции газа на твердом
адсорбенте? Напишите уравнение этой зависимости и
объясните ее.
2.4. Что называется эффектом аггравации в
гомогенном катализе и чем объясняется этот эффект?
2.5. Коэффициент самодиффузии азота при 293 К
равен 0,221 см2/с, а при 353 К он равен 0,287 см2/с
Определите энергию активации диффузии в Дж/моль.
2.6. При горении угля в канале, через который
пропускается воздух, константа скорости диффузии при 1323 К
равна 31,6 см-с-1. Чему она будет равна, если вместо
воздуха в канал с такой же скоростью будет поступать
азот, к которому примешана двуокись углерода,
взаимодействующая с углем по уравнению С + С02->£СО?
Коэффициенты диффузии СОг и Ог соответственно равны
2,00 и 2,35 см2/с
3.1. -Напишите уравнение, выражающее зависимость
коэффициента диффузии от температуры.
3.2. Что называется общим кислотным и основным
катализом?
3.3. Поясните основной смысл и значение принципа
структурного (геометрического) соответствия мульти*
плетной теории гетерогенного катализа Баландина.
81
3.4. Какие условия необходимы для осуществления
стационарного состояния диффузионного потока?
Запишите их математически. Представьте график изменения
концентрации диффундирующего вещества в
зависимости от расстояния для различных промежутков времени
Ть т2, тз от начала реакции.
3.5. Стержень железа погружен в 0,01 М раствор НС1.
Через 200 мин от начала реакции при постоянном
перемешивании измеренная концентрация оказалась равной
10~4 моль/л. Определите время, по истечении которого
•концентрация раствора станет равной 0,001 моль/л.
Какие предположения и допущения необходимо
использовать при решении этой задачи?
3.6. Обезуглероживание поверхности стали в
атмосфере водорода при 1673 К протекает в переходной области.
В каком соотношении должны находиться константа
скорости химической реакции (&х.р) и константа скорости
„диффузии углерода (&д), чтобы при стационарном
течении процесса отношение поверхностной концентрации
углерода к объемной (Cs/Cv) было равно 0,5?
4.1. Чему равен температурный коэффициент
диффузии Y = %^?
4.2. Как изменяется активность нанесенных
катализаторов с увеличением степени заполнения и чем
объяснить указанный характер изменения?
4.3. По какому порядку протекает мономолекулярная
гетерогенно-каталитическая реакция при малых
давлениях газообразного реагента? Аргументируйте ответ.
4.4. Напишите уравнение, описывающее
нестационарную диффузию, а также условия осуществления
нестационарного диффузионного потока. Представьте график
.зависимости концентрации С от расстояния х для
различных промежутков времени ть тг, Тз от начала реакции.
4.5. Ион Вг~ в кислой среде катализирует
разложение перекиси водорода до кислорода и воды.
Образующаяся бромноватистая кислота НВгО, как
промежуточное соединение, по уравнению реакции
Н2Оа -Ь Вт- + Н+ X НВгО + Н20 (1)
«быстро восстанавливается перекисью водорода по
уравнению реакции
Н202 + НВгО % Н20 + Вг- + Н+ + 02 (2)
в2
Образующийся ион Br- реагирует с другой молекулоГ?
Н202 и т. д. Суммарное уравнение катализируемой
реакции
2Н202^2Н20-|-02
Пользуясь методом стационарных концентраций,
выведите уравнение для скорости образования кислорода. Какой
порядок по перекиси водорода имеет эта реакция?
Зависит ли скорость реакции от концентрации
катализаторов— ионов Вг~ и Н+?
4.6. Константа скорости реакции растворения
хлорида свинца в воде при 298 К равна 0,016 мин-1.
Растворимость этой соли при той же температуре 36-103 моль/л.
Определите концентрацию соли в растворе по прошествии
43 мин после начала растворения.
5.1. Запишите выражение для скоровти v гомогенной
каталитической реакции 1-го порядка по реагирующему
веществу S для специфического кислотно-основного
катализа при осуществлении его одновременно и ионами
водорода, и гидроксила. Обозначения: ko — константа
скорости реакции без катализатора; ku+—константа
скорости реакции в кислом растворе; &он константа
скорости реакции в щелочном растворе.
5.2. По какому порядку протекают гетерогенные
реакции, наиболее хмедленной стадией которых является
стационарный поток диффузии исходных веществ к
поверхности раздела фаз?
5.3. Чем катализатор отличается от индуктора?
5.4. Представьте график зависимости скорости
диффузии и скорости химической реакции от температуры
для гетерогенной реакции и укажите, в каком интервале
температур реакция протекает в диффузионной области,
а в каком — в кинетической. Каков порядок величины
энергии активации в диффузионной области и каков — в
кинетической?
5.5. При растворении вращающегося диска из
прессованного хлорида кальция поверхностью 5 см2 в 100 мл
чистой воды концентрация СаС12 через 30 мин
увеличилась до 165 г/л. Считая, что скорость растворения
лимитируется стационарным потоком диффузии, определите
коэффициент диффузии СаС12 в растворе, если
растворимость СаС12 при данной температуре 600 г/л и
толщина диффузионного слоя 5* 10~3 см.
83
5.6. При давлении 1,19 Па адсорбция двуокиси
углерода на слюде (Г= 155 К) составляет 2,09-10~10 моль/см2,
а при давлении 9,80 Па — 3,70-10~10 моль/см2.
Определите адсорбционную емкость слюды (моль/см2), считая, что
адсорбция С02 на слюде описывается уравнением Лэнг-
мюра.
6.1. От чего зависит коэффициент диффузии в
разбавленных растворах?
6.2. Как изменяется степень заполнения адсорбента
данным эдсорбатом с повышением температуры при
химической адсорбции?
6.3. В чем состоит основной смысл и значение
принципа энергетического соответствия в мультиплетной теории
гетерогенного катализа Баландина?
6.4. Почему и на какую величину энергия активации
гетерогенно-каталитической реакции, измеряемая на
опыте (£каж), меньше энергии активации той же реакции,
протекающей без катализатора, если считать, что обе
реакции протекают через образование одного и того же
переходного состояния?
6.5. Определите давление паров НгО (Па) на
расстоянии 0,04 к от поверхности воды, находящейся в трубке
длиной 0,05 м, если над верхним отверстием трубки
продувается сухой воздух. Вода и пар находятся при
температуре 328 К. Необходимые для расчета данные возьмите
в справочнике. Какой случай диффузии представлен в
этом опыте?
6.6. Скорость растворения диска из прессованного
хлорида калия зависит от скорости его вращения. При
одной скорости вращения диска и концентрации КС1 в
растворе 160 г/л толщина диффузионного слоя и скорость
растворения диска составляют соответственно 2,5-10~2см
и 2,5 мг/мин, при другой скорости вращения и
концентрации КО 100 г/л — соответственно 1 -10~2см и 9 мг/мин.
Рассчитайте растворимость КС1 в воде, приняв
коэффициент диффузии, поверхность диска, объем раствора и
температуру постоянными.
7.1. Что называется скоростью гетерогенной
каталитической реакции?
7.2. Что такое мультиплет согласно мультиплетной
теории гетерогенного катализа Баландина?
84
7.3. Какие признаки свидетельствуют о наличии
активированной адсорбции?
7.4. По какому порядку протекает мономолекулярная
гетерогенно-каталитическая реакция при высоких
давлениях газообразного реагента? Аргументируйте ответ.
7.5. Какой из приведенных на рис. 20, а, б графиков
показывает распределение концентрации
растворяющегося вещества при перемешивании раствора?
ъ2
а
Рис. 20
7.6. На основании данных по адсорбции азота 1 кг
активированного угля при 273 К и двух давлениях
Я, Па-Ю-3 0,524
fNi,Kr....^. .... 1,234-103
7,495
12,886-103
определите константы b и Гто уравнения Лэнгмюра, а
также степень заполнения поверхности угля В при
Р=3-103Па.
8.1. Каков физический смысл коэффициента b в
уравнении изотермы адсорбции Лэнгмюра: г = тт — ?
8.2. Какие экспериментальные данные необходимы
для решения вопроса о том, в какой области —
диффузионной или кинетической — протекает рассматриваемая
гетерогенная реакция при данных условиях?
8.3. Почему при рассмотрении гетерогенных
каталитических реакций говорят о «кажущемся» порядке реакции?
8.4. Какое общее представление лежит в основе
объяснения действия катализатора в гомогенном и
гетерогенном катализе?
85
8.5. Коэффициент самодиффузии бензола при 298 К
равен 2,15-Ю-5, а при 318 К — 2,67-10~5 см2/с. Чему
равен коэффициент самодиффузии бензола при 328 К?
8.6. Вычислите площадь поверхности катализатора,.
который для образования монослоя адсорбирует 103 см3/г
азоха (вычислено при Р = 1,0133-105 Па и 273 К).
Адсорбция измерена при 468 К, эффективная площадь, занятая
при этой температуре молекулой азота на поверхности,,
равна 16,2 А2.
9.1. Что называется процессом диффузии?
9.2. Чем понятие «абсорбция» отличается от понятия
«адсорбция»?
9.3. Представьте график изменения количества
адсорбированного вещества (Г) в зависимости от времени для
температур 7\ и Г2, причем Т\<Т2.
9.4. Что такое «оптимальный» катализатор согласно
принципу энергетического соответствия в мультиплетноГ?
теории гетерогенного катализа Баландина? Чему равна
энергия активации процесса с применением такого
катализатора?
'9.5. Раствор пальмитиновой кислоты С16Н32О2 в
бензоле содержит 4,24 г/л кислоты. Когда раствор наносят
на поверхность воды, то бензол испаряется, и
пальмитиновая кислота образует сплошную мономолекулярнук*
пленку. Какой объем раствора нужно взять, чтобы
таким монослоем покрыть поверхность площадью 500 см2?
Площадь, занимаемая одной молекулой пальмитиновой
кислоты на поверхности воды, равна 21А2.
9.6. Зависимость константы скорости реакции
C-f 02=С02 от температуры выражается уравнением
5590
где #х.р выражена в см/с. Определите константу
скорости диффузий при 1373 К, если эффективная константа
скорости реакции &9фф при этой температуре равна
23,4 см/с.
10.1. Что называется диффузионным слоем?
10.2. Что называется удельной каталитической
активностью катализатора?
10.3. Представьте график зависимости количества
адсорбированного вещества Г от температуры при посто-
86
янном давлении для физической и активированной
(химической) адсорбции.
10.4. В каком случае скорость гетерогенной
химической реакции А -> продукты реакции, лимитируютvn
стадией которой является адсорбция исходного вещества,
описывается уравнением 1-го порядка?
10.5. В течение 10,5 мин в 1 л воды растворилось
6,14• 10—3 моль, а за 1 ч 24,58-Ю-3 моль РЬСЬ-
Рассчитайте среднюю величину константы скорости растпоре-
ния РЬСЬ и время, необходимое для того, чтобы
насыщение раствора хлоридом свинца достигло 90%, t-c.iit
растворимость РЬС12 в воде при 300 К рант
38,66-10"3 моль/л. Считать скорость вращения образа
и площадь его поверхности постоянными.
10.6. Константа скорости реакции гидролиза дил «*-
уксусного эфира
N2CHCOOC2Hs + НгО->-НОСНзСООС2Н5 + N2
изменяется с концентрацией ионов водорода' следукиг.пч
образом:
ГН80+1, моль/л ..... . 0,00046 0,00087 0,001581 O.OUTJ*
kt л/моль -с 0,0168 0,0320 0,0578 " 0,12^
Определите среднюю константу скорости катализа
кечами водорода £н+, если реакция имеет 1-й порядок по
эфиру.
ОТВЕТЫ
) Г л а в a I
f.l. Разница в энергии квантов приводит к возбуждению
различных видов молекулярного движения: в микроволновой и дальней
ИК-областях возбуждается вращательное движение, в средней
и ближней ИК — колебательное движение, в видимой и УФ —
, n 2B .
электроны. 1.2. о)с<о)к<о)а. 1.3. Р-ветвь: <* — <йе 0- — *хе)— *~:— Л
2В
he
#-ветвь: w = toe (1—2.^) 4- -—(/ + -1). 1.4. Различия будут,
пс
Во &$>ащательном спектре вследствие разницы в моментах инерции,
з колебательном вследствие различной частоты колебаний. 1.5. 2,32Х
Х)0~10 м. 1.6. 2559,4; 5028,5 см"1; ИК-область. 2.1. Молекула Вг2
'КОЛ
макс
Рис. 21
зе имеет дипольного момента, а молекула НВг полярна. 2.2.
v>
1 /Т
= —— 1/ .2.3. о) = о)еи[1— xe{v + \)]. 2.4.
2л у [а
Возбуждается
только вращательное движение. 2.5. 1,29 см-1. 2.6. Нг прочнее иа
229 кДж/моль. 3.1 с<£вр = ■ У (У + 1); Д/= ± 1. 3.2.
Электронные полосы поглощения наблюдаются в Уф- и видимой областях.
3.3, 12, 3.4. Acohf>Acono, так как /no>/hp. 3.5. 787,5 см-1;
8л9-10-3. 36. 1,66-10"" Дж. 4.1. (—М =^0. 4.2. Интенсив-
\ од ;^-о
весть линий возрастает в ряду: антистоксова, стоксова,
классического рассеяния. 4.3. HF. 4.4. г —
v
4Д2С/л1/л2Дс4
4.5. 4,36Х
for21 Дж. 4.6. 57; 261 кДж/моль. 5.1. Рис. 21. 5.2. Можно рассчи-
Ы собственную частоту колебаний, коэффициент ангармоничности,
В
тию диссоциации. 5.3. о>=2——(jf -f- l). 5.4. 3. 5.5. 3,4 см-1.
he
1183 см"1. 6.1. £кол = (v 4- —J hve — (v + —J ftvexe. От О до
0,5
кс = — 0,5. 6.2. Вращательный спектр будет наблюдать-
для Н20; колебательный — для Н20, ССЦ, С6Н6. 6.3. Силовая кон-
нта двухатомной молекулы есть величина, характеризующая
iyгость связи н численно равная силе, деформирующей связь на
_ ницу длины. 6.4. Наличие только двух ветвей объясняется пра-
.Зрилом отбора для вращательных переходов при изменении колеба-
\Згельного состояния: Д/=—1 (Р-ветвь); Д/= +1 (/?-ветвь); Д/=^0.
S&5. l,78-10~iO м. 6.6. 190 кДж/моль. 7.1. По данным чисто
вращательного спектра можно рассчитать межъядерные расстояния, углы
между связями, моменты инерции. 7.2. S = *— (1 —хе)2. 7.3. Ис-
чезает тонкая вращательная, а иногда и колебательная структура
полосы из-за сильного межмолекулярного взаимодействия. 7.4. 4.
7.5. 0,01476 см. 7.6. 2379 см-1. 8.1. Чисто вращательный спектр
представляет собой серию равноотстоящих линий (в масштабе
частот или волновых чисел)_ в микроволновой и -дальней ИК-областях.
8.£. со цъ5С[1^гъС1 = к 2.8.3. Появление этой полосы можно
приписать только продукту взаимодействия С12 и Вг2 — молекуле BrCl,
так как ни Вг2, ни С12 не способны к поглощению в ИК-области из-за
отсутствия дипольного момента. 8.4. N2. 8.5. 67,3* Ю-47 кг-м2. 8.6.
6,37-J0-21 Дж. 9.1. Н2; HD; HT, D2. 9.2. Прн переходе на более
высокий вращательный уровень увеличивается скорость вращения
молекулы. 9.3. Разность линий будет больше для НС1 из-за меньшего
момента инерции. 9.4. Наиболее прочная связь в молекуле Г.
9.5. 1,53-Ю-10 м. 9.6. 3365 Дж/моль. 10.1. При переходе на более
высокий колебательный уровень увеличивается амплитуда колебаний
ядер в молекуле. 10.2. Основной полосой в колебательном спектре
называется полоса, соответствующая переходу молекул с нулевого
на первый колебательный уровень. 10.3. Угловая скорость вращения
увеличилась в 2,24 раза. 10.4. Некоторые колебания вырождены, т. е.
обладают одинаковой частотой. Поэтому число различных частот в
молекуле ССЦ равно 4, а каждая частота дает пару линий в
спектре КР- Ю.5. 1,30- Ю-10 м. 10.6. 6,64-106 см2/моль; 15,1%.
Глава II
1.1. 6<2 = <Ш+6Л; Q — АС/+Л. 1.2. Тепловой эффект уменьшается.
1.3. Работа расширения больше для двухатомного газа. 1.4.
Энтальпия ацетилена возрастет больше. 1.5. 39,9-106 Дж/кмоль. 1.6. (QP —
—Q*)298= —4955 Дж; {Qp~Qv)aoo^= —3326 Дж. 2.1. Тепловой эффект
химической реакции зависит только от вида и состояния исходных
веществ и продуктов реакции, но не зависит от пути перехода при
условии, если объем и температура или давление и температура в
ходе реакции остаются постоянными. 2.2. 6С+5/2H2-bl/2N2+02=
4—786- 89
v
= C6H5N02. 2.3. Работа расширения наибольшая в процессе (б).
2.4. АСР« —4,627+31,8-10~3 Г — 55,47- 10~б Т\ 2.5. —78,2 кДж.
2.6. Теплоты на испарение потребуется больше для воды на 1,3 кДж.
«3.1. Количество энергии, которое система выделяет или поглощает
в виде теплоты при полном необратимом протекании реакции при
постоянстве температуры и объема или давления и температуры.
3.2. АЯ-СР(Г2— Тх). 3.3. Д#>Д(У. 3.4. Рис. 22. 3.5. Л= —74,1 кДж;
Q= —972 кДж; А<7« —896 кДж. 3.6. —205,54 кДж. 4.1. \~г
= АСр. 4.2, Ни внутренняя энергия, ии энтальпия не изменяются.
4.3. А—О. 4.4. Можно. Температурный коэффициент теплоты
испарения— отрицательная величина. Для D20 величина ДС=СЦ— Сж
более отрицательна, чем для Н20. Следовательно, при росте
температуры величина ДЯИСц Для D20 будет убывать быстрее, чем для
Н20, и величины те плот испарения будут приближаться друг к дру-
ЩСр
т
Рис. 22
гу. 4.5. 3. 4.6. —1486 кДж/моль. 5.1. Для определений теплоты
сгорания необходимо из суммы те плот образования продуктов
сгорания данного органического соединения вычесть теплоту образования
этого соединения. 5.2. При повышении температуры тепловой
эффект может расти, может падать и может оставаться постоянным.
Характер зависимости определяется знаком и величиной ДС. 5.3.
Противоречие кажущееся. В законе Гесса идет речь о тепловом
эффекте при условии постоянства давления или объема, т. е. при
заданном термодинамическом пути процесса. При этом тепловой
эффект QP или Qv становится функцией состояния. Если же
изменить термодинамические условия ^протекания процесса, то изменится
и тепловой эффект реакции: в обшем случае Qp=^=Qv> 5.4. А —
^nRTln ~ ; А*=Ау. 5.5. 625 Дж. 5.6. 47,7. кДж. 6.1. Тепловой
эффект уменьшится. 6.2. Если в реакции участвуют вещества только
в конденсированных фазах. 6.3. Рис. 23. 6.4, Температурный
коэффициент теплоты испарения больше для D20. 6.5. —104,0 кДж. 6.6.
29,72 кДж/моль. 7.1. H=U+PV. 7.2. Теплотой сгорания
нитрофенола называют тепловой эффект окисления нитрофенола до следующих
конечных продуктов: С02 (г), Н20 (ж), N2 (г), 7.3.
Воспользоваться следует данными по теплотам образования. Теплоты образования
меньше, чем теплоты сгорания тех же веществ, поэтому при расчете
90
разности теплот образования погрешность будет меньше7"4: Ра~°"
та расширения обоих газов одинакова. А = R{T2' 1>ш
т
17,10 кДж/моль. 7.6. 82,0-106 Дж/кмоль. 8.1. Д#= f CpdT. 8.2.
AH^AU±AnRT. 8.3. Работа расширения больше в Изо^рическом
процессе. 8.4. Рис. 24. 8.5. —6240 кДж/моль. 8.6. I'7»1 кДж-
9,1. С ростом температуры внутренняя энергия веществ' уве,?ичи"
вается (dU/dT)v=Cv. 9.2. а) Д#-2п,-(А#обр)прод-2п^обр)ис*;
б) ДЯ«2/г*(АЯсгоР)«сх —2«*(АЯогор)прод. 9.3. Для о*»их газов
работа расширения равна нулю. 9.4. Тепловой эффект ^ньшится
в интервале от 298 до 1000 К. Для всего указанного инт^в.апла т*м"
ператур справочных данных иет. 9.5. —1535 кДж. 9.6. э4и кДЖ'
АН
Ъп-Л
т
Рис. 23
Рис. 24
/°лиС Ростом температуры энтальпия вещества увел!1ЧИвается-
\~^fj =Ср- 10*2- CP = CV+R. Ю.З. Тепловой эффе*т бУдет
меньше 89,03 кДж. 10,4. Изменение энтальпии больше для
двухатомного газа. 10.5. —27,5 кДж/моль. 10.6. 3,22 Дж/град.
Глава III
Ы. dS >
«Чгнеобр
1.2. AS>0; AG<0. 1.3. S (r)rS (ж)>
>S (тв). 1.4. Энтропия системы увеличивается. 1.5. 4,17 Д^/мольХ
Хград. Кб. —107,5 Дж/моль. 2.1. G-F+PK. 2.2. Изменен*'* энтр0'
пии не происходит в адиабатическом процессе. 2.3. Это происх?дит
при таких условиях обратимого протекания процессов, ког/*а Убыл^
соответствующей термодинамической функции равна максЙмалЬо°г?
полезной работе процесса. 2.4. AGo6p=AGEeo6p=200 /*ж' 2'5,
—189 Дж/град. Вывода о направлении реакции сделать не/1ЬЗЯ' так
как энтропия является критерием направленности процессов только
в изолированных системах. 2.6. —1,72-10* Дж. 3.1. В этих У^^иях
максимальная полезная работа сове.ошяется зя сче^ Уб]Ё1ЛИ
88 0; необратимый
4*
полезная работа
макс
процесс
совершается
dS>0. 3.3. Так как зав
энергии Гиббса: Л'макс = — AG." 3.2." Обрат'имый" процесЯ dS ~
исимость
91
fdAG \
AG от температуры определяется уравнением ~~—1 = —AS,
\ оГ }р
то AG увеличивается с ростом температуры, если энтропия
продуктов реакции меньше энтропии исходных веществ. В
противном случае величина AG уменьшается с ростом
температуры. 3.4. ДЗяяобяр = Л5ИЗОХор. 3-5- 3,26-Ю3 Дж/град. 3.6,
—14,8 кДж/моль. 4.1. Следует выбрать энергию Гиббса (иэобарно-
изотермический потенциал) G. 4.2. (-—г*) = V. 4.3. Д50бР —
\ дР )т
= ASHeofip. 4.4. AG=*AF+nRT. 4.5. 206 Дж/моль-град. 4.6. 7,64Х
ХЮ6 Дж. 5.1. Необходимо поддерживать постоянными внутреннюю
энергию U и объем V. 5.2. Энтропия такой системы не меняется.
5.3. Изменение указанных функций можно рассчитать, если
необратимый переход от начального к конечному состоянию можно
заменить одним или несколькими обратимыми процессами. 5.4. Энергия
Гиббса быстрее меняется для 12. 5.5. 38,2 Дж/моль-град; AS не
изменится. 5.6. 538 Дж/град; 993 кДж. 6.1. А'шкс = — АН +
( дАткс \
+ Т I—— I . 6.2. S^Si+Sz+S* 6.3. AS! = A52. 6.4.
Д#<0 и AS>0. 6.5. 63,6 Дж/моль-град. 6.6. —6,3 кДж/моль. 7.1.
Энтропия стремится к нулю. 7.2. Следует выбрать энергию Гельм-
гольца (изохорно-изотермический потенциал). А/г<0. 7.3. AG—0;
AF=—RT. 7.4. Понятие о термодинамических потенциалах вводится
для решения вопроса о направлении процессов, протекающих в
неизолированных системах. 7.5. 10,5 к Дж/град. 7.6. —1031 кДж.
Возможно. 8.1. С ростом объема энергия Гельмгольца уменьшается;
/ dF \
[ ' "I = —P. 8.2. АН может служить критерием направления
\ oV )т
процесса при постоянных S и Р; А//<0. 8.3. AG<0; твердое. 8.4.
Будет наблюдаться максимальное изменение энергии Гиббса. 8.5.
4,40 Дж/град. 8.6. —191,5 кДж. 9.1, Необходимо поддерживать
постоянными Р и Т. 9.2. Энергия Гельмгольца увеличивается. 9.3.
Для системы А. 9.4. Изменение энтропии никогда не равно работе.
9.5. 10,7-103 Дж/кмоль*град. 9.6. —3,1 кДж/моль. 10.1. С ростом
температуры энергия Гиббса уменьшается: I ~7^~) *= —5. 10.2.
Величина AG не изменится. 10.3. При нагревании величина TS
растет, при конденсации уменьшается. 10.4. Наибольшее изменение
энтропии будет при изобарическом нагревании. 10.5. 1,28 Дж/град»
10.6. 0.
Глава IV
fdlnZ \
1.1. U-Uq^RTZI ■ ■ . 1.2. Рис. 25. 1.3. Частоты
\ ОТ Jv
внутримолекулярных колебаний у молекулы РС13 ниже, поэтому они
дают больший вклад в колебательную составляющую теплоемкости.
1.4. С12. 1-5. 40%. 1.6. 24,62; 2494 Дж/моль; 8,314 Дж/моль-град.
/ д In Z \ td*\nZ\
2.1. С*^2ЛГН^Н +RT \afTL' • Для ВЫЧЙСле'
92
ния колебательной составляющей энергии Гельмгольца необходимо
знать частоту внутримолекулярных колебаний. 2.3. СО. 2.4. D2, HC1,
HD, Н2. 2.5. 8,85 кДж/моль. 2.6. 3,1%. 3.1. H — Hq^rt
+ Т
fdluZ
, дТ
'V
О.Ьш £>щ -—■
i +
3.3. 1214; 2722, 2739 см-1.
3.4. Так как момейт инерции молекулы 12 примерно в 500 раз
больше момента инерции HF, квантовые вращательные уровни
молекулы 12 сильно сближены и квантовая природа вращательного
движения для этой молекулы в отличие от молекулы HF проявляется
мало. Поэтому вращательная теплоемкость 12 быстро достигает
О 2 4 6 8 Ю 12 14 16 fS J 0
Рис. 25
Рис. 26
классического предела, равного R. 3.5. *2,5; 8,14 Дж/моль-град.
BJU+D
3.6.0,14. 4.1. Рис. 26. 4.2.
Nt (2y+l)*
kT
4.3. К2.
N Zbp
4.4. Молекула N20 линейная и имеет две степени свободы
вращательного движения. Молекула N02 нелинейная и имеет три степени
свободы вращательного движения. Поэтому вращательная
составляющая теплоемкости N02 больше, чем для N20, на у2 R, т. е. на
4,15 Дж/моль-град. Так как молярные теплоемкости газов равны,
эта величина в точности компенсирует «недостачу» колебательной
составляющей теплоемкости N02. Таким образом, разность
колебательных составляющих теплоемкостен N20 и N02 составляет
4,15 Дж/моль-град. 4.5. 1,33-10ю. 4.6. 29,1 кДж/моль. 5.1.
Классическая теория теплоемкости не может объяснить экспериментально
наблюдаемую зависимость теплоемкости от температуры. 5.2.
Зависит. С ростом температуры сумма состояний увеличивается. 5.3.
В обоих случаях доля молекул на данном уровне определяется фор-
мулои — - . Для колебательного движения
статистический вес уровня всегда равен I, поэтому число молекул с
ростом v уменьшается экспоненциально. При распределении же
молекул по вращательным уровням сказывается величина
статистического веса (£=2/ + 1), что и приводит к появлению максимума.
5-4-сСан4 = сна0< 5.5. 351 см"1. 5.6. —183 кДж/моль. 6.1. С— Й0=
93
=RT(\—InZ). 6.2. Характеристическая колебательная температура
не зависит от температуры газа, она определяется только частотой
внутримолекулярных колебаний. 6.3. Теплоемкость СС]4 выше, чем у
СН4, так как частоты внутримолекулярных колебаний у ССЦ ниже,
чем у СН4. 6.4. При повышении температуры сумма состояний
увеличится, а число молекул на рассматриваемом уровне уменьшится.
6.5. 118,5. 6.6. 1226 Дж/моль; 3,55 Д ж/моль-град. 7.1. Можно
рассчитать F—F0 и G—G0. 7.2. При повышении температуры число молекул на
нулевом колебательном уровне уменьшается. 7.3. В{=2В2. 7.4.
Наибольший вклад в теплоемкость дает колебание v4. 7.5. 0,030. 7.6.
36,0 Дж/моль-град; 36,8 кД ж/моль. 8.1. г=^е~~%1!кТ- 8.2. Одна
степень свободы дает вклад, равный 1/2/?~4,15 Дж/моль-град. 8.3.
Молекула SO2 имеет три степени свободы вращательного движения,
а молекула С02 вследствие своей линейности — только две.
Поэтому вращательная составляющая теплоемкости SO2 на 1^R
больше, чем для СОг, что и сказывается на общей величине
теплоемкости. 8.4. Причина в различных числах симметрии для этих
молекул: <Тсо = 1, (%а =2. 8.5. 1640 см-1. 8.6. 244 Дж/моль«град. 9.1.
Сумма состояний поступательного движения определяется молекулярной
массой, давлением н температурой. 9.2. Z9J1~g0j Эл(£о, эл —
статистический вес основного электронного состояния). 9.3. Зависит. Чем
больше частота колебаний, тем меньше сумма состояний. 9.4. gco —
= 1,8 gin. 9.5. 35,9 Дж/моль-град. 9.6. 9,4%. 10.1. ZUoct>Zbv>
>ZK0л>2'эл. 10.2. S = R In Z + RT[ —— . 10.3. Молекула PCI3
\ or }v
имеет более низкие частоты внутримолекулярных колебаний, чем
С2Н2. Кроме того, молекула РС13 имеет три степени свободы
вращательного движения, а молекула С2Н4 вследствие своей линейности —
только две. Поэтому и колебательная, и вращательная составляющая
теплоемкости РС13 больше, чем С2Н2. 10.4. (G—G0)hcl>(G—G0)co.
10.5. 1,428 Дж/моль-град; 46,4 Дж/моль. 10.6. 418.
Глава V
1.1. Насыщенным паром жидкости называется пар,
находящийся в равновесий с жидкостью. 1.2. С—\. 1.3. Тройная точка — это
точка на диаграмме, параметры которой (давление и температура)
соответствуют одновременному существованию трех фаз (твердой,
жидкой и газообразной), находящихся в равновесии. 1.4. Теплота
испарения этилацетата больше теплоты испарения циклогексана,
поэтому температура кипения циклогексана с повышением давления
dT RT2
растет быстрее: ~7гГ ~ оА t/—"• *■*>■ 21,6 кДж/моль. 1.6.
—36,6° С. 2.1. Составляющая системы — это вещество, которое может
быть выделено из системы и существовать в свободном виде вне ее.
2.2. Общим термодинамическим условием фазового равновесия
является равенство химических потенциалов каждого компонента во
всех фазах. 2.3. Давление насыщенного пара над твердым телом
растет при увеличении температуры, поскольку АЯВОЗг > 0,
UP А//„пчг
А^возг - ТЛтар - ^тв > 0 И — - тAl/°J > 0. 2.4. Д#исй =
94
=—— -tga, рис. 27. 2.5. 5400 Па. 2.6. 11,3 Дж/град. 3.1.
Компонентом называется независимая составляющая системы. Число
компонентов равно числу составляющих минус число уравнений,
связывающих их концентрации. 3.2. Рис. 28. 3.3. С=0. 3.4. Зависимость
теплоты испарения от температуры кипения можно выразить только урав-
Рис. 27 Рис. 28
нением ДЯИсп = 62,5-103—12,5 7*, так как с увеличением температуры
кипения теплота испарения всегда уменьшается. 3.5. 140 Дж/г.
3.6. 5,2* 10* Па. $Л* Фазой называется совокупность гомогенных
частей системы, обладающих одинаковыми физическими и химически-
Рис 29
ми свойствами и отделенных от других частей системы видимыми
границами раздела. 4.2. Начало кривой — тройная точка, конец —
критическая температура. 4.3. Величины Д£ИСц для всех
перечисленных веществ примерно равны, так как по правилу Трутона для
неполярных жидкостей Л5ИСП = — ~ const. 4.4. АЯИсп =
= 62 600—5,41 Т. 4.5. 4,15 кДж. 4.6. 2,*3-10"2 м3/кмоль. 5.1. Числом
термодинамических степеней свободы называется число независимых
параметров, которые можно изменять, не меняя числа н вида фаз
в системе. 5.2. Рис. 29. 5.3. Температура плавления с ростом
давления может расти, а может и падать. Характер зависимости
определяется знаком Д^пл^Уж—Утв: если ДУ>0, то температура плавле-
95
Шя с ростом давления растет, в Противном случае падает, 5.4.
( dP \ АЯИСП (dP\
[irL = "^г • (-jfL > °* потому что всегда
АЯисп>0 и ДУисп = Vn — Vm > 0. 5.5. Энтропия изменится на
115 Дж/моль«град. 5.6. 290 Па/град. 6.1. Температурой кнпення
называется температура, при которой давление насыщенного пара
жидкости равно внешнему давлению. 6.2. (""ТГ") =
\ аТ /возг
А^возг / dP\
= 'т AI/ ' ("7/7*1 > 0' ТаК КаК BCer^a Д"возг>0 И
'возгАК в0эг \ *** /возг
AV/Bosr=l/n—1/тв>0. 6.3. Величина давления насыщенного пара в
тройной точке для воды меньше, а для иода больше атмосферного
давления. 6.4. Температура кипения цнклогексана будет выше тем-
dT
пературы кипения трифторхлорметана, поскольку величина —г —
КГ2
= —— для трифторхлорметана больше. 6.5. 4,3-104 Па;
РДЯИСП
99 Дж/моль-град. 6.6. 3,8-107 Па.
Г л а в а VI
1.1. Давление насыщенного пара растворенного летучего
вещества изменяется по закону Генри: 'Ръ^к'Сч. 1.2. P=Pl0N1-\-P2°N2-
1.3. Величина эбуллиоскопической постоянной определяется только
свойствами растворителя: £ = , где Т кип — температу-
IUUU/-JJQU
ра кипения растворителя; LKCn — удельная теплота испарения
растворителя. 1.4. Раствор сульфата натрия имеет большее осмотическое
давление, поскольку сульфат натрия в растворе диссоциирует и его
изотонический коэффициент (коэффициент Вант-Гоффа) i будет
больше 1: n=iCRT. 1.5. 729,5 Дж/град. 1.6. —0,04°. 2.1. Константу
Генри определяют экстраполяцией зависимости ^г/Л^^/ЧЛ^) до /V2=
=0, т. е. k=P2lN2 при W2->0. 2.2. S>S°; H=H°; G<G°. 2.3. По за-
кону Рауля —т— = N9 = . Величина ДР при прочих
равных условиях зависит от числа молей flj=<7i/Wf растворителя,
а при одинаковой массе g\— от молекулярной массы М1л Поэтому
АР раствора в этилацетате больше АР раствора в циклогексане.
2.4. Энергия Гиббса при растворении убывает (AGptT<0), так как
растворение — самопроизвольный процесс. 2.5. Давление
насыщенного пара понизится на 8,55 Па. 2.6. а=0. 3.1. Давление насыщенного
пара различается. Оно будет всегда больше над раствором летучего
вещества по сравнению с раствором нелетучего. 3.2. Величина ДР[
растет, так как APJPf=/V2=const, а давление пара над чистым
растворителем Р\° с ростом температуры увеличивается. 3.3. Молярная
энтропия и парциальная молярная^ энтропия различаются на
величину Si—Si°=R\nNi, причем S»°>£i, так как Ni<\. 3.4. Независимо
от ассоциации (или диссоциации) нелетучего растворенного
вещества давление пара над раствором всегда меньше давления пара над
96
чистым растворителем (закон Рауля). Однако при ассоциации
коэффициент Вант-Гоффа i<\ и понижение давления пара над
раствором будет меньше, чем в отсутствии ассоциации. 3.5.
—11900 Дж.'З.б. 153. 4.1. Наибольшую температуру кипения будет
иметь раствор нелетучего вещества, так как давление насыщенного
пара над ним будет наименьшим. 4.2. Предпочтительнее
использовать камфору, так как наибольшее значение криоскопической
постоянной даст наименьшую ошибку при определении молекулярной
массы. 4.3. V=V°\ U=U°\ F<F°. 4.4. С ростом температуры
растворимость газов в жидкостях падает^ поскольку растворение газов —
экзотермический процесс. 4.5. £свн,« —300,4 Дж/моль«град;
S c7Hit =335,3 Д ж/моль -град. 4.6. 0,0128е. 5.1. Давление
насыщенного пара растворенного летучего вещества с ростом
температуры растет, так как с увеличением температуры растет константа k'
в уравнении Генри: P2=k'C2. 5.2. При увеличении диссоциации
растворенного вещества давление насыщенного пара над разбавленным
раствором уменьшается пропорционально коэффициенту Вант-Гоф-
фа i. 5.3. При образовании совершенного раствора закон Рауля
Соблюдается ДЛЯ КаЖДОГО КОМПОНента, Д^смешенип^О, Д#смешения —
=0. Однако Д^с >0 и AGC метения <0. 5.4. ДГК1Ш = **£т, где
i—l-ta(v—1). При прочих равных условиях указанные вещества
отличаются числом ионов v, на которые диссоциирует одна
молекула. Поэтому ^ai2(S04)8 > Tzncu > rCu(N08)2 > tkcv 5*5- 3,24-105 Па.
5.6. 1,09-104 Па.
Глава VII
1.1. It = (-z—I „ ИФ'Ц. 1-2. Nld\n\l+N2d\n\2=-0. 1.3.
Из второго закона Гиббса — Дюгема HtiidLi~0 следует, что
производные парциальных молярных величин компонентов двухкомпонент-
ного раствора имеют противоположные знаки. Поэтому если для
одного компонента зависимость Vj от состава имеет максимум, то для
другого компонента при той же концентрации раствора будет
наблюдаться минимум (рис. 30). 1.4. Концентрация раствора уменьшится.
'СНС13
Рис. 30
Вследствие того, что химический потенциал растворителя в растворе
меньше, чем химический потенциал чистого растворителя, будет
97
наблюдаться массопередача растворителя в сосуд с раствором через
паровую фазу. 1.5. Сц2о =0,965; Л^няО ——81 Дж/моль. 1.6.
FNaci=—1,0 см3/моль; Т7Нг0 =18,8 см3/моль. 2.1. Парциальной
молярной энергией Гиббса компонента раствора называется
изменение энергии Гиббса раствора, которое наблюдается при введении
в него одного моля данного компонента при неизменном составе и
постоянных Р, Т и числе молей всех остальных компонентов. 2.2.
1
Ли ' "" КдТ Jp
реальн / д\Х \ _
/ = ~ . ^.«3. I т^^- I = — о; химический потенциал
метилового спирта с ростом температуры уменьшается, так как
5Сн он > 0. 2.4. Изменение энергии Гиббса при смешении
AGcM=niA|ii + «2A(j,2 есть величина отрицательная. 2.5. По условию I
Y(CH8)2co =1»31. По условию II V(CHs)2co =0,63. 2.6. А =
— —Д(?=8400 Дж/моль. 3.1. В отличие от молярного объему V0,
который всегда больше нуля, парциальный м_олярный объем V
может принимать любые значения: F=0; F>0; V<0. 3.2. Молем
раствора называкггтакое количество раствора, при котором число молей
каждого компонента равно его-^иольной доле. 3.3. Коэффициент
активности — мера той дополнительной работы, которую следовало
бы затратить при постоянных Р и Т для преодоления сил
взаимодействия при переносе одного моля компонента идеального раствора в
реальный раствор той же концентрации. 3.4. Активность компонента
раствора при повышении общего давления может увеличиваться и
уменьшаться в зависимости от знака парциального молярного объема
этого компонента
(д\паЛ V[ nr
1 =- —1— о.о.
дР )t,n RT
a//H2S04 =—56,0,кДж/моль. 3.6. Л=— Дб=2140 Дж/моль. 4.1.
Активностью называется такая функция концентрации, подстановка
которой вместо концентрации в термодинамические уравнения для
идеальных растворов делает эти уравнения применимыми для ре-
альных растворов. 4.2. 2jiid«i=0. 4.3. ДоА = —II —
= — RlnNд .4.4. Активность компонента раствора зависит от тем-
[д\паЛ ЛЯ/
пературы по уравнению ~~^Г~ = — ~^ZT ■ Характер зави-
V о! J PiN RT*
симости определяется знаком и величиной относительной
парциальной молярной энтальпии &Hi=Hi—Яг-° этого компонента в растворе.
При А#«>0 активность с ростом температуры уменьшается, при
AEi<0 активность с ростом температуры увеличивается. 4.5. ASmg =
=2,4 Дж/моль-град. 4.6. Л=—AG=_—600 Дж/моль<0.
Образование раствора невозможно. 5.1. £=2£*/г?\ 5.2. От принятого способа
выражения концентрации активность не зависит. 5.3. u,Fe = M.°Fe+
+ RT\nNFe—2095N^j. 5.4. Активность компонента может быть
меньше его рациональной концентрации при отрицательных
отклонениях от закона Рауля. В этом случае Pi, реальН>-Рг, ид. А_поскольку
Oi=Pi, реальн/Я*0 И Ni=Pi, ид/Л°, TO CLi>Ni. 5.5. FCHeoH =
= 39,7 см3/моль. 5.6. AFAu = l,3-104 Дж/моль.
98
Глава VIII
1.1. 56% пентана. 1.2. В двухкомпонентнои системе насыщенный
пар по сравнению с равновесным раствором относительно богаче
тем компонентом, прибавление которого к системе повышает общее
давление пара, или при данном давлении снижает температуру ки-
Р°
с н
пения. 1.3. Nc н = ■ Л^н • 1-4. Для этой системы от-
клонение от закона Рауля отрицательное. 1.5. «ж=9,6 моль, Пц =
-10,4 моль. 1.6..45,5°. 2.1. 102,1° и 101,2°; 31% СНзСООН. 2.2.
Жидкость, содержащая 56% СНзСООН, и пар, содержащий 38%
СНзСООН. 2.3. В паре увеличивается относительное содержание
СНзСООН. 2.4, Нуль. Ни один параметр менять нельзя. 2.5.
16,7 масс.% Н20. 2.6. 150 г СН3СООН. 3.1. Жидкая фаза (жидкий
раствор). 3.2. 68°, 35% СС14. 3.3. На основании первого закона
Вревского пар обогатится ССЦ. 3.4. Тепловой эффект взаимодействия
компонентов меньше нуля, так как в данном случае наблюдается от*
рицательное отклонение от закона Рауля. 3.5. 0,322 кг пара, 0,678 кг
жидкости. 3.6. 0,699 кг эфира. 4.1. 75°. 4.2. Точки -максймум-а
^„минимума на кривых общего давления пара (или температур кипения)
для двухкомпонентнои системы отвечают растворам, состав которых
одинаков с составом равновесного с ними пара. 4.3. 91%) СС14.
4.4. К=1; Ф=2; С=0. В точке минимума фазы имеют
тождественный состав, поэтому систему следует рассматривать как однокомпо-
нентиую. 4.5. 11,3 моль. 4.6. 2,9 кг С2Н5ОН. 5.1. т. 1: 100% Н20 при
100°; т. 2: 100% HN03 при 85°; т. 3: 65% Н20 при 121,5°. 5.2.
Дистиллят 100% Н20; кубовый остаток — азеотропная смесь. 5.3.
В азеотропной смеси увеличится концентрация HNO3, а в паре над
жидкостью, содержащей 60% HN03, увеличится концентрация Н20.
5-4- /н20-Н20 < /наО-НКО, >f HN03~HNOa > так как *ля ЭТ0Й
системы наблюдается отрицательное отклонение от закона
Рауля. 5.5. 5,35 кг. 5.6. 0,146 кг НШз.
Глава IX
1.1. Компоненты полностью взаимно растворимы и в твердом и
в жидком состоянии. 1.2. Т. 1. Жидкий раствор, содержащий 70%
С3Н8; т. 2. Жидкий раствор, содержащий 50% С3Н8, и твердый
раствор, содержащий 10% С3Н8; т. 3. Твердый CsHi2 и жидкий С5Н]2;
т. 4. Твердый раствор, содержащий 55% C5Hi2. 1.3. Т. I. Две; т. 2.
Одна; т. 3. Нуль; т. 4. Две. 1.4. + Г, —30°; 81% С5Н12. 1.5. Рис. 31.
1.6. 0,32 кг жидкого раствора и 0,23 кг твердого раствора. 2.1.
Компоненты А и В кристаллизуются неизоморфно во всем диапазоне
концентраций. 2.2. Т. 1. Две фазы: кристаллы А и кристаллы В; т. 2.
Две фазы; кристаллы А и расплав; т. 3. Одна фаза: расплав; т. 4.
Три фазы: кристаллы А, кристаллы В и расплав; т. 5. Три фазы:
кристаллы А, кристаллы В и расплав. 2.3. Система гомбгенна выше
250°. 2.4. 200°, 250°, 30% В. Наиболее низкая температура плавления
при 70% А. 2.5, Рис. 32. 2.6. 0,345 кг В, 3.1. Диаграмма плавкости
двух неизоморфно кристаллизующихся веществ, образующих
устойчивое химическое соединение и полиостью взаимно растворимых в
жидком состоянии. 3.2. а) 250°, 250°; б) 250°, 800°; в) 840°, 840°;
99
г) 600°, 810°. 3.3. Твердая эвтектика существует в областях Л и Б.
В области Л она состоит нз кристаллов А и кристаллов химического
соединения. В области Б она состоит из кристаллов В и кристаллов
химического соединения. ЗА Кристаллы химического соединения
начнут выпадать при 720°. Кристаллы В вообще выпадать не будут.
Время
Время
Рис. 31
Рис. 32
3.5. Т. 1. Нуль; т. 2. Нуль; т. 3. Одна; т. 4. Одна. 3.6, 15 кг А.
4.1. Между компонентами образуется термически неустойчивое
химическое соединение, содержащее 48 масс.%. BaSi03, Верхний пре-
ttc
1345
1309
то
tr
L-
0
Время
Li
20 40 60
Масс.%
SO
too
Рис. 33
Рис. 34
дел его существования в твердом состоянии равен 1309°. 4.2. 1260°,
1345°. Первые капли расплава имеют эвтектический состав:
73 масс.%. BaSi03. 4.3. Т. 1. Расплав; т. 2. Тв. CaSi03 + расплав;
т. 3. Тв. СаБЮз + расплав + тв. хим. соед.; т. 4. Тв. BaSi03; т. 5.
Тв. BaSiOs + тв. хим. соед. 4.4. 42—100% CaSi03. 4.5. Рис. 33.
4.6. 58 кг CaSiOs. 5.1. Висмут и свинец ограниченно взаимно
растворимы в твердом состоянии и полностью растворимы в жидком со-
100
стоянии. 5.2. Т. 1. Жидкий расплав; т. 2. Твердый раствор свинца в
висмуте и жидкий расплав; т. 3. Два твердых раствора; т. 4.
Твердый раствор висмута в свннце. 5.3. Начало плавления 230°, конец
плавления 333°. Первые капли жидкости содержат 72% свинца. 5.4.
Твердый раствор Bi—Pb при 113° можно получить при содержании
висмута от 0 до 10% и от 90 до 100%- При понижении температуры
растворимость падает. 5.5. Рис. 34. 5.6. В равновесии находятся
твердый раствор свинца в висмуте (8,4 кг) и твердый раствор
висмута в свинце (42,0 кг).
Глава X
1.1. Константы равновесия Кр и К с зависят только от природы
реагирующих веществ и от температуры. 1.2. Характер зависимости
/Ср от температуры определяется знаком и величиной теплового
эффекта реакции. При ДЯ°>0 КР растет при увеличении температуры,
при ДЯ°=0 /СР не зависит от температуры, при Д//°<0 /<р падает
d In ^p ДЯ°
при увеличении температуры: — = ~~"г,™ * *-^- Константа
равновесия /СР зависит от формы записи уравнения химической ре-
акции. Отсюда К*<>= (К/)2. 1А КР = — _^)(3__2,)2 I
4х (2 — лг)2(#Г)2
к*~ ibo-xK-w • 1А°'257- 1А7Д-10-9-2ХРавновес-
ный выход химической реакции изменяется с изменением давления,
если Дгс=^0. Так как у реакции CH4+2H2S = CS2+4H2 Дя=2, то
равновесный выход уменьшится с ростом давления. 2.2. >*=
Я2
HRr
= — RT In /Cp + RT In . 2.3. Характер зависимости Кр
от температуры определяется знаком теплового эффекта ДЯ =
d 1п *ф ЛЯ
= (2Я)К0Н—(2Я)ИСХ: — = „_„■ • Для данного случая
dl RT*
ДЯ<0, поэтому /СР уменьшится при повышении температуры. 2.4.
^с — -77~; ZT • 2.5. 0,05 моль. 2.6. 6,6-10~8. 3.1. Реакция,
V{\ — a)2
для которой тангенс угла наклона зависимости lgKp=f(UT)
отрицательный, эндотермическая. 3.2. Мерой стандартного сродства
химической реакции, протекающей при постоянных Р и Г, является
максимальная полезная работа реакции или убыль энергии Гиббса (изо-
барно-изотермического потенциала) при условии, что парциальные
давления всех веществ участников реакции равны между собой
*(3—1,5*)3/2
и равны 1 атм. 3.3. Кр~ г£ 7^>— •
(2-0,5х)1/2(1-2х)2Р3/2
JJ.4. Для увеличения равновесного выхода PQs необходимо увели-
V^ 5
чить Р, так как An = — —- , и понизить Т, так как ДЯ°298<0.
3.5. 1,414-10* Па-0-5. 3.6. —188,8 103 Дж. 4.1. Константа равновесия
химической реакции К с и Кр от концентрации реагирующих веществ
101
не зависит. 4.2. Константа равновесия Кр равна равновесному
давлению в системе при заданной температуре для гетерогенной
реакции, в которой образуется единственный газообразный продукт.
причем согласно уравнению реакции образуется 1 моль этого"
продукта. 4.3. Добавление к равновесной системе инертного газа при
сохранении общего давления увеличивает сумму чисел молей. Кон-
_ псо пс\%
станта равновесия при этом не меняется. лр = Р . От-
сюда равновесный выход СО и С12 при добавлении инертного газа
увеличивается. 4.4. А#^ = 18,17-Ю4—0,166 Т [Дж]. 4.5. 187 Па.
4.6. 3,1* Ю-3. 5.1. КрЖс. 5.2. Константа равновесия химической
реакции Кр не зависит от количества молей веществ, участвующих в
ней. 5.3. Степень диссоциации HCI не изменится, так как при
диссоциации HCI число молей газообразных веществ не меняется (Ая—0).
Степень диссоциации Н20 уменьшится, так как Ая>0. 5.4. Кр=РЩ.
5.5. 0,250- 10s Па. 5.6. 0,71. 6.1. Kp=Kc(RT) Л/г. Кр может быть
больше, меньше или равно Кс Это зависит от знака и величины
изменения числа молей газообразных веществ (An) при переходе от
исходных веществ к продуктам реакции. 6.2. AGT — — RTlnKp-h
Ч~ hnRT In (1,0133-105). (Второй член в правой части этого
уравнения появляется в результате перевода атм в Па, так как за
стандартное состояние принято давление 1 атм). 6.3. Изменение числа
молей газообразных продуктов в данной реакции Ап>0. Введение
инертного газа увеличивает равновесный выход веществ С и D.
Увеличение давления уменьшает равновесный выход веществ С н D.
Отсюда равновесный выход С и D зависит от соотношения этих двух
противоположно действующих факторов. 6.4. В данном интервале
температур АЯ<0 и ие зависит от температуры. Для расчета ДЯ
необходимо определить тангенс угла наклона прямой к оси абсцисс:
АЯ=—2,3 Rtga. 6.5. —69,64*103 Дж. Реакция самопроизвольно
протекает слева направо. 6.6. 6,25* 104 Па2. 7J. Самопроизвольно
протекает реакция в обратном направлении. 7.2. Изменение общего
давления реагирующих веществ ие изменит значение Kv. 7.3. В этой
реакции тепло поглощается.* 7.4. Рис. 35. 7.5. 3,018-10~3 Па-"1. 7.6.
Р2
—0,152 град-1. 8.1./Ср = . 8.2. На константу равно-
^SOa^Oe
веси я Кр из перечисленных факторов влияют только природа
реагирующих веществ и температура. 8.3. При диссоциации изменение
числа молей газообразных веществ равно нулю, поэтому давление не
влияет на равновесие этой реакции. Диссоциация — реакция
эндотермическая, поэтому в соответствии с уравнением изобары Вант-
Гоффа по мере роста температуры увеличивается величина Кр, а
следовательно, растет и степень диссоциации. 8.4. Равновесный
выход АВ меньше равновесного выхода CD. 8.5. 331,03 кДж. Реакция
пойдет в сторону образования Н2. 8.6. 1,777* Ю-10 Па-1. 9.1. Для
реакции Н2+С12=2НС1 Кр=Кс, для реакции СО+С12=СОС12 Кр<Кс.
f Къ ДЯ / 1 1 \
9.2. Уравнением In —— = — —— -—- — — можно пользовать-
К\ R \ Т% Г г J
с я при условии, если в интервале температур от 7\ до Г2 тепловой
эффект реакции А# можно считать постоянным, 9.3. Рис. 36. -9.4.
102
- , а -- /~ 0,5аЯ
Кр==1 — а V 1+0,5а
Константа равновесия /<р не
зависит от давления. 9.5. 16,9 кДж. 9.6. Ниже 492 К. ЮЛ. Константа
равновесия Кр не зависит от давления, но зависит от температуры.
Так как реакция эндотермическая, с ростом температуры Кр
увеличивается. 10.2. По знаку изменения энтальпии в ходе химической
реакции можно судить о возможности ее протекания при постоянных
РяТ, если AHdt>TAS°t. 10.3.
Ко =
^сн8он^2 -
АЯ,
^СО^Ня
е
RT
10.4. Константы равновесия обеих реакций уменьшатся при повыше-
ЦКР
Г^КР
AH-2,3RT*tgd
Рис. 35
Рис. 36
нии температуры. Константа равновесия реакции образования СНзС!
сильнее изменяется при изменении температуры, так как по абсолют-
/ dh\Kp \ / d In KP \
ной величине —— ) > —
\ dT /обр. CHSC1 \ dT /обр. СН3Вг
10.5. 3,85-103. 10.6. 0,804-104 Па.
Глава XI
1.1. Число переноса нона — это отношение количества
электричества, перенесенного ионами данного рода сквозь какое-либо
поперечное сечение электролита, к общему количеству электричества,
и+
прошедшего через электролит сквозь это сечение: t± =
*_ =
U-
и+\и^>
j- —г . 1.2. В разбавленных растворах сильных элект-
t/+ -г U ~~
ролитов типа I — I X и Igy изменяются пропорционально корню
4а8С2
квадратному из моляльной концентрации, 1.3. К =
1-й
1.4.
Наибольшей подвижностью обладают ионы Н+ и ОН~ за счет
проявления прототропного эффекта, т. е. эстафетной передачи протонов
103
между молекулами воды. 1.5. /?г±=0,456. 1.6. Сн+ =7,4-10~4 г-ион/л;
/С—1,8-10~5 г-ион/л. 2.1. x={plRx. 2.2. Константа диссоциации с
ростом диэлектрической проницаемости увеличивается. 2.3. as>ai. 2.4.
Нужно залить 6,67 л. 2.5. —2,3 кДж/моль. 2.6. 1,11-10—Б моль/л.
3.1. Рнс. 37. 3.2. В сильно разбавленных растворах средний ионный
коэффициент активности не зависит от природы электролита в
пределах данного валентного типа и определяется только ~ величиной
ионной силы. 3.3. Свойством растворителя, определяющим его
ионизирующую способность, является диэлектрическая проницаемость.
3.4. Для многих слабых электролитов в водных растворах
зависимость степени диссоциации от температуры проходит через
максимум, так как при низких температурах диссоциация растет
вследствие эндотермичности реакции диссоциации, а при более высоких
падает, так как начинает преобладать фактор уменьшения диэлект-
ъпектролиты
зе
Рис. 37
Рис. 38
рической проницаемости воды с ростом температуры, что смещает
равновесие в сторону недиссоцинрованных молекул. 3.5.
Растворимость AgCl понизится с 10~5 до 10~8 моль/л. 3.6. 44,93 Ом-]-м2Х
Хкг-экв"1. 4.1. X = Хю — aj/C . 4.2. Для растворов электролитов
используется переменный высокочастотный ток. Это делается для
того, чтобы избежать электролиза и возникающей в связи с этим
противо-э. д. с. (э. д. с. поляризации). 4.3. Диссоциация происходит
самопроизвольно в процессе растворения и вызывается влиянием
растворителя как химическим (взаимодействие-с. растворенным
веществом), так и физическим (растворитель как среда с определенными
диэлектрическими свойствами ослабляет взаимодействие между
ИОНаМи). 4.4. Аогидр = 2л>ионов — 2^ИОНОв в газообразном»
в растворе состоянии в вакууме
где Д5Гпдр<0, так как ионы в газе находятся в более хаотичном
состоянии, чем в растворе. 4.5. 2,22-Ю-4 моль/л; 2,53-10"* моль/л.
4.6.0,563. 5.1. Л= 1000и/С. 5.2. Я„=Л++Л-;Х = Хго — а^С .
5.3. Для расчета теплоты диссоциации слабого электролита
необходимо иметь А и L при разных температурах. 5.4. Константа
диссоциации в метиловом спирте уменьшится, так как вследствие
понижения диэлектрической постоянной усилится взаимодействие между
ионами и понизится степень диссоциации. 5.5. 0,0037. 5.6. С + =1,8Х
ХЮ-4 г-ион/л; рН 3,74. 6.1. lgy±= — ЗЛ |/7\ 6.2. Рис. 38.
104
6.3. Термодинамическая константа диссоциации не изменится,
степень диссоциации возрастет. 6.4. Рис. 39, где V\ — объем щелочи,
израсходованный на титрование HCI; {V2—V\)—объем щелочи,
израсходованный на титрование НСООН. 6-5. рН изменится на 0,7.
6А 0,0106 Ом-1-см-1. 7.1. а±=аы , 7.2. Удельная
электропроводность слабого электролита при низких концентрациях растет, а затем
начинает падать. 7.3. /f2=10tfi. 7.4. С, а, Г, ц, г. 7.5. 0,65. 7.6. 2,90.
ML
V,
NG0H
Рис. 39
8.1. При увеличении разведения раствора слабого электролита
степень диссоциации его растет, а константа диссоциации остается
постоянной. 8.2. В уксусной кислоте как растворителе хлорная кислота
сильнее азотной. 8.3. Чтобы экспериментально найти уменьшение
Рис. 40
электропроводности, обусловленное электрофоретическим
торможением, необходимо измерить эквивалентную электропроводность в
поле высокого напряжения и вычесть величину эквивалентной
электропроводности, измеренную в высокочастотном поле. 8.4. Радиус
ионной атмосферы уменьшится, так как увеличение кулоновских сил
повлечет за собой уменьшение среднего расстояния между ионами
в ионной атмосфере. 8.5. 2,9. 8.6. 147,8 Ом"1'См2-г-экв-1. 9.1. Чем
больше концентрация, тем меньше радиус ионной атмосферы. 9.2.
По мере роста концентрации коэффициент активности падает,
проходит через минимум, а затем начинает возрастать, превышая
единицу для сильно концентрированных растворов. 9.3. В электрическом
поле высокой частоты устраняется эффект релаксационного тормо-
105
жения. 9.4. Д#1<Д#п, так как в соответствии с уравнением изобары
Вант-Гоффа теплота диссоциации пропорциональна отношению
констант диссоциации. 9.5. 7,82-Ю-4 см2/В-с. 9.6. Д#°=12,8 кДж/моль;
А5°=— 37,4 Дж/моль-град; AG°=23,9 кДж/моль. 10.1. Рис. 40.
10.2. Na+, K+, Rb+, Cs+. Подвижность определяется радиусом гидра-
тированного иона, а степень гидратации увеличивается с
уменьшением собственного радиуса иона. 10.3. 3/AgNoe = ^co(Cio4)2'
10.4. Чтобы экспериментально найти уменьшение электропроводности,
обусловленное электрорелаксационным торможением, необходимо
измерить эквивалентную электропроводность в поле высокой частоты
и вычесть эквивалентную электропроводность, измеренную на
обычном мостике Кольрауша. 10.5. /С=2-10~4; А°= — 21,2 кДж/моль.
10.6. а± увеличится в 67 раз.
Глава XII
1.1. На положительном электроде гальванического элемента
протекает реакция восстановления. 1.2. Условным электродным
потенциалом называется э. д. с. элемента, составленного из данного
электрода (справа) и стандартного водородного электрода (слева).
1.3. Мп2+ -J- 5Со3+ -Ь 4Н20 = MnO^ -f 8Н+ + 5Со2+. 1.4. С ростом
температуры э. д. с. этого элемента падает. 1.5. 3,5* 10~5 моль/л.
1.6. 3,1. 2.1. На отрицательном электроде гальванического элемента
протекает реакция окисления. 2.2. При измерении э. д. с.
гальванических элементов элемент Вестона выполняет роль нормального
элемента и используется для определения э. д. с. аккумулятора в
электрической компенсационной схеме. 2.3. Pt, H2 | НО, Hg2Cl21 Hg \ Pt.
dE
2.4. q = nFE; -— > 0. 2.5. 4,0-IO15. 2.6. 0,045. 3.1. Положительный
dl
заряд на поверхности металлического электрода образуется, если
химический потенциал металла меньше химического потенциала
ионов этого металла в растворе. 3.2. Не зависит от величин
стандартных электродных потенциалов э. д. с. концентрационных
элементов. 3.3. Наибольший вклад в величину электродного потенциала
при данной активности иона дает стандартный электродный
потенциал ф°. 3.4. Э. д. с. гальванического элемента нельзя измерить
вольтметром, так как при этом ие будут соблюдаться условия
электрохимического равновесия: через систему будет проходить ток и из-
за электрохимической поляризации показания вольтметра не дадут
истинного значения э. д. с. 3.5. 2AgCl -f Cd = 2Ag -J- 2C1~ + Cd2+
AG-—130 кДж; AS= —126 Дж/град; Д#= —168 кДж. З.6. 0,44.
4.1. Заряд на поверхности металла будет отсутствовать, если
химический потенциал металла равен химическому потенциалу ионов
RT
этого металла в растворе. 4.2. ?AgCi/Ag — ^Agci/Ag ~~ ~~р~ Хпас\~'
4.3. Рис. 41, где V\ — объем щелочи, израсходованный на титрование
HCI; (V2—Vi)—объем щелочи, израсходованный на титрование
СНзСООН. В качестве индикаторных можно использовать
электроды: водородный, хингидронный, стеклянный, сурьмяный. 4.4.
— Hg — CdlCdS04|Cd — Hg-h . 4.5. 1,1-10-». 4.6. — 53 кДж;
at с8 Oi
106
193 Дж/град. 5.1. <р = v° +
RT
nF
1пд+. 5.2. Заряд поверхности
металла может быть и положительным, и отрицательным, и равным
нулю. Это зависит от соотношения химических потенциалов металла
и иоиов этого металла в растворе. 5.3. AS = nFb; AG=—nF(a-\-bT)\
АН= —nF(a+bT)+nFbT. 5.4. ЕХ=Е2. 5.5. 0,359 В. 5.6. Выделяется
11550 Дж. 6.1. 9 = ?°4-
RT
nF
In
атап
а
6.2. Химическими
называют элементы, электрическая работа которых получается за счет
химической реакции, идущей в элементе. 6.3. Присутствие
посторонних ионов влияет на потенциал электрода 1-го рода через коэффи-
RT
циент активности: <р = <р° ~Ь—— ln/#+Y+- Коэффициент активно-
сти в свою очередь уменьшается с ростом ионной силы раствора.
Таким образом, чем больше ионная сила раствора, тем более
отрицательным будет потенциал электрода. 6.4. Так как
\дР)т
nF
где АУ=Угаз— 1^конд>0, то
\dF)r<0 иростдав-
ления снижает э. д. с. 6.5. 0,008 В. 6.6/ —106 кДж. 7.1. Величина
стандартной э. д. с. зависит от природы реакции, протекающей в
данном элементе, и температуры. 7.2. Знак э. д. с. считается
положительным, если положительный заряд внутри элемента переносится
слева направо. 7.3. Присутствие посторонних ионов делает потенциал
каломельного электрода более положительным вследствие
уменьшения коэффициента активности и падения активности ионов хлора:
RT
о = и0 — —_-.jnfl- 7.4. Этот элемент работает с погло-
nF ci
щением тепла. 7.5. 0,458 В. 7.6. —0,302 кДж. 8.1. Стандартной э. д. с.
называется э. д. с. элемента, составленного из двух стандартных
RT
электродов. 8.2. ?х.г = ?хт+ VlnaH + - 8.3. Ag|Ag2Cr04> К2Сг04
* ll IB раствор
107
RT
Ag2Cr04-f2e=2Ag-fCr02- ?=?o_ — \na 2_ .8.4. Если dE/dT=0,
то внутренняя энергия элемента при его работе в обратимых
условиях уменьшается, так как единственным источником
электрической энергии является химическая реакция, протекающая в данном
элементе. 8.5. 1-Ю™8 В/град2. 8.6. 0,1115 В. Элемент
концентрационный без переноса. 9.1. Для расчета электрической работы,
совершаемой элементом, необходимо знать э. д. с, число переносимых
электронов, число Фарадея. 9.2. Элемент Вестона относится к химическим
элементам без переноса. 9.3. Pt|IO^", I2, H+\|SOj", H+,
PbS04 I PbC>2 I Pt. 9.4. При толщине диффузной части двойного
электрического слоя, равной нулю, равновесный потенциал
электрода 1-го рода падает линейно с увеличением расстояния от
поверхности электрода в глубь раствора. 9.5. 1083. 9.6. 1,60- 10s Па (1,58 атм).
10.1. При увеличении давления соответственно водорода и хлора
потенциал водородного электрода становится более отрицательным,
потенциал хлорного — более положительным. 10.2. Отрицательный
полюс образует кадмиевый электрод. 10.3. Чем больше ионная сила
раствора, тем тоньше диффузная часть двойного слоя. 10.4. С ростом
внешнего давления э. д. с. водородно-кислородного топливного
элемента, в котором протекает реакция 2Н24-02=2Н20 (ж),
увеличится \ AV
ся, так как —rzr-l = — —— , a AV=V (ж) — V (г) <0 и по-
\ дР /т
nF
( дЕ
этому [ 1 > 0. Ю.5. В указанных условиях данная реакция
\ оР /г
осуществима; /(=0,335. 10.6. 0,044 В.
Глава XIII
dv dv dv dT RT*
1.3. Для реакции нулевого порядка концентрация продукта с
течением времени возрастает по линейному закону. 1.4. Время
достижения максимальной концентрации промежуточного вещества В
зависит от отношения констант скоростей последовательных стадий реак-
In
ции и от их разности: тмакс = "7 Г— • '-5. 51,8 кДж/моль.
dx
1.6. 1,52. 2.1. -— = (k0 + М(С0,Ф — *№о,к - •*)• 2*2- Гра-
фик в координатах lnk=f (~) представляет собой прямую линию.
С увеличением Т~х логарифм константы скорости падает. 2.3. k\ =
=2k2. 2.4. Максимальное количество промежуточного вещества В
определяется отношением констант скоростей реакций образования и
разложения этого вещества и начальной концентрацией исходного
вещества. 2.5. 7,85-1010 с-1. 2.6. 3. 3.1. Период полупревращения для
108
реакции 2-го порядка обратно пропорционален исходной
концентрации. 3.2. Экспериментальной энергией активации сложной реакции
называется параметр Е в уравнении Аррениуса, который
определяется на основании экспериментальных данных и является некоторой
функцией энергий активации отдельных стадий реакции или вообще
эмпирической величиной. 3.3. Рис. 42. 3.4. Метод стационарных
концентраций не применяется для начального периода реакции, когда
происходит накопление активных промежуточных частиц. 3.5.
0,0403 ч_|. 3.6. 312 К. 4.1. Молекулярностью химической реакции
называется число молекул, участвующих в элементарном акте
химического превращения. 4.2. Период полупревращения для реакции
1-го порядка не зависит от исходной концентрации реагирующего
вещества. 4.3. Быстрее заканчивается реакция 1-го порядка.
Рис. 42
4.4. О влиянии промежуточных веществ и конечных продуктов на
скорость реакции свидетельствует различие между временным и
концентрационным порядками реакции. 4.5. 376 кДж/моль. 4.6. 6,81 мин.
5.1. Порядком химической реакции называется сумма показателей
степеней при концентрациях в кинетическом уравнении данной
реакции. 5.2. Константа скорости реакции — размерная величина, ее
размерность зависит от порядка реакции. 5.3. Для определения
концентрационного (истинного) порядка реакции по данному
компоненту необходимо поставить несколько опытов с различными исходными
концентрациями данного компонента (остальные компоненты берутся
в избытке). Определить графически начальную скорость реакции прн
различных исходных концентрациях и на основании этих даииых
построить график lgv=f(\gC). Тангенс угла наклона полученной
прямой к оси lg С даст концентрационный порядок реакции по данному
компоненту. 5.4. kx > k2. 5.5. 0,12 см3/моль-с. 5.6. 2,0-Ю-7 с. 6.1.
1 С*
k = — In —— . 6.2. При использовании химических методов ана-
лиза необходимо тем или иным способом затормозить реакцию в
пробе. 6.3. Константа скорости реакции 2-го порядка численно равна
тангенсу угла наклона прямой к оси абсцисс в координатах 1/С=
=f(x). 6.4. Сущность метода стационарных концентраций состоит в
том, что в ходе процесса концентрацию активных промежуточных
частиц принимают постоянной. 6.5. Третий; 8,3-10~3 мин'^моль^-л2.
6.6. 1,88. 7.1. Лимитирующей стадией сложной химической реакции
называется наиболее медленная ее стадия, определяющая суммарную
109
скорость нескольких последовательных химических превращений.
7.2. Константа скорости реакции 2-го порядка имеет размерность
3
«время"1-концентрация-1». 7.3. ъгр = £" • 7*4- Если объем си-
стемы постоянен. 7.5. 0,75 л/моль-ч; 24,0 ч, 7.6. 69 кДж/моль.
dx
8.1. — = ki (С0 А — х) — /г2 (Сов -f х). 8.2. Рис 43. 8.3. 5/г,=
—ki. 8.4. Для определения порядка реакции необходимы
экспериментальные данные об изменении концентрации одного из
реагирующих веществ с течением времени при постоянной температуре.
8.5. 3000 с. 8.6. 404 К. 9.1. На скорость химической реакции влияют
все перечисленные факторы. 9.2. Кинетическая кривая выражает из-
V
Г
Рис. 43
менение концентрации какого-либо вещества со временем в ходе
химического превращения. 9.3. При k2<kx. 9.4. &i 4-&2 + ^з =
1
а
; а=44,7 ммоль/л. 9.5. kxlk2^\fl-1010. 9.6. Нулевой;
= —In
13 а — х
7,39 Па-с-1. 10.1. На константу скорости влияют природа
реагирующих веществ, катализатор, растворитель, температура. 10.2. При
составлении кинетических уравнений сложных реакций используется
принцип независимости протекания отдельных элементарных стадий.
10.3. Для расчета энергии активации необходимо иметь константы
скорости реакции при двух температурах. 10.4. Величина D равна
количеству вещества, прореагировавшего к моменту наступления
равновесия. 10.5. 6,10-10~3 моль/л-ч. 10.6. 0,0683 град-1.
Глава XIV
1.1, lg—y- = zCL 1.2. Д#^ =:EQ—RT. 1.3. Скорость цепной
реакции будет больше в реакторе, где отношение поверхности
реактора 5 к его объему V меньше, т. е. в реакторе сферической формы.
1.4. Увеличение ионной силы раствора увеличивает скорость реакции
ПО
между одноименно заряженными и уменьшает скорость реакции
между разноименно заряженными ионами. Кроме того, изменение
коэффициента активности при изменении ионной силы может
сказаться иа скорости реакции за счет смещения равновесия при диссо-
циации или гидролизе. 1.6. kjk2= 155. 1.6. v = k3I—— J [C2HF] =
= k [C2H6]. 2.1. v = A (evx — 1) и Лесрт. 2.2. Оптической
плотностью называется десятичный логарифм отношения интенсивности
падающего света к интенсивности света, прошедшего через раствор.
2.3. Теория абсолютных скоростей химических реакций позволяет
рассчитать константу скорости на основании данных о свойствах
реагирующих молекул и об условиях протекания реакции. 2.4. Число
сталкивающихся и число вступающих в реакцию молекул всегда
различаются, так как к реакции способны не все сталкивающиеся
молекулы, а только активные, кроме того, даже активные молекулы при
столкновении могут не вступить в реакцию, что учитывается стери-
ческим фактором. 2.5. 3,8 • 10"20; 1,9 ■ 10~10. 2.6. v = k [CH3CHO] 1/2J
^~^3("Г7/ . 3.1. На коэффициент поглощения влияют природа
поглощающей среды, длина волны падающего света и температура.
3.2. Трансмиссионный множитель и учитывает вероятность перехода
активного комплекса в направлении слева направо вдоль вершины
энергетического барьера (в сторону образования продуктов реакции).
3.3. £оп = £ист+1/2/?7\ 3.4. В присутствии K2SO4 скорость указанной
реакции понизится. 3.5. 117 кДж/моль. 3.6. 103. 4.1. Каждому
поглощенному кванту света соответствует изменение (химическое или
физическое) одной молекулы. 4.2. По теории бинарных столкновений
скорость реакции определяется числом двойных соударений активных
молекул в единицу времени в единице объема, ориентированных
надлежащим образом друг относительно друга в пространстве.
4.3. В «медленных» реакциях активированный комплекс по строению
близок к продукту реакции, т. е. полярен, следовательно, сильнее
связывает молекулы растворителя по сравнению с частицами
исходных веществ. Отсюда отрицательная энтропия активации и Р<С1.
4.4. Нижний предел давления, начиная с которого разветвленная
цепная реакция развивается со скоростью взрыва, можно уменьшить,
увеличивая диаметр сосуда, вводя в реакционную систему инертный
газ или покрывая стенки сосуда парафином. 4.5. 1,45-Ю-8. 4.6.
VT -
Первый. 5.1. г = —-— sta^wn^. 5.2. Предэкспоненциальный
множитель в уравнении Аррениуса — это произведение стерического
множителя на фактор соударений: A=Pz0. 5.3. Фотохимическая реакция
может иметь 1-й порядок при малом поглощении света реакционной
средой. 5.4. Энергия активации в растворе по сравнению с энергией
активации реакции в газовой среде может уменьшаться,
увеличиваться или не меняться в зависимости от соотношения между тепло-
тами сольватации активированного комплекса и исходных веществ.
5.5. 101,06 кДж/моль. 5.6. == ±—& .
dv k-x [02] + k2 [03]
6.1. Обычно не влияет. Если же лимитирующей стадией является^
111
Ч.
одна из вторичных тем новых реакщш, то с
скорость может увеличиваться.
6.2. k — х.
ростом температуры
е
RT
h
^АВ^С
6.3. kp>kr, если реагируют ионы одного знака. 6.4.
Мономолекулярная реакция является сложным процессом, состоящим из двух
стадий: бимолекулярной активации и мономолекулярного превращения.
При малых давлениях за время между активирующим и
дезактивирующим соударениями молекула успевает прореагировать. В таком
случае скорость процесса определяется скоростью активации, т. е.
пропорциональна квадрату концентрации, и порядок реакции будет
вторым. 6.5. 8-Ю13 с-1. 6.6. 100 Дж/моль«град. 7.1. О цепном
механизме реакции свидетельствуют следующие признаки: малая энергия
активации; большой квантовой выход; независимость скорости реак-
tgd^-2
Рис. 44
ции от способа ее инициирования; увеличение скорости реакции с
течением времени; малый температурный коэффициент скорости
реакции; экспериментальное обнаружение свободных атомов и
радикалов в реакционной смеси. 7.2. Экспериментальная энергия
активации отрицательна для тримолекулярных реакций, температурный
коэффициент скорости которых отрицательный. 7.3. Рис. 44. 7.4.
Энтропия активации — это изменение энтропии при переходе
исходных молекул в состояние активированного комплекса в расчете иа
1 моль активированного комплекса. Рассчитывается по теории
переходного состояния иа основании экспериментальных данных о кои-
й [N02CI]
станте скорости и энергии активации. /.э. — -
= 2ifei [N02CI]. 7.6. 16,5. 8.1. k = x
кТ
h
dv
8.2. Активация молекул в мономолекулярных реакциях
происходит за счет столкновений реагирующих молекул друг с другом.
8.3. Основной недостаток теории бинарных столкновений
заключается в необходимости введения дополнительного множителя — стери-
ческого фактора, теоретический расчет которого в рамках этой теории
невозможен. 8.4. Квантовый выход фотохимической реакции можег
112
быть больше единицы, если первичный фотохимический акт приводит
к развитию цепной реакции. 8.5. 2,6-106 моль/Э.8.6. — ~Т~ ~
ki [SiH4]
£3
1 + "~ [На]
9.1. \g k= lg&0 + 2Агкг^I . 9.2. Цепны-
.ми называются такие сложные реакции, в которых первоначально
зародившиеся активные частицы вызывают большое число (цепь)
превращений неактивных молекул вследствие регулярного чередова-
V
S
ь.*.»
Pi
Рис. 45
иия нескольких элементарных реакций, в каждой из которых
происходит регенерация одной или нескольких активных частйД. 9.3. Сте-
рический фактор согласно теории абсолютных скоростей является
вероятностным фактором и определяется главным образов энтропией
активации. 9.4. Если понизить давление, то порядок мономолекуляо-
ной реакции изменится с первого на второй. 9.5. 68,3 Дж/моль-град.
d [HI] d [HI]
9.6. Механизм I: —: = 2&[H2][l2]. Механизм II:
d%
2k,k2 [H2][l2]
k-i 4- k2 [H2]
10.1. &p = kT
VabYc
dv
10.2. Энергией
активации элементарного акта химического превращения (истинной
энергией активации) называется минимальная энергия
(отсчитываемая от нулевого уровня в расчете на 1 моль взаимодействующих
частиц), которой должна обладать исходная система, чтобы в ней
могло произойти рассматриваемое химическое превращение. 10.3.
Энтропия активации может быть меньше нуля, если активированный
комплекс имеет более упорядоченную структуру, чем исходные
вещества. 10.4. Рис. 45. В интервале давлений Р\—Р% реакция
проходит со скоростью взрыва (изотермический взрыв). Наличие пределов
Pi и Р2 связано с различием в механизме обрыва цепей: ниже -Pi —
обрыв на стенках сосуда, выше Ръ — обрыв за счет тройных соударе-
л d[A2] *iWAJA]
ний в объеме. 10.5.—1—^~ = - ~ —— . 10.6. 38 смЗ/моль-с.
dv k3 + (kx + k2)[A]
113
Глава XV
t . _ _ ЬР
1.1. Г^ГМ ,р . 1.2. Количество вещества,
диффундирующее в единицу времени через поверхность с площадью, равной
единице и перпендикулярную направлению диффузии, при единичном
градиенте концентрации называется коэффициентом диффузии.
1.3. Первая реакция протекает в кинетической, вторая — в
диффузионной области, так как температурный коэффициент скорости
химической реакции всегда в 2—3 раза больше соответствующего
коэффициента скорости диффузии. 1.4. Согласно представлениям Баландина,
лимитирующими при гетерогенном каталитическом взаимодействии
могут быть или адсорбция исходных веществ на поверхности
катализатора, или десорбция с этой поверхности продуктов реакции; сам
же процесс химического взаимодействия не является замедленным.
dC
1.5. £«/£=602,6. 1.6. Р=0,545-105 Па. 2.1. dn = — DS <Л2.
dx
2.2. Катализатор направляет реакцию по другому пути, требующему
меньшей затраты энергии, через образование поверхностных
соединений с катализатором. Энергия активации при этом снижается.
2.3. При постоянной степени заполнения константа адсорбционного
равновесия уменьшается с ростом температуры. Это видно из урав-
dixvb ДНадС _
нения —-г—= , где ДЯадс<0, так как адсорбция — про-
dl I\l £
dlnb
цесс экзотермический. Поэтому величина —"-— < 0. 2.4. Эффек-
аТ
том аггравации называется увеличение каталитической активности
катализатора при усложнении структуры его молекул. Полагают, что
он связан с рекуперацией энергии: за счет части энергии,
выделяющейся в ходе элементарного акта, молекула катализатора
возбуждается и далее последовательно активирует реагирующие молекулы.
Поскольку молекула катализатора имеет сложную структуру, она
может накопить в себе много избыточной энергии, не разлагаясь.
2.5. 3,908-103 Дж/моль. 2.6. 26,9 с"1. 3.1. D=^ADe~tDlR'J\ 3.2.
Общим кислотным и основным катализом называется катализ, который
вызывается не водородными и гидроксильными ионами, а другими
веществами — донорами и акцепторами протонов. 3.3. Принцип
структурного (геометрического) соответствия предусматривает такое
пространственное расположение атомов в реагирующих молекулах
и атомов катализатора на его поверхности, которое обеспечивает
соразмерное наложение реагирующих атомов молекулы (индексной
группы) с сохранением валентных углов на определенную группу
атомов катализатора (мультиплет). Этот принцип дает возможность
подбора оптимального катализатора,- исходя из соответствия
геометрических параметров реагирующих молекул параметрам
кристаллической решетки катализатора. 3.4. Для осуществления стационарного
состояния на границе диффузионного потока необходимо каким-либо
способом поддерживать постоянную во времени концентрацию:
/ дс \ ( Ж \
( —— I = const и I = 0. График (рис. 46) имеет вид для
\ дх /х \ дл )х
любого т. 3.5. 100 мин. Предполагается, что толщина диффузионного
слоя б и объем раствора V сохраняются постоянными и что поверх-
114
ность стержня железа 5 в ходе опыта не меняется. Допускается, что
6 не меняется с концентрацией раствора, хотя б зависит от вязкости
раствора, а вязкость является функцией концентрации. Допущение
применимо, так как раствор сильно разбавлен. По этой же причине
принимается, что коэффициент диффузии D не меняется с
изменением концентрации раствора. 3.6. &х.р=&д. 4.1. y== I,l-=-l»5, 4.2.
Обычно активность катализатора увеличивается с ростом его
концентрации. Однако при увеличении заполнения носителя атомами
катализатора свободные валентности последних взаимно насыщаются и
активность начинает падать — кривая проходит через максимум. 4.3. При
малых давлениях газообразного реагента мономолекулярная гетеро-
генно-каталитическая реакция протекает по первому порядку. Под-
Рис. 46
Рис. 47
ставив в кинетическое уравнение выражение поверхностной концент-
ЬР
рации по изотерме Лэнгмюра, получим v — hC$ = ^Г^ г \
1 + ЬР
при малых Р можно пренебречь величиной ЬР в знаменателе: v =
дС\ _ D(d2C ) (дС\
(—) ФО. 45. d[®2] =:fei[H202][Br-][H+].
=kTcobP, 4.4. Рис. 47.
. -I ф const;
OX ]x
Порядок по перекиси водорода — первый; скорость реакции прямо
пропорциональна концентрации ионов Вг~ и Н+. 4.6. 1,8-Ю-2 моль/л.
5.1. v = k0 [S] + *н+ [Н30+] [S] + kQH_ [OH-][S]. 5.2.
Гетерогенные реакции, наиболее медленной стадией которых является
стационарный поток диффузии исходных веществ, протекают по
1-му порядку. Это вытекает из уравнения стационарного потока
диффузии. 5.3. В отличие от индуктора катализатор не расходуется
в ходе реакции и влияет на скорость только тех реакций, которые
термодинамически могут идти самопроизвольно в данных условиях.
5.4. Рис 48. При температуре ниже Т\ — кинетическая область;
£»40^-400 кДж/моль. При температуре выше Т2 — диффузионная
область; £«12-=-20 кДж/моль. В интервале Т\—Т2—переходная
область. 5.5. 1,8-10~5 см2/с. 5.6. 4,15-10~10 моль/см2. 6.1.
Коэффициент диффузии в разбавленных растворах зависит от природы рас-
115
творителя, растворенного вещества и температуры. 6.2. Степень
заполнения адсорбента при химической адсорбции с ростом
температуры всегда понижается, так как адсорбция — экзотермический
процесс. 6.3. Принцип энергетического соответствия указывает путь
к выбору наиболее активного катализатора исходя из
термодинамических характеристик: энергии связи катализатора с исходными
веществами, теплового эффекта реакции и энергии связи катализатора
с продуктами реакции. 6.4. Энергия активации гетерогенно-каталити-
ческон реакции (Екат) меньше энергии активации этой же реакции,
но протекающей без катализатора, за счет адсорбции
активированного комплекса на поверхности катализатора. Разница в этих энер-
Рис. 48
гиях активации (Евек&т — £каяс.кат) соответствует теплоте адсорбции
активированного комплекса (АН^ДС). 6.5. 3,147-103 Па. В этом опыте
представлена стационарная диффузия. 6.6. 296 г/л. 7.1. Скоростью
гетерогенной каталитической реакции называется количество
вещества, реагирующего на единице поверхности раздела фаз в единицу
времени. 7.2. Мультиплет — это группа атомов на поверхности
катализатора (состоящая минимум из двух атомов «дублет»),
участвующих в образовании поверхностного соединения. 7.3. О наличии
активированной адсорбции свидетельствуют большая величина
теплоты адсорбции (порядка теплот химической реакции), большой
температурный коэффициент скорости адсорбции, малая толщина
адсорбционного слоя (мономолекулярный слой), специфичность и
необратимость адсорбции, медленное достижение равновесия. 7.4.
Мономолекулярная гетерогенно-каталитическая реакция при высоких
давлениях газообразного реагента протекает по нулевому порядку
относительно газообразного реагента, так как скорость пропорциональна
поверхностной концентрации, которую можно рассчитать по уравне-
ТЬР
нию изотермы Лэнгмюра: v~ kC$ = k
Если Р велико,
1 Л-ЬР
то {<^ЬР. Тогда u=ftr«> = const. 7.5. Распределение концентрации
вещества при перемешивании раствора показано на рис. 20, д.
Концентрация растворяющегося вещества изменяется в прилегающем к
поверхности тонком диффузионном слое только за счет диффузии.
7.6. 6 = 5,457- Ю-5 Па"1; Г«=44,39210""3 кг; в=0,141. 8Л.
Коэффициент Ь в уравнении Лэнгмюра есть константа равновесия процесса
116
адсорбции. 8.2. Для решения вопроса о том, в какой области
протекает гетерогенная реакция, нужно изучить влияние температуры и
перемешивания на скорость реакции. Если перемешивание изменяет
скорость реакции, а температурный коэффициент скорости и энергия
активации реакции малы, то реакция протекает в диффузионной
области. Наблюдаемый порядок реакции при этом первый. 8.3.
О «кажущемся» порядке реакции говорят потому, что в выражение
скорости гетерогенно-каталитической реакции входят величины,
характеризующие значение концентрации реагирующих веществ в
объеме, а не на поверхности. Скорость же процесса определяется
поверхностной концентрацией. Так, если реагирует одно вещество то
/ dx
истинный порядок реакции — первый I = £6, где G —
поверхностная концентрация). Кажущийся же порядок (показатель степени
при Р) может изменяться от нулевого (при больших Р) через
дробный до 1-го (при малых Р). 8.4. В основе объяснения действия
катализатора в гомогенном и гетерогенном катализе лежит
представление об образовании промежуточного соединения исходного
вещества с катализатором и о снижении энергии активации за счет
энергетически более выгодного пути процесса. Природа
промежуточного соединения разная: при гомогенном катализе это стехиометри-
ческое соединение; при гетерогенном — поверхностное соединение
образующееся за счет хемосорбции. 8.5. 2,94-10~5 см2/с 8.6. 449 и2]
9.1. Процесс диффузии —это процесс самопроизвольного
выравнивания концентрации. 9.2. Абсорбция в отличие от адсорбции состоит
в поглощении веществ всем объемом поглотителя, а не только его
поверхностью. 9.3. Рис. 49. 9.4. Оптимальный катализатор — это
катализатор, отвечающий условию равенства энергии активации
образования активированного комплекса с катализатором и энергии
активации распада этого комплекса. Энергия активации для
оптимального катализатора равна половине теплового эффекта данной
химической реакции. 9.5. 0,0239 см3. 9.6. 30,8 см/с. 10.1.
Диффузионным слоем называется слой, прилегающий к поверхности раздела
фаз, который не затрагивается перемешиванием и где выравнивание
концентрации происходит только за счет диффузии. 10.2. Удельной
каталитической активностью катализатора называется разность в
скоростях реакции с катализатором и без него («каталитическая
активность»), отнесенная к единице количества катализатора. 10.3.
117
Рис. 50, где / — равновесная физическая адсорбция; 2— равновесная
активированная адсорбция; 3—неравновесная активированная
адсорбция. 10.4. Скорость гетерогенной реакции, лимитирующей ста-
Г
т
Рис. 50
дией которой является адсорбция исходного вещества, описывается
уравнением 1-го порядка, когда адсорбция реагирующих веществ
мала. 10.5. 137,9 мин. 10.6. 37 с"1.
ОГЛАВЛЕНИЕ
Стр.
Предисловие 3 .
Глава I. Молекулярная спектроскопия б"
Глава II. Первый закон термодинамики. Термохимия ... Ю
Глава III. Второй закон термодинамики 17
Глава IV. Молекулярная статистика. Статистическая
термодинамика 23
Глава V. Фазовое равновесие в однокомпонентных системах 29 .
Глава VI. Идеальные растворы (разбавленные и
совершенные) 32
Глава VII. "Реальные растворы 36
Глава VIII. Равновесие жидкость—пар в двухкомпонент-
ной системе 40
Глава IX. Равновесие твердое тело — жидкость в двухком-
понентиой системе 44 J
Глава X.-Химическое равновесие ,»*47
Глава XI. Растворы электролитов 54
Глава XII. Э. д. с. гальванических элементов и электродные
потенциалы 60
Глава XIII. Формальная кинетика. Зависимость скорости
реакции от температуры 67
Глава XIV. Теории кинетики. Фотохимические, цепные
реакции и реакции в растворах 73
Глава XV. Гетерогенная кинетика. Диффузия. Адсорбция.
Катализ 80