Автор: Нил М.Дж.
Теги: лекарственные средства в соответствии с их активным веществом фармакология фармация токсикология медицина
ISBN: 5-88816-063-6
Год: 1999
Текст
Серия • ЭКЗАМЕН НА ОТЛИЧНО
НАГЛЯДНАЯ
ФАРМАКОЛОГИЯ
Medical Pharmacology
at a Glance
MICHAEL J. NEAL
Professor and Chairman of the
Division of Pharmacology and Toxicology
United Medical and Dental Schools
of Guy's and St Thomas's Hospitals (UMDS)
Department of Pharmacology
St Thomas's Hospital, London
THIRD EDITION
Blackwell
Science
Майкл Дж. Нил
Наглядная
фармакология
Перевод с английского
Под редакцией д-ра мед. наук М. А. Демидовой
Москва
ГЭОТАР МЕДИЦИНА
1999
УДК 615.2/3@75.8)
ББК 52.81я73
Нбб
Нил М. Дж.
Наглядная фармакология: Пер. с англ. / Под ред. М.А. Демидовой. - М.:
ГЭОТАР МЕДИЦИНА, 1999. - 104 с. - (Экзамен на отлично)
ISBN 5-88816-063-6
В книге содержится современная информация по вопросам общей и частной
фармакологии. Фармакологический материал представлен в виде рисунков и схем, что
делает его наглядным и удобным в использовании при подготовке к занятиям.
Предназначена студентам медицинских вузов, фармакологам и врачам различных
специальностей.
УДК 615.2/3@75.8)
ББК 52.81я73
Напечатано в Российской Федерации.
Права на данное издание принадлежат издательству ГЭОТАР МЕДИЦИНА. Воспроизведение и
распространение в каком бы то ни было виде части или целого издания не может быть
осуществлено без письменного разрешения издательства.
ISBN 5-88816-063-6
© ГЭОТАР МЕДИЦИНА, 1999
© Blackwell Science Ltd., 1997
Н66
Содержание
От издательства 7
Предисловие 7
Как пользоваться книгой 7
Список литературы для дополнительного чтения 7
1. Введение: принципы действия лекарственных веществ ... 8
2. Взаимодействие лекарственных веществ
с рецепторами 10
3. Всасывание, распределение и выведение
лекарственных веществ 12
4. Метаболизм лекарственных веществ в организме 14
5. Местные анестетики 16
6. Лекарственные средства,
действующие на нервно-мышечную передачу 18
7. Вегетативная нервная система 20
8. Холинергичсские средства 22
9. Адренергические средства 24
10. Лекарственные средства, действующие на глаза 26
11. Лекарственные средства, применяемые
при бронхиальной астме, поллинозе и анафилаксии 28
12. Лекарственные средства,
действующие на желудочно-кишечный тракт.
I. Противоязвенные средства 30
13. Лекарственные средства,
действующие на желудочно-кишечный тракт.
II. Средства, влияющие на моторику и секрецию 32
14. Лекарственные средства, специфически влияющие
на почки: диуретики (мочегонные средства) 34
15. Лекарственные средства,
применяемые при артериальной гипертензии 36
16. Антиангинальные средства 38
17. Противоаритмические средства 40
18. Лекарственные средства,
применяемые при сердечной недостаточности 42
19. Лекарственные средства,
влияющие на свёртывание крови 44
20. Гиполипидемические средства 46
21. Лекарственные средства, стимулирующие эритропоэз.... 48
22. Медиаторы центральной системы 50
23. Общие анестетики (средства для наркоза) 52
24. Транквилизаторы и снотворные средства 54
25. Противоэпилептические средства 56
26. Препараты, применяемые при паркинсонизме 58
27. Антипсихотические средства — нейролептики 60
28. Средства, применяемые при аффективных состояниях.
Антидепрессанты 62
29. Опиоидные (наркотические) анальгетики 64
30. Противорвотные средства. Антиэметики 66
31. Лекарственная зависимость и злоупотребление
лекарствами 68
32. Нестероидные противовоспалительные средства 70
33. Препараты гормонов коры надпочечников
(кортикостероиды) 72
34. Половые гормоны и их препараты 74
35. Гормоны щитовидной железы
и антитиреоидные средства 76
36. Средства, применяемые при сахарном диабете
(антидиабетические средства) 78
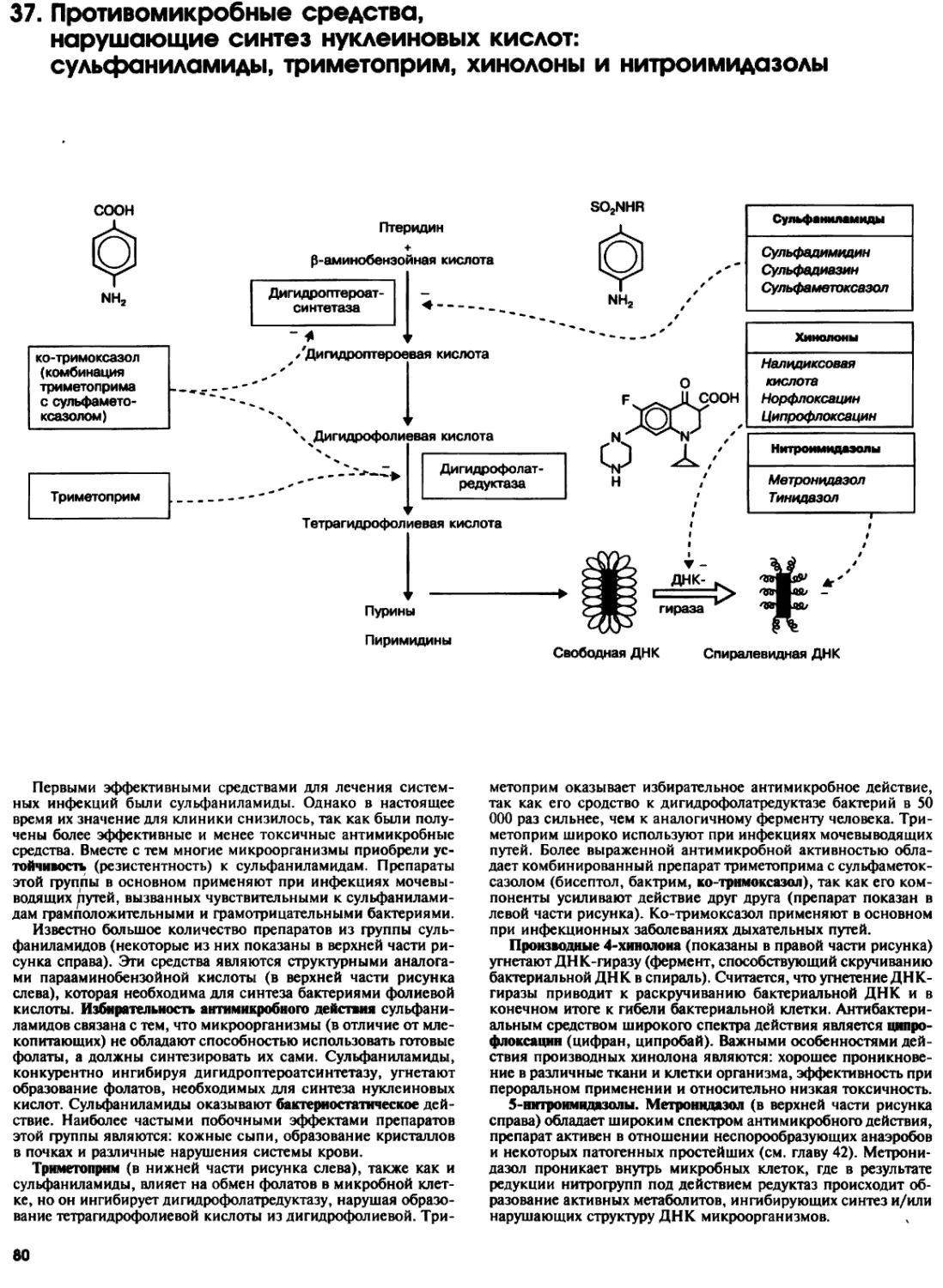
37. Противомикробные средства, нарушающие синтез
нуклеиновых кислот: сульфаниламиды, триметоприм,
хинолоны и нитроимидазолы 80
38. Противомикробные средства, угнетающие синтез
белков клеточной стенки бактерий: пенициллины,
цефалоспорины и ванкомицин 82
39. Противомикробные средства, угнетающие синтез
белка внутри микробной клетки: аминогликозиды,
тетрациклины, макролиды и левомицетины 84
40. Противогрибковые и противовирусные средства 86
41. Противопаразиnарные средства.
1. Противоглистные препараты 88
42. Противопаразитарные средства.
II. Противопротозойные препараты 90
43. Противоопухолевые средства 92
44. Отравления лекарственными веществами 94
45. Побочное действие лекарств 96
Предметный указатель 99
5
От издательства
Уважаемые читатели!
Мы представляем вашему вниманию новую книгу из серии
«Экзамен на отлично» — «Наглядная фармакология».
Автор «Наглядной фармакологии» — Майкл Дж. Нил,
профессор объединённой медицинской и стоматологической
школы Госпиталя Гвайса и святого Томаса в Лондоне.
Книга выдержала три издания на английском языке. На
русском языке она выходит впервые.
Предисловие
Настоящая книга в первую очередь предназначена для
студентов-медиков, но также может быть использована всеми
желающими получить базовые знания по фармакологии. В этой
книге текст сокращён до минимума и сопровождается
большим количеством иллюстраций. В каждой главе содержатся
краткие сведения об особенностях действия и применения
лекарственных средств различных фармакологических групп. Это
третье издание книги, в котором большая часть материала
существенно обновлена. В книгу включены новые главы, в них
дана характеристика гиполипидемических, противорвотных и
противоглистных средств, а также разбираются вопросы
побочного действия лекарств и лекарственных отравлений.
Как пользоваться книгой
Каждая из 45 глав книги посвящена отдельной теме общей
или частной фармакологии и приблизительно соответствует 60-
минутной лекции. Для наиболее полного понимания
фармакологического материала внимание лучше всего
сконцентрировать на иллюстрациях. Некоторые из них довольно сложные и
могут быть не восприняты с первого раза. Каждая
иллюстрация должна быть тщательно изучена и сопоставлена с
объяснением в тексте. Многие лекарственные средства упоминаются в
нескольких главах, поэтому в книге предусмотрены
перекрёстные ссылки, которые помогут усвоить учебный материал. По
мере изучения фармакологии вы будете всё меньше нуждаться
в повторении информации, а для освежения в памяти
пройденного материала вам будет достаточно просто беглого взгляда
на иллюстрации.
Список литературы
для дополнительного чтения
1. British National Formulary. British Medical Association and
The Royal Pharmaceutical Society of Great Britain, London (about
700 pp).
BNF обновляется дважды в год.
2. Rang, H.P. & Dale, M. M. A995) Pharmacology, 3rd edn.
Churchill Livingstone, Edinburgh (855 pp).
3. Ritter, J. M., Lewis, L. D. & Mant, G.K. Textbook of Clinical
Pharmacology, 3rd edn. Edward Arnold, London G25 pp).
7
1. Введение: принципы действия лекарственных веществ
Ацетилхолин
Норадреналин
Дофамин
Серотонин
у-аминомасляная
кислота (ГАМК)
Глутаминовая
кислота
Нервное окончание
ИНГИБИТОРЫ ОБРАТНОГО
ЗАХВАТА МЕДИАТОРОВ
Трициклические
антидепрессанты
ИНГИБИТОРЫ ФЕРМЕНТОВ
Антихолинэстераэные
сродства
Ацетилхолинэстеразу
Карбоангидразу
Моноаминоксидаау
Циклооксигеназу
Фосфорилирование
белков (ферментов)
¦*> Клеточный эффект
(антагонисты кальция)
Na -каналы
(местные анестетики)
1УГНЕТАЮТ АКТИВНЫЙ
|ТРАНСП0РТ
|ингибируют
Na+/K+- АТФ-азу
(сердечные гликозиды)
Фармакология — это наука, изучающая взаимодействие
лекарственных веществ с организмом человека.
Основными разделами фармакологии являются:
1) фармакодинамнка — изучает биологические эффекты
лекарств в организме;
2) фармакокинетнка — изучает процессы всасывания,
распределения, метаболизма и экскреции лекарственных веществ.
На рисунке показаны некоторые механизмы действия
лекарственных веществ в организме. Отдельные лекарственные
вещества (например, общие анестетики, осмотические
диуретики) оказывают неспецифическое действие, обладая физико-
химическим механизмом действия. Некоторые лекарственные
средства действуют как ложные субстраты или ингибиторы
ферментов (в нижней части рисунка слева) и транспортных
систем (в нижней части рисунка справа). Многие лекарственные
вещества специфически связываются с белками биологических
мембран клеток. Эти белки называются рецепторами (§^). С
рецепторами связываются различные эндогенные вещества
организма: медиаторы (в верхней части рисунка слева, ф) и
гормоны (в верхней части рисунка справа, •). Так, например,
медиатором, высвобождающимся из окончаний мотонейронов и
активирующим рецепторы скелетной мускулатуры, вызывая тем
самым сокращение мышц, является ацетилхолин. Медиаторы
и лекарственные вещества, активирующие рецепторы и
вызывающие биологический эффект, называются агоиистамн.
Лекарственные вещества, связывающиеся с рецепторами, но не
вызывающие их активации и биологического эффекта,
уменьшающие или устраняющие эффекты а гон истов, называются
антагонистами (на рисунке показаны в виде ).
Активация рецепторов агонистами или гормонами
приводит к усилению физиологического или биохимического ответа
клеток. Клеточные эффекты могут быть связаны с изменением
ионной проницаемости мембран, усилением процессов
транскрипции ДНК, а также изменением концентрации
внутриклеточных вторичных посредников (мессеиджерош) (в нижней части
рисунка).
Взаимодействие между лекарственным веществом и
связывающей частью рецептора зависит от степени их комплемен-
тарности (пространственного соответствия). При высокой
степени комплементарности между лекарственными веществами
и рецепторами образуется больше связей (обычно нековалент-
ных), силы притяжения между ними будут сильнее, а сродство
лекарства к рецепторам больше. Способность лекарственных
веществ соединяться с рецепторами определенного типа
называется специфичностью (избирательностью). Абсолютной
избирательности действия веществ практически не существует, но
многие соединения обладают относительной избирательностью
(селективностью) взаимодействия с рецепторами определенных
типов.
Лекарственные средства наряду с основным
(терапевтическим) действием могут вызывать целый ряд побочных
(нежелательных) эффектов (см. главу 45), варьирующих от
тривиальных (например, легкая тошнота) до фатальных (например, ап-
ластическая анемия).
8
многие средства
активируют (агомиоты)
ИЛИ блокируi0f
(антагонисты) рацалторы
Мшюторьм
средства угнетают
медиатора
Фермента-
тивное
расщепление
Обратный
захват
Везикула
Высвобождение
Кровь
Клетка
эндокринной
железы
Гормоны
ЭНДОКРИННЫХ ЖЕЛЁЗ
Инсулин
Тироксин
Кортизол
Альдостерон
Тестостерон
Эстрадиол
ВНУТРИКЛЕТОЧНЫЕ
(МЕСТНЫЕ)
Гистамин
Серотонин
Простагландины
Ферменты
Синтез
-Депонирование
Захват
предшественников
Ферменты
Некоторые срадст—
упмтяют
следующие процессы
Q-белки
Аденилат-
циклаэа
ФИДФ
АТФ(
Некоторые средства
угнетают
трш«слортны« процессы
БЛОКИРУЮТ ИОННЫЕ
КАНАЛЫ
Са -каналы
Протеинкиназы
Вторичные Ns-
мессенджеры
цДМФ
дг
•ИР,
Рецепторы
Рецепторы — это активные группировки макромолекул, с
которыми специфически взаимодействуют медиаторы или
гормоны. Многие рецепторы являются белками, в настоящее
время некоторые из них клонированы и определена их
аминокислотная последовательность. Ниже перечислены четыре
основных типа рецепторов:
1) рецепторы, связанные с ионными каналами (например,
н-холинорецепторы; см. главу 6; ГАМК-рецепторы; см.
главу 24). Они состоят из нескольких белковых субъединиц,
которые располагаются в биологических мембранах клеток в
радиальном порядке, формируя ионные каналы;
2) рецепторы, связанные с G-белками (см. ниже),
состоящие из белковых молекул, семикратно прошивающих
биологические мембраны. Биологический эффект при активации этих
рецепторов осуществляется при участии системы вторичных
мессенджеров;
3) ядерные рецепторы, регулирующие процессы
транскрипции ДНК и, соответственно, синтеза белка. К этой группе
относятся рецепторы стероидных (см. главу 34) и тиреоидных
(см. главу 35) гормонов;
4) рецепторы, связанные с тирозинкиназой (например, ин-
сулиновые рецепторы; см. главу 36).
Медиаторы — это вещества, которые высвобождаются из
нервных окончаний, диффундируют в синаптическую щель и
специфически связываются с рецепторами. Активация
рецепторов способствует изменению их конформации, что в свою
очередь приводит к развитию постсинаптических реакций и
формированию соответствующего клеточного эффекта (например,
к сокращению мыши или изменению секреции желез). В
дальнейшем медиаторы разрушаются ферментами (например, аце-
тилхолин) или подвергаются обратному нейрональиому или
экстранейрональному захвату (например, норадреналин, ГАМ К)
(показано в левой части рисунка). Действие многих
лекарственных веществ связано с их влиянием на процессы
синаптической передачи импульсов.
Гормоны — это биологически активные вещества,
вырабатываемые эндокринными железами и специальными клетками
в тканях. Они высвобождаются непосредственно в кровоток и
вызывают физиологические эффекты, взаимодействуя со
специальными рецепторами клеток.
Лекарственные вещества могут угнетать (антитиреоидные
средства; см. главу 35) или увеличивать (пероральные противо-
диабетические средства; см. главу 36) секрецию гормонов.
Некоторые лекарственные вещества могут активировать
(например, стероидные противовоспалительные средства; см. главу 33)
или блокировать (антагонисты эстрогенов; см. главу 34)
гормональные рецепторы.
При различных патологических процессах из клеток
высвобождаются местные (внутриклеточные) гормоны — такие, как
гистамин, серотонин E-гидрокситриптамин, 5-НТ), кинины и
простагландины. Действие гистамина может быть устранено ан-
тигистаминными соединениями (см. главу 11), а синтез про-
стагландинов угнетают многие противовоспалительные
средства (например, аспирин; см. главу 32).
Транспортные системы
Белково-фосфолипидные мембраны клеток являются
барьером для транспорта гидрофильных веществ в клетку или из
клетки (внутрь клеток гидрофильные вещества попадают лишь
при участии транспортных систем).
Ионные каналы — это селективные поры в мембране клеток,
через которые осуществляется транспорт определенных ионов
по их электрохимическому градиенту. Проницаемость ионных
каналов (открытие и закрытие каналов) контролируется
мембранным потенциалом (потенциалзависимые каналы) или
медиаторами (медиаторзависимые каналы). Некоторые каналы
(Са2+-каналы в сердечной мышце) являются одновременно
потенциал- и медиаторзависимыми. Потенциалзависимые
каналы для Na+, K+ и Са2+ имеют сходную структуру (см.
главу 5). Существуют различные подтипы этих каналов.
Антагонисты кальция (см. главу 16) блокируют потенциалзависимые
кальциевые каналы L-типа в сердце и сосудах гладкой
мускулатуры, а местные анестетики (см. главу 5), некоторые противосу-
дорожные (см. главу 25) и противоаритмические средства (см.
главу 17) блокируют Na^-каналы. Клинически значимых
лекарственных средств, действующих на потенциалзависимые К+-
каналы, нет. Пероральные противодиабетические средства
действуют на АТФ-зависимые К*-каналы, проницаемость
которых регулируется уровнем АТФ в клетке (см. главу 36).
Перенос веществ через биологические мембраны против их
градиента концентраций происходит путем активного транспорта.
Активный транспорт осуществляется с затратой энергии при
участии специальных переносчиков.
Ниже приведено несколько примеров активного транспорта
веществ через мембраны клеток:
1) натриевый насос способствует выведению Na* из клетки.
Одновременно происходит вход К+ в клетку. Эти процессы
осуществляются с использованием энергии АТФ при участии NaV
К*-аденозинтрифосфатазы (Na*/К+-АТФазы). С влиянием на
натриевый насос связан механизм действия некоторых
лекарственных средств. Так, например, сердечные гликозиды
угнетают NaVK^-АТФазу (см. главу 18), некоторые диуретики инги-
бируют активный транспорт Na+ и/или ОТ в эпителии
канальцев почек (см. главу 14);
2) активный транспорт норадреналина (обратный нейрональ-
ный захват норадреналина). Обратный нейрональный захват
норадреналина в адрснсргичсских синапсах ЦНС блокируют три-
циклические антидепрессанты, что приводит к усилению
действия норадреналина (см. главу 28).
Ферменты
Это специфические белки, являющиеся биологическими
катализаторами и активирующие биохимические реакции в
организме. Механизм действия многих лекарственных веществ
связан с их способностью ингибировать различные ферменты.
Примерами таких веществ являются: антихолинэстеразные средства
(усиливают действие ацетилхолина, блокируя ацетилхолинэс-
теразу; см. главы 6 и 8); ингибиторы карбоангидразы
(диуретики; см. главу 14), ингибиторы циклооксигеназы (нестероидные
противовоспалительные средства; см. главу 32), ингибиторы
моноаминоксидазы (антидепрессанты; см. главу 28).
Вторичные мессенджеры
Взаимодействие агонистов с рецепторами приводит к
изменению содержания в клетке вторичных посредников
(мессенджеров). Повышение или снижение (гораздо реже)
концентрации вторичных мессенджеров в клетках приводит к
формированию клеточного ответа. Наиболее изученными вторичными
мессенджерами являются: Са2+, циклическая форма аденозин-
монофосфата (цАМФ), инозитол-1,4,5-трифосфат (ИР3) и ди-
аиилглицерол (ДГ)-
цАМФ образуется из АТФ под действием адснилатциклазы,
например, в результате активации р-адренорецепторов. цАМФ
активирует протеинкиназу А, которая фосфорилирует белки
(белки ионных каналов или ферменты), что приводит к
развитию биологического эффекта.
ИР3 и ДГ образуются из мембранных фосфатидилинозитол-
4,5-дифосфатов под влиянием фосфолипазы С. Эти вторичные
мессенджеры могут (подобно цАМФ) активировать протеин-
киназы. Действие ИР3 связано с увеличением концентрации
в клетке Са2+. С фосфоинозитидной системой вторичных
мессенджеров связаны м-холино- и оц-адренорецепторы.
G-белки. Активация некоторых рецепторов приводит к
стимуляции аденилатциклазы и фосфолипазы С при участии G-
белков (ГТФ-связывающих белков). Комплекс рецептор-аго-
нист вызывает конформационные изменения в G-белках,
способствуя связыванию а-субъединицы G-белков с ГТФ. Затем
комплекс а-ГТФ диссоциирует из G-бслка и способствует
активации (или угнетению активности) ферментов. а-ГТФ-ком-
плекс обладает внутренней ГТФазной активностью, поэтому
он способен лимитировать свое действие на ферментные
системы клетки, гидролизуя ГТФ до ГДФ. В дальнейшем
комплекс а-ГДФ связывается с (fy-субъсдиницами G-белка.
9
2. Взаимодействие лекарственных веществ с рецепторами
Кривая зависимости эффект-доза
Логарифмическая кривая
зависимости эффект-доза
Действие антагонистов
1
Конкурентные
антагонисты
,°
' Антагонисты
0 необратимого
действия
* Частичные агонисты
не вызывают
максимального эффекта
Концентрация агониста [А]
log [А]
log [A]
Межмолекулярные
Электростатические
Гидрофобные
Ван-дер-Ваальса
Водородные
Агонист
Рецептор Комплекс Трансдуктор Комплекс агонист/
агонист / рецептор рецелтор/трансдуктор
Эффект
Сродство
к рецепторам (КА)
Внутренняя
активность
(Кдр= сродство комплекса агонист/рецептор
к трансдуктору)
Воздействие агонистов на органы и ткани вызывает
развитие различных биологических эффектов (например,
сокращение мышц, повышение секреции желез и др.). Зависимость
между концентрацией агониста и выраженностью
физиологического ответа клеток может быть определена методом
биоанализа. Начальный этап взаимодействия лекарственных веществ
с рецепторами, т.е. присоединение лекарства к рецептору,
изучают путем определения числа связей лекарственных веществ с
рецепторами.
Экспериментально выявлено, что кривая зависимости
эффекта агонистов от их концентрации в тканях обычно имеет
вид гиперболы (кривая зависимости эффект — доза
(концентрация), в верхней части рисунка слева). Чаше используют
графическое изображение зависимости физиологического эффекта
от логарифма концентрации лекарственного вещества (т.н.
логарифмическая кривая зависимости эффект — доза
(концентрация), показана в верхней части рисунка в центре). Если
взаимодействие между лекарственным веществом (А) и
рецептором (Я) (в нижней части рисунка) подчиняется закону
действия масс, то концентрация рецепторов, связанных с
лекарственным веществом (АР), определяется по формуле:
где Р0 — общая концентрация рецепторов, А — концентрация
лекарственного вещества (агониста), АГд — равновесная
константа диссоциации, АР— концентрация рецепторов,
связанных с лекарственным веществом.
Поскольку кривая зависимости эффект — доза
(концентрация) лекарственного вещества имеет вид гиперболы, то
биологический эффект, вызванный лекарством, обычно прямо
пропорционален числу связанных рецепторов. Однако это
правило не распространяется на действие частичных агонистов.
Частичные агонисты, связываясь с рецепторами, не вызывают
максимального эффекта даже при одинаковой с полными агонис-
тами степени сродства к этим рецепторам (показано в виде
пунктирной линии на графиках в верхней части рисунка).
Таким образом, агонисты кроме сродства к рецепторам обладают
также внутренней активностью, т.е. способностью вызывать
биологический эффект в результате присоединения к рецепторам
(в нижней части рисунка).
Конкурентные антагонисты взаимодействуют со
специфическими рецепторами, но не вызывают биологического эффекта,
т.е. они не обладают внутренней активностью. Это приводит к
параллельному сдвигу логарифмической кривой эффект — доза
(концентрация) вправо (показано в верхней части рисунка на
правом графике в виде ¦), но максимальный эффект
конкурентных антагонистов при увеличении их концентрации в
тканях не уменьшается. В отличие от конкурентных антагонистов
максимальный эффект антагонистов необратимого действия (в
высоких концентрациях) значительно снижается (показано в
верхней части рисунка на правом графике в виде •). Однако
логарифмическая кривая эффект необратимых антагонистов —
доза (низкие концентрации) смещается вправо без снижения
максимального эффекта (показано в верхней части рисунка на
правом графике в виде О). Так как антагонисты необратимого
действия эффективно уменьшают число рецепторов в системе,
становится понятным, что после достижения максимального
эффекта в тканях остаются свободные рецепторы (т.н. рецеп
торный резерв).
10
Агонисты
Полные
агонисты
/ Полные
/ агонисты
f с низким
аффинитетом
к рецепторам^
' Частичные
агонисты
Полные агонисты
\АР\.
Ка +М1
Межмолекулярное
взаимодействие
Взаимодействие лекарственное вещество — рецептор
осуществляется за счет межмолокулярных связей (в левой части
рисунка). Вначале молекулы лекарственных веществ
притягиваются к рецепторам с помощью электростатических сил
(относительно дальнего действия). Затем, если лекарство обладает
комплементарностью к рецепторам, между лекарственными
веществами и рецепторами образуются водородные или Ван-
дер- Ваальсовы связи. Антагонисты необратимого действия
образуют с рецепторами достаточно сильные ковалентные связи.
Аффинитет
Аффинитет (сродство) — это способность вещества
связываться с рецептором. Степень сродства лекарственных
веществ к рецепторам характеризуется величиной равновесной
константы диссоциации (Ад). Равновесная константа
диссоциации равна соотношению значений обратимого (к-\) и
необратимого (?+,) связывания лекарственных веществ с
рецепторами. Величина обратная Кд называется равновесной
константой ассоциации (Ад). КА (в отсутствие рецепторного резерва;
см. ниже) соответствует концентрации лекарственного
вещества, в которой лекарство оказывает эффект равный 50%
максимального.
Антагонисты
Антагонисты — это лекарственные вещества, которые
связываются с рецепторами, но не вызывают их активации и
формирования биологического эффекта (не обладают внутренней
активностью). Различают антагонисты конкурентного и
необратимого действия.
Конкурентные
антагонисты
Связь антагонистов конкурентного действия с рецепторами
носит обратимый характер. В связи с этим повышение
концентрации агонистов в области блокированных рецепторов может
восстанавливать клеточный ответ, так как при этом
увеличивается вероятность образования агонист-рецепторных связей и
снижается возможность связывания с рецепторами
антагонистов. Такое явление называется «конкурентным антагонизмом».
При этом отмечается параллельный сдвиг кривой зависимости
эффект конкурентных антагонистов — доза (концентрация)
вправо.
Эффекты антагонистов необратимого действия (например, фе-
ноксибензамина) введением агонистов (в высоких дозах) не
устраняются.
Рецепторный
резерв
Способность антагонистов необратимого действия вызывать
сдвиг логарифмической кривой зависимости эффект — доза
без снижения уровня максимального эффекта свидетельствует
о том, что во многих тканях после достижения максимального
эффекта остаются свободные рецепторы. Эти рецепторы
иногда называют «запасными», однако это определение является
ошибочным, поскольку рецепторный резерв выполняет
определенные функции. Так, например, эти рецепторы
увеличивают чувствительность и скорость системы, так как
концентрация агонист-рецепторных комплексов (и, соответственно,
выраженность эффекта) зависит не только от концентрации
лекарственных веществ, но и от общего числа рецепторов.
Частичные агонисты
Частичные агонисты — это лекарственные вещества,
которые, связываясь с рецепторами, не вызывают максимального
эффекта. Причины этого явления не совсем понятны. Недавно
было высказано предположение, что характер действия
агонистов зависит от сродства комплекса лекарственное вещество —
рецептор к транедуктору (в нижней части рисунка). Так,
комплекс полного а гон иста с рецептором обладает высоким
сродством к транедукторам (например, к G-белкам, см. главу I),
тогда как комплекс частичного а гон и ста с рецептором
обладает гораздо меньшим сродством к транедукторам, поэтому не
может обеспечить полного ответа. При самостоятельном
применении частичные агонисты вызывают специфический
физиологический ответ клеток, однако активность полных
агонистов они уменьшают (например, некоторые антагонисты р-ад-
ренорецепторов; см. главы 15 и 16).
Внутренняя активность
Внутренняя активность — это способность агонистов
вызывать биологический эффект, изменяя конформацию
рецепторов. Это явление определяется как сродство комплекса аго-
нист — рецептор к транедуктору.
Частичные агонисты и рецепторный резерв. Существуют
лекарственные вещества, которые в тканях без рецепторного
резерва действуют как частичные агонисты, а в тканях с большим
рецепторным резервом могут выполнять функции полных
агонистов, так как их слабая активность возмещается активацией
гораздо большего числа рецепторов, чем при действии полных
агонистов.
Биоанализ. Зависимость между концентрацией
лекарственных веществ и выраженностью их биологического эффекта в
различных тканях можно изучать методом биоанализа. С этой
целью обычно используют изолированные биологические
ткани, что позволяет исключить рефлекторное действие веществ,
а также облегчает определение концентрации вещества в
тканях. Биологический анализ позволяет определять;
- концентрацию лекарственного вещества в тканях;
- способность лекарственного вещества связываться с
рецепторами тканей;
- активность лекарственного вещества по сравнению с
активностью других средств.
Определение чувствительности рецепторов к различным
веществам является одним из основных принципов их
классификации (например, классификация адренорецепторов; см.
главу 7).
Определение числа рецепторов, связанных с лекарством
Способ определения числа рецепторов, связанных с
лекарственным веществом, достаточно прост и очень удобен. С этой
целью фрагменты мембран гомогенизированных тканей
инкубируют с лекарственными веществами, меченными
радиоактивными изотопами (обычно ЭН), а затем выделяют путем
фильтрации. После поправки на неспецифическое связывание
измеряют концентрацию связанного с рецепторами
3Н-лекарственного вещества и рассчитывают КА и Впых (число
связанных участков мембран — рецепторов). Этот метод широко
используют для изучения рецепторов, с которыми связываются
лекарственные вещества, однако он имеет целый ряд
недостатков. Так, например, этот метод не позволяет оценить
выраженность функционального ответа тканей, вместе с тем иногда
лекарственные вещества, меченные радиоизотопами, не
связываются ни с какими рецепторами.
11
3. Всасывание, распределение и выведение лекарственных веществ
Факторы,
определяющие всасывание
лекарства из кишечника
Лекарственная
форма
Устойчивость к
кислотам и ферментам
Перистальтика
кишечника
Объём и состав пищи
Выраженность
метаболизма первого
прохождения
Степень
липофильности
зависит от
рК лекарства
и рН среды
Неиониэированные
средства являются
более липофиль-
ными, чем
ионизированные
Для слабых оснований
соотношение между
ионизированной и
неионизированной
формой лекарств
определяется по формуле:
в
*°°ПГ=рКа-рН
Пути введения лекарств
- - «* Пероральный (наиболее часто)
Слабые Сублингвальный
(минуя барьер печени)
/ Внутривенный
(минуя абсорбционные
основания
(В) рК,=7
^барьеры)
Ротовая полость
Желудок
Кишечник
Большинство
молекул
ионизировано
Объём распределения VD
Липофильные вещества
проникают в клетку (этанол)
Высокоиокизированные вещества
остаются в экстрацеллюлярном
пространстве (тубокурарин)
Вещества, значительно связыва-
юи;иеся с белками плазмы крови и
имеющие большой молекулярный
вес, остаются в кровотоке (гепарин)
[Некоторые лекарства |
[Большинство лекарств |
Абсорбция
Распределение
Экскреция
Kelt
1одСР=1одС0- ^03
Наклон=
2,303
Время (t)
Многие лекарственные средства используют для приёма
внутрь (перорального применения), В этом случае до
поступления лекарственных веществ в системный кровоток они
должны пройти через стенку кишечника (в левой части рисунка,
«=>). Абсорбция (всасывание) лекарств из кишечника зависит от
многих факторов (показаны в левой части рисунка), но обычно
пропорциональна степени их липофильности. Так, например,
абсорбция неионизированных молекул (В) идет быстрее, так
как эти вещества являются более липофильными, чем
ионизированные соединения (ВН+), которые окружены «оболочкой»
из молекул воды. Лекарственные вещества всасываются в
основном в тонком кишечнике, так как эта часть
желудочно-кишечного тракта имеет наибольшую всасывающую поверхность.
В тонком кишечнике абсорбируются даже слабые кислоты
(например, аспирин), которые не ионизируются в кислой среде
желудка (в присутствии НС1). Из желудочно-кишечного тракта
лекарства всасываются в систему воротной вены (в левой части
рисунка, у/ А) и с током крови поступают в печень, где
некоторые вещества активно метабол и зируются («метаболизм
первого прохождения»).
Липофильные лекарственные средства быстро абсорбируются
из кишечника и с током крови распределяются по организму.
В крови многие лекарственные вещества частично
связываются с альбуминами плазмы, в результате в плазме крови
устанавливается равновесие между связанной с белками (ПВ) и
свободной (В) частью лекарства. Лекарственные вещества,
связанные с белками плазмы крови, не оказывают
фармакологического эффекта, так как не покидают кровеносное русло.
При внутривенном введении лекарственные средства
поступают непосредственно в кровоток и быстро распределяются по
органам и тканям. Скорость элиминации лекарственных
веществ можно определить путем повторного измерения их
концентрации в плазме крови (верхний график в правой части
рисунка). Снижение концентрации лекарственных веществ в
плазме крови часто происходит вначале быстро, а затем
прогрессивно замедляется (по экспоненциальному закону). В этом
случае интенсивность элиминации лекарств обычно
пропорциональна их концентрации в плазме крови. По
экспоненциальной кривой можно в любой период времени определить
количество выведенного из организма лекарственного
вещества. Основными механизмами элиминации лекарств являются:
1) экскреция с мочой в результате фильтрации в клубочках
почек (в правой части рисунка, \ГГА)\
2) разрушение лекарственных веществ в организме (обычно
в печени);
3) экскреция с желчью (показано в нижней части рисунка в
виде жирной линии).
При процессах первого порядка скорость элиминации
лекарственных веществ зависит от их концентрации в плазме крови
в определенный период времени. Элиминация большинства
лекарств происходит согласно кинетике первого порядка. При
угнетении активности ферментных систем организма,
ответственных за метаболизм лекарственных веществ, элиминация лекарств
осуществляется согласно кинетике нулевого порядка. При
процессах нулевого порядка скорость элиминации лекарственных
веществ постоянна и не изменяется при увеличении их
концентрации в плазме крови (например, этанол, дифенин).
12
Внутриклеточная
жидкость
' Иитерсици- '
альная жидкость
Воротная
вена
Лекарство,
связанное с белками ,
плазмы ~щА
Первый
порядок
Точечные
канальцы
Время (t)
желчный проток
Метаболизм
первого
прохождения
Многие неиони-
зированные
вещества
реабсорби-
i руются
'Большинство С
ионизирован- ?
ных веществ ~
экскретируется
Моча
Почечный
клубочек
Пути введения лекарств
Различают энтеральный (через желудочно-кишечный тракт)
и парентеральный (минуя желудочно-кишечный тракт) пути
введения лекарств в организм.
Многие лекарственные вещества хорошо всасываются из
кишечника, поэтому в клинической практике наиболее часто
используют их пероральное применение. Однако некоторые
лекарственные средства (например, бензилпенициллин, инсулин)
разрушаются в кислой среде желудка или ферментами в
кишечнике, поэтому их можно вводить только парентерально.
При внутривенном введении лекарственные вещества
поступают непосредственно в кровоток, минуя абсорбционные
барьеры. Этот путь введения используют:
- при необходимости достижения быстрого эффекта
(например, внутривенное введение фуросемида при отеке легких);
- для длительного введения лекарственных средств
(внутривенно кагтельно);
- для введения больших объемов лекарств;
- для введения лекарственных средств, которые могут
вызвать местное повреждение тканей, если вводятся другим
способом (например, цитостатические средства).
Внутримышечное и подкожное введение. Лекарственные
вещества из водных растворов при внутримышечном и
подкожном введении обычно всасываются достаточно быстро, тогда
как их эфиры абсорбируются гораздо медленнее, что
используют для удлинения действия лекарств (например, нейролептики
пролонгированного действия; см. главу 27).
Другие пути введения лекарств. Лекарства можно применять
также ингаляционно (например, средства для ингаляционного
наркоза; некоторые противоастматическис средства) и местно
(например, в виде мази). Лекарства, введенные сублингвально
или ректально, не попадают в систему воротной вены и
печень, поэтому под язык наиболее рационально вводить
лекарственные вещества, которые значительно разрушаются в
процессе метаболизма первого прохождения.
Распределение и экскреция
После поступления лекарственных веществ в кровоток
начинается их распределение в организме. Для того чтобы
оказать биологический эффект, лекарственные вещества должны
попасть в ткани.
U/i (период полуэлиминации) — это время, в течение
которого концентрация лекарственного вещества в плазме крови
снижается на 50% от исходного уровня (в правой части
рисунка на верхнем графике). С помощью (\/2 можно вычислить
константу скорости элиминации (К&) по формуле:
'l/2
Константа скорости элиминации — это часть
лекарственного вещества, которая должна элиминировать за единицу
времени (например, при А^| = 0,02 в мин1 за 1 минуту должно
элиминировать 2% лекарственного вещества).
Экспоненциальная кривая зависимости концентрации
лекарственного вещества в плазме крови (Ср) от времени (/)
может быть рассчитана по формуле:
где Q — первоначальная концентрация лекарственного
вещества в плазме крови. Посредством логарифмирования
экспоненциальная кривая может быть преобразована в более
удобную прямолинейную зависимость, по которой легко
определить показатели Q и t\/2.
Объём распределения (VD) — это предполагаемый объём, в
котором распределено лекарственное вещество. При
внутривенном введении лекарств объем распределения определяется
по формуле:
г, доза
Если объём распределения лекарственного вещества менее
5 литров (KD < 5), считают, что лекарственное вещество
находится в сосудистом русле, при VD< 15 — во внеклеточной
жидкости, а при VD > 15 литров — лекарство распределено во всей
водной фазе или сконцентрировалось в определённых тканях.
Значение объёма распределения можно использовать для
расчета клиренса лекарственного вещества.
Клиренс является важным понятием фармакокинетики. Это
объём крови или плазмы, очищающийся от лекарственного
вещества за единицу времени. Общий (системный, плазмы
крови) клиренс лекарственных веществ (С/р) определяется по
формуле:
C/p=KD*el.
Скорость элиминации лекарственных веществ равна CipxCp.
Общий клиренс является суммой клиренсов различных тканей
и органов, участвующих в элиминации лекарств. Таким
образом, С/р = С/т (клиренс вследствие метаболизма лекарств) +
С/г (почечный клиренс лекарств). Именно значение клиренса
лекарственных веществ, а не периода полуэлиминации (/1/2)
отражает способность печени и почек экскретировать
лекарственное вещество.
Дозирование лекарств. Знание значения клиренса
лекарственного вещества позволяет правильно его дозировать.
Желательно, чтобы в процессе фармакотерапии равновесная
концентрация лекарственного вещества в плазме крови (Ср^) сохранялась
в терапевтических пределах. Для сохранения равновесной
концентрации лекарственного вещества в плазме крови
необходимо, чтобы количество вводимого лекарственного вещества было
равно количеству вещества, выделяемого из организма. Таким
образом, поддерживающая доза лекарственного вещества при
его внутривенном введении (когда известно количество
вещества, поступающего в кровоток) равна С/рхС^. Для перораль-
ного применения лекарств этот показатель рассчитывается
следующим образом:
/Гхдоза = С/р хСр
интервал между введениями
где F— биодоступность лекарственного вещества. Для
предупреждения создания токсического или, напротив,
неэффективного уровня лекарственных веществ в крови при определении
интервалов между введениями лекарств необходимо учитывать
значение периода их полуэлиминации.
Биодоступностъ — это соотношение между дозой введенного
в организм лекарственного вещества и его количеством,
поступившим в кровоток. При внутривенном введении
лекарственных веществ их биодоступность составляет 100% (F= !).
Биодоступность лекарственных веществ при их пероральном
применении индивидуальна для каждого пациента и варьирует для
различных препаратов. Вещества, подвергающиеся
значительным метаболическим превращениям при первом прохождении
печени, при пероральном применении могут не оказывать
эффекта (например, нитроглицерин, лидокаин).
Экскреция
Основная часть лекарственных веществ выводится из
организма путем почечной экскреции. Липофильныс
лекарственные вещества после фильтрации в клубочках почек могут реаб-
сорбироваться в почечных канальцах путём пассивной
диффузии. В процессе метаболизма лекарственных веществ в
организме образуются гидрофильные метаболиты, что
способствует их выведению почками (см. главу 4).
Ионизация слабых кислот и оснований зависит от рН мочи,
поэтому для повышения почечной экскреции некоторых
лекарственных веществ можно изменять рН мочи. Так,
например, применение бикарбонатов вызывает сдвиг рН мочи в
щелочную сторону, что приводит к усилению почечной
экскреции аспирина, так как способствует ионизации и снижению
степени липофильности препарата.
В проксимальных канальцах почек активно секретируются
слабые кислоты и основания. Таким путём из организма
выводятся, например, пенициллины.
Экскреция лекарственных веществ с желчью. Некоторые
лекарственные вещества (например, стильбэстрол),
накапливаясь в печени, выводятся с жёлчью в кишечник, где могут
повторно всасываться в кровь, т.е. совершать в организме кишеч-
но-печеночную циркуляцию. Кишечно-печеночная циркуляция
лекарств способствует увеличению продолжительности их
нахождения в организме.
13
4. Метаболизм лекарственных веществ в организме
Цитохром Р-450
зависимое окисление
АРОМАТИЧЕСКОЕ
ГИДРОКСИЛИРОВАНИЕ
Фенобарбитал
Пропранолол
Дифенин
Амфетамин
Варфарин
ОКИСЛИТЕЛЬНОЕ N-ДЕЗАЛ-
КИЛИРОВАНИЕ
Морфин
Р-450 НЕЗАВИСИМОЕ
ОКИСЛЕНИЕ
Адреналин
Индукция ферментов
Фармакогенетика
Иногда отмечается генетически
обусловленное снижение
активности ферментов
(например, медленное /
ацетилиррвание) /
Некоторые средства
усиливают синтез ферментов
(барбитураты)
Некоторые средства
ингибируют ферменты
(циметидин, этанол)
Усиление метаболизма
других лекарственных
средств
Варфарина
Пероральных
контрацептивов
Лекарство
(липофильное)
Восстановление
Преднизолон
Налоксон
Гидролиз
Новокаин
Аспирин
Лидокаин
Печень
Фаза
^Метаболиты
RNHCH
¦а"
RCH2NH2
ОН
RNH,
RCHO
RCR*
II
О
RCHR'
I
ОН
R1COOR2 -^R^OOH+RjOH
RCONHR1 -^RCOOH+R^Hj
Фаза II
Конъюгация
Конъюгация
с глюкуроновой
кислотой
с серной кислотой
с аминокислотами
(глицином)
с глутатионом
метилирование
ацетилирование
Угнетение метаболизма
лекарственных средств
(например, варфарина)
Метаболиты
(гидрофильные)
Почечная экскреция
Метаболизм первого прохождения
При пероральном применении все
лекарства до поступления в системный кровоток проходят через печень
Некоторые лекарства при пероральном применении
не активны (лидокаин, нитроглицерин)
Метаболизм лекарственных веществ в организме приводит
к следующим последствиям:
1) лекарственные вещества становятся гидрофильными, что
ускоряет их выведение из организма через почки (показано в
правой части рисунка), так как при этом снижается их реаб-
сорбция в почечных канальцах;
2) образующиеся метаболиты лекарственных веществ
обычно обладают меньшей активностью, чем сами лекарства. Иногда
метаболиты лекарственных веществ более активны, чем
первоначальные средства. Например, диазепам (транквилизатор) ме-
таболизируется в активные метаболиты нордиазепам и оксазе-
пам. Про-лекарства сами не активны, но в организме в
процессе метаболизма превращаются в активные вещества.
Например, противопаркинсоничсское средство леводопа (см. главу 26)
оказывает эффект, превращаясь в организме в дофамин, а ме-
тилдопа (гипотензивное средство; см. главу 15) действует, ме-
таболизируясь в а-метилнорадреналин.
Метаболизм лекарственных веществ в основном
осуществляется в печени. Выделяют два основных типа реакций
метаболизма лекарств в организме.
Реакции I фазы. В процессе этих реакций лекарственные
вещества переходят в более полярные и более водорастворимые
метаболиты, чем исходное лекарственное средство (в левой
части рисунка), за счет присоединения или освобождения
активных функциональных групп (например, —ОН, -NH2, -SH).
Основными реакциями I фазы являются реакции окисления.
Катализаторами этих реакций являются ферменты, называемые
оксидазами смешанного действия (цитохром Р-450).
Субстратная специфичность этих энзимов очень низка, поэтому они
окисляют различные лекарственные вещества (примеры
показаны в верхней части рисунка слева). К другим реакциям I фазы
относятся процессы восстановления (в левой части рисунка в
центре) и гидролиза (в нижней части рисунка слева).
Реакции II фазы. Лекарственные вещества и их метаболиты,
образующиеся в результате реакций I фазы, могут быть
недостаточно полярными и поэтому не могут экскретироваться
почками. В печени путем конъюгации с различными эндогенными
веществами они превращаются в гидрофильные соединения (в
центре рисунка).
Повторное применение некоторых лекарственных средств (в
верхней части рисунка) приводит к повышению скорости
синтеза цитохрома Р-450 (индукция ферментов). Это способствует
усилению метаболизма лекарственных и других веществ,
разрушающихся этими ферментами (в верхней части рисунка
справа). С другой стороны, некоторые лекарственные средства,
напротив, ингибируют микросомальные ферменты (в верхней
части рисунка), усиливая действие других веществ, инактивиру-
ющихся этими энзимами (в верхней части рисунка справа).
Следует отметить, что интенсивность метаболизма
лекарственных веществ зависит также от генетических особенностей
организма (фармакогенетика), возраста и некоторых
заболеваний — особенно тех, при которых отмечается нарушение
функции печени.
14
Полярность лекарственных веществ
Некоторые лекарственные вещества (например, галл амин;
см. главу 6) являются высоко полярными соединениями,
поэтому при физиологических значениях рН они бывают
полностью ионизированными. Такие лекарственные средства слабо
или совсем не метаболизируются в организме, их
продолжительность действия зависит в основном от скорости экскреции
почками. Большинство лекарственных веществ являются ли-
пофильными и значительно связываются с белками плазмы
крови. Липофильные лекарственные средства, связанные с
белками плазмы крови, не фильтруются в клубочках почек, а их
свободная (не связанная с белками) часть может реабсорбиро-
ваться из почечных канальцев в кровь, поэтому такие
лекарства могут оказывать продолжительное действие, если их
выведение из организма зависит только от скорости почечной
экскреции. В целом лекарственные вещества в процессе
метаболизма становятся более полярными (гидрофильными),
поэтому легче выводятся из организма почками.
Метаболизм лекарств в печени
Метаболизм лекарственных веществ в основном
осуществляется в печени, в меньшей степени в других внутренних
органах (например, в желудочно-кишечном тракте, лёгких, почках).
Лекарственные средства, введенные перорально, абсорбируясь
из тонкого кишечника, поступают в систему воротной вены и в
печень, где они могут метаболизироваться (например, морфин,
пропанолол). Этот процесс называется «метаболизмом первого
прохождения». Метаболизм первого прохождения может
осуществляться не только в печени, но и в других внутренних
органах. Например, аминазин сильнее метаболизируется в
кишечнике, чем в печени.
Реакции I фазы
Реакции 1 фазы представлены преимущественно реакциями
окисления, а также восстановления и гидролиза.
Микросомалъные оксидазы смешанной функции. В метаболизме
лекарственных веществ принимает участие большое количество
различных ферментов, локализованных в микросомах
(везикулах) эндоплазм этического ретикулума, образующихся при
гомогенизации тканей. Из гомогенатов тканей микросомы могут
быть выделены с помощью дифференциального
центрифугирования.
В микросомальном окислении лекарственных веществ
участвуют никотинамидадениндинуклеотид фосфат (НАДФ),
молекулярный кислород и два ключевых фермента: (I) флавопро-
теин — НАДФ-цитохром-Р-450-редуктаза; и (II) гемопротеин —
цитохром Р-450. Известно большое число изоформ (изоэнзи-
мов) цитохрома Р-450 с различной, но часто совпадающей
субстратной специфичностью.
Реакции II фазы
Реакции II фазы обычно протекают в печени, к ним
относятся процессы конъюгации лекарственных веществ или их
метаболитов, образующихся в результате реакций I фазы с
эндогенными веществами. Образующиеся конъюгаты обычно
менее активны, чем исходное вещество. Эти соединения
обладают высокой полярностью, поэтому хорошо экскретируются
почками.
Факторы, влияющие на метаболизм
лекарственных веществ в организме
Индукция ферментов. Некоторые лекарственные средства
(например, фенобарбитал, карбамазепин, этанол и особенно рифам-
пиит) и полютанты (например, полициклические углеводороды
табачного дыма) вызывают индукцию (повышение
активности) микросомальных ферментов, участвующих в метаболизме
лекарств. Механизм этого явления не совсем ясен. Известно,
что некоторые вещества влияют на специфические участки ДНК,
активируя синтез соответствующих ферментов (обычно изоэн-
зимов цитохрома Р-450). Лекарственные средства индуцируют
не только микросомальные ферменты, но и ферменты другой
локализации. Так, например, возможна лекарственная
индукция алкогольдегидрогенезы, которая локализуется в
цитоплазме клеток печени.
Угнетение активности ферментов. При снижении активности
ферментов, инактивирующих лекарственные вещества, возможно
развитие побочных эффектов, связанных с длительной
циркуляцией этих соединений в организме. Лекарственные средства
угнетают различные изоэнзимные формы цитохрома Р-450 и
поэтому нарушают метаболизм только тех веществ, которые
разрушаются этими ферментами. Так, например, циметидин
замедляет метаболизм таких потенциально токсичных
лекарственных средств, как теофиллин, варфарин и фенитоин.
Эритромицин, ингибируя систему цитохрома Р-450, повышает активность
теофиллина, варфарина, карбамазепина и дигоксина.
Генный полиморфизм. Влияние генетических факторов на
действие лекарственных веществ в организме изучает фармакоге-
нетика. Ответные реакции организма на введение лекарств
носят индивидуальный характер и подчиняются Гауссовому
распределению. Эти факты свидетельствуют о том, что действие
лекарств в организме зависит от многих факторов. Возможны
различные ответные реакции организма на введение
лекарственных средств. Всё население по ответной реакции на введение
некоторых лекарств может быть разделено на несколько групп,
что предполагает существование генного полиморфизма.
Примером генного полиморфизма является гидроксилирование
производных хинина. В среднем около 8% населения являются
слабыми гидроксиляторами, поэтому лекарственные вещества,
подвергающиеся гидроксилированию в печени (например, пропра-
нолол и метопролол; см. главу 15), в организме таких
пациентов действуют более продолжительно.
Ацетилирование лекарственных веществ. Существует
генетический полиморфизм N-ацетилтрансферазы печени. Так,
известно, что около 50% населения быстро ацетилируют изониазид
(противотуберкулезное средство), тогда как другие —
медленно. Способность медленно инактивировать изониазид связана
с уменьшением активности печеночной N-ацетилтрансферазы,
что наследуется по аутосомно-рецессивному типу. Улиц с
медленной инактивацией изониазида (медленных ацетиляторов)
чаще наблюдается кумуляция этого препарата в организме и
усиление выраженности его побочных эффектов. Имеются
сведения о полиморфизме ацетилирования и других
лекарственных средств (например, гидралазина, новокаинамида).
Псевдохолинэстераза плазмы крови. Этот фермент
кодируется четырьмя генами. Относительно редко A случай на 2500)
отмечается атипичная форма псевдохолинэстеразы, что
способствует повышению активности и удлинению действия (от 6
минут до 2 часов или более) дитилина (часто применяемый
миорелаксант).
Возраст. Интенсивность метаболизма лекарств зависит от
возраста. Так, например, у новорождённых, особенно
недоношенных, элиминация лекарств существенно замедлена, так как у
них снижены активность микросомальных энзимов печени и
почечная экскреция. Однако уже в течение первых четырех
недель жизни наблюдается быстрое их развитие. В связи с тем,
что имеются возрастные особенности действия лекарств в
организме, существуют различные способы расчета доз
лекарственных веществ для детей различного возраста (см. Британский
национальный формуляр).
У людей пожилого возраста отмечается замедление
метаболизма лекарственных веществ в печени и снижение
экскреторной функции почек (что является более важным). К 65 годам
интенсивность гломерулярной фильтрации уменьшается на 30%,
а в каждый последующий год снижается еще на 1-2% (из-за
уменьшения почечного кровотока и снижения числа клеток).
Поэтому пациентам пожилого возраста необходимо снижать
дозы лекарственных веществ, особенно средств центрального
действия (например, опиоидов, бензодиазепинов,
антидепрессантов), к действию которых они наиболее чувствительны (за
счет возрастных изменений в головном мозге).
Метаболизм лекарственных веществ и их токсичность
Метаболиты лекарственных веществ могут оказывать
токсическое действие на различные органы, в том числе на печень.
Так, например, парацетамол (широко используемый слабый
анальгетик-антипиретик) обычно подвергается в печени глю-
куронизации и сульфатации. Однако при использовании
препарата в высоких дозах процессы его глюкуронизации и
сульфатации нарушаются, и он начинает конъюгировать с глюта-
тионом. При истощении запасов глютатиона в организме
может отмечаться опасная для жизни гепатотоксическая
кумуляция препарата (см. главу 44).
15
5. Местные анестетики
1 Местные анестетики!
АМИДЫ
Лидокаин
Тримекаин
Бупивакаин
ЭФИРЫ
Кокаин
Анестезин
Дикаин
Новокаин 9*'Ф
\
Ч
Ч
рК,
7.9
^7,9
8,1 1
^ 1
, -e.fi
8,9
Строение
Влияние рН
Мембрана аксона
Снаружи
Закрытый
Na -канал
(покой)
Открытый
Na -канал
Аксон
-70 мВ
Внутри
Закрытый канал
(инактивирование)
-50 MB I . _20 мВ
Быстрая
деполяризация
Порог ПД
Потенциал действия
Большинство местных анестетиков — слабые
основания, которые могут существовать в
ионизированной (протонной) форме
В+Н* » ВН*
Соотношение между этими двумя формами
определяется по формуле:
ВН*
log -— *рК,-рН
в например: 8,4-7,4=1
Следовательно, преобладает иониэиро-
| ванная форма A0:1)
Порог ПД не достигнут
При остаточном
потенциале
канал становится
инактивированным
Снаружи
Местные анестетики (в верхней части рисунка слева) — это
средства, вызывающие местную потерю чувствительности
тканей, блокируя проведение импульсов в нервных волокнах. В
первую очередь они устраняют чувство боли. Большинство
местных анестетиков являются слабыми основаниями и при
рН=7,4 находятся в основном в ионизированной (протонной)
форме (в нижней части рисунка слева). Местные анестетики
проникают в нервы в неионизированной (липофильной)
форме, но внутри аксона могут превращаться в ионизированные
молекулы. Проникая в аксон, они блокируют Na+-каналы,
препятствуя генерации потенциала действия (в нижней части
рисунка).
К местным анестетикам чувствительны все нервные
волокна, хотя, как правило, мелкие нервные волокна более
чувствительны, чем крупные. Благодаря этому происходит
последовательное выключение различных видов чувствительности
тканей: в первую очередь выключается болевая чувствительность,
затем температурная, в последнюю очередь — тактильная. При
использовании местных анестетиков в высоких дозах
блокируются и двигательные нервные волокна. Местные анестетики
различаются по силе и продолжительности действия,
токсичности, способности всасываться через слизистые оболочки.
Наряду с местноанестезирующим действием препараты этой
группы могут оказывать целый ряд резорбтивных эффектов.
Так, например, местные анестетики обладают кардиодепрес-
сивным действием, оказывают существенное влияние на ЦНС.
Синтетические вещества вызывают седативный эффект, хотя
иногда могут возникать волнение и беспокойство, возможно,
из-за угнетения центральных тормозных синапсов. В высоких
дозах местные анестетики могут вызывать диплопию и другие
нарушения зрения, в токсических дозах — судороги и кому;
результатом их тормозного воздействия на уровне
продолговатого мозга является угнетение дыхания и сердечной
деятельности. Кокаин оказывает преимущественно стимулирующее
влияние на ЦНС, но при использовании препарата в высоких
дозах возбуждение ЦНС сменяется её угнетением. При
отравлении кокаином смерть наступает от угнетения дыхательного
центра.
Одним из наиболее широко используемых местных
анестетиков является лидокднн (лигнокаин). Препарат эффективен
при всех видах местной анестезии, действие его развивается
быстро и продолжается около 90 минут. Сходным с л идо
каином действием обладает прилокаин, но он является менее
активным и менее токсичным, так как более интенсивно метабо-
лизируется в организме. Препаратом длительного действия
является бупивакаин. Его эффект проявляется в среднем через 30
минут после введения и продолжается до 8 часов. Бупивакаин
часто используют для эпидуральной анестезии для
обезболивания родов. Анестезин (бензокаин) плохо растворим в воде,
поэтому используется только для поверхностной анестезии
невоспаленных тканей (например, слизистой ротовой полости и
глотки). Более токсичные препараты, дикаин (аметокаин) и
кокаин, имеют ограниченное применение. Кокаин первоначально
использовался для поверхностной анестезии, когда
желательным было его сосудосуживающее действие (например, на
слизистой носа). Глазные капли с дикаином используют в
офтальмологии для анестезии роговицы, однако и в этом случае
предпочтение отдается менее токсичным местным анестетикам ок-
сибупрокаину и проксиметакаину, так как они оказывают мень-
, шее раздражающее действие.
При использовании местных анестетиков возможно
появление аллергических реакций, которые наиболее часто
отмечаются в ответ на введение новокаина (прокаина) и других эфи-
ров парааминобензойной кислоты.
16
Местные
анестетики
Большинство анестетиков
Дикаин
"рецептор"
Лекарство прочно
связывается
в инактивированном
канале
h-воротау
закрыты/
m-ворота
п-ворота
h- ворота
m- ворота
Натриевые каналы
В мембранах нервных волокон имеются специфические
Na+-каналы, которые состоят из а-субъединицы (большого
гликопротеина) и двух меньших р-субъединиц (гликопротеи-
нов). а-субъединица имеет четыре идентичных домена,
каждый из которых состоит из шести покрытых мембранами а-спи-
ралей (S1-S6). 24 цилиндрические спирали, располагаясь ра-
диально внутри мембраны, формируют центральный канал.
Функция р-субъединиц не изучена. Как именно
функционируют Na^-каналы, неизвестно, но их проводимость (gNa+)
выражается следующим образом: gNa+ = gNa+ m3h, где gNa+ —
максимально возможная проводимость, a m и h — константы
проводимости, которые зависят от величины потенциала
мембраны. На рисунке эти константы показаны схематически как
физические ворота внутри канала. Во время потенциала покоя
большинство h-ворот открыто, а m-ворота закрыты (канал
закрыт). Медленная деполяризация вызывает открытие т-ворот
(канал открыт), но быстрая деполяризация во время генерации
потенциала действия вновь приводит к закрытию Na+-канала
(инактивация канала). Последовательность этих процессов
показана на рисунке (слева направо), h-ворота представлены
четырьмя позитивно заряженными S4 спиралями, которые
закрывают канал, продвигаясь к наружной части мембраны, в
ответ на ее деполяризацию. h-ворота (в период инактивации) могут
перекрестно связывать S3 и S5 спирали; эти процессы
протекают во внутренних устьях канала.
Потенциал действия
Если достаточное число Na+ -каналов открыто, то
количество входящих в аксон Na+ превышает количество выходящих
К+, что в дальнейшем приводит к деполяризации мембраны.
Это способствует еще большему открытию Na^-каналов, в
результате чего происходит дальнейшая деполяризация
мембраны, что приводит к открытию еще большего числа Na+-кана-
лов и так далее. Быстрый поток Na+ внутрь клетки вызывает
деполяризацию мембраны до равновесного Na+-потенциала
(около +67 т\Л. Затем инактивация Na+-каналов и
продолжающийся ток К* приводит к реполяризации мембраны. В
дальнейшем натриевый насос восстанавливает потерянные К+ и
удаляет избыточные Na+.
Механизм действия местных анестетиков
Местные анестетики проникают внутрь аксона в форме ли-
пофильных оснований. Внутри нервного волокна местные
анестетики переходят в ионизированную (протоновую) форму и
вызывают блок Na+-каналов в результате соединения с
«рецептором». Таким образом, четвертичные (полностью
ионизированные) местные анестетики действуют внутри нервного
волокна, а неионизированные соединения (например, анестезин)
растворяются в мембране, блокируя Na+-каналы полностью или
частично. Как ионизированные, так и неионизированные
молекулы местных анестетиков блокируют Na+-каналы,
предупреждая открытие h-ворот (т.е. вызывая инактивацию каналов).
В итоге инактивируется так много Ыа+-каналов, что число
открытых Ыа+-каналов падает ниже определенного минимума,
необходимого для достижения критического уровня
деполяризации, в результате потенциал действия не генерируется и
возникает нервный блок. Отмечено, что нервный блок
усиливается пропорционально усилению нервной стимуляции. Это
связано с тем, что большая часть молекул местных анестетиков (в
их ионизированной форме) входит в Na+-каналы при их
открытии, вызывая инактивацию большего числа этих каналов.
Химическая структура местных анестетиков
Местные анестетики состоят из липофильной (часто
ароматическое кольцо) и гидрофильной частей (обычно вторичный
или третичный амин), соединенных эфирной или амидной
связью.' По химической структуре местные анестетики
подразделяются на замещенные анилиды (амиды) и сложные эфиры.
Эффекты
местных анестетиков
Действие местных анестетиков может быть:
1) местным — включает блокаду нервных волокон, а также
прямое действие на гладкую мускулатуру сосудов;
2) региональным — заключается в потере чувствительности
тканей (болевой, температурной, осязательной и др.) и
изменении тонуса сосудов, находящихся в зоне действия
блокированного нерва;
3) общим (резорбтивным) — возникает вследствие
всасывания вещества в кровь или его внутривенного введения.
Местные анестетики могут оказывать влияние на сердце (этот
вопрос обсуждается в 17-й главе). В высоких дозах местные
анестетики могут оказывать кардиотоксическое действие.
Влияние разных местных анестетиков на гладкую
мускулатуру сосудов различно. Кокаин суживает сосуды, так как
оказывает симпатомиметическое действие, угнетая обратный нейро-
нальный захват норадреналина, тогда как новокаин расширяет
сосуды. Большинство амидов в малых концентрациях сосуды
суживают, а в более высоких — расширяют. Препараты этой
группы (прилокаин, лигаокаин и бупивакаин) в терапевтических
дозах на месте применения обычно суживают сосуды, тогда
как их региональными эффектами является вазодилятация,
возникающая вследствие блокады симпатических нервов.
Продолжительность действия. Сила и продолжительность
действия местных анестетиков в основном зависит от степени их
липофильности, так как липофильные соединения легко
проникают в клетку. Увеличению продолжительности
анестезирующего эффекта также способствует сужение сосудов, так как
при этом замедляется всасывание анестетиков в кровь.
Сужение сосудов достигается путём добавления к растворам
местных анестетиков сосудосуживающих средств — таких, как
адреналин, норадреналин или фелипрессин (вазоактивный
пептид). Сосудосуживающие средства нельзя использовать для
усиления действия местных анестетиков при обезболивании
пальцев рук и ног, так как они могут вызвать продолжительную
ишемию тканей и развитие гангрены.
Замещённые анилиды подвергаются дезалкилированию в
печени, а эфиры парааминобензойной кислоты гидролизуются
псевдохолинэстеразой плазмы крови. Скорость метаболизма
местных анестетиков практически не влияет на
продолжительность их действия в тканях.
Основные виды
местной анестезии
Поверхностная анестезия — анестетик наносят на раневую
поверхность или слизистые оболочки.
Инфильтрационная анестезия — раствором анестетика
последовательно пропитывают кожу и более глубокие ткани. Для
этого вида анестезии местные анестетики обычно используют
в сочетании с сосудосуживающими веществами.
Проводниковая анестезия — анестетик вводят по ходу нерва.
Существуют различные разновидности этого вида анестезии —
от внутрипульпарной до эпидуральной (анестетик вводят в
пространство над твердой оболочкой спинного мозга) и
спинномозговой (анестетик вводят субарахноидально).
Спинномозговую анестезию технически выполнить значительно легче, чем
эпидуральную, но зато после эпидуральной анестезии
отсутствует такое осложнение спинномозговой анестезии, как
головная боль.
Внутривенная региональная анестезия. Анестетик вводится
внутривенно в обескровленную ветвь сосуда. Наложенный на
конечность жгут не позволяет лекарству поступить в
системный кровоток.
17
6. Лекарственные средства,
действующие на нервно-мышечную передачу
Халинергическое нервное окончание
Вещества,
уцитынвницие
высвобождение
ацетилхолиие
Гвмихолиний
Ботулиновый токсин
Аминогликозиды
2+ 2+
Мд , Со
Куререлодобиые
средстве
НЕДЕПОЛЯРИЗУЮЩИЕ
(конкурентные)
Тубокурарин
Галламин
Панкуроний
Векуроний
Атракурий
Рокуроний
Средства,
улучшающие
иараио-мышечиую
парадачу
АНТИХОЛИНЭСТЕРАЗНЫЕ
СРЕДСТВА
Пирщостигмин
Прозерин
Эдрофоний
Дистигмин
Физостигмин
Постсинаптическая
мембрана концевой
пластинки
Внутриклеточное повышение [Na ] —«-деполяризация
(потенциал концевой пластинки)
Под влиянием нервного импульса происходит
деполяризация мембран нервных окончаний мотонейронов, что приводит
к увеличению тока Са2+ в клетку, который в свою очередь
способствует высвобождению ацетилхолнна путем экзоцитоза (в
верхней части рисунка). Ацетилхолин диффундирует в
синаптическую щель и связывается с н-холннорецепторами концевых
пластинок мышечных клеток. Обратимая связь ацетилхолнна с
рецепторами (в нижней части рисунка) приводит к открытию
катионных каналов концевой пластинки, вызывая ток Na* и в
меньшей степени К*. Возникающая деполяризация
(локальный синаптический потенциал) распространяется по всей
мембране клетки, а достигнув определенной величины, приводит к
генерации потенциала действия и мышечному сокращению.
Ацстилхолин отскакивает от рецепторов в синаптическую щель
и быстро гидролизуется ацетилхолинэстеразой, которая
находится в постсинаптической мембране вблизи рецепторов.
Нервно-мышечная передача может быть усилена введением
антихолинэстеразиых средств (ингибиторов холннэстеразы) (в
нижней части рисунка слева), которые ингибируют аиетилхо-
линэстеразу и уменьшают гидролиз ацетилхолнна в синапти-
ческой щели (см. главу 8). Прозерин (неостигмин) и пиридос-
тигмин используют для лечения миастении и устранения мио-
релаксации после хирургического вмешательства. Передозировка
антихолинэстеразиых средств приводит к накоплению избытка
ацетилхолнна, что вызывает стойкую деполяризацию
постсинаптической мембраны. Антихолинэстеразные средства
потенцируют также влияние ацетилхолнна на мускариночувствитель-
ные рецепторы (м-холинорецепторы), но эти эффекты
блокируются м-холиноблокатором атропином (см. главу 7).
Курареподобные средства (средства, вызывающие
нервно-мышечный блок; миорелаксанты периферического действия;
справа) используют в анестезиологии для расслабления скелетной
мускулатуры во время хирургических операций, а также для
предупреждения мышечных сокращений во время
электросудорожной терапии (ЭСТ). Большинство применяемых в
медицине миорелаксантов конкурируют с ацетилхолином за
рецепторы, но не вызывают открытия ионных каналов. Эти
«конкурентные» препараты уменьшают деполяризацию
постсинаптической мембраны, вызываемую ацетилхолином, до уровня ниже
порога потенциала действия и тем самым приводят к
обратимому параличу мышц. Деполяризующие миорелаксанты также
действуют на холинорецепторы нервно-мышечного синапса, но,
напротив, вызывают открытие ионных каналов. Их действие
не устраняется введением антихолинэстеразиых средств. Такой
эффект оказывает дитилин (суксаметоний) — единственное
лекарство этого типа, используемое в клинике.
Некоторые лекарственные средства (в верхней части
рисунка слева) блокируют нервно-мышечную передачу, действуя прс-
синаптически, угнетая высвобождение ацетилхолииа.
18
Потенциалы действия
Ацетил КоА + холин
Ацетилхолин-
трансфераза
Ацх
Процесс обратного
захвата
\ холима
ДЕПОЛЯРИЗИРУЮЩИЕ
Дитилин
Закрытый канал
Медленная
диссоциация
Везикулы
Поток Са
Усиление
экзоцитоза
Синаптическая щель
Ацх связывается с
А а-субъединицвми
Холин
+
Уксусная
кислота
Ацетилхолин синтезируется в нервных окончаниях из холи-
на и ацетил-коэнзима А (ацетил-КоА) при участии энзима
ацетил холи нтрансферазы (хол и н ацетил азы). Холин захватывается
нервными окончаниями из экстрацеллюлярной жидкости с
помощью специального хол и ново го переносчика,
локализованного на концевой мембране.
Экзоцнтоз. Ацетилхолин накапливается в нервных
окончаниях в цитоплазме и в синаптических везикулах (каждая
везикула содержит около 1000-3000 молекул ацетилхолина). Когда
потенциал действия достигает нервных окончаний, в них
входит Са , вызывающий продвижение везикул к внешней
мембране. При этом в течение I миллисекунды из везикул
высвобождается несколько сот «квантов» ацетилхолина. Этот
процесс, называемый «квантовым высвобождением ацетилхолина»,
чувствителен к изменению внеклеточной концентрации Са2\
Двухвалентные ионы Mg2+, Co2* и Мп2+, являясь
антагонистами Са2+, угнетают передачу возбуждения в холинергическом
синапсе.
Холинорецепторы нервно-мышечных синапсов могут
активироваться никотином, и поэтому называются «никотиночувстви-
тельными» (н-холинорецепторами). Н-холинорецептор нервно-
мышечных синапсов состоит из четырех различных белковых
субъединиц ф, у, 5 и двух а), располагающихся в мембране
таким образом, что они окружают ионный канал, через
который проходят катионы (в основном Na+). Молекулы
ацетилхолина связываются с двумя а-субъединицами, вызывая их кон-
формаиионные изменения, в результате чего происходит
открытие канала на 1 миллисекунду.
Миастения — это аутоиммунное заболевание, при котором
нарушается нервно-мышечная передача, так как
циркулирующие антитела (IgG) приводят к уменьшению числа
функционирующих холинорецепторов в скелетной мускулатуре.
Основными средствами для лечения миастении являются
ингибиторы холинэстсразы, которые увеличивают содержание
ацетилхолина в сииаптической щели. Иммунологическое лечение
заболевания включает назначение иммунодепрессантов предни-
золона и азатиоприна (см. главу 43). Улучшить мышечную
активность при миастении может плазмафереэ, при котором из
организма удаляется часть плазмы крови, в результате чего
снижается уровень циркулирующих иммунных комплексов в
крови. При миастении может быть показана и тимэктомия
(удаление вил очковой железы).
Лекарственные средства пресинаптического действия
Лекарственные средства, угнетающие высвобождение
ацетилхолина. Ботулиновый токсин, продуцируемый анаэробной
бациллой Clostridium botulinum (см. главу 37), является
чрезвычайно сильным экзотоксином, способным угнетать
высвобождение ацетилхолина из пресинаптической мембраны. Механизм
этого действия остаётся неизвестным. С. botulinum являются
причиной серьезных пищевых отравлений, которые
сопровождаются развитием мышечного паралича. Ботулиновый токсин типа
А используют при лечении некоторых видов дистоний —
таких, как блефароспазм и стробизм. При этих заболеваниях
малые дозы токсина вводят в соответствующую мышцу, чтобы
вызвать ее паралич, продолжающийся около 12 недель. Нервно-
мышечную блокаду могут вызвать аминогликозидные
антибиотики (например, гентамицин), так как они тормозят ток Са2+,
необходимый для экзоцитоза. Этот нежелательный эффект ами-
ногликозидов обычно развивается при их комбинированном
применении с другими средствами, нарушающими нервно-
мышечную передачу. Применение аминогликозидов может
ухудшать течение миастении.
Курареподобные средства недеполяриэующего
(конкурентного) действия
Миорелаксанты недеполяриэующего действия обычно имеют
громоздкую молекулу, и большинство из них содержат 2 атома
четвертичного азота (два катионных центра). Препараты этой
группы, связываясь с н-холинорецепторами концевой пластинки,
препятствуют деполяризующему действию ацетилхолина.
Миорелаксанты вводят внутривенно. Они не проникают через ге-
матоэниефалический барьер и плаценту. Выбор миорелаксанта
часто зависит от его побочных эффектов, которые включают
либерацию гистамина, м-холиноблокирующее, ганглиоблоки-
рующее и симпатомиметическое действие. Скорость
появления и продолжительность нервно-мышечного блока зависят от
дозы миорелаксанта и других факторов (например, от
применения энфлурана, потенцирующего действие миорелаксантов
этого типа, или первоначального использования дитилина).
Тубокурарнн был введен в клиническую практику в 1942 г.
Он оказывает относительно продолжительное миорелаксирую-
щее действие C0-60 минут). Тубокурарин блокирует ганглии,
вызывая гипотензию, а также стимулирует высвобождение
гистамина у некоторых пациентов, что также может
способствовать снижению артериального давления.
Галламин может вызвать нежелательную тахикардию за счёт
блокады м2-холинорецепторов (подтип холинорецепторов,
которые преобладают в миокарде). Препарат не обладает гангли-
облокирующим действием и не вызывает либерацию гистамина.
Паккуроиий — это стероидный препарат, обладающий
достаточно продолжительным миорелаксирующим действием. Он
не оказывает ганглиоблокирующего действия и не вызывает
высвобождение гистамина. Однако он оказывает дозозависимое ат-
ропимоподобное влияние на сердце, что проявляется в
развитии тахикардии.
Векуроний и атракурий — это часто используемые недеполя-
ризующие курарелодобные средства. Продолжительность мио-
релаксирующего действия векурония зависит от скорости его
инактивации в печени и составляет в среднем 20-30 минут.
Препарат не обладает кардиоваскулярными эффектами. Его
используют преимущественно при коротких оперативных
вмешательствах. Атракурий действует 15-30 минут. Этот препарат
стабилен только при низких температурах и рН. При
нормальных значениях рН и температуры тела препарат спонтанно
инактивируется в плазме крови, поэтому его элиминация не
зависит от выделительной функции печени и почек. Это
препарат выбора для пациентов с нарушениями функции этих
органов. Атракурий может вызвать высвобождение гистамина, что
проявляется гиперемией кожных покровов и артериальной ги-
потензией.
Рокуроний — это новый иедеполяризующий миорелаксант с
продолжительностью миорелаксирующего эффекта около 30
минут. Его действие характеризуется быстрым началом миоре-
лаксации (через 1—2 мин), что сходно с эффектом дитилина.
Препарат не вызывает кардиоваскулярных эффектов.
Курарелодобные средства деполяризующего действия
Дитилин (суксаметоний, сукцинил-холин) используют в
основном из-за его быстрого и очень короткого
миорелаксирующего действия C-7 минут). В норме препарат быстро гидроли-
зуется в плазме крови псевдохолинэстеразой. У пациентов с
генетически обусловленной атипичностью этого фермента ми-
орелаксирующее действие дитилина может продолжаться в
течение нескольких часов. Дитилин вызывает стойкую
деполяризацию концевой пластинки и не разъединяется быстро с
рецепторами, тем самым вызывая продолжительную активацию
рецептора. В период первоначальной нестойкой
деполяризации концевой пластинки возникает кратковременное
напряжение мышечных волокон, что сопровождается
фибриллярными подергиваниями мышц. Нервно-мышечный блок
возникает в результате: (I) инактивации потенциал зависимых Ыа+-ка-
налов в мембранах мышечных волокон, что препятствует
генерации потенциалов действия; (II) трансформации
активированных рецепторов в неактивное состояние, при котором они
не восприимчивы к ацетилхолину. Одним из основных
побочных эффектов дитилина является мышечная боль,
появляющаяся на следующий день после применения препарата и
связанная с повреждением мышечных волокон во время их
фибриллярных подёргиваний, а также с высвобождением К+ из
клеток. При повторном введении дитилина (без атропина) может
возникать брадикардия (м-холиномиметический эффект).
)9
7. Вегетативная нервная система
?,/Р2
а
а
а/р:
Симпатическая система
Высвобождение
Парасимпатическая система
Высвобождение
Эффекты
Постганглионарные
нейроны
Действие
на органы
Расширение
зрачка (мидриаэ)
Секреция слюны
Сужение
Расширение
Повышение силы
и частоты сердечных
сокращений
Расширение бронхов
Снижение моторики
и тонуса кишечника
Сокращение
сфинктеров ЖКТ
Гликогенолиз
Глюконеогенеэ
Сокращение капсулы*
Адреналин
Расслабление
Сокращение сфинктера
Повышение или
снижение тонуса
миометрия
(зависит от
гормонального статуса)
Эякуляция
Потоотделение
Пилоэрекция
Радиальная
мышца радужки(+)
Слюнные
железы(+)
Кровеносные
сосуды
Сердце(+)
Дыхательные
пути(-)
Кишечник(-)
Сфинктеры ЖКТ(+)
Печень(+>
Селезёнка(+).
Мозговое вещество
надпочечникое(+)
Мочевой пузырь(-)
Сфинктер(+)
Матка(+)
Семявыносящий
проток(+)
Семянные
пузырьки(-)
Потовые желеэы(+||
Пиломоторные
мышцы(+)
Преганглио-
иарные нейроны
(-) Сфинктеры ЖКТ
(+) Железы ЖКТ
(+) Поджелудочная
железа
(+) Мочевой
пузырь
(-) Сфинктер
(+) Прямая кишка
(+) Сокращение
венозных
сфинктеров
полового члена
Уменьшение силы и
частоты сердечных
сокращений
Сужение бронхов
Усиление секреции
желез бронхов
Повышение
моторики и тонуса
Расслабление
Повышение секреции
Усиление
экзокринной и
эндокринной функции
Мочеиспускание
Дефекация
Эрекция
2
Q.
Р
С
*
Q.
О
Z
X
с;
о
х
Преобладающие
адренорецепторы
(* не у человека)
Примечание:
(+) = усиление
(-) = угнетение
работы органов
В симпатической системе:
(+) для а-адренорецепторов
(-) для р-адренорецепторов
Функционирование различных систем организма человека
(например, пищеварительной, сердечно-сосудистой и др.)
контролируется вегетативной нервной (и эндокринной) системой.
Работа вегетативной нервной системы осуществляется по
принципу отрицательной обратной связи с участием множества
афферентных (чувствительных) нервных волокон, которые передают
информацию центрам в гипоталамусе и продолговатом мозге.
Эти центры контролируют работу вегетативной нервной
системы, которая анатомически подразделяется на два отдела:
симпатический (в левой части рисунка) и парасимпатический (в правой
части рисунка). Многие органы иннервируются обоими
отделами вегетативной нервной системы, которые в основном
оказывают противоположное воздействие. Влияние симпатической (в
левой части рисунка) и парасимпатической (в правой части
рисунка) стимуляции на различные органы показано во
внутренних столбцах, а результаты этого влияния — в боковых столбцах.
Симпатические нервы (в левой части рисунка) выходят из
тораколюмбальной области спинного мозга (Т|-Ьз). Их
синапсы расположены либо в паравертебральных, либо в преверте-
бральных ганглиях и нервных сплетениях, находящихся в
брюшной полости. Постганглионарные немислинизированные
нервные волокна (в левой части рисунка) иннервируют
большинство внутренних органов.
Из симпатических нервных окончаний высвобождается
медиатор норадреналин (в верхней части рисунка слева).
Инактивацаия этого медиатора происходит в основном путем
его обратного нейронального захвата. Некоторые преганглио-
нарные симпатические волокна непосредственно подходят к
мозговому слою надпочечников, который продуцирует и
высвобождает в кровоток адреналин. Норадреналин и адреналин
оказывают влияние на внутренние органы, стимулируя а-, рг
или р2-ядренорецепторы (в левой части рисунка).
Преганглионарные волокна (в правой части рисунка)
парасимпатической нервной системы выходят из центральной
нервной системы в составе черепно-мозговых нервов (особенно
III, VII, IX и X), а также третьего и четвертого сакральных
спинальных корешков. Преганглионарные волокна
парасимпатических нервов значительно длиннее, чем у симпатических
нервов, так как ганглии парасимпатических нервов часто
расположены в самих внутренних органах (в правой части рисунка).
20
Норадремалин
Ацетилхолин
Эффекты
Действие
на органы
(+) Слёзная
железа
(+) Круговая
мышца радужки
(+) Цилиарная
мышца
(+) Слюнные
железы
(-) Сердце
(+) Дыхательные
пути
(+) Кишечник
Усиление секреции
Сужение зрачка
(миоз)
Усиление
аккомодации
Секреция жидкой
слюны
Средний
мозг .
Продолговатый
. мозг л
Нервные окончания постганглионарных парасимпатических
волокон (в правой части рисунка) выделяют ацетнлхолин (в
верхней части рисунка справа), который воздействует на органы,
стимулируя мускариночувствительные рецепторы (м-холино-
рецепторы). Ацетнлхолин в синаптической щели инактивиру-
ется энзимом аиетилхолинэстеразой.
Адреналин воспроизводит большинство эффектов
симпатической нервной системы, то есть он является симпатомимети-
ком (см. главу 9). Эллиот в 1904 г. высказал предположение,
что адреналин — это медиатор симпатической анервной
системы, но Дейл в 1910 г. показал, что основным медиатором этой
системы является норадреналин,
Эффекты возбуждения симпатической нервной системы. Эти
эффекты наиболее ярко проявляются при развитии «реакции
страха или бегства». Среди возбуждающих и тормозных
эффектов можно отметить следующие:
1) расширение зрачка (больше света достигает сетчатки);
2) расширение бронхов (способствует усилению легочной
вентиляции);
3) увеличение силы и частоты сердечных сокращений;
повышение артериального давления (больше крови требуется для
усиленной работы скелетной мускулатуры — бег!);
4) сужение сосудов кожи и внутренних органов и
расширение сосудов скелетной мускулатуры (необходимое
перераспределение крови в мышцы);
5) для снабжения организма дополнительной энергией
происходит стимуляция гликогенолиза и повышается уровень
глюкозы в крови. Тонус желудочно-кишечного тракта и мочевого
пузыря снижается.
Адренорецепторы подразделяются на два главных типа:
а-адренорецепторы, через которые опосредуются возбуждающие
эффекты катехоламинов, тогда как их тормозные эффекты в
основном связаны со стимуляцией $-адренорецепторов
(исключением являются а-адренорецепторы кишечника, стимуляция
которых приводит к уменьшению моторики и тонуса, и р-адре-
норецепторы сердца, активация которых усиливает работу
органа). Определить тип адренорсцепторов можно: (I) с помощью
фентоламина или пропранолола, которые селективно
блокируют соответственно только а- или р-адренорецепторы; (II) по
чувствительности различных тканей к адреналину (А), норад-
реналину (НА) и изадрину (изопреналину) (И). По силе
воздействия на а-адренорецепторы эти вещества можно
расположить в следующей последовательности: НА>А>И, на
р-адренорецепторы сильнее действует изадрин (т.е. И>>А>НА).
Р-адренорецепторы не однородны. Например, норадреналин
эффективно стимулирует р-адренорецепторы миокарда, но мало
или практически не действует на р-адренорецепторы сосудов.
Р-адренорецепторы в зависимости от их чувствительности к
различным лекарственным веществам подразделяют на два
подтипа: р] (в сердце, гладкой мускулатуре кишечника) и р2 (в
гладкой мускулатуре бронхов, сосудов и миометрия).
а-адренорецепторы также подразделяются на два подтипа в
зависимости от их локализации на постсинаптической (сц) или
пресинаптической (а2) мембране. Стимуляция пресинаптичес-
ких а2-адренорецепторов норадреналином, высвободившимся
из пресинаптической мембраны, снижает дальнейший выброс
медиатора (обратная отрицательная связь). Постсинаптическис
<х2-адренорецепторы встречаются в немногих тканях,
например, в головном мозге, гладкой мускулатуре сосудов (но и там
главным образом присутствуют агадрснорецепторы).
Ацетнлхолин — это медиатор, который высвобождается в
окончаниях:
1) всех преганглионарных волокон (симпатических и
парасимпатических);
2) всех постганглионарных парасимпатических волокон;
Все преганглионарные нервные волокна (симпатические и
парасимпатические) миелинизированы и в своих окончаниях
высвобождают ацетнлхолин, который вызывает деполяризацию
ганглионарных нейронов, активируя никотиночувствительные
рецепторы (н-холинорецепторы).
3) некоторых постганглионарных симпатических волокон
(терморегуляция секрецией потовых желез и расширение
сосудов скелетной мускулатуры);
4) нервов, иннервирующих мозговой слой надпочечников;
5) соматических нервов, иннервирующих скелетную
мускулатуру;
6) некоторых нейронов центральной нервной системы.
Холинорецепторы подразделяются на
никотиночувствительные (н-холинорецепторы) и мускариночувствительные (м-хо-
линорецепторы) — в основу этого деления положена
чувствительность холинорецепторов к мускарину или никотину.
М-холинорецепторы. Ацетнлхолин, высвобождающийся из
нервных окончаний постганглионарных парасимпатических
волокон, действует на м-холинорецепторы; эти эффекты могут
блокироваться атропином. Существуют три подтипа м-холино-
рецепторов: мь щ и мз. М|-холинорецепторы находятся в
клетках головного мозга и париетальных клетках желудка, м2-холи-
норецепторы локализованы в сердце, а мз-холинорецеиторы —
в гладкой мускулатуре и железах. За исключением лирензепина
(гастроцепина), который избирательно блокирует
М\-холинорецепторы (см. главу 12), применяемые в клинике агонисты и
антагонисты м-холинорецепторов либо слабо, либо совсем не
проявляют избирательности в отношении различных подтипов
этих рецепторов.
Н-холинорецепторы находятся в ганглиях (в том числе и
видоизмененных) и в мозговом слое надпочечников, эти
рецепторы могут быть селективно блокированы введением гексаме-
тония. Н-холинорецепторы в нервно-мышечных синапсах
скелетной мускулатуры не угнетаются гексаметонием, но
блокируются тубокурарином. Таким образом, н-холинорецепторы в
ганглиях и нервно-мышечных синапсах различны, хотя оба типа
этих рецепторов стимулируются никотином и поэтому
называются никотиночувствительными.
Эффекты ацетиАХОлина
Мускариноподобные (м-холиномиметические) эффекты ацетил-
холина отмечаются при возбуждении парасимпатической
нервной системы (кроме потоотделения и вазодилятации), они в
основном противоположны эс|)фектам стимуляции
симпатической системы. Эти эффекты включают: сужение зрачка (миоз),
спазм аккомодации (глаз устанавливается на близкое видение)
(см. главу 10), обильное слюноотделение, сужение бронхов,
повышение секреции бронхиальных желез, артериальную ги-
потензию (обусловленную брад и кард ией и вазодилятацией),
увеличение моторики и секреции желудочно-кишечного
тракта, сокращение гладкой мускулатуры мочевого пузыря и
усиленное потоотделение.
Никотиноподобные (н-холиномиметические) эффекты ацетил-
холина включают эффекты стимуляции симпатических и
парасимпатических ганглиев. Однако влияние ацетил холина на
ганглии значительно слабее, чем на м-холинорецепторы, поэтому
в итоге преобладают парасимпатические эффекты. Влияние
ацетилхолина на симпатические ганглии может быть
продемонстрировано на примере изменения артериального давления
при введении ацетилхолина на фоне предварительной блокады
м-холинорецепторов атропином. При этом внутривенное
введение ацетилхолина в большой дозе приводит к повышению
артериального давления, так как вследствие стимуляции
симпатических ганглиев и мозгового слоя надпочечников
развивается сужение сосудов и тахикардия.
21
8. Холинергические средства
Холиномиметики
Преганглионарный
парасимпатический нейрон
М-холиномиметики
Метахолин
Карбахолин
Бетанехол
Пилокарпин
Днтихолинэстеразные
средства
Эдрофоний
Прозврин
Пиридостигмин
(фосфороргани-
ческив соединения)
Парасимпатические
эффекты
Преганглионарный
симпатический нейрон
Н-холиномиметики
Никотин
Карбахолин (слабый)
Антихолинэствразные
средства
Гаиглиоблокаторы
Бензогексоний
Арфонад
Избыток никотина
(деполяризирующий
блок)
Ацетилхолим
М-холиноблокаторы
Атропин
Скополамин
Тропикамид
Циклодол
Симпатические
аффекты
Лцстилхолин, выделяющийся окончаниями постганглионар-
ных нейронов парасимпатических нервов (в левой части
рисунка), оказывает воздействие на различные органы,
активируя мускариночувствительные рецепторы (м-холинорецепторы).
Листилхолин обычно вызывает возбуждающие эффекты,
исключением является его угнетающее влияние на сердце (через
n.vagus) (см. главу 17). Лекарственные средства, которые
воспроизводят эффекты ацетилхолина, называются «холиномиме-
тиками» и подразделяются на две группы:
1) холиномиметики прямого действия (агонисты м- и н-холн-
норецепторов);
2) антихолннэстеразные средства (ингибиторы холнвэстеразы),
стимулирующие холинорецепторы за счет накопления в синапсе
ацетилхолина.
Агонисты м-холинорецепторов (м-холиномиметикн) (в верхней
части рисунка слева) имеют несколько показаний к
клиническому применению. Пилокарпин (в глазных каплях) используют
для снижения внутриглазного давления у пациентов с
глаукомой (см. главу 10). Карбахолин и бетанехол используют очень
редко. В основном их назначают для стимуляции гладкой
мускулатуры кишечника и мочевого пузыря при
послеоперационной атонии этих органов и при задержке мочеиспускания, если
исп обструкции мочеиспускательного канала (например, в
неврологической практике).
Алтихолииэстеразные средства (ингибиторы холинэстеразы) (в
левой части рисунка) оказывают слабое влияние на ганглии, их
никотиноподобные (н-холиномиметические) эффекты
проявляются главным образом в стимуляции нервно-мышечной
проводимости. Ингибиторы холинэстеразы применяют при
миастении, а также для устранения эффектов миорелаксантов
конкурентного действия.
Антагонисты м-холинорецепторов (м-холияоблокаторы) (в
нижней части рисунка в центре) блокируют действие
ацетилхолина, высвобождающегося из окончаний постганглионарных
волокон парасимпатических нервов. Основные эффекты м-хо-
линоблокаторов показаны на рисунке в главе 7. Следует
отметить, что чувствительность различных эффекторных органов,
получающих парасимпатическую иннервацию, к действию м-
холиноблокаторов значительно варьирует. Так, например,
слюнные, бронхиальные и потовые железы высоко чувствительны к
действию этих препаратов, а для расширения зрачка, паралича
аккомодации и устранения влияния п. vagus на сердце требуются
большие дозы м-холиноблокаторов. Еще более высокие
концентрации препаратов необходимы для уменьшения
парасимпатического влияния на тонус гладкой мускулатуры кишечника и
мочевого пузыря. Наиболее резистентна к действию
м-холиноблокаторов секреция соляной кислоты в желудке (см. главу 12).
Атропин, пюсцин (скополамин) и другие
м-холиноблокаторы используют:
1) в анестезиологии для снижения угнетающего действия
блуждающего нерва на сердце и для подавления секреции
бронхиальных желез;
2) для подавления спазма кишечника, например, при
синдроме раздражённой кишки;
3) для снижения желудочной секреции (пирензепин; см.
главу 12);
22
4) при паркинсонизме (циклодол; см. главу 26);
5) для предупреждения проявлении болезни укачивания (ско-
поламин; см. главу 30);
6) для расширения зрачка с целью осмотра глазного дна (тро-
пикамид) и для расслабления ресничной мышцы (см. главу 10);
7) в качестве бронхолитиков при бронхиальной астме (ип-
ратропий; см. главу 11).
Ходиномиметики
Агоннсты н-холииорецепторов (н-холиномиметики)
оказывают многочисленные эффекты, так как стимулируют н-холино-
рецепторы как парасимпатических, так и симпатических
ганглиев. В результате стимуляции симпатических ганглиев
развиваются тахикардия, сужение сосудов и артериальная гипертен-
зия. Парасимпатические эффекты проявляются в стимуляции
перистальтики кишечника, увеличении слюноотделения,
повышении секреции бронхиальных и кишечных желез.
Препараты этой группы не находят клинического применения.
Агоннсты м-холинорецеиторов (м-холнномиметикн) возбуждают
мускариночувствительные рецепторы (м-холинорецепторы),
обычно оказывая стимулирующие эффекты. Важным
исключением является их влияние на сердце, где активация
доминирующих м2-холинорецепторов приводит к уменьшению частоты
и силы сердечных сокращений. Стимуляция мг-холинорецеп-
торов через Gj-белок приводит к угнетению аденилатциклазы,
чем и объясняется отрицательный инотропный эффект аце-
тилхолина (Ацх). р, у-субъединицы Gj-белка усиливают К+-про-
водимость в миокарде, вызывая гиперполяризацию мембран и
развитие брадикардии (см. главу 17). Ацетилхолин, активируя
мз-холинорецепторы, повышает секрецию желез и усиливает
сокращение гладкой мускулатуры. Стимуляция этих
рецепторов приводит к активации фосфолипазы С и образованию из
мембранных фосфоинозитидов вторичных мессенджеров ино-
зитол-1,4,5-трифосфата (ИР3) и диацилглицерола (см. главу 1).
ИР3 повышает содержание Са2+ в цитоплазме клеток и, таким
образом, приводит к усилению сокращения гладкой
мускулатуры и секреции желез. Внутривенное введение ацетилхолина
вызывает расширение сосудов, так как способствует
высвобождению оксида азота (N0) из эндотелия сосудов (см. главу 16).
Однако большинство кровеносных сосудов не имеет
парасимпатической иннервации, а физиологическая роль м-холиноре-
цепторов сосудов пока остается неизвестной.
Эфиры ацетилхолина. Карбахолин и бетанехол — это
четвертичные аммониевые соединения, поэтому они не проникают
через гематоэнцефалический барьер. Препараты не гидролизу-
ются ацетилхолинэстеразой, вследствие чего обладают более
продолжительным действием, чем ацетилхолин.
Пилокарпин является производным третичного азота, что
обеспечивает его липофильность. Это позволяет лекарству при
местном применении в виде глазных капель свободно
проникать в роговицу глаза и проходить через
гематоэнцефалический барьер при пероральном и парентеральном применении.
Антихолинэстеразные средства (ингибиторы холинэстеразы).
Это холиномиметики непрямого действия. Основная часть
ингибиторов холинэстеразы (прозерин, пиридостигмин)
являются четвертичными аммониевыми соединениями, поэтому не
проникают через гематоэнцефалический барьер и обладают
незначительной центральной активностью. Они плохо
всасываются при пероральном применении. Физостнгмин (эзерин) —
производное третичного амина, поэтому является более липо-
фильным. Он хорошо абсорбируется при пероральном и
местном (в виде глазных капель) применении и проникает через
гематоэнцефалический барьер.
Механизм действия. Ацетилхолин связывается с активными
центрами (анионным и эстеразным) ацетилхолинэстеразы и
вначале гидролизуется до свободного холи на и ацетил ирован-
ного энзима, затем распадается ковалентная ацетил-энзимная
связь. Примером ингибиторов холинэстеразы обратимого дей-
Проведение возбуждения через вегетативные ганглии
стимулируют агонисты н-холинорецепторов (н-холиномиметики),
а устраняют ганглиоблокаторы (вещества, избирательно
блокирующие н-холинорецепторы ганглиев). Н-холиномиметики
в клинике практически не используют, а ганглиоблокаторы
применяют в основном в анестезиологии.
ствия является эдрофоний. Он связывается с активным
(анионным) центром холинэстеразы за счёт электростатических сил.
Эта связь не является ковалентной, поэтому она сохраняется
короткий промежуток времени B-10 минут). Карбаминовые
эфиры (прозерин, пиридостигмин) подвергаются такому же
двухступенчатому распаду, как и ацетилхолин, однако разрушение
карбамид-энзим ной связи происходит значительно медленнее
(от 30 минут до 6 часов). Фосфорорганические соединения (ар-
мин) вызывают фосфорилирование активного (эстеразного)
центра фермента. Ковалентная фосфорно-энзимная связь очень
стабильна и холинэстераза остаётся неактивной в течение
сотни часов, поэтому фосфорорганические соединения относятся
к ингибиторам холинэстеразы необратимого действия. Они
чрезвычайно токсичны и используются как инсектициды (дихло-
фос, хлорофос, тиофос) и боевые отравляющие вещества.
Эффекты антихолинэстеразных средств в основном подобны
эффектам агонистов м-холинорецепторов прямого действия,
вместе с тем они способны стимулировать передачу
возбуждения в нервно-мышечных синапсах. Ингибиторы холинэстеразы
в меньшей степени, чем м-холиномиметики, вызывают
расширение сосудов, так как оказывают воздействие лишь на
немногие сосуды, получающие холинергическую иннервацию.
Противодействовать сосудорасширяющим эффектам препаратов
может одновременная стимуляция симпатических ганглиев. Только
в высоких (токсических) дозах антихолинэстеразные средства
вызывают заметную брадикардию и артериальную гипотензию.
В токсических дозах ингибиторы холинэстеразы вначале
вызывают симптомы чрезмерной стимуляции
м-холинорецепторов: миоз (сужение зрачка), саливацию, потоотделение,
сужение бронхов, повышенную секрецию бронхиальных желёз, рвоту
и понос. Чрезмерная стимуляция н-холинорецепторов может
вызвать нервно-мышечную блокаду за счёт стойкой
деполяризации. Если лекарство липофильное (физостигмин,
фосфорорганические соединения), то могут возникнуть судороги, кома и
остановка дыхания. Реактиваторы холинэстеразы (пиридоксим,
изонитразин) могут разрушить фосфорно-энзимную связь,
связываясь с фосфорорганическими соединениями и
восстанавливая активность фермента. Позднее это становится
невозможным, потому что процесс «старения» усиливает
фосфорно-энзимную связь.
Антагонисты холинорецепторов
Ганглиоблокаторы вызывают артериальную гипотензию, мид-
риаз (расширение зрачка), сухость во рту, запор, задержку мочи
и импотенцию. Арфонад (триметафан) используют для
получения управляемой артериальной гипотензии во время
некоторых хирургических операций.
Антагонисты м-холинорецепторов (м-холиноблокаторы).
Атропин — это алкалоид, содержащийся в таких растениях, как
красавка (Airopa belladonna), белена, дурман. Атропин является
слабым стимулятором центральной нервной системы, особенно
центра n.vagus; при использовании в малых дозах может
вызывать брадикардию, а в высоких — тахикардию. Гносцин (скопо-
ламин) обладает успокаивающим действием и часто вызывает
сонливость и амнезию. В токсических дозах оба лекарственных
препарата вызывают возбуждение, тревогу, галлюцинации и
кому. Эффекты м-холиноблокаторов показаны на рисунке в
главе 7. Студенты должны понимать, почему эти средства
вызывают расширение зрачков, нарушение зрения, сухость во рту,
запоры и затруднение мочеиспускания.
23
9. Адренергические средства
Адреномиметики
НЕПРЯМОГО ДЕЙСТВИЯ: I Выдвлвнив
Эфедрин
Амфетамин
Фенамин
Кокаин
ПРЯМОГО ДЕЙСТВИЯ:
АГОНИСТЫ а-АДРЕНО-
РЕЦЕПТОРОВ
Норадрвналин
Адреналин
«2
Клофелин
а-мвтилнорадреналин
Мезатон
Метоксамин
АГОНИСТЫ Р-АДРЕНО-
РЕЦЕПТОРОВ
р,/р2
Адреналин
Иэадрин
Р2
Сальбутамол
Тербуталин
Р,
Норадрвналин
Добутамин
Окончание норадренергического нерва
Дезаминирован-
ные метаболиты
Симлатолитики
Резерпин
Октадин
Бетанидин
Адреноблокаторы
а-АДРЕНОБЛОКАТОРЫ
а,/а2
Феноксибензамин
Фентоламин
«1
Празозин
Р-АДРЕНОБЛОКАТОРЫ
Р,/Рг
Пропранолол +
Надолал++
Тимолол+
Пиндолол*
Окспренолол+ *
Альпренолол*
р, (кардио-
селективные)
Метопролол+
Атенолол++
Ацебутолол*
0-адрено-
Рецептор
МАО - Моноаминоксидаэа -^^енил^тциклаза
КОМТ — Катехол-О-метилтрансфераза
* Внутренняя симлатоми-
метическая активность
+ наиболее липофильные
++ наименее липофильные
Симпатическая нервная система играет важную роль в
регуляции функции таких внутренних органов» как сердце и
периферические сосуды. Основным медиатором, высвобождающимся
из симпатических нервных окончаний, является норадреналин,
но при некоторых формах стресса из мозгового слоя
надпочечников может также высвобождаться адреналин. Эти катсхола-
мины инактивируются главным образом путём обратного ней-
роналыюго захвата.
Адреномиметики (в левой части рисунка) — это
лекарственные вещества, которые частично или полностью повторяют
эффекты норадреналина и адреналина. Они действуют либо
непосредственно на а- и/или р-адренорецепторы (в левой части
рисунка), или косвенно на пресинаптические окончания (в
верхней части рисунка слева), способствуя высвобождению
норадреналина. Эффекты адренергической стимуляции
показаны на рисунке в главе 7.
р2-адреномиметики (агонисты р2-адренорецепторов)
вызывают расширение бронхов и расслабляют гладкую мускулатуру
эндометрия, поэтому их применяют при бронхиальной астме
(см. главу 11) и в качестве токолитиков для предотвращения
преждевременных родов. pt-адреномиметики (агонисты ргадре-
норецепторов) (добутамин) иногда используют при острой
сердечной недостаточности для стимуляции сократимости
миокарда (см. главу 18). а|-адреномиметики (агонисты арадреноре-
цепторов) (например, мезатон) применяют как мидриатики
(см. главу 10) и в качестве средств, повышающих артериальное
давление. а2-адреномиметики (агонисты а2-адренорецепторов),
клофелин (клонидин) и метилдофа (действует после своего
превращения в ложный медиатор — а-метилнорадреналин)
являются гипотензивными средствами центрального действия (см.
главу 15).
Адреномиметики непрямого действия (симпатомиметики)
(например» фенамин, син. амфетамин) действуют в основном
пресинаптически, усиливая высвобождение норадреналина,
который стимулирует а- и р-адренорецепторы. Эфедрин не
только увеличивает высвобождение норадреналина из пресинапти-
ческой мембраны, но также оказывает прямое стимулирующее
влияние на адренорецепторы. Эффекты эфедрина сходны с
действием адреналина, но более продолжительны. Эфедрин
оказывает умеренное стимулирующее влияние на ЦНС.
Фенамин, который лучше проникает через гематоэнцефалический
барьер, обладает более выраженным психостимулирующим
эффектом, повышает настроение и жизненный тонус, а также
действует как анорексиген (понижает аппетит). К фенамину
может развиваться лекарственная зависимость, поэтому он
используется очень редко (см. главу 31).
р-адреноблокаторы (антагонисты Р-адренорецепторов) (в
нижней части рисунка справа) являются важными средствами для
лечения артериальной гипертензии (глава 15), стенокардии (см.
главу 16), нарушений сердечного ритма (см. главу 17) и глаукомы
24
Симпатически* аффекты
(см. главу 10). а-адреноблокаторы (антагонисты а-адренорецеп-
торов) (в центре рисунка справа) имеют ограниченное
клиническое применение. Празозин, селективный агадреноблокатор,
иногда используют для лечения артериальной гипсртензии. Фе-
нокснбензамин. а-адреноблокатор необратимого действия,
применяют при феохромоцитоме для уменьшения а-адреномиме-
тических эффектов катехоламинов. Многие а-адреноблокато-
Основное количество норадреналина, выделившегося в си-
наптическую щель, подвергается обратному нейрональному
захвату (захват I) с помощью высокоаффинной транспортной
системы. Небольшие количества медиатора подвергаются экстра-
нейрональному захвату (захват 2) эффекторными клетками. Эк-
странсйрональная транспортная система менее селективна и
легко насыщается.
МАО (моноамнноксидаза) и КОМТ (катехол-О-метилтранс-
фераза) — широко распространенные ферменты, которые
разрушают катехоламины. Угнетение МАО и КОМТ
незначительно усиливает эффекты стимуляции симпатической нервной
системы или введенных извне катехоламинов (норадреналина,
адреналина), так как катехоламины преимущественно инакти-
вируются, подвергаясь обратному захвату.
а|-адренорецепторы расположены постсинаптически. Их
активация в некоторых тканях (гладкая мускулатура, слюнные
железы) вызывает увеличение содержания инозитол-1,4,5-три-
фосфата и цитозольного Са2* (см. главу 1), в результате чего
повышается сократимость мыши (исключение гладкая
мускулатура кишечника) и увеличивается секреция желез.
а2-адренорецепторы расположены пресинаптически. Их
активация норадреналином снижает дальнейшее высвобождение
медиатора путем угнетения аденилатциклазы и понижения
притока Са2+ в период генерации потенциала действия.
Активация р-адренорецепторов вызывает стимуляцию
аденилатциклазы, усиливая превращение АТФ в цАМФ. цАМФ
действует как «вторичный мессенджер», вызывая свойственный
активации рецептора эффект.
Симпатомиметики
Симпатомнметики имеют структурное сходство с
норадреналином» поэтому подвергаются обратному нейрональному
захвату (захват 1) нервными окончаниями, где вызывают выброс
норадреналина из везикул в аксоплазму. В аксоплазме
некоторое количество медиатора метаболизируется МАО, но
оставшийся норадреналин высвобождается в синаптическую щель и
возбуждает адренорецепторы.
Фенамин (амфетамин) не разрушается МАО. Его
периферические эффекты (тахикардия, гипертензия) и центральное
психостимулирующее действие главным образом связаны с
усилением высвобождения катехоламинов из прссинаптической
мембраны нервных окончаний. Д-амфстамин (дексамфетамин)
используют при нарколепсии (патологической сонливости) и
иногда для повышения двигательной активности у детей. К
лекарственным веществам амфетаминового ряда возникает
лекарственная зависимость (см. главу 31).
Кокаин является не только местным анестетиком (см. главу
5), но и симпатомиметиком, так как подавляет захват
норадреналина нервными окончаниями. Препарат обладает
выраженным, психостимулирующим действием, что вызывает быстрое
развитие пристрастия.
Адреномиметикн. Эффекты адреномиметиков зависят от того,
какой тип адренорецепторов они стимулируют (а- или/и Р-
адренорецепторы), а также от выраженности компенсаторных
реакций, возникающих при их действии.
Адреналин и норадреналин разрушаются в кишечнике и
обладают короткой продолжительностью действия при
парентеральном введении из-за их быстрого обратного захвата и
метаболизма. Адреналин повышает артериальное давление,
увеличивая частоту и силу сердечных сокращений (ргадреномиме-
тический эффект). Стимуляция а-адрснорсцепторов сосудов
ры используют при различных нарушениях периферического
кровообращения, но обычно с малым успехом.
Симпатолитикн (в верхней части рисунка справа) либо
истощают запасы норадреналина в нервных окончаниях (резерпин),
либо предотвращают его высвобождение. Их используют как
гипотензивные средства (см. главу 15).
приводит к их сужению (сосуды внутренних органов, кожи), а
активация Рз-адренорецепторов вызывает расширение сосудов
скелетных мышц, при этом общее периферическое
сопротивление сосудов может значительно снижаться.
Норадреналин практически не влияет на р2-адренорецепто-
ры, а действуя на а-адренорецепторы сосудов, суживает их и
повышает артериальное давление, что приводит к появлению
рефлекторной брад и кард ии, которая превалирует над прямым
Pt-адреностимулирующим действием.
Инъекционное введение адреналина применяют при
анафилактическом шоке (см. главу 11).
р-адреяомиметнкн. Изадрин (изопреналин) стимулирует р-
адренорецепторы, увеличивая частоту и силу сердечных
сокращений и вызывая расширение сосудов. В результате этого диа-
столическое давление снижается, а систолическое давление
изменяется мало. р2-адреномнметикн (агон исты Рг-адренорецепто-
ров) не являются абсолютно селективными средствами. Они
обладают выраженным бронхорасширяющим действием при
использовании в дозах, в которых оказывают минимальное
влияние на сердце. Они не разрушаются моноаминоксидазой и,
вероятно, не подвергаются обратному нейрональному захвату.
Их используют главным образом при бронхиальной астме (см.
главу 11).
Адреноблокаторы
а-адреноблокаторы уменьшают тонус артериальных и
венозных сосудов, вызывая снижение периферического
сопротивления сосудов и снижение артериального давления. Они
извращают прессорный эффект адреналина, поскольку на фоне
блокады а-адренорецепторов проявляется сосудорасширяющее
действие адреналина за счет активации рз-адренорецепторов, в
результате чего периферическое сопротивление сосудов
падает. а-адреноблокаторы вызывают рефлекторную тахикардию,
которая сильнее выражена при использовании неселективных
препаратов, которые также блокируют пресинаптические а2-
адренорецепторы, в результате чего усиливается
высвобождение норадреналина, который стимулирует ргадренорецепторы
сердца. Празознн, селективный агадреноблокатор, вызывает
менее выраженную тахикардию.
р-адреноблокаторы различаются по степени их липофильно-
сти и кардиоселективности. Все они блокируют
р|-адренорецепторы сердца и одинаково эффективно понижают
артериальное давление и предупреждают приступы стенокардии. Чем
более липофилькы лекарства, тем быстрее они всасываются в
кишечнике, активнее подвергаются метаболизму в печени и
быстрее элиминируют из организма. Липофильные
Р-адреноблокаторы проходят через гематоэнцефалический барьер и
оказывают центральное действие (например, нарушение сна). Кар-
диоселективность р-адреноблокаторов относительна и
уменьшается с увеличением дозы. Вместе с тем ргадреноблокаторы
в меньшей степени вызывают сужение периферических
сосудов (симптом холодных рук и ног) и не уменьшают вызванную
физической нагрузкой гипогликемию (стимуляция глюконео-
генеза в печени идет через р2-адренорецепторы). Кардиоселек-
тивные препараты могут оказывать слабое р2-адрснсйблокирую-
щее действие и тем самым вызывать бронхоспазм у пациентов
с бронхиальной астмой, поэтому р-адреноблокаторы не
желательно назначать при этом заболевании. Некоторые Р-адрсноб-
локаторы обладают внутренней симпатомиметической
активностью (частичные агонисты; см. главу 2), хотя клиническая
важность этого их свойства дискутируется (см. главу 16).
25
10. Лекарственные средства, действующие на глаза
Местные анестетики
Флуоресцин
Антибиотики
Противовирусные
средства
Противовоспалительные средства
Радужка
МИДРИАЗ
М-холиноблокаторы
Тропикамид
Циклопентолат
а-адреномиметики
Меэатон
миоз
Пилокарпин
Передняя
камера
Образование
катаракты
Реомична* мышца
ЦИКЛОПЛЕГИЯ
Атропин
Тропикамид
Циклопентолат
СОКРАЩЕНИЕ
(спазм аккомодации)
Пилокарпин и
др. м-холиномиметики
Антихолинэстераэ-
ные средства
Физостигмин
Глкжокортикостероиды
Антихолинэстераэные
средства
Сахарный диабет
Шлеммов
канал
Интрасклеральная
вена
<а-.в-АР)
Эписклеральная
вена
Склеральная шпора
Сокращение ресничной мышцы
натягивает склеральную шпору
и открывает трабекулярную сеть
0-АДРЕНОБЛОКАТОРЫ
Тимолол и другие
Диакарб
Адреналин
сосуды
Сосудистая
оболочка
глаза
Склера
Хлорохин
Сахарный диабет
Артериальная
гипертензия
Гипербарическая
оксигенация у
новорождённых
Глаз — это выпуклая сферическая камера, наружная
оболочка которой состоит из богатой коллагеном склеры.
Нормальное внутриглазное давление составляет около 15 мм рт.ст.,
при повышении внутриглазного давления развивается
глаукома. Баланс водянистой влаги глаза поддерживается ресничным
(цидиарным) телом путем регуляции оттока жидкости через
трабекулярную систему в Шлеммов канал. При глаукоме от-
крытоугольной формы из-за патологических изменений в тра-
бекулярной сети, приводящих к снижению оттока
внутриглазной жидкости, внутриглазное давление увеличивается до 24 мм
рт.ст. и более. Повышение внутриглазного давления может
вызвать повреждение зрительного нерва. Обычно повышенное
внутриглазное давление удается снизить, увеличивая отток
внутриглазной жидкости с помощью м-холнномиметиков — таких,
как пилокарпин (в нижней части рисунка слева), или понижая
образование водянистой влаги с помощью различных
лекарственных средств (например, Р-адреноблокатора тимемюла).
Передняя склера глаза переходит в роговицу (в верхней
части рисунка слева). Прозрачность роговицы обеспечивается за
счет особого строения коллагеновых волокон. Многие
манипуляции — такие, как тонометрия (измерение внутриглазного
давления) и удаление инородного тела из роговицы, требуют
использования местных анестетиков. Для обнаружения
повреждения в эпителии роговицы в глаз обычно закапывают
флуоресцин, который в зоне повреждения начинает светиться
зеленым светом. При аллергическом конъюнктивите и химических
ожогах роговицы используют местные противовоспалительные
средства (см. главу 33). При инфекционных поражениях глаз
химиотерапевтические средства часто применяют совместно с
противовоспалительными препаратами, так как последние
уменьшают резистентность микроорганизмов к
антибактериальной терапии.
Радужка (в левой части рисунка в середине) имеет две
мышцы: круговую мышцу, получающую парасимпатическую
иннервацию, и радиальную мышцу, которая иннервируется
симпатическими нервными волокнами. М-холиноблокаторы и а-ад-
реномиметики расширяют зрачок (вызывают мидриаэ), в то
время как м-холиномиметики и а-адреноблокаторы суживают
зрачок (вызывают миоз).
М-холиномиметики вызывают сокращение ресничной мышцы,
получающей парасимпатическую иннервацию, что приводит к
расслаблению цинновой связки и увеличению кривизны
хрусталика, в результате чего глаз устанавливается на ближнюю точку
видения (возникает спазм аккомодации). М-холиноблокаторы,
напротив, вызывают расслабление ресничной мышцы (циклоп-
легию), в результате чего возрастает натяжение цинновой
связки, уменьшается кривизна хрусталика и развивается паралич
аккомодации, глаз устанавливается на дальнее видение.
Аккомодационную способность глаза обеспечивает
хрусталик Помутнение хрусталика называется «катарактой». К
развитию катаракты может приводить применение некоторых
лекарственных веществ (например, глюкокортикоидов).
Сетчатка глаза является частью центральной нервной
системы. Лекарственные средства, как правило, оказывают слабое
воздействие на сетчатку, так как плохо проникают через гема-
торетинальный барьер. Однако некоторые лекарства (хлорохин,
хинин, этамбутол), а также гипербарическая оксигенация у
новорожденных могут вызывать повреждение сетчатки глаза.
26
Хрусталик
Стекловидное
тело
Приток
водянистой
влаги ё
Круговая
мышца
радужки
Ресничное тело
Ретинопатия
Ресничное (цилиарное) тело хорошо васкуляризировано, оно
участвует в образовании внутриглазной жидкости. Клетки
эпителия ресничного тела содержат АТФазу и карбоангидразу. Они
селективно абсорбируют Na+ из стромы и транспортируют его
в межклеточную щель, которая открывается только на стороне
выхода внутриглазной жидкости. Гиперосмолярность в
межклеточной щели вызывает движение воды из стромы,
способствуя постоянному току водянистой влаги. В эпителии
ресничного тела осуществляется пассивная фильтрация жидкости;
около 30% внутриглазной жидкости может быть образовано
ультрафильтрацией.
Трабекулярная сеть. Водянистая влага поступает в переднюю
камеру глаза через зрачок и оттекает в Шлеммов канал
(венозный синус склеры — круговой канал в лимбе) и в итоге — в
эписклеральные вены. Трабекулярная сеть угла передней
камеры глаза (Фонтановы пространства) — это крыша Шлеммова
канала, своеобразный фильтр, через который водянистая влага
поступает в венозный синус.
Глаукома
Глаукома — это группа заболеваний глаза, основным
проявлением которых является повышение внутриглазного давления.
Глаукома может привести к потере зрения. Это заболевание
встречается у 1% лиц старше 40 лет. При осмотре глазного дна
у больных глаукомой диск глазного нерва кажется вогнутым
из-за потери нервных волокон. Механизм дегенерации нервных
волокон не ясен, но предполагают, что в этом процессе может
принимать участие механический фактор или/и локальная
ишемия. Наиболее часто встречается открытоугольная
(хроническая) форма болезни. При глаукоме закрытоугольной формы
уменьшен угол между роговицей и радужкой (угол передней
камеры глаза). Иногда угол закрывается полностью,
препятствуя оттоку водянистой влаги, в результате чего
внутриглазное давление повышается. Во время этих приступов
происходит повреждение сетчатки, поэтому внутриглазное давление
должно быть снижено как можно быстрее. Для снижения
внутриглазного давления используют глазные капли с
пилокарпином, при необходимости — в сочетании с внутривенным
введением диакарба (ацетазоламида) и гипертонического раствора
маннитола для ускорения выведения воды из организма. Диа-
карб ингибирует карбоангидразу ресничного тела, снижая
синтез бикарбоната. Это ведёт к угнетению транспорта Na+ и
уменьшению образования внутриглазной жидкости, так как
транспорт Na+ зависит от концентрации бикарбоната.
Пилокарпин, являясь третичным амином, быстро
диффундирует через роговицу во внутриглазную жидкость. Препарат
понижает внутриглазное давление, вызывая сокращение
ресничной мышцы, что приводит к натяжению склеральной
шпоры, растягиванию трабекулярной сети и усилению оттока
водянистой влаги из передней камеры глаза.
Фиэостнгмин из-за его местного раздражающего действия при
глаукоме используют редко. Применение при глаукоме
антихоли нэстеразных средств необратимого действия (например,
эхотиопада) повышает риск катаракты.
Все м-холиномиметики вызывают миоз, приводящий к
нарушению ночного видения и возникновению жалоб на
затуманивание зрения. Спазм аккомодации, который увеличивает
близорукость и вызывает нарушение зрения, обычно не
беспокоит больных глаукомой. Однако некоторые пациенты тяжело
переносят этот эффект.
Р-адреноблокаторы. Тимолол — препарат выбора при
глаукоме открытоугольной формы. Он блокирует р2-адренорецепто-
ры ресничного тела, что ведет к снижению секреции
внутриглазной жидкости. Кроме того, тимолол может блокировать р-
адренорецепторы афферентных кровеносных сосудов.
Возникающее в результате этого сужение сосудов уменьшает процесс
ультрафильтрации и образование водянистой влаги. Тимолол
не оказывает свойственного пилокарпину нежелательного
действия на глаз, однако его способность хорошо всасываться
может быть причиной развития брадикардии и бронхоспазма у
больных бронхиальной астмой, поэтому р-адреноблокаторы
(даже селективные pi-адреноблокаторы) противопоказаны
пациентам с бронхиальной астмой, сердечной недостаточностью,
блокадами сердца и брадикардией.
Адреналин и а-адреномиметики понижают внутриглазное
давление за счет сужения кровеносных сосудов ресничного тела.
Снижение внутриглазного давления может обеспечить
комбинированное применение а-адреноблокаторов и р-адреномиме-
тиков (особенно р2-адреномиметиков). Эти средства
увеличивают отток внутриглазной жидкости сильнее, чем понижают ее
образование, предположительно за счет расширения эпискле-
ральных вен. Гуанстндин увеличивает и пролонгирует действие
адреналина, блокируя его захват тканями.
Как альтернатива лекарственной терапии при глаукоме
может быть использована лазерная трабекулярная хирургия. Под
местной анестезией хирург, используя аргонный или диодный
лазер, наносит около 100 ровных насечек на внутренней
поверхности трабекулярной сети. Лазерные «ожоги» вызывают
местное уплотнение ткани, которое оказывает влияние на
соседние непораженные участки, расширяя отверстия в
трабекулярной сети и увеличивая отток внутриглазной жидкости.
При глаукоме закрытоугольной формы делают отверстие на
периферии радужки. Это вмешательство способно купировать
острый приступ глаукомы, так как способствует частичному
оттоку внутриглазной жидкости через зрачок.
Лечение больных глаукомой закрытоугольной формы дает
хорошие результаты, чего нельзя сказать о лечении пациентов
с открытоугольной формой заболевания, так как нет данных,
свидетельствующих о долгосрочном эффекте медикаментозной
и лазерной терапии.
МиАриспгики
Для осмотра глазного дна необходимо расширение зрачка —
мидриаз. Для офтальмоскопии в основном используют м-хо-
линоблокаторы короткого действия, например, тропикамид и
цикдопентолат, которые вызывают мидриаз и циклоплегию. и-
адреномиметик мезатои (фенилэфрин) вызывает мидриаз без
изменения реакции зрачка на свет и без нарушения процесса
аккомодации. После завершения осмотра глазного дна можно
использовать физостигмин или пилокарпин в качестве
антагонистов мидриатиков. Мидриаз, вызванный введением мезато-
на, может быть устранён применением а-адреноблокаторов
(например, тимоксамнна). Мидриаз может привести к обострению
глаукомы закрытоугольной формы у пациентов старше 60 лет.
27
11. Лекарственные средства, применяемые
при бронхиальной астме, поллинозе и анафилаксии
Антиген
Аллергены
Пыльца растений
Шерсть животных
Клещи
Лекарства:
Антибиотики
Препараты железа
Аспирин и др.
Укус
Местно
беклометаэон
Местно
кромолин-
натрий
Медиаторы
СПАЗМОГЕНЫ
Гиствмин
Лейкотриены
(ЛТС+ЛТО^
Простагландины
(ПП>2)
Фактор активации
тромбоцитов (ФАТ)
Астемизол
Терфенадин
Супрастин
Хемотаксические
факторы: ЛТВФ ФАТ
Глкжокортико-
стероиды
Генерализированное
выделение
Лёгкие
Адреналин
Глюкокортико-
стероиды
Антигистаминные
средства
Сосудистый
коллапс
Вронхоспазм
Кожная сыпь
Отёк слизистой носа и глотки
Рвота
Бронхоспазм
Бронхиальная
астма
Эпизодически
Рг-АДРЕНОМИМСТИКИ
Сальбутамол
Тврбугалин
Сальметврол
KСАНТИНЫ
Теофиллин
Аминофиллин
М-ХОЛИН0БЛ0КАТОРЫ
Ипратропий
(аэрозоль)
Глюкокортикостероиды
ИНГАЛЯЦИОННЫЕ
Беклометаэон
Будесонид
ПЕРОРАЛЬНЫЕ
Преднизалон
Патогенез таких аллергических заболеваний, как
бронхиальная астма, лоллиноз и анафилаксия, связан со следующими
основными процессами: поступающие в организм антигены
взаимодействуют с фиксированными на поверхности тучных
клеток антителами (иммуноглобулинами Е, IgE), что приводит к
синтезу и высвобождению из этих клеток различных
медиаторов (в левой части рисунка). Если выброс медиаторов носит
локальный характер, то может развиваться поллиноз (в
верхней части рисунка справа) или бронхиальная астма (в нижней
части рисунка справа), а генерализованное выделение
медиаторов вызывает анафилаксию, которая является редкой, но
опасной аллергической реакцией (наиболее часто отмечается при
применении пениииллинов). Антигены, вызывающие
аллергические реакции, называются «аллергенами» (в верхней части
рисунка слева).
Бронхиальная астма — это воспалительное заболевание, при
котором эпизодически появляются нарушения бронхиальной
проходимости (приступы удушья экспираторного типа),
связанные с бронхоспазмом, выраженным отеком слизистой
бронхов и гиперсскрецией бронхиальных желёз (в нижней части
рисунка справа). Постепенно хроническое воспаление
дыхательных путей приводит к формированию необратимых
морфологических изменений в тканях бронхов. Существует две
разновидности бронхиальной астмы (примечание: в Англии
используется классификация бронхиальной астмы, предложенная
Rackermann в 1918 году): экзогенная и эндогенная форма. Развитие
экзогенной бронхиальной астмы (соответствует атопической
форме) связано с воздействием различных внешних аллергенов,
а развитие эндогенной формы заболевания с ними не связано.
При бронхиальной астме лёгкой формы или средней тяжести
препаратами первого ряда являются р2-адреномиметики
короткого действия (в центре рисунка справа), применяемые по мере
необходимости ингалиционно. Если потребность в
использовании р2-адрсномиметиков возникает чаше одного раза в день,
то их комбинируют с регулярным ингаляционным
применением глкжокортикостероидов (в нижней части рисунка справа) и
кромолин-натрия (интала). При бронхиальной астме тяжелой
формы рз-адреномиметики короткого действия сочетают с
ингаляционным применением глкжокортикостероидов в высоких
дозах и при необходимости с препаратами второго ряда,
такими, как сальметерол (ингаляционно), ипратропиум (ингаляци-
онно), пролонгированные формы теофиллина (перорально).
Некоторым больным при недостаточной эффективности этих
средств показано пероральное применение
глкжокортикостероидов (обычно пред ни зол он; см. главу 33).
Астматический статус (Status asthmaticus). При
астматическом статусе обычная лекарственная терапия не является
эффективной. Астматическое состояние — показание для
неотложной госпитализации пациентов.
При развитии анафилаксии (в нижней части рисунка слева)
необходимо немедленное внутримышечное (а при
возможности внутривенное) введение адреналина каждые 10 минут до
нормализации артериального давления. Наилучший эффект дает
парентеральное введение глкжокортикостероидов в течение
нескольких часов до улучшения состояния пациентов. Может
быть полезным внутривенное применение антигистаминных
средств (например, супрастина).
Поллиноз — это аллергическое заболевание, вызываемое
пыльцой растений и характеризующееся преимущественным
поражением слизистых оболочек дыхательных путей и глаз.
Некоторые симптомы этого заболевания устраняются
применением антигистаминных препаратов. Высоко эффективным
является интраназальное (капли в нос) введение
глкжокортикостероидов. При аллергическом конъюнктивите в качестве
вспомогательного средства могут быть использованы глазные
капли с инталом.
28
Перорально
Кромолин-натрий
Тучная клетка
-адреномиметики
Нос и глотка
Гранулы
Медиаторы,
n. vagus
Анафилаксия
Haiiainin
Слизь
„Отвк
Воспаление
Иммуноглобулины Б (IgE) являются основной группой
реагинов — антител, принимающих участие в аллергических
реакциях (к реагинам также относятся некоторые IgG).
Содержание специфических антител в крови больных аллергическими
заболеваниями может быть увеличено в 100 и более раз по
сравнению с их уровнем у здоровых людей. IgE, фиксированные на
поверхности тучных клеток с помощью Fc-фрагмента,
обладают способностью перекрестно связываться с антигенами. Это
приводит к увеличению притока Са2+ в тучные клетки и
способствует их дегрануляции.
Тучные клетки находятся практически во всех тканях
организма. В цитоплазматических гранулах этих клеток
содержится основной запас гистамина в организме (в комплексе с
гепарином и АТФ). Высвобождение гистамина из тучных клеток
увеличивается при повышении внутриклеточной концентрации
Са2+. цАМФ понижает содержание Са2* в клетке, уменьшая
проницаемость клеточных мембран для этих ионов.
Лекарственные средства, увеличивающие синтез (Рг-адрсномиметики) или
угнетающие разрушение (ксантины) цАМФ, угнетают процесс
высвобождения гистамина из тучных клеток.
Медиаторы. Немедленная фаза острого приступа
бронхиальной астмы в основном связана с развитием бронхоспазма
вследствие высвобождения из тучных клеток медиаторов-спазмоге-
нов (в центре рисунка слева). Вторая, поздняя (отсроченная),
фаза бронхиальной астмы является результатом
высвобождения из клеток-мишеней аллергии (тучных клеток и базофилов)
хемотаксинов, которые привлекают в очаг аллергического
поражения различные клетки, особенно эозинофилы. Эти клетки
в свою очередь начинают выделять медиаторы. При этом
развивается расширение сосудов, отёк слизистой оболочки
бронхов, усиление секреции слизи и бронхоспазм. Возникающие
изменения в тканях бронхов вначале носят обратимый
характер, в дальнейшем формируется необратимая обструкция
бронхиальных путей вследствие повреждения эпителия и
гипертрофии гладкой мускулатуры бронхов. В повреждении эпителия
слизистой оболочки бронхов в основном принимают участие
медиаторы эозинофильных гранул (особенно главный
основной протеин (ГОП) и пероксидаза).
Лекарственные средства, расширяющие бронхи
(бронхолитики)
Р-адреномкметики. В гладкой мускулатуре бронхов
преобладают р2-адренорецепторы, стимуляция которых вызывает брон-
ходилятацию. Активация ^адренорецепторов приводит к
увеличению внутриклеточной концентрации цАМФ, в-результате
активируется протеинкиназа, что в свою очередь приводит к
фосфорилированию и угнетению активности миозинкиназы
лёгких цепей и расслаблению гладкой мускулатуры бронхов.
fo-адреномиметики (например, сальбутамол) используют
преимущественно ингаляционно. Препараты этой группы не
оказывают строго избирательного действия на р2-адренорецепто-
ры. Вместе с тем при использовании в дозах достаточных для
расширения бронхов их ргадреномиметичсские эффекты
(стимуляция работы сердца) обычно не проявляются. Побочные
эффекты р-адреномиметиков включают: легкий тремор, нервное
напряжение и тахикардию, которые обычно не проявляются
при ингаляционном введении препаратов. При невозможности
ингаляционного применения (дети и другие пациенты,
которые не могут использовать аэрозольные препараты) р-адрено-
миметики используют перорально. Сальметерол действует
более продолжительно (около 12 часов), чем сальбутамол, но его
бронхорасширяющий эффект развивается медленно, поэтому
этот препарат не предназначен для купирования приступов
бронхиальной астмы. Известно, что частое бесконтрольное
применение ингаляций р2-адреномиметиков может вызвать
ухудшение течения бронхиальной астмы (причины не известны).
Ипратропий (атровент) — это м-холиноблокатор, умеренно
расширяющий бронхи. Препарат устраняет бронхоспазм,
связанный с активацией п.vagus при раздражении гистамином
чувствительных нервных окончаний дыхательных путей. Ипратропий
применяют ингаляционно, поэтому побочные атропиноподоб-
ные реакции при его применении отмечаются крайне редко.
Ксантины. Пероральное применение теофиллина (входит в
состав эуфиллина) показано детям, которые не умеют
использовать ингаляторы, и взрослым, у которых преобладают
ночные приступы удушья. При пероральном применении
теофиллина (даже его пролонгированных форм продолжительностью
действия до 12 часов) часто отмечаются побочные эффекты.
Тошнота, головокружение, бессонница и нарушения функции
кишечника могут наблюдаться даже при терапевтических
концентрациях теофиллина в крови (в пределах 10-20 мг/л). При
концентрации теофиллина в крови выше 25 мг/л могут
появляться серьёзные нарушения сердечного ритма и судороги.
Механизм бронхолитического действия препарата до конца не
изучен. Теофиллин ингибирует фосфодиэстеразу и
увеличивает уровень цАМФ в гладкомышечных клетках. Однако
препарат угнетает фосфодиэстеразу в концентрациях, которые
значительно превышают терапевтические. Вместе с тем имеются
данные, что подтип этого фермента в гладкой мускулатуре
бронхов обладает более высокой чувствительностью к метилксанти-
нам, чем в других тканях.
Кромолин-натрий
Кромолин-натрий (интал) эффективен только для
предупреждения аллергических реакций. Для купирования острых
проявлений аллергии (в том числе и приступов бронхиальной астмы)
препарат не применяют. Кромолин-натрий наиболее
эффективен у больных молодого возраста (особенно у детей).
Противоаллергический эффект препарата появляется не сразу, а только
в течение нескольких недель регулярного применения.
Механизм противоаллергического действия препарата не совсем ясен.
Кромолин-натрий угнетает высвобождение медиаторов
аллергии из тучных клеток и базофилов. Возможно, что его действие
частично связано с угнетением чувствительных нервных
окончаний бронхов и блокадой местных рефлексов,
стимулирующих воспаление.
Глюкокортикоиды
Глюкокорпгикостеронды (глюкокортикоиды) улучшают
бронхиальную проходимость при бронхиальной астме, оказывая
противовоспалительное и противоаллергическое действие, что в
основном связано с угнетением фосфолипазы А2 и уменьшением
образования из мембранных фосфолипидов медиаторов,
образующихся в результате липооксигеназного и циклооксигсназно-
го пути ее метаболизма. Пероральное применение глюкокорти-
костероидов сопровождается многочисленными побочными
эффектами, которые можно существенно уменьшить, используя
ингаляционное введение гормональных препаратов в форме
аэрозолей (например, беклометазон). Назальные спреи с глю-
кокортикостероидами (например, беклометазон, будесонид) дают
хороший лечебный эффект при поллинозе и аллергическом
рините, когда затруднение носового дыхания не устраняется
применением антигистаминных средств. Пероральное
применение гормонов может быть необходимо при
неэффективности других видов лекарственной терапии.
Тяжёлый приступ бронхиальной астмы
При тяжелом приступе бронхиальной астмы применяют
ингаляции кислорода в сочетании с ингаляционным или
внутривенным введением Рг-адроюмиметиков (например, сальбута-
мола). Затем внутривенно вводят гидрокортизон, который
начинает действовать только через несколько часов. Можно
ингаляционно вводить ипратропий (атровента), однако этот
препарат может вызвать болезненные позывы к мочеиспусканию.
Если проводимая лекарственная терапия не дает эффекта, то
внутривенно вводят эуфиллин (аминофиллин), хотя
эффективность его использования в данной ситуации не доказана. Иногда
при тяжелом приступе бронхиальной астмы возникает
необходимость проведения искусственной вентиляции легких (ИВЛ).
Антигистоминные средства
Антигистаминные средства, блокирующие Нргистаминовыс
рецепторы, используют в основном при таких аллергических
состояниях, как поллиноз, крапивница, отек Квинке,
лекарственная и инсектная аллергия. Нггистаминоблокаторы
первого поколения (например, димедрол, супрастнн, дипразин)
обладают м-холиноблокирующим действием и проникают через
гематоэнцефалический барьер, вызывая сонливость и
некоторые психомоторные нарушения. Нггистаминоблокаторы
второго поколения (например, астемизол, терфенадин) не
обладают м-холиноблокирующей активностью и не проникают через
гематоэнцефалический барьер, поэтому не оказывают седатив-
ного действия, однако они менее эффективны, чем препараты
первого поколения. Терфенадин и астемизол могут вызывать
нарушения сердечного ритма, поэтому их нельзя сочетать с
другими аритмогенными средствами (например, с три
циклическими антидепрессантами и нейролептиками).
29
12. Лекарственные средства, действующие
на желудочно-кишечный тракт. I. Противоязвенные средства
Аитациды
NaHC03
CaC03
Мд(ОНJ
А1(ОНK
I Нейтрализация
RH
Подавление
Helicobacter pylori
ТРОЙНАЯ ТЕРАПИЯ
Дв-нол
Мвтронидазол
Амоксициллин
Омвпразол
Кларитромицин
Мвтронидазол
Гастропротекторы
Сукральфат
Препараты висмута
Простагландины
Антисекреторные
средства
ИНГИБИТОРЫ
ПРОТОНОВОГО НАСОСА
Омвпразол
М-ХОЛИНОБЛОКАТОРЫ
Пиренэепин
Н2-ГИСТАМИНО-
БЛОКАТОРЫ
Циметидин
Ранитидин
Паракринные
клетки
Париетальные
клетки
Пептическая язва (язвенная болезнь) — это изъязвление
слизистой оболочки желудка и луковицы двенадцатиперстной
кишки, связанное с воздействием соляной кислоты и пепсина
желудочного сока. Основные противоязвенные средства либо
понижают желудочную секрецию (антисекреторные средства, в
правой части рисунка), либо увеличивают резистентность
слизистой оболочки к воздействию соляной кислоты и пепсина
(гастропротекторы, в нижней части рисунка слева).
Секрецию соляной кислоты париетальными клетками
желудка угнетают Н2-п1Стаминоблокаторь1, которые являются
препаратами первого ряда при лечении язвенной болезни. Омеп-
разол понижает кислотность желудочного сока, необратимо
угнетая протоновый насос (Н+/К+-АТФазу) париетальных
клеток желудка, обеспечивающий секрецию Н*. Препарат высоко
эффективен даже при язвенной болезни, резистентной к
терапии Н2-гистаминоблокаторами. Пиренэепин (гастроцепин) —
мгхолиноблокатор с относительно селективным влиянием на
желудочно-кишечный тракт. Препарат понижает секрецию
соляной кислоты менее эффективно, чем Н2-гистаминоблокато-
ры, поэтому используется редко. Гастропротекторы (средства,
защищающие слизистую оболочку желудка) стимулируют
заживление язвы, обволакивая язвенную поверхность и защищая
ее от воздействия соляной кислоты и других раздражающих
факторов (в левой части рисунка). Они не только обеспечивают
механическую защиту слизистой оболочки желудка, но и
повышают секрецию НС03~ и нормализуют значение рН в слое
слизи, вырабатываемом мукозными клетками.
Прекращение приёма противоязвенных средств может
привести к рецидиву язвы. Имеются сведения об эффективности
применения хелатных комплексов висмута (например, де-нола)
для противорецидивного лечения пептических язв, однако
механизм их противоязвенного действия не совсем ясен.
Возможно, он связан с антибактериальной активностью препаратов
висмута в отношении Helicobacter pylori, присутствие которой
является важным этиологическим фактором в образовании язвы.
Инфекция H.pyiori приводит к хронической гипергастринемии,
которая в свою очередь стимулирует продукцию соляной
кислоты и вызывает язву (в нижней части рисунка справа). Для
подавления H.pyiori используют комбинированное применение
антибактериальных средств (в левой части рисунка в центре).
Антадиды (в верхней части рисунка слева) — это соединения
основного характера, нейтрализующие соляную кислоту желудка
и нормализующие значение рН желудочного сока (в левой
части рисунка). Они эффективны при различных видах
диспепсий, симптоматически облегчают течение язвенной болезни и
рефлюкс-эзофагита. В группу антацидных средств относится
большое количество препаратов, содержащих смесь
соединений магния и алюминия.
30
Париетальная клетка
Ацх
n. vagus
Обволакивание
основания
язвы
Уничтожение
Н. pylori v
Мукоэная
клетка
Слизь
АТФ
цАМФ
-Гастрин
Гастрин
Секреция соляной кислоты
Париетальные клетки секретируют соляную кислоту в
просвет желудка с помощью уникальной Н+/К+-АТФазы (прото-
нового насоса), которая катализирует обмен внутриклеточного
Н+ на внеклеточный К\ Секрецию НС1 стимулирует ацетил-
хмин> выделяющийся окончаниями постганглионарных
волокон n.vagus (в правой части рисунка), и гастрин,
высвобождаемый в кровоток из Г-клеток слизистой оболочки антральной
части желудка в результате воздействия химических веществ
(аминокислоты и белки пищи) и механических раздражителей.
Париетальные клетки желудка содержат мгхолинорецепто~
ры и гастриновые (Г) рецепторы. Ацетилхолин и гастрин
стимулируют секрецию соляной кислоты преимущественно
непрямым путём, увеличивая высвобождение гистамина из паракрин-
ных клеток, расположенных рядом с париетальными. Гиста-
мин, активируя Н2-гистаминовыс рецепторы париетальных
клеток, вызывает повышение внутриклеточной концентрации
цАМФ и усиление секреции соляной кислоты. Поскольку
ацетилхолин и гастрин реализуют свои эффекты через усиление
выделения гистамина, то действие гастрина и стимуляции n.vagus
на секреторную активность париетальных клеток желудка
уменьшается применением Н^-гистаминоблокаторов.
Холиномиметики могут стимулировать секрецию соляной
кислоты в присутствии Н2-гистаминоблокаторов. Этот факт
свидетельствует о том, что влияние ацетилхолина на секреторную
активность желудка частично связано с его прямым
воздействием на м-холикорецепторы париетальных клеток. Гастрин
также может оказывать непосредственное влияние на
париетальные клетки желудка, увеличивая секрецию соляной
кислоты; этот эффект гастрина усиливается при активации гистами-
новых рецепторов.
Защитные факторы
Слой слизи образует механический барьер (толщиной в
среднем 500 цт) на поверхности слизистой оболочки желудка и
проксимального отдела двенадцатиперстной кишки и состоит
из мукозного геля, в который секретируется НС03~. Внутри
геля НСОз~ нейтрализует соляную кислоту, поступающую из
просвета желудка. Это создает градиент рН, и слизистая
оболочка желудка поддерживает нейтральный рН, даже когда в
просвете желудка значение рН=2. Слизистой оболочкой
желудка синтезируются простагландины группы Е2 и 12, которые
оказывают гастропротекториое действие, стимулируя секрецию
слизи и бикарбоната, а также увеличивая кровоток в слизистой
оболочке желудка.
Противоязвенные средства
Лекарственные средства, уменьшающие секрецию желёз
желудка
Антагонисты Нъ-гистаминовых рецепторов {Нг-гистаминоб-
локаторы). Циметидин и раиитидин хорошо всасываются при
пероральном применении. Они блокируют действие гистамина
на париетальные клетки, понижая их секреторную активность.
Эти препараты ускоряют заживление язв и уменьшают
выраженность болевого синдрома. Побочные эффекты при их
применении выражены слабо. Циметидин может оказывать анти-
андрогенное действие и вызывать гинекомастию. Циметидин,
связываясь с цитохромом Р-450, может угнетать печёночный
метаболизм некоторых лекарств (например, неодикумарина,
теофиллина, фенитоина).
Впокаторы протонового насоса, Омепразол неактивен при
нейтральной рН, но в кислой среде превращается в активные
метаболиты, которые реагируют с сульфгидрильными группами
Н+/К+-АТФазы (протонового насоса), ответственной за
транспорт ионов Н+ из париетальных клеток. Так как фермент
блокируется необратимо, то секреция соляной кислоты
возобновляется только после синтеза нового энзима. Это особенно
важно для лечения пациентов с синдромом Золлингера-Эллиссо-
на (редкое состояние, обусловленное опухолью (гастриномой)
клеток поджелудочной железы, секретирующей гастрин), а также
с рефлюкс-эзофагитом. резистентных к действию других
противоязвенных средств.
Н. pylori — это подвижная спиральной формы
грамотрицательная бактерия, которая паразитирует глубоко в мышечном
слое, где значение рН~7,0 является оптимальной для ее роста.
Бактерия поражает поверхностный эпителиальный слой
слизистой оболочки желудка, выделяя токсины и аммоний,
которые, обладая сильной уреазной активностью, вызывают
повреждение клеток. Гастрит, связанный с инфекцией Н. pylori, может
существовать годами или всю жизнь, что обусловлено высокой
секрецией гастрина и вследствие этого повышенной базальной
секрецией НС1. Увеличение продукции гастрина может быть
результатом образования цитокииов в зоне воспаления.
Трофический эффект гипергастринемии связан с увеличением
количества париетальных клеток, секретирующих HCI в ответ на
гастрин. В двенадцатиперстной кишке соляная кислота
вызывает повреждение слизистой оболочки и метаплазию клеток в
гастральный фенотип. Хроническое воспаление этих клеток
приводит к образованию язвы. Ликвидация Н. pylori
значительно снижает секрецию НС1, что способствует заживлению язвы
двенадцатиперстной кишки и, вероятно, язв желудка.
Стандартная тройная терапия язвенной болезни включает
одновременное назначение метронидазола, амоксициллина и препаратов
висмута B недели). Это уничтожает //. pylori у 70-80%
пациентов, но при этом часто отмечаются побочные эффекты
(тошнота, понос). Комбинированное применение омепразола, кла-
ритромицина и метронидазола ликвидирует бактерии И. pylori
у 95-100% больных в течение 1-й недели и вызывает при этом
мало побочных эффектов. Серьезную проблему создаёт в
последнее время резистентность бактерий к метронидазолу.
Гастропротекторы (лекарственные средства, защищающие
слизистую оболочку желудка). Препараты висмута (например, де-
нол, десмол) могут действовать подобно сукральфату (вентер).
Они обладают высоким сродством к гликопротеинам
слизистой оболочки, особенно некротических тканей язвенной
поверхности; при этом язва покрывается защитным слоем поли-
мергликопротеинового комплекса. Сукральфат полимеризует-
ся при значениях рН ниже 4 и образует очень клейкий гель,
интенсивно покрывающий язвенную поверхность. Висмут
может окрашивать зубную эмаль и кал в тёмный цвет. Препараты
висмута и сукральфат применяют натощак, так как они могут
образовывать комплексы с белками пиши.
Антациды
Антациды увеличивают рН желудка. Это повышает скорость
его опорожнения, что приводит к укорочению их эффекта.
Повышение рН стимулирует секрецию гастрина, а значит, и
секрецию HCI. Для предупреждения развития этого
компенсаторного эффекта требуется назначение высоких доз антацидов.
Применение антацидов в таких дозах способствует
заживлению язвы, но подобное лечение практикуется редко.
Натрия гидрокарбонат — единственный водорастворимый ан-
тацид. Он оказывает быстрое антациднос действие.
Применение натрия гидрокарбоната в высоких дозах может привести к
развитию алкалоза вследствие его всасывания в кровь.
Магния оксид и магния трисиликат не растворимы в воде и
оказывают достаточно быстрое антацидное действие. Они
вызывают диарею, так как обладают слабительным действием.
Алюминия гидроокись действует медленно. А13+ образует
комплексы с некоторыми лекарственными веществами (например,
с тетрациклинами). Применение препаратов алюминия может
вызывать запор. Комбинация соединений магния и алюминия
позволяет уменьшить нежелательное воздействие на моторику
желудочно-кишечного тракта.
31
13. Лекарственные средства, действующие на желудочно-кишечный
тракт. II. Средства, влияющие на моторику и секрецию
Проптотослшлмтьлъныо
средств»
ГЛЮКОКОРТИКО-
СТЕРОИДЫ
Гцдрокортиэон
Преднизалон
(внутрь, рвктально)
Сульфасалазин
Месалазин
Холелитолигики
ПРЕПАРАТЫ ЖЕЛЧНЫХ
КИСЛОТ:
Хенодезоксихолевой
Урсодезоксихолевой
Печень
поджелудочной
Панкреатин
ОБЪЁМНЫЕ
Отруби
Метилцеллюлоза
ОСМОТИЧЕСКИЕ
MoS04
Лактулоза
СТИМУЛЯТОРЫ
ХЕМОРЕЦЕГТТОРОВ
Бисакодил
Препараты сенны
РАЗМЯГЧАЮЩИЕ
КАЛОВЫЕ МАССЫ
Дркуэат
Вазелиновое масло
Цизаприд
Метоклопрамид
Домперидон
Поджелудочная
железа
Спазмолитики
М-Х0ЛИНОБЛ0КАТОРЫ
Атропин
Пропантелин
Дицикломин
Подслизистое нервное сплетение
Межмышечное
сплетение
- Продольные мышцы
- Циркулярные мышцы
. Подслизистый
слой
- Слизистая оболочка
Антидиарейны*
средстве
опиоиды
Морфин
Кодеин
Дифеноксилат
Лоперамид
АДСОРБЕНТЫ
Каолин
Моторная и секреторная функции желудочно-кишечного
тракта контролируются вегетативной нервной системой.
Брюшной отдел вегетативной нервной системы представлен гангли-
онарными сплетениями, связанными нервными волокнами с
гладкой мускулатурой, слизистой оболочкой кишечника и
сосудами. Парасимпатические нервные волокна оказывают
возбуждающее воздействие, а симпатические — угнетающее
влияние на моторную и секреторную активность кишечника.
Холиномиметикн (например, карбахолин и прозерин)
усиливают моторику кишечника и могут вызвать колику и диарею.
Иногда их используют для лечения паралитического илеуса (см.
главу 8). Значительно чаше применяют стимуляторы моторики
кишечника (прокинстики) (в нижней части рисунка слева),
усиливающие высвобождение ацетилхолина из межмышечного
сплетения. Их используют при рефлюкс-эзофагите и при
задержке эвакуации пищи из желудка. Слабительные средства (в
нижней части рисунка слева) увеличивают моторику
кишечника и ускоряют дефекацию. Слабительные, увеличивающие объём
кишечного содержимого (наполнители, или объемные
слабительные), стимулируют механорецепторы кишечной стенки.
Слабительные, стимулирующие хеморецепторы слизистой
кишечника, усиливают перистальтику, оказывая возбуждающее
влияние на межмышечное нервное сплетение кишечника.
Некоторые слабительные средства размягчают каловые массы.
М-холиноблокаторы (в верхней части рисунка справа)
угнетают моторику кишечника, их используют в качестве
спазмолитиков при кишечной колике. К противодиарейным средствам
(в нижней части рисунка справа) относятся вещества,
угнетающие перистальтику, и что еще более важно, особенно при
диарее инфекционного генеза и у новорождённых,
предупреждающие потерю воды и электролитов.
Противовоспалительные средства — такие, как глюкокорти-
костероиды и аминосалицилаты (вверху слева), используют при
язвенном колите и болезни Крона. Для снижения дозы глюко-
кортикостероидов их обычно комбинируют с иммунодепрес-
сантами (например, с азатноприном).
Через общий жёлчный проток, регулируемый сфинктером
Одди, в двенадцатиперстную кишку поступают желчь и
панкреатический сок (в верхней части рисунка справа). Препараты
жёлчных кислот (в верхней части рисунка в центре) иногда
используют для растворения холестериновых камней в
жёлчном пузыре. Панкреатические ферменты (в левой части
рисунка) применяют перорально при недостаточной функции
поджелудочной железы в качестве средств заместительной терапии.
32
Жёлчный пузырь
CpeneiMp применяемы»
прикопит»
Жёлчный проток
Просвет кишечника
Механо-
рецепторы
- Кршечноб.'
содержимбе/
Слабительны*
Стимуляторы моторики
Стимуляторы моторики кишечника
Метоклопрамид (реглан, церукал) и домперидон являются
антагонистами дофамина. Они оказывают противорвотное
действие, блокируя центральные 02-дофаминовые рецепторы хе-
морецепторной (пусковой) зоны (см. главу 30). Препараты
усиливают моторику желудка и повышают тонус нижнего
сфинктера пищевода, ускоряя опорожнение желудка. Прокинетичес-
кая активность метоклопрамид а и домперидона в большей
степени связана с их способностью увеличивать высвобождение
ацетил холи на из межмышечного сплетения. Цизаприд также
усиливает моторику кишечника, способствуя высвобождению
ацетилхолина, но он не является антагонистом дофамина и не
обладает противорвотным действием.
Слабительные средства
Запор характеризуется чувством дискомфорта в животе,
потерей аппетита, общей слабостью из-за недостаточного
опорожнения кишечника. Запор приводит к уплотнению кала.
Частота и объём дефекации лучше всего регулируются диетой.
Наполнители (объёмные слабительные) стимулируют
перистальтику кишечника, увеличивая объём кишечного
содержимого. Такое действие оказывают неперевариваемые
полисахариды: целлюлоза (отруби) и метил целлюлоза. Осмотические
слабительные увеличивают объём кишечного содержимого,
оказывая осмотический эффект и удерживая воду в просвете
кишечника. К ним относятся лактулоза (нормазе) и соли,
плохо всасывающиеся в кишечнике (магния сульфат и натрия
сульфат).
Некоторые слабительные (стимуляторы хеморецепторов)
усиливают моторику кишечника, раздражая хеморецепторы
слизистой оболочки и нервных сплетений. При их применении
возможны спастические боли в животе. Основными
представителями этой группы препаратов являются антрагликозиды
растительного происхождения. Из антрагликозидов,
содержащихся в листе сенны, коре крушины и других растениях, в
кишечнике высвобождаются антрахиноны, которые, раздражая
хеморецепторы, стимулируют межмышечное сплетение и
усиливают перистальтику кишечника. Бисакодил оказывает
слабительное действие, раздражая чувствительные нервные
окончания кишечной стенки.
Средства, вызывающие размягчение каловых масс, оказывают
послабляющее действие. Они способствуют дефекации,
вызывая размягчение каловых масс (докузат) и смазывая стенки
кишечника (вазелиновое масло), что облегчает эвакуацию кала.
Длительное применение вазелинового масла может привести к
нарушению всасывания жирорастворимых витаминов А и D.
Антидиарейные средства
Инфекционная диарея — частая причина заболеваемости и
высокой смертности в развивающихся странах. Причиной
многих тяжёлых случаев инфекционной диареи являются
бактерии, но чаще встречается диарея вирусной этиологии. Для
симптоматического лечения при острой диарее лёгкой формы и
средней тяжести используют средства, уменьшающие
перистальтику кишечника. Опиоиды — такие, как морфин, дифенок-
силат и кодеин, активируют ц-рецепторы межмышечных
нейронов, вызывая гиперполяризацию мембран за счёт
увеличения калиевой проводимости. Это тормозит высвобождение
ацетилхолина из мезентериального сплетения и понижает
моторику кишечника. Наиболее подходящим опиоидом для
воздействия на кишечник является лоперамид (имодиум), так как он
практически не проникает через гематоэнцефалический
барьер и проявляет слабое центральное действие. Развитие
лекарственной зависимости к этому препарату маловероятно.
Для лечения диареи (самостоятельно или в сочетании с
другими средствами) используют адсорбенты (такие, как каолин),
но их эффективность в этом отношении сомнительна.
Регидратационная терапия. Для ликвидации выраженной
дегидратации при диарее, являющейся следствием инфекции или
интоксикации организма, перорально вводят растворы,
содержащие электролиты и глюкозу.
Антибиотики (в основном тетрациклины) обычно
применяют только при инфекционной диарее (например, при холере,
бациллярной дизентерии). В отношении большинства
бактерий, вызывающих диарею, эффективны хинолоны —
относительно новые антибактериальные средства (см. главу 37).
Лекарственные средства, применяемые
при воспалительных заболеваниях кишечника
Воспалительные заболевания толстого кишечника делятся
на две группы:
1) болезнь Крона (гранулематозный колит) — поражен весь
кишечник;
2) язвенный колит — поражен только толстый кишечник.
При обострении колита используют стероидные
противовоспалительные средства — глюкокортикостероиды (например, пред-
низолон; см. главу 33). Однако выраженные побочные
эффекты, отмечающиеся при их применении, снижают их значимость
в качестве средств поддерживающей терапии. Наименьшие
побочные эффекты отмечаются при использовании будесони-
да — глюкокортикостероида, плохо всасывающегося в
кишечнике и поэтому практически не вызывающего угнетения
надпочечников. При болезни Крона и неспецифическом
язвенном колите лёгкой формы, а также в качестве средств
поддерживающей терапии эффективны аминосалицилаты. Сульфаса-
лазин (салазосульфапиридин) представляет собой соединение
5-аминосалициловой кислоты с сульфаниламидом. Молекула
сульфасалазина под влиянием бактерий в кишечнике
распадается с образованием 5-аминосалициловой кислоты, которая
обладает противовоспалительной активностью, и сульфапириди-
на, который подвергается абсорбции и может вызвать
нежелательные эффекты, характерные для группы сульфаниламидов
(тошнота, сыпь, изменение картины крови). Новым, менее
токсичным препаратом 5-аминосалицилата является месалазин.
Олсалазин (азодисалицилат) содержит 2 молекулы
5-аминосалициловой кислоты, соединённые азосвязыо. Аминосалицило-
вая кислота высвобождается из олсалазина под влиянием
бактерий в кишечнике. Механизм действия 5-аминосалицилатов
неизвестен.
Лекарственные средства, применяемые для растворения
жёлчных камней (холелитолитики)
Жёлчь содержит холестерин и жёлчные соли, последние
играют важную роль в поддержании холестерина в растворенном
состоянии. Увеличение концентрации холестерина и
снижение содержания жёлчных солей может привести к
образованию холестериновых камней. Основным способом удаления
жёлчных камней из жёлчного пузыря является
лапароскопическая холецистэктомия. Однако небольшие некальцинирован-
ные камни могут быть растворены в результате длительного
перорального применения препаратов жёлчных кислот (хено-
дезоксихолевой или урсодезоксихолевой), которые уменьшают
содержание холестерола в жёлчи, ингибируя З-гидрокси-3-ме-
тилглутарилкоэнзим А-редуктазу — энзим, участвующий в
синтезе холестерина. Хенодезоксихолевая кислота часто вызывает
диарею, а иногда и поражение печени.
Панкреатические ферменты
Панкреатический сок содержит ферменты, которые
расщепляют белки (трипсин, химотрипсин), углеводы (амилаза) и жиры
(липаза). При некоторых заболеваниях поджелудочной железы
(хронический панкреатит и кистозный фиброз) отмечается
снижение содержания или отсутствие этих ферментов в
панкреатическом соке. При недостаточности функции поджелудочной
железы применяют панкреатин, который содержит протеазу,
липазу, амилазу. Панкреатические ферменты инактивируются
соляной кислотой желудка, поэтому перед их использованием
назначают Н2-гистаминоблокаторы (например, циметидин). В
последнее время стали появляться новые препараты
панкреатических ферментов, покрытые оболочкой, которая
растворяется в кишечнике (кишечно-растворимые таблетки и драже),
поэтому энзимы не подвергаются воздействию HCI.
33
14. Лекарственные средства, специфически влияющие на почки:
диуретики (мочегонные средства)
Петлевые диуретики
Фуросемид
Бумвтанид
Угнетение
(Проксимальный
'каналец
Просвет
Реабсорбция в дне-
тальном канальце
регулируется •
альдостероиом I
Тиаэиды
Бендрофлуаэид
Гидрохлоротиазид
Мвтолазон
_Голстый сегмент
восходящей части
петли Генле ,
Собирательная
трубка
Альдостерон
Баэолатеральная
мембрана
70 мВ
Клетка канальца
NB! клеточная
мембрана Люминальная
непрони- мембрана
цаема для НСОэ~
50 мВ
Просвет
Карбо-
ангидраэа
(цитоэольная)
Калийсбврегающие
диуретики
Спиронолактон
Амилорид
Триамтврен
Блок
Na -каналов
ЗОмВ
Реабсорбция Na (стимулируется
альдостероном) усиливает секрецию К* и Н*
Антипорт
Синпорт
Каналы
Диуретики — лекарственные средства, специфически
действующие на почки и увеличивающие выведение из организма
мочи. Действие большинства диуретиков связано с их
способностью угнетать процесс реабсорбции электролитов в
почечных канальцах. Увеличение экскреции электролитов
сопровождается повышением экскреции соответствующего количества
воды. Диуретики используют для уменьшения отёков при
застойной сердечной недостаточности, болезнях почек, циррозе
печени и других заболеваниях. Некоторые мочегонные средства
(например, тиазиды) широко используют для лечения
артериальной гипертензии, но гипотензивное действие этих
препаратов связано не только с их диуретическими свойствами.
Тиазиды и тиазидоподобные препараты (в верхней части
рисунка справа) — это мочегонные средства с умеренной
диуретической активностью, эффективные и безопасные при перо-
ральном применении. Наиболее мощно увеличивают диурез
петлевые диуретики (в верхней части рисунка слева). Они
действуют очень быстро, но обычно непродолжительно. Эти
препараты вызывают максимальный диурез. При их применении
возможны серьёзные электролитные нарушения и
дегидратация. Метолазон — это тиазидоподобный препарат, по
активности находящийся между петлевыми диуретиками и ти азидам и.
Метолазон является синергистом фуросемида. Комбинация этих
препаратов может быть эффективна при почечной
недостаточности с устойчивыми отёками. Тиаэиды и петлевые диуретики
увеличивают выведение калия из организма, поэтому для
предупреждения развития гипокалиемии их применяют совместно
с препаратами калия.
Некоторые диуретики (в нижней части рисунка справа)
являются калийсберегающими. Они обладают слабой
диуретической активностью. Препараты этой группы часто используют в
комбинации с тиазидами и петлевыми диуретиками для
предупреждения гипокалиемии.
Ингибиторы карбоангидразы (в нижней части рисунка слева)
оказывают слабое диуретическое действие, поэтому в качестве
мочегонных средств их используют редко. Осмотические
диуретики (например, маннитол) — это вещества, которые
фильтруются в клубочках почек, но плохо реабсорбируются в почечных
канальцах, создавая высокое внутриканальцевос осмотическое
давление, и выделяются почками в неизменном виде с изоос-
мотическим количеством воды. Их используют при отеке
мозга и для форсированного диуреза.
Основной путь выведения большинства лекарственных
веществ из организма — экскреция почками. Нарушение
функции почек в пожилом возрасте или при их заболевании может
вызвать значительное нарушение экскреции лекарственных
средств.
34
Ингибиторы
карбоангмдрюы
Ацетазоламид
Менее активны:
Тиазиды
и петлевые
диуретики
Антагонизм
Дистальный каналец
NaV^-АТФаза
Карбо-
ангидраза
Минералокортикоид альдостерон стимулирует реабсорбцию
Naf в дистальных канальцах и собирательных трубках,
повышает секрецию и выделение с мочой К* и Н*. В цитоплазме
клетки он взаимодействует с альдостероновыми рецепторами,
образовавшийся комплекс поступает в ядро — в результате
усиливается синтез белков, необходимых для увеличения
транспорта Na+: Ыа*/К+-АТФазы базолатеральной мембраны и пер-
меазы, увеличивающих проницаемость натриевых каналов.
Диуретики повышают концентрацию Na+ Ь просвете
дистальных канальцев и (кроме калийсберегающих препаратов)
усиливают секрецию и выведение К* с мочой. Этот эффект
выражен сильнее при повышенном уровне альдостерона в плазме
крови. Интенсивная терапия диуретиками может приводить к
истощению запасов Na в организме.
Ингибиторы карбоангндразы уменьшают реабсорбцию Na* в
проксимальных канальцах, угнетая процессы гидратации С02,
приводящие к образованию угольной кислоты, служащей
источником Н* (Н+ поступают в просвет канальцев в обмен на
Na+). Ингибиторы карбоангндразы увеличивают экскрецию
НСОз", Na+ и Н20. Потеря организмом бикарбонатов может
привести к возникновению метаболического ацидоза, что
сопровождается снижением диуретического эффекта
ингибиторов карбоангндразы. Таким образом, снижая содержание
бикарбонатов в крови, они уменьшают свое собственное
мочегонное действие. Повышение концентрации Na* в дистальном
отделе нефрона ведёт к увеличению секреции К*. Диакярб (аце-
тазоламид) используют при глаукоме для снижения
внутриглазного давления за счёт подавления образования НС03~ и
уменьшения секреции водянистой влаги. Диакарб также применяют
как профилактическое средство при острой горной (высотной)
болезни.
Тиаэиды
Тиазиды были созданы в результате модификации
структуры диуретиков из группы ингибиторов карбоангидразы.
Однако диуретическая активность тиазидов не связана с их
влиянием на активность карбоангидразы. Тиазиды широко
применяют при лёгких формах сердечной недостаточности (см. главу
18), при артериальной гипертензии (см. главу 15), что
уменьшает угрозу инсульта. Существует большое количество
тиазидов, но они различаются только по продолжительности
действия. Наиболее широко используемыми диуретиками этой
группы являются дихлотиазид и бендрофлуазид.
Механизм действия тиазидов. Тиазиды действуют в
основном в начальной части дистальных канальцев нефрона, где
угнетают реабсорбцию Na+ и СГ. В результате повышается
выведение из организма Na+, СГ и Н20. Увеличение содержания
Naf в просвете дистальных канальцев стимулирует процессы
обмена Na+ на К+ и Н+, увеличивая их экскрецию и вызывая
гипокалиемию и метаболический алкалоз.
Основные побочные эффекты тиазидов. При применении
тиазидов возможны; слабость, импотенция и кожные сыпи.
Тяжелые аллергические реакции (тромбоцитопения) встречаются
редко. Наиболее часто отмечаются метаболические сдвиги:
1) гипокалиемия, на фоне которой могут возникать аритмии,
особенно у пациентов, принимающих сердечные гликозиды.
Гипокалиемию можно предупредить, комбинируя тиазиды с
препаратами калия или калийсберегающими диуретиками;
2) гиперурикемия. Тиазиды повышают уровень мочевой
кислоты в крови, уменьшая ее экскрецию с мочой, так как они
выводятся из организма теми же транспортными системами,
что и мочевая кислота. Это может привести к обострению
подагры;
3) тиазиды могут нарушать толерантность к глюкозе, поэтому
они противопоказаны больным инсулиннезависимым сахарным
диабетом (II типа);
4) липидный обмен. Тиазиды повышают уровень холестерина
в крови в первые 6 месяцев применения.
Петлевые диуретики
Петлевые диуретики (обычно фуросемид) используют при
сердечной недостаточности средней тяжести и тяжелой формы для
уменьшения периферических отёков и отёка лёгких (см. главу
18). Их применяют внутривенно при отёке лёгких, который
возникает как следствие острой левожелудочковой
недостаточности. В отличие от тиазидов петлевые диуретики эффективны
у пациентов со сниженной функцией почек.
Механизм действия. Петлевые диуретики оказывают тиази-
доподобное влияние на процессы реабсорбции в начальной
части дистальных канальцев, однако основное их действие
связано с угнетением процесса реабсорбции Na+ и С\ в толстом
сегменте восходящей части петли Генле, где реабсорбируется
наибольшее количество ионов. В связи с этим препараты
данной группы являются самыми мощными мочегонными
средствами. Петлевые диуретики селективно блокируют Na*, К+,
2СГ-котранспортёр в апикальной мембране, нарушая
транспорт названных ионов (Na+ активно выводится из клеток Na+/
К+-АТФазой через базолатеральную мембрану в интерстици-
альное пространство), а также повышают экскрецию Mg2+ и
Са2+. Специфичность действия этих препаратов на почки
связана с их способностью концентрироваться в почечных
канальцах. Однако при использовании в высоких дозах петлевые
диуретики могут нарушить электролитный баланс эндолимфы, что
может привести к глухоте.
Побочные эффекты. Петлевые диуретики вызывают
гипергликемию, гиперурикемию, артериальную гипотензию и
гипокалиемию, гипомагниемию и др. Потеря Kf, как и при
действии тиазидов, не имеет клинического значения, пока не
возникает риск развития аритмии (например, при лечении дигок-
сином). Активное использование петлевых диуретиков
(высокие дозы, внутривенное введение) может вызвать обратимое
ухудшение слуха (при комбинировании с другими ототокси-
ческими средствами часто возникает глухота необратимого
характера).
Калийсберегающие диуретики
Эти диуретики действуют на альдостеронзависимый участок
дметального отдела нефрона, где контролируется гомеостаз К+.
Альдостерон, увеличивая реабсорцию Na+, вызывает
отрицательный электрический потенциал в просвете канальцев, за счёт
чего осуществляется перенос К+ и Н+ (при этом повышается
их секреция и экскреция). Калийсберегающие диуретики
понижают реабсорбцию Na+, конкурируя с альдостероном за ци-
топлазматические рецепторы (спиронолактон — конкурентный
антагонист альдостерона) или блокируя натриевые каналы
апикальной мембраны (амилорид, триамтерен); при этом
снижается способность клеток секретировать К+. Препараты данной
группы могут вызвать гиперкалием и ю, особенно на фоне
нарушения функции почек. Гиперкалиемия также возможна у
пациентов, принимающих одновременно с диуретиками
ингибиторы ангиотензинпревращающего фермента (например, каптоп-
рил), поскольку последние тормозят высвобождение
альдостерона, а значит, усиливают гиперкалиемию.
Спиронолактон конкурентно блокирует связывание
альдостерона с цитоплазматическими рецепторами, в результате чего
увеличивается экскреция Na+ (а также СГ и Н20) и
уменьшается секреция К+. Препарат является слабым диуретиком, так
как только 2% Na*, профильтрованного в клубочках,
реабсорбируется при участии альдостерона. Некоторые метаболиты спи-
ронолактона вызывают рак у мышей, поэтому в настоящее время
его используют только при печёночном асците и синдроме Кона
(первичный гиперальдостеронизм).
Амилорцд и триамтерен снижают проницаемость апикальной
мембраны для Na+ в дистальном отделе нефрона, блокируя
натриевые каналы в отношении 1:1. Это увеличивает экскрецию
Na+ (а также СГ и Н20) и уменьшает экскрецию К+.
35
15. Лекарственные средства,
применяемые при артериальной гипертензии
Препараты
центрального
действия
Клофелин
Метилдофа
Продолговатый
мозг
Ангиотензиноген
Ренин
^-адреноблокаторы
Pl/P2
Пропрвнолол
р, (кардио-
селективные)
Атвнолол
Мвтопролол
Тиаэидовые диуретики
Бендрофлуазид
Гидрохлоротиаэид
Другие |
Тиазиды
(длительное применение)
Венозные(ёмкостные)
сосуды
Ваэодилятаторы
Ингибиторы ангиотензин-
превращающего
фермента
Каптоприл
Эналаприл
Антагонисты
ангиотензина It
Лозартан
Антагонисты кальция
Нифедипин
Амлодипин
оц -адреноблокаторы
Празозин
Доксазозин
Активаторы К -каналов
Миноксидил
Донаторы NO (ЭРФ)
Нитропруссид
Неизвестного
механизма
Гидралазин
Высокое артериальное давление уменьшает
продолжительность жизни и увеличивает риск инсульта, заболеваний сердца
и других органов (например, ретинопатии, почечной
недостаточности). К сожалению, до сих пор точные показания к
проведению антигипертензивной терапии не определены.
Снижение артериального давления у пациентов с показателем диас-
толического давления свыше 90 мм рт.ст. обычно
сопровождается уменьшением смертности и заболеваемости, однако это
касается лишь 25% всего населения. В Англии принято
начинать лечение артериальной гипертензии при уровне диастоли-
ческого давления более 100 мм рт.ст., а систолического —
более 160 мм рт.ст. К факторам риска гипертонической болезни
относятся: курение, ожирение, гиперлипидемия, сахарный
диабет, гипертрофия левого желудочка. Вторичная артериальная
гипертензия развивается при почечных и эндокринных
заболеваниях. У некоторых пациентов с артериальной гипертензией
лёгкой формы уровень артериального давления нормализуется
при снижении веса, уменьшении в рационе питания
поваренной соли и отказе от употребления алкоголя, однако
необходимость проведения медикаментозной терапии сохраняется.
В настоящее время препаратами первого ряда для лечения
артериальной гипертензии являются р-адреноблокаторы (в
центре рисунка слева) и тназидовые диуретики (в верхней части
рисунка справа). Однако механизм их гипотензивного действия
не вполне ясен. Для лечения артериальной гипертензии
используют средства, уменьшающие тонус сосудов и
понижающие периферическое сопротивление току крови. Наиболее
важными из них являются ингибиторы ангиотензинпревращающего
фермента (АПФ), уменьшающие уровень циркулирующего в
крови ангиотензина II (вазоконстриктора), и антагонисты
кальция (в центре рисунка справа), блокирующие медленные
кальциевые каналы в гладкой мускулатуре сосудистой стенки.
Другие ваэодилятаторы (в нижней части рисунка справа) в
настоящее время используют редко, хотя определенный интерес
вызывает применение агадреноблокаторов, которые оказывают
благоприятное воздействие на липидный обмен в крови.
Препараты с центральным действием (в верхней части рисунка
слева) уменьшают тонус сосудов, стимулируя центральные а2-ад-
ренорецепторы, однако они также редко используются из-за
выраженных побочных эффектов.
При артериальной гипертензии лёгкой и средней тяжести
обычно применяют одно гипотензивное средство (тиазидовый
диуретик или р-адреноблокатор), при недостаточном
гипотензивном эффекте монотсрапии используют комбинацию двух
препаратов (например, диуретик и р-адреноблокатор или
диуретик и ингибитор АПФ), при необходимости можно добавить
третий препарат, обычно и|-адреноблокатор (доксазозин).
36
Каротидный синус
Начальный
эффект „ ..
Содержание
Na в орга- I
ниэме {
ОЦК 1
Ангиотензин I
Альдостерон
Симпатические
нервы
Начальный
эффект
Сердечный
выброс
р-адренорецептор
Артериальные
(резистивные)
сосуды
АПФ
Ангиотензин II
Тиаэидовые диуретики
Механизм гипотензивного действия тиазидовых диуретиков
не совсем ясен. В начале их применения артериальное
давление снижается за счёт уменьшения объёма циркулирующей
крови, снижения сердечного выброса и венозного возврата
крови. Постепенно сердечный выброс восстанавливается, но
гипотензивный эффект сохраняется, очевидно, из-за
уменьшения периферического сопротивления сосудов. Диуретики не
оказывают прямого влияния на гладкую мускулатуру сосудов,
а механизм их сосудорасширяющего действия связан с
небольшим, но стабильным снижением содержания Na+ в организме.
Уменьшение концентрации Na* в гладкой мускулатуре сосудов
ведёт к последующему уменьшению концентрации
внутриклеточного Са2+, в результате чего мышцы становятся менее
возбудимыми. Тиазиды могут вызывать гипокалиемию,
обострение сахарного диабета, подагры, повышать уровень
атерогенных липидов в крови (см. главу 14). С применением тиазидов
(чаще, чем с применением р-адреноблокаторов) связаны такие
побочные эффекты, как импотенция и снижение либидо. В
малых дозах, используемых для лечения артериальной гипер-
тензии, тиазиды оказывают незначительный метаболический
эффект.
р-адреноблокаторы
Р-адреноблокаторы в начале терапии снижают артериальное
давление за счёт уменьшения сердечного выброса. При
дальнейшем применении препаратов сердечный выброс
нормализуется, но артериальное давление остается сниженным,
очевидно, за счёт уменьшения периферического сопротивления
сосудов, хотя механизм этого эффекта полностью не выяснен
(отдельные препараты обсуждаются в главе 9). Наиболее
частыми побочными эффектами р-адреноблокаторов являются:
похолодание конечностей и чувство усталости, реже
отмечаются приступы бронхиальной астмы, признаки сердечной
недостаточности и нарушение сердечной проводимости.
Применение р-адреноблокаторов может вызывать повышение уровня
триглицеридов и липопротеидов высокой плотности в крови.
Гипотензивное действие оказывают все представители группы
Р-адреноблокаторов; менее выраженными побочными
эффектами обладают кардиоселективные препараты (Pi-адренобло-
каторы) с гидрофильными свойствами (т.е. препараты,
которые не подвергаются метаболическим превращениям в печени
и не проникают через гематоэнцефалический барьер),
например, атенолол.
Вазрдилятаторы (сосудорасширяющие средства)
Ингибиторы АПФ (ингибиторы ангиотензинпревращающего
фермента). Ангиотензин II является сильным вазоконстрикто-
ром. Ингибиторы АПФ уменьшают образование ангиотензин а
II, что приводит к снижению периферического сопротивления
сосудов и снижению артериального давления. Ингибиторы АПФ
лишены многих побочных эффектов диуретиков и
р-адреноблокаторов. Общим нежелательным эффектом ингибиторов АПФ
является сухой кашель, связанный с повышением содержания
брадикинина в крови (АПФ участвует в метаболизме брадики-
нина). Редкими, но серьёзными осложнениями являются
сосудистый отёк, протеинурия, нейтропения. При первом
применении препаратов этой группы возможно резкое снижение
артериального давления у пациентов, принимающих диуретики
(за счёт уменьшения содержания Na+). Ингибиторы АПФ
могут вызвать почечную недостаточность у пациентов с
двухсторонним стенозом почечных артерий, так как в этом случае для
поддержания адекватной гломерулярной фильтрации
ангиотензин II вызывает сужение постглюмерулярных артериол.
Угнетение образования ангиотензина II незначительно снижает
секрецию альдостерона, но гиперкалиемия развивается только у
пациентов, принимающих препараты калия или калийсберега-
ющие диуретики (альдостерон увеличивает реабсорбцию Na+ и
экскрецию К+; см. главу 14).
Антагонисты ангнотензнновых рецепторов. Лозартан — новый
лекарственный препарат, который снижает артериальное
давление, блокируя ангиотензиновые (ATi) рецепторы. Он не
вызывает кашля, так как не влияет на обмен брадикинина.
Антагонисты кальция (см. главу 16 и 17). Тонус гладкой
мускулатуры сосудов в основном зависит от концентрации цито-
плазмати чес кого Са2+. Увеличение концентрации Са2* в
гладкомышечных клетках сосудов отмечается при возбуждении аг
адренорецепторов (повышение симпатического тонуса).
Активация агадренорецепторов сосудов через увеличение
содержания вторичного мессенджера инозитол-1,4,5-трифосфата
приводит к высвобождению Са'г+ из саркоплазматического ретику-
лума (см. главу 1). В мембранах гладкомышечных клеток
имеются связанные с рецепторами катионные каналы, о которых
мало что известно. Тем не менее эти каналы играют важную
роль. Катионы, проходя через эти каналы, вызывают
деполяризацию мембран, открывая потенциалзависимые кальциевые
каналы (L-типа), через которые происходит вход
дополнительного количества Са5* в клетку. Антагонисты кальция
(например, нифедипин, амлодипнн) связываются с каналами L-типа и,
блокируя вход Са2* в клетку, вызывают расслабление гладкой
мускулатуры артерий. Это приводит к уменьшению
периферического сопротивления сосудов и способствует снижению
артериального давления. Выраженность гипотензивного действия
антагонистов кальция подобна эффекту тиазидов и
р-адреноблокаторов. Побочные эффекты антагонистов кальция связаны
с их выраженным сосудорасширяющим действием и
проявляются в виде головокружения, покраснения кожи и отёка
голеностопного сустава.
агадреноблокаторы. Празозин и доксазозин (препарат
продолжительного действия) вызывают расширение сосудов,
избирательно блокируя агадренорецепторы сосудов. В отличие
от неселективных а-адреноблокаторов применение этих
препаратов редко вызывает тахикардию, но может быть ортостати-
ческая гипотензия (особенно при первом применении
препаратов).
Гидралазин используют в комбинации с р-адреноблокатора-
ми и диуретиками. Побочные эффекты: рефлекторная
тахикардия, которая может спровоцировать приступ стенокардии,
головная боль, задержка жидкости в организме (из-за
вторичного гиперальдостеронизма). У лиц, являющихся медленными
ацетиляторами, гидралазин может вызвать волчаночный
синдром, лихорадку, артральгию, недомогание, гепатит.
Миноксндил (активный метаболит — миноксидила сульфат)
является сильным сосудорасширяющим средством,
применение которого может вызвать активную задержку жидкости в
организме и появление отёков. Однако в комбинации с р-адре-
ноблокаторами и петлевыми диуретиками, препарат
эффективен при артериальной гипертензии, которая не поддаётся
лечению другими средствами. Миноксидила сульфат открывает
АТФ-чувствительные К+-каналы в мембранах гладкомышечных
клеток сосудов, вызывая гиперполяризацию мембран и
расслабление мышц. Эти каналы в норме закрыты внутриклеточной
АТФ, конкурентом которой, по-видимому, является
миноксидила сульфат.
Препараты центрального действия
(средства, угнетающие сосудодвигательный центр)
К гипотензивным веществам центрального действия
относят клофелин (клонидин) и метилдофу (допегит, альдомет).
Метилдофа в адренергических нервных окончаниях
превращается в псевдомедиатор, а-метилнорадреналин, который
стимулирует центральные а2-адренорецепторы тормозных нейронов
сосудодвигательного центра и понижает тонус сосудов. При
применении препарата часто наблюдается задержка в организме
жидкости и солей, у 20% пациентов отмечается положительная
реакция Кумбса и гемолитическая анемия (см. главу 45).
Одним из наиболее эффективных гипотензивных препаратов
является агонист постсинаптических а2-адренорецепторов
центральных нейронов клофелин: при его резкой отмене отмечается
повышение артериального давления.
Гипертонический криз
При гипертоническом кризе лекарственные средства вводят
внутривенно (гидралазин при эклампсии у беременных, нитро-
пруссид при злокачественной гипертензии с энцефалопатией),
затем переходят на пероральный приём препаратов. Нитропрус-
сид метаболизируется в крови, высвобождая NO (эндотелиаль-
ный релаксирующий фактор). N0 стимулирует гуанилатцикла-
зу, способствуя образованию цГМФ в гладкомышечных
клетках сосудов, что приводит к расширению сосудов.
37
16. Антиангинальные средства
р-едреноблоюторы
Пропрвнолол
Другие
(главы 9 и 15)
Уменьшение
постнагрузки
Частота
сердечных сокращений
Сократимость |
Потребность
в кислороде
Уменьшение
пред-
нагруэки
Уменьшение
венозного возврата
Гладкомышечная клетка сосуда
Кальмодулин
Антагонисты
кальции
Нифедипин
Дилтиаэем
Верапамил
лцм -©
Нитраты
Нитроглицерин
Изосорбида
динитрат
Изосорбида
мононитрат
Кровоснабжение миокарда осуществляют коронарные
артерии. С возрастом вследствие атеросклеротического стенозиро-
вания этих сосудов при увеличении нагрузки на сердце
возникает несоответствие между потребностью миокарда в
кислороде и его доставкой коронарным кровотоком. Возникающая при
этом ишемия миокарда характеризуется как «грудная жаба» или
стенокардия. Болевой синдром при стенокардии, вероятно,
связан с накоплением в ишемизированных участках миокарда не-
доокисленных продуктов.
Основными направлениями медикаментозной терапии
стенокардии являются: уменьшение работы сердца (и,
соответственно, уменьшение потребности сердечной мышцы в
кислороде) и увеличение доставки кислорода к сердечной мышце.
Препаратами первого ряда для лечения стенокардии являются
нитраты (в нижней части рисунка). Они вызывают расширение
периферических сосудов, особенно вен, снижая тонус гладкой
мускулатуры сосудов за счёт образования NO и увеличения
содержания внутриклеточного цГМФ (в правой части
рисунка). В результате снижается венозный возврат к сердцу и
уменьшается объём желудочков. Уменьшение напряжения сердечной
мышцы приводит к снижению потребности сердца в
кислороде, что способствует ослаблению болевого синдрома. Для
купирования острых приступов стенокардии нитроглицерин
применяют под язык (чтобы избежать разрушения при первом
прохождении печени). При недостаточной эффективности
монотерапии нитратами их комбинируют с р-адреноблокаторами (в
верхней части рисунка слева) или антагонистами кальция (в
верхней части рисунка в центре).
р-адреноблокаторы уменьшают частоту и силу сердечных
сокращений, в результате чего снижается потребность миокарда
в кислороде. Кроме того, р-адреноблокаторы увеличивают
кровоснабжение ишемизированной зоны, так как, уменьшая
частоту сердечных сокращений, увеличивают продолжительность
диастолы, тем самым удлиняя время коронарного кровотока.
р-адреноблокаторы являются стандартными средствами для
лечения стенокардии, однако из-за выраженных побочных
эффектов к их применению есть много противопоказаний (см.
главу 15). При невозможности использования р-адреноблока-
торов (например, у пациентов с бронхиальной астмой)
совместно с нитратами короткого действия применяют антагонисты
кальция. Антагонисты кальция снижают потребность
миокарда в кислороде, а также вызывают расширение
периферических артерий и артериол, тем самым уменьшая постнагрузку на
сердце. Недавно проведенные исследования показали, что
применение антагонистов кальция короткого действия
(например, нифедипииа и дилтиазема) при стенокардии (и возможно
при гипертонической болезни) может повышать смертность
пациентов. Поэтому в настоящее время предпочтение отдают
веществам длительного действия (например, амлодипнну),
которые применяют один раз в сутки.
При нестабильной стенокардии риск инфаркта миокарда
значительно уменьшает применение аспирина (с целью снижения
агрегации тромбоцитов). Применение аспирина повышает
выживаемость пациентов при инфаркте миокарда и значительно
снижает опасность повторного инфаркта (см. главу 19).
38
Киназа
Сокращение
Гуанилатциклаза
Лёгкие
цели
миозина
(ЛЦМ)
Актин
ГТФ
цГМФ
Система _
циркуляции*
Артериолярные
резистивные сосуды
Венозные
ёмкостные
сосуды
Зона ишемии
Стенокардия имеет типичную симптоматику, являющуюся
следствием развития ишемии миокарда, обычно связанной с
атероматозным сужением просвета коронарных сосудов.
Основные симптомы стенокардии — чувство сжатия в груди, заг-
рудинные боли, обычно иррадиирующие в руку,
провоцируемые нагрузкой и уменьшающиеся во время отдыха или при
применении нитратов.
Стабильная и нестабильная стенокардия. Стабильная
стенокардия характеризуется постоянными по частоте и
выраженности приступами стенокардии. При внезапном учащении и
утяжелении приступов стенокардии, которые появляются даже
при сниженных нагрузках и во время отдыха, говорят о
нестабильной стенокардии. Нестабильная стенокардия имеет другой
патогенез и, вероятно, развивается как следствие
комбинированного атеросклеротического изменения сосудистой стенки и
повышения агрегации тромбоцитов. Антиагрегантная терапия
аспирином при нестабильной стенокардии снижает вероятность
инфаркта миокарда на 50%.
Нитраты
Нитраты короткого действия. Нитроглицерин (таблетки или
спрей) при сублингвальном применении действует около 30
минут. Более продолжительно (до 24 ч) действуют пластыри с
нитроглицерином в форме трансдермальных систем.
Нитраты продолжительного действия более стабильны, их
эффект сохраняется в течение нескольких часов.
Продолжительность действия нитратов зависит от их химической структуры
и способа применения (субпингвально или перорально). При
стенокардии широко используют изосорбнда дннитрат, но он
быстро метаболизируется в печени. Применение изосорбнда мо-
вонитрата, являющегося основным активным метаболитом изо-
сорбита динитрата, позволяет избежать непостоянства
скорости всасывания и быстрого метаболизма при первом
прохождении печени. Применение нитратов продолжительного действия
наиболее рационально при нестабильной стенокардии.
Побочные эффекты. Наиболее частым побочным эффектом
нитратов является головная боль, возникающая вследствие
расширения сосудов и уменьшающаяся при снижении дозы
препаратов. К более серьёзным нежелательным явлениям
относятся артериальная гипотония и обмороки. Нитраты могут
вызвать рефлекторную тахикардию, но её можно предотвратить,
комбинируя их с р-адреноблокаторами. Длительное
применение нитратов в высоких дозах может привести к развитию мет-
гемоглобинемии.
Механизм действия. В процессе метаболизма нитратов
вначале при участии тиосоединений (R-SH) происходит
высвобождение ионов NO2". Затем внутри клеток из N02~
образуется NO, активирующий гуанилатциклазу и тем самым
увеличивающий содержание цГМФ в гладкомышечных клетках
сосудов. цГМФ уменьшает концентрацию Са2+ в цитозоле и
способствует дефосфорилированию лёгких цепей миозина (ЛЦМ),
что приводит к расширению сосудов (фосфорилирование
лёгких цепей вызывает взаимодействие миозина с актином и
мышечное сокращение).
Ко всем препаратам группы нитратов может развиваться
толерантность. Например, длительное назначение эриннта (пен-
таэритронила тетранитрата) вызывает развитие резистентности
к сублингвальному применению нитроглицерина, а
четырёхкратный ежедневный пероральный приём изосорбита динит-
рата в средних терапевтических дозах может приводить к
снижению его антиангинальной активности. Однако если
изосорбита динитрат применять дважды в день, в 8 ч и в 13 ч, то
резистентность не возникает. Считают, что в период ночного
отдыха чувствительность тканей к препарату
восстанавливается. Механизм развития резистентности к нитратам не
расшифрован, но, возможно, он связан с истощением запасов
донаторов сульфгидрильных групп в тканях. Эта теория была
подтверждена экспериментами in vitro с использованием N-аце-
тилцистеина.
р-адреноблокаторы
Р-адреноблокаторы применяют для профилактики
приступов стенокардии. При стенокардии имеет большое значение
правильный выбор препарата этой группы. Так, например,
наличие внутренней симпатомиметической активности у р-адре-
ноблокаторов при ишемической болезни сердца является
нежелательным. Препаратами выбора являются кардиоселектив-
ные средства (атенолол и метоиролол). р-адреноблокаторы нельзя
назначать больным бронхиальной астмой, так как они могут
вызвать бронхоспазм. При применении препаратов этой
группы обязательно следует учитывать их побочные эффекты и
противопоказания (см. главу 9 и 15).
Антагонисты кальция
При стенокардии широко используют антагонисты кальция.
Побочные эффекты при применении препаратов этой группы
выражены слабее, чем при использовании р-адреноблокаторов
Антагонисты кальция блокируют потенциалзависимые
кальциевые каналы L-типа в гладкой мускулатуре артерий, вызывая
их расширение. Преднагрузка при этом изменяется
незначительно. Препараты этой группы, снижая поступление Са2+ б
клетки миокарда, уменьшают силу сердечных сокращений
(отрицательное инотропное действие). Частота сердечных
сокращений под влиянием блокаторов кальциевых каналов
изменяется неоднозначно. Применение дигидропиридинов (например,
нифеднпнна и амлодипина) в терапевтических дозах приводит к
появлению рефлекторной тахикардии, возникающей на
гипотензивное действие препаратов. Тахикардия при применении
амлодипина (препарата продолжительного действия) менее
выражена, чем при использовании нифедипина. Веранамил и
днлтиазем (в меньшей степени) вызывают умеренную брад и-
кардию, угнетая автоматизм синусового узла. Верапамил (в
отличие от нифедипина) замедляет проводимость в атриовентри-
кулярном узле, благодаря чему уменьшает частоту сокращений
желудочков при мерцательной аритмии (противоаритмическое
действие антагонистов кальция разбирается в главе 17).
Отрицательный инотропный эффект верапамила и дилтиазема
частично компенсируется рефлекторным усилением адренергичес-
кого влияния на сердце и уменьшением постнагрузки за счёт
расширения артерий. Верапамил при стенокардии не
применяют, так как он может вызвать сердечную недостаточность и
атриовентрикулярную блокаду. Дилтиазем оказывает среднее
действие между верапамилом и нифедипином. Препарат
используют при ишемической болезни сердца (ИБС), так как он
не вызывает тахикардии.
Курение табака. Курение оказывает протромбогенное и ате-
рогенное действие, приводит к снижению коронарного
кровотока и учащению сердечных сокращений, что увеличивает
потребность миокарда в 02. Образование карбоксигемоглобина
снижает способность крови доставлять кислород тканям.
Состояние многих больных улучшается после того, как они
бросают курить.
При неэффективности лекарственной терапии больным ИБС
показано коронарное шунтирование или транслюминальная
баллонная дилятация (ангиопластика) стенозированных венечных
артерий. При коронарном шунтировании между аортой и
участком за стенозом поражённой артерии вшивается сегмент
бедренной вены или внутренней грудной артерии.
Положительный эффект после операции наблюдается у 90% больных,
однако у 50% пациентов в течение последующих 7 лет снова
появляются признаки заболевания. При чрескожной
трансартериальной ангиопластике для разрушения или сжатия атерома-
тозной бляшки используют баллонный катетер.
39
17. Противоаритмические средства
Синусовая
брадикардия
Атропин
Окончания п. vagus
Симпатические нервные окончания
Желудочковые и иад-
желудочковые тахи-
аритмии
Класс II!
Амиодарон
Соталол
Класс IA
Хинидин
Дизопирамид
Класс 1С
Флекаинид
Желудочковые тахи-
аритмии
Класс IB
Лидокаин
Наджелудочкоаые 1
тяхиаритмии
Аденозин
Дигоксин
Верапамил
Стресс-иидуцирован-
иые аритмии
Класс II
р-адреноблокаторы:
Пропранолол
Атенолол
Соталол
Стресс
Высвобождение
норадреналина/
ч адреналина
Потенциал водителя ритма
дК снижается
gNa увеличивается
р-адренорецепторы gK
Эффективный
рефрактерный период
Большинство
противоаритмических
средств
Потенциал действие миокардитов (ПД)
Удлинение эффективного
рефрактерного периода и
продолжительности ПД
В норме ритм сердечной деятельности зависит от
активности пейсмекерных клеток (водителей ритма) синоатриального узла
(СУ, в верхней части рисунка). Однако их функция может быть
нарушена, что приводит к появлению нарушений сердечного
ритма и клинически проявляется различной симптоматикой (от
ощущения незначительного дискомфорта до сердечной
недостаточности) и даже внезапной смертью. Аритмия может
возникать у практически здоровых людей, но обычно серьёзные
нарушения сердечного ритма (желудочковая тахикардия)
связаны с различными заболеваниями сердца (например, с
инфарктом миокарда). Ритм сердца регулируется ацетилхолином
(Ацх) и норадреналином (НА), выделяемых соответственно
окончаниями парасимпатических и симпатических нервов (в
верхней части рисунка).
"При наджелулочковой (суправентрикулярной) аритмии очаг
аритмической активности находится в стенке предсердий или
в атриовентрикулярном узле, при желудочковой (вентрикуляр-
ной) — в желудочках. Аритмия может быть связана с появлением
эктопических очагов, генерирующих импульсы с большей
частотой, чем нормальные водители ритма. Аритмии часто
развиваются по механизму «re-entry» («повторного входа»). В этом случае
вследствие различных патологических процессов в отдельных
участках сердечной мышцы, имеющих укороченный
рефрактерный период, возникает повторный вход возбуждения,
вызывающий новую волну деполяризации (циркуляцию импульсов).
Многие противоаритмические средства обладают местноа-
нсстезирующей активностью (блокируют потенциалзависимые
Na^-каналы) или являются антагонистами кальция. Они
уменьшают автоматизм пейсмекерных клеток и увеличивают
длительность эффективного рефрактерного периода предсердий,
желудочков и волокон Пуркинье.
Противоаритмические средства подразделяются на
следующие группы:
1) эффективные при наджелудочковьгх (суправентрикулярных)
аритмиях (в верхней части рисунка справа);
2) эффективные при желудочковых аритмиях (в нижней
части рисунка слева);
3) эффективные при наджелудочковых и желудочковых
аритмиях (в центре рисунка слева).
При аритмиях, связанных с нервным стрессом (при
психоэмоциональном напряжении, тиреотоксикозе, инфаркте
миокарда), сопровождающихся повышением адренергической
активности, эффективны Р-адреноблокаторы (в нижней части
рисунка справа). Синусовую брадикардию, возникающую при
остром инфаркте миокарда и сопровождающуюся снижением
сердечного выброса, устраняют внутривенным введением м-
холинобпокатора атропина (в верхней части рисунка слева).
Противоаритмические средства влияют на различные фазы
потенциала действия миокардиоцитов (показано на нижнем
рисунке). Многие противоаритмические препараты сами могут
вызывать аритмию (иногда со смертельным исходом), особенно у
пациентов с ишемической болезнью сердца. Исключение
составляют р-адреноблокаторы, применение которых при
инфаркте миокарда уменьшает смертность пациентов по сравнению
с результатами использования других противоаритмических
средств.
40
Пучок Гиса
Удлинение
Частота
сердечных
сокращений
Блокада
Са -каналов
Угнетение
быстрого
потока Na
Потенциал действия миокардиоцитов
В клетках миокарда отмечается два деполяризирующих
потока: быстрый Na+-TOK и медленный Са2+-ток. В синоатриаль-
ном и атриовентрикулярном узлах (АВУ) осуществляется
только Са2+-ток, но так как он происходит очень медленно, то между
предсердными и желудочковыми сокращениями возникает
интервал. В норме продолжительный рефрактерный период мио-
фибрилл защищает их от повторного входа возбуждения во время
сердечного сокращения.
Пейсмекерные клетки (водители ритма)
Активность пейсмекерных клеток в синоатриальном (СУ) и
атриовентрикулярном (АВУ) узлах регулируется изменением
проницаемости клеточных мембран для К+, постепенное
уменьшение которой вызывает их деполяризацию. Скорость
деполяризации в СУ выше, чем в АВУ, поэтому в норме синоатриаль-
ный узел оказывает доминирующее влияние на сердечный ритм
(синусовый ритм). Водители ритма и клетки проводящей
системы сердца получают вегетативную иннервацию.
Ацетилхолин. В окончаниях парасимпатических нервных
волокон выделяется ацетилхолин, который активирует м2-холи-
норецепторы миокарда, что приводит к повышению
^-проницаемости (gK) и к замедлению процессов деполяризации
(снижению крутизны пейсмекерного потенциала). Таким образом,
порог потенциала действия достигается медленнее и частота
сердечных сокращений уменьшается. Проводимость по пучку
Гиса замедляется.
Норадреналин. Являясь медиатором симпатической нервной
системы, норадреналин возбуждает ргадренорецепторы
пейсмекерных и других клеток миокарда. Он уменьшает gK,
поэтому порог потенциала действия достигается быстрее и частота
сердечных сокращений увеличивается (положительное хронот-
ропное действие). Норадреналин также увеличивает силу
сердечных сокращений, усиливая ток Са2+ в клетку в период ре-
поляризации (фаза 2) (положительный инотропный эффект).
Средства, применяемые
при наджелудочковых аритмиях
Дигоксин повышает тонус п.vagus (см. главу 18), вызывая
высвобождение ацетилхолина, что приводит к угнетению
проводимости и удлинению эффективного рефрактерного периода
атриовентрикулярного узла и пучка Гиса. Дигоксин
применяют перорально при трепетании и мерцании предсердий
(сопровождаются частыми неритмичными сокращениями
желудочков), так как он, замедляя атриовентрикулярную
проводимость, способствует уменьшению частоты сокращения
желудочков.
Аденозин стимулирует Араденозиновые рецепторы и
открывает ацетилхолин-чувствительные К+-каналы. Это приводит к
гиперполяризации мембран клеток атриовентрикулярного узла,
блокаде медленных Са2+-каналов и замедлению проводимости
в атриовентрикулярном узле. Аденозин быстро инактивирует-
ся (tm = 8-10 секунд), поэтому его побочные эффекты
(диспноэ, оронхоспазм) кратковременны. Аденозин используют
внутривенно для купирования приступов пароксизмальной супра-
вентрикулярной тахикардии.
Вераламил блокирует Са2+-каналы L-типа (TV класс проти-
воаритмических средств) (см. главы 15 и 16) и оказывает
преимущественное влияние на атриовентрикулярный узел,
проводимость которого зависит от проницаемости Са2+-каналов.
Вераламил оказывает отрицательное инотропное действие, так как
подавляет вход Са2+ в клетку в фазе плато потенциала действия
(фаза 2). Внутривенное использование верапамила при надже-
лудочковой тахикардии вытесняется применением более
безопасного противоаритмического средства — аденозина (из-за
нежелательного отрицательного инотропного эффекта
верапамила). Верапамил в основном используют перорально для
профилактики суправентрикулярной тахикардии. Препарат нельзя
комбинировать с р-адреноблокаторами или хинидином, так как
при этом усиливается его отрицательный инотропный эффект.
Средства, применяемые
при наджелудочковых и желудочковых аритмиях
Препараты III класса оказывают противоаритмическое
действие, замедляя реполяризацию C фаза) и увеличивая
продолжительность потенциала действия и эффективного
рефрактерного периода во всех отделах сердца. Амиодарон блокирует
некоторые ионные каналы (К+-каналы и неактивные Na
-каналы) и р-адренорецепторы сердца. Амиодарон используют
только при неэффективности других противоаритмических средств,
потому что он вызывает серьёзные побочные эффекты,
включающие повышенную светочувствительность, нарушение
функции щитовидной железы, нейропатию и лёгочную
недостаточность. Kill классу противоаритмических средств относится
соталол, который действует также активно, как и препараты II
класса (р-адреноблокаторы). Он лишен побочных эффектов
амиодарона, но обладает всеми нежелательными свойствами р-
адреноблокаторов.
Препараты класса IA действуют, блокируя (открытые)
потенциалзависимые Na+-каналы. Противоаритмическис средства
этой группы замедляют фазу «0* (период быстрой
систолической деполяризации) и удлиняют эффективный рефрактерный
период. Применение препаратов класса IA может вызвать
нарушение атриовентрикулярной проводимости (А-В блок).
Дизопирамид (ритмилен, ритмодан). Препарат используют в
основном перорально для профилактики рецидива
желудочковой аритмии. Дизопирамид оказывает отрицательное
инотропное действие, его применение может вызвать артериальную
гипотензию (особенно при внутривенном введении) и обострить
сердечную недостаточность. Его использование ограничивают
и другие нежелательные эффекты, включающие тошноту,
рвоту и антихолинергическое действие.
Хинидин эффективен как при наджелудочковой, так и
желудочковой аритмии, но его использование ограничено
возможностью возникновения потенциально опасных сердечных и
внесердечных побочных эффектов, включающих в себя:
антихолинергическое действие, тошноту, рвоту, понос и аритмию.
Средства, применяемые при желудочковых аритмиях
Противоарнтмические средства класса IB блокируют
(неактивные) потенциалзависимые Na+-каналы. Лидокаин применяют
внутривенно для купирования желудочковой тахиаритмии,
осложняющей течение острого инфаркта миокарда. В отличие от
препаратов класса IA, которые блокируют открытые Na+-кана-
лы, лидокаин в основном блокирует неактивные Na+-каналы.
На здоровые участки миокарда лидокаин оказывает слабое
влияние, так как быстро элиминирует из открытых Na+-каналов.
В зоне ишемии миокарда гипоксия вызывает деполяризацию
клеточных мембран и появление аритмогенных очагов. При этом
многие Na+-каналы инактивируются и становятся
чувствительными к лидокаину.
Альтернатива лекарственной терапии аритмий
При полной атриовентрикулярной блокаде и иногда при та-
хиаритмиях используют искусственные водители ритма.
Электрическая дефибрилляция приводит к восстановлению
синусового ритма у большинства пациентов с фибрилляцией
предсердий, но у 60% в течение 1-го года возникают рецидивы,
несмотря на поддерживающую терапию дизопирамидом.
Успешным методом хирургического лечения наджелудочковой
тахикардии является резекция эктопического очага или пучка
Гиса. Значительно более безопасным является метод
экстирпации эктопического очага или пучка Гиса с помощью
электродов интракардиального катетера. Для проведения этого
вмешательства необходимо использование временного водителя
ритма, так как возможно появление атриовентрикулярного блока.
41
18. Лекарственные средства,
применяемые при сердечной недостаточности
Кардиотонические
средства
Дигоксин
Мильринон*
Добутамин
Na+/Ca + обмен
Токсические
уровни
'Деполяризация
Генерация
потенциала
действия
Аритмии
Положительный
инотропный
эффект
Диуретики
ТИАЗИДЫ
Бвндрофлуазид
ПЕТЛЕВЫЕ
Бумет анид
Фуросемид
Выход К+из клетки
Укорочение
потенциала
действия
Порог потенциала
действия ,
Ингибиторы АПФ
(ангиотенэинпревра-
щающего фермента)
Уменьшают
преднагрузку
и пост на грузку
Каптоприл
Эналаприл
Застойные симптомы
Диспноэ
Конечное диастолическое ^
давление в левом желудочке
Сердечная недостаточность — это патологическое
состояние, при котором сердечный выброс не обеспечивает
нормальную перфузию органов и тканей. Это ведёт к появлению
усталости, одышки и отёков. Застойная сердечная недостаточность
обычно возникает при комбинированном поражении левого и
правого желудочков, в результате чего возникает отёк лёгких и
периферические отёки. Причиной возникновения сердечной
недостаточности чаще всего является артериальная гипертен-
зия и ишемическая болезнь сердца. Снижение сердечного
выброса при сердечной недостаточности приводит к активации
симпатической нервной системы, что увеличивает частоту и
силу сердечных сокращений и поддерживает артериальное
давление, увеличивая резистентность сосудов. Увеличение
постнагрузки ведёт к дальнейшему снижению сердечного выброса.
Понижение почечного кровотока способствует повышению
секреции ренина и увеличению уровня ангиотензина и альдосте-
рона в плазме крови. Задержка Na+ и воды в организме
приводит к повышению объёма циркулирующей крови, увеличению
пред нагрузки на сердце и возникновению отёков.
Лечение сердечной недостаточности обычно начинают с
применения диуретиков (в верхней части рисунка в центре; см. главу
14), которые увеличивают выведение Na+ и воды из организма,
снижают объём циркулирующей крови, понижают
преднагрузку на сердце и устраняют отёки. При сердечной
недостаточности средней тяжести обычно используют тиазиды (например,
бендрофлюазид), но при более серьёзных проявлениях
сердечной недостаточности назначают петлевые диуретики. Если
диуретики не оказывают желаемого эффекта, то присоединяют
сосудорасширяющие средства, обычно из группы ингибиторов
ангиотензинпревращающего фермента (ингибиторы АПФ).
Ингибиторы АПФ (например, каптоприл) понижают нагрузку на
сердце (диагональная стрелка справа) и, как показали
клинические исследования, улучшают состояние и увеличивают
продолжительность жизни пациентов с сердечной
недостаточностью. При неэффективности комбинированного использования
диуретиков и ингибиторов АПФ при сердечной
недостаточности дополнительно применяют кардиотонические средства
(кардиостимуляторы, препараты с положительным инотропным
действием) (в верхней части рисунка слева).
Кардиотонические средства увеличивают силу сердечных
сокращений (вертикальная стрелка справа), повышая уровень ци-
топлазматического Са2+ (в левой части рисунка), р-адреноми-
метики (например, добутамин) и ингибиторы фосфодиэстера-
зы (например, милринон) увеличивают приток Са2+, повышая
уровень цАМФ (слева), а дигоксин повышает содержание
внутриклеточного Са2+, иигибируя мембранную Na*/К+-АТФазу.
Применение кардиотонических средств может вызвать аритмию.
так как значительное повышение концентрации Са2+ в
цитоплазме может привести к электрофизиологическим изменениям
в мембранах. Основным кардиостимулятором является
сердечный гликозид дигоксин. При острой сердечной недостаточности,
когда возникает опасная для жизни недостаточность
кровоснабжения мозга и почек (кардиогенный шок), внутривенно вводят
Pi-адреномиметик добутамин в комбинации с дофамином.
42
Норма
Застойная сердечная
недостаточность
АТФаэа,
Сосудорасширяющие средства
Расширение вен способствует уменьшению венозного
давления (снижается преднагрузка), а артериальная вазодилята-
ция приводит к снижению сопротивления сосудов сердечному
выбросу (снижается постнагрузка). Уменьшение сосудистого
тонуса вызывает снижение работы сердца и уменьшение его
потребности в кислороде. Наиболее часто используемыми ва-
зодилятаторами при сердечной недостаточности являются
ингибиторы АПФ (например, каптоприл, эналаприл; см. главу 15),
поскольку они расширяют как венозные, так и артериальные
сосуды, предупреждая образование ангиотензина II (сильного
вазоконстриктора), содержание которого при сердечной
недостаточности обычно возрастает. Сердечный выброс
повышается, в результате этого снижается реноваскулярная
резистентность и увеличивается почечный кровоток. Усиление
почечного кровотока и понижение продукции альдостерона (ангиотен-
зин II стимулирует продукцию альдостерона) приводит к
повышению экскреции Na и воды, снижению объёма
циркулирующей крови и венозного возврата к сердцу. Другие
вазодилятаторы в настоящее время назначают только
пациентам, которые не переносят ингибиторы АПФ.
Кордиотонические средства
Днгоксин — это сердечный гликозид, получаемый из листьев
наперстянки (Digitalis sp.). Он содержит в своей структуре
стероидное ядро (агликон), с которым связана
фармакологическая активность вещества, и гликон (сахаристый компонент —
дигитаксоза), который определяет фармакокинетические
свойства препарата.
Эффекты и терапевтическое применение. Дигоксин
увеличивает силу сердечных сокращений при сердечной
недостаточности и уменьшает (относительно) потребность миокарда в
кислороде, что и составляет основную терапевтическую ценность
дигоксина при сердечной недостаточности. Однако
эффективность применения дигоксина при хронической сердечной
недостаточности при наличии синусового ритма подвергается
сомнению. Клинические исследования показали, что
применение дигоксина может уменьшать выраженность симптомов
сердечной недостаточности у пациентов, которые постоянно
получают диуретики. Применение дигоксина особенно
показано при сердечной недостаточности в сочетании с
фибрилляцией предсердий (см. главу 17).
Механизм действия. Дигоксин ингибирует мембранную Na*/
К+-АТФазу, которая отвечает за перенос Na+ и К+ через
мембрану миокардиоцитов. Угнетение К|а+/К*-АТФазы приводит к
повышению содержания внутриклеточного Na+, снижению К+
и опосредованно к увеличению концентрации
внутриклеточного Са2+, что повышает сократимость миокарда. Уровень
внутриклеточного Са2+ возрастает за счёт уменьшения его выхода
из клетки путём Na+/Ca2+ обмена во время диастолы, что
связано со снижением мембранного градиента Na+. Дикогсин и
К+ конкурируют за «рецептор» (Na+/К+-АТФазу) на внешней
стороне мембраны миокардиоцита, поэтому применение
дигоксина (особенно в сочетании с диуретиками) может
приводить к развитию гипокалиемии.
Электрофизиологнческие эффекты дигоксина.
Электрофизиологические изменения являются результатом прямого и
непрямого (косвенного) действия дигоксина на сердце.
Прямое действие. Дигоксин в нетоксических концентрациях
вызывает укорочение потенциала действия миокардиоцитов (в
результате увеличения содержания внутриклеточного Са2+,
который повышает выведение К*), что приводит к укорочению
эффективного рефрактерного периода миокардиоцитов
предсердий и желудочков. В токсических концентрациях дигоксин
вызывает деполяризацию мембран (связанную с угнетением
Na+-насоса) и появление после нормальных потенциалов
действия колебательных деполяризационных постпотенциалов
(связаны с увеличением концентрации внутриклеточного Са2+). Если
постпотенциал достигает порога потенциала действия
(критического уровня деполяризации), то генерируется потенциал
действия, который вызывает эктопическое сокращение. При
увеличении дозы дигоксина эктопические сокращения
учащаются, вызывая желудочковую тахикардию, которая может
прогрессировать в фибрилляцию желудочков.
Непрямое действие, Дигоксин оказывает м-холиномимети-
ческое действие на сердце, повышая активность n.vagus, что
проявляется: (I) замедлением частоты сердечных сокращений;
(II) угнетением атриовентрикулярной проводимости; (III)
удлинением эффективного рефрактерного периода атриовен-
трикулярного узла и пучка Гиса. Эти эффекты могут
использоваться при фибрилляции предсердий (глава 17), но в
токсических дозах дигоксин может вызвать атриовентрикулярную
блокаду.
Действие на другие органы. Дигоксин оказывает воздействие
на все возбудимые ткани, а его выраженная кардиоселектив-
ность связана с большей зависимостью функции миокарда от
скорости Na+-TOKa. Наиболее часто дигоксин оказывает
влияние на желудочно-кишечный тракт. Применение препарата
может вызвать нарушение аппетита, тошноту, рвоту и диарею.
Эти эффекты частично связаны с влиянием на гладкую
мускулатуру кишечника, а также являются следствием стимуляции
центра n.vagus и возбуждения хеморецепторов триггер-зоны.
Реже возникают беспокойство и даже психозы.
Токсичность. Токсические проявления действия дигоксина
наблюдаются достаточно часто. Для уменьшения
нежелательных эффектов дигоксин комбинируют с препаратами калия,
противоаритмическими средствами (дифенин, лидокаин), а в
случае развития интоксикации сердечными гликозидами
применяют дигоксин-специфические антитела (препарат ФАБ).
Адреномиметики
Р-адреномиметики стимулируют ргадренорецепторы
сердца и через G-белки активируют аденилатциклазу. В результате
повышается содержание цАМФ, активирующего
цАМФ-зависимую протеинкиназу, что приводит к фосфорилированию и
открытию кальциевых каналов L-типа. В результате
повышается вход Са2+ в миокардиоциты и увеличивается сила сердечных
сокращений, pi -адреномиметики при сердечной
недостаточности используют редко, так как они обладают аритмогенным
действием, а также повышают частоту сердечных сокращений
и увеличивают потребность миокарда в кислороде, что
приводит к усилению ишемии и увеличению зоны некроза при
инфаркте миокарда.
Добутамин стимулирует Р|-адренорецепторы сердца и
повышает сократимость сердечной мышцы, незначительно влияя
на частоту сердечных сокращений. Препарат используют
внутривенно капельно при прогрессирующей острой сердечной
недостаточности.
ргадренорецепторы сердца стимулирует также дофамин. Его
применяют внутривенно, капельно. Положительное инотроп-
ное действие дофамина сочетается с расширением почечных и
мезентериальных сосудов (за счёт дофаминовых рецепторов
гладких мышц). Дофамин используют внутривенно капельно
при кардиогенном шоке (часто в сочетании с добутамином).
Ингибиторы фосфодиэстеразы
К негликозидным кардиотоническим средствам, являющимся
ингибиторами фосфодиэстеразы, относится мильринон.
Препарат повышает сократительную активность миокарда и
вызывает расширение сосудов. Механизм кардиотонического действия
препарата связан с тем, что, ингибируя фосфодиэстеразу III
(ФДЭ, в левой части рисунка), он вызывает повышение уровня
цАМФ и увеличивает вход Са*+ в миокардиоциты. Мильринон
применяют внутривенно при острой сердечной
недостаточности, не поддающейся терапии сердечными гликозидами.
Мильринон и другие ингибиторы фосфодиэстеразы при сердечной
недостаточности используют редко, так как нет доказательств,
что они снижают смертность пациентов при данной патологии.
43
19. Лекарственные средства, влияющие на свёртывание крови
Анти коагулянты
НЕПРЯМОГО ДЕЙСТВИЯ
Варфарин
Несщикумарин
ПРЯМОГО ДЕЙСТВИЯ
Гепарин
(стандартный)
Низкомолекулярные
гепарины
(ГНМВ)
Дальтепарин
Антитромбин
Комплекс антитромбин/тромбин
Фибринолитические
средства
Стрептокиназа .„
Анистреплаза
Альтеплаэа
Антиагрегенты
Аспирин
Дипиридамол
Эпопростенол
(ПП2)
Ьь_
Каскад
свёртывания
крови
*> Фибрин
(мономер)
Плаэмин
(фибринолизин)
Растворимые фрагменты
В центре рисунка показана последняя стадия формирования
тромба, который состоит из сгустка фибрина, пронизанного
тромбоцитами и эритроцитами. Одним из факторов
способствующих тромбообразованию в венах является замедление
скорости венозного кровотока. Для профилактики и лечения
венозных тромбозов и эмболии (например, предупреждение
послеоперационных тромбозов; лечение тромбозов глубоких вен
конечностей, тромбозов при фибрилляции предсердий и у
пациентов с искусственными клапанами сердца) широко
используют антикоагулянты (в верхней части рисунка слева),
особенно гепарин и варфарин. Основными побочными
эффектами антикоагулянтной терапии являются кровотечения и
кровоизлияния.
Гепарин — это антикоагулянт прямого действия. Препарат
активен как in vivo (в организме), так и in vitro; его вводят инъ-
екционно. Продолжительность действия гепарина составляет
2—6 часов. Антикоагулянтный эффект гепарина проявляется в
присутствии антитромбина III (ингибитора сериновых проте-
аз), образующего в крови комплекс с тромбином в
соотношении 1:1 (показано стрелкой <=> в центре рисунка). Гепарин,
связываясь с антитромбином III, повышает скорость
образования этого комплекса в среднем в 1000 раз, что приводит к
быстрой (почти мгновенной) инактивации тромбина (фактора Па).
Одновременно нейтрализуются фактор Ха и некоторые другие
факторы свертывания крови (например, ХНа, IXa, XIa).
Следует отметить, что низкомолекулярные (фракционные)
гепарины в комплексе с антитромбином III ингибируют только
фактор Ха.
Варфарин — это антикоагулянт непрямого действия, он
активен только при приёме внутрь. Препарат является
производным кумарина и по своей химической структуре сходен с
витамином К. Варфарин ингибирует витамин К-зависимое у-кар-
боксилирование глутаминовой кислоты, входящей в состав
факторов свертывания крови (прямоугольник в верхней части
рисунка), что приводит к образованию неактивных
модифицированных факторов VII (проконвертин), IX (антигемофильный
глобулин В), X (тромботропин) и II (протромбин). Эти
факторы не вызывают свёртывания крови, так как только у-карбок-
силирование придаёт им Са2+-связывающие свойства, что
необходимо для образования активного каталитического
комплекса. Антикоагулянты непрямого действия эффективны
только in vivo, их антикоагулянтный эффект начинает проявляться
в среднем через 36-48 часов. Для достижения более быстрого
противосвертывающего действия их комбинируют с гепарином.
Антикоагулянты мало активны в предупреждении
артериальных тромбозов, так как в артериях в условиях быстрого
кровотока формируются тромбы с малым содержанием фибрина и
большим количеством тромбоцитов. Для предупреждения
развития артериальных тромбозов используют антнагреганты —
средства, угнетающие агрегацию тромбоцитов (показаны на
рисунке справа). Активным антиагрегантом является аспирин.
Препарат высоко эффективен при ишемической болезни
сердца и особенно для предупреждения инсультов. Механизм анти-
агрегантного действия аспирина связан с его способностью
угнетать синтез тромбоксана А2 (ТХА2) (на рисунке справа) в
тромбоцитах. ТХА2 является производным арахидоновой
кислоты (эйкозаноидом), активирующим агрегацию тромбоцитов.
При тромбозах внутривенно вводят фибринолитические (тром-
болитнческие) средства (показаны в нижней части рисунка
слева). Эти средства способны быстро лизировать тромбы,
активируя превращение плазминогена (профибринолизина) в плаз-
мин (фибринолизин) (показано стрелкой в нижней части
рисунка) — протеолитический фермент, вызывающий
растворение фибрина и тем самым разрушение тромбов.
Фибринолитические средства, особенно стрептокиназу, активно используют
в комбинации с аспирином при инфаркте миокарда, что
приводит к снижению смертности пациентов. Наиболее
выраженный эффект отмечается при применении препаратов в первые
3 часа развития инфаркта миокарда и менее выраженный —
после 24 часов. Раннее применение фибринолитиков при
инфаркте миокарда является даже более важным, чем
использование специфических антиишемических средств.
44
Протромбин
Декарбокси-
протромбин
Витамин КН2
(гидрохиноновая
форма)
Витамин К
(эпоксидная форма)
Арахидоновая
кислота
циклоокси-
^ генаэа У
Тромбин
Фибриноген
Агрегация
Активатор
плазминогена
Плазминоген
(профибринолизин)
Тромбоз — это нежелательное свертывание крови в просвете
сосуда. Тромбоз чаще всего возникает при замедленной
скорости кровотока, что создаёт условия для генерации активных
факторов свёртывания, которые не удаляются кровотоком из-
за возникшего стаза. Иногда частицы тромбов отрываются (эм-
болы) и с током крови переносятся в различные органы и
ткани, вызывая тромбоэмболию сосудов (например,
тромбоэмболию лёгочной артерии). Наибольшую проблему в этом
отношении создают послеоперационные тромбозы вен нижних
конечностей. Образование тромбов в полости предсердий
отмечается при мерцательной аритмии вследствие застоя крови,
развивающегося из-за нарушения сократительной активности
предсердий. В результате отрыва пристеночных тромбов
предсердий может возникнуть тромбоэмболия сосудов головного
мозга (инсульт).
Антикоагулянты
Гепарин — это эндогенное высокомолекулярное
производное глюкозаминогликана, содержащее большое количество
остатков серной кислоты. Молекулярный вес его колеблется от
5000 до 15000. Подкожное или длительное внутривенное
введение гепарина существенно уменьшает частоту инфаркта
миокарда и инсульта, а также послеоперационных тромбозов
глубоких вен нижних конечностей.
Основным побочным эффектом гепарина является
появление кровотечений и кровоизлияний. Продолжительность
действия гепарина составляет всего 4-6 часов, поэтому обычно
его нежелательные эффекты устраняются при отмене
препарата. Для устранения чрезмерного эффекта гепарина используют
внутривенное введение его антагониста — протамина
сульфата. Протамина сульфат — это белок, обладающий основными
свойствами, который способен взаимодействовать с гепарином
(обладающим кислыми свойствами) с образованием
нерастворимого комплекса. Применение гепарина может привести к
развитию аллергических реакций и тромбоцитопении.
Кроме высокомолекулярного (нефракционного или
стандартного) гепарина достаточно часто используют низкомолекулярные
(фракционные) гепарины (гепарины низкого молекулярного
веса — ГНМВ), которые имеют более длительный период полу-
элиминации. Их подкожное введение так же эффективно, как
внутривенное применение стандартного гепарина в равных дозах.
Антикоагулянты непрямого действия
(антагонисты витамина К)
Варфарин хорошо всасывается при пероральном
применении, но антикоагулянтный эффект отмечается в среднем через
1—3 дня. В течение этого периода неактивные факторы
свёртывания крови постепенно замещают активные свёртывающие
факторы. Варфарин имеет длительный период
полуэлиминации (около 40 часов), поэтому антисвёртывающий эффект
препарата сохраняется ещё в течение 5 дней после его отмены,
пока не нормализуется протромбиновый индекс. Препарат
превращается в печени в неактивный метаболит — 7-гидроксивар-
фарин. Лекарственные средства, активирующие микросомаль-
ные ферменты печени (например, барбитураты, карбамазепин),
ускоряют разрушение и уменьшают выраженность антикоагу-
лянтного эффекта варфарина, а препараты, угнетающие
активность ферментов печени (например, циметидин, этанол, мет-
ронидазол), напротив, замедляют метаболизм варфарина и
усиливают его действие. При комбинированном применении
варфарина со средствами, вызывающими индукцию микросомаль-
ных ферментов печени, отмена последних может привести к
появлению кровотечений.
Для быстрого устранения эффектов передозировки
антикоагулянтов непрямого действия применяют концентраты
факторов свёртывания крови (или свежезамороженную плазму,
которая их содержит). Можно также использовать внутривенное
введение витамина К (викасола), однако его эффект проявится
только через 6-12 ч.
Антиагреганты
Применение аспирина уменьшает риск инфаркта миокарда
при нестабильной стенокардии и повышает выживаемость
больных с инфарктом миокарда, а также снижает опасность
инсульта при транзиторных нарушениях мозгового
кровообращения. Благоприятное действие аспирина при заболеваниях,
сопровождающихся повышенной свёртываемостью крови,
связано с его способностью угнетать образование тромбоксана А2
(фактора усиливающего агрегацию тромбоцитов) в
тромбоцитах. Тромбоксан А2 взаимодействует с рецепторами на
мембране тромбоцитов и активирует фосфолипазу С, способствуя
образованию из мембранных фосфоинозитидов вторичного
мессе нджера инозитол-1,4,5-трифосфата (ИРз), что приводит к
увеличению внутриклеточной концентрации Са2+, который
запускает агрегацию тромбоцитов. В эндотелиальных клетках
сосудистой стенки вырабатываются простагландины группы 12
(ПП2 или простациклины), которые являются
функциональными антагонистами тромбоксана А2. Простагландины группы
[2, стимулируя рецепторы на мембранах тромбоцитов,
активируют аденилатциклазу, увеличивая содержание в клетках цАМФ,
что приводит к снижению уровня внутриклеточного Са2+ и
угнетению агрегации тромбоцитов. Аспирин уменьшает
образование тромбоксана А2 в тромбоцитах, необратимо угнетая цик-
лооксигеназу (см. главу 32). Тромбоциты не обладают
способностью вновь синтезировать циклооксигеназу, тогда как в
эндотелиальных клетках сосудов этот фермент образуется снова,
приводя к образованию простациклина. Поэтому длительность
снижения содержания тромбоксана больше, чем
простациклина. Вследствие этого применение аспирина через день (в
суточной дозе 320 мг) эффективно угнетает агрегацию
тромбоцитов. Для предупреждения тромбообразования после
протезирования клапанов сердца используют дипирндамол (курантил)
в сочетании с варфарином. Однако механизм антиагрегантного
действия дипиридамола не совсем ясен, а эффективность
сомнительна.
Фибринолитические (тромболитические) средство
Фибринолитические средства (например, препараты стреп-
токиназы и активатора тканевого плазминогена) применяют
внутривенно при инфаркте миокарда для растворения тромбов в
коронарных артериях. Применение фибринолитических средств
в течение первых 3-х часов после возникновения тромбоза
способствует восстановлению коронарного кровообращения у 50%
пациентов. Хороший эффект при инфаркте миокарда оказывает
введение фибринолитических средств в сочетании с аспирином.
Основными побочными эффектами фибринолитиков
являются: тошнота, рвота, аллергические реакции, кровотечения
(обычно на месте инъекции препаратов) и кровоизлияния (очень редко
инсульт). Применение препаратов активатора тканевого
плазминогена (например, альте плазы) кровотечений не вызывает.
Стрептокиназа связывается с плазм и ноге ном с образованием
активного комплекса, который переводит плазм и ноге н (про-
фибринолизин) в плазм и н (фибринолизин). Следует отметить,
что в крови циркулирует много ингибиторов плазм и на,
которые могут его нейтрализовать. Внутри тромба концентрация
ингибиторов плазмина не высока, поэтому стрептокиназа
оказывает преимущественное воздействие на тромб, практически
не вызывая кровотечений.
Альтеплаза — это препарат человеческого активатора
тканевого плазминогена, полученный методом генной инженерии.
Применение альте плазы не вызывает аллергических реакций.
Этот препарат можно назначать пациентам, которым
противопоказана стрептокиназа (например, пациентам, недавно
перенесшим стрептококковую инфекцию). Благоприятный
аддитивный эффект оказывает комбинированное применение альтеп-
лазы с гепарином, однако при этом возникает опасность
инсульта. Альте плазу широко используют в США. Препарат
особенно эффективен при применении в ранние сроки тромбоза.
Анистренлаза — это комбинированный препарат стрептоки-
назы и человеческого плазминогена, содержащего ан и зольную
группу, которая связывает неактивным каталитический центр
стрептокиназы. В крови анизольная группа медленно
отделяется от центра, что приводит к активации комплекса плазми-
ноген-стрептокиназа и образованию плазмина. Препарат
обычно вводят внутривенно однократно, он действует в среднем в
течение 4—6 часов. Так как анистреплаза содержит стрептоки-
назу, то при её применении возможны аллергические реакции.
45
20. Гиполипидемические средства
Экскреция
жёлчных
кислот
Липопротеинлипаза
в капиллярах мышечной
и жировой ткани
Жирные кислоты
ЛПНП
Нерастворимые в воде липиды — такие, как триглицериды
и эфиры холестерина, транспортируются в крови в виде частиц
(липопротеинов), покрытых гидрофильной оболочкой,
состоящей из фосфолипидов и свободного холестерина. В её состав
входят также аполипопротеины (один или несколько),
являющиеся лигандами рецепторов на поверхности клеток
организма. Около 2/3 липопротеинов крови синтезируется в печени.
Триглицериды (ТГ) циркулируют в крови в виде липопротеинов
очень низкой плотности (ЛПОНП) (показаны на рисунке
стрелкой >=>). В эндотелии капилляров мышечной и жировой ткани
содержится фермент — липопротеинлипаза, который гидроли-
зует триглицериды до жирных кислот и глицерина. Жирные
кислоты затем усваиваются мышечными клетками
(используются как источники энергии) и адипоцитами (депонируются).
Оставшиеся частицы содержат в своём составе преимущественно
эфиры холестерина. Их называют «липопротеинами низкой
плотности (ЛПНП)*. Клетки печени и других тканей организма
содержат на своей поверхности ЛПНП-рецепторы (показаны на
рисунке в виде ^^), связывающие л ипопротеины этого
класса и способствующие их удалению из плазмы крови путём эн-
доцитоза (в основном в этом процессе принимают участие
ЛПНП-рецепторы печени).
В клетках слизистой оболочки кишечника из экзогенных
(пищевых) триглицеридов и холестерина образуются хиломикроны,
которые поступают в плазму крови через грудной
лимфатический проток. В крови из триглицеридов хиломикронов при
воздействии липопротеинлипазы образуются жирные кислоты, а
остатки триглицеридов катаболизируются в печени.
Существует прямая связь между концентрацией в плазме
крови ЛПНП и выраженностью атеросклеротических
изменений в средних и крупных артериях. Применение
лекарственных средств, способствующих снижению содержания в крови
атсрогенных ЛПНП и увеличению уровня антиатерогенных
ЛПВП (липопротеинов высокой плотности), уменьшает про-
грессирование атеросклероза коронарных сосудов. При ИБС,
наследственной гиперхолестеринемии, а также при наличии
большого количества факторов риска, способствующих
развитию атеросклероза, применяют гиполипидемические средства.
Анионообменные смолы (секвестранты жёлчных кислот)
(показаны в верхней части рисунка слева, А) из
желудочно-кишечного тракта не всасываются, в кишечнике связывают жёлчные
кислоты (ЖК), образовавшийся комплекс выводится из
организма, одновременно увеличивается экскреция холестерина.
Огатины, ингибиторы З-гадроксн-З-метолглутарнл-коэнзнм А-
редуктазы (ГМГ-КоА-редуктазы) (показаны в верхней части
рисунка справа), угнетают синтез холестерина в печени. При
применении статинов и анионообменных смол в ответ на
уменьшение концентрации холестерина в плазме крови и тканях
компенсаторно увеличивается синтез ЛПНП-рецепторов в печени
(показано в верхней части рисунка), что приводит к ещё
большему снижению содержания холестерина в плазме крови.
Кислота никотиновая (в правой части рисунка в центре) понижает
содержание в крови ЛПОНП, тогда как фнбраты, активируя
липопротеинлипазу в основном уменьшают содержание в плазме
крови триглицеридов.
46
смолы
Халестирамин
Колестипол
Холестерин
ЛПНП-рецептор
лпнп
Эндоцитоз
Лиэис
Ингибиторы
ГМГ-КаА-р*дукт*зы
Симвастатин
Правастатин
Флувастатин
Никотиновая кислота
Фибрагты
Угнетение
Увеличение
Активация
Мевалонат
Холестерин
Жёлчный
проток
Воротная
вена
Кишечник
ЭФХ
ЛПНП-рецептор
ацетил-КоА
ГМГ-КоА
тг
Бензафибрат
Гвмфиброзил
Другие
ЭФХ
лпвп
Хол
Липопротеины подразделяют на 5 классов в зависимости от
их плотности (выделение липопротеинов различной плотности
осуществляют с помощью метода ультрацентрифугирования).
Крупные частицы (хиломикроны, ЛППП — липопротеины
промежуточной плотности и ЛПОНП) не являются высоко атеро-
генными из-за своих больших размеров C0-500 нм в
диаметре), что препятствует их проникновению в стенки сосудов.
Наибольшей атерогенностью обладают ЛПНП (диаметр их
частиц 18—25 нм), так как они легко проникают в стенки
сосудов, вызывая повреждение артерий. Частицы ЛПВП имеют
небольшой диаметр E-12 нм). Исследования показали, что при
повышении содержания в крови ЛПВП снижается риск
развития атеросклероза. ЛПВП принимают избыток холестерина (не-
этерифицированного) из клеток и других липопротеинов,
которые потеряли триглицериды и содержат избыточное
количество поверхностных компонентов, в том числе свободного
холестерина. В процессе реэтерификации (образования эфиров
холестерина) полярность холестерина уменьшается, что
способствует его перемещению в гидрофобный слой. В результате
холестерин покидает поверхностный слой ли по протеиновых
частиц, который больше не связывает холестерин. В дальнейшем
эфиры холестерина транспортируются в печень. Основой ан-
тиатерогенного действия ЛПВП является их способность
удалять холестерин из стенок артерий.
Гиперлнпидемии. Первичные дислипопротеинемии могут быть
связаны с увеличением содержания в крови холестерина и/или
триглицеридов. Вторичные гиперлипидемии развиваются в
результате различных заболеваний — таких, как сахарный
диабет, гипотиреоз. Наиболее часто наблюдается гиперхолестери-
немия. В 5% случаев она является наследственной болезнью,
но в основном причина её развития не известна. Соблюдение
строгой диеты является основным способом борьбы с гиперли-
пидемией (уменьшение содержания в пище жиров,
низкокалорийная диета способствуют снижению веса тела).
Атеросклероз. Точно неизвестно, каким образом в артериях
образуются атероматозные бляшки, но считается, что процесс
локального повреждения интимы сосудов запускает
турбулентный кровоток. Атероматозные бляшки, выступающие в
просвет сосудов, богаты холестерином и имеют липидную основу.
При разрыве шапки атероматозной бляшки в зоне
повреждения сосудистой стенки образуется тромб, а окклюзия просвета
артерий тромбом может вызвать развитие нестабильной
стенокардии, инфаркта миокарда или инсульта. Исследования
показали, что между концентрацией холестерина в плазме крови и
выраженностью атеросклероза коронарных артерий
существует прямая связь. Атерогенез усиливается при воздействии
дополнительных факторов риска (курение, артериальная гипертен-
зия, сахарный диабет, наследственные или приобретенные
болезни сердца, гипертрофия левого желудочка).
Гиполипидемические средства
Ингибиторы ГМГ-КоА-редуктазы (статны) являются
новыми гиполипидемическими средствами. Они эффективно
снижают как общий уровень липидов в крови, так и содержание
липопротеинов низкой плотности. Применение статинов
уменьшает выраженность коронарной недостаточности и снижает
смертность пациентов при этой патологии. Ингибиторы ГМГ-
КоА-редуктазы являются препаратами выбора при
заболеваниях, связанных с атеросклерозом. Статины, ингибируя фермент
З-гидрокси-3-метилглутарил-коэнзим А-редуктазу, угнетают
синтез холестерина в печени. Уменьшение содержания
холестерина в плазме крови и тканях способствует
компенсаторному увеличению его синтеза в печени (иногда до нормы даже в
присутствии лекарств). Одновременно повышается
образование ЛПНП-рецепторов в клетках печени, которые
захватывают холестерин, уменьшая его содержание в плазме крови.
Доказательством того, что статины снижают содержание
холестерина в плазме крови, увеличивая число ЛПНП-рецепторов,
является тот факт, что при наследственной гомозиготной ги-
перхолестеринемии (при этой патологии отсутствуют ЛПНП-
рецепторы) препараты этой группы не оказывают эффекта.
Побочные эффекты при их применении возникают редко и в
основном сводятся к появлению миопатий. Частота
возникновения миопатий возрастает при комбинированном применении
статинов с никотиновой кислотой и фибратами. Статины
противопоказаны при беременности, так как для нормального
развития плода необходим холестерин.
Анионообменные смолы (секвестранты жёлчных кислот). Хо-
лестирамин и колестипол — это порошкообразные вещества,
которые следует запивать водой. Они увеличивают выведение
жёлчных кислот из организма, одновременно уменьшая
всасывание холестерина из кишечника. Снижение концентрации
холестерина в гепатоцитах вызывает компенсаторное
увеличение числа ЛПНП-рецепторов и повышение активности ГМГ-
КоА-редуктазы. Увеличение числа ЛПНП-рецепторов в
печени является основным механизмом гипохолестеринемического
действия препаратов этой группы, так как они не эффективны
при наследственной гомозиготной гиперхолестеринемии.
Побочные эффекты препаратов связаны с их влиянием на
кишечник. Препараты не всасываются из желудочно-кишечного
тракта; при их применении возможно появление вздутия живота,
диспепсии, поноса или запора.
Кислота никотиновая снижает содержание в плазме крови
ЛПОНП, триглицеридов (на 30-50%), холестерина (на 10-20%)
и увеличивает уровень ЛПВП. Кислота никотиновая была
первым гиполипидемическим средством, позволившим снизить
смертность при ИБС. Её применение ограничивает частое
возникновение побочных эффектов (например, покраснение лица,
головокружение, сердцебиение). В настоящее время
никотиновую кислоту в комбинации с анионообменными смолами
используют при наследственной гиперхолестеринемии.
Фибраты (например, гемфиброзил, бензафибрат) умеренно
снижают содержание в крови ЛПНП (в среднем на 10%) и
повышают уровень ЛПВП (в среднем на 10%). Стимулируя ли-
попротеинлипазу, фибраты активно снижают содержание в
плазме крови триглицеридов (в среднем на 30%). Фибраты
являются препаратами выбора при повышенном уровне
триглицеридов в плазме крови, когда имеется риск развития
панкреатита.
Побочные эффекты. Применение фибратов может вызвать
миозитоподобный синдром, который наиболее часто
отмечается при сочетании фибратов со статинами, поэтому подобных
комбинаций следует избегать.
Комбинированное применение пшолипидемических средств. При
некоторых видах гиперлипидемии необходимо
комбинированное применение гиполипидемических средств, например,
совместное использование анионообменных смол и ингибиторов
ГМ Г- КоА-редуктазы (статинов).
47
21. Лекарственные средства, стимулирующие эритропоэз
Деэоксиадено-
эилкобаламин
Метил мал он ил- КоА
Сукцинил-КоА
Витамин В,2
Гидроксикобаламин
5-метил-тетра-
гидрофолат
Гетрагидро-
фолат
Кофакторы фолата
Препараты железа
ПЕРОРАЛЬНЫЕ
Железа сульфат
Железа глюконат
Железа фумарат
ПАРЕНТЕРАЛЬНЫЕ
Железа сорбитол
Кобаламин
Фолаты пищи
Метионин Гомоцистеин Дигидрофолиевая кислота
Дигидрофолат-
редуктаэа (ДР)
Фолиевая кислота
Фолиевая кислота
«•Для нормального эритропоэза необходимы ионы железа,
витамин В,2 и фолиевая кислота, дефицит которых приводит к
развитию анемии. Эритропоэз регулируется эритропоэтином —
гормоном, образующимся преимущественно в почках (в
антенатальном периоде синтезируется также в печени). При
хронических заболеваниях почек из-за сниженной продукции эрит-
ропоэтина часто наблюдается развитие анемии.
Железо необходимо для синтеза гемоглобина. Дефицит
железа в организме приводит к образованию эритроцитов с
малым содержанием гемоглобина (т.е. к развитию микроцитар-
ной гипохромной анемии). При гипохромной анемии,
связанной с хронической кровопотерей, беременностью (плод
забирает железо у матери), различными заболеваниями кишечника
(уменьшается всасывание железа из кишечника), у
недоношенных детей (малые запасы железа в организме при рождении)
применяют препараты железа (показаны в верхней части
рисунка справа).
Основными побочными эффектами перорального
применения препаратов железа являются частые желудочно-кишечные
расстройства. Лечение железодефицитной анемии
продолжают до нормализации уровня гемоглобина в крови, затем в
течение нескольких месяцев применяют препараты железа в
меньших дозах для восстановления его запасов в депо. Дети высоко
чувствительны к токсическому действию железа, ребенок
может погибнуть даже при введении такой небольшой дозы, как 1
г железа сульфата. При передозировке препаратов железа пе-
рорально или парентерально вводят дефероксамин (десферал),
который образует с железом хелатные комплексы.
Витамин В|2 и фолиевая кислота необходимы для синтеза в
организме ДНК. Дефицит любого из этих витаминов в
организме может нарушать эритропоэз (приводить к развитию
мегалобластной анемии). Дефицит витамина Вп в организме
вызывает также дегенеративные изменения в центральной нервной
системе. Развитие В^-дефицитной анемии связано с
нарушением синтеза тетрагидрофолиевой кислоты (показано в
нижней части рисунка), а дегенеративные изменения в
центральной нервной системе при дефиците витамина В,2 возникают
вследствие накопления в клетках головного мозга мстил мало-
нил-коэнзима А (показано в верхней части рисунка).
Дефицит витамина В|2 (В|2-дефицитная анемия, перници-
озная анемия, анемия Аддисона-Бирмера) в организме
наблюдается при нарушении его всасывания в
желудочно-кишечном тракте вследствие пониженной (или при отсутствии)
секреции внутреннего фактора Касла (например, после резекции
желудка), а также при различных заболеваниях тонкого
кишечника. При В12-дефицитной анемии нарушен синтез ДНК,
угнетаются процессы деления клеток, но синтез РНК и белка
продолжается, в результате образуются крупные хрупкие
эритроциты. При пернициозной анемии витамин Bj2 применяют и
качестве средства заместительной терапии пожизненно инъек-
ционно (на рисунке слева). Пероральное применение
препарата эффекта не дает. Препаратом выбора для проведения
заместительной терапии является оксикобаламин, поскольку он
дольше сохраняется в крови, так как более прочно связывается с
белками плазмы и медленнее выделяется с мочой, чем циано-
кобаламин.
Дефицит фолиевой кислоты, который может возникать при
беременности (вследствие повышения потребности вфолатах),
а также при синдроме мал абсорбции (например, при стеатор-
рее или спру), приводит к развитию макроцитарной анемии.
При фолиеводефицитной анемии используют пероральное
введение фолиевой кислоты.
48
5-метил-тетрагидро-
фолат-гомоцистеин-
метилтрансфераэа
Мембраны клеток ЦНС
Подострая дегенерация
Мвтилмалонил-КоА мутаза
Нетипичные жирные кислоты
(необходимо для синтеза ДНК)
Метилкобаламин
Железо
Гем, содержащий в своём ядре железо, в комбинации с
соответствующими глобиновыми цепями образует протеин —
гемоглобин. В составе гемоглобина находится более 90% недепо-
нированного железа (около 2,3 г). Меньшее количество железа
(около 1 г) в форме ферритина и гемосидерина депонируется в
макрофагах, в селезёнке, печени и костном мозге.
Абсорбция. Железо всасывается в двенадцатиперстной
кишке и в проксимальном отделе тощей кишки. В норме
всасывается только 5—10% принятого с пищей железа (около 0,5—1 мг
в день), но при снижении запасов железа в организме
абсорбция его возрастает. Абсорбции подвергаются лишь ионы Fe2+
за счёт активного транспорта. В плазме крови железо
находится в комплексе с трансферрином, являющимся р-глобулином,
Специального механизма экскреции железа из организма нет —
его баланс регулируется только процессами абсорбции.
Препараты железа
Перорально применяют только препараты двухвалентного
железа (Fe5+), поскольку соединения трёхвалентного железа (Fe3+)
из кишечника практически не всасываются. При железодефи-
цитных состояниях для синтеза гемоглобина требуется 50-100
мг железа ежедневно. Поскольку при пероральном
применении препаратов железа абсорбироваться может только около
25% принятой дозы, то для быстрой коррекции недостатка
железа в организме его необходимо применять в дозе 200-400 мг
вдень. При появлении желудочно-кишечных расстройств
(тошнота, боли в животе, понос или запор) возможно снижение
дозы железа, однако в этом случае дефицит железа в организме
устраняется медленнее.
При невозможности перорального применения препаратов
железа их назначают парентерально, однако это обычно не
ускоряет повышение уровня гемоглобина в крови.
Фербитол (железа сорбитол) — это комплекс сорбитола,
железа и лимонной кислоты. Препарат вводят глубоко
внутримышечно, чтобы не вызвать окрашивания кожи (внутривенно
фербитол не используют). Парентеральное применение
препаратов железа может привести к развитию анафилактической
реакции.
Токсичность железа. Острое отравление железом может
наблюдаться у детей при приёме большого количества таблеток,
содержащих железо. Отравление препаратами железа
характеризуется некротическим гастроэнтеритом с болью, рвотой,
кровянистым поносом, позднее возможно развитие коматозного
состояния. Даже после видимого улучшения состояния при
отравлении железом может развиться ацидоз, кома и возможен
летальный исход.
Витамин В12
Витамин В}2 (внешний фактор Касла) всасывается из
кишечника только в комплексе с внутренним фактором Касла (гли-
копротеином, секретируемым париетальными клетками
слизистой оболочки желудка). Всасывание витамина В12 происходит
в дистальном отделе подвздошной кишки при участии высоко
специфичной транспортной системы; в крови витамин В,2
транспортируется в связи с транскобаламином II (гликопроте-
ином плазмы крови). При пернициозной анемии дефицит
внутреннего фактора Касла возникает вследствие продукции ауто-
антител к самому гликопротеину или к париетальным клеткам
желудка (развивается атрофический гастрит). В центре
молекулы витамина Bt2 находится атом кобальта, который ковалентно
связывается с различными лигандами, образуя кобаламины.
Активными формами витамина В12 являются метилкобаламин
и дезоксиаденозилкобаламин.
Метнлмалоннл-КоА-мутаза. Этот фермент при участии де-
зоксиаденозилкобаламина способствует превращению метил-
малонил-коэнзим А в сукцинил-коэнзим А. При отсутствии
витамина В12 эта реакция не идет, поэтому накапливается ме-
тилмалонил-коэнзим А. В результате происходит синтез
аномальных жирных кислот, которые встраиваются в мембраны
нервных клеток и вызывают нарушения их функции, что ярко
проявляется при дефиците витамина В12.
З-метил-тетрагадрофолат-гомоцнстенн метнлтрансфераза
превращает 5-метил-тетрагидрофолат и гомоцистеин соответственно
в тетрагидрофолат и метионин. Одновременно в этой реакции
происходит превращение кобаламина в метилкобаламин. При
дефиците витамина В12эта реакция угнетается, в результате не
происходит превращение 5-метилтетрагидрофолиевой
кислоты (основного пищевого и эндогенного фолата) в тетрагидро-
фолиевую кислоту, необходимую для синтеза ДНК. Эта
реакция связывает метаболизм фолиевой кислоты и витамина В12 и
объясняет тот факт, что применение фолиевой кислоты в
больших дозах при дефиците витамина В]2 может уменьшить
выраженность анемии, но не влияет на дегенеративные изменения
в нервной системе.
Фолиевая кислота
Запасы фолатов в организме относительно невелики E-20
мг), тогда как суточная потребность в них высока, поэтому при
нарушении поступления в организм фолиевой кислоты анемия
развивается достаточно быстро (в течение 1—6 месяцев).
Фолиевая кислота полностью абсорбируется в проксимальном
отделе тощей кишки. Фолаты пищи представлены в основном по-
лиглутаматами 5-метилтетрагидрофолиевой кислоты. Полиглу-
таматы перед всасыванием подвергаются гидролизу с
образованием моноглутаматов 5-метилтетрагидрофолиевой кислоты.
Дефицит фолиевой кислоты в организме наиболее часто
связан с недостаточным поступлением фолатов с пищей (в
отличие от дефицита витамина В12, связанного с нарушением его
абсорбции). Приём контрацептивов, фенитоина, изониазида и
других препаратов может снижать всасывание фолиевой
кислоты из кишечника и вызывать её недостаточность в
организме.
Фолиевая кислота и витамин Bj2 не оказывают
токсического действия. Следует отметить, что при В ^-дефицитной
анемии нельзя применять только фолиевую кислоту, так как при
этом выраженность анемии уменьшается, но усиливаются
неврологические нарушения (могут приобрести необратимый
характер).
Эритропоэтин
Синтез гемоглобина и выход эритроцитов в кровеносное
русло стимулируют гипоксия или кровопотеря. Эти процессы
приводят к повышению содержания в крови эритропоэтина
(гликопротеина, содержащего 166 аминокислотных остатков).
Эритропоэтин связывается с рецепторами на мембранах
стволовых клеток-предшественников эритропоэза в красном
костном мозге и повышает транскрипцию фермента, участвующего
в синтезе гема. Рекомбинантный эритропоэтин (эпоэтин)
используют внутривенно или подкожно при анемии, связанной с
нарушением выработки эритропоэтина при хронической
почечной недостаточности.
[
49
22. Медиаторы центральной системы
Нвйроивдиоторы,
оеущмтамммщю
«быструю снгашимцию»
Ацвтилхолин
(никотиновые
эффекты)
АМИНОКИСЛОТЫ
глугаминовав ^
аспарагиновая *""
у-аминомабЛЬйф
глицин
Возбуждающий
постсинаптический
потенциал (ВПСП)
Окончание
тормозного
нейрона
осущфстилтощие *люд-
НЕЙРОПЕПТИДЫ
Субстанция Р
Мет-энкефалин
Лей-энкефалин
Ангиотенаин
Соматостатин
Лютеинизирующий
гормон (ЛГ)
Тиреотропный
гормон (ТТГ)
Другие
МОНОАМИНЫ
Дофамин
Норадреналин
Адреналин
Серотонин E-НТ)
Ацвтилхолин (муска-
риновые эффекты)
NO
Тормозной
постсинаптический
потенциал (ТПСП)
Варикозные
расширения
«Облако»
нейро-
медиатора
Моноаминергический
аксон
В клинической практике широко используют
лекарственные средства, действующие на центральную нервную систему.
Вместе с тем такие вещества центрального действия, как
кофеин, алкоголь и никотин, часто используют для достижения
чувства благополучия (эйфории). Продолжительное применение
этих средств часто приводит к формированию лекарственной
зависимости, поэтому многие препараты этой группы
используют под строгим контролем (см. главу 31). Механизм действия
этих веществ, как правило, неизвестен, что является
отражением ограниченности наших представлений о
неврологических и психических заболеваниях. Знания о медиаторах
центральной нервной системы важны, так как фактически все
лекарственные средства центрального действия влияют на
процессы синаптической передачи импульсов.
К нейромедиаторам, осуществляющим «быструю
сигнализацию», относятся аминокислоты (показаны на рисунке слева),
а также ацетилхолин, действующий на н-холинорецепторы хо-
линергических синапсов. Основным возбуждающим
медиатором ЦНС является глутаминовая кислота. Она вызывает
деполяризацию мембран нервных клеток, увеличивая их
проницаемость для Na*. у-аминомасляная кислота (ГАМК) — основной
тормозной медиатор ЦНС, выделяющийся в 1/3 всех
центральных синапсов. ГАМК вызывает гиперполяризацию мембран
нейронов, увеличивая их проницаемость для С1", и
стабилизирует потенциал покоя мембран на уровне эквивалентного
потенциала СГ. Глицин также является тормозным
медиатором, но преимущественно спинного мозга.
Кроме системы «быстрой сигнализации» в головном мозге
функционирует также более диффузная система «медленной
сигнализации», основными нейромедиаторами которой являются
моноамины (показаны в правом нижнем углу рисунка). Тела
нейронов через свои ветвящиеся аксоны проецируются на
различные зоны мозга. Медиаторы высвобождаются посредством
диффузии из многочисленных участков сети варикозных
расширений окончаний моноаминергических нейронов,
воздействуя на большое количество клеток-мишеней. Функции
центральной моноаминергической системы не вполне ясны, но
нарушение моноаминергической медиации участвует в
патогенезе таких заболеваний, как паркинсонизм, депрессия, мигрень и
шизофрения.
В центральных нейронах и нервных окончаниях
обнаружены многочисленные нейропептиды (показаны в правом
верхнем углу рисунка). Окончательных доказательств их роли как
медиаторов ЦНС ещё нет. Возможно, они образуют особую
группу диффузно действующих медиаторов ЦНС, но
физиологическая роль большинства из них неизвестна.
Совсем недавно было высказано предположение, что оксвд
азота (NO) может функционировать как медиатор центральной
нервной системы.
50
Окончание
возбуждающего
ноиронв
Регистрирующий электрод
Глутаматный
рецептор
Пресинаптическая
мембрана тормозного
.нейрона J
Аксон
Аминокислоты
у-аминомасляная кислота (ГАМК) присутствует во всех
образованиях центральной нервной системы, в основном в
тормозных промежуточных нейронах. ГАМК вызывает быстрое
торможение центральных нейронов, воздействуя на постсинапти-
ческие ГАМКА-рецепторы, которые блокируются бикукулли-
ном (судорожным ядом). Некоторые ГАМК-рецепторы (ГАМКВ)
не блокируются бикукуллином, но избирательно активируются
баклофеном (парахлорфенил-ГАМК). Многие ГАМКв-рецеп-
торы расположены на пресинаптических мембранах нервных
окончаний, их активация приводит к уменьшению выделения
медиаторов (например, глутамата или самой ГАМК). Баклофен
уменьшает высвобождение глутамата в спинном мозге и
оказывает антиспастическое действие, что используется для
уменьшения спастичности при рассеянном склерозе.
Высвобождаясь из пресинаптических нервных окончаний,
аминокислотные нейромевиаторы инактивируются в основном
путём обратного захвата.
К ГАМ К-ергическим средствам относятся бензодиазелины,
барбитураты (см. главу 24), противосудорожные препараты ви-
габатрин и, возможно, вальпроаты (см. главу 25).
Глицин — это тормозной медиатор промежуточных
нейронов спинного мозга. Глициновые рецепторы блокируются
стрихнином, а высвобождение глицина из нервных окончаний
угнетается столбнячным токсином. Оба вещества вызывают
судороги.
Глутамат возбуждает практически все центральные
нейроны, взаимодействуя с аминокислотными рецепторами
различных типов. Эти рецепторы подразделяются на AM РА
(активируются а-амино-3-гидрокси-5-метил-4-изоксазолпропионовой
кислотой), NMDA (активируются N-метил-D-аспартатом) и
каинатные (активируются каиновой кислотой). Существует
также группа метаботропных рецепторов (связаны с G-белками).
Антагонисты NMDA-рецепторов (например, 2-аминофосфоно-
валерат) обладают противоэпилептической активностью d
эксперименте на животных и оказывают благоприятное действие
при судорожном синдроме, связанном с нейрональными
нарушениями вследствие значительного высвобождения глутамата.
Ламотриджин является противоэпилептическим средством,
механизм действия которого связан с угнетением высвобождения
глутамата из пресинаптических мембран нейронов (см. главу 25).
Моноамины
Ацетилхолин является в основном возбуждающим
медиатором ЦНС. Он высвобождается из нервных окончаний
мотонейронов нервно-мышечных синапсов и в синапсах
коллатеральных аксонов с клетками Реншоу в спинном мозге (это
примеры н-холинергических синапсов). Возбуждающие эффекты
ацетилхолина на центральные нейроны в основном
опосредуются через м-холинорецепторы, активация которых приводит
к угнетению потенциалзависимого К+-тока в мембранах
нервных клеток. Это способствует возбуждению нервных клеток
и облегчению формирования их ответа на тонические
возбуждающие импульсы.
Холинергических нейронов особенно много в базальных
ганглиях. Они принимают участие в проведении восходящих
кортикальных импульсов и в процессах формирования памяти.
М-холиноблокаторы (атропиноподобные средства) могут
вызывать нарушения памяти (амнезию). Скополамии (гиосцин)
используют в анестезиологии для премедикации в качестве
средства, вызывающего амнезию и оказывающего успокаивающее
действие (см. главу 23). Центральные эффекты препаратов этой
группы используют при морской болезни и паркинсонизме (см.
главу 26). При болезни Альцхаймера (форма сенильной демен-
ции, лечение которой в настоящее время практически не
эффективно) отмечается снижение числа холинергических
нейронов и ухудшение памяти. Такрии — это антихолинэстеразное
средство, которое оказывает благоприятное действие при
болезни Альцхаймера (у 15% пациентов), но обладает
выраженной гепатотоксичностью.
Катехоламины (при локальном нанесении на центральные
нейроны) оказывают преимущественно тормозной эффект.
Дофаминергические пути проецируются от субстанции «ниг-
ро» в средний мозг к базальным ганглиям и из среднего мозга
в лимбическую кору и другие лимбические структуры. Туберо-
инфундибулярный дофаминергический путь участвует в
регуляции высвобождения п рол актина, а нигростриатный путь — в
управлении произвольными движениями, его поражение
приводит к развитию паркинсонизма. Мезолимбический
дофаминергический путь чрезмерно активируется при шизофрении,
однако причины этого неизвестны. Агонисты дофамина
используют при паркинсонизме (см. главу 26), а антагонисты
(нейролептики) применяют при шизофрении (см. главу 27).
Дофаминовые рецепторы находятся в хеморецепторной триггерной
(пусковой) зоне, поэтому антагонисты дофаминовых рецепторов
оказывают противорвотное действие (см. главу 30).
Норадреналинергическне нейроны встречаются в нескольких
образованиях ствола головного мозга. Больше всего этих
нейронов находится в голубом пятне (locus coemleus) в мосту, от
которого аксоны нейронов проецируются на всю дорсальную
часть переднего мозга, особенно в кору головного мозга и гип-
покамп. Большое количество норадренергических волокон
находится в гиппокампе. Норадреналин и дофамин в лимбичес-
ких структурах переднего мозга (особенно nucleus accumbens)
могут участвовать в формировании чувства «удовольствия», что
имеет значение в развитии лекарственной зависимости (см.
главу 31). Нарушение адренергических функций может быть
причиной развития депрессии (см. главу 28).
Серотонин E-гидрокситриптамин, 5-НТ) находится в
основном в телах нейронов ядер шва ствола мозга, которые
посылают волокна в передний мозг, а также к вентральным и
дорсальным рогам спинного мозга. Последние могут модулировать
болевые импульсы (см. главу 29). Нарушения в серотонинерги-
ческой системе, также как и в норадреналинергической
системе, могут приводить к возникновению депрессии. 5-НТ3-рецеп-
торы локализованы в триггерной зоне рвотного центра,
поэтому антагонисты этих рецепторов обладают антиэметическим
(противорвотным) действием. 5-НТю-рецепторы находятся в
сосудах головного мозга, агонист этих рецепторов суматриптан
облегчает течение мигрени, суживая сосуды головного мозга,
чрезмерно расширенные во время приступа.
Нейропептнды образуют самую многочисленную группу
центральных нейромедиаторов, функция которых малоизвестна.
Субстанция Р и энкефалины предположительно участвуют в
проведении болевых импульсов (см. главу 29).
Оксид азота (NO). Синтез N0 осуществляется в 1-2%
нейронов многих областей головного мозга — таких, как кора
головного мозга, гиппокамп и стриатум. Образование NO
происходит совместно с выделением других нейромедиаторов:
глутамата, ГАМК, соматостатина, нейропептида Y. N0 влияет на
процессы высвобождения некоторых нейромедиаторов.
Физиологическая роль NO в головном мозге не ясна, однако
существуют сведения, что NO может регулировать синаптическую
пластичность.
51
23. Общие анестетики (средства для наркоза)
Премедикация
УСТРАНЕНИЕ ТРЕВОГИ
Беизодиазепины
УМЕНЬШЕНИЕ СЕКРЕЦИИ
И ВАГУСНЫХ РЕФЛЕКСОВ
М-холиноблокаторы
УСТРАНЕНИЕ
ПОСЛЕОПЕРАЦИОННОЙ РВОТЫ
Антиэмвтики
УСТРАНЕНИЕ БОЛИ
Наркотические
анальгетики
Ядра таламуса
Кора головного мозга
Диффузное проецирование
Средства для
ингаляционного наркоза
Закись азота
Фторотан
Изофлуран
Энфлуран
Активирующая
система
ретикулярной формации
Время, (мин)
*() Коэффициент растворимости
кровь/газ
Высокий коэффициент
свидетельствует о лучшей
растворимости в крови,
более длительном входе в наркоз
и медленном выходе из него
Спинной мозг
Внутривенное
введение
Время, (мин)
Общая анестезия (наркоз) — это состояние,
характеризующееся отсутствием чувствительности, обратимой потерей
сознания, подавлением рефлекторной деятельности, снижением
тонуса скелетных мышц. Многие химические соединения, от
инертных газов до стероидов, способны вызывать общую
анестезию у животных, но только некоторые из них применяют в
клинике (показаны на рисунке справа). К традиционным
наркотическим средствам относятся эфир для наркоза, хлороформ,
циклопропан, хлорэтил, трихлорэтилен.
Средства для наркоза угнетают все возбудимые ткани,
включая центральные нейроны, миокард, гладкую и скелетную
мускулатуру. Однако ткани обладают различной
чувствительностью к общим анестетикам, наиболее чувствительны к ним
участки головного мозга, ответственные за сознание человека
(в центре рисунка). Поэтому существует возможность
использовать средства для наркоза в концентрации, вызывающей
потерю сознания без угнетения жизненно важных центров
(дыхательного и сосудодвигательного) и миокарда. Однако
большинство средств для наркоза обладает очень небольшой широтой
наркотического действия.
Обычно для обеспечения адекватного общего
обезболивания используют различные лекарственные средства для:
• премедикации (показаны в верхней части рисунка слева);
• вводного наркоза (показаны в нижней части рисунка справа);
• поддержания наркоза (показаны в верхней части рисунка
справа).
Основными целями премедикации являются:
предупреждение развития парасимпатических эффектов во время
проведения наркоза (брадикардия, повышенная секреция бронхиальных
желез); устранение чувства тревоги и боли. При проведении
малых операций к премедикации часто не прибегают. При
необходимости внутривенно вводят вещества, потенцирующие
действие общих анестетиков (например, скополамин).
Вводный наркоз в основном достигается внутривенным
введением тиопентал-натрия или пропофола (дипривана). Наркоз
развивается в течение нескольких секунд и поддерживается
применением ингаляционных анестетиков. Фторотан — широко
используемое летучее средство для ингаляционного наркоза, при
применении которого иногда отмечается развитие
послеоперационных гепатитов. Энфлуран и изофлуран — новые средства
для ингаляционного наркоза, которые всё чаще применяют в
анестезиологии из-за их низкой гепатотоксичности. Для
общего обезболивания широко применяют закись азота (в
концентрации до 70%) в смеси с кислородом. Смесь закиси азота (N20)
с кислородом используют в сочетании с другими средствами
для ингаляционного наркоза или в комбинации с опиоидными
(наркотическими) анальгетиками (например, с фентанилом).
Закись азота вызывает развитие анальгезии, но применения
одной закиси азота для поддержания хирургического наркоза
недостаточно. При применении наркотических средств
(особенно эфира для наркоза) отмечаются следующие стадии
наркоза: I стадия — анальгезии; II стадия — стадия возбуждения
(её развитие вызвано угнетением тормозных нейронов
ретикулярной формации); III стадия — хирургического наркоза,
глубина которого зависит от концентрации наркотических средств,
При использовании современных средств для наркоза эти
стадии прослеживаются слабо.
52
Кровь
Средства для
неингаляционного наркоза
Барбитураты
Тиопентал-натрий
Гвксвнал
Небарбитуровые
Кетамин
Пропофол
Активирующая система ретикулярной формации (РАС). Это
комплекс полисинаптических путей ретикулярной формации в
стволе мозга, которые диффузно проецируются в кору
головного мозга. РАС участвует в поддержании сознания, поэтому
она особенно чувствительна к угнетающему действию
наркотических средств и является важным звеном в их действии.
Механизм действия общих анестетиков. В настоящее время
механизм действия общих анестетиков окончательно не
выяснен. Сила наркотического действия общих анестетиков
напрямую связана со степенью их липофильности. Средства для
наркоза могут растворяться в липидном слое мембран нервных
клеток, изменяя структуру и увеличивая жидкостность
(текучесть) мембран. Результатом мембранных нарушений может
быть изменение ионного тока (уменьшение притока Na+ и
увеличение — К+) и развитие общей анестезии. Подтверждением
этой теории является тот факт, что выраженность общей
анестезии уменьшается при высоком уровне артериального
давления, предположительно за счёт «восстановления» структуры
клеточных мембран. По другой теории общие анестетики
могут связываться с гидрофобной частью белков и нарушать их
функции.
Премедикация
Устранение тревоги и страха (см. главу 24). Наиболее
эффективными средствами для устранения страха, тревоги и
беспокойства являются бензодиазепины — такие, как диазепам (си-
базон, реланиум) и лоразенам.
Снижение секреции желёз и устранение отрицательных
рефлексов n.vagus. Для предупреждения усиленной секреции
слюнных, бронхиальных и других желёз используют м-холнноблока-
торы (атропин или скополамин). Эти препараты также
препятствуют развитию брадикардии, которая часто отмечается при
использовании фгоротана (галотана), дитилина (суксаметония)
и прозерина (неостигмина). Скополамин (гиосцин) оказывает
также противорвотное действие и вызывает некоторую амнезию.
Анальгетики. Опиондные (наркотические) анальгетики
(например, морфин; см. главу 29) могут назначаться перед операцией
пациентам с выраженным болевым синдромом. Фентанил и ему
подобные средства (например, алфентанил) используют
внутривенно дополнительно к анестезии закисью азота. Эти опио-
иды обладают высокой липофильностью, поэтому действуют
быстро, но кратковременно из-за быстрого перераспределения
в организме.
Послеоперационные антиэметики (противорвотные средства).
После наркоза могут возникать тошнота и рвота. Наиболее
частой причиной их развития является применение
наркотических анальгетиков до и после операции. Некоторые
антиэметики (например, метоклопрамид, ондансетрон) используют для
премедикации, но эти средства более эффективны при их
внутривенном введении во время наркоза.
Средства для неингаляционного наркоза
Средства для неингаляционного наркоза самостоятельно
используют только при кратковременных операциях, в основном
их применяют для вводного наркоза.
Барбитураты. Тиопентал-натрия при внутривенном введении
вызывает наркоз менее чем через 30 секунд, так как является
высоко липофильным препаратом и быстро проникает в
хорошо кровоснабжаемый головной мозг. Выход из наркоза,
вызванного введением тиопентал-натрия, также быстрый, так как
препарат перераспределяется в слабо перфузируемые ткани.
Тиопентал-натрия метаболизируется в печени со скоростью 12-
16% в час. При передозировке препарата отмечается кардио-
депрессия и угнетение дыхательного центра. Очень редко при
его использовании развивается анафилаксия.
Небарбитуровые препараты. Многие из них имеют
преимущество перед барбитуратами (так как менее выражено
угнетают миокард и быстрее элиминируют из организма). Известно
большое количество веществ этого ряда, но лишь немногие из
них применяют для наркоза. Наркоз, вызванный пропофолом
B,6-диизопропилфенол), характеризуется быстрым
пробуждением без тошноты и чувства опьянения. Однако при
применении пропофола возможны судороги и очень редко
анафилаксия. Кетамин вводят внутривенно или внутримышечно. Этот
анальгетик может вызывать галлюцинации. Кетамин часто
используют в детской анестезиологии.
Средства для ингаляционного наркоза
Насыщение и распределение (показано в нижней части
рисунка слева). Скорость наступления наркоза зависит в
основном от растворимости анестетика в крови и концентрации
вещества во вдыхаемом воздухе. Для насыщения крови
средствами со слабой растворимостью в крови (например, закисью
азота) требуется относительно малое количество анестетика,
поэтому достаточно быстро достигается его напряжение
(равновесие парциального давления анестетика в крови и во вдыхаемом
воздухе) в артериальной крови (и в головном мозге). При
использовании более растворимых в крови средств (например,
фгоротана) наркоз наступает медленнее, так как для
насыщения ими крови требуются большие дозы анестетика. Скорость
выхода из наркоза при повышении растворимости анестетика
также замедляется.
Закись азота обладает слабой наркотической активностью,
поэтому обычно её применяют в сочетании с другими
летучими наркотическими средствами. Закись азота не
воспламеняется и не поддерживает горения. Она является хорошим
анальгетиком, в смеси с кислородом E0%) её используют для
обезболивания (например, при травмах и родах). Закись азота на
сердечно-сосудистую и дыхательную систему влияет слабо.
Фторотан (галотан) является сильным наркотическим
средством, его пары не обладают раздражающим действием.
Фторотан снижает артериальное давление в основном за счёт
уменьшения сердечного выброса. При применении фгоротана
возможны сердечные аритмии, так как он сенсибилизирует
миокард к катехоламинам. Введение адреналина во время фторота-
нового наркоза может вызвать остановку сердца (вследствие
фибрилляции желудочков). Как и большинство летучих
анестетиков, фторотан угнетает дыхательный центр, что приводит
к увеличению напряжения С02 в крови. Наиболее опасным
побочным эффектом фторотана является массивный некроз
печени, который встречается у одного пациента на 35 000
случаев применения препарата; менее выраженные повреждения
печени встречаются гораздо чаще. Более 20% введённого
фторотана биотрансформируется в печени до метаболитов.
Некоторые из них оказывают прямое гепатоксическое действие или,
связываясь с макромолекулами клеток, образуют антигены, к
которым возможна выработка антител. При повторном
использовании фторотана тяжёлые повреждения печени встречаются
чаще, поэтому этого следует избегать.
Энфлуран по действию сходен с фторотаном, но слабее ме-
таболизируется B%) и не вызывает повреждения печени.
Недостатком энфлурана является то, что он может вызвать
эпилептическую активность (на электроэнцефалограмме, ЭЭГ) и,
временами, мышечные подергивания.
Изофлуран действует подобно фторотану, но обладает
меньшим кардиодепрессивным действием и не вызывает
сенсибилизации миокарда к адреналину. Он вызывает снижение
артериального давления, уменьшая периферическое сопротивление
сосудов. Только 0,2% введённого препарата метабол изируется,
следовательно, маловероятны случаи гепатита.
53
24. Транквилизаторы и снотворные средства
ГАМК-ергическое нервное окончание
Снотворны» средства
БЕНЗОДИАЗЕПИНЫ
Темазепам* F)
Лормвтазвпам A0)
Нитразепам B4)
ДРУГИЕ
Зопиклон ,--"'
Хлоралгидрат
Хлормвтиазол
(барбитураты)
( )= Период
полуэлиминации (часы)
* Метаболиты не активны
Повышение
аффинитета
ГАМК
Трмвшилиааторы
БЕНЗОДИАЗЕПИНЫ
Диазвпам C2)
Лоразепам* A2)
АНТИДЕПРЕССАНТЫ
Амитриптилин
Буспирон
Р-АДРЕНОБЛОКАТОРЫ
Пропранолол
ГАМК
+
Бензодиазепины
Бензодиазепины способствуют
открытию СГ-канала
Для лечения бессонницы и устранения чувства страха и
тревоги используют преимущественно бензодиазепины (БД). При
применении этих препаратов на ночь (в высоких дозах)
отмечается снотворный эффект, а при приёме в малых дозах в
дневное время они оказывают успокаивающее действие, а также
уменьшают страх, тревогу и внутреннее напряжение.
Бензодиазепины обладают анксиолитическим
(транквилизирующим), снотворным, противосудорожным и миорелаксирую-
щим действием (см. главу 25). Механизм действия бензодиазе-
пинов связан с усилением ГАМК-ергического торможения в
центральной нервной системе. ГАМК высвобождается из нервных
окончаний (показано в верхней части рисунка в центре) и
связывается с ГАМКА-рецепторами, активация которых
увеличивает проницаемость мембран нейронов для ионов СГ
(показано в нижней части рисунка справа). Комплекс ГАМКА-рецеп-
тор/СГ-канал содержит также модулирующий бензодиазепи-
новый рецепторный участок (бензодиазепиновый рецептор),
стимуляция которого бензодиазепинами вызывает конформа-
ционные изменения в ГАМК-рецепторах. Это повышает
аффинитет ГАМК к рецепторам и усиливает её влияние на
проницаемость мембран нейронов для СГ (показано в нижней части
рисунка слева). Барбитураты связываются с другими участками
комплекса (барбитуратовыми рецепторами) и аналогично бен-
зодиазепинам усиливают действие ГАМК. В отсутствие ГАМК
бензодиазепины и барбитураты в малых дозах не влияют на
проницаемость мембран для ионов СГ.
Популярность применения бензодиазепинов связана с их
относительно низкой токсичностью, однако в настоящее время
выявлено, что длительное использование препаратов этой
группы может привести к развитию толерантности, а также вызвать
когнитивные расстройства и лекарственную зависимость.
Поэтому бензодиазепины следует использовать не более 3-4
недель при бессоннице, неврозах или состояниях тревоги и страха.
Многие антндепрессанты (например, амитриптилин) также
обладают анксиолитической активностью, но не вызывают
лекарственной зависимости. Буспирон является анксиолитиком
без седативной активности, он действует на 5-НТ-синапсы (се-
ротонинергические).
Бензодиазепины используют в качестве снотворных средств
(показаны в верхней части рисунка слева) или как
транквилизаторы (показаны в верхней части рисунка справа). В
основном выбор препарата зависит от продолжительности его
действия. Многие бензодиазепины метаболизируются в печени до
активных метаболитов, которые имеют большую
продолжительность действия, чем само лекарство. Так, например, дназелам
(ti/2 = 20—80 часов) превращается в активный N-десметилдиа-
зепам, период полуэлиминации которого составляет около 200
часов.
Бензодиазепины, используемые в качестве снотворных
средств, подразделяются на препараты короткого и
продолжительного действия. Предпочтение обычно отдают веществам с
быстрой элиминацией из организма (например, темазепам), так
как это позволяет избежать дневной сонливости. Препараты
продолжительного действия (например, нитразепам), как
правило, назначают пациентам, которые ночью нуждаются в
снотворном, а днём — в транквилизирующем эффекте. Зопиклон
также действует на бензодиаэепиновые рецепторы, но по своей
химической структуре является циклопирролоном. Это
средство, недавно введённое в клиническую практику, обладает
короткой продолжительностью действия.
54
ГАМК
Обратный захват
Янтарный
полуальдегид
Глутамат
ГАМК
гдк
ГАМК
ГАМК-рецепггоры (см. главу 22). Снотворное и
транквилизирующее действие препаратов опосредуется через ГАМКА-ре-
цепторы. ГАМКА-рецепторы принадлежат к семейству
рецепторов, связанных с ионными каналами (другие примеры
подобных рецепторов: н-холинорецепторы, глициновые и 5-НТ3-
рецепторы). ГАМ КА-рецепторы состоят из нескольких
субъединиц (а, р, у и о), каждая из которых имеет несколько
подтипов (шесть а-, четыре р-> четыре у-, две о-субъединицы). Состав
субъединиц ГАМКА-рецепторов в головном мозге неизвестен.
Если ГАМКА-рецепторы являются пентамерными (подобно н-
холинорецепторам), то их основной подтип, вероятно, состоит
из 2аь 2^2 и 72 субъединиц, так как в клетках головного мозга в
значительных количествах находятся иРНК, декодирующие эти
субъединицы. Электрофизиологические исследования,
проведённые на яйцеклетках жабы, содержащих различные
комбинации ГАМКА-субъединиц (образуются в результате введения
иРНК в яйцеклетки), показали, что ГАМКА-рецепторы
состоят из а- и р-субъединиц, стимуляция которых ГАМ К приводит
к усилению проницаемости СГ-каналов. Но для того чтобы эти
рецепторы полностью реагировали на бензодиазепины,
необходимо наличие уг-субъединицы. Данные последних
экспериментов свидетельствуют о том, что бензодиазепин- и ГАМК -
связывающие участки обычно расположены на а-субъедини-
цах (показаны в нижней части рисунка).
Недавно были открыты вещества, являющиеся
антагонистами и частичными агонистами бензодиазепиновых
рецепторов. Известны соединения, которые усиливают тревогу и
являются агонистами бензодиазепиновых рецепторов
необратимого действия. Возможно, дальнейшие исследования в этом
направлении позволят получить анксиолитические средства без
седативного эффекта.
Флумазенил является конкурентным антагонистом бензоди-
азепинов, обладает короткой продолжительностью действия.
Препарат применяют внутривенно для устранения седативного
эффекта бензодиазепинов, в анестезиологии, интенсивной
терапии, при проведении диагностических процедур и при
передозировке средств бензодиазепинового ряда.
Барбитуратовые рецепторы. Барбитураты усиливают ГАМК-
зависимое торможение в ЦНС, увеличивая продолжительность
открытия СГ-каналов, связанного с активацией ГАМКА-рецеп-
торов (тогда как бензодиаэепины увеличивают число открытых
СГ-каналов). Барбитураты являются более сильными
угнетающими ЦНС средствами, чем бензодиазепины, так как в
высоких дозах они непосредственно увеличивают проницаемость
Cl-каналов и уменьшают чувствительность постсинаптических
мембран нейронов к возбуждающим нейромедиаторам.
Раньше барбитураты использовали достаточно широко, но в
настоящее время в качестве снотворных и успокаивающих
средств их практически не применяют, так как их
использование может сопровождаться развитием психической и
физической зависимости. Барбитураты вызывают индукцию микросо-
мальных ферментов печени. Они токсичны, их передозировка
(даже относительно небольшая) может привести к летальному
исходу, тогда как передозировка бензодиазепинов к серьёзным
последствиям, как правило, не приводит. Барбитураты
(например, тиоаеитал-нжтрнй; см. главу 23) используют в качестве
средств для наркоза и как противосудорожные средства
(например, фенобарбитал; см. главу 25).
Бензодиазепины
Бензодиазепины эффективны при пероральном применении.
Они не вызывают индукции микросомальных ферментов, хотя
метаболизируют в печени путём окисления. Бензодиазепины
угнетают ЦНС, но в отличие от других анксиолитических и
снотворных средств их пероральное применение не вызывает
выраженного угнетения дыхания и гибели пациентов.
Угнетение дыхания может наблюдаться при внутривенном введении
препаратов, а также у пациентов с бронхо-лёгочными
заболеваниями.
Побочные эффекты. Бензодиазепины вызывают сонливость,
нарушение внимания и координации движений, особенно у
пожилых людей.
Лекарственная зависимость. Синдром отмены может
отмечаться даже у пациентов, принимавших бензодиазепины в
течение короткого периода времени. Тревога, депрессия,
бессонница, тошнота, расстройство восприятия могут отмечаться на
протяжении нескольких недель и даже месяцев после отмены
бензодиазепинов.
Взаимодействие бензодиазепинов с другими средствами.
Бензодиазепины усиливают действие средств, угнетающих ЦНС —
таких, как алкоголь, барбитураты и антигистаминные средства.
Внутривенное введение барбитуратов (например, диазепа-
ма, клоназепама) используют при эпилептическом статусе (см.
главу 25), иногда при состоянии панического возбуждения
(однако в этом случае более эффективным и безопасным является
пероральное применение алпразолама). Мидазолам применяют
внутривенно как успокаивающее средство при
эндоскопических и стоматологических манипуляциях. При внутривенном
введении бензодиазепинов отмечается выраженный амнести-
ческий эффект, поэтому пациенты могут ничего не помнить о
неприятных процедурах.
Аитидепрессанты
Анксиолитической активностью обладают трициклические
антидепрессанты (например, амитриптилнн). Их используют при
депрессивных и тревожных состояниях, а также у пациентов,
которым необходимо назначение транквилизаторов, но
существует опасность развития лекарственной зависимости к бен-
зодиазепинам. Ингибиторы МАО особенно эффективны при
фобиях (см. главу 28).
Средства, действующие
на серотониновые E-НТ) рецепторы
Серотонинергические нейроны локализуются в ядре шва
среднего мозга и проецируются во многие области головного
мозга, включая области, отвечающие за формирование тревоги
(гиппокамп, миндалевидное тело, кора лобных долей). У крыс
повреждение ядра шва вызывает транквилизирующий эффект,
в то время как стимуляция 5-НТ-рсцепторов специфическими
агонистами вызывает эффект тревоги. Экспериментально было
показано, что микроинъекции бензодиазепинов в дорсальные
ядра шва уменьшают частоту нейрональных разрядов и
вызывают транквилизирующий эффект. Результаты этих
экспериментов подтверждают участие 5-НТ-рецепторов в
формировании тревоги и показывают, что антагонисты 5-НТ-рецепторов
могут использоваться в качестве анксиолитиков. Антагонисты
5-НТз-рецепторов (например, овдансетрон) и 5-НТ2-рецепто-
ров (например, ританзерин) имеют слабую анксиолитическую
активность (или вообще ей не обладают). Однако буспирон —
частичный агонист 5-НТ1А-рецепторов проявляет
анксиолитическую активность, возможно, действуя как антагонист
постсинаптических 5-НТ1А-рецепторов, расположенных в гиппокам-
пе. Буспирон не обладает седативным действием и не вызывает
лекарственной зависимости. К сожалению, транквилизирующий
эффект препарата проявляется только после его 2-недельного
применения, а показания для его использования не определены.
р-адреноблокаторы (например, пропранолол) могут
эффективно устранять вегетативные проявления тревоги — такие, как
тремор, сердцебиение, потоотделение и диарею.
Хлоралгидрат в организме превращается втрихлорэтанол,
который обладает снотворным действием. Недостатком
препарата является его раздражающее действие на слизистую оболочку
желудочно-кишечного тракта. Дихлоралфеназон является
производным хлоралгидрата, но в отличие от него не обладает
раздражающим действием. Эти препараты удобны для применения
у детей и престарелых людей. Однако они вызывают
лекарственную зависимость, к ним может возникать толерантность.
Хлорметназол не имеет существенных отличий от других
бензодиазепинов короткого действия, за исключением того, что у
престарелых людей он может вызвать чувство небольшого
опьянения. Препарат вводят внутривенно при алкогольной
абстиненции и при эпилептическом статусе. Хлорметназол
вызывает лекарственную зависимость, поэтому его применяют в
течение ограниченного периода времени.
S5
25. Противоэпилептические средства
Средства,
применяемы* при больших
лелтических припадках
Дифвнин
Карбамазепин
Вальпроаты * -
Ламотриджин"
Вигабатрин
„Фенобарбитал
Снижение порога ПД
Са2+-спайк
(таламические нейроны) Са2+-канал
Т-типа
Хлорметиазол
Клонаэепам
Диаэепам
Этосуксимид
Вальпроаты
Эпилепсия — это хроническое заболевание,
характеризующееся появлением припадков, обусловленных патологическим
возбуждением церебральных нейронов. Припадки
классифицируются эмпирически.
Парциальные (фокальные) припадки генерируются в
специфическом эпилептогенном очаге головного мозга (в верхней
части рисунка справа) и могут ограничиваться
подёргиваниями конечностей. Однако судорожный разряд может
распространяться (на рисунке показано стрелкой ¦=>) и становиться
генерализованным (вторичный генерализованный припадок). При
генерализованных припадках нет признаков локализованного
очага возбуждения; возбуждение охватывает оба полушария
головного мозга. Они включают тонико-клонические припадки
(большие эпилептические припадки — grand mat, — периоды
тонической ригидности, следующие за массивными
конвульсиями тела) и абсансы (малые эпилептические припадки — petit
mal, — потери сознания, обычно продолжающиеся менее 10
секунд).
При тонико-клонических и парциальных припадках перо-
рально применяют карбамазепин, дифенин (фенитоин) или
вальпроаты. Эти средства обладают сходной эффективностью про-
тивоэпилептического действия, они способны предупреждать
тонико-клонические припадки у 70-80% пациентов, а
парциальные припадки — только у 30—40%. При их недостаточной
эффективности применяют ламотриджин, вигабатрин или габа-
пентин, которые уменьшают частоту припадков, но только у 7%
пациентов полностью их предупреждают. Альтернативными
средствами при тонико-клонических и парциальных
припадках являются фенобарбитал, гексамидин (примндон) и
клонаэепам, но у них значительно выражены седативные свойства.
Для предупреждения абсансов используют этосуксимид или
вальпроаты (в нижней части рисунка справа). Малые
эпилептические припадки у детей редко сохраняются во взрослой
жизни, в 50% случаев позднее развиваются большие
эпилептические припадки.
Эпилептический статус — это тяжелое состояние, при
котором припадки следуют один за другим с одновременной
потерей сознания. При эпилептическом статусе, который может
вызвать истощение и тяжёлые повреждения головного мозга,
проводится неотложная терапия с внутривенным введением
препаратов (в нижней части рисунка слева). Для купирования
судорог применяют клонаэепам или диазепам, но лучший
эффект дает продолжительное внутривенное введение хлорметиа-
зола.
Механизм действия противоэпилептических средств
окончательно не выяснен, но в основном он связан либо с
усилением ГАМК-зависимого торможения в ЦНС (бензодиазепины,
вигабатрин, фенобарбитал, вальпроаты) (показано на рисунке
слева), или с уменьшением проницаемости мембран нейронов
для Na+ (дифенин, карбамазепин, вальпроаты, ламотриджин)
(показано на рисунке справа). Этосуксимид и вальпроаты могут
угнетать входящий ток Са2+ в таламических нейронах, что
препятствует генерации потенциала действия (показано в нижней
части рисунка справа).
56
Янтарный
полуальдегид
Очаг эпилептической активности
Распространение
при малых мииимпи-
часких припадках
сютум
ГАМК
ГАМК
гдк
Глу
Причины эпилепсии
В 70% случаев этиология эпилепсии неизвестна, но среди
причин заболевания важную роль играет наследственность.
Провоцировать развитие эпилепсии могут повреждения головного
мозга, например, опухоли, асфиксия, инфекции, травмы.
Судороги у больных эпилепсией могут вызывать некоторые
лекарственные вещества, например, фенотиазины, трицикличес-
кие антидепрессанты и многие антигистаминные средства.
Механизм действия противосудорожных средств
Наиболее изученным противоэпилептическим средством
является дифенин (фенитоин), который в терапевтических
концентрациях не влияет ни на высвобождение медиаторов, ни на
глутамат- или ГАМК-зависимый нейрональный ответ.
Механизм его противоэпилептического действия, вероятно, связан
с его способностью предупреждать высокочастотную
активность эпилептогенного очага. Каким образом это достигается,
до сих пор неясно. Экспериментально показано, что при
эпилепсии отмечается относительное увеличение числа
неактивных Na+-каналов. Предположительно, дифенин связывается с
неактивными (закрытыми) Na+-каналами, стабилизируя их в
неактивном состоянии, и не позволяет им выйти из состояния
покоя, чтобы они могли вновь открыться (см. главу 5).
Повторная высокочастотная деполяризация мембран увеличивает
пропорцию неактивных Na+-каналов, и так как этот подтип
Na+-каналов блокируется дифенином, то ток Na+
прогрессивно уменьшается до тех пор, пока станет недостаточным, чтобы
вызвать потенциал действия. Дифенин не влияет на нейрональ-
ную передачу нормальной частоты, потому что в норме
пропорция неактивных Na+-каналов значительно меньше, чем при
эпилепсии. Карбамазепин, ламотриджин и вальпроаты влияют
на Na+-каналы нейронов подобно дифенину. Вальпроаты
одновременно усиливают центральное ГАМК-ергическое
торможение, активируя глутаматдекарбоксилазу (ГДК) и/или инги-
бируя ГАМК-трансферазу (ГАМК-Т). Вигабатрин необратимо
ингибирует ГАМК-Т, в результате чего увеличивается
содержание ГАМК в тканях мозга и усиливается её синаптическое
высвобождение. Бензодиазепины (например, клоназепам) и
фенобарбитал также усиливают действие синаптически
высвободившейся ГАМК на комплекс ГАМКА-рецептор/СГ-канал
(см. главу 24). Фенобарбитал также может уменьшать
активность глутамата в возбуждающих синапсах.
Приступы абсанс-эпилепсии сопровождаются осциллятор-
ной нейрональной активностью между таламусом и корой
головного мозга. Эти осцилляции связаны с увеличением
проницаемости Са2+-каналов Т-типа в нейронах таламуса, что
приводит к снижению порога потенциала действия и способствует
возбуждению нервных клеток. Последнее подтверждается тем,
что противоэпилептические средства (этосуксимид и
вальпроаты), применяемые при абсансах, уменьшают ток Са2+ и
ликвидируют таламо-кортикальные осцилляции, которые являются
критическими и вызывают приступы эпилепсии.
Средства, применяемые при парциальных и больших
эпилептических припадках
Монотерапия эпилепсии более предпочтительна, так как при
этом уменьшается риск развития побочных эффектов. Кроме
того, большинство больных не чувствуют себя лучше при
использовании комбинации нескольких веществ. Препаратами
первого ряда при этих видах эпилепсии являются карбамазепин
и вальпроаты, так как у них мало побочных эффектов и при их
применении не нарушаются познавательная функция и
поведение. Некоторые противоэпилептические средства, особенно
дифенин (фенитоин), фенобарбитал и карбамазепин вызывают
индукцию микросомальных ферментов печени и ускоряют
разрушение многих лекарственных средств (например, пероральных
контрацептивов, неодикумарина и теофиллина).
Карбамазепин метаболизируется в печени до карбамазепин-
10,11-эпоксида, его активного метаболита, обладающего
противосудорожной активностью и выраженной нейротоксичнос-
тью. Между содержанием карбамазепина в сыворотке крови и
введённой дозой препарата существует линейная зависимость
(в отличие от дифенина). Даже слабые нейротоксические
эффекты карбамазепина (тошнота, головная боль, сонливость,
диплопия и атаксия) часто заставляют снижать дозу препарата.
Иногда наблюдается идиосинкразия на карбамазепин,
выражающаяся в развитии агранулоцитоза.
Дифенин (фенитоин) гидролизуется ферментными
системами печени. Скорость метаболизма препарата значительно
варьирует у различных пациентов, иногда может потребоваться
до 20 дней для стабилизации уровня препарата в сыворотке
крови после изменения его дозы. Поэтому дозу дифенина
следует увеличивать постепенно до прекращения приступов или
до момента появления первых признаков церебральных
нарушений (нистагм, атаксия, дизартрия). При длительном
применении дифенина необходимо определять уровень препарата в
крови, так как даже небольшое увеличение дозы дифенина
может вызвать подъём его уровня в крови до токсического из-
за насыщения ферментов, гидроксилирующих дифенин.
Побочные эффекты дифенина включают головную боль,
тремор, тошноту, головокружение. При длительном применении
препарата может развиться гипертрофия дёсен, повышение
секреции сальных желёз, огрубение черт лица и гирсутизм.
При тонико-клонических и больших эпилептических
припадках эффективен также фенобарбитал, но по сравнению с
карбамазепином и дифенином у него более выражен седатив-
ный эффект. При длительном применении к препарату
развивается толерантность, а внезапная отмена фенобарбитала
может спровоцировать развитие эпилептического статуса.
Побочные эффекты включают церебральные симптомы (вялость,
сонливость, атаксию, нистагм) и развитие гиперкинезии у детей.
Гексамидин (примидон) метаболизируется в активные
метаболиты, обладающие противосудорожной активностью. Одним из
них является фенобарбитал.
Вигабатрин, габапентин и ламотриджин — новые
противоэпилептические препараты, добавляемые к основной терапии
при недостаточной эффективности других противоэпилепти-
ческих средств. Ламотриджин может использоваться для
монотерапии эпилепсии. Этот препарат по противоэпилептической
активности сходен с дифенином, но обладает менее
выраженными побочными эффектами.
Средства, применяемые при малых
эпилептических припадках
Единственным эффективным средством при малых
эпилептических припадках и миоклонических судорогах
(кратковременных судорожных подёргиваниях без потери сознания)
является этосуксимид.
Средства, применяемые при больших и малых
эпилептических припадках
Вальпроаты. Преимуществами этих средств являются
широкий спектр противоэпилептического действия и слабый седа-
тивный эффект. При их применении могут отмечаться слабо
выраженные побочные эффекты (тошнота, повышение веса тела,
транзиторное выпадение волос и нарушение свёртываемости
крови). Основным недостатком препарата является опасность
появления идиосинкразии, при которой развивается
токсическое поражение печени, иногда носящее фатальный характер.
Бензодиазепины. Клоназепам — активный противоэпилепти-
ческий препарат, эффективен при абсансах,
тонико-клонических и миоклонических судорогах. Он обладает выраженным
седативным действием. При продолжительном пероральном
применении к нему возникает толерантность.
57
26. Препараты, применяемые при паркинсонизме
Этиология
В основном неизвестна
ТОКСИЧЕСКОГО ГЕНЕЗА
МФТИ
СО
Марганец
ЛЕКАРСТВЕННОГО ГЕНЕЗА
Нейролептики
(антагонисты
дофамина)
Дегенерация нигростриатных
нейронов
Холиноргичоокио
сродства
М-ХОЛИНОБЛОКАТОРЫ
Циклодол
Бензотропин
Орфенадрин
Ингибиторы МАО-В
Селегилин (депренил)
Дофаминоргические
оредства
ПРЕДШЕСТВЕННИКИ
ДОФАМИНА
Леводопа
f + карбидопа или
бенсеразид)
УВЕЛИЧИВАЮЩИЕ
ВЫСВОБОЖДЕНИЕ
ДОФАМИНА
Мидантан
АГОНИСТЫ ДОФАМИНА
Бромокриптин
Лизурид
Апоморфин
Паркинсонизм — это заболевание, связанное с поражением
базальных ганглиев и характеризующееся скованностью
движений, ригидностью и тремором. Болезнь прогрессирует и при
отсутствии адекватного лечения приводит к инвалидности.
В начале 60-х годов исследования мозга пациентов,
умерших от болезни Паркинсона, выявили снижение уровня
дофамина в базальных ганглиях (nucleus caudatus, put a men, globus
pallidas). Паркинсонизм, таким образом, стал первой болезнью,
которая ассоциировалась с нарушением медиаторного обмена
в головном мозге. Основной патологией при паркинсонизме
являются интенсивные дегенеративные изменения на уровне
дофаминергического нигрострйатного тракта, хотя причины их
возникновения до сих пор неизвестны. Клетки различных
образований этого тракта расположены в черной субстанции
(substantia nigra) в среднем мозге. Выраженные проявления
паркинсонизма отмечаются при дегенерации более 80% нейронов
этой субстанции. У 1/3 всех больных паркинсонизмом
развивается деменция.
Сам дофамин при паркинсонизме не применяют, так как он
не проникает через гематоэнцефалический барьер. Однако его
предшественник, леводопа (L-ДОФА), проникает в головной
мозг, где подвергается декарбоксилированию и превращается в
дофамин. Леводопа при пероральном применении метаболи-
зируется в основном в периферических тканях, поэтому её
комбинируют с ингибиторами периферической ДОФА-декарбоксила-
зы (с карбид опой и бснсеразидом). При этом за счёт
подавления периферического метаболизма уменьшается выраженность
периферических побочных эффектов (тошнота, ортостати-
ческая гипотензия) и снижается эффективная доза леводопы.
Леводопа в сочетании с ингибиторами периферической ДОФА-
декарбоксилазы является основным средством для лечения
паркинсонизма. К другим дофаминергическим средствам,
использующимся при паркинсонизме, относятся агонисты
дофаминовых рецепторов и мидантан (амантадин), увеличивающий
высвобождение дофамина в синаптическую щель. Выраженность
некоторых периферических побочных эффектов дофаминерги-
ческих средств уменьшается при использовании домперидона —
антагониста дофаминовых рецепторов, не проникающего через
гематоэнцефалический барьер. Действие леводопы усиливает
депренил (селегилин) — ингибитор моноаминоксидазы В (МАО-
В). Монотерапия депренилом незначительно уменьшает
выраженность симптомов паркинсонизма, что может отсрочить на
несколько месяцев необходимость применения леводопы.
В результате прогрессивной дегенерации нигростриатных
нейронов при паркинсонизме снижается высвобождение
дофамина и повышается активность холинергических нейронов в
полосатом теле (corpus striatum) (на рисунке слева), что
обосновывает рациональность применения при паркинсонизме
антихолинергических средств (показаны в нижней части
рисунка слева). Эти средства эффективно уменьшают характерный
для паркинсонизма тремор. Отмена антихолинергических
средств может обострить симптоматику паркинсонизма.
Внутривенное введение бензотропнна используют при острой
листании, вызванной нейролептическими средствами (см. главу 27).
58
Торможение
Возбуждение
Метаболиты
ДОФА-
декарбоксилаза
L-ДОФА
Этиология
Этиология паркинсонизма неизвестна; экзогенные и
эндогенные нейротоксины, способные вызвать паркинсонизм, пока
не обнаружены. Однако о возможности токсического
поражения дофаминергических нейронов свидетельствует недавний
случай в Калифорнии, когда дегенерация нигростриатного
тракта и паркинсонизм развились у наркомана с лекарственной
зависимостью к петидину. Петиции A-метил-4-фенил-1,2,3,6-тет-
рагидропиридин, МФТП) проявляет действие через свой
активный метаболит A-метил-4-фенилпиридин, МФП+),
образующийся под действием фермента МАО-В. Каким образом
это вещество вызывает дегенерацию дофаминергических
нейронов, не совсем понятно: возможно, повреждение
митохондрий и мембран нервных клеток вызывают свободные радикалы,
образующиеся при МАО-В-зависимом превращении петидина.
Нейролешпгики блокируют дофаминовые рецепторы и часто
вызывают проявления паркинсонизма.
Дофаминергические средства
Наиболее эффективным средством при паркинсонизме
является леводола в сочетании с ингибиторами периферической
ДОФА-декарбоксилазы.
Механизм. Леводопа — это непосредственный
предшественник дофамина. Леводопа проникает через гематоэнцефаличес-
кий барьер в головной мозг, где превращается в дофамин. В
каких участках головного мозга больных паркинсонизмом
происходит её декарбоксилирование, точно не определено.
Возможно, это осуществляется в неповреждённых
дофаминергических нейронах, так как содержание ДОФА-декарбоксилазы в
ЦНС строго не ограничено. С другой стороны, эта реакция
может протекать в норадренергических и серотонинергических
нейронах, так как декарбоксилазная активность не является
строго специфичной. При применении леводопы улучшение
состояния отмечается у большинства пациентов.
Побочные эффекты при использовании леводопы
отмечаются часто и в основном связаны с активацией дофаминовых
рецепторов различной локализации. Вследствие возбуждения хе-
морецепторной триггерной зоны возникают тошнота и рвота.
Эти побочные эффекты могут быть ослаблены применением
домперидона (антагониста дофаминовых рецепторов
периферического действия). Основными побочными эффектами,
ограничивающими применение леводопы, являются нарушения
психики, включающие галлюцинации, психозы, яркие
сновидения, помешательство. Эти эффекты, вероятно, вызваны
активацией дофаминовых рецепторов мезолимбических и мезо-
кортикальных путей. Распространённым, но часто
бессимптомным осложнением леводопы является ортостатическая гипо-
тензия. На ранних стадиях паркинсонизма возможно
появление дискинезии, что связано либо с передозировкой леводопы,
либо со снижением её дозы или изменением режима введения.
Проблемы длительного лечения. После 5 лет лечения у 50%
больных не остаётся шансов на улучшение состояния. У
некоторых пациентов снова появляется акинезия, происходит
укорочение действия каждой последующей дозы леводопы. Со
временем могут появиться нарушения двигательной активности и
различные дискинезии, что связано с изменениями уровня
леводопы в плазме крови. Прогрессирующая дегенерация
нейронов понижает возможность стриатума уменьшать колебания
уровня леводопы в плазме крови, поэтому продолжение дофа-
минергической стимуляции осуществляется внутривенным
введением леводопы и подкожным — апоморфина, что может
уменьшить дискинезию. К сожалению, для длительного
применения эта схема лечения не подходит, но сочетание пер-
орального введения леводопы с инъекциями апоморфина во
время приступов помогает улучшить самочувствие больных.
Агонисты дофаминовых рецепторов
Бромокркптнн (парлодел) — селективный агонист D2-pcuen-
торов. Препарат часто используют в сочетании с леводопой на
поздних стадиях паркинсонизма для уменьшения побочных
эффектов леводопы. Побочные эффекты у него такие же, как и у
леводопы (тошнота, психические расстройства,
ортостатическая гипотензия), но только более частые и серьёзные. Бромок-
риптин применяют при гиперпролактинемии (галактореи), так
как он тормозит высвобождение пролактина из гипофиза.
Препарат также используют при акромегалии, бромокриптин
угнетает выделение соматотропного гормона при акромегалии, хотя
у здоровых людей действует наоборот. Это связано с тем, что у
больных акромегалией имеются дофаминовые рецепторы,
которых нет в норме.
Лизурид является агон истом Эг-рецепторов. Он действует
подобно бромокриптину, но при его использовании ярче
проявляются побочные эффекты, связанные с нарушением психики.
Апоморфин стимулирует Dr и Эг-дофаминовые рецепторы.
Препарат используют подкожно при запущенном паркинсонизме.
Средства, усиливающие высвобождение дофамина
в синоптическую щель
Мидантан (амантадин) обладает м-холиноблокирующей
активностью и, вероятно, увеличивает высвобождение дофамина
в синаптическую щель. Препарат оказывает умеренное проти-
вопаркинсоническое действие, к нему быстро развивается
толерантность.
Ингибиторы МАО-В
Депренил (селегилин) избирательно угнетает МАО-В в
тканях мозга. Этот фермент избирательно разрушает дофамин, не
действуя на норадреналин или серотонин. Депренил, угнетая
МАО-В, уменьшает разрушение дофамина в головном мозге и
потенцирует действие леводопы, что позволяет уменьшить дозу
леводопы в среднем на 1/3. Поскольку депренил защищает
животных от эффекта МФТП, предполагалось, что он способен
замедлить прогрессирование паркинсонизма. К сожалению, эти
предположения не оправдались.
Антихолинергические средства
М-холиноблокаторы оказывают умеренное противопаркин-
соническое действие в начальной стадии заболевания, но
слабо действуют на акинезию. Общими побочными эффектами
препаратов этой группы являются сухость во рту, задержка мочи
и запоры. Они могут вызывать и более серьёзные побочные
эффекты — такие, как нарушение памяти и концентрации
внимания, а также спутанность сознания со зрительными
галлюцинациями, особенно у престарелых пациентов и у больных с
деменцией.
59
27. Антипсихотические средства — нейролептики
Химическое строение
Блокаде рецепторов
Блокада 02-дофаминовых рецепторов
Особенно
Алифатические
Аминазин
Пиперидиноеые
Тиоридазин
Пилеразиновые
Фторфеназин
Седативное действие
Выраженное
Умеренное
Слабое
М-холиноблокирующее действие
Умеренное
Выраженное
Слабое
Экстрапирамидные расстройства
Умеренно
выраженные
Слабо
выраженные
Выраженные
Атипичные
нейролептики
Азалептин
Риспвридон
Тиоридазин
Сульпирид
Тиоксантены
Флупентиксол
Бутирофеноны
Галоперидол
Сухость во рту
Нарушение зрения
Затруднение
мочеиспускания
Запор
Блокада
\ М -холинорецепторов
Нейролептики
/Блокада
а-адрено-
рецепторов
Ортостатическая
гипотензия
Гипотермия Блокада
гистаминовых
и серотониновых
рецепторов "*"
Влияние на
психику
Кора
Лимбическая система
Антипсихотическое
и седативное
действие
Мезолимбический путь
Вязальные ганглии
(полосатое тало)
Тубероинфун-
дибулярный путь
Гипофиз
Пролактин
Эндокринные
нарушения
Двигательные
расстройства
Паркинсонизм
Акатизия
Дискинеэия
в том числе
поздняя
Гинекомастия
Галакторея
Нарушение менструального цикла
Импотенция
Увеличение массы тела
Шизофрения — это психическое заболевание,
характеризующееся выраженными изменениями личности. Продуктивная
симптоматика шизофрении включает в себя бред,
галлюцинации, нарушения мышления и поведения. Существуют данные,
что появление шизофрении связано с аномалиями развития
гиппокампа, миндалевидного тела, височной и фронтальной
долей коры головного мозга. В этиологии шизофрении важную
роль играют наследственность, а также внутриутробные и
акушерские поражения головного мозга. Нейролептики
устраняют многие проявления шизофрении, в том числе позитивную
симптоматику заболевания (галлюцинации и бред), слабо влияя
на такие негативные симптомы, как: социальная апатия,
эмоциональное оскудение, аутизм. При применении
нейролептиков у 30% больных шизофренией отмечается лишь
незначительное улучшение состояния, а в 7% случаев даже длительная
терапия нейролептиками не даёт положительного эффекта.
Нейролептики являются антагонистами дофаминовых
рецепторов, что свидетельствует о повышении активности при
шизофрении мезолимбических и мезокортикальных дофаминергинеских
путей (показано на рисунке справа). Это положение
подтверждает тот факт, что фенамин (амфетамин), усиливающий
высвобождение норадреналина и дофамина в нервных синапсах,
может вызвать психотическое состояние, сходное с
параноидной шизофренией, у психически здоровых людей. Для
купирования острых приступов шизофрении нейролептики
применяют в течение нескольких недель, большинство же пациентов
принимают эти препараты для поддерживающей терапии на
протяжении многих лет, так как при отмене нейролептиков
более чем у 2/3 пациентов в течение года отмечается рецидив
заболевания. Рецидивы шизофрении могут возникать даже на
фоне лекарственной терапии.
Нейролептики блокируют дофаминовые рецепторы в базаль-
ных ганглиях (стриатуме), что часто приводит к появлению
двигательных расстройств (экстрапирамидных нарушений) (на
рисунке справа). Экстрапирамидные нарушения включают в себя
явления паркинсонизма, острой дискинезии (для их
устранения применяют антихолинергические средства), акатизии
(непоседливость, потребность в движении), а также поздней
дискинезии (хореоатетоидные сокращения мышц лица, тела и
конечностей), которые могут приобрести необратимый
характер. Причины появления поздней дискинезии неясны,
возможно, они связаны с повышением чувствительности
дофаминовых рецепторов стриатума, так как отмена нейролептиков не
приводит к исчезновению этого синдрома. Некоторые
атипичные антипсихотические средства при использовании в малых
дозах (показаны в нижней части рисунка слева) практически
не вызывают экстрапирамидных расстройств. Клоэапин
является единственным антипсихотическим средством, полностью
лишённым этого побочного действия.
Нейролептики, блокируя 02-дофаминовые рецепторы
гипофиза, увеличивают выделение пролактина, что приводит к
развитию эндокринных нарушений (показаны в нижней части
рисунка справа).
Нейролептики оказывают также м-холиноблокирующее и а-
адреноблокирующее действие, что приводит к развитию
вегетативных нарушений (показаны в центре рисунка), в том числе,
ортостатической гипотензии, сухости во рту и запору.
Выраженность побочных эффектов, связанных с м-холиноблокиру-
ющим и а-адреноблокирующим действием, зависит от
химической структуры нейролептиков.
60
Фенотиазины
Блокада D2-
дофаминовых
рецепторов
Нигро-
I стриатный
' путь
Дофаминовые рецепторы
Вначале дофаминовые рецепторы подразделялись на два
класса: D] и D2. В дальнейшем было клонировано пять
подтипов дофаминовых рецепторов, которые входят в эти два
класса. D]-подобные дофаминовые рецепторы включают Dt и D5
подтипы, а D2-подобные дофаминовые рецепторы включают
D2, D3 и D4 подтипы. Дофаминовые рецепторы посредством
G-белков связаны с аденилатциклазой (стимуляция Di-рецеп-
торов активирует аденилатциклазу, а 02-рецепторов — угнетает).
Dгподобные дофаминовые рецепторы (подтипы D] и D5)
участвуют в процессах постсинаптического торможения.
Большинство нейролептиков блокирует D\-рецепторы, но выраженность
этого эффекта не коррелирует с их антипсихотической
активностью. Так, например, бутерофеноны являются сильными
нейролептиками, но слабыми антагонистами D!-рецепторов.
02-подобные дофаминовые рецепторы (подтипы D2, D3 и D4)
участвуют в процессах пресинаптического и
постсинаптического торможения. Большинство известных эффектов
дофамина связано с активацией D-рецепторов. Выраженность
антипсихотической активности нейролептиков прямо
пропорциональна их сродству к 02-рецепторам. Этот факт
свидетельствует о том, что развитие шизофрении связано с активацией D2-
рецепторов центральных дофаминергических путей. D2-рецеп-
торы (а также D3 и D4) в основном находятся в лимбической
системе, которая отвечает за формирование настроения и
эмоций. В области хвостатого ядра имеется большое количество
D2-рецепторов, которые получают волокна от нигростриатного
дофаминергического пути. Нейролептики блокируют эти
рецепторы, поэтому часто вызывают двигательные нарушения.
Участвуют ли Dз-рецепторы в реализации антипсихотического
эффекта нейролептиков наравне с D2~рецепторами,
неизвестно. Азалептин имеет высокое сродство к D4-рецепторам и
слабое к D2-рецепторам.
Механизм действия нейролептиков. Каким образом
нейролептики уменьшают продуктивную симптоматику шизофрении,
неизвестно. Так как все антипсихотические средства являются
антагонистами дофаминовых рецепторов, предполагают, что
развитие шизофрении связано с повышенной активностью ме-
золимбических и мезокортикальных дофаминергических путей.
Однако убедительных доказательств изменений дофаминерги-
ческой системы при шизофрении нет.
Химическое строение
Антипсихотические средства имеют различную химическую
структуру, однако все они блокируют дофаминовые рецепторы.
Фенотиазины подразделяются в зависимости от строения
боковой цепи, присоединённой к атому азота фенотиазинового
кольца, на следующие группы:
1) алифатические производные (содержат пропиламиновую
боковую цепь). Алифатические производные фенотиазина
обладают относительно слабой антипсихотической активностью и
вызывают много побочных эффектов (показаны на рисунке).
Аминазин (хлорпромазин) был первым фенотиазином,
достаточно широко применяемым при шизофрении, несмотря на
выраженные побочные эффекты. Препарат оказывает сильный
седативный эффект, он особенно эффективен при
психомоторном возбуждении. Аминазин может вызвать реакции
повышенной чувствительности в виде агранулоцитоза,
гемолитической анемии, кожной сыпи, холестатической желтухи,
фотосенсибилизации;
2) пнперидиновые производные (содержат в боковой цепи ядро
пиперидина). Основным препаратом этой группы является ти-
оридазнн (меллерил, сонапакс). Препарат эффективен у
пациентов пожилого возраста, не вызывает сонливости, обладает
выраженной антихолинергической активностью, двигательные
нарушения при его применении возникают реже, чем при
использовании других нейролептиков. Тиоридазин может
вызвать сексуальные расстройства (в том числе нарушения
эякуляции), иногда (при использовании в высоких дозах) —
дегенерацию сетчатки;
3) пиперазиновые производные (содержат в боковой цепи ядро
пиперазина). К этой группе относятся: фторфенаэин (флуфена-
зин, модитен), этаперазнн (перфеназин) и трифтазин (трифлуо-
перазин). Седативное и антихолинергическое действие
препаратов этой группы менее выражено, чем у аминазина. Однако
при их применении возможно появление двигательных
расстройств, особенно у пожилых пациентов.
Нейролептики
другой химической структуры
Бутерофеноны. Галоперидол оказывает слабое антихолинер-
гическое действие, слабее аминазина угнетает ЦНС и снижает
артериальное давление. Однако при его применении часто
наблюдаются двигательные нарушения.
Атипичные нейролептики (азалептин, рисперидон,
тиоридазин, сульпирид). Эти препараты называются «атипичными», так
как они редко вызывают двигательные нарушения. Азалептин
(клозапин) является единственным истинным атипичным
нейролептиком, потому что он практически не вызывает
экстрапирамидных расстройств и эффективен при резистентности к
лечению другими антипсихотическими средствами. Препарат
может вызвать нейтропению C% пациентов) и агранулоцитоз
A% пациентов), поэтому его применяют в основном при
неэффективности других антипсихотических средств. В процессе
лечения азалептином необходимо тщательно следить за
картиной крови. Азалептин в терапевтических дозах блокирует в
основном D4-рецепторы (находящиеся преимущественно в
лимбической системе), оказывая слабое влияние на D2-рсцепторы
стриапаллидарной системы. Вместе с тем азалептин блокирует
м-холинорецепторы и 5-НТ2-рецепторы. Возможно, что
атипичное действие азалептина связано с его м-холиноблокирующей
активностью, так как антихолинергические средства
уменьшают выраженность двигательных нарушений, вызванных
применением нейролептиков. Однако тиоридазин, также
оказывающий м-холиноблокирующее действие, может вызвать
экстрапирамидные расстройства. Существует предположение, что
атипичные свойства азалептина связаны с блокадой 5-НТ2-рецеп-
торов. Однако этому положению противоречит тот факт, что
антагонист 5-НТ2-рецепторов ритансерин не устраняет
галлюцинации и бред. Рисперидон — это новое антипсихотическое
средство без седативного эффекта, оказывающее слабое анти-
холинергическое и а-адреноблокирующее действие.
Рисперидон является антагонистом 5-НТ2-рецепторов и 02-рецепторов
(более сильным, чем азалептин). При использовании в малых
дозах не вызывает экстрапирамидных расстройств (однако при
применении в высоких дозах двигательные нарушения могут
появляться). Сульпирид является антагонистом 02-рецепторов,
оказывает седативное действие, обычно хорошо переносится
пациентами. Препарат широко используют при шизофрении,
так как он редко вызывает экстрапирамидные нарушения,
возможно, это связано с тем, что сульпирид имеет большее
сродство к мезолимбическим D2-рецепторам, чем к стриатным D2-
рецепторам.
Депо-препараты
(препараты пролонгированного действия)
Число пациентов с шизофренией в настоящее время
неуклонно возрастает, что требует создания препаратов
пролонгированного действия (депо-препаратов) для поддерживающей
терапии. Масляные растворы галоперидола деканоата, фторфе-
назин-деканоата (модитен-депо, флуфеназина деканоат) флу-
пентиксола деканоата применяют внутримышечно с
интервалами в 1-4 недели, однако использование этих препаратов
увеличивает частоту возникновения двигательных расстройств.
61
28. Средства, применяемые при аффективных состояниях.
Антидепрессанты
Ингибиторы обратного
майронального захвата
норвдрвналина
и/или 5-НТ
Амитриптилин*
Имипрвпин
Доксепин*
Лофепрамин
ДРУГИЕ
Венлафаксин
Избирательные
ингибиторы нейронального
захвата 5-НТ
Флуоксетин
Флуваксомин
аитмдапрассаиты
(на влияющие на
обратный захват
Миансерин*
Тразодон*
Ингибиторы моиоамии-
оксидаэы (ИМАО)
ОБРАТИМОГО ИЗБИРА-
ТЕЛЬНОГО ДЕЙСТВИЯ
(ИМАО-А)
Моклобемид
НЕОБРАТИМОГО
И НЕИЗБИРАТЕЛЬНОГО
ДЕЙСТВИЯ
Фвнвязин
Иэокарбоксазид
Высвобождение
Седативные свойства
М-холино- атропиноподобное
рецепторы —действие
агадрвно-
<- рецепторы
Ортостатическая
гипотензия
Тахикардия
Нарушение
зрения
Сухость во рту
Запор
Затруднение
мочеиспускания
Аффективные состояния (лат. affectus — душевное
волнение, страсть) — это эмоциональные нарушения,
сопровождающиеся изменением поведения и соматовегетативными
расстройствами (нарушение аппетита, сна, изменение массы тела и др.).
Наиболее ярким проявлением эмоциональных расстройств
являются маниакально-депрессивные психозы,
характеризующиеся чередованием маниакальных и депрессивных фаз.
Депрессия отмечается чаще, чем маниакальное состояние
(повышенное настроение, психомоторное, интеллектуальное и речевое
возбуждение). Депрессия характеризуется подавленным
настроением, чувством страха, неуверенности и безнадежности, в этом
состоянии очень высока вероятность самоубийства, хотя в
основном прогноз бывает благоприятным.
Большинство антидепрессантов (лекарственных средств,
применяемых при депрессии) угнетают обратный нейрональный
захват норадреналина (НА) и/или серотонина E-НТ) (в
верхней части рисунка слева). Трициклические антидепрессанты
являются препаратами 1-го поколения, они обладают, с одной
стороны, высокой антидепрессивнои активностью, а с другой —
выраженным седативным и вегетотропным действием
(побочные эффекты препаратов, связанные с блокадой м-холиноре-
цепторов и а-адренорецепторов, показаны в нижней части
рисунка), что ограничивает их применение в клинике. При
передозировке трициклических антидепрессантов возможны
проявления кардиотоксического действия и появление судорог. К
новому поколению антидепрессантов относятся избирательные
ингибиторы нейронального захвата серотонина, более
безопасные при использовании и имеющие другие побочные эффекты
(в основном вызывают желудочно-кишечные расстройства).
Ингибиторы моноаминоксидазы (ИМАО) (в верхней части
рисунка справа) применяют редко, так как при их использовании
может отмечаться появление «тираминового» синдрома
(возникает при приёме лекарств и продуктов питания, содержащих
тираминоподобные вещества, например, сыра, копчёностей).
Частота использования ингибиторов моноаминоксидазы
увеличилась после введения в клиническую практику ингибиторов
МАО-А обратимого действия (в верхней части рисунка справа).
Некоторые «атипичные» антидепрессанты не являются
ингибиторами МАО и не угнетают захват моноаминов (в нижней
части рисунка слева). Антидепрессанты противопоказаны при
эпилепсии, так как они могут спровоцировать появление
судорожных припадков. Терапевтический эффект
антидепрессантов проявляется через 2-3 недели. Возможно, это связано с
постепенным изменением чувствительности центральных 5-НТ-
рецепторов и/или адренорецепторов. Антидепрессанты
эффективны при депрессии в среднем у 70% пациентов. При
отсутствии эффекта от медикаментозной терапии в случаях
выраженной депрессии иногда используют электрошоковую
терапию. В тяжёлых случаях (отсутствие эффекта от монотерапии
антидепрессантами и электрошоковой терапии) некоторые
психиатры рекомендуют комбинировать трициклические
антидепрессанты с препаратами лития или ингибиторами
моноаминоксидазы, однако вследствие их взаимодействия возможны
опасные побочные эффекты. Для предупреждения рецидивов
депрессии антидепрессанты применяют в течение 4-6
месяцев. Внезапная отмена антидепрессантов, особенно
ингибиторов МАО, может вызвать тошноту, рвоту, паническое
состояние, тревогу и двигательное возбуждение.
Причины развития депрессии и механизм действия
антидепрессантов неизвестны. Согласно молоаминовой теории,
депрессия является результатом понижения активности
центральных норадренергических и/или серотонергических систем,
однако у этой теории есть много противоречий. В настоящее
время широко изучают влияние антидепрессантов на активность
рецепторов в головном мозге.
При мании и биполярных эмоциональных расстройствах
(чередование маниакального и депрессивного состояний)
эффективны препараты лития. Соли лития токсичны, имеют малую
широту терапевтического действия и часто вызывают
побочные эффекты. Способностью корригировать настроение
обладает карбамазепин — препарат можно использовать при маниях
в случаях неэффективности или при наличии противопоказа
ний к применению солей лития.
62
ТРИЦИКЛИЧЕСКИЕ
ь Блокада
рецепторов
Рецепторная регуляция?
Норадренергическое
окончание
Митохондрия
Метаболиты
Везикула
Отрицательная
обратная связь
Обратный захват
Высвобождение
Моноаминовая теория депрессии. Резерпин, часто
вызывающий развитие депрессии, истощает запасы норадреналина и
серотонина в головном мозге, тогда как антидепрессанты
напротив увеличивают концентрацию моноаминов в головном
мозге, блокируя их обратный нейрональный захват (трицикли-
ческие соединения и родственные им соединения) или
уменьшая их разрушение (ингибиторы МАО). Оба этих механизма
приводят к увеличению количества норадреналина и/или
серотонина в синаптической щели, что свидетельствует о связи
развития депрессии со снижением активности норадреналина и/
или серотонина в головном мозге. Однако выраженных
изменений в норадренергической и серотонергической системах
головного мозга при депрессии не обнаружено. Моноаминовая
теория депрессии имеет много противоречий. Так, например,
антидепрессивный эффект трициклических соединений
развивается в течение нескольких недель, несмотря на то, что они,
блокируя обратный нейрональный захват моноаминов, быстро
увеличивают концентрацию норадреналина и серотонина в
головном мозге. С другой стороны, некоторые «атипичные»
антидепрессанты не влияют на нейрональный захват
моноаминов (например, миансерин, тразодон), а кокаин, угнетающий
обратный нейрональный захват норадреналина, не является
антидепрессантом.
Активность рецепторов. Длительное применение
антидепрессантов (у грызунов) постепенно понижает чувствительность
центральных 5-НТ2-рецепторов, Pi- и аг-адренорецепторов к
моноаминам. Подобные изменения чувствительности рецепторов
при применении антидепрессантов у людей не изучены.
Однако имеются сведения, что при длительном использовании
антидепрессантов уменьшается чувствительность организма к
клофелину (а2-адреномиметику центрального действия).
Ингибиторы нейронального захвата моноаминов
Трициклические антидепрессанты, полученные на основе ди-
бензоазепина (например, имипрамин) и дибензоциклогептена
(например, амитриотилин), имеют в своей основе циклическую
структуру. Подобные им антидепрессанты 2-го поколения имеют
в своей химической структуре одно, два или четыре кольца.
Трициклические соединения обладают сходной
антидепрессивной активностью, поэтому выбор препарата определяется
специфичностью терапевтического действия или
выраженностью побочных эффектов. Антидепрессанты с седативным
действием (тимолептики) — такие, как амитриптимнн и доксепин, в
большей степени показаны возбуждённым пациентам, при
назначении на ночь они действуют как снотворные средства.
Трициклические соединения имеют структурное сходство с фено-
тиазинами. Подобно фенотиазинам они оказывают м-холиноб-
локирующее, а-адреноблокирующее и антигистаминное действие,
что может вызвать сухость во рту, нарушение зрения, запор,
задержку мочи, тахикардию и ортостатическую гипотензию. При
передозировке трициклических антидепрессантов могут
появляться сердечные аритмии (вследствие антихолинергического
и хинидиноподобного действия препаратов) и даже внезапная
смерть. Препараты противопоказаны при заболеваниях сердца.
Ингибиторы нейронального захвата серотонина не
стимулируют аппетит и не оказывают нежелательных вегетотропных
эффектов, характерных для трициклических соединений, но при
их применении возможно появление тошноты, рвоты, диареи
или запора. В настоящее время ингибиторы нейронального
захвата серотонина являются препаратами 1-го ряда при
депрессии, особенно при сопутствующих сердечно-сосудистых
заболеваниях, а также при нежелательности седативного или м-хо-
линоблокирующего действия трициклических
антидепрессантов. Венлафаксин — новый антидепрессант, угнетающий
нейрональный захват серотонина и норадреналина, но не
обладающий способностью трициклических соединений блокировать
рецепторы (гистамино-, м-холино- и а-адренорецепторы). Его
нежелательные эффекты характерны для всей группы
ингибиторов нейронального захвата серотонина.
Атипичные антидепрессанты
Атипичные антидепрессанты практически не влияют на
обратный нейрональный захват моноаминов, оказывают
незначительное вегетотропное действие. Передозировка этих средств
менее опасна, чем трициклических антидепрессантов, так как
они обладают слабой кардиотоксичностью. Миансерин и
тразодон — это атипичные антидепрессанты, обладающие седатив-
ной активностью. Миансерин блокирует пресинаптические (а2-
адренорецепторы в ЦНС, повышая уровень норадреналина в
синаптической шели. Применение препарата может вызвать
развитие агранулоцитоза и апластической анемии (особенно у
пожилых пациентов).
Ингибиторы МАО
Старые представители этой группы (например, ниаламид)
являются необратимыми и неселективными ингибиторами МАО,
их применяют при атипичной депрессии и фобиях. При
использовании этих препаратов часто отмечаются нежелательные
эффекты (ортостатическая гипотензия, головокружение, анти-
холинергические эффекты и поражение печени). При
комбинированном применении с си м патом и мети ка ми (например, с
эфедрином, который может входить в состав противокашлевых
микстур и противоспалительных средств) или с продуктами,
содержащими тирамин (сыр, мясо, алкогольные напитки),
ингибиторы МАО могут вызывать развитие стойкой
артериальной гипертензии («тираминовый» синдром). Обычно
принятый с пищей тирамин метаболизируется моноаминоксидазой в
стенках кишечника и в печени, но при угнетении этого
фермента, тирамин всасывается в кровь и вызывает
высвобождение норадреналина из симпатических нервных окончаний
(оказывая непрямое симпатомиметическое действие). Ингибиторы
МАО угнетают также метаболизм барбитуратов, опиоидных
анальгетиков и алкоголя. Применение петидина на фоне
ингибиторов МАО может привести к развитию гиперпирсксии,
артериальной гипотензии и комы. Моклобемид — это обратимый
ингибитор моноаминоксидазы А (тогда как избирательным
ингибитором МАО-В является депренил (селегилин; см. главу 26).
Препарат хорошо переносится, его основными побочными
эффектами являются бессонница и тошнота. Моклобемид
может взаимодействовать с другими ингибиторами МАО, но так
как он является препаратом обратимого действия, эффекты этого
взаимодействия быстро уменьшаются после его выведения из
организма. Моклобемид является препаратом 2-го ряда для
лечения депрессии после трициклических антидепрессантов и
ингибиторов нейронального захвата серотонина.
Для профилактики и лечения маний при
маниакально-депрессивном психозе используют препараты лития. Эффект
лития развивается в течение нескольких дней, поэтому при
острых маниакальных состояниях предпочтение обычно отдают
применению других антипсихотических средств. В
комбинации с три циклическим и антидепрессантами соли лития
используют при депрессии (в случаях резистентности к монотерапии
антидепрессантами).
Литий быстро всасывается из кишечника. При лечении
препаратами лития необходимо проводить определение
концентрации лития в крови, так как широта терапевтического
действия лития очень мала (широта терапевтической
концентрации в крови 0,4—1,0 тМ). Побочные эффекты препаратов
лития включают тошноту, рвоту, анорексию (потерю аппетита),
диарею, мышечную слабость, тремор, полидипсию (жажду) и
полиурию (у некоторых пациентов развиваются нарушения
выделительной функции почек), гипотиреоидизм и увеличение
массы тела. Острое тяжелое отравление литием проявляется
атаксией, сонливостью, помрачением сознания, а при уровне
лития в сыворотке крове выше 2-3 тМ могут возникать
угрожающие жизни судороги и кома.
Механизм действия препаратов лития неизвестен.
Предполагается, что он связан с влиянием лития на фосфоинозитид-
ную систему вторичных мессенджеров. Так, например, было
показано, что литий в концентрациях менее 1 тМ уменьшает
образование мембранных фосфатидилинозитолдифосфатов
(ФИДФ), влияя на процессы гидролиза инозитол-1-фосфата в
инозитол (блокирует инозитол-1-фосфатазу). Снижение
уровня фосфатидилинозитолдифосфатов в мембранах приводит к
уменьшению образования вторичных мессенджеров инозитол-
1,4,5,-трифосфата и диацилглицерола (ИРз и ДГ) и снижению
ответа клеток при активации рецепторов, связанных с фосфо-
инозитидной системой вторичных мессенджеров (см. главу 1).
63
29. Опиоидные (наркотические) анальгетики
Околоводопроводное серое.
вещество
Опиоидные
рецепторы
Большое
ядро шва
Голубое пятно
(locus coeruieus]
Эндогенные
пептиды
СИЛЬНЫЕ
Морфин
Диаморфин
(героин)
Фвназоцин
Лвворфанол
Метадон
Петидин
Бупренорфин+
Нальбуфин*
УМЕРЕННЫЕ/СЛАБЫЕ
Мептазинол
Пентазоцин+
Дигидрокодеин
Кодеин
Декстропропо-
ксифен
Норадреналин
* Частичные агонисты
+ Агонисты-антагонисты
Распространение болевых
импульсов в таламус
Задние рога
спинного мозга
С-полимодальные "]
А5-механорецепторы / ноцицепторы
Отвечают на
повреждающей стимул
Болевые импульсы от ноцицепторов (болевых рецепторов)
по первичным афферентным волокнам передаются в задние
рога спинного мозга (пластинки I и II), где происходит их
переключение на первый вставочный нейрон. Отсюда
возбуждение распространяется через таламус к сенсорным зонам коры
головного мозга. Практически ничего не известно о
медиаторах, участвующих в проведении болевых импульсов, однако
выявлено, что в окончаниях первичных афферентных волокон
высвобождаются некоторые пептиды (например, субстанция Р,
кальцитониноподобный пептид) (показано в нижней части
рисунка).
Активность вставочных нейронов задних рогов спинного
мозга регулируется несколькими ингибиторными
механизмами. К ним относятся промежуточные нейроны,
высвобождающие опиоидные пептиды (например, мет-энкефалины),
окончания норадренолинергическых и серотонинергических волокон,
идущих от различных образований головного мозга (показаны в
верхней части рисунка слева), которые активируются опиоид-
ными пептидами. Опиоидные пептиды, высвобождающиеся как
в головном, так и спинном мозге, понижают активность
вставочных нейронов задних рогов спинного мозга и вызывают
анальгезию (обезболивание). Каким образом осуществляется
торможение болевых импульсов, неясно, известно лишь, что
действие опиоидных пептидов опосредовано их влиянием на
опиоидные рецепторы.
Опиоидные (наркотические) анальгетики — это средства (на
рисунке справа), которые воспроизводят эффекты эндогенных
опиоидных пептидов, активируя опиоидные рецепторы (в
основном ji-рецепторы), что сопровождается развитием
анальгезии, эйфории, седативного эффекта и угнетением
дыхательного центра. Действуя на опиоидные рецепторы нервных
сплетений кишечника, наркотические анальгетики могут вызвать
запор (что в ряде случаев требует применения слабительных
средств; см. главу 13). Действие опиоидов часто
сопровождается появлением тошноты и рвоты (вследствие чего может
возникнуть необходимость использования противорвотных
средств). Длительное использование препаратов этой группы
вызывает формирование лекарственной зависимости и
развитие толерантности. Лечение болевого синдрома у безнадежно
больных пациентов требует постоянного увеличения дозы
наркотических анальгетиков, что, как правило, связано не с
развитием толерантности, а с усилением боли. Развитие
лекарственной зависимости в данной ситуации не имеет
клинического значения. К сожалению, перестраховка в использовании
опиоидов может быть причиной недостаточного контроля над
болью.
Некоторые наркотические анальгетики (например, кодеин)
обладают меньшей обезболивающей активностью, чем морфин.
Применение этих препаратов в дозах, вызывающих
выраженную анальгезию, сопровождается серьёзными побочными
эффектами. Слабые наркотические анальгетики менее выражено
угнетают дыхательный центр, лекарственная зависимость к этим
средствам формируется реже. Слабые наркотические
анальгетики применяют при болях средней интенсивности.
Специфическим антагонистом опиоидных рецепторов
является иалоксон, он устраняет угнетение дыхательного центра,
вызванного наркотическими средствами. Налоксон может
спровоцировать синдром отмены у пациентов с опийной
лекарственной зависимостью. Препарат устраняет также обезболивающий
эффект электроакупунктурной анальгезии и анальгезии,
связанной с приёмом плацебо, что свидетельствует об участии
эндогенных опиоидных пептидов в этих видах обезболивания.
64
Эндорфины
Динорфины
Энкефалины
Олиоиды
Олиоидные
анальгетики
Энкефалинергический
нейрон i
Серотонин
E-НТ)
Афферентное
волокно
Опиоидные
рецепторы
Субстанция Р
Глутамат
Вставочный |
нейрон
Ошюиды — это вещества, эффекты которых устраняются на-
локсоном. Известно 3 семейства опиоидных пептидов,
являющихся производными крупномолекулярных предшественников,
кодирующихся отдельными генами. Проопиомеланокортин
(ПОМК) является предшественником Р-эндорфинов и
некоторых неопиоидных пептидов, включая адренокортикотропный
гормон (АКТГ). Проэнкефалин даёт начало лей-энкефалинам
и мет-эн кефали нам. Продинорфин является
предшественником опиоидных пептидов, содержащих в своих окончаниях лей-
энкефалины (например, динорфина А). Опиоидные пептиды,
являющиеся производными различных предшественников,
различаются по локализации в ЦНС и сродству к разным
подтипам опиоидных рецепторов. Функции опиоидных пептидов в
ЦНС точно не известны.
Опиоидные рецепторы. Опиоидные рецепторы широко
распространены в ЦНС и подразделяются на 3 группы (ц-мю, к-
каппа и 5-дельта). д-рецепторы участвуют в процессах
формирования боли; взаимодействие опиоидов с этими рецепторами
вызывает развитие анальгезии. Концентрация ц-рецепторов в
головном мозге невелика. Агонистами 8- и к-рецепторов
являются, соответственно, энкефалины и динорфины. Активация
к-рецепторов вызывает анальгезию, которая обычно
сопровождается чувством дисфории (например, при применении пента-
зоцина, нальбуфина), тогда как активация ji-рецепторов
(например, морфином) вызывает анальгезию,
сопровождающуюся эйфорией. Некоторые опиоидные анальгетики (например,
пентазоцин) действуют на о-рецепторы, вызывая
психостимулирующий и психозомиметический (галлюциногенный)
эффекты (известно, что галлюциноген фенциклидин является агони-
стом этих рецепторов), которые не устраняются введением на-
локсона. Этот факт свидетельствует о том, что с-рецепторы не
являются опиоидными. Активация ц- и 5-рецепторов при
участии G-белков приводит к увеличению проницаемости К+-ка-
налов и вызывает гиперполяризацию мембран нейронов.
Активация к-рецепторов уменьшает проницаемость Са^+-каналов
мембран нейронов. Опиоидные пептиды угнетают синаптичес-
кую передачу в ЦНС и кишечнике.
Сильные опиоидные (наркотические) анальгетики
Эти наркотические анальгетики используют при сильных
слабо локализованных болях со стороны внутренних органов.
При локализованных болях меньшей интенсивности
применяют слабые наркотические или ненаркотические анальгетики
(нестероидные противовоспалительные средства; см. главу 32). Для
устранения сильной боли морфин вводят парентерально, перо-
ральное применение морфина показано в терминальных
стадиях заболеваний.
Морфии и другие наркотические анальгетики оказывают
множество центральных эффектов. Кроме выраженной анальгезии
наркотические анальгетики вызывают состояние эйфории,
угнетение дыхательного и сосудодвигательного центров (что
может привести к ортостатической гипотензии), оказывают седа-
тивное действие, стимулируют триггерную хеморецепторную
зону (вызывая тошноту и рвоту). Опиоиды стимулируют центр
глазодвигательного нерва, вызывая сужение зрачка — миоз
(исключением является петидин, обладающий слабой м-холиноб-
локирующей активностью). Препараты угнетают кашлевой
центр, однако выраженность этого эффекта не коррелирует с
их опиоидной активностью. При применении наркотических
анальгетиков возможны запоры, спазм жёлчных протоков и
сфинктера Одди. Морфин может вызвать либерацию гистами-
на, что приводит к расширению сосудов и появлению кожного
зуда. Морфин метаболизируется в печени путём конъюгации с
глюкуроновой кислотой, образуя неактивный морфин-3-глю-
куронид и высоко активный морфин-6-глюкуронид.
При продолжительном применении опиоидных
анальгетиков к ним развивается толерантность (т.е. привыкание —
уменьшение чувствительности организма к лекарству). Такие
побочные эффекты наркотических анальгетиков, как сужение зрачка
и запоры, не уменьшаются при длительном их применении.
К опиоидным анальгетикам развивается психическая и
физическая лекарственная зависимость, резкая отмена препаратов
вызывает абстинентный синдром (см. главу 31).
Диаморфин (героин, диацетилморфин) в два раза активнее,
чем морфин. В организме быстро превращается в активный
метаболит 6-ацетилморфин и более медленно в морфин. При
применении героина отмечается выраженная эйфория;
тошнота, запор и артериальная гипотенэия выражены слабее, чем при
использовании морфина.
Метадон хорошо всасывается при приёме внутрь, оказывает
продолжительное действие. Его применяют перорально в
комплексной терапии опийной наркомании для предупреждения
абстинентного синдрома («ломки»).
Петидин по своим свойствам напоминает морфин, но
действует короче. При применении в дозах, вызывающих
анальгезию, угнетает дыхательный центр, оказывает слабое противо-
кашлевое действие и практически не вызывает развития
запоров. Препарат высоко липофилен, поэтому его эффект
развивается быстро. В печени петидин превращается в норпетидин,
который может вызывать целый ряд побочных эффектов
(например, расширение зрачка, судороги). При комбинированном
применении с ингибиторами МАО петидин может вызывать
появление делирия, повышение температуры тела, судороги и
угнетение дыхания.
Бупренорфин — это частичный агонист ц-рецепторов, лигто-
фильный, эффективный при сублингвальном применении.
Препарат действует продолжительнее, чем морфин. При его
использовании возможно появление продолжительной рвоты.
Бупренорфин прочно связывается с опиоидными
рецепторами, поэтому налоксон практически не устраняет угнетение
дыхания, вызванное применением препарата.
Нальбуфин (агонист к-рецепторов и антагонист ц-рецепто-
ров) соответствует морфину по анальгезирующей активности и
способности угнетать дыхательный центр; тошнота и рвота при
его применении отмечаются реже. При использовании в
высоких дозах вызывает дисфорию.
Слабые наркотические (опиоидные) анальгетики
Слабые наркотические анальгетики используют при болях
умеренной интенсивности. Эти препараты вызывают
лекарственную зависимость и могут быть объектами для
злоупотреблений. Однако они вызывают слабую эйфорию, поэтому
являются менее привлекательными для наркоманов.
Пентазоцин является слабым наркотическим анальгетиком,
неприятным на вкус. При парентеральном введении оказывает
обезболивающее действие (среднее между обезболивающим
эффектом морфина и кодеина). Пентазоцин является агонис-
том к- и 5-опиоидных рецепторов, но антагонистом
^-рецепторов. Препарат часто вызывает галлюцинации, кошмарные
сновидения, расстройство умственной деятельности из-за
активации о-рецепторов. Преимуществом препарата является его
слабая способность вызывать лекарственную зависимость.
Кодеин (метилморфин) хорошо всасывается при перораль-
ном введении, обладает слабым сродством к опиоидным
рецепторам. Около 10% препарата диметилируется в печени в
морфин, с которым преимущественно и связан его
обезболивающий эффект. Побочные эффекты (запоры, рвота,
угнетение ЦНС) не позволяют увеличивать дозу для достижения
более сильного болеутоляющего эффекта. Кодеин используют в
основном как противокашлевое и противопоносное средство.
Анальгезирующая активность декстропропоксифена
выражена в 2 раза слабее, чем у кодеина. Препарат часто используют в
комбинации с аспирином или парацетамолом, однако
доказательств более высокой эффективности подобных комбинаций
по сравнению с использованием только ненаркотических
анальгетиков нет. Более того, при совместном применении этих
препаратов увеличивается количество побочных эффектов, так как
декстропропоксифен вызывает угнетение дыхания и оказывает
кардиодепрессивное действие, а парацетамол гепатотоксичен.
65
30. Противорвотные средства. Антиэметики
Антагонисты
рецепторов
Прохлорперазин
Метоклолрамид
Домпвридон
Циркулирующие в крови токсины
и некоторые лекарственные
средства (опиоиды, апоморфин)
Антагонисты
б-НТа-р«целторов
Ондансвтрон
Гранисвтрон
Амтмхолинер-
гические средства
Скополамин
Антигистаминные
Циннаризин
Циклизин
Причинами появления тошноты и рвоты могут быть
вестибулярные нарушения, мигрень, беременность, применение
некоторых лекарственных средств (например, противоопухолевых
препаратов, опиоидов, общих анестетиков, дигоксина) и
многие другие. Предупреждать появление рвоты легче, чем
устранять развившуюся рвоту. Поэтому противорвотные средства
применяют в основном профилактически до появления
рвотного рефлекса. Рвоту необходимо устранить как можно
быстрее еще до выяснения её причины, что можно сделать
несколько позднее.
Рвотный рефлекс появляется при стимуляции рвотного
центра, который расположен в продолговатом мозге. Активность
рвотного центра регулируется хеморецепторной триггерной
(пусковой) зоной (ХТЗ) дна IV желудочка. Триггерная зона
находится вне гематоэнцефалического барьера, вследствие чего её
могут возбуждать циркулирующие в крови токсины и
лекарственные средства (показаны в верхней части рисунка). В
триггерной зоне находится большое количество 02-дофаминовых
рецепторов, поэтому дофаминомиметики, применяемые при
паркинсонизме, часто вызывают тошноту и рвоту, а
антагонисты дофаминовых рецепторов (показаны в левой части рисунка)
обладают противорвотным действием, их используют для
подавления тошноты и рвоты, связанной с применением эмето-
генных средств (например, цитостатических
противоопухолевых препаратов).
Недавно было установлено, что эффективными антиэмети-
ками (противорвотными средствами) являются антагонисты
5-НТ3-рецепторов (например, ондансетрон; показаны в
нижней части рисунка слева). У препаратов этой группы мало
побочных эффектов, поэтому их стали широко использовать для
предупреждения тошноты и рвоты при проведении
противоопухолевой терапии, а также общей анестезии. Механизм про-
тиворвотного действия антагонистов 5-НТ3-рецепторов не ясен.
Вместе с тем известно, что в триггерной зоне имеется большое
количество 5-НТ3-рецепторов. Для развития противорвотного
эффекта антисеротониновых средств может иметь значение и
их периферическое действие. Многие цитостатические
средства (а также ионизирующая радиация) вызывают
высвобождение из хромаффинных клеток кишечника (на рисунке
показаны в виде ф) серотонина E-НТ), который активирует 5НТ3-
рецепторы чувствительных нервных окончаний (на рисунке
показаны в виде ф), провоцируя появление рвоты. Рвотный
рефлекс вызывает также стимуляция рецепторов слизистой
оболочки желудка раздражающими веществами (например,
препаратами ипекакуаны, бактериальными токсинами).
Антагонисты дофаминовых и 5-НТ3-рецепторов
эффективны при укачивании (болезни движения). Противорвотный
эффект оказывают также антихолииергические и антигистаминные
средства (на рисунке справа). Они действуют непосредственно
на рвотный центр, однако часто вызывают побочные эффекты.
Антигистаминные средства (например, циннаризин), феиотиази-
ны и бетагистин применяют при головокружении и рвоте,
вызванных вестибулярными нарушениями.
66
Раздражение ели
эистой оболочки
Рвотный центр
(м, н-холинорецепторы)
ХТЗ (Dr> 5-HTa-
I рецепторы)
Рвотный цеиггр расположен симметрично в области
ретикулярной формации продолговатого мозга. Он получает
афферентные волокна от следующих образований:
1) коры лимбической системы. Тошнота и рвота возникают
под влиянием психических раздражителей (неприятные
запахи, внешний вид и т.д.) Рвота может развиваться также на вид
или запах неприятных (в том числе цитотоксических)
лекарственных препаратов;
2) хеморецепторной триггерной зоны;
3) солнечного сплетения* Нейроны солнечного сплетения
замыкают дугу рвотного рефлекса (в том числе, рвотного
рефлекса, возникающего при надавливании на корень языка);
4) спинного мозга. Спинно-ретикулярные волокна
способствуют возникновению тошноты и рвоты при механических
повреждениях;
5) вестибулярной системы. Тошнота и рвота возникают при
вестибулярных нарушениях и болезни движения (укачивании).
Точно неизвестно, какие медиаторы принимают участие в
патогенезе возникновения рвоты. Выявлено, что в
хеморецепторной триггерной зоне находится много дофаминовых (D2) и
серотониновых E-НТ3) рецепторов, а в передаче возбуждения
от вестибулярного аппарата к рвотному центру участвуют хо-
линергические и гистамннергические синапсы.
Активация рвотного центра приводит к возбуждению
блуждающего нерва и спинальных мотонейронов (стимулируют
мышцы брюшной стенки), участвующих в координации рвотного
акта. Антиперистальтические движения кишечника приводят к
поступлению кишечного содержимого в желудок. Происходит
закрытие голосовой щели, дыхание задерживается (это
приводит к изоляции дыхательных путей от рвотных масс). Пище-
водно-желудочный сфинктер расслабляется, а сильные
сокращения диафрагмы и мышц брюшного пресса способствуют
извержению содержимого желудка наружу через рот.
Рвота, связанная с применением лекарств. Цитотоксические
противоопухолевые средства отличаются по своей способности
вызывать рвоту. Выраженным эметогенным действием
обладают препараты платины (например, цнсплатин). Способность
противоопухолевых препаратов вызывать рвоту, вероятно, связана
с их стимулирующим воздействием на хеморецепторы
триггерной зоны, поэтому для предупреждения рвоты при проведении
химиотерапии опухолей применяют антагонисты дофаминовых
рецепторов. Метеразин (прохлорперазин) является
производным фенотиазина, препарат широко применяют в качестве про-
тиворвотного средства. Он оказывает менее выраженное седа-
тивное действие, чем аминазин, но может вызвать
экстрапирамидные расстройства (подобно всем типичным нейролептикам;
см. главу 27). Метоклопрамид (церукал) является антагонистом
02-рецепторов, оказывает прокинетическое действие (см.
главу 13). Вместе с тем препарат увеличивает абсорбцию многих
лекарственных средств из кишечника. Способность метоклоп-
рамида повышать абсорбцию анальгетиков может быть
использована при мигрени. Побочные эффекты при применении
препарата отмечаются редко, иногда возникает выраженная дис-
кинезия (обычно у молодых людей и женщин). Сходным с ме-
токлопрамидом действием обладает домперидон (мотилиум).
Препарат не проходит через гематоэнцефалический барьер,
поэтому практически не оказывает седативного эффекта и не
вызывает экстрапирамидных нарушений. Антагонисты 5-НТ3-ре-
цепторов (например, ондансетрон) не обладают побочными
эффектами антагонистов Ьг-дофаминовых рецепторов, но
могут вызвать появление запоров и головную боль. Клиническая
практика показывает, что при сильной рвоте, связанной с
применением высоко эметогенных цитостатиков, наиболее
эффективным является внутривенное введение противорвотных
средств — таких, как метоклопрамид и дексамегазон. Для
предупреждения рвоты, связанной с применением цисплатины,
применяют комбинацию ондансетрона и дексаметазона.
Механизм противорвотного действия дексаметазона не известен.
Болезнь движения (в том числе морская, воздушная болезнь
и др.) встречается достаточно часто. Укачивание
характеризуется появлением холодного пота, бледности кожных покровов,
тошноты и рвоты. Клинические признаки болезни
развиваются относительно медленно, но в конечном счёте приводят к
появлению рвоты, после которой часто отмечается временное
улучшение самочувствия. Продолжительное воздействие
факторов, провоцирующих развитие болезни движения (например,
при длительном путешествии на корабле), способствует
развитию адаптации. Обычно признаки морской болезни исчезают
после 4 дней воздействия укачивающих факторов.
Предполагают, что болезнь движения возникает вследствие
рассогласования сенсорной информации (в частности сигналов зрительной
и вестибулярной систем). Механизм возникновения этой
болезни изучен недостаточно, но проявления болезни исчезают
после лабиринтэктомии или резекции части мозжечка.
Положительный эффект при болезни движения оказывают
действия пациентов, уменьшающие рассогласование
зрительной и вестибулярной информации. Так, например, для
уменьшения укачивания при морской болезни желательно
зафиксировать взгляд на горизонте (находясь на палубе корабля) или
закрыть глаза (в закрытом помещении), вместе с тем
необходимо избегать резких поворотов головы. Скополамин (гиосцин)
является одним из наиболее эффективных препаратов,
предупреждающих развитие болезни движения. Скополамин относится
к группе м-холиноблокаторов, при его применении отмечается
развитие таких побочных эффектов, как сонливость, сухость
во рту и нарушение зрения. Циннаризин (стугерон) обладает
антигистаминной активностью. По противорвотной
активности напоминает скополамин, но вызывает меньше
нежелательных эффектов. Препарат следует принимать за 2 часа до
ситуации, провоцирующей появление тошноты и рвоты.
Вестибулярные нарушения. Рвота может быть обусловлена
перевозбуждением лабиринтного аппарата. Основным симптомом
вестибулярных нарушений является головокружение
(ощущение вращения окружающей обстановки), связанное с
повышением активности симпатической нервной системы,
сопровождающееся тошнотой и рвотой.
Выраженное головокружение с тошнотой и рвотой часто
наблюдается при остром лабиринтите (обычно возникает как
осложнение вирусных инфекций). Приступы резкого
головокружения, сопровождающиеся тошнотой, рвотой, нарушением
слуха и звоном в ушах, отмечаются при болезни Меньера. Их
появление связано с повышением давления эндолимфы в
лабиринте внутреннего уха. В межприступный период
заболевания глухота и звон в ушах сохраняются и постепенно
усиливаются. При вестибулярных нарушениях применяют антнгиста-
минные средства (циннаризин, циклизин) и фенотназины
(аминазин, метеразин). При болезни Меньера используют также бета-
гистин — препарат, понижающий давление эндолимфы в
лабиринте.
Беременность. При беременности противорвотные средства
должны использоваться только при выраженной тошноте и
сильной рвоте, так как они могут оказать нежелательное
воздействие на плод. Считается, что при беременности является
безопасным применение прометазина.
67
31. Лекарственная зависимость и злоупотребление лекарствами
Средства,
угнетающие ЦНС
Алкоголь
Барбитураты
Хлоралгидрат
Хлорметиаэол
Са2+-каналы
Бензодиазвпины
Олиомды
Героин (диаморфин)
Морфин
Петидин
Другие
Усиление синтеза
эндогенных агонистов
необратимого действия
Повышение
активности
аденилатциклаэы
Истощение запасов
медиаторов
Уменьшение
активности
5-НТ2-рецепторов
Вторичные
мессенджеры
Поихоетимуляторы
Кокаин
Амфетамин
Дексамфетамин
Метилендиокси-
метамфетамин
(«экстази»)
Галлюциногены
Диэтиламид лизерги-
новой кислоты (ЛСД)
Псилоцин
Мескалин
Диметилтриптамин
(ДМТ)
Другие средства
Никотин
Каннабис
Отношение общества к применению наркотических средств
является сложным и неоднозначным, так как изменяется с
течением времени. Так, например, если в XIX столетии была
популярной настойка опия, которую часто использовали в
домашних условиях, то в настоящее время препараты опия запрещены
к употреблению. Из психотропных средств во всём мире
широко используют никотин и алкоголь, злоупотребление которыми
вызывает значительное увеличение заболеваемости и
смертности среди населения. Курение табака увеличивает
предрасположенность к злокачественным новообразованиям, вследствие
чего в Великобритании ежегодно умирает около 100 000 человек.
Злоупотребление лекарствами — это использование
запрещённых лекарственных средств, а также веществ, которые могут
вызвать нарушения физического или психического состояния
человека. Кроме алкоголя и никотина частыми объектами для
злоупотреблений являются бензодиазепииы и
психостимуляторы (отпускаемые в аптеке только по предписанию врача).
Лекарственная зависимость — это потребность в постоянном
использовании лекарственных веществ с целью достижения
психических эффектов (повышения настроения, улучшения
самочувствия и др.), а также для устранения неприятных
симптомов, возникающих при их отмене.
Формирование лекарственной зависимости зависит от
многих факторов, в том числе, от вида и механизма действия
лекарственного вещества, способа его применения и индивидуальных
особенностей пациентов. Быстрое поступление наркотических
веществ в организм (например, их внутривенное введение или
курение кокаина и героина) ускоряет развитие лекарственной
зависимости. Внутривенное введение наркотиков способствует
также заражению тяжёлыми инфекционными заболеваниями
(такими, как СПИД, гепатит, сепсис и др.).
Лекарственная зависимость часто сочетается с развитием
толерантности (снижением чувствительности организма к
лекарству при его длительном применении), что приводит к
необходимости постоянно увеличивать дозу вещества для достижения
обычного эффекта. Развитие толерантности может быть
связано с ускорением метаболизма вещества (фармакокинетическая
толерантность), но в основном с адаптивными изменениями в
головном мозге.
Механизмы формирования лекарственной зависимости и
развития толерантности изучены недостаточно. Известно, что
длительное использование лекарственных веществ вызывает
развитие гомеостатических адаптивных изменений в головном
мозге, которые приводят к уменьшению активности лекарств.
Отмена психотропных веществ вызывает изменение
возбудимости центральных нейронов. Так, при отмене средств,
угнетающих ЦНС (например, алкоголя, барбитуратов), могут
отмечаться судороги, а при отмене психостимуляторов (например,
амфетамина) развивается депрессия.
Адаптивные изменения в головном мозге, развивающиеся
при длительном применении лекарственных веществ, имеют
различный характер. Они могут проявляться увеличением
проницаемости Са2+-каналов мембран нейронов (в верхней части
рисунка слева), истощением запасов нейромедиаторов (в
верхней части рисунка справа), уменьшением активности
рецепторов (в центральной части рисунка справа), изменениями в
системе вторичных мессенджеров (в нижней части рисунка
слева) и усилением синтеза эндогенных агонистов необратимого
действия (в центральной части рисунка слева).
Области головного мозга, отвечающие за формирование
лекарственной зависимости, точно неизвестны. Однако в
экспериментах на животных было выявлено, что в развитии
лекарственной зависимости принимают участие дофаминергические
пути. С помощью метода микродиализа (позволяющего
определять концентрацию нейромедиаторов в различных участках
головного мозга) было показано, что многие наркотические
средства (психостимуляторы, опиоиды, никотин, алкоголь)
увеличивают высвобождение дофамина в nucleus accumbens и/или
фронтальной доли коры головного мозга. Некоторые вещества
(например, амфетамин, кокаин), непосредственно влияют на
дофаминергические нервные окончания, тогда как другие
(опиоиды) увеличивают высвобождение дофамина, угнетая
влияние ГАМ К на дофаминергические нейроны. В экспериментах
на животных было показано, что введение кокаина и опиоидов
в nucleus accumbens сопровождалось появлением чувства
удовольствия. Подобные механизмы формирования лекарственной
зависимости возможны и у человека.
66
Нервное
окончание
Медиатор
Психостимуляторы
Амфетаминооодобные средства при пероральном применении
уменьшают аппетит, вызывают ощущение свободы,
повышение жизненной энергии и прекрасного физического
самочувствия. Эти средства вызывают также периферические симпато-
миметические эффекты (повышение артериального давления,
тахикардию) и бессонницу. Амфетаминоподобные средства
повышают высвобождение дофамина и норадреналина нервными
окончаниями (их основные психотропные эффекты связаны с
увеличением выделения дофамина). Кокаин угнетает обратный
нейрональный захват дофамина, оказывая сходное с
амфетамином психостимулирующее действие.
Психостимуляторы имеют несколько показаний к
применению (например, нарколепсия), однако их не следует
использовать для понижения аппетита при ожирении, так как при
длительном введении они могут вызвать лекарственную
зависимость.
Кокаина гидрохлорид обычно применяют в виде порошка
для вдыхания, а его более летучее основание («КРЭК»)
используют для курения, при этом вещество быстро абсорбируется из
альвеол в кровь, вызывая эйфорию («кайф»). К развитию
сходной эйфории приводит внутривенное введение амфетамина,
поэтому наркоманы часто используют обе группы веществ.
Психостимуляторы вызывают развитие наркомании и оказывают
отрицательное влияние на психику. Повторное применение этих
средств может вызвать состояние, напоминающее острый
приступ шизофрении.
Метнлендиоксиметамфетамин (МДМА, «экстази») — это
производное амфетамина, обладающее как психостимулирующим,
так и галлюциногенным действием (последнее, очевидно,
является следствием усиленного высвобождения серотонина).
МДМА широко применяют как «развлекательное» средство,
однако его введение может привести к развитию серьёзных
психических нарушений и острой гипертермической реакции
иногда со смертельным исходом.
Опиоиды
Частыми объектами злоупотреблений являются диаморфин
(героин) и другие опиоиды. Эти соединения (особенно при
внутривенном введении) вызывают выраженную эйфорию,
поэтому к ним формируется лекарственная зависимость. При резкой
отмене опиоидов у опийных наркоманов возникает страстное
желание принять наркотик для устранения абстинентного
синдрома, который характеризуется повышением потоотделения,
зеванием, появлением «гусиной» кожи, тремора,
раздражительности, анорексии, тошноты и рвоты. Эти симптомы
сохраняются в среднем 7—10 дней. Синдром отмены препаратов
продолжительного действия (таких, как метадон) менее
выраженный, но более продолжительный, для предупреждения его
возникновения дозы наркотических средств снижают постепенно.
Применение клофелина (клонидина) может устранить
некоторые проявления опийного синдрома отмены (особенно
тошноту, рвоту и диарею). Вместо клофелина с этой целью часто
используют лофексндин (аналог клофелина), так как он меньше
снижает артериальное давление и слабее угнетает ЦНС.
Активным антагонистом опиодов является налтрексон. Этот
препарат применяют перорально для предупреждения рецидива
опийной лекарственной зависимости, так как он препятствует
развитию эйфории при введении опиоидов.
Механизм формирования опийной наркомании и развития
толерантности к опиоидам неизвестен. Длительное
применение опиоидов не вызывает повреждения опиоидных
рецепторов, однако приводит к важным изменениям в системе
вторичных мессенджеров. Так, например, активация опиоидами
ц-рецепторов в locus coeruleus (голубом пятне) приводит к
угнетению аденилатциклазы, однако при длительное применении
опиоидов активность этого фермента напротив увеличивается.
Отмена опиоидов повышает образование* цАМФ в нервных
клетках, что может способствовать увеличению возбудимости
нейронов.
Галлюциногены (психозомиметики)
Диэтиламид лнзерпшовой кислоты (ЛСД) и родственные им
соединения вызывают острые состояния, характеризующиеся
яркими и необычными сенсорными ощущениями, чувством
экстаза и деперсонализации. Иногда при введении ЛСД
возникают устрашающие галлюцинации и иллюзии, ощущения
панического страха. Обычно эти явления быстро проходят,
однако позднее могут проявиться снова.
В механизме действия галлюциногенов принимает участие
серотонинергическая система. ЛСД ингибирует передачу
возбуждения в серотонинергических нейронах ядра шва,
активируя 5-НТ2-рецепторы (угнетающие аугорецепторы) этих
клеток. Механизм развития толерантности к ЛСД-подобным
соединениям связан с понижением активности 5-НТ2-рецепто-
ров. При отмене галлюциногенов не бывает синдрома отмены,
и к ним не формируется лекарственная зависимость.
Каннабис (марихуана, гашиш). Активным компонентом
марихуаны является тетрагидроканнабинол (ТГК), обладающий
галлюциногенным и центральным угнетающим действием.
Применение марихуаны вызывает эйфорию, релаксацию и
благодушие. Это не опасный наркотик, но к нему может
развиваться лекарственная зависимость. Использование марихуаны
может вызвать острый психоз, напоминающий действие ЛСД.
Средства, угнетающие ЦНС
Способностью вызывать лекарственную зависимость
обладают барбитураты, синдром отмены барбитуратов может
проявляться развитием эпилептических припадков и делирия.
Действие алкоголя напоминает эффект общих анестетиков.
Этиловый спирт уменьшает проницаемость пресинаптических
мембран нейронов для Са2+ (повышая высвобождение
медиаторов) и потенцирует ГАМК-ергическое торможение. К
алкоголю может развиваться толерантность, механизм появления
которой не совсем ясен. Этиловый спирт способствует
увеличению числа Са2+-каналов в пресинаптических мембранах
нейронов, поэтому при отмене алкоголя резко увеличивается
высвобождение медиаторов, что способствует развитию абстиненции.
Длительное употребление алкоголя приводит к
формированию лекарственной зависимости (алкоголизма). В Англии
ежегодно около 14800 больных алкоголизмом поступают в
психиатрические клиники с алкогольными психозами; при
алкоголизме часто отмечается развитие энцефалопатии и
заболеваний печени, в том числе цирроза. Проявления синдрома
отмены алкоголя варьируют от состояния «похмелья» до развития
эпилептических припадков и алкогольного психоза (белой
горячки), при котором отмечаются галлюцинации, спутанность
сознания, беспокойство. При алкогольной абстиненции и
синдроме отмены барбитуратов для предупреждения развития
судорог применяют хлорметиазол и бензодиазепины. Иногда
используют клофелин, но он не устраняет судороги.
Табакокурение (лекарственная зависимость к никотину)
наносит больший вред здоровью населения в Великобритании,
чем все другие лекарственные средства (в том числе алкоголь).
Ко многим эффектам никотина развивается толерантность (на
частоту появления тошноты и рвоты толерантность не влияет).
При табакокурении кроме никотина на организм человека
действуют и другие вредные вещества табачного дыма, многие из
которых являются канцерогенами. Курение провоцирует
развитие рака лёгких, сердечно-сосудистых заболеваний. Курение
во время беременности повышает перинатальную смертность
плода и снижает вес ребёнка при рождении.
\ Прекращение курения вызывает развитие абстинентного
синдрома (продолжительностью в среднем 2-3 недели),
характеризующегося тягой к табакокурению, раздражительностью,
нарушением концентрации внимания и увеличением массы тела.
Никотиновую абстиненцию уменьшают н-холиномиметики
(например, в виде жевательных резинок, назального спрея,
кожных пластырей). Однако преодолеть тягу к табакокурению очень
сложно. Наиболее часто стараются бросить курить пациенты,
перенёсшие инфаркт миокарда.
69
32. Нестероидные противовоспалительные средства
Нестероидные
протиеоеоолАлитель- ч
ные средстве N>
САЛИЦИЛАТЫ
Аспирин
ПРОИЗВОДНЫЕ
ПРОПИОНОВОЙ
КИСЛОТЫ
Ибупрофвн
Налроксвн
ПРОИЗВОДНЫЕ
ФЕНИЛУКСУСНОЙ
КИСЛОТЫ
Дикпофенак
ПРОИЗВОДНЫЕ ИНДОЛ-
УКСУСНОЙ КИСЛОТЫ
Индометацин
ПРОИЗВОДНЫЕ
ОКСИКАМОВ
Пироксикам
ПРОИЗВОДНЫЕ
ПИРАЗОЛОНА
Бугадион
Фвнилбутаэон
АНАЛЬГЕТИКИ-АНТИПИРЕТИКИ
Парацетамол
Активация
Фосфолипиды
Фосфолилаза Ag
- Липокортин f <
Арахидоновая кислота
Лилооксигеназа
Гидропероксиды и
гидроксижирные
кислоты
Лейкотриены
(ЛТД, и ЛТС4=МРС-А)
Циклооксигеназа
Эндопероксиды
Простагландин-
изомераза
Тромбоксан-
сйнтетаэа
Простациклин-
синтетаза
Простагландииы
ПГЕг
ПГДг
Тромбоксан-As
Простациклин
цАМФ в тромбоцитах
| Антиагрегатное действие
Расширение сосудов
Лекарстиычые формы
аспирине
(оказывающие слабое
действие)
С буферными
свойствами
(алоксиприн)
Микрокапсулиро-
вемные
Кишечно-растворимые
Бенорилат
(аспирин с
парацетамолом)
Нестероидные противовоспалительные средства (НПВС)
оказывают обезболивающее, жаропонижающее и
противовоспалительное (в высоких дозах) действие. Эти средства широко
применяют при различных формах ревматических заболеваний (в
Великобритании почти четверть пациентов получает НПВС).
Аспирин, парацетамол и нбупрофен используют при головной,
зубной, мышечной и некоторых других видах болей. Однако НПВС
не эффективны при висцеральных болях (например, при
инфаркте миокарда, почечной колике, острых болях в животе),
при которых применяют наркотические (опиоидные)
анальгетики. Вместе с тем НПВС оказывают анальгезируюшее
действие при некоторых видах сильной боли (например, при
опухолях костей). Аспирин является активным антиагрегантом (см.
главу 19).
К НПВС относятся препараты различного химического
строения (показаны в левой части рисунка), угнетающие цнжлоок-
снгеназу (ЦОГ) (на рисунке ЦОГ изображена в виде ¦=>) и тем
самым уменьшающие образование простагландинов. Влияние
на обмен простагландинов является ключевым моментом в
механизме действия НПВС. Угнетение синтеза простагландинов
в слизистой оболочке желудка часто приводит к появлению
желудочно-кишечных расстройств (например, диспепсии,
тошноты, воспаления слизистой оболочки желудка). Более
серьёзным осложнением являются желудочно-кишечные
кровотечения и перфорации язв. Известны две изоформы циклооксиге-
назы: тканевая ЦОГ] и ЦОГ2, образующаяся под влиянием
цитокинов в зоне воспаления. Противовоспалительный эффект
НПВС преимущественно.связан с угнетением ЦОГ2, тогда как
появление желудочно-кишечных расстройств связано с инги-
бированием ЦОГ]. Современные НПВС в основном ингибиру-
ют ЦОГ], но, возможно, в дальнейшем будет возможен синтез
селективных ингибиторов ЦОГ2, которые будут обладать менее
выраженными побочными эффектами.
Аспирин (ацетилсалициловая кислота) является
эффективным противовоспалительным и анальгезирующим средством.
Продолжительность действия аспирина составляет около 4-х
часов. Аспирин применяют при различных видах слабых болей
и болей умеренной интенсивности. Он хорошо всасывается при
пероральном применении. В кислой среде желудка аспирин
находится в неионизированной форме (так как является
слабой кислотой, рКа = 3,5), поэтому всасывание препарата
начинается уже в желудке, хотя основная его часть абсорбируется в
верхнем отделе тонкого кишечника. Аспирин гидролизуется
эстеразами в крови и тканях до активного салицилата и
уксусной кислоты. Салицилаты в основном биотрансформируются в
печени в водорастворимые конъюгаты, которые быстро
выводятся из организма почками. Щелочная реакция мочи
увеличивает ионизацию салицилатов, что снижает их реабсорбцию в
эпителии почечных канальцев и увеличивает экскрецию с мочой.
Аспирин эффективен при воспалительных заболеваниях
суставов. Однако около 50% пациентов плохо переносят аспирин
из-за его побочных эффектов (тошноты, боли в эпигастрии,
рвоты), возникающих при использовании водорастворимого
аспирина в высоких дозах, необходимых для достижения
противовоспалительного эффекта. Созданы различные
лекарственные формы аспирина (показаны в правой части рисунка),
оказывающие минимальное побочное действие на
желудочно-кишечный тракт. В настоящее время при воспалительных
заболеваниях суставов используют преимущественно новые НПВС.
При назначении НПВС необходимо учитывать
индивидуальную чувствительность пациентов к этим препаратам (хотя у
60% больных эффективны все НПВС). Производные пропио-
новой кислоты (например, нбупрофен, шшрожсен) реже других
НПВС оказывают побочные эффекты, поэтому их используют
в первую очередь.
Парацетамол не обладает противовоспалительной
активностью, но его широко применяют в качестве слабого анальгетика
при болях, не связанных с воспалением. Парацетамол при
пероральном применении хорошо всасывается из кишечника и
не вызывает раздражения слизистой оболочки желудка.
Основным недостатком препарата является его высокая гепатоток-
сичность (см. главы 4 и 44).
70
ИРЭ в тромбоцитах
Агрегация тромбоцитов
Сужение сосудов
Стероиды
(см. главу 33)
Механизм обезболивающего действия НПВС имеет
центральный и периферический компонент, хотя превалирует
последний. Обезболивающее действие НПВС напрямую связано с
их противовоспалительным эффектом, являющимся
следствием угнетения синтеза простагландинов в воспалённых тканях.
Простагландины сами вызывают слабую болевую реакцию, но
в основном усиливают альгогенное действие других
медиаторов воспаления (например, гистамина, брадикинина).
Противовоспалительное действие. Простагландины
участвуют в патогенезе воспаления, вызывая расширение сосудов и
повышая проницаемость сосудов. НПВС, угнетая синтез
простагландинов, ослабляют воспалительную реакцию, но
полностью не устраняют её, так как не влияют на синтез других
медиаторов воспаления. Вместе с тем НПВС оказывают
достаточно сильный противовоспалительный эффект при
ревматоидном полиартрите. Препараты уменьшают болезненность,
скованность и припухлость суставов, но они не устраняют
причину заболевания.
Жаропонижающее действие. Механизм возникновения
лихорадки связан с возбуждением центра терморегуляции в
гипоталамусе эндогенными пирогенами (интерлейкин I),
высвобождающимися из лейкоцитов. При лихорадке отмечается
повышение концентрации простагландинов в головном мозге,
которые также обладают пирогенным действием. Аспирин
препятствует гипертермическому эффекту интерлейкина I,
уменьшая уровень простагландинов в головном мозге. НПВС не
снижают повышенную температуру тела при солнечном ударе
(возникает вследствие дисфункции гипоталамуса) и не влияют
на нормальную температуру тела.
Влияние на ЦОГ (циклооксигеназу). НПВС угнетают цикло-
оксигеназу различными путями. Аспирин необратимо угнетает
фермент, ацетилируя остатки серина в его молекуле, что
препятствует взаимодействию субстрата (арахидоновой кислоты) с
активным центром циклооксигеназы. Другие НПВС обратимо
блокируют циклооксигеназу. Парацетамол снижает активность
цитоплазматических пероксидов, необходимых для перехода
циклооксигеназы в активную форму. При воспалении
парацетамол мало эффективен, так как в зоне воспаления содержится
большое количество Н202 и продуктов перекисного окисления
липидов, продуцируемых нейтрофилами и моноцитами.
Препарат эффективен при болях, не связанных с воспалением (когда
нет инфильтрации тканей лейкоцитами).
Побочные эффекты являются общими для всех НПВС, так
как эти средства обычно применяют в высоких дозах в течение
длительного времени, а также потому, что их часто используют
у пожилых людей (которые особенно чувствительны к их
побочным эффектам).
Влияние на желудочно-кишечный тракт. НПВС вызывают
повреждение слизистой оболочки желудочно-кишечного тракта
вследствие уменьшения синтеза простагландинов.
Простагландины группы Е2 и 12 (ПГЕ2 и ПП2) угнетают секрецию соляной
кислоты в желудке, улучшают кровоснабжение слизистой
оболочки желудка и оказывают цитопротективное действие. ПГЕ2
и некоторые его аналоги способствуют заживлению пептичес-
ких язв. НПВС, угнетая образование простагландинов,
оказывают ульцерогенное действие, вызывают ишемию слизистой
оболочки желудка и повреждают защитный слой слизи, что
способствует повреждению слизистой оболочки соляной
кислотой. Мнзопростол (является производным ПГЕО
эффективно предупреждает желудочно-кишечные расстройства,
вызванные воздействием НПВС. Препарат применяют при
необходимости использования НПВС у пациентов с язвенной болезнью
в анамнезе.
Нефротоксическое действие. Простагландины группы Е2 и
12, синтезирующиеся в мозговом веществе и клубочках почек,
оказывают выраженное сосудорасширяющее действие, участвуют
в регуляции почечного кровотока и экскреции из организма
солей и воды. Угнетение синтеза простагландинов в почках мо*
жет привести к задержке Na+, уменьшению почечного
кровотока и развитию почечной недостаточности, особенно при ре-
нальной вазоконстрикции, связанной с повышением уровня в
крови катехоламинов и ангиотензина II (например, при
сердечной недостаточности, циррозе печени). НПВС могут
вызвать интерстициальный нефрит и гиперкалиемию. Длительное
применение НПВС (в течение нескольких лет) может вызвать
развитие папиллярного некроза и почечной недостаточности.
К другим побочным эффектам НПВС относятся: бронхоспазм
(особенно у больных бронхиальной астмой), крапивница и
другие аллергические реакции.
НПВС других химических групп
Производные пропионовой кислоты ибупрофен (бруфен), ке-
топрофен, напроксен (напросин) широко применяют при
воспалительных заболеваниях суставов, так как они реже других
НПВС оказывают побочные эффекты.
Производные индолуксусной кислоты. Одним из наиболее
эффективных нестероидных противовоспалительных средств
является индометацин. При его применении часто наблюдаются
побочные эффекты: головная боль, головокружение,
желудочные кровотечения, язвообразование. Индометацин может
вызвать развитие агранулоцитоза.
Производные оксикамов. Пироксикам обладает длительным
периодом полуэлиминации, поэтому его применяют один раз в
сутки. Препарат часто вызывает желудочные кровотечения
(особенно у пожилых людей).
Производные пиразолона. Бутадион (фенилбутазон)
оказывает выраженное противовоспалительное действие, но является
высоко токсичным препаратом. Бутадион иногда применяют
при артритах, в том числе при анкилозирующем спондилите
обычно в условиях стационара, так как он может вызвать
развитие апластической анемии. Азалропаэон не угнетает
костномозговое кроветворение, но вызывает другие побочные
эффекты НПВС. Его применяют при неэффективности других
противовоспалительных средств.
Подагра
Подагра характеризуется отложением кристаллов мочевой
кислоты (уратов) в суставах, что сопровождается появлением
болевого синдрома. При острых приступах подагры применяют
индометацин, напроксен, пироксикам и другие НПВС. Аспирин
при подагре не используют, так как в небольших дозах препарат
повышает концентрацию мочевой кислоты в плазме крови,
угнетая её секрецию в почечных канальцах. Выраженным
противовоспалительным действием при подагре обладает колхицин.
Механизм противовоспалительного действия препарата связан
с его взаимодействием с микротубулярным белком лейкоцитов
и угнетением миграции этих клеток в область отложения
мочевой кислоты. Однако колхицин может вызывать рвоту,
тошноту, диарею и боли в животе.
Средства, применяемые для предупреждения приступов подагры
Аллопуринол понижает концентрацию мочевой кислоты в
плазме крови, угнетая ксантиноксидазу (фермент,
участвующий в синтезе мочевой кислоты). Препарат применяют для
предупреждения приступов подагры.
Урикозурические средства (средства, способствующие
выведению мочевой кислоты). Антуран (сульфинпиразон) и пробе-
нецид угнетают реабсорбцию мочевой кислоты в почечных
канальцах, что повышает её выведение с мочой. Препараты
следует запивать большим количеством воды для профилактики
образования мочевых камней в мочевыводящих путях. Эти
средства менее эффективны и более токсичны, чем аллопуринол.
Их применяют при непереносимости пациентами аллопуринола.
71
.33. Препараты гормонов коры надпочечников (кортикостероиды)
Гипоталамус
Кортикотропин
(АКТГ)
Кора
надпочечника
Кортикостероиды —» (q) <
(гидрокортизон, у^
альдостврон) /
-"-^
Глюкокортикоиды
ЕСТЕСТВЕННЫЕ
Гидрокортизон
(кортизол)
(кортизон)
СИНТЕТИЧЕСКИЕ
Преднизалон
Преднизон
Метилпреднизолон
Бетаметазон
Двксамвтазон
Триамцинолон
Стероидный
ответ
Воспалительный ответ
Иммунологический ответ
Отложение гликогена
в печени
Глюконеогенеэ t
Уровень глюкозы в крови
Утилизация глюкозы [
Катаболизм белка j _ _
мРНК
Клетка-мишень
Катаболизм
костной ткани
Психика
Соляная кислота
и пепсин желудка
Реабсорбция Na
Минералокорти-
коидные эффекты 1 Экскреция К+/Н
Минералокортикоиды
Альдостврон
Флудрокортизон
Угнетение функции
надпочечников
Повышение
восприимчивости к инфекциям
Сахарный диабет
Мышечное истощение
Угнетение роста
у детей
Остеопороз
Психоз
Изъязвление слизистой
оболочки желудка
Задержка в организме Na*и НгО
Гипокалиемия
Артериальная гипертензия
Мышечная слабость
В коре надпочечников образуются различные стероидные
гормоны. Основными группами гормонов коры надпочечников
являются минералокортикоиды (минералокортикостсроиды) и
глюкокортикоиды (глюкокортикостероиды), кроме того, в сетчатой
зоне коры надпочечников синтезируется небольшое
количество половых гормонов. Минералокортикоиды (в основном аль-
достерон), образующиеся в клубочковой зоне, регулируют
водно-солевой обмен в организме. Глюкокортикоиды (в основном
гидрокортизон) синтезируются в пучковой зоне, эти гормоны
влияют на углеводный и белковый обмен, а также обладают
выраженной минералокортикоидной активностью.
Секреция гидрокортизона (кортизола) регулируется
гормонами гипоталамуса и передней доли гипофиза по принципу
обратной связи (показано в верхней части рисунка слева).
Снижение уровня глюкокортикоидов в плазме крови приводит к
увеличению продукции адренокортикотропного гормона (АКТГ,
кортикотропина), который усиливает синтез и высвобождение
гидрокортизона, активируя аденилатциклазу и способствуя
образованию цАМФ. цАМФ активирует протеинкиназу А,
которая фосфорилирует и тем самым активирует холестерилэстер-
гидролазу, участвующую в синтезе стероидных гормонов. АКТГ
влияет также на секрецию альдостерона, однако этот процесс в
основном регулируется другими факторами (например, рснин-
ангиотензиновой системой, уровнем К+ в плазме крови).
Кортикостероиды — это гормоны, влияющие на геном
клеток организма. Они воздействуют на ядро клетки, способствуя
образованию и РНК, что приводит к усилению синтеза
специфических белков, вызывающих эффекты, характерные для этих
гормонов.
Глюкокортикоиды (гидрокортизон и кортизон) в комбинации
с синтетическими минералокортикоидами (обычно с флудро-
кортизоном; показаны в верхней части рисунка справа)
применяют для заместительной терапии при надпочечниковой
недостаточности (при болезни Аддисона). В основном в
клинической практике используют синтетические глюкокортикоиды
(показаны в центре рисунка), так как они слабее влияют на водно-
минеральный обмен в организме по сравнению с
естественными гормонами.
Глюкокортикоиды (часто преднизалон) применяют в качестве
противовоспалительных, противоаллергических и иммунодеп-
рессивных средств. Противовоспалительные свойства
глюкокортикоидов используют при лечении многих заболеваний
(например, ревматоидного полиартрита, неспецифического
язвенного колита, бронхиальной астмы, тяжёлых воспалительных
заболеваний глаз и кожи). Иммунодепрсссивные свойства этих
гормонов имеют существенное значение при трансплантации
органов. Глюкокортикоиды применяют при лимфолейкозе и
лимфоме в качестве средств, угнетающих образование
лимфоцитов.
Глюкокортикоиды эффективны при многих заболеваниях,
однако их длительное применение (особенно в высоких дозах)
вызывает много тяжёлых побочных эффектов (показаны в
правой части рисунка). Знание механизма действия этих препаратов
позволяет уменьшить выраженность нежелательных эффектов.
72
Кортиколиберин
Гипофиз
Экзогенные
гормональные средства
Синтез
белка
Рецептор
Активация
АКТГ
Кортиколиберин (КЛ — гормон, стимулирующий
высвобождение кортикотропина) является полипептидом (состоит из 41-й
аминокислоты). Он образуется в гипоталамусе и через гипота-
ламо-гипофизарную портальную систему попадает в аденоги-
пофиз, где стимулирует высвобождение кортикотропина.
Кортнкотропин (АКТГ) образуется из крупномолекулярного
предшественника —проопиомеланокортина (ПОМК),
находящегося в кортикотропных клетках передней доли гипофиза.
ПОМК является также предшественником $-липотропина и р-
эндорфина, АКТГ действует на надпочечники, усиливая синтез
и высвобождение гидрокортизона (кортизола). Вместе с тем
АКТГ повышает чувствительность клубочковой зоны коры
надпочечников к воздействию факторов, усиливающих
высвобождение альдостерона (низкий уровень Na+, высокая
концентрация К+ и ангиотензина II в плазме крови).
Глюкокортикоиды
Механизм действия. Гидрокортизон (и синтетические
глюкокортикоиды) проникают в клетки-мишени, где связываются
с цито плазматически ми глюкокортикоидными рецепторами (к
этому семейству рецепторов относятся также другие
стероидные, а также тиреоидные (см. главу 35) и ретиноидные
рецепторы). Активный комплекс глюкокортикоид-рецептор входит
в ядро клетки и связывается со специфическим глюкокортико-
идным регуляторным элементом молекулы ДНК, усиливая или
угнетая процессы транскрипции генов. Синтетические
глюкокортикоиды обладают более высоким сродством к глюкокорти-
коидным рецепторам, они медленнее инактивируются и
вызывают менее выраженные нарушения водно-минерального обмена,
поэтому в клинической практике их используют чаще, чем
естественные гормоны.
Гидрокортизон применяют: I) перорально (в качестве
средства заместительной терапии); 2) внутривенно (при различных
видах шока и астматическом статусе); 3) местно (для
смазывания пораженных участков кожи при экземе, в клизме при
неспецифическом язвенном колите).
Преднизалон широко используют при воспалительных
заболеваниях и аллергических реакциях.
Бетамегаэон и дексамезатон являются активными
гормональными средствами, практически не обладающими минералокор-
тикоидной активностью. Они особенно эффективны при отёке
мозга (так как при этой патологии является нежелательной
задержка жидкости в организме).
Беклометазона дилролионат (бекотид) и будесонид
оказывают преимущественно местное противовоспалительное действие
с минимальным системным воздействием, так как плохо
всасываются через мембраны. Эти препараты используют в виде
аэрозоля для ингаляций при бронхиальной астме и местно при
экземе.
Триамцинолон применяют при тяжелой форме бронхиальной
астмы, а также при артритах (для внутрисуставного введения).
Эффекты. Глюкокортикоиды влияют на большинство
клеток организма.
Влияние на обмен веществ. Глюкокортикоиды являются
жизненно-важными гормонами. Они способствуют образованию
гликогена, ингибируют синтез и стимулируют катаболизм
белков до аминокислот. Глюконеогенез, накопление гликогена и
высвобождение глюкозы из печени стимулируются, но
периферический захват глюкозы тормозится. Во время голодания
глюкокортикоиды жизненно необходимы для предупреждения
(иногда смертельной) гипогликемии.
Противовоспалительное действие. Глюкокортикоиды
обладают сильным противовоспалительным действием. Механизм
противовоспалительного эффекта этих гормонов достаточно
сложный. Они уменьшают количество иммунокомпетентных
клеток и макрофагов в крови, угнетают образование простаглан-
динов, лейкотриенов и фактора активации тромбоцитов (ФАТ),
являющихся медиаторами воспаления. Глюкокортикоиды
стимулируют синтез в лейкоцитах белка — липокортина, который
ингибирует фосфолипазу Аг. Этот фермент активируется при
повреждении клеток и способствует образованию из
мембранных фосфолипидов арахидоновой кислоты, которая является
предшественником многих медиаторов воспаления (см. главу 32).
Иммунодепрессивное действие. Глюкокортикоиды угнетают
функциональную активность моноцитов и макрофагов,
уменьшают содержание в крови Т-лимфоцитов, особенно Т-хелпе-
ров (Т4-лимфоцитов). Вместе с тем глюкокортикоиды снижают
высвобождение интерлейкинов ИЛ-1 и ИЛ-2 (участвующих в
процессах пролиферации лимфоцитов). Одновременно
угнетается транспорт лимфоцитов к месту антигенной стимуляции.
Глюкокортикоиды также ингибируют антителогенез.
Побочные эффекты
Глюкокортикоиды вызывают много побочных эффектов
(особенно при применении в высоких дозах). Сходные эффекты
отмечаются при повышенной секреции глюкокортикоидов при
синдроме Кушинга.
Нарушение обмена веществ в организме. Глюкокортикоиды в
высоких дозах вызывают перераспределение жира с верхних и
нижних конечностей на туловище и лицо (способствуя
округлению и покраснению лица, т.н. «лунообразное» лицо).
Отмечается появление багровых стрий (полос растяжения) и
синяков. Изменение углеводного обмена проявляется повышением
содержания сахара в крови (гипергликемия) и развитием
стероидного диабета. Под влиянием глюкокортикоидов
угнетается синтез и ускоряется катаболизм белка, вследствие чего
возникает слабость и дряблость скелетных мышц. Применение
глюкокортикоидов способствует развитию остеопороза.
При комбинированном применении глюкокортикоидов с
веществами, обладающими минералокортикоидной активностью,
развиваются задержка жидкости в организме, гипокалиемия и
артериальная гипертензия (например, при использовании
гидрокортизона в сочетании с минералокортикоидами в качестве
средств заместительной терапии при надпочечниковой
недостаточности).
Угнетение надпочечников. Глюкокортикоидная терапия
приводит к угнетению секреции АКТГ и способствует атрофии
надпочечников. Восстановление функции надпочечников
происходит в среднем в течение 6—12 месяцев после отмены
гормонов. Глюкокортикоиды снижают ответную реакцию организма
на стресс, поэтому их применяют при тяжелых стрессорных
ситуациях (например, при операциях, инфекции).
Глюкокортикоиды следует отменять постепенно, так как их резкая
отмена может вызвать надпочечниковую недостаточность.
Глюкокортикоиды снижают сопротивляемость организма к
инфекциям, так как угнетают иммунный ответ.
К другим осложнениям глюкокортикоидной терапии
относятся: развитие психозов, катаракты, глаукомы, пептических язв
желудка и обострение хронических инфекций (например,
туберкулёза).
Минеролокортикоиды
Флудрокортнзон (фторгидрокортизон) применяют в
комбинации с гидрокортизоном при надпочечниковой
недостаточности (при болезни Аддисона, после адреналэктомии) для
усиления влияния последнего на водно-электролитный обмен.
73
34. Половые гормоны и их препараты
Гестагеиы
Прогестерон
Деэогестрел
Левоноргестрел
Норэтистврон
Другие
Эстрогены
Эстрадиол
Этинилэстрадиол
Местранол
Стильбэстрол
Эффекты
Развитие
Матки
Влагалища
Маточных труб
Рост и половое
созревание
Вторичные половые
признаки
Развитие молочных
желёз
Распределение
жира в организме
Развитие эндометрия
Уменьшение
резорбции костной ткани
Средства, применяемые
при бесплодии
/ ''\
Эффекты
Андрогенный Анаболический
Вторичные синтез
половые белка
признаки
(маскулинизация
у женщин)
Оволосение
по мужскому типу
Огрубение голоса
Изменение
психологии
Рост
Антиэстрогены
Кломифен
Гонадотропины
Менотрофин
(ЛГи<РСГ)
Гонадотропин
хронический
(в основном
содержит ЛГ)
Амдрогены
Тестостерон
Тестостерона
пропионат
Местеролон
Анаболические
стероиды
Нандролон
Станозолол*
Оксиметолон*
* 17-а-алкилтестостероны,
метаболиты которых
могут вызвать развитие
холестатической желтухи
Время (дни)
В половых железах (яичниках и яичках) кроме созревания
половых клеток (гамет) происходит синтез половых гормонов
(эстрогенов и андрогенов соответственно). Секрецию
эстрогенов (в основном эстрадиола) и андрогенов (в основном
тестостерона) стимулируют гонадотропные гормоны передней доли
гипофиза (лютеинизирующий — ЛГ и фолликулостимулирую-
щий — ФСГ) (в центре рисунка). В свою очередь
высвобождение ЛГ и ФСГ регулируется гонадотропин-рилизинг
гормонами (фоллиберином и люлиберином) гипоталамуса (ГТРГ; в
верхней части рисунка).
В извитых семенных канальцах яичек (на рисунке справа)
происходит созревание сперматозоидов. Этот процесс
регулируют ФСГ и тестостерон, образующийся в интерстициальных
клетках (клетки Лейдига, гландулоциты) мужских половых
желёз под влиянием ЛГ. Тестостерон способствует
формированию мужского фенотипа (показано в нижней части рисунка
справа). Андрогены (в правой части рисунка в середине)
применяют в основном для заместительной терапии после
кастрации, при гипогонадизме, развивающемся при некоторых
заболеваниях гипофиза или яичек. Тестостерон при пероральном
применении быстро инактивируется в печени, тогда как
синтетические андрогены (например, местеролон) при приёме внутрь
сохраняют свою активность. Анаболические стероиды (в
нижней части рисунка справа) обладают слабой андрогенной
активностью, их используют в основном в качестве средств,
усиливающих синтез белка (например, после тяжёлых
хирургических операций, а также при различных хронических
заболеваниях). Основными побочными эорфсктами андрогенов и
анаболических стероидов (в меньшей степени) являются развитие
маскулинизации у женщин и у детей прспубертатного
возраста, угнетение выработки ФСГ и ЛГ.
ФСГ (и ЛГ) стимулирует созревание фолликула в яичниках
(в верхней части рисунка слева), а также синтез эстрадиола
гранулёзными клетками оролликула. В ранней стадии фоллику-
линовой фазы менструального цикла низкий уровень
эстрадиола в крови (в середине рисунка слева) способствует усилению
высвобождения ФСГ (по принципу обратной связи), который
в свою очередь стимулирует созревание фолликула. В середине
менструального цикла уровень эстрадиола в крови
повышается, что усиливает секрецию ЛГ (по принципу положительной
обратной связи), способствуя овуляции. Таким образом,
изменение концентрации эстрадиола в крови в различные фазы
менструального цикла по принципу обратной связи влияет на
выработку ГТРГ в гипоталамусе и гонадотропных гормонов в
адсногипофизе. На месте лопнувшего фолликула образуется
жёлтое тело, где синтезируются гестагены и эстрогены (в
середине рисунка слева) во второй (лютеиновой) фазе
менструального цикла. В фолликул и новой фазе менструального цикла под
74
Дигидротестостерон
Тестостерон
Прогестерон
Эстрадиол
Фолликул
Ооцит
Жёлтое'
тело
Лютеиновая фаза
Развитие фолликула
Извитые свмвн-4
ные канальцы
, Интврстициальные,
**«±_ клетки ^у^
Сперматозоиды
ФСГ
Яичко
Передняя доля
гипофиза
Нарушение
обратной
связи
Зрительный перекрест
Обратная
отрицательная
связь
Гонадотропин
-рилизинг
Г\ гормон
Воротное сплетение
ГТРГ нейроны
гипоталамуса
+ обратная
связь
Вызывает лютеини-
зирующий гормон,
который индуцирует
овуляцию
лг
Разрыв
фолликула
ФСГ
лг
влиянием эстрогенов происходит пролиферация эндометрия
(фаза пролиферации). В лютеиновой фазе под влиянием
прогестерона отмечается развитие желёз эндометрия (фаза
секреции), в дальнейшем в фазе десквамации (менструации)
происходит отторжение всего функционального слоя эндометрия.
Эстрогены оказывают много различных эффектов (показаны
в нижней части рисунка слева). Эти гормоны используют для
заместительной терапии при первичном гипогонадизме и в пост-
ГТРГ (гонадорелин) является декапептидом,
стимулирующим высвобождение ФСГ и Л Г в аденогипофизе. ГТРГ
применяют внутривенно при гипоталамическом гипогонадизме.
ФСГ и ЛГ — это гормоны передней доли гипофиза,
являющиеся гликопротеинами и регулирующие функционирование
половых желёз.
Бесплодие
Для лечения ановуляторного бесплодия используют средства,
стимулирующие овуляцию в яичниках.
Антиэстрогенные средства кломифен и тамоксифен
блокируют рецепторы эстрогенов, нарушая обратную отрицательную
связь, что приводит к увеличению высвобождения гипотала-
мических рилизинг-факторов лютеинизируюшего и фоллику-
лостимулирующего гормонов и соответственно ФСГ и ЛГ в
аденогипофизе.
При женском бесплодии, связанном с гипофункцией
гипофиза, а также при неэффективности кломифена применяют
препараты гонадотропинов. В первую фазу менструального цикла
для стимуляции созревания фолликула внутримышечно вводят
менотрофин (содержит поровну ФСГ и Л Г) или урофоллитро-
фин (ФСГ), затем используют хорионический гонадотропин (в
основном содержит Л Г) в высоких дозах для стимуляции
овуляции. После лечения развитие беременности отмечается в
среднем у 20-30% женщин. Гонадотропины применяют также для
стимуляции сперматогенеза и повышения продукции андроге-
нов у мужчин.
АнАРогены
Основным андрогеном является тестостерон. Около 2%
тестостерона циркулирует в плазме крови в свободном состоянии,
остальная часть гормона в различных тканях организма (в коже,
предстательной железе, в семенных пузырьках и в придатках
яичка) превращается в дигидротестостерон. При андрогенной
недостаточности внутримышечно вводят пролонгированные
препараты тестостерона пропионата.
Эффекты андрогенов. Андрогены вызывают развитие
вторичных половых признаков у мужчин. Применение андрогенов в
высоких дозах у мужчин угнетает высвобождение гонадотроп-
ных гормонов и приводит к атрофии интерстициальной ткани
и извитых канальцев яичек. У женщин андрогены вызывают
маскулинизирующий эффект (вирилизм).
Эстрогены
Основным эстрогеном, высвобождающимся из яичников,
является эстрадиол. Однако для перорального применения более
эффективными являются синтетические эстрогены.
Побочные эффекты (см. также в разделе: пероральные
контрацептивы). Длительное применение эстрогенов вызывает
гиперплазию эндометрия, способствует появлению маточных
кровотечений и увеличивает частоту возникновения карциномы
эндометрия. При комбинированном применении эстрогенов с
гестагенами частота развития рака яичников и эндометрия
снижается.
Гестагены
Гестагены применяют для гормональной контрацепции, при
гипофункции яичников, а также при различных
гинекологических заболеваниях (например, при дисменорее, эндометрио-
зс, гирсутизме, маточных кровотечениях).
менопаузе у женщин (для предупреждения возникновения
чувства приливов, атрофического вагинита и остеопороза).
Эстрогены применяют при нарушениях менструального цикла
(дисменорее), а в комбинации с гестагенами в качестве
контрацептивов. Гестагены (в верхней части рисунка слева) в основном
используют для гормональной контрацепции. Половые
гормоны и их антагонисты применяют при некоторых видах гормо-
нозависимых опухолей (см. главу 43).
Пероральные контрацептивы
Комбинированные геста ген-эстроген ные контрацептивы
применяют ежедневно в течение 21-го дня (с 5-го дня
менструального цикла), затем следует 7-дневный перерыв, когда
появляется менструальноподобная реакция.
Контрацептивы, содержащие малые дозы гестагенов (мини-
пили) применяют постоянно (без перерывов).
Для гормональной контрацепции используют два
эстрогена — этинилэстрадиол и местранол. Следует отметить, что
одновременный приём пероральных контрацептивов со
средствами, вызывающими индукцию микросомальных ферментов
печени (например, фенобарбитал, карбамазепин, дифенин и
особенно рифампицин) снижает эффективность гормональной
контрацепции.
Механизм действия» Комбинированные гестаген-эстрогенные
контрацептивы по принципу обратной связи угнетают
высвобождение гипоталамических рилизинг-факторов гонадотропных
гормонов и соответственно гонадотропных гормонов аденоги-
пофиза, что приводит к нарушению процессов овуляции
(возникновению ановуляторных циклов). Вместе с тем
гормональные контрацептивы вызывают изменения эндометрия,
препятствующие имплантации оплодотворенной яйцеклетки, изменяют
состав и количество цервикальной слизи и нарушают
транспорт яйцеклетки по фаллопиевым (маточным) трубам. Эти
механизмы контрацептивного действия имеют особое значение
при применении препаратов гестагенов (мини-пили), так как
при этом овуляция отсутствует только у 25% женщин. При
использовании мини-пили отмечается развитие нерегулярного
менструального цикла.
Побочные эффекты. Основными осложнениями гормональной
контрацепции (как комбинированных гестаген-эстрогенных
препаратов, так и мини-пили) являются: маточные кровотечения,
увеличение массы тела, изменение либидо, «нагрубание»
грудных желёз, головная боль и тошнота. Комбинированные
контрацептивы могут вызвать развитие депрессии, появление гир-
сутизма и грибковой инфекции влагалища. Нежелательные
эффекты гормональной контрацепции отмечаются в среднем у
20—30% женщин A0—15% женщин из-за появления побочных
эффектов прекращают приём контрацептивов). При применении
только гестагенов (мини-пили) осложнения наблюдаются реже.
Основными побочными эффектами этих препаратов являются
маточные кровотечения и нарушения менструального цикла.
Серьезные побочные эффекты гормональной контрацепции
отмечаются редко. К ним относятся развитие холестатической
желтухи и тромбоэмболических осложнений, которые,
вероятно, связаны с действием эстрогенов. Вместе с тем отмечено,
что тромбоэмболические осложнения отмечаются чаще при
использовании комбинированных препаратов, содержащих ге-
стоден и дезогестрел. Курение, артериальная гипертензия,
наличие тромбоэмболии в анамнезе, сахарный диабет повышают
риск развития тромбоэмболических осложнений при перораль-
ной контрацепции.
Средства, обладающие абортивным действием
Прогестерон способствует сохранению беременности, тогда
как антагонисты прогестерона (например, мифепристон)
обладают способностью прерывать беременность в основном на её
ранних стадиях, особенно при комбинированном применении
с простагландинами. Основными побочными эффектами
химического аборта являются болевые ощущения и маточные
кровотечения.
75
35. Гормоны щитовидной железы и онтитиреоидные средства
Антитмреомдные
средстве
ТИОНАМИДЫ
Карбимаэол
Мвтимазол (США)
Пропилтиоурацил
ПРЕПАРАТЫ ЙОДА
Раствор Люголя
Лучевая терапия ( J)
Хирургическое
лечение
Цитоплаэматическая
мембрана
Синтез
Структурных .белков
Ферментов мРНК
Секреторных
Утилизация
кислорода t
Теплопродукция f
BMPf
Поглощение клетками J
глюкозы и аминокислот
Размеры и число
митохондрий f
Активность
митохондрий f
РНК-полимеразная
активность *
мРНК f
Активность ферментов f
Синтез белка *
(включая адреноре-
цепторы)
Симпатические
эффекты
Мембрана ядра
клетки
В щитовидной железе синтезируются йодсодержащие
гормоны: трийодгиронин (Т3) и тироксин (тетрайодтиронин, Т4),
регулирующие процессы роста, развития, дифференцировки
тканей и активирующие обмен веществ в организме. В пара-
фолликулярных клетках щитовидной железы образуется каль-
цитонин, участвующий в регуляции обмена кальция.
Для синтеза трийодтиронина и тироксина необходимы йо-
диды, которые обычно поступают в организм с пищей. Йодиды
(I ) поглощаются фолликулярными клетками (тироцитами) (в
центре рисунка) за счёт активного транспорта (на рисунке
показано в виде (=>). Этот процесс контролируется пшреотропным
гормоном (ТТГ). В субапикальной зоне цитоплазмы тироцитов
при участии пероксидазы происходит быстрое окисление иоди-
дов в более активный атомарный йод A°). Йодирование тире-
оглобулина (содержит в своём составе тирозин и его
производные — тиронины) приводит к образованию тиреоидных
гормонов: тироксина (Т4 показан на рисунке в виде ф) и трийодти-
ронина (Т3 показан на рисунке в виде ф). Эти йодтиронины
содержатся в коллоиде фолликулов щитовидной железы в
составе молекул тиреоглобулина.
Высвобождение Тз и Т4 фолликулами щитовидной железы
регулируется по принципу обратной связи (показано в верхней
части рисунка). При снижении уровня Тз и Т4 в крови
увеличивается выделение тиреотропина (тиреотропного гормона, ТТГ)
из передней доли гипофиза, что приводит к усилению реабсор-
бции коллоида (путём эндоцитоза) в клетки фолликулов. В
цитоплазме тироцитов капли коллоида сливаются с лизосомами,
в результате чего протеолитические ферменты лизосом
расщепляют тиреоглобулины, высвобождая Т3 и Т4 в кровь. Тиреоид-
ные гормоны (Т3 и Т4) взаимодействуют с рецепторами (Р) на
мембранах клеток и внутриклеточными рецепторами (в
нижней части рисунка), вызывая различные эффекты (показаны на
рисунке справа).
Нарушения функции щитовидной железы (гипер- и
гипотиреоз) являются наиболее частой эндокринной патологией, они
отмечается у 2% населения (в 2-3% случаев эти нарушения
сочетаются с сахарным диабетом). При Базедовой болезни (ги-
пертиреоидизме) повышение функции щитовидной железы
связано с выработкой специфических антител (LATS — длительно
действующих тиреоидных стимуляторов), которые
стимулируют ТТГ-рецепторы, что приводит к избыточной продукции
тиреоидных гормонов (Т3 и Т4). При повышенной функции
щитовидной железы используют антитиреоидные средства,
радиотерапию (I131) и хирургическое лечение. Для уменьшения
повышенного тонуса симпатической нервной системы при
гипертиреоидизме используют р-адреноблокаторы (например,
пропранолол). При Базедовой болезни часто развивается
офтальмопатия аутоиммунного генеза, трудно поддающаяся
лечению.
Первичный гипотиреоидизм (микседема) в большинстве
случаев возникает вследствие клеточного иммунного ответа
против фолликулярных клеток щитовидной железы. Препаратом
выбора для проведения заместительной терапии при
гипотиреозе является тироксин.
76
Гипоталамус
Гипофиз
Тиреотропин-
рилизинг гормон
Тиреоглобулин (Т)
средства при
гипотиреозе
Тироксин (TJ
Лиотиронин (TJ
f Длительно >v
действующие >
тиреоидные стимуляторы
(Базедова болезнь) .
Эндоцитоз
Коллоид
Эффекты Т,/Т4
Высвобождение
Органификация
Поглощение
йодидов
Глюкоза
Аминокислоты
АДФ АТФ
ттг
Фолликулярные клетки
Тиреотрошш-рилнзннг гормон (ТТРГ) является трипептидом.
Этот гормон синтезируется в гипоталамусе и транспортируется
по капиллярам гипофизарной портальной венозной системы в
гипофиз, где стимулирует синтез и высвобождение ТТГ.
ТТГ, Тиреотропный гормон является гликопротеином,
высвобождающимся из передней доли гипофиза (аденогипофиза).
ТТГ активирует аденилатциклазу, которая стимулирует синтез
и высвобождение Т3 и Т4 из щитовидной железы. Повышение
уровня ТТГ при гипотиреоидизме или при недостаточном
поступлении йода в организм (реже) приводит к увеличению
размеров щитовидной железы (формированию зоба).
Циркулирующие в крови тиреоидные гормоны (Т3 и Т4)
почти полностью связаны с белками плазмы крови (99,5% и 99,95%
соответственно). В фолликулах щитовидной железы
синтезируется только около 20% Т3, остальное количество этого
гормона образуется в периферических тканях из Т4 (путём
отщепления йода от его молекулы). Таким образом, Т4 является
основным предшественником Т3.
Механизм действия. Механизм действия тиреоидных
гормонов полностью не изучен. Известно, что гормоны щитовидной
железы обладают высоким сродством к рецепторам ядра
клеток, митохондрий и ццтоплазматических мембран.
Взаимодействие тиреоидных гормонов с рецепторами приводит к
развитию различных эффектов (в том числе к усилению синтеза
белка и повышению обмена веществ). Большинство тиреоидных
рецепторов являются внутриклеточными. Ядерные рецепторы
для Т3 (так же как и стероидные рецепторы и рецепторы
витамина D) кодируются семейством генов, родственных цис-он-
когенам. Свободные тиреоидные гормоны (Т3 и Т4) проникают
в клетку с помощью специального механизма переноса. В
цитоплазме клеток большая часть Т4 превращается в Тз (или рТз —
реверсивный Т3), который связывается с С-терминалями
тиреоидных рецепторов и вызывает конформационные изменения
в их ДНК-связывающем участке. Активированные тиреоидные
рецепторы взаимодействуют с молекулами ДНК. В результате
изменяются процессы транскрипции генов, а синтез белка
стимулируется или угнетается.
Гипертиреоидиэм
(тиреотоксикоз)
При гипертиреоидизме отмечается усиление основного
обмена, повышение температуры тела, развитие сердечной
аритмии и повышение аппетита. Кожные покровы становятся
тёплыми и влажными. Увеличивается нервная возбудимость и
возникает гиперкинезия. Повышение активности симпатической
нервной системы способствует развитию тахикардии,
повышенной потливости и тремора. Может развиваться стенокардия и
сердечная недостаточность. Отмечается появление ретракции
верхнего века (симптом Кохера) и развитие экзофтальма.
При гипертиреоидизме у лиц молодого возраста применяют
антитиреоидныс средства, при рецидивах тиреотоксикоза
выполняют субтотальную резекцию щитовидной железы.
Пациентам старше 40 лет проводят радиоактивную терапию йодом
(I131). При гипертиреозе у пациентов молодого возраста можно
применять длительную радиотерапию (I131) в сочетании с
приёмом карбимазола.
Антитиреоидные средства
Тионамиды содержат активную тиокарбамидную группу
(S = С—Н). Эти соединения угнетают синтез тиреодных
гормонов, подавляя катализируемые каталазой процессы
образования активной формы йода. В результате отмечается
нарушение процессов йодирования тирозина и превращения йодтиро-
зина в дийодтиронин. Вместе с тем, возможно, что тионамиды
оказывают иммуносупрессорное действие (снижают уровень
LATS в крови). Антитиреоидные средства применяют перораль-
но. Препараты накапливаются в щитовидной железе, однако
их действие проявляется не сразу, а после истощения запасов
тиреоидных гормонов в организме (в среднем через 3—4 недели).
Карбимазол в организме быстро превращается в метимазол
(метилмеркаптоимидазол — мерказолил). Препарат
используют с целью создания у больного эутиреоидного состояния, а
затем уменьшенные дозы карбимазола применяют для
поддерживающей терапии. Часто возникает возможность прекратить
лечение через 1-2 года. Побочные эффекты карбимазола
включают появление кожной сыпи, редко развитие агранулоцитоза
(у некоторых пациентов отмечается болезненность при глотании).
При непереносимости пациентами карбимазола используют
пропилтиоурацил. Этот препарат вызывает развитие
агранулоцитоза чаще @,4%), чем карбимазол @,1%). Пропилтиоурацил
не только угнетает синтез тиреоидных гормонов, но также
тормозит превращение Т4 в Тз в периферических тканях и,
возможно, оказывает иммуносупрессорное действие.
Препараты йода. Механизм действия препаратов йода при
гипертиреозе изучен недостаточно. Йодиды угнетают синтез и
высвобождение тиреоидных гормонов (возможно, нарушая
процессы протеолитического расщепления тиреоглобулинов).
Вместе с тем йодиды уменьшают объём и васкуляризацию гиперп-
лазированной щитовидной железы. Препараты йода
применяют для предоперационной подготовки пациентов к тиреоидэк-
томии, а в комбинации с другими средствами — для
купирования тиреотоксического криза (при этом исчезновение тирео-
токсических симптомов наблюдается в течение 2-7 дней).
Препараты йода при гипертиреоидизме нельзя использовать
длительное время, так как в этом случае снижается их антити-
реоидная активность.
р-адреноблокаторы пропранолол (анаприлин) и атенолол
уменьшают частоту сердечных сокращений и выраженность
других проявлений гипертиреоидизма (до их полного устранения
мерказолилом). Их применяют в процессе предоперационной
подготовки к тиреоидэктомии. При тиреотоксическом кризе
пропранолол используют в комбинации с гидрокортизоном,
мерказолилом и препаратами йода.
Гипотиреоидиэм
Наиболее частыми симптомами гипотиреоза являются
чувство усталости и сонливость. К другим проявлениям
заболевания относятся угнетение основного обмена, понижение
аппетита, уменьшение сердечного выброса вплоть до развития
сердечной недостаточности. Характерным признаком гипотиреоза
является сухость кожных покровов. Недостаточность
тиреоидных гормонов в раннем детском возрасте приводит к задержке
умственного и физического развития (кретинизм).
Возникающие изменения носят необратимый характер, поэтому
гипотиреоз необходимо диагностировать как можно раньше и
назначать заместительную терапию тиреоидными гормонами с
самого рождения ребенка.
Заместительная терапия
Препаратом выбора для проведения заместительной
терапии при гипотиреозе является тироксин. Наиболее часто
применяют синтетический тироксин (Т4), который представляет
собой натриевую соль L-тироксина. При его применении
отмечается латентный период, продолжительность которого
определяется временем насыщения тироксином белков плазмы
крови и тканевых рецепторов. Фармакотерапия тиреоидными
гормонами должна проводиться под контролем уровня ТТГ в
плазме крови, так как его содержание в крови нормализуется
при достижении оптимальных доз тироксина.
Лиотиронин является натриевой солью трийодтиронина.
Препарат меньше связывается с белками плазмы крови, поэтому
действует быстрее, чем тироксин. Лиотиронин в основном
применяют внутривенно в комбинации с гидрокортизоном при ги-
потиреоидной (микседематозной) коме.
77
36. Средства, применяемые при сахарном диабете
(антидиабетические средства)
Кдтф-каналы
Препараты
инсулина
КОРОТКОГО ДЕЙСТВИЯ
Растворимый
инсулин
СРЕДНЕЙ
ПРОДОЛЖИТЕЛЬНОСТИ ДЕЙСТВИЯ
Суспензия аморфного
цинк-инсулина
(инсулин-семиленте)
Иэофан-инсулин
Инсулин-ленте
ДЛИТЕЛЬНОГО
ДЕЙСТВИЯ
Инсулин-ультраленте
Потенциал зависимые
Са ^-каналы
Деполяризация
C-клетки
р-клетка
Инсулин — это гормон, секретируемый р-клетками
островков Лангерханса поджелудочной железы (в верхней части
рисунка). Высвобождение инсулина из секреторных гранул р-кле-
ток происходит под влиянием различных стимулов, но в
основном — при увеличении уровня глюкозы в крови (при
гипергликемии). Инсулин связывается со специфическими
рецепторами на мембранах клеток, вызывая целый ряд
биологических эффектов, в том числе, способствуя усвоению глюкозы
клетками мышечной, жировой ткани и гепатоцитами.
При сахарном диабете развивается абсолютная или
относительная недостаточность инсулина в организме, вызывающая
снижение поглощения глюкозы инсулинчувствительными
тканями и другие серьёзные последствия (показаны в нижней
части рисунка). Усиление липолиза и катаболизма белка в
мышечной ткани при сахарном диабете приводит к уменьшению
массы тела и развитию мышечной слабости. Одновременно
отмечается повышение уровня свободных жирных кислот и
глицерина в крови. Избыточное образование в печени ацетил-
коэнзима А (ацетил-КоА) способствует увеличению его
превращения в ацетоуксусную кислоту, которая сначала переходит
в $-гидроксимасляную кислоту, а затем декарбоксилируется до
ацетона. Накопление кетоновых тел в крови приводит к
развитию кетоацидоза. Инсулинзависимый сахарный диабет (тип I),
характеризующийся выраженной недостаточностью инсулина
в организме, отмечается у 25% пациентов. Развитие этой формы
сахарного диабета связано с аутоиммунной деструкцией р-кле-
ток поджелудочной железы, а также с наследственной
предрасположенностью к этому заболеванию (ассоциация с HLA
антигенами). При инсулинзависимом сахарном диабете имеется
склонность к развитию кетоацидоза, при этой форме
заболевания необходимо проведение заместительной инсулинотерапии.
С этой целью используют различные препараты инсулина
(показаны в левой части рисунка) и разные режимы их введения.
Доказано, что раннее применение инсулина при сахарном
диабете может отсрочить или даже предупредить развитие
диабетических осложнений (осложнения сахарного диабета
показаны в нижней части рисунка слева). Этиология ннсулннлезавн-
симого сахарного диабета (тип II) неизвестна, но в его развитии
определённую роль играет наследственная
предрасположенность. При этой форме сахарного диабета отмечается
снижение числа инсулиновых рецепторов и толерантность тканей к
инсулину. Кетоацидоз для этого типа заболевания не характерен.
Развитие инсулин независимо го сахарного диабета часто
связано с ожирением. Снижение массы тела (с помощью диеты и
физической нагрузки) уменьшает резистентность тканей к
инсулину и способствует восстановлению обмена веществ у 1/3
пациентов. При инсулиннезависимом сахарном диабете
наряду с диетическими мероприятиями используют также перораль-
ные противодиабетические средства (показаны в верхней части
рисунка справа). Производные сульфанилмочевины закрывают
78
Глюкоза
Инсулин
Рецепторы
Пероральиые
антидиабетические
средства
Производные
сульфонил мочевины
Глибенкламид
Толбутамид
Глипизид
Бигуаниды
Метформин
Ингибиторы
а-гликоэидазы
Акарбоза
Эффекты инсулина
Мембранные эффекты
Захват глюкозы \
Захват аминокислот \
Внутриклеточные
эффекты
Синтез РНК и ДНК |
Синтез белков |
Гликогенеэ t
Липогенез t
Липолиэ |
Индукция1 клеточного
роста
Осложнения
сахарного диабета
Катаракта
Ретинопатия
Нейропатия
Нефропатия
Атеросклероз
(повышение содержания
в крови свободных
жирных кислот)
Дефицит инсулина
Липолиэ
Свободные жирные кислоты
Кетонемия •
Ацидоз
Кетонурия
Кома и смерть
Жажда и полидипсия
Гипергликемия
Глкжозурия
Полиурия
К+Атф-каналы (в центре рисунка), что приводит к
деполяризации мембран р-клеток поджелудочной железы и повышению
высвобождения инсулина. Представителем новой группы
антидиабетических средств, уменьшающих всасывание глюкозы
из кишечника, является акарбоза (глюкобай). При неэффек-
Инсулин
Инсулин — это полипептидный гормон, состоящий из двух
аминокислотных цепей (А-цепь, состоит из 21 аминокислоты,
а В-цепь, — из 30 аминокислот), связанных дисульфидными
мостиками. Предшественником инсулина является проинсулин,
который в секреторных гранулах р-клеток поджелудочной
железы гидролизуется до инсулина и С-пептида. Инсулин
находится в секреторных гранулах р-клеток в виде кристаллов,
содержащих цинк.
Высвобождение инсулина. Самым сильным стимулятором
высвобождения инсулина из р-клеток поджелудочной железы
является повышение уровня глюкозы в крови, поэтому после
приёма пищи отмечается повышение базальной секреции
инсулина. В мембранах р-клеток имеются К+-каналы,
проницаемость которых регулируется уровнем АТФ в клетке (К*Атф-
каналы, АТФ-зависимые К+-каналы). При повышении
содержания глюкозы в крови увеличивается её поступление в р-клетки
поджелудочной железы, что приводит к повышению
внутриклеточной концентрации АТФ и закрытию К+Атф_каналов. В
результате возникает деполяризация мембран р-клеток — это
способствует увеличению вхождения в клетки Са2+ через по-
тенциалзависимые Са2+-каналы, что в свою очередь приводит
к усилению высвобождения инсулина.
Инсулиновые рецепторы
Инсулиновые рецепторы — это гликопротеины клеточных
мембран, состоящие из двух а- и двух р-субъединиц, ковалентно
связанных дисульфидными мостиками. Инсулин связывается с
а-субъединицами инсулиновых рецепторов, образовавшийся
инсулин -рецепторный комплекс проникает внутрь клеток, где
происходит его разрушение лизосомальными ферментами. При
снижении активности инсулиновых рецепторов (например, при
ожирении) процесс проникновения инсулин-рецепторного
комплекса в клетку может нарушаться, это приводит к
повышению уровня инсулина в крови. Роль образования
инсулин-рецепторного комплекса в механизме действия инсулина не
совсем понятна. Вместе с тем известно, что существенное
значение в механизме действия инсулина имеют процессы фосфо-
рилирования р-субъединиц инсулиновых рецепторов и их ти-
розинкиназная активность.
Препараты инсулина
При сахарном диабете в основном применяют рекомбинан т-
ные человеческие инсулины, получаемые методом генной
инженерии, хотя иногда используют инсулины, выделяемые из
поджелудочных желез коров и свиней. Инсулины вводят в
основном подкожно, абсорбция инсулинов может быть замедлена при
увеличении размеров частиц препарата (т.к. кристаллы
всасываются медленнее, чем аморфные вещества) и использовании
комплексных препаратов инсулина с цинком и протамином. По
продолжительности действия инсулины подразделяются на препараты
короткого, средней продолжительности и длительного действия.
Инсулины короткого действия. Растворимый инсулин (инсулин
для инъекций) представляет собой простой раствор инсулина
(с началом действия через 30 минут, пиком активности через
2—4 часа и продолжительностью действия до 8 часов). Препарат
можно использовать внутривенно при гипергликемической коме,
однако его эффект при этом проявляется только через 30 минут.
Инсулины средней продолжительности и длительного действия.
Продолжительность действия препаратов этой группы
составляет в среднем от 16 до 35 часов. Инсулин-семиленте — это
суспензия аморфного цинк-инсулина. Инсулин-ленте
представляет собой смесь аморфного цинк-инсулина C0%) и
кристаллического цинк-инсулина G0%), за счёт которого значительно
удлиняется действие препарата.
Изофан-ннсулнн является комплексным препаратом инсулина
и протамина. В организме под действием протеолитических
ферментов происходит расщепление протамина, а свободный
инсулин всасывается в кровь. Продолжительность действия изо-
фан-инсулина составляет около 20 часов (также как и
продолжительность действия инсулина-ленте).
тивности пероральных противодиабетических препаратов при
сахарном диабете типа II используют инъекционное введение
инсулина. Обычно необходимость применения инсулина
отмечается у пациентов со сниженной массой тела, у которых
отмечается недостаточность первой фазы инсулинового ответа.
Двухфазные инсулины содержат в своём составе
растворимый инсулин короткого действия C0%) и изофан-инсулин
G0%). Растворимый инсулин обеспечивает быстрое
наступление эффекта, а изофан-инсулин — продолжительное действие.
Инсулин-ультраленте — это суспензия слабо растворимого
кристаллического цинк-инсулина, действующая до 35 часов.
Применение инсулина-ультраленте может привести к
накоплению инсулина и развитию гипогликемии.
Побочные эффекты
Частым и наиболее серьёзным осложнением инсулинотера-
пии является гипогликемия, которая развивается при
передозировке инсулина или при использовании неадекватной диеты. При
этом может развиваться гипогликсмическая кома (может
привести к гибели пациентов). Для устранения опасной для жизни
гипогликемии необходимо введение глюкозы (при гипогликс-
мической коме — внутривенно). Антитела к инсулину, К любым
инсулинам в организме могут вырабатываться антитела (но
наиболее часто к бычьему инсулину). На месте введения препаратов
инсулина возможно появление липодистрофии, развитие
местных аллергических реакций наблюдается достаточно редко.
Режим применения препаратов инсулина. При сахарном
диабете типа I в основном используют подкожное введение 2 раза
в сутки (до завтрака и перед ужином) комбинации инсулинов
короткого и средней продолжительности действия. Наиболее
оптимальным считается снижение уровня глюкозы в крови
почти до нормы (нормогликемии), что позволяет уменьшить
выраженность осложнений сахарного диабета (при этом
используют однократное подкожное введение инсулина средней
продолжительности действия, обеспечивающее поддерживающий
уровень инсулина в крови, и 3-кратное введение инсулина
короткого действия перед приёмами пиши).
Пероральные противодиабетические средства
Производные сульфанилмочевины назначают при инсулинне-
зависимом сахарном диабете пациентам (в основном с
нормальной массой тела), у которых не удастся ликвидировать
гипергликемию только с помощью строгой диеты. Однако эти
препараты не оказывают эффекта у 30% больных.
Производные сульфанилмочевины стимулируют высвобождение
инсулина из р-клеток островков Лангерханса поджелудочной
железы, поэтому они оказывают эффект только при сохранении
активности ^-клеток (хотя бы частичной). При сахарном
диабете (типа II) широко используют глибенкламид (манинил, дао-
нил), который обладает большей активностью, чем бутамид.
При неэффективности глибенкламида другие производные
сульфанилмочевины также не окажут эффекта. Бутамид (толбута-
мид) менее активное сахароснижающее средство, чем
глибенкламид. Препарат оказывает короткое действие, что делает его
применение предпочтительным у пожилых пациентов.
Побочное действие. При использовании производных
сульфанилмочевины иногда отмечаются желудочно-кишечные
расстройства и появление кожной сыпи. При применении
препаратов продолжительного действия (особенно у пациентов
пожилого возраста) могут развиваться гипогликемические
состояния. Производные сульфанилмочевины не применяют при
выраженной гипергликемии (особенно при кетоацидозе и
гипергликемической коме) и сахарном диабете типа I, при которых
используют инсулинотерапию.
Бнгуаниды. Глиформин (метформин) усиливает поглощение
глюкозы тканями, однако механизм этого действия
неизвестен. Препарат не увеличивает высвобождение инсулина,
поэтому редко вызывает развитие гипогликемии. Побочные
эффекты препарата включают тошноту, рвоту, диарею; очень редко
отмечается появление лактоацидоза.
Акарбоза (глюкобай) ингибирует кишечную а-гликозидазу
(фермент, расщепляющий полисахариды до моносахаров), что
приводит к уменьшению всасывания полисахаридов (крахмала
и сахарозы) из кишечника и к снижению уровня глюкозы в
крови. Препарат принимают во время еды. Основным
побочным эффектом акарбозы является усиленное газообразование
в кишечнике.
79
37. Противомикробные средства,
нарушающие синтез нуклеиновых кислот:
сульфаниламиды, триметоприм, хинолоны и нитроимидазолы
ко-тримоксазол
(комбинация
триметоприма
с сульфамето-
ксазолом)
Птеридин
+
р-аминобенэойная кислота
Дигидроптероат-
синтетаза
Триметоприм
/Дигидроптероевая кислота
Дигидрофолат-
редуктаза
Тетрагидрофолиевая кислота
Пурины
Пиримидины
Сульфаниламиды
Сульфадимидин
Сульфадиазин
Сульфамвтоксазол
Хинолоны
Налидиксовая
кислота
Норфлоксацин
Ципрофлоксацин
Метронидазол
Тинидазол
гираза
Свободная ДНК Спиралевидная ДНК
Первыми эффективными средствами для лечения
системных инфекций были сульфаниламиды. Однако в настоящее
время их значение для клиники снизилось, так как были
получены более эффективные и менее токсичные антимикробные
средства. Вместе с тем многие микроорганизмы приобрели
устойчивость (резистентность) к сульфаниламидам. Препараты
этой группы в основном применяют при инфекциях мочевы-
водящих рутей, вызванных чувствительными к
сульфаниламидам грамположительными и грамотрицательными бактериями.
Известно большое количество препаратов из группы
сульфаниламидов (некоторые из них показаны в верхней части
рисунка справа). Эти средства являются структурными
аналогами парааминобензойной кислоты (в верхней части рисунка
слева), которая необходима для синтеза бактериями фолиевой
кислоты. Избирательность антимикробного действия
сульфаниламидов связана с тем, что микроорганизмы (в отличие от
млекопитающих) не обладают способностью использовать готовые
фолаты, а должны синтезировать их сами. Сульфаниламиды,
конкурентно ингибируя дигидроптероатсинтетазу, угнетают
образование фолатов, необходимых для синтеза нуклеиновых
кислот. Сульфаниламиды оказывают бактериостатическое
действие. Наиболее частыми побочными эффектами препаратов
этой группы являются: кожные сыпи, образование кристаллов
в почках и различные нарушения системы крови.
Триметоприм (в нижней части рисунка слева), также как и
сульфаниламиды, влияет на обмен фолатов в микробной
клетке, но он ингибирует дигидрофолатредуктазу, нарушая
образование тетрагидрофолиевой кислоты из дигидрофолиевой.
Триметоприм оказывает избирательное антимикробное действие,
так как его сродство к дигидрофолатредуктаэе бактерий в 50
000 раз сильнее, чем к аналогичному ферменту человека.
Триметоприм широко используют при инфекциях мочевыводящих
путей. Более выраженной антимикробной активностью
обладает комбинированный препарат триметоприма с сульфаметок-
сазолом (бисептол, бактрим, ко-тримоксазол), так как его
компоненты усиливают действие друг друга (препарат показан в
левой части рисунка). Ко-тримоксазол применяют в основном
при инфекционных заболеваниях дыхательных путей.
Производные 4-хииолона (показаны в правой части рисунка)
угнетают ДНК-гиразу (фермент, способствующий скручиванию
бактериальной ДНК в спираль). Считается, что угнетение ДНК-
гиразы приводит к раскручиванию бактериальной ДНК и в
конечном итоге к гибели бактериальной клетки.
Антибактериальным средством широкого спектра действия является
ципрофлоксацин (цифран, ципробай). Важными особенностями
действия производных хинолона являются: хорошее
проникновение в различные ткани и клетки организма, эффективность при
пероральном применении и относительно низкая токсичность.
5-ннтронмидазолы. Метронидазол (в верхней части рисунка
справа) обладает широким спектром антимикробного действия,
препарат активен в отношении неспорообразующих анаэробов
и некоторых патогенных простейших (см. главу 42).
Метронидазол проникает внутрь микробных клеток, где в результате
редукции нитрогрупп под действием редуктаз происходит
образование активных метаболитов, ингибирующих синтез и/или
нарушающих структуру ДНК микроорганизмов.
80
ДНК-
Дигидрофолиевая кислота
Избирательность действия химиотералевтическнх средств»
Использование химиотерапевтических средств с целью
уничтожения в организме человека различных бактерий, паразитов,
вирусов, а также опухолевых клеток называется
«химиотерапией». Химиотерапевтические средства должны оказывать
избирательное действие на возбудителей заболевания и не влиять
на организм человека. Многие антибактериальные средства
обладают относительно низкой токсичностью, так как
биохимические процессы в бактериальных клетках существенно
отличаются от процессов, протекающих в клетках организма
человека. С другой стороны, опухолевые клетки незначительно
отличаются от нормальных клеток организма, поэтому
противоопухолевые средства обладают слабой избирательностью
действия на опухолевые клетки и, как правило, являются высоко
токсичными препаратами (см. главу 43).
Бактерностатнческне средства задерживают рост и
размножение бактерий, а бактерицидные — уничтожают
микроорганизмы. Характер действия антимикробных средств не имеет
особого значения для клиники, так как в конечном итоге при
их применении происходит элиминация бактерий из
организма пациентов. Однако при иммунодефицитах (например, при
СПИДе), при применении глюкокортикоидов, иммунодепрес-
сантов, противоопухолевых препаратов должны
использоваться антимикробные средства только бактерицидного действия.
Резистентность микроорганизмов к противомикробным
средствам может быть первичной и вторичной (приобретённой).
Первичная резистентность бактериальных штаммов отмечает-
ся ещё до применения антибактериальных средств. Например,
бактерии Pseudomonas aeruginosa всегда резистентны к флук-
локсациллину. Наибольшее значение для клиники имеет вто-
ричная резистентность микроорганизмов к антибиотикам,
которая возникает при проведении антимикробной терапии.
Известны следующие механизмы формирования резистентности
микроорганизмов к антибиотикам:
1) выработка микроорганизмами ферментов, разрушающих
антибактериальные средства. Например, стафилококки
продуцируют р-лактамазы, инактивирующие многие препараты из
группы пенициллинов и цефалоспоринов;
2) уменьшение накопления антибактериальных средств в
микробной клетке. Например, резистентность микроорганизмов к
тетрациклинам развивается при уменьшении проницаемости
клеточной стенки бактерий для этих препаратов или при
ускорении их выведения из бактериальной клетки;
3) нарушение процессов связывания антибактериальных средств
с микробной клеткой. Так, например, аминогликозиды и
эритромицин нарушают синтез белка внутри микробных клеток,
связываясь с рибосомами бактерий. При резистентности
микроорганизмов к этим антибиотикам нарушается связь
препаратов с рибосомами, что приводит к снижению их
антимикробной активности;
4) формирование альтернативных путей метаболизма в
микробных клетках. Например, резистентность микроорганизмов
к сульфаниламидам и триметоприму формируется при
выработке ими измененных дигидроптероатсинтетазы и дигидро-
фалатредуктазы, которые практически не чувствительны к
действию этих средств.
Резистентность бактериальных популяций к антибиотикам
может развиваться несколькими путями:
1) путём естественного отбора (селекции). В бактериальной
популяции появляются отдельные микроорганизмы, которые
приобретают резистентность к антибактериальным средствам.
При проведении химиотерапии чувствительные к
антимикробным средствам микроорганизмы уничтожаются, а
нечувствительные (резистентные) напротив быстро размножаются;
2) путём передачи резистентности микроорганизмами. В
микробных клетках имеются гены лекарственной устойчивости,
которые могут передаваться от одного микроорганизма к другому
в составе плазмид. Плазмиды — это внехромосомные молекулы
ДНК в цитоплазме микробных клеток, способные автономно
реплицироваться. Плазмиды могут передаваться от одного мик-
! роорганизма к другому при конъюгации бактерий.
Способностью к конъюгации обладают многие грамотрицательные и грам-
, положительные бактерии. В процессе трансдукции участки ДНК
плазмид передаются от одних микроорганизмов к другим
микробам этого же вида. Этот способ передачи лекарственной
устойчивости является недостаточно эффективным, но он имеет
клиническое значение в формировании антибиотикорезистен-
тных штаммов стафилококков и стрептококков.
Сульфаниламиды
Сульфадимизин (сульфадимидин) и сульфазин (сульфадиазин)
хорошо всасываются при пероральном применении. Эти
препараты можно использовать при «банальных» инфекциях мо-
чевыводящих путей, однако многие штаммы Escherichia coli
являются резистентными к этим препаратам. В настоящее время
известны более эффективные и менее токсичные
антимикробные средства.
Побочные эффекты. Наиболее частыми осложнениями
применения сульфаниламидов являются аллергические реакции, в
том числе кожные сыпи, иногда сопровождающиеся
повышением температуры тела. Редко отмечаются более серьёзные
побочные эффекты — такие, как синдром Стивена-Джонса (одна
из форм мультиформной эритемы, при которой отмечается
высокий уровень смертности пациентов). Плохо растворимые
сульфаниламиды (например, сульфазин) могут вызывать
повреждение почечных канальцев, образуя кристаллы в кислой среде
мочи (кристаллурия). Это осложнение можно предупредить
путём ощелачивания мочи (назначая обильное щелочное
питьё). Кристаллурия не наблюдается при использовании хорошо
растворимых сульфаниламидов (например, сульфаметоксазола).
При применении сульфаниламидов могут развиваться
нарушения системы крови — такие, как агранулоцитоз, апластическая
и гемолитическая анемии (гемолитическая анемия отмечается
при дефиците глюкозо-6-фосфатдегидрогеназы).
Триметоприм хорошо всасывается при пероральном
применении. Препарат эффективен при многих инфекциях нижних
отделов мочевыводящих путей. Иногда триметоприм
используют при инфекционных заболеваниях дыхательных путей,
однако он практически не эффективен в отношении Streptococcus
pneumoniae и Streptococcus pyogenes. Наиболее часто используют
комбинированный препарат триметоприма с сульфометоксазо-
лом (ко-тримоксазол, бисептол, бактрим). Побочные эффекты
ко-тримоксазола типичны для всей группы сульфаниламидов.
Препарат широко применяют при пнеемоцистной пневмонии,
нокардиазе и токсоплазмозе.
Хинолоны
Налиднксовая кислота была первым производным 4-хиноло-
на, обладающим антибактериальной активностью. Препарат
используют только при инфекциях мочевыводящих путей. Цип-
рофлоксацнн (цифран, ципробай) относится к группе фторхи-
нолонов (содержит фтор в 6-м положении хинолонового
кольца), препарат эффективен как против грамположительных, так
и особенно против грамотрицательных бактерий, включая
Escherichia coli, Pseudomonas aeruginosa, сальмонеллу и кампило-
бактер. Резистентные к ципрофлоксацину формы
микроорганизмов встречаются довольно редко. Ципрофлоксацин хорошо
всасывается при пероральном применении, его можно
использовать также внутривенно. Выделяется в основном в
неизменном виде почками. Побочные эффекты отмечаются достаточно
редко, они включают: тошноту, рвоту, кожные сыпи,
головокружение и головную боль. Иногда могут наблюдаться
судороги, так как хинолоны являются антагонистами ГАМК. Норф-
локсацин применяют при инфекциях мочевыводящих путей, так
как он концентрируется в моче. Системной
антибактериальной активности препарат не имеет.
5-нитроимидазолы
Метронидазол хорошо всасывается при пероральном
применении, его также можно использовать внутривенно. Препарат
активен против большинства анаэробов, включая бактериоды.
Метронидазол является препаратом выбора при некоторых про-
тозойных инфекциях (например, при амёбной дизентерии, лям-
блиозе, трихомонозе; см. главу 42). Основными побочными
эффектами препарата являются желудочно-кишечные
расстройства. Сходным, но более продолжительным действием обладает
тинидаэол (фасижин).
81
38. Противомикробные средства,
угнетающие синтез белков клеточной стенки бактерий:
пенициллины, цефалоспорины и ванкомицин
Бвнзилпенициллин
Бензилпенициллина
новокаиновая соль
Феноксиметилпе-
нициллин
УСТОЙЧИВЫЕ К ДЕЙСТВИЮ
ПЕНИЦИЛЛИНАЗЫ
Метициллин
Флуклоксациллин
ШИРОКОГО СПЕКТРА
Амоксициллин
Ампициллин
АНТИСИНЕГНОЙНЫЕ
Пипврациллин
Азлоциллин
Тикарциллин
Цефалоспорины
ДЛЯ ПЕРОРАЛЬНОГО
ПРИМЕНЕНИЯ
Цвфадроксил
ДЛЯ ПАРЕНТЕРАЛЬНОГО
ПРИМЕНЕНИЯ
Цефуроксим
ШИРОКОГО СПЕКТРА
ДЕЙСТВИЯ
Цефтазидим
Цефтриаксон
Многие другие
Ванкомицин
Тейкопланин
, В структуре пенициллинов (вверху рисунка слева) и цефа-
лоспоринов (вверху рисунка справа) имеется р-лактамное
кольцо, с которым связана их противомикробная активность.
Модификация группировок R] и R2 в структуре р-лактамов
позволяет получить различные полусинтетические антибиотики,
некоторые из которых являются кислотоустойчивыми (и потому
активны при пероральном применении), имеют широкий спектр
антибактериального действия и не разрушаются р-лактамазами
бактерий. Пенициллины (показаны в левой части рисунка)
являются антибиотиками основного ряда; цефалоспорины
(показаны в правой части рисунка) имеют специальные
показания к применению. Все р-лактамные антибиотики обладают
бактерицидным действием. Механизм антимикробного действия
этих препаратов связан с нарушением синтеза клеточной
стенки микроорганизмов, р-лактамные антибиотики
препятствуют образованию связей между полимерными цепями
пептидогликанов с помощью пентаглициновых мостиков (на
рисунке показаны в виде •), так как часть их структуры
напоминает D-аланил-D-аланин-пептидную цепь клеточной стенки
бактерий.
Первым препаратом из группы пенициллинов был бензил-
пенициллин, который не потерял клинического значения и
сегодня. Бензилпенициллин разрушается соляной кислотой
желудка, поэтому его применяют инъекционно. Феноксиметилпе-
ннциллин обладает сходным с бензилпенициллином спектром
антимикробной активности, но сохраняет активность и при
пероральном применении. Многие микроорганизмы, в том
числе большое количество стафилококков, являются
резистентными к пенициллинам, так как они продуцируют ферменты
(р-лактамазу, пенициллиназу), разрушающие р-лактамное
кольцо антибиотиков. Способность продуцировать р-лактамазы
передаётся от одних микроорганизмов к другим с помощью плаз-
мид (см. главу 37). Некоторые пенициллины (например,
флуклоксациллин) активны в отношении стафилококков,
продуцирующих Р-лактамазы. Многие пенициллины не влияют на гра-
мотрицательные бактерии, так как плохо проникают через поры
в их наружной фосфолипидной оболочке (грамположительные
микроорганизмы этой оболочки не имеют). Пенициллины
широкого спектра действия (например, амоксициллин и
ампициллин) более гидрофильны, чем бензилпенициллин, поэтому легче
проникают через эти поры и являются активными в
отношении некоторых грамотрицательных бактерий. Амоксициллин и
ампициллин не влияют на микроорганизмы, вырабатывающие
пенициллиназу. Антисинегнойные пенициллины используют в
основном при тяжёлых инфекциях, вызванных Pseudomonas
aeruginosa (в нижней части рисунка слева).
Пенициллины обладают низкой токсичностью, однако в
высоких концентрациях в организме (при почечной
недостаточности, неправильном их применении) могут вызвать развитие
энцефалопатии, которая может быть смертельной. Наиболее
существенными побочными эффектами пенициллинов
являются аллергические реакции, которые чаще проявляются в виде
крапивницы, редко развитием анафилактического шока (в 10%
случаев со смертельным исходом).
82
р-лактамы
N-ацетилмураминовая кислота
Транспептидаза
Полимерные цепи
пелтидогликанов
Пентаглициновый мостик
Связь между
полимерными целями
Пенициллины
Бензилпенициллии (натриевая и калиевая соли)
по-прежнему является одним из наиболее широко применяемых
антибиотиков. Препарат имеет ограниченный спектр антимикробной
активности, влияя в основном на грамположительные
бактерии. Бензилпенициллии применяют при инфекциях,
вызванных пневмококками, стрептококками, менингококками и леп-
тоспирами. Препарат также используют для профилактики
газовой анаэробной гангрены, вызываемой клостридиями.
Большинство Staphylococcus aureus не чувствительны к бензилпени-
циллину, так как продуцируют пенициллиназу.
Бензилпенициллии является кислотонеустойчивым антибиотиком, поэтому
плохо всасывается при пероральном применении.
Бензилпенициллии обычно применяют внутримышечно, однако его
внутримышечные инъекции болезненны, поэтому при
необходимости введения больших доз его используют внутривенно.
Бензилпенициллии хорошо проникает в различные ткани
организма, но не проходит через гематоэнцефалический барьер
(проходит только при менингите, когда проницаемость этого барьера
повышается). После внутримышечного введения бензилпени-
циллина максимальная концентрация препарата в плазме
крови отмечается через 15-30 минут, затем препарат быстро экск-
ретируется почками в основном в неизменном виде. Период
полуэлиминации (t^) бензилпенициллина составляет в
среднем 30 минут, однако при анурии может возрастать до 10
часов. Органические кислоты (например, пробенецид) могут ин-
гибировать секрецию пенициллина в канальцах почек, что
приводит к сохранению высокой концентрации препарата в
плазме крови в течение длительного времени.
Бензилпенициллина новокаиновая соль — это плохо
растворимая соль бензилпенициллина, оказывающая
продолжительное действие. Препарат вводят внутримышечно.
Бензилпенициллина новокаиновая соль входит в состав бициллина —
пенициллина длительного действия, который применяют при
сифилисе.
Феноксиметнлпеницнллин имеет такой же спектр
антимикробного действия, как и бензилпенициллии, но является менее
активным антибиотиком. Препарат кислотоустойчив, поэтому
его применяют перорально. Однако всасывание феноксимети-
пенициллина из кишечника вариабельно. Феноксиметилпени-
циллин применяют только при инфекциях, вызванных высоко
чувствительными к препарату микроорганизмами, при
необходимости быстрого достижения антимикробного эффекта
(например, при стрептококковом тонзиллите).
Феноксиметилпенициллин используют также для противорецидивного лечения
ревматизма.
Пенициллиназоустойчивые пенициллины (например, флуклок-
сацнллнн). Флуклоксациллин применяют при инфекциях,
вызванных пенициллин-резистентными стафилококкоками,
продуцирующими пенициллиназу (они составляют около 90%
госпитальных стафилококковых инфекций). Этот
полусинтетический пенициллин устойчив к действию пенициллиназы, так как
его изоксазоловая группа в положении R\ р-лактамного кольца
препятствует доступу этого фермента к кольцу антибиотика.
Флуклоксациллин обладает менее выраженной антимикробной
активностью, чем бензилпенициллии. Препарат хорошо
всасывается при пероральном применении. При тяжёлых
инфекциях флуклоксациллин вводят инъекционно в сочетании с
другими антибиотиками. Некоторые штаммы Staphylococcus aureus
(золотистого стафилококка) резистентны к метициллину, флук-
локсациллину и другим антибиотикам. Лечение инфекций
(особенно внутрибольничных), вызванных антибиотикорезистент-
ными стафилококками, является серьёзной проблемой
современной химиотерапии. При этих инфекциях наиболее
эффективным является внутривенное введение ванкомицина.
Пенициллины широкого спектра действия. Ампициллин и амок-
сяцнллин активны в отношении не продуцирующих р-лактамазы
грамположительных бактерий, а также в отношении
неотрицательных бактерий (некоторых штаммов Escherichia coli,
Haemophilus influenzae и Salmonella), Препаратом выбора для
перорального применения является амоксициллин, так как он
лучше всасывается из кишечника, чем ампициллин, который
более рационально использовать парентерально.
Амоксициллин и ампициллин инактивируются пенициллиназой,
продуцируемой некоторыми видами бактерий. К амоксициллину не
чувствительны большинство штаммов Staphylococcus aureus, 50%
штаммов Escherichia coli и до 15% штаммов Haemophilus influenzae.
р-лактамазы многих бактерий ингибирует клавулановая
кислота. Комбинированный препарат амоксициллина с клавулановой
кислотой (амоксиклав) активен в отношении пенициллиназоп-
родуцирующих бактерий. Амоксиклав применяют при
инфекциях дыхательных и мочевыводящих путей, при
неэффективности монотерапии амоксициллином.
Антисинегнойные (антипсевдомонадные) пенициллины. Пипе-
рацнллин, азлоциллин, тикарциллин используют инъекционно
при инфекциях, вызванных неотрицательными бактериями,
особенно Pseudomonas aeruginosa (при синегнойной инфекции).
В комбинации с аминогликозидами антисинегнойные
пенициллины применяют при тяжёлых инфекциях не
установленной этиологии (например, при септицемии, септическом
эндокардите).
Цефалоспорины
Цефалоспорины применяют при менингите, пневмонии,
септицемии. Цефалоспорины обладают сходным с пенициллина-
ми механизмом антимикробного действия и похожей фарма-
кокинетикой. Они могут вызывать развитие аллергических
реакций, к ним возможна перекрёстная с пенициллинами
резистентность микроорганизмов. Они экскретируются в основном
почками и их действие может быть продлено пробенецидом.
Цефалоспорины обладают широким спектром
антибактериальной активности, хотя отдельные препараты этой группы имеют
различную активность в отношении определённых бактерий.
Цефадроксил применяют перорально при инфекциях
мочевыводящих путей, резистентных к действию других
антибиотиков. Цефуроксим используют инъекционно (в комбинации с
метронидазолом) для профилактики анаэробной инфекции в
клинике интенсивной терапии. Цефуроксим используют при
тяжёлых инфекциях, устойчивых к действию других
антибиотиков, так как этот препарат не разрушается р-лактамазами.
Цефтазидим эффективен в отношении многих грамотрицательных
микроорганизмов (в том числе Pseudomonas aeruginosa), менее
активен в отношении грамположительных бактерий (например,
Staphylococcus aureus). Цефтазидим хорошо проникает через
гематоэнцефалический барьер, поэтому его используют при
менингите, вызванном грамотрицательными бактериями. Цефт-
рнаксон имеет более длительный период полуэлиминации, чем
другие цефалоспорины, поэтому его применяют один раз в день.
Ванкомицин
Ванкомицин обладает бактерицидным действием в
отношении большинства грамположительных микроорганизмов.
Препарат угнетает образование пептидогликанов в микробной
стенке. Ванкомицин не всасывается при пероральном применении,
внутривенное введение препарата используют при септицемии
и септическом эндокардите, вызванных метициллин-резистен-
тными штаммами Staphylococcus aureus (золотистого
стафилококка). Ванкомицин является препаратом выбора (при
пероральном применении) при псевдомембранозном колите,
являющемся серьёзным осложнением антибиотикотерапии
(возникает вследствие повреждения слизистой кишечника токсинами,
вырабатываемыми Clostridium difficile, при кишечной
суперинфекции). Ванкомицин иногда может оказывать нежелательное
действие на почки и вызывать снижение слуха.
83
39. Противомикробные средства,
угнетающие синтез белка внутри микробной клетки:
аминогликозиды, тетрациклины, макролиды и левомицетины
Тетрациклин
Миноциклин
Доксициклин
Угнетение связывания
тРНК с А-участками
Р-участок
Доставка аминоацил-тРНК
Нарушение считывания
кода мРНК
Аминогликозиды
Гвнтамицин
Нвтилмицин
Тобрамицин
Амикацин
Стрептомицин
Неомицин
Транспептидация
Транслокация
Угнетение
пептидилтрансферазы
Левомицетин
Свободный А-участок
Макролиды
Эритромицин
Кларитромицин
Азитромицин
Аминогликозиды, тетрациклины, макролиды и
левомицетины угнетают синтез белка внутри микробных клеток.
Избирательность антимикробного действия этих антибиотиков
связана с тем, что рибосомы бактерий (на них происходит синтез
белка) состоят из SOS- и 308-субъединиц, тогда как рибосомы
млекопитающих — из 60S- и 408-субъединиц.
Белки синтезируются из аминокислот на рибосомах (в
центре рисунка), которые движутся A-2-3) вдоль матричной
рибонуклеиновой кислоты (мРНК,) таким образом, что
инициирующие кодоны мРНК (на рисунке показаны в виде Ш)
проходят через акцептор (аминоацильный участок, А-участок
рибосом), к которому присоединяется соответствующая тРНК,
несущая следующую аминокислоту (¦), необходимую для
удлинения пептидной цепи. Тетрациклины (в левой части
рисунка сверху) и аминогликозиды (в левой части рисунка внизу)
присоединяются к 308-субъединицам бактериальных рибосом и
ынгибыруют связывание аминоацил-тРНК с А-участками.
Аминогликозиды также нарушают процессы считывания кода мРНК,
что приводит к синтезу функционально неактивных белков.
Следующим этапом синтеза белка является транспептидация B),
когда растущие аминокислотные цепи (на рисунке показано в
виде -ОСЬ), присоединенные к Р-участкам (пептидильным
участкам) рибосом, переносятся в А-участки к аминокислотам
(¦)> соединенным с т-РНК (аминоацил-тРНК). Левомицетин
(хлорамфеникол) (в правой части рисунка) нарушает этот
процесс, ингибируя пептидилтрансферазу в 508-субъединице
рибосом. На следующем этапе происходит транслокация
аминокислотной цепи из А-участка рибосом в Р-участок C)» а с
освободившимся А-участком связывается новая аминоацил-
тРНК. Макролиды (в правой части рисунка) связываются с 50S-
субъединицей бактериальных рибосом и ингибируют процесс
транслокации.
Аминогликозиды (например, гентамицин) вводят
парентерально. Эти антибиотики особенно эффективны при тяжёлых
инфекциях, однако они оказывают нефротоксическое и ототок-
сическое действие. Тетрациклины применяют в основном пе-
рорально, они обладают широким спектром антимикробного
действия, однако к тетрациклинам резистентно большое
количество микроорганизмов, что существенно снижает их
эффективность. Спектр антимикробного действия макролидов
(например, эритромицина) напоминает спектр действия бензилпени-
циллина. К эритромицину наиболее чувствительны грамполо-
жительные бактерии, так как в них накапливается в 100 раз
больше антибиотика, чем в грамотрицатсльных
микроорганизмах. Левомицетин обладает широким спектром
антимикробного действия, однако его использование ограничивают
серьёзные побочные эффекты (например, апластическая анемия).
84
Татра циклины
А-участок
тРНК
Высвобождение
тРНК
Угнетение
транслокации
Аминогликозиды
Аминоглнкозцды при пероральном применении из
кишечника не всасываются, поэтому их вводят инъекционно. Эти
антибиотики оказывают бактерицидное действие, но являются
высоко токсичными препаратами, так как имеют низкий химио-
терапевтический индекс.
Аминогликозиды выводятся из организма через почки,
поэтому при почечной недостаточности возрастает риск развития
их токсического действия. Основными побочными эффектами
аминогликозидов являются повреждение VIII пары черепно-
мозговых нервов (ототоксическое действие) и поражение почек
(нефротоксическое действие). Выраженность нежелательных
эффектов аминогликозидов зависит от их дозы, поэтому при
длительном применении этих антибиотиков необходимо
определять их уровень в крови. Аминогликозиды могут нарушать
нервно-мышечную проводимость, поэтому они
противопоказаны при миастении.
Существует несколько механизмов развития резистентности
микроорганизмов к аминогликозидам. Основным механизмом
развития устойчивости бактерий к аминогликозидам является
продукция ферментов (способность продуцировать эти
ферменты передается от одних микроорганизмов к другим с помощью
плазмид), инактивирующих эти антибиотики путём ацетилиро-
вания, фосфорилирования или аденилирования. К другим
механизмам микробной резистентности к аминогликозидам
относятся: нарушение проницаемости клеточной стенки бактерий
для аминогликозидов и изменения акцепторов на ЗОБ-субъе-
динице рибосом, что приводит к нарушению связывания
антибиотиков с рибосомами (характерно только для стрептомицина).
Основным препаратом из группы аминогликозидов является
гентамицин. Этот антибиотик применяют в основном при
тяжёлых внутрибольничных инфекциях, вызванных грамотрицатель-
ными микроорганизмами (например, Pseudomanas aeruginosa).
Гентамицин в комбинации с пенициллинами или ванкомици-
ном применяют при стрептококковом эндокардите, так как он
является синергистом этих антибиотиков. При тяжёлых
инфекциях, вызванных грамотрицательной микрофлорой, не
чувствительной к гентамицину, используют амикацин, который в
меньшей степени, чем гентамицин, разрушается ферментами
бактерий. Нетилмиции является менее токсичным антибиотиком, чем
гентамицин. Стрептомицин активен в отношении Mycobacterium
tuberculosis (возбудителя туберкулёза). Однако в настоящее
время при туберкулёзе чаще используют рифампицин в
комбинации с другими противотуберкулёзными средствами (например,
с изониазидом, пиразинамидом, этамбутолом). Стрептомицин
оказывает дозозависимое ототоксическое действие (вызывает
глухоту). Неомицин используют местно при кожных
инфекциях и перорально для подавления кишечной микрофлоры перед
операциями на кишечнике, для парентерального введения
препарат не используют, так как он слишком токсичен.
Макролиды
Макролиды применяют в основном перорально, при
необходимости эритромицин и кларитромицин (клацид) можно
вводить внутривенно. По спектру антимикробного действия
макролиды напоминают бензилпенициллин (спектр их
антимикробного действия ограничен, препараты активны в основном в
отношении грамположительных микроорганизмов).
Макролиды используют в качестве антибиотиков резерва при
непереносимости пенициллинов, особенно при инфекциях, вызванных
стрептококками, пневмококками и клостридиями. Макролиды
не эффективны при менингите, так как плохо проникают
через гематоэнцефалический барьер. В отличие от пенициллинов
макролиды активны в отношении хламидий и риккетсий. Эти
антибиотики особенно показаны при микоплазменной
пневмонии и болезни легионеров. Развитие резистентности
микроорганизмов к макролидам связано с изменениями структуры
рецепторов на SOS-субъединицах бактериальных рибосом, что
нарушает связывание антибиотика с рибосомами
бактериальных клеток (передача вторичной резистентности к макролидам
осуществляется с помощью плазмид).
Эритромицин метаболизируется в печени. При почечной
недостаточности дозы эритромицина необходимо снижать в
целях предупреждения развития осложнений. Макролиды
достаточно безопасные антимикробные средства. Применение эрит-
римицина в высоких дозах может привести к появлению
тошноты и рвоты, тогда как при использовании азитромицина и
кларитромицина эти побочные эффекты отмечаются гораздо
реже. Азитромицин имеет длительный период
полуэлиминации (t|/2«40—60 часов). Однократное введение этого
антибиотика эффективно при уретрите, вызванном хламидиями, тогда
как продолжительность применения тетрациклинов при хла-
мидиозе составляет 7 дней. Макролиды ингибируют цитохром
Р-450, поэтому замедляют разрушение и вызывают повышение
уровня варфарина, терфенадина и астемизола в плазме крови.
Тетрациклины
Тетрациклины используют в основном перорально, но их
можно вводить также инъекционно. Интенсивность
всасывания тетрациклинов из желудочно-кишечного тракта широко
варьирует. Так, например, всасывание этих антибиотиков из
кишечника уменьшается в присутствии ионов Са2+
(содержатся в молоке), магния, железа и пищи. Тетрациклины являются
антибиотиками широкого спектра действия, однако в
настоящее время при большинстве инфекций используют более
эффективные проти во микробные средства. Тетрациклины
применяют в основном при инфекциях, вызванных
внутриклеточными микроорганизмами, например, при хламидиозе
(неспецифический уретрит, трахома) и риккетсиозе (лихорадка Ку).
Тетрациклины проникают внутрь микробных клеток,
чувствительных к этим антибиотикам, путём пассивной диффузии и
частично за счёт активного транспорта. В клетки резистентных
микроорганизмов тетрациклины не проникают. Широкое
применение тетрациклинов привело к появлению (путём
селекции) большого количества резистентных к этим антибиотикам
штаммов стрептококков, стафилококков, пневмококков и ко-
либактерий. Гены устойчивости к тетрациклинам передаются
от одних микроорганизмов к другим с помощью плазмид. К
тетрациклинам часто резистентны микроорганизмы,
устойчивые и к другим антибактериальным средствам (например,
сульфаниламидам, аминогликозидам, левомицетину). Длительное
применение тетрациклинов может привести к изменению
цвета зубной эмали у молодых людей. Тетрациклины не следует
назначать детям до 8 лет, беременным женщинам и кормящим
матерям. При использовании тетрациклинов могут отмечаться
тошнота и диарея. Иногда применение тетрациклинов
приводит к развитию кандидамикоза (в том числе кандидамикозного
стоматита).
Левомицетины
Левомицетин (хлорамфеникол) обычно применяют
перорально, иногда — внутривенно. Это антибиотик широкого спектра
действия. Левомицетин может вызывать серьёзные побочные
эффекты, включая аплазию костного мозга A на 40 000,
обычно со смертельным исходом), обратимое (дозозависимое)
угнетение эритро- и лейкопоэза, энцефалопатию, неврит
зрительного нерва, что ограничивает его клиническое применение.
Препарат используют при системном сальмонеллсзе
(тифоидной лихорадке) и менингите, вызванном Haemophilus influenzae.
Левомицетин хорошо проникает в различные ткани организма,
в том числе проходит через гематоэнцефалический барьер,
метаболизируется в печени. Левомицетин угнетает метаболизм
некоторых лекарственных средств, усиливая действие дифени-
на, варфарина и производных сульфонилмочевины. При
длительном применении левомицетина в высоких дозах необходимо
периодически проводить подсчёт числа клеток крови
(особенно у новорожденных и пациентов с почечной
недостаточностью). В организме новорожденных левомицетин не
метаболизируется, вследствие чего возможна его кумуляция с развитием
синдрома «серого ребёнка», характеризующегося бледностью
кожных покровов, вздутием живота, рвотой и падением
артериального давления.
65
40. Противогрибковые и противовирусные средства
Противогрибковь
средства
ПОЛИЕНОВЫ& - -
АНТИБИОТИКИ*'
Амфотерицин
Нистатин
ПРОИЗВОДНЫЕ
ИМИДАЗОЛА
Миконазол
Кетоконаэол
Клотримазол
ПРОИЗВОДНЫЕ
ТРИАЗОЛА
Флуконазол
Интраконазол
Гризеофульвин
Флуцитозин
ДНК
Фторурацил
Флуцитоэин
Синтез структурных
белков
Скопление вирусных
частиц и их
высвобождение
Противовирусные
средстве
УГНЕТАЮЩИЕ
ПРОНИКНОВЕНИЕ ВИРУСА В КЛЕТКУ
Амантадин
у-глобулин
УГНЕТАЮЩИЕ СИНТЕЗ
НУКЛЕИНОВЫХ КИСЛОТ
Ацикловир
Ганцикловир
Идоксуридии
Трибавирин
Фоскарнет
Зидовудин
ИНГИБИТОРЫ
ВИЧ-ПРОТЕАЗЫ
Сахинавир
Ритонавир
Грибковые инфекции (микозы) могут быть
поверхностными или системными. Системные микозы обычно развиваются
при различных приобретенных иммунодефицитах (например,
при СПИДе, при проведении противоопухолевой и глюкокор-
тикоидной терапии). В настоящее время существует
небольшое количество эффективных противогрибковых средств
(показаны в левой части рисунка). Препаратом выбора при
тяжёлых формах системных микозов (опасных для жизни) является
высоко токсичный полиеновый антибиотик амфотерицин.
Амфотерицин взаимодействует (на рисунке показано в виде ¦¦)
с эргостеролом (Е), входящим в состав мембран грибковых
клеток, в результате чего в них образуются поры, через
которые происходит потеря содержимого грибковых клеток (/~V>).
Амфотерицин оказывает избирательное противогрибковое
действие, так как в клетках человека основным стероидом
является холестерин, а не эргостерол, как в грибковых клетках.
Флуцитозин — это менее токсичное, чем амфотерицин,
противогрибковое средство. Однако этот препарат обладает
ограниченным спектром противогрибковой активности, и к нему быстро
развивается резистентность грибков. Флуцитозин в грибковых
клетках (но не в клетках человека) превращается во
фторурацил (Э), который угнетает синтез грибковой ДНК (см. главу
43). Производные имидазола (на рисунке слева) обладают
широким спектром противогрибкового действия, их используют в
основном местно. Механизм противогрибкового действия ими-
дазолов связан с угнетением синтеза эргостерола в мембранах
грибковых клеток. Производные триазола — это новые
противогрибковые средства, имеющие структурное сходство с ими-
дазолами, но обладающие более широким спектром
противогрибкового действия. Триазолы оказывают меньше
побочных эффектов, так как избирательно угнетают ланостерол-
а-деметилазу, что приводит к нарушению синтеза эргостерола.
При некоторых формах грибковых заболеваний кожи и
особенно ногтей в течение нескольких месяцев перорально
применяют гризеофульвин. Механизм противогрибкового действия
гризеофульвина связан с его взаимодействием с микротубуляр-
ной системой грибковых клеток.
Вирусы — это внутриклеточные паразиты, которые не
имеют независимого метаболизма и могут размножаться только в
живых клетках хозяина. Так как процессы репликации вирусов
тесно связаны с метаболизмом клеток хозяина, то очень
сложно создать лекарственные средства, оказывающие
избирательное противовирусное действие. Поэтому основой борьбы с
вирусными инфекциями (например, с полиомиелитом, оспой,
жёлтой лихорадкой, корью, паротитом, коревой краснухой)
является вакцинация. Вместе с тем в настоящее время
синтезировано небольшое количество эффективных
противовирусных средств (в правой части рисунка), но их использование в
клинике весьма ограничено. Некоторые из них применяют при
тяжёлых вирусных заболеваниях (например, при
герпетической инфекции). Репликация вирусов осуществляется в
несколько этапов (показано в правой части рисунка). Проникновение
вирусов в клетки угнетают амантадин (мидантан) и у-глобулин,
большинство противовирусных средств (в правой части
рисунка в центре) нарушают синтез нуклеиновых кислот вирусов (и
достаточно часто нуклеиновых кислот человека), так как
являются аналогами нуклеозидов. Новые противовирусные средства,
особенно ацикловир (один из наиболее часто используемых
препаратов), оказывают относительно избирательное
противовирусное действие, так как становятся активными только после
их фосфорилирования преимущественно вирусными
ферментами. Зидовудин, диданозии и зальцитабин являются высоко
токсичными противовирусными средствами для лечения СПИДа.
Однако к этим средствам быстро развивается резистентность
вирусов иммунодефицита, поэтому необходима срочная
разработка новых эффективных противовирусных препаратов. При
репликации вируса иммунодефицита человека (ВИЧ) под
влиянием протеазы происходит превращение полипептидных
предшественников в зрелые вирусоспецифические белки (одним из
таких белков-ферментов является обратная транскриптаза).
Ингибиторы «ВИЧ протеазы» (показаны в правой части рисунка
снизу) угнетают репликацию вируса иммунодефицита
человека in vitro, в комбинации с другими противовирусными
средствами (например, азидотимидином) дают весьма
обнадеживающие результаты при СПИДе. Противовирусным действием
обладает лейкоцитарный а-интерферон, который в настоящее
время может быть получен рекомбинантным путём. Его
применяют внутримышечно при хроническом персистирующем
гепатите В и С.
86
Синтез неструктурных
белков
Синтез РНК и ДНК
Грибковые инфекции
Известно три группы грибков, патогенных для человека.
1. Плесени (филаментные грибы) растут как длинные фила-
менты и образуют мицелий. Примерами этих грибков
являются дерматофиты и Aspergillus fumigatus. Дерматофиты получили
своё название за способность переваривать кератин. Они
вызывают поражение кожи, нопс*!. волос. Aspergillus fumigatus
вызывают легочный и диссеминированный аспергиллёз.
2. Истинные дрожжевые грибки — это грибки круглой и
овальной формы. К ним относятся, например, Ctyptococcus
neoformans, которые могут вызывать развитие менингита и
пневмонии (обычно при иммунодефицитах).
3. Дрожжеподобные грибки похожи на дрожжевые, но могут
образовывать длинные, не ветвящиеся филаменты.
Наибольшее значение имеют Candida albicans, которые являются
естественными комменсалами и находятся в кишечнике, ротовой
полости, влагалище. Эти грибки вызывают стоматиты,
вагиниты, эндокардиты и септицемию (часто с фатальным исходом).
Полиеновые антибиотики
Амфотерицнн обладает широким спектром
противогрибковой активности, его используют при потенциально опасных
(часто фатальных) системных инфекциях, вызванных Aspergillus,
Candida ablicans, Cryptococcus neoformans. Препарат плохо
всасывается при пероральном применении, поэтому его вводят
внутривенно или эндолюмбально (при грибковом поражении
центральной нервной системы). При применении препарата
часто отмечаются побочные эффекты: повышение
температуры тела, озноб и тошнота. При длительном использовании ам-
фотерицина развивается поражение почек, которое обратимо,
если замечено в ранней стадии. Нистатин высоко токсичен при
парентеральном введении. Препарат используют при кандидо-
микозе кожи (в виде крема и мази) и слизистых (леденцы,
вагинальные суппозитории). Кандидоз слизистой полости рта и
глотки является одним из наиболее частых симптомов СПИДа,
а также проявлением дисбактериоза при применении
антибиотиков широкого спектра действия, противоопухолевой и глю-
кокортикоидной терапии.
Флуцитоэин
Флуцитозин применяют перорально и внутривенно.
Препарат активен только в отношении дрожжевых грибков, его
используют при системном кандидозе и криптококковых
инфекциях. К флуцитозину часто развивается толерантность
грибков, поэтому его комбинируют с амфотерицином. Флуцитозин
и амфотерицин являются синергистами; их комбинация
эффективна при криптококковом менингите.
Производные имидаэоло
Производные имидазола являются противогрибковыми
средствами широкого спектра действия. Резистентность грибков к
препаратам этой группы развивается очень редко.
Производные имидазола плохо всасываются из кишечника при
пероральном применении (исключение — кетоконазол). Клотрима-
зол, эконазол, миконазол используют местно при дерматомико-
зах и кандидозе кожи и слизистых оболочек. Миконазол вводят
внутривенно при системных микозах при непереносимости
пациентами амфотерицина. Применение миконазола может
привести к развитию тошноты, рвоты, обморока и
анафилаксии. Кетоконазол хорошо всасывается при пероральном
применении, его используют при местных и системных микозах.
Популярность препарата снизилась, так как было обнаружено,
что он может вызывать некроз печени и угнетение функции
надпочечников.
Производные триазола
Флуконазап применяют перорально и внутривенно при
различных формах поверхностных и системных микозов (но не
при аспергиллёзе). В отличие от кетоконазола флуконазол не
обладает гепатотоксичностью и не угнетает синтез стероидов в
надпочечниках. Итраконазол хорошо всасывается при
пероральном применении, эффективен при аспергиллёзе (в отличие от
имидазолов и флуконазола).
Противовирусные средства
Средства, угнетающие проникновение вируса в клетки
Амантадин (мидантан) иногда применяют для
профилактики гриппа А. Основным недостатком препарата является узкий
спектр его противовирусного действия. Для профилактики
гриппа более эффективным является использование
противогриппозной вакцины.
^-глобулин. Среди человеческих иммуноглобулинов
имеются специфические антитела против поверхностных антигенов
вирусов, которые препятствуют проникновению вируса в
клетки хозяина. Инъекционное введение у глобулина используют
для профилактики гепатита А.
Средства, угнетающие синтез нуклеиновых кислот вируса
Ацикловир (ациклогуанозин, зовиракс). Вирусы герпеса
(например, Herpes simplex и Varicella zoster) содержат тимидинки-
назу, которая метаболизирует ацикловир в ациклогуанозин
монофосфат, который затем последовательно фосфорилируется
ферментами клеток хозяина в ациклогуанозинтрифосфат. Ацик-
логуанозинтрифосфат в свою очередь угнетает вирусную ДНК-
пол имеразу и нарушает синтез вирусной ДНК. Избирательность
противовирусного действия ацикловира связана с тем, что
вирусная тимидинкиназа быстрее клеточной связывается с ацик-
ловиром, а сродство ацикловира к вирусной ДНК-полимсразе
гораздо выше, чем к аналогичному ферменту человека.
Ацикловир активен в отношении вируса герпеса, но он не вызывает
полного удаления его из организма. Препарат вводят внутрь,
парентерально и местно, что зависит от локализации и тяжести
вирусной инфекции. Ацикловир широко используют при ге-
нитальном герпесе (вызванном Herpes simplex), а в высоких
дозах — при опоясывающем лишае (вызванном Varicella zoster).
Эффективным препаратом для лечения герпетической
инфекции является также идоксурндин (керецид). Препарат
применяют только местно при герпетическом поражении кожи, глаз и
гениталий. Идоксуридин является высоко токсичным
препаратом, поэтому чаще используют другие противовирусные
средства.
Ганцикловир применяют внутривенно. Из-за высокой
токсичности (вызывает нейтропению) препарат используют
только при тяжелой цитомегаловирусной (ЦМВ) инфекции.
Ацикловир при цитомегаловирусной инфекции не эффективен, так
как ЦМВ не продуцирует тимидинкиназу, активирующую
ацикловир.
Трибавирин (рибавирин) эффективен при лихорадке Ласса,
тяжёлой аденовирусной инфекции.
Зидовудин (З-азидо-3-диокситимидин, азидотимидин)
активен в отношении вируса иммунодефицита человека (ВИЧ),
поэтому его применяют (перорально) при СПИДе. В клетках
организма зидовудин активируется последовательным фосфорили-
рованием до моно-, ди- и трифосфатов. Активная форма
препарата ингибирует обратную транскриптазу, нарушая синтез
вирусной ДНК. Сродство зидовудина к обратной транскрипта-
зе вируса в 100 раз выше, чем к ДНК-полимеразе человека.
Зидовудин встраивается в молекулу вирусной ДНК, прерывая
дальнейший её рост, так как не содержит в своей структуре 3-
гидроксильную группу и не может образовывать З'-б'-фосфо-
диэстеразную связь с нуклеотидами. В среднем через 12—18
чесчиев от начала применения препарата к зидовудину
развитие i си резистентность ВИЧ. Некоторые пациенты тяжело
переносит серьёзные побочные эффекты препарата — такие, как
анемию, нейтропению, тошноту, головную боль.
Диданозин (ДДЛ) и зальцитабин (ДДЦ) — это новые
средства для лечения СПИДа, являющиеся ингибиторами
обратной транскриптазы.
87
41. Противопаразитарные средства.
I. Противоглистные препараты
Филярии
Ивермектин
Диэтилкарбамазин
Плоские черви
Трематоды
Шистосомы
Празиквантель
Цестоды
Празиквантель
Никлосамид
Мембраны мышечных клеток
гельминтов
СГ-канал
Паразитизм — это форма взаимоотношений между
организмами разных видов, при которой один (паразит) использует
другого (хозяина) в качестве источника питания или среды
обитания. К паразитам обычно относят простейших и гельминтов,
хотя многие микроорганизмы (например, бактерии) также
можно рассматривать в качестве паразитов. Простейшие и
гельминты являются типичными эукариотами и имеют сложный
цикл развития. В Великобритании встречается только
несколько видов паразитов (например, круглые черви, лямблии).
Паразитарные инвазии наиболее широко распространены в
условиях жаркого и влажного климата (в тропиках и субтропиках),
который обеспечивает оптимальную среду для развития
личинок паразитов и их промежуточных хозяев (например,
комаров). Распространению паразитарных заболеваний
способствуют также плохая санитария, переутомление и недостаточное
питание населения. Паразитарные инвазии отмечаются в
среднем у одной тысячи миллионов людей. В борьбе с
паразитарными заболеваниями важную роль играет применение проти-
вопаразитарных средств, вместе с тем используют и другие
методы. В частности, для уничтожения промежуточных хозяев
паразитов применяют инсектициды, проводят осушение
болотистых мест.
Гельминты (черви) бывают круглые (нематоды) (на рисунке
слева) и плоские (цестоды и трематоды) (на рисунке справа).
Нервная система гельминтов значительно отличается от нервной
системы позвоночных, что является основой избирательного
влияния на гельминты большинства противоглистных средств.
Мускулатура круглых червей имеет как тормозные, так и
возбуждающие нервно-мышечные синапсы, медиаторами которых
являются ацетилхолин (действует на н-холинорецепторы
нервно-мышечных синапсов) и Y-аминомасляная кислота (ГАМК).
Пирантел (комбантрин) и левамизол (декарис) (в центральной
части рисунка слева) стимулируют н-холинорецепторы нервно-
мышечных синапсов гельминтов, вызывая спастический
паралич их мускулатуры, что приводит к удалению гельминтов из
организма. Ивермектин (новое противоглистное средство,
применяемое при различных нематодозах) усиливает ГАМК-срги-
ческое торможение в нервно-мышечных синапсах круглых
червей, а пиперазин является агонистом ГАМК. Эти
противоглистные средства вызывают паралич мускулатуры круглых червей.
ГАМК-ергические средства неэффективны в отношении
трематод и цестод, так как у плоских червей нет периферических
ГАМК-ергических нейронов. Празиквантель — высоко
эффективное противоглистное средство, вызывающее мышечное
сокращение и спастический паралич паразитов, увеличивая
приток ионов кальция в мышцы червей. Некоторые антигельмин-
тные средства (в частности, производные бензимидазола)
влияют на биохимические процессы гельминтов. Так, например,
мебендазол (вермокс) (в левой части рисунка в центре)
связывает Р-тубулин и блокирует передвижение секреторных гранул
и других органелл в мышечных клетках круглых червей.
Механизм действия некоторых противоглистных средств неясен,
например, дитразина (диэтилкарбамазина) — препарата,
применяемого при лимфатическом филяриатозе.
88
Аскариды
Анкилостомы
Власоглавы
Мебендаэол
Пирантел - -
Левамизол
Пипераэин -
Кишечные
нематоды
>ГАМК
> Ацетилхолин
Ji-тубулин
Нарушение полимеризации
Са*
Н-холино-
рецепторы
Внокишечны*
нематоды
Нематодозы (инвазии круглыми червями)
Аскаридоз (инвазия Ascaris lumbricoides) отмечается в
среднем у 25% всего населения. Аскариды — это круглые черви
длиной от 10 до 30 см. Наиболее широко аскаридоз
распространён среди населения субтропической зоны, особенно в
местах с плохой санитарией. Основными средствами для лечения
аскаридоза являются мебендазол (вермокс), левамизол (декарис)
и пирантел (комбантрин). При аскаридозе эффективен также
пиперазнн, однако при его использовании возможно появление
рвоты и диареи.
Анкилостомцдозы — это кишечные гельминтозы,
возбудителями которых являются Ancylostoma duodenale и Necator
americanus. Эти небольшие круглые черви (длиной около I см)
присасываются к слизистой оболочке кишечника и питаются
кровью хозяина. Анкилостомидозы являются частой причиной
развития железодефицитной анемии у жителей тропической и
субтропической зоны. При этих гсльминтозах эффективны
мебендазол и пирантел.
Стронгилоидоз. Возбудителями этого кишечного
гельминтоза являются маленькие круглые черви длиной около 2 мм
(Strongyloides stercoral'®). Строигилоидофз встречается
достаточно часто и в основном протекает бессимптомно. При этом
гельминтозе применяют тиабендазол и альбендазол.
Энтеробиоз — это кишечный гельминтоз, вызываемый
острицами (Enterobius vermicularis) — круглыми червями длиной
около I см. Энтеробиоз встречается достаточно часто,
особенно у детей. Основным симптомом энтеробиоза является
кожный зуд в области заднего прохода, который возникает
вследствие раздражения кожи перианальной области, где самки
остриц откладывают яйца. Самозаражение происходит в
основном через руки, загрязнённые яйцами гельминтов в результате
расчесывания кожи. Высоко эффективными средствами для
лечения энтеробиоза являются мебендазол и пирантел, которые
используют обычно всей семьей.
Трихоцефалез. Возбудителем этого кишечного гельминтоза
является власоглав Gлс/шш trichiauria). Трихоцефалез часто
отмечается в сочетании с аскаридозом и анкилостомидозами. В
основном отмечается лёгкое или бессимптомное течение этого
гельминтоза. При трихоцефалезе наиболее активен мебендазол,
применение пирантела эффекта не даёт.
Филяриатозы. В организме человека паразитируют как
взрослые, так и личиночные формы филярий. В организм человека
эти гельминты попадают при укусах кровососущих насекомых.
Взрослые филярий могут паразитировать в организме человека
длительное время (в течение многих лет). Тяжесть заболевания
зависит от числа взрослых гельминтов в организме хозяина.
Лимфатические филяриатозы — это гельминтозы с
преимущественным поражением лимфатической системы,
возбудителями которых являются Wuchereria bancrofti, Brugia malayi и Brugia
timori, попадающие в организм человека при укусе комаром.
Взрослые гельминты паразитируют в лимфатических сосудах и
узлах, что приводит к развитию патологических изменений в
лимфатической системе и появлению слоновости (в обструк-
тивной стадии гельминтоза). Лимфатические филяриатозы
наиболее широко распространены среди населения Китая, Индии
и Индонезии (всего в мире насчитывается около 90 миллионов
людей, заражённых этими гельминтами). Возбудителем онхо-
церхоза является Onchocerca volvulus. Этот гельминтоз
встречается в основном в Африке и Центральной Америке. Заражение
человека происходит преимущественно в районе водоёмов (по
берегам рек, ручьёв, где размножаются мошки) при укусе чёрной
мошкой. Погибшие микрофилярии вызывают хронический зуд
кожи, а при проникновении паразитов в глаза развивается
поражение роговицы (паннус) и даже слепота (речная слепота).
Основными средствами для лечения филяриатозов являются
дитразин (диэтилкарбамазин) и иверниктин. При онхоцеркозе
в течение многих лет используют дитразин, который активен
только в отношении личиночных форм микрофилярии (на
взрослые формы паразита препарат не действует). Механизм
антигельминтного действия дитразина неясен. В процессе
лечения в результате гибели микрофилярии может отмечаться
обострение заболевания с развитием тяжёлых осложнений, одним
из которых является поражение глаз. В настоящее время
препаратом выбора при онхоцеркозе является ивермектин, применение
которого вызывает менее выраженное обострение заболевания.
Возбудителями токсокароза являются личиночные формы
Toxocara canis и ToxocaracatL Заражение людей (преимущественно
детей) происходит при проглатывании яиц паразитов с пищей
и водой, загрязненных испражнениями собак или кошек.
Вышедшие из яиц личинки с током крови попадают в различные
органы и ткани (в том числе в глаза), где погибшие паразиты
образуют специфические гранулемы. При токсокарозе возможны
тяжёлые поражения глаз с развитием слепоты. Для лечения
токсокароза используют дитразин, который вызывает гибель
паразитов в крови, но не действует на инкапсулированные
формы гельминта в тканях.
Трематодозы
Шистосомоз (бильгарциоз) — инвазия, вызываемая шисто-
сомами. Эти трематоды поражают мочевыводящие пути
(Schistosoma haematobium) и кишечник (Schistosoma mansoni и
Schistosoma japonicum). Промежуточным хозяином гельминтов
является водяная улитка (моллюск). Из поражённого
моллюска в воду выделяются церкарии гельминтов. Проникновение
гельминтов в организм человека (преимущественно детей
младшего возраста) происходит при купании в заражённых
водоёмах. При шистосомозе применяют празиквантель, который
эффективен при всех видах трематодозов (кроме фасциолёза,
инвазии гельминтом Fasciola hepatica).
Цестодозы (инвазии плоскими червями)
Тениаринхоз и тениоз возникают в результате употребления
в пищу плохо обработанного мяса (говядины или свинины),
инфицированного личинками (циститерками, финнами)
соответственно Taenia saginata и Taenia solium. В тонком кишечнике
человека из циститерков выделяются сколексы (головки
цепня), которые прикрепляются к стенке кишечника. Затем
происходит образование самооплодотворяюшихся члеников.
Длина ленточных червей может достигать 5-10 метров. Эти
гельминтозы часто не вызывают яркой симптоматики. При
употреблении в пищу недостаточно термически обработанной рыбы,
содержащей личинки ленточного червя Diphyllobothrium latum,
возникает дифиллоботриоз. Наиболее эффективным средством
для лечения цестодозов является празиквантель.
Противоглистные (антигельминтные) средства
Производные бензимидазола (например, мебендазол и
альбендазол) обладают широким спектром противоглистного
действия, особенно эффективны при кишечных нематодозах.
Препараты применяют перорально, они вызывают небольшое
количество побочных эффектов, так как плохо всасываются mj
кишечника (обладают низкой биодоступностью).
Пирантел является миорелаксантом деполяризующего
действия и антихолинестеразным средством, поэтому вызывает
спастический паралич мускулатуры круглых червей (остриц,
аскарид, анкилостом). Избирательность противоглистного действия
препарата связана с тем, что его применяют перорально, а и$
кишечника он практически не всасывается. Основными
побочными эффектами пирантела являются
желудочно-кишечные расстройства. При нематодозах эффективен также
левамизол, действие которого сходно с эффектами пирантела.
Ивермектин связывается с ГАМК-рсцспторами
нервно-мышечных синапсов гельминтов (в 100 раз активнее, чем с
синапсами позвоночных) и вызывает паралич их мускулатуры,
усиливая ГАМК-ергическое торможение. Вместе с тем недавно было
показано, что ивермектин активирует глутаматзависимые
хлорные каналы, которые обнаружены только у беспозвоночных.
Препарат не эффективен в отношении цестод и трематод, так
как мембраны их мышечных клеток не имеют участков для
связывания ивермектина. Ивермектин вызывает гибель
личиночных форм Onchocerca volvulus, но не влияет на взрослые
формы этого гельминта. Препарат используют перорально при
энтеробиозе, аскаридозе и стронгилоидозе. Побочные
эффекты при его применении выражены незначительно. При
онхоцеркозе ивермектин применяют однократно через каждые 6-
12 месяцев, однако полного удаления гельминтов из организма
человека препарат не вызывает.
При трсматодозах и цестодозах (но не нематодозах) высоко
эффективен празинквантель. Препарат применяют перорально,
он не вызывает серьёзных побочных эффектов. Празиквантель
увеличивает проницаемость мембран мышечных клеток
гельминтов для Са2+, что приводит к развитию спастического
паралича мускулатуры червей и пассивному выведению их из
организма хозяина. Вместе с тем препарат вызывает повреждение
поверхностной оболочки гельминтов, что способствует
разрушению паразитов.
89
42. Противопаразитарные средства.
II. Противопротозойные препараты
Малярия
Виды плазмодия
Plasmodium falciparum
Plasmodium vivax
Plasmodium malariae
Plasmodium ovale
(редко)
Гистошиэотролиые
средства
Примахин
(при дефиците глюкоэо-6-
фосфат дегидрогвнаэы)
Предупреждение
Печень
Преэритроцитарная
или тканевая стадия
Кровь
Эритоцитарная стадия
Гематошиэотролные
средства
Острый приступ малярии
Амёбная дизентерия
Метронидазол
Дилаксонид
Лямблиоэ
Метронидазол
Трихомоноз
Метронидазол
Пневмоцистоз
Ко-тримоксазол
Пентамидин
Лейшманиоз
Стибоглюконат
Трипаносомоз
Сурамин
Одной из наиболее серьёзных протозойных инфекций
является малярия. Несмотря на то, что в Европе и Северной
Америке нет эндемий данного заболевания, существует опасность
заражения малярией при путешествиях в зоны её
распространения. Риск заражения малярией существенно снижает
профилактическое применение противомалярийных препаратов.
Однако резистентность Plasmodium falciparum ко многим
противомалярийным средствам создаёт опасность заражения
путешественников малярией даже при применении
профилактических препаратов. К сожалению, не существует эффективных
профилактических средств и при других протозойных
инфекциях (например, при лямблиозе).
Возбудителями малярии являются четыре вида плазмодия (в
верхней части рисунка слева), которые проводят часть
жизненного цикла в организме самки малярийного комара (Anopheles
mosquito). При укусе комаром в организм человека попадают
спорозоиты, которые с током крови поступают в печень, где
размножаются и превращаются в тканевые шизонты. Это прс-
эритроцитная или первич нотка не вая стадия болезни (в левой
части рисунка). Через 15—16 дней шизонты разрываются и из
них выделяются (*=$) тысячи мерозоитов #, которые
внедряются в эритроциты, что даёт начало эритроцитарной стадии
болезни (в правой части рисунка). При малярии, вызванной
P. vivax и P. ovale (но не P. falciparum), в печени в течение
длительного времени (нескольких месяцев или лет) происходит
бессимптомное повторение циклов развития плазмодия (пара-
эр итроцитарные формы плазмодия), что обуславливает
появление рецидивов заболевания (¦>).
Многие противомалярийные средства влияют на эритроци-
тарные шизонты (гематошизотропные средства). Быстро
действующие гематошизотропные средства (хлорохин, хинин,
мефлохин и галофантрин) используют для купирования приступов
малярии. Прогуанил является медленнодействующим
противомалярийным препаратом, поэтому его применяют для
профилактики малярии. Хлорохин и мефлохин используют как ддя
лечения, так и для профилактики малярии (хинин для
профилактики не используют, так как он высокотоксичный). Прима-
хин является гистошизотропным средством. Его применяют
после устранения клинических проявлений малярии хинином
или хлорохином для уничтожения параэритроцитарных форм
плазмодия в печени (для радикального лечения малярии).
90
Комар
Профилактика
МЕДЛЕННОДЕЙСТВУЮЩИЕ
Прогуанил
Пириметамин
БЫСТРОДЕЙСТВУЮЩИЕ
- Хлорохин
_Мефлохин
Галофантрия'
Хинин
Капилляр
Спорозоиты
Трофозоиты
Мерозоиты
Тканевые
шизонты
ПардэрйТ'
роцитарные
формы
плазмодия .
Рецидивы
Месяцы-год
15-16 день
Гематошизотропныв средства (медленнодействующие)
Прогуанил и пириметамин являются эффективными гемато-
шизотропными средствами, однако их действие развивается
слишком медленно, поэтому для купирования острых
приступов малярии их не используют. Прогуанил применяют для
профилактики малярии обычно в комбинации с хлорохином. Фан-
сидар (комбинированный препарат пириметамина с сульфа-
доксином) используют после применения хинина при
малярии, вызванной P.falciparum. Малоприм (комбинированный
препарат пириметамина с диафенилсульфоном) в сочетании с
хлорохином иногда используют для профилактики малярии,
возбудителями которой являются резистентные к хлорохину
штаммы P.falciparum. Сульфадоксин и диафенилсульфон
(дапсон) имеют такую же направленность действия, что и
пириметамин, но влияют на другие звенья синтеза фолатов (см.
главу 37).
Механизм действия. Пириметамин и активный метаболит про-
гуаиила (циклогуанил) являются антагонистами фолатов. Они
угнетают образование тетрагидрофолиевой кислоты, ингиби-
руя дигидрофолатредуктазу, в результате чего нарушается
синтез ДНК и деление клеток. Сродство этих препаратов к дигид-
рофолатредуктазс плазмодиев в 1000 раз выше, чем к
ферментам человека, с чем и связана избирательность их действия в
отношении возбудителей малярии (сравните с действием ме-
тотрексата; см. главу 43).
Гематошизотропныв средства (быстродействующие)
Хлорохин обычно устраняет малярийную лихорадку в
течение 24-48 часов. Препарат используют при малярии,
вызванной Р, vivax и P. ovale, однако он не действует на параэритро-
цитарные формы плазмодиев, поэтому после его применения
необходимо курсовое введение примахина. Следует отметить,
что возбудители тропической малярии (P. falciparum) в
большинстве районов мира приобрели резистентность к хлорохину,
поэтому его не следует использовать при этом виде малярии.
Хлорохин применяют в основном перорально, но при тяжёлом
состоянии пациентов его можно вводить и внутривенно.
Механизм действия. Внутри поражённого эритроцита
плазмодии вначале превращают гемоглобин в гем (феррипротопор-
фирин IX), являющийся токсичным для паразита. В
дальнейшем под действием гем-полимеразы плазмодиев происходит
преобразование гема в нетоксичный гемазоин. Хлорохин и
хинин проникают внутрь чувствительных к ним плазмодиев и
ингибирует гем-полимеразу, что приводит к накоплению гема,
вызывающего разрушение мембран паразитов и их гибель.
Побочные эффекты. При профилактическом применении
противомалярийных средств в малых дозах побочные эффекты
отмечаются крайне редко. В высоких дозах противомалярийные
средства (при лечении малярии) могут вызвать тошноту, рвоту,
диарею, кожные сыпи и иногда психозы. Длительное
применение препаратов в больших дозах может привести к
необратимому повреждению сетчатки глаз.
Хинин, лифлохин, галофантрин используют при тропической
малярии (вызванной P.falciparum). При необходимости
(например, при бессознательном состоянии пациентов) хинин можно
вводить внутривенно. Препарат применяют в виде курсов
продолжительностью семь дней. При резистентности плазмодиев
к хинину применяют фансидар или тетрациклин (при
неэффективности фансидара). Мефлохин и галофантрин являются
более активными и менее токсичными противомалярийными
средствами, чем хинин, поэтому их используют для
монотерапии заболевания.
К побочным эффектам хинина относятся: боль в животе,
тошнота, головная боль, нарушение зрения и аллергические
реакции. Мефлохин может привести к развитию
нервно-психических нарушений. Механизм действия хинина, мефлохина и га-
лофантрина неизвестен.
Гистошизотролные средства
Примахин является наиболее эффективным
противомалярийным средством, так как он уничтожает параэритроцитарные
формы P. vivax и P.ovale в печени. Однако препарат не
эффективен для лечения острых приступов малярии, так как
оказывает слабое воздействие на эритроцитарных шизонтов.
Механизм действия примахина неизвестен. Считают, что
повреждение паразита вызывают активные метаболиты вещества,
обладающие окислительной активностью. При наследственном
дефиците глюкозо-6-фосфатдегидрогеназы примахин может
вызвать гемолиз эритроцитов, поэтому до начала лечения
препаратом необходимо определить активность глюкозо-6-фос-
фатдегидрогеназы в крови.
Побочные эффекты примахина включают тошноту, рвоту,
угнетение костномозгового кроветворения и гемолитическую
анемию.
Амёбная дизентерия
Entamoeba histolitica вызывает развитие амёбиаза. При
острой амёбной дизентерии (но не при бессимптомном цистоно-
сительстве) используют метронидазол (см. главу 37). Для
борьбы с цистоносительством используют дилоксанида фуроат.
Лямблиоз
Лямблии {Giardia lamblia) — это простейшие,
паразитирующие в желудочно-кишечном тракте и вызывающие развитие
метеоризма и диареи. При лямблиозс эффективен метронидазол.
Трихомоноз
Trichomonas vaginalis вызывает развитие трихомонадного
вагинита и уретрита (у обоих сексуальных партнёров).
Эффективным средством лечения этого заболевания является
метронидазол.
Пневмоцистоз
Pneumocystis carinii — это микроорганизмы, которые,
вероятно, попадают в организм человека в раннем возрасте и
находятся в неактивном состоянии в лёгких. При иммунодепрессии
(например, при СПИДе, применении глюкокортикоидов и им-
мунодепрессантов) Pneumocystis carinii могут вызвать разритие
интерстициальной пневмонии. При пневмоцистной пневмонии
применяют ко-тримоксаэол (см. главу 37) или пентамидин
парентерально или ингаляционно. Механизм действия пентами-
дина неизвестен. Препарат имеет много побочных эффектов, в
том числе тяжелых.
Лейшманиоз
Лейишании — это внутриклеточные простейшие, которые
попадают в организм человека при укусе москитов. Различают
кожный и висцеральный (кала-азар) лейшманиоз. Основным
средством для лечения лейшманиоза является стибоглюконат.
Стибоглюконат — это органическое соединение
пятивалентной сурьмы, которое взаимодействует с тиоловыми группами и
уменьшает образование АТФ в организме паразитов.
Препаратами второго ряда при лейшманиозе являются пентамидин и
амфотерицин (см. главу 40).
Трипаносомоз
Переносчиком африканского трипаносомоза (сонной
болезни) является муха Це-Це, а возбудителями — Trypanosoma
gambiense или Trypanosoma rhodesiense. В первой стадии
трипаносомоза эффективен сурамин, который уничтожает паразитов
в крови и лимфатических узлах, однако механизм действия
препарата неизвестен. Сурамин не проникает через гематоэн-
цефалический барьер, поэтому не эффективен во второй (ге-
матоэнцефалитной) стадии при появлении неврологической
симптоматики.
91
43. Противоопухолевые средства
Ингибирующие
синтез ДНК
-Цитарабин'
Антиметаболиты
Метотрексат —
Фторурацил
Меркаптопурин
Тиогуанил
•->
Ингибирование
Д Н К-пол имеразы
Ингибирование диги-
дрофолатре-
дуктаэы
Метилирование дезокси-
уридиловой кислоты
Ингибирование
тимидилсинте-
тазы
Алкалоиды
барвинка
Винбластин
Винкристин
Пиримидины
Угнетение синтеза
пуриновых оснований
Образование перекрестных
ковалентных связей
Внедрение (интеркаляция)
между соседними парами
оснований ДНК
и нарушение синтеза РНК
Повреждение ДНК
свободными радикалами
Алкилирующие средства
Мустин
Циклофосфамид
Хлорбутин
Цисплатин
Антибиотики
Доксорубицин
Дактиномицин
Блеомицин
М -фазоспецифичные
РНК
(транспортные, рибосомальные, матричные)
Стероидные гормоны
Глюкортикоиды
Эстрогены
Антиэстрогены
Андрогены
Связываются с тубулином, / \
нарушая образование , *
Премито-
тическая
фаза
Белки
(ферменты, гормоны)
Многие
противоопухолевые средства
являются
циклоспецифичными
(фазонеспецифичными)
Постмитотическая фаза
Противоопухолевые
средства практически
не действуют на клетки
в состоянии покоя
Основной целью лечения онкологических больных является
радикальное удаление опухолей, а при невозможности
радикального лечения — проведение паллиативной терапии. Кроме
хирургического и лучевого лечения локализованных опухолей
при распространении опухолевого процесса на другие органы
используют системное введение противоопухолевых средств.
Лекарственные средства, применяемые при злокачественных
новообразованиях, угнетают процессы пролиферации
опухолевых клеток. К сожалению, противоопухолевые средства
оказывают токсическое действие не только на опухолевые клетки, но
и на активно пролиферирующис нормальные клетки
организма (особенно клетки костного мозга, эпителия
желудочно-кишечного тракта и волосяных фолликулов). Избирательность ци-
тостатического действия противоопухолевых средств в
отношении злокачественных опухолей связана с тем, что число
активно делящихся клеток в опухолевой ткани значительно выше,
чем в здоровых тканях организма.
Противоопухолевые средства классифицируют в
зависимости от характера их действия на синтез макромолекул
опухолевых клеток (в верхней части рисунка). Некоторые
противоопухолевые средства эффективны только в определённых фазах
клеточного цикла (фазоспецифичные средства, в левой части
рисунка), тогда как другие активны в течение всего клеточного
цикла (циклоспецифичные или фазонеспецифичные средства; в
правой части рисунка).
Алкилирующие средства (в верхней части рисунка справа)
легко образуют ковалентные связи. Они взаимодействуют с
молекулами ДНК, образуя перекрёстные мостики («сшивки»)
внутри двойной спирали ДНК, что приводит к угнетению
процессов деления клеток. В качестве противоопухолевых средств
широко используют некоторые антибиотики (вырабатываемые
различными видами лучистых грибков (Streptomyces)), которые
также взаимодействуют с молекулами ДНК опухолевых клеток
(в центре правой части рисунка). Некоторые
противоопухолевые средства нарушают синтез ДНК в клетках опухолей (в
верхней части рисунка слева). Подобным механизмом действия
обладают антиметаболиты, угнетающие синтез пуриновых и
пиримидиновых оснований. В эту группу противоопухолевых
средств относится, например, антагонист фолиевой кислоты
метотрексат. Алкалоиды барвинка (в нижней части рисунка
слева) обладают антимитотической активностью, так как
угнетают образование веретена деления клеток опухоли»
связываясь с микротубулярными белками. Для лечения
злокачественных новообразований используют и лекарственные средства
других групп (например, прокарбазин). Достаточно часто
применяют стероидные гормоны и антигормональные средства. При
некоторых видах опухолей (например, при болезни Ходжкина)
комбинированное применение противоопухолевых средств
является более эффективным, чем использование отдельных
препаратов.
Применение противоопухолевых средств сопровождается
появлением неприятных и даже опасных для жизни побочных
эффектов. Некоторые антибластомные препараты обладают
специфическим токсическим действием. К общим побочным эф-
о>ектам многих противоопухолевых средств относятся:
тошнота, рвота (выраженность этих эффектов уменьшают антиэме-
тики — такие, как мстеразин, дексаметазон и ондансетрон),
изъязвление слизистой оболочки полости рта и жслудочно-
92
Пурины
Деполимеризация
Инактмвирующие ДНК
Прокарбазин
S-фаэоспецифичные
Митоз
Go
фаза
покоя
кишечного тракта, диарея, аллопеция (выпадение волос), мие-
лодепрессия (угнетение костномозгового кроветворения —
одного или нескольких ростков). Лейкопения увеличивает риск
присоединения инфекционных осложнений; тромбоцитопения
Комбинированное применение противоопухолевых
средств
Обычно при злокачественных новообразованиях
используют чередование комбинаций противоопухолевых средств, что
является более эффективным, чем длительное применение
одного препарата. Рациональным является комбинированное
применение противоопухолевых препаратов с разными
побочными эффектами и неодинаковыми механизмами действия, что
позволяет увеличить противоопухолевую активность без
повышения токсичности. Так, например, комбинированное
применение мустина (дегранола), винкристина, прокарбазина и пред-
низолона (МОПП) при лимфогранулематозе (болезни Ходж-
кина) вызывает ремиссию у 80% пациентов, в то время как
использование отдельных противоопухолевых препаратов
способствует развитию ремиссии менее чем у 40% пациентов.
Избирательность действия противоопухолевых средств
Противоопухолевые средства обладают слабой
избирательностью действия в отношении опухолевых клеток.
Благоприятный эффект противоопухолевой терапии отмечается при более
быстром восстановлении активности клеток костного мозга, чем
клеток злокачественных новообразований после применения
противоопухолевых средств, так как повторное введение
противоопухолевых средств (вызывающих гибель опухолевых
клеток и исчезновение опухоли) проводится только после
восстановления активности клеток костного мозга. Эффективность
химиотерапии варьирует от «излечения» (например, при
остром лимфобластном лейкозе у детей) до полной устойчивости
опухали к противоопухолевым препаратам (например, при раке
толстого кишечника).
Алкилирующие средства
При проведении химиотерапии злокачественных опухолей
широко используют алкилирующие средства. Длительное
применение этих препаратов часто вызывает нарушение гаметоге-
неза, что в большинстве случаев приводит к развитию
бесплодия. Применение алкилирующих противоопухолевых средств
сопровождается увеличением частоты возникновения острых
нелимфоцитарных лейкозов. Циклофосфамид метаболизирует-
ся в печени с образованием нескольких активных метаболитов.
Один из метаболитов, акролеин, может вызывать развитие
геморрагического цистита (достаточно серьёзного осложнения).
Для устранения токсического влияния препарата на мочевой
пузырь внутривенно вводят уропротектор 2-меркаптоэтан-суль-
фонат натрия (МЕСНА), который связывает акролеин.
Циклофосфамид используют при различных видах злокачественных
новообразований, обычно в комбинации с другими
противоопухолевыми средствами. Хлорбутин (хлорамбуцил)
применяют перорально. Однако в настоящее время его используют
редко (заменяя другими алкилирующими противоопухолевыми
средствами) из-за выраженных побочных эффектов препарата.
Мустин (дегранол) вводят внутривенно при лимфогранулематозе.
Это очень токсичный препарат, вызывающий сильную рвоту.
Противоопухолевые антибиотики
Доксорубицин является одним из наиболее эффективных
противоопухолевых препаратов, его используют при острых
лейкозах, лимфомах и истинных (солидных) опухолях.
Доксорубицин является производным антрациклина. Препарат может
внедряться между соседними парами оснований ДНК (интер-
каляция ДНК), что приводит к угнетению синтеза ДНК и РНК.
Вместе с тем доксорубицин, вероятно, ингибирует топоизоме-
разу-И и/или вызывает образование свободных радикалов.
Применение препарата в высоких дозах сопровождается развитием
кардиотоксических эффектов, вероятно, за счёт образования
свободных радикалов кислорода, которые из-за
недостаточного содержания в миокарде каталазы не инактивируются и
вызывают повреждение сердечной мышцы.
Алкалоиды барвинка
Виикристин используют при остром лимфобластном лейкозе,
лимфомах. и некоторых истинных опухолях. Препарат оказы-
способствует появлению кровотечений, а уменьшение
образования эритроцитов приводит к развитию анемии. Угнетения
костномозгового кроветворения не вызывают только
виикристин и блеомицин.
вает выраженное нейротоксическое действие. Винбластин
используют при лимфомах и тестикулярных тератомах. Он
вызывает более выраженное угнетение костномозгового
кроветворения, чем винкристин, но обладает меньшим нейротоксичес-
ким действием.
Антиметаболиты
Антагонисты фолиевой кислоты. Метотрексат конкурентно
ингибирует дигидрофолатредуктазу и угнетает образование тетра-
гидрофолиевой кислоты и её коферментной формы — мети-
лен-тетрагидрофолиевой кислоты, которые необходимы для
превращения дезоксиуридиловой кислоты (дезоксиуридин-5-мо-
нофосфата) в тимидиловую кислоту. Метотрексат нарушает
процессы клеточного деления, так как активно
размножающимся клеткам для синтеза ДНК необходимо повышенное
количество дезокситимидилата. Препарат используют при остром
лимфобластном лейкозе, лимфомах и некоторых истинных опухолях.
Антагонисты пиримидина. Фторурацил в клетках опухоли
превращается в 5-фтор-2-дезоксиуридиловую кислоту, которая
ингибирует тимидилсинтетазу (фермент, катализирующий
превращение дезоксиуридиловой кислоты в тимидиловую).
Уменьшение образования тимидиловой кислоты приводит к
нарушению синтеза ДНК. Фторурацил вводят преимущественно
внутривенно при истинных опухолях, особенно при раке молочной
железы. Фторурацил является препаратом выбора при раке
толстого кишечника с метастазами. Цитарабин применяют при
острых лейкозах и лимфомах.
Антагонисты пурина нарушают синтез пуриновых нуклеоти-
дов, но механизм их действия неясен. Меркаптопурин
используют для поддерживающей терапии при остром лейкозе.
Гормоны
Глюкокортикоиды (например, преднизолон) угнетают
процессы деления клеток, влияя на синтез ДНК. Эти гормоны
широко используют в комплексной терапии лейкозов, а также
при лимфомах и раке молочной железы. Половые гормоны и их
антагонисты. Рост некоторых злокачественных
новообразований (особенно опухолей молочной и предстательной желёз)
частично зависит от гормонального фона. К регрессии гормо-
нозависимых опухолей может привести удаление некоторых
эндокринных желёз (например, орхидэктомия при раке
предстательной железы), применение гормонов с противоположным
действием или антигормональных препаратов. Тамоксифен
является антагонистом эстрогенов. Препарат широко
используют при раке молочной железы с метастазами у женщин в
менопаузе. При раке предстательной железы применяют аналоги го-
надотропин-рилизинг гормона (например, бусерелин), так как
они вызывают меньше побочных эффектов, чем фосфэстрол
(стильбэстрол). Длительное применение бусерелина
сопровождается парадоксальным угнетением секреции лютеинизирую-
щего гормона, что приводит к уменьшению высвобождения
тестостерона. Однако противоопухолевый эффект
гормонотерапии носит временный характер, так как в опухолевой ткани
преобладают гормононезависимые клетки.
В ряде случаев при злокачественных новообразованиях
используют иммунодепрессанты (например, циклоспорин и азати-
оприн). Эти средства в основном применяют для
предупреждения отторжения тканей после трансплантации органов, а
также при коллагенозах и других аутоиммунных заболеваниях.
Эффективным иммунодепрессантом является циклоспорин;
препарат относится к пептидным антибиотикам, подавляет
пролиферацию Т-лимфоцитов. Важным отличием циклоспорина
от цитостатиков является незначительное угнетение
костномозгового кроветворения, однако он оказывает нефротоксическое
действие. Механизм цитостатического действия азатиоприна
связан с угнетением синтеза инозиновой кислоты,
являющейся предшественником адениловой и гуаниловой кислот, что
приводит к нарушению обмена нуклеиновых кислот. Препарат
широко применяют в комбинации с преднизолоном. Иммуно-
депрессивным действием обладают глюкокортикоиды, они
влияют в основном на активность полиморфно-ядерных клеток и
макрофагов.
93
44. Отравления лекарственными веществами
Антидоты
ОКИСЬ УГЛЕРОДА (СО)
О2 (гипербаричвская
оксигенация)
ПАРАЦЕТАМОЛ
Внутривенно I
ацетилцистеин
Перорально метионин
ОПИОИДЫ
Налоксон
БЕНЗОДИАЗЕПИНЫ
Внутривенно
флумазенил
ПРЕПАРАТЫ ЖЕЛЕЗА
Десферал
МЕТАНОЛ
Этанол
ФОСФОРОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ
Атропин
СВИНЕЦ/РТУТЬ
Унитиол
Комплексобразующие
соединения
Токсическое
вещество
Доза
Длительность
применения
Рвотный рефлекс
Температура тела
Уменьшение
абсорбции
Оценка состояния
сознания
Дыхание
Артериальное
давление
Активированный
уголь
Определение кон-
Зондовое промывание
желудка
Специфические
антидоты
Салицилаты
Фенобарбитал
Внутривенное
введение NaHC03
Повторное
применение
активированного угля
Гемоперфузия
Гемодиализ
Парацетамол
Железо
Соли лития
Салицилаты
Метанол
Теофиллин
Дигоксин
Салицилаты
Многие противо-
элиптические
средства
Салицилаты
Соли лития
Метанол
Теофиллин
Барбитураты
Ко-проксямол (комбинированный препарат парацетамола с
декстропропоксифеном), парацетамол и трициклические
антидепрессанты — это наиболее доступные лекарственные
средства, отравление которыми может привести к летальному
исходу. Наиболее частой причиной смертельных исходов является
отравление окисью углерода (выхлопным газом автомобилей).
Нередко отмечаются отравления двумя и более
лекарственными веществами, причем около 50% всех случаев отравлений
связаны с приёмом алкоголя. Наиболее часто сознательные
отравления лекарственными веществами являются попытками
покончить жизнь самоубийством (суицидальными попытками),
от которых погибает в среднем 3000 человек в год.
Лекарственные отравления в структуре внутрибольничной смертности
пациентов составляют не более 1%. Случайные отравления
лекарственными веществами и бытовыми ядохимикатами
встречаются в основном у детей (преимущественно до 5 лет). При
лекарственных отравлениях первоначально проводят быстрый,
но тщательный клинический осмотр пациентов и оценивают
их состояние (показано в верхней части рисунка). При этом
исключают другие возможные причины развития комы и
нарушения общего состояния пациентов (например, травму
головы, эпилепсию, сахарный диабет). В большинстве случаев при
лекарственных отравлениях необходимо проведение только
общих поддерживающих мероприятий. При оказании неотложной
помощи при лекарственных отравлениях определение
концентрации токсического вещества в крови требуется относительно
редко. Однако при отравлении некоторыми лекарственными
средствами (показаны в верхней части рисунка справа) общее
состояние пациентов может не соответствовать тяжести
отравления, поэтому для выбора адекватных способов элиминации
яда из организма (в нижней части рисунка в центре) и
специфических антидотов (в левой части рисунка) необходимо
определить содержание этих веществ в плазме крови.
Всасывание лекарственных веществ из желудочно-кишечного
тракта может быть уменьшено путём эондового промывания
желудка или рвоты, вызванной назначением рвотных средств
(например, сиропа ипекакуаны). Раннее промывание желудка
способствует уменьшению содержания яда в организме. Обычно
промывание желудка проводят, если с момента отравления
прошло не более 4 часов, иногда — до 10 часов (например, при
отравлении трициклическими соединениями или другими
веществами, которые медленно эвакуируются из желудка), при
отравлении аспирином промывание желудка проводят, даже если
с момента отравления прошло 24 часа. Для уменьшения
всасывания токсических веществ из кишечника часто применяют
активированный уголь. При тяжёлых отравлениях
лекарственными веществами используют специальные приёмы ускорения
элиминации ядов из организма (например, гемодиализ, гемо-
перфузию и др.; показаны в нижней части рисунка).
94
Опрос и осмотр
Усиление
элиминации
Уменьшение всасывания токсических веществ
Рвота, Применение сиропа ипекакуаны (рвотного корня)
вызывает развитие рвоты у 90% пациентов в течение 30 минут
после приёма препарата. Рвотные средства назначают
преимущественно детям (находящимся в сознании), так как зондовое
промывание желудка является для них крайне неприятной
процедурой.
Более эффективным является зондовое промывание желудка,
особенно у пациентов, находящихся в бессознательном
состоянии. С этой целью в желудок вводят зонд, через который
осуществляют 3-4-кратное промывание желудка 300-600 мл воды.
При бессознательном состоянии пациентов осуществляют
интубацию трахеи. Активированный уголь (в среднем 50 г)
применяют только в том случае, если не планируют пероральное
введение антидотов (так как активированный уголь
адсорбирует антидоты так же хорошо, как и токсические вещества). При
отравлении едкими и горючими (например, бензином)
веществами промывание желудка противопоказано.
Активированный уголь — это мелкий пористый порошок
чёрного цвета, обладающий большой адсорбирующей
поверхностью A000 M2/r"'). Активированный уголь адсорбирует на своей
поверхности многие лекарственные вещества (кроме
препаратов железа, лития, едких веществ и органических
растворителей). 10 грамм активированного угля адсорбирует в среднем 1
грамм лекарственных веществ.
Усиление элиминации токсических веществ
Усиление элиминации токсических веществ ускоряет
выздоровление пациентов при отравлениях, однако нет
достаточных доказательств, что при этом снижается смертность
пациентов (кроме пациентов, находящихся в тяжёлом коматозном
состоянии).
Повторное применение активированного угля. Повторное
пероральное применение активированного угля является
безопасной и эффективной процедурой и может повысить
эффективность зондового промывания желудка.
Щелочной диурез. При внутривенном введении натрия
гидрокарбоната AЧаНСОз) происходит сдвиг рН мочи в щелочную
сторону (рН 7,5-8,5). В щелочной среде усиливается
ионизация слабых кислот (например, аспирина) в просвете почечных
канальцев, что приводит к уменьшению их реабсорбции. В свою
очередь сдвиг рН мочи в кислую сторону может быть полезен
при отравлении щелочными веществами (например,
амфетамином). Форсированный щелочной диурез вызывают
внутривенным введением больших объёмов жидкости с NaHC03,
однако эта процедура является опасной, поэтому в настоящее
время практически не применяется.
Гемодиализ и гемоперфузия — это инвазивные манипуляции,
требующие катетеризации артерий и вен (обычно на руках) для
обеспечения временного экстракорпорального кровообращения.
При гемодиализе лекарственные вещества проходят по
градиенту концентраций через диализную мембрану и переходят в
диализную жидкость. При гемоперфузии кровь проходит через
колонку с активированным углем или смолой, где происходит
адсорбция токсических веществ. Проведение этих манипуляций
сопровождается высоким риском развития различных
осложнений (например, кровотечений, воздушной эмболии,
повреждения периферических сосудов, инфекционных осложнений).
Отравление аспирином
Отравление салицилатами проявляется звоном в ушах,
одышкой и повышением потоотделения. При тяжёлом отравлении
салицилатами возможно развитие коматозного состояния.
Вместе с тем отмечаются нарушения кислотно-основного
состояния организма, так как салицилаты, стимулируя дыхательный
центр, вызывают развитие респираторного алкалоза, а
вследствие разобщения окислительного фосфорилирования —
метаболический ацидоз. При отравлении салицилатами
необходимо определить их содержание в плазме крови, а также
концентрацию электролитов, Ог и СО2. В период до 24 часов с момента
отравления проводят зондовое промывание желудка, после чего
вводят активированный уголь. При тяжёлом отравлении
салицилатами (при их концентрации в плазме крови выше 50 мг/л1)
необходимо внутривенное введение NaHC03 для сдвига рН мочи
в щелочную сторону. При угрожающих жизни состояниях
применяют гемодиализ.
Отравление парацетамолом
Отравление парацетамолом может протекать бессимптомно
или характеризоваться появлением тошноты и рвоты, но через
48-72 ч отравление даже небольшим количеством препарата
(около 10 г, 20-30 таблеток) может привести к развитию
некроза печени. Парацетамол метабол и зируется
преимущественно путём конъюгации в печени, однако при использовании
препарата в высоких дозах эти процессы нарушаются, и
парацетамол начинает окисляться в токсичный хинон (N-ацетил-
бензохинонимин). Хинон инактивируется путём конъюгации с
глютатионом, но применение парацетамола в высоких дозах
приводит к истощению запасов глютатиона, в результате
хинон ковалентно связывается с тиоловыми группами клеточных
белков, что приводит к их гибели. Ацетилцистеин
(внутривенно, перорально) и метионнн (перорально) — это антидоты,
способные спасти жизнь пациентам в случаях отравления
парацетамолом, так как они усиливают синтез в печени глютатиона.
При передозировке парацетамола необходимо немедленно
определить концентрацию парацетамола в плазме крови для того,
чтобы рассчитать необходимые дозы антидотов. Если с
момента отравления парацетамолом прошло не более 4 часов, то
проводят зондовое промывание желудка. Необходимость
применения специфических противоядий определяется по номограмме
в зависимости от концентрации препарата в крови (с этой
целью на номограмме соединяют точки, соответствующие
концентрации парацетамола 200 мг/л'1 через 4 часа и 30 мг/л !
через 15 часов с момента передозировки). Использование
номограммы позволяет выбрать наиболее эффективную тактику
лечения отравления парацетамолом, так как номограмма
построена на основе изучения различных результатов лечения.
Обычно антидототерапию проводят, если концентрация
парацетамола в крови выше «линии-200» на номограмме. При
отравлении парацетамолом на фоне применения веществ,
вызывающих индукцию микросомальных ферментов печени (например,
алкоголя), риск неблагоприятного исхода отравления
увеличивается. Таким пациентам антидототерапию проводят, если
концентрация препарата в крови выше «линии-100» на
номограмме (линии, образующейся при соединении точек,
соответствующих концентрации парацетамола в крови 100 мг/л ' через 4
часа и 15 мг/л через 15 часов после передозировки
препарата). В течение первых 4 часов после отравления парацетамолом
концентрация препарата в крови не отражает тяжести
состояния, так как всасывание препарата из кишечника ещё
продолжается. В течение 8 часов с момента отравления препаратом
внутривенно вводят ацетилцистеин (наиболее эффективный
антидот при отравлении парацетамолом). Побочные эффекты
ацетилцистеина (в том числе развитие анафилактических
реакций) отмечаются у 15% пациентов.
Отравление опиоидами
Отравление опиоидами характеризуется развитием комы,
сужением зрачков и угнетением дыхания. Специфическим
антидотом опиоидов является налоксон. При отравлении
опиоидами налоксон вводят внутривенно до нормализации дыхания.
Налоксон необходимо вводить продолжительно, так как его
период полуэлиминации меньше, чем опиоидов, поэтому
после прекращения введения налоксона признаки отравления
могут вновь проявиться. Следует отметить, что применение
налоксона может вызвать развитие абстинентного синдрома у
опийных наркоманов.
Отравление трициклическими антидепрессантами
Токсические проявления передозировки трициклических
антидепрессантов связаны в основном с их центральным антихо-
линергическим (угнетение дыхания, депрессия, галлюцинации,
судороги) и кардиотоксическим действием. При отравлении
этими препаратами обычно необходимо наблюдение за
пациентами и проведение обычных дезинтоксикационных мероприятий,
а также дача кислорода для устранения гипоксии. Из-за атро-
пиноподобного эффекта антидепрессантов при их
передозировке часто возникает синусовая тахикардия. Удлинение
комплекса QRS на ЭКГ (хин иди но подобный эффект) является
опасным признаком, предшествующим появлению судорог, при
которых используют диазепам (сибазон, реланиум) или хлор-
метназол.
95
45. Побочное действие лекарств
Т-лимфоцит
Реакции I типа
анафилактические
Пенициллины
Цефалоспорины
Сульфаниламиды
Рентгеноконтрастные
средства
Крапивница
Ринит
Гистамин
Комплемент
Бронхиальная
астма
Анафилактический шок
Ангионевро-
тический отёк
Реакции III типа
иммунокомплексные
Пенициллины
Сульфаниламиды
Тиазиды
Точно установить частоту возникновения побочного
(нежелательного) действия лекарственных веществ достаточно сложно.
Вместе с тем известно, что около 5% случаев неотложной
госпитализации пациентов связано с развитием побочных
эффектов лекарственных препаратов. Появление нежелательных эф-
фектов лекарств отмечается в среднем у 20% пациентов,
находящихся на стационарном лечении. Побочные эффекты
лекарственных веществ редко носи? угрожающий для жизни
характер, однако около 0,5-1% смертности пациентов, находящихся
на стационарном лечении, в большей или меньшей степени
связаны с нежелательным действием лекарств. Большинство
побочных эффектов лекарственных веществ подразделяются на
дозозависимые и гдозонезависимые. Побочные эффекты лекарств,
развитие которых не зависш oi дозы, встречаются
относительно редко и обычно имеют иммунную основу. Так. например,
известны лекарственные вещества, обладающие тератогенным
(появление врожденных уродств) и канцерогенным (появление
опухолей) действием. Некоторые лекарства при длительном
применении приводят к развитию адаптивных изменений в
организме, прекращение их введения вызывает появление синдрома
отмены (например, отмена бензодиа зспинов приводит к развитию
бессонницы и тревожного состояния, отмена глюкокортикои-
дов может вызвать острую надпочечниковую недостаточность).
Развитие побочных эффектов, зависящих от дозы
лекарственного вещества (А типа), является предсказуемым, так как
связано с усилением основных (например, развитие
гипогликемии при введении инсулина и кровотечений при введении
гепарина) или нежелательных эффектов лекарств (например,
угнетение дыхания при введении морфина). Дозозависимые
побочные эффекты чаще всего встречаются при применении
лекарственных веществ с небольшим различием между
терапевтической и токсической дозой (т.е. с малым терапевтическим
индексом = LD50/ED50), кривая зависимости эффект-доза
которых имеет большой угол наклона. К лекарственным
веществам с низким терапевтическим индексом относятся
антикоагулянты, гипогликемические средства, дигоксин, противоарит-
мические препараты, амшюгяикозиды, ксантины,
противоопухолевые средства и иммунодепрессанты. Развитие дозо зависимых
побочных реакций обычно связано с превышением дозы
лекарственных веществ или с ишенением их фармакокинетики
(например, при нарушении элиминации лекарств при почечной
недостаточности). В 10-20% случаев развитие нежелательных
эффектов фармакотерапии является результатом взаимодействия
лекарственных веществ, что особенно часто наблюдается у
пациентов пожилого возраста, которые чаще получают большое
количество лекарственных препаратов для лечения различных
заболеваний.
Побочные эффекты, развитие которых не зависит от дозы
лекарственных веществ (В типа, идиосинкразия), отмечаются
относительно редко, однако их появление не является
предсказуемым и нередко сопровождается смертностью пациентов
(в отличие от дозозависимых побочных эффектов).
Лекарственная аллергия может проявляться в виде реакций
гиперчувствительности (с I по IV типы; показаны на рисунке), другие виды
дозонезависимых побочных эффектов классифицировать
сложно. Самым опасным проявлением лекарственной аллергии
является анафилактический шок, при котором может отмечаться
гибель пациентов.
Дозозависимые побочные эффекты (А типа)
Фармакокинетические нарушения
Имеются особенности элиминации лекарств у различных
пациентов. Уменьшение элиминации лекарственных веществ из
организма с развитием их побочных эффектов отмечается при
различных генетических нарушениях (например, при
наследственном дефиците псевдохолинэстеразы дитилин вызывает
длительное апноэ; см. главу 4). При заболеваниях почек возможно
развитие кумуляции и токсических эффектов лекарственных
веществ, выделяющихся из организма путём гломерулярной
фильтрации или секреции в канальцах почек (например, ди-
гоксина, амфотерицина, каптоприла, гентамицина и других
амином и козидов).
Взаимодействие лекарств
Взаимодействие лекарственных веществ — это изменение
действия одного лекарства под влиянием другого.
Взаимодействие лекарственных веществ может быть фармакодинамичес-
ким и фармакокинетическим. Наиболее часто нежелательные
эффекты вследствие взаимодействия лекарств отмечаются при
96
Тучная клетка
Клетки-
мишени
Реакции IV типа
Т-клеточиые
(замедленные)
Пенициллины
Цефалоспорины
Местные анестетики
Дифенин
Реакции II типа
цитоксические
Гемолитическая
анемия
Пенициллины
Хинидин
Мвтилдофа
Агранулоцитоз
Карбимазол
Клозапин
Тромбоцитопения
Хинидин
Гепарин
Комплемент
Повреждение
Лизис
Фагоцит
совместном применении лекарственных веществ, имеющих
малую широту терапевтического действия.
Фармакодинаминеское взаимодействие
Наиболее часто встречается фармакодинамическое
взаимодействие лекарственных веществ, которое обычно имеет
простой механизм. Лекарственные вещества со сходными
эффектами (синергисты) могут усиливать действие друг друга
(например, бензодиазепины и алкоголь при совместном
применении оказывают аддитивное действие и могут вызвать
выраженное угнетение ЦНС). Напротив, некоторые лекарственные
вещества, являясь антагонистами, оказывают противоположное
действие (например, применение р-адрсноблокаторов снижает
эффективность р-адреномиметиков (и теофиллина) при
бронхиальной астме, что может привести к развитию тяжёлого
приступа бронхоспазма даже со смертельным исходом).
Фармакокинетическое взаимодействие
Абсорбция. Абсорбцию лекарств из желудочно-кишечного
тракта могут изменять лекарственные вещества, увеличивающие
(например, метоклопрамид) и уменьшающие (например,
атропин) скорость опорожнения желудка. Антибактериальные
средства могут нарушать кишечно-печёночную циркуляцию перо-
ральных контрацептивов (особенно препаратов, содержащих
малые дозы эстрогенов), что в ряде случаев приводит к
наступлению нежелательной беременности (антибиотики уничтожают
нормальную микрофлору кишечника, уменьшая высвобождение
стероидных гормонов из конъюгатов, выделяющихся с жёлчью).
Распределение. Многие вещества, циркулирующие в крови в
связанной с альбуминами форме, могут вытесняться из этой
связи другими лекарственными веществами. Обычно
способность некоторых лекарственных соединений вытеснять другие
лекарственные вещества из связи с белками плазмы крови имеет
небольшое практическое значение, так как повышенная
концентрация свободных лекарственных веществ быстро
снижается за счёт их элиминации из организма. Это явление может
иметь значение для действия некоторых лекарственных веществ
(например, варфарина, дифенина, толбутамида), которые
связываются с белками плазмы крови более чем на 90%.
Метаболизм. Индукция ферментов печени некоторыми
лекарственными средствами (например, дифенином,
фенобарбиталом, карбамазепином, рифампицином) может привести к
уменьшению активности других лекарственных веществ,
разрушающихся при участии этих ферментов (например,
варфарина). Ингибиторы микросомальных ферментов печени
(например, циметидин), напротив, потенцируют эффект варфарина и
могут вызвать интоксикацию дифенином и теофиллином.
Выделение. Транспорт лекарственных веществ в
проксимальных канальцах почек может осуществляться одними и теми же
транспортными системами. Так, например, пробенсцид
конкурентно снижает экскрецию пенициллинов. Тиазидовые и
петлевые диуретики понижают реабсорбцию Na+, вызывая
компенсаторное увеличение реабсорбции одновалентных ионов в
проксимальных канальцах почек. Это может способствовать
накоплению в организме солей лития и развитию
интоксикации этими соединениями. Комбинированное применение ка-
лийсберегающих диуретиков с препаратами калия и
ингибиторами ангиотензинпревращающего фермента может привести к
развитию гиперкалиемии.
Доэонезависимые побочные эффекты
Лекарственные вещества могут вызывать развитие реакций
гиперчувствительности (лекарственной аллергии), в основе
которых лежат иммунологические реакции. Выраженными
антигенными свойствами обладают крупномолекулярные
лекарственные вещества (например, вакцины, инсулин, декстраны),
низкомолекулярные вещества антигенной активности не имеют.
Однако в организме некоторых пациентов лекарственные
вещества или их метаболиты играют роль гаптенов, соединяясь с
белками тканей с образованием антигенного комплекса.
Поступление антигенов в организм индуцирует синтез
специфических антител, что в дальнейшем приводит к развитию
реакций гиперчувствительности (например, кожных сыпей,
анафилактического шока). Несмотря на то, что появление
лекарственной аллергии предсказать невозможно, аллергические реакции
к лекарственным веществам чаще отмечаются у пациентов,
имеющих в анамнезе различные аллергические заболевания
(например, поллиноз, бронхиальную астму, экзему).
Анафилактические реакции
(реакции гиперчувствительности I типа)
При анафилактических реакциях лекарственные вещества
взаимодействуют с IgE, фиксированными на поверхности
тучных клеток и базофилов, приводя к высвобождению гистамина
и других медиаторов. К лекарственным веществам (показаны в
правой части рисунка сверху), которые наиболее часто
вызывают развитие анафилактических реакций, относятся пеницил-
лины. С введением пенициллинов связано около 75% случаев
гибели пациентов при анафилактическом шоке. Некоторые
лекарственные препараты (например, рентгеноконтрастные
средства) могут вызвать развитие анафилактоидных реакций
(реакций, напоминающих анафилаксию) даже при первом
применении.
Нарушения системы крови. Проявлениями реакций
гиперчувствительности II или цитотоксического типа (в нижней части
рисунка слева) к лекарствам могут быть различные нарушения
системы крови. Лекарственные вещества (гаптены)
связываются с мембранами клеток крови, образуя комплексные
антигены. Циркулирующие антитела (IgM и IgG) взаимодействуют с
антигенными комплексами, приводя к активации системы
комплемента и лизису клеток крови. Развитие нарушений системы
крови при введении некоторых лекарственных препаратов
можно предсказать. Так, например, многие противоопухолевые
препараты могут угнетать костномозговое кроветворение, а
некоторые лекарственные средства (например, примахин) при
дефиците глюкозо-6-фосфат-де гид роге пазы — вызывать
развитие гемолитической анемии.
Некоторые лекарственные вещества вызывают развитие
реакций гиперчувствительности III или иммунокомплексного типа
(в нижней части рисунка справа), при которых в кровеносном
русле образуются комплексы антител (IgG) с антигенами (гап-
тенами, связанными с белками организма). Иммунные
комплексы остаются в системе кровообращения, вызывая
активацию фагоцитов и системы комплемента, что приводит к
развитию воспаления и повреждению эндотелия капилляров.
Особенно серьёзные последствия отмечаются при повреждении
иммунными комплексами сосудов жизненно важных органов
(например, почек). При аллергических реакциях III типа
возможно появление лихорадки, артритов, кожной сыпи и лим-
фоаденопатии.
Дерматиты. Лекарственные вещества (в верхней части
рисунка слева) могут вызывать развитие различных дерматитов,
некоторые из которых опасны для жизни (например, иногда
отмечается развитие токсического эпидермального нскролиза.
при котором погибает 35% пациентов). В механизме
возникновения реакций гиперчувствительности IV или замедленного типа
участвуют сенсибилизированные Т-лимфоциты, которые
взаимодействуют с клетками-мишенями (КМ), вызывая развитие
воспалительной реакции. При нанесении антигенов на кожу
(например, антибиотиков в виде мази) возможно развитие
местной аллергической реакции в виде отека и покраснения кожи
(экземоподобная реакция).
Тератогенность
Применение некоторых лекарственных веществ в первом
триместре беременности вызывает нарушение развития плода
(тератогенное действие). Так как большинство лекарственных
веществ хорошо проходят через плацентарный барьер, то их не
следует применять во время беременности. Тератогенный
эффект могут вызывать алкоголь (алкогольный синдром плода),
противоопухолевые препараты, варфарин (множественные
врождённые дефекты), тетрациклины (нарушают
формирование скелета), вальпроаты, карбамазепин (дефекты нервной
системы) и другие противоэпилептическис средства.
Канцерогенность
Лекарственные вещества очень редко обладают
канцерогенным действием (вызывают развитие опухолей), так как
фармацевтическая индустрия препятствует появлению на рынке
таких препаратов. Механизм канцерогенного действия
лекарственных веществ обычно неизвестен. Вместе с тем отмечено, что
применение иммунодспрсссантов (например, азатиоприна и
преднизолона) сопровождается увеличением частоты развития
лимфом, а введение алкилирующих противоопухолевых средств
(например, циклофосфамида) может привести к развитию не-
лимфоидного лейкоза, активируя «ген токсичности».
97
E-вариант этой книги
создан исключительно
с целью личного
временного
ознакомления!
Не для продажи и
какого-либо
распространения!!!
Предметный указатель
а-адреномиметики 24-27
а-адре норе цеп горы 21, 25
а-интерферон 86
а-адреноблокаторы 24-27, 36, 37
Р-адреноблокаторы 21
р-адреномиметики 24, 25, 27, 36-39, 40, 41, 55
у-глобулин 86, 87
G-белки 9
Helicobacter pylori 30, 31
NMDA-рецепторы 51
абортивные средства 75
абсорбция (лекарств) 12, 13, 97
агонисты рецепторов 8
агонисты дофамина 58, 59
аденозин 41
адреналин 20, 21, 25, 27, 28
адреноблокаторы 25
адренорецепторы 20, 21, 25
азапропазон 71
азатиоприн 93
азитромицин 85
азлоциллин 83
акарбоза 79
акромегалия 59
АХТГ (кортикотропин) 73
алкалоиды барвинка 92, 93
алкилирующие средства 92, 93
алкоголь 50, 68, 69
аллергические реакции 28, 29
аллопуринол 71
алфентанил 53
альдостерон 72
альпразолам 55
альтеплаза 45
амантадин 58, 59, 87
амёбная дизентерия 91
аметокаин 16
амидарон 41
амикацин 85
амилорид 35
аминогликозиды 19, 84, 85
аминокислоты-медиаторы 50, 51
амитриптилин 54, 55
амлодипин 37, 39
амоксиклав 83
амоксициллин 82, 83
анальгетики 53, 64, 65, 70, 71
анаприлин 77
анафилаксия 28, 96, 97
ангиотензин 36, 37
андрогены 74, 75
анестезин 16
анионообменные смолы 47
анистреплаза 45
антагонисты витамина К 44, 45
антагонисты дофамина 33, 53, 58, 60, 61, 66, 67
антагонисты кальция 36, 39
антагонисты Н2-гистаминовых рецепторов 30, 31
антагонисты пиримидина 93
антагонисты пурина 93
антагонисты рецепторов 10, И
антагонисты фолиевой кислоты 93
антациды 30,31
антибактериальная терапия 31, 80—85, 92, 93
антигистаминные средства 28-31, 57, 66, 67
антидепрессанты 54, 55, 57, 62, 63
антидиарей ные средства 32, 33
антикоагулянты 44, 45
антиметаболиты 92, 93
антипсихотические средства 60, 61
антитиреоидные средства 76, 77
антихолинэстеразные средства 18, 19, 22, 23
антиэметики 53, 66, 67
апоморфин 59
аритмии 40,41
артериальная гипертензия 36, 37
артериальные тромбозы 44
аспирин 70,71
астемизол 29
атенолол 39, 77
атеросклероз 46, 47
атракурий 19
атропин 22, 23, 53
ацетазоламид 27, 35
ацетилхолин 18, 19, 21-23, 31, 41, 51
ацетилхолинэстераза 15, 19, 22, 23
ацикловир 86, 87
баклофен 51
барбитураты 51-57, 69
беклометазон 73
бендрофлуазид 35
бензафибрат 47
бензилпенициллин 82, 83
бензодиазепины 51, 53-55, 57, 69, 94
бензокаин 16
бенсеразид 58
бессонница 54, 55
бетагистин 66,67
бетаметазон 73
бетанехол 22,23
бикукуллин 51
бисакодил 33
бициллин 83
блокаторы ангиотензивных рецепторов 37
болезни сердца и сердечная недостаточность 34, 35, 38-43
болезнь Аддисона 72, 73
болезнь движения 66
бронхиальная астма 28, 29
бронходилятаторы 28, 29
бруфен70, 71
будесонид 33
буп ива каин 16, 17
бупренорфин 65
бусерелин 93
буспирон 54, 55
бутирофеноны 61
В|2 гиповитаминоз 48, 49
вазелиновое масло 33
вазодилятаторы 36, 37, 43
вакцины 86
вальпроаты 51, 56, 57
ванкомицин 83
варфарин 44. 45
вегетативная нервная система 20, 21
векуроний 19
99
венлафаксин 63
венозный тромбоз 44
верапамил 39,41
взаимодействие лекарств и рецепторов 10, 11
вигабатрин 56, 57
винбластин 93
винкристин 93
вирус герпеса 86, 87
вирусные инфекции 86, 87
ВИЧ инфекция 86, 87
внутривенное введение лекарств 13
внутримышечное введение лекарств 13
водители ритма 41
вторичные мессенджеры 8, 9, 23, 25, 29, 38, 39, 43,
габапентин 56, 57
галламин 19
галлюциногены 68, 69
галоперидол 61
галотан 52, 53
галофантрин 90,91
ГАМК и ГАМК-рецепторы 50, 51, 55, 57, 88
ганглиоблокаторы 23
ганцикловир 87
гастрин 31
гашиш 69
гсксаметоний 21
гемфиброзил 47
генетические факторы и метаболизм лекарств 14, 15
гентамицин 84, 85
гепарин 44, 45
героин 65, 69
гидралазин 37
гидрокортизон 72,73
гидроксид алюминия 31
гидроксид магния 31
гидроксикобаламин 48
гиосцин 22, 23, 51, 53, 67
гиперлипидемия 47
гиперпролактинемия 59
гипертиреоидизм 77
гиперхолестеринемия 46,47
гиперхолестеринемия наследственная 46, 47
гипотензивные средства 36, 37
гипЬтиреоидизм 77
гистамин 28, 29, 31
гистаминовые рецепторы 31
глаукома 26, 27
глибенкламид 79
глицин 50, 51
глутаминовая кислота (глутамат) 50, 51, 57
глюкокортикоиды 32, 33, 72, 73
глюкокортикостероиды 72, 73, 93
гонадорелин 75
гонадотропины 75
гормоны 9, 74, 75
гризеофульвин 86
гуанетидин 27
дегидратация 53
декарис 88, 89
дексаметазон 67, 73
декстропропоксифен 65
депрессия 62, 63
десферал 48
дефероксамин 48
диазепам 53-55
диакарб 27, 35
диа морфин 65, 69
диацилглицерол 9
дигоксин 41-43
диданозин 86, 87
дизопирамид 41
дикаин 16
дилтиазем 39
динорфины 65
дипиридамол 45
дитилин 18, 19
диуретики 34-37, 42
дифенин 56, 57
дихлоралфеназон 55
диэтилкарбамазин 88, 89
добутамин 24, 42, 43
доксазозин 37
доксорубицин 93
домперидон 58, 67
дотиепин 63
дофамин 43, 51, 58-61, 66, 68
дофаминовые рецепторы 61
дроперидол 53
жаропонижающие средства 46, 47
железо и препараты железа 48, 49, 94
желудочно-кишечный тракт 30-33
желчные кислоты 32, 33
закись азота 52, 53
зальцитабин 86, 87
зидовудин 86, 87
зондовое промывание желудка 94
зопиклон 54
ИБС46
ибупрофен 70, 71
ивермектин 88, 89
идоксуридин 87
изониазид 15
изопреналин 25
изофан инсулин 79
изофлуран 52, 53
имипрамин 63
иммуноглобулины 87
иммунодепрессанты 93
ингибиторы АПФ 36, 37, 42, 43
ингибиторы ГМГ-КоА-редуктазы 47
ингибиторы карбоан гид разы 34,35
ингибиторы МАО 59, 62, 63
ингибиторы фосфодиэстеразы 42,43
ингибиторы холинэстеразы 18, 19, 22, 23
индометацин 71
индукция ферментов 15, 97
инотропные средства 42, 43
инсектициды 23
инсулин-ленте 79
инсулин 78, 79
инсулин-се м ил енте 79
инсулин-ультраленте 79
интал 29
инфекции 75
ионные каналы 9
ипекакуана 94
ипратропий 29
итраконазол 87
йод 77
калиевые каналы 9, 37, 79
кальциевые каналы 8, 9, 37, 39, 41, 43, 56, 57
кальцитонин 76
кандидомикоз 85, 87
каннабис 69
канцерогенное действие 97
канцерогены 97
каолин 33
каптоприл 36, 42, 43
карбамазепин 56, 57, 62
карбахолин 22, 23
карбидопа 58
100
катаракта 27
катехол-О-метилтрансфераза 25
кетамин 53
кислота никотиновая 47
кларитромицин 88
клиренс лекарств 13
клозапин 60» 61
кломифен 75
клоназепам 56, 57
клонидин 24, 36, 69
клофелин 24, 36, 69
кодеин 64, 65
кожная сыпь 66, 67
кокаин 16, 17, 25, 69
колестипол 47
колхицин 71
КОМТ 25
контрацептивы 75
концентрация лекарств в плазме крови 12, 13
ко-проксамол 94
кордарон 41
коронарное шунтирование 39
кортизол 72, 73
кортикотропин 73
ко-тримоксазол 80.81,91
кофеин 50
кривая зависимости эффект—доза 10
курантил 45
курение табака 39, 50, 68, 69
лактулоза 33
ламотриджин 56, 57
левамизол 88, 89
леводопа 58, 59
левомицетин 84, 85
лейкозы 93
лейшманиоз 91
лекарственные отравления 94, 95
лекарственные средства, применяемые в офтальмологии 26, 27
лидокаик 16, 17, 41
лизурид 59
лиотиронин 77
липопротеины 47
липофильные средства 12
лития препараты 62, 63, 97
лозартан 37
лоперамид 33
лоразепам 53
лофексидин 69
ЛСД 69
лямблиоз 91
макролиды 84, 85
малоприм 91
малярия 90, 91
маниакально-депрессивные состояния 63
мания 62, 63
МАО 25
марихуана 69
мебендазол 88, 89
мегалобластическая анемия 48, 49
медиаторы 9
медиаторы ЦНС 50, 51, 55, 65
мезатон 24, 27
менотрофин 75
меркаптопурин 93
месалазин 33
местеролон 74
местное применение лекарств 13
мертные анестетики 16, 17, 26, 41
местранол 75
метаболизм лекарств 12, 14, 15
метаболизм первичного прохождения 12, 15
мстадон 65, 69
метилдопа 24,37
метилцеллюлоза 33
метоклопрамид 33, 53, 67
метолазон 34
метопролол 39
метотрексат 93
метронидазол 80, 81, 91
метформии 79
мефлохин 90, 91
механизмы действия лекарств 8, 9
миансерин 63
миастения 19
миграин 51
мидазолам 55
мидантан 58, 59, 87
мидриатики 26, 27
мидриаз 26, 27
мизопростол 71
микседсма 77
мильринон 42, 43
минералокортикоиды 72, 73
миноксидил 37
миоз 26
мифепристон 75
моклобемид 63
моноаминоксидаза (МАО) 25
морфин 53, 65
мустин 93
м-холиномиметики 22, 23, 26, 29, 32, 53, 58, 59
м-холинорецепторы 21,22,51
назальный спрей 29
налбуфин 65
налидиксовая кислота 81
налоксон 64, 65
налтрексон 69
напрокссн 70, 71
нарушения менструального цикла 67
нарушения системы крови 97
натриевый насос 9
натрия гидрокарбонат 9, 17, 35, 41, 57
нейролептики 60, 61
нейропептиды 51, 64, 65
нематодозы 88, 89
неодикумарин 44, 45
неомицин 85
неостигмин 18, 23
нервно-мышечная проводимость 18, 19
неспецифический язвенный колит 32, 33
нестероидные противовоспалительные средства 70, 71
нетилмицин 85
никотин 21, 22, 50, 68, 69
нистатин 87
нитразепам 54
нитраты 38, 39
нитроглицерин 38, 39
нитроимидазолы 80, 81
нитропруссид 37
нифедипин 37
норадреналин 20, 21, 25, 41, 51, 62, 63
норфлоксацин 81
н-холиномиметики 22, 23
н-холинорсцепторы 19, 21, 23, 51
общие анестетики 52, 53
оксибупрокаин 16
оксид азота (NO) 37, 39, 50, 51
омепразол 30, 31
ондансетрон 53, 55, 67
опиоиды 33, 53, 63-65, 68, 69
определение интенсивности связывания лекарств с
рецепторами 10, 11
опухоли 92, 93, 97
осмотические диуретики 34
101
панкреатин 32, 33
панкуроний 19
паразиты 88-91
парасимпатическая нервная система 20-21
парацетамол 70, 71, 94, 95
парентеральное введение лекарств 13
паркинсонизм 58, 59
пенициллины 82, 83, 97
пентазоцин 65
пентамидин 91
пептидные нейромедиаторы 50, 51
пептическая язва 30, 31
период полуэлиминации 13, 54
пернициозная анемия 48, 49
пероральное применение лекарств 13
перо рал ьные контрацептивы 75
перфеназин 61
петидин 65
печень 14, 15
пилокарпин 22, 23, 26, 27
пиперазин 88, 89
пиперациллин 83
пирантел 88,89
пирензепин 30
пиридостигмин 18, 23
пириметамин 91
пироксикам 71
цневмоцистозы 91
побочное действие лекарств 96, 97
подкожное введение лекарств 13
половые гормоны 74, 75, 93
потенциал действия 17, 18, 41
мочегонные средства 34, 35
почечная экскреция 13
празиквантель 88, 89
празозин 25, 37
пралидоксим 23
преднизалон 72, 73
премедикация 52, 53
препараты висмута 30, 31
препараты сенны 33
прилокаин 16, 17
примахин 90, 91
примидон 56, 57
пробенецид 71
проводниковая анестезия 17
прогестерон 75
прогуанил 90, 91
прозерин 18, 23
производные имидазола 86, 87
производные сульфонилмочевины 79
производные хинолона 80, 81
проксиметакаин 16
прометазин 29, 67
пропилтиоурацил 77
пропофол 52, 53
пропранолол 77
лростагландины 31, 71, 86
противоаритмические средства 40, 41
противовирусные средства 86, 87
противовоспалительные средства 32, 33, 70, 71
противоглистные средства 88, 89
противогрибковые средства 86, 87
противодиабетические средства 78,79
противомалярийные средства 90, 91
противомикробные средства 19, 80-85
противоопухолевые средства 92, 93
противопаразитарные средства 88-91
противопаркинсонические средства 58, 59
противопоносные средства 32, 33
противорвотные средства 53, 66, 67
противоэпилептические средства 86, 87
протозойные инфекции 88, 90, 91
прохлорперазин 67
процессы нулевого порядка 12
процессы первого порядка 12
псевдохолинэстераза 15, 19
психоз и шизофрения 60, 61
пути введения (лекарств) 13
равновесная константа ассоциации (К*) 11
ранитидин 31
рвота 53, 66, 67, 94
рвотные средства 53, 66, 67
реакции гиперчувствительности 16, 45, 49, 53, 82, 96, 97
ректальное введение лекарств 13
реланиум 53—55
рефлкже-эзофагит 31
рецепторы 8-11, 19-23, 25, 50, 51, 55, 61, 64, 65, 76-72
рибавирин 87
рисперидон 61
ритансерин 55
ритмилен 41
рокуроний 19
салметерол 29
сахарный диабет 78, 79
связь лекарственных веществ с альбуминами плазмы крови 12
секреция соляной кислоты 31
селегилин 58
сен ильная деменция 51
серотонин E-НТ) 51, 55, 62, 63, 66, 69
сибазоп 53-55
симпатическая нервная система 20, 21, 24, 25
симпатомиметики 24, 25, 43
синдром Золлингера-Эллиссона 31
синдром Стивена-Джонсона 81
сироп ипекакуаны 94
скополамин 22, 23, 51, 53, 67
слабительные средства 32, 33
снотворные средства 54, 55
сосудорасширяющие средства 36, 37, 43
соталол 41
СПИД 86, 87, 91
спинномозговая анестезия 17
спиронолактон 35
средства для ингаляционного наркоза 52, 53
средства для наркоза 52, 53
статины 47
стенокардия 38, 39
стероиды 28, 29, 32, 33, 74, 92, 93
стибоглюконат 91
стильбэстрол 93
стрептокинаэа 44, 45
стрептомицин 85
стрихнин 51
стронгилоидоз 89
сублингвальное применение лекарств 13
субстанция Р 51, 64
сукральфат 31
суксаметоний 18, 19
сульпирид 61
сульфаниламиды 80, 81
сульфасалазин 33
сульфинпиразол 71
суматриптан 51
сурамин 91
такрин 51
тамоксифен 75, 93
темазепам 54
теофиллин 29
терапевтический индекс 96
тератогенное действие 97
терфенадин 29
тестостерон 74,75
тетрациклины 84, 85
тиазидовые диуретики 34-37, 42
102
тикарииллин 83
Химоксамии 27
ти молол 27
тинидазол 81
тионамиды 77
тиопентал 52, 53
тиоридазин 61
тиреоидные средства 76, 77
тиреотоксикоз 77
тироксин 77
тканевой активатор плазминогена 45
токсин ботулизма 19
токсическое действие лекарств 15, 23, 48, 53, 57, 63, 69
токсичность фосфорорганических средств 23
токсокариоз 89
тол бута мид 79
толерантность 68
тошнота 53, 66, 67
тразодон 63
транквилизаторы 54, 55
трематодозы 88,89
триазолы 86, 87
триамтерен 35
триамцинолон 73
трибавирин 87
тримепразин 29
триметоприм 80, 81
трипаносомоз (сонная болезнь) 91
трифлуоперазин 61
трихомоноз 91
триииклические антидепрессанты 62, 63, 94, 95
тромболитические средства 44, 45
тропикам ид 27
тубокурарин 19, 21
угнетение активности ферментов 15
уменьшение уровня холестерина в крови 46, 47
урофоллитрофин 75
урсодезоксихолиевая кислота 33
фармакогенетика 14, 15
фармакодинамика 8
фармакокинетика 8, 12—15
фенбуфен 71
фенелзин 63
фенилбутазон 71
фенилэфрин 24, 27
фенитоин 56, 57
фенобарбитал 56, 57
феноксибензамин 25
фенокси метил пенициллин 83
фенотиазины 57, 61, 66, 67
фентанил 53
ферменты 9
фибраты 47
фибринолитические средства 44, 45
физостигмин 23, 27
филяриатозы 89
флудрокортизон 73
флуклоксациллии 82, 83
флуконазол 87
флумазенил 55
флупентиксол 61
флутоцитозин 86, 87
флуфеназин 61
фосфэстрол 93
фторотан 52, 53
фторурацил 93
фуросемид 35
хенодезоксихолиевая кислота 33
химиотерапевтические средства 92, 93
хинидин 41
хинин 90, 91
хлоралгидрат 55
хлорамбуцил 93
хлорамфеникол 84, 85
хлорметиазол 55, 56, 69
хлорохин 90, 91
хлорпромазин 61
хлорфенирамин 29
холестирамин 47
холиномиметики 22, 23
холинорецепторы 21
хромогликат 29
цАМФ 9, 25, 29
цГМФ 38,39
целлюлоза 33
церукал 33, 53, 67
цестодозы 88, 89
цефадроксил 83
цефалоспорины 82, 83
цефтазидим 83
цефтриаксон 83
цефуроксим 83
цианокобаламин 48
цизаприд 33
циклопентолат 27
циклоплегические средства 26
циклоспорин 93
циклофосфамид 93
циметидин 31
циннаризин 67
ципрофлоксацин 80, 81
цитарабин 93
цитотоксические средства 92, 93
цитохром Р-450 14, 15
частичные агонисты 10, И
шизофрения 60, 61
шистосомоз 89
эдрофоний 23
эзофагит31
экскреция лекарств 12, 13, 34
экскреция лекарств с жёлчью 13
экстаз 69
электросудорожная терапия 62
элиминация лекарств 12, 13, 94, 95
эмболия 44
эмоциональные расстройства 62, 63
эналаприл 43
энкефалины 51, 64, 65
энтонокс 53
энфлуран 52, 53
элидуральная анестезия 17
эпилепсия 56, 57
эпоетин 49
эритромицин 84, 85
эритропоэтин 49
эстрогены 74, 75
этинилэстрадиол 75
этосуксимид 56, 57
эфедрин 24
язва (пептическая) 30, 31
Учебное издание
M. Дж. Нил
Наглядная фармакология
Переводчик и редактор
Демидова М.А.
Корректор
Тарковская Е.И.
Техническая группа
Евдокимов СИ.
Рахматулина Г.Е.
Пелипенко О.А.
Слинько С, В,
Байрамов Р. И.
Дементьев Е.Е.
Издательство ГЭОТАР МЕДИЦИНА
119828, Москва, ул. Малая Пироговская, 1а
ЛР№ 064871 от 15. 12.96.
Отпечатано с готового оригинал-макета в ООО «ИНФОРМПОЛИГРАФ».
Подписано в печать 5.04.99. Печать офсетная. Бумага офсетная.
Формат 60x90/8, объем 13 п..л., тираж 5 000 экз., заказ № 145