Автор: Дерябина Н.Е.
Теги: химия органическая химия
Текст
Дерябина Н.Е.
Минисправочник
школьника и абитуриента
ОРГАНИЧЕСКАЯ
ХИМИЯ
В РЕАКЦИЯХ
АЛЬДЕГИД /
О КЕТОН
-с-
АЛКЕН
/С==СХ
<-н,
АЛКИН
—с=с—
X
КАРБОНОВАЯ
о кислдтА
। —
+С|2
« -НС1
ДИГАЛОГЕН-
АЛГ1Н
2На1—
(Hal = Cl, Br)
-HCI
'ОН
ТРИГАЛОГЕН-
АЛКАН
ЗНа1—
Hal = Cl. Br)
Классификация
органических веществ
ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
4- И
ГАЛОГЕНСОДЕРЖАЩИЕ ] СОЕДИНЕНИЯ ДРУГИЕ
vrnPRnnnPnnw КИСЛОРОДСОДЕРЖАЩИЕ АЗОТСОДЕРЖАЩИЕ УГЛЕВОДОРОДЫ СОЕДИНЕНИЯ СОЕДИНЕНИЯ
АЛКАНЫ СпН2П*2 ' СПИРТЫ RjOH 1 Сп№п+2О •Ь НИТРОАЛКАНЫ 1 CnHzn+iNOz R-NO2
АЛКЕНЫ^н-СН-Р СпН2П J ПРОСТЫЕ R-O-R' ЭФИРЫ СПН2П+2О АМИНОАЛКАНЫ Cn№n+3N R-NH2
АЛКИНЫ R4=5C R. СпНап-2 1 АЛЬДЕГИДЫ .О СпН2пО R-C-H АРОМАТИЧЕСКИЕ ” АМИНЫ СпН2п-5Ы
ДРУГИЕ (циклоалканы СпН2п, алкадиены СпН2п-2, арены СпНгп-б и т.д.) СЛОЖНЫЕ о ЭФИРЫ R-CjO-R‘ СпН2пО2 R КЕТОНЫ R-C-R’ СпН2пО & КАРБОНОВЫЕ о КИСЛОТЫ R-Cjtoh СпН2пО2 -> ДРУГИЕ СОЛИ КАР- л БОНОВЫХ r_г*ЬМв КИСЛОТ
д ГИЕ
НАЗВАНИЕ МОНО- ФУНКЦИОНАЛЬНОГО СОЕДИНЕНИЯ название углеводо- родной цепи число функциональ- ных арупп (ФГ) (ди-, три-...) суффикс класса локанты (№№ С-ат-в. к которым при- соединены ФГ)
ингСнг-СН-СН-СН3 ^бнон пентан ди on -2.3
С-атомов Sh™
в цепи назваиия
1 Мет-
2 Эт-
3 Прол-
4 Бут-
5 Пент-
6 Гекс-
7 Гепт-
8 Окт-
9 Нон-
Ю Д^-
Класс Суффикс
соединений названия
Алкан -ан
Алкен -ен
Алкадиен -диен
Алкин -ин
I Спирт -ол
Альдегид -аль
Кетон -он
Карбоновая -овая
кислота кислота
Амин -амин
Число Вид
связей гибрид и*
С-атома зации
3 х х С-атома.
х 3 л угол Меж-
S' .х .х дугибрид-
J g ° нымиор-
£ 4 ь биталями
4 - - sp3Z10Sf28‘
2 1 - SP2Z12O°
1 - 1 spZ180°
2 - spZ180°
МОЛЕКУЛЯРНЫЕ МАССЫ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
РАДИКАЛЫ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
-h -Cl -Br -ОН -NO, -NH, -сно -соон
СН3- метил- 16 50 95 32 61 31 44 60 92 |
С2Н5- этил- 30 65 109 46 75 45 58 74 106 I 120 I
С3Н7- пропил- 44 79 123 60 89 59 72 88
С4Нд- бутил- 58 93 137 74 103 73 86 102 134 ।
СН2=СН- винил- 28 63 107 - 73 43 56 72 104
СеН5- фенил- СН3СО- ацетил- 78 113 157 94 123 93 106 122 154
44 78 123 60 89 59 72 88 120
Получение органических веществ
из неорганических
гГ ж isk НС5СН с'н"
MaHSO4
сн,он
•4А1(ОН)3
увеличиться
или
уменьшиться
4^ - число С-ат. в результате реакции
увеличивается I может увеличиться
^3 - число С-ат. в результате реакции
уменьшается / может уменьшиться
££ - число С-ат. в результате реакции л
может «-9С. Г7
>4С
-зсо
А12О3
Общая формула
гомологического ряда
Общая формула гомологического ряда алканов: СпН2п+2
ВЛИЯНИЕ
НА ЧИСЛО Н-атомов
ФРАГМЕНТ ОРГАНИЧЕСКОЙ МОЛЕКУЛЫ
Цикл _________
двойная
тройная
одновалентный (Hal, Me*1 и др.)
Гетероатом двухвалентный (О, Me*2 и др.)
-2
-2
не влияет
трехвалвнтный 14 е аминах, Me” и др.)
Именные реакции
Бакеланда (св-ва фенолов (6)); Буво-Блана (св-ва сложных эфиров (5)),
Бутлерова (пНгС=О => CnHsnOn - смесь углеводов)-, Вагнера (св-ва ал-
кенов (6)); Вёлера (получ. алкинов (2)); Вильямсона (алкоголят + гало-
геналкан => простой эфир + MeHal); Вюрца (получ. алканов (4)); Вюр-
ца-Фиттига (получ. аренов (5)); Гелля-Фольгарда-Зелинского (св-ва
карб. к-т (7))\ Гольдшмидта (получ. карб. к-т (5(1))); Гофмана (получ.
аминов(2)); Густавсона (дигалогеналкан + Zn > циклоалкан + ZnHaty;
Дюма (получ. алканов (5)); Зелинского-Казанского (получ. аренов (1));
Зинина (получ. аминов (1, для анилина)); Канниццаро (CpHs HC-O =>
СеНв-СНгОН + СбН5-СООН); Кирхгофа (гидролиз крахмала: (CeHioOsjn +
+ пНгО => пСеНнОе); Кольбе (получ. алканов (6)); Коновалова (св-ва ал-
канов (2)); Кучерова (св-ва алкинов (4)); Лебедева (св-ва спиртов (9));
Меншуткина (св-ва аминов (2(6))); Сабатье-Сандерана (св-ва алкенов
(1,для этилена); Савича (получ. алкинов (3)); Удриса-Сергеева (получ.
фенолов (3(2))); Фишера-Тропша (получ. алканов (2)) . Фишера-Ш пай-
ера (св-ва спиртов (2)); Фокина (гидрогенизация жиров); Фриделя-
Крафтса (се-ва аренов (3)) © Дерябина Н.Е., 2003
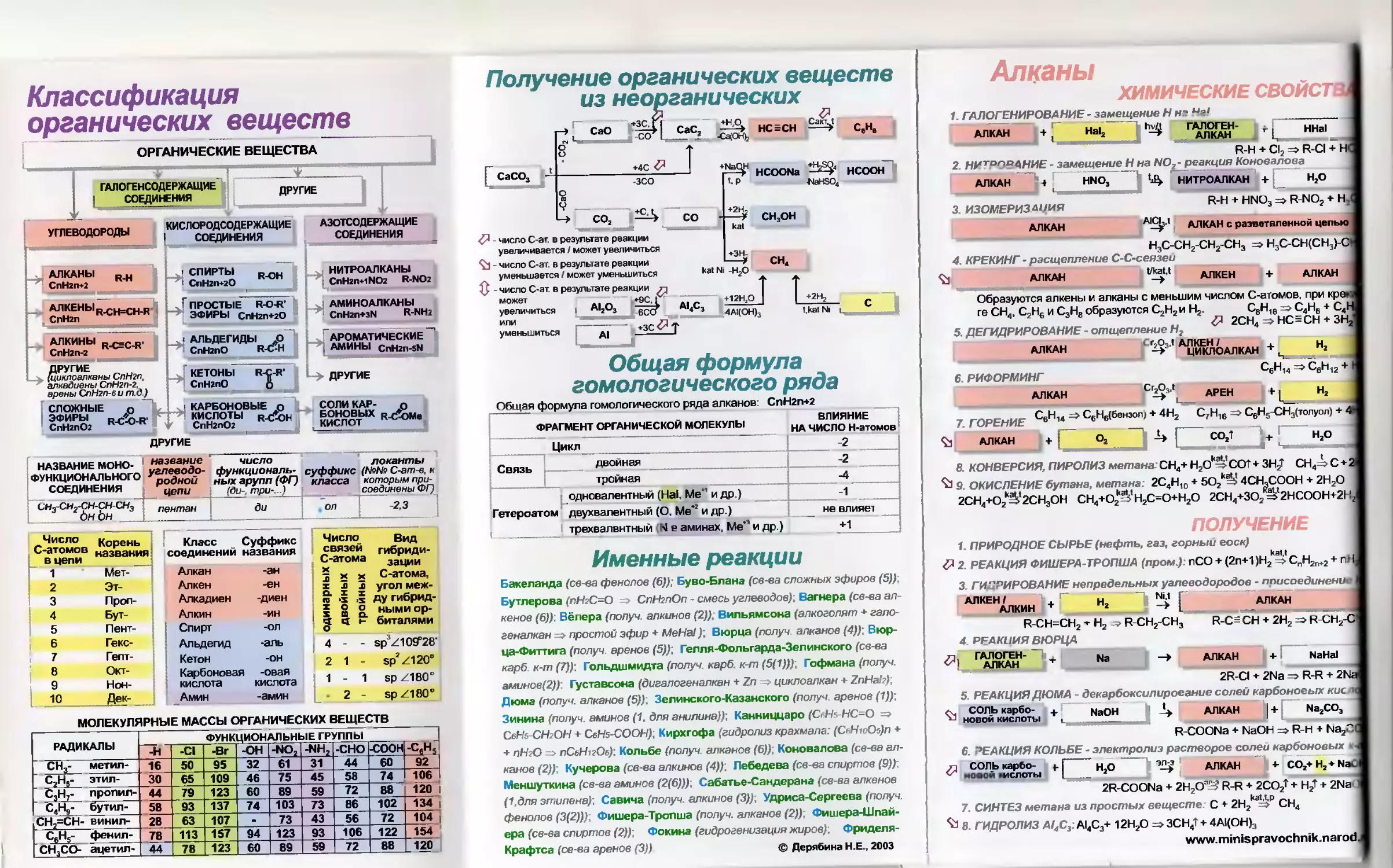
Алканы
ХИМИЧЕСКИЕ СВОЙСТВ
1. ГАЛОГЕНИРОВАНИЕ - замещение Н на Нг! __________
АЛКАН j+ Hal, I Г АЛКАН*’ г ННа1
R-H + Cl2 => R-CI + Н
2. НИТРОРАНИЕ - замещение Н на NOZ- реакция Коновалова
АЛКАН |-t [ UNO, 1 НИТРОАЛКАН + Н2О
3. ИЗОМЕРИЗАЦИЯ R-H + HND3 =>RNO? + н,
АЛКАН А1С^Л алкан с разветвленной цепью
Н3С-СН2-СН2-СН3 => Н3С-СН(СН3)-О
4 КРЕКИНГ - расщепление С-С-сеязеи
АЛКАН АЛКЕН + АЛКАН
Образуются алкены и алканы с меньшим числом С-атомов, при кре»ч
ге СН4, С2Н6 и С3НВ образуются С2Н2и Н2. СВН1В => С4НВ + С4Н
5. ДЕГИДРИРОВАНИЕ -отщепление Нг & ZCH< НС=СН + ЗН!
АЛКАН АЦИКЛОАЛКАН + ч Н»
6. РИФОРМИНГ СбН’4 э Ceh’2 + ’
АЛКАН СrZ$s '| АРЕН 1 Н,
7 ГОРЕНИЕ С6Н« => С6Н6(6внзол, + 4Н2 С7Н16 СвН5-СН3(толуол) + 4>
Ъ АЛКАН + [ О, | -U | С<\т У ' н;° j
8. КОНВЕРСИЯ, ПИРОЛИЗ метана. СН4+Н2Ока1> ССГ + ЗН2* СН41с+2
9. ОКИСЛЕНИЕ бутана, метана. 2С4Н10 + 5О2к^> 4СН.СООН + 2Н2О
2СН4+()2кй'2СН3ОН СН4+О2&'Н2С=О+Н2О 2СН4+ЗО2'э'2НСООН+2Нг
ПОЛУЧЕНИЕ
1. ПРИРОДНОЕ СЫРЬЕ (нефть, газ, горный еоск)
& 2. РЕАКЦИЯ ФИШЕРА-ТРОПША (пром.) пСО + (2п+1)Н2к5.‘спН2п+2 + пН
3. ГИДРИРОВАНИЕ непредельных уалеводородов - присоединения
АЛКЕН / . Г н N'J Г АЛКАН
АЛКИН + J | АЛКАН _
R-CH=CH2 -г Н2 ? R-CH2-CH3 R-C= CH + 2Н2 => R-CH2-C
4. РЕАКЦИЯ ВЮРЦА
<Я| ГАЛКАН<‘ -Г Na -> АЛКАН j + l NaHal
2R-CI ♦ 2Na Z R-R + 2Na
5. РЕАКЦИЯ ДЮМА - декарбоксилирование солей карбоновых кис д
ъ + , NaOH J АЛКАН
R-COONa + NaOH => R-H + Na2C(
6. РЕАКЦИЯ КОЛЬБЕ - электролиз растворов солеи карбоновых *-
л СОЛЬ карбо- *.[ н о эл£ ддкАН + CO,+ H,+ NaO
новом рислоты _____г __ 2 г 22
2R-COONa + 2Н2Оа=? R-R + 2CO2f + Н2Т + 2Na •
7. СИНТЕЗ метана из простых веществ: С + 2H2kat'>₽ СН4
Ъ 8. ГИДРОЛИЗ Д/4С3 А14С3+ 12Н2О => ЗСН„1 + 4АЦОН),
www.minispravochnik.narod.
Алкены
ХИМИЧЕСКИЕ СВОЙСТВА
1. ПАРИРОВАНИЕ- присоединение Н2_ I
АЛКЕН + [ Н, | tij! АЛКАН —Л
r-ch=ch2 + Н2 => R-CH2-CH3
2. ГАЛОГЕНИРОВАНИЕ присоединение На1г_
АЛКЕН +| Hal, 1 -♦ £ ДИГАЛОГЕНАЛКАН
R-CH=CH2+ Вг2 => R-CHBr-CH2Br (качественная)
3. ГИДРОГАЛОГЕНИРОВАНИЕ - присоединение ННа!
АЛКЕН + ННа! -> ГДЛОГЕНАЛКАН
R-CH=CH2 + НВг => R-CHBr-СНз
4. ГИДРАТАЦИЯ - присоединение Н-О
АЛКЕН + Н2О АЛКАНОЛ (одноатомный спирт)
R-CH=CH2 + НОН => R-CHOH-CH3
5. ПОЛИМЕРИЗАЦИЯ
& АЛКЕН (мономер)
ПОЛИАЛКЕН (полимер)
nH2C=CH2 => ( CH2-CH2-jn
6. ОКИСЛЕНИЕ в нейтральной/слабощелочной среде - р-ция ВАГНЕРА
АЛКЕН (О], Н2О(ОН~) КМ^°4 АЛКАНДИОЛ (двухатомный спирт)
R-CH=CH2 + [О] + Н2О => R-CHOH-CH2OH
7. ОКИСЛЕНИЕ в кислой среде
Ъ АЛКЕН * [О], Н,О(Н*) К^0< КАРБОНОВЫЕ К-ТЫ/КЕТОНЫ/СО,
При окислении кипящим R-CH=CH-R + [О]+ Н*=> R-COOH + R'-COOH
р-ром КМпО4 в кислой среде рвется двойная связь; в зависимости от ее
положения образуются карбоновые кислоты, кетоны или СО2.
8. ГОРЕНИЕ _______________ _ ___
<О| АЛКЕН |+ , о, J 1» | со,1 [ н,о
9. ОКИСЛЕНИЕ с kat PdCI„ СиС1,: 2СН2=СН2 + О2 2СН3-НС=О
2СН3-СН=СН, + О2каЬ 2СН3-С(О)-СН3
ПОЛУЧЕНИЕ Г
^3 1. КРЕКИНГ АЛКАНОВ (см. свойства алканое)
2 ГИПРИРОВАНИЕ алкинов или алкадиенов - присоединение Н2
[^Жадиен к Г L_
R-C=CH + Н2 => R-CH=CH2
3. ДЕГИДРАТАЦИЯ спиртов - отщепление Н2О
СПИРТ АЛКЕН | + I Н,О к I
L --- t >150 -J —
r-ch2-ch2oh r-ch=ch2 + Н2О
4. ДЕГИД°ОГАЛОГЕНИРОВАНИЕ галогеналканов - отщепление HHal I
+ NaOH (спирт.) -> АЛКЕН Е NaHal+ Н,О
AJ1ЛАП .
R-CH2-CH2CI + №ОН(спирт.) =9 R-CH=CH2 + NaCI + Н2О
5 । ~ГАЛОГЕНИРОВАииЕ дигалогеналканов - отщепление На12 .
ЯИйнЙнЕН’ * Zn/M9 -»• АЛКЕН + Z"Hab'MgHali
R-CHBr-CH2Br + Zn => R-CH=CH2 + ZnBr2
6. ДЕГИДРИРОВАНИЕ алканое - отщепление Н2
АЛКАН АЛКЕН___J+ Н,
R-CH2-CH2-R’ => R-CH=CH-R'+ Н2
Алкины
ХИМИЧЕСКИЕ СВОЙСТВА
1 Г И ip Mt 'I HiAHHI Ftt ^соединение H.
•" ► j Ц | АЛКЕН/АЛКАН j
И ( 1.1 Г • Н. R-CH=CH2 R-C=CH т 2Н2 => r-ch2-ch3
2 I AHMi I uni и/МПИ/ присоединение Нв'п _
Ж||Им|| . ц-1 к ДИГАЛОГЕНАЛКЕН /
АЛКИН ♦ Н-1, м ТЕТРАГАЛОГЕНАЛКАН
Hi iibit! К < Hi (HHi R-OCH+2Br2 => Н-СВг2-СНВг2(качеств.)
ПРАИИЛО МАРКСЖНИКОВА
I I|ih мри* пидинппии мпнокун HHal или H2O к нессиметричным алкенам и
ппнипым 11 «ним при! «1ПДИНЯО1СЯ к тому С-атому при кратной связи, кото-
рый < ми адм« Th и и шим чи< к >м Н-атомов [наиболее гидрогинезирован).
/ t tt/i rul AlllJI / ПИРОВАНИЕ-прист ••,/.// Д/lj/
АЛКИН ♦ HHal -> | ГАЛ°ГЕНАЛ1<Е,ЬиГАЛОГЕНАЛКАН
l/l ( 11 I I III. R CBr=CH2 R-C=CH + 2HBr => R-CBr2-CH3
4 I ИДРА I At 1ИН nput оодчнпние H2O - резки ня Ky tepoea
АЛКИН ♦ H,o HSj- Ацвтапьдагид'кетон
11ри (ииртлции < Н; обрвзувтся ацетальдегид СН3-СН=О, при гидрата-
ции дружм □имин ш обризукнся кетоны. R-C^CH + Н2О => R-C(O)-CH3
5 IU Н1ИМ11 ’И IA ЦИН
АЛКИН (м»мпмвр) ПОЛИАЛКИН (ди-, три-, полимер)
нн I .Пи1Л.н»пп) 2C^IZ Н2С СН-С=СН 3C2H2~>h2C=CH-(^C-CH=CH2
0 ОАрл ацмпипинидое - КИСЛОТНЫЕ СВОЙСТВА
(...*«ви".нИ) ' l*u(N".UOH -♦ ,[~НН3.Н,О
(А.ЛЙУХнИ! * I' "<N».),|CI I -» АЦЕТИЛЕНИД рГ NH,.NH4g^
I Ш|н| «уинцит и НС ‘CH + [Ag(NH3)2]OH R-C^C-Ag-i-*- 2NH3 + Н2О
|цп1инини;и.1 рдт К С CH + [Cu(NH3)2]CI -=> R-C=C-CuJ.+ NH3 + NH4CI
tun »Kiii и при доисгвии HCI с выделением исходного алкина.
7 OKMt ill НИ1
АМИН l<4. H,O КГ*°< КАРБОНОВЫЕ КИСЛОТЫ / CO,
I i ipt fiuiiiii nip* iMiuwi < «ин» и образуются карбоновые кислоты или СО2
(ы ни * мн ш и мн1цп цепи). R-C=C-R‘ + 3[О]+ Н2О =>R-COOH + R’-COOH
0 I ОЫ НИ!
ПОЛУЧЕНИЕ
1 KPf КИН1 < Ht и «во ближайших еомологое: 2СН4 => НС^СН + ЗН2
2 I ИД/ОНИ I (4С СвС?* 2Н2О НС^СН + Са(ОН)2
3 Д11 и нч>! AflOf f ПИРОВАНИЕ дигалогена^аное - отщепление HHal
ПИд*1"7[,' 11 I N.IMI (. пир,) -» АЛКИН т Г NaHal ♦ Н,о '
Ан>мы iniiiiin II < II Cl н + 2МаОН5спирт.) => R-C=CH + 2NaCI + 2Н2О
ид д<111И1|||«1 iiiikivin।i.< и у двух соседних, либо у одного и того же С-атома
4 АПКИНИРОПАНИ! «л пшленидое ____________
АЦ1 1ИП1НИД 4 'a!IkAUH АЛКИН NaHal
R-CsCNa + R‘ Cl => R-CsC-R’ + NaCI
Арены
ХИМИЧЕСКИЕ СВОЙСТВА
1 га поГЕНИРОВАНИЕ - замещение Н р.г е бензольном кольце
БЕ етУгомологУ Г ГАЛОГЕНАР^н] + HHal ||
У гомологов бензола замещается Н-атом C6H6+CI2 => C6H5-CI+HCi
у того С-атома, который находится С6Н5-СН3+С12 => С1-С6Н4-СН3+НС1
в орто-(2,6) или пара-(4) положениях по отношению к боковой цепи.
Нь'ТГЭВАНИЕ- замещение Н на NO?в бензольном кольце_
Ьее???о'молог + HNOjKOHlfl НИТРОАРЕН pl Н,О |
См. описание реакции 1. С6Н6 + HNO3 => C6H5-NO2 * Н2О
3. АЛКИЛИРОВАНИЕ । Ф, .деля-Крафтса) - введение радикала в кольцо
БЕНЗОЛ/ . ГАЛОГЕН- AlHal,. гомолог нн h
его гомолог + АЛ* АН 3 БЕНЗОЛА + |ц ННа| _
См. описание реакции 1 С6Н6 + СНЭО => С6Н5-СН3 + НО
4. ГИДРИРОВАНИЕ - присоединение Н2
БЕНЗОЛ/ . . н Nit ЦИКЛОГЕКСАН/
его гомолог + I п2 -> его гомолог
CfiHfi + ЗН? => С6Н12
5. ПРИСОЕДИНЕНИЕ CI х бензолу 6 2 6 _
БЕНЗОЛ El Cl2 ГЕКСАХЛОРЦИКЛОГЕКСАН
6. ЗАМЕН 1ЕНИЕ Н на Hal е боковой цепи СеНе + Зс12 => CsH<sa<i
БЕНЗОМ + Г На|. J ГАЛОГЕНАРЕН + HHal
Замещается Н-атом у того С6Н5-СН2-СН3+ Cl2=> С6Н5-СНС1-СН3 * НО
С-атома, который непосредственно связан с бензольным кольцом.
7 ОКИСЛЕНИЕ ____
гомолог ’ rm и* ЖМпО41 ароматическая , I ^7» о Ь
Ъ БЕНЗОЛА + 1°11Н -> КИСЛОТА + СО2 + Н2О
Гомологи бензола окисляют- С6Н5-С2Н5+6[О]=>С6Н5-СООН+СО2+2Н2О
ся, если есть хотя бы один атом Н у а-С-атома (связанного с кольцом).
а-С-атом окисляется до -СООН, а остальная боковая цепь до СО2 и HgO
г, (в нейтральной среде образуется соль кислоты и карбонат).
/ ОгЬНИЕ
ЗЕНЗОЛ/
его гомолог
ПОЛУЧЕНИЕ
1. ТРИМЕРИЗАЦИЯ АЦЕТИЛЕНА : ЗНС=СН CSJ С6Не(бензол)
2. ДЕГИЛРМР^ВАНИЕ циклических уалее^Апппдов - отщепление Нг
ЦИКЛОГЕКСАН / РЦ БЕНЗОЛ / . н
его гомолог ~> егогомол н 2
3. ДЕГИДРИРОВАНИЕ и ЦИКЛИЗАЦИЯC8Hlz => С6Н6* ЗН>
АЛКАН (6 и болов С-атомов) БЕ“°?0'м0лог + [ Н,
^6^14 С6Н6+ 4н2
ДЕКАРБОКСИЛИРОВАНИЕ солей ароматических кислот
СОЛЬ аромати- , N,nH к БЕНЗОЛ f . на со
< кой кислоты 4 NaUM -* его гомолог * «a2vw3
5 РЕАКЦИЯ ВЮРЦА-ФИТТИГА WOONa + №ОН C^^CO,
ГЖЕН- + Na k ГЖН- бЁЙзТл'а NaHal j
CeH5CI + 2Na + CH3CI => С6Н5-СН3 + 2NaCI
£16. АЛКИЛИРОВАНИЕ бензола и его гомологе - см. свойства аренов (3)
Спирты
ХИМИЧЕСКИЕ СВОЙСТВА
1. ЗАМЕЩЕНИЕ Н е ОН-группе на активны" Me
^[~~СПИРТ активный -» [ АЛКОГОЛЯТ I- Н,1
2ROH + 2Na =э 2RONa + Н2’
2. ЭТЕ°ИФИКАЦИЯ - образование эфира ь
СПИРТ |+ КИСЛОТА СЛЭФИР1И ? +1 Н,О j
3. ЗАМЕЩЕНИЕ ОН-группы на Hal ROH + R'COOH « RJCOOH + HjO
СПИРТ | а- [ HHal | <+ [ Г{Ж^Н" j-r | Н,О
ROH + НВг» RBr + Н2О
4. ВНУТРИМОЛЕКУЛЯРНАЯДЕГИДРАТАЦИЯ-отщепление НгО
СПИРТ АЛКЕН | *• I H?°
R-CH2-CH2On =» R-CH=CH2 + Н2О
5. МЕЖМОЛЕКУЛаРНАЯ ДЕГИДРАТАЦИЯ - отщепление Н20
СПИРТ j
ROH + ROH => ROR + H2O
6. ДЬГИДРИРОВАНИЕ - отщепление Н3
СПИРТ первичный^^р |ЧцЬй "ЛЬ | ^^^к^ОН 1 +
R-CH2OH => R-CH=O + Н2 R-CHOH-R R-C(O)-R’ + Н2
7. ОКИСЛЕНИЕ
СПИРТ "|+[~JO] j -> АЛЬДЕГИД/КАРБОНОВАЯ К-ТА^
Первичные спирты превращаются r_ch2OH +(О] С^>11 R-CH=O+H2O
в альдегиды, а затем в кислоты, +?fniK^°«R СООН+Н О
вторичные в кетоны, третичные не K-unzU oJkmS 2
окисляются без разрыва С-С связи. R-CHOH-R’+Й ’ => R-t(O)-R’+H2O
8. ГОРЕНИЕ _______
<^j| СПИРТ ~~| + [ I | СОаТ |+| Н>° |
9. РЕАКЦИЯ ЛЕБЕДЕВА :2C2H5OHZnQ^°3,tCH2=CH-CH=CH2 + Н2 + 2Н2О
10. КАЧЕСТВЕННАЯ реакция на МНОГОАТОМНЫЕ спирты с ОН-груп-
нами у соседних С-атомое: R-CHOH-CHOH-R’ + Си(ОН)2 =э> синий р-р
ПОЛУЧЕНИЕ
1. ГИДРАТАЦИЯ алкенов - присоединение Н2О ______________
АЛКЕН +1~ НаО | *4 £ СПИРТ
R-CH=Cm2 + Н2О R-CHOH-CH,
2. ВОССТАНОВЛЕНИЕ альдегидов и кетон™
АЛЬДЕГИД? н h Ni.t Г СПИРТ первичный/ .
КЕТОН | 2 L вторичным
R-CH=O + Н2 R-CH2OH R CfO)-^ + Н2 => R-CHOH-R’
3. ГИДРОЛИЗ галогеналканое __
r^J^H- + рлаОН(водн.) ' СПИРТ I1? " NaHal
RCI + МаОН(водн.) => ROH + NaCI
4. ГИДРОЛИЗ сложных эфиров e щелочной среде
СЛОЖНЫЙ . NaOH Ь -> СПИРТ + СОЛЬ карбо-
ЭФИР + Nauri VI win + новой кислоты
R-COO-R + NaOH => R’OH + RCOONa
5. Получение СН3ОН из СН4 и СО. 2СН4+О^ 2СН3ОН СО+2Н2а^>₽СН3ОН
^3 6. Синтез С2HSOH брожением глюкозы: С6Н12О^в₽*=>ТЬ12С2Н5ОН + 2СО2
Фенолы
ХИМИЧЕСКИЕ СВОЙСТВА
1. ЗАМЕЩЕНИЕ Н-ато^ оН-группе при взаимодействий с Me
<?[ ФЕНОЛ I- а'^^й [ФЕНОЛЯТ j+ ‘ Н,Т
Фенол - очень слабая кислота, 2С6Н5ОН + 2Na => 2C6H5ONa + Н2Т
поэтому феноляты разлагаются под действием даже угольной кислоты:
C6H5ONa + Н2О + СО2=> СеН5ОН +. NaHCO3
РЯД АКТИВНОСТИ (СИЛЫ) кислот
HNO3 > (СООН)2 > С13ССООН > HHSO3> CICHjCOOH > НСООН > С,НСООН >
>СН3СООН > С3Н,СООН > ННСО3 > С6Н5ОН > НСО3 > НОН > С2Н5ОН
Более сильные ки лоты вытесняют менее сильные из растворов их солей.
2. З.АМГ=ЩЕНИЕ Н-ат. в ОН-г руппе при в??.‘.содействии со щелочью
& Р ФЕНОЛ | + ЩЕЛОЧЬ -> [ ФЕНОЛЯТ Ь + [ Н2О |
СеН5ОН + NaOH => C6H5ONa + Н2О
3. ЭТЕРИФИКАЦИЯ - образе-гяг/е сложных эфиров _
л! dveunn ’ а. ГАЛОГЕН- v 1 СЛОЖНЫЙ . . г нн_.
<?| ФЕНОЛ Г АНГИДРИД ЭФИР 4 ННа|
С6Н5ОН + СН3-С(О)-С1 => СН3-СОО-С6Н5 * HCI
4. ГАЛОГЕНИРОВАНИЕ замещение Н- ь - Н. нзольного кольца на Hal
। ФЕНОЛ 4&WhS?F|*[~ Н» 1
Замещается Н-атом у того С-атома, С6Н5ОН + Cl2 => С1С6Н4ОН + НО
который находится в орто-(2,6) или пара-(4) положении к ОН-группе.
rt\Cunn а. ' Rr У 2,4,6-ТРИБРОМ , ltd. I
ФЕНОЛ 4 вг? —* 1 ' ФЕНОЛ 4 НВ| 1
Обесцвечивание бромной воды и С6Н5ОН + 3Br2 => C6H2Br3OHi+ ЗНВг
выпадение белого осадка С6Н2Вг3ОН - качественная реакция на фенол.
5. НИТРОВАНИЕ - замещение Н-атомое бенюльноао кольца на NO2
1 ФЕН0Л HNC>i i гЛбфЕНОЛТР0' + Н*°
С6Н5ОН + 3HNO3 => C6H2(NO2)3-OH + ЗН2О
6. ПОЛИКОНДЕНСАЦИЯ фенола с формам , г .. до* i
<?[ ФЕНОЛ~ t[7 Н;С°° формальдегидная Н*° I
7. ВОССТАНОВЛЕНИЕ фенола С6Н5ОН + 2[Н]Ы|Л> JC6H6 + Н2О
С6Н5ОН*ЗНг СеН„ОН
в. ОКИСЛЕНИЕ С6Н5ОН + [О] => различные в-ва (при горении СО2и Н2О)
9. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА фенол: С6Н5ОН+РеС13 = фиолетовый р-р
ПОЛУЧЕНИЕ
1. ИЗ ГАЛОГЕНАРЕНОВ
ГАЛОГЕНАРЕН i L NaOH -> , ФЕНОЛ н NaHal |
« -а. . C.H.CI+ NaOH => С.Н.ОН + NaCI
2. ИЗ ФЕНОЛЯТОВ (солеи фенола) 6 5 5
1 ФЕНОЛЯТ j <' HCI | -» ФЕНОЛ +[ MeClx
C6H3ONa + HCI C6H5OH + NaCl"
I 3. КУМОЛЬНЫЙ СПОСОБ: 1) C6H6+ CH3-CH=CH, => С6Н5-СН-(СН3)2 (кумол)
I 2) С6Н5-СН-(СН3)2 + о2нк§>< С6Н5ОН + СН3-С(О)-СН3
БЕНЗОЛ И ЕГО
ПРОИЗВОДНЫЕ
(тривиальные
названия)
Альдегиды, кетоны
ХИМИЧЕСКИЕ СВОЙСТВА
' ~^МНЕНИЕ __ _______
АЛЬДЕГИД/ + и Ni.t * СПИРТ первичный/
КЕТОН I _ 2 I -* 1_ СПИРТ вторичный
R-CH=O + Н2 => R-CH2OH R-C(O)-R' + Н2 , R-CHOH-R’
2. ОКИСЛЕНИЕ Aq?O - реакция “серебри ,ч ириала" (качественная)
АЛЬДЕГИД + [Ag(NH,);]OH -> „“ЖЬ«рво^, ( АЯЬ»Н,.Н,О
R-HOO + 2[Ag(NH3)2]OH => R-COONH4t 2Agr+ 3NH + Н2О
Сокращенное уравнение: R-HC=O + AgzO,^’R-COOH + 2Agl
3. ОКИСЛЕНИЕСи(ОН)2(качественная1
г АЛЬДЕГИД ^ г~ CujoHh | *» ' Кислота”1 *• с^от-и.о"
R-HC=O+2Cu(OH)2 => R-COOH+2CuOH+HjO / 2CuOH => Cu2O.+ HZO
(голубой) (желтый) (красный)
4. ОКИСЛЕНИЕ сильными окислителями (КМпО4, К,Сг2О7 и др.) __
АЛЬДЕГИД ],+ | |О] | КАРБОНОВАЯ КИСЛОТА
Д, ЗАМЕЩЕНИЕ О-атома на 2 атома Hal Й-6Н=О + [О] > RCOOH
I АЛЬД6гкиДон + РНа|» | Й“ЯЕН' Г~ POHal, |
R-CH=O + PCI5=> R-CHCl2+ РОС1э R-C(O)-R’+ РВг5=> R-CBr2-R + POBr3
f -ЦИНЕНИЕ HCN. NaHSO3 ____________________
АЛЬДЕГЖон + HCN1 NaHSO —> продукты присоединения
R-HC=O + HCN R-HC(OH)-CN R-HC=O + NaHSO3 R-HC(OH)-SO3Na
7. ПОЛИМЕРИЗАЦИЯ ______________________________________
АЛЬДЕГИД (мономер) ~| —> Г ПОЛИ АЛЬДЕГИД (три-, полимер)
t , .•45 пН2С=О => (-СН2-О-)п полиформальдегид (параформ)
+ ГТI <4-Г н^° ~
9. ПОЛИКОНДЕНСАЦИЯ формальдегида и фенола: см. свойства фенола
ПОЛУЧЕНИЕ
1. ГИДРАТАЦИЯ алкиное - присоединениеН,О
АЛКИН +В Н2О Ацетальдегид / КЕТОН
См. свойства алкинов. R-C=CH + НОН -> R-C(O)-CH3
2. ДЕГИДРИРОВАНИЕ спиртов - отщегяайу? и
СПИРТ первичный/ чнь,й АЛЬДЕП^/^ * Н2Т
R-CH2OH => R-CH=O + Н2 R-CHOH-R’ => R-C(O)-R + Н2
3 миСЛЕНИЕ спиртов ______
СПИРТ первичный/ +. CuO t АЛЬДЕГИД / + Си + н о
I вторичный ..в ~* t„ КЕТОН JT i _ j .4
R-CH2OH+CuO=>R-CH=O+Cu+H2O / R-CHOH-R'+CuO-=>R-C(O)-R’+Cu*H2O
4. ГИДРОЛИЗ дигал'' “'чалканов
I ПИАГи<АНЕН" *• NaOH<B°«H) -> АЛЬДЕГЖн + NaHal>H,O
Если оба атома Hal на- R-CHCI2+NaOH(eoflM.) => R-HC=O+NaCI+H2O
ходятся у первичного Р-СС12-Р’+№ОН(водн) => R-C(O)-R'+NaCI+H?O
С-атома, образуются альдегиды, у вторичного С-атома - кетоны.
5. ПОЛУЧЕНИЕ Н2С=О окислением CHt: СН,+ О^1 Н2С=О + Н2О
6. КУМОЛЬНЫЙ СПОСОБ получения ацетона: см. получение фенола (3)
7. ОКИСЛЕНИЕ алкенов 2СН2=СН2+ О2 S22CH3-HC=O см. св-ва алкенов (9).
8. ТЕРМОЛИЗ кальциевых солей: (RCOO)2Ca => R-C(O)-R + СаСО3
Карбоновые кислоты
ХИМИЧЕСКИЕ СВОЙСТВА
1 Н?ЛИМПДРИСТВИЕ С активными Me
ул КАРБОНОВАЯ . МЕТАЛЛ СОЛЬ карбо- . J 37 Ъ
КИСЛОТА »«тм1мый новой кислоты 2
2RCOOH + Zn => (RCOO)2Zn + Н2Т
2. ВЗАИМОДЕЙСТВИЕ г г>'"ыпяаниями и п^нояныму оксидами
ул КАРБОНОВАЯ лгиг|рлп1лр __ь СОЛЬ карбо- j, НО I
<< КИСЛОТА * , ОСНОВАНИЕ -> новой KMC7iOTbl + |
П КАРБОНОВАЯ . ОСНОВНОЙ”* _> СОЛЬ карбо” . ы О
КИСЛОТА F ОКСИД новой кислоты 2 !
RCOOH + КОН • RCOOK + Н2О 2RCOOH + MgO => (RCOO)2Mg + Н2О
3. ВЗАИМОДЕЙСТВИЕ с солями более слабых кислот
ул КАРБОНОВАЯ СОЛЬ более ____х СОЛЬ карбо- » кмепотл
КИСЛОТА ъ слабой кислоты новой кислоты * khvjiwim
RCOOH + NaHCO3 => RCOONa т H2O + CO2t
I । । и . КАЦИЯ - образование сложного -yrbi 4а __
г, КАРБОНОВАЯ . гпмрт н> СЛОЖНЫЙ . ‘ н о Ь
КИСЛОТА + | СПИРТ ЭФИР + Н2и
RCOOH + R’OH о RCOOR’-r Н2О
5. МЕЖМОЛЕКУЛЯРНАЯ ДЕГИДРАТАЦИЯ - отщепление HQ
ф КАРБОНОВАЯ КИСЛОТА tJ^5. АНГИДРИД Р |~
Н-
2RCOOH ь (RCO)2O + Н2О
POHalj* HHal I
Н3РО3/SOz+HCI
3RCOOH+PCI3 => 3RCOCI+H3PO3
6. ЗАМЕЩЕНИЕ ОН-группы ча Hal
КАРБОНОВАЯ
КИСЛОТА
PHal,/
* PHal, / SOCL
> ГАЛОГЕН-
АНГИДРИД
RCOOH+PCI5 > RCOCI+POCI3+HCI
RCOOH+SOCI2 => RCO-Cl+SO2+HCI
7 3AMFIUFHME Н-атома у и-С-атома на Hal
КАРБОНОВАЯ Г щы I РКР ГАЛОГЕНКАРБО- . нн_. I
КИСЛОТА 1 2 НОВАЯ КИСЛОТА + ииа|
Атомы водорода у u-C-атома R-CH2-COOH+8r2 => R-CHBr-COOH+HBr
(соседнего с С-атомом ФГ) R-CH2-COOH+2Br2 => R-CBr2-COOH+2HBr
замещаются на атомы Hal с образованием а-галогенкарбоновых кислот.
Я ГПРРНИР
к«^я -1 | ГГ^О" I Н;О
9. ВОССТАНОВЛЕНИЕ: RCOOH + 4[H]L'I"HIJRCH.OH + Н2О
10. ОСОБЫЕ СВОЙСТВА муравьиной кислоты Н-СООН:
1) НСООН + Ад?О -5"2Ад1 + СО/ + Н2О;
НСООН + 2Си(ОН)2 => Си2О. + СО/ + Н2О;
2) НСООН COt+Н2О; 3) НСООН + О2 => CO/+HCI;
4) не образует ангидрида, самая сильная в своем гомологической ряду.
ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ R-С^ЭН
Г f Т Т Т J
СОЛЬ СЛОЖНЫЙ АНГИДРИД ГАЛОГЕН- АМИД НИТРИЛ
карбоновой ЭФИР карбоновой АНГИДРИД
кислоты кислоты q
R-C^Na R-C^S-R’ R-C^ R-C^Sal R-C?NH2 R-C=N
Карбоновые кислоты
ПОЛУЧЕНИЕ
1. ОКИСЛЕНИЕ углеводородов
АЛГОМО/ЛОГКБЕНЗОЛАИН 1 [Оу КАРБОНОВАЯ КИСЛОТА
Алканы окисляются с ката- RCH2CH2R'+ О2 => RCOOH + R’COOH + Н2О
лизаторами с образованием смеси карбоновых кислот. Окисление ос-
тальных углеводородов - см. св-ва алкенов, алкинов, аренов.
2. ОКИСЛЕНИЕ спиртов, альдегидов ь _
[ СПИРТ первичный / АЛЬДЕГИД КАРБОНОВАЯ КИСЛОТА
R-CH2OH + 2(0] R-COOH + Н2О R-CH=O + [О] => R-COOH
3. ГИДРОЛИЗ про1>ггс^нь1я нзрбоновыхю^стт __
СЛОЖНЫЙ ЭФИР / АНГИДРИД Г HjO КАРБОНОВАЯ КИСЛОТА
ГАЛОГЕНАНГИДРИД / АМИД / СОЛЬ -> КАРБОНОВАЯ КИСЛОТА
Кислотный гидролиз сл. эфиров: RCOOR’+ Н2О RCOOH + R’OH
Щелочной гидролиз сл. эфиров: RCOOR' + КОН => RCOOK + R’OH
Гидролиз ангидридов: (RCO)2O + Н2О => 2RCOOH
Гидролиз галогенангидридов: RC(O)CI + Н2О => RCOOH + HCI
Гидролиз амидов: RC(O)NH2 + Н2О + НО => RCOOH + NH4CI
Гидролиз солей карбоновых кислот: RCOOK + НО => RCOOH + КО
4. ГИДРОЛИЗ тригалогеналканое
I ТРИАЛКАНГЕН’ + МаОН(вОДн.Г -» , +; №На| + Н,О
Тригалогеналкан должен содержать все три атома Hal у одного С-атома.
R-CCI3 + 3№ОН(водн.) => R-COOH (R-COONa) + 3NaC1 + Н2О
5. Получение НСООН и СН,СООН: NaOH + СО'4 HCOONa э НСООН
2CH„+3O2IJS 2НСООН + 2Н2О <^2С,Н,„+ 5О2'*§ 4СН3СООН + 2Н2О
2С2Н5ОН + 2О^еР“вН,2СН3СООН + 2Н О СН,ОН + СО “ СН3СООН
13 6. Получение молочной и масляной к-т С6Н12(^Р“РН5СН3СН(ОН)СООН
брожением глюкозы: Сбн,2С?в^,*Ь3Н7СООН ♦ 2СО2 + 2Нг
Сложные эфиры
ХИМИЧЕСКИЕ СВОЙСТВА
1. Кислотный гидролиз: R-COO-R + Н£) RCOOH + R’OH
2. Щелочной гидролиз: R-COO-R’ + NaOH RCOONa + R’OH
О 3. Переэтерификация-алкоголиз. R-COO-R’ + R”OH <=> RCOOR" + R’OH
3 4. Переэтерификация-ацидолиз: R-COO-R’ + R"COOH<t>R”COOR’+RCOOH
5. Восстановление: R-COO-R’ + [H] => RCH2OH + R’OH
6. Образование амидов: R-COO-R‘ + NH3 => R-C(O)-NH2 + R’OH
Реакция этерификации, взаимодействие: j 1 ' УМЕА/1
а) карбоноеой кислоты co спиртом: RCOOH + R’OH <=> RCOOR' + H2O
ф б) ангидрида к-ты co спиртом: (RCO^O + R’OH => RCOOR’ + RCOOH
в) хлорангидрида к-ты co спиртом: R-C(O)-CI + R’OH => RCOOR’ + HCI
г) хлорангидрида с алкоголятом: R-C(O)-Cl + R'ONa => RCOOR' + NaCl
Соли карбоновых кислот
ХИМИЧЕСКИЕ СВОЙСТВА
'£11. Декарбоксилирование: R-COONa + NaOHc=> R-H + Na2CO3
2. Термическое разложение солей Саг (R-COO)/3a => R-C(O)-R + СаСОз
3. Термическое разложение солей NH«. R-COONH4=> R-C(O)-NH2 + H/D
4. Образование ангидридов R-COONa + R’-C(O)-CI =>R-C(O)-O-C(O)-R'+NaCI
5. Электролиз (реак. Кольбе): 2R-COONa + 2H2O3=>3R-R + 2СО2+ Н2+ 2NaOH
\мины
ХИМИЧЕСКИЕ СВОЙСТВА
1~ВЗ&имОДЕЙСТВИЕ С КИСЛОТАМИ (кроме HNO,)_______________
АМИИ 1 КИСЛОТА —| -> СОЛЬ АМИНА
Соли превращаются в амины RNH? ♦ HCI => [RNHJCI
под действием щелочей. [RNHJCI + NaOH Ь RNH2T+ NaCI + Н2О
2. АЛКИЛИРОВАНИЕ змииое
АМИН + ГДЛКАНН ) “> Г СОЛЬ АМИНА
Амины реагируют с гапогеналканами,
образуя соли аминов более высокой
степени замещенности и четвертич-
ные аммониевые соли. Практически
получается смесь солей аминов, из
которых амины выделяют под дейст-
вием щелочи и разделяют перегонкой.
RNH2 + RCI => [R2NH2]CI
RNH2 + 2RCI => [R3NH]CI + HCI
RNH2 + 3RCI => [R4N]CI + 2HCI
R2NH + RCI => [R3NH]CI
R2NH + 2RCI => (R4N]CI + HCI
R3N + RCI => [R4N]CI
3. ВЗАИМОДЕЙСТВИЕ С АЗОТИСТОЙ
j АМИН |+ | HNOa I ->
КИСЛОТОЙ (качественная)
Г продукты взаимодействия
Азотистую кислоту получают: NaNO2 + HCI - HNO2 + NaCI
Первичные амины с HNO2: RNH2 + HNO2 => ROH + N2t + H2O
Вторичные амины c HNO2: R2NH + HNO2 => R2N-N=O + H2O
Третичные амины c HNO2 не реагируют. нитрозоамин
C6H5NH2 + HNO2 + HCI => [C6H5-N=N]*Cr+ 2Н2О
соль диазония
Анилин
4. ГОРЕНИЕ
5. ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ нерастворимых оснований
АМИНОАЛКАН +' СОЛЬ -» СОЛЬ АМИНА И н°С»?в%»йос
3RNH2 + FeCI3 + ЗН2О -=> 3[RNH3]Cl + Fe(OH)3l.
6. ГАПГ,ГЕ ПИРОВАНИЕ - замещение Н-ат. бензольного кольца на Hal
~ АНИЛИН Г Вга | -♦ мд» | +1 НВг~~~~~||
Под действием бромной воды C6H5NH2+ ЗВг2=> C6H2Br3NH2-i+ ЗНВг
образуется белый осадок триброманилина (качеств).
7. ОКИСЛЕНИЕ анилина (кач.): C6H5NH2+ СаОС12 => фиолетовый раствор
ПОЛУЧЕНИ
1. ВОССТАНОВЛЕНИЕ нитросоединений
'НИТнениеЕД,,'|+ | И I -♦ Р I нго |
Так получают
первичные
аминоалканы
и анилин.
RNO2+ ЗН2*^ RNH2 + 2Н2О
RNO2+ 3Zn(Fe) + 7HCI => RNH3CI + 3ZnCI2(FeCl2) +2H2O
RNO2+ 2AI + 2NaOH + 4H2O _> RNH2 + 2Na[AI(OH)4]
RNO2+ 3(NH4)2S => RNH2 + 3S *6NH3 + 2HZO
2. АЛКИЛИРОВАНИЕ аммиака и аминов (см. еыше) - реакция Гофмана
| I <- Г аШОТЕрЮ -» СОЛЬ АМИНА
Соли превращаются в амины NH3 + RCI => [RNHJCI
под действием щелочей. [RNHJCI + NaOH Л RNH2 + NaCI + Н2О
3. ВОССТАНОВЛЕНИЕ нитрилов
АМИН
R-CSN + 4[H]li|"HJR-CH2-NH2
Качественные реакции
органических соединений
ФРАГМЕНТ МОЛЕКУЛЫ РЕАКТИВ, ПРИЗНАКИ
(реакционный центр) СХЕМА РЕАКЦИИ РЕАКЦИИ
>с=с< -с=с- бромная вода (р-р Вг2 в Н2О) (см св-ва алкенов (2), алкинов (2)) КМлО4 обесцвеч-ие р-ра обесцвеч-ие р-ра
(св-ва алкенов (6,7), алкинов (7))
-с=сн [Ag(NH3)2]OH (св-ва алкинов (6)) [Cu(NH3)2]CI (св-ва алкинов (6)) I J белый | | 4-Крисно-коричн.
О HNO3, H2SO4 (св-ва аренов (2)) св.-желт. маслянис- тая ж-ть с запахом горького миндаля
КМпО4 (св-ва аренов (7)) обесцвеч-ие р-ра
-он Na св-ва спиртов (1).фенолов (1)) тс£5
-СН2-ОН >сн-он СиО (св-ва спиртов (7)) I
КМпО4 (св-ва спиртов (7)) К2Сг2О7 (св-ва спиртов (7)) обесцвеч-ие р-ра сине-зеленый р-р
-С(ОН)-С(ОН)- Си(ОН)2 (св-ва спиртов (10))
он лакмус
FeCI3 (св-ва фенолов (9)) бромная вода (Вг2 в Н2О) (св-ва фенолов (4))
0 обесцвеч-ие р-ра J белый '
[Ag(NH3)2]OH (св-ва альдегидов (2) | | ^серебр. зеркало I
Си(ОН)2 (св-ва альдегидов (3)) | J
-С -Н КМлО4, Н* (св-ва альдегидов (4)) К2Сг2О7, Н’ (св-ва альдегидов (4)) обесцвеч-ие р-ра сине-зеленый р-р
лакмус 1
X) -сон NaHCO3 (св-ва карб. к-т (3)) Na (св-ва карб. к-т (1)) спирт (св-ва карб. к-т (4)) запах сложи, эфира
nh2 бромная вода (Вг2 в Н2О) (св-ва аминов (6)) | обесцвеч-ие р-ра j белый J
СаОС12 (св-ва аминов (7))
хромовая смесь 4, черный 1
HCI конц. (св-ва аминов (1)) | ч- белый
r-nh2 HNO2 (св-ва аминов (3))
r2-nh HNO2 (св-ва аминов (3)) характерный запах
(C6H10O5)n - крахмал р-р 12
❖° -C-NH- CuSO4, NaOH (биуретовая реакция)' фиолетовое окр»ш
Характер пламени при горении
Алканы, спирты одноатом., сложные эфиры - бесцветное (голубое) пламя.
Алкены - коптящее (светящееся) пламя ♦ витого цвета
Арены, высшие карбоновые кислоты, жиры - коптящее пламя
Алкины - сильно коптящее пламя.