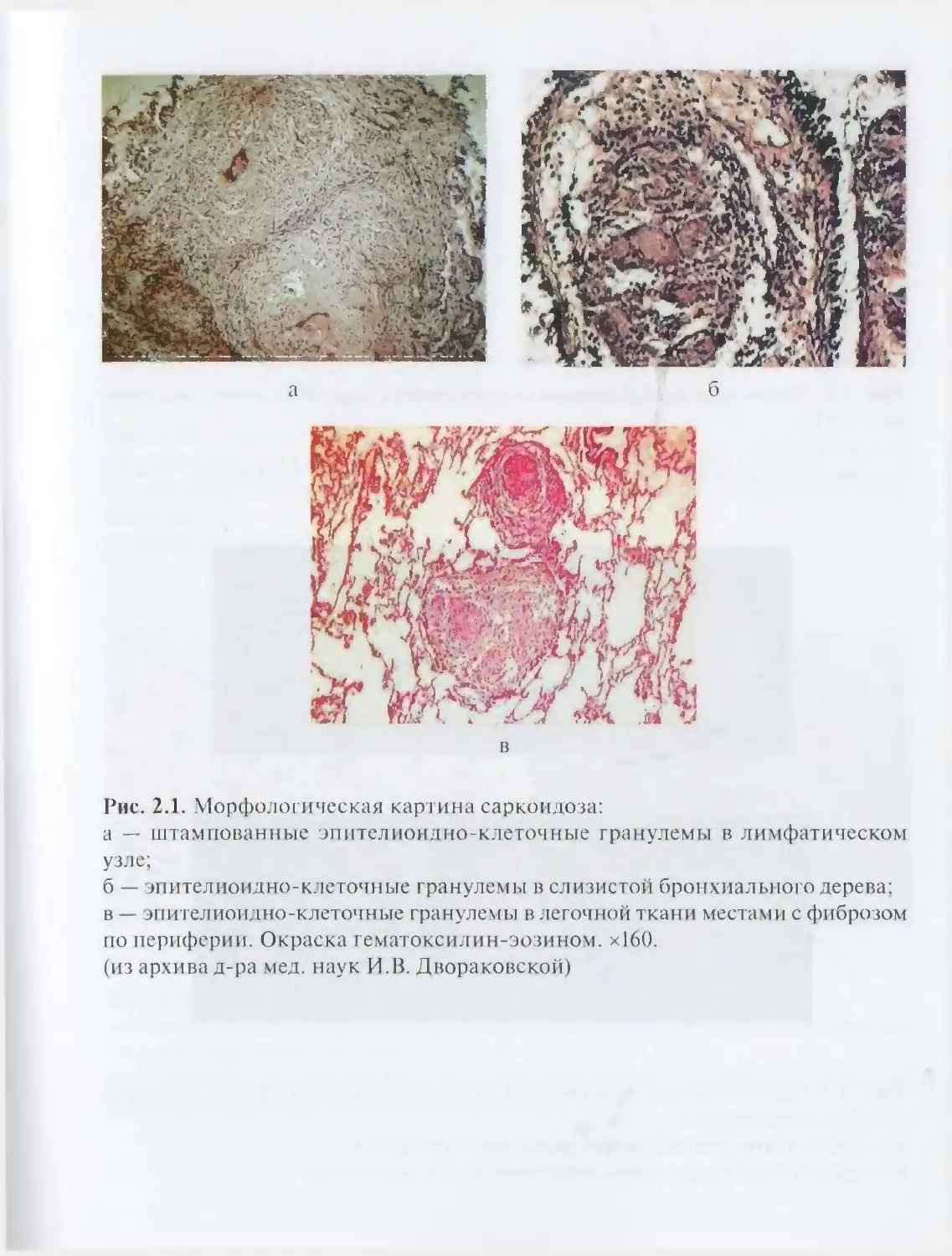
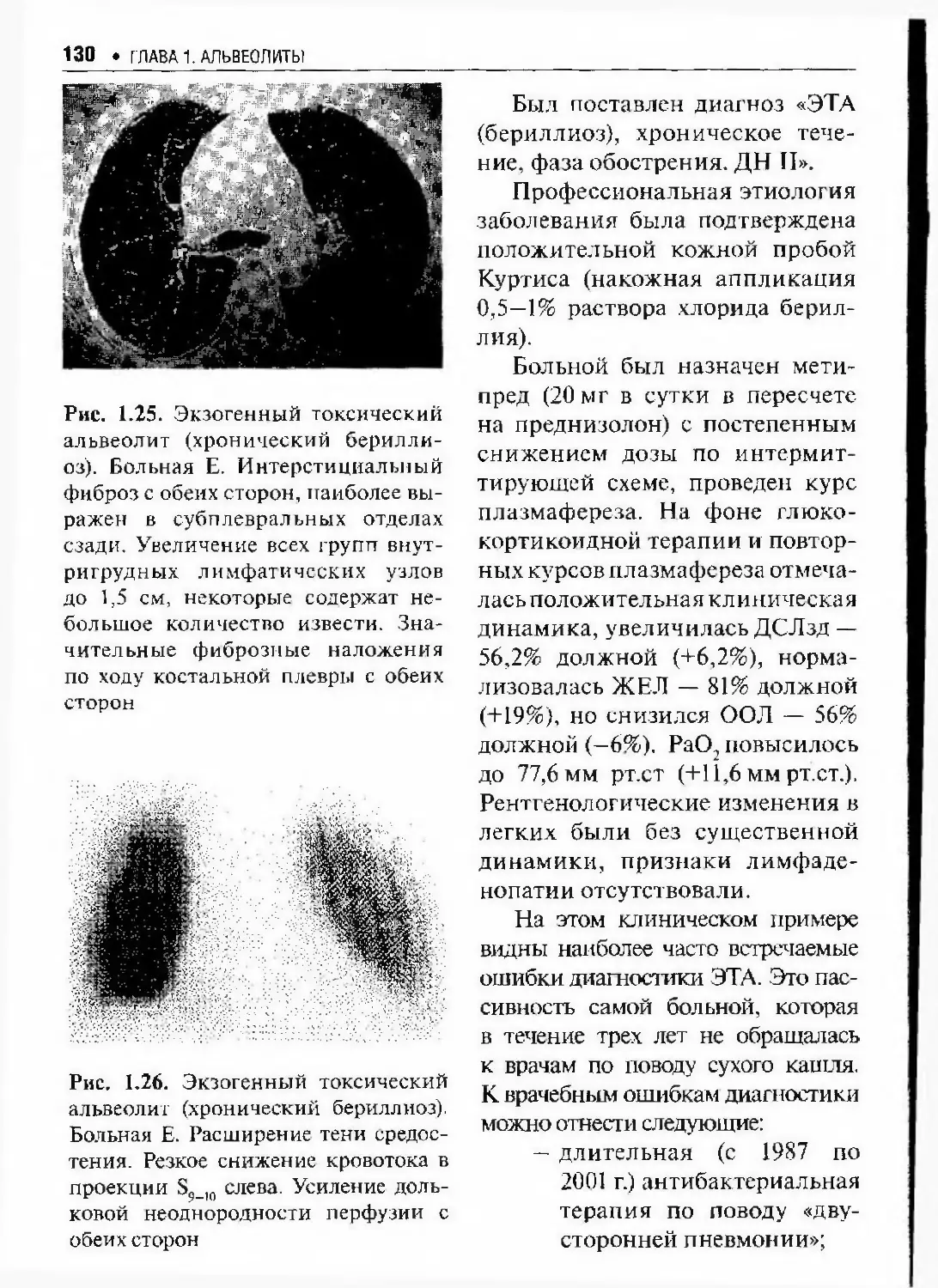
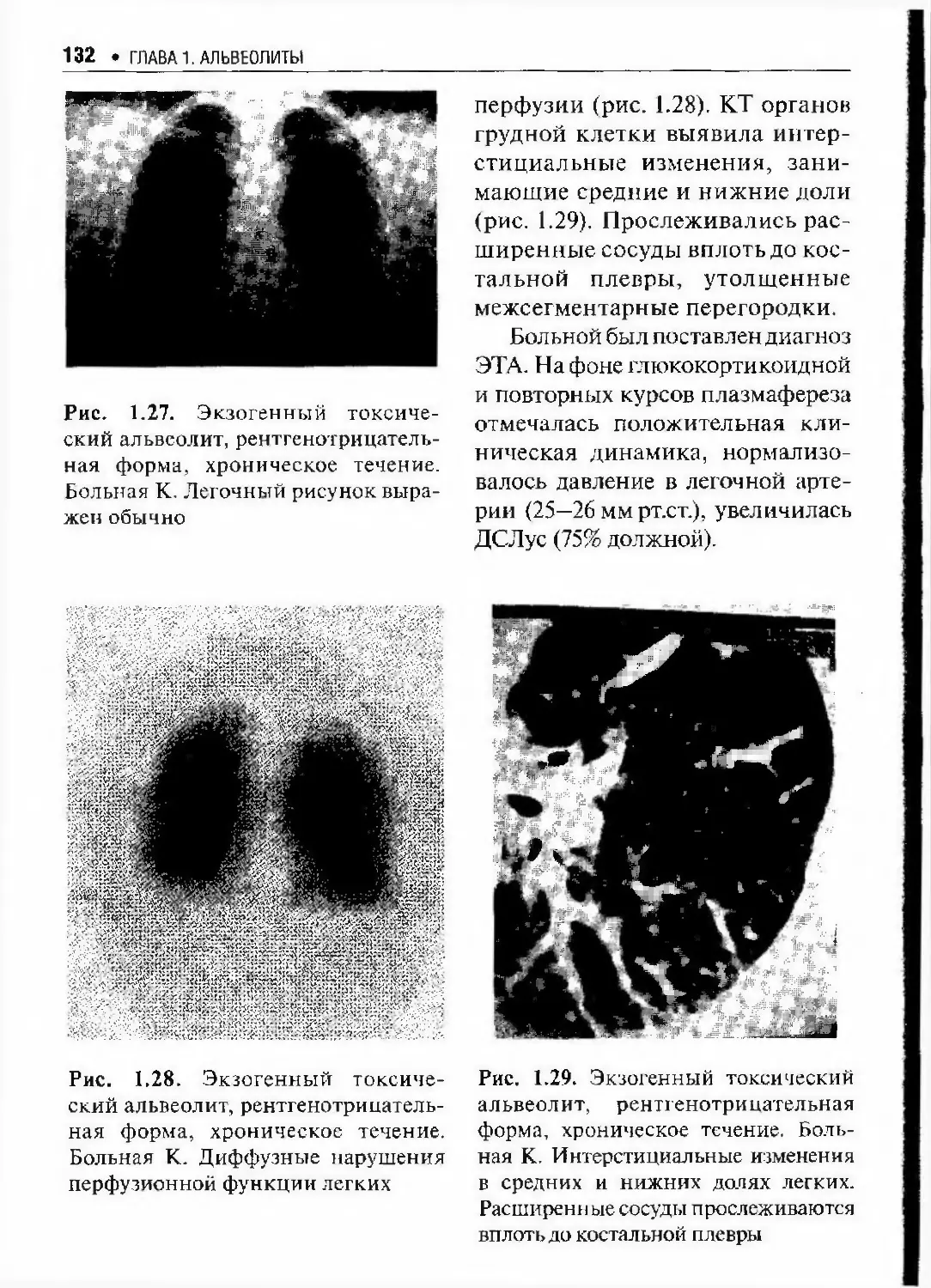
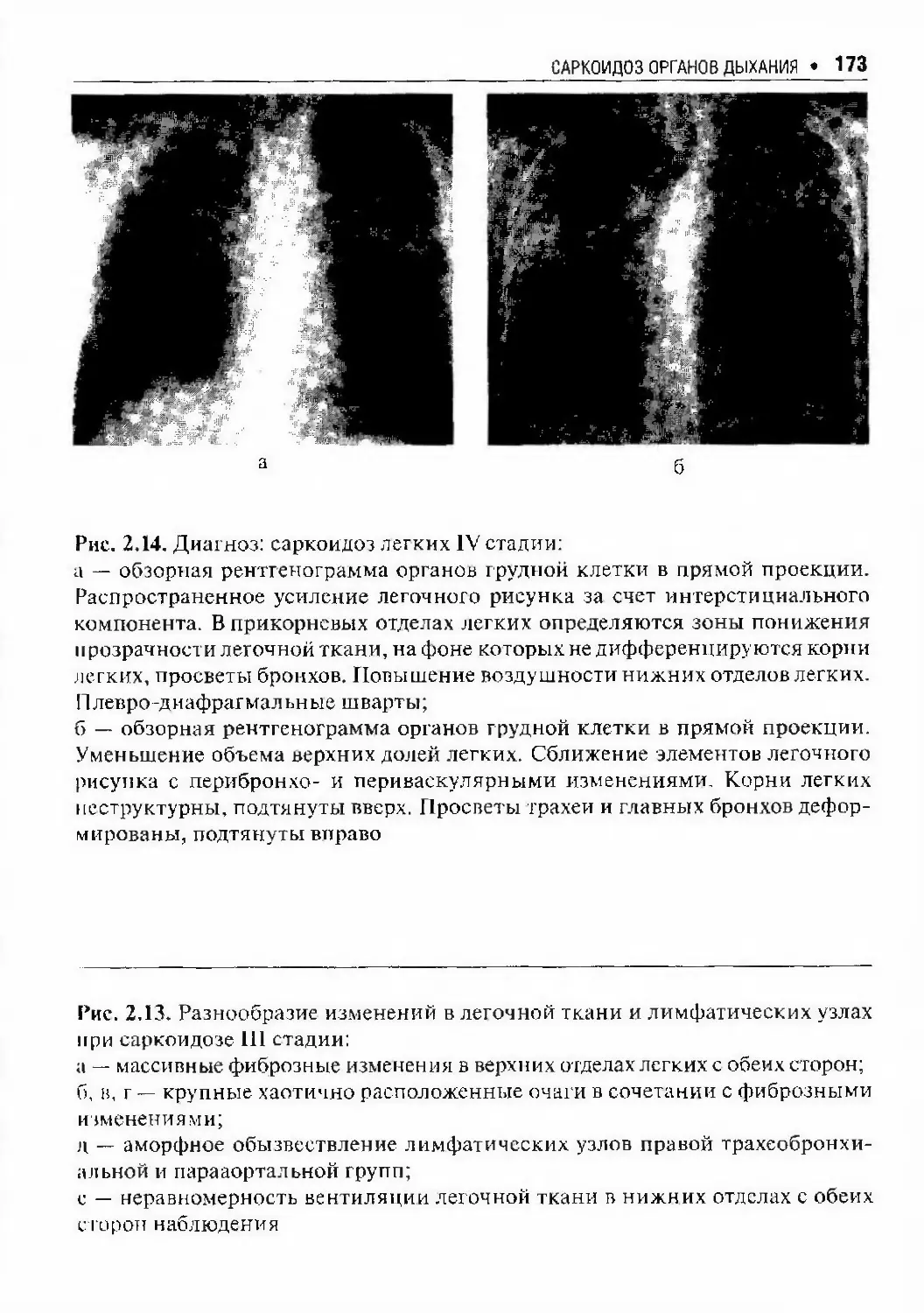
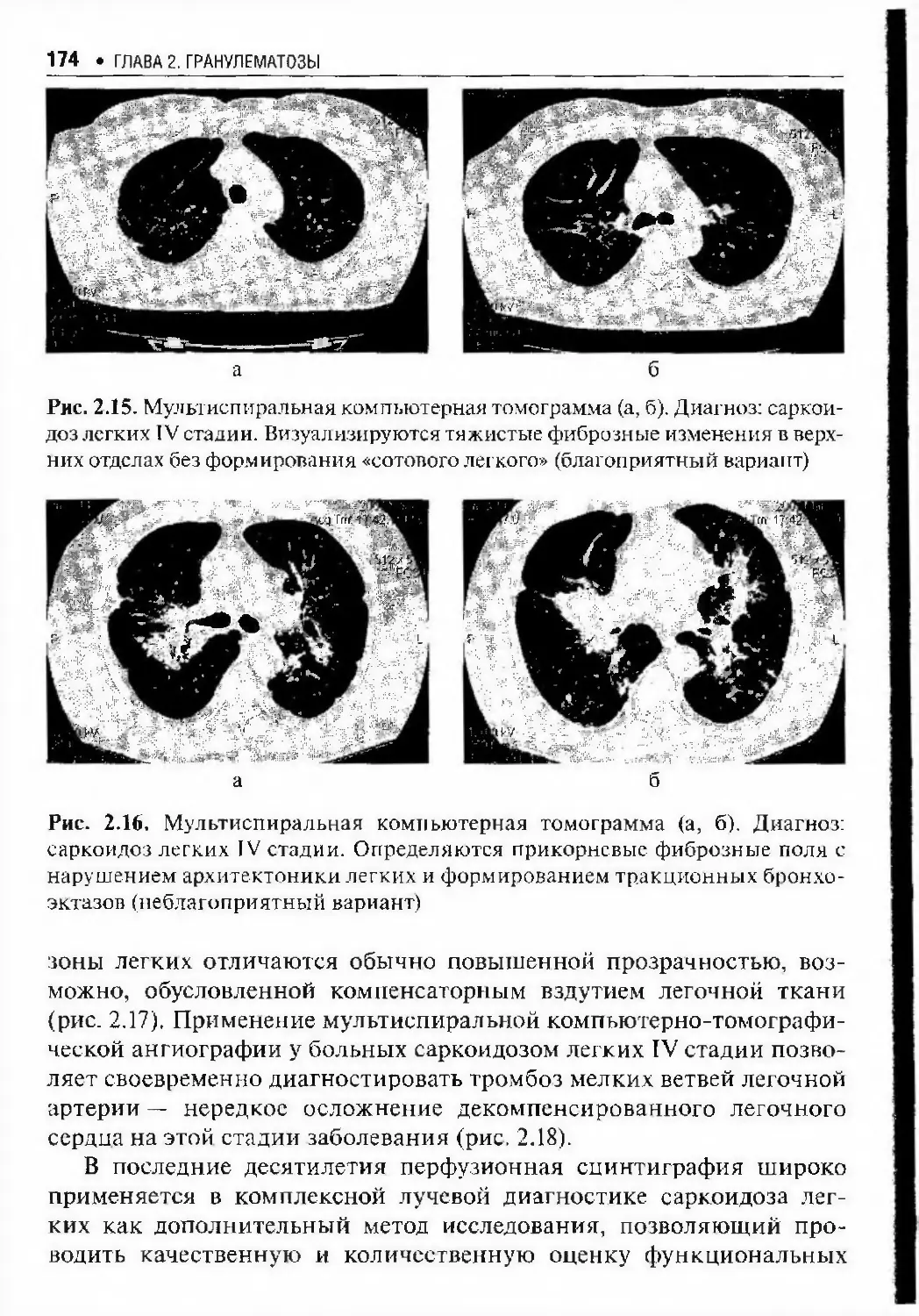
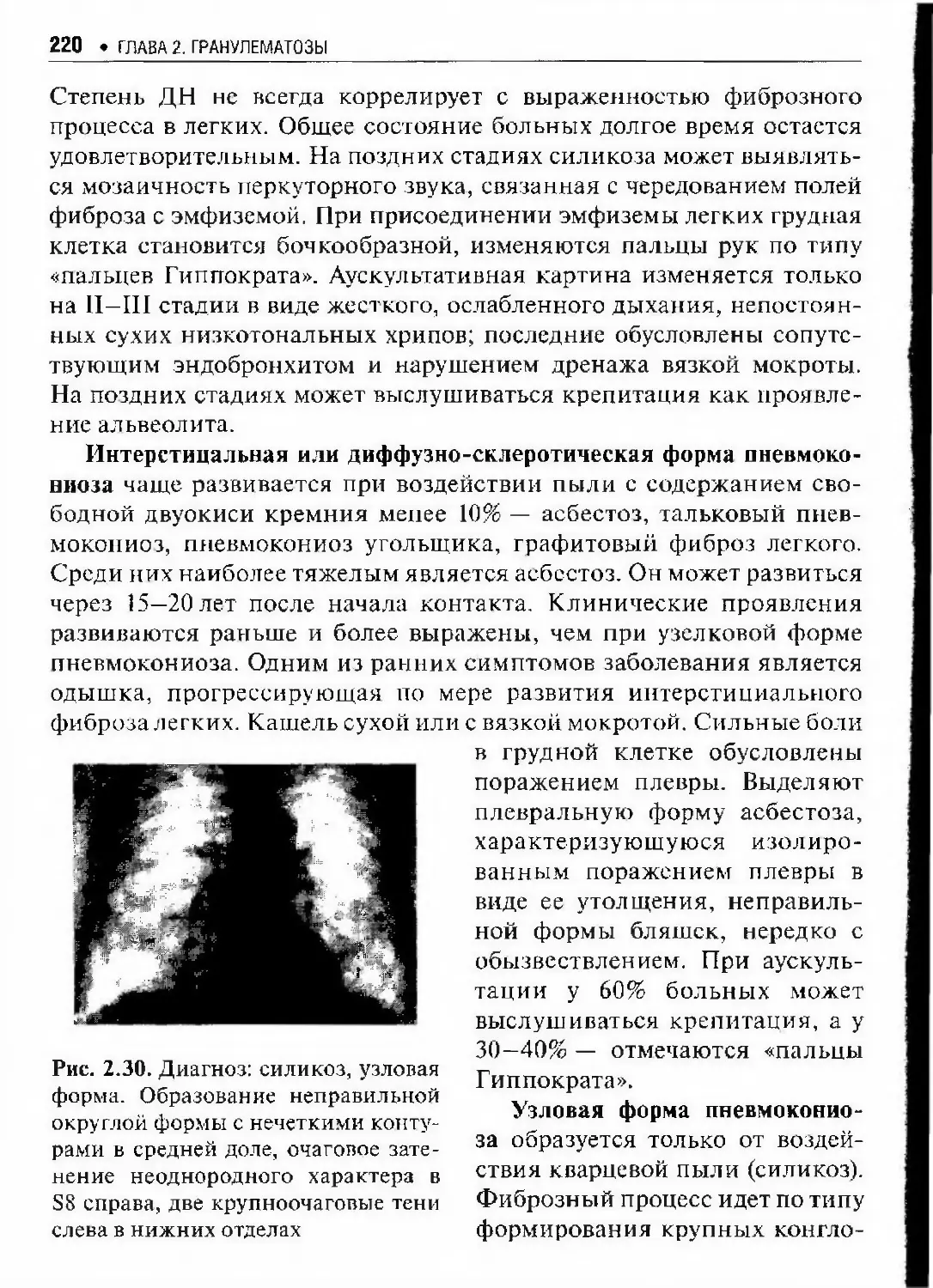
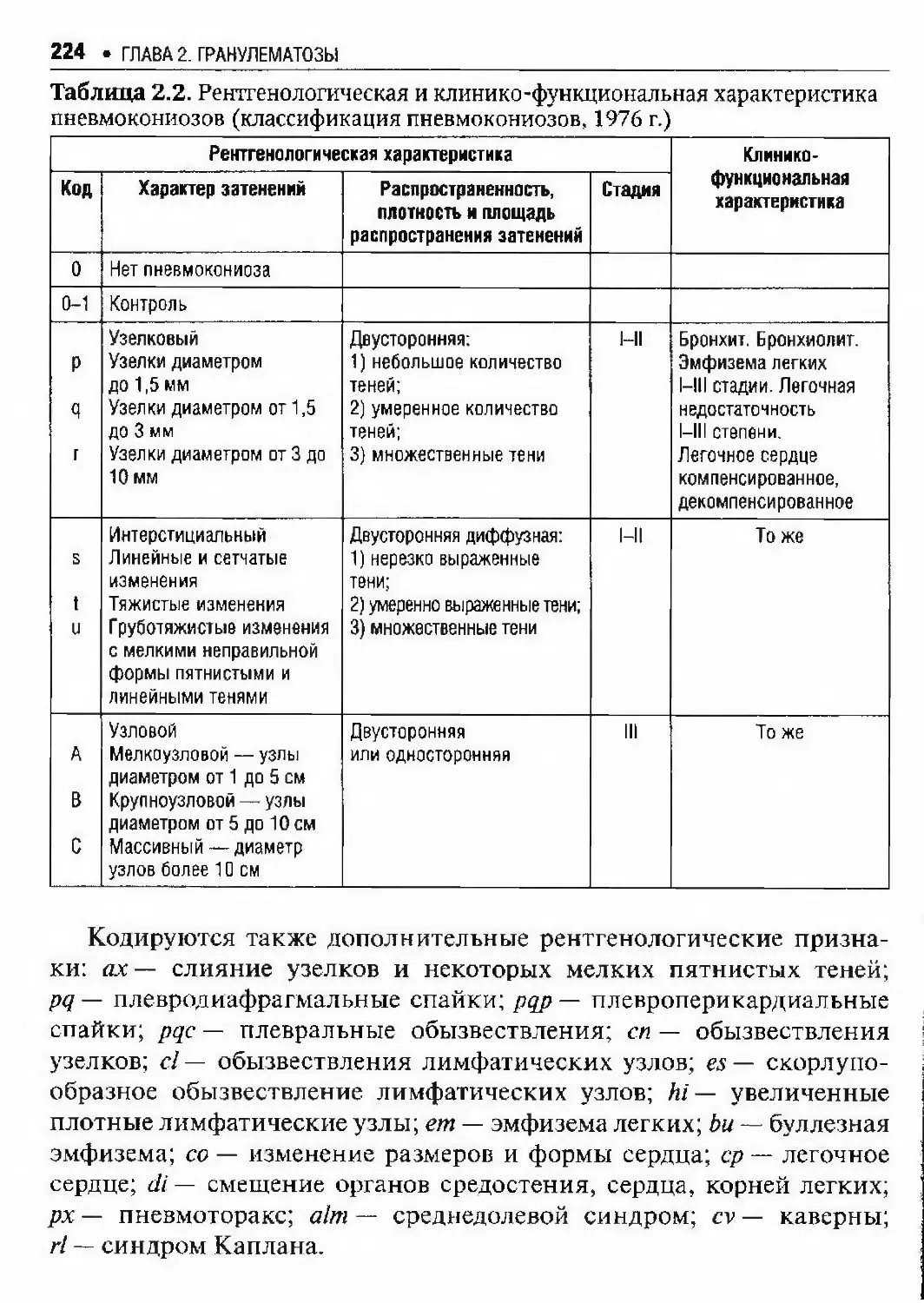
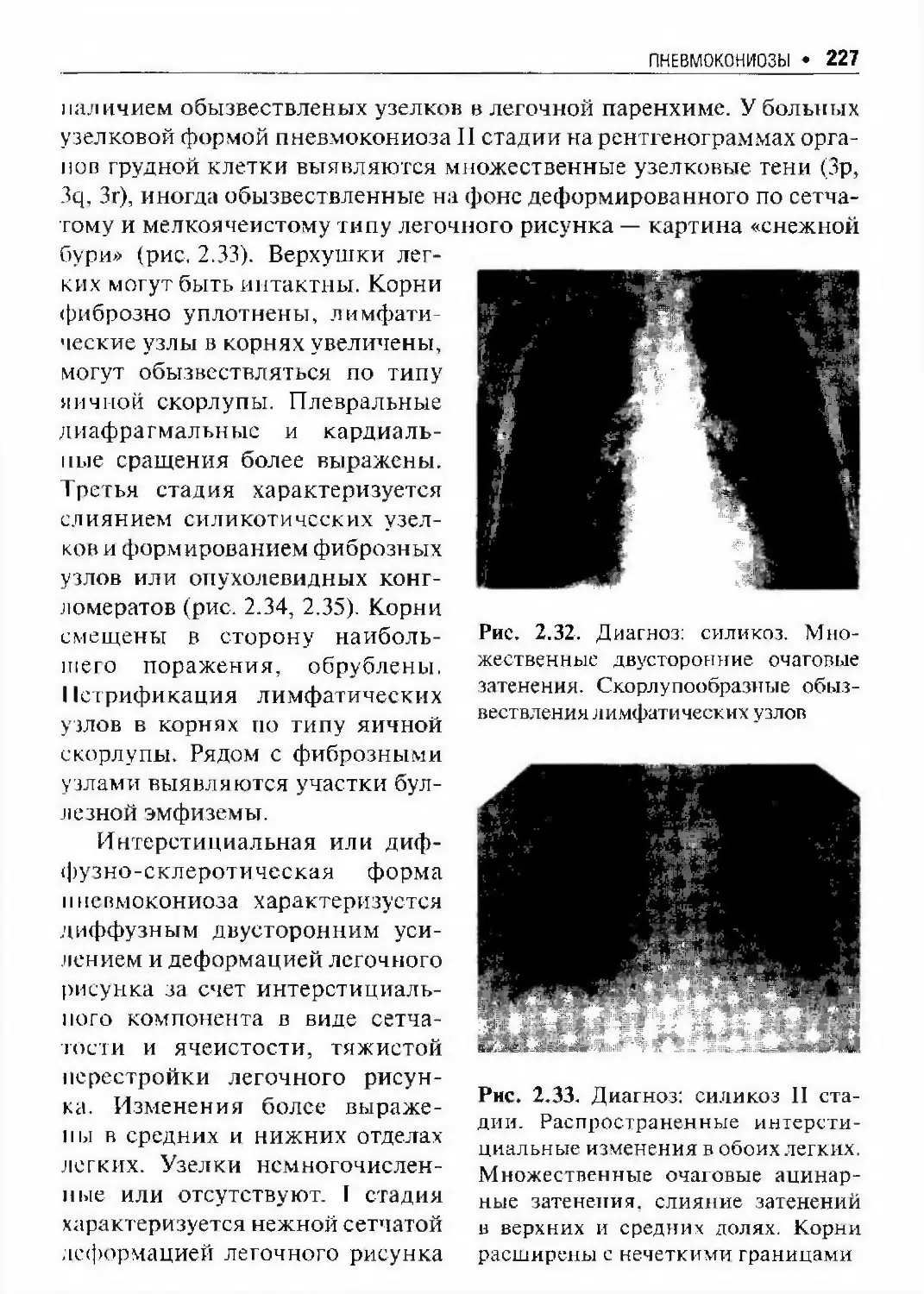
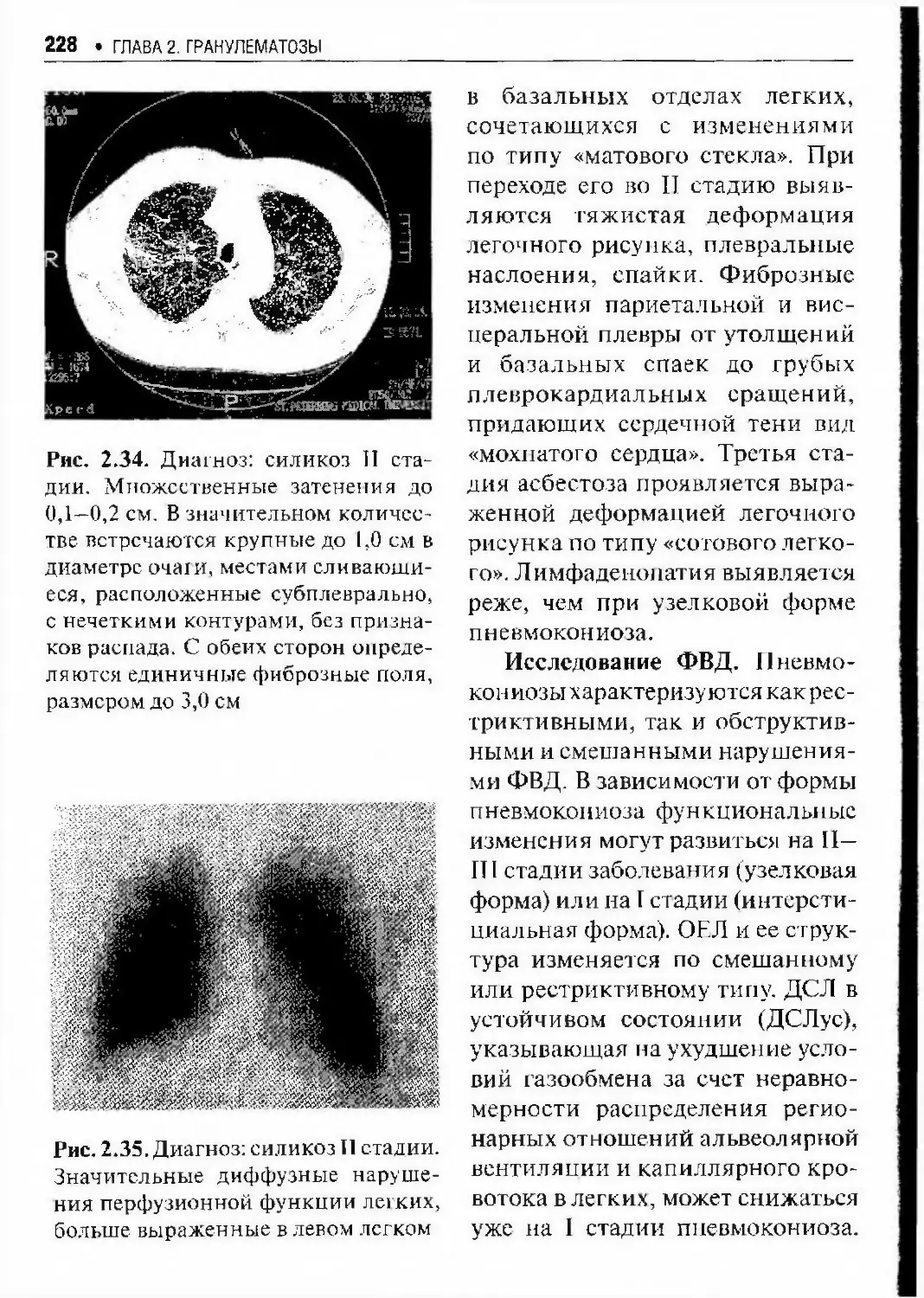
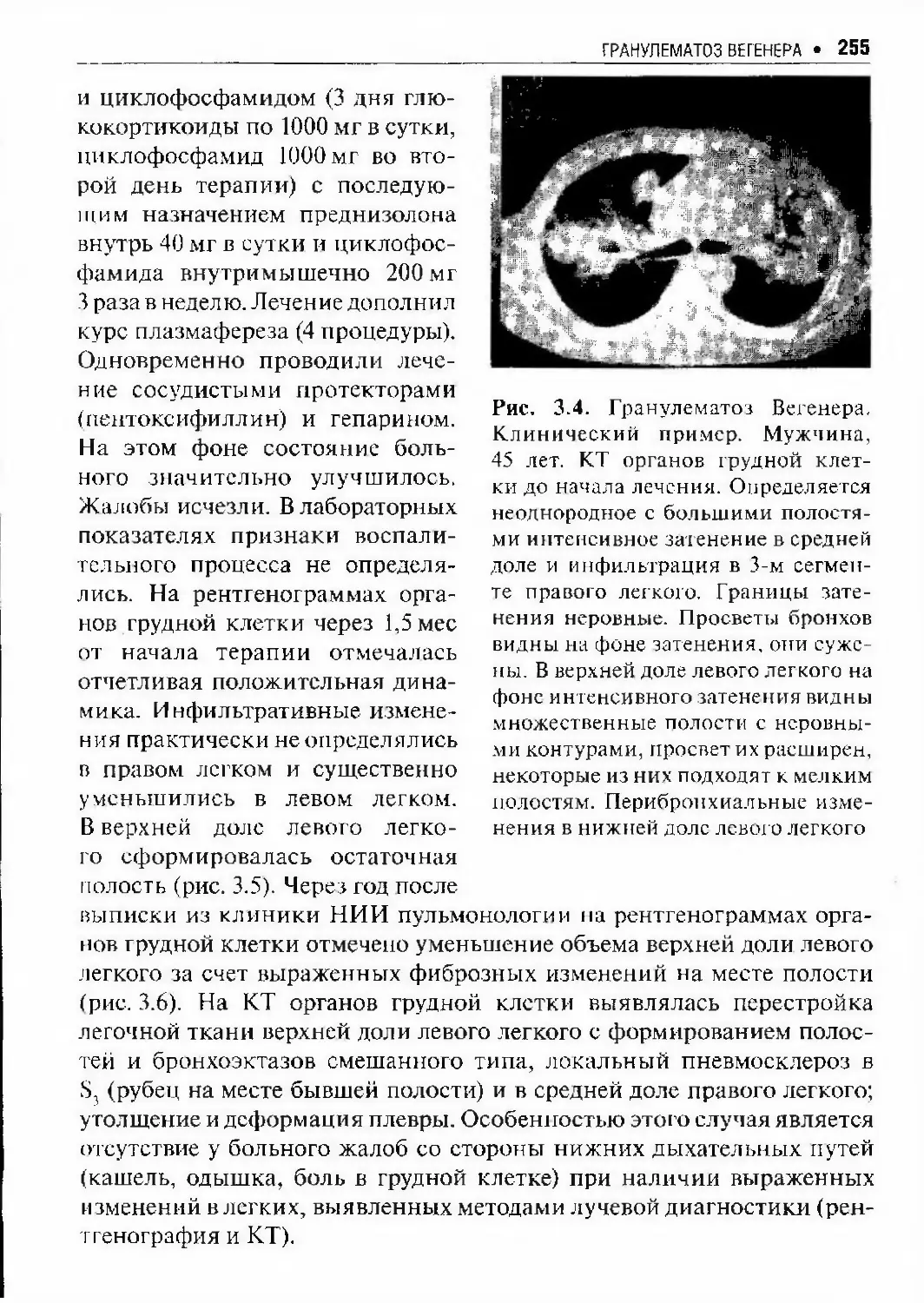
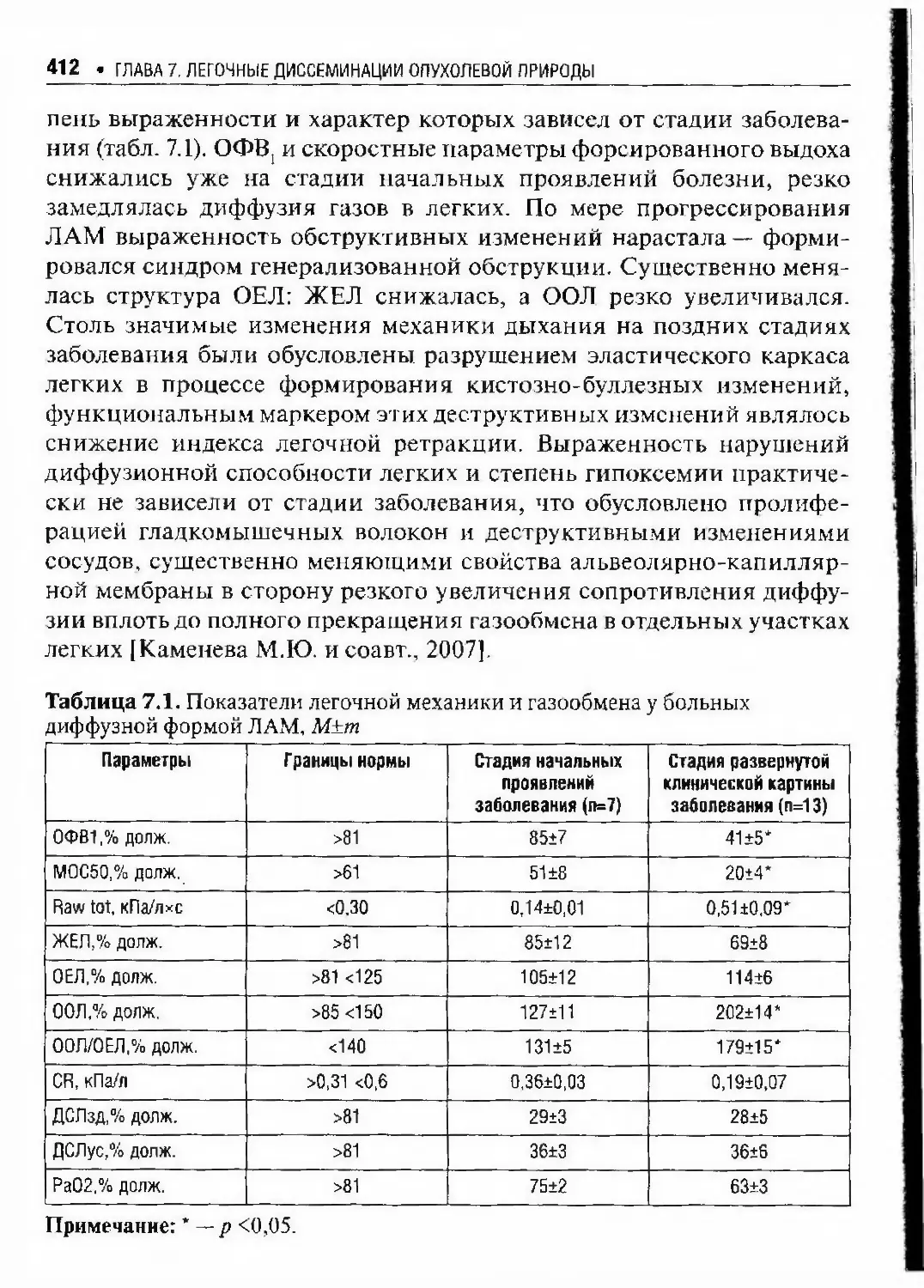
Автор: Илькович М.М.
Теги: заболевания дыхательной системы внутренние болезни медицина практическая медицина
ISBN: 978-5-9704-0
Год: 2011
Текст
БИБЛИОТЕКА«^^ВРАЧА-СПЕЦКАЛИСТАПУЛЬМОНОЛОГИЯФТИЗИАТРИЯзаболевания легкихПод редакцией
профессора
М.М. ИльковичаИЗДАТЕЛЬСКАЯ ГРУППА«ГЭОТАР-Медиа»
библиотекаВРХЧХ-СПЕЦНАЛКТАПУЛЬМОНОЛОГИЯФТИЗИАТРИЯДиссеминированные
заболевания легкихПод редакцией
профессора М.М. ИльковичаМоскваИЗДАТЕЛЬСКАЯ ГРУППА«ГЭОТАР-Медиа»2011
УДК 616.24
ББК 54.123
Д44Д44 Диссеминированные заболевания легких / под ред. М. М. Ильковича. ~
М. ; ГЭОТАР-Медиа, 2011. — 480 с. : ил. — (Серия ^Библиотека врача-
специалиста«>).ISBN 978-5-9704-І 334-0В книге представлены основные заболевания и синдромы, проявля¬
ющиеся рентгенологическим синдромом легочной диссеминации. в пуль¬
монологии эта группа заболеваний является наиболее сложной в диагно¬
стическом плане: ошибочный диагноз ставится в 80% слу'шев. Особое
внимание в книге уделено альвеолитам и гранулематозам, которые в пос¬
ледние годы все чаще встречаются в работе врача. Наряду с этим, в книге
нашли отражение поражения легких при диффузных болезнях соеди¬
нительной ткани, лекарственные и профессиональные заболевания лег¬
ких, системные васкулиты с поражением органов дыхания, легочные
диссеминации опухолевой природы, болезни накопления.Книга рекомендована врачам-интернистам (терапевтам, пульмоноло¬
гам, рентгенологам, врачам функциональной диагностики, профпа-
тологам, ревматологам, торакальным хирургам, патоморфологам), науч¬
ным работникам, а также студентам старших курсов, интересующимся
проблемами пульмонологии.УДК 616.24
ББК 54,123Права на данное издание принадлежат ООО Издательская группа «ГЭОТАР-Медиа»^.
Воспроизведение и распространение в каком бы то ни было виде части или целого
издания не могут быть осуществлены без письменного разрешения ООО Издательская
группа «ГЭОТАР-Медиа^.© Илькович М.М., 2010© ООО Издательская группа «ГЭОТАР-Медиа», 2010
ISBN 978-5-9704-1334-0 ©ООО Издательская группа«ГЭОТАР-Медиа*>,оформление, 2010
АВТОРСКИИ КОЛЛЕКТИВАкопов Андрей Леонидович — доктор медицинских наук, про¬
фессор заведующий отделом хирургической пульмонологии НИИ
пульмонологии СПбГМУ им. акад. И.О. Павлова.Баранова Ольга Петровна— кандидат медицинских наук, стар¬
ший научный сотрудник НИИ пульмонологии СПбГМУ им. акад.
И.П. Павлова.Вогданов Александр Николаевич ~ доктор медицинских наук, про-
ilieccop кафедры терапии № 1 им. Э.Э. Эйхвальда Санкт-Петербургской
медицинской академии последипломного образования.Бондаренко Инна Борисовна — кандидат медицинских наук, науч¬
ный сотрудник кафедры терапии и профзаболеваний Первого МГМУ
нм. И-М. Сеченова, г. Москва.Двораковская Иветта Владиславовна — доктор медицинских наук,
іісдуший научный сотрудник лаборатории экспериментальной пуль¬
монологии и патоморфологии НИИ пульмонологии СПбГМУ им.
;ікад. И.П. Павлова.Ильковнч Михаил Михайлович — доктор медицинских наук, профес¬
сор, заведующий кафедрой пульмонологии СПбГМУ им. акад. И.П. Пав¬
ло на.Илькович Юлия Михайловна — кандидат медицинских наук, заве¬
дующая лабораторией фармакоэкономики НИИ пульмонологии
СПбГМУ им. акад. И.П. Павлова.Каменева Марина Юрьевна — кандидат медицинских наук, заведу¬
ющая лабораторией клинической физиологии дыхания НИИ пульмо¬
нологии СПбГМУ им, акад. И.П. Павлова.Лучкевич Владимир Станиславович — доктор медицинских наук,
профессор, заведующий кафедрой общественного здоровья и здраво¬
охранения Санкт-Петербургской государственной медицинской ака¬
демии им. И.И. Мечникова, заслуженный деятель науки РФ.Новикова Любовь Николаевна — кандидат медицинских наук, заве¬
ду юіцая лабораторией интерстициальных заболеваний легких НИИ
пульмонологии СПбГМУ им. акад. И.П. Павлова.Орлова Галина Павловна — доктор медицинских наук, заведующая
лабораторией экологической и профессиональной пульмонологии
НИИ пульмонологии СПбГМУ им. акад. И.П. Павлова.
• АВТОРСКИЙ КОЛЛЕКТИВОрлов Сергей Владимирович — доктор медицинских наук, заведу¬
ющий лабораторией торакальной онкологии НИИ пульмонологии
СПбГМУ им. акад. И.П. Павлова.Смульская Ольга Александровна — кандидат медицинских наук,
доцент кафедры общей врачебной практики СПбГМУ им. акад.
И.П. Павлова, заместитель главного врача по медицинской части
СПбГУЗ «Городская больница № 25. Городской ревматологический
центр».
ОГЛАВЛЕНИЕ11 редисловие (М.м. Илькович) 7(ліисок сокращений 8Гс'рминология и классификация {ММ. Илькович) 10I !ри11ципы диагностики {ЛЛ. Новикова, А.Л. Акопов,и.В. Двораковская) 14Глава 1, Альвеолиты 24I Ідиопатический фиброзирующий альвеолит {ММ. Илькович,Л.П. Новикова, И.В. Двораковская, B.C. Лучкевич) 24^)к;и.)генный аллергический альвеолит {М.М. Илькович,ЛЛ. Новикова, Г.П. Орлова) 84'•>кзогенный токсический альвеолит {Г.П. Орлова) 112І'ліша 2. Гранулематозы 137('.аркоидоз органов дыхания {М.М. Илькович, Л.Н. Новикова,О.П. Баранова) 137Гистиоцитоз X легких {М.М. Илькович, Л.Н. Новикова,И.В. Двораковская) 1961 Інсвмокониозьі (Г./7. Орлова) 211Глава 3. Системные васкулиты с поражением органов дыхания{О.А. Смульская) 239Г[)аііулематоз Вегенера 240с;имдром Черджа—Стросс 257Микроскопический полиангиит 268Идиопатический гемосидероз легких {М.М. Илькович) 277Глава 4. Лекарственные поражения легких {М.М. Илькович,/;//. Орлова) 2851’лана 5. Поражение органов дыхания при диффузных болезняхсоединительной ткани (О.Л. Смульская) 305(Системная склеродермия 305і’сііматоидньїй артрит 320(лістемная красная волчанка 334110ЛИМИ03ИТ и дерматомиозит {А.Н. Богданов,И.В. Бондаренко) 355
б • ОГЛАВЛЕНИЕГлава 6. Болезни накопления 367Альвеолярный иротеиноз {ММ. Илькович, ЮМ. Илькович,Л.Н. Новикова) 367Амилоидоз легочный (бронхолегочный) (ЛІ.М. Илькович) 377Пневмопатия остеопластическая {ММ. Илькович) 384Глава 7. Легочные диссе ми нации опухолевой природы 387Бронхиолоальвеолярный рак легкого {С.В. Орлов) 387Метастатическое поражение легких {С.В. Орлов) 395Лимфангиолейомиоматоз легких {М.М. Илькович,И.В. Двораковская, М.Ю. Каменева) 404Эпителиоидная гемангиоэндотелиома легких{И.В. Двораковская) 418Литература 423Предметный указате,ль 457
ПРЕДИСЛОВИЕЗаболевания, проявляющиеся рентгенологическим синдромом
114 очной дисссминации, представляют собой одну из наиболее слож¬
ных дифференциально-диагностических проблем в пульмонологии.
Ошибочная интерпретация выявляемых на рентгенограммах двусто-
[ИХІИИХ изменений — скорее правило (80% случаев), нежели исклю-
'к-ние. В то же время поздняя и неверная диагностика сказываются
нередко роковым образом на исходе большинства нозологических
и синдромов, входящих в эту группу, в названии книги мы
использовали понятие «диссеминированные заболевания легких», так
к;1к 'J10 понятие более широкое, чем «интерстициальные заболевания
;ici ких». Ряд нозологических форм, представленных в этой книге, вряд
'111 могут быть отнесены к интерстициальным в строгом смысле этого
L tioita (болезни накопления, опухолевые диссеминации и др.).ІІ Н ИИ пульмонологии СПбГМУ им. акад. И.П. Павлова (ранее —
Всесоюзный НИИ пульмонологии Минздрава СССР) за последние
<10 лет накоплен уникальный опыт по диагностике, лечению, профи-
іщктике и реабилитации больных с так называемыми диссеминиро-
11;> и и ы м и заболевани ями легких. Этот опыт был обобщен в нескольких
монографиях, последняя из которых — «Интерстициальные заболе-
ттия легких» — издана в 2005 г. Прошло всего четыре года, однако
длжс за столь короткий период наши представления об этой пато-
Л1)1ии претерпели существенные изменения, в настоящей книге мы
ііомі.італись не только представить на современном уровне базисные
сисдсиия об этой патологии, но и осветить те новые представления,
ко торые появились в последние годы по проблеме диссеминирован-
кых заболеваний легких.л т оры книги будут признательны своим читателям за конструк-
тиииую и доброжелательную критику.Главный редактор — заведующий кафедрой пульмонологии факуль¬
тета последипломного образования СПбГМУ им. акад. И.П. Павлова,
док 1ч>р медицинских наук, профессор М.М. Илькович.
список СОКРАЩЕНИЙ*— обозначение торговых наименований лекарственных средствобозначение не зарегистрированных в РФ лекарственных средств
АН А (ANA) — антинуклеарные (противоядерные) антитела
АНЦА (ANCA) ~ антинейтрофильные цитоплазматические аутоан¬
тителаАПФ — ангиотензинпревращающий ферментАФК — активные формы кислородаБАЛ — бронхоальвеолярный лаважБАР — бронхиолоальвеолярный рак легкогоВРКТ — высокоразрешающая компьютерная томографияГВ — гранулематоз ВегенераГХЛ — гистиоцитоз X легкихДБСТ — диффузные болезни соединительной тканиДЗЛ — диссеминированные заболевания легкихДМ — дерматомиозитДН — дыхательная недостаточностьДНК — дезоксирибонуклеиновая кислотадел — диффузионная способность легкихДСЛзд — диффузионная способность легких при задержке дыханияДСЛус — диффузионная способность легких в устойчивом состоянииЖБАЛ — жидкость бронхоальвеолярного лаважаЖЕЛ — жизненная емкость легкихИГЛ — идиопатический гемосидероз легкихИЗЛ — интерстициальные заболевания легкихИЛ — интерлейкинИФА — идиопатический фиброзирующий альвеолитИФН — интерфероныКТ — компьютерная томографияЛАМ — лимфангиолейомиоматоз легкихМКБ-10 — международная классификация болезней 10-го пересмотра
МО С — максимальная объемная скорость выдоха
МПА — микроскопический полиаигиит
мРНК — матричная РНКНИИП — Научно-исследовательский институт пульмонологии
ОЕЛ — общая емкость легких
ООЛ — остаточный объем легкихОФВ^ — объем форсированного выдоха за первую секунду
НМ ~ полимиозит
список СОКРАЩЕНИЙРА — ревматоидный артрит1*НК — рибонуклеиновая кислотаСКВ — системная красная волчанка(ЮД ~ саркоидоз органов дыханияСОЭ — скорость оседания эритроцитовС'СД — системная склеродермияСФА — синдром фиброзирующего альвеолита(’ЧС — синдром Черджа-СтроссгРН К — транспортная РНКГФА ~ токсический фиброзирующий альвеолитГЭЛА — тромбоэмболия легочной артерииУЗИ — ультразвуковое исследование<1>ВД — функция внешнего дыхания<1>ЖЕЛ — форсированная жизненная емкость легкихЦИК — циркулирующие иммунные комплексыЧББ — чрезбронхиальная биопсия■ )АЛ — экзогенный аллергический альвеолит’')'ГА — экзогенный токсический альвеолитЛІР — острая интерстициальная пневмония1К)1 Р — облитерирующий бронхиолит с интерстициальной пневмонией( ОР — криптогенная организующая пневмонияI )1 Р — десквамативная интерстициальная пневмония(ІІР — гигантоклеточная интерстициальная пневмония\{\Л {human leucocytes antigen) — человеческий лейкоцитарный антигенIgA, FgE, TgG, TgM — иммуноглобулины классов А, Е, G, М1.1Р — лимфоцитарная интерстициальная пневмонияМС’Р {monocyte chemoattractantproteine) — моноцит-хемоаттрактантныймротеинМІР — макрофагальный воспалительный протеин
NSIР — неспецифическая интерстициальная пневмония
РаСО^ — парциальное давление углекислого газа в артериальной крови
РаО^ — парциальное давление кислорода в артериальной крови
PAS {periodic-acid-Schiff) — окрашивание с реактивом Шиффа
RANTES (РАНТЕС) — активатор и хемоаттрактант Т-лимфоцитов,
жспрессируемый и секретируемый нормальными Т-клетками
КВ1LD — респираторный бронхиолит и интерстициальное заболева¬
ние легкихTG F — трансформирующий фактор роста
'FN F — фактор некроза опухоли
IJIР — обычная интерстициальная пневмония
ТЕРМИНОЛОГИЯ и КЛАССИФИКАЦИЯТермином «диссеминированные заболевания легких» условно объ¬
единены болезни и синдромы, обшим признаком которых служит
рентгенологический синдром легочной диссеминации.Значительный рост числа больных^ у которых патологический
процесс в легких проявляется рентгенологическим синдромом двусто¬
ронней легочной диссеминации, отмечен с начала 60-х годов прошлого
столетия, в частности, по данным ряда зарубежных авторов, диссе-
минированые заболевания легких (ДЗЛ) составляют от 3 до 15% всех
болезней органов дыхания, причем около половины из них — неизвес¬
тной природы (так называемые идиопатические). У большинства боль¬
ных этой категории (около 75%) в клинической картине доминирует
прогрессирующая одышка, как правило, инспираторного характера, а
при исследовании вентиляционной способности легких может опреде¬
ляться рестриктивный синдром и диффузионные нарушения.среди возможных причин увеличения числа больных этой катего¬
рии следует выделить (наряду с улучшением диагностики) наиболее
вероятные;— увеличение контактов человека с множеством новых веществ
органической и неорганической природы в связи с загрязнен¬
ностью атмосферы промышленными поллютантами;— контакт человека с различными химиотоксическими вещес¬
твами в профессиональной сфере. К этому следует добавить
получившую в последние годы широкое распространение
полипрагмазию.Поражения легких, связанные с приемом лекарственных препара¬
тов, обобщены в главе 4 «Лекарственные поражения легких».К настоящему времени этиология многих заболеваний, входящих
в группу ДЗЛ, неизвестна, что исключает возможность разработки
этиологической классификации. Исходя из морфологических осо¬
бенностей, большинство патологических процессов, проявляющихся
рентгенологическим синдромом легочной диссеминации, можно раз¬
делить на три группы (см. рисунок);— интерстициальные заболевания легких (ИЗЛ);— болезни накопления;— диссеминации опухолевой природы.Интерстициальные заболевания легких (ИЗЛ) — гетерогенная груп¬
па заболеваний и патологических состояний, характеризующаяся раз-
ТЕРМИНОЛОГИЯ и КЛАССИФИКАЦИЯ • 111*ис. Классификация диссеминированных заболеваний легкихличной степенью паренхиматозного неинфекционного воспаления
(іигьвеолита) и фиброза. Исходя из морфологических особенностей,
можно выделить три группы ИЗ Л.• Фиброзирующие альвеолиты (идиопатический, экзогенные
аллергические, токсические), а также фиброзирующие альве¬
олиты как синдром других заболеваний [диффузных болезней
соединительной ткани (ДБСТ), хронического активного гепатита
и др.]. Как следует из представленного перечня, фиброзируюший
альвеолит может быть не только самостоятельной нозологичес¬
кой формой, но и одним из синдромов при других заболеваниях, в
частности при ДБСТ. Интерстициальный фиброз, развивающий¬
ся при фиброзирующих альвеолитах, следует отличать от других
заболеваний и патологических состояний, при которых тоже воз¬
можно развитие интерстициального фиброза в легких, — левоже¬
лудочковая недостаточность кровообращения (так называемый
кардиогенный пневмосклероз), возможный исход «шокового»
легкого, радиационные поражения легких.■ Гранулематозы легких [саркоидоз, гистиоцитозХ(ГХЛ), диссеми¬
нированный туберкулез легких, пневмокониозы, пневмомикозы],
в эту группу объединены заболевания как известной (диссеми¬
нированный туберкулез легких, пневмокониозы, пневмомикозы),
так и неизвестной природы (саркоидоз, ГХЛ). Характерной осо¬
бенностью этой группы считают образование в легких гранулем,
строение которых при разных заболеваниях имеет свои специфи¬
ческие особенности. Следует, впрочем, отметить, что при экзо¬
генном аллергическом альвеолите (ЭАА), отнесенном в первуюI руппу, также может наблюдаться образование гранулем. Однако,
учитывая то обстоятельство, что формирование неспецифи-
чсского гранулематозного узелка при ЭАА характеризует лишь
12 • ТЕРМИНОЛОГИЯ и КЛАССИФИКАЦИЯкратковременный и, возможно, необязательный этап в развитии
болезни, а формирование интерстициального фиброза при хрони¬
ческом течении патологического процесса неизбежно, целесооб¬
разным сочли отнести это заболевание в группу фиброзирующих
альвеолитов. Нечто подобное можно сказать о саркоидозе легких,
только наоборот: ранняя стадия болезни напоминает альвеолит
(в частности, лимфоцитарный). Стадия экзогенного токсического
альвеолита (ЭТА) кратковременна, редко диагностируется и не
является специфичной только для этого заболевания,• Системные васкулиты с поражением легких: гранулематоз
Вегенера (ГВ), синдром Черджа—Стросс (СЧС), микроскопичес¬
кий полиангиит (МПА), идиопатический гемосидероз легких
(ИГЛ) и др.Болезни накопления (альвеолярный протеиноз, амилоидоз бронхо¬
легочный, альвеолярный микролитиаз и др.) не могут быть отнесены
в группу ИЗЛ, так как поражение интерстиция для них не характер¬
но и может наблюдаться лишь на заключительных стадиях болезни,
а основным морфологическим критерием является отложение и
накопление в альвеолах белково-липоидного вещества.Заболевания легких опухолевой природы [бронхиолоальвеолярный
рак (БАР), метастатическое поражение легких, лимфангиолейоми-
оматоз легких (ЛАМ), эпителиоидная гемангиоэндотелиома легких
и др.] в группе ДЗЛ стоят особняком и рассматриваются в большей
степени как объект дифференциальной диагностики. В группу опухо¬
левых диссеминаций отнесен лейомиоматоз (ЛАМ) легких, опухоле¬
вую природу которого признают не все исследователи. Большинство
авторов относит это заболевание к многофокусным гамартомным
процессам, в прогрессировании которых важную роль играет дисба¬
ланс женских половых гормонов.Несмотря на несомненную объективность морфологических кри¬
териев, положенных в основу представленной классификации ДЗЛ,
абсолютизировать этот принцип нельзя, так как нередки случаи, когда
даже детальное гистологическое и иммунногистохимическое иссле¬
дование не позволяют поставить правильный диагноз. Отличаясь
по этиологии, многие ДЗЛ имеют не только сходную клиническую
симптоматику, рентгенологическую картину, функциональные нару¬
шения, некоторые общие патогенетические механизмы развития, но
и сходную морфологическую картину- В особенности это относится
к некоторым нозологическим формам внутри перечисленных выше
групп. Например, сосудистая сеть легких поражается не только при
ТЕРМИНОЛОГИЯ и КЛАССИФИКАЦИЯ • 13классических васкулитах, но, хотя и в меньшей степени, при идиопа-I ическом и токсическом фиброзируюших алъвеолитах (ИФА и ТФА).
<1>ормирование классической гранулемы нередко оказывается лишь
напом (более или менее длительным) при таких заболеваниях, как
с:іркоидоз легких и ГХЛ. Высказанные соображения подтверждают¬
ся трудностями гистологического диагноза при саркоидозе легких,
іюскольку гранулемы саркоидного типа (источником формирования
которых является иммуногистиоцитарная система) могут возникать
н при некоторых других заболеваниях (бериллиоз, ЭАА, опухолевые
процессы, туляремия, листериоз, кандидамикоз, ревматизм, лимфо-
і ранулематоз и некоторые другие заболевания). Особенно трудна
ди(|)ференпиальная диагностика гранулем при саркоидозе и при
диссеминированном туберкулезе легких. Из сказанного следует, чтоII ответ на различные экзо- и эндогенные причинные факторы легоч-
лаи ткань в одних случаях отвечает экссудативно-пролиферативной
реакцией с образованием гранулемы, в других — острой экссудатив¬
ной реакцией по типу альвеолита. Вчасти случаев можно говорить
ііиіпь о преимущественном типе реагирования.Таким образом, нозологическую форму патологии определяют:- этиология заболевания (в тех случаях, когда она известна);~ характер и степень выраженности альвеолита;“ наличие или отсутствие гранулематозной стадии;- степень выраженности поражения сосудистого русла легких;- скорость формирования интерстициального фиброза.От упомянутых особенностей зависит степень нарушения вен-
1'иляции и перфузии легких, определяющих характер клинических
проявлений, течение и прогноз заболевания.
ПРИНЦИПЫ ДИАГНОСТИКИДиагностика ДЗЛ до настоящего времени остается крайне неудов¬
летворительной, диагностические ошибки составляют до 80%.
Больные с ДЗЛ направляются в специализированные пульмонологи¬
ческие учреждения поздно: в среднем через 18 мес после появления
первых симптомов болезни, что, несомненно, роковым образом ска¬
зывается на прогнозе. Можно назвать несколько причин столь удру¬
чающего состояния диагностики ДЗЛ. Отсутствие патогномоничных
признаков (клинических, реіітгенологических, функциональных,
лабораторных и даже морфологических) при большинстве нозологи¬
ческих форм, относящихся к ДЗЛ, несомненно, затрудняет диагнос¬
тику. Далеко не во всех случаях имеется возможность применения
современных диагностических методов [компьютерная томография
(КТ), чрезбронхиальная биопсия (ЧББ) или видеоторакоскопическая
биопсия легких и др.]. Но основной причиной поздней диагностики
является недостаточная осведомленность практических врачей об
этом виде патологии и, соответственно, ошибочная интерпретация
результатов обследования.Появление первых признаков болезни заставляет пациента обра¬
щаться к участковому врачу или врачу общей практики. Поэтому
именно от врачей первичного звена в большинстве случаев зависит,
насколько долгим окажется диагностический процесс. Основная
задача, стоящая перед врачом в этой ситуации, — своевременно запо¬
дозрить наличие ДЗЛ, подтвердить это предположение результатами
обследования (обязательные диагностические методы) и направить
больного для уточнения диагноза в специализированное пульмоно¬
логическое учреждение.Предположение о ДЗЛ на любом этапе обследования должно обос¬
новываться наличием следующих признаков;— прогрессирующая одышка преимущественно инспираторного
или смешанного характера;— распространенные двусторонние очаговые и (или) интерсти¬
циальные изменения в легких на рентгенограммах;— рестриктивные нарушения функции внешнего дыхания
(ФВД).Предположение о ДЗЛ должно возникнуть при наличии даже
одного из перечисленных признаков. Так, например, при хрони¬
ческих формах саркоидоза, пневмокониозах, диссеминированном
ПРИНЦИПЫ ДИАГНОСТИКИ • 15I у()сркулезе легких, ГХЛ, очаговой форме лейомиоматоза, болезнях
накопления на ранних стадиях патологического процесса, а также в
нскоюрых случаях метастатического поражения легких клиническая
Iимптоматика может отсутствовать и заболевание в этих ситуациях
проявляется только рентгенологическим синдромом диссеминации.Наибольшие диагностические трудности возникают при наличии
юлько одного признака ДЗЛ — одышки. Такие больные нуждаются
МО іінимательном врачебном осмотре и дополнительном обследова¬
нии. В этих ситуациях сначала необходимо исключить патологию
го стороны сердечно-сосудистой системы, в том числе тромбоэмбо-
;|11К) легочной артерии (ТЭЛА). Если изменения на рентгенограммах
(исугствуют или они минимальны, прежде всего следует подуматьо р;тних стадиях или рентгенонегативных формах фиброзирующихII III,цеолитов и системных васкулитов, можно предположить наличие
/и1(1к1)у:зиой формы лейомиоматоза у женщин.Методы диагностики ДЗЛ условно можно разделить на обязатель-
мыс и дополнительные (специальные).ОбязательныеК обязательным методам относятся: клинические, лабораторные,
рентгенологические, инструментальные (спирография, электрокар-
діюграфия, бронхофиброскопия). Они могут быть выполнены амбу-
jurrnpno в условиях поликлиники или диагностического центра.Клинические• Жалобы больного, время появления, характеристика и динамика их.• Факторы, предшествующие началу заболевания.• I шательный врачебный осмотр и адекватная оценка его данных.
При сборе анамнеза следует особое внимание обраш,ать на фак-■1Ч)ры, предшествующие началу болезни, и ее первые проявления.
Кот акт С аллергическими или токсическими агентами на работе илиII Смит у, в том числе и прием лекарственных препаратов, обладающих
»1ЛДс|)1 ическими и (или) токсическими свойствами, может стать при¬
чиной развития экзогенного альвеолита (аллергической, токсичес¬
кой, юксико-аллергической природы),С'понтанный пневмоторакс в анамнезе может быть одним из пер¬
вых проявлений некоторых нозологических форм ДЗЛ (ГХЛ, лейоми-
«мигоз легких).
16 • ПРИНЦИПЫ ДИАГНОСТИКИДля диагностики ДЗЛ иногда решающее значение имеют клини¬
ческие проявления со стороны других органов и систем, вовлеченных
в патологический процесс. Например, узловатая эритема, артралгии,
синдром интоксикации и лимфаденопатия средостения являются
достаточно характерным симптомокомплексом острой формы сарко-
идоза (синдром Лефгрена). У большинства больных с ДБСТ на первый
план выступают внелегочные симптомы. Специфические изменения
кожи могут развиваться при саркоидозе, ГХЛ, ДБСТ. Более подробно
эти вопросы будут рассматриваться в соответствующих главах.Лабораторные• Клинический анализ крови.• Общий анализ мочи.• Биохимическое исследование крови.• Иммунологическое исследование крови.Лабораторные методы исследования при ДЗЛ играют лишь вспо¬
могательную роль и диагностического значения не имеют, но поз¬
воляют уточнить степень активности патологического процесса, а в
ряде случаев исключить другие заболевания.Рентгенография органов грудной клетки в двух проекцияхБольшое значение в диагностике ДЗЛ принадлежит рентгенологи¬
ческому исследованию. Оно позволяет установить факт наличия ДЗЛ,
его распространенность, выраженность и преимущественную лока¬
лизацию: интерстициальная ткань, альвеолы. Рентгенологическая
диагностика затрудняется тем, что скиалогические характеристики
различных ДЗЛ на определенных этапах патологического процесса
могут совпадать. Кроме того, при ДЗЛ зачастую необходимо проведе¬
ние дифференциальной диагностики лимфаденопатий средостения,
которые могут иметь место при таких заболеваниях, как диссемини¬
рованный туберкулез легких, саркоидоз легких, а также лимфомы,
тимомы, злокачественные эпителиальные опухоли и др.Инструментальные■ Исследование ФВД (спирография),• Электрокардиография.• Бронхофиброскопия.Изменения слизистой бронхиального дерева при легочных дис-
семинациях, как правило, неспецифичны и выявляются при брон-
ПРИНЦИПЫ ДИАГНОСТИКИ • 17хо(|)иброскопии не более чем у 10-15% больных в виде гипервас-
куляризации слизистой бронхов, мелкобугорковых образований,
иимфангоита, стенозов бронхов за счет увеличенных лимфатиче¬
ских узлов, при обнаружении перечисленных признаков поражения
вроихов показано выполнение биопсии слизистой. В то же время при
саркоидозе диагностическая ценность бронхоскопии с биопсией сли-
И1СТ0Й бронхов может достигать 40-60%, так как вовлечение бронхов
tt патологический процесс наблюдается чаще, чем это возможно уста¬
новить визуально.Наиболее частые врачебные ошибки на этом этапе диагностики.• Необоснованное установление диагноза: двусторонняя пневмо¬
ния при выявлении любого синдрома легочной диссеминации с
последующей длительной антибактериальной терапией.• Направление всех больных с рентгенологическим синдромом
диссеминации в противотуберкулезный диспансер независимо
от наличия или отсутствия других признаков диффузных ієнєй
в легких.• Ошибочная интерпретация результатов обследования в случаях
отсутствия изменений на рентгенограммах.ДополнительныеПо результатам обязательных методов обследования можно лишь
подтвердить наличие ДЗЛ, а для уточнения диагноза, определения
активности патологического процесса и оценки течения заболевания
ис'обходимо использовать дополнительные методы обследования.Комплексное исследование ФВД [спирография, механика дыха-
иия, плетизмография, диффузионная способность легких (ДСЛ),
гаювый состав крови]. Определение вентиляционных нарушений
играет важную роль, как в диагностике, так и в адекватной оценке
гемения болезни и эффективности лечения, в то же время следуето гметить, что нбзологическая интерпретация функциональных нару¬
шен и й при ДЗЛ практически невозможна, так как стереотипность
реакции легочной ткани в ответ на различные патогенные факторы
определяет и стереотипность функциональных нарушений. Наконец,
рестриктивный синдром, выраженный в различной степени, может
иметь место не только Y болыгых ДЗЛ, но и при ожирении, массивных
плевральных сращениях pa^HFHoro происхождения, Ьри тяжелых
сколиотических деформаїщж груДйоЙ кДетки
18* ПРИНЦИПЫ ДИАГНОСТИКИКТ и высокоразрешающая компьютерная томография (ВРКТ) органов
грудной клетки и других органов (по показаниям). КТ позволяет уточ
нить локализацию и характер изменения как в легочной ткани, так и в
Других органах. Преимуществом этого метода исследования является
возможность получить картину макроскопической структуры легких.КТ выявляет изменения в ткани легких и лимфаденопатию средосте¬
ния на стадии, когда они еще не видны на обычных рентгенограммах.Для уточнения состояния сосудистого русла легких применяют КТ с
контрастированием или ангиопулъмонографию.Перфузионная сцинтиграфия легких, костей. Метод применяют
для уточнения состояния сосудистой микроциркуляции в легких.
Выявление участков повышенного накопления радиофармпрепарата
в костях у пациентов с ГХЛ может свидетельствовать о специфичес¬
ком поражении костей.Эходопплеркардиография позволяет определить состояние миокар¬
да, клапанного аппарата и гемодинамики малого круга кровообраше-
ния, что крайне важно как для диагностики ДЗЛ, так и для оценки
течения болезни и эффективности лечения.Ультразвуковое исследование (УЗИ) брюшной полости, малого таза,
щитовидной железы и других органов применяется при подозрении на
лейомиоматоз легких и по другим показаниям.Цитологическое, биохимическое и иммувологическое исследование
жидкости бронхоальвеоляриого лаважа (ЖБАЛ). Бронхоальвеолярный
лаваж (БАЛ) позволяет получить материал для цитологического, имму-
ноцитохимического и биохимического исследований. Основная задача
исследования ЖБАЛ — установить соотношение клеточных элементов
в лаважной жидкости с целью уточнения особенностей воспаления,
степени активности альвеолита, прогнозирования течения заболевания.
Для определения прогноза заболевания и эффективности терапии одно¬
кратного исследования, как правило, недостаточно. Цитологическое
исследование является особой разновидностью морфологических иссле¬
дований, которое включает цитологический анализ браш-биопсий сли¬
зистой бронха, материала экссудатов серозных полостей, лаважной жид¬
кости, бронхиальных смывов, обычной и индуцированной мокроты.Консультации специалистов (фтизиатр, дерматолог, эндокринолог,
гинеколог, кардиолог и др.) показаны для исключения или подтверж¬
дения внелегочных проявлений болезни, а также для уточнения
состояния других органов и систем, сопутствующей патологии.Биопсия легочной ткани: ЧББ, трансторакальная, видеоторакоско-
пическая, открытая биопсия и др. Широкое распространение в кли-
ПРИНЦИПЫ ДИАГНОСТИКИ * 1Диической практике получила ЧББ легкого. Этот метод относительно
1СГК0 переносится больными. Недостатки ЧББ — возможность раз-
пития осложнений, таких как пневмоторакс и кровотечение, а также
малый объем биоп гата, деформация его биопсийными щипцами, что
ттрудняет интерпретацию полученных данных, особенно на стадии
ииевмофиброза.В последние годы все большее распространение находит мето¬
дика чрестрахеальной или чреспищеводной аспирационной био¬
псии медиастинальных лимфатических узлов — способ получения
патологического материала для цитологического исследования через
мглу, подводимую к лимфатическому узлу через бронхоскоп или
>юфагоскоп. Такая процедура может производиться под контролем
•ндотрахеального или внутрипищеводного УЗИ. Опыт применения
ной методики при ДЗЛ еще небольшой, информативность метода
достаточно не изучена.Трансцервикальные методы получения патологического матери¬
ала при ДЗЛ включают в себя биопсию увеличенных шейных и над¬
ключичных лимфатических узлов (в клинической практике имеет
место нечасто), а также медиастиноскопию. Медиастиноскопия (видео-
мсдиастиноскопия) позволяет из доступа в области яремной вырезки
осмотреть передневерхнее средостение и получить необходимый для
морфологической оценки материал в 80—95% наблюдений. Операция
шлполняется под общим эндотрахеальным наркозом. Осложнения
развиваются не более чем у 5—7% больных (кровотечение, пневмо-
юракс, ранение пищевода, возвратного нерва, медиастинит и др.).
Ііизуализации и биопсии доступны паратрахеальные и, в большинстве
наблюдений, бифуркационные лимфатические узлы, однако остаются
недоступными лимфатические узлы аортального окна, корня легкого.Трансторакальная игловая биопсия легкого в последние годы все
реже применяется в дифференциальнойдиагностике ДЗЛ. Большинство
авторов отмечают ее низкую информативность при этой патологии, не
превышающую 20% в связи с небольшим количеством получаемого
материала. В 14-30% случаев пункция осложняется кровотечением,
почти в половине случаев — пневмотораксом. Были предприняты
попытки повысить диагностическую значимость и безопасность транс-I оракальной биопсии, выполняя ее под контролем УЗИ или КТ, однако
широкого распространения при ДЗЛ это не нашло.Одним из наиболее часто и давно используемых способов био¬
псии лимфатических узлов переднего средостения, аортального окна,
паратрахеальной зоны является парастернальная медиастинотомия
20 . ПРИНЦИПЫ ДИАГНОСТИКИпо Chamberlain, выполняемая под общим наркозом. Преимуществом
метода является не только возможность доступа к патологическому
очагу в средостении, но, при необходимости, выполнение биопсии
верхней доли легкого путем вскрытия плевральной полости, к недо¬
статкам операции можно отнести невозможность, во многих случаях,
визуальной оценки патологического процесса, когда хирург ориен¬
тируется лишь пальпаторно. Тем не менее информативность этого
вмешательства достаточно высока и достигает 90-95%. Осложнения,
такие как эмфизема средостения и послеоперационное кровотечение,
имеют место в 3—7% наблюдений.Несмотря на достаточно широкое распространение малоинвазив¬
ных методов диагностики ДЗЛ, до настоящего времени не утратила
значения открытая биопсия легкого. В 80-х годах прошлого века этот
метод был признан во всем мире «золотым стандартом» при обследо¬
вании по поводу ДЗЛ, позволяющим получить биоптаты достаточ¬
ных размеров из любого подозрительного участка легкого, оценить
состояние париетальной и висцеральной плевры, а также, при необ¬
ходимости, вскрыть и осмотреть средостение, произвести удаление
лимфатических узлов. Необходимо отметить, что макроскопических
признаков, патогномоничных для тех или иных заболеваний, вхо¬
дящих в группу ДЗЛ, не существует. Макроскопическая картина
«препарата» должна сопоставляться с рентгенологической, включая
результаты КТ. Информативность открытой биопсии легкого достига¬
ет 95—98%. Наибольшую диагностическую ценность имеют биоптаты
размером не менее 1 см\ полученные из зон легкого с изменениями
средней степени выраженности, так как в участках с наибольшими
изменениями высока вероятность развития неспецифического пнев¬
мофиброза [Оржешковский о. в., 1983].Возможность совместить малоинвазивность эндоскопических
вмешательств и диагностическую ценность открытой биопсии лег¬
кого появилась после внедрения в клиническую практику видеото¬
ракоскопии. В последние 10—15 лет благодаря развитию видеоэндос-
копической техники и созданию специального эндоскопического
инструментария этот метод прочно занял место в диагностике и лече¬
нии различной легочной патологии. У больных, перенесших видео-
торакоскопическую биопсию легкого, длительность операции и выра¬
женность послеоперационного болевого синдрома, длительность дре¬
нирования плевральной полости и пребывания в стационаре сущес¬
твенно меньше, чем при торакотомиии. Видеоторакоскопия также
высоко информативна у больных лимфаденопатиями средостения.
ПРИНЦИПЫ ДИАГНОСТИКИ • 21при этой методике биопсии доступны практически все группы внут-
ригрудных лимфатических узлов со стороны операции.Гистологические методы (гистотопографическое исследование,
световая микроскопия, электронная микроскопия, гистохимическое
и иммуногистохимическое исследование, микроэлементный анализ
легочной ткани) позволяют в большинстве случаев (95—98%) уточнить
диагноз.Гистотопографическое исследование занимает промежуточное
положение между макроскопическим и гистологическим. Оно поз¬
воляет оценить на всем протяжении среза органа, доли или сегмента
легкого распространенность и разнородность изменений. Вместе с
юм, применив гистологические окраски, можно дифференцировать
разные по клеточному и тканевому составу компоненты очага пораже-
иия и ткани легкого, сохранившей обычный тип строения.При анализе патогистологических данных нужно принимать во
внимание возрастные особенности, а также артефакты, связанные
с инструментальным вмешательством (слушивание эпителия, сдав¬
ление ткани и клеток, свежие кровоизлияния, термическая коа¬
гуляция). Обычное патогистологическое исследование должно
дополняться гистохимическим, иммуногистохимическим, электрон-
|1()-микроскопическим и молекулярно-генетическим исследовани¬
ями. Достоверность любого морфологического метода повышается
использованием морфометрии.Гистохимическое исследование применяется для дифференциаль¬
ной диагностики ДЗЛ. Окрашивание ДНК (дезоксирибонуклеино¬
вая кислота) и РНК (рибонуклеиновая кислота) с помошью методов
(1>сльгена—Браше, Эйнарсена, позволяет оценивать нарушения пло-
идиости ядер, последствий хромосомных аберраций и других патоло-I ий генома. Такой анализ показан не только при изучении опухолей и
нредопухолевых процессов, но и при дисрегенераторных процессах,
сопровождающих многие формы ДЗЛ. Суммарное выявление бел¬
ков с применением метода Бонхег, а также определение аргинина по
С'акагуши и триптофана по Адамсу показано при ряде заболеваний,
сііязанньїх с нарушением синтеза белков. Для выявления альвеоляр¬
ного протеиноза рекомендуется одновременное определение белка и
иіикозоаминогликанов с помощью реактива Шиффа, или PAS-реак-
ния {periodic-acid-Schiff). Для дифференцирования разных вариантов
амилоидоза применяется не только окрашивание препаратов (Конго-
рог, генициан-виолет, йод-грюн), но и исследование в поляризацион¬
ном микроскопе.
22ПРИНЦИПЫ ДИАГНОСТИКИМикроэлементарный анализ тканей показан при заболеваниях,
связанных с профессиональными факторами, загрязнением окружа¬
ющей среды и пневмосклерозе неясной этиологии. Микроэлементы
могут быть выявлены методом плазменной фотометрии. Спектромет¬
рическая информация в виде рентгеновских спектров обрабатывается
на персональном компьютере. Полученные результаты представляются
в виде графика.Иммуногистохимические методы, в основе которых лежит выявле¬
ние комплексов антиген-антитело, являются высокочувствительны¬
ми и специфичными. Они позволяют выявить практически любой
антиген, если сохранена антигенная детерминанта в исследуемой
ткани, и объективизировать морфологическое заключение. Наиболее
распространенными методами иммуногистохимического исследо¬
вания являются пероксидазно-антипероксидазный и авидин-био-
тиновый. Скрининг-панели антител для иммуногистохимической
дифференциальной диагностики наиболее часто встречаемых ДЗЛ
представлены в таблице.Таблица. Специфические антитела, применяемые для диагностики диссемини¬
рованных заболеваний легкихДиагнозСерии антителгхлS-100 protein, CDIa, CD68Злокачественный системный гистиоцитозCD3, CD20, CD44R0, CD68, S-100ЛАМНМВ-45, vimentin, desmin, actin, receptor estro¬
gen, progesteronЭпителиоидная гемангиоэндотелиомаCD31, CD34, фактор V111 (von Willibrand)Саркоидоз, туберкулезMycobacterium tuberculosis (clone 1.1/3/1)Дополнительные методы обследования больных ДЗЛ могут быть
выполнены лишь в специализированных медицинских учреждениях,
располагающих современной диагностической аппаратурой. К таким
медицинским учреждениям могут быть отнесены городские диагнос¬
тические центры, пульмонологические отделения многопрофильных
городских и областных больниц, НИИ пульмонологии и НИИ фти-
зиопульмонологии. Обследование больных ДЗЛ следует проводить
амбулаторно, основным показанием для госпитализации больных
этой категории является необходимость выполнения инвазивных
диагностических методов.Правильный диагноз может быть установлен только на основании
анализа результатов комплексного обследования пациента. Если
ПРИНЦИПЫ ДИАГНОСТИКИ • 23(iiiai ноз не ясен, следует своевременно прибегать к гистологической
т-рификации диагноза.В каждом конкретном случае совсем не обязательно выполнять
IU с перечисленные выше дополнительные диагностические методы.
Клиницист должен определить оптимальный круг обследования
ин)линого, достаточный для установления правильного диагноза.
Применение излишне большого числа методов обследования замед-
||яс- г процесс диагностики, увеличивает вероятность осложнений при
их проведении и не исключает диагностических ошибок.Наиболее частые врачебные ошибки на этапе диагностики в специ-ІІ )1 »пированных медицинских учреждениях.• Проведение длительных курсов тест-терапии противотуберку¬
лезными препаратами у больных без уточнения диагноза.* Ошибочная интерпретация результатов обследования пациента,
н том числе биопсийного материала.Таким образом, перечень диагностических методов в каждом
конкретном случае должен быть индивидуальным. Рациональность
нрпчебных действий должна обосновываться возможностью на ран¬
них стадиях болезни установить правильный диагноз и тем самымі.'ічастую спасти жизнь больного. Поэтому применение так называ¬
емой разумной выжидательной тактики, проведение тест-терапии в
(рудных диагностических ситуациях представляются не только мало¬
убедительными, но и неприемлемыми.
Глава 1
АльвеолитыИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ
АЛЬВЕОЛИТШиопатический фиброзирующий альвеолит (ИФА) (сино¬
нимы: идиопатический фиброз легких, криптогенный
фиброзирующий альвеолит, болезнь Хаммена-Рича и
др.) представляет собой своеобразный патологический
процесс в легких неясной природы, характеризующий¬
ся нарастающей дыхательной недостаточностью (ДН)
вследствие развития преимущественно в интерстици¬
альной ткани легких небактериального воспаления и
прогрессирующего интерстициального фиброза.В последние годы накоплен значительный клиниче¬
ский и научный материал благодаря широкому использо¬
ванию самых современных методов исследования: ВРКТ,
иммуногистохимические исследования, молекулярная
диагностика и др. Однако складывается впечатление, что
этот богатый фактический материал пока до настоящего
времен и не получил глубокого систем ного анализа и адек¬
ватной оценки. Несмотря на «соглашения» (консенсусы),
разработанные группами специалистов Европейской
респираторной ассоциации и Американского торакаль¬
ного общества на основе многочисленных публикаций
последних лет, проблема остается открытой для дискус¬
сий, так как сохраняются противоречия в представлени¬
ях об этом заболевании.
ИДИОПАТИЧЕСКИЙ Ф1/ІБР03ИРУЮЩИЙ АЛЬВЕОЛИ! • 25Для того чтобы понять причины существующих противоречий,
представляется целесообразным вспомнить основные этапы изуче¬
ния :зтой проблемы в историческом аспекте. Известно, что L. Hamman
и Л. Rich [1933, 1935 и 1944J одни из первых описали «острый диф-
(|»узный интерстициальный фиброз легких» у четырех пациентов с
ііроірессирующей ДН, приведшей к летальному исходу в течение
'I -6 мес. Эпонимический термин «болезнь Хаммена—Рича» в насто¬
ящее время применяется лишь как синоним острого течения ИФА.
Термин «фиброзирующий альвеолит», впервые предложенный в
1964 г. J. Scadding, по нашему мнению, наиболее адекватно отражает
су ] ь того патологического процесса, который имеет место в легочнойI кани. Понятие «альвеолит» характеризует, во-первых, место пораже¬
ння (не только стенка альвеолы, но и сама альвеола), во-вторых, этоII широком понимании воспаление (естественно, не бактериальное),II котором участвуют соответствующие клетки-эффекторы и которое
приводит к широкому спектру клеточной и тканевой дезорганизации.
Определение «фиброзирующий» как нельзя лучше подчеркивает
динамику этого заболевания и его исход. Определение «идиопати-
мсский» вычленяет этот патологический процесс из целой группы
фиброзирующих альвеолитов известной природы и вызванных, как
правило, экзоге*шыми аллергическими, токсическими или токсико-
ііллергическими агентами.В последнее десятилетие Б американской литературе широко
используется термин «идиопатический легочный фиброз», который
иря д ли можно считать удачным. Дословно этот термин говорит о том,
чК) в легочной ткани имеется фиброз, развившийся по неизвестной
причине, в то же время понятие «фиброз» — это не нозологичес¬
кая форма, так же как не является нозологической формой понятие
•рубец» (посттравматический или послеоперационный).С начала 60-х годов прошлого столетия отмечается значитель¬
ный рост числа больных ИФА. Распространенность ИФА варьи¬
рует, по данным разных авторов, в достаточно широких пределах:
от 6 до 32 случаев на 100 000 населения [Coultas D.B., Hubbard R,,
2004J. В Финляндии распространенность фиброзирующего альве-
олита составляет 16-18 на 100 000 населения [Hodson U. et al., 2002].
Достаточно единодушное мнение о том, что за последние годы число
Сольных ИФА увеличивается, было подтверждено результатами эпи¬
демиологических исследований ученых разных стран. Von Plessen и
соант. [2003] сообщили о росте распространенности ИФА в Норвегии
■ia семь лет с 19,7 [1991] до 23,9 [1998] на 100 000 населения. J. Gribbin
26 • ГЛАВА І.АЛЬВЕОЛИТЬІИ соавт. [2006] доказали прогрессивный рост заболеваемости ИФА в
период с 1991 по 2003 г. {р <0,00001) в Северной Англии и Шотландии.
Средние «интернациональные» показатели распространенности и
заболеваемости составляют соответственно 10—20 и 7—10 на 100 ООО
населения [Diaz J.I., Ouellette D.R., 2008].В нашей стране не проводилось исследований по определению
распространенности ИФА с применением современных эпидемио¬
логических методов. Существует представление об ИФА как о редко
встречающемся заболевании. Такая ситуация сложилась вследствие
широкого использования в недалеком прошлом диагноза «хрони¬
ческая пневмония», а в последние годы — «затяжная пневмония»
и гипердиагностики туберкулеза легких. Этому также способству¬
ет недостаточная осведомленность врачей об ИЗ Л и ограниченное
использование современных диагностических методов. Нередки слу¬
чаи, когда гистологическое исследование материала биопсии или даже
аутопсии не вносит ясности и диагнозы «неспецифическое заболева¬
ние легких» и «распространенный пневмофиброз» остаются в патоло¬
гоанатомических заключениях. К сожалению, эти истории болезни не
становятся предметом обсуждения на патологоанатомических конфе¬
ренциях, так как формально расхождения диагнозов нет, и у лечащего
врача создается иллюзия в правильности своих диагностических и
терапевтических действий. Несомненно, представление об ИФА как
об исключительно редком заболевании отнюдь не способствует его
своевременной диагностике. Вероятно, поэтому в отечественной
литературе нам не удалось найти каких-либо сведений о распростра¬
ненности ИФА. В публикациях представлены, как правило, лишь
единичные наблюдения или обзоры литературных источников.Поданным НИИ пульмонологии СПбГМУ им. акад. И.П. Павлова,
гиподиагностика ИФА составляет 80—82%. В этой связи особенно
актуально звучит мысль, высказанная акад. Е.М. Тареевым еще в
1974 г. по поводу так называемых редких болезней; «Практически все
болезни, в том числе составляющие своего рода основной диагности¬
ческий фонд современной терапевтической клиники, первоначально
описывались как редкие, чтобы через какой-то период «инкубации»,
раньше исчислявшийся десятилетиями, а теперь годами и даже меся¬
цами, стать весьма распространенными».За последние 25 лет в НИИ пульмонологии наблюдались 485 боль¬
ных ИФА. Соотношение мужчин и женщин в этой группе составило
1:2,5. По данным зарубежных авторов, мужчины болеют ИФА чаше,
чем женщины [Schwartz D.A., 2000 и др.], В США распространенность
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АПЬВЕОЛИТ • 27ИФЛ составляет 20 на 100 000 среди мужчин и 13 на 100 000 среди
жсишин, а заболеваемость соответственно 11 и 7 на 100 ООО населения
I Kaghu G. et aL, 2006]. Преобладание мужчин среди больных ИФА в
работах англо-американских авторов может объясняться терминоло-
I ическими противоречиями, в связи с чем в эту группу включались
пациенты не только с ИФА, но и с другими фиброзируюшими альве¬
ол итами, возникшими в ответ на воздействия известных, например
химиотоксических, факторов.В международном консенсусе 2000 г., разработанном группами спе-
и иалистов Европейской респираторной ассоциации и Американского
иіракального общества, указывается, что ИФА чаще заболевают люди
пожилого возраста. Результаты собственных наблюдений показали,
что ИФА болеют преимущественно люди среднего возраста, одна¬
ко это заболевание может проявиться как у детей, так и у пожилых
июлей. Средний возраст больных, наблюдаемых в НИИП, составил
47±0,9 лет, 22,8% пациентов были старше 60 лет.Этиология и факторы рискаДо настоящего времени этиология ИФА остается неизвестной.
Предположение о вирусной природе заболевания впервые высказа¬
ли еще J. Hamman и А. Rich в 1935 г., но дальнейшие исследования,
направленные на поиск вируса возбудителя, не увенчались успехом.
! ем не менее в настоящее время нет достаточных оснований ни пол¬
ностью отвергнуть эту гипотезу, ни подтвердить ее. Ставшие уже
классическими экспериментальные исследования, проведенные на
мышах [Jacob J. etal, 1983], показали, что вирусная инфекция вызыва-
С1‘ хроническую мононуклеарную интерстициальную пневмонию по
і ипу альвео;гита. Было выявлено, что после перенесенной инфекции,
иызванной вирусом гриппа, высокая концентрация соответствующе¬
го антигена сохраняется в легких в течение года и является стимулом
для развития хронического альвеолита. Через 4—6 мес после перене¬
сен пой мышами вирусной инфекции в легочной ткани выявлялись
(|)иброзные изменения, проведенное исследование позволило авторам
сделать вывод, что персистирование вирусного антигена, вызываю¬
щее хроническую стимуляцию иммунной системы с клеточной меди¬
ацией, может способствовать формированию в легких альвеолита
и фиброзных изменений посредством многих механизмов, включая
нугоиммунный. Вместе с тем подобные работы не могут с достовер¬
ностью объяснить причину возникновения ИФА у человека.
28 • ГЛАВА 1.АЛЬВЕОЛИТЫТаким образом, предположение о вирусной природе заболевания
пока не нашло достаточно убедительных подтверждений. Наиболее
часто у больных ИФА отмечалась персистенция вирусов Эпштейна-
Барр, гриппа, герпеса, гепатита С, цитомегаловируса, а также внут¬
риклеточных микроорганизмов (микоплазма, хламидия, легионе л л а)
[Jiwa М. et al., 1990; Meliconi R, P. et al., 1996; Egan JJ. et al., 1997].
Вирусы Эпштейна—Барр выявлялись в клетках легочного эпителия,
а антигены этого вируса определялись в легочной ткани методом
иммунофлюоресценции [Stewart J.P. et al., 1999]. Следует отметить, что
вирусы Эпштейна—Барр с большей частотой выявлялись у больных с
неблагоприятным прогрессирующим течением ИФА [Malizia А.Р. et
al., 2008]. W.E. Lawson и соавт. [2008] доказали, что вирус герпеса, кото¬
рый часто выявляется у больных ИФА, вызывает нарушение функции
альвеолоцитов И вследствие мутации, в результате чего происходит
повреждение протеина с, сурфактанта. Клинические наблюдения
в НИИ пульмонологии свидетельствуют о том, что у больных ИФА
вирусная инфекция предшествовала началу болезни в 32,3% и нередко
служила причиной обострения.Предположение о том, что курение — один из факторов риска,
высказываемое многими учеными, нашло свое отражение в меж¬
дународном консенсусе. Результаты исследования К.М. Antoniou и
соавт. [2008] показали, что из 249 больных ИФА 166 (66,6%) являлись
курильшиками, именно у этих пациентов заболевание протекало
особенно неблагоприятно. Если учесть, что по обобщенным данным
в России курят 63% мужчин и 15% женщин, то мнение о том, что
курение является фактором риска развития ИФА, представляется
малоубедительным. Среди наблюдаемых нами пациентов с ИФА
курильщики составили лишь 11,0% (47,7% мужчин и 1,8% женщин),
что во много раз ниже, чем в общей популяции, однако у курящих
пациентов заболевание протекало неблагоприятно. Согласно меж¬
дународному консенсусу гастроэзофагеальный рефлюкс относится
к одному из факторов риска развития ИФА, однако оригинальных
исследований в этой области недостаточно, R.W. Tobin и соавт. [1999]
обследовали группу пациентов с ИФА (19 человек) и обнаружи¬
ли гастроэзофагеальный рефлюкс у подавляющего большинства
больных ИФА (94%). G. Ragu и соавт. [2006] выявили у 87% больных
ИФА клинические проявления гастроэзофагеального рефлюкса.
Симптомы гастроэзофагеального рефлюкса нами выявлены в 20,9%
случаев. Наличие у больных ИФА гастроэзофагеального рефлюкса
не исключает его роли в развитии патологического процесса, однако
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ • 29но шожна и обратная связь, т.е. формирование гастроэзофагеального
рсм|)люкса на фоне прогрессирующего пневмофиброза и глюкокор-
шкоидной терапии.В последние годы высказываются гипотезы о генетической пред-
рисіюложенности к этому заболеванию. Выявление ИФА у родствен¬
ников, которые в течение многих лет проживали вдали друг от друга,I иидетельствует в пользу такой возможности. Частота возникновения
семейного ИФА, по данным разных авторов, колеблется от 1 до 25%.1 Ісрвое сообщение о семейном фиброзирующем альвеолите появи¬
лось в 1907 г., т.е. задолго до широко известной публикации Хаммена
и Рича [1935].R.P. Marschall и соавт. [2000j выявили 67 случаев ИФА в 25 семьях.
Ре зультаты их эпидемиологического исследования показали, что рас-
щюстраненность семейной формы ИФА составляет 1,34 случая на 100 ООО
ікіселения. В Финляндии семейные формы составляют 3,3 — 3,7%
иссх случаев ИФА [Hodson U. et ai., 2002J. По данным J.E. Loyd [2003],
20% всех случаев ИФА являются семейными. Считается, что семей-
III.IC ИФА чаше встречаются у лиц с HLA-A2, В8, В12 (HLA — human
Ivucocytes antigen — человеческий лейкоцитарный антиген), одна¬
ко повышение частоты выявления упомянутых антигенов не было
сіатистически достоверно. Результаты исследования, проведенного
W.b. Lawson и J.E. Loyd [2006], показали, что мутация гена, «ответс-
1'нснного» за сурфактант С, является причиной развития семейного
ИФА. У больных семейной формой ИФА выявили мутацию в генах,
кодирующих теломеразу, которая, в свою очередь, активизирует апоп-
103 клеток [Fridlender Z.G. et al., 2008]. Следует отметить, что среди 485
больных ИФА, наблюдавшихся нами, были выявлены 8 случаев (1,6%)
семейной формы ИФА.Гипотеза об аутоиммунной природе ИФА не получила достаточ¬
ных доказательств. Впервые мнение о том, что ИФА является своеоб¬
разным коллагенезом, было высказано Дж. Крофтоном и А. Дугласом
11974]. Синдром фиброзирующего альвеолита (СФА), который разви-
нается при системной склеродермии (ССД), ревматоидном артрите
(РА) и других Д БСТ, в отличие от ИФА характеризуется высокой лабо¬
раторной активностью, в том числе иммунологической, в большинс-
! не случаев смешанным нарушением ФВД, наличием признаков вас-
кулита в биоптатах легочной ткани и более благоприятным течением
на фоне глюкокортикоидной терапии и экстракорпоральных методов
лечения (плазмаферез и гемосорбция). В связи с этим к СФА и ИФА
нельзя относиться как к одному и тому же заболеванию.
зо • ГЛАВА І.АПЬВЕОЛИТЬІПо-Прежнему актуальна гипотеза о полиэтиологичности ИФА,
предполагающая, что факторы бактериальной, вирусной, аллерги¬
ческой, токсической или другой природы могут играть роль пусково¬
го момента, вызывающего стереотипную реакцию легочной ткани.
Этому предположению не противоречат отрицательные данные мно¬
гочисленных бактериологических и микологических исследований
при ИФА, осуществляемых, как правило, на поздних стадиях болез¬
ни. В соответствии с одной из гипотез роль антигенного стимула при¬
писывается базальным мембранам альвеол.Определенное значение в возникновении ИФА могут иметь урба¬
низация в современном индустриальном обществе, усиливающееся
загрязнение воздушного бассейна и профессиональные вредности.
В последние годы все активнее высказывается мнение о том, что ИФА
относится к профессиональным заболеваниям. При минералоги¬
ческом анализе в легочной ткани больных ИФА обнаружили повы¬
шенное содержания кремния и металлов, включая железо и никель
[Мопсо Е. et al., 1990]. Исследования К.В. Baumgartner и соавт. [2000] и
S. Taskar V.S. и D.B. Coultas [2006] выявили более частую встреча¬
емость ИФА у работников сельского хозяйства, животноводства,
птицеводства, у парикмахеров, а также у людей, контактирующих с
металлической пылью, занимающихся резкой или шлифовкой камня.
Непроизвольно возникает вопрос: почему заболевания, развивающи¬
еся при контакте с профессиональными вредностями, — ИФА, а не
ЭАА или ЭТА?Среди наблюдавшихся нами больных не удалось выявить какие-
либо предшествующие заболеванию факторы, которые можно было
бы предположительно связать с возникновением болезни, среди
заболевших преобладали лица умственного труда (64%). Лишь 15%
больных имели постоянный или кратковременный контакт с про¬
фессиональными вредностями. Таким образом, все попытки найти
конкретный этиологический фактор (факторы), играющий роль в
возникновении ИФА, на сегодняшний день безуспешны.Патогенезв настоящее время можно выделить две основные гипотетические
теории о патогенезе ИФА. Сторонники одной из них — классической,
считают, что патологический процесс при ИФА представляет собой
своеобразное воспаление и состоит из последовательных стадий —
отека, клеточной инфильтрации (альвеолита) и последующего фиб-
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ ♦ 31\нуул. Основоположниками второй теории, более современной, стали
м. Sclman и соавт. [2001]. Согласно этой гипотезе основой патогенеза
яиляется не воспаление, а нарушение процессов регенерации альве-
о'юцитов после повреждения. Патологический процесс запускается
I к ифежденными альвеолоцитами и характеризуется миграцией и про-
)и1(1>срацией фибробластов и миофибробластов, угнетением апоптоза
миофибробластов и повышением активности цитокинов, стимули¬
рующих пневмофиброз [трансформирующий фактор роста (TGF-pi),
<1>лк'1'ор некроза опухоли альфа (TNF-a), фактор роста тромбоцитов и
ипсулиноподобный фактор роста]. В результате происходит ремоде-
нирование внеклеточного матрикса, включая деструкцию базальной
мембраны, ангиогенез и фиброз.Такое представление о патогенезе ИФА является дискутабельным.
Нее упомянутые выше процессы могут иметь место, но это не исключает
роли воспаления как стереотипной реакции на повреждение. Возможно,
U 1ЛВИСИМОСТИ от особенностей реагирования организма воспалитель-
|||>1й процесс развивается по тому или иному типу. При десквамативном
илрианте заболевания в большей степени выражена экссудация и кле-
тпч пая инфильтрация, муральный вариант ИФА характеризуется преоб¬
ладанием процессов фиброзирования. Только этим может объясняться
и|к|)ективность глюкокортикоидов у больных с десквамативной формой
И<1)Д или на ранних стадиях при муральном варианте заболевания.В связи с тем что единого мнения о патогенезе ИФА до настояще-
И) времени не сложилось, целесообразно рассматривать отдельные
іі:ітогенетические механизмы. Исследования экспериментального
(|)иброза у животных, проводимые в НИИ пульмонологии СПбГМУ,
позволили в большей степени приблизиться к пониманию пато¬
генетических механизмов развития этого заболевания у человека
(Данилов Л.Н. и др., 1991; 1998]. Как уже отмечалось, в результате пока
неизвестных причин в легочной паренхиме при ИФА возникает пато-
логический процесс, характеризующийся дезорганизацией клеток,
составляющих структурную основу альвеол (альвеолоциты I, II и ПІІ ИНОВ, эндотелиальные клетки капилляров, интерстициальные клет¬
ки). Поражение эндотелиальных клеток прргводит к нарушению их
многогранных функций; защитной, трофической, метаболической,
поддержания динамического равновесия системы брадикигіинанги-
отензин и др. Дезорганизация клеток, составляющих паренхиматоз¬
ную основу альвеол, приводит к снижению выработки и изменению
кячественного состава сурфактанта, продуцируемого в норме альвео¬
лярными клетками П типа, нарушению функции аэрогематического
32 • ГЛАВА І.АЛЬВЕОЛИТЬІбарьера, образуемого альвеолярными клетками I типа. Существует
гипотеза, что атипичность сурфактанта объясняется мутацией гена,
ответственного за синтез протеина С сурфактанта, или поражением
альвеолоцитов вирусом герпеса [Lawson W.E. et al., 2008].Результаты некоторых исследований, в том числе К. Kuwano и
соавт. [2003], выявили повышенную оксидативную активность аль¬
веолоцитов, что позволяет предположить участие в развитии ИФА
свободных радикалов. Так, предположение о том, что железо является
кофактором, необходимым для повреждения легких свободными
радикалами, было подтверждено на модели экспериментального фиб¬
роза, вызванного фактором, полученным из яда кобры; введение экс¬
периментальным животным железосвязывающих соединений позво¬
лило предотвратить развитие фиброзирующего процесса в легких.
Этот факт может иметь большое значение, так как у больных ИФА
было выявлено достоверное повышение уровня железа в перифери¬
ческой крови, коррелирующее с выраженностью ДН.в последнее время все больше исследований посвящены изучению
роли апоптоза в патогенезе ИФА. Апоптоз альвеолоцитов может сти¬
мулироваться разными причинами, в том числе оксидативным стрес¬
сом, ангиотензином И, TGF-P,. Представляет интерес исследование
активности теломеразы, которая угнетает клеточный апоптоз, в ее
состав входят РНК и каталитический белок. Z.G. Fridlender и соавт.
[2008] показали, что у больных ИФА акивность теломеразы резко сни¬
жена в альвеолоцитах и повышена в фибробластах.Большое значение в повреждении паренхимы легких придается
нейтрофилам. Увеличение числа нейтрофилов в лаважной жидкости
(10—30% всего клеточного состава), а также в материале, получаемом
при открытой биопсии легочной ткани, связывают с выделением аль¬
веолярными макрофагами нейтрофильного хемотаксического факто¬
ра. Сравнительно короткий период жизни нейтрофилов и освобож¬
дение при их гибели протеолитических ферментов (в первую очередь
коллагеназы, разрушающей коллаген) играет, по-видимому, важную
роль в патогенезе ИФА, так как известно, что расщепление коллагена
активированной нейтрофильной коллагеназой приводит к усиленно¬
му ресинтезу патологического коллагена.Как известно, легкие не имеют надежных средств инактивации
коллагеназы при длительном ее гиперсинтезе (в отличие от эла-
стазы, инактивирующейся антипротеазами, основной из которых
является а^-антипротеаза). По-видимому, этим объясняется отсут¬
ствие у больных ИФА изменений по эмфизематозному типу. Доказано
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ • 33га К же повреждающее действие на альвеолярные клетки радикалов
кислорода, высвобождаемых нейтрофилами и альвеолярными мак¬
рофагами.Существенное значение в патогенезе ИФА имеют альвеолярные
макрофаги, которые активируются иммунными комплексами. Синтез
:1львеолярными макрофагами фибронектина, тромбоцитарного фак-
юра роста, а также так называемого фактора роста альвеолярных
макрофагов и других факторов оказывает значительное влияние
на пролиферацию фибробластов и других мезенхимальных клеток
((І)ибронектин оказывает хемотаксический эффект на фибробласты,
способствует их фиксации на коллагеновой матрице и усиливает их11 ролиферацию).Изучение механизмов роста и пролиферации альвеолярных мак¬
рофагов при фиброзирующих процессах в легких позволило получить
ді)іюлнитсльную информацию о процессах, имеющих место в легоч¬
ном интерстиции. Оказалось, что фибробласты могут синтезировать
НС только фибронектин, коллаген матрикса, эластин, ряд протеиназ,
по и тканевой ингибитор протеиназ — металлопротеиназы.Таким образом, потеря контроля над синтезом и распадом ком¬
понентов соединительной ткани приводит к тому, что в процесс
коллагенообразования вовлекаются кроме так называемых активи¬
рованных фибробластов и другие клетки, в норме не продуцирующие
коллаген. Возможно, что избыточный синтез фибробластами коллаге¬
на стимулируется гипоксией, возникающей вследствие отека межкле-
1’омного вещества, и поддерживается альвеолярными макрофагами,
лимфоцитами, нейтрофилами, эозинофилами, тучными клетками.
В частности, отмечено супрессорное действие некоторых субпопуля¬
ций лимфоцитов на продукцию коллагена в норме и отсутствие этого
)ф(|)екта при ИФА. Вырабатываемые лимфоцитами лимфокины,
и сною очередь, способствуют пролиферации фибробластов, активи-
ру ют способность альвеолярных макрофагов секретировать коллаген.
Лимфоциты выделяют так нызываемый мигрирующий ингибитор-
иый фактор, в обычных условиях тормозящий коллагеновый синтез
иа 30-40%. Одной из причин гиперпродукции коллагена может быть
срыв супрессорного действия этого фактора.Получены данные о том, что у больных ИФА ]товышается цитоток¬
сичность лимфоцитов периферической крови и ЖБАЛ. Снижение цито-
ІЧЖСИЧНОСТИ лимфоцитов в процессе лечения достигается преимущест¬
венно у лиц, хорошо реагирующих на глюкокортикоидные препараты.
Аналогичные данные получены и в эксперименте; лимфоцитарная цито-
34 • ГЛАВА 1.АЛЬВЕОЛИТЫТОКСИЧНОСТЬ резко возрастает через четыре дня после интратрахеального
введения блеомицина экспериментальным животным.О состоянии коллагенового обмена в организме косвенно можно
судить по изменению его метаболитов в крови, моче и ЖБАЛ.
Исследования, проведенные в лаборатории биохимии НИИ пуль¬
монологии (Санкт-Петербург), показали, что у больных этой груп¬
пы статистически достоверно увеличивается (по сравнению с нор¬
мой) экскреция с мочой урогликопротеидов и гликозаминогликанов.
У более половины больных (52%) увеличивается экскреция с мочой
оксипролина. Отмечается также статистически значимое {р <0,001)
повышение уровня как общей протеолитической, так и антитрипти-
ческой активности крови. Отклонения от нормы упомянутых биохи¬
мических показателей свидетельствуют о выраженных в различной
степени нарушениях обмена в межуточной соединительной ткани
легких. Дополнительной характеристикой, указывающей на дезорга¬
низацию соединительной ткани у больных ИФА, служат показатели
содержания сиаловых кислот и гаптоглобина в сыворотке крови, сред¬
ние уровни которых, как правило, повышены.До настоящего времени нет единого мнения о степени и харак¬
тере участия иммунологических механизмов в патогенезе ИФА.
Предполагается, что наиболее вероятным типом иммунологических
реакций, имеющих место при этом заболевании, является реакция
замедленного типа. В патологический процесс вовлекаются иммун¬
ные комплексы, некоторые компоненты комплемента, лизосомаль-
ные ферменты, альвеолярные макрофаги, нейтрофилы и метаболиты
активированного кислорода. Об изменениях гуморального звена
иммунитета в сторону его активации свидетельствуют следующие
данные: повышенные уровни циркулирующих иммунных комплек¬
сов (ЦИК) выявляются у 41% больных; более чем у половины пациен¬
тов определяются неполные противолегочные аутоантитела; у боль¬
шинства больных ИФА (76%) регистрируются повышенные уровни
иммуноглобулинов класса А и класса G — IgA и IgG (у 41% больных);
в лаважной жидкости больных обнаруживаются повышенные уровни
IgG и IgM, а приблизительно у одной трети больных выявляется анти-
нуклеарный фактор и несколько реже (24%) — ревматоидный фактор.
Частота встречаемости ревматоидного фактора и противоядерных
антител (антинуклеарных антител — АНА или ANA) нарастает по
мере прогрессирования заболевания.Таким образом, представленные данные свидетельствуют о нали¬
чии у больных ИФА дисбаланса в соотношении клеток, обладающих
ИДИО ПАТИ ЧЕСКИ Й ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ • 35чічіпсрной и супрессорной активностью, что приводит к активации
It системы иммунитета и, соответственно, вызывает сдвиг показате-
к-й, характеризующих гуморальный иммунитет, в сторону его повы¬
шения.Важную роль в развитии ИФА играют цитокины, вырабатывае¬
мые иммунокомпетентными клетками. Условно цитокины можно
рлщелить на два типа: ТЫ и Th2. Цитокины ТЫ [интерфероны
(ИФН-у), интерлейкины (ИЛ): ИЛ-2, ИЛ-12, ИЛ-18] относятся к про-
ипспалительным. Цитокины Th2 (ИЛ-4, ИЛ-5, ИЛ-10, ИЛ-13) являют-
(и противовоспалительными, участвуют в активации гуморального
«исиа иммунитета [Stricter R.M., Keane М.Р., 2000]. Пролиферация
фибробластов и прогрессирующий пневмофиброз обусловлены пито-
к и новым дисбалансом, повышенной активностью профибротических
ш-йкотриенов и дефицитом антифибротических простагландинов.В настоящее время предполагают, что возникновение ИФА, осо-
(>снности течения, ответ на проводимую терапию во многом обуслов-
(1СНЫ генотипом [Lawson W.E., Lloyd J.E., 2006]. Ряд авторов упомина¬
ют о наличии так называемого гена фиброзирования, влияющего наI интез фактора, стимулирующего рост фибробластов.Основным патологическим субстратом, определяющим клини¬
ческую картину ИФА, является разрастание соединительной ткани в
исгких, что приводит к утолщению и уплотнению межальвеолярных
iii: ре городок, облитерации альвеол и капилляров фиброзной тка¬
нью. Следствием коллагенизации интерстициальной стромы легких
яі^ляется уменьшение эластичности стенок альвеол и легких в целом.
Увеличение эластического сопротивления легочной ткани обуслов¬
ливает уменьшение растяжимости и, соответственно, недостаточ¬
ное расправление альвеол, ухудшение альвеолярной вентиляции
и увеличение работы дыхания. Однако гипоксемия, выявляемая у
больных ИФА, зависит не только от функциональных свойств самой
ильвеолярно-капиллярной мембраны, но и от степени поражения
капиллярного русла легких. Морфометрические и ангиографические
исследования альвеол и капиллярной сети легких при этом заболе-
нании подтвердили глубокие изменения капиллярного русла легких,
характеризующиеся значительной его редукцией. Вследствие проис¬
ходящих изменений увеличивается скорость тока крови в функци¬
онирующих капиллярах легких, в особенности в условиях нагрузки
(нри увеличении минутного объема сердца), что ведет к уменьшению
не только площади, но и времени контакта эритроцитов с альвеоляр¬
ным воздухом.
36 • ГЛАВА І.АЛЬВЕОЛИТЬІТаким образом, уменьшение ДСЛ у больных ИФА не только свя¬
зано с изменениями, происходящими в альвеолярно-капиллярной
мембране, но и зависит от нарушений перфузии и усугубляется сни¬
жением проницаемости альвеолярного эпителия для газов в связи с
метаплазией его в кубический, а также поражением мелких дыхатель¬
ных путей по типу облитерирующего бронхиолита. В нарушениях
газообмена при этом заболевании определенную роль играет вено-
артериальный шунт. Гипоксемия, обусловленная перечисленными и
другими причинами, увеличивается благодаря рефлекторному суже¬
нию сосудов легких вследствие эндокапиллярной гипоксемии (реф¬
лекс Эйлера—Лильестренда). Повышение давления в малом круге
кровообращения может привести к формированию легочного сердца.Патологическая анатомияИФА — заболевание, характеризующееся прогрессирующим пора¬
жением интерстициальной ткани легких. Прогрессирование патоло¬
гического процесса не ограничивается поражением соединительной
ткани межальвеолярных перегородок, а распространяется и на пери-
лобулярную, перибронхиальную и периваскулярную соединитель¬
ную ткань. Разрастание интра- и перибронхиальной соединительной
ткани приводит к поражению мелких бронхов (мелкими считаются
внутридольковые бронхи, диаметр просвета которых не превышает2 мм). Характер и особенности клеточных реакций и морфологичес¬
ких изменений являются основанием для выделения не только ста¬
дий, но и морфологических форм болезни.Макро- и микроскопическая картина легких зависит от формы и
стадии болезни. На ранних стадиях патологического процесса пора¬
женные легкие увеличены в объеме, тестоватой консистенции, на раз¬
резе — серого цвета. Наиболее ранними проявлениями ИФА являют¬
ся очаговые повреждения эндотелия сосудов, которые сначала можно
обнаружить только при электронно-микроскопическом исследова¬
нии (отек цитоплазмы, увеличение числа пиноцитозных вакуолей,
разрыв цитоплазматической мембраны). Эти изменения во многом
объясняют дальнейшую перестройку легочной ткани. Повреждение
сначала приводят к интерстициальному отеку соединительной ткани
и накоплению клеток преимущественно в стенках альвеол. Отечная
жидкость бедна клетками. При окраске альциановым синим и при
PAS-реакции определяются кислые и нейтральные мукополисахари-
ды. Межальвеолярные перегородки в отдельных участках расширены.
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИ! * 37ин(|)ильтрированы лимфоцитами, нейтрофилами, мононуклеарами
(рис. 1.1 а, см. ЦБ, вклейку).Гиперплазия аргирофильных волокон, пролиферация и набухание
ИІДОТСЛИЯ альвеолярных капилляров приводит к сужению их про-
тега, постстенотическим расширениям и стазу крови. В просветах
;| )М)Веол местами определяется серозный экссудат, макрофаги и деск-
намированный эпителий. Наряду с отеком интерстициальной ткани
и гиперплазией аргирофильных волокон выявляются варикозные
И иіутия, разволокнение и распад на отдельные фрагменты аргиро-
<1)ильных волокон. Эластические волокна дистрофичны, разорваны,
утолщены и фрагментированы (рис. 1.1 б, см. ив. вклейку).При прогрессировании процесса наблюдаются дистрофические
и шенения капилляров (спадание стенок, деструкция эндотелия).
Назальная мембрана разволокнена, альвеолярные перегородки рас¬
ширены, утолщены за счет пролиферации септальных фиброблас-
Toit. Пневмоциты I типа слущиваются в просветы альвеол, и с целью
иосстановления альвеолярной выстилки происходит гиперплазия
мисвмоцитов II типа. В гистологической картине доминирует гріпер-
млазия альвеолярного эпителия и превращение его в кубический с
образованием «аденоматозных» структур, а также признаки прогрес¬
сирующего склероза межальвеолярных перегородок (рис. 1.1 в, см. цв.
иклейку).В далеко зашедших стадиях болезни легкие макроскопически
плотны на ощупь, уменьшены в объеме. Морфологическая структу¬
ра их резко нарушена: межальвеолярные перегородки утолщены и
уплотнены за счет их фиброзирования. Преимущественно в субплев-
рал ьных отделах легких образуются микрокисты, в просветах кото-
[1І.ІХ иногда выявляются белковые массы, альвеолярные макрофаги,
просветы сосудов сужены за счет склероза и гиперплазии интимы,
(Іюрмируется «сотовое легкое». Микроскопически, особенно в под¬
ії лсвральных отделах, наблюдаются многочисленные кисты, выстлан¬
ные бронхиолярным эпителием. Микрокисты содержат в просветах
белковые массы, богатые нейтральными и кислыми гликозоаминог-
ликанами (рис. 1.1 г, см. цв. вклейку).Кисты имею'г толстые фиброзные стенки, организация серозно-
(Іжброзной жидкости, содержащейся в бронхиолах, ведет к развитию
облитерирующего бронхиолита с выраженными перибронхиальными
изменениями, в ряде случаев выявляются участки организующейся
пневмонии (рис. 1.2 а, б, см. цв. вклейку). Во многих участках гисто¬
архитектоника легочной ткани резко нарушена, встречаются участки
38 • ГЛАВА 1,АЛЬВЕ0ЛИТЫС «миоидным» склерозом, ангиоматозом и перестройкой сосудов по
замыкательному типу (рис. 1.2 в, г, см. цв. вклейку).При электронно-микроскопическом исследовании определяются
фибробласты с большим числом лизосомальных структур, свобод¬
ных рибосом и полисом в цитоплазме. Наряду с этим выявляется
значительное разрастание неклеточных компонентов соединитель¬
ной ткани — обширные поля коллагеновых волокон, В легочном
интерстиции накапливается коллаген преимущественно III, IV
и V типов.На поздней стадии болезни возникает выраженная пролиферация
эпителия мелких бронхов и бронхиол, а также альвеолярного эпите¬
лия с очагами метаплазии и дисплазии (рис. 1.3 а, б, см. цв. вклейку).В 1967 г. и. Ceqla предложил выделить две клинико-морфологи¬
ческие формы ИФА: муральную (с преимущественым поражением
интерстициальной ткани легких) и десквамативную (с преимущест¬
венным поражением альвеол). По мере прогрессирования десквама-
тивной формы ИФА, если не проводилось своевременное адекватное
лечение, клеточная инфильтрация, выявляемая на ранних стадиях
болезни, постепенно уменьшается, и на первый план выступают про¬
цессы фиброзирования. Исходом патологического процесса (как и
при муральной форме) является интерстициальный фиброз и форми¬
рование «сотового» легкого.Электронно-микроскопическое исследование биопсийного мате¬
риала при десквамативной форме болезни свидетельствует о том,
что альвеолы заполняются не только слуш;енными альвеоцитами, но
(в значительной мере) и альвеолярными макрофагами. При десквама-
тивном варианте ИФА десквамация эпителия превалирует над фиб¬
розом и клеточной инфильтрацией интерстиция. Просветы альвеол
заполнены альвеолярными макрофагами, пневмоцитами, межаль-
веолярные перегородки практически не утолщены (рис. 1.3 в, см. цв.
вклейку), в фагоцитарных вакуолях некоторых макрофагов обнару¬
живают пластинчатые тельца, по-видимому, частицы сурфактанта,
оставшиеся от погибших пневмоцитов. Следует отметить, что очаги
лимфоцитарной инфильтрации могут наблюдаться как при мураль¬
ной, так и десквамативной форме ИФА (рис. 1.3 г, см. цв. вклейку).Острая форма ИФА характеризуется интерстициальным отеком,
формированием гиалиновых мембран, а также тромбообразованием в
мелких сосудах (рис. 1.4, см. цв. вклейку).Наше отношение к продолжающимся спекуляциям вокруг морфоло¬
гических форм ИФА мы высказали в главе этой книги «Терминология
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ • 39И классификация диссеминированных заболеваний легких». Ретро¬
спективное клинико-морфологическое исследование позволяет счи¬
тать, что ИФА является самостоятельной нозологической формой со
свойственной ей клиникой, морфогенезом, гистологической харак-
геристикой, прогнозом, в пользу этого утверждения свидетельствует
маличие различных гистологических вариантов (организующая пнев¬
мония, обл итерирующий бронхиол ИТ, лимфоцитарная инфильтрация)
на разных стадиях ИФА. Полученные результаты не исключают, что так
называемые NSIP (неспецифическая интерстициальная пневмония) и
LIР (лимфоцитарная интерстициальная пневмония) — это лишь стадии
развития ИФА, ане отдельные нозологические формы. Если на этих ста¬
диях больной получает адекватную терапию, то прогноз благоприятный.
В других случаях заболевание прогрессирует, развивается пневмофиб¬
роз, формируется «сотовое легкое» и появляются признаки, характер-
кые для так называемой обычной интерстициальной пневмонии (UIP).Таким образом, изменения в паренхиме легких при ИФА можно
представить в виде трех взаимосвязанных стадий (фаз): интерс¬
тициального и, в меньшей степени, альвеолярного отека; интер¬
стициального «воспаления» (альвеолита) и интерстициального
(|)иброза. На 1 стадии повышенная проницаемость стенок капилля¬
ров приводит к отеку межальвеолярных перегородок и появлению
іигутриальвеолярного серозно-фибринозного экссудата, относи-
гельно бедного (при муральной форме) клеточными элементами.
Увеличение числа клеточных элементов характеризует переход
патологического процесса во И стадию -- стадию альвеолита. Для
этой фазы заболевания характерна инфильтрация лимфоидными и
плазматическими клетками, а также увеличение числа фиброблас-
юв, гистиоцитов в септальных пространствах межальвеолярных
перегородок. Десквамированные альвеолярные клетки оголяют
базальную мембрану, образуется так называемая альвеолярная
язва. Вследствие поражения эндотелия и базальной мембраны
капилляров возникают микрокровоизлияния.В септальных пространствах межальвеолярных перегородок в
норме выявляются лишь единичные фибробласты, при ИФА число
их увеличивается, изменяется их фенотип, возрастает их функцио¬
нальная активность, проявляющаяся в гиперсинтезе ретикулиновых
и коллагеновых волокон, что ведет к утолщению межальвеолярных
перегородок. Описанные изменения представляют собой уже элемен¬
ты перехода патологического процесса в ПІ стадию заболевания —
стадию интерстициального фиброза.
40 • ГЛАВА І.АПЬВЕОЛИТЬІПатологические изменения при ИФА, как правило, более выраже¬
ны в периферических (субплевральных) отделах легких. Поскольку
именно из этих отделов получают биопсийный материал при диагнос¬
тической торакотомии, степень морфологических изменений нередко
переоценивается.При стереоскопическом и электронно-оптическом исследовании
легочной ткани было выявлено, что у больных ИФА альвеолярные
пространства уменьшены почти наполовину по сравнению с нормой.
В еще большей степени редуцированным оказалось капиллярное
русло в пораженных участках. В то же время масса соединительной
ткани была увеличена более чем в три раза, а альвеолокапиллярная
мембрана утолщена более чем в 2 раза. Утолшение межальвеолярных
перегородок, уменьшение числа пор Кона, цитоз и другие изменения
подтверждены методом сканирующей и трансмиссионной электрон¬
ной МИКрОСКОПРГИ.Определенный интерес представляют применяемые в последние
годы гистоиммунологические методы исследования, которые позво¬
ляют выявить взаимосвязь между морфологическими изменениями
при ИФА и выраженностью иммунологических нарушений.Таким образом, в настоящее время отсутствуют абсолютно пато-
гномоничные морфологические признаки ИФА, в связи с этим диф¬
ференциальная диагнос ги ка представляет определенные трудности и
требует комплексного клинико-морфологического подхода.Клиническая картинаПроявления болезниДля большинства случаев (78%) ИФА характерно хроническое
течение, заболевание начинается с исподволь возникшей прогресси¬
рующей одышки, сухого или малопродуктивного кашля, повышен¬
ной утомляемости (муральная форма), Значительно реже (22%) отме¬
чается острое начало заболевания, которое проявляется повышением
температуры тела до 38—39 "“С, быстро прогрессирующей одышкой,
слабостью, сухим кашлем. Острое течение ИФА характерно для деск-
вамативной формы.Обязательным клиническим признаком ИФА является неук¬
лонно прогрессирующая одышка инспираторного типа, рефрак¬
терная к антибактериальной и бронхоспазмолитической терапии.
Этот признак определяется в 100% случаях ИФА. Степень выра¬
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ • 41женности одышки является достаточно объективным критерием,
позволяющим судить о тяжести и прогрессировании заболевания.
Большинство больных (80%) отмечают характерную особенность
дыхания — невозможность сделать глубокий вдох. Почти половина
больных (43%) предъявляет жалобы на сердцебиение, которое усили¬
вается при физической нагрузке и кашле. У больных с выраженной
одышкой выявляется тахикардия до 90—140 в минуту. Кашель сухой
или со скудной слизистой мокротой отмечают 90% больных. Как
первый признак болезни кашель отмечен у 15% больных, у остальных
больных он появляется на более поздних стадиях и приобретает пос-
юянный характер. Кашель провоцируется физической нагрузкой,
разговором или попыткой сделать глубокий вдох. Приблизительно
и половине случаев больные отмечают боль в грудной клетке без
четкой локализации. В ряде случаев боли могут напоминать стено-
кардическис.Похудание, наблюдаемое в 45% случаев, и повышение температура
тела (42%) указывают, как правило, на прогрессирование патологи¬
ческого процесса и ДН. При остром течении болезни (десквамативная
форма) больные могут терять до 10—12 кг в течение 3—4 мес. У одной
трети больных наблюдается повышение температуры тела до субфеб-
рильной или фебрильной, что также является признаком, свидетель¬
ствующим об активизации патологического процесса. Характерная
особенность лихорадки заключается в том, что пик повышения тем¬
пературы тела нередко приходится на дневные, а не вечерние часы, как
при большинстве воспалительных заболеваний. Следует отметить,
что лихорадка, обусловленная прогрессированием ИФА, рефрактерна
к антибактериальной терапии, но купируется глюкокортикоидными
препаратами.Суставной синдром, включая утреннюю скованность иногда в
сочетании с синдромом Рейно, выявляется у 22% больных ИФА пре¬
имущественно при остром течении болезни. По мере прогрессирова¬
ния болезни артралгии встречаются чаще. Общую слабость и быструю
утомляемость отмечают практически все больные ИФА.Выраженность цианоза зависит от тяжести заболевания: на ранних
этапах хронического течения болезни цианоз наблюдается только при
физической нагрузке. При остром течении болезни цианоз является
.одним из ранних симптомов. Почти у половины больных (46%) выяв¬
ляются характерные изменения ногтевых фаланг по типу «барабанных
палочек» и «часовых стекол» (так называемые пальцы Гиппократа).
Скорость формирования симптома «пальцев Гиппократа» также
42 • ГЛАВА І.АЛЬВЕОЛИТЬІзависит от активности и длительности патологического процесса,
выраженности ДН, отмечается в 20—50% по данным разных авторов.Перкуссия легких выявляет притупление перкуторного тона над
областью поражения (как правило, это нижние легочные поля).
Характерным аускультативным признаком ИФА является ослаб¬
ленное везикулярное дыхание (укорочение фазы вдоха и выдоха) и
крепитирующие хрипы, выслушиваемые, как правило, с обеих сто¬
рон, преимущественно по задней и среднеподмышечной линиям, а
также между лопатками. Нередко этот звуковой феномен называют
«треском целлофана». Пик слышимости крепитации — конец вдоха.
Однако следует отмстить, что крепитация не является патогномо-
ничным признаком ИФА, так как, во-первых, встречается не у всех
больных (у 75—87%), а во-вторых, может выслушиваться и при других
ИЗ Л. Наконец, крепитация у конкретного больного может исчезать
на фоне адекватной терапии. Крепитируюшие хрипы у больных
ИФА на разных стадиях заболевания имеют некоторые отличия:
на ранних этапах болезни (в экссудативную фазу) выслушивается
нежная крепитация; по мере прогрессирования патологического
процесса и развития фиброзных изменений крепитация становится
более звучной и грубой.в далеко зашедших случаях болезни выявляется еще один аускуль¬
тативный феномен — так называемое попискивание, по характеру
напоминающее звук трения пробки. Чаще «попискивание» выслуши¬
вается на вдохе, преимущественно над областью верхних легочных
полей (по передней поверхности грудной клетки). Наличие «попис¬
кивания» преимущественно у больных с распространенным пнев¬
мофиброзом позволяет считать этот звуковой феномен признаком
выраженного плевро-пневмосклероза. Однако ни крепитация, ни
ослабленное везикулярное дыхание, ни «попискивание», не являются
патогномоничными для ИФА. Только в комплексе с другими призна¬
ками они используются в диагностике для уточнения фазы (обостре¬
ние, ремиссия) и тяжести самого заболевания.Клиническая симптоматика ИФА, как следует из изложенного,
не отличается многообразием. Наиболее постоянными симптомами
являются прогрессирующая инспираторная одышка, кашель и быс¬
трая утомляемость. Менее постоянно встречаются повышение тем¬
пературы тела, боли в груди, артралгии, синдром Рейно, похудание.
По мере прогрессирования заболевания нарастают симптомы ДН:
цианоз, изменение ногтевых фаланг по типу «барабанных палочек» и
«часовых стекол» и др.
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ • 43Течение болезниДля ИФА в большинстве случаев характерно первично хрониче¬
ское прогрессирующее течение. Возникшая однажды одышка имеет
тенденцию только к нарастанию. Скорость прогрессирования одыш¬
ки у разных больных может быть различна и зависит от активности
и особенностей течения патологического процесса. У большинства
пациентов (75%) хроническая форма болезни медленно прогресси¬
рует без эпизодов обострения, в остальных случаях периодически
возникают обострения, которые проявляются резким ухудшением
состояния за счет усиления одышки, кашля, цианоза, похудания,
отрицательной динамики показателей ФВД [снижение жизненной
емкости легких (ЖЕЛ) и ДСЛ] и рентіенологической картины, ухуд¬
шением газового состава крови вследствие гипоксемии и повышением
давления в легочной артерии. Иногда присоединяется лихорадка и
лабораторн ые изменения [лейкоцитоз, сдвиг лейкоцитарной формулы
влево, увеличение скорости оседания эритроцитов (СОЭ), острофазо¬
вые реакции].Острое течение болезни проявляется резкой одышкой, слабо¬
стью, высокой лихорадкой и быстрым прогрессированием патоло¬
гического процесса. Такое начало и течение болезни характерно
для десквамативных форм и встречается приблизительно в 15%
случаев. Следует отметить, что десквамативная форма ИФА при
своевременно начатой и адекватной терапии имеет благоприятный
прогноз. При относительно неблагоприятном течении дескваматив-
ной формы болезнь может приобрести хроническую форму, прояв¬
ляющуюся прогрессирующим пневмофиброзом и формированием
«сотового легкого «>.Влияние беременности на течение ИФА изучено недостаточно.
Описаны единичные случаи прогрессирования заболевания на фоне
беременности и более благоприятного его течения в послеродовом
периоде. Однако большинство исследователей считают, что основной
проблемой беременности на фоне ИФА является нарушение газооб¬
мена плода, зависящего от выраженности ДН беременной женщины.
Использование глюкокортикоидных препаратов и иммуносупрессан-
тов допустимо только с конца второго триместра беременности.В НИИ пульмонологии среди больных ИФА женщины детород¬
ного возраста в 30,4% случаев заболели во время беременности или
непосредственно после родов. Течение болезни у этих пациенток
было хроническим, в 32,9% случаев прогноз оказался неблагопри¬
ятным. Следует подчеркнуть, что повторные беременности и аборты
44 • ГЛАВА 1. АЛЬВЕОЛИТЫПОЧТИ всегда сопровождались обострением ИФА и прогрессировани¬
ем болезни.КлассификацияРациональная классификация ИФА до настоящего времени не
разработана, так как не изучены многие аспекты этой проблемы (эти¬
ология, патогенез), существует терминологическая неопределенность,
мнения по эпидемиологическим аспектам разноречивы, не решены
вопросы лечения. Существующие классификации имеют определен¬
ные недостатки и противоречия, в связи с этим применение их в кли¬
нической практике ограничено.В 1965 г. А, Liebow и соавт. описали десквамативную интерстици¬
альную пневмонию (DIP), а в 1968 г. А. Liebow и D. Smith выделили
пять морфологических вариантов так называемой интерстициальной
пневмонии:- UIP (Usual Interstitial Pneumonia);- DIP (Desquamative Interstitial Pneumonia);- LIP (Lymphocytic Interstitial Pneumonia);- гигантоклеточная интерстициальная пневмония (Giant Cell
Interstitial Pneumonia (GIP);- облитерирующий бронхиолит с интерстициальной пневмони¬
ей (Broncholitis Obliterans with Interstitial Pneumonia (BOIP).В «Статистической классификации болезней травм и причин
смерти» (Международная классификация болезней 10-го пересмот¬
ра (МКБ-10), 1992 г.] понятием «пневмония» обозначаются патоло¬
гические процессы в легких инфекционного происхождения (т.е.
вызванные бактериями и (или) вирусами). В раздел «Другие рес¬
пираторные болезни, поражающие главным образом интерстици¬
альную ткань» (J80—J84) включены заболевания, природа которых,
как правило, неизвестна. Из этой рубрики исключены заболевания,
вызываемые бактериями, вирусами, в том числе вирусом иммуно¬
дефицита человека (ВИЧ), простейшими, паразитами и грибами.
В этой рубрике отсутствуют системные поражения соединительной
ткани, а также поражения легких, вызванные известными внеш¬
ними агентами, включая лекарственные препараты, бытовые или
профессиональные химиотоксические вещества. Отсутствие в этом
разделе термина «пневмония» представляется вполне логичным и
оправданным.
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ • 45Еще в 1967 г. J. Scadding и К. Hinson считали, что DIP является не
отдельной нозологической формой, а только вариантом (дескваматив-
ным) фиброзирующегоальвеолита. Все остальные формы интерстици¬
альной пневмонии (представленные в классификации А. Liebow), при
которых клеточная инфильтрация и десквамация в просвет альвеол
не являются преобладающими симптомами, было предложено назы¬
вать муральным вариантом фиброзируюшего альвеолита [ГТутов Н.В.,
Илькович М.М., 1986; Amthor М., 1979].Тем не менее термин «интерстициальная пневмония» из класси¬
фикации А. Liebow [1968] перекочевывает во все последующие клас¬
сификации, которые в той или иной мере уточняют, видоизменяют
классификацию А. Liebow.А теперь некоторые комментарии к самой классификации интер¬
стициальных пневмоний А. Liebow. GIP была зарегистрирована лишь
в единичных случаях, и, как оказалось впоследствии, эти больные
имели контакт с тяжелыми металлами (гиперчувствительность к
кобальту). Это послужило основанием для исключения в последую¬
щем GIF из группы идиопатических интерстициальных пневмоний.Целесообразность включения в эту группу «BOIPi» вызывает опре¬
деленные сомнения. Как показывает опыт многолетнего наблюдения
в НИИ пульмонологии (Санкт-Петербург): 485 больных с ИФА (а всего
больных с ИЗЛ 3347); если в клинической картине доминируют при¬
знаки облитерирующего бронхиолита, это, как правило, заболевание,
вызванное экзогенными факторами (вдыхание агрессивных токсичес¬
ких газов, паров, дымов; у детей наиболее частая причина вирусная
инфекция). Соответственно, такая патология легких не может отно¬
ситься к идиопатической. В то же время нам приходилось констатиро¬
вать наличие признаков облитерирующего бронхиолита в биопсийном
материале как при ИФА, так и при других ИЗЛ, о чем свидетельствует
клинический опыт и других авторов [Malhotra А. et al,, 2003], Таким
образом, нет достаточных оснований для выделения нозологической
формы — BOIR В какой-то мере можно было бы согласиться с другой
формулировкой: интерстициальная пневмония с облитерирующим
бронх иол итом. и последнее возражение: если это обл итерирующий
бронхиолит, то почему он входит в классификацию интерстициальной
пневмонии? Только потому, что он с ней «ассоциироваи>|>?В настоящее время вряд ли можно считать объективно обоснованным
выделение и L1P. Есть все основания полагать, что преобладание в иссле¬
дуемом материале (лаважная жидкость, легочная ткань) лимфоцитов,
46 • ГЛАВА 1.АЛЬВЕОЛИТЫплазматических клеток, серозной жидкости скорее говорит об актив¬
ности (остроте) процесса, нежели о том, что мы имеем дело с какой-то
особой формой ИФА. Доказано, что по мере прогрессирования фибрози-
рующсш процесса в легких клеточный пейзаж как в лаважной жидкости,
так и в легочной ткани меняется в сторону преобладания нейтрофилов.Термин «D1P», строго говоря, тоже не вполне отражает суть пато¬
логического процесса. Как теперь известно, при DIP альвеолы запол¬
нены преимущественно альвеолярными макрофагами и, в мень¬
шей степени, десквамированными альвеолярными клетками. Тем не
менее этот термин получил широкое распространение, и менять его
на «альвеолярно-макрофагальный пневмонит», как это предлагают
некоторые авторы, вряд ли целесообразно.В последующие годы классификация А. Liebow была модифици¬
рована. В частности, А. Katzenstein и J. Myers [1998] провели клини¬
ко-морфологические сопоставления и предложили выделять четыре
варианта «идиопатического легочного фиброза»:- ШР;- DIP;- острая интерстициальная пневмония (А1Р);- NSIP.Эта классификация привлекает своим более упрощенным видом,
однако кроме уже прозвучавших замечаний в отношении «пневмо¬
нии», в ней нарушен классификационный принцип; «А1Р»— это
понятие, характеризующее течение болезни, а остальные три формы
отражают морфологические особенности.Под патронажем Европейского респираторного общества и
Американского торакального общества ведущими учеными было
разработано Международное соглашение по ИФА [Idiopathic pulmonary
fibrosis: diagnosis and treatment. Internationa) consensus statement, 2000 и
2002J. В классификации, предложенной консенсусом, группа идио-
патических интерстициальных пневмоний представлена семью гис¬
тологическими паттернами, причем каждому из них соответствует
самостоятельная нозологическая форма:- UIP;- DIP;- респираторный бронхиол ИТ и ИЗЛ (RBILD);- AIP;- NSIP;- криптогенная организующая пневмония (СОР);- L1P
ИДИОПАТИ ЧЕСКИ Й ФИ БРОЗИРУЮЩИЙ АЛЬВЕОЛ ИТ • 47Авторы этото соглашения пришли к заключению, что «UIP»
представляет собой гистопатологический паттерн, который сле¬
дует отождествлять с «интерстициальным легочным фиброзом»
(в принятой у нас терминологии — ИФА). Паттерны таких форм, как
DIP, респираторная бронхиолит-ассоциированная интерстициальная
болезнь легких, облитерирующий бронхиолит с организующей пнев¬
монией, а также NSIP, LIP и AIP, должны обсуждаться, как отдельные
нозологические формы и быть исключены из группы пациентов с
ИФА. Вряд ли можно полностью согласиться со столь радикальным
изменением в представлениях об ИФА (идиопатический легочный
фиброз— в американской литературе, криптогенный фиброзиру-
юш,ий альвеолит — в британской). Известно, что у одного и того же
больного ИФА в биоптатах, полученных из разных участков легкого,
обнаруживают различные гистологические паттерны. Этот факт под¬
тверждается, как собственными результатами (см, «Патологическая
анатомия»), так и исследованиями других авторов [Monaghan Н. et
al., 2004J. В связи с этим нет оснований для рассматривания NSTP как
самостоятельного заболевания, тем более что NSIP по своим кли¬
ническим, рентгенологическим и функциональным проявлениям
не отличается от UIP [Maher Т.М. et al., 2007]. Эти авторы считают,
что выделение А1Р в самостоятельную нозологическую форму тоже
необоснованно. Известно, что при хронической форме течения ИФА
1ЮЗМОЖНЫ обострения. Гистологическое исследование ткани легкого
в этих ситуациях может выявлять диффузное альвеолярное поврежде¬
ние, т.е. AIP [Ibid], иногда в сочетании с десквамацией альвеолопитов
н просвет альвеол и клеточной инфильтрацией (DIP).Недостаточно оснований для включения в эту классификацию
термина «облитерирующий бронхиолит с организующей пневмо¬
нией». Известно, что «организующая пневмония» может развиться
вследствие бактериальных, вирусных, грибковых инфекций, как
реакция на лекарственные препараты, токсические вещества, при
«коллагеновых сосудистых заболеваниях», ЭАА, хронической эози¬
нофильной пневмонии. «Организующая пневмония» чаще формиру¬
ется при бактериальных пневмониях на фоне хронического бронхита,
эмфиземы, бронхоэктазов, муковисцидоза, аспирации [ColbyУ, 2000].
Вполне логично предположить, что если развилась «организующая
пневмония» вследствие перечисленных выше известных причин, то и
«ассоциированный» с ней «облитерирующий бронхиолит» развился
в результате тех же известных причин.
48 • ГЛАВА 1. альвеоли™Таким образом, классификация идиопатических интерстици¬
альных пневмоний, предложенная авторами консенсуса, имеет не
только сторонников, т.м. Maher и соавт. [2007] считают, что такая
классификация лишь препятствует решению наиболее актуальных
аспектов проблемы ИФА — патогенез, диагностика и лечение. При
разработке классификации ИФА необходимо учитывать патогене¬
тические механизмы, клинические, рентгенологические проявления
и особенности течения болезни, а не одну гистологическую картину,
которая при фиброзируюших альвеол итах отражает стереотипную
реакцию легочной ткани.Анализ наших 485 наблюдений пациентов с ИФА (в большинстве
случаев диагноз подтвержден гистологически) дает нам основания
высказать свою точку зрения, отнюдь не претендуя на истину в пос¬
ледней инстанции. На основании данных литературы и собственного
опыта ИФА можно представить как своеобразный патологический
процесс в легких, развивающийся в ответ на неизвестный причинный
агент, который вызывает стереотипную реакцию в легочной ткани: от
интерстициального и альвеолярного отека через стадию алъвеолита
к интерстициальному фиброзу и формированию так называемого
сотового легкого.Эта упрощенная схема развития фиброзируюшего патологического
процесса в паренхиме легких представляет собой тот гипотетический
путь, по которому развивается болезнь.В зависимости от остроты патологического процесса и его стадии,
в клеточном пейзаже паренхимы легких могут преобладать альвео¬
лярные макрофаги, десквамированные альвеолоциты, лимфоциты,
нейтрофилы, фибробласты, интерстициальные клетки и др. Наконец,
большинство авторов согласно с тем, что поражение легких при ИФА
является мозаичным, а не диффузным. Поэтому вряд ли можно счи¬
тать обоснованным выделение (даже на основе изучения материала
открытой биопсии), например, лимфоцитарной формы ИФА, так как
за пределами исследуемого участка вполне возможно преобладают
нейтрофилы, участки интерстициального фиброза и даже облитериру-
ющего бронхиолита. Такой подход можно сравнить с мнением людей,
ощупывающих с завязанными глазами разные части тела слона и име¬
ющих совершенно разный ответ на вопрос; что же такое слон?Таким образом, представляется, что ИФА следует рассматривать
как единую нозологическую форму, клинические проявления кото¬
рой и течение (острое, подострое или хроническое) зависят от выра¬
женности экссудации и пролиферации в легочной ткани.
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ * 49Острое течение ИФА (резкая одышка, лихорадка, двусторонние
крепитирующие хрипы, резко увеличенная СОЭ) характеризует¬
ся выраженным отеком легочной ткани, накоплением в альвео¬
лах серозной жидкости, альвеолярных макрофагов, десквамирован-
ных альвеолоцитов (так называемая десквамативная форма ИФА).
Своевременное назначение адекватной дозы глюкокортикоидных
препаратов приводит не только к быстрому улучшению состояния
больных, но нередко к полному выздоровлению.в тех случаях, когда экссудация выражена слабо и преобладает
пролиферация фибробластов, гиперсинтсз коллагена, и уже с самого
начала закладываются основы будущего интерстициального фиб¬
роза, болезнь проявляется незаметно возникшей инспираторной
одышкой при умеренной физической нагрузке. Одышка постепенно
прогрессирует. Эта форма болезни в литературе получила назва¬
ние «муральной». При применении лучевых методов исследования
(рентгенография, ВРКТ) выявляется усиление легочного рисунка за
счет интерстициальной ткани, преимущественно видимое в нижних
легочных полях, в последующем формируется тяжистый пневмо¬
фиброз, прогрессирует ДН. При исследовании ФВД определяется
классический рестриктивный синдром. По мере прогрессирования
болезни нарастает гипоксемия, повышается давление в легочной
артерии. При муральной форме ИФА морфологические изменения
более глубокие, чем при дссквамативной, так как поражаются не
только альвеолярные клетки, но и эндотелий капилляров, а также
базальные мембраны. Преобладание пролиферативного компонента
при слабо выраженной экссудации и клеточной инфильтрации дела¬
ет эту форму заболевания рефрактерной к проводимой терапии и
прогностически неблагоприятной.Между представленными двумя крайними проявлениями ИФА
суіцествует целый ряд промежуточных форм, 410 подтверждается не
только различной эффективностью лечения у каждого конкретного
больного, но и прогнозом.Таким образом, ИФА можно представить как заболевание, воз¬
никающее в ответ на пока неизвестный причинный фактор, вызы¬
вающий стереотипную реакцию легочной ткани в виде альтерации,
экссудации и пролиферации. Острота клинических проявлений,
особенности течения к прогноза зависят от преобладания упомяну-1 ых процессов у каждого конкретного больного, что ставит под сом¬
нение обоснованность выделения многочисленных самостоятельных
морфологических и клинических форм болезни. Такой подход при¬
50 • ГЛАВА! АЛ ЬВЕОЛІ/ІТЬ!нципиально важен и перспективен в плане разработки особенностей
лечебной тактики и улучшения прогноза у этой категории больных.ОсложненияУ больных ИФА вследствие прогрессирующего пневмофиброза
развивается легочная гипертензия и формируется легочное сердце,
наличие которого подтверждается данными эходопплеркардиогра-
фии, затем появляются соответствующие изменения на электрокар¬
диограммах, рентгенограммах (расширение ствола и ветвей легочной
артерии), клинические симптомы (тахикардия, увеличение печени,
периферические отеки, цианоз).Пневмоторакс является редким осложнением ИФА (не более 1%) и
наблюдается только на стадии «сотового легкого»^. Еще реже (0,5%) у
больных выявляются плевральные экссудаты. В финальных стадиях
ИФА описаны также эмболии легочной артерии, которые могут стать
непосредственной причиной летального исхода.ДиагностикаВ международном консенсусе по ИФА [2000] сформулированы
основные диагностические критерии. К «большим» диагностическим
критериям относятся:— исключение ИЗЛ известной этиологии (токсической, профес¬
сиональной) и синдрома при ДБСТ;— рестриктивные и диффузионные нарушение ФВД, отсутствие
обструктивных изменений;— характерная КТ-картина (двусторонние ретикулярные измене¬
ния с минимальными изменениями по типу «матового стекла»);— ЧББ и БАЛ не обнаруживают признаки других заболеваний,К «малым» диагностическим критериям относятся:— возраст старше 50 лет;— инспираторная одышка;— длительность заболевания более 3 мес;— двусторонние крепитирующие хрипы.Наличие четырех «больших» диагностических признаков и трех из
четырех «малых» позволяет установить диагноз ИФА без гистологи¬
ческой верификации.По нашему мнению, для диагностики ИФА большое значение
имеет адекватная оценка анамнестических данных, жалоб больного
ИДИОПАТМЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ • 51И результатов врачебного осмотра. Необходимо подробно и в хроно¬
логическом порядке собрать сведения о профессии^ географических
факторах, особенностях окружающей среды, сведения о бытовых
условиях.Лабораторные методы (общеклинические, биохимические, иммуно¬
логические, вирусологические, микробиологические). Диагностическая
ценность общепринятых лабораторных методов исследования незна¬
чительна. В начале заболевания и при остром течении средний показа¬
тель уровня гемоглобина у больных не выходит за пределы нормальных
значений (126Д±0,90г/л). У 28% больных уровень гемоглобина ниже
110 г/л. На поздних стадиях заболевания при выраженной ДН в боль¬
шинстве случаев повышается вязкость крови и содержание гемоглоби¬
на превышает норму.Лейкоцитоз свыше 9,5хЮУл выявляется у 25% и только у 10% больных
свыше 12х10Ул. Средний показатель СОЭ составляет 22,5±0,78 мм/ч.
Уровни СОЭ выше 25 мм/ч регистрируются приблизительно у одной
трети больных. Лейкоцитоз, палочкоядерный сдвиг в формуле крови
(до 20-25%) и увеличение СОЭ определяется у больных с острым тече¬
нием болезн и, при обострении хронической формы ИФА, а также если
присоединяется инфекция, при медленно прогрессирующем течении
хронической формы ИФА показатели клинического анализа крови
могут не выходить за пределы нормальных значений. Эозинофилия
периферической крови выявляется редко и, как правило, является
следствием длительного и необоснованного назначения антибакте¬
риальных препаратов.Диспротеинемия регистрируется в основном за счет увеличения
фракции у-глобулинов с различной частотой (от 40 до 80% случаев).
Увеличение у-глобулинов свыше 24% выявляется приблизительно у
одной трети больных.Изменения показателей иммунологического статуса при ИФА
также неспецифичны, поэтому исследование их имеет большое зна¬
чение не столько в плане нозологической идентификации пато¬
логического процесса, сколько в оценке патогенетических меха¬
низмов развития болезни, в решении вопросов лечебной тактики.
Для этих целей определяются следующие показатели в перифе¬
рической крови: ЦИК, IgA, IgG и IgM, комплемент, ревматоид¬
ный фактор, АНА, аут£>аіи:ш:елаДтоотжврлегрч[н к митохондри¬
ям, к гладкой мускулатуре)'-{та|бл.г1.Я- .Перечисленное показатели
могут служить критерием интенеийнЫ^тм аутоиммунных процессов
в организме.
02 . [71АВА 1. ДЛЬВЕОЛИТЫПоказатели (содержание
8 сыворотке крови)частота отклонения показателя
в сторону увеличения. %НИИПЛитературные данныеЦИК49igA353(М0 [Crystal J, et al, 1984]igM343(М0 [Crystal J. et al., 19841igG' 34ci0-40[Crysfal J, et al., 1984]Ревматоидный фактор3120-30 [Johnston Y. et al., 1997]
30 [Michaelson J.E. et al.! 20001
40 [Keating D.T. et al., 2007]Антинуклеарный фактор
__ 3720-30 [Johnston Y. et al.. 1997]
30 [Michaelson J.E. etal.] 2000]
40 [Keating D.T. et al., 2007]в связи с тем что степень отклонения иммунологических пока¬
зателей от нормы зависит от особенностей течения болезни, в лите¬
ратуре можно встретить существенные различия в оценке имму¬
нологической реактивности больных ИФА. Это же относится и
к оценке ряда иммунологических показателей, определяемых в
ЖБАЛ. Исследования, проведенные Т.П. Сесь и соавт, [2000], сви¬
детельствуют о том, что наиболее информативными у больныхМЛА ЯВЛЯЮТСЯ следующие ПОКЯЧЯТРГТМ- пдпиилсс информативными у больных
ЦФА являются следующие показатели: повышение общего числа
эффекторных клеток в ЖБАЛ (альвеолярных макрофагов, нейтро-
фИЛОР, лимфоцитов), увеличение им^тта Т -U повышениеэффект ІІ±ЛЬ.П(^ҐЛГтстг\г-.^филов, лимфоцитов), увеличение числа Т-лим^Г'’”*’’"'^
повышение активности ИЛ-1 и ИЛ-2 пп/^г, а. — хелперов, ^x+i/ATii/rTTlR. я If тиактивностиповышение ^ У1Л_, ппппг^А.Т-лимфоцитов, активности протеолитическм^''^.^'®''''*
стазы Н коллагеназы. А.С Захарова и соавт ~показали, что повышение уровней ИЛ S лт oni ^ работеот 61 до 95 нг/мл и уменьшение содержаний wn Т ™F'«--wtr А ИЛ-Ї от 100 до 30■> ■'••'•‘О до /UU нг/мл 7от 61 до 95 нг/мл и уменьшение содержания ИЛ-1 от 100 до 300
в крови и ЖБАЛ больных ИФА свидетельствуют об активности
логического процесса и его прогрессировании.Ппи ИФАї как и при большингтп#* тт^г300 пг/мл
)сти пато-J-1 ».-1 w іфигрессировании.При ИФА, как и при большинстве других ИЗЛ, патологи¬
ческий процесс локализуется преимущественно в респираторной зоне.
В связи с этим диагностическая информативность исследования мок¬
роты невелика. Показатели анализа мочи, концентрационной и выде¬
лительной функции почек у больных ИФА не отклоняются от нормы
Лучевые методы исследования. Возникновение рентгенологичес¬
ких симптомов, как правило, совпадает с появлением ведущего
клинического признака — одышки, однако у части больных одышка
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИ! • 53может предшествовать появлению рентгенологических изменений,
в редких случаях (5%) рентгенологический симптом легочной диссе-
минации выявляется на доклинической стадии заболевания (Diaz J.I.,
Ouellette D.R., 2008]. Анализ рентгенологических проявлений ИФА
позволяет выделить группы больных с преимущественным пораже¬
нием интерстициальной ткани легких (муральный вариант болезни)
и с преимущественным поражением альвеол (десквамативный вари¬
ант). Исход как мурального, так и десквамативного варианта болезни
проявляется рентгенологической картиной «сотового легкого».Изменения на рентгенограммах двусторонние, несимметричные,
с наибольшей выраженностью в нижних легочных полях. Стадия
интерстициального отека и интерстициального «воспаления» рент¬
генологически обычно характеризуется появлением дополнительных
элементов легочного рисунка, утратой его четкости, потерей струк¬
турности корней, субплевральными реакциями, перегородочными
линиями (линии Керли), сетчатой деформацией легочного рисунка.
Сетчатость и тяжистость отчетливо прослеживаются до периферии
легких, иногда полностью перекрывая сосудистый рисунок. Наряду
с этим могут определяться вздутые дольки, дисковидные ателекта¬
зы. Объем нижних долей уменьшается. Вокруг бронхососудистого
пучка базальных сегментов определяются муфтообразньте изменения.
Прозрачность легочной ткани в верхних долях кажется повышенной
в сравнении с нижними (рис. 1,5 а). Однако при томореспираторной
пробе объем и прозрачность верхних и нижних долей легких меня¬
ются в одинаковой степени. Куполы диафрагмы могут располагаться
выше обычного (на уровне переднего отдела IV—V ребер) [рис. 1.5 6].
Расширение легочных артерий в корнях может быть обусловлено как
интерстициальными изменениями, уменьшением объема нижних
долей, так и повышением давления в малом круге кровообращения.
По мере прогрессирования пневмофиброза перестройка легочного
рисунка становится все более выраженной, образуются мелкопузыр¬
чатые вздутия, проявляющиеся рентгенологически ячеистой дефор¬
мацией легочного рисунка и формированием картины «сотового
легкого» [Илькович м.м., 1998].Для преимущественно интерстициального типа рентгенологи¬
ческих изменений характерно постепенное начало болезни, хрони¬
ческое и медленное прогрессирование. Исследование биопсийного
материала выявляет у этих больных признаки умеренной клеточ¬
ной инфильтрации и прогрессирующего фиброза межальвеолярных
перегородок. Перечисленные клинические, рентгенологические и
54 • ГЛАВА І.АПЬВЕОЛИТЬІРис. 1.5 . Рентгенограмма органов грудной полости больной идиопатическим
фибрсзирующим альпеолитом:а — в прямой проекции: распространенные интерстициальные изменения в
виде сетчатой и тяжистой деформации легочного рисунка преимушественно
в нижних отделах, уменьшение объема нижних долей;б — в боковой проекции: распространенное усиление и деформация легоч¬
ного рисунка за счет интерстициального компонента преимущественно в
нижних отделах, высокое расположение куполов диафрагмыРис. 1.6. Рентгенограмма органов
грудной полости в прямой проекции
больной идиопатическим фибрози-
рующим альвеол итом.
Распространенные изменения пре¬
имущественно в средних и нижних
отделах легких в виде малоинтенсив¬
ных инфильтративных затенений с
нечеткими границами, плохо диф¬
ференцируется диафрагмагистологические критерии слу¬
жат основанием для выделения
мурального варианта ИФА.Приблизительноу 10-15% боль¬
ных ИФА выявляются рентгеноло¬
гические изменения альвеолярно¬
го характера по типу двусторонних
очаговых и (или) инфильтратив¬
ных затенений различной интен¬
сивности и протяженности. На
фоне инфильтративных затенений
диафрагма дифференцируется
плохо. Корни легких с нечеткими
контурами (рис. 1.6).В клиническом плане эта груп¬
па больных отличается острым
началом заболевания (десквама-
тивная форма). При гистологи¬
ческом исследовании биопсийно-
го материала легких определяется
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ • 55выраженная клеточная инфильтрация альвеол и межальвеолярных
перегородок. Фиброзирование межальвеолярных перегородок при
десквамативном варианте болезни выражено незначительно.Гипертензия малого круга кровообращения приблизительно у
одной трети больных ИФА на рентгенограммах проявляется расши¬
рением основных стволов легочной артерии. Увеличение внутригруд-
ных лимфатических узлов не характерно.Описаны так называемые рентгенонегативные формы ИФА: нор¬
мальная рентгенологическая картина при наличии инспираторной
одышки и выраженных изменений вентиляционной способности
легких по рестриктивному типу.Рентгенологические изменения при ИФА зависят не только от
формы (муральная, десквамативная), но и стадии болезни. Так, ста¬
дия интерстициального отека легких на рентгенограммах может не
проявляться, поэтому ориентация на рентгенологические данные
как наиболее ранние проявления болезни вряд ли обосновано. В этих
случаях более информативной является КТ.При выполнении ВРКТ основными признаками ИФА являются
диффузные, нежные ретикулярные изменения, обусловленные утол¬
щением внутридолькового и междолькового интерстиция. Контуры
плевральных листков, сосудов и бронхов становятся неровными и
нечеткими. Максимально выраженные изменения локализуются в под-
плевральных и наддиафрагмальных зонах, отмечается их нарастание
по направлению от верхушек к диафрагме. На более поздних стадиях
патологического процесса именно в субплеврально расположенных
участках ретикулярных изменений возникают наиболее ранние при¬
знаки «сотового легкого» в сочетании с тракционными бронхоэктазами
и бронхиолоэктазами. Воздушные ячейки размером от 2 до 20 мм в диа¬
метре на КТ выявляются значительно раньше, чем на рентгенограммах
и линейных томограммах. Это позволяет на значительно более ранних
этапах установить стадию формирования так называемого «сотового
легкого». Те изменения, которые на обычных рентгенограммах пред¬
ставляются равномерными (диффузными), на КТ мозаичны с преиму¬
щественно периферической (субплевральной) локализацией.Участки пониженной прозрачности легочной ткани по типу «мато¬
вого стекла*> также являются типичными для ИФА, чаще они лока¬
лизуются в зонах ретикулярных изменений в кортикальных отделах
вдоль диафрагмальной поверхности плевры. В зонах «матового стек¬
ла» могут возникать и безвоздушные участки уплотнения (рис. 1.7).
При прогрессировании заболевания с течением времени на месте
56ГЛАВА І.АЛЬВЕОЛИТЬ!Рис. 1.7. Компьютерная томограм¬
ма органов грудной полости больной
идиопатическим фиброзирующим
альвеол итом.Распространенные интерстициаль¬
ные изменения, участки повышения
плотности легочной ткани по типу
«матового стекла»Рис. 1.8. Компьютерная томограм¬
ма органов грудной полости больной
идиопатическим фиброзируюшим
альвеол итом.Выраженные распространенные ин¬
терстициальные изменения за счет
фиброза и формирования мелких воз¬
душных полостей с толстыми стенка¬
ми, картина «сотового легкого»участков «матового стекла» формируются зоны нежных ретикуляр¬
ных изменений, а затем и «сотового легкого» (рис. 1.8).Десквамативная форма ИФА при ВРКТ проявляется наличием зон
«матового стекла» в кортикальных отделах легких, в глубине легочной
ткани или диффузно на всем протяжении легких. Признаки фиброза
отсутствуют или выражены весьма умеренно в виде тонких линейных
тяжей вдоль плевры.Общепринятым является мнение о тесной взаимосвязи симптома
«матового стекла» и активности воспалительного процесса в легоч¬
ной ткани. Однако нет убедительных доказательств количественной
взаимосвязи между степенью выраженности симптома «матового
стекла» и уровнем активности патологического процесса, определя¬
емой результатами биохимических, иммунологических и морфоло¬
гических методов исследования [Тюрин И.Е., 2003].КТ может также использоваться для адекватной оценки эффектив¬
ности приводимого лечения больных ИФА. Результаты исследования
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АПЬВЕОЛИТ • 57Д.Н. Виноградовой и соавт. {2002} показали, что при ИФА на ран¬
ней стадии патологического процесса изменения по типу «матового
стекла», равномерное утолщение стенок бронхов и расширение теней
сосудов были обратимыми. Участки уплотнения легочной ткани
подвергались частично обратному развитию с формированием в этих
областях интерстициального фиброза линейной формы. На осно¬
вании динамического наблюдения были определены необратимые
изменения на КТ: хаотичная сетчатая и (или) линейная деформация
легочного рисунка, воздушные кисты от 2 до 20 мм в диаметре, брон-
хиолоэктазы в участках уплотнения легочной ткани, тракционные
бронхоэктазы, сочетание расширения бронхососудистых лучков и
неравномерного утолщения стенок сосудов и бронхов, Все эти измене¬
ния являются элементами сформированного «сотового легкого».Сцинтиграфическое исследование легких с радиоактивным ®’[Ga],
обладающим способностью концентрироваться в воспалительно-
измененных тканях, может использоваться для оценки активности
патологического процесса. Показатель накопления изотопа в легких
у больных на стадии альвеолита зависит от его активности и ока¬
зывается достоверно выше по сравнению с контрольной группой.
О степени активности альвеолита можно судить по значениям опреде¬
ленных коэффициентов. Это позволяет дифференцировать активный
процесс (стадию альвеолита) от необратимых фиброзных изменений.
Перфузионная сцинтиграфия с радиоактивным технецием дает воз¬
можность оценить степень поражения легочного кровотока на уровне
мелких сосудов и капилляров у больных ИФА.Важная информация о состоянии легочного кровотока у больных
ИФА может быть получена также с помощью ангиопульмонографии.
Наиболее характерные признаки ангиографической картины ИФА;
расширение центральных ветвей легочной артерии и сужение их
на периферии с нечеткими контурами и выраженным замедлением
артериальной фазы кровотока. В пользу ИФА свидетельствует также
наличие на ангиограммах участков быстрого артерио-венозного шун¬
тирования с ускоренным контрастированием венозного русла. В 62,7%
случаев у больных ИФА регистрируется повышенное (более 30 мм рт.
ст.) систолическое давление в легочной артерии.Исследование ФВД. ФВД у больных ИФА нарушена уже на ранних
стадиях заболевания, и по мере его прогрессирования формирует¬
ся классический рестриктивный синдром, который проявляется
диффузионными нарушениями, увеличением ригидности легочной
ткани (повышение индекса ретракции), гипоксемией и уменьшением
58 • ГЛАВА 1.АЛЬВЕОЛИТЫстатических объемов; остаточного объема легких (ООЛ), ЖЕЛ, общей
емкости легких (ОЕЛ). Так, значительное снижение ОЕЛ определя¬
ется у 94% больных. Средний показатель ОЕЛ составляет 64,1+1,7%
должной величины. Анализ структуры ОЕЛ показывает, что столь
значительное ее снижение происходит в основном за счет уменьше¬
ния (у 97% больных) ЖЕЛ, величина которой составляет в среднем
54,4±1,9% должной. ООЛ снижается в меньшей степени, поэтому про¬
исходит увеличение отношения ООЛ/ОЕЛ.Объем форсированного выдоха за первую секунду (ОФВ,) у больных
ИФА значительно снижен и составляет в среднем 54,4±1,9% должной,
а отношение ОФВ,/ЖЕЛ (тест Тиффно), наоборот, имеет тенденцию
к увеличению. Это объясняется резким снижением ЖЕЛ, вследс¬
твие чего форсированный выдох заканчивается быстрее чем за 1 с,
что приводит к искусственному увеличению отношения ОФВуЖЕЛ,
несмотря на то что объемная скорость форсированного выдоха сниже¬
на. Максимальная объемная скорость при выдохе 25% ЖЕЛ (МОС23)
находится, как правило, в пределах нормы. У значительной части боль¬
ных (преимущественно с выраженными фиброзными изменениями в
легких) отмечается снижение МОС^„ (у 69% больных) и МОС^^ (у 80%).
Можно предположить, что основными причинами снижения MOCjy и
МОС,^ могут быть, во-первых, резкое снижение величины ЖЕЛ у этой
категории больных и, во-вторых, вовлечение в патологический про¬
цесс периферических дыхательных путей в далеко зашедших случаях
болезни.у большинства больных ИФА бронхиальная проходимость остает¬
ся в пределах нормы. Некоторую тенденцию к снижению бронхиаль¬
ной проходимости (не выходящую, однако, за пределы нормальных
величин) у больных с выраженными изменениями в легких можно
объяснить, по-видимому, прогрессирующим уменьшением растяжи¬
мости легочной ткани и, соответственно, увеличением мертвого про¬
странства за счет средних и крупных бронхов. Растяжимость легочной
ткани у больных ИФА резко уменьшена и, соответственно, резко уве¬
личен индекс ретракции легких. Работа дыхания увеличивается более
чем в два раза, причем в основном за счет эластической фракции.Диффузионные нарушения при ИФА проявляются уменьшением
диффузионной способности легких при задержке дыхания (ДСЛзд) и в
устойчивом состоянии (ДСЛус). у всех больных отмечается резкое сни¬
жение величины мембранного компонента ДСЛ. Средние показатели
объема крови в легочных капиллярах у этих больных находятся в преде¬
лах нормы, а альвеоло-артериальная разница кислорода увеличивается.
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИ! • 59Уменьшение показателей эффективности альвеолярной вентиляции,
а также повышение альвеоло-артериальной разницы кислорода указыва¬
ет на расстройство вентиляционно-перфузионных отношений в легких.Парциальное напряжение кислорода в артериальной крови (РаО^)
у больных ИФА снижается статистически значимо. Выявляемая
тенденция к гипокапнии объясняется имеющей место гипервенти-
лядией, благодаря которой поддерживается на нормальном уровне
альвеолярное и, соответственно, артериальное напряжение кисло¬
рода. Гиперкапния выявляется только у больных с выраженной
ДН, т.е. находящихся практически в терминальном состоянии
[Каменева М.Ю., 2005}.Таким образом, симптомокомплеке нарущений вентиляционной
способности легких при ИФА включает: увеличение частоты дыха¬
ния, уменьшение объема вдоха, уменьшение статических легочных
объемов (ЖЯЛ, ОЕЛ, в меньшей степени — ООЛ), увеличение эласти¬
ческого сопротивления легких (снижение растяжимости и повыше¬
ние ригидности легких), снижение дел, отсутствие нарушений брон¬
хиальной проходимости. Нарушения бронхиальной проходимости на
уровне периферических путей определяются лишь в случаях прогрес¬
сирования патологического процесса и развития в легких выражен¬
ных фиброзных изменений. Обструктивные нарушения для ИФА не
характерны, однако они могут присоединиться на стадии «сотового
легкого» в случаях вовлечения в патологический процесс перифе¬
рических дыхательных путей, а также у больных с сопутствующей
обструктивной патологией (хронической обструктивной болезнью
легких). Формирование обструктивного синдрома у больных ИФА
является неблагоприятным прогностическим признаком.Исследование легочно-сердечной гемодинамики. Результаты иссле¬
дования гемодинамики малого круга кровообращения методом эхо-
кардиографии свидетельствуют о том, что у большинства больных
имеются изменения правых отделов сердца (гипертрофия или дила-
тация правого желудочка) и умеренное повышение систолического
давления в легочной артерии [Перлей В.Е., 1998]. Средний показатель
систолического давления у больных ИФА, по данным эхокардиогра-
фии, составил 31,5±1,0 ммрт.ст., а измеренный прямым методом во
время ангиопульмонографии — 33,5±1,]3 мм рт.ст. [Некласов Ю.Ф.,
1989]. У большинства больных (63,6%) показатель среднего давления
в правом желудочке также повышен. При электрокардиографическом
исследовании повышенное давление в системе легочной артерии под¬
тверждается правограммой, синусовой тахикардией.
60 • ГЛАВА 1. АЛЬВЕОЛИТЫМеханизмы развития легочной гипертензии при ИФА изучены
недостаточно. Легочная гипертензия развивается преимуществен¬
но у лиц с выраженными анатомическими изменениями в легких
(интерстициальный фиброз), прогрессирующими рестриктивны¬
ми и значительными диффузионными нарушениями. Если учесть,
что объем крови в легких уменьшается линейно с уменьшением
объема легких, то анатомические изменения, возникающие при
ИФА, можно считать одним из основных факторов развития легоч¬
ной гипертензии. Об этом же свидетельствует статистически досто¬
верное увеличение у этой категории больных общего легочного и
артериального сопротивлений. Вторым важным фактором, учас¬
твующим в формировании легочной гипертензии, можно считать
альвеолярную и артериальную гипоксемию. Все перечисленные
показатели у больных ИФА отличаются от нормы статистически
достоверно. Физическая нагрузка, несмотря на гипервентиляцию,
приводит к гипоксемии и повышению систолического давления
даже у тех больных, у которых оно было в покое нормальным. Столь
выраженная реакция на физическую нагрузку свидетельствует о
том, что компенсаторно-приспособительные механизмы у этих
больных исчерпаны и уже в покое газообмен осуществляется на
пределе компенсаторных возможностей. Нарастание гипоксемии
при физической нагрузке является важным дифференциально¬
диагностическим признаком.Броихологические методы исследования. Бронхоскопия у большин¬
ства больных ИФА выявляет умеренную гиперемию слизистой обо¬
лочки бронхов, в 25% случаях эндоскопическая картина не отличает¬
ся от нормы.Определенное значение придается цитологическому и иммунобио-
химическому исследованию ЖБАЛ [Герасин В.А., 1988]. Для ИФА
характерно увеличение нейтрофилов и, в меньшей степени, лим¬
фоцитов в жидкости БАЛ (табл. 1.2). При благоприятном течении
заболевания сравнение клеточного состава ЖБАЛ до и после лечения
позволяет выявить снижение обеих популяций клеток. Лечебные
мероприятия оказываются более эффективными у лиц с исходно
высоким содержанием лимфоцитов. Отмечено неблагоприятное тече¬
ние заболевания у лиц, в ЖБАЛ которых определяется большое число
альвеолярных макрофагов (экскретирующих фибронектин и фактор
пролиферации фибробластов). Уровень коллагеназы и эластазы в
ЖБАЛ в 10 раз превышает норму в стадии обострения и может сни¬
жаться до нормы в фазе ремиссии.
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ61Таблица 1.2. Клеточный состав жидкости бронхоальвеолярного лаважа
у больных идиопатическим фиброзирующим альвеолитомПоказателиСредние значения,
10° в 1 млЧастота отклонения, %НИИПДанные литературыЧисло нейтрофилов30,5±3,98970-90 [Drent М. et al., 1996]Число лимфоцитов4,6+1,21810-20 [IbidJЧисло альвеолярных макрофагов61,9+3,680Эндоскопические и хирургические методы. Из методов биопсии
легочной ткани наиболее информативными при ИФАявляются видео-
торакоскопическая и открытая. Сравнительно невысокая диагности¬
ческая информативность ЧББ (менее 50%) объясняется отсутствием
при ИФА патогномоничных морфологических признаков болезни, а
также малым объемом получаемых проб. Выполнение биопсии легоч¬
ной ткани на ранних стадиях болезни облегчает гистологическую
интерпретацию и, что самое важное, позволяет своевременно назна¬
чить адекватное лечение.Морфологические методы исследования. При исследовании био-
псийного и аутопсийного материала используются следующие морфо¬
логические методы: световая микроскопия с различными окрасками,
электронная микроскопия и иммуногистотипирование. Применение
этих методов исследования позволяет выявить морфологические при¬
знаки, характерные для ИФА.Формулировка диагноза• ИФА, острое течение (десквамативная форма), ДН П-ПІ сте¬
пени.• ИФА, хроническое течение (муральная форма), фаза обострения.
Легочная гипертензия (35 мм рт.ст.), субкомпенсированное легоч¬
ное сердце, ДН И степени.• ИФА, хроническое течение, стадия формирования «сотового
легкого». Легочная гипертензия (50 мм рт.ст.), декомпенсирован-
ное легочное сердце, ДН ПІ степени, сердечная недостаточность
П—ПІ степени.Дифференциальная диагностикаНаиболее частым среди ошибочных диагнозов еще в недалеком
прошлом была хроническая пневмония, а в настоящее время — дву-
62 * ГЛАВА І.АЛЬВЕОЛИТЬІсторонняя или затяжная пневмония, реже — хроническая обструк¬
тивная болезнь легких и диссеминированный туберкулез легких,
в результате столь неудовлетворительного состояния диагностики
более 80% больных ИФА получают в течение длительного времени
противопоказанную им антибактериальную терапию, несмотря на
ухудшающееся состояние. Прогрессирование болезни служит пово¬
дом для направления части больных (31%) в противотуберкулезные
учреждения, где им проводятся длительные курсы лечения специфи¬
ческими противотуберкулезными препаратами. Наряду с противо¬
туберкулезными и антибактериальными препаратами больные полу¬
чают, как правило, противовоспалительные препараты, биологически
активные добавки, физиотерапевтические процедуры. Бее перечис¬
ленные методы лечения ведут лишь к ухудшению состояния больных,
прогрессированию патологического процесса и переходу его в необ¬
ратимую стадию «сотового легкого». В результате срок от появления
первых признаков болезни до установления диагноза составляет у
этих больных 1,5—2 года в нашей стране и 1—2 года в других странах
IDiaz J.I., Ouellette D.R-, 2008].У большинства практических врачей сложилось ошибочное пред¬
ставление, что диагноз ИФА может быть установлен только с помощью
сложных (инвазивных) методов исследования в условиях специализи¬
рованной клиники. Из поля зрения такого врача ускользают простые,
доступные исследованию и пониманию и «лежащие на поверхности»
клинические признаки, учет которых позволяет на поликлинческом
приеме больных отвергнуть наиболее частые ошибочные диагно¬
зы: двусторонняя пневмония, затяжная пневмония, хронический
обструктивный бронхит, бронхиальная астма, эмфизема легких и др.
Одним из таких признаков является одышка и ее характеристики:
однажды возникнув, она имеет тенденцию только к прогрессирова¬
нию. Одышка не зависит (или почти не зависит) от времени суток, тем¬
пературы окружающего воздуха и других факторов. Отличительная
особенность дыхания больных — укорочение фазы вдоха и выдоха и
в связи с этим учащение дыхания в единицу времени, гипервентиля-
ционный синдром. Еще одна характерная черта: затрудненный вдох,
попытка глубоко вдохнуть вызывает кашель или боль за грудиной.
Однако следует отметить, что кашель (как самостоятельный признак)
встречается не у всех больных ИФА и дифференциально-диагности¬
ческого значения не имеет.Среди ошибочных диагнозов наиболее часто встречается двусто¬
ронняя пневмония. Известно, что двусторонняя пневмония развива¬
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АПЬВЕОЛИТ • 63ется преимущественно у лиц так называемых групп риска (иммуно-
супрессивные состояния различного генеза, тяжелая сопутствующая
патология, пожилой возраст). Пневмония отличается от ИФА целым
рядом признаков.• Клинические:— наличие простудного фактора;— особенности анамнеза (пожилой возраст, сопутствующие забо¬
левания, нарушение иммунного статуса);— кашель с мокротой слизисто-гнойного характера;— боль в грудной клетке;— симптомы интоксикации;— влажные хрипы;— адекватная антибактериальная терапия дает положительный
эффект.• Лабораторные:— изменение клинического анализа крови (лейкоцитоз или лей¬
копения, палочкоядерный сдвиг лейкоцитарной формулы,
увеличение СОЭ);— положительные острофазовые реакции;~ выявление возбудителей заболевания в мокроте, ЖБАЛ бакте-
риоскопическими и (или) бактериологическими методами;— выявление антител к антигенам возбудителя в сыворотке
крови.• Рентгенологические:— инфильтративные затенения соответствуют долевому и сег¬
ментарному строению легких, в отличие от этого при ИФА
изменения на рентгенограммах и КТ носят диффузный харак¬
тер без четкой анатомической локализации в пределах отде¬
льных долей легких;— обычное расположение диафрагмы;— положительная динамика рентгенологической картины на
фоне адекватной антибактериальной терапии.ИФА легко отличить от так называемых эозинофильных пневмо¬
ний, для которых характерны гиперзозинофилия периферической
крови, эозинофилия мокроты, летучесть инфильтративных затенений
в легких, отсутствие корреляции между выраженностью рентгенологи¬
ческих изменений в легких и умеренной клинической симптоматикой.
Исследование материала чрезбронхиальной биопсии легких у больных
эозинофильной пневмонией выявляет инфильтрацию эозинофилами и
наличие серозной жидкости в альвеолах, что не характерно для ИФА.
64 • ГЛАВА І.АЛЬВЕОЛИТЬІДифференциальную диагностику ИФА следует проводить также
с СФА при ДБСТ. Системность поражения соединительной ткани ~
наиболее важный дифференциально-диагностический критерий ДБСТ.Значительные трудности в ряде случаев представляет дифферен¬
циальная диагностика между ИФА и БАР. В пользу БАР свидетель¬
ствуют следующие признаки;— выделение большого количества слизистой пенистой мокроты
(от 200 мл до 4 л в сутки), что зависит от секреторных свойств
эпителия, из которого развивается опухоль;— концентрическое сужение бронхов в пораженных участках
легкого (признак непостоянный, выявляется при эндоскопи¬
ческом исследовании);— данные цитологического исследования мокроты, бронхиаль¬
ного смыва, ЖБАЛ, гистологическое исследование материала
биопсий легочной ткани (комплексы опухолевых клеток, высо-
кодиффсренцированная аденокарцинома).Дифференцировать ИФА необходимо и с другими формами неоп¬
ластических процессов — гематогенное и лимфагенное метастазиро-
вание в легкие. Основными отличительными признаками карцинома-
тоза легких являются:— особенности клинической картины: неуклонное прогресси¬
рование заболевания, выраженные признаки интоксикации с
субфебрильной или фебрильной температурой тела;— возможное развитие серозного или серозно-фибринозного
плеврита.Раковый лимфангиит легких развивается при диссеминации опу¬
холевых клеток по лимфатическим сосудам интерстициальной ткани
(ортоградное и ретроградное метастазирование). Дифференциальная
диагностика ракового лимфангиита легких проводится по тем же
признакам, что и гематогенного метастазирования в легкие с учетом
особенностей рентгенологических изменений: увеличение лимфа¬
тических узлов средостения (при ретроградном метастазировании)
с радиально отходящими от них линейными тенями. Верификация
первичной опухоли или выявление атипических клеток в мокроте,
бронхиальном смыве, ЖБАЛ, материале биопсии подтверждают зло¬
качественный характер поражения легких.Как уже упоминалось, нередко больных ИФА направляют в проти¬
вотуберкулезные учреждения, где они длительно получают противо¬
туберкулезную терапию. В связи с этим необходимо учитывать следу¬
ющие дифференциал ьно-диагностические признаки, характерные для
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ • 85диссеминированного туберкулеза легких (именно эта форма туберку¬
леза легких чаще всего ошибочно предполагается у больных ИФА):— анамнестические данные (контакт с больным туберкулезом, пере¬
несенный в прошлом туберкулез легких или других органов);— особенности клинического течения: от практически бессимп¬
томного и длительного течения при хронических формах, уме¬
ренно выраженных симптомов интоксикации при под острых
формах до протекающих по типу септического заболевания с
резко выраженной одышкой, менингеал ьными симптомами —
при острых милиарных формах;— рецидивирующие плевриты;— возможность поражения других органов (лимфатические узлы,
серозные оболочки, глазное дно, кости, почки, мозговые обо¬
лочки и др.);— данные рентгенологического исследования:о симметричность и однотипность легочных изменений (мел¬
коочаговые затенения величиной 1-2 мм, вокруг которых
может образовываться зона перифокалъного воспаления);
о преимущественная локализация патологических изменений
в верхних и средних отделах легких;
о возможность повторных волн диссеминаций («волны отсе¬
ва»), наличие признаков распада легочной ткани с образова¬
нием так называемых штампованных каверн;— данные исследования ФВД (отсутствие изменений или умерен¬
но выраженный рестриктивный синдром, возможно умерен¬
ное снижение ДСЛ);— положительные серологические реакции и полимеразная цеп¬
ная реакция;— данные гистологического исследования материала биопсии
легких, слизистой оболочки бронха: эпителиоид но-клеточные
гранулемы с некрозом в центре;— выявление возбудителя туберкулеза при бактериоскопическом
исследовании мокроты; посеве крови, мокроты, а также в био¬
псий ном материале.Дифференциальная диагностика ИФА и саркоидоза легких не
вызывает, как правило, больших затруднений. Саркоидоз легких от
ИФА отличают следующие признаки:— относительно доброкачественное и малосимптомное течение,
болезнь нередко выявляется при профилактическом флюоро¬
графическом исследовании;
66 • ГЛАВА І.АЛЬВЕОЛИТЬІ— системность поражения (чаще всего поражаются прикорне¬
вые лимфатические узлы и легкие, реже — печень, селезенка,
костная система, глаза, сердце, кожа, нервная и эндокринная
системы и др.);— повышение в крови уровня ангиотензинпревращающего фер¬
мента (АПФ);~ туберкулиновая анергия (при ИФА реакция на туберкулин не
изменяется);— отсутствие или умеренные нарушения ФВД;— гиперваскулярзация слизистой оболочки бронхов, специфи¬
ческие саркоидныс бугорки (признаки непостоянные), выяв¬
ляемые при эндоскопическом исследовании;— данные гистологического исследования биопсийного материа¬
ла: эпителиоиднок л сточные гранулемы без некроза.Пневмокониозы (силикоз, силикатозы и др.) следует дифференци¬
ровать от ИФА по следующим признакам:— контакт с соответствующими видами пыли на работе;— преимущественная локализация изменений в среднелатеральных
легочных полях, тенденция к слиянию мелких очаговых теней в
средние и крупные, бесструктурность и уплотнение корней легких;— отсутствие параллелизма между выраженностью рентгеноло-
гических изменений и степенью одышки;— выявление силикотических гранулем при гистологическом
исследовании материала биопсий легочной ткани.Среди профессиональных заболеваний легких необходргмо выде¬
лить бериллиоз, создающий нередко значительные дифференциаль¬
но-диагностические трудности, разрешить которые может только
гистологическое исследование материала открытой биопсии (грану¬
лемы, содержащие так называемые конхоидальные тельца, окрашива¬
ющиеся гематоксилином в сине-фиолетовый цвет). Важное значение
имеет факт контакта больного с бериллием или его соединениями в
настоящем или прошлом.Большие затруднения вызывает дифференциальная диагностика
ИФА и лейомиоматоза легких. В пользу лейомоматоза свидетельству¬
ют следующие признаки:— лейомоматозом болеют только женщины;— выявление лейомиом матки, почек, печени, забрюшинного
пространства и других локалзаций;— кровохарканье;
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ • 67— гидроторакс, асцит, перикардит хилезного или геморрагиче¬
ского характера;— отсутствие крепитирующих хрипов;— на рентгенограммах и компьютерных томограммах выявляется
распространенная ячеистая перестройка легочного рисунка,
низкое расположение куполов диафрагмы, в ряде случаев при¬
знаки пневмоторакса и (или) гидроторакса;— при исследовании ФВД определяются резко выраженные диффу*
зионные нарушения в сочетании с обструктивным синдромом;— характерные морфологические изменения в биопсийном
материале легочной ткани (пролиферация гладкомышечных
клеток).Дифференциальную диагностику ИФА следует проводить и с дру¬
гими ИЗЛ: ИГЛ, синдромом Гудпасчера, ГВ, альвеолярным протеи-
нозом, ГХЛ, о которых более подробно сказано в соответствующих
главах.Суммируя представленные данные, необходимо отметить, что
предположение о наличии у больного ИФА должно возникнуть у
врача после выявления различных сочетаний признаков следующего
симптомокомплекса:— одышка, возникающая или усиливающаяся при физической
нагрузке (если она не обусловлена другими заболеваниями);— затрудненный вдох;— кашель сухой или со скудной слизистой мокротой (признак
непостоянный);— цианоз, возникающий или усиливающийся при физической
нагрузке;— повышение температуры тела до субфебрильной или фебриль¬
ной (признак непостоянный);— крепитирующие хрипы одно- или двусторонние, слышимые на
высоте вдоха (признак частый, однако необязательный);— укорочение фазы вдоха и выдоха (признак постоянный);— укорочение перкуторного тона над областью поражения;— преимущественно интерстициальные и (или) инфильтратив-
ные двусторонние затенения, особенно заметные в нижних
легочных полях; высокое стояние куполов диафрагмы;— рестриктивный синдром, снижение дел (постоянные признаки);— гипоксемия без гиперкапнии в покое или только при физиче¬
ской нагрузке.
Б8 • ГЛАВА ГАЛЬВЕОЛИТЫЛечениепроблема лечения больных ИФА пока не нашла удовлетвори¬
тельного решения. В большинстве случаев ИФА диагностируется на
стадии «сотового легкого», больным назначают бессистемные курсы
глюкокортикоидных препаратов на фоне интенсивной антибактери¬
альной терапии. Нередко в комплекс терапевтических мероприятий
включают биологически активные добавки и другие лекарственные
препараты, физиотерапевтические процедуры. Вполне закономерно,
что такое лечение всегда неэффективно и не будет преувеличением
сказать, что оно способствует неблагоприятному исходу. На этом
основании сложилось представление о фатальности этого заболева¬
ния и полной бесперспективности лечения этой категории больных.в течение последнего десятилетия продолжается поиск новых
лекарственных средств, эффективных при ИФА, завершена целая
серия клинических исследований, планируются новые исследования.
Несомненно, глюкокортикоидная терапия при ИФА пока не имеет
альтернативы, однако следует учитывать, что максимальный эффект
она дает только на ранних стадиях, в случаях десквамативной формы
болезни, а также при отсутствии индивидуальной генетически детер¬
минированной резистентности к глюкокортикоидам. Многие аспек¬
ты этой проблемы (показания, дозы, длительность курсов лечения
и др.) не уточнены. Согласно рекомендациям консенсуса [2000; 2002]
глюкокортикоиды назначают в суточной дозе 0,5 мг на 1 кг массы тела
на протяжении 3 мес, в дальнейшем глюкокортикоидную терапию
продолжают только в тех случаях, если она эффективна.Противоречивы мнения о целесообразности применения иммуно-
су прессантов. Не решены вопросы лечения больных ИФА антифибро-
тическими препаратами, а также антиоксидантами. В литературе
имеются лишь единичные публикации о принципах диспансерного
наблюдения больных ИФА. Положение осложняется тем, что приме¬
нение двойного слепого метода в разработке вопросов лечения столь
тяжелой категории больных неприемлемо.На основании опыта длительного наблюдения больных ИФА в
НИИП СПбГМУ были разработаны принципы лечения с учетом осо¬
бенностей патогенеза и стадии патологического процесса.Базисная терапияМорфологические изменения в легких больных ИФА, как уже
упоминалось, можно представить в виде трех последовательных и
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ69тесно взаимосвязанных и взаимопроникающих друг в друга стадий
(фаз): интерстициального (реже и альвеолярного) отека, альвеолита
и интерстициального фиброза, В связи с этим на каждом этапе разви¬
тия болезни целесообразно использовать препараты, воздействующие
на патогенетические звенья болезни и корригирующие возникающие
нарущения (рис. 1.9).На стадии интерстициального отека и альвеолита представляется
целесообразным использовать препараты, обладающие антиэкссуда-
тивным эффектом и способностью ингибировать иммунологические
реакции. Этим требованиям в наибольшей степени отвечают глюко-
кортикоиды. При переходе патологического процесса в стадию интер¬
стициального фиброза показано назначение препаратов, обладающих
антифибротическим действием (пеницилламин и др.). Доза глюко-
кортикоидов на этой стадии должна быть минимальной (так назы¬
ваемая поддерживающая доза). Назначение лекарственных средств,
обладающих выраженным иммуносупрессивным действием, должно
обосновываться наличием аутоиммунных нарушений (повышенные
титры полных и неполных противолегочных аутоантител, наличие
ревматоидного фактора, АНА, а также высокие титры ЦИК) на любой
стадии болезни.Основанием для разработки конкретных схем лечения послужили
упомянутые выше положения. Комбинации назначаемых препаратов,Рис. 1.9. Лечение больных идиопатическим фиброзирующим альвеолитом
в зависимости от стадии болезни
70 • ГЛАВА! АЛ ЬВЕОЛИТЫДОЗЫ, длительность курсов должны зависеть от активности патоло¬
гического процесса, степени морфологических изменений и выра¬
женности иммунологических нарушений с учетом индивидуальных
особенностей больного (возраст, вес, сопутствующие заболевания,
переносимость лекарственных средств). Таким образом, показаниями
для назначения глюкокортикоидов больным ИФА следует считать:- раннее установление диагноза (фаза отека, фаза альвеолита);- преимущественно десквамативная форма болезни;- признаки обострения ИФА.В таких ситуациях показана пульс-терапия метилпреднизолоном,
который вводится внутривенно по 1000 мг в сутки в течение трех дней,
затем переходят на пероральный прием глюкокортикоидов. В этих
случаях начальная доза глюкокортикоидных препаратов должна быть
максимальной (0,8—1,0 мг на 1кг массы тела в сутки в расчете на
преднизолон) в течение 3-10 дней в зависимости от остроты пато¬
логического процесса. Начальная доза препаратов затем постепенно
снижается в течение 6—8 мес до поддерживающей 5—10 мг в сутки
(лучще 10—20 мг через день). Скорость снижения дозы глюкокорти¬
коидных препаратов зависит от динамики патологического процесса.
Длительность лечения составляет 18—20 мес. Однако нередко возни¬
кает необходимость в назначении поддерживающих доз (как правило,
через день) в течение 3—5 лет и более.Известно, что элементы интерстициального фиброза формируются
уже на стадии альвеолита. В связи с этим при переходе патологичес¬
кого процесса в стадию интерстициального фиброза показано назна¬
чение пеницилламина в сочетании с глюкокортикоидами, начальная
доза которых может быть ниже и составлять около 20—35 мг в сутки.Пеницилламин (купренил*, металкаптаза*) был синтезирован
в 1940 г., а в 1970 г. впервые применен для лечения больных ИФА в
расчете на его способность тормозить коллагеновый обмен, а также
иммуносупрессивный эффект, в настоящее время доказано, что
у больных с прогрессирующим фиброзирующим процессом в лег¬
ких в сыворотке крови увеличивается концентрация меди. Так как
свободная медь ускоряет SH-окисление и тем самым образование
поперечных связей коллагена, было высказано предположение о
том, что повышение концентрации меди способствует коллагени-
зации интерстициальной стромы легких. Учитывая способность
пеницилламина ингибировать медьсодержащую аминоксидазу (что
приводит к торможению созревания коллагена из-за блокирования
перехода растворимых тропоколлагенов в нерастворимый коллаген),
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ • 71было сочтено целесообразным применить пеницилламин в лечении
больных ИФА. Несмотря на то что переход нерастворимого колла¬
гена в растворимый под влиянием пеницилламина нельзя считать
доказанным, такая возможность тоже допускается. Предполагается
также, что пеницилламин изменяет физические свойства легоч¬
ной ткани в лучшую сторону: деформированные грануляционной
тканью капилляры и альвеолы в результате воздействия препарата
могут расправляться и восстанавливаться. На моделях эксперимен¬
тального фиброзирующего процесса в легких получены данные,
свидетельствующие о благоприятном воздействии пеницилламина
и на более ранних этапах патологического процесса. В частности,
оказалось, что предварительное введение этого препарата снижает
выраженность эндотелиального повреждения в ответ на введение
блеомицина. Отмечено также, что пеницилламин обладает и имму-
носупрессивным действием (угнетает метаболические процессы в
лимфоцитах и синтез IgA, IgG, IgM), а также повышает фагоцитар¬
ную активность альвеолярных макрофагов; оказывает некоторый
противовоспалительный эффект.Назначение больших доз пеницилламина (начальная — 0,3 г в
сутки, максимальная ~ 3,6 г в сутки), как показывает опыт, явля¬
ется причиной возникновения множества побочных эффектов, что
ведет к необходимости преждевременной отмены препарата. Описаны
следующие побочные эффекты, связанные с назначением пени¬
цилламина: кожные поражения (сыпь, эритема, пузырчатка, выпа¬
дение волос), респираторные поражения (токсическое воздействие
на эндотелий капилляров легких, облитерируюший бронхиолит),
желудочно-кишечные нарушения (анорексия, тошнота, рвота, боли
в животе), нарушения функции почек {протеинурия, нефротический
синдром, псевдосиндром Гудпасчера, синдром системной красной
волчанки (СКВ)], гематологические нарушения (лейкоцитопения,
тромбоцитопения, анемия, агранулоцитоз), нейромышечные рас¬
стройства (невриты, миастенический синдром, нарушение вкусовых
ощущений). Суточная доза пеницилламина 2 г и более вызывает у
большинства больных изменение вкусовых ощущений вследствие
нарушения обмена меди и никеля.Учитывая особенности механизма действия неницилламина, воз¬
никновение в значительной части случаев многочисленных побоч¬
ных эффектов при назначении высоких доз препарата, в НИИ пуль¬
монологии СПбГМУ им. акад. И.ТТ. ТТавлова были апробированы две
схемы лечения.
72 • ГЛАВА І.АЛЬБЕОЛИТЬІ* Первая неделя по 0,3 г в сутки, вторая неделя — 0,6 г, третья неде¬
ля — 0,9 г в сутки, затем доза пеницилламина снижается в том же
порядке. Поддерживающая доза составляет 0,15—0,3 г в сутки в
течение длительного времени (6—18 мес).* По 0,3 г пеницилламина в сутки в течение 3—5 мес, затем по 0,15 г
в сутки в течение 1—1,5 лет.Таким образом, высшая доза пеницилламина составляет 0,9 г в
сутки (первая схема), т.е. она в 4 раза ниже по сравнению с дозами,
рекомендуемыми зарубежными авторами. Показаниями для назна¬
чения первой схемы являются: острое течение болезни, обострение
патологического процесса. Применение второй схемы показано при
хроническом течении болезни без четко выраженных обострений.
Использование этих схем показало, что терапевтическая эффектив¬
ность препарата, назначаемого в значительно более низких дозах, не
уменьшается, зато позволяет свести к минимуму побочные эффекты.Азатиоприн считают препаратом выбора из группы иммуносупрес-
сантов, так как он обладает выраженным иммуносупрессивным и, в
значительно меньшей степени, цитостатическим действием. Осложнения
на фоне приема этого препарата развиваются значительно реже по срав¬
нению с другими иммуносупрессантами. Другие препараты, обладающие
иммуносупрессивным действием (циклофосфамид, хлорамбуцил), при¬
меняют реже. Азатиоприн следует назначать при наличии выраженных
нарушений иммунологического статуса. Назначают азатиоприн по следу¬
ющей схеме; 150 мг препарата в сутки в течение 1—2 мес, затем по 100 мг в
сутки 2—3 мес, поддерживающая доза (50 мг в сутки) — в течение 3—6 мес.
Критериями снижения дозы или полной отмены препарата служат пока¬
затели иммунологического статуса больного (снижение уровня ЦИК,
иммуноглобулинов, противолегочных аутоантител). Продолжительность
приема азатиоприна в среднем составляет 1,5—2 года.В ряде случаев возникает необходимость в одновременном
назначении глюкокортикоидов, пеницилламина и азатиоприна.
Особенностью этой схемы является возможность использовать срав¬
нительно низкие дозировки всех основных препаратов, что позво¬
ляет уменьшить число побочных эффектов и получить достаточный
антиэкссудативный, иммуносупрессивный и антипролиферативный
эффект. Ранняя диагностика и назначение базисных препаратов в
адекватных дозах позволяют достичь положительной динамики и при
муральной форме болезни.Во всех случаях наряду с перечисленными базисными препара¬
тами следует назначать лекарственные средства, предупреждаю¬
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИ! • 73щие или нивелирующие побочные действия первых. Во избежание
развития дефицита калия, кальция, магния глюкокортикоидная
терапия должна сопровождаться назначением панангина* (аспарка-
ма*), калий-нормина*, препаратов кальция (кальций-ДЗ-никомед*,
альфа-ДЗ-ТЭВА* и др). Для предупреждения остеопороза, а также его
лечения применяют кальцитонин (миакальцик*), остеогенон*, фоса-
макс*. С целью уменьшения катаболического действия глюкокорти-
коидов целесообразно назначать анаболические гормоны (нандро-
лон, метандиенон и др.). Длительное лечение глюкокортикоидами
предполагает обязательное включение в схему лечения препаратов,
улучшающих микроциркуляцию, так называемых ангиопротекто¬
ров: пентоксифиллин, дипиридамол, В период обострения ИФА к
лечению необходимо добавлять антикоагулянты (надропарин, энок-
сапарин, варфарин), так как нередко регистрируются нарушения
микроциркуляции вследствие тромбоза и тромбоэмболии мелких
ветвей легочной артерии.Длительный прием пеницилламина и азатиоприна может привести
к дефициту витамина В^ (пиридоксина) [Насонова В.А., Бунчук Н.В.,
1997]. В связи с этим в комплекс лечения больных необходимо вклю¬
чать пиридоксин в суточной дозе 10—80 мг в зависимости от дозы
пеницилламина и азатиоприна.Отмечен положительный эффект при использовании в комплекс¬
ном лечении больных ИФА спиронолактона. Наряду с известным
мочегонным и калийсберегающим эффектом, спиронолактон оказы¬
вает положительное влияние на перфузию легких, уменьшая интер¬
стициальный отек. Существует также предположение об умеренном
иммуносупрессивном действии спиронолактона, объясняемом цик¬
лической структурой этого препарата. Суточная доза спиронолактона
25—50 мг, длительность лечения 6—12 мес.В лечении больных ИФА целесообразно использовать также пре¬
параты, обладающие антиоксидантными свойствами, в частности
ацетилцистеин (флуимуцил*) 600-1800 мг и более в сутки, витамин Е
(токоферола ацетат), 50% раствор, 0,2—0,6 в сутки.Легочная гипертензия и другие нарушения гемодинамики малого
круга кровообращения, в том числе признаки формирования легоч¬
ного сердца, являются показаниями для назначения лекарственных
препаратов, относящихся к ингибиторам АПФ (каптоприл, лизи-
ноприл, эналаприл и др.), блокаторам кальциевых каналов (вера-
памил, нифедипин, дилтиазем и др.), а также нитраты (изосорбита
мононитрат).
74 • ГЛАВА 1. АЛЬВЕОЛИТЫСоблюдение условий приема глюкокортикоидов (в утренние
часы, после еды, интермиттирующие схемы) и выполнение всех
упомянутых ранее мероприятий, направленных на профилактику
осложнений глюкокортикоидной терапии, позволяют избежать их
в большинстве случаев. Это подтверждают данные табл. 1.3, пред¬
ставляющие частоту развития осложнений глюкокортикоидной
терапии у больных ИФА, наблюдавшихся в нашей клинике в тече¬
ние последних трех лет.Таблица 1.3. Осложнения глюкокортикоидной терапии у больных
идиопатическим фиброзирующим альвеолитом (N=485)ОсложнениеЧисло больныхСахарный диабет336,8Остеопороз (клинические проявления)142,9Остеопороз, по данным денситометрии (N=72)1620,8Туберкулез1,9Язва желудка1,4Недостаточная эффективность глюкокортикоидов и новые пред¬
ставления о регулятщи процессов повреждения, заживления и
фиброгенеза явились стимулами для поиска новых лекарственных
средств патогенетического действия. В табл. 1.4 представлены некото¬
рые лекарственные препараты, механизм действия которых и целесо¬
образность применения при ИФА изучаются в экспериментальных и
клинических исследованиях. При составлении таблицы использованы
обзоры зарубежных авторов [Acharya P.S , Zisman D.A., 2001; SelmanM.
et al, 2001].Таблица 1.4. Новые лекарственные средства патогенетической терапии
идиопатического фиброзирующего альвеолитаНазваниеОсновные механизмы действияОценка эффективностиСредства, подавляющие пролиферацию и аістивность фибрабластовКолхицинПодавляет фактор роста
фибробластов, синтез молекулы
коллагена, усиливает распад
коллагена.Побочные эффекты: тошнота, диарея,
миопатия, мышечные судороги,
бессонница, депрессияРандомизированное проспективное
сравнительное исследование
с глюкокортикоидами.Преимущество колхицина не доказано
[Douglas W.W. et al., 2000]
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ75Продолжение табл. 1.4НазваниеОсновные механизмы действияОценка эффективностиПирфенидон®Подавляет синтез коллагена,
ингибируя экспрессию TGF-P
и фактора роста тромбоцитов,
блокируя митогенную активность
профибротических цитокинов
в фибробластах.Побочные эффекты; желудочно-
кишечные расстройства,
утомляемость, фоточувствительностьЭффективен у животных с
блеомициновым пневмофиброзом.
Проспективное открытое клиническое
исследование (54 больных без
контрольной группы) выявило
относительную эффективность
(стабилизация показателей ФВД)[Ragu G. et at.. 1999].
Рандомизированное двойное
слепое клиническое исследование
пирфенидона*' у 107 пациентов с ИФА
выявило его эффективность [Azuma А.
etal.,2005]ЙФН-у-16Регулирует функцию макрофагов,
подавляет пролиферацию
фибробластов и синтез коллагена,
уменьшая продукцию TGF-p.
Побочные эффекты: лихорадка,
озноб, миалгии, лейкопения,
гипертриглицеридемияРандомизированное проспективное
контролируемое исследование
(18 пациентов) подтвердило
эффективность ИФН-у-1б в сочетании
с глюкокортикоидами по сравнению
с ионотерапией кортикостероидами
[Ziesche R. et al., 1999]ИФН-Р-ІЗПодавляет миграцию и пролиферацию
фибробластов, синтез коллагена
фибробластами, активизирует
коллагеназу.Побочные эффекты; гриппоподобные
симптомы, миалгии, головная больПредварительные результаты
многоцентрового рандомизированного
двойного слепого клинического
исследования не доказали значимой
эффективностиРелаксинБелок, секретируемый беременной
маткой, ингибирует зкспрессию
фибронектина и TGF-p, стимулирует
синтез коллагеназыМеханизм действия изучается
в эксперименте, клинические
иследования не проводилисьСредства, стимулирующие апоптоз фибробластовЛовастин®Блокирует формирование
грануляционной ткани, индуцируя
апоптоз фибробластовКлинические исследования
не проводилисьБарактант#*Экстракт бычьего легкого,
содержащий фосфолипиды,
нейтральные жиры, жирные кислоты,
сурфактант, стимулирует апоптоз
фибробластовКлинические исследования
не проводилисьСредства, защищающие эпителий от поврежденияN-ацетилцистеинУсиливает антиоксидантную защиту
и предотвращает повреждение
эпителия кислородными радикалами,
так как является предшественником
глютатионаСравнительное проспективное
кпиническое исследование N-ацетил-
цистеина выявило увеличение содер¬
жания глютатиона в ЖВАЛ, улучшение
показателей ФВД и уменьшение
летельности на 2% [Behr J. et al., 2002;
Demedts М. et al.. 2005]
76 • ГЛАВА 1. АЛ ЬВЕОЛИТЫОкончание табл. 1.4НазваниеОсновные механизмы действияОценка эффективностиКаптоприлИнгибирует АПФ, тормозит
индуцирумый апоптоз альвеолоцитов,
подавляет пролиферацию
фибробластовПроводится клиническое
исследование в Национальном
институте респираторных заболеваний
в МехикоФактор ростакератиноцитовСтимулирует пролиферацию
альвеолоцитов II типа, активизирует
экспрессию гена белка сурфактантаЭкспериментальное исследование
показало защитную функцию фактора
роста кератиноцитовПолучены результаты использования бозентана^" в качестве лекарс¬
твенного препарата при ИФА. Двойное слепое многоцентровое ран¬
домизированное исследование показало эффективность применение
бозентана*" в течение 12 мес в суточной дозе 125 мг и 250 мг. У больных,
получающих бозентан^, по сравнению с пациентами, получающими
плацебо, отмечалось увеличение продолжительности жизни и улучше¬
ние качества жизни [KingT.E, etal., 2008]. В качестве лечебного средства
при ИФА использовался антогонист тумор-некротизирующего факто¬
ра— этанерсепт^’. Исследователи доказали, что этанерсепт*” способен
затормозить прогрессирование ИФА [Raghu G. et al., 2008].При ИФА используются также и немедикаментозные методы
лечения: эфферентная терапия, длительная кислородотерапия,
трансплантация легких. Из методов эфферентной терапии с успехом
применяется плазмаферез, реже — гемосорбция. Показаниями для
проведения плазмафереза являются:- острое течение или обострение заболевания, характеризующе¬
еся высокой степенью активности патологического процесса,
для купирования которого необходимы высокие дозы глюко-
кортикоидов, иммуносупрессантов, пеницилламина;- неуклонно прогрессирующее течение болезни, резистентное к
проводимой терапии;- возникновение побочных эффектов и осложнений медикамен¬
тозного лечения (повыщение артериального давления, стеро¬
идный остеопороз и др.);- выраженные нарушения иммунного статуса (активация гумо¬
рального иммунитета, дисбаланс показателей клеточного
иммунитета).Противопоказания для проведения плазмафереза:- острые респираторные вирусные инфекции;- гиповолемическое состояние, вызванное кровопотерей, шоком
различного генеза или другими причинами;
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУГОЩИЙ АЛЬВЕОЛИТ • 77— геморрагические синдромы (тромбоцитопения, недостаточ¬
ность плазменных факторов свертывания);— гипопротеинемия (ниже 60 г/л);~ склонность к судорожным припадкам (эпилепсия и др.);— отечные синдромы (почечные, сердечные с явлениями отека
легких).Следует отметить, что перечисленные состояния не являются
абсолютными противопоказаниями и нередко после соответствую¬
щего лечения плазмаферез может быть проведен по обычной методике
[Воинов В.А., 2002].Курс плазмафереза состоит из четырех сеансов, проводимых
через 1-2 дня. За один сеанс плазмафереза следует забирать около
800-1000 мл плазмы. Всего за курс необходимо удалять 1-1,5 объема
циркулирующей плазмы. Во время курса плазмафереза дозы принима¬
емых больным лекарственных препаратов обычно остаются прежними,
суточная доза глюкокортикоидов может быть даже увеличена примерно на
50%. Снижение дозы базисных препаратов производится постепенно через
10-14 дней после завершения курса плазмафереза [Воинов В.А., 2002].Опыт показывает, что плазмаферез эффективен у 70% больных
фиброзируюпшми альвеолитами. Улучшение самочувствия отмечается
нередко уже после первого сеанса: уменьшается одышка, увеличива¬
ется глубина вдоха, уменьшаются или прекращаются боли в суставах.
Наряду с клиническим улучшением в некоторых случаях определяется
положительная динамика данных рентгенологического, лабораторного
и функционального исследований. У 35—40% больных удается снизить
дозы базисных препаратов (глюкокортикоиды, пеницилламин, азати-
оприн). Длительность ремиссии колеблется от 4 мес до 1,5 лет.Ретроспективное сравнительное открытое клиническое иссле¬
дование, проведенное в НИИП СПбГМУ, показало, что включение
плазмафереза в комплекс лечения больных ИФА позволяет увеличить
продолжительность жизни пациентов (рис. 1.10).Длительная кислородотерапия используется при ИФА в сочетании
с медикаментозным лечением. Основными показаниями для этого
метода лечения являются прогрессирующее течение болезни, гипок-
семия (менее 55 мм рт.ст.) и легочная гипертензия. Сравнительное
клиническое исследование J. Zielinski [2000] показало, что длительная
кислородотерапия не влияет на продолжительность жизни больных
ИФА, но улучшает качество их жизни.При неблагоприятном течении болезни и отсутствии эффекта от
проводимой терапии применяется трансплантация легких. По опре-
78 • ГЛАВА 1. АЛЬВЕОЛИТЫГоды9.3+1,1□ Монотерапия
кортикостероидами□ Комплексная
медикаментозная
терапия■ Комплексная
терапия,
включающая
плазмаферезРис. 1.10. Продолжительность жизни умерших больных идиопатическим
фиброзирующим альвеолитом в зависимости от методов леченияделенным показаниям может проводиться пересадка одного легкого,
обоих легких и комплекса сердце—легкие. Наряду с общепринятыми
основные критерии для включения больного в «лист ожидания»: сни¬
жение дел менее 39% от должной величины и уменьшение форсиро¬
ванной жизненной емкости легких (ФЖЕЛ) более чем на 10% за 6 мес
[Keating D.T. et al., 2007]. Относительные противопоказания для пере¬
садки легких при ИФА: возраст старше 60 лет, неадекватный психоло¬
гический статус, выраженная сопутствующая патология, сердечная,
почечная или печеночная недостаточность. В случаях успешной транс¬
плантации не только наблюдается положительная клиническая дина¬
мика, но и улучшаются показатели ФВД, восстанавливается функция
правого желудочка сердца и нормализуется давление в легочной арте¬
рии. Пяти летняя выживаемость после трансплантации легких состав¬
ляет 60% [1PF. International consensus statement., 2000]. Неблагоприятный
исход трансплантации может быть обусловлен осложнениями, которые
подразделяются на ранние: отторжение трансплантанта, инфекция,
сердечная недостаточность и поздние; облитерирующий бронхиолит,
инфекция, онкологические заболевания.Диспансерное наблюдениеДиспансерное наблюдение больных ИФА должно осуществляться
в специализированных пульмонологических учреждениях, распо¬
лагающих соответствующими специалистами и возможностями для
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ79обследования больных на современном уровне. Схема диспансерного
наблюдения больных зависит, как правило, от степени компенсации
патологического процесса. В связи с этим в качестве критериев для
деления больных ИФА на диспансерные группы были взяты разли¬
чия в течение заболевания, выраженность и обратимость рентгено¬
логических, функциональных и лабораторных показателей. Однако
распределение больных на диспансерные группы может быть в зна¬
чительной мере упрощено при использовании наиболее характер¬
ного для этого заболевания и наиболее доступного для определения
клинического синдрома— степени выраженности ДН. Так, боль¬
ные с I степенью ДН (одытяка при умеренной физической нагрузке)
могут быть отнесены в диспансерную группу с компенсированным
течением, со и степенью (одышка при незначительной физической
нагрузке) — в группу с субкомпенсированным течением и больные с
III степенью ДН (одышка в покое, цианоз) — в группу с деком пепси-
рованным течением. Кратность контрольных обследований больных
ИФА различных диспансерных групп представлена в табл. 1.5.Таблица 1.5. Принципы диспансерного наблюдения больных идиопатическим
фиброзирующим альвеолитомДиапансерная группаЧастота контрольных обследованийКомпенсированное течение ИФА1 раз в годСубкомпенсированное течение ИФА2 раза в годДекомпенсированное течение ИФА3-4 раза в год или по необходимостиКонтрольное обследование обычно включает:- осмотр врача-пульмонолога;— лабораторные методы (клинический анализ крови, биохими¬
ческое и иммунологическое исследование крови);- комплексное исследование ФВД;- эходопплеркардиография;- рентгенография и (или) КТ органов грудной клетки;— денситометрия костей;— дополнительные методы обследования по показаниям (фибро-
бронхоскопия, сцинтиграфия, УЗИ органов брюшной полости);— консультации специалистов и др.Результаты контрольного обследования позволяют оценить актив¬
ность патологического процесса, особенности течения болезни и
эффективность проводимой терапии, а также определить дальней¬
80 . ГЛАВА 1,АЛЬВЕ0ЛИТЫшую тактику лечения. В случае обострения патологического процесса
больной должен быть госпитализирован в пульмонологическое отде¬
ление (центр). Больные с декомпенсированным течением наблюдают¬
ся по индивидуальной схеме.При минимальных признаках активности может назначаться под¬
держивающая глюкокортикоидная терапия и (или) азатиоприн, и
(или) пеницилламин. Число одновременно назначаемых препаратов
зависит от соответствующих показаний.Отсутствие обострений и признаков прогрессирования заболевания
по клиническим, рентгенологическим и функциональным данным
обследования на фоне приема поддерживающих доз глюкокортикоид-
ных препаратов в течение 1,5—2 лет дает основание для прекращения
лечения. Из 485 больных ИФА, наблюдаемых в НИИП, у 18 человек
лечение оказалось эффективным и было отменено в среднем через
1,5—3 года. Эти случаи можно расиенить как выздоровление с дефек¬
том: функциональные возможности пациентов были нормальными
или снижены за счет умеренного уменьшения дел. На КТ у 10 больных
определялись признаки незначительно выраженного пневмофиброза,
преимущественно в наддиафрагмальной области, без тенденции к про¬
грессированию, Перфузионная сцинтиграфия выявляла различную
степень редукции сосудистого русла легких. Сравнительный анализ
группы больных, которым лечение было отменено, с другими больны¬
ми ИФА, наблюдавшимися в НИИП СПбГМУ, выявил статистически
достоверные отличия, представленные в табл. 1.6.Таблица 1.6. Характеристика группы больных идиопатическим
фиброзирующим альвеолитом, которым терапия была отмененаПоказательГруппа IN =412Группа II N = 18РМ/Ж1/3,81/8<0,05Десквамативная форма ИФА,%13,238,9<0,05Срок установления диагноза, годы1,5±0,10,6±0,1<0,01«Сотовое легкое», %21,80,0<0,01«Пальцы Гиппократа»0.430,00<0,001«Попискивание»0,190,00<0,001Систолическое давление в легочной артерии, мм рт.ст.32,6±1.923,Б±0,9<0,01Данные таблицы свидетельствуют о том, что:— ИФА у женщин протекает благоприятнее, чем у мужчин;— наиболее успешным лечение ИФА может быть при десква-
мативном варианте заболевания, установлении правильного
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ • 81диагноза и начала адекватной терапии в течение первых шести
месяцев болезни, т.е. до развития необратимых изменений в
легочной ткани;- наличие положительного симптома «пальцев Гиппократа»,
аускультативного феномена «попискивания», ячеистой пере¬
стройки легочного рисунка, легочной гипертензии свидетель¬
ствуют о далеко зашедшей стадии патологического процесса и
неблагоприятном прогнозе.ПрогнозПрогноз при ИФА зависит от многих факторов, поэтому его трудно
оценить однозначно. До настоящего времени преобладающим является
мнение о фатальности этого заболевания. Летальный исход насту¬
пает в среднем через 3—5 лет от появления первых симптомов болез¬
ни, а пятилетняя выживаемость больных ИФА составляет не более
50% [Freudenberger Т., Raghu G., 2000; Acharya P.S, Zisman D.A., 2001;
Khalil N.O, O’Connor R., 2004]. Результаты исследования J.P. Lynch и
соавт. [2001] показали, что больные ИФА умирают в среднем через
3—8 лет и только 10-20% больных живут более 10 лет. Некоторые уче¬
ные, в том числе G.J. Laurent и соавт. [2008], считают, что прогноз
при ИФА хуже, чем при некоторых опухолевых заболеваниях. В США
смертность при ИФА в 2003 г. составила 50,8 на 1млн населения
[Olson A.L. et al., 2007J.Тем не менее имеющийся к настоящему времени опыт лечения боль¬
ных ИФА в НИИП СПбГМУ им. акад. И.П. Павлова свидетельствует
о возможности благоприятного прогноза. Пяти летняя выживаемость
(продолжительность жизни от начала болезни) в целом по группе
составила 81,6%; у пациентов мужского пола этот параметр был значи¬
тельно ниже (65,8%), чем у пациентов женского пола (85,7%) [рис. 1.11].
Более 10 лет от момента начала заболевания прожили 25,9% больных.Анализ литературных и собственных данных позволяет выделить
два наиболее важных прогностических признака, которые с большой
долей вероятности свидетельствуют в пользу благоприятного прогно¬
за; преимуш;ественно десквамативная форма болезни и раннее начало
адекватного лечения. Лечение ИФА — это прежде всего лечение альве-
олита. К настоящему времени отсутствуют какие-либо способы лече¬
ния развившегося в легких интерстициального фиброза; стабилизация
патологического процесса — это максимум, которого далеко не всегда
удается достичь.
82ГЛАВА 1. АЛЬВЕОЛИТЫВсебольныеРис. 1.11. Пятилетняя выживаемость больных идиопатическим фиброзиру-
ющим альвеолитомУстановление диагноза на стадии формирования «сотового легкого»
делает прогноз неблагоприятным. Продолжительность жизни у этой
группы больных составляет в среднем 1,5—3 года. Неблагоприятными
в прогностическом плане признаками болезни являются следующие:
муральная форма заболевания, рецидивирующее течение патологи¬
ческого процесса, возраст старше 45 лет, мужской пол заболевшего,
похудание на фоне проводимого лечения, наличие в легких распро¬
страненных фиброзных изменений к началу лечения, повышение
давления в легочной артерии, гипоксемия, а также раннее изменение
пальцев по типу «барабанных палочек» и «часовых стекол».В ряде случаев для оценки прогноза используется исследование
клеточного состава лаважной жидкости. Отмечено, что у больных
ИФА с содержанием в лаважной жидкости лимфоцитов более 11%,
а нейтрофилов менее 4% достигаются лучшие результаты лечения и
более благоприятный прогноз. Нейтрофилез ЖБАЛ является небла¬
гоприятным прогностическим признаком, 30% больных умирают в
течение года [Kinder B.W. et al., 2008].Как уже упоминалось, в НИИП СПбГМУ 212 больных ИФА наблюда¬
лись более пяти лет. За время наблюдения умер 81 пациент (38,2%). Среди
больных мужского пола летальный исход составил 54,5% (24 человека),
а среди лиц женского пола — 33,9% (57 человек). Продолжительность
ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУЮЩИЙ АЛЬВЕОЛИТ83жизни (от начала заболевания) в среднем составила 5,4±0,5 года и колеба¬
лась в широких пределах в зависимости от многих факторов. У женщин
продолжительность жизни была больше, чем у мужчин (табл. 1.7).Таблица 1.7. Продолжительность жизни умерших пациентов, страдавших
идиопатическим фиброзирующим альвеолитомГруппа больныхПродолжительность жизни, годыПродопжіггельность жизни, годы (min-max)Вое больные5,4±0,50,5-25Мужчины3,8±0,63,8+0,6Женщины6,0±0,60,5-5Причиной смерти больных ИФА является, как правило, про-
трессируюшая ДН, а также присоединяющаяся на поздних стадиях
болезни сердечная недостаточность. Присоединение интеркуррен-
тной инфекции (в первую очередь туберкулезной микотической)
ускоряет летальный исход. Непосредственной причиной смерти
может быть тромбоэмболия ветвей легочной артерии, а в ряде случа¬
ев присоединение онкологического заболевания. Согласно результа¬
там исследования зарубежных авторов у больных ИФА рак легкого
развивается значительно чаще, чем в популяции, и даже с большей
частотой, чем у курильщиков [Hubbard R. et al., 2000]. По данным
N. Roueti и соавт. [1999], 25% больных ИФА умерли от перифериче¬
ского рака легкого. Анализ аутопсийного материала ИФА [Hironaka М.,
Fukayma М., 1999] выявил, что в 32 случаях из 70 был обнаружен
периферический рак легкого. В табл. 1.8 представлены причины
смерти больных, которые наблюдались в НИИП СПбГМУ.Таблица 1.8. Причины смерти больных идиопатическим фиброзирующим
альвеолитомПричина смертиЧисло больныхЧисло больных, %ДН6782,7Острый инфаркт миокарда33,7Туберкулез легких33,7Онкологическое заболевание22,5ТЭЛА22,5Госпитальная пневмония22,5Инсульт11,2Несчастный случай11.2
84 • ГЛАВА І.АЛЬВЕОЛИТЬІК настоящему времени накоплен достаточно большой опыт, позво¬
ляющий считать реальной возможность благоприятного прогноза при
этом заболевании. Необходимым условием благоприятного прогноза
является, как уже упоминалось, ранняя диагностика и адекватное
патогенетически обоснованное лечение, что на практике представля¬
ет собой скорее исключение, нежели правило.ПрофилактикаПрофилактика ИФА не разработана.ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИТЭкзогенный аллергический альвеолит (ЭАА) (синонимы: гиперчувс-
твительный пневмонит, интерстициальный гранулематозный альве¬
олит, ингаляционная пневмопатия и др.) — патологический процесс,
представляющий собой аллергическую реакцию преимущественно
респираторного отдела легких на те или иные аллергены.Впервые клинические проявления этого заболевания были пред¬
ставлены Ramazzini еще в 1700 г. В 1874 г. в Исландии это заболевание
было описано как «сенной катар». Детальное описание так называе¬
мого легкого фермера впервые дал J. Campbel в 1932 г. В последующие
годы появились многочисленные работы, посвященные ЭАА у рабо¬
чих многих профессий, а в 1967 г. J. Pepys предложил термин «ЭАА»
для обозначения заболевания легких от воздействия органической
пыли, заканчивающегося пневмофиброзом.Распространенность ЭАА зависит от многих факторов: профес¬
сии, бытовых условий, географических особенностей местности,
состояния окружающей среды. ЭАА чаще встречается среди жите¬
лей сельской местности. Так, «легкое фермера», по данным разных
авторов, встречается у 0,4—8% лиц, занятых в сельском хозяйстве
(8—540 случаев на 100 000 фермеров); «легкое птицевода» — у 5—7%
работающих на птицефабриках, у 3% голубеводов, у 8% рабочих дере¬
вообрабатывающей промышленности, у 5% занятых в производстве
солода. ЭАА от увлажнителей воздуха развивается у 52% работников
офисов. Среди членов клубов любителей голубей и птиц признаки
ЭАА выявляются у 8—30%. По нашим данным, в структуре ИЗЛ на
долю ЭАА приходится 10,2%, а согласно результатам исследования
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИТ • 85зарубежных авторов — 6,6—15,1%. В настоящее время считается, что
число больных ЭАА составляет около 3% всех пациентов пульмоно¬
логического профиля. При этом на долю «легкого фермера» в США
приходится 11% больных ЭАА.Этиология и факторы рискаЭтиологические факторы развития ЭАА можно условно разделить
на 5 групп:— бактериальные факторы (термофильные актиномицеты,
Bacillus subtilis, MicropoUspora faeni и др.);— грибковые факторы {Aspergillus fumigatus, Alternaria, РепісШіит
casei, Penicilliumglaucum,CravinumaureobasidiumpuHam,Coniosporum
corticate, Cryptostroma corticate, различные плесневые грибы);— белковые антигены животного происхождения (сывороточные
белки и экскременты кур, голубей, попугаев и других птиц,
крупного рогатого скота, свиней, антигены пшеничного дол¬
гоносика, пыль рыбной муки, пыль пшеничной муки, пыль,
содержащая частицы шерсти животных, экстракт задней доли
гипофиза крупного рогатого скота (лекарственный препа¬
рат адиурекрин*), клеш,и {Sitophilus granarius, Dermaiophagoides
pteronissimus, Euroglyphus maynei, Europhagus putrescentiae)\— антигены растительного происхождения (опилки дуба, кедра,
коры клена, красного дерева, заплесневелая солома, экстракты
кофейных зерен; пыль, содержащая частицы хлопка, льна,
конопли и др.);— медикаментозные антигены (противомикробные, противо¬
воспалительные, противопаразитарные препараты, ферменты
и другие лекарственные средства белкового происхождения,
контрастные вещества и др.).На основании этиологических факторов можно выделить ряд про¬
изводств, работа в которых может представлять риск развития ЭАА:— сельское хозяйство: работники птицеводческих хозяйств,
животноводческих комплексов, зерновых хозяйств, заготови¬
тели кормов, работники парниковых хозяйств; лица, работаю¬
щие в силосных ямах и др.;~ пиш,евая промышленность: производство пива, молочных про¬
дуктов, дрожжей, сыров и др.;— текстильная и швейная промышленность: обработка меха,
хлопка, конопли» льна;
86 * ГЛАВА! АЛЬВЕОЛИТЫ— химическая и фармацевтическая промышленность: произ¬
водство моющих средств, пластмасс, красителей; производство
лекарственных препаратов, витаминов;- деревообрабатывающая промышленность: обработка древеси¬
ны, производство бумаги, контакт с веществами, применяемы¬
ми для обработки древесины (пентахлорфеноламин и др.).Наиболее частыми разновидностями ЭАА принято считать «лег¬
кое фермера», «легкое птицевода» и медикаментозные аллергические
альвеолиты. «Легкое фермера» чаще встречается в географических
широтах, отличающихся сырым и холодным климатом, в горных
районах после периода дождей. Среди идентифицированных анти¬
генов, вызывающих «легкое фермера», наиболее распространенным
является Saccharopolyspora rectivirgula. Антигены, вызывающие «легкое
птицевода», содержатся во всех тканях, перьях и экскрементах птиц.
Выраженными антигенными свойствами обладают экскременты,
содержащиеся в большом количестве в виде пыли в воздухе производс¬
твенных помещений, где содержится птица. Вследствие индустриали¬
зации птицеводства и создания крупных птицеводческих комплексов
значительно возросло число больных ЭАА типа «легкое птицевода».Развитие фармацевтической промышленности, полипрагмазия и
рост аллергизации населения приводят кутому, что в последние годы
значительно чаще стали встречаться медикаментозные аллергические
альвеолиты. Выраженными аллергенными свойствами обладают пре¬
жде всего гормональные препараты белкового происхождения (инсу¬
лин, адиурекрин, адренокортикотропный гормон и др.), ферменты
(трипсин, химотрипсин, стрептаза, дезоксирибонуклеаза, урокиназа
и др.), лечебные сыворотки, диагностические рентгеноконтрастные
вещества. Чаще всего медикаментозные аллергические альвеолиты
являются следствием необоснованного применения антибактериаль¬
ных препаратов. Полипрагмазия усугубляется стереотипной реакци¬
ей больных и некоторых врачей при любом недомогании прибегать
к антибиотикам и другим препаратам. Аллергические альвеолиты
могут возникать в ответ на прием биологически активных добавок,
различных снадобий, которыми потчуют больных резко активизи¬
ровавшиеся в последние годы так называемые народные целители,
знахари и др.До настоящего времени нет однозначного ответа на вопрос: поче¬
му курильщики реже болеют ЭАА (80—95% больных ЭАА не курят).
Существует предположение, что у курильщиков подавлен ответ
иммунной системы на антигенное раздражение.
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИТ • 87В предрасположенности к развитию ЭАА важную роль играют гене-
тичекие факторы. Описаны семейные случаи ЗАА. Отмечена более
частая встречаемость антигена HLA-Bg у больных с «легким фермера»
и «легким голубеводов». А. Сатагепа и соавт. [2001] в своей работе
показали, что число гаплотипов HLA-DR и HLA-DQ в группе больных
ЭАА («легкое фермера») сравнительно больше, чем среди людей, рабо¬
тающих на фермах, но не отличается от обшей популяции. С другой
стороны, некоторые авторы считают, что восприимчивость отдельных
любителей птиц и голубеводов к заболеванию не имеет генетически
детерминированного механизма, связанного с HLA-антигенами.Вопрос о роли вирусов в возникновении и развитии ЭАА в насто¬
ящее время обсуждается. Складывается мнение о том, что вирус¬
ная инфекция способствует развитию ЭАА. Вирусные антигены
при ЭАА обнаруживаются в клетках ЖБАЛ и легочных биоптатов.
В экспериментальной работе G. Gudmundsson и соавт. [1999] было
показано, что респираторный синцитиальный вирус и вирус Сендай
стимулировали развитие ЭАА. Вирусы изменяют функциональную
способность альвеолярных макрофагов, снижают фагоцитирующую
активность клеток, стимулируют пролиферацию Т-лимфоиитов и тем
самым потенцируют развитие и прогрессирование ЭАА.Клинические проявления, течение болезни, иммунологические
нарушения и морфологические изменения, возникающие в легких
при воздействии перечисленных выше этиологических факторов,
не имеют принципиальных отличий, что позволяет объединить их
понятием «ЭАА».Патогенезв зависимости от типа иммунологической реакции одни и те же
антигены могут вызвать приступ удушья (реакция гиперчувстви¬
тельности I типа по Geli и Coombs) или возникновение ЭАА (реак¬
ция гиперчувствительности III и IV типов). Преимушественный тип
реакций, реализующийся в конкретную клиническую симптоматику,
в каждом случае зависит от многих причин: дисперсности вдыхае¬
мых частиц, их антигенных свойств, интенсивности и длительности
экспозиции, а также от особенностей иммунного ответа больного.
Мелкодисперсные частицы (менее 2—Змкм), обладающие антиген¬
ными свойствами, проникают глубоко в дистальные воздухоносные
пути и являются причиной развития ЭАА. Роль ПТ типа иммунной
реакции в патогенезе ЭАА подтверждается длительностью периода от
88 • ГЛАВА І.АЛЬВЕОЛИТЬІмомента воздействия антигена до появления в ЖБАЛ специфических
антител и иммунных комплексов. В типичных случаях ЭАА у боль¬
ных определяются нормальные уровни IgE, отсутствует эозинофилия
периферической крови, нет склонности к аллергическим реакциям,
в ответ на поступление в дистальные дыхательные пути частиц,
обладающих антигенными свойствами, в иммунологическую защиту
легких включаются реакции как гуморального, так и клеточного имму¬
нитета. Концепия полузамедленной и замедленной гиперчувствитель¬
ности (III—IV тип) объединила в одну группу заболевания, проявляю¬
щиеся в шоковом органе изменениями по типу феномена Артюса.Первой реакцией на антигенное воздействие является приток ней-
трофилов в альвеолы и мелкие дыхательные пути, сопровождающийся
увеличением числа мононуклеаров. Эти клетки освобождают протео-
литические ферменты, простогландины и лейкотриены. Продукция
ИЛ, цитокинов, факторов роста и других различных медиаторов
Т-лимфоцитами и макрофагами играет важную роль в патогенезе ЭАА.
Гидролитические ферменты, секретируемые альвеолярными макро¬
фагами, вызывают расщепление комплемента, фиксированного на их
комплемент-рецепторах, с образованием СЗ-компонента комплемента.
Расщепление последнего приводит к образованию СЗв-компонента,
который, комбинируясь с фактором В из альтернативного пути, при¬
водит к еще большей интенсивности распада СЗ, образуя при этом
еще больше СЗв, и т.д. Это один из путей активации комплемента.
Антигенное раздражение активирует продукцию иммуноглобулинов
В-лимфоцитами и, соответственно, приводит к повышенному обра¬
зованию иммунных комплексов, состоящих из антигена и преципи-
тирующих антител классов G и М (рис. 1.12). Иммунные комплексы
способны активизировать систему комплемента, а также стимулиро¬
вать альвеолярные макрофаги и секрецию ими ферментов. Антитело,
входящее в состав иммунных комплексов, определяет их сродство к
определенным тканям. При избытке антигена иммунные комплексы
циркулируют в крови в растворимом состоянии. Повышение прони¬
цаемости сосудистой стенки вследствие высвобождения вазоактивных
аминов (лизис тромбоцитов в присутствии иммунных комплексов,
иммунное прилипание тромбоцитов в присутствии нейтрофилов и др.)
создают условия для отложения ЦИК на базальной мембране сосудов
легких. Фиксация комплемента на поверхности ЦИК делает последние
доступными для поглощения фагоцитами. Высвобождающиеся при
этом лизосомальные ферменты оказывают повреждающее действие на
легочную паренхиму по типу феномена Артюса.
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИТ89Рис. 1.12. Схема патогенеза экзогенного аллергического альвеолита [Berto-
relli G., Bocchino V., Olivieri D., 2000]:АГ — антиген; AT — антитело; ПК — плазматическая клетка; Т-л — Т-лим-
фоцит; АРС — антигснпрезентирующая клетка; TCR — Т-клеточный рецеп¬
тор; HLA-DR, VLA-1, В1у-7, CD69, р55 IL-2R, р75 TL-2R — активационные
молекулы.
90 • ГЛАВА І.АЛЬВЕОЛИТЬІФиксация иммунного комплекса или антигена на поверхности
антигенпрезентирующей клетки вызывает активацию Т-лимфоцитов
через Т-клеточный рецептор. Активированный Т-лимфоцит экспрес¬
сирует молекулы активации клеток. Этиологический агент при ЭАА
стимулирует секрецию провоспалительных цитокинов ИЛ-1, ИЛ-6,
ИЛ-12, TNF-a альвеолярными макрофагами и лимфокинов ИЛ-2 и
ИФН-у лимфоцитами, которые играют центральную роль в развитии
воспалительного процесса. Повреждающим действием на легочную
ткань обладают такие продукты жизнедеятельности альвеолярных
макрофагов, лимфоцитов и нейтрофилов, как кислородные радика¬
лы, протеолитические ферменты, продукты метаболизма арахидоно-
вой кислоты (простагландины, лейкотриены и др.).Интенсивность окислительного метаболизма в альвеолярных мак¬
рофагах у больных с острым течением ЭАА значительно выше, чем
при хроническом течении заболевания. Вследствие напряженности
окислительных процессов происходит декомпенсация внутриклеточ¬
ной системы антиоксидантной защиты, на что указывает снижение
активности супероксиддисмутазы при нарастании уровня малоново¬
го диальдегида.В патогенезе образования гранулем при ЭАА важную роль играют
медиаторы клеточного иммунитета— лимфокины. Предполагают,
что гранулемы являются следствием реакции на инородное тело,
нарушения равновесия между Т- и В-системами иммунитета или дру¬
гие неизвестные причины.в случаях продолжающегося антигенного стимула болезнь может
переходить в фазу фиброзирования. Возможно, этому способствует сек-
ретируемый альвеолярными макрофагами фактор, индуцирующий рост
фибробластов и продукцию ими коллагена. Секреция фибробластами
(изменившимися качественно и увеличившимися численно) коллаге¬
на ведет к развитию интерстициального легочного фиброза. Другим
возможным механизмом, потенцирующим процесс фиброзирования,
является нарастаютцая декомпенсация в локальной системе «перекис-
ное окисление липидов — антиоксидантная защита». Снижение уровня
фибррнектина в ЖБАЛ в этой фазе заболевания может быть обусловлено
потреблением его на синтез соединительной'ткани.При медикаментозных ЭАА могут иметь место реакции гипер¬
чувствительности Г типа, сопровождающиеся эозинофилией перифе¬
рической крови, бронхоспазмом или протекающие по типу синдрома
Леффлера, Ингаляционные и кожные пробы в этих случаях выявляют
сочетание немедленной и полузамедленной гиперчувствительности.
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИТ * 91Возникновению медикаментозных ЭАА способствуют полипрагма-
зия, одновременное назначение препаратов, усиливающих побочные
действия друг друга, нарушения функционального состояния печени,
почек, ретикулоэндотелиальной системы, эндокринных желез, дефи¬
цит витаминов и др.Таким образом, при ЭАА гуморальная форма ответа, связанная с
В-системой иммунитета, включается уже на первом этапе заболева¬
ния (полузамедленный и замедленный тип гиперчувствительности).
При продолжении антигенного стимула включаются реакции клеточ¬
ного иммунитета, связанные с Т-системой и определяющие дальней¬
шее течение заболевания.Патологическая анатомияХарактер морфологических изменений в легочной ткани при ЭАА
зависит от течения заболевания: острое, подострое, хроническое.
Для острого течения ЭАА характерны внутриклеточный и интер¬
стициальный отек, инфильтрация альвеол и межальвеолярных пере¬
городок лимфоцитами, плазматическими клетками, нейтрофилами,
гистиоцитами, гигантскими клетками. В ультраструктурных элемен¬
тах эндотелиальных клеток кровеносных капилляров наблюдаются
признаки набухания и повреждения. Базальная мембрана эндотелия
в некоторых участках не контурируется. Для подострой стадии забо¬
левания характерно образование эпителиоидно-клеточных неказеоз-
ных гранулем саркоидного типа (IV тип реакции гиперчувствитель¬
ности). Отличительной особенностью гранулематозной стадии ЭАА
(от саркоидоза) является ее кратковременность. При продолжающем¬
ся контакте с аллергеном начинают преобладать пролиферативные
процессы. Увеличение клеточных и неклеточных элементов соеди¬
нительной ткани способствует формированию интерстициального и
внутриальвеолярного фиброза. Происходит замещение эластических
волокон проколлагеновыми и коллагеновыми, что ведет к коллаге-
низации интерстициальной стромы легких. Гранулемы трансфор¬
мируются в соединительнотканные структуры. Число лимфоцитов,
плазматических клеток, гистиоцитов и эозинофилов в интерстиции
легких уменьшается. При хроническом течении ЭАА отмечается зна¬
чительное повреждение аэрогематического барьера легких, замеще¬
ние кровеносных капилляров волокнистой соединительной тканью,
развитие интерстициального фиброза. Повреждение эластических
волокон в виде их расслоения, истончения и фрагментации приводит
92 • ГЛАВА І.АЛЬВЕОЛИТЬІК образованию микрокистозных полостей (рис. 1.13, см. цв. вклейку).
Морфологическая картина ЭАА на этой стадии полностью теряет
специфичность. В связи с этим отсутствие гранулем в биопсийном
материале, естественно, не исключает диагноз ЭАА.Центром, вокруг которого образуются гранулемы, могут быть
нерастворимые иммунные комплексы, фиксированные в тканях.
Однако выявление в центре гранулем двоя копре лом л я ющих инород¬
ных тел (рис. 1,14, см. цв. вклейку) скорее указывает на неорганиче¬
скую их природу.Гранулемы, выявляемые при ЭАА, следует дифференцировать с
гранулемами при саркоидозе, туберкулезе, микотических, лимфоре¬
тикулярных и других заболеваниях. Наибольшие диагностические
трудности возникают при дифференциации с саркоидными грану¬
лемами, так как туберкулезные отличаются казеозным некрозом в
центре, а микоз может быть диагностирован с помощью микробио¬
логических и серологических тестов, в отличие от саркоидоза, при
ЭАА гранулемы неправильной формы (при саркоидозе их называют
«штампованными» из-за их сходства друг с другом), с нечеткими
границами, меньших размеров, немногочисленные, располагаются
только в интерстициальной ткани легких (при саркоидозе они нахо¬
дятся не только в интерстициальной ткани легких и в подслизистом
слое крупных бронхов, но также пери- и интраваскулярно), обычно
исчезают через несколько месяцев после прекраш;ения контакта с
антигеном. Инфильтрация лимфоцитами и плазматическими клет¬
ками при саркоидозе определяется только вокруг гранулем, при ЭАА
такой закономерности нет. Уже упоминалось, что при ЭАА некроз
в центре гранулем отсутствует, тогда как при саркоидозе иногда
выявляются участки гиалинового, а при туберкулезе, как правило,
казеозного некроза.Кроме того, при ЭАА могут выявляться признаки облитерации аль¬
веол. Причиной облитерации альвеол является организация эндоброн-
хиального экссудата, который появляется в бронхиолах в острой стадии
заболевания. При прогрессировании заболевания и развитии интер¬
стициального фиброза происходит деформация бронхиол, что также
способствует их облитерации (хроническое течение ЭАА). Признаки
бронхиолита, а в ряде случаев облитерирующего бронхисшита, выяв¬
ляются в 25—75% случаев. Встречаются участки эмфиземы и дистелек-
таза. Эластические волокна фрагментированы, количество их умень¬
шается. Видны фибробласты, окруженные коллагеновыми волокнами.
Гранулемы на этой стадии болезни практически не определяются.
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИ! • 93Клиническая картинаХарактер клинических проявлений ЭАА зависит от многих фак¬
торов; степени антигенности причинного аллергена, продолжитель¬
ности и массивности антигенного воздействия, особенностей макро¬
организма, Эти же факторы определяют и течение болезни: острое,
подострое, хроническое. Острая форма ЭАА развивается, как прави¬
ло, через 4—12 ч после попадания антигена в организм (ингаляционно,
внутрь, парентерально). Характерными признаками болезни являют¬
ся озноб, повышение температуры тела, одышка, кашель сухой или со
скудной слизистой мокротой, обш;ая слабость, боль в груди, мышцах,
суставах, головная боль. У части больных могут возникать присту¬
пы затрудненного дыхания, явления вазомоторного ринита. При
аускультации определяются мелко- и среднепузырчатые влажные
хрипы, нередко над всей поверхностью легких. При наличии явлений
бронхоспазма выслушиваются сухие свистящие хрипы. В случаях
прекращения контакта с антигеном перечисленные симптомы могут
исчезать без лечения в течение сравнительно короткого времени
(12—48 ч). Однако в тех случаях, когда контакт с причинным агентом
продолжается, заболевание прогрессирует и прогноз становится зна¬
чительно более серьезным.Подострое течение ЭАА наблюдается при воздействии ка организм
небольших доз антигена. Начало заболевания не столь демонстра¬
тивно, и больные далеко не всегда своевременно обращаются к врачу.
Однако даже своевременное обращение к врачу отнюдь не гарантиру¬
ет раннюю диагносі'ику заболевания. Как правило, устанавливаются
диагнозы острой респираторной вирусной инфекции, пневмонии,
мил парного туберкулеза легких и др., так как постепенное развитие
симптомов болезни затрудняет выявление связи между клиниче¬
скими проявлениями ЭАА и воздействием какого-либо конкретного
профессионального или бытового фактора. Подострая форма ЭАА
характеризуется одышкой при умеренной физической нагрузке, каш¬
лем с небольшим количеством слизистой мокроты, субфебрильной
температурой тела, повышенной утомляемостью, снижением аппети¬
та, похуданием. Повторные контакты с причинным фактором вызы¬
вают обострение патологического процесса.Формированию хронической формы ЭАА способствует длительный
(нередко многолетний) контакт с небольшими дозами антигена, что
ведет к развитию фиброзирующего процесса в легких, сопровождаю¬
щегося прогрессирующей одышкой, цианозом, похуданием и другими
94• ГЛАВА 1. АЛЬВЕОЛИТЫсубъективными и объективными признаками, не отличающимися
от таковых при ИФА. Симптомы хронического бронхита (кашель с
отхожлением слизистой мокроты) наблюдаются в 20—40% случаев.
У любителей голубей, страдающих ЭАА, зачастую развивается нару¬
шение мукоцилиарного клиренса. Поздняя диагностика и неправиль¬
ная лечебная тактика, как правило, приводят к хронизации процесса.
Развивается цианоз, симптом «пальцев Гиппократа». При аускультации
у больных с хронической формой ЭАА определяются крепитирующие
хрипы, но более звучные и грубые, чем при острой форме болезни.
Феномен «попискивания» выслушивается в далеко зашедших случаях
при наличии выраженного пневмо- и плеврофиброза.КлассификацияНаиболее часто используется классификация ЭАА по этиологиче¬
скому признаку (табл. 1.9).Таблица 1.9. Этиологическая классификация экзогенных аллергических аль-
веолитовНазвание болезниИсточник антигенного
воздействияЭтиологический фактор«Легкое фермера»Заплесневелое ссно, зерно,
силос, компостТермофильные
актиномицеты:
Micropofyspora faeni,
Thermoactinomyces vulgaris,
Thermoactinomyces saccharii
(viridis, candidus)«Легкое птицевода»
(«легкое гатубевода»)Птичий помет, пыль от
перьев птиц (куры, голуби,
попугаи, утки, индюки)Ферменты экскрементов,
Tricfiosporon cutaneum, белки
птиц (сыворотка, экскреты)Альвсолит сыроваров
(сыроделов)Сырная ллссеньРепісіШит caseii
РепісіШит roguefortiАльвеолитизгоч-аапивающих солодЗаплесневелый солод,
ячменьAspergillus clavatus
Aspergillus JumigatusАльвеолит мукомоловЗерно (мука), зараженное
пшеничным долгоносикомSitophilus granariusАльвеолит обрабатываюихих
ірибьіКомпост для выращивания
фибов (шалшиньонов)Thermoactinomyces Vulgaris,
Thermoactinomyces viridis,
Micropoiyspora faeniЛетний тип а-^тьвеолитаСезонное загрязнение
атмосферы микробамиCriptococcus neoformans
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИТ • 95Продолжение табл. 1.9Название болезниИсточник антигенного
воздействияЭтиологический факторЛегкие проиаводителей
детергентовФерменты детергентовBacillus subtilisБагассозЗаплесневелый сахарный
тростникThermoactinomyces sacchariiА-тьвеолиты работающих
с корой клена, с красным
деревом, красным кедром,
буком, секвойейКора, опилки, пульпа
дереваCryptostroma corticale,
Aureobasidium pullulans,
Aspergillus Jumigatus, Rhizopus
nigricans, Altemaria tenniusСуберозПыль заплесневелой
пробкиPenicilUum freguentansБиссинозКомпоненты хлопковой
пыли5-гидрокситрипта\шп;
фактор, способствующий
высвобождению метаболитов
арахидоновой кислоты;
липополисахариды стенок
бактериальных клеток и
фибов: Klebsiella, Enterobacier
{glomerans, Acinetobacter,
Aggrobacteriae, Pseudomoms,
Fusarium, Altemaria,Aspergillus, Mucor, Rhizppus,
PeniciUium, SpomtrichiumАльвеолит работающих
с рыбной мукойРыбная мукаБелок рыбной мукиАльвеолит работающих
с аэрационными системами
(кондиционеры, увлажни¬
тели воздуха)Вода и воздух, загрязненные
микроорганизмамиBacillus subtilis, Aspergillus,
Mucor, PeniciUium,
Micropolyspora faeni,
PuUularia, Naegleria pv-
beri, Flavobacterium,
Fusarium, Cephahsporium,
Thermoactinomyces vulgaris
(candidas)Аіьнеолит владельцев
бассейновВодные резервуарь[Acantamoeba, Aspergillus«Легкое банщиков»Пары из труб с горячей
водойMycobacterium aviumАльвеолит жителей Новой
ГвинеиСоломенные крышиStreptomyces olivaceusАльвеолит обрабатывающих
красный перецЗаплесневелые стручки
перцаMucor stolonifer, PeniciUium
glaucum, Rhizopus nigricansАльвеолит работающих
с грызунами (работники
вивариев)КрысыЭкскременты, шерсть,
сыворотка животных
96 • ГЛАВА 1. АЛЬВЕОЛИТЫОкончание табл. 1.1Название болезниИсточник антигенного
воздействияЭтиологический факторАльвеол ИТ скорняковШкуры и шерсть животныхКомпоненты пыли,
животные белкиАльеволит вдыхающих
адиурскринЛдиурскринЧужеродные белки (свиной
или бычий гипофиз)А;іьвеолит, вызванный
молокомМолокоБелки молокаАльвеолит обработчиков
кофейных зеренКофейная пыльРастительная пыльАльвеолитшлифовальщиков рисаРисовая пыльРастительная пыльАльвеолит обрабатывающих
пеньку {«пеньковая»
лихорадка)Экстракт (пыль) коноплиРастительная пыльАльвеолит обрабатывающих
раковины моллюсковАльвеолиты, вызванные
химическими
низкомолекурярными
соединениямиПыль раковиныСоли тяжелых мeтaлJЮв,
лиизоцианаты,
тримелитиковый ангидрит
и др.Пыль раковины морских
улитокХимические соединенияМедикаментозн ые
аллергические альвеолитыАнтибиотики, производные
нгарофурана, амиодарон,
ферменты, соли золота,
контрастные вещества и
многие другиеЛекарственные препаратыКлассификация ЭАА по клиническому течению.• Острая форма.• Подострая форма.• Хроническая форма.ОсложненияНаиболее существенным из осложнений ЭАА является прогрес¬
сирующая ДН (преимущественно инспираторного типа). У больных
с хронической формой ЭАА, вследствие нарушения гемодинамики
малого круга кровообращения, возможно развитие легочной гипер¬
тензии и формирование легочного сердца. Кровохарканье, плевриты
пневмотораксы для ЭАА нехарактерны. ’
і с. ,Рис. 1Л. Идиопатический фиброзирующий альвеолит:
а — расширение и инфильтрация лимфоцитами, нейтрофилами, мононуклсара-
ми межальвеолярных перегородок. Окраска гематоксилином-эозином. х160;
б — дистрофия эластических волокон, разрывы, утолщения, фрагментация.
Окраска по Ван-Гизону, с докраской на эластику. х200;
в — фиброз альвеолярных перегородок, альвеолярный эпителий кубический.
Окраска по Ван-Гизону. х180;г — микрокисты, содержащие в просветах белковые массы. PAS-реакция. х200
Рис. 1.2. Идиопатический фиброзируюший альвеолит:а — бронхиолит. Перибронхиальная инфильтрация лимфоцитами;б — организующаяся пневмония. В альвеолярных ходах и альвеолах очагикарнификации;в — участок миоидного склероза. Окраска гематоксилином-эозином. х180,
х200, ХІ80;г — ангиоматоз, перестройка сосуда по замыкательному типу. Окраска
ШИК-реакция в сочетании с Хейл-реакцией. х180
Рис. 1.3. Идиопатический фиброзирующий альвеолит:
а — выраженная пролиферация мелких бронхов и бронхиол;
б — фиброз и пролиферация альвеолярного эпителия с дисплазией;
в — десквамативный вариант ИФА. Просветы альвеол заполнены альвео¬
лярными макрофагами, пневмоцитами;г — лимфоцитарная инфильтрация с образованием фолликул.Окраска гематоксилином-эозином. х200, х240, х180, х180
Рис, 1.4, Идиопатический фиброзирующий альвеолит:а — острая форма. Интерстициальный и внутриальвеолярный отек, форми¬
рование гиалиновых мембран;
б — в просвете сосуда — тромб.Окраска гематоксилином-эозином. х200, х160Рис, 1,13,Экзогенныйаллергический
альвеолит. Утолщение межальвео-
лярных перегородок за счет разрас¬
тания соединительной ткани, пере¬
стройка альвеолярного эпителия в
однорядный кубический с началом
формирования кист. Окраска гема¬
токсилин-эозином. х20 (из архива
ст.н.с. И.С. Платоновой)Рис, 1,14, Экзогенный аллергический
альвеолит. В очагах фиброза встре¬
чаются включения «игольчатой»
формы, окруженные многоядерны¬
ми клетками рассасывания инород¬
ных тел, образующие гранулемы.
Окраска гематоксилин-эозином. х20
(из архива ст.н.с. И.С. Платоновой)
Рис. 2.1. Морфологическая картина саркоидоза:а — штампованные эпителиоидно-клеточные гранулемы в лимфатическом
узле;б — эпителиоидно-клеточные гранулемы в слизистой бронхиального дерева;
в — эпителиоидно-клеточные гранулемы в легочной ткани местами с фиброзом
по периферии. Окраска гематоксилин-эозином. х160.(из архива д-ра мед. наук И. В. Двораковской)
Рис. 2.2. Планарная перфузионная сцинтиграфия миокарда левого желудоч¬
ка с ’’-"[Тс):а — нормальное распределение радиофармпрепарата;
б — значительные нарушения перфузии миокарда левого желудочкаMian М»Ичік.ч(%)Рис. 2.3. Однофотонная эмиссионная компьютерная томограмма миокарда
с ’’"’[Тс]-технетрилом:а — нормальное распределение радиофармпрепарата;
б — дефект перфузии в передней стенке левого желудочка
Рис. 2.20. Гистиоцитоз X:а — инфильтрат из гистиоцитарных клеток разной степени зрелости;б — крупные «пенистые» клетки со светлой цитоплазмой, лимфоциты, эози-нофилы.Окраска гематоксилин-эозином. х120, х240Л г #'.?• ІІ*.-
1^:.ifРис. 2.21. Гистиоцитоз X:а — среди гистиоцитарного инфильтрата большое количество эозинофилов.
Окраска азур-эозином. х200;б — иммуногистохимическое исследование (ИГХ), экспрессия антигена
S-100 в цитоплазме гистиоцитарных клеток. х400
Рис. 2.22. Гистиоцитоз X. Иммуногистохимическое исследование (ИГХ) —
реакция с антителами CDla. Отложение CDla на мембране клеток Лангер-
ганса. х240Рис. 2.28. Диагноз: пневмокониоз. Очаги пневмофиброза с включениями
черного и коричневого цветов с формированием гранулем. Окраска гематок¬
силин-эозином. х20 (из архива ст.н.с. И.С. Платоновой)
Рис. 3.1. Гранулематоз Вегенера:а - деструктивно-продуктивный артериит, инфильтративно-пролифератив-
ная клеточная реакция, склероз стенки сосуда. Периваскулярная геморра¬
гическая инфильтрация ткани легких. Окраска гематоксилином-эозином.
ХІ80;б — гранулематоз Вегенера. Склероз и гиалиноз артерии. Периваскулярно
видны многоядерные образования типа симпластов.Окраска гематоксилин-эозином. х180
Рис. 3.2. Гранулематоз Вегенера:а — склероз и гиалиноз артерии с формированием периваскулярно грануле¬
мы. Окраска гематоксилин-эозином. х180;б — гранулематоз Вегенера. Некротизируюшаяся гранулема в легких.
Гигантские клетки типа Ланханса в зоне некробиотических изменений гра¬
нуляционной ткани. Окраска гематоксилин-эозином. х180Рис. 3.3. Гранулематоз Вегенера. Клинический пример. Мужчина, 45 лет.
Рентгенограмма органов грудной клетки до начала лечения. Определяется
интенсивное неоднородное затенение верхней доли левого легкого, связан¬
ное с расширенным левым корнем. На его фоне видны участки более интен¬
сивных затенений долькового характера. Нельзя исключить наличие распада
в центре. Справа неоднородное затенение средней доли с мелкими участками
распада в ее верхних отделах
Рис. 3.7. Васкулит Черджа-Стросс.
Гранулема, состоящая из макрофа¬
гов, эозинофилов, эпителиоидных
клеток и многоядерных гигантских
клеток. Окраска гематоксилин-эози¬
ном. ХІ80Рис. 3.8. Васкулит Черджа-Стросс.
Эозинофильная инфильтрация стен¬
ки сосуда и в периваскулярной ткани.
Окраска гематоксилин-эозином. х180sfVr,;
> г '. • ;V л• -..'.л' - .. -i~! ^->І5-Г! 'S'■ ■ : .Рис. 6.1. Альвеолярный протеиноз. Просветы альвеол заполнены PAS-поло-
жительным содержимым. ХІ20 (из архива д-ра мед. наук И.В. Двораковской)
Рис. 6.2. Альвеолярный протеиноз. В просветах альвеол - PAS-положитель-
ное содержимое и альвеолярные макрофаги, осуществляющие его клиренс.
х220 (из архива д-ра мед. наук И.В. Двораковской)Ш'-'Рис. 6.5. Осадок жидкости, полученной при проведении лечебного лаважа
у больного альвеолярным протеинозом (из архива проф. В.А. Герасина и
проф. Г.Ф. Паламарчук, НИИП СПбГМУ)
^ % "ЩРис. 7.5. Лимфангиолейомиоматоз;а — очаговая форма, хаотически переплетающиеся гладкомышечные волокна;
б — диффузная форма, разрастание гладкомыщечных клеток в межальвео-
лярных перегородках, в стенках мелких сосудов;
в — выпячивание гладкомышечного пролиферата в просвет сосуда.Окраска гематоксилин-эозином. х120
Рис. 7.6. Лимфангиолейомиоматоз:а — очаги десмопластики. Окраска по Ван-Гизону. х120;б — экспрессия НМВ-45 в гладкомышечном пролиферате. х180
Рис. 7.7. Лимфангиолейомиоматоз:а — экспрессия прогестерон-рецепторов (PRs) в ядрах пролиферирующих
гладкомышечных клеток;б — экспрессия эстроген-рецепторов (ERs) в ядрах пролифирирующих глад¬
комышечных клеток.Стрептавидин-биотиновый метод окраски. х180Рис. 7.12. Эпителиоидная геман-
гиоэндотелиома легких. Просветы
альвеол выполнены опухолевыми
массами. Окраска гематоксилином-
эозином. ХІ80Рис. 7.11. Диффузная форма лимфан-
гиолейомиоматоза. Гладкомышечные
пролифераты в стенке бронхиолы,
межальвеоалярных перегородках,
мелких сосудов. Окраска гематокси-
лин-эозином. ХІ20
Рис. 7.13. Эпителиоидная гемангиоэндотелиома легких. Экспрессия CD3I
в опухолевых клеткахРис. 7.14. Эпителиоидная гемангиоэндотелиома легких. Экспрессия CD34
в опухолевых клетках
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИ! • 97ДиагностикаКлинический анализ крови у больных ЭАА изменяется в зависи¬
мости от остроты течения болезни и ее стадии. Лейкоцитоз, сдвиг
влево лейкоцитарной формулы, увеличение СОЭ характерны для
острого и менее характерны для под острого течения ЭАА. Редко, как
правило, при ЭАА, вызванном асиергиллами, может определяться
умеренная эозинофилия. Гемограмма больных хронической формой
ЭАА практически не отличается от таковой при ИФА. При исследо¬
вании белковых фракций у больных с хронической формой болезни
определяется диспротеинемия (гипергаммаглобулинемия). Leon D.£.
Aguilar и соавт. [2003] выявили ревматоидный фактор у 52,8% больных
ЭАА и только в 4,2% случаев среди лиц, контактирующих со специфи¬
ческими антигенами, но не страдающими ЭАА. Изменения лабора¬
торных показателей неспецифичны и должны учитываться в первую
очередь для оценки активности и тяжести патологического процесса.Ведущее значение в диагностике ЭАА и уточнении связи заболева¬
ния с профессией придается выявлению специфических преципити-
нов (преципитирующих антител), относящихся к классу IgG. Среди
контактирующих лиц выделяют три группы, в зависимости от нали¬
чия или отсутствия специфических преципитинов: больные ЭАА со
специфическими преципитинами, больные ЭАА без специфических
преципитинов и лица с преципитинами, но без клинических при¬
знаков болезни. Частота обнаружения преципитирующих антител в
сыворотке крови больных ЭАА в значительной мере зависит от пра¬
вильного выбора антигена, т.е. от тщательности собирания анамнеза.
Следует отметить, что выявление преципитирующих антител у лиц,
контактирующих с определенным антигеном, не имеет самостоятель¬
ного значения и свидетельствует в первую очередь о контакте с соот¬
ветствующим антигеном и наличии к нему гиперчувствительности.
Так, например, у фермеров, не имеющих признаков ЭАА, в 10—50%
случаев выявляются специфические антитела. Существует также
мнение, что выявление преципитинов в сыворотке крови не может
считаться доказательством их участия в патогенезе заболевания.
И даже если преципитины вовлечены в патогенез, результирующее
воспаление является следствием активации комплемента. Наряду
с этим следует учесть возможность ложноположительных реакций
между полисахаридными компонентами бактерий, грибов, органи¬
ческой пыли, а также С-реактивным белком, образующимся при
98 • ГЛАВА І.АЛЬВЕОЛИТЬІвоспалениях различной этиологии. С другой стороны, отсутствие
преципитирующих антител в сыворотке крови больных не является
основанием для отрицания диагноза ЭАА. Это следует особо подчер¬
кнуть во избежание диагностических ошибок.Преципитирующие антитела определяются методом двойной диф¬
фузии по Quatherlony, методом встречного иммуноэлектрофореза,
иммуноферментным анализом. Плохая растворимость многих меди¬
каментов ограничивает применение методов радиальной диффузии
в геле и встречного иммуноэлектрофореза для диагностики медика¬
ментозных аллергических альвеолитов. В этих случаях используют¬
ся: тест аллергического лейкоцитолиза, дополненный параллельной
постановкой теста дегрануляции тучных клеюк; гест торможения
миграции лейкоцитов или макрофагов; реакция бласттрансформа-
ции лимфоцитов. В последние годы для диагностики медикаментоз¬
ных аллергических альвеолитов предложен тест агрегации лейкоци¬
тов. Высокая информативность в выявлении гиперчувствительности,
протекающей с клеточной медиацией, простота выполнения и воз¬
можность количественной оценки результатов выгодно отличают этот
тест от упомянутых выше.Для диагностики ЭАА ряд исследователей предлагают исполь¬
зовать провокационный ингаляционный тест. Он оценивается как
положительный в случаях, если после вдыхания аэрозолей, содер¬
жащих предполагаемые антигены, субъективное состояние больного
ухудшается (оценивается больным как гриппоподобное), повышают¬
ся температура тела, частота дыхания; уменьшается ЖЕ Л, снижается
дел. При подозрении на профессиональную этиологию ЭАА инга¬
ляционные провокационные тесты могут быть проведены в произ¬
водственных условиях (на рабочем месте). Больной обследуется до
начала работы и, в зависимости от самочувствия, через определенный
интервал времени или в конце рабочего дня. Оцениваются прежде
всего следующие показатели: частота дыхания, температура тела,
аускультативная картина, величина ЖЕЛ. При необходимости этот
перечень может быть дополнен. Отмечено, что результаты провока¬
ционных ингаляционных тестов в естественных (производственных)
условиях отличаются высокой специфичностью и не сопровождаются
серьезными осложнениями.Наиболее информативно проведение провокационных ингаляци¬
онных тестов в острой стадии ЭАА, однако сопряжено с ухудшением
состояния больного. Менее информативны эти тесты в подостром
и практически неинформативны в хроническом течении болезни.
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИТ99Рис, 1.15. Экзогенный аллергиче¬
ский альвеолит, острое течение.
Затенения по типу инфильтрацииПрименение кожных тестов не
получило широкого распростра¬
нения из-за высокого процента
отрицательных результатов при
наличии развернутой клиничес¬
кой картины заболевания.Рентгенологическая карти¬
на в легких при ЭАА также зави¬
сит от течения заболевания (ост¬
рое, подострое, хроническое).Стадия интерстициального и
альвеолярного отека, стадия аль-
веолита могут проявляться уси¬
лением легочного рисунка без
четких границ. При остром тече¬
нии болезни могут выявлятьсялокальные затенения по типу инфильтрации (рис. 1,15). При остром
течении заболевания у 10% пациентов изменений в легких может не
наблюдаться.Распространенные двусторонние мелкоочаговые затенения отра¬
жают гранулематозную стадию болезни и чаще встречаются при
подостром течении ЭАА. Необходимо отметить, что сетчатая дефор¬
мация легочного рисунка при суммации теней может имитировать
картину милиарных очагов. Прекращение воздействия антигена
может привести к обратной динамике имеющихся рентгенологи¬
ческих изменений в течение нескольких недель, в тех же случаях,
когда болезнь продолжает прогрессировать, мелкоочаговые тени
в подострой стадии могут сочетаться как с признаками отека, так
и с признаками формирующегося интерстициального фиброза.
При ЭАА улиц, обрабатывающих грибы, любителей птиц и фермеров
в ряде случаев может выявляться увеличение лимфатических узлов
в корнях легких. Переход болезни в хроническую форму характери¬
зуется прогрессированием фиброзирующего процесса (рис. 1.16), что
на заключительных этапах болезни может привести к формирова¬
нию «сотового легкого».Для уточнения характера изменений в легочной паренхиме применя¬
ется ВРКТ. У больных с острой или подострой формами ЭАА на КТ опре¬
деляются более или менее распространенные зоны уплотнения легочной
1'кани по типу «матового стекла» и немногочисленные центролобуляр-
пые очаги. Изменения по типу «матового стекла» могут быть диффуз¬
100 • ГЛАВА І.АЛЬВЕОЛИТЬІРис. 1,16. Экзогенный аллергиче¬
ский а львеол ИТ, хроническая форма.
Прогрессирование фиброзирующего
процесса и формирование «сотового
легкого»Рис. 1,17. Экзогенный аллергиче¬
ский альвеолит, подострое тече¬
ние. Локальные участки понижен¬
ной плотности обычно сочетаются
с изменениями по типу «матового
стекла»ными и захватывать весь объем легких. Локальные участки пониженной
плотности обычно сочетаются с изменениями по типу «матового стекла»
(рис. 1.17). В этих участках отмечается уменьшение калибра сосудов и их
количества, что типично для картины мозаичной плотности. Реже изме¬
нения представлены множественными, центролобулярными очагами
низкой плотности с нечеткими контурами.При острой и подострой формах ЭА А изменения на рентгенограм¬
мах могут отсутствовать, но выявляются при ВРКТ. Так, у 70% боль¬
ных «легким фермеров» острого и подострого течения отмечаются
нормальные рентгенограммы органов грудной клетки. Однако при
минимальных патологических изменениях в легких результаты ВРКТ
в 50% случаях могут быть также отрицательными.При хронической форме ЭАА на КТ выявляются тонкие линейные
структуры, морфологической основой которых является утолщение
внутридолькового интерстиция. На более поздних стадиях патологи¬
ческого процесса определяется картина фиброза с участками «сотового
легкого» преимущественно в кортикальных отделах.Исследование ФВД. В острой фазе заболевания выявляются диф¬
фузионные нарушения, некоторое снижение ЖЕ Л, а также нарушения
бронхиальной проходимости. По мере прогрессирования патологиче¬
ского процесса и развития интерстициального фиброза у больных ЭАА
формируется рестриктивный синдром, имеющий тенденцию к про¬
грессированию и, в ряде случаев, сочетающийся с необратимым или
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИ! • 101частично обратимым нарушением проходимости дыхательных путей.
На этой стадии резко снижается ДСЛ, развивается гипоксемия.Легочно-сердечная гемодинамика изменяется на поздних стадиях,
как правило, при хроническом течении заболевания. Эходопплер-
кардиография выявляет умеренное повышение давления в легочной
артерии, диастолическую дисфункцию [гравого желудочка, а в даль¬
нейшем формируется хроническое легочное сердце.Бронхологические методы исследования. Катаральные изменения
слизистой оболочки бронхов при фибробронхоскопии выявляются у
24% больных ЭАА. В 9-10% случаев определяется гиперреактивность
и гиперсекреция слизистой бронхиального дерева.Цитологическое исследование ЖБАЛ выявляет увеличение обще¬
го числа клеток и процентного содержания лимфоцитов (от 20 до
90% общего клеточного состава). Среди Т-лимфопитов преоблада¬
ют CD8, в связи с этим отношение CD4/CD8 становится менее 1.
Экспериментальные и клинические исследования выявили, что на ран¬
них стадиях развития патологического процесса, т.е. через несколько
часов после попадания в организм специфического антигена, клеточ¬
ный состав ЖБАЛ характеризуется высоким содержанием нейтрофи-
лов и тучных клеток. Приблизительно через неделю число нейтрофи-
лов и тучных клеток в лаважной жидкости уменьшается и наблюдается
значительный прирост числа лимфоцитов. Уменьшение числа лимфо¬
цитов и нормализация клеточного состава лаважной жидкости сви¬
детельствует об эффективности проводимого лечения. Однако другие
авторы указывают на наличие изменений цитологического состава
ЖБАЛ и специфических антител у асимптоматичных лиц, что умень¬
шает диагностическую значимость этого метода исследования.Кроме того, у больных ЭАА в лаважной жидкости определяются
повышенные уровни IgA, IgG и IgM, а также гистамина и триптазы.
Значительное увеличение активности супероксиддисмутазы, катала-
зы и высокий уровень малонового диальдегида свидетельствуют об
интенсивности процессов свободнорадикального окисления в брон¬
хоальвеолярном пространстве у больных ЭАА,Для гистологической верификации ЭАА проводят ЧББ, видео-
торакоскопическую или открытую биопсию легких. Для уточнения
диагноза при острой или подострой форме ЭАА ЧББ является инфор¬
мативной более чем в половине случаев. При переходе болезни в
хроническую стадию ЧББ малойнформативна. В этих случаях может
возникнуть необходимость в проведении видеоторакоскопической
или открытой биопсии легкого.
102 • ГЛАВА І.АЛЬВЕОЛИТЬІМорфологические методы исследования. Для исследования био-
псийного и аутопсийного материала используется световая микро¬
скопия с различными окрасками, электронная микроскопия и метод
иммунофлюоресценции. Выявление серозной жидкости в альвеолах,
преимущественно лимфоцитарной инфильтрации альвеол и межаль-
веолярных перегородок, а также гранулем, о которых более детально
упоминалось дальше (см. «Патологическая анатомия»), позволяет
(с учетом данных анамнеза и других методов исследования) устано¬
вить диагноз ЭАА. Исследование гистологического материала в поля¬
ризационном микроскопе нередко определяет двоякопреломляющие
кристаллы различной формы и величины, а также тельца Шауманна.
Обращает на себя внимание большое количество образований «пус¬
той» игольчатой формы. Для определения и идентификации неор¬
ганических включений применяется спектральный анализ ЖБАЛ и
ткани легкого. Отложения иммунных комплексов в стенках альвеол
можно выявить при иммунофлюоресцентном исследовании материа¬
ла биопсий легочной ткани, что может косвенно подтвердить иммуно¬
логическую природу заболевания.В заключение следует отметить, что морфологические картины
ЭАА и ИФА имеют много общих черт. Причем на стадии интерстици¬
ального фиброза они практически неотличимы.Выделяют основные и вспомогательные диагностические крите¬
рии ЭАА.Основные критерии.• Начало или ухудшение заболевания через несколько часов после
контакта с аллергеном при характерных для ЭАА клинических
проявлениях.• Подтверждение контакта с аллергеном: анамнез, санитарно-гиги¬
еническое исследование воздуха рабочей зоны, выявление сыво¬
роточных преципитируюших антител или антител в ЖБАЛ.• Характерные изменения на рентгенограммах и ВРКТ органов
грудной клетки.• Лимфоцитоз ЖБАЛ.• Характерные морфологические изменения.• Появление клинических и функциональных признаков и лабора¬
торных изменений после контакта с предполагаемым фактором.Вспомогательные критерии.• Крепитация.• Снижение дел.• Артериальная гипоксемия в покое или при нагрузке.
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИ! • ЮЗФормулировка диагноза• ЭАА («легкое фермера»), острая форма.• Медикаментозный аллергический альвеолит (название препара¬
та, вызвавшего заболевание), подострая форма, легочная недоста¬
точность (степень).• ЭАА («легкое птицевода»), хроническая форма. Хронический
бронхит, бронхоспастический синдром. Легочная недостаточ¬
ность (степень). Хроническое субкомпенсированное легочное
сердце.Клинический примерБольная Н., 48 лет, наблюдается в НИИ пульмонологии СПбГМУ
им. акад. И.П. Павлова с февраля 2007 г., когда была направлена
на консультацию для уточнения диагноза и коррекции терапии.
В момент осмотра предъявляла жалобы на сухой кашель, слабость.Заболела остро в декабре 2006 г., когда внезапно поднялась тем¬
пература тела до 39 °С, появилась одышка при физической нагрузке,
слабость. На флюорографии были выявлены двусторонние измене¬
ния в легких, которые трактовались как «двусторонняя пневмония».
Терапия антибиотиками была неэффективна, и 18.12.2006 г. больная
была госпитализирована в пульмонологическое отделение клиники
госпитальной терапии СПбГМУ, где был поставлен диагноз ЭТА.
Проводилась глюкокортикоидная терапия (250 мг гидрокортизона
инфузионно) с положительным эффектом. Для уточнения возможной
связи заболевания с профессией больную направили в НИИ пульмо¬
нологии СПбГМУ им. акад. И.П. Павлова.С 1995 г. шесть раз переносила пневмонии, в том числе три
раза — двусторонние. Наследственность и аллергологический анам¬
нез не отягошены. Больная с 1976 по 1980 г. работала живописцем в
художественной лаборатории на фарфоровом заводе им. М.В. Ломо¬
носова. В состав производственной пыли входил шестивалентный
хром. С 1988 г. работала бутафором-декоратором городского дворца
пионеров. Имела контакт с гуашью, водоэмульсионной краской,
бумагой, клеем «Момент». Перед заболеванием в течение 3 нед боль¬
ная интенсивно работала по подготовке декораций к новогодним
праздникам.При поступлении в стационар общее состояние больной было
удовлетворительное. Дыхание везикулярное, крепитация в ниж-
104 • ГЛАВА 1. АЛЬВЕОЛИТЫНИХ отделах легких. В клиничес¬
ком анализе крови отмечалось
повышение СОЭ до 37 мм/ч. На
флюорограммах выявлялась ин¬
фильтрация в Cj, С,ц правого и С,
левого легкого на фоне распро¬
страненного усиления интерс¬
тициального компонента легоч¬
ного рисунка (рис. 1.18). Ком¬
плексное функциональное иссле¬
дование ФВД выявило умерен¬
ные рестриктивные нарушения,
умеренное снижение дел ус и
ДСЛзд, умеренную гипоксемию
в покое. На фоне проводимой
глюкокортикоидной терапий
отмечалась положительная кли-
нико-рентгенологическая дина¬
мика: исчезновение одышки,
СОЭ, показателей ФВД. КТ орга¬
нов грудной клетки, сделанная
через 12 дней после флюорогра¬
фи и, выявила участки инфильтрации в С.^, левого и дольковую
инфильтрацию правого легкого, нормализаиию легочного рисун¬
ка (рис. 1.19).При амбулаторном обследовании в феврале 2007 г. у боль¬
ной сохранялся сухой кашель, слабость. На рентгенограммах
органов грудной клетки от 09.01.2007 г. выявлялся дисковидный
ателектаз в ^ левого легкого, сближение элементов легочного
рисунка в среднем отделе правого легкого (рис. 1.20). Показатели
комплексного функционального исследования ФВД были в пре¬
делах нормы. Эходопплеркардиография не выявила патологичес¬
ких изменений. Систолическое давление в легочной артерии было
28 мм рт.ст.Был поставлен диагноз «ЭА А острое течение, фаза разрешения^!*.Профессиональная этиология заболевания была подтверждена
выявлением шестивалентного хрома в гуаши «окись хрома», которой
пользовалась больная. Аллергизация больной к шестивалентномуРис. 1.18. Больная Н. Диагноз; экзо-
геттный аллергический альвеолит,
острое течение. Инфильтрация п
С^, Cj^ правого и Cj левого легкого
на фоне распространенного усиле¬
ния интерстициального компонента
леї очного рисунка
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИТ • 105Рис. 1.19. Больная Н. Диагноз: экзо¬
генный аллергический альвеолиг,
острое течение. Участки инфильтра*
НИИ в Cj, Cj левого легкогоРис. 1.20. Больная Н. Диагноз: экзо¬
генный аллергический альвеолиг,
острое течение. Дисковидный ате¬
лектаз в С. , левого легкого, сбли-4, 5 •жение элементов легочного рисунка
в среднем отделе правого легкогохрому была подтверждена положительными реакциями специфиче¬
ской агломерации лейкоцитов и специфического гемолиза.Дифференциальная диагностикаНаиболее частая ошибка при диагностике ЭАА — диагноз «пнев¬
мония» («двусторонняя пневмония»). Можно выделить следующие
признаки, отличающие бактериальную пневмонию от ЭАА:— связь начала заболевания с простудным фактором или возник¬
новение пневмонии как осложнения других заболеваний; ііачало
ЭАА обусловлено вдыханием органической или неорганической
пыли, обладающей антигенными свойствами или приемом внутрь,
в ингаляциях или парентерально лекарственных средств;— особенности клинических проявлений пневмонии: кашель,
боль в грудной клетке, признаки общей интоксикации; в кли¬
нической картине ЭАА доминирует инспираторная одышка;— аускультация при пневмонии выявляет локальные мелкопу¬
зырчатые хрипы над областью поражения; у больных острой
формой ЭАА крепитирующие хрипы выслушиваются, как пра¬
вило, над всей поверхностью легких;
106 • ГЛАВА І.АЛЬВЕОЛИТЬІ— отсутствие прогрсссируюших рестриктивных нарушений вен¬
тиляционной способности легких, существенного снижения
дел у больных пневмонией и наличие упомянутых нарушений
у больных ЭАА, наиболее выраженных при подостром или хро¬
ническом течении заболевания;— бактериологическая идентификация возбудителя пневмонии
в мокроте и (или) ЖБАЛ в диагностических титрах;— на рентгенограммах органов грудной клетки у больных пнев¬
монией можно, как правило, четко определить границы пнев¬
монической инфильтрации (сегмент, сегменты, доля, доли);
при ЭАА рентгенологические изменения (интерстициальные,
инфильтративные, очаговые) не имеют четких границ;— противомикробная терапия эффективна при пневмонии
и неэффективна и противопоказана при ЭАА;— быстрая положительная динамика клинических проявлений
и рентгенологических изменений у больных ЭАА на фоне глю-
кокортикоидной терапии.Острую фазу ЭАА, следует дифференцировать с легочными эози¬
нофильными инфильтратами (синдромом Леффлера), при которых
отмечается эозинофилия периферической крови.Следует проводить дифференциальную диагностику ЭАА с дру¬
гими формами фиброзирующих альвеолитов, в частности с ИФА.
Основным признаком, отличающим эти две формы фиброзирующих
альвеолитов, является известный причинный фактор, вызвавший
ЭАА, и неизвестный — при ИФА. Характерным проявлением обоих
заболеваний является инспираторная одышка, которая при ИФА
доминирует и практически определяет всю клиническую картину.
Затруднение глубокого вдоха отмечают 90% больных ИФА и только
25% больных ЭАА. Кашель при обоих заболеваниях, как правило,
сухой или со скудной слизистой мокротой. Бронхоспазм может
наблюдаться у одной трети больных ЭАА и никогда при ИФА. Эти
и другие дифференциально-диагностические признаки ЭАА и ИФА
представлены в табл. 1.10. Разброс частоты встречаемости признака
зависит от течения и стадии заболевания.Наибольшие трудности возникают при дифференциальной диаг¬
ностике ЭАА и ЭТА (см. «Экзогенный токсический альвеолит*>). Если
этиологический агент не только является антигеном, но и оказывает
токсическое действие на легочную ткань, то речь может идти об экзо¬
генном токсико-аллергическом альвеолите.
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИТ • 107Таблица 1.10. Дифференциально-диагностические признаки экзогенного
аллергического и идиопатического фиброзирующего альвеолита и частота
их выявления, %признакиЭААИФАЭтиологический факторИзвестенНеизвестенИнспираторная одышка60-95100Затрудненный вдох25-5080Сухой (малопродуктивный) кашель8565-90Бронхоспастический синдром330Похудание2245Артралгии922Цианоз1765«Пальцы Гиппократа»946Ослабленное дыхание30-5095-100Крепитирующие хрипы3575-87Сухие хрипы20-250Течение болезниВолнообразноеПрогрессирующееФВД;рестриктивный синдром60-95100обструктивный синдром25-354Гипоксемия60-S070-100Легочная гипертензия10-2040-60Фибробронхоскопия: катаральный эндобронхит4125Цитология ЖБАЛ:
лимфоцитоз70-10010^30нейтрофилез15-3070-100Наряду с этим ЭАА приходится дифференцировать с саркоидозом
легких, диссеминированным туберкулезом легких, ГХЛ и другими
ИЗЛ.ЛечениеПри подозрении на наличие ЭАА необходимо немедленно прекра¬
тить контакт с этиологическим фактором, принять меры, направлен¬
ные на элиминацию антигена из организма. От этого в определенной
мере зависит эффективность последуюших лечебных мероприятий.
В случаях когда заболевание развивается на фоне длительной и мае-
108 • ГЛАВА І.АЛЬВЕОЛИТЬІсивной экспозиции антигена, состояние пациента может быть сред¬
ней тяжести и даже тяжелым, что является абсолютным показанием
для назначения глюкокортикоидных препаратов в расчете на их про¬
тивовоспалительный эффект и способность ингибировать аллерги¬
ческие реакции.Вопрос о начальной дозе глюкокортикоидов и длительности лече¬
ния должен решаться индивидуально, т.е. с учетом остроты процесса
(степени выраженности клинических проявлений), возраста, массы
тела, наличия сопутствующих заболеваний (в частности, гипертони¬
ческой болезни, сахарного диабета, язвенной болезни желудка или
двенадцатиперстной кишки). Длительность приема глюкокортико¬
идов зависит от быстроты обрагной динамики клинических прояв¬
лений, рентгенологических изменений и нарушений иммунологи¬
ческих показателей. Важно отметить, что выявление преципитинов
при решении вопросов лечебной тактики самостоятельного значения
не имеет. Начальная доза глюкокортикоидов обычно не превышает
1 мг на 1 кг массы тела (расчет на преднизолон), однако может быть
значительно ниже. Длительность лечения глюкокортикоидами при
остром течении болезни, как правило, не превышает 1—2 мес. При
подостром течении заболевания глюкокортикоидная терапия может
продолжаться в среднем около 3—6 мес до достижения стойкой поло¬
жительной клинической и рентгенологической динамики.При остром и рецидиве подострого течения ЭАА показана небу-
лайзерная терапия ингаляционными глюкокортикоидами (будесонид
до 2000 мкг в сутки), что позволяет уменьшить дозу системных глю¬
кокортикоидов, а при длительном поддерживающем лечении — заме¬
нить таблетированные глюкокортикоиды ингаляционными. Такая
лечебная тактика позволяет избежать многочисленных побочных
эффектов, свойственных таблетированным глюкокортикоидам. На
стадии фиброзирования (хроническая форма ЭАА) лечебная тактика
принципиально не отличается от таковой при ИФА.Для лечения ЭАА показана эфферентная терапия, которая носит
характер не только патогенетического, но и этиотропного лечения,
поскольку выведение из организма аллергенов ликвидирует источник
заболевания и способствует излечению, если развившиеся изменения
еще обратимы. У больных с острой и подострой формой ЭАА плаз-
маферез может применяться в качестве монотерапии или в сочета¬
нии с ингаляционными глюкокортикоидными препаратами в усло¬
виях полного прекращения контакта с этиологическим фактором.
Показаниями для проведения плазмафереза у больных с хронической
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИ! • 109формой ЭАА являются: высокая степень активности патологическо¬
го процесса; неуклонно прогрессирующее течение, резистентное к
проводимой терапии; наличие сопутствующих заболеваний (гипер¬
тоническая болезнь, ожирение и др.), ограничивающих применение
глюкокортикоидов; возникновение побочных эффектов и осложне¬
ний медикаментозного лечения при хроническом течении болезни
(язва желудка, остеопороз и др.) и выраженные нарушения иммунного
статуса (высокие уровни ЦИК, иммуноглобулинов, дисбаланс показа¬
телей клеточного иммунитета).В 30% случаев ЭАА сопровождается приступами затрудненного
дыхания, что определяет необходимость назначения бронхосиазмо-
литиков (сальбутамол, формотерол, салметерол), дозированных инга¬
ляционных глюкокортикоидов (беклометазон дипропионат, флу-
тиказон) или комбинированных препаратов (серетид*, симбикорт*,
биастен*) в общепринятых дозировках.При ЭАА абсолютно противопоказано назначение антибактери¬
альных препаратов. К сожалению, в практическом здравоохранении
выздоровление больного ЭАА нередко приписывается назначению
антибактериальных препаратов (имеются в виду случаи, когда не
антибиотики являются причиной болезни), однако рецидив забо¬
левания после возвращения больного в прежние условия (бытовые,
профессиональные) свидетельствует об ошибочной диагностике
пневмонии.Острая форма болезни обычно является показанием для госпита¬
лизации. Хотя при легком течении острой формы не противопоказано
амбулаторное лечение. Контрольное обследование в обоих случаях
(клинический анализ крови, анализ мочи, рентгенография органов
грудной клетки в прямой и боковой проекциях и спирография) долж¬
но быть проведено через 1—4 мес после выздоровления. Это дает воз¬
можность своевременно определить рецидив болезни или переход ее в
подострую (хроническую) форму.при хронической форме ЭАА после установления диагноза боль¬
ной может быть выписан из стационара с конкретными рекоменда¬
циями. Контрольное обследование пациента должно быть проведено
через 3—4 мес в амбулаторных условиях и включает упомянутые выше
методы исследования. Дальнейшая лечебная тактика зависит от
результатов обследования. Объем лечебных мероприятий в процессе
диспансерного наблюдения больных ЭАА зависит от особенностей
течения болезни. Наличие одышки, рестриктивного синдрома, соот¬
ветствующих рентгенологических изменений рассматривается как
110 • ГЛАВА 1.АЛЬВЕОЛИТЫпоказание для назначения глюкокортикоидов, поддерживающая доза
которых обычно составляет в среднем от 2,5 до 10 мг в сутки. На фоне
снижения дозы глюкокортикоидов при наличии умеренной эози-
нофилии периферической крови, явлений бронхоспазма к лечению
могут быть добавлены десенсибилизирующие и бронхоспазмоли¬
тические препараты. Критерием снижения дозы глюкокортикоидов
или их отмены является динамика клинических признаков болезни
(ДН, бронхоспастический синдром), рентгенологических, функцио¬
нальных и иммунологических показателей. Диспансерное наблюде¬
ние больных ЭАА при наличии прогрессирующего пневмофиброза не
отличается от такового при ИФА.ПрогнозПрогноз ЭАА зависит от формы болезни и своевременности диаг¬
ностики. По данным разных авторов, смертность от «легкого фер¬
мера» колеблется от О до 20%. Распознавание ЭАА на ранних стадиях
острого течения позволяет, как правило, достичь полного выздо¬
ровления благодаря прекращению контакта с причинным агентом и
назначению (при необходимости) соответствующего лечения. В тех
случаях, когда одышка у больного уменьшилась, однако полностью
не исчезла, сохраняется снижение ЖЕЛ и ДСЛ, а на рентгенограммах
выявляется усиление легочного рисунка за счет интерстициальной
ткани, речь может идти о неполном выздоровлении или переходе
болезни в подострую (хроническую) форму.Ошибочная диагностика и, как следствие этого, продолжение кон¬
такта с причинным фактором, неправильная лечебная тактика спо¬
собствуют активизации процессов пролиферации в легочной ткани
и переходу болезни в необратимую стадию, клинически выражаю¬
щуюся прогрессирующей ДН, морфологически — прогрессирующим
интерстициальным и внутриальвеолярным фиброзом, облитерирую-
щим бронхиол и том и формированием «сотового легкого».при хронической форме болезни прогноз неблагоприятен: боль¬
ные погибают от прогрессирующей ДН. В случае развития «сотового
легкого» при «легком фермера» чувствительность к глюкокортикои-
дам снижается до 20%, а пятилетняя выживаемость составляет менее
10%. Длительность жизни больных хронической формой ЭАА суще¬
ственно не отличается от таковой при ИФА и составляет 7,1 года.
ЭКЗОГЕННЫЙ АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИТ • 111Прогноз при «легком любителей птиц» серьезнее, чем при «легком
фермера». Это связано с высокой антигенной экспозицией и длитель¬
ным сохранением антигенов птиц в доме даже после удаления птиц из
помещения. Эти факторы играют сушественную роль в пятилетней
выживаемости больных ЭАА, достигающей только 30%.ПрофилактикаВажную роль в возникновении ЗА А играют экологические фак¬
торы: болезнь чаще возникает в климатических зонах с холодным и
дождливым летом, в районах с горным климатом. Технологические
процессы заготовки и складирования сельскохозяйственной про¬
дукции (сена, соломы, зерна, муки, силоса, комбикормов и др.)
при неблагоприятных погодных условиях нередко нарушаются, что
создает благоприятные условия для интенсивного размножения тер¬
мофильных актином ицетов, являющихся наиболее частой причиной
ЭАА. Значительно снизить риск возникновения ЭАА позволяют меха¬
низация и автоматизация наиболее трудоемких процессов, связанных
с образованием пыли при работе с зерном, мукой и другой сельскохо¬
зяйственной продукцией («легкое птицевода», «легкое сыроваров» и
другие ЭАА, связанные с условиями труда).Чаще всего причиной ЭАА являются термофильные актиномицеты.
В связи с этим целесообразно убирать из пульмонологических отделе¬
ний цветочные горшки с торфоземельной смесью, нередко содержа-
тцей патогенные актиномицеты. Источником грибковой аллергизации
могут быть и сами больные — носители патогенных грибов.В производствах, связанных с повышенным образованием орга¬
нической или неорганической пыли (сельское хозяйство, пищевая,
текстильная, деревообрабатывающая, фармацевтическая и другие
виды промышленности), наряду с улучшением условий Труда важное
значение придается использованию противопылевых респираторов,
соответствующей спецодежды, что также позволяет снизить риск воз¬
никновения ЭАА.Эффективность лечебных мероприятий и прогноз при ЭАА в зна¬
чительной мере зависят от своевременности диагностики, в связи с
чем исключительно важно проведение на производствах, потенци¬
ально опасных в плане развития ЭАА, соответствующих клинико-
эпидемиологических исследований. В настоящее время эти вопросы
112 • ГЛАВА 1. АЛЬВЕОЛИТЫнаиболее полно разработаны для лиц, занятых на птицефабриках и
птицеводческих комплексах. В группу повышенного риска развития
ЭАА относят лиц, у которых обнаруживаются специфические преци-
питины при отсутствии респираторных симптомов (т.е. практически
здоровых людей, однако сенсибилизированных соответствуютцими
антигенами), а также лиц, у которых выявлена бронхолегочная симп¬
томатика вне зависимости от наличия или отсутствия специфических
преципитирующих антител. Целесообразно использование специ¬
альных анкет, позволяющих оптимизировать обработку полученных
данных и стандартизировать результаты. Такой подход позволяет не
только улучшить диагностику ЭАА, но и сформировать группу риска
развития болезни и нуждающихся в проведении соответствующих
профилактических мероприятий.Для профилактики медикаментозных альвсолитов следует раци¬
онально назначать лекарственные препараты (в первую очередь это
относится к антибиотикам) с учетом аллергологического анамнеза,
исключать полипрагмазию и самолечение. Большое значение имеет
рациональное трудоустройство лиц, перенесших острую или подос-
трую форму ЭАА, а также лиц, относящихся к группе риска разви¬
тия ЭАА.экзогенный токсический альвеолитЭкзогенный токсический альвеолит (ЭТА) ~ патологический про¬
цесс, возникающий вследствие воздействия на паренхиму легких
веществ, обладающих цитотоксическими свойствами.Впервые заболевания легких у работающих на производстве спла¬
вов карбидов тяжелых металлов и кобальта были описаны в Германии
в І940-Х годах. В 1949 г. H.L. Hardy и L.R. Taberskaw выявили диссе¬
минированный гранулематозный процесс в легких у работающих с
флуоресцентными лампами (контакт с бериллием). Первые случаи
медикаментозного ЭТА были описаны 1. Morrow в 1953 г. у больных,
принимавших гексометоний, а в 1972 г. появляется первый обзор
19 лекарственных препаратов, обладающих пневмотоксичностью.Интерес к ЭТА от воздействия тяжелых металлов значительно
возрос в 80-х годах XX века в связи с ростом заболеваемости пнев¬
мофиброзом среди полировщиков алмазов после введения новых
высокоскоростных полировочных дисков, в 1984г. Н.В. Путовым и
ЭКЗОГЕННЫЙ ТОКСИЧЕСКИЙ АЛЬВЕОЛИ! • 113М.М. Ильковичем было дано понятие «ТФА» как патологического
процесса в легких, возникающего «вслсдствис токсическоі о воздейс¬
твия ряда химических веществ, в первую очередь некоторых групп
лекарственных препаратов». Увеличение числа новых лекарственных
препаратов и биологически активных добавок, широкая реклама и
доступность медикаментов приводят к учащению случаев побочного
токсического действия на легочную ткань некоторых лекарственных
препаратов. Развитие малого бизнеса, индивидуальной трудовой
деятельности, наряду с появлением новых технологий при неадекват¬
ной индивидуальной защите, также способствует увеличению риска
развития ЭТА на производстве и в быту. Среди больных диссеми¬
нированными процессами в легких, госпитализированных в НИИ
пульмонологии СПбГМУ за период J985—2007 гг., ЭТА составлял 3,8%
(127 пациентов).Лекарственно обусловленный ЭТА нередко развивается при лече¬
нии амиодароном, нитрофуранами, некоторыми цитотоксически-
ми препаратами и антиметаболитами. По данным разных авторов,
медикаментозный ЭТА составляет от 1,8 до 3,5% всех ИЗЛ. Так, блео-
мицин вызывает ЭТА в 15—20% случаев, особенно если суммарная
доза превышает 400 мг, а возраст больных старше 60 лет. При приеме
амиодарона фиброзирующий альвеолит развивается в 5—10% случаев.
Изменения в легких могут сохраняться или прогрессировать даже
после отмены препарата. Митомицин может инициировать развитие
ЭТА в 4% случаев, нитрофураны и циклофосфамид — менее чем в 1%
случаев, нитрозомочевина в дозе более 1500 мг/м^ — у 50% больных.Эпидемиология заболеваний легких от воздействия аэрозолей
металлов изучена недостаточно. Литературные данные, как правило,
сводятся к описанию отдельных случаев поражения легких при экс¬
позиции аэрозолей определенных металлов (кобальт, никель и др.) в
отдельных группах рабочих. Так, пневмофиброз у зубных техников
на Крите встречается в 9,8% случаев. ЭТА выявляется у 3% хлопко¬
робов, 9,8% зубных техников, у 1-16% рабочих, контактирующих с
бериллием, у 23 из 108 работающих в контакте с индием. В 1997 г.
в Великобритании поражения легких, вызванные ингаляционны¬
ми раздражающими и токсическими веществами, составляли 6% от
общего числа профессиональных заболеваний легких. В литературе
отсутствуют данные, касающиеся распространенности заболеваний
легких от воздействия органических растворителей. Имеются лишь
описания отдельных случаев поражения легких при экспозиции раз¬
личных веществ: ксилол, стирол, трихлорэтилен и др.
114 • ГЛАВА І.АЛЬВЕОЛИТЬІЭтиология и факторы рискаВпервые этиологические факторы ЭТА были систематизированы
Н.В. Путовым и М.М. Ильковичем в 1986 г. Были выделены две группы
факторов: лекарственные препараты и токсические вещества производс¬
твенной сферы. С учетом результатов исследований последних лет в насто¬
ящую классификацию включены антибиотики, цитокины, моноклональ¬
ные антитела, запрещенные препараты и органические растворители.К лекарственным препаратам, обладающим пневмотропным ток¬
сическим действием, относят следующие группы.• Противоопухолевые препараты: алкилирующие препараты
(бусульфан, циклофосфамид, хлорамбуцил, мелфалан), антиме¬
таболиты (метотрексат, 6-меркаптопурин, азатиоприн, цитозин-
арабинозид, гемцитабин, флударабин), антибиотики (блеомицин,
митомицин-С), препараты растительного происхождения (винк-
ристин, винбластин), подофиллотоксины (этопозид, паклитак-
сел, доцетаксел), препараты других групп (нитрозомочевина, про-
карбазин, L-аспарагиназа, иматиниб, гефитиниб, эрлотиниб).• Производные нитрофурана (нитрофурантоин, фуразолидон).• Сульфаниламиды.• Антибиотики (цефалоспорин, миноциклин*).• Нейроактивные препараты (дифенил, карбамазепин, хлорпромазин).• Сердечно-сосудистые препараты (амиодарон, бензогексоний^,
гидралазин, р-адреноблокаторы — пропранолол, анаприлин).• Мочегонные (гидрохлортиазид).• Противодиабетические препараты (хлорпропамид).• Анорексические препараты (меноцил).• Цитокины (гранулоцит-макрофаг-колоний-стимулирующий
фактор, TNF-a, ИЛ-2, ИФН-а, ИФН-у).• Моноклональные антитела (инфликсимаб, адалимумаб).• Запрещенные препараты (героин, кокаин, опиаты, кодеин, про-
поксифен*, амфетамин).• Кислород.К токсическим веществам производственной сферы относят:• Раздражающие газы (сероводород, хлор, аммиак, хлорпикрин и др.).• Металлы в виде паров, дымов, окислов, солей (кадмий, ртуть, пен-
токсид ванадия, вольфрам, марганец, бериллий, кобальт, никель,
кадмий, цинк, ртуть, цирконий, хлорид сурьмы, титан и др.).• Органические растворители (алифатические углеводороды — бен¬
зин, нефть, минеральный спирт, керосин, ароматические углево¬
ЭКЗОГЕННЫЙ ТОКСИЧЕСКИЙ АЛЬВЕОЛИ! • 115дороды — бензол, толуол, ксилол, стирол, галогенизированные
углеводороды — тетрахлорэтилен, трихлорэтилен, метиленхло¬
рид, тетрахлорметан, кетоны — ацетон, альдегиды — формаль¬
дегиды, глютеральдегиды, гликоли — этиленгликоль, эфиры —
этиладетат, другие — этиленоксид).• Гербициды: смесь Бордо, паракват, дикват и др.• Инсектициды (бутокс, циперметрин, эстразоль, фенотиозин).• Пластмассы: полиуретан, политстрафлюороэтан и др.Пневмотоксический эффект медикаментов чаше возникает при
создании высоких (пиковых) концентраций препарата в крови.
Предрасполагающими к возникновению ЭТА факторами являются:
комбинированное назначение химиопрепарагов в сочетании с дли¬
тельным вдыханием кислорода, лучевой терапией, гемотрансфузия¬
ми, а также возраст старше 60 лет и длительность терапии (например,
применение амиодарона более двух месяцев). Применение комбини¬
рованных схем лечения увеличивает риск развития ЭТА до 40%. При
дозе амиодарона более 400 мг в сутки смертность на ранних сроках
ЭТА достигает 5—10%.Следует отметить, что минимальные концентрации бериллия
могут вызывать ЭТА даже при отсутствии профессионального кон¬
такта с этим металлом (проживание вблизи заводов по очистке берил¬
лия, работа одного из членов семьи на производстве бериллия). Так,
бериллиоз выявлялся у людей, живущих за 10 км от предприятий,
использующих бериллий.в развитии ЭТА немаловажную роль играют генетические особен¬
ности организма. Экспериментальные исследования по моделирова¬
нию у мышей блеомицинового фиброза легких выявили зависимость
степени выраженности интерстициального пневмофиброза от пород
мыщей. В патогенезе ЭТА важное значение имеет генетическая недо¬
статочность антиоксидантной активности. Некоторые тяжелые метал¬
лы, например кобальт, могут стимулировать выработку активных
форм кислорода (АФК), в связи с чем лица с генетически детермини¬
рованной слабостью систем детоксикации, например от оксидантной
агрессии, представляют собой группу риска развития «кобальтового
легкого». В этом случае кислородотерапия при «кобальтовом легком»
приводит к молниеносному прогрессированию болезни.Генетическая предрасположенность к бериллиозу подтверждается
преобладанием среди больных хроническим бериллиозом лиц, имею¬
щих аллель HLA-DP-P,-glutamin-69 (97%), в то время как у контакти¬
рующих с бериллием здоровых рабочих такая аллель выявляется лишь
118 • ГЛАВА І.АЛЬВЕОЛИТЬІВ 30% случаев. Наличие этого генетического маркера повышает риск
развития бериллиоза в 8—10 раз. Такой генный маркер, как TNF-a,
ассоциируется с гиперчувствительностью к бериллию в реакции про¬
лиферации лимфоцитов и выявляется как у больных бериллиозом,
так и у здоровых рабочих. Маркер HLA-DR-Arg-74 предупреждает
развитие заболевания и ассоциируется с гиперчувствительностью к
бериллию у здоровых рабочих, но не у больных. Роль молекул HLA-DP
аллелей не ясна, но in vitro подтверждено, что эти молекулы связывают
кобальт, а присутствие HLF-DP-Glu-p-69, ассоциирующееся с воз¬
никновением заболеваний легких от патогенного действия тяжелых
металлов, определяет высокую степень связывания металлов.С.М. Black и соавт. [1993] не исключают генетически обусловлен¬
ную чувствительность к некоторым химическим веществам (винил-
хлорид), способствующую развитию склеродерматоидного синдрома
с рестриктивными нарушениями ФВД.ПатогенезПатогенетические механизмы развития ЭТА изучены недоста¬
точно. Предполагается, что триггером может быть множественное
микроскопическое и непрерывное повреждение эндотелия сосудов
легких, что приводит к нарушению микроциркуляции, интерсти¬
циальному отеку с некрозом альвеолярных клеток и последующему
развитию интерстициального фиброза легких. Токсическое действие
некоторых лекарственных препаратов на легочную паренхиму много¬
компонентно и включает следующие механизмы:— поражение капиллярного русла вследствие некроза эндотелия
капилляров;— нарушение диффузии газов через альвеолярно-капиллярную
мембрану вследствие иїггерстициального отека, а также уплот¬
нения и утолщения межальвеолярньтх перегородок за счет
гиперпродукции ретикулиновых и коллагеновых волокон;— нарушение аэрогематического барьера вследствие массивного
некроза альвеолоцитов I типа;— спадение альвеол вследствие метаплазии альвеолоцитов
И типа и потери ими способности вырабатывать сурфактант.Токсические вещества могут как непосредственно воздействовать
на клетки иммунной системы, так и опосредованно нарушать иммун¬
ный статус организма, изменяя антигенную структуру белков. Так,
паракват и блеомицин активируют нейтрофилы и альвеолярные мак¬
ЭКЗОГЕННЫЙ ТОКСИЧЕСКИЙ АЛЬВЕОЛИ! • 117рофаги, а золото, нигрофуран, метотрексат активируют лимфоциты
супрессоры. Бериллий вызывает клеточно-опосредованную грану¬
лематозную реакцию, обусловленную активацией CD4' Т-клетокI типа, вовлечением ИФН-у, ИЛ-2, ИЛ-6 и TNF-a, При воздействии
диоксида титана на крыс фибропролиферативный ответ ассоции¬
руется с повышенной экспрессией цитокина остеопонтина, облада¬
ющего хемоатрактантными и клеточно-адгезивными свойствами.
Существенную роль в развития ЭТА от воздействия химических
веществ и металлов (кадмий, цинк) играют аутоиммунные процессы.
Химические вещества, соединяясь с белками организма, могут изме¬
нять структуру белков, делая их антигенно-чужеродными, запуская
аутоиммунный механизм повреждения легочной ткани. При воздейс¬
твии металлов могут ііарушаться метаболические реакции, катали¬
зирующиеся металлоферментами. Кроме того, некоторые металлы
(кадмий и свинец) могут непосредственно повреждать альвеолоциты
И типа.Одним из механизмов действия многих веществ является нару¬
шение баланса в оксидант-антиоксидантной системе (блеомицин,
циклофосфамид, нитрофуран), а кобальт даже способен сам выраба¬
тывать АФК. Так, у онкологических больных, получающих помимо
химиотерапевтических препаратов и радиотерапию, АФК играют
ключевую роль в развитии альвеолита и легочного фиброза. Реакция
газообразного хлора с тканевой жидкостью приводит к образованию
гидро- и гипохлоридных кислот и образованию свободных кислород¬
ных радикалов, повреждающих клетки легочной ткани.Не менее важным является наруліение баланса между синтезом и
распадом коллагена под воздействием таких препаратов, как блеоми¬
цин, золото, пеницилламин.Органические растворители оказывают прямое токсическое (про¬
дукты распада тетрахлорэтилена: фосген, четыреххлористый углерод,
соляная кислота) или раздражающее (ароматические углеводороды,
этилен гликоль, метилизобутилметан, минеральные спирты, этиле-
ноксид, тетрахлорэтилен, формальдегид) действие.Патологическая анатомияМорфологические изменения при ЭТА неспецифичны и могут
наблюдаться при «шоковом легком», лучевых поражениях легких,
ИФА и других заболеваниях легких. В легочной ткани выявляются
некроз эндотелия легочных капилляров, транссудация жидкой части
118 • ГЛАВА 1. АЛЬВЕОЛИТЫКрови в альвеолы и межальве-
олярные перегородки, некроз
альвеолоцитов 1 типа, гиперпла¬
зия и метаплазия альвеолоцитовII типа, пролиферапия фиброб-
ластов с гиперпродукцией рети¬
кулиновых и коллагеновых воло-
кон- В острых случаях может
наблюдаться внутриальвеоляр-
ный отек, сменяющийся через3—6 нед интерстициальным и
внутриальвеолярным фибро¬
зом (отравление паракватом).
В подострых случаях выявляют¬
ся гранулемы из гигантских кле¬
ток, очаговые скопления лимфо¬
цитов, плазматических клеток,
эозинофилов (метотрексат). При
хроническом бериллиозе в интер-
стиции легких, преимущест¬
венно вокруг бронхососудистых
пучков, а также в подслизистом
слое бронхов, субплеврально и во внутригрудных лимфатических
узлах формируются эпителиоидно-клеточные неказеозные грану¬
лемы. в этом случае морфологические изменения напоминают ЭАА
с более выраженной диффузной инфильтрацией мононуклеарными
клетками. На поздних стадиях заболевания формируется «сотовое
легкое».Патогномоничным для заболеваний легких от аэрозолей тяжелых
металлов («кобальтовое легкое») является GIP (гигантские много¬
ядерные клетки с чертами каннибализма — «клетка в клетке»), но
могут выявляться изменения, характерные для DIP (десквамация
клеток в альвеолы), лимфоплазмоцитарная инфильтрация и различ¬
ная степень интерстициального, преимущественно центрилобуляр-
ного фиброза (рис. 1.21). Так, при воздействии вольфрама и некоторых
лекарственных препаратов могут выявляться соответственно причуд¬
ливой формы пенистые альвеолярные макрофаги. Пропан вызывает в
легочной ткани изменения, напоминающие DIP с большим количест¬
вом многоядерных гистиоцитов.Рис. 1.21. Гистологический препарат
материала чрезбронхиальной био¬
псии легкого больного с., 40 лет.
Диагноз: экзогенный токсический
ал ьвеолит. Альвеолярные перегород¬
ки расширены, отечны, инфильтри¬
рованы преимущественно лимфо¬
цитами, гистиоцитами. В просветах
некоторых альвеол — серозная жид¬
кость
ЭКЗОГЕННЫЙ ТОКСИЧЕСКИЙ АЛЬВЕОЛИТ • 119Клиническая картинаНачало ЭТА может быть острым или стертым в зависимости от
агрессивности токсического агента, его концентрации, времени экс¬
позиции и индивидуальной реакции организма.Острое течение ЭТА характеризуется появлением первых симпто¬
мов в первые-вторые сутки после контакта с токсическими или раз¬
дражающими веществам. Отмечаются симптомы ларингофарингита
в виде болей в горле, осиплости, свистящего стридорозного дыхания.
Непродуктивный кашель, боли или чувство тяжести в грудной клетке
могут свидетельствовать о развитии токсического бронхита. Могут
наблюдаться лихорадка (иногда с ознобами), слабость, слезотечение,
чихание, носовое кровотечение, кровохарканье, ощущение неполного
вдоха, артралгии, похудание. В легких выслушиваются сухие и влаж¬
ные мелкопузырчатые хрипы, крепитация. Через 2—3 дня появляется
одышка. В тяжелых случаях заболевание протекает как респиратор¬
ный дистресс-синдром. При контакте с окислами азота, фосгеном,
хлором может развиться токсический отек легких. Острая реакция
в легочной ткани при приеме нитрофурантоина может наступить в
течение первого месяца приема препарата. При кадмиевом пневмо¬
ните ведущей жалобой является прогрессирующая одышка. Также
могут наблюдаться слезотечение, чихание, носовое кровотечение,
боли в горле, осиплость, кашель, свистящее стридорозное дыхание,
боли или чувство тяжести в грудной клетке, в тяжелых случаях
развивается отек легких. Острое течение болезни проявляется лихо¬
радкой (90% больных), одышкой (75—95%), непродуктивным кашлем
(60-70%), болями в груди (30%), артралгиями (5-15%), слабостью и
быстрой утомляемостью (80-100%), похуданием (30—40%). Одна треть
больных жалуется на ощущение неполного вдоха. Крепитация выслу¬
шивается у половины пациентов. При поражениях легких производ¬
ными нитрофурана у 10-15% больных острой формой ЭТА описаны
плевральные выпоты, токсико-аллергическая сыпь на коже. Острое
ингаляционное повреждение может разрешиться полным выздоров¬
лением. Неадекватная лечебная тактика или поздно начатое лечение
приводят к развитию фиброза легких, бронхиолита, бронхоэктазов,
стойкой неспецифической гиперреактивности бронхов — реактивной
дисфункции дыхательных путей.К острым формам ЭТА следует относить ингаляционные лихо¬
радки от воздействия металлов, в особенности окиси цинка (метал-
120 • ГЛАВА 1, АЛЬВЕОЛ ИТЫличсская дымная лихорадка), высоких концентраций органических
веществ (токсический синдром от органической пыли) или пласт¬
масс (полимерная дымная лихорадка). Заболевание развивается через4—6 ч после контакта и напоминает респираторную вирусную инфек¬
цию. В клинической картине преобладают лихорадка, озноб, сла¬
бость. Респираторные симптомы (кашель, тяжесть в груди, одышка)
могут быть слабо выраженными. После экспозиции окислов металлов
(сварка гальванизированной стали) и ряде случаев появляется метал¬
лический привкус во рту, проходящий самостоятельно. Заболевание
развивается при воздействии высоких концентраций повреждающих
веществ, вызывающих нсаллергичсский выброс цитокинов из аль¬
веолярных макрофагов и эпителиальных клеток, обусловливающий
лейкоцитоз периферической крови и приток нейтрофилов в легкие.
Развивается цитокин- и простагландин-индуцируемая лихорадка.
Через 12—48 ч наступает спонтанная обратная динамика клинических
проявлений. Особенностью ингаляционной лихорадки является раз¬
витие толерантности: заболевание развивается только в том случае,
когда контакту иредществовало несколько дней без экспозиции, и
не развивается в дни после лихорадки, даже если контакт с вредным
фактором продолжается.Токсический отек легких развивается через 4—8 ч после контакта
с высокими концентрациями наров формальдегида, ксилола, стирола,
трихлорэтилена, метиленхлорида и тетрахлорэтилена. Клиническая
картина характеризуется симптомами прогрессирующей ДН, Над
легкими могут выслушиваться как влажные мелкопузырчатые, так
и сухие хрипы. Исходом патологии может быть реактивный синдром
дисфункции дыхательных путей, облитсрирующий бронхиолит или
переход в хроническую форму ЭТА. в легких случаях и при свое¬
временной и адекватной терапии может наступить выздоровление
с полной обратной динамикой изменений в легких. В тяжелых случа¬
ях через 24-48 ч может наступить смерть больного.Респираторный дистресс-синдром может развиваться при аспи¬
рации растворителей (керосин, алкогольные напитки, разбавленные
метанолом, стеклоочистительные жидкости), приеме лекарственных
препаратов (противоопухолевые алкилирующие препараты, блеоми-
цин, амиодарон).Начало заболевания при хроническом течении ЭТА может быть
стертым. Первые симптомы могут появиться через несколько лет
после начала контакта с вредными веществами. В этих случаях одыш¬
ка возникает исподволь и имеет тенденцию к прогрессированию.
ЭКЗОГЕННЫЙ ТОКСИЧЕСКИЙ АЛЬВЕОЛИ! • 121Хроническая форма ЭТА при приеме нитрофурантоина может раз¬
виваться в интервале от 2мес до 5 лет непрерывного лечения нит-
рофурантоином. Наиболее характерными симптомами заболевания
являются одышка (89%), кашель (78%), субфебрилитет (58%), слабость
(58%), затрудненность вдоха (47%), боли в грудной клетке (33%). Реже
наблюдаются похудание (25%) и кровохарканье (11%). У половины
больных выслушивается крепитация. На поздних стадиях заболе¬
вания отмечаются признаки ДН: акроцианоз, изменение ногтевых
фаланг по типу «барабанных палочек» и «часовых стекол» («пальцы
Гиппократа»), На этой стадии клинические проявления ЭТА практи¬
чески не отличаются от клиники ИФА.Характер клинических проявлений ЭТА может зависеть от экс¬
позиционного фактора. Так, при хроническом бериллиозе первые
проявления заболевания могут развиться через много лет после экс¬
позиции (10—15 лет). При бериллиозе могут наблюдаться внелегоч-
ные поражения: лимфаденопатия, поражения кожи (но, в отличие
от саркоидоза, не бывает узловатой эритемы), слюнных желез, пече¬
ни, но не бывает поражения глаз и нервной системы. У некоторых
пациентов с «кобальтовым легким» отмечается прогрессирование
пневмофиброза и развитие «сотового легкого», несмотря на глюко-
кортикоидную терапию. Воздействие органических растворителей на
организм характеризуется полиорганным поражением с преобладани¬
ем токсических изменений центральной нервной системы (депрессия
и наркотический эффект), ирригационного дерматита, изменениями
со стороны крови, поражением печени и почек. Зарубежными авто¬
рами выделяется «органический психосиндром от воздействия рас¬
творителей» или «энцефалопатия от воздействия растворителей». Для
этого симптомокомплекса характерны слабость, головокружение,
снижение либидо, нарушение сна, памяти и концентрации внимания,
изменение поведения (агрессивность, депрессия), вегетативная симп¬
томатика (тахикардия, потливость). Для пульмонологов представляет
интерес тот факт, что у больных токсической энцефалопатией могут
наблюдаться различные респираторные симптомы, в том числе и
гипервентиляционный синдром.При воздействии органических растворителей (хлорированных
этиленов: трихлорэтилена, трихлорэтана, винилхлорида, аромати¬
ческих углеводородов) на кожу рестриктивные поражения легких
могут сочетаться со склеродермическим синдромом. Заболевание
проявляется рубцовыми изменениями кожи, синдромом Рейно, арт-
ралгиями, миалгиями, склеродактилией, поражением пиіцевода.
122 • ГЛАВА І.АЛЬВЕОЛИТЬІКлассификацияПоследний СПИСОК профессиональных заболеваний был утверж¬
ден в 1996 г, Минздравмедпромол! РФ. Согласно этому списку, ЭТА, а
также и ЭА А (хотя последний был внесен в список профболезней как
самостоятельная нозологическая форма) были отнесены к третьей
группе пневмокониозов, развивающихся от воздействия аэрозолей
токсико-аллергенного действия. Включение в разряд пневмоко¬
ниозов такой нозологической формы, как альвеолит, характеризу¬
ющейся яркостью и динамичностью клинических проявлений и
требую!гіей принципиально другого терапевтического подхода, чем
пневмокониоз, на наш взгляд, нецелесообразно. Использование
таких терминов, как «токсическая пневмония» и «пневмосклероз от
воздействия внешних агентов» вместо термина «ЭТА» неправомер¬
но, так как они обозначают исход заболевания, а не его cyjuHocTb.
Термин «альвеолит» указывает на патогенетические особенности
патологического процесса: небактериальное воспаление преиму¬
щественно в интерстициальной ткани легких. Отсутствие термина
«альвеолит» в практике профпатолога приводит к неадекватной
оценке патологического процесса и, соответственно, неправильному
и даже противопоказанному лечению. В настоящее время назрела
острая необходимость пересмотра существующей классификации
профессиональных заболеваний легких.В МКБ-10 ЭТА соответствуют следующие рубрики в разделе
J68 «Респираторные состояния, вызванные вдыханием химических
веществ, газов, дымов и паров»,• J68.1 Острый легочный отек, вызванный химическими вещества¬
ми, газами, дымами и парами.• Химический легочный отек (острый).• J68.4 Хронические респираторные состояния, вызванные хими¬
ческими веществами, газами, дымами и парами.' Легочный фиброз (хронический), вызванный вдыханием хими¬
ческих веществ, газов, дымов и паров.• J68.8 Другие респираторные состояния, вызванные химическими
веществами, газами, дымами и парами.• J68.9 Неуточненные респираторные состояния, вызванные хими¬
ческими веществами, газами, дымами и парами.• Интерстициальные легочные нарушения, вызванные лекарствен¬
ными средствами (острые, хронические).
ЭКЗОГЕННЫЙ ТОКСИЧЕСКИЙ АЛЬВЕОЛИТ • 123Объединение токсических поражений легких в группу ЭТА поз¬
волит изменить тактику ведения больных, не ограничиваться сим¬
птоматической терапией, а своевременно назначать адекватное
лечение. В частности, при рецидивирующих ингаляционных лихо¬
радках можно предотвратить переход заболевания в хроническую
форму. В связи с этим в НИИ пульмонологии СПбГМУ им. акад.
И.П. Павлова разработана следующая классификация ЭТА.По клиническому течению.• Острое течение.• Подострое течение.• Хроническое течение.Острая форма ЭТА может протекать по следующим типам:• Ингаляционная лихорадка:— металлическая дымная лихорадка;— полимерная дымная лихорадка (аэрозоли пластмасс);— токсический синдром o r органической пыли.• Токсический отек легких.• Респираторный дистресс-синдром.• Альвеолит.хроническое течение ЭТА. Б зависимости от этиологического фак¬
тора выделяют:— хронический бериллиоз;— «кобальтовое легкое»;— «амиодароновое легкое»;• ЭТА:— от воздействия органических растворителей;— от воздействия других токсических факторов (медикаментоз¬
ный, от воздействия тяжелых металлов и др.).По рентгенологическим проявлениям.■ Рентген положительная форма ЭТА.• Рентгенотрицательная форма ЭТА.ОсложненияОсновными осложнениями ЭТА при его хроническом течении
являются прогрессирующая ДН, развитие легочной гипертензии и
хронического легочного сердца. Реже заболевание может осложняться
кровохарканьем (11% больных).
124 . ГЛАВА І.АЛЬВЕОЛИТЬ!ДиагностикаВажное значение для постановки диагноза имеет профанамнез,
установление факта возникновения заболсваїіия после контакта с
токсическими веществами или после приема лекарственных препара¬
тов. Следует учитывать преобладание в клинической картине одыш¬
ки, каїпля, затрудненного вдоха.Данные клинического анализа крови не содержат каких-либо харак¬
терных для этого патологического процесса признаков. Однако в слу¬
чаях острого поражения легких увеличение СОЭ и лейкопигоз опре¬
деляются у 80% больных. Для ингаляционных лихорадок характерен
лейкоцитоз периферической крови, прием препаратов, способных
вызывать наряду с токсическим аллергическое повреждение легочной
гкани (метотрексат, прокарбазин), может сопровождаться эозинофи-
лией периферической крови, которая более характерна для хрониче¬
ской формы заболевания.Биохимические показатели (гипоальбуминемия, гипер-а,- и у-гло-
булинемия и др.) диагностически неинформативны. Их изменения
неспсцифичны и зависисят от осіротьі патологического процесса.
Высокие титры АНА в сыворотке крови более характерны для хрони¬
ческой формы ЭТА (определяются у 90% больных при хроническом
течении ЭТА от воздействия нитрофурантоина). Тем не менее специ¬
фичность этого показателя невысока.Специфическая диагностика бериллиоза включает кожную пробу
Куртиса (накожная аппликация 0,5—1% раствора хлорида берил¬
лия), Проба считается положительной в случае появления эритемы.
В последние годы все чаще стали применяться реакция пассивной
гемагглютинации, реакция специфической агломерации лейкоцитов,
реакция торможения миграции лейкоцитов, реакция бласттрансфор-
мации лимфоцитов, реакция пролиферации лимфоцитов, измеряе-
-мая по включению меченного тритием тимидина в ДНК делящихся
клеток. Последние две реакции можно проводить с лимфоцитами
ЖБАЛ.В последнее время все большее значение придается выявлению
в крови повышенного уровня сывороточного гликопротеина KL-6
(больше 520 ЕД/мл — верхняя граница нормы), продуцируемого аль-
веолоцитами II типа и являющегося маркером интерстициального
фиброза легких. Этот тест используется при диагностике «амиодаро-
пового легкого» и других медикаментозных ЭТА.
ЭКЗОГЕННЫЙ ТОКСИЧЕСКИЙ АЛЬВЕОЛИ! • 125Лучевые методы исследова¬
ния. Рентгенологическая карти¬
на при ЭТА зависит от стадии
заболевания. В начальной фазе
выявляются признаки отека ин¬
терстициальной ткани легких и
распространенные мелкоочаго¬
вые затенения. При прогресси¬
ровании процесса формируются
двусторонние изменения легоч¬
ного рисунка по типу интерсти¬
циального фиброза, преимущес¬
твенно в нижних отделах легких
(рис. 1.22). В далеко зашедших
случаях определяется мелко- и
крупноячеистая деформация ле¬
гочного рисунка. Описаны слу¬
чаи, когда единственным рентге-
нолоі’ическим признаком болезни
был односторонний плевральный
выпот. Отсутствие каких-либо из¬
менений на рентгенограммах
отнюдь не исключает ЭТА. У 30%
из 71 больных ЭТА, обследован¬
ных в НИИП СПбГМУ им. акад.И .П. Павлова, в момент обследо¬
вания изменений на рентгенограммах не было. Группа больных ЭТА
была обозначена условно кате рентгснотрицательная группа. Уточнить
диагноз помогает КТ легких, выявляющая интерстициальные изме¬
нения в легочной ткани по типу «матового стекла», усиление и дефор¬
мацию легочного и сосудистого рисунка (рис. 1.23), ВРКТ выявляет
«матовое стекло» и другие изменения в легочной паренхиме, которые
не видны при обычном рентгенологическом исследовании. Но даже
ВРКТ не всегда выявляет изменения в легочной ткани. Так, в 25%
случаев гистологически подтвержденного хронического бериллиоза
легких ВРКТ была нормальной.Рентгенологические изменения в легких при ингаляционных
лихорадках могут отсутствать или проявляться в виде летучих
инфильтратов,Рис. Т.22. Обзорная рентгенограмма
в передней проекции больною С,,
40 лет. Диагноз: экзогенный токси¬
ческий альвеолит. Равномерное сни¬
жение прозрачности легочной ткани
за счет интерстициального компо¬
нента в виде сстчатостп и множест¬
венных мелкоочаговых теней с пре-
имушественной локализацией над
диафрагмой, уменьшение объема
нижних долей, небольшое расши¬
рение корней леї’ких, но без увели¬
чения лимфатических узлов, высо¬
кое стояние куполов диафрагмы
(па уровне IX ребра)
126 • ГЛАВА І.АЛЬВЕОЛИТЬІПри бериллиозе помимо диф¬
фузных инфильтратов и усиления
легочного рисунка за счет интер¬
стициального компонента может
выявляться лимфаденопатия.
Рентгенологически выделяют
следующие стадии бериллиоза,• I СТАДИЯ. Умеренное усиление и
деформация легочного рисунка
за счет интерстициального ком¬
понента или только увеличение
внутригрудных лимфатичес¬
ких узлов, которое может быть
единственным рентгенологичес¬
ким проявлением бериллиоза.• и стадия. Выраженная дефор¬
мация легочного рисунка за счет
сосудистых и перибронхиальных
изменений и многочисленные
мелкоточечные тени, создающие
картину «наждачной бумаги».
Мелкие узелки перемежаются с
мелкобуллезной эмфиземой.• III стадия. На фоне резко выраженной деформации сосудисто-
бронхиального рисунка выявляются многочисленные очаговые
тени, склонные к слиянию с образованием полей фиброза с учас¬
тками крупнобуллезной эмфиземы. Массивные плевродиафраг¬
мальные и плевроперикардиальные сращения.Исследование ФВД. Характер и степень изменения ФВД при ЭТА
зависят от рентгенологического варианта заболевания. У половины
больных ЭТА выявляется резкое и значительное снижение ОЕЛ с
перестройкой ее структуры по рестриктивному типу, достоверно
более выраженной у рентгенположительной группы больных, по
сравнению с рентгенотрицательной группой. Эластическая отдача
легких умеренно увеличивается, дел снижается как в устойчивом
состоянии, так и при задержке дыхания. При бериллиозе ее снижение
может наблюдаться за несколько лет до появления рентгенологиче¬
ских изменений.Рестриктивный синдром при рентгенотрицательном варианте ЭТА
выражен в меньшей степени, чем при рентгенположительном ЭТА,Рис. 1.23. Компьютерная томограмма
легких больного М., 47 лет. Диагноз:
экзогенный токсический альвео-
лит, рептгснотрипательная фор¬
ма. Деформация, неравномерность
хода, ттекоторое расширение пери¬
ферических кровеносных сосудов.
На срезах ниже бифуркации трахеи
отмечается резкое снижєеіис воз¬
душности легочной ткани и усиле¬
ние интерстициального компонен¬
та. Денситометрическая плотность
легочной ткани резко повышена (до
460 ЕД ни R отдельных участках)
ЭКЗОГЕННЫЙ ТОКСИЧЕСКИЙ АЛЬВЕОЛИ! • 127И ведущим является нарушение ДСЛ. Так, при воздействии органи¬
ческих растворителей (хлорированных этиленов: трихлорэтилена,
трихлорэтана, винилхлорида; ароматических углеводородов) ЭТА
может протекать как рентген-отрицательный вариант с рестриктив¬
ным синдромом и снижением ДСЛ. Следует отметить, что у больных
ЭТА может выявляться обструктивный синдром, обусловленный
развитием облитерирующего бронхиолита. Рестриктивного синдрома
при ингаляционных лихорадках может не быть или он выражен отно¬
сительно слабо.Исследование легочно-сердечной гемодинамики. При эходопплер-
кардиографии отмечается увеличение систолического давления в
легочной артерии за счет повышения общего легочного сопротив¬
ления по отношению к нормальным величинам. Наличие нару¬
шений гемодинамики малого круга кровообращения подтверж¬
дается данными сцинтиграфии легких с [Тс], указывающими
на диффузные нарушения перфузии разной степени выраженно¬
сти.Бронхологические методы исследования. Фибробронхоскопия вы¬
являет наличие диффузного катарального эндобронхита или атрофи¬
ческие изменения слизистой оболочки бронхов как следствие перене¬
сенного токсического бронхита.Отмечается как нейтрофилез, так и лимфоцитоз ЖБАЛ. При
ингаляционнах лихорадках в ЖБАЛ увеличивается число нейтро-
филов и цитокинов. Прогрессирование пневмофиброза сопровож¬
дается увеличением числа нейтрофилов в ЖБАЛ, Цитологический
состав ЖБАЛ позволяет уточнить характер экспозиционного фак¬
тора. Повышение числа лимфоцитов и значительное повышение
отношения CD4/CD8 клеток в ЖБАЛ характерно для бериллиоза.
При ЭТА от аэрозолей тяжелых металлов («кобальтовое легкое») в
ЖБАЛ повышается число всех видов клеток: альвеолярных макро¬
фагов, лимфоцитов, нейтрофилов, эозинофилов и даже выявляют¬
ся тучные клетки. При воздействии цинка, магния, кадмия, никеля
и ванадия в ЖБАЛ повышается число нейтрофилов. В ряде случаев
в ЖБАЛ можно выявить изменения альвеолярных макрофагов,
характерные для воздействия определенных веществ: вольфрама
(причудливые макрофаги), лекарственных препаратов (пенистые
макрофаги), кобальта (причудливые гигантские многоядерные
клетки с признаками каннибализма, так называемые «клетка в
клетке»). Ядерноактивный анализ ЖБАЛ помогает уточнить тип
металла.
128 • ГЛАВА І.АЛЬВЕОЛИТЬІЭндоскопические и хирургические методы исследования, в сложных
для диагностики ЭТА случаях показано проведение ЧББ, видеотора-
коскопической или открытой биопсии легких для гистологической
верификации диагноза. Наиболее информативной при небольшой
травматичности является видеоторакоскопическая биопсия легких.
В случае подозрения на хронический бериллиоз легких при неинфор-
^faтивнoй ЧББ и наличии лимфоцитоза Ж БАЛ более 20% рекоменду¬
ется повторить биопсию легкого.Клинический пример N91Больная Е., 53 года, поступила в клинику пульмонологии СПбГМУ
им. акад. И.П. Павлова в марте 2001 г. с жалобами на одышку инспи-
раторного характера при умеренной физической нагрузке, сухой при¬
ступообразный кашель, слабость, потливость.С 1984 г. отмечала першение в горле, сухой кашель. К врачу не
обращалась. В 1987, 1996 гг. лечилась по поводу двусторонних изме¬
нений в легких на флюорографии, трактовавшихся как «двусто¬
ронняя пневмония». Терапия антибиотиками была неэффективна.
С 1996 г. больная отмечала постоянное покашливание, постепенно
нарастающую одышку, которая значительно усилилась к 2000 г.
С диагнозом «двусторонняя пневмония» больная вновь, без эффек¬
та, получала антибиотикотерапию. Сохранялись изменения на рен¬
тгенограммах органов грудной клетки. Для уточнения диагно¬
за больная была направлена в клинику пульмонологии СПбГМУ
им. акад. И.П. Павлова. Наследственность по болезням органовдыха¬
ния, аллергологический анамнез не отягощены. Профессиональных
вредностей не было. Однако больная с 1973 по 1984 г. работала
инженером-технологом на предприятии по производству бериллий-
содержаших деталей. Во время работы отмечала слезотечение, зало¬
женность носа, першение в горле, покашливание. После увольнения
сохранялся сухой кашель.При поступлении общее состояние больной было удовлетворитель¬
ное. Дыхание везикулярное, крепитация в нижних отделах легких,
больше справа. В клиническом анализе крови отмечалось повышение
СОЭ до 35 мм/ч. Были повышены С-реактивный белок (+) и ЦИК
(260 ЕД/258%) в крови. На рентгенограммах органов грудной клет¬
ки выявлялось умеренно выраженное усиление интерстициального
компонента легочного рисунка в виде сетчатости, участков тяжистой
деформации, преимущественно в нижних отделах легких, расши¬
ЭКЗОГЕННЫЙ ТОКСИЧЕСКИЙ ЛПЬВЕОЛИТ • 129рение корней за счет лимфати¬
ческих узлов, уменьшение объ¬
емов нижних долей (рис. 1.24).
Комплексное функциональное
исследование внешнего дыхания
выявило умеренное снижение
ЖЕЛ — 62% должной, резкое сни¬
жение ОЕЛ — 59% должной, зна¬
чительное снижение ООЛ — 62%
должного, умеренное повышение
эластической отдачи легких —
0,63 кПа/л и резкое снижение
ДСЛзд — 50% должной при
умеренном снижении ДСЛус —
79% должной. Гипоксемии в
покое не выявлялось— PaOj —Рис. 1.24. Экзогенный токсический
альвеолит (хронический берилли-
оз). Больная Е. Умеренно выражен¬
ное усиление интерстициального
компонента легочного рисунка п
виде сетчатости, участков тяжистой
деформации, преимущественно в
нижних отделах легких. Корни рас¬
ширены за счет лимфатических узлов.
Уменьшение объемов нижттих долей.
Диафрагма немного приподнята68ммрт.ст (84% должной). Доп-
плерэхокардиография не выяви¬
ла патологических изменений.Систолическое давление в легоч¬
ной артерии было 29 мм. рт.ст.При фибробронхоскопии опре¬
делялся двусторонний диффузный катаральный эндобронхит,
В ЖБАЛ выявлялся нейтрофилез (28%) при нормальном числе
лимфотщтов (5%). КТ органов грудной клетки выявила признаки
интерстициального фиброза в обоих легких, наиболее выраженно¬
го в задних субплевральных отделах. Отмечалось увеличение всех
групп внутригрудных лимфатических узлов до 1,5 см, некоторые из
которых содержали небольшое количество извести. Значительные
фиброзные наложения по ходу костальной плевры с обеих сторон
(рис. 1.25), При сцинтиграфии легких с ^^""[Тс] определялось расши¬
рение тени средостения, резкое снижение кровотока в проекции Sg jy
слева, усиление дольковой неоднородности перфузии с обеих сторон
(рис. 1,26). Больной была произведена ЧББ легкого. Гистологическое
исследование материала биопсии выявило интерстициальный скле¬
роз межальвеолярньтх перегородок, заполнение альвеол альвеоляр¬
ными макрофагами, склероз стенок артерий, круглый очаг из лим¬
фоцитов и веретенообразных клеток с черным и серым пигментом
в цитоплазме и между клетками. Очаг похож на склерозированную
г'ранулему.
130 • ГЛАВА 1. АЛЬВЕОЛИТЫРис. 1.25. Экзогенный токсический
альвеолит (хронический берил л и-
оз). Больная Е. Интерстициальный
фиброз с обеих сторон, наиболее вы¬
ражен в субплевральных отделах
сзади. Увеличение всех групп внут-
ригрудных лимфатических узлов
до 1,5 см, некоторые содержат не¬
большое количество извести. Зна¬
чительные фиброзные наложения
по ходу костальной плевры с обеих
сторонРис. 1.26. Экзогенный токсический
альвеолит (хронический бериллиоз).
Больная Е, Расширение тени средос¬
тения. Резкое снижение кровотока в
проекции слева. Усиление доль-ковой неоднородности
обеих сторонперфузии сБыл поставлен диагноз «ЭТА
(бериллиоз), хроническое тече¬
ние, фаза обострения. ДН II».Профессиональная этиология
заболевания была подтверждена
положительной кожной пробой
Куртиса (накожная аппликация
0,5—1% раствора хлорида берил¬
лия).Больной был назначен мети-
пред (20 мг в сутки в пересчете
на преднизолон) с постепенным
снижением дозы по интермит-
тирующей схеме, проведен курс
плазмафереза. На фоне глюко-
кортикоидной терапии и повтор¬
ных курсов плазмафереза отмеча¬
лась положительная клиническая
динамика, увеличилась ДСЛзд —
56,2% должной (+6,2%), норма¬
лизовалась Ж ЕЛ — 81% должной
(+19%), но снизился ООЛ — 56%
должной (-6%). PaOj повысилось
до 77,6 мм рт.ст (+11,6 мм рт.ст.).
Рентгенологические изменения в
легких были без существенной
динамики, признаки лимфаде-
нопатии отсутствовали.На этом клиническом примере
видны наиболее часто встречаемые
ошибки диагностики ЭТА. Это пас¬
сивность самой больной, которая
в течение трех лет не обращалась
к врачам по поводу сухого кашля.
К врачебным ошибкам диагностики
можно отнести следующие:— длительная (с 1987 по
2001 г.) антибактериальная
терапия по поводу «дву¬
сторонней пневмонии»;
ЭКЗОГЕННЫЙ ТОКСИЧЕСКИЙ АЛЬВЕОЛМТ • 131— не учитывался профессиональный анамнез (возможный кон¬
такт с бериллием);— наличие симптомов раздражения слизистых оболочек глаз и
верхних дыхательных путей во время работы (слезотечение,
заложенность носа, першение в горле, покашливание) было
поводом для увольнения, а не направления к профпатологу.Клинический пример N° 2Больная к., 31 год, поступила в НИИ пульмонологии СПбГМУ
им. акад. И.П. Павлова в мае 1989 г. с жалобами на одышку при мини¬
мальной физической нагрузке, сухой кашель, субфебрилитет, сла¬
бость, кровохарканье.Заболевание началось остро в октябре 1989 г., когда во время
аварии на производстве в течение 8 мин находилась в условиях
повышенного содержания аммиака. В это время отмечалась кратко¬
временная потеря сознания. Во время эвакуации появился сухой
кашель, слезотечение, першение в горле, удушье. Ночью состояние
больной ухудшилось, появилась одышка, фебрильная темпера¬
тура тела. Симптоматическая терапия была неэффективна. Через
4 дня появилось кровохарканье, лихорадка выше 39 °С, спутанность
сознания. Лечилась стационарно с диагнозом «двусторонняя пнев¬
мония». Антибиотикотерапия и симптоматическое лечение были
неэффективны. Одышка прогрессировала. Сохранялось кровохар¬
канье и субфебрилитет. Для уточнения диагноза больная была гос¬
питализирована в НИИП СПбГМУ им. акад. И.П. Павлова.При поступлении состояние больной было средней тяжести,
при физической нагрузке выявлялся акроцианоз. На фоне ослаб¬
ленного дыхания в нижних отделах легких выслушивалась крепи¬
тация. В клиническом анализе крови изменений не выявлялось.
Комплексное функциональное исследование внешнего дыхания
выявило умеренное снижение ЖЕЛ — 69,1% должной, ОЕЛ — 15%
должной и резкое снижение ДСЛус — 53,0% должной. На рентгено-
I раммах органов грудной клетки изменений не выявлялось
(рис. 1.27). При фибробронхоскопии определялось истончение сли-
шстой оболочки бронхиального дерева. ВЖБАЛ выявлялся ней-
[рофилсз (10%) и при умеренном повышении числа лимфоцитов
(14%). Допплерэхокардиография выявляла повышение систоличе¬
ского давления в легочной артерии до 39 мм рт.ст. При сцинтиграфии
легких с ^^"’[Тс] определялись значительные диффузные нарушения
132 • ГЛАВА 1. АЛ ЬВЕОЛИТЫРис. 1.27. Экзогенный токсиче¬
ский альвеолит, рентгенотрицатель-
ная форма, хроническое течение.
Больная К. Легочный рисунок выра¬
жен обычноперфузии (рис. 1.28). КТ органов
грудной клетки выявила интер¬
стициальные изменения, зани¬
мающие средние и нижние доли
(рис. 1.29). Прослеживались рас¬
ширенные сосуды вплоть до кос¬
тальной плевры, утолщенные
межсегментарные перегородки.Больной был поставлен диагноз
ЭТА. На фоне глюкокортикоидной
и повторных курсов плазмафереза
отмечалась положительная кли¬
ническая динамика, нормализо¬
валось давление в легочной арте¬
рии (25—26 ммрт.ст.), увеличилась
ДСЛус (75% должной).Рис. 1.28. Экзогенный токсиче¬
ский альвеолит, рентгенотрицатель-
ная форма, хроническое течение.
Больная К. Диффузные нарушения
перфузионной функции легкихг*#ibeiiLJSaiРис. 1.29. Экзогенный токсический
альвеолит, рентгенотрицательная
форма, хроническое течение. Боль¬
ная К. Интерстициальные изменения
в средних и нижних долях легких.
Расширенные сосуды прослеживаются
вплоть до костальной плевры
ЭКЗОГЕННЫЙ ТОКСИЧЕСКИЙ АЛЬВЕОЛИ! • 133Диагностические критерии ЭТА• Основные критерии.— Начало или ухудшение заболевания через несколько часов
после контакта с токсическими веществами при характерных
для ЭТА клинических проявлениях.— Подтверждение контакта с токсическим веществом: анамнез,
санитарно-гигиеническое исследование воздуха рабочей зоны.— Характерные изменения на рентгенограммах и ВРКТ органов
грудной клетки.— Лимфоцитоз и (или) нейтрофилез ЖБАЛ (выявление пенистых
альвеолярных макрофагов, содержащих пластинчатые включе¬
ния, указывают на воздействие амиодарона).— Характерные морфологические изменения.— Появление клинических и функциональных признаков и лабо¬
раторных изменений после повторных контактов с предполагае¬
мым фактором (анамнез).— Высокое содержание токсических веществ (металлов) в биоло¬
гических средах.— Положительные пробы на гипсрчувствительность к металлам
(кожные, серологические, ЖБАЛ).— Выявление в крови повышенного уровня сывороточного гли¬
копротеина KL-6.• Дополнительные критерии.— Крепитация.— Рестриктивный тип нарушений ФВД.— Снижение дел.— Легочная гипертензия.— Артериальная гипоксемия в покое или при нагрузке.Формулировка диагноза• ЭТА, острое течение. ДН П степени.• ЭТА, хроническое течение, фаза обострения. ДН П степени.Вторичная легочная гипертензия 1 степени. Хроническое субком-пенсированное легочное сердце.Дифференциальная диагностикаВ первую очередь При диагностике экзогенных альвеолитов необходи¬
мо уточнить наличие контакта с внешним фактором. Следует отметить,
134 * ГЛАВА 1. АЛЬВЕОЛИТЫ4Т0, В отличие ОТ ЭАА, ЭТА возникает при первом контакте с высокими
концентрадиями токсических веіцеств (нагтример, токсический синдром
от органической пыли). Поражаются сразу несколько лиц, находившихся
в зоне повышенного содержания вредных факторов, в то время как при
ЭАА заболевает, как правило, один человек, ранее конгактировавший с
этим веществом, и концентрация этиологического фактора может быть
небольшой. Если ЭАА и ИФА болеют преимущественно женщины, то ЭТА
чаще развивается у мужчин, что, возможно, связано с характером трудовой
деятельности пациентов. Клиническая картина, рентгенологические и
функциональные признаки фиброзирующих альвеолитов: ЭТА, ЭАА и
ИФА — однотипны, в связи с чем подчас чрезвычайно трудно установить
нозологическую форму альвеолита. При дифференциальной диагностике
этих заболеваний следует учитывать следующие признаки.• Развитие бронхоспастического синдрома характерно для ЭАА,• Кровохарканье может наблюдаться при ЭТА.• Формирование таких признаков хронической гипоксии, как
«пальцы Гиппократа», значительно чаще отмечается при ИФА
(36%), чем при ЭТА (13%) и ЭАА (9%).• Наибольшая степень выраженности рестриктивных изменений
характерна для ИФА, в то время как при ЭАА и ЭТА могут выяв¬
ляться смешанные нарушения вентиляционной способности лег¬
ких: при ЭАА за счет присоединения бронхоспастического синд¬
рома, при ЭТА — за счет развития облитерирующего бронхиолита
или реактивной дисфункции дыхательных путей.• Инфильтративные изменения на рентгенограммах органов груд¬
ной клетки характерны для ЭАА и ЭТА, причем при ЭАА отмеча¬
ется быстрая динамика этих изменений. Для ИФА свойственны
интерстициальные изменения с уменьшением объемов нижних
долей легких и высокое стояние куполов диафрагмы.• Бронхофиброскопия выявляет катаральный эндобронхит при
всех рассматриваемых заболеваниях. Атрофические изменения
слизистой оболочки бронхов могут выявляться только при ЭТА.• В ЖБАЛ характерными являются высокий лимфоцитоз у боль¬
ных ЭАА (до 30—70%), нейтрофилез при ИФА. При ЭТА может
увеличиваться как число лимфоцитов, так и число нейтрофилов.
Лимфоцитоз ЖБАЛ ассоциируется с выраженностью альвеолита.
Обнаружение пенистых клеток, содержащих пластинчатые вклю¬
чения, указывает на воздействие амиодарона.• Положительные иммунологические реакции с определенными
аллергенами позволяют достоверно поставить диагноз ЭАА.
ЭКЗОГЕННЫЙ ТОКСИЧЕСКИЙ АЛЬВЕОЛИ! • 135• Спонтанная обратная динамика проявлений заболевания харак¬
терна для ЭАА, но также может наблюдаться при ингаляционных
лихорадках. Благоприятное течение заболевания на фоне глюко-
кортикоидной терапии с последующей отменой препаратов может
с большой долей вероятности указывать на ЭАА.Лечениепри подозрении на ЭТА Б первую очередь необходимо немедленно
устранить предполагаемый этиологический фактор. Лечебная такти¬
ка при ЭТА принципиально не отличается от тактики лечения ИФА.
Базисной терапией ЭТА являются глюкокортикоидные препараты в
начальной дозе 0,5—1 мг на 1 кг массы тела в пересчете на преднизолон
с последующим снижением дозы в зависимости от быстроты обратной
динамики заболевания. В отличие от ИФА, больным ЭТА не назнача¬
ются азатиоприн и пеницилламин из-за их возможного пневмотокси-
ческого действия. Однако при бериллиозс в случаях резистентности
к глюкокортикоидной терапии рекомендуется метотрексат в дозе5—10 мг в неделю (принимать в первые два дня в неделю по поло¬
винной дозе. Широко применяются экстракорпоральные методы
лечения: плазмаферез, гемосорбция, плазмацитоферез с инкубацией
лимфоцитов с глюкокортикоидами. Повторные курсы лечения реко-
мендуеч'ся проводить через 0,5-1 год. Учитывая роль оксидативного
стресса в поражении легочной ткани, назначают антиоксидантную
терапию: ацетилцистеин (флуимуцил*) в начальной дозе 1200 мг
в течение Змее с последующим снижением дозы до 600мг в сутки
в течение 3—6 мес.критерием полной излеченности больных является исчезновение
одышки, нормализация ФВД (в первую очередь — ДСЛ), газов крови,
данных рентгенологического исследования органов грудной клетки.
В случае сохранения снижения ДСЛ, даже при нормализации других
показателей, состояние расценивается как выздоровление с дефектом.
Исходом ЭТА могут быть пневмофиброз, реактивная дисфункция
дыхательных путей, облитерирующий бронхиолит с организующейся
пневмонией.ПрогнозЗависит от сроков установления диагноза и быстроты устраііенияиологического фактора. Своевременная и адекватная терапия может
136 • ГЛАВА І.АЛЬВЕОЛИТЬІПривести к полному или частичному (сохраняется снижение ДСЛ)
выздоровлению. Лечебные мероприятия на поздних стадиях заболева¬
ния малоэффективны, и прогноз, как правило, неблагоприятный.ПрофилактикаВедущими методами первичной профилактики ЭТА, возникаю¬
щего в производственных условиях, являются инженерно-техниче¬
ские мероприятия, направленные на снижение уровня запыленнос¬
ти, нормализацию микроклиматических условий на рабочих местах,
внедрение очистных сооружений в рамках общегосударственной про¬
граммы, Обязательно использование эффективных индивидуальных
средств защиты органов дыхания в виде респираторов, противогазов,
а при ряде работ необходимо использование масок с принудительной
подачей воздуха.Медицинские мероприятия включают прежде всего качественное
проведение предварительных (при поступлении на работу) и пери¬
одических медицинских осмотров. Обязательным условием долж¬
но стать проведение профессионального отбора во вредные для
дыхательной системы производства. Повторные курсы антиокси-
дантной терапии у лиц, имеющих длительный контакт с вредными
факторами, позволят снизить риск развития ЭТА, Рекомендуется
ацетилцистеин 200 мг в сутки, триовит* 2 капсулы в сутки, активит*
1 капсула в сутки, чередуя препараты по 1 мес каждый препарат в
течение 6 мес в году.при проведении химиотерапии необходимо избегать сочетания
двух и более пневмотропных токсических препаратов, особенно на
фоне длительной кислородотерапии.
Глава 2ГранулематозыСАРКОИДОЗ ОРГАНОВ ДЫХАНИЯСаркоидоз (синонимы: Бека болезнь, Бека саркоид,
Бенье—Бека-Шауманна синдром, Бенье—Бека-Шауманна
болезнь, Шауманна синдром) — полисистемное заболева¬
ние неизвестной этиологии, относящееся по своим морфо¬
логическим особенностям к группе гранулематозов.Английский врач-дерматолог J. Hutchinson впервые
описал в 1877 г. заболевание кожи рук и ног, которое
назвал «папиллярный псориаз», В 1889 г. норвежский
дерматолог Е. Besnier описал поражение кожи под назва¬
нием Lupus pernio, а через 10 лет, в 1899 г., С, Восск впер¬
вые применил термин «доброкачественный саркоид»,
основываясь на внешнем сходстве изменений кожи с
саркомой.Появление в начале XX столетия новых описаний
саркоида не только кожи, но и поражений внутренних
органов позволило шведскому дерматологу J. Schaumann
[1936] объединить все опубликованные ранее случаи
болезни (включая поражение различных групп лим¬
фатических узлов) и предложить термин «доброка¬
чественная лимфогранулема». Длительное время в
классической немецкой и французской медицинской
литературе для обозначения этого заболевания широко
применялся эпонимический термин «болезнь Бенье—
Бека—Шауманна», однако в 1948 г. Международная кон-
138 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫферениия (Вашингтон, США) сочла целесообразным рекомендовать
термин «саркоидоз».ЭпидемиологияПо результатам многочисленных эпидемиологических исследова¬
ний, распространенность саркоидоза в различных странах варьирует
от 0,2 до 64 случаев на 100 ООО населения. В странах Африки, Азии,
Центральной и Южной Америки показатели распространенности
саркоидоза самые низкие, в Скандинавских странах и в афро-аме-
риканской популяции США — самые высокие. В США соотноше¬
ние распространенности между черной и белой расами составляет
от 10:1 до 17:1. Распространенность саркоидоза среди ирландских
женшин детородного возраста составляет 213 на 100 000 населения.С аркой доз редко встречается в Индии, Саудовской Аравии, Испании
и Португалии и очень редко — в Новой Зеландии. В экономически и
социально благополучных странах число больных саркоидозом еже¬
годно увеличивается на 1,9%, а число больных туберкулезом умень¬
шается на 5%.Данные о распространенности саркоидоза в Российской Федерации
немногочисленны. В Москве в 2001 г. распространенность саркоидо¬
за составила 11,5 [Шмелев Е.И., 2004], в Республике Татарстан —
14,8 на 100 ООО населения [Визель А.А., Гурылева М.Э., 2002]. В Санкт-
Петербурге показатели распространенности и заболеваемости с 1988
по 2006 г. существенно не изменились (19,7 и 20,0, 3,5 и 3,2 случаев
на 100 ООО населения соответственно) [Baranova О.Р. et al., 2007].
Саркоидоз органов дыхания (СОД) встречается у лиц обоего пола, но
чаще диагностируется у женщин (55-60%). В Японии саркоидоз опре¬
деляется у женщин в 1,72 раза чаще, чем у мужчин (заболеваемость
саркоидозом у женщин составляет 1,26 случая против 0,73 у мужчин
на 100 ООО населения) [Morimoto Т. et al, 2008]. Болезнь возникает
преимущественно (80%) у лиц молодого и среднего возраста (от 20 до
40 лет). Имеются лишь единичные публикации о выявлении саркои¬
доза у детей.Отмечены определенные отличия в течение заболевания у лиц
разных рас: легкое, нередко бессимптомное течение или острое с бла¬
гоприятным прогнозом у представителей белой расы и более тяжелое
течение в сочетании с внелегочными поражениями (кожи, глаз, серд¬
ца и др.) у лиц афро-американской и японской популяции.
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ * 139Этиология и факторы рискаВ 1905 Г. С. Воек описал саркоидоз как «бациллярное инфекци¬
онное заболевание, которое либо полностью идентично туберкуле¬
зу, либо тесно связано с ним», и на протяжении более века активно
проводится поиск этиологического фактора саркоидоза с помощью
гистологических, микробиологических, молекулярно-биологических
методов, в частности, у больных саркоидозом с помощью полимераз¬
ной цепной реакции действительно показано присутствие микобак-
териальных ДНК и РНК [Newman L.S. et al., 1997; Kita S. et al., 19991.
Однако патогенетическая роль как Mycobacterium tuberculosis, так и
других микобактерий в развитии саркоидоза не доказана [Smith R.E.
et al., 1995; Brown S.T. et aK, 2003].В нашей стране длительное время доминировало предположение о
саркоидозе как об «особой форме туберкулеза». Мнение о том, что сар¬
коидоз этиологически независим от туберкулеза, наиболее убедительно
было сформулировано Дж. Крофтоном и А. Дугласом еще в 1974 г.Преимущественное поражение отдельных органов при саркоидозе
и туберкулезе различно (глаза, печень, слюнные и слезные железы,
скелетная мускулатура при саркоидозе; надпочечники, серозные обо¬
лочки при туберкулезе). Как известно, туберкулез является причиной
поражения коры надпочечников в 50—85% случаев. Саркоидоз как
причина поражения надпочечников — казуистика.Саркоидная гранулема по своему гистологическому строению близка
к неказеифицирующейся туберкулезной гранулеме, однако гранулема
саркоидного типа формируется и при других заболеваниях (бериллиоз,
заболевания лимфоретикулярной системы и во многих других случаях).Сторонники этиологической связи саркоидоза и туберкулеза
используют наличие анергии на туберкулин при саркоидозе в качест¬
ве аргумента, подтверждающего неадекватную реакцию организма на
микобактерии туберкулеза. Однако и этот довод несостоятелен, так
как у больных саркоидозом анергия на туберкулин нередко сочетает¬
ся с гиперергической реакцией, проявляющейся узловатой эритемой.
Наконец, присоединение туберкулеза у больных саркоидозом дает
вираж туберкулиновой пробы (т.е. больные не теряют способность
нормально реагировать на микобактерии туберкулеза). Из этого сле¬
дует: анергия — результат саркоидоза, а не его причина.Саркоидоз очень редко встречается в детском возрасте (в отличие
от туберкулеза).
140 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫЗаболеваемость туберкулезом и саркоидозом в разных странах раз¬
лична. Однако в экономически развитых странах с высоким уровнем
организации здравоохранения прослеживается четкая тенденция
снижения заболеваемости туберкулезом.Распространенность саркоидоза не зависит от социальных усло¬
вий жизни (в отличие от туберкулеза). В заболеваемости саркоидозом
намечаются определенные расовые различия.Противотуберкулезные препараты при саркоидозе неэффектив¬
ны, а лечение глюкокортикоидными препаратами дает положитель¬
ный эффект. Следует также добавить, что выявляемые в единичных
случаях у больных СОД кислотоустойчивые палочки не поддаются
культивации и существенно отличаются по своей микроструктуре от
возбудителя туберкулеза.Описываемые ранее так называемые переходные формы саркоидо¬
за (т.е. переход саркоидоза в туберкулез и наоборот) при тщательном
анализе исследователями во .многих странах доказать не удалось ни
в одном случае (в отличие от отечественных фтизиатров, которые
такое развитие событий до недавнего времени считали вполне естест¬
венным). В 50—70 годах прошлого столетия многие ученые стали рас¬
сматривать саркоидоз как самостоятельную нозологическую форму,
вызываемую каким-то еще неизвестным агентом. Число сторонников
туберкулезной этиологии саркоидоза в последние десятилетия значи¬
тельно уменьшилось.Мультицентровое исследование ACCESS (А Case Control Etiologic
Study of Sarcoidosis), проведенное в 10 клиниках США, также не под¬
твердило этиологическую роль микобактерий в развитии саркоидоза.
При сравнении образцов посевов крови 197 больных саркоидозом и
150 здоровых лиц частота обнаружения микобактерий с признаками
дефицита клеточной стенки у больных саркоидозом (38%) существен¬
но не отличалась от здоровых лиц (41%) [Brown S.T. et al., 2003].Известно, что помимо микобактерий (при туберкулезе) некоторые
вирусы также способны вызывать гранулемоподобное воспаление.
В ряде случаев у больных саркоидозом определяются высокие титры
антител к вирусам Эпштейна—Барр, герпес-вирусу, парагриппу, цито-
мегаловирусу, причем эти данные согласуются с результатами диа¬
гностики методом полимеразной цепной реакции [Kita S. et al., 1999].
Вместе с тем вирусная этиология саркоидоза не подтверждается куль¬
туральными методами исследования.Результаты эпидемиологических исследований также не исклю¬
чают возможности инфекционной природы саркоидоза, поскольку
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 141отмечена сезонная «кластеризация» (в июне и июле), повышенная
распространенность этого заболевания у работающих лиц и, наконец,
возможность передачи саркоидоза при трансплантации, несмотря на
проводимую реципиентам иммуносупрессирующую терапию [Du
Bois R.M. et аК, 1992; Guede К. J. et aL, 1998]. Саркоидоз у реципиентов
развивался после трансплантации легких даже в тех случаях, когда у
доноров наблюдалась в свое время спонтанная ремиссия этого заболе¬
вания [Minshall Е,М. et al., 1997]. В качестве возможных инфекцион¬
ных агентов рассматривались бактерии Borreiia burgdorferi. Mycoplasma,
Chlamidia^ Nocardia; микобактерии туберкулеза, микобактерии парату-
беркулеза; вирусы (ретровирус, герпес-вирус, вирус Эпштейна—Барр).
Сходство некоторых клинических (лимфаденопатия, узловатая эри¬
тема, артралгии) и морфологических признаков, выявляемых в пора¬
женных лимфатических узлах и селезенке, позволило предложить
иереи НИИ в качестве возможного этиологического агента саркоидоза.
Повышение сывороточных антител против упомянутых инфекци¬
онных агентов можно рассматривать скорее как сопутствующий
феномен, чем как ответ на конкретный специфический причинный
агент. Это подтверждается методами молекулярной диагностики; ни
один инфекционный специфический агент определить (изолировать,
культивировать) пока не удалось [Costabel U., 2001].Приблизительно у половины заболевших имеет место профес¬
сиональный контакт с различными химическими веществами и
физическими воздействиями (пары кислот, щелочей, красок, ацетон
и другие растворители, пластмассы, цемент, радиация, поле сверх¬
высокой частоты и др.). Имеются указания на ряд факторов, способ¬
ных играть этиологическую роль в возникновении саркоидоза: сосно¬
вая пыльца, глина, бериллий, цирконий, тальк, алюминий и некото¬
рые медикаменты — сульфаниламиды, .метотрексат и др. Тем не менее
к настоящему времени не представляется возможным говорить о
каких-либо научно доказанных факторах риска этого заболевания.Большинство исследователей в настоящее время придерживаются
мнения о полиэтиологичности саркоидоза. Накоплено много научных
фактов, свидетельствующих о том, что в основе возникновения саркои¬
доза лежат нарушения иммунных механизмов, ведущие к повреждению
соответствующих органов и тканей (аккумуляция Т-лимфоцитов и
мононуклеарных фагоцитов, формирование неказеозных эпителиоид-
ноклеточных гранулем с последующей их фиброзной трансформацией).Развитие при саркоидозе гранулемы иммунного типа (т.е. гранулемы,
являющейся следствием дисбаланса субпопуляций иммунорегулятор-
142 « ГЛАВА 2. ГРАНУЛЕМАТОЗЫных клеток и ослабления Т-клеточного звена иммунитета) свидетель¬
ствует в пользу предположения о том, что саркоидоз является результа¬
том иммунологических нарушений вследствие воздействия на организм
различных факторов экзогенного происхождения, изменяющих иммун¬
ный статус, или результатом первично измененного (г снстически-детер-
минированного) иммунного статуса. Таким образом, специфического
агента, вызывающего саркоидоз, до настоящего времени не найдено.ПатогенезНаиболее часто эффекторным органом воспаления при саркоидозе
являются легкие, однако могут также наблюдаться поражения кожи,
печени, глаз, костей, нервной системы, сердца. В связи с этим сарко¬
идоз определяют как мультиорганное заболевание неустановленной
этиологии, которое характеризуется Т-лимфоцитарно-моноцитарной
инфильтрацией в пораженных органах, формированием гранулем и
нарушением нормальной микроархитектуры ткани. То есть для саркои-
доза характерно развитие лимфоцитарно-моноцитарного типа воспале¬
ния, при этом саркоидныс гранулемы представляют собой скопления
активированных клеток моноцитарно-макрофагального ряда, а также
развивающихся в условиях воспаления гигантских многоядерных кле¬
ток, эпителиоидных клеток и лимфоцитов. Поскольку гранулемы при
саркоидозе содержат большое число лимфоцитов, их еще называют
«иммунными» — в отличие от гранулем, образующихся в ответ на
чужеродные неорганические агенты — такие, например, как силициум
или бериллий, соответственно при силикозе и бериллиозе.Д.Н. Маянский называл саркоидные гранулемы «аварийными
органами иммунитета», так как в них происходят иммунные реакции,
направленные на элиминацию неустановленных пока антигенов.
И действительно, в саркоидных гранулемах обнаружены антигени ре-
зснтирующие клетки моноцитарно-макрофагального ряда, а также
лимфоциты, осуществляющие иммунные реакции [1991].Результаты изучения клеток моноцитарно-макрофагального ряда
и лимфоцитов в легочной ткани и в периферической крови больных
саркоидозом легких показали, что активация характерна лишь для
клеток, полученных либо из ж БАЛ, либо из материалов ЧББ легких,
в то время как в периферической крови феномен активации клеток
отсутствует [МоИег D.R. et al., 1996J. Эти наблюдения позволили
создать концепцию о компартментализации воспалительного про¬
цесса в легочной ткани.
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ ■ 143У больных саркоидозом легких альвеолярные макрофаги освобож¬
дают целый ряд цитокинов, хемотаксических факторов для моноци¬
тов, что приводит к миграции моноцитов из крови в легочную ткань.
На активированное состояние клеток моноцитарно-макрофагально-
го ряда в легких больных саркоидозом указывает их способность к
спонтанному ех vivo освобождению ИЛ-1р, TNF-a, ИЛ-6, MIP-1 (мак-
рофагальный воспалительный протеин), МСР-1 (monocyte chemoattra-
ctant proteine — моноцит-хемоаттрактантный протеин), RANTES
(активатор и хемоаттрактант Т-лимфоцитов) [Nakayma Т. et al., 1996;
Romagnani S., 2003J.Результаты исследования клеточных культур свидетельствуюто том, что в свежевыделенных из ЖБАЛ альвеолярных макрофагах
больных саркоидозом повышена транскрипция мРНК (матричной
РНК) TNF-a и ее уровень снижается в течение последующих 24 ч
культивирования клеток in vitro [Moller D,R. et al., 1996; Romagnani S.,
2003J. Плейотропные эффекты TNF-a, в том числе его кахектиновые
свойства, однако, не проявляются на уровне организма у больных
саркоидозом легких. Эти наблюдения позволяют предполагать, что
в легочной ткани больных наряду с освобождением в повышенных
количествах TNF-a, также постоянно освобождаются TNF-a-связы-
вающие или нейтрализующие белки и противовоспалительные цито-
кины. В частности, уже доказано, что в ЖБАЛ больных саркоидозом,
в отличие от других ИЗ Л (например, от ИФА), существенно повыщен
уровень растворимых рецепторов к TNF-a (sTNF-aR), которые спо¬
собны к конкурентному связыванию с TNF-a, что приводит к сни¬
жению или отмене его токсических эффектов [Reiser Н., Stadecker JV1.J.,
1999]. Эти и другие данные легли в основу разработки новой патогене¬
тической стратегии терапии саркоидоза, основанной на применении
препаратов, являющихся либо блокаторами TNF-a, либо ингибитора-
ми TNF-a-сигнального каскада (ингибиторы р38, JNK, ERK, фактора
активации NFkB) [Reimold A.M., 2002J. Представляется перспектив¬
ным более широкое применение антицитокиновой и антисигнальной
терапии в клинической практике в дальнейшем.Гранулематозный тип воспаления, в основе которого лежит реак¬
ция гиперчувствительности замедленного типа, характеризуется
активацией Т-хелперов I типа. Одним из ключевых цитокинов для
индукции клеточного иммунного ответа в легких является ИЛ-12.
Взаимодействие ИЛ-12 со специфическими рецепторами на поверх¬
ностной мембране лимфоцитов приводит к активации синтеза y-lNF
и развитию клона Th 1-клеток. У больных саркоидозом обнаружены
144 • ГЛАВА2.ГРАНУЛЕМАТ03Ывысокие уровни экспрессии мРНК р70 и р40-субъединиц гетеродиме¬
ра ИЛ-12 [Lammi L. et al., 1997]. С помощью иммуногистохимических
методов показано, что ИЛ-12р40 экспрессируется эпителиоидными
клетками и макрофагами гранулем. Уровень экспрессии ИЛ-12р40
моноцитами крови также достоверно повышен, установлена поло¬
жительная корреляционная связь между уровнями Y-INF и ИЛ-12 в
сыворотке крови больных саркоидозом [Smith R,E. et al., 1995J,Активация Т-лимфоцитов наблюдается не только в альвеолярных
пространствах у больных саркоидозом, но и в гранулемах и в легочных
лимфатических узлах. Т-клетки саркоидных гранулем экспрессируют
в повышенных количествах мРНК ИЛ-2, ИЛ-6, TNF-y, причем уровни
экспрессии матричных РНК коррелируют с количеством этих цито-
кинов, определяемых в экстрактах лимфатических узлов [МоПег D.R.
et al., 1996].Иммуногистохимические исследования образцов ЧББ легочной
ткани у больных саркоидозом указывают на то, что Т-лимфоциты в
гранулеме распределяются следующим образом: СD4^-клетки, экс¬
прессирующие в повышенных количествах маркеры активации -- HLA-
DR, VLA-1 и CD25 (1L-2R), находятся преимущественно во внутренних
зонах гранулем, тогда как С08^-лимфоциты с небольшим числом мар¬
керов активации — в наружных зонах (Kern D. et al., 1993].В ЖБАЛ больных саркоидозом повышено не только общее число
Т-лимфоцитоБ, но и числоТ-лимфоцитов-хелперов (CD4'"). При актив¬
ном саркоидозе соотношение CD4VCD8+ в ЖБАЛ — так называемый
субпопуляционный индекс — может достигать 10 (при нормальном
соотношении 2,2).В отличие от «неиммунных гранулем», образующихся в ответ на
неорганические агенты (силигщум, бериллий и др.), -^иммунные»
гранулемы при саркоидозе легких не образуются без специфического
Т-клеточного ответа. В этой связи с большой вероятностью можно
предполагать, что инициирующий агент при саркоидозе обладает
свойствами антигенности, находится в нижних отделах респиратор¬
ного тракта, поглощается альвеолярными макрофагами и предостав¬
ляется в иммуногенной форме Т-лимфоцитам [МоИег D.R. et al, 1996].
Эти предположения подтверждаются также результатами экспери¬
ментальных исследований, в которых введение фрагментов мембран
альвеолярных макрофагов больных саркоидозом легких в кожу экс¬
периментальных животных вызывало развитие кожных саркоидных
реакций, а также способностью гранулем персистировать в пора¬
женной ткани [TbidJ. Таким образом, упомянутые выше факты сви¬
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 145детельствуют, что иммунная гранулема при саркоидозе не является
застывшим образованием. Можно выделить определенную динамику
формирования, роста, «созревания» гранулемы, и на всех этих ста¬
диях жизненного цикла гранулемы большую роль играют цитокины,
обеспечиваюш;ие межклеточные взаимодействия макрофагов, лим¬
фоцитов и на более поздних этапах — фибробластов. Акцессорные
и иммунокомнетентные клетки, составляющие гранулему, секрети-
руют цитокины, которые аттрактируют и активируют фибробласты.
Для саркоидоза характерен перигранулемный тип фиброзирования
[МоНег D.R. et al., 1996]. Поскольку процесс фиброзирования легочной
ткани носит необратимый характер, с целью его возможного предо¬
твращения проводится поиск маркеров интенсивности процесса фиб-
розообразования при саркоидозе, который, к сожалению, еще не при¬
вел к положительным результатам. Такие показатели, как активность
коллагеназы, гиалуронидазы, уровень проколлагенового пептидаІІ1 типа, а также уровни продуктов деградации фибриногена
(D-димер) не могут служить в качестве достоверных дифференци¬
альных критериев между процессом фиброзирования и нормальным
процессом обмена соединительнотканных структур легочной ткани
[Klemen Н, et al., 20001.Выделяют следующие показатели иммунореактивности, характе¬
ризующие прогрессирующее течение саркоидоза.Высокие уровни хемокинов в супернатантах клеток ЖБАЛ и
в самой жидкости БАЛ — СХС-хемокинов (MIP-1, МСР-1, RANTES),
а также СС-хемокина ИЛ-8 [Rolf M.W. et al., 1993]. Именно эти хемоки-
ны ответственны за рекрутирование эффекторньтх клеток воспаления
» легочную ткань.Повышенные уровни экспрессии ИЛ-2 и INF-у, а также CXCR3,
CCR5, ИЛ-UR, ИЛ-ISR, СВ4^Т-лимфоцитами ЖБАЛ [МоПег D.R.
et al., 1996; Edmondstone W., 1998; Katchr К. et al., 2003].Наибольшей прогностической ценностью обладает уровень синте¬
за TNF-a альвеолярными макрофагами. С помощью зіого критерия
можно выделить группу больных, у которых в ближайшее время заболе¬
вание будет прогрессировать и может перейти в стадию формирования
пневмофиброза [Reiser Н., Stadecker 1999; Reimold A.M., 2002].В последние годы внимание учёных привлекают растворимые
молекулы, к числу которых относятся рецепторы цитокинов — sTNF-
RI, STNF-R2, STL-2R, а также рецепторный антагонист ИЛ-1 (IL-lra) и
межклеточная адгезионная молекула-1 (sICAM-1). Эти молекулы син¬
тезируются и освобождаются различными клетками — участниками
146 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫвоспаления и определяются в ЖБАЛ больных с неактивной формой
заболевания, а их появление в периферической крови наблюдается
при активном саркоидозе [Baumer 1. et al, 1997; Ziegrnhagen M.W.
et al, 2003J. Роль растворимых молекул в регуляции иммунного вос¬
паления интенсивно изучается, поскольку их возможное применение
в клинической практике может существенно расширить подходы к
терапии больных. Уже доказано, например, противовоспалительное
и противофиброзирующее действие при саркоидозе растворимых
рецепторов к TNF, обусловленное их способностью к конкурентно¬
му связыванию с TNF-a, Дискутируется роль slL-2R в регуляции
Thl/Th2 типов иммунного ответа, а также иммунорегуляторная роль
ИЛ-1та и sICAM-1 IZiegrnhagen M.W. et al., 2003].Установлено, что ИЛ-6 как маркер активности воспаления при сар¬
коидозе имеет двойственную природу. При остром воспалении ИЛ-6
в синергизме с другими цитокинами — ИЛ-1р и TNF-a — необходим
для индукции острофазового ответа, характеризующегося лихорад¬
кой, активацией процесса миграции лейкоцитов из периферической
крови в очаг воспаления и продукцией гепатоцитами острофазо¬
вых белков ^Thomson А., 1998]. У больных с активным саркоидозом
отмечаются высокие уровни экспрессии ИЛ-6 альвеолярными мак¬
рофагами fPetrek М. et al., 1997]. При хроническом течении саркоидо-
за ИЛ-6 обладает иммунорегулирующими свойствами, способствуя
активации и пролиферации Т-лимфоцитов, а также синтезу антител
плазматическими клетками. В этой связи оценку значимости уровня
экспрессии ИЛ"6 как прогностического параметра саркоидоза необ¬
ходимо проводить с учетом активности заболевания [МоПег D.R. et al.,
1996; Ziegrnhagen M.W. et al., 2003].В настоящее время интенсивно изучается роль противовоспали¬
тельных цитокинов в иммунорегуляторных процессах при саркоидозе
легких, к их числу, как известно, относится ИЛ-10, ингибирующий
продукцию цитокинов, а также пролиферацию моноцитов и лимфо¬
цитов [Thomson А., 1998; Tong Z. et al„ 2003]. Важнейшим иммуно-
регуляторным фактором является также TGF-p, который имеет важ¬
ное прогностическое значение при саркоидозе, особенно для оценки
возможной спонтанной ремиссии заболевания. TGF-P, принадлежит
к суперсемейству протеинов, необходимых для клеточного роста и
дифференцировки, а также для синтеза белков внеклеточного мат¬
рикса. TGF-pj является также мощным иммуномодулятором, прояв¬
ляющим противовоспалительные свойства и ингибирующим развитие
ТЫ-клеток [МоПег D.R, et al., 1996; Thomson А., 1998; Rabin D.L. et
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 147а!,, 2001]. У больных со спонтанной ремиссией заболевания уровень
TGF-{3, существенно повышен в супернатантах клеток Ж БАЛ, при
прогрессирующем течении его содержание не отличается от контроль-
11ЫХ значений. Эти данные свидетельствуют о возможности существо¬
вания механизмов, подавляющих развитие гранулематозного воспа¬
ления при саркоидозе. Однако остается неясным, действительно ли
TGF-p| является ключевым цитокином, приводящим к спонтанной
ремиссии саркоидоза и, возможно, связанным с активацией особых
(юнуляций Т-лимфоцитов, либо он действует в синергизме с другими,
пока еще неизвестными ингибиторными факторами [МоИег D.R. et al.,
1996; Thomson А„ 1998; Costabel U., 200Ц.Таким образом, для более полной характеристики особенностей
иммунопатогенеза саркоидоза необходимо дальнейшее изучение цито-
киновой регуляции и межклеточных взаимодействий в легочной ткани
больных саркоидозом наряду с иммуногенетическими исследовани¬
ями, выявляющими особенности полиморфизма генов системы HLA
и ключевых цитокинов (ответственными за выработку АПФ, TNF-a,I снами рецепторов к витамину D и др.) [Thomson А., 1998; Grunewald J.,
liklund А., 2001J. Было отмечено, что у носителей HLA Al/B8/Cw7/DR3
антигенов саркоидоз достоверно чаще проявляется узловатой эритемой,
артралгиями и увеитом (т.е. острой формой болезни) и характеризуется
блаюириятньш прогнозом. У больных саркоидозом, носителей HLA-B13
антигенов (у японцев) и BW15 (у афро-американцев) болезнь чаще про¬
текает хронически. У жителей Скандинавских стран, носителей HLA-
1Ж17, заболевание ассоциировалось с хорошим прогнозом [Abe S. et ai,,
1987; Berlin М. et ai., 1997; Eklund A., Grunevald J., 2000]. Получены мно-
ючисленные доказательства, свидетельствующие о наличии врожден¬
ной предрасположенности к этому заболеванию. В частности, об этом
свидетельствуют расовые различия в частоте возникновения и особен¬
ностях течения болезни у представителей разных рас, многочисленные
описания семейных случаев заболевания. Болезнь может наблюдаться у
бл изнсн,ов (чаще у монозиготов, чем у дизиготных пар). Таким образом, в
настоящее время доминирует представление о саркоидозе как об имму-
1ІОЛО] ическом ответе на воздействие внешних специфических антигенов
при наличии генетической предрасположенности.Патологическая анатомияШтампованные гранулемы, содержащие единичные гигантские
клетки Пирогова—Лангханса, представляют собой основу морфоло¬
148 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫгической характеристики саркоидоза. Центральная часть грануле¬
мы состоит из эпителиоидных и гигантских многоядерных клеток.
Периферию гранулемы составляют преимущественно лимфоциты,
макрофаги, а также плазматические клетки и фибробласты. Все пере¬
численные клетки находятся на ранних стадиях дифференциации.
Плазматические клетки, располагающиеся по периферии грануле¬
мы, продуцируют иммуноглобулины, которые образуют скопления,
трансформирующиеся в последующем в гиалин (фиброзно-гиалиноз-
ная стадия). Преимущественная локализация гранулем — субплев-
ральная, периваскулярная, перибронхиальная и интерстициальная
ткань легких (рис. 2Л, см. цв. вклейку).Продуцирование активированными лимфоцитами и макрофагами
ряда медиаторов ведет к формированию так называемой бесказеозной
гранулемы с последующим превращением ее в фиброзную ткань.
Широкое внедрение в практику метода БАЛ, биопсийных методов
позволило доказать, что начальным морфологическим проявлением
саркоидоза является не эпителиоидноклеточная гранулема (как счи¬
талось ранее), а макрофагально-лимфоцитарный альвеолит (пред-
гранулематозная стадия). Таким образом, гистологически саркоидоз
можно определить как болезнь, характеризуемую формированием
во многих органах и тканях эпителиоидноклеточных гранулем без
казеозного некроза. Однако в части гранулем может иметь место
фибриноидный некроз в центре гранулемы, который предществует
либо резорбции гранулемы, либо ее гиалинизации. Фиброзированию
гранулем предшествует увеличение в них содержания щелочной
фосфатазы. У 5—10% больных саркоидозом легких развивается пнев¬
мофиброз (Ш—TV стадия саркоидоза), представляющий собой исход
заболевания.Гранулемы, определяемые при саркоидозе, имеют сходные черты
с туберкулезными, микотическими гранулемами, а также грануле¬
мами, обнаруживаемыми при ЭАА. Наибольшие диагностические
трудности возникают при дифференциации с гранулемами тубер¬
кулезной этиологии, отличающимися казеозным некрозом в центре.
Микоз может быть отдифференцирован с помощью серологических
и микробиологических методов. Определенные отличия имеют гра¬
нулемы при ЭАА: они менее правильной формы (чем при саркоидо¬
зе), с нечеткими границами, меньших размеров, не столь многочис¬
ленные (в отличие от саркоидоза), обычно исчезают через несколько
месяцев после прекращения контакта с антигеном. Инфильтрация
лимфоцитами и плазматическими клетками при саркоидозе опре-
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 149деляется только вокруг гранулем; при ЭАА такой закономерности
нет. Имеются определенные отличия и в локализации гранулем.
При саркоидозе они располагаются не только в интерстициальной
ткани легких и в подслизистом слое крупных бронхов, но и пери- и
интраваскулярно. Для ЭАА более характерно расположение гранулем
в интерстициальной ткани легких. При ЭАА никогда не определя¬
ется некроз в центре гранулемы, при саркоидозе иногда выявляется
гиалиновый, а при туберкулезе — как правило, казеозный некроз.
Значительные трудности представляет морфологическая дифферен¬
циальная диагностика саркоидоза с саркоидальным ангиитом легких.
По своему строению гранулемы при этом заболевании напоминают
саркоидньте, однако менее четко очерчены, гигантские клетки мень¬
ших размеров. В наиболее крупных гранулемах выявляются участки
некроза в центре. Основными отличительными особенностями гра¬
нулем при саркоидальном ангиите является их локализация — стенки
легочных артерий и вен, а также диффузная инфильтрация лимфоци¬
тами отдельных участков сосудов и околососудистой ткани.Саркоидоподобные гранулемы (так называемая саркоидная реак¬
ция) в легких, лимфатических узлах и других органах (печень, селе¬
зенка и т.д.) могут определяться при туляремии, сальмонеллезе,
листериозе, гистоплазмозе, кокцидиодомикозе, кандидамикозс,
актиномикозе, цитомегаловирусной инфекции, Ку-лихорадке, сифи¬
лисе, паразитарных заболеваниях (аскаридоз, амебиаз, шистосомозы,
анкилостомоз), последствиях иммунологических аберраций, лекарс¬
твенной болезни, болезни крона, язвенном колите, первичном били¬
арном циррозе, ревматизме, СПИДе, лимфогранулематозе, ГХЛ, ГВ,
при наличии дефектов ферментативных систем, новообразованиях,
кри воздействии на организм некоторых химических веществ (берил¬
лий, крахмал, силикон, кремний, некоторые медикаменты).Клиническая картинаОрганы дыхания вовлекаются в патологический процесс при сар-
коидозс в 95% случаев. В зависимости от клинических проявлений
вьЕделяют острое, хроническое и генерализованное течение саркои¬
доза легких.Для острой формы саркоидоза, наблюдаемой у 12-20% больных,
характерны следующие симптомы:— лимфаденопатия средостения;- повышение температуры тела (у 23% больных);
150 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫ— артралгии (75%);— узловатая эритема (66%);— увеличение периферических лимфатических узлов (58%);— боли в грудной клетке (50%);— сухой кашель (41%);— похудание (25%).Симптомокомплекс, включающий лимфаденопатию средостения,
повышение температуры тела, узловатую эритему, артралгии и увели¬
ченную СОЭ, получил название синдрома Лефгрена (Lofgren). Синдром
Лефгрена встречается преимущественно у женщин до 30 лет и в 80—85%
случаев заканчивается спонтанным обратным развитием болезни.Узловатая эритема представляет собой гиперергическую реак¬
цию. Эритематозные узелки, слегка приподнятые над кожей, могут
возникать на любом участке тела, хотя излюбленной локализацией
узловатой эритемы являются голени, бедра, разгибательная повер¬
хность предплечий. Отдельные узелки могут сливаться, образуя
участки отека кожи. Кожные элементы узловатой эритемы разреша¬
ются в течение 3-4 нед. Лимфаденопатия средостения при синдроме
Лефгрена, как правило, двусторонняя (лишь в 1—3% случаев — одно¬
сторонняя).Острое течение может проявляться также увеитом, поражением
слюнных желез, 7-й пары черепно-мозговых нервов и лихорадкой
(синдром Хеерфорда—Вальденстрема). Преимущественно встречается
передний и задний увеит (60-70% от обшего числа).Бессимптомное течение при первично-хронической форме отме¬
чается у 40-50% больных и выявляется случайно при профилакти¬
ческом флюорографическом обследовании. Следует отметить, что
частота встречаемости бессимптомных форм болезни, приводимая
отдельными авторами, колеблется в широких пределах. Эти разли¬
чия зависят от того, насколько широко в конкретном регионе (стра¬
не) проводится профилактическое рентгенологическое обследование
(флюорография) населения, скрининговые исследования. У другой
половины заболевших начало болезни может быть малозаметным и
постепенным. Иногда больные отмечают некоторый дискомфорт за
грудиной, слабость, повышенную утомляемость, потливость. Может
быть сухой кашель (редко со скудной слизистой мокротой). По мере
прогрессирования болезни может возникнуть одышка, проявляюща¬
яся при умеренной физической нагрузке. Выраженная одышка отме¬
чается у больных ПІ—IV стадией заболевания.
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ *151Повышение температуры тела до субфебрильных цифр отмечают
25% больных. Кровохарканье для больных саркоидозом нехарактерно.
Крайне редко кровохарканье может наблюдаться в виде осложнений
у больных 111—IV стадией заболевания (при наличии тракционньтх
бронхоэктазов, аспергиллем или присоединившейся ТЭЛА).Отличительной особенностью клинической картины саркоидоза
является отсутствие параллелизма между выраженностью морфоло¬
гических изменений в соответствуюш,ем органе и скудностью кли¬
нических проявлений. Параллелизм отсутствует также между выра¬
женностью клинических проявлений и степенью рентгенологических
изменений. Так, по нашим данным, 54% больных не отмечают одыш¬
ки, несмогря на наличие рентгенологически выявляемого синдрома
легочной диссеминации.При физикальном обследовании на коже могут определяться измене-
и ИЯ по типу узловатой эритемы (при синдроме Лефгрена) или подкожные
уплотнения (редко), увеличенные периферические лимфатические узлы
(надключичные, заднешейные и др.). Акроцианоз (цианоз) определяется
голько в далеко зашедшей стадии заболевания. У большинства больных
саркоидозом легких (65%) аускультативная картина не отличается от
1юрмы. Реже (у 20%) отмечается ослабление везикулярного дыхания,
Крепитация для больных саркоидозом нехарактерна. Она может выслу¬
шиваться у больных на стадии формирования «сотового легкого^.Чаше всего определяется увеличение поверхностных шейных,
мадключичных лимфатических узлов, реже выявляются увеличен¬
ные подмышечные и еще реже — локтевые и паховые лимфатические
у$лы. Лимфатические узлы, вовлеченные в патологический процесс
при саркоидозе, обычно не спаяны между собой и окружающими
I канями, имеют четкие границы и плотноэластическую консистен¬
цию, безболезненны при пальпации. В отличие от туберкулеза и рака
.'гимфатические узлы при саркоидозе не имеют склонности к распаду
и образованию свищей.Верхние дыхательные пути также могут поражаться саркоидозом.
Изменения на слизистой носа выявляются у 20% больных, глотки —
» 5% случаев. Описаны случаи поражения миндалин окологлоточно¬
го кольца, голосовых связок. Плотные узелки с гиперемированной
периферией или бледно-желтые бляшки могут выявляться на языке,
м я гком и твердом нёбе, на миндалинах. Сравнительно редко диагнос-
гируется гингивит саркоидной природы (в сочетании с саркоидозом
лимфатических узлов средостения). Клинически гингивит прояв-
152 * ГЛАВА 2. ГРАНУЛЕМАТОЗЫляется возникновением на слизистой оболочке полости рта и деснах
множественных гранулематозных изменений, иногда с поверхност¬
ными изъязвлениями.Поражение плевры клинически проявляется у 2—4% больных.
Это могут быть плевральные наслоения, спонтанный пневмото¬
ракс, плевральный выпот (в 1-3% случаев) одно- или двусторонний.
Массивные выпоты для саркоидоза нехарактерны. Плевральная жид¬
кость может быть экссудатом, транссудатом и очень редко геморра¬
гической. Плевральные выпоты при саркоидозе могут выявляться
на любой стадии болезни и во всех случаях требуется тщательная
дифференциальная диагностика с целью исключения других причин
гидроторакса: туберкулез, бактериальная или микотическая инфек¬
ция, опухолевый процесс, сердечная недостаточность.Поражение печени, как известно, при саркоидозе стоит на первом
месте после органов дыхания (диагностируется у 50-90% больных).
Гепатомегалия определяется в 20—30% случаев, У большинства паци¬
ентов поражение печени клинически не проявляется. Описаны случаи
лихорадки неясного генеза при поражении печени. Функция печени,
как правило, не нарушается, однако может регистрироваться уме¬
ренное повышение в сыворотке крови уровня щелочной фосфатазы,
трансаминаз, билирубина. Описаны случаи, когда саркоидные гра¬
нулемы приводили к внутрипеченочному холе стазу и даже к циррозу
печени, портальной гипертензии. Лапароскопия с биопсией печени
(или пункция печени тонкой иглой) может иметь важное дифферен¬
циально-диагностическое значение. Нахождение эпителиоидных гра¬
нулем в печени нельзя рассматривать в качестве патогномоничного
признака саркоидоза, так как гранулемы саркоидного типа в печени
могут обнаруживаться во многих случаях, не связанных с саркоидо-
зом: побочное действие лекарственных препаратов, инфекционные
заболевания, заболевания лимфоретикулярной системы.Спленомегалия наблюдается у 5—15% больных саркоидозом, как
правило, с минимальными клиническими проявлениями. О пораже¬
нии селезенки может свидетельствовать лейкопения. Из более тяже¬
лых проявлений поражения селезенки следует отметить тромбоцито-
пению, гемолитическую анемию, разрыв селезенки. Описаны случаи
панцитопении.Поражение кожи при саркоидозе отмечается в 25-50% случаев.
Можно выделить две разновидности поражения кожи: специфи¬
ческое (гранулематозное) и неспецифическое (негранулематозное).
Примером неспецифического поражения кожи при острой форме
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 153саркоидоза является узловатая эритема — гиперергическая кожная
реакция (эритематозные узелки, симметрично располагающиеся по
передней поверхности конечностей, исчезающие самопроизвольно
через 2-4 нед). На месте узловатой эритемы могут оставаться участки
гиперпигментации. Узловатая эритема нередко сочетается с лихорад¬
кой, артралгиями, увеличенной СОЭ, острым увеитом.По данным разных авторов, специфический гранулематозный
саркоидоз кожи выявляется у 4-35% больных и ассоциируется с хро¬
ническим течением и более неблагоприятным прогнозом. Поражение
кожи может быть в виде гипер- или гипопигментированных пятен,
папул, бляшек, узлов, язв, рубцов, а также Lupus pernio (ознобленная
волчанка). Описаны и более редкие проявления саркоидоза кожи;
эритродермия, ихтиозиформные высыпания, келоиды, аннулярньте
высыпания, изменения по типу узловатой эритемы, диссеминирован¬
ный ангиолюпоид, рубцовая аллопеция, псориазоформные пораже¬
ния и др. Набухание, покраснение и увеличение рубцов на коже может
служить индикатором активности саркоидоза. Среди больных с
саркоидозом кожи преобладали женщины (в отношении к мужчинам
5;1) [Самцов А.В. и соавт., 2001], В клинике кожных болезней Военно-
медицинской академии им. С.М. Кирова (заведующий кафедрой —
нроф, А.В. Самцов) разработаны схемы лечения ознобленной вол¬
чанки: на фоне длительного приема системных глюкокортикоидов
рекомендуются курсы проспедина (на курс 3-4 г) и плазмафереза.
Начальную дозу глюкокортикоидов (30 мг из расчета на преднизо-
лон) постепенно снижают в течение 4—6 мес. Проведение 3—4 курсов
комбинированного лечения обеспечивает стойкую ремиссию у 70%
пациентов с ознобленной волчанкой в течение двух лет.Поражение глаз и их структур при саркоидозе встречается прибли¬
зительно у П-83% больных (Constantino Т. et al., 2000J. По результатам
исследования С.Г. Поповой, поражение глаз выявляется у 15% паци¬
ентов саркоидозом легких [2005]. Автором определены осложнения
саркоидозных увеитов, которые могут привести к стойкому, иногда
необратимому снижению зрительных функций: катаракта, вторичная
rjrayKOMa, центральная дегенерация сетчатки, атрофия зрительных
нервов.Гранулематозный увеит может протекать остро или хронически, быть
одно- или двусторонним. Богатая сосудами конъюнктива вовлекается в
патологический процесс в 10-60% случаев, слезные железы — в 10—12%
случаев, радужная оболочка — у 5—7% больных. Поражение слезных желез
и конъюнктивы нередко протекает субклинически. В патагюгический
154 • ГЛАВА 2, ГРАНУЛЕМАТОЗЫпроцесс может вовлекаться и зрительный нерв, что может быть признаком
поражения нервной системы. Саркоидоз слезных желез (нередко дву¬
сторонний) выявляется у 5-15% больных и напоминает по клиническим
проявлениям синдром Съегрена [Tanouc L.T., Elias J.A., 2004].Во всех случаях СОД консультация окулиста больному обяза¬
тельна. И наоборот, выявление окулистом увеита неясной этиологии
должно служить поводом для направления больного на рентгеногра¬
фию органов грудной клетки.Саркоидоз сердца впервые был описан в 1929 г., первый случай
смерти от саркоидозного миокардита — в 1937 г. Вовлечение сердца в
патологический процесс является, как правило, следствием систем¬
ного саркоидоза. Локализация гранулематозной инфильтрации может
быть различной, однако чаще саркоидозом поражаются миокард
левого желудочка и папиллярные мышцы. Нарушения в проводящей
системе сердца (при локализации изменений в задней части перего¬
родки, зоне атриовентрикулярного узла и пучка Гиса) клинически
и электрокардиографически могут проявляться соответствующими
нарушениями ритма вплоть до полной блокады сердца. Из нарушений
ритма чаще встречается желудочковая тахикардия, реже — предсерд¬
ные аритмии. Возникновение предсердных аритмий связывают не с
1'ранулематозным поражением, а с дилатацией предсердия, развиваю¬
щейся вследствие дисфункции левого желудочка.Частота поражения сердца, по данным разных авторов, колеблется
в широких пределах. Поражение сердца, на основании морфологи¬
ческих исследований, полученных во время аутопсий, наблюдается у
20—27% больных саркоидозом. Однако только 596 больных имеют кли¬
нические проявления, которые часто являются неспецифичными, что
значительно усложняет диагностику.Саркоидная инфильтрация с последующими фиброзными измене¬
ниями стенок камер сердца электрокардиографически проявляется при¬
знаками трансмурального инфаркта и может привести к формированию
аневризмы. Диффузный саркоидный гранулематоз миокарда ведет к
развитию так называемой дилатационной кардиомиопатии, прогноз при
которой неблагоприятен. Локализация саркоидных гранулем в сосоч¬
ковых мышцах может привести с течением времени к недостаточности
клапанов. Клиническая диагностика поражения сердца представляет
значительные трудности, так как боли за грудиной, перебои в области
сердца, одышка при умеренной физической нагрузке, отеки на ногах,
а также электрокардиографические изменения могут напоминать про¬
явления ишемической болезни сердца (в ряде случаев даже острого
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 155инфаркта миокарда), миокардита. В 15—17% случаев внезапная смерть
может быть первым проявлением заболевания, чаще у молодых людей
[Добин В.Л., Калиничев ГЛ., 1991]. Это обусловливает важность своевре¬
менной прижизненной диагностики поражения сердца.В последнее время появились работы, свидетельствующие о том,
что хроническое легочное сердце при саркоидозе легких развивается
не только вследствие распространенного пневмофиброза при IV ста¬
дии заболевания, но может быть одним из признаков непосредствен¬
ного поражения саркоидозом сердца [Моисеев СВ., 20011. В связи с
низкой информативностью эндомиокардиальной биопсии (40-45%)
особое внимание уделяется другим методам исследования, позволя¬
ющим с большой вероятностью предполагать поражение миокарда
саркоидозом fUemura Akihisa, 1999].В НИИ пульмонологии СПбГМУ им. акад. И.ГГ. Павлова был пред¬
ложен комплекс методик, включающий эхокардиографию, электро¬
кардиографию и (или) суточное мониторирование сердечной деятель¬
ности, сцинтиграфию миокарда, исследование липидного спектра
(для исключения сопутствующей сердечно-сосудистой патологии),
и позволяющий установить поражение саркоидозом сердца у 6% боль¬
ных саркоидозом легких [Лебедева Е,В., 2004].Клинически установленным саркоидоз сердца считается в случа¬
ях, когда диагноз саркоидоза подтвержден биопсией любого другого
органа или установлен клинико-рентгенологически саркоидоз легких
и имеется один из признаков, перечисленных в пункте «а» и один
или более признаков из пунктов «б—г» [Критерии рекомендованы
Sarcoidosis Division of the Specific Diffise Pulmonary Disease Research
Group (Japanese Ministry of Health and Welfare)]:- атриовентрикулярная блокада, желудочковая тахикардия,
желудочковые экстрасистолы, патологическая 0-волна, изме¬
нения сегмента ST—T при электрокардиографии или суточном
мониторировании сердечной деятельности;— наличие участков асинергии в левом желудочке, истончения
или гипертрофия стенок левого желудочка, снижение общей
сократительной способности миокарда левого желудочка,
выявленные при эхокардиографии;— выявление при радионуклидном исследовании сердца дефек¬
тов перфузии;- при сцинтиграфии миокарда с ’'’"'[Тс] или дефектов накопле¬
ния во время сцинтиграфии с ^^[Ga]-цитратом (рис. 2.2, 2.3,
см. цв, вклейку; 2.4);
156 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫ— изменение амплитуды движения стенок или снижение фрак¬
ции выброса левого желудочка при вентрикулографии.Однако диагноз саркоидоза сердца становится абсолютно досто¬
верным, когда во время гистологического исследования биоптатов
миокарда, полученных при эндомиокардиальной биопсии или
оперативном вмешательстве, выявлены эпителиоидно-клеточные
гранулемы.Зарубежные публикации последних лет свидетельствуют об успеш¬
ном применении магниторезонансной томографии в диагностике сар¬
коидоза сердца.Поражение почек клинически проявляется у больных саркоидозом
сравнительно редко (1—10%). Одним из хорошо известных осложнений
является гиперкальдиемия и гиперкальцийурия. Последняя может
протекать бессимптомно. С гиперкальциемией и гиперкальцийурией
связано развитие нефролитиаза, нефрокальциноза и, как следствие,
почечной недостаточности. Однако это осложнение наблюдается
редко, как и саркоидозный гломерулонефрит.Частота вовлечения в патологический процесс костного мозга
при саркоидозе изучена недостаточно, так как пункция грудины и
биопсия костного мозга проводятся редко. По-видимому, по этой
причине столь различны данные разных авторов о частоте встречае¬
мости этой патологии: от О до 43%; в среднем — около 20%. Поражение
костного мозга может быть заподозрено на основании данных анализа
периферической крови (анемия, лейкопения, тромбоцитопения).Приблизительно у 5% больных саркоидозом определяются изме¬
нения в костях. При рентгенологическом исследовании преимущес¬
твенно в фалангах пальцев кистей и стоп определяются множествен¬
ные очаги разрежения костной ткани. Кистообразные разрежения
могут определяться в костях черепа, позвонках, а также в длинных
трубчатых костях. Поражение костей может не проявляться клини-Л*Рис. 2.4. Однофотонная эмиссионная компьютерная томограмма миокарда
с ‘’^[Са]-цитратом. Очаг патологического накопления радиофармпрепарата
в передней стенке левого желудочка
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ * 157чески, однако описаны случаи припухання тканей и болезненности
в области поражения.Суставы вовлекаются в патологический процесс у 25—50% больных
саркоидозом. Артралгии, асептические артриты отмечаются преиму¬
щественно в крупных суставах. Артралгии, как правило, мигрирую¬
щие, в редких случаях определяется деформация суставов.Описаны поражения скелетных мышц, как правило, без нарушения
их функций; в редких случаях с клиническими проявлениями поли¬
миозита (ПМ).Поражения нервной системы определяются приблизительно у 5—7%
больных саркоидозом. Одним из поражений центральной нервной сис¬
темы может быть базилярный гранулематозный менингит. Менингит
саркоидозной этиологии очень часто остается нераспознанным, так
как в большинстве случаев протекает без клинических проявлений.
Однако исследование спинномозговой жидкости позволяет выявить
характерные для саркоидозного менингита признаки: повышение
концентрации белка, сахара, лимфоцитоз. Отрицательные резуль¬
таты цитологического, вирусологического и бактериологического
исследований (отсутствие кислотоустойчивых бактерий, культурьі
грибов, антител к вирусам) свидетельствуют в пользу саркоидозного
менингита,У половины больных нейросаркоидозом в патологический про¬
цесс вовлекаются черепно-мозговые нервы. Так, нередко выявляется
одно- или двустороннее поражение лицевого нерва. На втором месте
по частоте — поражение зрительного нерва. Далее следуют IX и X
пара черепно-мозговых нервов, поражение которых проявляется дис-
фагией, охриплостью, отсутствием рвотного рефлекса, дисфункцией
голосовых связок и др. [Tanoue L.T., Elias J.A., 2004]. Описаны пораже¬
ния гипофиза и гипоталамуса. Признаки поражения периферической
нервной системы (моно- или поли нейропатии) выявляются у 15%
больных с нейросаркоидозом.В последние годы в диагностике нейросаркоидоза ведущая роль
отводится магнито-резонансной томографии, позволяющей выявить
специфические очаговые изменения в головном и спинном мозге.Поражения щитовидной железы клинически могут проявляться
гинертиреоидизмом с диффузным зобом, полиаденопатией и повы¬
шением температуры тела.Как уже упоминалось, поражение коры надпочечников с клини¬
ческими проявлениями синдрома Аддисона встречается исключи¬
тельно редко. Описаны поражения репродуктивных органов, однако
158 • ГЛАВА2. ГРАНУЛЕМАТОЗЫразвитие бесплодия у этих больных — редкость. Беременность, как
правило, не влияет iia течение саркоидоза и в большинстве случаев
приводит к обратному развитию заболевания, однако после прекра¬
щения лактационного периода возможен рецидив болезни.Увеличение околоушных слюнных желез наблюдается у больных
саркоидозом, как правило, двустороннее и проявляется клиничес¬
ки у 6—8% больных. Паротит, как уже упоминалось, входит в клас¬
сический симптомокомплекс Хеерфордта-Вальденстрема. Наряду
с этим саркоидоз может поражать подчелюстные и подъязычные
слюнные железы. Описаны единичные случаи ксеростомии. Другие
экзокринные железы (предстательная, поджелудочная) поражаются
еще реже.Поражение саркоидозом желудочно-кишечного тракта диагности¬
руется, как правило, на аутопсии или при хирургических вмешатель¬
ствах, так как протекает в основном бессимптомно.Клинические признаки активности саркоидозаОпределению критериев активности саркоидоза посвящены мно¬
гочисленные исследования. Мнения на этот счет противоречивы.Однако в «Соглашении» Американского торакального общества,
Европейского респираторною оби^есгва и Всемирной ассоциации
саркоидоза и других гранулематозов [Hunninghake G.W. et al, 1999]
определен следующий перечень признаков (маркеров), характеризую¬
щих активность саркоидоза.• Клинические признаки активности: лихорадка, увеит, узловатая
эритема, Lupus pemio, изменения рубцов, полиартралгия, спле-
номегалия, лимфаденопатия, увеличение слюнных или слезных
желез, признаки поражения сердца, паралич лицевого нерва и
другие признаки нейросаркоидоза, прогрессирование респира¬
торных симптомов (одышка, кашель).• Биохимические и инструментальные признаки активности:
АПФ сыворотки крови, гиперкальциемия, отклонения показа¬
телей функции печени, лимфоцитоз и увеличение соотношения
CD4/CD8 в жидкости БАЛ; изменения на электрокардиограмме,
при эхокардиографии и при сцинтиграфическом исследовании
с радиоактивным таллием; ухудшение ФВД.• Рентгенологические признаки активности: прогрессирование
изменений на рентгенограммах и КТ, обнаружение поражения
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ * 159костей (кист), в последнее время в клинической практике широко
применяется ВРКТ для оценки течения патологического процес¬
са, позволяющая своевременно диагностировать переход первой
стадии во вторую.Классификацияв соответствии с международными соглашениями Европейского
респираторного общества, Американского торакального общества и
Всемирной ассоциации саркоидоза и других гранулематозов стадии
болезни определяются на основе данных рентгенологического иссле¬
дования органов грудной клетки;• О стадия; изменения на рентгенограммах отсутствуют;• I стадия: двусторонняя прикорневая лимфаденонатия;• П стадия: двусторонняя прикорневая лимфаденонатия, измене¬
ния в легочной паренхиме;• III стадия: изменения в легочной паренхиме без двусторонней
прикорневой лимфаденопатии;• IV стадия; фиброзные изменения в легочной ткани, включая фор¬
мирование «сотового легкого».В О стадию отнесены пациенты, у которых отсутствуют изменения
на рентгенограммах органов грудной клетки, однако имеются экстра-
торакальные проявления саркоидоза. Тем не менее у значительной
части этих больных могут быть выявлены гранулемы в биопсийном
материале легочной ткани. По обобщенным статистическим дан¬
ным, число пациентов с О стадией составляет 5-10% от общего числа
больных саркоидозом, пациентов с Ї стадией — 40-60%, II стади¬
ей — 15—30%, III сталией — 10-15%, IV стадией — 5—10% [Statement on
sarcoidosis, 1999].ОсложненияОсложнения заболевания, как правило, диагностируют у больных
СОД III и IV стадии в виде; ТЭЛА, развивающейся на фоне правоже¬
лудочковой сердечной недостаточности и присоединения микотичес¬
кою или инфекционного процесса (включая туберкулез) у больных со
сниженной иммунореактивностью (длительно принимавших глюко-
кортикоиды).
160 • ГЛАВА2. ГРАНУЛЕМАТОЗЫДиагностикаСогласно рекомендациям «Соглашения» Американского торакаль¬
ного общества, Европейского респираторного общества и Всемирной
ассоциации саркоидоза и других гранулематозов [Hunninghake G.W. et
al., 1999], для установления диагноза саркоидоза крайне желательно
наличие трех критериев:— клинические и рентгенологические проявления болезни соот-
ветствугот саркоидозу;— при исследовании биопсийного материала выявляются эпите-
лиоидные гранулемы без некроза;— другие причины гранулематозных изменений исключены.Типичных для саркоидоза изменений гемограммы нет. Средниепоказатели гемоглобина, числа эритроцитов и лейкоцитов у больных
саркоидозом не выходят за пределы нормальных величин. Лейкопения
наблюдается приблизительно у 30—35% больных. Лейкоцитоз и СОЭ
свыше 20 мм/ч определяются у больных острой формой саркоидоза
(синдром Лефгрена). У более половины больных саркоидозом (55%)
СОЗ не превышает 15 мм/ч.Эозинофилия периферической крови (свыше 5%) отмечается при¬
близительно в 20% случаев саркоидоза, причем преимущественно у
больных, которым в течение длительного времени назначались анти¬
бактериальные препараты.Абсолютная лимфопения (1,65±0,47х10/л) регистрируется у 53%
больных, что свидетельствует о нарушениях в системе иммунитета.
Как уже упоминалось, лимфопения возникает преимущественно за
счет статистически значимого абсолютного и относительного умень¬
шения числа Т-клеток периферической крови.Увеличение абсолютного числа В-клеток отмечается почти у
половины больных (43%). Об активации В-системы иммунитета
свидетельствует также повышение уровня TgA (у 60% больных), IgM
(у 25—50% больных), В период ремиссии уровень IgA имеет тенден¬
цию к снижению до нормальных величин. Существенной динамики
уровней IgG у больных саркоидозом легких не отмечено. Уровень
IgM достоверно превышает норму, в особенности у больных I стади¬
ей саркоидоза.Значительное повышение (нередко в несколько раз) содержания
ЦИК имеет место у больных острой формой саркоидоза и при обос¬
трении хронического течения. Число лимфоцитов с фенотипом Т4 в
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ *161периферической крови достоверно снижается, что ведет к снижению
субпопуляциониого индекса Т-лимфоцитов (хелперы/супрессоры).в НИИ пульмонологии СПбГМУ им. акад. И.П. Павлова для выяв¬
ления наиболее значимых иммунологических параметров для оценки
прогноза течения сарком доза легких были определены уровни TNF-a,
IFN-y, ИЛ-10, ЦИКТ, ЦИКИ и IgA, IgG, IgM в сыворотке крови
у 94 болм1ых с впервые выявленным СОД в зависимости от стадии
заболевания (табл. 2.1).Таблица 2.1. Средние иммунологические показатели в сыворотке крови
больных саркоидозом органов дыхания при различных стадиях
воспалительного процессаСтадияIL-10,пг/млTNF-0,Г/МЯINF-y,пг/млigA.мкг/млigG,мкг/мл>дм,икг/мпЦИК,%INF-rIL-101 стадия13,5±33,12±19,5±2,65+12,51+2,03+252,2+1,61 +п=131,34"*3,1*1,99**0,11*0,64*0,2*25,09*01*^II стадия29,03+36,47±74,41 +1,88+12,11 +1,87+152,8+4,58±п=282,88*з,г7.38*0,150,75*0.1714,26*0.3**III стадия42,54+57,26+69,47±2,52+11,21 +1,88±195,4+11,31±п=234,14'5,6*"6,84‘0,24*1,10.179,17*0,1**IV стадия40,73±30,27±151,0±2,56±11,17+1,01±204,0±1,31±N=154,6*3,015,0*'0,23*0,970.120,19*0,3**ДонорыN=206,0±0,521,0±
1,40+0,51,9±0,099,8±0,71,3±0,180.0±7,70+0Примечания:* — достоверность различий от доноров (/j<0,05);# — достоверность различий между стадиями (/?<0,05).Как известно, направление дифференцировки CD4' Т-лимфо¬
цитов, определяющее тип специфического иммунного ответа, кон-
гролируется цитокинами, продуцируемыми в ходе воспалительной
реакции. По преобладанию продуктов Thl или Th2 можно судить о
характере иммунного ответа. Достоверное повышение провоспали-
іельного цитокина TNF-a определялось в периферической крови у
больных саркоидозом легких I, П, ПІ стадий (по сравнению с доно¬
рами). При IV стадии заболевания уровень TNF-a не отличался от
контрольных значений.Содержание провоспалительного цитокина INF-y и противовос¬
палительного цитокина ИЛ-10 было достоверно повышено в сыво¬
ротке крови больных сод на всех стадиях патологического процесса.
162 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫОтмечалась сильная положительная корреляция между содержанием
INF-y и ИЛ-10 в периферической крови больных СОД: коэффици¬
ент корреляции Пирсона составил г = 0,877, р <0,005, коэффициент
детерминации составил = 0,769. Полученные результаты позво¬
лили предложить для оценки течения заболевания коэффициент
к = (lNF-y)/(IL-10), равный соотношению наиболее патогенетически
значимых медиаторов воспаления при реакции гиперчувствительно-
сти замедленного типа. Значения коэффициента к достоверно
{р <0,05) было повышено по сравнению с донорами и отличалось на
различных стадиях заболевания.Учитывая то, что патологический процесс при саркоидозе лег¬
ких локализуется, как правило, в респираторной зоне легких, диаг¬
ностическая информативность исследования мокроты невелика.
Показатели анализа мочи, концентрационной и выделительной функ¬
ций почек, как правило, не отклоняются от нормы. В случаях пораже¬
ния почек определяются выраженные в различной степени функцио¬
нальные нарушения.Гиперкальцийурия может иметь место без гиперкальциемии крови
и регистрируется приблизительно у 18—40% больных (по данным
разных авторов). Частота гиперкальциемии составляет от 2 до 63%,
в среднем у 15—18% больных. При субактивном саркоидозе гиперкаль-
циемия может быть транзиторной. Отмечено, что гиперкальциемия
чаше встречается у больных, проживаюших в районах с повышенной
инсоляцией. Нефрокальциноз встречается сравнительно редко и
объясняется отложением кальция в канальцах почек. Нормализация
метаболизма кальция происходит в первые 2 нед лечения глюкокор¬
тико идами. В тех случаях, когда, несмотря на лечение, обмен кальция
не нормализуется, следует предположить наличие у больного первич¬
ного гиперпаратиреоидизма.Уровни сиаловьтх кислот и гаптоглобина в сыворотке крови не
выходят за пределы умеренных сдвигов. С-реактивный белок не
выявляется у половины больных, у другой половины регистрируется
в умеренных количествах.у больных саркоидозом имеются существенные изменения экскре¬
ции с мочой биохимических ее компонентов, а также в системе протеа-
зы~антииротеазы сыворотки крови. Однонаправленность этих сдвигов
может свидетельствовать о выраженных в различной степени наруше¬
ниях обмена в межуточной соединительной ткани легких. Таким обра¬
зом, исследование биохимических показателей крови и мочи не имеет
существенного дифференциально-диагностического значения.
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 163У больных саркоидозом АПФ усиленно продуцируется ^іпителио-
идными клетками саркоидных гранулем, что позволило использовать
(1>акт повышения АПФ в сыворотке крови больных саркоидозом в
качестве не только диагностического теста, но и показателя актив-
I юсти патологического процесса. Уровни АПФ повышены у 50—75%
больных, не получавших лечение. Нормальная величина АПФ опре¬
деляется у 90% здоровых пациентов. Это значит, что в 10% случаев
результаты ложноположительные. Повышенные уровни АПФ регис-
ірируются и при других заболеваниях (сахарный диабет, вирусный
гепатит, гипертиреоз, силикоз, асбестоз, бериллиоз, проказа, болезнь
Г{)шс), что, несомненно, снижает диагностическую ценность этого
показателя. Однако при ряде заболеваний бронхолегочной систе¬
мы (туберкулез, бронхиальная астма, хроническая обструктивная
болезнь легких, рак легкого) уровень АПФ снижается (в отличие от
саркоидоза). На фоне лечения гл юкокортикоидами больных саркои¬
дозом уровень АПФ снижается у большинства больных. В сыворотке
крови больных саркоидозом определяется также повышение уровня
іизоцима— фермента, содержащегося в гранулоцитах и моноцитах
крови. Несмотря на то что существует корреляция между повышением
уровня АПФ и лизоцима в периферической крови, диагностическая
ініформативность последнего недостаточна, так как активность лизо¬
цима повышается при очень многих заболеваниях.В последние годы большое значение для оценки активности сар¬
коидоза придают определению в ЖБАЛ содержания D-димера — про¬
дукта деградации фибриногена [Andrew F. Shorr et al, 2000; Kawada Н.
L‘l al., 2005]. В исследовании, проведенном Rafael L. Perez и соавт.
12007], уровень D-димера в ЖБАЛ превышал нормальные значения
у 61% афроамериканцев, больных саркоидозом, и только у 21% белых
пациентов по сравнению с контролем (<71 ng/ml).Проба Квейма. Экстракт из пораженного саркоидозом лимфати¬
ческого узла (названного впоследствии антигеном Квейма) автор
I Kveim А., 1941] ввел 13 больным саркоидозом, и у 12 из них в месте вве¬
дения в промежуток времени от 9 дней до 4 нед образовались узелки,
гистологическое исследование которых подтвердило диагноз саркои¬
доза (эпителиоидноклеточная гранулема). Последующие электронно¬
микроскопические исследования показали, что по своей ультраструк-
гурс сформировавшиеся Квейм-гранулемы аналогичны саркоидным.
Лимфоциты, составляющие приблизительно одну треть клеток гра¬
нулемы, представлены Т-хелперами и Т-супрессорами. Улиц конт¬
рол 1>([ой группы через 2 нед в месте введения плацебо были выявлены
164 • ГЛАВА2.ГРАНУЛЕМАТОЗЫЛИШЬ незначительные скопления лимфоцитов и многоядерных клеток,
а спустя 4 нед никаких изменений зарегистрировано не было. Вскоре
проба Квейма стала широко применяться в разных странах. Наиболее
приемлемым материалом для приготовления антигена является пора¬
женная саркоидозом ткань лимфатического узла из-за Квейма плот¬
ного (по сравнению с другими органами и тканями) скопления грану¬
лем. Однако из-за небольших объемов лимфатического узла нередко
используется ткань селезенки, удаляемой, как правило, при наличии
резких изменений клеточного состава крови.В настоящее время применяется стандартный саркоидиый ан¬
тиген, который вводится внутрикожно в область предплечья
(0,15—0,2 мл), и через 3—4 нед место введения антигена иссекается
(включая подкожно-жировую ткань) даже при отсутствии видимых
изменений. Эритема в месте инъекции через 3—4 дня диагностическо¬
го значения не имеет, так как саркоидные гранулемы формируются не
ранее 2-3 нед. Последующее образование гранулем в месте инъекции
может продолжаться очень долго (описан случай образования гранулем
в течение 9 лет). На время проведения пробы Квейма глюкокортико-
идная терапия должна быть прекращена. Диагностическая информа¬
тивность Квейм-теста составляет, по данным разных авторов, 30-90%
(в среднем — 60—70%). Лож неположительные результаты встречаются
у 1-3% больных. Сложности приготовления Квейм-антигена, срав¬
нительно длительный период ожидания результатов (3-6 нед), воз¬
можность ложноположительных результатов, не столь высокая диа¬
гностическая информативность (60—70%) и, наконец, положительный
тест Квейма у одной трети больных туберкулезом привели к тому,
что в последние годы интерес исследователей к этому тесту несколько
снизился. Тем не менее использование пробы Квейма можно считать
оправданным и целесообразным в тех случаях, когда проведение био-
псийных методов исследования противопоказано или их результаты
оказались отрицательными; при диагностике внелегочных поражений
(в частности, глаз), а также при наличии подострого менингита неясной
этиологии, парезах черепно-мозговых нервов.Туберкулиновая анергия. Существует обратная зависимость выражен¬
ности кожной анергии к туберкулину и активностью патологического
процесса. Отмечено, что у больных саркоидозом, инфицированныхтубер-
кулезом, туберкулиновая проба становится положительной. Это позволяет
использовать туберкулиновую пробу в процессе наблюдения за больными
саркоидозом. Кожная анергия у больных саркоидозом наблюдается и на
другие антигены (фихофитин, стрептокиназу, кандиды).
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ *165Н. Yasutake и соавт. [2005] выявили достоверное повышение
сывороточных уровней предсердного и мозгового натрийурети-
ческих пептидов у больных с саркоидозом сердца по сравнению с
интактным сердцем. Несмотря на неспецифичность натрийурети-
ческих пептидов (повышаются при различной сердечной патологии),
предлагается применять исследование сывороточной концентрации
предсердного и мозгового натрийуретических пептидов для ран¬
ней диагностики саркоидоза сердца, в том числе — доклинической1 ІСаган Е,А. и соавт, 2007].Цитологическое исследование жидкости БАЛ выявляет ста¬
тистически достоверное увеличение среднего показателя общего
числа клеток, процентного содержания лимфоцитов, нейтрофилов.
Отклонение от нормы цитограммы лаважной жидкости не только
наблюдается в фазе обострения, но и сохраняется (хотя и в меньшей
степени) в фазе ремиссии. Так, при острой форме болезни лимфоци-
гоз в лаважной жидкости может достигать 35—40%. По мере сниже¬
ния активности патологического процесса снижается и процентное
содержание лимфоцитов в ЖБАЛ. Для альвеолярных макрофагов
характерна противоположная динамика. По мере прогрессирова¬
ния саркоидоза и нарастания фиброзирования паренхимы легких
процентное содержание лимфоцитов в лаважной жидкости умень-
ишется и увеличивается процентное содержание нейтрофилов. Тем
не менее диагностическую значимость лимфоцитоза в лаважной
жидкости не следует переоценивать; лимфоцитоз, превышающий
15% клеточного состава, определяется у 30% больных ИФА, у 52%
больных ДБСТ с синдромом поражения легких и у 10% больных
пневмокониозами. Кроме того, высокий лимфоцитоз ЖБАЛ регис¬
трируется у 20% больных раком легкого, у 43% больных туберкуле¬
зом легких и в 60% случаев СПИДа. Одним из важных показателей
активности патологического процесса является резкое увеличение
(и 4 раза) индекса цитотоксичности, свидетельствующего о выра¬
женности активации естественных киллеров в лаважной жидкости
п фазе обострения. В фазе ремиссии этот показатель имеет тенден¬
цию к снижению, тем не менее остается статистически достоверным
иыше нормы (5,0+0,80%),Лучевые методы исследования органов грудной клетки. Рентгено¬
графия является ведущим методом исследования в первичной диа¬
гностике саркоидоза легких. Рентгенологическая картина I стадии
іаболевания характеризуется симметричным увеличением лимфати¬
ческих узлов средостения (бронхопульмональных, паратрахеальных,
166 • ГЛАВА2. ГРАНУЛЕМАТОЗЫпарааорта Л ьных, бифуркационных) с четкими ровными контурами.
В легочной ткани изменения не определяются (рис. 2.5, 2.6).При выполнении КТ увеличенные внутригрудные лимфатические
узлы отчетливо определяются на фоне жировой клетчатки средостения
благодаря устранению суммационного эффекта, который присутству¬
ет при использовании рентгенологического метода исследования и
затрудняет визуализацию отдельных групп лимфатических узлов.
По структуре лимфатические узлы однородны, в единичных случаях
определяются обызвествления аморфного или глыбчатого характера.
Как правило, при саркоидозе не наблюдается слияние лимфатических
узлов в конгломераты и сдавление бронхов. Даже незначительное уве¬
личение лимфатических узлов бролхопульмональной группы можно
определить с помощью мультиспиральной компьютерно-томографи¬
ческой ангиографии благодаря значительной разнице контрастиро¬
вания узлов и сосудов легкого (рис. 2.7). Применение ВРКТ позволяет
выявить начальные изменения легочного рисунка, невидимые при
обычной КТ, что помогает своевременно диагностировать прогрес¬
сирование заболевания, рецидивы заболевания, адекватно оценитьРис. 2.5. Диагноз; саркоидоз легких 1 стадии;а — обзорная рентгенограмма органов грудной клетки в прямой проекции.
Двухстороннее увеличение бронхопульмональных лимфатических узлов.
Изменения в легочной ткани не определяются;б — линейная томография легких. Срез на уровне бифуркации трахеи.
Расширение тени верхнего средостения вправо за счет увеличения паратра-
хеальных лимфатических узлов. Расширение теней корней легких за счет
увеличения бронхопульмональных лимфатических узлов
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ * 167стадию патологического процес¬
са и скорректировать терапию
(рис. 2.8). У единичных больных
саркоидозом легких I стадии при
ВРКТ может наблюдаться симп-
IOM «матового стекла» — очаго¬
вые тени с перилимфатическим
расі іространен нем.При II стадии саркоидоза лег¬
ких на рентгенограммах органов
[рудной клетки визуализирует¬
ся увеличение внутригрудных
лимфатических узлов и двухсто¬
ронние диффузные симметрич¬
ные интерстициальные измене¬
ния (иногда с большей степенью
выраженности в правом легком):
сстчатость, нечеткость контуров
сосудов, перибронхо- и перивас-
кулярные изменения (рис. 2.9).
При КТ на фоне сохраняющих-Рис. 2.6. Диагноз: саркоидоз легких
1 стадии. Обзорная рентгенограмма
органов грудной клетки в прямой
проекции. Расширение тени верхнего
средостения вправо за смет увеличе¬
ния паратрахеальных лимфатических
узлов. Расширение теней корней лег¬
ких за счет увеличения бронхопуль¬
мональных лимфатических узловся увеличенных лимфатических
у злов средостения наблюдается деформация легочного рисунка, как за
смет усиления периферического и центрального интерстиция, так и заРис. 2.7. Диагноз: саркоидоз легких 1 стадии. Мультиспиральная компьютер¬
но-томографическая ангиограмма. Увеличение лимфатических узлов параа-
ортальной (а) и бронхопульмональных (б) групп
168 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫРис. 2.8, Преимущества высокоразрешаюшей компьютерной томографии.
Диагноз; саркоидоз легких И стадии:а — при нативном КТ-исследопании патологических изменений не выявлено;
б — при проведении ВРКТ определяются единичные очаги в стенке вторич¬
ных легочных долек и вдоль междолевой плеврыРис. 2-9. Диагноз: саркоидоз легких II стадии:а — обзорная рентгенограмма органов грудной клетки в прямой проекции.
Расширение теней корней за счет увеличения бронхопульмональных лимфа¬
тических узлов. В аксиллярном субсегменте правого легкого на фоне интерс¬
тициальных изменений (сетчатость) определяется скопление очаговых теней;
б — обзорная рентгенограмма органов грудной клетки в прямой проекции.
Распространенное усиление легочного рисунка за счет интерстипиального
компонента (сетчатость, перибронхо- и периваскулярные изменения). Во
всех отделах легких визуализируются очаговые тени с наибольшей выражен¬
ностью в прикорневых отделах легких. Увеличение лимфатических узлов
парааортальной и бронхопульмональных групп с обеих сторон
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ *169Рис. 2.10. Диагноз: саркоидоз легких II стадии:а — нативное КТ-исследование - КТ-картина усиления периферического
легочного интерстиция по типу «матового стекла»;Г) — ВРКТ — КТ-картина «матового стекла» обусловлена наличием мелких
перилимфатических очагов (диаметром 1-2 мм) и усилением внутридолько-
ІЮГО интерстиция и междольковых перегородоксчет наличия мелкой (или среднеочаговой) диссеминации, перилимфа-
1’ически расположенной, может определяться понижение прозрачности
легочной ткани по типу «матового стекла». ВРКТ выявляет утолщение
стенок междольковых перегородок, бронхов, сосудов с наличием очагов
» этих структурах, а также — в междолевой и костальной плевре, слия¬
ние очагов в фокусы уплотнения легочной ткани (рис. 2.10).У больных саркоидозом легких III стадии на рентгенограммах орга¬
нов грудной клетки и более отчетливо на КТ сохраняются перилим-
(|)атически расположенные очаги в легких — по междолевой плевре,
в стенке вторичных легочных долек (диаметр их может быть различ¬
ным) и усиление центрального и периферического легочного интерс-
гиция (утолщение стенок вторичных легочных долек, внутридолько-
вого интерстиция, «псрибронховаскулярньте муфты»), у единичных
больных выявляется уменьшение объема сегмента или субсегмента
(преимущественно задних сегментов верхних долей легких) и тяжис-
іая деформация легочного рисунка. При наблюдении в динамике
іаметно нарастание фиброзных полей в виде формирования грубых
ирикорневых фиброзных изменений с развитием тракционных брон-
170 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫРис. 2.11. Компьютерно-томографи¬
ческие признаки прогрессирования
саркоидозй. Саркоидоз легких 11—111
стадии:а — КТ-исследование, мягкотканое
электронное окно ~ увеличение
лимфатических узлов бронхопуль¬
мональных групп;б, в — легочное электронное окно,
ВРКТ. Нарастание интерстициаль¬
ных изменений, увеличение коли¬
чества мелких перилимфатически
расположенных очагов (в стенках
вторичных легочных долек, ПС меж-
долепой плевре, вдоль псрибронхо-
васкулярного интерстиция)хоэктазов мелких бронхов, попавших в гзоны наиболее выраженного
фиброза (рис. 2л 1—2.13).На рентгенограммах органов грудной клетки у больных IV стадией
заболевания определяется выраженное изменение нормальной архи¬
тектоники легких и утолщение костальной, медиастинальной и диа¬
фрагмальной плевры с наличием грубых шварт. Рентгенологическая
картина характеризуется псрибронхо- и периваскулярными изменени¬
ями, тяжистой деформацией легочного рисунка, крупной ячеистостью.
Крупная ячеистость и буллы (до 2-3 см) чаще наблюдаются в субплев-
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ *1711*ис. 2Л2. Диагноз: саркоидоз легких IJI стадии;;1 — обзорная рентгенограмма органов грудной клетки в прямой проек¬
ции. Распространенные псрибронхо-периваскулярные изменения в легочной
ткани, на фоне которых во всех отделах легких визуализируются очаговые
тени. Корни легких неструктурны, подтянуты вверх;Cl — обзорная рентгенограмма органов грудной клетки того же больного в
динамике — через 2 годаралъных отделах верхних и центральных зон легких. Объем задних
сегментов верхних долей и (или) верхушечных сегментов нижних долей
легких обычно уменьшен в одинаковой степени с обеих сторон сим¬
метрично, иногда степень уменьшения объема части легкого больше
пыражена в правом легком (рис. 2.14). При КТ выявляются утолщенные
и деформированные междольковые перегородки, неравномерно утол¬
щенные стенки крупных бронхов и сосудов с формированием вокруг
них перибронхиальных и пери васкулярных инфильтратов. Объем вер-
х)1их долей легких чапіе уменьшен за счет развития пневмофиброза
но втором сегменте, реже определяется уменьшение в объеме шестого
сегмента (в большей степени в правом легком) [рис. 2.15, 2.16],в некоторых случаях у больных с III—IV стадиями саркоидоза
легких в прикорневых отделах легких формируются участки пони¬
женной прозрачности легочной ткани (плотные конгломераты фиб¬
розных масс в центральных зонах легких, нарушаюш;ие нормальное
анатомическое строение легочной ткани), на фоне которых не диф¬
ференцируются структуры легочного рисунка и корни легких. При
мрогрессировании фиброза крупные бронхососудистые стволы пере-
мспіаются вверх, развиваются тракционные бронхоэктазы. Нижние
172 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫ
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 173Рис. 2,14, Диагноз: саркоидоз яегких IV стадии;а — обзортшя рентгенограмма органов грулной клетки в прямой проекции.
Распространенное усиление легочного рисунка за счет интерстициального
компонента. В прикорневых отделах легких определяются зоны понижения
прозрачности легочной ткани, на фоне которых не дифференцируются корни
легких, просветы бронхов. Повышение воздушности нижних отделов легких.
Плевро-диафрагмальные шварты;Г) — обзорная рентгенограмма органов грудной клетки в прямой проекции.
Уменьшение объема верхних долей легких. Сближение элеметпов легочного
рисунка с перибронхо- и периваскулярными изменениями. Корни легких
неструктурны, подтянуты вверх. Просветы трахеи и главных бронхов дефор¬
мированы, подтянуты вправоРис. 2,13. Разнообразие изменений в легочной ткани и лимфатических узлах
мри саркоидозе 111 стадии;а — массивные фиброзные изменения в верхних отделах легких с обеих сторон;
б, в, г ~ крупные хаотично расположенные очаги в сочетании с фиброзными
изменениями;л — аморфное обызвествление лимфатических узлов правой трахеобронхи¬
альной и пара аортальной групп;с — неравномерность вентиляции легочной ткани в нижних отделах с обеих
с 1'оротт наблюдения
174 • ГЛАВА 2. ГРАНУЛ ЕМ АТОЗЫРис. 2.15. Мультиспиральная компьютерная томограмма (а, б). Диагноз: саркои-
доз легких I V стадии. Визуализируются тяжистые фиброзные изменения в верх¬
них отделах без формирования <<сототюго легкого» (благоприятный вариант)Рис. 2.16. Мультиспиральная компьютерная томограмма (а, б). Диагноз:
саркоидоз легких IV стадии. Определяются прикорневые фиброзные поля с
нарушением архитектоники легких и формированием тракционных бронхо-
эктазов (неблагоприятный вариант)зоны легких отличаются обычно повышенной прозрачностью, воз¬
можно, обусловленной компенсаторным вздутием легочной ткани
(рис. 2.17), Применение мультиспиральной компьютерно-томографи¬
ческой ангиографии у больных саркоидозом легких IV стадии позво¬
ляет своевременно диагностировать тромбоз мелких ветвей легочной
артерии — нередкое осложнение декомпенсированного легочного
сердца на этой стадии заболевания (рис. 2.18).В последние десятилетия перфузионная сцинтиграфия широко
применяется в комплексной лучевой диагностике саркоидоза лег¬
ких как дополнительный метод исследования, позволяющий про¬
водить качественную и количественную оценку функциональных
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ » 175І'ис. 2.17. Мультиспиральная компьютерно-томографическая ангиограмма
Ги*льного саркоидозом легких IV стадии:;i, 6 — легочное окно. Типичные проявления TV стадии саркоидоза легких:
нарушение архитектоники легких, формирующийся грубый фиброз верхних
оглелов легких чередуется с участками попышениой воздушности легких
(неравномерность вентиляции), тракционные бронхоэктазы, уменьшение
оОьсма верхних отделов, плевральные наслоения;I), I — мягкотканое окно. Расширение ствола легочной артерии и ее крупных
ис 1 ией, тромбоз мелких ветвей легочной артерии в зоне массивного фиброза
(но втором сегменте справа)
176 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫРис. 2.18. Мультиспиральная компьютерная томоі рамма. Диагноз: саркоидоз
легких ПІ—TV стадии;а — мягкотканое окно - аморфные и глыбчатые обызвествления в лимфати¬
ческих узлах пери трахеобронхиальных групп, грубые прикорневые фиброз¬
ные изменения;б — легочное электронное окно - в области прикорневых фиброзных полей
отмечается полное нарушение архитектоники легких, формирование гракдион-
ных бронхоэктазов, сохраняются хаотичные крупные очаги в легочной тканинарушений, локализацию, распространенность изменений и степень
активности патологического процесса. При выполнении перфузион-
ной сцинтиграфии на всех стадиях заболевания (включая 1 стадию)
определяются диффузные нарушения кровотока чаш;е в верхних зонах
легких. Асимметрия кровотока, локальные дефекты перфузии выяв¬
ляются преимущественно у больных с ТТТ—IV стадией саркоидоза.У больных саркоидозом легких с обструктивным синдромом при
функциональной КТ может наблюдаться негомогенность вентиляции
легочной ткани.В НИИ пульмонологии совместно с кафедрой рентгенологии и
радиологии СПбГМУ им. акад. И.П. Павлова был разработан комп¬
лексный метод лучевой диагностики саркоидоза легких и алгоритм
диагностических действий (рис. 2.19), определяющий целесообраз¬
ность применения методик в зависимости от конкретной клинической
ситуации, тем самым ограничивая и регулируя лучевую нагрузку.Особое внимание было уделено вопросу оптимизации рентгеноло¬
гического метода исследования, повышению его информативности,
что при сопоставлении с результатами рентгеновской КТ и радио-
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ * 177Рис, 2.19. Диагностический алгоритм обследования больного с пред положи¬
тельным диагнозом «саркоидоз органов дыхания*нуклидными методами исследования позволяет усовершенствовать
рснггсносемиотику саркоидоза.Уточнены следующие критерии лучевой диагностики саркоидоза
легких:— симметричное увеличение лимфатических узлов средостения
(бронхопульмональных, паратрахеальных, парааортальной и
бифуркационной групп);— диффузные интерстициальные изменения в легких (утолще¬
ние стенок бронхов, сосудов, междольковых перегородок, меж-
долевой и костальной плевры), очаги с перилимфатическим
распространением. При прогрессировании процесса — умень¬
шение объема задних сегментов верхних долей легких, фор¬
мирование плотных фиброзных конгломератов вокруг круп¬
ных бронхососудистых стволов, тракционньтх бронхоэктазов,
нарушение архитектоники легких;— деформация сцинтиграфического контура по медиастиналъ-
ной поверхности легких, диффузные нарушения кровотока
преимущественно в верхних зонах легких, асимметрия крово¬
тока, локальные дефекты перфузии;— негомогенность вентиляции легочной ткани.
178 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫНарушения ФВД у больных саркоидозом зависят от стадии заболе¬
вания. Результаты обследования больных саркоидозом легких, про¬
веденного в лаборатории клинической физиологии дыхания (руко¬
водитель — канд. мед. наук М.Ю. Каменева) НИИ пульмонологии
СПбГМУ им. акад. И.П, Павлова, свидетельствуют о том, что у
большинства больных с I стадией показатели ФВД не выходили за
пределы нормальных величин. Только в 2,2% случаях наблюдались
легкие наруитения проходимости дыхательных путей и умеренное
снижение дел, определяемой в устойчивом состоянии вентиляции
(ДСЛус).По мере прогрессирования заболевания выраженность и характер
изменений ФВД меняются. Нарушения проходимости дыхательных
путей выявляются более чем у половины пациентов со П—1П стадией.
Преобладают обструктивньте нарушения легкой и умеренной степени
выраженности. Рестриктивные изменения отмечаются у 20% боль¬
ных. Условия легочного газообмена ухудшаются независимо от типа
вентиляционных наруїпений; ДСЛзд была снижена у 36% пациентов,
а ДСЛус-у 87%.На IV стадии заболевания у всех больных выявляются изменения
легочной механики либо по рестриктивному, либо по смешанному
типу, сочетаюш,иеся с выраженным ухудшением легочного газооб¬
мена. Значительное или резкое снижение ДСЛ определялось как при
задержке дыхания (у 44% больных), так и в устойчивом состоянии
вентиляции (у 100% больных).Исследование гемодинамики малого круга кровообращения.Ангиопульмонография у больных саркоидозом выявляет неко¬
торое повышение среднего значения систолического давления в
легочной артерии — 30,4±1,47 мм рт.ст., а также умеренное повыше¬
ние средних значений минутного объема кровообращения, ударно¬
го объема, ударного индекса, работы правого и левого желудочков
сердца и венозного шунта. Сердечный индекс не выходит за пределы
нормальных значений. Выявляются также некоторые ангиографичес-
кие признаки, характерные для саркоидоза легких: уменьшение ско¬
рости артериального кровотока, запаздывание капиллярной фазы.
Ангиопульмонограммьт изменены в наибольшей степени у больных
с ИІ—IV стадией саркоидоза при наличии легочной гипертензии
[Некласов Ю.Ф., Гуляева Н.В., 19861.С целью ранней диагностики нарушений гемодинамики малого
круга кровообращения и поражения саркоидозом сердца у 111 боль¬
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 179ных саркоидозом легких (средиий возрасг 37,9±1,99 лет) нами были
выполнены эхокардиография, эходопплеркардиография с пробой
Вальсальвы и сцинтиграфия. Саркоидоз легких 1 стадии был диагнос¬
тирован у 34 больных (30,6%), 11 стадии — у 36 (32,4%), III стадии —
у 27 (24,3%) и IV стадии — у 8 (7,2%) человек. У всех больных было диа¬
гностировано обострение саркоидоза. У 30 (27%) больных отмечалось
острое течение (синдром Лефгрена). Первично-хроническое течение
наблюдалось у 81 (73%) пациента.У большинства больных (74%) систолическое давление в легочной
артерии не превышало нормальные значения. Во время проведения
пробы Вальсальвы у 7 больных диагностирована латентная легочная
гипертензия, что позволяет рассматривать эту нагрузочную пробу в
качестве метода ее ранней диагностики. Уменьшение фракции выбро¬
са левого желудочка определялось у 17 человек. Увеличение толщины
миокарда правого желудочка в диастолу наблюдалось у одной і ре г и
больных с 1 и II стадиями и у половины больных с III и IVстадиями.
У больных саркоидозом легких определялась как систолическая, так и
диастолическая дисфункции желудочков. У большинства пациентов
через 6 мес лечения положительная динамика рентгенологической
картины прямо коррелировала с тенденцией к нормализации пока*
затслей эходопплеркардиографии и эхокардио! рафии. Проведенное
исследование показало, что хроническое легочное сердце у больных
саркоидозом легких выявляется с частотой 0,15. Следует отметить, что
развитие хронического легочного сердца при 111 и IV стадиях заболе¬
вания чаше является следствием нарастающих изменений в легких, в10 время как на начальных стадиях патологического процесса может
быть признаком поражения миокарда саркоидозом.Приблизительно у половины больных саркоидозом легких при
электрокардиографическом исследовании регистрируются наруше¬
ния внутрижелудочковой и (или) атриовентрикулярной проводимос¬
ти. у части больных (5—10%) имеет место синусовая брадикардия.Бронхологические методы исследования. В течение последних деся-
'1'илетий метод фибробронхоскопии с ЧББ остается «золотым стандар¬
том» для гистологической верификации СОД.В НИИ пульмонологии, в лаборатории бронхологии и эндоскопи¬
ческой хирургии (руководитель — проф. в.А. Герасин) диагностиче¬
ская значимость ЧББ, проведенной у 560 больных саркоидозом легких
(1, II, 111 стадии), оказалась наиболее информативной у больных с II
и 111 стадиями (73,3 и 83,3% соответственно), у больных саркоидозом
180 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫлегких I стадии — 50%. Информативность эндобронхиальной био¬
псии (ЭББ), проведенной у 79 больных СОД в условиях стационара
дневного пребывания, составила 31,2% даже при отсутствии видимых
изменений слизистой оболочки. Выявление гиперваскуляризации,
бугорков, утолщения слизистой и др. повышает процент положитель¬
ных результатов до 38,1 [Молодцова В.П. и др., 2006].Для определения диагностических возможностей и факторов,
влияющих на результативность ЧББ и эндобронхиальной биопсии
слизистой оболочки, было обследовано 122 больных саркоидозом
легких (I стадия — 51; II стадия — 48; ТП стадия — 23). При гис¬
тологическом исследовании биоптатов эпителиоидно-клеточныс
гранулемы были выявлены у 62,5% больных (при 1 стадии — у 51,1%,
при II — у 70,4% и при III — у 61,6%). В биоптатах легочной ткани
саркоидные гранулемы обнаруживались значительно чаше (75,3%),
чем в биоптатах, представленных преимущественно бронхиальной
стенкой (38,5%). У больных саркоидозом легких 1 стадии в бронхи¬
альных стенках гранулемы выявлялись значительно реже (18,8%),
чем при II и III стадиях (56,3% и 42,9% соответственно) [Герасин В.А.
и др., 20081. Таким образом, получение биоптатов, содержащих
легочную ткань, увеличивает результативность диагностики сарко-
идоза легких, особенно на ранней стадии заболевания. Применение
эндобронхиальной биопсии слизистой оболочки способствует рас¬
ширению диагностических возможностей бронхологических мето¬
дов исследования у больных саркоидозом. Проведение ЧББ противо¬
показано при наличии легочной гипертензии (50 мм рт.ст. и выще),
крупноячеистой деформации легочного рисунка, крайне резких
нарушениях проходимости дыхательных путей, тяжелой патологии
сердечно-сосудистой и нервной систем. Крайне редко (в 1-2% слу¬
чаях) ЧББ может осложниться умеренным легочным кровотечением
(не более 50 мл) или пневмотораксом.При отрицательных результатах ЧББ показано проведение откры¬
той биопсии легких. В последнее десятилетие в клинической практи¬
ке широко применяется видеоторакоскопия, которая, являясь менее
инвазивным вмешательством по сравнению с открытой биопсией
легких, позволяет получить достаточный объем материала для полно¬
ценного морфологического исследования.Принципиально важным в диагностике саркоидоза является
необходимость гистологической верификации диагноза, в особен¬
ности в тех случаях, когда течение болезни отличается какими-
либо атипичными проявлениями. Биопсия должна проводиться
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 181В первую очередь из мест наиболее доступных исследованию
(пораженные участки кожи, увеличенные периферические лимфа¬
тические узлы). Медиастиноскопия показана при подозрении на
ігаличие у больного лимфогранулематоза или другого заболевания
лимфоретикулярной системы.Диагностическая информативность различных биопсийных мето¬
дов неодинакова. При наличии увеличенных внутригрудных лимфа¬
тических узлов наиболее информативной является медиастиноскопия
или парастернальная медиастинотомия. Гистологическая верификация
саркоидоза в этих случаях достигает 90—95%. Столь же высока диагнос¬
тическая информативность видеоторакоскопической и открытой биоп¬
сии ЛСІ ких, показанием для которых является наличие распространен¬
ных двусторонних очаговых (нередко в сочетании с усилением легочного
рисунка за счет интерстиция) затенений при отсутствии или умеренно
у вел ичен н ых брон хопул ьмонал ьн ы х л и мфа г и чес к и х узл ах. Важ ное д иа-
['ностическое значение может иметь торакоскопия (плевроскопия). На
поверхности плевры при всех стадиях саркоидоза нередко определяются
беловато-желтоватые узелки, гистологическое исследование которых
гюказывает различную степень зрелости саркоидных гранулем.Формулировка диагноза• Саркоидоз легких Т стадии, острое течение (синдром Лефгрена).• Саркоидоз легких I стадии, хроническое течение, фаза обостре¬
ния (ремиссии, полного обратного развития).• Системный саркоидоз с поражением легких II стадии, фаза
обострения (ремиссии), саркоидоз кожи (локализация). ДН
О—I степени.• Саркоидоз легких III стадии, фаза обострения (ремиссии). ДН
И степени.• Саркоидоз легких IV стадии, «сотовое легкое». Аспергил лема в
области верхней доли правого легкого. ДН И степени. Хроническое
компенсированное легочное сердце. Вторичная легочная гипертен¬
зия I—II степени. Сердечная недостаточность I степени.Дифференциальная диагностикаДифференциальная диагностика саркоидоза представляет значи-
гсльные трудности. Первую стадию болезни следует дифференци¬
ровать с лимфомами (лимфогранулематоз, лимфоретикулосаркома,
182 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫмодулярная лимфосаркома, болезнь Нрилла—Симмерса, неклассифи-
цируемые лимфомы, плазмоцитома), туберкулезом лимфатических
узлов средостения, метастазами рака бронха (предстательной железы,
желудка, яичников и др.) в лимфатические узлы средостения.Следует особо отметить гипердиагностику туберкулеза лимфати¬
ческих узлов, которая имела место в 37% случаях среди первичных
больных, поступивших в НИИ пульмонологии. По частоте ошибоч¬
ных диагнозов это заболевание занимает первое место. Вслед за оши¬
бочным диагнозом следует ошибочная лечебная тактика: в течение
длительного времени (в среднем 4—6 мес) больные получают проти¬
вотуберкулезные препараты без какого-либо эффекта. Основной при¬
чиной такого положения являются дефекты в обследовании больных:
диагноз базируется, как правило, лишь на данных рентгенологическо¬
го исследования. В последнее время все чаще наблюдается ошибочная
интерпретация материалов биопсии легких (включая иммунногисто-
химическис реакции с ДНК микобактерий).Исключительно важной (с точки зрения прогноза) является диф¬
ференциальная диагностика между саркоидозом и лимфограну¬
лематозом. В качестве опорных пунктов для диагноза могут быть
использованы следуюищс. Лимфатические узлы при лимфограну¬
лематозе достигают значительных размеров. Уже один этот факт
должен вызвать сомнение в диагнозе саркоидоза. При рентгено- и
томографическом исследовании лимфатических узлов средостения у
больных лимфогранулематозом представляют собой массивный кон¬
гломерат с выпуклыми дугами (при саркоидозе нередко можно видеть
контуры отдельных увеличенных лимфатических узлов), границы
отдельных лимфатических узлов (нередко включая паратрахеальные)
можно проследить и при лимфогранулематозе на начальных стадиях.
При лимфогранулематозе симметричное увеличение лимфатических
узлов наблюдается крайне редко; увеличенные лимфатические узлы
часто сдвигают пищевод, трахею, бронхи, что для саркоидоза нехарак¬
терно. Значительные дифференциально-диагностические трудности
возникают в случаях острого течения саркоидоза: общее недомогание,
повышение температуры тела, лимфопения, увеличенная СОЭ, тубер¬
кулиновая анергия, узловатая эритема могут наблюдаться при обоих
заболеваниях. Однако спонтанное улучшение (включая регрессию
увеличенных лимфатических узлов) позволяет с большой долей веро¬
ятности предположить у больного наличие саркоидоза.Первичная локализация лимфосаркомы в лимфатических узлах сре¬
достения имеет особенности, отличающие ее от саркоидоза: признаки
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 183сдавления сосудов верхней полой вены, осиплость голоса, затруднение
дыхания, одутловатость и синюшность лица. Из лимфосарком, первич¬
но поражающих лимфатические узлы средостения, следует отметить
болезнь Брилла—Сим мерса (макрофолликулярная лимфома). От сар-
коидоза это заболевание отличается следующими признаками. Болезнь
Брилла—Симмерса встречается преимущественно у мужчин пожилого
іюзраста. Наряду с тем что первично могут поражаться лимфатические
узлы средостения (а также забрюшинныс и др.), болезнь нередко начи¬
нается с увеличения одного (шейного, подмышечного, пахового) ЛИМ-
([)агического узла. Изолированное поражение одного лимфатического
узла в течение длительного времени (5—15 лет) может ничем клинически
НС проявляться. Генерализация процесса сопровождается лихорадкой,
анемией, спленомегалисй, кахексией. Болезнь Брилла—Симмерса отли¬
чается от саркоидоза также формированием компрессионного синдро¬
ма (в случае поражения медиастинальных лимфатических узлов) или
развитием асцита при поражении брыжеечных узлов. Гистологическое
исследование лимфатических узлов позволяет верифицировать диагноз
(картина макрофолликулярной лимфомы).Лимфаденопатия средостения может наблюдаться при остром лим-
(|)областном лейкозе (приблизительно в 10% случаев). Отличительными
особенностями лимфобластного лейкоза являются быстро прогрес¬
сирующее течение, лихорадка, анемия, кожные геморрагии, гепа-
госплсномегалия, выраженный лейкоцитоз периферической крови,
бластные клетки в мазке крови, а в лейкоірамме— «лей кем и чес кое
зияние» в ряду гранулоцитов, развитие синдрома диссеминирован-
иого внутрисосудистого свертывания, раннее присоединение вто¬
ричной инфекции, в 90% случаев диагноз лимфобластного лейкоза
может быть подтвержден при изучении морфологии гистологических
препаратов костного мозга.Дифференциальная диагностика саркоидоза I стадии должна про¬
водиться и с другими заболеваниями средостения: загрудинный зоб,
июкачественные опухоли щитовидной и вилочковой желез, нсвриио-
мы, фибромы, липомы, тератомы, гемангиомы, бронхогенные кисты.
Дермойдная киста или тератома по мере увеличения могут создавать
па рентгенограммах картину двустороннего увеличения лимфатичес¬
ких узлов. Однако локализация этих опухолей в переднем средосте¬
нии и отсутствие увеличенных лимфатических узлов в корнях легких
позволяют исключить саркоидоз.в ряд диагнозов для дифференциальной диагностики следу¬
ет включить и медиастинит, болезни пищевода, сердца, сосудов,
184 • ГЛАВА 2. ГРАНУЛБМАТОЗЫВ частности аневризму аорты, аномалии крупных сосудов. В ряде
случаев расширенные центральные участки легочной артерии также
могут быть ошибочно приняты за увеличенные лимфатические узлы.
Дополнительные исследования (рентгеноскопия, томография сре¬
достения, УЗИ сердца и сосудов и, наконец, ВРКТ с ангиографией)
позволяют установить правильный диагноз.Умеренное увеличение лимфатических узлов средостения может
быть при острых инфекционных заболеваниях (у взрослых редко).
В этих случаях дифференциальная диагностика с саркоидозом не
представляет значительных трудностей, так как ни степень увели¬
чения лимфатических узлов, ни их конфигурация, как правило, не
соответствуют таковым при саркоидозе.Трудности могут возникнуть при проведении дифференциальной
диагностики между саркоидозом (в особенности его острой формы) и
инфекционным мононуклеозом. Для этого заболевания характерны
обшее недомогание, лихорадка, ангина, увеличение лимфатических
узлов и селезенки, наличие в крови большого числа мононуклеаров
(до 60% от общего числа лейкоцитов). Диагноз инфекционного моно-
нуклеоза подтверждается выявлением в крови гетерофильных анти¬
тел (положительная реакция Пауля-Буннеля) и повышением титра
антител к вирусу Эпштейна—Барр (в особенности в начале болезни).II и III стадии саркоидоза легких следует дифференцировать со
следующими заболеваниями:— опухолевые процессы в легких (первичный или вторичный
карциноматоз легких, БАР);— диссеминированный туберкулез легких;— пневмокониозы;— проявления сердечной недостаточности.IV стадию саркоидоза легких необходимо дифференцировать с;— исходом других ИЗЛ;— хронической обструктивной болезнью легких, осложненной
легочной гипертензией и хронической рецидивирующей ТЭЛА.в условиях поликлиники подозрение на СОД должно возникать
при наличии:— узловатой эритемы на фоне лимфаденопатии средостения,
повышения температуры тела, увеличенной СОЭ (выше
25—30 мм/ч), полиартралгий;— лимфаденопатии средостения при общем хорошем самочувс¬
твии больного и нормальных показателях клинического ана¬
лиза крови;
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 185— распространенных двусторонних интерстициальных (сетча-
тость, перебронхиальные, переваскулярные изменений, симп¬
том «матового стекла») и очаговых теней, чагае сочетающихся
с лимфаденопатией средостения, выявляемых на рентгено¬
граммах органов грудной клетки, как правило, при отсутствии
клинической симптоматики и нормальных функциональных
показателях внешнего дыхания.Обязательные методы исследования, проводимые у больных при
подозрении на саркоидоз легких в условиях поликлиники;— врачебный осмотр;— лабораторные методы (клинический анализ крови, обший ана¬
лиз мочи, биохимическое и иммунологическое исследование
периферической крови);— спирография;— электрокардиография;— рентгенография (в двух проекциях — прямой и боковой), КТ
(или ВРКТ) органов грудной клетки;— консультация окулиста;— УЗИ органов брюшной полости;— эходопплеркардиография;— всех больных с подозрением на СОД следует направлять на
консультацию к пульмонологу.ЛечениеВопрос о целесообразности назначения глюкокортикоидных пре¬
паратов больным саркоидозом до настоящего времени окончательно
не решен. Наряду со сторонниками применения глюкокортикоид-
иой терапии многие исследователи считают, что назначение глюко-
кортикоидов не показано. Авторы аргументируют свое мнение, во-
первых, отсутствием статистически достоверных данных, которые
бы свидетельствовали о том, что глюкокортикоиды положительно
влияют на прогноз, а во-вторых, тем, что назначение этих лекаре-
1 пенных средств само по себе может стимулировать развитие фиб¬
роза легких. Наконец, возможность самопроизвольного излечения
не позволяет с достоверностью оценить роль глюко корти кои дов в
положительной динамике патологического процесса. Наблюдение
больших групп пациентов показало, что только 30—50% больных сар¬
коидозом нуждаются в назначении глюкокортикоидных препаратовI Hunninhage G.W. et al,, 1999].
186 • ГЛАВА 2. ГРАНУЛ Е1ИАТ03ЫОбобщая опыт, накопленный к настоящему времени, можно сде¬
лать следующие выводы [Илькович М.М., 2005J.• Глюкокортикоидныс препараты показаны и эффективны у боль¬
ных с активным (прогрессирующим) саркоидозом, а также при
возникновении экстраторакальных поражений.• Глюкокортикоиды не показаны больным с I стадией саркоидоза,
протекающего чаще всего бессимптомно, при нормальных показате¬
лях ФВД и отсутствии экстраторакальных поражений. Каждые 4 мес
(в течение года) больной должен быть осмотрен врачом, проведено
рентгенологическое исследование органов грудной клетки, исследо¬
вание ФВД, клинический аналїтз крови. Глюкокортикоиды следует
назначать только в случае отрицательной динамики заболевания:
ухудщения рентгенологической картины, снижения показателей
ФВД более чем на 15%; появления экстраторакальных поражений.
Спонтанное обратное развитие имеет место у 55—90% бол ьн ых.• Глюкокортикоиды не показаны при остром течении саркоидоза.
Спонтанная ремиссия наступает в 85-90% случаев в течение года.
При необходимости могут назначаться нестероидные противо¬
воспалительные препараты.• Глюкокортикоиды не показаны больным саркоидозом легких11 стадии при отсутствии или минимальных клинических про¬
явлениях, нормальных или близких к норме показателях ФВД.
Отрицательная динамика упомянутых показателей в процессе
наблюдения является показанием для назначения глюкокортико-
идных препаратов. Положительная динамика наступает в течение
3—4 мес. Спонтанная ремиссия у больных саркоидозом II стадии
наступает в 40-70% случаев.• Больным с саркоидозом 111—IV стадии глюкокортикоиды могут
назначаться в низких дозах.Таким образом, показанием для назначения глюкокортикоидов
является переход болезни во ТІ стадию, наличие экстраторакальных
поражений, в особенности жизненно важных органов (центральная
нервная система, сердце, глаза, почки), гемолитической анемии, поли-
артралгий. Назначение глюкокортикоидов больным саркоидозом лег¬
ких I стадии показано только при наличии выраженных клинических
проявлений болезни, а іакже при выявлении гиперкальциемии.Большинство авторов рекомендуют начальные дозы 30—40 мг
(здесь и далее расчет на преднизолон), назначаемые ежедневно или
через день в течение длительного времени (от 4 до 6—12 мес и даже
нескольких лет). Однако опыт показывает, что эффективность лече¬
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 187ния не снижается и при назначении более низких доз — 20—30 мг в
сутки. Длительность курса лечения (6-12 мсс) зависит от исходной
активности патологического процесса, выраженности рентгенологи¬
ческих изменений, наличия признаков генерализации заболевания.Назначение глюкокортикоидов показано и при IV стадии саркои-
доза, однако начальная доза в этих случаях обычно не должна превы¬
шать 10—15 мг в сутки. Сочетание глюкокортикоидных препаратов с
пеницилламином (купренил*, металкаптаза*) по 150 мг в сутки в тече¬
ние 6-12 мес нередко позволяет достичь определенной стабилизации
процесса, затормозить процесс фиброзирования.Наряду с системными (таблетированньши) глюкокортикоидами
в последние годы широко применяются ингаляционные глюкокор-
тикоиды: беклометазона дипропионат, флутиказон, будссонид и
др. В суточной дозе 800—1000 мкг в сутки. Прогрессирование болез¬
ни, признаки генерализации процесса не являются показанием для
назначения ингаляционных глюкокортикоидов. Проведенные мно¬
гочисленные открытые, а также двойные слепые рандомизированные
исследования пока не дали окончательного ответа об эффективности
ингаляционных глюкокортикоидов у больных СОД. Тем не менее
назначение ингаляционных глюкокортикоидов больным саркоидозом
с наличием респираторных симптомов вследствие поражения верхних
дыхательных путей, слизистой бронхов следует считать оправданным.
Местное применение кремов, капель, спреев, содержащих глюкокор-
тикоиды, показано больным с поражением кожи, глаз (ириты, увеиты
и др.), слизистой носа [Шмелев Е.И., 2004J,В условиях генерализации патологического процесса, протекаю¬
щего с поражением сердца, центральной нервной системы, и выра¬
женной активности аутоиммунитета даже максимальные дозы глю¬
кокортикоидных препаратов (1 мг на 1 кг массы тела) могут оказаться
неэффективными. Положительный эффект может быть достигнут
при использовании экстракорпоральных методов лечения, о которых
будет сказано ниже. При наличии поражения сердца, проявляюще¬
гося полной атриовентрикулярной блокадой, показана имплантация
•)лектрокардиостимулятора.Цитотоксические арепараты. Контролируемые исследования не
проводились, однако показаниями для их назначения принято счи-
чап ь следующие: выраженные побочные эффекты глюкокортикоид-
ной терапии, прогрессирование болезни на фоне глюкокортикоидной
1'срапии, тяжелые кожные поражения. Метотрексат может назначать¬
ся в дозе 7,5-25 мг в неделю. Азатиоприн назначается в суточной дозе
188 • ГЛАВА2.ГРАНУЛЕМАТОЗЫ150 м Г в течеиие месяца, 100 мг в сутки в течение 2—3 мес и по 50 мг
в сутки в течение 4-6 мес. Циклофосфамид назначается в суточной
дозе 50-150 мг. Надежды, возлагавшиеся на циклоспорин, способный
снижать количество активированных Т-клеток в жидкости БАЛ, не
оправдались: положительной динамики в легких при использовании
циклоспорина получено не было. Последующие исследования пока¬
зали, что циклоспорин может оказывать положительный эффект при
нейросаркоидозе, рефрактерном к глюкокортикоидным препаратам и
цитостатикам [Agbodu B.N. et al., 1995 и др.].Препараты, ингибирующие синтез TNF-a. Поскольку TNF является
центральным цитокином, участвующим в формировании гранулемы
и поддержании хронического воспалительного процесса, сформи¬
ровалось новое направление патогенетического лечения саркоидо-
за — применение препаратов с анти-TNF-a активностью. В последние
годы широкое применение получил пентоксифиллин (25 мг/кг в сутки
в течение 6 мес) [Zabel Р. et al., 1997], Препарат применяется в качестве
монотерапии или в сочетании с глюкокортикоидами. Сообщается о
попытках применения талидомида<“, препарата, обладающего выра¬
женным противовоспалительным эффектом, а также способностью
ингибировать продукцию TNF-a fBaughman R.R ct al., 2002j. При
назначении талидомида^’ необходимо учитывать его способность ока¬
зывать тератогенный эффект, вызывать сонливость, периферическую
нейропатию. Влечении саркоидоза, рефрактерного к глюкокорти-
коидам и цитотоксическим препаратам, может найти применение
инфликсимаб (ремикейд*), применяемый при РА и болезни Крона.
Он образует с TNF-a устойчивый комплекс и тем самым снижает его
функциональную активность.Из других лекарственных средств положительный эффект может
оказать, по мнению ряда авторов, витамин Е (природный антиокси¬
дант) по 50—100 мг в день в течение 1—2 мес, а также N-ацетилдистеин
(флуимуцил*) по 400—600 мг в сутки в течение 3—6 мес и более.Нередко больным саркоидозом фтизиатры назначают тиосуль¬
фат натрия (30% раствор внутривенно по 5-10 мл, 5—10 инъекций).
Положительный эффект этого препарата у больных саркоидозом не
доказан и использовать его нецелесообразно. В недалеком прошлом
отечественные фтизиатры всем больным саркоидозом назначали хло-
рохин или гидроксихлорохин. Упомянутые препараты относят к так
называемым медикаментам сомнительной эффективности, и исполь¬
зование их может быть показанным только при поражениях кожи,
гиперкальцием ИИ. Имеются отдельные сообщения об их эффектив¬
САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ • 18Sности при нейросаркоидозе. Считается, что высокая токсичность и
отсутствие эффекта являются противопоказанием для назначения
левам изола (декариса*).Туберкулостатики, лучевая терапия у больных саркоидозом неэф¬
фективны. Назначение противотуберкулезных препаратов (изониазид0,3 г в сутки) следует считать показанным только при наличии старых
туберкулезных очагов и опасности их реактивации, положительных
туберкулиновых пробах.Немедикаментозные методы леченияв последние годы все большее внимание уделяется разработке
новых патогенетически обоснованных методов лечения, что обуслов¬
лено как недостаточной, в ряде случаев, эффективностью глюкокор-
тикоидной терапии, так и отсутствием единой концепции лечебной
тактики. Увеличилось число сторонников более сдержанного отно¬
шения к назначению глюкокортикоидной терапии на начальных ста¬
диях заболевания в связи с повышением процента рецидивов среди
больных, получавших глюкокортикоидные препараты. Кроме того, на
фоне глюкокортикоидной терапии возможно развитие осложнений в
виде синдрома Иценко-Кушинга, стероидного сахарного диабета или
остеопороза и утяжеление течения сопутствующей патологии (язвен¬
ной болезни, артериальной гипертензии, ожирения).Анализ зарубежных публикаций, посвященных лечению саркои-
доза, свидетельствует о новых тенденциях в решении этой проблемы:
применение небольших доз глюкокортикоидов в сочетании с другими
лекарственными средствами.ВНИИ пульмонологии СПбГМУ была проведена апробация мето¬
да лечебного голодания у больных саркоидозом. За основу была взята
разработанная А.Н, Кокосовым и С.Г. Осининым [1984] методика
лечебного голодания, которая в течение многих лет используется для
лечения больных бронхиальной астмой.Из многообразия механизмов лечебного действия лечебного голо¬
дания наиболее важными применительно к больным саркоидозом
я ізляются:- коррекция показателей иммунореактивности;- стимуляция функции коры надпочечников.При назначении лечебного голодания больным саркоидозом легких
с сопутствующей патологией необходимо учитывать следующие осо¬
бенности методики лечебного голодания. Повышение литогенности
желчи в период голодания может быть причиной возникновения при¬
190 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫступов печеночной колики у больных с сопутствующим хроническим
холециститом, холангитом. Проведение тюбажей (2—3 раза в неделю)
в подготовительном периоде позволяет предотвратить возникновение
печеночной колики.Известно, что во время лечебного голодания повышается кон¬
центрационная функция почек, у больных с хронической патоло¬
гией мочевыделительной системы это может явиться провокаци¬
онным моментом для возникновения приступа почечной колики.
Применение спазмолитиков, анальгетиков, тепловых процедур
оказывает положительный терапевтический эффект. После купи¬
рования почечной (печеночной) колики (при отсутствии наруше¬
ния функции органа, лихорадки и других признаков обострения
болезни) лечебное голодание может быть продолжено, у больных
с сопутствующей гипертонической болезнью во время лечебного
голодания имеет место четкая тенденция к нормализации артери¬
ального давления.После 14-днсвного курса полного лечебного голодания осущест¬
вляется постепенный переход к обычному питанию (восстановитель¬
ный период). Длительность этого периода обычно составляет поло¬
вину разгрузочного периода. Во время восстановительного периода
назначается специальная молочная, овощная или крупяная диета.
С целью профилактики отеков применение поваренной соли в восста¬
новительном периоде следует исключить.Общее состояние больных после лечебного голодания улучшается
в 75% случаев. Уменьшение размеров лимфатических узлов средосте¬
ния на рентгенограммах отмечается у одной трети больных саркои-
дозом легких 1 стадии после 2-недельного курса лечебного голодания
без применения глюкокортикоидов. Однако более чувствительные
методы исследования (рентгенопневмололиграфия, перфузионная
сцинтиграфия) позволяют зафиксировать усиление регионарной аль¬
веолярной вентиляции и капиллярного кровообращения в верхних
отделах легких у 80% больных после курса голодания. Тенденция к
улучшению сохраняется у этой группы больных и в более отдаленные
периоды (через 6 мес).У части больных саркоидозом легких И стадии после лечебного
голодания легочный рисунок становится более четким, уменьшается
выраженность очаговой диссеминации, уменьшаются размеры внутри-
грудных лимфатических узлов. Следует отметить, что тенденция
к улучшению также сохраняется и в отдаленный период (через 6 и12 мес). Комплексное рентгенофункциональное и радионуклидное
САРКОИДОЗ ОРГАНОВДЫХАНИЯ • 191исследование свидетельствует о положительной динамике количес¬
твенных показателей, характеризующих регионарную вентиляцию
и легочную перфузию у 61% больных саркоидозом легких II стадии и
19% больных с III стадии после курса лечебного голодания.У большинства больных (68%) определяется четкая тенденция к
нормализации показателей гуморального иммунитета. Под воздей¬
ствием лечебного голодания наблюдается повышение в перифериче¬
ской крови общего числа Т-лимфоцитов, а также субпопуляций, в част¬
ности «активных» Т-лимфоцитов и Т-лимфоцитов с фенотипом CD4^.
Наблюдаются и другие изменения, свидетельствующие о тенденции к
нормализации соотношения иммунорегуляторных клеток не только
в периферической крови, но и в ж БАЛ (снижение исходно повышен¬
ного числа лимфоцитов CD4* и достоверное увеличение числа клона
супрессоров (CD8^), снижение функциональной активности Т-лим-
фог[итов лаважной жидкости до нормального уровня).Положительные сдвиги после курса лечебного голодания прояв¬
ляются и в нормализации функционального состояния естественных
киллеров, отмечено восстановление поглотительной способности
нейтрофилов. Метод лечебного голодания наиболее эффективен при
1 и П стадиях саркоидоза и в меньшей степени у больных с III—IV ста¬
дией саркоидоза.Таким образом, на фоне голодания происходит коррекция нару¬
шений иммунного статуса, играющего ведущую роль в патогенезе
заболевания. Повышение общего пула циркулирующих Т-лимфоци-
гов и лимфоцитов CD4* (хелперов), возможно, связано со снижением
активности альвеолита и уменьшением накопления Т-лимфоцитов в
легких. Не исключены также активация гемопоэтических процессов
и рекрутирование лимфоцитов из депо в периферическую кровь под
влиянием лечебного голодания. Кроме этого, повышается чувстви¬
тельность организма к глюкокортикоидам и увеличивается эндоген¬
ная выработка их за счет стимуляции коры надпочечников.Отдаленные результаты после лечебного голодания представля¬
ются более обнадеживающими; через год после курса голодания1 юложительная динамика была отмечена у 14 больных (0,82) из 17, ста¬
билизация — у 2 человек и только у 1 больного был зарегистрирован
рецидив болезни.Противопоказаниями для проведения лечебного голодания явля¬
ются следующие:“ прогрессирующее течение саркоидоза легких, сопровождаемое
снижением массы тела;
192 • ГЛАВА 2. ГРАНУЛ ЕМАТОЗЫ— наличие в анамнезе (или на рентгенограммах) данных, свиде¬
тельствующих о ранее перенесенном туберкулезе легких;— сопутствующие паразитарные, психические или злокачествен¬
ные заболевания;— острые воспалительные или обострение хронических заболе¬
ваний;— сердечная недостаточность 11—111 степени;— печеночная и почечная недостаточность;— беременность и период лактации.В последние годы все чаще в комплексном лечении больных сарко-
идозом применяются эфферентные методы, в частности плазмаферез.
Он показан больным с прогрессирующим, генерализованным и реци¬
дивирующим течением саркоидоза, рефрактерным к проводимой тера¬
пии гдюкокортикоидами, с выраженными нарушениями иммуноре¬
активности и внелегочными проявлениями саркоидоза [Романов В.В.,
2001; Воинов В.А., 2002]. В НИИ пульмонологии СПбГМУ им. акад.
И.П. Павлова проведена оценка влияния плазмафереза на функ¬
циональное состояние иммунокомпетентных клеток периферичес¬
кой крови больных саркоидозом. Основу исследования составили
39 больных саркоидозом легких (11 стадии — 16 больных, 111 стадии —
14 пациентов и IV стадии — 9 человек). Все больные находились в
стадии ремиссии и получали глюкокортикоидную терапию в под¬
держивающей дозе (7,5—10 мг в сутки в пересчете на преднизолон).
Мониторинг про- и противовоспалительных цитокинов (TNF-a,
IFN-y и ИЛ-10) проводился до плазмафереза и непосредственно после
плазмафереза. На момент исследования отмечалось достоверное повы¬
шение уровней как про-, так и противовоспалительных цитокинов
при всех стадиях заболевания. Непосредственно после проведения
плазмафереза в периферической крови больных саркоидозом легкихII и III стадий наблюдалась тенденция к нормализации соотношения
уровней про- и противовоспалительных цитокинов: снижение содер¬
жания TNF-a и IFN-y {р <0,05) и повышение концентрации ИЛ-10
{р <0,05). У больных саркоидозом легких IV стадии достоверных изме¬
нений в содержании исследуемых цитокинов не наблюдалось, что,
по-видимому, свидетельствует о недостаточности компенсаторных
механизмов иммунной системы у этой группы больных. Проведенное
исследование подтверждает патогенетическую обоснованность при¬
менения плазмафереза у больных саркоидозом.В условиях генерализации патологического процесса, при выра¬
женных изменениях иммунореактивности даже максимальные дозы
САРКОИдоз ОРГАНОВ ДЫХАНИЯ • 193глюкокортикоидных препаратов (1 мг на 1 кг массы тела) могут оказа¬
ться неэффективными. Положительный эффект может быть достиг¬
нут при комбинированном применении глюкокортикоидных и экс¬
тракорпоральных методов лечения. При наличии поражения сердца,
проявляющегося полной атриовентрикулярной блокадой, показана
имплантация электрокардиостимулятора.Длительная кислородотерапия на дому является одним из основных
методов лечения больных саркоидозом легких TV стадии. Применение
длительной кислородотерапии позволяет увеличить толерантность к
физической нагрузке, улучшить показатели газового состава крови,
стабилизировать состояние малого круга кровообращения и повысить
качество жизни этой категории больных.Важной составной частью зарубежных реабилитационных про-
1'рамм для больных саркоидозом является применение физических
упражнений. Лечебная физкультура должна быть направлена на
увеличение мышечной массы у больных с хронической дыхательной
недостаточностью, длительно применяющих глюкокортикоидную
терапию.Обучение больных саркоидозом. Больные саркоидозом нуждаются
в психологической поддержке со стороны окружающих их людей —
родственников, медработников, сотрудников социальной помощи,
в последние годы появились публикации (буклеты), предназначен¬
ные для больных саркоидозом и их родственников, написанные
пульмонологами и пациентами. Кроме того, в сети Интернет имеются
сайты, где больные могут получить ответы на свои вопросы как от
людей, страдающих саркоидозом, так и ведущих ученых, специа¬
лизирующихся по этой проблеме. Информация для больных имеет
следующие разделы: представление о саркоидозе (клинические про-
я вления, особенности течения, осложнения, лечение); рекомендации,
касающиеся диеты, физиотерапии, реабилитации.Диспансерное наблюдениеНепредсказуемый характер течения болезни (возможность реци¬
дивов, прогрессирование заболевания), возникновение внелегочных
поражений, а также использование в лечении препаратов, обладаю¬
щих побочными эффектами, обусловливают необходимость длитель¬
ного диспансерного наблюдения больных саркоидозом. Наблюдение
больных должно проводиться в специализированных пульмоно¬
логических учреждениях, располагающих современными метода-
194 • ГЛАВА г. ГРАНУЛЕМАТОЗЫМИ исследования. Группы диспансерного наблюдения формируют в
зависимости от особенностей течения заболевания — благоприятное,
прогрессирующее, рецидивирующее или стабильное течение.при благоприятном и стабильном течении саркоидоза контроль¬
ное обследование проводится через 5—6 мес, при прогрессирующем
и рецидивирующем течении — через 3—4 мес. Контрольное обследо¬
вание включает обязательные (упомянутые выше) и дополнительные
методы исследования.Дополнительные методы обследования включают:— функциональное исследование внешнего дыхания (спиро¬
метрия, общая плетизмография, исследование механических
свойств легких, исследование ДСЛус и при ДСЛзд, газовый
состав крови);— перфузионную сцинтиграфию легких с ’^'"ITcl, ^’IGa] и при
необходимости — сердца, печени, почек, селезенки, костей;— магниторезонансную томографию головного мозга;— суточное холтеровское мониторирование;— консультации специалистов (невропатолога, кардиолога,
нефролога, фтизиатра).Экспертиза трудоспособностиДиагноз «саркоидоз»* может быть установлен в специализированном
пульмонологическом центре амбулаторно или в стационарных условиях.Лечение, которое предстоит этой категории больных в течение
длительного времени (3—12 мес и более), следует проводить в амбу¬
латорных условиях. Искусственное ограничение трудоспособности
больных саркоидозом (в особенности при отсутствии клинических
проявлений) и проведение лечения глюкокортикоидами в сочетании
с противотуберкулезными препаратами в течение 3—4 мес в проти¬
вотуберкулезных стационарах следует считать ошибочным и недо¬
пустимым. Нередко больных саркоидозом после пребывания в про¬
тивотуберкулезных стационарах направляют в специализированные
санатории, предназначенные для больных, перенесших туберкулез
легких. Затем этих больных переводят на инвалидность на 1-2 года.
Это не только наносит экономический ущерб (расходы на пребыва¬
ние в стационаре, санатории, инвалидность), но и сказывается на
социальном статусе каждого конкретного больного. Как показывает
опыт, большинство больных после выписки из стационара могут при¬
ступить к работе через 1—2 нед. Очевидно, что в каждом конкретном
САРКОМДОЗ ОРГАНОВ ДЫХАНИЯ *195случае этот вопрос должен решаться индивидуально с учетом состо¬
яния (стадии болезни, степени нарушения ФВД, наличия внелегоч-
Fibix поражений). В трудных экспертных случаях применяется проба
Вальсалъвы, 6-минутный и кардиопульмональный тесты.Для больных саркоидозом легких I—II стадии ограничений режима
нет. Больной может приступить к работе (если нет каких-либо специ¬
альных противопоказаний). Нет никакой необходимости ограничивать
больного в его двигательном режиме (занятия физкультурой, плава¬
ние и т.д.). Скорее, наоборот: больного следует убедить в том, что его
поведение практически не должно отличаться от такового до болезни.
Ьолъных следует лишь предупредить о возможности активации пато¬
логического процесса в случаях избыточной инсоляции. Ограничения
режима у больных саркоидозом легких III—IV стадии зависят от степе¬
ни выраженности легочной и сердечной недостаточности.Саркоидоз легких I—II стадии, как правило, не является поводом
ІІ.ЛЯ определения группы инвалидности. Необходимость в этом может
ІЮЗНикнуть в случае появления внелегочных поражений (глаза, серд¬
це, нервная система и др.), а также при переходе болезни в ПТ стадию.
Критерием для определения степени стойкой нетрудоспособности
служит выраженность легочной и сердечной недостаточности (что,
как правило, имеет место только у больных с III—IV стадией болезни),
степень органических и функциональных нарушений других органов
и систем (при наличии внелегочных поражений).ПрогнозСаркоидоз относится к доброкачественным заболеваниям, имею¬
щим тенденцию (в значительной части случаев) к самопроизвольному
излечению. Острая форма саркоидоза (синдром Лефгрена) у 85—90%
больных благополучно разрешается в течение 6—12 мес. Спонтанная
ремиссия у больных саркоидозом I стадии наступает в 55—90% случа¬
ен, II стадии — Б 40—70%, III стадии — в 10-30% случаев и у больных
с IV стадией саркоидоза — в 0—5% случаев. Большинство авторов
считают, что от саркоидоза умирает приблизительно 5% заболевших,
причем у 25% из них на аутопсии выявляется поражение миокарда.Как уже упоминалось, непосредственной причиной летального
исхода может быть поражение сердца (смерть от остановки сердца
ііследствис нарушений в проводящей системе). Крайне редко при¬
чиной смерти становятся поражение нервной системы, проявления
печеночной, почечной или ДН.
196 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫПрофилактикаПервичная профилактика саркидоза не разработана.Вторичная профилактика заключается в назначені и и адекватного
лечения, длительном диспансерном наблюдении, что позволяет пре¬
дупредить возникновение рецидивов болезни.ГИСТИОЦИТОЗ X ЛЕГКИХГистиоцитов легких (ГХЛ) (синонимы: легочный лангергансокле-
точный ГИСТИОЦИТОЗ, легочная эозинофильная гранулема, лангерганс-
оклеточный гранулематоз, болезнь Таратынова и др.) — заболевание
ретикулогистиоцитарной системы неизвестной этиологии, характери¬
зующееся первичной пролиферацией атипичных гистиоцитов (клеток
X) и образованием в легких, а также в других органах и тканях гистио-
цитарных гранулем (инфильтратов). Природа атипичных гистиоцитов
неясна. Выявлено их сходство с клетками Лангерганса. В последние
годы [с 1987 г.] в англоязычной литературе было предложено исполь¬
зовать термин «легочный лангергансоклеточный гистиоцитоз» вместо
общепринятого «ГХЛ». Основанием для изменения названия болезни
послужил тот факт, что в гистиоцитах из очага поражения были выяв¬
лены структурно-функциональные маркеры эпидермальных клеток
Лангерганса. Новое название, по мнению авторов, отражает гистоге-
нетическое происхождение клеток, составляющих морфологическую и
патофизиологическую основу заболевания. Однако нам представляется,
что новое название болезни вряд ли приблизилось к сути заболевания,
но, несомненно, стало более тяжеловесным и труднопроизносимым
[Илькович М.М., 2005]. В настоящей книге мы будем использовать тер¬
мин <сГХЛ*> как широко известный и понятный практическим врачам.Термином «ГИСТИОЦИТОЗ X» Л. Лихтенштейн [1953] объединил опи¬
санные в разное время патологические процессы, характеризу ющиеся
различной степенью выраженности гистиоцитарной пролиферации
и, по-видимому, вследствие этого отличающиеся по клиническому
течению и прогнозу: болезнь Абта—Леттерера—Сиве, болезнь Хенда—
Шюллера—Крисчена и так называемую эозинофильную гранулему.В литературе имеются лишь единичные данные о распростра¬
ненности ГХЛ, что, по-видимому, связано с ошибочной трактовкой
не только клинических, но нередко и секционных данных. Следует
ГИСТИОЦИТОЗХ ЛЕГКИХ • 197отметить, что в последние годы значительно возросло число публи¬
каций, обобщающих наблюдения достаточно больших групп боль¬
ных. Приводятся данные о том, что в детском возрасте частота ГХЛ
составляет в среднем 3-4 на 1 млн, у взрослых 1 на 560 ООО жителей, а
в группе ИЗЛ ГХЛ составляет 4% [ Vassallo R. et al., 2002]. Среди более
3500 пациентов с ИЗЛ, наблюдавшихся в клинике пульмонологии
СПбГМУ им. акад. И.П. Павлова, больные ГХЛ составили 5,5%.Этиология и факторы рискаЭтиология ГХЛ остается неизвестной. Клональный характер про-
лиферации клеток Лангерганса в очагах поражения дал основание
предполагать опухолевую природу заболевания. Однако возможность
сіЕонтанньїх ремиссий при гистиоцитозс X делают это предположение
маловероятным.Все описанные случаи ГХЛ спорадическиме. Неизвестна также
причина того, что ГХЛ встречается в основном только среди пред¬
ставителей белой расы. Не выявлены какие-либо средовые факторы
риска, связанные с развитием ГХЛ. Единственная ассоциация была
|$ыявлена с курением: абсолютное большинство заболевших ГХЛ
ЯІШЯЮТСЯ курильщиками (более 90%). Дополнительным аргументом
н пользу этой связи служат данные о формировании у мышей в ответ
ма воздействие табачного дыма интерстициального гранулематозного
носпалительного ответа, сходного с реакцией при ГХЛ. После окон¬
чания действия дыма в эксперименте количество клеток Лангерганса
иозвращалось к нормальному уровню [Vassallo R. et al., 2004].Обсуждаются иммунопатологические нарушения как причина раз¬
вития гистиоцитоза X. В экстрапульмональных очагах пролиферации
при этом заболевании повышен синтез TNF-a, GM-CSF, ИЛ-1, ИЛ-6.,
В ткани легкого экспрессируется TGF-(3, GM-CSF, TNF-a,
■)ги медиаторы играют критическую роль в патогенезе заболевания,
поскольку in vitro показана их способность вызывать формирование
клеток Лангерганса из CD34* гемопоэтических клеток и они являются
ключевыми медиаторами легочного повреждения у моделей легочного
(|)иброза у животных.Большинство исследователей отмечают преобладание ГХЛ среди
лиц мужского пола [Илькович М.М., 2005; Tazi А, et al., 2000 и др.].
Может быть в связи с этим фактом в ряде публикаций курение рас¬
сматривается в качестве фактора риска [ Delobbe А. et al., 1996; Tazi А.
ct al,, 2000 и др.]. Авторы считают, что табакокурение может стиму¬
138 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫлировать пролиферацию гистиоцитов и рекрутирование их в легкие.
Предположение о курении как о факторе риска нам представляется
сомнительным по двум причинам: во-первых, табакокурением зло¬
употребляют миллионы (сотни миллионов) людей, а ГХЛ встречает¬
ся, как уже упоминалось, крайне редко (2—4 на 1 млн), а во-вторых,
ГХЛ нередко наблюдается и среди некурящих. Если учесть, что ГХЛ
встречается только у лиц, принадлежащих к белой расе, среди забо¬
левших преобладают мужчины (по нашим данным это соотношение
составляет 10:1) и заболевание возникает преимущественно в возрас¬
тном диапазоне от 20 до 50 лет, то скорее есть основания предполагать
роль генетических дефектов, рашифровка которых еще предстоит.ПатогенезПатогенез болезни изучен недостаточно. Отсутствие четких отли¬
чий ГХЛ от злокачественных заболеваний моноцитарно-макрофа-
гальной системы в известной степени размывает нозологические
границы этого патологического процесса.Гранулемы, формирующиеся при ГХЛ, содержат преимуществен¬
но патологические (атипичные) гистиоциты, источником которых
является костный мозг. Болезнь начинается с пролиферации ати¬
пичных гистиоцитов (овоидной формы, умеренно увеличенных, с
эозинофильной цитоплазмой, неправильной формы ядром (с зазуб¬
ринами), тонко рассеянным хроматином). Другие эффекторные клет¬
ки (лимфоциты, моноциты, эозинофилы, плазматические клетки),
а также гуморальные факторы (в частности, иммунные комплексы)
играют вспомогательную роль в патогенезе ГХЛ [Tazi А. et al., 2000],
Взаимодействие между упомянутыми клетками, продуцирующими
цитокины, может стимулировать иммунный ответ и процесс фибро-
зирования. Секреция таких цитокинов, как TNF-a и GM-CSF, может
рекрутировать атипичные гистиоциты в легкие и способствовать
формированию нового поколения атипичных гистиоцитов из CD34+
гемопоэтических клеток костного мозга [Vassallo R, et al., 2000].
Ранее было доказано [Aguauo S.M., 1994], что табакокурение вызывет
гиперплазию нейроэндокринных клеток легких и повышение уровня
бомбезинподобного пептида {bombesin-like peptides, BLPs) в нижних
отделах дыхательных путей. Бомбезин представляет собой хемотак-
сический фактор для моноцитов и митогенный для фибробластов, что
объясняет его роль в воспалительных и фиброзирующих процессах.
Иммуногистохимическое исследование выявляет в легких больных
ги СТИОЦИТОЗ X ЛЕГКИХ • 199ГХЛ значительное (10-кратное) увеличение числа бомбезин-позитив-
ных нейроэндокринных клеток по сравнению со здоровыми куриль¬
щиками или больными ИФА [Aguauo S.M., 1994].Заболевание относится к системным: гранулемы могут обнаружи-
наться во всех органах и тканях (кости, кожа, легкие, мягкие ткани,
печень, почки, селезенка, желудочно-кишечный тракт, лимфатичес¬
кие узлы, центральная нервная система и др.). Наиболее частая лока¬
лизация патологического процесса легкие и кости. Причем, если для
болезни Абта—Леттерера—Сиве (острая форма) свойственна злокачес¬
твенная пролиферация незрелых гистиоцитов, то для первично-хро¬
нических форм гистиоцитоза X (болезнь Хенда—Ш юл л ера—Крисчена,
эозинофильная гранулема) ведущим в патогенезе является не столько
избыточная гистиоцитарная пролиферация, сколько различные мета¬
болические нарушения в гистиоцитах, что дало основание некоторым
авторам отнести ГХЛ к так называемой группе болезней накопления.Патологическая анатомияк настоящему времени нет общепринятой морфологической клас¬
сификации ГХЛ. Тем не менее можно выделить некоторые общие
морфологические закономерности развития этой болезни. Наиболее
характерной морфологической особенностью ГХЛ является пато¬
логическая пролиферация гистиоцитов и образование в различных
органах и тканях гистиоцитарных инфильтратов.Макро- и микроскопическая картина изменений в легких вари¬
абельна. При остром течении патологического процесса легкие уве¬
личены в объеме, в периферических отделах на разрезе могут выяв¬
ляться многочисленные кистозные образования до 1 см в диаметре.
Микроскопически определяются скопления (гранулемы) гистиоцитар¬
ных клеток, эозинофилов, плазматических клеток, а также различная
с тепень выраженности пролиферации ретикулиновых волокон.При хроническом течении ГХЛ макроскопическая картина легких
отличается многообразием: от диффузных милиарных узелков, по¬
крывающих поверхность легких, полипозных гранулематозных изме¬
нений с плевральными наслоениями до крупноочаговых с четки¬
ми краями серовато-белых или рыжевато-коричневых отложений и
кистоподобных эмфизематозных вздутий. Легкие на разрезе имеют
вид сот с выраженной фиброзной перестройкой легочной паренхимы
(в патологический процесс вовлекаются субплевральная, интерлобу-
л>ірная, перибронхиальная и пери васкулярная соединительная ткань).
200 • ГЛАВА2.ГРАНУЛБМАТ03ЫМожно предположить, что динамика описанных макроскопических
изменений соответствует различным этапам эволюции патологиче¬
ского процесса. На ранних стадиях первично-хронических форм ГХЛ
микроскопическое исследование выявляет картину гранулематоза.Преобладающим элементом гранулемы являются гистиоциты,
эозинофильные гранулоциты, лимфоциты, плазматические клетки.
Инфильтраты состоят из гистиоцитарных клеток разной степени зре¬
лости с овальным или округлым ядром с нежным равномерно распре¬
деленным хроматином; преобладают поля «пенистых» крупных клеток
со светлой цитоплазмой и центрально или эксцентрически располо¬
женным ядром (клетки Лангерганса). Встречаются лимфоциты, эози-
нофилы, многоядерные гигантские клетки {рис. 2.20, см. цв. вклейку).
Местами эозинофилы формируют скопления, дающие положитель¬
ную реакцию при окраске азур-эозином (рис. 2.21, см. цв. вклейку).
Светлые «пенистые» клетки содержат суданофильные включения.
У некоторых макрофагов в цитоплазме присутствует гемосидерин.
Митозы редки.Полиморфизм клеточного состава гранулемы, а также выявление
многоядерных гигантских клеток может напоминать гистологиче¬
скую картину лимфогранулематоза. Следует также отметить, что
наличие эозинофилов в так называемой эозинофильной гранулеме не
является строго обязательным (у одной трети больных гранулемы не
содержат эозинофилов), что делает сомнительной целесообразность
использования термина «эозинофильная гранулема».На поздних стадиях развития гистиоцитарные инфильтраты уда¬
ется найти лишь на серийных срезах: преобладают очаги фиброза,
иррегулярной эмфиземы, буллы, выстланные уплощенным альве¬
олярным или кубическим эпителием, в этой стадии заболевания,
при выявлении на рентгенограммах фиброзно-буллезных изменений
в легких, морфологический диагноз ГХЛ без знания клинических
проявлений заболевания крайне затруднителен. Тщательный поиск
гистиоцитарных инфильтратов облегчает правильное определение
нозологии поражения.Иммуногистохимическое исследование клеток инфильтрата, про¬
веденное нами в 25 случаях, позволило подтвердить морфологиче¬
ский диагноз ГХЛ [Рыбакова М.Г и соавт., 2008]. Были выполнены
иммуногистохимические реакции с антителами к CDla (клон МТВ1)
и белку S-100, которые являются специфическими маркерами клеток
Лангерганса. В подавляющем больщинстве клеток Лангерганса обна¬
ружена экспрессия CDla и белка S-100 (рис. 2.22, см. цв. вклейку).
ГИСТИОЦЩ-ОЗХ ЛЕГКИХ • 201При проведенном нами электронно-микроскопическом исследо¬
вании клеток ЖБАЛ больных ГХЛ основную массу составляли мак¬
рофаги разной степени зрелости. Молодые формы характеризовались
округлым ядром, единичными митохондриями с плотным матриксом,
многочисленными свободными рибосомами и полисомами, слабо раз¬
витыми структурами комплекса Гольджи и ШЭР, первичными и вто¬
ричными лизосомами, расположенными как в перинуклеарной, так и
в околомембранной цитоплазме. Основную массу составили зрелые и
«старые» дегенеративные формы макрофагов, диаметром 15—20 мкм,
с эксцентрически расположенным ядром, часто имеющим неправиль¬
ную форму, и многочисленными ауто- и гетеросомами. Последние
могли достигать значительных размеров, часто занимали большую
часть цитоплазмы клетки. В цитоплазме зрелых макрофагов обна¬
ружились характерные для ГХЛ гранулы Бирбека, представляющие
собой небольшие образования с пенталамеллярным телом диаметром
20-25 нм и булавовидными утолщениями на конце, диаметром 50 нм.
В цитоплазме и ядрах дегенеративных форм макрофагов иногда встре¬
чались вирусные включения. Электронно-микроскопическое исследо¬
вание лаважной жидкости больных ГХЛ позволяет оценить функци¬
ональную активность альвеолярных макрофагов и обнаружить в них
специфические для этой патологии гранулы Бирбека. Обнаружение
гранул Бирбека (Х-гранул, или Х-телец) при электронной микроско¬
пии в цитоплазме гистиоцитов и особого S-100 белка до недавнего
времени считалось патогномоничным для ГХЛ. Однако в последние
годы специфичность их ставится под сомнение.Пролиферация гистиоцитов, содержащих избыточное количест¬
во липидов (преимушественно холестерина), чаще встречается при
болезни Хенда-Шюллера-Крисчена. Инфильтрация стенок капил¬
ляров, артериол гистиоцитами вызывает стаз крови, а в дальнейшем,
при пролиферации ретикулиновых волокон, — развитие фиброзной
I кани. Эти же изменения в сосудах могут быть причиной микро¬
кровоизлияний в легочную паренхиму. Характерной особенностью
1 истологической картины ГХЛ является раннее формирование кис¬
тозных изменений в легких, эмфизематозных тонкостенных булл
(формирование картины «сотового легкого»).Клиническая картинаПроявления болезни варьируют от минимальных со спонтанным
излечением до генерализованных, быстро прогрессирующих и приво¬
202 ♦ ГЛАВА 2. ГРАНУЛЕМАТОЗЫдящих к полиорганной недостаточности. Одиночные или множествен¬
ные поражения костей — наиболее частая локализация болезни (ребра,
нижняя челюсть, голени, позвонки, кости свода черепа, височная
кость, сосцевидный отросток). Поражение верхней и нижней челюс¬
ти может сопровождаться выпадением зубов. Развитие несахарного
диабета, диагноз которого основывается на выявлении полидипсии,
полиурии и изогипостенурии, — характерный признах ГХЛ. У одной
трети больных определяются поражения кожи: дерматозы экзематоз¬
ного, себорейного, ксантоматозного типов. У 30% детей определяется
поражение лимфатических узлов, у взрослых значительно реже: в 4%
случаев. Поражение легких у взрослых пациентов встречается у более
половины больных гистиоцитозом (в 50—60% случаев).Острое (злокачественное) течение ГХЛ (болезнь Абта—Леттерера—
Сиве) встречается, как правило, у детей в возрасте до 3 лет (так назы¬
ваемый дессеминированный или мультифокальный ГХЛ). Болезнь
характеризуется острым началом (высокая лихорадка, прогрессиру¬
ющая одышка, кожные высыпания (папулы в области грудины и
позвоночника), гепатоспленомегалия, системное увеличение лим¬
фатических узлов, повышенная СОЭ, нейтрофильный лейкоцитоз).О генерализации патологического процесса свидетельствует поражение
плоских костей, почек, кожи, тимуса, центральной нервной системы,
несахарлое мочеизнурение, экзофтальм и др.). Может присоединяться
гнойный отит, мастоидит себорейный дерматит. Болезнь может закон¬
читься летальным исходом в течение нескольких месяцев.Болезнь Хенда—Шюллера-Крисчена (ксантоматоз) встречается
преимушественно у детей школьного возраста. Для этой формы
ГХЛ характерно поражение костей черепа и (или) таза, развитие
экзофтальма, несахарного диабета, гепатомегалии, лимфаденопатии,
возникновение петехиальной сыпи, себореи, стоматита. Нередко
перечисленные проявления болезни сочетаются с ожирением, отста¬
ванием в физическом развитии, что может быть связано с дисфункци¬
ей передней доли гипофиза, или гипота лами ческой дисфункцией.Первично-хронические формы ГХЛ протекаюі более благопри¬
ятно. Средний возраст больных ГХЛ составляет 30±2,2 года. Болезнь
длительное время может протекать бессимптомно и выявляться при
профилактическом флюорографическом исследовании (у одной трети
больных). Первым проявлением ГХЛ может быть спонтанный пневмо¬
торакс (у 60-10% больных). У 60% больных ГХЛ причиной обращения
к врачу служит медленно прогрессирующая одышка, непостоянный
сухой кашель. Описанная при хронической форме ГХЛ триада призна¬
ГИСТИОЦИТОЗ X ЛЕГКИХ • 203ков (деструктивный остеолизис,
экзофтальм, связанный с гистио-
цитарной инфильтрацией орбиты
и несахарный диабет) встречается
в таком сочетании не всегда (при¬
близительно у 10% больных).Экзофтальм может быть одно-
или двусторонним. Наиболее
часто поражаются кости черепа
(рис. 2.23), таза и ребра. Реже пато-
ІІОГИЧЄСКИЙ процесс возникает
в турецком седле (мелкие очаги
деструкции дна и спинки седла).Очаги деструкции турецкого седла
нередко сочетаются с несахарным
мочеизнурением. В зависимости
от локализации костных пора¬
жений могут возникать патологические переломы, выпадение зубов,
искривление-позвоночника. Вокруг глаз, а также в других местах иногда
наблюдаются инфильтративные изменения кожи (ксантелазмьт).По мере прогрессирования заболевания односторонний или дву¬
сторонний пневмоторакс (как правило, рецидивируюишй) наблюда¬
ется у 50% больных ГХЛ. Следует отметить, что наличие системных
проявлений болезни (легкие, кости, кожа и др.) в значительной мере
облегчает интерпретацию изменений, выявляемых в легких. Наличие
высокой лихорадки, анемии, гепатоспленомегалии малохарактерно
для ГХЛ у взрослых. Наличие упомянутых признаков может быть
предиктором неблагоприятного прогноза.Рис, 2.23. Двустороннее pacnpociра¬
ненное усиление легочного рисунка
за счет интерстиция. Мелкосетчатая,
мелкоячеистая деформация легочно¬
го рисункаДиагностикаПри осмотре больных может выявляться акроцианоз, симптом
«барабанных палочек» и «часовых стекол» («пальцы Гиппократа»), что
за висит от степени выраженности и длительности ДН. У большинства
больных (63%) аускультация выявляет ослабленное дыхание, реже
сухие хрипы и у единичных больных — крепитацию.Увеличенная СОЭ, лейкоцитоз, анемия, тромбоцитопения, эози-
пофилия, увеличение числа ретикулоцитов и плазматических кле-
иж, гиперхолестеринемия, гиперглобулинемия, гипоальбуминемия,
гипербеталипопротеинемия определяются при острой форме болезни.
204 • ГЛАВА2.ГРАНУЛЕМАТОЗЫРис. 2.24* Гистиоцитоз X. Поражение
костей черепаВ особо тяжелых случаях может
развиться панцитопения. Пора¬
жение почек проявляется выра¬
женной протеинурией, прогрес¬
сирующей почечной недостаточ¬
ностью. Гепатоспленомегалия,
лимфаденопатия могут пред¬
шествовать появлеііиго легочной
симптоматики.При хронической форме ГХЛ
гемограмма, как правило, в пре¬
делах нормы. Участи больных
отмечается повышение уровня
сывороточной меди и щелоч¬
ной фосфатазы лейкоцитов.
Определяемое у некоторых боль¬
ных изменение иммунологических показателей (повышение уров¬
ня сывороточных иммуноглобулинов, ЦИК, дефицит клеточного
иммунитета) неспецифично. У ряда больных может обнаруживаться
диспротеинемия (ttj-, а,- и у-глобулинемия). Гиперхолестеринемия —
необязательный признакхронического ГХЛ. Злокачественное течение
болезни сопровождается повышением активности АПФ в сыворотке
крови. Важное значение в диагностике ГХЛ придается исследованию
лаважной жидкости, в частности определению в гистиоцитах харак¬
терных включений, или выявлению клеток Лангерганса.На ранней стадии заболевания рентгенологическое исследо¬
вание выявляет двусторонние мелкоочаговые затенения на фоне
усиленного (за счет интерстициальной ткани) легочного рисунка
(рис. 2.24). Лимфаденопатия средостения для этой формы заболе¬
вания нехарактерна. В дальнейшем на рентгенограммах и компью¬
терных томограммах определяется ячеистая деформация легочного
рисунка, образование тонкостенных кистозно-буллезных просвет¬
лений (рис. 2.25, 2.26).Сопоставление рентгенологической картины с данными морфо¬
логического исследования материала биопсий легочной ткани или
аутопсии показало, что выявляемые на ранних этапах болезни мелко¬
очаговые затенения, усиление легочного рисунка в морфологическом
аспекте соответствуют стадии пролиферации гистиоцитов, образо¬
ванию гранулем (I стадия). Быстрая трансформация гранулематоз¬
ных изменений в интерстициальный фиброз на рентгенограммах
ГИСТИОЦИТОЗХ ЛЕГКИХ • 205Рис. 2.25. ГистиоцитозХ легких.
Распростратіенная двусторонняя
деформация легочного рисунка.
Тонкостенные буллезно-кистозные
измененияРис. 2.26. ГистиоцитозХ легких. КТ:
множественные воздушные буллез¬
ные образованияпроявляется мелкосетчатой, мелкоячеистой перестройкой легочного
рисунка (II стадия). Крупноячеистая деформация легочного рисунка,
(})ормирование кистозно-буллезных образований указывает на пере¬
ход болезни в третью, заключительную стадию — стадию «сотового
легкого».Ранняя диагностика ГХЛ имеет исключительно важное значение,
так как выявление двусторонних мелкоочаговых затенений в легких
предполагает ттроведение дальнейших диагностических мероприя¬
тий, в частности ЧББ легких, а при ее неинформативности — видео-
торакоскопической или открытой биопсии. Выявление гранулем,
состоящих преимущественно из пролиферирующих гистиоцитов,
позволяет верифицировать диагноз. На второй и, н особенности, наIII стадии болезни открытая биопсия легких не показана, так как
поиски специфических для этого патологического процесса гранулем,
как правило, безуспешны. Противопоказана и ЧББ вследствие риска
возникновения травматического пневмоторакса.Исследования, проведенные в лаборатории клинической физио¬
логии дыхания НИИ пульмонологии (заведующая лабораторией —
М.Ю. Каменева), выявили нарушения ФВД у 90% больных. Несмотря
на то что средняя величина ОЕЛ у больных ГХЛ не отличается от
нормы, структура ее, как правило, перестроена за счет уменьшения
Ж ЕЛ и увеличения ООЛ. В связи с этим отношение ООЛ/ОЕЛ оказы-
1ШЄТСЯ выше нормы (увеличивается воздухонаполненность легких).
206 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫУ больных ГХЛ изменяются также показатели, характеризующие
бронхиальную проходимость: ОФВ^, отношения ОФВ/ЖЕЛ (проба
Тиффно). Уменьшение МОС 25, 50 и 75% ЖЕЛ (MOCj^ 50 „) в опреде¬
ленной мере может указывать на нарушение бронхиальной проходи¬
мости на всех уровнях воздухопроводящих путей. Средний показа¬
тель растяжимости легких уменьшается, а коэффициент ретракции
имеет тенденцию к увеличению, у 40% больных ГХЛ определяется
увеличение показателя общей работы дыхания.Средние показатели ДСЛ у больных ГХЛ также снижены.
Нарушения газообмена отражаются на РаО^, которое составляет
83,63±2,58% от должной. Статистически значимого отклонения РаСО,
(парциального давления углекислого газа в артериальной крови) и pH
у больных этой группы не определяется.Таким образом, анализ средних показателей ФВД свидетельствуето сочетании у больных ГХЛ рестриктивных и обструктивныхнаруите-
ний вентиляции. При анализе изменений ФВД у отдельных больных
в динамике выявляется определенная закономерность. На ранних
стадиях заболевания формируется рестриктивный синдром, но по
мере прогрессирования болезни присоединяются обструктивные
нарушения.Фибробронхоскопия не выявляет каких-либо характерных для
ГХЛ признаков. При цитологическом исследовании лаважной жид¬
кости определяется умеренный лимфопитоз с некоторым преоблада¬
нием клона Т-супрессоров.Перфузионная сцинтиграфия легких выявляет резкое нарушение
микроциркуляции с различной величины участками выключе¬
ния кровотока. На компьютерных томограммах определяются тон¬
костенные различной величины кистозно-буллезные образования,
распространенные во всех отделах легких, более выраженные суб-
плеврально. Верифицировать диагноз позволяет морфологическое
исследование на ранних стадиях болезни: выявление специфиче¬
ского маркера клеток Лангерганса — поверхностного CDla антигена
на крупных клетках с овальным (почковидным) ядром, получен¬
ных из очага поражения. Важным для диагностики ГХЛ является
также выявление при электронно-микроскопическом исследовании
цитоплазматических органелл— г ранул Бирбека. Гистологическая
картина, как правило, полиморфна, В материале биопсии определя¬
ются также в различных соотношениях эозинофилы, нейтрофилы,
лимфоциты, гигантские многоядерные клетки, фагоцитирующие
макрофаги, а также очаги некроза и фиброза. По мере прогресси-
ГИСТИОЦИТОЗ X ЛЕГКИХ • 207рования болезни все реже патоморфолог может выявить грануле¬
мы, клетки Лангерганса и преобладающим субстратом в материале
исследования является фиброз.Формулировка диагнозаПолученные к настоящему времени данные об особенностях кли¬
нических проявлений и течения ГХЛ позволяют считать нецелесо¬
образным использование эпонимических терминов (болезнь Абта—
Леттерера-Сиве, Хенда-Шюллера-Крисчена), а также понятия
«эозинофильная гранулема», так как все упомянутые термины ничего
не говорят о существе заболевания, отражая скорее историю его изу¬
чения. Более оправданным представляется выделение диссемини¬
рованной (генерализованной) формы ГХЛ (первично острая форма
болезни), встречающейся, как правило, в раннем детском возрасте, и
первично хронической формы, выявляемой преимущественно у лиц
старшего школьного возраста, и у взрослых. Это позволяет формули¬
ровать диагноз следующим образом.• Диссеминированный гистиоцитоз X; ведущий синдром: легоч¬
ный, эндокринный, костный, кожный и др.• ГХЛ, первично хроническая форма (фаза ремиссии, обострение).Дифференциальная диагностикаОстрое течение болезни следует дифференцировать с милиарньш
іуберкулезом легких. Однако наличие полисистемности поражения
(легкие, кости, кожа, печень и другие органы и системы) позволяет
предположить наличие острой формы ГХЛ. Поражение легких при
хронических формах ГХЛ следует дифференцировать от таких дис¬
семинированных процессов в легких, как лейомиоматоз, саркоидоз,
ЭАА, ИФА, альвеолярный протеиноз легких, диссеминированный
туберкулез легких.Отличительной особенностью ГХЛ легких является раннее фор¬
мирование тонкостенных кистозно-буллезных образований во всех
отделах легких, что несомненно отличает это заболевание от упомя¬
нутых выше. Дифференциально-диагностическими критериями ГХЛ
являются: рецидивирующий пневмоторакс, формирование «сотового
легкого», сочетание рестриктивных и обструктивных нарушений
вентиляции, возможность системного поражения. Наряду с этим1 енерализованный гистиоцитоз X следует дифференцировать с кост-
208 • ГЛА8А2.ГРАНУЛЕМАТ03ЫНОЙ формой туберкулеза, остеомиэлитом, остеосаркомой, фиброзной
остеодистрофией, нейробластомой, лимфогранулематозом, лейкозом,
гликолипидозами Гистологическое исследование позволяет верифи¬
цировать диагноз: выявление в легочной ткани гранулем, содержащих
пролиферирующие гистиоциты, ксантомные клетки. В далеко зашед¬
ших случаях гистологическая картина, как правило, не поддается
нозологической идентификации.ЛечениеНа ранних стадиях болезни используются глюкокортикоидные
препараты. Доза их зависит от соотношения степени активности
процесса и степени выраженности фиброзных изменений. Острое
течение служит показанием для назначения глюкокортикоидов в дозе1 мг на 1 кг массы тела (расчет на преднизолон). Наряду с глюкокор-
тикоидами показано назначение иммуносупрессантов и цитоста-
тических препаратов (азатиоприн, циклофосфамид, винкристин,
винбластин, хлорамбуцил и др.). Перечисленные препараты назнача¬
ются в обычных терапевтических дозах, а длительность их примене¬
ния зависртт от особенностей течения болезни. Имеются сообщенияо положительном эффекте комбинации препаратов, включающих
преднизолон, этопозид и винбластин (Протокол LSN-11) при зло¬
качественном течении заболевания [Vassallo R. et аІ., 2002 и др.].
Этопозид представляет собой цитостатик, относящийся к полусин-
тетическим производным растительного алкалоида ~ подофилло-
токсина. Препарат задерживает синтез ДНК путем воздействия на
фермент ее репликации — топоизомеразу И, подавляя тем самым
рост опухолевых клеток (при обсуждаемом заболевании— проли¬
ферацию гистиоцитов). Этопозид может вводиться внутривенно
(флаконы по 5,0 мл 2% концентрата, содержащего 100 мг препарата)2 раза в сутки в течение 3 дней. Такие курсы лечение повторяют с
интервалом 3 нед. Для приема внутрь используются желатиновые кап¬
сулы розового цвета с 50 и 100 мг препарата.Умеренные и низкие дозы глюкокортикоидов (около 30 мг в сутки
с постепенным снижением) следует назначать при хронической
форме ГХЛ, наличии в легких выраженных кистозно-буллезных
изменений. Высокие дозы глюкокортикоидов в этих случаях не пока¬
заны. Поддерживающая доза глюкокортикоидов составляет от 2,5 до10 мг в сутки. Курс лечения 12—18 мес. Глюкокортикоиды оказывают
эффект только на ранних стадиях (предотвращают прогрессирова-
ГИСТИОЦИТОЗХ ЛЕГКИХ • 209ниє, однако не гарантируют от рецидивов болезни). Клинический
опыт лечения больных первично хронической формой ГХЛ в НИИ
пульмонологии (Санкт-Петербург) свидетельствует о том, что назна¬
чение низких доз системных глюкокортикоидов в сочетании с аза-
тиоприном (имураном*) является более эффективным, чем моно¬
терапия системными глюкокортикоидами. Ориентировочная схема
лечения азатиоприном: 150 мг в сутки в течение месяца, 100 мг в
сутки — 3 мес и 50 мг в сутки в течение 6 мес. Наличие рентгенологи¬
ческих изменений, свидетельствующих о переходе болезни в стадию
интерстициального фиброза, может рассматриваться как показа¬
ние для назначения пеницилламина (купренила*). Пеницилламин
препятствует образованию перекрестных связей полипептидов в
процессе формирования коллагена, угнетает лизосомальную фер¬
ментативную активность. Длительность лечения и дозы пеницилла¬
мина при ГХЛ соответствуют таковым при ИФА, В комплекс лече¬
ния включаются также пиридоксин (витамин В^), анаболические
гормоны, препараты калия, магния; при необходимости ~ мочегон¬
ные. Лечение иммуносупрессантами, пеницилламином и цитоста¬
тически ми препаратами проводят при тщательном контроле крови,
мочи с целью своевременного выявления возможных побочных
эффектов. Рецидивирующий спонтанный пневмоторакс может быть
показанием для торакотомии с целью ушивания булл, плеврэкто-
мии. Хирургическое вмешательство, а также лучевая терапия могут
быть использованы при наличии деструктивного поражения костей.
При наличии несахарного мочеизнурения назначаются препараты
задней доли гипофиза.Во всех случаях ГХЛ табакокурение категорически противопока¬
зано по двум причинам: во-первых, курение способствует нарастанию
обструктивного синдрома, формирующегося при этом заболевании;
iio-вторых, высказывается предположение [ Silagy С. et al., 2004Jо возможности усиление пролиферации гистиоцитов под влиянием
курения.в терминальной стадии ГХЛ может проводиться трансплантация
легких. Описаны рецидивы заболевания в трансплантанте.ПрогнозУстановление диагноза на гранулематозной стадии и назначение
адекватного лечения может привести к полному выздоровлению, что
подтверждается отсутствием жалоб, нормализацией рентгенологи¬
210 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫческой картины и показателей вентиляционной способности легких.
Однако, как уже упоминалось, случаи столь раннего установления
диагноза исключительно редки. Правилом является обращение боль¬
ного к врачу и установление диагноза на стадии необратимой кистоз¬
но-буллезной перестройки легочной паренхимы.В прогностическом отношении наиболее неблагоприятны: острая
форма болезни, прогрессирование кистозно-буллезных изменений
в легких с рецидивирующим одно-двусторонним пневмотораксом,
генерализация патологического процесса. Острое течение болезни
заканчивается летально в 70—90% случаев вследствие прогрессиру¬
ющей ДН, присоединения почечной недостаточности. Хроническое
течение ГХЛ (при отсутсгвии поражения других органов и систем),
ранняя диагностика, адекватное лечение позволяют нередко достичь
стабилизации патологического процесса, а иногда и полного выздо¬
ровления. Описаны лишь единичные случаи самопроизвольного
излечения.Медико-социальная экспертизаПри выявлении рентгенологических изменений в легких, напоми¬
нающих ГХЛ, больной должен быть госпитализирован в специали¬
зированное пульмонологическое отделение (центр) для установления
диагноза и назначения лечения. После выписки из стационара боль¬
ной может приступить к работе, продолжая получать лекарствен¬
ные препараты в поддерживающих дозах. Противопоказан тяжелый
физический труд, работа в условиях запыленности, загазованно¬
сти, резких перепадов температур. Категорически противопоказано
курение. Плановая госпитализация через 5—6 мес, в последующем —1 раз в 8—10 мес. Срочная госпитализация показана при возникнове¬
нии спонтанного пневмоторакса.Хроническое течение болезни при отсутствии выраженных нару¬
шений вентиляционной способности легких практически не оказыва¬
ет влияния на трудоспособность больных. Тем не менее возможность
внезапного возникновения спонтанного пневмоторакса на фоне,
казалось бы, полного благополучия предопределяет необходимость
соблюдения некоторых ограничений: больным ГХЛ противопоказан
тяжелый физический труд, служба в армии, в военном и граждан¬
ском флоте, работа в экспедициях. Прогрессирующая ДН, рецидиви¬
рующий пневмоторакс являются показанием для перевода больных
на инвалидность.
ПНЕВМОКОНИОЗЫ • 211ПНЕВМОКОНИОЗЫПневмокониоз — это профессиональное заболевание легких от воз¬
действия промышленной пыли, проявляющееся хроническим диф¬
фузным пневмонитом с развитием фиброза легких.Заболевания легких, причиной которых является длительное вды¬
хание пыли, известны с древних времен. Термин «пневмокониоз»
впервые предложил F.A. Zenker в 1866 г., как производное от греческих
словрпеитоп — легкое и konia — пыль. В 1870 г. Visconti впервые назвал
шболсвание легких, возникающее от постоянного воздействия квар¬
цевой пыли, «силикозом».До настоящего времени распространенность пневмокониозов оста¬
ется высокой. Болезни легких занимают второе место в структуре
профессиональных заболеваний. Это обусловлено как недостаточным
контролем за экспозицией производственной пыли в промышлен¬
ности, вредными условиями труда, использованием вредных матсри-
плов, так и поздней диагностикой заболевания в связи с отсутствием
выраженной клинической симптоматики, В странах Европы и США
ш последние 16 лет распространенность пылевых заболеваний легких
(] I нсвмокониоза и хронического пылевого бронхита) снизилась с 13,8 до
4%, реже (с 8,1 до 2,6%) стали встречаться случаи с выраженными рент¬
генологическими изменениями. По данным разных авторов, пневмо-
кониозом заболевают от 26,6 до 53% рабочих различных пылеопасных
специальностей. Развитие пневмокониоза и прогрессирование рентге¬
нологических изменений влегких прямо коррелируют с длительностью
зкспозиции пыли и содержанием в ней кварца. Это йоді верждается тем
(|)актом, что в горно-рудной промышленности при стаже работы менее
20 лет силикоз выявлялся у 3% рабочих, при стаже работы 20—30 лет —
у 12% рабочих, а среди лиц, проработавших более 30 лет, распростра¬
ненность силикоза составляла 17%. Шахтеры заболевают пневмокони-
t)30M в 2 раза реже, чем литейщики.У шахтеров пневмокониоз остается ведущей причиной смерти:
смертность от пневмокониоза почти в 2,5 раза превышает смертность
от сердечно-сосудистых заболеваний.Этиология и факторы рискаПыль, находящаяся во вдыхаемом воздухе, является основным
>гиологическим фактором, ведущим к развитию пневмокониоза.
212 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫПо происхождению разделяют неорганическую, органическую и сме¬
шанные пыли, состоящие из неорганических и синтетических час¬
тиц. Выделяют аэрозоли дезинтеграции, образующиеся в результате
механического измельчения твердых тел, и аэрозоли конденсации,
образующиеся при возгонке твердых веществ.На проявление фиброгенных свойств пыли влияют физическое
состояние и химической состав пыли, растворимость, форма и сте¬
пень твердости пылинок, свойства их поверхности, а также размеры
частиц. Наибольшим воздействием на легочную ткань обладает мел¬
кодисперсная пыль с размерами частиц 0,5—7 мкм. По фиброгенным
свойствам различают три класса опасности пыли.Высокофиброгенные пыли — это пыли, предельно допустимые кон¬
центрации которых не превышают 1—2 мг/м^ К ним относятся двуо¬
кись кремния и аэрозоли, содержащие свыше 10% свободной двуоки¬
си кремния или более 10% асбеста.Средне- или умереннофиброгенные пыли — это пыли с предельно допус¬
тимыми концентрациями в диапазоне 4—6 мг/м^ К ним относятся
аэрозоли, содержащие 2—10% свободной двуокиси кремния, крем¬
немедистый сплав, карбиды кремния, тальк, стекловолокно, глину,
апатит, цемент и др.Слабофиброгенные пыли ~ это пыли с предельно допустимыми кон¬
центрациями 8—10 мг/м\ К ним относятся каменный уголь, магнезит,
асбестобакелит и др.Среди кристаллических форм кремния наиболее распространен¬
ной является кварц, реже встречаются кристобалит и тридимит.
К профессиям с риском экспозиции кремниевой пыли относятся кам¬
не ломщики, камнедробильщики, шахтеры, проходчики, пескоструй¬
щики, дробильщики гранита (песчаника), литейщики, формовщики,
выбивальщики,К факторам риска развития пневмокок иозов относя гея время экспо-
зиции пыли, предшествующие неспецифические респираторные забо¬
левания и курение. Так, асбестоз развивается у 10% рабочих со стажем
работы 10—19 лет, у 73% рабочих со стажем 20—29 лет и у 92% — при стаже
более 40лет. Курение значительно повышает риск развития заболева¬
ния. Показаію, что курение повышает устойчивость B0JЮK0H асбеста
и изменяет механизм фагоцитоза волокон клетками в легочной ткани,У курильщиков, больных пневмокониозом, более выражены обструк-
тивные нарушения, чаще развивается эмфизема легких, увеличивается
риск развития рака легких в 2—22 раза. Частые острые респираторные
вирусные инфекции также увеличивают риск развития пневмокониоза.
ПНЕВМОКОНИОЗЫ • 213Семейные случаи пневмокониоза в литературе не описаны.
Однако исследования последних лет показали наличие генетичес¬
кой предрасположенности к развитию этого заболевания. Выявлены
различия в HLA-системе, предполагающие развитие пневмоконио¬
за. Фосфоглюкомутаза-1 (-2) и витамин D-транспортный протеин R
генетически предопределяют развитие силикоза. Наследственную
предрасположенность к развитию пневмокониоза подтверждает
тот факт, что представители негроидной расы заболевают пнев-
мокониозом значительно чаще (в 2,14 раза), чем белые люди. Так,
ежегодная заболеваемость силикозом среди чернокожих мужчин
составляла 14,3 случая на 100 ООО, что в 7 раз выше, чем среди бело¬
кожих: 2,1 случая на 100 ООО рабочих мужчин. При силикозе, как
и при других гранулематозных заболеваниях, отмечается повы¬
шенная экспрессия гена остеопонтина, являющегося цитокином
и хемоатрактантом для макрофагов. Ген, кодирующий глютатион
S-трансферазы класса mu, ассоциируется с асбестозом и, так же
как и ген />53, предопределяет развитие асбест-обусловленного рака
легких. Силикоз ассоциируется с рядом генных маркеров: гапто-
глобйн, ингибитор протеиназ М,, трансферрин С,, трансферрин С,^,
трансферрин D, комплемент 3F.ПатогенезПо мерс накопления научных данных такие теории патогене¬
за пневмокониоза, как механическая [1885J, токсико-химическая
[1922], теория поверхностной активности частиц пыли [1949], усту¬
пили место иммунологической [1955] и свободнорадикальной тео¬
риям [1994]. Частицы пыли фагоцитируются альвеолярными мак¬
рофагами, играющими ключевую роль в патогенезе пневмокониоза.
Свободнорадикальная теория предполагает, что в основе поврежда¬
ющего действия кремния на альвеолярные макрофаги лежит процесс
ферментативного образования АФК: синглетного кислорода, гидро¬
ксильного радикала, пероксидного радикала, супероксидного анио¬
на. Частицы кварца могут генерировать АФК за счет имеющихся на их
поверхности ионов железа (реакция Фентона).Fe'^ + О^- Ре^+ +Ре2+ + Н,0, Fe^* + ОН- + ОН
214 • ГЛАВА2. ГРАНУЛЕМАТОЗЫПродолжающаяся адсорбция железа из организма находящимися
в легких частицами пыли и, следовательно, выработка АФК приво¬
дят к прогрессированию пневмокониоза даже после прекращения
контакта с пылью. Большое значение имеет не только количество
АФК, но и их состав. Так, самым сильным из всех биологических
окислителей является гидроксильный радикал. Большим повреж¬
дающим действием обладает перекись водорода. Избыток АФК
развивается за счет их генерации наружной мембраной клетки,
образования супероксидного аниона при разобщении окислитель¬
ного фосфорилирования и нарушении структуры митохондрий,
возникновения АФК при распаде аденозинтрифосфорной кислоты
в цитозоле макрофага. Образование АФК в кониофагах приводит к
окислительной деструкции фагоцита.В развитии пылевых заболеваний легких имеет значение степень
цитотоксичности пыли, Высокоцитотоксичная пыль (диоксид крем¬
ния и др.), вызывая быструю гибель кониофагов, эвакуируется из
легких преимущественно внеклеточно по внутритканевым лимфати¬
ческим путям, вызывая развитие патологического процесса в легочной
паренхиме. Слаботоксичная или инертная пыль, удаляясь путем муко¬
цилиарного клиренса, ведет к развитию пылевого бронхита. Однако
большие концентрации этих пылей также могут вызывать относи¬
тельно быструю гибель перегруженных частичками пыли кониофагов
и, следовательно, развитие пневмокониоза. Длинные волокна асбеста
трудно фагоцитируются и плохо удаляются защитными механизмами
организма, что приводит к развитию асбсстоза, а заболевание может
прогрессировать даже после прекращения контакта.Свободнорадикальная теория патогенеза пневмокониоза пред¬
ставлена на схеме (рис, 2.27).Повторяющийся процесс фагоцитоза пыли и гибели альвеолярных
макрофагов запускает иммунные механизмы воспаления. Активируя
иммунную систему, АФК могут участвовать в формировании спе¬
цифического аутоиммунноі'о ответа с гиперчувствитсльностью
замедленного типа. В присутствии ионов Fe^^ и Си^^ АФК вызывают
деструкцию белков и ДНК, что обусловливает формирование аутоан¬
тигенов. Так, у больных силикозом могут обнаруживаться ауто-АН А,
характерные для синдрома Съегрена и СКВ, при отсутствии клини¬
ческих проявлений этих заболеваний. Таким образом, при пылевой
патологии легких «респираторный взрыв» фагоцита способен не
только разрушить кониофаг, но и запустить аутоиммуные механизмы
воспаления.
ПНЕВМОКОНИОЗЫ • 215Рис. 2.27. Схема свободнорадикальной теории патогенеза пневмокониозов
{Орлова Г.П., 2005]Протеолитические ферменты и АФК, освобождаемые альвеоляр¬
ными макрофагами и нейтрофилами, вызывают повреждение клеток
и разрушение внеклеточного матрикса; освобождаются медиаторы
воспаления, такие как цитокины и метаболиты арахидоновой кис¬
лоты. Матриксная металлопротеиназа и эластаза, секретируемые
альвеолярными макрофагами и нейтрофилами, являются протеоли-
тическими ферментами, воздействующими на компоненты внеклс-
гочного матрикса. Дисбаланс в системе протеазы-ингибиторы про¬
теаз усугубляется АФК, которые инактивируют ингибиторы протеаз,
в частности а,-антитрипсин, В результате повышается активность
зластазы и повреждается эластический и коллагеновый каркас лег¬
ких, развивается эмфизема легких.Активация пероксидации липидов и длительная стимуляция
монооксигеназной системы в ответ на выработку АФК приводят к
хромосомным аберрациям и усиливают канцерогенность минераль¬
ной пыли. Кроме того, угольная пыль вызывает истощение системы
216 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫантиоксидантной защиты. Отмечено снижение уровней антиоксидан¬
та селена и глютатион пероксидазы у шахтеров.Частицы пыли активируют продукцию альвеолярными макрофа¬
гами провоспалительных цитокинов TNF-a, ИЛ-1, ИЛ-6 и хемокинов
(MIPla и M1F2) в легких. Ведущую роль в притоке нейтрофилов в лег¬
кие при экспозиции пыли играет TNF-a. Содержание TNF-a в крови
больных силикозом увеличивается уже на ранних стадиях заболева¬
ния, коррелирует с тяжестью силикоза и развитием рака легких при
асбестозе. «Рекрутируемые» в зону воспаления нейтрофилы также
секретируют TNF-a, ИЛ-1. При силикозе и антракозе наблюдается
повышенное содержание в легких TNF-a и ИЛ-1, которые индуциру¬
ют накопление коллагена и фибронектина в легочных фибробластах
и стимулируют пролиферацию фибробластов. Многие авторы ука¬
зывают на ключевую роль TGF-p в патогенезе легочного фиброза.
Этот фактор стимулирует пролиферацию фибробластов, экспрессию
коллагена и фибронектина, инактивирует протеазы. Рядом авторов
показано, что альвеолярные макрофаги больных силикозом и антра¬
козом спонтанно выделяют значительное количество факторов роста
фибробластов. Эти медиаторы участвуют в пролиферативном ответе
эпителиальных клеток II типа, встречаюшихся при прогрессивном
массивном фиброзе.Патогенез острого силикоза до конца не изучен. Неясно, что вызы¬
вает отложение липопротеина в альвеолах при силикопротеинозе:
либо гиперплазия альвеолоцитов П типа с гиперпродукцией сурфак¬
танта, либо снижение функциональной активности альвеолярных
макрофагов к удалению нормально продуцируемого сурфактанта.
Нет единого мнения о механизмах развития легочной гипертензии
при пневмокониозах. Компоненты пыли могут непосредственно вли¬
ять на легочные капилляры, изменять сосуды легких в очагах фиброза
и в фокальных эмфизематозных участках. Некоторые авторы описы¬
вают сужение просвета сосудов в результате развития силикотических
гранулем непосредственно в сосудистой стенке.Патологическая анатомияМорфологические изменения в легочной ткани при пневмокони¬
озах зависят от формы заболевания. Макроскопически легкие увели¬
чены в объеме, плотные, маловоздушные, не спадаются при вскрытии
грудной клетки, при разрезании их слышится хруст. Плевральные
полости облитерированы плотными спайками.
ПНЕВМОКОНИОЗЫ * 217Первоначальные изменения происходят в лимфатических узлах,
вокруг посткапиллярных венул легочных долек. Эти изменения
являются центральным звеном в формировании пневмокониоза. Так,
на ранних стадиях силикоза гистологически выявляются периваску-
лярные и перибронхиальные скопления альвеолярных макрофагов и
раннее формирование гранулем в легочной ткани. По мере прогрес¬
сирования процесса развивается пневмофиброз. Для пневмокониозов
характерны три типа эмфиземы:— 1-й тип — проксимальная ацинарная эмфизема, особенностью
которой является сочетание фокальных эмфизематозныхучаст-
ков и интерстициального фиброза;— 2-й тип— иррегулярная эмфизема, характеризующаяся уве¬
личением и деструкцией ацинусов в сочетании с выраженным
рубцовым процессом в легочной ткани, с чем и связывают
иррегулярный характер эмфиземы;— 3-й тип — буллезная эмфизема.В морфогенезе пневмокониоза выделяют четыре гистологические
стадии:— I стадия — альвеолярный липопротеиноз;— 11 стадия — серозно-десквамативный альвеолит с формирова¬
нием катарального эндобронхита;— ПІ стадия — кониотический лимфангиит с возможным фор¬
мированием гранулематозного воспаления;— IV стадия — кониотический пневмосклероз с прогрессирую¬
щим склерозирующим эндобронхитом.Изменения в легких и плевре сопровождаются поражением при¬
корневых и паратрахеальных лимфатических узлов. В патологический
процесс часто вовлекаются лимфатические узлы не только органов
г рудной полости, но и расположенные вне ее (шейные и брюшные).
Развитие склеротического процесса в лимфатических узлах ведет к
нарушению их строения, а это, в свою очередь, определяет состояние
и м мунной систем ы.Различают две формы пневмокониоза — узелковую и диффузно-
с клеротическую (интерстициальную).Для узелковой формы пневмокониоза характерно наличие во всех
отделах легочной ткани силикотических узелков различной формы
и величины серого или серо-черного цвета. Излюбленной локализа¬
цией узелков является периваскуляркая перибронхиальная соеди-
иительная ткань. Отдельные субплеврально расположенные узелки
м()[ ут кальцинироваться, образуя плотный плевральный фиброз по
21В • ГЛАВА 2. ГРАНУЛЕМАТОЗЫтипу панциря. Узелки часто сливаются, образуя конгломераты раз¬
личных размеров. В крупных конгломератах узелков иногда видны
очаги некроза (в виде крошащихся масс). Трахеобронхиальные,
бронхопульмональные лимфатические узлы увеличены, часть из них
имеет сплошное черное и серо-черное окрашивание, часть — пестро¬
го вида с прослеживаемым рисунком узелков. Формирование брон-
хоэктазов нехарактерно, а очаги эмфиземы выражены слабо.Микроскопическая структура гранулем зависит от стадии раз¬
вития процесса. Свежие гранулемы представляют собой скопления
одноядерных и многоядерных макрофагов, содержащих в цито¬
плазме угольный пигмент и двоякопреломляющие кристаллы раз¬
ной формы и величины (рис. 2.28, см. цв. вклейку). Вокруг них рас¬
положены в беспорядке лимфоциты, фибробласты, пучки коллаге-
новых и преколлагеновых волокон, идущих в разных направлениях,
и капиллярные сосуды с набухшим эндотелием. Зрелая гранулема
имеет округлую форму и чередование концентрически располо¬
женных слоев клеток (альвеолярных макрофагов и фибробластов)
и гиалинизированных волокон соединительной ткани (рис. 2.29).
Сосуды единичны, со склерозированными стенками, часть из них
облитерирована. Иногда обнаруживаются атипичные гранулемы с
центральным аморфным некрозом, среди которого располагаютсясвободно лежащие двоякопре¬
ломляющие кристаллы, части¬
цы угля и кальцификаты. По
периферии расположена гиали-
низированная соединительная
ткань с единичными фибро¬
цитами. Сосуды практически
отсутствуют. Изменения легоч¬
ной ткани вне гранулем выра¬
жены незначительно.При диффузно-склеротиче¬
ской (интерстициальной) форме
пневмокониоза ткань легкого
уплотнена, неравномерной воз¬
душности. По ходу крупных
бронхов и сосудов, а также меж-
долевых щелей определяются
грубые тяжи плотной соедини¬Рис. 2.29. Диагноз: пневмокониоз
электросварщика. Гранулемы с пыле¬
выми частицами, с альвеолярными
макрофагами, содержащими вклю¬
чения коричневого и черного цветов.
Очаги концентрическою фиброза
ПНБВМОКОНИОЗЫ *219тельной ткани. В крупных и мелких бронхах— бронхоэктазии.
Паренхима легкого неравномерной воздушности: очаги ателектаза
чередуются с участками эмфиземы, чаще буллезной. Четких сили-
котических узелков не видно. Лимфатические узлы увеличены,
черного и серого цветов. На плевре многочисленные спайки и плос¬
костные сращения.Микроскопическая картина при этой форме пневмокониоза
сходна с интерстициальной пневмонией, с разницей лишь в том,
что в межальвеолярных перегородках и в просветах альвеол видны
многочисленные кониофаги, часть из которых содержит двоякопре-
ломляющие кристаллы. В старых очагах запыления соединительная
ткань гиалинизирована, бедна сосудами. В лимфатических узлах
выявляются единичные, нечетко очерченные силикотические гра¬
нулемы.Диффузный интерстициальный фиброз, развивающийся при
асбестозе, характеризуется наличием в интерстиции легких асбесто¬
вых телец, представляющих собой волокна асбеста, фагоцитирован¬
ные и окутанные железосодержащим белковым веществом.Острый силикоз морфологически можно определить как сили-
копротеиноз —- альвеолит с альвеолярным липопротеоинозом. Это
самая тяжелая форма силикоза.Клиническая картинапроявления болезниКлинические проявления пневмокониоза зависят от формы забо¬
левания: узелковой, интерстициальной, узловой.Узелковый пневмокониоз развивается от воздействия пыли с содер¬
жанием свободной двуокиси кремния более 10%, а также при метал-
локониозах, пневмокониозах электросварщиков и щдифовщиков.
Особенностью силикоза как наиболее яркого представителя узел¬
ковой формы пневмокониозов является длительное бессимптомное
течение. Кашель, выделение мокроты и одышка появляются в связи
с сопутствующим хроническим бронхитом, протекающим, как пра¬
вило, с обструктивными нарущениями вентиляции. Боли в груд¬
ной клетке обычно связаны с поражением плевры и неинтенсивны.
Обычно прогрессирующая одышка при физической нагрузке является
единственным симптомом силикоза (одышка в покое бывает редко).
220 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫСтепень ДН не всегда коррелирует с выраженностью фиброзного
процесса в легких. Общее состояние больных долгое время остается
удовлетворительным. На поздних стадиях силикоза может выявлять¬
ся мозаичность перкуторного звука, связанная с чередованием полей
фиброза с эмфиземой. При присоединении эмфиземы легких грудная
клетка становится бочкообразной, изменяются пальцы рук по типу
«пальцев Гиппократа». Аускультативная картина изменяется только
на II—III стадии в виде жесткого, ослабленного дыхания, непостоян¬
ных сухих низкотональных хрипов; последние обусловлены сопутс¬
твующим эндобронхитом и нарушением дренажа вязкой мокроты.
На поздних стадиях может выслушиваться крепитация как проявле¬
ние альвеолита.Интерстицальная или диффузно-склеротическая форма пневмоко-
ниоза чаще развивается при воздействии пыли с содержанием сво¬
бодной двуокиси кремния менее 10% — асбестоз, тальковый пнев-
мокониоз, пневмокониоз угольщика, графитовый фиброз легкого.
Среди них наиболее тяжелым является асбсстоз. Он может развиться
через 15—20 лет после начала контакта. Клинические проявления
развиваются раньше и более выражены, чем при узелковой форме
пневмокониоза. Одним из ранних симптомов заболевания является
одышка, прогрессирующая по мере развития интерстициального
фиброза легких. Кашель сухой или с вязкой мокротой. Сильные болив грудной клетке обусловлены
поражением плевры. Выделяют
плевральную форму асбестоза,
характеризующуюся изолиро¬
ванным поражением плевры в
виде ее утолщения, неправиль¬
ной формы бляшек, нередко с
обызвествлением. При аускуль¬
тации у 60% больных может
выслушиваться крепитация, а у
30-40% — отмечаются «пальцы
Гиппократа».Узловая форма пневмоконио¬
за образуется только от воздей¬
ствия кварцевой пыли (силикоз).
Фиброзный процесс идет по типу
формирования крупных конгло-Рис. 2.30. Диагноз: силикоз, узловая
форма. Образование неправильной
округлой формы с нечеткими конту¬
рами в средней доле, очаговое зате¬
нение неоднородного характера в
S8 справа, две крупноочаговые тени
слева в нижних отделах
ПНЕВМОКОНИОЗЫ • 221мсратов, одно- или двусторонних, имеющих неправильно-округлую
(|)орму и четкие неровные контуры — так называемые поля фибро-
т (рис. 2.30). Структура конгломератов может быть негомогенной,
нередко с множественными мелкими обызвествлениями. Развивается
иррегулярная и буллезная эмфизема, локализующаяся рядом с узла¬
ми. Резкая деформация бронхиального дерева может привести к раз¬
витию сегментарных гиповентилядии и ателектазов.В 10% случаев силикоз может сочетаться с аутоиммунными забо-
лсЕшниями: СКВ, ГВ, ССД {синдром Эразмуса), ревматоидным поли¬
артритом (синдром Каплана), интерстициальным гранулематозным
дерматитом (синдром Аккермана), дерматомиозитом (ДМ), а также
с аутоиммунным поражением почек и обыкновенной пузырчаткой.
Возможны внелегочные проявления силикоза: силикотические гра¬
нулемы могут обнаруживаться в печени, брюшине, отложения крем¬
ния могут выявляться в роговице глаза.Течение болезниПо характеру течения различают следующие формы пневмокониоза.• Быстро прогрессирующий пневмокониоз: переход I стадии воII стадию происходит в течение 3-5 лет и даже быстрее.• Медленно прогрессирующий пневмокониоз: переход I стадии воII стадию происходит через 5-10, а иногда и десятки лет.• Регрессирующий пневмокониоз. Встречается только при скопле¬
нии в легких рентгеноконтрастной пыли за счет ее элиминации
и рассасывания клеточных скоплений и молодых кол л are новых
волокон. На нащ взгляд, эту форму пневмокониоза следует рас¬
ценивать как обратное развитие ЭАА после прекращения экс¬
позиции патогенного материала. Только в небольщом проценте
случаев пневмокониоз можно расценивать как истинно регрес¬
сирующий. Это касается только сидероза, станноза, баритоза,
антимониоза (сурьмяного пневмокониоза).• Острый силикоз. Заболевание быстро развивается и приводит к
летальному исходу в течение 0,5—1,5 лет.• Поздний силикоз. Развивается через 10—20, а иногда и более лет
после прекращения работы с относительно непродолжительной
(4-5 лет) экспозицией больших концентраций кварцсодержа¬
щей пыли.Ряд авторов кроме острого, выделяют подострый, хронический и
осложненный хронический силикоз. Подострый силикоз развива¬
222 • ГЛАВА 2, ГРАНУЛ ЕМ АТОЗЫется при контакте с пылью с большим содержанием свободной дву¬
окиси кремния (пескоструйщики, проходчики). Через 2-5 лет после
начала экспозиции пыли появляются изменения на рентгенограмах
органов грудной клетки. Смерть больных наступает в среднем через
10 лет после установления диагноза. Хронический силикоз разви¬
вается при контакте с пылью с умеренным содержанием свободной
двуокиси кремния (литейщики, гончары и др.). Рентгенологические
изменения появляются не раньше чем через 20 лет после экспо¬
зиции. при осложненном силикозе отмечается слияние мелких
очагов в большие конгломераты (более 10 мм), которые могут нару¬
шать проходимость дыхательных путей. К осложненному силикозу
также относят силикотуберкулез, синдромы Каплана, Эразмуса,
Аккермана.КлассификацияВ 1996 г. М3 РФ была утверждена классификация, выделяющая три
группы пневмокониозов по этиологическому признаку.1. Пневмокониозы от воздействия высоко- и умереннофиброген¬
ной пыли (содержащей более 10% свободной двуокиси крем¬
ния) — силикоз и приближающиеся по своей сущности к сили¬
козу антракосиликоз, силикосидероз, силикосиликатоз. Эти
пневмокониозы имеют склонность к прогрессированию процес¬
са и осложнению туберкулезом.2. Пневмокониозы от слабофиброгенной пыли (содержащей менее
10% свободной двуокиси кремния или НС содержащей его),
к ним относятся силикатозы (асбестоз, талькоз, коалиноз, оли-
виноз, нефелиноз, цементный и слюдяной пневмокониозы),
карбокониозы (антракоз, графитоз, сажевый пневмокониоз и
др.), пневмокониоз шлифовальщиков или наждачников, пнев¬
мокониозы от рентгеноконтрастных пьтлей (сидероз, баритоз,
станноз, манганокониоз и др.). Для них характерны умеренно
выраженный фиброз, более доброкачественное и малопрогрес¬
сирующее течение.3. Пневмокониозы от аэрозолей токсико-аллерген ного действия —
бериллиоз, алюминоз, «легкое фермера».Недостаток этой классификации — включение в третью груп¬
пу пневмокониозов такой нозологической формы, как альвеолит
ПНЕВМОКОНИОЗЫ • 223(ЭАА и ЭТА), который характеризуется яркостью и динамично¬
стью клинических проявлений и требует принципиально друго¬
го терапевтического подхода. Это более чем нецелесообразно,
так как ЭАА в 1996 г. был включен в список профессиональных
болезней.В настоящее время разрабатывается новая классификация про¬
фессиональных болезней, и в частности пневмокониозов на основе
МКБ-Ш.Согласно МКБ-10 пневмокониоз по этиологическому принципу
относится к X классу — «Болезни органов дыхания», блоку J60—J70 —
«Болезни легкого, вызванные внешними агентами». Согласно этой
классификации выделяют:• J60 Пневмокониоз угольщика (антракосиликоз, антракоз, «легкоеугольщика»),• J61 Пневмокониоз, вызванный асбестом и другими минеральны¬
ми веществами (асбестоз).• J62 Пневмокониоз, вызванный пылью, содержащей кремний(включен; Силикатный фиброз (обширный) легкого).J62.0 Пневмокониоз, вызванный тальковой пылью.— J62.8 Пневмокониоз, вызванный другой пылью, содержащей
кремний (силикоз).• J63 Пневмокониоз, вызванный другой неорганической пылью.— J63.0 Алюминоз (легкого).— J63.1 Бокситный фиброз (легкого).— J63.2 Бериллиоз,— J63.3 Графитный фиброз (легкого).— J63.4 Сидероз.— J63.5 Станноз.— J63.8 Пневмокониоз, вызванный другой уточненной неоргани¬
ческой пылью.• J64 Пневмокониоз нсуточненный.• J65 Пневмокониоз, связанный с туберкулезом.При постановке диагноза «пневмокониоз»^ используется рентге¬
нологическая и клинико-функциональная характеристика пневмо¬
кониозов, представленная в табл. 2.2. Рентгенологическая часть этой
классификации в основном соответствует Международной класси-
(|)икации пневмокониозов, принятой Международной организациейі руда (МОТ) в 1980 г.
224 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫТаблица 2.2. Рентгенологаческая и клинике-функциональная характеристика
пневмокониозов (классификация пневмокониозов, 1976 г.)Ренп«налогическая характеристикаКлинико-КодХарактер затененийРаспространекность,
плотность и площадь
распространения затененийСтадияфункциональнаяхарактеристика0Нет пневмокониоза0-1КонтрольрqгУзелковый
Узелки диаметром
до 1,5 ммУзелки диаметром от 1,5
до 3 ммУзелки диаметром от 3 до
10 ммДвусторонняя:1) небольшое количество
теней:2) умеренное количество
теней;3) множественные тениИ1Бронхит. Бронхиолит.
Эмфизема легких
I-III стадаи. Легочная
недостаточность
I-III степени.Легочное сердцекомпенсированное,декомпенсированноеStUИнтерстициальный
Линейные и сетчатые
изменения
Тяжистые изменения
Груботяжистые изменения
с мелкими неправильной
формы пятнистыми и
линейными тенямиДвусторонняя диффузная:1) нерезко выраженные
тени;2) умеренно й)1раженные тени;3) множественные тени1-11То жеАВСУзловойМелкоузловой — узлы
диаметром от 1 до 5 см
Крупноузловой — узлы
диаметром от 5 до 10 см
Массивный — диаметр
узлов более 10 смДвусторонняя
или односторонняяIIIТо жеКодируются также дополнительные рентгенологические призна¬
ки: ах— слияние узелков и некоторых мелких пятнистых теней;
pq — плевродиафрагмальные спайки; pqp — плевроперикардиальные
спайки; pqc — плевральные обызвествления; сп — обызвествления
узелков; с1 — обызвествления лимфатических узлов; es — скорлупо-
образное обызвествление лимфатических узлов; hi— увеличенные
плотные лимфатические узлы; ет — эмфизема легких; Ьи — буллезная
эмфизема; со — изменение размеров и формы сердца; ср — легочное
сердце; di — смещение органов средостения, сердца, корней легких;
рх — пневмоторакс; aim — среднедолевой синдром; cv — каверны;
г/ — синдром Каплана.
ПНЕВМОКОНИОЗЫ • 225Этот раздел классификации в 1996 г. был дополнен оценкой изме¬
нений плевры при воздействии пыли асбеста; диффузных плевраль¬
ных утолщений и локальных наложений (бляшек),В зависимости от обширности рентгенологических изменений
выделяют три стадии лневмокониозов, обозначаемые кодами, соот¬
ветствующими характеру и распространенности затенений в легочной
ткани (см. табл. 2.2).ОсложненияТуберкулез является наиболее частым осложнением пневмокони-
оза. Развитие туберкулеза связано с обострением первичных очагов в
легких или лимфатических узлах с последующим распространением
процесса на легочную паренхиму. Туберкулез чаше встречается при
узелковой и узловой формах пневмокониоза (в 40—50% случаев).
Интерстициальная форма осложняется туберкулезом лишь в 5-10%
случаев. Пневмокониозы могут осложняться бронхиальной астмой,
бронхоэктазами, бронхоспастическим и бронхообструктивным синд¬
ромами. Неопластические процессы наиболее часто являются ослож¬
нением асбестоза и реже — силикоза.ДиагностикаЛабораторные методы. При пневмокониозах изменения общекли-
пичсских, биохимических, иммунологических, вирусологических и
микробиологических показателей неспецифичны и диагностически
ігезначимьт. Прогрессирующие формы силикоза имеют более яркие
клинические проявления и сопровождаются повышением показате¬
лей острофазовых реакций, увеличением содержания общего белка
и (І- и у'Глобулинов в периферической крови, в крови увеличивается
содержание белковосвязанного оксипролина и снижается экскреция
с мочой его пептидно-связанных и свободных фракций, что указы-
|»ает на преобладание процессов синтеза коллагена над его резорб¬
цией. В случае выявления характерных для синдрома Каплана рен¬
тгенологических изменений (периферически расположенные оча¬
говые тени) без признаков РА подтвердить диагноз помогает тест
па ревматоидный фактор, который может быть положительным
у 62% больных.
226 • ГЛАВА2.ГРАНУЛЕМАТ03ЫЛучевые методы исследования. Диагноз пневмокониоза в первую
очередь — рентгенологический: выявляются двусторонние изменения
на рентгенограммах органов грудной клетки в виде распространенных
мономорфных мелкоочаговых затенений или деформации легочного
рисунка за счет интерстициального фиброза. Особенности рентгено¬
логических изменений в легких при пневмокониозах представлены
в рентгенологической части классификации этой патологии. При
асбестозе у 10—20% больных с гистологическими признаками фибро¬
за могут быть нормальные рентгенограммы органов грудной клетки.
В последнее время все большее значение придается КТ легких, выпол¬
ненной в высокоразрешающем режиме. Это позволяет на ранних ста¬
диях выявить изменения в легочной ткани (очаговые, интерстициаль¬
ные), в плевре (при асбестозе), а также неопластические изменения,
наиболее часто развивающиеся при асбестозе. При остром силикозе
ВРКТ выявляет изменения по типу «матового стекла» или альвеоляр¬
ные затенения при отсутствии очаговых теней.При 1 стадии узелковой формы
пневмокониоза на рентгенограм¬
мах грудной клетки выявляется
небольшое количество узелков
(1,2р, l,2q, 1,2г), локализующихся
симметрично с двух сторон, пре¬
имущественно в средних и ниж-
нихотделах(рис. 2.31), Отмечается
умеренное диффузное усиление
легочного рисунка за счет интер¬
стициального компонента в виде
мелкосетчатой деформации.
Могут выявляться перинодуляр-
ная эмфизема, мелкие плевраль¬
ные спайки, утолщения меж-
долевой плевры. Корни легких
расширены, фиброзно уплотне¬
ны, нередко отмечается ноли-
цикличность их контура за счет
плотных увеличенных лимфати¬
ческих узлов. Могут выявлять¬
ся скорлупообразные обызвест¬
вления лимфатических узлов
(рис. 2.32), часто сочетающиеся сРис. 2.31. Диагноз: пневмокониоз.
Распространенное усиление легоч¬
ного рисунка за счет интерстициаль¬
ного компонента в виде сетчатости,
местами - мелкой ячеистости, на
фоне которого в верхних и средних
отделахлегкихопределяются неочер¬
ченные очаговые тени 0,3—0,4 см в
диаметре и более мелкие единичные
очаговые тени диаметром 0,2—0,3 см
в нижних отделах легких. Диафрагма
расположена обычно
ПНЕВМОКОНИОЗЫ • 227наличием обызвествленых узелков в легочной паренхиме. У больных
узелковой формой пневмокониоза II стадии на рентгенограммах орга¬
нов грудной клетки выявляются множественные узелковые тени (Зр,
3q, Зг), иногда обызвествленные на фоне деформированного по сетча¬
тому и мелкоячеистому типу легочного рисунка — картина «снежной
бури» (рис. 2.33). Верхушки лег¬
ких могут быть иитактны. Корни
(|)иброзно уплотнены, лимфати¬
ческие узлы Б корнях увеличены,
могут обызвеСТЕЛЯТЬСЯ по типу
яичной скорлупы. Плевральные
диафрагмальные и кардиаль-
иые сращения более выражены.Третья стадия характеризуется
слиянием сили коти чсск их узел¬
ков и формированием фиброзных
узлов или опухолевидных конг¬
ломератов (рис. 2J4, 2,35). Корни
смещены в сторону наиболь¬
шего поражения, обрублены.I Істрификация лимфатических
узлов в корнях по типу яичной
скорлупы. Рядом с фиброзными
узлами выявляются участки бул¬
лезной эмфиземы.Интерстициальная или диф¬
фузно-склеротическая форма
ииевмокониоза характеризуется
диффузным двусторонним уси¬
лением и деформацией легочного
|)исунка за счет интерстициаль¬
ного компонента в виде сетча-
юсти и ячеистости, тяжистой
перестройки легочного рисун¬
ка. Изменения более выраже¬
ны в средних и нижних отделах
легких. Узелки немногочислен¬
ные или отсутствуют. Т стадия
характеризуется нежной сетчатой
дс(}юрмацией легочного рисункаРис. 2.32. Диагноз; силикоз. Мно¬
жественные двустороиїгие очаговые
затенения. Скорлупообразиые обыз¬
вествления лимфатических узловРис. 2,33, Диагноз: силикоз II ста¬
дии. Распространенные интерсти¬
циальные изменения в обоих легких.
Множественные очаговые ацинар-
ные затенения, слияние затенений
в верхних и средних долях. Корни
расширены с нечеткими границами
228 • ГЛАВА2. ГРАНУЛЕМАТОЗЫРис. 2.34. Диагноз: силикоз II ста¬
дии. Множественные затене!іия до
0,1-0,2 см. В значительном количес¬
тве встречаются крупные до 1,0 см в
диаметре очаги, местами сливающи¬
еся, расположенные субплеврально,
с нечеткими контурами, без призна¬
ков распада. С обеих сторон опреде¬
ляются единичные фиброзные поля,
размером до 3,0 см" .V-. . .У.Х,.'■7;Рис, 2.35. Диагноз: силикоз Т1 стадии.
Значительные диффузные наруше¬
ния перфузионной функции легких,
больше выраженные в левом легкомв базальных отделах легких,
сочетающихся с изменениями
по типу «матового стекла». При
переходе его во II стадию выяв¬
ляются тяжистая деформация
легочного рисунка, плевральные
наслоения, спайки. Фиброзные
изменения париетальной и вис¬
церальной плевры от утолщений
и базальных спаек до грубых
плеврокардиальных сращений,
придающих сердечной тени вид
«мохнатого сердца». Третья ста¬
дия асбестоза проявляется выра¬
женной деформацией легочного
рисунка по типу «сотового легко¬
го». Лимфаденопатия выявляется
реже, чем при узелковой форме
пневмокониоза.Исследование ФВД. Пневмо-
кониозы характеризуются как рес¬
триктивными, так и обструктив-
ными и смешанными нарушения¬
ми ФВД. В зависимости от формы
пневмокониоза функциональные
изменения могут развиться на II—
ІТІ стадии заболевания (узелковая
форма) или на I стадии (интерсти¬
циальная форма). ОЕЛ и ее струк¬
тура изменяется по смешанному
или рестриктивному типу, дел в
устойчивом состоянии (ДСЛус),
указывающая на ухудшение усло¬
вий газообмена за счет неравно¬
мерности распределения регио¬
нарных отношений альвеолярной
вентиляции и капиллярного кро¬
вотока в легких, может снижаться
уже на I стадии пневмокониоза.
ПНЕВМОКОНИОЗЫ • 229Этот показатель наиболее чувствителен и изменяется на ранних ста¬
диях развития заболевания. Наибольшие изменения ДСЛус и ДСЛзд
развиваются при интерстициальной форме пневмокониоза. Снижение
ДСЛзд указывает на ухудшение газообмена в легких за счет уменьше-
ПИЯ функционирующей поверхности легких. Индекс ретракции легких
ііовьіпіастся на поздних стадиях заболевания, что указывает на повы¬
шение эластической отдачи легких при пневмофиброзе.Исследование легочно-сердечной гемодинамики. Эходопплеркар-
диографическос исследование гемодинамики малого круга кровооб¬
ращения уже на ранних стадиях силикоза может выявлять легочную
гипертензию, которая нарастает при минимальных изменениях ФВД.
Выявляются признаки хронического легочного сердца.Характерно наличие сочетанных диффузных и локальных
(реже — только локальных) нарушений перфузии легких на спинти-I рам мах с ^^"'[Тс].Бронхологические методы исследования. Фибробронхоскопия
выявляет наличие атрофических изменений слизистой оболочки
бронхов, реже — трахеобронхиальную дискинезию различной степе¬
ни выраженности, что указывает на развитие cony гствуюшсго пыле-
пого бронхита.В ЖБАЛ может выявляться как нейтрофилез, так и лимфоцитоз.
Обнаружение двоякопреломляющих кристаллов, бурых или черных
включений в альвеолярных макрофагах, а также минеральных эле¬
ментов при спектральном анализе, асбестовых телец в ЖБАЛ указы¬
вает на наличие контакта с фиброгенной пылью, но не может считать¬
ся признаком заболевания. Для подтверждения наличия контакта с
асбестом информативным является выявление в мокроте асбестовых
гслец, представляющих собой фагоцитированные и покрытые желе-
июодсржащим белковым веществом и определяемые при традицион¬
ной световой микроскопии. Чистые волокна асбеста видны только в
электронном микроскопе.Эндоскопические и хирургические методы исследования, в сложных
случаях диагностики показано проведение ЧББ, видеоторакоскопи-
ческой или открытой биопсии легких для гистологической верифика¬
ции диагноза. Наиболее информативной при небольшой травматич-
иости является видеоторакоскопическая биопсия легких.Морфологические методы исследования. Гистологическая верифи¬
кация диагноза имеет большое значение не только в диагностически
сложных случаях, но и для аргументации связи заболевания с про¬
230 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫфессией. Выявление асбестовых телец в легочной ткани может сви¬
детельствовать о наличии контакта с асбестом, но их отсутствие ни в
коем случае не отрицает асбестоз. Однако некоторые авторы считают
обязательным выявление асбестовых телец в ткани легкого для под¬
тверждения наличия асбестоза.Формулировка диагнозаВ последнее Время При формулировке диагноза стадия заболева¬
ния не ставится. Вместо этого, для определения распространенности
рентгенологических изменений, используются коды.• Силикоз 2q, ДН — Т степени. (Силикоз 11 стадия, узелковая форма
(умеренное количество узелков диаметром 2,5 мм), ДН — I сте¬
пени.)♦ Силикоз (А 3q сп с1 em ср), сил икоту беркулез, ДН 11, субком-
пенсированное легочное сердце, (Мелкоузловой силикотуберку-
лез, силикоз ИТ, эмфизема легких, ДН 11, субкомпенсированное
легочное сердце.)Дифференциальная диагностикаПневмококиозы следует дифференцировать с диссеминирован¬
ными процессами в легких другой природы. Тщательно собранный
профессиональный анамнез помогает выявить контакт пациента с
фиброгенными аэрозолями.Наибольшее значение имеет дифференциальная диагностика
между пневмокониозами и диссеминированным туберкулезом легких.
Трудность представляет диагностика осложненной формы заболева¬
ния — кониотуберкулеза. При пневмокониозе отсутствуют признаки
интоксикации (субфебрилитет, слабость, утомляемость, повышен¬
ная потливость), нормальная СОЭ, отрицательные тесты с туберку¬
лином.Пневмокониоз, так же как и саркоидоз легких, длительное время
может протекать бессимптомно. Л имфаденопатия при пневмокониозе
менее выражена, чем при саркоидозе. Обызвествления внутригруд-
ных лимфатических узлов по типу «яичной скорлупы» характерны
для пневмокониоза. Спонтанная или на фоне глюкокортикоидной
терапии ремиссия заболевания указывает на саркоидоз легких. Для
уточнения диагноза следует проводить ЧББ легкого с гистологиче¬
ским исследованием ткани легкого.
ПНБВМОКОНИОЗЫ • 231Интерстициальные формы ииевмокониоза следует дифференци-
роБать с фиброзирующими альвеолитами, клинические проявления
которых значительно более выражены (степень ДН, рестриктивный
синдром) и склонны к быстрому прогрессированию.с неопластическим процессом в лег ких следует дифференцировать
узловые и узелковые формы силикоза. Большое значение при этом
имеет анализ выраженности клинических проявлений (отсутствуют
или минимальные при пнсвмокониозе), цитологическое исследова¬
ние мокроты и смыва из бронхов на атипические клетки и гистологи¬
ческое исследование биопсийного материала.ЛечениеТактика лечения пневмокониоза должна основываться на трех
основных моментах.1. Улучшение экологической обстановки на рабочих местах. Это —
залог успешного ведения больного и профилактики ocJюжнeний.2. Исключение вредных привычек, в первую очередь курения таба¬
ка (80% работающих курят).3. Лечебные мероприятия должны учитывать патогенетические
механизмы формирования пылевых заболеваний легких.К сожалению, до настоящего времени отсутствуют эффективные
патогенетические средства, которые бы оказывали антифиброгенное
действие и препятствовали прогрессированию силикотического про¬
цесса. Поэтому лечение хронических пылевых заболеваний легких
должно опираться на следующие принципы.Усиление системы антиоксидантной защиты организма. К естест¬
венным антиоксидантам, поступающим в организм с пищей, отно¬
сятся витамин Е (а-токоферол), витамин С (аскорбиновая кислота),
витамин Р (рутин), р~каротин, цинк, селен. Витамин Е накаплива¬
ем ся в фосфолипидах клеточных мембран и реагирует с радикалами
липидов в месте их возникновения, ингибирует фосфолипазу и уве¬
личивает плотность упаковки фосфолипидов в клеточной мембра¬
не, повышая ее устойчивость. Курсы приема: по 50-100 мг в день в
течение 3 мес, повторные курсы 2—3 раза в год. Витамин С реагирует с
радикалами кислорода внутри- и внеклеточно (в тканях, межклеточ¬
ной жидкости и секретах), предохраняя слизистую оболочку бронхов
о| действия АФК, выделяемых фагоцитами при воздействии токси¬
ческих веществ, пылевых частиц, микробов и вирусов. Аскорбиновая
кислота может отдавать свои восстановительные эквиваленты
232 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫа-токоферолу, предохраняя организм от недостаточности витамина Е.
Витамин С назначают по 0,1—0,2 г в день в течение 3—6 мес. Витамин Р,
р-каротин, цинк, селен входят в активные центры антиоксидантных
ферментов. Для лечения рекомендуются курсы антиоксидантных
препаратов 2—3 раза в год. Б.Т. Величковский [1995] рекомендует сле¬
дующую пропись: аскорбиновая кислота — 0,1 г, а-токоферол — 0,02 г,
р-каротин — 0,25 г по 2-3 раза в день перед едой в течение 15-30 дней.
Используется также сел цинк-плюс* — комбинированный препарат,
включающий такие микроэлементы, как селен, цинк и антиокси¬
данты (Р-каротин и др.). Курс лечения: по 1 таблетке в день в течение
3 мес, повторные курсы 2 раза в год. Феокарпин* — комплексный
хлорофи л л содержащий препарат, обладающий антиоксидантной и
ангиогфотекторной активностью. Курс лечения: по 3 таблетки в день
в течение 3-6 мес. Луновит-плюс* — высокоактивный антиокси-
дантный комплекс, содержащий витамин Е в липосомальной форме
(10 мг) и органически связанный селен (50 цкг). Применяется по
1 таблетке в день после еды в течение 3 мес. В последнее время широко
применяется ацетилцистеин (флуимуцил*) в дозе 600 мг 1 раз в день
в течение как минимум 6 мес с последующим переходом на поддержи¬
вающую дозу 200 мг в сутки, чередуя с другими антиоксидантами по
1 мес каждый препарат.Повышение устойчивости кониофагов (альвеолярных макрофа¬
гов, фагоцитировавших пыль) к энергодефицитному состоянию и
внутриклеточной гипоксии. Глутаминовая кислота (глутамат натрия,
кальция) является наиболее активным стимулятором биоэнергети¬
ческих процессов. Она стимулирует окислительные процессы и повы¬
шает устойчивость к гипоксии, участвует в белковом и углеводном
обмене, улучшает обезвреживание и выведение из организма аммиака,
способствует синтезу ацстилхолина и аденозинтрифосфорной кисло¬
ты, переносу ионов калия. Глутаминовая кислота, проникая через
гематоэнцефалический барьер, стимулирует передачу возбуждения
в синапсах центральной нервной системы. Препарат рекомендуется
принимать по 1,0 г в день до еды 15-30 дней. Курсы по 2—3 раза в год.
Противопоказания к приему глутаминовой кислоты общеизвестны.
Рекомендуется чередовать курсы глутаминовой кислоты с антиокси¬
дантами (ацетилцистеин, витамин Е, феокарпин*, селцинк*, луно-
вит-плюс*) по 1 мес каждый препарат.Противовоспалительная терапия. В связи с тем что воспалительные
изменения чаще всего обусловлены не бактериальной инфекцией, а
влиянием АФК, образуемых кониофагами, то вопрос о назначении
ПНЕВМОКОНИОЗЫ • 233антибиотиков решается только при доказанном участии микрофло¬
ры в процессе воспаления. Предпочтительны антибиотики цефа-
лоспоринового ряда третьего поколения: цефоперазон (цефобид*) по
1—2г 2 раза в день, цефотаксим (клафоран*) по 1 г 2—3 раза в день,
цсфтазидим (фортум*) по 1 г 3 раза в день, цефтриаксон (роцефин*)1-2 г 1 раз в день внутривенно или внутримышечно. Для лечения вос¬
палительного процесса при пневмокониозах целесообразно исполь¬
зовать глюкокортикоиды в небольших дозах и короткими курсами.
Наиболее оптимальным является применение ингаляционных форм
беклометазона дипропионата в суточной дозе 500-1000 мкг. Из «перо-
ральттых» глюкокортикоидов рекомендуется применять препараты
группы триамцинолона, обладающих наименьшим побочным эффек¬
том. Глюкокортикоидная терапия при пневмокониозах назначается
обычно только при силикозе и асбестозе, в связи с их склонностью
к прогрессированию. В случаях быстро прогрессирующего сили¬
коза показано применение глюкокортикоидов в дозе 3—4 таблетки
(15-16 мг в пересчете на преднизолон) через день в течение 6—12 мес с
исследующим уменьшением дозы каждые 15-30 дней по 0,5 таблетки
{2,5 мг в пересчете на преднизолон) через день.Нарушения гемодинамики малого круга кровообращения могут
развиваться уже на ранних стадиях пылевых заболеваний легких,
поэтому необходимо назначать препараты, улучшающие микроцир¬
куляцию: пентоксифиллин (0,1 г), цинаризин* (0,25 г), дипиридамол
(0,025 г). Прием по 2 таблетки в день, чередуя по 1 мес каждый препа¬
рат. При развитии вторичной легочной гипертензии следует назначать:
молсидомин по 2—4 мг в 2 раза в сутки, дилтиазем 30-60 мг по 2 раза
[І день, пролонгированные формы — 90 мг 1 раз в день), эналаприл по
5-10 мг в день, в течение 3—6 мес с последующим эходопплеркардио-
I рафическим контролем.При выраженной ДН, целесообразно применение оксигенотера-
пии (30-50% увлажненный кислород по 30-40 мин через носовой
катетер со скоростью 4—6 л/мин). На поздних стадиях заболевания
при прогрессировании ДН в редких случаях возможна транспланта¬
ция легких. В США больные с пневмокониозом составляют 1% всех
пациентов, подвергшихся пересадке легких.ПрогнозНа начальных этапах заболевания, при условии отстранения от
работы в запыленных зонах, прогноз может быть относительно бла-
234 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫгоприятным. При пневмокониозах, как правило, изменения в легких
носят необратимый характер, а при силикозе и асбестозе могут про¬
грессировать даже после прекращения контакта с пылью. Летальный
исход обычно связан с прогрессированием ДН и декомпенсацией хро¬
нического легочного сердца.ПрофилактикаПрофилактика заболеваний легких пылевой этиологии включает
инженерно-технические и медицинские мероприятия. Инженерно-тех¬
нические мероприятия направлены на снижение уровня запыленности,
нормализацию микроклиматических условий на рабочих местах, внед¬
рение очистных сооружений в рамках общегосударственной програм¬
мы. Важная роль должна отводиться эффективной местной и обще¬
обменной приточно-вытяжной вентиляции, особенно при работе в
замкнутых емкостях (цистернах, корпусах кораблей и пр.). Обязательно
использование эффективных индивидуальных средств защиты органов
дыхания в виде респираторов, противогазов, а при ряде работ необходи¬
мо использование масок с принудительной подачей воздуха.Медицинские профилактические мероприятия включают в себя пре¬
жде всего качественное проведение предварительных (при поступлении
на работу) и периодических медицинских осмотров. Проведение профес¬
сионального отбора должно стать обязательным условием при приеме на
работу во вредные для дыхательной системы виды производств лиц,
часто болеюших острыми респираторными вирусными инфекциями,
имеющих склонность к аллергическим заболеваниям, а тем более боль¬
ных хроническими заболеваниями органов дыхания. Медицинскими
противопоказаниями к работе, связанной с различными видами про¬
мышленной пыли, являются;— выраженные субатрофические изменения верхних дыхатель¬
ных путей, озена, искривление носовой перегородки, препят¬
ствующее нормальному носовому дыханию;- хронический бронхит, бронхиальная астма;— распространенные остаточные явления в легких после перене¬
сенного туберкулеза;- заболевания сердечно-сосудистой системы.Периодические медицинские осмотры позволяют своевременнообнаружить начальные признаки профессиональных заболеваний.
Основой профилактики заболеваний легких была и остается правиль¬
но организованная диспансеризация больных. Исследования, прово¬
ПНЕВМОКОНИОЗЫ • 235димые на протяжении многих лет в НИИ пульмонологии СПбГМУ
им. акад. И.П. Павлова, доказали необходимость активного выяв¬
ления больных хроническими заболеваниями органов дыхания на
ранних этапах формирования патологии с целью их полноценной
диспансеризации и проведения своевременного лечения.Профилактические мероприятия можно представить в виде трех
’jTanoB. На протяжении всех этапов проводятся мероприятия по
борьбе с курением (разъяснительная работа о вреде курения и необ¬
ходимости бросить курить), улучшению экологической обстановки на
рабочих местах, проведению курсов антиоксидантной терапии, при
этом дозы препаратов зависят от этапа профилактики. На каждом
jTaiic профилактики проводятся мероприятия, свойственные только
этому этапу.Первичная профилактика — направлена на выявление и нивелиро¬
вание факторов риска развития пылевой патологии легких.* Регулярный санитарно-гигиенический контроль рабочих мест.
Исследование пыли в воздухе рабочей зоны, выявление вредно¬
стей, их концентрации.• Внедрение в практику работы эффективных индивидуальных
средств защиты органов дыхания.• Активное выявление лиц с высоким риском легочных заболева¬
ний, например выявление иммунологических признаков сенси¬
билизации, проявлений гиперреактивности бронхов.• Проведение «биологического мониторинга»: определение воз¬
можного наличия вредных факторов, выявленных на рабочих
местах, в крови и моче у работающих.* Регулярный контроль ФВД (спирометрия) в сравнении с исход¬
ными данными у всех работающих.* Проведение курсов антиоксидантной терапии (селцинк* —1 таблетка в день, витамин Е — 50 мг в день, глутаминовая кис¬
лота — 1,0 г в день, феокарпин* — 2 таблетки в день, луновит-плюс*
(50 мкг селена) — 1 таблетка в день) курсами по 1 мес 2—3 раза
в год.Вторичная профилактика — это идентификация ранних, а в случае
ипсвмокониоза — латентно протекающих изменений в легких с целью
приостановления патологического процесса, профилактика обостре¬
ний и осложнений заболевания.Рекомендуется проводить профилактическое обследование рабо-I ающих 1 раз в год, включающее: регулярное анкетирование больных,
рентгенографию грудной клетки, спирометрию.
236 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫПри подозрении на наличие болезни органов дыхания показано
более углубленное обследование для своевременной диагностики
пылевых заболеваний легких, включающее эходопплеркардиогра-
фиЮз определение ДСЛзд и ДСЛус, бодиплетизмография, ВРКТ лег¬
ких, по показаниям — сцинтиграфию легких с ^^'"[Те].Проведение профилактических курсов медикаментозной терапии
на этом этапе предусматривает использование антиоксидантов (сел-
цинк* — 1 таблетка в день, витамин Е — 50-100 мг в день, глутамино¬
вая кислота — 1,0 г в день, феокарпин* — 3 таблетки в день, луновит-
плюс* (50 мкг селена) — 1 таблетка в день) курсами по 3 мес 2—3 раза
в год. При развитии бронхоспастического синдрома показано назна¬
чение длительно действующих Р^-^Т'^НИСТОВ (формотерол 9—12 мкг2 раза в сутки, салметсрол 50-100 мкг 2 раза в сутки), антихолинэрги-
ческих препаратов пролонгированного действия (тиотропия бромид
18 мкг в сутки). При заболеваниях легких от воздействия металлов и
органических растворителей (третья группа пневмокониозов), т,е. при
ЭТА, тактика лечения описана в соответствующем разделе.Третичная профилактика — направлена на предупреждение раз¬
вития осложнений пневмокониоза. Для этого необходимо 1 раз в год
проводить диспансерное обследование работающих, включающее;— рентгенографию грудной клетки;— спирометрию;— бодиплетизмографию;— исследование ДСЛ и эластических свойств легких;— эхокардиографию с допплеркардиографией;— проведение ВРКТ легких, что особенно важно для выявления
ранних симптомов злокачественных новообразований (напри¬
мер, при асбестозе);— бронхофиброскопию с цитологическим исследованием ЖБАЛ.
При подозрении на новообразование — биопсия слизистой
оболочки бронхов или ЧББ легких;— при наличии силикоза — постановка туберкулиновых проб для
своевременного выявления туберкулезного процесса, часто
осложняющего пневмокониозы;— проведение своевременного и адекватного лечения больных.Медико-социальная экспертизаПорядок установления учреждениями медико-социальной экспер¬
тизы степени утраты профессиональной трудоспособности лицами,
ПНЕВМОКОНИОЗЫ • 237получившими повреждение здоровья в результате несчастных слу¬
чаев на производстве и профессиональных заболеваний, определен
в «Правилах установления степени утраты профессиональной трудо¬
способности в результате несчастных случаев на производстве и про¬
фессиональных заболеваний», утвержденных Правительством РФ от
16.10.2000 г. № 789. Вопросами экспертизы трудоспособности и трудо¬
устройства занимаются профессиональные бюро медико-социальной
экспертизы. Основным критерием оценки трудоспособности больных
с пневмокониозом является степень ДН.Наибольшие трудности встречаются при экспертизе трудоспособ¬
ности больных с I стадией пневмокониоза без ДН. Не рекомендуется
продолжать работу в пылеопасных условиях лицам молодого возрас¬
та, при повышенной чувствительности к производственной пыли, при
раннем развитии заболевания (контакт с пылью менее 5 лет) или в слу¬
чаях его прогрессирования, при осложнении пневмокониоза тубер¬
кулезом, бронхоспастическим синдромом, бропхоэктазами. Если
при переводе на другую работу теряется квалификация, то рабочие
должны быть признаны ограниченно трудоспособными. В остальных
случаях при отсутствии ДН вопрос о возможности продолжения
работы по своей профессии решается в зависимости от санитарно-
гигиенических условий труда. При снижении уровня запыленности
до предельно допустимых или близких к ним концентраций пациенты
могут продолжать работу по специальности при диспансерном наблю¬
дении с обследованием не реже двух раз в год.Наличие ДН 1 степени у пациентов с пневмокониозом является
показанием для выведения их из неблагоприятных условий труда.
Осли трудоустройство при этом связано с потерей квалификации, то
определяется UI группа инвалидности. При большом стаже работы
за 2-3 года до выхода на пенсию по возрасту пациенты с пневмоко¬
ниозом 1 стадии с ДН Т степени могут продолжать работу по своей
специальности под постоянным врачебным наблюдением. Потеря
квалификации и значительное уменьшение объема производствен¬
ной деятельности при трудоустройстве этих больных с ДН II степени
позволяют определить им ГТТ группу инвалидности.Показания для направления на медико-социальную экспертизу:— повторные длительные обострения, развитие тяжелых необ¬
ратимых осложнений, резистентность к проводимой терапии,
низкий реабилитационный потенциал;— необходимость в переводе на другую работу по другой непро-
тивопоказаной профессии или в существенном уменьшении
238 • ГЛАВА 2. ГРАНУЛЕМАТОЗЫобъема производственной деятельности по прежней про¬
фессии;— декомпенсированиое хроническое легочное сердце.критерии групп инвалидности по пневмокониозам.* III группа инвалидности определяется больным с I или II стадией
болезни, отстраненным от выполнения работы по основной про¬
фессии. В дальнейшем в случаях рационального трудоустройства
больного при отсутствии прогрессирования патологии и ДН в
течение нескольких лет, при переосвидетельствовании может
быть решен вопрос о признании больного трудоспособным.♦ II группа инвалидности определяется при наличии стой¬
ких нарушений функции дыхания и кровообращения (ДН
И—ПТ степени и СН 11 степени), обусловленных пневмокониозом
и и 111 стадии или его осложнениями (туберкулез, частые обос¬
трения и непродолжительные ремиссии хронических болезней
органов дыхания). Больные не способны к постоянному про¬
фессиональному труду в обычных производственных условиях.
Имеется ограничение одной или нескольких категорий жизне¬
деятельности (способности к самообслуживанию, передвиже¬
нию и др. — П степени, к трудовой деятельности, обучению —I1-1II степени) при низком реабилитационном потенциале, В ряде
случаев такие пациенты могут работать в специально созданных
условиях (на дому, с учетом профессиональных навыков).• Г группа инвалидности определяется больным лневмоконио-
зом II—111 и III стадии с ДН и сердечной недостаточностью
І1Б-ІП степени, а также при наличии тяжелых соматических
осложнений. Ограничены одна или несколько категорий жиз¬
недеятельности III степени, причина инвалидности устанавли¬
вается как «профессиональное заболевание но пневмокониозу».
Помимо этого в соответствующих случаях больным определяется
степень утраты трудоспособности (в процентах), уровень которой
зависит от выраженности патологии, квалификации, специаль¬
ной подготовки.
Глава З
Системные васкулиты
с поражением органов
дыханияВаскулит — патологический процесс, характеризу¬
ющийся воспалением и некрозом сосудистой стенки,
приводящий к ишемическим изменениям органов и
тканей, кровоснабжающихся соответствующими сосу¬
дами. При васкулитах в патологический процесс могут
вовлекаться сосуды любого калибра (крупные, средние,
мелкие), расположенные в любой области человеческого
организма, что обусловливает большое разнообразие
клшіических проявлений. Васкулиты могут быть пер¬
вичными, являясь самостоятельными заболеваниями,
или вторичными, развиваясь на фоне других пато¬
логических пропессов (инфекционные заболевания,
злокачественные новообразования, системные пора-
ЖЄ1ІИЯ соединительной ткани и др.). Васкулиты бывают
локальными, поражая один оріан, или системными,
поражая несколько органов и систем, сопровождаясь,
как правило, тяжелыми клиническими проявлениями,
часто с летальным исходом. Под системными легочны¬
ми васкулитами подразумевается группа первичных
системных васкулитов, при которых в патологический
процесс вовлекаются сосуды мелкого и, реже, среднего
240 » ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯкалибра, имеющие общий патогенетический механизм, ассоцииро¬
ванный с образованием антинейтрофильных цитоплазматических
аутоантител (АНЦА), в клинической картине которых ведущее
место занимает поражение легких. К системным легочным васкули-
там традиционно относят ГВ, СЧС, МПА.ГРАНУЛЕМАТОЗ ВЕГЕНЕРАГранулема ВегнераіТВ) — гранулематозное воспаление респира¬
торного тракта и некротизирующий заскулит, поражающий мелкие и
средние сосуды (капилляры, венулы, артериолы, артерии) и обычно
сочетающийся с некротизирующим гломерулонефритом. Заболевание
впервые описано Клингером [Н. Klinger] в 1932 г. В самостоятельную
нозологическую форму его выделил Ф. Вегенер [F. Wegencrj в 1936 г.Данных о частоте встречаемости ГВ по России нет. Имеются еди¬
ничные сообщения о распространенности ГВ. В Великобритании—2,4 случая на 1 млн населения [Watts R.A. et al., 1995]. В США распро¬
страненность ГВ составляет 3 случая на 100 ООО населения [Cotch 1VT.F.
et al., 1996]. Ежегодная заболеваемость ГВ за последние два десяти¬
летия увеличилась. Так, в Швеции первичная регистрация случаев
ГВ выросла с 0,77 на 1 млн населения в 1975 г. до 11,9 случаев в 2001 г.
В Германии, по данным недавнего 8-летнего исследования (1998-
2005 гг.), отмечен рост первичной заболеваемости ГВ от 6 до 12 (в сред¬
нем 8,5) новых случаев на 1 млн жителей. Среди всей группы АНЦА-ас-
социированных системных васкулитов в Германии ГВ составляет 75%
[Hcrlyn К. et al., 2008]. ГВ чаще встречается в северных странах, чем в
южных [O’Donnell J.L. et al., 2007; Herlyn К. et al., 2008]. Болезнь обыч¬
но дебютирует в возрасте 35-45 лет, однако ГВ могут заболеть дети
[Akikusa J.D. et al,, 2007; Levine D. et al., 2007] и люди старшего возраста
[Herlyn К- et al., 2008].Этиология и факторы рискаФакторы риска развития ГВ, так же как и этиология заболевания,
неизвестны. Предполагается, что любые инфекционные агенты могут
спровоцировать развитие воспалительного процесса в стенке сосудов
любого калибра. Для ГВ наиболее значимым является золотистый
стафилококк {Staphilococcus aureus) [DurkoT. et al., 2007], который часто
ассоциируется с обострением заболевания.
ГРАНУЛЕМАТОЗ ВЕГЕНЕРА • 241Данных о наличии предрасположения к патологии легких у боль¬
ных Г В нет. Однако изучение иммуногенетических маркеров пред¬
расположенности к развитию системных васкулитов выявило связь
между носительством HLA аллелей DQ-w7, DR4 и персистированием
АНЦА при ГВ [Spenser S. et al., 1992]. К маркерам ГБ относят также
HLA-антигены В7, В8, DR2.ПатогенезПатогенетические механизмы развития ГВ до конца не выяснены.
Важнейшим звеном патогенеза ГВ являются процессы, связанные
с синтезом AHUA (ANCA). АНЦА— это гетерогенная популяция
аутоантител, реагирующих с различными ферментами цитоплазмы
нейтрофилов, в первую очередь протеиназой-3 и миелопероксида-
зой, реже — лактоферрином, катспсином G и другими цитоплазма-
гическими нейтрофильными ферментами. АНЦА к протеиназс-3
иначе называют классическими АНЦА или цитоплазматическими
(К'АНЦА или с-AN С А), а к миелоп ер оксида зе — перинуклеарными
АНЦА (п-АНЦА или p-ANCA). Для развития ГВ наиболее важным
является синтез АНЦА к протеиназе-3. Этот фермент считают ауто¬
антигеном Вегенера, так как синтез АНЦА именно к протеиназе-3
очень характерен для ГВ и выявляется у 90% больных fPagnoux С.,
2008]. Протеиназа-3 является лизосомальным полифункциональным
белком с ферментной и антимикробной активностью. По-видимому,
и ответ на этиологический фактор в организме происходит актива¬
ция иммунокомпетентных клеток, которые секретируют во внекле-
гочное пространство провоспалительные цитокины: ИЛ-І, ИЛ-6,
ИЛ-8, TNF-a, ИФН и др. Результаты исследований последних лет
показали, что в присутствии АНЦА эпителиальные клетки человека
(в легких, почках, коже) приобретают свойства, не характерные для
мих в обычном состоянии. АНЦА активируют выработку эпителиаль¬
ными клетками провоспалительных цитокинов в ответ на действие
матоген-ассоциированных молекулярных протеиназ. Предполагают,
‘ПО этот механизм также участвует в патогенезе ГВ [Uehara А. et al.,
2008]. Под влиянием TNF-a активируются нейтрофилы, экспресси¬
руя на поверхности своей мембраны цитоплазматические ферменты.
Гранслокация протеиназы-3 и миелопероксидазы на поверхность
мембран нейтрофилов позволяет цитоплазматическим ферментам
»чаимодействовать с АНЦА. Это ведет к дополнительной активации
нейтрофилов, продукции ими активных радикалов кислорода и
242 « ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ лизосомальных ферментов, приводящих к индукции лизиса клеток
эндотелия сосудов, экспрессии молекул адгезии на поверхности кле¬
ток эндотелия и повышенной адгезии нейтрофилов и лимфоцитов к
эндотелию сосудов и трансэндотелиальную миграцию клеток вос¬
паления в околососудистое пространство, т.е. в гкани. Под влиянием
провоспалительных цитокинов одновременно активируются клетки
эндотелия сосудов, которые также содержат в цитоплазме протеина-
зу-3 и экспрессируют ее на поверхности своей мембраны. Это приво¬
дит к тому, что АНЦА могут напрямую взаимодействовать с клетками
эндотелия сосудов, повреждают их и стимулируют экспрессию моле¬
кул адгезии на поверхности мембран эндотелиальных клеток. Таким
образом, АНЦА обеспечивают важнейшие механизмы повреждения
сосудистой стенки при ГВ. Кроме того, наличие гранулематозного
воспаления при этом заболевании позволяет предположить участие
в развитии ГВ клеточных иммунологических механизмов. При ГВ
обнаружена инфильтрация интерстициальной ткани почек и дыха¬
тельных путей Т-лимфоцитами, преимущественно их CD4 субпопу-
ляцией. Пролиферация Т-лимфоцитов стимулируется протеиназой-3.
В периферической крови наблюдается увеличение числа Т-лимфоци-
тов CD25 в сочетании с увеличением концентрации неоптерина (мар¬
кер ИФН-у-зависимой активации макрофагов), растворимых рецеп¬
торов ИЛ-2 и TNF-a.Патологическая анатомияМорфологическим субстратом ГВ являются васкулит, грануле¬
матозное воспаление и паренхиматозный некроз. Васкулит лока¬
лизуется в сосудах среднего калибра и микроциркуляторного русла
(капилляры, венулы, артериолы) прежде всего легких и почек.
В сосудах среднего калибра развиваются экссудативные изменения,
инфильтрация стенок сосудов лимфоцитами, макрофагами, нейтро-
филами, эозинофилами, сопровождающаяся гибелью нейтрофилов.
В процессе развития пролиферативных изменений в стенках арте¬
рий появляются эпителиоидные клетки, фибробласты и плазмоци-
ты (рис. 3.J а, см. ЦБ. вклейку) [здесь и далее фото и коментарии к
морфологическим иллюстрациям д-ра мед. наук И.В. Двораккской].
Воспалительный процесс заканчивается фибриллогенезом, склеро¬
зом и гиалинозом артерий, периваскулярно можно увидеть крупные
образования, напоминающие симпласты (рис. 3.1 б, см. цв. вклей¬
ку). В стенках артериол выявляется плазматическое пропитывание.
ГРАНУЛЕМАТОЗ ВЕГЕНЕРА • 243мукоидизация, в наружных отделах формируются эпителиоидные
гранулемы (рис. 3.2 а, см. пв. вклейку). Поражение вен носит про¬
дуктивный характер. В основе капилляритов лежат процессы дист¬
рофии и некроза эндотелиальных клеток с накоплением в просвете
сосудов клеток воспаления (лимфоцитов, моноцитов, нейтрофилов,
зозинофилов). в местах деструкции мелких сосудов и в прилежа¬
щих альвеолах формируются гранулемы, представляющие собой
узелки разнообразного клеточного состава (множество гигантских
клеток Лангханса, плазматические клетки, лимфоциты, гистио¬
циты) [рис. 3.2 б, см. цв. вклейку]. Особенностью гранулемы при
JTOM заболевании является ее палисадное (частокольное) строение
и отличие от компактной гранулемы при туберкулезе и саркоидозе.
Гранулемы, расположенные в органах, контактирующих с внещней
средой (воздухоносные пути, желудочно-кищечный тракт), часто
искротизируются, способствуя распространению патологического
процесса на непораженные участки ткани.В развитии гранулемы можно выделить три фазы: микронекроза
(ІІ центре), макронекроза и фиброза. В органах, не имеющих прямой
сиязи с внешней средой (почки, печень), чаще формируются гранулемы,
содержащие большое количество эпителиоидных клеток и фиброблас-
гов. Такие гранулемы склонны к рубцеванию. Гранулемы при ГБ часто
[)асполагаются эксграваскулярно в межальвеолярных перегородках,
I.e. в интерстиции легких, а иногда — в стенках бронхов.Несмотря на то что ГВ — это васкулит, гистологические признаки
болезни в стенках сосудов могут отсутствовать. Морфологические
изменения, характерные для ГВ, в этом случае обнаруживаются толь¬
ко в паренхиме пораженных органов [Malyak М., 2001].Экссудативно-инфильтративные изменения характеризуют тече¬
ние острого воспаления, а формирование гранулем — течение хро¬
нического воспаления. У большинства пациентов ГВ при гистоло¬
гическом исследовании выявляют признаки как хронического, так и
острого воспаления с преобладанием одного из них. Острое воспале¬
ние может переходить в хроническое с образованием гранулем. При
[)азрешении воспаления происходит рассасывание очага воспаления
(без рубцовых изменений) либо его организация (с отложением кол-
л;1геновых волокон и образованием рубца). В почках при ГВ развива-
с 1'ся очаговый или диффузный интракапиллярный мембранозный и
иролиферативно-мембранозный гломерулонефрит, сочетающийся с
экстракапиллярным продуктивным гломерулонефритом с полулу-
ниями.
244 * ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ Клиническая картинаДля ГВ, как для любого системного васкулита, характерны общие
симптомы воспаления: лихорадка, общая слабость, похудание,
миалгии, сфтралгии, реже — неэрозивные артриты.На начальных этапах болезни появляются симптомы со стороны
верхних дыхательных путей. У больных отмечаются гнойные, гной¬
но-сукровичные выделения из носа, постоянное чувство заложенно¬
сти носа, боль в области придаточных пазух носа. Часто (в 70% слу¬
чаев) наблюдается образование язв, корочек на слизистой носа, лов-
торные носовые кровотечения, нередко разрушается хрящевая пере¬
городка носа с формированием его седловидной деформации. Более
чем у половины больных (65—80%) отмечается тяжелый гнойный
синусит. У 30% больных развивается серозный средний отит, который
часто осложняется вторичной инфекцией, приводящей к гнойному
отиту, приблизительно у 10—30% больных (по данным разных авто¬
ров) встречается так называемая обезглавленная форма болезни, при
которой поражение носоглотки отсутствует. Кроме слизистой полос¬
ти носа возможно поражение слизистой полости рта (изъязвление с
формированием гингивита, глоссита, афтозного стоматита), слизис¬
той гортани и трахеи (с развитием субглоточного стеноза в результате
образования подскладочной гранулемы, дисфонии и стеноза трахеи).Лсікие вовлекаготся в патологический пронссс при ГВ у боль¬
шинства больных (до 87—95% случаев), однако клинические легочные
проявления неспецифичны. Больные предъявляют жалобы на кашель,
который может быть непродуктивным или сопровождаться отделение.м
гнойной мокроты, одышку разной степени выраженности. Тяжелая
одышка развивается у больных с выраженным альвеолярным кровоиз¬
лиянием и обычно сопровождается повторяющимся кровохарканьем.
Альвеолярное кровоизлияние является результатом некроза мель¬
чайших разветвлений легочной артерии (артериолы, прекапилляры,
капилляры), расположенных в интерстиции легких. Это состояние не
всегда сопровождается кровохарканьем. Наличие кровохарканья сви¬
детельствует о массивном альвеолярном кровоизлиянии с вовлечением
в патологический процесс большого количества сосудов интерстиция
легких, насыщения интерстиция легких кровью и проникновением
крови из интерстиция в альвеолы. Иногда возникает боль в грудной
клетке, обусловленная развитием плеврита, как правило, геморраги¬
ческого (у 5—8% больных) или пневмоторакса. Описаны случаи образо¬
вания бронхопульмональных свищей. Лихорадка септического типа —
ГРАНУЛЕМАТОЗ ВЕГЕНЕРА • 245ОДИН из наиболее постоянных симптомов болезни. Деструктивный
процесс в легких (образование полостей, содержащих некротическую
ткань) предопределяет возможность легочных кровотечений, присо¬
единения вторичной инфекпии. Важно отметить, что у одной трети
больных ГВ поражение легких протекает бессимптомно, хотя на рент¬
генограммах легких определяются выраженные изменения.На втором месте по частоте поражения (после органов дыха¬
ния) находятся почки. Гломерулонефрит (очаговый или диффузный
некротизирующий) развивается у 80—85% больных и характеризуется
быстро прогрессирующей почечной недостаточностью с выраженной
протеинурией. Вовлечение почек в патологический процесс свиде¬
тельствует о генерализации процесса и ухудшает прогноз.Помимо верхних и нижних дыхательных путей и почек при ГВ
могут повреждаться любые органы и системы. Гак, примерно у поло¬
вины больных имеется поражение глаз в виде склерита, эписклери-
га, увеита, конъюнктивита, неврита зрительного нерва и тромбоза
артерии сетчатки. У 15% больных развивается псевдоопухоль орбиты
глаза: за счет воспалительных и фиброзных изменений ретробульбар-
ного пространства глазное яблоко выбухает вперед и вниз.Часто (в 40—50% случаев) выявляются различные изменения кожи:
пальпируемая пурпура, язвы, подкожные узелки, везикулы. Редким
проявлением является акроостеолиз [Modi М. et al., 2007].Нервная система поражается реже (в 15% — периферическая, в 8% —
центральная) в виде множествеипых моїюневритов, эпилептиформно-
го синдрома, энцефалита, инсульта, поражения черепных нервов.Редко (у 10—15% больных) развиваются поражение сердца. Могут
быть выявлены перикардит, миокардит, коронариит. Описан случай
полной поперечной блокады сердца при ограниченной форме ГВ
ILisitsinS. et al., 2007J.Возможно поражение других органов и систем, но они встречают¬
ся редко. Есть сообщения о развитии гепатолиенального синдрома,
язвенно-некротических изменениях тонкого кишечника, поражении
поджелудочной железы, молочных желез, предстательной железы,
шейки матки, наружных половых органов, геморрагическом цистите.КлассификацияПо МКБ-10 [Женева, 1995] системные васкулиты входят в Х1Н
класс — системные поражения соединительной ткани и отнесены
к подгруппам МЗО и М31. ГВ имеет код М31.3.
246 « ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЬІХАНИЯ В классе VII болезней легких отдельной рубрики «Системные
легочные васкулиты» нет. В подгруппе J61 есть рубрика «поражение
легких при ДБСТ, в том числе при гранулемагозс Вегенера».Клиническая классификация ГБ основана на выделении клини¬
ческих форм заболевания, в зависимости от вовлечения в патологи¬
ческий процесс тех или иных органов и систем, учитывает вариант
течения и степень активности болезни.Клинические формы ГБ.• Локальная, с изолированным поражением верхних дыхательных
путей, глаз. Возможно наличие обших симптомов воспаления
(лихорадка, слабость, снижение веса).• Ограниченная, с признаками поражения верхних дыхательных
путей, глаз и других органов и систем (легких, нервной системы,
опорно-двигательного аппарата и др.), кроме почек.• Генерализованная — с характерной триадой признаков: пораже¬
ние верхних дыхательных путей, почек и системного некроти-
зирующего васкулита с поражением артерий мелкого и среднего
калибра и венозного русла. Именно вовлечение почек в патоло¬
гический процесс знаменует собой переход болезни в генерали¬
зованную форму.• Гранулематозная — единственным проявлением заболевания
является формирование гранулемы, которое может предшество¬
вать развитию других форм заболевания. Примером гранулема-
гозной формы болезни является псевдоопухоль орбиты глаза как
единственный симптом ГВ.Варианты течения ГВ:- острое, характеризуется коротким периодом начальных про¬
явлений (не более 1—2 мес), бурным прогрессированием забо¬
левания. При отсутствии лечения больные умирают через
5—6 мес;“ рецидивирующее, характеризуется более длительным пери¬
одом начальных проявлений (иногда до года и более), мед¬
ленным развитием нефропатии, единичными инфильтра¬
тами в легких; при правильном лечении больные живут до
7—10 лет;- хроническое (встречается редко).Степень активности ГВ:— минимальная (1);~ умеренная (П);— высокая (ІП).
ГРАНУПЕМАТОЗ ВЕГЕНЕРА • 247Осложненияк осложнениям ГВ относят развитие признаков функциональ¬
ной недостаточности органов и систем, вовлеченных в пагологи-
ческий процесс: почечная недостаточность, ДН, недостаточность
кровообращения. Возможным осложнением ГВ могут быть кровоте¬
чения различных локализаций (носовые, легочные). Течение ГВ часто
сопровождается инфекционными осложнениями (рецидивирующие
инфекции придаточных пазух носа, пневмония, инфицирование
полости распада в легких). Подозрение об инфекционном осложне¬
нии должно возникать у врача в тех случаях, когда на фоне успешного
лечения базисными препаратами внезапно повышается температура
тела, увеличиваются изменения в легочной ткани, нарастают симпто¬
мы интоксикации. К осложнениям также можно отнести токсическое
воздействие лекарственных препаратов (чаше всего цитостатиков),
используемых для лечения ГВ (токсический альвеолит, геморрагиче¬
ский цистит, нарушение кроветворения и др.).ДиагностикаДля ГВ разработаны классификационные (диагностические) кри¬
терии, которые приняты Американской коллегией ревматологов в
1990 г. Всего предложено четыре критерия.♦ Воспаление носа или полости рта. Развитие болезненных или
безболезненных язв полости рта, гнойные или геморрагические
выделения из носа.• Патологические изменения в легких, выявленные при рентгено¬
логическом исследовании. Наличие плотных инфильтратов или
полостей в легких.• Изменения мочевого осадка: микрогематурия (>5 эритроцитов в
поле зрения) или скопления эритроцитов.* Гранулематозное воспаление, выявляемое при биопсии органов
и тканей. Гранулематозное воспаление в стенке артерий или
артериол и образование гранулем в периваскулярных/экстравас-
кулярных областях.Наличие двух из четырех критериев свидетельствует о достовер¬
ном ГВ. Чувствительность любых двух и более критериев составляет
Х8,2%, а специфичность — 92,0%.Диагноз ГВ основывается на характерной клинической картине
(триада признаков: поражение верхних дыхательных путей, легких,
248 * ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ почек) в сочетании с лабораторными и инструментальными призна¬
ками, подтверждающими изменения в органах-мишенях.Лабораторные методы. Среди лабораторных показателей специ¬
фическим является только наличие АНЦА к протеиназе-3 в сыво¬
ротке крови. В период активного воспалительного процесса (как в
дебюте заболевания, так и при его рецидиве) высокие титры АНЦА
к протеиназе-3 выявляются у большинства пациентов (86-100%),
однако в период ремиссии Г В АНЦА могут отсутствовать. Уровень
АНЦА коррелирует со степенью активности воспаления при ГВ.
Другие изменения лабораторных показателей свидетельствуют об
активности воспалительного процесса и не являются специфичными
для Г В. У пациентов развивается анемия, лейкоцитоз, тромбоцитоз,
увеличивается СОЭ, выявляется выраженная диспротеинемия в виде
снижения фракции альбуминов и увеличения фракции глобулинов в
основном за счет а,- и у-глобулинов. Возможно лоявлснис ревматоид¬
ного фактора и увеличение циркулирующих иммунных компонентов
(ЦИК). Поражение почек подтверждается изменениями мочевого
осадка (гематурия, протеинурия, лейкоцитурия, клеточные цилин¬
дры) и показателей азотовыделительной функции почек (повышение
концентрации креатинина, мочевины) в сыворотке крови.Лучевые методы исследования. На рентгенограммах и компью¬
терных томограммах органов грудной клетки в легких выявляются
одиночные или множественные инфильтраты, которые иногда могут
быть «летучими», в очагах затенения нередко образуются полости
распада от нескольких миллиметров до 10 см и более в диаметре (фиб¬
розно-гнойный процесс с некрозом). При прогрессировании заболе¬
вания увеличивается число и размер полостей распада. Обширные
инфильтраты или геморрагические инфаркты легочной ткани с боль¬
шими полостями распада — характерный рентгенологический при¬
знак болезни. Симптом «матового стекла», лучше определяемый на
КТ, варьирует по плотности и свидетельствует о наличии альвеоляр¬
ного кровоизлияния. Распространенные альвеолярные затенения
могут исчезать или сливаться. На их фоне сохраняются просветы
бронхов и полости. Могут формироваться бронхоплевральные свищи,
в плевральной полости иногда определяется выпот. Увеличение лим¬
фатических узлов средостения для Г'В не характерно, но иногда может
присутствовать.Рентгенография черепа в динамике позволяет подтвердить раз¬
рушение носовой перегородки, если сформировалась седловидная
деформация носа.
ГРАНУЛЕМАТОЗ ВЕГЕНЕРА • 249Исследовавие ФВД обычно выявляет смешанные нарушения вентиля¬
ции у болыиинства больных (может быть преобладание обструктивного
или рестриктивного компонента), снижение дел. Особенности наруше¬
ний легочной функции не имеют существенного значения для диагнос¬
тики ГВ, однако степень их выраженности в npoti^ecce лечения может
служить одним из критериев эффективности проводимой терапии.Бронхологические методы. При проведении фибробронхоскопии
изменения выявляются более чем в половине случаев; изолированные
воспалительные изменения, трахеальные, субглоточные и бронхиаль¬
ные стенозы, язва, псевдоопухоль, изолированные кровотечения из
дистальных воздухоносных путей.Морфологические методы. Для подтверждения диагноза может быть
выполнена биопсия пораженных органов: слизистой носа, придаточ¬
ных пазух носа, легкого, почек (при подозрении на вовлечение почек
в патологический процесс). Следует помнить о том, что ЧББ легких и
биопсия почек сопряжены с высоким риском развития кровотечения,
а малый объем биопсийного материала и неспецифичность выявля¬
емых изменений затрудняют их адекватную трактовку. При морфо¬
логическом исследовании биопсийного материала из респираторных
отделов легких можно выявить признаки:• экстраваскулярного воспаления:— при хроническом течении — гранулематозное воспаление;— при остром течении — очаги воспаления, инфильтрированные
нейтрофилами;• васкулита:— при хроническом течении — гранулематозное воспаление;— при остром течении — нейтрофильная инфильтрация и разви¬
тие фибриноидного некроза;• фиброза.В материале, полученном при биопсии бронхиальной стенки через
бронхоскоп, обнаруживают инфильтрацию полиморфноядерными
нейтрофилами (иіюгда с образованием микроабсцессов), лимфоцита¬
ми, плазматическими и гигантскими клетками.БАЛ не имеет диапіостической ценности при постановке диагноза
ГВ. ВЖБАЛ чаще всего обнаруживают только увеличение числа ней-I рофилов или лимфоцитов, что является неспецифическим признаком и
встречается также при других заболеваниях. Однако исследование ЖВАЛ
полезно для диагностики легочных кровоизлияний и дифференциальной
диагностики между рецидивом ГВ и его инфекционными осложнениями
(например, пневмоцистная пневмония) у леченых пациентов.
250 « ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ Формулировка диагнозаВ диагнозе отражается нозологическая форма системного васкули-
та с указанием формы заболевания, органов и систем, вовлеченных в
патологический процесс, вариант течения, степень активности болез¬
ни, осложнения. Приводим примеры диагнозов,• ГВ. Генерализованная форма (поражение верхних дыхательных
путей — гнойно-геморрагический ринит, двусторонний гайморит,
деструкция носовой перегородки; легких — бессимптомный вари¬
ант с двусторонними инфильтратами, глаз — эписклерит, почек —
мембранозно-пролиферативный гломерулонефрит. Острое тече¬
ние. Активность ИТ степени. Осложнения: хроническая почечная
недостаточность ПА. Тяжелая железодефицитная анемия.• ГВ. Локализованная форма. Хронический двусторонний гаймо¬
рит. Пневмонит. Рецидивирующее кровохарканье. Симметричная
периферическая полинейропатия. Рецидивируютцее течение.
Активность П степени. Осложнения; ДП П степени. Легкая желе¬
зодефицитная анемия.• ГВ. Гранулематозная форма. Псевдоопухоль орбиты правого
глаза. Хроническое течение. Активность I степени.Дифференциальная диагностикаДифференциальную диагностику ГВ следует проводить с большой
группой заболеваний, при которых поражаются легкие.•Другие первичные системные васкулигы, часто протекающие с
поражением легких, т.е. с СЧС и МПА. Для СЧС не характерна
деструкция тканей верхних дыхательных путей, наклонность
легочных инфильтратов к распаду. Морфологически в тканях
выявляются экстраваскулярно расположенные скопления эози-
нофилов, гранулемы содержат много эозинофилов. Для МПА
также нехарактерна деструкция тканей верхних дыхательных
путей, формирование полостей деструкции в легочной ткани,
формирование гранулем. В отличие от ГВ при СЧС и МПА в
сыворотке крови чаще выявляются АНЦА к миелопероксидазе, а
не к протеиназе-3.• Болезни, сопровождающиеся почечно-легочными поражениями.
Это синдром Гудпасчера и другие иммунокомплексные заболе¬
вания (например, СКВ). Для синдрома Гудпасчера характерно
выявление аутоантител к базальным мембранам клубочков почек
ГРАНУЛЕМАТОЗ ВЕГЕНЕРА • 251И альвеол в сыворотке крови. Для СКВ характерно наличие АН А,
антител к двуспиральной ДНК, антигену Смита (Sm-антигену),
низкий уровень комплемента в сыворотке крови, при иммунофлю-
оресцентном исследовании биопсированной ткани почек опреде¬
ляются гранулярные отложения и линейные отложения АНА.• Сосудистые иммунопролиферативные заболевания, к которым
относится лимфоматоидный гранулематоз. Заболевание протекает
с поражением легких, реже — кожи, нервной системы. В отличие
от ГВ при лимфоматоидном гранулематозе типичный заскулит не
развивается. Стенки сосудов инфильтрируются атипичными одно¬
ядерными лимфоидными, плазмоцитоидными, ретикуло-эндоте-
лиальными клетками, В пораженных органах могут выявляться
гранулемы. В процессе прогрессирования лимфоматоидного грану-
лематоза возможно развитие истинной злокачественной лимфомы.• Злокачественные опухоли легких. Окончательный диагноз уста¬
навливается при гистологическом исследовании измененного
участка ткани легкого.• Инфекции, сопровождающиеся гранулематозным воспалением.
Это туберкулез, микозы, сифилис. Для их исключения необходи¬
ма идентификация возбудителя.• Псевдоваскулитные синдромы при миксоме предсердия, подост-
ром инфекционном эндокардите, синдроме атероэмболии. Для их
подтверждения необходимо выполнение эхокардиографии, посева
крови, чреспищеводной эхокардиографии, ангиографии, биопсии.• Изменения слизистой верхних дыхательных путей при интрана-
зальном злоупотреблении наркотиками (кокаин). В пользу этого
предположения будет свидетельствовать анамнез и поражение
преимущественно носовой перегородки.ЛечениеВ настоящее время стандартом лечения ГВ является комбиниро¬
ванная терапия цитостатиками и глюкокортикоидами, которая явля¬
ется базисной. Схема, опубликованная A.S. Fauci и соавт. в 1983 г.,
включает в себя назначение циклофосфамида внутрь в дозе 2-3 мг/кг
в сутки в сочетании с преднизолоном в дозе 1 мг/кг в сутки.
Глюкокортикоиды в такой дозе используют до снижения клинико¬
иммунологической активности процесса (достигается приблизительно
в течение 4 нед), а затем дозу преднизолона снижают по 5 мг каждые2 нед или переводят больного на прерывистый прием препарата —
252 » ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ ПО 60 мг через день, в последующем дозу продолжают снижать до
гюлной отмены (если это возможно). Лечение циклофосфаМИДОМ про¬
должают в течение года после достижения клинико-лабораторной
ремиссии, постепенно снижая дозу на 25 мг каждые 2-3 мес. Сложность
ведения больных заключается в том, что на фоне лечения часто воз¬
никают осложнения: в виде подавления кроветворения (лейкопения,
лимфопения, анемия), геморрагический цистит, возможен рак мочево¬
го пузыря, пневмонит. Для своевременной диагностики упомянутых
осложнений необходимо регулярно (1 раз в 7-10 дней) контролировать
клинический анализ крови и общий анализ мочи. В крови уровень лей¬
коцитов должен быть не менее 3,0—3,5хЮул, а количество нейтрофилов
не менее 1,0—1,5х107л. При более низких показателях герапию цикло-
фосфамидом следует временно отменить и возобновить прием в мень¬
шей дозе после восстановления нормальных показателей крови. При
появлении изменений мочевого осадка (гематурия) необходимо выпол¬
нение цистоскопии. Цитостатические препараты также снижают про-
тивоинфекционный иммунитет, поэтому у пациентов часто возникают
инфекционные осложнения (бактериальные пневмонии, вирусные и
бактериальные инфекции верхних дыхательных путей, мочсвыводя-
ших путей), при развитии инфекционного воспаления также показана
отмена цитостатиков и назначение антимикробной и другой терапии до
купирования осігожнения. В качестве средства, обладающего как пато¬
генетическим действием, так и способствующим уменьшению частоты
инфекционных осложнений, используется триметоприм/сульфомстак-
созол. Его назначение внутрь в низких дозах показано всем больным ГВ
в период ремиссии [Ognibene R et al., 1995; Godeau В. et aL, 1995]. С целью
лечения инфекционных осложнений со стороны верхних дыхательных
ггутей триметоприм/сульфометаксозол (бисептол*, бактрим*) назнача¬
ют по 2 таблетки 2 раза в сутки, а при тяжелом течении — по 3 таблетки2 раза в сутки после еды в течение 4-8 нед. Препарат следует назначать
с осторожностью, учитывая тот факт, что он сам может вызвать нефро¬
патию, лейкопению и даже агранулоцитоз. Лечение инфекций верхних
дыхательных путей дополняется промыванием синусов, их хирургиче¬
ским дренажем. Тяжелое поражение гортани, трахеи, крупных бронхов
может явиться показанием для трахеотомии.При агрессивном течении заболевания лечение начинают с более
высоких доз препаратов: циклофосфамид в дозе 3—5 мг/кг в сутки, а
преднизолон — 2—15 мг/кг в сутки парентерально в течение несколь¬
ких дней (так называемая пульс-терапия), а в последующем переходят
на стандартную схему лечения.
ГРАНУЛЕМАТОЗ ВЕГЕНЕРА • 253При невозможности использовать никлофосфамид назначают дру¬
гие цитостатические средства: азатиоприн, циклоспорин А, метотрек¬
сат. Метотрксат назначают в случае более благоприятного течения
болезни (без угрожающих жизни изменений со стороны легких и
почек) в дозах 0,15 — 0,30 мг/кг в неделю в сочетании с высокими доза¬
ми преднизолона — 1 мг/кг в сутки.Для улучшения микроциркуляции в комплекс лечения обязательно
включают антикоагулянты и антиагреганты. Используют низкие дозы
нефракционированного гепарина (по 5 ООО ЕД 4 раза в день) с постепен¬
ным снижением дозы либо низкомолекулярные гепарины (эноксапа-
рин, далтепарин, надропарин по 0,2 мл 1 раз в день) подкожію в область
передней стенки живота в течение 4—6 нед в сочетании с пентоксифил-
лином (продектином*, дипиридамолом, пирикарбатом). Сосудистые
протекторы назначают длительно — 4—6 мес. Возможно использование
низкомолекулярных декстранов (полиглюкин*, реополиглюкин* и др.),
которые также способствуют улучшению микроциркуляции за счет
уменьшения вязкости крови и агрегации тромбоцитов.В последние годы в лечении больных ГВ применяется плазмаферез,
гемосорбцим и другие экстракорпоральные методы лечения (наряду с
базисной терапией), позволяющие достичь ремиссии у 90% больных и
значительно улучшить прогноз.В исключительно тяжелых случаях может возникнуть необходи¬
мость в двусторонней нефрэктомии с последующей трансплантацией
почки. Однако рецидивы болезни в трансплантате не исключены.В комплекс лечения включаются витамины, стимуляторы кровет¬
ворения, гемотрансфузии, анаболические гормоны, симптоматичес¬
кие средства.Наличие субглоточного стеноза требует проведения местной тера¬
пии, так какэта форма проявления Г В не под дается обратной динамике
под влиянием системных глюкокортикондов. Используют инъекции
пролонгированных глюкокортикоидов (триамиинолон, дипроспан)
в очаг поражения, лазерную деструкцию гранулемы, хирургическую
мластику, введение силиконового стента [Langford С.А. et al., 19961.Клинический примерМужчина, 45 лет, поступил в НИИ пульмонологии СПбГМУ
им. акад. И.П. Павлова с жалобами на гнойно-геморрагические выде¬
ления из носа, образование корочек на слизистой носа, покраснение
1'лаз, фебрильную лихорадку, нарастающую общую слабость, снижение
254 < ГЛЛВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ веса на 15 кг за 3 мес. Заболел остро, когда без видимой причины по¬
явились гнойные, а затем гнойно-геморрагические выделения из носа,
сопровождавшиеся в последующем повторяющимися носовыми кро¬
вотечениями. Лечился амбулаторно антибактериальными средствами,
включая их введение в гайморовы пазухи путем пунктирования, и
физиотерапевтическими методами. Без эффекта. Состояние пациента
ухудшалось. Через 3 нед от начала болезни появилась лихорадка (37,3—
38,9 "С), снизился аппетит, стал худеть, появилась и нарастала общая
слабость. Жалоб со стороны нижних дыхательных путей не предъ¬
являл. Через 1 мес от начала болезни сформировалась седловидная
деформация носа. В клиническом анализе крови выявлено увеличение
СОЭ до 56-65 мм/ч. Госпитализирован в терапевтическое отделение
стационара, где на рентгенограммах органов грудной клетки выяв¬
лены двусторонние инфильтративные изменения: в S3 и средней доле
справа и верхней доле слева. В левом легком на фоне инфильтративных
изменений отмечались просветления. Получал антибактериальную
терапию по поводу предполагаемой пневмонии без эффекта в течение
месяца. При поступлении в НИИ пульмонологии сохранялись прежние
жалобы. Состояние пациента было тяжелым. В клиническом анализе
крови выявлены анемия (гемоглобин 67 г/л, эритроциты 2,6x10‘Ул, цве¬
товой показатель 0,79), лейкоцитоз (лейкоциты ІЗхІоул), увеличение
СОЭ (69 мм/ч). Биохимические показатели свидетельствовали в пользу
активного воспалительного процесса (повышены значения печеноч¬
ных трансаминаз, щелочной фосфатазы, диспротеинемия за счет повьт-
шения у-глобулинов). В анализах мочи определялся белок 0,25 мг/л
в сутки и эритроциты (сплошь покрывали поля зрения). Осмотр
ЛОР-органов выявил субатрофический риносинусит с наличием коро¬
чек в слизистой оболочке носа, левосторонний гнойный гайморит. При
рентгенологическом исследовании придаточных пазух носа определя¬
лось затенение обеих верхнечелюстных пазух с признаками деструкции
носовой перегородки и нижнего края орбиты справа. На рентгенограм¬
мах (рис. 3.3, см. цв. вклейку) и компьютерных томограммах (рис. 3.4)
органов грудной клетки сохранялись двусторонние изменения с фор¬
мированием множественных полостей распада в верхней доле левого
легкого. Заподозрен ГВ. Выполнено иммунологическое исследование
крови на наличие антинейтрофильных цитоплазматических антител.
Обнаружили АНЦА к протеиназе-3 (33,97 U/ml при норме до 5 U/ml).
Установлен диагноз: системный васкулит, ГВ генерализованная форма
с поражение ЛОР-органов, легких, почек, глаз. Активность III степени.
Пациенту проведена комбинированная пульс-терапия солу-медролом*
ГРАНУЛЕМАТОЗ ВЕГЕНЕРА • 255И циклофосфаМИДОМ (3 дня глю-
кокортикоиды по 1000 мг в сутки,
циклофосфамид 1000 мг во вто¬
рой день терапии) с последую¬
щим назначением преднизолона
внутрь 40 мг в сутки и циклофос-
фамида внутримышечно 200 мг3 раза в неделю. Лечение дополнил
курс плазмафереза (4 процедуры).Одновременно проводили лече¬
ние сосудистыми протекторами
(пентоксифиллин) и гепарином.На этом фоне состояние боль¬
ного значительно улучшилось.Жалобы исчезли. В лабораторных
показателях признаки воспали¬
тельного процесса не определя¬
лись. На рентгенограммах орга¬
нов грудной клетки через 1,5 мес
от начала терапии отмечалась
отчетливая положительная дина¬
мика. Инфильтративные измене¬
ния практически не определялись
в правом легком и существенно
уменьшились в левом легком,
в верхней доле левого легко¬
го сформировалась остаточная
полость (рис. 3.5). Через год послевыписки из клиники НИИ пульмонологии на рентгенограммах орга¬
нов грудной клетки отмечеііо уменьшение объема верхней доли левого
легкого за счет выраженных фиброзных изменений на месте полости
(рис. 3.6). На КТ органов грудной клетки выявлялась перестройка
легочной ткани верхней доли левого легкого с формированием полос¬
тей и бронхоэктазов смешанного типа, локальный пневмосклероз в
(рубец на месте бывшей полости) и в средней доле правого легкого;
утолщение и деформация плевры. Особенностью этого случая является
огсутствие у больного жалоб со стороны нижних дыхательных путей
(кашель, одышка, боль в грудной клетке) при наличии выраженных
изменений в легких, выявленных методами лучевой диагностики (рен¬
тгенография и КТ).Рис, 3.4. Гранулематоз Вегенера.
Клинический пример. Мужчина,
45 лет. КТ органов грудной клет¬
ки до начала лечения. Определяется
неоднородное с большими полостя¬
ми интенсивное затенение в средней
доле и инфильтрация в 3-м сегмен¬
те правого легкого. Границы зате¬
нения неровные. Просветы бронхов
видны на фоне затенения, они суже¬
ны. В верхней доле левого легкого на
фоне интенсивного затенения видны
.множественные полости с неровны¬
ми контурами, просвет их расширен,
некоторые из них подходят к мелким
полостям. Перибронхиальные изме¬
нения в нижней доле левого легкого
256 • ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯРис. 3.5, Гранулематоз Вегенера.
Мужчина, 45 лет. Рентгенограмма
органов грудной клетки через 1,5 мес от
начала лечения кортикостероидами и
циклофосфаном. Значительная обрат¬
ная динамика инфильтративных изме¬
нений, Они практически отсутствуют
Б правом легком. Имеется инфилыра-
иия в 1-2 сегментах левого легкого, где
сформировалась большая полость диа¬
метром 4,5 см. Верхний контур полости
неровный, бухтообразный. Имеются
интерстициальные изменения за счет
утолщения междолевых и межсегмен-
тарных перегородок. Левая половина
диафрагмы приподнятаРис. 3.6« Гранулематоз Вегенера.
Мужчина, 46 лет. Рентгенограмма
органов грудной клетки через год
от начала лечения. Определяется
уменьшение объема левого легкого за
счет выраженных фиброзных изме¬
нений верхней доли, где ранее рас¬
полагалась инфильтрация и полость,
тяжистость и дистелектазы в 5-м сег¬
менте левого легкого. Справа в 3-м
сегменте тяжистость и дистелектазы.
Диафрагма слева расположена выше
обычногоПрогнозБез проведення адекватной терапии прогноз для жизни пациен¬
тов при ГВ неблагоприятный: длительность ее не превышает 5 мес.
Современная комбинированная терапия цитостатиками и глюкокор-
тикоидами позволяет достичь ремиссии у подавляющего большинс¬
тва (до 80—91%) больных. Предикторами ранней смерти являются
длительность заболевания, низкий уровень гемоглобина, потребность
в гемодиализе, возникновение кашля. По данным последних исследо¬
ваний, риск ранней смерти в 16 раз выше у пациентов ГВ, требующих
использования гемодиализа, и в 15 раз выше у пациентов ГВ с наличи¬
ем кашля, по сравнению с пациентами без тяжелой почечной недоста-
СИНДРОМ ЧЕРДЖА-СТРОСС • 257ТОЧНОСТИ и кашля. Наиболее неблагоприятным является одновремен¬
ное вовлечение в патологический процесс почек и легких IZycinska К.
et al., 2007]. Основными причинами летальных исходов являются
интеркуррентные инфекционные заболевания, ДН и почечная недо¬
статочность. Среди пациентов, влечении которых используется гемо¬
диализ, после одного года наблюдения выживают 55%, после двух лет
наблюдения — 31% [Ibid].ПрофилактикаПервичная профилактика ГВ не разработана.Вторичная профилактика заключается в проведении длительной (не
менее 1 года) адекватной терапии цитостатиками после достижения кли¬
нико-лабораторной ремиссии в стационаре в сочетании с триметопри-
мом/сульфаметоксазолом в условиях диспансеризации. В последующем
необходимо рациональное трудовое устройство. Больным ГВ проти¬
вопоказаны: работа в неблагоприятных метеорологических и мик¬
роклиматических условиях; контакт с токсическими веществами и
резкими запахами; воздействие различных физических факторов (уль¬
трафиолетовое облучение, вибрация, ультравысокая частота и т.д.);
работа, связанная с физической нагрузкой, фиксированным положением
тела, психо:>моциональным перенапряжением и нагрузкой на зрение.СИНДРОМ ЧЕРДЖА-СТРОСССиндром Черджа—Стросс (Churg—Strauss) (СЧС) — эозинофильное,
гранулематозное воспаление респираторного тракта и некротизирую-
щий заскулит, поражающий мелкие и средние сосуды, часто сочета¬
ющийся с астмой и эозинофилией.Это заболевание впервые было описано в 1939 г. Раккеманом
(Kackemann) и Грином (Greene) как особая форма узелкового полиарте-
риита, который характеризовался приступами бронхиальной астмы и
эозинофилией периферической крови. В 1951 г. Чердж (Churg) и Стросс
(Strauss) уже более подробно описали основные клинические, анато¬
мические и гистологические признаки этой особой формы системного
ішскулита, предположили значительную роль аллергии в генезе заболе¬
вания. В настоящее время СЧС рассматривается как самостоятельная
нозологическая форма системного некротизирующего васкулита.
258 * ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ СЧС — редкое заболевание, частота его встречаемости составля¬
ет 0,47 на 100 ООО населения. Первичная заболеваемость составляст2,5 случая на 100 000 взрослого населения в год. Эта форма систем¬
ного васкулита составляет 20% среди всех васкулитов группы узел¬
кового полиартериита. Возраст дебюта заболевания варьирует от
15 до 70 лет, однако заболевание чаще диагностируется в 35—50 лет.
Мужчины болеют несколько чаще, чем женщины. Соотношение муж¬
чин и женщин составляет от 1,1:1 до 3,0:1 [Watts R.A, et aL, 2000]. По
другим данным СЧС поражает чаще женщин в возрасте около 50 лет
[Guillevin L. et al., 1999].Этиология и факторы рискаЭтиология СЧС неизвестна. Не выявлено связи заболевания с
инфекцией, в частности с вирусом гепатита В (как при узелковом
полиартериите). Отмечено, что в ряде случаев СЧС возникал после
вакцинации, проведения гипосенсибилизации, применения анти¬
биотиков, сульфаниламидов, препаратов мышьяка, хинидина, солей
золота, иодидов, однако наличия причинно-следственной связи пока
не выявлено. В. Bonaci-Nikolic и соавт. [2005] прищли к выводу, что
развитие АНЦА-ассоциированных васкулитов, в том числе СЧС, может
быть вызвано приемом антитиреоидных препаратов. Заслуживает вни¬
мания факт развития СЧС у больных бронхиальной астмой, леченных
препаратами из группы антагонистов лейкотриеновых рецепторов
(зафирлукаст, монтелукаст). Являются ли эти препараты причиной
развития васкулита остается не ясным, так как у описанных пациентов
бронхиальная астма протекала тяжело и назначение антагонистов лей¬
котриеновых рецепторов совпадало с одновременной отменой систем¬
ных глюкокортикоидов. Это позволяет предположить, что пациенты
изначально страдали системным васкулитом, а отмена системных сте¬
роидов привела к активации процесса и развитию выраженной клини¬
ческой симптоматики СЧС [Keogh К.А. et al., 2003].ПатогенезМеханизмы патогенеза СЧС сходны с таковыми при других сис¬
темных васкулитах, ассоциированных с АННА, хотя до настоящего
времени не совсем ясны. При СЧС в развитии патологического про¬
цесса большее значение имеют АНЦА, обладающие специфичностью
к миелопероксидазе. Около 40% пациентов СЧС имеют в сыворотке
СИНДРОМ ЧЕРДЖА-СТРОСС • 259Крови АНЦА, три четверти которых являются перинуклеарными.
Присутствие АНЦА ассоциируется с развитием гломерулярных и
легочных капилляритов, т.е. с развитием гломерулонефрита и альве¬
олярных кровоизлияний [Sinico R.A. et al., 2005]. Отсутствие АНІДА
ассоциируется с развитием кардиомиопатии и поражением легочной
паренхимы. Существует предположение, что по наличию АНЦА в
сыворотке крови больных СЧС можно выделить два патогенетичес¬
ких типа пациентов. АНЦА-положительный (отличается развитием
васкулитного варианта изменений) и АНЦА-отрицательный (харак¬
теризуется токсическими эффектами эозинофильной инфильтра¬
ции) [Pagnoux С. et al., 2007]. Кроме того, развитие болезни связы¬
вают с повышенной иммунологической чувствительностью по типу
феномена Артюса. Основное место в этой реакции отводится IgE,
которые, адсорбируясь на поверхности тучных клеток и базофилов,
вызывают и к дегрануляцию и выброс в кровь медиаторов воспале¬
ния. В последние годы изучается патогенетическая роль в развитии
СЧС таких компонентов эозинофильного воспаления, как ИЛ-5
(стимулирует продукцию, активацию и созревание эозинофилов),
TNF-a (является центральным звеном аутоиммунного гранулема¬
тозного воспаления), антиген Т-лимфоцитов CD95 (его связывание
с TNF-a приводит к активации апоптоза клеток, экспрессирующих
CD95) и др. Длительное выживание эозинофилов связано с инги¬
бированием CD95 и подавлением апоптоза этих клеток [Hellmich В,
et а!., 2003; Pagnoux С. et al., 2007]. Роль эозинофилов заключается
п инактивации медиаторов тучных клеток и фагоцитозе их гранул.
В гранулах самих эозинофилов содержатся вещества, способные пов¬
реждать слизистые оболочки, эндотелий сосудов различных органов
и эндокард.Патологическая анатомияОсновными патоморфологическими признаками СЧС являются
мелкие некротизирующие гранулемы и некротизирующий васкулит
мелких артерий и вен. Гранулемы располагаются чаще всего во внесо-
судистом пространстве вблизи артерий и вен малого калибра (рис. 3.7,
см. цв. вклейку). Они состоят из центрального эозинофильного ядра
и радиально окружающих его макрофагов и гигантских клеток. Их
обычно описывают как эозинофильные микроабсцессы [Воуег D. et al.,
2006; Sugita Y. et al., 2006]. В воспалительном инфильтрате преобладают
юзинофилът, в меньшей степени встречаются нейтрофилы, а количес¬
2S0 » ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ тво лимфоиитов незначительно. Клетки воспаления инфильтрируют
стенки сосудов (рис. 3.8, см. цв. вклейку), интерстиций легких, стенки
бронхиол, междольковые перегородки [Silva С.Т. et al., 2005; Kim Y.K. et
al., 2007]. При СЧС в патологический процесс чаще всего вовлекаются
легкие, сердце и кожа. Возможно поражение почек, мышц, нервной
системы, селезенки, а также других органов и систем.Клиническая картинаПроявление болезниЗаболевание может начаться с поражения верхних дыхательных
путей. Аллергический ринит сохраняется в течение многих лет, часто
осложняется полипозом носа и рецидивирующими инфекционными
синуситами. Синуситы могут быть причиной постоянных или при¬
ступообразных головных болей, дают болезненность при пальпации
области придаточных пазух носа.Поражение нижних дыхательных путей проявляется в первую оче¬
редь бронхоспастическим синдромом и нередко предшествует кли¬
ническим проявлениям системного васкулита. В дебюте заболевания
бронхоспазм выражен умеренно, но в дальнейшем постепенно разви¬
вается синдром бронхиальной астмы, У всех взрослых пациентов СЧС
астма отличается поздним началом (чаще в возрасте около 40—50 лет).
Являясь проявлением СЧС, астма, по данным спирометрии и уровню
эозинофильного воспаления, обычно протекает тяжелее, но признаки
гиперреактивности бронхов у пациентов этой группы выражены мень¬
ше, чем у больных астмой без СЧС [Tsurikisawa N, et al, 2007]. Часто
синдромная астма требует раннего назначения системных глюкокор-
тикоидов, которые бывают мало эффективны. Нередко бронхиальная
астма осложняется инфекционными процессами в легких [Nureki S. et
al,, 2007]. Есть сообщения о возможности формирования бронхоэкта¬
зий. В период развития симптомов системного васкулита отмечается
уменьшение тяжести течения бронхиальной астмы, а также возможно
развитие ее ремиссии. Иногда первым визуальным признаком СЧС
могут быть изменения слизистой оболочки трахео-бронхиального
дерева, выявляемые при фибробронхоскопии. На слизистой образу¬
ются воспалительные узелки, которые гистологически представляют
собой эозинофильные микроабсцессы [Matsushima Н. et al., 2006].Легочными проявлениями СЧС являются инфильтраты, которые
носят мигрирующий характер, локализуются в нескольких сегментах,
СИНДРОМ ЧЕРДЖА-СТРОСС * 261часто двусторонние. Инфильтраты быстро исчезают на фоне глюко-
кортикоидной терапии. Никогда не формируются полости распада.
Возможно развитие плеврального выпота, вызывающего появле¬
ние болей в грудной клетке и усиление одышки. При исследовании
плевральной жидкости обычно выявляют большое количество эози-
нофилов. в легких также развивается некротизирующий васкулит
сосудов межальвеолярных перегородок, который может осложниться
альвеолярными кровоизлияниями. Массивные альвеолярные кро¬
воизлияния сопровождаются кровохарканьем (его может не быть),
нарастанием одышки, быстрым развитием анемии, гипоксемии,
снижением альвеолярно-капиллярного градиента кислорода, ДСЛ,
высоким уровнем тромбомодулина в сыворотке крови [Utsugi М.
et al., 2008].Со стороны желудочно-кишечного тракта диагностируется эози¬
нофильный гастроэнтерит, который проявляется болями в живо¬
го, диареей. Эозинофильный гастроэнтерит может предшествовать
развитию васкулита. На фоне генерализации процесса, в период
развития васкулита возможно возникновение желудочно-кишечного
кровотечения и перфорации стенки кишки, а следовательно — пери¬
тонита и кишечной непроходимости.Со стороны сердечно-сосудистой системы возможно развитие
перикардита, коронариита, инфаркта миокарда, миокардита (за счет
(формирования эозинофильных гранулем в миокарде), а также вов¬
лечение в патологический процесс эндокарда (эндокардиальный
(})иброз) [Matsuo S. et al, 2007]. Обычно у больных определяется уве¬
личение размеров сердца, тахикардия, глухость тонов, различные
нарушения на электрокардиограмме. Вовлечение сердца в патологи¬
ческий процесс приводит к развитию тромбоэмболических осложне-
tiHH и прогрессирующей недостаточности кровообращения, которая
не всегда купируется на фоне патогенетической терапии основного
заболевания глюкокортикоидами. Возможно развитие артериальной
гипертензии. Осложнения со стороны сердечно-сосудистой систе¬
мы (недостаточность кровообращения, инсульт) стоят на первом
месте в качестве причин летальных исходов при СЧС [Guilleven L.
et al., 1999].У большинства больных СЧС (60%) наблюдаются изменения со сто¬
роны нервной системы. Поражение периферических отделов нервной
системы проявляется множественными мононевритами, симметрич¬
ной сенсорномоторной полинейропатией. Возможно вовлечение в
патологический процесс краниальных нервов, особенно зрительного.
262 ♦ ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ Участи больных (1/3-1/4) отмечается энцефалопатия, гиперкинез,
инсульты, психические расстройства, что отражает патологию цент¬
ральной нервной системы.Поражение кожи типично для СЧС. Кожные изменения могут по¬
явиться в любом периоде заболевания, но характер их неспецифичен.
Кожный синдром отличается полиморфизмом. На коже пациентов
можно выявить петехии, пурпуру, эритему, крапивницу, кожные
некрозы, сетчатое ливедо, подкожные узелки. Редким вариантом кож¬
ных изменений является дигитальный ангиит с тяжелой гангреной
пальцев [Ferenczi К. et al., 2007].Почки редко вовлекаются в патологический процесс при СЧС.
Если же поражение почек возникло, то оно протекает мягче, чем при
ГВ. У пациентов чаше всего диагностируется очаговый гломеруло¬
нефрит, сопровождающийся артериальной гипертензией.Течение болезниСЧС — хроническое рецидивирующее заболевание. Длительность
ремиссии зависит от активности патологического процесса и адек¬
ватности назначенного лечения. Частота обострений, их тяжесть,
необходимость назначения поддерживающей терапии, степень выра¬
женности нарушений вентиляционной способности легких являются
критериями определения группы инвалидности.в течении СЧС условно выделяют три периода.• Первый — продромальный период, который обычно длится
несколько лет (2-3), но может быть очень коротким — несколь¬
ко месяцев, или очень длинным — до нескольких десятков лет,
отличается тем, что у пациентов развиваются различные аллер¬
гические заболевания. Это может быть аллергический ринит,
поллиноз, бронхиальная астма.• Второй период развития СЧС является периодом эозинофилии
крови и тканей. В этот период у больных в периферической крови
наблюдается высокая (иногда достигающая 80%) эозинофилия, а
в различных органах развивается эозинофильная инфильтрация.
Токсические эффекты эозинофилоБ проявляются разнообразны¬
ми клиническими симптомами.■ В третьем периоде болезни доминируют признаки системного
васкулита. Генерализация процесса характеризуется появлением
общих симптомов в виде лихорадки, общей слабости, снижения
веса, артралгий, реже ~ артритов, болей в мыщцах. На этом фоне
развиваются полиорганные поражения.
СИНДРОМ ЧЕРДЖА-СТРОСС • 263КлассификацияПо МКБ-10-го пересмотра СЧС входит в XIII класс, блок МЗО-
М36 «Системные поражения соединительной ткани», рубрику МЗО
«Узелковый полиартериит и родственные состояния», имеет шифр М30.1.
«Полиартериит с поражением легких (СЧС)». По патогенетическим меха¬
низмам СЧС относится к группе АНЦА-ассоциированных васкулитов.
В течении болезни выделяют две фазы: обострения и ремиссии.По степени активности процесса выделяют:- минимальную (I);- среднюю (U);- максимальную (ПІ).ОсложненияОсложнения СЧС аналогичны таковым при ГВ. К ним относят
развитие признаков функциональной недостаточности органов и
систем, вовлеченных в патологический процесс: ДН, недостаточность
кровообращения, почечная недостаточность. Заболевание может
сопровождаться инфекционными осложнениями. Подозрение об
инфекционном осложнении должно возникать у врача в тех случаях,
когда на фоне успешного лечения базисными препаратами внезапно
повышается температура тела, увеличиваются изменения в легочной
ткани, нарастают симптомы интоксикации.Кровотечения при СЧС встречаются редко.ДиагностикаДиагностика СЧС основывается на следующей триаде симпто-
мокомплексов: выраженный бронхоспастический синдром, гипер-
^озинофилия и симптомокомплекс васкулита. Прямой зависимости
между тяжестью бронхоспастического синдрома и активностью вас¬
кулита нет.Американской коллегией ревматологов в 1990 г. разработаны и при¬
няты следующие классификационные (диагностические) критерии.• Астма — затруднение дыхания или хрипы при выдохе.• Эозинофилия — более 10% при подсчете эозинофилов.• Аллергия в анамнезе — сезонная аллергия (аллергический ринит)
или другие аллергические реакции (пищевая, контактная), за
исключением лекарственной.
264 ♦ ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ • Мононейропатия или полинейропатия — мононейропатия, мно¬
жественная мононейропатия или поли нейропатия по типу пер¬
чаток/чулок.• Легочные инфильтраты — мигрирующие или транзиторные
легочные инфильтраты, выявляемые при рентгенологическом
исследовании.• Синуситы — боли в области придаточных пазух носа или рентге¬
нологические изменения в них.■ Внесосудистые эозинофилы — скопления эозинофилов во внесо-
судистом пространстве (по данным биопсии).Наличие у больного четырех и более из любых перечисленных
признаков позволяет поставить диагноз с чувствительностью 85% и
специфичностью 99%.Лабораторные методы. Результаты лабораторных исследований
неспецифичны. В клиническом анализе крови обращает на себя вни¬
мание эозинофилия и гиперэозинофилия, лейкоцитоз, увеличение
СОЭ. при исследовании биохимических показателей крови выявля¬
ются положительные острофазовые реакции, диспротеинемия за счет
гипергаммаглобулинемии. Иммунологическое исследование крови
позволяет выявить повышенные уровни ЦИК, в состав которых вхо¬
дят преимущественно IgE, высокий уровень общего IgE и повышен¬
ные титры АННА, со специфичностью к миелопероксидазе. Именно
наличие перинуклеарных АННА, реагирующих с миелопероксидазой,
является специфическим иммунологическим маркером, позволяю¬
щим подтвердить диагноз СЧС. Наряду с этим в крови может выяв¬
ляться ревматоидный фактор, криоглобулины как неспецифические
показатели активности иммунного воспаления. При поражении почек
в анализах мочи выявляется протеинурия, гематурия, лейкоцитурия,
цилиндрурия, а в крови — повышение уровня креатинина, мочевины,
снижение уровня общего белка.При массивном альвеолярном кровоизлиянии выявляют гипоксе-
мию, анемию, высокий уровень тромбомодулина (маркер поврежде¬
ния клеток эндотелия сосудистой стенки).Лучевые методы исследования. На рентгенограммах органов груд¬
ной клетки у 2/3 пациентов выявляются инфильтративньте изменения
легочной ткани, занимающих большой объем (несколько сегментов,
І-2 доли, все легкое). Не характерно формирование однородных
уплотнений и полостей распада. В настоящее время наиболее инфор¬
мативным методом лучевого исследования легких при СЧС является
ВРКТ [Pesci А. et al., 2007]. КТ-призиаками легочных проявлений СЧС
СИНДРОМ ЧЕРДЖА-СТРОСС * 265являются: паренхиматозные изменения (утолщение стенок воздухо¬
проводящих путей и альвеолярные затенения), мелкие узелки, сим¬
птом «матового стекла», уплотнения. При сопоставлении данных КТ
с результатами морфологических исследований выяснено, что парен¬
химатозные затенения (встречаются у 3/4 больны[х СЧС) обусловлены
эозинофильным воспалением, некротизирующими эозинофильными
гранулемами и гранулематозным васкулитом. Мелкие узелки отра¬
жают наличие эозинофильного бронхиолита и перибронхиальный
васкулита. Утолщение бронхиальных стенок ассоциируется с их
эозинофильно-лимфоцитарным воспалением [Kim Y.K. et al., 20071.
У части больных СЧС изменения в легочной ткани никогда не появ¬
ляются в процессе заболевания. Плевральный выпот возникает редко,
его можно выявить с помощью КТ.Лучевыми методами определяются затенения в придаточных пазу¬
хах носа. Деструкция тканей верхних дыхательных путей никогда не
развивается.Исследование ФВД. Одним из ведущих клинических проявле¬
ния при СЧС является синдром бронхиальной астмы. Поэтому при
исследовании ФВД чаще всего выявляется синдром преходящей
обструкции. Однако при развитии легочного васкулита, альвеоляр¬
ного кровоизлияния, плеврального выпота, пареза диафрагмы при¬
соединяется рестриктивный компонент, и тогда функциональные
изменения могут иметь смешанный характер.Морфологические методы исследования. Для гистоморфологичес-
кой диагностики используют материал, полученный при биопсии
пораженных органов и тканей (легких, бронхов, кожи, слизистой
носа, желудочно-кищечного тракта, почек). Морфологические изме¬
нения, характерные для СЧС, описаны выше (см. «Патологическая
анатомия»). При исследовании ЖБАЛ и содержимого плевральной
полости выявляется эозинофилия.Формулировка диагнозаВ диагнозе указывается нозологическая фора системного васкули¬
та, вариант органных поражений, фаза заболевания, степень актив¬
ности процесса, осложнения. Примеры формулировки диагнозов.• СЧС с поражением легких (синдром Леффлера: эозинофильные
мигрирующие инфильтраты в легких: S, слева и справа), верх¬
них дыхательных путей (полипозная риносинусопатия), синдро¬
мом бронхиальной астмы, гормонозависимой; поражением кожи
266 » ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ (петехиальные высыпания). Фаза обострения. Активность П сте¬
пени. Осложнение: ДН I степени.• СЧС с поражением легких (двусторонние инфильтраты, двусто¬
ронний эозинофильный плеврит), нервной системы (мононеврит
нижней и верхней конечностей слева), суставов (полиартралгия),
сердца (миокардит, перикардит), кожи (пурпура нижних конеч¬
ностей). Фаза обострения. Активность Ш степени.• Осложнения: ДН II степени. Сердечная недостаточность III фун¬
кционального класса. Синдром Кушинга. Стероидный сахарный
диабет, компенсированный.Дифференциальная диагностикаДифференциальную диагностику СЧС следует проводить с теми
заболеваниями, которые имеют похожие клинические проявления.• ГВ. Отличительные черты СЧС: ринит, полипоз носа, отсутствие
деструкции тканей верхних дыхательных путей, обязательное
наличие синдрома бронхиальной астмы и других аллергичес¬
ких заболеваний, редкое вовлечение в патологический процесс
почек, эозинофилия >10% лейкоцитов крови, эозинофильые
некротические гранулемы, выявляемые при морфологическом
исследовании, АНЦА к миелопероксидазе и высокий уровень
общего IgE в сыворотке крови, в легких летучие инфильтраты
без распада.• Идиопатический гиперэозинофильный синдром (ИГЭС).
Данное заболевание относится к группе миелопролифератив-
ных заболеваний. Характеризуется персистирующей высокой
эозинофилией крови и полиорганной патологией, связанной
с циркуляцией в крови [и (или) с пролиферацией в органах]
эозинофилоБ. в процессе заболевания развиваются гепато-
спленомегалия, тромбопластический (и (или) фиброзирую-
щий] эндомиокардит с застойной недостаточностью крово¬
обращения, диффузная или локальная менингоэнцефалопа-
тия, периферическая полинейропатия, фиброз легких, потеря
массы тела и др. в любых сочетаниях, В отличие от СЧС, при
идиопатическом гиперэозинофильном синдроме отмечается
более высокий уровень эозинофилов в периферической крови,
отсутствие синдрома бронхиальной астмы и аллергии в анам¬
незе, признаков васкулита, низкая эффективность монотера¬
пии глюкокортикоидами.
СИНДРОМ ЧЕРДЖА-СТРОСС • 267Лечениев качестве базисной терапии СЧС используются глюкокортикои-
лът. В отличие от ГВ, СЧС хорошо поддается лечению глюкокортико-
идными препаратами в виде монотерапии. Положительный эффект
глюкокортикоидов у больных СЧС можно объяснить их многогран¬
ным действием, которое в значительной мере соответствует основным
механизмам этого заболевания.В зависимости от тяжести течения заболевания начальная доза пред-
низолона составляет 40—60 мг в сутки, что приблизительно соответству¬
ет 1 мг/кг в сутки. Такую дозу применяют в течение нескольких недель,
а затем постепенно снижают в зависимости от динамики клинических,
лабораторных и рентгенологических данных. Полная отмена глюко¬
кортикоидов возможна не ранее чем через год от начала лечения. Часто
низкие дозы глюкокортикоидов приходится назначать длительно для
контроля астмы [Wechsler М.Е., 2007]. При недостаточной эффективнос¬
ти глюкокортикоидов (обычно при вовлечении в процесс сердца, почек,
нервной системы и др.) лечение дополняют цитотоксическими препа¬
ратами. Используют циклофосфамид в дозе 1—2 мг/кг в сутки с посте¬
пенным снижением дозы в течение 6—9 мес (для индукции ремиссии).
После достижения ремиссии возможно продолжение поддерживающей
терапии азатиоприном в дозе 150 мг в сутки 1 мес, 100 мг в сутки 3 мес,
50 мг в сутки 3—6 мес или метотрексатом [Haubitz М., 2007]. В случае
отсутствия ответа на стандартную терапию предлагается использовать
современные биологические агенты: моноклональные антитела к TNF-а
(инфликсимаб, одалимумаб), IgE (омализумаб), ИЛ-5 (меполизумаб)I Booth А. et al., 2004; Pagnoux С. et al, 2007; Giavina-Bianchi P. et al., 2007].
Применение экстракорпоральных методов лечения (плазмаферез, гемо¬
сорбция) наряду с базисными препаратами позволяет значительно быс¬
трее достичь ремиссии. Как и при ГВ, в комплексном лечении больных
СЧС (в особенности при наличии признаков тромбогеморрагического
синдрома) показано применение гепарина в течение 4—6 нед в сочетании
с ангиопротекторами (пентоксифиллин, дипиридамол и др.) в течение
длительного времени (4—8 мес).В зависимости от выраженности бронхоспастического синдрома
используется широкий диапазон современных бронхоспазмолитичес¬
ких препаратов (сальбутамол, фенотерол, формотерол и др.) и ингаля¬
ционных глюкокортикоидов (беклометазон, будесонид, флутиказон и
др.). При наличии признаков бронхиолита рекомендуется использо¬
вание брохоспазмолитических препаратов и глюкокортикоидов через
268 « ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ небулайзер. В фазе ремиссии показано поддерживающее лечение глю-
кокортикоидами, симптоматическими средствами.ПрогнозБез лечения прогноз неблагоприятный. При своевременном назна¬
чении патогенетического лечения прогноз для жизни благоприятный.
Ухудшает прогноз вовлечение в патологический процесс сердца и
сосудов центральной нервной системы.ПрофилактикаПервичная профилактика СЧС не разработана.Вторичная профилактика заключается в проведении адекватной под¬
держивающей терапии в условиях диспансеризации, а также выполне¬
нии тех принципов, которые изложены в разделе, посвященном ГВ.МИКРОСКОПИЧЕСКИЙ ПОЛИАНГИИТМикроскошпеааш патангиит (МПА) (полиартериит) — некротизирую-
щий васкулит с минимальными иммунными депозитами, поражающий
мелкие сосуды (капилляры, венулы, артериолы), редко артерии малого и
среднего калибра, в клинической картине которого доминируют явления
некротизирующего гломерулонефрита и легочного капиллярита. Иными
словами, МПА можно назвать некротизирующим васкулитом микроцир-
куляторного русла [Семенкова Е.Н. и соавт., 1995].Впервые МПА был описан как особая форма узелкового полиар¬
териита в 1948 г. [Davson J. et al.]. Авторы отметили, что сегментар¬
ный некротизирующий гломерулонефрит, развивающийся у части
больных при узелковом полиартериите, является отдельной формой
заболевания. Официально в самостоятельную нозологическую форму
МПА был выделен в конце 80-х годов XX века после широкого внедре¬
ния в клиническую практику определения АНЦА.Сведений о распространенности МПА в России нет. По данным
зарубежных авторов, первичная заболеваемость МПА составляет 0,33—
0,36 на 100 ООО населения [Andrews М. et al., 1990; Watts et al., 1996], что
существенно больше, чем частота встречаемости классического узел¬
кового полиартериита. В Китае МПА составляет 79,1% от всей группы
МИКРОСКОПИЧЕСКИЙ ПОЛИАНГИИТ • 269АНЦА-ассоциированных васкулитов [Chen М. et al., 2005]. МПА пора¬
жает лиц среднего возраста (55—60 лет), однако могут заболеть дети и
люди старшего возраста. Среди пациентов отмечается небольшое пре¬
обладание мужчин. Соотношение мужчини женщин 1,8:1.Этиология и факторы рискаЭтиология МПА неизвестна. Как и при других системных васку-
литах, в качестве этиологических факторов обсуждаются инфекци¬
онные (бактерии, вирусы) агенты, медикаменты, (антитиреоидные
препараты) (Bonaci-Nikolic В. et al., 2005], профилактические прививки
против гриппа [Uji М. et al., 2005]. Данных о семейном предрасполо¬
жении к патологии легких при МПА нет. Одним из факторов, прогно¬
зирующих поражение легких при МПА, считают уровень сосудистого
эндотелиального фактора роста в сыворотке крови. Чем выше уровень
сосудистого эндотелиального фактора роста в сыворотке, тем тяжелее
поражение легких и тем хуже прогноз [Iwakawa J. et aL, 2006]. МПА часто
коррелирует с наличием у пациента HLA—DQw7 [Spencer S. et al., 1992].ПатогенезМеханизмы патогенеза МПА сходны с таковыми при других сис¬
темных васкулитах, ассоциированных с АНЦА. В развитии патоло¬
гического процесса при МПА в большей степени принимают участие
АНЦА, обладающие специфичностью к миелопероксидазе. АНЦА
к миелопероксидазе обнаруживаются более чем в 60% случаев МПА
[Pagnoux С., 2008]. АНЦА активируют нейтрофилы и клетки эндо¬
телия сосудов, приводя к иммунному воспалению и некрозу стенок
сосудов, преимуш^ественно микроциркуляторного русла.Патологическая анатомияМорфологической характеристикой МПА является распростра¬
ненный некротизируюший васкулит мелких по калибру сосудов,
т.е. сосудов микроциркуляторного русла. Иногда в патологический
процесс вовлекаются сосуды среднего калибра. В воспалительном
клеточном инфильтрате преобладают полиморфноядерные лей¬
коциты. Отсутствуют гранулемы и аневризмы стенок сосудов.
В патологический процесс при МПА могут быть вовлечены любые
органы и ткани, но наиболее выраженные изменения выявляются в
270 » ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ почках, легких и коже. В почках развивается некротизирующий гло¬
мерулонефрит с экстракапиллярной пролиферацией эпителиальных
клеток и формированием полулуний. В легких развивается некро¬
тизирующий альвеолит с септальными капилляритами и частыми
альвеолярными кровоизлияниями.Клиническая картинаПроявление болезниЗаболевание начинается с появления общих симптомов, харак¬
терных для всех системных васкулитов; лихорадки, общей слабости,
снижения веса, артралгий, миалгий.Легкие вовлекаются в патологический процесс у 30-66% больных.
Пациенты предъявляют жалобы на кашель, боль в грудной клетке,
кровохарканье. Альвеолярное кровоизлияние является наиболее
характерным проявлением МПА (12—29%) и часто возникает в
дебюте болезни [Vuotto F. et al., 2007]. Может развиться инспиратор-
ная одышка, обусловливающая выраженную ДН. При возникнове¬
нии рецидивирующих субклинически протекающих альвеолярных
кровоизлияний (чаще встречается у детей) формируется картина
интерстициального легочного фиброза, который может быть выяв¬
лен при рентгенологическом исследовании органов грудной клетки
у пациентов с анемией неясного происхождения. Обычно в таких
случаях в сыворотке крови выявляются АНЦА к миелопероксидазе.
Гистологически в легких подтверждается некротизирующий альве¬
олярный капиллярит. [Birnbaum J. et al., 2007; Pesci A., Manganelli P.,
2007]. Клинические признаки болезни подтверждаются инструмен¬
тальными исследованиями: рентгенологически в легких выявля¬
ются двусторонние инфильтраты без распада с реакцией плевры,
иногда — признаки альвеолита, интерстициального фиброза, иног¬
да — гиперинфляции.Поражение почек отмечается в 100% случаев. Почечная недоста¬
точность развивается быстро (в среднем через 3 мес от начала заболе¬
вания), но не сопровождается артериальной гипертензией. Эти кли¬
нические особенности отличают МПА от классического узелкового
полиартериита, для которого характерна артериальная гипертензия,
но не характерно развитие и быстрое прогрессирование почечной
недостаточности. В анализах мочи выявляется умеренная протеину-
рия, гематурия. Иногда развивается нефротический синдром.
МИКРОСКОПИЧЕСКИЙ ПОЛИАНГИИТ • 271Более чем у половины пациентов (до 60%) поражается кожа.
Варианты кожных изменений неспецифичны и разнообразны.
Возможно развитие геморрагического васкулита, пальпируемой пур¬
пуры, язвенно-некротических изменений и других вариантов. Иногда
патологические изменения распространяются на мягкие ткани.Часто заболевание сопровождается изменениями со стороны желу¬
дочно-кишечного тракта (в 32—58%). Клинически это проявляется
болями в животе, диареей, желудочно-кишечным кровотечением.
Иногда выявляется увеличение размеров печени.У одной трети больных отмечается поражение верхних дыхатель¬
ных путей в виде язв слизистой носа и ротовой полости, атрофии сли¬
зистой носа, носовых кровотечений, синусита. Эти изменения сходны
по своим проявлениям с таковыми при ГВ, отличаясь тем, что носят
обратимый характер и никогда не сопровождаются деструкцией тка¬
ней верхних дыхательных путей.Приблизительно у 30% больных встречается поражение нервной
системы. Развивается периферическая полинейропатия или наблюда¬
ются изменения со стороны центральной нервной системы.Кроме того, МПА может сопровождаться поражением глаз (эпис¬
клерит), сердца (перикардит), предстательной железы (простатит)
[Lamarche J.A. et al., 2007J.Течение болезниТечение МПА рецидивирующее в отличие от классического узел¬
кового полиартериита, для которого свойственна стойкая ремиссия
(если ее удалось достичь). Каждое новое обострение МПА сопровож¬
дается вовлечением в патологический процесс органов и систем, не
пораженных на предыдущих этапах болезни [Gordon М. et аК, 1993].КлассификацияПо МКБ-10 пересмотра МПА входит в ХПТ класс, блок М30-М36
«Системные поражения соединительной ткани», рубрику МЗО «Узелковый
полиартериит и рсдственные состояния», имеет шифр МЗО. 8. «Другие
состояния, связанные с узелковым полиартериитом: МПА (полиартериит)».В течении болезни выделяют две фазы: обострения и ремиссии.По степени активности процесса выделяют:— минимальную (I);— среднюю (П);— максимальную (ПІ).
272 » ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ Осложненияк осложнениям МПА относят развитие признаков функциональ¬
ной недостаточности органов и систем, вовлеченных в патологический
процесс: почечная недостаточность, ДН, недостаточность кровообра¬
щения. Частым осложнением МПА также являются кровотечения
различных локализаций (особенно характерны жслудочно-кищеч¬
ные кровотечения). Возможно развитие инфекционных осложнений
(чаще всего — пневмония) и токсическое воздействие лекарственных
препаратов (чаще всего цитостатиков), используемых для лечения
МПА (токсический альвеолит, геморрагический цистит, нарушение
кроветворения и др.). Редким осложнением МПА является генерали¬
зованный амилоидоз внутренних органов [Ubara Y. et al., 2006].ДиагностикаКлассификационные (диагностические) критерии МПА до насто¬
ящего времени не разработаны. Диагноз устанавливают на основа¬
нии клинических проявлений, данных гистологического исследова¬
ния и обнаружении АНЦА к миелопероксидазе. Клинически МПА
характеризуется развитием общих симптомов иммунного воспаления
(лихорадка, общая слабость, быстрая утомляемость, снижение веса,
полиартралгии), полисиндромностью проявлений со стороны многих
систем и органов, наиболее выраженными из которых являются пора¬
жение почек, легких и кожи.Лабораторные методы. При лабораторном исследовании на пер¬
вый план выступают изменения, характеризующие воспалительную
реакцию организма. В клиническом анализе крови отмечается уве¬
личение СОЭ, гипохромная анемия, нейтрофильный лейкоцитоз.
Иногда именно анемия может быть тем признаком, который приводит
к исследованию легких (при исключении кровотечений других лока¬
лизаций) и выявлению альвеолярный кровоизлияний, протекающих
субклинически. Об этом надо помнить, особенно в случаях беспри¬
чинной анемии у детей, так как именно дети, в отличие от взрослых,
хорощо переносят незначительные рецидивирующие альвеолярные
кровоизлияния [Vuotto F. et al., 2007]. В биохимическом анализе крови
отмечается диспротеинемия в виде снижения общего белка и увели¬
чения глобулиновой фракции за счет а^- и у-глобулинов, увеличение
конпентрации фибриногена, сиаловых кислот. Всегда выявляются
признаки нарушения функции почек: повышается уровень креати-
МИКРОСКОПИЧЕСКИЙ ПОЛИАНГИИТ • 273нина, мочевины. В пробе Реберга— признаки нарушения концен¬
трационной и фильтрационной функции почек. В общем анализе
мочи — потейнурия, гематурия. При исследовании иммунологиче¬
ских показателей можно выявить ревматоидный фактор, иногда —
ан1 инуклеарный фактор. Специфичным иммунологическим пока¬
зателем для МПА считается обнаружение в сыворотке крови боль¬
ных АНЦА, реагирующих с миелопероксидазой. Частота выявления
АНЦА зависит от стадии процесса. В период обострения или в дебюте
заболевания на высоте проявления симптомов болезни тест на АНЦА
к миелопероксидазе положителен у 60—80% больных, иногда также
могут быть выявлены АНЦА к протеиназе-3.Лучевые исследования. На рентгенограммах и КТ органов грудной
клетки в легких выявляются инфильтраты без склонности к распаду,
реакция плевры. При развитии альвеолярных кровоизлияний опреде¬
ляются двусторонние диффузные затенения, на ранних стадиях в виде
«матового стекла», становясь плотнее на поздних стадиях. Затенения
могут иметь различную локализацию. Выраженные затенения обыч¬
но исчезают после лечения без следа. Иногда выявляются симптомы
альвеолита, иногда — признаки обструкции (гиперинфляция). Редко
выявляется интерстициальная эмфизема. Скопление воздуха может
быть очень значительным и сопровождаться его присутствием в сре¬
достении и подкожной эмфиземой. Использование ВРКТ предпочти¬
тельнее, так как ее разрешающая способность значительно выше, чем
рутинной рентгенографии [Pesci А., Manganelll Р., 2007].Исследование ФВД при МПА позволяет выявить различные нару¬
шения, которые носят, как правило, смешанный характер. Иногда
развивается необратимая обструкция. Постоянно отмечается сниже¬
ние дел. Гипоксемия сопровождает массивные алвеолярные крово-
гечения.Бронхологические методы исследования. Фибробронхоскопия
суіцественногозначения для диагностики МПАне имеет. Выполнение
МВБ легкого опасно в связи с высокой вероятностью развития кро¬
вотечения. Метод используется для получения ж БАЛ с целью ее
цитологического и микробиологического анализа. При подозрении
на инфекционный процесс в легких исследование ЖВАЛ позволяет11 ровести дифференциал ьный диагноз.Морфологические методы исследования. Для морфологического
исследования используют материал, полученный при биопсии пора¬
женных органов (легких, почек, кожи) и ЖБАЛ. Морфологическим
признаком МПА является васкулит сосудов микроциркуляторного
274 ♦ ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ русла любой локализации, с преимущественным поражением сосу¬
дов почек, легких, кожи. Васкулит сопровождается нейтрофиль-
ной инфильтрацией и развитием: в почках— некротизирующего
гломерулонефрита с «полулуниями», в легких — некротизирующего
альвеолита, часто с альвеолярным кровоизлиянием. В жидкости
БАЛ, полученной при фибробронхоскопии в момент альвеолярного
кровотечения, находят эритроциты, при окраске по Перлу (Perl’s)
выявляют увеличение содержания сидерофагов более чем до 30%.
Отличительным морфологическим признаком МПА является отсутс¬
твие гранулем в биопсийном материале.Формулировка диагнозаВ диагнозе указывается нозологическая форма васкулита, отмеча¬
ются органы и системы, вовлеченные в патологический процесс, по
возможности с морфологической характеристикой характера пораже¬
ния, фаза заболевания, степень активности, осложнения.• МПА с поражением почек (некротизирующий гломерулонефрит с
«полулуниями»), легких (некротизирующий альвеолит с рециди¬
вирующим альвеолярным кровотечением, кровохарканьем), вер¬
хних дыхательных путей (атрофический ринит, рецидивирующее
носовое кровотечение), кожи (пальпируемая пурпура в области
голеней), нервной системы (периферическая поли нейропатия).
Фаза обострения. Активность ПІ степени. Осложнения: хрони¬
ческая почечная недостаточность ПІ стадии. Нефротический
синдром. Тромбоэмболия мелких ветвей легочной артерии $3
левого легкого. ДН П степени.Дифференциальная диагностикаДифференциальную диагностику следует проводить с группой
заболеваний, имеющих сходство клинической картршы с МПА.• Классический узелковый полиартериит. Для узелкового поли¬
артериита клинически не характерно развитие быстро прогрес¬
сирующей почечной недостаточности, практически никогда не
вовлекаются в патологический процесс легкие и не обнаружива¬
ются АНЦА в сыворотке крови. Для полиартериита характерно
преобладание суставного синдрома, поражение периферической
и центральной нервной системы, инфаркты внутренних органов,
реноваскулярная гипертензия, морфологически — поражение
МИКРОСКОПИЧЕСКИЙ ПОЛИАНГИИТ • 275сосудов среднего, реже мелкого калибра с микроаневризмами,
стенозами.ГВ. Клиническими отличительными признаками ГВ являются
более частое поражение верхних дыхательных путей нередко с
деструкцией их тканей, формирование инфильтратов в легких,
склонных к распаду и формированию полостей, обнаружение
в сыворотке крови АН1ДА к протеиназе-3, морфологически —
выявление эпителиоидных некротизирующих гранулем.
Злокачественные новообразования. На фоне любого злокачест¬
венного новообразования могут развиться симптомы вторичного
васкулита, которые трудно отличить от симптомов первичного
васкул ита. Обследование пациента по онкологической программе
с использованием эндоскопических, лучевых и морфологических
методов позволяет выявить локализацию первичного злокачест¬
венного очага.СКВ. Для СКВ характерно наличие фотосенсибилизации, харак¬
терных кожных изменений в области лица («бабочка»), усиленное
выпадение волос, выявление LE-клеток, высоких титров анти-
нуклеарного фактора, антител к двуспиральной ДНК, низкого
уровня комплемента и С-реактивного белка в сыворотке крови.
СКВ чаще болеют женщины детородного возраста.ЛечениеЛечение должно быть индивидуализированным. В лечении выде¬
ляют два этапа: этап индукционной терапии и этап поддерживающей
терапии fPesci А., Manganelli Р., 2007; Насонов Е.Л., 2008]. Целью
индукционного этапа является достижение клинико-лабораторной
ремиссии заболевания. Для лечения МПА используется комбиниро¬
ванная терапия глюкокортикоидами и цитостатиками. Преднизолон
назначают внутрь в дозе 1 мг/кг в сутки в течение 10—14 дней, затем
дозу снижают до поддерживающей. Снижение дозы должно быть пос¬
тепенным, медленным. Циклофосфамид назначают в дозе 1—2 мг/кг
к сутки внутрь в течение 7—14 дней с последующим снижением дозы,
которую определяют по количеству лейкоцитов периферической
крови. При быстром прогрессирующем течении васкулита в первые
три дня доза может быть увеличена до 3-4 мг/кг в сутки внутрь в
течение 3 дней, затем 2 мг/кг в сутки в течение 7 дней или 10-15 мг/кг
и сутки в виде пульс-терапии. После достижения ремиссии дозу
276 « ГЛАВА З- СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ циклофосфамида снижают по 25—50 мг каждые 2-3 мес. Возможно
применение препарата в интермиттирующем режиме (500-700 мг/м^
1 раз в месяц) в течение 6—12 мес [Насонов Е.Л., 2008]. В последние
годы циклофосфамид рассматривают в качестве препарата, инду¬
цирующего ремиссию васкулита. После достижения клинико-
лабораторной ремиссии поддерживающее лечение проводят чаще
азатиоприном (имуран*) [Haubitz М. et al,, 2007; Brusselle G.G., 2007, На¬
сонов Е,Л., 2008], но можно с этой целью использовать мофетила мико-
фенолат. Терапию цитостатиками следует проводить под контролем
клинического анализа крови с интервалом в 10—14 дней. Необходимо
поддерживать уровень лейкоцитов в крови 3,0—3,5х10Ул, нейтрофи-
лов 1,0—1,5х10Ул. Если в крови будет прогрессировать лейкопения, то
цитостатики следует отменить до нормализации показателей крови.
Общая длительность лечения должна бьггь не меньше 18 мес [Pagnoux С.
et al, 2008].Очень агрессивное течение болезни или отсутствие эффекта от
стандартной терапии требует проведения пульс-терапии метилпред-
низолоном или солу-медролом (по 1 г препарата в 250 мл физиологи¬
ческого раствора вводят внутривенно в течение 45 мин, ежедневно
в течение трех дней подряд) в сочетании с введением I г циклофос¬
фамида в 50 мл физиологического раствора, внутривенно во второй
день пульс-терапии, однократно. Следует помнить, что при почечной
недостаточности (креатинин сыворотки крови >117 мкмоль/л) доза
циклофосфамида должна быть снижена на 25—50%.Пациентам, у которых развивается диффузное альвеолярное крово¬
течение и (или) почечная недостаточность (креатинин >500 мкмоль/л),
обусловленная некротизирующим гломерулонефритом, (потенциаль¬
но смертельное течение), комбинированную пульс-терапию цикло-
фосфамидом и глюкокортикоидами необходимо сочетать с плазма-
ферезом. Плазмаферез проводят 3 раза в неделю в течение 2-3 нед
[Brusselle G.G., 2007; Насонов Е.Л., 2008]. В случае развития ост¬
рой гипоксемии в результате диффузного альвеолярного кровотече¬
ния применяют экстракорпоральное насыщение крови кислородом
[Agarwal H.S. et al, 2005].К перспективным новым методам лечения МПА относятся био¬
логические препараты, т.е. моноклональные антитела к TNF-a (инф-
ликсимаб) и CD20 антигену В-лимфоцитов (ритуксимаб) [Booth A.D.
et al., 2002; Eriksson P., 2005; Collins C.E., Quismorio P.P., 2005]. Их
используют в случаях болезни, рефрактерных к стандартной терапии,
в качестве дополнительных средств.
ИДИОПАТИЧЕСКИЙ ГЕМОСИДЕРОЗ ЛЕГКИХ • 277Все остальные методы лечения системных васкулитов (гепарино-
терапия, сосудистые протекторы, антиоксиданты) применимы и для
МПА. Есть сообщение об успешном применении у пожилой паци¬
ентки в комплексном лечении МПА габексата-месилата (ингибитор
протеаз, в том числе фосфолипазьт-А^) [Miyawaki К. et al., 2006]. При
отсутствии эффекта от проводимой терапии и прогрессировании
почечной недостаточности показано проведение программного гемо¬
диализа и пересадки почек.ПрогнозПрогноз при МПА зависит от степени поражения почек и легких.
Развитие изменений в легких ухудшает прогноз. Современные методы
лечения позволяют достичь ремиссии в 80% случаев. Однако МПА
отличается агрессивным течением, частыми рецидивами: повторные
эпизоды развиваются у 30% пациентов в течение 5 лет [Pagnoux С. et al.,
2007]. Пятилетняя выживаемость не превышает 65% даже при своевре¬
менно начатом адекватном лечении глюкокортикоидами и цитостати¬
ками. Причиной летальных исходов являются почечная недостаточ¬
ность, альвеолярные кровоизлияния, инфекционные осложнения.ПрофилактикаПервичная профилактика МПА не разработана.Вторичная профилактика заключается в адекватном проведении
поддерживающей терапии после достижения ремиссии заболевания.ИДИОПАТИЧЕСКИЙ ГЕМОСИДЕРОЗ ЛЕГКИХИдиопатинеский геомосидероз легких {УІТЩ-- редкое заболевание,
характеризующееся эпизодическим кровохаркай ьем вследствие реци¬
дивирующих внутриальвеолярных кровоизлияний, вторичной же¬
лезодефицитной анемией и волнообразным рецидивирующим тече¬
нием, приводящим к распространенному пневмофиброзу и ДН.
Заболевание впервые было описано Р. Вирховым в 1864 г. под назва¬
нием «бурая индурация легких». Болезнь чаще встречается в детском
возрасте (преимущественно до 10 лет), однако поражает и взрослых
(20% от общего числа заболевших). Среди взрослых чаще болеют
278 » ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ мужчины в возрасте 20-40 лет. Истинная распространенность ИГЛ
неизвестна [Fontenot А.Р., Schwarz M.I., 2004].Этиология и факторы рискаЭтиология ИГЛ неизвестна. Одной из первых гипотез, объясняв¬
ших причину этого заболевания, было предположение о врожденной
неполноценности эластических волокон сосудов, что ведет к диля-
тации легочных капилляров, замедлению в нртх кровотока, гипок¬
сии и диапедезу эритроцитов в легочную паренхиму с отложением
в ней гемосидерина. Высказываготся предположения о врожденной
аномалии сосудистых анастомозов, соединяющих бронхиальные
артерии с легочными венами; повышенном гемолизе эритроцитов
вследствие патологической функции селезенки и неспособности
печени ассимилировать освобождающееся железо. Высказываются
также предположения о связи возникновения ИГЛ с воздействи¬
ем экологических факторов, заболеваниями желудочно-кишечного
тракта. Описаны случаи возникновения ИГЛ у кровных родствен¬
ников, что может свидетельствовать в пользу генетической предрас¬
положенности.В последние годы наибольшее признание получила гипотеза об
иммуноаллергической природе заболевания. Косвенным подтверж¬
дением этой гипотезы является положительная реакция Кумбса,
а также различного рода проявления аллергии у многих больных
ИГЛ: аллергические высыпания на коже, бронхоспастический син¬
дром, эозинофилия периферической крови и др. в более 50% случа¬
ев ИГЛ определяются повышенные уровни IgA в сыворотке крови
[Costabel и. et al., 20071,Патогенез и патологическая анатомияРазличают первичный и вторичный гемосидероз легких. Вто¬
ричный гемосидероз легких — синдром других заболеваний, сопро¬
вождающихся повторными кровоизлияниями в альвеолы, таких как
хроническая левожелудочковая недостаточность, системные васку-
литы с поражением легких, тромбоцитопеническая пурпура. При
первичном ИГЛ реализация в легких реакции антиген—антитело
ведет к некрозу стенок сосудов с микро- и макрокровоизлияниями
в паренхиму легких с последующей импрегнацией солями железа
ИДИОПАТИЧЕСКИЙ ГЕМОСИДЕРОЗ ЛЕГКИХ • 279сосудистых и бронхиальных стенок, утолщением и фиброзировани-
ем межальвеолярных перегородок. Основным гистопатологическим
проявлением ИГЛ являются внутриальвеолярные кровоизлияния;
альвеолярные макрофаги, содержащие гемосидерин. Повторные
кровоизлияния в легочную паренхиму ведут к развитию пневмофиб¬
роза, легочной гипертензии и формированию в дальнейшем легоч¬
ного сердца. ИГЛ имеет ряд общих черт с синдромом Гудпасчера,
так как в обоих случаях основным патогенетическим механизмом
является воздействие антител против базальных мембран легочных
альвеол, а при синдроме Гудпасчера и против почечных клубочков.
Однако роль иммунного фактора при ИГЛ нельзя считать полностью
доказанной. Возможно, он играет роль лишь пускового механизма,
так как далеко не во всех случаях удается выявить иммунные комп¬
лексы на базальных мембранах.При макроскопическом исследовании легкие увеличены в разме¬
рах, уплотнены, на разрезе бурого цвета могут определяться свежие
кровоизлияния. Микроскопическое исследование выявляет диффуз¬
ную импрегнацию железом межальвеолярных перегородок и в первую
очередь эластических волокон, что ведет к их истончению и фраг¬
ментации. Межальвеолярные перегородки утолщены за счет отека
и отложения фибрина. Мелкие сосуды легких расширены, извиты, с
участками некроза стенок. А^тьвеолоциты 11 типа гиперплазирова-
ны. В просветах альвеол, в перибронхиальной, периваскулярной и
интралобулярной соединительной ткани определяются макрофаги,
содержащие гемосидерин. Иммунные комплексы отсутствуют. В фазе
обострения в паренхиме легких выявляются участки свежих крово¬
излияний с гемолизом. Повторные обострения приводят к развитию
распространенного пневмофиброза.При гистохимическом исследовании определяется резкое повыше-
ние (в 100—200 раз) содержания железа в легочной ткани. Электронно¬
микроскопическое исследование выявляет повреждение эпители¬
альных клеток Т типа, нарушения структуры базальной мембраны
капилляров межальвеолярных перегородок (разрывы) и отложение в
мембране коллагена [Costabel U. et al, 2007].Клиническая картинаКлинические проявления ИГЛ зависят от особенностей течения.
Болезнь может протекать остро (преимущественно в детском воз¬
280 « ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ расте), подостро или приобретать волнообразное (рецидивирующее)
течение. Следует также выделять периоды ремиссии и криза. Острое
течение (или криз) характеризуется резкой слабостью, лихорадкой,
головокружением, одышкой, сердцебиением и ослаблением тонов
сердца, болями в груди (суставах, брк5шной полости), увеличением
печени, а нередко и селезенки; кровохарканьем, легочным крово¬
течением. У пациентов могут определяться фотодерматозы, прояв¬
ления пищевой и лекарственной аллергии. Выраженность одышки
тем больше, чем значительнее площадь кровоизлияния в легочную
паренхиму. Присоединение инфаркт-пневмонии, рецидивирующего
пневмоторакса, легочного кровотечения может привести к летально¬
му исходу. Обострение болезни (криз) продолжается от нескольких
часов до 1-2 не д. В крови определяется анемия (микроцитарная и
гипохромная). Уровень сывороточного железа снижается, а уровень
билирубина может повышаться. Ремиссия наступает спонтанно. Во
вре.мя ремиссии у больных могут полностью отсутствовать какие-
либо жалобы. Длительность ремиссии также может быть различной
(от нескольких недель до нескольких лет). Как правило, последующие
обострения игл протекают все более тяжело. Беременность утяжеля¬
ет течение заболевания [Илькович М.М., 2005].Основные осложнения ИГЛ: профузное легочное кровотечение,
закупорка бронхов кровью, аспираиионная пневмония, рецидиви¬
рующий пневмоторакс, инфаркт-пневмония на фоне выраженной
легочной или легочно-сердечной недостаточности, присоединение
туберкулезной инфекции. При хроническом течении игл отмечены
случаи поражения почек (по типу синдрома Гудпасчера), что значи¬
тельно ухудшает прогноз заболевания.ДиагностикаОсмотр больных: отмечают бледность кожных покровов, икте-
ричность склер, цианоз. Над участками притупления перкуторного
тона могут выслушиваться сухие и (или) разнокалиберные влажные
хрипы. Присоединение бронхоспастического синдрома вносит соот¬
ветствующие изменение в аускультативную картину болезни. У одной
трети больных игл может определяться гепатоспленомегалия.Лабораторные методы. По клиническому анализу крови определяют,
как правило, признаки гипохромной анемии, анизоцитоз, пойкилоци-
тоз, ретикулоцитоз. При присоединении инфаркт-пневмонии: лейко-
ИДИОПАТИЧЕСКИЙ ГЕМОСИДЕРОЗ ЛЕГКИХ • 2В1Рис. 3.9. Идиопатический гемосиде¬
роз легких. Множественные мелко-
очаговые тени. Преимущественная
локализация — средние и нижние
легочные поляцитоз, сдвиг лейкограммы влево,
увеличение СОЭ. В сыворотке
крови определяется повышение
уровня непрямого билирубина и
сывороточного железа. В мокроте,
бронхиальном смыве, лаважной
жидкости обнаруживаются сиде-
рофаги. Миелограмма указывает
на усиленный эритропоэз, в пери¬
ферической крови могут появлять¬
ся ретикулоциты. в сыворотке
крови при игл не определяются
АНЦА, АН А, ревматоидный фак¬
тор и антитела против базальной
мембраны (АВМА). Уровни комп¬
лемента в пределах нормы.Лучевые исследования. Рентгенологическая картина вариабельна:
от вуалеподобного понижения прозрачности легочных полей, появле¬
ния множественных мелкоочаговых (от 1-2 мм до 1—2 см в диаметре)
теней, покрывающих равномерно все легочные поля или локализую¬
щихся преимущественно в средних и нижних отделах легких, до воз¬
никновения более крупных полициклических очагов (инфильтратов),
местами сливающихся между собой (рис. 3.9). Характерной особен¬
ностью рентгенологических изменений при игл является внезап¬
ное их возникновение и сравнительно быстрая (в течение 3-5 дней)
обратная динамика. Повторяющиеся обострения болезни приводят
к развитию интерстициального пневмофиброза. Упомянутые изме¬
нения на рентгенограммах, как правило, двусторонние, однако могут
быть и односторонними. Увеличение лимфатических узлов средосте¬
ния отмечается в 10-15% случаев, в особенности в период обострения
заболевания. Перфузионная сцинтиграфия у больных ИГЛ выявляет
двусторонние нарушения легочного кровотока.Показатели ФВД могут быть нормальными, однако в большинстве
случаев определяются нарушения бронхиальной проходимости. По
мере прогрессирования заболевания формируется рестриктивный
синдром, снижается ДСЛ.Диагноз ИГЛ может быть подтвержден при гистологическом
исследовании материала, полученного при ЧББ легких: в альвеолах
выявляется большое количество гемосидерофагов. Показания для
282 * ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ биопсийных методов исследования у больных игл должны быть
максимально сужены в связи с повышенным риском возникновения
кровотечения.Формулировка диагнозаигл, обострение (ремиссия). ДН (степень).Дифференциальная диагностикаДифференциальная диагностика наиболее трудна с синдромом
Гудпасчера. Вполне вероятно, что эти два патологических процесса
являются разновидностью одного и того же заболевания. Сочетанное
поражение легких и почек, выраженный аутоиммунный компонент,
преобладание среди заболевших лиц мужского пола, прогрессиру¬
ющее течение болезни, недостаточная эффективность глюкокорти-
коидной и иммуносупрессивной терапии свидетельствуют в пользу
синдрома Гудпасчера. Затенение в легких по типу инфильтрации при
ИГЛ может быть ошибочно расценено как проявление пневмонии.
Быстрая обратная динамика инфильтративных затенений на рентге¬
нограммах и эозинофилия периферической крови создают дифферен¬
циально-диагностические трудности с эозинофильной пневмонией
(синдром Леффлера).Дифференциальную диагностику ИГЛ следует проводить также
с диссеминированным (милиарным) туберкулезом легких, гемохро-
матозом, канцероматозом легких, пневмокониозами, поражением
легких при ДБСТ, а также вторичным гемосидерозом, возникающим
вследствие застоя крови в легких при сердечной недостаточности.
Отложение гемосидерина в легочной ткани может наблюдаться также
при многократных гемотрасфузиях, митральном стенозе, врожден¬
ных пороках сердца с явлениями недостаточности кровообращения,
гемолитической и апластической анемии, бронхоэктатической болез¬
ни, туберкулезе и др. — так называемый вторичный гемосидероз.
Клинические проявления ИГЛ могут иметь место у детей с повы¬
шенной чувствительностью к коровьему молоку (синдром Гейснера).
у таких пациентов в крови определяются высокие титры преципи-
тинов к коровьему молоку, а кожные пробы с диагностическими
аллергенами белков коровьего молока положительны. Исключение из
рациона ребенка коровьего молока ведет к уменьшению симптомов
ИГЛ. Прогноз благоприятный [Артамонов Р.Г., 2002].
ИДИОПАТИЧЕСКИЙ ГЕМОСИДЕРОЗ ЛЕГКИХ • 283Лечениепроблема лечения больных ИГЛ не решена. Опубликованные раз¬
розненные результаты лечения трудно комментировать из-за отсутс¬
твия адекватно проведенных закрытых исследований (не в последнюю
очередь из-за редкой встречаемости заболевания). Глюкокортикоид-
ные препараты, несомненно, показаны при ИГЛ, в особенности при
остром течении или обострении заболевания, однако нет доказа¬
тельств того, что они могут изменить естественное течение забо¬
левания. Доза системных глюкокортикоидов в период обострения
составляет около 1 мг на 1 кг массы тела в сутки. По мере улучшения
состояния доза снижается с переходом во время ремиссии на под¬
держивающую (2,5—10 мг в сутки в расчете на преднизолон). После
стабилизации патологического процесса в качестве поддерживаю-
ш;ей терапии могут назначаться ингаляционные глюкокортикоиды.
Прогрессирование интерстициального фиброза может быть показа¬
нием для назначения пеницилламина в суточной дозе 250 мг в сутки
в течение 3—6 мес, затем по 150 мг в течение 6—8 мес. Выявление ауто¬
иммунных нарушений является основанием для назначения иммуно-
супрессивных препаратов (азатиоприн, циклофосфамид). Показана
симптоматическая терапия, при необходимости — гемотрансфу¬
зии. Следует отметить, что проведение гемотрансфузий сопряжено с
опасностью возникновения у этих больных острой гемолитической
анемии. Отмечен определенный положительный эффект при назна¬
чении дефероксамина (десферала*), связывающего железо и спо-
собствуюш,его выведению его почками (суточная доза 50—70 мг/кг).
Результаты лечения могут быть более обнадеживающими при удале¬
нии селезенки. В последние годы в комплекс лечебных мероприятий
включают гемосорбцию и плазмаферез [Шмелев Е.И., 2007]. Имеются
сообщение о положительном эффекте сочетанного применения мас¬
сивного плазмафереза и цитостатиков (азатиоприн, циклофосфа¬
мид). Развитие железодефицитной анемии является показанием для
назначения железосодержащих препаратов (ферроплекс*, конферон*,
тардиферон* и др.). Больные должны находиться под наблюдением
пульмонолога, в период обострения обязательна госпитализация.ПрогнозПрогноз при остром течении неблагоприятный. Летальный исход
может наступить в течение нескольких месяцев, прогноз для жизни
284 • ГЛАВА 3. СИСТЕМНЫЕ ВАСКУЛИТЫ С ПОРАЖЕНИЕМ ОРГАНОВ ДЫХАНИЯ у взрослых пациентов лучше, чем у детей, приблизительно у 25%
больных прогрессирующее течение болезни ведет к развитию распро¬
страненного интерстициального пневмофиброза. Еще у 25% больных
массивные легочные кровотечения могут быть причиной летального
исхода. При рецидивирующем течении, которое чаще встречается у
взрослых, средняя продолжительность жизни составляет 2,5—5 лет.
Описаны случаи спонтанной ремиссии.ПрофилактикаПрофилактика ИГЛ не разработана.
Глава 4
Лекарственные
поражения легкихПоражения легких, вызываемые воздействием лекар¬
ственных препаратов, представляют собой широкий
спектр респираторных заболеваний от некардиогенно-
го отека легких, ЭАА и ЭТА до бронхиальной астмы.
Ранняя диагностика лекарственных поражений легких
актуальна, так как своевременное прекращение приема
препарата и, при необходимости, назначение адекватной
терапии позволяет предотвратить дальнейшее поврежде¬
ние легких и тем самым улучшить прогноз.В США ежегодно отмечается более 2 млн случа¬
ев лекарственно обусловленных реакций, в том числе
100 ООО со смертельным исходом. Лекарственные пора¬
жения легких составляют 1,8—3,5% всех ИЗ Л. По дан¬
ным зарубежных авторов, реакцией пациентов на лекар¬
ственные препараты обусловлены 5% госпитализаций и
0,3% смертельных случаев среди стационарных больных.
Лекарственные поражения легких развиваются у 10—18%
госпитализированных больных.В 1972 г. был опубликован первый обзор 19 лекар¬
ственных препаратов, обладающих пневмотоксичностью.
В настоящее время известно более 380 лекарственных
препаратов, которые могут вызывать те или иные пора-
286 > ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХжения легких. По данным зарубежных авторов, заболевания легких
развиваются у 0,1-50% лиц, получавших амиодарон, у 10% — блеоми-
цин, у 3—8% — метотрексат, у 3—25% — нитрофураны, у 75% — ИЛ-2.
Ингибиторы АПФ в 10% случаев вызывают кашель. Волчаночный
синдром при применении гидралазина в 30% случаев сопровождается
поражением легких и менее чем в 5% вызывает изолированное пора¬
жение легких.По данным НИИ пульмонологии СПбГМУ, у 3,9% всех больных
ЭТА, госпитализированных в клинику за период 1985-2007 гг. (127
пациентов), заболевание развилось на фоне приема лекарственных
препаратов.Этиология и факторы рискаФакторами риска развития лекарственных поражений легких счи¬
тают следующие.• Предшествующие реакции респираторной системы на лекар¬
ственные препараты.• Основное заболевание, по поводу которого назначается препарат.• Контакт с профессиональными вредными факторами (асбест
и др.).• Индивидуальные особенности механизмов активации и детокси¬
кации лекарств.• Генетическая предрасположенность к определенным реакциямна прием препаратов.‘ Назначение одновременно нескольких пневмотоксических пре¬
паратов.• Нарушения выделительной функции почек.• Возраст больных (дети и лица старше 70 лет).• Кислородотерапия.Так, применение гефитиниба по поводу рака легкого вызывает раз¬
витие ИЗЛ у і,9% жителей Японии по сравнению с 0,3% во всех других
странах мира. Кашель при применении ингибиторов АПФ чаще отме¬
чается у чернокожих. Применение кислородотерапии одновременно
с препаратами, нарушающими баланс в оксидант-антиоксидантной
системе (блеомицин, амиодарон и др.), может спровоцировать разви¬
тие респираторного дистресс-синдрома.
ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХ • 287ПатогенезОсобенности патогенеза различных форм лекарственных пораже¬
ний легких подробно рассмотрены в соответствующих главах.
Выделяют шесть основных механизмов патогенеза.• Оксидативный стресс. АФК, продуцируемые альвеолярными
макрофагами, моноцитами, нейтрофилами, участвуют в окисли¬
тельно-восстановительных реакциях, окисляя жирные кислоты,
что ведет к нестабильности мембран и, возможно, аутогенной
цитотоксичности. Классический пример — хроническое воздейс¬
твие нитрофуранов, противоопухолевых препаратов, амиодарона.
Эти препараты генерируют АФК в клетках легких и подавляют
антиоксидантные защитные механизмы, запуская тем самым
воспалительные и фибротические процессы,• Повреждение сосудов легких, которое развивается при остром
отеке легких, ИЗЛ, веноокклюзионной болезни легких, легочной
гипертензии и легочном кровоизлиянии. Предполагают следую¬
щие механизмы поражения легочных сосудов:— увеличение микроциркулярного гидростатического давления;— повышение проницаемости эндотелия сосудов;— окклюзия сосудов за счет как непосредственной активации
воспалительных и иммунных процессов, так и опосредованно
за счет стимуляции внутрисосудистой коагуляции (тромбэм-
болия мелких ветвей легочной артериии);— нарушение гомеостаза.• Внутриклеточное отложение фосфолипидов. Происходит накоп¬
ление фосфолипидов в липосомах альвеолярных макрофагов и
альвеолоцитах П типа, ингибируя фосфолипазуА (амиодарон).
Ультраструктурные исследования показали наличие миелиноид-
содержащих включений в пораженных тканях. Эти процессы
обратимы при прекращении действия препарата.■ Поражение иммуннокомпетентной системы. Лекарственные пре¬
параты действуют как антигены или гаптены, активируя иммун¬
ные механизмы повреждения легких.• Поражение центральной нервной системы. Стимуляция симпати¬
ческого звена вегетативной нервной системы приводит к повыше¬
нию внутричерепного давления, что стимулирует гипоталамус и
вазомоторные центры продолговатого мозга. Развивается нейро¬
генный отек легких.
288 . ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХ• Прямое токсическое действие более характерно для химиотера¬
певтических препаратов. Так, блеомицин повреждает хромосомы,
расщепляя спираль ДНК.Патологическая анатомияМорфологические изменения в легких от воздействия лекарс¬
твенных препаратов неспепифичны (см. «Экзогенный токсический
альвеолит!і>).В острых случаях может развиваться альвеолярный отек. При
подостром течении заболевания выявляются гранулемы из гигант¬
ских клеток, очаговые скопления лимфоцитов, плазматических кле¬
ток, эозинофилов (метотрексат), неказеозные саркоидные грану¬
лемы, окруженные лимфоцитами (интерферон). Для хроническо¬
го течения морфологическая картина аналогична изменениям при
ИФА. Выявляются утолщенные, фиброзированныс межальвеолярные
перегородки, инфильтрация легочного интерстиция нейтрофилами,
лимфоцитами, гистиоцитами, плазматическими клетками, фиброб-
ластами; десквамация альвеолярного эпителия в просвет альвеол
(амиодарон, блеомицин, эрлотиниб и др.). При воздействии амио-
дарона развивается внутриклеточный дислипидоз, что приводит к
формированию пенистых альвеолярных макрофагов. Лекарственные
препараты вызывают однотипные морфологические изменения, что
предполагает общие механизмы клеточного повреждения.Клиническая картинаКлинические проявления различных форм лекарственных пора¬
жений легких описаны в соответствующих разделах. Различают
острое, подострое и хроническое течение лекарственных поражений
легких.Классификацияв зависимости от вида лекарственного препарата и наличия фак¬
торов риска могут развиваться следующие заболевания легких и
респираторные синдромы: ЭАА, ЭТА, некардиогенный отек лег¬
ких, веноокклюзионная болезнь легких, легочно-почечный синдром
(псевдосиндром Гудпасчера), облитерирующий бронхиолит, облите¬
рирующий бронхиолит с организующей пневмонией, легочный эози-
ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХ • 289иофильный инфильтрат, волчаночный синдром, АНЦА-положитель-
ный ангиит, СЧС, ТЭЛА, легочные кровоизлияния, неврологические
нарушения (миастениеподобный синдром). Некоторые препараты
могут вызывать кашель или бронхоспазм (в ряде случаев с гиперэози-
нофилией).Основные препараты, которые могут инициировать те или иные
поражения легких, представлены в табл. 4.1.Лекарственные препараты в одном случае могут быть причиной
некардиогеішого отека легких, в другом — ЭАА (антибиотики и др.)
или ЭТА (нитрофурантоин, амиодарон и др.), облитерирующего брон¬
хиол ита (D-пеницилламин, сулъфасалазин) или псевдосиндрома
Гудпасчера (D-пеницилламин).Подробное описание клинических, рентгенологических и функ¬
циональных проявлений различных нозологических форм и вопросы
терапии даны в соответствующих разделах.Таблица 4Л. Основные группы лекарственных препаратов, вызывающих пора¬
жения легкихЛекарственный препаратНаиболее часто встречающиеся поражения легкихЦитотоксические антибиотикиБлеомицинЭТА, подострое течениеМитомицинЭТА, подострое течениеЗйностатин*Веноокклюзионная болезньАлкилирующие препаратыБусульфанЭТА, хроническое течениеЦиклофосфамидЭТА, хроническое течениеИфосфамидЭТАХлорамбуцилЭТАМелфаланЭТАNitrosureas {BCNU. CCNU)ЭТАVinca alkaloidsЭТААнтиметаболитыМетотрексатЭТАЦитозинНекардиогенный отек легкихАзатиопринЭТА,6-меркаптопуринЭТАФлударабинЭТА
290 . ГЛА8А 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХПродолжение табл. 4.1Лекарственный препаратНаиболее часто встречающиеся поражения легкихL-АспарагиназаТЭЛА5-фторурацилЭТАКолхицинНекардиогенный отек легкихДругие противоопухолевые препаратыЦиклоспорин АЭТАПрокарбазинЭТАЭтопозидЭТАГефигинибЭТАИрикотеканЭТАГормональные препаратыТамоксифенТЭЛАНилутамидЭТАБикалутамидЭАА, легочный эозинофильный инфильтратЦитокиныил-2Некардиогенный отек легкихTNFНекардиогенный отек легких, легочные
кровоизлиянияГранулоцит-макрофаг колоний-
стимулирующий факторЭТА, некардиогенный отек легкихИФНЭТАИммуноглобулин и антитела к вилочковой
железеЭТА, некардиогенный отек легкихAii-trans-retinoic acidЭТА, некардиогенный отек легкихПротквомикробные препаратыНитрофурантоинЭТА, ЭАА, волчаночный синдромСульфасалазинЭТА, ЭААТетрациклин и миноциклинЭАА, легочный эозинофильный инфильтрат,
волчаночный синдромСульфонамидыЭАА, легочный эозинофильный инфильтрат,
волчаночный синдромПенициллинЭАА, легочный эозинофильный инфильтрат,
волчаночный синдромПарааминосалициловая кислотаЭАА, легочный эозинофильный инфильтратЭтамбуголЭАА, легочный эозинофильный инфильтратАмпициллинЭАА, ЭТАМалопримЭАА. ЭТА
ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХ • 291Продолжение табл. 4.1Лекарственный препаратНаиболее часта встречающиеся поражения легкихЦефалоспориныЭЛА, ЭТАПириметаминНекардиогениый отек легкихТриметоприм/сульфаметаксазолНекардиогенный отек легкихАмфотерицин-ВЭТААнтиаритмические препзріггьіАмиодаронЭТАЛидокаинНекардиогенный отек легкихТокаинидЭТАВерапамилНекардиогенный отек легкихПрокаинидЭТА, миастениеподобный синдром, волчаночный
синдромСоталолОблитерирующий бронхиолит с организующей
пневмониейПротмвосудорожные препаратыДифенилгидантоинЭТА, ЭАА, волчаночный синдромКарбамазепинЭТА, ЭААОбезболивающие препаратыАцетилсалициловая кислотаЭАА, некардиогенный отек легкихМесаламинЭТАНестероидные противовоспалительные преапаратыНапроксенВолчаночный синдром,
бронхоспазм с гиперэозинофилиейСулиндакВолчаночный синдром,
бронхоспазм с гиперэозинофилиейПироксикамВолчаночный синдром,
бронхоспазм с гиперэозинофилиейДифлюнисалВолчаночный синдром,
бронхоспазм с гиперэозинофилиейДиклофенакВолчаночный синдром,
бронхоспазм с гиперэозинофилиейПротиворевматические препаратыО-пеницилламинОблитерирующий бронхиолит с организующейпневмонией,волчаночный синдром,миастениеподобный синдром, псевдосикдром
ГудпасчераЗолотоЭТА, волчаночный синдром
292 • ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХПродолжение табл. 4. /Лекарственный препаратНаиболее часто встречающиеся поражения легкихСимпатомиметикиТоколитикиНекардиогенный отек легкихАнтидепрессанты, нейроактивные препаратыАмйтриптилинЭТА,бронхиолитКломипраминОблитврирующий бронхиолит с организующей
пневмониейФлуоксетинЭАА, легочный эозинофильный инфильтратГалоперидолНекардиогенный отек легкихРентгенококтрастные препаратыМасленые контрастные вещества для
лимфангиографииНекардиогенный отек легкихВодные растворы контрастных веществНекардиогенный отек легкихИнгибиторы АПФВсе препараты этой группыПостоянный кашельПрепараты других группГидрохлортиазидНекардиогенный отек легких, ЭТА, волчаночный
синдромБеклометазонЛегочный эозинофильный инфильтратСиликонЭТААдреноблокаторыЭТА, волчаночный синдром, бронхоспастический
синдромЭрготаминЭТАГидралазин изоникотиновой кислотыЭТАДесферралНекардиогенный отек легкихРитодринНекардиогенный отек легкихДилтиаземНекардиогенный отек легкихТербугалинНекардиогенный отек легкихМеноцилЭТАХпорпропамидЭТАЗапрещенные препараты, наркатикк, седативные препаратыГероинНекардиогенный отек легкихМетадонНекардиогенный отек легкихБупренарфинНекардиогенный отек легкихПропоксифенНекардиогенный отек легкихХлордиазелоксидНекардиогенный отек легких
ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХ • 293Окончание табл. 4.1Лекарственный препаратНаиболее sacTfl встречающиеся поражения легкихЭтхлорвинолНекардиа генный отек легкихПаральдегидНекардиогенный отек легкихКодеинНекардиогенный огек легкихВромокарбамидНекардиогенный отек легкихФебарбамидНекардиогенный отек легкихНалоксонНекардиогенный отек легкихКокаинНекардиогенный отек легких, облитерирующий
бронхиолитс организующей пневмониейЭАА медикаментозной этиологии, как правило, протекает остро
или подостро. Острая форма ЭАА развивается через 4—12 ч после
попадания аллергена в организм. При прекращении приема препарата
симптомы исчезают через 12—48 ч. При подострой форме ЭАА начало
заболевания не столь демонстративно.Повторные курсы лекарственных препаратов приводят к обостре¬
нию заболевания. Длительный многократный контакт с небольшими
дозами лекарственных препаратов ведет к формированию хроничес¬
кой формы ЭАА.В диагностике медикаментозного ЭАА большое значение прида¬
ется определению специфических преципитирующих антител класса
IgG, но их отсутствие не исключает наличие заболевания. Плохая рас¬
творимость многих медикаментов ограничивает применение методов
радиальной диффузии в геле и встречного иммуноэлектрофореза для
диагностики медикаментозных ЭАА. В этих случаях используются:
гсст аллергического лейкоцитолиза, дополненный параллельной пос-
гановкой теста дегрануляции тучных клеток, тест торможения миг¬
рации лейкоцитов или макрофагов, реакция бласттрансформации
лимфоцитов, тест агрегации лейкоцитов.В случаях ранней диагностики прогноз благоприятный.Клинический примерБольная в., 45 лет, поступила в клинику НИИ пульмонологии
» марте 2005 г, с жалобами на одышку при умеренной физической
нагрузке.Заболела в мае 2004 г., когда появились одышка при физической
нагрузке, сухой кашель, слабость. Изменения на флюорограммах
294 • ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХбыли расценены как двусторонняя пневмония. Лечилась амбулаторно
в течение месяца, затем в стационаре. Антибиотикотераиия и симп¬
томатическое лечение были неэффективны. Одышка прогрессиро¬
вала. В августе 2004 г. был заподозрен ЭАА, назначен преднизолон
в суточной дозе 25 мг с положительной клинико-рентгенологичес¬
кой динамикой. При снижении дозы преднизолона до 15 мг в сутки
вновь наросли изменения на рентгенограммах. Доза преднизолона
была увеличена до 30мг в сутки. Для уточнения диагноза больная
была госпитализирована в НИИ пульмонологии СПбГМУ им. акад.
И.П. Павлова.Контакта с профвредностями не было. Не курила. Аллерголо¬
гический анамнез спокойный. Больная с февраля 2004 г, постоянно
принимала биологически активную добавку «Тенториум» (в состав
входит 15 наименований).При поступлении состояние больной было удовлетворитель¬
ное. Дыхание ослабленное, крепитация в нижних отделах легких.
Клинический анализ крови — без патологических изменений. На
рентгенограммах органов грудной клетки от июня 2004 г. выявлялось
усиление легочного рисунка за счет интерстициального компонента
в обоих легких, инфильтративное затенение в нижних отделах пра¬
вого легкого. КТ органов грудной клетки от июня 2004 г. выявила
усиление легочного рисунка за счет интерстициального компонента,
изменения по типу «матового стекла». При обследовании в клинике
на рентгенограммах органов грудной клетки выявлялась положитель¬
ная динамика изменений в легких: незначительное усиление легоч¬
ного рисунка за счет интерстициального компонента. На КТ органов
грудной клетки отмечалась выраженная положительная динамика.
При комплексном функциональном исследовании внешнего дыхания
выявлялось умеренное снижение ДСЛзд — 67% при нормальных ЖЕЛ
(105%) и показателях проходимости дыхательных путей. Эластическая
отдача легких была в пределах нормы (0,51 кПа/л). Больной был пос¬
тавлен диагноз ЭАА, ДН П степени. Назначена терапия глюкокор-
тикоидными препаратами: 4 таблетки триамцинолона через день с
постепенным снижением дозы, препараты калия, нандролон, ангио¬
протекторы. На фоне проводимой терапии одышка исчезла. ДСЛус
повысилась, но оставалась умеренно сниженной (78%).ЭТА. Полипрагмазия, достигшая широких масштабов с 80-х годов
XX века, стала проявляться ростом распространенности медикамен¬
тозного ЭТА, который, по данным разных авторов, составляет от 1,8 до
3,5% всех медикаментозных ИЗЛ. Участились случаи развития пнев¬
ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХ • 295мофиброза у онкологических больных, получавших химиотерапию,
а затем и кардиологических больных — «амиодароновое легкое».ЭТА наиболее часто развивается при лечении химиотерапевтиче¬
скими препаратами, амиодароном (табл. 4.2).Таблица 4.2. Частота развития медикаментозного экзогенного токсического
альвеолитаПрепаратПроцент развития ЭТА, %Нитрозомочевина20-60при дозе более 1,5 г/м^50при дозе более 525 мг/м^47при дозе более 1500 мг/м^50Амиодарон0,1-50при дозе более 500 мг5-15при дозе менее 200 мг0.1-1,6Бусульфан5-46Цитозин-арабинозид15-44Блеомицин4-15-2GМетотрексат (острая форма)0,3-11,6Гемцитабин7,1Митомицин3-6,5Симпатомиметики (албутерол*, тербуталин*}0,5-5Нитрофураныменее 1Циклофосфамидменее 1Опиаты (при передозировке)50-70Комбинированные схемы лечения40К лекарственным препаратам, обладающим пневмотропным ток¬
сическим действием, относят следующие группы,• Противоопухолевые препараты: алкилирующие (бусулъфан,
циклофосфамид, хлорамбуцил, мелфалан), антиметаболиты
(метотрексат, 6-меркаптопурин, азатиоприн, цитозин-араби-
нозид*, гемцитабин, флударабин), антибиотики (блеомицин,
митомицин-С), препараты растительного происхождения (вин-
кристин, винбластин), подофиллотоксины (этопозид, пакли-
таксел, доцетаксел), препараты других групп (нитрозомоче-
вина, прокарбазин, L-аспарагиназа, иматиниб, гефитиниб,
эрлотиниб).• Производные нитрофурана (нитрофурантоин, фуразолидон).• Сульфаниламиды.
296 • ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕННЯ ЛЕГКИХ• Антибиотики (цефалоспорины, миноциклин*).• Нейроактивные препараты (дифенил, карбамазепин, хлорпрома-
аин).• Сердечно-сосудистые препараты (амиодарон, кордарон*, бен-
зогексоний*, гидралазин, р-адреноблокаторы — пропранолол,
анаприлин).• Мочегонные (гидрохлортиазид).• Противодиабетические препараты (хлорпропамид),• Анорексические препараты (меноцил).• Цитокины (гранулоцит-макрофаг-колоний-стимулиругощий
фактор, TNF-a, ИЛ-2, ИФН-а, ИФН-у).• Моноклональные антитела (инфликсимаб, адалимумаб).■ Запрещенные препараты (героин, кокаин, опиаты, кодеин, про-
поксифен*, амфетамин).• Кислород.Так же как и ЭАА, заболевание может протекать в острой, подос-
трой и хронической формах. Острая реакция в легочной ткани при
приеме нитрофурантоина может наступить в течение первого месяца
приема препарата. Хроническая форма может развиваться в интервале
от 2 мес до 5 лет непрерывного лечения нитрофурантоином. В случаях
поражения легких производными нитрофурана у 10—15% больных
острой формой ЭТА описаны плевральные выпоты, токсико-аллер-
гическая сыпь на коже. Хроническая форма болезни более характерна
для ЭТА, вызванных приемом химиопрепаратов.В диагностике лекарственных поражений легких все большее
признание получает ВРКТ. В 26% случаев медикаментозного ЭТА
изменения на обычных рентгенограммах органов грудной клетки не
определяются и их можно увидеть только при проведении ВРКТ. По
данным D.A. White [1999], проведение скрининговой КТ среди боль¬
ных, получавших блеомицин, позволило выявить изменения в легких
в 38% случаев, в то время как обычное рентгенографическое исследо¬
вание обнаруживало патологические изменения только в 15%.Изменения в клиническом анализе крови и биохимических пока¬
зателей неспецифичны, в ряде случаев может выявляться гиперэо-
зинофилия периферической крови, что указывает на присоединение
аллергического повреждения легочной ткани (метотрексат, прокар-
базин).Характерно раннее формирование легочной гипертензии.
ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХ * 297Клинический примерБольной Л., 63 года, поступил в клинику пульмонологии в октябре
2002 г. с жалобами на одышку при физической нагрузке (подъем на
4-й этаж).Заболел остро в марте 2002 г., когда внезапно появились одышка
при физической нагрузке, затрудненение при попытке сделать глу¬
бокий вдох, слабость. В связи с прогрессирующей одышкой больной
был госпитализирован в городскую больницу, где был поставлен
диагноз ИФА и назначена терапия преднизолоном 60 мг в сутки с
постепенным снижением дозы. Через 2 нед лечения больной отметил
уменьшение одышки. Для уточнения диагноза и коррекции терапии
больной был переведен в клинику пульмонологии СПбГМУ им. акад.
И.П. Павлова.Контакта с профврсдностями не было. Курил эпизодически 3 года
до 1997 г. Аллергологический анамнез спокойный. Сопутствующие
заболевания: с 1997 г. страдает гипертонической болезнью ИВ. С июня2001 г. — пароксизмальная мерцательная аритмия, по поводу которой
принимал амиодарон в дозе 300 мг в сутки с июня 2001 г. С апреля2002 г. препарат был отменен как пульмотоксический и была назначе¬
на глюкокортикоидная терапия.При поступлении состояние больного было удовлетворительное.
Дыхание ослабленное. Клинический анализ крови — без патологи¬
ческих изменений. На рентгенограммах органов грудной клетки от
04.04.2002 г. выявлялось усиление легочного рисунка за счет интер¬
стициального компонента в обоих легких с участками дольковой и
сливной инфильтрации над диафрагмой и паракостально (больше
справа) с реакцией междолевой плевры. К 28.04.2002 г. инфильтра¬
ция отчетливо не определялась. Сохранялись интерстициальные
изменения, выраженность которых постепенно снижалась к июлю
и октябрю 2002 г. КТ органов грудной клетки выявила распростра¬
ненные интерстициальные изменения по типу «матового стекла»
в субплевральных отделах обоих легких, больше в средних и ниж¬
них отделах, участки вздутия легочной ткани. Легочный рисунок
умеренно усилен за счет интерстициального компонента, больше в
базальных отделах справа. В нижних отделах рисунок деформирован.
Сцинтиграфия легких с ^^'"[Тс] выявила выраженные нарушения пер¬
фузии в верхнесредних плащевых отделах обоих легких и справа.
Дефектов накопления радиофармпрепарата, соответствующих долям,
298 • ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХсегментам, выявлено не было, что позволило исключить гемоди¬
намически значимую ТЭЛА. По сравнению с апрелем 2002 г. ~ без
динамики. Комплексное функциональное исследование внешнего
дыхания выявило умеренное снижение ДСЛзд — 57% и ООЛ (66%)
при нормальных ЖЕЛ (113%) и показателях проходимости дыхатель¬
ных путей. Эластическая отдача легких была умеренно повышена
(0,75 кПа/л). Эходопплеркардиография выявляла повышение расчет¬
ного систолического давления в легочной артерии до 35—36 мм рт.
ст. Больному был поставлен диагноз: ЭТА, «амиодароновое легкое»,
ДН II степени. Вторичная легочная гипертензия I степени.
Назначена терапия берликортом* по 2,5 таблетки (12,5 мг в пере¬
счете на преднизолон) через день, препараты калия, нандролон,
ангиопротекторы. На фоне проводимой терапии через 6 мес одышка
исчезла. ДСЛус повысилась на 9%, но оставалась умеренно сни¬
женной (66%). Нормализовалось давление в легочной артерии
(28 мм рт.ст,),Некардиогенный отек легких — отек легких, не обусловленный забо¬
леванием сердца. Может быть вызван рядом лекарственных средств.Список лекарственных средств, способных вызвать некардиоген-
ный отек легких (чаше всего в случаях их передозировки), расширяет¬
ся; в настоящее время к препаратам этой группы относят:— аспирин* (ненаркотический анальгетик);— галоперидол (нейролептик);— лидокаин (местно анестезирующее средство);— хлордиазепоксид (транквилизатор);~ героин* (наркотическое средство);“ пропоксифен* (наркотическое средство);— метадон* (наркотическое средство);— налоксон (антагонист морфина);— тербуталин* (Р^-адреностимулятор);— гидрохлортиазид (мочегонное средство);— ритодрин^ (токолитик, расслабляет мускулатуру матки);— колхицин (противоопухолевый препарат растительного про¬
исхождения);— ИЛ-2 (цитокин);— цитарабин (противоопухолевый препарат);— метотрексат (противоопухолевый препарат);— циклофосфамид (противоопухолевый препарат);— клопидогрел (антиагрегант);— рентгеноконтрастные препараты.
ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХ • 299Признаки некардиогенного отека легких имеют место более чем
у одной трети лиц, госпитализированных в связи с превышени¬
ем дозы наркотических средств (героин*, пропоксифен*, метадон*).
Факторами риска развития заболевания кроме передозировки препа¬
ратов являются пожилой возраст и непереносимость лекарственного
препарата.Патогенез некардиогенного отека легких изучен недостаточно.
Предполагается, что повышение проницаемости легочных капилля¬
ров может развиваться за счет селективной ингибиции циклоокси-
геназного пути метаболизма арахидоновой кислоты, приводящей к
избыточному синтезу лейкотриенов (аспирин), воздействия на цент¬
ральную нервную систему (транквилизаторы, аспирин), дегрануля¬
ции тучных клеток с высвобождением медиаторов — лейкотриенов и
гистамина (опиаты), повреждения эндотелия капилляров вследствие
активации комплемента (героин*, Р-симпатомиметики).Возникающие при некардиогенном отеке легких изменения в
легочной ткани чаще всего напоминают таковые при токсических
поражениях легочной паренхимы: инфильтрация лимфоцитами аль¬
веол и межальвеолярных перегородок, пролиферация альвеолоцитов
и типа, интерстициальный фиброз (развивается при длительном воз¬
действии причинного фактора) или облитерирующий бронхиолит, не
отличающийся морфологически от облитерируюїдих бронхиолитов
другого генеза.Основными клиническими проявлениями некардиогенного отека
являются одышка и непродуктивный кашель. В зависимости от
степени выраженности отека легких кашель может сопровождать¬
ся выделением пенистой мокроты. Отмечаются цианоз вследствие
гиповентиляции, сонливость. Аускультация выявляет крепитацию.
Повышение температуры тела нехарактерно.Для диагностики заболевания показана консультация кардио¬
лога. Соответствующие данные анамнеза и исключение сердечно¬
сосудистого заболевания позволяют подтвердить некардиогенный
I енез отека легких.Как и при экзогенных альвеолитах, данные лабораторных иссле¬
дований неинформативны. В клиническом анализе крови иногда
определяется лимфоцитоз. Различная степень гипоксемии и гиттер-
капнии — наиболее часто регистрируемый признак некардиогенного
отека легких. Нередко определяется протеинурия.При рентгенологическом исследовании, как правило, выявляются
признаки отека легких, ацинарные инфильтраты. При прогрессиро¬
300 • ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХвании заболевания развивается рестриктивный синдром (снижается
ЖЕЛ, ДСЛ). Регистрация нарушений бронхиальной проходимости
на уровне мелких бронхов может свидетельствовать о формировании
облитерирующего бронхиолита.Тактика ведения больного заключается в своевременной адекват¬
ной оценке общего состояния пациента и отмене соответствующего
препарата, вызвавшего некардиогенный отек легких. В большинстве
случаев отмена препарата приводит к полному выздоровлению.
В зависимости от тяжести состояния больного может возникнуть
необходимость в использовании вспомогательной вентиляции лег¬
ких, во введении антагонистов опиатов (при передозировке опиатов).
Патогенетически обосновано назначение мочегонных, кислорода.
Положительный эффект применения глюкокортикоидных препара¬
тов при некардиогенном отеке легких не доказан.Веноокклюзионная болезнь легких характеризуется окклюзией
легочных вен, что ведет к развитию легочной гипертензии и про¬
является постепенным нарастанием одышки. На рентгенограммах
органов грудной клетки выявляются линии Керли при отсутствии
кардиомегалии. Веноокклюзионная болезнь легких вызывается рядом
цитотоксических препаратов. Прогноз неблагоприятный.Легочно-почечный синдром (псевдосиндром Гудпасчера) встречает¬
ся редко и напоминает синдром Гудпасчера, У больных развивается
одышка, гипопластическая анемия, гематурия. Патоморфологически
выявляются легочные кровоизлияния, но линейных отложений
иммуноглобулинов не обнаруживается. Заболевание развивается при
приеме D-пеницилламина.Облитерирующий бронхиолит с организующейся пневАюнней явля¬
ется редким осложнением лекарственной терапии и связывается в
большинстве случаев с D-пеницилламином. Описан случай разви¬
тия бронхиолита на фоне приема противоопухолевого препарата
топотекана. Отмечается одышка, кашель. Аускультация может не
выявлять изменений, в ряде случаев могут выслушиваться «попис¬
кивание» или крепитация. Рентгенологически отмечается повыше¬
ние прозрачности легочной ткани. Функциональная КТ выявляет
воздушные ловушки и мозаичность изменений. Морфологически
обнаруживается облитерация мелких проводящих путей с концен¬
трическим сужением их просвета за счет массивной лимфоидной
инфильтрации. Типичные для немедикаментозного облитерирую¬
щего бронхиолита окклюзионные пробки из грануляционной ткани
обычно не выявляются.
ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХ • 301Легочные эозинофильные инфильтраты. Синдром Леффлера про¬
является «лету^шми» инфильтративными затенениями в легких (на
рентгенограммах органов грудной клетки) с быстрой обратной дина¬
микой через 6-12 дней, гиперэозинофилией до 20—40%. При морфо¬
логическом исследовании отмечается заполнение альвеол эозинофи-
лами, лимфоцитами и плазматическими клетками, содержащими в
цитоплазме эозинофильные гранулы, обтурапия дистальных бронхи¬
ол скоплениями эозинофилов, утолшение стенок бронхов за счет бес-
клеточного отека, пери васкулярная инфильтрация эозинофилами.Волчаночный синдром могут вызывать гидралазин, прокаинамид,
квинидин^’, изониазид, дифенилгидантоин, нитрофураны, тетрацик¬
лин, сульфаниламиды, нестериодные противовоспалительные пре¬
параты, золото, тиазиды, р-адреноблокаторы. Волчаночный синдром
характеризуется частыми легочно-плевральными осложнениями при
редком вовлечении в процесс почек и нервной системы.АНЦА-лоложительный ангиит может протекать с развитием легоч¬
ного капиллярита (или без него) илегочныхкровотечений. Развивается
при лечении антитиреоидным препаратом — пропилтиоурацилом, а
также рядом других лекарственных средств (миноциклин*, левами-
зол, сульфасалазин, аллопуринол).СЧС развивается при приеме аспирина*, макролидов, сульфанила¬
мидов и других препаратов. Заболевание описано у больных бронхи¬
альной астмой, принимающих антагонисты лейкотриенов.Легочные кровоизлияния являются осложнением антикоагулянт-
ной терапии или лекарственно обусловленной тромбоцитопении.
В очень редких случаях могут быть проявлением легочно-почечно¬
го синдрома (псевдосиндрма Гудпасчера). Развиваются при приеме
нитрофуранов, цитозин-арабинозида^’, амиодарона, квинидина^ и
оксифенбутазона^', высоких доз циклофосфамида, митомицинаС.
Диагноз устанавливается при БАЛ, выявляющем нарастающее окра¬
шивание кровью ЖБАЛ в последующих порциях.Неврологические нарушения. Некоторые лекарственные препараты
(прокаинамид, D-пеницилламин) ингибируют нервную проводи¬
мость, что приводит к периферической нейропатии и блоку нейро-
мьтшечной функции. Развивается слабость респираторных мышц.Другие побочные действия лекарственных препаратовКашель. Хронический кашель в 5—15% случаев могут вызывать
ингибиторы АПФ (каптоприл, хинаприл, лизиноприл, рамиприл.
302 • ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХтрандолаприл, фозиноприл, эналаприл и др.). Препараты этой группы
используются для лечения артериальной гипертонии при неэффектив¬
ности или непереносимости р-адреноблокаторов и тиазидных диуре¬
тиков. Ингибиторы АПФ применяют как в ранние сроки инфаркта
миокарда, так и в постинфарктном периоде. Они являются препарата¬
ми выбора при сочетании артериальной гипертонии с инсулинзависи¬
мым сахарным диабетом с нефропатией. Сухой кашель возникает через1 мес лечения и чаще развивается у женщин. Возможны также перше¬
ние в горле, ринит, синуситы. Возникший упорный сухой кашель на
фоне приема ингибиторов АПФ является достаточным основанием для
их отмены и перехода на прием блокаторов ангиотензина II (лозартан,
вальсартал, эпросартан, телмисартан и др.). Препараты этой группы не
ингибируют расщепление брадикинина и других кининов, благодаря
чему лишены свойства вызывать упорный сухой кашель.Бронхоспазм. Бронхоспастический синдром могут вызывать многие
лекарственные препараты — аспирин*, нестероидные противовоспали¬
тельные препараты, р-блокаторы. Эта реакция часто развивается у лиц,
страдающих бронхиальной астмой или хронической обструктивной
болезнью легких. Осложнение развивается через минуты или часы после
приема препаратов, может быть тяжелым и трудно поддаваться лечению.
В связи с этим назначение |3-блокаторов больным астмой и другими
обструктивными заболеваниями нецелесообразно.Плевральный выпот может развиваться при лечении метотрекса¬
том, нитрофуронами, амиодароном, прокарбазином, кармустином,
циклофосфамидом. Может наблюдаться при лекарственно индуциро¬
ванном волчаночіюм синдроме.Средостенная лимфаденопатия может развиваться у больных, полу¬
чающих фенитоин, блеомицин, карбамазепин. Кроме того, при лече¬
нии ИФН-а и ИФН-р может развиваться псевдосаркоидный синдром.Медиастинальный липоматоз представляет собой накопление избыт¬
ка неинкапсулированного жира в средостении. Развивается при глюко-
кортикоидной терапии (синдром И цснко—Кушинга). Выявляется при
рентгенологическом исследовании: расширение переднего и заднего
средостения без деформации трахеи. Жировые отложения в костодиа¬
фрагмальном углу также часто увеличены.ОсложненияЛекарственные поражения легких могут осложняться пневмофиб¬
розом. ДН, ТЭЛА, легочной гипертензией, пневмотораксом.
ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕНИЯ ЛЕГКИХ • 303ДиагностикаЛекарственное поражение легких, как правило, ставится после
исключения других возможных причин заболевания. Чаще меди¬
каментозные поражения легких возникают при продолжительном
приеме лекарственных препаратов. При отмене этиологически зна¬
чимого препарата может наступить спонтанное выздоровление, в
го время как продолжение терапии может привести к необратимым
изменениям в легких, при повторном приеме лекарственных средств
наблюдается возобновление симптомов заболевания. Лекарственные
поражения легких представлены многообразными нозологическими
формами и не имеют общих патогномоничных клинических, лабора¬
торных, функциональных и рентгенологических признаков. При их
диагностике следует учитывать также возможное отсроченное начало
■заболевания при воздействии некоторых лекарственных препаратов
через недели (амиодарон) и даже годы после прекращения приема
препарата. Описан случай развития пневмофиброза через 17 лет после
лечения опухоли мозга в детском возрасте. Повышение уровня сыво¬
роточного гликопротеина KL-6, продуцируемого альвеолоцитами
И типа, является маркером амиодароновой токсичности (больше
520 ЕД/мл — верхняя граница нормы). Исследование ФВД и легоч¬
но-сердечной гемодинамики, лучевые, бронхологичсские, эндоско¬
пические и хирургические методы исследования подробно описаны
в соответствующих разделах. Выявление в ЖБАЛ пенистых клеток,
содержащих пластинчатые включения, может свидетельствовать
о воздействи и амиодарона.ЛечениеПри подозрении на лекарственно обусловленные поражения лег¬
ких необходимо немедленно отменить препарат. Назначаются глю-
кокортикоиды в начальной дозе 0,5-1,0 мг на 1 кг веса в сутки в пере¬
счете на преднизолон с последующим снижением дозы в зависимости
от быстроты обратной динамики заболевания. Предпочтительные
препараты — триамцинолон, метилпреднизолон, таблетированный
триамцинолон. Рецидив «амиодаронового легкого» может возникать
на фоне снижения дозы глюкокортикоидов даже через несколько
недель или месяцев после отмены препарата. Показано применение
экстракорпоральных методов лечения: плазмаферез, гемосорбция,
плазмацитоферез с инкубацией лимфоцитов с глюкокортикоидами.
304 • ГЛАВА 4. ЛЕКАРСТВЕННЫЕ ПОРАЖЕННЯ ЛЕГКИХПрогнозОстрые формы лекарственных поражений легких могут разре¬
шаться через 24—48 ч после отмены этиологически значимого препа¬
рата. При хронических формах прогноз серьезный и зависит от сроков
устанолления диагноза.При остром течении летальность при приеме метотрексата дости¬
гает 15%, «Амиодароновое легкое» заканчивается летально у 40—50%,
несмотря на глюкокортикоидную терапию. При подостром/хрониче-
ском течении амиодароновый ЭТА в 5—20% случаев прогрессирует даже
после отмены препарата и в 10—33% случаев заканчивается летально.ЭТА, вызванный нитрозомочевиной*, в 90% случаев приводит
к летальному исходу, несмотря на глюкокортикоидную терапию.
Поражение легких, развивающееся при приеме циклофосфамида,
заканчивается летально в 50% случаев. При воздействии бусульфана
средняя выживаемость после установления диагноза и начала тера¬
пии составляет 5%. Летальность от блеомицина — 1—2%, а диффузное
альвеолярное кровоизлияние при приеме цитотоксических препара¬
тов приводит к смертельному исходу в 50-100% случаев.ПрофилактикаИзбегать полипрагмазии, одновременного назначения нескольких
препаратов, обладающих пневмотропным токсическим действием.
Глава 5
Поражение органов дыхания
при диффузных болезнях
соединительной тканиСИСТЕМНАЯ СКЛЕРОДЕРМИЯСистемная склеродермия (ССД)— аутоиммунное забо¬
левание соединительной ткани с характерным пораже¬
нием кожи, сосудов, опорно-двигательного аппарата и
внутренних органов (легких, сердца, пищеварительного
тракта» почек), в основе которого лежат нарушения мик¬
роциркуляции, воспаление и генерализованный фиброз
[Гусева Н.Г., 2008]. По МКБ-10 ССД относится к I группе
ревматических заболеваний — диффузным системным
болезням соединительной ткани (ДБСТ).Первичная заболеваемость ССД составляет 3,7—20 слу¬
чаев на 1 млн населения в год. Распространенность в
среднем — 240—290 на 1 млн населения. ССД занимает по
частоте встречаемости среди ДБСТ второе место после
СКВ. ССД болеют во всех странах мира, но отмечено, что
лица негроидной расы болеют чаще, чем лица белой расы.
Среди заболевших преобладают женщины. Соотношение
306 « ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... женшин и мужчин составляет в среднем 7:1-9:1, причем преимущес¬
твенное поражение женщин наиболее выражено в возрасте 15—44 лет
(репродуктивный период). Средний возраст дебюта болезни составляет
38,8 лет, а выявляют заболевание обычно в период от 30 до 50 лет, хотя
описаны случаи начала заболевания как в 10-месячном, так и в 80-лет¬
нем возрасте [Ibid; Pagalavan L., Ong S.G., 2007].Поражение легких при ССД встречается чаще, чем при других
ДБСТ. Легочные проявления ССД входят в диагностические критерии
заболевания, разработанные Американской ревматологической ассо¬
циацией. Очевидные изменения легочной ткани выявляются на рент¬
генограммах органов грудной клетки у 25-65% [Minai О.А. et al., 1998]
а на ВРКТ у 92,9% [Goldin J.G. et al., 2008] больных ССД. При аутопсии
легочный фиброз находят почти у 75% пациентов [Wiedemann Н.Р.,
Matthay R.A., 1989], а функциональные тесты позволяют определить
нарушения в 90% случаев. Частота обнаружения легочной гипертен¬
зии при ССД колеблется, по данным разных исследователей, от 5 до
60%. Частота вовлечения легких в патологический процесс зависит
от формы ССД. При лимитированной ССД интерстициальный дву¬
сторонний базальный легочный фиброз встречается в 20% случаев,
легочная гипертензия— у 8-28% больных. При диффузной форме
ССД в 31-59% случаев развивается СФА, а легочная гипертензия —
очень редко. Чаще всего (от 19 до 85%, в среднем 38%) интерстициаль¬
ное поражение легких в сочетании с легочной гипертензией (21—21%)
выявляется при перекрестном <5Уег/а/)-синдроме [Collier H.D., 2001].Этиология и факторы рискаЭтиология ССД изучена недостаточно. В развитии заболева¬
ния принимают участие как генетически обусловленные факторы
риска, так и факторы окружающей среды, играющие роль триггеров.
В настоящее время расшифрованы некоторые механизмы генети¬
ческой предрасположенности к развитию ССД. Выявлено сочетание
определенных антигенов и аллелей системы гистосовместимости
(HLA) с ССД; HLA-A9, В8, В35, DR1, DR3, DR11, DR52, С4А и др.,
варьирующие в разных популяциях. Носительство определенных
HLA-антигенов предрасполагает к выработке различных аутоанти¬
тел, характерных для ССД и определяющих развитие соответствую¬
щих клинических синдромов и субтипов заболевания. Так, наличие
HLA-DR3/DR52, DR5 (DR11), DQ7 аллелей и синтез аутоантител к
топоизомеразе I (АТА), т.е. анти-8с1-70 антител сочетается с быстро
СИСТЕМНАЯ СКЛЕРОДЕРМИЯ • 307прогрессирующим (в течение первых двух лет болезни) фиброзом
кожи и внутренных органов, в том числе легких, т.е. предопределя¬
ет острое «злокачественное» течение ССД. Наличие HLA-A10, DR1,
DR11, DQB1, DR4 и синтез антицентромерных аутоантител коррели¬
рует с лимитированным поражением кожи, хроническим течением
болезни, поражением микроциркуляторного русла легких, развитием
легочной гипертензии [Гусева Н.Г., 1993; Steen V.D. et al., 2007; Renzo-
ni E.A., 2007; Grassegger A. et aL, 2008].К химическим агентам, провоцирующим развитие легочного фиб¬
роза при ССД, относятся хлорвинил, Д-пеницилламин, органические
растворители (бензол, толуол), трихлорэтилен, триптофан, пентоза¬
ми н, блеомицин, силиконовые материалы, растительное рапсовое
масло, денатурированное анилином [Silver R.M., 1996].Для возникновения легочной гипертензии у больных ССД основ¬
ными факторами риска являются длительность заболевания, актив¬
ность склеродермического процесса и степень выраженности синдрома
Рейно. Предикторами относительно быстрого прогрессирования легоч¬
ной гипертензии при ССД являются возраст пациентов старше 50 лет и
наличие антицентромерных аутоантител IKampolis С, et al., 20081.ПатогенезОсновными патогенетическими механизмами ССД являются
нарушения иммунного статуса, функции фибробластов и микро¬
циркуляции tYazawa N. et al., 2007]. Патогенез легочного фиброза
при ССД аналогичен патогенезу ИФА. Первоначальное повреждение
легких приводит к возбуждению клеток, участвующих в развитии
легочного фиброза. К ним относятся фибробластьт, эндотелиальные
клетки, гладкомышечные клетки, Т-лимфоциты, моноциты (мак¬
рофаги), тучные клетки, тромбоциты. Основным клеточным эле¬
ментом, участвующим в безудержном синтезе коллагена при ССД,
являются фибробласты. Выявлено, что при ССД фибробласты при¬
обретают особые свойства: для них характерна гиперфункция, уве¬
личение биосинтеза коллагена, неофибриллогенеза, увеличение син¬
теза фибронектина и других компонентов межклеточного матрикса,
формирование дефектности мембранной рецепции. В фибробластах
происходит нарушение синтеза коллагена I типа и подавление син¬
теза матричной РНК. Гладкомышечные клетки и эндотелий, обладая
фибробластной активностью и вызывая вазоконстрикцию, вносят
свой вклад в фиброзообразование [Du Bois R.M., 2007]. При ССД нару-
308 « ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... ттгено соотноіггение рецепторов к эндотелину типа А и в за счет уве¬
личения количества рецепторов к эндотелину типа в. Тучные клетки
участвуют в активации эндотелия и фибробластов, внося свой вклад
в развитие фиброза. Тромбоциты — источник факторов роста и цитоки-
нов, высвобождающихся при дегрануляции. Иммунокомпетентные
клетки (Т-лимфоциты и моноциты) являются источником медиато¬
ров воспаления и участвуют в поддержании аутоиммунного воспа¬
ления на всех этапах патологического процесса. Межклеточные вза¬
имодействия осуществляются посредством медиаторов воспаления
[Насонов Е.Л. и соавт., 2003], к которым относятся;• Молекулы адгезии (селектины, интегрины, суперсемейство имму¬
ноглобулинов). Их экспрессия на поверхности клеток эндотелия
усиливается под влиянием различных медиаторов. Эти молекулы
обеспечивают костимулирующий сигнал для активации лей¬
коцитов и пролиферации лимфоцитов, регулируют миграцию
лейкоцитов из кровяного русла и их накопление в зоне тканевого
воспаления.• Факторы роста — TGF-p, фактор роста соединительной ткани,
тромбоцитарный фактор роста. TGF-|5 регулирует экспрессию
гена коллагена, вызывая ее повышение, и участвует в высвобож¬
дении фактора роста соединительной ткани. TGF-p является
мощным активатором выработки коллагена и присутствует в
большом количестве в легких пациентов ССД, активно участ¬
вует в формировании фиброза [Leask А,, 2008; Bogatkevich G.S.
et al., 20071.■ TNF-a задействован на ранних этапах развития заболевания и
является ключевым фактором формирования фиброза.• ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-15, ИФН-у и ИФН-а участ¬
вуют в патогенезе на разных этапах воспалительного процесса,
поддерживая его.■ Эндотелин-1 (участвует как в развитии сосудистых изменений,
так и в формировании фиброза, является активатором TGF-P
[Shiwen X. et al., 2007]), адреномедуллин [Мок M.Y. et al., 2007] и
другие вазоактивные пептиды.• Макрофагальный воспалительный протеин макрофагов (МІР) —
активатор, хемоаттрактант и регулятор активности макрофагов и
лимфоцитов.• RANTES (РАНТЕС) — активатор и хемоаттрактант Т-лимфоцитов,
экспрессируемый и секретируемый нормальными Т-клетками.• EGR-1-транскрипционный фактор, индуцирующий экспрессию
СИСТЕМНАЯ СКЛЕРОДЕРМИЯ • 309TGF-p, что ведет к активации фибробластов и чрезмерному обра¬
зованию коллагена [Bhattacharyya S, et al., 2008].Многие из перечисленных медиаторов обладают потенциальным
фиброгенным эффектом. Под действием медиаторов воспаления раз¬
вивается инфильтрация интерстииия легких клетками воспаления и
иммунокомпетентными клетками. Этот процесс предшествует разви¬
тию быстро прогрессирующего фиброза в легочной ткани. Исходом
является синдромный фиброзирующий альвеол ит.Нарушения микроциркуляции играют важную роль в патогенезе
ССД. Страдает микроциркуляторное русло всех органов, в том числе и
легких. Под влиянием этиологического фактора нарушается функци¬
ональная активность миофибробластов, участвующих в образовании
сосудистой стсики. В стенках сосудов происходит пролиферация и
деструкция эндотелия, утолщение и гиперплазия интимы, фибрино¬
идный некроз и склерозирование, приводящие к сужению просвета
мелких сосудов вплоть до облитерации их просветов. Одновременно
развиваются нарушения проницаемости сосудистой стенки и рео¬
логических свойств крови. Отмечается увеличение вязкости крови,
гиперкоагуляция, угнетение фибринолиза, агрегация форменных
элементов крови, стаз, деформация и редукция капиллярной сети с
образованием бсссосудистых полей. Именно эти нарушения микро-
циркуляиии приводят к развитию синдрома Рейно, включая его экви¬
валент во всех органах и тканях (почки, легкие, желудочно-кишечный
тракт, сердце), обусловливая возникновение распространенных тро¬
фических, ишемических и некротических изменений.Патологическая анатомияПатологическая анатомия легких при ССД практически неот¬
личима от таковой при ИФА и харктеризуется утолщением альвео¬
лярных перегородок за счет инфильтрации их клетками воспаления
(мононуклеаров, гранулоцитов и плазматических) и соединитель¬
нотканного матрикса (фибробластов, тучных, макрофагов) в сочета¬
нии с накоплением внутриальвеолярных макрофагов, пролифера¬
цией пневмоцитов ЇІ типа. В дальнейшем утолщение альвеолярных
перегородок обусловливается разрастанием соединительной ткани,
которая местами замещает собой просветы альвеол. Капилляры аль¬
веолярных перегородок резко расширяются, их базальные мембраны
утолщаются, разрыхляются, местами выбухают в просвет альвеол и
имеют вид «проволочных петель». Эндотелий капилляров набуха¬
3tD ♦ ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... ет. в стенках мелких артерий и венул развиваются дистрофические
(мукоидное набухание) и воспалительные (продуктивный васкулит)
изменения, В периваскулярной соединительной ткани выявляются
очаговые фибриноидные изменения. Наиболее значимо поврежде¬
ния сосудов развиваются при медленно прогрессирующем течении
болезни и заканчиваются облитерацией просвета сосудов и возник¬
новением легочной гипертензии. Кардинальный морфологический
признак легочной артериопатии при ССД — концентрический скле¬
роз артериол. Изменения максимально выражены субплеврально и
в нижнебазальных отделах легких с появлением микроскопических
узелков, на месте которых формируется «сотовое легкое» в процессе
прогрессирования болезни. Некоторые особенности морфологичес¬
кой картины в легких зависят от варианта течения заболевания. При
остром и подостром течении ССД быстро развивается диффузный
фиброзирующий альвеолит. При хроническом течении болезни пнев¬
мофиброз очагово-распространенный, значительно менее выражен,
чем при других вариантах течения, но сопровождается развитием
выраженной, иногда злокачественной, легочной гипертензии.Клиническая картинаКлинические проявления ССД обусловлены развитием прогрес¬
сирующего склероза в различных органах и тканях, что отражается
в полиморфизме проявлений заболевания. Основным клиническим
синдромом, давшим название болезни (склеродермия, т.с. твердо¬
кожие), является поражение кожи^ которое проходи [ несколько ста¬
дий — плотный отек (каменистой плотности), индурапию, атрофию.
Характерный признак ССД - синдром Рейно. Практически у всех
больных наблюдается поражение опорно-двигательного аппарата.
Среди висцеритов, характерных для ССД, возможно поражение серд¬
ца, желудочно-кишечного тракта, почек, легких.Поражение легких - одна из важных висцеральных локализаций
склеродермического процесса, от которого часто зависит прогноз
заболевания. Легкие могут вовлекаться в патологический процесс
в дебюте болезни и быть одним из первых симптомов ССД (встре¬
чается редко) [Van der Kamp R. et al., 2007J. Чаще поражение легких
развивается на фоне уже развернутой картины ССД. Среди вариантов
поражения легких выделяют интерстициальный фиброз легких или
фиброзирующий альвеолит, легочный васкулит, легочную гипертен¬
зию, которая может развиться на фоне прогрессирующего распро-
СИСТЕМНАЯ СКЛЕРОДЕРМИЯ • 311страненного интерстициального фиброза легких или сопровождать
легочный васкулит [Heresi G.A. et al., 2008; Kumar U. et al., 2008;
Steen V. et al., 2008J.Интерстициальный фиброз легких. Клиническая картина скле-
родермического интерстициального фиброза легких неспецифич¬
на и часто появляется после многих лет бессимптомного течения.
Наличие жалоб свидетельствует о далеко зашедшем легочном про¬
цессе. Больные жалуются на одышку и сухой кашель при физической
нагрузке, ош^ушение невозможности сделать полный вдох, боль в
грудной клетке. Прогрессирование склеродермического фиброзиру-
юшего альвеолита чаще всего происходит медленно (годами) и при¬
водит к появлению одышки в покое. При аускультации над легкими
выслушивается жесткое дыхание, крепитация в начале вдоха (фено¬
мен Велькро). Выраженность интерстициального фиброза легких
зависит не столько от длительности заболевания, сколько от степени
активности склеродермического процесса. При остром и подост-
ром течении ССД наблюдается развитие быстро прогрессирующего
фиброзирующего альвеолита, тогда, как при хроническом течении
заболевания пневмофиброз прогрессирует медленно. Наличие пнев¬
мофиброза обычно коррелирует с выраженностью сосудистых изме¬
нений (генерализованным синдромом Рейно, трофическими нару¬
шениями кожи), наличием других висцеритов, высоким уровнем IgG
в сыворотке крови [Komura К, et al., 2008].Легочный васкулит и легочная гипертензия. Поражение сосудов
легких является характерной чертой ССД и может выступать как
самостоятельный вид поражения легких, так и развиваться у паци¬
ентов с прогрессирующим интерстициальным фиброзом легких.
Преобладание сосудистой патологии ведет к развитию легочной
гипертензии, чаще обнаруживаемой у больных с хроническим тече¬
нием заболевания. Напротив, при быстро прогрессирующем фиб-
розирующем альвеолите легочный васкулит и легочная гипертензия
развиваются редко. Клиническая картина легочной гипертензии, воз¬
никшей на фоне ССД, неспецифична и отчетливо появляется после
длительного (в течение первых 5—10 лет) «бессимптомного^ периода.
Пациенты предъявляют жалобы на постепенное нарастание одыш¬
ки, которая вначале появляется только при физической нагрузке, а
затем — в покое. Одышка сопровождается сердцебиением, возможны
кратковременные обморочные состояния. Иногда отмечаются при¬
ступы удушья при выходе на холод, что связывают с функциональным
изменением сосудов легких — вазоспазмом, эквивалентным перифе¬
312 « ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... рическому синдрому Рейно, Нередко отмечается катпель с небольшим
количеством слизистой мокроты, при аускультации сердца выслуши¬
вается акцент 11 тоиа на легочной артерии, ритм галопа из-за пере¬
грузки правого желудочка, шум недостаточности трикуспидального
клапана или клапана легочной артерии. При осмотре выявляется
набухание вен шеи и отеки на ногах.КлассификацияОбщепринятой классификации поражений легких при ССД не
существует. Выделяют интерстициальный фиброз легких, легочный
васкулит, легочную гипертензию [Highland К,В. et al., 2007].ОсложненияК осложнениям, которые могут развиться на фоне склеродер¬
ми ческого легочного фиброза, относят вторичную бактериальную
пневмонию, туберкулез легких, микоз легких, буллезные изменения,
кистоподобные полости, спонтанный пневмоторакс, бронхоэктазии,
альвеолярные геморрагии, кровохарканье, рак легких, ДН.ДиагностикаДля диагностики поражений легких при ССД используется комп¬
лекс клинико-лабораторных и инструментальных методов. Сложность
постановки диагноза заключается в определении вторичного характе¬
ра поражения легких по отношению к основному заболеванию.Лабораторные методы. Среди общеклинических лабораторных
показателей, специфичных для ССД, нет. Признаки выраженной
неспецифической лабораторной активности (увеличение СОЭ, сни¬
жение гемоглобина, лейкоцитоз, изменение лейкоцитарной формулы;
отклонения биохимических показателей: гиперпротеинемия, дис-
протеинемия, повышение трансаминаз и др.) встречаются только при
быстро прогрессирующем легочном фиброзе, на фоне острого течения
ССД. Признаков неспецифической лабораторной активности может
не быть. Среди иммунологических показателей выявляется увеличе¬
ние иммуноглобулинов, чаще IgG, могут быть ревматоидный фактор,
антинуклеарный фактор, антитела к фосфолипидам. Специфичными
для ССД с быстро прогрессирующим легочным фиброзом являются
антитела к топоизомеразе-1 (антигену Scl-70), а для медленно про¬
СИСТЕМНАЯ СКЛЕРОДЕРМИЯ • 313грессирующего поражения легких, протекающего с формированием
легочного васкулита и легочной гипертензии, специфично обнару¬
жение антител к центромерам (антицентромерные антитела). Иногда
синтезируются антитела к Ul-рибонуклеопротеиду (U1-RNP), что
обычно совпадает с развитием перекрестного {overlap) синдрома.
Выявление антител к U3-RNP ассоциируется с легочной гипертензи¬
ей и ранним началом болезни. Недавно было показано, что биологи¬
ческим маркером поражения легочных сосудов при ССД может слу¬
жить высокий уровень физиологически неактивного терминального
прогормона — мозгового натрийуретического пептида (NT-proBNP)
[Choi HJ. et al, 2008].Лучевые методы исследования. При рентгенологическом иссле¬
довании легких на основании оценки легочного рисунка выделяют
две формы склеродермического пневмофиброза: преимущественно
диффузную и преимущественно кистовидную с локализацией изме¬
нений в базальных отделах обоих легких [Спасская П.А., Бартусеви-
ченеА.С., 1988].При диффузном пневмофиброзе определяются избыточность и сет¬
чатая деформация легочного рисунка на протяжении обоих легочных
полей до периферических отделов с тенденцией к увеличению изме¬
нений в базальных отделах легких. Степень диффузных изменений
может быть различной: от едва намечающейся сетчатости до картины
выраженного пневмосклероза. Картина диффузного сетчатого пнев¬
мофиброза обусловлена изменениями соединительной ткани легких
(междольковых и внутридольковьтх прослоек, перибронхиальных и
периваскулярных слоев). В ряде случаев наблюдаются значительные
перибронхиальные изменения с утолщением стенок броіїхов и даже
формированием тракиионных бронхоэктазий. На рентгенограммах
это отображается в виде параллельных парных полосок в хвостовых
отделах корней легких, ячеистой деформации легочного рисунка в
базальных отделах легких. Диффузному пневмофиброзу сопутствует
эмфизема легких, что проявляется умеренным увеличением ретрос-
тернального пространства.При втором типе, преимущественно кистовидного, пневмофибро¬
за на рентгенограммах в базальных отделах легких над диафрагмой
выявляются участки сотовой перестройки легочного рисунка, обус¬
ловливающие снижение пневматизации этих отделов, В плащевидном
слое легкого располагаются ячейки неправильно округлой формы
размерами до 3—5 мм, по виду напоминающие пчелиные соты. Эти
рентгенологические феномены обусловлены изменениями в парен¬
314 • ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... химе легких, утолщением и частичным лизисом альвеолярных пере¬
городок. примерно у половины больных выявляются плевральные
изменения в виде адгезивных процессов— утолщения костальной
плевры, двусторонней облитерации костно-диафрагмальных синусов.
Экссудативный плеврит наблюдается крайне редко.Изменения на рентгенограммах органов грудной клетки выявля¬
ются у 20—80% больных ССД, но в больщинстве случаев — лишь при
развернутой клинической симптоматике, что снижает их диагности¬
ческую ценность.При изолированном поражении сосудов изменений на рентге¬
нограммах нет, но при значительной легочной гипертензии можно
отметить выбухание конуса легочной артерии, увеличение размеров
сердца за счет правых отделов. ВРКТ позволяет выявить изменения,
описанные выше, до их появления на обычных рентгенограммах
легких. На ранних стадиях заболевания изменения локализуются в
субплевральных и базальных отделах, распространяясь вверх и к цен¬
тру. Изменения, выявляемые в легких при проведении ВРКТ у паци¬
ентов ССД, схожи с таковыми, выявляемыми при ИФА, однако при
ССД верхние отделы легких поражаются значительно реже и могут
выявляться признаки вовлечения в патологический процесс плевры.
Изменения по типу «матового стекла» (очаговое или диффузное уве¬
личение плотности легочной ткани) наблюдаются у 49,4% пациентов
и свидетельствуют о наличии активного альвеолита. Легочный фиб¬
роз обнаруживают в 92,9% случаев, «сотовое легкое» формируется в
37,2% [Goldin J.G. et al., 2008]. Внедрение в клиническую практику
ВРКТ привело к существенному улучшению диагностики пораже¬
ний легких при ССД. ВРКТ при необходимости позволяет выбрать
оптимальную зону для биопсии легкого, осуществлять мониторинг
при лечении ССД [Madani G.et al., 2008]. Данные ВРКТ коррелируют
с результатами других методов исследования, позволяющих подтвер¬
дить развитие фиброзирующего альвеолита при ССД. При наличии
симптома «матового стекла» в ЖВАЛ выявляют высокое содержание
клеток воспаления, а легочный фиброз сочетается со снижением ДСЛ
[Goldin J.G. et al., 2008].При легочной гипертензии данные ВРКТ обычно не изменены,Перфузионная сцинтиграфия легких не является основным методом
диагностики поражения легких при ССД. Иногда используют перфу-
зионную сцинтиграфию с технецием f ^'"Тс), оценивая количественно
его клиренс с целью выявления субклинической стадии болезни,
при подозрении на вовлечение в патологический процесс легочных
СИСТЕМНАЯ СКЛЕРОДЕРМИЯ *315сосудов и для оценки прогноза. Высокий клиренс технеция свиде¬
тельствует в пользу повреждения эпителиальных клеток и высокого
риска прогрессирования заболевания. Нормальный клиренс техне¬
ция почти всегда ассоциируется с отсутствием прогрессирования
процесса [Wells А,и. et al., 1993; Kaloudi О. et al., 2007].Исследование ФВД является наиболее информативным методом,
позволяющим выявить вовлечение легких в патологический процесс
на самых ранних этапах развития болезни. Еще на доклинической
стадии альвеолита наблюдается снижение ДСЛус. При прогрессиро¬
вании болезни отмечается снижение ДСЛзд, Физическая нагрузка
усиливает проявления вентиляционно-перфузионных нарушений.
Отмечается тесная корреляция показателей ДСЛ и данных ВРКТ
[Quadrelli S. et al., 2007]. Исследование газового состава крови на
ранних стадиях болезни изменений не выявляет. При прогрессиро¬
вании фиброзирующего альвеолита определяется гипоксемия при
нормальном уровне PaCOj. При ССД гипоксемия выражена меньше,
чем при ИФА при однотипных изменениях на ВРКТ. По результатам
исследования спирометрии и общей бодиплетизмографии при раз¬
витии склеродермического интерстициального фиброза отмечается
снижение объемов по рестриктивному типу (снижается ЖЕЛ, ООЛ,
ОЕЛ). Однако у незначительного числа больных (10%) выявляется
увеличение ООЛ в сочетании с рестриктивными изменениями. Еще
реже определяется изолированное увеличение ООЛ, что позволяет
предположить вовлечение в патологический процесс при ССД тер¬
минальных отделов дыхательных путей на ранних этапах болезни,
предшествующих нарушению ДСЛ [Shahin А.А. et al., 2001].Исследование легочно-сердечной гемодинамики проводится с помо¬
щью эхокардиографии с допплеровским анализом. У пациентов ССД
может быть выявлена легочная гипертензия, которая в 61,5% слу¬
чаев сопровождает легочный фиброз, чаще развивается у мужчин.
Ежегодное выполнение эхокардиографии пациентам ССД позволяет
выявить доклиническую стадию развития легочной гипертензии
[Wangkaew S. et al, 2008]. Результаты, полученные с помощью эхокар¬
диографии, совпадают с данными, полученными прямым способом
с помощью катетеризации правых камер сердца, Прогрессирование
легочной гипертензии способствует развитию гипертрофии правого
желудочка, увеличению размеров правых камер сердца, относитель¬
ной трикуспидальной недостаточности, снижению сократительной
функции миокарда (признаки легочного сердца). Повышение давле¬
ния в легочной артерии коррелирует со снижением ДСЛ и гипоксе-
316 > ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... мией fSteen V. et al., 2008]. Часто выявляется фиброз миокарда желу¬
дочков.Эндоскопические и хирургические методы диагностики используют¬
ся с целью получения материала для последующего морфологическо¬
го исследования. Фибробронхоскопия позволяет получить жидкость
БАЛ и выполнить ЧББ легочной ткани. Если результаты исследования
такого биоптата малоинформативны, тогда прибегают к выполнению
видеоторакоскопии или открытой биопсии легких.Морфологические методы исследования. По данным исследо¬
вания ЖБАЛ, альвеолит выявляется более чем в 70% случаев. Ее
цитологическая оценка оказывает помощь в определении характе¬
ра поражения легких в рамках ССД, степень активности процесса
[Strange С. et al.> 2008]. Общее число клеток в 1 мл ЖБАЛ повы¬
шено за счет накопления клеток воспаления (альвеолярных мак¬
рофагов, лимфоцитов, гранулоцитов). У большинства пациентов
выявляется нейтрофильный или нейтрофильно-эозинофильный
характер альвеолита, значительно реже в клеточном составе ЖБАЛ
доминируют лимфоциты. Цитологический состав ЖБАЛ наиболее
точно отражает активность легочного процесса при ССД: степень
повышения количества нейтрофилов и эозинофилов определяет
степень повреждения легочной ткани, а лимфоцитоз свидетель¬
ствует об иммунологической активности СФА. Кроме того, цито-
функциональные характеристики альвеолярного смыва позволяют
установить стадию поражения интерстиция легких. Активация
альвеолярных макрофагов и повышение содержания нейтрофилов
соответствуют латентному альвеолиту. Максимальное увеличение
содержания нейтрофилов и эозинофилов с сопоставимой актива¬
цией альвеолярных макрофагов соответствует активному альве¬
олиту. Неактивный фиброзирующий альвеол и т характеризуется
снижением уровня лимфоцитов и истощением метаболических
ресурсов альвеолярных макрофагов.Формулировка диагнозаСледует указывать форму основного заболевания, вариант его
течения, степень активности процесса, варианты поражения различ¬
ных органов и систем, включая легкие.• ССД, лимитированная форма, хроническое течение с поражени¬
ем кожи (склеродактилия, остеолиз ногтевой фаланги 3-го пальца
левой кисти, амимимия, трофические нарушения — хроническая
СИСТЕМНАЯ СКЛЕРОДЕРМИЯ * 317язва кожи левой голени), синдромом Рейно, поражением желу¬
дочно-кишечного тракта (эзофагит), поражением легких (легоч¬
ный васкулит, легочная гипертензия И степени, фиброзирующий
альвеолит), вторичным синдромом Шегрена (ксеростомия, ксе-
рофтальмия, ксеробронхит). Активность I степени.• ССД, диффузная форма, острое течение с поражением кожи (гене¬
рализованный фиброз, гиперпигментация, склеродактилия), сус¬
тавов (полиартрит), синдромом Рейно, поражением легких (фиб¬
розирующий альвеолит). Активность ПТ степени. Осложнения:
ДН II степени.• Дифференциальная диагностика.Дифференциальную диагностику поражений легких, выявлен¬
ных на фоне достоверной ССД, проводить нет необходимости. Но в
случаях раннего поражения легких при отсутствии явных признаков
ССД (вариант дебюта заболевания с висцеральным проявлением, что
встречается крайне редко) приходится проводить дифференциальную
диагностику с ИФА, ЭТА, ЭАА, поражением легких на фоне других
ДБСТ, системными васкулитами. В этих случаях следует обращать
внимание на условия возникновения заболевания (профессиональ¬
ные вредности), пол (ССД чаще страдают женщины), возраст (ССД
чаще дебютирует в возрасте 20-50 лет), общую клиническую картину,
т.е. выявлять минимальные клинические признаки ССД. Для поста¬
новки диагноза ССД Американская коллегия ревматологов разрабо¬
тала диагностические критерии.• «Большой» критерий: проксимальная склеродермия (симметрич¬
ное утолщение и индурация кожи пальцев, распространяющиеся
проксимально от пястно-фаланговых и плюснефаланговых сус¬
тавов. Изменения могут затрагивать лицо, шею, грудную клетку,
живот).• «Малые» критерии: склеродактилия, дигитальные рубчики, дву¬
сторонний базальный пневмофиброз.Для подтверждения диагноза необходим «большой» критерий или
два «малых» критерия. Эти критерии высокочувствительны и специ¬
фичны. Из лабораторных исследований для быстро прогрессирующей
ССД характерна гипергаммаглобулинемия, антитела к топоизомеразе I
(антиген Scl-70), для хронического течения специфичны антитела к
центромерам, а при перекрестном синдроме и подостром течении —
антитела к рибонуклеопротеиду (RNP). В сложных диагностических
случаях необходима морфологическая верификация диагноза, кото¬
рая возможна при выполнении биопсии легких.
ЗІВ * ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... ЛечениеЛечение ССД в целом и ее легочных проявлений является сложной
и до конца НС решенной проблемой. При активном быстро прогресси¬
рующем фиброзе легких назначают глюкокортикоиды в сочетании с
антифиброзными препаратами, цитостатиками.Преднизолон назначают в дозе 20-30 мг в сутки на 3-4 нед, с пос¬
ледующим снижением дозы по 2,5 мг во второй день приема 1 раз в2 нед до поддерживающей дозы 7,5—10 мг в сутки, Д-пеницилламин
(артамин*, купренил*, металкаптаза*, троловол^^О подавляет синтез и
созревание коллагена, тем самым уменьщая избыточное фиброзооб-
разованис. Начинают лечение с 250—300 мг в сутки, постепенно (1 раз
в 3 мес) повышая дозу препарата на 250-300 мг до 600—900—1200 мг в
сутки. Терапевтическая доза назначается в течение нескольких меся¬
цев до появления клинического эффекта, а затем дозу постепенно
снижают до поддерживающей — 250—300 мг, реже — 450 мг в сутки,
которую следует принимать годами. При отсутствии эффекта в тече¬
ние 3-4 мес препарат отменяют. В последние годы эффективность
Д-пеницилламина в отношении легочного фиброза подвергается сом¬
нению [Mouthon L. etal, 2007]. Одновременно стали шире использовать
для лечения склеродермического пневмофиброза циклофосфамид с
хорошим эффектом. Пульсовое введение препарата снижает актив¬
ность альвеолита, однако предотвратить прогрессивное снижение
функциональных показателей циклофосфамид не позволяет [Mittoo S.
et ai., 2007]. Препарат максимально эффективен в течение первого года
лечения. В последующем эффективность циклофосфамида снижает¬
ся [Tzelepis G.E. et al., 2007; Afshar К, Sharma О.P., 2008]. Для поддержа¬
ния эффекта, достигнутого пульсовым введением циклофосфамида
в течение года, в последующем назначают азатиоприн в дозе 100 мг
Б сутки [Раопе С. et аК, 2007]. Использование метотрексата для лече¬
ния легочного фиброза при ССД дает скромные результаты. Лечение
можно дополнить аминохинолиновыми средствами, влияющими на
реологические свойства крови, — хлорохин по 0,25 мг в сутки или
гидроксихлорохин по 0,2 мг в сутки. Появились данные о положитель¬
ном влиянии на функциональные показатели (увеличивается ЖЕЛ)
и КТ-признаки легочного фиброза у пациентов ССД при использова¬
нии препарата микофенолата мофетил (2 г в сутки) [Gerbino А. J. et al.,
2008; Zamora А.С. et aL, 2008]. Есть сведения о применении биологи¬
ческих препаратов (ритуксимаб) для лечения легочного фиброза при
ССД [McGonagle D. et al., 2008J. Целесообразно применение методов
экстракорпоральной гемокоррекции (плазмаферез).
СИСТЕМНАЯ СКЛЕРОДЕРМИЯ • 319Лечение вторичной легочной гипертензии малоэффективно, при
ее развитии рекомендуют назначение блокаторов кальциевых кана¬
лов, лучшим из которых в этой ситуации считается нифедипин.
Препарат используют в дозе 30—80 мг в сутки на длительный срок.
Оправдано назначение ингибиторов АИФ (эналаприл), антагонистов
рецепторов ангиотензина И (лозартан), простагландинов (вазапрос-
тан), антиагрегантов (дипиридамол), антикоагулянтов (варфарин),
простациклинов (илопрост, эпопростенол и др.). Курсовое введение
илопроста позволяет предотвратить развитие тяжелой легочной гипер¬
тензии [АІГО Р. et al., 2007]. В последние годы с эффектом используют
антагонист рецепторов эндотелиина-1 — бозентан*". Использование
бозентана^’ (125 мг в сутки в 2 приема) улучшает выживание боль¬
ных ССД с легочной гипертензией [Afshar К., Sharma О.Р., 2008;
Heresi G.A., Minai О.А., 2008J, В качестве средства, снижающего дав¬
ление в легочной артерии, также используют ингибиторы фосфодиэс-
теразьт (силденофил^" по 50 мг в сутки) [Henness S., Wigley F.M., 2007;
Tamborrini G. et al., 2008].ПрогнозПрогноз при ССД в целом зависит от распространенности пора¬
жения кожи. Поражение легких значительно отягощает прогноз.
Особенно ухудшает прогноз возникновение легочной гипертензии
[Kumar и. et al., 2008; Afshar К. et аК, 2008; Steen V. et al., 2008]. При
дел менее 40% должной величины пяти летняя выживаемость
составляет 10%.ПрофилактикаПервичная профилактика ССД аналогична тем же мероприяти¬
ям, которые применяются для первичной профилактики основного
заболевания — ССД. Этот комплекс заключается в проведении про¬
филактических осмотров и диспансерного наблюдения лиц, угрожа¬
емых в отношении заболевания, рациональном трудоустройстве лиц,
подозрительных в отношении ССД. Условия труда должны исключать
охлаждение, травмы, перенапряжения. Лицам группы риска по ССД
противопоказаны профилактические прививки.Вторичная профилактика — профилактика развития склеродер-
мического пневмофиброза заключается в ранней диагностике основ¬
ного заболевания и своевременном адекватном лечении ССД.
320 « ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ,.. РЕВМАТОИДНЫЙ АРТРИТРевматоидный артрит (РЛ) — хроническое системное заболевание
соединительной ткани с прогрессирующим поражением преимущес¬
твенно периферических (синовиальных) суставов по типу симметрич¬
ного прогрессирующего зрозивію-деструктивного полиартрита, а в
ряде случаев — с характерными внесуставными поражениями.РА является одним из наиболее часто встречающихся заболева¬
ний из группы ДБСТ, составляя 10% среди них. Женщины болеют в
3—5 раз чаще, чем мужчины (Насонов Е.Л. и соавт., 2008]. Средний
возраст дебюта заболевания для женщин составляет 40,8 года, а для
мужчин — 44,6 года.Этиология и факторы рискаЭтиология РА до настоящего времени остается неизвестной.
К факторам риска, определяющим предрасположенность к развитию
легочного фиброза при РА, относят наличие у пациентов антигенов
главного комплекса гистосовместимости В8 и Dw3 и высокие титры
ревматоидного фактора [Mori S. et al., 2008J в сыворотке крови. Однако
имеются наблюдения, в которых отмечается развитие интерстици¬
ального поражения легких у серонегативных больных [Богданов А.Н.,
1998]. Некоторые авторы относят к факторам риска, способствующим
развитию интерстициального поражения легких при РА, — курение
табака [Patel R.R., Ryu J.H., Vassallo R., 2008J, использование метотрек¬
сата для лечения РА и высокие альвеолярные концентрации ИФН-у и
TGF-p, [Gochuico B.R. et a(., 2008].ПатогенезВ настоящее время общепризнанным является факт иммуно¬
патологической природы ревматоидного воспаления, которое в
дебюте заболевания развивается местно в синовиальной оболочке
суставов и приводит к повреждению синовиоцитов, развитию сино-
вита и различных внесуставных повреждений — ретикулоэндотели-
альной системы, серозных оболочек, сердца, сосудов, почек, глаз,
нервной системы, легких. Поскольку поражение легких является
проявлением основного заболевания — РА, то в патогенезе любых
патологических изменений со стороны органов дыхания основную
РЕВМАТОИДНЫЙ АРТРИТ • 321роль играют аутоиммунные механизмы. В ответ на неспецифическое
антигенное воздействие возникает возбуждение иммунокомпетен-
тиых клеток легочного интерстиция (макрофагов, Т-лимфоцитов),
запускающее каскад тех же иммунных реакций, которые происходят
в синовии суставов. Активированные клетки системы моноцит/
макрофаг за счет фагоцитоза ими антигена выбрасывают во внекле¬
точное пространство провоспалителъные цитокины (ИЛ-1, TNF-a,
ИЛ-6, ИЛ-8), активируя Т-лимфоциты-хелперы I типа, и способс¬
твуют гиперэкспрессии клеточных молекул адгезии. Последние
стимулируют пролиферацию лимфоцитов, активируют лейкоциты,
регулируя их миграцию из кровяного русла в зону тканевого воспа¬
ления. Стимулированные Т-лимфоциты - хелперы 1 типа выраба¬
тывают свои провоспалительные цитокины (ИЛ-2, TNF-a, ИФН-у,
ИЛ-17, ИЛ-18), что ведет к активации В-лимфоцитов. Последние
трансформируются в плазматические клетки, продуцирующие
иммуноглобулины преимущественно класса G. Их соединение
с антигеном запускает иммунную реакцию. Возникновение заболе¬
вания обеспечено особенностями иммунореактивности больных РА,
Им свойственны сниженная толерантность к собственным тканям,
обусловленная генетическими маркерами (носительство HLA DR4),
и сниженная супрессорная активность в виде недостаточной про¬
дукции антивоспалительных цитокинов (ИЛ-10, растворимый анта¬
гонист ИЛ-1, растворимые TNF-рецепторы, ИЛ-4) [Насонов Е.Л.,
2000]. Эти особенности иммунореактивности способствуют чрез¬
мерной активации В-лимфоцитов, которые вырабатывают значи¬
тельное количество антител, в том числе и на собственные IgG.
У больных РА IgG приобретают особые свойства за счет формиро¬
вания дефектного Рс-фрагмснта. Именно к таким дефектным IgG и
вырабатываются аутоантитела преимущественно класса М, которые
носят название ревматоидного фактора и являются маркером РА.
Выработка иммуноглобулинов ведет к формированию иммунных
комплексов, активирующих систему комплемента и стимулирую-
ІЦИХ фагоцитарную активность макрофагов. Активированные ком¬
поненты комплемента осуществляют лизис и повреждение клеток-
мишеней, а также способствуют хемотаксису, активации фагоцитов
и синтезу иммуновоспалительных цитокинов, чем поддержива¬
ют воспаление. Фагоцитируя иммунные комплексы, макрофаги
и нейтрофилы вырабатывают различные биологически активные
вещества (протеолитические лизосомальные ферменты: коллагена-
зу, эластазу, катепсиньт, активатор плазминогена; метаболиты ара-
322 ■ ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ- хидоновой кислоты — простагландины, простациклин, тромбоксан,
лейкотриеиы; гистотокси ческие радикалы кислорода; компоненты
комплемента). Одновременно активируются тучные клетки, сек-
ретирующие в межклеточное пространство медиаторы воспаления
(гепарин, серотонин, ренин, триптазу и др.) [Atkins S.R. et al., 2006].
В работах последних лет показано, что ренин, вырабатываемый
тучными клетками локально в легких, способствует формированию
фиброза и бронхоконстрикции, а триптаза активирует выработку
сосудистого эндотелиального фактора роста [Masuko К. et al., 2008].
Активированные Т-лимфоциты — хелперы I типа параллельно
с активацией гуморального иммунитета индуцируют образование
цитотоксических Т-лимфоцитов, обладающих способностью напря¬
мую взаимодействовать с антигеном и аутоантигеном, участвуя
в поддержании воспаления. Итогом этого иммунного воспаления
является диссеминированный интерстициальный процесс в легких,
сходный по патогенезу, морфологии и клиническим проявлениям
с ИФА — СФА. Также могут возникнуть разнообразные поврежде¬
ния воздухопроводящих путей, сосудов, плевры.Патологическая анатомияИзменения интерстиция легких, возникающие в результате мест¬
ного аутоиммунного ревматоидного воспаления, развиваются в соот¬
ветствии с теми же закономерностями, которые характерны для
ИФА. Выделяют фазы интерстициального отека, интерстициального
воспаления (альвеолит) и интерстициального фиброза. При морфо¬
логическом исследовании на ранней стадии болезни часто выявляет¬
ся инфильтрация интерстиция легких лимфоцитами, увеличенные
перибронхиальные лимфоидные фолликулы, содержащие скопления
лимфоцитов и зародышевые центры. В мелких воздухопроводяших
путях (альвеолярных ходах, терминальных бронхиолах) и альвеолах
определяют наличие пробок грануляционной ткани в сочетании с лег¬
кой лимфоцитарной инфильтрацией хорошо сохраненных бронхио-
лярных стенок и окружающего легочного интерстиция. Также обна¬
руживается незначительная пролиферация пневмоцитов И типа.В поздней стадии интерстициальный фиброз легких при РА харак¬
теризуется утолщением альвеолярных стенок за счет клеток воспале¬
ния (мононуклеаров, гранулоцитов, плазматических клеток) и клеток
соединительнотканного матрикса в сочетании с накоплением альве¬
олярных макрофагов, пролиферацией пневмоцитов II типа и облите-
РЕВМАТОИДНЫЙ АРТРИТ • 323рацией сосудов. Изменения наиболее выражены в субплевральных и
нижнебазальных отделах легких, где при прогрессировании болезни
выявляются изменения по типу «сотового легкого» с полным нару¬
шением нормальной архитектоники легочной ткани. Изменения
неоднородны даже в пределах одного образца ткани легкого, взятого
при биопсии: участки нормальных альвеол соседствуют с участками
выраженной ремодуляции в виде рубцовых изменений. Ревматоидные
узелки легких, выявляемые в ряде случаев, гистологически идентич¬
ны ревматоидным узелкам других локализаций и представляют собой
ревматоидную гранулему, состоящую из палисадообразно располо¬
женных эпителиоидных клеток с некрозом в центре, окруженным
лимфоцитарным инфильтратом [Highton J. et al., 2007].Бронхиолит, выявляемый иногда при фиброзирующем альвеолите
у больных РА, гистологически делят на две формы: облитерирую¬
щий (констриктивный) бронхиолит и фолликулярный бронхиолит.
Обл итерирующий бронхиолит характеризуется инфильтрацией брон-
хиолярной стенки грануляционной тканью, сужением просвета и фак¬
тическим замещением бронхиол фиброзной тканью. Фолликулярный
бронхиолит проявляется внешним сдавлением бронхиол за счет
гиперпластических лимфоидных фолликул и вариабельной лимфо¬
цитарной инфильтрацией бронхиолярной стенки.Клиническая картинаКлиническая картина поражения легких ттри РА зависит от того,
какой вариант легочной патологии имеет место у конкретного больного.КлассификацияСуществует несколько видов поражения легких при РА, которые
группируют по принципу определения локализации поражения и по
гистологическим признакам. Общепринятой классификации пора¬
жений легких при РА не существует. Выделяют следующие легочные
проявления РА.• Поражение интерстиция легких.- Фиброзирующий альвеолит.- Поражения интерстиция легких, отличные от фиброзирующе-
го альвеолита.с> Легочные ревматоидные узелки,
о Амилоидоз.
324 ♦ ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... • Нспаренхиматозные поражения легких.— Бронхиолит.
оОблитерирующий бронхиолит.
о Фолликулярный бронхиолит.о Диффузный панбронхиолит.— Бронхоэктазии.— Амилоидоз трахеи и бронхов.— Поражение плевры.о Экссудативный плеврит.О Сухой плеврит.о Фиброз плевры.* Поражение сосудов легких.— Легочный васкулит.— Легочная гипертензия.— Диффузные альвеолярные геморрагии с капилляритами.■ Вторичные поражения дыхательной системы.— Оппортунистические инфекции (легочный туберкулез, ати¬
пичная микобактериальная инфекция, ноккардиоз, аспегил-
лез, цитомегаловирусный пневмонит).— Поражения легких, вызванные токсическим действием анти-
ревматических средств (метотрексат, соли золота, D-пеницил-
ламин, сульфасалазин, лсфлюномид^% нестероидные противо¬
воспалительные средства, биологические препараты).Плеврит является частым проявлением вовлечения легких в пато¬
логический процесс при РА. Плеврит, выявляемый клинически,
обычно имеет экссудативный характер, но значительное количество
жидкости накапливается редко, поэтому симптоматика чаще стерта и
плеврит обнаруживается в этом случае лишь при рентгенологическом
исследовании органов грудной клетки. Как правило, плеврит разви¬
вается в течение первых пяти лет от момента появления суставного
синдрома [Balbir-Gurman А. et al,, 2006].Высокая частота развития интерстициального поражения легких
при РА позволяет считать легочный фиброз основной проблемой
патологии легких при этом заболевании. У части больных (20%) рев¬
матоидное легкое является первым клиническим проявлением РА,
развиваясь до появления суставного синдрома. Несмотря на то что по
данным морфологических и рснтгено-компьютеро-томографических
исследований, частота встречаемости СФА достигает 67—70%, кли¬
ническая симптоматика и прогрессирование процесса определяются
менее чем у 10% пациентов. У больных постепенно нарастает одыш¬
РЕВМАТОИДНЫЙ АРТРИТ • 325ка с затруднением вдоха, которая может быть выраженной. Иногда
у падиентов появляется сухое покашливание, хотя этот симптом
описывается редко и его появление заставляет предположить разви¬
тие вторичного синдрома Шегрена. У больных с прогрессирующим
ревматоидным легким часто формируются «пальцы Гиппократа*,
развивается цианоз кожных покровов и видимых слизистых. При
аускультации легких отмечается ослабление везикулярного дыха¬
ния, на фоне которого преимущественно в нижних отделах легких,
в конце фазы вдоха выслушивается крепитация, характер которой
(нежная, грубая) зависит от степени выраженности и стадии развития
фиброзирующего альвеолита. Клиническими признаками, с которы¬
ми наиболее часто коррелирует СФА, являются одышка и синдром
Рейно. Фиброзирующий альвеолит на фоне РА чаще всего протекает
бессимптомно, благоприятно, однако в 5—10% случаев имеет яркие
проявления, выходя на первый план в клинической картине заболе¬
вания. Иногда интерстициальный фиброз предшествует развитию
суставного синдрома, а в ряде случаев носит характер быстро прогрес¬
сирующего процесса по типу синдрома Хаммена-Рича.Ревматоидные узелки легких считаются редким вариантом поражения
легких при РА. На рентгенограммах органов грудной клетки ревмато¬
идные узелки определяются менее чем у 1% больных РА. Однако на КТ
легких и при открытой биопсии легких их обнаруживают более чем у 20%
больных. Ревматоидные узелки могут быть одиночными или множес¬
твенными, диаметром от 1 до 3 см и обычно ассоциируются с высоким
титром ревматоидного фактора в сыворотке крови и ревматоидными
узелками, расположенными в других участках тела, но иногда предшес¬
твуют развитию системных проявлений болезни. Ревматоидные узелки
легких могут изменяться в размерах в зависимости от активности РА,
могут трансформироваться в полости, подвергаться распаду, вскрываясь
в дренирующий бронх или в полость плевры, вызывая развитие пнев¬
моторакса или гидроторакса, иногда являясь причиной легочных кро¬
вотечений, Описано сочетание ревматоидных узелков (одиночных или
множественных) с пневмокониозом у шахтеров, страдающих РА. В этом
случае предполагают, что ревматоидные узелки легких являются резуль¬
татом гиперчувствительной реакции на вдыхание угольной пыли, веро¬
ятно, за счет повышенной иммунологической реактивности. Эта форма
поражения легких носит название синдрома Каплана по имени автора,
описавшего его в 1953 г. fCaplan А., 1953]. Особенности рентгенологи¬
ческой картины при возникновении ревматоидных узелков приводят
к необходимости проведения дифференциальной диагностики с други-
326 ♦ ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... МИ объемными процессами в легких, в первую очередь со злокачествен¬
ными новообразованиями. Для верификации диагноза необходимо гис¬
тологическое исследование легочной ткани [Zielonka ХМ. et aL, 2005].Бронхоэктазии присущи РА и на КТ выявляются у 30% пациентов
[Cornet В., Flipo R.M. et al., 1995J.Бронхиолит является редким вариантом поражения легких при РА, но
среди всехДБСТ именно при РА бронхиолит встречается чаще. Развитию
бронхиолита может предшествовать инфекционное воспаление, под-
тверждеішое выделением патогенной бактериальной флоры из мокроты
пациентов. Предрасполагающим фактором к возникновению брон¬
хиолита считают развитие вторичного синдрома Шегрена на фоне РА,
лечение Д-пеницилламином и (реже) препаратами золота. Бронхиолит
характеризуется поражением дистальных воздухопроводящих путей
(бронхиол). Клинически проявляется стойкой одышкой с затруднением
выдоха, цианозом кожных покровов. У части бальных бронхиолит про¬
текает бессимптомно, часто сочетаясь с фиброзирующим альвеолитом.
Диагностируется бронхиолит с помощью КТ легких, на которой видна
неравномерность вентиляции с участками повышенной воздушности
легочной ткани (симптом воздушной ловушки), обеднение легочного
рисунка, эмфизема. При исследовании ФВД выявляется обструктивный
синдром в виде увеличения ООЛ, снижения показателей бронхиальной
проходимости без их улучшения после ингаляции бронхорасширяющих
средств, снижение дел, в первую очередь при устойчивом состоянии,
а в случае выраженного прогрессирования процесса — и при задержке
дыхания. Как уже упоминалось, гистологически выделяют облитери-
рующий (констриктивный) бронхиолит и фолликулярный бронхиолит.
Последний отличается тем, что он имитирует фиброзирующий альве-
олит, редко бывает клинически значимым и лучше, чем облитерирую-
ший бронхиолит, отвечает на глюкокортикоидную терапию.Легочный васкулит при РА развивается чрезвычайно редко, В основе
васкулита лежит иммунокомплексное воспаление сосудистой стенки
на уровне мелких и мельчайших сосудов. При развитии клинических
признаков формируется симптоматика легочной артериальной гипер¬
тензии.Инфекционные воспаления дыхательных путей (бронхиты, пневмо¬
нии) являются постоянными «спутниками» аутоиммунных болезней,
в лечении которых используются препараты, подавляющие естествен¬
ные иммунологические механизмы защиты от бактериальных, вирус¬
ных агентов и грибов (глюкокортикоиды и цитостатики). Чаще всего
на фоне РА возникают пневмонии, обусловленные грамотридательной
РЕВМАТОИДНЫЙ АРТРИТ * 327флорой, вирусами, грибами, В последние годы часто сообщают о раз¬
витии пневмоцистной пневмонии, туберкулеза легких, нетуберкулез¬
ной микобактериальной болезни легких. Фактором, предрасполагаю¬
щим к пневмоцистной пневмонии, является лечение малыми дозами
метотрексата [Minagawa S. et al., 2008; likuni N. et al., 2006], a фактором,
предрасполагающим к возникновению туберкулеза, — лечение анта¬
гонистами TNF-a [Bernscherer G. et al., 2008]. Пневмония является
грозным осложнением РА и может заканчиваться летально.Многие лекарственные антиревматические средства, применяе¬
мые для лечения РА, оказывают повреждающее действие на легкие.
В частности, побочные эффекты со стороны легких описаны для
метотрексата, препаратов золота, салазопроизводных (сульфасалазин,
салазоперидазин), Д-пеницилламина, лефлюномида*^, биологичес¬
ких препаратов (ингибиторов TNF, антагонистов С020-рецепторов
В-лимфоцитов), При РА наиболее часто встречаются метотрексат-
индуцированные интерстициальные пневмониты, потому что имен¬
но метотрексат широко используется в рутинной клинической прак¬
тике в качестве базисного препарата для лечения этого заболевания.
Имеются данные о встречаемости «метотрексатного легкого*> у 3—18%
пациентов (в среднем у 5% больных) [Cannon G.W., 1997; Bernscherer G.
et al., 2008]. «Метотрексатный пневмонит», потенциально опасный
для жизни, клинически проявляется кашлем, одышкой, лихорад¬
кой, распространенной крепитацией, определяемой аускультатив-
но, функциональными рестриктивными нарушениями и легочными
инфильтратами на рентгенограммах грудной клетки и КТ, которые
могут быть локальными или диффузными. Эозинофилия перифери¬
ческой крови наблюдается в половине случаев. ВЖБАЛ выявляется
лимфоцитоз, при котором повышен уровень CD4 позитивных лим¬
фоцитов и повышено соотношение CD4/CD8 (что не характерно для
других форм ревматоидного легкого). Иногда «метотрексатный пнев-
монит» развивается остро, но чаще начало бывает подострым (с нарас¬
танием симптомов болезни в течение 2 мес до постановки диагноза).
В большинстве случаев диагноз устанавливается в течение четы¬
рех месяцев от начала приема метотрексата. Гистологические при¬
знаки не помогают диагностике, хотя выраженная лимфоцитарная
инфильтрация увеличивает вероятность интоксикации метотрекса-
гом. Смертность от токсического воздействия метотрексата на легкие
составляет 15-20% [Кгетег J.M. et al., 1997]. У небольшого числа боль¬
ных развивается ограниченная форма метотрексатной интоксикации,
проявляющаяся сильным, не поддающимся лечению, кашлем. Так
328 » ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... как клинические и рентгенологические особенности метотрексат-
индуцированного легкого неспецифичны, то о таком диагнозе всегда
следует думать при лечении пациентов, получающих этот препарат
и имеющих прогрессирующее поражение легких. При малейшем
подозрении на возникновение токсического влияния метотрексата
на легкие следует немедленно прекратить прием препарата и назна¬
чить глюкокортикоидную терапию, что часто способствует быст¬
рому обратному развитию изменений в легких [Cho I. et al., 2007].
Доказанным считается факт увеличения риска развития злокачест¬
венных новообразований, в том числе рака легкого, на фоне примене¬
ния метотрексата у больных РА f Buchbinder R. et al., 2008; Smitten A.L.
et al.,2008].Поражение легких, обусловленное применением препаратов золота,
встречается редко. Клинически «золотое легкое» чаще всего протекает
в виде альвеолита. У больных появляется лихорадка, кашель непродук¬
тивный или с небольшим количеством слизистой мокроты, прогресси¬
рующая инспираторная одышка, при аускультации в легких выслуши¬
вается крепитация. Одновременно с изменениями в легких развивается
дерматит. В сыворотке крови выявляется эозинофилия, низкий уровень
ревматоидного фактора. Рентгенологически определяются затенения
в области альвеол, прилегающих к бронховаскулярным пучкам, которые
лучше всего выявляются на КТ высокой степени разрешения. В ЖБАЛ —
лимфоцитоз. Легочные осложнения терапии препаратами золота могут
развиться через 7—30 дней от начала лечения, но чаше всего появляются
на 2—4-м месяце использования препарата. В России препараты золота
в последнее десятилетие применяются редко.Д-пеницилламин, используемый для лечения РА, является при¬
чиной развития облитерируюшего бронхиолита, альвеолита или,
крайне редко, легочно-почечного синдрома (синдром Гудпасчера).
Обычно токсические эффекты препарата проявляются в течение 6 мес
от начала терапии.Лефлуномид'"'— ингибитор дегидрооротатдегидрогеназы — ключе¬
вого фермента синтеза пиримидина в активированных лимфоцитах —
относительно новый базисный препарат, используемый для лечения
РА в течение последних 10 лет. Его негативное воздействие на легкие
проявляется редко. Описано развитие диффузного альвеолярного
кровотечения [Carloni А, et al., 2008], альвеолита [OtsukaT. et aL, 2008;
Ju J-H. et al., 2007; Ochi S. et al., 20061, вторичного легочного протеиноза
[Wardwell N.R.Jr. et al., 2006], ревматоидных узелков в легких, гипер¬
трофической легочной остеопатии [RozinA. et al., 2006].
РЕВМАТОИДНЫЙ АРТРИТ • 329Биологические препараты, позволяющие достичь значительного
улучшения состояния больных РА, а в ряде случаев добиться клини¬
ческой ремиссии, также способны оказывать токсическое воздействие
на легкие. Известны легочные осложнения при применении ингибито¬
ров TNF-a (инфликсимаб, адалимумаб, этанерсепт^). Эти препараты
могут способствовать возникновению быстро прогрессирующего фиб-
розирующего альвеолита, отека легких, а также развитию вторичных
инфекционных поражений: туберкулеза, бактериальной пневмонии,
пневмоцистной пневмонии, бронхита, бронхоэктазий, кокцидиоми¬
коза [Bernscherer G. et al., 2008; Dweik М. et al., 2008; Imaizumi K. et al.,
2006]. СФА, развивающийся на фоне лечения ингибиторами TNF-a,
имеет плохой прогноз, даже при отмене препарата, что усугубляет¬
ся сопутствующим действием метотрексата, который, как правило,
используют в качестве базисного средства для лечения РА в сочетании
с биологическими агентами [Ramos-Casals М. et al, 2007].Применение моноклональных антител к СD20-рецепторам В-лим-
фоцитов (ритуксимаб) значительно реже оказывает побочное дей¬
ствие на легкие, но и на его фоне возможно развитие альвеолярного
кровоизлияния, инфильтратов в легоч ной ткани, что гистологически
проявляется формированием организующейся пневмонии [Soubrier М.
et ai., 2008].ДиагностикаУстановление вовлечения легких в патологический процесс в рам¬
ках РА не всегда является простой задачей, так как часто поражение
легких протекает бессимптомно. В настоящее время наиболее инфор¬
мативными методами исследования, позволяющими подтвердить
патологию легких на фоне РА, признаны КТ легких, исследование
ФВД с определением дел и гистологическое исследование ЖБАЛ
либо образца ткани легкого, полученного методом видеоторакоско¬
пии или открытой биопсии легкого.Лабораторные методы исследования. Специфических лабораторных
тестов, характерных только для поражения легких на фоне РА, нет.
Все общеклинические лабораторные показатели выявляют наличие
воспалительного процесса и степень его активности. Отмечается
увеличение СОЭ, снижение гемоглобина и эритроцитов, лейкоци¬
тоз, палочкоядерный сдвиг влево. Также изменены биохимические
показатели: диспротеинемия за счет гипергаммаглобулинемии, повы¬
шение трансаминаз. Всегда имеются иммунологические измене¬
330 » ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ...ния. в сыворотке крови выявляются повышенные титры IgG и IgM.
в высоких титрах вырабатывается ревматоидный фактор. В низких
титрах может выявляться антинуклеарный фактор. Возможно обна¬
ружение антител к фосфолипидам.Лучевые методы исследования. На рентгенограммах органов груд¬
ной клетки при СФА, сочетающемся с РА, выявляются признаки,
характерные для ИФА: усиление легочного рисунка за счет интерсти¬
циального компонента преимущественно в нижних отделах легочных
полей. Возможно выявление двусторонних мелкоочаговых инфиль-
тративных затенений, чередующихся с симптомом «матового стекла».
При прогрессировании болезни уменьшается объем нижних долей
легких, перестройка легочного рисунка приобретает характер крупно¬
ячеистой деформации, что знаменует собой формирование «сотового
легкого». Иногда симметричные интерстициально-инфильтративные
изменения локализуются в верхних долях легких, симулируя измене¬
ния, характерные для анкилозирующего спондилоартрита. Однако у
части больных традиционная рентгенография органов грудной клет¬
ки бывает малоинформативной (не имеет признаков патологии), в то
время как одновременное исследование с помощью ВРКТ позволяет
выявить признаки поражения интерстиция легких [Удельнова И.А.
и соавт., 2006; Zrour S.H. et al., 2005]. Эта ситуация характерна для
начальной стадии развития СФА.КТ-признаки СФА при РА идентичны таковым при ИФА. Наличие
симптома «матового стекла» свидетельствует о большой вероятности
воспалительных изменений. На поздних стадиях болезни выявляет¬
ся перестройка легочного интерстиция по типу «сотового легкого».
Первоначально изменения локализуются в субплевральной области
и заднебазальных отделах легких, которые постепенно распростра¬
няются в направлении верхних, передних и центральных отделов
легких.Исследование ФВД. Нарушение ФВД при СФА на фоне РА наибо¬
лее часто характеризуется изолированным снижением ДСЛ в устой¬
чивом состоянии, отражая субклиническое вовлечение интерстиция
легких в патологический процесс. При развитии явного фиброза лег¬
ких развиваются рестриктивные вентиляционные нарушения, харак¬
теризующиеся снижением спирометрических и плетизмографичес-
ких объемов (ЖЕЛ, ОЕЛ), снижением растяжимости и повышением
ригидности легочной ткани, снижением ДСЛ. Изменение функцио¬
нальных легочных показателей хорошо коррелирует с изменениями,
выявляемыми на КТ fPejcic Т. et al., 2005]. Уровень РаО^ снижается
РЕВМАТОИДНЫЙ АРТРИТ • 331При нормальном или сниженном уровне PaCOj, но гипоксемия все же
выявляется редко.Исследование легочно-сердечной гемодинамики проводят с помо¬
щью эхокардиографии с допплеровским анализом. Этот метод позво¬
ляет подтвердить наличие легочной гипертензии, выявить дилатацию
и гипертрофию правого желудочка.Эндоскопические и хирургические методы диагностики использу¬
ются с целью получения материала для последующего морфологи¬
ческого исследования. Фибробронхосколия позволяет получить жид¬
кость БАЛ и выполнить ЧББ. Если результаты исследования такого
биоптата малоинформативны» прибегают к видеоторакоскопии или
открытой биопсии легких.Морфологические методы исследования. У больных с признаками
фиброзирующего альвеолита в ЖВАЛ определяется увеличение числа
клеток, изменение их соотношения; увеличение числа нейтрофи-
лов и лимфоцитов, иногда — появление эозинофилов. Отмечается
уменьшение соотношения CD4/CD8. В ряде случаев упомянутые
изменения ЖБАЛ обнаруживаются у пациентов без КТ-признаков
фиброзирующего альвеолита, но с наличием измененных показателей
ФВД. В случае присоединения бактериального воспаления в ЖБАЛ
выявляется патогенная микрофлора.Формулировка диагнозаВ диагнозе должно быть отражено: название болезни — РА, наличие
или отсутствие ревматоидного фактора, антител к циклическому цит-
руллиновому пептиду, клиническая стадия, степень активности рев¬
матоидного воспаления, внесуставные признаки, рентгенологическая
стадия поражения суставов, функциональный класс, осложнения.Примеры клинических диагнозов.• РА, серопозитивный, развернутая клиническая стадия, III степень
активности с системными проявлениями (лимфаденопатия, лихо¬
радка, снижение массы тела, ревматоидные узелки, поражение
легких — СФА), 111 рентгенологическая стадия, функциональ¬
ный класс ПТ. Осложнения: медикаментозный синдром Кушинга.
Системный остеопороз смешанного генеза. ДН II степени,• РА, серопозитивный, поздняя клиническая стадия, И степень
активности с системными проявлениями (амиотрофии, полиней¬
ропатия, ревматоидные узелки, поражение легких — бронхоэкта¬
зии нижней доли левого легкого, левосторонний сухой плеврит).
332 » ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... IV рентгенологическая стадия, Анти-ЦЦП-положительиый, фун¬
кциональный класс ЇІІ.Дифференциальная диагностикаДифференциальная диагностика СФА при РА проводится с други¬
ми вариантами поражения легких на фоне РА (облитерирующий брон-
хиолит, броихоэктазии, ревматоидные узелки в легких, хотя возможно
сочетание этих состояний): бактериальной пневмонией, токсическим
поражением легких лекарственными препаратами, применяемыми
для лечения РА; поражением легких в рамках лимфопролиферативных
заболеваний, всем спектром диссеминированных процессов легких,
солидными опухолями, изменениями легких при прогрессирующей
недостаточности кровообращения с венозным застоем в малом круге
кровообращения. Следует помнить, что РА может дебютировать СФА.
Пациент первоначально наблюдается с диагнозом ИФА. Отсутствие
эффекта от применения глюкокортикоидов в этой ситуации требует
проведения морфологического исследования ткани легкого, иногда
повторного, для верификации диагноза и назначения цитостати-
ческой терапии [Mori S. et al., 2008]. Исследования последних лет
позволяют использовать для дифференциальной диагностики между
ИФА и симптоматическим фиброзирующим альвеолитом некоторые
маркеры иммунного воспаления и уровень сывороточного белка KL-6
(Krebs von den Lungen-6), являющегося индикатором интерстициаль¬
ного легочного повреждения. Так, при ИФА развивается воспаление
преимущественно ТК2-типа, а при симптоматическом фиброзирую-
щем альвеолите — ТЫ-типа. Соответственно баланс CD4(+)/CD8(+)
при ИФА ниже, чем при фиброзе интерстиция легких на фоне РА.
Уровень сывороточного белка KL-6 повышен при повреждении легоч¬
ного интерстиция любого генеза [Shimizu Y. et al, 2006; Turesson С.
et al., 2005J. Течение фиброзирующего альвеолита на фоне РА отлича¬
ется меньшей агрессивностью по сравнению с ИФА. ДН редко бывает
причиной летального исхода при РА, в то время как пациенты ИФА
чаще погибают от прогрессирующей ДН, обусловленной резким сни¬
жением дел и нарастающей гипоксемией [Rajasekaran А. et al., 20061.ЛечениеЛечение поражений легких при РА остается до настоящего времени
трудной проблемой, в связи с тем что в большинстве случаев пато¬
РЕВМАТОИДНЫЙ АРТРИТ • 333логический процесс в легких чаще всего протекает субклинически,
прогрессирует медленно или на протяжении многих лет остается
стабильным, рекомендуется динамическое наблюдение за больными.
Выжидательная тактика оправдана тем, что рано начатое агрессивное
лечение может увеличить риск побочных эффектов. Терапия назна¬
чается в случае ухудшения состояния пациентов. Аутоиммунный
генез РА подразумевает аутоиммунный механизм поражения легких в
рамках РА. Поэтому лечение проводится с учетом ведуших патогене¬
тических механизмов развития заболевания. Назначают комбинацию
циклофосфамида (2 мг на 1 кг массы тела в сутки до максимальной
дозы 150 мг в сутки) с преднизолоном (20 мг в сутки в альтернатив¬
ные дни). Возможна комбинация преднизолона с азатиоприном или
пеницилламином. В последние годы для лечения РА применяют цик¬
лоспорин А (сандиммун) в суточной дозе 2,5—3,0мг/кг массы тела.
Появились сообщения об успешном использовании микофенолата
мофетила в качестве базисного (болезнь-модифицирующего) средс¬
тва, обладающего антифиброзной активностью при РА, протекающем
с поражением легочного интерстиция [Sakctkoo.L.A, Espinoza L.R.,
2008].Наличие бронхиолита требует назначения бронхолитических
средств в сочетании с ингаляционными глюкокортикоидами в боль¬
ших дозах, доставляемых через небулайзер. Оппортунистические
инфекции поддаются лечению соответствующими (в зависимости от
этиологического агента) противомикробными, притивомикотичес-
кими, противовирусными средствами.при выявлении изменений в легких, обусловленных действием
антиревматических средств» терапию токсичным препаратом следует
отменить и назначить глюкокортикоиды. Целесообразно включение в
комплекс лечения методов эфферентной терапии (плазмаферез).ПрогнозПоражение легких редко является ведущим симптомом, ограни¬
чивающим трудоспособность пациентов, страдающих РА. Наиболее
неблагоприятные варианты легочной патологии — быстро прогрес¬
сирующий альвеолит по типу синдрома Хаммена—Рича, инфекцион¬
ные осложнения, токсическое поражение легких антиревматически-
ми лекарственными средствами. Эти состояния ухудшают прогноз,
который в целом зависит от своевременности установления диагноза,
активности ревматоидного воспаления в целом и адекватности про-
334 * ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ- ВОДИМОЙ терапии. По последним данным предиктором смерти при
РА является высокий уровень растворимого рецептора к TNF. Смерть
чаще всего связана с патологией сердечно-сосудистой системы [Mori S.
et al., 2007; Maradit-Kremers Н. et al., 2005),профилактикаПервичная профилактика поражений легких при РА не разработана.
Для своевременного выявления вовлечения лег ких в патологический
процесс целесообразно включать рентгенологическое и функцио¬
нальное исследование легких в комплекс обследования больных РА,
даже в случае отсутствия клинических проявлений болезни со сторо¬
ны дыхательной системы.СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКАСистемна красная волчанка (СКВ) — системное аутоиммунное забо¬
левание неизвестной этиологии, характеризующееся гиперпродукцией
органонеспецифических аутоантител к различным компонентам кле¬
точного ядра с развитием иммуновоспалительного повреждения тканей
и внутренних органов. Распространенность СКВ составляет от 4 до
250 случаев на 100 ООО населения, а первичная заболеваемость составля¬
ет 50-70 новых случаев на 1 млн населения в год [Клюквина Н.Г., 2008].
СКВ — болезнь молодых женщин, так как более 70% заболевших состав¬
ляют женщины детородного возраста (от 15 до 40 лет). Однако заболеть
СКВ мої’ут дети и люди пожилого возраста. Описан случай тяжелой
СКВ (геморрагические альвеолярные кровоизлияния и гломеруло¬
нефрит) у младенца мужского пола в возрасте 1 мес. Диагноз подтверж¬
ден гистологическими и иммунологическими методами [Kreindler J.
et а!., 2005]. Соотношение мужчин и женщин составляет 1:8—1:10,При СКВ могут поражаться практически все органы и системы
организма с общими проявлениями, выраженность которых зависит
от степени активности аутоиммунного процесса. Для СКВ характер¬
ны общая слабость, лихорадка, потеря массы тела, поражение кожи,
суставов и околосуставных мягких тканей, сердца и сосудов, желудоч¬
но-кишечного тракта, почек, нервной системы, легких.Все компоненты респираторной системы могут вовлекаться в патоло¬
гический процесс при СКВ. Поражаются верхние и нижние дыхатель¬
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА • 335ные пути, легочная паренхима, сосуды легких, плевра и дыхательные
мышцы. Каждая локализация волчаночного процесса обеспечивает раз¬
витие определенного клинического синдрома [Swigris J.J. et al., 2008;
Memet В., Ginzler E.M., 2007]. В целом в процессе прогрессирования
болезни легочные проявления СКВ выявляются более чем у половины
пациентов. Клинические признаки вовлечения легких в патологический
процесс встречаются у 23,7% пациентов, изменения на обычных рентге¬
нограммах выявляются в 18,4% случаев, ВРКТ легких позволяет отметить
отклонения от нормы у 55,3% больных, нарушение ФВД определяется
в 28,9% случаев (Kakati S. et al„ 2007]. Однако частота встречаемости
различных форм респираторной патологии зависит не только от вида
поражения, но и диагностических методов, используемых для ее выяв¬
ления. Плевральный выпот обычно является проявлением волчаноч-
ного полисерозита и встречается у 50—80% больных СКВ [Good J.T. Jr.
et al., 1983], острый волчаночный пневмонит диагностируется в 1-4%
случаев СКВ. Альвеолярные кровоизлияния наблюдаются примерно
у 2% больных, но среди госпитализированных по поводу СКВ этот
вариант легочных проявлений болезни выявляется в 22% случаев
[Zamora M.R. et al, 1997; Shen М, et al. 2005; Cacas C. et al, 2007].
Диффузное интерстициальное поражение легких (легочный фиброз)
при СКВ выявляется с помощью обычного рентгенологического иссле¬
дования менее чем в 5% случаев, как в дебюте, так и в процессе про¬
грессирования заболевания. Однако изменения на КТ, сравнимые
с диффузным фиброзом легких, встречаются в 35% случаев СКВ [Yeh Т.Т.
et al., 2007]. По данным биопсии легких и аутопсийных исследова¬
ний, диффузное поражение интерстиция легких выявляют в 33 и 50%
[Ion D.A. et al, 2006]. Легочная гипертензия, по данным эхокардиогра-
фии, определяется у 10—14% пациентов, а по результатам катетериза¬
ции правых отделов сердца повышение давления в легочной артерии
определяется в 5% случаев. Дисфункция дыхательных мышц в виде их
слабости, преимущественно со стороны диафрагмы встречается при
СКВ почти в половине случаев (40-43%), по данным S.A. Evans и соавт.
[1992]. Поражение верхних дыхательных путей не характерно для СКВ,
хотя отдельные случаи описаны [Martin L. et al., 1992]. Вовлечение в
патологический процесс нижних дыхательных путей при СКВ про¬
является нарушением бронхиальной проходимости по тесту Тиффно
(отношение ОФВ,/ФЖЕЛ) у 10% больных, причем на частоту выявле¬
ния этого нарушения не влияет факт курения. Чистый обструктивный
синдром при СКВ встречается крайне редко. Чаще наблюдается сме¬
шанный вариант нарушений ФВД в виде необратимого или частично
336 » ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... обратимого нарушения бронхиальной проходимости, снижения ЖЕЛ
и дел. Инфекционные осложнения — наиболее частая форма пораже¬
ния легких при СКВ. Легочные инфекции являются причиной смерти
50-76% больных СКВ [РоЫ М.А. et aL, 1991].Лекарственная волчанка встречается в 10 раз реже, чем СКВ. По
данным R.L. Yung, B.C. Richardson [1994], среди пациентов СКВ от 5 до
10% случаев болезнь индуцируется приемом лекарственных препара¬
тов. Эти же авторы отмечают, что при лекарственной волчанке легкие
вовлекаются в патологический процесс у 25-40% больных, причем
чаще всего развивается плеврит и интерстициальный пневмонит.Этиология и факторы рискаЭтиология СКВ до настоящего времени остается неизвестной.
К факторам, способствующим развитию заболевания, относятся:
нерсистенция вирусной инфекции в организме человека (ретро-
вирусы, вирус Эпштейна—Барр, цитомегаловирус и др.); уровень
женских половых гормонов (для женщин— гиперэстрогения, для
мужчин — относительная гиперэстрогения за счет снижения уровня
тестостерона); принадлежность к негроидной рассе (болеют чаще, чем
европейцы), факторы окружающей среды (ультрафиолетовое излу¬
чение солнца, бактериальная инфекция, прием некоторых лекарс¬
твенных препаратов, психоэмоциональный стресс); генетическая
предрасположенность. При СКВ чаще встречаются HLA-A1, В8, DR2,
DR3. Часть этих антигенов (DR2, DR3) ответственны за некоторые
иммунные функции. Кроме того, у больных СКВ определяется гене¬
тически обусловленный дефицит комплемента и его компонентов,
особенно Cj, С^, С^Факторы риска развития большинства легочных проявлений СКВ
не описаны. Поздний дебют СКВ (в возрасте 50—65 лет) ассоциирует¬
ся с более частым развитием серозита (в том числе плеврита) и пораже¬
нием интерстиция легких [Rovensky J., Tuchynova А., 2008]. У больных
с выраженным синдромом Рейно определяется явная или субклини-
ческая легочная гипертензия, а у больных с СКВ-связанной легочной
гипертензией синдром Рейно встречается в 75% случаев. Кроме того,
выявлена тесная связь между легочной гипертензией и наличием анти-
фосфолипидных антител у больных СКВ. Возникновению легочной
гипертензии также способствуют развитие плеврита, перикардита,
поражение интерстиция легких, ТЭЛА, легочный васкулит [Pope J.,
2008]. Причиной инфекционных поражений легких могут быть как
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА • 337«обычные^ микроорганизмы, так и оппортунистические инфекции
{Pneumocystis earini. Aspergillosis, Nocardiosis, Cryptococcosis, Cytomegalovirus,
Virus Herpes и др.). Более чем в 5% случаев СКВ у больных развивается
туберкулез. Авторы одного из исследований, оценивавших факторы
риска инфекционных осложнений при СКВ, пришли к выводу, что
инфекционные осложнения в большей степени связаны с поражением
органа, чем с иммуносупрессивной терапией [Jallouli М. et al., 2008j.К этиологическим факторам лекарственной волчанки относяі' сле-
дуюш,ие лекарственные средства: гидралазин, метилдопа, прокаина-
мид, дифенин, гидантоин, изониазид, хлорпромазин, метилтиоураиил,
хлорталидон, диуретин*, D-пеницилламин, сульфаниламиды, пени¬
циллин, тетрациклин, оральные контрацептивы, билитраст, миноцик-
лин*, ловастатин, ИФН, рекомбинантные биологические препараты
(ингибиторы TNF-a — инфликсимаб, этанерсепт^’) [Иванова М.М,
2004; Diri Е. et al., 2007; Ramos-Casals М. et al., 2007]. Наиболее часто
лекарственная волчанка развивается под влиянием гидралазина и про-
каинамида. Развитию лекарственной волчанки способствует генети¬
чески обусловленный характер метаболизма лекарственных препаратов
в печени в виде медленного их ацетилироваыия,ПатогенезПатогенез СКВ связан с неконтролируемой выработкой большого
количества разнообразных аутоантител и образованием ЦИК или
иммунных комплексов на месте {in situ), приводяш;их к поражению
сосудов и тканей различных органов и систем, включая легкие. При
СКВ вырабатываются аутоантитела к 40 и более чем 2000 потенциально
аутоантигенных клеточных компонентов. Наиболее важными аутоан¬
тигенами являются ядерные ДНК и поливалентные внутриклеточные
нуклеопротеиновые комплексы (нуклеосома, рибонуклеопротеины и
др.) [Клюквина И.Г., 2008]. В возникновении и поддержании аутоим¬
мунного воспаления при СКВ участвует большое количество провос-
палительных цитокинов (ИЛ-1, ИЛ2, ИЛ-8, TNF-a, TGF-p, ИФН-а,
ИФН-у и др.), молекулы адгезии (клеточные — VCAM-1, внутриклеточ¬
ные — ICAM-1, Е — селектин). Дополнительным фактором, способству¬
ющим повреждению эндотелия сосудов при СКВ, являются антиэндо¬
тел иа л ьные антитела, которые также участвуют в патогенезе васкулита
ICieslik Р. et al, 2008]. СКВ — это системный иммунокомплексный вас-
кулит, максимально выраженный в тех сосудах, где имеется макси¬
мальная экспрессия молекул адгезии на поверхности эндотелиоцитов.
338 » ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... Оценка патогенетических механизмов, предопределяющих вовлечение
легких в патологический процесс, позволила выявить более высо¬
кий уровень провоспалительных цитокинов (ИЛ-8, ИФН-у, ИФН-а)
и более высокий уровень отношения провоспалительных цитокинов
к противовоспалительным у пациентов с поражением легких, чем
у пациентов без легочных проявлений СКВ [Al-Mutairi S. et al., 2007],Патологическая анатомияПатоморфологические изменения органов дыхания при СКВ зави¬
сят от того, образец какой ткани взят для исследования, и от характера
патологического процесса.Морфологическое исследование плевры у больных СКВ позволяет
выявить ее инфильтрацию лимфоцитами и плазматическими клетка¬
ми (иногда в форме герминальных фолликулов), сопровождающуюся
утолщением и фиброзом. Иногда встречаются гематоксилиновые
тельца. С помощью иммунофлюоресцентного окрашивания в плевре
можно выявить депозиты, содержащие иммуноглобулины и компле¬
мент. Васкулиты плевры встречаются редко.Острый волчаночный пневмонит не имеет специфических мор¬
фологических признаков, в стенках альвеол развивается воспаление
(альвеолит) и некроз, выявляется альвеолярные кровоизлияния,
отек, гиалиновые мембраны, интерстициальный пневмонит и капил¬
лярные тромбозы. Непостоянно присутствуют депозиты иммуногло¬
булинов и комплемента. Описан бронхоцентрический гранулематоз
[Chaiamnuay S. et al., 2007].Гистологические изменения при альвеолярном кровон:?лиянии
включают: инфильтрацию интерстиция легких нейтрофилами и лим¬
фоцитами, гиалиновые мембраны, альвеолярные некрозы, отек, тром¬
бозы сосудов микроциркуляторного русла, альвеолярные макрофаги,
нагруженные гемосидерином, пролиферацию интимы сосудов и орга¬
низованные внутристеночные тромбы. Наблюдаются диффузные аль¬
веолярные повреждения и возможно присутствие признаков инфек¬
ции. Кроме того, описаны изменения, характеризующие воспаление
мелких легочных артериол (микроангииты) и частично капилляров
(капилляриты). Капилляриты встречаются в большинстве (до 80%)
случаев морфологических исследований [Zamora IVI, R. et a.i., 1997].]У1орфологические изменения при хроническом интерстициальном
пневмоните заключаются в лимфоцитарной инфильтрации интерсти¬
ция легких, интерстициальном фиброзе, гиперплазии пневмоцитов
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА • 339II типа, утолщении мышечного слоя легочных артерий без призна¬
ков васкулита и «сотового легкого», характерных для конечной ста¬
дии легочного фиброза. Иммунологические исследования позволяют
выявить наличие депозитов иммуноглобулинов и комплемента в аль¬
веолярных перегородках [Weinrib L. et aL, 1990].СКВ-ассоциированная легочная гипертензия не имеет отчетливых
гистопатологических признаков. Морфологические признаки вклю¬
чают: гипертрофию медии, пролиферацию интимы, фиброз адвен-
тиции, повреждение эластической пластины, а иногда тромбоз in
situ. Легочные васкулиты встречаются редко и сопровождаются более
типичными изменениями сосудов [Roncoroni AJ. et al., 1992J.Причина слабости дыхательных мышц у больных СКВ остается
неясной. У большинства пациентов отсутствуют гистологические
признаки миозита или васкулита. Иногда при биопсии дыхательных
мышц выявляют признаки лимфоцитарного васкулита, а также про¬
бки грануляционной ткани, заполняющие просветы дыхательных
путей респираторной зоны, скопление внутриальвеолярных макро¬
фагов и лимфоцитарно-макрофагальную инфильтрацию сохранен¬
ных стенок бронхиол и окружающего интерстиция легких [Mana F.
et al., 1993; Carvalho L., Freitas S., 2007].Клиническая картинаВолчаночный плеврит сопровождается жалобами на боль в грудной
клетке, кашель, одышку, лихорадку. Плеврит обычно носит двусто¬
ронний характер, но может быть и односторонним. Жидкость в плев¬
ральной полости обычно накапливается в небольшом или умеренном
количестве, но иногда плеврит может быть массивным, трудно подда¬
ющимся терапии. Плеврит, как правило, возникает у пациентов с уже
установленным диагнозом СКВ: а также он может быть первым прояв¬
лением заболевания, поэтому об СКВ нужно думать всегда в случаях
возникновения плеврита неясного генсза. В свою очередь, причиной
плеврального выпота при СКВ могут быть и инфекционное воспале¬
ние, недостаточность кровообращения или почечная недостаточность.
Это обусловливает необходимость проведения диагностической плев¬
ральной пункции с исследованием полученного плеврального содер¬
жимого. Иногда спонтанно может развиться гемоторакс.Острый волчаночный пневмонит — очень тяжелая форма поражения
легких при СКВ. Этот вариант легочного поражения развивается чаще
всего на фоне генерализации болезни, но иногда СКВ дебютирует
340 * ГЛАВА 5- ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... острым волчаночным пневмонитом. Обычными признаками острого
волчаночного пневмонита являются одышка, сухой кашель, лихо¬
радка» иногда сопровождающиеся кровохарканьем, возможны боли в
грудной клетке [Chaiamnuay S. et al., 2007]. Обычно развивается тяже¬
лая ДН. Смертность при остром волчаночном пневмоните составляет
более 50% [Orens J.B. et al., 1994]. Клинико-рентгенологические при¬
знаки острого волчаночного пневмонита неспецифичны, поэтому
их наличие всегда требует исключения других причин, вызывающих
острый патологический процесс в легких. В первую очередь проводят
дифференциальную диагностику с респираторными инфекциями и
альвеолярным кровотечением.Альвеолярные кровоизлияния являются редким опасным для жиз¬
ни, проявлением СКВ, Альвеолярные кровоизлияния отличаюся
скоротечностью и могут быть причиной смертельного исхода. Такие
кровоизлияния впервые были описаны Ослером [Osier W.O., 1885J, а
затем подробно изучены на аутопсийном материале пациентов, умер¬
ших от СКВ [Purnell D.C., 1955]. Спектр клинических проявлений
альвеолярного кровоизлияния включает в себя редкие умеренные по
интенсивности хронические формы и острые массивные опасные для
жизни кровотечения. Альвеолярные кровоизлияния развиваются,
как правило, через 31—35 мес от начала болезни, но могут быть первым
признаком СКВ [Cacas С. et. al., 2007]. Больных беспокоят выраженная
одышка и кашель, у 26% пациентов возникает лихорадка выше 38 °С.
Кровохарканье часто сопровождает данный тип кровоизлияний,
однако его может не быть, что не исключает наличия альвеолярных
геморрагий. Альвеолярные кровоизлияния сопровождаются разви¬
тием тяжелой гипоксемии, требующей более чем у половины боль¬
ных проведения ИБЛ. в большинстве случаев СКВ с альвеолярным
кровоизлиянием обнаруживаются признаки внутригоспитальной
инфекции (78%) fRojas-Serrano J. et al., 2008], развивается волчаноч-
ный нефрит (от 60 до 93%) и выявляются АНЦА [Yu YW, et al, 2006].
Смертность при данной патологии высока и составляет от 50 до 90%
[Zamora M.R. et al, 1997; Schwab E.R et al, 1993; Shen M. et aL, 2005].
Увеличению летальности способствуют такие факторы, как низкий
уровень гемоглобина [Tseng J.R. et al., 2006], использование ИВЛ, раз¬
витие инфекции и применение циклофосфамида в лечении пациен¬
тов до развития альвеолярного кровоизлияния.Хронический интерстициальный пневмонит выявляется почти
у четверти больных СКВ. Такой пневмонит развивается у лиц
с 10—12-летней длительностью СКВ в возрасте после 40 лет
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА • 341(45—49 лет), иногда имеющих в анамнезе острый волчаночный пнев-
монит. Клинически хронический интерстициальный пневмонит про¬
является одышкой, упорным кашлем со скудной мокротой или сухим
и симптомами плеврита. Аускультативно в легких могут выслуши¬
ваться сухие и мелкопузырчатые влажные хрипы или крепитация.
Легочные симптомы развиваются постепенно в течение недель и
месяцев, у некоторых пациентов возникает цианоз и формируются
«пальцы Гиппократа». У всех пациентов имеются полисистемные
проявления СКВ: синдром Рейно, поражение кожи, центральной
нервной системы и другие синдромы, характерные для пациентов
без поражения легких. С целью выявления активного воспаления в
легочной ткани наиболее информативными методами в настоящее
время считаются ВРКТ и исследование ЖБАЛ, которые позволяют
подтвердить диагноз. В ряде случаев только биопсия легочной ткани
способна верифицировать диагноз.Симптомы вторичной легочной гипертензии у пациентов СКВ не отли¬
чаются от проявлений первичной легочной гипертензии. Для паци¬
ентов характерна быстрая утомляемость, прогрессирующая одышка,
непереносимость физической нагрузки, признаки перегрузки правых
отделов сердца [Duman D. et al., 2008) с дальнейшим формированием
легочного сердца. Легочный васкулит в большинстве случаев легочной
гипертензии при СКВ отсутствует, однако у небольшого числа пациен¬
тов он может быть причиной повышения давления в легочной артерии.
В таких случаях на фоне проведения иммуносупрессивной терапии
отмечается снижение давления в легочной артерии. Иногда легочная
гипертензия развивается вторично на фоне имеющегося хронического
интерстициального пневмонита. Легочная гипертензия может (очень
редко) приводить к хронической тромбоэмболии мелких ветвей легоч¬
ной артерии [Groen R. et al., 1993]. Для исключения ТЭЛА выполняют
КТ-ангиографию и сцинтиграфию легких.Острая обратимая гипоксемия вызывает появление жалоб на боль
в грудной клетке плеврального характера, одышку и нечетко опреде¬
ляемое чувство дискомфорта в грудной клетке. Рентгенологических
признаков поражения легких у этой группы пациентов не определя¬
ется. На фоне глюкокортикоидной терапии значительно улучшаются
показатели ФВД, снижается альвеолярно-артериальный градиент и
уровни продуктов деградации комплемента.Поражение дыхательных мышц («синдром усадки легкого»^) — ред¬
кий вариант легочных проявлений СКВ [Vilaplana-GarcHa R. et al., 2008;
Oud К.Т. et al., 2005], и диагностировать этот синдром бывает сложно
342 > ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... [Bied В. et al., 2006J. Его надо подозревать у пациентов с жалобами
на одышку, усиливающуюся в положении ортопное (сидя), без при¬
знаков поражения интерстиция легких, плевры и легочных сосудов.
Именно этот клинический признак (усиление одышки в положении
сидя) отличает поражение диафрагмы от волчаночного хронического
интерстициального пневмонита, для которого не характерна зависи¬
мость выраженности одышки от положения тела. Усиление одышки
в положении ортопноэ объясняют тем, что роль диафрагмы в дыха¬
тельных экскурсиях в положении сидя увеличивается [Alberto C.J. et
а1., 2006]. «Синдром усадки легкого» обычно сочетается с поражением
диафрагмального нерва, обусловливающего паралич диафрагмы, и не
сопровождается генерализованной слабостью мышц.Поражение дыхательных путей. Изменения верхних дыхательных
путей при СКВ могут проявляться гюдглоточными изъязвлениями,
воспалением гортани, надглоточных хрящей, субглоточным стенозом,
параличом голосовых связок. Они часто возникают у пациентов после
интубации, но иногда волчаночные изменения верхних дыхательных
путей требуют интубации. Подозревать патологию верхних дыхатель¬
ных путей следует в случаях выраженной одышки без рентгенологи¬
ческих признаков поражения легочной ткани непосредственно после
экстубации или у пациентов активной СКВ, требующих проведения
эндотрахеальной интубации. Вовлечение в патологический процесс
нижних дыхательных путей при СКВ обычно обусловлено развитием
облитерирующего бронхиолита, который клинически проявляется
выраженной одышкой, сухим кашлем, крепитацией над легочными
полями, лихорадкой. Для диагностики большое значение играет
выполнение ВРКТ с проведением функциональных проб, исследова¬
ние ФВД, включая пробу с бронхолитиком. В трудных случаях диа¬
гноз устанавливается с помощью биопсии легких.Инфекционные осложнения очень характерны для СКВ, чему спо¬
собствует дисфункция иммунной системы и цитотоксическая тера¬
пия в предшествующие 3 мес. Клинически инфекционные пораже¬
ния легких проявляются синдромом пневмонии: лихорадка, кашель с
мокротой, боль в грудной клетке со стороны поражения, одышка. Для
подтверждения инфекционного генеза легочных изменений рекомен¬
дуется выполнение диагностической фибробронхоскопии с получе¬
нием для исследования ЖВАЛ. В связи с высоким риском развития
инфекционных осложнений при СКВ о них всегда следует думать при
появлении признаков поражения легких у таких пациентов до тех пор,
пока инфекция не будет исключена.
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА • 343Поражения легких, индуцированные лекарственными средствами.Токсические воздействия на легкие препаратов, используемых для
лечения СКВ, встречаются редко. Описаны случаи интерстициаль¬
ных легочных изменений, сходных по клинико-рентгенологическим
проявлениям с ИФА, на фоне применения азатиоприна, лефлуноми-
да, циклофосфамида и метотрексата. Хроническая эозинофильная
пневмония может быть индуцирована приемом нестероидных проти¬
вовоспалительных средств [Swigris J.J. et al., 2008].Лекарственная волчанка отличается от первичной СКВ тем, что
при ней часто выявляются антинуклеарный фактор и антитела к гис-
тонам, но не характерно наличие антител к нативной ДНК и отсут¬
ствует гипокомплементемия. Легочные проявления лекарственной
волчанки разнообразны. Их спектр включает: плеврит, пневмонит,
легочную гипертензию, антифосфолипидные антитела, облитериру-
юший бронхиолит, ТЭЛА, поражение дыхательных мышц. Чаще всего
описывают плеврит и пневмонит.КлассификацияОбщепринятой классификации поражений легких при СКВ не сущес¬
твует. Выделяют следующие варианты легочных проявлений СКВ.• Плеврит.• Острый волчаночный пневмонит.• Хронический интерстициальный пневмонит (хроническая интер¬
стициальная болезнь легких с фиброзом).• Альвеолярные кровоизлияния.• Острая обратимая гипоксемия.• Поражение дыхательной мускулатуры («синдром усадки легко¬
го» — «shrinking lung syndrome»).• Облитерирующий бронхиолит.• Легочный васкулит с легочной гипертензией.• Тромбоэмболия ветвей легочной артерии.• Инфекционные осложнения (бактериальные пневмонии, брон¬
хиты, туберкулез легких, микозы легких, вирусные инфекции).• Поражения легких, индуцированные лекарственными средствами.ДиагностикаПоражение органов дыхания при СКВ сопровождается неспе-
цифичсскими жалобами на кашель сухой или с наличием мокроты,
344 « ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... одышку на вдохе (пневмонит), выдохе (бронхиолит) или в обе фазы
дыхания (ТЭЛА, легочная гипертензия, альвеолярные кровоизлия¬
ния); боль в грудной клетке при дыхании (плеврит), кровохарканье
(альвеолярные геморрагии, ТЭЛА), а также жалобы общего характера
на повышение температуры тела, снижение веса, боль в суставах и
мышцах. Для подтверждения вовлечения органов дыхания в пато¬
логический процесс используются обш,еклинические и специальные
методы лабораторного и инструментального обследования.Лабораторные методы. Общеклинические лабораторные показа¬
тели позволяют определить степень активности воспалительного
процесса. Отмечается увеличение СОЭ, снижение гемоглобина, эрит¬
роцитов, лейкоцитов (иногда в дебюте болезни или при вторичной
инфекции может быть лейкоцитоз), лимфопения, тромбоцитопения.
Также изменены биохимические показатели (могут быть повышены
трансаминазы, креатинин, мочевина, формируется диспрогеине-
мия за счет повышения и у-глобулинов и др.). В сыворотке крови
выявляют LE-клетки, гематоксилиновые тельца, низкий уровень
комплемента, высокий уровень IgG и IgM. Характерны для СКВ
высокий уровень антинуклеарного фактора (выше чем 1:100), антител
к нативной (двуспиральной) ДНК. Возможно определение антител к
экстрагируемым внутриядерным антигенам (Sm— специфичен для
СКВ, Ro/SSA, La/SSB). Выявление антител к кардиолипину, волча-
ночного антикоагулянта, ложноположительной реакции Вассермана
свидетельствует о наличии антифосфолипидного синдрома, который
часто развивается на фоне СКВ. Высокая степень активности аутоим¬
мунного воспаления при СКВ коррелирует с высоким уровнем ИФН-у
[Tang J.P. et al., 2005]. При остром волчаночном пневмоните в крови
выявляется гипоксемия. Важным признаком наличия альвеолярного
кровоизлияния, особенно в тех случаях, когда отсутствует кровохар¬
канье, является снижение гематокрита в среднем на 7% с максималь¬
ным отклонением до 18% [Zamora M.R. et al, 1997]. Альвеолярные
кровоизлияния обычно сочетаются с наличием антинуклеарного
фактора, гипокомплементемией, значительным повышением уровней
продуктов деградации комплемента, и чаще, чем в целом среди боль¬
ных СКВ, обнаружением антикардиолип и новых антител [Schwab Е.Р.
et al., 1993]. При легочной гипертензии повышен у ровен ь эндотел ина-1
в сыворотке крови [Pope J., 2008].Рентгенография органов грудной клетки. При волчаночном плеврите
выявляется небольшой, обычно двусторонний выпот в области кардио-
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА • 345диафрагмальных синусов с косой верхней границей. Иногда выпот
может быть массивным, односторонним с умеренным смещением
средостения в здоровую сторону. Исход плеврита дает утолщение кос¬
тальной плевры, междолевой плевры, умеренную деформацию купо¬
лов диафрагмы, облитерацию синусов. Особенностью плевральных
изменений при СКВ является их малая выраженность, динамичность,
незначительность спаек. У части больных изменений на рентгено¬
граммах выявить не удается. Наличие в легочной ткани двусторонних
инфильтративных изменений ацинарного типа, преимущественно
в нижних отделах легких, обычно с признаками плеврита или сим¬
птома «матового стекла» позволяет предположить развитие остро¬
го интерстициального пневмонита, альвеолярных кровоизлияний
или инфекционного процесса. Выявление диффузной двусторон¬
ней интерстициальной инфильтрации, преимущественно в нижних
долях легких, которая сосуществует с плевральными наслоениями,
высоким уровнем стояния диафрагмы, дисковидными ателектаза¬
ми и локальными инфильтратами, наблюдается при хроническом
интерстициальном пневмоните. При наличии легочной гипертензии
у больных СКВ в раннем периоде болезни изменений может не быть,
но позже появляются типичные признаки расширения легочной
артерии, усиление легочного рисунка за счет сосудистого компонента
в виде расширения, сгущения, нечеткости очертаний сосудов легких.
Вторичная легочная гипертензия сочетается с изменениями легочной
паренхимы, признаками плеврита, перикардита. При облитерирую-
щем бронхиолите рентгенологически выявляется очаговая или диф¬
фузная инфильтрация интерстиция легких. Высокое стояние купола
диафрагмы (чаще справа, но может быть двустороннее повыщение) в
сочетании с уменьшением легочных объемов и дисковидными ателек¬
тазами в виде полосовидных теней шириной 0,5—2,0 см, располагаю¬
щихся параллельно диафрагме, не совпадающих по направлению с
утолщенной междолевой плеврой в нижних отделах легочных полей,
отражает поражение дыхательной мускулатуры при СКВ, в первую
очередь — диафрагмы. Именно эти рентгенологические признаки
послужили основанием для введения термина «синдром усадки лег¬
кого» в клиническую практику. Иногда может быть выявлено увели¬
чение лимфатических узлов средостения. Поражение легких при СКВ
может протекать без изменений на рентгенограммах органов грудной
клетки (острая обратимая гипоксемия, легочная гипертензия, ТЭЛА,
начальные стадии хронического интерстициального пневмонита).
346 « ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... КТ органов грудной клетки, особенно в режиме высокого разреше¬
ния, позволяет в значительно большем проценте случаев подтвердить
вовлечение легких в патологический процесс при СКВ, особенно в тех
случаях, когда клинические проявления заинтересованности легких
есть, а обычная рентгенография не выявляет патологии. КТ-цризна-
ки интерстициального фиброза легких при СКВ сходны с таковыми
при ИФА. Более четко выявляется на КТ симптом «матового стекла»,
характерный для острого волчаночного пневмонита и альвеоляр¬
ных геморрагий, дисковидные ателектазы легких, не совпадающие
с анатомическими границами отдельных структур легочной ткани
при «синдроме усадки легкого». Выполнение функциональных проб
позволяет выявить зоны повышенной воздухонаполненности легких
(симптом «воздушных ловушек»), характерных для облитерирующего
бронхиолита.функциональная диагностика. Изменения функции легких при
СКВ разнообразны. Чаще всего выявляется изолированное сни¬
жение дел, определяемое по угарному газу [Рагап D. et al., 2007].
Диффузия газов отражает состояние респираторной зоны легких,
поэтому ее снижение свидетельствует о субклиническом пораже¬
нии интерстиция или сосудов легких, при явном легочном фиброзе
присоединяется снижение спирометрических и плетизмографи-
ческих объемов, при альвеолярных геморрагиях, ТЭЛА, острой
обратимой гипоксемии одновременно со снижением ЖЕЛ и зна¬
чительным снижением дел отмечается увеличение альвеолярно-
артериального градиента кислорода. При облитерирующем брон-
хиолите выявляются обструктивные или смешанные нарушения
в сочетании с гипоксемией. Развитие «синдрома усадки легкого»
сопровождается формированием рестриктивных нарушений меха¬
нических свойств легких: уменьшение ЖЕЛ без изменений растя¬
жимости, но со снижением ротового давления на вдохе и выдохе.
Величина дел может быть как в пределах нормальных значений,
так и умеренно снижаться, при этом ее соотношение с вентилиру¬
емым альвеолярным объемом также либо остается нормальным,
либо умеренно снижается [Alberto C.J. et al., 2006]. Восстановление
функции диафрагмы приводит к нормализации параметров, харак¬
теризующих как механические, так и газообменные свойства лег¬
ких. Для дифференциальной диагностики рестриктивных нару¬
шений, обусловленных разными процессами, можно пользоваться
следующими признаками (табл. 5.1).
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА • 347Таблица 5.1. Дифференциальные признаки рестриктивных вентиляционных
нарушений [Murin S. et al., 1998]ПризнакиСлабость дыхательных мышцИнтерстициальное поражение легкихРастяжимость легкихНормальная или умеренно
снижена (нормализуется после
восстановления объема легких)СниженаОдышкаУсиливается в положении
ортолноэ (сидя)Не зависит от положения телаРентгенография органов
грудной клеткиЧистые легочные лоля или
базальные дисковидные
ателектазыИзмененные легочные поля
(усиление легочного рисунка)дел (DLCO)Нормальная или умеренно
сниженаСниженаОтношение
диффузионной
способности легких
к вентилируемому
альвеолярному объему
(DLCO/VA)Нормальное или умеренно
сниженоСниженоМаксимальное ротовое
давление на вдохе и
выдохеСниженоНормальноеИсследование легочно-сердечной гемодинамики актуально при
подозрении на развитие легочной гипертензии. Эхокардиография
с допплеровским анализом позволяет косвенным методом под¬
твердить повышение давления в легочной артерии. Однако косвен¬
ный метод может дать ложно положительный результат, поэтому
существуют рекомендации подтверждать легочную гипертензию
прямым измерением путем катетеризации сердца |Роре J., 2008].
Эхокардиография также позволяет выявить признаки перегрузки
правых отделов сердца, наличие перикардита, поражение миокарда,
клапанов сердца.Эндоскопические и хирургические методы. Фибробронхоскопия
позволяет выявить изменения в крупных и средних дыхательных
путях (изъязвления слизистой оболочки, паралич голосовых связок,
воспаление гортани и др.). Этот метод также позволяет получить мате¬
риал для морфологического исследования. С помощью ЧББ возможно
получение образца легочной ткани. При неинформативности данного
материала используют видеоторакоскопию или открытую биопсию
легких.
348 » ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... Морфологические методы. Для морфологической диагностики
используют плевральную жидкость, участки легочной ткани, получен¬
ные с помощью ЧББ, видеоторакоскопии или открытой биопсии лег¬
кого. Для СКВ типичен серозный или серозно-кровянистый характер
плевральной жидкости, являющейся экссудатом. В клеточном соста¬
ве плевральной жидкости преобладают полиморфноядерные нейтро-
филы или лимфоциты, причем избыточное содержание последних
свидетельствует о наличии длительно существующего (не менее1 нед) экссудата. Для подтверждения волчаночной природы плеврита
используют исследование экссудата на наличие LE-клеток, анти-
нуклеарного фактора и оценивают уровень глюкозы. Обнаружение
LE -клеток может быть очень информативным (до 90%), однако тест
сложно выполним технически, что снижает его чувствительность,
иногда доходящую до 0%. Тест на антинуклеарный фактор патогномо-
ничен для СКВ, он достоверен в случае обнаружения антинуклеарного
фактора в титре не менее чем 1/320 и совпадения его значений в сыво¬
ротке крови, причем свечение чаще всего бывает гомогенным. У 10%
пациентов без СКВ также можно выявить антинуклеарный фактор,
но титр его при этом не превышает 1 /40 и свечение имеет крапчатый
характер [Light R.W., 1995]. Высокий уровень глюкозы (выше 70 мг/дл)
позволяет отличить волчаночный плеврит от ревматоидного выпо¬
та, при котором уровень глюкозы низкий (ниже 20 мг/дл). При СКВ
в экссудате уровень лактатдегидрогеназы обычно не превышает
500 МЕ/л, а pH выше 7,2. Исследование плевральной жидкости на
наличие ревматоидного фактора, иммунных комплексов, уровень
комплемента имеют ограниченную диагностическую ценность, так
как уровни этих показателей сходны при экссудатах другой этиологии,
в частности при РА. Исследование ЖБАЛ позволяет дифференциро¬
вать инфекционное поражение легких от собственно волчаночного.
Ее цитологическая оценка оказывает помощь в определении харак¬
тера поражения легких в рамках СКВ, степень активности процесса.
Варианты морфологических изменений легочной ткани при СКВ
представлены в разделе «Патологическая анатомия легких».Формулировка диагнозаДиагноз должен отражать характер течения СКВ, степень
активности процесса и вариант поражения различных органов,
осложнения.
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА • 349Примеры клинических диагнозов• СКВ, острое течение, ПІ степень активности, с поражением кожи
(«васкулитная бабочка», дигитальный заскулит), суставов (не-
эрозивный генерализованный артрит), почек (быстро прогресси¬
рующий гломерулонефрит), сердца (перикардит), легких (острый
волчаночный пневмонит, двусторонний плеврит, гипоксемия).
Осложнения: ХПН, ДН III степени, сердечная недостаточностьII степени.• СКВ, подострое течение, II степень активности, с антифосфо-
липидным синдромом (сетчатое ливедо в области кожи верхних
и нижних конечностей, привычное невынашивание беременно¬
сти), поражение легких (рецидивирующая тромбоэмболия мел¬
ких ветвей легочной артерии). Осложнения: ДН 11 степени, вто¬
ричная легочная гипертензия II степени.• СКВ, хроническое течение, I степень активности, с поражением
кожи (дискоидные очаги), суставов (неэрозивный артрит мелких
суставов кистей), синдром Рейно, легких (хронический интер¬
стициальный пневмонит). Осложнения: ДН II степени. Вторичная
легочная гипертензия И степени.Дифференциальная диагностикаПри наличии признаков поражения легких на фоне установ¬
ленного диагноза СКВ необходимо проводить дифференциальную
диагностику аутоиммунного легочного процесса в рамках основно¬
го заболевания с различными вариантами такового и инфекцион¬
ным поражением легких (бактериальным, вирусным, микотическим,
туберкулезным). Об инфекции следует думать при рецидиве лихорад¬
ки, появлении кашля с мокротой, новых инфильтратов в легочной
ткани на фоне успешно проводимой иммуносупрессивной терапии.
Для уточнения диагноза выполняют фибробронхоскопию с цитологи¬
ческим и микробиологическим исследованием ЖБАЛ. Исследование
ЖБАЛ является наиболее информативным методом, так как позво¬
ляет исключить или подтвердить инфекцию и установить характер
возбудителя. Проводят микробиологическое, вирусологическое и
микологическое исследование крови, в редких случаях применяют
биопсию легочной ткани в связи с высокой активностью процесса и
неспецифичностью морфологических изменений.Особые трудности представляет диагностика характера пора¬
жения легких в случае дебюта СКВ легочным синдромом, В этой
350 « ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... ситуации необходимо проводить дифференциальную диагностику
с различными формами альвеолитов (ИФА, ЭАА, ЭТА), легочны¬
ми проявлениями других ДБСТ. Наличие кровохарканья требует
исключения бронхоэктазий, синдрома Гудпасчера, МПА, ГВ, дру¬
гих системных васкулитов, новообразований легких [Trindade Е.
et al,, 2007]. Информативными для дифференциальной диагнос¬
тики являются результаты иммунологического исследования. Для
СКВ характерно наличие в сыворотке крови высоких титров
актинуклеарного фактора, антител к нативной ДНК, антител к
антигену Смита (Sm Ag), Ro/SS-A и La/SS-B антигенам, LE-кле-
ток, гематоксилиновых телец, низкий уровень комплемента. При
РА обнаруживают высокий уровень ревматоидного фактора и
антитела к циклическому цитруллиновому пептиду, при ССД —
антитела к центромерам и антигену Scl-70; легочный процесс,
сопровождающий ПМ/ДМ, ассоциируется с наличием антител
к Jo-1 антигену. При синдроме Гудпасчера обаруживаются антите¬
ла к базальным мембранам клубочков почек и альвеол, при ГВ
вырабатываются АНЦА к протеиназе-3. Важным для диффе¬
ренциальной диагностики является обнаружение клинических
и других лабораторных признаков СКВ [Tzetepis G.E. et ai., 2008].
Американская ревматологическая ассоциация разработала диа¬
гностические критерии СКВ, представленные ниже.• Сыпь на скулах: фиксированная эритема на скуловых выступах,
имеющая тенденцию к распространению к носогубной зоне.• Дискоидная сыпь: эритематозные приподнимающиеся бляшки с
прилипающими кожными чешуйками и фолликулярными проб¬
ками; на старых очагах могут быть рубцы.• Фотосенсибилизация: кожная сыпь, возникающая в результате
необычной реакции на солнечный свет.• Язвы в полости рта и носа: изъязвление в полости рта и носа,
обычно безболезненное.• Артрит: неэрозивный артрит, поражающий два и более перифе¬
рических сустава и проявляющийся болезненностью, отеком и
выпотом.• Серозит: плеврит (плевральные боли или шум трения плевры или
наличие выпота) или перикардит (подтвержденный с помощью
эхокардиографии или выслушиванием шума трения перикарда).• Поражение почек: персистирующая протеинурия более 0,5 г за
сутки или цилиндрурия (эритроцитарная, гемоглобиновая, зер¬
нистая или смешанная).
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА • 351• Поражение центральной нервной системы: судороги или психоз
(в отсутствие приема лекарственных средств или метаболических
нарушений).• Гематологические нарушения: гемолитическая анемия с ретику-
лоцитозом или лейкопения <4,0х107л (зарегистрированной 2 раза
и более) или тромбоцитопения <100х10Ул (в отсутствие приема
лекарственных средств).• Иммунологические нарушения: наличие антител к ДНК или
антител к Sm-антигену или антител к фосфолипидам: увеличение
уровня IgG или IgM (антитела к кардиолипину); положительный
тест на волчаночный антикоагулянт при использовании стандар¬
тных методов; ложноположительная реакция Вассермана в тече¬
ние как минимум 6 мес при подтвержденном отсутствии сифили¬
са с помощью реакции иммуномобилизации бледной трепонемы
и теста флюоресцентной адсорбции трепонемных антител.• Антинуклеарный фактор: повышение титров (при отсутствии
приема лекарственных средств, вызывающих волчаночноподоб-
ный синдром).Присутствие четырех признаков делает диагноз достоверным. При
затруднении установления диагноза также следует учитывать молодой
возраст, женский пол, упорную лихорадку, быструю и значительную
потерю массы тела, усиленное выпадение волос.При невозможности установить диагноз неинвазивными методами
используют морфологическую диагностику.ЛечениеЛечение легочных проявлений СКВ нельзя рассматривать в отры¬
ве от лечения СКВ в целом. Принципы лечения основного заболе¬
вания распространяются и на лечение легочных синдромов СКВ.
Основные средства лекарственной терапии — глюкокортикоидные
препараты в сочетании с цитостатиками (циклофосфамид, азатиоп-
рин, реже — хлорамбуцил, циклоспорин А), назначаемые в течение
длительного времени (годами) с коррекцией дозы в процессе наблю¬
дения. При обострении СКВ в последние годы с успехом использу¬
ются методы экстракорпоральной гемокоррекции — гемосорбция и
плазмаферез.Волчаночный плеврит хорошо поддается обратной динамике на
фоне глюкокортикоидной терапии, причем купируются признаки не
только экссудативного плеврита, но и сухого. Иногда происходит само-
352 > ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ- Произвольное исчезновение выпота, в случаях отсутствия эффекта от
противовоспалительной терапии и сохранении болей в грудной клет¬
ке иногда применяют введение талька в плевральную полость с целью
ее облитерации, крайне редко выполняется плеврэктомия.Для лечения острого волчаночного пневмонита обычно используют
большие дозы глюкокортикоидов (1—2 мг на 1 кг массы тела в сутки —
здесь и далее ~ в пересчете на преднизолон), что, как правило, дает
благоприятный результат. В случае неэффективности такой терапии
может развиться фатальная ДН. В настоящее время для оптимиза¬
ции терапии используют сверхвысокие дозы глюкокортикоидов в
виде пульс-терапии (метилпреднизолон или солумсдрол* 1 г в сутки
внутривенно, капельно в течение 3 дней подряд), в сочетании с пульс-
терапией циклофосфамидом (1 г в сутки внутривенно, капельно) во
второй день лечения и плазмаферезом. Иногда используют другие
иммуносупрессанты (азатиоприн, метотрексат или их комбинации).
Однако препаратами первого ряда остаются глюкокортикоиды, а
иммунодепрессанты присоединяют только в случае неэффектив¬
ности препаратов первого ряда и ухудшении состояния пациента
[KingT.E., 1998J.Лечение альвеолярных кровоизлияний также начинают с назначе¬
ния высоких доз глюкокортикоидов (1-3 мг/кг массы тела в сутки) или
в виде комбинированной пульс-терапии. При подозрении на наличие
инфекции и при ее подтверждении циклофосфамид в комплекс
лечения не включают до ее купирования. Применение в комплексе
лечения плазмафереза [Cacas С, et al., 2007j и экстракорпоральной
мембранной оксигенации улучшает прогноз при альвеолярном крово¬
излиянии. Есть сообш:ение об успешном использовании ритуксимаба
(моноклональные антитела к CD20 рецепторам В-лимфоцитов) при
диффузном альвеолярном кровоизлиянии [Nellessen С.М. et al., 2008].
В связи с тем что такие кровоизлияния часто симулируют пневмонию
и осложняются респираторной инфекцией, существует опыт эмпири¬
ческого назначения антибактериальных препаратов широкого спект¬
ра действия в комбинации с общепринятыми средствами с хорошим
эффектом в виде 100% выживаемости пациентов [Santos-Ocampo A.S,
et al., 2000; Rojas-Serrano J. et al., 2008].Для лечения хронического интерстициального пневмонита тра¬
диционно используют глюкокортикоиды, позволяющие добиться
улучшения или стабилизации процесса у большинства пациентов.
Глюкокортикоиды — основа лечения также острой легочной гипоксе-
мии в сочетании с кислородотерапией.
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА • 353Лечение легочной гипертензии при СКВ окончательно не раз¬
работано. Применение вазодилататоров в большинстве случаев не¬
эффективно, хотя у единичных больных отмечается положительный
эффект. Как правило, используют большие дозы глюкокортикоидов,
иммуносупрессантов, антикоагулянты, вазодилататоры в виде про-
стапиклина и простагландинаЕ,, При тяжелой прогрессирующей
легочной гипертензии рекомендуют пересадку комплекса «сердце-
легкие». В случае тяжелой ДН, обусловленной легочной гипертензией,
и в период двусторонней пересадки легких применяют экстракорпо¬
ральную мембранную оксигенацию [Hsu Н.Н. et al., 2008].Оптимальная терапия «синдрома усадки легкого» не разработана.
В большинстве случаев используют средние дозы глюкокортикои¬
дов (20—40 мг в сутки в пересчете на преднизолон). Есть единичные
сообщения о положительном эффекте применения больших доз те0“
филлина (750 мг в сутки) и р^-агонистов. Несмотря на то что одышка
в результате слабости дыхательных мышц может быть существенной,
она хорошо поддается обратной динамике на фоне проводимой тера¬
пии, и в последующем никаких признаков нарушения функции дыха¬
тельных мышц не остается.Лечение поражений дыхательных путей при СКВ проводят высо¬
кими дозами системных глюкокортикоидов в сочетании с их ингаля¬
циями через небулайзер (будесонид в дозе 1000-2000 мгк и больше в
2 приема в сутки). Применение ингаляций бронходилататоров мало¬
эффективно.При подозрении на инфекционный процесс в легких назначают
антибактериальные препараты широкого спектра действия и их ком¬
бинации: защищенные р-лактамные пенициллины, карбапенемы,
цефалоспорины 3-4 генерации, респираторные фторхинолоны, ами-
ногликозиды, при подозрении на пневмоцистную или нокардиальную
инфекцию — сульфаметоксазол с триметопримом. В случае развития
грибковых инфекций используют антимикотические средства (низо-
рал, дифлюкан). Новый класс антимикотиков — эхинокандины (кас-
пофунгин^^, микафунгин'^), активные в отношении широкого спектра
возбудителей {Candida spp., Aspergillus spp, Coccidiodes immutis и др.),
улучшают прогноз при возникновении микоза легких [Domergue V.
et aL, 2008]. У иммуносупрессивных больных (таковыми являются
все пациенты СКВ) возможно развитие суперинфекции грибами,
нечувствительными даже к последним поколениям антимикоти¬
ков {Criptococcus neoformans), что утяжеляет течение болезни и может
привести к летальному исходу [Suzuki К, et al., 2008]. При выявлении
354 • ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... вирусной причины легочных изменений назначают притивовирус-
ные препараты (ганцикловир) [Tanaka Y. et al,, 2008J, Подтверждение
туберкулеза требует проведения лечения туберкулостатиками.
Антимикробная, притивопротозойная, противогрибковая и про¬
тивотуберкулезная терапия проводится на фоне патогенетического
лечения СКВ глюкокортикоидами, но без цитостатиков.Лечение лекарственной волчанки, в том числе и ее легочных про¬
явлений, заключается в отмене причинно значимого лекарственно¬
го препарата и назначении нестероидных противовоспалительных
средств. Иногда, при поздней диагностике, требуется назначение глю-
кокоргикоидов, доза которых определяются тяжестью течения забо¬
левания (от 0,1 до 1,0 мг/кг в сутки) [Yung R.L., Richardson B.C., 1994].Есть сообщения об успешном использовании новых лекарствен¬
ных средств при СКВ с поражением легких. Трехокись мышьяка
(AsO^) [Bobe Р. et al., 20061 и трансплантация немиелобластной гема-
топоэтической стволовой клетки [Burt R.K. et al., 2006] приводили к
значительному снижению общей активности заболевания, улучше¬
нию функциональных легочных показателей, нормализации рентге¬
нологической картины.ПрогнозВовлечение легких в патологический процесс при СКВ существенно
ухудшает прогноз. Он зависит от вида легочной патологии и степени
активности волчаночного процесса в целом, своевременности и адекват¬
ности проводимого лечения. Наиболее неблагоприятными вариантами
легочной патологии являются острый волчаночный пневмонит, альвео¬
лярные кровоизлияния, легочная гипертензия, инфекционные ослож¬
нения. Эти состояния резко ухудшают прогноз, так как трудно поддают¬
ся лечению и сопровождаются высокой смертностью (до 50% и более).ПрофилактикаПервичная профилактика СКВ не разработана.Вторичная профилактика заключается в строгом выполнении
рекомендаций по поддерживающему медикаментозному лечению и
исключении контактов с факторами риска обострения заболевания
(солнечная инсоляция, ультрафиолетовое облучение, физическое и
эмоциональное переутомление, прививки).
полимиозит и ДЕРМАТОМИОЗИТ • 355полимиозит и ДЕРМАТОМИОЗИТПолимиозит (ПМ) и дерматомиозит (ДМ) относят к гетероген¬
ной группе хронических аутоиммунных воспалительных заболеваний
неизвестной этиологии, протекающих с преимущественным пораже¬
нием скелетной мускулатуры и входящих в группу ДБСТ [Насонов Е.Л.,
2005]. ПМ и ДМ, а также некоторые близкие к ним заболевания обозна¬
чают как идиопатические воспалительные миопатии.Заболеваемость ПМ/ДМ, по данным эпидемиологических иссле¬
дований, составляет от 2 до 10 случаев на 1 млн населения в год.
В последние десяти летия отмечается увеличение заболеваемости идио-
патическими воспалительными миопатиями, причем ДМ встречае¬
тся у детей и молодых людей (ювенильный ДМ), а ПМ развивается
преимущественно »0 второй декаде жизни (30—50 лет). ДМ и ПМ чаще
встречаются у женщин. Поражения легких развиваются в 45-80% слу¬
чаев миопатий.Этиология и факторы рискаОписания поражений легких при ПМ/ДМ появились сравнитель¬
но недавно, в связи с чем вопросов, касающихся целого ряда механиз¬
мов формирования поражения легких, значительно больше, нежели
ответов. По мнению ряда исследователей, в качестве этиологических
факторов развития ПМ/ДМ и поражения легких рассматриваются
пикорновирусы (особенно эхо- и кардиовирусы), вирус Эпштейна-
Барр, Коксаки-вирусы и др.Развитие симптомокомплекса, напоминающего ПМ/ДМ, бывает
при некоторых инфекциях (риккетсиозе, шистозоматозе, трихинел¬
лезе и т.д.), описаны случаи идиопатических воспалительных мио¬
патий при приеме иммуносупрессивных препаратов (Д-пеницилла-
мина, азатиоприна). Паранеопластический ДМ с СФА развивается у14—30% онкологических больных. Однако более популярной в послед¬
нее время является точка зрения о значении вирусов как триггерного
фактора, резко меняющего «направленность» иммунологических
защитных реакций. Считается, что длительное персистирование
вирусов вызывает в мышечных клетках или клетках иммунной систе¬
мы иммунорегуляторные дефекты и развитие аутоиммунных реакций
против инфицированных клеток.
356 » ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... Существует гипотеза, согласно которой аутоантитела (в том числе
миозитспецифические) могут являться антиидиопатическими анти¬
телами против антивирусных антител. Косвенным подтверждением
роли вирусной инфекции в гиперпродукции миозитслецифических
антител могут быть данные о сезонности обострений и возникнове¬
ния болезни (Антелава О.А. и соавт., 2007].Нет единого мнения относительно факторов риска развития пора¬
жения легких при идиопатических воспалительных миопатиях, хотя
при поздней диагностике миозита с тяжелыми поражениями дыха¬
тельных мышц, диафрагмы, мышц гортани часто возникают аспира-
ционные пневмонии и ДН. СФА с тяжелым прогредиентным течением:
чаще возникает, по мнению ряда авторов, у больных ПМ/ДМ с син¬
дромом Рейно и (или) высоким уровнем антисинтетазных антител,
отсутствием эффекта от лечения глюкокортикоидами, что подтверж¬
дается и нашими наблюдениями. Наследственное предрасположение
к поражению легких при ПМ/ДМ в литературе не описано, хотя
существуют указания о гомологии коротких участков бактериальной
гистидил-тРНК-синтетазы (тРНК ~ трансиортнан РНК), миозина и
белков мышечного пикорновируса или вируса энцефаломиелита.ПатогенезПо современным представлениям наиболее вероятным механиз¬
мом развития аутоиммунного воспаления при ПМ/ДМ является пере¬
крестное взаимодействие ряда инфекционных агентов и аутоантиге¬
нов, по направлению к которым осуществляется синтез аутоантител
[Dalakas М., 2006]. Развитие этих миопатий связано с синтезом целого
«семейства» аутоантител, направленных к цитоплазматическим бел¬
кам и рибонуклеиновым кислотам. Упомянутые антитела присут¬
ствуют в сыворотках почти 90% больных с ПМ/ДМ и рассматривают¬
ся как миозитспецифические антитела, подразделяющиеся на четыре
основные группы.• Наиболее часто встречаются антитела каминоацилсинтетазам тРНК
(1-я группа). Наличие этих антител ассоциируется с определенным
симптомокомплексом, включающим поражения по типу СФА и
ряд других клинических проявлений, объединенных определением
«антисинтетазный синдром». Частота СФА у больных с антисин-
тетазным синдромом составляет 0,6-0,8 [Yoshifuji Н. et al, 2006].
полимиозит и ДЕРМАТОМИОЗИТ • 357• 2-я группа антител реагирует с частицами сигнального распозна¬
вания, представляющими комплекс из 6 белков и молекулы РНК,
обеспечивающими перенос вновь синтезированных молекул к
эндоплазматическому ретикулуму.• 3-я группа антител получила название антител к Мі2 (белко¬
во-ядерный комплекс с неизученной функцией) и выявляется
у больных дм с кожными изменениями, хорошим ответом на
лечение глюкокортикоидами и относительно благоприятным
прогнозом. Поражения легких у больных этих групп практически
не описаны.•Антитела 4-й группы (PL-12, KS, 0J, EJ) встречаются реже.
Вместе с тем их наличие сопряжено с проявлениями поражения
легких по типу СФА [Betteridge Z., 2007].Частота обнаружения миозитспецифических антител при ПМ/ДМ
достигает от 50 до 90%. Обычно больные имеют какой-либо один тип
миозитспецифических антител. Иногда антитела начинают синтези¬
роваться до развития у больного клинических проявлений болезни.
Их уровень может коррелировать с активностью болезни и нормали¬
зоваться при достижении ремиссии.Паталогическая анатомияв целом гистологическая картина очень напоминает изменения
при ИФА и поражение легких при ССД. При гистологическом иссле¬
довании биоптатов легких больных ПМ/ДМ с СФА участки пораже¬
ния неравномерно распределены между участками здоровой ткани.
Выявляется гиперплазия пневмоцитов II типа, утолщение альвеоляр¬
ных стенок и перегородок, разрастание перибронхиальной и перивас-
кулярной соединительной ткани, гиперпластический склероз малых
артерий. Воспалительный инфильтрат состоит преимущественно
из лимфоцитов и плазматических клеток, эозинофилы и лейкоциты
встречаются редко. Отмечается гиперпластический склероз мелких
артерий и венул.Классификации поражений органов дыхания при ПМ/ДМ как
таковой пока не существует, описываются различные клинико-мор¬
фологические варианты поражений легких, предприняты попытки
систематизировать поражения легких по типу СФА согласно принци¬
пам клинико-морфологической классификации ИФА.
358 » ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... Клиническая картинав клинической картине ПМ/ДМ можно выделить следующие син¬
дромы поражения легких.Мышечные расстройства различной степени выраженности встре¬
чаются у подавляющего большинства больных. Поражение дыхатель¬
ных мышц, высокое стояние диафрагмы и вялость ее дыхательных
экскурсий в 40% приводят к рестриктивного типа изменениям ФВД.
Снижается кашлевой и дыхательный клиренс легких, легочный
кровоток, что создает условия для развития гиповентиляционной
пневмонии, легочной гипертензии. Нарушение глотания приводит к
аспирации пищи и слюны с развитием в последующем аспирацион-
ной пневмонии.Пневмония — самая частая форма легочных поражений, встреча¬
ется при ПМ в 29—54% случаев. В ее генезе важнейшую роль играет
аспирация пищи и др. в связи с поражением мышц глотки и пище¬
вода, Частота аспирационного синдрома, приводящего к возник¬
новению аспирационной пневмонии, у больных ПМ/ДМ достигает
30%. Примерно половина всех пневмоний при ПМ ассоциирована с
дисфагией. Предрасположенность к аспирации усугубляется и тем,
что пациенты в этих условиях не способны занять удобное положе¬
ние при рвоте, в 30% случаев возбудителями пневмонии у больных
ПМ/ДМ являются Pseudomonas aeruginosa. Cryptococcus neoformans.
Staphylococcus aureus и др. Возникновению пневмоний могут спо¬
собствовать нарушения общего и местного иммунитета и других
механизмов защиты.Гиповентиляционный синдром оказывает влияние на общее состо¬
яние больного и приводит к дополнительному риску развития пнев¬
монии, Выраженная респираторная недостаточность развивается в
7—8% случаев. Снижение ЖЕЛ до 1 л и менее является показанием
для ИВЛ.СФА “ один из висцеральных проявлений ПМ/ДМ. Частота СФА
при миозите составляет от 10 до 63%, согласно собственным данным —
55%. Этот синдром при ПМ манифестируется спектром клинико¬
лабораторных проявлений, близких к таковым при других системных
поражениях соединительной ткани, и имеет сходство с ИФА. Ряд
исследователей выделяет три формы СФА при ПМ/ДМ по характеру
течения [Targoff I.N. et ah, 1992J,
полимиозит и ДЕРМАТОМИОЗИТ • 359• к 1-й группе относятся пациенты, у которых поражение легких
протекает по типу быстро прогрессирующего ИФА (синдром
Хаммена—Рича) — остро появляются непродуктивный кашель,
одышка в покое, лихорадка; при этом симптомы миозита как бы
оказываются на втором плане. На рентгенограммах выявляется
множественная мелкоочаговая инфильтрация и сетчатая дефор¬
мация легочного рисунка. Такое течение часто сравнительно
быстро заканчивается фатальным исходом.• У больных 2-й группы болезнь развивается более медленно, мани¬
фестирует одышкой при нагрузке, иногда — непродуктивным
кашлем. Эти проявления могут предшествовать началу миозита,
возникать одновременно или после. Во всех случаях второй вари¬
ант интерстициального поражения легочной ткани при ПМ/ДМ
может «маскировать» миозит. У ряда больных в 1-й и 2-й группах
определяется тахипноэ, крепитация в нижних отделах легких,
развивается легочное сердце. Симптом «барабанных палочек»
встречается редко.• К 3-й группе относятся пациенты без выраженной клинически
легочной симптоматики, однако обнаруживаются изменения при
рентгенологическом и функциональном исследовании легких.Клиника СФА может опережать появление миозита в 10% случаев
на срок от нескольких месяцев или даже лет. Возможна одновремен¬
ная манифестация СФА и миозита, и, наконец, чаще СФА развивается
после дебюта миозита. Как правило, это происходит на ранних этапах
основного заболевания. Плеврит при ПМ/ДМ описан в основном в
сочетании с СФА. При аутопсии обычно находят небольшой выпот и
плевродиафрагмальные спайки.Описаны случаи ассоциации аллергического васкулита легких
(признаки выраженного расстройства кровообращения в виде пол¬
нокровия сосудов, периваскулярных геморрагий, отека) с фибрози-
рующим альвеолитом, а также комбинации альвеолита с кожным
васкулитом.В настоящее время доказано, что при миозите часто формируется
ассоциация СФА с определенным клинико-иммунологическим синд¬
ромом fBetteridge Z. et al., 2007]. Этот синдром получил название анти-
си нтетазного и характеризуется сочетанием миозита с СФА, артритом,
синдромом Рейно и наличием антител к аминоацилсинтетазам тРНК,
функция которых заключается в катализе процесса связывания отде¬
льных аминокислот с соответствующей тРНК (табл. 5.2).
360 ■ ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ...
Таблица 5.2. Спектр антител к аминоацилсинтетазамАнтителаАнтигенHLAКлиническая хараістеристикаАнти-Jo-IГистидил-тРНК-синтетазаDR3/DRW52DQA1 *0501Острый тяжелый ПМ/ДМ, СФА,
лихорадка, полиартрит, синдром
Рейно,склеродактилия, синдром
карпального канала. Начало чаще
весной, обострения на фоне
снижения'дозы глюкокортикоидов
и неполный ответ на
глюкокортикоиды; прогноз
неблагоприятный {5-летняя
выживаемость — 70%)Анти-Р1-7Треонил-тРНК-синтетазаТе жеПМ/ДМ, рецидивирующая
лихорадка, СФА, хронический
полиартритАнти-РІ-12Аланин-тРНК-синт0тазаТе жеТо жеАнти-OJИзолейцил-тРНК-синтетазаТе жеТо жеАнти-EJГлицил-тРНК-синтетазаТе жеТожеJo-1-антитела получили свое название по имени пациента Р. John,
страдавшего ПМ и фиброзирующим альвеолитом, у которого эти
антитела были впервые обнаружены. Jo-1-антитела выявляются от
28,1 до 79%. Клинические проявления антисинтетазного синдрома
(анти-Jo-l) достаточно разнообразны и наблюдаются с различной
частотой (табл. 5,3).Таблица 5.3. Клинические проявления у больных антисинтетазным
синдромом (анти-Jo-l)ПризнакиЧастота проявлений, %Феномен Рейно93Артрит/артралгия90Миозит83СФА79Склеродактилия72Синдром Шегрена59Кожные высыпания {дерматомиозитная сыпь)38Дисфагия31Кальциноз24
полимиозит и ДЕРМАТОМИОЗИТ * 361Другие антитела, входящие в эту группу (анти-РЬ-7, анти-PL-12,
анти-OJ, анти-EJ), встречаются в 5—10 раз реже, чем анти-Jo-1, и были
описаны у пациентов, чья клиническая симптоматика сходна с кли¬
никой пациентов с Jo-1-антителами. В выделенных группах больных
с антисинтетазными антителами частота СФА достигает 50—75%.
Важно, что антисинтетазные антитела имеют выраженную связь с
такими антигенами гистосовместимости, как HLA DR3, DRw5. То
есть СФА при ПМ/ДМ ассоциирован с определенными комплексами
клинико-иммунологических и генетических признаков, характеризу¬
ющихся острым началом, сезонностью (преимущественно — весна),
артритами, синдромом Рей но, недостаточным лечебным эффектом
глюкокортикоидов и обострением миозита при попытке снизить дозу
глюкокортикоидов, относительно высокой летальностью, наличием
антисинтетазных антител.ОсложненияНаиболее частым осложнением СФА при ПМ/ДМ является про¬
грессирующая ДН, в литературе описаны также пневмомедиастинум
и пневмоторакс.ДиагностикаДля диагностики поражений легких у больных миозитами исполь¬
зуются клинические, лабораторные исследования, рентгенография и
КТ органов грудной клетки, изучение ФВД, ДСЛ, ЖБАЛ, а также ЧББ
и открытая биопсия легких, видеоторакоскопия с биопсией легкого.Лабораторная диагностика. Общеклиническое исследование поз¬
воляет сформулировать первоначальную диагностическую гипотезу
и составить план целенаправленного исследования с помощью обще-
клинических методов. При поражениях легких у больных ПМ/ДМ
описаны жалобы на кашель (сухой или с выделением мокроты), боли
в грудной клетке, связанные с дыханием или кашлем, затруднение
вдоха, появление кашля при глубоком вдохе, одышку, лихорадку. При
сборе анамнеза основное внимание уделяется изучению хронологи¬
ческой последовательности появления основного заболевания и сим¬
птомов поражения легких. Объективно могут выявляться признаки
плеврита, бронхита, пневмонии, альвеолита и т.д. Все эти данные,
необходимые для оценки клинической картины, степени и тяжести
патологии легких, оказывают достаточно существенную помощь в
362 * ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ...дифференциальной диагностике и составлении плана дальнейшего
обследования, однако не могут служить основанием для ттостановки
окончательного диагноза.Основой диагностики поражения легких у больных ДМ/ПМ явля¬
ется использование рационального набора неинвазивных и инвазив¬
ных исследований, поскольку клиническая картина (особенно в нача¬
ле поражения) является скудной и непатогномоничной. Достаточно
сказать, что одно из основных проявлений СФА — одышка характерна
и для дебюта и (или) для обострения ПМ/ДМ, в особенности при
поражении мышц плечевого пояса и грудной клетки.В то же время имеются несколько клинических признаков и дан¬
ных лабораторных исследований, которые являются типичными при
формировании СФА у больных с ПМ/ДМ, а именно:- прогрессирующая одышка, при которой достоверно чаще отме¬
чается снижение ДСЛ;- синдром Рейно, коррелируюш,ий со степенью снижения ДСЛ;- цитологические признаки альвеолита при исследовании
ЖБАЛ;- наличие антисинтетазных антител, коррелирующих с синдро¬
мом Рейно, признаками фиброзирующего альвеолита, сниже¬
нием ДСЛ.Клинические анализы крови, мочи, мокроты не имеют само¬
стоятельного диагностического значения. Биохимические методы
исследования выявляют преимущественно неспецифические изме¬
нения (повышение уровня сиаловой кислоты и С-реактивного белка,
увеличение креатинфосфокиназы, лактатдсгидрогеназы, аспартата-
минотрансферазы и аланинаминотрансферазы в крови), свидетель¬
ствующие скорее об активности основного заболевания. В то же время
некоторые из них несут дополнительную информацию о нозологиче¬
ской форме миозита и вовлечении иммунологических механизмов.Изучение уровня антинуклеарных, антимиелопероксидазных и
антисинтетазных антител имеет значение для диагностики СФА при
ПМ/ДМ и дифференциальной диагностики СФА с другими видами
патологии (ИФА, поражением легких при СКВ, ССД, РА). Так, у боль¬
ных, страдающих ПМ/ДМ с СФА, чаще обнаруживаются антитела к
аминоацил-тРНК-синтетазе, а у больных ИФА не находят антинук¬
леарных, антимиелопероксидазных и антисинтетазных антител. Есть
данные, что выявление протеина S-100 и антимиелопероксидазных
антител у больных РА коррелирует с повышением поражений легких
(Богданов А.Н. и соавт., 1998]. При поражении органовдыхания, обус¬
полимиозит и ДЕРМАТОМИОЗИТ • 363ловленном СКВ, АНА встречаются у 95% больных. У больных ССД
антитела обнаруживаются в более низком титре у 70-90% больных.
Чаще при ССД выявляются антицентромерные, антигистоновые
антитела и антитела Scl-70.Лучевые методы исследования. Изменения на рентгенограммах
органов грудной клетки выявляются у большинства пациентов
с СФА на фоне ПМ/ДМ при развернутой картине болезни. Однако
у 10% больных с гистологически доказанным СФА рентгенологиче¬
ские изменения минимальны. Наиболее типичным признаком СФА
является усиление легочного рисунка за счет интерстициального
компонента преимущественно в нижних отделах легочных полей.
Определяются двусторонние мелкоочаговые затенения, череду¬
ющиеся с изменениями по типу «матового стекла». При прогре¬
ссировании процесса перестройка легочного рисунка становится
более выраженной и распространенной, приобретает характер
крупноячеистой деформации, в дальнейшем формируется «сотовое
легкое*».Более информативным методом исследования является КТ, кото¬
рая помогает существенно улучшить диагностику всех видов пораже¬
ний легких у больных ПМ/ДМ. Использование ВРКТ позволяет:— уточнить морфологическую картину поражения при наличии
клинических признаков и изменений ФВД в сочетании с мало-
измененной рентгенограммой органов грудной клетки;— дифференцировать активный альвеолит и фиброз легких;~ выявить признаки обл итерирующего бронхиолита;— уточнить место проведения биопсии или БАЛ.Изменения на КТ на более ранних стадиях болезни обычно лока¬
лизуются в субплевральных и базальных отделах, распространяясь в
дальнейшем в верхние и центральные отделы легких. Изменения по
типу «матового стекла» наблюдаются у 30—40% пациентов. Под влия¬
нием эффективной терапии глюкокортикоидами и иммуносупрессан-
тами может наступить стабилизация процесса или обратное развитие.
Если заболевание прогрессирует, то рентгенологические признаки
СФА при ПМ/ДМ идентичны таковым при ИФА и отражают этапы
формирования легочного фиброза. На поздних стадиях перестройка
легочного интерстиция происходит по типу «сотового легкого».Исследование ФВД, Частота изменений ФВД при различных мио-
патиях колеблется в достаточно больших пределах (от 15 до 80%),
в ряде случаев эти изменения связаны с поражениями диафрагмы,
дыхательных мышц и мышц плечевого пояса и прежде всего харак¬
364 « ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ... теризуются снижением ЖЕЛ из-за невозможности правильно выпол¬
нить дыхательный маневр. Чаще при СФА у больных с ДМ/ПМ выяв¬
ляются рестриктивные вентиляционные изменения. Учитывая, что
нарушения легочной вентиляции могут развиваться до клинических
проявлений СФА, возможно использование этих показателей для
ранней диагностики, однако по мере восстановления мышечной силы
дыхательных мышц показатели могут улучшиться, что не коррелиру¬
ет с нарастанием интерстициальных поражений и (или) альвеолита
[Fathi М. et al., 2008].Значительно более точным тестом диагностики СФА у этой кате¬
гории больных является определение дел. Результаты этого исследо¬
вания коррелируют с данными КТ и биопсии легкого. Изолированное
снижение дел ~ ранний признак СФА у больных ПМ/ДМ.Фибробронхоскопия вряд ли сможет помочь при диагностике СФА,
поскольку у этих больных изменения слизистой бронхиальною дере¬
ва минимальны. Цель данного исследования — получение ЖБАЛ,
использующейся для последующего цитологического, иммунологи¬
ческою исследования.Исследования ЖБАЛ у больных ПМ/ДМ представлены единич¬
ными работами, однако их авторы также подчеркивают связь между
активно текупшм ал ьвеолитом, изменениями ЖБАЛ и, иногда, весьма
скромными рентгенологическими данными. Собственные исследова¬
ния позволили выявить преимущественно лимфоцитарный характер
альвеолита у больных ПМ/ДМ с СФА.Для окончательной диагностики СФА иногда применяют ЧББ
или открытую биопсию. Однако ЭТА-процедура у больных ПМ/ДМ
в настоящее время применяется редко, учитывая особенности забо¬
левания, прежде всего связанные с нарушениями глубины дыхания,
обездвиженностью больных и опасностью развития у них гипостати-
ческих пневмоний.Таким образом, с помощью применения ряда современных методов
диагностики верификация поражения легких по типу СФА возможна
даже на ранних этапах его формирования.Дифференциальная диагностикаДифференциальная диагностика проводится с ИФА, а также пора¬
жениями легких при другой системной патологии соединительной
ткани.
полимиозит и ДЕРМАТОМИОЗИТ ♦ 365Формулировка диагнозаВарианты формулировки диагноза.• ПМ, подострое течение, активность III степени, с поражением
проксимальных групп мышц конечностей, гортани, грудной
клетки и диафрагмы. Аспирационная пневмония нижней доли
правого легкого (возбудитель Cryptococcus neoformans), средьштяже-
лого течения, ДН П степени.• ДМ, подострое течение, активность П степени I, с поражением
проксимальных групп мышц. Синдром Рейно. Поражение легких
по типу СФА (фаза активного альвеолита — лимфоцитарный тип
воспаления). Выраженная гипоксемия. ДН II степени.ЛечениеТерапия СФА у больных ПМ/ДМ связана с немалыми трудностя¬
ми; отмечено, что лечение глюкокортикоидами СФА при миозите дает
более благоприятные результаты (около 50%), чем при ССД [Насо¬
нов Е.Л., 2003; Антелава О.А, и соавт., 2006]. Терапия СФА, как и при
ИФА, начинается с прсднизолона (1—2 мг/кг массы тела) и продолжа¬
ется в течение 6 нед [Oddis C.V., 2005]. Существует группа больных с
СФА при миозите, отвечающих только на очень высокие дозы нред-
низолона (100-150 мг в сутки и более). Снижение дозы глюкокорти-
коидов можно начинать лишь после улучшения клинико-лаборатор¬
но-инструментальных данных, но весьма постепенно — со скоростью2,5 мг в неделю. Пульс-терапия применяется в случае быстрого про¬
грессирования дисфагии и (или) альвеолита.При отсутствии улучшения от тераіши глюкокортикоидами необ¬
ходимо решать вопрос о присоединении цитостатиков. Среди трех
основных используемых при миозите цитостатиков (метотрексат, аза-
тиоприн, циклофосфамид, циклоспорин А) наиболее приемлемы при
СФА метотрексат и циклофосфамид. К сожалению, проблема выбора
цитостатика перекрещивается с проблемой лекарственно-индуци-
рованного СФА. Токсичность метотрексата в отношении легких не
коррелирует ни с кумулятивной дозой, ни с полом, ни с возрастом
больных. Не исключено, что азатиоприн также может провоцировать
СФА. Этот риск на фоне приема циклофосфамида возникает с куму¬
лятивной дозы 10 г и становится фатальным при дозе 40 г. Ряд авторов
считает, что циклофосфамид представляется менее опасным с точки
366 » ГЛАВА 5. ПОРАЖЕНИЕ ОРГАНОВ ДЫХАНИЯ ПРИ ДИФФУЗНЫХ БОЛЕЗНЯХ...Зрения индукции вторичного (цитостатического) СФА. Существует
мнение, что циклофосфамид помогает преодолевать стероидрезис-
тентносгь и стероидзависимость СФА при миозите. Циклофосфамид
применяется в дозах 100—150 мг в сутки per oj и в качестве пульс-
терапии — 950—1250 мг в сутки [Yoshida Т. et al,, 1999J. Сроки лечения
составляют от 8 до 12 мес. Первые положительные сдвиги появляются
в промежутке от нескольких недель до 3 мес. в последние годы при¬
знается перспективным в лечении ПМ/ДМ применение циклоспори-
на-А (сандиммуна*) и сходного по иммуномодулирующему эффекту
такролимуса^'.Предлагается также введение липидных препаратов в сочетании
с большими дозами иммуносупрессантов [Asanuma Y. et al., 1997],
высокие дозы иммуноглобулина внутривенно (375 мг/кг массы тела)
в сочетании с циклоспорином. В последние годы для лечения ПМ/ДМ
с СФА стали применять ингибиторы TNF, в частности инфликсимаб
[Efthrimion Р. et al., 2006J. Все указанные выше лечебные мероприятия
проводятся на фоне базисной терапии миозитов.ПрогнозПрогноз при поражении легких у больных ПМ/ДМ зависит от вида
легочной патологии, своевременности и адекватности назначенной
терапии. Установление диагноза на стадии формирования «сотового
легкого» или сочетание поражения легких с высоким уровнем анти-
Jol-антител делает прогноз неблагоприятным. Средний срок продол¬
жительности жизни больных ПМ/ДМ с поражением легких без соот¬
ветствующего лечения составляет, по данным ряда авторов, 29 мес от
начала заболевания миозитом.ПрофилактикаДля профилактики или, что более правильно, для ранней диа¬
гностики поражения легких при ПМ/ДМ необходимо включить в
алгоритм диагностики миопатии обязательно раннее рентгенологи¬
ческое исследование (в том числе ВРКТ), изучение ФВД, ДСЛ, анти-
Jol-антител.
Глава 6Болезни накопленияАЛЬВЕОЛЯРНЫЙ ПРОТЕИНОЗАльвеолярный протеиноз (синонимы: альвеолярный
липопротеиноз, альвеолярный фосфолипидоз) — редкое
заболевание неизвестной этиологии, характеризующееся
умеренно прогрессирующей одышкой вследствие накоп¬
ления в альвеолах и мелких дыхательных путях внекле-
точно расположенного белково-липоидного вещества,
дающего положительную PAS-реакцию. Болезнь впервые
описана S.H. Rosen и соавт. в 1958 г. Альвеолярный про¬
теиноз относится к редким заболеваниям и встречается
с частотой от 1 до 4 случаев на 1 млн взрослых [Shah P.L.
ct al., 2000J, преимущественно у лиц среднего возраста
(20-50 лет), причем у мужчин чаще, чем у женщин (3:1).
Описаны случаи заболевания у детей и лиц пожилого
возраста.Этиология и факторы рискаЭтиологию альвеолярного протеииоза следует рас¬
сматривать в зависимости от формы болезни: врожден¬
ная, приобретенная или вторичная (псевдопротеиноз).
Врожденная форма обусловлена мутациями генов, коди¬
рующих структуру белков сурфактанта В и С или р с цепи
рецептора гранулоцитарно-моноцитарного колониести-
мулирующсго фактора (GM-CSF) [dcMello D.E., Lin Z.,
368 • ГЛАВА 6. БОЛЕЗНИ НАКОПЛЕНИЯ2001]. В 90% случаев альвеолярный протеиноз является приобретен¬
ным, или идиопатическим. Вторичный протеиноз может развиться
вследствие двух основных причин:1) инфекции: вирусные, пневмоцистные пневмонии у лиц с имму¬
носупрессией;2) злокачественные заболевания крови.Воздействие таких веществ, как углеводороды, кадмий, титан,
асбест, алюминий, имеет место приблизительно у половины больных
приобретенным альвеолярным протеинозом. Действие экзогенных
поллютантов подтверждается в экспериментах на мышах: ингаляции
солей металлов провоцировали появление в легких изменений, напо¬
минающих альвеолярный протеиноз. В этих моделях пары металлов
вызывали приток альвеолярных макрофагов в альвеолярные про¬
странства, пролиферацию альвеолоцитов II типа и накопление фос¬
фолипидов. Альвеолы заполнялись липопротеиновыми включени¬
ями из гиперплазированных альвеолоцитов II типа и альвеолярных
макрофагов, содержащих фосфолипиды.ПатогенезИзбыточное накопление сурфактантоподобного вещества в аль¬
веолярном пространстве может отражать дисбаланс метаболизма
фосфолипидов: нарушение их клиренса в сочетании с избыточной
продукцией сурфактанта альвеолоцитами II типа. Клиренс или
катаболизм сурфактанта в значительной мере обеспечивается аль¬
веолярными макрофагами. Этот процесс регулируется действием
цитокинов, основным из которых является GM-CSF, Недавние
исследования показали, что основной причиной накопления сур¬
фактанта при альвеолярном протеинозе может служить дефицит
GM-CSF [Mazzone P.J. et al,, 2002]. Экспериментальные данные сви¬
детельствуют, что у мышей, нокаутных по гену GM-CSF или его
рецептору (линии животных с разрушенным геном GM-CSF или
геном р-иепи рецептора GM-CSF/ ИЛ-З/ИЛ-5 (GM-CSF/IL-3/IL-5),
вследствие чего неспособных к синтезу соответствующих белков),
нарушен гомеостаз сурфактанта и в легких выявляются изменения,
сходные с проявлениями альвеолярного протеиноза [Naito М., 2008;
Thomassen M.J. et al., 20071. У таких мышей отмечается значительное
увеличение содержания эозинофильного сурфактантоподобного
материала, а также белков сурфактанта SP-A и SP-B в альвеолах и в
ЖБАЛ. Проявления альвеолярного протеиноза у эксперименталь¬
АЛЬВЕОЛЯРНЫЙ ПРОТЕИНОЗ • 369ных животных в большей степени обусловлены нарушением GM-
CSF-регулируемого клиренса сурфактанта, нежели его повышенным
синтезом [Mazzone P.J. et al., 2002], К снижению клиренса сурфак¬
танта приводят дефекты фагоцитоза, миграции и фаголизосомаль-
ной функции альвеолярных макрофагов, выявленные у больных
протеинозом. Накопление сурфактанта, в свою очередь, ингибирует
функцию альвеолярных макрофагов, что в дальнейшем еще более
подавляет его клиренс.До настоящего времени попытки найти определенные мутации
генов GM-CSF, играющие роль в развитии приобретенного альвео¬
лярного протеиноза, в отличие от врожденной формы заболевания,
не увенчались успехом [Bewig В. et al., 2000]. У новорожденных с
признаками врожденного альвеолярного протеиноза многие исследо¬
ватели описывали различные мутации гена SP-B [Teja К. et al., 1981J.
В исследовании U. Dirksen и соавт. [1997] у троих детей с протеинозом
были выявлены дефекты р-рецептора GM-CSF/IL-3/TL-5 (аналогично
нокаутным моделям мышей) при нормальном уровне SP-B. Однако у
взрослых, больных альвеолярным протеинозом, гены GM-CSF, рецеп¬
тора GM-CSF и уровень мРНК GM-CSF оказались в норме [Bewig В.
et аК, 2000]. Ответ альвеолярных макрофагов на действие GM-CSF
также был не изменен [Carraway M.S. et al., 2000]. Таким образом,
убедительных доказательств связи развития альвеолярного проте¬
иноза у взрослых с мутациями гена GM-CSF и (или) его рецептора
не получено. Более вероятным считается предположение об аутоим¬
мунном механизме альвеолярного протеиноза. Многие исследова¬
тели выявили наличие нейтрализующих аутоантител (IgG) против
GM-CSF в ЖБАЛ и сыворотке больных протеинозом, отсутствующих
как у здоровых доноров, так и у больных другими заболеваниями
легких [Т. Kitamura et al., 2000; Seymour J.F. et al., 2001; Sergeeva A.
et al., 2008], что в большинстве случаев объясняет механизм наруше¬
ния GM-CSF-зависимого клиренса сурфактанта при альвеолярном
протеинозе.Однако не все случаи альвеолярного протеиноза могут быть
объяснены наличием нейтрализующих антител против GM-CSF.
Гомеостаз сурфактанта — комплексный процесс, его синтез и рас¬
пад регулирует множество различных цитокинов. В частности, in
vitro выявлено, что избыточный синтез ИЛ-4 клетками Клара ведет
к увеличению синтеза сурфактанта и появлению изменений, напо¬
минающих данный протеиноз. Кроме того, доказано, что к наруше¬
нию метаболизма сурфактанта может вести повышение активности
370 • ГЛАВА 6. БОЛЕЗНИ НАКОПЛЕНИЯИЛ-10, fn vitro под действием ИЛ-10 концентрация GM-CSF в сыво¬
ротке резко снижается, а после обработки анти-ИЛ-10-антите-
лами — увеличивается. In vivo определено, что при альвеолярном
протеинозе значительно повышено содержание ИЛ-10 и уровень его
мРНК. Таким образом, дефицит GM-CSF при альвеолярном протеи¬
нозе может возникать в результате ингибирования его синтеза ИЛ-10.
Интересно, что максимально высокий уровень экспрессии ИЛ-10
отмечается у больных, не отвечающих на терапию рекомбинантным
GM-CSF, что позволяет считать ИЛ-10 предиктором ответа на тера¬
пию GM-CSF.Патологическая анатомияНа поверхности легких определяются серовато-белые плотные
бугорки в виде зерен. Легкие уплотнены, альвеолярные пространства
и респираторные бронхиолы заполнены гранулярным, аморфным
ацидофильным содержимым. Альвеолярные перегородки обычно не
изменены. Признаков воспаления или фиброза не обнаруживается,
однако отмечается гиперплазия альвеолоцитов 11 типа. Материал,
содержащийся в альвеолах, включает сурфактантоподобное вещес¬
тво. Это фосфолипиды, которые дают яркий пурпурный цвет при
окрашивании реактивом Шиффа (PAS-реакция) и не окрашиваются
Alcian blue (рис. 6.1, 6.2, см. цв. вклейку) [Shah P.L. et al., 2000],Изменения выявляются преимущественно в субплевральных отде¬
лах легких. Близлежащие участки легочной ткани поражаются нерав¬
номерно: часть альвеол может быть заполнена белково-липоидньгм
материалом, а в соседних участках могут обнаруживаться лишь мел¬
кие вкрапления белкового вещества и абсолютно интактные (непора¬
женные) участки. Наряду с этим определяются гиперплазированные
и гипертрофированные альвеолоциты II типа.ЖБАЛ имеет характерные особенности. Это маслянистая, неп¬
розрачная, молочно-белая, иногда желтоватая жидкость, которая
образует белый осадок при отстаивании. В ЖБАЛ также обнаружива¬
ется значительное количество PAS-положительных, эозинофильных
бесклеточных телец и альвеолярных макрофагов, содержащих грану¬
лярный эозинофильный материал в фаголизосомах или цитоплазме.
Повышено содержание белков сурфактанта SP-A, SP-D, что выявляет¬
ся при помощи иммуногистохимических методов, практически у всех
больных в сыворотке крови и ЖБАЛ выявляются антитела к GM-CSF
[Kttamura Т, et al., 2000]. Повышение содержания таких веществ, как
АЛЬВЕОЛЯРНЫЙ ПРОТЕИНОЗ * 371карциноэмбриональный антиген, цитокератин 19, муциноподобный
їликопротеин KL6, МСР-1 [Kobayashi М. et al., 2008; lyonaga К. et al.,
1999] в ЖБАЛ и в сыворотке крови также выявляются при альвеоляр¬
ном протсинозе, однако эти изменения неспецифичны и прогности¬
ческое значение их уровня остается неясным.При электронной микроскопии выявляются альвеолярные макро¬
фаги, заполненные фаголизосомами, комплексными включениями,
ламеллярными тельцами, каплями холестерола липидов [Shah P.L.
et al., 2000J. Концентрические ламеллярные тельца, содержащие фос¬
фолипиды, тубулярный миелин и миелиновые структуры в альвео¬
лярных пространствах и в ЖБАЛ, являются патогномоничными для
альвеолярного протеиноза.Клиническая картинав течение длительного времени заболевание протекает бессим¬
птомно и нередко выявляется случайно при профилактическом
флюорографическом исследовании. Ведущим клиническим призна¬
ком болезни является медленно прогрессирующая одышка, которая
может сопровождаться сухим или со скудной мокротой кашлем,
субфебрильной температурой, болями в груди, похуданием, быстрой
утомляемостью, изредка больные отмечают кровохарканье. При про¬
грессировании ДН отмечается цианоз. Периоды обострения болезни,
сопровождающиеся ухудшением общего самочувствия и лихорадкой,
следует рассматривать, вероятно, как присоединение суперинфекции,
а не как обострение основного заболевания.Течение болезни, как правило, хроническое, однако описаны и
острые формы. По мере прогрессирования хронической формы аль¬
веолярного протеиноза усиливается цианоз, формируются «пальцы
Гиппократа». Похудание— непостоянный симптом. Из осложне¬
ний следует отметить присоединение бактериальной или грибковой
суперинфекции, развитие легочной гипертензии и формирование
в терминальной стадии легочного сердца.ДиагностикаДиагностика альвеолярного протеиноза трудна, вследствие чего
срок между началом заболевания и установлением диагноза нередко
составляет несколько лет. Патогномоничные клинические признаки
при протеинозе отсутствуют.
372 ♦ ГЛАВА 6. БОЛЕЗНИ НАКОПЛЕНИЯДаниы€лабораторногоисследования(клиничсскийанализ перифери¬
ческой крови, показатели иммунного и биохимического статуса) неспе¬
цифичны. Повышение активности сывороточной лактатдегидрогеназы
отмечается у 80% больных. Степень гипокссмии зависит от тяжестизаболевания. При физикальном
обследовании больных альвео¬
лярным протеинозом определяет¬
ся укорочение перкуторного тона
преимущественно над нижними
легочными полями. Аускультация
выявляет ослабленное везикуляр¬
ное дыхание, иногда— нежные
крепитируюшие хрипы.Лучевая диагностика. На рент¬
генограм мах у больных альвеоляр¬
ным протеинозом определяются
мелкоочаговые (мелкоточечные)
затенения, имеющие тенденцию
к слиянию (рис. 6.3). Изменения
двусторонние,симметричные,пре¬
имущественная локализация —
средние и нижние легочные поля.
Асимметричные или односто¬
ронние изменения встречаются в15-20%. КТ помогает детализиро¬
вать изменения, видимые на рент¬
генограммах, и выявить участки
«матового стекла», четко отграни¬
ченные от неизмененной легочной
ткани — симптом «географичес¬
кой карты», а также полигональ¬
ные утолщенные междольковые
перегородки — симптом «булыж¬
ной мостовой» или crazy paving
(рис. 6.4).Корреляция меж^ду клиничес¬
кими и рентгеїюлогическими дан¬
ными отсутствует; выраженные
рентгенологические изменения
могут сопровождаться лишь скуд-Рис. 6.3. Рентгенологическая кар¬
тина альвеолярного прогеиноза.
Двусторонние мелкоочаговые зате¬
нения, имеющие тенденцию к слия¬
нию, локализоватптые преимущест¬
венно в средних легочных поляхРис. 6.4. Компьютерная томограм¬
ма легких у больного альвеолярным
протеинозом. Отграниченные учас¬
тки «матового стекла» ~ симптом
«географической карты»; утолщен¬
ные междольковые перегородки —
симптом «булыжной мостовой»
АЛЬВЕОЛЯРНЫЙ ПРОТЕИНОЗ • 373НОЙ клинической симптоматикой. В далеко зашедших стадиях заболева¬
ния могут выявляться распространенные фиброзные изменения.Показатели ФВД могут быть в пределах нормы, но по мере прогресси¬
рования болезни выявляется тенденция к формированию рестрикти вного
синдрома: снижается ДСЛ, усиливается гипоксемия.Фибробронхоскопия не выявляет каких-либо признаков, характер¬
ных для альвеолярного протсиноза, однако исследование лаважной
жидкости часто помогает поставить правильный диагноз. ВЖБАЛ
патогномоничным для данного протеиноза является многократное
(в 10—100 раз) увеличение содержания белка, а также выявление бескле-
точной глобулярной субстанции, имеющей положительную PAS-peax-
цию. При исследовании материала биопсии легочной ткани в альвеолах
также выявляется материал, дающий пурпурный или лилово-красный
НІЗЄ1 при окраске его реактивом Шиффа. Однако следует отметить, что
окрашивание реактивом Шиффа не позволяет отдифференцировать пер¬
вичный протеиноз от вторичного: PAS-реакция положительна в обоих
случаях. Более специфичной считается реакция с иммунопероксидазой,
которая всегда положительна у больных с первичным альвеолярным
протеинозом. Реакция больных ЭТА оказывается положительной при
исследовании не только биопсийного материала легочной паренхимы,
но и лаважной жидкости. У больных с вторичным протеинозом реак¬
ция с иммунопероксидазой отрицательна. В осадке лаважной жидкости
очень низкое содержание альвеолярных макрофаюв, которые в боль¬
шинстве своем содержат эозинофильные зернистые включения. Наряду
с этим в осадке могут определяться мелкие эозинофильные зерна, рас¬
положенные внеклеточно. Патогномоничным для альвеолярного про-
гсиноза является обнаружение в альвеолах и альвеолярных макрофагах
при электронной микроскопии сурфактанта в виде пласгинчатых телец
с наличием характерных остроконечных отверстий — следов выделив¬
шихся во время обработки материала кристаллов холестерина.Формулировка диагнозаАльвеолярный протеиноз, хроническое (острое) течение. ДН
(степень).Дифференциальная диагностикаДифференциальную диагностику следует проводить в первую оче¬
редь с вторичным протеинозом, являющимся осложнением других
374 • ГЛАВА 6. БОЛЕЗНИ НАКОПЛЕНИЯ(чаще всего гематологических) заболеваний. Первичный альвеоляр¬
ный протеиноз отличается от вторичного равномерным окрашива¬
нием содержащегося в альвеолах PAS-положительного вещества, в
то время как для вторичного протеиноза характерно гранулярное
(очаговое) окрашивание. Дополнительным диагностическим тестом
является реакция с иммунопероксидазой.Альвеолярный протеиноз следует дифференцировать с саркои-
дозом, диссеминированным туберкулезом легких, нередко прояв¬
ляющимся субклинически. Изучение рентгенологического архива и
выявление лимфаденопатии средостения на начальных этапах болез¬
ни позволяет исключить альвеолярный протеиноз, для которого уве¬
личение лимфатических узлов средостения нехарактерно. Проведение
целого ряда исследований (микробиологических, серологических,
эндоскопических, цитологических, лучевых) в большинстве случаев
позволяет исключить или подтвердить специфическую природу забо¬
левания. Однако этих исследований недостаточно для верификации
диагноза альвеолярного протеиноза. Трудности диагностики нередко
являются причиной ошибочной лечебной тактики. Как правило,
больные альвеолярным протеинозом лечатся в учреждениях фтизиат¬
рического профиля, получая противопоказанную им противотубер¬
кулезную терапию. Только гистологическое исследование материала
биопсии легочной ткани дает возможность избежать досадных диаг¬
ностических ошибок, наносящих вред здоровью больных. Нередки
случаи, когда выявляемые при профилактическом флюорографичес¬
ком исследовании мелкоочаговые (мелкоточечньте) затенения (иногда
сливающиеся и создающие картину инфильтрации) с обеих сторон
расцениваются врачом как двусторонняя пневмония. И это, несмотря
на отсутствие каких-либо жалоб, хотя бы отдаленно напоминающих
пневмонию, нормальные показатели клинического анализа крови,
нормальную температуру тела. После безуспешного лечения анти¬
бактериальными препаратами больных направляют для дальнейшего
обследования и лечения в противотуберкулезные стационары.ЛечениеПри альвеолярном протеинозе противопоказано назначение анти¬
бактериальных, глюкокортикоидных препаратов, иммуносупрессан-
тов в связи с их неэффективностью. Единственным эффективным
методом лечения больных протеинозом является лечебный БАЛ,
который применяется с 1965 г. Процедура проводится под общим
АЛЬВЕОЛЯРНЫЙ ПРОТЕИНОЗ • 375обезболиванием. Одно легкое вентилируется кислородом через двух-
просветную трубку, а второе легкое (доля, сегменты) промывается
теплым (температуры тела) стерильным изотоническим раствором,
содержащим ферменты (ацетилцистеин, стрептаза, стрептокиназа,
химотрипсин и др.), гепарин. Общий объем жидкости зависит от
объема промываемого участка (сегмент, доля, легкое) и составляет
от 1 до 10 литров и более. Средняя длительность процедуры 3-5 ч
[Shah P.L. et al., 2000]. В результате эффективно проведенного лечеб¬
ного БАЛ получают мутную жидкость с образованием после отстаи¬
вания беловатого цвета осадка (рис. 6.5, см. цв. вклейку). Уменьшается
одышка, улучшаются показатели ФВД и газов крови, определяет¬
ся положительная динамика рентгенологических изменений. Как
показывает опыт, процедура БАЛ в достаточной мере безопасна.
Возможные осложнения: пневмоторакс, отек легких, бронхоспазм,
утяжеление ДН, аспирационная пневмония. Мониторньтй контроль
напряжения кислорода в артериальной крови, концентрации электро¬
литов и центрального венозного давления показан у больных с выра¬
женной легочной и сердечной недостаточностью. Лечебный БАЛ —
процедура высокоэффективная. Клиническое, функциональное
и рентгенологическое улучшение отмечается у 75—95% больных
[Shah P.L. et al., 2000] (рис. 6.6). Дать конкретные рекомендации о
частоте лечебного БАЛ трудно, так как у некоторых пациентов послебРис. 6.6. Динамика изменений компьютерной томограммы после выполне¬
ния лечебного лаважа у больного альвеолярным протеинозом:
а — до процедуры;
б — после проведения процедуры
376 • ГЛАВА 6. БОЛЕЗНИ НАКОПЛЕНИЯпервой процедуры отмечается длительное улучшение и даже выздо¬
ровление, у других больных белково-липоидное вещество накаплива¬
ется вновь, однако с разной скоростью.Лечебный БАЛ является пока методом выбора при альвеолярном
протеинозе. Назначение йодистых препаратов, ингаляций фермен¬
тов, а также ограниченных по протяженности промываний через
фибробронхоскоп неэффективно.Недавно были получены предварительные результаты клиничес¬
ких исследований применения GM-CSF в лечении больных альве¬
олярным протеинозом. Ежедневное подкожное введение препарата
было эффективно у части больных [Mazzone P.J. etal., 2002; Seymour J.F.
et al,, 2001; Kavuru M.S. et al., 20001, введение его в аэрозольной форме
было успешным лишь в одном случае IMazzone P.J. et al., 2002]. Эти
данные обнадеживают, однако оптимальная доза, путь введения,
длительность терапии окончательно не определены, также как и дли¬
тельность ремиссии заболевания на фоне терапии GM-CSF.Лечение врожденных форм альвеолярного протеиноза поддержива¬
ющее, хотя имеются отдельные сообщения об успешной транспланта¬
ции легких [Hamvas А. et al., 1997J. Терапия вторичного альвеолярного
протеиноза подразумевает лечение основного заболевания. В этих
случаях целесообразность выполнения лечебного БАЛ представляется
сомнительной. Так, например, при альвеолярном протеинозе, развив¬
шемся на фоне гематологического заболевания, успешная химиоте¬
рапия последнего или трансплантация костного мозга значительно
уменьшают выраженность изменений в легких [Ladeb S. et al., 1996].Прогнозпрогноз при альвеолярном протеинозе, как правило, благоприят¬
ный: течение болезни доброкачественное, очень медленно прогрес¬
сирующее. Смерть может наступить вследствие присоединения бак¬
териальной или грибковой суперинфекции, чему в немалой степени
способствует дефект хемотаксиса, имеющий место у больных проте¬
инозом, а также неправильное лечение. Анализ отдаленных резуль¬
татов лечения 343 больных альвеолярным протеинозом [Seymour J.F.
et al., 2002] показал, что пятилетняя выживаемость составила около
75%, Летальные исходы в 72% были обусловлены ДН, развившейся
вследствие основного заболевания, и около 20% — в результате присо¬
единения инфекции. Спонтанная ремиссия наблюдается, по данным
разных авторов, в 10—30% случаев.
АМИЛОИДОЗ ЛЕГОЧНЫЙ (БРОНХОЛЕГОЧНЫЙ) » 377АМИЛОИДОЗ ЛЕГОЧНЫЙ (БРОНХОЛЕГОЧНЫЙ)Амилоидоз легочный — системное заболевание, характеризующее¬
ся внеклеточным отложением в паренхиме легких, стенках сосудов,
слизистой оболочке дыхательных путей, плевре, лимфатических узлах
средостения продуктов нарушения белкового обмена: нерастворимых
депозитов р-фибриллярных белков в виде складчатых пластинок.
Наряду с бронхолегочной системой в патологический процесс могут
вовлекаться многие другие органы и тканевые структуры. Мужчины
болеют чаще, чем женщины (2:1). В большинстве случаев заболевание
развивается после 40 лет.Этиология и факторы рискаЭтиология заболевания неизвестна. Выделяют:— первичный амилоидоз, по-видимому, представляющий собой
врожденную ферментопатию, наследуемую аутосомно-доми¬
нантным путем;— вторичный амилоидоз, развивающийся на фоне хронических
заболеваний (остеомиэлит, коллагеновые заболевания, тубер¬
кулез и др.), а также на фоне заболеваний, характеризующихся
выраженными иммунопатологическими нарушениями (сыво¬
роточная болезнь, неспецифический язвенный колит и др.);— идиопатический;— сенильный амилоидоз.Предполагается также, что в развитии амилоидоза важную роль
могут играть нарушения клеточного иммунитета. Некоторые авторы
отмечают общность между легочным амилоидозом и миеломной болез¬
нью: нарушение синтеза иммуноглобулинов. Данные о семейном пред¬
расположении к легочному амилоидозу в литературе отсутствуют.ПатогенезКак уже упоминалось, важная роль в возникновении легочного
амилоидоза отводится нарушениям клеточного иммунитета: угнете¬
ние синтеза Т-лимфоцитов (в первую очередь супрессоров) обуслов¬
ливает выход из-под контроля В-клеток, что ведет к гиперсинтезу
иммуноглобулинов и циркулирующего в крови гликопротеина —
амилоидного Р-компонента (SAP) — предшественника амилоида. Это
предопределяет появление в крови белка амилоидных фибрилл, кото¬
378 • ГЛАВА 6. БОЛЕЗНИ НАКОПЛЕНИЯрый, соединяясь с белками сыворотки крови, поглощается макрофа¬
гами и откладывается в органах и тканях в виде амилоида. Считается,
что наиболее вероятным местом образования амилоидных фибрилл
являются ретикулоэндотелиальные клетки селезенки.Патологическая анатомияЛокализованный амилоидоз трахеи (бронхов) макроскопически
характеризуется выступанием пораженных участков в просвет в виде
гладких серовато-беловатых возвышений на широком основании,
покрытых интактным эпителием, иногда с признаками метаплазии.
Диффузная инфильтрация стенок трахеи и бронхов, а также пери-
бронхиальиой соединительной ткани амилоидом ведет к значитель¬
ному уменьшению просвета мелких бронхов.Для солитарной формы амилоидоза характерно образование одного или
нескольких очаговых (псещюопухолевых) отложений амилоида в паренхи¬
ме одного или обоих легких. Диффузный амилоидоз (часто являющийся
проявлением генерализованного первичного амилоидоза) характеризуется
отложением амилоида в межальвеолярных перегородках, вокруг капилля¬
ров, артериальных и венозных сосудов, вызывая их сужение и запустевание.
Амилоидные отложения могут обызвествляться и окостеневать.Амилоид дает положительную окраску Конго красным. При
исследовании биопсийного материала в поляризационном микро¬
скопе выявляется яблочно-зеленое свечение и двойное преломление.
Идентифицировано несколько типов амилоидных белков, встреча-
юш;ихся при разных типах амилоидоза. Первичный амилоидоз ассо¬
циируется с отложением фрагментов легких цепей иммуноглобулина
(амилоид AL) и может быть идиопатическим или ассоциироваться с
патологией плазматических клеток (например, множественная миело-
ма). Вторичный амилоидоз ассоциируется с амилоидом АА и, как пра¬
вило, является осложнением хронических воспалительных заболева¬
ний (туберкулез, остеомиэлит, бронхоэктатическая болезнь, малярия,
коллагеновые и другие хронические воспалительные заболевания).Клиническая картинаСимптомы и течение амилоидоза зависят от его формы. Заболевание
встречается чрезвычайно редко и может поражать любой орган, одна¬
ко встречается преимущественно в верхних дыхательных путях, сер¬
дце, почках, желудочно-кишечном тракте, языке, суставах, печени.
АМИЛОИДОЗ ЛЕГОЧНЫЙ (БРОНХОЛЕГОННЫЙ) • 379селезенке, нервной системе. Амилоидоз может быть локализованным,
если амилоид откладывается в пределах органов одной системы, или
генерализованным. В группу генерализованного относится амило¬
идоз, ассоциированный с иммуноклеточной дискразией, миеломой;
ассоциированный с хроническими воспалительными заболевания¬
ми; реактивный системный амилоидоз, наследственные синдромы
(преимущественно нейропатические, нефропатические или кардио-
миопатические формы), а также старческий системный амилоидоз.
Поражение языка (мегалоглоссия) является классическим и срав¬
нительно частым проявлением амилоидоза. Вторичный амилоидоз
развивается на фоне других заболеваний, имеющих непосредственное
отношение к возникновению амилоидоза: опухолевые поражения
различной локализации, бронхоэктазы, остеомиелит, сифилис, маля¬
рия, хронические инфекции, коллагеновые болезни, парапротеине-
ми ческие гемобластозы.При трахеобронхиальном амилоидозе возникают жалобы на над¬
садный сухой кашель, затрудненное (свистящее) дыхание. Может
быть кровохарканье вследствие отложения амилоида в стенках сосу¬
дов. Нарушение дренажной функции бронхов ведет к ателектазу соот¬
ветствующего участка, рецидивирующему воспалительному процессу
[Илькович М.М., 2005J. Отложение амилоида в трахее и гортани кли¬
нически проявляется охриплостью голоса. Узловой паренхиматозный
амилоидоз — это медленно растущие одиночные или множественные
узлы диаметром 0,5—5,0 см, хотя описаны и более крупные узлы.
Приблизительно в одной трети случаев узлы кальцифицируются
или в них образуются полости. Системные проявления отсутствуют.
Солитарные отложения амилоида в паренхиме легких, как правило,
бессимптомны и определяются только при рентгенологическом иссле¬
довании. Множественная узловая форма сопровождается медленно
прогрессирующей одышкой, кашлем, иногда умеренно выраженным,
но рецидивирующим кровохарканьем. Повышение температуры тела
для амилоидоза нехарактерно.Диффузный амилоидоз стенок альвеол, интерстиция обычно
встречается в сочетании с первичным системным амилоидозом или
миеломной болезнью и протекает крайне тяжело: прогрессирующая
одышка, рефрактерная к какому-либо лечению, кашель, рециди¬
вирующее кровохарканье. При аускультации легких — крепитация.
Поражение миокарда (как проявление системности) ведет к застойной
сердечной недостаточности. Боли в груди могут указывать на пора¬
жение плевры. Описаны случаи синдрома верхней полой вены, а при
380 • ГЛАВА 6. БОЛЕЗНИ НАКОПЛЕНИЯпоражении прикорневых и внекорневых лимфатических узлов — кли¬
нические проявления дисфагии.При длительном течении бронхолегочный амилоидоз может ослож¬
няться легочной гипертензией вследствие поражения сосудистого
русла амилоидными отложениями и формированием легочного сер¬
дца. в качестве осложнений описаны также инфаркт легкого, гемото¬
ракс, легочное кровотечение. Кальцификация пораженных участков
может быть причиной трансформации амилоидоза в остеопластичес-
кую трахеобронхопатию как исход болезни.Течение болезни медленно, но неуклонно прогрессирующее.КлассификацияКлассификация первичного бронхолегочного амилоидоза [De-
medts М., Thomer М., 2000] включает следующие формы:— трахеобронхиальный амилоидоз;— узловой паренхиматозный амилоидоз;— диффузный амилоидоз стенок альвеол, интерстиция;— орофарингеальный амилоидоз с макроглоссией;— амилоидоз лимфатических узлов ворот легкого и (или) средос¬
тения;— амилоидоз плевры;— амилоидоз сосудов легких.Наиболее распространенной формой является трахеобронхиаль¬
ный амилоидоз, который может быть локальным или диффузным, но
без системных проявлений. Отложение амилоида в плевре и медиа-
стинальных лимфатических узлах встречается крайне редко.ДиагностикаДиагностика бронхолегочного амилоидоза трудна из-за отсутствия
патогномоничных клинических признаков. Больные с субмукоидным
отложением амилоида в течение многих лет лечатся с ошибочным
диагнозом хронической обструктивной болезни легких или брон¬
хиальной астмы. Данные объективного обследования, как правило,
малоинформативны. У больных с поражением трахеобронхиального
дерева выслушиваются сухие свистящие хрипы. При отложении ами¬
лоида в стенках альвеол может выслушиваться крепитация.Лабораторная диагностика. У больных амилоидозом изменяются био¬
химические показатели крови; определяются гипергаммаглобулинемия,
АМИЛОИДОЗ ЛЕГОЧНЫЙ (БРОНХОЛЕГОЧНЫЙ) • 381Рис. 6.7. Амилоидоз легких пер¬
вичный. Множествеиные очаговые
затенения с обеих сторон на фоне
усиления легочного рисунка за счет
интерстицияснижение альбумин-глобулино-
вого коэффиииента за счет повы¬
шения грубодисперсных фрак¬
ций белка; гиперхолестеринемия,
гиперфибриногенемия, повыше¬
ние уровня щелочных фосфатаз,
повышение СОЭ. Иногда опреде¬
ляется тромбоцитоз (в особенно¬
сти при генерализованной форме
амилоидоза). Перечисленные изме¬
нения лабораторных показате¬
лей неспецифичны. С помощью
иммуноэлектрофореза в сыворотке
крови и моче часто определяются
моноклональные IgM и IgG.Лучевая диагностика. Рент¬
генологическое исследование при
диффузном трахеобронхиальной
амилоидозе выявляет усиление
бронхиального рисунка за счетуплотнения стенок бронхов. Узловые формы амилоидоза выявляют¬
ся, как правило, при профилактическом флюорографическом иссле¬
довании; они имеют вид одиночных или округлых множественных
затенений с четкими контурами, в диаметре от 1 до 5 см. При выяв¬
лении внутри упомянутых затенений просветлений или кальцинатов
дифференциальную диагностику следует проводить с карцинома-
тозом легких при остеогенной саркоме, гамартомой, эхинококковой
кистой.Диффузный амилоидоз легких рентгенологически проявляется
усилением легочного рисунка (синдром заполнения альвеол) или
диффузными мелкоочаговыми затенениями (рис. 6.7). Определение
на рентгенограммах утолщения плевры, увеличен ных лимфатических
узлов с тенденцией к их обызвествлению также может свидетельство¬
вать об их поражении. Отложение амилоида на поверхности плевры
может стать причиной плеврального выпота, нередко геморрагичес¬
кого.Нарушение ФВД зависит от формы амилоидоза: при трахеоброн¬
хиальном амилоидозе выявляются обструктивные нарушения, при
диффузном амилоидозе легких — рестриктивный синдром и диффу¬
зионные нарушения.
382 * ГЛАВА 6. БОЛЕЗНИ НАКОПЛЕНИЯЭндосЕопическое исследование при трахеобронхиальном амилои-
дозе выявляет отечную слизистую с грубыми складками (так назы¬
ваемая булыжная мостовая), на фоне которых видны белесоватые
бляшки в подслизистом слое, реже — опухолевидные полипы.Диагноз может быть верифицирован только при гистологичес¬
ком исследовании биопсийного материала легких (трахеи, бронхов).
Окраска полученного материала Конго красным резко положитель¬
ная, Микроскопия в поляризационном микроскопе выявляет аморф¬
ное вещество с двоякопреломляющими зеленоватого цвета волокнами
амилоида. Жалобы больного на ощущения тяжести в эпигастральной
области после еды, диспепсические расстройства, тупые или спасти¬
ческие боли в животе, запоры или упорные поносы служат основани¬
ем для исключения амйлоидоза желудка, кишечника.Единственным достоверным методом диагностики является био¬
псия пораженных органов и тканей. При окраске срезов Конго крас¬
ным, метиленовым синим в материале биопсий обнаруживают амило¬
ид. Для подтверждения диагноза используется также функциональная
проба: внутривенное введение Конго красного и метиленового синего
характеризуется быстрым исчезновением красок из кровяного русла и
резким снижением выделения их с мочой вследствие фиксации кра¬
сок амилоидом. Однако при первичном амилоидозе такой результат
непостоянен. При подозрении на первичный амилоидоз показан тща¬
тельный генетический анализ, в частности выявление амилоидоза
у родственников.Формулировка диагноза— амилоидоз трахеи (бронхов) солитарньтй, множественный;— амилоидоз трахеи (бронхов) диффузный;— амилоидоз легких солитарный;— амилоидоз легких диффузный, легочная недостаточность (сте¬
пень);— амилоидоз плевры;— амилоидоз медиастинальных лимфатических узлов.Дифференциальная диагностикаЛокализованные формы амилоидоза следует отличать от бронхо¬
генного рака, аденомы бронха, туберкулеза, туберкулемы. Диффузную
форму амилоидоза легких необходимо дифференцировать с альвеол¬
АМИЛОИДОЗ ЛЕГОЧНЫЙ (БРОНХОЛЕГОЧНЫЙ) • 383ярным протеинозом, саркоидозом легких, пневмокониозами и дру¬
гими из л. Медленное прогрессирование выявленных изменений в
легких, тенденция к кальцификации и явное несоответствие между
выраженными изменениями на рентгенограммах и вполне удовлет¬
ворительным состоянием больных свидетельствуют в пользу амило-
идоза. Наличие у пациента хронических воспалительных заболева¬
ний или иммунопатологических состояний позволяет предположить
наличие вторичного амилоидоза.Лечениек настоящему времени в литературе отсутствуют данные о возмож¬
ности проведения этиологической или патогенетической терапии.
Глюкокортикоиды и цитостатики противопоказаны, так как возника¬
ющее при этом угнетение функции иммунной системы способствует
амилоидогенезу. Получен определенный положительный эффект при
назначении препаратов 4-аминохиполинового ряда. Имеются отде¬
льные сообщения о применении унитиола.Солитарные амилоидные образования удаляют оперативным
путем, что является единственным радикальным методом лечения
локализованных форм амилоидоза (циркуляторная резекция бронха
или лобэктомия). в ряде случаев локальные образования в бронхах
могут быть удалены при эндоскопии. Прогрессирующий стридор
может быть показанием для проведения трахеотомии и установления
трахеостомы. Рецидивы возникают редко. Перспективно использо¬
вание лазерной коагуляции. При наличии вторичного амилоидоза
показано активное лечение основного заболевания. Показана симп¬
томатическая терапия; поливитамины, диуретические средства (при
выраженных отеках), переливание плазмы крови и др.Прогнозпрогноз при локальных формах амилоидоза благоприятен.
Диффузные формы амилоидоза трахеи и бронхов у 30% пациентов в
течение 5 лет приводят к летальному исходу вследствие ДН, асфиксии,
кровотечения. Узловой паренхиматозный амилоидоз легких про¬
гностически благоприятен. Прогноз неблагоприятен при диффузном
амилоидозе легких: продолжительность жизни менее 2 дет. В такие
же сроки летальный исход наступает при поражении сердца, почек,
нервной системы. В то же время описаны случаи 15-летней выжива¬
384 • ГЛАВА Б. БОЛЕЗНИ НАКОПЛЕНИЯемости. Смерть больных системным амилоидозом может наступить
от дыхательной недостаточности, истощения, почечной, сердечной
недостаточности.ПрофилактикаПрофилактика первичного амилоидоза легких не разработана.ПНЕВМОПАТИЯ ОСТЕОПЛАСТИЧЕСКАЯПневмопатия остеошгастическая {синонимы: остеохондропатия
легких, окостенение легочной ткани, легочная оссификания) — ред¬
кое заболевание, сопровождающееся патологическим образованием
хрящевой и трабекулярной костной ткани в слизистой оболочке тра¬
хеи и бронхов или в легочной ткани.ЭпидемиологияВ настоящее время в мире зарегистрировано более 140 случаев забо¬
левания. Идиопатическая ветвистая форма поражает мужчин старшего
возраста. Туберозная (узловая) форма остеохондропатии легких наблю¬
дается чаще у более молодых лиц с митральным стенозом.Этиология и факторы рискаЭтиология заболевания неизвестна, однако можно предположить
роль факторов окружающей среды, в частности холодового пораже¬
ния легких. Описанные семейные случаи остеохондропатии легких не
исключают генетически детерминированного характера заболевания.ПатогенезПатогенез до конца не изучен. Костная ткань постепенно форми¬
руется из элементов соединительной ткани. Коллагеновые волокна
образуют пучки, набухают, гиалинизируются, а местами и обызвест-
вляются. Фибробласты, оказавшиеся замурованными в измененной
соединительной ткани, тоже претерпевают преобразование. Ядро
ПНЕВМОПАТИЯ ОСТЕОПЛАСТИЧЕСКАЯ * 385ИХ уменьшается, цитоплазма приобретает грубое сетчатое строение,
также уменьшается в объеме. Клетка становится маленькой, угло¬
ватой- В дальнейшем в костные пластинки врастают кровеносные
сосуды с рыхлой соединительной тканью, давая начало образованию
костномозговых полостей и элементов костного мозга.Патологическая анатомияПри макроскопическом исследовании обращает на себя внимание
увеличение массы легких, определяются мелкие костные выступы,
которые при разрезе издают треск в результате надломов костных
пластинок. Микроскопически по ходу бронхов, сосудов, между аль¬
веолами определяются тонкие полоски костной ткани, нередко с
элементами костного мозга. В редких случаях костная ткань распола¬
гается внутри альвеол. Костные тяжи образуют сеть, в петлях которой
находится легочная ткань, местами фиброзированная.Клиническая картинаНа ранних стадиях остеопластическая пневмопатия может про¬
текать бессимптомно. Наиболее часто встречающиеся симптомы —
медленно прогрессирующая одышка смешанного характера, кашель,
сухой или со скудной слизистой мокротой, иногда кровохарканье,
возможны спонтанные пневмотораксы.КлассификацияМожно выделить три формы остеопластической пневмопатии:1) узловую (туберозную), которая характеризуется формированием
единичных костных образований диметром 2—3 см в небольшом
участке легкого;2) ветвистую с образованием ветвящихся костных балок;3) диффузную, которая проявляется сплошным, массивным пора¬
жением легких.Принято различать первичную (идиопатическую) остеопластичес-
кую пневмопатию и вторичную оссификацию легких, которая может
выявляться у больных с приобретенными пороками сердца, а также
сопровождать обызвествление легочной ткани при туберкулезном
процессе, секвестрации и некоторых других заболеваниях.
386 • ГЛАВА 6. БОЛЕЗНИ НАКОПЛЕНИЯДиагностикаНа рентгенограммах и КТ наиболее часто определяются распростра¬
ненные интерстициальные изменения в виде ветвящихся линейных
теней, довольно интенсивной плотности; изменения прогрессируют
медленно, в некоторых случаях обнаруживаются множественные рас¬
пространенные очаговые тени различной величины, плотные, с четки¬
ми гладкими или неровными контурами. При узловатой форме заболе¬
вания выявляются отдельные образования округлой или причудливой
формы, неоднородной структуры с включениями интенсивной плот¬
ности. По мере прогрессирования заболевания выявляется пневмо¬
фиброз и (или) буллезные вздутия, при исследовании ФВД выявляются
вентиляционные нарушения обструктивного или смешанного характе¬
ра, снижение дел и постепенно прогрессирующая гипоксемия. В связи
с отсутствием патогномоничных клинических и рентгенологических
признаков заболевания достоверная диагностика возможна только на
основании гистологического исследования биопсийного материала,
полученного при видеоторакоскоп и ческой биопсии легких или откры¬
той биопсии легкого [Илькович М.М., 2005].Дифференциальная диагностикаОстеопластическую пневмопатию следует дифференцировать с дру¬
гими болезнями накопления (альвеолярный микролитиаз легких, брон¬
холегочный амилоидоз), а также с диссеминированным туберкулезом
легких, пневмокониозами, гистоплазмозом, идиопатическим или вто¬
ричным гемосидерозом легких и метастатическим процессом в легкие,
сопровождающимся гетеротопическим образованием костной ткани.ЛечениеСимптоматическое, при узловой форме возможно применение
хирургических методов.ПрогнозОпределяется степенью прогрессирования патологического про¬
цесса и выраженностью ДН.ПрофилактикаПрофилактика пневмонатии остеопластической не разработана.
Глава 7
Легочные диссеминации
опухолевой природыБРОНХИОЛОАЛЬВЕОЛЯРНЫЙ РАК ЛЕГКОГОБронхиалоальвеалярныйрак легкого (БАР) — один из пяти
основных подтипов аденокарииномы легкого (немелкок¬
леточный рак легкого). Под этим на:званием объединяют¬
ся карциномы, развившиеся из эпителиальных элементов
дистальных вне- и виутридольковых бронхиол, распро¬
страняющиеся вдоль альвеолярных перегородок без их
инвазии.ЭпидемиологияНа долю БАР приходится 3—6% от всех случаев забо¬
леваний раком легкого. В последние годы отмечается
учащение обнаружения этой опухоли, что в значительной
степени связано с улучшением диагностики (до недавне¬
го времени она терялась в общей массе аденокарцином).
Среди больных преобладают лица 50-70 лет, но известны
случаи заболевания и в более молодом возрасте.
388 « ГЛАВА 7. ЛЕГОЧНЫЕ ДІ4ССЕМИНАЦИИ ОПУХОЛЕВОЙ ПРИРОДЫ Этиология и факторы рискаВозникновение и развитие БАР — это длительный процесс (10—
15 лет), связанный с мутацией генетического аппарата. В отличие от
других гистологических типов рака легкого БАР в меньшей степени
связан с курением и частота его возникновения у мужчин и женщин
практически одинакова. Группу риска заболевания раком легкого
составляют:- имеющие хронические обструктивные заболевания легких;- имевшие предшествующие онкологические заболевания верх¬
них дыхательных путей и легких;- имеющие в семейном анамнезе онкологическую патологию;- заядлые курильщики старше 40 лет.Патологическая анатомияМакроскопически выделяют пневмониеподобную, узловую (ло¬
кальную), мультинодальную и смешанные формы БАР. При пнев¬
мониеподобной форме опухоль поражает от сегмента до доли, не
вполне четко отграничена от окружающей ткани, мягковатой кон¬
систенции, на разрезе серого цвета, поэтому макроскопически и
рентгенологически может напоминать пневмоническое поражение.
При узловой форме БАР опухоль чаше всего расположена в верхней
доле, обычно периферически, субплеврально. В центральных отде¬
лах опухоли иногда выявляются очаги некроза, изредка с образо¬
ванием полости. Ранее считалось, что БАР является альвеолярным
раком. Многочисленными исследованиями доказано, что исход¬
ной точкой пролиферации, так же как и при остальных легоч¬
ных карциномах, является бронхиальный аппарат. БАР развивается
из эпителиальных элементов дистальных вне- и внутридольковых
бронхиол, а также альвеолярных каналов с мукоцилиндрической
метаплазией несекреторных кубических элементов, сосочковой про¬
лиферацией внутри просветов и инвазией альвеолярных просветов
вдоль их стенок. Особенностью микроструктуры опухоли является
отсутствие собственной стромы — опухолевые клетки выстилают
внутренние поверхности легочных альвеол. Они могут слущивать-
ся в их просвет, способствуя аэрогенному распространению опу¬
холи.По гистологическому строению различают два основных типа
опухоли: слизеобразующий (светлоклеточный) и без слизеобразо¬
БРОНХИОЛОАЛЬВЕОЛЯРНЫЙ РАК ЛЕГКОГО • 389ван И Я (темноклсточный). Чаще встречается слизеобразующий тип
(40—60% случаев). Слизеобразуюший тип БАР имеет тенденцию к
мультицентральному росту, может вызывать уплотнение доли или
целого легкого, как при пневмонии. Неслизеобразующий БАР (20—
45% случаев) более часто выглядит как солитарный узел, В 12—14%
случаев бывают смешанные формы и в 7% встречается полиморф¬
ноклеточный низкодифференцированный тип опухоли. Все они
обычно имеют ацинарно-папиллярное или папиллярное строение.
В ряде случаев разграничить бронхогенную аденокарциному и БАР
бывает очень трудно, тем более что бывают смешанные формы. БАР
следует дифференцировать от метастазов рака другой локализации
(в первую очередь желудочно-кишечного тракта), атипичной гипер¬
плазии альвеолярного эпителия при фиброзирующем альвеолите.
В связи с этим согласно патологоанатомической классификации
рака легкого, одобренной Всемирной организацией здравоохра¬
нения (ВОЗ), окончательный диагноз БАР может быть установлен
после выполненной хирургической резекции.Клиническая картинаСвоевременная диагностика рака легкого на стадии, когда воз¬
можно радикальное излечение, представляет определенные трудно¬
сти в связи со скудностью клинических проявлений и объективных
данных. Классическая картина БАР с выделением большого коли¬
чества слизистой пенистой мокроты (бронхореи) встречается редко.
Периферическая локализация опухоли обусловливает длительное
бессимптомное течение у большинства пациентов.КлассификацияПо степени распространения процесса в легких различают огра¬
ниченную и диффузную формы. При ограниченной (узловой) форме
процесс начинается в периферических отделах легких в виде узла или
нескольких узелков, достигая размера от 0,5 до 10 см, с неровными, но
четкими контурами. Структура узла чаще неоднородная, фрагменти¬
рованная, легочная ткань вокруг опухоли мало изменена. Диффузная
форма БАР встречается в двух формах: пневмониеподобной, про¬
являющейся массивным участком уплотнения легочной ткани, и
диссеминированной — в виде множественных рассеянных узелковых
образований различных размеров.
390 » ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНАЦИИ ОПУХОЛЕВОЙ ПРИРОДЫ ДиагностикаЗаболевание, как правило, выявляется случайно при рентгенологи¬
ческом исследовании. При этом нередко устанавливается ошибочный
диагноз «пневмония» или «туберкулез» (особенно при пневмоние-
подобной форме опухоли) и проводится длительное антибактериаль¬
ное лечение. Диагностика БАР, как и большинства онкологических
заболеваний, состоит из двух последовательных этапов.• Первичная диагностика: установление клинико-анатомической
формы, гистологической структуры опухоли и степени диффе-
ренцировки опухолевых клеток.• Уточняющая диагностика направлена на:— определение степени распространения опухоли (стадирование
по системе TNM);— оценка общего состояния пациента (ФВД и функции сердечно¬
сосудистой системы, активность лактатдегидрогеназы, уро¬
вень альбумина и другие лабораторные данные).Первичная диагностика^ Перкуссия и аускультация грудной клетки
даже при поражении сегмента, а зачастую и доли, чаще всего не при¬
водит к выявлению патологии. Как правило, только развитие пораже¬
ния всего легкого, появление плеврального выпота или увеличенных
надключичных лимфатических узлов позволяет на основанрти осмот¬
ра больного установить диагноз. К сожалению, это свидетельствует
уже о распространенном процессе и помогает лишь избежать других
более сложных методов обследования.Большинство первичных диагнозов рака легкого устанавлива¬
ются при рентгенографических обследованиях грудной клетки.
Ренгенологически БАР проявляется повышением плотности легоч¬
ной ткани, связанным с замещением воздуха в альвеолах экссудатом
и опухолевыми клетками. Пораженные альвеолы сливаются, образуя
тень с нечеткими контурами. Когда процесс распространяется из
пораженных в соседние интактные участки легкого по межальвео-
лярным каналам (поры Кона), сосуды легкого становятся труднораз¬
личимыми, и появляется тенденция к лобарному или сегментарному
поражению. Просветы бронхов, заполненные воздухом, на фоне
уплотнения легочной ткани дают картину просветления, что обозна¬
чается термином «воздушная бронхография». При БАР бронхи, как
правило, не изменены, но могут поражаться вторично. Возникающие
ателектазы являются следствием обтурации бронхов секретом или
сдавления опухолевыми массами. Легочные изменения сопровожда¬
БРОНХИОЛОАЛЬВЕОЛЯРНЫЙ РАК ЛЕГКОГО • 381ются поражением плевры, которая может быть покрыта опухолевыми
узелками.Проведение бронхофйброскопии рекомендовано всем больным
БАР. Крупные бронхи при БАР не изменены, и верификация диагноза
проводится с помощью цитологического или гистологического мате¬
риала, полученного при ЧББ и БАЛ. Другим эффективным методом
диагностики БАР является трапсторакал ьная пункция, выполняемая
под контролем КТ или рентгеноскопии. Вместе с тем отрицательный
ответ при ЧББ или трансторакальной пункпии не исключает диагноза
рака, так как у 20—30% таких пациентов впоследствии устанавлива¬
ется злокачественный характер поражения. Только гистологическое
доказательство доброкачественного диагноза может исключить злока¬
чественный характер заболевания, однако это бывает редко. Именно
поэтому многие пациенты подвергаются хирургическому лечению,
минуя трансторакальную пункцию или бронхоскопию. Пациенты с
отрицательным ответом, полученным в ходе трансторакальной пун¬
кции, не подвергавшиеся хирургическому удалению подозритель¬
ного образования вследствие серьезных противопоказаний, должны
наблюдаться по крайней мере в течение двух лет.Наличие плеврального выпота у больного БАР чаще всего сви¬
детельствует о плевральных метастазах, однако в 30-40% случаев
экссудат может быть также вследствие парапневмонического про¬
цесса и других заболеваний. Поэтому доказательство злокачествен-
ности необходимо, так как от этого может зависеть тактика лечения.
Первичным методом оценки плеврального содержимого является
торакоцентсз с цитологическим исследование 50—100 мл жидкости,
что позволяет поставить диагноз приблизительно у 65% пациентов с
выпотом злокачественной природы. Закрытая пункционная биопсия
плевры имеет более низкую диагностическую ценность. Поскольку
повторное цитологическое исследование плевральной жидкости уве¬
личивает вероятное! ь выявления опухолевых клеток, целесообразно
в случае первичного негативного заключения повторить процедуру.
Если после торакопентеза не получено подтверждения злокачествен¬
ной природы поражения, однако клинические подозрения сохраня¬
ются, то на следующем этапе целесообразной представляется тора¬
коскопия. Диафрагмальная, висцеральная и медиастинальная плевра
легко доступна для осмотра и прицельной биопсии. Дополнительным
преимуществом торакоскопии является возможность определить сте¬
пень поражения внутри грудных лимфатических узлов или прораста¬
ние других медиастинальных органов и структур, которые могли бы
392 • ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНАЦИИ ОПУХОЛЕВОЙ ПРИРОДЫ помешать успешной резекции и излечению. Если других препятствий
для хирургической резекции не имеется, то торакоскопия должна
проводиться первым этапом запланированной хирургической опера¬
ции. Выявление метастатического поражения плевры позволит избе¬
жать ненужного оперативного вмешательства.Уточняющая диагностика. Применение КТ для оценки медиастиналь-
ной лимфаденопатии рекомендуется всем пациентам БАР. От КТ груд¬
ной клетки можно отказаться только в том случае, если у пациента при
объективном исследовании и рентгенографии грудной клетки выявлены
отдаленные метастазы (Mj) и не предполагается дальнейшего хирур¬
гического или лучевого лечения. Следует подчеркнуть, что вследствие
низкой специфичности КТ увеличенные лимфатические узлы должны
подвергаться биопсии с целью точного определения стадии заболевания.
В 37% случаев в увеличенных удаленных во время операции узлах (раз¬
мером до 4 см) обнаруживается доброкачественная гиперплазия, особен¬
но часто в случаях, когда имеется параканкрозный пневмонит.Поиск отдаленных метастазов требует тщательного клинического
обследования для оценки состояния пациента с вновь диагностирован¬
ным БАР. Такие неспецифические симптомы, как потеря веса, боли в
костях скелета, недавние изменения в ментальном состоянии, обморо¬
ки, головные боли, анемия, должны вызывать подозрения на наличие
отдаленных метастазов. Доказано, что тщательное обследование позво¬
ляет обнаружить отдаленные метастазы у 50% таких больных. Наиболее
часто поражаются надпочечники, печень, кости, головной мозг.Дифференциальня диагностикаДифференциальня диагностика может быть достаточно трудна.
По течению эта форма рака может походить на периферический рак
легкого, затяжную пневмонию, гематогенно-диссеминированный
туберкулез, саркоидоз, пневмосклероз и др. От пневмонии и тубер¬
кулеза БАР отличают несоответствие клинических проявлений и
рентгенологической картины, нарастание симптоматики на фоне
антибактериальной терапии, пенистая мокрота.ЛечениеПри БАР I—П стадии показано хирургическое лечение с обя¬
зательным выполнением прикорневой и медиастинальной лимфо-
диссекции, обеспечивающей помимо элиминации субклинических
БРОНХИОЛОАЛЬВЕОЛЯРНЫЙ РАК ЛЕГКОГО • 393лимфогенных метастазов корректное стадирование процесса. При
определении метастазов в лимфатических узлах средостения показа¬
на профилактическая послеоперационная лучевая терапия средосте¬
ния и воротниковой зоны с суммарной очаговой дозой не менее 40 Гр.
Проведение послеоперационной многокурсовой полихимиотерапии
при Nj не показало преимуществ по выживаемости больных. Вместе с
тем появление новых групп химиопрепаратов, возможно, внесет свою
поправку. При ПІА стадии целесообразна комбинированная тактика
с предоперационной полихимиотерапией (не менее двух курсов), в
задачу которой входит резорбция основного и локорегионарных оча¬
гов опухолевого поражения, а также девитализация отдаленных суб-
клинических метастазов. При НТВ стадии, как правило, предпочтение
отдается комбинированной химиолучевой терапии. Суммарная очаго¬
вая доза при этом составляет не менее 50 Гр. TV стадия в большинстве
случаев является показанием к многокурсовой полихимиотерапии.
Схема первой линии включает препараты платины в сочетании с это-
позидом, винорельбином*^, таксанами^, гемцитабином. БАР является
гораздо более химио- и радиорезистентным, чем другие виды рака
легкого. Определенные надежды связаны с появлением новых проти¬
воопухолевых так называемых таргетных препаратов, активных при
БАР— ингибиторов передачи внутриклеточных сигналов (пресса,
эрлотиниб), моноклональных антител, ингибиторов ангиогенеза и др.
Для назначения этих препаратов целесообразно молекулярно-гене¬
тическое исследование биоптата опухоли. Выявление определенных
видов мутаций, таких как мутация гена рецептора эпидермального
фактора роста, является показанием для назначения ингибиторов
тирозинкиназы (гефитиниб, эрлотиниб).ПрогнозОсновными факторами, влияющими на прогноз, считаются ста¬
дия заболевания и возможность выполнения радикальной резекции
опухоли. Немуцинозный тип БАР отличается более длительным
выживанием, даже без лечения. При распространенном заболевании,
особенно при слизеобразующем (муцинозном) гистологическом под¬
типе, прогноз неблагоприятный: половина леченых больных живут
менее года. Вместе с тем появление новых препаратов в ряде случаев
позволяет добиться более длительного выживания.Общая выживаемость с момента диагностики распространенного
немелкоклеточного рака легкого 4,5 года (рис. 7.1 - 7.4),
394 • ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНАЦИИ ОПУХОЛЕВОЙ ПРИРОДЫРис. 7.1. Компьютерная томограм- Рис. 7.2. Компьютерная томограмма
ма больной Г., 63 года, до лечения больной Г., 63 года, лосле леченияирессойирессой. Полный ответРис. 7.3. Компьютерная томограмма Рис, 7.4. Компьютерная томограмма
больной Г., 63 года. Прогрессия забо- больной Г., 63 года. Стабилизация налевания на фоне лечения ирессойфоне лечения авастином* и тарцсвой*Клиническим примером эффективности таргетной терапии может
служить следующее наблюдение.Клинический примерБольная Г., 63 года. Диагноз: БАР, T^N^M,. Мутация EGFR.2003 г., февраль. Резекция нижней доли левого легкого по поводу
узловой формы БАР.2004 г., май. Рецидив заболевания: двух сторонняя диффузная
форма БАР.1-я линия ПХТ (цисплатин-этопозид 4 цикла).
МЕТАСТАТИЧЕСКОЕ ПОРАЖЕНИЕ ЛЕГКИХ • 3952005 г., январь. Прогрессия заболевания, 2-я линия химиотерапии
(таксол).Май. Прогрессия заболевания, 3-я линия терапии (пресса).Июль. Частичный ответ.Сентябрь. Полный ответ.2007 г., декабрь. Прогрессия заболевания, 4-я линия терапии
(гемцитабин — 3 цикла).2008 г., март. Прогрессия заболевания, 5-я линия терапии (возоб¬
новление приема тарцевы* 150 мг в сутки и назначение авастина*7,5 мг/кг I раз в 3 нед).Сентябрь. Стабилизация. Клиническое улучшение.ПрофилактикаПрофилактика БАР легкого не разработана.МЕТАСТАТИЧЕСКОЕ ПОРАЖЕНИЕ ЛЕГКИХМетастазирование опухолей в легкие может осуществляться гема¬
тоген ным, лимфогенным, бронхогенным или смешанным путем.
Наиболее частыми являются первые два механизма, в связи с чем в
клинической практике принято выделять гематогенные и лимфоген-
ньте метастазы легких.До середины XX века, согласно гипотезе Хольстеда (W. Halsted), счи¬
талось, что процесс метастазирования носит этапный лимфогенный
характер: из первичной опухоли раковые клетки попадали сначала в
лимфатические узлы первого, затем второго и третьего порядка, и лишь
затем происходила гематогенная диссеминация опухоли. Однако в 1965 г.
Бернардом Фишером (В. Fisher) было доказано, что лимфогенная и гема¬
тогенная диссеминация происходит одновременно. Предполагается,
что формирование метастазов является длительным процессом, начи¬
нающимся на ранних стадиях развития опухоли и нарастающим со
временем. Первая возможность метастазирования появляется у опухоли
с появлением в ней сосудов, т.е. с началом ангио-генеза опухоли. Ранее
считалось, что ангиогенез начинается после того, как опухоль достигнет
размера в 0,5-1 мм (1000 клеток). Однако в настоящее время установле¬
но, что формирование сосудов в опухоли может начинаться при числе
клеток 100—200, т.е. гематогенное метастазирование может начинаться
задолго до клинического проявления опухоли.
396 » ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНАЦНИ ОПУХОЛЕВОЙ ПРИРОДЫ Клиническая картина и диагностикаГематогенные метастазы легкихОтдельные опухолевые клетки или их группы, оторвавшись от пер¬
вичной опухоли, с венозной кровью большого круга кровообрашения
попадают в распространенную сеть легочной паренхимы. Однако не
все опухолевые эмболы, оторвавшиеся от новообразования и попав¬
шие в бронхолегочное кровообращение, в конце концов обусловлива¬
ют образование одного или многих опухолевых узлов. Большинство
клеток (99,9%) новообразования, попавших в сосудистое русло и затем
в легкое, подвергаются разрушению, фагоцитированию и рассасыва¬
нию. Согласно теории Пэджета [Paget S., 1889], для метастазирова-
ния опухоли «необходимы как хорошее семя, так и хорошая почва».
Следовательно, только те опухолевые клетки, которые экспрессируют
надежные адгезионные молекулы, способны успешно атаковать и
захватить новую область.Гематогенные метастазы в легких подразделяются на одиночные
(солитарные), единичные (2-3 очага) и множественные. Наиболее
часто метастазы развиваются в нижних и средних отделах легкого, пос¬
кольку эти зоны кровоснабжаются более интенсивно. Большинство
метастазов реализуются в ближайшие годы после выявления и лече¬
ния первичной опухоли, однако могут выявляться и через 10—20 лет.
При некоторых иммунозависимых формах рака, например раке почки,
возможно обратное развитие заболевания — в литературе описаны
случаи спонтанной полной регрессии метастазов опухоли.Гематогенные метастазы злокачественных опухолей в легкие часто
протекают бессимптомно, нередко их обнаруживают только при пла¬
новом рентгенологическом исследовании или уже на аутопсии (30%
случаев). Такая бессиматомность чаш,е всего бывает при солитарных
или единичных метастатических узлах. Множественная мелкооча¬
говая диссеминация опухоли в легкие или присоединение карцино-
матоза лимфатических сосудов сопровождаются более выраженной
клинической картиной, ведущими симптомами которой являются
прогрессирующая одышка и непродуктивный кашель.Хотя метастазы в легких могут наблюдаться при большом числе
различных опухолей, некоторые особенности рентгенологиче¬
ской картины позволяют предположить определенный тип опухоли.
Солитарные или единичные, легочные узлы встречаются при коло¬
ректальном раке и раке почки, саркомах и меланомах, хорионэпите-
лиоме и опухолях яичка. Просовидное поражение чаще бывает при
МЕТАСТАТИЧЕСКОЕ ПОРАЖЕНИЕ ЛЕГКИХ • 397медуллярном раке шитовидной железы, меланоме, раке почки и раке
яичников. Полостные образования встречаются при плоскоклеточ¬
ном раке любого происхождения (опухоли головы и шеи, рак шейки и
тела матки), раке толстой кишки, остеогенных саркомах, раке подже¬
лудочной железы и раке мочевого пузыря. При остеогенных саркомах
часто наблюдается пневмоторакс, который иногда становится первым
проявленим заболевания. При этом заболевании могут выявляться
кальцифицированные метастазы.Лимфогенные метастазы легкихЛимфогенное метастазирование в легкие наиболее часто возни¬
кает при раке молочной железы, поджелудочной железы, желудка и
толстого кишечника. Менее часто это происходит при раке простаты
и шейки матки, эмбриональных (герминогенных) опухолях, особен¬
но яичка. Из опухолей торакальной локализации причиной ракового
лимфангиита может быть рак легкого и лимфомы. Часто лимфоген¬
ные метастазы в легких возникают вследствие первичного поражения
внутригрудных лимфатических узлов. При этом вследствие их тоталь¬
ного поражения возникает блок и ретроградный ток лимфы в легкие с
заносом в них опухолевых эмболов из блокированных лимфатических
узлов. Причиной блока нормального тока лимфы может быть не толь¬
ко опухолевое поражение внутригрудных лимфатических узлов, но
и ранее перенесенное воспалительное заболевание, например тубер¬
кулез. Помимо ретроградного распространения опухолевых клеток
возможен и антеградный (от плевры к средостению) путь поражения
легких, при этом источником лимфогенного метастазирования может
быть как первичный рак легкого, так и гематогенный метастаз.Лимфогенный карциноматоз (милиарный карциноз, канцерома-
тозный лимфангит) является тяжелым прогрессирующим пораже¬
нием легких, приводящим к смерти больного в течение нескольких
месяцев, в ряде случаев лимфогенный карциноматоз может быть
первым клиническим и рентгенологическим проявлением опухо¬
левой прогрессии, когда локализация первичной опухоли неизве¬
стна. в основе лимфогенного канцераматоза лежит инвазия лим¬
фатических сосудов, расположенных внутри легочной паренхимы
(перибронхиально, периваскулярно, субплеврально). Обычно в рас¬
пространении участвует также и гематогенный компонент, однако
лимфатический компонент резко преобладает. При лимфогенном
карциноматозе легкое увеличено в размерах и имеет плотную кон¬
систенцию. Межсегментарные границы более выражены вследствие
398 » ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНАЦИИ ОПУХОЛЕВОЙ ПРИРОДЫ набухания лимфатических сосудов, которые макроскопически при
пересечении выглядят как беловато-желтые узелки. Гистологическая
структура новообразования в расширенных лимфатических сосудах
в большинстве случаев сохраняет признаки пролиферации, суще¬
ствующие в первичной опухоли. Злокачественных поражений стенок
лимфатических сосудов при этом не отмечается.Клинические проявления лимфогенного карциноматоза характери¬
зуются незаметно возникающей и стремительно нарастающей одыш¬
кой, сухим изнуряющим кашлем. Нередко отмечается фебрильная
или субфебрильная температура тела. Высокие дозы глюкокортико-
идов оказывают кратковременный эффект. Гипоксемия, связанная
с распространением инфильтрата, нарастает. У больных наблюдает¬
ся прогрессирующая легочно-сердечная недостаточность, которая в
большинстве случаев служит причиной смерти. В ее патогенезе поми¬
мо обтурации лимфатических и кровеносных сосудов опухолевыми
эмболами большую роль играет присоединяющийся тромбоз мелких
ветвей легочной артерии. Функциональные легочные тесты выявля¬
ют снижение дел, уменьшение легочных объемов и эластичности
легочной ткани; определяется гипоксемия.Рентгенологическая картина лимфогенного карциноматоза напо¬
минает интерстициальный отек легких; усиление бронхососудистого
рисунка и подчеркнутость септ. Могут наблюдаться линии Керли,
более выраженные в центральных отделах легких, а также увеличение
лимфатических узлов корня легкого и средостения. Возможно сочета¬
ние интерстициальных изменений с узел ковами, что в целом создает
своеобразную сетчатонодулярную картину. Вместе с тем провести
дифференциальный диагноз с рядом интерстициальных заболеваний
или сердечной недостаточностью, по данным рентенографии, затруд¬
нительно, поэтому обязательно выполнение ВРКТ.При КТ лимфогенный канцероматоз характеризуется увеличением
количества неравномерно утолщенных септальных линий, образу¬
ющих сложный многогранный рисунок. Они могут быть генерали¬
зованными, двусторонними или односторонними, у части больных
могут локализоваться в пределах одной доли. Контуры сосудов и
бронхов становятся нечеткими. Междольковыс перегородки равно¬
мерно утолщаются и определяются как линии Керли. Утолщение
внутридольковых перегородок приводит к появлению мелкоячеистой
деформации легочного рисунка, а дальнейшее распространение лим-
фостаза на межальвсолярные перегородки сопровождается нерав¬
номерным уплотнением легочной ткани по типу «матового стекла».
МЕТАСТАТИЧЕСКОЕ ПОРАЖЕНИЕ ЛЕГКИХ • 339Характерными признаками лимфогенного карциноматоза является
плевральный выпот и увеличение лимфатических узлов средостения
и корней легких.Дифференцирование лимфогенного карциноматоза необходимо
проводить с рядом заболеваний: саркоидоз, пневмокониоз, ИФА, гис-
тиоцитоз X, ЭАА, милиарный туберкулез.Метастазы в лимфатические узлы корня легкого и средостенияМетастазы в лимфатические узлы корня легкого и средостения
могут возникать при торакальном и экстраторакальном расположе¬
нии опухоли. При установлении локализации первичной опухоли
(рак легкого, рак молочной железы или др.) определение природы
лимфаденопатии не представляет значительной трудности. Сложнее
на основании клинико-рентгенологичсских данных определить
характер поражения лимфатических узлов при отсутствии сведений
о первичной опухоли.Типичным для метастатического процесса является поражение
лимфатических узлов перитрахсобронхиальной группы, расположен¬
ных в центральном средостении. Увеличенные у злы могут выявляться
в виде изолированных округлых или овальных образований диамет¬
ром более 10 мм или сливаться к конгломераты. Плотность таких
узлов обычно не превышает +40 HU и незначительно повышается
после болюсного внутривенного введения контрастного вещества.
В метастазах железистого рака и остеогенных сарком в пораженных
узлах могут возникать участки обызвествления или патологического
костеобразования. Наличие очаговых обызвествлений в увеличенных
лимфатических узлах не противоречит предположению о метастати¬
ческом их поражении. Обызвествления наблюдаются у 5—7% больных
с метастазами в лимфатические узлы средостения.Метастатическое поражение лимфатических узлов корня легко¬
го и средостения необходимо дифференцировать со следующими
заболеваниями; лимфомы, саркоидоз, туберкулез внутригрудных
лимфатических узлов, пневмокониозы. Злокачественные лимфомы
(лимфогранулематоз, или болезнь Ходжкина, и злокачественные
неходжкинские лимфомы) различаются по кііиническому течению и
локализации измененных лимфатических узлов. Лимфогранулематоз
характеризуется преимущественным поражением периферических
и внутригрудных лимфатических узлов, которые выявляются в
начальной стадии заболевания у 60—80% больных. В последующем
в патологический процесс вовлекаются лимфатические узлы брюш-
4D0 > ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНАЦИИ ОПУХОЛЕВОЙ ПРИРОДЫ НОЙ полости и таза, а также паренхиматозные органы, чаще печень,
селезенка, легкие. Неходжкинские лимфомы отличаются более
частым поражением лимфатических узлов живота, в то время как
узлы средостения увеличиваются у 10—20% больных. Системный
характер поражения при злокачественных лимфомах предопреде¬
ляет расширение зоны обследования при КТ. При первичном иссле¬
довании в нее должны быть включены следующие анатомические
области: грудная полость, верхний отдел живота до нижних границ
почек, бифуркация аорты и малый таз. Измененные лимфатические
узлы грудной полости у больных злокачественными лимфомами
обычно локализуются в переднем верхнем средостении. Они могут
изображаться на поперечных срезах в виде отдельных округлых
образований, более крупных конгломератов неправильной формы
или диффузно инфильтрировать жировую клетчатку средостения.
На более поздних стадиях в патологический процесс вовлекаются
лимфатические узлы переднего нижнего средостения (прекардиаль-
ные), а также центрального и заднего средостения. При распростра¬
ненных изменениях нередко возникает сдавление крупных сосудов
средостения, прежде всего венозных. Оценка степени и протяжен¬
ности сужения должна проводиться по данным ангио-КТ. Другими
признаками злокачественного поражения являются: прорастание
опухоли в прилежащую легочную ткань, образование узлов в плевре
и накопление жидкости в плевральной полости. В целом основные
отличия злокачественных лимфом заключаются в преимуществен¬
ном поражении лимфатических узлов переднего средостения, гене¬
рализованном характере поражения с вовлечением лимфатических
узлов грудной клетки, живота и таза, увеличении печени и селезен¬
ки. Окончательный диагноз устанавливается при гистологическом
исследовании пораженных лимфатических узлов.Дифференциальная диагностикаПрактически все круглые опухоли в той или иной степени вызывают
диагностические затруднения. Периферической тенью в легком могут
проявляться многие заболевания: злокачественные новообразования
(рак, саркома, метастазы), доброкачественные новообразования (аде¬
нома бронха, карциноид, гамартома), туберкулема, воспалительные
заболевания легких; киста, заполненная жидкостью, осумкованный
плеврит, опухоли плевры, первичное поражение ребер, позвонков,
первичное поражение диафрагмы, артериовенозная фистула.
МЕТАСТАТИЧЕСКОЕ ПОРАЖЕНИЕ ЛЕГКИХ • 401Выполнение высокоразрешающей КТ для проведении дифферен¬
циальной диагностики и определения дальнейшей тактики лечения
является обязательным, так как это исследование позволяет избе¬
жать эффекта суммации и выявить более мелкие образования (5 мм).
При КТ периферический рак и солитарный метастаз изображаются
на поперечных срезах в виде округлого или неправильной формы
патологического образования с нечеткими бугристыми контурами,
Лучистость контуров связана с развитием лимфангита в прилегаю¬
щей легочной ткани. Аденокарциномы отличаются длинными толс¬
тыми редкими лучами, отходящими от опухолевого узла к плевре и
корню легкого. Плоскоклеточный рак характеризуется более корот¬
кими (до 5—7 мм) и частыми лучами. Такие изменения не характерны
для доброкачественных опухолей, воспалительных и туберкулезных
инфильтратов. Вместе с тем у больных низкодифференцированным
раком лучистость может вообще отсутствовать и контуры образова¬
ния могут быть ровными как при доброкачественных образованиях.
Важнейшим дифференциально-диагностическим признаком зло¬
качественной опухоли является повышение плотности образова¬
ния после болюсного введения контрастного вещества. Накопление
контраста связано с выраженной собственной сосудистой сетью в
злокачественной опухоли, в то время как доброкачественные опухоли
отличаются менее интенсивным и более медленным контрастирова¬
нием. Характерным признаком гематогенных метастазов является их
связь с мелкими артериальными сосудами. Обызвествление в пери¬
ферических опухолях и солитарных метастазах встречается в 5—7%
случаев при остеогенных саркомах и некоторых аденокарциномах.
Этот признак не имеет большого дифференциально-диагностичес¬
кого значения, поскольку характерен и для туберкулем. Сочетание
обызвествления и жировых включений является патогномоничным
признаком для гамартом. Бронхогенньте кисты, заполненные жид¬
костью, та же как доброкачественные опухоли и туберкулемы, имеют
четкие контуры, изменения в окружающей легочной ткани отсутству¬
ют. Вместе с тем более высокая плотность жидкости, определяемая с
помощью денситометрического анализа, позволяет отличить кисту от
мягкотканых образований и туберкулем [Тюрин И.Е., 2003].В последние годы с целью дифференциальной диагностики между
доброкачественными и злокачественными образованиями легких
применяют позитронно-эмиссионную томографию и различные
радионуклидные методы (неоспект и др.). Наиболее часто применя¬
ют позитронно-эмиссионную томографию — метод, основанный на
402 ♦ ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНДЦИМ ОПУХОЛЕВОЙ ПРИРОДЫ регистрации значительного усиления метаболизма глюкозы в злока¬
чественных клетках. Отрицательный результат при этом исследовании
позволяет в ряде случаев избежать применения инвазивной биопсии и
ограничиться динамическим наблюдением за больным. Однако этот
метод малоинформативен при опухолях менее 1 см, а также при карци-
ноидах и высокодифференцированных аденокарциномах (БАР) в связи
с низким метаболизмом глюкозы в этих образованиях. В то же время
активный воспалительный процесс (пневмония, губеркулез) ведет к
усилению метаболизма глюкозы и ложноположительным результатам.Несмотря на то что многие из перечисленных выше заболеваний
имеют свои семиотические признаки, как на рентгенограммах, так и
на КТ в большинстве случаев только гистологическое исследование
позволяет убедительно свидетельствовать в пользу того или иного
окончательного диагноза. Цитологическое исследование мокроты и
ЖБАЛ позволяет верифицировать диагноз не более чем в 30% случаев.
Наиболее часто используемые методики исследования — это брон¬
хоскопия и трансторакальная биопсия. Бронхоскопия эффективна
в случае, когда метастаз локализуется в стенке бронха, что бывает
редко. ЧББ образований, прилегающих к бронху, менее информатив¬
на, обіцая чувствительность метода не превышает 65%. В связи с этим
широкое распространение получила трансторакальная тонкоиголь¬
ная аспирационная биопсия. В о тличие от других внутренних органов
биопсия образований легких возможна только под контролем рент¬
геноскопии или КТ. Проведение этой процедуры в 20—45% случаев
сопровождается развитием пневмоторакса, что требует дренирования
плевральной полости у 5—15%. Тонкоигольная аспирационная био¬
псия имеет чувствительность 64—97% и специфичность — 50—88%.Установить, является обнаруженная опухоль первичной или вто¬
ричной, бывает трудно даже при детальном сопоставлении мор¬
фологических и клинико-рентгенологических данных. Существует
немного типов первичной опухоли легких, для которых иатогистоло-
гический анализ может бесспорно подтвердить их первичное брон¬
холегочное происхождение. Такими опухолями считаются мелко¬
клеточный рак, БАР, карциноид бронха. Напротив, злокачествен¬
ные меланомы легкого всегда имеют метастатическое происхожде¬
ние. Такие опухолевые типы, как, например, аденокарцинома, чаще
бывают метастатическими, чем первичными, легочными опухолями.
Метастазы больших размеров могут вызываться первичными ново¬
образованиями, имеющими минимальные размеры. Общеизвестен
тот факт, что при метастазах иногда теряются первичные признаки
МЕТАСТАТИЧЕСКОЕ ПОРАЖЕНИЕ ЛЕГКИХ • 403опухоли, изменяется степень ее дифференцировки в ту или иную
сторону. Поэтому при интерпретации опухолей и типов следует при¬
нимать во внимание их частоту в легких, метастатический потен¬
циал определенных карцином или сарко\г, развивающихся в других
органах. Необходимо учитывать и предпочтительную локализацию
определенных новообразований в некоторых тканях. Так, например,
при выявлении плоскоклеточного рака опухоль может считаться пер¬
вичной ввиду большой частоты этого рода новообразований в легких.
Однако нельзя забывать, что для этих опухолей могут существовать и
другие исходные точки: гортань, пищевод, кожные покровы и т.д.Лечениев большинстве случаев при метастатическом поражении легких
методом выбора является лекарственная противоопухолевая терапия.
При множественных метастазах химиотерапия, воздействуя на все
опухолевые узлы, имеет преимущества перед хирургическим и луче¬
вым лечением, особенно при метастазах опухолей, чувствительных
к химиопрепаратам (хорионэпителиома, опухоль яичка, молочной
железы, остеосаркома). Однако при метастазах рака желудка, толстой
кишки, почки химиотерапия малоэффективна, в связи с чем к насто¬
ящее время проводятся исследования по поиску новых противоопу¬
холевых препаратов, обладающих другим механизмом действия. Это
ингибиторы эпидермального фактора роста, ретиноиды, монокло¬
нальные антитела, специфичные к антигенам первичной опухоли.Вместе с тем в последние годы стали расширяться показания к
хирургическому лечению метастазов в легкие, особенно при соли-
тарном или единичных узлах. При решении вопроса об оперативном
лечении метастазов легких в первую очередь необходимо принимать
во внимание биологические свойства первичной опухоли — гистоло¬
гическую структуру, дифферснцировку, степень инвазии кровеносных
и лимфатических сосудов и ряд других характеристик. В ряде случаев
удаление одного или нескольких метастазов может носить относи¬
тельно радикальный характер и позволяет продлить жизнь больного.
В других случаях целью операции является уменьшение массы опухоли
(циторедукция), изучение ее свойств и чувствительности к химиотера¬
пии (лекарственный патоморфоз). Последующее применение лекарс¬
твенных методов лечения при этом сопровождается большей эффек¬
тивностью и позволяет предупредить развитие осложнений, связанных
с ростом метастазов, и улучшить качество жизни пациентов.
404 > ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕШНАЦИИ ОПУХОЛЕВОЙ ПРИРОДЫ ПрогнозПрогноз зависит в основном от локализадии и гистологической
структуры первичной опухоли, степени ее дифференцировки, коли¬
чества метастазов, интервала между окончанием лечения первичной
опухоли и появлением метастазов, времени удвоения опухоли, чув¬
ствительности опухоли к химиотерапии.ПрофилактикаПрофилактика не разработана.ЛИМФАНГИОЛЕЙОМИОМАТОЗ ЛЕГКИХЛимфангиолейомиоматоз легких (ЛАМ) — редкое заболевание, харак¬
теризующееся опухолеподобным разрастанием гладком ышечных воло¬
кон в интерстициальной ткани легких, вокруг кровеносных и лим¬
фатических сосудов, бронхов, бронхиол, в лимфатических узлах с
последующей мелкокистозной трансформацией легочной паренхимы
(«сотовое легкое», мелкокистозное легкое). Болезнь впервые была опи¬
сана в 1918 г. R. Lautenbacher, затем в 1937 г. Е. von Stosscl.ЭпидемиологияБолезнь поражает только женщин, как правило, детородного воз¬
раста (средний возраст 30 лет), однако может встречаться и в других
возрастных диапазонах. В 2000 г. были описаны два случая ЛАМ у лиц
мужского пола М.С. Aubry и соавт., однако наличие у этих пациентов
ангиофиброматоза лица, ангиом иол ипомы почек позволяет отнести
эти случаи скорее к туберозному склерозу Бурнвиля, при котором гис¬
тологические изменения в легких (если они поражаются) практичес¬
ки неотличимы от ЛАМ [Warth А. et al, 2008J. Эпидемиологические,
генетические и молекулярные исследования показывают связь между
спорадическим ЛАМ и туберозным склерозом Бурнвиля — аутосом-
но-доминантным заболеванием с неполной пенетрантностью, обус¬
ловленным мутацией генов TSC1 и TSC2,Установить истинную распространенность ЛАМ не представляется
возможным не только из-за редкой встречаемости заболевания, но и
ЛИМФАНГИОЛЕЙОМИОМАТОЗ ЛЕГКИХ • 405трудностей диагностики, нередко ошибочной трактовки как клиничес¬
ких, так и аутопсийных данных. ЛАМ нередко сочетается с туберозным
склерозом — семейным заболеванием с аутосомно-доминантным типом
наследования, при котором могут выявляться гамартомы, ангиофибро¬
мы, ангиолипомы почек, дисплазии многих органов. Распространенность
ЛАМ составляет приблизительно 1-5 на 1 млн женщин, а ориентировоч¬
ная численность больныхЛ AM, пообобщенным статистическим данным,
составляет от 25 ООО до 50 ООО. В отличие от ЛАМ, туберозный склероз
встречается с одинаковой частотой у обоих полов с частотой 1,2 на 1,5 млн
человек. За последние 10-20 лет были опубликованы результаты наблю¬
дения сравнительно больших групп больных: от 32 до 69 [Johnson S.R.,
2000; Kitaichi М., et al., 1995; Urban Т. et al., 1999]. В клинике пульмоноло¬
гии СПбГМУ диагноз ЛАМ был установлен у 66 больных. Передача ЛАМ
от матери к дочери не описана. Имеются единичные сообщения о семей¬
ных случаях сочетания ЛАМ с туберозным склерозом Бурнвиля.Этиология и факторы рискаЭтиология ЛАМ неизвестна. О важной роли эндокринных наруше¬
ний в возникновении и развитии этого заболевания свидетельствуют
следующие факты: возникновение ЛАМ только у женщин и, как
правило, в детородном возрасте; усиление ДН во время менструации,
обострение болезни во время беременности, замедление прогрессиро¬
вания заболевания в части случаев после наступления менопаузы или
удаления яичников, частое сочетание ЛАМ с фибромиомой (лейо-
миомой) матки. Об этом же свидетельствует и тот факт, что начало
болезни или ее обострение могут быть спровоцированы лечением
эстрогенами. Некоторые авторы относят ЛАМ к многофокусным
гамартомным процессам, в прогрессировании которых важную роль
иірают женские половые гормоны. Обсуждается роль генетической
предрасположенности к ЛАМ. Речь идет о наличии генетического
дефекта, являющегося причиной аномального ответа мышечных кле¬
ток на женские половые гормоны. У больных ЛАМ помимо точечных
мутаций гена TSC2 могут также выявляться мутации, называемые
утратой гетерозиготности локуса TSC2 [Carsillo Т. et al., 2000]. Эти
аномалии приводят к потере функции подавления опухолевого роста
клетки и могут объяснить бесконтрольную пролиферацию клеток
при ЛАМ [Pacheco-Rodriguez G. et al., 2002]. Предположения о ЛАМ
как следствии метастазирования клеток ЛАМ из опухоли почек,
лимфатических узлов и других органов подтверждается и другими
406 « ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНАЦИИ ОПУХОЛЕВОЙ ПРИРОДЫ авторами fCrooks D.M., 2004J. Гипотезу метастазирования косвен¬
но подтверждает факт возникновения ЛАМ в донорском легком
после трансплантации [Bittmann 1. et al., 2003J. Еше один фактор,
важный в возникновении ЛАМ, — сывороточный ответный фактор
{serum response factor— SRF). Он является фактором транскрипции
и избыточно представлен в клетках, пролиферирующих при ЛАМ.
Повышенный уровень SRF увеличивает экспрессию матриксных
металлопротеиназ ММР-2 и ММР-14. Их содержание при ЛАМ повы¬
шается. Уровень тканевых ингибиторов металлопротеиназ (Т1МР-3),
наоборот, снижается. Этот дисбаланс вносит дополнительный вклад в
необратимую перестройку легочной ткани, выявляюшуюся при ЛАМ
[Zhe Z. et al, 2003]. Как следует из представленных данных, основная
«поломка» при развитии ЛАМ происходит на уроне генов, которые в
норме должны подавлять бесконтрольную пролиферацию при про¬
хождении всех этапов клеточного цикла.ПатогенезПатогенез ЛАМ изучен недостаточно. Основой патологического
процесса является пролиферация атипичных гладкомышечных клеток
в интерстициальной ткани легких, в стенках бронхов и сосудов, в лим¬
фатических узлах, а также в других органах (матка, почки, абдоминаль¬
ные лимфатические узлы и др). Недостаточно изучена роль эстрогенов
в патогенезе ЛАМ. Известно, что эстрогены регулируют транскрипцию
многих генов, а также могут играть роль стимула в пролиферации и
миграции гладкомышечных клеток в другие органы и ткани. Наряду
с этим клетки ЛАМ участвуют в секреции деструктивных протеаз.
Выявляемый в атипичных гладкомышечных клетках больных ЛАМ
дисбаланс протеаз (избыточный синтез матриксных металлопроте-
иназ-1, 2 и 9 и угнетение тканевых ингибиторов металлопротеиназы-3)
может играть важную роль в формировании деструктивных измене¬
ний — множественных кист в легочной паренхиме. В гладкомьтшечных
волокнах части больных ЛАМ находят прогестероновьте и эстрогено-
вые рецепторы, которые обычно отсутствуют в нормальных гладко¬
мышечных клетках, однако эти данные противоречивы [Matsui К. et
al., 20001. Выявлены два морфологических варианта эпителиоидных
клеток, формирующих фокусы ЛАМ: веретенообразные и кубические.
Оба вида клеток дают положительную окраску на актин, виментин и
десмин. Однако только кубические клетки реагируют с моноклональ¬
ными антителами НМВ-45, синтезирующимися против премеланосом-
ЛИМФАНГИОЛЕЙОМИОМАТОЗ ЛЕГКИХ • 407НОГО белка gp-100, фермента меланогенеза. Меланом'зависимый маркер
НМВ-45 никогда не определяется в нормальных гладкомышечных
клетках. Так как другие гладкомышечные повреждения не реагируют
с упомянутыми моноклональными антителами, это иммуногистохи-
мическое исследование имеет высокую диагностическую ценность.
Специфичность этого теста составляет >95% [Zhe X. et al., 2004; и др.].
Предполагается, что формирование бронхообструктивного синдрома
при ЛАМ также связано с инфильтранией и пролиферацией гладкомы¬
шечных клеток в дыхательных путях [Zhe Z. et al., 2003J.Патологическая анатомияЛАМ легких может проявляться в виде двух морфологических форм:
очаговой или диффузной. Гистологическая картина очаговой формы
ЛАМ характеризуется возникновением в легких опухолевидных обра¬
зований, морфологическая структура которых соответствует лейомио-
мам. Диффузная форма ЛАМ отличается характерной макроскопичес¬
кой картиной: легкие увеличены в объеме с видимыми на поверхности
распространенными кистозными вздутиями размером от нескольких
миллиметров до нескольких сантиметров в диаметре. В плевральной
полости может обнаруживаться хилезная жидкость. По мере прогрес¬
сирования болезни эмфизематозные вздутия увеличиваются в объеме.Морфологическое исследование биопсийного и аутопсийного мате¬
риала проведено нами в 44 наблюдениях. Микроскопическая кар¬
тина уже на ранних стадиях заболевания характеризуется мульти-
центричностью очагов поражения в виде мелких гладкомышечных
пролифератов с четкой локализацией в альвеолярных перегородках,
стенках сосудов с их деформацией в виде участков выпячивания про-
лиферахов в просвет и его сужением и (или) дилатацией (рис. 7.5, см.
ЦБ. вклейку). При прогрессировании заболевания имеется тенденция
к увеличению и слиянию очагов с формированием кист. Стенки кис¬
тозных полостей представлены гладкомышечньтми пролифератами.
Гистоархитектоника легочной ткани нарушена. Для поздних стадий
характерно нарастание десмопластики, топографически связанной
с клетками пролифератов (рис. 7.6, см. цв. вклейку). Гладкомышечные про-
лифераты разнообразны по архитектонике и цитологическим особен¬
ностям. Клетки пролиферата веретеновидные, округлой формы, встре¬
чаются крупные эпителиоподобные; ядра гиперхромные, удлиненные,
митозы отсутствуют. Кое-где встречаются большие зоны хаотично
переплетающихся всретеновидных клеток, в которых обнаруживаются
408 » ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНАЦИИ ОПУХОЛЕВОЙ ПРИРОДЫ обрывки эластичных волокон, маркирующих зоны деструкции легоч¬
ной ткани.Проведенное иммуногистохимическое исследование (19 случаев)
подтверждает гладкомышечную природу пролифератов и десмопласти-
ческие потенции: экспрессия НМ В-45, актина и десмина постоянна и
более значительна в крупных эпителиоидных клетках (рис. 7.6 б, см. дв.
вклейку), экспрессия десмина свидетельствует о связи десмопластики с
гладкомышечным пролифератом и разной степени его выраженности.
ЛАМ является одним из проявлений системной гладкомышечной про¬
лиферации с гормональной зависимостью, что подтверждено иммуно-
гистохимическим исследованием эстраген (ERs) и прогестерон (PRs)
рецепторов Щвораковская И.В. и соавт., 2005].Иммуногистохимическое исследование ERs и PRs рецепторов
показало, что в 80% наблюдается их экспрессия в атипических глад¬
комышечных клетках (рис. 7.7, см. цв. вклейку). К. Matsui и соавт.
12000] в своем исследовании обнаружили снижение регуляции ERs
и PRs в пролиферирующих гладкомышечных клетках пяти больных
ЛАМ, прошедших лечение медоксипрогестероном и комбинацией
его с тамоксифеном. При электронно-микроскопическом исследова¬
нии выявляются; дифференцированные гладкомышечные клетки,
незрелые миоциты и миофибробласты. Для зрелых миоцитов харак¬
терна крупная величина, вытянутая форма, крупные овальные ядра.
В цитоплазме клеток содержаться комплексы миофиламентов около
10 нм, большое число пиноиитозных пузырьков, везикул и незначи¬
тельное содержание митохондрий и гликогена. Незрелые миоциты
меньше размером, с крупными ядрами, цитоплазма их не содержит
миофибрилл, бедна органоидами и богата свободными рибосомами и
полисомами.Еще одним типом клеток являются зрелые миоциты, в цитоплазме
которых наряду с миофибриллами имеются структуры эндоплазмати-
ческого ретикулума, что в совокупности с тесной связью их с пучками
коллагеновых фибрилл позволяет отнести их к коллагеносинтезиру¬
ющим.Таким образом, для гистологической картины ЛАМ характерно:
пролиферация гладкомышечных волокон, деструктивные изменения
альвеол, стенок бронхов, лимфатических и кровеносных сосудов.
Аналогичные изменения могут выявляться в средостении, органах
брюшной полости, ретроперитонеальном пространстве и лимфати¬
ческих узлах. Прогрессирование болезни ведет к формированию так
называемого м икрокистозного легкого.
ЛИМФАНГИОЛЕЙОМИОМАТОЗ ЛЕГКИХ • 409Клиническая картинаКак уже упоминалось, ЛАМ возни кает только у лиц женского пола,
причем преимущественно в репродуктивном возрасте. Тем не менее
переход женщины в менопаузу не исключает возможности возникно¬
вения ЛАМ. Очаговая форма ЛАМ может протекать бессимптомно и
выявляться при профилактическом флюорографическом исследова¬
нии. Выявление лейомиом в брюшной полости, ретроперитонеальном
пространстве, матке, кишечнике, почках и других органах свидетель¬
ствует о системности заболевания. Формирование опухолевидных
образований в кишечнике может явиться причиной непроходимости
и потребовать хирургического вмешательства.Анализ клинических проявлений у 66 больных, показал, что
при диффузной форме ЛАМ одышка является, как правило, пер¬
вым признаком болезни. По мере прогрессирования заболевания
одышка неуклонно усиливается. Кровохарканье регистрируется у
20% заболевших. У 49% больных ЛАМ встречается пневмоторакс, а
приблизительно у 1/3 больных он считается первым проявлением
болезни. Пневмоторакс (одно- или двусторонний) в дальнейшем, как
правило, рецидивирует, по времени часто совпадает с менструацией.
Вовлечение в патологический процесс лимфатических сосудов при¬
водит к накоплению в плевральной полости хилезной жидкости у 20%
женшин. Нередко возникает необходимость в многократной эвакуа¬
ции хилезной жидкости. По мере прогрессирования болезни может
определяться хилоперикардит, хилезный асцит (хилоперитонеум),
хилурия, хилоринорея. Около половины больных отмечают боль в
груди. Лейомиомы (фибромиомы) матки выявляются в 72% случаев,
преимущественно односторонние ангиомиолипомы почек — в 20%.
Ангиомиолипомы почек (как правило, двусторонние) у больных тубе¬
розным склерозом Бурн вил я или при сочетании туберозного склероза
и ЛАМ выявляются значительно чаще — в 70—80% случаев [Franz D.M.
et al., 2001]. Спонтанные кровотечения в ангиомиолипоматозных узлах
могут проявляться болями в брюшной полости, острым снижением
артериального давления по типу циркуляторного коллапса и (или)
анемией. Увеличение лимфатических узлов ретроперитонеального
пространства может имитировать рак почек, яичников, лимфому.Течение диффузной формы ЛАМ неуклонно прогрессирующее,
однако скорость прогрессирования у разных больных различна.
Течение очаговой формы более благоприятно. Нам приходилось
наблюдать случай самопроизвольного обратного развития очаговой
410 . ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНАЦИИ ОПУХОЛЕВОЙ ПРИРОДЫформы болезни, подтвержденной гистологически. Активизации пато¬
логическою процесса способствуют прием контрацептивных препа¬
ратов, беременность, роды. Однако влияние беременности, а также
использования экзогенных эстрогенов, контрацептивов на течение
ЛАМ требует дальнейшего изучения.ДиагностикаДиагностика ЛАМ представляет значительные трудности. Специ¬
фических физикальных признаков болезни нет. Аускультативная
картина также не имеет специфических черт. Хрипы выслуши¬
ваются у 15—20% больных. Выявление признаков наличия жид¬
кости (воздуха, хилезной жидкости, крови) в плевральной полос¬
ти, признаков асцита при наличии соответствующих изменений
в ЛЄ10ЧН0Й ткани должно вызвать подозрение в отношении ЛАМ.
Лабораторные методы исследования (клинический анализ крови, био¬
химические, иммунологические показатели крови) неинформативны.
Определяемая в ряде случаев эозинофилия периферической крови
может быть обусловлена аллергизирующим воздействием на орга¬
низм хилезного экссудата плевральной полости или других локали¬
заций.Лучевая диагностика. На рентгенограммах органов грудной клетки
у больных с диффузной формой ЛАМ может определяться широкий
спектр двусторонних изменений: от нормальной рентгенологической
картины до усиления легочного рисунка за счет интерстициальнойткани (рис. 7.8), сетчато-очаговых
затенений, эмфизематозных взду¬
тий до 2 см в диаметре, жидкости
в плевральной полости (рис. 7.9),
повышенной прозрачности легоч¬
ных полей. По мере формирова¬
ния мслкокистозных образова¬
ний, эмфизематозных вздутий
рентгенологическая картина при¬
обретает черты, которые можно
назвать «кистозно-буллезным»
легким (рис. 7.10), несомненно
отличающимся от «сотового лег¬
кого», которое формируется при
других ИЗЛ (например, при ИФА).Рис. 7.8. Лимфангиолейо.миоматоз.
Двустороннее усиление легочно¬
го рисунка за счет интерстиция.
Лейомиома слева
ЛИМФАНГИОЛЕЙОМИОМАТОЗ ЛЕГКИХ • 411Рис. 7.9. Лимфангиолейомиоматоз.
Усиление и деформация легочного
рисунка. Хилоторакс слеваРис. 7.10. Лимфангиолейомиоматоз.
Диффузная форма. Множественные
буллыпреимущественная локализация кистозно-буллезных вздутий — пери¬
ферические, субплевральные верхние и средние легочные ПОЛЯ.Иногда у больных ЛАМ выявляются признаки несостоятельности
грудного лимфатического протока. Очаговая форма ЛАМ на рент¬
генограммах проявляется множественными различной величины
(0,5-1,5 см) очагами, четко очерченными, без какой-либо преиму¬
щественной локализации. ВРКТ позволяет выявить двусторонние
множественные тонкостенные кисты даже в тех случаях, когда на
обычных рентгенограммах определяется лишь сетчатая деформа¬
ция легочного рисунка. Фокальные затенения по типу «матового
стекла» отмечаются у 12% больных [Urban Т. et а)., 1999], фокальные
кровоизлияния в альвеолы — у 59% больных ЛАМ [Kitaichi М. et al.,
1995J. Особенностью КТ-картины ЛАМ является отсутствие измене¬
ний архитектоники сосудистого рисунка даже при почти тотальном
замещении легочной ткани кистами [Тюрин И.Е., 2005]. Увеличение
лимфатических узлов средостения выявляется у менее 10% пациен¬
ток, ретроперитонеальных лимфатических узлов — у 25% больных.
В органах брюшной полости (селезенка, почки, лимфатические узлы
и др.) КТ нередко выявляет ангиомйолипомы, кисты.Исследование ФВД. Изменение параметров внешнего дыхания
характерно для диффузной формы ЛАМ. По результатам комплексно¬
го функционального исследования внешнего дыхания, проведенного
в клиникие НИИ пульмонологии 20 больным с диффузной формой
ЛАМ, во всех случаях были выявлены обструктивные изменения, сте¬
412 * ГЛАВА 7, ЛЕГОЧНЫЕ ДИССЕМИНДЦМИ ОПУХОЛЕВОЙ ПРИРОДЫ пень выраженности и характер которых зависел от стадии заболева¬
ния (табл. 7.1). OOBj и скоростные параметры форсированного выдоха
снижались уже на стадии начальных проявлений болезни, резко
замедлялась диффузия газов в легких. По мере прогрессирования
ЛАМ выраженность обструктивных изменений нарастала — форми¬
ровался синдром генерализованной обструкции. Существенно меня¬
лась структура ОЕЛ: ЖЕЛ снижалась, а ООЛ резко увеличивался.
Столь значимые изменения механики дыхания на поздних стадиях
заболевания были обусловлены разрушением эластического каркаса
легких в процессе формирования кистозно-буллезных изменений,
функциональным маркером этих деструктивных изменений являлось
снижение индекса легочной ретракции. Выраженность нарушений
диффузионной способности легких и степень гипоксемии практиче¬
ски не зависели от стадии заболевания, что обусловлено пролифе¬
рацией гладкомышечных волокон и деструктивными изменениями
сосудов, существенно меняющими свойства альвеолярно-капилляр¬
ной мембраны в сторону резкого увеличения сопротивления диффу¬
зии вплоть до полного прекращения газообмена в отдельных участках
легких [Каменева М.Ю. и соавт., 2007].Таблица 7.1. Показатели легочной механики и газообмена у больных
диффузной формой ЛАМ, М±тПараметрыГраницы нормыСтадия начальных
проявлений
заболевания(п=7)Стадия развернутой
клинической картины
заболевания (п=13)0ФВ1.% долж.>8185±741±5*МОС50,% долж.>6151 ±820±4*Raw tot, кПа/лхс<0,300,14±0.010,51 ±0,09*ЖЕЛ,% долж.>8185±1269±8ОЕЛ,% долж.>81 <125105±12114+6ООЛ.% долж.>85 <150127±11202±14*ООЛ/ОЕЛ,% долж.<140131 ±5179+15*CR, кПа/л>0,31 <0,60,36±0,030,19±0.07ДСЛзд,% долж.>8129±328+5ДСЛус,% долж.>8136±336±6Ра02,% долж.>8175±263+3Примечание; * — р <0,05.
ЛИМФАНГИОЛЕЙОМИОМАТОЗ ЛЕГКИХ • 413В отличие от диффузной формы, для очаговой формы ЛАМ изме¬
нение показателей ФВД нехарактерно. Только у двух из семи обсле¬
дованных нами больных в процессе динамического наблюдения
отмечалось умеренное снижение ДСЛус при нормальных значениях
остальных параметров внешнего дыхания.Фибробронхоскопическое исследование, как правило, не выявляет
каких-либо эндоскопических отклонений от нормы, в 60—80% случа¬
ев в ЖБАЛ определяются гемосидерофаги.Биопсия легких. ЧББ на ранних стадиях часто бывает неинформа¬
тивна, а на поздних стадиях не только неинформативна, но и проти¬
вопоказана из-за множественных кистозных образований. Диагноз
может быть верифицирован с помощью видеоторакоскопической
или открытой биопсии легких. Кроме того, окраска биопсийного
материала на НМВ-45 в значительной мере специфична для ЛАМ,
может быть использована для дифференциальной диагностики
ЛАМ от гладкомышечных пролифераций в легких, вызванных дру¬
гими причинами (доброкачественная метастазирующая лейомиома,
лейомиосаркома и др.). При невозможности проведения инвазивных
биопсийных методов диагноз может быть установлен с учетом дан¬
ных анамнеза (одно- или многократное прерывание беременности,
наличие фибромиомы матки, нарушения менструального цикла и
др.), характерных клинических проявлений болезни, выявлении
хилоторакса, хиллезного асцита, ангиомиолипом почек, печени,
матки, селезенки и других органов брюшной полости, данных ВРКТ
и исследования ФВД.Приводим клинический случай ЛАМ, верифицированный гисто¬
логически и иммуногистохимически.Клинический примерБольная Т., 1950 г, рождения, поступила клинику НИИ пульмоно¬
логии в декабре 2005 г. с жалобами на одышку смешанного характера
при умеренной физической нагрузке, сухой редкий кашель в течение
дня, недомогание, слабость.Анамнез заболевания. В 1994 г. у больной диагностирован гени¬
тальный эндометриоз и выполнена операция радикальной экстирпа¬
ции матки. Жалобы со стороны органов дыхания впервые появились
в 1998 г., когда после переохлаждения стал беспокоить кашель; лечи-
414 » ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНАЦИИ ОПУХОЛЕВОЙ ПРИРОДЫ лась амбулаторно, симптоматически, без существенного эффекта.
В поликлинике по месту жительства был поставлен диагноз «бронхи¬
альная астма»; лечение бронходитиками и антибиотиками не привело
к улучшению самочувствия.В октябре 2005 г. одышка стала нарастать, при рентгенологи¬
ческом исследовании органов грудной клетки в обоих легких была
выявлена распространенная деформация легочного рисунка за счет
интерстициального компонента по сетчатому и мелкоячеистому типу,
отдельные ячейки более крупного размера (до 1 см), расположение
диафрагмы обычное. С предположительным диагнозом «гистиоцитоз
X» больная была направлена на консультацию в НИИ пульмонологии
СПбГМУ им. акад. И.П. Павлова.При аускультации легких определялось ослабленное дыхание и
нежные крепитирующие хрипы в нижних отделах. КТ легких выявила
с обеих сторон перестройку легочной ткани по типу «сотового легко¬
го» за счет тонкостенных булл.Результаты проведенного функционального исследования внеш¬
него дыхания показали наличие резко выраженной обструкции
(ОФВ^ — 35% должного) и перестройки ОЕЛ по обструктивному типу
(ООЛ/ОЕЛ — 166% должного), обусловленные формирующейся эмфи¬
земой (CR — 0,15 кПа) и приведшие к существенному снижению ДСЛ
(ДСЛзд — 31% должного).При микроскопическом исследовании материала, получен¬
ного при открытой биопсии легких, видны гладкомышечные
пролифераты, состоящие из веретеновидной формы клеток с
гиперхромными ядрами, встречаются крупные эпитслиоидного
вида светлые клетки. Митозы отсутствуют, в окружающей легоч¬
ной ткани мелкие очаги кровоизлияния, иррегулярная эмфизе¬
ма. Гистологический диагноз: диффузный лейомиоматоз легких
(рис. 7.11, см. цв. вклейку). Иммуногистохимическое исследова¬
ние с моноклональными антителами к НМВ-45, гладкомышечно¬
му десмину, актину и виментину гладкомышечных волокон дало
положительный результат.На основании проведенного в НИИ пульмонологии обследо¬
вания был поставлен диагноз: лейомиоматоз легких, диффузная
форма, стадия «сотового легкого». Несмотря на проводимую тера¬
пию: оксипрогестерона капронат, инфузионную терапию, аспар-
кам*, пентоксифиллин, лечебную физкультуру, небулайзерную
терапию, — состояние больной остается тяжелым, заболевание
прогрессирует.
ЛИМФАНГИОЛЕЙОМИОМАТОЗ ЛЕГКИХ *415Формулировка диагноза• ЛАМ, диффузная форма, степень ДН.• ЛАМ, очаговая форма.При наличии экстрапульмоналъных проявлений заболевания
(лейомиом) необходимо указать их локализацию.Дифференциальная диагностикаВремя ОТ появления первых признаков болезни до установления
диагноза составляет в среднем от 2 до 4 лет. Редкая встречаемость
заболевания, а также неспецифичность симптомов (включая данные
рентгенологического исследования) являются основными причинами
ошибочной диагностики. Среди ошибочных диагнозов чаше всего
встречаются двусторонняя пневмония, ИФА, хроническая обструк¬
тивная болезнь легких и даже бронхиальная астма из-за наличия у этих
больных (молодых женш,ин) одышки и бронхообструктивного синд¬
рома. Нередко у этой категории больных диагноз ставится лииіь после
выявления хилоторакса, ангиомиолипомы почек. Дифференциальную
диагностику следует проводить с ГХЛ, при котором рецидивирую¬
щий пневмоторакс также является одним из характерных признаков
болезни, однако если ЛАМ болеют только женщины, то ГХЛ — пре¬
имущественно мужчины. ЛАМ следует дифференцировать также с
эмфиземой, синдромом Шегрена. Более редко встречающиеся метаста-
зирующая лейомиома, эндометриальная стромальная саркома, низко-
дифференцированная лейомиосаркома могут метастазировать в легкие
с образованием кистозных изменений, напоминающих ЛАМ. Среди
других заболеваний, способных создавать диагностические трудности,
следует назвать лимфангиоматоз, лимфан[иоэктазы и лимфатические
дисплазии [Paul J.L. ct al., 2000]. Значительные трудности возникают
при проведении дифференциальной диагностики между ЛАМ и тубе¬
розным склерозом Бурнвиля, при котором идентичные гистологиче¬
ские изменения в легких развиваются от I до 4% больных. Клинически
туберозный склероз Бурнвиля проявляется у этих больных одышкой,
кашлем, кровохарканьем. Беременность вызывает обострение при
обоих заболеваниях. В отличие от ЛАМ, туберозный склероз — пато¬
логия семейная, сопровождается характерным признаком — умствен¬
ной отсталостью, неврологическими проявлениями, пальпируемыми
кожными поражениями, называемыми «шагреневой кожей», лицевым
ангиофиброматозом, подногтевым фиброматозом.
416 ■ ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНАЦИИ ОПУХОЛЕВОЙ ПРИРОДЫ ЛечениеК настоящему времени нет контролируемых и статистически
доказательных исследований, посвященных лечению больных ЛАМ.
В связи с этим отсутствуют национальные и международные консен¬
сусы по лечению этой категории больных. Эффективность приме¬
няющихся в настоящее время методов лечения ЛАМ крайне низка.
Лучевая терапия, глюкокортикоиды, иммуносупрессанты неэффек¬
тивны, Учитывая то, что ЛАМ — болезнь только лиц женского пола
и в патогенезе важная роль отводится эстрогенам, усилия ученых
направлены на разработку медикаментозной (антиэстрогенами) или
хирургической (удаление яичников) редукции синтеза эстрогенов.
Препараты, содержащие эстрогены, должны быть отменены. Пока
нет достаточных оснований считать эффективным удаление яични¬
ков. Так, по данным J.R. Taylor и соавт. [1990], овариэктомия оказа¬
лась неэффективной у 16 из 16 женщин, которым она проводилась.
В качестве медикаментозной антиэстрогенной терапии применяются
прогестерон, тамоксифен, андрогены, агонисты лютеинизирующе-
го гормона (гонадотропина). Состояние всех 9 больных, которым
J.R. Taylor и соавт. [1990] назначали тамоксифен, ухудшилось и толь¬
ко у 2 из 19 пациенток, которые использовали медроксипрогестерон,
состояние улучшилось или стабилизировалось. В 1995 г. М. Kitaichi
и соавт. были опубликованы результаты лечения 40 больных ЛАМ.
Овариэктомия или назначение прогестерона оказались неэффектив¬
ными. Сочетание овариэктомии и прогестерона улучшило состояние
у одной падиентки, и у другой течение болезни стабилизировалось.
Течение болезни ухудшилось у 9 больных а также у 12 пациен¬
ток, получавших тамоксифен. Болезнь продолжала прогрессировать
также у всех 6 пациенток, получавших агонист гормона гонадотро¬
пина (leuprolide acetate). Отмечено было улучшение у одной больной,
получавшей сочетание прогестерона, тамоксифена и овариэктомии.
Лечение оказалось неэффективным также у 6 пациенток на фоне лече¬
ния leuprolide acetate. Авторы пришли к выводу, что назначение тамок¬
сифена при ЛАМ нецелесообразно, так как этот препарат обладает
лишь частичной антиэстрогенной активностью. Тем не менее боль¬
шинство ученых, имеющих опыт лечения больных ЛАМ, считают, что
эмпирическое применение прогестерона, leuprolide acetate, соматоста-
тина, а также овариэктомии целесообразно, учитывая неблагоприят¬
ный прогноз естественного течения ЛАМ.
ЛИМФАНГИОЛЕЙОМИОМАТОЗ ЛЕГКИХ *417Попытки применения у больных ЛАМ антиэстрогенного пре¬
парата окси прогестерон а капроната в клинике пульмонологии
СПбГМУ показали, что у ряда больных может быть достигнута
некоторая стабилизация патологического процесса (или замедление
его прогрессирования), замедление накопления хилезной жидкости
в плевральной полости. Курс лечения состоял в назначении окси-
прогестерона капроната (12,5%) внутримышечно 1 мл 1 раз в неделю
в течение 6 мес. В зависимости от динамики патологического про¬
цесса эта доза может быть сохранена или уменьшена на следующие
6 мес [Илькович М.М., Каменева М.Ю., 2005]. Антиэстрогенная
терапия, малоподвижный образ жизни являются показанием для
проведения денситометрии.Как уже упоминалось, больные Л АМ должны избегать беременнос¬
ти. Прогрессирование нарушений бронхиальной проходимости явля¬
ется показанием для назначения (З^-агонистов, М-холинолитиков, при
необходимости — длительной кислородотерапии. Накопление хилез¬
ной жидкости в плевральной полости — показание для ее эвакуации.
С целью предупреждения рецидивов пневмо-, гидро- или хилоторак-
са показаны плеврэктомия или плевродез. Следует, однако, иметь в
виду, что использование склерозирующих плевру препаратов может
увеличить риск операционного кровотечения при трансплантации
легких, возможность которой должна обсуждаться при ОФВ, <30% от
должной. Ретроспективный анализ результатов трансплантации лег¬
ких у 34 больных ЛАМ показал 1—2-летнюю выживаемость 69% и 58%
больных соответственно [ВоеЫегА. etal., 1996]. Как уже упоминалось,
отмечена возможность развития ЛАМ в пересаженном легком.Больные ЛАМ не должны курить, они должны быть предупрежде¬
ны о риске возникновения пневмоторакса при авиаперелетах.ПрогнозПрогноз для жизни неблагоприятный. Болезнь медленно, но неук¬
лонно прогрессирует, и летальный исход наступает в сроки от 3 до
15 лет. По данным S.R. Johnson и соавт. [2004], Ш-летняя выжива¬
емость составляет от 10 до 60%. Есть основания предполагать, что
лечение антиэстрогенами может способствовать замедлению про¬
грессирования заболевания. Случаи спонтанного обратного развития
очаговой формы ЛАМ представляют собой исключение.
418 » ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНАЦИИ ОПУХОЛЕВОЙ ПРИРОДЫПрофилактикаПрофилактика ЛАМ не разработана. Однако следует учитывать
что одним из факторов риска развития заболевания может быть искус ’
ственное прерывание беременности (в особенности многократное)ЭПИТЕЛИОИДНАЯ ГЕМАНГИОЭНДОТЕЛИОМА ЛЕГКИХЛшж^иои^ гешнгиоз«дота,иомалегких- многофокусное обоа-
зование легких с низкой степенью злокачественности ранее извест
нос как внутрисосудистая склерозирующая бронхиолоальвеолярная'
опухоль легких. Эта своеобразная опухоль была впервые описана
C.J. Farinacc. и соавт. В 1973 г и отнесена к легочному децидуозу при
внематочной беременности, но в дальнейшем эта точка зрения L
нашла подтверждения. Термин «эпителиоидная гемангиоэндоте
лиома легких, впервые был предложен S.W. Weiss и соавт в 1986 г
Истинная частота эпителиоидных гемангиоэндотслиом неизвестна'
обычноописываются лишь единичные наблюдения. L, Socilian и соавт
в I9S3 г. обобщили данные литературы о 27 случаях таких гемангио
эндотмиом и дали подробное описание собственного наблюдения
К 2000 г. опубликовано приблизительно 50 случаев наблюдений этой
редкой патологии (Makundan G. et а|„ 2000]. В отечественной литеоа-
туре имеются сообщения лишь о единичных наблюдениях эиители
оидной гемангиоэндотелиомы легких (Абросимов А Ю Малик Г ГПроцесс поражает преимущественно женщин (80%). Возраст больных
от 12 до 60 лет. Как правило, поражаются легкие, но изредка в процесс
могут вовлекаться печень, мягкие ткани, кости [Согпп В, 19821 и тпудно
решить, чтоэто -мультицентрическое поражение илиметастатич^кое
Несмотря на редкость, интерес к этой патхшогии не ослабевает.Этиология и факторы рискаЭтиология эпителиоидной гемангиоэндотелиомы легких неизве
стна. Не исключается возможность генетической предрасположен
ности к данному заболеванию. О роли генетических факторов в разви
тииданного заболевания известно мало. A.S. Boudousquie et al в Wr
ЭПИТЕЛИОИДНАЯ ГЕМАНГИОЭНДОТЕЛИОМА ЛЕГКИХ • 419описали несколько клональных аномалий у пациентов с эпителио-
идной гемангиоэндотелиомой легких, включая комплексную транс¬
локацию между хромосомами 7 и 22 с множественными поломками,
робертсоновскую транслокацию хромосомы 14. Моносомия по 11-й
хромосоме была отмечена в субпопуляции опухолевых клеток.ПатогенезПатогенетические механизмы развития эпителиоидной гемангио-
эндотелиомы легких не выяснены.Патологическая анатомияМакроскопически в материале биопсий выявляются серо-белого
цвета очаги хряшевой плотности размерами от 0,1 до 2—3 см в диаметре
без капсулы. При гистологическом исследовании видны округлой или
овальной формы узелки, располагающиеся в бронхиолах, альвеоляр¬
ных ходах, просветах альвеол, сосудах. Мелкие узелки опухоли состоят
из одного многоклеточного слоя или из двух наружных слоев. В крупных
узлах опухоли можно выделить три зоны. Центральная — бесклеточ-
ная — представлена гомогенной розовой тканью типа гиалинизиро-
ванной соединительной ткани, дающей слабую реакцию на амилоид,
положительную реакцию с альциановым синим, слабоположительную
PAS-реакцию, изредка видны кальцификаты. Промежуточная — бес-
клеточная — опухолевая масса с опухолевыми клетками разной вели¬
чины и округлыми лагунами, содержащими 2-3 клетки. Эта зона напо¬
минает хрящевую ткань, но основное вещество ее окрашивается более
оксифильно и содержит меньшее количество кислых и нейтральных
гликозоаминогликанов. Гомогенное вещество дает нежную окраску
Конго красным, пикринофильно. Лакуны содержат клетки более мел¬
кие, чем в хрящевой ткани. И наконец, наружная зона характеризуется
многоклеточностью, клетки отличаются полиморфизмом и базофилией
цитоплазмы, встречаются клетки отростчатой формы. Наряду с одно¬
ядерными клетками кое-где видны многоядерные. Ядра округлой или
овальной формы с более плотным, чем у округлых клеток, хроматином.
Клетки местами образуют мелкие скопления или цепочки, располага¬
ются в отечной миксоидной строме, содержащей капиллярные сосуды
и сосудистые почки, лишенные просветов, кое-где незначительная
инфильтрация, преимущественно лимфоцитами. В периферических
участках опухолевая ткань напоминает полипы, которые как бы запол¬
420 * ГЛАВА 7. ЛЕГОЧНЫЕ ДИССЕМИНАЦИН ОПУХОЛЕВОЙ ПРИРОДЫ няют просвет альвеол, кое-где полиморфные клетки свободно лежат
в просвете альвеол (рис, 7.12, см. цв. вклейку). Местами опухолевые
массы видны в просветах артерий и вен. Поверхность опухолевых узлов,
которые выбухают в просвет альвеол, выстлана гиперплазированным
альвеолярным эпителием и носит реактивный характер. В окружающей
легочной ткани — участки дистелектаза, в просветах альвеол — макро¬
фаги. При иммуногистохимическом исследовании с эндотелиальны¬
ми маркерами CD31, клон ТАЮ и CD34, RTU-END, клон QBEnd/10
(«Novoka$tra*>, UK) выявляется экспрессия CD31 и CD34 в клеточных
пролифератах, что подтверждает гистогенетическую связь клеток с
полипотентной стволовой сосудообразующей клеткой (рис. 7.13, 7.14,
см. цв. вклейку). На этапе пролиферации имеется интенсивная экс¬
прессия CD31 и CD34, которая убывает по мере накопления депозита.Клиническая картинав большинстве случаев эпителиоидная гемангиоэндотелиома
характеризуется бессимптомным течением, и изменения легочной
ткани выявляются случайно при профосмотрах. Изредка больные
жалуются на боли в грудной клетке, одышку разной степени выра¬
женности, кашель, кровохарканье. Течение данного заболевания
неуклонно прогрессирует, но очень медленно. Самопроизвольного
обратного развития болезни, по литературным данным, не наблюда¬
лось.ДиагностикаДиагностическая ценность общепринятых лабораторных методов
исследования незначительна. На рентгенограммах и КТ опреде¬
ляются четкие узелки разной величины и интенсивности. Однако
могут выявляться и солитарные легочные массы с кальцифи катами.
Показатели ФВД могут не изменяться в течение длительного времени.
Далее может произойти уменьшение ОФВ, и снижение скоростных
показателей, увеличение бронхиального сопротивления, перестройка
нормальной ОЕЛ за счет уменьшения ЖЕЛ и увеличения ООЛ.Дифференциальная диагностикаДифференциальїіая диагностика проводится с гранулематозными
заболеваниями, гамартомой, склерозирующей гемангиомой, мета¬
ЭПИТЕЛИОИДНАЯ ГЕМАНГИОЭНДОТЕЛИОМА ЛЕГКИХ • 421статическим поражением легких. Изменения в легких первоначально
расцениваются как туберкулезный процесс, метастатическое пора¬
жение, множественные гамартомы. Диагноз устанавливается только
после исследования биопсийного материала (ЧББ, видеоторакоско¬
пия, диагностическая торакоскопия).Прогноз этого процесса непредсказуем. По мере разрушения легоч¬
ной ткани нарастает легочная недостаточность, от которой больные
погибают.ЛечениеЛечение эпителиоидной гемангиоэндотелиомы легких симптома¬
тическое.Интерес представляет клиническое наблюдение с поражением
легких и печени.Клинический примерЖенщина, 41 год, инженер-химик. В октябре 1998 г. при профилак¬
тическом осмотре рентгенологически выявлены двусторонние изме¬
нения в легких, преимущественно в нижних отделах. Лимфатические
узлы не увеличены. Жалоб больная не предъявляла. Произведена
открытая биопсия легочной ткани. Макроскопически под висце¬
ральной плеврой и в ткани легкого определялись узелки серо-белого
цвета, плотноватой консистенции, размерами от 0,2 до 0,6 см. При
гистологическом исследовании в мелких бронхах и сосудах определя¬
лась опухолевая ткань, состоящая из гомогенного основного вещества
с включениями эпителиоидных клеток, местами образующих гнезда.
Опухолевые клетки округлой, овальной или отростчатой формы, с
ядрами, богатыми хроматином. Митозы отсутствовали. Опухолевая
ткань в виде «полипов» как бы заполняет просветы альвеол, местами
опухолевые массы видны в просветах артерий и вен. Гистологический
диагноз — эпителиоидная гемангиоэндотелиома легких (см. рис. 7.12).
В феврале 2002 г. при обследовании в левой доле печени выявлено
образование диаметром 1,2 см. Жалобы на одышку инспираторного
характера. При КТ легких определяются многочисленные, хорошо
ограниченные узлы, некоторые из которых содержат кальцификаты.
Местами картина «матового стекла». В плевральной полости слева
около 50 мл жидкости. Показатели ФВД снижены: ОФВ, —71% долж¬
ной, ФЖЕЛ — 62% должной. Заболевание прогрессировало, и через
422 « ГЛАВА 7. ЛЕГОЧНЫЕ ДИССШИНДЦИИ ОПУХОЛЕВОЙ ПРИРОДЫ 5 лет после установления диагноза больная умерла от прогрессиру¬
ющей ДН. Гистологическое строение опухолевых узлов из легких и
печени было однотипным, при иммуногистохимическом исследова¬
нии в обоих препаратах (легкое, печень) выявлена экспрессия CD31 и
CD34.Диагноз: эпителиоидная гсхмангиоэндотелиома с поражением лег¬
ких и печени.Прогнозпрогноз эпителиоидной гемангиоэндотелиомы легких неблаго¬
приятные при возникновении метастатического процесса.ПрофилактикаПрофилактика эпителиоидной гемангиоэндотелиомы легких не
разработана.
ЛИТЕРАТУРААнтелава О.Л., Насонов Е.Л., Хитрое А.И. Идиопатические воспалительные
миопатии// Рус. мед. журн. — 2007. — Т. 5, № 26. — С. 1951-1958.А}апелава ОЛ, Соловьев С.К., Хитрое АН, Насонов ЕЛ. Новые аспекты фармакоте¬
рапии идиопатических воспалительных миопатий (Обзор литературы) //
Рус. мед. журн. — 2006. — 14, 8 (260). — С. 627-629.Артамонова В.Г,, Мухин НА, Профессиональные болезни. — М,: Медицина,2004. - 480 с.Артамонов Р.Г, Идиопатический гемосидероз легких // Мед. науч. и учеб.-
метод. журн, — 2002. — № 6. — С. 189-193.Богданов А. М., Мазуров В.И., Новик А.А. Поражения легких при ревматоид¬
ном артрите // Санкт-Петербургские медицинские ведомости. — 1998. —
№ 3. - С. 6-12.Богданов А.Н. Особенности поражений легких при ревматоидном артрите,
системной красной волчанке и склеродермии: Автореф. дис. ... д-ра мед.
наук. — СПб., 1998. — 41 с.Величковский Б.Т. Патогенетическая терапия и профилактика хронического
пылевого бронхита с обструктивным синдромом // Пульмонология. —1995. - № 3. - С. 6-19,Виноградова Д.Н., Амосов В.М., Илькович ММ. Идиопатический фиброзиру-
ющий альвеолит: возможности компьютерной томографии в первич¬
ном распознавании и угочнении стадии патологического процес¬
са // Folia Otorhinolaringol. Pathol, Respir. — 2002. — Vol. 8. — № 1-2. —
P. 51-55.Воинов B.A. Фиброз ирующие альвеолиты I I Эфферентная терапия. Мембран¬
ный плазмаферез. — СПб.: Эскулап, 2002. — С. 65-69.Воинов ВЛ. Эфферентная терапия, мембранный плазмаферез: 3-є изд., доп. —
М., 2002. - С. 272.Герасин ВЛ., Молодцова В.П., Деревянко А.В., Баранова О.П, Двораковская И. В.
Чрезбронхиальная биопсия легких в диагностике саркоидоза органов
дыхания // Тер. арх. — 2008. — № 4. — С. 43-46.Герасин В.А., Паламарчук Г.Ф., Журавлев А.В, Диагностический бронхоальвео¬
лярный лаваж в оценке эффективности лечения идиопатического фибро-
зирующего альвеолита // Тер. арх. — 1988, — 12. — С. 63-66.Гусева НГ Системная склеродермия // Ревматология: национальное руко¬
водство / Под ред. Е.Л. Насонова, В.А. Насоновой. — М.: ГЭОТАР-Медиа,
2008. - С, 447-466.Гусева и.Г. Системная склеродермия и псевдосклеродермические синдро¬
мы, — М.: Медицина, 1993. — 270 с.Данилов Л.Н., Лебедева Е.С., Кириллов Ю.А. и др. Влияние сурфактанта легкого
крупного рогатого скота на течение блсомицин-индуцированной патоло¬
гии легких крыс II Пульмонология. — 1998. — № 3. — С. 51—55.
424 • ЛИТЕРАТУРАДанилов Л.Я., Лебедева Е.С., Колесов В.А. и др. Моделирование токсического
фиброзирующего альвеолита // Актуальные проблемы пульмонологии:
Сб. науч. тр. — Л,, 1991. — С. 45-48.Двораковская КВ., Баранова О.П. Лимфангиолейомиоматоз легких // Арх.
пат. -2005. - № 5. - С. 26-29.Добин В.Л., Калиничев Г.А. Поражение сердечно-сосудистой системы при сар-
коидозе // ГТробл. туб. — 1991. — № 2/2. — С. 71-73.Ерохин В.В., Гедъшнн Л.Е., Лепеха Л.Я., Двораковская И.В. Интерстициальные
болезни легких // Клеточная биология легких в норме и при патологии:
Руководство для врачей / Под ред. В.В. Ерохина, Л.К. Романовой. —
М.; Медицина, 2000. — С. 385-410.Заболевания органов ды.хания // Библиотека врача общей практики. — Т. 2 /
Под ред. М.М. Ильковича — СПб.; Нордмедиздат, 1998. — С. 464.Захарова А.С., Сесь Т.П., Новикова Л.И. и др. Иммунологические критерии актив¬
ности хронического воспалительного процесса у больных идиопатичес-
ким фиброзирующим альвеолитом // МЕДЛАЙН-Экспресс. — 2006. —
№ 2-3 (186). - С. 17-20.Золотницкая B.II, Баранова 0.11, Кабанова СЮ. Перфузионная сцинтигра-
фия в оценке состояния микроциркуляции у больных саркоидозом
легких//Регионар. кровообращение и микроциркуляция. —2007. — №3. —
С. 47-51.Шькович М.М. Амилоидоз бронхолегочный первичный // Интерстициальные
заболевания легких / Под ред. М.М. Ильковича, А.Н. Кокосова. —
СПб.; Нордмедиздат, 2005. — С. 460-465.Ильковин М.М. Гистиоци гоз X легких // Интерстициальные заболевания лег¬
ких / Под ред, М.М. Ильковича, А.Н. Кокосова. — СПб.; Нордмедиздат,2005. - С. 329-340.Илькович М.М. Заболевания органовдыхания. — СПб.: Нордмедиздат, 1998, —
С, 185-198.Илькович М.М. Идиопатический гемосидероз легких // Интерстициальные
заболевания легких / Под ред. М.М. Ильковича, А.Н. Кокосова. —
СПб.; Нордмедиздат, 2005. — С. 445-450.Илькович М.М., Каменева М.Ю. Лейомиоматоз легких // Интерстициальные
заболевания легких / Под ред. М.М. Ильковича, А.Н. Кокосова. —
СПб.; Нордмедиздат, 2005. — 560 с.Илькович М.М., Новикова Л.И. Экзогенный аллергический альвеолит //
Интерстициальные заболевания легких / Под ред. М.М. Ильковича,А.Н. Кокосова. - СПб., 2005. - Гл. 3.2. - С. 183-211.Илькович М.М. Саркоидоз органов дыхания // Интерстициальные заболевания
легких / Под ред. М.М. Ильковича, А.Н. Кокосова. — СПб.: Нордмедиздат,2005. - С. 288-329.Иванова М.М. Системная красная волчанка // Диффузные болезни соеди¬
нительной ткани (системные ревматические заболевания). — Казань:
Медицина, 2004. — С. 253-340.
ЛИТЕРАТУРА ♦ 425Илькович М.М., Орлова ГЛ. Лекарственное поражение легких / Чучалин А.Г.,
Синопальников А.И., Страчунский Л.С. Пневмония. — М.: Мед. информ.
агентство, 2006. — Гл. 17. — С. 445-462.Илькович М.М. Остеопластическая иневмопатия // Интерстициальнь5е
заболевания легких / Под ред. М.М. Ильковича, А.Н. Кокосова. —
СПб.: Нордмедиздат, 2005, — С. 465-469.Каминская Г.О., Абдуллаев Р.Ю., Филиппов В.ЇЇ. Биохимические характеристики
жидкости и клеток бронхоалъвеолярньтх смывоп у больных экзогенным
аллергическим альвеолитом // Пробл. туб. — 2002. — № 8. — С. 26—31.Каменева М.Ю., Двораковская И. В., Новикова ЛМ. и др. Лейсмиоматоз легких
(морфо-функциональное исследование) // Болезни органов дыхания. —2007, - № 1. - С. 85-96.Каменева М.Ю. Исследование функции внешнего дыхания // Интерстициаль¬
ные заболевания легких / Под ред. М.М. Ильковича, А.Н. Кокосова. —
СПб.: Нордмедиздат, 2005. — С. 50-59.Классификация пневмокониозов: метод, указания № 95/235 М3 МП РФ. —
М., 1996.-27 с.Клюквина Н.Г Системная красная волчанка // Ревматология: национальное
руководство / Под ред. Е.Л. Насонова, В.А. Насоновой. — М.: ГЭОТАР-
Мелиа, 2008. - С. 400-418.Коган Е.А., Козловская Л. В., Корнев Б.М. и др. Саркоидоз // Интерстициальные
заболевания легких. Практические руководства/ Под ред. Н.А. Мухина. —
М.; Литтерра, 2007. - С. 120-156.Крофтон Дж., Дуглас А. Заболевания органов дыхания: Пер. с англ. —
М.: Медицина, — 1974. — С. 728.Кузьмина Л.П., Спицин В.А., Тарасова Л.Л., Милишникова В.В. Генетические аспек¬
ты силикоза: особенности распределения частот полиморфных генов //
Вестн. РАМН, - 1998. - № 5. - С. 7-10.Лашина Е.Л. К вопросу ранней диагностики респираторных нарушений у рабо¬
тающих в условиях воздействия пылевого и биологического факторов про¬
изводственной среды: Авторсф. дис. ... канд. мед. наук: 14.00.05, 14.00.07 /
Санкт-Петербург, гос, мед. акад. им. И.И. Мечникова. — СПб., 1998. — 24 с.Лебедева Е.В. Функциональное состояние миокарда и особенности гемо¬
динамики малого круга кровообраш,ения у больных саркоидозом лег¬
ких по данным эхокардиографии: Автореф дис. ... канд, мед, наук. -
СПб., 2004. - 22 с.Лощилов Ю.А. Патогенез пневмокониоза (история вопроса и современные
представления) // Пульмонология. — 1997. — № 4. — С. 82—86.Лощ^юв Ю.А. Патологическая анатомия и особенности морфогенеза пылевых
заболеваний легких // Пульмонология. — 1998. — № 1. — С. 74-86.Маянский Д.Н. Хроническое воспаление. — М.: Медицина, 1991. — 272 с.Моисеев С.В. Инфильтративные поражения миокарда. Варианты течения, кли¬
нико-морфологические сопоставления и диагностика: Автореф. дис. ...
д-ра мед. наук. ~ М., 2001. — 27 с.
426 • ЛИТЕРАТУРАМолодцова В.П., Двораковская КВ., Баранова ОМ, и др. Эндобронхиальная био¬
псия в диагностике саркоидоза легких // Пробл. туб. — 2006. — № 4. —
С. 28-31.Монаетоеа Л.М. Пневмокоьшозы // Болезни органов дыхания. — М.:
Медицина, 1990. — Т. 4. — С. 269-334.Мустафаев И.А., Гусейнова А.Д., Баранова О.П., Коревский К.С. Влияние плазма-
фереза на динамику клинических и иммунологических показателей при
саркоидозе легких // Соврем, достижения азербайджанской медицины
(Azerbaycan t3bab3tinin muasir паіііуузіїзгі). — 2007. — № 4. — С. 74—78.Насонов ЕЖ Воспалительные заболевания мышц // Рациональная фармако¬
терапия ревматических заболеваний. — М.; Литтерра, 2003. — С. 195—202.Насонов Е.Л. Идиопатические воспалительные миопатии // Ревматология. —
М.: 2005.-С. 192-201.Насонов Е.Л., Каратеев Д.Е., Балабанова P.M. Ревматоидный артрит //
Ревматология; национальное руководство / Под ред. Е.Л. Насонова,B.А. Насоновой. - М.: ГЭОТАР-Медиа, 2008. - С. 290-331.Некласов Ю.Ф., Гуляева Н.В. Гемодинамические особенности малого круга кро¬
вообращения и их диагностическое значение у больных идиопатическим
фиброзируюищм альвеолитом и саркоидозом легких // Дифференциаль¬
ная диагностика заболеваний легких. — Д., 1986. — С. 102-106.Орлова ГІ1. Пневмокониозы // Интерстициальные заболевания легких /
Под ред. М.М. Ильковича, А.Н, Кокосова. — СПб., 2005. — Гл. 5.5. —C. 356-384.Орлова Г.П. Экзогенный токсический альвеолит // Интерстициальные за-
болеваїшя легких / Под ред. М.М, Ильковича, А.Н. Кокосова. — СПб.,2005,-Гл. 3.3.-С. 211-230.Перлей В.Е. Функция правых отделов сердца и развитие правожелудочковой
недостаточности у больных интерстициальными заболеваниями легких //
Рос. мед. вестн. — 1998. — Т. 3, № 2. — С, 53-60.Попова С.Г. Особенности выявления, клиники и лечения заболеваний глаз у
больных туберкулезом и саркоидозом органов дыхания: Автореф. дис. ...
канд, мед. наук. — СПб., 2004, — 22 с.Путав КВ., Ильковт М.М. Фиброзируюпще альвсолиты. — Д.: Медицина,
1986.- 168 с.Ревматические болезни. Руководство по внутренним болезням / Под ред.В.Л. Насоновой, Н.В. Бунчука. — М.: Медицина, 1997.Ревматология. Клинические рекомендации / Под ред. Е.Л. Насонова. —
М.: ГЭОТАР-Медиа, 2008. - С. 202-216.Романов В.В. Экстракорпоральные методы в лечении больных саркоидозом //
Пробл. туб. — 2001. — № 3. — С, 45-49.Рыбакова М.Г., Двораковская И. В., Байков В. В., Маркусевич Е.В. Иммугтомор-
фологическая характеристика гистиоцитоза из клеток Лангерганса в лег¬
ких // Арх. пат. — 2008. — Т. 70, 4. — С. 3-5.Самцов А.В., Илькович М.М., Потекаев Н.С. Саркоидоз. — СПб.: Невский диа¬
лект, 2001. — С. 158.
ЛИТЕРАТУРА • 427Семенкова Е.Н., Бекетова ТВ., Коган Е.А. и др. Современные представления о
микроскопическом полиартериите // Тер. арх. — 1995. — № 5. — С. 39-41.Сесь Т.П., Колодкина Л.Л,, Суркова КА, и др. Характеристика аутоиммунного
компонента хронического воспалительного процесса при идиопати-
ческом фиброзируюшем альвеолите // Мед. иммунол. — 2000. — № 3. —С. 291-298.Сесь Т.П., Походзей И.В., Булычев Л.Г., Леонтьева Е.А. И.ммунологические и био¬
химические особенности патогенеза саркоидоза легких и фиброзирую-
щих альвеолитов // Пульмонология. — 1993. — № 2. — С. 83-86.Сесь Т.П., Баранова О.П., Бакланова О.Э. и др. Особенности активации Т-лимфо-
цитов хелперов 1 и 2 типа у больных саркоидозом легких // МЕДЛАЙН-
Экспресс. - 2006. - № 2-3(186). — С. 57-59.Системная склеродермия // Рациональная фармакотерапия ревматических
заболеваний рук / В,А. Насонова, Е.Л. Насонов, Р.Т. Алекперов и др.;
под общ. ред. В.А. Насоновой, Е,Л. Насонова.— М.: Литтерра, 2003.—С. 181-188.Спасская П.Л., Бартусевичене Л.С. Клиническая рентгенодиагностика колла-
генозов. — Вильнюс: Мокслас, 1988. — 146 с.Тюрин Е.И., Власова М.М,, Мапков Ю.В., Никонов А.А, Актуальные вопросы диа¬
гностики и лечения диссеминированных процессов л легких / Под ред.
М.М. Ильковича. — Л., 1989. — С. 61-64.Тюрин И.Е. Интерстициальные заболевания легких // Компьютерная томог¬
рафия органов грудной полости. — СПб.: ЭЛБИ-СНб, 2003. — С. 326-331.Тюрин И.Е, Компьютерная томография органов грудной полости. —
СПб,, 2003; 2005. ~ С. 371.Удельнова КА., Муравьев Ю.В. Особенности легочной патологии при ревмато¬
идном артрите // Клин. мед. — 2006. — Т. 84, № 3. — С. 19-22.Шмелев ей. Идиопатический гемосидероз легких // Респираторная медицина /
Под ред. А.Г. Чучалина. — М.: ГЭОТАР-Медиа, 2007. — С. 288-291.Шмелев Е.И. Саркоилоз // Атмосфера. — 2004. — № 2 (13). — С. 3-10.Abe S., Yamaguchi Е., Makimura S. et ai Association of HLA-DR with sarcoidosis:
correlation with clinical course // Chest, — 1987. — Vol. 92. — P. 488-490.Acharya P.S, Zisman D.A. Antifibrotic therapy for idiopathic pulmonary fibrosis //
Clin. Pulm. Med. - 2001. - Vol. 8, N 6. - P. 327-334.Afshar K., Sharma O.P. Interstitial lung disease: trials and tribulations // Curr. Opin.
Pulm. Med. — 2008, Sep. — Vol. 14, N 5. — P. 427-433.Agarwal H.S., Taylor M.B., Grzeszczak M.J. et ai Extra corporeal membrane oxygen¬
ation and plasmapheresis for pulmonary hemorrhage in microscopic polyangiitis //
Pediatr. Nephrol. — 2005, Apr. — Vol. 20, N 4. — P. 526-528. Epub 2005 Feb 16.Agbodu B.N., Stern B.J., Sewell C., Yang G. Therapeutic considerations in patients with
refractory neurosarcoidosis//Arch. Neurol. — 1995. — Vol. 52. — P. 875-879.Aguayo S.M. Determinants of susceptibility tu cigarctte smoke: potential roles
for neuroendocrine cells and neuropeptides in airway inflammation, airway
wall remodeling, and chronic airflow obstruction // Am. J. Respir. Crit. Care
Med. - 1994. — Vol. 149. — P. 1692-1698.
428 • ЛИТЕРАТУРАAguilar Leon D.E., Novelo Кеїапа V., Martinez-Cordero E. Anti-avian antibodies and
rheumatoid factor in pigeon hypersensitivity pneumonitis // Clin. Exp. Allergy. —
2003. - Vol. 33, N 2. - P. 226-232.Aird P., Rossi М., Scarsi М., Danieli E. et al. Disease-modifying effects of long-term
cyclic iloprost therapy in systemic sclerosis. A retrospective analysis and compari¬
son with a control group // Clin. Exp. Rheumatol. — 2007, Sep.-Oct. — Vol. 25,
N 5. - P. 722-727.Akgun M, Araz 0., Akkurt 1. et al. An epidemic of silicosis among former denim sand-
blasters // Eur. Rcspir. J. - 2008. - Vol. 32. - P. 1295-1303.Akikusa J.D., Schneider R., Harvey E.A. etal. Clinical features and outcome of pediatric
Wegener’s granulomatosis // Arthritis Rheum. — 2007, Jun. 15. — Vol. 57, N 5. —
P 837-844.Alazemi S., Campos M.A, Interferon-Induced Sarcoidosis // Int. J. Clin. Pract. —2006. - Vol. 60, N 2. - R 201-211.Alberto C.J., Diana Д, Guillermo N.G. Shrinking lungs syndrome, a rare manifestation
of systemic lupus erythematosus // Int. J. Clin. Pract. — 2006, Dec. — Vol. 60,
N 12. - P 1683-1686.AHA., Schmidt Byrd Jr. R.P., TalaveraE, SharmaO.P. Drug-Induced Pulmonary
Toxicity // Article Last Updated. — 2008, Sep. 24. — eMedicine Specialties >
Pulmonology > Iatrogenic Pulmonary Disorders.Almenoff P.L., Johnson A., Lesser М., Mattman L.H. Grovt^th of asid-fast L-forms
from the blood of patients with sarcoidosis // Thorax. — 1996. — Vol. 51. —
R 530-533.Al-Mutairi S., Al-Awadhi A., Raghupathy R. et al. Lupus patients with pulmonary
involvement have a proinflammatory cytokines profile // Rheumatol. Int. — 2007,
May. - Vol. 27, N 7. - P 621-630.Amanullah S., D'Alonzo Jr.G.E., Lessnau K.D. Chemical Worker’s Lung, — 2007,
Oct 19. — eMedicine Specialties > Pulmonology > Occupational Lung Diseases.Amthor M. Die Stellung der Liebowschen Desquamativpneumonia interbalb der
chronischen interstitielten Pneumonien // Prax. Pneum. — 1979. — Bd. 33. —
S. 647^650.Andrevs М., Edmunds М., Campbell A. etal. Systemic vasculitis in the 1980’s — is the an
incr5easing incidence ofWegener’sgranulematosisand microscopic polyarteriitis?//
J. R. Coll. Ohys. ~ 1990. - Vol. 24. - R 284-288.Antoniou K.M., Hansel D.М., Rubens M.B. etal. Idiopathic pulmonary fibrosis; outcomc
in relativ smoking status // Am. J. Respir. Crit. Care Med, — 2008. — Vol. 177,
N2.-R 190-194.Asanuma Y., Yamada H., Matsuda T et al. Successful treatment of interstitial pneu¬
monia with lipo-PGEl and pentoxilylline in a patient with dermatomyositis //
Ryumachi. - 1997. - Vol. 37, N 5. - R 719-726.Atkins S.R., Matteson E.L., Myers J.L. etal. Morphological and quantitative assessment
of mast cells in rheumatoid arthritis associated non-specific interstitial pneu¬
monia and usual interstitial pneumonia // Ann. Rheum. Dis. — 2006, May. —
Vol. 65, N 5. - R 677-680.
ЛИТЕРАТУРА • 429Aubry М.С., Myers J.L., Ryu JM. ei at. Pulmonary lymph angi omyomatosis // Am. J.
Respir. Crit. Care Med. - 2000. - Vol. 162. - P. 749-752.Ayhan-Ardic F.F., Oken O., Yorgandoglu Z.R. et al. Pulmonary involvement in life¬
long non-smoking patients with rheumatoid arthritis and ankylosing spondylitis
w^ithout respiratory symptoms // Clin. Rheumatol. — 2006, Mar.— Vol. 25,
N 2. - R 213-218.Azuma A„ Nukiwa Т., Tsuhoi E. et al. Double-blind, Placebo-controlled Trial of
Pirfenidone in Patients with Idiopathic Pulmonary Fibrosis //Am. J. Respir. Crit,
Care Med. - 2005. - Vol. 171, N 9. - R 1040-1047.Balbir-Gurman A., Yigla М., NahirA.M., Braun-Moscovici Y. Rheumatoid pleural effu¬
sion // Semin. Arthritis Rheum. — 2006, Jun. — Vol. 35, N 6. — P. 368-378.Baldwin C.L., Todd A., Bourke S. et al. Pigeon fanciers lung; effects of smoking on
serum and sal ivaryantidody responses to pigeon antigens//Clin. Explmmunol. -1998.-Vol. 113.-R 166-172.Balmes J.R. Occupational respiratory diseases // Primary Care; Clinics in Office
Practice. - 2000. - Vol. 27, N 4. - R 1009-1038. - Copyright @ 2000
W.B. Saunders Company. — MD Consult L.L.C. http://www.mdconsult.comBaranova N., Vishnykov N., Korzina N. Refitskaya «The incidence, prevalence and
features of the course of pulmonary sarcoidosis» (PS) in Saint-Petersbui^ for
1998-2006 years // ERJ. - 2007. - N 30 (Suppl. 51). - R K54 (P994).Barrios R.J. Hypersensitivity pneumonitis: histopathology review // Arch. Pathol.
Lab. Med. - 2008. - Vol. 132, N 2. - R 199-203.Bartolucci P., Ramanoclina J., Cahen O. et al. Efficacy of the anti — TNF-a antybody
infliximab against refractory systemic vacculitidesran open pilot stady on 10
patients // Rheumatology. — 2002. — Vol. 41. — P. 1126-1132.Basoglu A., Celik B., Yetim T.D. Massive spontaneous hemopneumothorax complicat¬
ing rheumatoid lung disease //Ann. Thorac. Surg. — 2007, Apr. — Vol. 83, N 4. —
R 1521-1523.Baughman R.P., Judson M.A., Teirstein AS. et al. Thalidomide lor chronic sarcoidosis //
Chest. - 2002. - Vol. 122. - R ІП-ГП.Bautner /, Zissel G., Schlaak М., Muller-Quemheim J. Shed slCAM-1 molecules
in BAL cell supernatants and serum of patients with pulmonary sarcoidosis //
Lung. - 1997.-Vol. 175.-R 105-116.Baumgartner K.B., Samet J.M, Coultas D.B. et al Occupational and Environmental
Risk Factors for Idiopathic Pulmonary Fibrosis: A Multicenter Case-Control
Study//Am. J. Epidemiol. — 2000. — Vol. 152, N 4. — P. 307-315.Becklake M.R., Cowie R.L. Pneumoconiosis // Textbook of Respiratory Medicine /
Murray and Nadcl. 3rd ed. — P. 1811—1824. — Copyright © 2000 W.B. Saunders
Company. — MD Consult L.L.C. http://www.mdconsult.comBehr J., Degenkolb B., Krombach F., Vogelmeier C. Intracellular glutatione and
bronchoalveolar cells in fibrosing alveolitis: effects of N-acetylcystcinc // Eur.
Respir J. - 2002. - Vol. 19, N 5, - R 906-911.Beinet N., Binder D., Stuschke M. et ai Oxidant-induced lung injury in anticancer
therapy // Eur. J. Med. Res. - 1999. - Vol. 4, N 2. - R 43-53.
430 • ЛИТЕРАТУРАBerlin М., Forgdell-Hahn А., Olerup О. et al. HLA-DR predicts the prognosis in
Scandinavian patients with pulmonary sarcoidosis // Am. J. Respir. Crit. Care
Med. - 1997. - Vol. 156. - P. 1601-1605.Bernscherer G., Karabelyos C., Tarjan Z, The pulmonological manifestations
of rheumatoid arthritis // Orv. Hetil. — 2008, Jul 20. — Vol. 149, N 29. —
P. 1355-1361.Bertorelli G., Bocchino V., Olivieri D. Hypersensitivity pneumonitis // Interstitial Lung
Diseases: Eur. Respir. Monogr. — 2000. — Vol. 5. — P. 120-137.Besnier E. Lupus pernio de la face // Ann. Dermatol. Syphiiol. (Paris). — 1889. —
Vol. 10. - P. 33-36.Betteridge Z, Gunawardena И., North J. et al. Anti-synthetase syndrome: a new
autoantibody to phenylalanyl transfer RNA synthetase (anti-Zo) assotiated with
polymyositis and interstitial pneumonia // Rheumatology. — 2007. — Vol. 46. —
P. 1005-1008.Bemg B., Wang X.D., Kirsten D. et al GM-CSF and GM-CSF beta с receptor in
adult patients with pulmonary alveolar proteinosis // Eur. Respir J. — 2000. —
Vol. 15. - R 350-357.Bhattacharyya S., Chen S.J., }Vu M. et al. Smad-independent transforming growth fac-
tor-beta regulation of early growth response-1 and sustained expression in fibrosis:
implications for sckrodcrma // Am. J. Pathol. — 2008» Oct. — Vol. 173, N 4. —
R 1085-1099.Bilgici A., Ulusoy H., Kuru O. et al. Pulmonary involvement in rheumatoid arthritis //
Rheumatol. Int. - 2005, Aug. - Vol. 25, N 6. - R 429-435.Birnbaum J., Danoff S., Askin F.B., Stone JM. Microscopic polyangiitis presenting as
a «pulmonary-muscle» syndrome: is subclinical alveolar hemorrhage the mecha¬
nism of pulmonary fibrosis? // Arthritis Rheum. — 2007, Jun. — Vol. 56, N 6. —
R 2065-2071.Bittmann L, Rolf B., Amann G. et al. Recurrence of lymphangioleiomyomatosis after
single lung transplantation: New insights into pathogenesis // Hum. Pathol. —
2003. - Vol. 34. - R 95-98.Black CM., Welsh K.I., Walker A.E. et al. Genetic susceptibility to sclcrodcrma-like
syndrome induced byvinyl chloride // Lancet. — 1983. — Vol. 8314-5, N 1. —
P. 53-55.Bobe P., Bonardelle D., Benihoud K. etal. Arsenic trioxidc: A promising novel therapeu¬
tic agent for lymphoproliferative and autoimmune syndromes in MRL/lpr mice I I
Blood. ~ 2006, Dcc 15. - VoL 108, N 13. - R 3967-3975.Boeck C. Multiple bcningn sarcoid of the skin // J. Cutan. Genital Urinary Dis. —
1899. - Vol. 17. - R 543-550.Boehler A., Speich R., Russi ЕЖ et al. Lung transplantation for lymphangioleiomyo¬
matosis//N. Engl. J. Med. - 1996. - Vol. 335. - R 1275-1280.Bogatkevich G.S., Ludwicka-Bradley A., Highland K.B, et al. Down-regulation
of collagcn and connective tissue growth factor expression with hepatocyte
growth factor in lung fibroblasts from white scleroderma patients via two
signaling pathways // Arthritis Rheum. ~ 2007, Oct. — Vol. 56, N 10. —
R 3468-3477.
ЛИТЕРАТУРА • 431Boger С.Л., Banas В., Kramer В.К. Differential diagnosis and therapy of pulmorenal
syndrome — the nephrologist’s perspective // Dtsch. Med Wochenschr. — 2007,
Sep. - Vol. 132, N 36. - P. 1842-1847.Bonaci-Nikolic B., Nikolic M.M., Andrejevic S. et al Antineutrophil cytoplasmic anti¬
body (ANCA)-associated autoimmune diseases induced by antithyroid drugs:
comparison with idiopathic ANCA vasculitides // Arthritis Res. Ther. — 2005. —
Vol. 7, N 5. - P. 1072-1081. Epub 2005, Jul 13.Booth A.D., Jefferson H.J., Ayliffe W., Anderws Р.Л., Jayne D.R. Safety and efficacy of
TNf blockade in relapsing vasculitis // Ann. Rheum. Dis. — 2002. — Vol. 61. —
P. 559.Booth A., Harper L., Hammand T et al. Prospective study of TNF Blocade with inf¬
liximab in antineutrophil cytoplasmic antibody-associated systemic vasculitis //
J, Am. Soc. Nephrol. - 2004. - Vol. 15. - P. 717-721.Bourke S.J., Carrer R., Andersen K. et al. Obstructive airways disease in non-smoking
subjects with pigeon fanciers lung // Clin. Exp. Allergy. — 1989. — Vol. 19. —
R 629-632.Bourke S.J., Dalphin J.C., Boyd G., McSharry C., Baldwin C.I. et al Hypersensitivity
pneumonitis: current concepts // Eur. Respir. J. — 2001. — Vol. 18, suppl. 32. —
R 81-92.Boyer D., Vargas S.O., Slattery 0. et al. Churg-Strauss syndrome in children: a clinical
and pathologic review // Pediatrics. — 2006, Sep. — Vol. 118, N 3. — P. 914-920.
Epub 2006, Aug 7.Brichet A., Saiez E, Lamblin C., Waltaert B. Coal workers’ pneumoconiosis and sili¬
cosis // Occupational lung disorders: Eur. Respir. Monogr. — 1999. — Chap. 7. —
R 136-157.Brihaye B., Aouba A., Pagnoux C. et ai Adjunction of rituximab to steroids and immu¬
nosuppressants for refractory/relapsing Wegener’s granulomatosis: a study on
8 patients // Clin. Exp. Rheumatol.— 2007, Jan.-Feb. — Vol. 25, N 1.—
Suppl. 44. - R 23-27.BrilletP.Y., BraunerM. Pulmonary imaging in ANCA-associated vasculitides // Presse
Med. - 2007, May. - Vol. 36, N 5. - Pt 2. - R 907-912. Epub 2007, Apr 3.Brown S.T., Brett I., Almenoff P.L.et al. Recovery of cell wall-deficient organisms from
blood does not distinguish between patients with sarcoidosis and control subjects//
Chest. - 2003. - Vol. 123, N 2. - R 413-417.Brusselle 6.G. Pulmonary-renal syndromes // Acta Clin. Belg. — 2007, Mar.-Apr. —
Vol. 62, N 2. - R 88-96.Buchhinder R., Barber М., Heuzenroeder L. et al. Incidence of melanoma and other
malignancies among rheumatoid arthritis patients treated with methotrexate //
Arthritis Rheum. - 2008, Jun. 15. - Vol. 59, N 6. - R 794-799.Burke iV., Kroghh A., Maloney P., Delprado W., Bryant D., Spratt P. Transmittion
of sarcoidosis via cardic transplantation // Lancet. — 1990. — Vol. 336. —
R 1579-1583.Burt R.K., Traynor A., Statkute L. et al. Nonmyeloablative hematopoietic stem cell
transplantation for systemic lupus erythematosus // JAMA. — 2006, Feb. 1. —
Vol. 295, N 5. - R 527-535.
432 • ЛИТЕРАТУРАCamarena А., Juarez Л., Mejia М, et al. Major histocompatibility complex and tumor
necrosis factor-alpha polymorphisms in pigeon breeder’s disease // Am. J. Respir.
Crit. Care Med. - 2001. - Vol. 163. - P. 1528-1533.Campbell J.A. Acute symptoms following work with hay // BMJ. — 1932. — Vol. 2. —
P. 1143-1144.Camus P., Fanton A., BonniaudP., Camus C., Foucher P. 1 nterstitial Lung Disease Induccd
by Drugs and Radiation // Respiration. — 2004. — Vol. 71. — P. 301-326.Camus Ph., Foucher P., Bonniaud Ph., Ask K. Drug-induced inliltrative lung disease //
Eur. Respir. J. - 2001. - Vol. 18, suppl. 32. - R 93-100.Cams C; Tohon G.J., Granados М., Fernandez L. Diffuse alveolar hemorrhage in
Colombian patients with systemic lupus erythematosus // Clin. Rheumatol, —2007, Nov. - Vol. 26, N 311. - R 1947-1949.CarbniA., PiciucchiS., Giamakakis K, etal. Diffuse alveolar hemorrhage after lefluno-
midetherapy in a patient with rheumatoid arthritis//J. Thorac. Imaging. — 2008,
Feb. - Vol. 23, N 1. - R 57-59.Carraway M.S., Ghio A.J., Carter J.D. et al. Detection of granulocyte-macrophage
colony-stimulating factor in patients with pulmonary alveolar proteinosis // Am.
J. Respir. Crit. Care Med. - 2000. - Vol. 161. - R 1294-1299.Carsillo Т., Astrinidis A., Henske E.P. Mutations in the tuberous sclerosis complex gene
TSC2 are a cause of sporadic pulmonary lymphangioieiomyomatosis // Proc. Natl
Acad. Sci. USA. - 2000. - Vol. 97. - R 6085-6090.Carvalho L., Freitas S. Vasculitis and diffuse panbronchiolitis-like in systemic lupus
erythematosus — case report // Rev. Port. Pneumol. — 2007, Mar.-Apr. —
Vol. 13, N2.-R 267-274.Chaiamnuay S., Heck L.W., Bell W.C., Bastian И.М. Acutc granulomatous lupus pneu¬
monitis: the first case report // Lupus. — 2007. — Vol. 16, N 3. — P. 201-204.Chan-Yeung М., Dimich-Ward И. Natural history of occupational lung diseases //
Occupational lung disorders: Eur. Respir. Monogr. — 1999. — Chap. 3.—
R 46-63.Chen М., Yu F, Zhang Y., Zhao M.H. Clinical (corrected) and pathological character¬
istics of Chinese patients with antineutrophil cytoplasmic autoantibody associated
systemic vasculitides: a study of 426 patients from a single centre // Postgrad.
Med. J. - 2005, Nov. - Vol. 81(961). - R 723-727.Cho L, Mori S., Imamura E, KiyoJujiC., Sugimoto M. Methotrexate pneumonia lacking
dyspnea and radiographic interstitial patterns during treatment for early rheuma¬
toid arthritis: bronchoalveolar lavage and transbronchial lung biopsy in a differen¬
tial diagnosis // Mod. Rheumatol. — 2007. — Vol. 17, N 3. — P. 256-261.Choi H.J., Shin Y.K., Lee H.J. et al. The clinical significance of serum N-terminal
pro-brain natriuretic peptide in systemic sclerosis patients // Clin. Rheumatol. —2008, Apr. - Vol. 27, N 4. - R 437-442.Chonan T„ TaguchiO., Omae K. Interstitial pulmonary disorders in indium-processing
workers // Cytochem. - 2006. - Vol. 54, N 12. - R 1315-1325.Chun S. Asbestosis //Aug 11, 2004. — eMedicine Specialties > Radiology > CHEST.ChurgJ., Strauss L. Allergic granulomatosis, allergic angiitis, and periarteritis nodosa //
Am. J. Pathol. - 1951. - Vol. 27, N 2. - R 277-301.
ЛИТЕРАТУРА • 433Cieslik P., Hrycek Л., Ktucinski P. Vasculopathy and vasculitis in systemic lupus ery¬
thematosus I I Pol. Arch. Med. Wewn. — 2008, Jan,-Feb. — Vol. 11, N 1-2. —
P. 57-63.Colby V. Update on idiopathic interstitial pneumonias // ATS Postgraduate Course. —
Toronto, 2000, May 6.Collier D.H. Системная склеродермия // Секреты ревматологии / Под ред.
Д.В. Стерлинга. — М.: Бином; СПб.; Невский диалект, 2001. — С. 188-198.Collins С.Е., Quismorio F.PJr. Pulmonary involvement in microscopic polyangiitis //
Curr. Opin. Pulm. Med. - 2005, Sep. - Vol. 11, N 5. - P. 447-451.Constantino T, Digre K., Zimmerman P. Neuro-ophthalmic complications of sarcoid¬
osis// Semin. Neurol. - 2000. - Vol, 20. - R 123-137.Cooke W.E, Pulmonary Asbestos is // Br. Med. J. ~ 1927. — P. 1024-1025, cited in
G. Peters & B. Peters, Sourcebook on Asbestos Diseases, Vol. 1, 1980, pg. Gl.Cormier Y., Samson N„ fsrael-Assayag E. Viral infection enhances the response to
Saccharopolyspora rectivirgula in mice prechallenged with this farmer’s lung
antigen // Lung. - 1996. - Vol. 174. - P 399-407.Cornet B., Flipo R.M., Remy-Jrdin M et ai Use of high resolution computed tomog¬
raphy of the lungs in patients with rheumatoid artritis // Ann. Rheum. Dis. —1995.-Vol. 54. - P 815-819.Costabel U. Sarcoidosis: clinical update I I Eur. Respir. J. — 2001. — Vol. 18,
suppl. 32. - P 56-68.Costabel U., du Bois R.M., Egan JJ. Diffuse Lung Disease // Prog. Respir. Res. —
Basel: Karger, 2007. - Vol. 36. - R 250-263.Cotch M.F., Hojfman G.S., YergD.E. etal. The epidemiology of Wegener’s granulema-
losis//Arthritis Rheum. - 1996. ~ Vol. 39. - R 87-92.Coultas D.B., Hubbard R. Epidemiology of idiopathic pulmonary fibrosis // Idiopathic
Pulmonary Fibrosis / Ed. D. Lynch. — New York: Marcel Dekker, 2004. —
P 1-30.Crooks DM.f Pacheco-Rodriguez G., Decastro R.M. etal. Molccular and genetic analysis
of disseminated neoplastic cells in lymphangioleiomyomatosis // Proc. Natl Acad.
Sci. USA. - 2004. - Vol. 101. - P 17462-17467.Crystal R.G., Bitterman P.B., Rennard S.J. et al Interstitiallung diseases of unknown
cause; disorders characterized by chronic inflammation of the lower respiratory
tract // N. Engl. J. Med. - 1984. - Vol. 310. - P 154-166; 235-244.Dalakas M. Mechanisms of disease: signalyng pathways and immunobiology of
inflammatory myopathies // Nat. Clin. Pract. Rheumatol. — 2006. — Vol. 12,
N 4. - P 219-227.Davson J,, BallJ., Hiatt R., The kydney in periarteriitis nodosa // Q. J. Med. — 1948. —
Vol. 285. - P 606.De Raeve И., Nemery B. Lung diseases induced by metals and oi^anic solvents //
Occupational lung disorders: Eur. Respir. Monogr. — 1999. — Chap. 9 —
R 178-213.De Raeve H., Nemery B. Lung diseases induced by metals and organic solvents //
Occupational lung disorders: Eur, Respir, Monogr. — 1999. — Chap. —
P 178-213.
434 • ЛИТЕРАТУРАDelobbe А., Durieu У., Duhamel А. et ai Determinants of survival in pulmo¬
nary Langcrhans’cell granulomatosis (histiocytosis X): Groupe d’Etude en
Pathologie Interstitielle de la Societe de Pathoiogie Thoracique du Nord // Eur.
Respir. J. - 1996. - Vol. 9. - P. 2002-2006.Demedts М., BehrJ., Buhl R. etal. Higth dose acetylcysteine in idiopathic pulmonary
fibrosis // N. Engl. J. Med. - 2005. - Vol. 353, N 24. - R 2229-2242.Demedts М., Gheysens B., Nagels J. et al. Cobalt lung in diamond polishers // Am. Rev.
Respir. Dis. - 1984. - Vol. 130. - P. 130-135.Demedts М., ThomeerM. jf Interstitial lung diseases: ERS monogr. — Vol. 5, monogr. 14,
Aug. 2000. - R 267-269.Demedts М., Thomeer M. Rare diffuse lung diseases and mimics of diffuse lung dis¬
eases I I Interstitial Lung Diseases: Eur. Respir. Monogr. — 2000. — Chap. 16 —
R 267-288.Demedts М., Thomeer M. Rare diffuse lung diseases and mimics of diffuse lung dis¬
eases // Interstitial Lung Diseases: Eur. Respir, Monogr. — 2000. - Chap. !6 —
R 267-288.DeMello D.E., Lin Z. Pulmonary alveolar proteinosis: a review // Pediatr. Pathol. Мої.
Med. - 2001. - Vol. 20. - R 413-432.Derevyanko A.A., Gerasin У.А., Dvorakovskay I. V., Baranova O.P. Transbronchial lung
biopsy in the diagnosis of pulmonary sarcoidosis: the value of tissue sampled by
biopsy // Eur. Respir. J. — 2006. — Vol. 28, N 50. — P. 355.Di Alberty L., Piattelli A., Artese L. Human herpesvirus 8 variants in sarcoid tissues //
Lancet. - 1997. - Vol. 350. - R 1655-1661.Diaz J.L, Ouellette D.R. Pulmonary Fibrosis, Idiopathic // Article Last Updated:
Mar. 7, 2008.Dirt E., Telia W., Ratnqff W.D., Nugent K. Infliximab-induced SLE-like syndrome
involving the lung and pleura I I Lupus. — 2007. — Vol. 16, N 9. — P. 764—766.Dirksen U, Nishinakamura R., Groneck P. et al. Human pulmonary alveolar proteino¬
sis associated with a defect in GM-CSF/IL-3/IL-5 rcccptor common beta chain
expression //J. Clin. Invest. — 1997. — VoL 100, N 9. — R 2211-2217.Domergue K, Orlandini V., Begueret И. er al. Cutaneous, pulmonary and bone asper¬
gillosis in a patient presumed immunocompetent presenting subacute cutaneous
lupus erythematosus // Ann. Dermatol. Venereol. — 2008, Mar. — Vol. 135,
N3.-R 217-221.Douglas ИКИК, Ryu J.H., Schroeder D.R, Idiopathic pulmonary fibrosis: impact of oxy¬
gen and colchicines, prednisone, or no therapy on survival I I Am. J. Respir. Crit.
Care Med. - 2000. - Vol. 159. - R 1172-1178.Drent М., Van Nierop M.A., Gerritsen F.A. et al, A computer program using BALF-
analysis results as a diagnostic tool in interstitial lung diseases // Am. J. Respir.
Crit. Care Med. - 1996. - Vol. 153, N 2. - R 736-7341.Drent М., Van Velsen-Blad H., Diamant M. et al Bronchoalveolar lavage in extrin¬
sic allergic alveolitis: effect of time elapsed since antigen exposure // Eur.
Respir J. - 1993. - Vol. 6. - R 1276-1281.Du B(jis R,M. Mechanisms of scleroderma-induced lung disease // Proc. Am. Thorac.
Soc. - 2007, Aug. - Vol. 15, N 4(5). - R 434-438.
ЛИТЕРАТУРА • 435Du Bois R.M., Kirby М., Balbi В., Saltini С., Crystal R.G. T-lympbocytes that
accumulate in the lung in sarcoidosis liave evidence of resent stimulation of
the T-cell antigen receptor // Am. Rev. Respir. Dis. — 1992. — Vol. 145. —
P. 1205-1211.Duman D., Masailioglu S., Demlrtung R., Karadag B. Increased pulmonary artery stiff¬
ness and its relation to right ventricular function in patients with systemic lupus
erythematosus // Turk. Kardiyol, Dern. Ars. — 2008, Mar. — Vol. 36, N 2. —
P. 82-89.Durko T, Lapienis М., Jankowski A. Wegener’s granulomatosis-diagnostic problem //
Otolaryngol. Pol. - 2006. ^ 60(3). - P. 355-362.Dweik М., Baethge В.Л., Duarte A.G. Coccidioidomycosis pneumonia in a nonen¬
demic area associated with infliximab // South. Med. J. — 2007, May. ~ Vol. 100,
N 5.-P. 517-518.Dweik R.A., Hnatiuk 0Ж, Talavera F et al. Berylliosis, 2007, Oct 19. — eMedicine
Specialties > Pulmonology > Occupational Lung Diseases.Edgerton C.C.j Gilman M, Roth BJ. Topotecan-lnduced Bronchiolitis // South.
Med. J. - 2004. - Vol. 97, N 7. - P 699-701.Edmondstone W. Sarcoidosis in nurses: is there an association? I I Thorax. — 1998. —
Vol. 43. - R 342-343.Efthimion P., Schwartzman S., Kagen L. Possible role for TNF inhibitor in the treat¬
ment of resistant dermatomyositis and polymiositis // Ann. Rheum, Dis. —2006, - Vol. 13. - P. 20.Egan J.J., Woodcock A. A., Stewart J.P. Viruses and idiopatic pulmonary fibrosis // Eur.
Respir. J. - 1997. - Vol. 10. - P 1433-1437.Eklund A., Grunewald J. Sarcoidosis // Eur. Respir. Monogr. — 2000. — Vol. 14. —
P. 96-1! 9.El Bied B., Afif H., Sqfieddine S., Hassani L., Aichane A., Trombati N.. Bouayad Z.
Disseminated erythematous lupus with bilateral diaphragmatic involvement //
Rev. Pneumol. Clin. - 2006, Jun. - Vol. 62, N 3. - R 187-190.Erdinler I.e., (Jeer E., Eksik A. et al. Noncardiogenic pulmonary edema associ¬
ated with clopidogrel; a serious but unexpected side effect of clopidogrel // Can.
J. Cardiol. - 2007, May 1. - Vol. 23, N 6. - R 478-80.Eriksson P. Nine patients with anti-neutrophil cytoplasmic antibody-positive vasculi¬
tis successfully treated with rituximab // J. Intern. Med. — 2005, Jun. — Vol. 2.57,
N 6. - P 540-548.Evans S.A., Hopkinson N.D., Kinnear WJ. et al. Respiratory disease in systemic lupus
erythematosus: correlation with results of laboratory tests and histological appear¬
ance of muscle biopsy specimen // Thorax. — 1992. — Vol. 47. — P. 957-961.Evers Y., Harzbecker K. The evolution of pulmonary arterial hypertension silicosis —
results of cross-sectional and follow-up studies // 5th int. Conf. «Environ, and
Occupat. Lung Dis.»; Book of abstr. — Orlando, Florida, 1995. — P. 42.Fathi М., Vikgren J., Boijsen M. et al Interstitial lung disease in Polymyositis and
Dermatomyositis: longitudinal evaluation by pulmonary function and radiology //
Arthritis Rheum (Arthritis Care and Research). — 2008, May 15. — Vol. 59,
N 5, - R 677-685.
436 • ЛИТЕРАТУРАFauci F.S., Haynes В.Г., Katz et ai Wegener, s granulomatosis; Prospective clinical
and therapeutic experience with 85 patients for 21 years // Ann. intern. Med, —
1983. - Vol. 98. - R 76.Paul J.I., Berry GJ.f Colby T.V. et al. Thoracic lymphangiomas, lymphangiectasis,
lymphangiomatosis, and lymphatic dysplasia syndrome I I Am. J. Respir. Crit.
Care Med. -- 2000. - Vol. 161. - P. 1037-1046.Ferenczi K.f Chang Т., Camouse M. et al A case of Churg-Strauss syndrome associ¬
ated with antiphospholipid antibodies // J. Am. Acad. Dermatol, — 2007, Apr. —
Vol. 56, N 4. - P. 701-704, Epub 2006 Dec I.Fielder D.B., Travis W.D. Pathologic characteristics of drug-induccd lung disease //
Clin. Chest Med. - 2004. - Vol. 25. - P. 25-36.Finkelstein M.M. Silicosis surveillance in Ontario; detection rates, modifying fac¬
tors, and screening intervals // Am. J. Ind. Med. — 1994.— Vol. 25, N 2.—
P. 257-266.Fontenot A.P., Schwarz M.L Alveolar Hemorrhage Syndromes // Baums Textbook of
Pulmonary Diseases. 7th ed. / Eds J.D. Crapo et al. — 2004. — P. 623.Forni A. Bronchoalveolar lavage in the diagnosis of hard metal disease // Sci. Total
Environ. - 1994. - Vol. 150. - P 69-76.Franz D.N., Brody A., Meyer C. et al. Mutational and radiographic analysis of pulmo¬
nary disease consistent with lymphangioleiomyomatosis and micronodular pneu-
mocyte hyperplasia in women with tuberous sclerosis // Am. J. Respir. Crit. Care
Med. - 2001. - Vol. 164. ^ R 661-668,Fraser. Drugs // Fraser and Fare’s Diagnosis of the Chest. 4th ed. — 1999. —
Chap. 63. — P. 2537—2575. — Copyright © 1999 W.B. Saunders Company. —
MD Consult L.L.C. http://www.mdconsult.comFrequent genetic alterations at the microsatellite level in cytologic sputum samples
of patients with idiopathic pulmonary fibrosis // Am. J. Respir. Crit. Care
Med. - 2000, Sep. - Vol. 162, N 3. - Pt 1, - R 1115-1119.Freudenberger T, Raghu J. Idiopathic pulmonary fibrosis: an evolving approach to
diagnosis and treatment // Interstitial Lung Diseases: Eur. Respir. Monogr.—
2000. - Vol. 5. - R 79-96.Fridlender Z.G., Cohen P. X, Golan O. et al. Telomerasa activity in bleomycn-induced
epithelial cell apoptosis and lung fibrosis // Eur. Respir. J, — 2008. — Vol. 30,
N 2.-R 205-213.Froudarakis M.E., VoloudakiA., BorousD.etal. Pneumoconiosis among Cretan dental
techniciants // Respiration. — 1999. — Vol. 66, N 4, — P, 338-342.Froudarakis M.E., Voloudaki A., Borous D., Drakonakis G., Hatzakis K., Siafakas N.M.
Pneumoconiosis among Cretan dental techniciants I I Respiration. — 1999. —
Vol. 66, N 4. - R 338-342.Gaffo A.L., Alarcyn G.S. Methotrexate is not associated with progression of interstitial
lung disease in rheumatoid arthritis // Arch. Intern. Med, — 2008, Sep 22. —
Vol. 168, N 17. - R 1927-1928.Gerbino A.J., Goss C.H., MoUtor J.A. Effect of mycophenolate mofetil on pulmo¬
nary function in scleroderma-associated interstitial lung disease // Chest. —
2008, Feb. - Vol. 133, N 2. - R 455-460.
ЛИТЕРАТУРА • 437Giavina-Bianchi P., Giavina-Bianchi М., Agondi R., Kalil J. Administration of anti-IgE
to a Churg-Strauss syndrome patient // Int. Arch. Allergy Immunol. — 2007. —
Vol. 144, N 2. - P. 155-158. Epub 2007 May 29.Gochuico B.R., Avila N.A., Chow C.K. et at. Progressive preclinical interstitial lung
disease in rheumatoid arthritis // Arch. Intern. Med. — 2008, Jan 28. — Vol. 168,
N 2. - P 159-166.GodeauB., MainardiJ.L., Roudot-Thoraval F et al. Factor associated with Pneumocystis
carlni pneumonia in Wegener, s granulomatosis // Ann. Rheum. Dis. — 1995. —
Vol. 54. - P. 991-994.Goldin J.G., Lynch D.A., StroUo D,C. et al. High-resolution CT scan findings in patients
with symptomatic scleroderma-related interstitial lung disease // Chest. — 2008
Aug. - Vol. 134, N 2. - R 358-367.Good J.T.Jr, King T.E., Antony KB. et al. Lupus pleuritis. Clinical features and pleural
fluid characteristics with special reference to pleural fluid antinuclear antibodies //
Chest. - 1983. - Vol. 84. - R 714-718.Gordon М., Lugmani R.A., Adu D. et al. Relapses in patients with systemic vasculitis //
0. J. Med. - 1993.- 779 p.Grassegger A., Pohla-Gubo G., Frauscher М., Hintner H. Autoantibodies in systemic
sclerosis (scleroderma); clues for clinical evaluation, prognosis and pathogenesis //
Wien. Med. Wochenschr. - 2008. - Vol. 158, N 1-2. - P. 19-28.Gribbin J., Hubbard R.B., Jeune I. et al. Incedcnce and mortality of Idiopathic
Pulmonary Fibrosis and Sarcoidosis in the UK // Thorax, — 2006. — Vol. 61. —
R 980-985.Groen H., Bootsma И., Fostma D.S. et at. Primary pulmonary hypertension in a patient
with .systemic lupus erythematosus: Partial improvement with cyclophosphamide //
J. Rheumatol, - 1993. - Vol. 20. - R 1055-1059.Grunewald J., Eklund A. Human leukocyte antigen genes may outweigh radical
background when generating a specific immune response in sarcoidosis // Eur.
Respir. J. - 2001. - N 5. - P 1046-1048.Gudmundsson G., Monick M.M., Huminghake G. W. et al. Viral infection modulates
expression of hypersensitivity pneumonitis // J. Immunol. — 1999. — Vol. 162. —
R 7397-7401.Guede K.J., Fitschen J., Ernst M. et al Expression and shedding of tumor nccrosis factor
receptors in bronchoalveolar cells // Am. J. Respir. Crit. Care Med. — 1998. —
Vol. 157. - R 434-435,Guilkven L., Cohen P., Gayraud M. et al, Churg Strauss syndrome. Clinical study
and long-term follow-up of 96 patients // Medicine.— 1999.— Vol. 78.—
R 26-37.Hamman L., Rich A.R. Acute diffuse interstitial fibrosis of the lungs // Bull. John
Hopkins Hosp. — 1944. - Vol. 74. - R 177-204.Hamman L., Rich A.R. Fulminating diffuse interstitial fibrosis of the lungs // Trans.
Am. Clin. Climatol. Assoc. - 1935. - Vol. 51. - R 154-163.Hamvas A., Nogee L.M., Mallory G.BJr. et al. Lung transplantation for treatment of
infants with surfactant protein В deficiency II J. Pediatr. — 1997. — Vol. 130. —
R 231-239.
438 * ЛИТЕРАТУРАHanak V., Golbin J.M., Ryu J.H. Causes and presenting features in 85 consecutive
patients with hypersensitivity pneumonitis // Mayo Clin Proc. — 2007, Jul. —
Vol. 82, N7-P. 812-816.Hance AJ. Pulmonary immune cells in health and disease: dendritic cells and
Langerhans’cells // Eur. Respir. J. — 1993. — Vol. 6. — P. 1213-1220.Hafel F.V., Ryu J.H,, Reed C.E. Hypersensitivity pneumonitis: Current concepts and
futurequestions//J. Allergy Clin. Immunol. —2001.—Vol. 108,N5. —Copyright
©2001 Mosby, Inc. — MD Consult L.L.C, http;//www.mdconsult.comHaubitz M. ANCA-associated vasculitis: diagnosis, clinical characteristics and treat¬
ment // Vasa. — 2007, May. — Vol. 36, N 2. — P. 81-89.Hellmich 5., Ehlers S., Csernok E., Gross W.L. Update on the pathogenesis of Churg-
Strauss syndrome // Clin. Exp, Rheumatol.— 2003, Nov.—Dec. — Vol. 21,
N 6. - Suppl. 32. - P. 69-77.Henness Wigley KM. Current drug therapy for scleroderma and secondary
Raynaud’s phenomenon: evidence-based review // Curr. Opin. Rheumatol. —2007, Nov. - Vol. 19, N 6. - P 611-618.Heresi О.Л., Minai O.A. Bosentan in systemic sclerosis // Drugs Today (Bare.). — 2008,
Jun. - Vol. 44, N 6. - P. 415-428.Herlyn K., Hellmich B., Gross IV.L, Reinhold-Keller E. Stable Incidence of Systemic
Vasculitides in Schleswig-Holstein, Germany // Dtsch. Arztebl, Int. — 2008. —
Vol. 105, N 19. - R 355-361.Highland K.B., Garin M.C., Brown K.K. The spectrum of scleroderma lung disease //
Semin. Respir. Crit. Care Med. — 2007, Aug. — Vol. 28, N 4. — P. 418-429.Highton J., Hung N., Hessian P., Wilsher M. Pulmonary rheumatoid nodules dem¬
onstrating features usually associated with rheumatoid synovial membrane //
Rheumatology (Oxford). — 2007, May. — Vol. 46, N 5. — P. 811-814.Hironaka М., Fukayama M. Pulmonary fibrosis and lung carcinoma: a comparative
study of metaplastic epithelia in honeycombed areas of usual interstitial pneu¬
monia with or without lung carcinoma // Pathol. Int. — 1999, Dec. — Vol. 49,
N 12-P. 1060-1066.Hodgson i!., Laitinen T, Tukiainen P. Nationwide prevalence of sporadic and familial
diopathic pulmonary fibrosis; evidence of founder effcct among muhiplex families
in Finlan // Thorax. - 2002, Apr. - Vol. 57, N 4. - P 338-342.Hosoda Y., Yamaguchi М., Hiraga Y. Global epidemiology of sarcoidosis // Clin. Chest
Med. - 1997. - Vol. 18. - R 681-694.Hsu H.H., Ко W.J., Chen J.S. et al. Extracorporeal membrane oxygenation in pulmo¬
nary crisis and primary graft dysfunction // J. Heart Lung Transplant. — 2008,
Feb. - Vol. 27, N 2. - P. 233-237.Hubbard R., Venn A., Lewis S. et al. Lung cancer and cryptogenic fibrosing alveolitis.
A population-based cohort study // Am. J. Respir. Crit. Care Med. — 2000. —
Vol. 161. -R 5-8.Hunninghake G.W., Costabel V., Ando M. et al. ATS/ERS/WASOG Statement
on Sarcoidosis // Sarcoidosis Vase. Diffuse Lung Dis. — 1999. — Vol. 16. —
R 149-173.
ЛИТЕРАТУРА • 439Husgafvel-Pursiainen К., KannioA., Oksa P. etal. Mutations, tissue accumulations, and
serum levels of p53 in patients with occupational cancers from asbestos and silica
exposure // Environ. Мої. Mutagen, — 1997. — Vol. 30, N 2. — P. 224—230.Hutchinson J. Case of livid papillary psoriasis // Illustrations of Clinical Surgery. —
London: L. and A. Churchill, 1877. — P. 42.Idiopathic pulmonary fibrosis: diagnosis and treatment. International consen¬
sus statement. ATS and ERS // Am, J. Respir. Crit, Care Med. — 2000. —
Vol. 16. - P. 646-664.likuni N., Kiiahama М., Ohio S. et al Evaluation of Pneumocystis pneumonia infec¬
tion risk factors in patients with connective tissue disease // Mod. Rheumatol. —2006. - Vol. 16, N 5. - P. 282-288.Imaizumi K., Sugishita М., Usui M. et al. Pulmonary infectious complications associ¬
ated with anti-TNFalpha therapy (infliximab) for rheumatoid arthritis // Intern.
Med. - 2006. - Vol. 45, N 10. - R 685-688.Ion D.A., Chivu R.D., Chivu L.L Aspects of pleural/pulmonary involvement in sys¬
temic lupus erythematosus// Pneumologia. — 2006, Oct.-Dec. — Vol. 55, N 4. —
R 151-155.Ishiguro T, Takayanagi N., Kurashima K. et al. Development of sarcoidosis during
etanercept therapy // Intern. Med. — 2008. — Vol. 47, N 11, — P. 1021-1025.Iwakawa J., Matsuyama W., Kubota S. etal. Increased serum vascular endothelial growth
factor levels in microscopic polyangiitis with pulmonary involvement // Respir.
Med. - 2006, Oct. - Vol. 100, N 10. ~ R 1724-1733. Epub 2006 Mar. 20.lyonaga K., Suga М., Yamamoto T. et al. Elevated bronchoalvcolar concentra¬
tions of MCP-1 in patients with pulmonary alveolar proteinosis // Eur.
Respir. J. - 1999. - Vol. 14. - R 383-389.Jacob G.L, Astry C.L., Warr G.A. Alveolitis induced by Influenza virus // Am. Rev.
Respir. Dis. - 1983. - Vol. 128. - R 730-739.Jallouli ., Frigui М., Marzouk S., Meahul L, Kaddour N., Bahloul Z. Infectious com¬
plications in systemic lupus erythematosus; a series of 146 patients // Rev. Med.
Interne, - 2008, Aug. - Vol. 29, N 8. - R 626-631.Jedynak A.R., Schwartz R.A., EberC.D. Silicosis and Coal Worker Pneumoconiosis I I
Jul. 24, 2007. — eMedicine Specialties > Radiology > CHEST.Ji Y.Q., Zhang Z.L., Lu ЖХ. The clinical analysis of pulmonary arterial hypertension
in connective tissue disease // Zhonghua Nei Ke Za Zhi. — 2006, Jun. — Vol. 45,
N 6. - R 467-471.Jiwa М., Steenbergen R.D., Zwan KE. et al. Three sensitive methods for the detection
of cytomegalovirus in lung tissue of patients with interstitial pneumonitis // Am.
J. Clin- Pathol. - 1990. - Vol. 93. - R 491-494.Johnson S.R., Whale C.L., Hubbard R.B. et al Survival and disease progression in
UK. patient with lymphangioleiomyomatosis // Thorax. — 2004.— Vol. 59. —
R 800-803.Johnston I.D.A., Prescott R.J., Chalmers J.C. et. at. British Thoracic Societe study of
cryptogenic fibrosing alveolitis; current presentation and initial management //
Thorax. - 1997. - Vol. 52 - R 38-44.
440 • ЛИТЕРАТУРАJu J.H., Кіт S.l, Lee J.H, et ai. Risk of interstitial lung disease associated with
lenunomidc treatment in Korean patients with rheumatoid arthritis // Arthritis
Rheum. - 2007, Jun. - Vol. 56, N 6. - P. 2094-2096.JuMJ.H., Kuhlman J.E. Diseases of Occupational, Chemical, and Physical Origin //
Juhl: Paul and Juhl’s Essentials of Radiologic Imaging. 7th ed. — 1998. —
Chap. 27. — P. 955-986. — Copyright © 1998 Lippincott Williams & Wilkins. —
MD Consult L.L.C, http://www.mdconsult.comKakati S., Doley B., Pal S., Deka UJ. Pulmonary manifestations in systemic lupus
erythematosus (SLE) with special reference to HR CT // J. Assoc. Physicians
India. - 2007, Dec. - Vol. 55. - R 839-841.Kaloudi O., Miniati Т., Atari S., Matucci-Cerinic M. Interstitial lung disease in systemic
sclerosis // Intern. Emerg. Med. — 2007, Dec. — Vol. 2, N 4. — P. 250-255.Kampolis C., Piastiras S., Viachoyiannopoulos P., Moyssakis L, Tzelepis G. 1 he presence
of anti-centromere antibodies may predict progression of estimated pulmonary
arterial systolic pressure in systcmic sclerosis // Scand. J, Rheumatol. — 2008,
Jul.-Aug. - Vol. 37, N 4. - R 278-283.Katchr K., Eklund A., Grunewald J. Expression of Th 1 markers by lung accumu¬
lated T cells in pulmonary sarcoidosis // J. intern. Med. — 2003. — Vol. 254. —
P. 564-571.Katzenstein A., Myers J. idiopathic pulmonary fibrosis; clinical relevance of patho¬
logic classification // Am. J. Respir. Crit. Care Med. — 1998,— Vol. 157. —
P. 1301-1315.Kavuru M.S., Sullivan E.J,, Piccin R. et al. Exogenous granulocyte-macrophage col¬
ony-stimulating factor administration for pulmonary alveolar proteinosis // Am.
J. Respir. Crit. Care Med. - 2000. - Vol. 161. - P. 1143-1148.Keating D.T, McCullagh B., Egan JJ. Idiopathic pulmonary fibrosis // In: Diffuse
Parenchymal Lung Disease (Progress in Repiratory Research) by U. Costabel,
R.M. du Bois, J.J. Egan. — Switzerland, 2007. — P. 148-160.Kelley J. Occupational Lung Diseases Caused by Asbestos, Silica, and Other Silicates //
Baum’s Textbook of Pulmonary Diseases / Eds J.D. Crapo, J. Glassroth, К J.B.
arlinsky, T.E. King. - 2004. - R 951-973.Kelsey K.T., Nelson H.H., Wiencke J.K., Smith C.M., Levin S. The glutathione S-trans-
ferase theta and mu dcleton polymorphisms in asbcstosis // Am. J, Ind. Med. —
1997. - Vol. 31, N 3. - R 274-279.Keogh K.A., Specks U. Churg-Strauss syndrome: clinical presentation, anti neutrophil
cytoplasmic antibodies, and leukotrienc receptor antagonists // Am. J. Med. —
2003, Sep. - Vol. 115, N 4. - R 284-290.Kern D., Neill М., Wrenn D., Varone J. Investigation of a unique time-space cluster
of sarcoidosis in Firefighters // Am. Rev. Respir, Dis. — 1993. — Vol. 148. —
R 974-980.Kern D.G., Kuhn C.Ili, Ely ЕЖ etal. Flock Worker’s Lung. Broadening the Spectrum
of Clinicopathology, Narrowing the Spectrum of Suspected Etiologies I I Chest. —2000. - Vol. 117, N 1. - R 251-259.
ЛИТЕРАТУРА • 441Khalil Н., Molinary Е., StollerJ.K. Diclofenac (Valtarcn)'induced eosinophilic pneu¬
monitis: case report and rcviev of the literature // Arch. Intern. Med. — 1993. —
Vol. 153. ~ P. 1649-1652.Khalil N.O., O'Connor R. Idiopathic Pulmonary Fibrosis: current understanding of
the pathogenesis and the status of treatment // CMAJ. — 2004. — Vol. 356. —
P. 153-160.Khan A.N., Irion K.L., Kasthuri R.S., MacDonald S. Extrinsic Allergic Alveolitis //
May 2, 2008. — eMedicine Specialties > Radiology > CHESTKhan A.N., Irion K.L, Nagarqjaiah C.P. Lung, Drug-Induced Disease //Article Last
Updated, Jun. 4, 2008. — eMedicine Specialties > Radiology > CHESTKim Ї.К., Lee K.S., Chung M.P. et at. Pulmonary involvement in Churg—Strauss syn¬
drome: an analysis of CT, clinical, and pathologic findings // Eur. Radiol. — 2007,
Dec. - Vol. 17* N 12. - R 3157-3165. Epub 2007 Jun 29.Kinder ВЖ, Brown K.K., Schwarz M.L etal. Baseline Bal neutrophilia predicts in idio¬
pathic pulmonary fibrosis // Chest. — 2008. — Vol. 133, N 1. ~ P. 226-232.King T.E. Connective tissue disease // Interstitial Lung Disease. 3rd ed. / Eds M.I.
Schwarz, T.E. King. — Hamilton, Ontario, B.C.: Decker, 1998. — 451 p.King ТЕ., Behr J,, Brown K.K. et al. BUILD-1: randomized placebo-controlled trial
of bosentan in idiopathic pulmonary fibrosis // Am. J. Respir. Crit. Care Med. —
2008. - Vol. 177, N 1. - R 75-81.Kita S., Tsuda Т., Sugisagi K., Miyazaki E., Matsumoto T. Characterization of distribu¬
tion of T lymphocytes subsets and activated T lymphocytes infiltrating into sarcoid
lesions // Intern. Med. - 1999. - Vol. 34. - R 847-855.Kitaichi М., Nishimura K., itoh H. et al. Pulmonary lymphangioleiomyomatosis: a
report of 46 patients including a clinicopathologic study of prognostic factors //
Am. J. Respir. Crit. Care Med. - 1995. - Vol. 151. - R 527-533.Kitamura Т., Uchida K, Tanaka N. etal. Serological diagnosis of idiopathic pulmonary
alveolar proteinosis // Am. J. Respir. Crit. Care Med. — 2000. — Vol. 162. —
R 658-662.Klemen li, Husain A.N., Cagle P.T et al. Mycobacterial DNA in recurrent sarcoidosis
in the transplanted lung — a PCR-based study on four cases // Virchows Arch. —2000. - Vol. 436. - R 365-369.Kobayashi М., Takeuchi Т., Ohtsuki Y. Differences in the immunolocalization of sur¬
factant protein (SP)-A, SP-D, and KL-6 in pulmonary alveolar proteinosis //
Pathol. Int. - 2008. - Vol. 58. - R 203-207.Komura K, Yanaba K, Ogawa F. et al. Elevation of IgG levels is a serological indicator
for pulmonary fibrosis in systemic sclerosis with anti-topoisomerase 1 antibodies
and those with anticentromere antibody // Clin. Exp. Dermatol. — 2008, May. —
Vol. 33, N 3. - R 329-332.Korn-Wendisch F., Kempf A., Grund E. et al. Transfer of Faenia rectivirgula Kurup
and Agrc to the genus Saccharopolyspora Lacey and Goodfellow 1975, elevation
of Saccharopolyspora hirsute subs // Int. J. Syst. Bacteriol. — 1989. — Vol. 39. —
R 430-441.
442 • ЛИТЕРАТУРАKowalewska В., Szechinski J., Roszkowska E. Wegener’s granulomatosis effectively ^
treated with rituximab: a case study // Pol. Arch. Med. Wewn. — 2008, Jun. —Vol. 118, N6.-R 381-385.Kremer JM,, Alarson G.S., Weinblatt M.E. et ai Clinical, laboratory, radiographic, j
and histopathologic features of mtthotrexate-associated lung injury in patients |
with rheumatoid arthritis: a multi ctnter study with literature review // Arthritis |
Rheum. - 1997. - Vbl. 40. - R 1829-1837.Kumar U-, Ramteke R., Yadav R. et al. Prevalence and predictors of pulmonary artery |
hypertension in systemic sclerosis // J. Assoc. Physicians India. — 2008, Jun. —\bl. 56. - R 413-417, jKuwano K., Nakashima N., Inoshima /. et al. Oxidative stress in lung epithelial cellsfrom patients with idiopathic interstitial pneumonias // Eur. Respir. J. — 2003. — і
Vol. 216. - R 232-240. IKveim A. En ny og spesifikk kuran-reaksjon ved Boecks sarcoid // Nord. Med. —1941.-Vol. 9.-R 169-172.Ladeb S., Fleury-Feith J., Escudier E, et al. Secondary alveolar proteinosis in cancer
patients // Support Care Cancer. — 1996. — Vol. 4. — P. 420-426.Lamarche J.A,, Feguero A.M., Rosario J.O., Patel A., Courville C. Anti-MPO small-
vessel vasculitis causing prostatis and nephritis // Clin. Exp. Nephrol. — 2007,Jun. - Vol. 11, N 2. - R 180-183. Epub 2007 Jun 28.Lammi L., Kinnula K, Lahde S. Propeptide levels of type III and type T procollagen in
serum and bronchoalveolar lavage fluid of patients with pulmonary sarcoidosis //Eur. Respir. J. - 1997. - Vol. 10. - R 2725-2730.Lampreht P., Voswirkel J., Lilienthal T. et al. Effectiveness of TNF — blokade with |
infliximab in refractory Wegener’s granulematosis // Rheumatology. ~ 2002. — |
Vol. 41.-R 1302-1307. |Langford C.A., Sneller M.C., Hallahan СЖ et al Clinical features and theraoeutec |
management of subglottic stenosis in patients with Wegener’s granulomatosis //
Artritis Rheum. — 1996. — Vol. 39. — P. 1754-1760.Laurent G.J., McAnulty R.J., Hill М., Chambers R. Escape from the Matrix: Muhiple
Mechanisms for Fibroblast Activation in Pulmonary Fibrosis // Proc. Am.
Thorac. Soc. - 2008. - Vol. 5. - R 311-315.Lautenbacher R. Dysembryomes metotipiques des reins, carcinose submiliere aigO
poumon avec amphyseme generalise et double pneumothorax // Ann. Med.Tnterne (Paris). - 1918. - N 5. - R 435-450.Lamon W.E., Crossr^o P.F, Polosukhin V.V., Roldan J. et al. Endoplasmic reticulum
stress in alveolar epithelial cells is prominent in IPF: association with altered sur¬
factant protein processing and herpesvirus infection // Am. J. Physiol. Lung Cell
Мої. Physiol. - 2008. - Vol. 294. - R 1119-1126.Lawson W.E., Loyd У.£. The genetic approach in pulmonary fibrosis: can it provide
clues to this complex disease? I I Proc. Am. Thorac. Soc. — 2006. — Vol. 3,N 4. - R 345 -349.Leask A. Targeting the TGFbeta, endothclin-1 and CCN2 axis to combat fibrosis in
sclerodcrma I I Cell. Signal. — 2008, Aug. — Vol. 20, N 8. — P. 1409-1414.
ЛИТЕРАТУРА • 443Lengyel С., Boros L, Varkonyi T. et al. Amiodaron altal eloidezett tudoflbrosis //
Orv. Hetil. - 1996. - Vol. 137, N 32. - P. 1759-1762.Levine D., Akikusa Manson D., Silverman E., Schneider R. Chest CT findings in
pediatric Wegener’s granulomatosis// Pediatr. Radiol. —■ 2007, Jan. — Vol. 37,
N I. - R 57-62. Epub 2006 Oct 28.Lichtenstein L. Histiocytosis X. rntegration If eosinophilic granuloma of the bone,
«Letterer-Siwe disease» and «Schuller-Christian disease» as related manifestation
of a single nosologic entit // Arch, Pathol. — 1953. — N 56 — P. 84-102.LiehowA.A., Smith D.E. New concepts and enthics in pulmonary disease // The Lung /
Hrsg. von A.A. Liebow. — Baltimore: Williams and Wilkins, 1968.Liebow A.A., Steer A., Billingsley J.G. Desqamative interstitisl pneumonia // Am.
J. Med. - 1965. - Vol. 39. - P. 369.Light R.W. Pleural disease due to collagen vascular diseases // Pleural Disease / Ed.D.C. Retford. — Baltimore, Maryland: William and Wilkins, 1995. — 208 p.Lisitsin S., Farah R., Shay M. Limited Wegener’s granulomatosis — is it limited? //
Clin. Rheumatol. - 2007, Nov. - Vol. 26, N 11. - P. 1999-2000. Epub 2007
Mar 31.Liu V., White D.A., Zakowski M.F. etal Pulmonary toxicity associated with erlotinib //
Chest. - 2007, Sep. - Vol. 132, N 3. - P. 1042-1044.Loyd J.E. Pulmonary fibrosis in families //Am. J. Respir. Cell Мої. Biol. — 2003. —
Vol. 29, N 3. - Suppl. - P 47-50.Lynch J.P. 3rd. White E. Flaherty K. Corticosteroids in idiopathic pulmonary fibrosis I I
Curr. Opin. Pulm. Med. - 2001, Sep. - Vol. 7, N 5. - P. 298-308.Machado R.F., Dweik R.A., Demeter S.L., Ahmad M. Drug-induced pulmonary dis¬
ease // Baum’s Textsdock of Pulmonary Diseases. 7th ed. / Eds J.D. Crapo,
J. Glassroth, J.B. Karlinsky, T.E. King. - 2004. - P. 657-677.Madani G., Katz R.D., Haddock J,A., Denton C.R, Bell J.R. The role of radiology in
the management of systcmic sclerosis // Clin. Radiol. — 2008, Sep. — Vol. 63,
N 9. - P 959-967.Maher T.M., Wells A.U., Laurent G.J. Idiopathic pulmonary fibrosis: multiple causes
and multiple mechanisms? // Eur. Respir. J. — 2007. — Vol. 30. — P, 835-839.Malhotra A., Muse V.V., Eugene J.M. Case 12-2003 — An 82-Year-Old Man with
Dyspnea and Pulmonary Abnormalities // N. Engl. J. Med. — 2003. — Vol. 348,
N 16.-R 1574-1585,Malizia Л.Р., Keating D.T, Smith S.M. et at. Alveolar epithelial cell injury with
Epstein-Barr virus upregulates TGFl expression // Am. J. Physiol. Lung Cell
Мої. Physiol. - 2008. ~ Vol. 295. - R 451-460.Malyak M, Гранулематоз Вегенера и прочие заболевания, при которых
выявляются антинейтрофильные цитоплазматические антитела //
Секреты ревматологии / Под ред. Стерлинга Дж. Веста. — М.: Бином;
СПб.: Невский диалект, 2001. — С. 269—279.ManaF., Mets Т., Vincken W. etal. The association of bronchiolitis obliterans organiz¬
ing pneumonia, systemic lupus erythematosus, and Hunner’s cystitis // Chest. —1993. - Vol. 104. - P 642-644.
ЛИТЕРАТУРАManai О.А., Dweik R.A., Arroliga А. Manifestations of scleroderma pulmonary disea¬
se //Clin. Chest Med. - 1998. - Vol. 19. ~ P. 713-731.Maradit-Kremers U., Nicota PJ., Crowson C.S. et al. Cardiovascular death in rheu¬
matoid arthritis: a population-based study // Arthritis Rheum. — 2005, Mar. —
Vol. 52, N 3. - P. 722-732.Marshall R.P., Puddicomhe A., Cookson W.O. Laurent GJ. Adult familial crypto¬
genic fibrosing alveolitis in the United Kingdom // Thorax. ~ 2000. — Vol. 55,
N 2. - P. 143-146.Martin L., Edworthy S.M., Ryan J.P. et al. Upper airway disease in systemic lupus
erythematosus; a report of 4 cases and a review of the literature // J. Rheumatol, —
1992. - Vol. 19. - P. 1186-1190.Masuko K., Murata М., Xiang Y. et al. Tryptase enhances release of vascular endo¬
thelial growth factor from human osteoarthritic chondrocytes // Clin. Exp.
Rheumatol. - 2007, Nov. - Vol. 25, N 6, - R 860-865.Matsui K., Takeda K., YuZ. etal. Downregulation of estrogen and progesterone recep¬
tors in the abnormal smooth muscle cclls in pulmonary lymphangioleiomyomato-
sis following therapy; an immunohistochcmical study // Am. J. Respir. Crit. Care
Med. - 2000. - Vol. 161. - R 1002-1009.Matsuo S., Sato K, Matsumoto Т., Naiki N., Horie M. Churg-Strauss syndrome present¬
ing with massive pericardial effusion // Heart Vessels. — 2007, Mar. — Vol. 22,
N 2. - R 128-130. Epub 2007 Mar 23.Matsushima K, Takayanagi N., Kurashima K, etal. Multiple tracheobronchial mucosal
lesions in two cases of Churg-Strauss syndrome // Respirology. — 2006, Jan. —
Vol. ILN 1.-R 109-112.Mazzone P.J., Thomassen М., Kavuni M.S. Pulmonary Alveolar Proteinosis: recent
advances // Semin. Respir. Crit, Care Med. — 2002. — Vol. 23, N 2. — P. 115-126.McGonagle D., Tan A.L., Madden J. et al. Successful treatment of resistant scleroderma-
associated interstitial lung disease with rituximab // Rheumatology (Oxford). —
2008, Apr. - Vol. 47, N 4. - R 552-553.Meliconi R., Andreone P., Fasano L. et al. Incidence of hepatitis С virus infection
in Italian patients with idiopatic pulmonary fibrosis // Thorax. — 1996. —
Vol. 51. - R 315-317.Meltzer E., Guranda L., Peretman M. et al. Lipoid pneumonia: a preventable form of
drug-induced lung injury// Eur. J. Intern. Med. — 2005, Dec. — Vol. 16, N 8. —
R 615-617.Memet B., Ginzler E.M. Pulmonary manifestations of systemic lupus rythematosus //
Semin. Respir. Crit. Care Med. — 2007, Aug. — Vol. 28, N 4. — P. 441-450.Mercola J. Obesity Drugs Linked To Rise in Lung Disease // Chest. — 2000. —
Vol. 117, N 3. -- R 796-800.Meyer J.D., Holt D.L., Cherry N.M., VcDonald J.C. SWORD’98: surveillance of work-
related and occupational respiratory disease in the BK, // Occup. Med. (Oxf.). —1999. - Vol. 49, N 8. - R 485-489.Michaelson J.E., Aguayo S.M., Roman J. Idiopathic pulmonary fibrosis: a practi¬
cal approach for diagnosis and treatment // Chest. — 2000.— Vol. 118. —
R 788-794.
ЛИТЕРАТУРА • 445Minagawa S., Takayanagi N., Hara K. et al. A case of rheumatoid arthritis complicated
with methotrexate-induced pneumonitis and pneumocystis pneumonia // Nihon
Kokyuki Gakkai Zasshi. — 2008, Mar. — Vol. 46, N 3. — P. 237-242,Minami R., Miyamura Т., Watanabe H. et al. Successful treatment of a patient with
refractory Wegener’s granulomatosis by Rituximab// Nihon Rinsho Mencki
Gakkai Kaishi. - 2007, Apr. - Vol. 30, N 2. - R 133-138.Mittoo S., Wigley F.M., IVise R. et al. Persistence of abnormal bronchoalveolar
lavage findings after cyclophosphamide treatment in scleroderma patients with
interstitial lung disease // Arthritis Rheum. — 2007, Dec. — Vol. 56, N 12. —
R 4195-4202.Miyawaki K., Shimishi J., T^msumi Y. et al. Bcneficial effect of gabexate mesilate on
microscopic polyangiitis with renal dysfunction and pulmonary hemorrhage:
A case report // Angiology. — 2006, Aug.—Sep. Vol. 57, N 4. — P. 522—525.Modi М., Vats A,К., Prabhakar S., Singla V., Mishra S. Acro-osteolysis and mononeu¬
ritis multiplex as a presenting symptom of systemic angiitis of Wegener’s type //
Indian L Med. Sci. - 2007, Apr. - Vol. 61, N 4. - R 212-5.Mok M.Y., Cheung B.M., Lo Y. et al. Elevated plasma adrenomedullin and vascular
manifestations in patients with systcmic sclerosis // J. Rheumatol. — 2007, Nov. —
Vol. 34, n 11. - R 2224-2229.MoUer D.R,, Forman J.D., Liu M.C. Enhanced expression of IL-12 associated with
Thl cytokine profiles in active sarcoidosis // J. Immunol. — 1996. — Vol. 156. —
R 4952-4960.Monaghan H., Wells A.U., Colby TV. et al, Prognostic implications of histologic pat¬
terns in multiple surgical lung biopsies from patients with idiopathic interstitial
pneumonias // Chest. — 2004. — Vol. 125. — P. 522-526.Monso E., Tura J.M., Marsal М., Morrell F, Pujadas J., Morera J. Mineralogical micro¬
analysis of idiopathic pulmonary fibrosis // Arch. Environ. Health. — 1990.—
Vol. 301.-R 1015-1017.Mori S., Cho I., Koga Y., Sugimoto M. A simultaneous onset of organizing pneu¬
monia and rheumatoid arthritis, along with a review of the literature // Mod.
Rheumatol. - 2008. - Vol. 18, N 1. - R 60-66.Morimoto Т., Azuma A., Abe S. et al. Epidemiology of sarcoidosis in Japan // Eur.
Respir. J. - 2008. - Vol. 31. - R 372-379.MouthonL, Berezn Г.А., BraunerM. etal. Interstitiallung disease in systemic sclerosis//
Rev. Mai. Respir. — 2007, Oct. — Vol. 24, N 8 . — P. 1035-1046.Murin S., Wiedemann H. P., Matthay R.A. Pulmonary manifestations of systemic lupus
erythematosu // Chn. Chest Med. - 1998. - Vol. 19. - R 641-666.NaitoM, Macrophage differentiation and function in health and disease//Pathol. Int. —
2008. - Vol. 8. - R 143-155.Nakayama Т., Hasimoto S., Amenta £., Horie T Elevation of plasma-soluble tumor
necrosis factor receptors (TNF-R) in sarcoidosis // Clin. Exp. Immunol.—1996. ~ Vol. 104 - R 318-324.Nau G.J., Guilfoile P., Chupp G.L et al. A chemoattractant cytokine associated
with granulomas in silicosis // Proc. Natl Acad. Sci. USA. — 1997. — Vol. 94,
N 12.-R 6414-6419.
448 • ЛИТЕРАТУРАNellesaen CM, Рб^е U., Breming K.A. etal. Diffuse alveolar haemorrhage in a systemic
lupus erythematosus patient successfully reated with rituximab: a case report //
Nephrol. Dial. Transplant. - 2008, Jan. - Vol. 23, N 1. - P. 385-386.Nemery B. Late consequences of accidental exposure to inhaled irritants: RADS and
the Bhopal disaster// Eur. Respir. J. — 1996. — Vol. 9. — R 1973-1976.Nemery B., Lewis CPL., Demendis M. Cobalt and possible oxidant-mediated toxicity і I
Sci. Total Environ. ~ 1994. — Vol. 150. — R 57-64.Newman L.S., Rose C.S,, MaierI.A. Medical progress: sarcoidosis I I N. Engl. J. Med. —
1997. - Vol. 336. - R 1224-1234.Newman Taylor A J., Cullman P. Diagnosis of occupational lung disease //Occupational
lung disorders: Eur. Respir. Monogr. — 1999. — Chap. 4. -- R 64—105.Nicolls M.R., Newman L.S. Chronic beriliium disease (berilliosis) // UpToDate. —
2002. — http://www.uptodate.comNieman G.F., Clark W.R., Paskanik A., Feldbaum D. Segmental pulmonary vascular
resistance folowing wood smoke inhalation // Crit. Care Med. — 1995. — Vol. 23,
N 7. - R 1264-1271.Nureki S., Miyazaki E., Maisuno O. et at. Corynebacterium ulcerans infection of the
lung mimicking the histology of Churg-Strauss syndrome // Chest. — 2007,
Apr. - Vol. 131, N 4. - R 1237-1239.Ochi S., Harigai М., Mizoguchi F. et at. Leflunomide-related acute interstitial pneu¬
monia in two patients with rheumatoid arthritis: autopsy findings with a mosaic
pattern of acute and organizing diffuse alveolar damage // Mod. Rheumatol. —2006. - Vol. 16, N 5. - R 316-320.Oddis C.V. Outcomes and disease activity measures for assessing treatments in the
idiopathic inflammatory myopathies // Curr. Rheumatol. Rep. — 2005. —
Vol. 7. - R 87-93.O’Donnell J.L., Stevanovic V.R., Frampton C. et al. Wegener’s granulomatosis in
New Zealand: evidence for a latitude-dependent incidence gradient // Intern.
Med. J. - 2007, Apr. - Vol. 37, N 4. - R 242-246.O"Driscoll B.R., Hasleton P.S., Taylor P.M. et al. Active lung fibrosis up to 17 years after
chemotherapy with carmustine (BCNU) in childhood // N. Engl. J. Med. — 1990,
Aug. 9. - Vol. 323, N 6. - R 378-382.Ognibene F.P., Shelhamer J.H., Hoffman G.S. et al. Pneumocystic carini hneumonia:
a maior complication of Wegener’s granulomatosis I I Am. J. Respir. Crit. Care
Med. - 1995. - Vol. 151. - R Ш-Ш.Olson A.L., SwigrisJJ., Letotte D.C. etal. Mortality from Pulmonary Fibrosis Increaed
in the United States from 1992 to 2003 // Am, J. Respir. Crit. Care Med. —2007. - Vol. 176. - R 277-284.OrensJ.B., Martinez F.J., Lynch J.P. Ill: Pleuropuimonary manifestations of systemic lupus
erythematosus // Rheum. Dis. Clin. North Am. — 1994. — Vol. 20. — P. 159-193.Osier W.O. On the visceral complications of erythema exudativum multiforme //
Am. J. Med. Sci. - 1885. - Vol. 110. - R 629-635Osuna A., Garrido J. Cyclophosphamide-intolerant Wegener’s granulomatosis
successfully treated with mycophenolate mofetil // Acta Reumatol. Port. —2008. Apr.-Jun. - Vol. 33, N 2. - R 224-228.
ЛИТЕРАТУРА • 447Otsuka Т., Коуата Т., Ohtani R. ei al. Leflunomide-induced lung injury that developed
after its withdrawal, coinciding with peripheral blood lymphocyte count decrease //
Mod. Rheumatol. - 2008. - Vol. 18, N 1. - R 96-99.Oud K.T., Bresser P., ten Berge R.J., Jankers R.E. The shrinking lung syndrome in sys¬
temic lupus erythematosus: improvement with corticosteroid therapy // Lupus. —2005. - Vol. 14, N 12. - P. 959-963.Pacheco-Rodhguez G., Kristof A.S., Stevens L.A. et al Genetics and gene expression in
lymphangioleiomyomatosis// Chest. — 2002. — Vol. 121, N 3. — P. 56-60.Pagalavan L., Ong S,G. Demography, clinical and laboratory features of systemic
sclerosis in a Malaysian rheumatology centre // Med. J. Malaysia. — 2007, Jun. —
Vol. 62, N2.-P. 117-121.Pagmux C, Wegener’s granulomatosis and microscopic polyangiitis // Rev. Prat. —
2008, Mar. 15. - Vol. 58, N 5. - R 522-532.Pagnoux C, Guilpain P., Guitlevin L. Churg-Strauss syndrome // Curr. Opin.
Rheumatol. - 2007, Jan. - Vol. 19, N 1. - R 25-32.Pagnoux C., Guilpain P., Guillevin L. Microscopic polyangiitis // Presse Med, — 2007,
May. - Vol. 36, N 5. - Pt 2. - R 895-901. Epub 2007 Mar 12.Paone C., Chiarolanzfl I., Cuomo G. et at. Twelve-month azathioprine as maintenance
therapy in early diffuse systemic sclerosis patients treated for 1-year with low dose
cyclophosphamide pulse therapy // Clin. Exp. Rheumatol. — 2007, Jul.-Aug. —
Vol. 25, N 4. - R 613-616.Paran D.f Fireman E., Levartovsky D. et al. Pulmonary dysfunction in system¬
ic lupus erythematosus and anti-phospholipid syndrome patients // Scand.
J. Rheumatol. - 2007, Jul.-Aug. - Vol. 36, N 4. - R 285-290.Patel R.R., Ryu J.ff., Vassallo R. Cigarette smoking and diffuse lung disease //
Drugs. - 2008. - Vol. 68, N 11. - R 1511-1527.Pepys J. Hypersensitivity to inhaled organic antigens // J. R. Coll. Physicans. —
1967.-Vol. 2.-R 42-51.Perez-Padilla R., Gaxioia М., Salas J. et at. Bronchiolitis in chronic pigeon breeder’s
disease. Morphologic evidence of a spectrum of small airway lesions in hypersen¬
sitivity pneumonitis induced by avian antigens // Chest. — 1996. — Vol. 110. —
R 371-377.Pesci A., Manganelli P. Respiratory system involvement in antineutrophil cytoplasmic-
associated systemic vasculitides: clinical, pathological, radiological and therapeu¬
tic considerations I I Drugs R D. — 2007. — Vol. 8, N 1. — P. 25-42.Petrek М., Pantelidis P., Southcott A.M. The source and role of RANTES in interstitial
lung disease // Bur. Respir. J. - 1997. - Vol. 10. - R 1207-1216.PoM M.A., Lon S.P., Bert T. Plasmapheresis does not increase the risk for infection
in immunosuppressed patients with severe lupus nephritis. The Lupus Nephritis
Collaborative Study Group //Ann. Intern. Med. — 1991. — Vol. 114. — P. 924-928.Poll LW., May P., Koch J.A., Hetzel G. et al. HRCT findings of amiodarone pulmonary
toxicity; clinical and radiologic regression // J. Cardiovasc. Pharmacol. Ther. —2001. - Vol. 6, N 3. - R 307-311.Pope J. An update in pulmonary hypertension in systemic lupus erythematosus —
do we need to know about it? // Lupus. — 2008. — Vol. 17, N 4. — R 274-277.
448 • ЛИТЕРАТУРАPotoUcchio I., Fesiucci A., Hausler P., Sorrentino R. HLA-DP molccules bind cobalt:
a posible explanation for the genetic association with hard metal disease // Eur.
J. Immunol. - 1999. - Vol. 29, N 7. - P. 2140-2147.PotoUcchio L, Festucci A., Hausler P., Sorrentino R. HLA-DP molecules bind cobalt:
a posible explanation for the genetic association with hard metal disease // Eur.
J. Immunol. - 1999. - Vol. 29, N 7. - R 2140-2147.Purnell D.C., Baggenstos A.H., Olsen A.M. Pulmonary lesions in disseminated lupus
erythematosus //Ann. Intern. Med. — 1955. — Vol. 42. — P. 619-621.QuadreUi S., Cialielia L., Pellet A.C, et al. Lung involvement in systemic sclerosis //
Medicina (В. Aires). — 2007. — Vol. 67, N 5. — P. 429-435.Rubin D.L., Richardson M.S.A., Stein S.R., Yearger H. Sarcoidosis severity and socio¬
economic status // Eur. Respir. J. -— 2001. — Vol. 18. — P. 499-506.Rafael L. Perez, Anthony P. Kimani, Talmadge E. King Jr., Samuel M. Aguayo, Jesse
Roman Bronchoalveolar Lavage Fluid D Dimer Levels Are Higher and More
Prevalent in Black Patients with Pulmonary Sarcoidosis // Respiration. — 2007. —
Vol. 74. - R 297-303.Raghu G., Brown K.K., Costabel U. et al. Treatment of idiopathic pulmonary fibro¬
sis with etanercept // Am. J. Respir. Crit. Care Med. — 2008. — Vol. 178. —
R 948-955.Raghu G; Johnson W.C., Lockhart D. et al. Treatment of idiopathic pulmonary fibrosis
with new anti fibrotic agent, pirfenidone: results of a prospective, open-label Phase
II study//Am. J, Respir. Crit. Care Med,. - 1999. - Vol. 159. - R 1061-1069.Raghu G., Weyeker D., Edelsberg J. et at. Incidence and prevalence of idiopathic
pulmonary fibrosis I I Am. J. Respir. Crit. Care Med. -- 2006. — Vol. 174. —
R 810-816.Rajasekaran A., Shovlin D., Saravanan V. etal. Interstitial lung disease in patients with
rheumatoid arthritis: comparison with cryptogenic fibrosing alveolitis over 5 years //
J. Rheumatol. - 2006, Jul. - Vol. 3, N 7. - R 1250-1253.Ramazzini da Capri B. De Morbis Artifucum Diatriba, 1713: Translation. — Chicago,
IL: University of Chicago Press, 1940.Ramos-Casals М., Brito-Zeron P., MuOoz S. et al. Autoimmune diseases induced by
TNF-targeted therapies: analysis of 233 cases // Medicine (Baltimore). — 2007,
Jul. - Vol. 86, N 4. - R 242-251.Reimold A.M. TNF alpha as therapeutic target; new drugs, more applications // Curr.
Drug Targets Inflamm. Allergy. — 2002. — Vol. 1. — P. 377-392,Reiser H., Stadecker M.J. Co stimulatory B7 molecules in the pathogenesis of infec¬
tious and autoimmune diseases // N. EngL J. Med.— 1999.— Vol. 335.—
R 1369-1377.Renzoni E.A. Interstitial lung disease in systemic sclerosis // Monaldi Arch. Chest
Dis. - 2007, Dec. - Vol. 67, N 4. - R 217-228,Richeldy L., Sorrentino R., Saltini C. HLA-DPBl glutamate 69: a genetic marker of
berylhum disease // Science. — 1993. — Vol. 262. — R 242-244.Rivera M.H., Kris M.G., Gralia R.J., White D.A. Syndrome of acutc dyspnea related to
combined mitomycin plus vinca alkaloid chemotherapy //Am. J. Clin. Oncol. —1995. - Vol. 323. - R 378-382,
ЛИТЕРАТУРА • 449Rodriguez de Castro E, Carrillo Т., Castillo R. et al. Relationships between characteris¬
tic of exposure to pigeon antigens // Clinical manifestation and humoral immunt
response // Chest. — 1993. — Vol. 103. — P. 1059-1063.Rojas-Serrano J., Pedroza J,, Regalado J. etai High prevalence of infections in patients
with systemic lupus erythematosus and pulmonary haemorrhage // Lupus. —
2008. ~ Vol. 17, N 4. - P. 295-299.RolfM.W., Standiford T.J., Kuttkel S.L. Intcrlcukin-1 receptor antagonist expression in
sarcoidosis//Am. Rev. Resplr. Dis. — 1993. — Vol. 148, ~ P. 1378-1384.Romagnani S. Thl and Tb2 in human diseases // Clin, Immunol. Immunopathol. —1996. - Vol. 80. - P. 225-235.Roncoroni A.J., Alvarez C., Molinas F Plexogenic arterlopathy associated with pul¬
monary vasculitis in systemic lupus erythematosus // Respiration.— 1992.—
Vol. 59, - P. 52-54.Rosen S.H., Castleman B., Liebow A.A. Pulmonary alveolar proteinosis // N, Engl.
J. Med. ~ 1958. - Vol. 258. - R 1123-1142.Rosenman K.D., Reilly M.J., Kalinowski D.J., Watt FC. Silicosis in the 1990s (see com¬
ments) I I Chest. - 1997. - Vol. 111, N 3. - R 779-786.Rouetbi N., Battikh М., el Kamel A. Diffuse interstitial pulmonary fibrosis and bron¬
chial cancer// Rev. Pneumol. Clin. — 1999, Dec. — Vol. 55, N 6. — P. 370-372.RovenskyJ., TuchynovaA. Systemic lupus erythematosus in the elderly// Autoimmun.
Rev. - 2008, Jan. - Vol. 7, N 3. - R 235-239.Rozin A., Yigla М., Guralnik L. et al. Rheumatoid lung noduiosis and osteopathy asso¬
ciated with leflunomide therapy // Clin. Rheumatol. — 2006, May. — Vol. 25,
N 3. - R 384-388.Saketkoo L.A., Espinoza L.R. Rheumatoid arthritis interstitial lung disease:
mycophenolate mofetil as an antifibrotic and disease-modifying antirheu-
matic drug // Arch. Intern. Med. — 2008, Aug 11,— Vol. 168, N 15.—
R 1718-1719.Saltini C, Richeldi L., Losi M. et al Major histocompatibility locus genctic markers of
beryllium sensitization and disease I I Eur. Respir. J. — 2001. — Vol. 189, N 4 —
R 677-684.ScaddingJ.G. Fibrosing alveolitis // BMJ. — 1964. — Vol. 2. — P. 686.Scadding J.G., Hinson K. Diffuse fibrosing alveolitis (diffuse interstitial fibrosis of the
lungs): correlation of histology at biopsy with prognosis // Thorax. — 1967. —
Vol. 22. - R 291-304.Schumann J. Lymphogranuloma benigna in the light of prolonged clinical observa¬
tions and autopsy findings // Br. J. Dermatol. — 1936. — Vol. 48. — P. 399.Schuyler М., Cormier Y. The diagnosis of hypersensitivity pneumonitis // Chest. —1997, Mar. - Vol. Ill, N 3 - R 534-536.Schwab E.P., Schumacher li.RJr., Freundlich B. et al. Pulmonary alveolar hemor¬
rhage in systemic lupus erythematosus // Semin. Arthritis Rheum. — 1993. —
Vol. 23. - R 8-9.Schwartz D.A. Epidemiology, Morbidity, Mortality, and Familial Distribution of
Idiopathic Pulmonary Fibrosis // New Approaches to Managing Idiopathic
Fibrosis. - 2000, Sep. - R 1-8.
450 . ЛИТЕРАТУРАSchwarz М.I., Fontenot А.Р. Drug-induced diffuse alveolar hemorrhage syndromes and
vasculitis I I Clin. Chest Med. — 2004, Mar. — Vol. 25, N 1. — P. 133—140.Segal E.y Lang E. Toxicity, Chlorine Gas // 2006, Oct. 10. — eMedicine Spe-
cialties>Emergency Medicine>TOXICOLOGY.Segura A. Pulmonary fibrosis induced by cyclophosphamide // Ann. Pharmacother. —2001, - Vol. 35, N 7-8. - P. 894-897.Selman М., Talmadge E., King E., Pardo A. Idiopathic pulmonary fibrosis: Prevailing
and Evolving Hypotheses about its Pathogenesis and Implications for Therapy //
Ann. Intern. Med. - 2001. - Vol. 134. - P. 136-151.Sergeeva A., Ono Y., Rios R. et al. High titer autoantibodies to G M-CSF in patients with
AML, CML and MDS arc associated with active disease // Leukemia. — 2008. —
Vol. 22. - P. 783-790.Seymour J.F., Presneill J.J. Pulmonary alveolar proteinosis: progress in the first 44
years//Am. J. Respir. Crit. Care Med. - 2002. - Vol. 166. - P. 215-235.Shah P.L., ffansell D.M., Lawson PR. et al. Pulmonary alveolar proteinosis: clinical
aspects and current concepts on pathogenesis // Thorax. — 2000. — Vol. 55. —
P. 67-77.Shahim АЛ., Sabri Y.Y., Mostafa U.A. et al. Pulmonarі function tests, high-resolution
computerized tomography, alpha 1-antitrypsin measurement, ande early detec¬
tion of pulmonary involvement in patient with systemic sclerosis // Rheumatol.
Int. - 2001. - Vol. 20, 3. - P. 95-100.Sharma O.P. Cardiac and neurologic dysfunction in sarcoidosis I і Clin. Chest Med. —1997.-Vol. 18.-P 813-825.Sharma S. Hypersensitivity Pneumonitis // Jun 1, 2006.— eMedicine Specialties >
Pulmonology > Interstitial Lung DiseasesShen М., Wang .y, Xu W.B. et al Pleuropulmonary manifestations of systemic lupus
erythematosus // Zhonghua Yi Xue Za Zhi. — 2005, Dec. 21. — Vol. 85, N 48. —
P 3392-3395.Shimizu y., Kuwabara H., Ono A. et al. Intracellular Thl/Th2 balance of pulmonary CD4{4-)
T cells in patients with active interstitial pneumonia evaluated by serum KL-6 //
Immunopharmacol, Iramunotoxicol. — 2006. — Vol. 28, N 2. — P. 295-304.Shi-wen X., Kennedy L., Renzoni ЕЛ et al Endothelin is a downstream mediator of pro-
fibrotic responses to transforming growth factor beta in human lung fibroblasts //
Arthritis Rheum. - 2007, Dec. - Vol. 56, N 12. - P 4189-4194.Silagy C., Lancaster Т., Stead L. etal. Nicotine replacement therapy for smoking cessa¬
tion I I Cochrane Database Syst. Rev. — 2004. — Is. 3; CD000146.Sil\a C.L, Mailer N.L., Fujimoto K, etal. Churg-Strauss syndrome: high resolution CT
and pathologic findings // J, Thorac. Imaging. — 2005, May. — Vol. 20, N 2. —
P. 74-80.SilverR.M. Scleroderma and Pseudoscleroderma: Environmtntal Exposure // Systemic
Sclerosis / Eds P.J. Clements, D,E. Furst. ~ Baltimore: Williams and Wilkins,1996.-Vol. 45.-R 81-98.Sinico R.A., Di Toma L., Maggiore U. et al. Prevalence and clinical significance of
anti neutrophil cytoplasmic antibodies in Churg-Strauss syndrome // Arthritis
Rheum. - 2005, Sep. - Vol. 52, N 9. - R 2926-2935.
ЛИТЕРАТУРА • 451Smith R.E., Strirter RM., Zhang K. et al. A role for C-C hemokines in fibrotic lung
disease // J. Leukoc- Biol. — 1995. — Vol. 57. — P. 782-787.Smitten A.L., Simon T.A., Hochberg M.C., Suissa S. A meta-anaiysis of the incidence of
malignancy in adult patients with rheumatoid arthritis // Arthritis Res. Ther. —2008. - Vol. 10, N 2 - P. 45-48.Soubrier М., Jeannin G., Kemeny J.L. et ai Organizing pneumonia after rituximab
therapy: Two cases // Joint Bone Spine. — 2008, May. — Vol. 75, N 3. —
P. 362-365.Spenser SJW., Burns A., Gaskinn G. et al. HLA class II specificities in vasculitis
with antibodies to neutrophil cytoplasmatic antigens // Kidney Int. — 1992. —
Vol. 41. - P. 1059-1085.Steen ТЖ, Gyi K.M., White N.W.et al. Prevalence of occupational lung disease among
Botswana men formely employed in the South African mining industry // Occup.
Environ. Med. - 1997. - Vol. 54, N 1. - P. 19-26.Steen K, Chou М., Shanmugam V., Mathias M. et al. Exercise-induced pulmonary
arterial hypertension in patients with systemic sclerosis // Chest. — 2008, Jul. —
Vol. 134, N 1. - P. 146-151.Steen V.D., Lucas М., Fertig N., Medsger TAJr. Pulmonary arterial hypertension and
severe pulmonary fibrosis in systemic sclerosis patients with a nucleolar antibody //
Rheumatology. - 2007, Nov. - Vol. 34, N 11. - R 2230-2235.Steigel D., Bubendorf L., Oberhoker M. et al. Ciprofloxacin-induced acute interstitial
pneumonitis // Eur. Respir. J. - 2004. - Vol. 23, N I. - R 172-175.Stewart J.P., Egan J.J., Ross A.J. et al. The detection of Epstein-Barr virus DNA in
lung tissue from patients with idiopathic pulmonary fibrosis //Am. J. Respir. Crit.
Care Med. - 1999.-Vol. 159.- R 1336-1341.Strange C, Bolster M.B., Roth M.D. etal. Bronchoalveolar lavage and response to cyclo¬
phosphamide in scleroderma interstitial lung disease // Am. J. Respir. Crit. Care
Med. - 2008, Jan. 1. - Vol. 177, N 1. - R 91-98.Strieter R.M., Keane M.P. Cytokine Biology and the Pathogenesis of Interstitial Lung
Disease // New Approaches to Managing Idiopathic Pulmonary Fibrosis. —2000. - N 9. - R 27-35.Sundreji R., Kanji Z., Gin K. Pulmonary effccts of low dose amiodaronc: A review of
the risks and recommendations for surveillance // Can. J. Cardiol. — 2000. —
Vol. 16. - R 1435-1440.Suzuki K., Nakase K., Ino K. et al. Breakthrough cryptococcosis in a patient with sys¬
temic lupus erythematosus (SLE) receiving micafungin // J. Infect. Chemother. —2008, Aug. - Vol. 14, N 4. - R 311-314.Swigris J.J., Fischer A., Gillis J. et al Pulmonary and thrombotic manifestations
of systemic lupus erythematosus // Chest. — 2008, Jan. — Vol. 133, N 1. —
R 271-280.Taha R.A,, Minshall E.M., Olivenwtein R. etal. Increased expression of lL-12 receptor
mRNA in active pulmonary tuberculosis and sarcoidosis // Am. J. Respir. Crit.
Care Med. - 1999. - Vol. 160. - R 1119-1123.Tamborrini G., Distler M, DistlerO. Systemic sclcrosis I I Med. Monatsschr. Pharm. —2008, May. - Vol. 31, N 5. - R 162-172.
452 • ЛИТЕРАТУРАTanaka Y., Seo R., Nagai Y. et al. Systemic lupus erythematosus complicated by
cytomegalovirus-induced hemophagocytic syndrome and pneumonia // Nihon
Rinsho Meneki Gakkai Kaishi. - 2008, Feb. - Vol. 31, N 1. - P. 71-75.TangJ.P., Gu Y.Y., Shen N. et al. Peripheral blood mRNA and interferon gene expres¬
sion in systemic lupus erythematosus // Zhonghua Nei Ke Za Zhi. — 2005,
Feb. - Vol. 44, N 2. - P. 106-110.Tanoue L.T., Etias J.A. Systemic Sarcoidosis // Baum’s Textbook of Pulmonary
Diseases. 7th ed. / Eds James D. Crapo et al. — 2004. — P. 539-562,Targoff I.N., Trieu E.P., Plotz P.H., Miller EW. Antibodies to glycyl-transfer RNA syn¬
thetase in patients with myositis and interstitial lung disease // Arthritis Rheum
(N.Y.). - 1992. - Vol. 35, N 7. - R 821-830.Taskar V.S., CouHas D.B. Is Idiopathic Pulmonary Fibrosis an Environmental
Disease? // Proc. Am. Thorac. Soc. — 2006. — Vol. 3. — P. 293-298.Tatrai E., Kovacikova Z, Hudak A. el al. Comparative in vitro toxicity of cadmium
and lead on redox cycling in type II pneumocytes // J. Appl. Toxicol. — 2001. —
Vol. 21, N 6. - P. 479-483.Taylor J.R., Ryu J., Colby TV et al Lymphangioleiomyomatosis: clinical course in 32
patients // N. Engl. J. Med. - 1990. - Vol. 323. - P 1254-1260.Tazi A., Soler P., Hance A.J. Adult Pulmonary Langerhans’ cell histiocytosis //
Thorax, - 2000. - Vol. 55. - P. 405-416.Teja K., Cooper P.H., Squires J.E. et al. Pulmonary alveolar proteinosis in four
siblings I I N. Engl. J. Med. - 1981. - Vol. 305, N 23. - R 1390-1392.Thomasaen M.J., Barna B.P., Malur A.G. et al. ABCGl is deficient in alveolar mac¬
rophages of GM-CSF knockout micc and patients with pulmonary alveolar pro¬
teinosis//J. Lipid Res. - 2007. ~ Vol. 48. - P. 2762-2768.Thomeer М., Demedts Vandeurzen K. etal. Epidemiological registration of interstitial
lung diseases //Am. J. Respir. Crit. Care Med. — 1997. — Vol. 155. — P. A320.Thomeer M.J., Vansteenkiste J., Verbeken E.K., Demedts M. Interstitial lung dis¬
eases: characteristics at diagnosis and mortality risk assessment // Respir.
Med. - 2004. - Vol. 98, N 6. - P 567-573.Thomson A. The Cytokine Handbook. — Acad. Press, 1998. — P. 1017Tobin R.!V., Pope S.E., Pellefrini C.A. et al. Increased prevalence of gastroesophageal
reflux in patients with idiopathic pulmonary fibrosis // Am. J, Respir. Crit. Care
Med. - 1999. - Vol. 150. - R 670-675,Toem G.B. Interstitial Lung Disease // Cecil Textbook of Medicine / Goldman. 21st
ed. — Chap. 78. — P. 393—401. — Copyright © 2000 W.B. Saunders Company. —
MD Consult L.L.C. http://www.mdconsult.comTomoika H., King T.E.Jr. Gold induced pulmonary disease: clinical features, outcomes
and differentiation from rheumatoid lung disease // Am. J. Respir. Crit. Care
Med. - 1997. - Vol. 155. - P 1011-1020.TongZ., Dai H., Chen B, et al. Inhibition of cytokine release from alveolar macrophages
in pulmonary sarcoidosis by pentoxifilline: comparison with dexametasone I I
Chest. - 2003. - Vol. 124. - R 1526-1532.Trindade E., Silva L.P., Cabrera H. etal. Hemoptysis: an uncommun case//Acta Med.
Port. - 2007, Sep.-Oct. - Vol. 20, N 5. - R 457-461.
ЛИТЕРАТУРА * 453Tseng J.R., HmgJJ., Huang J.L. The clinical differences between early-and late-onset
pulmonary hemorrhage in systemic lupus erythematosus patients // Acta Paediatr
Taiwan. - 2006, Sep.-Oct. - Vol. 47, N 5. - P. 232-237.Turesson C., Matteson E.L., Colby T.V etal. Increased CD4+ T cell infiltrates in rheuma¬
toid arthritis-associated interstitial pneumonitis compajred with idiopathic intersti¬
tial pnemnonitis I I Arthritis Rheum. — 2005, Jan. — Vol. 52, N 1. — P. 73-79.TzekpisG.E., Plastiras S.C., Karadimitrakis S.P., Vlachoyiannopoulos P.G. Determinants
of pulmonary fuiKtion improvement in patients with scleroderma and interstitial
lung disease // Clin. Exp. Rheumatol, — 2007, Sep—Oct. — Vol. 25, N 5. —
P. 734-739.Tzelepis G.E., Toya S.P., Moutsopoulos HM, Occuh connective tissue diseases mimick¬
ing idiopathic interstitial pneumonias // Eur. Respir. J. — 2008, Jan. — Vol. 31,
N l.-P. 11-20.Ubara Y., Tagami T, Suwabe T etal. Systemic A-amyloidosis related to MPO-ANCA
microscopic polyangiitis: a case report I I Amyloid. — 2006, Sep. — Vol. 13,
N 3.- R 178-183.Uehara A., Hirabayashi X, Takada H. Antibodies to proteinase 3 prime human oral, lung,
and kidney epithelial cells to secrete proinflammatory cytokines upon stimulation
with agonists to various Toll-like receptors, NODI, and N0D2 // Clin. Vaccine
Immunol. - 2008, Jul. - Vol. 15, N 7. - P. 1060-1066. Epub 2008 May 21.Vemura Akihiaa, Morinoto Sh'm-icniro and al. Histology diagnosis rate of cardiac
sarcoidosis: evaluation of endomyocardial biopsies // Am. Heart J. — 1999. —
Vol. 138, N 2. - P. 299-302.Urban Т., Lazor R., Lacronique J. et al. Pulmonary lymphangioleiomyomatosis; a study
of 69 patients: Groupe d’Etudes et de Recherche sur les Maladies «Orphelines»
Pulmonaires (GERM>>0»P) // Medicine (Baltimore). — 1999. — Vol. 78. —
R 321-337,Van der Kantp R., Так P.P., Jansen H.M., Bresser P. Interstitial lung disease as the
first manifestation of systemic sclerosis // Neth. J. Med. — 2007, Nov. — Vol. 65,
N 10. - R 390-394.Van Zyl J.R., Obenour R.A. Coal Worker’s Pneumoconiosis // Sep 5, 2007. — eMedi¬
cine Specialties > Pulmonology > Occupational Lung Diseases.Vassallo R., Ryu J.H., Colby T.V. et at. Pulmonary Langcrhans’ cell histiocytosis //
N. Engl. J. Med. - 2000. - Vol. 342. ~ R 1969-1978.Vassallo R., Ryu J.H., Schroedcr D.R. et al. Clinical outcomes of pulmonary
Langerhans’cell histiocytosis in adults // N. Engl. J. Med. — 2002. — Vol. 346. —
P. 484-490.Venables K.M. Epidemiology // Occupational lung disorders: Eur. Respir. Monogr. —1999.-Chap. 2.-R 22-45.Vilaplana-Garcia R., D-uJilloSantos A.J., Vera-Mendez f.J. Shrinking lung syndrome:
a rare manifestation of systemic lupus erythematosus I I Arch. Bronconeumol. —2008, Jun. - Vol. 44, N 6. - R 341-342.Vofi Plessen C. Grinde O. Gulsvik A. Incidence and prevalence of cryptogenic fibrosing
alveolitis in a Norwegian community // Respir. Med. — 2003. — Vol. 97, N 4. —
R 428-435.
454 - ЛИТЕРАТУРАFon S/osse/ E. Uber muskulare Cirrhose der Lunge (Muscular cirrhosis of the lung) I I
Beitr. Klin. Tuberk. - 1937. - Vol. 90. - P. 432-442.Vouriekis J.S., Schwarz M.J., Cherniack R.M. et al. The effect of pulmonary fibrosis on
survival in patients with hypersensitivity pneumonitis // Am. J. Med. — 2004, —
Vol. 116, N 10. - P. 662-668.Vuotto F., Queyret V., Lambert M. et al MPO-ANCA related vasculitis presenting as
chronic iron deficiency anemia due to paucisymptomatic intra-alveolar haemor¬
rhage // Rev. Med. Interne. — 2007, Jul. — Vol. 28, N 7. — P. 484-487. Epub 2007
Mar 8.Wangkaew S., Kasiianon N., Phrommintikul A. et al. Pulmonary arterial hypertension
in Thai patients with systemic sclerosis // J. Med. Assoc Thai. — 2008, Feb. —
Vol. 91, N 2. - P. 166-172.Wardwell N.RJr, Miller R., IVare L.B. Pulmonary alveolar proteinosis associated
with a disease-modifying anti rheumatoid arthritis drug // Respirology, — 2006,
Sep. - Vol. 11, N 5. - P. 663-665.Warth A., Herpel E., Schmahl A. et al Mediastinal angiomyolipomas in male
patient affected by tuberous sclerosis // Eur. Respir. J. — 2008. — Vol. 31. —
P. 678-680.tVatts R.A., Carruthers D.M., Scott D.G. Epidemiology of systemic vasculitis; changing
incidence or definition? // Semin. Artritis Rheum. — 1995. — Vol. 25. — P. 28-34.Weinrib L., Sharma O.P., Quismorio F.PJr. A long-term study of interstitial lung
disease in systemic lupus erythematosus // Semin. Arthritis Rheum. — 1990. —
Vol. 20. - R 48-50.Wells A.U., Hansell D.M., Harrison N.K. et al. Clearance of inhaled ^’"'Tc DTPA
predicts the clinical course of fibrosis alveolitis // Eur. Respir. J. — 1993. —
Vol. 6. - R 797-802.White D.A. Drugs and the Lungs // Comprehensive Respiratory Medicine / Albert, 1st
ed. — 1999. — Chap. 77. — Copyright © 1999 Mosby, Inc, — MD Consult L.L.C.
http;//www. mdconsult.com.Wiedemann H.P., Matthay R.A. Pulmonary manifestations of collagen vascular dis¬
eases // Clin. Chest Med. - 1989. - Vol. 10. - R 677-721.Wild L.G., Chang E.E. Farmer’s Lung // Oct 16, 2008. — eMedicine Specialties >
Pulmonology > Occupational Lung DiseasesWilt J.L., Banks D.E., Weissman D.N. et al. Reduction of lung dust burden in pneu¬
moconiosis by whole-lung lavage // J. Occup. Environ. Med. — 1996. — Vol. 38,
N 6. - P. 619-624.Yamagami ¥., Kohda М., Mimura S., Ueki H. Pemphigus vulgaris associated with sili¬
cosis // Dermatology. — 1998. — Vol. 197, N 1. — P. 55-57.Yasutake H., SeinoY., Kashiwagi M, et al Detection of cardiac sarcoidosis using Cardiac
markers and myocardial integrated backscatter II Int. J. Cardiol. — 2005. —
Vol. 135.-C. 27-31.Yazawa N,, Fujimoto М., Tamaki K. Recent advances on pathogenesis and therapies
in systemic sclerosis // Clin. Rev. Allergy Immunol. — 2007, Oct. — Vol. 33,
N 1-2. -R 107-112.
ЛИТЕРАТУРА • 455Yeh ТТ., Yang У.Н., Lin Y.T. et al. Cardiopulmonary involvement in pediatric sys¬
temic lupus erythematosus; a twenty-year retrospective analysis // J. Microbiol,
Immunol. Infect. — 2007, Dec. — Vol. 40, N 6. — P. 525-531.Yoshida T, Koga H., Saitoh P etal. Pulse intravenous cyclophosphamide treatment for
steroid-resistant interstitial pneumonitis associated with polymyositis // Intern.
Med. - 1999. - Vol. 38, N 9, - P. 733-738.Yoshifuji K, Fujii T, Kobayashi S. et al. Anti-aminoacyl-tRNA synthetase antibod¬
ies in clinical course prediction of interstitial lung disease complicated with
idiopathic inflammatory myopathies // Auloimmunity. — 2006. — Vol. 39.—
P. 233-241.Yu ХЖ, Liu Z.R.j Xie D. et al. Clinical significance of antineutrophil cytoplasmic
antibodies in patients with lupus nephritis I j Nan Fang Yi Ke Da Xue Xue Bao. —2006, Jun. - Vol. 26, N 6. - P. 833-836,Yung R.L., Richardson B.C. Drug-induced lupus // Rheum. Dis. Clin. North Am. —1994.-Vol. 20.-P. 61.Zabel P., Entzian P., DalhoffK., SchlaakM. Pentoxifylline in treatment of sarcoidosis//
Am. J. Respir. Crit. Care Med. - 1997. - Vol. 155. - P. 1665-1669.Zamora A.C., Walters P.J, Collard H.R. et al. Use of mycophenolate mofetil to treat
scleroderma-associated interstitial lung disease // Respir. Med. — 2008, Jan. —
Vol. 102, N l.-P. 150-155.Zamora M.R., Warner M.L., Tuder R. et al. Diffuse alveolar hemorrhage and systemic
lupus erythematosus. Clinical presentation, histology, survival, and outcome //
Medicine (Baltimore). - 1997. - Vol. 76. ~ P. 192-195.Zhe X., Schuger L, Combined smooth muscle and melanocj^ic differentiation in
lymphangioleiomyomatosis // J. Histochcm. Cytochem, — 2004. — Vol. 52. —
R 1537-1542.Zhe X., Yang Y., Jakkaraju S. et al. Tissue inhibhor of metal loproteinase-3 downregu-
lation in lymphangioleiomyomatosis: Potential consequence of abnormal serum
response factor expressio // Am. J. Respir. Cell Мої. Biol. — 2003. — Vol. 28. —
R 504-511.Ziegrnhagen M.W., Rathe M.E., Schlaak М., Muller-Quernheim J. Bronclioalveolar
and scrological parameters reflecting the severity of sarcoidosis // Eur.
Respir. J. - 2003. - Vol. 21. - R 407-413.Zielinski J. Long-term oxygen therapy in conditions other then chronic obstructive
pulmonary disease // Respir. Care. ~ 2000. — Vol. 45. — P. 172-177.Zielonka T.M., Bareta D., Zukowska M. et al. Caplan’s syndrome: case repor //
Pol. Arch. Med. Wcwn. - 2005, Aug. - Vol. 114, N 2. - R 779-784.Ziesche R., Hqfbauer E., Wittmann K. et al. A preliminary study of long-term treatment
with interferon gamma-lb and low-dose prednisolone in patients with idiopathic
pulmonary fibrosis // N. Engl. J. Med. — 1999. — Vol. 341. — P. 1264-1269.Zrour S.H., Touzi М., Bejia I. et al. Correlations between high-resolution computed
tomography of the chest and clinical function in patients with rheumatoid arthri¬
tis. Prospective study in 75 patients // Joint Bone Spine. — 2005, Jan, — Vol. 72,
N 1. - R 41-47.
45в • ЛИТЕРАТУРАZycinska К., Wardyn К.А., Tyszko R, Otto M. Analysis of early death based on the
prediction model in Wegener’s granulomatosis with pulmonary and renal involve¬
ment // J. Physiol. Pharmacol, — 2007, Nov. — Vol. 58, suppl. 5. — Pt 2. —
P. 829-837.Zycinska K., Wardyn K.A., Zielonka T.M., Otto M. The role ANCA and anti-GBM
antibodies in pulmonary-renal syndrome due to Wegener’s granulomatosis //
J. Physiol. Pharmacol. - 2007, Nov. - Vol. 58, suppl. 5. - Pt 2. - P. 839-846.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬАгранулоцитоз 71,252
Адалимумаб 114,296,329
Аденокарцинома легких 387
А^іенома бронха 400
Адиурекрин 85
Азатиоприн 72, 135, 187, 208,253, 267, 276, 283, 289,
318,351,365
Акропианоз 152, 203
Активит 136
Актиномицеты 85, 111
Албутерол 295
Аллоттуринол 301
Альвеолит 25, 30, 39, 122, 247,272,
310, 322, 328, 350, 361,399
адкурекрин-индуцированный 96
аэраторов (работающихсаэрационнымисистемаами) 95
виварийный 95
фанулематозныйинтерстициальный 84
фибников (обрабатьгвающїіх
грибы) 94
кофейный 96
краснодеревщиков 95
летний 94медикаментозный 96
молочный 96
мукомолов 94
некротизирующий 274
пеньковый 96
рыбной муки (работающих
с рыбной мукой) 95
скорняков 96солодовый (изготавливающих
солод) 94
сыроваров (сыроделов) 94
фиброзирующий 11идиопатический 24, 47, 67, 106,
207,288, 332,415
интерстициальный 38, 49
токсический 113
экзогенныйаллергический 84, 99,134, 207,
285, 288, 293,317
токсический 112,119,129,285,288, 294, 304, 317
химический 96
Альфа-ДЗ-ТЭВА 73
Алюминоз 223
Амилоидоз 323
генерализованный 272
легочный 377, 386
вторичный 379
Амиодарон 113, 286, 287,295, 301
Амитриптилин 292
Ампициллин 290
Амфетамин 114,296
Аліфотерицин В 291
Анализ
PAS 21
Адамса 21
Сакагуши 21
Фельгена-Браше 21
Эйнарсена 21
Анаприлин 114, 296
АнгиитАН ЦА- положительный 289,301
дигитальный 262
Ангиолипома почки 409
Ангиопульмонография
альвеолит интерстициальный
фиброзирующий 57
саркоидоз 178
Ангиофиброматоз кожи 415
Анемия 71, 248, 252
апластическая 282
458 • ПРЕДМЕТНЫЙ УКАЗАТЕЛЬгемолитическая 282,351
гиттопластическая 300
гипохромная 280
железодефицитная 277
микроцитарная 280
Анергия 139
і-уберкулиновая 164
Анорексия 71
Антиген Смита 251,350
Антитела 22
антинейтрофильиыецитоплазматические 240
гетерофильные 184
преципитирующие 97
Антракоз 216
Антракосиликоз 223
Апоптоз альвеолоцитов 32
Артериопатия легочная 310
Артралгия 121, 141, 150,157, 184,
244,270
Артрамин 318
Артрит 350, 361
неэрозивиьтй 244
ревматоидный 29, 188, 320
Артюса феномен 88,259
Асбестоз 163,219,223
Аспарагиназа 290
Аспаркам 73
Аспергиллез 324
Аспирин 298, 302
Астма бронхиальная 163, 225, 260,285,415
Асцит хилезный 409
Атрофия зрительных
нервов 154
Ацетилцистеин 73, 75,135, 188,
232, 375Багассоз 95
Бактрим 252
Барактант 75Беклометазон 109,187, 233, 267, 292
Бензогексоний 114,296Беременность
альвеолит фиброзируюпщй
идиопатический 43
гемосидероз легкихидиопатический 280
лимфангиолейомиоматоз легких405,415
саркоидоз 158
Бериллиоз 13, 66, 115, 163, 223
хронический 121,129
Бесплодие 158
Бета-каротин 231
Биастен 109
БикaJ•Iyтaмид 290
Билитраст 337
Биопсия
амилоидоз легочный 382
волчанка системная
красная 348
гемангиоэндотелиома легких
эпителиоидная 419
гранулематоз Вегенера 249
лимфангиолейомиоматоз легких
407,413
пневмофиброзсклеродермический 316
саркоидоз 144,179
трансторакальная игловая 19
чрезбронхиальная 18
Бирбека гранулы 206
Бисептол 252
Биссиноз 95Блеомицин 34, 71, 113, 286, 288, 302
Блокада сердечная 155,156,187,193,245
Бозентан 76,319
Болезнь(и)Абта-Летгерера—Сиве 196, 202
Бека 137Бенье-Бека-Шау манна 137
Брилла—Симмерса 182
бронхиолит-ассоциированная
интерстициальная 47
броихоэктатическая 282
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ • 459веноокклюзионная легких 287, 300
гапертоническая 190
Гоше 163диссеминированные легких 10
диффузные соединительной ткани
16,305,320
интерстшиальные легких 10,184
Крона 188
тшкопления 12
неспецифические легких 26
обструктивная хроническая
легких 62, 163, 184, 415
опухолевой природы 12
ревматические 305
Таратынова 196
Хаммена-Рича 25
Хенда-Шюллера-Крисчена 196,202
Ходжкина 399
Бореллии 141Бронхиолит 92, 267, 323, 344
артрит ревматоидный 326
облитерируюший 45, 92,135, 288,
299, 300, 323, 332, 343
респираторный 46
фолликулярный 323
эозинофильный 265
Бронхит 326,361
Бронхофафия воздушная 390
Бронхорея 389
Бронхоскопия
альвеолитфиброзирующий 60
интерстициальный 60
экзогенный
аллергический 101
токсический 127
волчанка системная красная 347
гранулематоз Вегенера 249
пневмокониоз 229
полиангиитмикроскопический 273
протеиноз альвеолярный 373
саркоидоз 179
Бронхоспазм 90,93, 289, 302, 375Бронхофиброскопия 16
Бронхоэктазы 225, 260, 312, 326.332, 350
Будесонид 108, 187,267, 353
Буллы 207
Бупренарфин 292
Бусульфан 114, 289ВВазапростан 319
Вальсартан 302
Варфарин 73, 319
Васкулит 239, 311, 324
геморрагический 271
легочный 311, 326, 336, 341
аллергический 359
некротизируюший 268
перибронхиальный 265
системный 12,239,317
некротизирующий 257
Верапамил 73,291
Видеомедиастиноскопия 19
Видеоторакоскопия 20,180
Винбластин 114, 208,295
Винкристин 114, 208, 295
Винорельбин 393
Вирус(ы)
гепатита В 258
гепатита С 28
іерпеса 28, 140
гриппа 28иммунодефицита человека 44
Коксаки 355
парагриппа 140
Эпштейна-Барр 28, 140, 184,
336,355
ВитаминВ, 73, 209
Е 73,188.231,235
Р 231
С 231
Волчанка
лекарственная 336, 343, 354
ознобленная 153
460 - ПРЕДМЕТНЫЙ УКАЗАТЕЛЬсисте\шая красная 214, 250,275,334
Вромокарбид 293
Выпот плевральный 119, 125, 152,
261,296, 302, 335, 340
рак легких 391Габексат-мексилат 277
Галоперидол 292, 298
Гамартома 400,420
Ганцикловир 354
Гастроэнтеритэозинофильный 261
Гемангиома 183
склерозирующая 420
Гемаигиоэндотслиома легкихэпителиоидная 12, 22, 418
Гематурия 270, 300
Гемосидероз легких 67,386
вторичный 282
идиопаитаеский 277
Гемосорбция 29, 76, 135, 267,351
Гемохроматоз 282
Гемцитабин 114, 295, 393
Гепарин 267
Гепатит вирусный 163
Гепатомегаяия 153,202
Гепатоспленомегалия 266
Героин 114, 292, 298
Гефитиниб 114,286, 290, 393
Гиалиноз артерий 242
Гидантоин 337Гидралазин 114,292,296,301,337
Гидроксихлорохин 188,318
Гидроторакс 152
Гидрохлортиазид 114, 292,298
Гингивит 244
саркоидный 152
Гипербеталипопротеинемия 203
Гипергаммаглобулинемия 97
Гиперглобулинемия 203
Гиперинфляция 273
Гиперкальциемия 162Гиперкальцийурия 162
Гиперканнш! 59, 299
Гиперкинез 262
Гиперпаратиреоидизм 158
Гипертензия легочная 50,60, 73, 96,
184, 216, 279, 300,307, 324,335
волчанка системная красная 336, 353
вторичная 319, 341
склеродермия 311
Гипертиреоз 163
Гиперхолестеринемия 203
Гиперэстрогения 336
Гипоальбуминемия 203
Гиповолемия 76
Гипокапния 59
Гипоксемия 36,299, 332, 398
волчанка системная красная 342
эндокапиллярная 36
Гипопротеинемия 77
Гипотеза Хольстеда 395
Гистиоцитоз
системный злокачественный 22
Хлегких 11, 22, 67,196, 207,399, 415
Гистоплазмоз 386
Глаукома 154
Гликолипидоз 208
Гломерулонефрит 243, 245, 334
некротизируюший 240,268
сакоидозный 157
Глоссит 244Голодание лечебное 189
Гранулема 11
альвеолит экзогенный
аллергический 91, 149
токсический 118
гигантоклеточная 288
гистиоцитоз X 198
гранулематозная 243
иммунная 141
неиммунная 144
пневмокониоз 218
саркоидная 92,139, 148
неказеозная 288
саркоидоподобная 149
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ * 461силикотическая 221
Черджа—Стросс синлром 259
ттампованная 92
эозинофильная 261
легочная 196
Гранулематоз 11
бронхоцентрический 338
Вегенера 67, 221, 240, 247, 266,
275, 350
лангергансоклеточный 196
лимфоматоидньтй 251
миокарда саркоидный
диффузный 155Далтепарин 253
Дегенерация сетчатки 154
Дезоксирибонуклеаза 86
Декарис 189
Денситометрия 417
Дерматит гранулематозныйинтерстициальный 221
Дерматоз 202
Дерматомиозит 221,355
паранеопластический 355
Десферал 383,292
Дефероксамин 283
Диабет
несахар1тый 202, 203
сахарный 74, 108, 163,189, 302
Диклофенак 291
Дилтиазем 73, 233,292
Дипиридамол 73, 233, 253, 267, 319
Дипроспан 253Дислипидоз внутриклеточный 288
Дисплазия лимфатическая 415
Диспротеинемия 97
Дистелектаз 92
Дисфония 244
Дисфункция дыхательных
мышц 335, 342
полимиозит/дерматомиозит 358
Диуретин 337
Дифенил 114,296Дифенилгидантоин 291, 301
Дифенин 337
Дифлюкан 353
ДифлюниcaJ'l 291
Доцетаксел 114, 295Зиностатин 289
Зоб загрулинный183Изогапостенурия 202
Изониазид 189,301,337
Изосорбита мононитрат 73
Илопрост 319
Иматиниб 114,295
Имуран 209, 276
Инлурация легких бурая 277
Инсулин 86
Инсульт 245, 261
Интерлейкин
-2 90,114, 117, 290,296, 298
-6 117
Интерферон
альфа 114,296,302
бета 75, 302гамма 35, 75,90,117,296,320
Инфаркт
миокарда 261
пневмония 280
Инфильтрат эозинофильный
легочный 288, 301
Инфликсимаб 114, 188, 267, 276, 296,329, 337, 366
Иресса 393
Иринотекан 290
Исследование
биохимическое 18
гистологическое 21
иммуногистохимическое 22
иммунологическое 18
ультразвуковое 18
цитологическое 18
Ифосфамид 289
462 • ПРЕДМЕТНЫЙ УКАЗАТЕЛЬКалргй-нормин 73
Кальций-ДЗ-никомед 73
Кальците НИН 73
Кандидамикоз 13
Канцероматоз легких 282
Капиллярит 243, 259, 324, 338
альвеолярный 270
легочный 301
Каитоприл 73.76, 301
Карбамазепин 114,291, 302
Кардиовирусы 355
Кардиомиопатиядилатационная 155
Кармустин 302
Карциноз милиарный 397
Карциноид 400
Карцинома 387Карциноматоз легких 64, 184, 396
лимфогенный 397
Каспофунгин 353
Катаракта 154
Кашель 301
Квинидин 301Кислорода активные формы 287
Кислородотерапия 77, 233, 417
длительная 193
Кислота
аскорбиновая 231
ацетилсалициловая 291, 298, 302
глутаминовая 232, 235
парааминосалициловая 290
Киста 37, 207
бронхогениая 183,401
дермоилиая 183
саркоидозная 159
Клафоран 233
Клетки
Латїгерганса 200
Пирогова-Лашханса 291
Кломипрамі-ш 292
Клоп идо грел 298
Кодеин 114, 293
Кокаин 114, 251, 293Коксаки-вирусы 355
Колика
печеночная 189
почечная 190
Колхицин 74, 290, 298
Комплексы иммунные 321, 337
Кониотуберкулез 230
Конферон 283
Конъюнктивит 245
Кордарон 296
Коронариит 245, 261
Крепитация 42, 119, 220, 311
треск целлофана 42
Кровоизлияние 279
альвеолярное 270, 334, 340
внутриальвеолярное 277
легочное 287,301
Кровотечение 247
альвеолярное 276, 312
легочное 280, 301
Кровохарканье 244, 277, 312, 341, 379
Ксантоматоз 202
Купренил 70,187,209, 318ЛЛаваж бронхоальвеолярный 18
Ларингофарингит 119
Левамизол 189,301
Легионсллы 28
Легкоеамиодароновое 123,295,304
банщиков 95детергентное (производителей
детергентов) 95
золотое 328кистозно-буллезное 410
кобальтовое 115,118
мелкокистозное 404
птицевода 84, 94
ревматоидное 324
сотовое 37, 39,100, 118,152, 207,
339, 404
фермера 84, 94
шоковое 117
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ • 463Лейкоз 208
Лейомиома 405, 409
метастазирующая 415
Лейомиоматоз легких 12,66, 207
Лейомиосаркома 415
Лефлюномид 324, 328
Ливедо сетчатое 262
Лидоісаин 291,298
Лизиноприл 73, 301
Лимфаденопатш! 141,202
медиаститгальная 392
прикорневая двусторонняя 149
средостения 20,150, 183,184, 302
Лимфангоит раковый 64, 397
Л имфангиолейомиома тоз
легких 12, 22, 404
Лимфангиоэкгазы 415
Лимфангитканцероматозный 397
Лимфоретикулосаркома 181
Лимфогранулемадоброкачественная 137
Лимфогранулематоз 13, 181, 208, 399
Лимфодиссекция 392
Лимфокины 90
Лимфома 181
неходжкинскаязлокачественная 399
Лимфопения абсолютная 160
Лимфосаркома нодулярная 182
Липома 183Липоматоз медиастинальный 302
Липопротеинозальвеолярный 219, 367
Листериоз 13
Лихорадка 151,244
ингаляционная 123
металлическая дымная 120
пеньковая 96
полимерная дымная 120
простагландин-индунированная 120
септическая 244
цитокин-индуцироваиная 120
Ловастатин 337Ловастин 75
Лозартан 302,319
Луновит-плюс 232, 235мМалоприм 290
Мегалоглоссия 379
Медиастинит 183
Медиастиноскопия 19
Меланома 396, 397
Мелфалан 114,289
Менингит 164
гранулематозный 157
саркоидозный 158
Мснингоэнцефалопатия 266
Мсноцил 114, 292, 296
Мсполизумаб 267
Меркаптопурин 114, 289
Месаламин 291
Метадон 292,298
Металкаптаза 70, 187,318
Метандиенон 73
Метастазы легких 395,421
гематогенные 396
лимфатических узлов
корня легкого 399
средостения 399
лимфогенные 397
Метилдопа 337Метилнреднизолон 70, 276, 303, 352
MeтиJІTИoypaцил 337
Метотрексат 114, 124, 135, 141, 187,
253, 267,286, 288, 298, 304, 318.
324, 365
Миакальцик 73
Миалгия 121,244,270
Микафунгин 353
Микобактерии 141
Мжоз легких 148,312
Микоплазма 28,141
Микофенолата мофетил 333
Микроангиит 338
Микролитиаз альвеолярный 386
Микроскопия 21
464 • ПРЕДМЕТНЫЙ УКАЗАТЕЛЬМиксома предсердия 251
Миноциклин 114, 290, 296, 301, 337
Миокардит 245, 261
саркоидозный 154
Миопатии идиопатические
воспалительные 355
Митомицин 113,289
Молсидомин 233
Мононуклеоз инфекционный 184
Мочеизнурение сахарное 209ННадропарин 73, 253
Налоксон 293, 298
Нандролон 73
Напроксен 291
Невринома 183
Неврит 71, 245, 261
Н едостаточность
дыхательная 96, 210, 220, 237, 247,
272,277, 332,375
кровообращеїшя 247, 261, 266,
272,282
легочная 280
почечная 247,272
сердечная 83, 184, 238
Нейробластома 208
Нейропатия периферическая 188
Некроз паренхиматозный 242
Нефрит волчаночный 341
Нефрокальииноз 157
Нефролитиаз 157
Нефропатия 252, 302
Низорал 353
Нилутамид 290Нитрозом 04 евина 113,295,304
Нитрофурантоин 114, 289, 296, 300
Нифедипин 73, 319
Нокардии 141
Ноккардиоз 324Овариэктомия 416
Одалимумаб 267Одышка 10, 14, 299, 325, 344,362,415
альвеолит интерстициальный
фиброзирующий 40
полиангиит микроскопический 270
силикоз 219
Окостенение легочной ткани 384
Оксипрогестерона капронах 417
Оксипролин 34
Омализумаб 267Опухоли легких 12, 184,251, 275, 350
бронхиолоалъвеолярные 387
склерозирующиевнугрисосудистые 418
метастазирование 395
Оссификация легочная 384
Остеогенон 73Остеодистрофия фиброзная 208
Остеомиелит 208
Остеопатия гипертрофическая
легочная 328
Остеопороз 73, 189
Остеосаркома 208
Остеохондропатия легких 384
Отекальвеолярный 39,288
внутриклеточный 91
интерстициальный 39,91
легких 120,287,375
кардиогенный 285
некардиогенный 288, 298
Отит средний 244пПаклитаксел 114,295
Панангин 73
Панбронхиолит 324
Панцитопения 204
Паралич голосовых связок 342
Паральдегид 293
Паротит 158Патоморфоз лекарственный 403
Пеницилламин 70,135, 187,209,283,289, 300,318, 324, 328, 337 ■
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ • 465Пенициллин 337Пентоксифиллии 73, 188, 233, 253, 267Перикардит 245, 261, 271, 336, 350Пиридоксин 73, 209Пирикарбат 253Пириметамин 291Пироксикам 291Пирфенидон 75Плазмаферсз 29,135, 267, 276, 333, 351
альвеолит идиопагичесий
фиброзирующий 76
саркоидоз 192
Плазмацитоферез 135
Плазмощп'ома 182
Плеврит 244, 324, 350, 361
волчаночный 340, 351
осумкованный 400
Плевро-пневмосклероз 42
Плеврофиброз 94
Плеврэктомия 209,417
Плетизмография 17
Пневмокониоз 11, 66,184, 211, 221,
230, 282, 383, 386,399
интерстициальный 218
неуточненный 223
тальковый 220
угольщика 220
узелки ревматоидные 325
узелковый 217
узловой 220
Пневмомикоз И
Пневмонит 211, 252, 344
волчаночный 340, 352
гиперчувствительный 84
интерстициальный
хронический 341
кадмиевый 119
метотрексатный 327
параканкрозный 392
цитомегаловирусный 324
Пневмония 44, 105, 247, 272, 326, 332,
361, 392
аспирационная 280, 375
бактериальная 312двусторонняя 17,61,105,415
интерстициальная 44,47
гигантоклеточная 45
десквамативная 45
криптогенная организующая 46
лимфоцитарная 45
неспецифическая 46
острая 46
организующаяся 300,329
п ол и миозит/дерматомиозит 358
токсическая 122
хроническая 26,61
эозинофильная 63. 282
Пневмопатия
остеоиластическая 384
ингаляционная 84
Пневмосклероз 392
кардиогенный 11
Пневмотоксичность 295
Пневмоторакс 203, 244, 375
лимфангиолейомиоматоз
легких 409
рецидивирующий 207,280,415
спонтанный 152,312
Пневмофиброз 42, 94,135, 217, 277,295,310
распространенный 26
склеродермический 313
Полиаденогштия 158
Полиангиитмикроскопический 268, 350
Полиартериит
микроскопический 268
узелковый 257, 274
Полиартрит ревматоидный 221
Полиглюкин 253
Полидипсия 202
Полимиозит 355
Полинейропатия 158,271
периферическая 266
сенсомоторная 261
Полипоз 266
Полипрагмазия 86
Полисерозит волчаночный 335
466 . ПРЕДМЕТНЫЙ УКАЗАТЕЛЬПолиурия 202Преднизолон 70, 208, 251,267, 275,
303,318,333, 365
Прсципитины 97
Проба
Вальсальвы 179, 195
ингаляционная 90
провокационная 98
кардиопульмональная 195
Квейма 163
кожная 90
Тиффно 58томорсспираторная 53
шестиминутная 195
Прогестерон 416
Продектин 253
Проказа 163
Прокаинамид 301,337
Прокаинид 291Прокарбазин 114, 124, 290,302
Пропилтиоураиил 301
Пропоксифен 114, 292, 296, 298
П ропранолол 114,296
Простатит 271
Протеиноз
альвеолярный 67, 207, 367, 383
вторичный 373
первичный 373
Протеинурия 71, 270, 299, 350
Псевдоопухоль орбиты 245
Псевдопротеиноз 367
Психоз 351
Пузырчатка 71,221
Пункция трансторакальная 391РРак 163
бронхоальвеолярный 184
вилочковой железы 183
колоректальный 396
легких 12,312,350
бронхиолоальвеолярный 387
периферический 392
молочной железы 397мочевого пузыря 252,397
плоско клеточный 397
поджелудочной железы 397
почки 396шейки и тела матки 397
щитовидной железы 183, 397
яичника 396
Раминрил 301
Реакция
гиперчувствительности 87, 143
гранулематозная клеточно¬
опосредованная 117
Пауля—Бут^неля 184
саркоидная 149
Фентона 213
Ревматизм 13
Релаксин 75
Ремикейд 188
Рентгенография 16
альвеолит фиброзирующий 53
интерстициатьный 53
экзогенный
аллергический 99
токсический 125
амилоидоз легочный 38!
артрит ревматоадный 330
берилл иоз 126волчанка системная красная 344
гемосидероз легкихидиопатический 281
гистиоцитозХ 204
гранулематоз Вегенера 248
карциноматоз легких
лимфогенный 398
л имфангиолейомиоматоз
легких 410
нневмокониоз 224, 226
пневмонияостеопластическая 386
инсвмофиброзсклеродермический 313
полиангиит микроскопический 273
полимиозит/дерматомиозит 362
протеиноз альвеолярный 372
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ • 4S7рак бронхиолоальвеолярный 390
саркоидоз 165
синдром фиброзирующего
альвеолита 330
Черджа—Стросс синдром 264
Реополиглюкин 253
Ретровирусы 336Рефлекс Эйлера-Лильестранда 36
Рефлюкс гастроэзофагеальный 28
Ринит 266, 302
аллергический 260
вазомоторный 93
Ритодрин 292, 298
Ритуксимаб 276, 318, 329, 352
Роцефин 233
Рутин 231Салметерол 109, 236
Сальбутамол 109, 267
Сандиммун 333, 366
Саркоид Бека 137
Саркоидоз 11,22, 92, 137, 159, 185,
207, 374
гранулематозный кожи 153
легких 65, 166,383, 392, 399
сердца 154
слезных желез 154
Саркома 396
эндометриальная стромальная 415
Себорея 202
Селцинк 235
Селцинк-плюс 232
Сердце легочное 50, 73, 96, 155, 341
Серетид 109
Серозит 350
Сидероз 223
Силикатоз 66
Силикоз 66, 163, 211, 220
острый 219
хронический 222
Силикопротеиноз 219
Силикотуберкулез 222
Симбикорт 109Симптом
барабанных палочек 41, 121,203
булыжной мостовой 372
воздушной ловушки 326, 346
геофафической карты 372
матового стекла 167, 185, 226, 248,330, 345,372
мохнатого сердца 228
пальцев Гиппократа 41, 94, 203, 220,
341,371
снежной бури 227
часовых стекол 41, 121,203
яичной скорлупы 230
Синдром
overlap 306
Аддисона 158
Аккермана 221
антисинтетазный 360
атероэмболии 251
Бенье—Бека—Шау манна 137
бронхиальной астмы 265
бронхообструкгивный 225, 415
бронхоспастический 225,260,267,302
волчаночный 289, 301
Гейснера 282
геморрагический 77
гепатолиенальный 245
гиперэозинофильныйидиопатический 266
гиповентиляционный 358
Гудпасчера 67,71, 250, 279, 282, 350
псевдо- 288, 300
дистресс респираторный 119, 286
Ипенко—Кушинга 189, 302
Кагшана 221,325
кожный 262легочно-ночечный 288, 300
легочной диссеминаци и 10
Лефгрена 16, 150,160
Леффлера 90, 106, 282, 301
миастенический 71
миастения-подобный 289
нефротический 71,270
обструктивный 209, 335
468 • ПРЕДМЕТНЫЙ УКАЗАТЕЛЬотечный 77преходящей обструїщии 265
пседцоваскулитный 251
псевдосаркоидный 302
психооргаиический от воздействия
растворителей 121
Рейно 121,307,325,336,361
рестриктивный 49, 127, 300
системной красной волчанки 71
склеродермический 121
суставной 41, 325
Съефена 154,214
тромбогеморрагический 267
усадки легкого 342,353
фиброзирующего альвеолита 29, 64,
324, 356
Хаммена—Рича 325, 359
Хеерфорда-Валвденстрема 151
Черджа-Сфосс 250,257,265,289,301
Шауманна 137
Шегрена 325,415
эпилептиформный 245
Эразмуса 221
Синовит 320
Синусит 260, 302
гнойный 244
Склерит 245
Склеродакгилия 121
Склеродермия 310
системная 29,221,305
Склероз туберозныйБурнвшш 404,415
Соталол 291
Спирография 17
альвеолит фиброзирующий 57
интерстициальньгй 57
экзогенный аллергический 100
экзогенный токсический 126
артрит ревматоидный 330
волчанка системная красная 346
гемосидероз легкихидиопатический 281
гистиоцитозХ 205
гранулематоз Вегенера 249лимфангиолейомиоматоз
легких 411
пневмокониоз 228
пневмония остеолласптческая 386
пневмофиброзсклеродермический 315
полиангиит микроскопический 273
полимиозит/дерматомиозит 363
саркоидоз 178Черджа-Стросс синдром 265
Спиронолактои 73
Спленомегалия 153
Станноз 223Стеноз субглоточный 253,342
Стоматит 202
афтозный 244
Стрептаза 86, 375
Стрептокиназа 375
Стридор 383
Субероз 95
Судороги 351
Сулиндак 291Сульфасалазин 289, 301, 324
Суперинфекция 371
Сурфактант 28
протеиноз альвеолярный 386
Сцинтиграфия 18
альвеолит фиброзирующий
интерстициальный 57
гистиоцитоз X 206
пневмофиброзсклеродермический 314
саркоидоз 176
Сыпь дискоидная 350Такролимус 366
Талидомид 188
Тамоксифен 290,416
Тардиферон 283
Телмисартан 302
Теория Пэджета 396
Тератома 183
Тербуталин 292, 295, 298
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ • 469Тетрациклин 290, 301, 337
Тиосульфат натрия 188
Тиотропия бромид 236
Токаинид 291
Токоферол 231
Токоферола ацетат 73
Томография
аденокарцинома 401
альвеолит фиброзируюший 55
интерстициальный 55
экзогенныйаллергический 100
токсический 125
волчанка системная красная 346
гранулематоз Вегенера 248
карциноматоз легких
лимфогенный 398
компьютерная 18
высокого разрешения 18
метастазы 401
пневмокониоз 226
пневмония остеопластическая 386
позитронно эмиссионная 401
полиангиитмикроскопический 273
полимиозит/дерматомиозит 363
протеиноз альвеолярный 372
рак периферический 401
саркоидоз 166Черджа-Стросс синдром 264
Торакотомия 209
Торакоцентез 391
Трандолаприл 302
Трансплантация 353
легких 77, 233, 417
Триамцинолон 253, 303
Триметоприм/сульфаметоксазол 252,291,353
Триовит 136
Трипсин 86
Троволол 318
Тромбоз 73, 174
артерий сетчатки 245
Тромбоцитопения 77Тромбоэмболия 15, 73, 83, 261
легочной артерии 289, 336
хроническая рецидивиругошая 184
Туберкулез 139, 163, 225, 392
костей 208
легких 22, 312
диссеминированный 13, 62, 184,
207,374,386
лимфатических узлов 182
милиарный 282, 399
Туберкулема 400
Туляремия 13Увеит 151,245
гранулематозный 154
Узелки ревматоидные 325,332
Урокиназа 86ФФактор ревматоидный 320
Фебарбамвд 293
Фенитоин 302
Феномен Велькро 311
Фенотерол 267
Феокарпин 232, 235
Ферроплекс 283
Фибриллогенез 242
Фиброз 25, 299, 322
бокситный 223
графитовый 220, 223
легких 211,266, 324, 335
идиопатический 25,47
интерстициальный 11,39, 90, 219,307,311
плевры 324
силикатный 223
эндокардиальный 261
Фиброма 183,409
Фиброматоз подногтевой 415
Фибромиома 405
Фистула артериовенозная 400
Флударабин 114, 289
Флуимуцил 73, 135, 188, 232
470 * ПРЕДМЕТНЫЙ УКАЗАТЕЛЬФлуоксетин 292
Флутиказон 109,187, 267
Фозиноприл 302
Формотерол 109, 236, 267
Фортум 233
Фосамакс 73Фосфолипидоз альвеолярный Зб7
Фотосенсибилизация 350
Фторурацил 290
Фуразолидон 114,295Хилоперикардит 409
Хилоперитонеум 409
Хилоринорея 409
Хилурия 409
Химотрипсин 86, 375
Хинаприл 301
Хламидии 28,141
Хлорамбуцил 72, 114,208, 289, 35 [
Хлордиазепоксид 292, 298
Хлорохин 188,318
Хлорлромазин 114,337
Хлорпропамид 114, 292,296
Хлорталидон 337
Холангит 190
Холецисі'ит 190
Хорионэпитслиома 396цЦефалоспорин 114
Цефобид 233
Цефоперазон 233
Цефотаксим 233
Цефтазидим 233
Цефтриаксон 233
Цианоз 41, 94, 152
Циклоспорин 188, 290, 333, 351, 3^
Циклофосфамид 72, 113,188, 20^ ^
251,267,275,283,289,318 "
333,351, 365
Циннаризин 233Цистит геморрагический 245, 25^ -ч
Цитарабин 298 *Цитозин 289Цитозин-арабинозид 295, 301
Цитокины 35, 290
Цитомегаловирус 28, 140, 336
Цит0ред[ук11ия 403эЭкзофтальм 202
Электрокардиография 16
альвеолит фиброзирующий
интерстициа1ьный 59
саркоидоз 156
Эмфизема 92, 220, 326, 415
ацинарная проксимальная 217
буллезная 217
иррегулярная 217
Эналаприл 73, 233, 302, 319
Эндокардит инфекционный 251
Эндомиокардит 266
Эноксапарин 73, 253
Энцефалит 245
Энцефалопатия 262
от воздействия растворителей 121
Эпилепсия 77
Эписклерит 245,271
Эпопростенол 319
Эпросартан 302
Эрготамин 292
Эритема 71, 153,350
узловатая 141, 150,184
Эрлотиниб 114, 288, 393
Этамбутол 290
Этанерсепт 76, 329,337
Этопозид 114,208, 290,295, 393
Этхлорвинол 293
Эхо-вирусы 355
Эходопплеркардиография 18
альвеолит фиброзирующий 59
интерстициальный И
экзогенный аллергический 101
пневмокониоз 229
пневмофиброзсклеродермический 315